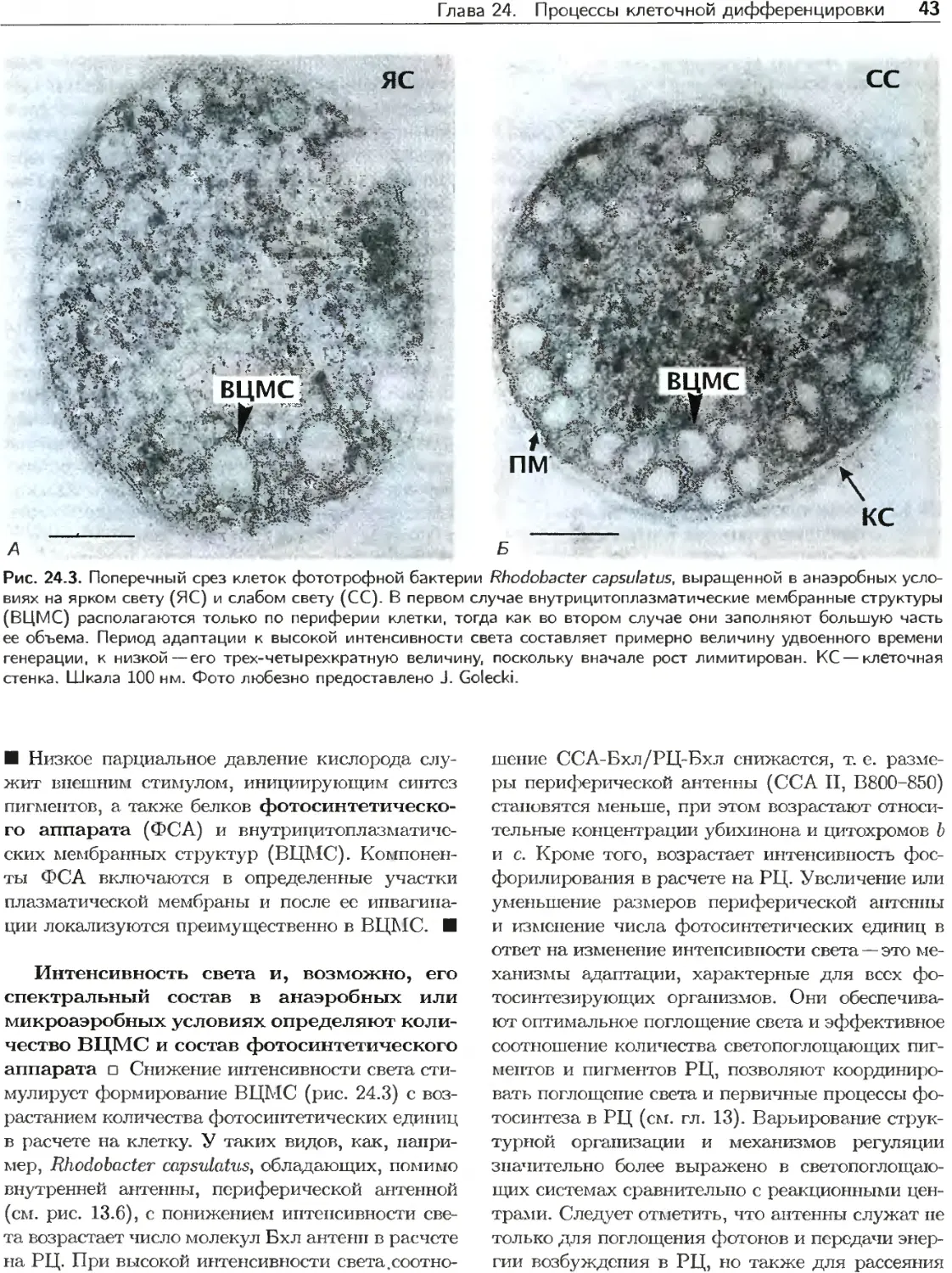
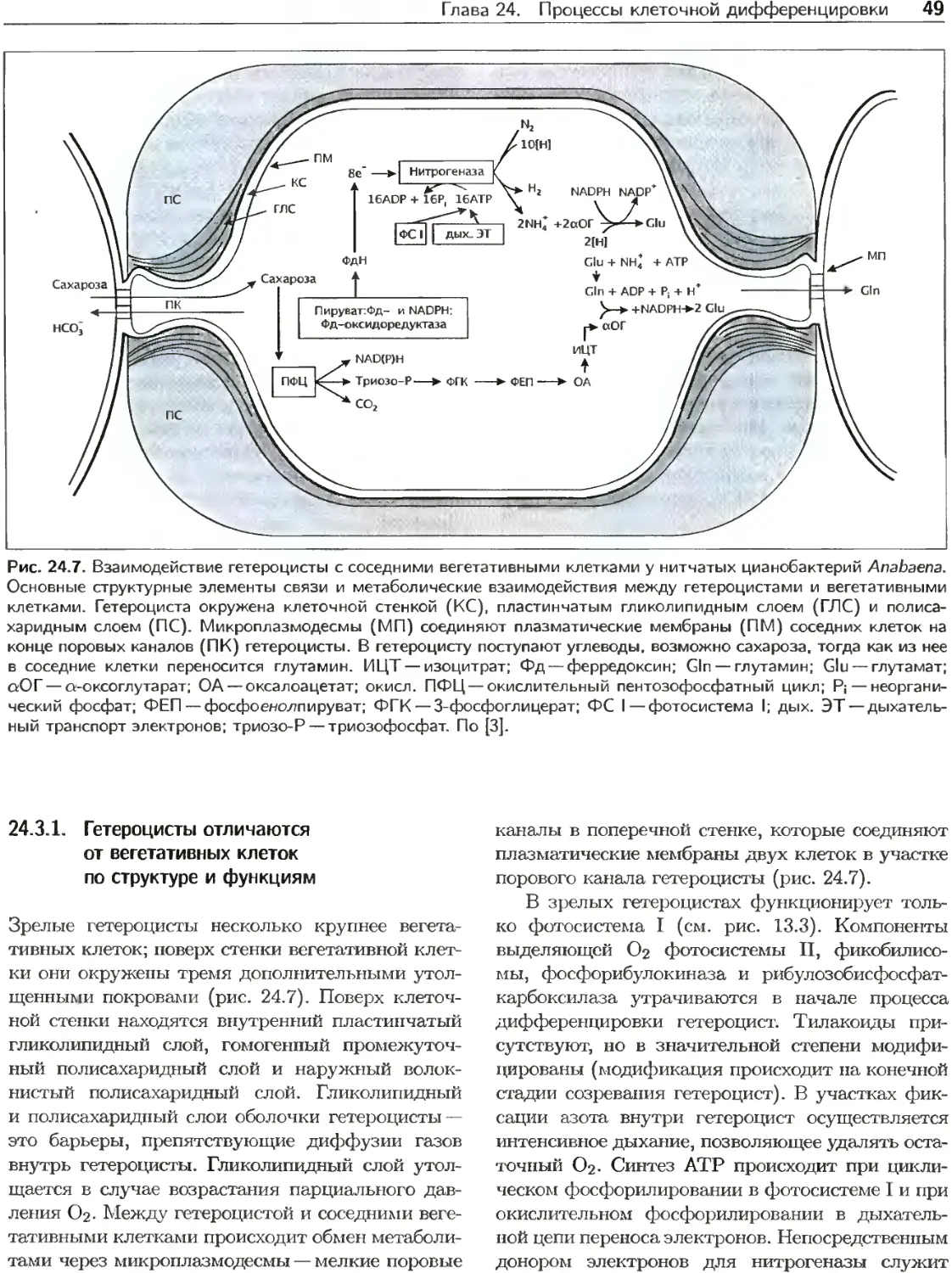
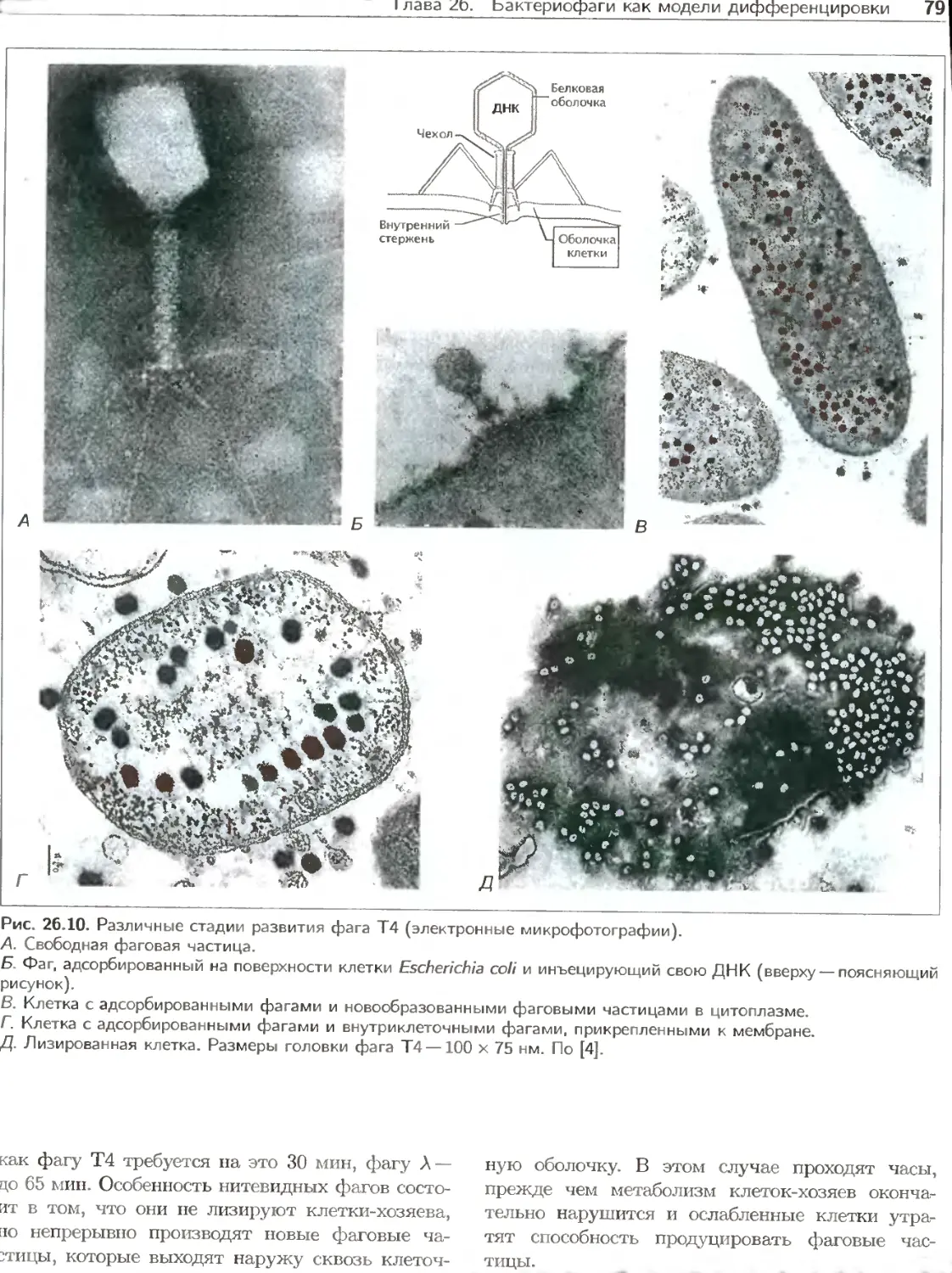
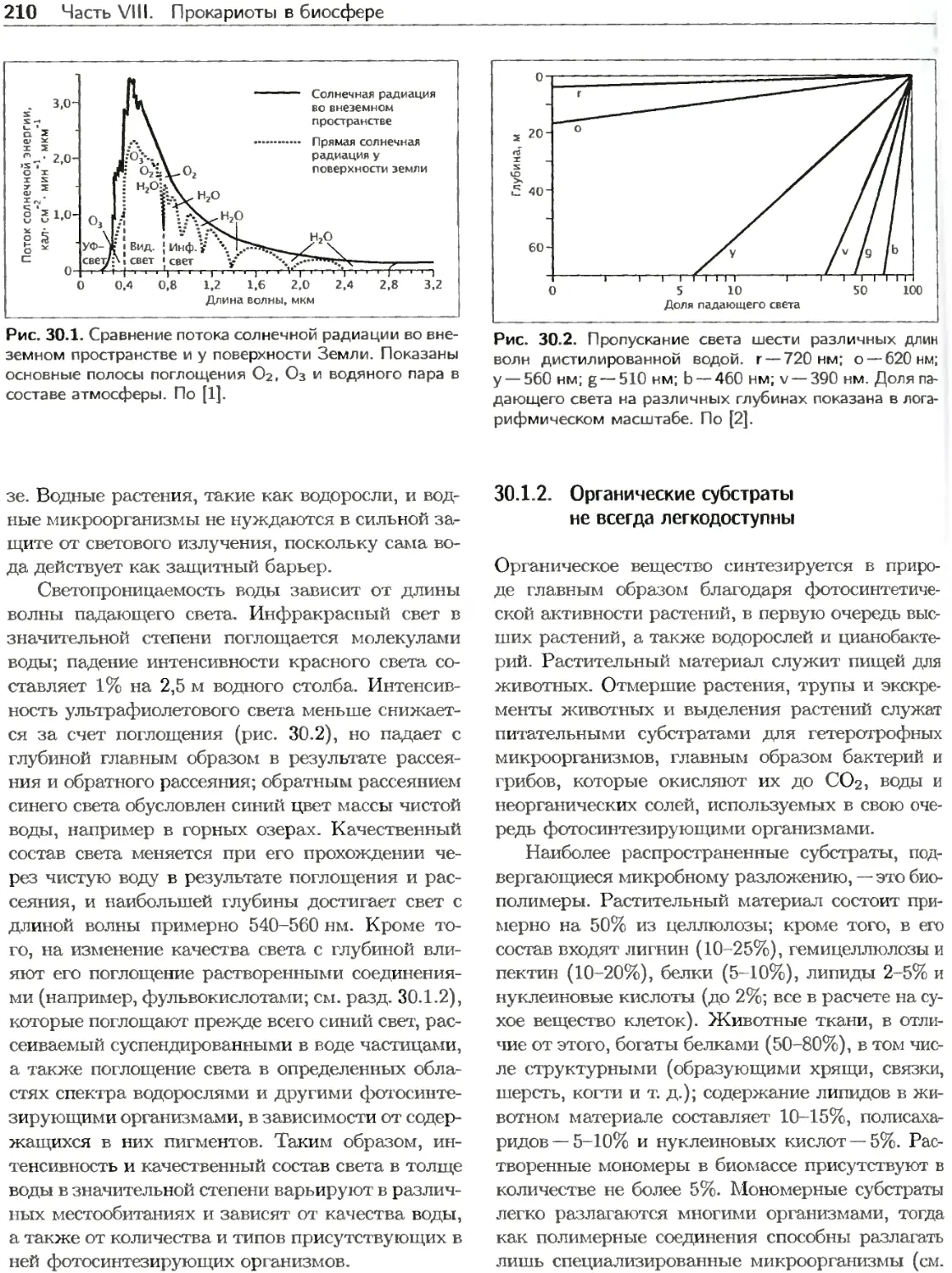
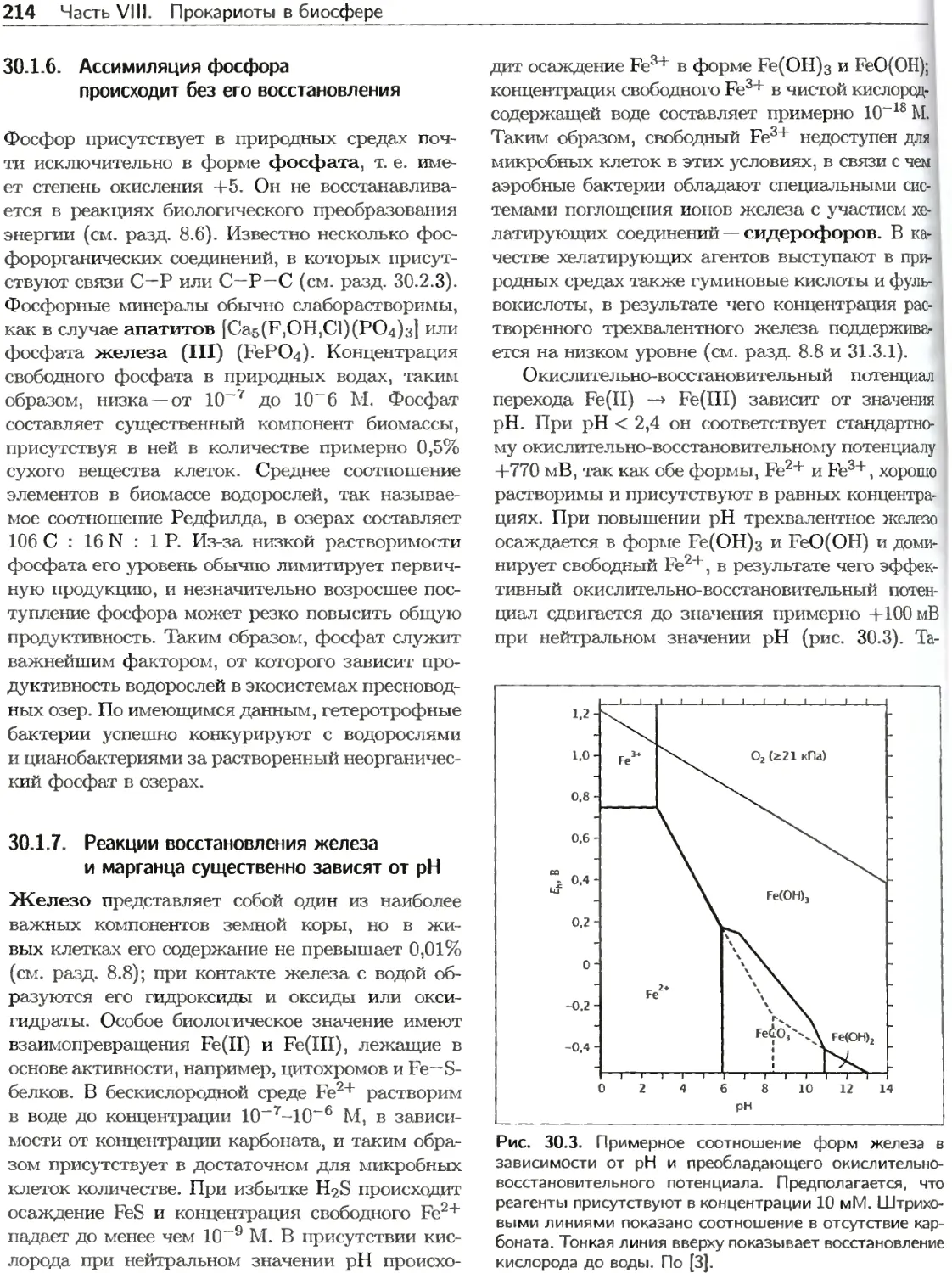
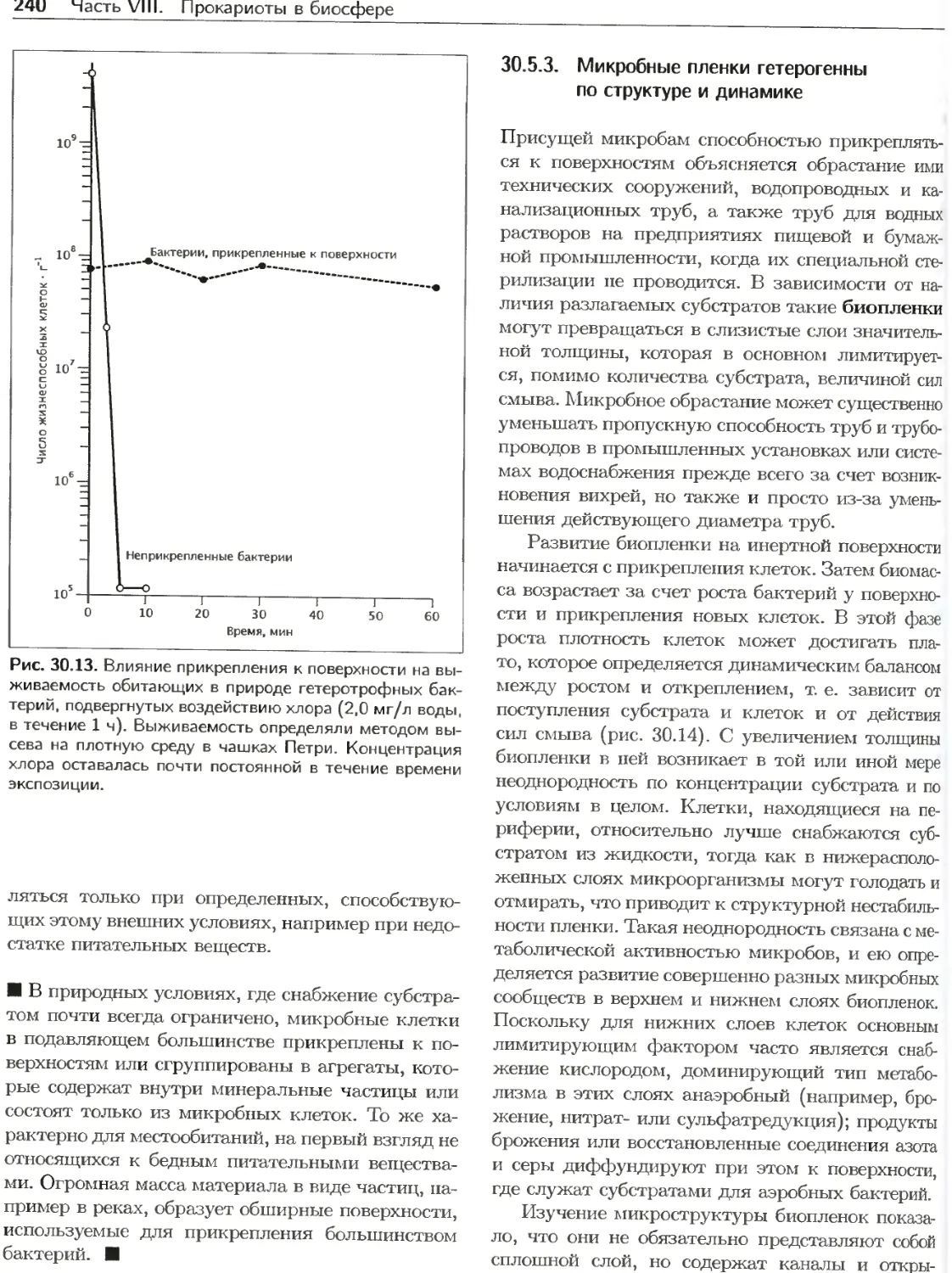
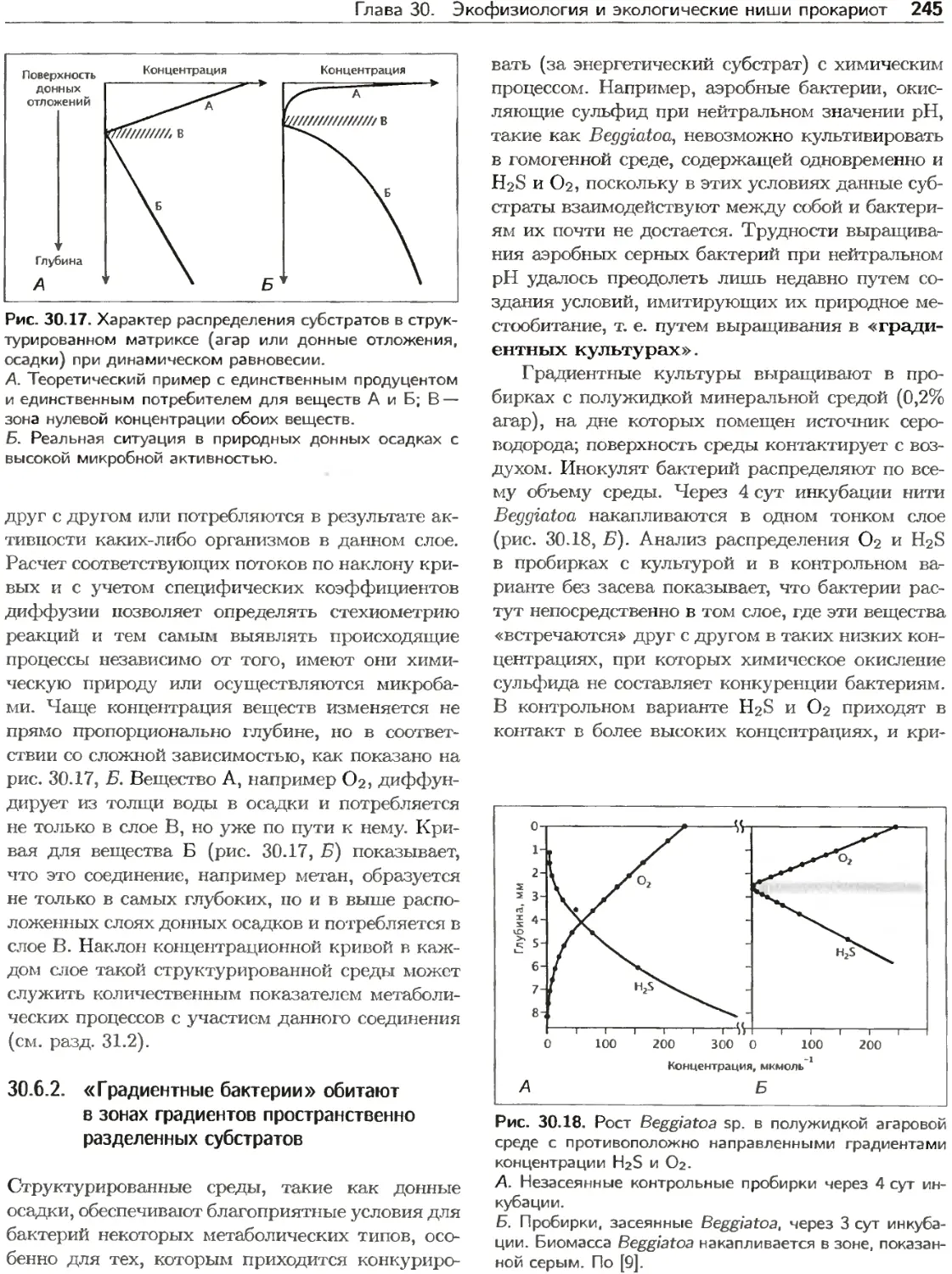
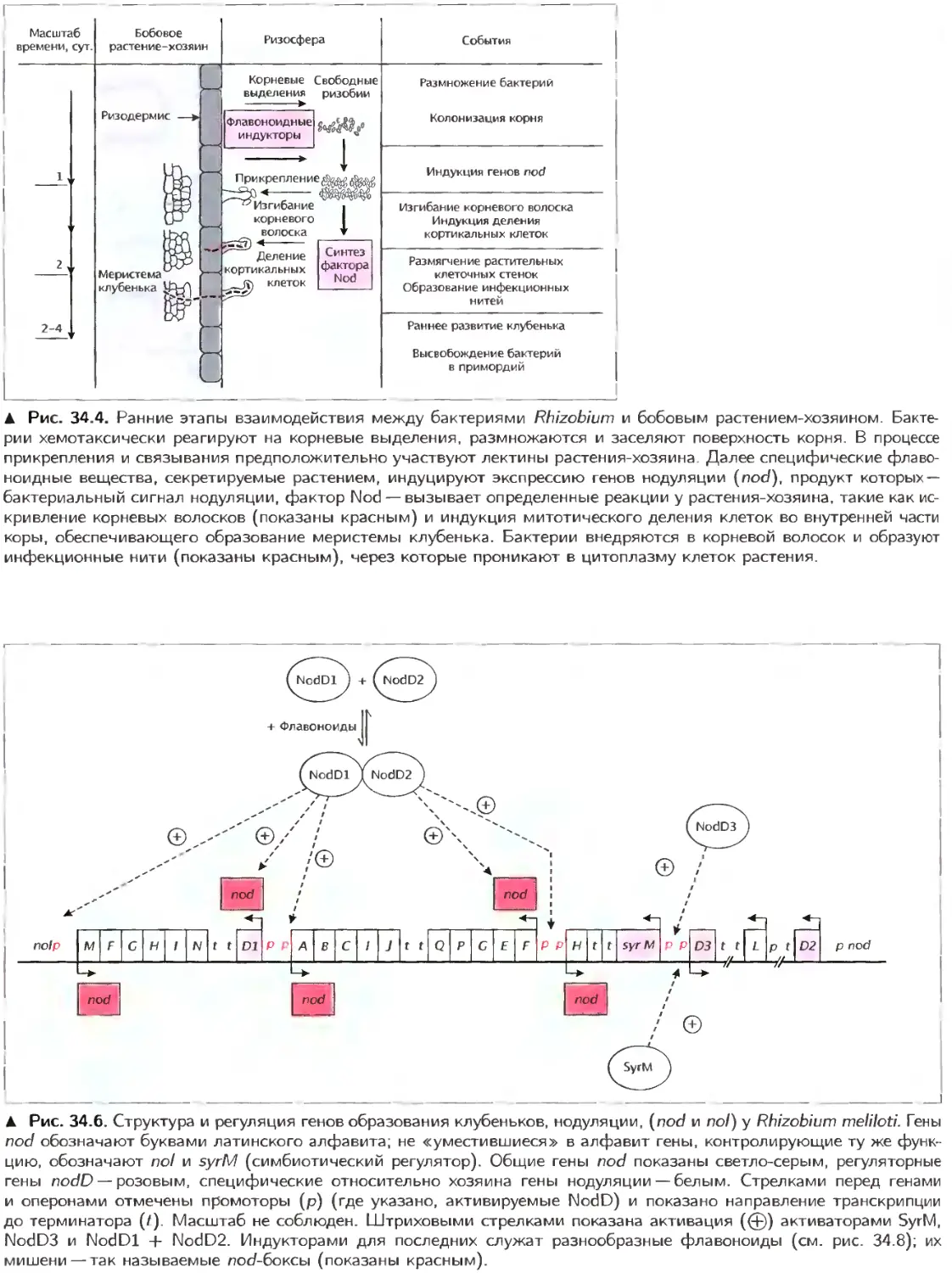
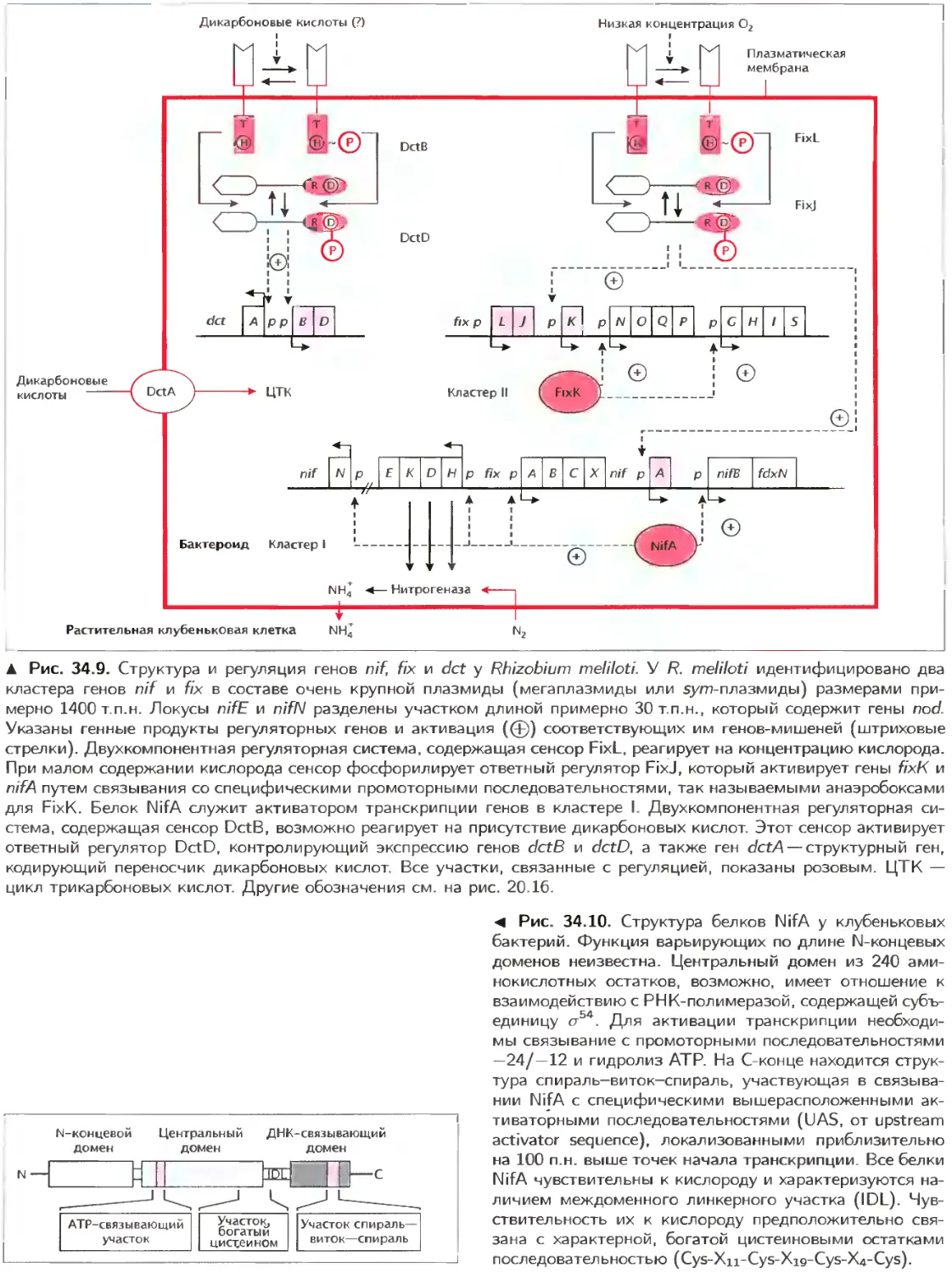
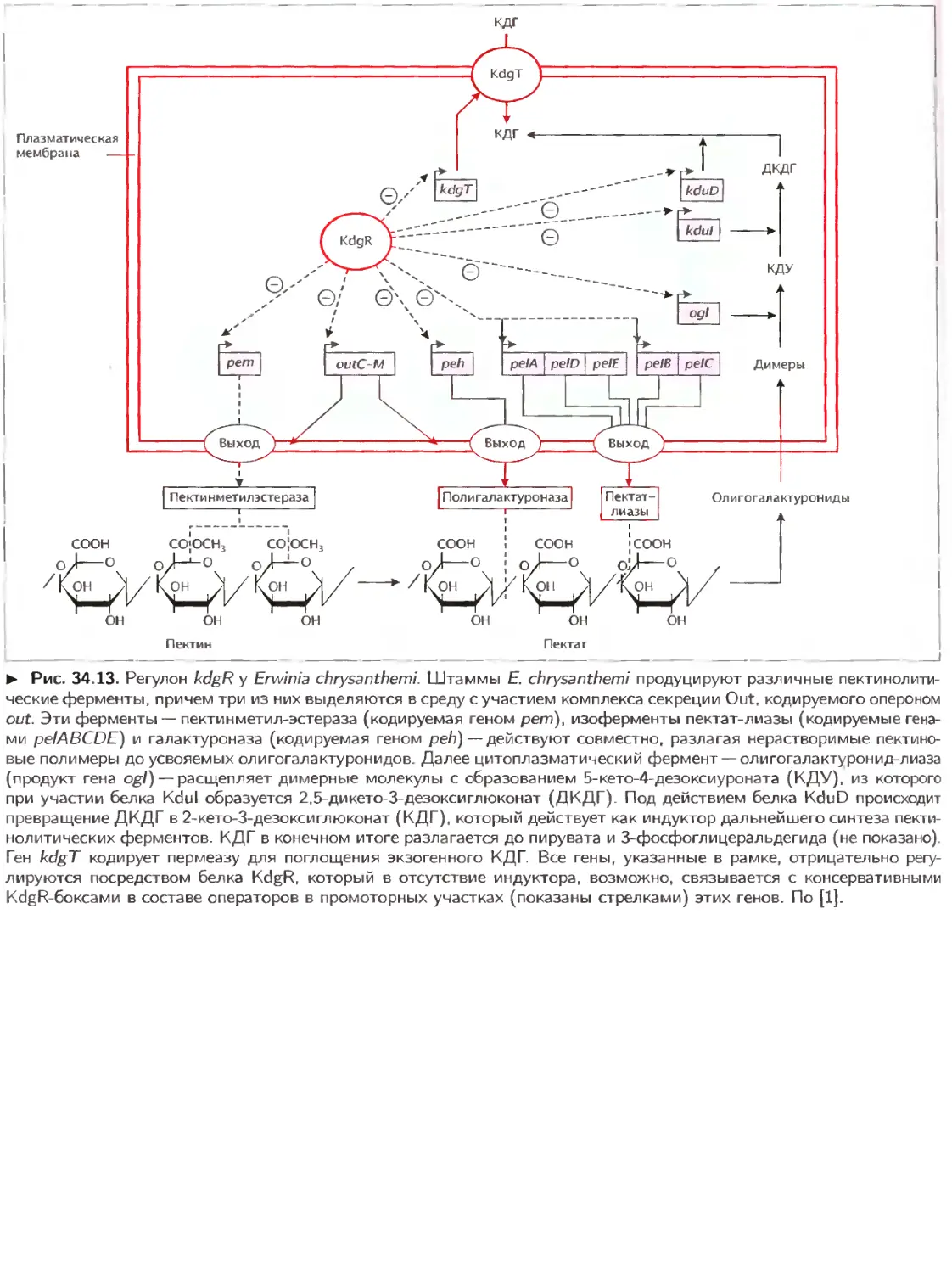
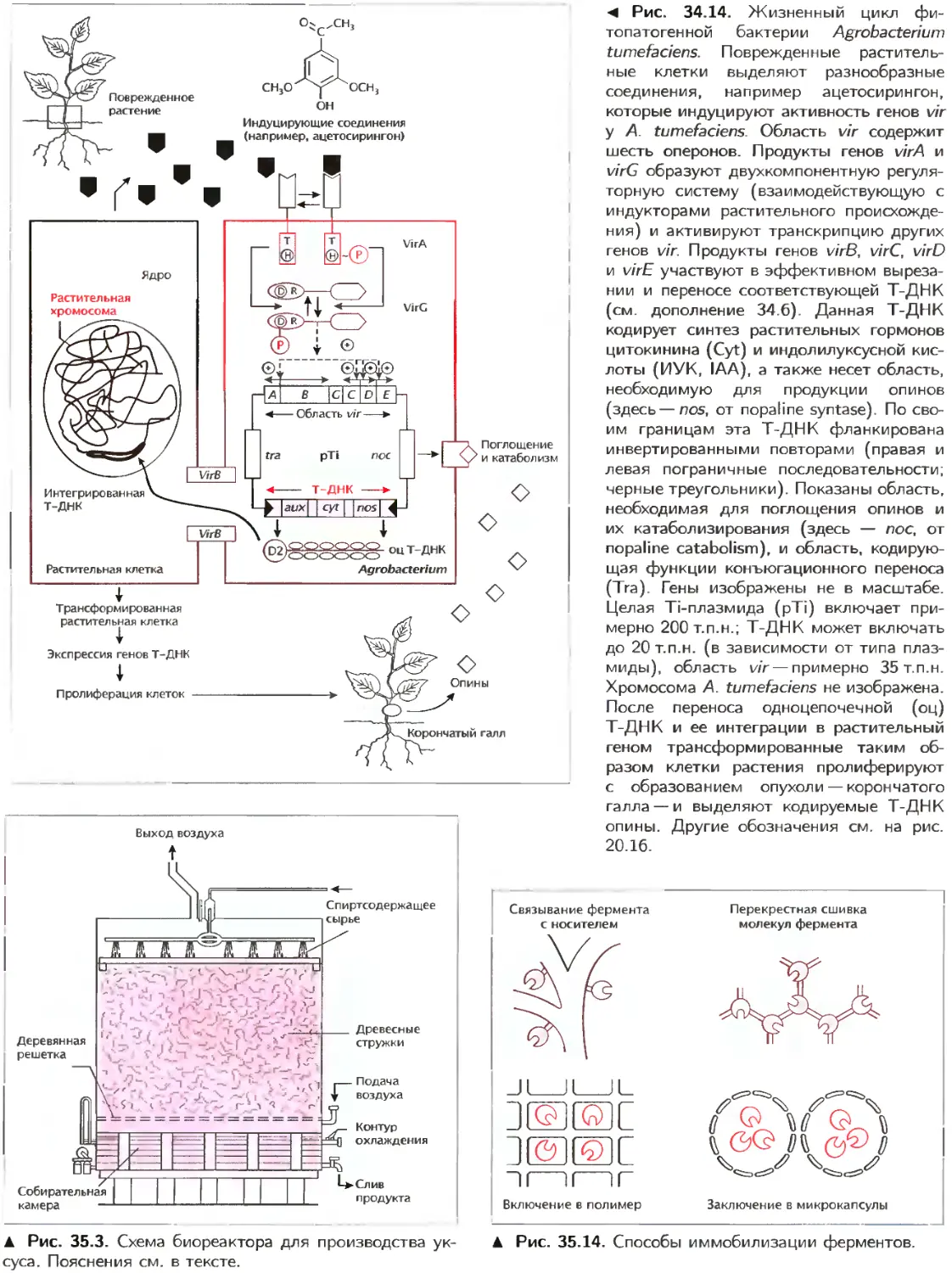
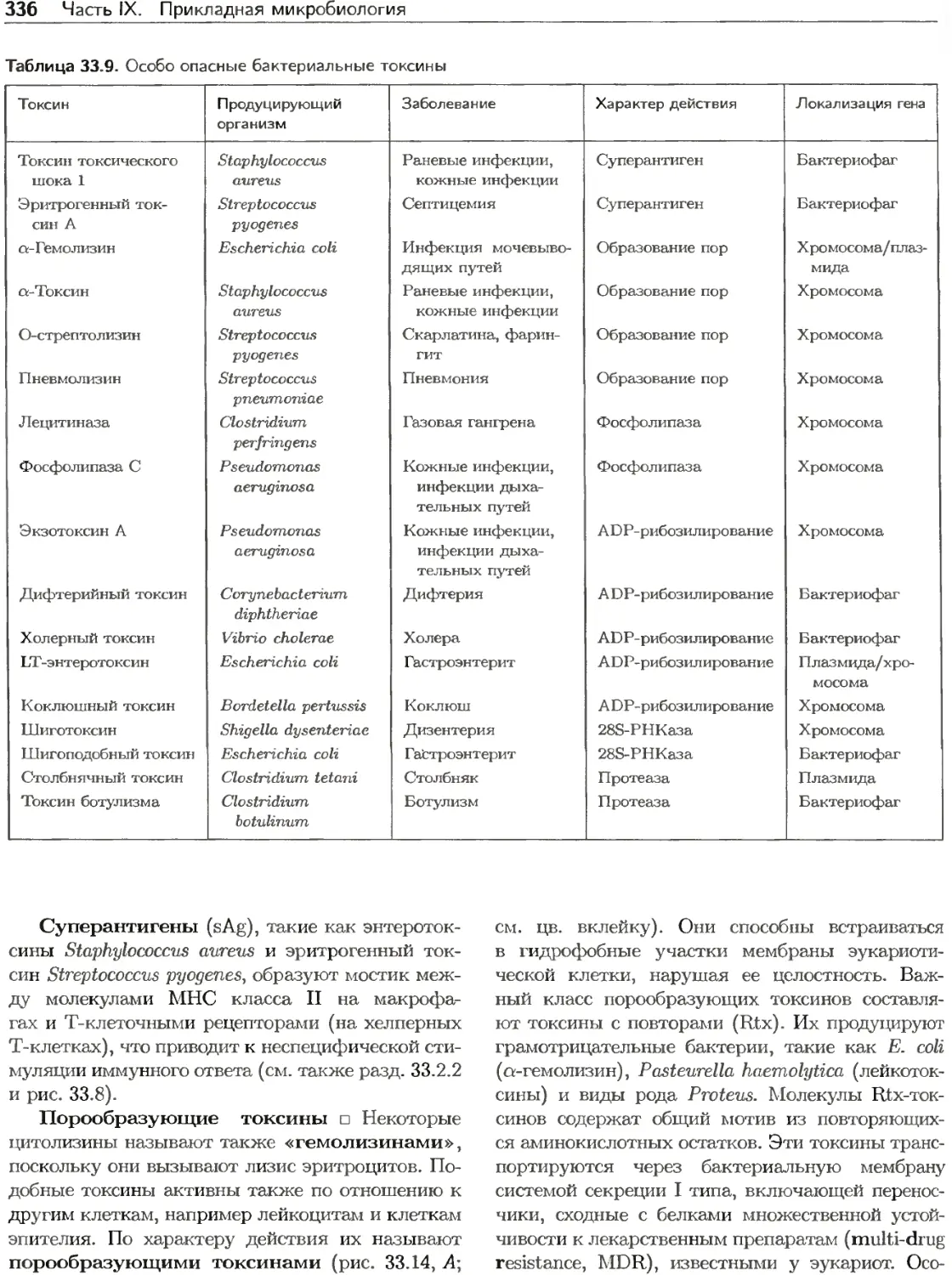
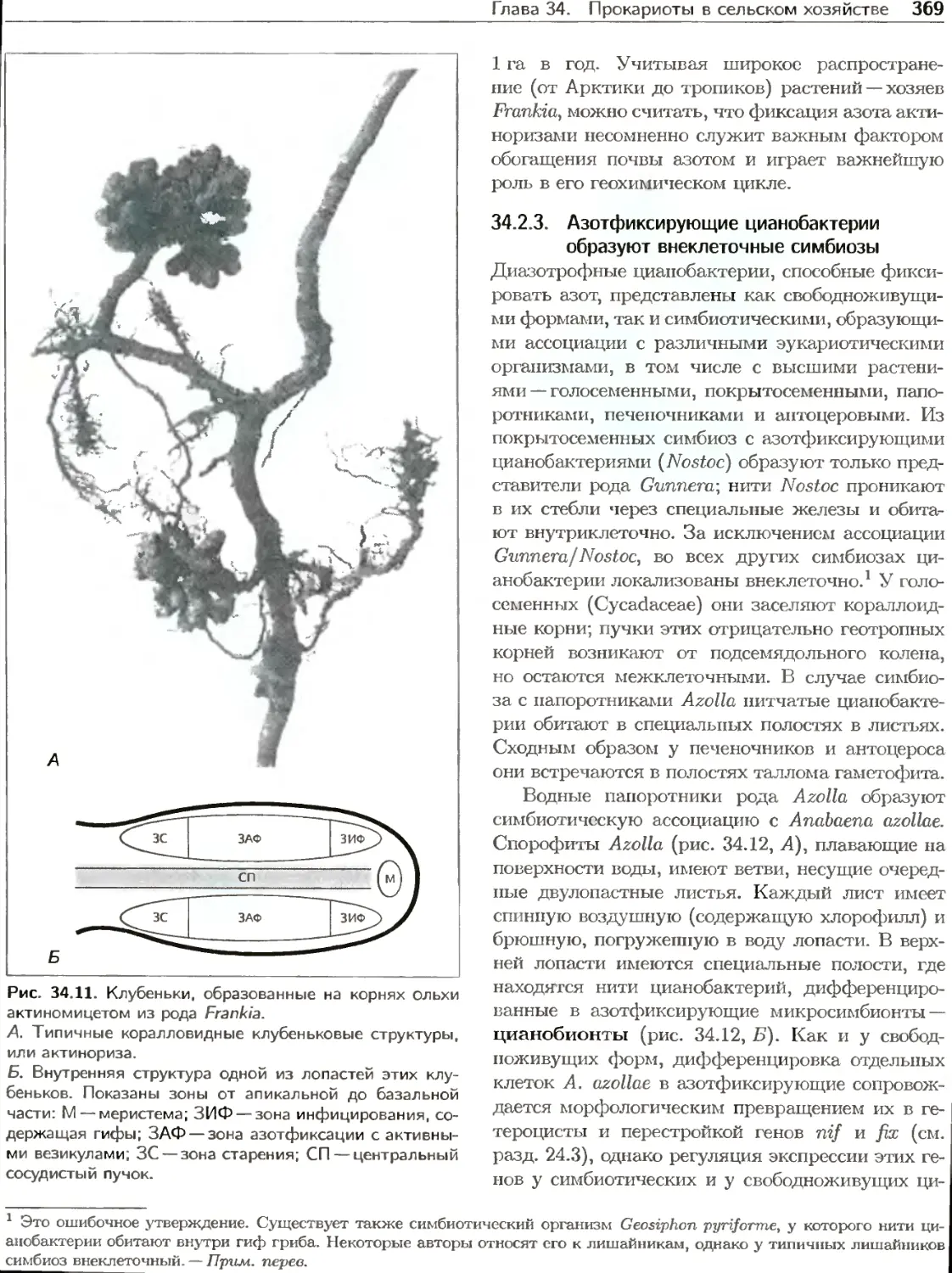
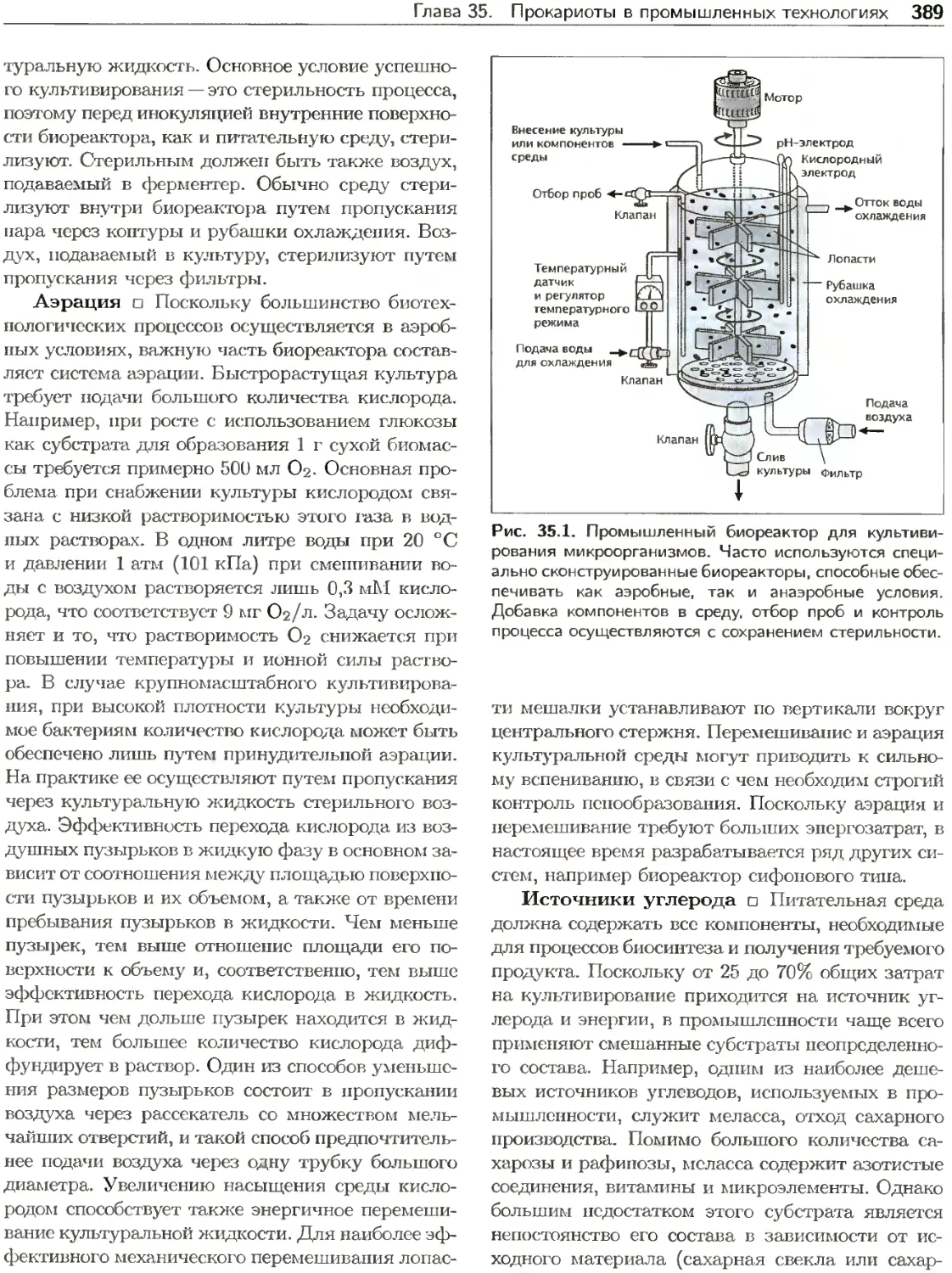
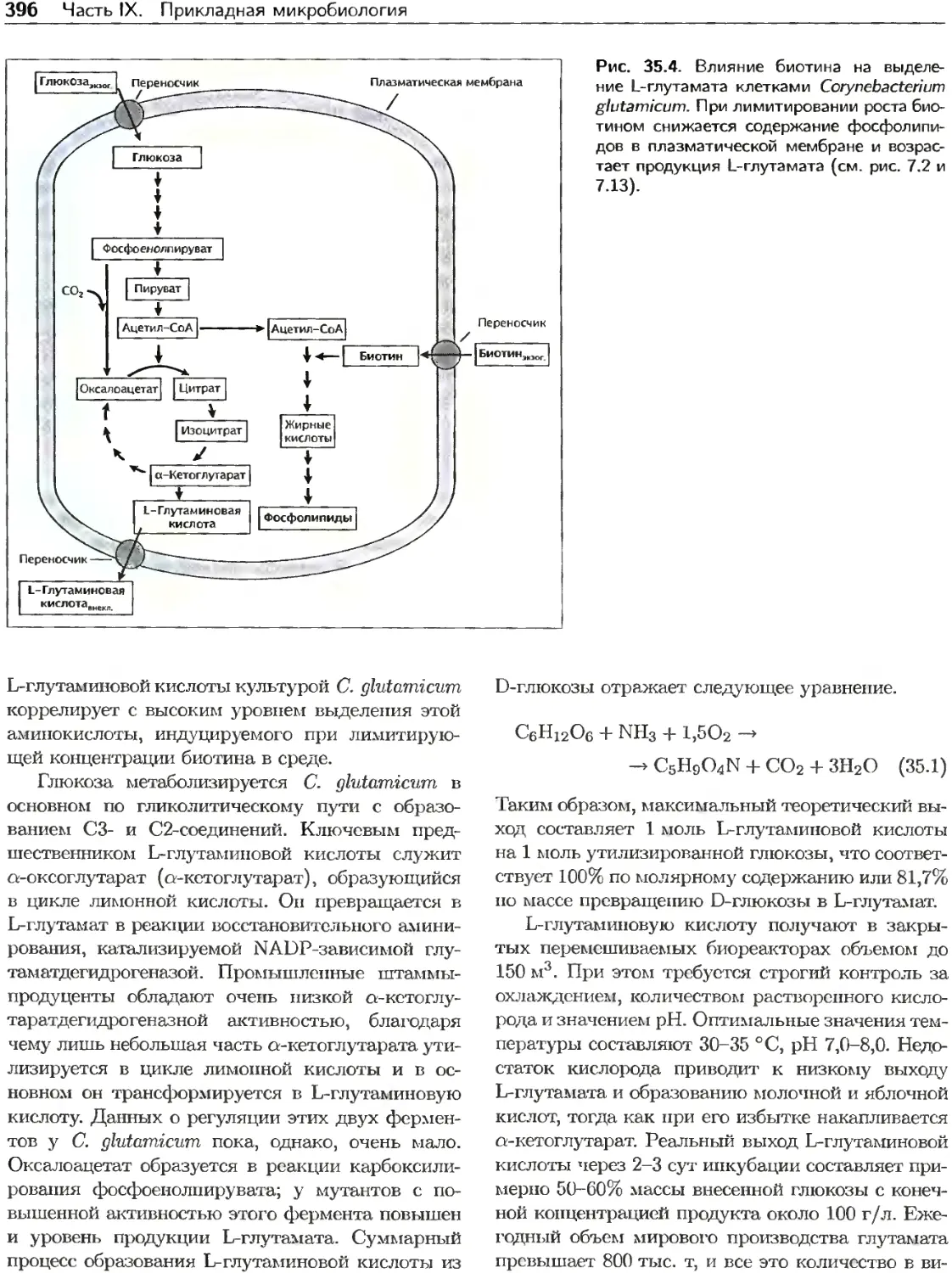
Текст
СОВРЕМЕННАЯ
МИКРОБИОЛОГИЯ
4^ .ч *ь ", 5 к. - Тf к * '
‘ г ПРОКАРИОТЫ
* '1R 4F Alt " WK'
{Л'. S2* J *» J.iri~ i'JJT » ' 9:Я'. J
Л';\
р « Г
L
I/
И.ЛЕНГЕЛЕРЙ
Г. ДРЕВСА
Г. ШЛЕГЕЛЯ
-ТI
F
Л
ё'
: /
Издательство «МИР» '
At Ли •
ЛУЧШИЙ
ЗАРУБЕЖНЫЙ
УЧЕБНИК
современная
микробиология
ПРОКАРИОТЫ
Под редакцией
Й. Ленгелера, Г. Древса и Г. Шлегеля
В 2-х томах
Том 2
Перевод с английского
канд. биол. наук И. В. Алферовой, канд. биол. наук А. В. Лебединского
и канд. биол. наук К. Л. Тарасова
под редакцией
д-ра биол. наук А. И. Нетрусова
Москва «Мир» 2005
Часть VI
РОСТ И ДИФФЕРЕНЦИРОВКА
КЛЕТОК
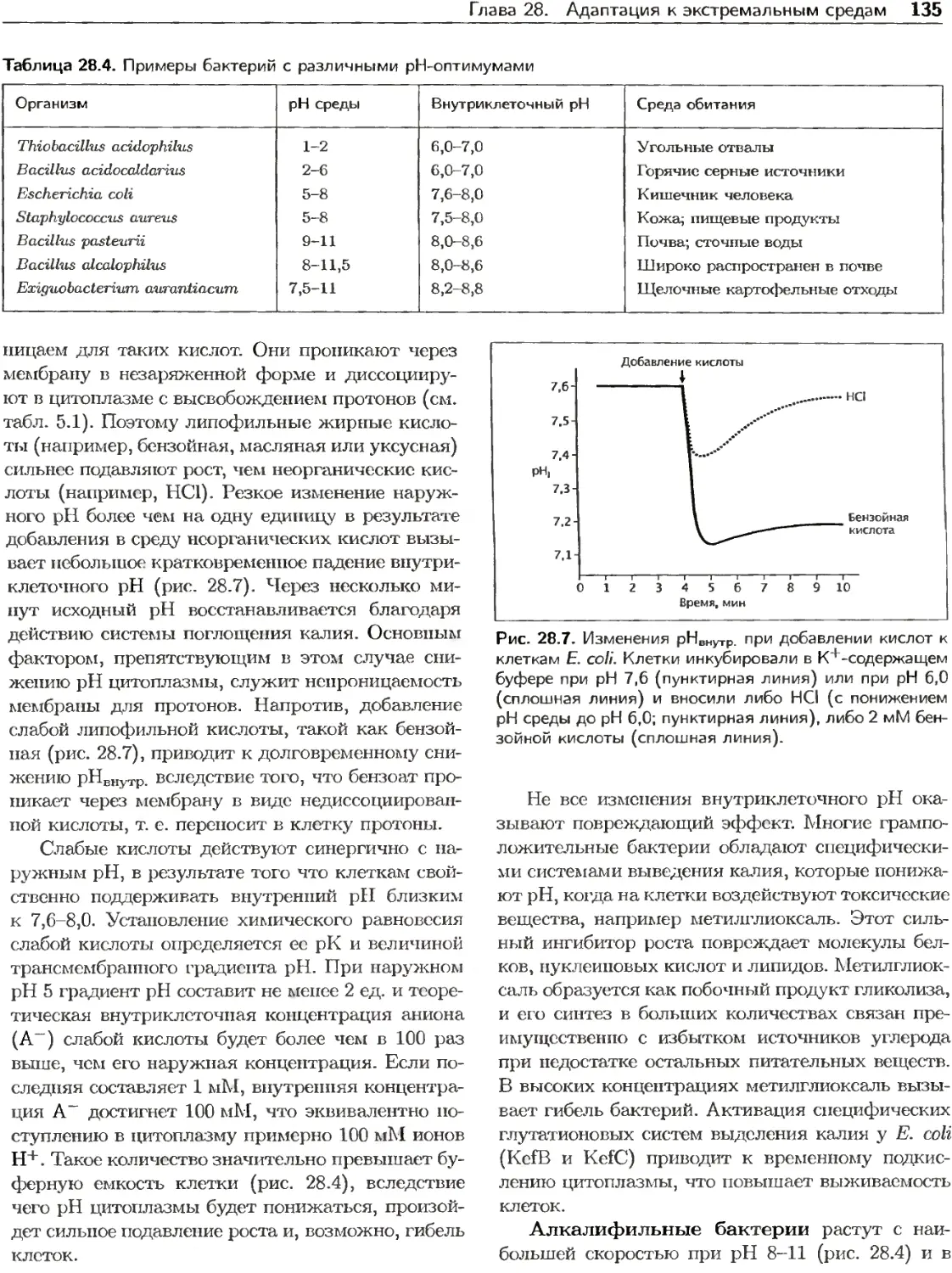
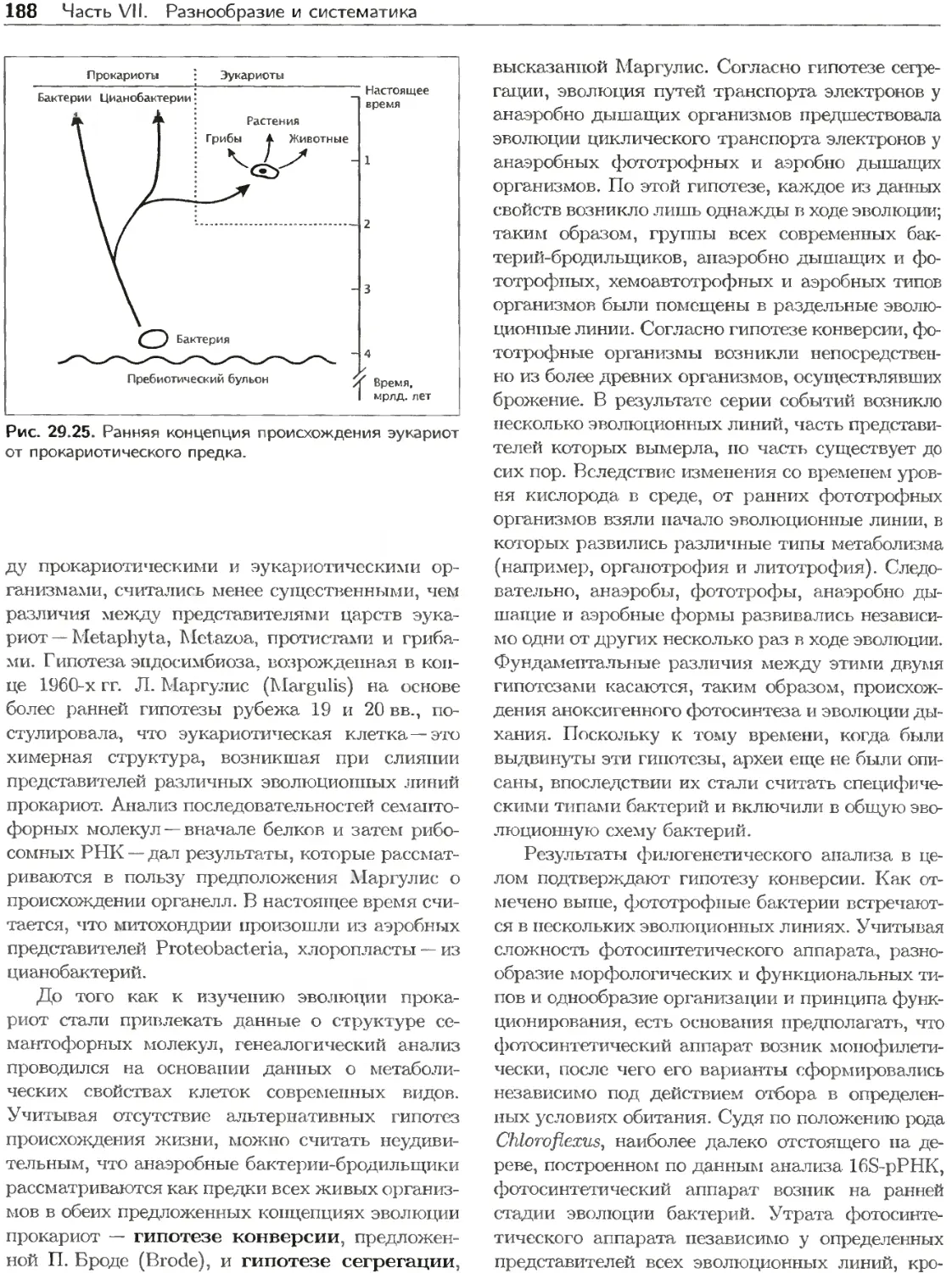
Клетки прокариот подвергаются непосредствен-
ному воздействию физических и химических фак-
торов постоянно изменяющейся среды. В процессе
эволюции они приобрели разнообразные свойства
для конкуренции с другими организмами и ис-
пользования ресурсов экосистем. Некоторые орга-
низмы адаптированы к постоянно экстремальным
условиям, другие обладают необычайной гибко-
стью метаболизма, благодаря которой они могут
жить в местообитаниях с варьирующими услови-
ями (см., например, гл. 28).
Все микроорганизмы способны к быстрым от-
ветным реакциям, например на уровне функ-
ций «домашнего хозяйства», использования пере-
носчиков для поглощения субстратов, выведения
ионов при временном солевом стрессе либо так
называемого переходного процесса при оксиген-
ном фотосинтезе (распределения энергии возбуж-
дения между фотосистемами I и II при различной
освещенности (см. разд. 13.3.1).
Более сложные и длительные процессы изме-
нений на функциональном и структурном уров-
нях под действием тех или условий среды
относят к процессам дифференцировки. Но-
вые функции и структуры появляются благо-
даря регулируемой экспрессии определенных ге-
нов или генных кластеров и морфогенетическим
перестройкам, для которых обычно необходим
синтез белка. Дифференцировка представляет
собой необратимый процесс; в первоначальное со-
стояние клетка может вернуться только посред-
ством нового процесса дифференцировки. В по-
нятие дифференцировки включают изменения
ответных реакций, экспрессии генов, активно-
сти ферментов и в итоге — роста и морфо-
генеза. Дифференцировку могут индуцировать
внутренние сигналы, например клеточного цик-
ла (см. разд. 24.1.1; Caulobacter), но в большин-
стве случаев она начинается под действием сре-
довых стимулов (например, смены аэробных усло-
вий анаэробными или бедной питательной среды
богатой).
Процесс изменения формы и структуры орга-
низма, клетки или части организма посредством
регулируемого роста и клеточной дифференци-
ровки называют морфогенезом. В то же время
сборку вирусов, жгутиков, пилей и других клеточ-
ных органелл называют морфопоэзом, посколь-
ку эти структуры собираются из субъединиц при
участии вспомогательных белков (шеперонов) да-
же в отсутствие роста клетки.
Процессы клеточной дифференцировки интен-
сивно изучаются на молекулярном уровне, что от-
ражено в содержании этой части книги. Ни один
из них полностью пока не изучен, хотя многие
детали уже известны. По-видимому, в основе диф-
ференцировки у бактерий, архей и эукариот ле-
жит ограниченное число механизмов распознава-
ния и амплификации сигнала, общего контроля,
экспрессии генов и образования клеточных струк-
тур. Механизмы распознавания белками своей
мишени и сборки с образованием сложных струк-
тур описаны в разд. 19.4. У прокариот в диффе-
ренцировке участвует система мембран, по-види-
б
Часть VI. Рост и дифференцировка клеток
мому непрерывная, не образующая обособленных
компартментов наподобие тех, которые характер-
ны для эукариотических клеток, но в то же вре-
мя сложным образом организованная. К настоя-
щему времени дифференцировка изучена лишь у
небольшого числа прокариот. Будущие исследова-
ния должны расширить наши знания в этой обла-
сти и раскрыть общие принципы клеточной диф-
ференцировки .
В гл. 22 рассмотрен клеточный цикл бак-
терий— регулируемый и координированный про-
цесс репликации хромосом и клеточного деления.
В гл. 23 описывается образование поверхностных
слоев клеток в качестве структур, важных для
взаимодействия их с окружающей средой. В гл. 24
представлены три примера клеточной дифферен-
цировки и ее регуляции: образование швермер-
ных и стебельковых клеток в клеточном цикле
Caulobacter, мембранная дифференцировка у фо-
тотрофных бактерий и образование гетероцист у
цианобактерий. В гл. 25 описываются процессы
спорообразования, их регуляция у бацилл и стреп-
томицетов, а также образование многоклеточных
структур. В гл. 26 рассмотрены биология и мор-
фопоэз бактериофагов. Глава 27 посвящена опи-
санию процессов биосинтеза антибиотиков и вто-
ричных метаболитов и регуляции этих процессов.
Наконец, в гл. 28 рассмотрены различные аспек-
ты адаптации бактерий к экстремальным место-
обитаниям.
Глава 22
Клеточный цикл бактерий
Рост клеток у всех организмов происходит пу-
тем увеличения их массы и последующего де-
ления с образованием двух идентичных дочер-
них клеток. Жизненный цикл от деления до сле-
дующего деления, называемый вегетативным
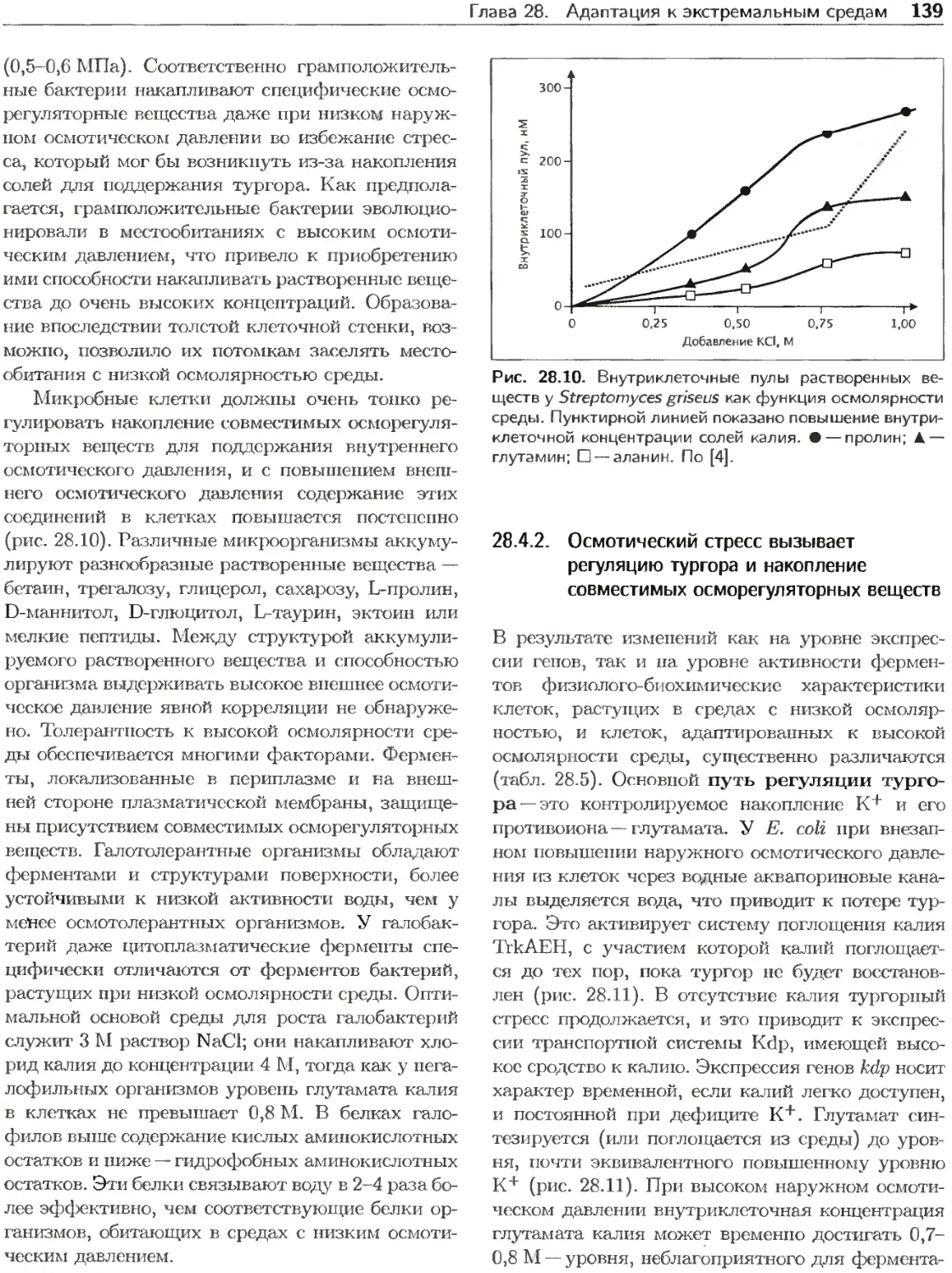
клеточным циклом, включает несколько после-
довательных этапов: удвоение генетического ма-
териала, расхождение двух наборов хромосом и
деление клетки. Эти процессы протекают как ско-
ординированые между собой и с увеличением мас-
сы клетки. Клеточные циклы у прокариотических
клеток и эукариотических клеток во многом сход-
ны, однако бактериальный цикл имеет некоторые
особенности, отсутствующие в цикле у эукариот.
Например, один цикл репликации генетического
материала у бактерий может занимать намного
меньше времени, чем клеточный цикл, и во вре-
мя быстрого роста в одной клетке одновременно
могут происходить два или три цикла репликации
хромосом. В этой главе вегетативный клеточный
цикл описывается главным образом на примере
Escherichia coli.
22.1. Фазы вегетативного клеточного цикла
определяются ключевыми событиями
Этапы клеточного цикла прокариотических и эу-
кариотических клеток приведены в табл. 22.1,
бактериальный клеточный цикл более детально
показан на рис. 22.1 (см. цв. вклейку). Каждый
из этапов характеризуется определенным ключе-
вым событием.
1. В цикле эукариотических клеток существует
начальная фаза — Gapl (от gap — промежу-
ток), сокращенно G1, в течение которой воз-
растает масса клетки. В определенный мо-
мент фазы G1 (точка старта) клетки становят-
ся коммитированными к вхождению в цикл
(начало цикла). У бактерий соответствующая
фаза названа периодом В. При умеренных и
высоких скоростях роста период В отсутству-
ет (см. ниже и рис. 22.4 па цв. вклейке).
2. Во время следующей фазы происходит репли-
кация генетического материала (период С,
или фаза S). У эукариот после завершения
S-фазы начинается фаза Gap2, или G2.
3. Образовавшиеся дочерние хромосомы распре-
деляются в клетке таким образом, чтобы
каждая дочерняя клетка наверняка получила
один полный геном. Этот процесс составляет
первую часть периода D у прокариот и фазу
митоза (М) у эукариот. В процессе митоза у
эукариот участвует сложная структура — ве-
ретено деления, которое служит для распре-
деления дочерних хромосом. Деление клеток с
образованием двух идентичных дочерних кле-
ток у бактерий происходит во второй части
периода D, у эукариот — в фазе цитокинеза.
Вегетативный клеточный цикл у прокариот
включает удвоение генетического материала, рас-
хождение образовавшихся дочерних хромосом и
деление клетки. В нем выделяют три фазы — пе-
риоды В, С и D. Репликация хромосомы происхо-
дит в период С, расхождение дочерних нуклеои-
дов и деление клетки — в период D.
8 Часть VI. Рост и дифференцировка клеток
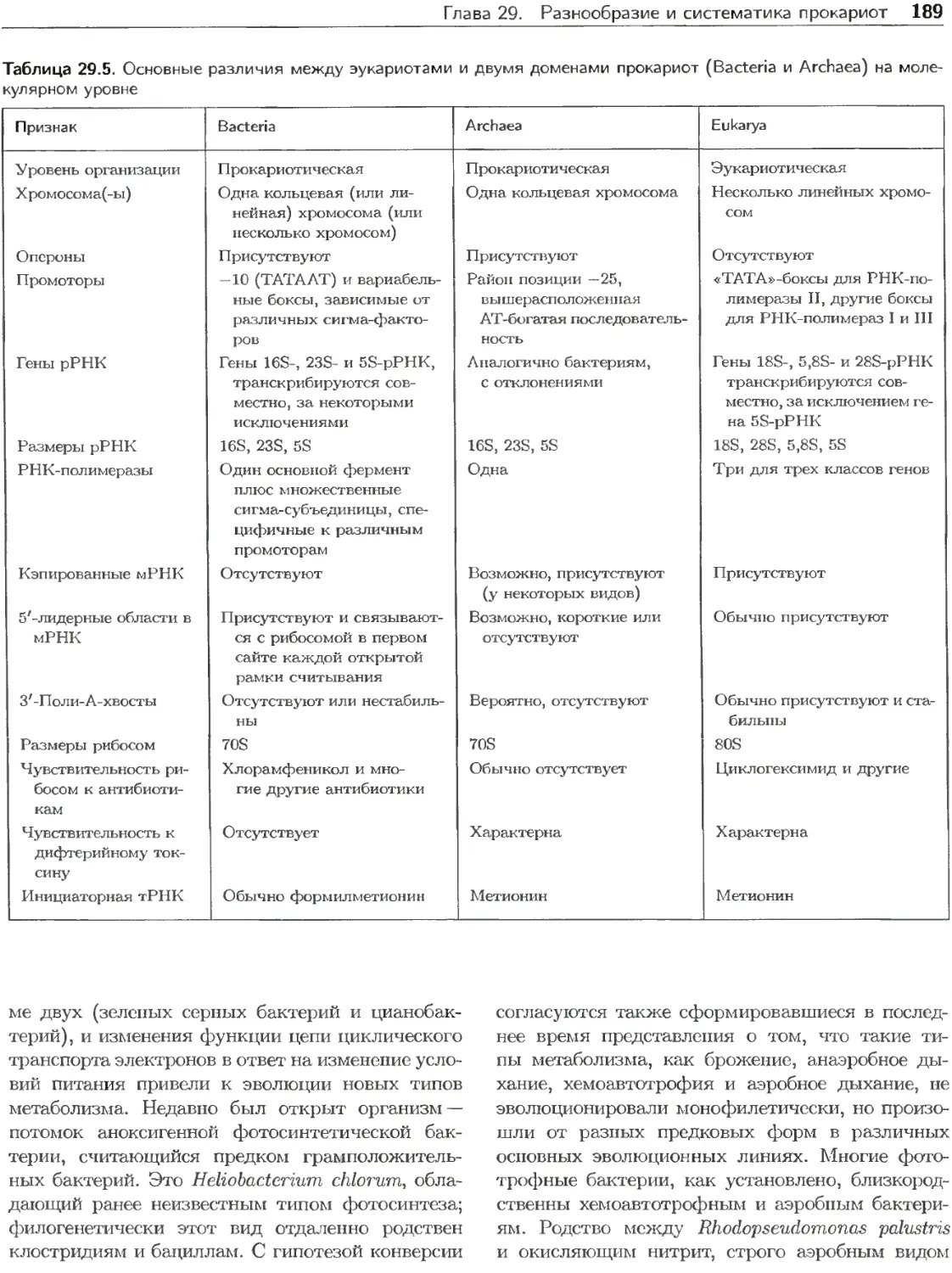
Таблица 22.1. Этапы клеточного цикла прокариотических и эукариотических клеток
Этап Прокариоты Эукариоты
Увеличение массы Синтез ДНК Увеличение массы Расхождение дочерних хромосом Разделение клеток 1 При быстром росте отдельный период В от 2 В фазе G1 имеется контрольная точка старп быть остановлен. 3 Завершение фазы М часто определяют по ; Период В 1 Период С Период D Период D сутствует и циклы ре а. после которой кле эасхождению дочери Фаза Gapl, или G1 2 Синтез ДНК (фаза S) Фаза G2 Митоз (фаза М) 3 Цитокинез пликации перекрываются, точный цикл уже не может их ядер.
22.1.1. Методы определения начала и
длительности этапов клеточного цикла
В экспоненциально растущей бактериальной по-
пуляции клетки находятся на различных стади-
ях клеточного цикла, и для нее характерно такое
распределение их по возрасту, при котором чис-
ло только что разделившихся (образовавшихся)
клеток вдвое превышает число делящихся клеток.
Для изучения клеточного цикла иногда необходи-
мо, чтобы все клетки находились на одной и той
же стадии клеточного цикла, т. е. чтобы популя-
ция была синхронизована (см. ниже).
Время наступления и длительность различ-
ных ключевых процессов клеточного цикла в экс-
поненциально растущих популяциях определяют
следующими способами: 1) методом элюции с
мембраны, 2) путем анализа распределения кле-
ток по размерам и 3) методом проточной цито-
метрии.
Метод элюции с мембраны для исследо-
вания клеточного цикла, предложенный Хельм-
стеттером (Helmstetter) и Купером (Cooper), схе-
матически показан на рис. 22.2 (см. цв. вклейку).
Он состоит в том, что культуру на экспоненци-
альной стадии роста фильтруют через нитроцел-
люлозный фильтр и затем пропускают через него
питательную среду; в процессе роста клеток на
фильтре с него вместе с просачивающейся средой
удаляются только что отделившиеся дочерние
клетки (смывается та из двух разделившихся кле-
ток, которая не прикреплена к фильтру). Анализ
дочерних клеток, образовавшихся через разные
промежутки времени, позволяет изучать последо-
вательность событий клеточного цикла. Этот ме-
тод был использован для измерения длительности
репликации всей хромосомы (периода С) и перио-
да завершения клеточного деления после оконча-
ния репликации (период D), а также для опре-
деления продолжительности периода В в клетках
медленно растущих культур. Использование ме-
ченых плазмид позволяет применять этот метод
для определения тех моментов клеточного цикла,
в которые происходит репликация плазмид.
Клетки растущей культуры можно фракцио-
нировать по размерам (возрасту) с помощью цен-
трифугирования, например в градиенте сахарозы.
Благодаря тому, что клетки меньших размеров
оседают медленнее, чем крупные, путем отбора
отдельных фракций клеток после градиентного
центрифугирования можно получать субпопуля-
ции клеток различных возрастов. Если произве-
сти импульсное мечение экспоненциально расту-
щей культуры (рис. 22.2, Б) и затем фракциони-
ровать клетки по их размерам, то в полученных
фракциях можно определить, например, степень
репликации ДНК. Это позволяет отличать пери-
оды клеточного цикла без репликации ДНК от
тех периодов, в которые репликация происходит,
а также определять число действующих реплика-
ционных вилок.
Проточную цитометрию используют для
анализа распределения клеток по размерам и
содержанию ДНК. Принцип этого метода и ре-
зультаты, получаемые с его помощью для экс-
поненциально растущей культуры Е. coli, пред-
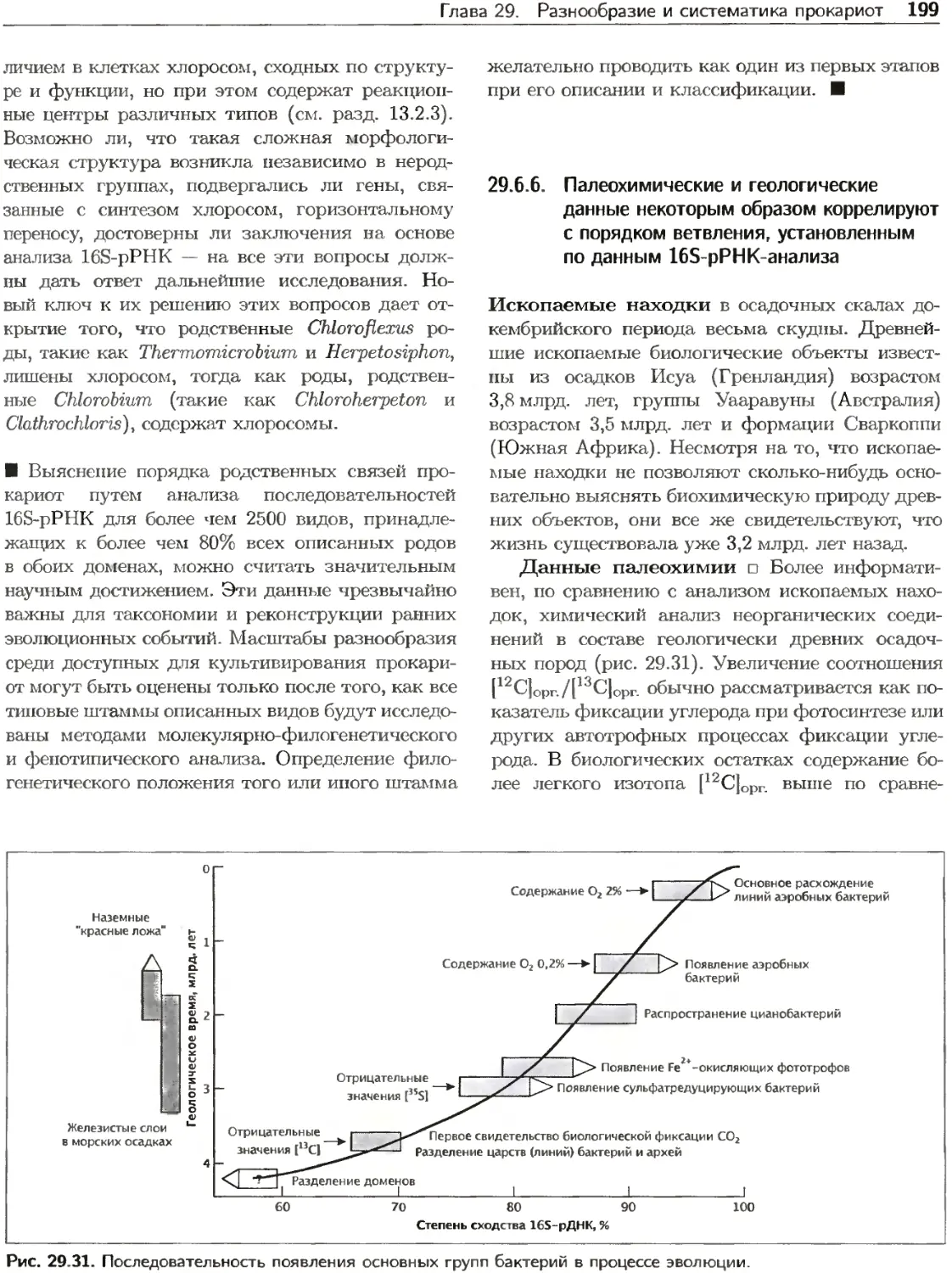
ставлены на рис. 22.3. При низкой скорости роста
(рис. 22.3, А) получаемый четкий максимум кле-
ток с одной хромосомой показывает, что большин-
ство клеток находится в периоде В. При быстром
росте (рис. 22.3, Б) максимумов клеток с целым
числом хромосом не наблюдается вследствие пе-
рекрывания циклов репликации (см. рис. 22.4), по
получаемые данные можно сравнивать с распре-
Глава 22. Клеточный цикл бактерий
9
Рис. 22.3. Проточная цитометрия. Суспензию клеток
пропускают через измерительный оптический прибор.
Проходящий через суспензию свет рассеивается клет-
ками; величина светорассеяния приблизительно про-
порциональна их размерам. Флуоресцентно меченные
клеточные компоненты, например ДНК, при освещении
светом соответствующей длины волны дают фотоэмис-
сию, пропорциональную их содержанию в клетке. Про-
точный цитометр измеряет светорассеяние и флуорес-
ценцию каждой из клеток суспензии. На рисунке пред-
ставлены результаты, полученные для культур Е. coli
с разными скоростями роста: культуры, выращенной в
минимальной среде с ацетатом (медленный рост; А),
и культуры, выращенной в богатой питательной среде
(быстрый рост; Б). Г рафики показывают распределение
клеток популяции по размерам и содержанию ДНК.
делениями в компьютерных моделях, созданных
с использованием различных значений продолжи-
тельности периодов С и D. Таким путем была рас-
считана продолжительность периодов В, С и D
для широкого диапазона скоростей роста.
Продолжительность периода С можно также
рассчитать, зная скорость движения рсплисомы
(т. е. скорость действия механизма репликации,
приблизительно 800 нуклеотидов/с при 37 °C в
случае Е. coli), и размеры хромосомы (4,8 м.п.п.
у Е. coli).
Описанные выше методы применяют при ис-
следовании экспоненциально растущих популя-
ций. Кроме того, для изучения клеточного цикла
используют синхронные культуры, т. е. попу-
ляции, в которых все клетки находятся на одной
и той же стадии клеточного цикла. Синхронизо-
ванную популяцию можно получить путем отбо-
ра новообразованных клеток с помощью метода
элюции с мембраны при 0 °C (рис. 22.2) либо пу-
тем выделения наиболее мелких клеток при цен-
трифугировании в градиенте плотности сахарозы.
Рост клеток такой популяции инициируют добав-
лением свежей, предварительно нагретой пита-
тельной среды. Таким путем получают популя-
ции, в которых все клетки синхронно проходят
клеточный цикл и делятся одновременно. Син-
хронизировать культуры можно также созданием
условий аминокислотного голодания, однако при
этом клетки подвергаются стрессу, способному
вызвать изменение их физиологического состоя-
ния.
22.1.2 . Время начала и продолжительность
периодов клеточного цикла
зависят от условий роста
Применение методов, описанных в предыдущем
разделе, в частности метода элюции с мембраны,
позволило установить, что инициация репликации
хромосом в экспоненциально растущей культуре
происходит в определенный момент клеточного
цикла. Однако время ее начала меняется с изме-
нением скорости роста (рис. 22.4, Б). Продолжи-
тельность периодов С и D почти не зависит от
скорости роста (у Е. coli при 37 °C она равна при-
близительно 40 и 20 мин соответственно). Таким
образом, в зависимости от скорости роста суще-
ственно варьирует продолжительность периода В.
В соответствии с характером корреляции между
событиями клеточного цикла и временем генера-
ции, показанной па рис. 22.4, при уменьшении вре-
мени генерации (г) уменьшается продолжитель-
ность периода В: при т, равном 60 мин, она равна
нулю и при более низких значениях т переходит в
область отрицательных величин. Следовательно,
при т 60 мин инициация репликации происходит
в материнских клетках, при т 30 мин — в клетках
предыдущего поколения. Таким образом, в одной
и той же клетке может одновременно происходить
два или три перекрывающихся цикла репликации
ДНК. По-видимому, это типично для бактерий, в
отличие от эукариотических клеток; у эукариот
подобный феномен не обнаружен.
Продолжительность периодов С и D клеточно-
го цикла почти не зависит от скорости роста, то-
гда как продолжительность периода В возрастает
с увеличением времени генерации.
При быстром росте в бактериальной клетке
протекает одновременно два или три перекрыва-
ющихся цикла репликации хромосомы.
10 Часть VI. Рост и дифференцировка клеток
22.2. Стратегии репликации ДНК хромосом и плазмид
У большинства прокариот жизненно важный и
видоспецифичный генетический материал содер-
жится в одной ковалентно замкнутой кольцевой
(ссс, от covalently closed circular), двухцепочеч-
ной (ds, от double stranded) молекуле ДНК —
бактериальной хромосоме. У. таких бактерий,
как Е. coli и Bacillus subtilis, она содержит
приблизительно 5 м.п.н., у некоторых других бак-
терий (например, Mycoplasma} имеет значитель-
но меньшие размеры (примерно 1 м.п.н.). У ря-
да бактерий (например, видов рода Streptomyces}
клетки содержат, по-видимому, одну или несколь-
ко (до 7 у Rhizobiaceae) линейных хромосом (см.
разд. 14.2).
Как правило, помимо хромосомы бактерии со-
держат дополнительные молекулы ДНК — плаз-
миды, определяющие факультативные свойства.
Размеры плазмид варьируют в диапазоне от
1,5 т.п.н. до более чем 1 м.п.н. Как предполагает-
ся, мегаплазмиду можно отличить от хромосомы
по наличию в последней генов «домашнего хозяй-
ства». Согласно этому критерию, существуют бак-
терии с несколькими хромосомами (о плазмидах
см. разд. 14.3).
22.2.1. Методы изучения репликации
хромосом и плазмид
Известный опыт Мезелсона (Meselson) и Сталя
(Stahl) с переносом клеток из изотопно-тяжелой
в изотопно-легкую среду, первоначально прове-
денный для демонстрации того, что репликация
ДНК осуществляется полуконсервативпым спо-
собом (см. разд. 14.12), позволяет также изме-
рять временной интервал между последователь-
ными этапами репликации. Принцип этого метода
представлен па рис. 22.5 (см. цв. вклейку). В по-
пуляции, растущей экспоненциально в изотопно-
тяжелой среде, ДНК дополнительно метят [3Н]
в течение нескольких минут и затем переносят
клетки в изотопно-легкую среду. При инкубации
клеток в этой среде определяют время, необхо-
димое для следующей репликации радиоактивно
меченной ДНК (рис. 22.5, А, Б). Если репликация
ДНК жестко связана с клеточным циклом, радио-
активная ДНК гибридной плотности не появится
до тех пор, пока не пройдет время удвоения массы
клеток (т. е. один цикл деления) после изменения
плотности среды (рис. 22.5, Б). Это наблюдается
у штаммов дикого типа Е. coli. Таким образом,
в каждой точке начала репликации хромосомы
инициация происходит только один раз в каждом
поколении клеток. Если репликация растянута во
времени, т.ё. инициация репликации в различных
точках начала происходит не одновременно, ДНК
гибридной плотности появляется намного раньше
(рис. 22.5, Б).
Эксперименты с изменением плотности среды
используют также для анализа репликации плаз-
мид и мини-хромосом (искусственных плазмид,
которые реплицируются с той же точки начала,
oriC, что и хромосома; они представляют собой
удобные модели для изучения хромосомной ре-
пликации; см. разд. 14.1.3). Такие эксперименты
проводят, как описано выше, но долю радиоактив-
но меченных плазмид во фракциях определяют
методом гибридизации. Как установлено, плазми-
ды реплицируются случайным образом и в отно-
шении выбора копии для репликации, и в отно-
шении момента начала репликации в клеточном
цикле: меченая плазмидная ДНК средней плот-
ности появляется вскоре после изменения плотно-
сти среды и количество ее снижается экспоненци-
ально (рис. 22.5, Б). Однако существует эклипс-
период, в течение которого новореплицированная
плазмида не может принимать участия в следую-
щей репликации (рис. 22.5, Б). В отличие от этого,
репликация мини-хромосом происходит так же,
как и репликация природных хромосом.
Следует отметить, что эксперименты с измене-
нием плотности среды позволяют определять про-
межуток времени между двумя циклами репли-
кации того или иного репликона, по не момент
клеточного цикла, в который она инициируется.
Кроме того, если в каждой клетке в течение од-
ного цикла деления происходит более одной ини-
циации, экспоненциальная кривая указывает на
случайный выбор копий для репликации; это на-
блюдается в случае плазмид.
Глава 22. Клеточный цикл бактерий 11
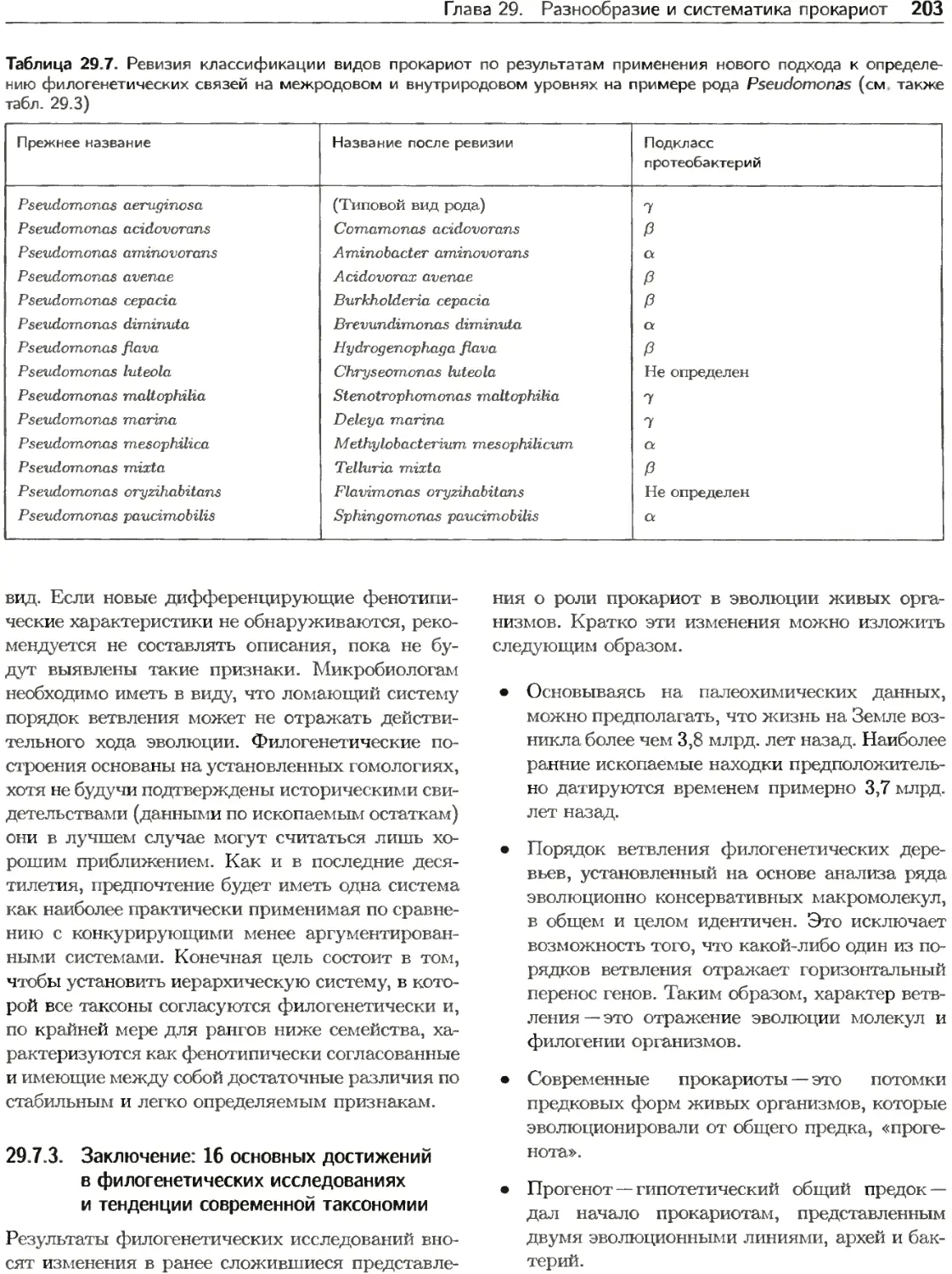
Рис. 22.6. Репликация хромосомы у Е. coli.
А. Генетическая карта Е. coli показывает локализацию
опС и terC. Цифрами по кругу указаны координаты кар-
ты (в минутах).
Б. Градиент числа копий генов в экспоненциально рас-
тущих популяциях бактерий. Продолжительность пери-
одов С и D 40 и 20 мин соответственно. Приведены кри-
вые для трех значений времени генерации т.
22.2.2. Репликация хромосом
включает три процесса
В ходе репликации последовательно протекают
этапы, называемые инициацией, элонгацией и тер-
минацией.
1. Инициация. Кольцевые бактериальные хро-
мосомы реплицируются в двух направлениях
с одной (единственной) точки начала (опС);
встреча двух реплисом происходит в области
точки окончания (ierC) (рис. 22.6, Л). Мо-
лекулярный механизм репликации описан в
разд. 14.1.2. В клетках растущих культур ге-
ны, расположенные вблизи точки начала ре-
пликации, присутствуют в большем числе ко-
пий, чем гены, расположенные ближе к обла-
сти окончания. Среднее число копий данного
гена на клетку (F) в экспоненциально расту-
щей популяции составляет
р __ 2lc(i-x)+D]/r,
где С и D — соответствующая продолжитель-
ность периодов С и D, т — время генерации
и х — относительная удаленность гена от oriC
(для oriC х = 0, для terC х = 1). Это урав-
нение позволяет определять градиент числа
копий генов от oriC к terC (рис. 22.6, Б).
Кроме того, если провести гибридизацию с
ДНК-зондами, комплементарными oriC и
terC или генам в непосредственной близости
от этих областей, с его помощью можно уста-
новить продолжительность периода С:
F oric/FterC ~
От продолжительности периода D данное со-
отношение, как видно из формулы, не зависит.
Множественные акты инициации репликации
во время быстрого роста скоординированы.
2. Этап элонгации (формирование цепи ДНК)
не требует синтеза белка de novo, в связи с чем
подавление синтеза белка хлорамфениколом
или синтеза РНК рифампицином приводит
лишь к постепенной остановке синтеза ДНК;
начавшийся процесс репликации продолжа-
ется до завершения (инерционная реплика-
ция) (рис. 22.7, Л; см. цв. вклейку). У Е. coli
при 37 °C инерционная репликация продол-
жается 40 мин, что четко продемонстриро-
вано в экспериментах с вытеснением метки
(рис. 22.7, Л). Во время инерционного синте-
за количество ДНК в культуре возрастает, и
это его относительное повышение, называемое
приростом, может быть рассчитано следую-
щим образом.
Среднее число копий генома на клетку (G)
равно:
G = (т/С • In 2) • [2(c+D)/t - 2d/t]
Прирост количества ДНК после добавления
рифампицина составляет:
Прирост + 1 = Foric/G =
= С-1п2/[т(1 -2~с/т)]
Следовательно, прирост ДНК увеличивается
с повышением скорости роста (рис. 22.7, Б).
В конце эксперимента с ингибированием
антибиотиком клетки содержат только пол-
ные хромосомы, число которых равно числу
имеющихся в клетках на момент добавления
рифампицина точек начала репликации. Это
показывает цитограмма, полученная методом
проточной цитофлуорометрии (рис. 22.7, В;
результат контрольного опыта без добавления
рифампицина см. на рис. 22.3).
Часть VI. Рост и дифференцировка клеток
Проточную цитометрию можно также ис-
пользовать для изучения координации мно-
жественных инициаций репликации в одной
клетке. Если все копии oriC в каждой клетке
инициируются одновременно, в эксперимен-
те с ингибированием репликации антибиоти-
ком культура будет содержать клетки с 1, 2,
4 или 8 копиями генома (рис. 22.7, В); это
так называемый синхронный фенотип. Если,
однако, инициация репликации в различных
точках oriC происходит не одновременно, ри-
фампицин может блокировать инициацию ре-
пликации в некоторых клетках прежде, чем
осуществятся все инициации. В этом случае
цитограмма зафиксирует также клетки с 3, 5,
6 или 7 эквивалентами генома — асинхронный
фенотип (рис. 22.7, В). Чем больше растяну-
то в сумме время репликаций, тем больше мо-
жет быть это ненормальное число эквивален-
тов генома. Следует отметить, однако, что та-
кой результат возможен также в случае, если
инициация репликации в разных точках нача-
ла происходит одновременно, но в некоторых
клетках инициируются не все точки начала
репликации. Теоретически, 4 или 8 эквивален-
тов генома могут образоваться при участии
механизма, который выбирает точки начала
для инициации случайным образом, но всегда
обеспечивает точное удвоение числа точек на-
чала репликации в течение какого-то коротко-
го периода в клеточном цикле.
У Е. coli в последовательностях GATC оста-
ток аденина метилирован Dam-ферментом
(ДНК-аденинмети лазой). После репликации
одна из цепей остается неметилированной
(т. е. в целом молекула ДНК полуметилирова-
на). В области oriC присутствует двенадцать
сайтов GATC (см. разд. 14.1.3) и в полумети-
лированной ДНК oriC не может участвовать
в новой инициации. По-видимому, это часть
механизма, запрещающего последовательные
инициации одной и той же точки начала ре-
пликации. Мутации, которые обусловливают
образование неактивного фермента Dam, при-
водят к потере координации множественных
инициаций репликации, т. е. к асинхронному
фенотипу (рис. 22.7, В; см. также разд. 14.1).
Асинхронную инициацию репликации можно
получить, заменив oriC плазмидным репли-
коном (штаммы inRl\ интегративная супрес-
сия). Асинхронная инициация не летальна для
клеток и проявляется незначительным умень-
шением скорости роста.
3. Терминация. Область окончания реплика-
ции (terC) фланкирована последовательно-
стями ter, которые блокируют продвижение
реплисомы; для ее остановки необходимо, что-
бы белок Tus (от terminus utilising substance)
связался с последовательностями ter. Флан-
кирующие последовательности имеют проти-
воположную полярность. Таким образом, две
реплисомы встречаются в области terC. Био-
логическое значение области terC не ясно, так
как она может быть делетирована без ущер-
ба для клеток. Однако делеция хотя бы од-
ной из фланкирующих областей оказывает по-
вреждающее действие, возможно из-за того,
что затрудняется преодоление остановки реп-
лисомы на последовательности ter. Некото-
рые негативные последствия однонаправлен-
ной репликации ослабляет инактивация ге-
на tus. Область terC может быть важна для
поддержания оптимального числа копий генов
или для правильного разделения новообразо-
ванных хромосом. При рекомбинации область
terC выполняет роль горячей точки.
22.2.3. Репликация плазмид
происходит автономно
Плазмиды как внехромосомные генетические эле-
менты автономны и обладают способностью ре-
гулировать свою репликацию (см. разд. 14.3).
Репликация плазмид не зависит от отдельных эта-
пов репликации хромосом и от стадий клеточ-
ного цикла; они реплицируются случайным об-
разом на протяжении всего клеточного цикла.
Среди плазмид внутриклеточной популяции неко-
торые не реплицируются пи разу, другие —один
раз или два и более раз в цикле клеточного де-
ления. Это установлено при изучении реплика-
ции ДНК во фракциях клеток определенных раз-
меров (= возраста) в экспериментах по методу
Мезелсона-Сталя с изменением плотности среды
и в экспериментах с использованием метода элю-
ции с мембраны.
Случайным образом происходит также вклю-
чение в репликацию тех или иных копий плазмид
из присутствующих в клетке. Если клетка содер-
жит два меченных по-разному производных од-
ного плазмидного репликона, случайный харак-
Глава 22. Клеточный цикл бактерий 13
тер выбора для репликации приводит к искаже-
нию пропорции между числом копий этих двух
производных, причем такому, которое не может
быть исправлено позднее (в этом состоит одна из
причин несовместимости плазмид; см. разд. 14.3).
В итоге образуются культуры, все клетки которых
содержат только один из двух видов плазмидных
производных.
22.3. Нуклеоид прокариотической клетки эквивалентен
ядру эукариотической клетки
Нуклеоид (см. рис. 2.17, В и 14.13) как область
локализации хромосомы в клетках бактерий
содержит также все белки, необходимые для тран-
скрипции и репликации ДНК и процессинга нук-
леоида. Репликация ДНК и расхождение дочер-
них хромосом скоординированы, но строго не
коррелируют с клеточным делением. Процесс раз-
деления дочерних хромосом/нуклеоидов и пере-
мещения их к центрам будущих дочерних клеток
называют расхождением.
Процесс разделения дочерних хромосом/нук-
леоидов назван расхождением.
22.3.1. После репликации хромосом
начинается процессинг нуклеоида
Бактериальную хромосому, неким образом свя-
занную с плазматической мембраной, можно
выделить из клетки в виде крупного комплекса
ДНК-РНК-мембрана, так называемой конден-
сированной хромосомы. В этом виде хромо-
сомы быстро (>2000 S) осаждаются при центри-
фугировании в градиенте сахарозы. При изуче-
нии нуклеоидов с помощью световой микроскопии
клетки в большинстве случаев обрабатывают
хлорамфениколом для отделения нуклеоида от
мембраны, затем фиксируют и производят окра-
шивание ДНК. Эти процедуры приводят к кон-
денсации ДНК, и в результате кажется, что
нуклеоид занимает относительно малую часть
клетки. Если, однако, произвести прижизненное
окрашивание, т. е. окрасить ДНК, не обрабаты-
вая клетки хлорамфениколом и не фиксируя, ста-
новится видно, что хромосома занимает значи-
тельную часть объема клетки. Это заключение
подтверждают электронно-микроскопические ис-
следования. Вместе с тем при репликации и раз-
делении цепей ДНК имеют место этапы конденса-
ции и релаксации хромосом.
После завершения репликации две дочерние
хромосомы часто оказываются спутанными и
сцепленными. Следовательно, для того чтобы фи-
зически разделиться, они должны быть вначале
расцеплены. На последней стадии деления нук-
леоида дочерние хромосомы передвигаются в цен-
тры будущих дочерних клеток. Весь этот про-
цесс соответствует митозу у эукариот. Согласно
последним данным, расхождение хромосом про-
исходит не резко, а постепенно.
Нарушение расхождения нуклеоидов ранее
предполагалось у мутантов Рат-, характеризую-
щихся неправильной морфологией нуклеоида и
затрудненным расхождением дочерних нуклеои-
дов. По характеру деления клеток они сходны
с мутантами Min, так как осуществляют поляр-
ные деления, в результате которых образуются
клетки без ДНК (см. ниже). Позднее было об-
наружено, что Раг~-мутанты дефектны по генам
ДНК-гиразы и других топоизомераз, вследствие
чего у них нарушено развитие процесса реплика-
ции ДНК. По этой причине у данных мутантов не
наблюдалось и расхождения хромосом.
Впоследствии удалось получить мутанты, ли-
шенные функции расхождения хромосом. Значи-
тельная часть клеток этих мутантов (до 15%)
не получает хромосомной ДНК при делении.
Соответствующие мутантные гены были назва-
ны тпикА и тпикВ. Белок MukA оказался иденти-
чен описанному ранее белку наружной мембраны,
То1С, тогда как белок MukB — весьма крупный по-
липептид (мол. масса «180 кДа) — до этого не был
известен. Белок MukB содержит несколько доме-
нов: ДНК-связывающий домен, домен TAP-азы и
область, сходную с белками — генераторами силы
растяжения. Возможно, это часть системы, ана-
14 Часть VI. Рост и дифференцировка клеток
логичной аппарату веретена деления у эукариот.
Вместе с тем аналога центромеры у бактерий пока
не обнаружено.
Изучение процесса расхождения хромосом у
бактерий затруднено в связи с тем, что малые раз-
меры клеток не позволяют выявлять необходимые
детали при морфологических исследованиях.
После репликации хромосомной ДНК две до-
черние хромосомы расходятся и перемещаются к
центрам будущих дочерних клеток.
22.3.2. Вегетативный клеточный цикл
завершается делением клеток
Деление материнской клетки и расхождение до-
черних клеток происходит в конце периода D
(см. рис. 22.1). В процессе деления наблюдает-
ся изменение направления роста пептидоглика-
нового слоя, в результате которого клеточная
оболочка (клеточная стенка и плазматическая
мембрана) инвагинируют в середине клетки (см.
рис. 2 17, Л). Для этого требуется активация од-
ного из пенициллин-связывающих белков, РЬрЗ,
который участвует в синтезе пептидогликана по-
перечных стенок. В центре клеток, находящихся в
этом периоде, обнаружена специфическая струк-
тура, перисептальное кольцо которое можно
определить как участок/органеллу, охватываю-
щую область инвагинации клеточной оболочки.
У Staphylococcus aureus описана сложная струк-
тура, образующая поперечную стенку и разделя-
ющая клетки.
Как и при репликации хромосомы, в процессе
деления существует момент, после которого оно
продолжается даже в отсутствие синтеза белка.
Этот момент приблизительно совпадает с завер-
шением репликации хромосомы.
Для целей исследования получено большое
число мутантов с нарушениями клеточного деле-
ния. В связи с жизненной важностью процесса де-
ления мутации большинства участвующих в нем
генов условно-летальны, и эти гены были иден-
тифицированы путем анализа, например, мутан-
тов, жизнеспособных при 30, но не при 42 °C.
Некоторые дефекты этих генов настолько суще-
ственно нарушают клеточное деление, что изме-
няется форма бактерий, например клетки Е. coli,
в * норме палочковидные, могут стать округ-
Рис. 22.8. Три типа клеточного деления. Клетки Е. coli,
окрашенные ДАФИ (4,б-диамино-2 фенилиндолом) для
выявления ДНК (флуоресцентная микроскопия в фазо-
вом контрасте).
А. Нормальные клетки дикого типа с разошедшимися
нуклеоидами в делящихся клетках.
Б. Клетки minB-мутанта с нуклеоидами неправильной
формы и делением, в результате которого образуются
мини-клетки без ДНК.
В. Клетки дикого типа после инкубации в присутствии
цефалексина (ингибитора клеточного деления) образу-
ют нити, но нуклеоиды имеют нормальную форму и раз-
деляются должным образом.
Глава 22. Клеточный цикл бактерий 15
лыми или приобрести неправильную форму
(en^B-мутанты). Благодаря анализу фенотипов
подобных мутантов были идентифицированы по
меньшей мере две стадии деления: образования
септы и разделения клеток (см. рис. 22.1).
Многие мутанты с нарушением деления отно-
сятся к группе fts (от filamentation temperature-
sensitive). В случае этих условно-летальных
мутаций клеточное деление блокировано при
непермиссивной температуре. У мутантов одного
особого класса (fisA и sefA) формирование септы
начинается, но не может быть завершено, из-за че-
го образуются длинные клетки с инвагинациями.
В разделении клеток специфически участву-
ют два гена—envA и cha. Мутантные по ним
клетки образуют длинные цепи. Цитоплазма до-
черних клеток у этих мутантов полностью раз-
деляется, но клеточные оболочки не расходят-
ся, т. е. пептидогликановые слои поверхности до-
черних клеток остаются ковалентно связанными
между собой. Как установлено, у этих мутантов
понижена активность фермента N-ацетилмура-
мил-Ь-аланинамидазы, расщепляющей связи в
слоях пептидогликана. Данные мутанты высоко-
чувствительны к разнообразным лекарственным
препаратам.
Молекулы одного из белков, специфически
участвующих в ранней стадии клеточного деле-
ния, FtsZ, образуют кольцо в центре клетки непо-
средственно перед началом клеточного деления.
Экспрессия гена ftsZ связана с клеточным цик-
лом.
В норме деление происходит посередине клет-
ки. Однако у определенных мутантов (по локу-
су тплпВ) эта обычная локализация клеточного
деления нарушена (см. рис. 22.8) и клеточное
деление часто происходит у того или иного полю-
са клетки, так что образуется одна сферическая
мини-клетка, лишенная ДНК, и одна удлинен-
ная клетка, содержащая всю ДНК материнской
клетки. Согласно одной из гипотез, деление опре-
деляется функциями трех продуктов генов оперо-
на mmB, белков MinC и MinD и MinE, следующим
образом: белки MinC и MinD ингибируют де-
ление в центре клетки и на тех потенци-
альных участках деления, которые близки к
полюсам клетки или представляют следы преды-
дущего клеточного деления; белок MinC воздей-
ствует непосредственно на FtsZ (см. разд. 22.4.2)
и белок MinE препятствует действию двух дру-
гих белков Min в центре клетки, благодаря чему
у клеток дикого типа деление происходит толь-
ко посередине клетки. Альтернативная гипотеза
относительно действия оперона тгпВ (рассмат-
риваемая в разд. 22.4.3) предполагает, что бел-
ки группы MinB участвуют в процессинге ДНК
или нуклеоида и полярные деления происхо-
дят потому, что в отсутствие MinB нарушает-
ся процесс расхождения хромосом — ДНК зани-
мает центр клетки, препятствуя делению в этой
области.
Деление клетки инициирует кольцевая ин-
вагинация плазматической мембраны в середине
клетки. В образовании септы и разделении слоев
пептидогликана дочерних клеток участвует боль-
шое число белков. Один из них, FtsZ, действует
на ранней стадии деления.
22.4. Клеточный цикл обеспечивают
регулируемые и координируемые процессы
Три основных процесса клеточного цикла—ре-
пликация хромосом, процессинг нуклеоида и кле-
точное деление — тонко регулируются в соответ-
ствии с возрастанием клеточной массы и при этом
взаимно координируются. В культурах штаммов
дикого типа лишь в редких случаях обнаружива-
ются клетки, лишенные ДНК.
22.4.1. Предложено несколько моделей
регуляции клеточного цикла
Существующие модели регуляции клеточного
деления в большинстве своем являются чисто спе-
кулятивными и не основанными на молекулярно-
биологических данных. Некоторые модели пред-
16 Часть VI. Рост и дифференцировка клеток
Рис. 22.9. Модели репликации.
А. Модель репликона, предложенная Жакобом, Брен-
нером и Кюзеном в 1963 г.: 1) сайт начала репликации
(ог/С) бактериальной хромосомы (изображена не в мас-
штабе) прикреплен к специфическому сайту плазмати-
ческой мембраны; 2) в определенный момент клеточно-
го цикла некий сигнал инициирует репликацию. Две до-
черние хромосомы прикреплены друг рядом с другом;
3) между дочерними хромосомами формируется мем-
брана; новосинтезированная мембрана показана серым;
4) с ростом мембраны дочерние хромосомы отодвига-
ются одна от другой; 5) деление клетки начинается в
середине клетки, между дочерними клетками. Дочер-
ние хромосомы теперь расположены в центре дочерних
клеток. По [1].
Б. Ауторепрессорная модель, предложенная Сомпей-
реком и Маалё в 1973 г. Регуляторная схема состоит
из двух генов (Р1 и Р2), представляющих собой части
одного оперона. Продукт Р1 действует как репрессор
транскрипции (0) оперона (о — оператор; р — промо-
тор). Белок Р2 — инициаторный белок, участвующий в
инициации репликации (0). По [2].
полагают связь клеточного цикла с физическими
параметрами, такими как соотношение массы и
размеров клеток, длина клеток и внутриклеточ-
ный тургор, но не с химическими параметрами.
Однако в большинстве гипотез важная роль в ре-
гуляции бактериального клеточного цикла отво-
дится таким факторам, как уровни Са2+ и ppGpp.
Согласно классической модели репликона
(рис. 22.9, Л), предложенной в 1963 г. Жакобом,
Бреннером и Кюзеном, клеточный цикл связан
с некой специфической структурой в плазмати-
ческой мембране, участием которой обусловлено
расхождение хромосом. Предполагается, что ини-
циация происходит, когда белок-инициатор вза-
имодействует с фиксированным активаторным
сайтом (аналогом оггС) в каждом репликоне и
реплицирующаяся ДНК связана с гипотетической
структурой в мембране. При инициации реплика-
ции эта структура удваивается и каждая дочер-
няя хромосома оказывается связанной с одной из
новообразованных структур, которые расходятся
в результате того, что между ними синтезируется
материал мембраны. В итоге происходит полное
расхождение дочерних хромосом. В подтвержде-
ние этой модели установлено, что области, близ-
кие к оггС, способны специфически связываться
с фракциями наружной мембраны и со специфи-
ческим белком. К сожалению, эти последние ис-
следования не были завершены. Данная модель
репликона не объясняет, каким образом регулиру-
ется удвоение мембранной структуры, с которой
связана ДНК, и даже не ставит вопрос об этой
цепи регуляции. Возможно, данная модель важна
для объяснения расхождения хромосом, но не для
регуляции начала репликации.
Р. Причардом (Pritchard) предложена так на-
зываемая модель с разведением ингибитора.
Это модель отрицательной регуляции с участием
трех компонентов: 1) точки начала репликации,
2) белка-инициатора и 3) репрессора, действую-
щего на точку начала репликации. При инициа-
ции репликации стимулируется синтез репрессо-
ра, и в результате его концентрация удваивает-
ся. Взаимодействуя с точкой начала репликации
или с белком-инициатором, репрессор ингибиру-
ет в дальнейшем инициацию до тех пор, пока не
удвоится объем клетки; таким образом инициа-
ция репликации связана с ростом клеток. Для ре-
пликации плазмид установлен факт отрицатель-
ной регуляции, но осуществляется она не путем
взаимодействия между ингибитором и точкой на-
чала репликации; вместо этого происходит отри-
цательная регуляция синтеза белка, участвующе-
го в репликации и лимитирующего ее скорость,
или превращения пре-затравки в затравку репли-
кации (см. разд. 14.1). Каких-либо данных о суще-
ствовании репрессора начала репликации с отгС
не имеется.
Для объяснения того, каким образом в течение
одного клеточного цикла может синтезироваться
определенное число копий молекулы-инициатора,
Сомпейреком и Маалё (Sompayrac, Maalpe) пред-
ложена так называемая ауторепрессорная мо-
дель (рис. 22.9, Л). Она предполагает, что синтез
белка DnaA, участвующего в инициации хромо-
сомной репликации на очень ранней стадии (см.
разд. 14.1.3), подвержен ауторегуляции. Соглас-
Глава 22. Клеточный цикл бактерий 17
но гипотезе, этот белок регулирует инициацию
репликации и концентрация его свободных мо-
лекул во время клеточного цикла изменяется,
поскольку он связывается с многочисленными
DnaA-боксами, распределенными по длине хро-
мосомы. В свободной форме белок DnaA отсут-
ствует, пока эти боксы не насыщены, но после
их насыщения он накапливается и связывает-
ся с oriC. Возможно, однако, что такой регуля-
ции, как в случае регуляции плазмид (т. е. путем
«измерения» концентрации репликона; см. также
разд. 14.3), здесь не существует и скорее у бакте-
рий, как и у эукариот, точки начала репликации
реплицируются один раз за клеточный цикл неза-
висимо от их числа. Это заключение основано на
изучении клеток, содержащих мини-хромосомы;
наличие даже многих копий мини-хромосомы не
влияет на время репликации у Е. coli. Однако
между мини-хромосомами и хромосомой суще-
ствует несовместимость, например у В. subtilis.
Два следующих важных факта установлены
в работах Донахью (Donachie): 1) инициация ре-
пликации хромосомы у Е. coli начинается при
определенном соотношении клеточная масса/ ori С
(масса инициации) и 2) клеточное деление
начинается при определенной длине клетки неза-
висимо от скорости роста. Эффекторные молеку-
лы, опосредующие связь клеточной массы и дли-
ны с этими параметрами, неизвестны (см., впро-
чем, выше о белке DnaA). Недавно полученные
данные показывают, однако, что масса инициации
несколько варьирует. Кроме того, гипотезе кри-
тической массы противоречит тот факт, что при-
сутствие плазмид, содержащих oriC, не влияет на
время начала репликации хромосомы у Е. coli.
Предложено несколько моделей регуляции кле-
точного цикла у бактерий, однако достоверно ее
молекулярный механизм пока не установлен.
22.4.2. Предположительно в стадиях клеточного
цикла существует несколько контрольных
точек
Процессы синтеза ДНК, РНК и белка регули-
руются преимущественно на уровне инициации.
Начавшись, эти процессы обязательно заверша-
ются. То же характерно для процесса деления
клетки. Инициация репликации хромосом и кле-
точного деления требует синтеза белка. Однако
после инициации эти процессы продолжаются до
завершения, даже если вызвать на последних эта-
пах подавление синтеза белка (см. разд. 22.2.2).
Клеточный цикл у прокариот нельзя отнести
к настоящим циклам, где все последующие со-
бытия требуют завершения всех предыдущих и
инициация нового цикла невозможна без заверше-
ния всех событий предыдущего цикла. Если пода-
вить само деление клеток (например, цефалекси-
ном), их рост и репликация хромосомы продол-
жаются и дочерние нуклеоиды расходятся, что
приводит к образованию длинных клеток-нитей
с двумя, четырьмя, восемью, шестнадцатью и
даже большим числом четко разделенных нук-
леоидов (см. рис. 22.8, В). То же наблюдается у
дрожжей Schizosaccharomyces pombe и эукарио-
тических клеток в особых условиях. Для начала
М-фазы в эукариотических клетках необходимо
завершение S-фазы и наоборот. У быстрорасту-
щих бактерий циклы репликации перекрываются
и завершение расхождения хромосом не являются
необходимым условием для инициации реплика-
ции хромосом; в рамках одного клеточного цикла
расхождение хромосом и инициация репликации
могут происходить в любом порядке.
Если бы клеточный цикл бактерий был цик-
лом в строгом смысле, в нем достаточно было бы
регуляции только одного события (например, ини-
циации репликации), которое просто запускало бы
остальные события. Однако ряд данных указыва-
ет на то, что процесс деления имеет собственную
регуляцию. Регулируются ли также отдельно про-
цессинг нуклеоида и расхождение хромосом, пока
неясно. Вероятно, по меньшей мере два процес-
са (репликация и деление) или даже три процес-
са, входящие в клеточный цикл, могут протекать
параллельно. У эукариот, по-видимому, два или
три параллельных процесса регулируются в один
и тот же период клеточного цикла — один процесс,
начинающий S-фазу, и другой, приводящий в ко-
нечном итоге к митозу (см. табл. 22.1). Почкова-
ние у Saccharomyces cerevisiae также инициирует-
ся одновременно с S- и М-фазами. Имеются све-
дения о том, что экспрессия гена ftsZ достигает
максимума во время инициации репликации, т. е.,
возможно, в прокариотических клетках реплика-
ция и клеточное деление инициируются в одно и
то же время в клеточном цикле. Белок FtsZ, по
некоторым свойствам аналогичный тубулинам эу-
кариот, дейопгвует за эхаде клеточного ie-
18 Часть VI. Рост и дифференцировка клеток
ления. Он синтезируется в большом количестве и
присутствует по всей клетке, но в момент иници-
ации клеточного деления образует кольцевидную
структуру в середине клетки. В спорулирующих
клетках Bacillus subtilis образуется по одному та-
кому кольцу вблизи каждого полюса, но сохра-
няется только то кольцо, на котором происходит
формирование предспоры. В сборке кольца FtsZ
участвует, возможно, белок FtsW. Как предпола-
гается, сборка этого кольца входит в процесс ини-
циации образования септы. Белок FtsZ, возмож-
но, участвует не только в инициации клеточного
деления, но и в его регуляции; сверхэкспрессия ге-
на ftsZ приводит к делению более мелких клеток,
чем в норме.
В эукариотических клетках регуляция про-
цесса инициации S- и М-фаз происходит по-
средством циклического фосфорилирования бел-
ков. У бактерий подобных циклических процессов
(за исключением циклических изменений экспрес-
сии ftsZ) пока не обнаружено. Иной тип регуля-
ции может быть основан на участии структурных
элементов. Можно предположить, что когда кон-
центрация и локализация (нескольких) ключевых
элементов достигает порогового уровня, происхо-
дит формирование новых структур. Такой тип ре-
гуляции осуществляется при споруляции как осо-
бом типе клеточного деления у В. subtilis (см.
гл. 25). Процесс образования споры протекает с
участием ряда <7-факторов, которые обеспечива-
ют последовательную экспрессию ранних и позд-
них генов споруляции. У Caulobacter (см. гл. 24)
каждое клеточное деление приводит к образова-
нию двух различных дочерних клеток, швермер-
ной и стебельковой. С учетом этих фактов можно
предположить, что поиск единственного регуля-
торного события довольно бесперспективен.
22.4.3. Клеточный цикл находится
под контролем общей регуляторной сети
Бактериальный клеточный цикл включает ряд
процессов, которые тонко регулируются в со-
ответствии с увеличением клеточной массы
(рис. 22.10). Для их координации используются
системы вето, о чем свидетельствуют результаты
изучения условно-летальных (например, темпера-
турочувствительных, Ts) мутантов с применением
ингибиторов. Ниже мы кратко описываем подоб-
ные эксперименты.
Рис. 22.10. Бактериальный клеточный цикл включает
три параллельных процесса. Нереплицирующиеся и реп-
лицирующиеся нуклеоиды представлены закрашенными
и незакрашенными фигурами соответственно. Показан-
ный цикл относится к медленнорастущей популяции;
при повышенной скорости роста последовательные цик-
лы репликации могут перекрываться.
Перенос мутанта dnaA (Ts) в условия непер-
миссивной температуры приводит к постепенной
остановке репликации (см. разд. 22.2.2). Впослед-
ствии возможно деление с образованием клеток
различных размеров без ДНК. При ингибирова-
нии инициации репликации, например рифампи-
цином или хлорамфениколом, клеточного деле-
ния не происходит, так как для него необходим
синтез белка в момент терминации процесса ре-
пликации хромосом.
Аналогичный перенос мутанта dna (Ts) с
нарушением элонгации приводит к подавлению
клеточного деления и образованию нитевидных
клеток с одним нуклеоидом.
Мутации дутВ (Ts; нарушение функции
ДНК-гиразы), а также обработка, понижающая
скорость репликации ДНК, вызывают нарушения
клеточного деления. Если для завершения репли-
кации требуется слишком много времени, моле-
кулы ДНК запутываются и нуклеоиды не могут
должным образом разделиться. Это приводит к
делению клетки у полюсов и в середине с обра-
зованием мини-клеток без ДНК. Такая картина
напоминает фенотип мутантов minB, у которых
нуклеоиды также не разделяются (рис. 22.8, Б).
Это сходство показывает, что система MinB в
определенной степени участвует в процессинге
Глава 22. Клеточный цикл бактерий 19
ДНК и нуклеоида (см. также разд. 22.3.2). Исхо-
дя из этого Уолдринг (Woldringh) с сотрудниками
предложили так называемую модель нуклео-
идной преграды (nucleoid occlusion), согласно
которой клеточное деление нс может произой-
ти в зоне, где присутствует ДНК. Обнаружено
высокое сходство между белками MinB и неко-
торыми белками, участвующими в расхожде-
нии или репликации плазмид (включая белок
с АТРазной активностью). Сверхрепликация
хромосомной ДНК (т. е. повышенное соотношение
число инициаций в oriC/клеточная масса) приво-
дит к понижению скорости движения реплисомы,
аномальной морфологии нуклеоида и аномалиям
клеточного деления. Следовательно, клеточное
деление не происходит в областях клетки, где
присутствует ДНК. Пониженная репликация
(т. е. пониженное соотношение число инициаций в
огг С/клеточная масса) приводит к образованию
нитевидных клеток.
У дрожжей мутации cut вызывают такое де-
ление клеток, при котором геном расщепляется
между дочерними клетками; имеются данные о
подобном классе мутантов и у В. subtilis. Суще-
ствование таких мутантов показывает, что в нор-
ме имеет место перекрестное сообщение между ре-
пликацией и клеточным делением.
Отсутствие некоторых белков (например,
FtsZ, MinC, MinD и MinE) или их сверхпродукция
часто вызывает затруднения в расхождении нук-
леоидов, и, вероятно, вследствие этого клеточное
деление может быть дефектным (отсутствовать,
происходить в неправильном месте или даже при-
водить к ветвлению клеток). По-видимому, для
нормального клеточного деления важны коорди-
нация многих процессов и поддержание необходи-
мого баланса между концентрациями различных
белков.
В случае повреждения ДНК развивается так
называемый SOS-ответ, приводящий к подавле-
нию клеточного деления. Это подавление опо-
средует белок SulA (SfiA) путем взаимодействия
с FtsZ. В норме экспрессию гена sulA ингиби-
рует белок LexA (см. разд. 15.7). При повре-
ждении ДНК он расщепляется (инактивируется)
белком RecA, синтезируемым в процессе SOS-
ответа. Поскольку белок SulA нестабилен, инги-
бирование клеточного деления, вызываемое SOS-
ответом, обратимо.
Блокада репликации ДНК приводит к подав-
лению клеточного деления и в отсутствие SOS-
ответа. Считается, что в этом регуляторном меха-
низме участвует единственный белок FtsA.
Вероятно, имеется также связь между стресс-
реакциями и делением клеток; так, инактивация
гена dnaK, кодирующего один из основных белков
теплового шока, приводит к подавлению клеточ-
ного деления.
Клеточный цикл у прокариот — это тонко
регулируемый процесс, включающий несколько
различных событий. Они четко регулируются
и координируются в соответствии с увеличени-
ем клеточной массы. Системы вето блокируют
клеточное деление, если репликация хромосо-
мы или расхождение нуклеоидов не завершено.
При повреждении ДНК или ингибировании син-
теза ДНК клетки утрачивают способность к
делению. Нарушение расхождения дочерних хро-
мосом может приводить к тому, что клеточное де-
ление происходит у полюсов, а не в середине клет-
ки. Молекулярные механизмы регуляции событий
клеточного цикла и их связи с возрастанием кле-
точной массы пока не ясны. Деление клеток мож-
но исключить или подавить без нарушения других
событий клеточного цикла.
22.5. Заключение
Клетки прокариот и эукариот обнаруживают мно-
жество различий, изучение которых представляет
интерес во многих аспектах. В то же время между
этими двумя типами клеток существует сходство,
которое позволяет, например, проводить сравне-
ние циклов деления у прокариот и эукариот.
Возможно, основное различие между прокари-
отическим и эукариотическим циклами состоит в
том, что гены, участвующие в регуляции разви-
тия цикла, обнаруживаются только у эукариот.
Все гены клеточного цикла прокариот, обнару-
женные к настоящему времени, связаны в первую
20 Часть VI. Рост и дифференцировка клеток
очередь с осуществлением ключевых событий, а
не их регуляцией. Например, белок DnaA действу-
ет на первой стадии инициации репликации хро-
мосомы; вместе с тем, по мнению некоторых ис-
следователей, он участвует в регуляции этого про-
цесса. Это показывает, что у прокариот не всегда
легко различить механизмы регуляции и самого
осуществления процесса.
В данной главе рассмотрен главным образом
вегетативный клеточный цикл Е. coli, приводя-
щий к образованию двух идентичных дочерних
клеток (рис. 22.1). Однако у бактерий извест-
ны и многие другие типы клеточного деления;
они характерны для процессов дифференцировки.
Так, у Caulobacter crescentus деление происходит
с образованием двух различных дочерних клеток:
свободноживущей швермерной клетки и стебель-
ковой клетки, которая прикрепляется к поверхно-
стям (см. разд. 24.1). У Bacillus клеточное деление
может в определенных условиях служить этапом
споруляции, когда одна дочерняя клетка стано-
вится предспорой, а вторая — материнской клет-
кой (см. разд. 25.1).
Дополнительная литература
Cooper S. (1991) Bacterial growth and division: bioche-
mistry and regulation of prokaryotic and eukaryotic
division cycles. New York London: Academic Press.
Donachi W.D. (1993) The cell cycle of Escherichia coli
Annu. Rev. Microbiol. 47: 199-230.
Donachi W. D., Robinson A. C., (1987) Cell division: pa-
rameter values and the process. In: Neidhardt C.,
Ingraham J.L., Brooks Low K., Magasanik B., Scha-
echter M., Umbarger H. E., (eds.) Escherichia coli
and Salmonella typhimurium: Cellular and molecu-
lar biology. 1st edn. Waschington, DC: ASM Press;
1578-1593.
Helmstetter С. E., (1996) Timing of synthetic activities
in the cell cycle. In: Neidhardt C., Curtiss III, R.,
Ingraham J. L., Lin E. С. C., Brooks Low K., Ma-
gasanik B., Reznikoff W. S., Schaechter M., Unbar-
ger H. E. (eds.) Escherichia coli and Salmonella:
Cellular and molecular biology, 2nd edn. Washington
DC: ASM Press; 1627-1639.
Hiraga S. (1992) Chromosone and plasmid partitioning in
Escherichia coli. Annu. Rev. Microbiol. 61: 283-306.
Hunt A., Murray T. (1993) The bacterial cell cycle.
Chapter 11. In: Hunt A., Murray T. The cell cycle.
San Francisco: Freeman.
Ischihama A., YoshikawaH., eds. (1991) Control of cell
growth and division. Tokyo: Japan Scientific Societies
Press.
Jacob F., Brenner S., Cuzin F. (1963) On the regulation
of DNA replication in bacteria. Cold Spring Harbor
Symp. Quant. Biol. 28: 329-348.
Lutkenhaus J., Mukerjee A. (1996) Cell division.
In: Neidhardt C., Curtiss III, R., Ingraham J. L.,
Lin E. C., Brooks Low K., Magasanik B., Rezni-
koff W.S., Schaechter M., Umbarger H. E., (eds.)
Escherichia coli and Salmonella: cellular and
molecular biology, 2nd edn. Washington DC: ASM
Press; 1615-1626.
Messer W., Weigel C. (1996) Initiation of chromosome
replication. In: Neidhardt C., Curtiss III, R.,
Ingraham J. L., Lin E. С. C., Brooks LowK., Ma-
gasanik B., Reznikoff W. S., Schaechter M., Umbar-
ger H E. (eds.) Escherichia coli and Salmonella:
cellular and molecular biology, 2nd edn. Washington
DC: ASM Press; 1579-1601.
Nordstrom K., AustinS. J. (1989) Cell-cycle-specific
initiation of replication. Mol. Microbiol. 10: 457-463.
Nordstrom K., Bernander R., DasguptaS. (1991) The
Escherichia coli cell cycle or multiple independent
processed that are co-ordinated? Mol. Microbiol. 5
769-774.
Schmid M.B., von Freiesleben U. (1996) Nucleoid Seg-
regation. In: Neidhardt C., Curtiss III, R., In-
graham J. L., Lin E. C.C., Brooks LowK., Maga-
sanik B., Reznikoff W. S., Schaechter M., Umbar-
ger H. E., (eds.) Escherichia coli and Salmonella:
cellular and molecular biology, 2nd edn. Washington
DC: ASM Press; 1662-1671.
Skarstad К., Boyce E. (1994) The initiator protein DnaA:
evolution, properties and function. Biochim. Biophys.
Acta 1217: 111-130.
Sompayrak L., Maalpe O. (1973) Autorepressor model
for control of DNA replication. Nature New. Biol.
241: 133-135.
VinellaD., D’Ari R. (1995) Overview of controls in the
Escherichia coli cell cycle. Bioassays 17: 527-536.
Woldringh C. L., Mulder E., Huis P. G., Vischer N.
(1991) Toporegulation of bacterial division according
to the nucleoid occlusion model. Res. Microbiol. 142:
309-320.
Источники рисунков
1. Jacob F., BrennerS., Cuzin F. (1963) Cold Spring
Harbor Symp. Quant. Biol. 28: 329-348.
2. Sompayrak L., Maalpe O. (1973) Nature New. Biol.
241: 133-135.
Глава 23
Сборка структур клеточной поверхности
Сборка клеточной мембраны из ее компонентов —
биогенез мембраны—это один из фундаменталь-
ных биологических процессов. Механизм его
пока во многом неясен. Известно, что сборка на-
ружной мембраны происходит на матрице, ко-
торой служит пептидогликан, из ранее синтези-
рованных мембранных липидов и белков. Таким
образом, образование поверхностных струк-
тур бактериальной клетки представляет со-
бой не процесс de novo, но происходит как
достройка имеющейся матрицы из компонентов,
синтезируемых внутри клетки и транспортируе-
мых на клеточную поверхность с участием спе-
циальных механизмов. Как предполагается, ком-
поненты мембраны переносятся на поверхность
через специализированные (возможно, времен-
ные) участки, в которых внутренняя и наружная
мембраны контактируют между собой. Для обо-
рота компонентов мембран эти участки (мембран-
ные контакты) распределены по всей поверхности
клетки; при латеральном росте, предшествующем
делению клеток, эти участки располагаются в ви-
де так называемых перисептальных колец парал-
лельно плоскости клеточного деления.
Процесс образования компонентов бактери-
альной клеточной стенки (пептидогликана, липо-
полисахаридов, тейхоевых кислот, белков и ли-
попротеинов) и внеклеточных структур (капсул
и жгутиков) включает биосинтез в цитоплаз-
ме активированных предшественников, их по-
лимеризацию и перенос через плазматическую
мембрану. Завершающие этапы формирования
стенки —это транспорт компонентов к поверхно-
сти клетки и встраивание в поверхностные струк-
туры. Поскольку для сборки снаружи плазмати-
ческой мембраны не могут быть использованы
такие источники энергии, как АТР, предшествен-
ники наружных структур должны синтезиро-
ваться в активированной форме. Это особенно
характерно для компонентов сложных углево-
дов, входящих в состав пептидогликана, липо-
полисахарида (ЛПС), тейхоевых кислот и по-
лисахаридов капсулы. В их синтезе участвует
в качестве кофактора специфическое соедине-
ние — ундекапреполфосфат. У архей ту же роль
выполняет долихолфосфат — кофактор, который
кроме архей присутствует только в клетках эука-
риот.
В данной главе рассматривается процесс сбор-
ки наиболее важных компонентов поверхностных
структур грамноложительных бактерий, грамот-
рицательных бактерий и архей.
23.1. Пептидогликан формируется из активированных предшественников
Пептидогликан (муреин) представляет собой сет-
чатую структуру, образующую так называемый
муреиновый мешок — ригидный слой бактериаль-
ных клеточных стенок (см. рис. 2.2. 2.11 и 2.13),
который придает клеткам физическую проч-
ность. У грамположительных бактерий (напри-
мер, Staphylococcus) муреиновый мешок много-
слойный, тогда как у грамотрицагельных бакте-
рий (например, Escherichia coli) — однослойный.
Пептидогликан состоит из углеводных цепей с
присоединенными к ним пептидными цепочка-
ми. Углеводные цепи (гликан) образованы че-
редующимися остатками N-ацетилглюкозамина
(GlcNAc) и З-лактил-П-ацстиглюкозамина (N-аце-
тилмурамовая кислота, MurNAc), соединенны-
ми (3- 1,4-связями. Через карбоксильную группу
остатка лактата остатки мурамовой кислоты со-
единены амидной связью с пептидными цепочка-
ми, перекрестно связывающими между собой уг-
леводные цепи (см. ниже).
22 Часть VI. Рост и дифференцировка клеток
23 1.1. Сборка структурной единицы
Биосинтез пептидогликана начинается в цито-
плазме с образования UDP-N-ацетилмурамовой
кислоты (UDPMurNAc) из UDPN-ацетилглюкоза-
мина (UDPGlcNAc) и фосфоемолпирувата (ФЕП).
Далее происходит последовательное присоеди-
нение к UDPMurNAc аминокислотных остат-
ков из их тРНК-активированных форм: L-Ala
(аланин), D-Glu (глутаминовая кислота), диами-
нокислоты [например, лгезо-диаминопимелиновой
кислоты или L-Lys (лизин)] и, наконец, двух
остатков D-Ala. Последние два остатка D-Ala при-
соединяются вместе в виде П-аланил-В-аланипа,
образуемого из L-Ala в реакциях, катализируемых
аланинрацемазой и ATP-зависимой D-Ala-D-Ala-
лигазой (см. разд. 7.9 и рис. 7.31).
Образованный комплекс N-ацетилмурамовой
кислоты с пентапептидом переносится в форме
1-фосфата от UDP на ундекапренолфосфат
(undec-P) в Mg2+-зависимой обратимой реакции:
UDPMurNAc + undec-P undec-P-P-MurNAc + UMP
L-Ala L-Ala
D-Glu D-Glu
L-R3 L-R3
D-Ala D-Ala
D-Ala D-Ala
В результате этой изоэнергетической реакции
обмена комплекс сахарид-пентапептид связы-
вается с внутренней стороной плазматической
мембраны через локализованный в ней липид-
переносчик ундекапренолфосфат. Завершает об-
разование структурной единицы пептидоглика-
на перенос остатка GlcNAc, соединенного с UDP
(UDPGlcNAc), и его связывание с С4-атомом
остатка мурамовой кислоты. Схематично этот
процесс показан в правой части рис. 23.1. Далее
образованный комплекс дисахарид-пентапептид с
помощью липидного переносчика перемещается
через плазматическую мембрану на ее периплаз-
матическую сторону для встраивания в растущие
гликановые цепи.
23.1.2. Наращивание гликановых цепей
и их перекрестное связывание
Строительные блоки для синтеза пептидогликана,
представляющие собой комплексы дисахарид-
пентапептид, связанные с ундекапренолдифос-
фатом, присоединяются к растущей цепи пеп-
тидогликана путем переноса дисахарида-пента-
пептида от undec-P-P на тот свободный конец
цепи, который заканчивается N-ацетилглюкоза-
мином (GlcNAc). Кроме этого, несколько таких
структурных единиц могут полимеризоваться, бу-
дучи связанными с ундекапренолдифосфатом, и
затем переноситься на растущие цепи пептидогли-
кана (см. разд. 7.9.4).
Рис. 23.1. Биосинтез и сборка пептидогликана у Esche-
richia coli. Справа показан синтез строительного бло-
ка, слева — его включение в сеть пептидогликана.
Подробности см. в тексте. G — N-ацетилглюкозамин;
М—N-ацетилмурамовая кислота (3-О-лактил-1\1-аце-
тилглюкозамин); undec — ундекапренол. Обратите вни-
мание, что одни реакции происходят на цитоплазма-
тической стороне клеточной мембраны, другие — в пе-
риплазме. Отмечено ингибирование отдельных реакций
упомянутыми в тексте антибиотиками.
Глава 23. Сборка структур клеточной поверхности 23
Перекрестное связывание гликановых цепей
через пептидные цепочки происходит с участи-
ем фермента трансамидазы. У Е. coli она ката-
лизирует образование перекрестной связи меж-
ду вторым от конца остатком D-аланина в
составе одного структурного блока и аминогруп-
пой. третьего остатка (L-R3; это всегда остаток
диаминокислоты) в составе смежного структур-
ного блока. Фермент присоединяется к субтер-
миналыюму остатку D-Ala с высвобождением
концевого остатка D-Ala. Это расщепление кон-
цевой связи D-Ala-D-Ala в пентапептиде сопро-
вождается выделением энергии, необходимой для
образования повой пептидной связи — перекрест-
ной сшивки. В левой части рис. 23.1 схема-
тично изображен рост и перекрестное связыва-
ние цепей пептидогликана. У грам положитель-
ных бактерий свободная аминогруппа остатка
двухосновной аминокислоты L-R3 (например, ли-
зина у Staphylococcus aureus} вначале замеща-
ется несколькими аминокислотными остатками
(у S. aureus это, например, остатки глицина). По-
следующее перекрестное связывание цепей гли-
капа происходит с участием остатка аланина в
одной цепи и остатка диаминокислоты (через
аминогруппу остатка глицина в боковой цепи)
соседней цепи. В результате пептидогликановая
сеть у грамположительных бактерий формирует-
ся как более рыхлая по сравнению с грамотрица-
тельными.
23.1.3. Сборку пептидогликана обеспечивает
координированное и регулируемое
участие автолитических
и синтетических ферментов
Сборка пептидогликана в процессе роста и де-
ления клеток происходит преимущественно в об-
ласти образования септы, разделяющей дочерние
клетки. Рост пептидогликана протекает как ре-
гулируемый процесс, в котором локальное рас-
щепление гликановых цепей автолитическими
ферментами скоординировано с последующим
удлинением образующихся свободных концов.
На синтез пептидогликана воздействуют мно-
гие антибиотики. Пенициллин ингибирует пу-
тем ковалентного связывания фермент транса-
мидазу, имея частичное стерическое сходство с
аланил-аланиновым участком в цепи пептидогли-
кана. По этой причине активность пенициллина
как антибиотика проявляется только в отношении
растущих бактерий, интенсивно синтезирующих
пептидогликан. Туникамицин подавляет пере-
нос пептидилмурамовой кислоты из комплекса
с UDP на ундекапренолфосфат. Бацитрацин
ингибирует дефосфорилирование упдекапренол-
фосфата, образуя Mg2+-зависимый комплекс с
undec-P-P-фосфатазой в плазматической мем-
бране и прерывая тем самым регенерацию этого
липидного кофактора; в результате подавляется
также синтез других компонентов поверхностных
структур (липополисахаридов, материала кап-
сул и тейхоевых кислот). Среди других ингиби-
торов фосфономицин ингибирует образование
UDP-мурамовой кислоты, генцианвиолет—
присоединение остатка L-алапина к UDP-мурамо-
вой кислоте, циклосерин — изомеризацию L-Ala
и образование D-Ala-D-Ala.
Сборка пептидогликана включает следую-
щие стадии. Вначале на внутренней стороне плаз-
матической мембраны образуется ундекапренол-
дифосфомурамовая кислота, замещенная пента-
пептидом (undec-P-P-MurNАс-пентапептид). За-
тем происходит присоединение GlcNAc с об-
разованием связанного с липидом-псреносчиком
комплекса дисахарид-пентапептид, undec-P-P-
MurNAc-neHTarieiiTivvGkNAc, который затем пе-
реносится через плазматическую мембрану в
периплазму. Эти активированные структурные
единицы вначале интегрируются в уже существу-
ющую структуру пептидогликана и затем пере-
крестно связываются через пептидные боковые
цепи с высвобождением концевого остатка алани-
на. Акцепторные участки для включения новых
единиц создаются путем гидролитического рас-
щепления в сети пептидогликана, и расширение
сети происходит благодаря поддержанию тонко
регулируемого баланса между литическими и син-
тетическими процессами (рис. 23.1).
24 Часть VI. Рост и дифференцировка клеток
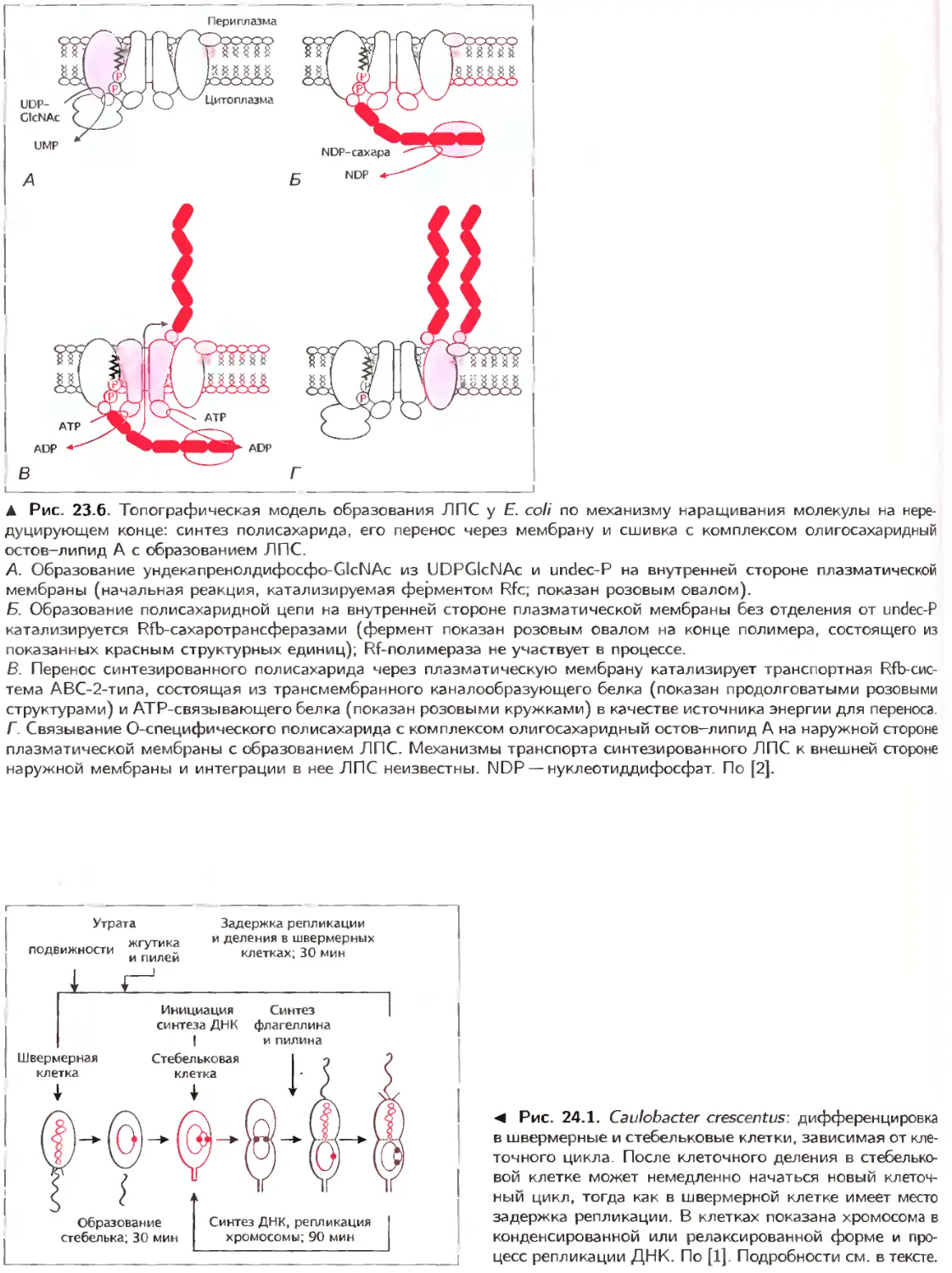
23.2. Липополисахарид синтезируется в плазматической мембране
из строительных блоков
Липополисахарид (ЛПС) — это компонент кле-
точной стенки грамотрицательных бактерий, ко-
торый составляет у них внешний слой наруж-
ной мембраны (см. рис. 2.7). ЛПС служит ба-
рьером для проникновения в клетку токсичных
соединений, например солей желчных кислот в
случае бактерий кишечной группы. При сероло-
гическом типировании патогенных грамотрица-
тельных бактерий определяют ЛПС как основную
антигенную детерминанту. Молекулы ЛПС слу-
жат также рецепторами бактериофагов, в некото-
рых случаях совместно с белками наружной мем-
браны (комплексные рецепторы бактериофагов).
Наличие рецепторов бактериофагов в наружной
мембране лежит в основе фаготипирования гра-
мотрицательных бактерий, наиболее разработан-
ного для различных видов Salmonella. Липидная
часть ЛПС патогенных бактерий (липид А; см.
разд. 23.2.4) оказывает токсическое действие на
организм-хозяин при инфекции, в первую очередь
стимулируя выделение регуляторных факторов,
таких как фактор некроза опухолей (ФНО), ин-
терлейкины (ИЛ-1, ИЛ-6, ИЛ-8), простагландины
и лейкотриены. В связи с этим липид А и содержа-
щие его ЛПС называют эндотоксинами (в проти-
воположность бактериальным экзотоксинам, ко-
торые представляют собой секреторные белки).
Молекула ЛПС состоит из трех частей: липида
А, олигосахаридного остова и О-специфического
полисахарида. У грамотрицательных бактерий
могут происходить мутации, затрагивающие об-
разование О-специфического полисахарида. В от-
личие от бактерий дикого типа, образующих на
агаре колонии с гладкой блестящей поверхностью
и поэтому называемых S-формами (от smooth —
гладкий), мутанты, синтезирующие ЛПС без
О-специфического полисахарида, образуют коло-
нии с шероховатой поверхностью и поэтому назва-
ны R-мутантами (от rough— шероховатый). Со-
ответствующие ЛПС называют S-ЛПС и R-ЛПС.
Следует отметить, что R-мутанты практически
авирулентны, даже когда они происходят от ви-
рулентных форм.
Три составные части молекулы ЛПС синтези-
руются раздельно на плазматической мембране,
затем происходит их соединение, перенос к на-
ружной мембране и включение в нее. Эта после-
довательность схематически показана на рис. 23.2
(см. также разд. 7.10.3).
Молекулы ЛПС локализованы только па по-
верхности наружной мембраны и тесно ассоции-
рованы с входящими в ее состав белками. У мно-
гих R-мутантов содержание белка во внешней
мембране ниже, чем у S-форм, и соответствующее
пространство заполнено фосфолипидами. Таким
образом, у R-мутантов наружная мембрана содер-
жит области с двойным слоем фосфолипидов и в
результате они более чувствительны к некоторым
гидрофобным агентам, а также к солям желчных
кислот.
undec-P
Синтез О-полисахарида
на undec-P, катализируемый
белками Rfb и Rfc
Синтез липида А, катализируемый
белками Lpx и Kdt
I
I Липид А I
Синтез олигосахаридного остова
на липиде А, катализируемый
белком Rfa
| О-полисахарид-Р-Р-ипбёс~|
Комплекс олигосахаридный
остов—липид А
Перенос О-полисахарида на комплекс
олигосахаридный остов—липид А,
катализируемый белком RfaL— RfbT
1
О-полисахарид—олигосахаридный остов—липид А
(липополисахарид; О-антиген)
Рис. 23.2. Основной путь сборки липополисахаридов.
Части молекулы липополисахарида — О-специфический
полисахарид и комплекс из олигосахаридного остова и
липида А — синтезируются раздельно и затем соединя-
ются. Переносчиком при сборке О-полисахарида служит
ундекапренолфосфат. Олигосахаридный остов собира-
ется на липиде А. Гены, детерминирующие синтез ЛПС,
распределены по бактериальному геному, образуя клас-
теры синтеза полисахарида (rfb, rfc) и синтеза олигоса-
харидного остова (rfa).
Глава 23. Сборка структур клеточной поверхности 25
23.2.1. Липид А заякоривает ЛПС
в наружной мембране
Первый этап синтеза липида А состоит в том,
что предшественник UDPGlcNAc подвергается
З-Озамегцению и затем N-замещепию Д-гидрок-
симиристиновой кислотой. Образованное диацил-
производное формирует димер, при этом высво-
бождается UMP. Образовавшийся 1-фосфодимер
замещается 2-оксо-З-дезоксиоктоновой кислотой
(ОДО) из CMP-ОДО, этерифицируется жирны-
ми кислотами по гидроксильным группам Д-гид-
роксимиристиповой кислоты и, наконец, фосфо-
рилируется по С4-атому (т. е. по нередуциру-
ющему остатку глюкозам ина). Полностью этот
процесс показан на рис. 23.3 (по данным, полу-
ченным для R-мутанта Е. coli).
Ацильные заместители в процессе синтеза
ЛПС переносятся у Е. coli непосредственно от
ацилпереносящего белка, входящего в состав
комплекса синтетазы жирных кислот, а не от
производных ацил-СоА. Замещение ОДО служит
необходимым условием протекания реакции эте-
рификации в иных, чем СЗ и СЗ', положениях.
Остатки ОДО переносятся от CMP-ОДО толь-
ко одной ОДО-трапсферазой. Ингибитор синтеза
жирных кислот церуленип подавляет синтез ли-
пида А и соответственно ЛПС (см. разд. 7.10.2-
7.10.3).
23.2.2. Олигосахаридный остов ЛПС связывает
между собой липид А и О-специфический
полисахарид
Биосинтез олигосахаридного остова ЛПС опре-
деляется генами rfa. Сокращение Rf означа-
ет rough (шероховатый) и употребляется в свя-
зи с тем, что олигосахаридный остов, детер-
минируемый г/а-гепами, является единственным
углеводным компонентом R-ЛПС. Олигосаха-
ридный остов образуется на комплексе [липид
А-(ОДО)2], который служит акцептором. Пер-
вый этап синтеза состоит в переносе трех еди-
ниц Ь-глицеро-О-манногептозы (Нер) из ADPHep
на ближайший к липиду остаток ОДО; эти еди-
ницы затем замещаются этаноламипфосфатом
(EtNH2P) и фосфатом. Сборка олигосахаридного
остова заканчивается последовательным перено-
сом остатков глюкозамина (Glc), галактозы (Gal)
и N-ацетилглюкозамина (GlcNAc) из их UDP-про-
изводных.
UDPGlcNAc
LpxA
s' РНМ-АПБ
Щ*- АПБ
UDP-(3-₽HMGIcNAc)
Ацетат
s' ₽НМ-АПБ
>• АПБ
UMP
UDP-(2,3-ди-PHMGIcN)
а-(2,3-ди-₽НМС!сМ)-1-Р
Р-(2',3'-ди-рНМС1сМ)-(1,6)-а-(2,3-ди-РНМС1сМ)-1-Р
Рис. 23.3. Синтез липида А у Escherichia coli. ДНМ
— /3-гидроксимиристиновая кислота; N-GIcNAc —
N-ацетилглюкозамин; АПБ — ацилпереносящий белок;
kdsB — ген, детерминирующий синтез СМР—ОДО
(СМП-2-оксо-3-дезоксиоктоновой кислоты). Указаны
известные продукты генов, участвующие в синтезе
липида А. По [1].
Из экстрактов бактериальных клеток выделе-
ны ферменты глюкозилтрансфераза I и галакто-
зилтрансфсраза I, активность которых стимули-
руется фосфолипидами. С помощью центрифу-
гирования в градиенте плотности был выделен
четырехчленный комплекс, состоящий из фосфа-
гидилэтаноламина, глюкозилтрансферазы I, га-
лактозилтрансферазы I и неполного ЛПС в ка-
честве акцептора. Добавление к этому комплексу
UDPGlc или UDPGal приводит к переносу обо-
их сахаров на незавершенный олигосахаридный
остов ЛПС.
У R-мутантов синтез ЛПС заканчивается на
стадии образования комплекса олигосахаридный
26 Часть VI. Рост и дифференцировка клеток
остов-липид А, т. е. R-ЛПС. У штаммов дикого
типа (гладких, или S-штаммов) образование ли-
пополисахарида (S-ЛПС) завершается последую-
щим присоединением О-специфического полиса-
харида (см. ниже).
Липид А синтезируется из UDPGlcNAc
и остатков жирных кислот, которые перено-
сит ацилпереносящий белок. Перенос ОДО из
CMP-ОДО важен для завершения синтеза липида
А путем этерификации длинноцепочечными жир-
ными кислотами. Олигосахаридный остов со-
бирается на остатке ОДО липида А путем по-
следовательного переноса остатков сахаров из их
комплексов с нуклеотидами.
23.2.3. О-специфический полисахарид
в составе Л ПС состоит из повторяющихся
олигосахаридных единиц
Полисахаридная часть молекулы ЛПС представ-
ляет собой основной антиген грамотрицатель-
ных бактерий, определяющий их серологическую
О-специфичность (отсюда название О-специфи-
ческий полисахарид). О-специфичсские полисаха-
риды состоят из повторяющихся олигосахарид-
ных структурных единиц. Биосинтез этих поли-
сахаридов включает синтез олигосахаридов и их
последующую полимеризацию, как показано па
рис. -23.4.
Данный биосинтетический путь исследован
главным образом у Salmonella anatum и S. typhi-
murium. О-специфический полисахарид S. anatum
имеет следующую структуру: [-(6)-/?-D-Man-(l,4)-
Q-L-Rha-(l,3)-o:-D-Gal-(l)-]n, где Мал — манноза,
Rha—рамноза и Gal —• галактоза.
Биосинтез начинается с обратимого Mg2+-
зависимого переноса галактозо-1-фосфата из
UDPGal на ундекапренолфосфат (этап 1). Ката-
лизирующий эту реакцию фермент кодируется ге-
ном rfbP. Последующий перенос других остатков
сахаров, рамнозы (R2) и маннозы (R3), завер-
шается образованием олигосахаридной структур-
ной единицы, связанной с ундекапреполдифосфа-
том (этап 2). Ферменты этих реакций кодируют
гены rfbN и rfbU. В результате последующей
полимеризации олигосахаридов, связанных с уп-
декапренолом (этап 3; в случае S. anatum обра-
зуется трисахарид), происходит сборка полисаха-
рида ЛПС, связанного с ундекапренолдифосфа-
том. На каждой ступени полимеризации высво-
Рис. 23.4. Синтез О-полисахарида у Salmonella и
его связывание с комплексом олигосахаридный остов-
липид А. Подробности см. в тексте. NDR — нуклео-
тиддифосфат; NMP — нуклеотидмонофосфат; undec —
ундекапренол; Ri— Rn—остатки сахаров, которые пе-
реносятся с их нуклеотидфосфатных производных на
олигосахарид, связанный с акцептором пирофосфатной
связью. Номера в кружках обозначают стадии синтеза.
У S. anatum Ri —это галактоза (Gal; в активированной
форме UDPGal), R2 — рамноза (Rha; в активированной
форме TDPRha), R3 —манноза (Man; в активированной
форме GDPMan). Поскольку О-специфический полиса-
харид у S. anatum содержит трисахаридные структурные
единицы, в данном примере п равно трем (этап 1: пере-
нос сахар-1-фосфата; этап 2: перенос сахаров). В слу-
чае ЛПС, гетерогенных по длине цепи их полисаха-
ридных компонентов, т варьирует примерно от 15 до
60, составляя в среднем 40. При сборке связанной с
липидом полисахаридной цепи из m-числа связанных
с липидом олигосахаридов (этап 3) высвобождает-
ся (m — 1) молекул ундекапренолдифосфата. Послед-
няя молекула undec-P-P высвобождается в процессе
переноса синтезированного полисахарида при участии
RfaL/RfbT-транслоказы от undec-P-P на комплекс оли-
госахаридный остов-липид А (этап 4). Все молеку-
лы undec-P-P возвращаются в цикл после дефосфо-
рилирования мембраносвязанной undec-P-фосфатазой
(этап 5).
бождается одна молекула ундекапренолдифосфа-
та. В этом процессе связанная с липидом цепь пе-
реносится с помощью полимеразы (Rfc) к нере-
дуцирующему концу только что образованного,
связанного с липидом олигосахаридного остова.
У некоторых бактерий соответствующий ген вхо-
дит в г/Ь-кластер; у других он находится за преде-
лами этого локуса. (Полисахарид S. anatum под-
вергается ацетилированию по Сб-атому каждой
галактозной единицы, после полимеризации и пе-
ред сшивкой.)
Глава 23. Сборка структур клеточной поверхности 27
По имеющимся данным, полимеризация про-
исходит на периплазматической стороне плазма-
тической мембраны. Таким образом, связанные
с липидом олигосахариды должны быть вначале
перенесены через плазматическую мембрану.
. Дополнение 23.1. В полностью синтезиро-
ванном О-специфическом полисахариде ино-
гда происходит замещение моносахаридом
(например, глюкозой у S. typhimurium) с об-
разованием ответвления длиной в один моно-
мер. Моносахариды переносятся в комплек-
се с ундекапренолмонофосфатом (в качестве
донора), и замещение сопровождается высво-
бождением undec-P. В этой форме переносчик
включается в данный биосинтетический путь
непосредственно, тогда как undec-P-Р, высво-
бождающийся при полимеризации О-полиса-
харида, должен вначале дефосфорилировать-
ся до undec-P специфической фосфатазой
(этап 5), высокогидрофобной и интегрирован-
ной в плазматическую мембрану.
У штаммов Е. coli 08 и 09, клетки которых
в качестве О-специфического полисахарида
содержат маннан, обнаружен иной механизм
его биосинтеза. Процесс начинается с обрати-
мого переноса GlcNAc из UDPGlcNAc (NDP-
R1) на undec-P с образованием undec-P-P-
GlcNAc (фермент, катализирующий эту реак-
цию, кодируется геном r/е). Полисахаридная
цепь наращивается, оставаясь связанной с
этим липидом на нередуцирующем конце, пу-
тем последовательного присоединения ман-
нозных единиц непосредственно из GDPMan
без участия undec-P. У этих штаммов по-
лимеризация О-специфического полисахари-
да происходит на внутренней (цитоплазмати-
ческой) стороне плазматической мембраны.
Аналогичный механизм синтеза предполага-
ется для некоторых О-специфических поли-
сахаридов бактерий рода Klebsiella', эти поли-
сахариды состоят из маннозы или галактозы
и, таким образом, представляют собой гомо-
полисахариды. Механизм их синтеза не зави-
сит от гена г/с.
Известно два механизма образования
О-специфических полисахаридов.
1. У Salmonella anatum синтез их повторяющих-
ся структурных единиц начинается с обрати-
мого переноса Gal-1-Р от UDPGal на унде-
капренолфосфат с образованием undec-P-P-
Gal. Далее синтез олигосахаридных единиц
продолжается путем присоединения осталь-
ных сахаров из их нуклеотид-активированных
форм. Затем происходит сборка полисахари-
дов из олигосахаридных единиц путем пере-
несения связанной с липидом цепи к нереду-
цирующему концу связанной с липидом оли-
госахаридной единицы. Таким образом, цепь
растет на редуцирующем конце и закан-
чивается остатком P-P-undec.
2. У Escherichia coli шт. 09 первый этап синте-
за состоит в переносе GlcNAc-1-Р на undec-
р. Полисахаридная цепь синтезируется путем
последовательного присоединения к продукту
этой первой реакции — undec-P-P-GlcNAc —
маннозных единиц без дальнейшего участия
undec-P. При этом цепь растет на нереду-
цирующем конце и заканчивается остатком
P-P-undec.
23.2.4. Присоединение О-полисахарида
к комплексу олигосахаридный
остов-липид А и перенос
липополисахарида на клеточную
поверхность
Связанный с P-P-undec О-полисахарид присоеди-
няется к комплексу из олигосахаридного остова
и липида А в реакции, катализируемой лигазой
(этап 4 на рис. 23.4). Этот фермент состоит из
двух субъединиц, RfaL и RfbT.
У S. typhimurium и S. anatum связанный с
undec-Р-Р полисахарид локализован на периплаз-
матической стороне мембраны и сшивка должна
происходить именно на этой стороне мембраны
после перенесения к ней комплекса олигосахарид-
ный остов-липид А.
Соединение комплекса олигосахаридный ос-
тов-липид А с О-специфическим полисахаридом
происходит сопряженно с транспортом новообра-
зованного ЛПС на поверхность клетки. У мутанта
S. typhimurium, не образующего UDPGal-4-эпиме-
разу и не содержащего, в отличие от штамма ди-
кого типа, галактозу в олигосахаридном остове и
в О-полисахариде, после добавления галактозы в
среду культивирования на определенных участ-
ках бактериальной поверхности появляется ново-
28 Часть VI. Рост и дифференцировка клеток
образованный ЛПС. Это участки, где наружная
и внутренняя мембраны находятся в тесном кон-
такте (сайты контакта мембран). В таких участ-
ках, по-видимому, осуществляется транспорт мно-
гих макромолекул через мембраны, изнутри нару-
жу (например, новосинтезированного материала)
или снаружи внутрь (например, ДНК бактерио-
фага при инфицировании им бактерии).
У Е. coli шт. 09 и штаммов Klebsiella полно-
стью синтезированный полисахарид перемещает-
ся через плазматическую мембрану с помощью
мембранной транспортной системы ABC-типа (от
АТР-bindmg cassette — ATP-связывающая кассе-
та). Эта система состоит из двух копий транс-
мембранного (каналообразующего) белка и нахо-
дящихся на цитоплазматической стороне мембра-
ны двух копий белка, обеспечивающего перенос
энергией за счет гидролиза АТР. Эту транспорт-
ную систему, осуществляющую также перенос
полисахаридов капсулы, в настоящее время на-
зывают АВС-2-переносчиком. Предполагаемый
механизм переноса ЛПС через мембраны на по-
верхность клеток у S. typhimurium и Е. coli 09
иллюстрируют рис. 23.5 и 23.6 (см. цв. вклейку)
соответственно (см. также гл. 19).
Сборка О-специфического полисахарида
по механизму, при котором его удлинение про-
исходит на редуцирующем конце, осуществляет-
ся па внешней стороне плазматической мембраны,
и вначале через мембрану переносятся олигосаха-
ридные структурные единицы. Механизм синтеза
О-специфического полисахарида с его ростом на
нередуцирующем конце действует на внутренней
стороне плазматической мембраны, и синтезиро-
ванный полисахарид переносится через мембрану
с помощью АВС-2-переносчика.
23.2.5. Регуляция биосинтеза липополисахарида
Регуляция биосинтеза ЛПС основана на обра-
тимости детерминированного геном rfbP или rfe
переноса гликозил-1-фосфата на ундекапренол-
фосфат (этап 1 на рис. 23.4). У штаммов дико-
го типа на этом этапе регулируется длина цепи
О-специфических полисахаридов посредством
продукта гена rol (от regulation of length —ре-
гуляция длины). Белок Rol координирует актив-
ность Rfc-полимеразы и RfaI/RfbT-транслоказы,
в результате чего образуются ЛПС с различной
длиной цепи. Сигнал, модифицирующий актив-
ность Rol, неизвестен. Температурные условия
при культивировании не влияют на синтез ЛПС.
Участие ундекапренола связывает между со-
бой биосинтез ЛПС и других компонентов
клеточной стенки грамотрицательных бактерий
(например, пептидогликана и материала капсул),
который также зависит от этого липидного ко-
фактора. Взаимозависимость этих путей биосин-
теза можно продемонстрировать in vitro.
23.3. Тейхоевые и липотейхоевые кислоты представляют собой
полиолсодержащие компоненты клеточной стенки
грамположительных бактерий
Тейхоевые и липотейхоевые кислоты относятся к
полимерам с высокой плотностью зарядов, и за
счет их присутствия на клеточной стенке концен-
трируются катионы. Эти кислоты образуют ком-
плексы с белками, участвующими в делении кле-
ток, и предположительно служат также регуля-
торами оборота компонентов стенки, возможно на
уровне активности ферментов автолиза и ресин-
теза пептидогликана. Тейхоевые кислоты играют
роль важных антигенов грамположительных бак-
терий и имеют таксономическое значение. Липо-
тейхоевая кислота у Streptococcus pyogenes ассоци-
ирована с М-белком в составе клеточной стенки;
этот комплекс участвует в адгезии бактерий на
клетках-мишенях хозяина и в механизме устой-
чивости бактерий к фагоцитозу.
В составе клеточной стенки тейхоевые кисло-
ты ковалентно связаны с пептидогликаном. По
структуре они представляют собой полимеры гли-
церолфосфата (Glp) или рибитолфосфата (RtlP),
Глава 23. Сборка структур клеточной поверхности 29
которые могут содержать остатки сахаров и/или
аминокислот (в большинстве случаев аланина) в
качестве заместителей.
Первый этап синтеза тейхоевой кислоты у
Staphylococcus aureus состоит в обратимом пе-
реносе Ы-ацетилглюкозамин-1-фосфата на унде-
капренолфосфат (см. рис. 7.30 и стадию 1 на
рис. 23.4). Далее происходит присоединение трех
остатков глицеролфосфата из CMPGlp (анало-
гично стадии 2 на рис. 23.4). Продукт реакции за-
мещается цепью из (приблизительно) 40 единиц
рибитолфосфата (Rtl-P), которые переносятся
в форме CDPRtl.
Полностью синтезированные молекулы тей-
хоевых кислот переносятся от ундекапре-
нолдифосфата на Сб-атом остатка мурамо-
вой кислоты в составе пептидогликана с об-
разованием фосфодиэфирной связи между
Сб-атомом мурамовой кислоты и Cl-атомом кон-
цевого остатка N-ацетилглюкозамина в составе
тейхоевой кислоты. Освободившийся ундекапре-
нолфосфат вновь включается в биосинтетический
процесс. Очевидно, что механизм синтеза тейхое-
вых кислот во многих отношениях сходен с син-
тезом ЛПС.
Нередко гидроксильные группы рибитола в
составе тейхоевых кислот замещены остатками
моносахаридов или олигосахаридов. Эту моди-
фикацию катализируют специфические гликозил-
трансферазы, возможно после полимеризации.
Участия ундекапренолфосфата в этом не обнару-
жено. Замещение аланилом происходит путем пе-
реноса этого остатка из комплекса с аланил-пере-
носящим белком.
Многие грамположительные бактерии обра-
зуют, кроме тейхоевых, липотейхоевые кисло-
ты (известные также как мембранные тейхое-
вые кислоты или глицеролтейхоевые кислоты).
В противоположность тейхоевым кислотам они
не связаны ковалентной связью с пептидогли-
каном, но образуют гидрофобные связи с ком-
понентами плазматической мембраны. Липотей-
хоевые кислоты представляют собой полимер
1-3-глицеролфосфата, связанного с диглюкозил-
1-3-диацилглицеролом в качестве гидрофобной
части молекулы (см. разд. 7.10.3). Длина це-
пи полиглицеролфосфата достаточна для того,
чтобы пересечь слой пептидогликана и достичь
поверхности клетки. Биосинтез липотейхоевых
кислот значительно отличается от биосинтеза тей-
хоевых кислот. Гидрофобная часть молекулы син-
тезируется путем переноса двух остатков глю-
козы с UDPGlc-на диацилглицерол (рис. 23.7;
реакция 1). Этот акцептор затем замещается гли-
церолфосфатом (Glp) в реакции, где донором
служит фосфатидилглицерол (рис. 23.7; реак-
ция 2). Рост цепи полимера происходит путем по-
вторения реакции 2.
В отличие от синтеза тейхоевых кислот,
синтез липотейхоевых кислот тесно связан с син-
тезом и оборотом мембранных фосфолипидов.
Синтез (рибитол)тейхоевых кислот начина-
ется с образования комплекса undec-P-P-GlcNAc,
на который переносится глицеролфосфат из
СМР-глицеролфосфата. Затем происходит удли-
нение остова путем последовательного присоеди-
нения рибитолфосфата (Rtl-P) из CDP-рибитола.
Синтез (глицерол)липотейхоевых кислот
начинается с образования липида — диглюкозил-
диацилглицерола, к которому затем присоеди-
няются Glp-единицы из фосфатидилглицерола.
Предшественниками тейхоевых кислот служат,
таким образом, фосфолипиды.
Рис. 23.7. Синтез липотейхоевой кислоты у стрепто-
кокков. Полиглицеролфосфатная цепь [(Glp)n] собира-
ется при синтезе липотейхоевой кислоты на диглюко-
зилдиацилглицероле [(Glc)2-GI(Ac)2], который образует-
ся путем глюкозилирования диацилглицерола [GI(Ac)2].
В процессе роста цепи донором глицерол фосфата слу-
жит фосфатидилглицерол [GI(Ac)2-P-GI]. Последний об-
разуется с участием sn-глицерол-З-фосфата (Glp), стар-
тового соединения при синтезе липидов. В кружках —
номера этапов (1 и 2) (см. текст).
30 Часть VI. Рост и дифференцировка клеток
23.4. Тейхуроновые кислоты — компоненты поверхности
грамположительных бактерий, содержащие гексуроновую кислоту
Тейхуроновые кислоты грамположительных бак-
терий представляют собой полимеры гексуро-
новых кислот. У Micrococcus luteus тейхуроно-
вая кислота содержит остатки N-ацетилманно-
заминуроновой кислоты (ManNAcA) и глюкозы,
тейхуроновая кислота В. licheniformis — остатки
глюкуроновой кислоты и N-ацетилгалактозамина.
Начальная реакция биосинтеза тейхуроновой кис-
лоты у М. luteus состоит в переносе GlcNAc-1-Р из
UDPGlcNAc на ундекапренолфосфат (аналогич-
но этапу I на рис. 23.4). Затем происходит при-
соединение двух единиц ManNAcA и поочеред-
но Glc и ManNAcA из их UDP-активированных
форм (этап 2 на рис. 23.4). На конечном этапе цепь
переносится на Сб-атом мурамовой кислоты пеп-
тидогликана с образованием области связывания
(-ManN AcA-ManNAcA-GlcNAc- 1-P-MurN Ac-).
Синтез тейхуроновой кислоты у В. licheni-
formis начинается с переноса GalNAc-1-Р
из UDPGalNAc-1-P на ундекапренолфосфат;
затем происходит последовательное присо-
единение остатков Glc и GalNAc из их
UDP-активированных форм. В данном слу-
чае области связывания между пептидоглика-
ном и цепью тейхуроновой кислоты не образу-
ется.
Бациллы обладают свойством образовывать
как тейхоевые, так и тейхуроновые кислоты.
Пути биосинтеза, ведущие к образованию этих
компонентов поверхностных структур, регули-
руются содержанием фосфата в среде: синте-
зу тейхоевой кислоты благоприятствует высокая
концентрация фосфата, тейхуроновой кислоты —
низкая.
23.5. Клеточные капсулы у многих грамположительных
и грамотрицательных бактерий состоят из кислых полисахаридов
Многие грамположительные и грамотрицатель-
ные бактерии обладают капсулами (см. рис. 2.6),
защищающими их клетки от неблагоприятных
внешних воздействий. У патогенных бактерий
капсулы служат важными факторами вирулент-
ности, противодействуя защитным механизмам
хозяина. В частности, они предотвращают лизис
и/или опсонизацию под действием комплемента,
а также препятствуют фагоцитозу. По имеющим-
ся данным, капсулы способствуют адгезии бакте-
рий на различных поверхностях in vitro и in vivo.
Хотя материал капсул, как и другие компоненты
поверхностных структур, частично выделяется в
среду, не следует путать капсулы с бактериаль-
ной слизью, которая не закреплена на поверхно-
сти клеток.
Капсулы состоят главным образом из кис-
лых полисахаридов. Механизм их биосинте-
за и переноса на поверхность клетки изучен у
Е. coli, Neisseria meningitidis, Haemophilus influen-
zae, Klebsiella и Streptococcus группы А. Капсуль-
ные полисахариды E. coli разделяются на группы
I (Klebsiella-подобные) и II (Neisseria- и Наето-
phiZws-подобные).
Капсульные полисахариды Klebsiella и кап-
сульные полисахариды группы I Е. coli синте-
зируются с участием ферментов, гены которых
соответствуют генам rfb, участвующим в биосин-
тезе ЛПС. Полимеризация капсульных полисаха-
ридов может включать промежуточное образова-
ние олигосахаридов, связанных с ундекапренол-
дифосфатом, или осуществляется без этого этапа.
Конечным акцептором некоторых капсульных по-
лисахаридов группы II у Е. coli, Н. influenzae
и N. meningitidis служит фосфатидовая кисло-
та. Этот компонент предположительно опосре-
дует связывание капсулы с поверхностью через
гидрофобные взаимодействия. У Е. coli (кап-
сулы группы II) и N. meningitidis связывание
полисахаридов с фосфатидовой кислотой сопря-
жено с их переносом через плазматическую мем-
брану. Участками переноса капсульных полиса-
харидов у грамотрицательных бактерий служат
участки контакта мембран.
Глава 23. Сборка структур клеточной поверхности 31
23.5.1. Синтез и перенос капсульных
полисахаридов на поверхность клетки
Синтез капсульных полисахаридов у N. meningiti-
dis, Н. influenzae и (группы I) у Е. coli детермини-
рован сходными кластерами генов — kps (Е. coli),
cps.(H. influenzae) и ctr (N. meningitidis). Ген-
ный кластер kps состоит из трех областей. Цен-
тральная область кластера, от которой зависит
полимеризация капсульных полисахаридов, типо-
специфична. Она фланкирована двумя консер-
вативными областями, определяющими перенос
капсульных полисахаридов на поверхность клет-
ки. Аналогичным образом построены кластеры
генов cps и ctr. Синтезируемые с их участием кап-
сульные полисахариды полимеризуются на внут-
ренней стороне плазматической мембраны. Пере-
нос синтезированного полисахарида осуществляет
АВС-2-переносчик, аналогично тому, как это про-
исходит в случае синтеза липополисахарида (см.
рис. 23.6). Таким образом, перенос капсульных по-
лисахаридов группы II на фосфатидил-ОДО схо-
ден, вероятно, с переносом О-специфического по-
лисахарида на комплекс олигосахаридный остов-
липид А.
Капсула, образуемая видами Streptococcus
группы А, содержит гиалуроновую кисло-
ту — гликозаминогликан, имеющий структуру
[3)-/5-GlcA(l,3)-^-GlcNAc-( 1171. Синтез и транс-
порт гиалуроновой кислоты на поверхность
клетки протекают сопряженно. Полимеризация
осуществляется путем поочередного переноса
остатков глюкуроновой кислоты (GlcA) и GlcNAc
непосредственно из UDP-активированных форм
без участия ундекапренолфосфата в качестве ко-
фактора.
У стрептококков перенос гиалуроновой кис-
лоты на поверхность клетки для синтеза
капсульного полисахарида происходит более
простым образом, поскольку наружная мем-
брана у них отсутствует. Предположительно
полисахарид растет на редуцирующем конце и вы-
талкивается из клетки в процессе элонгации. Мем-
браносвязанный комплекс гиалуронатсинтетазы
(белка с трансферазной активностью в отношении
как GlcA, так и GlcNAc) и UDPGlc-дегидрогеназы
одновременно синтезирует гиалуроновую кислоту
и переносит ее на поверхность клетки.
23.5.2. Регуляция синтеза капсул
Биосинтез капсул у Klebsiella и Е. coli (кап-
сулы группы I) контролируется двухкомпонент-
ной регуляторной системой res (от regulation of
capsule synthesis — регуляция синтеза капсулы),
впервые описанной для синтеза полисахарида
слизи (полисахарид М, от mucus — слизь) Е. coli
(см. также разд. 20.4). Эта регуляторная систе-
ма состоит из сенсорного белка RcsC и ответного
регулятора RcsB. Оба белка функционируют сов-
местно с белком RcsA и протеазой LonB Е. coli.
Стимул, воздействующий на мембраносвязанный
сенсор — продукт гена res С, неизвестен. Данные
регуляторные гены локализованы в различных
участках хромосомы вне '/Д-связанно го кластера
генов синтеза капсулы.
Образование капсул группы II у Е. coli регу-
лирует не система Res, а продукт гена rfaH, вза-
имодействующий с последовательностью ДНК,
расположенной выше генов kps. Эта последова-
тельность локализована непосредственно перед
генами многих полисахаридов и названа поэто-
му стартовой последовательностью JUMP (от just
upstream of many polysaccharide expression genes).
Белок RfaH (18 кДа), распознающий стартовую
последовательность JUMP (39 п.н.), действует в
качестве антитерминатора при транскрипции кап-
сульных генов. В отличие от капсул группы I,
образование капсул группы II зависит от темпе-
ратуры и регулируется с участием пока не иден-
тифицированных генов, расположенных выше
генов kps.
Механизм регуляции образования капсул у
других упомянутых родов пока не изучен.
Капсульные полисахариды у N. meningitidis,
Н. influenzae и Е. coli (группы II) синтезиру-
ются на внутренней стороне плазматической
мембраны путем элонгации на нередуцирующем
конце, оставаясь связанными с первичным ак-
цептором (предположительно ундекапренолфос-
фатом). Синтезированные полисахариды перено-
сятся через плазматическую мембрану с помо-
щью переносчика АВС-2-типа и передаются на
вторичный акцептор — ОДО-фосфатидовую кис-
лоту.
32 Часть VI. Рост и дифференцировка клеток
23.6. Сборка полисахаридов сопряжена с циклом ундекапренолфосфата
У ндекапренол фосфат синтезируется у бактерий
из мевалоновой кислоты с участием АТР, в виде
дифосфата сложного моноэфира (см. разд. 7.9).
Прежде чем принять участие в биосинтезе по-
лисахаридов, он дефосфорилируется до монофос-
фата бацитрацин-чу вствительной фосфатазой,
локализованной в плазматической мембране.
В мембране существует сбалансированное соот-
ношение между ундекапренолом (undec), undec-P
и undec-P-P, определяемое участием этого липи-
да в различных процессах биосинтеза (например,
в биосинтезе пептидогликана и полисахаридов, а
также тейхоевых и тейхуроновых кислот) и ско-
ростью его синтеза. При образовании, полимери-
зации и переносе олигосахаридов происходит пре-
вращение undec-P в undec-P-P (рис. 23.8).
В переносе олигосахаридов, по-видимому, все-
гда участвует undec-P-P, тогда как моносахариды
переносит undec-P. Таким образом, undec-P, вы-
свобождающийся при гликозилировании с перено-
сом моносахаридов, может непосредственно вновь
участвовать в цикле, в отличие от undec-P-P, ко-
торый после высвобождения в процессе переноса
олигосахаридов должен быть вначале дефосфори-
лирован для дальнейшего участия в процессе.
У архей в процессе синтеза олигосахаридов
с их переносом на белок действует аналогичный
цикл липидов, но в случае этих организмов роль
липидов-переносчиков выполняют долихол и его
фосфорилированные формы, участвующие в дан-
ном процессе также у эукариот (см. рис. 7.30).
Ундекапренол (undec) служит важным ли-
пидным компонентом бактериальной мембраны
Рис. 23.8. Цикл липидов при сборке полисахаридов.
Центральное соединение цикла — ундекапренолфосфат
(undec-P), синтезируемый из мевалоновой кислоты,—
выполняет роль кофактора, переносящего олигосаха-
риды или полисахариды [(S)n] и моносахариды (S).
При переносе олигосахаридов или полисахаридов на ак-
цептор R высвобождающийся липид приобретает пи-
рофосфодиэфирную связь, происходящую от первона-
чально перенесенного сахар-1-фосфата. Липид в форме
undec-P-P должен быть дефосфорил и рован для регене-
рации кофактора (правый цикл на схеме). При перено-
се моносахарида липид высвобождается с монофосфо-
диэфирной связью, в форме undec-P, и способен сразу
включаться в цикл (левая часть схемы). Ундекапренол-
фосфат может также дефосфорил и роваться до унде-
капренола и вновь фосфорилироваться с участием АТР.
и присутствует в двух формах — монофосфата
и дифосфата (undec-P и undec-P-P). В форме
undec-P он выполняет роль акцептора в синте-
зе полисахаридов и при переносе гликозильных
остатков высвобождается в виде undec-P-P; таким
образом, синтез полисахаридов связан с оборотом
различных форм этого липида.
23.7. Наружная мембрана грамотрицательных бактерий содержит
порообразующие белки (порины) и структурные белки
Наружная мембрана содержит ряд белков. Од-
ни из них представляют собой порины, такие как
OmpC, OmpF и PhoE в случае Е. coli, которые
олигомеризуются, образуя в мембране каналы
(поры) для транспорта ионов и мелких молекул.
Аналогичные порообразующие белки описаны у
Salmonella, Neisseria, Haemophilus, Pseudomonas и
Rhodobacter capsulatus. Другие белки, такие как
OmpA и липопротеин у Е. coli, служат структур-
ными белками, участвующими в сборке и поддер-
Глава 23. Сборка структур клеточной поверхности 33
жании стабильности наружной мембраны; они же
выполняют роль рецепторов для бактериофагов и
бактериоцинов.
23.7.1. Порины
Порины синтезируются на полисомах на внут-
ренней стороне плазматической мембраны в ви-
де белков-предшественников, которые переносят-
ся затем через плазматическую мембрану секре-
торной (Sec) системой с участием белка SecB в
качестве шеперона (белка-помощника), после че-
го с участием сигнальной пептидазы I превраща-
ются в зрелые порины. Правильную ориентацию
поринов в наружной мембране обеспечивают
внутренние сигналы прекращения переноса. В ре-
зультате этот белок пронизывает наружную мем-
брану в виде многочисленных петель и антипа-
раллельные /3-цепи в составе его молекулы об-
разуют в мембране структуру наподобие бочонка
(см. рис. 5.9).
Поры в наружной мембране служат для спе-
цифичного транспорта в клетку растворенных ве-
ществ, таких как фосфат (белок PhoE у Е. coli, бе-
лок PhoP у Pseudomonas), глюкоза (белок PhoD
у Pseudomonas) или мальтоза (белок LamB у
Е. coli), либо для менее специфичного транспорта
мелких молекул (белки ОтрС и OmpF у Е. coli).
Первые белки названы специфическими порина-
ми, вторые — общими поринами. Экспрессию об-
щих поринов регулирует двухкомпонентная сиг-
нальная система (osm), чувствительная к осмо-
тическому давлению в среде. Экспрессию белков
ОтрС и OmpF можно в значительной степени по-
давить добавлением церуленина, который инги-
бирует синтез жирных кислот и тем самым син-
тез липополисахаридов. Синтез белков ОтрС и
OmpF коррелирует с синтезом липополисахари-
дов и зависит от него (см. разд. 20.4.2).
Синтез поринов коррелирует с синтезом ли-
пополисахарида (ЛПС). Порины, синтезирован-
ные вначале в виде белков-предшественников,
переносятся через плазматическую мембрану
Sec-зависимой транспортной системой, после чего
сигнальный пептид отщепляется сигнальной пеп-
тидазой I. Включение поринов в наружную мем-
брану происходит в тесной ассоциации с ЛПС и
сопровождается образованием поры. Липополиса-
харид, по-видимому, важен для синтеза и функ-
ции поринов.
23.7.2. Липопротеин Е. coli
Липопротеин Е. coli существует в двух формах:
как связанный с пептидогликаном и как свобод-
ный в наружной мембране. И в той, и в другой
форме липопротеин поддерживает стабильность
наружной мембраны, в основном благодаря гид-
рофобным взаимодействиям с ЛПС и белками.
Связанная с пептидогликаном форма важна так-
же для связи наружной мембраны с пептидогли-
кановым слоем клеточной! стенки.
Липопротеин синтезируется в виде белка-пред-
шественника с сигнальным пептидом на N-кон-
це. Первый аминокислотный остаток после сиг-
нального пептида — остаток цистеина. Пока липо-
протеин еще соединен с сигнальным пептидом, он
связывается через SH-группу этого остатка ци-
стеина с глицеролом из фосфатидилглицерола с
образованием тиоэфирного мостика. Затем про-
исходит ацилирование по обеим гидроксильным
группам глицерольного остатка жирными кисло-
тами в реакции обмена с фосфолипидами. По-
сле этого белок-предшественник пересекает внут-
реннюю мембрану и одновременно сигнальный
пептид отщепляется сигнальной пептидазой II.
В завершение аминогруппа N-концевого остатка
цистеина ацилируется, что приводит к образова-
нию липидной концевой части.
R-СО-О
I
R-CO-O-CH2-CHO-CH2-S
сн2
I
R-CO-NH-СН-СО-........
Связанный липопротеин образуется у Е. coli в
результате взаимодействия его свободной формы
через С-концевой остаток лизина с остатком диа-
минопимелиновой кислоты в составе пептидогли-
кана. Синтез свободного и связанного липопроте-
инов показан на рис. 23.9.
Липопротеин, содержащий три остатка
жирных кислот, синтезируется вначале как бе-
лок-предшественник, замещенный глицеролом, и
затем ацилируется по остатку глицерола двумя
остатками длинноцепочечных жирных кислот,
происходящими из фосфолипидов. Ацилирован-
ный белок-предшественник переносится через
плазматическую мембрану, процессируется специ-
34 Часть VI. Рост и дифференцировка клеток
Рис. 23.9. Синтез липопротеина у Е. coli. Волнистой
линией показан сигнальный пептид, прямой линией —
основная полипептидная цепь. На первом этапе про-
исходит связывание полипептида с глицеролом через
SH-rpynny цистеинового остатка (источником глицеро-
ла служит фосфатидилглицерол); в результате реак-
ции высвобождается фосфатидовая кислота и белок
приобретает заместитель тиоглицерол. (Тио)глицерол
этерифицируется жирными кислотами (их источником
служат две молекулы фосфатидил глицерола, и в ре-
зультате высвобождаются две молекулы лизофосфа-
тидилглицерола). Затем сигнальный пептид отщепля-
ется сигнальной пептидазой II (sig II) и к образовав-
шейся свободной аминогруппе также присоединяется
ацильная группа (из фосфатидилглицерола; в результа-
те реакции высвобождается лизофосфатидилглицерол).
Синтезированный липопротеин либо остается в свобод-
ной форме в наружной мембране, либо переносится на
пептидогликан с образованием пептидной связи между
С-концевым остатком лизина и карбоксильной группой
остатка L-R3 в пептидной части структурной единицы
пептидогликана (см. разд. 23.1.1). Обозначения и со-
кращения, как на рис. 23.7.
фической сигнальной пептидазой II и ацилирует-
ся по остатку цистеина третьим жирнокислотным
остатком.
Свободная форма липопротеина наружной
мембраны представляет собой предшественник
его формы, связанной с пептидогликаном.
23.8. Нитевидные фимбрии взаимодействуют
с поверхностными рецепторами клетки
Фимбрии (в статьях американских авторов они
часто описываются как пили) — это волосовид-
ные отростки бактериальных клеток, обеспечи-
вающие их адгезию к различным поверхностям
(см. разд. 2.6.3, 3.5 и 33.3; рис. 2.20). Прикреп-
ление фимбрий к клеткам млекопитающих ча-
сто является первой стадией бактериальной ин-
фекции. Большинство фимбрий распознает слож-
ные углеводы на поверхности клеток-мишеней.
Фимбрии Е. coli проявляют различную специ-
фичность: фимбрии I типа распознают а-мапнозу,
фимбрии P-типа —cv-Gal-(l,4)/?-Gal и фимбрии
S-типа —cv-NeuN Ас. Фимбрии состоят из струк-
турных субъединиц (молекул основного пептида)
и расположенных на конце фимбрии молекул ад-
гезивов (минорных пептидов).
Образование фимбрий детерминируют слож-
ные генные кластеры, включающие гены синте-
за адгезинов, структурного белка фимбрий и ря-
да дополнительных белков. В качестве приме-
ра на рис. 23.10 изображено строение кластера
ptzp-генов, кодирующих Р-фимбрии уропатогеп-
ных штаммов Е. coli. Адгезивные и структурные
субъединицы фимбрий синтезируются как белки-
Глава 23. Сборка структур клеточной поверхности 35
предшественники и в этой форме переносятся че-
рез плазматическую мембрану. При последующем
переносе через периплазматическое простран-
ство один из вспомогательных белков (в случае
Р-фимбрий — PapD) функционирует как челнок
и периплазматический шеперон для адгезивных
минорных пептидов (например, сахароспецифич-
ного белка PapG и белков РарЕ и PapF, специ-
фичных к компонентам белков хозяина), а так-
же для основного белка фимбрий, РарА. Эти
белки отделяются от белка PapD при взаимодей-
ствии с белком наружной мембраны РарС. Адге-
зив PapG первым переносится к наружной мем-
бране и выталкивается из нее несколькими мо-
лекулами белков РарЕ и PapF, которые вместе с
белком PapG образуют верхушку последователь-
но растущей фимбрии. Этот процесс схематичес-
ки показан на рис. 23.10.
В состав фимбрий входят белки, облада-
ющие свойством специфичного распознавания,
и поддерживающая белковая структура. Сборка
фимбрий осуществляется из субъединиц, синте-
зируемых в форме белков-предшественников, ко-
торые по отдельности переносятся через плаз-
матическую мембрану и транспортируются через
периплазматическое пространство в комплек-
се с молекулами белка-шеперона. Наращивание
структуры фимбрий происходит путем последо-
вательного выталкивания субъединиц сквозь на-
ружную мембрану; первым выталкивается распо-
знающий белок - адгезии.
Рис. 23.10. Структура генного кластера и процесс сборки Р-фимбрий у Е. coli.
А. Кластер генов, детерминирующий биогенез фимбрий: papl и рарВ — гены регуляторных белков; другие гены
описаны в тексте (р — промотор). Числа под обозначениями генов — мол. масса (кДа) их продуктов — белков.
Б. Процесс сборки: молекулы адгезина PapG (белок, распознающий углеводы на поверхности клетки-хозяина; обо-
значен как G) транспортируются через плазматическую мембрану и образуют комплекс с белком-шепероном (белок
PapD; обозначен как D). Этот комплекс переносится к наружной мембране. В результате взаимодействия с участ-
ком экспорта (белок РарС; обозначен как С) в наружной мембране белок PapG остается в мембране; белок PapD
высвобождается и возвращается в цикл; таким же образом он переносит другие адгезивные субъединицы фимбрий
(минорные пептиды РарЕ и PapF, распознающие компоненты гликокаликса клеток-мишеней; обозначены на схеме
как Е и F соответственно) и белок РарА (обозначен как А), молекулы которого служат структурными субъединицами.
Таким образом, фимбрия в процессе сборки выталкивается из наружной мембраны. Рост фимбрии заканчивается
переносом белка РарН (обозначен как Н) и его включением в мембрану в качестве концевой (с мембранного конца)
субъединицы фимбрии. Пропорции на рисунке не соблюдены. Т — терминатор. По [3].
36 Часть VI. Рост и дифференцировка клеток
23.9. Сборка жгутиков происходит двумя путями
Бактериальные жгутики (см. разд. 2.3.8 и 20.5;
рис. 2.1, 2.19, 20.21 и 24.2) представляют собой
весьма сложные структуры, состоящие из внутри-
клеточного, мембранного, периплазматического и
внеклеточного участков. Жгутики функциональ-
но связаны с белками хемотаксиса (см. разд. 20.5),
и соответственно этому тесно связаны гены, био-
синтез и регуляция образования данных структур
клеточной поверхности.
Биогенез жгутиков —это строго регулиру-
емый, многоэтапный процесс. Предшественни-
ки, синтезируемые внутри клетки, участвуют в
сборке без помощи сигнальных пептидов. Пос-
ле сборки базального тельца, которое располага-
ется в плазматической и наружной мембранах,
происходит образование так называемого крюч-
ка-участка между кольцом в наружной мем-
бране и волокном жгутика. Пептиды, образую-
щие те части жгутика, которые локализованы
в клеточной стенке (от М- до L-кольца), пере-
носятся через мембрану по общему пути транс-
порта с использованием сигнальных пептидов,
системы секреции белков (Sec) и сигнальной пеп-
тидазы. На последнем этапе сборки происходит
формирование волокна из молекул флагеллина
в качестве субъединиц, без присоединения сиг-
нальных пептидов и их последующего отщепле-
ния. Субъединицы волокна проходят через по-
лый цилиндр растущего жгутика и включаются
в процесс сборки на его верхушке. В этом состо-
ит отличие данного процесса сборки от образо-
вания фимбрий, которые наращиваются в участ-
ке прикрепления к мембране. На N-конце моле-
кула флагеллина содержит сигнальную область,
обеспечивающую его распознавание и перенос че-
рез полый цилиндр внутри растущего жгутика.
Системы, контролирующей длину жгутика, не
обнаружено; по-видимому, длина жгутика огра-
ничена только возрастающим сопротивлением,
связанным с трением во время продвижения
субъединиц по центральному каналу. Экспрессия
генов жгутика у Caulobacter crescentus описана в
разд. 24.1.3.
Субъединицы мембранной части жгутика
(крючка и базального тельца) синтезируются без
дополнительной сигнальной последовательности
и в такой форме участвуют в сборке.
Молекулы флагеллина как субъединицы во-
локна жгутика переносятся через центральный
полый цилиндр внутри растущего жгутика и над-
страивают его верхушку.
При синтезе жгутиков действуют по меньшей
мере две системы экспорта белков.
23.10. Поверхность клеток и жгутики некоторых археи
состоят из гликопротеинов
Поверхность клеток у некоторых архей, напри-
мер рода Halobacterium, сформирована из плот-
но и симметрично упакованных молекул отрица-
тельно заряженных гликопротеинов, образующих
поверхностный S-слой. Жгутики этих организ-
мов также состоят из гликопротеинов, углевод-
ная часть которых по строению сходна с глико-
протеинами поверхности (S-слоя). Таким образом,
для синтеза материала клеточной поверхности и
жгутиков используются одни и те же углеводы-
интермедиаты (см. разд. 7.9.5).
Как установлено для Halobacterium halobium
и Halobacterium salinarum, углеводные компонен-
ты гликопротеинов делятся на два типа. Один из
них — это гликозаминогликан-подобная цепь, со-
стоящая примерно из 10-15 повторяющихся пен-
тасахаридных структурных единиц
GlcNAc-(l,4)-GalA-(l,3)-GalNAc
6 3
1 1
3-O-Me-GalA Gal,
другой тип — трисахарид Glc- [4-Нех А- (1-]2-з •
В последней структуре гексуроновая кислота
(НехА) может представлять собой глюкуроновую
кислоту (GlcA) в качестве основного компонента
или идуроновую кислоту (IduA) в качестве ми-
Глава 23. Сборка структур клеточной поверхности 37
норного компонента. С каждой олигосахаридной
единицей связаны две или три сульфатные груп-
пы.
Сборка цепи из пентасахаридных структур-
ных единиц происходит на долихолдифосфа-
те, где эти субъединицы сульфатируются и поли-
меризуются с высвобождением долихолфосфата.
Синтезированная цепь переносится на Asn-Ala-
Ser-последовательность белка, ассоциированного
с мембраной.
Трисахарид синтезируется на долихолфосфа-
те, сульфатируется и переносится на аналогичную
аспарагин-содержащую последовательность.
Высвобождаемый долихолфосфат дефосфори-
лируется, прежде чем снова принять участие в
биосинтезе.
Долихол-Р-Р-связапные олигосахариды внача-
ле переносятся через плазматическую мембрану и
уже затем на конечный акцептор (белок), подоб-
но тому как осуществляются аналогичные этапы
при сборке пептидогликана и полимеризации ли-
пополисахаридов.
Углеводные компоненты гликопротеинов по-
верхности у архей синтезируются на С^-полипре-
нолдолихолфосфате и затем переносятся на аспа-
рагин-содержащую белковую последовательность
(механизм, аналогичный биосинтезу гликопротеи-
нов у эукариот). Для гликопротеинов архей харак-
терно присутствие сульфатных групп в углевод-
ном компоненте. Долихол, участвующий в синтезе
гликопротеинов у архей и эукариот, отсутствует у
бактерий.
Дополнительная литература
Benz R. (1988) Structure and function of porins from
Gram-negative bacteria. Annu. Rev. Microbiol. 42:
359-393.
Fischer W. (1988) Physiology of lipoteichoic acids in
bacteria. Adv. Microb. Physiol. 29: 234-302.
Gottersman S., Stout V. (1991) Regulation of capsular
polysaccharide synthesis in Escherichia coli K12.
Mol. Microbiol. 5: 1599-1606.
Hayashi S., Wu H. (1990) Lipoproteins in bacteria.
J. Bioenerg. Biomembr. 22: 451-471.
Holtje J. V. (1995) From growth to autolysis: the murein
hydrolyses in E. coli. Arch. Vicrobiol. 164: 243-254.
Hultgren S.Normak S. (1991) Chaperone-assisted as-
sembly and molecular architecture of adhesive pili.
Annu. Rev. Microbiol. 45: 383-415.
Лапп K., Лапп B. (1984) Structure and biosynthesis of
O-antigens. In: Proctor R. A. (ed.) Handbook of en-
dotoxin. vol. 1. Rietschel E. T. (ed.) Chemistry of en-
dotoxin. Amsterdam New York: Elsevier: 138-186.
Лапп К., Лапп В., eds. (1990) Bacterial capsules. Curr.
Top. Microbial. Immunol, vol. 150. Berlin Heidelberg
New York: Springer.
Лапп К., Лапп В. (1997) Capsules of Escherichia coli.
In: M. Sussman (ed.) Escherichia coli: mechanisms
of virulence. Cambridge UK: Cambridge University
Press: 113-143.
Macnab R. M. (1992) Genetics and biogenesis of bacterial
flagella. Annu. Rev. Genet. 26: 313-358.
Mirelman D. (1979) Biosynthesis and assembly of cell
wall peptidoglycan. In: Inouye M. (ed.) Bacterial
outer membranes, biogenesis and functions. New
York: Wiley: 115-166.
RaetzC. R. H. (1993) Bacterial endotoxins: extraordi-
nary lipids that activate eukaryotic signal transduc-
tion. J. Bacterio!. 175: 5745-5753.
Raetz C. R. H. (1990) Biochemistry of endotoxins. Annu.
Rev. Biochem. 59: 129-170.
Reizer Reizer A., Saier M. H., .Ir (1992) A new sub-
family of bacterial ABC-type transport system cata-
lyzing export of drugs and carbohydrates. Protein Sci.
1: 1326-1332.
Saier M. H., .Ir. (1994) Computer-aided analyses of trans-
port protein sequences: gleaning evidence concer-
ning function, structure, biogenesis and evolution.
Microbiol. Rev. 58: 71-93.
Schnaitman C. A., Klena Л. D. (1993) Genetics of lipopo-
lysaccharide biosynthesis in enteric bacteria. Micro-
biol. Rev. 57: 655-682.
SleytrU. B., Messner P., Pum D., Sara M. (1993) Crys-
talline bacterial surface layers. Mol. Microbiol. 10:
911-916.
Sumper M. (1987) Halobacterial glycoprotein biosyn-
thesis. Biochem. Biophys. Acta 906: 69-79.
Whitfield C. (1995) Biosynthesis of polysaccharide О
antigens. Trends Microbiol. 3: 178-185.
Whitfield C., Valvano M. A. (1993) Biosynthesis and
expression of cell-surface polysaccharides in Gram-
negative bacteria. Adv. Microbial. Pathophys. 35:
136-246.
Источники рисунков
1. Raetz C. R. H. (1990) Annu. Rev. Biochem. 59: 129-
170,
2. Whitfield C. (1995) Trends Microbiol. 3: 178-185.
3. Hultgren S. .1., Normak S. (1991) Annu. Rev. Micro-
biol. 45: 383-415.
Глава 24
Процессы клеточной дифференцировки
В этой главе подробно рассматриваются три
примера дифференцировки клеток: 1) полярная,
связанная с клеточным циклом дифференциров-
ка у Caulobacter^ 2) зависящая от парциально-
го давления О2 дифференцировка фотосинте-
тических мембран у факультативно фототроф-
ных бактерий и 3) образование гетероцист у
цианобактерий при недостатке связанного азо-
та. Приведены также другие примеры подобных
процессов.
24.1. Образование роящихся (швермерных) клеток и стебельковых клеток
у Caulobacter связано с клеточным циклом
24.1.1. Клеточный цикл и полярная
дифференцировка протекают
координированно
Caulobacter crescentus относится к грамотрица-
тельным простековым (от греч. тгросгбцкт) — при-
даток) бактериям, обладающим также полярным
жгутиком (рис. 24.1; см. цв. вклейку). Клетки
этой бактерии несут простеку, или стебелек, —
вырост длиной 0,5-3,0 мкм, покрытый плазмати-
ческой мембраной и клеточной стенкой и содер-
жащий цитоплазму как продолжение клеточной
цитоплазмы, но лишенный рибосом и ДНК. Сте-
белек образуется па том полюсе клетки, где до
этого находился жгутик. На вершине стебель-
ка выделяется небольшое количество адгезивно-
го материала, который служит для прикрепления
клеток к различным поверхностям. После клеточ-
ного деления на свободном полюсе стебельковой
дочерней клетки образуется жгутик и несколько
пилей; здесь же присутствуют рецепторы бакте-
риофага срСЬК и хемосенсоры для хемотаксиса.
Жгутик состоит из трех основных компонентов:
1) базального тельца, 2) подвижного крючка и
3) волокна (рис. 24.2; см. цв. вклейку). Базаль-
ное тельце состоит из нескольких колец, находя-
щихся внутри: наружной мембраны — L-кольцо,
пептидогликанового слоя — P-кольцо, периплаз-
матического пространства — Е-кольцо и плазма-
тической мембраны — MS-кольцо, закрепляющее
жгутик в плазматической мембране и действую-
щее как ротор. Кольца и крючок скреплены с цен-
тральным стержнем (см. также рис. 20.21). Во-
локно состоит из трех различных белков флагел-
линов.
Пили представляют собой нити диаметром
примерно 4,0 им и длиной 1-4 мкм. Они состо-
ят из молекул пилипа — гидрофобного белка мол.
массой 8,0 кДа, который накапливается в цито-
плазме па полюсе клетки до тех пор, пока непо-
средственно перед делением клетки не начинается
сборка пилей.
В процессе вегетативного роста С. crescentus
происходит асимметричное бинарное деление кле-
ток с образованием дочерних клеток различных
типов: подвижной швермерной клетки и непо-
движной стебельковой клетки (рис. 24.1). Сте-
бельковая клетка вновь делится с образованием
швермерной клетки на дистальном по отношению
к стебельку полюсе. Швермерная клетка, несу-
щая жгутик на старом полюсе, не способна к ре-
пликации ДНК и клеточному делению. В течение
короткого времени опа подвижна, затем теряю-
ет жгутик, подвижность и пили и дифференци-
руется в стебельковую клетку. С началом форми-
рования стебелька на том участке, где находил-
ся жгутик, в клетке инициируется синтез ДНК
и опа вступает в S-фазу клеточного цикла (см.
разд. 22.1). Деление клеток начинается во вре-
мя репликации хромосомы и занимает примерно
половину времени клеточного цикла. Этим оно
отличается от клеточного деления, характерного,
Глава 24. Процессы клеточной дифференцировки 39
например, для энтеробактерий, у которых деле-
ние клеток происходит путем быстрого образова-
ния септы после завершения репликации хромо-
сомы. Механизм выбора полюса для образования
стебелька неизвестен. Предположительно в клет-
ках Caulobacter имеется организующий центр, со-
пряженный с системой экспрессии полярных бел-
ков и активируемый в начале клеточного деления.
Изучению дифференцировки, зависимой от
клеточного цикла, помогает наличие у клеток по-
лярных структур — маркеров дифференцировки,
а также то, что у данных организмов можно легко
получать синхронные культуры. Таким образом,
Caulobacter служит удобной моделью для иссле-
дования дифференцировки, зависимой от клеточ-
ного цикла.
Клетки Caulobacter crescentus делятся асиммет-
рично с образованием подвижной (швермерпой)
клетки и неподвижной стебельковой клетки. Ре-
пликация ДНК и клеточное деление происходят
только в стебельковых клетках. В виде швсрмср-
ной клетки, прежде чем она не потеряет жгутик и
пили и в ней не начнется образование стебелька,
этот организм не способен к синтезу ДНК.
24.1.2. Цикл репликации хромосомы служит
клеточным часовым механизмом
Биогенез полярных структур зависит от иници-
ации нового цикла репликации ДНК и от ее
синтеза, но не от завершения клеточного деле-
ния. Швермерная клетка содержит компактный
нуклеоид размерами более 6000S (S — константа
седиментации Сведберга), который на позд-
ней стадии клеточного цикла (когда швермер-
ная клетка дифференцируется в стебельковую)
превращается в нормальный нуклеоид, 3000S
(рис. 24.1). Компактный нуклеоид швермерной
клетки можно сравнить с гетерохроматином эу-
кариотической клетки, в котором экспрессии
генов не происходит по причине плотной упа-
ковки ДНК. Перед делением клетка содержит
один компактный нуклеоид для дочерней швер-
мерпой клетки и один нормальный нуклеоид
для стебельковой клетки. Переход от компакт-
ного нуклеоида к нормальному происходит рез-
ким образом. Дифференциальная регуляция син-
теза ДНК в сестринских клетках, швермер-
пой и стебельковой, у С. crescentus представ-
ляет один из наиболее поразительных при-
меров регуляторных механизмов, связанных с
развитием. В стебельковой клетке синтез ДНК
начинается непосредственно после разделения
дочерних клеток. В то же время сестринская
швермерная клетка вступает в S-фазу клеточного
цикла лишь после того, как начнется образование
стебелька (рис. 24.1).
Репликация хромосом, по-видимому,
служит часовым механизмом клеточного
цикла □ При репликации хромосомы у С. cres-
centus используется одна специфическая точка
начала репликации (опС), которая у Е. coli не
функционирует. Она содержит в качестве важ-
ных элементов мотив для связывания белка DnaA
и сильный промотор hemE (см. ниже). Инициа-
цию репликации хромосомы определяют по ре-
пликации низкокопийных плазмид и времени экс-
прессии соответствующих генов. Зависимая от
оггС репликация плазмид происходит координи-
рованно с инициацией репликации хромосомы в
период перехода от швермерной клетки к стебель-
ковой. Репликация и сегрегация хромосом требу-
ют последовательной экспрессии генов, продукты
которых необходимы для обоих этих процессов.
В числе таких временно экспрессирующихся ге-
нов — ген дугВ (кодирующий субъединицу гиразы
В) и orf-1. Оба эти гена «молчат», когда находят-
ся па швермерпом полюсе клетки перед деле-
нием, но специфически экспрессируются, когда
швермерная клетка превращается в стебелько-
вую. Транскрипция дуг В, orf-1 и других генов,
участвующих в репликации ДНК, происходит с
компетентной в отношении репликации хромосо-
мы в стебельковых клетках перед делением. Как
предполагается, инициация репликации в клетках
перед делением зависит также от активности про-
мотора hemE. Геномы для будущих швермерной
и стебельковой клеток неким образом дифферен-
цированы уже в фазе G2 клеточного цикла.
Непосредственно перед клеточным делением в
клетках С. crescentus экспрессируется ДНК-ме-
тилтрапсфераза. В швермерных клетках хромо-
сомные консенсусные сайты GANTC-типа пол-
ностью метилированы; при репликации ДНК в
стебельковых клетках эти распознающие последо-
вательности метилированы не полностью; вновь
метилированными они становятся непосредствен-
но перед делением клеток. Если ген метилтранс-
феразы поставить под контроль конститутивно-
40 Часть VI. Рост и дифференцировка клеток
го промотора, эти участки ДНК оказывают пол-
ностью метилированными на протяжении всего
клеточного цикла. В такой мутантной популя-
ции большая доля клеток имеет морфологические
отклонения и дополнительную хромосому. Вре-
менной контроль экспрессии метилтрансферазы,
вероятно, необходим для четкой регуляции про-
цесса репликации ДНК в течение клеточного цик-
ла и зависимой от него дифференцировки.
В передаче сигнала, координирующего по-
движность и образование стебелька с заверше-
нием цикла клеточного деления, участвуют ги-
стидипкиназа Р1еС и ответный регулятор DivK.
Белок DivK участвует также в пути передачи
сигнала, необходимого для деления клеток (см.
рис. 20.17).
Цикл репликации хромосомы у Caulobac-
ter действует, вероятно, в качестве часового меха-
низма клеточного цикла и инициирует неравную
сегрегацию мРНК в дочерние клетки. На птвер-
мерном и стебельковом полюсах клетки перед
делением экспрессия генов происходит дифферен-
цированно, возможно в результате избиратель-
ного «молчания» различных групп генов в хро-
мосомах, локализованных на двух этих полюсах.
Процессы репликации ДНК и клеточная диффе-
ренцировка зависят от временной регуляции ме-
тилирования ДНК.
24.1.3. Экспрессия жгутиковых генов
происходит последовательно
Процесс образования жгутиков — один из приме-
ров клеточной дифференцировки — подробно изу-
чен. Он протекает через ряд стадий и регулиру-
ется преимущественно на уровне транскрипции.
У С. crescentus сборку (морфопоэз) жгутика, его
функцию и реакцию хемотаксиса детерминируют
приблизительно 50 генов. Эти «жгутиковые» ге-
ны организованы в иерархическую систему, вклю-
чающую четыре уровня. Она характеризуется
строгой временной регуляцией, т. е. гены отдель-
ных уровней экспрессируются строго последова-
тельно, в порядке, соответствующем последова-
тельности сборки (из белковых субъединиц) жгу-
тиковых структур (базальное тельце —> крючок —>
волокно; см. рис. 24.2, Б). Экспрессия генов каж-
дого уровня зависит от продуктов генов предыду-
щих уровней иерархии. Гены уровня I (plcC, divK)
предположительно кодируют продукты, отвечаю-
щие непосредственно на сигналы клеточного цик-
ла и необходимые для экспрессии генов класса II.
Гены класса II кодируют белки базального тель-
ца жгутика*белки-переключатели, белки, участ-
вующие в транспорте жгутиковых белков (FliQ
и FliR), а также сигма-фактор а54 РНК-поли-
меразы (продукт гена rpoN). Консенсусные по-
следовательности в области промотора жгутико-
вых генов класса II расположены в основном в
—35-области (рис. 24.2, В). Белки, формирующие
Р- и L-кольца, крючок и стержень, кодируются
генами класса III. Гены класса IV кодируют три
флагеллина (FliJ, FliK и FliL) (рис. 24.2, А, Б).
Гены*одного и того же уровня иерархии (одно-
го и того же класса), даже если они включены в
различные транскрипционные единицы, считыва-
ются примерно в одно время. Время транскрип-
ции контролируется по каскадному механиз-
му шраме-активными регуляторными белками.
Гены класса II считываются РНК-полимеразой,
содержащей сги-субъедипицу, гены класса III и
IV —с участием сг54-субъедипицы. При сигнале
клеточного цикла ответный регулятор FlbD (про-
дукт гена класса II), вероятно, фосфорилирует-
ся киназой и связывается в этой форме с по-
следовательностями ДНК, например элементами
ftr, которые контролируют время транскрипции
сг54-зависимых генов классов III и IV.
На рис. 24.2, В показаны различные классы
промоторов, действующих на каждом уровне экс-
прессии жгутиковых генов. Дифференциальная
регуляция достигается с помощью специфических
энхансеров. Промоторы генов базального тель-
ца содержат вышерасположенный энхансер RE-1;
оперон figF — нижерасположепный энхансер
RE-2. Активатор транскрипции FlbD связывает-
ся с /Ь’-энхансером. Регуляция некоторых генов
в этой иерархии осуществляется по механизму
репрессии. Белок FlbD содержит специфичный
к последовательности ДНК-связывающий актив-
ный участок на СООН-конце и действует в ка-
честве положительного и отрицательного регуля-
тора путем связывания с последовательностями
ftr для активации транскрипции генов классов III
и IV и репрессии транскрипции с промотора клас-
са II. В активированной (фосфорилированной)
форме белок FlbD подавляет транскрипцию соб-
ственного гена и активирует поздние жгутико-
вые гены; он присутствует на швермерном по-
люсе клетки. Белок, эквивалентный белку IHF
Глава 24. Процессы клеточной дифференцировки 41
(от integration host factor — клеточный фактор
интеграции) Е. coli, перед делением аккумули-
руется в клетках и связывается с нескольки-
ми жгутиковыми промоторами классов III и IV,
транскрипция которых происходит только в хро-
мосоме па швермерном полюсе клетки. Экспрес-
сия некоторых генов fla определяется, вероятно,
некой стадией процесса синтеза ДНК. Жгути-
ковые гены, находящиеся па вершине их иерар-
хии или близко к ней, возможно, отчасти регули-
руются специфическим фактором транскрипции.
Инициация транскрипции ранних генов синтеза
жгутика обусловлена сигналами клеточного цик-
ла. В случае прерывания репликации ДНК тран-
скрипция этих генов подавляется. Модель иерар-
хической регуляции жгутиковых гопов представ-
лена па рис. 24.2, Б и Б.
24 1.4. Экспрессия генов жгутиков
и локализация их продуктов
компартмент-специфичны
Одним из механизмов, обеспечивающих необхо-
димую локализацию белков при дифференциров-
ке, служит компартмент-специфичпая экспрессия
генов на швермерном полюсе клетки перед
ее делением (например, генов /ПК и flaNQ).
После образования септы в швермерной клет-
ке продолжается экспрессия поздних жгутиковых
генов. Белок FlbD присутствует перед делени-
ем на обоих полюсах клетки, но на швермер-
ном полюсе он, по-видимому, фосфорилируется и
это приводит к компартмент-специфичной тран-
скрипции Дг-содержащих промоторов с участием
ст54 (рис. 24.2, Б).
Дополнение 24.1. На швермерном полю-
се клетки перед ее делением осуществляет-
ся транскрипция поздних жгутиковых генов
и репрессия ранних жгутиковых генов; па
стебельковом полюсе происходит транскрип-
ция ранних жгутиковых генов. После деле-
ния клетки в швермерной клетке происхо-
дит сборка поздних жгутиковых структур, в
стебельковой клетке — сборка ранних жгу-
тиковых структур. Компоненты механизма
хемотаксиса (см. гл. 20) локализованы па
швермерном полюсе клетки перед ее деле-
нием. Белки хемотаксиса — метилтрапсфс-
раза (CheR), метилэстераза (CheB) и метил-
рецепторпые белки (MRP) — синтезируют-
ся непосредствено перед делением клетки
одновременно £ синтезом флагеллина и бел-
ка крючка. Во время клеточного деления они
переходят в швсрмерпые клетки вместе с ап-
паратом жгутика, однако не направляются
исключительно на ограниченный участок
мембраны, в отличие от флагеллинов.
Пили у С. crescentus штамма СВ 15 формиру-
ются на полюсе швермерной клетки путем сбор-
ки из молекул белка пилина (мол. масса 8 кДа)
вскоре после клеточного деления. Когда образу-
ется стебелек, пили втягиваются внутрь клетки.
Субъединицы пилина постоянно синтезируются
в стебельковых клетках и в клетках перед де-
лением, накапливаясь в цитоплазме. Посттранс-
ляциопный временной контроль сборки пилей
связан с разделением клеток. Как упоминалось
выше, в регуляции полярного морфогенеза и
клеточного деления участвуют, возможно, белки
Р1еС и DivJ.
24.1.5. Деление клетки и образование стебелька
зависят от белка SecA
Белок SecA опосредует перенос через плазмати-
ческую мембрану многих белков (см. разд. 19.4).
Мутанты С. crescentus, лишенные SecA, способны
сбрасывать полярный жгутик, элиминировать хе-
морецепторы и инициировать репликацию ДНК
в процессе перехода от швермерной клетки к
стебельковой клетке, но не способны образовы-
вать стебелек, завершать репликацию ДНК и осу-
ществлять клеточное деление. Это указывает, что
деление клеток и образование стебелька зависят
от SecA.
Гены жгутика и пилей, а также белков хе-
мотаксиса экспрессируются согласно регулятор-
ной иерархии, в которой активность генов каж-
дого уровня зависит от предыдущего. Временной
контроль осуществляется с участием транс-ак-
тивных регуляторных факторов, сигма-факторов
и цпе-активных элементов ДНК. Общая регу-
ляторная сеть, ответственная за специфическую
для клеточного цикла дифференцировку полюсов
клетки, реагирует, вероятно, на сигналы от аппа-
рата репликации ДНК. Экспрессия данных генов
и локализация их продуктов специфичны в отно-
шении компартмента.
42 Часть VI. Рост и дифференцировка клеток
24.1.6. Другие примеры полярной
дифференцировки
Известны и другие примеры полярности бакте-
риальных клеток: образование прикрепленных к
клеточной поверхности белков у Bradyrhizobium
japonicum, сборка актина на старых полюсах кле-
ток у Listeria monocytogenes и секреция гидрокси-
да железа на вогнутой стороне бобовидных клеток
Gallionella.
24.2. Дифференцировка мембран у факультативно фототрофных бактерий
зависит от изменений концентрации кислорода и интенсивности света
Для фототрофных бактерий характерна клеточ-
ная дифференцировка и фототаксис, зависящие
от света и кислорода как внешних стимулов. Фа-
культативно фототрофные бактерии в условиях
темпового хемотрофпого роста используют кис-
лород в качестве конечного акцептора электронов
для дыхания. При низком парциальном давлении
кислорода у них формируется аппарат фотосинте-
за. Градиенты интенсивности и качественных ха-
рактеристик света, а также концентрации кисло-
рода служат для этих бактерий стимулами реак-
ций фототаксиса и хемотаксиса (см. разд. 20.5).
24.2.1. Синтез пигментов и белков
фотосинтетической мембраны
регулируется координированно
Влияние концентрации кислорода □ При
строго аэробном росте Rhodospirillum rubrum,
Rhodobacter sphaeroides и другие факультативно
фототрофные бактерии не синтезируют фотохи-
мический реакционный центр (РЦ) и свстособи-
рающие пигмент-белковые комплексы — антенны
(ССА) фотосинтетического аппарата (см. гл. 13).
Компоненты электронтранспортной цепи, необхо-
димые как для фотосинтетического аппарата, так
и для аппарата дыхания, конститутивно присут-
ствуют у них в плазматической мембране (ПМ
или в периплазме, но концентрация этих компо-
нентов зависит от интенсивности света и содержа-
ния кислорода. Снижение парциального давления
кислорода (рОг) в темноте ниже видоспецифич-
ного порогового уровня индуцирует координиро-
ванный синтез бактериохлорофилла (Бхл), ка-
ротиноидов и пигмент-связывающих белков. На-
против, повышение рС>2 индуцирует биосинтез
NADH-дегидрогеназы, цитохромоксидазы и, воз-
можно, других компонентов дыхательной цепи.
Одновременно с синтезом РЦ и ССА при
понижении рОг образуются впячивания ПМ и
морфологически видоспецифичные внутрици-
топлазматические мембранные структуры
(ВЦМС) (см. рис. 2.11 и 24.3). У Rhodospirillum
rubrum и Rhodobacter sphaeroides видоспецифич-
ные ВЦМС представляют собой везикулы, тогда
как у Rhodopseudomonas viridis— стопки ламелл
(см. рис. 2.12 и 24.3). Образование ВЦМС сопро-
вождается биосинтезом фосфолипидов и других
компонентов мембран и включением их в расту-
щую мембрану. Фосфолипиды интегрируются в
нее во время деления клетки, тогда как белки фо-
тосинтетического аппарата — на протяжении все-
го клеточного цикла. При низком р()‘2 ВЦМС ста-
новятся доминирующими мембранными структу-
рами в клетке (рис. 24.3, Б).
Плазматическая мембрана и впутрицитоплаз-
матическис мембраны соединены у фототрофных
бактерий тонкими трубковидными мембранными
выростами, образуя единую мембранную систему.
При разрушении клеток путем обработки ультра-
звуком или с помощью Френч-пресса связь между
мембранами нарушается. Мембранные фракции,
полученные после разрушения клеток и разделе-
ния их фрагментов центрифугированием в гради-
енте плотности сахарозы, различаются по плаву-
чей плотности, содержанию пигмента и белка и
ферментативной активности. Эти данные, как и
результаты изотопного анализа, показывают, что
компоненты фотосинтетического аппарата и ды-
хательной цепи включаются в мембрану в специ-
фических участках и не распределяются равно-
мерно в мембране путем латеральной диффузии.
Фотосинтетический аппарат локализован преиму-
щественно в системе ВЦМС, тогда как компонен-
ты дыхательной цепи —в плазматической мем-
бране.
Глава 24. Процессы клеточной дифференцировки 43
А
Рис. 24.3. Поперечный срез клеток фототрофной бактерии Rhodobacter capsulatus, выращенной в анаэробных усло-
виях на ярком свету (ЯС) и слабом свету (СС). В первом случае внутрицитоплазматические мембранные структуры
(ВЦМС) располагаются только по периферии клетки, тогда как во втором случае они заполняют большую часть
ее объема. Период адаптации к высокой интенсивности света составляет примерно величину удвоенного времени
генерации, к низкой—его трех-четырехкратную величину, поскольку вначале рост лимитирован. КС — клеточная
стенка. Шкала 100 нм. Фото любезно предоставлено J. Golecki.
Низкое парциальное давление кислорода слу-
жит внешним стимулом, инициирующим синтез
пигментов, а также белков фотосинтетическо-
го аппарата (ФСА) и внутрицитоплазматичс-
ских мембранных структур (ВЦМС). Компонен-
ты ФСА включаются в определенные участки
плазматической мембраны и после ее инвагина-
ции локализуются преимущественно в ВЦМС.
Интенсивность света и, возможно, его
спектральный состав в анаэробных или
микроаэробных условиях определяют коли-
чество ВЦМС и состав фотосинтетического
аппарата □ Снижение интенсивности света сти-
мулирует формирование ВЦМС (рис. 24.3) с воз-
растанием количества фотосинтетических единиц
в расчете на клетку. У таких видов, как, напри-
мер, Rhodobacter capsulatus, обладающих, помимо
внутренней антенны, периферической антенной
(см. рис. 13.6), с понижением интенсивности све-
та возрастает число молекул Бхл антенн в расчете
на РЦ. При высокой интенсивности света.соотно-
шение ССА-Бхл/РЦ-Вхл снижается, т. е. разме-
ры периферической антенны (CCA II, В800-850)
становятся меньше, при этом возрастают относи-
тельные концентрации убихинона и цитохромов b
и с. Кроме того, возрастает интенсивность фос-
форилирования в расчете на РЦ. Увеличение или
уменьшение размеров периферического антенны
и изменение числа фотосинтетических единиц в
ответ на изменение интенсивности света — это ме-
ханизмы адаптации, характерные для всех фо-
тосинтезирующих организмов. Они обеспечива-
ют оптимальное поглощение света и эффективное
соотношение количества светопоглощающих пиг-
ментов и пигментов РЦ, позволяют координиро-
вать поглощение света и первичные процессы фо-
тосинтеза в РЦ (см. гл. 13). Варьирование струк-
турной организации и механизмов регуляции
значительно более выражено в светопоглощаю-
щих системах сравнительно с реакционными цен-
трами. Следует отметить, что антенны служат не
только для поглощения фотонов и передачи энер-
гии возбуждения в РЦ, но также для рассеяния
44 Часть VI. Рост и дифференцировка клеток
излишней энергии возбуждения путем флуорес-
ценции или безызлучательного процесса.
Интенсивность света влияет на образова-
ние и состав фотосинтетического аппарата у фа-
культативно фототрофных бактерий в анаэ-
робных условиях. Снижение интенсивности света
вызывает увеличение числа фотосинтетических
единиц, размеров антенны относительно реакци-
онного центра, а также площади внутрицитоплаз-
матических мембран. С повышением интенсивно-
сти света возрастает концентрация переносчиков
электронов (цитохромов и хинонов) и скорость
фотофосфорилирования в расчете на реакцион-
ны!^ центр.
24.2.2. Гены, связанные с фотосинтезом,
функционируют под контролем
регуляторных сетей
Согласованный синтез Бхл, каротиноидов, пиг-
мент-связывающих белков, хинонов, цитохромов
и фосфолипидов и их упорядоченное включение
в формирующуюся мембрану предполагают нали-
чие общего контроля посредством регуляторных
сетей, координирующих все эти процессы, от пере-
дачи сигнала до образования мембраны. Здесь мы
описываем механизм такой регуляции на приме-
ре Rhodobacter capsulatus (а-подкласс протеобак-
терий). Сравнительные исследования других ви-
дов факультативно фототрофных пурпурных бак-
терий показали, что они обладают аналогичной
организацией генов и сходным механизмом регу-
ляции. О генных структурах и регуляции у пур-
пурных серных бактерий (Chromatiaceae) и зеле-
ных серных бактерий (Chlorobium и родственные
организмы) данных пока недостаточно.
Большинство оперонов фотосинтети-
ческих генов организовано в кластеры □
Гены, кодирующие ферменты синтеза Бхл,
ферменты поздних этапов синтеза каротинои-
дов, белки реакционного центра и внутренней
антенны (CCA I), а также регуляторные белки,
образуют у Rhodobacter capsulatus кластер —об-
ласть длиной 46 т.п.н. в составе хромосомы, со-
ставляя примерно 1,5% всего генома. Вне этого
кластера расположен оперон, кодирующий ге-
ны рис для периферической антенны (CCA II)
(рис. 24.4; см. цв. вклейку). Промоторы неко-
торых оперонов локализованы в вышерасполо-
женных оперонах, например промоторы оперона
puf — в кластере генов bchCXYZ. Транскрипция
генов может начинаться с различных промоторов
(на рис. 24.4 это отмечено стрелками над гена-
ми). Сильный промотор оперона puf, активируе-
мый в анаэробных условиях, локализован в гене
bchZ. Скорость транскрипции с этого промотора
может возрастать в 20-50 раз. При умеренном
парциальном давлении кислорода наблюдается
сопряженная транскрипция оперонов puf и puh
и слабее экспрессирующихся генов crt и bch (см.
длинные и тонкие стрелки на рис. 24.4). В этом
состоит так называемая супероперонная орга-
низация, обеспечивающая сквозное считывание
нескольких оперонов и сбалансированно низкий
уровень экспрессии фотосинтетических генов в
аэробных и микроаэробных условиях, а также их
совместную регуляцию при индукции.
Гены, кодирующие ферменты синтеза бактерио-
хлорофилла и каротиноидов, а также пигмент-
связывающих и регуляторных белков, локализо-
ваны в одном обширном кластере. Экспрессия
этих генов на сбалансированно низком уровне
начинается со слабых промоторов и охватывает
супероперонные ДНК-структуры. В анаэроб-
ных и микроаэробных условиях происходит ко-
ординированная транскрипция нескольких оперо-
нов на разных уровнях.
Стимулом для регуляторных цепей кон-
троля фотосинтетических генов служит из-
менение парциального давления кислоро-
да или интенсивности света □ У культур
Rhodobacter capsulatus, растущих в темноте, по-
нижение парциального давления кислорода ни-
же видоспецифичного порогового уровня пред-
положительно воспринимается окислительно-
восстановительной системой, однако механизм
восприятия этого стимула и преобразования его
в сигнал пока неизвестен. Выше оперонов рис и
puf расположены регуляторные области, чувстви-
тельные к цис- и тра?!с-элементам, влияющим на
них при изменениях концентраций кислорода и
интенсивности света. При одном и том же воздей-
ствии различные фотосинтетические гены экс-
прессируются на сильно различающихся (в 3-100
раз) уровнях. Предполагаемые премоторные об-
ласти оперонов puf, рис и puh не имеют никакого
Глава 24. Процессы клеточной дифференцировки 45
сходства с известными бактериальными промо-
торными элементами. Области двойной симмет-
рии в позициях до 100 относительно точки нача-
ла транскрипции, возможно, представляют собой
сайты связывания транс-активных регуляторных
белков.
В тр<жс-активации генов, кодирующих белки
РЦ и ССА, при низком уровне Оз у Rhodobacter
capsulatus участвует двухкомпонентная регуля-
торная система RegA/RegB. Белок RegB — мем-
браносвязанная сенсорная киназа — в анаэробных
условиях аутофосфорилируется; белок RegA —
ответный регулятор, локализованный в цитоплаз-
ме, — передает сигнал, инициируя каскад фосфо-
рилирования. В отсутствие кислорода RegA-P
стимулирует активность промотора оперонов puf,
puh и рг/с, аналогично эффектам других двухком-
понентных систем (см. гл. 20).
Кроме молекулярного кислорода на актив-
ность фотосинтетических генов влияет свет
(рис. 24.5). Однако действие света перекрывается
более сильным влиянием парциального давления
О2. В геноме Rhodobacter capsulatus вблизи обла-
сти гедА,гедВ расположен локус hvrA. Белок HvrA
связывается с областью ДНК, расположенной на
90-100 п.н. выше оперонов puf и puh. Воспринима-
ющий свет сенсор пока не обнаружен; предполо-
жительно им служит пигмент, поглощающий свет
в синей области спектра. На это указывает тот
факт, что синий свет высокой интенсивности ин-
гибирует экспрессию фотосинтетических пигмен-
тов. Хотя синтез полипептидов ССА II регули-
руется интенсивностью света обратно пропорци-
онально ее изменению, уровень мРНК гена рис не
понижается при повышении интенсивности света.
Синтез белков ССА II, возможно, регулируется
на посттранскрипционном уровне. Третья регуля-
торная система (Orf-469; см. рис. 24.5) действует
при высоком парциальном давлении О2 как ре-
прессор премоторных областей генов, связанных
с синтезом Бхл, каротиноидов и ССА II.
В общей регуляторной сети имеются и другие
элементы, ответственные за оптимальную адап-
тацию аппарата бактериального фотосинтеза к
изменениям интенсивности света, парциального
давления Ог и, предположительно, к метаболи-
ческим сигналам, однако механизмы их действия
пока не ясны. Существование сложной регулятор-
ной сети для дифференцировки фотосинтетиче-
ского аппарата установлено главным образом ге-
нетическими методами (см. разд. 20.1.3).
Стимул Сенсор Регулятор Опероны
ДФ
Низкая интенсивность -►?-* HrvA (+) -» puhA
света Активатор -» pufQBAIsMX
ДрО2
(Высокое содержание -*?-* Orf-469 (-) -► bchCXYZ
кислорода) Репрессор -* bchH
-► bchD
-» crtl
-» pucBACDE
(Низкое содержание -* RegB -» RegA (+) -* pufQBALMX
кислорода) puhA
pucBACDE
Рис. 24.5. Регуляторные системы для контроля тран-
скрипции фотосинтетических генов при изменении ин-
тенсивности света или парциального давления кисло-
рода. Структура оперонов представлена на рис. 24.4.
Функции продуктов генов описаны в тексте. Механизмы
регуляторного взаимодействия модулонов, приведенных
на этом рисунке, пока не известны.
24.2.3. Стабильность мРНК регулируется
на посттранскрипционном уровне
Различные продукты одного и того же оперо-
на требуются клеткам в весьма различных ко-
личествах. Так, хотя pufQBALMX — это тран-
скрипционная единица, уровни синтеза ее про-
дуктов нс одинаковы, например соотношение
PufBA/PufLM составляет 15:1 и белка PufQX
синтезируется значительно меньше, чем PufLM.
Различия в уровне синтеза белков, кодируемых
одним опероном puf в основном объясняются раз-
личиями в стабильности их мРНК — время по-
лужизни мРНК pufBALMX длиной 2,7 т.п.н. со-
ставляет 5 мин, тогда как мРНК pufВ А длиной
0,5 т.п.н.—20 мин. При высоких значениях рОг
время полужизни этих мРНК снижается, при низ-
ких — возрастает. Период полужизни мРНК опре-
деляется отдельными сегментами полицистрон-
ной мРНК, имеющими различную стабильность.
Одни из этих сегментов дестабилизируют мРНК,
представляя собой мишени расщепления нукле-
азами в пределах области, кодирующей белки РЦ.
В областях, кодирующих белки антенны, имеются
вторичные структуры, стабилизирующие мРНК.
Другие посттранскрипционные факторы, вли-
яющие на уровни синтеза компонентов фото-
синтетического аппарата, — это эффективность
трансляции и регуляция активности ферментов.
46 Часть VI. Рост и дифференцировка клеток
Парциальное давление О 2 и интенсив-
ность света служат стимулами, которые несо-
гласованно регулируют экспрессию фотосинтети-
ческих генов через общую регуляторную систему.
К настоящему времени известны лишь немногие
из транс-активных белков, репрессирующих или
активирующих транскрипцию этих генов. Коли-
чество продуктов опсрона зависит от различных
посттранскрипционных факторов, таких как ста-
бильность мРНК, регуляция трансляции и актив-
ность ферментов.
24.2.4. Синтез бактериохлорофилла
регулируется на уровне транскрипции
и на посттранскрипционном уровне
Для сборки комплексов РЦ и ССА необходи-
мо присутствие бактериохлорофиллов, каротино-
идов и пигмент-связывающих белков в определен-
ных стехиометрических соотношениях, специфич-
ных для каждого комплекса. Пулы свободных Бхл
и данных белков в клетках очень малы. Механизм
их координированной совместной регуляции неиз-
вестен. Синтез пигментов регулируется на тран-
скрипционном и посттранскрипционном уровнях.
Транскрипция генов bch и crt повышается в 2-12
раз в ответ на снижение парциального давления
кислорода. Кроме того, синтез Бхл регулирует-
ся, как многие анаболические пути, посредством
ингибирования (по механизму обратной связи)
аминолевулинатсинтазы, первого фермента пути
биосинтеза тетрапиррола, а также Mg-хелатазы
и метилтрансферазы, действующих в точке раз-
ветвления путей синтеза гема и Бхл из протопор-
фирина IX. Конечные продукты, влияющие пу-
тем ингибирования по механизму обратной свя-
зи на различные ключевые ферменты этих пу-
тей in vivo, пока не идентифицированы. In vivo
активны в этом отношении некоторые порфири-
ны и гемы. Другой элемент, способный вносить
вклад в совместное регулирование, — это продукт
гена pufQ, возможно Бхл-акцептирующий белок,
который переносит этот пигмент на белки антен-
ны или РЦ.
Изменения парциального давления Ог и интен-
сивности света регулируют синтез бактериохло-
рофиллов и каротиноидов на уровне транскрип-
ции (активация генов) и на посттранскрипцион-
ном уровне (регуляция ключевых ферментов по
механизму обратной связи, перенос Бхл на акцеп-
тирующие белки и другие, неизвестные механиз-
мы).
24.2.5. Сборка функциональных комплексов
фотосинтетического аппарата протекает
как многостадийный процесс
Как отмечено в предыдущем разделе, компонен-
ты пигмепт-белковых комплексов фотосинтети-
ческого аппарата синтезируются в стехиометри-
ческих количествах. Пигменты или их предше-
ственники и белки переносятся из цитоплазмы
в мембрану и включаются здесь в процесс
сборки сложных структур, включающих реак-
ционный центр, внутреннюю антенну и пери-
ферическую антенну. С новосинтезированными
пигмент-связывающими гидрофобными белками
по завершении трансляции связываются белки-
шепероны, такие как DnaK и GroEL, обеспечива-
ющие правильную укладку их молекул.
Перенос белков фотосинтетического аппара-
та к мембране и включение в нее обеспечива-
ют мембраносвязанные хелперные белки. Бел-
ки антенны после встраивания ориентируются
N-концевыми доменами в направлении цитоплаз-
мы и С-концами в направлении периплазмы
(рис. 24.6, А). N-концы молекул а- и /?-белков
взаимодействуют друг с другом и тем самым
стабилизируют весь комплекс (рис. 24.6). Высоко-
консервативный остаток гистидина, присутству-
ющий в гидрофобном трансмембранном спираль-
ном сегменте, в качестве пятого лиганда связан с
атомом Mg в тетрапиррольном кольце молекулы
Бхл; посредством нековалентных взаимодействий
молекулы Бхл связаны также с аминокислотны-
ми остатками в других позициях. Взаимодействия
Бхл-Бхл и Бхл-белок стабилизируют собранный
комплекс и вызывают сдвиг полосы поглощения
света от 770 нм (мономерный Бхл в ацетоне) до
820 нм (пигмент-белковый олигомер). Мономер-
ные субъединицы антенн агрегируют с образова-
нием кольцевидных олигомерных структур опре-
деленных размеров, что оптимизирует перенос
экситонов (пар электрон-дырка) и способству-
ет стабильности комплексов (рис. 24.6, Б). По-
сле смены индуцирующих условий неиндуциру-
ющими (например, условий фототрофии услови-
Глава 24. Процессы клеточной дифференцировки 47
Рис. 24.6. А. Схема расположения а- и /3-полипептидов CCA I в мембране. Представленная структура олигомерных
светособирающих комплексов описана в тексте. Аминокислотная последовательность CCA I R. capsulatus указана
однобуквенным кодом. N-концевые домены молекул этих и других белков светособирающих антенн расположены
на цитоплазматической стороне мембраны, тогда как С-концевые домены — на ее периплазматической стороне.
С остатками His-32 и His-38 в трансмембранном домене этих полипептидов координационно связан бактериохлоро-
филл через входящий в его молекулу ион Mg2+. Стрелками указаны сайты, где N-концевые и С-концевые пептиды
отщепляются протеазами. Центральные домены полипептидов состоят из гидрофобных аминокислотных остатков и
образуют а-спиральную структуру, которая пересекает двойной липидный слой мембраны. В процессе встраивания
остаток 2а-серина фосфорилируется.
Б. Кольцевидная олигомерная структура светособирающей антенны I (CCA I; В880). Проекционная карта двумерных
кристаллов комплекса CCA I Rhodospirillum rubrum показывает 16 пар белковых Л- и /3-субъединиц, образующих
цилиндр диаметром 116 А с отверстием диаметром 68 А в центре. а-Спирали в составе а- и /3-субъединиц пронизы-
вают мембрану; показан вид сверху. а-Спирали наружного кольца предположительно более наклонены относительно
плоскости мембраны, чем а-спирали внутреннего кольца. Пигменты бактериохлорофилл а (Бхл а) и спириллоксан-
тин локализованы, возможно, между наружным и внутренним кольцами. В центре изображен контур реакционного
центра (РЦ) Rhodopseudomonas viridis со специальной парой молекул Бхл b (Р940) для иллюстрации вероятного
строения внутреннего комплекса (РЦ + CCA I). По [2].
48 Часть VI. Рост и дифференцировка клеток
ями хемотрофии) синтез пигмент-белковых ком-
плексов прекращается; эти комплексы не разру-
шаются, но их концентрация постепенно падает в
результате разбавления по мере роста клеток.
Кольцевидная олигомерная структура уста-
новлена для ССА I Rhodospirillum rubrum с
помощью электронной микроскопии кристал-
лических препаратов с анализом изображений
(рис. 24.6, Б}, а также для ССА II Rhodo-
pseudomonas acidophila с использованием рент-
геновской спектроскопии высокого разрешения.
Комплекс ССА II представляет собой нонамер
одной субъединицы. Между двумя концентри-
ческими цилиндрами из 9 а-спиралей (внутрен-
ний цилиндр) и 9 /?-цепей (наружный цилиндр
радиусом 34 А) заключены, как в сэндвиче, 18
молекул Бхл. Тетрапиррольные кольца располо-
жены параллельно оси цилиндра (нормали мем-
браны). Девять дополнительных молекул Бхл
упакованы между /3-субъединицами так, что их
тетрапиррольные кольца расположены парал-
лельно поверхности мембраны. Перекрывающи-
еся и взаимодействующие молекулы Бхл све-
тособирающего комплекса функционируют как
запасное кольцо и способствуют делокализации
возбужденных состояний и равномерному распре-
делению энергии побуждения в светособирающем
комплексе.
Сборка светособирающих пигмент-белковых
комплексов представляет собой многостадийный
процесс, начинающийся с синтеза пигментов и
белков. Трансляция, перенос и направление бел-
ков к мембране происходит с участием хелпер-
ных белков (белков-«помощников»). Направление
к мембране — это предположительно процесс, спе-
цифичный к ее определенным участкам; за ним
следует включение белков в мембрану и перенос
через двойной липидный слой — стадия, зависи-
мая от протондвижущей силы. Молекулы пигмен-
тов связаны между собой нековалентными свя-
зями, стабилизирующими комплекс. Связывание
молекул Бхл с белком и между собой вызывает
смещение пика абсорбции Бхл из ближней крас-
ной области в инфракрасную область спектра,
способствуя необходимой ориентации тстрапир-
рольпых колец и оптимизации расстояния между
молекулами пигмента.
24.3. Гетероцисты цианобактерий — специализированные клетки,
осуществляющие фиксацию N2
Цианобактерии — это прокариоты, осуществляю-
щие фотосинтез с выделением О2 (см. гл. 13).
У некоторых нитчатых цианобактерий вегетатив-
ные клетки способны дифференцироваться в гете-
роцисты, акинеты (споры) или гормогонии (ко-
роткие, подвижные нити без чехла, в которых
клетки по форме отличаются от вегетативных).
Акинеты представляют собой покоящиеся клет-
ки с толстой стенкой; их появление характер-
но для цианобактерий некоторых родов, образу-
ющих гетероцисты (например, Cylindrospermum и
Anabaena), при дефиците источников питания или
энергии. Эти структуры служат для выживания
в условиях холода или засухи («экзоспоры»).
Гетероцистами называют специализирован-
ные клетки, основная функция которых состоит
в фиксации молекулярного азота. Они образуют-
ся из вегетативных клеток у Anabaena, Nostoc,
Cylindrospermum и других нитчатых цианобакте-
рий при недостатке связанного азота. Гетероци-
сты— это единственный новый тип клеток, кото-
рый формируется в этих условиях (приблизитель-
но за 24 ч), и только клетки этого типа способны
у данных цианобактерий фиксировать Г\;2- Гетеро-
цисты располагаются через одинаковые интерва-
лы вдоль нитей цианобактерий. Наиболее деталь-
но гетероцисты изучены у представителей рода
Anabaena.
Глава 24. Процессы клеточной дифференцировки 49
Рис. 24.7. Взаимодействие гетероцисты с соседними вегетативными клетками у нитчатых цианобактерий Anabaena.
Основные структурные элементы связи и метаболические взаимодействия между гетероцистами и вегетативными
клетками. Гетероциста окружена клеточной стенкой (КС), пластинчатым гликолипидным слоем (ГЛС) и полиса-
харидным слоем (ПС). Микроплазмодесмы (МП) соединяют плазматические мембраны (ПМ) соседних клеток на
конце поровых каналов (ПК) гетероцисты. В гетероцисту поступают углеводы, возможно сахароза, тогда как из нее
в соседние клетки переносится глутамин. ИЦТ — изоцитрат; Фд — ферредоксин; Gin — глутамин; Glu — глутамат;
сЮГ — ct-оксоглутарат; ОА — оксалоацетат; окисл. ПФЦ — окислительный пентозофосфатный цикл; Р, — неоргани-
ческий фосфат; ФЕП — фосфоенолпируват; ФГК — 3-фосфоглицерат; ФС I—фотосистема I; дых. ЭТ — дыхатель-
ный транспорт электронов; триозо-Р — триозофосфат. По [3].
24.3.1. Гетероцисты отличаются
от вегетативных клеток
по структуре и функциям
Зрелые гетероцисты несколько крупнее вегета-
тивных клеток; поверх стенки вегетативной клет-
ки они окружены тремя дополнительными утол-
щенными покровами (рис. 24.7). Поверх клеточ-
ной стенки находятся внутренний пластинчатый
гликолипидный слой, гомогенный промежуточ-
ный полисахаридный слой и наружный волок-
нистый полисахаридный слой. Гликолипидный
и полисахаридный слои оболочки гетероцисты —
это барьеры, препятствующие диффузии газов
внутрь гетероцисты. Гликолипидный слой утол-
щается в случае возрастания парциального дав-
ления Ог- Между гетероцистой и соседними веге-
тативными клетками происходит обмен метаболи-
тами через микроплазмодесмы — мелкие поровые
каналы в поперечной стенке, которые соединяют
плазматические мембраны двух клеток в участке
порового канала гетероцисты (рис. 24.7).
В зрелых гетероцистах функционирует толь-
ко фотосистема I (см. рис. 13.3). Компоненты
выделяющей Ог фотосистемы II, фикобилисо-
мы, фосфорибулокиназа и рибулозобисфосфат-
карбоксилаза утрачиваются в начале процесса
дифференцировки гетероцист. Тилакоиды при-
сутствуют, но в значительной степени модифи-
цированы (модификация происходит па конечной
стадии созревания гетероцист). В участках фик-
сации азота внутри гетероцист осуществляется
интенсивное дыхание, позволяющее удалять оста-
точный Ог- Синтез АТР происходит при цикли-
ческом фосфорилировании в фотосистеме I и при
окислительном фосфорилировании в дыхатель-
ной цепи переноса электронов. Непосредственным
донором электронов для нитрогеназы служит
50 Часть VI. Рост и дифференцировка клеток
специфический для гетероцист ферредоксин (ко-
дируемый геном fdxH) в восстановленной фор-
ме. Фиксация молекулярного азота нитрогеназой
требует затраты энергетических и восстанови-
тельных эквивалентов. Этот фермент гетероцист,
высокогомологичный нитрогеназам других азот-
фиксирующих бактерий, кодируется геном
nifHDK (см. разд. 8.5). Фиксация N2 и дыха-
ние требуют поступления в гетероцисты вос-
становителя в форме сахара (возможно, са-
харозы) из соседних вегетативных, фиксиру-
ющих СО2 клеток. Гетероцисты в свою очередь
высвобождают фиксированный азот в форме глу-
тамина, который переносится из гетероцист в
вегетативные клетки вдоль нити и немедленно
метаболизируется. Необходимый для фиксации
N2 ферредоксин, по-видимому, восстанавливает-
ся в гетероцистах пируват: ферредоксин-оксидо-
редуктазой или NADPH.-ферредоксин-оксидоре-
дуктазой (рис. 24.7).
24.3.2. При дифференцировке гетероцист
происходят значительные изменения
в структуре и функциях клеток
Образование гетероцист начинается в нитях ци-
анобактерий при исчерпании в среде связанно-
го азота (NH+ или NO3), т. е. в условиях, ко-
гда единственным источником азота становит-
ся молекулярный азот, N2 (рис. 24.8; см. цв.
вклейку). Полная дифференцировка вегетатив-
ной клетки в зрелую азотфиксирующую гетеро-
цисту занимает примерно 20 ч. На ранних стади-
ях дифференцировки образуются наружные слои
полисахаридов, затем происходит синтез глико-
липидного слоя. В течение нескольких часов ак-
тивируются или синтезируются две протеазы —
протеаза, расщепляющая фикобилипротеины (см.
разд. 13.3 и рис. 24.9 на цв. вклейке), и другая,
Са2+-зависимая протеаза, расщепляющая фер-
менты рибулозо-5-фосфаткиназу и рибулозо-
бисфосфат-карбоксилазу, участвующие в цикле
Кальвина (разд. 8.1.1), а также другие белки.
Синтез ряда белков, характерных для гете-
роцист, по-видимому, инициируется уже в ве-
гетативных клетках, но продолжается только
в развивающейся гетероцисте. Морфологическое
различие между будущей гетероцистой и вегета-
тивными клетками можно наблюдать через 5-10 ч
после начала дифференцировки. Это период пере-
хода к завершению дифференцировки, после ко-
торого прогетероцисты in vivo не ревертируют в
вегетативные клетки; однако изолированные про-
гетероцисты способны к такой реверсии. Тилакои-
ды претерпевают перестройку и деформируются;
в них сохраняется фотосистема I и некоторые ком-
поненты фотосистемы II (например, белок D1),
но утрачивается способность к выделению О2 и
транспорту электронов на фотосистему I. Позд-
нее в прогетероцистах завершается образование
волокнистого и гомогенного полисахаридных сло-
ев и каналы соединения с соседними клетками
уменьшаются в диаметре. В поровом канале (см.
рис. 24.7) может находиться пробка из запасно-
го белка цианофицина — сополимера аспартата
и аргинина. На поздней стадии дифференцировки
появляется нитрогеназная активность. В аэроб-
ных условиях она запаздывает относительно
появления зрелых гетероцист. В условиях анаэро-
биоза и подавления выделения О2 при недостатке
связанного азота синтез нитрогеназы индуциру-
ется раньше. Добавление О2 к стимулированным,
но не завершившим дифференцировку клеткам
приводит к быстрой инактивации нитрогеназы и
исчезновению соответствующей мРНК. Кроме
нитрогеназы, при дифференцировке гетероцист
синтезируются гидрогеназа и ферменты окисли-
тельного пентозофосфатного пути, глутаминсин-
тетаза и компоненты транспортных систем для
глутамина, а также углеводы. У АпаЪаепа гете-
роцисты образуются в нити через регулярные ин-
тервалы, приблизительно после каждой десятой
вегетативной клетки. (Дифференцировке подвер-
гается вегетативная клетка, располагающаяся по-
середине интервала между двумя зрелыми ге-
тероцистами.) Порядок расположения гетероцист
может измениться в результате мутации или ма-
нипуляций, таких как уменьшение длины ни-
ти механическим путем, изменение интенсивно-
сти света или создание условий недостатка мо-
либдена. Другие цианобактерии (например, рода
Cylindrospermum) образуют единственную гетеро-
цисту на конце нити.
24.3.3. Стимулом для регуляторной цепи,
контролирующей образование
гетероцист, служит исчерпание
в среде связанного азота
Дифференцировка вегетативных клеток в гете-
роцисты—это многостадийный процесс, регул и-
Глава 24. Процессы клеточной дифференцировки 51
руемый каскадом двухкомпонентных сенсорно-
регуляторных систем (см. гл. 20). Индентифи-
цированы пока лишь немногие компоненты этих
систем. Неизвестно, например, каким образом
у Anabaena инициируется формирование гетеро-
цист из определенных по счету клеток в нитях.
По имеющимся данным, через 30 мин после исчер-
пания связанного азота возникает общий сигнал
аминокислотного голодания, такой как синтез по-
лифосфорилированных нуклеотидов (алармонов,
например ppGpp), однако классического строго-
го ответа при этом нс наблюдается. Возможно,
дифференцировка гетероцист инициируется слу-
чайным образом, и от про гетероцисты вдоль ни-
ти в двух направлениях распространяется сигнал
ингибирования образования гетероцист.
Дополнение 24.2. У цианобактерий рода
Anabaena, при росте с использованием N2 в
качестве единственного источника азота, в
нитях имеется два градиента. Из гетероцист
в соседние вегетативные клетки происходит
поступление глутамина, который постепенно
расходуется параллельно линейной диффу-
зии. В противоположном направлении транс-
портируются углеводы, синтезируемые веге-
тативными клетками. Согласно другой ги-
потезе, существуют транспортные системы,
активируемые при недостатке азота и «выка-
чивающие» азот из соседних клеток. Образу-
ющийся в результате недостаток азота в со-
седних клетках активирует их транспортные
системы, которые выкачивают азот из сосед-
них к ним клеток. Последняя клетка, не спо-
собная получить какой-либо азот, кроме N2,
стимулируется к дифференцировке в гетеро-
цисту.
занного азота, а при его исчерпании образу-
ются многочисленные смежные гетероцисты.
Для созревания гетероцист требуется так-
же белок НерА — ATP-связывающий транс-
портный белок, локализованный в плазма-
тической мембране; синтез его индуцируется
в течение 6 ч после удаления из среды свя-
занного азота. Белок НерА участвует в пе-
реносе полисахаридов через плазматическую
и наружную мембраны. У мутантных по
hepA гетероцист, лишенных полисахаридно-
го слоя, оболочка более проницаема для О2,
чем у клеток дикого типа. Ген hglK ини-
циируется через три часа после наступления
дефицита азота; его продукт, по-видимому,
участвует в синтезе гликолипидного слоя. Ген
hetN, возможно, кодирует фермент, опосре-
дующий межклеточные взаимодействия, ко-
торыми регулируется развитие гетероцист у
Anabaena.
Некоторые стадии дифференцировки ге-
тероцист контролирует, вероятно, двухком-
понентная сенсорно-регуляторная система,
состоящая из белков Pat А и PatB. Ген
patA считывается на низком конститутив-
ном уровне как в присутствии, так и в
отсутствие связанного азота. Продукт ге-
на patB содержит в С-концевой области
мотив ciIираль-виток-спираль, характерный
показатель ДНК-связывающий функции, и в
N-концевой области —домен, типичный для
[4Ге-48]-ферредоксинов. Транскрипция patB
происходит через 3-6 ч после исчерпания свя-
занного азота в среде. По-видимому, белок
PatB осуществляет репрессию дифференци-
ровки гетероцист в ответ на соответствую-
щий окислительно-восстановительный потен-
циал клеток.
Дополнение 24.3. При наличии в сре-
де связанного азота у цианобактерий во
всех клетках нити экспрессируется ген hetR.
Уровень синтеза белка HetR регулируется
по механизму положительной ауторегуляции.
Инактивация HetR препятствует дифферен-
цировке гетероцист. В случае повышенного
числа копий hetR в клетках образование ге-
тероцист происходит и в присутствии свя-
Важную роль в дифференцировке гетероцист
выполняет, вероятно, регуляция на уровне
транскрипции. Экспрессию генов с сильных
промоторов определяют с помощью слияния
с генами цианобактерий генов бактериальной
люциферазы. Применение этого метода позволя-
ет определять, в каких клетках нити экспресси-
руется ген hep А, по расположению люминесциру-
ющих клеток. Таким способом визуализируется
пространственное распределение его экспрессии
52 Часть VI. Рост и дифференцировка клеток
в нити задолго до того, как дифференцировка
становится морфологически различимой. Некото-
рые гены, например glnA (глутаминсинтетаза),
atpBE (ATP-синтаза), psbB (белок PSII), sig А
(сигма-фактор) и hetR, транскрибируются в ге-
тероцистах и вегетативных клетках с различных
промоторов. Соответствующие промоторы веге-
тативных клеток содержат типичные Е. соН-по-
добные —10-последовательности. Промоторы ге-
тероцист распознаются РНК-полимеразой, содер-
жащей другой сигма-фактор (гены sigB и sigC).
Промотор nifHDK экспрессируется только в гете-
роцистах, тогда как промотор rbcLS (ген рибуло-
зобисфосфат-карбоксилазы) — только в вегета-
тивных клетках.
Через 2 ч после исчерпания в среде связан-
ного азота значительно возрастает экспрессия ге-
на hetR, активного и в зрелых гетероцистах. Бе-
лок HetR не содержит какого-либо известного
ДНК-связывающего мотива, но требуется для со-
зревания гетероцист, возможно как главный сиг-
нал дифференцировки.
24.3.4. В процессе дифференцировки
перестраивается геном гетероцист
У Andbaena ДНК вегетативных клеток содержит
два элемента, прерывающих опероны нитрогена-
зы и белков сборки. При дифференцировке гете-
роцист один из этих элементов, имеющий длину
11 т.п.н. и включенный в ген nifD, вырезается в
результате рекомбинации между повторами дли-
ной 11 п.н., присутствующими на концах этих эле-
ментов. Рекомбинацию катализирует белок Xis А,
экспрессируемый при развитии гетероцист. Вто-
рой элемент, длиной 55 п.н., прерывающий локус
fdxN [гены Fe-S-кластеров и Мо-кофактора нит-
рогеназы (см. разд. 8.5)], во время дифференци-
ровки гетероцист также вырезается путем сайт-
спсцифичной рекомбинации, катализируемой бел-
ком VisF (ген его локализован в этом элементе).
Как в вегетативных клетках, так и в гетероци-
стах присутствует транс-активный фактор NtcA
(BifА), который связывается с участками выше ге-
нов glnA, rbcL, nifH и xisA. Прерывание гена ntcA
приводит к подавлению фиксации молекулярного
азота и образования гетероцист.
24.3.5. ДНК-зависимая РНК-полимераза
использует во время дифференцировки
различные сигма-факторы
В вегетативных клетках цианобактерий основ-
ная форма РНК-полимеразы связывается с про-
моторами, содержащими консенсусные последова-
тельности в -10- и —35-районах, сходные с со-
ответствующими последовательностями у Е. coli.
Подобные премоторные участки присутствуют
также в генах домашнего хозяйства и генах бел-
ков фотосинтетического аппарата. В противо-
положность этому гены, экспрессируемые толь-
ко в гетероцистах, не содержат в промоторах
консенсусных последовательностей. При голода-
нии по связанному азоту активируются гены, ко-
дирующие сигма-факторы SigB и SigC. Нали-
чие множественных сигма-факторов обнаружено
также у не обладающей свойством дифференци-
ровки цианобактерии Synechococcus, т. е. их функ-
ции не ограничиваются клеточной дифференци-
ровкой. В гетероцистах специфически экспрес-
сируется более 1000 генов, составляющих таким
образом стимулоп (см. гл. 20). Немногие из этих
генов структурно и функционально идентифици-
рованы. Несколько их продуктов осуществляет
множественные функции, и некоторые родствен-
ны хорошо известным семействам бактериальных
регуляторных белков. Чтобы выявить весь каскад
регуляторных эффектов, обеспечивающих обра-
зование гетероцист, требуется идентифицировать
гораздо большее число участвующих в нем генов.
Гетероцисты — это специализированные клет-
ки нитчатых цианобактерий, образующиеся из
вегетативных клеток для фиксации N2. Мно-
гостадийный процесс дифференцировки вегета-
тивных клеток в гетероцисты, расположенные в
нити регулярным образом, инициируется при по-
нижении уровня связанного азота в среде и про-
текает с участием каскада сенсорно-регуляторных
систем. К основным событиям дифференциров-
ки относятся утолщение клеточной стенки с обра-
зованием дополнительного гликолипидного слоя,
утрата активности фотосистемы II и ферментов
фиксации СО2, деградация фикобилипротеинов,
перестройка ДНК, возрастание дыхательной ак-
тивности и индукция синтеза нитрогеназы. Из
гетероцист в соседние вегетативные клетки посту-
пает глутамин, в обратном направлении—угле-
воды.
Глава 24. Процессы клеточной дифференцировки 53
Дополнительная литература
Adams D.G. (1992) Multicellularity in cyanobacteria.
Symp. Soc. Gen. Microbiol. 47- 341-384.
Blankenship R. E., Madigan M. T., Bauer C.E., eds.
(1995) Anoxygenic photosynthetic bacteria. Dord-
recht: Kluwer.
Bryant D. A., ed. (1994) The molecular biology of cyano-
bacteria. Dordrecht: Kluwer.
Buikema W. J., Hasclcorn R. (1993) Cyanobacterial de-
velopment. Annu. Rev. Plant Mol. Biol. 44: 33—52.
Drews G., GoIeckiJ.R. (1995) Structure, molecular or-
ganization, and biosynthesis of membranes of purple
bacteria. In: Blankenship R. E. Madigan M.T.,
Bauer С. E. (eds.) Anoxygenic photosynthetic bac-
teria. Dordrecht: Kluwer: 231-257.
Gober J. W., Marques M. V. (1995) Regulation of cellular
differentiation in Caulobacter crescentus. Microbiol.
Rev. 59: 31-37.
Herdman M. (1987) Akinetes structure and function. In:
Fay P., van Baalen C. (eds.) The cyanobacteria. New
York: Elsevier: 227-250.
Marczynski G. T., Shapiro L. (1995) The control of
asymmetric gene expression during Caulobacter cell
differentiation. Arch. Microbiol. 163: 313-321.
McDermott G., Prince S.M., Freer A. A., Ilawthornth-
waite-Lawless A. M., PapizM.Z., Cogdell R. J., Isa-
acs N.W., (1995) Crystal structure of an inte-
gral membrane light-harvesting complex from photo-
synthetic bacteria. Nature 374: 517-521.
Newton A., Ohta N. (1990) Regulation of the cell division
cycle and differentiation in bacteria. Annu. Rev.
Microbiol. 44 689-719.
Tandeau de Marsac N., Houmard J. (1993) Adaptation
of cyanobacteria to environmental stimuli: new steps
towards molecular mechanisms. FEMS Microbiol.
Rev. 104. 119-190.
Whitton B. A. (1987) Survival and dormancy of blue-
green algae. In: Henis Y. (ed.) Survival and dormancy
of microorganisms. New York: Wiley: 109-167.
WolkC.P. (1982) Heterocysts. In: CarrN.G., Whit-
ton B. A. (eds.) The biology of cyanobacteria. Oxford:
Blackwell Scientific: 359-386.
Wolk С. P., Ernst A., Elhai .1. (1994) Heterocyst
metabolism and development. In: Bryant D. A. (ed.)
The molecular biology of cyanobacteria. Dordrecht:
Kluwer: 769-821.
Wolk С. P. (1996) Heterocyst formation. Annu. Rev.
Genet. 30: 59-78.
Wu J., Newton A. (1997) Regulation of the Caulobacter
flagellar gene hierarchy; not just for motility. Mol.
Microbiol. 24: 233-239.
Источники рисунков
1. Gober.J. W., MarguesM.V. (1995) Microbiol. Rev.
59: 31-47.
2. KarraschS., BulloghP. A., Ghosh R (1995) EMBO
J. 14: 631-638.
3. WolkC.P. (1982) Heterocysts. Im CarrN.G.,
Whitton B. A. (eds.) The biology of cyanobacteria.
Oxford: Blackwell Scientific: 359-386.
Глава 25
Споруляция и клеточная дифференцировка
Бактерии способны выдерживать длительные пе-
риоды стресса, сохраняя жизнеспособность в
течение многих лет в бедных питательными
субстратами местообитаниях или в условиях
бактерицидного действия химических и фи-
зических факторов. Реакции на стресс осу-
ществляются у них как сложные процессы,
включающие необратимую клеточную дифферен-
цировку или даже циклы развития, у некоторых
бактерий с образованием из одноклеточных форм
многоклеточных. Дифференцировка во многих
случаях приводит к формированию клеток осо-
бого типа, обладающих свойствами необычай-
ной устойчивости и длительной выживаемости
в неблагоприятных условиях. Классический при-
мер такого типа клеток — это бактериальные спо-
ры, характерные для организмов родов Bacillus,
Clostridium и Streptomyces, а также миксобакте-
рий (см. рис. 2.5 и 2.21). Споры бактерий вы-
полняют предположительно две экологические
функции. Во-первых, их образование служит спо-
собом приспособления к неблагоприятным усло-
виям для переживания длительного периода
стресса. Во-вторых, споры обеспечивают распро-
странение бактерий в окружающей среде, позво-
ляя виду колонизовать разнообразные местооби-
тания. Они могут переноситься на большие рас-
стояния потоками воздуха и дождевой воды, а
также животными, благодаря чему спорообразу-
ющис бактерии в природе вездесущи. Почвенную
бактерию Bacillus subtilis можно выделить из са-
мых разнообразных экосистем, включая океани-
ческие осадки. Таким образом, экологическое зна-
чение спор чрезвычайно велико.
Спорообразующие бактерии служат плодо-
творным объектом для изучения клеточной диф-
ференцировки и развития многоклеточных струк-
тур, в том числе с применением методов моле-
кулярной биологии. Процесс споруляции пока во
многом неясен, и в числе прочих исследуются сле-
дующие вопросы: 1) какими событиями па уровне
экспрессии генов инициируются процессы клеточ-
ной дифференцировки в ответ па стресс, 2) ка-
ким способом клетки сообщаются друг с дру-
гом для координированного поведения при фор-
мировании сложной многоклеточной структуры и
3) каким образом обеспечивается дифференциро-
ванная экспрессии генов для образования из од-
ной материнской клетки дочерних клеток с раз-
ными направлениями развития.
25.1. Процесс образования эндоспор у Bacillus subtilis
включает большое число генетически детерминированных этапов
Данные о механизме формирования и структуре
бактериальных спор получены главным образом
в исследованиях на Bacillus subtilis, Streptomyces
и Myxococcus xanthus с использованием молеку-
лярно-генетических методов и микроскопии.
Морфологические события, происходящие
при споруляции, наиболее подробно изучены у
В. subtilis (рис. 25.1; см цв. вклейку). В лабора-
торных, оптимальных для роста условиях клет-
ки В. subtilis размножаются с высокой скоростью
путем бинарного деления, при котором образует-
ся септа в центре материнской клетки. При ис-
черпании в среде питательных субстратов (усло-
вия голодания) и высокой плотности клеток в
культуре наблюдается первый морфологический
признак споруляции: появление в клетках асим-
метрично расположенной септы, называемой спо-
руляционпой септой. Как и септа при обычном
делении, споруляционная септа состоит из двух
мембран с тонким слоем пептидогликана между
ними. До ее появления клетка считается нахо-
дящейся на нулевой стадии (стадия 0) спо-
руляции. После формирования септы начинает-
ся стадия II (стадия I была описана, как об-
Глава 25. Споруляция и клеточная дифференцировка 55
разевание осевой нити, состоящей из слившихся
дочерних нуклеоидов, однако неясно, специфич-
но ли это для спорообразования). На стадии II
клетка разделяется септой на больший клеточный
компартмент, развивающийся далее в материн-
скую клетку, и меньший компартмент — будущую
спору. На этой же стадии пептидогликан споруля-
ционной септы подвергается деградации и ее мем-
браны выглядят как слившиеся. Концы мембра-
ны материнской клетки продвигаются к ближай-
шему полюсу, окружая меньший компартмент, и
таким образом начинает формироваться двойная
мембрана вокруг предспоры. На стадии III об-
разуется протопласт предспоры, покрытый двух-
мембранной структурой (зародышевой клеточной
стенкой). Во время стадии IV между этими дву-
мя мембранами откладывается пептидогликан.
Таким образом происходит формирование кор-
текса споры. Через некоторое время после ини-
циации образования кортекса начинается сборка
белковых покровов споры (стадия V). На послед-
ней стадии споруляции — стадии VI, или ста-
дии созревания, — спора становится высокоустой-
чивой к нагреванию и действию химических ве-
ществ (см. рис. 2.2, А, Б) и приобретает свойства
покоящейся формы, а также способность к про-
растанию (см. рис. 2.21, Б). На стадии VII про-
исходит лизис материнской клетки с высвобожде-
нием обезвоженной и сильно преломляющей свет
летки —споры (рис. 25.1).
Генетический подход к изучению споруля-
ции у В. subtilis основан на выделении мутан-
тов с нарушениями споруляции, изучение кото-
рых помогает идентифицировать гены, кодиру-
ющие структурные компоненты эндоспоры или
белки — регуляторы экспрессии генов дифферен-
ировки. Мутации классифицируют в соответ-
ствии со стадией, на которой нарушен процесс
споруляции. Так, мутации группы spoO (spoOA,
spoOB и др.) блокируют начало споруляции (до
образования споруляционной септы). Мутанты
spoil образуют споруляционную септу, но даль-
ше процесс у них не развивается. Мутации spoIII
блокируют образование кортекса, хотя прото-
пласт предспоры в этом случае образуется. Мута-
ции, блокирующие события последующих стадий,
слассифицировать труднее. Как правило, мутан-
ты spoIV образуют эндоспоры с незавершенным
кортексом и без покровов. У мутантов spoV спо-
ра имеет незавершенный покров, тогда как кор-
текс выглядит нормальным. Мутанты spoVI об-
разуют морфологически нормальные эндоспоры,
но эти споры не обладают характерной для зре-
лых эндоспор устойчивостью к неблагоприятным
воздействиям (нагреванию, обработке хлорофор-
мом и/или лизоцимом).
Процесс образования эндоспоры включает со-
бытия, происходящие в двух раздельных клеточ-
ных компартментах. В одном из них, будущей
споре, экспрессируется набор генов, специфич-
ных для предспоры (см. разд. 25.1.2), например
ssp — гены низкомолекулярных кислотораствори-
мых белков, связывающихся с хромосомной ДНК
споры. Напротив, гены cot, кодирующие белки
споровых покровов, экспрессируются в материн-
ской клетке. В то же время влияние некоторых
генов, экспрессия которых специфична для пред-
споры или материнской клетки, не ограничива-
ется одним компартментом. Существуют гены,
выполняющие регуляторную функцию через гра-
ницу между компартментами. Таким образом,
сообщение между компартментами составляет
важную часть процесса споруляции, подобно тому
как межклеточные сигналы обеспечивают регуля-
цию развития у высших организмов.
Споруляция представляет собой простую
форму дифференцировки. Она начинается с асим-
метричного деления клетки и образования двух
компартментов: предспоры, развивающейся в эн-
доспору, и материнской клетки, которая по за^
вершении процесса спорообразования лизируется,
высвобождая эндоспору.
25.1.1 . Инициацию спорообразования у Bacillus
subtilis вызывают множественные
клеточные и внеклеточные сигналы
В инициации спорообразования важную роль вы-
полняют регуляторные факторы, активирующие
экспрессию специфических для споруляции генов
в ответ на определенные сигналы. Природа та-
ких сигналов, или стимулов, неясна, но известны
условия их возникновения, которыми служат три
следующих фактора.
1. Исчерпание в среде питательных ве-
ществ. Необходимым условием инициации
спорообразования является исчерпание лег-
56 Часть VI. Рост и дифференцировка клеток
кометаболизируемого источника углерода или
азота. В качестве возможного сигнала к спо-
руляции при недостатке питательных веществ
рассматривается снижение уровня GTP.
Если па стадии экспоненциального роста
культуры, т. е. в условиях, подавляющих спо-
руляцию, внести в среду аналоги пуринов,
ингибирующие синтез GTP, клетки начи-
нают образовывать споры несмотря на вы-
сокую концентрацию питательных веществ,
даже наиболее предпочтительных для веге-
тативного роста (например, глюкозы и глу-
тамина). Как предполагается, существует ли-
бо фактор положительной регуляции, кото-
рый при снижении уровня GTP активируется,
либо, напротив, ингибитор, подвергающийся
при этом инактивации. Идентифицировано
несколько белков, подвергаемых гуанилиро-
ванию при переходе клеток в стационарную
фазу роста. К таким белкам относятся ком-
поненты фосфотрансферазной системы погло-
щения углеводов — фермент I и белок НРг (см.
разд. 20.2.4). Каким образом гуанилирование
может быть связано с индукцией споруляции,
пока неясно.
2. Высокая плотность клеточной популя-
ции. Индукция спорообразования зависит от
плотности культуры. При ее низкой плотности
клетки не осуществляют споруляцию, несмот-
ря на голодание или обработку аналогом пу-
ринов. Однако способность к споруляции вос-
станавливается, если клетки из культуры с
низкой плотностью ресуспендировать в филь-
трате культуры, клетки которой начали спо-
рулировать, т. е. находящейся в конце лога-
рифмической фазы роста. По-видимому, этот
эффект плотности популяции объясняется
присутствием в культуральной жидкости од-
ного или большего числа внеклеточных белко-
вых факторов, возможно в качестве сигналов,
благодаря которым дифференцировка про-
исходит лишь при достаточной плотности
популяции (эффект «кворум-сенсинг»; см.
разд. 20.1.4).
3. Синтез ДНК. Репликация ДНК необходима
для образования хромосом материнской клет-
ки и споры. Ингибирование синтеза ДНК в
клетках культуры на. поздней логарифмиче-
ской фазе блокирует инициацию спорообразо-
вания и экспрессию его ранних генов. Приро-
да сигнала, возникающего при синтезе ДНК и
активирующего экспрессию этих генов, пока
неизвестна.
Передача сигналов, возникающих при этих
трех условиях, осуществляется по так называе-
мому SpoO-фосфо-пути, в котором участвует
несколько продуктов генов spoO — белки SpoOF,
SpoOB и SpoOA (рис. 25.2; см. цв. вклейку). Белки
SpoOF и SpoOA принадлежат к классу белков —
ответных регуляторов, в свою очередь входяще-
му в семейство регуляторных белков двухком-
понентных систем (см. разд. 20.4). Белок SpoOF
служит мишенью действия гистидиновых проте-
инкиназ — продуктов генов kin A (spoilJ) и ктВ.
Предположительно белок SpoOF фосфорилирует-
ся и затем его фосфогруппа переносится на бе-
лок SpoOB — протеинфосфотрансферазу, которая
в свою очередь фосфорилирует остаток аспарта-
та в белке SpoOA. Белок SpoOA, активированный
благодаря фосфорилированию, выполняет функ-
цию регулятора транскрипции, осуществляюще-
го как положительный, так и отрицательный
контроль экспрессии генов (см. ниже). Такое
ступенчатое фосфорилирование с участием двух
протеинкиназ предположительно обеспечивает
интеграцию трех сигналов — о высокой плотно-
сти популяции, синтезе ДНК и исчерпании пи-
тательных веществ. На активность гистидино-
вой протеипкиназы, возможно, действует сигнал,
возникающий при дефиците источника углерода.
Сигнал о плотности популяции, по имеющим-
ся данным, может процессироваться продукта-
ми гена spoOK. Оперов spoOK кодирует ком-
плекс с активностью пептидпермеазы, сходный с
комплексом — переносчиком олигопептидов (Орр)
у Salmonella typhimurium. Как предполагается,
в поздней логарифмической фазе роста в куль-
туральной жидкости накапливаются низкомо-
лекулярные внеклеточные факторы (возможно,
мелкие олигопептиды), которые регулируют ини-
циацию споруляции, а также активность гисти-
диновых протеинкиназ и/или белка SpoO. Синтез
ДНК может оказывать влияние на активность ли-
бо белка SpoOB, либо SpoOF, судя по тому, что
при подавлении синтеза ДНК эти белки стиму-
лируют транскрипцию генов споруляции. Какой
именно сигнал, возникающий в результате синте-
за ДНК, воздействует на активность белков SpoOF
и SpoOB, пока неизвестно.
Глава 25. Споруляция и клеточная дифференцировка 57
25.1.2 . Ключевую роль в инициации
спорообразования у Bacillus subtilis
выполняет фосфорилированный
белок SpoOA
Суммарный эффект сигналов, возникающих в
неблагоприятных для роста и способствующих
споруляции условиях, состоит в повышении внут-
риклеточного уровня фосфорилированного
белка SpoA (SpoOA—Р; рис. 25.2). Образование
SpoA-P как конечного компонента, участвующе-
го в фосфо-пути передачи сигнала, установлено в
частности на мутантах spoA. Мутации гена spoA,
супрессорные по отношению к нуль-мутациям в
генах spoOB, spoOF, spoOK и kin, приводят либо к
независимости фосфорилирования от SpoO, либо
к проявлению активности белком SpoOA в нефос-
форилированном состоянии. Мутации последнего
класса делают транскрипцию генов споруляции
независимой от условий, которые в разд. 25.1.1
рассмотрены как источники сигналов, приводя-
щих к повышению уровня SpoOA-P.
Белок SpoOA-P осуществляет отрицательную
регуляцию транскрипции генов, участвующих
в подавлении споруляции, включая ген abrB,
кодирующий репрессор ряда индуцируемых го-
лоданием генов, в том числе генов споруляции.
Белок AbrB подавляет, например, активность ге-
на spoOH, кодирующего сигма-фактор сгн, необ-
ходимый для транскрипции ряда генов споруля-
ции. Фактор <тн необходим также для инициации
транскрипции с одного из двух промоторов ге-
на spoOA. Ингибируя транскрипцию abrB, белок
SpoOA—Р стимулирует продукцию SpoOH, уско-
ряя таким образом транскрипцию с промотора
spoOA и усиливая собственную продукцию (ауто-
регуляция).
Кроме того, белок SpoOA-P непосредствен-
но активирует транскрипцию нескольких ге-
нов споруляции, например оперонов spoIIA и
spoIIG, участвующих в инициации компартмент-
специфичной экспрессии генов в предспоре и
материнской клетке. Свои регуляторные функ-
ции белок SpoOA осуществляет путем связы-
вания с нуклеотидными последовательностями
внутри промоторов или рядом с промотора-
ми регулируемых генов. Одна из этих после-
довательностей, SpoOA-бокс, выявлена с помо-
щью футпринтинга. Таким образом, SpoOA-P
может либо препятствовать взаимодействию
РНК-полимеразы с промотором, либо стимулиро-
вать инициацию транскрипции, непосредственно
присоединяясь к РНК-полимеразе. Кроме того,
белок SpoOA-P способен косвенно стимулировать
синтез SpoIIA путем положительной регуляции
транскрипции гена sinl (продукт этого гена свя-
зывается с репрессором SinR и подавляет его ак-
тивность) (рис. 25.2).
Инициация спорообразования у Bacillus
subtilis происходит в результате интеграции мно-
гочисленных сигналов, активирующих гистидино-
вые протеинкиназы, которые в свою очередь ин-
дуцируют так называемый фосфо-путь передачи
сигнала.
25.1.3 . Экспрессия генов при споруляции
у Bacillus subtilis зависит
от компартмента
Рассмотренный в предыдущем разделе SpoO-фос-
фо-путь передачи сигнала обеспечивает также
асимметричную закладку споруляционной септы.
Как в вегетативно растущих клетках, так и в
клетках, приступающих к споруляции, закладка
септы происходит с участием белков клеточного
деления FtsZ и FtsA (см. гл. 22), однако участки
закладки септы в этих двух случаях разные. Вре-
менной ход экспрессии генов в процессе споруля-
ции показан на рис. 25.3 (см. цв. вклейку), меха-
низмы регуляции экспрессии генов в предспоре и
материнской клетке — на рис. 25.4 (см. цв. вклей-
ку). В табл. 25.1 приведены специфические для
споруляции сигма-факторы у В. subtilis.
Перед формированием септы белок SpoOA-P
активирует транскрипцию с оперонов spoIIA
и spoIIG. Оперон spoIIA содержит три гена:
spoil A A, spoil А В и spoil АС. Последний ген опе-
рона, spoil АС, кодирует сигма-фактор <rF, от-
ветственный за инициацию транскрипции с про-
моторов генов, экспрессируемых в предспоре.
Продукты генов spoIIA А и spoil А В регулируют
активность белка Spoil АС. Оперон spoIIG со-
держит два гена: ген spoIIGА, кодирующий мем-
браносвязанную протеазу, и ген spoIIGB, коди-
рующий предшественник сигма-фактора сгБ.
Этот предшественник образуется ранее образова-
ния споруляционной септы и предположительно
переходит в активную форму под действием про-
дукта гена spoIIGА после формирования спору-
58 Часть VI. Рост и дифференцировка клеток
Таблица 25.1. Сигма-факторы, специфичные для процесса споруляции у В. subtilis
Сигма-фактор Ген(-ы) Альтернативное название Функция
аЕ spoIICB (sigE) Экспрессия ранних генов споруляции в материнской клетке
spoil АС (sigF) Экспрессия ранних генов споруляции в предспоре
aG spoIIIG (sigG) Экспрессия поздних генов споруляции в предспоре
ок spoIVCB:spoIIIC (sig К) Экспрессия поздних генов споруляции в материнской клетке
ляционной септы. Зрелая форма субъединицы <тЕ
РНК-полимеразы активна, вероятно, только в ма-
теринской клетке.
Превращение предшественника, про-<тЕ,
в активную форму <тЕ и компартмента-
ция <т-факторов □ Превращение предшествен-
ника сгЕ в активную форму сгЕ требует уча-
стия фактора <jf, регулирующего транскрипцию
экспрессируемых в предспоре генов (рис. 25.4).
Активности сгЕ и aF приурочены к различным
клеточным компартментам, хотя кодирующие их
гены транскрибируются до образования споруля-
ционной септы. Обеспечивающий это простран-
ственное разделение сигма-факторов механизм
(пока неизвестный) участвует, таким образом, в
установлении компартмент-специфической экс-
прессии генов. Кроме того, для раздельной экс-
прессии требуется некий механизм коммуника-
ции между компартментаь и. Возможно, транс-
крипции генов в предспоре до формирования
септы препятствует белок SpoIIAB, действую-
щий как ингибитор фактора ст1', и это ингиби-
рование устраняется взаимодействием с белком
SpoIIAA, антагонистом белка SpoIIAB. Взаимо-
действие между SpoIIAA и SpoIIAB и между
SpoIIAB и <7F было продемонстрировано in vitro
с использованием антител к одному из белков,
Spoil А, в реакциях перекрестного связывания и
копреципитации. Каким образом регуляция ак-
тивности <jf связана с образованием септы, пока
неизвестно, но in vitro получены данные о том, что
на активность SpoIIAB могут влиять различия в
энергетическом заряде между предспорой и мате-
ринской клеткой. Белок SpoIIAB способен обра-
тимо связывать как АТР, так и ADP. Комплекс
SpoIIAB—АТР преимущественно взаимодейству-
ет с белком <tf и подавляет инициацию тран-
скрипции, катализируемой сгЕ-РНК-полимеразой
in vitro. Комплекс SpoIIAB—ADP преимуществен-
но взаимодействует с белком SpoIIAA. В предспо-
ре соотношение ATP/ADP может быть ниже, чем
в материнской клетке, и это должно способство-
вать взаимодействию SpoIIAB с белком SpoIIAA
и высокой активности сгЕ-РНК-полимеразы.
Механизм, обеспечивающий экспрессию ак-
тивности сгЕ избирательно в материнской клетке,
остается неясным. Возможно, процессинг пред-
шественника этого сигма-фактора происходит
только в материнской клетке либо после про-
цессинга сгЕ проявляет активность только в ма-
теринской клетке. В любом случае образование
активной формы пЕ зависит от событий, про-
исходящих в предспоре, поскольку требует уча-
стия crF. Возможно, существует специфичный для
предспоры ген (транскрибируемый гтЕ-РНК-поли-
меразой), который обеспечивает активацию про-
теазы SpoIIGA (предположительно локализован-
ной в мембране споруляционной септы) и тем
F
самым процессинг предшественника ст .
Регуляция синтеза и активности <rG □
Одним из генов, транскрибируемых сгЕ-формой
РНК-полимеразы, является spoIIIG, кодирующий
специфичный для предспоры сигма-фактор crG.
Регуляция экспрессии spoIIIG представляет ин-
терес по двум причинам. Во-первых, активность
белка SpoIIIG (<rG) зависит от <тЕ — сигма-фак-
тора, специфичного для материнской клетки.
Активация носит характер посттрапсляционно-
го, непрямого эффекта, возможно осуществляе-
мого с участием фактора У (см. рис. 25.5 на
цв. вклейке) — одного из гипотетических факто-
ров коммуникации между компартментами, необ-
ходимой для координации развития материнской
клетки и предспоры. Во-вторых, появление ак-
тивности <jG не следует непосредственно за тран-
скрипцией spoIIIG, по происходит лишь через
30 мин. Это указывает на посттранскрипцион-
ный уровень регуляции, возможно опосредуемой
Глава 25. Споруляция и клеточная дифференцировка 59
взаимодействием с белком SpoIIIAB, регулято-
ром фактора crF. К числу генов, транскриби-
руемых Д'-формой РНК-полимеразы, относятся
ssp-гены. Эти гены кодируют кислотораствори-
мые белки, которые связываются с хромосомой
предспоры и тем самым придают ей устойчивость
к УФ-облучению. Влияние crG распространяет-
ся за пределы предспоры, поскольку этот сигма-
фактор участвует также в развитии материнской
клетки (см. ниже).
Многочисленные функции <тЕ-факто-
ра □ Как предполагается, стЕ-РНК-полимераза
транскрибирует ген(-ы), с участием которых
предотвращается образование септы. Мутации
spoIIG п некоторых других spoil-генов обусловли-
вают двухспоровый фенотип — образование двух
септ на полюсах клетки. Это означает, что су-
ществуют гены, ответственные за подавление
закладки септы, однако они пока нс идентифици-
рованы. Вскоре после образования активной фор-
мы <тЕ начинается транскрипция с ее участием
генов, детерминирующих окружение предспоры
{spoIID и spoIIM} и более поздние процессы мор-
фогенеза споры. В то же время зависимая от <тЕ
транскрипция генов требуется для необходимой
экспрессии генов в предспоре.
От фактора сгЕ зависит также транскрип-
ция гена spoIIID, кодирующего белок, который
переключает транскрипцию с генов одного вре-
менно экспрессируемого (с участием сгЕ) клас-
са белков на гены белков другого класса. Бе-
лок SpoIIID вызывает инициацию транскрипции
и действует на регуляторные участки некоторых
генов, транскрибируемых стЕ-РНК-полимеразой,
Этот белок (SpoIIID) регулирует свой собствен-
ный синтез, стимулируя транскрипцию с промото-
ра гена spoIIID. После достижения высокого уров-
ня SpoIIID происходит активация второго класса
генов, транскрибируемых с участием генов, тран-
скрипция которых зависит от аЕ.
Синтез <тк требует сайт-специфической
рекомбинации и процессинга □ Белок SpoIIID
активирует огЕ-зависимую транскрипцию генов
spoIVCB и, кроме того, требуется для функ-
ционирования гена spoIVCA. Гены spoIVCA и
spoIVCB являются конвергентпо транскрибиру-
емыми. Экспрессия гена. spoIVCA, кодирующего
сайт-специфическую рекомбиназу, обеспечивает
необычный механизм регуляции, который вклю-
чает сайт-специфическую рекомбинацию, необхо-
димую для экспрессии <тк (см. разд. 18.11.3).
Необходимость в рекомбинации связана с тем, что
ген spoIVCB кодирует лишь N-концевой фраг-
мент молекулы сигма-фактора <тк, тогда как
С-копцевой участок его молекулы кодируется ге-
ном spoIIIC, расположенным на 42 т.п.н. ниже
гена spoIVCB. Рекомбиназа SpoIVCA удаляет
промежуточный фрагмент ДНК длиной 42 т.п.н.
и соединяет два участка {spoIVCB и spoIIIC} с
образованием гена sigK, кодирующего предше-
ственник сигма-фактора стк. Таким образом, экс-
прессия sigK регулируется на уровне транскрип-
ции и рекомбинации; однако для образования ак-
тивной формы необходим третий уровень ре-
гуляции, зависящий от экспрессии генов в пред-
споре.
Молекула про-сгк содержит на N-копце после-
довательность из 20 аминокислотных остатков,
удаляемую для образования активной формы <тк.
Этот процессинг отсутствует в клетках с мутаци-
ями в гене spoIIIG, кодирующем crG. Высказано
предположение, что существует фактор(-ы), ген
которого транскрибируется сгс’-РНК-полимеразой
в предспоре; этот фактор передает сигнал мате-
ринской клетке, что приводит к активации проте-
азы, расщепляющей предшественник сгк. С целью
идентификации генов, участвующих в процессин-
ге предшественника ск, получены мутанты, у ко-
торых сгк-зависимая транскрипция возможна в
отсутствие экспрессии генов предспоры. Такие
мутации, названные bof (от bipas of forespore, об-
ход предспоры), расположены в опсроне spoIVF.
Первый ген этого оперона, spoIVFA, является
сайтом мутаций, ряд которых приводит к обра^
зованию понсепс-аллелей. Второй ген, spoIVFB,
необходим для споруляции и является сайтом
мутаций, блокирующих процессинг предшествен-
ника <7К. Продукт этого гена, белок SpoIVFB,
предположительно действует как протеаза в
этом процессинге, однако основная его функ-
ция неизвестна. Белок SpoIVFA, возможно, осу-
ществляет отрицательную регуляцию активнос-
ти SpoIVFB. Другим связующим звеном между
функцией spoIIIG и процессингом предшествен-
ника сгк служит ген spoIVB, который транскри-
бируется в предспоре сгс’-РНК-полимеразой; он
кодирует продукт, подобный липопротеину. Му-
тации гена spoIVB блокируют процессинг пред-
шественника сгк, но эта блокада не снимается
bof-мутациями, из чего следует, что, помимо ак-
тивации сгк, SpoIVB выполняет при споруляции
некую дополнительную функцию.
60 Часть VI. Рост и дифференцировка клеток
Гены и белки, участвующие в образова-
нии покровов споры □ После синтеза фактора
<7К начинается экспрессия генов стк-модулона, в
который входят многочисленные со^-гены, коди-
рующие белки споровых покровов. Эти бел-
ки синтезируются в материнской клетке и от-
кладываются вокруг развивающейся эндоспоры.
Гены cot можно разделить на классы по вре-
мени их экспрессии. Одним из первых экспрес-
сируется ген cotE\ его экспрессия зависит от
сгЕ-РНК-полимеразы и наличия белка SpoIIID.
Белок CotE выполняет морфологическую функ-
цию: он необходим на ранних стадиях отло-
жения белков споровых покровов для их нор-
мальной сборки. Примечательно, что мутации
других coi-генов (7К-модулона оказывают лишь
слабый эффект или не влияют на споруляцию и
прорастание, хотя их продукты являются ком-
понентами споровых покровов. К числу генов
сгк-модулона относится также ген дегЕ, первона-
чально идентифицированный как сайт мутаций,
влияющих на прорастание. Продукт этого гена
служит положительным и отрицательным регуля-
тором транскрипции cot-генов. Подобно SpoIIID,
белок GerE представляет собой небольшой
ДНК-связывающий пептид, который стимули-
рует стк-зависимую транскрипцию нескольких
cot-генов (cofB, cotC и cotD), но подавляет тран-
скрипцию генов cotT и cotA. Транскрипция генов
cot А и cotT происходит непосредственно перед
накоплением GerE. Затем GerE подавляет экс-
прессию cotT и cot А и активирует транскрипцию
cotB, cotC и cotD. Этот порядок отражает диф-
ференциацию coi-генов по времени экспрессии.
Основная стратегия регуляции при развитии
споры уже очевидна, хотя остается выяснить
еще многие детали. Механизмы временной и про-
странственный регуляции обеспечивают образова-
ние специфичных для споры продуктов в опреде-
ленное время на определенной морфологической
стадии споруляции (рис. 25.5). Функции, необхо-
димые для завершения формирования определен-
ного структурного компонента споры, необходи-
мы также для запуска следующего (по времени
экспрессии) класса генов споруляции. Так, для
активации <тЕ- и сгЕ-зависимых модулонов необ-
ходимо завершение образования септы. Анало-
гичным образом, для активации <7С’-зависимого
модулона необходимо завершение окружения.
В регуляции активности Сигман-факторов важную
роль играет посттранскрипционный контроль.
Например, сгЕ и <7К-факторы вначале синтези-
руются в виде молекул-предшественников, под-
вергаемых процессингу после завершения опре-
деленной морфологической стадии споруляции.
Опероны, зависимые от специфических сигма-
факторов, и кодируемые ими регуляторы делят-
ся на классы по времени экспрессии. Переклю-
чение с экспрессии одного класса генов, транс-
крибируемых с участием сгЕ-РНК-полимеразы, на
экспрессию другого класса генов опосредует бе-
лок SpoIIID; белок GerE выполняет функции
как положительного, так и отрицательного ре-
гулятора во временной регуляции экспрессии
со/-генов. Подобные регуляторные механизмы ха-
рактерны, по-видимому, также для других про-
цессов сложной морфологической дифференци-
ровки у прокариот и хорошо известны для про-
цессов развития эукариотических организмов.
Образование клеток двух различных типов
при споруляции у В. subtilis зависит от диф-
ференциальной экспрессии генов в соответству-
ющих компартментах — предспоре и материнской
клетке. Эта запрограммированная экспрессия ге-
нов определяется последовательным появлением
пяти Сигман-факторов, связанных с дифференци-
ровкой.
25.1.4 . Методы, используемые для изучения
споруляции у Bacillus subtilis
Колонии дефектных по споруляции мутантов
В. subtilis выявляются на плотной среде как
лишенные характерной коричневой окраски, по-
скольку в их клетках отсутствует пигмент, син-
тез которого зависит от экспрессии гена cotA. Для
получения и анализа мутантов используют тра-
диционные методы генетики бактерий, такие как
мутагенез, общая трансдукция, опосредованная
фагом PBS1, и трансформация компетентных
клеток. Новым, весьма эффективным подходом
при идентификации и выделении генов спору-
ляции служит применение транспозонов. Наи-
более широко используется транспозон Тп917.
Сконструированные производные этого транспо-
зона позволяют легко выделять участки ДНК,
фланкирующие сайт встраивания транспозона, и
встраивать ген lacZ Е. coli таким образом, что-
Глава 25. Споруляция и клеточная дифференцировка 61
бы он образовывал непрерывно транскрибируе-
мый участок с геном, прерванным транспозоном.
Для определения компартмент-специфичной экс-
прессии генов применяют подход, включающий
встраивание гена lacZ и использование мечен-
ных золотом антител к /3-галактозидазе. Этими
антителами обрабатывают ультратонкие срезы
спорулирующих клеток; с помощью электронной
микроскопии по локализации пятен электроно-
плотного комплекса. /3-галактозидазы с меченны-
ми золотом антителами определяют компартмент
клетки, где происходит экспрессия данного гена-
25.2. Стрептомицеты образуют при споруляции экзоспоры
Бактерии рода Streptomyces относятся к актино-
мицетам — гетерогенной группе гр амполежитель-
ных организмов с высоким содержанием G 4- С
(73%) в геномной ДНК. Для этой группы харак-
терен особый признак —рост в виде ветвящегося
мицелия (рис. 25.6). Виды рода Streptomyces, ти-
пичные почвенные организмы, обладают необыч-
ной среди бактерий способностью к сложной
дифференцировке (эквивалентной клеточно-
му циклу) с образованием многоклеточной
структуры. Процесс такой дифференцировки
включает две отчетливо выраженные фазы: рост
в виде вегетативного мицелия в оптимальных
условиях и рост в виде воздушного мицелия в
условиях голодания. Рост воздушного мицелия
завершается образованием цепочек спор (споран-
гиев) на концах воздушных гиф. Зрелая колония
на твердом субстрате может состоять из частей,
находящихся на разных стадиях дифференциров-
ки: активно растущего на периферии колонии
вегетативного мицелия, который проникает в суб-
страт и растворяет его, и гиф воздушного ми-
целия с развивающимися на них спорами в цен-
тре колонии, где имеет место дефицит питатель-
ных веществ. На специализированных воздушных
гифах, поднимающихся вверх от субстрата, об-
разуются цепочки из 50 и большего числа спор.
Развитие воздушного мицелия происходит в ос-
новном за счет оборота материала вегетативного
мицелия.
Рис. 25.6. Цикл размножения Streptomyces
coelicolor. По [1].
Фенотип
WhiF
Пигментация
(серая окраска)
Округление
спор .
Рост
субстратных гиф
Субстратный мицелий
Экзоспора
Фенотип WhiE
(>7 генов)
Прорастание
и вырастание
Фенотип WFiiG
(белый); синтез
белков Sap
Фенотип
WhiD
Фенотип WhiA,
WhiB, Whil
Утолщение'
межспоровых
стенок
Септированне
Завершение
спирализации
Воздушные
гифы
Фенотип Bld (лысый)
(bldA
Индукция А-фактором
образования
воздушных гиф
(синтез антибиотика)
Фенотип
WhiH
Инициация
спирализации
62 Часть VI. Рост и дифференцировка клеток
При дифференцировке, приводящей к образо-
ванию цепочек спор, на концах гиф воздушно-
го мицелия образуются регулярно расположенные
компаргменты, содержащие по одной копии гено-
ма. Эти компартменты дифференцируются с из-
менением их формы и толщины клеточной стен-
ки, превращаясь в зрелые споры с рельефной гид-
рофобной поверхностью, по размерам сходные с
бактериальными эндоспорами. Образующиеся у
Streptomyces споры, называемые экзоспорами,
относительно устойчивы к высушиванию, но чув-
ствительны к высокой температуре.
При дефиците питательных субстратов, вызы-
вающем сложную клеточную дифференцировку,
многие виды Streptomyces образуют вторичные
метаболиты, к которым относится в том числе и
большинство известных антибиотиков (см. гл. 27).
Метаболические сигналы и генетические механиз-
мы, регулирующие эти процессы, рассматривают-
ся в следующих разделах.
25.2.1. Генетический и физиологический
уровни дифференцировки сопряжены
у стрептомицетов через сложную
систему связей
Метаболические сигналы □ Сенсорный меха-
низм, сигнализирующий о дефиците питатель-
ных веществ или других внешних условиях, вы-
зывающих образование воздушного мицелия и
спор у стрептомицетов, пока неизвестен. Пред-
полагается, что он связан с изменением уровня
гуаниновых нуклеотидов, по аналогии с Bacillus
subtilis, у которого непосредственным сигналом
для запуска споруляции служит снижение пу-
ла гуаниновых нуклеотидов, GTP и GDP (см.
разд. 25.1.1), неизвестным пока способом влия-
ющее на регуляцию транскрипции генов споро-
образования. Как установлено, при инициации
образования воздушного мицелия происходит рез-
кое снижение уровня GTP и повышение внутри-
клеточного содержания ppGpp. В погруженных
спорулирующих культурах S. griseus при лими-
тировании по азоту также происходит увеличе-
ние пула ppGpp, сопряженное с резким снижени-
ем уровня GTP. Кроме того, образование воздуш-
ного мицелия и спор наблюдается под действием
ингибитора GTP-синтазы — декоинина. Некото-
рые мутанты S. griseus и S. antibioticus, фено-
Рис. 25.7. Химическая структура A-фактора из Strepto-
myces griseus.
типически сходные с Rel~-мутантами Е. coli по
снижению синтеза РНК и накоплению ppGpp (см.
разд. 20.3), обнаруживают задержку в образова-
нии воздушного мицелия. Декоинин устраняет эту
задержку и индуцирует спорообразование, однако
накопления ppGpp при этом не наблюдается. Ве-
роятно, уровень GTP оказывает более непосред-
ственное влияние на инициацию споруляции, чем
концентрация ppGpp (ppGpp ингибирует актив-
ность IMP-дегидрогеназы и тем самым вызывает
снижение пула GTP).
Ауторегуляторные факторы □ Некото-
рые виды Streptomyces реагируют на эндогенно
синтезируемые диффундирующие факторы,
о которых известно, что они в чрезвычайно низ-
ких концентрациях способны индуцировать спо-
руляцию. Прототипом этой группы низкомолеку-
лярных веществ, иногда называемых микробными
гормонами или феромонами, является А-фак-
тор (см. разд. 27.6.4).
Впервые внеклеточный A-фактор, индуци-
рующий спорообразование и продукцию стреп-
томицина (Str) у мутантного штамма, не
способного к споруляции и образованию анти-
биотика, был обнаружен в культуральной жид-
кости спорулирующих культур S. griseus. Хими-
ческая структура A-фактора, представляющего
собой (2-изокаприлоил- 3 JR-ги дроксиметил-
7-бутиролактон) показана на рис. 25.7. Хи-
мически синтезированный A-фактор способен в
наномолярных концентрациях восстанавливать
фенотип мутантов, дефектных по А-фактору.
У S. griseus синтез A-фактора индуцируется непо-
средственно перед продукцией стрептомицина и
прекращается до того, как она достигнет мак-
симума. Поскольку A-фактор химически весь-
ма стабилен, его исчезновение, по-видимому, обу-
словлено ферментативным разложением.
Различные виды стрептомицетов выделяют в
среду подобные A-фактору соединения, со-
ставляющие обширное семейство (см. рис. 27.21).
Глава 25. Споруляция и клеточная дифференцировка 63
Как предполагается, эти аналоги A-фактора так-
же выполняют роль химических сигналов. Боль-
шинство их отличается от A-фактора тем, что
содержит в позиции 6 /3-гидроксигруппу вме-
сто обычной /3-кетогруппы. Кроме того, между
A-фактором и его аналогами существуют разли-
чия в ветвлении боковых ацильных цепей в пози-
ции 2. Многие штаммы, продуцирующие аналоги
A-фактора, способны отличать их от А-фактора,
несмотря на чрезвычайное структурное сходство;
такая специфичность характерна для феромонов.
Недавно проведенные биохимические иссле-
дования позволили прояснить путь биосинтеза
ауторегуляторов одного из классов — продуцируе-
мых S. antibioticus соединений группы 7-бутиро-
лактона. Эти соединения образуются путем сбор-
ки из двух молекул ацетата, одной молекулы изо-
валерата и одной молекулы глицерола в реакции
конденсации, подобной реакции удлинения поли-
кетида. При этом длина и ветвление боковых це-
пей в позиции 2 зависит от числа участвующих
в реакции молекул малонил-СоА (происходящих
из ацетата), а также от природы стартовой моле-
кулы. Предшественники, обычно /3-кетокислоты,
реагируют с производными глицерола с образо-
ванием соответствующего 7-бутиролактона. Фер-
мент реакции конденсации, ведущей к синтезу
A-фактора у S. griseus и S. coelicolor, предполо-
жительно кодируется геном afsA. У продуцентов
стрептомицина S. griseus и S. bikiniensis ген afsA
локализован в плазмиде, тогда как у S. coelico-
lor — в хромосоме. У S. coelicolor экспрессию afsA
регулирует ген afsR, продукт которого фосфори-
лируется белком AfsK. Подобно белкам В. subtilis
SpoOA и SpoilJ, белки AfsK входят в семейство
белков регуляторных двухкомпонентных систем
(см. разд. 20.4) и действуют как сенсор и ответ-
ный регулятор соответственно. У S. coelicolor бе-
лок AfsR служит независимым регулятором син-
теза A-фактора и антибиотиков актинородина,
ундецилпродигиозина, метилепомицина, а также
кальций-зависимого антибиотика CDA.
Благодаря получению мутантов S. griseus, де-
фицитных по A-фактору и при этом способных
спорулировать и продуцировать стрептомицин,
был обнаружен связывающий A-фактор бе-
лок с активностью репрессора экспрессии. Ревер-
танты этих мутантов одновременно теряют спо-
собность продуцировать стрептомицин и спорули-
ровать. Эти данные позволяют предполагать, что
A-фактор удаляет связывающий A-фактор белок
с ДНК и тем самым устраняет подавление им в
качестве репрессора генов споруляции и синтеза
стрептомицина (см. рис. 27.22).
У S. virginiae, продуцента антибиотика бута-
нолида, в качестве репрессора и дифференци-
ровки, и продукции вторичных метаболитов мо-
жет действовать подобный, рецепторный в отно-
шении A-фактора белок. В противоположность
этому у S. coelicolor морфологическая диффе-
ренцировка и продукция вторичных метаболитов,
по-видимому, не зависят от A-фактора, что пред-
полагает иной механизм их регуляции.
Из культур некоторых видов Streptomyces вы-
делены также ауторегуляторные факторы, от-
личные по химической структуре от А-фактора.
Например, В-фактор (бутиловый эфир З'-АМР,
восстанавливающий у некоторых мутантов Nocar-
dia sp. продукцию рифамицина В). Синтез
В-фактора из 2/,3/-сАМР и бутанола способен ка-
тализировать грубый экстракт клеток штамма-
продуцента. Структурное сходство В-фактора с
З'ф'-сАМР, выполняющим у различных организ-
мов роль важного регуляторного фактора, ука-
зывает па существенную роль В-фактора в ре-
гуляции дифференцировки. Вид S. alboniger син-
тезирует памамицин — фактор, стимулирующий
формирование воздушного мицелия и обладаю-
щий антибактериальной и антигрибковой актив-
ностью. Памамицин представляет собой смесь
по меньшей мере восьми гомологов, содержащих
16-членное макродиолидное кольцо; в низких кон-
центрациях они индуцируют образование воздуш-
ного мицелия, в более высоких — ингибируют об-
разование субстратного мицелия. Для уточнения
роли этих ауторегуляторов в морфогенезе орга-
низмов-продуцентов необходимы дальнейшие ге-
нетические и биохимические исследования.
Белок SapB □ С поверхностью воздушного
мицелия и спор у S. coelicolor ассоциированы бел-
ки Sap (от small aerial mycelium proteins, низко-
молекулярные белки воздушного мицелия). Один
из них, пептид SapB, действует как внеклеточ-
ный индуктор образования воздушного мицелия.
Мол. масса SapB, рассчитанная по его составу —
Ala(l), Arg (2), Asp(3), Gly(2), Не (1), Leu (5),
Ser (1), Thr (3), равна 1982. Белок SapB взаи-
модействует с реактивом Шиффа, что указывает
на присутствие близко расположенных гидрокси-
групп, характерное также для остатков сахаров в
гликопротеинах. Синтез SapB в воздушном мице-
лии не подавляется хлорамфениколом; на основа-
64 Часть VI. Рост и дифференцировка клеток
Рис. 25.8. Гипотетическая последовательность активации генов, регулирующих синтез белка SapB и морфологиче-
скую дифференцировку у Streptomyces coelicolor.
нии этого высказано предположение о нерибо-
сомном механизме его синтеза (рис. 25.8). Как
установлено с использованием антител к SapB,
этот белок присутствует в зоне вокруг коло-
ний, образующих воздушный мицелий. Мутан-
ты по генам bld, у которых блокировано об-
разование воздушного мицелия (см. ниже), не
способны синтезировать белок SapB. Однако
при росте вблизи колоний штамма дикого ти-
па, продуцирующего SapB, эти мутанты спо-
собны временно образовывать воздушный ми-
целий. Образование воздушного мицелия мож-
но индуцировать у b/d-мутантов непосредственно
добавлением очищенного белка SapB. Следова-
тельно, SapB, подобно A-фактору, способен, веро-
ятно, выполнять роль диффундирующего факто-
ра — сигнала для развития воздушного мицелия, а
также белка морфопоэза, вызывающего рост воз-
душных гиф. Об этом свидетельствует временная
и пространственная корреляция появления SapB
с формированием воздушного мицелия.
При дифференцировке у Streptomyces про-
исходит стимуляция внеклеточными фактора-
ми, к которым относятся метаболиты, эндоген-
но образуемые диффундирующие факторы (фе-
ромоны) и белок(-ки), регулирующие морфопоэз
гиф воздушного мицелия. Феромон, называемый
A-фактором (2-изокаприлоил-ЗЛ-гидроксиметил-
7-бутиролактон), и его производные в опре-
деленной степени сходны с аутоиндукторами,
участвующими в эффекте «кворум-сенсинг» (см.
разд. 20.1).
25.2.2. Гены, участвующие в процессах
споруляции и образования
воздушного мицелия
у Streptomyces coelicolor
Для изучения сложных процессов морфологиче-
ской и физиологической дифференцировки при
споруляции у S. coelicolor и их связи между собой
используются разнообразные генетические мето-
ды. С помощью этих методов обнаружено два ти-
па морфологических мутантов: b/d-мутанты (от
bald, лысый), не образующие морфологически от-
четливого мицелия и не способные спорулировать,
и ш/и-мутанты (от white, белый), сохраняющие
способность формировать воздушный мицелий,
но не имеющие характерной для штаммов дико-
го типа серой окраски спор.
Для S. coelicolor описано по меньшей мере семь
классов b/d-мутантов (bldA—H), у которых нару-
шено образование воздушного (но не вегетативно-
го) мицелия (рис. 26.6 и 26.8). Следует отметить,
что у bldA-, bldD-, bldG-, bldH- и MdE-мутантов
этот дефект условный: он проявляется при росте
на среде с глюкозой, но при замене глюкозы на
другой источник углерода, например маннитол,
мутанты имеют морфологию дикого типа. За ис-
ключением штаммов с дефектом гена bldC, у всех
b/d-мутантов наблюдается частичное или полное
нарушение антибиотикообразования, что указы-
вает на существование общих элементов генети-
ческой регуляции этого процесса и формирова-
ния воздушного мицелия. Из b/d-генов наиболее
хорошо изучен ген bld А; он кодирует лейцил-
Глава 25. Споруляция и клеточная дифференцировка 65
тРНК, несущую антикодон UAA и поэтому осу-
ществляющую трансляцию редкого лейцинового
кодона UUA. Известно, что кодон UUA встре-
чается в основном в генах, участвующих в про-
цессах развития, таких как гены устойчивости к
антибиотикам, регуляторные гены и гены, связан-
ные с образованием воздушного мицелия и про-
дукцией антибиотиков. Однако не все гены диф-
ференцировки содержат кодон UUA. В то же вре-
мя все гены вегетативного роста у S. coelicolor,
по-видимому, не содержат этого кодона, как по-
казывает фенотип Ь/гМ-мутантов. Как правило,
кодоны UUA весьма редко встречаются у стреп-
томицетов, что соответствует высокому содержа-
нию G + С. Исследования с использованием про-
мотора bldA, соединенного с индикаторным ге-
ном, показали, что ген bldA транскрибируется на
относительно поздней стадии развития колоний,
когда начинается образование воздушного мице-
лия. Сходные с bldA последовательности ДНК,
по-видимому, широко распространены и среди
других штаммов стрептомицетов. Таким образом,
bldA выполняет, возможно, функцию главного ре-
гуляторного гена, т. е. занимает позицию вблизи
вершины иерархии регуляторных генов, контро-
лирующих дифференцировку и продукцию вто-
ричных метаболитов. Однако анализ недавно по-
лученных мутантов S. coelicolor с нарушением ре-
гуляции аптибиотикообразования — asb, aba и о/$,
которые дефектны по продукции антибиотиков,
по осуществляют споруляцию, показывает, что
для индукции синтеза антибиотиков существует
дополнительный регуляторный механизм, отлич-
ный от механизма, регулирующего споруляцию
(рис. 26.8).
Ген bldC, по-видимому, занимает в иерархии
генов морфологической дифференцировки менее
высокое место, чем ген bldA, поскольку оказыва-
ет регулирующее влияние на морфогенез, по не
па метаболическую дифференцировку (включая
продукцию антибиотика). Однако по сравнению с
гиЛг-гепом ген bldC занимает более высокое место,
судя по тому, что мутанты Whi нс способны к спо-
рообразованию, но образуют воздушный мицелий
и антибиотик. Получение мутантов с нарушени-
ем образования серой окраски спор (см. рис. 25.6)
позволило выявить по меньшей мере девять
w/w-генов (whiA— Г). Мутанты по генам whiG,
whiH, whiA или whiB обычно не образуют спору-
ляциопных септ, однако у whil-мутантов септы в
воздушном мицелии образуются, хотя и в мень-
шем количестве, чем у штаммов дикого типа. Про-
дукты генов whiD, whiF и whiD участвуют в позд-
них этапах формирования спор. Мутации whiD
приводят к образованию спор с тонкими стенка-
ми, мутации whiE— к образованию внешне нор-
мальных, но пепигмептированных спор. Резуль-
таты морфологического изучения развития воз-
душного мицелия у w/гг-мутантов показали, что
экспрессия юЛг-генов происходит в следующем по-
рядке: whiG, whiH, whiA, whiB, whil, whiD, whiF,
whiE (рис. 25.6).
Проведенное недавно клонирование генов
whiE, whiB и whiG позволило установить, что
белок WhiG представляет собой сигма-фактор
РНК-полимеразы, который не требуется для ве-
гетативного роста, но необходим для образования
спор в гифах воздушного мицелия. Белок WhiG
сходен (38% гомологии) с полипептидом crD, ко-
торый у В. subtilis необходим для транскрипции
генов подвижности, но не для спорообразования.
В меньшей степени белок WhiG сходен с факто-
ром <тп, который у В. subtilis также необходим для
инициации спорообразования. Повреждение гена
whiG нарушает образование спор воздушным ми-
целием, но не влияет на рост. Имеется два доказа-
тельства того, что содержание WhiG определяет
локализацию и интенсивность спорообразования.
Экспрессия whi G-гена с высококопийной плазми-
ды вызывает такой аномальный феномен, как об-
разование спор в вегетативных гифах, которые в
норме должны подвергаться автолизу в ходе диф-
ференцировки. В то же время введение большого
числа копий ап-зависимого промотора В. subtilis
в клетки S. coelicolor снижает интенсивность спо-
руляции, что, по-видимому, происходит в резуль-
тате связывания части белка WhiG. На основании
этих данных высказано предположение, что про-
дукт гена whiG выполняет ключевую роль в раз-
витии гиф воздушного мицелия. Анализ нуклео-
тидной последовательности гена whiB показал,
что его продукт, состоящий из 87 аминокислот-
ных остатков, представляет собой, по-видимому,
фактор транскрипции. Локус whiE, необходимый
для того, чтобы незрелые белые споры приобре-
тали серую окраску, содержит по меньшей мере
семь генов, кодирующих синтазы соединений, по-
добных поликетидам, и ответственных, вероятно,
за образование пигмента спор.
Инициация 3-7-суточного процесса развития
многоклеточных структур может происходить
различными путями, на что указывает способ-
66 Часть VI, Рост и дифференцировка клеток
ность многих ЬИ-мутантов образовывать споры в
среде, содержащей в качестве единственного ис-
точника углерода маннитол вместо глюкозы, а
также индукция образования воздушного мице-
лия на богатой среде под действием белка SapB.
Сложность регуляции морфологической диф-
ференцировки на генетическом уровне у стреп-
томицетов объясняется связью последней с раз-
нообразными физиологическими процессами.
Последовательность биохимических событий,
приводящая к образованию гиф воздушного ми-
целия и спор, включает межклеточную комму-
никацию с участием метаболических сигналов,
ауторегуляторных факторов и внеклеточных сиг-
нальных белков.
25.2.3. Генетические подходы к анализу
спорообразования у стрептомицетов
Мутанты S. coelicolor с нарушением образова-
ния воздушного мицелия (bld) или спорообразова-
ния (whi) получают путем УФ-облучения культур
или их обработки М-метил-И'-нитро-И-нитрозо-
гуанидином. Генетический анализ мутантов про-
водят с использованием конъюгации и трансдук-
ции, а также метода слияния протопластов, полу-
ченных с помощью обработки клеток лизоцимом.
Трансформированные и регенерированные прото-
пласты S. coelicolor выявляют по способности вы-
зывать образование «оспинок» (см. разд. 16.2.4),
т. е. округлых зон отсутствия роста в газоне, об-
разованном на плотной среде другим штаммом
(обычно используют S. lividcms), не несущим ис-
пользованную для трансформации или родствен-
ную ей плазмиду. «Оспинка» образуется в месте
развития колонии, содержащей плазмиду.
Разработанные недавно для S. coelicolor си-
стемы клонирования с использованием плазмид
и умеренного фага </?С31 удалось применить и
к другим стрептомицетам. Фаг <^С31 образует
бляшки на газонах многих стрептомицетов или
делает их лизогенными. Получен ряд производ-
ных фага 9?С31, используемых для мутагенеза,
интеграции в хромосому путем гомологичной ре-
комбинации и «мутационного клонирования», при
котором вектор интегрируется в результате гомо-
логичной рекомбинации между клонированным
фрагментом, содержащим внутренний участок ге-
на, и соответствующей хромосомной ДНК («гомо-
генотизация»).
25.3. Развитие многоклеточных структур
у общественного организма Myxococcus xanthus
К роду Myxococcus относятся грамотрицательные
почвенные бактерии, обладающие способностью к
скользящему движению (см. разд. 20.5.1). Спо-
соб их питания основан на разложении нерас-
творимого органического материала с помощью
многочисленных внеклеточных гидролитических
ферментов. Такое питание носит кооперативный
характер, т. е. зависит от образования популя-
ций высокой плотности, содержащих тысячи кле-
ток, что необходимо, вероятно, для повышения
концентрации экзоферментов и тем самым эф-
фективности гидролиза органического материа-
ла. На кооперативный характер питания указы-
вает возрастание скорости роста миксобактерий
на белковом субстрате с увеличением плотности
популяции. Межклеточное взаимодействие у мик-
собактерий осуществляется и на еще более вы-
соком уровне сложности: они способны образо-
вывать в оптимальных для роста условиях так
называемые плодовые тела — уникальные мно-
гоклеточные формы, обеспечивающие селектив-
ное преимущество благодаря межклеточной ко-
операции.
25.3.1. Образование плодовых тел происходит
при исчерпании питательных веществ
Исчерпание питательных веществ, в первую оче-
редь аминокислот, в сочетании с высокой плот-
ностью популяции на твердой поверхности при-
водит к тому, что у миксобактерий активиру-
Глава 25. Споруляция и клеточная дифференцировка 67
ется ряд процессов развития (рис. 25.9; см. цв.
вклейку), направленных на образование много-
клеточной структуры, называемой плодовым те-
лом. Роды миксобактерий различаются по форме
плодового тела. Эти структуры, возвышающиеся
над субстратом примерно на 0,2 мм и содержащие
примерно 105 клеток, образуются следующим об-
разом. При замедлении роста популяции миксо-
бактерий и при условии, что ее плотность доста-
точно высока, начинается агрегация клеток, про-
должающаяся в течение 4 ч. На ранней стадии
агрегации наблюдается координированное рит-
мичное движение гребневидных скоплений кле-
ток, напоминающее рябь на поверхности воды.
Примерно через 12 ч асимметричные агрегаты
клеток приобретают форму эллиптических или
округлых возвышений. В результате этого движе-
ния миксобактерий и межклеточных взаимодей-
ствий возрастает численность клеток и плотность
скопления их в центрах развития; таким образом
образуется зрелое плодовое тело. Примерно через
24 ч развития некоторые клетки внутри плодо-
вого тела дифференцируются в миксоспоры, в то
время как другие лизируются. Во время этих упо-
рядоченных морфологических событий синтези-
руется более 30 новых белков и па клеточной по-
верхности появляются новые антигены (рис. 25.9).
25.3.2. Агрегации клеток и образованию
плодовых тел предшествует
межклеточный обмен сигналами
Важность межклеточных взаимодействий и обме-
на сигналами для развития плодовых тел уда-
лось продемонстрировать благодаря получению
четырех комплементарных групп мутантов (A-D)
с неавтономным развитием. Восстановление фе-
нотипа у этих мутантов возможно при добавлении
клеток дикого типа или клеток мутантов, относя-
щихся к другой группе комплементарности. Дан-
ные исследования показали, что существуют вне-
клеточные факторы, необходимые для диф-
ференцировки миксобактерий. Как установлено
путем генетического картирования с использо-
ванием инсерции Тп5, вышеупомянутые четыре
группы мутантов несут дефект в одном из че-
тырех различных хромосомных локусов, каждый
из которых ответствен за отдельный сигнал. Ген,
несущий мутации группы А, обозначен как asg (от
A-signal), гены, несущие мутации групп В, С и
D — как bsg (В-signal), csg (C-signal) и dsg (D-
signal). Мутации каждой группы приводят к оста-
новке развития на определенной стадии (в опре-
деленное время), судя по тому, в каком порядке
экспрессируются гены, активируемые в процессе
развития. Нарушение экспрессии генов (которую
определяют по активности /З-галактозидазы, ко-
дируемой /acZ-геном Е. coli, слитым с промото-
рами генов развития) компенсируется у asg-, bsg-
и dsg-мутантов при совместном росте с клетка-
ми дикого типа. Характер межклеточных сигна-
лов, за которые отвечают bsg- и dsg-гены, пока
не установлен, но известно, что ген bsgА кодирует
ATP-зависимую протеазу и что белок DsgA гомо-
логичен фактору инициации 3 (IF3) Е. coli.
Наиболее подробно изучены мутанты asg- и
csg-классов. Гены asg и csg участвуют в од-
ном и том же регуляторном механизме, причем
А-сигнал (asg-зависимый) передается раньше,
чем С-сигнал (csg-зависимый). В передаче A-сиг-
нал а участвуют три генетических локуса—asgА,
asgВ и asg С, в передаче С-сигнала—только локус
csg.
А-фактор □ Биохимические и генетические
исследования asg-мутантов позволили обнару-
жить ряд веществ, вместе называемых А-фак-
тором или A-сигналом (эти соединения отли-
чаются от A-фактора S. griseus, описанного в
разд. 25.2.1). Мутанты asg выделяют А-фактор
в количестве менее 5% относительно того, кото-
рое характерно для штаммов дикого типа. Экзо-
генный А-фактор восстанавливает способность к
агрегации и споруляции у asgB- и asgC-мутантов
и индуцирует агрегацию у asgA-мутанта. Основ-
ная активность A-фактора связана с двумя его
фракциями: термолабильной и термостабильной.
Термолабильная фракция содержит аминокис-
лоты (пролин, тирозин, фенилаланин, триптофан,
лейцин, изолейцин и аланин) и смесь полипеп-
тидов, в основном состоящих из этих аминокис-
лот. Эта фракция в микромолярной концентрации
вызывает экспрессию соответствующих генов у
asg-мутантов. Термостабильная фракция со-
стоит по меньшей мере из двух протеаз, мол. мас-
сой 10 и 27 кДа. Протеазы, выделенные из неочи-
щеных препаратов A-фактора, имеют двойную
субстратную специфичность. Возможно, их уча-
стие в передаче сигнала состоит не в том, что
они расщепляют специфическую связь, а в том,
что в результате их активности высвобождают-
68 Часть VI. Рост и дифференцировка клеток
ся внеклеточные аминокислоты. Действительно,
некоторые протеазы, включая трипсин и проте-
иназу К, оказывают тот же эффект, что термо-
стабильная фракция А-фактора. Очевидно, ос-
новные сигнальные молекулы А-фактора, отсут-
ствующие у asg-мутантов, — это аминокислоты и
мелкие пептиды. Миксококки, по-видимому, спо-
собны определять пороговый уровень концентра-
ции аминокислот; при более высоком содержании
аминокислот в среде экспрессия генов, связанных
с развитием, подавлена, при более низком — про-
цесс развития активируется. Однако существует и
минимальная концентрация внеклеточных амино-
кислот, ниже которой их уровень не инициирует
процесс развития (именно это наблюдается в слу-
чае asg-мутантов). Таким образом, концентрация
аминокислот служит индикатором наличия пита-
тельных веществ в окружающей среде и показате-
лем плотности популяции (эффект «кворум-сен-
синг»). При голодании этот эффект опосредован
активностью asg-генов.
Предполагаемый путь передачи сигнала, опо-
средующий ответ клеток на действие А-фактора,
пока не изучен, однако определенные сведения
об одном из его компонентов дает характеристи-
ка sasA-мутаций, супрессорных по отношению к
asgB-мутациям. Мутации локуса sasA являются
рецессивными и происходят с частотой, характер-
ной для мутаций с потерей функции, на основа-
нии чего предполагается, что продукт гена sasA
служит чувствительным к A-сигналу репрессором
определенных генов, связанных с развитием.
С-фактор □ Ген esg кодирует белок мол.
массой 17 кДа, аминокислотная последователь-
ность которого хотя и не обнаруживает суще-
ственного сходства с какими-либо другими белка-
ми, по на N-конце частично сходна с сигнальной
последовательностью, необходимой для трансло-
кации и секреции белков у энтеробактерий. В на-
номолярной концентрации С-фактор, выделен-
ный из плодовых тел, восстанавливает способ-
ность к агрегации и споруляции у csgA-мутаптов.
С-фактор прочно связан с продуцирующими его
клетками, не высвобождается при интенсивной
обработке солевым раствором и может быть вы-
делен только с помощью детергентов. Каким об-
разом столь прочно связанный белок выступа-
ет в роли сигнального фактора, выяснилось при
изучении неподвижных мутантов М. xanthus, ко-
торые неспособны завершить образование плодо-
вых тел при смешивании с клетками дикого типа,
но при добавлении очищенного С-фактора при-
обретают способность к споруляции. Как оказа-
лось, для образования плотных упаковок парал-
лельно уложенных клеток необходима подвиж-
ность и такая упаковка способствует передаче
С-сигнала. Если искусственным способом плотно
уложить клетки неподвижного мутанта вместе с
клетками дикого типа, передача С-сигнала возни-
кает. Остается выяснить, происходит ли при меж-
клеточной передаче сигнала физический перенос
С-фактора или же он остается связанным с клет-
кой-продуцентом. Клеточный ответ на С-фактор
является комплексным. Очевидно, С-фактор слу-
жит общим регулятором: оп влияет на активность
более чем 50 генов, продукты которых выполняют
функции, важные для движения клеток, их сли-
пания, агрегации и морфогенеза.
Регуляция образования многоклеточных агре-
гатов и спорообразования у М. xanthus зависит от
межклеточных взаимодействий и осуществляется
с участием ряда внутриклеточных и межклеточ-
ных сигнальных систем. В регуляции морфологи-
ческих изменений и активности генов, связанных
с развитием, участвуют по меньшей мере четыре
отдельных хромосомных локуса.
25.3.3. В регуляции дифференцировки
у М. xanthus, возможно,
участвуют киназы
Недавно были получены данные о функциони-
ровании у М. xanthus каскадного пути пере-
дачи сигнала с предположительным участием
трсонин/серин-спсцифичпых протеинкипаз, по-
добного пути, известному у эукариот. Прототип
протеинкиназ этой группы у М. xanthus кодиру-
ется геном ркп-1 и содержит 693 аминокислот-
ных остатка. Подобно киназам эукариот, Ркп-1
аутофосфорилируется с участием АТР по остат-
кам серина и треонина. Для выяснения роли этого
белка в процессе развития был получен мутант
с делецией гена ркп-1. Этот мутантный штамм
нормально растет на богатой среде, однако об-
разует дефектные плодовые тела: клетки агре-
гируют раньше времени и образуют плодовые
тела меньших размеров и меньшей плотности; ко-
личество спор составляет лишь примерно 35% их
выхода у штаммов дикого типа. Это свидетель-
Глава 25. Споруляция и клеточная дифференцировка 69
ствует о важной роли треонин/серииовой проте-
ипкиназы в спорообразовании и регуляции вре-
мени наступления ранних событий дифференци-
ровки у М. xanthus, однако остается неизвестным
субстрат(-ы) данной киназы in vivo.
25.3.4. Образование многоклеточных структур
и споруляция у различных организмов
основаны на общих механизмах
Этапы спорообразования, как и структура спор, у
миксобактерий отличаются от тех, которые опи-
саны для Bacillus subtilis и Streptomyces. Вегета-
тивные клетки Myxococcus реагируют на два раз-
личных сигнала: A-сигнал, который должен по-
ступить до агрегации, и С-сигнал, необходимый
для завершения агрегации и инициации спорооб-
разования. У Myxococcus спорообразование про-
исходит не путем асимметричной ссптации с об-
разованием двух клеточных ког.шартментов (как
у Bacillus), но путем дифференцировки всей веге-
тативной клетки. Внутри плодового тела палоч-
ковидные вегетативные клетки Myxococcus пре-
вращаются в почти сферические споры, кото-
рые содержат специфические споровые белки и
имеют пептидогликановый слой с большим ко-
личеством поперечных сшивок. Подобно спорам
Bacillus, миксоспоры устойчивы к высушиванию,
нагреванию и обработке детергентами и способны
длительное время выживать в почве, обнаружи-
вая при этом лишь слабую метаболическую актив-
ность. Несмотря на явные различия в морфогене-
зе спор, у Bacillus, Streptomyces и Myxococcus при
их образовании действует общая стратегия при-
ема/псрсдачи сигналов и межклеточного взаимо-
действия.
25.3.5. Методы анализа спорообразования
у М. xanthus
С целью определения природы сигналов, которы-
ми обмениваются клетки Myxococcus для коор-
динации развития плодового тела и спорообра-
зования, получены (путем обычного мутагенеза)
мутанты, условно дефектные в отношении процес-
сов развития. Путем попарного тестирования этих
мутантов и штаммов дикого тина на восстанов-
ление у мутантов способности образовывать спо-
ры были выявлены группы внеклеточной компле-
ментации. Фракционирование белковых экстрак-
тов клеток дикого типа и изучение способности
различных фракций восстанавливать развитие у
мутантов позволили идентифицировать сигналь-
ные факторы. Регулируемые в связи с процес-
сами развития транскрипционные единицы уда-
лось выявить путем инсерционного мутагенеза с
использованием транспозона Тп5, способного со-
единять лишенный промотора репортерный ген
lacZ с экзогенными промоторами. По экспрессии
Д галактозидазы с промоторов, регулируемых в
процессе развития, определяли степень очистки
добавляемых к мутантам сигнальных факторов
(С-фактора), выделенных из клеток дикого типа.
Для переноса генов между штаммами М. xanthus
(с целью конструирования мутантов, картирова-
ния локусов и получения лизогенных культур в
результате интеграции фага в хромосому) исполь-
зуются также миксофаги Мх4, Мх8 и Мх9 осу-
ществляющие общую трансдукцию. Отбор по при-
знакам устойчивости к канамицину, кодируемой
транспозоном Тп5, применялся для клонирова-
ния прилегающих генов в плазмиде Е. coli. Эту
плазмиду со вставкой можно перенести из Е. coli
в М. xanthus с помощью бактериофага Р1 или
путем трансформации. Другим способом служит
перенос независимых Тп5-вставок путем общей
трансдукции с помощью миксофага Мх8. Фаго-
вые частицы, содержащие Тп5 и соседние гены
М. xanthus, были использованы для исследования
комплементации мутантов, не способных образо-
вывать плодовые тела.
Дополнительная литература
Champness W. С., Chater К. F. (1994) Regulation and
integration of antibiotic production and morpholo-
gical differentiation in Streptomyces spp. In: Pig-
got P.Moran Jr., С. P., Youngman P. (eds.) Regu-
lation of bacterial differentiation. Washington, DC:
ASM Press: 61-93.
Chater К. E. (1989) Sporulation of Streptomyces. In:
Smith I., Slepecky R. A., Setlow P. (eds.) Regulation
of prokaryotic development: structural and functional
analysis of bacterial sporulation and germination.
Washington, DC: ASM Press; 277-299.
Chater K.E. (1993) Genetics of differentiation in
Streptomyces. Annu. Rev. Microbiol. 47: 685-713.
Errington G. (1993) Bacillus subtilis sporulation: regula-
tion of gene expression and control of morphogenesis.
Microbiol. Rev. 57: 1-33.
70 Часть VI. Рост и дифференцировка клеток
Gill Е. R., Shimkets L. (1993) Genetic approach for
analysis of mixobacterial behavior. In: Dworkin M.,
Kaiser D. (eds.) Myxobacteria. Vol. 2. Washington.
DC: ASM Press: 129-155.
Grossmann A. (1995) Genetic networks controlling the
initiation of sporulation and the development of ge-
netic competence in Bacillus subtilis. Annu. Rev. Ge-
netics 29: 477-508.
HaldenwagB. (1995) The sigma factors of Bacillus
subtilis. Microbiol. Rev. 59: 1-30.
Hopwood D. A., Bibb M. J., Chater K. F., Kieser T.,
Bruton C. J., Kieser H. M., Lydiate D. J., Smith С. P.,
Ward J. M., SchrempfH., eds. (1985) Genetic mani-
pulation of Streptomyces. A laboratory manual. Nor-
wich: John Innes Foundation.
Horinouchi S., Beppu T. (1992) Autoregulatory factors
and communication in Actinomycetes. Annu. Rev.
Microbiol. 46: 377-398.
Kaiser D. (1989) Multicellular development in Myxo-
bacteria. In: Hopwood D. A., Chater К. E. (eds.)
Genetics of bacterial diversity. New York London:
Academic Press; 243-263.
Kaiser D., Losick R. (1993) How and why bacteria talk
to each other. Cell 73: 873-885.
KimS.K. (1991) Intracellular signaling in Myxococcus
development: the role of C-factor. Trends Genet. 7:
361-365.
Losick R., Youngman P., Piggot P. J. (1986) Genetics of
endospore formation in Bacillus subtilis. Annu. Rev.
Genetics 20: 625-669.
Mohan S., Dow C., Cole J. A., eds. (1992) Prokaryotic
structure and function: a new perspective. Society
for General Microbiology Symposium, vol 47.
Cambridge: Cambridge University Press.
Moran С. P., Jr. (1993) RNA polimerase and transcrip-
tion factors. In: Sonenshein A., Hoch J. A., Losick R.
(eds.) Bacillus subtilis and other Gram-positive bac-
teria: biochemistry, physiology and molecular gene-
tics. Washington, DC: ASM Press; 653-667.
Piggot P. J., Moran C.P., Jr., Youngman P., eds. (1994)
Regulation of bacterial differentiation. Washington,
DC; ASM Press.
Reichenbach H. (1993) Biology of Myxobacteria: ecology
and taxonomy. In: Dworkin M., Kaiser D. (eds.) My-
xobacteria, vol 2. Washington, DC: ASM Press;
13-62.
Setlow P. (1981) Biochemistry of bacterial forespore de-
velopment and spore germination. In: Levinson H. S.,
Sonenshein A. L., Tipper D. J. (eds.) Sporulation and
germination. Washington, DC: ASM Press; 13-38.
SeungK.K., Kaiser D. (1992) Control of cell density
and pattern by intracellular signaling in Myxococcus
development. Annu. Rev. Microbiol. 46 117-139.
Shapiro L, Losick R. (1997) Protein localization and cell
fate in bacteria. Science 276: 712-718.
Shimkets L. J. (1990) Social and developmental biology
of Myxobacteria. Microbiol. Rev. 54: 473-501.
Youngman P. (1990) Use of transposon and integrational
vectors for mutagenesis and construction of gene
fusion in Bacillus species. In: Harwood C.R., Cut-
ting S. M. (eds.) Molecular biological methods for
Bacillus. New York: Wiley.
Источник рисунка
1. Chater К. F., Merrick M. J. (1979) Strcptomycetes.
In: Parish J. Y. (ed.) Developmental biology of the
prokaryotes. London: Blackwell: 93-114.
Глава 26
Бактериофаги как модели дифференцировки
Введение и экспериментальные методы
26.1.
26.1.1. Фаги — паразиты на молекулярном
уровне
Бактериофаги, обычно сокращенно называемые
фагами, могут рассматриваться, по выражению
С. Лурии, как облигатные «паразиты на молеку-
лярном уровне». Эти вирусы получили свое назва-
ние в соответствии с тем, что они «нападают» на
бактерии-хозяева и «пожирают» их клетки. Фа-
ги обнаруживаются везде, где обитают бактерии:
в почве, в пресных и соленых водах и даже в
экстремальных местообитаниях, например в горя-
чих источниках. Организмами в прямом смысле
слова фаги считать нельзя, так как сами по себе
они не являются живыми, но полностью зависят
от жизнедеятельности хозяев и существуют за их
счет. Как любые паразиты, фаги «эгоистичны» и
используют белки, ферменты и химические ком-
поненты клеток-хозяев для своего размножения
(т. е. репликации генома и образования новых фа-
говых частиц). Высвобождение последних обычно
сопровождается гибелью или, по меньшей мере,
крайним ослаблением клетки-хозяина. Фаги об-
ладают многими свойствами, присущими другим
автономным генетическим элементам, и на уровне
ДНК их лучше всего можно описать как плазми-
ды, которые приобрели дополнительные способ-
ности к выживанию вне своих хозяев.
С 1940 г. фаги стали одним из наиболее по-
пулярных объектов молекулярной биологии. Ис-
следования с использованием фагов позволили
раскрыть механизмы таких фундаментальных
биологических процессов, как репликация ДНК,
рекомбинация, транскрипция и генная регуляция.
Благодаря изучению фагов открылись также воз-
можности разработки многих важных методов и
направлений генной инженерии.
26.1.2. Экспериментальные методы
работы с фагами весьма несложны
Одна из причин того, что фаги стали едва ли
не наиболее изученными объектами молекуляр-
ной биологии,—это простота работы с ними и
их хозяевами-бактериями в лабораторных усло-
виях. Заражение бактерий можно производить по
мере необходимости, в контролируемых услови-
ях на плотных агаровых средах или в суспензи-
онной культуре (рис. 26.1, Л). Инфицированные
клетки смешивают с избытком неинфицирован-
ных клеток в полужидком агаре и затем распре-
деляют по поверхности агара в чашке Петри, где
полужидкий агар застывает. Через несколько ча-
сов инкубации при 37 °C на месте инфицирован-
ных клеток образуются «бляшки», или негатив-
ные колонии, т. е. пятна, где нет роста бактерий.
Они представляют собой области, в которых ли-
зис исходно инфицированных клеток и выход из
них новых фаговых частиц приводит к зараже-
нию ближайших неинфицированных клеток. Чем
плотнее агар, тем медленнее происходит диффу-
зия фагов-потомков, продвигающихся от первона-
чального места лизиса. В контролируемых усло-
виях можно наблюдать характерную морфологию
бляшки (рис. 26.2). Поскольку при этих услови-
ях источником ее образования послужила исход-
но одна инфицированная клетка, в данном мес-
те присутствует популяция генетически идентич-
ных фаговых частиц, т. е. клон. Чтобы выделить
фаг из негативной колонии, просто вырезают со-
держащий его кусочек агара и ресуспендируют в
жидкой среде (рис. 26.3) либо собирают часть ма-
териала с поверхности бляшки стерильной зубо-
чисткой или стеклянной палочкой.
Инфицированные клетки можно выращивать
в больших количествах в колбах Эрленмейера или
Рис. 26.1. Титрование фагов.
А Процедура 100- и 10-кратных серийных разведений в стерильном буфере, содержащем только соли и желатин для
стабилизации. Аликвоту из каждого разведения смешивают с небольшим количеством свежевыращенной культуры
индикаторной бактерии в расплавленном мягком агаре. Смесь быстро выливают на агар в чашке Петри, равномерно
распределяя по поверхности. Чашки инкубируют при 37 °C. Каждая фаговая частица дает начало образованию
бляшки в бактериальном газоне.
Б. Результаты инкубации чашек Петри с посевами из серийных разведений (10~6, 10-7 и 10~8) фаговой суспензии,
содержащей приблизительно 109 частиц фага Т4 в 1 мл. Титр фага, т. е. число бляшкообразующих единиц, или
число активных фагов в объеме, подсчитывают, умножая число стерильных пятен на величину разведения.
Рис. 26.2. Типы морфологии бляшек, характерные для различных фагов. Морфология бляшек, образуемых фагами
Т4, ТЗ и Т7. На границах обширных бляшек растут мелкие колонии устойчивых бактерий (н$ фото не видны)
Морфология бляшек, типичная для данного фага, может существенно изменяться и варьировать у его мутантов.
Это свойство широко используется как маркерное при изучении генетической рекомбинации.
Глава 26. Бактериофаги как модели дифференцировки 73
Рис. 26.3. Фаговые частицы в бляшке представляют
клон. Обычно из одной фаговой частицы образуются
многочисленные дочерние фаговые частицы, образую-
щие одну бляшку. Таким образом, в одной бляшке они
генетически идентичны и составляют клон. Фаги мож-
но выделить из отдельной бляшки смыванием и затем
размножить путем повторного посева.
в ферментерах, получая достаточно материала
для биохимического анализа. Жизненный цикл
большинства фагов короток, и время между ин-
фицированием и лизисом (латентный пери-
од) коррелирует со временем генерации клеток-
хозяев. Этот период может составлять всего
25 мин.
Среднее число фагов в расчете на инфициро-
ванную клетку, называемое выходом фага, ва-
рьирует в зависимости от его вида, но обычно в
момент лизиса клетки высвобождается несколько
сотен фаговых частиц-потомков. Одновременно,
как правило, высвобождается эквивалентное ко-
личество материала неполных фаговых частиц.
Число инфицированных клеток в культуре за-
висит от количества фагов, добавленных с це-
лью ее заражения. Численное соотношение вне-
сенных фаговых частиц и клеток в культуре
называют множественностью инфицирова-
ния (multiplicity of infection — m.o.i.). Посколь-
ку инфицирование зависит от случайных столк-
новений фагов и клеток, одни клетки могут
столкнуться с несколькими фаговыми частицами,
тогда как другие — не столкнуться пи с од-
ной. Доля множественно инфицированных кле-
ток в культуре определяется статистическими
законами, и ее можно приблизительно рассчи-
тать по формуле Пуассона. Например, если
желательно получить инфицирование большей
части клеток культуры только одной фаговой
частицей, величина m.o.i. должна быть мень-
ше единицы. Согласно распределению Пуассо-
на, при m.o.i. = 1 в культуре может оказаться
36% неинфицированных клеток, 36% клеток, ин-
фицированных только одной фаговой частицей,
и 28% клеток, инфицированных более чем од-
ной фаговой частицей. Если требуется, чтобы
большинство клеток было инфицировано, вели-
чина m.o.i. должна быть соответственно больше
единицы.
26.2.
26.2.1. Бактериофаги можно разделить
на различные группы (семейства)
Классификация вирусов основана главным обра-
зом на таких морфологических и биохимических
признаках, как размеры и форма вириона, при-
рода нуклеиновой кислоты генома, число и функ-
ции белков и наличие в составе фага липидов, а
также на дополнительных структурных призна-
ках, таких как наличие оболочки, и на сероло-
гических характеристиках. Фаги содержат в ка-
чество генетического материала РНК или ДНК,
молекулы которых окружены защитным белко-
вым капсидом. В большинстве случаев капсид
Классификация бактериофагов основана на их морфологии
состоит только из белков, но известно несколь-
ко фагов, капсид которых содержит дополнитель-
но липиды и материал бактериальной мембраны.
Большинство фагов содержит только одну, линей-
ную или кольцевую хромосому в виде двойной или
одиночной цепи нуклеиновой кислоты, однако из-
вестно также несколько фагов, содержащих боль-
ше одной хромосомы. Некоторые свойства бакте-
риофагов приведены в табл. 26.1.
26.2.2. Фаги обладают различными фенотипами
Капсид (оболочка) фагов выполняет двойную
функцию. Он защищает генетический материал
74 Часть VI. Рост и дифференцировка клеток
Таблица 26.1. Основные характеристики некоторых фагов. Обозначения: дц — двухцепочечная; оц — одноцепо-
чечная; лин—линейная; киз— концевая избыточность; кт — кольцевая трансформированная генетическая карта;
кольц — кольцевая
Структура и свойства генома Форма фаговой частицы Примеры фагов Примеры организмов w Примечания
ДНК дц, лин, киз, кт Полиэдрическая, продолговатая Т2, Т4, Тб Escherichia coli Вирулентные «четные» Т-фаги; Т4 содержит два гена с интронами
ДНК дц, лин, киз, кт Икосаэдрическая Pl, Р7, PBS1, PBS2 Escherichia coli/ Salmonella Bacillus subtilis Умеренные фаги; Р1 персистирует в клет- ках в виде свободной плазмиды
ДНК дц, лин, уни- кальная с липкими концами Икосаэдрическая Р2, Р4 Escherichia coli, Shigella, Serratia Умеренные фаги; для развития Р4 необхо- дим Р2
ДНК дц, лин, уни- кальная с концами из ДНК хозяина Икосаэдрическая Ми (или д) Escherichia coli К-12, С, энтеро- бактерии Умеренный фаг, «фаг- мутатор»; включается в геном хозяина слу- чайным образом
ДНК дц, лин, с лип- кими концами Икосаэдрическая А, <д80, у?82, <д434, <р424 Escherichia coli K-12 Умеренные фаги
ДНК дц, лин уни- кальная Икосаэдрическая <д29, Х15, Gal, M2Y Bacillus subtilis Вирулентные фаги
ДНК дц, лин, уни- кальная в отноше- нии концевой избы- точности Икосаэдрическая Tl, ТЗ, Т5, Т7, SPO1 Escherichia coli, Bacillus subtilis Вирулентные, «нечет- ные» Т-фаги
ДНК дц, лин, кт, киз Икосаэдрическая Р22 Salmonella, Escherichia coli Во многом сходен с фа- гом А
ДНК оц, конц Икосаэдрическая у?Х174, S13, уЖ, GE Escherichia coli
ДНК оц, лин Икосаэдрическая R17, f2, Q/3, MS2, M12, GA, SP, Fl Escherichia coli Специфичны к мужс- ким штаммам энте- робактерий
ДНК оц, лин Нитевидная M13, fd, Ff, IKe Escherichia coli Высвобождаются из клеток без их лизиса
ДНК дц, лин PM2 Alteromonas espejiano Морской фаг, состоит на 10% из липидов
ДНК дц, лин Pseudomonas phaseolicola Морской фаг; содержит три хромосомы; име- ет мембранную обо- лочку; на 20% состоит из липидов
ДНК дц, лин SMI Цианобактерии (специфичен к Sy- nechococcus elon- gates) Первый изолированный цианофаг
ДНК дц, лин, кт y?H Halobacterium halo- bium Наиболее изученный из галобактериофагов
Глава 26. Бактериофаги как модели дифференцировки 75
Рис. 26.4. Строение фагов М13 и у?Х174. [Показаны электронные микрофотографии и рисунки, иллюстрирующие
различные типы фагов.] Для структурных компонентов указаны обозначения соответствующих генов (gp — от gene
product, продукт гена).
А. Нитевидный фаг М13. На электронной микрофотографии стрелкой указана шиповидная структура на одном конце
фаговой частицы. На схеме изображено, каким образом одноцепочечная кольцевая хромосома ориентирована внутри
белковой оболочки. Отдельные гены обозначены номерами. Межгенная область (IG) всегда локализована на конце,
противоположном комплексу адсорбции (слева). Межцистронная область богата вторичными структурами и в том
числе содержит крупную шпилечную структуру, относящуюся к сигналу упаковки, (не показана). Одноцепочечная
хромосома из 6407 нуклеотидов кодирует девять белков. Указаны структурные белки, образующие оболочку. Длина
фага М13 составляет 89 нм, ширина — 6 нм.
Б. Икосаэдрический фаг <^>Х174, не обладающий отростком. На схеме показано расположение белковых субъединиц
в составе капсида. Капсид (диаметром 25 нм) имеет 12 вершин пятикратной симметрии и состоит из 60 молекул
gpF. Каждая вершина образована одной молекулой gpH и пятью молекулами gpG, которые формируют вместе
шиловидную структуру, шип. Внутри капсида находится одноцепочечная ДНК, включающая 5386 нуклеотидов и
кодирующая 11 белков. По [1].
от неблагоприятных внешних воздействий вне хо-
зяина и осуществляет функцию адсорбции, важ-
ную для проникновения в клетку-хозяина. Наибо-
лее сложноорганизованные фаги имеют, помимо
собственно капсида, специальную органеллу ад-
сорбции — отросток («хвост») с базальной пла-
стинкой. Строение оболочки в значительной сте-
пени варьирует по сложности у различных фагов.
Несмотря на множество особенностей оболочки,
характерных для разных фагов, различают толь-
ко две их основных формы — нитевидную и поли-
эдрическую.
Нитевидные фаги, такие как fd и М13, со-
держат кольцевую одноцепочечную хромосому,
окруженную оболочкой продолговатой формы из
сотен и тысяч субъединиц — молекул одного и то-
го же белка. Длина этой трубкообразной, очень
гибкой структуры составляет половину длины
окружности кольцевой ДНК, которую она покры-
вает (рис. 26.4, Л). Длина хромосомы у нитевид-
ных фагов определяет длину фага, поскольку кап-
сид формируется вокруг ДНК до тех пор, пока вся
хромосома не будет обернута. Благодаря этому в
хромосому нитевидного фага можно вводить до-
вольно крупные фрагменты чужеродной ДНК, не
создавая препятствий для ее упаковки. Это свой-
ство нитевидных фагов широко используется в
генной инженерии. Несколько молекул специаль-
ного белка, прикрепленных к одному из концов
фага, образуют органеллу адсорбции.
Для полиэдрических фагов характерна
сложная структура капсида, который чаще
всего имеет октаэдрическую (восьмигранную)
или икосаэдрическую (двадцатигранную) форму
(рис. 26.4, Б). В этот ригидный капсид заключе-
на хромосома, причем капсид способен вместить
только плотно упакованную хромосому стандарт-
ных размеров. Эти фаги обладают сложными
механизмами упаковки ДНК для введения ее в
предварительно образованный капсид (см. ниже).
От основания капсида отходит отросток, варьи-
рующий по степени сложности у разных фагов
и представляющий собой важную органеллу ад-
сорбции (рис. 26.5, А, Б).
Несмотря на огромное число фагов, обнару-
женных у бактерий и архей, их морфологиче-
ское разнообразие весьма ограничено. Как пра-
вило, фаг имеет оболочку — капсид, внутри кото-
рого находится линейная двухцепочечная ДНК;
реже носителем генетической информации слу-
жит ковалентно замкнутая кольцевая одпоце-
почечная ДНК либо даже РНК. У большин-
ства фагов капсид представляет собой полиэд-
Часть VI. Рост и дифференцировка клеток
Рис. 26.5. Строение фагов Л и Т4.
А Икосаэдры ческий фаг А с отростком. Электронная микрофотография — очищенный препарат фага А. На схеме
показаны капсид и отросток, состоящие из б и 11 белков соответственно. Белки обозначены их буквенным кодом.
Диаметр икосаэдрического капсида составляет 50 нм, длина отростка — 135 нм. Отросток заканчивается конической
частью с одиночной терминальной нитью. Двухцепочечная ДНК, содержащая примерно 48 т.п.н. (~50 генов), имеет
линейную форму и липкие концы. Левый конец, как следует из генетической карты, упаковывается последним и
выходит из головки (головкой называют капсид, содержащий ДНК) в верхнюю часть полого внутреннего стержня
отростка. Этот конец ДНК впрыскивается в клетку первым. По [2].
Б. Удлиненный икосаэдрический фаг Т4 с длинным отростком. Электронная микрофотография — очищенный препа-
рат фага. Длина головки 100 нм, ширина 75 нм. На рисунке указано расположение известных основных и минорных
белков головки и отростка. Вершины головки образованы протеолитически расщепленным gp24, промежутки между
вершинами состоят из белков gpSoc, gpHoc и gp23. Двухцепочечная линейная ДНК(~1бб т.п.н.) содержит примерно
130 известных генов и почти 100 функционально не идентифицированных открытых рамок считывания. Каждый
упакованный геном имеет 5% избыточность на одном конце, вследствие чего полная хромосома содержит 171 т.п.н.
Геномная карта — кольцевая пермутированная. Обе эти характеристики объясняются непрерывностью механизма
упаковки ДНК из конкатенированной ДНК-предшественника. По [3].
рическую структуру, либо с отростком и ба-
зальной пластинкой в качестве органеллы ад-
сорбции, либо без них, и содержит определенное
количество ДНК. Однако у немногих фагов кап-
сид имеет нитевидную форму; сборка фаговой ча-
стицы при этом осуществляется вокруг ДНК и
длину зрелого фага определяет длина ее моле-
кулы. Все эти признаки используются для мор-
фологической классификации бактериофагов (см.
табл. 26.1). М ______
Глава 26. Бактериофаги как модели дифференцировки 77
Рис. 26.6. Генетическая карта фага
у>Х174. На кольцевой карте </?Х174 по-
казаны 10 генов (А-Н, J, К), обес-
печивающие образование 11 белков, и
2 межцистронные области (//?), кото-
рые не транскрибируются. Одна об-
ласть IR содержит точку начала ре-
пликации для синтеза (—)-цепи ДНК и
образует складчатую вторичную струк-
туру. Несколько генов перекрываются,
что экономит величину генома. Указа-
ны предполагаемые функции продуктов
генов. Стрелками показаны промоторы
и направление транскрипции.
Точка начала
репликации (-)-цепи
Конкуренция с SS-RF
мРНК
Точка начала
репликации (+)-цепи
Адсорбция фага;
минорный белок шипа
Основной белок
шипа
Репликация RF-ДНК
Синтез вирусной цепи
мРНК
Предшественник капсида
ФХ174
Сборка капсида
Лизис клетки-хозяина
Основной белок капсида
Прекращение синтеза
ДНК клетки-хозяина
Сердцевинный белок;
белок, конденсирующий ДНК
в процессе упаковки
Повышенный
выход фагов
Созревание ДНК
мРНК
/Р0
%
Независимо от различий в способах существо-
вания все фаги имеют общие «проблемы» раз-
вития, которым соответствуют следующие основ-
ные пять стадий жизненного цикла: 1) адсорбция
па клетке-хозяине, 2) проникновение в клетку,
3) репликация ДНК, 4) синтез новых компонен-
тов оболочки, сборка фаговых частиц (морфопо-
эз) и 5) высвобождение фаговых частиц - потом-
ков. Вирулентные фаги размножаются только
посредством такого литического цикла. Для неко-
торых фагов характерна способность помимо ли-
тического пути осуществлять развитие по лизо-
генному пути. Вместо синтеза новых вирусных
частиц и лизирования клеток-хозяев эти фаги мо-
гут реплицировать свою ДНК при сосущество-
вании с геномом клетки-хозяина, и поэтому их
называют умеренными фагами. При лизогении
фаг, называемый в этом случае профагом, мо-
жет присутствовать в клетке в свободном плазми-
доподобном состоянии (пример — фаг Р1) или ин-
тегрироваться в хромосому клетки-хозяина. Ин-
теграция либо происходит во многих случайных
участках, как в случае фага Мн, либо ограниче-
на специальными участками присоединения («it),
как в случае фага А.
Лизогенное состояние клетки-хозяина может
продолжаться в течение длительного времени, по-
ка не произойдет индукция литического пути раз-
вития фага с образованием новых фаговых частиц
и лизисом клетки в конце цикла. Индукция мо-
жет быть вызвана внешними факторами, напри-
мер УФ-облучением или отсутствием источников
питания (см. разд. 26.4.4).
О сложности цикла развития фага (но не обя-
зательно об эффективности размножения) можно
судить по числу генов в его хромосоме. Напри-
мер, фаг <д! 74, характеризующийся одним из наи-
более мелких одноцепочечных геномов (5386 нук-
леотидов), содержит лишь 10 генов (рис. 26.6) и
имеет довольно простой цикл развития. В то же
время у фага Т4 (размеры генома приблизитель-
но 169 т.п.н.) имеется по меньшей мере 130 генов
(рис. 26.7; см. цв. вклейку). Однако оба эти фага
образуют почти одно и то же количество дочер-
них фаговых частиц за один цикл, занимающий
у них примерно одинаковые промежутки време-
ни. В сравнении с фагом ^174 фаг Т4 облада-
ет чрезвычайно сложным циклом развития (см.
разд. 26.3.5). Дополнительные гены обеспечивают
у него многочисленные механизмы дублирования
па всех этапах цикла развития и многочисленные
необычные структурные особенности. Некоторые
из них можно видеть в электронном микроскопе
(рис. 26.4, Б и 26.5, В). Геном фага А включает
50 т.п.н., т. е. его размеры примерно в 10 раз боль-
ше, чем размеры генома фага <£>174, и на две трети
меньше размеров генома фага Т4. Фаг А облада-
ет способностью как к литическому, так и к ли-
зогенному способу существования, и многие его
гены служат для тонкой регуляции, необходимой
при выборе того или иного из этих путей развития
(см. разд. 26.4.2).
78 Часть VI. Рост и дифференцировка клеток
26.3. Для вирулентных фагов характерно развитие по литическому пути
26.3.1. Размножение вирулентных фагов
всегда вызывает лизис клетки-хозяина
Впервые литический жизненный цикл фага опи-
сали в 1939 г. Э. Эллис и М. Дельбрюк по резуль-
татам своего знаменитого эксперимента с одиноч-
ным циклом развития фага Т4 Escherichia coli
(рис. 26.8; см. цв. вклейку). В этом эксперимен-
те фаг добавляли к клеткам Е. coli в количестве
10 частиц на клетку (m.o.i. = 10) в присутствии
KCN — ингибитора дыхания бактерий, внесенного
до инфицирования, чтобы предотвратить преж-
девременное развитие фага. Синхронное размно-
жение фага начиналось с момента суспендирова-
ния инфицированных клеток в свежей среде без
KCN. Через определенные интервалы времени из
культуры отбирали аликвоты и титровали для
определения свободных фаговых частиц (после
отделения интактных клеток путем центрифуги-
рования). Свободных вирионов не наблюдалось в
течение 22 мин после инфицирования — такое вре-
мя продолжался латентный период в цикле фага.
Этот эксперимент повторил в 1952 г. А. Дерман,
добавив к нему новый важный этап — определение
жизнеспособных фаговых частиц внутри клеток-
хозяев до начала их лизиса. С этой целью он
вызывал преждевременный лизис клеток воздей-
ствием хлороформа и затем титровал лизаты.
Новообразованные вирионы обнаруживались
внутри клеток через 12 мин после инфициро-
вания. В предшествующий период, называемый
скрытой фазой, в отсутствие жизнеспособных
фагов в клетках, несомненно, присутствовала фа-
говая ДНК («вегетативный фаг»). Период вре-
мени от инфицирования до спонтанного лизиса с
высвобождением фагов в среду назван латент-
ным периодом; за ним следует период лизиса,
когда все клетки разрушаются и культура стано-
вится полностью прозрачной (рис. 26.9, на цв.
вклейке, и рис. 26.10).
Множество проведенных позднее деталь-
ных исследований показало, что скрытая фа-
за, несмотря на свое исходное название — eclipse
period, в буквальном смысле — пустой, представ-
ляет собой наиболее активный период в развитии
фага. В это время действуют сложные регуля-
торные программы и метаболизм клетки-хозяина
берется под контроль фаговым геномом. При
этом быстро реализуется программа получения
определенных молекул от хозяина и экспрессии
продуктов собстведдаото генома. Функции фага
соответственно времени их проявления разделя-
ют на ранние и поздние, принимая за границу
между ними начало репликации фаговой ДНК
(рис. 26.9).
Ранние гены фага Т4 имеют обычные промо-
торы, которые соответствуют промоторам Е. coli
и транскрибируются РНК-полимеразой хозяина,
содержащей собственную субъединицу сг70 (см.
разд. 18.9). Продукты нескольких ранних генов
отвечают за модификацию субъединиц РНК-по-
лимеразы Е. coli путем ADP-рибозилирования
(гены mod и alt) или добавления новых сг-фак-
торов (гены 33 для а33 и 55 для ст55); эти моди-
фикации делают РНК-полимеразу специфичной к
определенным ранним и ко всем поздним промо-
торам (рис. 26.7). Модифицированная таким об-
разом РНК-полимераза уже не способна транс-
крибировать гены хозяина.
Все этапы репликации ДНК, начиная с синте-
за предшественников нуклеотидов, детерминиро-
ваны ранними фаговыми генами. Функции позд-
них генов в основном относятся к образованию
морфологических компонентов и сборке капси-
да. Примечательно, что ранние и поздние гены
в большинстве локализованы в двух раздельных
кластерах на геномной карте и транскрибируют-
ся в противоположных направлениях с различных
цепей ДНК (рис. 26.7).
Традиционно функции фагов разделяют на
ранние и поздние. Ранние гены участвуют глав-
ным образом в преодолении защитных барьеров
клетки-хозяина и переориентации ее метаболиз-
ма на образование фаговых частиц и реплика-
цию фаговой ДНК. Поздние гены участвуют в
образовании белков оболочки фага и его сборке с
последующим выходом вирионов и лизисом клет-
ки (см. рис. 26.9).
Период между адсорбцией и лизисом сущест-
венно варьирует по длительности у различных
фагов. У фагов Т1 и Т5 цикл развития завер-
шается через 12 мин после инфицирования, тогда
плава Z0. Ьактериофаги как модели дифференцировки 79
Рис. 26.10. Различные стадии развития фага Т4 (электронные микрофотографии).
А Свободная фаговая частица.
\Б. Фаг, адсорбированный на поверхности клетки Escherichia coli и инъецирующий свою ДНК (вверху — поясняющий
рисунок).
В. Клетка с адсорбированными фагами и новообразованными фаговыми частицами в цитоплазме.
Г. Клетка с адсорбированными фагами и внутриклеточными фагами, прикрепленными к мембране.
Д Лизированная клетка. Размеры головки фага Т4 —100 х 75 нм. По [4].
как фагу Т4 требуется на это 30 мин, фагу А —
цо 65 мин. Особенность нитевидных фагов состо-
ит в том, что они не лизируют клетки-хозяева,
то непрерывно производят новые фаговые ча-
стицы, которые выходят наружу сквозь клеточ-
ную оболочку. В этом случае проходят часы,
прежде чем метаболизм клеток-хозяев оконча-
тельно нарушится и ослабленные клетки утра-
тят способность продуцировать фаговые час-
тицы.
80 Часть VI. Рост и дифференцировка клеток
26.3.2. Цикл развития фагов начинается
после их адсорбции на поверхности
клетки-хозяина и проникновения
в нее фаговой ДНК
Первый контакт между фагом и клеткой-хозя-
ином происходит в результате случайного столк-
новения. Если клетка несет на поверхности
специфические рецепторы, может последовать
стабильное связывание (адсорбция) фага. Взаи-
модействие обычно опосредуют рецепторные бел-
ки клетки и специфические фаговые белки, лока-
лизованные на кончике отростка, нитях отростка
или, как в случае нитевидных фагов, на одном
из концов фага. Фаг Т4 распознает соответствую-
щие ему рецепторы посредством белка gp37. Ди-
мер этого полипептида присутствует в дистальной
части длинных нитей отростка. У некоторых фа-
гов (Л и Т4) стабильной адсорбции предшествует
стадия временной, обратимой адсорбции.
Рецепторами фагов могут служить многие
компоненты оболочки бактерий, в том числе ком-
поненты наружной или внутренней мембраны
либо клеточной стенки. Фаг Т4 связывается с
липополисахаридом (ЛПС), входящим в состав
наружной мембраны. Фаг Л адсорбцируется на
клетках Е. coli путем взаимодействия с мем-
бранным белком LamB, представляющим собой
мальтодекстриновый порин наружной мембраны.
Нитевидные ДНК-содержащие фаги прикрепля-
ются к верхушке половых пилей мужских бакте-
риальных клеток, тогда как РНК-содержащие фа-
ги — к боковым сторонам тех же пилей. В случае
мутаций гена рецептора клетки приобретают
устойчивость к определенным фагам. Фаги спо-
собны преодолевать эту устойчивость благода-
ря мутациям их генов, кодирующих белки, ко-
торые распознают рецепторы (приспособительная
супрессия). Такие фаги называют мутантами с
измененным кругом хозяев.
Фаги Мн и Р1 обладают сложной генетической
системой, позволяющей им сменять хозяев. Уча-
сток гена, кодирующего белок адсорбции, может
инвертироваться в результате сайт-специфичной
рекомбинации, после которой считывание его
происходит уже в противоположном направле-
нии (см. рис. 18.18). Такое переключение осу-
ществляется настолько часто, что примерно 50%
фаговых частиц-потомков представляет собой
фаги с одним кругом хозяев и 50% — с другим (см.
разд. 18.11.2).
Некоторым фагам для эффективной адсорб-
ции требуются кофакторы. Например, фаг Т4
нуждается в L-триптофане для полного разверты-
вания нитей его отростка перед адсорбцией. Дру-
гие фаги, такие как Л и Р1, нуждаются в добав-
лении генов Са2+ и Mg2+ соответственно.
За стабильной адсорбцией на поверхности
клетки немедленно следует впрыскивание фаго-
вой ДНК в клетку. Хотя механизм этого процесса
до конца не ясен, считается, что энергию, необ-
ходимую для переноса ДНК, обеспечивают в том
числе силы отталкивания между отрицательно за-
ряженными боковыми группами высококонденси-
рованной ДНК. Фаг Т4 несет несколько молекул
лизоцима, прикрепленных к базальной пластинке
отростка, по-видимому для локального гидроли-
за пептидогликана клеточной стенки. Фагу Л для
инъекции своей ДНК требуется участие клеточ-
ной системы транспорта углеводов, а именно ман-
нозо-специфичной фосфотрансферазной системы
(гены manXYZ). Перенос фаговой ДНК через
плазматическую мембрану, по-видимому, не тре-
бует дополнительной энергии [протондвижущей
силы (Др) или АТР] и, скорее всего, происходит
через поры или каналы. В случае фага Т4 протон-
ный потенциал на мембране, видимо, важен для
поддержания поры (канала) в открытом состоя-
нии или для образования участка активного при-
крепления.
За исключением некоторых фагов, например
Т5, процесс инъекции протекает очень быстро.
Интересно, что фаг Т5 впрыскивает свою ДНК
в две стадии, вначале перенося ее на 8% дли-
ны от проксимального конца хромосомы (FST
DNA) и затем, после паузы примерно в 4 мин,
вводя дистальную часть (оиДНК). Во время па-
узы происходит экспрессия генов, находящихся
на проксимальном конце генома, и синтезируют-
ся кодируемые ими белки, которые разрушают
геном клетки-хозяина, инактивируют ее рестрик-
тазы и, наконец, обеспечивают продолжение
процесса инъекции. Проксимальная последова-
тельность ДНК предположительно не содержит
сайтов рестрикции, чувствительных к рестрикта-
зам хозяина.
Как было установлено в историческом экспе-
рименте А. Херши и М. Чейз, в клетку прони-
кает только ДНК фага, но не его белки. В этом
опыте белок и ДНК фага Т2 дифференцирован-
но метили [35S] и [32Р] соответственно. Среди фа-
говых частиц-потомков, высвобождавшихся после
Глава 26. Бактериофаги как модели дифференцировки 81
заражения клеток родительскими фагами с двой-
ной меткой, некоторые содержали [32Р], но не
было фагов, меченных [32S] (рис. 26.11; см. цв.
вклейку). В настоящее время известно несколько
исключений из этого правила; у некоторых фагов
вместе с хромосомой инъецируется небольшое ко-
личество белков. Например, фаг Т4 несет копии
белка gp2, связанные с обоими концами его ДНК.
Этот белок мол. массой 25 кДа эффективно за-
щищает ДНК от ранней фрагментации под дей-
ствием белка рекомбинации и репарации RecBCD
клетки-хозяина (экзонуклеаза V). Следовательно,
фаги, у которых отсутствует белок gp2, могут раз-
виваться только в том случае, если у хозяина не
функционирует RecBCD-экзонуклеаза.
Эксперимент Херши и Чейз не дал бы своих
исторических результатов, если бы авторы выбра-
ли для него взамен Т2 нитевидные фаги, посколь-
ку, например, нитевидный фаг М13 проникает в
клетку бактерии целиком. В процессе пересече-
ния мембраны ДНК этого фага освобождается от
окружающего ее белка оболочки. Позднее старый
белок оболочки возвращается в цикл и вновь ис-
пользуется для того, чтобы «одеть» новые хромо-
сомы фагов-потомков на их пути через клеточную
мембрану наружу.
26.3.3. Наиболее ранние этапы фаговой
инфекции обеспечивают переориентацию
метаболизма клетки-хозяина
на продукцию фаговых частиц
Фаг Т4 образует в цикле инфекции примерно 600
копий своей хромосомы. Из них примерно полови-
на полностью упакована к моменту лизиса клетки
в инфекционные фаговые частицы. Остальные
копии ДНК остаются не полностью упакован-
ными и теряются после лизиса. Сверхпродук-
ция— это, вероятно, плата за быстрое развитие.
В течение 30 мин активного жизненного цикла
ДНК-полимераза Т4 связывает примерно 108 п.н.
(600 • 1,7 Ю5), синтезируя высокополимерную
ДНК. Для сравнения, приблизительно за такое же
время Е. coli реплицирует свою хромосому только
один раз, что эквивалентно полимеризации при-
мерно 2 • 106 п.н. Таким образом, Т4 реплицирует
ДНК почти в 100 раз быстрее, чем Е. coli. Это
требует участия быстродействующих ферментов.
кодируемых фагом Т4, и достаточного поступле-
ния дезоксинуклеотидтрифосфатов. Будучи пара-
зитом, фаг Т4 использует как источник нуклеоти-
дов хромосому клетки-хозяина.
При детальном изучении цикла инфекции в
случае фага Т4 можно наблюдать резкие из-
менения в хромосоме клетки-хозяина, в норме
свернутой в компактную структуру — нуклеоид.
Нуклеоид теряет компактную форму, затем рас-
падается и, наконец, разрушается. Эти события
независимы одно от другого, и известны мутации,
которые влияют па одно из них, не затрагивая
остальные.
Хромосома Е. coli, в норме свернутая с обра-
зованием многочисленных отрицательных сверх-
витков, постепенно разворачивается. Это зависит
от функционирования продукта гена unf/alc фага
Т4, который несет двойную функцию и необходим
также для блокады транскрипции ДНК хозяина,
содержащей цитозин. Ген разрушения нуклеои-
да ndd ответствен за передвижение ДНК из цен-
тральной области клетки к ее периферии, где она
прикрепляется к внутренней мембране. Продукт
этого гена, белок мол. массой 15 кДа, синтезиру-
ется вскоре после инфицирования (через 3-6 мин)
в стехиометрическом количестве — примерно 4000
молекул на инфицированную клетку — к концу
ранней стадии инфекции.
Затем происходит деградация клеточной
ДНК, инициируемая двумя фаговыми эндонукле-
азами: эндонуклеазой II (ген denA, от deficient for
endonuclease А) и эндонуклеазой IV (ген denB,
от deficient for endonuclease В). Оба эти фермен-
та разрушают только цитозинсодержащую ДНК
(т. е. ДНК хозяина) и не затрагивают модифи-
цированную фаговую ДНК с полностью глю-
козилировапными и гидроксиметилированными
цитозиновыми остатками. Деградация ДНК клет-
ки-хозяина начинается с массированного эндонук-
леолитического расщепления этими ферментами
и в конце концов приводит к образованию моно-
нуклеотидов под действием мембраносвязанной
экзонуклеазы (предположительно gp46 и gp47).
Нуклеотиды, высвобождающиеся в результа-
те деградации клеточной ДНК хозяина, фаг Т4
использует для собственного размножения: их
достаточно для образования примерно 20 ко-
пий фагового генома. Необходимый процессинг
этих рециклизованных нуклеотидов осуществля-
ется сложной системой из 14 ферментов, 12 из ко-
торых кодирует фаговая ДНК (рис. 26.12).
82 Часть VI. Рост и дифференцировка клеток
ДНК клетки-
хозяина
dAMP
dAMP-
киназа
dTMP 1
dNMP-
киназа
rNDP-
редуктаза ''
ADP » dADP
NDP-киназа
dATP
dTDP
I
dTTP
ДНК
| ДНК-глюкозилтрансферазы, метилаза
Модифицированная фаговая ДНК
Рис. 26.12. Синтез предшественников ДНК в клетках Escherichia coli, инфицированных фагом Т4. ДНК фага Т4
содержит вместо дезокси цитозина (dC) глюкозилированный гидроксиметилдезоксицитозин (dHMC). Чтобы гаран-
тировать полную замену dC на dHMC в ДНК дочерних вирионов, требуется 14 продуктов генов, 12 из которых
кодирует фаг Т4. ДНК этого фага устойчива почти ко всем ферментам рестрикции и многим обычным нуклеазам
благодаря присутствию в ней глюкозилированного dHMC. Основной пул дезоксинуклеотидмонофосфатов образует-
ся путем синтеза de novo и в результате вызываемой фагом деградации ДНК хозяина. Некоторые из этих реакций
катализируют ферменты хозяина (показано жирными стрелками), часто с участием кодируемых фагом ферментов
с аналогичными функциями (показано тонкими стрелками). Однако образование характерного для Т4 dHMC зави-
сит исключительно от фаговых генов. Глюкозилирование остатков цитозина (начинающееся с образования UDPGIc)
происходит в синтезированной ДНК и регулируется фаговыми генами. По [7].
26.3.4. Морфопоэз (сборка) фаговых частиц
происходит на позднем этапе цикла
На поздней стадии жизненного цикла фагов про-
исходит в основном сборка фаговых частиц. Они
образуются непрерывно, пока их продукцию не
прекратит лизис. У фагов известно два различ-
ных механизма сборки.
1. Для РНК-содержащих и нитевидных оцДНК-
содержащих фагов описан процесс, назы-
ваемый «одеванием хромосомы». Ново-
образованная фаговая ДНК, еще покрытая
ДНК-связывающими белками, окутывается
белками оболочки в процессе переноса вири-
она через клеточную стенку наружу. Это об-
менный процесс, в котором белок, связанный
с одноцепочечной ДНК, замещается белком
оболочки, до этого хранящимся в клеточной
мембране. Освобожденный белок подвергает-
ся рециклизации и вновь используется для
защиты синтезируемой ДНК фага. Наиболее
полно этот процесс изучен у фага М13 (см.
рис. 26.13).
2. Крупные дцДНК-содержащие фаги и оцДНК-
содержащие фаги с икосаэдрическими капси-
дами (см. табл. 26.1) осуществляют процесс
сборки, включающий взаимодействие не пол-
ностью собранных капсидов (прокапсидов) с
ДНК (рис. 26.12). Основные компоненты фа-
говой частицы, а именно головка (капсид,
заполненный ДНК), отросток и нити от-
ростка, собираются в несколько генетически
контролируемых этапов независимыми путя-
Глава 26. Бактериофаги как модели дифференцировки 83
ми. Дефект в любом из генов сборки вызыва-
ет прекращение продукции фага и накопление
незрелых предшественников фаговых частиц
(рис. 26.7). Синтезированная фаговая ДНК
активно упаковывается в предварительно об-
разованный белковый контейнер (капсид), в
котором нет избыточного пространства, и в
связи с этим необходима плотная упаковка
хромосомы в высококонденсированном состо-
янии («заполненная головка»). Полностью
сформированные элементы на конечном эта-
пе сборки соединяются с помощью допол-
нительных белков, образуя жизнеспособные
фаги, которые остаются внутри клетки до ее
лизиса. Этот тип сборки наиболее изучен у
фагов Т4 и Л. В случае фага Т4 пример-
но 40% генов обеспечивает морфологические
функции. Механизмы сборки были раскрыты
Эпстайном (R. Epstein) с сотрудниками путем
детального изучения фенотипов фагов, несу-
щих мутации в генах созревания.
26.3.5. Сборка капсида и упаковка ДНК
у фага Т4
Сборка фаговых капсидов происходит независи-
мо от того, присутствует ДНК для упаковки или
нет. Однако упаковка ДНК служит необходимым
условием соединения отростка с головкой. В от-
сутствие ДНК в клетке накапливаются пустые
капсиды («тени»). У фага Т4 в инициации упа-
ковки ДНК участвуют белки gpl6 и gpl7, тогда
как продолжение процесса упаковки в большой
степени зависит от белка gp49.
Процессинг капсида и созревание ДНК иллю-
стрирует рис. 26.14 (см. цв. вклейку). Упаков-
ка ДНК начинается, когда белки gpl6 и gpl7
опосредуют прикрепление подготовленной ДНК
к компетентным капсидам. После заполнения го-
ловка стабилизируется и скрепляется добавле-
нием белков gpHoc и gpSoc к капсиду и бел-
ков воротничка gpl3 и gpl4 к основанию голов-
ки. В таком виде заполненная головка готова
для спонтанного соединения с отдельно собран-
ным отростком (см. рис. 26.7). Капсид формиру-
ется как прикрепленная к внутренней мембране
клетки структура, образуемая двумя основными
белками-предшественниками (gp23 и gp24), кото-
рые наслаиваются на своего рода каркас, состоя-
щий из нескольких основных и минорных белков
(gp21, gp22, gp67, gp68, IPI, 1РП, IPIII и gpAlt).
Рис. 26.13. Сборка нитевидного фага М13 на поверхнос-
ти клетки.
А. Хромосомы дочерних частиц фага М13 появляются
после репликации в виде колец одноцепочечной ДНК,
защищенной от действия нуклеаз покровом из димеров
белка gp5, связанного с оцДНК. Белки gp7 и gp9 свя-
зываются с крупной шпилечной структурой (сигнал упа-
ковки) в межгенной области ДНК. В зрелой частице эти
белки локализованы на одном ее конце.
Б. Фаговые хромосомы переносятся к плазматической
мембране, где gp5 удаляется с поверхности частицы и
заменяется белком оболочки gp8, до этого соединенным
с мембраной посредством своего гидрофобного домена.
Это происходит одновременно с выталкиванием фаго-
вых частиц из клетки. Белки gp3 и gp6 локализованы
на противоположном конце зрелой частицы. По [8].
После протеолитического отщепления капси-
да от мембраны его структура готова к прие-
му ДНК, подготовленной к упаковке в резуль-
тате репликации в виде крупных конкатенатов
(2008-ДНК; S — константа седиментации), образу-
емых сцепленными молекулами ДНК (для срав-
нения, одиночная ДНК фага Т4 имеет разме-
ры 63S). Упаковка происходит с затратой АТР,
с участием процессированных капсидов и белков
gpl6 и gpl7. ДНК вводится в капсид до его за-
полнения, и при этом ДНК в головке оказыва-
ется примерно на 5% больше величины фагово-
го генома. Только тогда хромосома отщепляется
от цепи-предшественника, освободившийся конец
84 Часть VI. Рост и дифференцировка клеток
которой используется далее в качестве ново-
го участка инициации упаковки при заполнении
следующего капсида. Этим объясняется, почему
генетическая карта фага Т4 циклически пер-
мутирована и характеризуется концевой из-
быточностью в 5%, хотя отдельная хромосома
обнаруживает физическую линейность.
В процессе заполнения капсид увеличивается
в объеме и к его белковой рететке добавляют-
ся белки gpNoc и gpSoc. Сформированная таким
образом головка компетентна для вступления в
следующую важную стадию сборки фага — этап
присоединения отростка. Мутации в генах 16, 17
или 49 нарушают упаковку ДНК и созревание го-
ловок. Инициирующие белки gpl6 и gpl7 необхо-
димы для прикрепления конца молекулы ДНК к
процессированнму капсиду и инициации процесса
его заполнения. Дефект в любом из этих генов вы-
зывает накопление большей частью пустых кап-
сидов и неупакованной ДНК-предшественника.
Белок gp49 — это эндонуклеаза, ответственная за
удаление ответвлений и других структурных на-
рушений в новореплицированной ДНК, способ-
ных стерически препятствовать упаковке. К та-
ким структурным нарушениям относятся трех- и
четырехходовые ветвления, ошибки спаривания,
гэпы, одноцепочечные разрывы, одноцепочечные
выступающие концы и петли. Эндонуклеаза gp49
функционирует как защитная система, проверяю-
щая ДНК, отмечающая структурные ошибки од-
ноцепочечными разрывами и таким образом го-
товящая их к дальнейшей репарации. У мутан-
тов с дефектным геном 49 возможна инициация
упаковки ДНК, но завершения упаковки не проис-
ходит и процесс заполнения заканчивается преж-
девременно. Вследствие этого в клетках, ин-
фицированных такими мутантами, присутствуют
частично заполненные головки и в высокой степе-
ни разветвленные неупакованные ДНК-предшест-
венники (рис. 26.14).
26.3.6. Упаковка ДНК фага Л — пример
упаковки по механизму
заполненной головки
Двухцепочечная ДНК хромосомы фага Л содер-
жит 48 502 п.н. и имеет 5'-концевые одноцепочеч-
ные липкие концы (сайты cos) из 12 нуклеоти-
дов. После инфицирования клеток концы хромо-
сомы фага ковалентно связываются, и происходит
репликация по механизму катящегося кольца, т. е.
образование множества копий в составе длинной
непрерывной молекулы (конкатената). Упаков-
ка ДНК в капсид происходит в одном направле-
нии: начиная с левого конца генетической кар-
ты в направлении правого конца. В этом процес-
се участвуют кодируемая фагом терминала gpA,
клеточный фактор интеграции IHF и два сай-
та cos, которые фланкируют отрезок ДНК, пред-
назначенный для упаковки. Сайт cos содержит
сайт одноцепочечного разрыва во фрагменте дли-
ной 16 п.н., включающем липкий конец длиной
12 п.н., и, кроме того, сайты связывания белков
gpA и IHF, расположенные в пределах фрагмен-
тов из 200 п.н. по обеим сторонам сайта cos. Упа-
ковка ДНК может быть инициирована с любого
cos-сайта в конкатенате ДНК. При этом терми-
паза связывается одновременно с ДНК в сайте
cos и с соединяющим белком gpNul, который в
свою очередь связывается с основанием капси-
да. Эта многослойная конструкция приводит пу-
стой капсид в близкое соседство с сайтом, ини-
циирующим упаковку. Далее протекает процесс
укладки ДНК в капсид, требующий затраты АТР.
Укладка заканчивается на следующем сайте cos
с участием вновь белка gpA, который создает
липкие концы путем введения двух ступенчатых
одноцепочечных разрывов на расстоянии 12 п.н.
один от другого. Конец, упакованный последним,
остается вблизи основания капсида и входит в
полость внутри отростка после его присоедине-
ния. При последующем инфицировании клетки-
хозяина этот конец ДНК впрыскивается первым.
Количество упакованной ДНК определяется
как расстоянием между двумя сайтами cos, так
и объемом капсида. При естественных условиях
это количество точно соответствует одному гено-
му фага А. Отрезок ДНК между- двумя сайтами
cos не обязательно должен происходить из фага А,
но может быть любого происхождения, не превы-
шая лишь существенно по размерам емкость кап-
сида. Упаковка ДНК по механизму заполненной
головки обнаружена также и у других икосаэдри-
ческих фагов.
Глава 26. Бактериофаги как модели дифференцировки 85
26.4. Лизогения —альтернативный способ существования
умеренных фагов
26.4.1. Умеренные бактериофаги способны
интегрировать геном в хромосому
клетки-хозяина, не вступая
в литический цикл развития
Некоторые бактериофаги, например А, Р22, Р1,
Р2 и Ми, обладают возможностью выбора меж-
ду двумя путями развития — по литическому цик-
лу с лизированием клетки-хозяина и выходом до-
черних фаговых частиц, описанному выше, либо
по пути лизогении, при котором они на время
как бы исчезают в клетке, подобно безбилетному
пассажиру на судне (рис. 26.15; см. цв. вклейку).
В таком состоянии фаг называют профагом. Ка-
жущееся исчезновение фага с переходом в состо-
яние профага может быть обусловлено одним из
двух молекулярных механизмов: 1) в случае неко-
торых фагов (например, А), обладающих необ-
ходимыми высокоспециализированными механиз-
мами, ДНК включается в хромосому хозяина, где
опа пассивно копируется в каждом цикле репли-
кации хромосомы, сохраняясь в клетках-хозяевах
в течение неопределенно долгого периода времени
без образования вирионов и оставаясь незамечен-
ной защитными системами хозяина; 2) в случае
других фагов (папример, фага Pl Е. coli) фаго-
вый геном превращается в низкокопийную плаз-
миду, которая реплицируем ся с умеренной скоро-
стью и остается под строгим контролем клетки-
хозяина. Поскольку и в том, и в другом из этих
лизогенных состояний данные фаги не поврежда-
ют клетки, их назвали умеренными фагами в
отличие от вирулентных фагов, которые неиз-
бежно уничтожают клетку-хозяина.
Состояние лизогении относительно стабильно
в клеточной культуре, так как оно передается от
лизогенных клеток их потомкам. Иногда, однако,
лизогенный путь развития прекращается и фаг
переходит к развитию по литическому пути. Тогда
образуются дочерние фаговые частицы и клетка-
хозяин погибает в результате лизиса, при котором
высвобождаются вирионы-потомки.
Пример второго типа лизогенизации Е. coli
демонстрирует фаг Р1. Этот фаг превращает-
ся в однокопийпую плазмцду (одна копия на
хромосому), которая реплицируется синхронно с
хромосомой хозяина. После попадания в клет-
ку линейная хромосома фага Р1 замыкается в
кольцо с помощью кодируемого фагом белка
gpCre. Этот фермент обычно обеспечивает сайт-
специфичную рекомбинацию между двумя сайта-
ми 1охР, один из которых локализован среди генов
линейной карты и другой —в области концевой
избыточности. Аналогичной /о.т-сге-зависимой ре-
комбинацией обусловлен также распад плазмиды-
конкатената на мономерные геномы незадолго пе-
ред делением клетки-хозяина. В редких случаях
/от-сге-рекомбинация у фага Р1 служит для того,
чтобы интегрировать его геном в геном хозяина.
Между сайтом фага 1охР и сайтом хозяина 1охВ,
имеющими сходные последовательности, происхо-
дит сайт-специфическая рекомбинация.
Фаг Мп необычен тем, что соответствует
транспозирующсмуся генетическому элементу,
ДНК которого интегрируется практически в
любой участок хромосомы хозяина, используя
независимый от гомологии механизм транс-
позиции (« незаконная рекомбинация »).
Отсутствие селективности по отношению к по-
следовательности вызывает частую интеграцию в
интактные гены, которые таким образом инакти-
вируются. Эта способность дала фагу его назва-
ние Мп (от mutator—вызывающий мутагенез).
26.4.2. Бактериофаг А как типичный пример
умеренного фага
Впервые лизогения была описана в современных
терминах А. Львовым, работавшим в Институте
Пастера в Париже, в конце 1940-х гг. Молеку-
лярная природа ее была раскрыта в работах,
проведенных на фаге А и оперопе lac Е. coli.
Эти исследования показали, что фенотипическое
проявление тпранс-рсцессивных мутаций генов cl,
сП и сШ фага А (образование прозрачных бля-
шек, отличающихся от мутных бляшек умерен-
ного фага дикого типа) связано с недостатком
трех регуляторных белков. Напротив, г/^с-доми-
нантныс мутации, свойственные фагу Xvir (от
virulent — вирулентный, т. е. неизменно лизирую-
щий клетки-хозяев с образованием прозрачных
бляшек) были интерпретированы как мутации
86 Часть VI. Рост и дифференцировка клеток
промотора/оператора. Фаг А и сейчас остается
широко используемой модельной системой для
анализа процессов дифференцировки, таких как
необратимое переключение между литическим и
лизогенным вариантами развития. Кроме того,
фаг А используется как вектор в генной инжене-
рии.
В состав фага А входит приблизительно равное
количество белка и ДНК. Одна линейная двух-
цепочечная молекула ДНК (48 502 п.н.) заклю-
чена в икосаэдрическую головку, соединенную с
длинным отростком (рис. 26.5, А). Концы хромо-
сомы у фага А имеют специфическую форму, за-
канчиваясь одноцепочечнымп З'-выступами дли-
ной 12 нуклеотидов, которые называются «лип-
кими», поскольку могут прилипать друг к другу
с образованием замкнутого конца. Липкие кон-
цы образуются на поздних этапах цикла во вре-
мя упаковки, когда терминаза вырезает ДНК
из конкатенатов путем введения двух ступенча-
тых одноцепочечных разрезов на расстоянии 12
нуклеотидов один от другого (см. рис. 26.15).
Эти липкие, или связующие (cohesive), концы
(cos-концы) важны для замыкания хромосомы в
кольцо (циркуляризации) вскоре после впрыски-
вания ДНК фага в клетку. Замыкание хромосо-
мы в кольцо имеет значение как для образования
профага (см. разд. 16.3.1), так и для репликации
вегетативного фага при литическом цикле.
Генетическую карту фага А можно изобразить
тремя способами: в виде линейной ДНК, огра-
ниченной двумя последовательностями cos (в та-
ком виде она находится в фаговой головке); в
виде кольцевой молекулы, ковалентно замкну-
той лигазой на сайтах cos в вегетативном фа-
ге, и в линейной форме интегрированного про-
фага. Упрощенно геном вегетативного фага пред-
ставлен на рис. 26.16 (см. цв. вклейку). Как
и в случае других плазмид и фагов, наблю-
дается отчетливая кластеризация генетических
функций; она соответствует этапам жизненно-
го цикла фага (ранние и поздние функции).
Ранние функции включают активность регу-
ляторных генов, важных для противодействия
защитным механизмам хозяина и выбора меж-
ду литическим и лизогенным путями развития,
а также генов, участвующих в рекомбинации
(интеграция/исключение) и в репликации ДНК.
Типичная точка начала репликации расположе-
на в пределах гена О. Она используется снача-
ла для медленной двунаправленной репликации
(б1-механизм), но позднее переключается с по-
мощью белков О и Р на быструю реплика-
цию по механизму катящегося кольца (сг-меха-
низм), в результате которой образуется конка-
темерная ДНК, необходимая для упаковки (см.
разд. 23.3.6). Поздние функции связаны с
генами SR (клеточный лизис) и А — J (синтез бел-
ков головки, отростка и сборки фаговых частиц).
Хотя поздние гены выглядят на линейной карте
разделенными па сайтах cos (и в таком виде они
находятся в головке), в сссДНК они непрерыв-
ны и совместно транскрибируются с образованием
единственной полицистронной мРНК с промотора
Рд (см. разд. 26.4.4). В геноме фага генов намно-
го больше, чем представлено на рис. 26.16. Напри-
мер, локус red соответствует трем генам, участву-
ющим в рекомбинации, локус Q—девяти генам.
Поскольку многие из этих генов факультативные,
т. е. требуются в клетках только некоторых хозя-
ев, здесь они не рассматриваются. Другие обла-
сти, называемые «молчащими», по-видимому,
не содержат никаких генов и, возможно, нужны
только для того, чтобы обеспечить заполнение го-
ловки во время упаковки. Молчащую ДНК можно
заменять искусственно другими генами, получая
тем самым разнообразные векторы для генной ин-
женерии (см. разд. 17.1 2).
26.4.3. Интеграция генома бактериофага А
в бактериальную хромосому
и его исключение
При лизогении ДНК фага А интегрирована в хро-
мосому Е. coli (рис. 26.17; см. цв. вклейку). Вклю-
чение в геном клетки происходит с участием бел-
ка интеграции gplnt, мономерного белка 40 к Да,
и кодируемого клеткой-хозяином фактора инте-
грации IHF — гетеродимера из субъединиц при-
мерно одинаковых размеров (11,2 и 10,6 к Да, ге-
ны him А и himB соответственно). Рекомбинация
происходит между фаговым сайтом присоедине-
ния attP и бактериальным сайтом присоедине-
ния attB. Эти сайты присоединения различны по
длине — 240 п.н. у А и 23 п.н. у Е. coli, но содер-
жат гомологичную внутреннюю последователь-
ность длиной 15 п.н. После связывания несколь-
ких копий gplnt и IHF в определенных участках
в пределах сайтов attP и attB образуется инта-
сома — структура более высокого порядка, кото-
рая обеспечивает точное выравнивание двух сай-
тов присоединения. Спаривание, обмен и сшива-
Глава 26. Бактериофаги как модели дифференцировки 87
ние четырех цепей опосредует белок gplnt внутри
интасомы. Небольшой белок IHF отвечает за свя-
зывание ДНК при образовании интасомы. Инте-
грация протекает как двустадийный процесс, тре-
бующий образования ступенчатых одноцепочеч-
ных разрезов в срединной области сайтов присо-
единения на расстоянии 7 нуклеотидов друг от
друга. Обмен цепей начинается в левой точке раз-
реза и продолжается через правую точку разреза.
Образующиеся рекомбинантные сайты присоеди-
нения названы attR и attL соответственно.
Исключение генома фага из хромосомы хозя-
ина после индукции профага — это не просто про-
цесс, обратный интеграции, поскольку рекомби-
нантные сайты присоединения attR и attL в значи-
тельной степени отличаются от первоначальных
сайтов attP и attB (см. рис. 26.17, Б, В). Помимо
белков gplnt и IHF, участвующих и в интеграции,
исключение фага зависит от специального белка
gpXis (8,6 кДа), кодируемого фагом. При субопти-
мальных концентрациях gpXis вспомогательным
белком может служить белок FIS Е. coli.
При интеграции и исключении профага осу-
ществляется особый тип рекомбинации — локали-
зованная рекомбинация, или рекомбинация по
Кэмпбеллу, названная так в честь исследователя
A. Campbell, первым описавшего ее точный меха-
низм.
26.4.4. Лизогенные клетки-хозяева иммунны
и могут быть индуцированы с участием
сложных регуляторных цепей
Интеграция хромосомы фага Л в клеточную хро-
мосому обеспечивает пассивную репликацию ге-
нома фага в каждом цикле деления клетки.
При этом экспрессируется (с использованием
РНК-полимеразы хозяина) только один фаговый
ген, а именно cl, который кодирует репрессор
gpCI, или CI. Транскрипция происходит с един-
ственного промотора Рдм (от promoter repressor
maintenance — промотор поддержания репрессо-
ра) и останавливается на терминаторе (t), распо-
ложенном ниже оперона cl. Белок CI выполняет
двойную роль — репрессирует два основных про-
мотора, Pl и Рд, фага Л и активирует промотор
Prm в ауторегуляторном процессе, т. е., следова-
тельно, свой собственный синтез (см. рис. 18.10
и 26.18, А). В лизогенной клетке имеется при-
мерно 200 молекул репрессора CI. Если в такую
клетку проникает другой фаг Л (суперинфекция),
он немедленно репрессируется свободным бел-
ком CI. Это состояние называют иммунностью
(или, точнее, гомоиммунностью) лизогенных кле-
ток. Подобная иммунность распространяется и на
A-подобные, или лямбдоидные, фаги, в том
случае если они чувствительны к белку CI фага А
(«гетероиммунность»). Мутантные фаги А, ли-
шенные CI, не способны к лизогении и образуют
не мутные бляшки, а прозрачные, как вирулент-
ные фаги (отсюда—Ас], от clear — прозрачный).
При суперинфекции лизогенной клетки, несущей
фаг дикого типа Е. coli (А+), присутствующий в
избытке репрессор подавляет внедрившийся му-
тант Aci, чем объясняется транс-рецессивный фе-
нотип Aci в сравнении с А+-фагами.
Профаг А способен подвергаться индукции,
т. е. при некоторых внешних воздействиях мо-
жет вступать в литический цикл развития. Ин-
дукцию вызывают повреждающие ДНК агенты,
такие как УФ-излучение либо канцерогенные и
мутагенные вещества. Подобные воздействия при-
водят к возникновению разрывов ДНК и акти-
вируют протеазы хозяина, связанные с SOS-ре-
парацией (см. разд. 15.7 и 19.3.4). Эти проте-
азы гидролизуют связанные с ДНК белки, в том
числе белок CI, и таким образом вызывают ин-
дукцию профага. Ранние, задержанно-ранние и
поздние белки с литическими функциями фа-
га А экспрессируются в основном с двух промо-
торов— (левый) и Рд (правый), с которых
транскрипция происходит в противоположных на-
правлениях (рис. 26.18, Б). Гидролитическое рас-
щепление CI приводит к дерепрессии операторов
Оц,2,з И Ofii.2,3 (см. разд. 18.6). Кроме воздей-
ствий на ДНК, индукцию вызывает скрещивание
лизогенного Hfr-донора с нелизогенным реципи-
ентом, в клетках которого соответственно отсут-
ствует CI. Этот процесс, называемый зиготной
индукцией, обычно приводит к гибели клеток-
реципиентов.
Литический путь развития фагов связан с
временной экспрессией очень крупных оперонов.
Транскрипции их должны препятствовать сигна-
лы преждевременного внутриоперонного терми-
натора (Ti), предназначенные в норме для целей
временной и модульной экспрессии этих генов.
Следовательно, для транскрипции соответствую-
щих цистронов требуется участие механизмов ан-
титерминации. Один такой механизм основан на
88 Часть VI. Рост и дифференцировка клеток
Рис. 26.18. Три механизма развития фага Л.
А. В лизогенной клетке-хозяине фаг Л экспрессирует на низком уровне репрессор CI, обеспечивающий подавление
всех остальных фаговых генов и иммунность клетки к суперинфекции Л- или лямбдоидными фагами.
Б. Если вследствие повреждения ДНК происходит расщепление белка CI (индукция), начинается транскрипция
фаговых генов одновременно с левостороннего промотора Pl и правостороннего промотора Рд. Вначале синтези-
руются немедленно-ранние белки N и Сго и с их помощью задержанно-ранние белки (по ходу транскрипции до Xis
и Q). Это вызывает исключение профага из хромосомы и индуцирует синтез всех поздних белков, участвующих в
сборке фага, и лизис клетки.
В. Немедленно-ранние и задержанно-ранние белки синтезируются сразу после инфицирования клетки и в нача-
ле периода выбора пути развития после индукции. При высоком значении m.o.i (> 5,0) и в голодающих клетках
(с высоким уровнем сАМР) синтезируется активатор СП, вызывающий вначале интенсивный синтез репрессора CI и
затем интеграцию ДНК фага в хромосому с помощью интегразы Int. Впоследствии СП инактивируется в результате
того, что CI подавляет его дальнейший синтез, и уровень CI падает до уровня поддержания; профаг сохраняется в
клетке как стабильно интегрированный в ее геном. При нормальном уровне питательных веществ в среде внутри-
клеточная концентрация сАМР низкая, содержание СИ никогда не повышается вследствие присущей этому белку
нестабильности и как доминантный синтезируется белок Сго, а не CI; в результате этого развитие фага идет по
литическому пути. Пунктирными стрелками показана репрессия (О) или активация (©); промоторы, выделенные
полужирным, активны во время специфической фазы; важные регуляторные гены отмечены серым. Дополнитель-
ные объяснения см. в тексте.
действии фагоспецифичных РНК-полимераз, не
распознающих Tj. Лямбдоидные фаги обладают
иными механизмами. У этих фагов оба оперо-
па, Рд и Рд, содержат несколько терминаторов
(Тд/Тд), расположенных в разных сайтах. Ко-
дируемый фагом белок N, продукт первого ци-
строна, транскрибированного с Рд, способству-
ет преодолению РНК-полимеразой хозяина вли-
Глава 26. Бактериофаги как модели дифференцировки 89
яния терминаторов Tri и Tri/Tr2 в обоих опе-
ронах и распространению транскрипции на ни-
жерасположенные гены. Поскольку в отсутствие
белка N транскрипция останавливается па Ты и
Tri, этот антитерминатор выполняет основную
роль во временной регуляции экспрессии фаго-
вых генов. Известно об участии в этом процессе
цш?-активного сайта nut, белков клетки-хозяина
NusA, NusB и RpsJ (синоним S10 или NusE) и
антитерминатора Rho (NusD) (рис. 26.19; см. цв.
вклейку).
Наиболее ранние гены N и его транскрибиру-
ются с промоторов Pr и Pr соответственно, как
и задержанно-ранние гены. Белок Сго можно рас-
сматривать как анти-(С1)-репрессор. Как и СТ
(см. разд. 18.6), он связывается с операторами Or
и Or, но с противоположным сродством, т. е. наи-
большим в отношении Одз (Оьз) и наименьшим
к Ori (Оы). Таким образом, белок Сго, особен-
но в высокой концентрации, непосредственно пре-
пятствует связыванию присутствующих в инду-
цированной клетке молекул репрессора СТ с про-
моторами Or и Or и косвенно — положительной,
осуществляемой CI ауторсгуляции транскрипции
гена CI с Р rm-
Преодолевая с помощью белка N влияние Tri,
РНК-полимераза транскрибирует в левом на-
правлении полицистронную мРНК, включающую
транскрипт гена int. Поскольку транскрипция с
Рl нечувствительна к нормальным сигналам тер-
минации, она продолжается до области, обознача-
емой sib. Однако синтеза белка Int не происходит,
так как участок sib в Pr-mPHK является сайтом
расщепления РНКазой III. В результате расщеп-
ления З'-конец мРНК int становится подвержен-
ным деградации другими РНК-азами. Поскольку
экспрессию int регулирует сайт, расположенный
ниже, этот процесс называют ретрорегуляцией.
Задержанно-ранний продукт Xis, однако, стиму-
лирует исключение профага (см. разд. 26.4.3).
Преодолевая с участием белка N влияние Т/п
и Tr2, РНК-полимераза транскрибирует в правом
направлении гены О, Р и Q. Это активирует точку
начала репликации фага Л (огг), с которой связы-
ваются белки О и Р плюс белки хозяина, участ-
вующие также в нормальной репликации (см.
разд. 14.1); с этой точки начинается медленная
двунаправленная репликация ДНК. После синте-
за нескольких копий фагового генома реплика-
ция переключается (посредством катализируемых
белком Red процессов рекомбинации) на быструю
однонаправленную репликацию по механизму ка-
тящегося кольца с образованием необходимой для
упаковки конкатемерной ДНК (см. разд. 26.3.5).
Фаг А обладает только одним поздним промо-
тором, с которого транскрибируется весь набор
из 28 поздних генов (рис. 26.16 и 26.18, Б). Вна-
чале, однако, транскрипция останавливается на
терминаторе Тдз. Преодолению действия Тдз и
всех последующих сигналов терминации во всем
позднем опероне способствует второй аптитерми-
паторпый белок — Q (задержанно-ранний продукт
оперона Pr). Вместе с NusA белок Q действует по-
средством связывания с ДНК-сайтом gut и путем
прямой модификации РНК-полимеразы. Поздние
белки SR образуют эндолизип, участвующий в
контролируемом лизисе клетки-хозяина в конце
латентной фазы; гены A—J кодируют белки кап-
сида фага и сборку (морфопоэз) зрелых фаговых
частиц (см. разд. 23.3.6).
26.4.5. Генетическая регуляция включения
хромосомы фага А в хромосому
клетки-хозяина
Немедленно после инфицирования хромосома фа-
га А образует ковалентно замкнутое кольцо и на-
чинается транскрипция наиболее ранних генов N
и его с использованием РНК-полимеразы хозяи-
на. Белок N устраняет влияние терминаторов Tri
и Тц, обеспечивая возможность транскрипции
задержанно-раннего гена сП! (с промотора Pr)
и генов сП, О, Р и Q (с промотора Pr). На этом
этапе происходит выбор между лизогенным и ли-
тическим путями развития (то же обнаружено в
случае индуцированных профагов). Механизм пе-
реключения, обеспечивающий этот выбор, вклю-
чает участие всех упомянутых молекул, кроме
CI, Int и Xis. Поскольку успех или неудача раз-
множения фага непосредственным образом зави-
сит от обеспечения энергией клетки-хозяина, это
переключение предположительно связано с фи-
зиологическим состоянием клетки посредством
хозяип-специфичных факторов и тем самым с
внешними условиями. По существу, механизм пе-
реключения работает, позволяя образоваться CI
в случае лизогении, когда не синтезируются Сго
и Xis, и позволяя синтезироваться Сго (и Xis) в
случае литического пути, когда «выключено» об-
разование CI (рис. 26.18, В). При высокой m.o.i.
и голодании (т. е. при высоком уровне сАМР)
развитие происходит по пути лизогении. Пере-
90 Часть VI. Рост и дифференцировка клеток
ключение пути развития обусловлено сбаланси-
рованным взаимодействием между активирующи-
ми и репрессирующими регуляторными белками;
а также взаимовлиянием фаго-специфичных и
хозяин (среда)-специфичных факторов.
В фазе выбора важную роль выполняют
несколько белков (СП, СШ, а также факторы
IHF и НА клетки-хозяина) и промоторы Р/ (for
integration, для интеграции) и Pre (for repressor
establishment, для синтеза репрессора). Белок СП
активирует Pre и транскрипцию до терминатора,
расположенного непосредственно ниже локуса cl.
Это способствует быстрому синтезу CI и, соот-
ветственно, репрессии промоторов Pj/Pr с после-
дующим синтезом РНК — продукта гена его. Это
антисмысловая РНК, способствующая (через CI)
репрессии промотора Pr и в результате синтезу
литических белков Сго, О, Р и Q и всех позд-
них белков. Активатор СП, как лабильный бе-
лок, быстро разрушается протеазами хозяина (см.
разд. 19.3.4) с участием фактора НА А (от high
frequency of lisogenization by phage А —высокая
частота лизогенизации фагом А). Комплекс СП
и СШ, по-видимому, устойчив к НАА-зависимой
деградации и, кроме того, уровень СП стабили-
зируется при высокой внутриклеточной концен-
трации сАМР (имеющей место, например, в усло-
виях углеродного голодания; см. разд. 20.2). По-
скольку Pre представляет собой высокоэффек-
тивный промотор (в семь раз более эффективный,
чем Prm)> концентрация CI быстро повышается в
присутствии СП, что вызывает усиление репрес-
сии синтеза Сго, СП и СШ. Белок СП как лабиль-
ный постепенно исчезает, и промотор Pre инак-
тивируется. Тем временем, однако, концентрация
CI становится достаточно высокой, чтобы акти-
вировать Prm—промотор для поддержания ре-
прессора (рис. 26.18, А). В процессе этого с уча-
стием CI активируется Р/. Поскольку Р/ пере-
крывается с геном 375, белок Xis не синтезируется
с соответствующей мРНК. Транскрипт Р/ закан-
чивается на терминаторе t/ и не содержит сайта
расщепления РНКазой III, характерного для
транскрипта Pr (см. разд. 26.4.4). Таким обра-
зом, с транскрипта Р/ эффективно, но недолго
синтезируется белок Int, способствующий инте-
грации профага в хромосому хозяина с помощью
другого белка хозяина, IHF (от integration host
factor — фактор интеграции хозяина), как описа-
но в разд. 26.4.3.
26.5. Фаги служат важным инструментом генетических исследований
26.5.1. Фаги способны переносить
гены своих хозяев
Большинство фагов способно переносить чуже-
родную ДНК от одного хозяина другому (см.
гл. 16). Как описано выше, фаги упаковыва-
ют свою синтезированную в виде длинных кон-
катенатов ДНК, начиная с фагоспецифичной
последовательности рас. Если геном хозяина со-
держит аналогичные или идентичные последова-
тельности, упаковка иногда может ошибочно на-
чаться с одной из этих последовательностей и то-
гда в фаговую частицу оказывается заключенным
фрагмент ДНК хозяина. Такое событие происхо-
дит довольно редко (с частотой примерно 10~4),
и обычно только несколько фагов в популяции
несут ДНК хозяина. Эти фаги называют транс-
дуцирующими, поскольку они переносят ДНК
от своего прежнего хозяина в другую клетку. По-
дробно изучена способность умеренных фагов Р22
и Р1 переносить почти любой фрагмент ДНК
от Salmonella typhimurium и Escherichia coli со-
ответственно (общая трансдукция). Вирулент-
ные фаги, такие как Т1 и Т4, в благоприятных
селективных условиях также способны к общей
трансдукции. Фаг А служит типичным примером
специализированных трансдуцирующих фагов,
поскольку может нести участок ДНК, находив-
шийся в непосредственной близости от сайта инте-
грации attB (специализированная трансдук-
ция). Присутствуя в клетке-хозяине в форме
профага, фаг А при индукции способен исклю-
чаться из хромосомы (см. разд. 26.4.4). Процесс
вырезания протекает не всегда точно и иногда
ДНК может быть разрезана далеко от сайта ин-
теграции. По причине того, что капсид фага не
может вместить ДНК больше, чем в количестве,
эквивалентном одному фаговому геному, неверное
Глава 26. Бактериофаги как модели дифференцировки 91
разрезание вызывает равноценную потерю фаго-
вой ДНК и генов на другом конце генома. Этим
объясняется тот факт, что трансдуцирующие фа-
ги Л обычно дефицитны и им требуется хелпер-
ный фаг (фаг-помощник) для размножения в
следующей инфицируемой клетке. Нормальный
сайт интеграции фага А локализован вблизи ге-
нов gal Е. coli (рис. 26.17), и большинство транс-
дуцирующих фагов А несет часть или все гены gal.
Это свойство делает фаг А специализированным
трансдуцирующим фагом. Однако в случае мута-
ции нормального сайта включения attB (напри-
мер, делеции) фаг А может интегрироваться в
сайтах включения «второго выбора» и при этом
образуются трансдуцирующие фаги, специализи-
рованные в отношении других генов.
Трансдукцию легко обнаружить с помощью
генетических маркеров, переносимых из донорной
клетки в клетку-реципиент, где они становятся
стабильно включенными в геном в результате го-
мологичной рекомбинации.
26.5.2. Фаги способствуют возникновению
новых генотипов вследствие
генетической рекомбинации
Обмен генетическим материалом между хромо-
сомами организмов одних и тех же или, ино-
гда, даже различных видов — горизонтальный
перенос генов — относится к распространенным
природным феноменам. Для изучения различных
механизмов генетической рекомбинации исполь-
зуются разнообразные экспериментальные систе-
мы. Бактериофаги как легко воспроизводимые в
эксперименте объекты позволяют исследовать ге-
нетическую рекомбинацию на всех уровнях.
Обмен генетическим материалом может про-
исходить между интактными гомологичными хро-
мосомами, между их участками или между
более длинными (>200 п.н.) гомологичными по-
следовательностями в составе одной и той же
хромосомы. Эти события называют внутримо-
лекулярной или межмолекулярной гомоло-
гичной рекомбинацией либо общей рекомби-
нацией. Последнее название было выбрано, что-
бы отличать эти события от сайт-специфической
рекомбинации (описанной в этой главе для фа-
га А), ограниченной определенными короткими
последовательностями или участками локализа-
ции. Эти последовательности также имеют корот-
кие области гомологии, что отличает их от сайтов
незаконной рекомбинации и транспозиции.
Два последних события могут вовлекать участки,
не имеющие гомологии, и, таким образом, про-
исходить практически в любом сайте в пределах
хромосомы, как описано для фага Ми.
Многие фаги обладают одной или нескольки-
ми из этих систем рекомбинации. У некоторых
фагов, например Т4 и А (в состоянии профага),
размножение даже зависит от стадий рекомби-
нации как этапов нормального цикла развития.
В то же время у других фагов, например фа-
га Ми, обнаружены высокоспециализированные
сайт-специфичные системы рекомбинации, кото-
рые не требуются для нормального роста (их му-
тации не влияют на размножение фага).
На противоположных концах гипотетической
шкалы, отражающей различия между фагами по
механизму рекомбинации, находятся фаги, само-
стоятельно продуцирующие все необходимые для
рекомбинации ферменты, и фаги, не образующие
ферментов для рекомбинации и полностью за-
висящие от доступных им систем рекомбинации
хозяина. Исходя из здравого смысла, можно ожи-
дать, что крупные фаги, геномы которых спо-
собны вмещать гены «роскоши», обладают более
сложными механизмами рекомбинации по сравне-
нию с мелкими фагами. Действительно, фаг Т4
(165 т.п.н.) обладает полной системой гомологич-
ной рекомбинации. В эффективном обмене ДНК,
необходимом для развития фага Т4, участвуют
белки UvsX (Rec-A-подобный переносящий цепи
белок), UvsY (фактор, вспомогательный по отно-
шению к UvsX), gp32 (белок, связывающий од-
ноцепочечную ДНК), gp46 и gp47 (регуляторы
активности экзонуклеазы), gp30 (ДНК-лигаза),
gp43 (ДНК-полимераза), gp49 (резольваза струк-
тур Холлидея) и ряд других белков. Быстрая ре-
пликация фага Т4 основана на своевременном и
непрерывном образовании дополнительных стар-
товых сайтов, называемых вторичными точками
начала репликации. Его обеспечивает рекомби-
нация между гомологичными последовательно-
стями. Перенос цепи белком UvsX с участием
вспомогательных белков позволяет осуществлять
синтез ДНК, начиная с З'-ОН концов в смещен-
ных петлях. Непрерывно продолжающиеся цик-
лы рекомбинации и репликации ДНК приводят к
образованию высокоразветвленных, конкатениро-
ванных промежуточных продуктов репликации,
которые служат материалом для упаковки ДНК
92 Часть VI. Рост и дифференцировка клеток
в капсиды по механизму заполненной головки по-
сле удаления всех боковых ветвей, как описано в
разд. 20.3.5 (см. рис. 26.14).
Фаг А (50 т.п.н.) кодирует две системы реком-
бинации: 1) Int-систему для рекомбинации при
интеграции/исключении (ее компоненты описа-
ны в разд. 26.4.3) и 2) red-систему для гомоло-
гичной рекомбинации, в которую входят белки
gpGam (белки защиты от RecDCD-экзонуклеазы
Е. coli), gpExo (5'—►З'-дцДНК-специфичпая экзо-
нуклеаза) и gpb (фактор рснатурации комплемен-
тарной оцДНК и связывания с gpExo). Обе эти
системы рекомбинации зависят также от допол-
нительных белков хозяина.
Фаг Т7 (40 т.п.н.) обладает почти полным на-
бором белков, участвующих в общей рекомби-
нации. Однако в отличие от того, что известно
для фага Т4, они не служат важными компо-
нентами в механизме ранней репликации. Тем не
менее эта система необходима для обеспечения
полной репликации и упаковки, поскольку обес-
печивает образование конкатенированной ДНК.
Данная система рекомбинации включает эндо-
нуклеолитическую активность, обеспечивающую
ргтзрешение структур Холлидея (белок gp3), и
ATP-зависимую б'-специфичпую дпДНК-эпдо-
пуклеазу (белок gp6). Белок — переносчик цепи в
этом случае нс выявлен, и фаг Т7 в данном отно-
шении полностью зависит от белка RecA из Е. coli.
Фаг Ми (37 т.п.н.) имеет сайт-специфичную
систему инверсии (см. разд. 18.11.2) и еще два ме-
ханизма для интеграционной рекомбинации по ти-
пу незаконной рекомбинации. Они позволяют ге-
ному фага Ми либо включаться без репликации
в любой участок генома хозяина, либо реплици-
роваться как транспозон, распространяясь путем
копирования с оригинала, который остается в сай-
те интеграции.
Система инверсии фага Ми зависит от ко-
дируемого фагом фермента Gin и служит для
инверсии участка ДНК, локализованного перед
промотором, контролирующим экспрессию белка
отростка. Инверсия происходит точным обра-
зом, без потери или приобретения нуклеотидов.
Информация для синтеза белка считывается в
прямом или обратном направлении с промото-
ра, расположенного вне инвертируемого сегмента.
Каждый белок, образованный таким образом, де-
терминирует специфический круг хозяев. Анало-
гичная система инверсии обнаружена также у фа-
га Р1. Здесь инверсия зависит от кодируемого Р1
белка gpCin. Для максимальной активности ин-
версии требуются также белки HU и Fis из Е. coli.
При оптимальных условиях переключение в про-
цессе развития фага может привести к образо-
ванию в одном потомстве популяций, в которых
примерно 50% фагов специфично к одному кругу
хозяев и 50% — к другому.
Фаги М13 и <рХ174, содержащие геном все-
го из нескольких тысяч пар нуклеотидов и лишь
небольшое число генов, не экспрессируют каких-
либо белков для рекомбинации и полностью за-
висят от рекомбинационных функций клетки-хо-
зяина.
26.5.3. Фаги служат мощным инструментом
генных технологий
Подробное изучение развития фагов позволи-
ло не только выяснить разнообразные молеку-
лярные механизмы биологических процессов, но
также разработать новые эффективные методы
генной инженерии. Открытие феноменов рестрик-
ции и модификации, например, было сделано
У. Арбером (Arbor) при изучении фагов Р1 и А.
Это стало началом обнаружения сотен ферментов
рестрикции, которые сегодня широко используют-
ся как инструменты в экспериментальной молеку-
лярной биологии и генной инженерии, в основном
для разрезания ДНК на определенные фрагмен-
ты. С их помощью, кроме того, стала возможной
рекомбинация последовательностей ДНК из раз-
личных источников в условиях in vitro и, таким
образом, создание искусственных генных кон-
струкций. Следует подчеркнуть, однако, что ис-
пользуемые в генной инженерии ферментатив-
ные методы можно считать аналогами природных
феноменов, поскольку in vivo эти ферменты слу-
жат для осуществления тех же самых основных
реакций.
При разработке эффективных способов кло-
нирования генов из любого источника за осно-
ву были взяты естественные механизмы упаковки
фаговой ДНК. Для создания двух широко исполь-
зуемых сегодня систем клонирования использова-
ны фаги М13 и А (см. разд. 17.1). В этих техноло-
гиях участок чужеродной ДНК просто сшивается
с определенным сайтом очищенной ДНК одного
из этих фагов. В случае фага А сконструирован-
ная таким образом хромосома затем упаковывает-
ся in vitro с образованием инфекционных и жиз-
Глава 26. Бактериофаги как модели дифференцировки 93
неспособных фагов. При инфицировании клеток-
хозяев они дают начало дочерним фаговым ча-
стицам. В каждом цикле репликации чужеродный
фрагмент ДНК также копируется и затем может
быть выделен из очищенной ДНК в большом ко-
личестве. Количество чужеродной ДНК, которое
можно получить с помощью такой системы, огра-
ничено двумя важными факторами: 1) капсид не
может содержать больше ДНК, чем один эквива-
лент генома фага Л и 2) количество несуществен-
ной ДНК, которая замещается чужеродной ДНК
без влияния на жизненно важные функции, огра-
ничено примерно 20-30% фагового генома, т. е.
10-15 т.п.н.
Специфическое свойство нитевидного фага
М13 — способность к упаковке ДНК почти лю-
бых размеров (рис. 26.13) — позволяет включать
в него обширные участки чужеродной ДНК (до
нескольких т.п.н.). На основе этой системы недав-
но был разработан клонирующий вектор, спо-
собный при определенных условиях обеспечивать
образование неограниченного количества функ-
циональных эукариотических антител в клетках
Е. coli. Эта система требует наличия таких функ-
циональных модулей, как аутентичная для М13
стартовая последовательность упаковки ДНК,
фагоспецифичная точка начала репликации, с ко-
торой может начинаться синтез ДНК по механиз-
му катящегося кольца, и два фагоспецифичных
белка —белок оболочки gp8 и белок адсорбции
gp3. Эти модули могут происходить из различ-
ных нитевидных фагов, и их можно комбиниро-
вать с другими необходимыми модулями, происхо-
дящими, например, из плазмид. Благодаря боль-
шим возможностям комбинирования эта система
позволяет получать конструкты со смешанными
функциями, называемые фагмидами, посколь-
ку они содержат компоненты фагов и плазмид.
Такой вектор представлен на рис. 26.20 (см. цв.
вклейку). Следует отметить, что белок оболоч-
ки gp8 не является частью самого вектора, а по-
ставляется хелперным фагом, добавляемым позд-
нее в процессе роста фагмид-содержащих кле-
ток. Принцип этой системы довольно прост. Гены
вариабельных областей тяжелой цепи и соответ-
ствующей легкой цепи антител выделяют из ан-
тителообразующих клеток (например, клеток ги-
бридомы или селезенки мыши). Конструкцию со-
здают таким образом, чтобы тяжелая и легкая
цепи были связаны коротким искусственным пеп-
тидом и чтобы оба пептида, происходящие из ан-
титела, могли образовать присущую им индиви-
дуальную структуру антигенного домена. Затем
эту конструкцию клонируют, помещая се в ДНК
после индуцибельпого промотора и перед геном 3
вектора. При индукции связанные последователь-
ности антител транслируются вместе с геном gp3.
После упаковки векторной ДНК в фаговую ча-
стицу составной белок переносится на ее поверх-
ность, в место естественной локализации gp3 как
белка адсорбции. Упаковка ДНК начинается по-
сле добавления фагов-помощников, обеспечиваю-
щих доставку gp8. Каждая фаговая частица несет
на поверхности составной белок, образующий им-
муноглобулиновый домен. Функциональные доме-
ны отбирают путем инкубации фаговых частиц с
антигеном, который исходно был использован для
иммунизации эукариотического организма. Нега-
тивные фаги с персактивными антителами теря-
ются при очистке. Позитивные фаги с реактив-
ными антителами можно использовать для обра-
зования фагоподобных частиц в неограниченных
количествах. Возможно даже получение чистых
антител, если использовать другого хозяина, в ко-
тором не происходит сквозного прочитывания ге-
на 3 и составной белок не образуется. Наконец, ан-
титела выделяют из клеточных экстрактов Е. coh
и очищают, используя стандартные биохимиче-
ские методы.
Дополнительная литература
Birge Е. А. (1994) Bacterial and Bacteriophage Genetics.
3rd edn. Berlin Heidelberg New York: Springe.
B’ackL. W. (1995) DNA packaging and cutting by
phage terminascs: control in phage T4 by a synaptic
mechanism. Bioassays 17: 1025-1030.
Calendar R. (1988) The bacteriophage, vol. 1, 2. New
York London: Plenum Press.
Campbell A. M. (1996) Bacteriophages. In: Neid-
hardt F. C., Curtiss R., Ingraham .J. L., Lin E. С. C.,
Low К. B., Magasanik B., ReznikoffW., Riley M.,
Schaechter №., Umbarger H. E. (eds.) Escherichia coli
and Salmonella: cellular and molecular biology. 2nd
edn. Washington, DC: ASM Press; 2325-2338.
CasjensS., King .1. (1975) Virus assembly. Annu. Rev.
Biochem. 44: 555 611.
Denhardt D. T., Dressier U., Ray D. S. (1978) (eds.) The
single-stranded DNA phage. Cold Spring Harbor:
Cold Spring Harbor Press.
Fraenkel-Conrat H. (1985) The viruses. New York Lon-
don: Plenum Press.
94 Часть VI. Рост и дифференцировка клеток
Hendrix R.W., Roberts J. W-, Stahl F. W., Weis-
berg R. A. (1983) Lambda II Cold Spring Harbor:
Cold Spring Harbor Press.
Joset F., Guespin-Michel J. (1993) Prokaryotic genetics.
Genome organization, transfer and plasticity. Lon-
don: Blackwell.
Karam J. D. (1994) Molecular biology of bacteriophage
T4, 2nd edn. Washington, DC: ASM Press.
Kornberg A., Baker T. A. (1992) DNA replication. 2nd
edn. New York: Freeman.
Lewin B. (1994) Genes V. 5th edn. Oxford: Oxford
University Press.
LinnS.M., Lloyd R.S., Roberts R.L. (1993) Nucleases.
2nd edn. Cold Spring Harbor: Cold Spring Harbor
Press.
Luria S. E., Darnell J. E., Jr., Baltomore D., Campbell A.
(1978) General virology, 3rd edn. New York: Willey.
Mosig G. (1994) Homologous recombination. In: Molecu-
lar biology of bacteriophage T4, 2nd edn. Washing-
ton, DC: ASM Press; 54-82.
Ptashne M. (1992) A genetic switch. Phage lambda and
higher organisms, 2nd edn. Oxford: Cell Press and
Blackwell.
Stent G.S., Calendar R. (1978) Molecular genetics, 2nd
edn. New York: Freeman.
Tsurushita N., Fu H., Warren C. (1996) Phage display
vectors for in vivo recombination heavy and light
chain genes to make large combinatorial libraries.
Gene 172: 59-63.
Yonesaki T. (1995) Recombination apparatus of T4
phage. Adv. Biophys. 31: 3-22.
Yeo A., Feiss M. (1995) Specific interaction of terminase,
the DNA packaging enzyme of bacteriophage lambda,
with the portal protein of the prohead. J. Mol. Biol.
245: 141-150.
Источники рисунков
1. Kornberg A., Baker T. A. (1992) DNA replication,
2nd edn. New York: Freeman.
2. Ptashne M. (1992) A genetic switch, 2nd edn.
Oxford: Cell Press and Blackwell; 14.
3. Karam J.D., ed. (1994) Molecular biology of bacte-
riophage T4, 2nd edn. Washington DC: ASM Press;
209, 252.
4. Levine A. L. (1992) Viruses. New York: Freeman; 25,
21, 20.
5. Mathews С. K., Rutter E. M., Mosig G., Berget P. B.,
eds. (1983) Bacteriophage T4, 1st edn. Washington
DS: ASM Press; 9. 6.
6. Watson J. D., Gilman M., Witkowski J., Zoller M.
(1992) Recombined RNA, 2nd edn. New York:
Freeman.
7. Vathews С. К., К utter E. M., Mosig G., Berget P. B.,
eds. (1993) Bacteriophage T4. Washington DC: ASM
Press; 59-70.
8. Kornberg A., Baker T. A. (1992) DNA replication,
2nd edn. New York: Freeman; 571.
9. Mathews С. K., Kutter E. M., Mosig G., Berget P. B.,
eds. (1983) Bacteriophage T4, 1st edn. Washington
DC: ASM Press; 219-245.
10. Lewine B. (1994) Genes V. 5th edn. Oxford: Oxford
University Press; 994.
11. Das A. (1993) Annu. Rev. Biochem. 62: 893-930.
Глава 27
Вторичный метаболизм: пути образования
антибиотиков, регуляция и функции
Процессы дифференцировки у микроорганизмов
включают морфологическую дифференци-
ровку (морфогенез, споруляция, прорастание) и
химическую дифференцировку (вторичный
метаболизм). В регуляции этих двух типов диф-
ференцировки во многих случаях участвуют одни
и те же гены. Продукты вторичного метаболизма,
называемые вторичными метаболитами или идио-
литами, представляют собой низкомолекулярные
соединения. Вторичные метаболиты специфичны
для отдельных штаммов или для ограниченного
числа штаммов того или иного микроорганизма и
в отличие от основных метаболитов, очевидно, не
имеют существенного значения для роста. Если
вследствие мутации штамм-продуцент такого со-
единения теряет способность к его образованию, в
лабораторных условиях у него сохраняется обыч-
ная скорость роста и другие характеристики.
Вторичный метаболизм можно рассматри-
вать как химическую дифференцировку. В от-
личие от морфологической дифференцировки,
специфичной для видов и родов, вторичные ме-
таболиты специфичны для штаммов: различные
штаммы одного и того же вида могут образовы-
вать различные вещества этого типа. Вторичные
метаболиты выполняют многочисленные и важ-
ные функции.
В природных условиях вторичные мета-
болиты имеют значение для выживаемости
микроорганизмов-продуцентов, представляя со-
бой антибиотики, пигменты, феромоны или ток-
сины и тем самым выполняя роль эффекторов
экологической конкуренции и симбиоза. Некото-
рые вторичные метаболиты действуют как ин-
гибиторы ферментов, другие — как иммуномо-
дулирующие агенты, антагонисты и агонисты
рецепторов, пестициды, противоопухолевые аген-
ты или стимуляторы роста животных и расте-
ний. Большинство вторичных метаболитов, вы-
деленных к настоящему времени (>7000 из
культур прокариот), —это антибиотики, т. е. об-
разуемые живыми микробными клетками со-
единения, которые в низких концентрациях по-
давляют рост других микроорганизмов. Как
важные лекарственные препараты антибиотики
приобрели огромное значение в медицине и про-
изводстве продуктов питания. Большинство вто-
ричных метаболитов характеризуется необычной
химической структурой. Синтез их зависит от
концентрации питательных веществ, а также ско-
рости роста культуры и при этом индуцируется
по механизму обратной связи в ответ на инак-
тивацию определенных ферментов. В регуляции
синтеза вторичных метаболитов участвуют специ-
фические низкомолекулярные соединения, такие
как тРНК, сигма-факторы и генные продукты, ха-
рактерные для пост-экспоненциальной фазы ро-
ста. Ферменты вторичного метаболизма обычно
кодируются хромосомными генами, образующими
кластер, но иногда плазмидными генами. К насто-
ящему времени раскрыты пути биосинтеза огром-
ного числа антибиотиков. Этому способствовал
как чисто академический интерес многочислен-
ных исследователей, так и практические задачи
фирм — производителей антибиотиков, заинтере-
сованных в повышении продукции и получении
более активных препаратов. В данной главе бу-
дут рассмотрены пути биосинтеза различных ан-
тибиотиков и их регуляция, а также функции этих
специализированных метаболитов.
96 Часть VI. Рост и дифференцировка клеток
27.1. Синтез большинства вторичных метаболитов
обеспечивают всего несколько биосинтетических путей
Несмотря на огромное разнообразие химических
структур антибиотиков, метаболические реакции
их образования сводятся к относительно неболь-
шому числу биосинтетических путей.
Ключевыми этапами биосинтеза ряда антибио-
тиков служат реакции полимеризации, при кото-
рых несколько аналогичных единиц связываются
между собой с образованием остова более крупной
молекулы. На основании биохимических данных
и сведений о сходстве участвующих генов можно
выделить три типа реакций такой полимеризации.
1. Конденсация ацетат- малонатных еди-
ниц. Ацетат-малонатные единицы (иногда
пропионат-метилмалопатные) конденсируют-
ся по механизму, называемому поликетидным
синтезом. Он состоит в формировании цепей,
в которых чередуются единицы с кетогруп-
пами и единицы с метиленовыми группами.
В случае, когда вместо малоната включает-
ся метилмалонат, цепь разветвляется за счет
метильных групп. Некоторые из кетогрупп во
многих случаях полностью или частично вос-
станавливаются.
2. Конденсация аминокислот с образова-
нием олигопептидов. Для вторичного ме-
таболизма характерен механизм образования
полипептидов по тиоматричному механизму,
несколько сходному с поликетидным синте-
зом. Известен, однако, и ряд примеров син-
теза крупных полипептидных антибиотиков
на рибосомах. При синтезе по тиоматричному
механизму в качестве структурных единиц в
полимер часто включаются вместо аминокис-
лот гидроксикислоты и в результате продукт
представляет собой депсипептид, т. е. поли-
мер, в котором чередуются амидные и слож-
ноэфирныс связи между мономерами.
3. Конденсация углеводных единиц (час-
то аминосахаров) с образованием оли-
госахаридов. Молекулы ряда важных ан-
тибиотиков вместо сахара включают остаток
аминоциклитола, представляя собой псевдоса-
хариды.
Эти механизмы полимеризации сходны с ме-
ханизмами основных путей метаболизма, посред-
ством которых осуществляется синтез компонен-
тов клеточных стенок. Поликетидпый синтез и
до некоторой степени синтез на тиоматрицах,
по-видимому, можно рассматривать как произ-
водные механизма биосинтеза жирных кислот
мембраны (см. разд. 7.10), тогда как биосинтез
антибиотиков углеводной природы сходен с био-
синтезом О-специфических полисахаридов, или
О-антигенов, грамотрицательных организмов (см.
гл. 23).
Кроме полимеризации, пути синтеза антибио-
тиков включают модификацию тех или иных пер-
вичных метаболитов или конденсацию несколь-
ких модифицированных метаболитов. Такие
пути биосинтеза антибиотиков удобно классифи-
цировать в соответствии с путями первичного
(или промежуточного) метаболизма, с которы-
ми они связаны. Синтез некоторых антибиотиков
(или компонентов антибиотиков) связан с синте-
зом или катаболизмом аминокислот, метаболиз-
мом нуклеозидов или синтезом коферментов.
В последние годы выделены и охарактеризо-
ваны многочисленные гены, регулирующие био-
синтез вторичных метаболитов. Анализ их нук-
леотидных последовательностей во всех случаях
показал высокую степень сходства с генами фер-
ментов, катализирующих сходные реакции основ-
ного метаболизма, например биосинтеза жирных
кислот или О-антигенов клеточной стенки. Таким
образом, вторичный метаболизм можно рассмат-
ривать как производный по отношению к основ-
ному метаболизму.
В последующих разделах пути биосинтеза вто-
ричных метаболитов на примере антибиотиков
рассматриваются более подробно с описанием ме-
ханизмов полимеризации.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 97
27.2. Низкомолекулярные антибиотики синтезируются
с участием интермедиатов основного метаболизма
27.2.1. Пути синтеза антибиотиков, связанные
с метаболизмом аминокислот
Некоторые антибиотики или части их молекул
образуются в реакциях, сходных с реакциями
синтеза аминокислот. Типичным примером таких
антибиотиков может служить хлорамфеникол,
синтезируемый Streptomyces venezuelae. Углерод-
ный скелет сго молекулы формируется по основ-
ному пути синтеза ароматических аминокислот
(см. разд. 7.6.4). Этот путь ответвляется от пу-
ти основного метаболизма после этапа образова-
ния хоризмовой кислоты. При синтезе хлорам-
феникола хоризмовая кислота превращается в
п-амипофснилпировиноградпую кислоту, а не в
n-оксифенилпировиноградную кислоту, как при
синтезе тирозина (рис. 27.1). Примечательно, что
нитрогруппа в составе хлорамфеникола (функци-
ональная группа, редко наблюдаемая в природ-
ных продуктах) образуется в результате окисле-
ния аминогруппы, по-видимому в соответствии
с общим правилом образования функциональных
групп с окисленным азотом, таких как нитрозо-,
гидроксил амино- и нитрогруппы. Механизм фер-
ментативных реакций при таком превращении по-
ка неизвестен. Другая необычная реакция в этом
пути синтеза — образование дихлоруксусной кис-
лоты. Галогены включаются во вторичные мета-
болиты посредством реакций, в большинстве слу-
чаев катализируемых пероксидазами. Фермент,
катализирующий реакцию хлорирования при био-
синтезе хлорамфеникола, идентифицирован как
димерный гемсодержащий белок с высокой ката-
лазной и низкой пероксидазной активностями.
Алкилпролиповые остатки в составе линко-
мицина (продукт Streptomyces lincolnensis) и ан-
тибиотиков семейства антрамицина синтезиру-
ются в реакциях, сходных с реакциями пути
метаболизирования тирозина с образованием в ка-
честве конечных продуктов меланинов. На пер-
вом этапе этого пути превращений тирозина про-
исходит гидроксилирование ароматического коль-
ца с образованием дигидроксифепилаланина и
затем циклизация аминокислотной цепи с обра-
зованием пиррольного кольца. В случае образо-
вания алкилпролиновых остатков в составе лин-
комицина и антрамицина (рис. 27.2) происходят
циклизация аланиновой цепи в составе тирозина
с образованием пирролидинового (или пирроль-
ного) кольца и расщепление ароматического коль-
ца с образованием алифатической цепи. Антрани-
латная часть молекулы антрамицина образуется
из триптофана в другой хорошо известной после-
довательности реакций — пути метаболизма кину-
ренина (рис. 27.2).
Для биосинтеза нескольких антибиотиков ха-
рактерна реакция /3-гидроксилирования ами-
нокислот. В основном метаболизме эта реакция
Рис. 27.1. Биосинтез хлорамфенико-
ла у Streptomyces venezuelae. Хориз-
мовая кислота (см. рис. 7.18) через
серию многостадийных модификаций
(выделены полужирным) превращает-
ся в хлорамфеникол.
98 Часть VI. Рост и дифференцировка клеток
Рис. 27.2. Биосинтез алкилпролиновых цепей в соста-
ве молекул линкомицина (у Streptomyces lincolnensis) и
антрамицина (у Streptomyces refuineus). Атомы молеку-
лы тирозина, входящие в конечные продукты, выделены
полужирным.
не встречается (хотя ^-гидроксилирование алифа-
тических кислот весьма распространено), но во
многих путях вторичного метаболизма она осу-
ществляется на первом этапе. Можно предпола-
гать, что этим обеспечивается перевод амино-
кислоты из основного метаболизма во вторич-
ный. Как отмечено выше, ^-гидроксилирование
п-аминофенилаланина служит начальной стади-
ей биосинтеза хлорамфеникола. Другой интерес-
ный пример — биосинтез стрептолидиновой части
молекулы стрептотрицина F. Это гетероцик-
лическое соединение образуется из аргинина по-
средством /3-гидроксилирования с последующим
окислением до /3-кетоаргинина и циклизацией
(рис. 27.3). В этом, как и в некоторых других слу-
чаях, /3-гидроксилирование приводит к образова-
нию эритродиастреоизомера гидроксиаминокис-
лоты с сохранением S-конфигурации при а-атоме
углерода и потерей ш-атома водорода. Предполо-
жительно такому гидроксилированию подверга-
ется аминогруппа промежуточного продукта кон-
денсации пиридоксальфосфата.
Биосинтез нескольких вторичных метаболи-
тов включает превращение а-аминокислот (на-
пример, лизина) в /3-аминокислоты (рис. 27.3).
В этом процессе происходит внутримолекулярная
миграция аминогруппы от С2- к СЗ-атому и меж-
молекулярный переход про-И-водорода от СЗ- к
С2-атому, причем обе стадии приводят к инвер-
сии в соответствующих центрах.
Рис. 27.3. Биосинтез стрептолидиновой части молекулы
стрептотрицина F у Streptomyces lavendulae. Полужир-
ным шрифтом показано участие аминокислотной цепи
в образовании цикла. Превращение лизина в /3-лизин
происходит путем внутримолекулярной миграции ами-
ногруппы с инверсией конфигурации.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 99
Некоторые антибиотики образуются из пред-
шественников обычных аминокислот, например
хлорамфеникол — из интермедиатов пути синтеза
ароматических кислот, линкомицин из тирозина;
синтез других антибиотиков включает особые ре-
акции, такие как ^-гидроксилирование аминокис-
лот или образование ^-аминокислот. Некоторые
из молекул — предшественников антибиотиков
могут образовываться в результате сверхсинтеза,
когда в конце трофофазы (фазы роста) анаболи-
ческая активность намного превышает катаболи-
ческую.
27.2.2. Синтез антибиотиков в реакциях,
связанных с метаболизмом нуклеозидов
К настоящему времени известно более 150 ан-
тибиотиков нуклеозидной природы. Большинство
из них образуют актиномицеты и часть — ми-
целиальные грибы. Путь их биосинтеза чаще
всего представляет собой модификацию ранее
синтезированных пуриновых или пиримидиновых
нуклеотидов (см. разд. 7.8). Однако существуют
также антибиотики, образующиеся в модифици-
рованном пути синтеза нуклеотидов.
Интересным примером биосинтеза антибиоти-
ка, протекающего параллельно синтезу de novo
пиримидиновых нуклеотидов, может служить
синтез антибиотика РА-399 (5,6-дигидроазати-
мидина), продуцируемого Streptomyces platensis
(рис. 27.4). Первая реакция пути его синте-
за — это конденсация карбамоильной группы с
глиоксилмочевиной (при биосинтезе уридина в
конденсации участвует аспарагиновая кислота).
Последующие реакции — циклизация, рибозили-
рование и декарбоксилирование — аналогичны ре-
акциям биосинтеза пиримидиновых нуклеотидов.
Два этапа аналогичны этапам биосинтеза тимиди-
на: превращение рибозы в 2-дезоксирибозу и ме-
тилирование кольца.
Как отмечено выше, некоторые антибиотики
образуются путем модификации нуклеотидов или
нуклеозидов. Антивирусный агент видарабин син-
тезируется у Streptomyces antibioticus из адено-
зина. Антибиотики семейства полиоксинов, об-
разуемые Streptomyces cacaoi и используемые в
сельском хозяйстве в качестве антигрибпых пре-
паратов, образуются из уридина через ряд био-
синтетических реакций (рис. 27.5). Ключевой ре-
акцией служит окисление 5'-гидроксильной груп-
пы уридина с образованием альдегидной группы
и конденсация промежуточного продукта с фос-
фо енол пируватом. В этом процессе следует отме-
тить образование необычного азетидинового цик-
ла из изолейцина.
Многие антибиотики образуются путем моди-
фикации нуклеозидов или пуринов и пиримиди-
нов (например, видарабин и полиоксины) либо
в реакциях, представляющих собой модифици-
рованные реакции синтеза нуклеозидов (напри-
мер, РА 399). Такие антибиотики часто содержат
необычные химические группы.
27.2.3. Пути биосинтеза антибиотиков,
связанные с путями биосинтеза
коферментов
Известны два пути биосинтеза никотиновой
кислоты, промежуточного продукта в синте-
зе никотинамидадениндинуклеотида. У млекопи-
тающих и у Neurospora никотиновая кислота
синтезируется из триптофана с образованием в
качестве промежуточного продукта 3-гидроксиан-
траниловой кислоты. Однако у большинства бак-
Рис. 27.4. Биосинтез антибиотика РА 399.
Сравнение происхождения групп атомов, со-
ставляющих (А) тимидин и (Б) антибиотик
РА 399, продукт метаболизма Streptomyces
platensis.
100 Часть VI. Рост и дифференцировка клеток
Рис. 27.5. Биосинтез полиоксина А у Streptomyces cacaoi. Исходные молекулы уридина, изолейцина и глутамата,
претерпевая ряд модификаций (выделены полужирным), конденсируются с образованием полиоксина А.
терий и растений ее синтез происходит путем кон-
денсации аспарагиновой кислоты и триуглерод-
ной единицы, например глицерола или близкого
метаболита.
Ароматическое ядро молекул актиномици-
нов, продуцируемых некоторыми видами Strepto-
myces, образуется путем конденсации двух еди-
ниц — молекул З-гидрокси-4-метилантраниловой
кислоты. То же производное антраниловой кис-
лоты служит предшественником противоопухоле-
вого антибиотика антрамицина, продукта метабо-
лизма Streptomyces refuineus. Этот интермедиат
образуется из триптофана через 3-гидроксикин-
уренип, который является также промежуточ-
ным продуктом в биосинтезе никотиновой кис-
лоты у Neurospora (рис. 27.6). Таким образом,
среди реакций синтеза актиномицинов часть ха-
рактерна для основного метаболизма эукариот
и часть — для вторичного метаболизма стрепто-
мицетов. Сходство нуклеотидной последователь-
ности гена каталазы, участвующей в биосинтезе
хлорамфеникола, с геном эукариотической ката-
лазы можно предположительно объяснить пере-
носом генов от эукариотических микроорганиз-
мов прокариотическим. Высказана также гипоте-
за, что гены, регулирующие биосинтез (3-лактама,
были перенесены от Streptomyces clavuligerus гри-
бу Cephalosporium acremonium.
Коферменты и их предшественники могут ис-
пользоваться в качестве стартовых молекул для
синтеза важных антибиотиков. Примерами этого
служат актиномицины и антрамицин, синтезиру-
емые из кинуренина — промежуточного продукта
пути синтеза никотиновой кислоты. В некоторых
путях синтеза антибиотиков участвуют как фер-
менты, обнаруживаемые только у прокариот, так
и ферменты, известные у эукариот, что, возмож-
но, указывает на имевший место в процессе эво-
люции горизонтальный перенос генов.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 101
Рис. 27.6. Образование аромати-
ческого ядра актиномицина D у
Streptomyces antibioticus в сравне-
нии с синтезом никотиновой кисло-
ты у Neurospora. Общие для этих
процессов интермедиаты выделены
полужирным. Пептидная цепь ак-
тиномицина синтезируется по тио-
матричному механизму, показанно-
му на рис. 27.12 для биосинтеза
грамицидина S. 4-Метил-З-гидрок-
сиантраниловая кислота выполняет
роль молекулы — инициатора поли-
меризации.
27.3. Вторичные метаболиты некоторых классов
образуются из поликетометиленовых цепей
Многие антибиотики образуются путем поли-
меризации мелких кислотных единиц посред-
ством механизма, называемого поликетометиле-
новым (или поликетидным) синтезом. Среди
прокариот наиболее многочисленные продуценты
разнообразных поликетидпых антибиотиков — это
актиномицеты, однако некоторые метаболиты
данного класса выделены из миксобактерий и
небольшое число — из псевдомонад. Этот меха-
низм полимеризации во многом аналогичен про-
цессу биосинтеза жирных кислот по характеру
биохимических реакций и до некоторой степени
по первичной структуре ферментов (см. дополне-
ние 27.1 и рис. 7.33-7.35).
У микроорганизмов обнаружен ряд вариан-
тов основного пути биосинтеза жирных кислот
(см. дополнение 27.1). Например, у бацилл и ак-
тиномицстов молекулой-инициатором чаще всего
служит вместо уксусной кислоты изомасляная,
изовалериановая или 2-метилмасляная кислота и
в результате синтеза образуются разветвленные
алифатические кислоты. В других случаях опус-
кается одна стадия восстановления и образуется
мононасыщенная кислота. В биосинтезе вторич-
ных метаболитов процесс полимеризации, веду-
щий к образованию поликстометиленовых цепей,
катализируют синтазы двух типов: многофункци-
ональный фермент поликетометиленсинтаза I
(ПКС I типа) и мультиферментпый комплекс по-
ликетометиленсинтаза II (ПКС II типа). В от-
личие от синтаз жирных кислот, ферменты обоих
этих типов можно обнаружить у штаммов, при-
надлежащих к одному и тому же роду, например
Streptomyces.
Дополнение 27.1. У большинства бакте-
рий (и растений) биосинтез жирных кислот
катализирует полиферментный комплекс, на-
зываемый синтазой жирных кислот II типа
(type II FAS) (см. разд. 7.10). Синтаза жир-
ных кислот Т типа, присутствующая у по-
звоночных, представляет собой один много-
функциональный фермент. Основные стадии
в этом процессе следующие.
Инициация □ Ацетат и малонат в ак-
тивированной форме (в виде ацетил-СоА
и малонил-СоА) связываются синтазой с
образованием сложной тиоэфирной связи.
102 Часть VI. Рост и дифференцировка клеток
При этом ацетат как молекула-инициатор
связывается с доменом, называемым конден-
сирующим ферментом, тогда как малонат —
с ацилпереносящим белком (АПБ).
Элонгация □ 1. Ацетат через углеродный
атом своей карбоксильной группы и малонат
через углеродный атом его метиленовой груп-
пы вступают в реакцию конденсации; при
этом свободная карбоксильная группа мало-
ната элиминируется с выделением СО 2- В ре-
зультате реакции образуется ацетоацетат в
составе тиоэфира с АПБ. 2. /3-Кетогруппа
ацетоацетата восстанавливается до метилено-
вой группы в ходе трех реакций: восстанов-
ления до гидроксильной группы, дегидриро-
вания и насыщения образовавшейся двойной
связи. 3. Растущая цепь переносится к кон-
денсирующему ферменту, еще одна молеку-
ла малоната присоединяется к АПБ и снова
происходят стадии конденсации и восстанов-
ления. Процесс повторяется до тех пор, пока
не будет достигнута нужная длина цепи.
Терминация □ Жирная кислота (обычно
пальмитиновая) высвобождается с участием
тиоэстеразы.
27.3.1. Группа ароматических поликетидов
включает важные в медицинском
отношении тетрациклины
Путь синтеза многих микробных м етаболитов,
называемых поликетидами, сходен с синте-
зом жирных кислот, но в отличие от него
не содержит стадий восстановления. У прока-
риот в этом процессе, как правило, участвует
ПКС II типа. Синтезируемая основная струк-
тура представляет собой цепь, в которой че-
редуются кето- и метиленовые группы. Такая
структура высокореакционноспособна и поэтому
имеет тенденцию к свертыванию и образованию
циклов путем альдольной конденсации (с элими-
нацией воды) между кето- и метиленовыми груп-
пами. В зависимости от длины цепи и природы
участвующих ферментов могут образовываться
разнообразные структуры, во многих случаях
ароматические. Классическим примером этого пу-
ти биосинтеза может служить синтез тетрацикли-
на у Streptomyces aureofaciens (рис. 27.7). В этом
случае молекулой-инициатором служит моноамид
малоновой кислоты.
27.3.2. Многие важные в медицинском
отношении антибиотики образуются
из сложных поликетидных цепей
Биосинтез вторичных метаболитов нескольких
классов, в каждом из которых имеются важные
антибиотики, происходит в основном аналогично
синтезу ароматических поликетидов, но с опреде-
ленными модификациями.
У многих бактерий удлинение цепи осуществ-
ляется путем включения вместо остатков малона-
та алкилмалонатных единиц. Поскольку эти еди-
ницы в процессе роста цепи всегда присоединяют-
ся к атому углерода, соседнему с карбоксильной
группой, в результате образуется разветвленная
Рис. 27.7. Биосинтез ароматических
поликетидов. Показан путь биосинте-
за тетрациклина у Streptomyces aureo-
faciens. Поликетидная цепь изобра-
жена как поликетидная структура.
Объяснения см. в дополнении 27.1 и в
тексте. Последовательные модифика-
ции в процессе биосинтеза показаны
полужирным.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 103
цепь, несущая в качестве заместителей метильные
или этильные группы, в зависимости от включе-
ния метилмалонатных или этилмалонатных еди-
Другой распространенный вариант этого пути
характеризуется частичным или полным восста-
новлением большинства кетогрупп по мере роста
цепи. Такая цепь может в этом случае нести функ-
циональные кето- или гидроксигруппы, включать
двойные связи и соседние с ними метиленовые
руппы.
Подобные изменения в структуре исключа-
ют альдольную конденсацию с образованием
ароматических колец, поэтому возникают ли-
бо линейные молекулы, либо макроциклические
структуры. Именно таким путем синтезируются,
например, основные структуры макролидных ан-
тибиотиков — анзамицинов и ионофорных по-
Многие антибиотики синтезируются путем по-
лимеризации с образованием поликетидов, сход-
ной с синтезом жирных кислот. Существует
два типа поликетометиленсинтазных комплексов:
ПКС I типа и II типа. Активность ПКС I ти-
па основана на использовании разнообразных
кислот в качестве молекулы-инициатора и ал-
килмалонатных единиц в качестве удлиняющей
структуры; этот вариант пути не включает вос-
становительных стадий и приводит к образованию
линейных или макроциклических молекул. В ва-
рианте с участием ПКС II типа в качестве удлиня-
ющей структурной единицы участвует малонат;
восстановительные стадии в нем отсутствует и
конечные продукты представляют собой арома-
тические молекулы. В различных вариантах по-
ликетидного пути синтезируется огромное число
поликетидных антибиотиков, включая тетрацик-
лины, макролиды, эритромицины, рифамицины и
полиэфирные антибиотики.
Следует отметить, что при синтезе жирных
кислот и ароматических поликетидов почти все
циклы удлинения цепи идентичны. При биосинте-
зе этих классов антибиотиков сборка цепи должна
быть точно запрограммирована, чтобы на каждом
этапе присоединялась соответствующая струк-
турная единица с необходимой степенью восста-
новления в каждой позиции. На немногих изучен-
ных в этом отношении организмах установлено
(впервые — для биосинтеза эритромицина), что
такой запрограммированный синтез осуществля-
ют ПКС I типа.
Эритромицин, продукт Saccharopolyspora ету-
thraea^ представляет собой 14-атомпый лактон-
ный макроцикл, несущий кето- и метильные груп-
пы, а также два остатка сахаров. Макроцикл об-
разуется в процессе поликетидного синтеза из
одной молекулы пропионата в качестве единицы-
инициатора и шести метилмалонатиых удлиня-
ющих единиц (см. рис. 27.8). Синтазный ком-
плекс, как можно предсказать по структуре и
последовательностям генов, состоит из трех мно-
гофункциональных белков, каждый из которых
содержит две единицы, сходные с субъединица-
ми синтазы жирных кислот. Таким образом, этот
Рис. 27.8. Биосинтез сложных
поликетидов на примере синтеза
б-дезоксиэритроноли да В у Sac-
charopolyspora erythraea с участи-
ем поликетидсинтазы. СЕ — субъ-
единица синтазы; АПБ — ацил пе-
реносящий белок. Полужирным
выделены единицы пропионата,
присоединяемые на каждой ста-
дии элонгации.
104 Часть VI. Рост и дифференцировка клеток
комплекс включает шесть функциональных еди-
ниц, каждая из которых ответственна за один из
шести циклов элонгации, необходимых для по-
строения цепи. В таком цикле к растущей це-
пи присоединяется один остаток метилмалоната
и происходит полное или частичное восстанов-
ление /?-кетогрупп либо их восстановление от-
сутствует. Растущая цепь переносится от одной
субъединицы к соседней, так что порядок рас-
положения функциональных единиц определя-
ет порядок расположения различных химических
групп в продукте синтеза (рис. 27.8). Образован-
ная таким образом линейная цепь затем замы-
кается, образуя лактонный макроцикл дезоксиэ-
ритронолида В, наиболее ранний из идентифи-
цированных промежуточных продуктов данного
биосинтетического пути. В следующих реакциях
из него синтезируются антибиотики эритромици-
нового ряда (рис. 27.9).
Синтез антибиотиков семейства анзамицина
протекает по сходному пути. Один из этих ан-
тибиотиков, рифамицин В, образуемый Ату-
colatopsis mediterranez, производится промышлен-
ным способом. Строительными блоками для его
образования служат З-амино-5-гидроксибензой-
ная кислота (инициаторная молекула), два остат-
ка малоната и шесть метилмалопатных остатков.
Предполагаемый продукт этого синтеза представ-
лен на рис. 27.10. Образованная цепь замыкается
амидной связью с образованием проторифамици-
на I, наиболее раннего из выделенных к настояще-
му времени промежуточных продуктов данного
пути. Следует отметить, что эта алифатическая
цепь в свернутой конфигурации участвует в об-
разовании нафталинового ядра. Образование ко-
нечных продуктов пути, антибиотиков рифам ици-
на SV и рифамицина В, требует еще нескольких
реакций, включая внедрение атома кислорода в
углеродную цепь (рис. 27.10).
Обширный класс антибиотиков (>80) состав-
ляют полиэфирные соединения. Из них подроб-
но изучены монензин, лазалоцид и салиноми-
Рис. 27.9. Превращение б-дезокси-
эритронолида В в эритромицин; по-
лужирным показаны вновь добавля-
емые функциональные группы.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 105
Рис. 27.10. Биосинтез сложных по-
ликетидов. Синтез рифамицинов у
Amycolatopsis mediterranei. Разветв-
ленная восстановленная поликетидная
цепь приведена как гипотетическая.
Объяснения см. в тексте.
ции — важные кокцидиостатики и факторы роста.
Все они представляют собой линейные структу-
ры поликетидного типа, содержащие пирановые
или фурановые кольца. Примером путей синте-
за таких антибиотиков может служить образова-
ние монензина А у Streptomyces cinnamonensis.
Строительные блоки в этом случае включают од-
ну молекулу ацетата как инициаторную единицу,
четыре молекулы малоната, семь молекул метил-
малоната и одну — этилмалоната. Они конденси-
руются с образованием цепи (ее предполагаемая
структура приведена на рис. 27.11), которая да-
лее через ряд полностью пока не идентифициро-
ванных промежуточных продуктов превращается
в конечный продукт.
Рис. 27.11. Биосинтез сложных поликетидов. Предпола-
гаемый путь синтеза полиэфирного антибиотика монен-
зина у Streptomyces cinnamonensis.
106 Часть VI. Рост и дифференцировка клеток
27.4. Синтез полипептидных антибиотиков происходит
по двум механизмам полимеризации
27.4.1. Синтез антибиотиков на рибосомах
протекает по обычному механизму
белкового синтеза
Небольшая группа пептидных антибиотиков с
крупными размерами молекул синтезируется с по-
мощью системы транскрипции и трансляции, об-
щей для синтеза белков. Эти соединения называ-
ют лантибиотиками в связи с наличием в их
молекулах нескольких лантиониновых структур,
формирующихся в результате образования суль-
фидных мостиков между остатками цистеина и
серина (или треонина). Немногие из подобных
антибиотиков, например низин и субтилип, обра-
зуют грамположительные бактерии; другие, на-
пример анковенин и актагардин, — актиномицеты.
Изучение механизма их биосинтеза показало, что
непосредственно молекулы антибиотиков образу-
ются из более крупных синтезированных на ри-
босомах пептидов, называемых прелантибиотика-
ми. Они содержат лидерный пептид и амино-
кислотную последовательность, из которой путем
существенного трансляционного процессинга об-
разуется молекула антибиотика. На последней
стадии процессинга происходит отщепление ли-
дерного пептида.
27.4.2. В необычном тиоматричном механизме
участвуют исключительно ферменты
Огромное число пептидных антибиотиков синте-
зируется по тиоматричному механизму. Это на-
звание отражает основной характер процесса, а
именно то, что аминокислотная последователь-
ность антибиотика определяется порядком связы-
вания предшественников в виде сложных тиоэфи-
ров с одним или большим числом многофункцио-
нальных ферментов, действующих таким образом
в качестве матриц.
Процесс включает активацию аминокислот
путем связывания их с адениловыми нуклеоти-
дами, конденсацию карбоксильной группы ами-
нокислотных остатков и тиольных групп фер-
ментов с образованием сложных тиоэфиров и
постадийную полимеризацию. Полимеризация на-
чинается с образования пептидной связи между
карбоксильной группой первого аминокислотно-
го остатка и аминогруппой второго аминокислот-
ного остатка (за счет энергии разрыва сложной
тиоэфирной связи). Затем разрывается сложная
тиоэфирная связь, соединяющая образовавшийся
дипептид с ферментом, и карбоксильная группа
образует вторую пептидную связь с третьим ами-
нокислотным остатком. Конденсация повторяется
до завершения цепи, которая затем высвобожда-
ется с участием тиоэстеразы (см. рис. 27.12).
Ферментный комплекс, катализирующий весь
процесс, может содержать до четырех многофунк-
циональных ферментов. В каждом многофункци-
ональном ферменте имеется несколько участков,
каждый из которых содержит специфические до-
мены, способные катализировать активацию од-
ной аминокислоты, ее этерификацию путем вза-
имодействия с тиольной группой пантетеиновой
структуры и образование одной пептидной свя-
зи. Иногда в таком участке присутствуют так-
же домены, катализирующие изомеризацию ами-
нокислот (из L-формы в D-форму) или метили-
рование атома азота в составе новообразованного
амида. Этот механизм частично сходен с полике-
тидным синтезом, катализируемым ПКС I типа.
Так, на примере синтеза поликетидной цепи эрит-
ромицина (рис. 27.9) можно отметить, что пере-
нос растущей пептидной цепи (в пределах много-
функционального фермента или от одного такого
фермента к другому) происходит с участием при-
сутствующих в каждом функциональном участ-
ке пантетеин-содержащих структур как аналогов
ацилпереносящего белка.
Из пептидных антибиотиков наиболее деталь-
но изучен на уровне биосинтеза грамицидин S.
Это циклический пептид, образованный двумя
соединенными «голова к хвосту» идентичными
цепями из пяти аминокислотных остатков каж-
дая. Синтез его катализируют два многофунк-
циональных фермента: GS1 (мол. масса 130 кДа)
и GS2 (мол. масса ~500 кДа). Фермент GS1 ка-
тализирует активацию фенилаланина, его раце-
мизацию и связывание D-изомера (молекула-ини-
циатор) с образованием сложнотиоэфирной свя-
зи. Фермент GS2 активирует четыре остальных
предшественника и осуществляет все последую-
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 107
Рис. 27.12. Тиоматричный механизм синте-
за пептидных антибиотиков на примере син-
теза грамицидина S у Bacillus brevis. Фер-
мент GS1 содержит один синтазный участок
А1, несущий остаток D-фенилаланина. Фер-
мент GS2 содержит четыре участка А2-А5,
несущие остатки пролина, валина, орнити-
на и лейцина соответственно. Пантетеиновые
«ручки», переносящие растущую цепь от од-
ного участка фермента к другому, представ-
лены в виде структур SHAAAAA (см. также
рис. 7.33).
щие реакции. По завершении процесса полимери-
зации две образовавшиеся пентапептидные моле-
кулы соединяются «голова к хвосту» пептидными
связями, формируя окончательную структуру ан-
тибиотика (рис. 27.12).
27.4.3. /З-Лактамные антибиотики
Впервые классические /3-лактамные антибио-
тики - пенициллины и цефалоспорины — были
выделены из культур грибов. В течение долго-
го времени считалось, что прокариоты не способ-
ны синтезировать структуры этого типа, однако
к настоящему времени продемонстрирован синтез
пенициллина N, цефалоспорина С и различных
цефамицинов (7-метоксицефалоспоринов) некото-
рыми актиномицетами. Кроме того, способность
образовывать цефалоспорин-подобные антибио-
тики установлена для различных видов грамот-
рицательных почвенных бактерий.
Первая реакция пути синтеза пеницилли-
нов, цефалоспоринов и цефамицинов состоит
в соединении трех аминокислот — L-о-аминоади-
пиновой кислоты, L-цистеина и L-валина — с об-
разованием трипептида Ь-<5-амипоадипил-Ь-цис-
теинил-Э-валина (АЦВ). Олигомеризация проис-
ходит по тиоматричному механизму с участи-
ем многофункционального фермента АЦВ-сип-
тазы. Этот фермент, выделенный в очищенном
виде как из грибов, так и из прокариот, вклю-
чая Streptomyces clavuligerus, активирует и свя-
зывает аминокислоты в виде сложных тиоэфиров
(а-аминоадипиповая кислота активируется и свя-
зывается через ее 7-карбоксильную группу), пре-
вращает L-валин в D-валип и катализирует реак-
ции конденсации. Интересно, что секвенирование
гена, кодирующего АЦВ-сиптазу, показало при-
сутствие в нем трех многократно повторяющихся
областей, и каждая из них содержит последова-
тельности, соответствующие тем доменам, кото-
рые активируют одну аминокислоту.
В следующей реакции — циклизации, катали-
зируемой изопенициллин N-синтазой, образуется
изопснициллин N, последний общий промежуточ-
ный продукт путей биосинтеза пенициллина и
цефалоспорина. Как показано на рис. 27.13, цик-
лизация включает две стадии дегидрирования с
участием Fe2+ как кофактора, в которых акцеп-
тором водорода служит кислород. Вначале проис-
ходит формирование /3-лактамного цикла и затем
замыкание тиазолидинового кольца.
У грибов изопенициллин N может превра-
щаться в пенициллин G и другие пеницилли-
108 Часть VI. Рост и дифференцировка клеток
пы гидрофобной природы либо изомеризовать-
ся с образованием пенициллина N, подвергаемого
дальнейшей трансформации. У прокариот выяв-
лен только второй механизм: пятичленное коль-
цо пенициллина N расширяется и становится шс-
стичленным под действием фермента деацето-
ксицсфалоспорин-С-сиптазы (называемого также
экспандазой, от expand — расширять). Примеча-
тельно, что механизм этой реакции сходен с об-
разованием изопенициллина N, в котором также
участвует кислород в качестве косубстрата и Fe2+
в качестве кофактора. Следующая стадия так-
же состоит в окислении (гидроксилировании). Об-
разуемый в результате деацетилцсфалоспорин С
представляет собой последний общий промежу-
точный продукт биосинтеза цефалоспоринов и це-
фамиципов. Путь синтеза цефалоспорина С или
цефамицина С из изопенициллина N изображен
на рис. 27.14.
Из пептидных антибиотиков лишь немногие
синтезируются па рибосомах, тогда как большин-
ство—по тиоматричному механизму, путем
конденсации активированных аминокислот через
их карбоксильные группы с тиоловыми группа-
ми многофункционального фермента. При этом
Рис. 27.13. Биосинтез пеницил-
лина N — общего предшественника
пенициллинов, цефалоспоринов и
цефамицинов. АЦВ — L-5-аминоди-
пил-1_-цистоинил-0-валин; ИП-N —
изопенициллин N. Объяснения см. в
тексте.
Рис. 27.14. Путь биосинтеза ^-лак-
тамных антибиотиков у стрептоми-
цетов. Продуценты: S. clavuligerus,
S. lipmanii и Nocardia lactamdurans.
Глава 27. Вторичный метаболизм; пути образования антибиотиков, регуляция и функции 109
механизме синтеза последовательность аминокис-
лотных остатков в пептиде определяется по-
рядком их связывания с ферментом-матрицей.
Например, по такому механизму образуется три-
пептид, который в результате циклизации пре-
вращается в изопенициллин N. Этот трипеп-
тид служит предшественником пенициллинов и
цефамицинов/цефалоспоринов.
27.5. Аминогликозидные антибиотики, образуемые актиномицетами,
синтезируются путем олигомеризации углеводов
Согласно имеющимся данным, антибиотики оли-
госахаридной структуры синтезируются путем
сборки мономеров, активированных по аномерно-
му атому углерода присоединением пуклеозидди-
фосфата, аналогично биосинтезу обычных поли-
сахаридов клеточных стенок или других поверх-
ностных структур (см. разд. 7.9 и гл. 23).
Компоненты олигосахаридных антибиотиков
чаще всего представляют собой необычные уг-
леводы. Различают два пути их формирования:
1) сборка структуры из углеводов, характер-
ных для основного метаболизма, и последую-
цая модификация и 2) модификация углеводов
на уровне обычных сахаров-прсдшествепников,
например глюкозы или глюкозамина, и последую-
щая постадийная конденсация с образованием ко-
нечной молекулы. В случае последнего механизма
встречаются также реакции трансформации, как
правило с участием сахаров, активированных по
аномерному атому углерода присоединением нук-
леозиддифосфата. Абсолютного разделения меж-
ду этими двумя случаями, однако, не существует-
оба варианта могут быть включены в один путь
биосинтеза.
27.5.1. Аминоциклитолы стрептидин
и 2-дезоксистрептамин образуются
двумя различными путями
В состав молекул всех важных олигосахарид-
ных антибиотиков входит аминоциклитол; в слу-
чае стрептомицина это стрептидин, в большин-
стве остальных случаев — 2-дезоксистрептамип.
Несмотря на сходство структур, биосинтез этих
молекул происходит различными путями.
При биосинтезе стрептидина начальным
субстратом служит D-лшо-ипозитол — обычный
клеточный метаболит, образующийся путем цик-
лизации глюкозы. Путь синтеза включает две
идентичные серии реакций (рис. 27.15): лшо-ино-
зитол окисляется по второму атому углерода
с образованием сцилло-инозозы, которая путем
переаминирования превращается в сцилло-ино-
замин. Этот интермедиат фосфорилируется, и
Рис. 27.15. Биосинтез стрептидина.
Стрептидин составляет аминоцик-
литол ьную часть молекулы стрепто-
мицина. Стадии фосфорилирования
и дефосфорилирования не показа-
ны. Объяснения см. в тексте.
110 Часть VI. Рост и дифференцировка клеток
амин превращается в гуанидиновую функци-
ональную группу путем переноса амидиновой
группы [—C(=NH)—NH2] от аргинина. После де-
фосфорилирования повторяется та же серия реак-
ций, начиная с окисления /5-гидроксильной груп-
пы с образованием амидиновой группы.
При биосинтезе 2-дезоксистрептамина
глюкоза (возможно, активированная, в форме
6-фосфата) превращается в дезокси- сцилло-мно-
зозу; механизм этой реакции может быть ана-
логичен механизму образования дегидрохинной
кислоты (реакция пути биосинтеза ароматиче-
ских аминокислот) (рис. 27.16). Сходство со-
стоит в том, что эта реакция синтеза антибио-
тика включает в качестве промежуточных ста-
дий окисление и восстановление гидроксильной
группы при С4-атоме. Кетогруппа превращает-
ся в аминогруппу в результате переаминирова-
ния. Затем гидроксильная группа, соседняя с
метиленовой, окисляется до кетогруппы, после
чего в реакции переаминирования образуется ко-
нечный продукт.
27.5.2. Примеры синтеза
олигосахаридных антибиотиков
Молекула стрептомицина состоит из трех час-
тей — углеводов стрептозы (3-альдегидпентозы) и
N-метил-Ь-глюкозамина и аминоциклитола стреп-
тидина. Синтез стрептидина из D-мио-инозитола
описан выше. Для синтеза стрептозы активи-
рованная глюкоза в форме дезокситимидинбис-
фосфата (dTDP-глюкоза) изомеризуется с об-
разованием с!ТПР-4-кето-Ь-рамнозы (рис. 27.17).
Последняя затем перестраивается в dTDP-ди-
гидрострептозу, и уже эта молекула включает-
ся в сборку дигидрострептомицина. После олиго-
меризации происходит окисление остатка дигид-
рострептозы с образованием стрептозы. В пути
синтеза N-метил-Ь-глюкозамина первоначальным
субстратом служит D-глюкозамин. Стадии этого
синтеза, теоретически включающие инверсию че-
тырех хиральных центров, пока не установлены.
Известно, что D-глюкозамин активируется с обра-
зованием сложного UDP-эфира и в качестве про-
межуточного продукта образуется UDP-N-метил-
D-глюкозамин а.
Сборка молекулы стрептомицина продолжа-
ется путем присоединения дигидрострептозы к
стрептидинфосфату с последующим присоеди-
нением метил-Ь-глюкозамина к остатку дигид-
рострептозы и образованием дигидрострептоми-
цинфосфата. Последний затем превращается в
стрептомицин в реакциях окисления и дефосфо-
рилирования (рис. 27.18).
Важную группу антибиотиков составляет
семейство гентамицина/сизомицина/сагами-
цина — антибиотиков, активных, в частности,
против Pseudomonas и других грамотрицатель-
ных бактерий. Эта группа включает не менее
20 антибиотиков, большинство из которых обра-
зуют виды Micromonospora. В отличие от био-
синтеза стрептомицина, в данном случае все мо-
дификации углеводных компонентов происходят
после сборки основной структуры молекулы. Ос-
новная структура образуется путем постадийно-
Рис. 27.16. Биосинтез 2-дезокси-
стрептамина. Этот интермедиат
представляет собой аминоцикли-
тольную часть молекул несколь-
ких аминогликозидных антибио-
тиков. По механизму замыкания
цикла (Д) процесс аналогичен
образованию дегидрохинной кис-
лоты (Б); (показано для сравне-
ния). Объяснения см. в тексте и
на рис. 7.18.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 111
го присоединения D-глюкозамина или D-ксилозы
к 2-дезоксистрептамину (рис. 27.19). Последний
общий для всех представителей этой группы
интермедиат гентамицин Х2 образуется в ре-
зультате превращения З'-гидроксильной груп-
пы ксилозы в метил аминогруппу с последую-
щим метилированием по С4'-атому (с инверсией
гидроксильной группы). Последующие реак-
ции направлены на модификацию глюкозамина:
б'-гидроксильная группа превращается в амино-
группу; дегидрирование по ^-положению приво-
дит к образованию сизомицина, который, в зави-
симости от продуцента, либо выделяется в этой
форме, либо восстанавливается до гентамицина
Рис. 27.17. Происхождение дигидрострептозы и N-ме-
тил-1_-глюкозамина как углеводных компонентов стреп-
томицина. Первые три стадии синтеза dTDP-дигидро-
стрептозы идентичны стадиям синтеза dTDP-рамнозы
и других сахаров в основном метаболизме грамотрица-
тельных бактерий, но регулирующие их гены входят в
кластер генов стрептомицинового генного кластера (str)
и относятся таким образом к генам вторичного метабо-
лизма.
dTDP-глюкоза
иОР-метил-Ь-глюкозамин
Рис. 27.18. Сборка молекулы стреп-
томицина у Streptomyces griseus как
пример биосинтеза аминогликозид-
ных антибиотиков.
112 Часть VI. Рост и дифференцировка клеток
Рис. 27.19. Синтез аминоглико
зидных антибиотиков у различных
штаммов Micromonospora. Раз-
ветвления пути биосинтеза ведут
к образованию различных анти-
биотиков семейства гентамицина.
Объяснения см. в тексте.
С 1а — наиболее важного в медицинском отноше-
нии антибиотика. В процессе культивирования
Micromonospora sagamiensis гентамицин Cia ме-
тилируется с образованием сагамицина — конеч-
ного продукта биосинтеза.
Аминогликозиды, одна из групп меди-
цински важных антибиотиков, образуются пу-
тем олигомеризации сахаров. При этом обычные
сахара (часто в форме нуклеозиддифосфатов)
модифицируются после сборки олигомера или
превращаются в необычные предшественники до
его сборки. Как правило, эти антибиотики содер-
жат аминоциклитол — стрептидин или 2-дезок-
систрептамин, производные глюкозамина и слож-
ных углеводов (например, необычной стрептозы).
К представителям этого семейства антибиотиков
относятся стрептомицин, гентамицины и сизоми-
цин.
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 113
27.6. Вторичный метаболизм, как и другие процессы дифференцировки,
тонко регулируется
Синтез вторичных метаболитов чаще всего про-
исходит после завершения экспоненциального ро-
ста или при пониженной скорости роста. Фаза ро-
ста (трофофаза) и фаза образования вторичных
метаболитов (идиофаза) иногда легко различи-
мы, однако во многих случаях идиофаза наклады-
вается на трофофазу. Временное распределение
этих двух фаз можно сдвигать: при росте в среде,
стимулирующей быстрый рост, они четко разде-
лены, тогда как при росте в среде, поддержива-
ющей лишь медленный рост, частично или даже
полностью перекрываю гея. Название вторичный
метаболит означает то, что данное соединение
не участвует явным образом в вегетативном
росте культуры-продуцента, а не то, что он обра-
зуется после прекращения роста культуры. Утра-
та штаммом способности продуцировать вторич-
ный метаболит (например, в результате мута-
ции) не препятствует росту культуры и даже
может приводить к повышению скорости роста
(см. разд. 35.6).
Факторы, регулирующие вторичный метабо-
лизм, сложны по характеру и не вполне ясны.
Однако они должны иметь сходство с фактора-
ми, влияющими на другие механизмы общей ре-
гуляции (такие как катаболитная репрессия, стро-
гий ответ, реакция па углеродное голодание), а
также на регуляторные системы с участием аль-
тернативных сигма-факторов или на системы вре-
менного контроля (например, регуляции деления
клеток у Caulobacter или споруляции у Bacillus).
Начало вторичного метаболизма зависит от ско-
рости роста и дефицита определенных пита-
тельных веществ, но конкретные механизмы его
инициации пока неизвестны. Время инициации
вторичного метаболизма, несомненно, детермини-
ровано генетически, но на экспрессию соответ-
ствующих генов можно существенно влиять путем
изменения внешних условий.
Часто наблюдаемая задержка вторичного ме-
таболизма, вероятно, установилась под давлени-
ем отбора. Многие вторичные метаболиты обла-
дают антибиотической активностью и могут вы-
зывать гибель продуцирующих их клеток, если
образуются слишком рано. Устойчивость проду-
центов антибиотиков к их собственным метабо-
литам хорошо известна (см. разд. 33.5.3). Виды,
образующие антибиотики, обладают механизма-
ми, предотвращающими самоуничтожение. К та-
ким механизмам относятся 1) ферментативная де-
токсикация антибиотика, 2) модификация обыч-
ной мишени антибиотика в собственных клетках
и 3) модификация проницаемости для активно-
го удаления антибиотика из клеток и ограниче-
ния его входа в клетки. Эти механизмы часто бы-
вают индуцибельными, по в некоторых случаях
относятся к конститутивным. В случае индуци-
руемой устойчивости гибель клеток может быть
результатом слишком раннего образования анти-
биотика и запаздывания индукции устойчивости.
Задержка образования вторичного метаболита до
фазы голодания имеет смысл, если продукт ис-
пользуется как инструмент конкуренции в при-
родном сообществе либо как эндогенный эффек-
тор дифференцировки. В богатых питательны-
ми веществами местообитаниях, например в ки-
шечнике млекопитающих, где обильно представ-
лены энтеробактерии, образование вторичных ме-
таболитов нс так важно, как в почве и воде,
где содержание питательных веществ лимитирует
рост микроорганизмов. Таким образом, для энте-
робактерий, например Escherichia coli, не харак-
терно образование вторичных метаболитов, тогда
как типичные почвенные и водные микроорганиз-
мы-бациллы, актиномицеты и грибы — их об-
разуют. Дефицит источников питания в природе
часто вызывает морфологическую и химическую
дифференцировку микроорганизмов (т. е. спору-
ляцию и вторичный метаболизм соответственно);
оба эти вида дифференцировки способствуют вы-
живанию в природной среде и часто сходны в от-
ношении регуляции.
Гены вторичного метаболизма (локализован-
ные в хромосоме или плазмиде) у прокариот
обычно расположены в виде кластеров и органи-
зованы не только как отдельные опероны, но и
как регулопы и модулоны. Экспрессия этих генов
находится под строгим специфическим и общим
контролем и зависит от концентраций питатель-
ных веществ, индукторов, продуктов метаболиз-
ма и металлов, в совокупности определяющих ско-
рость роста. Как правило, регуляция вторичного
метаболизма происходит на уровне транскрипции,
но иногда, по-видимому, на уровне трансляции.
114 Часть VI.
Рост и дифференцировка клеток
Для культуры в экспоненциальной фазе ро-
ста (трофофазе), характерен рост клеток, в нор-
ме сопряженный с их делением, при котором все
дочерние клетки (исключая мутантные) генети-
чески идентичны, т. е. образуют клон в резуль-
тате вегетативного размножения. В процессе
перехода культуры из экспоненциальной фазы
роста в стационарную, а также при медленном
(линейном) росте метаболизм клеток при уча-
стии общих регуляторных механизмов переклю-
чается со стратегии роста па стратегию выжива-
ния. На морфологическом уровне это проявляет-
ся в образовании структур выживания (например,
спор или новых структур поверхности), на мета-
болическом уровне — как вторичный метаболизм.
Метаболиты, образующиеся во время этой фа-
зы развития культуры, называемой идиофазой,
имеют существенное значение для выживания
клеток и конкуренции (см. также гл. 28).
27.6.1. Регуляция источниками углерода
(углеродная катаболитная репрессия)
Наличие в среде глюкозы, которая для боль-
шинства бактерий служит предпочтительным ис-
точником углерода, препятствует образованию
многих вторичных метаболитов. При их про-
мышленном получении более высокого выхода
продукта удается достичь путем использования
в качестве источника углерода полисахаридов
(например, крахмала), олигосахаридов (напри-
мер, лактозы), масел (например, соевого масла
или метилолеата) либо других медленно исполь-
зуемых субстратов. В средах, содержащих смесь
легкоусвояемых и медленно метаболизируемых
источников углерода, вначале используются пер-
вые (диауксия; см. разд. 20.2), и вторичные ме-
таболиты при этом не образуются (или почти пе
образуются), в основном вследствие углеродной
катаболитной репрессии. После исчерпания лег-
коусвояемого соединения репрессия прекращает-
ся и наступает идиофаза, во время которой клет-
ки потребляют «второсортный» источник углеро-
да. Следует отметить, что у некоторых бактерий,
например у Bacillus subtilis, образующей бацили-
зип, вторичному биосинтезу препятствует не глю-
коза, а другие углеводы.
У грамположительных бактерий циклический
АМР, по-видимому, не участвует в углеродной
катаболитной репрессии вторичного метаболизма
(см. разд. 20.2.4). Подавление его глюкозой обыч-
но происходит на уровне транскрипции. Напри-
мер, в случае феноксазинонсинтазы, участвую-
щей в биосинтезе актиномицина, концентрация
соответствующей ей мРНК низка в трофофазе и
высока в идиофазе, причем в среде с глюкозой она
намного ниже, чем в среде с галактозой, которая
не оказывает подавляющего действия.
27.6.2. Регуляция источником азота
Синтез многих вторичных метаболитов подавля-
ют соединения азота, благоприятные в качест-
ве питательных веществ, например соли аммо-
ния (рис. 27.20). В промышленных технологиях
для поддержания интенсивной продукции вторич-
ных метаболитов в средах сложного состава часто
используется как источник азота белковый суб-
страт (например, соевая мука), в синтетических
средах — медленно ассимилируемая аминокисло-
та (например, пролин). Механизм отрицательно-
го влияния NHJ и определенных аминокислот на
биосинтез вторичных метаболитов пока неясен.
Возможно, он аналогичен регуляторной системе
Ntr кишечных бактерий (см. разд. 20.4). В обра-
зовании тилозина у Streptomyces fradiae чувстви-
тельным ферментом, вероятно, является валинде-
гидрогеназа, синтез и активность которой ингиби-
руются аммонием (валин участвует в образовании
циклических структур при синтезе антибиотиков-
макролидов).
Рис. 27.20. Влияние аммония на образование це-
фалоспорина. Показано образование антибиотика у
Streptomyces clavuligerus NRRL 3585 при росте в син-
тетической среде. Штриховая линия — среда с 15 мМ
аспарагином в качестве источника азота; сплошная ли-
ния-среда с 15 мМ аспарагином и 120 мМ хлоридом
аммония в качестве источников азота. По [1].
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 115
27.6.3. Регуляция источником фосфора
Регуляция источником фосфора осуществляется
с участием механизмов как специфического, так
и общего контроля. Специфический негативный
эффект неорганического фосфата заключается в
его способности подавлять синтез и/или актив-
ность фосфатаз. При синтезе некоторых идиоли-
тов (например, амидогликозидных антибиотиков)
участие этих ферментов необходимо, поскольку
отдельные предшественники фосфорилированы,
тогда как конечный продукт не фосфорилиро-
ван. Например, путь биосинтеза стрептомицина
у Streptomyces griseus включает по меныпей ме-
ре три стадии, на которых происходит отщепле-
ние фосфатной группы, и этот процесс высоко-
чувствителен к концентрации фосфата. Так, фос-
фат подавляет активность последнего фермента
этого пути, отщепляющего фосфатную группу от
дигидрострептомицин-6-фосфата.
Фосфат оказывает также и более общее воз-
действие, подавляя, по-видимому, многие пути
вторичного метаболизма, для которых участие
фосфорилированных промежуточных продуктов
не установлено. В таких случаях среда для куль-
тивирования с целью получения вторичного ме-
таболита должна содержать фосфат в концен-
трации, более низкой (обычно ниже 10 мМ) чем
оптимальная для роста. Фосфат подавляет синтез
ряда ферментов вторичного метаболизма, напри-
мер ферментов, участвующих в образовании кан-
дицидина у S. griseus. Пока неизвестно, служит ли
в этих случаях неорганический фосфат сам по се-
бе внутриклеточным эффектором, как неизвестен
и механизм общей регуляции фосфатом вторич-
ного метаболизма и его соотношение, например,
с Pho-системой у Escherichia coli. Возможно так-
же, что регуляция фосфатом ферментативной
активности осуществляется и на посттрансляци-
онном уровне с участием протеинкиназ и фосфо-
протеинфосфатаз (см. разд. 19.4).
27.6.4. В регуляции вторичного метаболизма
участвуют, вероятно, все известные
регуляторные механизмы
Общий контроль с участием A-фактора и
родственных соединений □ На синтез многих
вторичных метаболитов влияют продукты основ-
ного метаболизма; они индуцируют образование
необходимых синтаз, стимулируя тем самым об-
разование конечного продукта. Однако при куль-
тивировании актином ицетов-продуцентов значи-
тельно большее значение имеет воздействие
специфических регуляторных метаболитов, на-
пример так называемого A-фактора (2-5'-изо-
каприоил-З-А-гидроксиметил-7-бутиролактона) и
родственных ему 7-бутиролактонов (рис. 27.21).
Они выполняют роль алармонов, или аутоиндук-
торов, в механизме влияния плотности популя-
ции («кворум-сенсинг»; см. разд. 20.1.4). А-фак-
тор служит эффектором в механизме общей ре-
гуляции вторичного метаболизма. Он индуцирует
как морфологическую, так и химическую диффе-
ренцировку у Streptomyces griseus и Streptomyces
bikiniensis, вызывая образование воздушного ми-
целия, конидий, стрептомицинсинтаз и стрепто-
мицина. Этот A-фактор регулирует на уровне
транскрипции синтез по меньшей мере десяти бел-
ков у S. griseus, в том числе стрептомицин-6-
фосфотрансферазы — фермента, участвующего, с
одной стороны, в биосинтезе стрептомицина и,
с другой стороны, в устойчивости к нему. У мно-
гих, если не у всех, актиномицетов подобные 7-бу-
тиролактоны влияют на продукцию антибиотика
и морфологическую дифференцировку, но, веро-
ятно, весьма сложным образом (рис. 27.22) (по-
дробности см. в разд. 25.2).
Рис. 27.21. Химическая структура характерных для бак-
терий рода Streptomyces ауторегуляторных факторов
(A-факторов), содержащих 7-бутиролактонный цикл.
По [2].
116 Часть VI. Рост и дифференцировка клеток
Дефицит питательных веществ
(например, гены adp, aph, str)
(например, гены aba, abs,
afs, bld A-H, sap, whiA-Г)
Рис. 27.22. Известные факторы, влияющие на переход от трофофазы к идиофазе у стрептомицетов. Хотя влияние
дефицита питательных веществ и 7-бутиролактонов хорошо доказано, его регуляторные механизмы не установлены.
По аналогии с другими системами общих регуляторных сетей считается, что у грамположительных бактерий суще-
ственную роль выполняют р/ю-модулон, СсрА и cre-промоторы, азот-зависимый регулятор Ntr, механизм строгого
ответа и различные альтернативные сигма-факторы, например участвующие в реакциях на голодание по углероду и
на стресс. В регуляции скорости роста, по-видимому, участвует GTP-зависимый механизм, тогда как белок, связы-
вающий A-фактор, вносит вклад в эффект плотности популяции («кворум-сенсинг»). Регуляторные связи показаны
штриховыми стрелками; указаны идентифицированные гены.
Регуляция посредством специфических
механизмов □ Важную роль во вторичном ме-
таболизме выполняет регуляция по механизму
обратной связи (см. гл. 19). Многие вторичные
метаболиты ингибируют активность или синтез
ферментов собственного биосинтеза. Например,
канамицин подавляет синтез ацетилтрансферазы,
участвующей в его биосинтезе, хлорамфеникол —
ариламинсинтетазы. Ингибирование синтазы ан-
тибиотика известно также для путей биосинте-
за бацитрацина, грамицидина S, эритромицина,
тилозина и тетрациклина. Как отмечено выше,
вторичный метаболизм, вероятно, зависит от ре-
гуляции скорости роста. Она может быть основ-
ным фактором регуляции в случаях, когда синтез
вторичных метаболитов инициируется при дефи-
ците питательных веществ (как, например, син-
тез бацитрацина). В других случаях (например,
при синтезе тиенамицина) условиями синтеза вто-
ричных метаболитов являются и низкая скорость
роста, и дефицит определенных питательных ве-
ществ. Зависимость синтеза вторичных метабо-
литов от скорости роста связана, возможно, со
стабильностью мРНК, синтезом антисмысловой
РНК или регуляторных белков (сигма-факторов),
однако это лишь предположения. Некоторые пу-
ти вторичного метаболизма регулируются метал-
лами, например такими как цинк или марганец.
Во многих случаях синтез вторичных метабо-
литов, представляющих собой сидерофоры (см.
разд. 27.7.2) и защищающих клетки от голодания
по железу при падении его концентрации ниже
1 мкМ, подавляет железо. У Streptomyces pilosus
железо ингибирует па уровне транскрипции син-
тез лизиндекарбоксилазы, первого фермента пути
биосинтеза десферриоксамина.
В конечном итоге продукция вторичных ме-
таболитов прекращается под влиянием регуля-
ции по механизму обратной связи (см. выше) и
инактивации синтаз(-ы). Например, большинство
синтаз, участвующих в образовании пептидных
антибиотиков у бацилл, исчезает через несколь-
ко часов после образования. У продуцента гра-
мицидина S Bo.cillus brevis инактивация грамици-
дип-Я-синтаз зависит от кислорода и не зависит
от действия протеаз. Разрушение ферментов за-
медляется при наличии серусодержащих амино-
кислотных субстратов и легкоразлагаемых источ-
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 117
пиков энергии. Видимо, участками инактивации
являются SH-группы, участвующие в связывании
определенных аминокислот ферментами.
По сравнению с тем, что известно об эффек-
тах общих регуляторных сетей для других про-
цессов дифференцировки, относительно биохими-
ческих путей вторичного метаболизма и их спе-
цифической и общей регуляции сведений пора-
зительно мало, хотя процессы вторичного мета-
болизма лежат в основе многих биотехнологиче-
ских производств. Однако исходя из универсаль-
ности биологических механизмов можно предпо-
лагать, что переключение трофофаза/идиофаза и
регуляция вторичного метаболизма зависят от ме-
ханизмов наподобие эффекта плотности популя-
ции («кворум-сенсинг») с участием А-факторов,
регуляторных систем сенсор/ответный регулятор,
общих регуляторных белков и альтернативных
сигма-факторов (см. рис. 27.22).
27.7. Вторичные метаболиты выполняют важные функции
в природных экосистемах
Антибиотики и другие вторичные метаболиты, об-
разуясь при росте микроорганизмов в природ-
ных условиях, оказывают важные физиологиче-
ские эффекты. Более 40% штаммов актиномице-
тов, выделяемых из природной среды, образуют
антибиотики, и эти продукты их жизнедеятель-
ности обнаруживаются в почве, соломе и сель-
скохозяйственной продукции. В почве, например,
присутствуют сидерофоры, в экстрактах фекалий
человека обнаруживаются образуемые энтеробак-
териями антибиотики микроципы, важные, по-
видимому, для заселения бактериями кишечного
тракта человека в младенческом возрасте. Чет-
ким указанием на образование антибиотиков в
природе можно считать то, что большинство поч-
венных бактерий содержит плазмиды устойчиво-
сти к антибиотикам. Широкое распространение
среди прокариот свойства образования вторич-
ных метаболитов, их множественные функции и
консервативность мультигенных путей биосинте-
за позволяют утверждать, что вторичные мета-
болиты способствуют выживанию образующих их
организмов. Наиболее очевидно это в случае фе-
ромонов (половых гормонов) (см. разд. 16.2.4).
27.7.1. Многие вторичные метаболиты
используются для конкуренции
с другими организмами
Антагонизм среди бактерий □ Конкурент-
ные отношения между бактериями обуслов-
лены участием антибиотиков и выделяемых
«бактериями-убийцами» бактериоцинов. Так,
Agrobacterium rhizogenes синтезирует кодируемый
плазмидой агроцин-84, производное аденина, вы-
зывающее гибель фитопатогенпых агробактерий.
Промышленно получаемый препарат агроцина-84
используется для борьбы с такой болезнью расте-
ний, как корончатый галл.
Г.Гиксобактерии используют в качестве ис-
точника питания другие бактерии и для это-
го нуждаются в высокой плотности собствен-
ной популяции. Данный популяционный эффект
(см. эффект «кворум-сенсинг»; разд. 20.1.4) свя-
зан с необходимостью создать высокую кон-
центрацию литических ферментов и антибиоти-
ков в локальном участке окружающей среды.
Так, М. xanthus не может расти за счет лизи-
са клеток Escherichia coli, пока количество мик-
собактерий не достигнет по мепыпей мере уров-
ня 107 клеток/мл. При такой высокой клеточ-
ной плотности родительский штамм Myxococcus
xanthus растет, тогда как мутант, не образую-
щий антибиотик ТА, расти не способен. Это ука-
зывает на роль данного антибиотика в лизи-
се других бактерий и последующем использо-
вании их для питания. Антибиотики образует
60-80% изолятов миксобактерий.
Конкуренция существует также между штам-
мами одного вида. Примером этого могут слу-
жить образующие феназин культуры Pseudomo-
nas phenazinium. Штаммы — продуценты антибио-
тика устойчивы к нему, по образуют колонии
меньших размеров и достигают в суспензионной
культуре меньшей плотности клеток, чем мутант-
118 Часть VI. Рост и дифференцировка клеток
ные штаммы, не образующие антибиотик (по ско-
рости роста, однако, различий не имеется). Кро-
ме того, в средах, дефицитных по источникам
питательных веществ, жизнеспособность не обра-
зующих антибиотик мутантов выше, чем жизне-
способность родительских штаммов — продуцен-
тов антибиотика. Однако несмотря на этот ущерб
от образования антибиотика, в смешанной куль-
туре при росте на указанных средах штамм-про-
дуцент вытесняет мутантный штамм, поскольку
антибиотик феназин уничтожает клетки, не про-
дуцирующие антибиотик, тогда как родительский
штамм устойчив к собственному антибиотику.
Фитопатогенная бактерия Erwinia carotovora
subsp. betavasculorum, вызывающая, например,
некроз сосудов и корневую гниль сахарной свек-
лы, образует антибиотик неизвестной пока струк-
туры с широким спектром действия, позволя-
ющий продуценту успешно конкурировать на
картофеле с чувствительными к этому антибиоти-
ку штаммами Erwinia carotovora subsp. carotovora.
Отмечена полная корреляция между образовани-
ем антибиотика in vitro и ингибированием штам-
мов Е. carotovora subsp. carotovora при совмест-
ном развитии с Е. carotovora subsp. betavasculorum
па растении.
Бактерии против амеб □ Поскольку про-
стейшие используют микроорганизмы в качестве
пищи, неудивительно, что у бактерий существу-
ют механизмы защиты от них, в частности от
амеб. Так Serratia marcescens и Chromobacterium,
violaceum образуют обладающие антибиотической
активностью пигменты (продигиозин и виолацеин
соответственно), которые защищают эти виды от
поедания их амебами. В присутствии этих пигмен-
тов простейшие либо образуют цисты, либо поги-
бают. Непигментированные клетки S. marcescens
поглощаются амебами, тогда как пигментирован-
ные этого избегают. Аналогичные результаты по-
лучены и для других бактерий, таких как Pseudo-
monas руосуапеа и Pseudomonas aeruginosa, об-
разующих соответственно пиоцианип и феназин.
Таким образом, антагонизм между амебами и бак-
териями в природе существенно зависит от спо-
собности последних образовывать антибиотики.
Микроорганизмы против высших рас-
тений □ Известно более 150 микробных про-
дуктов, активных против растений и называе-
мых фитотоксинами или фитоагрессинами;
более чем для 40 из них установлена химическая
структура. Многие из этих соединений проявляют
также типичную антибиотическую активность
против микроорганизмов и могут быть поэтому
классифицированы и как антибиотики, и как фи-
тотоксины. Примеры бактериальных фитотокси-
нов и защиты от них растений с помощью фи-
тоалексинов рассмотрены в разд. 34.3; в разд. 34.4
приводятся примеры бактериальных продуктов —
стимуляторов роста растений.
27.7.2. В качестве антибиотиков могут
действовать переносчики металлов
Некоторые вторичные метаболиты участвуют в
поглощении металлов. Одну из групп таких ве-
ществ составляют сидерофоры (известные так-
же как сидерамины), необходимые для солю-
билизации и поглощения железа (см. разд. 8.8.1
и 33.3.5). Другая группа вторичных метаболи-
тов, участвующих в транспорте металлов,—это
антибиотики-ионофоры, обеспечивающие перенос
определенных ионов щелочных металлов; в эту
группу входят макротетролидные антибиотики,
повышающие проницаемость мембран для калия.
Многие железопереносящие соединения сходны
с антибиотиками. Они представляют собой ве-
щества, промежуточные между первичными и
вторичными метаболитами, так как нс относят-
ся к необходимым для роста компонентам кле-
ток, но стимулируют рост в условиях дефици-
та железа. К настоящему времени описано бо-
лее 100 сидерофоров. Их образуют, например,
все исследованные штаммы Streptomyces, Nocardia
и Micromonospora. Антибиотическая активность
этих соединений состоит в том, что они лиша-
ют другие виды микроорганизмов, не способные
поглощать комплекс Fe-сидерамин, источника
железа. К таким антибиотикам относятся но-
кордамин и десферритриацетилфузиген. Извест-
ны также соединения микробного происхождения,
специфически связывающие цинк и медь.
Для большинства живых клеток характер-
на высокая внутриклеточная концентрация К+ и
низкая — Na+, тогда как для внеклеточных жид-
костей, напротив, высокая концентрация Na+ и
низкая К+. Образование антибиотика-ионофора
(например, макротетролидного) способствует вы-
живанию, как установлено при сравнении штам-
ма Streptomyces griseus, образующего такой мак-
ротетролидный антибиотик, с не образующим его
мутантом. В присутствии Na+ мутантные клетки
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 119
пс поглощают К+, поэтому если культуры, выра-
щенные при высокой концентрации К+, перене-
сти в среду с высокой концентрацией Na+ и низ-
кой К+, клетки родительского штамма поглоща-
ют К+, тогда как мутантные клетки поглощают
Na+ и теряют К+. В результате различий в по-
глощении ионов рост мутантного штамма в среде
с высоким содержанием Na+ и низким — К+ по-
давлен, тогда как родительский штамм, образую-
щий антибиотик, способен расти в этих условиях.
27.7.3. Симбиоз между бактериями
и беспозвоночными
Антибиотики выполняют определенную роль в
симбиозе между бактериями рода Xenorhabdus
и нематодами — паразитами насекомых. Каждый
вид нематод, относящихся к сем. Heterorhabdi-
tidae и Steinernematidae, ассоциирован с един-
ственным видом бактерий рода Xenorhabdus,
обитающих в кишечнике нематод. После внед-
рения нематоды в насекомое-хозяина она прони-
кает в кишечник, где высвобождает бактерии,
которые вызывают гибель насекомого, обеспечи-
вая нематоде возможность закончить жизненный
цикл. В отсутствие этих бактерий гибели на-
секомого не происходит. Образуя антибиотики,
они предохраняют тело насекомого от разложе-
ния гнилостными бактериями. Из двух таких бак-
терий выделены две группы антибиотиков — про-
изводные триптофана и 4-этил-/4-изопропил-3,5-
дигидрокси- mpai i с-сти льбепы.
В симбиозе между внутриклеточно размножа-
ющимися микроорганизмами и насекомыми так-
же участвуют антибиотики. Обитающая на рас-
тениях риса коричневая дельфацида Nilaparavata
lugens содержит по меньшей мере два микроб-
ных симбионта — образующий полимиксин М вид
Bacillus и вид Enterobarter, образующий поли-
пептидный антибиотик с избирательным действи-
ем против Xanthomonas campestris var. oryzae
(фитопатогенпая бактерия, вызывающая белую
гниль риса). Благодаря антибиотической актив-
ности бактерии защищают насекомое от инфек-
ции и способствуют успешной конкуренции с па-
тогенными для риса бактериями.
Многие вторичные метаболиты служат у бакте-
рий факторами конкуренции с другими организ-
мами, как прокариотами, так и эукариотами. В ус-
тановлении и поддержании симбиотических отно-
шений между бактериями, бактериями и растени-
ями или бактериями и низшими беспозвоночными
также участвуют вторичные метаболиты.
27.7.4. Вторичные метаболиты: эффекторы
дифференцировки или продукты
дифференцировки?
По современным представлениям, вторичный ме-
таболизм представляет собой форму химической
дифференцировки, существующей наряду с мор-
фологической дифференцировкой, такой как спо-
руляция у бацилл и стрептомицетов (рис. 27.22)
или образование покоящейся формы у Escherichia
coli и других песпорулирующих микроорганиз-
мов. Оба эти пути дифференцировки иницииру-
ются, в случае дефицита питательных веществ,
с участием хемосенсоров (например, двухкомпо-
нентных регуляторных систем), передающих сиг-
нал о голодании на общие регуляторы (напри-
мер, систему Сгр у энтеробактерий или систему
сге-СсрА у Bacillus). В результате активируются
новые пути метаболизма, во многих случаях по-
средством альтернативных сигма-факторов. Мо-
дифицированные, вторичные пути метаболизма
служат источником предшественников для син-
теза антибиотиков и других вторичных метабо-
литов, которые используются для защиты, кон-
куренции, сохранения спор или создания симби-
оза с более высокоорганизованными существами.
Кроме того, вторичные метаболиты способны дей-
ствовать в качестве эффекторов при морфологи-
ческой и химической дифференцировке, напри-
мер как химические стимулы, вызывающие пере-
дачу сигнала.
Инициация спорообразования (см.
гл. 25) □ Из разнообразных функций, предпола-
гаемых для вторичных метаболитов, особое вни-
мание исследователей привлекает их возможное
участие в переходе клеток к образованию спор; на
такую функцию указывает появление этих соеди-
нений (в частности, антибиотиков) одновременно
с началом споруляции.
1. Синтез пептидных антибиотиков у бацилл
обычно начинается в конце экспоненциальной
фазы роста и сопровождает ранние стадии
споруляции.
2. Как спорообразование, так и синтез антибио-
тика индуцируются дефицитом какого-либо
важного питательного вещества.
120 Часть VI. Рост и дифференцировка клеток
3. Существует генетическая связь между синте-
зом антибиотиков и образованием спор. Ревер-
танты, трансдуктанты и трансформанты ста-
дии 0 аспорогенных мутантов В. subtilis вновь
приобретают способность синтезировать анти-
биотик вместе с восстановлением способности
к споруляции.
4. Между образованием антибиотика и образо-
ванием спор имеется физиологическая корре-
ляция. Так, некоторые ингибиторы спорооб-
разования подавляют также синтез антибио-
тика; внесение источника питания (например,
глюкозы) ингибирует оба эти процесса. Как
для споруляции, так и для синтеза антибио-
тика некоторыми видами Bacillus необходимо
присутствие Мп в высокой концентрации.
Несмотря на явную связь между образовани-
ем антибиотика и спор, продукция антибиотика
не является обязательным условием спорообразо-
вания. Получены мутанты, которые не образуют
антибиотик, но сохраняют способность к споруля-
ции, в частности у продуцентов: бацитрацина —
Bacillus licheniformis, микобациллина — Bacillus
subtilis, линейного грамицидина — Bacillus brevis,
стрептомицина — Streptomyces griseus и метилепо-
мицина A — Streptomyces coelicolor. Кроме того,
отмечено, что мутанты, отобранные по высокой
продуктивности антибиотика, часто не способны
к споруляции. По-видимому, образование микро-
организмами как антибиотиков, так и спор — это
следствие, а не причина перехода от вегетатив-
ного роста к дифференцировке. Такой переход
включает как споруляцию, так и вторичный мета-
болизм, и в норме образование антибиотика несу-
щественно для споруляции.
Хотя антибиотикообразование не является
обязательным условием споруляции, некоторые
антибиотики могут ее стимулировать. Так, пе-
ренос культуры Bacillus brevis АТСС 8185 (про-
дуцента тиротрицина) в экспоненциальной фа-
зе роста в среду без азота останавливает рост,
но не способствует споруляции; внесение в этих
условиях в среду тироцидина вызывает образо-
вание спор. Вероятно, тироцидин как компонент
тиротрицина служит при этом индуктором спору-
ляции.
Вещества, способствующие споруляции, из-
вестны также у актиномицетов. Одно из них —
антибиотик памамицин — образует Streptomyces
alboniger. У культуры-продуцента этот антибио-
тик стимулирует образование воздушного мице-
лия и вследствие этого конидий (см. разд. 25.2.1).
Прорастание спор □ Тесная связь между
споруляцией и образованием антибиотиков пред-
полагает, что некоторые вторичные метаболиты,
участвующие в прорастании, могут образовывать-
ся во время споруляции. Синтез этих соединений
и формирование спор может регулироваться об-
щим механизмом или сходными механизмами.
У актиномицетов обнаружены ингибиторы
прорастания спор. Один из них, продукт Strepto-
myces viridochromogenes, представляет собой спе-
цифический ингибитор ATP-синтазы, разобщаю-
щий процессы дыхания и образования АТР в
спорах до тех пор, пока не произойдет его вы-
деления из клеток во время прорастания. Этот
антибиотик, по-видимому, ответствен за поддер-
жание покоящегося состояния спор. После до-
бавления стимулятора прорастания — Са2+ — ин-
гибитор выделяется в среду, происходят актива-
ция АТР-сиптазы ионами Са2+, сопряженный с
окислением глюкозы синтез АТР и прорастание
споры.
Грамицидин S служит у Bacillus brevis ингиби-
тором фазы прорастания спор, называемой фазой
образованием ростовой трубки.
1. Экспоненциальный рост и инициация прорас-
тания (потемнение спор) не ингибируются ан-
тибиотиком.
2. В спорах грамицидин S-отрицательного му-
тантного штамма образование ростовой труб-
ки происходит за 1-2 ч, тогда как спорам
родительского штамма требуется для этого
6-10 ч. Добавление грамицидина S к спорам
мутантных клеток задерживает образование
у них ростовой трубки и, напротив, удале-
ние антибиотика или его инактивация в слу-
чае спор родительского штамма приводит к
быстрому образованию ростовой трубки. Та-
кой же эффект наблюдается, когда родитель-
ский штамм растет в среде, которая не способ-
ствует синтезу антибиотика.
3. Длительность периода задержки при обра-
зовании ростовой трубки у спор мутантных
клеток зависит от концентрации антибиоти-
ка. У родительского штамма он зависит от
концентрации в культуре спор и, следователь-
но, по-видимому, от концентрации грамициди-
на S. В смеси спор родительского и мутантно-
го штаммов наблюдается тот же эффект, что
Глава 27. Вторичный метаболизм: пути образования антибиотиков, регуляция и функции 121
и в случае спор родительского штамма, т. е. в
смешанной культуре происходит задержка об-
разования ростовой трубки. По-видимому, ан-
тибиотик, связанный с поверхностным слоем
спор родительского штамма, частично высво-
бождается в среду. Возможно, это действует
как способ коммуникации, с помощью кото-
рого споры Bacillus brevis определяют усло-
вия «перенаселения» и их вегетативный рост
не начинается до тех пор, пока плотность
спор не уменьшится. Для проверки такох^ ги-
потезы требуются эксперименты на экологи-
ческом уровне. Можно предполагать также,
что грамицидин S на поверхности и внутри
покоящихся инициированных спор защищает
их от поглощения амебами или выделяемый
антибиотик во время инициации прорастания
и образования ростовой трубки уничтожает
микробов-конкурентов в окружающей среде и
задержка образования ростовой трубки — это
«плата» за такую защиту.
Начало синтеза большинства вторичных мета-
болитов совпадает с началом стационарной фазы
роста и споруляции. Их образование следует счи-
тать скорее не причиной, а следствием этого рез-
кого сдвига в клеточной дифференцировке. Одна-
ко некоторые вторичны метаболиты выполняют
важную роль в инициации спорообразования и в
прорастании спор.
Дополнительная литература
Baltz R. II., Hegeman G. D., Skatrud P. L. (1993) Indust-
rial microorganisms: basic and applied molecular
genetics. Washington DC: ASM Press.
Bennet J. W., Bentley R. (1989) What is a name? Mic-
robial secondary metabolism. Adv. Appl. Microbiol.
34: 1-28.
Bibb M. (1996) The regulation of antibiotic production
in Streptomyces coelicolor A3(2). Microbiology 142:
1335-1344.
Corcoran J. W. (1981) Antibiotics IV — Biosynthesis.
Berlin Heidelberg New York: Springer.
Cundiffe E. (1989) How antibiotic-producing organisms
avoid suicide. Annu. Rev. Microbiol. 43: 207-233.
Demain A. I. (1989) Function of secondary metabolites.
In: Hershberger C. L. Queener S. W., Hegeman G.
(eds.) Genetics and molecular biology of industrial
microorganisms. Washington, DC: ASM Press; 1-11.
Demain A. L., Wolfe S. (1987) Biosynthesis of cephalo-
sporins. Dev. Ind. Microbiol. 27: 175.
Fisher H.P., Bellus D. (1983) Phytotoxicans from mic-
roorganisms and related compounds. Pest. Sci. 14:
334-346.
Hershberger C. L., Queener S.W., Hegeman C. (1989)
Genetics and molecular biology of industrial micro-
organisms. Washington, DC: ASM Press.
Horinouchi S., Beppu T. (1990) Autoregulatory factors
of secondary metabolism and morphogenesis in
actimomycetcs. Crit. Rev. Biotechnol. 10: 191-204.
Isono K. (1988) Nucleoside antibiotics: structure, antibio-
tic activity and biosynthesis. J. Antibiotics 41: 1711-
1739.
Katx L., Donadio S. (1993) Polyketidc synthesis: pros-
pects for hybrid antibiotics. Annu. Rev. Microbiol.
47: 875-912.
Kendrick B. (1986) Biology of toxigenic anamorphs. Pure
Appl. Chem. 50: 211—218.
Kleinkauf H., von Doren H. eds. (1997) Products of
secondary metabolism. Biotechnology, vol. 7. Wein-
heim: VCN.
LanciniG.C., Lorenzetti R. (1993) Biotechnology of
antibiotics and other bioactive microbial metabolites.
New York: Plenum Press.
LanciniG.C., Parenti F., Gallo G.G. (1995) Antibio-
tics— a multidisciplinary approach. New York: Ple-
num Press.
Neilands .LB. (1984) Siderophores of bacteria and fungi.
Microbiol. Sci. 1: 9-14.
Piggot P. J., Moran С. P., Youngman P., eds. (1994) Re-
gulation of bacterial differentiation. Washington, DC:
ASM Press.
Rosenberg E., Varon M. (1984) Antibiotics and lytic
enzymes. In: Rosenberg E. (ed.) Myxobacteria: deve-
lopment and cell interaction. Berlin. Heidelberg New
York: Springer; 110-125.
Singh B. N. (1945) The selection of bacterial food by soil
amoebae and the toxic effects of bacterial pigments
and other products on soil protozoa. Br. J. Exp.
Pathol. 26: 316-325.
Strobel C. A. (1977) Bacterial phytotoxins. Annu. Rev.
Microbiol. 31: 205-224.
Strohl W. R. (1997) Biotechnology of antibiotics. New
York: Dekker.
Swain T. (1977) Secondary compounds as protective
agents. Annu. Rev. Plant Pathol. 28: 479-501-
ViningL. C., Stuttard C. (1995) Genetics and bioche-
mistry of antibiotic production. Boston: Butterworth-
Heinemann.
Источники рисунков
1. Zhang J., Wolfe S., Demain A. L. (1989) Can. J. Mic-
robiol. 35: 399-402.
2. Horonouchi S., Beppu T. (1990) Crit. Rev. Biotech-
nol. 10: 191-204.
Глава 28
Адаптация к экстремальным средам
Адаптацию к экстремальным условиям следует
рассматривать в двух аспектах — в рамках ко-
роткой временной шкалы и в рамках длинной
временной шкалы. Большинство бактерий обла-
дает способность выдерживать изменения пара-
метров окружающей среды в тех или иных преде-
лах, адаптируясь к ним в течение периода време-
ни, измеряемого минутами, часами или сутками.
При экстремальных условиях они редко проявля-
ют полностью потенциал роста, и адаптация при
этом направлена на выживание, а не на рост. В то
же время в природных экстремальных местооби-
таниях обитают немногие организмы, адаптиро-
вавшиеся к ним в течение эволюционного времени
и проявляющие в данных экстремальных услови-
ях свой максимальный ростовой потенциал. Такие
организмы называют облигатными экстремо-
филами. Они настолько приспособлены к своим
местообитаниям, что для них благоприятны та-
кие условия среды, которые на другие микроорга-
низмы действуют как стрессовые. Данная глава в
первую очередь посвящена рассмотрению кратко-
срочной адаптации к стрессу, но в контексте адап-
тации в рамках эволюционной временной шкалы.
Дополнение 28.1. Стрессовые условия
возникают, когда значения тех или иных па-
раметров среды выходят за пределы нор-
мы. Растущие клетки испытывают множе-
ство различных стрессов, влияющих на их
биохимическую активность. В общем смыс-
ле любое изменение параметров окружающей
среды, вызывающее значительное изменение
в физиологическом состоянии клеток, мож-
но рассматривать как стрессовое воздействие.
Наиболее сложно определить, в чем состо-
ит отсутствие стресса. В некотором смыс-
ле любые условия среды можно рассматри-
вать как вызывающие определенный стресс
у организма, и соответственно адаптация не
представляет собой феномен по принципу
или—или. Напротив, существование клетки
можно описать как совокупность адаптиро-
ванных состояний. С увеличением влияния
стрессовых условий на микробные клетки из-
менения в них могут быть качественными
(экспрессия новых активностей) и количе-
ственными (изменение баланса уже действу-
ющих систем). В ответ на стрессовые условия
часто возрастает активность тех же фермен-
тов, которые функционируют в нормальных
условиях. Пределы этой нормы неодинаковы
для различных организмов.
28.1. Адаптация к стрессу сопряжена с изменением
физиологического состояния клеток и экспрессии генов
28.1.1. Стресс вызывает
физиологические сдвиги
Первоначальный ответ микробных клеток на лю-
бой стресс направлен на то, чтобы нивелировать
вызванные им сдвиги внутриклеточного равнове-
сия и обеспечить свое выживание. Почти во всех
случаях этот первый ответ основан на уже дейст-
вующих биохимических активностях, которые мо-
гут быть конститутивными или индуцибельными,
но на низком уровне экспрессируются даже в от-
сутствие явного стресса. Во вторую очередь мо-
гут происходить изменения в экспрессии генов —
для синтеза новых клеточных компонентов или
для стимуляции имеющихся систем. Это повыша-
ет выживаемость клеток и может восстанавли-
вать их быстрый рост. Если клетка не способна
Глава 28. Адаптация к экстремальным средам 123
преодолеть стресс, возможно возникновение сиг-
налов, приводящих к глобальным изменениям в
клеточном метаболизме. Поэтому не удивительно,
что изменения в экспрессии генов, вызванные од-
ним стрессом, происходят и в случае какого-либо
другого стрессового воздействия.
Клеточные активности, индуцируемые при раз-
личных стрессовых условиях, в значительной сте-
пени перекрываются. Это отражает две стороны
адаптации: во-первых, при ограниченном числе
основных систем, способных вызывать экспрес-
сию генов, должна существовать перекрестная
индукция систем, отвечающих за одни и те же
сигналы; во-вторых, любой сильный стресс вли-
яет на скорость роста и вследствие этого вызыва-
ет ряд общих для различных стрессов клеточных
реакций, обусловленных активностью стрессового
стимулона.
Такой общий ответ нс связан со специфиче-
скими для экстремальных условий функциями,
но обусловлен просто стимуляцией обычных био-
химических путей, поставляющих строительные
блоки для процессов биосинтеза при росте кле-
ток. В случае роста на среде сложного состава
клетки получают конечные продукты своих био-
синтетических путей извне и в результате уро-
вень содержания в них соответствующих фермен-
тов понижается более чем в десять раз вследствие
репрессии и аттенуации транскрипции струк-
турных генов (см. разд. 18.4). Поток углерода
через остаточные ферменты данного пути био-
синтеза предотвращается преимущественно путем
аллостерического влияния на активность клю-
чевых ферментов (ингибирование по механизму
обратной связи; см. разд. 19.2). При внезапном
исчерпании того или иного питательного веще-
ства это ингибирование немедленно снимается с
имеющихся ферментов биосинтеза, и происходит
пополнение пула питательных веществ благода-
ря повышению соответствующих ферментатив-
ных активностей. Если потребность в данном пи-
тательном веществе очень велика, может оказать-
ся, что имеющейся биосинтетической активности
недостаточно для ее удовлетворения, и тогда осу-
ществляется дополнительный синтез ферментов.
Если такой адаптации также недостаточно, чтобы
удовлетворить потребности клетки, инициируется
общая реакция — строгий ответ (см. разд. 20.3).
ности многих ферментов, переводя метаболизм
клетки в режим выживания.
Оптимальная динамика подобных процессов
для любой гомеостатической системы представле-
на на рис. 28.1 (см. цв. вклейку). Под гомеоста-
тической системой здесь подразумевается набор
ферментов или продуктов генов, активирующих-
ся при возмущении (сдвиге) в клетке для восста-
новления ее физиологического состояния, при ко-
тором клеточные процессы протекают на уровне,
оптимальном для роста или выживания. В нача-
ле стрессового воздействия активность системы
ответа на стресс относительно низка, поскольку
синтез соответствующих ферментативных систем
и активность имеющихся ферментов подавлены.
Давление стресса приводит к немедленной акти-
вации систем ответа и, возможно, стимулирует
транскрипцию генов, продукты которых в свою
очередь усиливают способность клеток адаптиро-
ваться к стрессовым условиям. Если активирован-
ные ферментные системы восстанавливают пред-
почтительное физиологическое состояние клетки
(способствующее быстрому росту), активность си-
стемы ответа на стресс снижается параллельно
преодолению клеткой стресса. При этом новый
стабильный уровень ее активности, как правило,
совершенно иной, чем в начале, и ниже, чем при
максимальной активности. В таком случае инду-
цированная экспрессия новых генов носит времен-
ный характер, поскольку индуцирующий сигнал
кратковременный (рис. 28.1). Если же гомеостаз
восстановить не удается, экспрессия новых генов
будет продолжаться и возможна экспрессия до-
полнительных генов. Обычно, если стресс продол-
жается, экспрессируются гены тех путей метабо-
лизма, которые означают для клетки все более г
более нежелательный выбор. В стрессовых сти-
мулонах имеет место своего рода иерархия, в ко-
торой при слабом стрессе экспрессируются гены
наиболее выгодного для клетки выбора, тогда как
при сильном стрессе активируются более «сильно-
действующие средства».
Иерархия системы ответа на стресс с
Когда большое число различных генов или опе-
ронов регулируется одним и тем же стрессовым
сигналом, их операторные последовательности
обычно различаются по сродству к данному ре-
гуляторному белку и положение каждого гена е
иерархии зависит именно от этого сродства. При
возрастании силы стрессового сигнала характер
124 Часть VI. Рост и дифференцировка клеток
его различных пороговых уровней, активирую-
щих ту или иную очередную систему. Поскольку
сигналы стресса возрастают при сго продолже-
нии, характер экспрессии генов становится за-
висимым от времени. Вначале активируются ге-
ны, быстро корректирующие слабый стресс. Позд-
нее экспрессируются гены с низким сродством к
регуляторному белку и, возможно, это означа-
ет последнюю попытку сохранить жизнеспособ-
ность. Такая иерархия ответа при стрессе поз-
воляет клетке осуществлять тонкие изменения в
случае слабого стресса и более существенные —
для выживания в условиях экстремального стрес-
са. Хотя иерархическую регуляцию обычно отно-
сят главным образом к экспрессии генов, можно
предполагать, что подобным образом осуществля-
ется и регуляция ферментов, участвующих в от-
вете на стресс, благодаря их различной чувстви-
тельности к аллостерическим эффекторам.
Дополнение 28.2. Транспортные системы,
связанные с реакцией на высокое тургорпос
давление, действуют согласно определенной
иерархии. Повышенное тургорпое давление
понижается клетками путем выделения в
среду специфических растворенных веществ
или высвобождения неспецифических раство-
ренных веществ через каналы, активируе-
мые при растяжении мембраны. Если изме-
нение тургорного давления происходит от-
носительно медленно (в течение минут, а
пе секунд), основным механизмом пониже-
ния тургора служит выделение специфиче-
ских растворенных веществ. Если же тур-
горное давление возрастает стремительно,
этих механизмов оказывается недостаточно и
тогда функционируют указанные каналы. Та-
кой выбор нежелателен для клетки, посколь-
ку каналы специфичны. В соответствии с
иерархией в регуляции повышенного тургор-
пого давления вначале подавляются систе-
мы поглощения, затем активируются систе-
мы выделения специфических растворенных
веществ и, если этого недостаточно, проис-
ходит активация неспецифических каналов,
активируемых растяжением мембраны. Для
каждой из этих систем должно существовать
свое пороговое значение тургорного давле-
ния, вызывающее их активность.
Существуют разнообразные специфиче-
ские механизмы передачи сигнала стресса,
по в конечном счете основной принцип состоит
в аллостерической регуляции активности белков.
Возможно, непосредственным специфическим эф-
фектором, вызывающим стресс-реакцию, служит
фосфорилированный белок (например, в составе
двухкомпонептной системы, подобной описанным
в разд. 20.4), но киназа или фосфатаза регули-
руется аллостерическим путем. Аллостерическая
регуляция посредством связывания низкомолеку-
лярного соединения используется не для всех бел-
ков; некоторые из них могут подвергаться обра-
тимым конформационным изменениям в ответ на
изменение физических параметров, таких как ак-
тивность воды, pH или температура. Важно, что
данный белок содержит сенсорный элемент, отве-
чающий на стресс изменением конформации, ко-
торое и вызывает ответ клетки.
В ответ па изменение условий среды в клет-
ках синтезируются низкомолекулярные соедине-
ния, называемые алармонами. Типичные при-
меры таких молекулс AMP, ppGpp, АррррА и
сходные с ними нуклеотиды или, в случае осмоти-
ческого стресса, глутамат калия, накапливаемый
в цитоплазме (см разд. 20.1). Синтез алармонов
обычно инициируется передачей сигнала стресса
в цитоплазму, за исключением стрессов, обуслов-
ленных 1) тепловым шоком, когда воздействую-
щий физический фактор непосредственно влия-
ет па рибосомы и другие белки цитоплазмы, и
2) действием агентов, способных свободно прони-
кать через плазматическую мембрану, таких как
супероксид-ион или слабые органические кисло-
ты. Возрастание пула алармонов в цитоплазме
при стрессе может быть очень быстрым и не за-
висимым от синтеза новых белков.
28.1.2. В реакции бактерий на стресс
важна роль ионных каналов
Как установлено за последние несколько лет, ион-
ные каналы могут выполнять важную роль в пе-
редаче сигнала стресса и поддержании гомеоста-
за (табл. 28.1). Ионные каналы отличаются от
других транспортных систем тем, что их функ-
ционирование не сопряжено с поступлением энер-
гии от иного источника; когда каналы находятся
в открытом состоянии, движение ионов и рас-
творенных веществ обусловлено их электрохими-
Глава 28. Адаптация к экстремальным средам 125
Таблица 28.1. Ионные каналы в плазматической мембране бактериальных клеток. Каналы, образуемые мембран-
ными белками, обеспечивают массовый перенос ионов или растворенных веществ (>104/отверстие). Переход из
открытого в закрытое состояние регулируется химическими (глутатионовые каналы) или физическими стимула-
ми (например, высоким тургором в случае каналов, активируемых растяжением, или щелочным pH цитоплазмы в
случае натриевых каналов)
Вид канала Функция Связь со стрессами и адаптацией
Аквапориновый Канал, активируемый растяжением мембраны Канал однонаправленного транспор- та внутрь клетки Глутатионовый канал Шейкср-подобные каналы 1 Натриевые каналы 2 1 Шейкер-подобные каналы структурно 2 Гипотетические каналы транспорта 1\)а Транспорт воды Выход неспецифических растворен- ных веществ из клетки Вход К+ в клетку Выход К+ из клетки Транспорт К+ Вход Na+ в клетку аналогичны каналам, обнаруженным в кл + внутрь клетки у алкалифильной бактер Осмотический стресс Понижение тургора при низкой осмо- лярности среды Неизвестна Защита от электрофильных агентов Неизвестна Регуляция внутриклеточного pH у алкалифилов еткэх Drosophila. ии Exiguobacterium aurantiacum.
ческим градиентом. Кроме того, каналы отли-
чаются от транспортных белков тем, что через
каждое канальное отверстие мембрану одновре-
менно пересекает множество ионов (часто более
104), тогда как транспортная система переносит
за один цикл один, редко больше трех ионов (мо-
лекул) . Любой канал в сущности представляет со-
бой аллостерически регулируемы!"! белок, актив-
ность которого зависит от связывания с регуля-
торной молекулой или от изменения физических
параметров (например, давления или мембранно-
го потенциала). Для ионных каналов характер-
но три основных состояния: открытое, закрытое
и инактивированное. Смысл терминов открытое
состояние и закрытое состояние очевиден, третий
термин относится к случаю, когда канал от-
крылся, но перешел в промежуточное инак-
тивированное состояние, при котором он уже
нечувствителен к стимулирующим молекулам или
изменениям физических факторов, определяю-
щим его активность (см. разд. 5.6).
К настоящему времени описаны или предло-
жены в качестве гипотез различные типы кана-
лов (табл. 28.1). Два основных класса каналов,
по-видимому распространенных у бактерий, — это
каналы, активируемые растяжением, и аквапори-
новые каналы. Каналы этих классов участвуют в
регуляции тургорного давления. Каналы, образу-
емые белками-аквапоринами, способствуют вы-
ходу воды через плазматическую мембрану и мо-
гут все время находиться в открытом состоянии.
Каналы, активируемые растяжением мем-
браны, открываются при очень высоком тургор-
ном давлении на мембрану. Эти каналы образу-
ют крупные поры в мембране, что приводит к
быстрой потере клеткой низкомолекулярных ве-
ществ, например аминокислот, сахаров и нуклео-
тидов, но не крупных молекул (таких как высоко-
молекулярные белки). Поскольку при активации
этих каналов изменяется внутриклеточный pH и
другие ионные градиенты, регуляция их весьма
важна для адаптации к изменениям осмотическо-
го давления; нерегулируемая активность в данном
случае может вызвать повреждение клетки.
28.1.3. Важный механизм адаптации к стрессу
состоит в изменении экспрессии генов
В течение последних десяти лет у бактерий опи-
саны три важных механизма регуляции экспрес-
сии генов, связанных с ответом на стресс: из-
менение топологии ДНК, активация двухкомпо-
нентных систем (см. разд. 20.4) и варьирование
специфичности РНК-полимеразы к промоторам.
Изменения топологии ДНК и специфичности
РНК-полимеразы, а также активация других ре-
гуляторных белков обычно происходят при адап-
тации к стрессу согласованно.
126 Часть VI. Рост и дифференцировка клеток
Таблица 28.2. Регуляция активности генов в ответ на стресс и воздействие антибиотиков, уменьшающих число
отрицательных сверхвитков ДНК, у энтеробактерий. Стрелки, направленные вниз, означают репрессию; вверх — ин-
дукцию экспрессии. Новобиоцин индуцирует активность ДНК-гиразы и этим препятствует введению отрицательных
сверхвитков в ДНК. Обозначения генов раскрыты в тексте
Фактор Новобиоцин Высокая осмолярность Щелочной pH Анаэробиоз
Отрицательная сверхсп и рал иза ция Понижение Возрастание Возрастание Возрастание
Ген: pro U 1 т т 1
tppB 1 т т
ompC 1 т т
дутВ т
tonB т 1
На экспрессию генов влияет тополо-
гия ДНК □ Кольцевая бактериальная хромо-
сома предположительно содержит примерно 50
сверхспирализованных доменов (см. разд. 14.2).
Образование отрицательных сверхвитков приво-
дит к изменению числа пар нуклеотидов на один
оборот спирали. Это должно влиять на срод-
ство ДНК-связывающих белков к распознавае-
мой последовательности вследствие изменения си-
лы связей между боковыми цепями аминокислот-
ных остатков в распознающей спирали и груп-
пами в составе нуклеотидов, экспонируемых в
большой бороздке (распознавание регуляторным
белком определенной последовательности в боль-
шой бороздке спирали ДНК означает его свя-
зывание с набором групп в составе нуклеотидов
через боковые цепи аминокислотных остатков в
распознающей спирали белка; см. разд. 18.15).
Возможно, в изменении сродства состоит один
из механизмов влияния сверхспирализации ДНК
на экспрессию регулируемых стрессом генов. Экс-
прессия может повышаться или снижаться по-
средством изменения отрицательной сверхспира-
лизации ДНК. Возрастание числа отрицательных
сверхвитков, возможно, способствует разделению
цепей ДНК и, таким образом, инициации тран-
скрипции. Однако сила промотора определяется
многими элементами последовательности, окру-
жающими точку начала транскрипции, и соответ-
ственно ответ каждого промотора на изменения в
сверхспирализации ДНК специфичен. Например,
активность гена pro U Salmonella typhimurium (это
один из наиболее подробно изученных генов, реа-
гирующих на изменение осмотического давления)
зависит главным образом от изменений тополо-
гии ДНК, однако чувствительный к топологии ре-
гуляторный элемент расположен вне промотора,
в первом структурном гене ниже по ходу транс-
крипции.
Изменение условий среды вызывает измене-
ния в топологии ДНК, способные влиять на ха-
рактер экспрессии генов. Имитировать это влия-
ние могут антибиотики, изменяющие активность
ДНК-гиразы; следовательно, можно предполо-
жить, что для транскрипции некоторых генов, ре-
гулируемых условиями среды, важны изменения
сверхспирализации ДНК. Они сходны с изменени-
ями топологии ДНК, вызываемыми «гистонопо-
добными» белками, которые, возможно, усилива-
ют экспрессию генов, регулируемых стрессовыми
условиями.
Изменения сверхспирализации ДНК мож-
но считать важным механизмом бактериальной
адаптации (см. разд. 18.8), поскольку 1) изме-
нения внешней среды влияют на уровень отри-
цательной сверхспирализации ДНК (количество
отрицательных сверхвитков) и 2) регулируемые
такими изменениями промоторы отвечают на из-
менения сверхспирализации ДНК (табл. 28.2).
У Escherichia coli степень отрицательной сверх-
спирализации ДНК повышается при анаэробио-
зе, щелочном pH и высоком осмотическом дав-
лении, а также в зависимости от температуры и
фазы роста. Неудивительно, что многие гены, ин-
дуцируемые определенным стрессом, который вы-
зывает изменения в сверхспирализации ДНК, ин-
дуцируются и другими условиями, вызывающими
аналогичные изменения топологии ДНК. Локус
Глава 28. Адаптация к экстремальным средам 127
tppB (кодирующий трипептидпермеазу) индуци-
руется в условиях анаэробиоза или высокого ос-
мотического давления, как и локус отпрС (коди-
рующий порин С —белок наружной мембраны).
Аналогично этому, осмотическая индукция локу-
са pro U повышается при слегка пониженном со-
держании кислорода и при слабощелочном pH.
В недавних исследованиях выявлена тес-
ная связь между топологией ДНК и числом
ДНК-связывающих белков, влияющих на ее
структуру, (см. табл. 14.2). Среди этих белков
наиболее изучен гистоноподобный белок H-NS эн-
теробактерий, который связывается с изогнутыми
участками ДНК и действует как блокатор тран-
скрипции. Инактивация белка H-NS вследствие
мутации делает некоторые регулируемые стрес-
сом генные системы частично конститутивными;
в частности, это относится к системам, индуци-
руемым осмотическим стрессом или повышением
температуры (с 28 °C до 37 °C). Мутации, затра-
гивающие H-NS-белок, имеют выражение плей-
отропный эффект. Например, такие мутации по-
вышают частоту переключения генов путем сайт-
специфичной инверсии и влияют на экспрессию
генов (см. разд. 18.8).
Дополнение 28.3. Экспрессия отдельных
модулонов у различных микроорганизмов за-
висит от специфических сигма-субъединиц
РНК-полимеразы. У одной бактерии те или
иные сигма-субъединицы (сигма-факторы)
специфичны к одним промоторам (обеспечи-
вают экспрессию одних генов), тогда как у
другой бактерии они же могут отвечать за
транскрипцию других генов. Например, го-
мологи ст54-субъединицы у Е. coli обеспечива-
ют транскрипцию генов, регулируемых уров-
нем азота, и некоторых генов, регулируемых
анаэробиозом, у Caulobacter, Pseudomonas и
Neisseria—транскрипцию генов поверхност-
ных структур, у различных родов — генов ме-
таболизма водорода и у Rhizobium— генов
транспорта дикарбоновых кислот. Все функ-
ции, зависимые от <т54-субъединицы, относят-
ся к специфическим реакциям на те или иные
стрессы и не обязательно связаны с голодани-
ем по азоту. I
Двухкомпонентные регуляторные систе-
мы выполняют роль сенсоров и передат-
чиков сигнала □ Белки суперсемейства двух-
компонентных систем служат рецепторами/сен-
сорами и передатчиками сигнала/ответными
регуляторами); некоторые из этих белков про-
низывают плазматическую мембрану и способ-
ны реагировать как на внутренние, так и на
внешние сигналы (см. рис. 20.17). Концентра-
ция фосфорилированной формы белка — ответно-
го регулятора зависит от баланса киназной, фос-
фотрансфсразной и фосфатазной активностей.
Сенсор-передатчик — это аллостерически модули-
руемый белок, который реагирует на возникно-
вение стрессовых условий непосредственно как
на физический стимул или через связывание с
ним низкомолекулярного соединения. Ответный
регулятор в нефосфорилированной форме во мно-
гих случаях обладает низким сродством к ДНК,
и фосфорилирование значительно повышает ве-
личину данного сродства.
Важную роль в регуляции экспрессии
генов играют изменения структуры и ак-
тивности РНК-полимеразы □ Основные из-
менения активности РНК-полимеразы при стрес-
се происходят на уровне выбора промотора.
Выбор промотора РНК-полимеразой может мо-
дулироваться двумя путями. Один из них —это
связывание аллостерического эффектора с холо-
ферментом через одну из сердцевинных субъеди-
ниц с изменением в результате предпочтительно-
го выбора промотора. Например, ppGpp смещает
специфичность РНК-полимеразы с генов рРНК
и тРНК на гены мРНК (см. разд. 20.3). Дру-
гой распространенный механизм изменения спе-
цифичности РНК-полимеразы состоит в замене
обычной сигма-субъединицы ст70 специфической
субъединицей, инициирующей транскрипцию на-
бора генов с необычной структурой промотора
(табл. 28.3).
Синтез и активность альтернативных сигма-
субъединиц регулируются специфическими кле-
точными сигналами, возникающими в ответ на
различные стрессы. Основным механизмом, опре-
деляющим количество альтернативной формы
РНК-полимеразы, служит регуляция синтеза дан-
ной сигма-субъединицы. Специфическое накопле-
ние альтернативной сигма-субъединицы обеспе-
чивает своевременную транскрипцию набора ге-
нов, необходимых для выживания в условиях
определенного стресса.
У организмов, для которых характерна запро-
граммированная дифференцировка (например, у
бацилл, клостридий и актиномицетов), последова-
128 Часть VI. Рост и дифференцировка клеток
Таблица 28.3. Примеры различных сигма-субъединиц в составе РНК-полимеразы у Escherichia coli
Основной фермент Сигма-субъединица Ген Холофермент Транскрибируемые гены
«2/3/3' — Е а70 rpoD Е<770 Гены обычного метаболизма
ст32 rpoll Ест32 Гены теплового шока
<7 24 гроЕ Ест24 Гены экстремального теплового шока
<754 rpoN Е<754 Гены, регулируемые уровнем азота
а28 rpoF Ест28 Жгутиковые гены и гены хемотаксиса
ст38 rpoS Ест38 Гены, регулируемые фазой роста
тельная экспрессия различных сигма-субъединиц
может быть основным механизмом, регулирую-
щим характер развития (см. гл. 24 и 25). Для
других организмов, таких как Е. coli, у кото-
рых дифференцировка, связанная с голоданием,
не выражена в такой степени, как у спорооб-
разующих организмов, экспрессия генов выжи-
ваемости аналогичным образом зависит от спе-
цифического сигма-фактора — ст38. Следует отме-
тить, что гены подвижности и хемотаксиса эн-
теробактерий также транскрибируются с участи-
ем специфической сигма-субъединицы; возмож-
но, активация этих генов требуется клетке для
того, чтобы покинуть местообитание, условия в
котором стали неблагоприятными. В этом смыс-
ле хемотаксис можно рассматривать как ответ
па стресс, и, действительно, энтеробактерии, как
установлено, удаляются из области низкого pH
и высокого осмотического давления. Кроме того,
наблюдаемый у энтеробактерий характер пере-
движения в ответ па химические стимулы соот-
ветствует гомеостатическому ответу, показанному
на рис. 28.1.
Синтез альтернативных сигма-субъеди-
ниц (сигма-факторов) — это распространенный у
бактерий механизм регуляции большого числа ге-
нов, родственных по способности обеспечивать
адаптацию клеток к изменению условий среды.
Основная сигма-субъединица ст70 или ее эквива-
лент регулирует экспрессию белков, ассоцииро-
ванных главным образом с клеточным ростом.
Экспрессию специфических генов, необходимых
для адаптации или выживания, у большинства
организмов регулируют разнообразные альтер-
нативные сигма-субъединицы. Накопление этих
сигма-субъединиц обычно происходит в ответ на
специфические сигналы путем экспрессии de novo
или изменения устойчивости данной сигма-субъ-
единицы к протеазам.
28.2. Адаптация к экстремальной температуре
Значительные сдвиги температуры (на 20 °C
или больше) вызывают временную остановку ро-
ста, после которой возобновляется нормальный
экспопенциальньш рост со скоростью, соответ-
ствующей этой температуре. Сильное пониже-
ние температуры может немедленно вызвать по-
терю жизнеспособности, вероятно из-за нару-
шения барьерных функций мембраны и потери
растворенных веществ. Проницаемость мембра-
ны может также нарушаться при внезапном по-
вышении температуры. У организмов, приспо-
собленных к обитанию в высокотемпературных
условиях, белки и мембранные системы способ-
ны нормально функционировать в этих услови-
ях. У некоторых термофильных микроорганиз-
мов при очень высокой температуре (>80 °C)
предположительно нарушается протонный по-
тенциал на мембране вследствие повышения ее
проницаемости для протонов. При этом термо-
филы переключаются на механизм энергетиче-
ского сопряжения с участием вместо протонов
ионов Na+, поскольку проницаемость мембра-
ны в отношении этих ионов менее подвержена
влиянию высокой температуры (см. разд. 5.6.2).
Высокая температура, кроме влияния на струк-
туру мембраны, вызывает денатурацию белков,
непосредственно влияя тем самым на метабо-
лизм.
Глава 28. Адаптация к экстремальным средам 129
28.2.1. Физиологическая адаптация
к изменениям температуры
Как правило, повышение температуры вызывает
в клетках два основных эффекта. Во-первых, по-
вышается степень текучести липидного бис-
лоя мембраны, который в конце концов мо-
жет стать проницаемым для ионов; возникаю-
щая при таком состоянии мембраны утечка ионов
приводит к понижению эффективности ионного
гомеостаза и преобразования энергии. Для под-
держания относительно постоянной вязкости
мембраны при различных температурах у боль-
шинства бактерий происходят изменения ее ли-
пидного состава. При низкой температуре необ-
ходимая степень текучести мембраны обеспечи-
вается включением в липиды короткоцепочечных
жирных кислот и ненасыщенных жирных кис-
лот. При повышении температуры в мембрану
включаются более насыщенные длинноцепочеч-
ные жирные кислоты. У некоторых организмов
мембрана содержит вместо ненасыщенных жир-
ных кислот жирные кислоты с разветвленной це-
пью, поскольку они также препятствуют плот-
ной упаковке липидных цепей, понижающей сте-
пень текучести мембраны. Изменения в липидном
составе обычно не требуют синтеза новых фер-
ментов, так как активность ферментов биосин-
теза фосфолипидов регулируется температурой.
У термофильных архей стабильность мембран
обеспечивается тем, что они содержат липиды
с простыми эфирными связями, которые значи-
тельно более стабильны при высокой температу-
ре, чем липиды со сложноэфирными связями (см.
разд. 7.10.5).
Второй эффект, вызываемый повышением
температуры, — это возрастание активности
ферментных систем (в два раза при повы-
шении температуры на 10 °C). Верхний предел
этого эффекта определяется естественной ста-
бильностью каждого фермента; в конечном итоге
подъем температуры ведет к денатурации белка и
потере ферментативной активности. Многие тер-
мофильные бактерии предположительно облада-
ют ферментами, устойчивыми к нагреванию. Для
термостабилизации фермента необходимо отно-
сительно небольшое число дополнительных свя-
зей. При изучении термостабильных ферментов
не обнаружено какого-либо общего структурного
принципа; в каждом случае имеет место особая
комбинация дополнительных связей. Таким обра-
зом, стабилизация белков достигается множест-
вом различных путей.
28.2.2. В ответ на сдвиг температуры
изменяется характер экспрессии генов
Адаптация к изменению температуры включает
синтез многих новых белков — одних в случае хо-
лодового шока, других в случае теплового шока.
При культивировании Е. coli понижение темпе-
ратуры с 37 °C до 10 °C приводит к индукции
ряда генных продуктов, часть из которых мо-
жет накапливаться в клетках, составляя значи-
тельную долю общего клеточного белка. Анало-
гичные данные получены для бактерий других
родов, как грамположительных, так и грамотри-
цательных. Многие из генов холодового шо-
ка могут быть индуцированы также добавле-
нием антибиотиков, подавляющих трансляцию;
возможно, в качестве сенсоров холодового шока
выступают сами рибосомы. Как при холодовом
шоке, так и при ингибировании трансляции ан-
тибиотиками в клетках Е. coli снижается цито-
плазматический пул ppGpp; как предполагается,
регуляция транскрипции генов холодового шока
частично обусловлена специфичностью комплек-
сов РНК-полимераза-ppGpp к промоторам (см.
разд. 20.3).
По мерс дальнейшего снижения температуры
в клетках начинает образовываться лед, и это вы-
зывает гибель бактерий. Образующиеся внутри
клеток кристаллы льда повреждают белки и мем-
браны, вызывая потерю целостности клетки. При
образовании льда вокруг клеток концентрируют-
ся соли, что приводит к локальному повышению
осмотического давления, инициирующему адапта-
цию к осмотическому стрессу. В результате при
очень низких температурах у некоторых микро-
организмов происходит накопление совместимых
осмо регуляторных веществ (см. ниже), и это мо-
жет защищать некоторые белки от повреждения
льдом. Отдельные бактерии обладают способно-
стью регулировать образование льда благодаря
наличию центров его кристаллизации в белках
наружной мембраны (например, у Pseudomonas
syringae; см. разд. 34.4.3). Преимущество в этом
случае дает упорядоченность структур льда, об-
разующихся при кристаллизации с участием этих
белков, поскольку такие структуры значительно
слабее повреждают клетки.
130 Часть VI. Рост и дифференцировка клеток
В ответ на тепловой шок при повышении
температуры до верхнего предела диапазона ро-
ста временно в 10-50 раз повышается уровень экс-
прессии отдельных белков, называемых белка-
ми теплового шока. У Е. coli и родственных
бактерий соответствующие гены транскрибиру-
ются РНК-полимеразой только в том случае, ес-
ли она несет специфическую сигма-субъединицу
сг32 (продукт гена гроН) вместо ст70, используе-
мой для экспрессии генов, обеспечивающих рост
в обычных условиях. Подобный ответ наблюда-
ется у различных бактерий, а также у большин-
ства эукариот, и в настоящее время ясно, что
белки теплового шока прокариот и эукариот пред-
ставляют собой аналоги, выполняющие, очевидно,
одни и те же функции. У Е. coli известен так-
же второй набор генов, активируемых при очень
высокой температуре; их экспрессия зависит от
особого сигма-фактора ст24 (продукт гена троЕ).
Функции этих генов включают деградацию бел-
ков, сборку и укладку молекул белков (с участи-
ем белков-шеперонов), а также синтез ДНК (см.
разд. 19.4). Кроме того, ответ на тепловой шок
значительно перекрывается с реакциями на дру-
гие стрессы, например при тепловом шоке наблю-
дается синтез каталазы — белка окислительного
шока, который при высокой температуре способ-
ствует выживанию благодаря, возможно, удале-
нию пероксидов, образование которых усиливает-
ся с повышением температуры.
Синтез многих белков теплового шока сти-
мулируется также добавлением этанола в высо-
кой концентрации (4-10%), УФ-облучением или
обработкой налидиксовой кислотой (ингибитор
ДНК-гиразы). В этих случаях образуются пере-
крывающиеся группы белков, что по-видимому,
отражает существование общих механизмов реак-
ции клеток на стрессы, непосредственно затраги-
вающие структуру белков или целостность ДНК.
Другие физиологические стрессы (сдвиги pH, ос-
мотического давления, содержания О2), вероятно,
не индуцируют синтез белков теплового шока.
Белки теплового шока составляют часть обыч-
ного набора клеточных белков, но для выживания
в экстремальных условиях они требуются в повы-
шенных концентрациях. Так, белок <т32 (продукт
гена гроН) необходим для роста Е. coli при темпе-
ратуре 16-44 °C. Это означает, что продукты ге-
нов теплового шока служат важными компонен-
тами растущих клеток, хотя первоначально они
были открыты благодаря возрастанию их синтеза
при температурном сдвиге. Индукция белков теп-
лового шока во время предварительной адапта-
ции при умеренной температуре повышает выжи-
ваемость при более высоких значениях температу-
ры. Аналогичным образом слабый окислительный
стресс (вызванный, например, пероксидом водо-
рода в низкой концентрации; см. ниже) приводит
к индукции каталазы и таким образом способству-
ет выживанию при более высоких концентраци-
ях пероксида. Общим механизмом реакции на эти
стрессы может быть синтез алармона АррррА
и родственных нуклеотидов в качестве инди-
каторов стресса. Алармон АррррА и сходные
молекулы образуются в клетках под действием
УФ-облучения, этанола, нагревания и разнообраз-
ных окислителей.
28.2.3. Функции белков теплового шока
в физиологии клеток
весьма существенны
У большинства организмов идентифицировано
два основных класса белков теплового шока: се-
мейства Hsp70 и Hsp60. У Е. coli основным бел-
ком семейства Hsp70 является DnaK, продукт
гена dnaK, представители семейства Hsp60 —
белки GroEL и GroES. Белок DnaK совместно с
белками GrpE и DnaJ предотвращает агрегацию
новосинтезированных белков и белковых молекул,
не свернутых должным образом вследствие кле-
точного стресса. Белок GroEL, возможно, служит
шепероном, поскольку способен обеспечивать
укладку новосинтезированных и несвернутых
белков, тогда как основная функция DnaK — это,
по-видимому, стабилизация несвернутых белков.
Таким образом, DnaK, GroEL и GroES действуют
последовательно (рис. 28.2; см. цв. вклейку).
Свертывание белковой молекулы происходит
как кооперативный процесс. Белок может со-
стоять из одной свернутой единицы или раз-
дельно свернутых доменов. Образование правиль-
ной структуры белка зависит от аминокислотной
последовательности всего белка или соответству-
ющего домена. Во время синтеза белка на рибо-
соме образующийся пептид должен быть защи-
щен от образования стабильных, но неверных свя-
зей с другими элементами полипептидной цепи.
Наиболее вероятно образование ошибочных свя-
зей в гидрофобных участках, обычно локализо-
ванных внутри белка. Как предполагается, белки
Глава 28. Адаптация к экстремальным средам 131
семейства Hsp70 распознают гидрофобные после-
довательности длиной 7-8 аминокислотных остат-
ков в новосинтезированных белках и выполняют
определенную роль в подготовке белков к пере-
носу через плазматическую мембрану. При пе-
реносе полипептид находится в развернутой кон-
формации, и у него остаются незащищенными ко-
роткие участки из гидрофобных аминокислотных
остатков; для предотвращения агрегирования они
связываются белками Hsp70. Эти белки участву-
ют также в сборке мультибелковых комплексов
(см. гл. 24 и 25). Таким образом, белки семейства
Hsp70 играют важную роль в физиологии клеток,
а также еще более важную роль в условиях, когда
белковые цепи вследствие стрессовых эффектов
могут быть несвернутыми.
Характерно, что белки Hsp70 при очистке ча-
сто выделяются совместно с полисомами, на ко-
торых они могут взаимодействовать с коротки-
ми белковыми цепями (до 55 остатков). Напро-
тив, белки Hsp60 присутствуют в цитоплазме
как свободные молекулы и не ассоциированы с ри-
босомами. Белки DnaJ и GrpE действуют совмест-
но с DnaK, изменяя структуру белка. Белок-шепе-
рон DnaJ (41 кДа) в растворе первым взаимодей-
ствует с незащищенными последовательностями
несвернутого или денатурированного белка. Об-
разующийся комплекс служит мишенью для
С-концевого домена белка DnaK. Анализ амино-
кислотных последовательностей гомологов Hsp70
показал, что N-концевая область у них высококон-
сервативна и участвует в связывании и гидролизе
АТР. Белки DnaK, DnaJ и несвернутая белковая
молекула образуют тройной комплекс в присут-
ствии АТР. Гидролиз АТР приводит к образова-
нию комплекса ADP-DnaK с высоким сродством
к несвернутой белковой цепи. Для высвобожде-
ния несвернутого белка требуется белок GrpE,
который индуцирует диссоциацию ADP из этого
комплекса и способствует связыванию АТР. Ком-
плекс АТР-DnaK имеет низкое сродство к несвер-
путому белку, и поэтому белок высвобождается.
Далее возможны различные варианты его пре-
вращений: правильное свертывание с помощью
белков GroEL и GroES (рис. 28.2), неправильное
свертывание и агрегирование либо регенерация с
участием комплекса DnaK-DnaJ. Четырнадцать
субъединиц белка GroEL формируют структуру,
имеющую центральную полость. Белок, который
должен быть свернут, временно размещается в
этом отверстии, где с помощью белка GroES пре-
вращается из «бесформенной глобулы» (форма
без необходимой пространственной укладки) в
правильно свернутую молекулу зрелого белка.
28.2.4. Белки теплового шока регулируют
свою собственную экспрессию
После повышения температуры возрастает кон-
центрация субъединицы ст32, что приводит к
повышению скорости транскрипции генов тепло-
вого шока. Предположительно на уровень ст32
влияют два фактора: 1) высокая нестабильность
этого белка (период полужизни ~1 мин) и 2) ре-
гуляция трансляции мРНК для ст32. При пониже-
нии температуры белок ст32, по-видимому, очень
быстро инактивируется, что приводит к сниже-
нию транскрипции генов теплового шока. В регу-
ляции накопления о in vivo могут участвовать
DnaK и другие Hsp-белки. Мутанты, лишенные
функционального гена (Ina К, экспрессируют бел-
ки теплового шока на высоком уровне даже при
низкой температуре, т. е. такие мутанты весьма
термотолерантны. С учетом нестабильности ст32
представляется вероятным, что при тепловом шо-
ке пул белков Hsp может изменять баланс меж-
ду неправильно свернутым, неактивным полипеп-
тидом ст32 и активной формой белка, вызывая
дальнейшую экспрессию генов, кодирующих бел-
ки Hsp.
И Ответ на тепловой шок — это типичный при-
мер реакции на стресс с участием генов, которые
участвуют и в процессах нормального роста, но
кроме того при высоком уровне своей экспрес-
сии обеспечивают выживание в экстремальных
условиях. При тепловом шоке имеющиеся пулы
Hsp-белков изменяют баланс между неправильно
свернутой, неактивной сг32-субъединицей и актив-
ной формой этого белка, что приводит к даль-
нейшей экспрессии генов, кодирующих белки Hsp.
Сверхэкспрессия этих генных продуктов дела-
ет возможным выживание при продолжающемся
тепловом стрессе, тогда как их экспрессия на
обычном уровне требуется во время нормального
роста в диапазоне температур 16-44 °C для осу-
ществления правильной сборки отдельных белков
и мультибелковых комплексов. Таким образом,
белки-шепероны не только служат инструментом
ответа на тепловой шок, но и постоянно участ-
вуют в укладке новосинтезируемых полипеп-
тидов.
132 Часть VI. Рост и дифференцировка клеток
28.3. Бактерии способны адаптироваться к экстремальным значениям pH
Среди бактерий можно выделить три основные
группы по диапазону pH, благоприятному для
роста: ацидофилы (pH-оптимум < 4), ней-
трофилы (рН-оптимум 6-7) и алкалифилы
(рН-оптимум 8-9). Такая специализация отража-
ет специфические пути эволюционной адаптации
к внешним стрессам, связанным с pH. Основные
проблемы, связанные с ростом при крайних значе-
ниях pH, — это поддержание pH цитоплазмы на
уровне, близком к нейтральному, а также обеспе-
чение активности выделяемых и поверхностных
белков. У неспециализированных бактерий экс-
тремальные значения pH среды вызывают необра-
тимое разрушение поверхностных белков, участ-
вующих в синтезе клеточной стенки и поглощении
питательных веществ, тогда как специализиро-
ванные микроорганизмы обладают белками, ста-
бильными при экстремальных значениях pH.
В частности, это характерно для алкалифилов,
которые даже используются в настоящее время
в качестве источника стабильных ферментов в
промышленных технологиях. Регуляция pH цито-
плазмы должна быть быстрой (в течение минут,
не часов), чтобы предотвратить подавление ро-
ста клеток или даже их гибель. Алкалифильпые
бактерии обладают эффективными механизмами
поддержания внутриклеточного pH, позволяющи-
ми им расти в сильно щелочной среде, сохраняя
pH цитоплазмы близким к 8.
28.3.1. Бактерии регулируют pH цитоплазмы
Поддержание pH цитоплазмы (рНвнутр.) в пре-
делах узкого диапазона, несмотря на изменения
pH среды, называют pH-гомеостазом. Напри-
мер, у Е. coli рНвнутр. изменяется менее, чем на
0,1 единицы при изменении pH среды на одну
единицу в диапазоне 4,5-7,9. В случае нарушения
внутриклеточного pH из-за дефицита калия или
в результате добавления неорганических кислот,
его возвращение к норме происходит с участием
ионов калия (рис. 28.3). Бактерии способны реа-
гировать на очень незначительные изменения pH
и отвечать па них изменениями той или иной ак-
тивности. Например, у клеток Е. coli в услови-
ях низкого pH или в присутствии слабых кислот
при движении наблюдается большая, чем в обыч-
ных условиях, частота кувырков, которая позво-
ляет им покинуть местообитание с кислой реак-
цией среды. Незначительные изменения рНвнутр.
могут также влиять на экспрессию генов, обеспе-
чивающих адаптацию. Гомеостаз достигается сов-
местным действием активных и пассивных меха-
низмов.
Пассивный гомеостаз □ Значительным из-
менениям внутриклеточного pH при изменении
pH среды препятствует главным образом очень
низкая проницаемость мембраны для протонов
и других ионов. Плазматическая мембрана — это
основной участок превращения энергии у бакте-
рий, с которым связан активный транспорт прото-
нов через мембрану. Однако последний не влияет
на гомеостаз pH, поскольку протоны входят и вы-
ходят из клетки с одной и той же скоростью. В то
же время протонные помпы выкачивают протоны
из клетки, если необходимо повысить внутрикле-
точный pH (см. разд. 5.6.3).
Другой фактор, предотвращающий наруше-
ние внутриклеточного pH, — это высокая бу-
Рис. 28.3. Гомеостаз pH у Е. coli. Клетки, истощенные
по калию в условиях инкубации при pH 5,3 (пунктирная
линия) и pH 7,1 (сплошная линия), демонстрируют эф-
фект сдвига и стабилизации внутриклеточного pH после
добавления KCI (1 мМ). Уровень накопления К+ одина-
ков при кислом и нейтральном pH среды. По [2].
Глава 28. Адаптация к экстремальным средам 133
ферная емкость клеточной цитоплазмы, которую
обеспечивает содержание в ней нуклеиновых кис-
лот и белков, а также пулов глутамата и поли-
аминов (рис. 28.4). В основном буферную емкость
обеспечивают фосфатные группы в составе РНК
и ДНК (в нейтральном диапазоне) и основные или
кислые боковые цени аминокислот в составе бел-
ков при крайних значениях pH; эти боковые цепи
чаще всего локализованы на поверхности белко-
вых молекул. Глутамат и полиамины имеют зна-
чения рК на крайних пределах диапазона pH; глу-
тамат аккумулируется в клетках в количестве, до-
статочном для защиты от сдвигов pH в кислую
сторону. У грамотрицательных бактерий глута-
мат может накапливаться до концентрации 400-
500 мМ и, хотя наиболее высокое значение его рК
относительно «кислое» (рК 4,07), высокая концен-
трация этой аминокислоты в цитоплазме способна
обеспечить значительную буферную емкость при
низких значениях внутриклеточного pH. Буфер-
ная емкость цитоплазмы максимальна при край-
них значениях pH, где она вдвое выше, чем при
pH 6-8 (рис. 28.4).
Активный pH-гомеостаз обеспечивается
транспортом ионов. В наиболее простом виде го-
меостаз pH можно объяснить трансмембран-
ным транспортом ионов Н+, К+ и Na+
(рис. 28.5; см. цв. вклейку). Вклад этих ионов в
поддержание pH внутри клеток не у всех мик-
роорганизмов равноценен. Перенос Na+ очень ва-
жен у алкалифилов, тогда как у ацидофильных
и нейтрофильных бактерий его роль менее суще-
ственна. Транспорт ионов калия и протонов имеет
важное значение у всех бактерий. В результате
переноса протонов через мембрану генерирует-
ся мембранный потенциал (Д^)> ограничиваю-
щий дальнейший выход протонов. Продолжение
выхода протонов может иметь место, только ес-
ли протоны вновь поглощаются клеткой посред-
ством одного из белковых комплексов, участ-
вующих в преобразовании энергии (например,
ATP-синтазы или транспортных белков). Образо-
вание мембранного потенциала на мембране обу-
словлено транспортом очень небольшого числа
протонов; на pH цитоплазмы это перемещение
протонов существенного влияния не оказывает.
Интенсивный транспорт протонов происходит в
том случае, если мембранный потенциал времен-
но разряжается в результате поглощения клет-
кой калия, за счет которого образуется трансмем-
бранный градиент pH (рис. 28.3). Мутанты Е. coli
Рис. 28.4. Буферная емкость цитоплазмы как функ-
ция pH. Буферная емкость возрастает при экстремаль-
ных значениях pH. В диапазоне внутриклеточного pH
6-8, характерном для большинства бактерий, буфер-
ную емкость цитоплазмы обеспечивают главным обра-
зом фосфатные группы в составе РНК и ДНК. Однако
при экстремальных значениях pH больший вклад вно-
сят карбоксильные и аминогруппы кислых и основных
аминокислот. При низкой реакции среды буферная ем-
кость может быть выше, чем при щелочной, вследствие
накопления в клетках глутамата как противоиона калия.
и Enterococcus faecalis, у которых отсутствует си-
стема поглощения калия, характеризуются пони-
женным рНвнутр и плохо растут при pH 6, что
подтверждает важность данной транспортной си-
стемы для подщелочения цитоплазмы. Равнове-
сие рНвнутр. у Е. coli устанавливается посред-
ством транспорта калия. Для регуляции pH не
существует специальной системы поглощения ка-
лия; его вход обеспечивается главным образом ак-
тивным выкачиванием Н+ протонными помпами.
У алкалифилов pH цитоплазмы должен под-
держиваться на более низком уровне по срав-
нению с pH среды. Это обеспечивается транс-
портом ионов натрия, в котором участвуют по
меньшей мере три системы (рис. 28.5). Система
антипорта Na+/H+ — центральный механизм цик-
ла Na+, способствующий поглощению протонов.
Активность ее зависит от pH и максимальна при
более высоких значениях pH цитоплазмы, чем оп-
тимальные для организма. Для полного цикла
Na+ требуется еще два механизма. Один из них —
это симпорт Na+ с органическими ионами,
который обеспечивает поступление в клетку Na+,
необходимого для систем антипорта, действую-
щих в направлении подкисления цитоплазмы. Од-
нако в первую очередь данная система симпор-
та участвует в снабжении клетки питательными
веществами и должна быть активна даже тогда,
134 Часть VI. Рост и дифференцировка клеток
Рис. 28.6. Na+ -зависимая регуляция внутриклеточно-
го pH у Exiguobacterium aurantiacum. Определяли изме-
нения рНвнутр. в клетках, инкубируемых в буфере при
pH 9,65 в присутствии К+, но в отсутствие Na+, и за-
тем после внесения NaCI. Штриховая линия — вариант
с внесением 0,1 мМ Na+; сплошная линия — вариант с
внесением 10 мМ Na+; пунктирная линия — вариант с
внесением 0,5 мМ Na+. По [3].
когда для поддержания гомеостаза pH ионы Na+
не требуются. Регуляцию входа Na+, необходи-
мую для поддержания pH, осуществляет рН-зави-
симый Na+-KanaH. Этот канал может открывать-
ся, когда цитоплазма слишком щелочная, обеспе-
чивая поступление Na+ в клетку, чтобы система
антипорта могла удалять Na+ из клетки в обмен
на протоны для снижения pH цитоплазмы.
Дополнение 28.4. Поддержание гомео-
стаза pH у алкалифилов обеспечивается
несколькими системами транспорта ионов.
Важность транспорта Na+ для алкалифи-
лов иллюстрирует рис. 28.6. Например, у
Exiguobacterium aurantiacum в отсутствие
ионов натрия внутриклеточный pH не под-
держивается на нужном уровне при инкуба-
ции в щелочной среде. Добавление ионов на-
трия вызывает быстрое восстановление pH
цитоплазмы до физиологического уровня.
При высокой концентрации натрия в сре-
де поглощение Na+ клетками превышает
уровень, необходимый для поддержания го-
меостаза pH и цитоплазма излишне подкис-
ляется, но затем вновь подщелачивается бла-
годаря транспорту других ионов (рис. 28.6),
наиболее вероятно ионов калия. Действие
этих трех систем транспорта ионов для регу-
ляции pH цитоплазмы у алкалифилов четко
скоординировано.
Регуляция pH цитоплазмы в бактериальных
клетках происходит на основе как активных, так
и пассивных механизмов. Плазматическая мем-
брана служит барьером для протонов; поступаю-
щие в клетку протоны нейтрализуются благодаря
буферной емкости цитоплазмы. Активные меха-
низмы поддержания гомеостаза pH —это циклы
ионного транспорта. Протонная помпа и системы
транспорта калия служат основными механизма-
ми регуляции pH у бактерий, обитающих в кис-
лых или нейтральных средах; они согласованно
действуют для повышения pH цитоплазмы. У ал-
калифилов наиболее важен транспорт Na+— для
снижения pH цитоплазмы относительно внешнего
pH.
28.3.2. Каждый микроорганизм обитает
в специфических для него условиях
Ацидофильные бактерии растут при значе-
ниях pH 2-3, которые для них оптимальны
(табл. 28.4). Благодаря низкой проницаемости
плазматической мембраны для протонов и дру-
гих катионов, pH цитоплазмы у этих организмов
несмотря на экстремальную кислотность среды
поддерживается на уровне 6,5-7,0. Белки поверх-
ностных слоев их клеток высокоустойчивы к низ-
ким значениям pH и у многих ацидофилов, напро-
тив, нестабильны при нейтральном pH.
Для нейтрофильных бактерий наиболее
благоприятен pH, близкий к нейтральному зна-
чению; внутриклеточный pH составляет у них
7,6-8,0 (табл. 28.4). Изменение pH цитоплазмы
всего на 0,5 ед. может привести к существенно-
му подавлению роста нейтрофилов. Сильное под-
кисление среды может вызвать гибель нейтро-
фильных бактерий, однако большинство их об-
ладает механизмами адаптации к низкому pH
(см. ниже). Часто причиной кислотного стрес-
са является присутствие в среде слабых ор-
ганических кислот, способных проникать через
липидный слой мембраны, который непроница-
ем для протонов, но относительно легко про-
Глава 28. Адаптация к экстремальным средам 135
Таблица 28.4. Примеры бактерий с различными рН-оптимумами
Организм pH среды Внутриклеточный pH Среда обитания
Thiobacillus acidophilus 1-2 6,0-7,0 Угольные отвалы
Bacillus acidocaldarius 2-6 6,0-7,0 Горячие серные источники
Escherichia coli 5-8 7,6-8,0 Кишечник человека
Staphylococcus aureus 5-8 7,5-8,0 Кожа; пищевые продукты
Bacillus pasteurii 9-11 8,0-8,6 Почва; сточные воды
Bacillus alcalophilus 8-11,5 8,0-8,6 Широко распространен в почве
Exiguobacterium aurantiacum 7,5-11 8,2-8,8 Щелочные картофельные отходы
ницаем для таких кислот. Они проникают через
мембрану в незаряженной форме и диссоцииру-
ют в цитоплазме с высвобождением протонов (см.
табл. 5.1). Поэтому липофильные жирные кисло-
ты (например, бензойная, масляная или уксусная)
сильнее подавляют рост, чем неорганические кис-
лоты (например, НС1). Резкое изменение наруж-
ного pH более чем на одну единицу в результате
добавления в среду неорганических кислот вызы-
вает небольшое кратковременное падение внутри-
клеточного pH (рис. 28.7). Через несколько ми-
нут исходный pH восстанавливается благодаря
действию системы поглощения калия. Основным
фактором, препятствующим в этом случае сни-
жению pH цитоплазмы, служит непроницаемость
мембраны для протонов. Напротив, добавление
слабой липофильной кислоты, такой как бензой-
ная (рис. 28.7), приводит к долговременному сни-
жению рНвнутр. вследствие того, что бензоат про-
никает через мембрану в виде недиссоциирован-
пой кислоты, т. е. переносит в клетку протоны.
Слабые кислоты действуют синергично с на-
ружным pH, в результате того что клеткам свой-
ственно поддерживать внутренний pH близким
к 7,6-8,0. Установление химического равновесия
слабой кислоты определяется ее рК и величиной
трансмембранного градиента pH. При наружном
pH 5 градиент pH составит не менее 2 ед. и теоре-
тическая внутриклеточная концентрация аниона
(А~) слабой кислоты будет более чем в 100 раз
выше, чем его наружная концентрация. Если по-
следняя составляет 1 мМ, внутренняя концентра-
ция А- достигнет 100 мМ, что эквивалентно по-
ступлению в цитоплазму примерно 100 мМ ионов
Н+. Такое количество значительно превышает бу-
ферную емкость клетки (рис. 28.4), вследствие
чего pH цитоплазмы будет понижаться, произой-
дет сильное подавление роста и, возможно, гибель
клеток.
Рис. 28.7. Изменения рНВНуТр. при добавлении кислот к
клеткам Е. coli. Клетки инкубировали в К+-содержащем
буфере при pH 7,6 (пунктирная линия) или при pH 6,0
(сплошная линия) и вносили либо HCI (с понижением
pH среды до pH 6,0; пунктирная линия), либо 2 мМ бен-
зойной кислоты (сплошная линия).
Не все изменения внутриклеточного pH ока-
зывают повреждающий эффект. Многие грампо-
ложительные бактерии обладают специфически-
ми системами выведения калия, которые понижа-
ют pH, когда на клетки воздействуют токсические
вещества, например метилглиоксаль. Этот силь-
ный ингибитор роста повреждает молекулы бел-
ков, нуклеиновых кислот и липидов. Метилглиок-
саль образуется как побочный продукт гликолиза,
и его синтез в больших количествах связан пре-
имущественно с избытком источников углерода
при недостатке остальных питательных веществ.
В высоких концентрациях метилглиоксаль вызы-
вает гибель бактерий. Активация специфических
глутатионовых систем выделения калия у Е. coli
(KcfB и KefC) приводит к временному подкис-
лению цитоплазмы, что повышает выживаемость
клеток.
Алкалифильные бактерии растут с наи-
большей скоростью при pH 8-11 (рис. 28.4) и в
136 Часть VI. Рост и дифференцировка клеток
связи с этим обладают тремя особенностями. Пер-
вая особенность — это свойство поддержания pH
цитоплазмы на физиологическом уровне в щелоч-
ной среде (см. выше). Вторая особенность алка-
лифилов состоит в том, что ферменты, находя-
щиеся па поверхности клетки или секретируемые
в окружающую среду, устойчивы к денатурирую-
щему влиянию щелочной среды. Убедительно до-
казано наличие у алкалифилов ферментов, устой-
чивых к высоким значениям pH; эти ферменты
используются при производстве детергентов. На-
конец, третья особенность связана с тем, что обра-
зование на мембране градиента pH с кислым по-
люсом внутри клетки нейтрализует мембранный
потенциал и, следовательно, снижает протондви-
жущую силу, которая обеспечивает синтез АТР
при дыхании. У ацидофильных и нейтрофильных
бактерий внутренний pH выше и градиент pH тер-
модинамически дополняет протондвижущую си-
лу. У алкалифилов для преодоления отрицатель-
ного эффекта пассивного pH-градиента имеются
два механизма: 1) мембранный потенциал имеет
необычайно высокую величину, и это компенсиру-
ет уменьшение протондвижущей силы и поддер-
живает ее на том же уровне, который характерен
для других бактерий, и 2) некоторые факульта-
тивно алкалифильныс бактерии синтезируют ин-
дуцибельные дыхательные цепи, при функциони-
ровании которых перенос электронов сопряжен с
выходом Na1 из клетки, и па этом основан меха-
низм запасания энергии.
У алкалифильных бактерий образование обрат-
ного градиента pH на мембране компенсируется
высокой величиной мембранного потенциала или
сопряжением транспорта электронов с выделени-
ем из клеток Na+ для поддержания гомеостаза pH
и запасания энергии.
28.3.3. Понижение pH цитоплазмы
влияет на экспрессию генов
Изменения внутриклеточного pH индуцируют
1) экспрессию генов, от которых зависит кор-
рекция повреждений, вызванных низким pH, и
2) экспрессию генов, обеспечивающих выживание
в кислой среде.
Первые сведения о кислотоиндуцируемой экс-
прессии генов касались дерепрессии синтеза де-
карбоксилаз аминокислот при снижении pH ци-
топлазмы. Активность генов этих ферментов ре-
гулируется весьма сложным образом, и предпо-
ложительно важную роль выполняют при этом
специфические регуляторные белки, изменения в
топологии ДНК и гистоподобные белки. Физио-
логический смысл индукции этих ферментов свя-
зан с тем, что в катализируемых ими реакциях
образуются диоксид углерода и полиамины. При
низком pH важная для роста угольная кисло-
та (рК 6,2) присутствует лишь в незначительной
концентрации. Повышение уровня декарбоксилаз
аминокислот способствует возрастанию концен-
трации угольной кислоты. В то же время секре-
тируемые полиамины могут повышать pH среды.
При щелочном pH среды экспрессируются дез-
аминазы, возможно в ответ на потребность в сво-
бодном аммиаке, и секретируются слабокислые
побочные продукты, понижающие pH среды. Ха-
рактером регуляции этих двух классов фермен-
тов объясняется тот известный факт, что в про-
цессе приспособления клеток Е. coli, растущих в
жидкой среде, к щелочным или кислым услови-
ям постепенно устанавливается нейтральное зна-
чение pH среды.
Выживаемость бактерий в среде с низ-
ким значением pH после преадаптации к
умеренно кислой среде □ Клетки бактерий,
инкубированные при pH 4,3-6,0 в течение ко-
ротких периодов времени, обнаруживают гораздо
более высокую выживаемость при pH 3,0 по срав-
нению с клетками тех же бактерий, выращен-
ных при нейтральном или слегка щелочном pH
(рис. 28.8). Эта адаптация зависит от синтеза бел-
ков, функции которых пока неизвестны. Эффект
преадаптации значительно усиливается благода-
ря экспрессии генов, инициируемой субъедини-
цей ст38 (белок RpoS; см. ниже) (рис. 28.8). Сиг-
нал, непосредственно регулирующий активность
генов кислотной адаптации, пока неизвестен. До-
статочным стимулом для изменения скорости син-
теза кислотоиндуцируемых генных может быть
временное понижение pH цитоплазмы, вызван-
ное внезапным сдвигом внешнего pH. Регулятор-
ное влияние изменений внутриклеточного pH па
экспрессию генов к настоящему времени убеди-
тельно доказано (например, установлено повыше-
ние транскрипции гена rpoS, кодирующего ст38).
Повышенная устойчивость к снижению pH на-
блюдается также у культур, растущих при ней-
тральном pH, в случае пониженной скорости ро-
ста и при переходе в стационарную фазу роста.
Глава 28. Адаптация к экстремальным средам 137
Рис. 28.8. Кислотоустойчивость бактериальных клеток
и экспрессия генов стационарной фазы роста. Клетки
штамма Е. coli дикого типа выращивали до начала экс-
поненциальной фазы роста при pH 7,0 (штриховая ли-
ния) или при pH 6,0 (сплошная линия), после чего куль-
туру разводили той же средой, забуференной для сни-
жения до pH 3; в пробах определяли число жизнеспособ-
ных клеток. Культуру изогенного мутанта по гену rpoS
предварительно выращивали при pH 6,0 и затем инку-
бировали в среде с pH 3 (пунктирная линия).
Этот эффект обусловлен экспрессией сигма-
фактора голодания <т38 (RpoS) (рис. 28.8). Од-
нако не все эффекты фазы роста или измене-
ний pH связаны с активностью фактора сг38;
другие механизмы еще предстоит идентифициро-
вать. Как установлено, изменения внутриклеточ-
ного pH вызывают повышение способности к ре-
парации ДНК (повышенная экспрессия модулона
SOS-репарации ДНК при щелочном pH) и возрас-
тание устойчивости к мутагенам и электрофиль-
ным агентам при кислом pH.
В бактериальных клетках pH цитоплазмы под-
держивается в относительно узком диапазоне ве-
личин. Возможны его незначительные измене-
ния— на 0,1 ед. pH при изменении наружного pH
на 1,0 ед. В ответ на такие незначительные сдви-
ги внутриклеточного pH в клетках индуцируется
адаптивная экспрессия генов. Сдвиги pH цито-
плазмы могут вызывать разнообразные измене-
ния в поведении клеток. Подвижные бактерии
способны удаляться из участков с неблагоприят-
ным pH (кислые местообитания, среды с высокой
концентрацией слабых кислот). При слабокис-
лом pH происходят изменения в экспрессии генов
(в ряде случаев при участии ст38), способствующие
выживанию нс только при экстремальных значе-
ниях pH, по и при стрессах других типов.
28.4. Выживание при осмотическом стрессе
обеспечивается у бактерий одним общим механизмом
Физиолого-биохимические механизмы противо-
действия осмотическому стрессу исследуются уже
в течение многих лет на широком круге микро-
организмов. Факторы повышения осмотического
давления, связанные с клеточной активностью,
довольно очевидны. Для функционирования фер-
ментов требуется более высокая концентрация
растворенных веществ в цитоплазме, чем в сре-
де, окружающей клетки, в соответствии с чем в
цитоплазме накапливаются растворенные веще-
ства. Это вызывает поступление в клетку воды
и повышение тургорного давления, которое мог-
ло бы разорвать мембрану, если бы она не была
защищена клеточной стенкой. Повышению турго-
ра способствует также и то, что в клетках боль-
шинства бактерий накопление растворенных ве-
ществ, в частности ионов, происходит до значи-
тельно более высоких концентраций, чем требу-
ется для биосинтетических процессов.
Дополнение 28.5. Для объяснения фено-
мена относительно высокого тургорного дав-
ления в бактериальных клетках А. Кохом
(Koch) предложена теория поверхностно-
го стресса. Согласно этой теории, бакте-
рии аккумулируют значительный пул рас-
творенных веществ для создания высокого
тургорного давления, что способствует рас-
тяжению клеточной стенки и тем самым
138 Часть VI. Рост и дифференцировка клеток
удлинению цепей пептидогликана. Таким об-
разом, уровень тургора, эволюционно опре-
делившийся вначале для обеспечения усло-
вий протекания ферментативных реакций в
цитоплазме, мог впоследствии стать движу-
щей силой реакций, протекающих на поверх-
ности клетки. При очень высокой осмолярно-
сти среды бактерии могут предотвращать по-
нижение тургора путем уменьшения степени
перекрестного связывания компонентов кле-
точной стенки. Вследствие этого клетка уве-
личивается в размерах соответственно ново-
му балансу между тургорным давлением и
устойчивостью к нему клеточной стенки.
28.4.1. Для ослабления осмотического стресса
в клетках бактерий накапливаются
совместимые осморегуляторные
вещества
В связи с тем, что от тургора зависит по-
строение клеточной стенки, возникает опреде-
ленная проблема на клеточном уровне. Как су-
щественный фактор роста тургорное давление
должно поддерживаться несмотря на колебания
осмолярности среды. При повышении осмолярно-
сти наружного раствора осмолярность цитоплаз-
мы также должна возрастать, чтобы сохранялся
необходимый тургор. Вместе с тем в условиях вы-
сокой осмолярности снижается активность мно-
гих ферментов. Существующий у микробов ме-
ханизм осмотической адаптации состоит в том,
что постоянство тургора поддерживается путем
накопления в клетках специфических растворен-
ных веществ, не влияющих на активность фер-
ментов; в соответствии с данной функцией они
названы совместимыми осморегуляторными
веществами. Эти соединения характеризуются
следующими свойствами.
1. Совместимые осморегуляторы обладают вы-
сокой растворимостью; концентрация их в ци-
топлазме нередко достигает 1 М.
2. Обычно они представляют собой либо ней-
тральные молекулы, не содержащие разно-
именно заряженных центров, либо цвиттер-
ионные нейтральные молекулы (несущие за-
ряженные центры).
3. Совместимые осморегуляторные вещества
способны проникать через клеточную мем-
брану путем регулируемого транспорта, бла-
годаря чему их цитоплазматический пул опре-
деляется внешним осмотическим давлением.
4. Совместимые осморегуляторы не влияют на
ферментативную активность и способны за-
щищать ферменты от денатурации под дей-
ствием солей.
5. Наиболее эффективные совместимые осморе-
гуляторы— бетаин, эктоин, трегалоза и
пролин (рис. 28.9) — обладают необычными
осмотическими свойствами, благодаря кото-
рым их низкие концентрации в цитоплазме
обеспечивают такое же осмотическое давле-
ние, какое достигается при высоких концен-
трациях менее эффективных специфических
осморегуляторов.
6. Как правило, совместимые осморегуляторные
вещества представляют собой конечные мета-
болиты, а не промежуточные продукты того
или иного пути биосинтеза.
Совместимые осморегуляторные соединения
обычно присутствуют в окружающей среде, так
как их синтезируют de novo многие бактерии, рас-
тения и животные. Кроме того, некоторые типич-
ные клеточные компоненты (например, белки и
липиды) могут гидролизоваться с образованием
предшественников специфических осморегулято-
ров, таких как пролин и бетаин, и в эвтрофных
(богатых источниками питания) экосистемах име-
ется достаточно источников совместимых осморе-
гуляторных веществ, используемых бактериями.
Для грамположительных бактерий характер-
на очень высокая внутриклеточная концентрация
растворенных веществ, поэтому тургорное давле-
ние составляет у них примерно 20 атм (2 МПа),
тогда как у грамотрицательных — 5-6 атм
Рис. 28.9. Структура некоторых распространенных сов-
местимых осморегуляторных веществ.
Глава 28. Адаптация к экстремальным средам 139
(0,5-0,6 МПа). Соответственно грамположитель-
ные бактерии накапливают специфические осмо-
регуляторные вещества даже при низком наруж-
ном осмотическом давлении во избежание стрес-
са, который мог бы возникнуть из-за накопления
солей для поддержания тургора. Как предпола-
гается, грамположитсльные бактерии эволюцио-
нировали в местообитаниях с высоким осмоти-
ческим давлением, что привело к приобретению
ими способности накапливать растворенные веще-
ства до очень высоких концентраций. Образова-
ние впоследствии толстой клеточной стенки, воз-
можно, позволило их потомкам заселять место-
обитания с низкой осмолярностью среды.
Микробные клетки должны очень тонко ре-
гулировать накопление совместимых осморегуля-
торных веществ для поддержания внутреннего
осмотического давления, и с повышением внеш-
него осмотического давления содержание этих
соединений в клетках повышается постепенно
(рис. 28.10). Различные микроорганизмы аккуму-
лируют разнообразные растворенные вещества —
бетаин, трегалозу, глицерол, сахарозу, L-пролин,
D-маннитол, D-глюцитол, L-таурин, эктоин или
мелкие пептиды. Между структурой аккумули-
руемого растворенного вещества и способностью
организма выдерживать высокое внешнее осмоти-
ческое давление явной корреляции не обнаруже-
но. Толерантность к высокой осмолярности сре-
ды обеспечивается многими факторами. Фермен-
ты, локализованные в периплазме и на внеш-
ней стороне плазматической мембраны, защище-
ны присутствием совместимых осморегуляторных
веществ. Галотолерантные организмы обладают
ферментами и структурами поверхности, более
устойчивыми к низкой активности воды, чем у
менее осмотолерантных организмов. У галобак-
терий даже цитоплазматические ферменты спе-
цифически отличаются от ферментов бактерий,
растущих при низкой осмолярности среды. Опти-
мальной основой среды для роста галобактерий
служит 3 М раствор NaCl; они накапливают хло-
рид калия до концентрации 4 М, тогда как у пега-
лофильных организмов уровень глутамата калия
в клетках не превышает 0,8 М. В белках гало-
филов выше содержание кислых аминокислотных
остатков и ниже — гидрофобных аминокислотных
остатков. Эти белки связывают воду в 2-4 раза бо-
лее эффективно, чем соответствующие белки ор-
ганизмов, обитающих в средах с низким осмоти-
ческим давлением.
Рис. 28.10. Внутриклеточные пулы растворенных ве-
ществ у Streptomyces griseus как функция осмолярности
среды. Пунктирной линией показано повышение внутри-
клеточной концентрации солей калия. • — пролин; ▲ —
глутамин; □ — аланин. По [4].
28.4.2. Осмотический стресс вызывает
регуляцию тургора и накопление
совместимых осморегуляторных веществ
В результате изменений как на уровне экспрес-
сии генов, так и на уровне активности фермен-
тов физиолого-биохимические характеристики
клеток, растущих в средах с низкой осмоляр-
ностью, и клеток, адаптированных к высокой
осмолярности среды, существенно различаются
(табл. 28.5). Основной путь регуляции турго-
ра— это контролируемое накопление К+ и его
противоиона — глутамата. У Е. coli при внезап-
ном повышении наружного осмотического давле-
ния из клеток через водные аквапориновые кана-
лы выделяется вода, что приводит к потере тур-
гора. Это активирует систему поглощения калия
ТгкАЕН, с участием которой калий поглощает-
ся до тех пор, пока тургор не будет восстанов-
лен (рис. 28.11). В отсутствие калия тургорпый
стресс продолжается, и это приводит к экспрес-
сии транспортной системы Kdp, имеющей высо-
кое сродство к калию. Экспрессия генов kdp носит
характер временной, если калий легко доступен,
и постоянной при дефиците К+. Глутамат син-
тезируется (или поглощается из среды) до уров-
ня, почти эквивалентного повышенному уровню
К+ (рис. 28.11). При высоком наружном осмоти-
ческом давлении внутриклеточная концентрация
глутамата калия может временно достигать 0,7-
0,8 М — уровня, неблагоприятного для фермента-
140 Часть VI. Рост и дифференцировка клеток
Таблица 28.5. Активности, зависящие от осмотического давления у энтеробактерий
Функция Гены Активность Генетический контроль
Проницаемость наружной мембраны ompF отрС Подавление Индукция
Синтез связанного с мембраной олиго- mdoG, mdoH — Подавление
сахарида
Поглощение К+ trkA, trkE, trkll kdpA, kdpB, kdpC + Конститутивная активность Индукция
Поглощение бетаина proP + Умеренная индукция
proU + Сильная индукция
Синтез бетаина bet A В Индукция
Поглощение холина betT + Индукция
Синтез трегалозы otsA, otsB + Индукция
Распад трегалозы treA Индукция
Синтез <738, сигма-фактора, специфиче- ского для условий голодания rpoS Экспрессия специфического набора генов
Каналы, активируемые растяжением mscL _ 1 Конститутивная активность
мембраны
Система выведения KefA-K+ kef A — (при низком тургоре) 2 Конститутивная активность
Система выведения BetX-бетаин Неизвестны _ 3 Неизвестны
1 Каналы, активируемые растяжением мембраны; открываются при быстром снижении осмолярности среды.
2 Система выведения KefA-K+ выполняет основную роль в выделении К+ при накоплении специфических осморегулятор-
ных соединений, таких как бетаин и трегалоза.
3 Относительно системы выведения BetX—бетаин известно, что она существует, но данных о регуляции ее активности пока
недостаточно.
тивных функций. Таким образом, быстрый рост
клеток в данных условиях зависит от вторичных
ответов, главным образом от накопления совме-
стимых осморегуляторных соединений: бе-
таина (N-триметилглицина), пролина и трегало-
зы. Накопление этих растворенных веществ в от-
вет на изменение осмолярности наружной среды
обеспечивается регулируемой активностью транс-
портных систем и метаболических путей. Клет-
ки либо поглощают совместимые осморегулятор-
ные вещества из среды, либо синтезируют de novo.
По мере их накопления в цитоплазме происходит
контролируемое высвобождение калия и глутама-
та (рис. 28.11) и соответственно понижение кон-
центрации солей в цитоплазме.
Для большинства микроорганизмов возмож-
ность роста при высокой осмолярности среды
определяется способностью организма поддержи-
вать клеточный тургор и баланс растворенные
в цитоплазме веществ, не влияющих на функ-
ции ферментов. Уровень накопления в цитоплаз-
ме таких веществ — совместимых осморегуля-
торов— всегда зависит от осмолярности среды
как в случае поглощения этих веществ клетка-
ми, так и в случае их синтеза. Это означает, чтс
существуют сенсоры осмотического стресса, пре-
образующие наружный стимул в сигнал, переда-
ваемый внутрь клетки для регуляции метаболи-
ческих и транспортных активностей. Транспорт-
ные системы пронизывают клеточную мембрану г
имеют выход на поверхность; их активность соот-
ветствующим образом изменяется при осмотиче-
ском стрессе. Эти системы оказывают наибольшее
регуляторное влияние па внутриклеточную кон-
центрацию растворенных веществ и, следователь
по, могут служить как сенсорами, так и передат-
чиками сигнала.
Глава 28. Адаптация к экстремальным средам 141
Рис. 28.11. Изменение содержания растворенных ве-
ществ в цитоплазме при осморегуляции у Escherichia
coli. Показаны изменения внутриклеточных пулов бе-
таина, калия и глутамата. Осмолярность среды повы-
шали путем добавления 1 М глюкозы (показано сплош-
ной стрелкой). Через несколько минут к инкубационной
смеси добавляли бетаин (показано пунктирной стрел-
кой). Пунктирные линии — содержание растворенных ве-
ществ в присутствии бетаина; сплошные линии — со-
держание растворенных веществ в отсутствие бетаина.
Через несколько минут после повышения наружного ос-
мотического давления начинается синтез трегалозы, что
также вызывает потерю глутамата калия (эти данные
опущены для упрощения рисунка).
28.4.3. Роль генов, индуцируемых
при осмотическом стрессе
При адаптации к осмотическому стрессу у бакте-
рий наблюдаются изменения в экспрессии генов.
Осмотический стресс вызывает многочисленные
цитоплазматические эффекты, каждый из кото-
рых может действовать как сигнал к адаптивной
генной экспрессии. Два основных фактора, влия-
ющих на экспрессию генов у энтеробактерий,—
это изменение топологии ДНК и повышенный
уровень синтеза сигма-фактора ст38, ответственно-
го за экспрессию генов в зависимости от фазы ро-
ста (см. ниже). Кроме того, как первичными, так
и вторичными стимулами генной экспрессии мо-
гут служить временные изменения внутриклеточ-
ного pH и более длительные изменения концен-
траций растворенных веществ, таких как глута-
мат калия, бетаин, полиамины и ppGpp. Во время
вызванного осмотическим стрессом подавления
роста временные изменения в метаболизме мо-
гут приводить к образованию токсичных побоч-
ных продуктов, вызывающих индукцию других
регуляторных ответов, таких как репарация ДНК
или разложение пероксидов. Многие из генов, ак-
тивность которых индуцируют изменения осмо-
лярности среды, выполняют очевидную адаптив-
ную функцию (например, гены систем биосинтеза
или переноса специфических осморегуляторных
веществ). Другие гены, активируемые в условиях
осмотического стресса, столь очевидной функции
не обнаруживают. Следовательно, набор сигна-
лов, возникающих при осмотическом стрессе, при-
водит к экспрессии ряда генов (входящих в состав
«стимулона»), часть из которых не существенна
для осмоадаптации, но выполняет функцию под-
готовки клеток к более эффективному противо-
действию другим стрессовым факторам.
Как и в случае pH-стресса, первоначальные сиг-
налы, вызываемые осмотическим стрессом, нель-
зя рассматривать изолированно от общего от-
вета клетки. Адаптивные изменения некоторых
центральных активностей могут служить источ-
ником новых сигналов и оказывать новые стрес-
совые эффекты, каждый из которых требует
экспрессии определенных генов для необходимо-
го противодействия. Осмотический стресс вызы-
вает сдвиги во многих участках клеточного ме-
таболизма, сопровождается временными измене-
ниями внутриклеточного pH, а также влияет на
концентрацию низкомолекулярных компонентов
цитоплазмы. Любые из этих изменений могут вы-
звать специфический ответ. Кроме того, осмоти-
ческий стресс индуцирует общую реакцию стресс-
тол ераптиости, которая зависит от специфиче-
ских сигма-факторов (в случае Е. coli и Bacillus
subtilis — ст38 и <тв соответственно).
142 Часть VI. Рост и дифференцировка клеток
28.5. Изменения скорости роста вызывают адаптивный ответ
Большинство бактерий способно расти с раз-
личными скоростями в зависимости от присут-
ствия необходимых питательных веществ в сре-
де и значений физических параметров, таких как
температура, pH и осмотическое давление. Изме-
нением скорости роста обусловлен ряд адаптив-
ных феноменов, в частности повышение уровня
синтеза сигма-фактора ст38, от которого зависит
экспрессия многих генов, важных для выжива-
ния в экстремальных условиях. Следовательно,
от скорости роста клетки непосредственно перед
стрессом в основном зависит ее последующее вы-
живание.
В естественных местообитаниях скорость рос-
та ограничена наличием специфических пита-
тельных веществ, и один из наиболее часто
испытываемых микроорганизмами стрессов — это
голодание. Распространение многих патогенных
микроорганизмов зависит от их способности к вы-
живанию в течение долгих периодов вне организ-
ма-хозяина, большей частью в условиях, неблаго-
приятных по величинам pH, осмотического дав-
ления и температуры (особенно влияет при этом
низкая температура). Условия голодания, обу-
словленного недостатком питательных веществ,
вызывают у бактерий множество физиологиче-
ских изменений — при кратковременном голода-
нии немедленный строгий ответ (см. разд. 20.3),
при более длительном — переход в покоящее-
ся состояние (в этом состоянии микроорганиз-
мы иногда определяют как «жизнеспособные, но
некультивируемые»; см. разд. 33.5.1). При голода-
нии повышаются скорости оборота белков и син-
теза новых белков, многие из которых ассоци-
ированы с ответами на другие стрессы. Клетки
становятся одновременно устойчивыми к различ-
ным стрессам, таким как окислительный, осмоти-
ческий, кислотный, тепловой и электрофильный;
у некоторых бактерий свойство патогенности про-
является лишь после короткого периода голода-
ния.
28.5.1. При голодании в клетках происходят
существенные физиологические
изменения
Основные физиологические изменения, наблюда-
емые в клетках при голодании, связаны с наруше-
нием либо энергетического статуса, либо балан-
са элементов питания, в зависимости от того, ка-
кие источники питания лимитированы. При недо-
статке каждого элемента питания, необходимого
для роста, имеет место специфический клеточный
ответ, обычно приводящий к улучшению харак-
тера питания. Однако в случае продолжения пе-
риода голодания клетки осуществляют «жертвен-
ный» метаболизм с расщеплением некоторых спе-
цифических полимеров для обеспечения синтеза
других полимеров. При дальнейшем продолжении
голодания происходит сморщивание и округление
клеток (в случае палочковидных форм). Такого
рода изменения повышают отношение поверхно-
сти к объему клетки и способствуют поглощению
питательных веществ.
В некоторых случаях клетки воспринимают
дефицит питательных веществ как специфи-
ческий сигнал локализации. Например, дефицит
железа у многих патогенных бактерий приводит
к экспрессии генов патогенности и систем погло-
щения железа, предназначенных для противодей-
ствия защитному механизму хозяина (лимитиро-
ванию количества железа) при инфекции. Де-
фицит углерода у большинства гетеротрофов
приводит к немедленному снижению синтеза АТР.
Избыток углерода на фоне дефицита других ис-
точников питания вызывает изменение характе-
ра метаболизма («метаболизм избытка»), направ-
ленное на подавление процессов запасания энер-
гии, судя по тому, что в среде обнаруживаются
при этом высокоокисленные углеродные остовы.
При лимитировании роста источником азота про-
исходит выделение в среду кислот и снижение
наружного pH. Накопление в среде побочных про-
дуктов метаболизма может само по себе действо-
вать как сигнал адаптации. Например, индукция
синтеза антибиотика метиленомицина у стрепто-
мицетов происходит после периода дефицита азо-
та. Эффект дефицита азота можно имитировать в
условиях избытка азота путем простого подкисле-
ния среды. Таким образом, метаболизм бактерий
претерпевает глубокие изменения при дефиците
любого источника питания, и это может вызывать
специфические адаптивные реакции.
Основные изменения, наблюдаемые в клет-
ках при кратковременном голодании, существен-
но совпадают с теми, которые вызывает стро-
гий ответ (см. разд. 20.3). Бактериальные клет-
Глава 28. Адаптация к экстремальным средам 143
ки осуществляют строгий ответ при дефиците ис-
точника энергии или аминокислот (понижающая
регуляция, «shift-down»). Любое снижение ско-
рости роста (например, при адаптации клеток к
повышению наружного осмотического давления)
приводит к строгому ответу. Напротив, любая
стимуляция питания (например, смена анаэроб-
ных условий аэробными, добавление аминокистот
к минимальной среде), как правило, ослабляет
строгость регуляции, определяющей предел ско-
рости роста (повышающая регуляция, «shift-up»).
Основные изменения в синтезе РНК происходят в
течение секунд от начала строгого ответа и при-
водят к снижению транскрипции рРНК и тРНК.
Вследствие этого большую часть синтезирован-
ной РНК составляет мРНК, и клетки переходят
из состояния роста (синтез рРНК и тРНК необхо-
дим для синтеза белков) в состояние адаптации.
Строгий ответ может быть как временным, так и
«постоянным», что соответствует характеру отве-
та и на другие стрессы, описанные выше. Времен-
ным строгим ответом обеспечивается то, что ско-
рость синтеза рРНК и, следовательно, рибосом со-
ответствует ростовому потенциалу среды. Как и в
случае многих других регуляторных систем, стро-
гий ответ устанавливается в диапазоне значений
«включен», а не значений «включен/выключен».
В этом контексте «постоянство» относится к пе-
риоду времени до поступления нового источни-
ка питательных веществ; в условиях природных
местообитаний этот период может длиться неде-
лями.
28.5.2. Эффект стимул он а голодания
близок к строгому ответу
Многие из рассмотренных выше стрессовых ре-
акций обеспечивает экспрессия стимулона голо-
дания, в который входят гены, обеспечивающие
«страховку» организма в неблагоприятных усло-
виях. Активность этих генов у энтеробактерий
зависит, по имеющимся данным, от специфиче-
ской для условий голодания сигма-субъединицы
ст38. Этот белок (RpoS) выявлен у энтеробакте-
рий как фактор, определяющий выживание при
кратковременном голодании и важный для раз-
вития общей устойчивости клеток. Подобные бел-
ки могут присутствовать и у других бактерий,
на что указывают белковые профили клеток, на-
ходящихся в условиях голодания, а также об-
Рис. 28.12. Приобретение устойчивости к электрофиль-
ным агентам по мере снижения скорости роста (старе-
ния культуры). Клетки Escherichia coli выращивали в
синтетической среде и на разных стадиях роста куль-
туры определяли выживаемость клеток в присутствии
сильного электрофильного агента —100 мкМ N-этили-
мида малеиновой кислоты.
щий для многих микроорганизмов феномен мно-
жественности сигма-субъединиц, регулирующих
блоки генов, связанные с адаптацией. Экспрессия
ст38 необходима для приобретения толерантности
к широкому диапазону стрессовых условий.
Клетки Е. coli, содержащие значительное ко-
личество белка RpoS (<т38), устойчивы к высокой
осмолярности среды, низкому pH, высокой тем-
пературе и электрофильным агентам (рис. 28.12).
Этот белок накапливается во всех случаях сни-
жения скорости роста (не обязательно его оста-
новки) и, следовательно, при экспоненциальном
росте «стимулов голодания» может экспресси-
роваться на значительном уровне. Ряд ассоции-
рованных с голоданием генов регулируется без
участия RpoS; на их экспрессию влияют регу-
ляторные системы, специфичные к основным ис-
точникам питания в случае их лимитирования.
Например, при голодании по углероду (инкуба-
ции в минимальной среде) клетки Е. coli в тече-
ние нескольких часов синтезируют более 50 бел-
ков (относительно специфический набор). Синтез
32 из этих белков стимулируется непосредственно
фактором ст38, тогда как остальных — повышени-
ем концентрации сАМР, вызванным недостатком
источника углерода (см. разд. 20.2).
Транскрипция кодирующего <т38 гена rpoS
происходит на всем протяжении роста культуры,
но специфически ее индуцируют слабые кисло-
144 Часть VI. Рост и дифференцировка клеток
ты и начало стационарной фазы. Важно, одна-
ко, что продукт гена rpoS подвержен регуляции
на посттранскрипционном уровне, вследствие че-
го белок а38 аккумулируется только при неопти-
мальных для роста условиях, в стационарной фа-
зе развития культуры (рис. 28.13). При осмотиче-
ском стрессе скорость роста снижается и происхо-
дит накопление <т38. Оба эти эффекта обратимы;
они элиминируются при добавлении совмести-
мых осморегуляторных веществ, например бета-
ина. Весьма сложный механизм регуляции накоп-
ления сг38 (рис. 28.13) включает протеолиз, подоб-
но механизму регуляции, описанному выше для
сигма-фактора теплового шока. Протеолиз сг38
катализирует протеаза ClpPX (см. разд. 19.3.4),
регулируемая двухкомпонентной системой RssB.
Природа сигнала из окружающей среды, прини-
маемого системой RssB, пока неясна. Для Е. coh
установлено, что синтез <т38 стимулируется уров-
нем нуклеотида ppGpp, концентрация которого
при большинстве условий роста обратно пропор-
циональна скорости роста (см. разд. 20.3).
Щелочной pH
Компоненты жидкой
среды
Гистоноподобные
белки
Сигналы из
окружающей
среды
Ген
rpoS
!©
I
Транс-
крипция
i©
▼
мРНК —— * Белок
Транс-
ляция
Стабилизация
Активная
, 38
субъединица а
RssB
i®
▼
ClpPX
Транскрипция генов
«сети безопасности»
Рис. 28.13. Факторы, вызывающие повышение концен-
трации белка RpoS в клетках Escherichia coli. Транс-
крипция гена rpoS несколько снижается при pH среды,
более высоком, чем рНвнуТр. (pH 7,5), а также под
влиянием компонентов среды. Трансляцию ингибируют
гистоноподобные белки; предположительно для стаби-
лизации белка RpoS требуется ppGpp. Концентрация
белка RpoS зависит в основном от протеолиза под дей-
ствием протеазы ClpPX, активность которой в свою оче-
редь определяет ответный регулятор RssB. Возможно,
белок RssB воспринимает сигналы из окружающей сре-
ды. связанные со скоростью роста, но природа этих сиг-
налов пока неизвестна.
Дополнение 28.6. Синтез факторов ви-
рулентности можно рассматривать как
ответ на стрессовое воздействие. Стресс-
реакции выполняют две совершенно различ-
ные роли в патогенезе. Во-первых, описанные
выше ответы па стрессовые условия обеспечи-
вают обход микробными клетками механиз-
мов защиты, которыми обладает организм-
хозяин. Во-вторых, восприятие средовых сти-
мулов позволяет бактериям экспрессировать
специфические белки, способствующие ин-
фекции. При внедрении в организм-хозяин
бактерии экспрессируют несколько факто-
ров вирулентности (см. разд. 33.3). Синтез
этих белков, зависящий от влияния фак-
торов среды, регулируется посредством ме-
ханизмов, общих для регуляции различных
стресс-реактивных генов. Так, выживание в
фагосомах зависит от устойчивости к кислым
значениям pH, токсичным супероксид-иону и
пероксиду водорода, а также к действию
ферментов деградации и катионных пепти-
дов. Каждое из этих свойств клетки при-
обретают благодаря экспрессии «стимулона
голодания», инициируемой с участием фак-
тора сг38.
В растущих клетках основная функция строго-
го ответа состоит в поддержании необходимого ба-
ланса между синтезом рРНК и тРНК, с одной сто-
роны, и скоростью роста, с другой стороны. Стро-
гий ответ действует при всех скоростях роста, то-
гда как аккумуляция сг38 происходит только при
снижении скорости роста. Важно подчеркнуть,
что сг38 присутствует и обладает активностью в
экспоненциально растущих клетках, а не только в
условиях голодания или в стационарной фазе ро-
ста. Вместе с тем от сг38 зависит экспрессия боль-
шого набора генов, участвующих в преодолении
стресса. Внезапное изменение скорости роста, вы-
званное дефицитом питательных веществ и уров-
нем ppGpp либо воздействием экстремальных
факторов, стимулирует экспрессию «стимулона
голодания», который с низкой скоростью экс-
прессируется при всех неоптимальных условиях
роста.
Глава 28. Адаптация к экстремальным средам 145
28.6. Заключение: стресс-реакция — это усиленный нормальный ответ
В течение долгого времени считалось, что адап-
тация к различным стрессам обусловлена специа-
лизированными функциями клеток, позволяющи-
ми им выживать в различных неблагоприятных
условиях. Однако на самом деле стресс-реакции
правильнее рассматривать в рамках нормального
роста и метаболизма. Адаптация к стрессу за-
ключается главным образом в усилении активно-
сти тех же механизмов, которые действуют при
нормальном росте, т. е. при стрессе происходит
изменение лишь в соотношении различных ак-
тивностей клеток. Для некоторых генетических
систем это значительное изменение уровня экс-
прессии, тогда как для других относительно
небольшое. Причины различий в истолковании
стресс-ответов очевидны. Наше восприятие эф-
фектов, связанных со стрессом, в большой степе-
ни обусловлено антропоцентричностыо позиции.
Часто исследователи тщательно определяют усло-
вия, подавляющие реакцию организма или прово-
цирующие ее, и гораздо меньше внимания обра-
щают та то, что означает «отсутствие стресса»
для микроорганизма. В первую очередь по этой
причине реакции на стресс рассматривают как
особые события, вместо того, чтобы определять
их как интеграцию процессов роста и выживания.
Дополнительная литература
Adams М. W. W. (1994) Enzymes and proteins from
organisms that grow near and above 100 °C. Anna.
Rev. Microbiol. 47: 627-658.
Booth L R., Douglas R. M., Fergusson G. P., Lamb A. W.,
Ritchie G. J. (1993) In: Bakker E. P. (ed.) Alkali
cation transport systems in prokaryotes. Boca. Raton.
Fla.: CRC Press; 291-308.
Booth I. R., Jones M. A., NcLaggan D., Nikolaev Y.,
Ness L., Wood С. M., Miller S., Totemeyer S., Fer-
gusson G. P. (1996) Bacterial ion channels. In:
Konings W. N., Kaback II. R., Lolkema J. S. (eds.)
Handbook of biological physics, vol. 2. Transport
processes in eukaryotic and prokaryotic organisms.
Amsterdam: Elsevier; 693-729.
CsonkaL. N., Epstein W. (1996) Osmoregulation.
In: Neidhardt F. C., Curtiss R., Ingraham J. L.,
Lin E. С. C., Low К. B., Magasanik B., Reznikoff W.,
Riley M., Schaechter M., Umbarger H. E. (eds.)
Escherichia coli and Salmonella: cellular and
molecular biology 2nd edn. Washington, DC: ASM
Press; 1210-1224.
Dem pie B. (1991) Regulation of bacterial oxidative stress
genes. Annu. Rev. Genet. 25: 315-339.
Dorman C. J., NiBhriain N. (1993) DNA topology and
bacterial virulence gene regulation. Trends. Micro-
biol. 1: 92-99.
Galinski E. A., Trupcr II. G. (1994) Microbial behaviour
in salt-stressed ecosystems. FEMS Microbiol. Rev.
15: 95-108.
Gross C. A (1996) Function and regulation of the
heat shock proteins. In: Neidhardt F. C., Curtiss R.,
Ingraham J. L., Lin E. С. C., LowK.B., Magasa-
nik B., Reznikoff W., Riley M., Schaechter M., Um-
barger H. E. (eds.) Escherichia coli and Salmonella:
cellular and molecular biology. 2nd edn. Washington;
DC: ASM Press; 1382-1399.
Hartl F.-U, Hlodan R., Langer T. (1994) Molecular cha-
perones in protein folding: the art of avoiding sticky
situations. Trends Biochem. Sci. 19: 20-25.
Hecker M., Schumann W., Volker U. (1996) Heat-shock
and general stress response in Bacillus subtilis. Mol.
Microbiol. 19: 417-428.
Kjellbcrg S., ed. (1993) Starvation in bacteria. New York
London: Plenum Press.
Koch A. (1983) The surface stress theory of microbial
morphogenesis. Adv. Microbial. Physiol. 24: 301-336.
RjningsW. N., Kaback H.R., Lolkema J. S., eds. (1996)
Handbook of biological physics. Vol. 2. Transport
processes in eukaryotic and prokaryotic organisms.
Amsterdam: Elsevier.
Lin E. С. C., Linch A.S., eds. (1995) Regulation of gene
expression in Escherichia coli. Austin, Tx.: Landes.
Loewen P. C., Hengge-Aronis R. (1994) The role of the
sigma factor crs (KatF) in bacterial global regulation.
Annu. Rev. Microbiol. 48: 53-80.
Miller K..J., Wood J. M (1996) Osmoadaptation by
rhizosphere bacteria. Annu. Rev. Microbiol. 50:
101-136.
Padan E., Schuldiner S. (1994) Molecular physiology of
Na+/H+ antiporters key transporters in circulation of
Na+ and H+ in cells. Biochim. Biophys. Acta 1185:
129-151.
Schwcder T., Lee К.-H., Lomovskaya O., Matin A. (1996)
Regulation of Escherichia coli starvation sigma factor
(cs) by ClpXP protease. .1. Bacteriol. 179: 470-476.
Slonczewski J. L., Foster J. W. (1996) pH-regulated
genes and survival at extreme pH. In: Neid-
hardt F. C., Curtiss R., Ingraham J. L., Lin E. С. C.,
LowK.B., Magasanik B., Reznikoff W., Riley M.,
Schaechter M., Umbarger H. E. (eds.) Escherichia coli
146 Часть VII. Рост и дифференцировка клеток
and Salmonella: cellular and molecular biology, 2nd
edn. Washington, DC: ASM Press; 1539-1549.
Stumpe S., Schlosser A., Schleyer M., Bakker E. P.
(1996) K+ circulation across the prokaryotic cell
membrane: K+ uptake system. In: KoningsW. N.,
KabackH. R., Lolkema.J.S. (eds.) Handbook of
biological physics. Vol. 2. Transport processes in
eukaryotic and prokaryotic organisms. Amsterdam:
Elsevier, 473-500.
YuraT., Nagai H., Mort H. (1994) Regulation of the
heat-shock response in bacteria. Annu. Rev. Micro-
biol. 47: 321-350.
Источники рисунков
1. Hartl F.-U., Hlodan R., Langer T. (1994) Trends
Biochem. Sci. 19: 20-25.
2. Kroll R.G., Booth J. R. (1981) Biochcm. .1. 198:
691-698.
3. McLaggan D., SelwynM.J., Dawson A. P. (1984)
FEES Lett. 165: 254-258.
4. Killham K., Firestone M. К. (1984) Appl. Environ.
Microbiol. 47: 301-306.
Часть VII
РАЗНООБРАЗИЕ И
СИСТЕМАТИКА
Глава 29
Разнообразие и систематика прокариот
Прокариоты, древнейшие и повсеместно распрос-
траненные организмы, в значительном своем
большинстве в науке не описаны. По сравнению
с общим числом известных видов животных, рас-
тений и низших эукариот число описанных видов
прокариот удивительно мало. Бактерии (Bacteria)
и археи (Archaea) составляют, по имеющимся дан-
ным, всего 0,2% всех известных видов живых
организмов, и это кажется неправдоподобным,
если учесть, что прокариоты, возможно, воз: шкли
более 3,5 млрд, лет назад и заселяют все исследо-
ванные природные местообитания. Они найдены в
таких экстремальных условиях среды, где жизнь,
казалось бы, невозможна: под соляными корками
высохших озер в Восточно-Африканской долине,
в районах фумарол, гейзеров, сольфатар и мор-
ских глубоководных каналов гидротерм, в щелоч-
ных озерах, внутри скал в Антарктике и внутри
тел беспозвоночных. Для сравнения, насекомых
насчитывается более миллиона видов и появились
они в кембрийский период, т. е. менее 600 млн. лет
назад.
Чем объяснить столь малое число видов
прокариот, остается неясным, и здесь рассмат-
риваются две возможные причины. Во-первых,
определение вида в бактериологии не сравнимо
с тем, которое используется в классификации
высших эукариот. Так называемая биологическая
концепция вида не может быть применена к про-
кариотам, поскольку, с одной стороны, у них от-
сутствуют гаметы и мейоз, и, с другой сторо-
ны, обмен генетическим материалом происходит
часто даже между отдаленно родственными
видами. Синапоморфные (общие производные)
признаки, на которых основана классификация
высших эукариот, труднее выявить среди про-
кариот, в связи с тем что они не имеют эм-
бриогенеза, анатомического строения и сложной
морфологии. Определение вида в бактериологии
искусственное, и при этом идентификация новых
видов представляет собой весьма трудоемкую
процедуру исследования филогенетических рас-
стояний, химических компонентов клеток, фи-
зиологических и морфологических признаков.
Во-вторых, большинство наблюдаемых в природе
прокариот не удается культивировать, из-за чего
невозможна их идентификация. Доля видов про-
кариот, существующих, по имеющимся сведени-
ям, в природе, по не выделенных в виде культур,
оценивается как 95-99% всех микроорганизмов.
На Земле, по-видимому, нет мест, не засе-
ленных микроорганизмами, и в то же время
оценить все многообразие прокариот полностью
пока невозможно. Прокариоты, очевидно, были
единственными формами жизни на пашей пла-
нете в течение более двух миллиардов лет. Мир
прокариот характеризуется огромным генетичес-
ким разнообразием, благодаря которому диапа-
зон физиологических и биохимических активнос-
тей в нем значительно более обширен, чем в
мире высших организмов. Митохондрии и хло-
ропласты микроорганизмов-эукариот и макро-
организмов произошли из бактерий. Таким обра-
зом, эукариотические клетки представляют собой
химерные структуры, многие гены которых име-
ют прокариотическое происхождение.
Микроорганизмам принадлежит ключевая
роль в поддержании жизни на Земле. Способ-
ность микробов разлагать и использовать всевоз-
можные природные материалы и промышленные
отходы определяет их чрезвычайно важную роль
в экологических процессах. Участие бактерий в
геохимических циклах азота, серы, углерода и
металлов, в связывании атмосферного азота, ко-
торое обеспечивает азотное питание растений, и
расщеплении макромолекул в пищеварительном
тракте человека и животных описано в последу-
ющих главах книги (гл. 30-32).
Микробные штаммы, поддерживаемые
в коллекциях, приспособлены к росту на
синтетических питательных средах □ Из-
вестные к настоящему времени микроорганиз-
мы следует рассматривать, таким образом, лишь
как малую часть обитающих в природе видов,
обнаруженную с помощью традиционных методов
исследования и классификации. Биохимическую
и геохимическую активность микроорганизмов в
естественной среде обитания сейчас можно до-
вольно полно характеризовать благодаря приме-
нению меченых атомов, стабильных изотопов и
Глава 29. Разнообразие и систематика прокариот 149
микроэлектродов, но обнаружить сами клетки тех
или иных прокариот или грибов в природных
местообитаниях значительно труднее по причи-
нам, связанным с их малыми размерами, сезон-
ностью роста, морфологической изменчивостью в
зависимости от наличия хозяина или субстрата,
а также способностью многих прокариот превра-
щаться в такие формы (стадии жизненного цик-
ла), которые не могут быть обнаружены. Сей-
час уже можно считать общепризнанным, что
микроорганизмы, выращиваемые в виде чистых
культур в лаборатории, — это объекты, которые
паилучшим образом адаптированы к искусствен-
ным условиям роста и не обязательно представ-
ляют собой клетки, метаболически активные и
встречающиеся в значительном количестве в при-
роде.
Пока нс идентифицировано большинство ви-
дов микробов и нет сведений об их распростра-
нении в естественных местообитаниях, как и о
роли в общей пищевой цепи, невозможно пол-
ностью оценить разнообразие микроорганизмов.
В связи с этим любая классификационная схе-
ма, ограниченная набором штаммов из коллек-
ций, должна быть достаточно гибкой для того,
чтобы допускать изменения па любом таксоно-
мическом уровне для внесения сведений о но-
вых выделенных организмах. Кроме того, пока не
будут накоплены новые данные в области так-
сономии, физиологии и экологического взаимо-
действия микроорганизмов, останутся неясными
вопросы о том, повсеместно ли распространены
свободноживущис микроорганизмы и необходимо
ли хранить микробные виды in situ для последу-
ющего восстановления той или иной активности в
данной среде.
Природная среда — неисчерпаемый ис-
точник новых для науки микробов □ По-
пытки определить число видов прокариот в том
или ином образце из окружающей среды (обыч-
но не больше нескольких граммов почвы или со-
тен литров воды) ранее ограничивались тем, что
в нем определяли известные физиологические и
морфологические группы. Выявление всех видов
в исследуемом местообитании, по-видимому, еще
не скоро станет реально возможным, поскольку
пока неизвестен масштаб числа видов и полный
диапазон генетического, физиологического и био-
химического разнообразия микроорганизмов. Для
продвижения в этой области крайне необходимы
новые методы культивирования, с помощью кото-
рых можно было бы выявлять и описывать новые
организмы.
Наша неспособность оценить все разнообразие
микробов связана не только с тем, что не удается
подобрать условия для получения чистых куль-
тур новых микроорганизмов. Основная ее при-
чина—это неумение получать рост так называ-
емых некультивируемых, покоящихся форм, т. е.
жизнеспособных, но не поддающихся культивиро-
ванию. Лишь в последнее время благодаря при-
менению молекулярно-биологических методов,
таких как экстракция нуклеиновых кислот непо-
средственно из окружающей среды, полимеразная
цепная реакция (ПЦР) и секвенирование нуклео-
тидных последовательностей, микробиологи впер-
вые получили возможность оценивать разнооб-
разие прокариот в природных образцах. Имеет-
ся также возможность идентифицировать виды
микроорганизмов путем анализа генетического
материала, главным образом секвенирования кон-
сервативных макромолекул. Поскольку такие по-
следовательности высокоспецифичны для данно-
го вида, создается база данных, с которой можно
сравнивать любую новую последовательность и
на основании этого идентифицировать новые изо-
ляты. Хотя сравнение последовательностей пока
не позволяет сделать качественную или количе-
ственную оценку всего разнообразия прокариот,
уже можно говорить о крупном шаге вперед в
микробной экологии. Сравнительный анализ по-
следовательностей с последующей идентификаци-
ей различий дает возможность выявлять новые
группы прокариот, но одного этого подхода недо-
статочно для охвата всего видового разнообразия,
оценки численности каждого вида, его физиоло-
гических свойств и экологической роли.
Громадное большинство обитающих в природе
прокариотических организмов пока не выделено
в виде культур. Имеющиеся коллекции содержат
лишь малую толику обитающих в природе микро-
организмов, и это означает, что все разнообразие
физиологических и биохимических возможностей
и тем самым биотехнологический потенциал про-
кариот, а также их экологическая роль до конца
пока неизвестны. Сравнение различных по гео-
графическому происхождению образцов той или
иной природной среды (например, морской во-
ды или почв из разных частей света) показывает
определенное сходство в видовом составе микро-
флоры, по одновременно значительные различия.
150 Часть VII. Разнообразие и систематика
Для сложных по составу сред обитания, таких как
почва, характерно большее разнообразие микроб-
ных видов, чем для сред, экстремальных по усло-
виям pH, солености или температуры, например
таких, как горячие источники или рудные отва-
лы, где осуществляется выщелачивание металлов.
К сложным средам обитания относятся и хозяева-
эукариоты, каждый из которых может содержать
по крайней мере один новый вид прокариот.
Термин микроорганизмы используется в этой
главе в применении к прокариотам, но многие так-
сономические принципы и стратегии классифи-
кации, рассматриваемые на примере бактерий и
архей, применимы также и для эукариотических
микроорганизов. Это означает, что методы, ис-
пользуемые сейчас для классификации бактерий,
приемлемы и в систематике мицелиальных гри-
бов, дрожжей, простейших и микроводорослей.
29.1. Систематика бактерий — одно из начал сравнительной биологии
Как подчеркивал Ф. Добжанский, «ничто в био-
логии не имеет смысла, кроме как в свете эволю-
ции». В то же время развитие систематики мик-
робов сложилось таким образом, что средний сту-
дент или микробиолог-исследователь может быть
осведомлен только о номенклатуре. Мы подразу-
меваем под этим, что внимание в систематике уде-
ляется главным образом изменению названий и
выделению новых таксонов, а не теории и фило-
софии классификации, совершенствованию мето-
дологии или выяснению вопросов эволюции и раз-
нообразия микроорганизмов. Чтобы охватить все
эти аспекты, прежде всего необходимо рассмот-
реть, что такое систематика и почему в ней так
важны верные определения.
29.1.1. Зарождение систематики связано
с трудами естествоиспытателей прошлого
Первую научную и основополагающую класси-
фикацию живых организмов представил в сво-
ей «Системе природы» Карл Линней (1707-1778).
Соответственно духу времени она была проник-
нута пониманием природы как божественного
творения. Когда же спустя столетие появилась
дарвиновская концепция эволюции, систематика
подверглась под ее влиянием решительному пе-
ресмотру. В развитии систематики основным ста-
ло эволюционное направление. Определяя мес-
то систематики в биологии, зоологи, например
Дж. Симпсон, рассматривали ее как основу зоо-
логии, поскольку нельзя изучать животных, пока
не установлена определенная таксономия, и, кро-
ме того, как всеобъемлющую часть зоологии, сум-
мирующую все, что известно о животных, будь
то сведения из области морфологии, физиологии,
психологии или экологии. Известный систематик
Э. Майр подчеркивал, что систематика — это об-
ширная наука о разнообразии организмов. Вы-
ражая свои взгляды, он писал: «в действитель-
ности систематика — это один из основных под-
разделов биологии: опа шире в своей основе, чем
генетика или биохимия, и выполняет нс только
подсобную роль, делая возможной идентифика-
цию и классификацию, но имеет также целью
сравнительное изучение организмов во всех аспек-
тах, а также выяснение роли высших и низших
таксонов в экономике природы и естественной ис-
тории. Она подразумевает синтез многих отрас-
лей знаний, теорий и методов, применяемых на
всех уровнях и направлениях классификации. Ко-
нечная задача систематика — не только описать
все разнообразие мира живых организмов, но так-
же способствовать его пониманию». В соответ-
ствии с этой концепцией систематика становит-
ся все более комплексной областью исследований.
Приведенные постулаты и содержание последую-
щих разделов должны ясно показать, что под си-
стематикой следует понимать нечто большее, чем
присвоение названий организмам. Согласно одной
точке зрения, понятия «систематика» и «таксоно-
мия» в сущности представляют собой синонимы,
тогда как по другой необходимо четко отличать
Глава 29. Разнообразие и систематика прокариот 151
Таксономия
Идентификация
Разносторонняя
характеристика
I
Применение теории и
метода классификации
Ф
Формирование таксономических
групп (таксонов)
Определение признаков с помощью
определенного набора тестов,
предварительно выбранных
в соответствии с изучаемой проблемой
I
Известные _____> Сравнение с
виды известными видами
Рис. 29.1. Взаимосвязь междуописани-
ем, классификацией и номенклатурой в
таксономии прокариот.
I
Присвоение таксонам
названий (номенклатура)
Отнесение к известному Нетождественность
виду (идентификация) с известными видами
(новый вид)
При необходимости
таксономический анализ
таксономию как теорию и практику классифи-
цирования организмов. Современная таксо-
номия включает три аспекта (см. рис. 29.1):
1) описание (получение данных о свойствах ор-
ганизмов), 2) классификация (теория и про-
цесс классификации организмов) и 3) номен-
клатура (присвоение названий соответствующе-
го таксономического ранга классифицируемым
организмам). Идентификацию не следует рас-
сматривать как часть таксономии; хотя, подобно
таксономии, опа связана с описанием организмов
и основана на сравнении их с известными таксо-
нами, рамки и цели идентификации существенно
уже.
29.1.2. Описание прокариот должно включать
данные о генотипе и фенотипе
Достоверность описания организма зависит от
используемых для его изучения методов. Полу-
чаемые данные в основе разделяются на фено-
типические и генотипические. Генотип пред-
ставлен геномом — совокупностью генов, содер-
жащих всю сумму наследуемой информации о
признаках организма (генетическая инфор-
мация), тогда как фенотип — это сумма всех
наблюдаемых признаков организма (на уровне
генотипа и фенотипа), составляющих феном
(фенетическая информация). Принято также
различать информацию, представленную непо-
средственно генами (генетическую) и продуктами
генов (эпигенетическую).
29.1.3. Классификация прокариот: субъективная
обработка объективных данных
Ни одну известную классификацию нельзя рас-
сматривать как «чистую» систему; чаще клас-
сификации предназначены для решения тех или
иных задач. Например, недавно введено деление
микроорганизмов на группы риска, т. е. на четы-
ре категории, которые представляют разные уров-
ни патогенности, или риска, для растений, жи-
вотных, человека и окружающей среды; никаким
иным целям это деление не служит. Другой прин-
цип классификации микробов основан па эволю-
ционном подходе, и он сейчас приходит на смену
прежнему направлению — систематике без учета
эволюции.
Дополнение 29.1. За время развития
биологии были созданы различные системы
классификации, и некоторые из них исполь-
зуются параллельно.
Эссенциализм — теория додарвиновского
периода, сутью которой была классификация
организмов согласно их основным свойствам.
Возникшая из представлений о сотворении
мира, она никак не касалась проблемы парал-
лелизма или конвергентной эволюции.
Номинализм отрицает реальность так-
сономических категорий, таких как виды,
роды или семейства, рассматривая их как
«артефакты» научного сознания. В опровер-
жение такого негативного взгляда можно ука-
зать на группы организмов, имеющих общего
предка и в различной степени биологически
сходных между собой. Это группирование не
152 Часть VII. Разнообразие и систематика
может быть продуктом человеческой логики;
оно отражает биологическую эволюцию. Тем
не менее, выбор критериев для выделения та-
ких групп номиналисты считают искусствен-
ным.
Эмпирицизм основан на представлении
о том, что для создания системы организ-
мов не требуется ни эволюционного подхода,
ни какой-либо другой теории классификации.
Группы обозначаются сами собой, когда опре-
делено и адекватно проанализировано доста-
точное число параметров изучаемых организ-
мов.
Фенетику часто называют нумерической
или численной таксономией либо нумериче-
ской фенетикой. Значение этого подхода для
таксономического анализа подробно рассмат-
ривается в разд. 29.2.
Кладистика (от греч. кХаёск; — ветвь)
рассматривает последовательное обособление
отдельных ветвей на филогенетическом дре-
ве и, вероятно, относится к наиболее проти-
воречивым направлениям систематики. Эту
область разрабатывают исследователи раз-
личных взглядов — от тех, кто исходит из так-
сономических принципов Дж. Симпсона, до
последователей «трансформированной кла-
дистики», или «кладистики паттернов», не
считающих, что ход эволюции важен для
определения родственных связей между так-
сонами. Как заметил в связи с этим С. Коуэн,
«поскольку мы ничего не знаем о филетиче-
ских линиях, или конвергенции, среди мик-
робов, кладистика неприменима к микробной
таксономии».
Искусственные классификации обычно
предназначены для решения определенных
задач и характерны для сферы приклад-
ной микробиологии. Примерами их могут
быть попытки группирования продуцентов
антибиотиков или других веществ, при кото-
ром в одну группу попадают представители
различных физиологических групп (напри-
мер, метилотрофы, автотрофы, нитрифика-
торы и метаногены). Подобные классифи-
кации не следует рассматривать как непра-
вомочные или неадекватные, поскольку они
полезны для определенных целей. Искус-
ственная классификация может нс отра-
жать действительное разнообразие внутри
выделенных групп. Организмы могут быть
распределены по таксономическим рангам,
таким как вид, род и семейство (см. «Опре-
делитель бактерий Берджи», издания 1-8),
однако в этих рангах не следует искать
какого-либо эволюционного содержания.
Эволюционная систематика, согласно
Э. Майру, исходит из дарвиновских концеп-
ций. Она охватывает ряд аспектов, включая
фенетическую концепцию «общего сходства»,
возможную эволюционную дивергенцию так-
сонов и их последующее эволюционное разви-
тие.
Филогенетическая классификация □
Термин «филогенетический», как производ-
ный от «филогении», происходит от грече-
ских слов <риХт) — (племя, колено) и уе/'т/ц
(происхождение, развитие). Впервые пред-
ложенный Э. Геккелем (1834-1919), одним
из наиболее ревностных приверженцев тео-
рии Дарвина (1809-1882), термин филогения
был введен как вариант взамен более ста-
рого термина систематика. У различных ав-
торов понятие «филогения» имеет неодинако-
вое содержание, и часто его заменяют таки-
ми терминами, как естественные родственные
связи или генеалогия. Под филогенией сле-
дует понимать ход (за геологическое время),
скорость и характер эволюции той или иной
группы организмов. В идеале филогенетиче-
ская классификация должна выявлять пред-
ковые таксоны и указывать продолжитель-
ность их эволюционирования до новых так-
сонов.
Биологические системы классификации основа-
ны на принципе выявления сходства организмов.
В соответствии с этим различные группы, неза-
висимо от того, представляют ли они собой при-
знанные таксоны (род, семейство и т. д.) или нет,
обычно объединяют организмы, в той или иной
степени «сходные» по некоторым или по всем
признакам. Микробные штаммы можно группи-
ровать несколькими способами, но наиболее пер-
спективно выделение групп по филогенетичес-
кому, генеалогическому родству, поскольку оно
объясняет многообразные генетические и биохи-
мические свойства.
Глава 29. Разнообразие и систематика прокариот 153
29.1.4. Сравнительная биология основана
на принципе гомологий
Для описания степени сходства предложены раз-
личные термины, в том числе подобие, близость,
родство и гомология (см. дополнение 29.2). Каж-
дый из этих терминов применим в любой систе-
ме классификации, но с некоторыми возможны-
ми различиями в их определении или интерпре-
тации. В рамках эволюционного подхода понятия
родство и гомология подразумевают происхожде-
ние от общего предка. Несмотря на простоту этой
идеи и невозможность наблюдать ход эволюции
ни в прошлом, ни в настоящем, концепции род-
ства и гомологии получили наибольшее призна-
ние со времени опубликования Дарвином в 1859 г.
его «Происхождения видов».1
Дополнение 29.2. Согласно классическим
определениям, гомология подразделяется на
«истинную гомологию» и «ложную гомоло-
гию». Термин гомология относится к «истин-
ной гомологии», тогда как для «ложной го-
мологии» используются термины «аналогия»
и «гомоплазия».
Гомология — это наличие у двух таксонов
общего свойства, ведущего происхождение от
одного и того же или эквивалентного свой-
ства у ближайшего общего предка.
Аналогия — это сходство не в результате
общего происхождения, но в связи с общей
функцией (например, крыльев у насекомых,
птиц и летучих мышей).
Гомоплазия может возникать вследствие
параллелизма (параллельной эволюции),
конвергенции (конвергентной эволюции)
или изменения направления эволюции на 1 2
обратное (возврата к менее сложному или бо-
лее раннему состоянию). Помимо этих терми-
нов, в научной литературе используются сле-
дующие понятия.
Изология — значительное сходство, отно-
сительно которого неизвестно, является ли
оно ортологичным, паралогичным или ксено-
логичным.
Ортология — понятие, эквивалентное «ис-
« 2
типнои гомологии».
Паралогия означает паралеллизм, обыч-
но как результат дупликации генов (следова-
тельно, исходно он трактовался как «истин-
ная гомология»). Параллелизм может быть
представлен одним признаком или комбина-
цией признаков у одного и того же организ-
ма (например, таких как семейства фосфо-
трансфераз, множественные изоферменты,
ДНК-полимеразы, ДНК-топоизомеразы).
Ксенология — приобретение свойств, явно
«чуждых» данному организму, обычно вслед-
ствие горизонтального переноса генов или
слияния эволюционных линий (например, это
может быть устойчивость к антибиотикам
или «химерные» свойства криптомонад).
В сравнительной биологии, таким образом, су-
щественно знать, является ли данное свойство
гомологичным (ортологичным) или оно общее у
исследуемых организмов вследствие гомоплазии
(параллелизма, конвергенции). Трудности в опре-
делении гомологии возникают, как будет ясно из
дальнейшего изложения, на всех уровнях био-
логической классификации, от фенотипического
(эпигенетического) до генетического.
1 Необходимо иметь в виду, что гипотеза о самозарождении жизни на Земле и эволюции живых организмов не относится
к научно достоверным. Как известно, она противоречит 2-му закону термодинамики, исключающему возможность подоб-
ного усложнения в природе на основе случайных событий (см. Э. Шредингер. Что такое жизнь с точки зрения физики?
М., ИЛ, 1947; переиздание: Э. Шредингер. Что такое жизнь? Иж.-М., РХД, 2002). Факты, на которые опирается теория
эволюции, по правилам формальной логики не могут служить доказательствами ее истинности. Опровергающие данные,
в том числе по датированию истории Земли, накапливаются, в частности, в Интернете на сайте www.evolution—facts.org.
Прим. сед. ред.
2 Это верно в отношении признаков, но не в отношении последовательностей. Последовательности могут быть гомоло-
гичными (т. е. иметь одно происхождение), но не ортологичными (имеют разные функции). Пример гсмоглооин (белок
крови) и миоглобин (мышечный белок). Поэтому для последовательностей эти термины не синонимы. — Прим. спец. ред.
154 Часть VII. Разнообразие и систематика
29.1.5. Истинную гомологию
трудно определить
ческим аппаратом, механизмами движения либо
хемотаксисом.
Существование гомологичных структурных эле-
ментов клеток, таких как молекулы, органеллы
или другие клеточные компоненты, указывает па
общее генетическое происхождение организмов, и
принцип гомологии может служить основой для
определения филогенетических, т. с. естествен-
ных, родственных связей. Хотя временная шка-
ла, используемая в настоящее время для оценки
периодов эволюции молекул, далека от точнос-
ти, предполагаемая последовательность эволю-
ционных событий позволяет построить систему
филогенетической классификации, в которой ор-
ганизмы группируются согласно их эволюционной
истории (генеалогии) и не обязательно по их сов-
ременным особенностям.
Выявление генеалогии прокариот представля-
ет значительные трудности по двум причинам.
Во-первых, для выведения генеалогических ли-
ний не имеется достаточного количества иско-
паемых остатков и по сохранившимся ископае-
мым остаткам невозможно анализировать геном и
фенотипические признаки. Во-вторых, у прокари-
от отсутствует сложная морфологическая струк-
тура, которая у эукариот помогает определению
гомологий. Филогенетическая система подразуме-
вает соответствие линий эволюции и надвидовых
таксонов, описываемых таксономистамп. В осно-
ве описания филогенетически достоверного таксо-
на любого ранга лежит представление о том, что
все включаемые в него организмы произошли от
одной предковой формы и свойства, возникшие у
этой предковой формы, встречаются только у се
потомков.
Основная проблема, с которой сталкиваются
таксономисты, — это вопрос о том, появлялись ли
апоморфные признаки у разных организмов
только однажды (сииапоморфия) или несколь-
ко раз, независимым образом (конвергенция).
На основе только морфологических и физиоло-
гических признаков биолог пе может решить,
являются ли те или иные особенности гомо-
логичными признаками или возникли в результа-
те параллельной (конвергентной) эволюции. Это
относится ко всем признакам, которые ранее ис-
пользовали для филогенетической классифика-
ции, в том числе к морфологическим, метаболи-
чсс ким или связанным, например, с фотосинтети-
29.1.6. Правила номенклатура
регламентированы
Международными кодексами
Почти всем известным организмам присвоено би-
номиальное название, состоящее из названий ро-
да и вида, которые обычно представляют собой
латинские или греческие слова либо составлены
из них. Эта система номенклатуры, введенная
К. Линнеем, лежит в основе таксономии растений,
животных и микробов, регламентированной меж-
дународными кодексами номенклатуры. Между-
народный кодекс ботанической номенклатуры в
свое время признали неприемлемым для прокари-
от, и на его основе в течение нескольких десятиле-
тий был разработан ныне действующий Междуна-
родный кодекс номенклатуры бактерий — МКНБ
(International Code of Nomenclature of Bacteria,
ICNB). МКНБ отличается от Ботанического ко-
декса тем, что типом вида в нем служит штамм,
т. с. живая чистая культура организма и, кроме
того, таксономические категории между подро-
дом и видом, а также формы внутри подви-
дов в нем не регламентированы. Цианобакте-
рии (прежнее название — синезеленые водорос-
ли) рассматриваются как организмы «двойной
принадлежности» и могут описываться по пра-
вилам как МКНБ, так и Ботанического Кодекса.
МКНБ рассматривает как исходную дату для на-
звания таксонов прокариот 1 января 1980 г. На-
звания, признанные правильными, были включе-
ны в «Одобренные списки названий бактерий».
Не включенные в них названия потеряли свое
положение в номенклатуре. Введение «Одобрен-
ных списков названий бактерий» имело целью
исключить употребление многочисленных, вво-
дящих в заблуждение синонимов, выявленных
при использовании усовершенствованных спосо-
бов диагностики. Как и другие кодексы, МКНБ
содержит правило, согласно которому названия
таксонов должны быть эффективно опубликован-
ными, т. е. опубликованными в общедоступном пе-
чатном издании. Хотя описание нового бактери-
ального таксона может быть помещено в любом
журнале, этот таксон считается действительно об-
народованным, если его описание опубликовано в
«International Journal of Systematic and Evolution
Глава 29. Разнообразие и систематика прокариот 155
Microbiology» (IJSEM) в виде отдельной статьи
или его название со ссылкой на ранее эффективно
опубликованное описание приведено в «Списках
утвержденных названий» («Validation Lists») —
периодическом перечислении названий, которые
были обнародованы не в IJSEM. Таксоны, обна-
родованные таким образом, приводятся не в ка-
вычках (например, Pseudomonas putida), тогда
как все остальные названия должны приводиться
в кавычках (например, «Haloarcula californiae»),
означающих, что таксон не утвержден. Этот ко-
декс в первую очередь должен препятствовать
увеличению числа названий, вводящих в заблуж-
дение, и устанавливать правила для присвоения
названий и для определения адекватных типовых
штаммов. Однако он не указывает, какие методы
следует использовать для описания организма, и
не касается теории классификации. К сожалению,
следует отмстить, что текущие ревизии в микро-
биологической таксономии приводят к многочис-
ленным изменениям видовых или родовых назва-
ний, в том числе хорошо известных организмов
(см. табл. 29.7).
29.1.7. Эффективность таксономии выясняется
при идентификации организмов
Идентификация включает описание штамма и
сравнение его с ранее классифицированными и
имеющими названия штаммами. Таким образом,
организм может быть идентифицирован (т. е.
определен как идентичный известному таксону),
только если этот таксон уже известен. Организ-
мы, которые ранее не были выделены, должны
быть идентифицированы вначале как новые и
затем классифицированы в рамках существую-
щей таксономии. Адекватность и эффективность
таксономии проверяются ее использованием при
идентификации организмов. Основное достоин-
ство существующей классификации определяется
тем, насколько точно она позволяет установить
положение нового организма в классификацион-
ной схеме.
29.1.8. Современная классификация прокариот
основана на генотипической информации
О возможности использования последовательно-
стей, т. е. первичной структуры клеточных макро-
молекул— носителей информации, для филоге-
нетической классификации живых организмов
впервые заявили Э. Цукеркандль и Л. Полинг
(Zuckerkandl, Pauling, 1965). Эти исследователи
разделили биологические молекулы на три кате-
гории по их информативности: 1) семантиды, к
которым относятся ДНК (первичные семан-
тиды), РНК (вторичные семантиды) и бел-
ки (третичные семантиды) — как носители ге-
нотипической информации (последовательности
мономеров в составе макромолекул рассматрива-
ются как исторический документ эволюции, и их
первичная структура, определяемая путем сек-
венирования, может быть использована для вы-
яснения эволюционных связей), 2) эписеманти-
ческие молекулы, синтезируемые при участии
третичных семантид; к таким молекулам отно-
сятся, например, АТР, каротиноиды и хемотаксо-
номические маркеры, и 3) асемантические мо-
лекулы, которые не синтезируются данным ор-
ганизмом и не несут какой-либо информации о
нем; эта категория включает, например, экзоген-
ные витамины, фосфат, кислород и вирусные ком-
поненты.
Цукеркандль и Полинг утверждали, что «на
любом уровне интеграции количество сохранен-
ной исторической информации тем больше, чем
выше сложность его элементов и чем меньше час-
ти этих элементов, на которые нужно повлиять,
чтобы вызвать существенное изменение. При бла-
гоприятном сочетании таких условий выявление
многих различий между двумя элементами не ме-
шает признанию их подобия». Эта гипотеза бы-
ла подтверждена построением филогенетических
деревьев на основе анализа ДНК и белков (см.
разд. 29.4.1). Эписемантические молекулы не рас-
сматриваются как полезные для эволюционных
построений, поскольку ферменты с различными
первичными структурами при сходстве активных
центров могут катализировать синтез идентич-
ных эписемантических или подобных им молекул
у различных организмов.
156 Часть VII. Разнообразие и систематика
29.2. Нумерическая (численная) таксономия
как подход для кластеризации штаммов на основе
большого набора невзвешенных фенетических данных
Началом новой эры в систематике бактерий мож-
но считать появление нумерической, или числен-
ной, таксономии — компьютерного метода клас-
сификации путем группирования таксономичес-
ких единиц (таксонов) на основе значений их
признаков с помощью нумерических методов.
Впервые он был предложен для классифика-
ции бактерий П. Спито л в 1957 г. Наиболее ши-
роко применяемый в бактериологии способ ну-
мерической таксономии основан на пяти прин-
ципах, сформулированных в 18 в. ботаником
М. Адапсоном (адансоновские принципы): 1) в
идеальной «естественной» таксономии таксоны
должны иметь наибольшее информационное со-
держание, т. е. характеризоваться наибольшим из
возможных числом признаков; 2) при построе-
нии «естественных» таксонов каждому признаку
придается одинаковый вес (значение); 3) общее
сходство (близость) пропорционально доле общих
признаков; 4) раздел ение таксонов следует произ-
водить по коррелирующим признакам и 5) бли-
зость рассматривается независимо от филогении.
Нововведенная процедура нумерической так-
сономии составила резкий контраст с традицией
выделения и идентификации таксонов по несколь-
ким субтсктивпо выбранным особенностям пове-
дения, морфологии и окраски. Таксономические
построения, основанные па одиночных призна-
ках или сериях одиночных признаков (мопотети-
ческие), как известно, недостоверны, поскольку
они имеют низкую информативность и не могут
учитывать штаммовую изменчивость (появление
«мутантов») или ошибки опыта. Напротив, пу-
мерическая таксономия имеет высокую информа-
тивность и может учитывать в определенной сте-
пени изменчивость штаммов. Достоинство этого
метода состоит также в том, что численно обо-
значенные группы нолитстичны, т. е. выделены
по нескольким признакам, пи один из которых не
достаточен для того, чтобы отнести организм к
какой-либо группе. Применение адансоновской
таксономии позволило существенно продвинуть-
ся в классификации бактерий, главным образом
благодаря выделению гомогенных групп, прирав-
ненных к таксовидам, т. е. группам бактерий, об-
ладающих большой долей общих признаков. С по-
мощью методов нумерической таксономии была
усовершенствована таксономия многих родов бак-
терий, принятая до 1960 гг., в том числе родов
Bacillus, Mycobacterium и Vibrio. Базы данных, со-
зданные для применения методов нумерической
таксономии, представляют также ценность как
богатые источники информации по фенотипичес-
ким признакам таксонов, полезные для специа-
листов различных профилей. Этапы типичного
исследования методом нумерической таксономии
приведены на рис. 29.2.
Выбор операционных таксономических единиц (ОТЕ)
I
Выбор тестов
I
Получение данных (п признаков у t особей)
Кодирование данных
I
Исходная матрица данных
I
Вычисление ошибки теста
I
Устранение недифференцирующих
и/или невоспроизводимых данных
Конечная матрица данных
Устранение штаммов-дубликатов
Определение сходства
I
Сортированная матрица сходства
I
Иерархическая кластеризация
I
Определение таксономического
ранга (дендрограммы/
затушеванные треугольники)
Методы ординации
I
Представление таксономической
структуры (2- или
3-мерные диаграммы)
I
Оценка
I
Анализ взаимосвязей
Оценка (коэффициент
кофенетической корреляции)
I
Определение
таксономического ранга
Рис. 29.2. Этапы анализа бактерий методом нумеричес-
кой таксономии.
Глава 29. Разнообразие и систематика прокариот 157
29.2.1. Результат классификации бактерий
методом нумерической таксономии
зависит от выбора штаммов, тестов
и способа кодирования данных
Общие соображения □ Эффективность мето-
да нумерической таксономии определяется тем,
что он позволяет обработать большое количе-
ство данных по многим штаммам. Все использу-
емые для классификации фепетические признаки
отражают небольшую часть генома (хромосом-
ных или плазмидных генов) бактерий. Теорети-
чески, чем больше фонетических признаков учте-
но, тем достовернее мера фенетического родства
и, следовательно, некоторого генетического род-
ства между штаммами. При этом важно проду-
манно выбирать штаммы, признаки и компьютер-
ные программы в соответствии с целью предпо-
лагаемой классификации. Поскольку выделение
групп штаммов основано на определении их сход-
ства, состав групп и общая схема классификации
зависят от того, какие методы были выбраны для
количественной оценки сходства и распределения
организмов по таксонам. Известны или предпола-
гаются различные факторы, влияющие на клас-
сификацию бактерий при использовании метода
нумерической таксономии. К ним относятся набор
и число штаммов и тестов, проверка воспроизво-
димости результатов, а также способ обработки
данных.
Выбор штаммов □ Объекты классифика-
ции (как правило, это штаммы) разделяют на
операционные таксономические единицы
(ОТЕ). По возможности они должны включать
типовые штаммы, хорошо изученные аутентич-
ные культуры и маркерные штаммы, не относящи-
еся к исследуемым организмам. Кроме того, жела-
тельно использовать свежевыделенные изоляты,
поскольку многократно пересевавшиеся штам-
мы могут быть недостоверными представителями
устанавливаемых таксонов. Примерно 10% штам-
мов необходимо исследовать в двух копиях как
отдельные ОТЕ, что обеспечивает контроль вос-
производимости результатов. Теоретически для
точного определения центра и радиуса таксови-
да требуется анализ примерно 25 штаммов. В на-
стоящее время имеется возможность включать
несколько сотен ОТЕ в одну процедуру анализа,
используя при этом автоматизированные системы
для получения и ввода необходимых данных, в
частности о биохимических признаках.
Выбор тестов □ Признаки, используемые
при компьютерной классификации, определяют
с помощью разнообразных тестов. Эти признаки
должны быть генетически стабильными и надеж-
но определяемыми, независимо от мелких неточ-
ностей эксперимента или наблюдения. Обычно
выбирают ряд биохимических, культуральных,
морфологических и физиологических признаков,
отражающих и генотип, и фенотип. При этом
особенно важно иметь достаточно информации
о дифференцирующих признаках, полезных для
разграничения таксонов. Необходимо включать в
анализ не менее 50, а лучше несколько сотен при-
знаков, хотя с увеличением их числа выигрыш в
информации не окупает возросшие трудности по-
лучения достоверных данных. Помимо количес-
тва признаков, важна надежность их определе-
ния, которая обеспечивается проведением тестов
в строго стандартизованных условиях.
Быстрый ввод данных □ Создание баз
данных весьма облегчается применением ав-
томатизированных процедур анализа. Авто-
матизированные системы разработаны для
определения отдельных ферментов; в них при-
меняются субстраты этих ферментов, конъюги-
рованные с флуорохромами, например 7-амино-
4-метилкумарином или 4-метилкумарином. При
расщеплении этих конъюгированных произ-
водных соответствующими ферментами флуо-
рохромы высвобождаются, и по их флуоресцен-
ции в видимой области спектра можно опреде-
лять активность фермента, поскольку в конъюги-
рованной с субстратом форме они обнаруживают
лишь слабую флуоресценцию. В обычной автома-
тизированной системе конъюгированные субстра-
ты автоматически вносятся в 96-луночные пане-
ли для микротитрования, и после инкубации в
течение нескольких часов происходит считывание
результатов на флуориметре, соединенном с ком-
пьютером для немедленного ввода в него данных.
При этом в программу вводят дискриминацион-
ные (пороговые) значения для данного признака,
которые позволяют дифференцировать положи-
тельные, отрицательные и слабо положительные
штаммы. Сходная система с использованием
микротитровальных панелей, в лунки которых
вносятся различные субстраты и краситель тетра-
золиевый синий, может применяться для опреде-
ления способности исследуемых штаммов исполь-
зовать широкий спектр органических соединений
в качестве источников углерода и энергии.
158 Часть VII. Разнообразие и систематика
Кодирование данных □ Операционные так-
сономические единицы кодируются с учетом боль-
шого числа свойств (битов информации), каждое
из которых называют единичным признаком.
Методы, используемые для кодирования единич-
ных признаков, различаются в зависимости от
характера тестов и особенностей компьютерных
программ. В большинстве случаев для этих при-
знаков используют две градации, т. е. считают
организм по данному признаку положительным
или отрицательным и соответственно кодируют
его цифрой 1 или 0. Когда различают больше
двух градаций (например, низкую и высокую про-
теолитическую активность), обычно применяют
дополнительное кодирование, дающее информа-
цию о степени выраженности признака. Таким об-
разом, результаты с тремя градациями призна-
ка могут быть закодированы следующим образом:
отрицательные штаммы — ООО; слабо положитель-
ные— 100; умеренно положительные —110; выра-
жение положительные—111. Качественные при-
знаки с многочисленными градациями, такие как
окраска колоний, кодируют по бинарной схеме,
используя общий исключающий метод кодирова-
ния, при котором ОТЕ с данной градацией при-
знака кодируется как положительная (1) по дан-
ной градации и как отрицательная (0) по всем
остальным градациям. Важная градация призна-
ка, которая может быть применена ко всем ти-
пам, обозначается как выпадение («missing»), или
NC (no comparison). Такие NC-признаки возника-
ют, например, когда тест нс был осуществлен или
был проведен некорректно. Признаки могут быть
также охарактеризованы как NC логическим пу-
тем; например, эта градация может применяться
к признаку форма спор (цилиндрическая, оваль-
ная, круглая), когда споруляции не обнаружено.
Присутствие большой доли NC-значений может
привести к ошибочным результатам, но отдель-
ные рассеянные NC-градации обычно приемлемы.
29.2.2. Для проверки результатов
нумерической таксономии
наиболее важно оценить ошибку
определения признаков
Определение ошибок тестов □ Вначале све-
ряют результаты тестов для штаммов, анализиру-
емых в двух повторностях (как отдельные ОТЕ),
по их кодам и затем вычисляют среднюю веро-
ятностную ошибку по дисперсии. Значения дис-
персии для отдельных тестов (s2) можно вычис-
лить по уравнению 29.1, приведенному в дополне-
нии 29.3. Наличие ошибок в определении призна-
ков в общем случае приводит к снижению величи-
ны сходства между штаммами и, если ошибка ве-
лика, к разрушению таксономической схемы, осо-
бенно резкому, если вероятность ошибки р > 0,1.
Поэтому данные по индивидуальным тестам, для
которых вероятность ошибки превышает 10%-й
уровень, должны быть изъяты из ряда матриц
н х t, но в таком случае необходимо компенсиро-
вать потерю данных. Причинами ошибок могут
быть изменчивость организмов, нестандартность
теста или оплошности экспериментаторов.
Дополнение 29.3. Ошибку опыта опре-
деляют путем анализа дисперсии данных:
s2 = n/2t, где п — число ОТЕ с различиями в
результатах и t — число штаммов, анализиру-
емых в двух повторностях. Вероятность оши-
бочного результата для данного теста (pi) со-
ставляет:
Pi = 1/2(1 - [^/1 - 4s?]) • 100, (29.1)
где i — признак и s —дисперсия. Значения
дисперсии для отдельных тестов усредняют,
чтобы определить общую дисперсию (s2):
s2 = (l/n)(si + S2 + - - - + sn), (29.2)
где n равно общему числу тестов и si, S2 и sn —
значения дисперсии для отдельных тестов, 1,
2 и так далее до п. Величину общей диспер-
сии затем используют для определения сред-
ней вероятности ошибочных результатов (р):
р = 1/2(1 - [\/1 - 4s2]) • 100 (29.3)
29.2.3. Для группирования штаммов
на основе величин сходства
существует несколько алгоритмов
Определение сходства □ Как только запол-
ненную матрицу п х t вводят в компьютер, про-
грамма выдает величины сходства и различия
между штаммами, вычисленные с использовани-
ем коэффициентов сходства. Известны различ-
ные коэффициенты сходства, но для таксономии
бактерий оказались применимыми немногие. Наи-
Глава 29. Разнообразие и систематика прокариот 159
более часто используются два из них — коэффи-
циент простого совпадения (Ssm) и коэффи-
циент Жаккарда (Sj), которые позволяют из-
мерять сходство между ОТЕ на основе бинарно
закодированных данных* Полезно использовать
оба коэффициента. Коэффициент Sj часто при-
меняют для проверки того, что взаимосвязи, уста-
новленные с помощью коэффициента Ssm, не ос-
нованы на отрицательной корреляции, т. е. ОТЕ
не определены как сходные потому, что имеют
много общих отрицательных признаков. Отрица-
тельные данные не обязательно служат показате-
лями сходства, поскольку штаммы могут не да-
вать положительных результатов по совершенно
различным причинам. Например, одни штаммы
могут быть генетически лишены данного призна-
ка, тогда как другие не проявляют его из-за несо-
ответствия условий опыта. Коэффициент Sj осо-
бенно полезен при одновременном анализе быст-
рорастущих и медленнорастущих штаммов.
Иерархическая кластеризация □ Обычно
ОТЕ разделяют на группы с высоким фе-
нотипическим сходством, применяя один или
чаще несколько методов кластерного анализа
(рис. 29.3). В любом случае первый этап состоит в
поиске по матрице сходства наибольшей величи-
ны сходства между парами штаммов. Затем най-
денную пару определяют как группу, или кластер,
и вычисляют величину сходства между этой груп-
пой и каждым из остальных штаммов, чтобы най-
ти следующее наибольшее сходство. Оно может
обнаружиться между двумя другими ОТЕ или
между найденной вначале парой и другой ОТЕ.
Этот процесс продолжается дальше, и в каждом
цикле к кластерам добавляются штаммы или кла-
стеры соединяются между собой, пока все штам-
мы не будут включены в один кластер (t — 1 цик-
лов; t — число ОТЕ).
Методы кластеризации варьируют в том, что
сходство между ОТЕ и группой и, в более
общем виде, между двумя группами определяет-
ся в них различным образом. Метод единствен-
ной связи (ближайшего соседа) позволяет опреде-
лять сходство между двумя группами как сход-
ство двух наиболее сходных ОТЕ, по одной из
каждой группы (рис. 29.3). В методе средней
связи берется среднее значение из всех величин
сходства в группе. Наиболее часто применяемый
вариант метода средней связи — это невесовой
попарно-групповой метод с использовани-
ем средних значений (unweighted pair group
Матрица данных (сходства)
ОТЕ
1
2
3
4
5
100
50 100
90 40 100
80 40 60 100
40 80 40 30 100
Д 1 2 3 4 5
Результаты кластеризации
Степень Средняя связь
сходства, % (UPCMA)
100 1 2 3 4 5
90 1,3
80 1. 3 2. 5
70 1. 3. 4 2. 5
60 1. 3, 4 2. 5
50 1, 3. 4 2, 5
40 1, 3, 4. 2, 5
Единственная связь
1 2 3 4 5
1,3
1, 3 2, 5
1. 3, 4 2, 5
1. 3, 4 2, 5
1. 3. 4 2, 5
1, 3, 4, 2, 5
Дендрограммы
Степень Средняя связь Степень Единственная
сходства, % ОТЕ (UPCMA) сходства, % связь ОТЕ
Матрицы кофенетической корреляции
40 100
90 40 100
70 40 70 100
40 80 z0 40 100
ОТЕ
1
2
3
4
5
1 2 3 4 5
50 100
90 50 100
80 50 80 100
50 80 50 50 100
Рис. 29.3. А—Г. Основные этапы анализа методом нуме-
рической таксономии.
А. Тест-штаммы исследуются по многим фенотипиче-
ским признакам, и общее сходство между штаммами
выражается как проценты в несортированной матрице
сходства.
Б. Сходные штаммы группируются с использованием
алгоритмов кластеризации.
В. Результаты кластерного анализа изображаются в ви-
де дендрограмм.
Г. Коэффициент кофенетической корреляции (г) выше
0,8 показывает, что данные пригодны для иерархическо-
го анализа (подробности в тексте).
method with averages, UPGMA), в котором берется
простое среднее арифметическое из величин сход-
ства по двум группам, причем каждому сходству
придается равный вес. Уровень сходства, доста-
точный для выделения кластеров, зависит от ис-
пользуемого алгоритма.
Для иерархической кластеризации чаще все-
го используют коэффициент кофенетической
корреляции (г), отражающий корреляцию меж-
160 Часть VII. Разнообразие и систематика
ду двумя вышеуказанными наборами данных (см.
пример на рис. 29.3). Обычно значения кофс-
нетической корреляции варьируют в пределах
0,6-0,95. Значения выше 0,8 означают, как пра-
вило, высокую достоверность, тогда как величи-
ны ниже 0,7 указывают, что взаимосвязи на денд-
рограмме лишь ограниченно достоверны. Полное
согласование между дендрограммами и матрица-
ми сходства не может быть достигнуто, посколь-
ку представление многомерных данных в дву-
мерной форме вносит искажение. Группирование
методом UPGMA всегда дает наивысшую кофе-
нетическую корреляцию по сравнению с други-
ми методами иерархической кластеризации. Это
само по себе служит хорошим основанием для
использования данного алгоритма. Результаты
группирования обычно представляют в форме
дендрограммы, где вершины ветвей — это ОТЕ,
а оси, отходящие под прямым углом к верши-
нам—это оси сходства, показывающие величи-
ны сходства, по которым формируются группы
(рис. 29.3).
По-своему ценны и неиерархические мето-
ды, причем они особенно полезны, когда дан-
ные непригодны для иерархического анализа.
Неиерархические методы, чаще всего используе-
мые в таксономии бактерий, — это анализ главных
компонент, анализ главных координат и неметри-
ческое многомерное сопоставление. Все они — ме-
тоды ординации (упорядочения), которые суще-
ственно уменьшают число измерений (по одному
для каждого признака) в данных, так что взаимо-
связи, заданные целым набором признаков, могут
быть суммированы значительно меньшим числом
измерений, обычно двумя или тремя, для рассмот-
рения в виде карты или модели. Оси координат
выбирают так, что первая ось отражает наиболь-
ший разброс ОТЕ, вторая — следующий по разме-
ру разброс и т. д. Методы ординации считаются
удовлетворительными, если изменчивость в вы-
черченных главных координатах составляет 40%
или большую долю общей исходной изменчивости.
29.2.4. Иерархическая кластеризация штаммов
может быть использована
для определения
их таксономического ранга
Определение таксономического ранга □ Ре-
зультаты кластерного анализа обычно представ-
ляют в виде затушеванных диаграмм, дендро-
грамм (иерархические методы) или графиков
ординации (неиерархические методы). Дендро-
граммы обычно упрощают путем группирова-
ния штаммов, которые сливаются па предыду-
щих уровнях сходства. Эти группы, или кластеры,
представляют как затушеванные треугольники,
у которых ширина основания пропорциональ-
на числу ОТЕ (рис. 29.4). Из рис. 29.4 видно,
Номер Таксономическая
кластера принадлежность
Степень Число
сходства, % штаммов или
лабораторный
1 Rhodococcus equi
2 Rhodococcus rhodochrous
5
3
4
Rhodococcus ruber
Rhodococcus coprophilus
Rhodococcus chlorophenolicus
Rhodococcus sp.
Rhodococcus sp.
Rhodococcus aichiensis
Штаммы Rhodococcus
7 Rhodococcus erythropolis
8 Rhodococcus globerulus
9 Rhodococcus sp.
J— Штамм Rhodococcus
Rhodococcus sp.
10 Rhodococcus sp.
— Штаммы Rhodococcus
11 Rhodococcus luteus
12 Rhodococcus sp.
Штаммы Rhodococcus
Штаммы Rhodococcus
13 Rhodococcus sp.
14 Rhodococcus fascians
— Штаммы Rhodococcus
15 Rhodococcus mans
16 Rhodococcus rhodnii
Rhodococcus marinonascens
Рис. 29.4. Сокращенная дендрограмма, показывающая
родственные связи между родококками. Кластеры опре-
делены на уровне сходства 89% или выше путем анали-
за коэффициента SsM-методом UPGMA. Звездочками
отмечены типовые штаммы или кластеры, содержащие
типовые штаммы.
Глава 29. Разнообразие и систематика прокариот 161
что родококки распадаются на несколько хорошо
очерченных таксономических групп, не все из ко-
торых описаны как таксоны. Результаты иерар-
хической кластеризации можно использовать для
установления таксономического ранга и в конеч-
ном итоге для присвоения названий группам бак-
терий. Уровень сходства, на котором следует раз-
делять виды (и роды), зависит от нескольких фак-
торов, особенно от величины коллекции штаммов,
набора признаков и использованных статистиче-
ских методов. Определить ранги с помощью денд-
рограмм или графиков ординации не всегда про-
сто, однако несмотря на возникающие при анализе
трудности обычно имеется хорошее соответствие
между результатами кластерного анализа с помо-
щью методов нумерической таксономии и класси-
фикации на основе других таксономических ме-
тодов, в первую очередь анализа сходства ДНК.
Особенно хорошо соответствие между таксовида-
ми и геномными видами можно видеть на примере
родококков.
Для применения метода нумерической таксо-
номии необходимо представить данные о таксо-
номических единицах в нумерической форме. Ос-
новные цели нумерической таксономии — распре-
деление индивидуальных штаммов бактерий по
группам, или кластерам, с использованием боль-
ших наборов фепетических данных, а также
совершенствование схем идентификации на ос-
нове нумерически выделенных групп. Методы
нумерической таксономии основаны на анали-
зе фенетических данных, т. е. величин сходства
между организмами по определяемым признакам
без учета происхождения таксона. Это означает,
что родственные связи между организмами и лю-
бые иерархии, основанные на этих взаимосвя-
зях, являются фенетическими, а не филогенети-
ческими.
29.3. Анализ химических признаков клеток как инструмент таксономии
Классификацию организмов на основе особенно-
стей химического состава клеток называют хе-
мотаксономией или хемосистематикой. Это
направление таксономии связано с применением
физико-химических методов, таких как газовая
хроматография, тонкослойная хроматография и
жидкостная хроматография высокого разреше-
ния, а также различных спектроскопических ме-
тодов. В некоторых случаях определение хил иче-
ского состава клеток позволяет быстро идентифи-
цировать известный таксон или выделить новый,
однако эти результаты, как правило, необходимо
проверять другими методами.
29.3.1. Таксономическими маркерами могут
служить компоненты клеточной стенки
Состав и структура пептидогликана постоянны у
данного организма, но варьируют у разных орга-
низмов, благодаря чему он может быть исполь-
зован как таксономический признак. Ранее счи-
талось, что пептидогликан присутствует в кле-
точной стенке у всех прокариот, однако теперь
известно, что у многих архей (метаногенов, неме-
тапогенных термофилов и галобактерий), а так-
же у некоторых бактерий (например, планктоми-
цетов, составляющих отдельную эволюционную
группу, и микоплазм) этот полимер отсутству-
ет. Как описано в гл. 7 (см. разд. 7.9.5), основу
пептидогликана составляют гликановые цепи, ко-
торые состоят из чередующихся остатков амино-
сахара и уроновой кислоты. К этим цепям присо-
единены пептидные цепочки, связанные с остатка-
ми уроновой кислоты; в свою очередь пептидные
цепочки перекрестно связаны между собой (см.
рис. 23.1). У большинства бактерий пептидогли-
кан относится к муреиновому типу, т. е. уроно-
вая кислота представлена мурамовой кислотой
и сахар — 1У-ацетил-П-глюкозамином. У неко-
торых бактерий имеются модификации в этой
молекуле, в частности фосфорилирована или аце-
162 Часть VII. Разнообразие и систематика
тилирована гидроксильная группа при Сб-атоме
мурамовой кислоты, не ацетилирована амино-
группа или не окислен N-ацетильный остаток, т. е.
не превращен в N-гликолильный. Среди «клас-
сических грамотрицательных» организмов не
наблюдается вариаций в структуре пептидогли-
кана или они незначительны, тогда как грампо-
ложительные бактерии, напротив, характеризу-
ются большим разнообразием пептидогликанов,
которые варьируют в зависимости от организма
по составу межпептидного мостика, связыва-
ющего через пептидные цепочки гликановые цепи
(см. разд. 23.1). Разработаны сложные номенкла-
туры пептидогликанов, отражающие многообра-
зие вариантов их структуры. Чаще всего исполь-
зуется номенклатура, предложенная Канцлером и
соавторами, в которой выделено два основных ти-
па структур: А-пептидогликаны (рис. 7.31, В) и
В-пептидогликаны (рис. 29.5).
У грамположительных метаногенов, относя-
щихся к археям, в качестве сахаров в пептидогли-
канах содержится либо N-ацетил-D-глюкозам ин,
либо К-ацетил-О-галактозамин и вторым ком-
понентом гликановой цепи служит N-ацетил-Б-
талозаминуроновая кислота. Пептидогликан та-
кого типа называют псевдомуреином. Наиболее
важный аспект структурной вариабельности этих
полимеров — изменчивость межпептидного мо-
стика, связывающего инвариантным образом гли-
кановые цепи. Характерными особенностями это-
сн,он сн.он
сн3-сн
со
I
Cly (Ser)
I
D-Clu --- Cly ---- ДА --- D-Ala
I I
Ак Ak
I I
D-Ala D-Clu
I
Ala
I
N-Ацетилглюкозамин------- Мурамовая кислота
Рис. 29.5. Общая структура пептидогликана В-типа.
ДА — диаминокислота (например, диаминопимелино-
вая кислота или лизин); Ак — аминокислота.
го мостика являются преобладание в его составе
D-аминокислот и отсутствие остатков ароматиче-
ских аминокислот, что делает весь полимер устой-
чивым к действию L-протеаз, таких как трипсин
или химотрипсин.
Другие компоненты клеточной стенки □
В отличие от пептидогликана, прочие компонен-
ты клеточной стенки прокариот, рассматривае-
мые как дополнительные, значительно менее изу-
чены. К ним относятся тейхоевые и тейхуроновые
кислоты, как правило присутствующие у грам-
положительных бактерий, липополисахариды, а
также белки или гликопротеины. У некоторых
прокариот клеточная стенка включает наружный
белковый S-слой; у многих архей, не содержащих
пептидогликана, подобный слой, очевидно, под-
держивает форму клетки. Варианты клеточной
стенки, не содержащей пептидогликана, у архей
разнообразны: их состав варьирует от чисто бел-
кового или гликопротеинового до преимуществен-
но гликанового, как у родов Methanosarcina или
Halococcus.
Гетерополисахариды клеточной стенки
архей могут быть структурно сходными
с полимерами эукариот □ По крайней ме-
ре у двух видов архей, Methanosarcina barken
и Halococcus morrhuae, основным компонентом
клеточной стенки служит гетерополисахарид.
У М. barkeri (и, возможно, у других видов это-
го рода) он представляет собой гликановую цепь
из повторяющихся мономеров и весьма сходен по
структуре с хондроитином (основным компонен-
том хряща у млекопитающих), в связи с чем по-
лучил название метанохондроитин. Гетеросаха-
рид Н. morrhuae имеет гораздо более сложную
структуру, включающую по меньшей мере три мо-
тива различной степени сложности из повторяю-
щихся мономеров. Этот полимер сильно сульфа-
тирован, что характерно также для гликопротеи-
на Halobacterium salinarum.
Бактериальная клеточная стенка обеспечива-
ет поддержание формы клетки. У большинства
бактерий в состав стенки входит пептидогликан.
Для архей характерны разнообразные по составу
клеточные стенки. Как среди бактерий, так и
среди архей обнаружен определенный диапазон
возможных компонентов клеточной стенки, и
структурная вариабельность этих компонентов
используется в качестве таксономического при-
знака.
Глава 29. Разнообразие и систематика прокариот 163
29.3.2. Разнообразные таксономические
маркеры присутствуют
в наружной мембране
У многих грамотрицательных бактерий, в част-
ности представителей Proteobacteria, клеточная
стенка состоит из тонкого слоя пептидоглика-
на и покрывающей его наружной мембра-
ны (см. гл. 2 и 23). В состав наружной
мембраны входит липополисахарид (ЛПС), наи-
более консервативной частью которого является
липид А, закрепляющий молекулу ЛПС в наруж-
ной мембране. У Salmonella (и многих других
родов) липид А содержит два глюкозаминовых
остатка, соединенных 1—>6-гликозидной связью
(рис. 23.3 и 29.6, А). У Rhodopseudomonas viridis
и Rhodopseudomonas palustris, а также у пред-
ставителей Brevundimonas, Bradyrhizobium, Afipia,
Nitrobacter, Brucella, Agrobacterium и Rhizobium
вместо этого димера присутствует 2,3-диамино-
2,3-дидезокси-П-глюкоза в виде мономера или ди-
мера (рис. 29.6, В, В). Этот участок липида А
относительно консервативен, но обнаружена ва-
риабельность цепей жирных кислот, соединенных
с этим аминосахаридным остовом. Жирные кис-
лоты связаны с остатками глюкозамина амидной
связью через аминогруппу глюкозамина, а так-
же эфирной связью с гидроксильной группой у
СЗ-атома (рис. 29.6, А). В отличие от этого
жирные кислоты, связанные с 2,3-диамино-2,3-
дидезокси-П-глюкозой, соединены только дву-
мя амидными связями с двумя аминогруппами
(рис. 29.6, Б и В). У Brevundimonas diminuta пре-
обладают цепи с амидными связями, но есть и
некоторое количество цепей со связями через ато-
мы кислорода гидроксильных групп. У некоторых
организмов липид А характеризуется как «сме-
шанный», поскольку в его состав входят и глю-
козамин, и 2-диамино-2-дидезоксиглюкоза. Соот-
ношение этих компонентов варьирует, но всегда
преобладает какой-либо один из них. В липидах А
различных типов N- или О-ацильные цепи обыч-
но представлены ^-гидроксилированными жир-
ными кислотами (3-ОН), однако обнаружены так-
же жирные кислоты 3-оксо; к ним могут быть
присоединены другие жирные кислоты, образую-
щие эфирные связи со свободными гидроксиль-
ными группами. У некоторых бактерий не все
жирные 3-ОН-кислоты, связанные с сахарным
остовом, далее этерифицированы, но этерифици-
рованы либо жирные кислоты, присоединенные к
Рис. 29.6. Примеры структурной изменчивости липи-
да А в составе липополисахарида.
А. (31 —> б-глюкозаминдисахарид.
Б. Мономер диаминоглюкозы.
В. Димер диаминоглюкозы.
одному остатку глюкозамина (что характерно для
сем. Enterobacteriaceae), либо только N-связанные
жирные кислоты (что типично для некоторых
представителей (3-подкласса Proteobacteria).
Олигосахаридный остов липополисахарида бо-
лее вариабелен, чем липид А, причем его состав
может различаться у штаммов одного вида, но
быть практически консервативным у других ви-
дов. Для таксономии представляют также интерес
присутствие или отсутствие в остове гептоз либо
2-кето-3-дезокси-Э-маннозы.
Наибольшей вариабельностью характеризует-
ся О-специфическая цепь в составе ЛПС. У неко-
торых организмов она полностью отсутствует, у
других варьирует по длине. Отсутствие О-цепи
может наблюдаться у всех штаммов внутри вида
164 Часть VII. Разнообразие и систематика
или только у некоторых. У энтеробактерий отсут-
ствием 0-цепи объясняется особенность морфоло-
гии колоний шероховатых штаммов. Серотипиро-
вание, основанное на определении последствий из-
менчивости О-цепи, широко использовалось для
установления таксономии рода Salmonella и дру-
гих бактерий кишечной группы.
Наружная мембрана считается характерным
признаком грамотрицательных бактерий и, по-
видимому, присутствует только у представителей
Proteobacteria. Липополисахариды, обладающие
антигенными свойствами, входят в состав наруж-
ной I гембраны не у всех бактерий. У организмов,
не имеющих наружной мембраны, антигенными
свойствами обладают иные компоненты поверх-
ности. Разнообразие и вариабельность структу-
ры компонентов клеточной поверхности делают
их полезными таксономическими маркерами.
29.3.3. Некоторые группы микроорганизмов
имеют дополнительные таксономические
маркеры
Определенная группа организмов, относящих-
ся к грамположительным бактериям с высоким
содержанием G + С (Corynebacterium, Nocardia,
Mycobacterium и близкие роды), отличается осо-
бым признаком — присутствием на поверхности
клеток необычных липидов — миколовых кислот.
Это разветвленные жирные 3-гидроксикислоты,
замещенные в положениях 2 и 3 алифатическими
цепями различной длины. Обычно они связаны
эфирной связью с арабиногалактаном, который в
свою очередь связан с пептидогликаном клеточ-
ной стенки. Миколовые кислоты служат допол-
нительным дифференцирующим признаком для
разделения таксонов, поскольку значительно раз-
личаются по длине углеродных цепей (от 20 до
80 атомов С), количеству двойных связей, при-
роде заместителей (оксо-, метокси- или эпокси-
группы), а также по соотношению длин алифа-
тических цепей при С2- и СЗ-атомах жирной кис-
лоты (рис. 29.7).
<х-Миколат НО СООН
I I
СНзЧСНДХЧСН^-УССНг^-СН-СНЧСНРр-СНз
СН2
X = цис—СН=СН— или цис—СН—СН —
СН, СН2
I / \
д Y = цис—СН=СН— или транс—СН=СН—СН2— или цис— СН=СН-
ск'-Миколат НО СООН
I I
СНз-(СН2),-СН=СН-(СН2)т -CH-CH-(CH2)n-CHj
Б
Рис. 29.7. А, Б. Структура миколовых кислот. Миколо-
вые кислоты, обнаруженные у представителей Согупе-
bacterium, Nocardia, Mycobacterium и некоторых близких
родов.
А. а-Миколаты.
Б. а-Миколаты.
29.3.4. Плазматическая мембрана присутствует
у всех прокариот и характеризуется
разнообразием состава
Липиды как основа мембран □ Строение
клеточной мембраны описано в гл. 2. Для прока-
риот характерно широкое разнообразие ее липо-
фильных компонентов (см. дополнение 29.4). Они
варьируют от полностью неполярных, таких как
сквален, до полярных, таких как гликолипиды,
содержащие четыре-пять остатков сахаров. Мем-
бранные липиды бактерий можно разделить на
липиды — производные глицерола, содержащие
ацильные группы (остатки жирных кислот), и ли-
пиды, представляющие собой изопреноиды (на-
пример, сквален, гопаноиды или каротиноиды).
В каждом из этих классов липидов присутствуют
как неполярные соединения (например, свобод-
ные жирные кислоты или диглицериды в первом
классе и сквален или /?-каротин во втором), так и
полярные (в первом классе — диацильные поляр-
ные липиды; во втором — гопаноиды и бактерио-
руберипы). У архей липиды представляют собой
эфиры глицерола, к которому простыми эфир-
ными связями присоединены изопреноидные цепи
(рис. 7.40).
Пигменты мембран, придающие окраску ко-
лониям микроорганизмов, могут относиться к ка-
ротиноидам или иметь другую природу, как, на-
пример, ксантомонадин (рис. 13.2 и 29.8).
Каротиноиды имеют большое значение для
таксономии аноксигенных фототрофных бакте-
Глава 29. Разнообразие и систематика прокариот 165
Рис. 29.8. Примеры пигментов прокариот. Показаны ка-
ротиноиды и другие пигменты.
А Зеаксантин (каротиноид).
Б. Флексирубин.
В. Ксантомонадин.
Г. Нонилпродигинин.
рий, особенно некоторых серных и несерных пур-
пурных бактерий. Например, те из этих бакте-
рий, которые имеют желто-коричневую окраску
при росте и анаэробных условиях, но розовую
в присутствии кислорода (вследствие образова-
ния сфероидинона), в высокой степени сходны по
данным анализа 16S-pPHK (представители родов
Rhodobacter, Rhodovulum и Roseobacter, а также
вид Rhodopseudomonas blastica). (О биосинтезе ка-
ротиноидов и их роли в процессе фотосинтеза см.
гл. 7 и 13 соответственно.) Каротиноидный состав
как таксономический признак безусловно важен,
но вместе с тем одни и тс же каротиноиды мо-
гут встречаться у весьма отдаленно родственных
организмов (родов).
Полярные липиды □ К ним относятся фос-
фолипиды, из которых в основном состоит плаз-
матическая мембрана, а также входящие в ее
состав гликолипиды, аминолипиды, полярные
изопреноиды и у некоторых организмов гопано-
иды (рис. 7.37). Большинство мембранных липи-
дов бактерий представляет собой сложные эфиры
глицерола, содержащие ацильные и/или алкиль-
ные группы (рис. 29.9). В некоторых случаях
в одном липиде присутствуют и простая эфир-
А н । но-с-н о 1 II H-C-O-C-R, H-C-O-C-R. 1 II Н О
Б X X О 1 1 1 х-п-п-п-х 1 1 1 о о х 1 1 Г> П=о X | п ™ 7
В н 1 но-с-н о 1 II H-C-O-C-R, 1 h-c-o-ch2-r2 н
Г н 1 но-с-н 1 H-C-O-CHj-R, H-C-O-CH2-R2 н
Д н 1 но-с-н н 1 1 H-C-O-CH2-Rj-сн2-о-с-н н—с—о—ch2-r2—сн2-о—с—н н н-с-он 1 н
Е н 1 но-с-н о 1 II H-C-O-C-R, 1 н—с—сн2—сн2—r2 н
Рис. 29.9. Структура основных липидов в составе мем-
бран.
А Диациловый эфир.
Б. Моноацилмоноалкил-1-ениловый эфир.
В. Моноацилмоноалкиловый эфир.
Г. Диалкиловый диэфир.
Д. Диалкиловый тетраэфир.
Е. Моноацилалкилдиоловый эфир.
ная, и сложноэфирная связи; у архей заместители
представляют собой изопреноидные цепи, связан-
ные с остатком глицерола простыми эфирными
связями.
Фосфолипиды названы так в соответствии с
природой полярной группы (рис. 29.10). Фосфат-
ная группа является единственным общим эле-
ментом в фосфолипидах прокариот, в остальном
весьма разнообразных.
Гликолипиды привлекают особое внимание
исследователей в связи с таксономией архей и
166 Часть VII. Разнообразие и систематика
и ।
х-о-р-о-с-н о
। и
О H-C-O-C-Ri
I
H-C-O-C-R,
I II
н о
Фосфолипид
Фосфатидовая кислота
Ri и R2 - остатки жирных кислот;
X - дополнительная функциональная
группа, содержащая фосфат
X
Н
Фосфатидилглицерол
Фосфатидилэтаноламин
Фосфатидил метил -
этаноламин
Фосфатидилдиметил-
этаноламин
Фосфатидилхолин
Фосфатидил инозитол
Фосфатидилсерин
СН2ОНСНОНСН2ОН
CH2OH-CH2NH2
ch2oh-ch2nhch3
CH2OH-CH2N(CH3)2
CH2OH-CH2N*(CH3)3
С6Н12О6
CH2OH-CHNH2-COOH
Рис. 29.10. Структура распространенных диациловых
фосфолипидов.
Орнитин H2N-(CH2)3-CH- СООН
(Acidiphilium) * 1
NH
I
СО-СН2-СН-(СН2)„СН3
А о-со-(сн2)псн3
Глицин H2N-CH-COOH
(Cytophaga) '
NH
l
CO - сн2- CH - (CH2)rCH3
Б o-co-(ch2)„ch3
Серин HO —CH2-CH—COOH
(Flavobacterium) '
NH
I
CO-CH2-CH-(CH2)n-CH-CH3
CH3
O-CO-(CH2)„-CH-CH3
В сн3
Рис. 29.11. Структура некоторых липидов, содержащих
аминокислоты и жирные кислоты.
А. Орнитинсодержащий липид (Acidiphilium').
Б. Глицинсодержащий липид (Cytophaga).
В. Серинсодержащий липид (Flavobacterium).
многих грамположительных бактерий, но присут-
ствуют и у других микроорганизмов. Гликолипи-
ды подразделяются на моно-, ди-, три- и тетрагли-
козильные, в зависимости от числа остатков са-
харов в составе молекулы. Помимо количества и
типа сахаров, в гликолипидах варьирует тип свя-
зи между остатками сахаров, что также может
быть использовано для таксономического анали-
за. Наиболее необычны по составу гликолипиды
бактерий рода Brevundimonas, содержащие уроно-
вые кислоты.
Аминолипиды — липиды, содержащие ами-
нокислоты — встречаются у многих, но не у
всех микроорганизмов. Чаще всего они содер-
жат остатки серина, глицина, орнитина, лизина
или дипептида орнитин-таурин (рис. 29.11). Для
многих исследованных аминолипидов установле-
но, что аминогруппа связана пептидной связью с
жирной гидроксикислотой, которая в свою оче-
редь связана со второй жирной кислотой эфирной
связью через свою гидроксильную группу.
Гидрофобные компоненты внутренней
области мембраны □ Гидрофобную область
клеточной мембраны образуют чаще всего цепи
жирных кислот; входящих в состав фосфолипи-
дов. Эти гидрофобные участки полярных липидов
часто, но не всегда представлены остатками жир-
ных кислот. Всего известно примерно 200 обычно
встречающихся жирных кислот (см. разд. 7.10.2).
У некоторых организмов обнаружены необычные
жирные кислоты, в том числе длинноцепочеч-
ные дикарбоновые кислоты, гекса- или гептацик-
лические жирные кислоты, а также монокарбо-
новые моноэфирные длинноцепочечные алканы
(рис. 29.12).
Жирные гидроксикислоты присутствуют
почти у всех прокариот. Наиболее распростра-
ненный их тип — 2-ОН-(а-)- и 3-ОН-(Д)-кисло-
ты, хотя обнаружены также жирные кислоты
«зо-ОН (щ2-ОН) (рис. 29.13). Некоторые виды
рода Legionella содержат жирные 2,3-дигидрокси-
кислоты. Гидроксикислоты присутствуют в со-
ставе различных клеточных компонентов, вклю-
чая липополисахариды, фосфолипиды и амино-
липиды. Жирные 2-гидроксикислоты входят в
состав мембранных фосфолипидов у бактерий ро-
дов Burkholderia, Nocardioides, Microtetraspora и
Saccharothrix. У некоторых видов рода Sphingo-
monas в составе сфинголипидов присутствуют
2-гидроксикислоты, соединенные амидной связью
с остатком сфингозина. Необычные жирные кис-
лоты «зо-ОН, длинноцепочечные, обычно вклю-
чающие 27-32 атома С, у некоторых представите-
лей о-подкласса Proteobacteria, по-видимому, свя-
заны с липополисахаридами.
Липиды с простыми эфирными связя-
ми характерны для археи □ Обнаруженные
у прокариот липиды с простыми эфирными свя-
зями могут быть подразделены на три класса
(см. разд. 7.10.5 и рис. 7.39): 1) изопреноид-
Глава 29. Разнообразие и систематика прокариот 167
Рис. 29.12. Строение молекул дикарбоновой кислоты и
монокарбоновой-моноэфирной кислоты.
Рис. 29.13. Строение молекул некоторых жирных гид-
роксикислот.
А. 2-ОН-кислота. Б. 3-ОН-кислота. В. изо-ОН- или,
о>2-ОН-кислота.
кого типа, 2) с прямой цепью и разветвленные и
3) алк-1-енил-типа. Липиды первого типа перво-
начально были обнаружены в составе клеточных
мембран галобактерий и рассматривались как
признак адаптации к высокой солености среды.
Позже они были выявлены у Thermoplasma
acidophilum, а также у некоторых видов родов
Sulfolobus и Acidianus и стали считаться при-
знаком адаптации к различным экстремальным
условиям. Изучение большого числа метаногенов
показало, что они также синтезируют липи-
цы с простыми эфирными связями, содержащие
изопреноидные цепи. Присутствие этих необыч-
ных липидов составляет отличительный признак
архей, позволяющий быстро идентифицировать
микроорганизм как представитель этой группы
прокариот.
Липиды архей с простыми эфирными связя-
ми (см. рис. 7.40 и 7.41) необычны в нескольких
аспектах. Помимо того, что боковые цепи в них
присоединены к глицеролу в sn-2,3-положениях
(тогда как у не-архей — в sn- 1,2-положениях), спе-
цифической особенностью этих липидов является
присутствие в них только изопреноидных боковых
цепей. Большинство липидов архей представляет
собой либо диэфиры глицерола, либо тетраэфиры
диглицерола, в которых изопреноидные Сзо-цепи
состоят из двух Сго-цепей, соединенных «голова
к голове». Одним из интересных следствий тетра-
эфирной структуры можно считать доступность
гидроксильных групп на каждом конце молеку-
лы; эти группы могут быть замещены полярными
группами.
Плазматическая мембрана, присутствующая у
всех прокариот, выполняет сходные функции у
всех живых существ. Несмотря на это, липидный
состав ее может быть весьма разнообразен. Диа-
пазон липидных компонентов, их распределение и
связь с путями биосинтеза делают состав мембра-
ны полезным таксономическим критерием.
Дополнение 29.4. Мембраны некоторых
микроорганизмов содержат нетипичные ком-
поненты.
Длинноцепочечные диолы могут вхо-
дить в состав клеточных липидов вместо гли-
церола. Открытие алкилдиолов у Т. roseum
позволило обнаружить неизвестный ранее ме-
ханизм формирования клеточной мембраны.
В этих липидах одним заместителем явля-
ется алкильная цепь, ко второй гидроксиль-
ной группе присоединена жирная кислота и
первая гидроксильная группа связана с фос-
фатсодержащим остатком или гликозильным
остатком.
Алкиламины — необычные компоненты
клеточной мембраны у бактерий рода Dei-
nococcus. Такой липид представляет собой
комплексный гликофосфолипид, в котором
фосфатидиловая группа связана фосфо-
эфирной связью с остатком глицерата,
который, кроме того, связан гликозидной
связью с глюкозой и пептидной связью с
длинноцепочечным алкиламином.
Сфинголипиды присутствуют как у эу-
кариот, так и у бактерий. Обычно они
рассматриваются как типичные компоненты
мембран эукариотических клеток, однако и
фосфо-, и гликосфинголипиды обнаружены
168 Часть VII. Разнообразие и систематика
у представителей различных родов прокари-
от, включая как Sphingomonas, Erythrobacter^
Sphingobacterium и Bacteroides. Немногочис-
ленные имеющиеся данные о механизме син-
теза этих соединений указывают па то, что
они образуются путем конденсации серина
и длинноцепочечпого ацил-СоА с последую-
щим декарбоксилированием и отщеплением
3-оксо-производного.
Капнины, возможно, играют роль в сколь-
зящем движении клеток. Они представля-
ют собой длипноцепочечные 1-сульфоно-З-
гидроксизамещенные алкильные соединения
(рис. 29.14, А). К настоящему времени кап-
нины обнаружены только в группе Flavobac-
terium/ Cytophaga / Bacteroides. В частности,
их синтезируют бактерии родов Cytophaga и
Capnocytophaga. Описаны также 2-ацил-про-
изводпые капнинов (рис. 29.14, Б). Функцио-
нальная роль капнинов не установлена. Син-
тез их осуществляется, по-видимому, путем
конденсации цистеина и длинноцепочечного
ацил-СоА и далее по пути, аналогичному пу-
ти синтеза сфинголипидов.
Гопаноиды (производные тритерпеков)
можно назвать ископаемыми молекулами в
живых организмах. Эти соединения присут-
ствуют у мхов и лишайников и обнаружены
также в некоторых окаменелостях углевод-
ной природы. По строению гопаноиды отча-
сти сходны со стероидами, и поэтому пред-
полагается, что эти два класса веществ мо-
гут иметь аналогичные функции в клеточной
мембране (см. гл. 7). Прокариоты не способ-
ны синтезировать стероиды de novo. В отли-
чие от стероидов, в синтезе которых у эука-
риот участвует кислород-зависимый фермент
сквалсн-2,3-оксид-циклаза, гопаноиды синте-
зируются с участием сквален-циклазы, не
зависимой от кислорода. У прокариот обна-
ружены разнообразные гопаноиды; они мо-
гут содержать либо небольшое число функ-
циональных групп, либо боковые цепи в
виде тетролов или пентолов, либо смешан-
ные амино- и гидроксизамещенные боковые
цепи, а также представлять собой еще бо-
лее сложные производные, в состав кото-
рых входят аминокислоты, аминосахара или
аденозильные группы. Преимущественно го-
Капнин
ОН
I
$Оз-СН2-СН-СН-(СН2)„ -снэ
А
n-Ацилкапнин р
SO3-СН2-СН-СН-(СН2)„-СНз
Б NH
СО-(Сн2)„ - сн3
Рис. 29.14. Примеры капнинов, обнаруженных у некото-
рых представителей рода Cytophaga.
А. Капнин. Б. п-Ацилкапнин.
паноиды присутствуют в составе клеточных
мембран у представителей а-, /3- и 7-под-
классов Proteobacteria, однако их содержат
также некоторые представители рода АНсус-
lobacillus. Исследованные виды архей не со-
держат гопаноидов.
29.3.5. Для таксономического
и филогенетического анализа можно
использовать переносчики электронов
Цитохромы входят в состав электронтранспорт-
ных цепей у разнообразных прокариот и эукариот.
Проведенное в 1960-70 гг. изучение аминокислот-
ных последовательностей цитохромов можно счи-
тать началом анализа последовательностей, при-
меняемого теперь для филогенетических рекон-
струкций (см. разд. 29.1.8).
Дыхательные хиноны могут иметь таксоно-
мическое значение, поскольку для них характер-
на вариабельность структуры (см. гл. 4 и 11), осо-
бенно в системе циклов, а также в изопреноидных
боковых цепях.
Убихиноны (см. рис. 4.8) присутствуют не у
всех микроорганизмов. Основные различия в их
структуре касаются числа изопреновых единиц в
боковой цепи, которое варьирует в пределах от 7
до 14 (Q-7-Q-14). У некоторых организмов обна-
ружены деметокси-производные убихинонов, од-
нако их роль пока не установлена. Известно так-
же, что некоторые облигатные метилотрофы син-
тезируют убихиноны, содержащие метиленовую,
либо и метиленовую и дополнительно метильную
группу в составе боковой изопреноидной цепи.
Глава 29. Разнообразие и систематика прокариот 169
Родохиноны, по-видимому, присутствуют
только у представителей о, /3- и 7-подклассов
Proteobacteria. Вариабельность этих соединений
связана с числом изопреновых единиц в боко-
вой цепи, варьирующим в пределах от 8 до 10
(RQ-8-RQ-10).
Пластохиноны обнаружены среди прокари-
от только у цианобактерий. Присутствие пласто-
хинонов у высших растений, а также у бурых,
зеленых и красных водорослей подтверждает ги-
потезу о происхождении хлоропластов от сим-
биотических цианобактерий. С ней согласуются
также данные по неполным последовательностям
168-рРНК/рДНК хлоропластов.
Гораздо чаще, чем убихиноны, в дыхатель-
ных цепях прокариот встречаются менахиноны
(2-метилнафтохиноны). Это наиболее распростра-
ненный тип дыхательных хинонов. Некоторые
микроорганизмы синтезируют только деметилме-
нахиноны (нафтохиноны), другие — монометил-
менахипопы [5 (или 8),2-димстилпафтохипоны];
редко встречаются диметилменахиноны [5 (или
8),6 (или 7),2-триметилнафтохиноны] (рис. 29.15).
Обнаружен также мстилтиопафтохипоп, со-
держащий дополнительную метилтионовую
группу. Число изопреновых единиц в боко-
вой цепи менахинонов варьирует от 6 до 15
(МК-6-МК-15). Многие микроорганизмы синте-
зируют полностью ненасыщенные нафтохиноны,
Рис. 29.15. Примеры структурной вариабельности аро-
матическрнр ядра молекул нафтохинонов.
но существуют и некоторые бактерии (грамот-
рицательные сульфатредукторы и представители
ветви грамположительных бактерий с высоким
содержанием G + С), продуцирующие нафтохино-
ны с не полностью насыщенными боковыми цепя-
ми. Степень насыщенности изменяется в пределах
от 1 до 4, и каждая позиция двойной связи специ-
фична для той или иной группы бактерий. Эти
соединения синтезируются с участием высоко-
стереоспецифичных ферментов, что может иметь
значение для таксономии. Целый ряд необычных
менахинонов с гексациклом в терминальном по-
ложении изопреноидной боковой цепи обнаружен
у всех аутентичных видов рода Nocardia. Неко-
торые археи также содержат м< нахиноны. Для
рода Thermoplasma и сем. Halobacteriaceae ха-
рактерны полностью ненасыщенные или дигид-
рогенировапные боковые цени. У архей родов
Archaeoglobus, Thermoproteus и Pyrobaculum бо-
ковые цепи нафтохинонов полностью насыщен-
ные. Неожиданным образом полностью насыщен-
ный менахинон у Pyrobaculum organotrophum со-
держит пентациклическую структуру.
Бензотиофенхиноны (рис. 29.16) обнару-
жены как серусодержащие компоненты клеток
архей, окисляющих серу и относящихся к по-
рядку Sulfolobales. У всех изученных представи-
телей данного порядка обнаружен кальдериел-
ла-хинон, первоначально описанный у «Calde-
riella acidophila» (нынешнее название — Sulfolobus
solfataricus). Сульфолобус-хинон вначале был
косвенно идентифицирован у Sulfolobus brierleyi
(этот вид перенесен теперь в род Acidianus) и
затем у «.Sulfolobus ambivalens» (в то время от-
носимого к роду Desulfurolobus, теперь — к роду
Acidianus).
Рис. 29.16. Примеры структурной вариабельности бен-
зотиофенхинонов
170 Часть VII. Разнообразие и систематика
29.3.6 . Бактериохлорофиллы
и другие порфирины прокариот
У прокариот описаны разнообразные Mg-содер-
жащие тетрапирролы, такие как хлорофилл а
(у цианобактерий) и бактериохлорофиллы а-е
и д (у аноксигенных фототрофных бактерий;
см. рис. 13.1 и табл. 13.1). Бактериохлоро-
филл а содержат также некоторые аэробные
бактерии о-подкласса Proteobacteria, в том чис-
ле представители родов Roseobacter, Acidiphilium
и Methylobacterium. Многие метаногенные археи
синтезируют никельсодержащий порфирин, фак-
тор F430, который участвует в образовании метана
(см. рис. 12.10).
Компоненты дыхательной цепи у различных
бактерий в той или иной степени варьируют по
структуре, что не влияет существенно на их функ-
цию. В молекулах многих переносчиков электро-
нов имеются консервативные области (такие как
активный центр цитохромов или бензохиноновое
кольцо в молекулах убихинонов) и вариабельные
области (например такие, как структурно гибкие
участки в молекулах цитохромов или варьирую-
щие по длине и степени насыщенности изопре-
ноидные боковые цепи в составе менахинонов).
Сочетание консервативных и вариабельных об-
ластей в молекулах этих соединений позволяет
выделять на основе их анализа таксономические
группы с иерархическим подразделением.
29.3.7 . Полиамины выполняют
разнообразные функции
Полиамины представляют собой алифатические
амины, синтезируемые из аминокислот (см.
рис. 7.43). Эти многофункциональные соедине-
ния присутствуют не у всех микроорганизмов;
у отдельных бактерий они обнаруживаются как
ковалентно связанные с пептидогликаном. Пред-
положительно полиамины участвуют в синтезе
нуклеиновых кислот и связаны с функцией сиде-
рофоров. Как считается, полиамины могут быть
полезными маркерами для химической классифи-
кации.
29.3.8 . Для оценки общей степени сходства
используются методы «отпечатков
пальцев» (фингерпринтинг)
Химические «отпечатки пальцев» (фин-
герпринты) □ Штаммы микроорганизмов мож-
но идентифицировать по наличию или отсут-
ствию в их клетках специфических соединений.
Для этого пригодны методы, позволяющие ана-
лизировать обширный срез эпигенетической ин-
формации, содержащейся в целых клетках, без
идентификации отдельных компонентов. Такие
методы можно рассматривать как эпигенетиче-
ские аналоги генетических методов — ПДРФ-ана-
лиза, амплификации со случайными праймерами
(RAPD-анализ) и риботипирования (разд. 29.4).
Наиболее часто используется метод определения
белкового состава клеток, масс-спсктроскопия
продуктов пиролиза, а также новый метод
ИК-ФС (см. дополнение 29.5). В тех случаях,
когда необходимо в короткий срок проанализи-
ровать большое количество штаммов, подобные
методы предпочтительны, поскольку позволяют
быстро сгруппировать штаммы по степени сход-
ства полученных профилей для тех или иных при-
знаков (здесь важную роль играет фенетическая
концепция общего сходства; см. разд. 29.2). Силь-
ная сторона этих методов — возможность сравни-
вать большое число штаммов с типовыми вида-
ми или ссылочными (референтными) штаммами,
но в то же время фингерпринтинг гораздо менее
пригоден для таких задач, как отнесение нового
вида к известному таксону более высокого ранга,
в частности при существенном несходстве между
известным таксоном и новым видом.
Дополнение 29.5. Некоторые химические
фингерпринты широко используются в так-
сономических исследованиях как эпигенети-
ческие маркеры.
Белковые профили □ С помощью
методов белковых профилей обычно опреде-
ляют состав растворимой белковой фракции
клеток, выращенных в контролируемых усло-
виях. Белки этой фракции можно разделить
с помощью обычного гель-электрофореза,
двумерного электрофореза (см. рис. 20.7) или
капиллярного электрофореза. Разработаны
модификации методов электрофореза, поз-
воляющие визуализировать разделенные
Глава 29. Разнообразие и систематика прокариот 171
изоформы ферментов по их активности,
применяя непосредственно в геле высоко-
специфичные субстраты (обычно конъюгиро-
ванные с красителем, приобретающим опре-
деленную окраску в зависимости от вос-
становления/окисления). Белковые профили
используют для выявления разнообразных
фенотипических признаков клеток, а также
для разделения на внутривидовом уровне,
когда требуется проанализировать большое
число штаммов.
Спектрофотометрические методы □
Надежным таксономическим критерием для
идентификации пигментированных микроор-
ганизмов служит спектр поглощения целых
клеток или их экстрактов в видимой области.
Например, этот критерий используют для
определения аноксигенных фототрофных
бактерий, различающихся по максимумам
поглощения (данные различия обусловлены
клеточным составом каротиноидов и бакте-
риохлорофиллов, химическое строение кото-
рых подробно изучено в специальных иссле-
дованиях). При идентификации пигментиро-
ванных прокариот этот метод эффективно
используется для группирования штаммов
со сходной пигментацией (например, так на-
зываемой группы желтых палочек). Новым
спектрофотометрическим методом, использу-
емым для классификации микроорганизмов,
служит метод инфракрасной фурье-спектро- I
скопии (ИК-ФС). Его применение основано I
на том, что различные компоненты клеток I
имеют максимумы поглощения в инфра-
красной области спектра. Многие химически
сходные соединения, содержащие одни и
те же функциональные группы, например
пептидные, фосфатные или карбоксильные,
обнаруживают спектральные различия, по-
скольку особенности микроокружения этих
групп вызывают некоторое смещение мак-
симумов и минимумов ИК-спектра. Метод
ИК-ФС применяют для анализа целых кле-
ток, поэтому трудно предполагать, какие
факторы будут влиять на характер полу-
чаемого спектра. Установлено, однако, что
изменение состава липополисахаридов, пере-
ход к спорообразованию, изменение состава
среды или обработка антибиотиком отража-
ется на ИК-спектре.
Масс-спектроскопия продуктов пи-
ролиза □ Пиролиз — разложение веществ в
инертной атмосфере под действием высоких
температур или лазерного излучения — при-
меняют для предварительной обработки ана-
лизируемых клеточных компонентов. Напри-
мер, миколовые кислоты расщепляются при
пиролизе в тех участках молекул, которые
находятся между соседними гидроксильной и
карбоксильной группами, что позволяет ана-
лизировать эти липиды далее методом га-
зовой хроматографии, иначе неприменимым
для их анализа. В последнее время пиролиз
применяют в сочетании с газовой хромато-
графией и масс-спектрометрией или только
масс-спектрометрией. В первом случае полу-
чают более детальные масс-спектры отдель-
ных соединений, разделенных хроматографи-
чески, тогда как во втором — общую картину
масс-спектра всех продуктов пиролиза, кото-
рые могут ионизироваться в данной газовой
фазе. Для обработки полученных результа-
тов обычно применяют специальные компью-
терные программы, используя доступные ба-
зы данных. Как и фурье-спектроскопия, этот
метод прост в исполнении, требует лишь ми-
нимальной подготовки проб и может приме-
няться с использованием автоматизирован-
ных тестовых систем.
29.3.9 . Значение хемотаксономии зависит
от правильного подхода к оценке
химических данных
Химические данные используют для изучения
таксономических взаимосвязей в различных груп-
пах микроорганизмов. По некоторым группам
микроорганизмов таких данных накоплено до-
вольно много, но в целом наши представления о
разнообразии прокариот по химическому составу
пока еще весьма ограничены. Помимо недостатка
сведений, при хемотакономическом анализе иссе-
дователи сталкиваются с трудностями в примене-
нии химических данных, которые частично обу-
словлены причинами исторического характера е
частично отсутствием конкретных теоретических
и методологических подходов к оценке этих дан-
ных. Исторические проблемы в основном связа
172 Часть VII. Разнообразие и систематика
ны с тем, что многие высшие таксоны прокариот,
выделенные ранее 1970 гг., по данным хемотаксо-
номии оказались гетерогенными, что заставляло
систематиков сомневаться в целесообразности ис-
пользования химических данных для таксономи-
ческого анализа. Однако с развитием представле-
ний о действительной таксономической гетероген-
ности этих таксонов значение химических данных
стало очевидным. Вместе с тем среди множества
публикаций, посвященных изучению химическо-
го состава представителей большого числа таксо-
нов, мало работ по теории и методологии оценки
получаемых данных. Иллюстрацией того, каким
образом химические данные (в совокупности с
другими сведениями) в отсутствие такой базы
используются в современных таксономических
исследованиях, могут служить следующие при-
меры.
Сем. Halobacteriaceae — таксон, выде-
ленный с применением хемотаксономичес-
кого подхода □ Различные роды архей, входя-
щие в сем. Halobacteriaceae, были первоначально
идентифицированы на основании физиологиче-
ских и биохимических признаков, однако в по-
следнее десятилетие все большее значение для
их таксономии приобретают признаки, относящи-
еся к составу клеточной мембраны. Проведенная
недавно классификация внутри этого семейства
па основе анализа 16S-pPHK позволила выделить
группы, практически совпадающие с теми, кото-
рые были выделены путем анализа других хими-
ческих соединений (табл. 29.1).
Энтеробактерии — традиционная фило-
генетическая группа □ Сем. Enterobacteriaceae
объединяет обитающие в кишечнике грамотри-
цательные, факультативно анаэробные палоч-
ки, включая патогенные для человека формы.
В систематическом отношении эта группа, по-
видимому, чрезмерно дифференцирована, что
объясняется ее важным медицинским значени-
ем и стремлением исследователей выделять в от-
дельные роды близкие, но вызывающие различ-
ные клинические симптомы бактерии (например,
бактерии рода Shigella можно рассматривать как
представителей рода Escherichia). На близость
всех организмов этой группы указывает сходство
фенотипов, химических профилей и последова-
тельностей 16S-pPHK. Химические профили для
разных родов данного семейства приведены в
табл. 29.2.
Род Pseudomonas — химически гетеро-
генный или таксономически некоррект-
ный? □ Впервые род Pseudomonas был описан
в 1894 г. С тех пор в этот род грамотрицатель-
ных аэробных подвижных палочек было вклю-
чено множество видов. Изучение их с помощью
методов хемотаксономии в конце 1960-х гг. пока-
зало, что многие виды должны быть исключены
из этого рода. Множество исследований, прове-
денных с применением методов РНК/ДНК-гиб-
Таблица 29.1. Липидный состав клеток представителей сем. Halobacteriaceae. ФГ — фосфатидилглицерол;
ФГ Ф — фосфатидилглицеролфосфат; ФГС — фосфатидил глицеролсульфат; S-ДГД — сульфатированный диглико-
зилдиэфир; S-ТГД — сульфатированный тригликозилдиэфир; ТеГД — тетрагликозилдиэфир; МК — менахиноны
Таксономический ранг Таксон Липиды co СЛОЖНО- эфирными связями Хиноны Полярные липиды
Семейство Род Halobacteriaceae Haloarcula Halobaculum Halobacterium Halococcus Haloferax Halorubrum Natronobac terium Natronococcus C20; C20, С25; Сго Сго; Сго, Сго; Сго, Сго; Сго, Сго; Сго, Сгь; Сго Сго; Сго, Сго; Сго, Сго; Сго, С25; Сго Сго; Сго, Сгь; Сго МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) МК8, МК8 (VIII-Нг) ФГ, ФГФ ФГ, ФГФ, ТГД-1 ФГ, ФГФ, ДГД-2 ФГ, ФГФ, ФГС, ТГД-2, 8-ТГД-2, ТеГД ФГ, ФГФ, ТГД-2 ФГ, ФГФ, ТГД-1 ФГ, ФГФ ФГ, ФГФ ФГ, ФГФ, циклический ФГФ
Глава 29. Разнообразие и систематика прокариот 173
ридизации, сравнения каталогов олигонуклеотид-
ных последовательностей 16S-pPHK и прямого
секвенирования этих молекул либо кодирующих
их генов дали основания для разделения едино-
го рода Pseudomonas на несколько самостоятель-
ных родов. Многие из этих новых родов лишь
отдаленно родственны действительным предста-
вителям рода Pseudomonas, типовым видом кото-
рого является Pseudomonas aeruginosa (см. так-
же табл. 29.7). Детальное изучение химических
профилей новообразованных родов (табл. 29.3)
показало, что каждый из них четко отделяется
от видов, составляющих собственно род Pseudo-
monas.
Микробные клетки содержат огромное чис-
ло различных органических соединений. Ана-
лиз молекулярного состава клеток проводят ли-
бо для выявления отдельных клеточных ком-
понентов (например, жирных кислот), либо
для получения комплексной характеристики хи-
мического состава клеток или их фрагментов (на-
пример, с помощью ИК-спектроскопии). Биохи-
мические методы служат мощным и в то же время
Таблица 29.2. Липидный состав клеток представителей сем. Enterobacteria. ФГ — фосфатидилглицерол; ФЭА — фос-
фатидилэтаноламин; ДФГ — дифосфатидилглицерол; Qn—убихинон п (с п-числом изопреновых единиц); МКп —
менахинон (с п-числом изопреновых единиц); ДМК — диметилменахинон (с n-числом изопреновых единиц)
Таксономический ранг Таксон Г1 реобл а да ющие жирные кислоты Хиноны Полярные липиды Г идроксилированные жирные кислоты
Семейство Enterobacteriaceae 16:0, 16:1, 18:1 Q8 ФГ, ФЭА, ДФГ ЗОН-14:0
Род Escherichia 16:0, 16:1, 18:1 Q8, МК8, ДМК8 ФГ, ФЭА, ДФГ 3-ОН-14:0
Salmonella 16:0, 16:1, 18:1 Q8, МК8 ФГ, ФЭА, ДФГ 3-ОН-14:0, 2-011-14:0
Proteus 16:0, 16:1, 18:1 Q8, МК8, ДМК8 ФГ, ФЭА, ДФГ 3-ОН-14:0
Serratia 16:0, 16:1, 18:1 Q8, МК8 ФГ, ФЭА, ДФГ 3-011-14:0, 2-ОН-12:0
Citrobacter 16:0, 16:1, 18:1 Q8, МК8 ФГ, ФЭА, ДФГ 3-ОН-14:0
Yersinia 16:0, 16:1, 18:1 Q8 ФГ, ФЭА, ДФГ 3-ОН-14:0, 3-ОН-13:0
Erwinia 16:0, 16:1, 18:1 Q8, МК8, ДМК8 ФГ, ФЭА, ДФГ 3-ОН-14:0
Таблица 29.3. Липидный состав клеток представителей родов, ранее входивших в род Pseudomonas. ФГ — фосфа-
тидилглицерол; ФЭА — фосфатидилэтаноламин; ДФГ — дифосфатидилглицерол; ФГЛ — фосфо гликолипид; УЛ —
липид, содержащий уроновую кислоту; ОЛ — орнитин-липид; Qn — убихинон п (с п-числом изопреновых единиц)
Таксономический ранг Таксон, подкласс Proteobacteria Преобладающие жирные кислоты Хиноны Полярные липиды Прежняя классификация
Род Pseudomonas, 7 16:0, 16:1 Q9 ФГ, ФЭА, ДФГ (в настоящее время) Р. aeruginosa, типовой вид
Stenotrophomonas, у 16:0, 16:1, 1-15:0 Q8 ФГ, ФЭА Р. maltophilia
Methylobacterium, а 16:0, 16:1, 18:1 Q10 ФГ, ФЭА, ДФГ Р. radiora
Brevundimonas, а 16:0, 16:1, 18:1 Q10 ФГ, ФГЛ, УЛ Р. diminuta
Sphingomonas, а 16:0, 16:1, 18:1 Q10 ФГ, ФЭА, сфинго- Р. capsulata
липид
Burkholderia, {3 16:0, 16:1, 18:1 Q8 ФГ, ФЭА, ОЛ Р. cepacia
Comamonas, /3 16:0, 16:1 Q8 ФГ, ФЭА Р. acidovorans
174 Часть VII. Разнообразие и систематика
простым инструментом таксономических исследо-
ваний, позволяя, в частности, выявлять характер-
ные признаки определенных таксонов, например
такие, как присутствие изопреноид-содержащих
липидов, характерных для архей. Хемотаксономи-
ческий подход приобретает все большее значение
благодаря тому, что уже проведены первые си-
стематические исследования на его основе, в том
числе 1) для разработки методов оценки данных
и 2) для изучения биологического и возможного
таксономического значения данных о химическом
составе клеток в современной систематике.
29.4. Геномные характеристики штаммов и видов
29.4.1. Штаммы и виды можно
идентифицировать путем анализа
их белковых профилей
и нуклеотидных последовательностей
Одним из наиболее важных практических вопро-
сов, связанных с систематикой микробов, мож-
но считать вопрос о том, как определить, при-
надлежит выделенный штамм к известному или
к новому виду. Анализ небольшого числа микро-
организмов хемотаксономическими, молекулярно-
биологическими и физиологическими методами
доступен для лабораторий, располагающих со-
временным оборудованием, однако в тех случа-
ях, когда необходимо идентифицировать боль-
шое число объектов, например в фармацев-
тическом производстве или при клинической
диагностике, ситуация иная. Здесь требуется
быстро и надежно проводить идентификацию, ис-
пользуя наиболее простые методы. Помимо ав-
томатизированных систем, соединенных с ком-
пьютером (разд. 29.2), и хемотаксономических
методов (разд. 29.3), быструю идентификацию
позволяет осуществлять анализ клеточных про-
филей первичных семантид, т. е. ДНК, РНК и
белков (табл. 29.4). Такие профили представляют
собой штамм-специфические фингерпринты. Ха-
рактер получаемых профилей (набор полос) за-
висит от методов, применяемых для расщепления,
амплификации, гибридизации и разделения дан-
ных макромолекул или их фрагментов. Исполь-
зование методов электрофореза с изменяющим-
ся направлением поля, или пульс-электрофореза
(для разделения фрагментов ДНК), гибридиза-
ции с мечеными зондами (для выявления иско-
мых генов), а также денситометрического лазер-
ного сканирования (для визуализации полос) с
компьютерным анализом существенно повышает
разрешающую способность такого анализа и об-
легчает его проведение (см. гл. 17). При исполь-
зовании этого подхода необходимо учитывать, что
белковые профили в определенной степени измен-
чивы, тогда как профили нуклеиновых кислот
обычно можно рассматривать в качестве стабиль-
ных геномных фингерпринтов. Имеются програм-
мы для построения на основе получаемых набо-
ров полос (профилей) той или иной дендрограм-
мы сходств. Какую именно процедуру анализа
необходимо применить для различения штаммов,
устанавливают экспериментально. Вследствие му-
таций даже клетки внутри отдельной колонии мо-
гут различаться на уровне первичной структу-
ры ДНК (см. гл. 15). Поэтому требуемый для
идентификации набор полос (характер профиля)
зависит от цели исследования, т. е. от конкрет-
ного таксономического вопроса. Подобрав опти-
мальный набор рестриктаз, зондов для гибриди-
зации или олигонуклеотидных праймеров, можно
использовать его и в дальнейших исследовани-
ях данной (но не другой) группы организмов.
Идентификацию на основании профилей произ-
водят путем сравнения одномерных профилей се-
мантид или их фрагментов, полученных для изу-
чаемых изолятов, с аналогичными профилями
предположительно близких ссылочных штаммов.
Такие профили не должны быть ни слишком
сложными для анализа, ни слишком простыми, не
отражающими различия в геномах. При соблюде-
нии этого условия исследуемые изоляты и ссылоч-
Глава 29. Разнообразие и систематика прокариот 175
Таблица 29.4. Быстрые методы анализа первичных се-
мантид
Рестрикционный анализ нуклеиновых кислот с исполь-
зованием бактериальных рестрицирующих эндонук-
леаз (метод BRENDA)
Определение полиморфизма длины рестрикционных
фрагментов (метод ПДРФ)
Риботипирование
Анализ профилей низкомолекулярных РНК
Рестрикционный анализ амплифицированной рибосом-
ной РНК (метод ARDRA)
Амплификация со случайными праймерами (метод
RAPD)
Гибридизация с олигонуклеотидными зондами
Анализ плазмидных профилей и плазмидный фингер-
принтинг (рестрикционный анализ плазмидной ДНК)
Анализ белкового состава клеток методами одномерно-
го и двумерного электрофореза
ные штаммы, между которыми обнаружено вы-
сокое сходство матриц, рассматривают как род-
ственные. Анализ профилей дополняет тра-
диционные методы типирования, используемые
главным образом в медицине, такие как серотипи-
рование, биотипирование и фаготипирование. Ес-
ли же исследуемый штамм характеризуется уни-
кальным профилем, то вопрос о том, относит-
ся ли он к известному виду или должен быть
выделен в новый вид, требует применения ко-
личественных методов, позволяющих определить
степень родства на геномном уровне. Ниже опи-
сываются различные методы анализа первичных
семантид, приведенные в табл. 29.4.
Метод BRENDA (от bacterial restriction
endonuclease nucleic acid analysis) состоит в том,
что хромосомную ДНК расщепляют различными
эндонуклеазами по отдельности, после чего раз-
деляют фрагменты в высокоразрешающем ага-
розном геле (рис. 29.17, А). Количество сайтов
рестрикции существенно различается в зависи-
мости от размеров генома и используемых ре-
стриктаз, поэтому получаемые наборы полос ва-
рьируют по степени сложности. Филогенетиче-
ская связь штаммов внутри вида непредсказуема,
и если полученные профили для разных штам-
мов сильно различаются между собой, результаты
данного исследования могут не дать немедленно-
го ответа на вопрос о родственных связях иссле-
дуемых изолятов. На рис. 29.17, А четко видны
1 2 3 4 5 6 7
1 2 3 4 5 6 7 8 9 10 11 12 13
Рис. 29.17. Примеры результатов BRENDA- и
RAPD-анализа геномной ДНК.
А. BRENDA-анализ ДНК с использованием рестрик-
тазы S61. Дорожки: 1 — маркер (ДНК фага А); 2 —
Escherichia coli В, штамм дикого типа; 3-7 — различные
штаммы Escherichia coli К-12 дикого типа (3-5) и
мутантов (б, 7). Фрагменты ДНК были разделены
методом пульс-электрофореза в 10% агарозном геле.
Б. RAPD-анализ ДНК штаммов, перечисленных в
пункте А (дорожки 2—7) и нанесенных в том же
порядке на дорожки 1-6 (праймер APR-2) и 7-12
(праймер APR-б); дорожка 13 — маркеры молекулярной
массы фрагментов. Фото любезно предоставлены
N. Ward-Rainey.
различия между штаммами Е. coli В и К-12 и ге-
номная гетерогенность штаммов К-12.
Рестрикционные фрагменты переносят затем
на мембрану и анализируют их методом опре-
деления полиморфизма длины рестрикционных
фрагментов, ПДРФ, т. е. путем гибридизации с
мечеными клонированными фрагментами ДНК
(случайным образом выбранными из библиоте-
ки клонов или полученными как специфические
участки хромосомной ДНК с известной или неиз-
вестной последовательностью), либо с синтезиро-
ванными специфическими олигонуклеотидными
176 Часть VII. Разнообразие и систематика
зондами. Наличие или отсутствие сайтов рестрик-
ции данной эндонуклеазы у двух данных штаммов
может приводить к изменению длины фрагмен-
тов, содержащих ген-мишень, и, следовательно, к
изменению положения этих фрагментов в набо-
ре полос на электрофореграмме. Сложность полу-
чаемых в результате гибридизации наборов полос
зависит от числа последовательностей-мишеней и
от позиций сайтов рестрикции.
Анализ профилей низкомолекулярных
РНК позволяет выявить различия в последова-
тельностях 5S-PHK и примерно 60 видов тРНК
на клетку. Разделение этих молекул с помо-
щью высокоразрешающего гель-электрофореза
дает таксон-специфические наборы полос. Боль-
шинство тРНК класса 1 разделяется плохо, по
различия в длине 5S-PHK и тех либо иных тРНК
класса 2 служат четкими видоспецифическими
критериями.
Риботипирование представляет собой вари-
ант метода ПДРФ, в котором в качестве зондов
используются меченые фрагменты рибосомной
РНК и рибосомной ДНК либо ген-специфические
олигонуклеотиды. Обычно получаемый этим ме-
тодом набор полос сложнее ПДРФ-набора, по-
скольку гены рРНК у прокариот одни из немно-
гих, которые присутствуют в геноме во множестве
копий — от 1 до 12 (по последним данным до 15. —
Спец, ред.) в зависимости от таксона. Разрешаю-
щая способность данного метода зависит от изу-
чаемого вида и выбранных рестриктаз.
Метод ARDRA (от amplified ribosome DNA
restriction analysis) заключается в том, что ге-
ны рРНК предварительно амплифицируют ме-
тодом ПЦР и затем расщепляют рестриктазами,
после чего полученные фрагменты разделяют с
помощью гель-электрофореза. Длина полученных
фрагментов и их положение на дорожке форе-
за зависят от числа и расположения сайтов ре-
стрикции в этих генах. Данный метод может быть
использован для быстрого скрининга большого
числа изолятов. Сравнение полученных наборов
полос с имеющимися в базе данных позволя-
ет отнести изоляты к определенным видам или
группам видов при высоком сходстве по этому
признаку.
Особенность метода RAPD (от random amp-
lified polymorphic DNA) состоит в том, что для
амплификации используются короткие (не более
10 нуклеотидов) праймеры со случайной последо-
вательностью (см. гл. 17). В зависимости от числа
комплементарных или частично комплементар-
ных праймерам участков в геноме (на обеих це-
пях ДНК) в процессе амплификации синтезирует-
ся некоторое количество фрагментов разной дли-
ны, количество и размеры которых могут быть
использованы для оценки степени сходства меж-
ду двумя штаммами (рис. 29.17, Б). Например,
с использованием двух различных случайных
праймеров были подтверждены предварительные
результаты BRENDA-анализа, указавшие на раз-
личия между наборами полос В-штамма Е. coli и
различных штаммов К-12, довольно однородных
по составу ДНК.
Использование олигонуклеотидных зон-
дов становится в настоящее эффективным
подходом для идентификации. Короткие олиго-
нуклеотиды (длиной не более 50 нуклеотидов)
способны гибридизоваться с комплементарными
участками хромосом в лизатах колоний, в пре-
паратах нуклеиновых кислот и даже в целых
клетках (рис. 17.11). Зонды могут быть подо-
браны для индивидуальных генов, кодирующих
специфические для данного таксона белки, для
спейсеров (некодирующих участков ДНК меж-
ду генами), рРНК, а также генов рРНК и даже
плазмид. Большое число копий рРНК в клетках
(примерно 104 на клетку) делает эти последо-
вательности наиболее подходящими мишенями.
Рибосомные РНК, а также кодирующие их гены
содержат мотивы (специфические участки по-
следовательностей), на основании которых мож-
но разработать таксон-специфические зонды для
определения филогенетически близких групп над-
штаммового уровня. В настоящее время созданы
специфические зонды практически для всех кли-
нически важных бактерий; многие из них входят
в состав готовых наборов для диагностических
тестов. Определение гибридизации в подобных
тестах достигает высокой точности, причем ис-
пользуются нерадиоактивные метки (такие, как
сульфоновая группа или флуорохромы). Разрабо-
таны методы с нерадиоактивным мечением, поз-
воляющие проводить определения на отдельных
клетках и благодаря этому изучать эндосимбион-
тов и паразитов, которых не удается культивиро-
вать в лабораторных условиях, а также микроор-
ганизмы в природных местообитаниях.
Плазмидные профили (для целых плаз-
мид) и плазмидные фингерпринты получают пу-
тем электрофореза грубых экстрактов клеток.
Этот метод применяют для эпидемиологическо-
Глава 29. Разнообразие и систематика прокариот 177
го анализа, для мониторинга источников рас-
пространения возбудителей инфекций и микроор-
ганизмов, вызывающих порчу пищевых продук-
тов (см. гл. 33). Для некоторых видов анализ
плазмидного состава может быть единственным
методом различения штаммов. Получение плаз-
мидного фингерприпта включает обработку пред-
варительно выделенной плазмидной ДНК ре-
стриктазами, что повышает разрешающую спо-
собность данного метода. Набор фрагментов ДНК
может быть также изучен с помощью ПДРФ-ана-
лиза.
Электрофоретическое разделение всех клеточ-
ных белков позволяет получать одномерные
и двумерные белковые профили, которые
служат грубой физико-химической характеристи-
кой продуктов экспрессии генов. При этом для
получения воспроизводимых результатов клет-
ки должны выращиваться в строго стандартизо-
ванных условиях и сравнение электрофореграмм
необходимо проводить с помощью компьютерных
методов (см. разд. 29.3).
Применение молекулярных методов существен-
но облегчает разграничение таксонов на всех
уровнях родства. Определение родственных вза-
имосвязей организмов на уровнях выше родово-
го имеет важное значение для выяснения вопро-
сов филогении и эволюции. В то же время для
целей клинической практики и в фармацевтиче-
ской промышленности удобны несложные методы
быстрой и точной идентификации видов и штам-
мов. Так, при изучении клинических и природ-
ных изолятов, а также штаммов бактерий, вы-
деленных из испорченных пищевых продуктов, и
штаммов, контаминирующих биотехнологические
культуры, требуется быстро определить, относит-
ся данный штамм к известному виду или пред-
ставляет собой новый вид, возможно обладающий
новыми свойствами.
29.4.2. Количественные характеристики ДНК
важны для определения родства
на внутри- и межвидовом уровнях
Большая часть генетической информации, пред-
ставленной в геноме прокариот, содержится в
хромосоме, что облегчает таксономический ана-
лиз (рис. 29.18; см. также гл. 14 и 15). Разме-
Штамм
Рис. 29.18. Схема процедуры количественного опреде-
ления сходства ДНК.
ры хромосом варьируют у прокариот в пределах
80 т.п.п-120 м.п.н. Наименьшие размеры хромо-
сомы характерны для облигатно паразитических
прокариот, тогда как у свободноживущих прока-
риот хромосомы более крупные. Размеры хромо-
сомы — это стабильный признак, который служит
полезным таксономическим признаком штамма.
Однако размеры всего генома (хромосома + плаз-
мидная ДНК) могут значительно варьировать у
разных штаммов данного вида, и этот факт, а
также сложность такого анализа (включающего,
например, центрифугирование в градиенте плот-
ности CsCl) снижают таксономическую ценность
данного признака.
Нуклеотидный состав ДНК, выражаемый
обычно в мол.% G + С (см. дополнение 29.6), ши-
роко варьирует у прокариот, от 24 (например, у
некоторых клостридиев и микоплазм) до 76 мол.%
(например, у некоторых актиномицетов). У фило-
генетически близких видов значения этого пока-
зателя не различаются больше чем на несколь-
ко процентов, однако у разных видов внутри
данного рода могут быть гораздо более далеки-
ми. При разбросе их более 15% род обычно рас-
сматривают как филогенетически гетерогенный
(примеры подобных родов — Bacillus, Clostridium
и Peptococcus). Для определения филогенетиче-
ских расстояний нельзя использовать ни разме-
ры генома, пи величину содержания G + С, по-
скольку различия в величине мол.% G + С не
коррелируют с различиями в последовательно-
сти ДНК, которые могут быть весьма значитель-
ными даже при идентичном нуклеотидном со-
ставе. G + С-состав ДНК — это исключительный
показатель в том отношении, что он сходен у
178 Часть VII. Разнообразие и систематика
родственных организмов, но само по себе сход-
ство по нему не обязательно указывает на близ-
кое родство изучаемых штаммов. Например, виды
грамположительных кокков родов Staphylococcus
и Micrococcus четко различаются по содержанию
G + C в ДНК (35 или 70 мол.% соответственно).
В то же время организмы со сходным нуклеотид-
ным составом и размерами генома могут быть
неродственными; например, величина 60 мол.%
G + С характерна для представителей таких ро-
дов, как Arthrobacter, Flavobacterium, Paracoccus,
Pseudomonas и Spirochaeta}.
Дополнение 29.6. Наиболее часто исполь-
зуемый метод для анализа нуклеотидного со-
става ДНК основан на способности этого по-
лимера денатурировать («плавиться») с вы-
свобождением одноцепочечной (оц) ДНК под
действием высокой температуры. Разделение
цепей сопровождается увеличением поглоще-
ния при 260 нм (гиперхроматический сдвиг)
примерно на 30% по сравнению с двухцепо-
чечной (дц) нативной ДНК, и этот сдвиг мож-
но зарегистрировать с помощью спектрофо-
тометра. Среднее значение поглощения меж-
ду оц- и дц-максимумами называют «точкой
плавления», Т„г. Температура, соответству-
ющая этой точке, служит показателем содер-
жания G + С в ДНК. Чем выше содержа-
ние G + С, тем больше тепловой энергии за-
трачивается на разделение цепей ДНК. Для
определения содержания G + С наиболее ча-
сто применяют следующую формулу:
%GCX = %GCCT. + 2,44[Tm(x) - Тт(ст.)],
(29.4)
где ст. — стандартный образец с известным
содержанием G + С и х — анализируемый об-
разец. Для оценки молярного содержания
G + С используют также график второй про-
изводной температуры перегиба гиперхрома-
тического сдвига, построение которого требу-
ет меньше расчетов. Ранее применялся также
метод оценки содержания G + С в ДНК по
величине плавучей плотности; наиболее со-
временный метод, используемый для данной
цели, — это метод HPLS, основанный на изме-
рении концентрации нуклеотидов в расщеп-
ленной ДНК.
29.4.3. Современный этап развития таксономии
связан с применением методов
гибридизации нуклеиновых кислот
Несмотря на достигнутый прогресс в секвени-
ровании полных геномов, пока невозможно вве-
сти в практику секвенирование и анализ больших
участков генома для оценки родства таксонов. До-
вольно точно позволяет определять степень гомо-
логии между последовательностями ДНК метод
ДНК/ДНК-гибридизации (см. дополнение 29.7).
Поскольку этим методом можно получить усред-
ненную оценку нуклеотидного сходства полных
геномов, он имеет преимущество перед другими
методами, позволяющими сравнивать лишь от-
дельные гены или продукты генов. Процедуру ги-
бридизации используют как стандартный метод
определения родства и филогенетической гомо-
генности штаммов данного вида, а также самосто-
ятельности видов (рис. 29.19). Разработаны раз-
личные методы гибридизации, осуществляемой
как в растворе, так и на мембранных фильтрах.
Уровень корреляции между величинами сходства,
полученными разными методами, должен быть не
ниже 30%.
Дополнение 29.7. Наряду с очевидными
преимуществами метод ДНК/ДНК-гибриди-
зации имеет и некоторые ограничения, кото-
рые необходимо учитывать при интерпрета-
ции данных.
1. Этот метод не позволяет определить, ка-
кие именно участки оцДНК из двух ор-
ганизмов формируют гибридные после-
довательности дпДНК. По этой причине
в данном случае более применим термин
«сходство», а не термин «гомология», ис-
пользовавшийся ранее (см. также допол-
нение 29.2).
2. Разрешающая способность методов
гибридизации очень низка, и с их помо-
щью можно установить родство только
между близкородственными видами или
штаммами внутри вида. ДНК штаммов,
различающаяся по содержанию G + С в
ДНК более чем на 10%, уже практически
не гибридизуются между собой в коли-
честве, которое можно измерить.
Глава 29. Разнообразие и систематика прокариот 179
Рис. 29.19.
ДНК/ДНК.
Способы измерения сходства
ДНК
"I
Спектрофотометрический
метод
Гибридизация
на фильтре
Гибридизация
в растворе
ОцДНК
(высокомолекулярная)
оцДНК
(общие фрагменты)
обработкой
нуклеазой S1
путем
отмывания
Смесь 1:1 общих фрагментов
ссылочной (референтной) и
исследуемой ДНК
I
Денатурация нагреванием
[определение сходства|
т Степень
Тт гибридов сходства_%
Ренатурация
I
Установление скорости
ренату рации и степени
сходства
3. При оптимальных условиях гибридиза-
ции (температура примерно на 25 °C
ниже температуры плавления нативной
ДНК), две цепи ДНК должны быть на SO-
85 % комплементарны, чтобы произошла
гибридизация. В зависимости от уровня
сходства последовательностей двух реас-
социирующих цепей ДНК степень гибри-
дизации может варьировать от 0% (отсут-
ствие гибридизации) до 100% (в случае
идентичности реассоциирующих цепей
ДНК). Поэтому, очевидно, та или иная ве-
личина сходства ДНК не отражает дей-
ствительную степень подобия на уровне
первичной последовательности.
4. Степень гибридизации зависит от
концентрации ДНК, размеров фрагмен-
тов, температуры, концентрации солей,
денатурирующих агентов, а также време-
ни инкубации. Все эти условия должны
строго контролироваться для получения
воспроизводимых результатов. С целью
повышения достоверности результатов
гибридизации часто определяют второй
параметр, термостабильность получа-
емых гибридных последовательностей.
Присутствие 1% неспаренных оснований
в гетеродуплексе снижает Тт на 1-1,5%.
Кривую температуры плавления строят
индивидуально для каждого гибрида
по окончании опыта, и величину Тт(е)
(е означает элюированный, высвободив-
шийся из гибрида) гетерологичного ги-
брида рассматривают как показатель ко-
личества неспаренных оснований в соста-
ве гибрида, сравнительно со значением,
полученным для гомологичного гибрида.
5. В отличие от данных, получаемых мето-
дом непосредственного сравнения после-
довательностей, величина сходства ДНК,
установленная методом гибридизации,
не является абсолютным показателем,
и в каждом эксперименте необходимо
анализировать также типовой штамм
исследуемой группы в качестве рефе-
рентного.
29.4.4. Определение сходства рРНК-цистронов
позволило прояснить родственные связи
внутри семейств и между ними
Нуклеотидные последовательности генов, коди-
рующих рРНК большой субъединицы рибосом
(16S- и 23S-pPHK), более консервативны, чем
последовательности генома в среднем. Следова-
тельно, анализ первичной структуры этих ге-
нов либо путем непосредственного секвенирова-
ния (см. разд. 29.5.3), либо косвенным путем,
с помощью гибридизации цистронов рРНК и
рДНК, может выявить степень отдаленной фило-
генетической связи между крупными таксонами.
180 Часть VII. Разнообразие и систематика
Основные механизмы формирования гетеродуп-
лексов ДНК/РНК практически не отличаются
от таковых для дуплексов ДНК/ДНК. По-
лученные результаты могут быть представле-
ны в двух формах: 1) как двумерная матри-
ца сходства, группирующая значения Tm(ej для
рРНК/ДНК-гибридов в сочетании с их долей,
и 2) как дендрограмма, построенная с помощью
средневзвешенной кластеризации значений Тт(е).
Для близкородственных штаммов внутри вида
значения Т7П(е) равны примерно 80 °C. В зависи-
мости от степени родства внутри и между семей-
ствами достоверные результаты для разграниче-
ния видов могут быть получены при значениях
Тт(е) от 80 до 65 °C. Возможности метода огра-
ничены диапазоном до 60 °C; при более низких
значениях Tm таксоны не различимы.
Все крупные достижения в систематике бакте-
рий за последние 30 лет основаны на количествен-
ном определении сходства на уровне ДНК и/или
рибосомной РНК.
29.4.5. Микробиологи используют
таксономическое определение вида,
а не биологическую концепцию вида
Биологическая концепция вида разработана
главным образом зоологами. Э. Майр определял
вид как «группы скрещивающихся или потенци-
ально способных скрещиваться природных попу-
ляций, репродукционпо изолированных от дру-
гих таких групп». Трудность применения этой
концепции в микробиологии связана с тем, что
прокариоты и многие эукариотические микро-
организмы не обладают полом в традиционном
смысле и критерий репродукционной изоляции
к ним неприменим. У прокариот часто происхо-
дит обмен генетической информацией даже меж-
ду филогенетически далекими организмами, но
степень гомологичной рекомбинации чужеродной
ДНК с ДНК клетки-хозяина различается в за-
висимости от ранга таксона. Предположительно
различия в степени рекомбинации можно исполь-
зовать в качестве генетического критерия вида у
бактерий. Основанием для этого служит предпо-
сылка, что на таксономическом уровне, где рас-
пространена рекомбинация между организмами
(например, на уровне близкородственных штам-
мов), филогенетические схемы, построенные на
основании последовательностей разных генов, бу-
дут статистически различаться между собой. В то
же время, на уровне, где рекомбинация редкое
событие (например, между штаммами менее близ-
кородственных таксонов), хромосомные гены дан-
ного организма имеют общую историю, и фило-
генетические схемы, построенные на основании
последовательностей различных генов, должны
согласовываться. Чтобы создавать определение
бактериального вида с помощью такого подхода,
требуется располагать данными о последователь-
ностях многих генов по нескольким репрезента-
тивным выборкам. Благодаря осуществлению в
настоящее время проектов по секвенированию ге-
номов, это становится вполне возможным.
Таксономисты продвинулись сейчас значи-
тельно дальше провозглашенной примерно чет-
верть столетия назад идеи, согласно которой за
вид можно принимать то, что компетентный си-
стематик считает за таковой. В настоящее вре-
мя принято, что штаммы прокариот относятся
к одному виду в том случае, когда нуклеотид-
ные последовательности их геномов тибридизуют-
ся по меньшей мере на 70% (сходство ДНК), а
температуры плавления [Тт(е)] гомодуплексов и
гетеродуплексов ДНК/ДНК этих штаммов разли-
чаются между собой не более, чем на 5 °C. Край-
нее значение 70%-го сходства выбрано по той при-
чине, что штаммы, родственные на таком уровне
и выше, обычно оказываются сходными и фено-
типически по тем признакам, которые использу-
ются для идентификации на уровне вида. Однако
70%-й уровень геномного сходства оставляет про-
странство для значительных геномных, филогене-
тических и фенотипических различий. Чтобы из-
бежать ошибок, рекомендуется не описывать об-
наруженный вид как новый на основании сходства
ДНК, пока нс выявлены дифференцирующие ди-
агностические признаки.
Даже при имеющемся общепринятом понятии
вида, в бактериологии пока нет единого представ-
ления о нем в отношении разнообразия штам-
мов или степени межвидового родства. Историче-
ски сложилось так, что применяются различные
критерии вида, поэтому преждевременное изме-
нение номенклатуры может привести к недора-
зумению. Так, штаммы Escherichia coli и Shigella
dysenteriae очень близки между собой, характе-
ризуясь показателем гибридизации 89%. Несмот-
Глава 29. Разнообразие и систематика прокариот 181
ря на это в эпидемиологии два данных таксона
считают не разными штаммами одного вида, а
признают двумя различными родами. Как под-
черкнуто выше, таксономия представляет собой
динамичную дисциплину, главная задача которой
состоит в правильной идентификации выделяе-
мых штаммов. Новые сведения о генотипических
и фенотипических свойствах клеток могут при-
вести к изменению определения вида. Поскольку
показатель сходства последовательностей ДНК в
настоящее время признан случайно выбранным,
таксономисты должны быть готовы изменить его
уровень или даже концепцию его применения в
определении вида, если будут выявлены новые
важные дифференцирующие признаки.
Понятие микробиологического вида в настоя-
щее время не удается согласовать с биологической
концепцией вида. Вид бактерий может быть опре-
делен как совокупность штаммов с высоким уров-
нем сходства последовательностей ДНК, а также
фенотипических признаков. Важным критерием
для разделения генетически близких видов слу-
жит, наряду с консервативными признаками, сте-
пень реассоциации ДНК, определяемая методом
ДНК-ДНК-гибридизации.
29.5.
29.5.1. Надежными филогенетическими
маркерами могут служить
лишь немногие молекулы
Современные живые организмы представляют со-
бой результат эволюции, и структура их ин-
формационных молекул (см. разд. 29.1; пер-
вичные, вторичные и третичные семантиды),
отражает эволюционную историю. В случае мик-
роорганизмов единственным «историческим до-
кументом» служит первичная структура гомо-
логичных информационных молекул. Количество
и качество различий в аминокислотных после-
довательностях белков и нуклеотидных последо-
вательностях ДНК отражают их филогенез и,
следовательно, позволяют выделять пары или
группы видов, имеющих общего предка. Таким об-
разом, сравниваемые организмы могут быть ран-
жированы в соответствии с их эволюционной ис-
торией.
В случае, когда изменения какого-либо при-
знака селективно нейтральны, т. е. независимы от
действия функционально заданного отбора, воз-
можно даже определить продолжительность пе-
риода, прошедшего со времени дивергенции от
ближайшего общего предка. Наиболее достовер-
ными «линейными» молекулярными хронометра-
Филогенетические деревья и их интерпретация
ми считаются «нефункциональные» последова-
тельности генома, в которых замены накаплива-
ются случайным образом. Однако на самом деле
последовательности всех секвенированных генов
и видов рРНК состоят из участков, различающих-
ся по степени консервативности, в зависимости
от того, насколько функционально важен данный
участок в молекуле РНК или белкового продук-
та гена. Множественные изменения в вариабель-
ных участках не позволяют проследить историю
данных молекул, порождая «ложное» сходство
(в результате обратных замен) и маскируя та-
ким образом действительное число эволюционных
событий. Поскольку последовательности состоят
из функционально важных и нефункциональных
участков, установить прямую корреляцию меж-
ду степенью различия последовательностей и вре-
менем, прошедшем с момента их расхождения, с
точностью невозможно. Области или отдельные
позиции в одной молекуле, консервативные в раз-
личной степени, информативны для анализа фи-
логенетических связей на различных таксоно-
мических уровнях. Если вариабельные участки
полезны для оценки поздних эволюционных собы-
тий и тем самым для выявления ближайших род-
ственных связей, то изменения в более консерва-
тивных участках указывают на более ранние эво-
люционные события, т. е. на отдаленное родство.
182 Часть VII. Разнообразие и систематика
29.5.2. Надежный филогенетический маркер
должен соответствовать определенным
требованиям
Филогенетическое положение видов, как и выс-
ших таксонов, может быть точно установлено пу-
тем анализа последовательностей-«хронометров»,
выбранных по определенным критериям. Наибо-
лее полезными молекулярными часами для дан-
ного филогенетического уровня служат такие по-
следовательности, которые: 1) универсальны, т. е.
присутствуют у всех представителей исследуемой
группы родственных организмов, 2) гомологич-
ны и ортологичны, т. е. не только происходят от
общего предка, как вытекает из сходства после-
довательностей, но и функционально постоян-
ны (поскольку функция определяется последо-
вательностью, но в свою очередь через давление
отбора характер изменения последовательности
зависит от функции, анализ эволюционных свя-
зей следует применять только к функционально
эквивалентным последовательностям или их
продуктам); 3) генетически стабильны, т. е. от-
носятся к так называемым генам «домашнего
хозяйства», обеспечивающим основу жизнедея-
тельности клетки. Если для такого анализа ис-
пользовать гены, подверженные горизонтальному
переносу, можно существенно исказить филогене-
тическую картину. Чтобы определить, приобре-
тен ли ген в результате горизонтального перено-
са, выявляют «химерные признаки» молекул как
возможные результаты рекомбинации, а также
сравнивают результаты анализа с альтернатины-
ми филогенетическими построениями на основе
других генов, предпочтительно такими, которые
функционально не родственны данному. Важный
фактор пригодности молекулярных объектов для
обширных филогенетических реконструкций —
это их длина. Поскольку отдельная позиция в
последовательности может нести информацию
лишь об относительно коротком эволюционном
времени, с возрастанием количества независимо
эволюционирующих позиций или участков уве-
личивается и количество доступных для анализа
филогенетических уровней. Первичная структура
молекулы, используемой в качестве филогенети-
ческого маркера, должна содержать независимо
эволюционирующие области (домены); это поз-
воляет проверять филогенетические заключения,
сделанные на основании локального сходства или
различий последовательности.
Надежные филогенетические маркеры (моле-
кулярные хронометры) — это универсально рас-
пространенные, функционально эквивалентные и
гомологичные гены «домашнего хозяйства», т. е.
жизненно важные гены или их продукты.
29.5.3. Наиболее часто в качестве
филогенетических маркеров используют
крупные молекулы рРНК
В настоящее время наиболее широко исполь-
зуемыми филогенетическими маркерами служат
рРНК больших и малых субъединиц рибосом
(168-или 23S-pPHK), в первую очередь 16S-pPHK
(см. дополнение 29.8). Эти последовательности
соответствуют всем необходимым для филоге-
нетического маркера требованиям, перечислен-
ным выше. В последовательностях этих молекул
чередуются константные (инвариантные), более
или менее консервативные и высоковариабель-
ные области. Частота нуклеотидных замен в раз-
личных позициях молекул рРНК весьма сильно
варьирует. Иллюстрацией этого могут служить
схематические модели вторичной структуры мо-
лекул ICS-рРНК (рис. 29.20, Л) и 23S-pPHK
(рис. 29.20, Б). Профили консервативности были
определены путем сравнительного анализа свы-
ше 1800 последовательностей 16S-pPHK и при-
мерно 100 последовательностей 23S-pPHK пред-
ставителей всех крупных групп домена Bacteria.
Инвариантные и высококонсервативные позиции
используются не только для выяснения родства
во всем диапазоне таксонов, но и для распозна-
вания и группирования гомологичных последова-
тельностей.
Дополнение 29.8. Сравнительный ана-
лиз последовательностей IGS-pPHK в каче-
стве подхода для филогенетического изу-
чения микробов впервые был применен
К. Вёзе более 20 лет назад. Сейчас такой под-
ход широко используется, при этом матери-
ал для секвенирования доступен в необходи-
мом количестве благодаря применению мето-
да амплификации с помощью полимеразной
цепной реакции (ПЦР). Консервативные об-
ласти, рассеянные в молекулах рРНК и их ге-
нов (рДНК), облегчают секвенирование, по-
Плава 29. Разнообразие и систематика прокариот 183
Рис. 29.20. Вторичные структуры РНК малой и большой субъединиц рибосом. Степень консервативности отдельных
позиций нуклеотидов показана различными оттенками серого — от черного (полностью консервативные позиции) до
белого (высоковариабельные позиции). Степень вариабельности оценивали по доле последовательностей, которые
содержат один и тот же наиболее часто встречающийся нуклеотид в данной позиции.
A 16S-PHK.
Б. 23S-PHK. Молекула разделена на две части. Для большей наглядности Б'-половина и З^половина молекулы
изображены по отдельности.
скольку служат мишенями олигопуклеотид-
ных праймеров (обычно длиной 14-20 н.п.),
необходимых и для амплификации, и для
секвенирования. Таким образом, не более 10
праймеров достаточно для анализа широкого
спектра генетически различных организмов.
Как правило, in vitro удается амплифици-
ровать почти полную последовательность
генов 16S-pPHK (168-рДНК), используя
консервативные участки на ее концах в
качестве мишеней для праймеров. Можно
также амплифицировать почти полную по-
следовательность генов 23S-pPHK, преиму-
щественно путем перекрывания небольшого
числа длинных фрагментов. Используя прай-
меры, комплементарные З'-концу 168-рДНК
и б'-концу 238-рДНК, можно также ам-
плифицировать и секвенировать межгенную
I спейсериую область (рис. 29.21). Амплифика-
цию генов рРНК проводят как в очищенных
препаратах нуклеиновых кислот, так и в
грубых экстрактах бактериальных клеток.
Теоретически для проведения анализа необ-
ходимо совсем небольшое количество клеток,
поэтому возможен филогенетический анализ
Рис. 29.21. Амплификация фрагментов гена рРНК и
межгенного спейсера. На рисунке представлены прайме-
ры и получаемые продукты. Обозначения: пара сплош-
ных черных линий — геномная ДНК, пары прерывистых
линий внизу — получаемые амплификаты; серые прямо-
угольники— участки генов рРНК; заштрихованные пря-
моугольники — праймеры.
некультивируемых бактерий или микробных
сообществ из природных образцов этим мето-
дом. При анализе смешанной популяции по-
лучаемую смесь фрагментов можно разде-
лить путем клонирования.
184 Часть VII. Разнообразие и систематика
29.5.4. Анализ вторичной структуры молекул
рРНК облегчает выравнивание
(элайнмент) последовательностей
Особенность молекул рРНК состоит в том, что
они формируют структуры второго порядка (па-
пример, спирали) посредством внутримолекуляр-
ных взаимодействий между комплементарными
участками на различных расстояниях (рис. 29.20
и 29.22). Образование таких структур можно
предсказать на основании координированных
нуклеотидных замен в гомологичных позици-
ях последовательностей из филогенетически раз-
личающихся организмов. Предполагается, что
структурное сходство указывает на консерватив-
ную функцию. Вторичные структуры рассмат-
ривают как доказательство родства, если ана-
логичные, но различающиеся по нуклеотидной
последовательности участки рРНК филогенети-
чески умеренно близких организмов формируют
одинаковые или очень сходные вторичные струк-
туры.
и и
С G
с-с
U—А
С . и
A —U и С
U-A С G
U—А C-G
С-С С-С
U-A А « С
и и А ° С и и
А ° С С < А С С
С ° А и и С-С
и и и и A-U
и и A —U A —U
A-U С-С G-C С А
A-U A-U A-U С А
с-с A-U A —U А —И
С- СА С-С С • и 11 —А
С д « С г- С С-С
сД ''G А Г с-с а"с г U с-с G • U С А G А
>А с "С А 'С G-C С-С
с-с А А С « А С-С
А'Ф С-С II—А С-С С-С
A А С-Сг С-С С-С С-С
С • д С ° л С » С С о А С о
<- А .с с. А с ^gA С-С С-СА
AA-U АС-С aa"u АС~С АС"С
G С с С С
с-с с-с с-с С-С с-с
и • с и • с и • с и • с и • с
G-C с-с с-с с-с с-с
Lactobacillus Vibrio Escherichia Bradyrhizobium Rhizobium
sanfrancisco furnissii coli japonicum meliloti
Рис. 29.22. Вторичная структура рРНК. Показано вы-
равнивание (элайнмент) пяти гомологичных последова-
тельностей различной длины (позиции 51-108 по после-
довательности рРНК Escherichia coli).
Молекулы 23S-pPHK содержат примерно 100
элементов вторичной структуры, молекулы 16S-
рРНК — примерно 50 таких элементов. При ана-
лизе 57- и З'-половипы двухцепочечных участков,
а также внутренние или терминальные одпоцепо-
чечпые петли можно рассматривать как гомоло-
гичные элементы, которые можно выровнять да-
же в том случае, если их первичные структуры
различаются.
В качестве стандартного быстрого метода для
классификации микроорганизмов применим ана-
лиз нуклеотидных последовательностей рРНК.
Однако с учетом того, что со времени расхожде-
ния основных эволюционных линий прошли мил-
лиарды лет, число информативных позиций в по-
следовательностях (даже крупных рРНК) следу-
ет считать весьма ограниченным. Определенная
доля этих позиций должна быть инвариантной
или высококонсервативной, чтобы сохранялась
функция маркерной молекулы. Многие осталь-
ные признаки не могут изменяться независимо
и информативны на одних и тех же филогене-
тических уровнях. Вследствие этого большинство
эволюционных событий остается скрытым. Срав-
нительный анализ современных последовательно-
стей позволяет выявить только отдельные момен-
ты в общем пути эволюции, тогда как происхож-
дение филогенетических групп установить часто
невозможно.
29.5.5. Выравнивание последовательностей
должно быть основано на достоверной
гомологии
Достоверность филогенетических схем (дере-
вьев), построенных на основе анализа последова-
тельностей, существенно зависит от того, насколь-
ко корректно произведено выравнивание последо-
вательностей. Корректное выравнивание состоит
в том, что обозначения только гомологичных нук-
леотидов (т. е. остатков, происходящих из одной
позиции в предковой последовательности) распо-
лагают столбцами и затем путем сравнения опре-
деляют последовательности как идентичные или
различающиеся. Благодаря тому, что доля высо-
кокопсервативных позиций или даже участков в
последовательностях рРНК довольно велика, про-
цедура выравнивания этих участков не представ-
ляет особой сложности (рис. 29.23). Однако час-
Глава 29. Разнообразие и систематика прокариот 185
Vibrio fluvialis GGGCUACACACGUGGIJACAALGCCGCAUACAGAGGGCGGCCAACULGCGAAAGUGAGCGAAUCCC
Vibrio vulnificus GGCCUACACACGUGCUACAAUGGCGCAUACAGACCGCGGCCAACUUGCGAAAGUGAGCGAAUCCC
Photobacteriumphosphoreum GCCCUACACACCUGCUACAAUCGCGUAUACAGACGGCUGCAAGCUAGCCAUAGUGAGCCAAUCCC
Escherichia coli GGCCUACACACGUGCUACAAIIGGCGCAUACAAAGAGAAGCGACCUCGCGACAGCAAGCGGACCUC
Thermotoga maritima GGCCGACACACGCCCUACAAUGGGCGGUACAAUGCGLIUCCGACCCCGCGAGGGGCAGCCAAUCCC
Сходство • • • 4...4..........4434 - • • • 3 4 • 4 • 3 2 • -2-2-42**--24-34-- • 4 4 • 4 • 4 •
Рис. 29.23. Выравнивание (элайнмент) пяти гомологичных участков последовательности 16S-PHK (позиции
1220-1265 последовательности рРНК Escherichia coli); звездочками отмечены инвариантные позиции; цифры 2,
3 и 4 указывают позиции, инвариантные в 2, 3 или 4 последовательностях.
то в последовательностях обнаруживаются круп-
ные делеции или вставки. Наиболее известным
примером такого рода служит стабильная ипсер-
ция длиной примерно сто нуклеотидных остат-
ков в молекуле 23S-pPHK у актиномицетов; уста-
новлено также, что у некоторых представителей
Proteobacteria отсутствует ее участок длиной при-
мерно 80 н. В последовательностях вариабельных
и высоковариабельных районов с большим чис-
лом нуклеотидных замен обнаружить достовер-
ные гомологии часто чрезвычайно трудно или во-
обще невозможно. Выравниванию таких участков
во многих случаях способствует привлечение дан-
ных об их предполагаемой вторичной структуре.
Несмотря на это, подобные участки чаще всего ис-
ключают из анализа при реконструкции филоге-
нии на уровне выше рода.
29.5.6. Существует несколько алгоритмов
для построения филогенетических
деревьев
Филогенетические взаимоотношения организмов,
установленные на основании сравнительного ана-
лиза последовательностей, можно наглядно вы-
разить графически. Такие деревья состоят из
внутренних точек и терминальных точек (узлов),
соединенных ребрами (ветвями). Для каждой на-
ры узлов существует путь (серия точек, соединен-
ных ветвями). Терминальные узлы представля-
ют собой операционные таксономические единицы
(ОТЕ; см. разд. 29.2), которыми в большинстве
исследований являются анализируемые организ-
мы. С помощью бескорневых деревьев наглядно
изображаются только внутренние взаимотноше-
ния между организмами, тогда как на укоренен-
ных деревьях положение общего предка показа-
но добавочной точкой. Обычно используются два
способа графического изображения филогенети-
ческих деревьев. Первый способ — это построение
радиальных деревьев, напоминающих очертания
настоящих, живых деревьев; он удобен при ана-
лизе небольшого количества объектов. Филогене-
тическая дистанция между двумя узлами (орга-
низмами) изображается в виде расстояния между
ними (рис. 29.24, Л). Второй способ — это постро-
ение дендрограммы, имеющей вильчатую форму;
при этом организмы обозначаются на концах вет-
вей и ограничений их количества не вводится. Ге-
нетическим дистанциям между видами соответ-
ствуют только горизонтальные компоненты (дли-
на ветвей) (рис. 29.24, Б).
Если все (как терминальные, так и внутрен-
ние) узлы дерева значительно отделены друг от
друга ребрами различной длины (что возмож-
но лишь в случае, если филогенетические уров-
ни, представленные организмами, составляющи-
ми выборку, достаточно различаются), выбор ме-
тода построения дерева и других параметров, об-
суждаемых ниже, практически не сказывается на
его топологии. Однако быстро возрастающий объ-
ем данных по секвенированию последовательно-
стей для культивируемых организмов и клонов
16S-pPHK из природных образцов позволит, ве-
роятно, заполнить пробелы, имеющиеся в фи-
логенетических построениях. Таким образом, на
подробных филогенетических деревьях многие
ветви будут расположены очень близко друг к
другу, поскольку эти части схемы уже на данном
этапе исследований формируются из многочис-
ленных близкородственных видов. Примеры мож-
но наблюдать в пределах таких родов, которые
состоят из большого числа очень близких меж-
ду собой видов, например Bacillus, Streptomyces,
186 Часть VII. Разнообразие и систематика
Рис. 29.24. Радиальное дерево и дендрограмма, постро-
енные на основании 165-рРНК-анализа.
А. Радиальное дерево для пяти организмов. Цифра-
ми обозначены значения филогенетических расстоя-
ний между видами, соответствующих расстоянию меж-
ду точкой ветвления и конечной точкой каждого ребра.
Филогенетическое расстояние между двумя организ-
мами соответствует сумме разделяющих их сег-
ментов (например, расстояние между Vibrio vulnifi-
cus и Thermotoga maritima составляет 0,3272, т. е.
0,0104 + 0,0226 + 0,0268 + 0,1710 + 0,0964).
Б. Дендрограмма для тех же пяти видов, что в пункте А.
Филогенетическим расстояниям соответствует только
длина ветвей (горизонтальная компонента).
Micromonospora, Legionella и кластер Agrobacte-
rium/ Rhizobium. Следовательно, в топологии фи-
логенетических деревьев возможны локальные
изменения при изменении метода построения де-
рева, а также массива данных, в связи с чем выбор
способа формирования топологии является реша-
ющим этапом филогенетического анализа.
29.5.7. Достоверность топологии
филогенетического дерева можно
проверить путем сравнения эволюции
различных молекул
Процесс эволюции организма можно описать
через сумму или усредненный показатель изме-
нений в его генах. Если ограничить филогенети-
ческий анализ анализом всего одной последова-
тельности, такой как молекула 16S-pPHK, будет
получено описание эволюции одной молекулы, но
абсолютно не обязательно — описание эволюции
всего организма, которому принадлежит эта по-
следовательность. Более достоверное описание
можно получить при проведении филогенетиче-
ского анализа нескольких функционально неза-
висимых генов (или их продуктов), если он при-
водит к единому заключению. Таким образом,
накопление данных по гомологичным последова-
тельностям, представляющим альтернативные ге-
неалогические маркеры, должно способствовать
выяснению эволюции и филогении исследуемого
организма. Такие данные могут также быть по-
лезны для повышения разрешающей способности
анализа, так как различные гены могут накап-
ливать мутации в течение различных периодов
эволюционной истории или, наоборот, сохранять
предковое состояние некоторых позиций в после-
довательностях в течение различных периодов.
Очень важно однако, использовать для такого
рода построений только гены, гомологичные по
происхождению и функции, достаточно инфор-
мативные для анализа таксонов сравнительно
одинакового филогенетического уровня и не во-
влеченные в процесс горизонтального переноса
генов. Для проверки результатов подробного фи-
логенетического анализа, основанного на сравне-
нии последовательностей 16S-pPHK, необходимо
использовать результаты такого анализа, прове-
денного на основе сравнения последовательностей
альтернативных генетических маркеров, которые
информативны в сопоставимой области филогене-
тического спектра.
Результаты сравнительного анализа последо-
вательностей других консервативных молекул,
ответственных за важные функции в клетках,
таких как факторы элонгации, субъединицы
АТРазы и РНК-полимеразы, хорошо согласуют-
ся с результатами анализа рРНК. Вместе с тем
существуют некоторые противоречия в локальной
топологии опубликованных филогенетических де-
ревьев, построенных с использованием в качестве
маркеров разных молекул, и тщательная провер-
ка данных показала, что последовательности бел-
ков содержат меньшее количество филогенети-
ческой информации, чем последовательности ри-
босомных РНК. Некоторое несоответствие меж-
Глава 29. Разнообразие и систематика прокариот 187
ду филогенетическими деревьями, сконструиро-
ванными с использованием маркерных молекул
разной структуры, может также быть следстви-
ем различной разрешающей способности анали-
за на данном филогенетическом уровне. Посколь-
ку на основании анализа существенно значимых,
функционально независимых молекулярных мар-
керов были получены сходные или по крайней ме-
ре непротиворечивые результаты, маловероятно,
что порядок ветвления какого-либо из сравнивае-
мых индивидуальных деревьев является артефак-
том, результатом горизонтального переноса генов.
Это не относится в то же время к несуществен-
ным, обычно менее консервативным генам и их
продуктам, и тем не менее такие молекулы при-
менимы в качестве маркеров на более низком фи-
логенетическом уровне, поскольку они могут ока-
заться специфичными и функционально консер-
вативными для какой-либо ограниченной группы
организмов, в которой горизонтальный перенос
для них не характерен.
Оценивать качество филогенетических дере-
вьев— довольно трудная задача. На их тополо-
гию (порядок ветвления) влияет огромное количе-
ство факторов, поскольку это динамическая кон-
струкция, которая может измениться в резуль-
тате добавления к массиву данных всего одной
новой последовательности. Обычно используются
три основных метода построения филогенетиче-
ского дерева: метод попарных расстояний, метод
максимальной экономии и метод максимального
сходства. Результаты сравнительного анализа по-
следовательностей других консервативных моле-
кул, ответственных за важные функции в клет-
ках, таких как факторы элонгации, субъединицы
ATP-синтаз и РНК-полимераз, в основном сходны
с результатами, которые дает сравнение последо-
вательностей рРНК. Таким образом, филогенети-
ческие деревья, построенные по результатам ана-
лиза рРНК, вполне отражают процесс эволюции
большей части генома, включая гены «домашнего
хозяйства».
29.6. От ранних форм жизни к современным видам прокариот
29.6.1. Прокариотам принадлежит значительно
большая роль в эволюции жизни,
чем считалось ранее
Сравнение структуры макромолекул, информа-
тивных для филогенетического анализа, позволя-
ет выявлять взаимосвязи между современными
организмами и строить предположения о приро-
де общего предка, давшего начало многим эволю-
ционным линиям, и отрезках времени, в течение
которых возникали на Земле отдельные группы
организмов. Заключения, сделанные при таком
подходе, можно сравнивать с предположениями о
ходе эволюции, основанными на анализе биохими-
ческих свойств прокариот.
До 1977 г. считалось, что ранние формы жи-
вых организмов и их современные потомки-
прокариоты представляют собой непрерывную
монофилетическую линию, в которой все фор-
мы сходны в отношении основ генетической и
клеточной организации, а также механизмов экс-
прессии генов. Согласно этому предполагалось,
что эукариотическая клетка возникла из прока-
риотической цианобактерии (синезеленой водо-
росли) сравнительно недавно — примерно 109 лет
назад (рис. 29.25). Этот предковый эукариоти-
ческий организм, предположительно одноклеточ-
ная водоросль, мог дать затем начало растени-
ям и —при утрате фотосинтетического аппара-
та— простейшим, грибам и высшим животным.
В учебниках отмечается, что различие между
клеткам эукариот и прокариот — это свидетель-
ство наиболее крупного единичного эволюционно-
го разрыва. Прокариоты исходно определяли на
основе чисто негативных критериев, т. е. отсут-
ствия тех свойств, которые имеются у эука-
риот (см. табл. 29.5), и до начала 1960-х гг.
характерные признаки, такие как присутствие
708-рибосом или пептидогликана, не использо-
вались для описания прокариот. Хотя прокари-
отам и был придан уровень царства — Мопега,
фундаментальные различия на клеточном и мо-
лекулярном уровнях, которые существуют меж-
188 Часть VII. Разнообразие и систематика
Рис. 29.25. Ранняя концепция происхождения эукариот
от прокариотического предка.
ду прокариотическими и эукариотическими ор-
ганизмами, считались менее существенными, чем
различия между представителями царств эука-
риот — Metaphyta, Metazoa, протестами и гриба-
ми. Гипотеза эидосимбиоза, возрожденная в кон-
це 1960-х гг. Л. Маргулис (Margulis) на основе
более ранней гипотезы рубежа 19 и 20 вв., по-
стулировала, что эукариотическая клетка—это
химерная структура, возникшая при слиянии
представителей различных эволюционных линий
прокариот. Анализ последовательностей семапто-
форных молекул — вначале белков и затем рибо-
сомных РНК —дал результаты, которые рассмат-
риваются в пользу предположения Маргулис о
происхождении органелл. В настоящее время счи-
тается, что митохондрии произошли из аэробных
представителей Proteobacteria, хлоропласты — из
цианобактерий.
До того как к изучению эволюции прока-
риот стали привлекать данные о структуре се-
мантофорных молекул, генеалогический анализ
проводился на основании данных о метаболи-
ческих свойствах клеток современных видов.
Учитывая отсутствие альтернативных гипотез
происхождения жизни, можно считать неудиви-
тельным, что анаэробные бактерии-бродильщики
рассматриваются как предки всех живых организ-
мов в обеих предложенных концепциях эволюции
прокариот — гипотезе конверсии, предложен-
ной П. Броде (Brode), и гипотезе сегрегации,
высказанной Маргулис. Согласно гипотезе сегре-
гации, эволюция путей транспорта электронов у
анаэробно дышащих организмов предшествовала
эволюции циклического транспорта электронов у
анаэробных фототрофных и аэробно дышащих
организмов. По этой гипотезе, каждое из данных
свойств возникло лишь однажды в ходе эволюции;
таким образом, группы всех современных бак-
терий-бродилыциков, анаэробно дышащих и фо-
тотрофпых, хемоавтотрофных и аэробных типов
организмов были помещены в раздельные эволю-
ционные линии. Согласно гипотезе конверсии, фо-
тотрофные организмы возникли непосредствен-
но из более древних организмов, осуществлявших
брожение. В результате серии событий возникло
несколько эволюционных линий, часть представи-
телей которых вымерла, по часть существует до
сих пор. Вследствие изменения со временем уров-
ня кислорода в среде, от ранних фототрофных
организмов взяли начало эволюционные линии, в
которых развились различные типы метаболизма
(например, органотрофия и литотрофия). Следо-
вательно, анаэробы, фототрофы, анаэробно ды-
шащие и аэробные формы развивались независи-
мо одни от других несколько раз в ходе эволюции.
Фундаментальные различия между этими двумя
гипотезами касаются, таким образом, происхож-
дения аноксигенного фотосинтеза и эволюции ды-
хания. Поскольку к тому времени, когда были
выдвинуты эти гипотезы, археи еще не были опи-
саны, впоследствии их стали считать специфиче-
скими типами бактерий и включили в общую эво-
люционную схему бактерий.
Результаты филогенетического анализа в це-
лом подтверждают гипотезу конверсии. Как от-
мечено выше, фототрофные бактерии встречают-
ся в нескольких эволюционных линиях. Учитывая
сложность фотосинтетического аппарата, разно-
образие морфологических и функциональных ти-
пов и однообразие организации и принципа функ-
ционирования, есть основания предполагать, что
фотосинтетический аппарат возник мопофилети-
чески, после чего его варианты сформировались
независимо под действием отбора в определен-
ных условиях обитания. Судя по положению рода
Chloroflexus, наиболее далеко отстоящего па де-
реве, построенном по данным анализа 16S-pPHK,
фотосинтетический аппарат возник на ранней
стадии эволюции бактерий. Утрата фотосинте-
тического аппарата независимо у определенных
представителей всех эволюционных линий, кро-
Глава 29. Разнообразие и систематика прокариот 189
Таблица 29.5. Основные различия между эукариотами и двумя доменами прокариот (Bacteria и Archaea) на моле- кулярном уровне
Признак Bacteria Archaea Eukarya
Уровень организации Прокариотическая Прокариотическая Эукариотическая
Хромосома(-ы) Одна кольцевая (или ли- нейная) хромосома (или несколько хромосом) Одна кольцевая хромосома Несколько линейных хромо- сом
Опероны Присутствуют Присутствуют Отсутствуют
Промоторы — 10 (ТАТААТ) и вариабель- ные боксы, зависимые от различных сигма-факто- ров Район позиции —25, вышерасположенная АТ-богатая последователь- ность «ТАТА»-боксы для РНК-по- лимеразы И, другие боксы для РНК-полимераз I и III
Гены рРНК Гены 16S-, 23S- и 5S-pPHK, транскрибируются сов- местно, за некоторыми исключениями Аналогично бактериям, с отклонениями Гены 18S-, 5,8S- и 28S-pPHK транскрибируются сов- местно, за исключением ге- на 5S-pPHK
Размеры рРНК 16S, 23S, 5S 16S, 23S, 5S 18S, 28S, 5,8S, 5S
РНК-полимеразы Один основной фермент плюс множественные сигма-субъединицы, спе- цифичные к различным промоторам Одна Три для трех классов генов
Кэпированные мРНК Отсутствуют Возможно, присутствуют (у некоторых видов) Присутствуют
б'-лидерные области в мРНК Присутствуют и связывают- ся с рибосомой в первом сайте каждой открытой рамки считывания Возможно, короткие или отсутствуют Обычно присутствуют
З'-Поли-А-хвосты Отсутствуют или нестабиль- ны Вероятно, отсутствуют Обычно присутствуют и ста- бильны
Размеры рибосом 70S 70S 80S
Чувствительность ри- босом к антибиоти- Хлорамфеникол и мно- гие другие антибиотики Обычно отсутствует Циклогексимид и другие
кам
Чувствительность к Отсутствует Характерна Характерна
дифтерийному ток- сину
Инициаторная тРНК Обычно формилметионии Метионин Метионин
ме двух (зеленых серных бактерий и цианобак-
терий), и изменения функции цепи циклического
транспорта электронов в ответ на изменение усло-
вий питания привели к эволюции новых типов
метаболизма. Недавно был открыт организм —
потомок аноксигенной фотосинтетической бак-
терии, считающийся предком грамположитель-
ных бактерий. Это Heliobacterium chlorum, обла-
дающий ранее неизвестным типом фотосинтеза;
филогенетически этот вид отдаленно родствен
клостридиям и бациллам. С гипотезой конверсии
согласуются также сформировавшиеся в послед-
нее время представления о том, что такие ти-
пы метаболизма, как брожение, анаэробное ды-
хание, хемоавтотрофия и аэробное дыхание, не
эволюционировали монофи л етически, но произо-
шли от разных предковых форм в различных
основных эволюционных линиях. Многие фото-
трофные бактерии, как установлено, близкород-
ственны хемоавтотрофным и аэробным бактери-
ям. Родство между Rhodopseudomonas palustris
и окисляющим нитрит, строго аэробным видом
190 Часть VII. Разнообразие и систематика
Nitrobacter winogradskyi особенно ярко указывает
на возможное возникновение дыхательной цепи из
фотосинтетической цепи транспорта электронов.
Следует, наконец, упомянуть, что гипотеза кон-
версии в целом согласуется с порядком ветвления
деревьев, построенных на основе анализа последо-
вательностей эволюционно консервативных мак-
ромолекул, но в деталях здесь возможны суще-
ственные расхождения.
29.6.2. Прокариоты составляют две основные
эволюционные линии: домен Archaea
и домен Bacteria
В 1977 г. Вёзе и Фокс (Fox) путем анализа непол-
ных последовательностей 16S- и 18S-pPHK уста-
новили, что прокариоты не представляют со-
бой единую филогенетическую группу организ-
мов. Данные анализа 16S-pPHK указали на две
главные эволюционные линии, обозначенные как
первичные царства (см. дополнение 29.9). Моле-
кулы 16S-pPHK у организмов каждой из этих
главных эволюционных линий столь же не сход-
ны между собой, как и с 18S-pPHK эукариот.
«Типичные» бактерии, например Escherichia coli,
были отнесены к царству бактерий, и несколько
типов организмов, фенотипически отличающих-
ся от бактерий, (табл. 29.5) — к царству архей.
Последующее изучение рДНК простейших пока-
зало, что наиболее древние эукариотические орга-
низмы — это лямблии, микроспоридии и близкие к
ним организмы. Как и прокариоты, эти простей-
шие обладают 16S-pPHK и лишены митохондрий.
Раздельность данных трех основных эволюцион-
ных линий, установленную по результатам анали-
за рРНК, позже подтвердили результаты анализа
генов некоторых белков, участвующих в процес-
сах трансляции или получения энергии.
Дополнение 29.9. В основу концепции
первичных царств были положены разли-
чия на клеточном уровне между тремя
филогенетически раздельными группами ор-
ганизмов. Анализ матрицы расстояний под-
твердил, что эти царства имеют монофиле-
тическое происхождение, но их разделяют
значительные расстояния. В пользу такой
топографии свидетельствовали и результаты
анализа 5S- и 23S-pPHK, а также секвени-
рования генов факторов элонгации EF-Tu и
EF-1 и а- и /3-субъединиц ATP-синтазы, хо-
тя и проведенного всего для нескольких ор-
ганизмов. В то же время анализ данных,
использованных Вёзе с коллегами, на осно-
ве метода максимальной экономии и нали-
чие четких различий в размерах и топологии
рибосом привели к появлению новой гипо-
тезы, предложенной Дж. Лейком (Lake). Со-
гласно этой гипотезе, археи не составляют
филогенетически единой группы и их следу-
ет распределить по трем эволюционным ли-
ниям: 1) галофилов, которые, возможно, от-
носятся к (настоящим) бактериям (наличие
«фотосинтетического» аппарата), 2) термо-
фильных, ассимилирующих серу архей, на-
зываемых эоцитами и образующих недавно
открытую, сильно разветвленную эволюци-
онную линию, связанную с линией эукариот
(действительно, существенное число «эоцит-
ных» свойств имеется и у эукариот, но на их
монофилетическое происхождение с археями
указывают лишь немногие данные), и 3) мета-
ногенов, которые представляют собой истин-
ные археи.
В настоящее время предпочтением поль-
зуется концепция Вёзе, поскольку она более
убедительна и учитывает значительную бли-
зость всех архей на генетическом и эпигене-
тическом уровнях. Обе указанные концепции
противоречат широко признанной зоологами
и ботаниками классификации пяти царств,
предложенной Маргулис. Согласно этой
последней классификации, прокариоты со-
ставляют одно царство (Мопега), тогда как
эукариоты распадаются на четыре царства
(растения, животные, грибы и протисты).
Однако по молекулярной и клеточной ор-
ганизации эти четыре царства фактически
идентичны, и концепция пяти царств не учи-
тывает фундаментальных различий между
двумя группами прокариот, включенных в
Мопега.
В начале 1970-х гг. у метаногенных и гало-
фильных архей был открыт ряд особенностей, в
том числе в структуре полимеров клеточной стен-
Глава 29. Разнообразие и систематика прокариот 191
ки и липидов (см. разд. 29.3). Однако значение
данных открытий как указаний на то, что ар-
хеи составляют новую для науки крупную груп-
пу прокариот, не могло быть доказано на ос-
нове анализа этих эписемантических маркеров.
После первых публикаций, в которых археи рас-
сматривались как возможные прямые потомки
эволюционно древних организмов, они стали из-
любленным объектом исследований в области эво-
люции, ультраструктуры, генетики, биохимии и
биофизики. С учетом того, что археи хорошо рас-
тут преимущественно в экстремальных услови-
ях, в которых, как считалось до 1977 г., жизнь
невозможна, усилия исследователей были направ-
лены на выделение новых типов архей из горячих
источников, сульфатар, глубоководных гидротер-
мальных выходов и щелочных озер. Это привело
к описанию многочисленных организмов с ранее
неизвестными физиологическими и генетически-
ми свойствами.
Классификация с выделением трех царств,
предложенная Вёзе, к настоящему времени заме-
нена концепцией доменов, принятой в качестве
предварительного варианта. Таксон домена был
предложен как более высокий по отношению к
царству, чтобы подчеркнуть значение подразде-
ления мира живого на три части. Чтобы избежать
впечатления, что суффикс «-bacteria» в названи-
ях двух из трех царств отражает их особое эво-
люционное родство, были предложены термины
Archaea и Bacteria взамен прежних Eubacteria
и Archaebacteria (или Archaeobacteria) и
термин Eukarya вместо термина Eukaryota.
Согласно этой концепции, две основные эволю-
ционные линии Archaea рассматриваются как
два царства: Crenarchaeota (термоацидофилы и
строго анаэробные термофилы) и Euryarchaeota
(галофилы, алкалифилы, метаногены, некоторые
строго анаэробные термофилы и Thermoplasma}
(рис. 29.26). Основные эволюционные ветви доме-
на Bacteria, описываемые как линии или отделы,
до настоящего времени не предложено рассмат-
ривать как царства, что связано со сложностью
филогенетической структуры этого домена. Пока
в нем выделено более 15 основных эволюционных
линий; некоторые из них разделены эволюцион-
ным расстояниями малой длины или содержат
лишь небольшое число представителей и не отра-
жены в общей схеме домена Bacteria (рис. 29.27).
Родственные связи внутри отдельных линий час-
то открываются как неожиданные, причем их
Рис. 29.26. Филогенетическая структура домена Ar-
chaea. Показан порядок ветвления основных эволюцион-
ных линий, определенный путем анализа матрицы рас-
стояний. Заштрихованные треугольники отражают фи-
логенетическую глубину царств и линий. Шкала — 10%
дивергенция последовательностей.
выявление основано главным образом на сопо-
ставлении последовательностей консервативных
генов.
Поскольку концепция домена до сих пор дис-
кутируется, термины эубактерии и архебакте-
рии используются наряду с терминами археи
(Archaea) и бактерии (Bacteria). Одна из задач
таксономии состоит в том, чтобы обеспечить ста-
бильность номенклатуры действительно опубли-
кованных таксонов, и утвержденные названия не
должны меняться по причине изменения ранга
таксонов и введения новых иерархических уров-
ней. Однако названия таксонов рангом выше по-
рядка не нуждаются в утверждении, и время по-
кажет, какие названия сохранятся. В этой гла-
ве используются термины археи и бактерии как
наиболее принятые. Несмотря на отказ от суф-
фикса «-bacteria» для высшего таксономического
ранга (например, Archaea вместо Archaebacteria),
необходимость стабильности действительно опуб-
ликованных родовых названий требует, чтобы
этот суффикс сохранялся в названиях несколь-
ких родов архей, а именно Methanobacterium,
Natronobacterium и Halobacterium, как свидетель-
ство того, что они были описаны ранее выделения
доменов.
192 Часть VII. Разнообразие и систематика
Рис. 29.27. Филогенетическая структура до-
мена Bacteria. Показан порядок ветвления ос-
новных эволюционных линий, определенный
путем анализа матрицы расстояний. Заштри-
хованные треугольники отражают филогене-
тическую глубину царств и линий. Шкала —
10% дивергенция последовательностей
29.6.3. Прогенот как гипотетический предок
современных типов клеток
Предположительный последний общий предок
трех основных типов ныне живущих организмов
был назван прогенотом. Идея о его существова-
нии появилась вскоре после того, как было при-
знано, что различия между доменами (на уровне
молекулярных структур и процессов) более суще-
ственны, чем различия внутри доменов, и вме-
сте с тем основное разделение живых организмов
на три крупнейшие эволюционные линии проис-
ходило в течение относительно короткого (с точ-
ки зрения геологии) промежутка времени, при-
мерно 1,5 • 109 лет. Если верно предположение,
что направления развития различных типов ор-
ганизмов разошлись от общего предка за такой
промежуток времени, то этот предок не мог быть
клеткой, в которой были уже хорошо «отлажены»
генетические процессы, экспрессия генов и их ре-
гуляция. Гипотетический прогенот должен рас-
сматриваться как организм с более частыми
ошибками при репликации ДНК и РНК, позво-
лявшими процессам экспрессии генов эволюци-
онировать со значительным диапазоном измене-
ний. Потомки прогенота должны были сохранять
центральные, необходимые для жизни функции,
такие как транскрипция и трансляция, но дру-
гие гомологичные функции в пределах различ-
ных эволюционных линий могли эволюциониро-
вать с разными скоростями и различным образом.
Об этом свидетельствует эволюция таких струк-
тур, как внутриклеточные мембраны и клеточ-
ные стенки, а также существование специфичес-
ких для домена, знаковых последовательностей.
Вопрос о количестве главных эволюционных
линий остается, однако, открытым. Если этих ли-
ний существует больше, то возможно, они будут
открыты с помощью современных подходов в об-
ласти экологии и идентификации.
Базовая топология эволюционного дерева жи-
вых организмов свидетельствует о существовании
трех главных линий, но не дает информации о
степени близости каждой из этих линий друг к
другу. Для того, чтобы укоренить дерево, нуж-
на внешняя группа. Поскольку, очевидно, ни одна
из молекул, используемых для генеалогических
исследований, не предоставляет такой возможно-
сти, была проанализирована первичная структу-
ра предковых генов, которые дуплицировались па
ранней стадии эволюции. Это событие дуплика-
ции привело к образованию пар гомологичных
генов и белков, как установлено для генов ферре-
доксина и некоторых факторов элонгации. Напри-
мер, поскольку все организмы содержат пары ге-
нов, кодирующих факторы элонгации EF-TU/la
и EF-G/2, дупликация, которая ведет к наличию
этой генной пары, должна была существовать
уже у их последнего общего предка. Так, дерево,
связанное со всеми EF-TU-последовательностями,
может быть укоренено при использовании после-
довательностей EF-G как внешней группы, по-
скольку EF-G — это функциональный эквивалент
EF-TU. То же самое может быть сделано и на-
Глава 29. Разнообразие и систематика прокариот 193
оборот. Анализ такого рода показал, что домены
Archaea и Eukarya имеют общее происхождение и
таким образом являются сестринскими таксона-
ми, тогда как домен Bacteria представляет собой
отдельную эволюционную линию, которая ответ-
вилась раньше от общего корня. Однако вопрос
о порядке расхождения основных ветвей дерева
остается спорным; он требует анализа более чем
одной или двух таких эволюционно консерватив-
ных пар генов.
29.6.4. Для доменов характерна
филогенетическая согласованность
и несколько исключительных
фенотипических свойств
Сравнение последовательностей — это генотипи-
ческий анализ, позволяющий выявлять разли-
чия в фенотипе внутри филогенетически сцеп-
ленных групп. Если, например, молекулярный
анализ нескольких консервативных макромоле-
кул указывает на существование основных эво-
люционных групп, можно ожидать, что удаст-
ся найти глубокие дополнительные различия, ко-
торые выражаются на фенотипическом уровне.
Во многих случаях наиболее быстрый способ от-
несения неизвестного организма к таксону высше-
го ранга — это анализ рРНК, но для идентифи-
кации весьма желательно выявить и специфиче-
ские свойства данного таксона. Признаки, общие
для представителей любых двух из трех царств,
не могут служить основанием для правильно-
го отнесения исследуемых штаммов к тому или
иному царству. Однако известны признаки, при-
сущие исключительно данному домену и таким
образом имеющие диагностическую ценность. Оп-
тимальный знаковый признак должен встречать-
ся у представителей только одного домена и от-
сутствовать в двух остальных доменах. Однако
присутствие исключительных признаков у двух
доменов представляет ценность для объяснения
хода их эволюции. Негомологичные фенотипы мо-
гут встречаться среди представителей различных
доменов, что отражает общее происхождение в
процессе эволюции. В то же время гомологич-
ные свойства могут встречаться как исключитель-
ные у представителей двух доменов вследствие
горизонтального переноса генов. В оптимальном
случае ценность признака как надежного знаково-
го должна выясняться опытным путем для каж-
дого нового организма при отнесении его к так-
сону более высокого ранга. При суммировании
основных молекулярно-биологических признаков
(табл. 29.5), которые служат дифференцирующи-
ми для каждого домена, и признаков, признавае-
мых в качестве индикаторных для определенного
домена, следует иметь в виду, что эти сведения
основаны на изучении лишь некоторой части из-
вестных штаммов.
В пользу самостоятельности Archaea как доме-
на, столь же не родственного Eukarya и Bacteria,
сколь неродственны два последних домена между
собой, говорит также открытие того факта, что
для Archaea характерен ряд особых эпигенетиче-
ских свойств (см. дополнение 29.10). Кроме того,
специфические свойства и клеточные компоненты
выявлены для определенных таксонов архей; это
коферменты, участвующие в метаногенезе, пиг-
менты пурпурных мембран, генерирующие энер-
гию — бактериородопсин, галородопсин и другие
сенсорные родопсины у галофилов, выживание
в условиях экстремально высокой температуры,
а также некоторые уникальные физиологические
свойства (например, наличие модифицированного
пути Энтнера-Дудорова) (см. дополнение 29.10).
Дополнение 29.10. К уникальным для ар-
хей эпигенетическим характеристикам отно-
сятся следующие:
• первичная структура рРНК и некото-
рых других семантофорных молекул, та-
ких как ATP-синтаза и фактор элонгации
EF-TU;
• вторичная структура рибосомных РНК;
• клеточную стенку образует не харак-
терный для бактерий пептидогликан;
ею служит либо наружная мембрана,
либо S-слой, состоящий из шести- или
четырехугольно расположенных субъ-
единиц белков или гликопротеинов
(у всех Crenarchaeota, термофильных
Euryarchaeota и Metanococcus), либо псев-
домуреин (Metanobacterium) либо гете-
рополисахариды (галофилы);
• устойчивость к пенициллину и D-цикло-
серину, обусловленная тем, что D-амино-
кислоты в клеточной стенке отсутствуют;
Часть VII. Разнообразие и систематика
• единственная ДНК-зависимая РНК-по-
лимераза нечувствительна к антибиоти-
кам, которые подавляют соответствую-
щий фермент у бактерий;
• природа мембранных липидов; полярные
и неполярные липиды содержат разветв-
ленные изопреноидные цепи, связанные с
глицеролом простыми эфирными связя-
ми, а не сложноэфирными связями;
• модификации тРНК.
Следующие свойства различных таксонов ар-
хей встречаются также в некоторых или во
всех таксонах бактерий и/или эукариот:
• ДНК-полимераза некоторых метаногенов
и галофилов ингибируется афидиколи-
ном — ингибитором ДНК-полимераз эу-
кариотического типа; ДНК-пол имеразы
из Methanobacterium thermoautotrophicum
и Sulfolobus acidocaldarius сходны с соот-
ветствующими ферментами бактерий;
• промоторные участки, подобные бак-
териальным (полимераза связывается
со структурами премоторного типа) и
эукариотическим (АТ-богатая последо-
вательность в районе позиции —25 и
потребность в ассоциированных белках
для инициации транскрипции);
• гистоноподобный белок Thermoplasma
acidophilum сходен по аминокислотной
последовательности с гистонами эука-
риот и соответствующим белком Е. coli.
Связывающийся с ДНК белок Metha-
nothermus fervidus сходен с гистонами
эукариот;
• ДНК-зависимая РНК-полимераза родст-
венна ферментам Pol II и Pol III эукариот;
• интроны присутствуют в тРНК (неко-
торые виды Halobacterium, Sulfolobus и
Thermo proteus) и рРНК (Desulfurococcus)-,
• структура оперона 16S-23S-5S-pPHK
раздробленная (термофилы) или не свя-
занная (Thermoplasma) (как у предста-
вителей некоторых родов бактерий, на-
пример Thermus, Planctomyces и Lepto-
spira)-,
• ферредоксин (Фд) 2Ее-28-типа Halo-
bacteria сходен с Фд хлоропластов и
цианобактерий (Bacteria). Ферредоксин
4Ее-48-типа, характерный для Crenar-
chaeota, сходен с Фд бактерий;
• рибосомы нечувствительны к хлорамфе-
николу и стрептомицину, связывают ани-
зомицин, но не циклогексимид (подобно
рибосомам эукариот);
• рибосомы по размерам соответствуют
рибосомам прокариот, но в то же время
у галофилов и некоторых метаногенов
обнаружены кислые рибосомные бел-
ки. Масса белков в составе рибосом
значительно варьирует, возрастая от
галофилов и Methanomicrobiales (бакте-
риоподобные) к термофильным Euryar-
chaeota и Crenarchaeota (Aquifex-mn). *
Поскольку у Euryarchaeota обнаружены неко-
торые общие генетические и эпигенетические
свойства с представителями Bacteria и в то же
время некоторые свойства Crenarchaeota дают ос-
нование сближать их с Eukarya, Archaea в целом
не представляются филогенетически единой груп-
пой (см. табл. 29.7). В связи с характерными осо-
бенностями рРНК этот домен медленно эволюци-
онйрующих организмов можно рассматривать как
искусственный таксон высшего ранга, который в
действительности состоит из двух или трех эво-
люционно различных групп, не имеющих общего
происхождения.
29.6.5. В домене Bacteria выделено более 15
основных эволюционных линий
Число признанных родов архей с 1977 г. возрос-
ло от 5 до примерно 40, тогда как число родов
бактерий почти не изменилось. Вместе с рода-
ми цианобактерий, которые могут быть описаны
согласно Международному кодексу номенклату-
ры бактерий и Международному кодексу ботани-
ческой номенклатуры, это число равно пример-
но 400.1 В противоположность Archaea, для ко-
торых фактически определено филогенетическое
положение каждого типового штамма, ближайшее
По другим источникам — примерно 1000 родов. — Прим. спец. ред.
Глава 29. Разнообразие и систематика прокариот 195
филогенетическое соседство более чем 80 родов
бактерий к настоящему времени не установлено.
Выделяют примерно 20 четко разграниченных от-
дельных эволюционных линий; однако большин-
ство видов бактерий относится к двум из них —
грамположительным бактериям и Proteobacteria.
В табл. 29.6 сопоставлены высшие таксоны до-
мена Bacteria и указано приблизительное число
родов в каждом из них. Поскольку студентам
важно в первую очередь ознакомиться с основ-
ными революционными изменениями в система-
тике прокариот, не вдаваясь в мелкие детали род-
ственных связей, мы не будем касаться здесь род-
ственных связей на родовом и видовом уровнях.
Многие роды до сих пор представляют собой фи-
логенетически гетерогенные таксоны (например,
Rhodopseudomonas, Pseudomonas, Blastobacter и
Thiobacillus среди Proteobacteria и Bacillus, Clos-
tridium, Desulfotomaculum и Peptococcus среди
грамположительных бактерий). Примером могут
служить некоторые виды, относимые к Clostri-
dium, которые являются, однако, аэробными бак-
териями сферической формы, не образующими
эндоспор (рис. 29.28). Следует ожидать, что даль-
Таблица 29.6. Основные филогенетические линии внут-
ри домена Bacteria по результатам анализа 16S-pPHK.
В скобках указано число родов., отнесенных к каждой
линии (за исключением цианобактерий)
Линия Aquifex (3)
Термофильные аэробы (6)
Линия Deinococcus (3)
Линия Thermodesulfobacterium (1)
Линия Bacteroid.es/Cytophaga (24)
Линия Chloroflexus (6)
Линия спирохет (10)
Линия Leptospirillum (3)
Линия Fusobacterium (4)
Линия хламидий (1)
Линия зеленых серных бактерий (5)
Линия Planctomycetales (4)
Линия Verrucomicrobiales (1)
Линия Synergistes (1)
Линия Acidobacterium (1)
Линия Fibrobacter (1)
Линия протеобактерий (^270)
Линия грамположительных бактерий (<^172)
Линия цианобактерий
И
Рис. 29.28. Филогенетические взаимосвязи меж-
ду некоторыми видами рода Clostridium и другими
таксонами. Показаны штаммы, различающиеся по
морфологии, окраске по Г раму и способности к спо-
рообразованию. Шкала — 10% дивергенция после-
довательностей. По [1].
г[
Clostridium clostridiiforme
— Clostridium symbiosum
----Clostridium aminophilum
----Butyrivibrio fibrisolvens
г Clostridium celerecrescens
"1--Clostridium sphenoides
г Clostridium aerotolerans
*- Clostridium xylanolyticum
-------Ruminococcus hansenii
-------Ruminococcus obeum
Clostridium coccoides
-------Ruminococcus productus
-------Butyrivibrio crossotus
-------Eubacterium saburreum
-------Eubacterium cellulosolvens
Eubacterium fissicatena
Eubacterium contortum
Clostridium oroticum
------------Ruminococcus torques
Clostridium nexile
------------Eubacterium formicigenerans
------------Ruminococcus gnavus
— Eubacterium rectale
------------Roseburia cecicola
— Eubacterium ramulus
------------Lachnospira pectinoschiza
------------Lachnospira multipara
Eubacterium eligens
--------------Eubacterium hallii
--------------Acetitomaculum ruminis
Eubacterium hadrum
— Eubacterium uniforme
--------------Eubacterium ventriosum
--------------Clostridium herbivorans
--------------Clostridium polysaccharolyticum
--------------Eubacterium xylanophilum
--------------Coprococcus eutactus
--------------Clostridium aminovalericum
— Clostridium populeti
0.10
196 Часть VII. Разнообразие и систематика
нейшие таксономические ревизии прояснят таксо-
номический статус этих неверно классифициро-
ванных видов. Как пример успехов таксономии
можно рассматривать порядок Actinomycetales,
который в настоящее время представляет со-
бой филогенетически хорошо очерченный так-
сон. Проанализированы последовательности по-
чти каждого типового штамма типовых видов, и
топология филогенетических деревьев этого по-
рядка может считаться стабильной (рис. 29.29).
Четыре эволюционные линии бактерий —
грамположительные бактерии, Proteobacteria,
таксон Bacteroides / Cytophaga I Flavo bacterium и
Cyanobacteria — имеют сложную филогенетиче-
скую структуру. Другие линии (например, вклю-
чающие роды Thermotoga, Chloroflexus, Thermo-
microbium и Herpetosiphon, Deinococcus и Ther-
mos, Chlorobium, Chloroherpeton и Clathrochloris,
а также Spirochaetales, Planctomycetales и некото-
рые другие филогенетические линии; табл. 29.6),
определены на основе анализа лишь несколь-
ких видов или даже одного единственного ви-
да. Заключения широкого плана в области фи-
логении, касающиеся филогенетических связей
на уровнях от домена до семейств, основаны
главным образом на результатах анализа 16S-
рРНК. Только родственные связи представителей
грамположительных бактерий, Proteobacteria и
филогенетической линии Cytophaga были про-
анализированы несколькими различными мето-
дами, такими как гибридизация ДНК—ДНК,
определение сходства цистронов рРНК и ана-
I— Cordona amarae
Cordona aichiensis ।— Mycobacterium smegmatis
1— Rhodococcus fascians J I— Rhodococcus erythreus 1 Nocardia vaccinii
1 Corynebacterium renale r- Saccharothrix longispora . И Saccharothrix australiensis
1— Actinokineosporia riparia । Pseudomycolata halophobica
Saccharopolyspora gregorii
1 Amycolatopsis orientafis । Nocardioides simplex 1 1 Nocardioides luteus 1 Aiernmirrnhii im pn.'thrpiiin
Г- — | I Propioniferax innocuum • Propionibacterium thoenii ।— Aureobacterium liquefaciens • Microbacterium lacticum 1 Terrabacter tumescens r| । Rathayibacter rathayi | । Clavibacter michiganensis О Curtobacterium citreum 1 Agromyces ramosum 1 Dermabacter hominis | 1— Brachybacterium faecium | । Micrococcus luteus * Renibacterium salmoninarum Dermatophilus congolensis Rothia dentocariosa 1— Brevibacterium casei I Brevibacterium linens [ Ceodermatophilus obscurus “t Blastococcus aggregatus Sporichthya polymorpha Frankia myricanod Kineococcus aurantiacus । Streptomyces setae I Streptomyces lividans । Gardnerella vaginalis
1 Bifidobacterium bifidum 1 Arcanobacterium haemolyticum 1 Actinomyces anitratus Thermocrispum agreste Coriobacterium alnmerans
I Atopobium minutum 0,10
Рис. 29.29. Филогенетическая структура порядка
Actinomycetales. Показаны взаимосвязи между се-
мействами и внутри семейств, определенные путем
анализа матрицы расстояний. Шкала — 10% дивер-
генция последовательностей.
Глава 29. Разнообразие и систематика прокариот 197
лиз последовательностей 23S-pPHK. В резуль-
тате этих исследований было установлено, что
несколько традиционно признаваемых таксонов
представляют собой также и филогенетиче-
ски однородные группы, например актиноми-
цетов (см. рис. 29.29), спирохет (на основа-
нии морфологии), миксобактерий, составляющих
единый кластер в пределах ^-подкласса про-
теобактерий (по признаку общественного пове-
дения), и цианобактерий (по признаку фото-
синтеза с выделением кислорода). Термофилия,
фототрофия, механизм подвижности и слож-
ная морфология (спиральная форма, почкование,
простеки, мицелий) в основном могут рассмат-
риваться как малоинформативные таксономичес-
кие маркеры для определения рангов на высших
уровнях, поскольку каждая из этих особенностей
встречается независимо у объектов, находящихся
в разных местах на филогенетическом дереве.
Линия грамположительных бактерий раз-
деляется на две основные ветви, при этом каж-
дая из ветвей содержит глубоко укореняющиеся
организмы, которые отрицательно окрашиваются
по Граму. Грамотрицательный род Fusobacterium
и близкие к нему роды (рис. 29.27), возмож-
но, связаны с грамположительпыми организма-
ми, но вопрос о том, составляют ли грамполо-
жительные бактерии филогенетически связанную
группу, пока остается спорным. Разделение их на
две основные ветви коррелирует с характерны-
ми для их представителей величинами содержа-
ния G 4- С в ДНК (ветвь клостридий, низкое со-
держание G + С, и ветвь актиномицетов, высокое
содержанием G + С), хотя установлены некото-
рые исключения из этого общего правила в обе-
их ветвях. Порядок ветвления филогенетическо-
го дерева таксонов грамположительных бактерий,
основанный на результатах анализа 16S-pPHK,
чрезвычайно информативен для таксономических
выводов и ревизий, поскольку в большинстве слу-
чаев позволяет выявлять группы действительно
родственных видов путем сопоставления хемотак-
сономических и других фенетических признаков.
Такие характеристики, как состав клеточных сте-
нок, структура липидов, жирных кислот, поли-
аминов и изопреноидных хинонов, нуклеотидный
состав ДНК, отношение к кислороду и некоторые
другие, являются информативными признаками
грамположительных бактерий (см. разд. 29.3),
позволяющими проводить четкое разграничение
таксонов по сочетанию химических, физиологиче-
ских и морфологических особенностей. Признаки,
традиционно используемые в качестве единствен-
ного критерия для описания высших таксонов, та-
кие как образование спор и морфологические осо-
бенности, теряют значимость в филогенетической
таксономии, поскольку имеют полифилетическое
происхождение или могли быть утрачены в ходе
эволюции.
Для класса Proteobacteria характерна сход-
ная, однако значительно более сложная ситуа-
ция. В нем на основе филогенетического анали-
за выделены подклассы, обозначенные буквами
греческого алфавита—от а до е. В этом классе
идентифицировано более 220 родов, большинство
из которых входит в о-подкласс (^70 родов) и
7-подкласс (^90 родов). Едва ли хотя бы од-
но классическое таксономическое свойство, счи-
тавшееся пригодным для выявления естествен-
ных родственных связей, такое как фототрофия,
скользящее движение, размножение почковани-
ем, автотрофия, литотрофия или местообитание,
позволяет определять здесь важную эволюцион-
ную ветвь (рис. 29.30). В пределах коротких фи-
логенетических расстояний можно отметить со-
вершенно различные фенотипы (фототрофы и
СО-окисляющие организмы, фототрофы и лито-
трофы, азотфиксаторы и фитопатогенные бак-
терии); организмы, образующие ассоциации с
высшими организмами, более родственны между
собой, чем считалось ранее (например, Agrobac-
terium, Rhizobium, Brucella и Rochalimaea в си-под-
классе). Удивителен состав (5-подкласса, который
не может быть объяснен па основании какого-
либо другого молекулярного свойства, посколь-
ку в него входят чрезвычайно сложноорганизо-
ванные миксобактерий, род Bdellovibrio, характе-
ризующийся хищничеством в отношениии других
бактерий, и анаэробные грамотрицательные бак-
терии, восстанавливающие сульфат и серу, такие
как Desulfovibrio и Desulfuromonas.
Специфические родственные связи обнару-
жились неожиданно между фенотипически не
сходными таксонами, такими как грамположи-
гельные, устойчивые к радиации деинобакте-
рии и грамотрицательный род Thermus, а так-
же между строго анаэробным родом Bacteroid.es
и эволюционными линиями аэробов Cytophaga и
Flavobacterium. Поскольку представители каждой
из этих двух фенотипически весьма разнородных
пар организмов никогда не рассматривались как
родственные, их ранее никогда не включали в сов-
198 Часть VII. Разнообразие и систематика
— Vibrio parahaemolyticus --------------
Vibrio vulnificus
----Vibrio logei
------Shewanella putrefaciens
-----Escherichia coli
Serratia marcescens
------Plesiomonas shigelloides
f----------------- Actinobacillus capsulatus
*---------Haemophilus paraphrophilus
-------------Таксон Бмсгаарда
Aeromonas trota
Aeromonas schubertii
-------------Deleya halophiia
----------Deleya aquamarina
-------Deleya marina
------Zymobacter patmae
----------Oceanospirillum minutulum
i— Pseudomonas aureofaciens
I-----Pseudomonas oleo
’— Pseudomonas mendocina
----Pseudomonas stutzeri
।---Pseudomonas aeuginosa
-------Pseudomonas alcaligenes
-----Pseudomonas flavescens
-----Pseudomonas putida
— Pseudomonas aerofaciens
— Pseudomonas chlororaphis
------Pseudomonas fluorescens
j---Pseudomonas viridiflava
----'----Pseudomonas cichorii
Рис. 29.30. Филогенетическое положе-
ние некоторых представителей родов о-,
/3-, и 7-подклассов класса Proteobac-
teria. Шкала — 10% дивергенция после-
довательностей.
---Acinetobacter haemolyticus
---Acinetobacter radioresistens
---Legionella wadsworthii
— Legionella rubrilucens
---1-------------Francisella tularensis
---Wolbachia persica
Xanthomonas oryzae
Xanthomonas phasedi
xanthomonas campestris
Xanthomonas fragariae
— Stenotrophomonas maltophilia
--------Xylella fastidiosa
-------Dichelobacter nodosus
Cardiobacterium hominis----- -------------- -
J Acidovorax facilis --------------------
Acidovorax delafieldii
Acidovorax temperans
~ Acidovorax avenae
- Acidovorax konjaci
- Comamonas testosteroni
— Comamonas terrigena
-----------Brachymonas denitrificans
<----------Hydrogenophaga taeniospiralis
______П-----Hydrogenophaga palleronii
1 ।----Hydrogenophaga pseudoflava
1— Hydrogenophaga flava
Comamonas acidovorans
_______r— Burkholderia solanacearum subsp.
J ------------Burkholderia pickettii
1 1 1 Alcaligenes eutrophus
Telluria chitinolytica
Zoogloea ramigera
— Burkholder!a cepacia
— Burkholderia gladioli subsp. патовар gladioli
— Burkholderia caryophylli
Pseudomonas andropogonis-------------------
Sphingomonas macrogoltabidus---------
Sphingomonas adhaesiva
Sphingomonas terrae
------Sphingomonas yanotkuyae
Rhizomonas suberifaciens
— Sphingomonas parapaucimobilis
— Sphingomonas sanguis
— Sphingomonas paucimobilis
Sphingomonas adhaesiva
Caulobacter subvibrioides
----------Zymomonas mobilis
— Sphingomonas capsulata
ОДО
Brevundimonas dimtnuta
Caulobacter crescentus
Caulobacter bacteroides
Rhizobium leguminosarum
Paracoccus denitrificans
Acetobacter aceti
Cluconobacter oxydans
------AcidiphiHum cryptum
С
₽
а
местный фенотипический анализ. Данных в поль-
зу такого группирования пока также немного, но
его достоверность подтверждается тем, что и де-
инобактерии, и виды Thermus содержат в составе
пептидогликана остатки лизина и в случае линии
Bacteroides-Cytophaga общим характерным при-
знаком является наличие сфинголипидов.
Примеры того, что какие-либо организмы
филогенетически неродственны между собой,
несмотря на наличие общего и явно филогене-
тически значимого признака, встречаются ред-
ко. Наиболее яркий пример такого рода—от-
сутствие родства между родами Chloroflexus и
Chlorobiurn. Оба эти таксона характеризуются на-
Глава 29. Разнообразие и систематика прокариот 199
личием в клетках хлоросом, сходных по структу-
ре и функции, но при этом содержат реакцион-
ные центры различных типов (см. разд. 13.2.3).
Возможно ли, что такая сложная морфологи-
ческая структура возникла независимо в нерод-
ственных группах, подвергались ли гены, свя-
занные с синтезом хлоросом, горизонтальному
переносу, достоверны ли заключения на основе
анализа 16S-pPHI< — на все эти вопросы долж-
ны дать ответ дальнейшие исследования. Но-
вый ключ к их решению этих вопросов дает от-
крытие того, что родственные Chloroflexus ро-
ды, такие как Thermomicrobium и Herpetosiphon,
лишены хлоросом, тогда как роды, родствен-
ные Chlorobium (такие как Chloroherpeton и
Clathrochloris), содержат хлоросомы.
Выяснение порядка родственных связей про-
кариот путем анализа последовательностей
16S-pPHK для более чем 2500 видов, принадле-
жащих к более чем 80% всех описанных родов
в обоих доменах, можно считать значительным
научным достижением. Эти данные чрезвычайно
важны для таксономии и реконструкции ранних
эволюционных событий. Масштабы разнообразия
среди доступных для культивирования прокари-
от могут быть оценены только после того, как все
типовые штаммы описанных видов будут исследо-
ваны методами молекулярно-филогенетического
и фенотипического анализа. Определение фило-
генетического положения того или иного штамма
желательно проводить как один из первых этапов
при его описании и классификации.
29.6.6. Палеохимические и геологические
данные некоторым образом коррелируют
с порядком ветвления, установленным
по данным 165-рРНК-анализа
Ископаемые находки в осадочных скалах до-
кембрийского периода весьма скудны. Древней-
шие ископаемые биологические объекты извест-
ны из осадков Исуа (Гренландия) возрастом
3,8 млрд, лет, группы Уааравуны (Австралия)
возрастом 3,5 млрд, лет и формации Сваркоппи
(Южная Африка). Несмотря на то, что ископае-
мые находки не позволяют сколько-нибудь осно-
вательно выяснять биохимическую природу древ-
них объектов, они все же свидетельствуют, что
жизнь существовала уже 3,2 млрд, лет назад.
Данные палеохимии □ Более информати-
вен, по сравнению с анализом ископаемых нахо-
док, химический анализ неорганических соеди-
нений в составе геологически древних осадоч-
ных пород (рис. 29.31). Увеличение соотношения
[12С|орг./[13С(Орг. обычно рассматривается как по-
казатель фиксации углерода при фотосинтезе или
других автотрофных процессах фиксации угле-
рода. В биологических остатках содержание бо-
лее легкого изотопа [12С]ОрГ. выше по сравне-
Рис. 29.31. Последовательность появления основных групп бактерий в процессе эволюции.
200 Часть VII. Разнообразие и систематика
нию с изотопом [13С]орг_. Фактор дискриминации
6 для [13С]Орг. составляет 25%о. Эта величина, ко-
торая была установлена также в материале из
породы возрастом 3,8 млрд, лет в осадках Исуа,
оставалась относительно постоянной на протя-
жении миллиардов лет, т. е. скорость продукции
биомассы фактически не изменялась за время
биологической эволюции. Распространение меха-
низмов фиксации СОз у представителей обоих
доменов наводит на мысль, что, как отмечалось
в разд. 29.6.3, эволюция гипотетического пред-
ка — прогенота — по двум направлениям эволюци-
онных линий прокариот происходила за довольно
«короткий» период (первые 700 млн. лет) после
образования планеты Земля. Не исключено, что
разделение изотопов углерода имело место даже
ранее, чем 3,8 млрд, лет назад, но их не удается
определить в осадочных породах.
Первым источником энергии и восстановите-
ля для фиксации СОг предположительно служи-
ло образование пирита. По этой гипотезе, выска-
занной Г. Вехтерхойзером (Wachtershauser), H2S
играет важную роль как предшественник моле-
кул с сульфгидрильными группами в каталити-
ческих центрах, тогда как пириты рассматрива-
ются в качестве предшественников железосерных
центров и ферредоксина. Экспериментально под-
тверждена только первая из приведенных ниже
реакций [уравнение (29.5)], но теоретически орга-
низмы могли развиваться в этом «железо-серном
мире» на основе следующих реакций:
FeS + H2S (растворенный) —> FeS2 + Н2
AG0/ = —41,9 ккал/моль (29.5)
СО2 (растворенный) + Н2 —>
—> НСООН (растворенный)
AG0/ — +30,2 кДж/моль (29.6)
FeS + H2S (растворенный) +
+ СО2 (растворенный) —» FeS2 + НСООН
AG’0/ = —11,7 кДж/моль (29.7)
Возможно, к предковым биохимическим типам
относятся термофильные и хемолитоавтотрофные
представители Crenarchaeota, на что указывает их
биохимический потенциал.
Важные палеохимические данные дает ана-
лиз отношения [32S]/[34S], величина которого воз-
растает в результате биологического восстановле-
ния сульфата. В осадочных породах Исуа, име-
ющих возраст 3,8 млрд, лет, такого возрастания
не обнаружено. Наиболее раннее заметное изме-
нение этого отношения выявлено в породах, име-
ющих возраст 3,2-2,8 млрд. лет. Сульфатное ды-
хание, известное у Desulfotomaculum (грамполо-
жительная бактерия) и Desulfovibrio, а также у
родственных бактерий (Proteobacteria), может
быть, таким образом, более поздней адаптаци-
ей, чем фотосинтез и метаногенез. Это предпо-
ложение согласуется с результатами анализа 16S-
рРНК, которые позволяют разделить эти линии
сульфатредукторов примерно на уровне 78% сход-
ства. Главное расхождение линий грамотрица-
тельных сульфатредукторов, возможно, произо-
шло на еще более поздней стадии эволюции (при-
мерно 82% сходство).
Аналогичным образом можно анализировать
историю появления в атмосфере молекулярного
кислорода, события которой важны для пример-
ного датирования более поздних периодов эво-
люции с использованием анализа сходства по-
следовательностей. Почти не вызывает сомнений,
что до появления растительного фотосинтеза сво-
бодный кислород присутствовал в атмосфере не
более чем в следовом количестве. Источник кис-
лорода в раннем докембрии неизвестен; малове-
роятно, что им мог быть фотолиз водяного па-
ра в верхних слоях атмосферы. Существование
железистого слоя в составе морских донных от-
ложений (возрастом примерно 3,2-1,9 млрд, лет),
который содержит магнетит и гематит, может
объясняться жизнедеятельностью оксигенных
прокариот. Остатки организмов, напоминающих
цианобактерии, присутствуют в строматолитах
возрастом 2,7 млрд, лет но их таксономическое
положение пока не установлено; главное расхож-
дение линий этих организмов происходило позд-
нее, чем 3,2-2,7 млрд, лет назад. Если, тем не ме-
нее, образование железистых слоев в морских дон-
ных отложениях вызывала жизнедеятельность
биологических объектов, то либо кислород долж-
ны были выделять организмы, для которых не
описано потомков, либо окисление Fe2+ до Fe3+
осуществлялось без участия кислорода анаэроб-
ными фототрофами. Более поздние типы фото-
трофов, родственные современным фототрофам,
как недавно установлено, обладают такой метабо-
лической активностью.
После окисления в морской среде всех до-
ступных для этого соединений началось форми-
Глава 29. Разнообразие и систематика прокариот 201
рование наземных железистых образований, из-
вестных под названием красные ложа (возраст
2,0-1,8 млрд. лет). Их существование можно объ-
яснять активностью цианобактерий, так как в
строматолитах формации Ганфлит, имеющей воз-
раст 2,0 млрд, лет, обнаружено большое разнооб-
разие остатков цианобактерий.
Интересно, что отмечается корреляция между
возрастанием уровня кислорода 1,5-1,9 млрд, лет
назад и появлением микроаэрофильных организ-
мов Lactobacillus, Streptococcus, Actinomyces, спи-
рохет и некоторых представителей Proteobacteria,
которые эволюционировали от анаэробных фо-
тотрофных и гетеротрофных предков в различ-
ных филогенетических линиях бактерий. Только
после того как была достигнута точка Пастера
(0,2% О2; 1,2-1,4 млрд, лет назад), для организ-
мов стало предпочтительным переключение с бро-
жения на аэробное дыхание (рис. 29.31). Разделе-
ние ветвей аэробных форм, эволюционировавших
от микроаэрофильных предковых организмов-
бродилыциков, коррелирует со сходством рРНК
приблизительно на уровне 87% , тогда как ос-
новное расхождение строго аэробных организмов
имело место при значениях сходства выше 92%.
Это событие могло произойти при парциальном
давлении кислорода 2%, в нижнем силуре (при-
мерно 440 млн. лет назад).
29.7. Комплексный подход к систематике бактерий
Конечная цель систематики микробов состоит в
том, чтобы связать их таксономию с эволюцией
и таким образом достичь уровня ботанической
и зоологической классификаций. Таксономичес-
кие единицы прокариот, произвольно определен-
ные исследователями для удобства работы, могут
не соответствовать реальным единицам в приро-
де. Построение иерархической системы неизбеж-
но становится компромиссом, поскольку мы не
способны полностью установить характер и темп
эволюции бактерий; масштабы таксономических
выводов ограничены из-за того, что они основы-
ваются на изучении лишь незначительной части
ныне существующих организмов и, следователь-
но, лишь малой части биоразнообразия. Следует
учитывать также и роль фактора субъективности
в оценке таксономистами тех или иных признаков
как важных или менее важных.
В будущем определение таксонов на всех уров-
нях, возможно, станет доступным исключитель-
но на основе информации о геноме, такой как
наличие специфических для данного таксона по-
следовательностей или позиций нуклеотидов. Од-
нако маркеры последовательностей, определен-
ные к настоящему времени, могут утрачивать свое
значение по мере того, как будет накапливать-
ся новая информация для большего разнообразия
организмов. Даже представитель низшего ран-
га иерархической структуры — штамм — не явля-
ется набором генетически идентичных клеток, но
представлен клонами, которые несколько отлича-
ются один от другого по генотипу и фенотипу.
Обычный уровень ошибок при репликации кле-
точной ДНК (примерно 10-8 на ген в поколении)
уже обусловливает возникновение в пределах од-
ной колонии мутантных клеток, которые отлича-
ются (несколькими нуклеотидными заменами) от
предковой клетки. Через несколько поколений мо-
гут возникать индивидуальные клоны, которые
положат начало отдельной эволюционной линии
в пределах вида.
29.7.1. Основная концепция современной
таксономии состоит в том, что следует
выбирать систему, удобную для
практического использования
Различия в скоростях эволюции в пределах от-
дельных эволюционных линий не позволяют опре-
делить единичную точку ответвления таксона на
любом уровне, особенно в связи с тем, что разли-
чия на уровне генома не обязательно сопровож-
даются различиями на фенотипическом уровне.
Однако, даже если анализ геномов позволяет со-
здать классификационную систему, основанную
исключительно на сходстве и различиях в после-
довательностях ДНК, руководства по таксономии
и схемы идентификации из практических сообра-
жений не должны быть ориентированы только на
молекулярный уровень анализа, недоступный для
применения большинству таксономистов.
202 Часть VII. Разнообразие и систематика
С целью совершенствования микробной таксо-
номии разрабатывается концепция комплексоно-
го подхода, позволяющего осуществлять выделе-
ние филогенетических групп и их разграничение
на основе соответствующих фенотипических ха-
рактеристик. Позиция таксономистов заключает-
ся в том, что сведение всего объема информации,
содержащейся в геноме, к данным лишь о пер-
вичной структуре макромолекул или единичном
свойстве неизвестной значимости не способствует
пониманию эволюционного процесса на всех уров-
нях информации.
В качестве достоверного и выполнимого спосо-
ба идентификации и классификации предлагает-
ся определять ранг изучаемого объекта в иерар-
хической системе на основе как генотипических,
так и фенотипических признаков, отличающих
его от соседних групп. Значимость признаков для
определения ранга часто изменяется с получением
новых данных о естественных родственных свя-
зях. Например, такие признаки, как фототрофия
или скользящее движение, ранее использовавши-
еся для описания порядков и семейств, в настоя-
щее время используются для описания лишь ро-
дов или видов. Важным условием пригодности
иерархической системы является то, чтобы она
была гибкой и доступной для изменений, отража-
ла ход эволюции насколько можно более точно и
облегчала классификацию в соответствии с есте-
ственными родственными связями организмов.
Применение анализа последовательностей эво-
люционно консервативных макромолекул в систе-
матике микробов создало основу для их груп-
пирования в соответствии с филогенетическим
родством. В то же время современный подход
к классификации основан на использовании ши-
рокого спектра данных, относящихся как к ге-
нетическому, так и эпигенетическому уровням.
Такой подход, пригодный для описания различ-
ных таксонов — от вида до домена, можно назвать
комплексным.
29.7.2. От филогенетической классификации
к таксономическим выводам
Каким образом может быть разработана дей-
ствительно комплексная система классификации?
Наиболее важное отличие этой новой системы
от созданных ранее должно заключаться в том,
чтобы она была высокостабильной и одновремен-
но гибкой. Основой для разработки комплекс-
ной системы служит хороню доказанный поря-
док филогенетического ветвления (по данным
гибридизационного анализа и анализа последо-
вательностей). Комплексная система классифи-
кации начала успешно разрабатываться несколь-
ко лет назад, после того как была установ-
лена высокая корреляция между сходством на
геномном уровне, по данным о реассоциации
ДНК, и сходством на уровне фенотипических при-
знаков. Этот подход был затем распространен
на более низкие уровни родства, включая сход-
ство рРНК-цистронов. Результатом подобных ис-
следований стала ревизия главным образом ор-
ганизмов, относящихся к родам грамотрицатель-
ных бактерий, которые ныне описываются по
таксономически значимым признакам (табл. 29.1-
29.3). Этот подход, позволяющий конструировать
более сложную иерархическую структуру, к на-
стоящему времени распространен на все уров-
ни родственных связей. На его основе пере-
смотрен род Pseudomonas, характерный пример
прежней неудачной классификации; его предста-
вители отнесены к а-, 0- и 7-подклассам про-
теобактерий. Только виды, родственные типово-
му виду Р. aeruginosa (7-подкласс), могут рас-
сматриваться как аутентичные псевдомонады. За
последние 15 лет описано несколько родов, кото-
рые содержат штаммы, ранее ошибочно считав-
шиеся представителями видов рода Pseudomonas
(табл. 29.7).
Определив филогенетическую линию, к ко-
торой принадлежит исследуемый неклассифици-
рованный организм, можно выявить близкие к
нему организмы. Если точка ответвления данного
объекта находится внутри области расхождения
членов филогенетически согласованного рода,
этот объект обнаружит скорее всего признаки
данного рода. Его таксономический статус, будь
это штамм описанного вида или новый вид,
зависит от филогенетического расстояния меж-
ду ним и соседними организмами и от фено-
типических характеристик. Значения гибридиза-
ции ДНК выше 70% и высокая термостабиль-
ность дуплексов ДНК/ДНК для исследуемого
штамма и типового штамма вида указывают,
что исследуемый штамм относится к данному
виду, тогда как более низкие значения этих
показателей указывают на то, что это новый
Глава 29. Разнообразие и систематика прокариот 203
Таблица 29.7. Ревизия классификации видов прокариот по результатам применения нового подхода к определе-
нию филогенетических связей на межродовом и внутриродовом уровнях на примере рода Pseudomonas (см. также
табл. 29.3)
Прежнее название Название после ревизии Подкласс протеобактерий
Pseudomonas aeruginosa Pseudomonas acidovorans Pseudomonas aminovorans Pseudomonas avenae Pseudomonas cepacia Pseudomonas diminuta Pseudomonas flava Pseudomonas luteola Pseudomonas maltophilia Pseudomonas marina Pseudomonas mesophilica Pseudomonas mixta Pseudomonas oryzihabitans Pseudomonas paucimobilis (Типовой вид рода) Comamonas acidovorans Aminobacter aminovorans Acidovorax avenae Burkholderia cepacia Brevundimonas diminuta Hydrogenophaga flava Chryseomonas luteola Stenotrophomonas maltophilia Deleya marina Methylobacterium mesophilicum Telluria mixta Flavimonas oryzihabitans Sphingomonas paucimobilis 7 fl a fl fl a fl He определен 7 7 a fl He определен a
вид. Если новые дифференцирующие фенотипи-
ческие характеристики не обнаруживаются, реко-
мендуется не составлять описания, пока не бу-
дут выявлены такие признаки. Микробиологам
необходимо иметь в виду, что ломающий систему
порядок ветвления может не отражать действи-
тельного хода эволюции. Филогенетические по-
строения основаны на установленных гомологиях,
хотя не будучи подтверждены историческими сви-
детельствами (данными по ископаемым остаткам)
они в лучшем случае могут считаться лишь хо-
рошим приближением. Как и в последние деся-
тилетия, предпочтение будет иметь одна система
как наиболее практически применимая по сравне-
нию с конкурирующими менее аргументирован-
ными системами. Конечная цель состоит в том,
чтобы установить иерархическую систему, в кото-
рой все таксоны согласуются филогенетически и,
по крайней мере для рангов ниже семейства, ха-
рактеризуются как фенотипически согласованные
и имеющие между собой достаточные различия по
стабильным и легко определяемым признакам.
29.7.3. Заключение: 16 основных достижений
в филогенетических исследованиях
и тенденции современной таксономии
Результаты филогенетических исследований вно-
сят изменения в ранее сложившиеся представле-
ния о роли прокариот в эволюции живых орга-
низмов. Кратко эти изменения можно изложить
следующим образом.
• Основываясь на палеохимических данных,
можно предполагать, что жизнь на Земле воз-
никла более чем 3,8 млрд, лет назад. Наиболее
ранние ископаемые находки предположитель-
но датируются временем примерно 3,7 млрд,
лет назад.
• Порядок ветвления филогенетических дере-
вьев, установленный на основе анализа ряда
эволюционно консервативных макромолекул,
в общем и целом идентичен. Это исключает
возможность того, что какой-либо один из по-
рядков ветвления отражает горизонтальный
перенос генов. Таким образом, характер ветв-
ления — это отражение эволюции молекул и
филогении организмов.
• Современные прокариоты — это потомки
предковых форм живых организмов, которые
эволюционировали от общего предка, «проге-
нота».
• Прогенот — гипотетический общий предок —
дал начало прокариотам, представленным
двумя эволюционными линиями, архей и бак-
терий.
204 Часть VII. Разнообразие и систематика
• Как установлено к настоящему времени, все
современные организмы эволюционировали
в пределах трех основных линий — Archaea
(археи), Bacteria (бактерии) и Eukarya (эу-
кариоты). Установление рангов и названий
выше уровня порядка не определяется прави-
лами Международного кодекса номенклатуры
бактерий, поэтому введение ранга доменов и
названий для них, хотя и научно обосновано,
не исключает возможности дальнейших изме-
нений.
• Оба домена прокариот включают несколь-
ко эволюционных линий. Внутри домена
Archaea выделены царства Crenarchaeota,
Korarchaeota и Euryarchaeota. Основные эво-
люционные линии имеют один и тот же ранг.
• Организация генома в виде интронов и экзо-
нов, была, возможно, той особенностью про-
генота, которая постепенно утрачивалась в
большинстве эволюционных линий прокариот.
• Эукариоты произошли от прокариотического
предка, который, возможно, был более род-
ствен Archaea, чем Bacteria.
• Эукариотическая клетка представляет со-
бой химерную структуру, содержащую ге-
ны из обеих эволюционных линий про-
кариот. Это позволяет предполагать, что
перенос генов между7 представителями трех
основных групп организмов был обычным со-
бытием на ранних этапах эволюции.
• Гены, составляющие геномы эукариот, имеют
в удивительно большом числе прокариотиче-
ское происхождение — как от Bacteria, так и от
Archaea. Представители домена Bacteria яви-
лись предками хлоропластов и митохондрий.
Археи и бактерии и сейчас играют важную
роль в отношении всех таксонов эукариот как
симбионты или паразиты.
• Филогенетические соседи архей в эволюцион-
ных линиях эукариот — это простейшие, такие
как Giardia и Microsporidia.
• Высшие таксоны, установленные на основании
фенотипического сходства, лишь изредка от-
ражают происхождение того или иного орга-
низма. Очевидно, признаки, использовавшие-
ся ранее для определения рангов, такие как
фотосинтез, скользящее движение, размноже-
ние почкованием, образование мицелия или
спор, не имеют исключительной значимости
для определении семейств, порядков и клас-
сов.
• Система классификации, установленная в на-
стоящее время для разграничения таксонов
прокариот, основана прежде всего на данных о
последовательностях семантофорных молекул
(ДНК и белков) в сочетании с определенными
фенотипическими признаками.
• Информация о последовательностях будет иг-
рать все более важную роль при подборе
олигонуклеотидных зондов и праймеров для
ПЦР, используемых в молекулярной палеон-
тологии, экологии и при диагностике микро-
организмов, связанной с медициной, охраной
окружающей среды и биотехнологией.
• Таксономические ранги представляют собой в
основном субъективно выделенные единицы,
которые облегчают научное общение и позво-
ляют создать систему для практического ис-
пользования.
• Конечная цель систематики микробов — это
создание таксономической схемы, соответ-
ствующей эволюции, по признакам гомологии
на геномном уровне. Однако пока эта пре-
тенциозная цель не будет достигнута, руко-
водства и методические разработки в области
систематики и таксономии не должны слиш-
ком отрываться от потребностей ежедневной
практики прикладной микробиологии, напри-
мер медицинских учреждений, агентств по
охране окружающей среды и биотехнологиче-
ских производств.
Дополнительная литература
Balows A., Triiper II. G., Dworkin М., Harder W., Schlei-
fcr K.-H. (1991) The prokaryotes. A handbook on the
biology of bacteria: ccophysiology, isolation, identi-
fication, applications. Berlin, Heidelberg, New York:
Springer.
DansonM.J., Hough D.W., LuntG.G. (1992) The ar-
chaebacteria: biochemistry and biotechnology. Bio-
chemical Society Symposium 58. London: Portland
Press.
Goodfellow M., O’Donnell A. G. (1993) A handbook of
new bacterial systematics. New York, London: Aca-
demic Press.
Глава 29. Разнообразие и систематика прокариот 205
Goodfellow М., O’Donnell A. G. (1994) Chemical me-
thods in prokaryotic systematics. New York: Wiley.
Holt J. G., Krieg N. R., Sneath F. H. A., Staley J. T,
Williams S.T, eds. (1994) Bergey’s manual of deter-
minative bacteriology, 9th edn. Baltimore: Williams
& Wilkins.
Li W.-H., Graur D. (1991) Fundamentals of molecular
evolution. Sunderland, Mass.: Sinauer.
Neidhardt F. C, Curtiss R., Ingraham J. L, Lin E. С. C,
LowK.B., Magasanik B., Reznikoff W., Riley M.,
Schaechter M., Umbarger H. E. (eds.) (1996) Esche-
richia coli and Salmonella: cellular and molecular
biology. 2nd edn. Washington, DC: ASM Press.
Pankhurst R. J. (1991) Practical taxonomic computing.
Cambridge: Cambridge University Press.
Ratledge C, Wilkinson S. G. (1989) Microbial lipids,
vol. 1. New York, London: Academic Press.
Sackin M. J., Jones D. (1993) Computer-assisted clas-
sification. In: Goodfellow M., O’Donnell A. G. (eds)
Handbook of new bacterial systematics. New York,
London-Academic Press; 282-313.
Schleifer К.-H., Ludwig W. (1989) Phylogenetic relation-
ships among bacteria In: Fernholm B., Bremer K.,
Jornwall H. (eds.) The hierarchy of life. Amsterdam-
Elsevier; 103-117.
Stackebrandt E. (1992) Unifying phylogeny and phe-
notypic properties. In: Balows A., Triiper H. G.,
Dworkin M., Harder W., Schleifer K.-H. (eds.) The
prokaryotes, 2nd edn. Berlin, Heidelberg, New York:
Springer 19-47.
Triiper H. G. (1992) Prokaryotes: an overview with
respect to biodiversity and environmental impor-
tance. Biodiversity Conservation 1: 227-236.
WoeseC. R. (1987) Bacterial evolution. Microbiol. Rev.
51: 221-271.
WoeseC.R., GutellR., GuptaR., NollerH. (1983) De-
tailed analysis of the higher order structure of
16S-like ribosomal ribonucleic acids. Microbiol. Rev.
47: 621-669.
Zuckerkandl E., Pauling L. (1965) Molecules as docu-
ments of evolutionary history. J. Theor. Biol. 8: 357-
366.
Источники рисунков
1. Stackebrandt E., Rainey F. A. (1997) Phylogenetic
relationships. In: Rood J. (ed.) Molecular biology
and pathogenesis of the Clostridia. New York
London: Academic Press.
2. Stackebrandt E. (1995) Origin and evolution of
prokaryotes. In: Gibbs A., Calisher С. H., Garcia-
Arenal F. (eds.) Molecular basis of virus evolution.
Cambridge: Cambridge University Press; 224-242.
Часть VIII
ПРОКАРИОТЫ В БИОСФЕРЕ
Сведения о микроорганизмах, изложенные в пред-
шествующих главах, получены при изучении чис-
тых лабораторных культур. Разработка методов
выделения чистых культур заложила основу раз-
вития микробиологии, и их изучение остается
главным источником наших знаний о микроорга-
низмах. В то же время в лабораторию микроор-
ганизмы попадают из природы, и для выяснения
их свойств необходимо знать условия, в которых
они находятся в природных местообитаниях.
Понимание феномена жизни подразумевает
понимание того, как эволюционировала жизнь;
понимание эволюции требует понимания экологи-
ческих условий, в которых она происходит. В
В последующих главах будут рассмотрены осо-
бенности различных природных сред обитания
микроорганизмов, а также влияние микроорга-
низмов на физические, химические и биологиче-
ские характеристики среды, т. е. создание мик-
робами адекватных условий для себя и других
организмов. Природные среды обитания микроор-
ганизмов в определенном смысле принципиально
отличаются от тех, в которых их выращивают в
лаборатории.
1. В естественных местообитаниях микроорга-
низмы обычно находятся скорее в условиях
дефицита субстратов, а не их избытка.
2. В природе микроорганизмы растут в присут-
ствии субстратов разных типов.
3. В природных местообитаниях редко присут-
ствует всего один микробный вид; чаще всего
каждый микроорганизм конкурирует или об-
разует кооперацию с другими видами.
4. Природные местообитания микробов про-
странственно гетерогенпы даже на очень ма-
лых участках.
5. Условия в естественных местообитаниях ред-
ко стабильны; они изменяются во времени,
следуя суточным и годичным циклам.
Экологические исследования позволяют выяс-
нять взаимовлияние данного организма или опре-
деленного типа организмов, с одной стороны, и
абиотических, а также биотических факторов,
формирующих среду7 обитания, с другой стороны.
Экология — это «наука о взаимосвязи организма
с окружающей его средой, под которой в широ-
ком смысле мы можем понимать все условия су-
ществования» (Э. Геккель, 1866).
Важность микроорганизмов для поддержания
биосферы долгое время недооценивали, полагая,
что при своих малых размерах они не могут ока-
зывать существенного влияния на экологические
системы. По современным представлениям, био-
масса прокариот составляет существенную часть
живой биомассы на Земле и им принадлежит
активная роль в превращениях органических и
неорганических соединений в окружающей среде.
Благодаря высокому численному соотношению
поверхность/объем клетки прокариот метаболи-
чески более активны, чем клетки эукариот, и этим
в большой степени обусловлена важная экологи-
ческая роль прокариотических организмов. Суще-
ствование микроорганизмов проявляется гораздо
заметнее в их активности, чем в видимом присут-
208 Часть VIII. Прокариоты в биосфере
ствии. Везде, где имеется достаточное количество
субстрата, пригодного в качестве источника энер-
гии для каких-либо живых организмов, с боль-
шой вероятностью будут обнаружены прокарио-
ты, осуществляющие данный процесс и способные
расти с использованием этого субстрата.
Экологию того или иного организма про-
ще всего исследовать путем прямого наблюде-
ния, однако в случае микробов это труднодо-
стижимо. Бактерии невозможно идентифициро-
вать с помощью микроскопии, поскольку их
морфологическое разнообразие весьма невели-
ко, и тем более с помощью оптических методов
нельзя определить метаболическую активность и
связанную с ней функцию того или иного орга-
низма в естественной среде обитания. По этим
причинам микробная экология начала развивать-
ся лишь в недавний период, значительно позже
экологии животных и растений.
Прежде чем приступить к дальнейшему из-
ложению, необходимо ввести некоторые опреде-
ления. За основную единицу в экологии принято
сообщество, или биоценоз (биота). Оно состав-
ляет живую часть экосистемы и включает фа-
уну (животные), флору (растения) и микро-
флору (микроорганизмы — грибы, простейшие,
прокариоты и вирусы). Биоценоз по-другому
называют «биом», характеризуя этим термином
сообщества определенных типов экосистем (на-
пример, пихтового леса, пустыни или океанской
бухты). Сообщество следует рассматривать в свя-
зи с физическими и химическими характери-
стиками данного местообитания. Биотические и
абиотические (физико-химические) компоненты
вместе составляют экосистему. Абиотические ком-
поненты экосистемы часто называют окружа-
ющей средой, хотя в понятие «окружающая
среда» нередко включают и биотические ком-
поненты. Экосистема представляет собой само-
достаточную функциональную единицу. Полная
экосистема состоит из первичных продуцентов,
консументов и минерализующих организмов. Эко-
системы могут быть таких масштабов, как океан,
пруд, озеро, река или лес, и каждая из них харак-
теризуется своей структурой и функцией, как в
отношении физико-химических, так и в отноше-
нии биотических компонентов.
Внутри экосистемы можно выделить место-
обитания (среду обитания) отдельных организ-
мов. Под местообитанием понимают локализа-
цию, местонахождение данного организма. Для
того или иного микроорганизма местообитанием
считают место, где он может быть обнаружен
и, возможно, выделен с использованием соответ-
ствующей методики, своего рода «адрес», по ко-
торому может быть найден данный организм.
Термин экологическая ниша, в отличие
от термина местообитание, не относится к про-
странственному распределению, обозначая толь-
ко функцию, или «профессию», организма. Све-
дения о местообитании и экологической нише
организмов необходимы для того, чтобы устано-
вить структуру и функцию данного сообщества
в пределах экосистемы. Экологические ниши мо-
гут быть широкими или очень узкими; некоторые
организмы можно определить как специализи-
рованные формы по метаболической активно-
сти или активности в отношении среды обитания,
другие —как неспециализированные формы.
Среди обитателей экосистемы, составляющих
биоту, можно дифференцировать постоянно оби-
тающие в ней организмы и организмы, встреча-
ющиеся лишь случайно. Так, С. Н. Виноградский
выделял два типа микроорганизмов, обитающих
в почве: автохтонные, или местные, микро-
организмы как обычно встречающиеся в дан-
ной экосистеме в виде довольно значительной
и стабильной популяции, размеры которой мало
варьируют во времени, и аллохтонные, зимо-
генные, не местные микроорганизмы — нети-
пичные компоненты данной экосистемы. Размеры
популяций аллохтонных микроорганизмов значи-
тельно— на несколько порядков — варьируют во
времени в зависимости от наличия источников пи-
тания или других лимитирующих факторов. Они
быстро растут при благоприятных условиях, но и
быстро погибают, когда условия меняются, в ре-
зультате чего выживает лишь незначительная их
часть. Эта концепция, исходно разработанная для
микробиологии почвы, может быть распростране-
на и па других экосистемы. Автохтонную микроб-
ную популяцию не всегда легко выявить, тогда
как аллохтонные бактерии во многих случаях из-
вестны гораздо лучше, поскольку их значитель-
но легче культивировать. Вместе с тем современ-
ная микробная экология должна изучать прежде
всего автохтонные, а не аллохтонные микроорга-
низмы.
Глава 30
Экофизиология и экологические ниши прокариот
Микробный штамм, выделенный в виде чистой
культуры, может быть изучен в лабораторных
условиях в отношении его метаболической актив-
ности, используемых субстратов, образуемых про-
дуктов, зависимости от параметров окружающей
среды (температуры, pH, ионной силы, влажно-
сти и освещенности), реакции на изменения этих
параметров в пространстве и времени, способно-
сти активно перемещаться и метаболически адап-
тироваться к изменяющимся условиям. Подобные
исследования дают сведения по аутоэкологии
организма. Они раскрывают потенциальные воз-
можности организма и позволяют выяснить спо-
соб его существования в природных условиях.
Однако с помощью аутоэкологического подхода
трудно установить, как влияет на физиологиче-
ские характеристики организма in situ комплекс
природных внешних факторов, не сходных с ла-
бораторными. Для того чтобы определить харак-
тер формирования сообщества организмов и зави-
симости его членов друг от друга в комплексной
природной экосистеме, необходимо применять при
анализе синэкологический подход. Посколь-
ку в природе на организмы одновременно влияют
разнообразные и комплексно взаимодействующие
факторы, синэкологическое исследование в мето-
дическом плане значительно сложнее, чем ауто-
экологическое. При синэкологическом подходе в
микробиологии следует принимать во внимание
также и экологию высших организмов, если иссле-
дуемая экосистема не относится к экстремаль-
ной среде обитания (см. разд. 31.4).
30.1. Количество субстратов в природе обычно лимитировано
Для лабораторных исследований удобно исполь-
зовать быстрорастущие и легкокультивируемые
организмы, для которых, кроме того, не характер-
но скучивание или прилипание к поверхностям.
Традиционные питательные среды содержат лег-
коразлагаемые субстраты в концентрациях, ко-
торые обеспечивают быстрый рост с достижени-
ем высокой плотности популяции. В природной
среде, где обитает данный микроорганизм, ситуа-
ция совершенно иная. Хотя в отдельных случаях
микроорганизм может «иметь в распоряжении»
субстрат в высокой концентрации (например,
гниющий фрукт или разлагающийся труп жи-
вотного), даже и тогда он находится в условиях
конкуренции с другими организмами и субстрат,
доступный для данного организма, очень скоро
становится лимитирующим. Типичные условия
обитания микроорганизма в природе — ограни-
ченное поступление субстратов (чаще их значи-
тельный дефицит), причем такая ситуация созда-
ется в результате активности самих микробов.
30.1.1. Свет служит источником энергии
и одновременно действует
как повреждающий агент
Свет — это первичный и основной источник энер-
гии почти во всех экосистемах. Солнечное излу-
чение, достигающее наружных слоев атмосферы,
в значительной части спектра поглощается в ней
озоном, кислородом и водой (рис. 30.1). На до-
лю видимого света приходится менее 50% све-
товой энергии, достигающей поверхности Земли;
небольшую ее часть составляет ультрафиолето-
вый свет и основную часть — инфракрасное излу-
чение (тепловая энергия).
Наземные организмы обладают различными
механизмами защиты от повреждающего дей-
ствия ультрафиолета; например, они синтезиру-
ют поглощающие его пигменты (каротиноиды или
меланины). Фотосинтезирующие организмы со-
держат светособирающие пигмент-белковые ком-
плексы (антенны) для наиболее эффективного
улавливания света, используемого при фотосинте-
210 Часть VIII. Прокариоты в биосфере
Рис. 30.1. Сравнение потока солнечной радиации во вне-
земном пространстве и у поверхности Земли. Показаны
основные полосы поглощения Ог, Оз и водяного пара в
составе атмосферы. По [1].
Рис. 30.2. Пропускание света шести различных длин
волн дистилированной водой, г — 720 нм; о — 620 нм;
у — 560 нм; g — 510 нм; b — 460 нм; v — 390 нм. Доля па-
дающего света на различных глубинах показана в лога-
рифмическом масштабе. По [2].
зе. Водные растения, такие как водоросли, и вод-
ные микроорганизмы не нуждаются в сильной за-
щите от светового излучения, поскольку сама во-
да действует как защитный барьер.
Светопроницаемость воды зависит от длины
волны падающего света. Инфракрасный свет в
значительной степени поглощается молекулами
воды; падение интенсивности красного света со-
ставляет 1% на 2,5 м водного столба. Интенсив-
ность ультрафиолетового света меньше снижает-
ся за счет поглощения (рис. 30.2), но падает с
глубиной главным образом в результате рассея-
ния и обратного рассеяния; обратным рассеянием
синего света обусловлен синий цвет массы чистой
воды, например в горных озерах. Качественный
состав света меняется при его прохождении че-
рез чистую воду в результате поглощения и рас-
сеяния, и наибольшей глубины достигает свет с
длиной волны примерно 540-560 нм. Кроме то-
го, на изменение качества света с глубиной вли-
яют его поглощение растворенными соединения-
ми (например, фульвокислотами; см. разд. 30.1.2),
которые поглощают прежде всего синий свет, рас-
сеиваемый суспендированными в воде частицами,
а также поглощение света в определенных обла-
стях спектра водорослями и другими фотосинте-
зирующими организмами, в зависимости от содер-
жащихся в них пигментов. Таким образом, ин-
тенсивность и качественный состав света в толще
воды в значительной степени варьируют в различ-
ных местообитаниях и зависят от качества воды,
а также от количества и типов присутствующих в
ней фотосинтезирующих организмов.
30.1.2. Органические субстраты
не всегда легкодоступны
Органическое вещество синтезируется в приро-
де главным образом благодаря фотосинтетиче-
ской активности растений, в первую очередь выс-
ших растений, а также водорослей и цианобакте-
рий. Растительный материал служит пищей для
животных. Отмершие растения, трупы и экскре-
менты животных и выделения растений служат
питательными субстратами для гетеротрофных
микроорганизмов, главным образом бактерий и
грибов, которые окисляют их до СО2, воды и
неорганических солей, используемых в свою оче-
редь фотосинтезирующими организмами.
Наиболее распространенные субстраты, под-
вергающиеся микробному разложению, — это био-
полимеры. Растительный материал состоит при-
мерно на 50% из целлюлозы; кроме того, в его
состав входят лигнин (10-25%), гемицеллюлозы и
пектин (10-20%), белки (5-10%), липиды 2-5% и
нуклеиновые кислоты (до 2%; все в расчете на су-
хое вещество клеток). Животные ткани, в отли-
чие от этого, богаты белками (50-80%), в том чис-
ле структурными (образующими хрящи, связки,
шерсть, когти и т. д.); содержание липидов в жи-
вотном материале составляет 10-15%, полисаха-
ридов—5-10% и нуклеиновых кислот —5%. Рас-
творенные мономеры в биомассе присутствуют в
количестве не более 5%. Мономерные субстраты
легко разлагаются многими организмами, тогда
как полимерные соединения способны разлагать
лишь специализированные микроорганизмы (см.
Глава 30. Экофизиология и экологические ниши прокариот 211
гл. 9). В зависимости от состава и строения био-
полимеров разложение может происходить быст-
ро, как в случае крахмала или глобулярных бел-
ков (табл. 30.1), либо очень медленно, если это
устойчивые к биодеградации полимеры, такие как
лигнин, кератин или целлюлоза, способные со-
храняться в определенных условиях (например,
в отсутствие кислорода и в присутствии ингиби-
рующих веществ, например таннинов) в течение
сотен и даже тысяч лет. Деревянные борта древ-
неримских военных кораблей сохраняются целы-
ми в бескислородных морских осадках в течение
уже примерно 2000 лет. Лигноцеллюлоза устой-
чива при таких условиях, поскольку для биораз-
ложения лигнина требуется молекулярный кисло-
род. Однако в некоторой степени древесина в этих
условиях повреждается, подвергаясь постепенно-
му разложению.
Биодеградации препятствует также то, что
многие растительные полимеры химически связа-
ны с другими соединениями в составе комплекс-
ных структур, а компоненты животных тканей
адсорбированы на поверхности минералов. Так
целлюлоза, довольно легко разлагаемый субстрат
в виде чистого полимера, более устойчива в ви-
де комплекса с лигнином в составе древесины.
Адсорбция белков или нуклеиновых кислот на
кремнеземных или глинистых поверхностях дела-
ет их почти недоступными для деполимеризую-
щих ферментов и увеличивает период полужизни
на несколько порядков величин.
Микробное разложение органического веще-
ства не всегда заканчивается его полной минера-
лизацией. В присутствии кислорода специфиче-
ские или неспецифические оксигеназы превраща-
ют ароматические и алифатические субстраты в
фенольные или спиртовые производные, которые
имеют тенденцию образовывать радикалы и поли-
меризоваться с образованием крупных агрегатов.
В частности, в почве с этим связано превраще-
ние древесины в гумус; в полимерные вещества,
составляющие гумус, могут дополнительно вклю-
чаться такие компоненты, как аминокислоты, са-
хара и разнообразные олигомеры, вследствие че-
го скорость разложения гумуса существенно сни-
жается. Как правило, почвенный гумус содержит,
помимо ароматических производных лигнина,
значительную долю алифатических соединений,
производных сахаров и белков. Мол. масса гуму-
совых веществ может возрастать до нескольких
миллионов дальтон. В воде озер присутствует эк-
Таблица 30.1. Измеренное время полураспада биополи-
меров в природе
Полимер Время полураспада
Лигнин Кератин (волосы, шерсть) Гуминовые соединения Целлюлоза Крахмал Глобулярные белки 20-2000 лет 1-2000 лет 2-200 лет 0,01-2 мес 1-10 сут 0,1-2 сут
вивалент этого почвенного вещества — водные
гуминовые кислоты; их мол. масса составляет
от 1,5 до примерно 150 кДа. Они беднее аромати-
ческими составляющими по сравнению с почвен-
ными гуминовыми кислотами, и их состав зависит
от поступления извне лигнинсодержащих остат-
ков. Гумусовые вещества медленно преобразуют-
ся под действием микробов, химических и фотохи-
мических факторов, в процессе чего химические
свойства их компонентов постепенно меняются.
Таким образом, полимерные субстраты могут
присутствовать в природной среде в изобилии,
составляя, например, до 70% сухого вещества в
поверхностном слое лесной почвы, но их разло-
жение происходит медленно (табл. 30.1). Дегра-
дации растительных полимеров значительно спо-
собствуют животные, такие как жуки, земляные
черви, улитки, ногохвостки, термиты и жвачные,
которые механически уменьшают размер частиц
и тем самым облегчают микробам использование
субстратов как внутри своего пищеварительного
тракта, так и в экскрементах (см. разд. 31.5). Про-
стейшие захватывают мелкие частицы посред-
ством фагоцитоза, тогда как прокариоты вначале
частично разлагают полимеры вне клеток с помо-
щью экзоферментов и поглощают только низко-
молекулярные субстраты.
Поскольку деградация биополимеров обычно
является этапом, лимитирующим скорость раз-
ложения отмершей биомассы, концентрация сво-
бодных мономерных органических соединений в
природной среде, как правило, низка, в результа-
те того что они быстро и эффективно поглоща-
ются разнообразными организмами, входящими в
микробное сообщество.
Концентрация свободных сахаров, по дан-
ным для различных местообитаний, варьирует от
нескольких микромоль в относительно богатых
средах обитания, например в ризосфере (область
212 Часть VIII. Прокариоты в биосфере
почвы непосредственно у корней растения), до пи-
комоль в океанской воде. Свободные аминокисло-
ты в водной среде и в почве обычно присутствуют
в наномолярной концентрации. Очевидно, таким
образом, что микроорганизмы, использующие для
роста сахара или аминокислоты, должным быть
способны поглощать их при очень низкой кон-
центрации. Следовательно, эффективное потреб-
ление таких субстратов зависит от наличия у
микроорганизма транспортных систем с высоким
сродством к субстратам (см. гл. 5 и разд. 30.4).
Низкая концентрация мономерных органических
веществ в стабильных природных местообитаниях
отражает уровень разлагающей микробной актив-
ности и наличие у микроорганизмов разнообраз-
ных транспортных систем с высоким сродством к
субстратам. Это относится и к указанным выше
органическим субстратам, и к субстратам других
типов.
Субстратами для микроорганизмов служат
главным образом биополимеры, из которых наи-
более устойчива к разложению лигноцеллюлоза.
Продукты деградации полимеров могут образо-
вывать радикалы и полимеризоваться с образова-
нием гумусовых веществ. Мономерные продукты
разложения, такие как сахара и аминокислоты,
присутствуют в природных средах лишь в низких
концентрациях, от микро- до наномолярных.
30.1.3. Кислород необходим облигатно аэробным
микроорганизмам, но способен оказывать
токсические эффекты
Молекулярный кислород присутствует в ат-
мосферном воздухе в количестве до 21%
(~9 ммоль/л). Аэробные микроорганизмы вы-
держивают такую концентрацию этого потенци-
ально токсичного газа и используют его для по-
лучения энергии в процессе дыхания (см. гл. 4 и
11). В водных средах при 4-20 °C равновесная
концентрация кислорода составляет 300-400 мкМ
(табл. 30.2). При растворении атмосферных га-
зов происходит относительное обогащение во-
ды кислородом по сравнению, например, с N2 и
Аг, вследствие его более высокой полярности, но
небольшой запас кислорода, растворенного в воде,
может весьма быстро потребляться микробами.
Концентрация органических субстратов, близкая
к 10 мг/л (расчет как для эквивалентов сахаров),
Таблица 30.2. Растворимость молекулярного кислорода
в чистой воде в зависимости от температуры при рав-
новесии с воздухом и стандартном давлении
Т, °C Концентрация О2
мг/л мкМ
0 14,62 457
4 13,10 409
10 11,29 353
20 9,09 284
30 7,56 236
40 6,41 200
50 6,25 195
100 5,08 159
достаточна для полного потребления микроор-
ганизмами растворенного в воде кислорода при
15 °C. Таким образом, процессы микробного раз-
ложения в водной среде, требующие участия кис-
лорода, зависят от интенсивного восполнения его
запаса в растворенном виде посредством, в част-
ности, вихревой конвекции (см. разд. 30.6). Рас-
творимость кислорода снижается с увеличением
солености воды. Морская вода с концентраци-
ей соли 3,5% (масса/объем) содержит при одной
и той же температуре на 20% меньше кислоро-
да, чем пресная. Подробно это рассматривается
для соответствующих местообитаний в разд. 31.1.
В присутствии света кислород может вызывать
повреждающие эффекты, так как воздействие
ультрафиолета на компоненты клеток способству-
ет образованию кислородных радикалов, разру-
шающих в том числе нуклеиновые кислоты.
30.1.4. Азот —второй из наиболее важных
биогенных элементов
Азот составляет примерно 16% сухого вещества
биомассы, будучи вторым по количеству элемен-
том после углерода в составе клеток. Неоргани-
ческий азот доступен в природе как субстрат для
ассимиляции в форме нитрата, нитрита, аммиа-
ка и молекулярного азота. Концентрация обще-
го связанного неорганического азота в различных
природных экосистемах варьирует в пределах
1-500 мкМ. В составе клеток азот обычно присут-
ствует в восстановленной форме; он поглощается,
Глава 30. Экофизиология и экологические ниши прокариот 213
а также высвобождается при разложении микроб-
ных клеток в виде аммиака (см. разд. 8.4). В при-
родных средах, богатых О2, связанный азот при-
сутствует главным образом в виде нитрата, для
ассимиляции которого требуется предварительное
восстановление до аммиака в процессе ассимиля-
ционной нитратредукции. Способность к ассими-
ляции молекулярного азота, N2, довольно ши-
роко распространенная среди прокариот, связана
с активностью сложного по структуре фермента
нитрогеназы (см. разд. 8.5). Процесс азотфикса-
ции требует большого количества энергии в фор-
ме АТР и строго регулируется во избежание ее
потерь. Всюду, где восстанавливается нитрат либо
окисляется аммиак, присутствует также нитрит.
Концентрация его in situ обычно не превышает
микромол яркого уровня; в более высокой концен-
трации нитрит оказывает повреждающий эффект
вследствие своего мутагенного действия. Подроб-
но превращения азота описаны в разд. 7.3.1, 8.4,
8.5 и 12.2.2.
30.1.5. Неорганические соединения серы
как необходимые питательные вещества
и источники энергии
Сера содержится в клетках в количестве пример-
но 0,2% сухого вещества биомассы и представляет
собой необходимый питательный элемент. В жи-
вых клетках сера присутствует обычно в восста-
новленной форме и ассимилируется в виде серо-
водорода, H2S (см. разд. 8.7). Эта соединение
серы стабильно только в строго анаэробной сре-
де. В присутствии кислорода H2S реагирует хими-
чески с кислородом с образованием тиосульфа-
та (ЗгОз-), сульфита (HSO3 ) или молекуляр-
ной серы (S°), и на этом основан лабораторный
метод удаления с помощью сероводорода мини-
количеств кислорода при культивировании стро-
гих анаэробов. Спонтанное окисление H2S/HS_
сравнительно быстро протекает при pH 7,5-8,5
и медленно при более низких значениях pH;
другой максимум скорости этой реакции имеет
место при pH 11. В присутствии каталитических
количеств тяжелых металлов или окисляющих се-
ру микроорганизмов сульфид может также пол-
ностью окисляться до сульфата — формы, в кото-
рой сера главным образом встречается в средах,
богатых кислородом. Для ассимиляции сульфата
клетки должны обладать сульфатредуктазной си-
стемой (см. разд. 8.7). В пресных водах, содержа-
щих кислород, сульфат присутствует в концентра-
циях 50-300 мкМ. Исключение составляют воды,
богатые гипсом (СаБСД); в насыщенной гипсом
воде при 25 °C концентрация сульфата близка к
14 мМ. Морская вода очень богата сульфатом —
концентрация SO2- составляет в ней 28 мМ. Вы-
деляющийся в донных осадках H2S реагирует с
ионами тяжелых металлов, в первую очередь же-
леза;
Fe2+ + H2S -> FeS 4- 2Н+ (30.1)
Поскольку оксиды и карбонаты железа, а так-
же других тяжелых металлов обычно присутству-
ют в водоемах в избытке, концентрация свобод-
ных H2S и HS- в осадках, даже морских, обычно
ниже 100 мкМ. Сульфид Fe(II) (FeS) осаждает-
ся в форме микрокристаллов, которые поглоща-
ют свет всего видимого спектра. Вследствие этого
отложения сульфида железа окрашены в черный
цвет и бескислородные осадки часто имеют окрас-
ку от темно-серой до черной.
FeS может далее взаимодействовать с H2S, об-
разуя пирит (Ре8г), в котором сера имеет степень
окисления —1:
FeS + H2S -> FeS2 + Н2 (30.2)
В этой реакции высвобождается некото-
рое количество свободной энергии (AG0/ —
—38,4 кДж/моль), однако к настоящему времени
нет сведений о том, что ее осуществляют мик-
роорганизмы. В литературе обсуждается возмож-
ность альтернативного образования пирита из FeS
и S°, но значение его в природе, вероятно, лишь
незначительное. Образующийся пирит стабилен
в отсутствие сильных окислителей и может быть
основным соединением серы в глубоких пресно-
водных или морских осадках.
Молекулярная сера (S°) почти нераствори-
ма в воде; в одном литре чистой воды при 25 °C ее
растворяется не более 5 мг (= 0,16 мкМ). В при-
родных средах она присутствует вследствие этого
не в воде, а главным образом в осадках как незна-
чительная фракция общей серы, меньшая, чем
фракции пирита и сульфида, либо внутри кле-
ток метаболизирующих серу бактерий (глобулы
серы). Более значительные отложения серы на-
капливаются вокруг горячих сероводородных ис-
точников, где H2S взаимодействует с кислородом
воздуха с образованием молекулярной серы.
214 Часть VIII. Прокариоты в биосфере
30.1.6. Ассимиляция фосфора
происходит без его восстановления
Фосфор присутствует в природных средах поч-
ти исключительно в форме фосфата, т. е. име-
ет степень окисления 4-5. Он не восстанавлива-
ется в реакциях биологического преобразования
энергии (см. разд. 8.6). Известно несколько фос-
форорганических соединений, в которых присут-
ствуют связи С—Р или С—Р—С (см. разд. 30.2.3).
Фосфорные минералы обычно слаборастворимы,
как в случае апатитов [Са5(Р,ОН,С1)(РО4)з] или
фосфата железа (III) (FePO^. Концентрация
свободного фосфата в природных водах, таким
образом, низка — от 10“7 до 10“ 6 М. Фосфат
составляет существенный компонент биомассы,
присутствуя в ней в количестве примерно 0,5%
сухого вещества клеток. Среднее соотношение
элементов в биомассе водорослей, так называе-
мое соотношение Редфилда, в озерах составляет
106 С : 16 N : 1 Р. Из-за низкой растворимости
фосфата его уровень обычно лимитирует первич-
ную продукцию, и незначительно возросшее пос-
тупление фосфора может резко повысить общую
продуктивность. Таким образом, фосфат служит
важнейшим фактором, от которого зависит про-
дуктивность водорослей в экосистемах пресновод-
ных озер. По имеющимся данным, гетеротрофные
бактерии успешно конкурируют с водорослями
и цианобактериями за растворенный неорганичес-
кий фосфат в озерах.
30.1.7. Реакции восстановления железа
и марганца существенно зависят от pH
Железо представляет собой один из наиболее
важных компонентов земной коры, но в жи-
вых клетках его содержание не превышает 0,01%
(см. разд. 8.8); при контакте железа с водой об-
разуются его гидроксиды и оксиды или окси-
гидраты. Особое биологическое значение имеют
взаимопревращения Fe(II) и Fe(III), лежащие в
основе активности, например, цитохромов и Fe—S-
белков. В бескислородной среде Fe2+ растворим
в воде до концентрации 10“7-10“6 М, в зависи-
мости от концентрации карбоната, и таким обра-
зом присутствует в достаточном для микробных
клеток количестве. При избытке H2S происходит
осаждение FeS и концентрация свободного Fe2+
падает до менее чем 10“9 М. В присутствии кис-
лорода при нейтральном значении pH происхо-
дит осаждение Fe3+ в форме Ве(ОН)з и FeO(OH);
концентрация свободного Fe3+ в чистой кислород-
содержащей воде составляет примерно 10“18 М.
Таким образом, свободный Fe3+ недоступен для
микробных клеток в этих условиях, в связи с чем
аэробные бактерии обладают специальными сис-
темами поглощения ионов железа с участием хе-
латирующих соединений — сидерофоров. В ка-
честве хелатирующих агентов выступают в при-
родных средах также гуминовые кислоты и фуль-
вокислоты, в результате чего концентрация рас-
творенного трехвалентного железа поддержива-
ется на низком уровне (см. разд. 8.8 и 31.3.1).
Окислительно-восстановительный потенциал
перехода Fe(II) —> Fe(III) зависит от значения
pH. При pH <2,4 он соответствует стандартно-
му окислительно-восстановительному потенциалу
4-770 мВ, так как обе формы, Fe2+ и Fe3+, хорошо
растворимы и присутствуют в равных концентра-
циях. При повышении pH трехвалентное железо
осаждается в форме Ре(ОН)з и FeO(OH) и доми-
нирует свободный Fe2+, в результате чего эффек-
тивный окислительно-восстановительный потен-
циал сдвигается до значения примерно 4-100 мВ
при нейтральном значении pH (рис. 30.3). Та-
Рис. 30.3. Примерное соотношение форм железа в
зависимости от pH и преобладающего окислительно-
восстановительного потенциала. Предполагается, что
реагенты присутствуют в концентрации 10 мМ. Штрихо-
выми линиями показано соотношение в отсутствие кар-
боната. Тонкая линия вверху показывает восстановление
кислорода до воды. По [3].
Глава 30. Экофизиология и экологические ниши прокариот 215
ким образом, энергетика восстановления и окис-
ления железа значительно варьирует в зависимос-
ти от pH.
Сходным образом в случае марганца, сте-
пень окисления которого изменяется от Мп(П)
до Mn(IV), растворимость в воде этих двух
ионных форм значительно различается и за-
висит от pH. Существуют также относитель-
но стабильные смешанные оксиды («М113О4»),
в форме которых марганец труднодоступен для
микроорганизмов. Реальные величины окисли-
тельно-восстановительного потенциала зависят от
активности протонов при pH > 6,0, и, как прави-
ло, они являются примерно на 500 мВ более вы-
сокими (электроположительными), чем редокс-
потенциал железа.
30.2. Бактерии осуществляют
окислительно-восстановительные превращения субстратов
Катализируемые микроорганизмами окислитель-
но-восстановительные реакции различных типов
составляют определенную иерархию по степени
предпочтительности. Где бы ни накапливалось ор-
ганическое вещество, наблюдается последователь-
ность катализируемых микробами окислительно-
восстановительных реакций, характерная для
всех изученных микробных экосистем — в толще
пресной воды, в морских осадках, увлажненной
почве, морском заливе, активном иле или микроб-
ном мате в горячем источнике и т. д.
30.2.1. Конечные акцепторы электронов
в аэробных и анаэробных условиях
Везде, где присутствует молекулярный кисло-
род, он служит наиболее предпочтительным ак-
цептором электронов при окислении органиче-
ских соединений в микробных сообществах. Мик-
роорганизмы используют О2 как терминальный
акцептор электронов в дыхательной цепи (см
гл. 4 и 11), а также как косубстрат в оксиге-
назных реакциях, необходимых для активации
инертных субстратов.
Оксигеназные реакции зависят от уникаль-
ной бирадикальной природы молекулы кислоро-
да; процессов, эквивалентных оксигеназным реак-
циям, в отсутствие молекулярного кислорода не
обнаружено.
Поскольку О2 слабо растворим в воде и мед-
ленно диффундирует через ее толщу, он быст-
ро расходуется, если нет восполнения его запаса
за счет конвекционных процессов (турбулентной
диффузии). В отсутствие кислорода бактерии ис-
пользуют в качестве конечного акцептора элек-
тронов нитрат, который при этом восстанавли-
вается через нитрит до газообразного азота, N2O
или аммиака (см. разд. 12.1 и рис. 30.4). В от-
личие от кислорода нитрат или его восстановлен-
ные производные могут служить только акцепто-
рами электронов, но не косубстратами в реакциях
активации инертных субстратов. Многие аэроб-
ные бактерии восстанавливают нитрат до моле-
кулярного азота, легко переключаясь с аэробного
дыхания на нитратное и обратно. В присутствии
кислорода нитратредукция не всегда полностью
подавляется, что давно было известно для неко-
торых подробно изученных лабораторных штам-
мов бактерий. Как установлено в недавних иссле-
дованиях, ряд штаммов Pseudomonas, Aeromonas,
Moraxella и Arthrobacter способен восстанавли-
вать нитрат при насыщении среды воздухом до
80%, т. е. осуществлять восстановление нитра-
та в аэробных условиях. Некоторые бактерии-
бродильщики восстанавливают нитрат только до
нитрита; этим в значительной мере объясняется
накопление нитрита в желудочно-кишечном трак-
те при «нитратной нагрузке», например при упо-
треблении загрязненной нитратом воды.
Важность процесса нитратредукции с обра-
зованием аммиака долгое время недооценивали.
Некоторые анаэробные бактерии, в том числе
сульфатредукторы, образуют аммиак из нитра-
та и таким путем сбрасывают больше электронов
в расчете на молекулу нитрата, чем при денит-
рификации. Следовательно, аммонификацию
нитрата следует рассматривать как предпочти-
тельный процесс в средах, богатых органическим
веществом, но бедных нитратом.
216 Часть VIII. Прокариоты в биосфере
Рис. 30.4. Последовательность окислительно-восстано-
вительных реакций в процессе минерализации органи-
ческого вещества.
При использовании молекулярного кислоро-
да и нитрата может осуществляться полное
окисление имеющихся органических субстратов,
обычно включая даже биополимеры. После ис-
черпания нитрата разложение органических суб-
стратов становится процессом, в котором участ-
вуют совместно различные группы микроорга-
низмов. Бактерии-бродилыцики превращают
полимерные или мономерные субстраты в клас-
сические продукты брожения, в том числе ор-
ганические кислоты, такие как молочная и ян-
тарная, спирты, газообразный водород и диоксид
углерода (см. гл. 12). Продукты первичного бро-
жения окисляются далее микробами с использо-
ванием железа (III) и марганца (IV) в каче-
стве акцепторов электронов (табл. 10.2 и 30.3).
К настоящему времени известны разнообразные
восстанавливающие железо бактерии, например
такие как Geobacter metallireducens и Shewanella
spp., способные окислять большой набор органи-
ческих субстратов, в том числе сахара, аминокис-
лоты и ароматические соединения. Перенос элек-
тронов на оксид железа, очевидно, сопряжен с за-
пасанием энергии. Путь переноса электронов на
практически нерастворимый (гидр)оксид железа
пока мало изучен; неизвестно, необходим ли для
этого непосредственный контакт клеток с соеди-
нением железа или же в процессе участвуют хела-
тирующие агенты либо органические переносчики
электронов, такие как компоненты гумуса.
Восстановление марганца не имеет существен-
ного значения в пресных водоемах, но может иг-
рать значительную роль в местах, где накапли-
вается марганец, например в некоторых морских
осадках, в Балтийском море или в некоторых
скальных породах. Получают ли бактерии, вос-
станавливающие марганец, метаболическую энер-
гию при этом окислительно-восстановительном
процессе, пока неясно.
В присутствии сульфата продукты первично-
го брожения полностью окисляются сульфатре-
дуцирующими бактериями до диоксида угле-
рода с параллельным восстановлением сульфата
до сульфида (см. разд. 12.1.3 и 12.1.8). Сульфат-
реду цирующих бактерий, которые могли бы воз-
действовать на сложные полимерные субстраты,
не обнаружено; все они зависят от кооперации с
первичными бактериями-бродильщиками. Таким
образом, сульфат-зависимое окисление слож-
ных органических веществ — это двухступенча-
тый процесс, в котором метаболическую энергию
получают оба партнера.
В морской воде восстановление сульфата,
вследствие его высокой концентрации, вносит
значительно больший вклад в общий поток элек-
тронов, чем в пресных водоемах. Однако в прес-
новодных осадках важную функцию выполняет
образующийся в малом количестве сероводо-
род, который взаимодействует с присутствующим
здесь в следовом количестве кислородом, резко
снижая окислительно-восстановительный потен-
циал и создавая таким образом условия для раз-
вития метаногенных бактерий и их партнеров.
Сера в качестве альтернативного акцептора
электронов играет лишь незначительную роль,
например в озерных осадках после фазы переме-
шивания (см. разд. 31.1.2). Серу восстанавливают
специализированные бактерии, а также бродиль-
щики и сульфатредуцирующие бактерии.
После полного восстановления сульфата и се-
ры до сульфида начинается процесс метаногене-
за как последний этап анаэробного разложения
(см. разд. 12.1.7.). В пресной воде, где сульфат со-
держится в незначительной концентрации, мета-
ногенез быстро становится доминирующим конеч-
ным процессом превращения органических суб-
стратов.
Круг субстратов, используемых метаногенны-
ми бактериями, очень узок — это только одноуг-
леродные соединения и ацетат. Брешь между раз-
нообразной смесью продуктов брожения и немно-
Глава 30. Экофизиология и экологические ниши прокариот 217
гими субстратами, используемыми метаногенами,
заполняется благодаря активности бактерий, осу-
ществляющих вторичное брожение и называемых
синтрофными бродильщиками или облигат-
ными протоноредукторами (см. разд. 12.2.5).
Они обитают в тесной кооперации с метаногенны-
ми археями (см. разд. 30.7) и превращают пропи-
онат, бутират, длинноцепочные жирные кислоты
и спирты в ацетат, водород и одноуглеродные со-
единения, используемые метаногенами.
В отсутствие О2 и нитрата превращение слож-
ных органических субстратов с образованием ме-
тана и СО2, т. е. полным переводом органиче-
ского углерода в наиболее восстановленное и
наиболее окисленное состояние, протекает как
трехступенчатый процесс, катализируемый пер-
вичными бродильщиками, вторичными бродиль-
щиками и метанобразующими бактериями.
Метаногенез как процесс превращений органи-
ческого вещества в реакциях дисмутации не зави-
сит от внешних акцепторов электронов.
Последовательность альтернативных процес-
сов окисления субстратов, происходящих везде,
где в природной экосистеме накопливаются ор-
ганические вещества, проявляется не только во
времени, но и в пространстве, например как
распределение процессов в толще озерных осад-
ков. В их поверхностный слой может прони-
кать О2 в результате турбулентной конвекции
через толщу воды. Непосредственно под поверх-
ностью осадков находится зона восстановления
нитрата, ниже — зона восстановления железа и
марганца и далее зона образования сульфида и
метана. Это пространственное распределение от-
ражает порядок протекания реакций; альтерна-
тивные окислители проникают путем молекуляр-
ной диффузии в осадки из толщи воды с примерно
одинаковыми скоростями и потребляются внутри
осадков в указанном порядке.
Таким образом, в зависимости от скоростей
реакций и скоростей диффузии их продук-
тов формируется пространственное распределе-
ние процессов, которые поддерживаются в состо-
янии динамического баланса за счет микробной
активности.
Размеры участков, в которых протекают все
эти последовательные процессы, могут сущест-
венно варьировать. В микробном мате с высо-
кой продуктивностью и быстрым оборотом проме-
жуточных продуктов они измеряются нескольки-
ми миллиметрами, тогда как в стратифицирован-
ных озерах или морских осадках простираются на
несколько метров. На размеры участков влияют
скорости диффузии, поступление органического
вещества и наличие альтернативных окислителей.
Подробно эти условия рассматриваются в гл. 31.
Описанная последовательность микробных
процессов восстановления (рис. 30.4) отражает
различия в количестве свободной энергии, вы-
деляющейся в соответствующих окислительно-
восстановительных реакциях (см. разд. 12.2).
Эту последовательность можно рассматривать
как термодинамически регулируемую в том от-
ношении, что процесс, дающий больше энер-
гии, осуществляется как более предпочтитель-
ный по сравнению с процессом, дающим меньше
энергии, и т. д. Изменение свободной энергии
в этих окислительно-восстановительных реак-
циях рассчитывают с использованием значе-
ний окислительно-восстановительных потенциа-
лов разнообразных акцепторов электронов, ко-
торые участвуют в окислении органических ве-
ществ, имеющих в среднем потенциал —434 мВ
(табл. 30.3). Утверждение, что энергетически бо-
лее выгодный процесс осуществляется предпочти-
тельнее менее выгодного, на первый взгляд убе-
дительно, во не полностью. Кинетика реакций не
зависит от изменения в них свободной энергии.
Выигрыш в конкурентной борьбе за лимитиру-
ющий субстрат, например за донор электронов
в описанных выше восстановительных процес-
сах, определяется прежде всего сродством транс-
портных систем к субстрату, т. е. эффективно-
стью его поглощения при низких концентрациях
(см. разд. 30.4). Хотя неоднократно отмечено, что
организмы, получающие больше энергии в про-
цессе разложения, обладают и системами транс-
порта с более высоким сродством к соответ-
ствующему субстрату, это ни в коей мере не
определяется энергетикой реакции разложения
как таковой. Остается неясным, каким обра-
зом соотносятся эти различные стороны про-
цессов трансформации органических веществ в
микробных клетках. Можно предполагать, что
бактерия, получающая больше энергии в процес-
се трансформации, чем другая, способна тратить
больше энергии на активность высокоаффинной
системы транспорта, требующей больших энерге-
218 Часть VIII. Прокариоты в биосфере
Таблица 30.3. Окислительно-восстановительные потен-
циалы основных систем переноса электронов при pH 7,0
Редокс-система Eq, мВ
О2/Н2О +810
NO3/N2 +751
NO3/NO- +430
NO3/NH+ +363
МпО2/Мп2+ +390
FeOOH/Fe2+ +150
SO2~/H2S -218
S°/H2S -240
СО2/СН4 -244
2Н+/Н2 -414
СО2/(СН2О) -434
тических затрат, но это биохимическая проблема,
решаемая по-разному у различных организмов, а
не просто следствие различий в энергетике реак-
ций.
Последовательность различных окислитель-
но-восстановительных процессов определяется,
прежде всего, кинетикой поглощения субстратов
в разнообразных метаболических нишах.
30.2.2. Восстановленные продукты
анаэробного окисления
могут далее окисляться литотрофами
Восстановленные продукты, образуемые в описан-
ных выше процессах анаэробного окисления, мо-
гут накапливаться в соответствующих местооби-
таниях до определенного уровня или подвергать-
ся последующим превращениям, как, например,
в случае H2S (см. разд. 30.1). В присутствии си-
стем с более высоким положительным окисли-
тельно-восстановительным потенциалом восста-
новленные продукты могут окисляться далее.
Процессы дальнейшего окисления (реокисления)
обычно осуществляют литотрофные бактерии
(см. разд. 10.6), но некоторые реакции протекают
и как чисто химические, без участия микроорга-
низмов.
При взаимодействии сероводорода с моле-
кулярным кислородом образуются главным об-
разом тиосульфат, сера и сульфит. При низких
значениях pH эти реакции протекают очень мед-
ленно; скорость их становится значительной при
рН>6,5. Таким образом, ацидофильные бактерии,
окисляющие H2S, например Thiobacillus, не ис-
пытывают конкуренции со стороны химических
реакций его окисления и легко культивируются
в присутствии H2S и 02- При нейтральном зна-
чении pH использование сульфида затрудняется.
Так, нейтрофильные серные бактерии Beggiatoa
должны конкурировать с процессами химическо-
го окисления H2S, и выращивать их с среде с
сульфидом и О2 удается только в градиент-
ной культуральной системе с пространственным
разделением этих двух реагентов, имитирующей
их распределение в пресноводных осадках (см.
разд. 30.6.2). Сероводород может также окислять-
ся нитратом в реакции, осуществляемой, напри-
мер, Thiobacillus denitrificans-, при этом не созда-
ется условий конкуренции с химическим окисле-
нием и подобные бактерии легко культивировать
в лаборатории. Еще один путь превращений —
это фототрофное окисление H2S зелеными или
пурпурными фотосинтезирующими бактериями,
обитающими в бескислородных зонах в толще
воды и в осадках. У них окисление сульфида со-
пряжено с ассимиляцией СО2 в процессе фотосин-
теза.
Двухвалентное железо также спонтанно
окисляется молекулярным кислородом при ней-
тральном значении pH; при сильнокислой ре-
акции среды этот процесс протекает медленно.
Микробное окисление Fe2+ при низких значени-
ях pH легко исследовать в случае Thiobacillus
ferrooxidans, поэтому для данного организма оно
подробно изучено. В то же время об окислении
железа видами рода Gallionella, окисляющими
Fe2+ молекулярным кислородом при нейтральном
значении pH и конкурирующими с процессом хи-
мического окисления, известно очень мало. Ранее
считалось, что окисление железа при pH 7 дает
слишком мало энергии для синтеза АТР. Этот ар-
гумент нельзя признать убедительным, если при-
нять во внимание действительные окислительно-
восстановительные потенциалы при этих услови-
ях (рис. 30.3). Можно рассчитать, что окисле-
ние Fe2+ при нейтральном значении pH дает да-
же больше энергии, чем в кислой среде. Пока
неизвестно, каким образом бактерии Gallionella
конкурируют с процессом химического окисления
железа; данному биологическому процессу бла-
гоприятствует градиентное распределение Fe2+ и
Глава 30. Экофизиология и экологические ниши прокариот 219
О2, в результате которого эти реагенты в значи-
тельной мере разделены (см. разд. 30.6). Двухва-
лентное железо способны также окислять нитрат-
редуцирующие бактерии нескольких типов и фо-
тотрофные бактерии, например Rhodomicrobium
vannielii.
Окисление аммиака требует участия моле-
кулярного кислорода в качестве косубстрата;
соответствующую начальную реакцию катализи-
рует монооксигеназа (см. разд. 10.7). Аммиак
окисляется через нитрит до нитрита; таким об-
разом, нитрат образуется как при восстановлении
нитрата, так и при окислении аммиака. Выявле-
ние нитрита в экосистеме показывает, что в дан-
ном местообитании соединения азота претерпе-
вают окислительно-восстановительные реакции;
однако по его присутствию нельзя судить, идет
реакция в направлении окисления или восстанов-
ления. Недавно получены данные об анаэробном
окислении аммиака. Этот процесс, хотя и до-
вольно медленный, представляет большой инте-
рес в связи с очисткой сточных вод. Он может
иметь важное значение в морских осадках, по по-
ка механизм его неизвестен.
Окисление метана метилотрофными бактери-
ями — это еще один аэробный процесс, первым
этапом которого является монооксигеназная ре-
акция (см. разд. 9.14.4). В энергетическом от-
ношении возможен процесс окисления метана с
участием сульфата, трехвалентного железа или
нитрата, но пока не удалось получить куль-
туры бактерий, которые бы его осуществля-
ли. Имеются достоверные сведения об анаэроб-
ном окислении метана с участием сульфата
в качестве акцептора электронов, в частности в
морских осадках (см. разд. 31.2), но пока нет
сведений о роли в нем бактерий и о механизме
реакций.
Рассмотренные процессы окисления и восста-
новления приведены на рис. 30.5. Эта схема по-
казывает альтернативные потоки электронов от
органического вещества на различные редокс-
системы и затем на кислород через реокисле-
ние акцепторов литотрофами. Указанные редокс-
системы служат временными резервуарами элек-
тронов и во всех случаях электроны поступают на
кислород как конечный акцептор либо непосред-
ственно, либо через такие промежуточные систе-
мы. На схеме показаны также фотореакции окис-
ления воды, двухвалентного железа или сульфи-
да. Окисление сульфида трехвалентным железом
Рис. 30.5. Теоретическая схема потока электронов от
органического вещества через различные промежу-
точные редокс-системы. (Прямые стрелки — темновые
реакции диссимиляции; волнистые стрелки — светоза-
висимые реакции ассимиляции; штриховая стрелка —
небиологический окислительно-восстановительный про-
цесс).
показано штриховой стрелкой, поскольку оно про-
исходит только химическим путем, без участия
живых организмов.
30.2.3. Микробы осуществляют
в природе и другие
окислительно-восстановительные
процессы
Помимо окислительно-восстановительных сис-
тем, описанных выше, роль акцепторов или доно-
ров электронов могут выполнять и другие соеди-
нения (табл. 30.4; см. также гл. 12). Например,
некоторые бактерии-бродилыцики, нитратредук-
торы или сульфатредукторы (см. разд. 9.17 и
12.19) используют в качестве доноров электро-
нов хлорсодержащие алкильные или арильные
соединения, осуществляя их восстановитель-
ное дегалогенирование. При этом происхо-
дит не разложение данного соединения, а лишь
его модификация; минерализовывать дегалоге-
нированные продукты могут совершенно другие
бактерии. Восстановительное дегалогенирование
происходит также небиологическим путем под
действием свободных корриноидов или других
тетрапирролов, таких как цитохромы или фактор
F430. Эти свободные коферменты вновь окисля-
ются уже в биохимических реакциях.
220 Часть VIII. Прокариоты в биосфере
Таблица 30.4. Окислительно-восстановительные потен-
циалы менее значимых систем переноса электронов при
pH 7,0 (ДМСО — диметилсульфоксид; ДМС — диметил-
сульфид; ТМАО — триметиламин-М-оксид; ТМА — три-
метиламин)
Редокс-система Eq, мВ
CIO3 /С1~ +1031
Fe3+/Fe2+ +770 (pH < 2)
Ал кил-С1/Алкил + С1_ +250-+580
Арил-С1/Арил + С1“ +310-+480
Нитробензол / Анилин +416
SeO^'/SeO^ +464
SeO|~/Se +256
НСгО4 /Сг3+ +380
HAsO2~/AsC>2 +154
ДМСО/ДМС +160
ТМАО/ТМА +130
СО2/СО -520
Н2РО4/РН3 -680
В некоторых природных средах, например
в загрязненных грунтовых водах, происходит
восстановление нитроароматических соеди-
нений до соответствующих аминов. Этот процесс
не всегда осуществляется непосредственно микро-
организмами, но они реокисляют участвующее в
нем как донор электронов двухвалентное железо
на поверхности Ее(Ш)-содержащих минералов.
Другие примеры восстановительных реакций,
происходящих в процессе очистки загрязнен-
ных почв или грунтовых вод, — это восстанов-
ление хлората, хромата, селената, селенита
и арсената. Благодаря сравнительно высоким
окислительно-восстановительным потенциалам
они могут служить акцепторами электронов. Од-
нако высокий окислительно-восстановительный
потенциал, например в случае хлората, способен
также быть причиной повреждающих эффектов
у чувствительных к подобным соединениям стро-
гих анаэробов.
Многие бактерии-бродильщики, например эн-
теробактерии, интенсивно размножающиеся на
выловленной рыбе, способны восстанавливать
присутствующий в тканях рыб, в частности мор-
ских, криопротектор триметиламин-1\-оксид
(ТМАО). Продукт реакции, триметиламин,—это
летучее вещество, и именно им обусловлен харак-
терный «рыбный запах» (обычно его стараются
уничтожить добавлением связывающей этот ще-
лочной амин кислоты, чаще всего лимонного сока
(см. разд. 12.15).
Фототрофные или хемотрофные бактерии,
окисляющие соединения серы, а также другие
бактерии способны окислять диметилсульфид,
превращая его в диметилсульфоксид. Диме-
тилсульфид образуется при частичном разложе-
нии диметилсульфониопропионата, который слу-
жит осморегулятором у зеленых водорослей, в
том числе макрофитов, а также у морских
высших растений — Spartina и Zostera, содержа-
щих его в молярных концентрациях. Фототроф-
ные пурпурные бактерии, так же как хемотроф-
ные аэробы и нитратредукторы, восстанавлива-
ют диметилсульфоксид до метилсульфида (см.
разд. 12.1.5).
Восстановление СО2 до СО — это биологиче-
ская реакция восстановления с наиболее низким
стандартным окислительно-восстановительным
потенциалом. Она имеет важное значение у анаэ-
робных бактерий, особенно у тех, которые осу-
ществляют гомоацетатное брожение и образуют
СО как промежуточный продукт при участии
СО-дегидрогеназы (ацетил-СоА-синтазы) при
синтезе ацетата. Содержащие СО-дегидрогеназу
анаэробные бактерии могут выделять СО в следо-
вых количествах, но он никогда не образуется как
основной продукт метаболизма (см. разд. 12.1.6).
Фосфор обычно присутствует в клетках толь-
ко в степени окисления +5, в виде фосфата, од-
нако имеются сведения о микробном восстанов-
лении фосфата до фосфана (фосфин, РН3), и в
низких (наномолярных) концентрациях фосфан
действительно обнаруживается в анаэробных
осадках, человеческом кале и помете свиней.
Происхождение этих восстановленных фосфор-
ных соединений пока неясно; предположительно
они могут быть продуктами гидролиза фосфидов
металлов. В любом случае фосфан не может об-
разовываться при восстановлении фосфата в про-
цессе дыхания. Окислительно-восстановительные
потенциалы реакций превращения фосфата через
фосфит и фосфор в фосфан (величины Е\л —510,
—1020 и —456 мВ соответственно, или —680 мВ
для полного восстановления фосфата до фосфа-
на) очень низки, и трудно представить, что они
сопряжены с окислением органических соедине-
ний (Eq = —434 мВ). Восстановление фосфата до
Глава 30. Экофизиология и экологические ниши прокариот 221
производных фосфита осуществляют, например,
некоторые грибы при синтезе фосфоруглеродных
вторичных метаболитов (например, фосфинотри-
цина), но эти восстановительные реакции требуют
значительной затраты АТР. Подобные частично
восстановленные фосфоруглеродные соединения
также могут быть предшественниками фосфана,
выявляемого в упомянутых анаэробных экосисте-
мах.
30.2.4. Микроорганизмы действуют
как химические катализаторы
Осуществляя описанные выше процессы, микро-
организмы выступают в природе в роли ката-
лизаторов, ускоряющих, аналогично химическим
катализаторам, термодинамически возможные
химические реакции. Иногда они могут даже кон-
курировать с чисто химическими реакциями, та-
кими как кислород-зависимое окисление сульфи-
да или двухвалентного железа при нейтральном
значении pH, восстановительное дегалогенирова-
ние или восстановление нитроароматических со-
единений, при которых свободные микробные ко-
ферменты (корриноиды, другие тетрапироллы)
действуют как катализаторы или же продукты
микробного метаболизма (двухвалентное желе-
зо) выполняют роль субстратов. На самом де-
ле в сложных природных системах не всегда
легко провести различие между микробной ак-
тивностью и чисто химическими процессами,
особенно когда в них участвуют химически неста-
бильные реагенты или когда условия благоприят-
ствуют химическим процессам, как, например, по-
вышенная температура в районах гидротермаль-
ных выходов. Тем не менее имеется несколько
основных признаков, по которым микробная ак-
тивность отличается от химически катализируе-
мых процессов: 1) микробы способны катализи-
ровать реакции, которые иначе происходили бы
крайне медленно (аэробное окисление алканов)
или протекали бы иным образом (окисление суль-
фида до сульфата вместо сульфита, тиосульфата,
серы и т. д.); 2) микробы обычно высокоспеци-
фичны в отношении субстратов и сдвигают ре-
акцию в определенном направлении; 3) микробы
могут комбинировать экзергонические реакции с
эндергоническими (например, эндергоническое
восстановление сульфата до сульфита с экзерго-
ническим восстановлением сульфита до сульфи-
да) или сочетать диссимиляционную активность
с ассимиляционной; 4) для микробных реакций
характерно наличие оптимальных значений тем-
пературы, pH, осмотической силы, содержания
кислорода и окислительно-восстановительного
потенциала, причем в довольно узких границах
(примерно 40 °C для температуры и 4 едини-
цы для pH); 5) скорость микробной реакции мо-
жет повышаться со временем благодаря увели-
чению количества катализатора (за счет роста
клеток), но это происходит не всегда (кометабо-
лическая активность; см. разд. 30.4.4); б) мик-
робная активность зависит от присутствия косуб-
стратов (источников С, N, S и Р и т.д.), а также
оборота таких субстратов; 7) микробные процес-
сы чувствительны к определенным токсичным со-
единениям (фенолам, тяжелым металлам и т. д.)
и 8) микробы образуют в природе новые, дочерние
клетки, а также внеклеточные полимеры, которые
вносят вклад в формирование структуры их ме-
стообитания; эти структурирующие свойства су-
щественно влияют на эффективность и лимитиро-
вание микробной трансформации в пространстве
и времени (ограничение диффузии, ограничение
переноса).
Перечисленные аспекты следует учитывать
при изучении любого, возможно нового, неясно-
го процесса превращения вещества в природных
условиях, а также при попытках использовать
микробную активность для «биовосстановления»,
например загрязненного участка почвы, вместо
химического или физического воздействия (на-
гревания или сжигания) (см. гл. 36).
222 Часть VIII. Прокариоты в биосфере
30.3. Кинетика микробного роста в природных экосистемах
Кинетика микробного роста подробно рассмотре-
на в гл. 6. Здесь будут затронуты лишь неко-
торые аспекты, связанные с ростом, а также
проблема круговорота субстратов в природных
экосистемах.
30.3.1. В периодической культуре рост
не лимитирован лишь короткое время
Рост в периодической (статической) лаборатор-
ной культуре, где оптимальные условия существу-
ют ограниченное время, описывается классиче-
ской кривой, включающей лаг-фазу, фазу экспо-
ненциального роста, стационарную фазу и фазу
отмирания клеток. Однако в течение короткого
времени субстраты присутствуют в этом случае в
среде в нелимитирующей концентрации; в приро-
де же такие условия скорее редкое исключение,
чем правило. Микробный рост в природе проис-
ходит в условиях, которые можно сравнить с кон-
цом фазы экспоненциального роста, когда коли-
чество субстратов становится лимитирующим и
затем недостаточным для поддержания роста.
Рост в таких условиях ограничен концентраци-
ей субстрата, а не количеством клеточной массы
(автокаталитически возрастающей), и кривая экс-
поненциального роста должна быть скорректиро-
вана введением понятия емкости с преобразова-
нием в «логистическую» кривую роста:
dN KTc-N
где N — число клеток; д — скорость роста и С —
емкость, до которой возможен рост, определяе-
мая, например, как количество лимитирующего
рост субстрата. Пока величина N невелика по
сравнению с С, последний сомножитель близок
к единице и несуществен. Однако, когда N при-
ближается к соответствию С, экспоненциальный
рост корректируется показателем емкости и на-
растание биомассы прекращается с достижением
стабильной конечной плотности популяции.
Показатель емкости С может относиться к
лимитирующему субстрату, т. е. источнику угле-
рода, азота, серы или фосфора, донору или ак-
цептору электронов либо другим факторам. Со-
гласно принципу Либиха, рост лимитирован
(30.3)
субстратом, который исчерпывается первым, ко-
гда остальные могут присутствовать еще в из-
бытке. Этот принцип не применим в полной
мере к микробным клеткам, так как у них воз-
можна определенная адаптация к изменениям
условий (состава) среды. Содержание азота, серы
или фосфора в клетках может варьировать в за-
висимости от количества субстрата в 2-10 раз.
Эффективность использования субстрата для
достижения конечной емкости С определяется
сродством к субстрату, Ks> данного организ-
ма. Этот термин означает концентрацию субстра-
та, при которой скорость роста равна половине
максимальной (см. разд. 6.8). Если рост и по-
требление субстрата тесно сопряжены, озна-
чает также концентрацию субстрата, при которой
скорость потребления субстрата составляет 1/2
ее максимального значения. Значение Ks можно
определить либо непосредственно по скорости по-
глощения субстрата (например, клеточной суспен-
зией, образцом осадков или почвы), либо в лими-
тированной количеством субстрата хемостатной
культуре при скорости разбавления, соответству-
ющей 1/2 максимальной скорости роста.
30.3.2. Моделью роста в природных системах
служит непрерывная культура
Хемостат (см. разд. 6.8) может использоваться в
микробной экологии как модельная система для
анализа поведения микроорганизмов в услови-
ях неоптимального количества субстратов. Непре-
рывное культивирование имитирует ситуации,
существующие в природе, в том смысле что мик-
роорганизм поддерживается в условиях постоян-
ного поступления субстрата в низкой концентра-
ции в течение определенного периода времени.
Однако следует подчеркнуть, что хемостат мо-
жет лишь имитировать именно эту ситуацию, но
не полностью условия природного местообитания.
Важно изучать культуры при низких скоростях
разбавления концентраций субстратов и клеток,
т. е. при условиях, которые считаются типичны-
ми для микробного роста в природе.
В хемостатной системе, сходной по услови-
ям с природной, концентрация субстрата опреде-
ляется исключительно величиной Ks и соотно-
Глава 30. Экофизиология и экологические ниши прокариот 223
шением между скоростью разбавления и макси-
мальной скоростью роста изучаемого организма
(см. разд. 6.8). Экстраполируя эти критерии на
природную среду, можно сказать, что в проточной
системе в условиях равновесия измеримая концен-
трация субстрата не позволяет судить о количе-
стве субстрата в обороте, но отражает сродство к
субстрату потребляющих его микроорганизмов и
скорость его поступления. Потребление субстрата
связано не только с образованием клеточной мас-
сы, но и с затратами на поддержание, которые ха-
рактеризует коэффициент поддержания ms (см.
разд. 6.8). Коэффициенты поддержания опреде-
лены для различных штаммов бактерий; они ва-
рьируют в пределах 0,3-10 ммоль АТР • г-1 • час-1
в зависимости от условий роста (см. табл. 6.4).
Предполагается, что для бактерий, адаптирован-
ных в природных условиях к незначительному по-
ступлению питательных веществ и голоданию, ха-
рактерны низкие величины энергии поддержания
(см. разд. 30.3.3).
Хемостат имитирует ситуацию, существую-
щую в природе, в том отношении, что клетки под-
держиваются в нем в условиях незначительного,
но непрерывного поступления субстрата. Измеря-
емая концентрация субстрата не дает никакой ин-
формации о количестве субстрата, находящемся
в обороте; она отражает лишь сродство к суб-
страту соответствующих микробных систем и его
связь со скоростью поступления субстрата. Рост
и оборот субстрата не обязательно связаны меж-
ду собой стабильным соотношением, но оборот
субстрата может быть все менее сопряжен с ро-
стом по мере снижения скорости поступления суб-
страта.
30.3.3. Микроорганизмы способны выживать
в условиях голодания и при стрессе
В природе микроорганизмы обычно находятся в
условиях недостатка субстрата или голодания,
при которых важнее их способность к выживанию
в таких условиях без существенного снижения
плотности популяции, чем быстрый рост при из-
бытке питательных веществ. Как отмечено выше,
этот аспект затронул С. Н. Виноградский в сво-
ей концепции автохтонных и аллохтонных микро-
организмов в почве. Случайные в данном место-
обитании, быстрорастущие аллохтонные бактерии
слабо приспособлены к выживанию в условиях го-
лодания в течение длительных периодов времени
и быстро гибнут, тогда как типичные для данной
среды автохтонные бактерии обладают большими
возможностями для выживания. Бактерии, рас-
тущие только при низких концентрациях
субстратов, называют олиготрофными, отли-
чая их от копиотрофных бактерий, способных
расти на богатых лабораторных средах. Олиго-
трофные бактерии трудно культивировать, поэто-
му об их физиологических и регуляторных спо-
собностях мало что известно; влияние на микро-
организмы условий голодания изучается главным
образом на лабораторных штаммах таких бакте-
рий, как Escherichia coli, Klebsiella или Paracoccus
(см. разд. 28.5), т. е. не на тех организмах, для
которых такие условия существования обычны в
природных средах.
При изучении способов выживания микроор-
ганизмов в природных условиях важно разделять
различные типы голодания. Голодание по источ-
нику углерода (обычно он служит одновремен-
но и источником энергии) — это совершенно иная
ситуация для клеток, чем голодание по источ-
нику азота, серы или фосфора, препятствующее
только росту, но не влияющее на процессы под-
держания. Недавние исследования показали, что
переход суспензионной бактериальной культуры
в стационарную фазу роста вследствие исчерпа-
ния источников углерода и энергии индуциру-
ет синтез ряда новых белков, которые не экс-
прессируются в экспоненциальной стадии роста
культуры. Некоторые из этих белков могут участ-
вовать в переключении на поглощение альтер-
нативных субстратов, однако функция большин-
ства новых белков неизвестна. Реакция клеток на
условия голодания как комплексный стрессовых"!
фактор в настоящее время изучается с помощью
молекулярно-биологических методов.
Клеточные стратегии выживания при недо-
статке энергетического субстрата сводятся к двум
основным типам, один из которых — это увеличе-
ние поглощения субстрата, даже при его низкой
концентрации, и другой — снижение потребностей
клеток в энергии. Оба эти варианта адаптации
существуют в природных микробных популяци-
ях, и возможно их сочетание. Эффективность по-
глощения субстрата может возрастать благодаря
увеличению числа систем транспорта (пермеаз и
224 Часть VIII. Прокариоты в биосфере
др.) либо индукции новых, более высокоаффин-
ных транспортных систем, обеспечивающих по-
глощение субстрата при его низкой концентра-
ции, например системы симпорта с использовани-
ем протондвижущей силы (см. гл. 5). У многих
хорошо изученных бактерий известны специфиче-
ские высокоаффинные системы транспорта таких
субстратов, как глицерол, фосфат, сахара и ами-
нокислоты. Молекулярные механизмы адаптации
к условиям голодания описаны в гл. 28.
Другая стратегия адаптации — это увеличе-
ние поверхности клетки, например путем обра-
зования простек (стебельков). Почкующиеся и
стебельковые бактерий, например родов Stella,
Prosthecochloris и Caulobacter, приспособлены к
обитанию в средах с низким содержанием суб-
стратов; при культивировании в лабораторных
условиях образуемые их клетками стебельки рас-
тут в длину по мере уменьшения концентрации
субстратов. Хотя эти клеточные выросты участ-
вуют также в размножении клеток и бесспорно
еще не доказано, что они «выстланы» транспорт-
ными белками, достигаемое таким путем увеличе-
ние поверхности клетки, очевидно, дает преиму-
щество в условиях голодания. В то же время при
данной стратегии возрастают потери энергии в ре-
зультате утечки протонов через увеличенную по-
верхность клетки.
Одним из способов длительного выживания в
условиях голодания путем снижения энергетиче-
ских затрат служит образование спор (см. гл. 25).
Такой переход в покоящуюся стадию обеспечива-
ет независимость от питания, а также защиту от
высыхания и нагревания, например у поверхно-
сти почвы. Другие предназначенные для выжива-
ния устойчивые формы, встречающиеся у отдель-
ных групп микроорганизмов, — это цисты, мик-
соспоры и акинеты (см. гл. 24 и 25).
Многие грамотрицательные бактерии при
неблагоприятных условиях не образуют спор,
но вместо этого снижают свою потребность в
энергии путем уменьшения размеров клеток.
При такой стратегии уменьшается также тра-
та энергии на поддержание мембранного потен-
циала. Образование подобных карликовых форм
(«карликовость») довольно широко распро-
странено у бактерий в незагрязненных озерах и
морской воде. Средние размеры бактериальных
клеток в бедных питательными веществами ме-
стообитаниях во много (до 30) раз меньше, чем
размеры не голодающих клеток, как показывает
изучение морских бактерий при различных кон-
центрациях субстрата.
Феномен карликовости детально изучен на
примере Vibrio sp. (штамм S14). Ключевые эта-
пы перехода в карликовую форму сходны с эта-
пами образования спор (рис. 30.6). В начале
периода голодания (0-0,5 ч) усиливается внутри-
клеточная деградация белков, падает дыхатель-
ная активность и синтезируются новые белки,
индуцируемые голоданием (Sti-белки, от Star-
vation-induced). Вторая фаза, наступающая спу-
стя 0,5 ч, длится до 6 ч после прекращения
роста и характеризуется деградацией запас-
ных веществ, например поли-/3-гидроксимасляной
кислоты, снижением протеазной активности,
изменением жирнокислотного состава мембран,
индукцией высокоаффинных транспортных си-
стем и синтезом других Sti-белков. В третьей
Низкое Высокое
сродство сродство
Met, Leu Met, Leu
Рис. 30.6. Физиологическая и морфологическая адап-
тация к общему голоданию у Vibrio S14. Период голо-
дания длительностью 100 ч подразделен на три фазы
(a-в). Стрелками показана стимуляция (J) или подав-
ление (J.) отдельных реакций у голодающих клеток по
сравнению с экспоненциально растущими (—>) клетка-
ми. Надписи «низкое сродство» и «высокое сродство»
характеризуют сродство систем поглощения к глюкозе
и лейцину, н.о. — не определяли; н.п. — не применимо.
РНВ — поли-/?-гидрокси бутират. По [4].
Глава 30. Экофизиология и экологические ниши прокариот 225
фазе происходит постепенное снижение метабо-
лической активности, уменьшение размеров кле-
ток и индукция альтернативных высокоаффин-
ных, периплазматических систем поглощения суб-
страта. В этой фазе могут образовываться вне-
клеточные гидролитические ферменты. В ито-
ге карликовая клетка представляет собой ста-
бильную резистентную форму, которая благодаря
малым размерам менее подвержена захвату
фитофагами-фильтраторами и, по-видимому,
устойчива к лизису в пищеварительных вакуолях
простейших-фитофагов. Вследствие описанных
модификаций карликовые клетки полностью от-
личаются по белковому составу от неголодающих
клеток.
У голодающих бактерий часто встречается об-
разование слизи. Внеклеточная слизь помога-
ет сохранению протонного градиента, поддержа-
нию протондвижущей силы и мембранного по-
тенциала. Однако более важна роль слизи в со-
хранении воды при высыхании и участие ее в
прикреплении клеток к поверхностям, име-
ющем, по-видимому, большое значение для обес-
печения субстратом при его низкой концентрации
(см. разд. 30.5).
Механизмы устойчивости к голоданию вклю-
чают увеличение числа высокоаффинных транс-
портных систем, увеличение клеточной поверх-
ности, образование спор, уменьшение размеров
клеток, адаптацию клеточного метаболизма пу-
тем синтеза индуцируемых голоданием белков и
образование слизи.
30.3.4. Число микробных клеток снижается
вследствие выедания консументами
и лизиса под действием бактериофагов
Приросту численности микробных клеток про-
тиводействуют в природе выедание, фаговая ин-
фекция и гибель в результате голодания. В вод-
ных местообитаниях бактериальные популяции
выедаются простейшими, а также коловратка-
ми и некоторыми веслоногими рачками. Рес-
ничные инфузории, жгутиконосцы и весло-
ногие питаются взвешенными бактериальными
клетками, отцеживая их из свободной воды, тогда
как амебы, коловратки и нематоды поедают
преимущественно прикрепленные бактериальные
клетки. Прикрепление к поверхностям — одна из
стратегий, позволяющих избежать выедания
животными, питающимися бактериями (см.
разд. 30.5). В то же время заметные агрегаты
бактерий на разлагающемся детрите поедают бо-
лее крупные животные, в том числе питающие-
ся планктоном рыбы, лишенные приспособлений
для фильтрации воды. В пресноводных озерах
средняя плотность бактерий поддерживается в
диапазоне 104-106/мл в толще воды вследствие
выедания. Очевидно, в этом диапазоне плотно-
сти выедание лимитировано. Подсчитано, что в
толще озерной воды в течение летнего периода,
в зависимости от трофического статуса озера,
2-12% стоячей бактериальной популяции выеда-
ется за 1 ч ресничными инфузориями, жгутико-
носцами и дафниями. Чтобы сбалансировать эти
потери, время удвоения при бактериальном росте
должно составлять от 6 ч до 2 сут.
Выедание снижает величину бактериальной
популяции и на первый взгляд кажется повре-
ждающим фактором. Однако уменьшение попу-
ляции приводит также к ослаблению конкурен-
ции за субстраты и, таким образом, способствует
повышению концентрации субстрата, его оборо-
ту и скорости роста бактерий, поддерживая мик-
робную популяцию в активном состоянии. Таким
образом, размеры бактериальной популяции зави-
сят как от поступления питательных веществ, так
и от выедания, и оба эти фактора влияют один на
другой через бактериальную популяцию.
Питающиеся бактериями животные превраща-
ют микробную биомассу в животную биомассу с
эффективностью, по данным лабораторных экс-
периментов, примерно 50%. Это означает, что по-
ловина биомассы-пищи минерализуется, обеспе-
чивая энергию для ассимиляции другой ее поло-
вины животным-консументом. При исследовании
превращений биомассы в озерах наблюдались зна-
чительно более низкие величины эффективности
питания — в диапазоне 20-30%, т. е. в условиях
недостатка пищи и меньшей скорости роста дан-
ный параметр снижается, аналогично тому как
это происходит при росте бактерий в условиях ли-
митирования субстратом (см. разд. 30.3.2).
Названные выше животные, питающиеся бак-
териями, относятся к аэробам, т. е. проявляют
активность в аэробных местообитаниях; о зна-
чении питания бактериями в анаэробных сре-
226 Часть VIII. Прокариоты в биосфере
дах мало что известно. С открытием факуль-
тативно или строго анаэробных ресничных
простейших, жгутиконосцев и грибов, оби-
тающих в бескислородных осадках, рубце жвач-
ных животных и других подобных местообита-
ниях (см. также разд. 30.7), возник вопрос о
роли этих организмов в регуляции численно-
сти бактерий в анаэробных сообществах. Опы-
ты по кормлению анаэробных ресничных инфу-
зорий из бескислородных вод высокоэвтрофных
озер показали, что эффективность их питания
значительно ниже (составляет примерно 5%) по
сравнению с аэробными ресничными инфузория-
ми, вследствие низкого энергетического выхода.
Таким образом, в анаэробных средах могут под-
держиваться лишь незначительные популяции
простейших, питающихся бактериями. Питание
анаэробных животных и соответственно величи-
на их популяций лимитированы также из-за при-
крепления бактерий к поверхностям, особенно в
осадках.
Вклад в регуляцию численности бактерий в
природных популяциях вносят также бактерио-
фаги. В последние годы становятся известными
все новые их виды, и можно предполагать, что ни
один из ныне известных видов бактерий не защи-
щен полностью от поражения фагами. Как уста-
новлено недавно, в природных местообитаниях в
большом количестве присутствуют фагоподобные
частицы. В пресноводных озерах свободные ви-
русы найдены в количестве 107-108 частиц/мл,
и до 2% бактерий в таких водах содержит фа-
гоподобные частицы. Тем не менее значение бак-
териофагов как факторов контроля бактериаль-
ных популяций в природе, возможно, проявляется
лишь в некоторых ситуациях, например если гене-
тически однородные популяции бактерий-хозяев
достигают высокой плотности, как при цветении
морских цианобактерий, когда гибель клеток на
50% обусловлена фаговой инфекцией. Популяции,
например гетеротрофных бактерий в толще воды,
слишком немногочисленны и слишком гетероген-
ны для того, чтобы численность фагов поддержи-
валась на достаточно высоком уровне, позволя-
ющем им влиять на численность этих бактерий-
хозяев. По предварительным оценкам, гибель
клеток бактерий всего на 5-10% вызвана лизисом
под действием фагов. О значении фагов в поч-
вах или осадках данных пока не имеется, посколь-
ку чрезвычайно сложно проводить микроскопиче-
ское исследование этих местообитаний.
30.3.5. Методы количественного анализа
микробных популяций в природе
Для количественной оценки микробных сооб-
ществ в природе необходимы специальные мето-
ды, отличные от используемых при изучении ла-
бораторных культур. Прямой подсчет клеток
под микроскопом на первый взгляд может ка-
заться весьма подходящим методом, но па самом
деле он применим только для анализа проб во-
ды. Однако даже в такой среде большинство бак-
терий прикреплено к частицам детрита и едва
различимо при непосредственной микроскопии.
Чтобы визуализировать бактериальные клетки
в пробах воды, их окрашивают флуоресцент-
ными красителями, такими как акридино-
вый оранжевый или 4',6-диамидино-2-фенилин-
дол (ДАФИ). Эти красители проникают через
плазматическую мембрану и связываются либо с
клеточными белками (акридиновый оранжевый),
либо с двухцепочечной ДНК (ДАФИ), обеспечи-
вая специфическое окрашивание бактериальных
клеток. Однако вопреки более ранним сведени-
ям эти красители не позволяют различать жи-
вые и мертвые клетки и среди подсчитанных с
их помощью клеток может быть значительная до-
ля мертвых. Имеется возможность специфически
выявлять активно дышащие бактерии, используя
новые красители, которые образуют флуоресцент-
ные производные только после восстановления
дыхательными ферментами (например, 5-циано-
2,3-дитолил-тетразолийхлорид). Прямой подсчет
с применением флуоресцентных красителей не
пригоден, однако, как метод для исследования об-
разцов осадков или почв, поскольку в этих средах
слишком велик фон естественно флуоресцирую-
щих соединений.
Другие методы, позволяющие выявлять ме-
таболически активные клетки, основаны на
применении радиоактивных меток и радиоавто-
графии. Для определения синтеза белка и роста
клеток используют 14С-лейцин, синтеза ДНК и
размножения клеток — 3Н-тимидин. Оба эти мар-
кера использовались в прошлом главным обра-
зом для изучения проб воды и осадков, но по-
лучаемые таким способом данные нельзя считать
точными, поскольку внесенный меченый предше-
ственник частично разлагается микробами и до-
ступная в результате информация не соизмерима
с усилиями, затраченными на эксперименты.
Оценка численности клеток в бактериальных
популяциях чашечным методом Коха, т. е. путем
Глава 30. Экофизиология и экологические ниши прокариот 227
высева на плотные среды в чашках Петри
и культивирования, даже при использовании
сложных и относительно неспецифических сред
дает весьма разочаровывающие результаты. Об-
щее число колоний, например на казеино-крах-
мало-пептонном агаре, применяемом в качестве
стандартной среды для учета пресноводных бак-
терий, обычно на 1-2 порядка ниже, чем коли-
чество клеток, определяемое путем прямого мик-
роскопирования. Это означает, что лишь 1-10%
клеток микробного сообщества могут давать ко-
лонии при использовании данной методики, и
другие среды в этом отношении отнюдь не лучше.
Все питательные среды и условия инкубации
селективны для небольшой фракции общей бак-
териальной популяции, имеющейся в исследуе-
мом образце; попытки составить менее специфи-
ческие, более соответствующие природным усло-
виям культуральные среды, позволяющие более
точно оценивать разнообразие и численность мик-
роорганизмов, пока не дали успеха.
Другой метод количественного учета клеток с
помощью культивирования—это метод наибо-
лее вероятного числа. Для определения чис-
ла микробов этим способом готовят последова-
тельные разведения (1:10) исследуемого матери-
ала в пробирках с жидкой питательной средой не
менее чем в трех повторностях и инкубируют про-
бирки в течение времени, необходимого для про-
явления роста (помутнения среды). Предполагая,
что в последней пробирке, где после достаточного
периода инкубации наблюдается рост, находилась
исходно одна-единственная клетка, подсчитывают
исходное число бактерий в образце. Преимуще-
ство данного метода состоит в том, что в жидкой
среде в отсутствие контакта с воздухом могут рас-
ти даже довольно чувствительные к О2 бактерии,
а также в том, что непосредственно в пробирках с
разведениями можно определять, например, про-
дукты метаболизма. Недостатком такого подсче-
та клеток является значительная статистическая
неопределенность, связанная с оценкой результа-
тов по принципу «да» или «нет» в трех независи-
мых повторностях разведений.
Культивирование позволяет получить более
достоверные сведения, если оно применяется для
количественного определения конкретных мета-
болических групп бактерий. Так, метаногенные
бактерии, растущие с использованием водоро-
да/формиата, можно непосредственно подсчиты-
вать в виде колоний в чашках Петри благодаря
естественной флуоресценции, выявляя таким об-
разом 20-50% клеток их популяции. Сульфатре-
дуцирующие бактерии также довольно успешно
подсчитываются путем культивирования с приме-
нением адекватных сред.
Все эти подсчеты — путем прямой микроско-
пии или с помощью культивирования — имеют в
основе допущение, что микробные клетки распре-
делены как отдельные единицы и в этом виде
различимы оптически либо по признаку роста.
Однако в природных местообитаниях микробы
часто образуют более или менее крупные агре-
гаты или прикрепляются к поверхностям, в том
числе к частицам растительного или животного
детрита, осадков или почвы, поэтому для их ко-
личественного учета с использованием любого из
вышеупомянутых методов необходимо предвари-
тельно отделить клетки от субстратов (поверх-
ностей), не нарушая жизнеспособности. Возмож-
ные способы такого отделения — это встряхива-
ние, гомогенизация или мягкая обработка проб
ультразвуком в присутствии пирофосфата, хе-
латирующих агентов либо детергентов. Следует,
однако, учитывать, что эти процедуры вызовут
гибель некоторых бактерий и пригодны лишь в
качестве компромиссного решения.
Совершенно иной подход к анализу природ-
ных популяций состоит в том, что в качестве
показателей биомассы используются клеточные
компоненты (химические маркеры). Общую жи-
вую биомассу (в действительности почти в лю-
бой экосистеме она представлена главным обра-
зом микробной биомассой) можно количественно
оценить, например в почвенном образце, путем
определения общего содержания АТР. Пока-
зателем биомассы может служить также общее
количество ДНК при условии, что процедура экс-
тракции позволяет отделить ДНК из живых кле-
ток от ДНК мертвых клеток, прикрепленных к
почвенным частицам. В почвенной микробиоло-
гии довольно широко применяется метод фуми-
гации, который состоит в том, что образец под-
вергают обработке парами хлороформа, при ко-
торой большая часть микробов погибает. Затем
в течение 10 сут измеряют количество СО2, обра-
зующегося в результате окисления отмершей био-
массы выжившими клетками. Количество СО2
считают показателем исходного содержания коли-
чества биомассы. В качестве альтернативного по-
228 Часть VIII. Прокариоты в биосфере
казателя определяют общую дегидрогеназную
активность клеток по восстановлению ими солей
тетразолия или диметилсульфоксида.
Более специфичная в отношении отдельных
таксонов информация может быть получена при
анализе специфических клеточных компонентов.
Так, специфичной таксономической характери-
стикой служит профиль клеточных жирных
кислот (см. разд. 29.3.4). К сожалению, для опре-
деления метаболических групп прокариот этот па-
раметр малоприменим, поскольку лишь немногие
из них, подобно сульфатредукторам, характери-
зуются специфическим составом жирных кислот.
Следует учитывать также, что жирнокислотный
состав мембранных липидов подвержен изменени-
ям в зависимости от условий среды. Кроме того,
этот метод предусматривает сравнение с чистыми
культурами исследуемых бактерий, но культиви-
руемые микроорганизмы, как подчеркивалось вы-
ше, часто составляют лишь малую и нерепрезен-
тативную фракцию общей популяции в данном об-
разце.
Химическим показателем присутствия грибов
в сложном микробном сообществе служит эрго-
стерол.
Для выявления и идентификации определен-
ных типов бактерий в природных образцах при-
меняют флуоресцентные антитела. В зави-
симости от использованных для их получения
антигенов антитела могут быть направлены про-
тив клеточных компонентов, специфичных для
отдельного штамма, вида или рода, поэтому уро-
вень специфичности, доступный в исследованиях
с применением антител, значительно варьирует.
Кроме того, этот метод, как и метод определе-
ния липидов, ограничен распознаванием культи-
вируемых бактерий, так как их используют при
этом для получения антител. Следует учиты-
вать также, что поверхностные свойства бактерий
(образование слизи, присутствие адгезинов и дру-
гие характеристики) в природных условиях и ла-
бораторных культурах могут существенно разли-
чаться. Таким образом, этот подход пригоден для
определенных, хорошо изученных систем, но в
целом его применимость весьма ограничена.
С успехом он используется для идентификации
метаногенов в анаэробном активном иле.
Определение численности микроорганиз-
мов в природных образцах можно осуществлять
путем прямого подсчета под микроскопом флуо-
ресцентно окрашенных клеток, радиоавтографии
клеток, меченных 14С или 3Н, подсчета колоний,
выросших на плотной питательной среде, опреде-
ления роста в жидкой среде с учетом разведения,
измерения общего содержания АТР, ДНК или бо-
лее специфических клеточных компонентов, та-
ких как жирные кислоты или хлорофилл, либо
методами с применением флуоресцентно мечен-
ных антител. Все эти методы имеют свои огра-
ничения.
Новые возможности для изучения микробных
сообществ открывает применение молекулярно-
биологических методов. Для большинства куль-
тивируемых бактерий уже имеются данные о
последовательностях 16S-pPHK, используемые
(на основе анализа гомологии) при создании фи-
логенетических схем (см. разд. 29.4). Принцип
учета микробов на основе анализа рРНК состоит
в том, что синтезированные олигонуклеотидные
рРНК-зонды для участков рРНК гибридизу-
ются специфически с определенными участками
рРНК клеток в исследуемом образце. Эти участ-
ки должны быть предварительно, путем сравне-
ния всех имеющихся данных о последовательно-
стях рРНК, определены как высоко- или низкова-
риабельные и как специфические для какого-либо
домена, типа, подтипа или таксона более низко-
го ранга в пределах данной системы, в некоторых
случаях вплоть до видового уровня. К такому зон-
ду, состоящему примерно из 18 или большего чис-
ла нуклеотидов, присоединяют флуоресцентный
краситель, и благодаря этому при специфической
гибридизации зонда с рРНК клетка-мишень при-
обретает флуоресцентную окраску. Живые клет-
ки бактерий содержат несколько тысяч копий
молекул рРНК, поэтому связывание флуорес-
центного зонда с клетками-мишенями обеспечива-
ет хорошо заметное свечение во флуоресцентном
микроскопе.
Этот метод применим, во-первых, для выяв-
ления определенной бактерии в микробном со-
обществе с помощью высокоспецифичного зон-
да. Во-вторых, использование менее специфичных
зондов позволяет в первом приближении иден-
тифицировать неизвестные бактерии в сообще-
стве, относя их к определенным филогенетиче-
ским группам. Таким способом до 90% общей мик-
робной популяции в пробах озерной воды может
быть распределено по двум основным доменам
прокариот. Другой пример подобного использо-
Глава 30. Экофизиология и экологические ниши прокариот 229
вания рРНК-зондов — идентификацию бактерий в
активном иле — иллюстрирует рис. 30.7. С помо-
щью более специфических зондов можно опреде-
лять некультивируемые формы прокариот, оби-
тающие, например, в организме простейшего, до
уровня рода. Если молекулярные зонды, специ-
фичные для групп различных уровней в преде-
лах данной таксономической системы прокариот,
связывать с различными флуоресцентными кра-
сителями, в одном препарате из природного об-
разца можно наблюдать распределение микробов
по группам различных филогенетических уров-
ней. Этот метод дает чрезвычайно эффектные
результаты при его сочетании с конфокальной
лазерной микроскопией (см. гл. 2), позволяя
одновременно визуализировать группы бактерий
различного систематического уровня в виде трех-
мерной картины и выявлять, например, их про-
странственные взаимосвязи.
Применение полимеразной цепной реакции
(ПЦР; см. разд. 17.4.3) позволяет копировать
даже единственную молекулу 16S-pPHK (в ви-
де ДНК) в экстрактах из природных образцов
для сравнения нуклеотидных последовательно-
стей этой ДНК с ДНК известных прокариот.
Таким способом предлагается изучать филоге-
нетические связи некультивируемых бактерий с
другими прокариотами (разд. 29.1 и 29.4). Ам-
плифицированную ДНК можно использовать для
создания зондов, специфичных к нуклеиновым
кислотам неизвестных микроорганизмов, и та-
ким образом оценивать разнообразие микробно-
го сообщества, независимо от способности данных
микроорганизмов расти в культуре. Этот же ме-
тод может быть использован для того, чтобы про-
следить судьбу некультивируемого организма при
тех или иных способах изучения общей популя-
ции, например в процессе получения накопитель-
ной культуры нового организма с неизвестными
потребностями или при изменениях в популяциях
некультивируемых бактерий, например активно-
го ила, в результате стрессовых природных ситу-
аций.
Для анализа сложных микробных сообществ
может также применяться амплификация непол-
ных последовательностей небольшого числа мо-
лекул рРНК. С этой целью амплифицируют по-
средством ПЦР фрагменты генов, кодирующих
16S-pPHK, и затем разделяют полученные оли-
гонуклеотиды путем электрофореза в градиенте
денатурирующего геля (denaturating gradient gel
Рис. 30.7. Определение протеобактерий /3-подкласса в
активном иле методом гибридизации in situ с группо-
специфическим нуклеотидным зондом к рРНК.
А. Фазово-контрастная микроскопия.
Б. Тот же препарат при флуоресцентной микроско-
пии с УФ-эпиосвещением. Фото любезно предоставлены
R. Amann
electrophoresis, DGGE). Получаемый набор полос
указывает на присутствие в изучаемом сообще-
стве соответствующих бактерий. Этот подход поз-
воляет следить сразу за несколькими микроорга-
низмами в сложном сообществе по их олигонук-
леотидным профилям (разд. 29.4).
Одиночные клетки или популяции микроорга-
низмов можно идентифицировать путем гибри-
дизации с синтетическими рРНК-зондами или с
рРНК-зондами, полученными на основе ампли-
фицированной (методом ПЦР) ДНК. Эти методы
можно применять в сочетании с оптическими для
выявления в том числе некультивируемых микро-
организмов в природных образцах.
Наряду с перспективностью методов молеку-
лярных зондов для микробной экологии следует
230 Часть VIII. Прокариоты в биосфере
отметить и их ограничения. Эти методы позво-
ляют установить присутствие определенного типа
микроорганизмов и его принадлежность к той или
иной ветви филогенетической системы, созданной
на основе анализа последовательностей. Однако в
большинстве случаев они не дают возможности
определить экологическую нишу (тип метаболиз-
ма) некультивируемого организма, поскольку фи-
логенетические группы не гомологичны метабо-
лическим группам, даже на уровне мельчайших
разветвлений системы. Кроме того, не все прока-
риоты одинаково доступны для применения мо-
лекулярных зондов. Некоторые бактерии, особен-
но обладающие толстыми клеточными стенками
или окруженные капсулой либо слизью, остаются
трудными объектами для экстракции ДНК или
гибридизации РНК с зондами. Поскольку метод
зондов к тому же селективен, определенные бак-
терии, возможно важные, при анализе популяций
этим способом могут остаться незамеченными.
30.4. Скорость потребления субстрата определяется кинетиками
его деполимеризации и поглощения
В любом местообитании при наличии субстрата,
доступного для микробного разложения, присут-
ствует не один организм, способный его разла-
гать, и число конкурентов тем больше, чем более
легко разлагаем данный субстрат. Легкоразлагае-
мые субстраты образуются, например, с низкой
скоростью при гидролизе полимерного соедине-
ния, и эта деполимеризация обычно является ли-
митирующим скорость этапом в общем процессе
разложения полимера. В конкурентной борьбе за
высвобождаемые мономерные субстраты может
выигрывать организм, который высокоэффектив-
но поглощает субстрат при его низкой концен-
трации. Модельной системой, имитирующей мед-
ленное, но относительно постоянное поступление
субстрата (условие, которое считается типичным
для многих сред обитания микробов), может слу-
жить хемостатная культура. В природных услови-
ях встречается также конкуренция за простран—
ственное преимущество, например за участки для
прикрепления на структурированном субстрате
или за участки с определенным температурным
режимом в зоне горячего источника, но наиболее
распространенный и важный тип микробной кон-
куренции в природе — это, несомненно, борьба за
субстрат.
30.4.1. Сродство к субстрату как ключевой
фактор в конкуренции за субстрат
При лимитирующем уровне субстрата эффектив-
ность его поглощения зависит от сродства к суб-
страту, Ks (см. гл. 6 и разд. 30.3.2) и тем самым
ОТ ВОЗМОЖНОЙ МаКСИМаЛЬНОЙ СКОРОСТИ рОСТа Дтах-
На рис. 30.8, А приведены кривые скорости ро-
ста в этих условиях для организмов трех типов.
Организм II имеет высокое сродство к субстрату,
т. е. характеризуется низким значением Ks и низ-
кой максимальной скоростью роста. В отличие от
него организм I имеет низкое сродство к субстра-
ту (высокое значение Ks) и высокую максималь-
ную скорость роста. При поступлении субстрата
в высокой концентрации организм I будет расти
значительно быстрее, чем организм II, и, возмож-
но, обгонит его в росте. При низкой концентра-
ции субстрата (область ниже точки пересечения
двух рассматриваемых кривых насыщения) орга-
низм II растет с большей скоростью относительно
организма I и выигрывает в конкурентной борь-
бе за субстрат. Организм II лучше адаптирован
к незначительному, но постоянному поступлению
субстрата, тогда как для организма I предпо-
чтительнее резкие повышения концентрации суб-
страта. Таким образом, организм II относится к
автохтонным микроорганизмам, которые харак-
теризуются медленным, но постоянным ростом
с использованием субстрата при его низкой, но
постоянной концентрации. Организм I представ-
ляет аллохтонный тип микробов с быстрым пе-
риодическим ростом, но низкой способностью к
конкуренции в условиях незначительного поступ-
ления субстрата. Наличие этих двух типов мик-
робов отражает общее разделение организмов на
К- и r-стратеги, известное из экологии: первые
растут медленно, но постоянно при максимальном
использовании емкости системы (К-стратеги),
тогда как вторые растут с высокой скоростью, но
существенно теряют в численности при флукта-
циях системы (г-стратеги). Организм I будет до-
Глава 30. Экофизиология и экологические ниши прокариот 231
Рис. 30.8. Влияние концентрации субстрата на скорость
роста (Д) и кинетику поглощения субстрата (Б) тремя
микроорганизмами (I, II, III) с различными характери-
стиками Ртах, KS И
ассимиляции. Как указано в разд. 30.3.3, при де-
фиците субстрата возможна индукция более высо-
коаффинных систем поглощения (с более низки-
ми значениями Ks) для данного субстрата. При
снижении концентрации субстрата могут также
возрастать уровень синтеза пермеазы и соответ-
ственно скорость поглощения без изменения Ks-
Для сравнения организмов по способности к
конкуренции за лимитирующий субстрат удобнее
рассматривать кинетику поглощения субстрата, а
не кинетику роста. Рост связан с оборотом суб-
страта через зависимый от субстрата экономиче-
ский коэффициент, или выход биомассы Ys, со-
гласно уравнению
dS
dt
и этот коэффициент
для каждого организма.
На основании уравнения Михаэлиса-Меитен
скорость оборота субстрата Vs может быть вы-
ражена как функция Ks, концентрации субстра-
та [S] И максимальной скорости поглощения Vmax
следующим образом:
(30.4)
варьирует индивидуально
<15 _ Ипах • [S]
dt Ks + [S']
(30.5)
минировать в периодической культуре с высокой
исходной концентрацией субстрата, тогда как ор-
ганизм II —в непрерывной культуре при низкой
скорости разбавления.
Третья кривая насыщения представляет ор-
ганизм III типа, для которого исход конкурент-
ной борьбы при лимитирующем уровне субстрата
определяется не только величиной Ks, но также
Р'тах - Хотя организм III характеризуется высоким
значением Ks, по сравнению с организмом II, по-
следний всегда будет вытесняться организмом III,
даже при низкой концентрации субстрата. Таким
образом, величина Ks — недостаточный критерий
для сравнения действительного сродства к суб-
страту различных организмов. Кроме того, Ks —
это на самом деле не константа, специфичная
для данного организма, но переменная, способная
меняться в зависимости от условий поступления
субстрата. Величину Ks определяют только как
эмпирическую кинетическую константу, но в дей-
ствительности неизвестно, к какой системе она от-
носится — первичного транспорта субстрата (пер-
меазам) или первого этапа его ферментативной
Кинетика поглощения субстрата (рис. 30.8, Б)
будет следовать кривым насыщения, сходным с
изображенными на рис. 30.8, А, если для про-
стоты предположить, что выход биомассы у всех
трех организмов один и тот же. Для сравнения
микроорганизмов по кинетике поглощения суб-
страта удобно использовать константу сродства
Vg. Эту величину определяют путем экстраполя-
ции начальной скорости поглощения субстрата на
концентрацию субстрата S = 0; таким образом,
Vg* соответствует наклону кривой насыщения при
S = 0, согласно уравнению:
уо = Ушах
S Ks
(30.6)
Величина Vg отражает действительное сродство
данного организма к субстрату, независимое от
параметров роста. Из рис. 30.8, Б очевидно, что
значения V&9, известные для трех разных орга-
низмов, могут указывать на исход конкурентной
борьбы между ними более адекватно, чем зна-
чения константы Ks- Величина Vg1 имеет раз-
мерность, обратную времени, и непосредственно
232 Часть VIII. Прокариоты в биосфере
Таблица 30.5. Характеристики процессов, осуществляемых сульфатредуцирующими и метаногенными организмами
в чистой культуре и при конкуренции в естественном местообитании
Сульфатредукторы Метаногены Пресноводные осадки
Окисление водорода Изменение свободной энергии AG0/, кДж/8 моль электронов Ks, мкМ Vmax, нмоль-мин-1 - (мг белка)-1 Разложение ацетата Изменение свободной энергии AG07, кДж/8 моль электронов Ks, мкМ Приведены средние величины в пределах изменений. -151 0,7-1,9 110-170 107,8 -63 67-200 н.о. — не определяли: -131 1,0-6,6 13-220 30,3 -35 300-500 н.п. — не применимо. 1,4-8,5 н.о. н.п. н.о.
сравнима с константой скорости реакции перво-
го порядка, определяемой в химической кинети-
ке. Здесь следует подчеркнуть, что этот параметр
сродства может быть определен для любых суб-
стратов, не только для источников углерода и
энергии, но также и для источников азота, серы,
фосфора, магния и т. д., и исход конкурентной
борьбы предсказывается на основе значений Ks,
Vmax и Vs°, если известна динамика поступления
субстрата.
В качестве примера рассмотрим конкуренцию
между сульфатредуцирующими и метаногенными
бактериями в пресноводных осадках. Эти орга-
низмы конкурируют за водород или ацетат как
наиболее важные для них субстраты, и сульфат-
редукторы обычно преобладают по численности
в присутствии сульфата. Данные, приведенные
в табл. 30.5, показывают, что сульфатредукто-
ры и метаногены имеют сходные значения Vmax
для поглощения водорода, но сродство к водо-
роду и ацетату у сульфатредукторов, как пра-
вило, выше, чем у метаногенов. Различие в кон-
стантах сродства к водороду объясняет исход этой
конкурентной борьбы. По-видимому, в обоих слу-
чаях доминирует энергетически более выгодная
реакция, так как катализирующие ее ферменты
характеризуются более высоким сродством к суб-
страту; это типично также для окислительно-
восстановительных микробных процессов, проте-
кающих при лимитирующей концентрации кисло-
рода (см. разд. 30.2.1). Однако, как упоминалось
выше, такое доминирование не связано непосред-
ственно с энергетикой реакций, и убедительного
общего объяснения этого феномена пока нет.
Данные, приведенные в табл. 30.5, показывают
также, что значения Ks для водорода в различ-
ных пресноводных осадках сравнимы с Ks чистых
культур сульфатредуцирующих и метаногенных
бактерий. Таким образом, кинетика поглощения
водорода в осадках, по-видимому, действитель-
но может определяться активностью таких бак-
терий. Это не совсем обычный факт; например,
поглощение водорода образцами почв существен-
но отличается от его поглощения культурами во-
дородокисляющих бактерий, показывая, что, воз-
можно, не их активностью обусловлено поглоще-
ние водорода в таких почвах (см. разд. 32.1.2).
Следует отметить, что сравнение лаборатор-
ных культур и природных образцов по сродству
к субстрату следует проводить с большой осто-
рожностью. Выше упоминалось, что микроорга-
низмы могут обнаруживать различные значения
Ks в зависимости от условий роста, т. е. при из-
бытке или недостатке субстрата. На кажущую-
ся величину сродства к субстрату влияют также
температура инкубации, прикрепление к субстра-
ту (см. разд. 30.5.3) и доступность дополнитель-
ных субстратов (см. разд. 30.4.2). Таким образом,
в сложных по составу среды природных место-
обитаниях микроорганизмы могут обнаруживать
константы сродства, весьма отличные от выявля-
емых для чистых лабораторных культур.
Глава 30. Экофизиология и экологические ниши прокариот 233
Оборот растворенного субстрата в при-
родной экосистеме определяется константой срод-
ства к нему (Vg) потребляющих микроорганиз-
мов. Эта константа отражает наклон кривой
поглощения субстрата при экстраполяции на его
нулевую концентрацию и непосредственно срав-
нима с константой скорости реакции 1-го поряд-
ка. Строго говоря, эта константа сродства не яв-
ляется константой как таковой; она варьирует в
зависимости от физиологического состояния мик-
робных клеток.
30.4.2. На кинетику поглощения
влияет присутствие других субстратов
За исключением нескольких специализированных
организмов, потребляющих только один субстрат,
микроорганизмы обычно способны использовать
различные субстраты. Лабораторные культуры
в присутствии двух субстратов используют их
поочередно (феномен, называемый диауксией;
см. разд. 20.2). Однако это довольно необычная
ситуация, создаваемая в лаборатории внесением
одновременно двух субстратов в высоких кон-
центрациях. В условиях роста Escherichia coli в
хемостате при низких концентрациях глюкозы и
галактозы классического подавления утилизации
галактозы глюкозой не происходит, но оба суб-
страта потребляются одновременно. Кроме того,
остаточная концентрация каждого из внесенных
субстратов на выходе из системы в этом случае
ниже, чем в культурах с внесением одного суб-
страта. При одновременном внесении до шести
субстратов остаточная концентрация становится
функцией относительного вклада каждого из суб-
стратов в питание клеток. В общем случае, в при-
сутствии дополнительного субстрата Б повыша-
ется кажущееся сродство к субстрату А.
Преимущество использования смесей субстра-
тов обнаружено также при выращивании в хе-
мостате смешанных культур, в которых бактерии
конкурируют за питательные вещества. В одном
из подобных экспериментов в минеральной сре-
де, содержащей тиосульфат и/или ацетат в каче-
стве источника энергии, выращивали совместно
облигатно литотрофную серную бактерию Thio-
bacillus neapolitanus, факультативно литотрофную
серную бактерию Thiobacillus шт. А2 и строго ге-
теротрофный вид рода Spirillum (рис. 30.9). При
Рис. 30.9. Конкуренция между Thiobacillus neapolitanus
(a), Thiobacillus А2 (•) и Spirillum G7 (о) за тиосульфат
и ацетат как лимитирующие рост субстраты в хемостате
при постоянной скорости разбавления (0,075 ч-1). От-
носительный количественный вклад отдельных видов в
накопление биомассы определяли путем прямого под-
счета клеток в микроскопе после достижения культурой
стационарного состояния в каждой среде с различными
концентрациями субстратов. По [5].
внесении только тиосульфата или только ацета-
та доминировал соответствующий специализиро-
ванный вид, превышая по численности факуль-
тативно литотрофную бактерию, способную ис-
пользовать оба субстрата. Это показывает, что
специализированные организмы имеют более вы-
сокое сродство к соответствующим субстратам.
При одновременном внесении обоих субстратов
с одинаковыми скоростями доминировал факуль-
тативный лито/органотроф, выигрывая в конку-
рентной борьбе за источники питания благода-
ря тому, что его сродство к каждому субстрату
возрастало в присутствии дополнительного суб-
страта. Аналогично этому бактерии, которые осу-
ществляют гомоацетатное брожение, не способны
успешно конкурировать с метаногенами или суль-
фатредукторами за водород либо с классическими
бактериями-бродилыциками за сахара, но поддер-
живают свою популяцию путем одновременного
использования субстратов нескольких типов, бла-
годаря гибкости метаболизма.
234 Часть VIII Прокариоты в биосфере
Организмы, не специализированные в отноше-
нии источников питания, проигрывают в числен-
ности специализированным формам при конку-
ренции за «их» субстраты, но поддерживают свою
популяцию благодаря одновременному использо-
ванию нескольких субстратов.
30.4.3. Разложение субстрата может иметь
пороговые ограничения
Разложение субстрата микроорганизмами нико-
гда не приводит к его полному исчезновению (ну-
левой концентрации). Достаточно чувствитель-
ные методы позволяют определять остаточную
концентрацию субстрата после прекращения ро-
ста в любой культуре и природной среде.
Даже в чрезвычайно чистой океанской воде
на большом удалении от берега присутствуют в
низких концентрациях все органические соедине-
ния, образующиеся как продукты биологической
активности. Эти низкие концентрации органиче-
ских соединений отражают одновременно эффек-
тивность микробной биодеградации в данном ме-
стообитании и ее пределы.
Низкие остаточные концентрации субстратов,
обнаруживаемые после прекращения микробно-
го разложения, называют пороговыми концен-
трациями. Их определение стало возможным
лишь в последние годы благодаря развитию ме-
тодов микроанализа, в том числе газовой хрома-
тографии в капиллярных колонках и жидкостной
хроматографии высокого разрешения.
Причины того, что субстраты в пороговых
концентрациях не потребляются, на самом деле
не ясны; можно было бы предполагать, что каж-
дая молекула субстрата должна метаболизиро-
ваться, если она контактирует с соответствующим
ферментным аппаратом, однако, как показывает
рис. 30.10, этого не происходит. Пороговые уровни
субстрата варьируют от наномолярных до пико-
молярных, в зависимости от бактерий. Сведения о
таких пороговых концентрациях имеются в основ-
ном для газообразных субстратов, что обуслов-
лено доступностью чувствительных методов их
анализа. Эксперименты с Щ-окисляющими бак-
териями различных физиологических групп пока-
зали, что пороговые концентрации Щ варьируют
в зависимости от изменения свободной энергии,
которым характеризуется соответствующая реак-
ция окисления водорода (табл. 30.6). Это означа-
ет, что наличие пороговых уровней обусловлено
энергетикой реакций, а не их кинетикой.
Рис. 30.10. Кинетика поглощения субстрата микробным
сообществом в случаях (Д) высокой максимальной ско-
рости поглощения, высокого сродства и низкого порога
и (Б) низкой скорости поглощения, низкого сродства и
высокого порога.
Таблица 30.6. Зависимость пороговых концентраций Н2 при его окислении от окислительно-восстановительного
потенциала электронакцепторной системы
Метаболический тип бактерий Пример Электронакцепторная система Eq, мВ Пороговая концентра- ция Н2. Па
Гомоацетогены Acetobacterium spp. CO2 /ацетат -290 52-95
Метаногены Methanospirillum spp. со2/сн4 -244 2,5-10
Восстанавливающие серу Desulfovibrio spp. S°/H2S -240 0,5-2,4
Восстанавливающие сульфат Desulfovibrio spp. so*-/h2s -218 0,8-1,9
Восстанавливающие фумарат Wolinella spp. Фумарат / сукцинат +30 0,002-0,009
Восстанавливающие нитрат Desulfovibrio spp. NO3/NH+ +363 <0,002
Глава 30. Экофизиология и экологические ниши прокариот 235
Для отдельного организма пороговая концен-
трация субстрата может быть снижена внесением
косубстрата-, это подтверждает, что она связана
с энергетическим статусом организма. Таким об-
разом, пороговые уровни, измеренные в лабора-
тории для чистых культур в средах с одним суб-
стратом, могут оказаться значительно более вы-
сокими, чем выявляемые в природных условиях,
где микробы используют одновременно несколько
субстратов. Пороговые концентрации имеют осо-
бое значение в связи с разложением ксенобиоти-
ков. В случае потенциально токсичных соедине-
ний недостаточно убедиться, что они в принципе
подвержены биодеградации; желательно устано-
вить, что в результате разложения концентрация
ксенобиотика снижается до такого уровня, при ко-
тором он не оказывает вредного воздействия в ре-
зультате непосредственной токсичности или био-
аккумуляции.
30.4.4. Кометаболизм может быть
неблагоприятен для микроорганизма
При разложении органических соединений микро-
бы обычно получают энергию для роста; в резуль-
тате биомасса их клеток и скорость разложения
субстрата возрастают. Однако некоторые субстра-
ты разлагаются «непродуктивным» образом, т. е.
их разложение не обеспечивает получения энер-
гии бактерией и поэтому при нем не увеличива-
ется число клеток. Такой метаболизм был исход-
но назван соокислением и позднее, в более общем
смысле, кометаболизмом. Классическим приме-
ром его служит окисление этана метанокисляю-
щими бактериями: образующийся при начальной
довольно неспецифической монооксигеназной ре-
акции этанол не метаболизируется далее метило-
трофами и может только служить субстратом для
других бактерий в данном местообитании:
СН4 + О2 + 2[Н] -♦ СН3ОН + Н2О
СНзОН + Н2О -* СО2 + 6[Н]
СН3СН3 + О2 + 2[Н] - СН3СН2ОН + Н2О
СНзСН2ОН —> далее не окисляется,
регенерации восстано-
вителя не происходит.
В результате активность окисления этана метано-
кисляющей популяцией не возрастает, пока при-
сутствует метан как дополнительный субстрат.
На самом деле окисление этана даже неблагопри-
ятно влияет на эти бактерии, так как оно свя-
зано с потреблением электронов в монооксиге-
назной реакции, но не приводит к их последующей
регенерации. Таким образом, даже поддержание
определенного уровня кометаболической окисли-
тельной активности может требовать внесения
разлагаемого косубстрата. Кометаболическая ак-
тивность представляет большой интерес в связи с
разложением ксенобиотиков, поскольку они час-
то вначале подвергаются неспецифическому воз-
действию ферментов деградации, но в этих ре-
акциях не образуются промежуточные продукты,
которые могли бы служить источником энергии
для данного организма. Внесение «продуктив-
ных» косубстратов во многих случаях помогает
усилить разлагающую способность микробных со-
обществ в реакторах для переработки отходов или
в почвах. Поскольку такая кометаболическая ак-
тивность непосредственно не дает выхода энер-
гии для организма, представляет интерес выяс-
нить ее влияние на кинетику превращения суб-
стратов, пороговые концентрации и т. д.
Кометаболизм не обеспечивает получение мик-
роорганизмом энергии или субстратов для роста и
может быть даже неблагоприятен для него. Осо-
бо важное значение кометаболическая активность
имеет для начального разложения ксенобио-
тиков.
30.4.5. Кинетику оборота субстрата в природе
измеряют различными способами
При рассмотрении кинетики оборота субстрата в
хемостате (разд. 30.3.2) отмечалось, что в слу-
чае сбалансированного режима измеримые кон-
центрации субстратов сохраняются постоянны-
ми. Поскольку известны скорости потоков, может
быть определена кинетика потребления субстра-
тов. В природной или полуприродной системе —
образце почвы или осадков — такого рода опреде-
ления требуют применения иных методов.
Наиболее простым способом измерения обо-
рота субстратов может быть определение какой-
либо суммарной активности, например дыха-
тельной, которую измеряют как поглощение кис-
лорода либо как высвобождение СО2 в природ-
ном образце при инкубации его в контролируемых
236 Часть VIII. Прокариоты в биосфере
условиях, сходных с условиями in situ. За разло-
жением субстрата можно также следить по ско-
рости его исчезновения. При таком способе суб-
страт необходимо внести в концентрации, значи-
тельно более высокой, чем в природной среде.
Вследствие этого измеряемая скорость разложе-
ния может превышать скорость, имеющую ме-
сто в условиях in situ. Чтобы избежать подобных
ошибок, для определения кинетики используют
радиоактивно меченные субстраты, которые мож-
но вносить в очень низких концентрациях; их ис-
пользование позволяет производить весьма точ-
ные измерения (например, образования 14СОг из
14 С-глюкозы).
Чаще всего в одном и том же местообитании
происходят и образование, и использование суб-
страта, т. е. оборот интермедиата реакции.
Простой пример такого рода показан на рис. 30.11
для оборота водорода в почвенном образце; в этом
случае чувствительный метод позволяет непо-
средственно определять субстрат. Путем пониже-
ния или повышения концентрации Нг в изучаемой
системе прослеживают кинетику образования или
использования водорода в процессе установления
ее нового равновесного состояния.
Чувствительным методом для определения
оборота других субстратов может служить ра-
диоизотопный анализ. Специфический мече-
ный субстрат вводят в образец, при этом кон-
центрация данного вещества изменяется в систе-
ме лишь незначительно, и затем измеряют его
потребление по исчезновению метки in situ. Ме-
тодически проще определять образование мече-
ных продуктов (рис. 30.12). По графику скорости
Рис. 30.11. Определение оборота молекулярного водо-
рода в почвенном образце. Н2 —добавление Н2; 1Ч2 —
введение газообразного азота; угол наклона А отража-
ет скорость окисления Н2; угол наклона Б — скорость
образования Н2.
Рис. 30.12. Измерение времени оборота субстрата с по-
мощью радиоактивной метки: ti — время оборота, опре-
деляемое по исчезновению субстрата; t2 — время оборо-
та, определяемое по образованию продукта. Обратите
внимание, что концентрация субстрата не всегда дости-
гает нуля и G и <2 не всегда одинаковые величины.
исчезновения субстрата или образования продук-
та устанавливают время оборота, позволяющее
рассчитать время оборота пула данного промежу-
точного продукта. Зная обратную величину вре-
мени оборота — это константа скорости оборота т
(с размерностью, например, ч-1)—и умножая ее
на концентрацию in situ — величину пула — рас-
считывают скорость оборота, например как ко-
личество субстрата (нмоль) на 1 г материала об-
разца в час:
„ dS rrrt , х
Vs = = г • (S] (30.7)
Величина пула и время оборота — независимые
показатели, которые в сочетании дают информа-
цию о скорости оборота субстрата. При неболь-
шой величине пула соединения могут быстрее обо-
рачиваться и служить значительно более важны-
ми субстратами, чем соединения, представленные
большим пулом, который изменяется лишь очень
медленно.
Классическим примером выявленной с помо-
щью адекватного подхода кинетики может слу-
жить оборот Нг при метаногенном (анаэробном)
разложении субстратов. В ранних исследованиях
этого процесса водород не учитывали, поскольку
в то время не имелось чувствительных датчиков
для его выявления; в настоящее время известно,
что Нг является в этом процессе одним из наи-
более важных промежуточных продуктов и вре-
Глава 30. Экофизиология и экологические ниши прокариот 237
мя его оборота измеряется секундами. В хемо-
стате как модельной системе величина пула эк-
вивалентна концентрации метаболита в реакторе
и время оборота эквивалентно времени пребыва-
ния в нем среды. При сбалансированном режиме
время пребывания в реакторе всех субстратов и
промежуточных продуктов одинаково, и в связи с
этим хемостат является довольно искусственной
системой, которая лишь ограниченно сравнима с
природными условиями. Указанные выше мето-
ды определения оборота хорошо разработаны и
легко применимы; основная проблема в большин-
стве случаев состоит в том, чтобы внести метку
гомогенно без нарушения внутренней структуры
образца. Значительно более достоверная инфор-
мация имеется о метаболизме газов в природных
системах, в связи с тем что газы легко вводить
и анализировать. Трудности резко возрастают по
мере усложнения внутренней структуры изучае-
мой системы, например при изучении процессов в
тонко структурированных осадках или слоях мик-
робных пленок, где пространственная организа-
ция непосредственно влияет на оборот вещества
(см. также разд. 30.6).
Другая проблема в подобных исследованиях
состоит в том, что оборот субстрата обычно
происходит более сложным образом, чем пред-
полагается при допущении, приведенном вы-
ше. Образование промежуточных продуктов ча-
ще всего следует кинетике нулевого поряд-
ка, т. е. скорость образования не зависит от
концентрации интермедиата, если оборот не по-
давляется накоплением последнего. Использова-
ние субстратов может следовать кинетике нуле-
вого или первого порядка в зависимости от то-
го, насыщена система субстратом или нет, и даже
кинетике второго или третьего порядка, если
в процессе участвуют дополнительные косуб-
страты.
Другие микробные активности (например,
разложение биополимеров) могут быть исследо-
ваны в экспериментах с радиоактивно или флуо-
ресцентно меченными субстратами (в последнем
случае краситель дает свечение, когда высвобож-
дается при гидролизе субстрата). Такие методы
обычно позволяют получать только полуколиче-
ственные данные о возможности разложения, но
не о скоростях преобразования in situ, так как
надмолекулярная структура природных полиме-
ров может существенно отличаться от структуры
меченого соединения. Полуколичественные дан-
ные о суммарной микробной активности можно
получать также с помощью метода внесения ме-
ченого тимидина или лейцина либо определения
АТР (разд. 30.3.5).
30.5. Для многих бактерий характерно
В лабораторной микробиологии предметом изуче-
ния чаще всего служат клетки, свободно взвешен-
ные в жидкой питательной среде, т. е. не прикреп-
ляющиеся к стенкам сосуда или проявляющие это
свойство в слабой степени. Прикрепление к по-
верхностям весьма нежелательно при лаборатор-
ных исследованиях, и культуры, растущие не в
виде гомогенных суспензий, обычно не использу-
ют в качестве объектов.
Вместе с тем в природных экосистемах мик-
робные клетки неизбежно контактируют с той
или иной поверхностью, каким бы ни было их
местообитание. Это очевидно в отношении бакте-
рий, обитающих в донных осадках или почве, а
также на животных или растительных тканях ли-
бо внутри них. Однако и в воде, например озер-
ной, имеются различные поверхности — по грани-
це донных осадков и воды, по наклонным участ-
прикрепление к поверхностям
кам дна и на малых частицах, таких как мертвый
или живой фито- и зоопланктон, а также на бак-
териальных клетках. Граница раздела фаз воз-
дух/вода также плотно заселена микроорганиз-
мами. Таким образом, поверхности присутствуют
везде и представляют собой местообитания мик-
робных клеток, совершенно отличные от тех сред,
где микробы присутствуют во взвешенном состо-
янии.
Некоторые поверхности активно атакуются
микроорганизмами; так, бактерии, разлагающие
полимерные субстраты, например целлюлозу, ин-
тенсивно взаимодействуют с их поверхностью.
Существуют и «инертные» поверхности, в част-
ности это поверхности минеральных частиц или
частиц трудноразлагаемого органического мате-
риала, но и на границе с ними водная среда су-
щественно отличается от свободной воды.
238 Часть VIII. Прокариоты в биосфере
Дополнение 30.1. Все естественные
поверхности, встречающиеся в природе,
несут электрические заряды, главным обра-
зом отрицательные, вследствие частичного
депротонирования кислотных функциональ-
ных групп, например остатков кремниевой,
угольной или гуминовых кислот. Незаряжен-
ные поверхности имеют неполярные субстра-
ты, такие как нефть и нефтепродукты. Кроме
того, неполярной поверхностью для взвешен-
ных в воде клеток микроорганизмов является
граница раздела фаз воздух/вода.
Между заряженными частицами (ионами)
возникают силы электростатического взаимо-
действия, падающие пропорционально квад-
рату расстояния. Ионы с противоположны-
ми зарядами притягиваются друг к другу,
с одинаковыми — взаимоотталкиваются. Про-
тивоположно заряженные двухвалентные ио-
ны могут образовывать мостики между оди-
наково заряженными группами. Межмоле-
кулярные взаимодействия включают также
ван-дер-ваальсовы, поляризационные и дис-
персионные силы. Они, как правило, менее
значительны, чем электростатические, всегда
приводят к притяжению молекул и возрас-
тают обратно пропорционально расстоянию
между ними в 4-6 степени. Отрицательно
заряженная частица в чистой воде с низ-
кой ионной силой отталкивается отрицатель-
но заряженной поверхностью, но противодей-
ствующие этому поляризационные и диспер-
сионные взаимодействия могут обеспечивать
притяжение на очень близкое расстояние. По-
ложительно заряженная частица притягива-
ется к отрицательно заряженной поверхности
в результате взаимодействий всех трех типов,
и то же самое справедливо для отрицатель-
но заряженных частиц в присутствии проти-
воположно заряженных ионов, что типично
для природных местообитаний. Незаряжен-
ные поверхности притягиваются друг к дру-
гу за счет только неэлектрических взаимо-
действий.
Таким образом, контакт поверхностей лю-
бого рода с водной фазой, содержащей неза-
ряженные молекулы или ионы, приводит к
обогащению раствора ионами в погранич-
ном слое вблизи поверхности. Бактериальная
поверхность заряжена отрицательно; у гра-
мотрицательных бактерий это обусловлено
присутствием кислых липополисахаридов и
белков в наружной мембране, у грамположи-
тельных — тейхоевых кислот.
Молекулы, притягиваемые к поверхности,
могут легко двигаться в пределах погранич-
ного слоя, но покинуть его легко не могут,
что связано с общим энергетическим состоя-
нием системы. Такие молекулы находятся в
этом слое как бы в двумерном пространстве,
аналогично липофильным молекулам в био-
логических липидных мембранах.
30.5.1. Прикрепление микробов к поверхности
как многоэтапный процесс
Между микробными клетками и поверхностью
вначале возникают только описанные выше
физико-химические взаимодействия, и это может
быть первым этапом в процессе прочного при-
крепления.
1. В результате физико-химических взаимо-
действий, как электростатических, так и прочих,
микробная клетка притягивается к поверхно-
сти («субстрату»), и таким образом возника-
ет начальный контакт. Это притяжение являет-
ся обратимым и полностью небиологическим, ему
подвергаются и мертвые клетки. Притяжению
противодействуют силы сбрасывания (например,
смыва), которые тем существеннее, чем больше
клетка выступает в пространство. «Субстрат» мо-
жет быть уже покрыт слоем полимеров, таких как
белки или полисахариды; едва ли в природных ме-
стообитаниях существуют «чистые» поверхности,
не покрытые такими полимерами.
2. Сближение микробной клетки с «субстра-
том» вызывает изменение ее формы и перерас-
пределение заряженных и незаряженных групп
на контактирующей клеточной поверхности. В ре-
зультате зона контакта увеличивается, что спо-
собствует взаимодействию с «субстратом». Этот
процесс, как и притяжение, обратим, но характе-
рен только для живых клеток. По-видимому, он
не зависит от синтеза белка (хлорамфеникол не
оказывает на него ингибирующего влияния).
3. Микробные клетки образуют специфиче-
ские белки (молекулы адгезии, адгезины), атак-
Глава 30. Экофизиология и экологические ниши прокариот 239
же полисахариды (гликокаликс) или органел-
лы (фимбрии), которые взаимодействуют с «суб-
стратом» и заполняют щель, возникающую в ре-
зультате отталкивания одноименных зарядов на
двух поверхностях, при ее ширине 100-300 нм.
Этот этап несомненно связан с индуцированной
биологической активностью, контролируемой спе-
циальными генами. Обычно в процессе прикреп-
ления к поверхности синтезируются адгезипы и
полисахариды. У некоторых бактерий синтез ад-
гезинов происходит конститутивно, и особенно это
характерно для патогенных бактерий, поскольку
продукция адгезинов необходима для инфициро-
вания организма-хозяина (см. разд. 33.3).
Прикрепление может быть также иницииро-
вано гидрофобными взаимодействиями. В част-
носги, прикрепление микробных клеток друг к
другу, по-видимому, зависит в первую очередь от
неполярных взаимодействий; гидрофобность кле-
точной поверхности является важным фактором
образования бактериальных хлопьев, например в
очистных сооружениях.
Прикрепление бактериальных клеток к по-
верхности происходит как процесс, включающий
по меньшей мере три различных этапа и связан-
ный как с физико-химическими взаимодействия-
ми, так и с биологической активностью. Физико-
химическое притяжение ведет к обогащению
пограничного слоя жидкой среды растворенны-
ми веществами и взвешенными частицами; в боль-
шинстве случаев это благоприятно для прикреп-
ленных микроорганизмов.
30.5.2. Прикрепление к поверхности
обеспечивает ряд преимуществ
Поскольку все молекулы, и полярные, и непо-
лярные, в результате физико-химического взаи-
модействия накапливаются у границы с поверхно-
стью, прикрепленные бактерии лучше снабжают-
ся субстратами, чем свободные клетки в жидкой
среде. Прикрепление к поверхности характерно
для бактерий, обитающих в бедных субстратами
средах. При дефиците субстратов свободноплава-
ющие бактерии обнаруживают тенденцию к смене
образа жизни на прикрепленный. У многих адап-
тированных к голоданию, олиготрофных бакте-
рий прикрепленная стадия является основной в
жизненном цикле. Поскольку растворенные моле-
кулы легко перемещаются внутри пограничного
слоя жидкости, они концентрируются в направ-
лении микробных клеток, которые выступают в
качестве приемника субстратов. Однако это пре-
имущество для прикрепленных клеток сохраняет-
ся только до тех пор, пока число их невелико и они
не покрывают поверхность полностью.
В проточной воде (ручье или реке) микроб-
ные клетки, прикрепленные к камням или другим
поверхностям, получают субстраты из больших
объемов воды без затраты энергии на движение.
На прикрепленные бактерии в меньшей сте-
пени воздействуют токсичные соединения, в том
числе кислород, так как они диффундируют толь-
ко с одной стороны и нейтрализуются всем мик-
робным сообществом, а не одиночными клетками.
Этот аспект важно учитывать при оценке эффек-
тивности дезинфицирующих веществ, например
при обработке питьевой воды или медицинских
процедурах. Например, прикрепленные бактерии
более устойчивы к хлору по сравнению с непри-
крепленными (рис. 30.13).
Прикрепленные клетки в значительно мень-
шей степени подвергаются выеданию ресничными
инфузориями или коловратками по сравнению со
свободно суспендированными клетками. Этот эф-
фект способствует, например в активном иле, об-
разованию крупных микробных агрегатов, кото-
рые легко оседают и поддерживают стабильность
системы (см. гл. 36).
Прикрепленные бактерии гораздо легче, чем
свободноплавающие бактерии, образуют коопера-
тивные структуры с другими бактериями. Это
особенно важно для развития синтрофной коопе-
рации (см. разд. 30.7). В прикрепленных бактери-
альных сообществах имеются также большие воз-
можности для обмена плазмидами.
При высокой численности прикрепленные к
поверхностям клетки образуют пленки, которые
удерживают воду и таким образом защищают со-
ставляющие их микроорганизмы от высыхания,
например на поверхности почвы.
Для различных типов бактерий прикрепление
характерно в большей или меньшей степени. Та-
кие специализированные бактерии, как Asticca-
caulis, Caulobacter и Hyphomicrobium, постоянно
прикреплены специфическими органеллами или
участками своей поверхности либо имеют обя-
зательную прикрепленную стадию в жизненном
цикле. Многие другие бактерии могут прикреп-
24U Часть VTT1. 11 рекариоты в биосфере
Рис. 30.13. Влияние прикрепления к поверхности на вы-
живаемость обитающих в природе гетеротрофных бак-
терий, подвергнутых воздействию хлора (2,0 мг/л воды,
в течение 1 ч). Выживаемость определяли методом вы-
сева на плотную среду в чашках Петри. Концентрация
хлора оставалась почти постоянной в течение времени
экспозиции.
ляться только при определенных, способствую-
щих этому внешних условиях, например при недо-
статке питательных веществ.
В природных условиях, где снабжение субстра-
том почти всегда ограничено, микробные клетки
в подавляющем большинстве прикреплены к по-
верхностям или сгруппированы в агрегаты, кото-
рые содержат внутри минеральные частицы или
состоят только из микробных клеток. То же ха-
рактерно для местообитаний, на первый взгляд не
относящихся к бедным питательными вещества-
ми. Огромная масса материала в виде частиц, на-
пример в реках, образует обширные поверхности,
используемые для прикрепления большинством
бактерий.
30.5.3. Микробные пленки гетерогенны
по структуре и динамике
Присущей микробам способностью прикреплять-
ся к поверхностям объясняется обрастание ими
технических сооружений, водопроводных и ка-
нализационных труб, а также труб для водных
растворов на предприятиях пищевой и бумаж-
ной промышленности, когда их специальной сте-
рилизации не проводится. В зависимости от на-
личия разлагаемых субстратов такие биопленки
могут превращаться в слизистые слои значитель-
ной толщины, которая в основном лимитирует-
ся, помимо количества субстрата, величиной сил
смыва. Микробное обрастание может существенно
уменьшать пропускную способность труб и трубо-
проводов в промышленных установках или систе-
мах водоснабжения прежде всего за счет возник-
новения вихрей, но также и просто из-за умень-
шения действующего диаметра труб.
Развитие биопленки на инертной поверхности
начинается с прикрепления клеток. Затем биомас-
са возрастает за счет роста бактерий у поверхно-
сти и прикрепления новых клеток. В этой фазе
роста плотность клеток может достигать пла-
то, которое определяется динамическим балансом
между ростом и откреплением, т. е. зависит от
поступления субстрата и клеток и от действия
сил смыва (рис. 30.14). С увеличением толщины
биопленки в ней возникает в той или иной мере
неоднородность по концентрации субстрата и по
условиям в целом. Клетки, находящиеся на пе-
риферии, относительно лучше снабжаются суб-
стратом из жидкости, тогда как в нижерасполо-
жепных слоях микроорганизмы могут голодать и
отмирать, что приводит к структурной нестабиль-
ности пленки. Такая неоднородность связана с ме-
таболической активностью микробов, и ею опре-
деляется развитие совершенно разных микробных
сообществ в верхнем и нижнем слоях биопленок.
Поскольку для нижних слоев клеток основным
лимитирующим фактором часто является снаб-
жение кислородом, доминирующий тип метабо-
лизма в этих слоях анаэробный (например, бро-
жение, нитрат- или сульфатредукция); продукты
брожения или восстановленные соединения азота
и серы диффундируют при этом к поверхности,
где служат субстратами для аэробных бактерий.
Изучение микроструктуры биопленок показа-
ло, что они не обязательно представляют собой
сплошной слой, но содержат каналы и откры-
Глава 30. Экофизиология и экологические ниши прокариот 241
Рис. 30.14. Развитие биопленки на инертной поверх-
ности. I—лаг-фаза; II—экспоненциальный рост; III —
лимитированный рост; IV — стационарное состояние;
V—распад; 6—диффузионный пограничный слой, не
подверженный воздействию турбулентных сил смыва;
1 — отложение полимера; 2 — отложение клеток; 3 —
прикрепление клеток; 4 — размножение клеток; 5 — от-
деление клеток (смыв). По [6].
гут существенно различаться по содержанию кис-
лорода, поступающего из воздуха и из агаровой
среды. На рис. 11.3 показано распределение Ог в
колонии Bacillus cereus, определенное с помощью
микроэлектрода. Концентрация кислорода резко
снижается по мере удаления от поверхности ко-
лонии, и на глубине более 20 мкм он уже не опре-
деляется. Таким образом, примерно 20 моносло-
ев бактериальных клеток полностью потребляют
диффундирующий О2, если из агаризованной сре-
ды поступает достаточное количество субстрата.
Анализ ферментов в клетках Enterobacter cloacae
из тонких срезов замороженных колоний показал,
что в нижних слоях клеток ключевые ферменты
цикла лимонной кислоты подавлены, тогда как в
верхних слоях их активность присутствует. Кон-
центрация субстрата, напротив, снижается в на-
правлении от агара к поверхностным слоям. Усло-
вия существования внутри колонии фактически
различны для всех слоев клеток. Эта структурная
неоднородность связана с метаболической актив-
ностью бактерий; по мере того как клетки отмира-
ют, распределение кислорода и субстрата между
колонией и агаром уравновешивается.
тые участки поверхности, обеспечивающие обмен
с окружающей водной средой. Таким образом в
микробную пленку могут поступать растворенные
вещества и даже мелкие частицы.
Биопленка представляет собой простран-
ственно структурированное гетерогенное сообще-
ство различных микроорганизмов и включает
также небиологические отложения; микробное со-
общество характеризуется специфической дина-
микой роста и разложения субстратов, которая
отражает в малом масштабе типы кооперации и
антагонизма, известные для лимитированных по
кислороду структурированных экосистем в це-
лом.
30.5.4. Бактериальные колонии
стратифицированы по содержанию О2,
концентрации субстрата и
метаболическому состоянию клеток
Особый тип биопленки представляет собой бакте-
риальная колония на агаризованной питательной
среде в чашке Петри. По крайней мере в круп-
ной колонии верхние и нижние слои клеток мо-
В колонии живых бактерий формируются рез-
кие взаимопротивоположные градиенты концен-
траций кислорода и субстратов. Эти градиенты
вызывают отмирание или изменение метаболиче-
ской активности клеток в глубине колонии по
сравнению с клетками на поверхности.
30.5.5. Формирование зубного налета
зависит от типа организма-хозяина
и нескольких типов бактерий
Зубной налет — это пример особой биопленки,
которую образуют несколько типов бактерий пу-
тем специфической кооперации. Поверхность зу-
бов представляет собой область формирования
микробного сообщества, включающего представи-
телей примерно 300 таксонов. Данное местообита-
ние характеризуется постоянным притоком слю-
ны и обильным поступлением легкоразлагаемых
субстратов, что делает ротовую полость сложной
системой своего рода непрерывного культивиро-
вания.
Чистая, стерильная поверхность зуба в рото-
вой полости вначале покрывается слюной, образу-
ющей на ней исходную пленку, в которой присут-
ствуют органические полимеры, такие как белки,
242 Часть VIII. Прокариоты в биосфере
гликопротеины и полисахариды. Они служат суб-
стратами для бактерий рода Streptococcus, обычно
S. oralis, S. mutans, S. mitis или S. sanguis, ко-
торые первыми заселяют эту поверхность. Клет-
ки указанных бактерий несут на своей поверхно-
сти молекулы адгезии, специфически взаимодей-
ствующие с поверхностными углеводами других
бактерий и таким образом усиливающие их от-
ложение. Присутствие и специфичность связыва-
ния этих молекул адгезии можно определить с
помощью специфичных к ним антител; организм-
хозяин может влиять на отложение дополнитель-
ных бактерий посредством антител, выделяемых
в слюну. Среди вторичных колонизаторов зуб-
ной поверхности доминирует Actinomyces naeslun-
dii и могут также доминировать строгие анаэ-
робы, такие как Veillonella atypica и Prevotella
loescheii, причем последний организм способен
обусловливать прикрепление других анаэробов,
например Actinomyces israeli и Capnocytophaga
gingivalis. В толстых слоях налета могут нахо-
диться другие строго анаэробные бактерии, на-
пример Fusobacterium nucleatunv, их присутствие
указывает на развитие патологического процес-
са — разрушение зубов, которое происходит глав-
ным образом в результате образования микроба-
ми молочной кислоты при обильном поступлении
сахарозы. Зубной налет находится в контакте со
слизистой оболочкой ротовой полости, которую
могут заселять наряду с другими микроорганиз-
мами спирохеты (например, виды рода Trepo-
nema'), способные проникать в слизистую обо-
лочку и развиваться в ней. Если слой налета
продолжает увеличиваться без существенного на-
рушения (при чистке щеткой), в нем возможно
развитие даже сульфатредуцирующих и метано-
генных бактерий, указывающее на серьезное по-
ражение зубов.
30.5.6. Микробы участвуют в процессах
коррозии и усиливают их
Металлические поверхности служат подходящим
субстратом для прикрепления бактерий, и мик-
робное обрастание внутренних поверхностей ме-
таллических труб уже упоминалось выше как
важнейшая проблема, например в системах снаб-
жения пресной водой. Бактерии могут использо-
вать металлы не только как поверхности для при-
крепления, но и как источники электронов в энер-
гетическом метаболизме, вызывая таким образом
коррозию и разрушение труб, особенно стальных
и железных.
Металлическое железо при контакте с водой
поляризуется и высвобождает ионы Fe2+. Элек-
троны при этом перемещаются внутри металла
и восстанавливают протоны в различных участ-
ках его поверхности, в результате чего образуется
тонкий слой газообразного водорода, который в
некоторой степени защищает поверхность железа
от дальнейшего окисления. Сульфатредуцирую-
щие бактерии, прикрепленные к такой поверхнос-
ти, поглощают водород, осуществляя восстановле-
ние сульфата до сульфида, и тем самым удаляют
защитную водородную пленку, ускоряя корро-
зию. Поступление дополнительных органических
субстратов повышает метаболическую активность
сульфатредукторов и поддерживает общий про-
цесс (рис. 30.15). Накапливающийся сульфид
железа может действовать в качестве дополни-
тельного катода и таким образом повышать кор-
родирующую активность сульфатредуцирующих
бактерий.
Бактерии заселяют также наружные стены
зданий из известняка и бетона. Они поглощают
в качестве питательных субстратов летучие неор-
ганические соединения серы и азота, которые при-
сутствуют в воздухе вследствие чрезмерного вне-
сения удобрений в сельскохозяйственные почвы,
сжигания содержащего серу каменного угля и час-
Рис. 30.15. Реакции, протекающие при анаэробной
коррозии железа (по теории деполяризации К. фон
Вольцоген-Кюра и И. ван дер Флюгта) и параллель-
ная сульфатредукция с использованием органических
субстратов. Светло-серым показано отложение сульфа-
та двухвалентного железа. Некоторые, но не все ор-
ганотрофно растущие бактерии-сульфатредукторы мо-
гут осуществлять также деполяризацию с использова-
нием водорода. СРБ — сульфатредуцирующие бактерии.
По И-
Глава 30. Экофизиология и экологические ниши прокариот 243
тичного окисления азота (образования NOX) при
работе автомобильных двигателей. Литотрофные
бактерии окисляют эти соединения до серной и
азотной кислот, которые растворяют карбонат-
ный «клей» известняка и бетона. Возникающая
коррозия наносит огромный ущерб, в частности
разрушая здания и монументы, представляющие
историческую ценность.
30.6. Перенос веществ обусловлен конвекцией и диффузией
по градиенту концентраций
В лабораторных опытах бактерии обычно куль-
тивируют в равномерно перемешиваемой жидкой
среде. При таких условиях растворенные субстра-
ты переносятся вместе со средой, т. е. с раство-
рителем, при ее движении, называемом конвек-
цией (или адвекцией). Аналогичным образом в
природе перенос растворенных веществ происхо-
дит с массой воды либо при ее горизонтальном пе-
ремещении (например, с течениями), либо — в сто-
ячей воде — при вертикальном турбулентном дви-
жении; в этом последнем случае перенос вещества
называют турбулентной диффузией. На са-
мом деле эта диффузия является процессом тур-
булентной конвекции. Процессы горизонтального
переноса (волны) вызывают образование вихрей,
с которыми растворенные вещества перемещают-
ся вниз в толщу воды и вновь вверх. Диаметр
таких вихрей может уменьшаться примерно до
0,5 мм в зависимости от температуры. В этом слу-
чае процесс связан с массопереносом воды в ма-
лом масштабе, который останавливается на рас-
стоянии примерно 0,5 мм от твердой поверхности.
На расстояниях менее 0,5 мм или в плохо переме-
шиваемых, негомогенных и полутвердых средах
(донные осадки, микробные пленки или ткани),
где конвекция механически тормозится, перенос
растворенных соединений возможен только путем
диффузии.
Дополнение 30.2. Газы в свободном со-
стоянии или растворенные в инертном рас-
творителе перемещаются путем диффузии,
которая описывается первым законом Фика:
de
J=-D~ (30.8)
d.T
где J — поток, т. е. количество соединения,
перемещающегося через единицу площади за
единицу времени; D — коэффициент диффу-
зии, который зависит от температуры и спе-
цифичен для данного соединения, и —
изменение концентрации на расстоянии х.
Время, необходимое для переноса путем диф-
фузии одной молекулы вдоль одной оси на
расстояние I, рассчитывается по формуле
t = (30.9)
Поскольку D — константа, время диффузии
возрастает пропорционально квадрату рас-
стояния. Таким образом, перенос путем диф-
фузии эффективен только на небольших рас-
стояниях. При малом масштабе расстояний
(на уровне размеров бактерий и процессов пе-
реноса веществ в их местообитаниях) перенос
путем диффузии занимает лишь миллисекун-
ды и является единственным реальным про-
цессом переноса. Более крупные организмы
зависят в гораздо большей мере от конвектив-
ного переноса веществ внутри своего тела, а
также в среде обитания.
При рассмотрении природных систем необ-
ходимо также учитывать характеристики ма-
териала, в котором происходит диффузия, та-
кие как пористость и кривизна; ими может
быть обусловлен более длинный случайный
путь, который проходит растворенная моле-
кула из-за повторных столкновений с части-
цами:
de
J = _^.ps (30.10)
da;
где ф — коэффициент пористости (в пределах
0,6-0,99) и Ds — кажущийся коэффициент
диффузии, рассчитанный с учетом эффекта
кривизны. Этот модифицированный вариант
первого закона Фика может быть использо-
ван для описания результирующего потока
244 Часть VIII. Прокариоты в биосфере
Рис. 30.16. Распределение Ог над и внутри глубоковод-
ных морских осадков. Концентрация кислорода снижа-
ется в направлении от области насыщения воздухом че-
рез диффузионный пограничный слой и далее к осад-
кам, достигая нуля на глубине 2,5 мм от поверхности
осадочных отложений. Обратите внимание, что в диф-
фузионном пограничном слое снижение концентрации
Ог имеет линейный характер. По [8].
растворенных веществ по градиенту концен-
трации от источника к приемнику, например
от продуцента к консументу. В качестве при-
мера диффузии газа на рис. 30.16 показан
профиль распределения кислорода над мор-
скими осадками и внутри них. Содержание
кислорода эквивалентно насыщающей кон-
центрации для воздуха (~300 мкМ) до глу-
бины примерно 0,5 мм над поверхностью, где
конвективный вихревой транспорт прекраща-
ется и возможна только диффузия («диффу-
зионный пограничный слой»). Кислород по-
требляется во всех слоях донных осадков до
глубины примерно 2,5 мм. Общую скорость
потребления кислорода в донных отложениях
можно определить с использованием уравне-
ния (30.10) по наклону линейной части кри-
вой концентрации кислорода в диффузион-
ном пограничном слое. Скорость потребле-
ния в более глубоких слоях осадков может
быть рассчитана таким же образом по накло-
ну кривой для каждого слоя.
Каждый градиент в структурированной
системе при ее динамическом равновесии
означает поток; каждый изгиб в таком гра-
диенте означает процесс.
Измерение градиентов диффузии стано-
вится распространенным подходом к изуче-
нию микробной активности в природных ме-
стообитаниях, поскольку созданы микроэлек-
троды с диаметром на кончике 5-20 мкм.
Эти микроэлектроды позволяют точно изме-
рять окислительно-восстановительные потен-
циалы и концентрации растворенных соеди-
нений, таких как протоны (pH), О2, H2S, NH3,
NO3 и NO2 ; сходные микроэлектроды име-
ются для определения метана. Таким обра-
зом, степень пространственного разрешения
при выяснении распределения субстратов и
метаболитов достигает уровня размеров бак-
териальных микроколоний.
30.6.1. Концентрационные градиенты
отражают динамику
потоков и активностей
Измеряя градиенты концентраций, можно полу-
чать сведения не только о распределении рас-
творенных веществ, но также об их потоках и о
связанных с их образованием и потреблением
микробных активностях. Для достоверной ин-
терпретации таких градиентов необходимо иметь
точные данные о температуре и других парамет-
рах, влияющих на микробную активность. Важ-
но также знать, находится изучаемая система в
динамическом равновесии (например, распреде-
ление сульфида в донных осадках) или еще не
достигла равновесия, вследствие, например, су-
точных изменений освещенности или поступления
кислорода.
Характеристики равновесных систем мож-
но проиллюстрировать двумя дополнительны-
ми примерами. Если в донных осадках концен-
трация соединения А снижается линейно в на-
правлении вниз от поверхности и концентрация
соединения Б — снизу к поверхности, это показы-
вает, что для данных соединений имеется толь-
ко один продуцент и один потребляющий орга-
низм (рис. 30.17, А). Снижение их концентраций
до нуля на одном и том же уровне В дает осно-
вание предполагать, что эти вещества реагируют
Глава 30. Экофизиология и экологические ниши прокариот 245
Рис. 30.17. Характер распределения субстратов в струк-
турированном матриксе (агар или донные отложения,
осадки) при динамическом равновесии.
А. Теоретический пример с единственным продуцентом
и единственным потребителем для веществ А и Б; В —
зона нулевой концентрации обоих веществ.
Б. Реальная ситуация в природных донных осадках с
высокой микробной активностью.
друг с другом или потребляются в результате ак-
тивности каких-либо организмов в данном слое.
Расчет соответствующих потоков по наклону кри-
вых и с учетом специфических коэффициентов
диффузии позволяет определять стехиометрию
реакций и тем самым выявлять происходящие
процессы независимо от того, имеют они хими-
ческую природу или осуществляются микроба-
ми. Чаще концентрация веществ изменяется не
прямо пропорционально глубине, но в соответ-
ствии со сложной зависимостью, как показано на
рис. 30.17, Б. Вещество А, например Ог, диффун-
дирует из толщи воды в осадки и потребляется
не только в слое В, но уже по пути к нему. Кри-
вая для вещества Б (рис. 30.17, Б) показывает,
что это соединение, например метан, образуется
не только в самых глубоких, по и в выше распо-
ложенных слоях донных осадков и потребляется в
слое В. Наклон концентрационной кривой в каж-
дом слое такой структурированной среды может
служить количественным показателем метаболи-
ческих процессов с участием данного соединения
(см. разд. 31.2).
30.6.2. «Градиентные бактерии» обитают
в зонах градиентов пространственно
разделенных субстратов
Структурированные среды, такие как донные
осадки, обеспечивают благоприятные условия для
бактерий некоторых метаболических типов, осо-
бенно для тех, которым приходится конкуриро-
вать (за энергетический субстрат) с химическим
процессом. Например, аэробные бактерии, окис-
ляющие сульфид при нейтральном значении pH,
такие как Beggiatoa, невозможно культивировать
в гомогенной среде, содержащей одновременно и
H2S и О2, поскольку в этих условиях данные суб-
страты взаимодействуют между собой и бактери-
ям их почти не достается. Трудности выращива-
ния аэробных серных бактерий при нейтральном
pH удалось преодолеть лишь недавно путем со-
здания условий, имитирующих их природное ме-
стообитание, т. е. путем выращивания в «гради-
ентных культурах».
Градиентные культуры выращивают в про-
бирках с полужидкой минеральной средой (0,2%
агар), на дне которых помещен источник серо-
водорода; поверхность среды контактирует с воз-
духом. Инокулят бактерий распределяют по все-
му объему среды. Через 4 сут инкубации нити
Beggiatoa накапливаются в одном тонком слое
(рис. 30.18, Б). Анализ распределения О2 и H2S
в пробирках с культурой и в контрольном ва-
рианте без засева показывает, что бактерии рас-
тут непосредственно в том слое, где эти вещества
«встречаются» друг с другом в таких низких кон-
центрациях, при которых химическое окисление
сульфида не составляет конкуренции бактериям.
В контрольном варианте H2S и О2 приходят в
контакт в более высоких концентрациях, и кри-
Рис. 30.18. Рост Beggiatoa sp. в полужидкой агаровой
среде с противоположно направленными градиентами
концентрации H2S и Ог-
А. Незасеянные контрольные пробирки через 4 сут ин-
кубации.
Б. Пробирки, засеянные Beggiatoa, через 3 сут инкуба-
ции. Биомасса Beggiatoa накапливается в зоне, показан-
ной серым. По [9].
246 Часть VIII. Прокариоты в биосфере
вые градиентов показывают, что оба эти веще-
ства частично потребляются в химической реак-
ции на довольно протяженных расстояниях, где
происходит диффузия (рис. 30.18, Л). Углы на-
клона кривых концентраций данных газов в опыт-
ном варианте значительно меньше по сравнению
с контрольным, что говорит о существенно более
интенсивном окислении сульфида в присутствии
бактерий.
Градиентные системы культивирования с
пространственным разделением взаимодействую-
щих субстратов необходимы для выращивания
«градиентных бактерий». Рост бактерий в такой
системе иллюстрирует, что осуществляемый ими
биологический процесс, как и все каталитичес-
кие реакции, значительно более эффективен, чем
некаталитическая реакция; скорость потребления
субстрата бактериями при его низкой концентра-
ции значительно выше, чем скорость химической
реакции с его участием. В результате своей ак-
тивности бактерии поддерживают разделение ре-
агентов и тем самым стабилизируют благоприят-
ную для них химическую структуру среды оби-
тания.
Рост серных бактерий Beggiatoa зависит от
пространственного разделения используемых ими
субстратов в донных осадках или в лаборатор-
ных условиях в полужидком агаре; в этих струк-
турирующих материалах бактерии могут переме-
щаться, обладая свойством хемотаксиса и спо-
собностью к скользящему движению. Другие
бактерии, окисляющие сульфид при нейтральной
реакции среды, например морские бактерии рода
Thiovulum^ обитают в толще воды и сами обеспе-
чивают себя структурирующим материалом. Ви-
ды Thiovulum пока не удается выделить в чистой
культуре, но возможно получить их накопитель-
ную культуру, если в аквариум с проточной мор-
ской водой поместить завернутый в марлю кусок
рыбы или сыра. Микробное разложение этого ор-
ганического материала при недостатке кислоро-
да вскоре приводит к выделению сероводорода в
процессе сульфатредукции. Через несколько дней
внесенный субстрат покрывается слоем бактерий.
Измерения с помощью микроэлектродов показы-
вают, что образующийся сплошной клеточный
слой является границей раздела между внутрен-
ней восстановленной зоной, богатой сероводоро-
дом, и наружной окисленной средой (рис. 30.19),
Рис. 30.19. Слой из клеток морских бактерий Thiovulum,
покрывающий плотный (анаэробный), богатый сульфи-
дом субстрат в кислородсодержащей морской воде. По-
глощение кислорода этими бактериями приводит к об-
разованию крутого градиента Ог в диффузионном по-
граничном слое толщиной 0,6 мм над слоем Thiovulum.
А. Схема экспериментальной системы.
Б. Кислородный градиент над слоем Thiovulum. По [10].
причем H2S и О2 с высокой скоростью потреб-
ляются внутри бактериальной пленки. Таким об-
разом, клетки сами разделяют два различных
компартмента и поддерживают это разделение в
результате активного окисления H2S в процессе
аэробного дыхания.
Необходимость разделения зон, как и в случае
окисления сероводорода кислородом, существует
при аэробном окислении железа. В среде с ней-
тральным значением pH ионы Fe2+ химически
окисляются молекулярным кислородом и железо-
окисляющие аэробные бактерии должны конку-
рировать с химическим процессом окисления. Та-
кие железобактерии, как Gallionella, относятся к
микроаэрофилам; они обитают в диффузионном
пограничном слое, прилегающем к отложениям
оксида трехвалентного железа, которые препят-
ствуют турбулентной конвекции воды. Кислород
может поступать в эту зону только путем диф-
фузии, причем диффузионный поток кислорода
зависит от интенсивности потребления О2 микро-
организмами пограничного слоя.
Магнитные бактерии также относятся к
микроаэрофилам и обитают в переходной зоне
между восстановленным и окисленным горизон-
тами в пресноводных донных осадках и морских
осадках, богатых органическими веществами. Эти
бактерии подвижны и в капле воды на предмет-
ном стекле собираются с ее северной или южной
стороны. С помощью кусочка скрепки их мож-
Глава 30. Экофизиология и экологические ниши прокариот 247
ю водить в этой капле в разных направлени-
IX. Ранее такие бактерии называли магнитотак-
:ическими по их способности ориентироваться в
магнитном поле. Клетки этих бактерий содержат
1,епочки частиц-магнитов диаметром 35-120 нм
рис. 2.18, Г), представляющих собой кристаллы
гибо магнетита (БезО4), либо грейгита (FesS^) и
физически ориентирующих клетку в магнитном
юле. Некоторые клетки содержат только одну та-
сую цепочку, другие несколько цепочек, располо-
кенных параллельно. Поскольку даже мертвые
слетки этих бактерий ориентируются в магнит-
юм поле, их поведение нельзя считать таксиче-
:ким (таксис предполагает участие сенсора и эф-
фектора), и позже им было дано более корректное
газвание— магнитные бактерии. К настоящему
времени лишь немногие из этих бактерий выде-
1сны в чистой культуре; несколько других штам-
пов из накопительных культур изучено в фило-
'енетичсском отношении с применением метода
1ЦР-амплификации. Магнитные бактерии не об-
>азуют цельного филогенетического кластера, но
?ходят, по-видимому, не менее чем в две раз-
1ые группы протеобактерий. Описанные чистые
сультуры являются микроаэрофильными бакте-
>иями; некоторые из них способны также вос-
станавливать нитрат. Они окисляют органиче-
ские субстраты, например жирные кислоты или
сукцинат; непосредственное участие железа в их
метаболизме не доказано. Отложению больших
соличеств железа в виде намагниченной смеси
?e(II)/Fe(III) способствуют условия окислитель-
но-восстановительной переходной зоны, в кото-
рую железо поступает в восстановленной форме
и затем подвергается окислению.
Для объяснения экологического значения маг-
нитной ориентации клеток предложена гипотеза,
согласно которой магнитная ориентация помо-
гает бактериям снова находить окислительно-
восстановительную переходную зону после ме-
ханического нарушения их местообитания. Без
магнитного управления движением бактерии
должны были бы искать подходящие для ник
условия «методом проб и ошибок», т. е. путем
обычного движения по способу пробежка/кувыр-
кание, наблюдаемого у других бактерий (см.
разд. 20.5.3). Силовые линии геомагнитного по-
ля, направленные к поверхности земли под угла-
ми, которые возрастают с приближением к по-
люсам, позволяют магнитным бактериям плыть
только в одном измерении, придавая их движе-
нию направление вниз, к бескислородным слоям
осадков. В пользу такого объяснения свидетель-
ствует тот факт, что магнитные бактерии, пре-
имущественно обитающие в северном полушарии,
обнаруживают движение, направленное к северу,
в южном полушарии — к югу. Такая поляризации
может изменяться под действием сильных маг-
нитных полей; она не детерминирована генетиче-
ски. Тем не менее каждая накопительная куль-
тура содержит также некоторое количество про-
тивоположно ориентированных клеток, возможно
имеющих низкую жизнеспособность в природных
условиях.
Ю.7. Микроорганизмы вступают
в различные кооперативные взаимодействия
£сли конкуренция весьма обычна в микробных
«обществах, то кооперация между разными ти-
гами микроорганизмов распространена менее ши-
юко. Большинство аэробных бактерий может осу-
цествлять энергетический метаболизм, например
>азложение сложного органического субстрата,
>ез существенной кооперации с другими мик-
юбами. Однако некоторые бактерии разлагают
убстрат не полностью, с высвобождением проме-
жуточного продукта разложения, и в конкурент-
ной борьбе за дальнейшее окисление могут побеж-
дать другие бактерии. Такая кооперация в приро-
де часто лишь факультативна, т. е. два данных
партнера не обязательно зависят друг от друга.
В других случаях кооперация основана на обмене
биогенными веществами, необходимыми для ро-
ста в микроколичествах, например витаминами
или агентами, хелатирующими тяжелые металлы.
248 Часть VIII. Прокариоты в биосфере
В лабораторных условиях такая зависимость мо-
жет быть преодолена путем внесения требуемых
веществ в питательную среду.
Более выраженная кооперация характерна
для анаэробных микробных сообществ. Полное
превращение сложного органического вещества,
такого как целлюлоза, в метан и диоксид угле-
рода в природе возможно только при совместной
активности не менее четырех различных групп
бактерий, в том числе первичных бродилыциков,
вторичных бродилыциков и двух типов метаноге-
нов (рис. 30.20).
Взаимоотношения между группами микроор-
ганизмов могут иметь различный характер. Для
случаев минимальной кооперации между дву-
мя партнерами применяют термин комменса-
лизм. Например, он характеризует ситуацию,
когда аэробная и анаэробная бактерии обитают
в одном и том же месте и аэробная бактерия,
потребляя кислород, создает условия для роста
анаэробной. В этом случае анаэробный организм
получает выгоду от активности аэробного, но по-
следний не имеет при этом заметной пользы или
вреда.
Применительно к пищевой цепи для коопе-
рации типа комменсализма употребляют термин
метабиоз. Так, метаногенное разложение фрук-
тозы можно получить в смешанной культуре, со-
стоящей из бактерии Acetobacterium woodii, ко-
торая сбраживает этот сахар с образованием
Рис. 30.20. Потоки углерода и электронов при метано-
генном разложении комплексного органического мате-
риала. Группы участвующих бактерий: 1 — первичные
бродильщики; 2 — водородокисляющие метаногенные
организмы: 3—метаногенные организмы, расщепляю-
щие ацетат; 4 — вторичные бродильщики; 5 — гомоаце-
тогенные бактерии; I, II, III — этапы разложения.
трех молекул ацетата, и бактерии Methanosarcina
barkeri, окисляющей ацетат до метана и диоксида
углерода. В этом случае второй компонент пище-
вой цепи получает выгоду от активности первого,
тогда как первый «остается при своих», кроме то-
го что превращение ацетата в нейтральные про-
дукты способствует стабилизации pH среды.
Термин синтрофизм относится к таким ва-
риантам кооперации, при которых оба партнера
полностью зависят друг от друга в своей жиз-
недеятельности и эта взаимозависимость не мо-
жет быть преодолена просто добавлением в среду
косубстрата или какого-либо другого питательно-
го вещества. Классический пример такого рода—
культура «Methanobacillus omelianskii», которая
оказалась смешанной культурой двух организмов-
партнеров: S-штамма и штамма М.о.Н. Эти штам-
мы совместно превращают этанол в ацетат и ме-
тан при обмене молекулярным водородом.
S-штамм:
2СН3СН2ОН + 2Н2О -> 2СН3СОО~ + 2Н+ + 4Н2
AG0' = +19 кДж/2 моль этанола (30.11)
Штамм М.о.Н.:
4Н2 + СО2 -» СН4 + 2Н2О
AG0/ = —131 кДж/моль метана (30.12)
Совместная культура:
2СН3СН2ОН + СО2 -> 2СН3СОО“ + 2Н+ + СН4
AG0/ = —112 кДж/моль метана (30.13)
Сбраживающая субстрат бактерия не может рас-
ти в отсутствие организма-партнера, удаляюще-
го водород, так как осуществляет в стандартных
условиях эндергоническую реакцию. Эта первая
реакция может протекать и служить источником
получения энергии только в том случае, если пар-
циальное давление водорода поддерживается на
достаточно низком уровне за счет активности ме-
таногена. Таким образом, ни один из партнеров по
отдельности не способен расти в среде с этанолом
и разложение этанола зависит от их кооперации.
Консорцией следует называть симбиотиче-
скую ассоциацию двух или большего числа ор-
ганизмов, образующих общую структуру. Извест-
ны фототрофные консорции «Pelochromatium» и
«Chlorochromatium», однако примеров образова-
ния подобных специфических структур среди бро-
Глава 30. Экофизиология и экологические ниши прокариот 249
дильных или других синтрофных ассоциаций по-
ка не обнаружено.
30.7.1. В анаэробных пищевых цепях образуются
метан, сероводород и диоксид углерода
Поскольку метаболические возможности у боль-
шинства строго анаэробных бактерий ограни-
чены, разложение ими сложных органических
соединений, например до метана и диоксида уг-
лерода, зависит от кооперации различных трофи-
ческих групп (рис. 30.20). Вначале под действием
главным образом внеклеточных гидролаз, выде-
ляемых первичными бродильщиками, биопо-
лимеры (полисахариды, белки, нуклеиновые кис-
лоты и липиды) расщепляются с образованием
олигомеров и мономеров (сахаров, аминокислот,
пуринов, пиримидинов, жирных кислот и глице-
рола). Далее те же бактерии разлагают их до
жирных кислот, сукцината, лактата, спиртов и
т. д. (рис. 30.20, группа 1). Ацетат, Нг и СО2, а
также другие одноуглеродные соединения могут
использоваться непосредственно метаногенами,
которые превращают их в метан и диоксид угле-
рода (рис. 30.20, группы 2 и 3). Разложение жир-
ных кислот с числом углеродных атомов боль-
ше двух, спиртов с числом углеродных атомов
больше одного, кислот с разветвленными цепя-
ми и ароматических жирных кислот осуществ-
ляет другая группа бактерий, называемых вто-
ричными бродильщиками (рис. 30.20, груп-
па 4). Они превращают свои субстраты в ацетат
и С1-соединения, используемые затем метаногена-
ми. Поскольку эти вторичные бродильщики осу-
ществляют реакции, которые в стандартных усло-
виях протекают с потреблением энергии (эндер-
гонические; см. разд. 12.2), они зависят от тесной
кооперации с партнером, осуществляющим следу-
ющую реакцию, как описано выше для смешанной
культуры «Mcthano bacillus omelianskii».
В анаэробных местообитаниях, богатых суль-
фатом, таких как морские донные осадки, началь-
ные процессы разложения полимеров также осу-
ществляют классические бактерии-бродилыцики,
образующие вышеупомянутые продукты бро-
жения. Многие бактерии, восстанавливающие
сульфат, обладают значительно более разнообраз-
ными метаболическими возможностями по срав-
нению с метаногенными бактериями и могут ис-
пользовать все основные классические продукты
брожения, окисляя их до диоксида углерода и од-
новременно восстанавливая сульфат до сульфи-
да. Недавно выделено несколько сульфатредуци-
рующих бактерий, способных использовать так-
же сахара или аминокислоты, но эти бактерии
не могут успешно конкурировать с классически-
ми бактериями-бродильщиками за субстраты.
Анаэробное разложение сложных орга-
нических соединений с образованием метана
происходит в три этапа. В нем участвуют бак-
терии — первичные и вторичные бродильщики
— и археи-метаногены; последние используют в
качестве субстратов ацетат, СО 2 и Н2. Сульфат-
зависимое окисление органических веществ про-
текает в два этапа и осуществляется первичными
бродильщиками и сульфатредуцирующими бакте-
риями. Другие бактерии могут выполнять вспо-
могательную роль в общем обороте субстратов.
В метаногенных и богатых сульфатом при-
родных средах первичные бродильщики (груп-
па 1) получают выгоду от активности водо-
родокисляющих партнеров, относящейся к ко-
нечному этапу разложения. Низкое парциальное
давление водорода (< 10-4 бар; < 10 Па) также
способствует высвобождению электронов в соста-
ве Н2 при окислительно-восстановительном по-
тенциале HADH (—320 мВ), и характер брожения
может сдвигаться в сторону большего образова-
ния ацетата, СО 2 и Н2, а не этанола или бути-
рата, и большего выхода АТР. Анаэробная бак-
терия Clostridium butyricum в чистой культуре
сбраживает гексозу с образованием ацетата, бу-
тирата, СО2 и Н2 и выходом энергии 3,3 моль
АТР на моль глюкозы. При давлении Н2, рав-
ном 10-4 бар (10 Па), С. butyricum образует толь-
ко ацетат, СО2 и Н2 с выходом энергии 4 моль
АТР на моль глюкозы.
В анаэробных осадках при равновесных усло-
виях или в водоочистной установке, где высокая
активность различных водородокисляющих бак-
терий способствует поддержанию низкого парци-
ального давления Н2, поток углерода и электро-
нов идет почти исключительно через «внешние»
части в общей схеме процессов (рис. 30.20), и вос-
становленные промежуточные продукты броже-
ния играют лишь незначительную роль. Тем не
менее поток центральных промежуточных про-
дуктов не может быть нулевым, поскольку при
250 Часть VIII. Прокариоты в биосфере
Таблица 30.7. Изменение свободной энергии при стандартных условиях в реакциях с выделением и потреблением
водорода. Для каждой реакции указаны характерные бактерии, осуществляющие синтрофное сбраживание субстра-
тов. Все расчеты основаны на опубликованных данных. В случае H2S и СОг использованы данные для газообразного
состояния
AG0/, кДж-моль-1 Характерные бактерии
Реакции с выделением Н2 Первичные спирты СН3СН2ОП + Н2о — СНзСОО- Ь Н' + 2Н2 +9,6 S-штамм, Dcsulfovibrio vulgaris Pelobacter acetylenicus
Органические кислоты СН3СН2СН2СОО- + 2Н2О 2СН3СОО- + Н+ + 2Н2 СН3СН2СОО- + 2Н2О -> СН3СОО- + со2 + ЗН2 СН3СОО- + Н+ + 2Н2О 2СО2 + 4Н2 +48,2 +76,0 +94,9 Syntrophomonas wolfei, S. sapovorans Syntrophobacter wolinii Штамм AOR
Ароматические соединения С6Н5СОО- + 6Н2О -> ЗСН3СОО- + 2Н+ + СО2 + ЗН2 +49,5 Syntrophus buswellii
Аминокислоты CH3CH(NH+)COO- + 2Н2О -> СНзСОО- + NH+ + СО2 + 2Н2 +2,7 Eubacterium acidaminophilum
Реакции с потреблением водорода
4Н2 + 2СО2 -> СН3СОО- + Н+ + 2Н2О 4Н2 + СО2 -» СН4 + 2Н2О н2 + S° -> H2S 4Н2 + SO4- + Н+ —» HS + 4Н2О H2C(NH^)COO~ + Н2 -* СНзСОО" + nh+ Фумарат + Н2 —» Сукцинат2- -94,9 -131,0 -33,9 -151,0 -78,0 -86,0 Acetobacterium woodii Methano spirillum hungatei Wolinella succinogenes Desulfovibrio vulgaris Eubacterium acidaminophilum Wolinella succinogenes
сбраживании липидов и аминокислот параллель-
но образуются жирные кислоты. Центральные
промежуточные продукты приобретают большее
значение, если в среде по той или иной причине
повышается содержание Щ, например при избыт-
ке субстрата брожения или снижении активности
метаногенных организмов вследствие падения pH
(< 6,0) либо воздействия токсичных соединений.
В этих условиях содержание в среде жирных кис-
лот будет возрастать, из-за чего может даже про-
исходить дальнейшее снижение pH, подавление
активности метаногенов и «свертывание» всей си-
стемы. Этот феномен часто наблюдается в плохо
сбалансированных системах очистки сточных вод
(см. гл. 36).
Метаногены, использующие водород и од-
ноуглеродные соединения, действуют как ре-
и, хотя осуществляемый ими этап разложения по-
следний, они обеспечивают максимальную энерге-
тическую эффективность всего процесса.
Роль бактерий, осуществляющих гомоацетат-
ное брожение (рис. 30.20, группа 5), в общем
процессе биоразложения органического материа-
ла менее ясна. Активность этих бактерий связы-
вает пулы одноуглеродных соединений и молеку-
лярного водорода с пулом ацетата. Благодаря раз-
нообразию своих метаболических возможностей
они способны участвовать и в сбраживании саха-
ров, и в разложении специфических субстратов,
таких как N-метильные соединения или метокси-
лированные фенолы. В определенных условиях,
например при низких значениях pH или низкой
температуре, они могут даже успешно конкури-
ровать с метаногенами и в той или иной мере вы-
Глава 30. Экофизиология и экологические ниши прокариот 251
30.7.2. В синтрофных ассоциациях
метаболически разнотипные
бактерии связаны межвидовым
переносом водорода
Помимо «Methanohacillus omelianskii», и другие
бактерии, такие как Thermoanaerobium brockii,
некоторые виды Pelobacter и окисляющие эта-
нол сульфатредукторы способны окислять этанол
в отсутствие сульфата благодаря тому, что во-
дород потребляется окисляющим его метаноген-
ным организмом-партнером. Некоторые метано-
гены способны непосредственно окислять этанол
без кооперации с синтрофными партнерами, но с
очень низкой скоростью, по-видимому не позво-
ляющей им конкурировать с синтрофными ассо-
циациями.
Сходная кооперация описана для синтроф-
ных культур, разлагающих органические кисло-
ты. Осуществляемые ими реакции с высвобожде-
нием водорода и названия бактерий приведены в
табл. 30.7. В общем, реакции разложения жирных
кислот до ацетата, Щ и СОг характеризуются
как значительно более энергозатратные при стан-
дартных условиях по сравнению с окислением
этанола, и парциальное давление водорода долж-
но достичь низкого значения (< 10-4 бар; 10 Па),
чтобы могло происходить разложение субстра-
та и запасание энергии. Синтрофное превраще-
ние субстрата с образованием двух молекул СО2
и четырех молекул Щ осуществляет умеренно
термофильная (58 °C) гомоацетогенная бакте-
рия, обозначаемая штамм AOR, способная как
окислять, так и синтезировать ацетат, в зависи-
мости от внешней концентрации Н2. Этот при-
мер показывает, насколько может быть близок к
термодинамическому равновесию анаэробный
энергетический метаболизм. Окислительным пре-
вращениям в ацетат и СО2 (плюс NH^) с со-
путствующим межвидовым переносом водорода
метаногенной бактерии-партнеру могут также
подвергаться ароматические соединения и ами-
нокислоты.
В реакциях с потреблением Н2 роль метаноге-
нов способны выполнять гомоацетогенные бакте-
рии или бактерии, восстанавливающие серу, суль-
фат, глицин либо фумарат (табл. 30.7). Таким
образом, сопряженное сбраживание двух ами-
нокислот (реакция Стикленда) может осуществ-
ляться не одной, а двумя бактериями-партнерами
в кооперации, при межвидовом переносе водоро-
2 Бутират
(10 мкМ)
I
-20 кДж
«Нг
4 Ацетат _
(50 мкМ)
СО2 (0,3 бар)
п—(0,7 бар)
-20 кДж
Рис. 30.21. Распределение общей свободной энергии
процесса между тремя метаболическими группами бак-
терий (I, II, III), участвующих в синтрофном превраще-
нии бутирата в метан и диоксид углерода.
да. Один партнер при этом окисляет, например,
аланин до ацетата, СО2, NH4 и Н2, тогда как дру-
гой использует Н2, например для восстановления
глицина до ацетата (см. рис. 12.32).
30.7.3. При синтрофном окислении
жирных кислот общий выход АТР
распределен по трем реакциям
Энергетику процесса превращения бутирата в ме-
тан и СОг бактериями-партнерами иллюстрирует
рис. 30.21. В общем процессе
2СН3СН2СН2СОО- + 2Н+ + 2Н2О -*
-» 5СН4 4- ЗСО2 (30.14)
при стандартных условиях изменение свободной
энергии AG0' составляет 177 кДж/2 моль бутира-
та. При концентрациях, близких к природным, на-
пример в пресноводных осадках или в водоочист-
ном сооружении-перегнивателе [бутират 10 мкМ;
СН4 0,7 бар (70 кПа); СОг 0,3 бар (30 кПа)], оно
равно 140 кДж/2 моль бутирата. Если это изме-
нение свободной энергии распределяется поровну
на все этапы процесса, то в каждой реакции AG0'
составляет примерно 20 кДж на 1 моль бутира-
та. Для этих значений свободной энергии могут
быть рассчитаны концентрации промежуточных
продуктов брожения: Н2 —10-4,7 бар; ацетат —
50 мкМ. Полученные величины довольно близки
к измеренным в активном иле. Сходным обра-
зом можно описать синтрофное разложение про-
пионата, при котором количество доступной для
бактерий-партнеров свободной энергии в отдель-
ных реакциях также составляет 20-22 кДж на 1
моль субстрата.
252 Часть VIII. Прокариоты в биосфере
Изменение свободной энергии в общем процес-
се разложения органических кислот с образова-
нием метана и СО2 разделено между отдельными
реакциями примерно равным образом (—20 кДж
на 1 моль исходного субстрата, что соответствует
1/3 эквивалента АТР; см. разд. 12.2). Эта вели-
чина находится в пределах минимальной порции
энергии, достаточной для образования АТР.
валента АТР. Все три промежуточных продукта
могут переноситься одновременно в данном про-
цессе разложения, или же происходит обмен в ос-
новном каким-либо одним из них, в зависимости
от типа разлагаемого субстрата. И
30.7.4. Межвидовой перенос формиата
и ацетата
Молекулярный водород, по-видимому, служит
идеальным переносчиком электронов между бак-
териями различных метаболических типов, но
иногда в этой роли выступает также формиат.
Стандартный окислительно-восстановительный
потенциал пары СОг/формиат примерно равен
потенциалу Н+/Н2 (—420 мВ и —414 мВ соответ-
ственно); таким образом, энергетика процесса в
обоих случаях примерно сходная. В лаборатор-
ных условиях можно выращивать искусственно
созданные синтрофные смешанные культуры, в
которых происходит перенос либо только фор-
миата, либо только Н2. В природных системах
водород и формиат могут использоваться как пе-
реносчики электронов одновременно.
Синтрофные бактерии-бродилыцики выделя-
ют также ацетат, используемый затем метано-
генами. Модель, представленная выше, показы-
вает, что удаление ацетата сильно влияет на
общую энергетику, например сбраживания бути-
рата. Ацетат служит единственным промежуточ-
ным звеном между партнерами при сиитрофном
превращении ацетона в метан и СО2; он должен
потребляться метаногенным партнером, чтобы не
происходило подавления активности первичных
броди лыциков.
Синтрофные ассоциации двух или трех мик-
роорганизмов осуществляют разложение слож-
ных органических соединений с образованием ме-
тана благодаря переносу между ними водорода,
формиата или ацетата в низких концентрациях.
Это позволяет каждому партнеру получать энер-
гию в количестве не менее —20 кДж на 1 моль
исходного субстрата, что эквивалентно 1/3 экви-
30.7.5. Метан образуется в различных средах
В наибольшем количестве метан образуется в
пресноводных осадках, увлажненных почвах,
анаэробных водоочистных установках и рубце
жвачных животных. Эти среды различаются по
скорости поступления субстрата, средней темпе-
ратуре и времени оборота веществ (табл. 30.8).
Для донных осадков (см. разд. 31.2) характер-
ны медленное поступление субстрата и низкая
температура; время разложения в них биомассы
до метана и диоксида углерода нс лимитировано.
В водоочистных установках (см. гл. 36) имеется
высокая концентрация частично трансформиро-
ванных субстратов, которые не полностью пре-
вращаются в метан и диоксид углерода за огра-
ниченное время (обычно 2-4 пед). Следовательно,
концентрации водорода, ацетата и жирных кислот
с более длинными цепями здесь несколько выше,
чем в осадках, по все же достаточно низки, чтобы
могло происходить сиптрофное разложение жир-
ных кислот. В рубец (см. разд. 31.5.1) периодиче-
ски поступает большое количество легкоразлагае-
мых субстратов, которые подвергаются быстрому
сбраживанию до жирных кислот и Н2 при повы-
шенной температуре. Среднее время пребывания
порции содержимого в рубце составляет 0,5-2 сут,
что недостаточно для развития метаногенов, ис-
пользующих ацетат, или синтрофных сообществ,
сбраживающих органические кислоты. В связи с
этим метан образуется в рубце только из одноуг-
леродных соединений и Н2 и одновременно проис-
ходит накопление в высоких концентрациях аце-
тата, пропионата и бутирата, которые поглоща-
ются через слизистую оболочку. Таким образом,
эта система оптимальна не для наиболее эффек-
тивного превращения органического материала в
метан и диоксид углерода, но для эффективного
сбраживания углеводов до жирных кислот и тем
самым для питания животного-хозяина.
Глава 30. Экофизиология и экологические ниши прокариот 253
Таблица 30.8. Характеристики местообитаний метаногенов
Средняя темпе- ратура, °C Среднее время задержания, d Концентрация
ацетат, мкМ пропионат, мкМ бутират, мкМ Н2. Па
Донные осадки эвтрофных озер 4-10 «00» 0,5-200 0,1-20 0,1-10 0,5-5
Водоочистная установка (активный ил) 30-35 15-30 5-6000 1-500 1-500 1-10
Рубец жвачных 37-39 0,5-2 60 000 20 000 10 000 20-5000
30.7.6. Метаногены могут образовывать
ассоциации с простейшими
Функцию первичных бродильщиков (группа 1 на
рис. 30.20) при разложении сложных органиче-
ских соединений до метана и СО2 могут осуществ-
лять строго анаэробные простейшие. Извест-
ны анаэробные грибы, ресничные инфузории и
жгутиковые, которые хорошо развиваются в пол-
ностью бескислородной среде при восстановитель-
ных условиях, и некоторые из них чрезвычай-
но чувствительны к О2. Поскольку аэробное ды-
хание в таких условиях невозможно, анаэробные
простейшие не содержат митохондрий. В их клет-
ках имеются выделяющие молекулярный водород
органеллы, называемые гидрогеносомами. Ме-
таболизм у этих простейших бродильного типа;
поглощаемые частицы, главным образом клетки
бактерий, поступают в пищеварительные вакуо-
ли, где перевариваются путем гидролиза и сбра-
живания.
Анаэробные простейшие могут образовывать
ассоциации с симбиотическими метаногенами, ло-
кализованными либо вне, либо внутри их клеток.
На поверхности ресничных инфузорий, обитаю-
щих в рубце жвачных животных, обычно при-
сутствуют метаногены, которые можно выявить
по их собственной флуоресценции (обусловленной
фактором F420). Эти метаногены, по-видимому,
тесно ассоциированы с поверхностью клеток про-
стейшего в периоды малого поступления субстра-
та и высвобождаются после приема животным пи-
щи. Ресничные инфузории, обитающие в строго
анаэробных донных осадках эвтрофных озер, со-
держат метаногены-партнеры даже внутри своих
клеток, часто в тесной ассоциации с гидрогено-
сомами. Метаногены удаляют водород и форми-
ат, обеспечивая условия для сбраживания орга-
нических веществ, главным образом до ацетата
и СО2- Благодаря этому не происходит потери
органических субстратов в виде восстановленных
конечных продуктов брожения, таких как этанол
и органические кислоты, и простейшее получает
максимальный выход АТР в результате брожения
(см. разд. 30.7.1).
В данном случае симбиотические метаноген-
ные организмы частично выполняют функцию
митохондрий, имеющихся у аэробных простей-
ших. Восстановительные эквиваленты удаля-
ет симбиотический партнер, и обмен веществ в
эукариотической клетке-хозяине обеспечивает
максимальный выход АТР. В экспериментах с
кормлением скорость роста и выход биомассы
ресничных инфузорий, ассоциированных с мета-
ногенами, могут быть на 35% выше, чем в кон-
трольных культурах без бактерии-партнера. Ме-
таногенные организмы занимают до 10% объема
клеток ресничной инфузории.
Молекулярный водород, выделяемый гидроге-
носомами, предположительно образуется в основ-
ном в результате окисления пирувата до ацетил-
СоА в пируватсинтазной реакции. Этот фермент
присутствует в гидрогеносомах наряду с фер-
редоксином и гидрогеназой (рис. 30.22; см. цв.
вклейку). Среди строго анаэробных ресничных
инфузорий подробно изучены Trimyema сотр-
ressum, Metopus striatus, М. palaeformis, Plagio-
pyla nasuta и P. frontata. В качестве их внут-
риклеточных симбионтов идентифицированы
среди прочих организмов Methanobacterium for-
micicum и Methanoplanus endosymbiosus. Гид-
рогеносомы и метаногенные эндосимбионты об-
разуют вместе функциональную структуру, ко-
торая в определенной степени заменяет мито-
хондрии для организмов в анаэробных место-
обитаниях. У некоторых простейших, напри-
254 Часть VIII. Прокариоты в биосфере
мер таких крупных ресничных инфузорий, как
Plagiopyla frontata, гидрогеносомы и метаноге-
ны расположены чередующимися слоями, что
обеспечивает оптимальный перенос водорода. По
одной гипотезе, гидрогеносомы строго анаэроб-
ных простейших возникли из митохондрий их
аэробных предков; согласно другой точке зрения,
гидрогеносомы родственны клостридиям. Изу-
чение кооперации метаногенных эндосимбион-
тов с простейшими-хозяевами сопряжено с боль-
шими трудностями, поскольку этих простейших
сложно культивировать. Пока описана только од-
на совместная (аксеничная) культура Тггтпуета
compressum. Метаногенные бактерии-партнеры
в большинстве случаев, по-видимому, находят-
ся в цитоплазме простейшего в свободновзве-
шенном состоянии, т. е. не окружены мембра-
ной. Каждый вид простейших содержит толь-
ко один тип флуоресцирующих метаногенных
эндосимбионтов. Очевидно, что эти эндосим-
бионты происходят не от метаногенных организ-
мов, случайно поглощенных в качестве пищи.
В клетках некоторых простейших обнаружива-
ются также фототрофные или сульфатредуциру-
ющие бактерии. Следует упомянуть, что многие
другие простейшие также содержат бактерии-
эндосимбионты, роль которых пока неизвестна.
В ассоциации со многими строго анаэробны-
ми простейшими обитают симбиотические ме-
таногенные организмы, присутствующие либо
на поверхности, либо внутри их клеток как свя-
занные с гидрогеносомами. Эти симбионты ча-
стично выполняют ту роль, которую у аэробных
простейших выполняют митохондрии. Бактерии
потребляют восстановительные эквиваленты, бла-
годаря чему эукариотическая клетка-хозяин мо-
жет осуществлять брожение с максимальным вы-
ходом АТР.
30.7.7. В синтрофных ассоциациях хемотрофов
и фототрофов связывающими их
субстратами служат соединения серы
Зеленые серные бактерии сем. Chlorobiaceae окис-
ляют H2S до сульфата с образованием в качестве
промежуточного продукта молекулярной серы,
которая откладывается вне клеток. В накопитель-
ных культурах зеленых серных бактерий, исполь-
зующих органические вещества, была обнаруже-
на фототрофная ассоциация (« Chloropseudomonas
ethylica»), в которой восстанавливающая серу ге-
теротрофная бактерия Desulfuromonas acetoxidans
окисляет органический субстрат (например, аце-
тат) и восстанавливает серу до H2S, обеспечивая
потребности фототрофной бактерии в восстанови-
теле (рис. 30.23). Таким образом, сера служит в
этой ассоциации переносчиком электронов между
двумя партнерами и регенерирует с высокой ско-
ростью. Кооперация становится тем теснее, чем
меньше пул серы, причем общий урожай клеток в
смешанной культуре значительно превышает сум-
марный выход биомассы в двух чистых культу-
рах. Отложение серы вне клеток у зеленых бакте-
рий (в противоположность пурпурным фототроф-
ным бактериям сем. Chromatiaceae, у которых
сера откладывается внутри клеток) обеспечива-
ет им преимущество — возможность кооперации с
бактерией-партнером.
Для описанной кооперации между фототроф-
ной и хемотрофной бактериями характерно обра-
зование структурных единиц, называемых кон-
сорциями. При микроскопическом исследовании
проб воды из окислительно-восстановительной
переходной зоны мелких эвтрофных озер или ка-
нав часто обнаруживаются мелкие зеленые «ор-
ганизмы» неправильной формы, в которых толь-
ко после их механического разрушения (напри-
мер, растиранием) можно выявить по крайней
мере два типа бактерий. В центре этих образо-
ваний находится бесцветная палочковидная бак-
терия; к ее поверхности прикреплено несколько
клеток зеленой или бурой фототрофной бакте-
рии. Хотя бактерии-партнеры из этих консорций
никогда не были выделены в виде чистых куль-
Рис. 30.23. Синтрофная кооперация на основе оборота
серы между зеленой фототрофной бактерией и хемот-
рофной бактерией, восстанавливающей серу.
Глава 30. Экофизиология и экологические ниши прокариот 255
тур, они носят названия в соответствии с исход-
ными описаниями — Chlorochromatium aggregatum
или Pelochromatium sp. (рис. 30.24; см. цв. вклей-
ку). Предположительно клетка в центре консор-
ции представляет собой хемотрофную бактерию,
восстанавливающую сульфат или серу до H2S и
тем самым снабжающую фототрофные эпибион-
ты источником электронов. Благодаря способно-
сти центральной клетки к движению комплексная
структура обладает фототаксической реакцией,
т. е. неподвижные зеленые эпибионты получают
выгоду от подвижности партнера. По-видимому,
между клетками этих двух типов имеет место сво-
его рода сигнализация.
30.7.8. Кооперация возможна
и во многих других формах
Накопительные культуры метанокисляющих
аэробных бактерий обычно содержат также ме-
танолокисляющие бактерии, и разделить эти два
типа организмов весьма сложно, особенно при
использовании сред с высокой концентрацией
субстрата. Метанокисляющие аэробы, такие как
Methylosinus trichosporium и Methylococcus, часто
ассоциированы с видами Hyphomicrobium, эффек-
тивно окисляющими метанол. Смешанная куль-
тура бактерий этих двух типов в среде с метаном
растет значительно лучше, чем чистая культура
метанокисляющей бактерии. Очевидно, стимуля-
ция ее роста происходит благодаря тому, что мета-
нокисляющие бактерии Hyphomicrobium потреб-
ляют токсичный в определенных концентрациях
метанол (и/или формальдегид), который метано-
кисляющие бактерии выделяют в значительном
количестве при избытке субстрата.
У азотфиксирующих нитчатых цианобакте-
рий вокруг гетероцист (их образование происхо-
дит при дефиците связанного азота) накаплива-
ется большое количество хемотрофных бактерий,
в том числе гетеро- и автотрофных водородокис-
ляющих бактерий. Эти бактерии растут за счет
использования выделяемых гетероцистами орга-
нических веществ и Щ и благодаря своей интен-
сивной дыхательной активности обеспечивают за-
щиту от О2 чувствительной к нему нитрогеназы,
содержащейся в гетероцистах.
Можно привести еще большое число приме-
ров подобного рода, так как в природе коопера-
ция между микроорганизмами различных мета-
болических типов, возможно, скорее правило, а
не исключение. При изучении микроорганизмов
по отдельности кооперативную активность часто
полностью упускают из вида.
Дополнительная литература
Akkermans A. D. L., van Elsas J.D., de BruijnE.J.
(1995) Molecular microbial ecology manual. Dord-
recht: Kluwer.
Amann R., Ludwig W., Schleifer К. H. (1995) Phyloge-
netic identification and in situ detection of individual
microbial cells without cultivation. Microbial Rev.
50: 143-169.
Atlas R. M., Bartha R. (1993) Microbial ecology, funda-
mentals and applications, 3rd edn. Mento Park, Calif:
Benjamin/Cummings.
Brock T. D. (1966) Principles of microbial ecology. Engle-
wood Cliffs, J: Prentice-Hall.
Costerton J. W., Lewandowski Z., Caldwell D. E., Kor-
ber D.R., Lappin-Scott H. M. (1995). Microbial bio-
films. Annu. Rev. Microbiol. 49: 711-745.
Egli T. (1995). The ecological and physiological signi-
ficance of the growth of heterotrophic microorga-
nisms with mixtures of substrates. In: Jones J. G.
(ed.) Advances in microbial ecology, vol. 14. New
York: Plenum Press; 305-386.
Fcnchel T., Blackburn T. H. (1979) Bacteria and mineral
cycling. London New York: Academic Press.
Ferry J. G. (1993) Methanogenesis. Ecology, physiology,
biochemistry and genetics. New York: Chapman &
Hall.
Finlay B..1. Fenchel T. (1992). Methanogens and other
bacteria as symbionts of free-living anaerobic ciliates.
Symbiosis 14: 375-390.
Fletcher M., Marshall К. C. (1992) Are solid surfaces
of ecological significance to aquatic bacteria? In:
Marshall K.C. (ed.). Advances in microbial ecology,
vol. 6. New York: Plenum Press; 199-236.
Geesey G. G., Lewandowski Z., Flemming H.-C. (1994)
Biofouling and biocorrosion in industrial water sys-
tems. Boca Raton Ann Arbor London Tokyo: Lewis.
Ghiorse W. C. (1984). Biology of iron- and manganese-
depositing bacteria. Annu. Rev. Microbiol. 38: 515-
550.
Gottschal J. C. (1993). Growth kinetics and competition:
some contemporary comments. Antonie can Leeuwen-
hoek 63: 299-313.
Grigorova R., Norris J. R., eds (1990). Methods in mic-
robiology, vol. 22: Techniques in microbial ecology.
London New York: Academic Press.
256 Часть VIII. Прокариоты в биосфере
Kjelleberg S. (1993). Starvation in bacteria. New York
London: Plenum Press.
Lawrence J. R., Korber D. R., Wolfaardt G. M., Cald-
well D.E. (1995). Behavioral strategies of surface-co-
lonizing bacteria. In: Jones .LG. (ed.) Advances in
microbial ecology, vol. 14. New York London: Plenum
Press; 1-75.
Leadbetter E. R., Poindexter J. S., eds. (1985) Bacteria in
nature, vols 1-3. New York London: Plenum Press.
Lovley D. R. (1993). Dissimilatory metal reduction. Annu
Rev. Microbiol. 47: 263-290.
Lynch J.M., Hobbie J.E. (1988). Microorganisms in ac-
tion: concepts and applications in microbial ecology.
Oxford London: Blackwell.
Mitchell R., ed. (1992). Environmental microbiology.
New York: Wiley.
Muller M. (1988). Energy metabolism of protozoa
without mitochrondria. Annu Rev. Microbiol. 42:
465-488.
Neu T. R. (1996) Significance of bacterial surface-active
compounds in interaction of bacteria with interfaces.
Microbiol. Rev. 60: 151-166.
Poindexter J. S. (1981).Oligotrophy. Fast and famine
existence. Adv. Microbial. Ecol. 5: 63-89.
Schink B. (1991). Syntrophism among prokaryotes. In:
Balows A., Triiper H. G., Dworkin M., Schleifer К. H.
(eds.) The prokaryotes, 2nd edn. Berlin Heidelberg
New York: Springer; 276-299.
Schwarzenbach R. P., Gschwend P. M., Imboden D. M.
(1993). Environmental organic chemistry. New York:
Wiley.
Schwertmann U., Cornell R. M. (1991). Iron oxides in the
Laboratory. Weinheim: VCH.
Stumm W., Morgan J. J. (1981). Aquatic chemistry, 2nd
edn. New York: Wiley.
Thauer R. K., Jungermann K., Decker K. (1977). Energy
conservation in chemotrophic anaerobic bacteria.
Bacteriol Rev. 41: 100-180.
Wetzel R.G. (1983). Limnology, 2nd edn. Philadelphia:
Saunders.
Widdel F. (1988). Microbiology and ecology of sulfate-
and sulfur-reducing bacteria. In: Zehnder A. J. B.
(ed.) Biology of anaerobic microorganisms. New York:
Wiley; 469-585.
Wimpenny J. W.T. (1993). Microbial systems: patterns
in time and space. Adv. Microbial Ecol. 12: 469-522.
Источники рисунков
1. Wetzel R. G. (1983) Limnology, 2nd edn. Philadel-
phia: Saunders; 46.
2. Wetzel R.G. (1983) Limnology, 2nd edn. Philadel-
phia: Saunders; 56.
3. Widdel F., Schnell S., Heising S., Ehenreich A., Ass-
mus B., Schink B. (1993) Ferrous iron oxidation by
anoxygenic phototrophic bacteria. Nature 362: 834-
836.
4. Ostling J., Homquist L, Flardh K., Svenblad B.,
Jouper-Jan A., Kjelleberg S. (1993) Starvation and
recovery of Vibrio. In: Kjelleberg S. (ed.) Starvation
in bacteria. New York London: Plenum Press; ЮЗ-
127.
5. Gottschal J. C, de Vries S., KuenenJ.G. (1979)
Competition between the facultatively chemolitho-
trophic Thiobacillus A2, an obligately chemolithotro-
phic Thiobacillus and a heterotrophic Spirillum for
inorganic and organic substrates. Arch. Microbiol.
121: 241-249.
6. Schink B. (1988) Principles and limits of anaerobic
degradation: environmental and technological as-
pects. In: Zehnder A. J. B. (ed.) Biology of anaerobic
microorganisms New York: Wiley; 771-846.
7. Widdel F. (1988) Microbiology and ecology of
sulfate- and sulfur-reducing bacteria. In: Zehn-
der A. J. B. (ed.) Biology of anaerobic microor-
ganisms. New York: Wiley; 469-585.
8. Revsbech N. P., Jorgensen В. B., Blackburn T. H.
(1980) Oxygen in the sea bottom measured with a
microelectrode. Science 207: 1355-1356-
9. Nelson D. C, Jorgensen В. B., Revsbech N. P. (1986)
Growth pattern and yield of a chemoautotrophic
Beggiatoa sp. in oxygen-sulflde microgradients. Appl.
Environ. Microbiol. 52: 225-233.
10. Jorgensen В. B., Revsbech N.P. (1983) Colorless
sulfur bacteria, Beggiatoa spp., Thiovulum spp., in
O2 and H2S microgradients. Appl. Environ. Micro-
biol. 45: 1261-1270.
11. Pfennig N. (1980) Syntrophic mixed cultures and
symbiotic consortia with phototrophic bacteria: a
review. In: Gottschalk G., Pfennig N., Werner H.
(eds.) Anaerobes and anaerobic infections. Stuttgart
New York: Fischer, 127-131.
► Рис. 22.1. Вегетативный клеточный цикл у бактерий
(в случае низкой скорости роста). Во внутреннем кру-
ге отмечены периоды В, С и D. Ключевые процессы
и форма клеток показаны в наружном круге. Нерепли-
цирующиеся нуклеоиды и реплицирующиеся нуклеоиды
показаны в клетках в виде белых и красных областей
соответственно.
А
Мембрана
Держатель
О
А
6
6
Элюция
свежей средой
д новообразованными
О клетками
Среда
Экспоненциально растущая культура
Перевертывание фильтра
Капли
использованной
среды
► Рис. 22.2. Метод элюции с мембраны.
А Экспоненциально растущую культуру бактерий быстро охлаждают и пропускают через нитроцеллюлозный
фильтр. Когда на фильтре собрано достаточное количество клеток, держатель фильтра переворачивают горлыш-
ком вниз. Затем через фильтр начинают пропускать нагретую питательную среду. На фильтре сохраняется слой
прикрепленных к фильтру бактерий, которые дают рост на его поверхности. Когда клетка разделяется, одна из
дочерних клеток (не прикрепленная к фильтру) элюируется со средой (см. Б); такие клетки собирают как исходный
материал для синхронной культуры или как фракцию для анализа.
Б. Экспоненциальная популяция состоит из клеток различного возраста. Возраст новообразованных клеток обозна-
чен как 0, клеток, заканчивающих деление — как 1. На схеме поперечного сечения фильтра показаны прикрепленные
клетки в порядке увеличения возраста (новообразованная клетка — слева). Неприкрепленная дочерняя клетка, об-
разовавшаяся из самой старой клетки (на схеме справа), элюируется первой; со временем появляются дочерние
клетки от клеток, которые были моложе в начале инкубации/элюции (на схеме справа налево в порядке уменьше-
ния возраста). Перед фильтрованием культура была импульсно помечена [3Н]-тимидином (таким образом метится
ДНК, которая реплицировалась во время мечения); на схеме клетки, включившие метку, показаны красным. Первые
дочерние клетки происходят от тех клеток, которые находились в момент осаждения на фильтре в периоде D; они не
включили метку. Затем появляются дочерние клетки от клеток, находившихся в периоде С или В; первые меченые,
тогда как вторые немеченые.
В. Во фракциях клеток, собранных в процессе элюции, измеряют радиоактивность. Г рафик показывает циклические
изменения в уровне радиоактивности новообразованных клеток и позволяет оценить продолжительность периодов
В, С и D.
◄ Рис. 22.4. 11ерекрывание циклов репликации при
быстром росте.
А. Репликация кольцевой бактериальной хромосомы на-
чинается с единственного сайта oriC и протекает в двух
направлениях, заканчиваясь на сайте терминации terC.
Показаны хромосомы на четырех различных стадиях ре-
пликации. Внизу приведен вид колец ДНК в боковой
плоскости, в которой они выглядят как линии с разветв-
лениями или без них.
Б. Время генерации изменяется в зависимости от со-
става среды. Продолжительность периодов С и D у
Е. coli не зависит от скорости роста и составляет при
37 °C примерно 40 и 20 мин соответственно. Время
«—100» означает момент за 100 мин до начала клеточ-
ного деления, происходящего в момент времени 0. Рису-
нок демонстрирует время инициации клеточного деле-
ния при различных скоростях роста. При времени гене-
рации свыше 60 мин (период С + период D) в молодых
клетках имеет место период без репликации ДНК (пе-
риод В). В образующихся дочерних клетках хромосома
находится в нереплицирующемся состоянии. При вре-
мени генерации 30—60 мин еще в материнской клетке
начинается репликация двух разошедшихся хромосом и
в дочерних клетках хромосома частично реплицирова-
на. Таким образом, в них присутствуют две точки на-
чала репликации и в течение одного клеточного цикла
происходит инициация в двух точках начала в каждой
клетке. Наконец, при времени генерации 20-30 мин по-
сле начала репликации в клетке-«бабке» в образующих-
ся клетках происходят два последовательных цикла ре-
пликации, т. е. в каждом клеточном цикле происходит
инициация в четырех точках начала репликации.
▲ Рис. 22.5. Эксперименты с изменением плотности среды по Мезелсону и Сталю.
А. Экспоненциальный рост бактерий в «тяжелой» среде (например, содержащей [13С]-глюкозу + (151\1]Н4С1). После
кратковременного мечения [3Н]-тимидином клетки переносят в «легкую» среду (например, содержащую [12С]-глю-
козу 4- [14N]H4.CI) на период, равный удвоенному времени генерации или больший период. Схема показывает рас-
пределение тяжелой и легкой ДНК в репликационной вилке в различное время.
Б. Через определенное время отбирают пробы и разделяют ДНК в градиенте плотности CsCI соответвенно ее
различной плотности. Измеряют радиоактивность в различных фракциях. График демонстрирует распределение,
полученное немедленно после введения метки [3Н] (слева) и в момент, когда примерно половина [3Н]-меченной ДНК
реплицировалась второй раз (справа).
В. На графике представлены результаты, которые получаются, если репликация жестко связана с клеточным циклом,
происходит случайным образом или случайным образом с эклипс-периодом между последовательными события-
ми репликации. Обозначения: жирная красная линия — тяжелая (Т) цепь ДНК; тонкая красная линия — легкая (Л)
цепь ДНК; красная пунктирная линия — импульсно меченная [3Н] тяжелая цепь ДНК; ТТ — обе цепи ДНК тяжелые;
ТЛ — в молекуле ДНК одна цепь тяжелая и одна легкая
▲ Рис. 22.7. Инерционная репликация.
А В момент времени 0 к экспоненциально растущей популяции бактерий был добавлен рифампицин, а также це-
фалексин (последний — для подавления клеточного деления во время эксперимента). Завершению уже начавшейся
репликации эти антибиотики не препятствуют. На графике показаны общее количество ДНК (сплошные линии) и
скорость синтеза ДНК, измеренная методом импульсного мечения (штриховая линия). Прирост — относительное
повышение содержания ДНК после подавления синтеза РНК.
Б. Прирост как функция времени генерации (т). В. Цитограммы, полученные методом проточной цитометрии.
После инерционной репликации ДНК все клетки содержат целое число копий генома, эквивалентное числу точек
начала репликации, присутствующих в клетках в момент добавления рифампицина. Если все копии oriC в каж-
дой клетке инициируются одновременно, в эксперименте по инерционной репликации образуются клетки с одним,
двумя, четырьмя или шестью копиями генома (синхронный фенотип; сплошная линия); если, однако, отдельные
акты инициации репликации происходят не одновременно, рифампицин может блокировать инициацию репликации
в некоторых клетках до того, как в них произойдут все акты инициации. Это приводит к появлению клеток с тремя,
пятью, шестью или семью копиями генома (асинхронный фенотип; штриховая линия). Цитограммы для культур без
добавления рифампицина приведены на рис. 22.3.
► Рис. 23.5. Топографическая модель образова-
ния ЛПС у 5. typhimurium по механизму наращи-
вания молекулы на редуцирующем конце: синтез
О-специфической структурной единицы и ее пе-
ренос через мембрану, сборка О-специфического
полисахарида и сшивка его с комплексом олиго-
сахаридный остов-липид А с образованием ЛПС.
А. Образование ундекапренолдифосфосахара из
NDP-caxapa (UDPGlcNAc или UDPGal) и undec-P
на внутренней стороне плазматической мембра-
ны (начальная реакция, катализируемая Rfe или
RfbP). Б. Образование повторяющейся структур-
ной единицы (показана красным овалом) О-спе-
цифической полисахаридной боковой цепи на
внутренней стороне плазматической мембраны
(его катализируют кодируемые генами rfb транс-
феразы, показанные большими розовыми овала-
ми) и ее перенос через плазматическую мембра-
ну (возможно, с помощью белка Rfbx; показан
розовым прямоугольником). В. Полимеризация
структурных единиц полисахарида на наружной
стороне плазматической мембраны катализиру-
ется Rfc-полимеразой (показана розовым). Г. Пе-
ренос синтезированного полисахарида на ком-
плекс олигосахаридный остов-липид А с обра-
зованием О-специфического ЛПС на наружной
стороне плазматической мембраны (катализиру-
ется транслоказой/лигазой Rfal и RfbT). Ме-
ханизм транспорта полностью синтезированного
ЛПС к внешней стороне наружной мембраны и
его включение в мембрану пока неясен. NDP —
нуклеотиддифосфат. По [2].
▲ Рис. 23.6. Топографическая модель образования ЛПС у Е. coli по механизму наращивания молекулы на нере-
дуцирующем конце: синтез полисахарида, его перенос через мембрану и сшивка с комплексом олигосахаридный
остов-липид А с образованием ЛПС.
А. Образование ундека пренолдифосфо-GlcN Ас из UDPGlcNAc и undec-P на внутренней стороне плазматической
мембраны (начальная реакция, катализируемая ферментом Rfc; показан розовым овалом).
Б. Образование полисахаридной цепи на внутренней стороне плазматической мембраны без отделения от undec-P
катализируется Rfb-сахаротрансферазами (фермент показан розовым овалом на конце полимера, состоящего из
показанных красным структурных единиц); Rf-полимераза не участвует в процессе.
В. Перенос синтезированного полисахарида через плазматическую мембрану катализирует транспортная Rfb-сис-
тема АВС-2-типа, состоящая из трансмембранного каналообразующего белка (показан продолговатыми розовыми
структурами) и ATP-связывающего белка (показан розовыми кружками) в качестве источника энергии для переноса.
Г. Связывание О-специфического полисахарида с комплексом олигосахаридный остов-липид А на наружной стороне
плазматической мембраны с образованием ЛПС. Механизмы транспорта синтезированного ЛПС к внешней стороне
наружной мембраны и интеграции в нее ЛПС неизвестны. NDP — нуклеотиддифосфат. По [2].
Утрата
подвижности ЖГУ™К?
и пилеи
Задержка репликации
и деления в швермерных
клетках; 30 мин
◄ Рис. 24.1. Caulobacter crescentus: дифференцировка
в швермерные и стебельковые клетки, зависимая от кле-
точного цикла. После клеточного деления в стебелько-
вой клетке может немедленно начаться новый клеточ-
ный цикл, тогда как в швермерной клетке имеет место
задержка репликации. В клетках показана хромосома в
конденсированной или релаксированной форме и про-
цесс репликации ДНК. По [1]. Подробности см. в тексте.
|Волокно
Классы генов
IV
fljJKL
tM
- о
- © FlbD
III
flgE
flaN (flgK) flaQ
flgFC
flgH, flgl
9P
Класс II
II
fliQR, fliP
fliM, fliF
rpoN
flbD
Сигналы клеточного цикла
Компоненты
жгутика и
другие
продукты
генов,
флагеллины
Крючок
HAP
Палочка
L-кольцо,
Р-кольцо
Экспорт,
переключение,
сигма-фактор,
специфичный для
MS-кольца.
трансактивный
фактор
В
к Рис. 24.2. Сборка (морфопоэз) жгутика у Caulobacter crescentus. Модель иерархической регуляции экспрессии
жгутиковых генов. А. Строение жгутика: базальное тельце, крючок и субъединицы волокна, а также белковые ком-
поненты жгутика и хелперные белки (НАР, от hook associated proteins — белки, ассоциированные с крючком).
Б. Гены, участвующие в синтезе жгутика, составляют четыре класса. Класс I включает гены, связывающие сигналы
клеточного цикла с экспрессией генов класса II. Каждый класс генов II—IV состоит из нескольких оперонов. Промо-
торные области этих оперонов содержат классоспецифичные консенсусные последовательности для сигма-факторов
и транс-активных ДНК-связывающих белков (см. рис. 24.2, В). Продукты генов класса II требуются в дополнение
к белку FlbD для активации промоторов генов класса III и вместе с фосфорилированным FlbD для отрицатель-
ной ауторегуляции промотора fliF. Все гены в транскрипционных единицах класса III требуются для экспрессии
генов класса IV. Первая морфологическая контрольная точка — сборка комплекса, состоящего из MS-кольца и пе-
реключателя, с участием продуктов всех генов класса II — определяет, возможно, активацию (фосфорилирование)
белка FlbD. Приведены гены классов II—IV и функции их генных продуктов. Жирными красными стрелками указана
иерархия и временной ход экспрессии генов. Знак (£) у черных стрелок означает активацию. В процессе сборки и
в регуляции генной экспрессии участвуют продукты нескольких генов.
В. На каждом уровне экспрессии жгутиковых генов действуют различные классы промоторов. Здесь показаны только
основные типы жгутиковых промоторов. Несколько ранних генов класса II считываются с промоторной последова-
тельности, узнаваемой crR — регуляторным сигма-фактором в составе РНК-полимеразы. Поздние жгутиковые гены
обладают сг54-промоторами и IHF-связывающими сайтами (белок IHF аналогичен клеточному фактору интеграции
Е. coli). Дифференциальную регуляцию обеспечивает участие специфических энхансерных элементов, таких как RE-
1-энхансер для базального тельца и RE-2-энхансер для оперона flgF. Гены, кодирующие структурные белки крючка
и некоторых флагеллинов, содержат ftr-энхансер — сайт связывания для активатора транскрипции FlbD. Стрелка у
обозначения «+1» показывает точку начала транскрипции. По [1].
▲ Рис. 24.4. Кластер фотосинтетических генов Rhodobacter capsulatus (46 т.п.н.) и его экспрессия, bch — гены,
кодирующие ферменты синтеза бактериохлорофилла (показаны розовым); crt — гены ферментов синтеза каротино-
идов (показаны серым); оперон puf—гены, кодирующие L и М-субъединицы реакционного центра и а- и 3-белки
светособирающей антенны (В870) (незакрашенные фигуры); PufQ и PufX — регуляторные белки с неизвестной пока
функцией; puhA — ген Н-субъединицы реакционного центра; оперон рис, локализованный вне кластера фотосинте-
тических генов, кодирует пигмент-связывающие белки о, /3 и 7 (рисВАЕ) светособирающей антенны II (В800-850)
и регуляторные белки С и D (pucCD). Стрелки над генными структурами обозначают величину транскриптов, часто
синтезируемых при сквозной транскрипции нескольких оперонов. orf-469 — ген ДНК-связывающего белка с функ-
цией репрессора промоторов, ответственных за синтез Бхл, каротиноидов и белков светособирающей антенны II в
аэробных условиях. Жирными стрелками обозначены транскрипты, синтез которых начинается с сильных промото-
ров. Гены регуляторных белков показаны красным.
Дефицит питательных
веществ и/или энергии
Исчерпание
связанного азота
◄ Рис. 24.8. Дифференцировка вегетативных клеток
Anabaena в гетероцисты (Г) и акинеты (А) при стрессе.
Акинеты могут прорастать и давать начало новым ни-
тям. Гетероцисты располагаются в нити регулярным об-
разом (дифференцировку претерпевает примерно каж-
дая десятая клетка).
f Дыхание
ррСрр Полисахаридный слой
f Гликолипидный слой
Нитрогеназная
T активность
Сигнал
о понижении
концентрации
азота
4г Разложение ----
белков Т Прогетероциста
sigBC т
t t
hetR I
hgIK _ i
hepA
patB
VcpcBA vapcAB
kglnA модификация
промотора
20 ч
Эксцизия из nifD, fdxN
nifHDK
orf-1, orf-2
fdxH
devA
◄ Рис. 24.9. Последовательность дифференцировки ге-
тероцист. Регуляторные цепи и компоненты общей ре-
гуляторной сети, определяющие развитие гетероцист,
большей частью неизвестны. Изображено несколько со-
бытий. Внешний стимул — исчерпание связанного азо-
та. nifHDK — гены, кодирующие нитрогеназу. Во вре-
мя перестройки генома элементы ДНК вырезаются из
генов nifD и fdxN. Гены: fdx — ферредоксин; sigBC —
сигма-фактор; срсВА — фикоцианин, арсАВ — аллофи-
коцианин. Стрелки, направленные вверх, означают акти-
вацию генов, повышение активности ферментов или об-
разование структур. Стрелки, направленные вниз, озна-
чают репрессию генов или уменьшение количества свя-
занного азота. Кроме того, стрелками указано начало
соответствующих процессов.
1
◄ Рис 25.1. Цикл развития Bacillus subtilis.
Вегетативная клетка (изображена слева) от-
мечена цифрой 0, обозначающей нулевую
стадию. Следующая (по ходу часовой стрел-
ки) клетка находится на стадии развития II.
Показаны двойная мембрана споруляцион-
ной септы и ее пептидогликановый слой. Да-
лее изображена клетка, в которой происходит
окружение будущей предспоры материнской
клеткой (этап стадии II); показана одинарная
мембрана. На стадии III образуется предспо-
ра. Клетка на IV стадии развития содержит
предспору с образующимся кортексом. На
V—VI стадиях клетка содержит развивающу-
юся спору со споровыми покровами и сфор-
мированным кортексом. Высвобождение зре-
лой споры происходит на VII стадии цикла.
Прорастание включает разрыв споровой обо-
лочки и выход растущей вегетативной клетки.
Периплазма
Стимулы стационарной фазы
Р,
I
RapA, В
SpoOE
SpoOB
SpoOA
и spoOE (продукт — SpoOE)
ComQ
Синтез ДНК?
ComX
GTP?
---—► Гены поздней компетентности,
например сотХ и comQ
(продукты — СотХ и ComXQ),
spoOL и spoOP (продукты — RapA
и RapB)
Sinl SinR
G .
ptspoll A E C
p^kinA (продукт — Ki nA)
p^sinlp2CsinR (продукт — SinR)
рГаЬгВ (продукт — AbrB)
♦ ©
Гены, активируемые голоданием,
например
spoOH (продукт — ст )
Стимулы
вегетативной
фазы
Эффект ‘ ‘
плотности
популяции
(«кворум-сенсинг»)
ComX’
SpoOF
[ Сотх- |-
SpoOK (=Орр?)
▲ Рис. 25.2. Гипотетическая схема SpoO-фосфо- и Сот-фосфо-путей передачи сигналов у Bacillus subtilis. Пока-
заны двухкомпонентные системы KinA—SpoOA и ComP-ComA (обозначения см. на рис. 20.16), их многочисленные
функции в регуляции компетентности (см гл. 16) и споруляции, а также связи между этими системами. Показанные
на рисунке белки, участвующие в этих двух путях передачи сигнала, стимулы, на которые они реагируют, и гены,
контролируемые ответными регуляторами SpoOA и ComA, описаны в тексте. Фосфорилированные по остатку His
(Н) или Asp (D) формы белков обозначены символом белка с добавлением буквы Р Белки RapA, RapB и SpoOE
представляют собой протеинфосфатазы. На схеме показаны также важные регуляторные белки, контролируемые
этими системами, такие как сигма-факторы (сг) Е, F и Н и репрессоры SinR и AbrB. Символом ComX обозначен пеп-
тид (кодируемый геном сотХ), который в результате процессинга, осуществляемого белком ComQ, превращается
в производное ComX* и после экспорта с участием белка SpoOK (= Opp) выполняет, возможно, роль в реакции на
плотность популяции (эффект «кворум-сенсинг») и в инициации аутофосфорилирующей активности белка СотР.
Пунктирные стрелки означают положительную (@) или отрицательную (Q) регуляцию на уровне экспрессии генов
или белков; сплошные стрелки —биохимические реакции.
► Рис. 25.3. Временная последовательность экспрес-
сии генов при споруляции в культуре Bacillus subtilis
Показана типичная кривая роста (красная линия) куль-
туры В. subtilis', То—точка прекращения экспоненци-
ального роста и начала стационарной фазы. Вверху
показаны этапы споруляции и клеточной локализации
сигма-факторов, специфичных для определенных ста-
дий. Линии под кривой роста показывают экспрессию
spo-генов. Обозначения генов поясняются в тексте.
Материнская клетка
Предспора
©
Септа
SpoIIAA SpoIIAB • АТР
SpollCA
SpolllD
(SpolllD)
©
spollM--Окружение
®,' spollD...
SpoIIAA SpoIIAB-ADP
>
— spoiVCB — spolVCA
(SpoIVCA)
SpolVB * ssp
Рекомбинация
sigK (spoIVCB-spolllC)
© * .<
\ pro-cr
©
gerE Q
(CerE) "
©
cotA
COtT
COtB
cotC
cotD
SpolVB
◄ Рис. 25.4. Регуляция экспрессии генов
споруляции и сообщение между материнской
клеткой и развивающейся предспорой. По-
сле образования споруляционной септы бе-
лок SpoIIAB ингибирует активность SpollAC
(crF) в материнской клетке, тогда как в
предспоре белок SpoIIAA ингибирует актив-
ность SpoIIAB, активируя таким образом crF.
В материнской клетке белок SpollGB (пред-
шественник сгЕ) подвергается протеолитиче-
скому процессингу под действием протеазы
SpollGA; в предспоре этот процесс зависит от
активности <jF. Продукт процессинга, актив-
ный белок SpollGB (стЕ) обеспечивает тран-
скрипцию генов, необходимых для окружения
предспоры (spoilМ и spollD), а также генов
spolllD (ген активатора некоторых стЕ-зави-
симых генов), spolVCA и spoiVCB. Белок
SpoIVCA служит сайт-специфичной реком-
биназой, катализирующей объединение ге-
нов spolllC и spoiVCB с образованием ге-
на sigK, продукт которого представляет со-
бой предшественник сигма-фактора <тк. По
завершении окружения активируется экспрес-
сия гена spoIIIG, также зависящая от пред-
спорового сигма-фактора <тк. Ген spoIIIG
кодирует предспоровый сигма-фактор <rG,
который стимулирует транскрипцию соб-
ственного гена, а также генов кислоторас-
творимых белков (Ssp) и гена spolVB. Ак-
тивность SpolVB необходима для процессинга
молекулы-предшественника гтк, предположи-
тельно с участием мембраносвязанной проте-
азы SpolVF. Активная форма <тк регулирует
транскрипцию гена sigK, cot-генов, кодирую-
щих белки споровых покровов, и гена gerE,
продукт которого регулирует транскрипцию
cot-генов. Штриховыми стрелками показана
положительная (©) и отрицательная (О) ре-
гуляция на уровне экспрессии генов или бел-
ков, сплошными стрелками — биохимические
реакции.
◄ Рис. 25.5. Основные этапы регуляции и передачи сиг-
налов при споруляции у Bacillus subtilis. Показаны аль-
тернативные сигма-факторы, функционирующие в ма-
теринской клетке (сЕ и сгк) и предспоре (сг и crG). Гипо-
тетические факторы X, Y и Z, участвующие в коммуни-
кации между компартментами, активируются на опре-
деленных стадиях споруляции. Происходит активация
сигма-специфичных (ст - и <тк-) модулонов и временных
классов генов в пределах каждого модулона, регулируе-
мых белками SpolllD и GerE.
► Рис. 25.9. Цикл развития Myxococcus xanthus. В при-
сутствии питательных субстратов происходит вегета-
тивный рост. После исчерпания в среде аминокислот
вегетативные клетки агрегируют с образование плодо-
вого тела, в котором дифференцируются ножка и го-
ловка. Клетки головки плодового тела претерпевают
морфогенез и превращаются в покоящиеся клетки —
миксоспоры. При благоприятных условиях миксоспоры
прорастают с образованием вегетативных палочковид-
ных клеток.
► Рис. 26.7. Генетическая карта фа-
га Т4. На кольцевой карте фага Т4
показана выборка из 76 генов, обо-
значенных номерами и буквами. Гены
морфогенеза, относящиеся к классу
поздних, охарактеризованы пикто-
граммами, которые показывают де-
фектные продукты при мутациях в
данном гене. Большинство этих ге-
нов входит в кластеры, показанные на
правой стороне карты, и считывает-
ся по часовой стрелке. Внутри кольца
показан предполагаемый путь сбор-
ки фага с тремя независимо регули-
руемыми ветвями для сборки отрост-
ка, головки и нитей отростка. Гены,
ответственные за определенные ста-
дии морфопоэза, отмечены номерами
рядом со стрелками, связывающими
две стадии развития. Ген 63— инте-
ресный пример гена с двойной функ-
цией продукта, который в морфопоэзе
катализирует прикрепление нити от-
ростка и, кроме того, способен функ-
ционировать как РНК-лигаза в ме-
таболизме нуклеиновых кислот. Гены
метаболизма ДНК, а именно ее син-
теза, рекомбинации, репарации и кон-
троля транскрипции (ранние гены),
расположены большей частью на ле-
вой стороне кольца и считываются
против часовой стрелки. Помимо ге-
нов, на схеме показаны участки избы-
точной ДНК (незакрашенные фраг-
менты). Эти области могут быть либо
функционально нейтральными, либо
спейсерами с неизвестной функцией,
либо еще не открытыми генами. Се-
квенирование генома выявило в этих
областях значительное число откры-
тых рамок считывания.
◄ Рис. 26.8. Кривая «одиночного цикла развития» фа-
га Т4. В этом известном эксперименте определяли ди-
намику образования вирусной ДНК, белков оболочки и
жизнеспособных фагов внутри клеток синхронной куль-
туры бактерий, а также время появления свободных фа-
говых частиц вне клеток. В цикле развития фага было
обнаружено три периода: 10-минутный интервал меж-
ду адсорбцией и появлением фаговых частиц внутри
клеток — скрытая фаза, составляющая часть латентно-
го периода; весь этот период занимает от 0 до примерно
22 мин; по его окончании начинается период лизиса кле-
ток и дочерние фаговые частицы появляются в среде.
Лизис считается полным, когда культура становится со-
вершенно прозрачной (примерно через 30 мин после ин-
фицирования). Среднее число образовавшихся частиц в
расчете на инфицированную клетку называют выходом
фага.
▲ Рис. 26.9. Цикл развития фага Т4 по литическому пути. Непосредственно после инфицирования синтезируются
ранние фаговые белки, инициирующие синтез предшественников ДНК и ее репликацию Через 10 мин после ин-
фицированя начинается синтез поздних белков с поздних мРНК, который продолжается вплоть до лизиса клетки.
Структурные компоненты капсида и отростка до сборки вириона прикреплены к клеточной мембране.
► Рис. 26.11. Исторический эксперимент Херши и Чейз. Белок и ДНК фага Т2 были радиоактивно помечены [35S]
и [32Р] соответственно с целью показать, что ДНК, а не белок служит генетическим материалом. По [б].
др23 + шепероны
gpCroEL (Е.сой + др31 (T4)
Сердцевинные
белки прокапсида
др21, др22, др67, дрб8
IPI, IPII, IPIII, gpslt
Инициирующий
комплекс (др2О+?)
связанный с мембраной
посредством др40
Прокапсид
др24
О
Прокапсид до
процессинга
f Отщепление
ветвей
др49
Реплицирующаяся
Прокапсид
после
процессинга
200S
Наружный
капсид
др13
др!4
дрНос
gpSoc
X______^Воротничок
др!7
Компетентная
головка Т4
ДНК фага
ДНК др16 + др!7
► Рис. 26.14. Сборка головки фага Т4. Образование головки начинается со сборки сердцевинных белков прокапси-
да на мембраносвязанном инициаторном комплексе, содержащем gp20. Белок GroEl Escherichia coli и gp31 фага Т4
действуют совместно в качестве шеперонов, создавая для gp23 молекулярную структуру, которая обеспечивает его
упорядоченную сборку. Добавление gp23, основного белка капсида, и затем белка gp24 завершает образование про-
капсида. Отделение процессированных прокапсидов от мембраны обеспечивается протеолитическим расщеплением
белков капсида gp23, gp24 и сердцевинных белков под действием gp21. В таком виде прокапсиды готовы к приему
ДНК из конкатенированных молекул, процессированных белком gp49 (удаление ветвей) до или во время упаковки
Упаковка ДНК в капсид происходит с затратой АТР и участием белков, обеспечивающих образование контакта
между ДНК и основанием капсида при инициации посредством gp20. В процессе упаковки капсид растягивается и
стабилизируется путем включения в него дополнительных белков — gpHoc и gpSoc. Упаковка заканчивается отре-
занием упакованной порции ДНК от ДНК-предшественника с помощью gpl7 и присоединением к головке белков
воротничка gpl3 и gpl4. Подробности см. в тексте. По [9].
Хромосома
клетки-хозяина
I Адсорбция на клетке-хозяине
и впрыскивание ДНК
▲ Рис. 26.15. Развитие фага Л может происходить по литическому пути или по лизогенному пути.
А. Проникая в клетку, линейная хромосома фага Л замыкается в кольцо (вегетативный фаг, или «кольцо Херши»)
и реплицируется затем по лизогенному или по литическому пути.
Б. Лизогенный путь начинается с репрессии генов литического пути и интеграции ДНК фага в хромосому хозяина.
В этом состоянии фаг называют профагом. Интегрированная фаговая ДНК остается в хромосоме клетки, пока те
или иные внешние факторы (такие, как УФ-облучение, вызывающее повреждение ДНК, или голодание) не вызо-
вут снятие репрессии (индукцию) и высвобождение фага из хромосомы хозяина путем исключения с дальнейшим
развитием по литическому пути. По [6].
◄ Рис. 26.16. Упрощенная генетическая карта фага А в
его вегетативной кольцевой форме Показаны основные
функциональные группы генов (ранние — черным, позд-
ние— красным), включая липкие концы (cos) и сайт
прикрепления (att) (отмечены розовым). Обозначение
генов и функции их продуктов объясняются в тексте.
Точка начала репликации ДНК (оп) локализована в
гене О.
► Рис. 26.17. Интеграция и исключение фага А из хро-
мосомы хозяина требует локальной рекомбинации.
А Вегетативный фаг А (кольцевая ДНК) несет сайт при-
крепления attP, подобный сайту прикрепления attB в
хромосоме Escherichia coli (между локусами gal и Ыо).
При лизогенном развитии кодируемая фагом интегра-
за (gplnt) совместно с клеточным фактором интеграции
(IHF; гены ЫтА и himB) катализирует локальную ре-
комбинацию с расщеплением и перекрестным слиянием
15 идентичных сердцевинных пар нуклеотидов в сайтах
att. В результате фаговая ДНК — профаг А — интегри-
руется в линейной форме в хромосому хозяина между
генами gal и Ыо.
Б. При индукции профаг исключается (выщепляется)
из хромосомы клетки посредством механизма, сходного
с интеграцией, но не просто как реверсия. Гибридные
сайты присоединения (attL и attR) отличаются от attB
и attP, и выщепление происходит с участием белков Int,
IHF и нуклеазы исключения Xis (gpXis). Если исклю-
чение сопровождается незаконной рекомбинацией, мо-
гут образовываться дефектные фаги (Ас/). У таких де-
фектных фагов гены Ь и j обычно замещены геном gal
(Xdgal+), и для размножения они нуждаются в допол-
няющем хелперном фаге.
В. Структура сайта attP. Общая сердцевинная после-
довательность из 15 п.н. расположена асимметрично в
пределах области из 240 п.н. Для интеграции белок Int
связывается с четырьмя сайтами в гене attP (отмече-
ны красными двусторонними стрелками) и белок IHF —
с тремя сайтами (отмечены черными двусторонними
стрелками), которые чередуются с lnt-связывающими
сайтами. Комплекс из белков IHF и Int располагает по-
следовательности attP (240 п.н.) и attB (23 п.н.) (не по-
казано) так, чтобы обе они обвились вокруг этого бел-
кового комплекса, называемого интасомой. Сердцевин-
ные последовательноси двух сайтов оказываются друг
против друга, и происходит обмен между ними с об-
разованием ступенчатых одноцепочечных разрывов на
расстоянии 7 п.н. на 5'-конце в сердцевинных последо-
вательностях attP и attB (отмечено стрелками на lnt-
связывающих сайтах, показанных в крупном масштабе)
(Остальные подробности см. в тексте.) По [10].
► Рис. 26.19. Модель антитерминации транскрипции
белком N фага А. Показаны специфические белок-
белковые и РНК-белковые взаимодействия и аппарат
антитерминации. Сайт nut содержит три компонента:
А, В и С. В молекуле РНК участок В содержит важ-
ную шпилечную структуру со специфической последо-
вательностью в петле. Фаговый белок N вместе с бел-
ками NusA, NusB и NusE (рибосомный белок с кон-
стантой S10) помогает РНК-полимеразе хозяина (РНП)
преодолеть сигнал терминации (Т) путем связывания с
nt/t-боксами А и В в РНК. Роль белка Rho (NusD) в
антитерминации определена генетически, но до конца
пока не ясна. По [11].
◄ Рис. 26.20. Технология получения антител с помо-
щью фагмид. Фрагменты генов вариабельных областей
тяжелых (Vh) и легких (Vl) цепей иммуноглобулинов
можно экспрессировать с индуцибельного промотора
(lacZp) в клетках Escherichia coli с использованием со-
ответствующих генов, клонированных в фагмиде.
А. Функциональные модули фагмиды pCANTAB 5Е и их
происхождение. Две точки начала репликации, одна из
плазмиды ColEl для репликации двухцепочечной ДНК и
одна из фага М13 для образования дочерних фагов од-
ноцепочечной ДНК, фланкированы геном устойчивости
к ампициллину, Ыа, необходимым для отбора фагмид-
содержащих клеток после трансформации. Этот фраг-
мент фагмиды и индуцибельный /ас-промотор (lacZp),
регулируемый репрессором Lacl4. относятся к вектору
pUC119. Гены вариабельных областей антител можно
клонировать между лидерной последовательностью и
основным фрагментом гена 3 фага fd, идентичного ге-
ну 3 фага М13. После индукции образуется состав-
ной белок, обладающий функциями обоих родительских
белков. Лидерная последовательность gp3 обеспечива-
ет его перенос к плазматической мембране Е. coli, где
этот белок присоединяется к верхушке фагов в про-
цессе сборки. Составной белок содержит также корот-
кую последовательность (Е tag), кодирующую пептид
с амбер-стоп-кодоном на 5'-конце. У клеток-хозяев, со-
держащих супрессор, этот стоп-сигнал преодолевается и
образуется полный составной белок, транспортируемый
на концевой участок дочерних фаговых частиц. Однако
у лишенных супрессора клеток трансляция останавли-
вается на амбер-кодоне и образуются только lg-белки с
лидерной последовательностью на N-конце и меченым
пептидом на С-конце. Этот белок транспортируется в
периплазму. Не включаясь в фаговые частицы, он на-
капливается в периплазме и может быть выделен из пре-
паратов клеточной стенки.
Б. Структура зрелого фага после сборки фагмидной
ДНК с клонированными фрагментами генов Vh- и Vl-
цепей 1g В промежутке между двумя фрагментами ге-
на находится линкерная последовательность (линкер).
Хромосома покрыта молекулами белка gp8 (показаны
розовыми кружками) из фага М13 и несет белок — про-
дукт гена 3 (gp3) из фага fd, соединенный с Vh- и
У|_-цепями 1g, способными образовать антигенсвязыва-
ющий домен.
◄ Рис. 28.1. Типичная динамика стресс-реакции с уча-
стием специфической системы ответа Перед изменени-
ем уровня стресса активность системы низка, но обыч-
но выше нулевой. Усиление стресса (показано красной
стрелкой) вызывает (А) быстрое изменение активности
системы ответа на стресс и, в результате, (Б) измене-
ния скорости синтеза ферментов, участвующих в стрес-
се. Если повышенная активность этих ферментов до-
статочна для восстановления гомеостаза, ее изменение
носит характер временного (черные линии); в против-
ном случае активность генов стресс-реакции и скорость
синтеза соответствующих ферментов (и систем транс-
порта) остаются высокими.
Рибосома
ATP-синтаза, транспорт,
жгутиковый мотор и т. д.
▲ Рис. 28.2. Роль белков DnaK, DnaJ, GrpE, GroEL и
GroES в укладке новосинтезированных и денатурирован-
ных белков. По [1].
▲ Рис. 28.5. Циклы ионов, участвующих в поддержа-
нии pH-гомеостаза клеток. Основное значение имеют:
цикл протонов с участием дыхательной протонной пом-
пы (выход Н+) и различных путей входа Н+ (напри-
мер, ATP-синтазы, транспортных систем, жгутикового
мотора); цикл К * с участием систем его поглощения
и выделения и цикл Na+ с участием систем его погло-
щения, гипотетического натриевого канала и антипорта.
При антипорте 1\1а+/Н+ количество выделенных ионов
Na+ (х) меньше, чем количество поглощенных ионов
Н+ (у), что делает эту систему электроген ной. Систе-
мы, предположительно регулируемые рНВнУтр., показаны
розовым.
▲ Рис. 30.22. Поток субстрата и роль гидрогеносом у
строго анаэробной ресничной инфузории, образующей
кооперацию либо с эндосимбиотическим, либо с эпи-
биотическим метаногеном-партнером.
▲ Рис. 30.24. Различные симбиотические ассоциации
фототрофных зеленых или бурых серных бактерий с
неизвестной хемотрофной бактерией (бесцветной).
A. Chlorochromatium aggregation.
Б. Chlorochromatium glebulum.
В. Pelochromatium roseum.
Г. Pelochromatium roseo-viride.
Д. Chloroplana vacuolata. По [11].
▲ Рис. 33.3. Схематическое изображение клетки эн-
терогеморрагического штамма Escherichia coli (ЕНЕС).
Показаны важные факторы вирулентности и кодирую-
щие их гены, локализованные либо в геноме фага, либо
в плазмиде, либо в хромосоме (остров патогенности).
Указаны также гены фимбрий (firn), гемолизина ЕНЕС
(e-hly), прикрепления и слущивания (еаеА, еаеВ), сек-
реции белков (sep) и шигоподобного токсина (sit).
▲ Рис. 31.8. Анатомия Riftia pachyptila. Показаны си-
стема кровообращения и трофосома с бактериями,
окисляющими серу.
▲ Рис. 33.4. Клетки слизистых оболочек. Показаны
эпителиальные клетки, М-клетка, макрофаг и прони-
кающие клетки бактерий. 1. Бактерии связываются с
М-клеткой. 2. Бактерии переносятся к макрофагу через
М-клетку. 3. Бактерии лизируются внутри макрофага;
бактериальные антигены представлены на поверхности
макрофага. 4. Активация Т- и В-клеток приводит к сек-
реции секреторного иммуноглобулина A (slgA).
Стволовые клетки костного мозга
Полиморфноядерные
гранулоциты
- короткоживущие клетки
- подвижные
- присутствуют
в жидкостях тела
Макрофаги
- долгоживущие
клетки
- резидентные
Моноциты
- долгоживущие
клетки
- подвижные
- присутствуют
▲ Рис. 33.8. Взаимодействие между Т-клетками, ан-
тигенпрезентирующими клетками (АПК) и клеткой-
мишенью. Показаны молекулы главного комплекса ги-
стосовместимости (МНС) классов I и II , Т-клеточные
рецепторы (ТкР) и молекулы поверхности CD4 и CD8.
Аг — антиген; сАг — суперантиген.
- органоспецифичные:
например, альвеолярные
макрофаги (легкие),
/\ клетки Купфера (печень)
▲ Рис. 33.5. Дифференцировка фагоцитарных клеток
и фагоцитоз бактерий.
А. Характеристика различных популяций клеток.
Б. 1. Бактерии (показаны красным) связываются либо
через СЗЬ и рецептор СЗЬ, либо через Fc-рецептор и ан-
титела (опсонизация) с фагоцитарной клеткой. 2. Бакте-
рии локализованы в вакуоли (фагосоме). 3. Последую-
щее слияние вакуоли с лизосомами (образование фаго-
лизосомы); лизис бактерий. 4. Бактериальные антигены
презентируются на поверхности фагоцитарной клетки.
▲ Рис. 33.10. Связывание бактериальной клетки, име-
ющей фимбрии, с рецепторами на клетке хозяина. Слева
показаны фимбрии с адгезином (минорной субъедини-
цей) на конце. Справа показаны рецепторы — углевод-
ные компоненты гликолипидов и гликопротеинов в мем-
бране эукариотической клетки.
▲ Рис. 33.13. Способы внедрения и размножения бак-
терий внутри клеток хозяина. 1. Связывание патогенной
бактерии с рецепторами на клетке хозяина. 2. Передача
сигнала от бактерии к клетке хозяина и проникновение
бактерии в клетку хозяина. 3. Стратегии выживания и
размножения бактерий в клетке хозяина.
▲ Рис. 33.14. Структура и механизмы действия токси-
нов различных типов.
А Порообразующие токсины. Канал, формируемый эти-
ми токсинами, внедряется в мембрану клетки хозяина,
что ведет к набуханию и лизису клетки.
Б. Цитолизин с ферментативной функцией. Полярная
головка фосфолипидов удаляется фосфолипазой, что
ведет к дестабилизации мембраны хозяина и лизису
клетки.
В. Структура токсинов А-В-типа на примере холерно-
го токсина (XT). Эти токсины состоят из обладающей
ферментативной активностью субъединицы А, образо-
ванной полипептидами А1 и А2, и пяти субъединиц
В, которые связываются с мембраной клетки хозяина.
S — S — дисульфидный мостик.
Г Механизм действия холерного токсина. Субъеди-
ница cis клеточного G-белка, связывающего гуани-
диновые нуклеотиды, претерпевает изменение вслед-
ствие ADP-рибозилирования. Происходит инактивация
СТРазы, что ведет к повышению активности аденилат-
циклазы. Повышенный уровень сАМР стимулирует вы-
ход из клетки электролитов и воды.
◄ Рис. 33.16. Изменчивость вирулентных свойств.
Вследствие геномных перестроек при необратимом из-
менении вирулентности или фазовой вариации либо
вследствие реакции на внешний стимул фенотип кле-
ток с фимбриями (вверху) изменяется на фенотип без
фимбрий (внизу). Проиллюстрирован также эффект ан-
тигенной изменчивости, при котором один тип фимбрий
обратимо меняется на серологически иной тип.
I
1 Клеточная стенка
2 Синтез белка
3 Репликация ДНК
4 Синтез РНК
Прямой тест
Поверхностный антиген
Антитела,
конъюгированные
с ферментом или
флуоресцентным
красителем
Непрямой тест
Поверхностный антиген
1 Функция
факторов
вирулентности
2 Экспорт
бактериальных
белков
3 Передача
сигнала
Цветная реакция
или флуоресценция
в ультрафиолетовом свете
Конъюгаты
антикроличьих
антител
Цветная реакция
или флуоресценция
в ультрафиолетовом свете
Б
▲ Рис. 33.22. Используемые и потенциальные мишени
антимикробных препаратов в клетках патогенных бакте-
рий.
А. Мишени применяемых в настоящее время антибио-
тиков.
Б. Потенциальные мишени.
▲ Рис. 34.2. Иммунологические тесты (прямой и непря-
мой) с использованием конъюгированных антител.
А. Прямой тест. Получают антитела (Ат) против бак-
териального антигена (здесь поверхностный антиген),
меченные либо ферментом, либо флуоресцентным кра-
сителем. Связывание этих конъюгированных антител с
антигеном определяют колориметрически или по флуо-
ресценции в ультрафиолете.
Б. Непрямой тест. Получают первые антитела, напри-
мер кроличьи, и затем вторые, например козьи, анти-
тела против этих кроличьих антител. Вторые антитела
метят, конъюгируя их, как указано выше. Меченые про-
тивокроличьи антитела связываются с первыми антите-
лами, что повышает чувствительность метода. Опреде-
ление реакции производят, как в прямом тесте.
▲ Рис, 33.23. Модель плазмиды мультирезистентности
(MR) MR-плазмиды несут наборы транспозонов. Неко-
торые транспозоны, например из группы Тп21, несут
интегроны, обеспечивающие интеграцию генных кассет,
содержащих гены устойчивости. Обмен такими кассета-
ми возможен между различными молекулами ДНК. Р —
промотор; sull — ген устойчивости к сульфонамиду; IR —
инвертированный повтор. По [2].
Масштаб
Бобовое
времени, сут. растение-хозяин
Ризосфера
События
Ризодермис —*
Меристема
клубенькг
Корневые Свободные
выделения ризобии
Изгибание
корневого
волоска
Синтез
фактора
Nod
Деление
кортикальных
клеток
Размножение бактерии
Колонизация корня
Прикрепление^^
Индукция генов nod
Изгибание корневого волоска
Индукция деления
кортикальных клеток
Размягчение растительных
клеточных стенок
Образование инфекционных
нитей
Раннее развитие клубенька
Высвобождение бактерий
в примордий
▲ Рис. 34.4. Ранние этапы взаимодействия между бактериями Rhizobium и бобовым растением-хозяином. Бакте-
рии хемотаксически реагируют на корневые выделения, размножаются и заселяют поверхность корня. В процессе
прикрепления и связывания предположительно участвуют лектины растения-хозяина. Далее специфические флаво-
ноидные вещества, секретируемые растением, индуцируют экспрессию генов нодуляции (nod), продукт которых —
бактериальный сигнал нодуляции, фактор Nod — вызывает определенные реакции у растения-хозяина, такие как ис-
кривление корневых волосков (показаны красным) и индукция митотического деления клеток во внутренней части
коры, обеспечивающего образование меристемы клубенька. Бактерии внедряются в корневой волосок и образуют
инфекционные нити (показаны красным), через которые проникают в цитоплазму клеток растения.
к Рис. 34.6. Структура и регуляция генов образования клубеньков, нодуляции, (nod и nol) у Rhizobium meliloti. Гены
nod обозначают буквами латинского алфавита; не «уместившиеся» в алфавит гены, контролирующие ту же функ-
цию, обозначают по/ и syrM (симбиотический регулятор). Общие гены nod показаны светло-серым, регуляторные
гены nodD— розовым, специфические относительно хозяина гены нодуляции — белым. Стрелками перед генами
и оперонами отмечены промоторы (р) (где указано, активируемые NodD) и показано направление транскрипции
до терминатора (/). Масштаб не соблюден. Штриховыми стрелками показана активация (@) активаторами SyrM,
NodD3 и NodDl + NodD2. Индукторами для последних служат разнообразные флавоноиды (см. рис. 34.8); их
мишени — так называемые nod-боксы (показаны красным).
Дикарбоновые кислоты (?)
Низкая концентрация О,
▲ Рис. 34.9. Структура и регуляция генов nif, fix и det у Rhizobium meliloti. У R. meliloti идентифицировано два
кластера генов nif и fix в составе очень крупной плазмиды (мегаплазмиды или sym-плазмиды) размерами при-
мерно 1400 т.п.н. Локусы nifE и nifN разделены участком длиной примерно 30 т.п.н., который содержит гены nod.
Указаны генные продукты регуляторных генов и активация ((+)) соответствующих им генов-мишеней (штриховые
стрелки). Двухкомпонентная регуляторная система, содержащая сенсор FixL, реагирует на концентрацию кислорода.
При малом содержании кислорода сенсор фосфорилирует ответный регулятор FixJ, который активирует гены fixK и
nifA путем связывания со специфическими промоторными последовательностями, так называемыми анаэробоксами
для FixK. Белок NifA служит активатором транскрипции генов в кластере I. Двухкомпонентная регуляторная си-
стема, содержащая сенсор DctB, возможно реагирует на присутствие дикарбоновых кислот. Этот сенсор активируез
ответный регулятор DctD, контролирующий экспрессию генов dctB и dctD, а также ген dctA — структурный ген,
кодирующий переносчик дикарбоновых кислот. Все участки, связанные с регуляцией, показаны розовым. ЦТК —
цикл трикарбоновых кислот. Другие обозначения см. на рис. 20.16.
N-концевой Центральный ДНК-связывающий
домен домен домен
◄ Рис. 34.10. Структура белков NifA у клубеньковы>
бактерий. Функция варьирующих по длине N-концевы?
доменов неизвестна. Центральный домен из 240 ами-
нокислотных остатков, возможно, имеет отношение к
взаимодействию с РНК-полимеразой, содержащей субъ-
единицу <т54. Для активации транскрипции необходи-
мы связывание с промоторными последовательностям!/
—24/—12 и гидролиз АТР. На С-конце находится струк-
тура спираль—виток—спираль, участвующая в связыва-
нии NifA с специфическими вышерасположенными ак-
тиваторными последовательностями (UAS, от upstrearr
activator sequence), локализованными приблизительнс
на 100 п.н. выше точек начала транскрипции. Все белки
NifA чувствительны к кислороду и характеризуются на-
личием междоменного линкерного участка (IDL). Чув-
ствительность их к кислороду предположительно свя-
зана с характерной, богатой цистеиновыми остатками
последовательностью (Cys-Xii-Cys-Xig-Cys-X4-Cys).
кдг
он он он он он он
Пектин
Пектат
► Рис. 34.13. Регулон kdgR у Erwinia chrysanthemi. Штаммы Е. chrysanthemi продуцируют различные пектинолити-
ческие ферменты, причем три из них выделяются в среду с участием комплекса секреции Out, кодируемого опероном
out. Эти ферменты — пектинметил-эстераза (кодируемая геном рет), изоферменты пектат-лиазы (кодируемые гена-
ми pelABCDE) и галактуроназа (кодируемая геном peh)— действуют совместно, разлагая нерастворимые пектино-
вые полимеры до усвояемых олигогалактуронидов. Далее цитоплазматический фермент — олигогалактуронид-лиаза
(продукт гена ogl)— расщепляет димерные молекулы с образованием 5-кето-4-дезоксиуроната (КДУ), из которого
при участии белка Kdul образуется 2,5-дикето-З-дезоксиглюконат (ДКДГ). Под действием белка KduD происходит
превращение ДКДГ в 2-кето-З-дезоксиглюконат (КДГ), который действует как индуктор дальнейшего синтеза пекти-
нолитических ферментов. КДГ в конечном итоге разлагается до пирувата и 3-фосфоглицеральдегида (не показано).
Ген kdgT кодирует пермеазу для поглощения экзогенного КДГ. Все гены, указанные в рамке, отрицательно регу-
лируются посредством белка KdgR, который в отсутствие индуктора, возможно, связывается с консервативными
KdgR-боксами в составе операторов в промоторных участках (показаны стрелками) этих генов. По [1].
Выход воздуха
▲ Рис. 35.3. Схема биореактора для производства ук-
суса. Пояснения см. в тексте.
◄ Рис. 34.14. Жизненный цикл фи-
топатогенной бактерии Agrobacterium
tumefaciens. Поврежденные раститель-
ные клетки выделяют разнообразные
соединения, например ацетосирингон,
которые индуцируют активность генов vir
у A. tumefaciens. Область vir содержит
шесть оперонов. Продукты генов virA и
virG образуют двухкомпонентную регуля-
торную систему (взаимодействующую с
индукторами растительного происхожде-
ния) и активируют транскрипцию других
генов vir. Продукты генов virB, virC, virD
и virE участвуют в эффективном выреза-
нии и переносе соответствующей Т-ДНК
(см. дополнение 34.6). Данная Т-ДНК
кодирует синтез растительных гормонов
цитокинина (Cyt) и индол ил уксусной кис-
лоты (ИУК, IAA), а также несет область,
необходимую для продукции опинов
(здесь — nos, от nopaline syntase). По сво-
им границам эта Т-ДНК фланкирована
инвертированными повторами (правая и
левая пограничные последовательности;
черные треугольники). Показаны область,
необходимая для поглощения опинов и
их катаболизирования (здесь — пос, от
nopaline catabolism), и область, кодирую-
щая функции конъюгационного переноса
(Тга). Гены изображены не в масштабе.
Целая Ti-плазмида (pTi) включает при-
мерно 200 т.п.н.; Т-ДНК может включать
до 20 т.п.н. (в зависимости от типа плаз-
миды), область vir — примерно 35 т.п.н.
Хромосома A. tumefaciens не изображена.
После переноса одноцепочечной (оц)
Т-ДНК и ее интеграции в растительный
геном трансформированные таким об-
разом клетки растения пролиферируют
с образованием опухоли — корончатого
галла — и выделяют кодируемые Т-ДНК
опины. Другие обозначения см. на рис.
20.16.
▲ Рис. 35.14. Способы иммобилизации ферментов.
Белок VP#1 из рекомбинантной
бактерии, используемый для
приготовления вакцины
◄ Рис. 35.17. Производство вакцин с ис-
пользованием технологии рекомбинантной
ДНК. Путем экспрессии вирусных генов в
Escherichia coli получают антигенный бе-
лок вируса, используемый для производ-
ства вакцины против вируса ящура.
Этап 3:
Химическая очистка-*)
К
Этап 2:
Биологическая очистка
Этап 1:
Механическая очистка
▲ Рис. 36.2. Установка для очистки сточных вод, в которой происходит развитие активного ила в качестве централь-
ного, биологического этапа. Этап 1 — механическая очистка; этап 2 — биологическая очистка; этап 3 — химическая
очистка. Объяснения см. в тексте.
▲ Рис. 36.5. Современные типы реакторов для анаэробной очистки сточных вод и активного ила.
А. Система анаэробной фильтрации. Биомасса прикрепляется к носителю, которой либо фиксирован (фиксирован-
ный наполнитель), либо находится во взвешенном состоянии в жидкой фазе (псевдоожиженный наполнитель)
Б. Реактор с псевдоожиженным нижним слоем, наполнителем и отводом для рециклизации путем обработки кислых
или иных токсичных отходов.
В. Анаэробный реактор с придонным слоем активного ила и восходящим потоком жидкости. Просеиватели отстой-
ника в верхней части служат для отделения газовых пузырьков и хлопьев ила от очищенной жидкости.
Глава 31
Местообитания прокариот
Предыдущая глава посвящена описанию поведе-
ния микроорганизмов в природных экосистемах
в целом с акцентом на организмы и их взаимо-
связь с абиотическими и биотическими условиями
среды обитания. В этой главе рассматриваются
сами местообитания — их характеристики, фор-
мирование при участии микробов и роль в под-
держании относительной стабильности экосистем
при взаимодействии сообществ микро- и макроор-
ганизмов.
31.1. Вода как идеальная среда обитания для микроорганизмов
Из всех химических соединений для жизни на
Земле наиболее важна вода, и вначале жизнь раз-
вивалась в водной среде. Организмы, обитающие
на суше, должны обладать механизмами защи-
ты от высыхания, особенно в экстремально су-
хих условиях; водные организмы защищены не
только от высыхания, но также и от резких из-
менений температуры благодаря высокой тепло-
емкости воды. Температура водной среды в те-
чение года меняется, как правило, не более чем
на 20-30 °C, тогда как температура на поверхно-
сти почвы в районах умеренного климата может
изменяться от —20 до +60 °C. Кроме того, вода
служит хорошим растворителем для большинства
биологически важных веществ, включая О2, СО2,
неорганические соли и органические соединения.
Вследствие этого водная среда пространствен-
но гораздо менее гетерогенна, чем, например,
почва.
Большая часть воды на Земле содержится в
морях и океанах. Имеющаяся пресная вода со-
ставляет лишь малую часть всей воды, и при этом
небольшая ее доля участвует в обмене через атмо-
сферу (табл. 31.1). Бблыпая часть пресной воды
на поверхности Земли связана в виде полярных
льдов, и обмен водяным паром между ними и ат-
мосферой происходит очень медленно. Из пресно-
водных сред для жизни пригодны грунтовые во-
ды, внутренние озера (из которых примерно 50%
составляют пресноводные озера), почвенная вла-
га, атмосферная вода и реки. Величина соответ-
ствующих запасов воды и время их оборота при-
ведены в табл. 31.1. Запасы атмосферной воды и
воды рек составляют небольшую величину и ха-
рактеризуются средним временем оборота при-
мерно 10-11 сут; время оборота других водных за-
пасов значительно больше и возрастает с увеличе-
нием их размеров.
Таблица 31.1. Распределение воды на Земле
Объем, 103 км3 % массы общей воды % массы пресной воды Время оборота, годы
Всего 1 458 703 100 — —
Океаны 1 370 373 94 — 3 000
Глубокие грунтовые воды 60 000 4 — 5 000
Общая доступная пресная вода 28 329 1,94 100 —
Полярный лед 24 000 1,64 84,5 8 000
Активные грунтовые воды 4 000 0,27 14 330
Пресноводные озера 125 0,0086 0,4 1-100
Соленые озера 104 0,0071 0,36 10-1000
Почвенная влага 85 0,0058 0,3 1
Водяной пар в атмосфере 14 0,00096 0,05 0,027 (10 сут)
Реки 1,2 0,00008 0,004 0,031 (11 сут)
258 Часть VIII. Прокариоты в биосфере
Пресноводные озера, хотя и не имеют боль-
шого значения в общем балансе воды, относят-
ся к наиболее изученным водным экосистемам.
Они составляют предмет лимнологии — науки,
изучающей поверхностные и подземные пресные
воды. Развитие ее началось в конце 19 в., и сей-
час она представляет, вероятно, наиболее разра-
ботанную область того направления экологии, ко-
торое ориентировано на изучение местообитаний.
Озера можно считать сравнительно высокострук-
турированными объектами, легкими для иссле-
дования в отношении отбора проб и определе-
ния физико-химических характеристик. Изучение
океанов требует применения значительно более
сложных подходов и больших затрат из-за огром-
ных размеров их акваторий.
В то же время традиционное лимнологическое
исследование не учитывает роли бактерий в озер-
ной экосистеме. В прошлом лимнологи не могли
увидеть бактерии, поскольку использовали мик-
роскопы с недостаточным для этого разрешением
и контрастом, а также потому, что водные бак-
терии обычно прикреплены к поверхностям и их
трудно выявить (см. разд. 30.5). Основным ме-
тодом водной микробиологии долгое время оста-
вался высев проб для подсчета бактерий на плот-
ные среды, которые обеспечивают, однако, рост
лишь небольшой доли бактерий из общей мик-
робной популяции. Только в последнее время с
помощью новых методов специфической визуали-
зации микробных клеток (см. разд. 30.3.5) в со-
четании с чувствительными методами определе-
ния микробной активности в природных образцах
(см. разд. 30.4.5) стало возможным установить,
что микроорганизмы в целом и особенно бактерии
выполняют чрезвычайно важную роль в кругово-
роте питательных веществ и поддержании пище-
вых и энергетических ресурсов в озерах. Микро-
организмы составляют наибольшую долю биомас-
сы в водной толще, и их необходимо учитывать
при анализе функционирования экосистемы в це-
лом.
31.1.1. Вода имеет уникальные физические
и химические свойства
Связи между атомами водорода и кислорода в
молекуле воды ориентированы под углом друг
к другу, благодаря чему она обладает диполь-
ным моментом и рядом необычных свойств. Это
простейшее соединение при обычной темпера-
туре представляет собой жидкость вследствие
того, что его молекулы образуют между собой
водородные связи. В жидкой воде ее молекулы
формируют агрегаты из 12-70 единиц в зависи-
мости от температуры, причем размеры этих аг-
регатов увеличиваются с понижением темпера-
туры. Их образование и разделение связано с
высвобождением и поглощением тепловой энер-
гии, чем обусловлена необычайно высокая теп-
лоемкость воды. Теплоемкость чистой воды со-
ставляет 4,19 кДж кг-1 • град-1 (см. дополне-
ние 31.1).
В фазе льда молекулы воды образуют кри-
сталлическую структуру в виде трехмерной сет-
ки, построенной из тетраэдров (четыре водо-
родные связи, образуемые молекулой воды в
конденсированных фазах, направлены приблизи-
тельно к вершинам правильного тетраэдра) с об-
ширными пустыми пространствами между от-
дельными молекулами. Близость угла Н~О~Н
к тетраэдрическому (109° 28') обусловливает рых-
лость структур льда и жидкой воды и, как след-
ствие, аномальную зависимость плотности от тем-
пературы. Плотность льда (0,9168 кг-л-1), та-
ким образом, значительно меньше, чем плотность
жидкой воды при 0 °C (0,99987 кг-л-1). В про-
цессе таяния льда его кристаллическая структу-
ра постепенно изменяется на агрегатную структу-
ру жидкой воды, и максимальная плотность до-
стигается при 3,94 °C. Благодаря аномальной
зависимости плотности воды от температу-
ры крупные водоемы не промерзают до дна (на
глубине температура не падает ниже 4 °C), что
важно для существования живых организмов в
озерах в областях с холодным климатом. Теп-
лопроводность жидкой воды чрезвычайно низ-
ка (0,0057 Дж-см-1-с-1-град-1), в результате чего
перенос теплоты через массу стоячей воды зави-
сит почти исключительно от конвекционных про-
цессов.
Высокая полярность воды определяет ее хоро-
шую растворяющую способность по отношению к
полярным, диссоциирующим на ионы веществам,
таким как соли и СОг, тогда как малополярные
газы, такие как N2, СН4 и О2, растворимы в ней
лишь в незначительной степени (см. разд. 30.1.3).
Образующийся при минерализации органических
соединений в воде СО2 реагирует с ней с обра-
зованием НСО3 и реакция их диссоциации
характеризуется рК 6,3 при 20 °C. Бикарбонат-
Глава 31. Местообитания прокариот 259
ная система СО2/НСО3 забуферивает как столб
воды, так и донные отложения. Растворимость би-
карбоната возрастает с увеличением содержания
в воде ионов кальция, магния и натрия, поэто-
му озера с жесткой водой (богатой кальци-
ем) имеют значительно более высокую буферную
емкость (щелочность), чем озера с мягкой во-
дой. На водосборной площади озер с жесткой во-
дой преобладают известковые породы, которые и
служат источником поступления в озера двухва-
лентных катионов; озера с мягкой водой характер-
ны для территорий, где доминируют скальные по-
роды вулканического происхождения, например в
Скандинавии, Шварцвальде (Германия) и Север-
ной Америке. Концентрация СО2, растворенного
в чистой воде, в соответствии с парциальным дав-
лением СОг в атмосфере (30 Па) составляет при-
мерно 15 мкМ. Из пресноводных озер СОг посту-
пает в атмосферу в периоды, когда не использу-
ется при фотосинтезе (ночное время) или когда
реакция воды недостаточно щелочная для удер-
жания углекислоты. Морская вода, обладая вы-
сокой щелочностью, содержит растворенный СОг
в своем поверхностном слое в концентрации, рав-
ной примерно 2 мМ Электропроводность воды
повышается пропорционально концентрации рас-
творенных в ней ионов; электропроводность чи-
стой воды очень низка. Таким образом, электро-
проводность может служить показателем концен-
трации электролитов, в частности бикарбоната и
его противоионов в пресноводных озерах (щелоч-
ность) и NaCl в соленых водах (соленость) (см.
дополнение 31.1).
Вода характеризуется высокой теплоемкостью
и термостабильностью, максимальной плотнос-
тью при 3,94 °C и низкой теплопроводностью в
состоянии льда. В воде хорошо растворяются по-
лярные соединения.
31.1.2. Поглощение теплоты
приводит к стратификации воды
Весной небольшие водоемы в зоне умеренно-
го климата перемешиваются от поверхности до
дна вследствие турбулентной конвекции, исходно
вызываемой ветром; теплота и растворенные со-
единения равномерно распределяются по всей
толще воды. Летом поверхность водоемов на-
гревается, при этом масса более теплой воды —
эпилимнион — отграничена от более холодной
водной массы — гиполимниона (термальная
стратификация). Переходную зону между дву-
мя этими слоями называют металимнионом
(рис. 31.1). В период летней стратификации обмен
водой между эпилимнионом и гиполимнионом
очень небольшой. Осенью отдача тепла усилива-
ется в связи с перемещениями водных масс под
действием ветра, и вода может перемешиваться
по всей ее толще, до поверхности донных осад-
ков. Зимой вода на поверхности образует ледяной
покров, который стабилизирует зимнюю страти-
фикацию обратного характера: наверху водного
столба вода холоднее (0-4 °C), чем внизу, где
она более плотная и имеет температуру 4 °C
(рис. 31.1). Этот годичный цикл с полным пе-
ремешиванием весной и осенью типичен для озер
малых и средних размеров в умеренном поясе,
так называемых димиктических озер. В усло-
виях более холодного климата летняя страти-
фикация может не развиваться до стабильного
состояния и зимой один раз происходит переме-
шивание (холодные мономиктические озе-
ра). В полярных областях вода озер никогда не
перемешивается, поскольку ледяной покров ни-
когда не тает (амиктические озера). В услови-
ях более теплого климата может не развиваться
зимняя стратификация (теплые мономиктиче-
ские озера). Пример самых северных озер этого
типа — оз. Констанц на юге Германии. В субтропи-
ках и тропиках ежегодного перемешивания озер
может не происходить, но суточные изменения
температуры вызывают дневную стратификацию
и непостоянное (олигомиктические озера) ли-
бо ежесуточное (полимиктические озера) пе-
ремешивание ночью, особенно на мелководье.
Рис. 31.1. Температурные профили воды димиктическо-
го пресноводного озера средних размеров в зоне умерен-
ных широт. Масштаб глубины варьирует в зависимости
от общей глубины озера и воздействия ветров.
260 Часть VIII. Прокариоты в биосфере
Перемешивание не всегда захватывает всю
толщу воды. В зависимости от формы во-
доема, особенно в глубоких озерах с малой
площадью поверхности, перемешивание может
быть неполным и нижняя часть гиполимниона
(монимолимнион) может никогда не обмени-
ваться с поверхностными водами. Такие озера на-
зывают меромиктическими. В монимолимни-
оне накапливаются газы микробного происхожде-
ния (например, СО2, СН4 и следы H2S), которые
лишь иногда выходят в атмосферу, например при
сейсмических явлениях. Во время одного из таких
событий в районе оз. Ниос (Восточная Африка)
(1986 г.) из него выделилось примерно 3 • 107 м3
газов, что привело к гибели от удушья и отравле-
ния сероводородом до 2000 человек. Перемешива-
ние водных масс особенно ослабляется с повыше-
нием концентрации солей в гиполимнионе вслед-
ствие поступления солей из почвы или притока
соленой воды, как, например, во фьордах или в
бухте о-ва Готланд в Балтийском море.
Дополнение 31.1. Физико-химические ха-
рактеристики водной массы озера мож-
но определить по ряду параметров, реги-
стрируемых с помощью автоматизированных
устройств с различными датчиками. Тем-
пературный профиль служит показате-
лем стратификации. Высокочувствительные
температурные датчики позволяют получать
данные о процессах горизонтального пере-
мешивания в больших водных массах. Со-
держание кислорода измеряют с помощью
электрода кларковского типа. Электропро-
водность служит показателем концентрации
растворенных ионов, в частности бикарбона-
та, в пресноводных озерах. В пресных водах
электропроводность варьирует в пределах
200-400 мкС-см-1, в морской воде близка к
50 000 мкС-см1. Измерение pH, наряду с
электропроводностью, позволяет определить
щелочность, или буферную емкость воды.
На поверхности эвтрофных озер вода подще-
лачивается до pH 9 вследствие поглощения
СОг фототрофными организмами при фото-
синтезе. В гиполимнионе реакция среды ва-
рьирует от нейтральной до слабокислой (до
pH 6,7 в озерах с жесткой водой и значитель-
но более низких величин в озерах с мягкой
водой и высоким содержанием кислых соеди-
нений). Освещенность в толще воды оце-
нивают с помощью диска Секки — отража-
ющей свет круглой металлической пластин-
ки диаметром 30 см, которую погружают в
воду до тех пор, пока она различима с по-
верхности. Глубина Секки — это показатель
мутности, обусловленной присутствием мик-
роорганизмов, главным образом фитопланк-
тона, или другого взвешенного органического
или неорганического материала в поверхност-
ном слое. Полностью чистая вода также по-
глощает и отражает падающий свет в раз-
ной степени, в зависимости от длины вол-
ны (см. разд. 30.1.1); на 80-метровой глубине
освещенность практически нулевая, даже в
очень прозрачной воде. Количественные и ка-
чественные изменения светового режима мо-
гут быть определены в толще воды с помо-
щью специфических датчиков освещенности.
Имеется специальное оборудование (батомет-
ры) для отбора проб воды с определенной
глубины без смешивания ее с водой других
слоев.
31.1.3. Первичная продукция ограничена
доступностью питательных веществ
Эпилимнион — это зона фотосинтеза (первичной
продукции) в озерах. Ранней весной, когда во-
да содержит все основные питательные вещества,
такие как диоксид кремния, связанный азот и
фосфат, в толще воды (пелагиали), на литора-
ли и на поверхности донных осадков среди фо-
тосинтезирующих организмов преобладают быст-
рорастущие диатомовые водоросли. Диатомеи и
золотистые водоросли нуждаются в SiC>2 как од-
ном из важных питательных веществ. Как только
его запасы исчерпываются, в качестве первичных
продуцентов начинают доминировать зеленые од-
ноклеточные водоросли. Образующаяся водорос-
левая биомасса содержит углерод, азот и фос-
фор в соотношении 106 : 16 : 1 (так называемое
соотношение Редфилда). По уровню первичной
продукции водоемы делят на олиготрофные, ме-
зотрофные, эвтрофные и высокоэвтрофные. Эти
термины отражают то, что продукция возраста-
Глава 31. Местообитания прокариот 261
ет с увеличением содержания в воде питатель-
ных веществ. Если в поверхностный слой воды по-
ступает большое количество фосфата, что типич-
но для эвтрофных и высокоэвтрофных озер,
лимитирующим фактором быстро становится со-
держание связанного азота, и в этих условиях
преимущество получают азотфиксирующие ци-
анобактерии, такие как Anabaena, Aphanizomenon
и Microcystis. Массовое развитие цианобактерий
на поверхности водоемов обычно указывает на
очень высокое содержание в воде биогенных эле-
ментов. В пресноводных озерах первичная про-
дукция зависит главным образом от поступле-
ния фосфата (табл. 31.2); климатические фак-
торы (освещенность и химический состав воды)
влияют на нее в меньшей степени. Слегка кислые
мягкие воды, богатые гуминовыми кислотами —
так называемые дистрофные озера — характе-
ризуются значительно более низким уровнем пер-
вичной продукции, чем тот, который наблюдается
в озерах с жесткой водой. Продуктивность океа-
нов в отдаленных от берега районах сравнима с ее
уровнем в олиготрофных пресноводных озерах, но
сильно зависит от притока питательных веществ с
течениями. Прибрежные морские воды и зоны ап-
веллинга сопоставимы по продуктивности с мезо-
трофными или эвтрофными озерами (табл. 31.2).
В зоне литорали, где солнечный свет проникает
до самого дна, продуктивность значительно вы-
ше, чем в пелагиали на отдалении от берега, по-
скольку питательные вещества, накапливающие-
ся в осадках на литорали, могут вновь использо-
ваться в коротких циклах. Биогенные элементы
из донных осадков в глубоководных участках озер
вносят лишь незначительный вклад в первичную
продукцию, поскольку их переносу препятствует
температурная стратификация.
Дополнение 31.2. Первичную продук-
цию можно определить либо по фиксации
СОг, либо по выделению Ог- Фиксацию СОг
измеряют с помощью метода, предложенного
в 1952 г. Стиманом-Нильсеном, — по включе-
нию 14СОг в клеточную биомассу. Этот ме-
тод до сих пор остается наилучшим как наи-
более чувствительный. Определение состоит
в том, что в стеклянные пузырьки с пробами
воды, содержащей планктон, вносят неболь-
шое количество №аН14СОг, после чего инку-
бируют их in situ в естественных условиях
температуры и освещенности. При этом па-
раллельно инкубируют защищенные от света
пузырьки (контрольный вариант) для уче-
та гетеротрофной и хемолитотрофной фик-
сации СОг. После инкубации пробы филь-
труют и измеряют радиоактивность фракции
частиц на фильтрах как показатель фото-
синтетической активности. Следует подчерк-
нуть, что с помощью этого метода измеряют
включение СО2 только в материал, представ-
ленный частицами. Соответственно выделяе-
мые водорослями растворенные органические
вещества (5-30% общей первичной продук-
ции) долгое время оставались вне поля зре-
ния исследователей. Этот недостаток данного
экспериментального подхода объясняет так-
же, почему лимнологи называют активность
гетеротрофных бактерий вторичной про-
дукцией; меченые растворенные органиче-
ские вещества, ассимилируемые этими бакте-
риями, измеряются в составе их клеток. Тем
не менее это результат нс продукции, а ми-
нерализации, в результате которой более 50%
образуемого в процессе фотосинтеза органи-
ческого вещества окисляется до СОг-
Таблица 31.2. Продуктивность озер и океанов
Общий Р. мкг л-1 Продуктивность, мг С • м~2 • год-1
Олиготрофные озера Мезотрофные озера Эвтрофные озера Открытый океан Прибрежные морские воды <10 10-50 35-100 2,5 >10 10-200 80-400 300-900 10-150 >300
31.1.4. Минерализующая активность
хемотрофных бактерий
Биомасса фотосинтезирующих планктонных ор-
ганизмов служит пищей для растительноядного
зоопланктона, который в свою очередь поедается
плотоядным планктоном; последний служит ис-
точником пищи для рыб. Эта классическая пище-
вая цепь (рис. 31.2) может быть и значительно
более сложной, включающей еще несколько уров-
262 Часть VIII. Прокариоты в биосфере
Рис. 31.2. Превращения неорганических и органических
веществ в экосистеме пресноводного озера. Сплошные
тонкие линии показывают классическую пищевую цепь
от первичных продуцентов через вторичные продуцен-
ты до рыб. Штриховые линии отображают детритную
пищевую цепь, сплошные жирные линии — «микробную
петлю». Органические выделения и детрит служат ос-
новными источниками питания гетеротрофных бакте-
рий.
ней. Лизис фитопланктонных организмов и вы-
свобождение частиц пищи при «неаккуратном»
кормлении на всех уровнях пищевой цепи при-
водит к образованию материала (в виде частиц
и растворенного органического вещества), назы-
ваемого детритом. Детрит потребляется пелаги-
ческими гетеротрофными бактериями либо непо-
средственно, либо после предварительной депо-
лимеризации внеклеточными ферментами. Эти
бактерии поглощают также выделяемые первич-
ными продуцентами растворенные органические
вещества (гликолат, глицерол и др.; 5-35% об-
щей продукции фотосинтеза), углерод которых
включается в бактериальную биомассу (так на-
зываемая микробная петля). Бактерии поеда-
ются растительноядным зоопланктоном и про-
стейшими (детритная пищевая цепь), и таким
образом материал их клеток поступает в клас-
сическую пищевую цепь на уровне зоопланк-
тона. С учетом микробной петли и детритной
пищевой цепи роль гетеротрофных бактерий сле-
дует считать гораздо более важной, чем пред-
полагалось ранее. Бактерии и простейшие —это
наиболее важные по метаболической активности
и общей биомассе организмы в пищевой цепи эв-
трофного озера. По относительной важности раз-
личных групп организмов мелководное эвтроф-
ное озеро сравнимо с прибрежными морскими ме-
стообитаниями (табл. 31.3), где на бактерии и
простейшие приходится наибольшая доля оборо-
та энергии. Поскольку поступление энергии в дан-
ную систему прямо пропорционально площади по-
верхности озера, такие превращения энергии при-
водят при расчетах к единице поверхности, т. е.
интегрируют эти активности по всей толще воды
и донных осадков. Роль детритной пищевой цепи
особо важна в тех случаях, когда лишь незначи-
тельная доля органического вещества окисляется
в толще воды и основная часть общей минерали-
зации происходит за счет биодеградации в донных
осадках.
В трофогенной зоне гетеротрофные бактерии
успешно конкурируют с первичными продуцента-
ми за неорганические питательные вещества, на-
пример фосфат. На гетеротрофные бактерии при-
ходится не менее 50% общего оборота фосфата в
условиях его дефицита, т. е. при концентрациях
ниже 30 нМ. Цианобактерии и одноклеточные во-
доросли обнаруживают меньшее сродство к фос-
фату, и для них имеет большое значение его вы-
свобождение при лизисе клеток.
Таблица 31.3. Биомасса и активность организмов различных трофических уровней в прибрежной морской воде.
(По Fenchel Т. М., Jorgensen В. В. 1977. Detritus food chains of aquatic ecosystems: the role of bacteria. In: Alexander M.
(ed.) Advances in microbial ecology, vol. 1, New York: Plenum Press: 1-58.)
Бактерии Простейшие Беспозвоночные Рыбы
Общая биомасса, г м-2 2,5 5 0,5 0,5
Число особей нам-2 5 1012 5- 107 5- 102 510“ 2
Биомасса особи, г 5 IO'13 110“7 110~3 10
Скорость метаболизма, кДж • м~2 сут-1 21 2,1 0,21 0,021
Скорость метаболизма, кДж • г-1 • сут-1 8,4 4,1 4,1 0,41
Глава 31. Местообитания прокариот 263
Одна из причин наблюдаемого разнообразия
трофических групп организмов в природных эко-
системах— это непостоянство скоростей поступ-
ления в них питательных веществ. В отличие от
хемостата, в котором поддерживается постоянный
приток питательной среды в течение неограничен-
ного времени, экосистема, например пресноводно-
го озера, даже относительно гомогенная, харак-
теризуется пространственной неоднородностью и
динамикой концентраций питательных веществ.
В результате этого периодическое преимущество
получают различные виды на каждом трофичес-
ком уровне.
Растворенное органическое вещество в
эпилимнионе составляет 1-50 мг -л-1, органиче-
ское вещество в составе частиц — 0,1-40 мг л’1,
и оба эти параметра зависят от трофического
статуса водоема. Большая часть растворенного
детрита — это полимерные соединения (фульво-
кислоты, водные гумусовые вещества), период
оборота которых составляет от нескольких лет
до десятилетий. Концентрации свободных ами-
нокислот в эпилимнионе мезотрофных пресно-
водных озер варьируют в пределах 0,1-4 мкМ;
скорость их оборота колеблется в диапазоне
10-1000 ч в летний период. Сходные значения
концентраций получены для свободных сахаров;
скорость их оборота — 1 сут на глубине 3 м и
8-25 сут на глубине 50 м. Выделяемые из прес-
ных вод с помощью традиционных методов планк-
тонные (свободноплавающие) бактерии относятся
к родам Pseudomonas, Alcaligenes, Flavobacterium,
Cytophaga и многим другим. Как подчеркивалось
выше (разд. 30.3.5), выделяемые таким способом
бактерии составляют лишь малую часть присут-
ствующего в воде сообщества прокариот. Чис-
ленность микробных клеток, определяемая путем
прямого подсчета после флуоресцентного окраши-
вания, варьирует в пределах 104-106 клеток/мл.
Эти значения численности варьируют в пределах
одного порядка величин в зависимости от вре-
мени года и не различаются существенно между
олиготрофными и эвтрофными озерами. Очевид-
но, численность зависит от эффективности вы-
едания бактерий зоопланктоном и простейшими
(нисходящий контроль), а не от доступно-
сти питательных веществ (восходящий кон-
троль). Соотношение численности свободнопла-
вающих бактерий и числа бактерий, ассоцииро-
ванных с частицами, варьирует от 0,3 до 3, причем
тенденция к образованию агрегатов клеток бо-
лее выражена в озерах, бедных питательными ве-
ществами.
Детрит в виде частиц, включая фекалии
планктонных организмов, медленно оседает на
дно озера, подвергаясь при этом разложению под
действием микробов. Этот органический матери-
ал в виде частиц образует непрочные агрегаты
диаметром до нескольких сантиметров, которые
медленно движутся вниз наподобие хлопьев сне-
га («морской снег», «озерный снег»). В таких
хлопьях обнаруживается повышенная микробная
активность по сравнению с чистой водой, в
том числе активность внеклеточных гидролаз,
расщепляющих хитин, целлюлозу, гемицеллю-
лозы и белки, а также повышенные концен-
трации фосфата и связанного азота. Разви-
тию прикрепленных к хлопьям микробных со-
обществ благоприятствует большое количество
питательных веществ вокруг этих агрегатов
органического материала. Как показали иссле-
дования с использованием флуоресцентно ме-
ченных, специфичных к нуклеотидным после-
довательностям зондов, проведенные в оз. Кон-
станц, в таких сообществах доминируют бактерии
/3- и 7-подклассов Proteobacteria. Представители
/3-подкласса Proteobacteria преобладают также в
активном иле; по-видимому, стратегия прикрепле-
ния к поверхностям хлопьев может в обоих слу-
чаях вести к селекции сходных организмов. Одна-
ко с этими хлопьями ассоциировано также повы-
шенное количество бактериофагов. Если в чистой
воде численное соотношение свободных вирусных
частиц и бактериальных клеток составляет при-
мерно 6 : 1, то в частицах «озерного снега» оно
возрастает до 20-40 : 1, и рост бактерий с относи-
тельно высокой скоростью на этих поверхностях
может в значительной мере уравновешиваться вы-
званным бактериофагами лизисом.
Частицы детрита, живой зоопланктон и бак-
терии, как свободноплавающие, так и прикреп-
ленные, оседают на дно с разной скоростью под
действием сил гравитации. Увеличение плотно-
сти воды в металимнионе приводит к временному
накоплению частиц и возрастанию активности де-
градации. Сходный эффект наблюдается на по-
верхности осадков. До какой стадии доходит мик-
робное разложение и какое количество органичес-
кого вещества достигает поверхности дна, зави-
сит от глубины озера, т. е. протяженности пути
оседания от продуктивного (трофогенного) слоя
264 Часть VIII. Прокариоты в биосфере
эпилимниона через лишенные света трофолити-
ческие слои воды (где доминирует потребление)
до уровня донных осадков. Доля фотосинтети-
чески синтезированного органического вещества,
достигающая осадков, варьирует от 5 до 80% в
зависимости от глубины озера. Окисление органи-
ческого вещества связано с потреблением кисло-
рода, особенно в высокопродуктивных озерах, и
может привести к полному исчерпанию кисло-
рода в гиполимнионе (рис. 31.3, Л). Восстанов-
ление альтернативных акцепторов электронов,
таких как нитрат, трехвалентное железо, четы-
рехвалентный марганец и сульфат, ведет к на-
коплению соответствующих восстановленных со-
единений и в конечном итоге к образованию
метана. Продукты реакций восстановления пере-
носятся вверх конвекционными потоками и мо-
гут вновь окисляться фототрофами (использова-
ние H2S, Fe2+) или хемотрофами в аэробных усло-
Рис. 31.3. Распределение температуры и растворенных
соединений в эвтрофном и олиготрофном озерах при
летней стратификации (зона умеренных широт).
А. В эвтрофном озере вода перенасыщена кислородом
в подповерхностном слое, но не содержит его в зоне ме-
талимниона. Градиенты СН4 и NH3 достигают глубины
исчезновения кислорода. Сероводород может использо-
ваться фототрофными бактериями в верхней части (по-
казана светло-серым) анаэробной зоны. Нитрат обнару-
живается только в эпилимнионе.
Б. В олиготрофном озере содержание кислорода воз-
растает в более глубоких слоях воды вследствие бо-
лее высокой растворимости при низкой температу-
ре и может убывать непосредственно над поверхно-
стью осадков. Нитрат представляет здесь единственную
растворимую форму азота над поверхностью осадков.
В верхних слоях воды он потребляется фитопланктоном.
Аммиак, метан и H2S не присутствуют в значительных
концентрациях. Т — температура; ось абсцисс — содер-
жание веществ и температура.
виях (использование СН4, NHj, а также H2S и
Fe2+), что приводит к характерным профилям
их распределения в водной толще в период лет-
ней стратификации (рис. 31.3, Л). В то же вре-
мя в олиготрофных озерах обнаруживаются лишь
незначительные изменения химического состава
воды от поверхности до дна (рис. 31.3, Б). В таких
озерах на поверхности осадков в течение всего го-
да вещества находятся в окисленной форме, при
этом указанные выше восстановительные реакции
протекают в слое осадков (см. разд. 31.2).
Аэробное окисление метана хемотрофами наи-
более интенсивно происходит в металимнионе—
переходной зоне, в которой вода содержит ме-
тан, поступающий со дна, и ограниченное коли-
чество Ог- Активность этих бактерий на самом
деле максимальна в тех водных слоях, где уровень
кислорода едва превышает предел чувствительно-
сти метода измерения, т. е. данные бактерии от-
носятся к микроаэрофилам. Такая же закономер-
ность характерна для реокисления аммиака хемо-
литротрофами. Фактически процессы окисления
аммиака и метана могут накладываться один на
другой, поскольку первичные оксигеназы гидрок-
силируют оба этих субстрата. Реокисление мета-
на, аммиака и других восстановленных продуктов
приводит к снижению уровня кислорода в погра-
ничном слое металимниона и способствуют стаби-
лизации распределения кислорода в этой переход-
ной зоне.
Основную роль в минерализации органическо-
го вещества в озерах выполняют бактерии и про-
стейшие. В высокопродуктивных водах особенно
важны микробная петля и детритная пище-
вая цепь.
Зона металимниона эвтрофного озера харак-
теризуется противоположно направленными гра-
диентами восстановленных и окисленных неорга-
нических и органических метаболитов, а также
накоплением органического вещества в виде ча-
стиц вследствие возрастания в этом слое плотно-
сти воды. Это зона повышенной диссимиляцион-
ной микробной активности, о чем свидетельству-
ют повышенная концентрация СО2 и пониженное
значение pH. В этой зоне соседствуют микробы,
осуществляющие процессы окисления и восста-
новления, и оборот интермедиатов окислительно-
восстановительных реакций (соединений азота и
серы) может происходить в этом слое с высокой
скоростью.
Глава 31. Местообитания прокариот 265
31.1.5. Аноксигенные фототрофные бактерии
окисляют восстановленные
соединения серы
В тех эвтрофных озерах, где до границы между
кислородной и бескислородной зонами еще прони-
кает солнечный свет, диффундирующий из ниж-
них слоев воды сульфид окисляют в первую оче-
редь аноксигенные фототрофные бактерии. Они
приспособлены к низкой освещенности, чувстви-
тельны к высокому уровню солнечной радиа-
ции и встречаются до глубины 10-15 м. В од-
ном из исследований в Черном море фототрофное
окисление сульфида наблюдалось в области хе-
моклина на глубине 80 м. Оптимальное развитие
фототрофных бактерий наблюдается в условиях
освещенности на уровне 0,1-5% освещенности у
поверхности воды. Активность этих организмов
называют вторичной первичной продукцией,
так как при фиксации СОг в процессе фотосин-
теза они используют доноры электронов, образо-
вание которых косвенно связано с активностью
первичных продуцентов, осуществляющих ок-
сигенный фотосинтез (зеленых водорослей, ци-
анобактерий и т. д.).
Пурпурные и зеленые фототрофные бактерии,
окисляющие сульфид, поглощают свет в том диа-
пазоне длин волн, в котором он проникает в во-
ду наиболее глубоко (рис. 30.2) и существенно
не поглощается эукариотическими одноклеточны-
ми водорослями (содержащими хлорофилл а) и
цианобактериями. Спектры поглощения зеленых
водорослей, пурпурных фототрофных бактерий
и зеленых фототрофных бактерий приведены на
рис. 31.4. Поскольку свет с длинами волны ме-
нее 400 нм и больше 700 нм не проникает в во-
ду на достаточно большую глубину, аноксиген-
ные фототрофы могут использовать свет только в
«окне» длин волн 450-600 нм, располагаясь ниже
слоя первичных продуцентов. Как у пурпурных,
так и у зеленых фототрофных бактерий свет в
этом диапазоне длин волн интенсивно поглощает-
ся каротиноидами. При массовом развитии пур-
пурных бактерий сем. Chromatiaceae слои воды
ниже зоны металимниона могут окрашиваться в
интенсивно-розовый цвет. В зависимости от хи-
мического состава озерной воды среди аноксиген-
ных фототрофов доминируют представители ро-
дов Thiopedia, Amoebobacter или Chromatium, ча-
сто в составе синтрофных консорций, подобных
«Pelochromatium» или «Chlorochromatium» (см.
Synechocystis spp.
Scenedesmus acutus
Пурпурные бактерии
Rhodospirillum rubrum (a)
Chromatium okenii (a)
Chlorobium vibrio forme (d)
Chlorobium phaeobacteroides (e)
Зеленые водоросли
и цианобактерии
” fll
Зеленые фототрофные
бактерии
600 800
Длина волны, нм
Rhodopseudomonas viridis (b)
Chloroflexus aurantiacus (c)
Рис. 31.4. Спектры поглощения целых клеток зеленых
водорослей, цианобактерий, пурпурных и зеленых фо-
тотрофных бактерий, сгруппированные в три «яруса»
соответственно расположению этих организмов в струк-
турированных водных экосистемах (см. текст). Типы ос-
новных бактериохлорофиллов указаны в скобках (а, Ь,
с, d, е). Дополнительно приведены характеристики по-
глощения инфракрасных фильтров, используемых для
селективного обогащения культур пурпурными бактери-
ями (А), пурпурными бактериями, содержащими бак-
териохлорофилл Ь (В) и пурпурными плюс зелеными
бактериями (С). По [1]. См. также рис. 13.1-13.5. Об-
ласть максимального поглощения света в толще воды
показана серым.
разд. 30.7.7). Зеленые фототрофные бактерии,
окисляющие соединения серы, располагаются в
слое воды, лежащем ниже слоя пурпурных бак-
терий и представлены часто Chlorobium limicola
и Pelodictyon clathratiforme. Если пурпурные и
зеленые фотосинтезирующие бактерии присут-
ствуют вместе в одном местообитании, зеленые
бактерии всегда расположены под слоем пур-
266 Часть VIII. Прокариоты в биосфере
пурных бактерий, поскольку высокоустойчивы
к сульфиду (> 0,5-4 мМ) и лучше, чем пур-
пурные бактерии, адаптированы к использова-
нию света низкой интенсивности благодаря более
высокому соотношению бактериохлорофилл ан-
тенны/бактериохлорофилл реакционных центров
(1000 : 1 против 100 : 1 у пурпурных бакте-
рий; см. гл. 13 и 24). Из Черного моря выделена
фототрофная бактерия, идентифицированная как
Chlorobium phaeobacteroides (группа зеленых фо-
тосинтезирующих бактерий, окисляющих соеди-
нения серы), которая адаптирована к крайне сла-
бой освещенности воды.
Рост окисляющих H2S фототрофных бактерий
на границе аэробной и анаэробной зон зависит
от качественного состава воды и света. В дис-
трофных озерах, богатых гуминовыми вещества-
ми, преобладают зеленые фототрофные бактерии,
так как они более эффективно по сравнению с
пурпурными используют красный свет, достига-
ющий Н 2 S-содержащих слоев воды в этих озерах.
Пурпурные серные бактерии способны к дви-
жению с помощью жгутиков или обладают пла-
вучестью благодаря наличию у них газовых ва-
куолей. Это позволяет им занимать оптимальное
положение в противоположно направленных гра-
диентах освещенности и Щй. Плавучесть в водной
толще за счет газовых везикул (см. рис. 2.18) ре-
гулируется, с одной стороны, через размеры ве-
зикул и, с другой стороны, путем агрегации и
расхождения клеток для увеличения или умень-
шения скорости оседания. Зеленые серные бакте-
рии не обладают способностью к движению; лишь
некоторые из них содержат газовые вакуоли.
Таким образом, сложные консорции «Chlorochro-
matium» и «Pelochromatium» (см. разд. 30.7.7)
имеют особое преимущество, поскольку эта коопе-
рация не только способствует обороту субстрата,
но также придает всему фототрофному агрегату
подвижность и способность к хемотаксису.
Сульфидокисляющие фототрофные бактерии
накапливаются в значительном количестве (до ви-
димой плотности) ниже температурно стабильной
переходной зоны O2/H2S, т. е. в тех слоях, где се-
роводород не подвергается химическому окисле-
нию и имеется достаточная освещенность. В отли-
чие от них пурпурным несерным фотосинтезиру-
ющим бактериям не свойственна какая-либо пред-
почтительная локализация в толще воды эвтроф-
ного водоема. Они достигают значительной чис-
ленности обычно в небольших озерках, где на по-
верхности донных осадков имеется разлагающий-
ся органический материал в виде частиц. В озе-
рах большей площади они присутствуют в неболь-
шой концентрации по всей толще воды, даже в
тех ее слоях, куда не проникает свет. Пурпур-
ные бактерии не приурочены к определенному
слою воды, поскольку используют органические
субстраты, которые не окисляются химически
кислородом. На свету они успешно конкурируют
с анаэробными и аэробными хемотрофными бак-
териями, так как благодаря осуществлению фо-
тосинтеза получают дополнительную энергию и
более эффективно используют субстрат, чем их
хемотрофные конкуренты. В темноте пурпурные
бактерии не имеют преимущества перед чисто хе-
мотрофными аэробами.
Массовое развитие сульфидокисляющих анок-
сигенных фототрофных бактерий определя-
ется противоположно направленными градиента-
ми интенсивности света и концентрации суль-
фида (сероводорода). Зеленые серные бактерии
(сем. Chlorobiaceae) накапливаются всегда ниже
слоя пурпурных серных бактерий (сем. Chroma-
tiaceae), поскольку более эффективно использу-
ют свет и более устойчивы к сероводороду. Рост
несерных пурпурных бактерий не зависит суще-
ственным образом от стратификации воды.
31.1.6. Океаны: обширные монотонные пустыни
Океаны покрывают примерно 70% поверхности
Земли, составляя большую часть биосферы. Это
высокостабильные в отношении температурных и
осмотических условий экосистемы. Примерно 8%
покрытой океанами площади приходится на райо-
ны континентального шельфа (глубины до 200 м),
15% — на материковый склон (глубины до 3000 м)
и основная часть (77%) — на глубоководные бас-
сейны (3000-6000 м). На малой части (1,3%) пло-
щади океанов глубина превышает 6000 м (глу-
боководные впадины, до 11 000 м). Температура
воды в поверхностном слое (над континентальным
шельфом) в среднем равна 8 °C, но существен-
но различается в тропических и полярных при-
брежных районах. Придонная часть водной тол-
щи в глубоководных областях океанов на всем
земном шаре имеет среднюю температуру не вы-
ше 2-4 °C.
Глава 31. Местообитания прокариот 267
Содержание Ог в поверхностном слое во-
ды, где фотосинтез преобладает над дыханием,
достигает высоких значений. Ниже фотической
зоны осуществляется только дыхание и концен-
трация кислорода более низкая. Благодаря пере-
мешиванию под действием ветра и течений кис-
лород содержится в океанской воде до самого дна
в концентрациях, достаточных для дыхания жи-
вотных. Исключения встречаются в мелководных,
закрытых прибрежных зонах и высокопродуктив-
ных районах, например в Мексиканском заливе, а
также Черном море и некоторых участках Бал-
тийского моря.
Максимальная глубина продуктивной зоны
океанов составляет 50-100 м. Фотосинтез осу-
ществляют зеленые, красные и бурые водоросли и
цианобактерии, среди которых доминируют одно-
клеточные палочковидные и кокковидные формы.
Первичная продуктивность в районах шельфа и
богатых питательными веществами зонах апвел-
линга в 10-20 раз выше, чем в открытом океане
(см. табл. 31.2), где, по современным данным, ее
лимитирует содержание в воде железа.
В открытом океане органическое вещество дет-
рита почти полностью окисляется по мере его
оседания на дно, в основном на первом отрез-
ке 1000 м. Содержание органического вещества в
растворенном состоянии и в составе частиц в во-
де морских глубин на 1-2 порядка величин ни-
же, чем в пресноводных озерах. Донные осадки
в глубоководных районах океана содержат очень
мало органического вещества (менее 1% уровня
первичной продукции; см. разд. 31.2). Время обо-
рота растворенного органического вещества в глу-
боководных зонах составляет, согласно расчетам,
2000-6000 лет.
Численность бактерий в поверхностном слое
океанской воды, по данным прямого подсчета,
варьирует в пределах 104-106 клеток/мл, т. е.
сравнима с их количеством в пресноводных озе-
рах. Судя по этим данным, величина популяций
водных микроорганизмов зависит в большей сте-
пени от интенсивности выедания, а не от ко-
личества питательных веществ. Однако лишь
очень небольшая фракция морских бактерий
(<102 клеток/мл) способна расти на стандартных
агаризованных средах. Достичь успеха в куль-
тивировании доминирующих морских бактерий
удалось только недавно благодаря применению
сильно разведенных жидких питательных сред.
Выделяемые из различных морских образцов бак-
терии не составляют предполагавшейся ранее так-
сономической группы, но распределяются по всей
таксономической системе и на всех таксономи-
ческих уровнях близкородственны бактериям из
других местообитаний. В антарктических и дру-
гих холодных областях Мирового океана значи-
тельную часть микробных популяций поверхност-
ного слоя воды составляют, возможно, неизвест-
ные типы архей, как свидетельствуют результаты
исследований с применением специфических
рРНК-зондов. В морских глубинах микроорга-
низмы ассоциированы в основном с оседающими
хлопьями («морским снегом») из неорганических
карбонатов и силикатов, а также частиц детрита.
Интенсивность процессов минерализации, осу-
ществляемой гетеротрофными бактериями в мор-
ских глубинах, по-видимому, значительно ниже,
чем на поверхности, так как высокое давление
подавляет метаболическую активность. Фактиче-
ски морские глубины могут рассматриваться как
экстремальные местообитания (см. разд. 31.4) в
том отношении, что в них может существовать и
размножаться лишь очень небольшое число спе-
циализированных организмов. Эксперименталь-
но установлено, что минерализующая активность
микрофлоры на глубине более 1000 м составляет
примерно 1% ее величины в поверхностных водах
океана. Влияние давления на метаболическую ак-
тивность более выражено при низкой температуре
(2 °C), чем при температуре поверхностного слоя
воды (8-10 °C). Повышенное давление подавляет
активность почти всех бактерий, независимо от
наличия субстратов и величины инокулята. В то
же время имеются достоверные сведения о том,
что на глубинах более 3000 м обитают бактерии,
адаптированные к условиям высокого давления —
облигатные барофилы. Они не способны расти
при нормальном атмосферном давлении, и в тече-
ние всего процесса выделения, начиная со стадии
отбора проб морской воды с больших глубин до
стадии получения чистой культуры, их подлер-
живают в условиях давления in situ, используя
специальное устройство для отбора проб и куль-
тивирования и не допуская декомпрессии. Другие
морские бактерии в определенной степени устой-
чивы к повышенному давлению, но теряют ак-
тивность по мере повышения давления. Механизм
влияния давления на метаболическую активность
пока остается загадкой, однако известно, что оно
непосредственно влияет на липидный состав мем-
бран и белковый состав клеток. Как бы то ни бы-
268 Часть VIII. Прокариоты в биосфере
ло, факт явного подавления микробной минера-
лизации органического вещества при повышенном
давлении в глубоководной зоне спасает океанские
глубины от превращения их в место сброса сточ-
ных вод и других отходов.
Прибрежные районы океанов характеризуют-
ся высокими величинами первичной продукции
и микробной активности. В эстуариях пресная
речная вода смешивается с морской водой, причем
область их смешивания смещается в зависимости
от приливов и отливов. Соответственно этому си-
дячие организмы находятся в условиях периоди-
ческого изменения солености воды и им необходи-
мы сложные механизмы осмотической адаптации
и ее регуляции. Некоторые анаэробные бактерии
содержат системы антипорта Na+/H+, и это мо-
жет иметь значение для адаптации к условиям та-
ких местообитаний (см. разд. 28.4).
Высокая продуктивность характерна также
для маршей — равнинных прибрежных террито-
рий, затопляемых морской водой во время при-
ливов, но не покрытых ею в период отлива. Бла-
годаря регулярному поступлению питательных
веществ в этих местообитаниях интенсивно раз-
виваются такие первичные продуценты, как
азотфиксирующие цианобактерии и диатомовые
водоросли. Их органические выделения и отмер-
шие клетки служат субстратами для гетеротроф-
ных бактерий, которые потребляют кислород в
более глубоких слоях, где в результате создает-
ся полностью анаэробная среда и происходит ин-
тенсивная сульфатредукция. Образующийся при
этом сероводород окисляют в первую очередь фо-
тотрофные пурпурные и зеленые серные бакте-
рии, а также аэробные хемолитотрофы. Типич-
ную картину смены слоев — темно-зеленый слой
цианобактерий, далее вниз розовый слой пурпур-
ных фототрофных бактерий, тонкий слой зеленых
фототрофных бактерий и, наконец, слой сульфвд-
ных осадков — можно наблюдать на пляжах, ес-
ли постепенно снимать песок тонкими ровными
слоями. Иногда пурпурные серные бактерии мо-
гут образовывать обширные ярко-розовые пятна
под тонкой пленкой воды, однако чаще они по-
крыты цианобактериями и диатомеями, со вре-
менем формирующими плотные слои — микроб-
ные маты, в которых доминирует Microcoleus
chthonoplastes в качестве структурной основы
(рис. 31.5). Слоистость этих сообществ обуслов-
лена несколькими факторами, в том числе гради-
ентом H2S с убыванием его концентрации вверх
и обратнонаправленными градиентами О2 и осве-
щенности. По мере прохождения через микроб-
ный мат изменяется также качественный состав
света вследствие поглощения его различными фо-
тосинтетическими пигментами. В отличие от си-
туации на дне озера, в микробных матах может
использоваться как источник энергии свет длин-
новолновой части спектра, и способность к по-
глощению этого света обеспечивает селективное
преимущество фотосинтезирующим бактериям.
Микробные маты представляют собой, таким
образом, высокоструктурированные сообщества.
Выделение кислорода цианобактериями в верх-
нем слое позволяет хемотрофным серным бак-
териям, таким, как Beggiatoa, обитать в этих
матах, перемещаясь в них в соответствии с рас-
пределением кислорода в суточном цикле. Разно-
образные взаимосвязи между всеми этими бакте-
риями были выявлены лишь недавно в исследо-
ваниях с применением микродатчиков высокого
разрешения, улавливающих изменения интенсив-
ности и качественного состава света в микрослоях.
Поверхность
Розовая
Розово-
красная
окраска
Окраска от
темно-серой
до черной
Желто-бурая
окраска
Сине-зеленая
окраска
Персиковая
Оранжево-
бурая
окраска
Оливково-
зеленая окр.
Диатомеи
Цианобак-
терии
Navicula sp.
Lyngbya
Цианобак-
терии
Пурпурные
серные
бактерии
Microcoleus
Oscillatoria
Phormidium
Thiocapsa
roseopersicina
Thiocystis
Хл а
860 нм
Бхл а
850 нм
ы
Зеленые cep-
ные бактерии
Осадки,
содержащие
FeS
Thiocapsa
pfennig"
Бхл b
1020 нм
Prostheco-
chloris
Бхл с
740 нм
Desulfovibrio
Рис. 31.5. Схематический поперечный срез слоистого
микробного мата в засоленном марше (местность Great
Sippewisset). Слева показано строение и отмечена окрас-
ка слоев. Справа приведены характерные микроорганиз-
мы и содержащиеся в их клетках хлорофилл (Хл) и бак-
териохлорофиллы (Бхл). По [2].
Глава 31. Местообитания прокариот 269
Поскольку такие микробные маты в засолен-
ных маршах выделяют большое количество се-
роводорода, они выедаются лишь незначительно
немногими видами крабов и других мелких чле-
нистоногих, сохраняясь целыми многие годы. По-
скольку метаболизм различных компонентов этих
микробных сообществ основан главным образом
на интенсивном круговороте соединений серы, та-
кая система получила название сульфуретум.
Регулярное периодическое обогащение мик-
робных матов питательными веществами из бо-
гатых ими прибрежных морских вод обеспечива-
ет интенсивную первичную продукцию, поэтому
сульфуретумы относят к наиболее продуктивным
из описанных экосистем. Интенсивная фиксация
СО2 в верхних слоях и соответственное подще-
лочение среды вызывает осаждение карбонатов и
силикатов внутри матов, в результате чего они мо-
гут постепенно превращаться в каменно-твердый
материал, внутри которого биологические объек-
ты сохраняются в виде окаменелостей. Как пред-
полагается, путем такого биологически обуслов-
ленного окаменения из микробных матов образо-
вывались строматолиты.
На глубинах более 100 м выделяющийся из
анаэробных донных осадков сульфид окисляют
в высокопродуктивных прибрежных районах уже
не фототрофные, а хемолитотрофные бактерии.
В таких участках встречается массовое развитие
морских видов Beggiatoa, покрывающих донные
осадки белым слоем толщиной 0,5-1 мм. На боль-
шом протяжении океанского дна вдоль побере-
жья Чили недавно были обнаружены обширные
структурированные микробные маты толщиной
несколько сантиметров, образованные нитчатыми
морскими серными бактериями Thioploca, окисля-
ющими сульфид (рис. 31.6). Некоторые их штам-
мы способны при окислении H2S использовать
нитрат в качестве акцептора электронов. Клет-
ки Thioploca аккумулируют нитрат в специаль-
ной внутриклеточной вакуоли, концентрируя его
более чем в 1000 раз относительно окружающей
морской воды, и тем самым способствуют поступ-
лению нитрата и сероводорода в эти толстые сло-
истые образования.
Океаны, несомненно, наиболее крупные и ста-
бильные местообитания микробов, но обычно бед-
ные питательными веществами. Более высокая
интенсивность продукции, потребления и мине-
рализации характерна для прибрежных райо-
нов, особенно на пространствах засоленных мар-
шей, где морская вода приносит в больших ко-
личествах неорганические питательные вещества,
обеспечивающие развитие сульфуретума — мик-
робного сообщества со сложной структурой и ин-
тенсивным оборотом органического вещества.
31.1.7. Гидротермальные венты
на океанском дне — оазисы в пустыне
Глубоководные донные осадки крайне бедны суб-
стратами, поскольку в них поступает очень мало
органического вещества; высшие организмы пред-
ставлены здесь лишь немногочисленными вида-
ми моллюсков и морских звезд. Однако в 1979 г.
Рис. 31.6. Виды Thioploca, обитающие
в донных отложениях у побережья Чи-
ли. Видны два типа нитей Thioploca.
Центральные вакуоли (не видны) в бо-
лее крупной нити оттесняют капли се-
ры к стенкам клеток. Шкала 50 мкм. Фо-
то любезно предоставлено J. Detmers и
J. Kiiver.
270 Часть VIII. Прокариоты в биосфере
на больших глубинах в областях разломов зем-
ной коры неожиданно были обнаружены обшир-
ные зоны с чрезвычайно высокой продуктивнос-
тью, густозаселенные необычными животными.
Такие зоны разломов на морском дне представ-
ляют собой разделительные линии, где встреча-
ются два тектонических пласта; при этом один
из них вытесняется на поверхность либо пласты
разделены между собой. В этих зонах разломов,
простирающихся примерно на 40 000 км через Ат-
лантический, Тихий и Индийский океаны, выхо-
дящая лава сжимается в результате охлаждения
и морская вода проникает через нее на несколько
километров вниз в океаническую кору. При тем-
пературах, превышающих 350 °C, и высоком дав-
лении эта вода реагирует с базальтовой скальной
породой, превращаясь в результате в кислую и
крайне восстановленную «гидротермальную жид-
кость», богатую металлами, сероводородом и мо-
лекулярным водородом (рис. 31.7). Эта жидкость
либо смешивается с холодной морской водой и
медленно проникает при умеренных температу-
рах (3-40 °C) в расположенную выше морскую
воду, либо выбрасывается непосредственно в хо-
ЖИДКОСТЬ
жидкость
НСО3 -► С02, СН4 Mg2* Mn2*Ca2* Fe2* Cu2*H,
t "Т
XXX ХХХХХХХХХХХ
~1200*С XX XX Базальт ХХХХХХХХХХХ Х>
ххххххххххххххххххххххххххххххх
Рис. 31.7. Схема циркуляции морской воды через океа-
ническую кору в зонах тектонических разломов. Поток
через теплые венты показан слева, через горячие вен-
ты — справа. По [3].
лодную воду без смешивания. В последнем случае
из нее осаждаются соли железа и марганца в виде
напоминающих дым облаков черных частиц (та-
кие выходы называют «черными курильщиками»;
см. рис. 31.7). В зонах черных курильщиков воз-
можны очень резкие градиенты температуры, от
350 до 2 °C, на участке в несколько дециметров;
из таких участков были выделены как мезофиль-
ные, так и экстремально термофильные микроор-
ганизмы.
Богатая фауна, обнаруженная вокруг подоб-
ных гидротермальных выходов, или вентов, мо-
жет существовать только на основе бактериаль-
ной хемосинтетической, но не фотосинтетической
активности, поскольку на этих глубинах царит
полная темнота. Донорами электронов для аэроб-
ного литоавтотрофного метаболизма здесь мо-
гут служить сульфид, тиосульфат, метан, водо-
род и восстановленное железо. Морская вода во-
круг гидротермальных вентов имеет некоторую
мутность вследствие высокой плотности в ней
бактерий, среди которых доминируют окисляю-
щие H2S виды Thiomicrospira. Другие выделен-
ные из этих зон бактерии окисляют восстановлен-
ное железо или марганец, метан, иные метиль-
ные соединения или аммиак; среди полученных
изолятов идентифицированы также водородокис-
ляющие аэробы, сульфатредукторы и метаноге-
ны. Все эти организмы, по-видимому, растут на
глубине 2000-3000 м с относительно высокой ско-
ростью, чему благоприятствует повышенная тем-
пература. Свободноплавающими бактериями пи-
таются бокоплавы и двустворчатые моллюски.
Однако поразительно крупные размеры домини-
рующих в этих экосистемах двустворчатых мол-
люсков, например Calyptogena magnifica (длина
тела — 30 см, вес до 800 г), едва ли согласуют-
ся с питанием исключительно взвешенными в во-
де бактериальными клетками. Такие двустворча-
тые моллюски содержат внутри жаберных клеток
эндосимбиотические бактерии, окисляющие H2S.
Другие двустворчатые в зонах гидротермальных
выходов, богатых метаном, образуют сходные ас-
социации с аэробными бактериями, окисляющи-
ми метан. К необычным животным, питание ко-
торых основано на симбиотической ассоциации с
хемосинтезирующими бактериями, относится ве-
стиментифера Riftia pachyptila — похожий на чер-
вя и сидящий в трубке организм, длина которо-
го достигает 2-3 м. Внутри его тела находится
специальный орган — трофосома, в которую че-
Глава 31. Местообитания прокариот 271
рез систему кровообращения поступают О2, СО2
и H2S из окружающей морской воды (рис. 31.8; см.
цв. вклейку). В трофосоме содержатся бактерии-
симбионты, которые продуцируют органическое
вещество и растут. Пока неясно, каким образом
эти бактерии обеспечивают питание животного-
хозяина; физиологические эксперименты затруд-
нены тем, что такие «черви» неустойчивы к де-
компрессии. Возможно, ассоциированные с ними
бактерии выделяют растворенные органические
вещества или медленно перевариваются хозяи-
ном, но сохраняют свою численность за счет раз-
множения.
Сообщества гидротермальных вентов пред-
ставляют огромный интерес как экосистемы, су-
ществующие на основе бактериальной хемосинте-
тической активности в полной темноте в океан-
ских глубинах и, казалось бы, не зависящие от
фотосинтеза. Однако и эти сообщества зависят
от фотосинтеза, осуществляемого в эвфотической
зоне, поскольку он служит источником кислоро-
да для окисления восстановленных компонентов
гидротермальной жидкости.
Вокруг глубоководных гидротермальных
выходов (вентов) на океанском дне в полной тем-
ноте обитают сложные сообщества из прокариот
и животных, существующие на основе бактери-
ального хемосинтеза. Литоавтотрофные бактерии
этих сообществ, окисляющие H2S, Н2 и Fe(II), а
также метилотрофные бактерии присутствуют в
них либо как свободноживущие формы, либо как
симбионты внутри специализированных органов
животных, продуцируя органическое вещество и
снабжая широкий круг животных источниками
углерода и энергии.
31.2. Донные осадки как «органы переваривания»
и «исторические документы»
Неорганические и органические частицы из вод-
ной толщи оседают на дно и здесь используются
в качестве питательных субстратов, главным об-
разом микробами. Оседающие частицы накапли-
ваются на донной поверхности, образуя слой осад-
ков, что способствует их разложению, посколь-
ку внеклеточные микробные ферменты в кон-
денсированном материале действуют с большей
эффективностью. При этом выделяются низко-
молекулярные органические соединения и неор-
ганические вещества и общая микробная ак-
тивность достигает значительно более высокого
уровня, чем в толще воды. Осадки — это как бы
органы переваривания относительно массы воды,
особенно в мелких озерах. Активность микроор-
ганизмов в осадках зависит от скорости поступ-
ления в них субстратов, т. е. скорости осаждения,
которая наиболее высока в эвтрофных озерах и
значительно ниже в олиготрофных озерах и оке-
анах. В свою очередь скорость отложения осад-
ков и содержание в них органического материа-
ла определяются уровнем первичной продукции и
глубиной водоема, а также химическим составом
воды (табл. 31.4).
Поскольку донные осадки служат источником
питательных веществ для обитающих в них со-
обществ микро- и макроорганизмов, химический
состав этих осадков, образующихся в результате
Таблица 31.4. Скорости осаждения в водных экосистемах
Толщина слоя осадков за год, мм Содержание органического углерода, вес. %
Олиготрофцые озера Эвтрофные озера Высокопродуктивные зоны апвеллинга в морях Глубоководные районы океанов 0,1-2 1-5 0,05-0,3 0,001-0,02 1-6 2-30 1-4 0,3-0,5
272 Часть VIII. Прокариоты в биосфере
биотрансформации, отражает химическую и био-
логическую историю данной системы. Панцири
диатомовых водорослей и фораминифер в мор-
ских осадках служат источником сведений об
изменениях температуры, солености и климати-
ческих условий в океане; остатки фотосинтети-
ческих пигментов (хлорофиллов, каротиноидов)
позволяют установить, какие первичные и вто-
ричные продуценты доминировали здесь тысячи
лет назад. Древнейшие осадочные скальные поро-
ды (возрастом примерно 3,8 - 109 лет) свидетель-
ствуют о наличии в то время на планете жид-
кой воды, а немного более поздние слои содержат
остатки органического углерода, указывающие на
появление автотрофной биотической активности.
31.2.1. Тип донных осадков зависит
от химических характеристик воды
и состава планктона
Химический состав осадков в значительной сте-
пени определяется присутствующими в воде хи-
мическими соединениями и биологической актив-
ностью в ее толще. Частицы органического дет-
рита обычно включают то или иное количество
неорганического материала, в том числе крем-
ниевые панцири диатомовых и золотистых водо-
рослей, а также карбонаты. Последние образуют-
ся в поверхностном слое озер с жесткой водой
в результате подщелочения воды, вызванного по-
треблением СО2 при фотосинтезе. При этом фор-
мируются небольшие кристаллы СаСОз, кото-
рые тонким слоем откладываются на поверхности
клеток водорослей. Эти карбонатные отложения
могут либо вновь растворяться в слоях воды, на-
сыщенных СО2, либо достигать дна, образуя из-
вестковые осадки. В озерах с мягкой водой осад-
ки содержат органические компоненты, но глав-
ным образом неорганические частицы силикатной
природы (например, глинистые). Зерна песка и
более крупные минеральные частицы указывают
на присутствие аллохтонных отложений — выно-
сов рек и т. д. В дистрофных, слабокислых озе-
рах и болотах осадочный материал, часто очень
рыхлый, состоит из не полностью разложившихся
древесных остатков, которые постепенно уплотня-
ются, образуя торф и позднее бурый уголь.
Осаждение карбонатов в озерах с жесткой во-
дой играет важную роль в переносе органическо-
го вещества в осадки. На карбонатах адсорбиру-
ются, например, фульвокислоты и аминокислоты,
поступающие таким образом в донные отложе-
ния. Именно осаждением органических веществ
на карбонатах объясняется прозрачность озер с
жесткой водой, обычно не содержащей бурова-
той мути, характерной для озер с мягкой водой.
Связывание органических веществ с неорганиче-
скими частицами имеет большое значение для
их микробного разложения, поскольку таким пу-
тем растворенные субстраты переносятся в осад-
ки и это стимулирует участие донных микроб-
ных сообществ в обороте органического вещества.
Морские осадки прибрежной полосы содержат в
основном песчаный материал в зоне прибоя и бо-
гатый органикой илистый материал в районах, от-
деленных от моря островами. Продуктивные осад-
ки па отдалении от берега (например, в областях
апвеллинга вдоль западных берегов Южной Аме-
рики и Южной Африки) имеют тонкозернистую
структуру и относительно богаты органическим
материалом. Осадки на больших глубинах крайне
бедны органическим веществом и состоят либо из
карбонатов, образовавшихся в продуктивных по-
верхностных водах, либо из пылевых частиц, пе-
реносимых из пустыни через атмосферу и вымы-
ваемых дождем.
Различия между водоемами разных типов в
скорости накопления осадков (табл. 31.4) отражав
ются на возрастной шкале этих слоев. В эвтроф-
ном озере осадочный слой на глубине 20 см мо-
жет иметь возраст 100 лет, а образец глубоковод-
ных морских осадков с той же глубины — пример-
но 100 000 лет. Очевидно, что по содержанию суб-
стратов эти осадки принципиально различны.
К сожалению, осадки не всегда настолько хо-
рошо сохраняются, чтобы их слои представля-
ли собой неповрежденную геологическую лето-
пись. Нарушение структуры донных отложений
связано с тем, что в них зарываются до глубины
50 см различные моллюски и черви, особенно на
мелководьях. Это способствует поступлению кис-
лорода в глубокие осадочные слои и повышает
площадь поверхности, где происходит обмен кис-
лородом. Во внутренних стенках жилищ рою-
щих червей имеет место резкий переход от окис-
ленных условий к восстановленным, и такие
поверхности представляют собой яркий пример
градиентных местообитаний. Заселение осадков
беспозвоночными может также использоваться
как индикатор трофического статуса данной вод-
Глава 31. Местообитания прокариот 273
ной системы. В олиготрофных осадках преоб-
ладают моллюски, иглокожие и глубокороющие
членистоногие; с повышением содержания орга-
нического материала и степени восстановления
осадочных слоев это сообщество изменяется в сто-
рону доминирования мелких полихет. Наконец,
осадки могут быть полностью восстановленны-
ми или в них могут доминировать на поверх-
ности окисляющие сероводород бактерии родов
Beggiatoa или Thioploca (см. разд. 31.1.6), и тогда
размножение животных невозможно.
Дополнение 31.3. Методы отбора проб
и анализа осадков, применяемые для раз-
ных глубин, весьма различаются. Отбор об-
разцов прибрежных и литоральных осадков
не представляет трудностей, тогда как глу-
бокозалегающие осадки отбирают с помощью
специальных измерительных и захватываю-
щих приспособлений, закрепленных на тро-
сах, либо подводных манипуляторов. Мате-
риал с поверхности осадков снимают с по-
мощью черпаков, таких как драга Экмана.
Если необходимо сохранить нативную слои-
стую структуру материала, в осадки погру-
жают открытые трубки (сверла) различных
размеров, с помощью либо ручных приспо-
соблений, либо балласта. Приспособления с
несколькими сверлами позволяют отобрать
серию из 4-24 кернов одновременно в одном
месте сбора. Повторности образцов, получа-
емые таким путем, показывают, насколько
неоднороден грунт, т. е. насколько различа-
ются химические и биологические параметры
в разных точках исследуемого участка. Для
анализа глубокозалегающих морских осад-
ков в грунт вводят глубинные керны длиной
5-10 м, используя балласт массой несколько
тонн.
Характер распределения биогенных ве-
ществ (О2, NO^, SO4", H2S, СН4, NH+ и
т. д.) определяют с применением традицион-
ных методов, анализируя тонкие срезы кер-
на. В настоящее время доступен и более со-
вершенный, микроэлектродный метод, даю-
щий высокое разрешение (см. разд. 30.6.1).
Поскольку распределение метаболитов может
изменяться, когда глубоководные осадки вы-
носятся на поверхность, были разработаны
специальные приспособления, опускаемые на
морское дно и измеряющие профили ве-
ществ автоматически in situ без декомпрес-
сии. Сравнение показывает, что, например,
поглощение кислорода, измеренное in situ,
значительно ниже по интенсивности, чем из-
меренное при атмосферном давлении (см.
разд. 31.1.6).
31.2.2. Химический состав осадков зависит
от микробной активности
Численность бактериальных клеток в осадках на
3-5 порядков величин выше, чем в расположен-
ных выше слоях воды. По данным прямого под-
счета с применением флуоресцентного красителя,
она равна 1О7 В *-1О10 бактериальных клеток на 1 г,
что соответствует биомассе в пределах 1-1000 мкг
углерода на 1 г осадков в зависимости от трофи-
ческого статуса водоема. Число клеток бактерий
максимально у поверхности осадков и снижает-
ся па 3-4 порядка в слое толщиной 50 см. Более
глубокие слои очень бедны субстратами, пригод-
ными для микробного разложения, но в них еще
регистрируется метаболическая активность (на-
пример, эстеразная или дыхательная). Жизнеспо-
собные микробные клетки в значительных коли-
чествах присутствуют в донных отложениях на
глубине до нескольких метров, где осадочный ма-
териал может иметь возраст свыше 100 000 лет.
В большинстве это споры, но встречаются и веге-
тативные клетки.
Химические условия в осадках в значитель-
ной мере определяются минерализующей микроб-
ной активностью. Поступление О2 в структуриро-
ванный матрикс происходит только путем диф-
фузии, поэтому аэробные процессы ограничены
верхним слоем осадков, тогда как в остальной
их массе преобладает метаболическая активность
с использованием других акцепторов электронов
(см. разд. 30.2.1). Типы основных окислительно-
восстановительных процессов в микробных место-
обитаниях с ограниченным доступом кислорода
во всех случаях сходны, но в зависимости от коли-
чества тех или иных акцепторов электронов и ско
рости отложения органического материала на по-
верхности осадков в их вертикальных слоях могут
доминировать различные по типу питания мик-
роорганизмы, и в соответствии с этим варьиру-
274 Часть VIII. Прокариоты в биосфере
ет относительный вклад отдельных процессов в
общий оборот углерода в осадках. Донные осад-
ки эвтрофного озера содержат кислород в слое
толщиной 1 мм, осадки олиготрофных озер или
продуктивные морские осадки — в слое толщи-
ной несколько сантиметров, глубоководные осад-
ки в отдаленных от берега районах—в слое 0,5-
1 м. Соответственно этому изменяются масштабы
окислительно-восстановительных процессов.
Молекулярный кислород и нитрат быстро вос-
станавливаются в самых верхних слоях осадков
(рис. 31.9, Л), тогда как железо и марганец обес-
печивают стабильный окислительный потенциал,
зависящий от наличия их гидроксидов. Пресные и
морские воды особенно различаются по содержа-
нию в них сульфата. В пресноводных осадках вос-
становление сульфата может происходить в незна-
чительных масштабах, однако оно существенно
понижает окислительно-восстановительный по-
тенциал системы, что обеспечивает возможность
метаногенеза — доминирующего здесь процесса.
В морских осадках сульфат обычно присутству-
ет до их значительной глубины, определяя ха-
рактер окислительно-восстановительных условий
(рис. 31.9, Б).
В табл. 31.5 приведены величины электрон-
акцепторной емкости различных соединений в
пресноводных и морских осадках. Если в тол-
ще воды условия окислительные, то кислород,
нитрат и другие акцепторы электронов по ме-
ре их потребления диффундируют в осадки, и
эти потоки можно рассчитать по градиентам
распределения. Рассмотрим в качестве примера
мезотрофное оз. Констанц (Германия), характе-
ризующееся годовой продуктивностью пример-
но 25 ммоль С м~2. Примерно 20% образованно-
го органического вещества достигает осадков (на
глубине в среднем 100 м), и его окислением обу-
словлены потоки интенсивностью 4,4 моль О2 и
0,4 моль NO3 на м2 в год. Сульфат образует-
ся в осадках только в конце лета и высвобож-
дается в толщу воды зимой; потребление его в
течение всего года незначительно. Метан не по-
ступает в толщу воды в значительных количе-
ствах. Однако в глубоких слоях осадков проис-
ходит восстановление сульфата и метаногенез; се-
роводород и метан диффундируют в их верхние
слои и здесь окисляются. В таких осадках до-
минирующим акцептором электронов всегда слу-
жит О2, или непосредственно, или косвенно, че-
рез другие, восстановленные интермедиаты (см.
Рис. 31.9. Распределение метаболитов в осадках.
А. Осадки в пресноводном озере (оз. Констанц, Герма-
ния).
Б. Донные отложения у побережья Дании. Обратите
внимание, что масштабы глубин на графиках различ-
ные.
также рис. 30.7). В противоположность этому
из литоральных осадков того же озера выделя-
ется существенное количество метана (примерно
10 ммоль СН4 на 1 м2 в год) благодаря боль-
шей продуктивности, незначительной минерали-
зации в толще воды и недостаточному реокисле-
Глава 31. Местообитания прокариот 275
Таблица 31.5. Электронакцепторная емкость донных осадков. Концентрации растворимых соединений — средние
значения для столба воды, содержащей кислород. Концентрация железа — общее содержание [включая оксиды
Fe(ll) и Fe(lll), FeS и FeS2] в осадках. Для марганца значения не приведены, так как его содержание существенно
варьирует в зависимости от местообитания
Электронакцеп- торная система Число принима- емых электронов Пресные водоемы Океан
Концентрация, мкМ Поглощение элек- тронов, мкэкв./л Концентрация, мкМ Поглощение элек- тронов, мкэкв./л
о2 4 400 1600 320 1280
NO3 -» n2 5 200 1000 5 25
no~ -» nh+ 8 200 1600 5 40
Fe(III) 1 20 000 20 000 20 000 20 000
so*- 8 300 400 28 000 224 000
HCO7/CO2 8 30 000 240 000 30 000 240 000
(неограниченное) (неограниченное)
нию. Таким образом, относительный вклад раз-
личных акцепторов электронов при минерализа-
ции биомассы варьирует на протяжении года, а
также в зависимости от конкретной зоны одно-
го и того же озера. Результирующее поглощение
оксидантов может не отражать полной картины
окислительно-восстановительных процессов, про-
текающих в осадках.
В осадках происходит также регенерация ос-
новных неорганических питательных веществ.
При разложении органических остатков высво-
бождается аммиак; он диффундирует в верх-
ние слои осадков, содержащие Ог, где окисляет-
ся до нитрата нитрифицирующими бактериями.
Максимум концентрации нитрата под поверхно-
стью осадков показывает зону его образования
(рис. 31.9, Б), откуда он диффундирует в рас-
положенную выше толщу воды. Часть нитрата
диффундирует в нижние слои осадков и восста-
навливается в процессах минерализации, главным
образом до N2- Таким образом, только часть свя-
занного азота, поступившего в осадки, возвраща-
ется в толщу воды как связанный азот, другая его
часть теряется в виде N2.
Фосфат связывается в толще воды главным об-
разом с ионами кальция и гидроксидами Fe(III),
осаждаясь в виде Саз(РС>4)2 и FePO4- В восста-
новительных условиях железо восстанавливается
до Fe(II) и осаждается в виде сульфида:
FePO4 + е~ + H2S FeS + Н2РО7 (31.1)
Таким образом, фосфат вновь растворяется и мо-
жет диффундировать в толщу воды. Этот процесс
ведет к рециклизации фосфата в эвтрофных озе-
рах («ремобилизация фосфата»), если в осадках
и в воде над ними условия полностью восстанови-
тельные. В иных условиях микробное или хими-
ческое реокисление железа у поверхности осадков
может приводить к улавливанию фосфата и удер-
жанию его в глубоких слоях осадков.
В морских осадках характер распределения
микробных метаболитов легко установить, по-
скольку эти отложения имеют толщину несколько
метров. Профиль микробных метаболитов в воде
скважины, сделанной в морских осадках высо-
копродуктивного района у юго-западного побере-
жья Африки, показан на рис. 31.10. Максимум
восстановления сульфата приходится на глубину
примерно 6 м; сероводород диффундирует вверх,
сульфат соответственно вниз. Между горизонта-
ми восстановления нитрата (на глубине 0,5 м) и
восстановления сульфата в воде скважины не об-
наружено окислительно-восстановительных про-
цессов с участием растворенных веществ. Оче-
видно, такие процессы в этом слое происходят
с участием слаборастворимых оксидов марганца и
железа и с ними связано реокисление сульфида на
горизонте 4 м. Рис. 31.10 иллюстрирует также два
других необычных процесса превращений, а имен-
но исчезновение аммиака на горизонте 4 м и мета-
на на горизонте восстановления сульфата. Анаэ-
робное окисление аммиака и метана пока недо-
статочно изучены как микробиологически, так и
биохимически. Таким образом, при изучении рас-
пределения метаболитов в донных осадках мо-
гут быть обнаружены новые метаболические про-
цессы.
276 Часть VIII. Прокариоты в биосфере
Рис. 31.10. Распределение растворенных метаболитов
в морских осадках в высокопродуктивной зоне апвел-
линга (юго-восточное побережье Африки, Намибия) на
глубине 1000 м.
Превращения органического вещества в осад-
ках, называемые диагенезом, ведут к образо-
ванию за большие периоды времени все более
устойчивых к разложению органических соеди-
нений, которые существенно отличаются от ис-
ходных. В богатых органическими остатками глу-
боких слоях осадков в результате микробных и
химических превращений может образовывать-
ся пастообразный, слегка маслянистый матери-
ал, называемый керогеном. Все вещества угле-
водной природы, аминокислоты и другие богатые
энергией соединения при диагенезе исчезают; од-
новременно исчезает фракция полианеллирован-
ных и алифатических фенолов и углеводородов.
Другие компоненты органических остатков, такие
как разветвленные жирные кислоты и изопрено-
идные соединения, в том числе каротиноиды и
мембранные липиды (стеролы, гопаноиды), дли-
тельное время сохраняются в немодифицирован-
ном состоянии и могут служить метками при ис-
торическом анализе водоема. В некоторых случа-
ях наиболее богатые сведения о продуктивности
озер, изменениях трофического статуса и геоло-
гической ситуации данного бассейна дает анализ
каротиноидов. Кроме того, химические соедине-
ния, сохранившиеся в керогене, служат показа-
телем тех горизонтов, где прекращается актив-
ность анаэробных микроорганизмов и геохимиче-
ские превращения.
В осадках преобладают микробные процессы
анаэробного разложения органических остатков,
которые ведут к накоплению восстановленных со-
единений. В зависимости от степени окисления
поверхностного слоя осадков восстановленные со-
единения либо реокисляются внутри осадков, ли-
бо высвобождаются в толщу воды. Дальнейшее
разложение органического вещества в осадках ве-
дет к образованию пока малоизученного матери-
ала, называемого керогеном, который содержит
устойчивые к деградации вещества биологическо-
го происхождения и другие соединения, близкие
по природе к компонентам нефти.
31.3. Почва обычно представляет собой сухую и гетерогенную среду обитания
Второй после океана наиболее важной средой
обитания микроорганизмов следует считать поч-
ву. Эти две основные для микробов экосистемы
принципиально различны. Если вода, особенно в
океанах, довольно гомогенна в пространственном
отношении, т. е. характеризуется лишь незначи-
тельно изменяющимися условиями, как в малом,
так и в крупном масштабе, почва представляет
собой чрезвычайно гетерогенную среду обитания.
Степень гетерогенности и структурная сложность
возрастают в ряду: свободная вода, донные осад-
ки, почва. Как показывает анализ образцов, ха-
рактеристики почвы в данном месте меняются от
поверхности до глубины 30 см или менее. То же
Глава 31. Местообитания прокариот 277
относится к образцам почв, взятым в разных мес-
тах на расстоянии метров, километров и сотен ки-
лометров, а также к точкам одного образца, на-
ходящимся на расстояниях порядка миллиметров
или микрон. В течение года почвы претерпевают
значительные изменения температуры, влажно-
сти, осмолярности, кислотности, содержания кис-
лорода и т. д. Почва — это наиболее сложная и ге-
терогенная среда из всех известных сред обитания
микробов, и неудивительно, что опа так мало изу-
чена в отношении микробной экологии, несмотря
на огромную значимость почв, например, для ро-
ста растений, питания человека, очистки поверх-
ностных и грунтовых вод, обезвреживания ксе-
нобиотиков и стабилизации концентраций газов,
присутствующих в атмосфере в следовых коли-
чествах.
Полифазность и гетерогенность почвы как
среды обитания микробов отражается в характер-
ном для нее разнообразии микробных геномов.
В пробе воды из рыбопромыслового пруда можно
обнаружить примерно 80 различных микробных
геномов, в образце из прибрежных морских осад-
ков их число достигает 1000, в почвенном образ-
це —10 000. Очевидно, почва будет в дальнейшем
наиболее важным предметом изучения в микроб-
ной экологии, как из общенаучного интереса, так
и в связи с потребностями экономики и сельского
хозяйства.
31.3.1. Химический состав и структура почв
Прежде всего следует провести различие между
почвой и земляной грязью. Хотя почти любую
почвенную фракцию можно гомогенизировать,
просеять или перемешать так, что из нес образует-
ся земляная грязь того или иного типа, нативная
почва, в отличие от нее, имеет гетерогенную внут-
реннюю структуру; это пространственно упоря-
доченная, организованная система, возникшая в
результате определенного развития. Почва состо-
ит из разнообразных компонентов. Минераль-
ные компоненты обычно представляют собой
продукты разрушения горных пород, образующи-
еся в результате выветривания и биологического
воздействия, например проникновения в минера-
лы грибных гиф, корней растений и их кислых
выделений. От природы скального материала за-
висит химическая реакция почвы: почвы на осно-
ве известняка имеют реакцию от нейтральной до
слабощелочной, тогда как почвы на силикатной
основе легче подкисляются под влиянием, напри-
мер, микробных метаболитов. Подкисление почв
по причине избыточного поглощения соединений
азота и серы и микробной активности ведет (при
pH < 5) к мобилизации ионов алюминия, токсич-
ных для растений. Источниками органических
компонентов почвы служат растительный опад,
животные остатки и отмершие клетки микроор-
ганизмов. Этот материал, который может быть
частично структурированным (например, содер-
жать древесные сучья или хитиновые панцири
членистоногих), медленно превращается в темно-
коричневый, сравнительно гомогенный материал,
называемый гумусом (см. также разд. 30.1.2).
Гумус образуется прежде всего благодаря мик-
робной активности — активации ароматических и
алифатических компонентов отмершей биомассы
с образованием радикалов, которые полимеризу-
ются в высокомолекулярные полимеры. В механи-
ческом измельчении и разложении органического
материала участвуют также черви, насекомые и
простейшие. Раньше считалось, что гумус состо-
ит только из производных лигнина; в настоящее
время известно, что с ароматическими остатка-
ми в составе гумуса ковалентно связаны углевод-
ные и пептидные цепи, которые могут составлять
значительную часть массы гумуса. Компоненты
гумуса можно частично экстрагировать из поч-
вы раствором NaOH или Na^^Oy. Оставшуюся
в почве после щелочной экстракции фракцию гу-
муса называют гумином; она состоит из моле-
кул массой более 100 к Да. Из щелочного экстрак-
та путем его подкисления до pH 2 осаждаются гу-
миновые кислоты. Они включают соединения
мол. массой в пределах 10-100 кДа. Часть мате-
риала, экстрагированного щелочным раствором,
остается растворимой при pH 2 — это низкомо-
лекулярные соединения (1000-30 000 Да), назы-
ваемые фульвокислотами. Гумин, гуминовые
кислоты и фульвокислоты — это основные компо-
ненты (>90%, вес.%) органического вещества, со-
ставляющего до 10% (вес.%) верхнего горизонта
лесной почвы, 0,5-3% сельскохозяйственных почв,
менее 0,1% пустынных почв и более 30% болотных
отложений.
Поскольку образование гумусовых веществ
происходит после ферментативной активации
компонентов природных полимеров и далее пу-
тем большей частью спонтанных реакций с уча-
278 Часть VIII. Прокариоты в биосфере
стием радикалов, структура образующихся кон-
денсатов непредсказуема и нет двух одинаковых
молекул гумусовых веществ. Карбоксильные
группы в составе компонентов гумуса, обладая
ионообменными свойствами, взаимодействуют с
анионными группами в составе минералов через
положительно заряженные ионы металлов (Fe, Al,
Са, Мп; рис. 31.11). Фенольные остатки и карбок-
сильные группы в составе гуминовых кислот об-
разуют комплексы с ионами металлов и связыва-
ют некоторое количество атомов азота. Гумусо-
вые вещества постепенно трансформируются под
действием внеклеточных микробных ферментов
(лигнинпероксидаз, лакказ и других оксигеназ;
см. разд. 9.6), что приводит к их частичной ми-
нерализации и дальнейшей конденсации. Преоб-
ладание в составе гумусовых веществ анионных
функциональных групп относительно катионных
делает эти вещества хорошими катионообменни-
ками; такие катионы, как аммоний, эффектив-
но связываются ими, тогда как анионы, напри-
мер нитрат, вымываются. С компонентами гу-
муса могут также связываться путем абсорбции
(ван-дер-ваальсовы взаимодействия) неполярные
алифатические или ароматические соединения.
К органическому веществу почвы относят также
биомассу живых микроорганизмов, главным об-
разом представленных грибами и бактериями (см.
разд. 31.1.2).
Структура (сложение) почвы определяет ее
плотность и эффективность обмена компонента-
ми с атмосферой. В зависимости от размеров ча-
стиц грунта почвы разделяют на песчаные, или-
стые, глинистые и различные смешанные типы.
На образование и стабилизацию пористой струк-
туры почвы, обеспечивающей ее аэрацию, суще-
ственно влияют грибные гифы, корни растений и
ходы земляных червей. Типы почв различают по
химическим, физическим и биологическим при-
знакам. К сожалению, единой системы классифи-
кации почв, которая была бы признана во всем
мире, не разработано; русская, английская, немец-
кая и другие системы имеют разную терминоло-
гию и непосредственно не сопоставимы.
Газовая фаза почвы («почвенный воздух»),
как правило, находится в состоянии газообмена с
атмосферным воздухом. Потребление кислорода
в процессах микробного окисления органических
веществ приводит к снижению его содержания в
почве и повышению содержания СОг, особенно в
биологически активном верхнем слое почвы; рас-
творяясь в воде, диоксид углерода снижает pH
почвенного раствора. Аэрация почвы и соответ-
ственно поступление кислорода в более глубокие
горизонты в значительной мере определяются ее
порозностыо (структурой) и содержанием воды.
Исчерпание кислорода в результате микробного
дыхания, а также различия в концентрации суб-
стратов, поступлении воздуха и распределении
воды приводят к образованию в частицах поч-
вы и вокруг них анаэробных микрозон, в кото-
рых преобладают процессы анаэробного дыхания
и брожения (см. разд. 30.2.1) и создаются восста-
новительные условия. Переувлажненные почвы с
плотным сложением (глины, суглинки) могут лег-
ко становиться полностью анаэробными.
Рис. 31.11. Строение моле-
кулы гуминовой кислоты, со-
держащей остатки аминокис-
лот и сахаров, и возможное
связывание ею неорганичес-
ких компонентов почвы.
Глава 31. Местообитания прокариот 279
Химический состав почвенного раствора за-
висит от растворимости различных органических
и неорганических компонентов почвы, пополне-
ния из поверхностной воды и ион-связывающей
способности почвы. Просачивающаяся сверху
дождевая вода вначале насыщается гумусовыми
веществами в горизонте О (до 30 мг органическо-
го углерода на литр) с образованием бурого рас-
твора и далее ионами железа, алюминия, каль-
ция и марганца, а также их комплексами; уровня
грунтовых вод она достигает как бесцветный рас-
твор, богатый неорганическими веществами. Кон-
центрация солей в почвенном растворе значитель-
но варьирует в зависимости от поступления воды
и ионообменной способности почвы. В сухие сезо-
ны почвенный раствор, перенасыщенный солями,
иногда сходен с рассолом (латеритные почвы).
Рис. 31.12. Горизонты лесной почвы в средней полосе.
Описание см. в дополнении 31.4.
Дополнение 31.4. Почвенный профиль на
примере лесной почвы в зоне умеренных ши-
рок показан на рис. 31.12. Верхний слой поч-
вы (горизонт О) богат органическим мате-
риалом на разных стадиях минерализации;
в сельскохозяйственных почвах он обычно от-
сутствует. Следующий за ним горизонт А
содержит органический материал до опреде-
ленной глубины (горизонт Аь), но в основ-
ном состоит из минеральных компонентов.
Горизонт Ар (пахотный слой) — это та часть
почвы, которая через регулярные промежут-
ки времени перемешивается при вспашке.
Просачивающаяся через почву вода вымыва-
ет компоненты в растворенном виде или в ви-
де частиц из горизонта А в горизонт В, ча-
сто имеющий темно-бурый цвет за счет вклю-
чений гумуса и богатый глиной. Горизонт С
образован минеральным почвенным матери-
алом, образовавшимся из подстилающей гор-
ной породы (R) в результате эрозии. Горная
порода или слои глины задерживают проник-
новение воды ниже, и над ними устанавли-
вается слой грунтовых вод. Грунтовые воды
могут насыщать нижние слои почвы (насы-
щенная зона) до горизонта В, тогда как на
поверхности почва обычно аэрируется (нена-
сыщенная зона) и содержит воду в том коли-
честве, которое зависит от осадков и клима-
тических условий.
31.3.2. Микроорганизмы
как важные компоненты почвы
Общая биомасса в лесной почве состоит при-
мерно на 86% (максимальная доля) из био-
массы грибов и на 7% из биомассы бактерий
(табл. 31.6); остальные 7% распределяются меж-
ду различными почвенными животными. В со-
ставе прокариот почвы доминируют, по данным
подсчета путем высева на плотные среды, споро-
образующие виды рода Bacillus и неспорообразу-
ющий вид рода Arthrobacter, который считается
типично почвенным; незначительную долю прока-
риот почвы составляют актиномицеты. В целом,
по результатам учета чашечным методом, в поч-
ве, по-видимому, доминируют грамположитель-
ные бактерии. К сожалению, метод рРНК-зондов
применим для почвы лишь в ограниченной степе-
ни из-за ее высокой фоновой аутофлуоресценции.
Среди грибов, обитающих в нейтральных почвах,
дрожжи составляют лишь небольшую фракцию
(> 2%), но в кислых почвах их доля возраста-
ет до 40%. Обитающие в почве микроорганизмы
в большинстве прикреплены к поверхности мине-
ральных или гумусовых частиц, образуя на них
гонкую пленку, которая сохраняет минимальное
количество воды даже в периоды засухи.
В разложении лесной подстилки основную
роль выполняют грибы. Потребление кислорода в
почве на 70-90% обусловлено дыхательной актив-
280 Часть VIII. Прокариоты в биосфере
Таблица 31.6. Оценки биомассы и ежегодного прироста
подстилки, относящиеся к лесной почве в зоне умерен-
ных широт
Группа организмов Сухое вещество биомас- сы, кгга-1
Бактерии 36,9
Актиномицеты 0,2
Г рибы 453,0
Простейшие 1,0
Нематоды 2,0
Земляные черви 12,0
Энхитреиды 4,0
Моллюски 5,0
Клещи 1,0
Ногохвостки 2,0
Двукрылые 3,0
Другие членистоногие 6,0
Общая микрофлора 492,1
Общая микрофауна 36,0
Общая биомасса 528,1
Общая продукция подстилки в год 7 640,0
ностью грибов и на 10-20% — бактерий, незави-
симо от pH. Количество микробной биомассы в
составе почв непосредственно коррелирует с со-
держанием в них органического вещества. Со-
ответственно этому микробная активность мак-
симальна у поверхности почвы и постепенно
убывает с глубиной (см. разд. 31.2.5). Данные,
приведенные в табл. 31.6, показывают, что еже-
годно образующееся количество подстилки в 15
раз превышает общую биомассу в составе поч-
вы. Допуская, что урожай клеток величиной 50%
(вес.%), типичный для аэробных процессов (см.
гл. 6), снижен на 80% вследствие гумификации
субстрата (см. выше), можно рассчитать, что поч-
венная биота увеличивается ежегодно в 2,5 раза,
т. е. биомасса всех организмов в среднем удваи-
вается один или два раза за год. Хотя это гру-
бый расчет, он позволяет оценить скорость роста в
природной экосистеме. Грибы и бактерии в коопе-
рации осуществляют минерализацию и трансфор-
мацию растительных и животных остатков при
участии почвенной микрофауны, которая их ме-
ханически измельчает и гомогенизирует. Дальней-
шая микробная трансформация до СОг и гуму-
совых веществ происходит главным образом соб-
ственно в почве, но в значительной степени также
в пищеварительном тракте почвенных животных
и в их фекалиях. Почвенные грибы, бактерии и
микрофауна выполняют, таким образом, важней-
шую роль в образовании гумуса, который служит
стабилизирующим фактором и ионообменником,
удерживающим в почве важные питательные ве-
щества. В почве присутствуют также свободные
ферменты, так называемые почвенные ферменты,
и большинство биополимеров подвергается рас-
щеплению вне микробных клеток, под действи-
ем гидролитических экзоферментов. Другие фер-
менты могут высвобождаться из лизирующихся
клеток после их отмирания; о том, изменяются ли
кинетические свойства этих ферментов после вы-
хода из клеток, данных пока мало.
Растворенные низкомолекулярные соедине-
ния, которые поступают в почву с водой, проса-
чивающейся с поверхности, также частично раз-
лагаются и частично интегрируются в гумусовый
матрикс путем ковалентного связывания после
начальной активации в оксигеназных реакциях.
Эксперименты с радиоактивно меченными аро-
матическими субстратами показывают, что в их
минерализации и иммобилизации участвуют как
грибы, так и бактерии. Это относится и к син-
тетическим соединениям (например, гербицидам,
инсектицидам и фунгицидам). Большинство хи-
мических препаратов, применяемых в сельском
хозяйстве, связывается в результате микробной
активности с полимерами в составе почвенно-
го гумуса или с глинистыми слоями, и только
незначительная их часть (10-30%) минерализует-
ся (или испаряется) за один вегетационный пе-
риод (рис. 31.13). Периоды оборота их связан-
ных остатков исчисляются десятилетиями, что
представляет постоянную проблему при сельско-
хозяйственном использовании почв, особенно ни-
зинных, с неглубокозалегающими грунтовыми во-
дами.
Трансформация соединений азота в почве —
почти исключительно сфера деятельности бак-
терий. Фиксацию молекулярного азота осу-
ществляют только бактерии (разд. 8.5), как сво-
бодноживущие (виды Azotobacter, Xanthobacter,
Alcaligenes, Bacillus, Clostridium), так и симбио-
тические (например, Bhizobium).
Внесение в почву аммонийных и нитратных
удобрений привело за последние 30 лет к пере-
насыщению ими сельскохозяйственных угодий.
Аммиак весьма эффективно связывается с поч-
венным гумусом (см. разд. 31.2 1), но в кислых
Глава 31. Местообитания прокариот 281
Рис. 31.13. Динамика превращения ксенобиотического
соединения в почве. К таким соединениям относятся
применяемые средства защиты растений — гербициды,
инсектициды и фунгициды. Ось времени дана не в мас-
штабе.
почвах превращается в результате нитрифика-
ции в нитрат (разд. 10.7). Нитрат как анион вы-
мывается из продуктивного почвенного горизон-
та и иногда обнаруживается в грунтовых водах.
Окисление аммиака может быть подавлено добав-
лением нитрапирина |2-хлор-6-(трихлорметил)-
пиридин; так называемый «N-serve»]. В анаэроб-
ных микрозонах и особенно в переувлажненных
почвах нитрат восстанавливается, преимуще-
ственно до N2, в процессе денитрификации (см.
разд. 12.1). Этот процесс протекает с высвобож-
дением NO и N2O в качестве побочных продук-
тов, поступающих в атмосферу; сильно удобрен-
ные переувлаженные почвы могут высвобождать
до 6% общего внесенного в почву азота в качестве
газообразных оксидов азота. В атмосфере NO и
N2O действуют как газы, создающие парниковый
эффект (см. гл. 32 и 34). До 70% N2O, выделя-
ющегося в атмосферу, происходит из сельскохо-
зяйственных почв, а также из удобренных лесных
почв.
Почвы выступают в качестве источников или
приемников газов, присутствующих в атмо-
сфере в следовых количествах. Почвы низин-
ных болот служат источниками выделения N2O,
NO и метана, тогда как почвы на возвышен-
ностях— «приемниками» водорода, метана и мо-
нооксида углерода (табл. 31.7). Многие из этих
газов вносят вклад в парниковый эффект или
участвуют в химических реакциях в тропосфе-
ре, и микробные процессы их превращений в поч-
ве играют важную роль в очистке атмосферного
воздуха. К сожалению, биохимические механизмы
потребления в почве газов, присутствующих в сле-
довых количествах, пока мало изучены. Культу-
ры аэробных метанотрофиых бактерий, бактерий,
окисляющих СО, и водородокисляющих бактерий
показывают кинетики поглощения газов, резко от-
Таблица 31.7. Вклад почвы в общие циклы газов,присутствующих в атмосфере в незначительных количествах. По
Conrad R. (1995) Soil microbial processes involved in production and consumption of atmospheric trace gases. In: Jones J. G.
(ed.) Advances in microbial ecology. New York: Academic Press; 207-250
Газы Время жизни, сут Относительное содержание. Общий баланс, Тг/год Ежегодный прирост, % Вклад (%) почвы как Область влияния
источника приемника
млрд. 1 объему по
n2o 60 000 310 15 0,2-0,3 70 ? Химические процессы в стра- тосфере; парниковый эффект
CH4 4000 1700 540 <0,8 60 5 Парниковый эффект; химиче- ские процессы в тропосфере и стратосфере
H2 1000 550 90 0,6 5 95 Влияние незначительное
ocs >350 0,5 12 ? 25 ? Образование аэрозолей
co 100 100 2600 1,0 1 15 Химические процессы в тропо- сфере
NO 1 <0,1 60 ? 20 ? Химические процессы в тропо- сфере
Тг = 1012 г — 10б т; млрд. 1 по объему — 1 • L0 12 часть всех молекул газов.
282 Часть VIII. Прокариоты в биосфере
личные от наблюдаемых в почвенных образцах.
Судя по характеру кривой насыщения для про-
цесса поглощения метана почвой, в ней имеют ме-
сто две различные активности: одна с большим
сродством к субстрату и низким максимумом ско-
рости поглощения и другая с низким сродством,
высоким максимумом скорости и высоким поро-
гом. Таким образом, организмы, ответственные за
поглощение метана в почвах при его низких кон-
центрациях (1,7 • млн.-1), неизвестны. То же от-
носится к поглощению СО и
31.3.3. Заболоченные почвы — глобально
важные местообитания
Заболоченные почвы занимают значительную
часть поверхности суши, особенно в зоне тунд-
ры в Северном полушарии. Первичная продукция
на этих заболоченных территориях недостаточно
уравновешивается аэробной минерализацией, по-
скольку доступ кислорода в глубокие слои почвы
ограничен. В связи с этим разложение здесь ор-
ганического вещества ведет, прежде всего, к об-
разованию метана или СО 2, и заболоченные тер-
ритории служат источником образования ПО Тг
метана в год, т. е. 20% всего метана, образующе-
гося за указанный период на Земле. Этот метан
частично окисляется метанокисляющими бакте-
риями, но основная его часть уходит в атмосфе-
ру. Таким образом, тундровые почвы — это один
из источников атмосферного метана (см. гл. 32).
На несколько месяцев в год затапливаются
пресной водой сельскохозяйственные почвы, ис-
пользуемые под рисовые поля. Остающееся на
них большое количество растительного материа-
ла подвергается интенсивному анаэробному раз-
ложению в период затопления. Почву рисово-
го поля можно рассматривать как промежуточ-
ную между пресноводными донными осадками и
сельскохозяйственной почвой, сходную с одним
или другим из этих типов в различные перио-
ды годового цикла. В период затопления при раз-
ложении органических остатков происходят вос-
становление сульфата и интенсивный метаноге-
нез. Часть образующегося метана реокисляется
на поверхности воды, где присутствует кисло-
род, другая его часть — в микрослое почвы, при-
легающем к поверхности корней растений риса.
Как и большинство растений, обитающих в на-
сыщенных водой средах, растения риса облада-
ют свойством активной вентиляции корневой си-
стемы для снабжения клеток корней кислородом.
Поскольку часть образующегося метана посту-
пает в атмосферу, избегая микробного реокис-
ления, рисовые поля представляют собой один
из основных источников атмосферного метана.
Чередование сухого и влажного периодов на та-
ких полях требует соответствующей адаптации
микроорганизмов этих почв. В сухой период ме-
таногенные бактерии выживают в насыщенной
кислородом почве, и через несколько дней после
затопления их активность полностью восстанав-
ливается. Аналогично этому другие анаэробные
бактерии (сульфатредукторы, бродильщики) в
достаточном количестве выживают в сухой пери-
од и облигатные аэробы — в анаэробных условиях
в период затопления.
В болотах — переувлажненных территориях,
для которых характерен низкий pH почвы (^ 2,5),
разложению органического вещества препятству-
ет высокая кислотность среды и накопление фе-
нольных соединений. Тем не менее болота и тор-
фяники не являются стерильными местообитани-
ями. В их почвах присутствуют в значительном
количестве поддающиеся культивированию бакте-
рии (104—106 клеток/л), возможно участвующие в
медленной трансформации торфа.
31.3.4. Жизнеспособные бактерии
присутствуют и глубоко под землей
В верхних горизонтах почвы микробная актив-
ность и микробная биомасса непосредственно кор-
релируют с количеством разлагаемых субстра-
тов (разд. 31.2.2), и оба эти параметра снижа-
ются от одного горизонта к другому по мере
уменьшения содержания органического вещества.
Можно было бы ожидать, что на определенной
глубине в почве вообще отсутствует микробная
активность. Однако, по имеющимся данным,
в осадочных почвах на глубине 200-400 м об-
щая численность жизнеспособных гетеротрофных
бактерий составляет 104-106 клеток на 1 г осадков
и измеряемая активность окисления 14С-ацетата
достигает значительного уровня, несмотря на то
что в этих слоях вряд ли содержатся какие-либо
разлагаемые субстраты. Имеются сведения, что
даже в твердой горной породе присутствует зна-
чительное число активных бактерий, которые мо-
Глава 31. Местообитания прокариот 283
гут использовать в качестве питательных веществ
находящиеся в ней следовые количества органи-
ческих и неорганических веществ, переносимых
грунтовыми водами. Эти автохтонные бактерии,
обитающие в крайне бедной среде, могут выпол-
нять важные функции очистки грунтовых вод от
следовых загрязнений (олиготрофные бактерии);
такие бактерии чрезвычайно трудно культивиро-
вать, и это препятствует их изучению. Нельзя ис-
ключать того, что во многих случаях встречаю-
щиеся in situ микроорганизмы занесены в дан-
ное местообитание грунтовыми водами. Бактерии
могут переноситься через пористый водоносный
слой на расстояния в несколько сотен метров.
Этот факт нужно учитывать при выборе места
для скважины или колодца, чтобы вода не содер-
жала, например, микробов из мест захоронения
отходов.
Почва характеризуется чрезвычайно высокой
пространственной и временной гетерогенностью
по таким параметрам, как активность воды, pH и
поступление органических и неорганических пи-
тательных веществ. Вместе с тем почва представ-
ляет собой наиболее важное местообитание мик-
робов в отношении поддержания роста растений,
питания человека и химической стабильности
атмосферы. Имеющиеся сведения об активностях
почвенных микроорганизмов очень ограничены
по причинам, связанным с гетерогенностью поч-
вы и отсутствием адекватных методов исследо-
вания.
31.4. В экстремальных средах обитают специализированные микробы
Экстремальные местообитания всегда привлекали
особое внимание микробиологов, с тех пор как по-
явились первые сведения о микробной жизни в
необычных средах, таких как источники с кипя-
щей водой, соленые озера и кислые угольные отва-
лы. Однако критерии, по которым условия отно-
сили к экстремальным, постепенно изменялись и
при этом всегда имели антропоцентрический отте-
нок. Несомненно экстремальными условиями сле-
дует считать температуры, близкие к точке ки-
пения воды или к точке ее замерзания. В то же
время для строго анаэробных бактерий экстре-
мальны условия жизни человека, т. е. атмосфера
воздуха, содержащего в количестве 21% токсич-
ный для них кислород.
В более общем смысле к экстремальным мож-
но относить условия, в которых выживают только
специализированные микроорганизмы несколь-
ких таксономических групп и погибают бактерии
многих других таксономических групп. Это поло-
жение легко проиллюстрировать на примере тем-
пературных условий. Для представителей всех ос-
новных форм жизни благоприятна температура в
диапазоне 20-30 °C; верхняя граница выживания
для позвоночных находится уже при 40 °C, для
сосудистых растений и других структурно высо-
коорганизованных форм — в пределах 40-50 °C;
некоторые простейшие, водоросли, грибы и прока-
риоты способны выживать при температурах вы-
ше 50 °C. При температурах выше 60 °C жизнь
возможна только для прокариот, выше 95 °C —
по-видимому, только для архей. Таким образом,
разнообразие живых организмов с повышением
температуры снижается; термальные местообита-
ния, например горячие источники, заселяет лишь
сравнительно небольшое число видов (которые,
однако, могут давать обильный рост) и многие
крупные таксоны в них отсутствуют. В соответ-
ствии с этим экстремальными местообитаниями
можно считать крайне холодные районы, крайне
соленые воды и биотопы с крайне кислой или ще-
лочной реакцией, так как основные таксономиче-
ские группы в них отсутствуют и в большинстве
случаев доминируют только прокариоты.
Связь определенных организмов со специ-
фическими условиями существования обознача-
ют эпитетами с окончанием «-фильный» или
«-толерантный». Термофильные бактерии
характеризуются наиболее интенсивным ростом
при повышенных значениях температуры. Тер-
мотолерантные организмы способны выживать
и даже, возможно, активно расти в услови-
ях повышенной температуры, но оптимальна
для них умеренная температура. Сходным об-
разом соответствующими специальными терми-
нами характеризуют организмы, приспособлен-
284 Часть VIII. Прокариоты в биосфере
ные к низкой температуре (психрофильные,
или криофильные, психротолерантные), к
высокой концентрации соли (галофильные, га-
лотолерантные), высокой кислотности среды
(ацидофильные, ацидотолерантные), высо-
кой щелочности (алкалифильные, алкали-
толерантные) и условиям высокого давления
(барофильные, или пьезофильные, барото-
лерантные).
Научный интерес к экстремальным местооби-
таниям связан как с поиском необычных свойств
вообще, так и конкретно с вопросом о механизмах
адаптации жизни к таким «трудным» условиям
и эволюции приспособленных к ним организмов.
Кроме того, экстремальные среды важно иссле-
довать как модельные объекты в целях разви-
тия микробной экологии в целом. При относи-
тельно малом разнообразии жизненных форм в
таких местообитаниях легче выявить кооперацию
микроорганизмов, чем в экосистемах с обычны-
ми условиями среды, высоким видовым разнооб-
разием и сложной структурной организацией. На-
конец, экстремальные местообитания могут слу-
жить источниками микроорганизмов, представля-
ющих интерес для биотехнологии. Термофильные
бактерии продуцируют термостабильные или тер-
моактивные ферменты, используемые для про-
мышленного разложения биополимеров с целью
получения сахаров в нестерильных условиях.
Протеазы из алкалифильных бактерий применя-
ются при дублении кожи, в пивоварении и произ-
водстве специфических детергентов. Термофиль-
ные липазы нашли применение как компоненты
моющих средств. Многие методы молекулярной
биологии основаны на применении ДНК-полиме-
разы Taq из Thermus aquaticus с целью контро-
лируемого синтеза ДНК на ДНК-матрицах. Для
активности этого фермента оптимальна темпера-
тура 75 °C и его можно «включать» и «выклю-
чать» путем изменения термического режима (см.
разд. 17.4.3).
31.4.1. Термофилам благоприятствует
высокая температура
Определение термофильных организмов неодно-
кратно менялось. В 1940-е гг. термофилами назы-
вали бактерии, растущие при температуре при-
мерно 40 °C. Позднее из саморазогревающе-
гося сена были выделены штаммы Bacillus и
Clostridium с температурным оптимумом в пре-
делах 60-70 °C. В 1970-х гг. прошлого века
известный американский микробиолог Т. Брок
(Brock) осуществил исследовательскую програм-
му по изучению горячих источников Йеллоустон-
ского национального парка (США). Им были вы-
делены многочисленные термофильные бактерии
с температурным оптимумом 65-75 °C. Посколь-
ку Йеллоустонский национальный парк располо-
жен на высоте 1600-2200 м над уровнем моря,
вода кипит там при температуре 92-94 °C и бо-
лее высокая температура воды не может быть до-
стигнута. Новому этапу в изучении термофилов
положили начало работы К. Штеттера (Stetter),
В. Циллига (Zillig) и Г. Яннаша (Jannasch), изу-
чавших горячие источники, расположенные на
уровне моря и в участках подводных вулканиче-
ских выходов. В 1980-е гг. удалось выделить мно-
гочисленные экстремально термофильные и ги-
пертермофильпые прокариотические организмы
с температурным максимумом до ПО °C. Та-
кие организмы называют также кальдоактивны-
ми. В настоящее время организмы, растущие в
диапазоне температуры 40-60 °C, называют тер-
мофильными, при температуре 55-80 °C—экс-
тремально термофильными, выше 75 °C — гипер-
термофильными .
Большинство известных на сегодня гипертер-
мофильных микроорганизмов — это археи, и лишь
немногие гипертермофилы представляют собой
бактерии. Как показано на рис. 31.14, гипертер-
мофильные археи и бактерии располагаются на
нижних коротких ветвях филогенетического дре-
ва живых организмов, построенного по данным
о сходстве нуклеотидных последовательностей
16S-pPHK; это указывает, что они относятся к
ранним формам жизни и она, возможно, вна-
чале развивалась в термальных условиях, напо-
минающих современные горячие источники или
гидротермальные венты. Гипертермофильные ор-
ганизмы рассматривают как первичные термофи-
лы, отличные от обитающих в менее экстремаль-
ных условиях так называемых вторичных термо-
филов, например видов Bacillus stearothermophilus
и Thermoactinomyces vulgaris, которые располага-
ются на более высоких ветвях филогенетического
древа, близкородственны многочисленным не тер-
мофильным видам и, вероятно, произошли в ре-
зультате вторичного развития в направлении пе-
рехода к термотолерантности и термофилии. Ме-
стообитания термофильных прокариот — это не
обязательно экзотические места. Обычная почва
Глава 31. Местообитания прокариот 285
Рис. 31.14. Расположение гипертермофи-
лов на филогенетическом древе. Жир-
ные линии относятся к термофильным
организмам, тонкие — к нетермофильным
группам. По [4].
в жаркие дни может нагреваться на поверхно-
сти до температуры 50-60 °C и, таким образом,
периодически быть подходящей средой для ро-
ста термофилов, особенно термофильных штам-
мов Bacillus. В компостных кучах при разложе-
нии органического вещества под действием грибов
и бактерий температура повышается до 80-85 °C
(см. гл. 36). Теплота выделяется в таких услови-
ях в результате частичного рассеяния энергии при
жизнедеятельности микроорганизмов. Аналогич-
ный этому процесс саморазогревания недостаточ-
но высушенного сена приводит к выделению водо-
рода, который иногда воспламеняется и вызывает
пожар на фермах. В сене доминируют при этом
гетеротрофные вторичные термофилы; водород,
образующийся как побочный продукт брожения,
может служить в таком местообитании источни-
ком электронов для литотрофных аэробов и анаэ-
робов.
Экстремально термофильные и гипертермо-
фильные прокариоты обитают в зонах морских
гидротермальных вентов (см. разд. 31.1.7) и на-
земных горячих источниках, которые встреча-
ются в районах вулканической активности, на-
пример на территории Италии и Исландии и в
Йеллоустонском национальном парке. Из таких
источников изливается горячая жидкость вулка-
нического происхождения, часто дополнительно
нагревающаяся при достижении поверхности ко-
ры. Фумаролы выделяют пар с температурой 150-
450 °C. Часто в нем содержатся в следовом ко-
личестве H2S, СО2, Нг, СО и другие газы (см.
разд. 31.1.7), а также восстановленное железо и
марганец в различных формах; H2S при контакте
с кислородом воздуха окисляется, в результате че-
го осаждается молекулярная сера, которая может
образовывать желтые отложения, особенно обиль-
ные вокруг фумарол. Эти соединения и элементы
служат основными источниками питания для ги-
пертермофилов, выделяемых из подобных место-
обитаний.
В горячих источниках с нейтральной или
слабощелочной реакцией может присутствовать
некоторое количество органического вещества эк-
зогенного происхождения, например из опавших
листьев с окружающих деревьев. Автохтонное ор-
ганическое вещество при температуре выше 73 °C
способны синтезировать только хемосинтезирую-
щие прокариоты, которые окисляют водород, вос-
станавливая при этом Ci-соединения, серу, суль-
фат, нитрат или кислород, в зависимости от
типа метаболизма. Другими источниками элек-
тронов для литоавтотрофов могут служить суль-
фид и молекулярная сера, а также, возможно,
восстановл иные железо и марганец (табл. 31.8).
Бродильщики и органотрофы, осуществляющие
анаэробное или аэробное дыхание, выступают в
роли консументов; при температуре ниже 80 °C в
микрофлоре горячих источников в значительном
количестве присутствуют вторичные термофилы
286 Часть VIII. Прокариоты в биосфере
Таблица 31.8. Представители метаболических групп гипертермофилов и экстремальных термофилов, обитающих в
наземных горячих источниках
Организмы T max» °C Осуществляемые реакции и процессы
Хемотрофы — первичные продуценты Pyrobaculum aerophilum 103 H2 + NO" -*no~ +h2o
Methanothermus sociabilis 97 4H2 + CO2 — CH4 + 2H2O
Acidianus inf emus 95 h2 + S° -> H2S
Desulfovibrio thermophilus 75 4H2 + SO^- + H+ -> HS~ + 4H2O
Sulfolobus addocaldarius 85 2S° + 3O2 + 2H2O -> 2SO^~ + 4H+
Фототрофы — первичные продуценты Synechococcus lividus 73 Оксигенный фотосинтез
Chloroflexus aurantiacus 70 Аноксигенный фотосинтез
Гетеротрофы — консументы Pyrobaculum islandicum 103 Окисление органических соединений с использованием S0
Thermotoga thermarum 84 Сбраживание органических соединений
Bacillus spp. 85 Окисление органических соединений с использованием О2
Thermus aquaticus 80 Окисление органических соединений с использованием NO^", О2
Thermoanaerobacter brockii 78 Сбраживание органических соединений
(виды родов Bacillus, Clostridium, Thermoanaero-
bacter).
Первичная продукция за счет фотосинтеза
возможна при температуре до 73 °C; в таких
условиях может хорошо расти цианобактерия
Synechococcus lividus. Этот вид образует заметные
окрашенные слои в вытекающих из горячих ис-
точников с нейтральной реакцией воды (напри-
мер, источника Осьминог в Йеллоустонском на-
циональном парке) ручьях, где вода постепенно
охлаждается от более чем 90 °C до температуры
окружающей среды. В зависимости от скорости
потока рост S. lividans распространяется от кра-
ев к середине таких ручьев; граница зеленоватого
слоя биомассы этой цианобактерии точно показы-
вает ее температурный максимум. В слоях био-
массы S. lividus присутствуют оранжевые пятна
роста Chloroflexus aurantiacus — аэробной зеленой
фототрофной бактерии, ассимилирующей выде-
ляемые этой цианобактерией органические веще-
ства. Эти слои фототрофных прокариот могут по-
степенно превращаться в маты толщиной несколь-
ко сантиметров, поскольку при температурах вы-
ше 40-45 °C они не выедаются животными. Хими-
ческий состав вод наземных горячих источников
широко варьирует в зависимости от типа скаль-
ной породы, поэтому состав микробных сообществ
в вытекающих из них ручьях может быть различ-
ным. В промышленных системах водонагрева ча-
сто обнаруживается рост олигокарбофильного ге-
теротрофного вида Thermus aquaticus.
Гипертермофильные и экстремально термо-
фильные прокариоты, выделенные из зон мор-
ских гидротерм, приведены в табл. 31.9 (см. также
разд. 31.1.7). Вокруг глубоководных гидротер-
мальных вентов имеется резкий градиент тем-
пературы (от более 250 °C до 2 °C в радиусе
нескольких метров); с помощью доступных мето-
дов сбора материала на больших глубинах весьма
трудно точно определять температурные границы
для метаболических групп обитающих в этих зо-
нах организмов.
Благодаря каким особым свойствам мик-
роорганизмы могут обитать при повышенных
температурах? Прежде всего, они должны обла-
дать термостабильными ферментами, не коагули-
рующими в этих условиях, в отличие от обыч-
ных белков. Вместе с тем по первичной структуре
ферменты экстремальных термофильных прока-
риот, как установлено, отличаются от аналогич-
ных ферментов мезофильных организмов толь-
ко несколькими аминокислотными остатками.
Однако за счет этих незначительных отличий тре-
тичная структура ферментов термофилов стаби-
лизирована таким образом, что они сохраняют
активность при высоких значениях температу-
Глава 31. Местообитания прокариот 287
Таблица 31.9. Представители метаболических групп гипертермофилов и экстремальных термофилов, обитающих в
зонах морских глубоководных гидротермальных вентов
Организмы 3 e и H о Осуществляемые реакции и процессы
Хемотрофы — первичные продуценты
Methanopyrus kandleri 110 4Н2 + СО2 -> СН4 + 2Н2О
Methanococcus igneus 91 4Н2 + СО2 -» СН4 + 2Н2О
Methanococcus jannaschii 86 4Н2 + СО2 СН4 + 2Н2О
Pyrodictium occultum 110 Н2 + S° —» HS- + н+
Archaeoglobus fulgidus 95 4Н2 + SO^- + Н+ -> HS- + 4Н2О
Aquifex pyrophilus 95 2Н2 + О2 — 2Н2О
2S° + ЗО2 + 2Н2О -» 2SQ2- + 4Н+
Гетеротрофы — консументы
Thermotoga maritima 90 Сбраживание органических соединений
Archaeoglobus profundus 90 Окисление органических соединений с использованием SO^-
ры. Помимо того, в клетках экстремальных тер-
мофилов присутствуют особые белки-шепероны,
которые организованы в так называемые тер-
мосомы, способствующие формированию специ-
фически термостабильной третичной структуры
белков; возможно, именно за счет наличия тер-
мосом ферменты гипертермофильных микробов
лишь очень незначительно отличаются по ами-
нокислотной последовательности от аналогичных
ферментов мезофилов. Дополнительно стабили-
зация белков при высоких температурах обеспе-
чивается образованием внутри молекул фермен-
тов, вследствие гидрофобных взаимодействий,
катионных мостиков и конденсированных струк-
тур (см. разд. 28.2).
Молекулы ДНК более термостабильны (име-
ют более высокие «точки плавления») при вы-
соком содержании в них G + С. Однако ДНК
гипертермофилов не характеризуется очень вы-
сокими значениями этого параметра; они варьи-
руют от 31 до 60 мол.%, т. е. не превышают со-
ответствующих величин у мезофильных бакте-
рий. Дополнительную стабильность ДНК могут
придавать положительные сверхвитки, образую-
щиеся под действием обратной гиразы, которая,
по-видимому, присутствует только у экстремаль-
ных термофилов. Некоторые термофилы содер-
жат полиамины спермидин и термин, возмож-
но способствующие стабилизации ДНК при повы-
шенных температурах, однако такие соединения
присутствуют и у мезофилов. Для стабилизации
ДНК при более высоких температурах могут быть
более важны основные белки (гистоны), сдвигаю-
щие ее точку плавления на 30 °C или больше. Оче-
видно, у экстремально термофильных и гипертер-
мофильных микроорганизмов имеется несколько
механизмов защиты ДНК и эту функцию выпол-
няет ряд стабилизирующих факторов, каждый из
которых действует по своему механизму.
Плазматическая мембрана у термофильных
бактерий богата длинноцепочечными жирными
кислотами и содержит меньше ненасыщенных
жирных кислот по сравнению с мембранами мезо-
филов. Это повышает «температуру плавления»
липидов и обеспечивает оптимальную стабиль-
ность и текучесть при повышенной температуре.
Мембраны архей состоят из липидов глицерол-
полипренильной природы, содержащих простые
эфирные связи (см. разд. 7.10.5). Такие липиды
создают гораздо большую жесткость по сравне-
нию с липидами бактерий, содержащими слож-
ноэфирные связи, особенно в условиях высокой
кислотности (pH < 4), которая сама по себе дей-
ствует как стрессовый фактор (см. разд. 31.4.3).
Особенно эффективно стабилизируют мембрану
при высокой температуре присутствующие по
всей ее площади липиды октопренил-диглицерол-
тетраэфирной структуры.
В связи с обнаружением прокариот при вы-
соких температурах возник вопрос о том, имеет-
ся ли верхний температурный предел для жиз-
ни и если да, то при каких значениях? Посколь-
ку для существования жизни необходима жидкая
вода, гипертермофилы, растущие при температу-
рах выше 100 °C, встречаются преимуществен-
но в средах с повышенным давлением, например
в зонах глубоководных гидротермальных вентов
(см. разд. 31.1.7), где точка кипения воды вы-
288 Часть VIII. Прокариоты в биосфере
ше 100 °C. Вместе с тем биохимические процес-
сы при высокой температуре ограничены физико-
химическими условиями. При 130 °C такие необ-
ходимые компоненты клеток, как АТР и ДНК,
разлагаются в результате термического гидроли-
за. Период их полужизни сокращается до несколь-
ких минут или даже секунд, и биохимическая ак-
тивность в обычном смысле едва ли возможна при
данных условиях. Таким образом, верхняя тем-
пературная граница жизни находится, вероятно,
между 113 и 130 °C; имевшие место сообщения о
наличии микробной активности при более высо-
ких температурах (250 °C) впоследствии не под-
твердились.
По механизмам энергетического и углеродно-
го метаболизма гипертермофильные прокариоты
могут отличаться от мезофильных. У гипертер-
мофильных архей-бродилыциков АТР образуется
с участием ацетил-СоА не через образование аце-
тилфосфата, а непосредственно через ADP-обра-
зующую ацетил-СоА-синтетазную реакцию, воз-
можно потому, что ангидридные связи кислот ме-
нее стабильны при повышенных температурах.
Начальные этапы разложения гексоз представ-
ляют собой модифицированные варианты путей
Эмбдена-Мейергофа-Парнаса и Энтнера-Дудо-
рова, имея меньшее число фосфорилированных
интермедиатов и давая меньший выход АТР от-
носительно соответствующих путей у мезофилов
(см. разд. 12.2.1). У гипертермофильной сульфат-
восстанавливающей археи Archaea gio bus fulgidus,
как установлено, в метаболизме одноуглеродных
соединений участвуют коферменты, которые ра-
нее были обнаружены и считались исключительно
принадлежащими метаногенным археям (метано-
фуран, тетрагидрометаноптерин, редокс-фактор
F42o)- Автотрофную фиксацию СОг гипертер-
мофилы осуществляют только через восстанови-
тельный цикл трикарбоновых кислот и СО-де-
гидрогеназный путь (см. разд. 8.1.2); циклом
Кальвина обладает среди термофилов только ци-
анобактерия Synechococcus lividus.
Молекулярные механизмы адаптации к тепло-
вому шоку описаны в разд. 28.2.
31.4.2. Некоторым микробам
благоприятствует холод
Большая часть биосферы Земли находится в
условиях холода. Стабильно низкую температуру
2-4 °C имеет вода океанских глубин; значитель-
но более низкая температура сохраняется боль-
шую часть года на поверхности суши в поляр-
ных областях. В зоне умеренных широт почва
замерзает лишь периодически на поверхности, в
зависимости от климата. Микроорганизмы, при-
способленные к жизни в условиях холода, на-
зывают психрофилами; они растут с макси-
мальной скоростью при температуре не выше
15 °C, и минимальная температура, при кото-
рой возможен их рост, может быть даже ни-
же 0 °C. Важными первичными продуцентами в
таких условиях, по-видимому,служат эукариоти-
ческие водоросли. Так, «снежная» зеленая водо-
росль Chlamydomonas nivalis, вегетативные клет-
ки которой окрашены в зеленый, а споры в
красный цвет, образует розоватые налеты на по-
верхности снега и льда. В постоянно покрытых
льдом водах Антарктики обнаруживаются диато-
мовые и зеленые водоросли.
В почвах и водоемах пояса умеренных широт
обитают психротолерантные микроорганизмы,
метаболически активные при температуре до
20-30 °C. Психрофильные и психротолерантные
микроорганизмы имеют особое значение в связи
с современными пищевыми технологиями. Охла-
ждение или замораживание, применяемые для со-
хранения продуктов питания, не обязательно пол-
ностью подавляют микробную активность; в этих
селективных условиях возможен рост психрото-
лерантных штаммов с небольшой, но заметной
скоростью. Порчу молока, которое после пасте-
ризации па молокозаводе хранится при низкой
температуре, вызывают не классические молочно-
кислые бактерии, а психротолерантные штаммы
Pseudomonas, которые превращают его в горькую,
дурно пахнущую и даже токсичную (за счет при-
сутствия аминов) жидкость. При температурах,
близких к точке замерзания воды, психрофиль-
ные и психротолерантные бактерии растут очень
медленно. Они адаптированы к низкой темпера-
туре благодаря высокому содержанию в липи-
дах мембран полиненасыщенных жирных кислот,
обеспечивающих достаточную текучесть и транс-
портную активность мембран при низкой тем-
пературе. Ферменты психрофильных бактерий
весьма чувствительны к тепловой денатурации и
теряют активность уже при незначительно повы-
шенной температуре.
Нижний температурный предел микробной ак-
тивности на несколько градусов ниже 0 °C;
при этих значениях температуры внутриклеточ-
Глава 31. Местообитания прокариот 289
пая вода начинает замерзать. Однако микроор-
ганизмы способны переживать замораживание;
в лабораторных условиях этому способствует
добавление в среду глицерола, сахаров или диме-
тилсульфоксида — веществ, препятствующих об-
разованию кристаллов льда и тем самым разру-
шению клеточных мембран. При глубоком замо-
раживании микробные культуры сохраняются в
течение нескольких лет без заметного поврежде-
ния, однако не все типы прокариот одинаково вы-
держивают такую процедуру.
31.4.3. Кислые и щелочные среды
как местообитания микробов
Большинство известных микроорганизмов рас-
тет в узком диапазоне значений pH, близких
к нейтральному — 5,5-8,5. Некоторые бактерии,
образуя органические кислоты (например, мо-
лочную, уксусную, пропионовую и масляную),
подкисляют среду примерно до pH 3-4. Наибо-
лее сильно снижают pH среды виды Acetohacter,
при росте которых концентрация в среде уксус-
ной кислоты (рК = 4,75) достигает 0,8 М, и мо-
лочнокислые бактерии, рост которых сопровож-
дается накоплением в среде молочной кислоты
(рК = 3,8) до концентрации 0,2 М. Подобные бак-
терии, называемые ацидотолерантными, спо-
собны выживать при весьма низких значениях pH
и расти при нейтральном значении pH. Слабо-
кислая среда образуется в процессе разложения
органического вещества при силосовании; здесь
развиваются главным образом молочнокислые
бактерии, но также и бактерии, образующие ук-
сусную и масляную кислоты; в результате возни-
кают умеренно кислые условия, которые препят-
ствуют дальнейшему разложению органического
вещества большинством менее ацидотолерантных
организмов. Этот пример также показывает, что
колебания pH, особенно в кислую сторону, неред-
ко происходят в природных средах, богатых ор-
ганическим веществом. Следует отметить, что
грибы в основном более ацидотолерантны, чем
бактерии; в слабокислых средах, таких как фрук-
товые соки (pH 2-4), наиболее активно развива-
ются молочнокислые бактерии и дрожжи.
Высокой кислотностью характеризуются при-
родные среды, содержащие неорганические кис-
лоты, такие как серная или азотная. Обе эти
кислоты могут образовываться как продукты
микробной активности. Серная кислота содер-
жится в воде многих горячих источников. Мик-
робное образование серной кислоты происходит
в зонах вулканической деятельности (горячие ис-
точники, фумаролы; см. разд. 32.4.1), где накап-
ливающаяся в больших количествах восстанов-
ленная сера в виде H2S или S0 окисляется сер-
ными бактериями до серной кислоты:
S0 4- 1,5О2 4- Н2О -4 SC)|- + 2Н+ (31.2)
Эта сильная кислота (рК = 1,9) накапливается в
среде до миллимолярной концентрации (значения
pH 0,5-3,0). В зонах вулканической активности
вода многих источников имеет не только силь-
нокислую реакцию, но и экстремально высокую
температуру (до 90 °C), т. е. полностью неблаго-
приятна для развития микробов. В большинстве
горячих источников pH воды близок к 2,5; несер-
ные источники обычно бывают слегка щелочными
(pH примерно 8,5).
Восстановленная сера составляет также ос-
новной компонент сульфидных минералов, таких
как пирит (FeS2) и сульфиды меди. Раствори-
мость пирита в воде очень низка, но тем не менее
он разрушается ацидофильными литотрофами —
железо- и серобактериями, например Thiobacillus
ferrooxidans, которые окисляют FeS2 полностью,
до Fe3+ и серной кислоты. Этот процесс проте-
кает в три этапа: вначале на FeS2 воздейству-
ют ионы Fe3+, которые при этом в свою очередь
восстанавливаются [реакция (31.3)]; как Fe2+,
так и Fe3+ хорошо растворимы при pH <2,0, и
переход Fe2+/Fe3+ действует как окислительно-
восстановительная система между бактериальной
клеткой и слаборастворимым минералом. Тио-
сульфат высвобождается в раствор и окисляется
теми же бактериями:
FeS2 4- 6Fe3+ + ЗН2О ->
7Fc2+ 4- S2O^“ 4- 6Н+ (31.3)
2Fe2+ 4- 0,5О2 4- 2Н+ -> 2Fe3+ 4- Н2О (31.4)
S2O2~ 4- 2О2 4- Н2О -> 2SO2- 4- 2Н+ (31.5)
Реакция (31.3) протекает с высокой скоро-
стью нефермептативным путем, тогда как реак-
ция (31.4)—это лимитирующий скорость этап,
катализируемый железоокисляющей бактерией.
В суммарном процессе высвобождается только
один протон в расчете па молекулу пирита:
4FeS2 4- 15О2 4- 2Н2О ->
-> 4Fe3+ + 8SO^ 4- 4Н+ (31.6)
290 Часть VIII. Прокариоты в биосфере
Окисление сульфидных минералов и растворение
ионов металлов в сильнокислых растворах — это
природный процесс, весьма обычный в рудных ме-
сторождениях. Он имеет практическое примене-
ние (для выщелачивания металлов из бедных руд;
см. разд. 10.6 и 36.7).
Роль первичных продуцентов в сильнокислых
средах обычно выполняют хемолитоавтотрофы,
такие как ацидофильные бактерии Thiobacillus
(Т. thiooxidans, Т. ferrooxidans), активные при pH
до 1,0. В кислых горячих источниках могут рас-
ти археи Sulfolobus acidocaldarius (оптимальные
условия — температура 70-80 °C и pH 2-3) и Ther-
moplasma acidophilum (температура 45-65 °C;
pH 2) или Acidianus infemus (температура до
95 °C; pH 2-3). Фотосинтетическую первич-
ную продукцию в кислых (pH до 1,0), умерен-
но термальных (температура до 50 °C) источ-
никах осуществляет одноклеточная красная (эу-
кариотическая) водоросль — Cyanidium caldarium
(а также одноклеточные красные водоросли ро-
дов Galdieria и Cyanidioschyzon. — Ред.) Несколь-
ко высших растений способны расти при pH около
3,0. Прокариотические фототрофные организмы
не встречаются при значениях pH ниже 4-5.
Гетеротрофные прокариоты, обитающие в кис-
лых средах, — это Bacillus acidocaldarius (опти-
мальные условия для роста — температура 60 °C
и pH 3), Thermoplasma acidophilum и Acidiphilium
cryptum (растут при умеренной температуре).
Описаны некоторые беспозвоночные и простей-
шие, распространение которых, возможно, дости-
гает зон с pH до 2; несколько видов позвоночных
встречается в зонах с pH примерно 3,0.
Окисление восстановленных соединений азота
нитрифицирующими бактериями ведет к образо-
ванию азотной кислоты (рК = —1,3). Поскольку,
однако, восстановленный азот не присутствует в
природе в больших количествах (за исключением
отдельных случаев, например навозных куч), об-
разующаяся азотная кислота не накапливается до
заметного уровня и большей частью нейтрализу-
ется, главным образом карбонатными минерала-
ми, которые претерпевают при этом кислотный
гидролиз. Выше упоминалась (см. разд. 30.5.6)
проблема коррозии стен зданий при окислении ча-
стично окисленных соединений азота, присутству-
ющих в составе атмосферного воздуха. Нитри-
фицирующие бактерии не считаются ацидофиль-
ными организмами; для них предпочтительны
даже слегка щелочные условия, которые созда-
ются, например, в известняковой породе или бе-
тоне.
Цитоплазма ацидофильных и ацидотолерант-
ных прокариот обычно имеет реакцию от ней-
тральной до слабокислой (>рН 5,5) при активнос-
ти протонов во внешней среде на 4-5 порядков
выше. Это обуславливает значительный гради-
ент pH на плазматической мембране, который в
экстремальных случаях компенсируется противо-
положно направленным электрическим потенци-
алом для поддержания протондвижущей силы в
обычном диапазоне 180-200 мВ и тем самым для
предотвращения короткого замыкания в резуль-
тате излишнего напряжения па мембране. Меха-
низмы гомеостаза pH описаны в разд. 28.3.
Щелочные условия также селективны для
определенных специализированных организмов.
Строгие алкалифилы изучены недостаточно. Их
трудно культивировать, из-за того что при вы-
соких значениях pH обычные минеральные ком-
поненты питательных сред выпадают в осадок.
Мало изучены и щелочные природные среды, та-
кие как щелочные термальные источники и озера,
богатые карбонатами (содовые озера в Нижнем
Египте и Израиле со значениями pH воды 9-10,5).
В таких озерах роль первичных продуцентов при-
надлежит цианобактериям родов Gloeothece, Plec-
tonema, Spirulina, Anabaenopsis и др., способным
расти при pH 9-11. Некоторые зеленые водорос-
ли рода Chlorella также могут обильно разви-
ваться при pH до 12-13. Аноксигенный фотосин-
тез осуществляют в этих местообитаниях (при
pH до 10) виды Ectothiorhodospira (см. также
разд. 31.4.4). Среди известных алкалифильных
гетеротрофных бактерий имеются штаммы, сход-
ные с Bacillus у для которых оптимален диапазон
pH 9-11,5. Свойством устойчивости к щелочным
условиям (алкалитолерантность) обладают гете-
ротрофные бактерии родов Flavo bacterium, Pseu-
domonas, Vibrio, Corynebacterium и Arthrobacter,
способные выдерживать pH до 11, но гораздо луч-
ше растущие при нейтральной реакции среды. Го-
меостаз pH у алкалифилов описан в разд. 28.3.
31.4.4. Соленые среды относятся
к местообитаниям с низкой
активностью воды
Ионы солей в растворе покрыты «оболочкой» из
молекул воды, т. е. они конкурируют с клеточ-
Глава 31. Местообитания прокариот 291
ними компонентами, особенно белками и нукле-
иновыми кислотами, за доступные свободные мо-
лекулы воды. Таким образом, растворенные соли
создают для организмов ту же проблему, что и
крайняя сухость, в том смысле что свободная во-
да для гидратации и поддержания структурной
целостности функциональных полимеров стано-
вится в присутствии солей лимитирующим факто-
ром. Доступность свободных молекул воды удоб-
но выражать как активность воды (ав) — отноше-
ние давления водяного пара в газовой фазе над
рассматриваемой системой (раствор соли, почва
и т. д.) при равновесии к его давлению над чи-
стой водой. Таким образом, значения ав меняют-
ся в пределах от 0 до 1. Величина ав, равная 1,00,
относится к чистой воде. Морская вода имеет ав
примерно 0,98, соленые озера — примерно 0,75, су-
хие продукты питания и засахаренные фрукты —
до 0,70.
В почве наряду с другими параметрами значи-
тельно варьирует содержание влаги — от ав = 1,00
при насыщении водой до ав = 0,90 при засуш-
ливых условиях. Типичные почвенные бактерии,
такие как Bacillus, Agrobacterium и Rhizobium,
способны адаптироваться к таким изменениям.
Недостаток воды оказывает стрессовое влияние,
вызывая вначале поглощение ионов калия, а за-
тем синтез специфических совместимых осморе-
гуляторных веществ (см. разд. 28.4.1).
В соленой, например морской, воде адаптация
не связана с особыми механизмами; ионы натрия
селективно выводятся из клетки путем антипор-
та против протонов или ионов калия (последние
требуют значительно меньше воды для гидрата-
ции). Как отмечено выше (разд. 31.1.6), во мно-
гих родах бактерий имеются и пресноводные, и
морские виды, т. е. определенные морские и прес-
новодные бактерии могут быть близкородствен-
ны друг другу и четких кластеров по этому эко-
логическому признаку не обнаружено. Некоторые
морские бактерии нуждаются в повышенной кон-
центрации NaCl; их называют галофильными.
Соленые озера могут возникать в основном
двумя путями: либо в результате конденсации
морской воды (так называемые талассогалин-
ные озера), либо при испарении воды из внут-
ренних водоемов. Качественный солевой состав
воды талассогалинных озер сходен с составом
морской воды, но концентрация солей в них выше.
Классическим примером соленых озер может слу-
жить Большое Соленое озеро (шт. Юта, США),
где вследствие испарения осталась одна десятая
часть исходной массы воды. Искусственные талас-
согалинные озера — это используемые для получе-
ния соли пруды с морской водой, из которых про-
исходит испарение на солнце. Их устраивают как
серию бассейнов, где растворенные соли последо-
вательно осаждаются в соответствии с их раство-
римостью. Хлорид натрия как наиболее раство-
римая соль осаждается в виде довольно чистого
вещества в последних бассейнах с самой высокой
ее концентрацией.
В большинстве районов с умеренным и влаж-
ным климатом соли, вымываемые из выветривае-
мых горных пород дождевой водой и грунтовы-
ми водами, переносятся реками в моря (дрени-
руемые бассейны). В местностях с засушливым
климатом реки не всегда достигают открытого
моря и могут заканчиваться в наземных долинах
(бассейны, обладающие только внутренним сто-
ком), где вода испаряется, а соли концентриру-
ются, как, например, в солончаках или соленых
озерах. Такие аталассогалинные озера могут
существенно отличаться по солевому составу во-
ды от озер морского происхождения, особенно по
количеству кальция, карбонатов и сульфатов, в
зависимости от типа скальных пород в их обла-
сти стока. В присутствии избытка ионов кальция
карбонат быстро осаждается в виде СаСОз (каль-
цит); насыщающая концентрация кальцита при
25 °C составляет 133 мМ. Осаждение карбоната
ведет к относительному обогащению воды суль-
фатом и хлоридом, и в этом случае озера назы-
вают сульфатными; примером их может служить
Мертвое море. При еще более высокой концен-
трации ионов кальция сульфат осаждается в виде
СаЗОд (гипс; насыщающая концентрация 14 мМ),
что приводит к относительному обогащению воды
хлоридом и ионами магния, натрия и калия. В от-
сутствие достаточного количества ионов кальция
карбонат остается в растворе и обусловливает ще-
лочную реакцию воды (содовые озера, например
Моно и Оуэнс, шт. Калифорния, США и озера в
Вади-Натрун, Египет). Таким образом, образова-
ние соленых озер и их солевой состав существенно
зависят от испарения воды и концентрации ионов
кальция.
Из эукариот в экстремально соленых средах
обитают лишь немногочисленные организмы. На-
пример, в южной части талассогалинного Боль-
шого Соленого озера, где соленость верхних сло-
ев воды составляет примерно 12% (масса/объем),
292 Часть VIII. Прокариоты в биосфере
вода может становиться розовато-красной в ре-
зультате массового развития зеленой водорос-
ли Dunaliella salina., содержащей красный пиг-
мент. Эта водоросль выступает здесь в качестве
основного первичного продуцента и выедается
жаброногим ракообразным артемией (Artemia sa-
lina). В микробном сообществе доминируют ге-
теротрофные виды многих родов, в том числе
Pseudomonas, Marinomonas, Vibrio, Deleya, Ha-
lomonas, Brevibacterium, Micrococcus, Bacillus и
Sporosarcina. В северной части озера, отделен-
ной дамбой и не получающей пресной воды в
существенных количествах, соленость возрастает
до 25% (масса/объем) и происходит осаждение
хлорида натрия (насыщенный рассол). В та-
кой воде эукариотические организмы не выжи-
вают и микробное сообщество представлено глав-
ным образом экстремальными галофилами родов
Halobacterium, Haloferax, Halomonas и других, а
также строго анаэробными видами родов Desul-
fovibrio, Desulfohalobium, Haloanaerobium и Halo-
anaerobacter. Вода и поверхность донных осадков
и здесь могут быть розовато-красными, главным
образом за счет пигментов пурпурных мембран
экстремально галофильных архей (см. разд. 13.4).
Здесь возможна в некотором масштабе первич-
ная продукция, осуществляемая экстремально га-
лофильными цианобактериями, но, кроме того,
поступление органического материала происходит
из внешних источников.
Для аталассогалинных озер также характер-
ны микробные сообщества, где роль первичных
продуцентов выполняют галофильные цианобак-
терии. В зависимости от степени щелочности
воды в них могут развиваться и галоалкали-
фильиые сульфидокисляющие фототрофные бак-
терии (Ectothiorhodospira), образующие заметные
красные пятна. Типичной галофильной цианобак-
терией является Aphanothece halophytica, приспо-
собленная к высоким концентрациям соли; к га-
лотолерантным видам цианобактерий относятся
Microcoleus chthonoplastes и Phormidium hender-
sonii, для которых предпочтительны низкие кон-
центрации соли.
В экстремально сухих средах также обита-
ют только специализированные формы. По имею-
щимся немногочисленным данным, в микрофлоре
жарких пустынь типичным ксерофильным ор-
ганизмом можно считать гриб Xeromyces bisporus’,
обнаруживаемые в пустынях спорообразующие
бактерии, возможно, способны лишь выживать в
таких условиях и растут в короткие периоды по-
сле дождей. Другой тип крайне сухих местооби-
таний— сухие долины в Антарктике, где в тече-
ние всего года сохраняется низкая температура
(—10 °C) и крайняя сухость. Здесь в поверхност-
ных слоях скальных пород хорошо развиваются
некоторые зеленые водоросли благодаря выпаде-
нию по ночам небольшого количества росы; пред-
полагается, что они используют также кристалли-
ческую воду, входящую в состав горной породы,
особенно на протяжении антарктического лета.
Эти водоросли образуют микробные сообщества с
гетеротрофными бактериями и дрожжами. В та-
ких крайне неблагоприятных для жизни условиях
обитают также лишайники.
Известны различные механизмы адаптации к
недостатку воды. Крайняя сухость, как и высокая
соленость, вызывает выход воды из цитоплазмы
во внешнюю среду по осмотическому градиенту.
Этому физико-химическому процессу препятству-
ет накопление в клетках специфических осмо-
регуляторных веществ, обеспечивающих под-
держание необходимого минимального содержа-
ния воды в цитоплазме (см. разд. 28.4.1).
31.4.5. Условия высокого давления
В глубоководных океанских областях, занимаю-
щих огромные пространства, давление воды до-
стигает значений выше 300 бар, или 30 МПа.
Вопросы, связанные с баротолераптностыо и ба-
рофилией, рассмотрены выше (разд. 31.1.6). По-
скольку морские глубины не следует считать экс-
тремальной средой обитания (по тому критерию,
что в морской среде представлены почти все ос-
новные таксономические группы), здесь они не
рассматри в аются.
Организмы, обитающие в экстремальных
условиях среды, подвергаются воздействию та-
ких экстремальных факторов, как неблагоприят-
ная температура, кислотность или щелочность и
недостаток воды, иногда в комбинации. Во всех
подобных местообитаниях преобладают прокари-
оты, а не эукариотические организмы, причем
в сверхэкстремальных средах обитают обычно
только прокариоты. Благодаря малым размерам
прокариотические клетки высокоригидны; у боль-
шинства прокариот нет внутренних мембран, ко-
Глава 31. Местообитания прокариот 293
торые могли бы повреждаться при температур-
ном или каком-либо другом стрессе; ДНК отно-
сительно стабильна благодаря кольцевой форме
молекулы, иногда образующей также свсрхвит-
ки; клеточная стенка способна противостоять ме-
ханическому и осмотическому стрессу в большей
степени, чем стенки более высокоорганизованных
клеток. Наиболее термоацидофильные организмы
представлены главным образом археями, а не бак-
териями, вероятно по причине того, что липиды с
простыми эфирными связями значительно более
устойчивы к высоким температурам, особенно в
условиях высокой ионной активности, чем липи-
ды со сложпоэфирными связями.
31.5. Ассоциации с пищеварительными системами животных
Поверхность тела животных в большей или мень-
шей степени заселена микробами, в зависимости
от наличия на ней легкоразлагаемых субстратов.
На слизистых оболочках внутренних полостей у
них также обитают разнообразные микроорга-
низмы, если организм-хозяин не обладает меха-
низмами, препятствующими их развитию. Пред-
почтительным местообитанием для бактерий,
мицелиальных грибов, дрожжей и простейших
служит пищеварительный тракт, где в избытке
имеются разлагаемые питательные вещества, ча-
стично уже трансформированные ферментами хо-
зяина, в достаточном количестве вода и доволь-
но стабильные условия pH и температуры. Благо-
даря высокой скорости роста микробы могли бы
полностью превосходить организм-хозяин в кон-
курентной борьбе за питательные вещества, если
бы он не обладал системами контроля за таки-
ми нежелательными «гостями». Функция пище-
варительной системы высших животных оптими-
зирована в отношении сопутствующей микрофло-
ры, причем наблюдаются различные связанные
с этим механизмы конкуренции и/или коопе-
рации, которые обеспечивают возможность су-
ществования и функционирования определенных
микробов. Представление о масштабах колониза-
ции микробами организмов-хозяев дает, напри-
мер, тот факт, что численность клеток бактерий в
толстом кишечнике взрослого человека более чем
в 10 раз превышает число собственных клеток его
тела.
Роль микробов в процессе пищеварения в зна-
чительной степени варьирует в зависимости от
типа питания животного. Некоторые животные
питаются другими животными (плотоядные),
иные — исключительно растительным материа-
лом (растительноядные, травоядные), третьи
потребляют как животную, так и растительную
пищу (всеядные). Еще одна группа использует
переваренные остатки биомассы, служившей пи-
щей другим животным, и не связана со специ-
фическим источником питания (детритофаги).
Для оценки важности микроорганизмов в пита-
нии животного в экспериментальных условиях по-
лучают контрольные особи, лишенные микрофло-
ры (для этого применяют кесарево сечение и за-
тем содержат и кормят животных в стерильных
условиях), либо проводят краткосрочные опыты с
введением животным больших доз антибиотиков.
Во многих случаях такие животные со стериль-
ной пищеварительной системой имеют серьезные
нарушения пищеварения или погибают, особенно
если это травоядные; всеядные, такие как мыши
и крысы, выдерживают содержание в стерильных
условиях длительное время.
Различные способы питания животных можно
сопоставить с общим строением пищеварительно-
го тракта (рис. 31.15). Пища, поступившая в рото-
Желудок
Толстый кишечник
Пищевод
Двенадцатиперстная кишка,
----- тонкий кишечник
Прямая
кишка
''I*'
। Послежелудочная пищеварительная
Преджелудочная пищеварительная камера (слепая кишка)
камера (например, рубец)
Рис. 31.15. Строение пищеварительной системы позво-
ночных. Штриховыми линиями изображены бродиль-
ные камеры, имеющиеся только у специализированных
животных.
294 Часть VIII. Прокариоты в биосфере
вую полость, механически измельчается до опре-
деленной степени и подвергается воздействию
ферментов слюны (например, амилаз), после чего
следует через пищевод в желудок, где среда ча-
ще всего сильнокислая. После прохождения через
топкий кишечник, в котором происходит всасы-
вание низкомолекулярных веществ, пищевой ко-
мок (химус) поступает в толстый кишечник, где
обезвоживается; здесь оставшиеся субстраты ме-
таболизируются кишечными бактериями. Нако-
нец, фекалии выходят через заднепроходное от-
верстие. Этот общий план организации являет-
ся достаточным для плотоядного животного, так
как мясная пища относительно легко переварива-
ется и не нуждается в дополнительной обработ-
ке. Животное-хозяин и обитающие в нем микро-
бы конкурируют за поступающую пищу (конку-
рентная модель). Микробы, проникающие в пи-
щеварительный тракт с пищевым материалом,
в большинстве погибают под действием соляной
кислоты в желудке; бактерии-бродилыцики и про-
стейшие закрепляются только в толстом кишеч-
нике, где ассимилируют остатки питательных ве-
ществ, не всосавшиеся в тонком кишечнике.
Животные, питающиеся в основном расти-
тельным материалом, в значительно большей сте-
пени зависят от активного участия микроорга-
низмов в процессе пищеварения (кооперативная
модель). Активность этих микробов обеспечена
тем, что пищеварительный тракт у растительно-
ядных животных имеет ряд отделов для сбра-
живания, которые расположены либо перед же-
лудком (дожелудочная пищеварительная камера,
рубец), либо между тонким и толстым кишеч-
ником (в слепой кишке), либо в самом тол-
стом кишечнике (послежелудочное пищеварение).
В первом случае микроорганизмы разлагают ис-
ходный материал до того, как он поступит в
желудок и тонкий кишечник, где переваривает-
ся как исходная пища, так и микробная био-
масса; во втором случае участвующие в пище-
варении микроорганизмы метаболизируют остат-
ки, которые животное не могло использовать,
делая их доступными для всасывания в толстом
кишечнике (комбинация конкурентной и коопе-
ративной моделей). Ниже более детально опи-
сывается несколько примеров: рубец коровы как
пример кооперативной модели, пищеварительный
тракт человека и кишка термитов — как приме-
ры комбинированной конкурентно-кооперативной
модели.
31.5.1. Рубец жвачных как система активной
кооперации между хозяином
и микробами
Пищеварительная система жвачных специфиче-
ски адаптирована к питанию травой, сеном и со-
ломой, основными компонентами которых явля-
ются полисахариды. Сухая трава примерно на
50% состоит из гемицеллюлоз типа полифрукто-
занов и поликсиланов; 40-50% ее биомассы состав-
ляет целлюлоза, 2-3% — лигниновые вещества,
остальное — белки и липиды. Поскольку жвачные
не обладают ферментами, расщепляющими цел-
люлозу и гемицеллюлозу, большая часть пищи не
могла бы у них перевариваться без участия цел-
люлозоразлагающих анаэробных бактерий.
Рубец коровы —это пищеварительная камера
объемом 100-250 л, представляющая собой рас-
ширение пищевода (рис. 31.16). Прежде чем пища
поступит в этот отдел, она интенсивно смешива-
ется в ротовой полости со слюной, выделяемой за
сутки в количестве 60-120 л; слюнная жидкость
сильно забуферена бикарбонатом. Эта масса по-
ступает в рубец, где перемешивается и движется
по кругу благодаря сокращению мышечной стен-
ки рубца. Волокнистое содержимое пищи просе-
ивается в сетку (второй отдел желудка) и соби-
рается в небольшие комочки (жвачки), которые
отрыгиваются в ротовую полость и вновь под-
вергаются пережевыванию. Таким образом, время
пребывания перевариваемой массы в рубце разли-
чается для растворенных веществ и материала в
виде частиц; последний отрыгивается и повторно
проглатывается для наилучшего усвоения.
Рис. 31.16. Пищеварительная система жвачных живот-
ных.
Глава 31. Местообитания прокариот 295
Таблица 31.10. Физические, химические и микробиологические характеристики рубца
Параметры Характеристики
Физические Кислотность, pH Окислительно-восстановительный потенциал Температура Осмолярность Содержание сухого вещества Химические Газовая фаза, об. % Летучие жирные кислоты, мМ Аммиак Аминокислоты Растворимые углеводы Неорганические вещества Микроэлементы / витамины Факторы роста Микробиологические Бактерии Ресничные простейшие Анаэробные грибы 5,5-6,9 (в среднем 6,4) от —350 до —400 мВ 37-42 °C 250-350 мэкв./л 10-18% СО2 (65), СН4 (27), N2 (7), О2 (0,6), Н2 (0,2) Уксусная (68), пропионовая (20), масляная (10), более длинноцепочечные (2) 2-12 мМ < 1 мМ < 1 мМ в течение 3 ч после кормления Высокое содержание Na+; другие вещества в нелимитирующих количествах Всегда присутствуют; в большом количестве имеются витамины группы В Жирные кислоты с разветвленными цепями и ароматические жирные кислоты, пурины, пиримидины и т. д. 101°-1011 клеток/г (>200 видов) 104-106 клеток/г (хищники) 102-104 зооспор/г
Рубец можно рассматривать как аналог пол-
ностью анаэробного ферментера с полунепрерыв-
ным протоком (табл. 31.10). Кислород может про-
никать в рубец в следовом количестве с пищей, но
немедленно потребляется. В результате перевари-
вания пищи в рубце может также накапливаться
(до концентрации несколько процентов) водород,
быстро превращаемый в метан. Присутствующие
в рубце разнообразные микроорганизмы разла-
гают растительный материал, в основном веще-
ства полимерной природы, и сбраживают его с
образованием органических кислот; суммарный
процесс описывается уравнением (31.7) (глюкоза
представляет здесь эквивалент гексоз в целом):
100 Глюкоза —>113 Ацетат 4- 35 Пропионат +
4- 26 Бутират 4-104 СО2 4- 61 СН4 4-
+ 43 Н2О (31.7)
Как упоминалось в разд. 30.7.2, метан у жвачных
образуется исключительно при ассимиляции мик-
роорганизмами одноуглеродных соединений, на-
пример СО2, формиата и Н2, и выделяется при
отрыжке. Метаногены, использующие ацетат,
и вторичные бродильщики, которые разлагают
жирные кислоты с большим числом углеродных
атомов, не закрепляются в рубце, так как время
пребывания в нем пищи для этого слишком ко-
ротко (0,4-2 сут). Образующиеся в рубце летучие
жирные кислоты — в количестве до 3,7 кг ацетата,
1,2 кг пропионата и 0,7 кг бутирата в сутки — вса-
сываются через его слизистую оболочку, поступа-
ют в кровь и далее окисляются в организме-хозя-
ине. Корова в действительности питается этими
кислотами, а не растительными полисахаридами.
В состав микрофлоры рубца входят строго
анаэробные бактерии (IO10—1011 клеток/г) и анаэ-
робные ресничные инфузории (104-106 клеток/г).
В разложении полимеров в некоторой степени
частично участвуют также анаэробные грибы
(102—104 зооспор/г). В табл. 31.11 приведены до-
минирующие прокариоты из числа более чем 200
видов, идентифицированных в рубце. Общий сос-
тав микрофлоры рубца довольно стабилен и раз-
нообразен; ни один вид не составляет более 3%
общей численности микробных клеток.
296 Часть VIII. Прокариоты в биосфере
Таблица 31.11. Доминирующие виды прокариот в мик-
рофлоре рубца
Группы организмов
Бактерии, разлагающие целлюлозу
Ruminococcus albus
Butyrivibrio fibrisolvens
Fibrobacter succinogenes
Clostridium locheadii
Бактерии, разлагающие гемицеллюлозу
Fibrobacter succinogenes
Butyrivibrio fibrisolvens
Ruminococcus albus
Lachnospira multiparus
Бактерии, разлагающие крахмал и сахара
Selenomonas ruminantium
Sucdnimonas amylolytica
Bacteroides ruminicola
Streptococcus bovis
Бактерии, разлагающие лактат
Selenomonas lactilytica
Megasphaera elsdenii
Veillonella spp.
Бактерии, декарбоксилирующие сукцинат
Selenomonas ruminantium
Veillonella parvula
Метаногенные археи
Methanobrevibacter ruminantium
Methanomicrobium mobile
Обитающие в рубце простейшие, главным об-
разом ресничные инфузории, питаются бактери-
альными клетками, а также участвуют в перева-
ривании целлюлозы и крахмала. Присутствие их
не обязательно для функционирования системы
рубца, но они вносят свой вклад в поддержание
ее стабильности. Некоторые из этих ресничных
инфузорий образуют ассоциацию с метаногенами
(см. разд. 30.7.6). Грибы рубца способствуют раз-
ложению полимеров, предположительно лигнина;
однако деградация лигнина вряд ли возможна в
отсутствие кислорода.
Микрофлора рубца формируется у новорож-
денных телят в течение нескольких месяцев; со-
ответствующий инокулят телята получают от ма-
тери при сосании. Телятам, растущим отдельно
от взрослых животных, требуется гораздо больше
времени для формирования стабильной микро-
флоры рубца; животные, выращенные в стериль-
ных условиях, имеют серьезные нарушения пище-
варения и нс выживают на травяном рационе.
Поскольку растительный материал беден азо-
том, особый физиологический механизм действу-
ет для снабжения азотом микробиоты рубца. В ре-
зультате микробной активности пул свободных
аминокислот остается на низком уровне. Азот
аминогрупп, высвобождающийся при переварива-
нии содержащегося в пище небольшого количе-
ства белка, частично всасывается в виде аммиа-
ка через слизистую желудка, как и образующиеся
при сбраживании углеводов органические кисло-
ты. Для обеспечения синтеза белка микробиотой
рубца часть мочевины, синтезируемой в печени,
не выделяется с мочой, а вновь поступает со слю-
ной в пищеварительный тракт и рубец (уреогепа-
тический цикл) и там гидролизуется; таким об-
разом, часть азота, ассимилированного из пищи,
возвращается в метаболизм организма-хозяина.
Значительной фиксации азота в рубце, по имею-
щимся данным, не происходит.
Жидкость рубца содержит, помимо преобла-
дающих в ней жирных кислот и аммиака, смесь
частично трансформированных аминокислот, на-
пример превращенных в жирные кислоты с раз-
ветвленными цепями и ароматические жирные
кислоты, которые могут поглощаться другими
членами микробного сообщества, подвергаясь вос-
становительному карбоксилированию и аминиро-
ванию с образованием аминокислот. Благодаря
этому микроорганизмы экономят энергию, кото-
рая должна была бы затрачиваться на синтез ами-
нокислот de novo. Такие предшественники амино-
кислот требуются ряду микроорганизмов рубца;
при их культивировании в среду необходимо вно-
сить жидкость рубца и в некоторых случаях опре-
деленные смеси жирных кислот.
Содержимое рубца переходит затем в третий
отдел желудка (книжку), в котором главным об-
разом происходит дальнейшее всасывание жир-
ных кислот — продуктов брожения. В следующем,
четвертом отделе желудка, сычуге, реакция сре-
ды кислая, как в желудке не жвачных живот-
ных; здесь под действием пищеварительных фер-
ментов гидролизуется микробная биомасса (400 г
массы бактерий и 300 г массы простейших в
сутки). В сычуг секретируется также лизоцим,
способствующий перевариванию бактериальной
биомассы, образующейся в рубце. Содержимое
Глава 31. Местообитания прокариот 297
сычуга поступает далее в тонкий кишечник, где
всасываются питательные вещества.
К жвачным относятся также козы и овцы.
В связи с тем, что в их пищеварительном трак-
те образуется метан, увеличение поголовья овец,
наблюдаемое особенно в развивающихся странах,
считается одним из факторов, вызывающих гло-
бальное повышение уровня метана в атмосфере
(см. гл. 32). Особым представителем «жвачных»
можно считать гоацина — нелетающую тропиче-
скую птицу, которая питается исключительно ли-
стьями. Если у всех остальных птиц зоб слу-
жит органом эффективного измельчения пищи, то
у гоацина он представляет собой огромную бро-
дильную камеру, сходную с рубцом, и обеспечи-
вает переваривание растительной пищи путем до-
желудочной ферментации.
Рубец жвачных — это своеобразная бродиль-
ная камера; благодаря его функции животное, ли-
шенное собственных целлюлаз и гемицеллюлаз,
может эффективно усваивать растительный ма-
териал. Необходимые для этого ферменты вы-
деляются строго анаэробными симбиотическими
бактериями, составляющими комплексное мик-
робное сообщество, которое сбраживает расти-
тельную биомассу с образованием уксусной, про-
пионовой и масляной кислот, всасывающихся
через слизистую оболочку пищеварительного
тракта. В качестве побочного продукта образует-
ся метан, выходящий из рубца через ротовую по-
лость. Связанный азот, необходимый бактериям
для синтеза белка, частично рециклизуется через
уреогспатический цикл и в результате перевари-
вания образовавшейся микробной биомассы.
31.5.2. Пищеварение у человека зависит
от конкуренции и кооперации
Для человека растительная пища составляет
лишь часть общего рациона, и его пищеваритель-
ная система не приспособлена оптимально к пе-
ревариванию растительных волокон. В ней нет
специальных расширений для интенсивного сбра-
живания, за исключением толстого кишечника,
который, однако, в относительном масштабе зна-
чительно крупнее, чем у чисто плотоядных жи-
вотных (например, собаки). Поскольку мясная
пища легко портится и под действием присут-
ствующих в ней бактерий-бродилыциков может
стать источником образования токсичных соеди-
нений (первичных аминов, птоамипов), вся она
прежде всего стерилизуется в желудке во избе-
жание неконтролируемого брожения. Для этого
в полость желудка секретируется соляная кис-
лота, в результате чего кислотность в нем со-
ставляет 0,8-1,5 ед. pH и большинство попав-
ших в него с пищей микробов уничтожается. Вы-
деляемые клетками желудка амилолитические и
протеолитические ферменты, активные в силь-
покислых условиях, расщепляют полимерные ве-
щества в составе пищи с образованием сахаров,
пептидов и аминокислот, которые всасываются
в двенадцатиперстной кишке. Выживание повы-
шенного числа клеток бактерий (> 102/мл) в
желудке указывает на неправильное, даже пато-
логическое состояние, которое часто обусловле-
но недостаточным образованием кислоты. Неко-
торые участки с умеренной кислотностью (в зоне
пилорических желез) способна заселять кислото-
устойчивая бактерия Helicobacter pylori, которая
может вызывать здесь образование язв (один из
возбудителей язвенной болезни желудка).
В двенадцатиперстной кишке и переднем от-
деле топкого кишечника микроорганизмы обычно
почти полностью отсутствуют. Общая числен-
ность их составляет здесь менее 102-103 кле-
ток/мл, и в основном это кислотоустойчивые бак-
терии родов Streptococcus, Lactobacillus и Ente-
rococcus. В переднем отделе тонкого кишечника
pH постепенно повышается, становясь слабоще-
лочным, и затем, при переходе к толстой киш-
ке, нейтральным. Численность бактерий посте-
пенно увеличивается в последнем отделе тонкого
кишечника; в зоне перехода его в толстый ки-
шечник она резко возрастает до 1010-1012 кле-
ток/мл. В толстом кишечнике доминируют стро-
го анаэробные бактерии (табл. 31.12), биомасса
которых составляет примерно до 50% каловых
масс в прямой кишке. Аэробные и факультативно
аэробные бактерии присутствуют в толстой киш-
ке в количестве менее 108 клеток/мл. Доля клеток
Escherichia coli составляет менее 0,1% численнос-
ти каловых бактерий.
Микрофлора толстого кишечника сбражива-
ет непереваренные волокнистые компоненты пи-
щи (целлюлозный и гемицеллюлозный материал)
с образованием летучих жирных кислот (уксус-
ной пропионовой и масляной), а также водорода
и СО2 или СН4. Эти кислоты всасываются через
298 Часть VIII. Прокариоты в биосфере
Таблица 31.12. Преобладающие виды прокариот, выде-
ленные из содержимого толстой кишки человека
Виды Численность на грамм сухого вещества
Bacteroides thetaiotaomicron 1011
Bacteroides vulgatus 10п
Bacteroides fragilis 1О10
Bacteroides distasonis 1011
Bacteroides ovatus ю10
Streptococcus intestinalis 1О10
Bifidobacterium adolescentis 1О10
Peptococcus prevotii 1О10
Peptostreptococcus productus 1О10
Штамм J 52 (гомоацетогенный) 10п
Штамм CS7H (гомоацетогенный) 109
слизистую оболочку кишечника, поступая в кро-
веносную систему; как установлено, 10-20% непо-
средственно усваиваемых человеком питательных
веществ составляют летучие жирные кислоты, ко-
торые всасываются в толстом кишечнике. Обра-
зующийся при брожении водород либо высвобож-
дается с кишечными газами, либо потребляется
гомоацетогенными или метаногенными бактери-
ями. В западных странах только у трети насе-
ления обнаруживается присутствие в кишечни-
ке стабильных метаногенных бактерий; у «не-
метаногенных» индивидов отсутствие популяций
метаногенов, очевидно, представляет собой осо-
бенность организма. «Совместимость» с метаноге-
нами и соответственно образование в кишечнике
метана являются, по-видимому, наследственным
свойством; по данным семейного анализа, для
всех кровных родственников в семье может быть
характерно либо образование метана, либо обра-
зование водорода. Количество газов, выходящих
из толстой кишки наружу, также относится к ха-
рактерным особенностям организма и составляет
у разных индивидов от менее 1 мл до 3 л в сут-
ки. Эти газы диффундируют также в кровь и вы-
свобождаются через легкие. Выяснить, является
ли человек метаногенным или нет, можно, таким
образом, просто по составу выдыхаемого возду-
ха с помощью чувствительного газового хромато-
графа.
Роль гомоацетогенных бактерий в пищеваре-
нии человека долгое время недооценивали, из-за
того что они нуждаются при культивировании в
смеси субстратов и не дают роста при исполь-
зовании обычных методов учета. По-видимому,
эти бактерии присутствуют в каловых массах в
большом количестве (см. табл. 31.12) и у «не-
метаногенных» лиц могут выполнять роль потре-
бителей водорода. Возможно, они повышают эф-
фективность усвоения пищи в том смысле, что
восстановительные эквиваленты используются с
образованием большого количества ацетата, ко-
торый всасывается в кишечнике. Эксперименты
с применением радиоактивных меток показыва-
ют, что источником от 1/4 до 1/3 всего количест-
ва ацетата, образующегося в толстом кишечни-
ке, служит восстановление СО2 гомоацетогенны-
ми бактериями.
Микрофлора толстого кишечника развивается
на первом году жизни и остается довольно ста-
бильной в течение всей жизни человека. Даже
после тяжелой диареи она быстро восстанавли-
вается в целом до прежнего состава. Такая ста-
бильность обусловлена прикреплением основных
кишечных бактерий к поверхности эпителия, на
которой происходит их стабильное и непрерыв-
ное размножение. Состав микрофлоры толстого
кишечника человека, по результатам обследова-
ния населения западных стран, мало варьирует
между разными индивидами и большей частью не
зависит от характера питания. Существенное раз-
личие в составе микрофлоры может быть, напри-
мер, между строгим вегетарианцем и «мясоедом».
Резкие изменения в составе микрофлоры толсто-
го кишечника вызывает интенсивное применение
антибиотиков.
Активность микробного брожения в толстой
кишке в значительной мере определяется коли-
чеством поступающих в него сбраживаемых суб-
стратов. Недостаточное всасывание определен-
ных компонентов пищи (например, лактозы у лиц,
не способных усваивать этот сахар) может вызы-
вать повышенную активность брожения, сопро-
вождающегося и повышенным образованием газа.
То же самое происходит при употреблении боль-
ших количеств растительных углеводов, не раз-
лагаемых ферментами двенадцатиперстной киш-
ки. К таким углеводам относятся, в частности,
галактозиды (рафиноза, стахиоза, вербаскоза),
которые составляют до 15% сухого вещества се-
мян конских бобов и других бобовых растений.
Строго восстановительные условия в толстом
Глава 31. Местообитания прокариот 299
кишечнике и высокая гибкость метаболизма обли-
гатно анаэробных бактерий имеют важное значе-
ние в том отношении, что могут быть причиной
побочных эффектов употребления тех или иных
пищевых продуктов и пищевых добавок. Напри-
мер, пищевые красители превращаются в резуль-
тате восстановления и расщепления азо-мостиков
в аминопроизводные; нитрогруппы восстанавли-
ваются до нитрозо- или аминогрупп; фенолы де-
митилируются или дегликозилируются; кетоны
восстанавливаются до вторичных спиртов; гало-
генизированные ароматические соединения под-
вергаются дегалогенированию. В связи с этим лю-
бое синтетическое соединение, добавляемое в пи-
щевые продукты, должно проходить проверку на
предмет его возможных анаэробных превращений
в потенциально токсичные или по другим причи-
нам опасные производные.
Переваривание клетчатки (растительных во-
локон) происходит исключительно в толстом ки-
шечнике. По-видимому, большего не требуется,
поскольку эти компоненты пищи не имеют суще-
ственного значения в качестве источников пита-
ния. Слепая кишка не развита у человека как от-
дельная «бродильная камера» и, судя по всему,
не выполняет какой-либо специальной функции
в пищеварении. В отличие от этого лошадь как
строго растительноядное животное имеет удли-
ненную слепую кишку (до 1 м) и все пищеваре-
ние у нее зависит от сбраживания растительного
материала в слепой кишке и во всех остальных от-
делах толстого кишечника; примерно 13% общей
микробной биомассы в слепой кишке лошади со-
ставляет сбраживающая целлюлозу и гемицеллю-
лозу бактерия Fibrobacter succinogenes. Специфи-
ческой системы для всасывания азота у лошади
нет, и связанный азот выделяется у нее в составе
непереваренной микробной биомассы и мочевины
с фекалиями и мочой. Поэтому конский навоз зна-
чительно более ценен в качестве азотного удобре-
ния, чем коровий.
У некоторых растительноядных грызунов, на-
пример кроликов, также имеется развитая слепая
кишка — камера для сбраживания клетчатки. По-
лучаемые из пищи питательные вещества всасы-
ваются в толстом кишечнике. Кролики поедают
и свой помет (копрофагия); очевидно, это необхо-
димо для дополнительного усвоения белков, вита-
минов и других питательных веществ микробных
клеток, которые недостаточно всасываются в тол-
стом кишечнике.
31.5.3. Специализация термитов связана
с разнообразными типами питания
Насекомые чрезвычайно разнообразны по спосо-
бам высокоспециализированного питания. В боль-
шинстве случаев эти способы, вероятно, связаны с
участием симбиотических микроорганизмов, роль
которых в пищеварении у насекомых еще пред-
стоит изучить. Одними из фитофагов среди насе-
комых являются термиты — основные минерали-
заторы подстилки в зоне тропиков и субтропиков
между 40° ю.ш. и 50° с.ш. В связи с важным эко-
логическим значением термитов и особенностя-
ми их питания (бедный рацион) пищеваритель-
ная система разнообразных видов этих насекомых
привлекает особое внимание исследователей. По-
скольку термитов насчитывается примерно 3 000
видов, характер питания может среди них силь-
но различаться и обобщения здесь делать труд-
но; здесь рассматривается только способ питания
древесиной у низших термитов, как наиболее по-
дробно изученный.
Пищеварительная система низшего термита
Reticulitermes flavipes схематически изображена
на рис. 31.17, А. Весь кишечник имеет длину при-
мерно 12 мм и общий объем несколько милли-
литров. Как показывает измерение окислительно-
восстановительных потенциалов, по крайней мере
в расширенной задней кишке у этого термита
условия строго анаэробные и значения Eq варьи-
руют от —200 до —300 мВ. На основании этого
был сделан вывод, что в данном случае задняя
кишка представляет собой аналог рубца коровы
и пищеварение в ней должно происходить подоб-
ным образом. Однако кишечный тракт у этого
термита in vivo тесно связан с заполненной воз-
духом трахейной системой, и эпителий тонко-
го кишечника не изолирует содержимое желуд-
ка от доступа кислорода. Таким образом, низкий
окислительно-восстановительный потенциал вну-
три задней кишки и очевидное отсутствие в ней
измеримого количества кислорода могут поддер-
живаться только за счет активного потребления
здесь кислорода. Исследования с применением
микроэлектродов выявили резкие градиенты кон-
центрации кислорода через кишечный эпителий и
позволили рассчитать действительный поток кис-
лорода в кишку. От рубца коровы задняя киш-
ка данного термита как микробное местообитание
полностью отличается также малыми размерами
и высоким отношением поверхности к объему.
300 Часть VIII. Прокариоты в биосфере
Рис. 31.17. Система пищеварения у низшего термита
(Reticulitermes flavipes), питающегося древесиной.
А. Строение пищеварительного тракта. Общая длина ки-
шечника 10-12 мм.
Б. Потоки углерода и электронов в пищеварительном
тракте. Толщина стрелок отражает относительную важ-
ность соответствующих путей.
Способ питания кормящихся древесиной низ-
ших термитов представляет собой замечатель-
ный пример эффективности кооперативной пище-
варительной системы. Сам термит Reticulitermes
fiavipes не обладает целлюлазами. Насекомое раз-
мельчает древесный материал с помощью манди-
бул и зоба, после чего расщепление компонентов
древесины осуществляется смешанным бактери-
альным сообществом, заполняющим заднюю киш-
ку примерно на 65% ее объема. В задней кишке со-
держится также большое количество простейших,
сбраживающих целлюлозу древесных частиц с об-
разованием главным образом ацетата, водорода
и СОг- Гомоацетогенные бактерии ассимилиру-
ют Нг и СОг, синтезируя дополнительное коли-
чество ацетата. Мономерные сахара, дисахариды
и трисахариды, высвобождаемые простейшими,
сбраживаются бактериями задней кишки в основ-
ном с образованием ацетата, а также в неболь-
шом количестве пропионата и бутирата. Хотя в
этом микробном сообществе высока численность
молочнокислых бактерий, лактат почти не выяв-
ляется в жидкости задней кишки. Имеются дан-
ные о том, что молочнокислые бактерии образуют
главным образом ацетат и часть электронов пе-
реносят на диффундирующий в кишку кислород,
способствуя таким образом, поддержанию анаэ-
робных условий. Суммарный процесс представля-
ет собой разложение целлюлозы древесины с об-
разованием ацетата как основного продукта бро-
жения, который всасывается через слизистую обо-
лочку кишки насекомого-хозяина (рис. 31.17, Б).
В задней кишке R. flavipes присутствуют также
в большом количестве метаногенные прокарио-
ты, однако значительного выделения метана не
происходит. Если метан образуется, он, вероятно,
немедленно окисляется вблизи кишечной стенки.
Другие термиты образуют значительное количе-
ство метана, существенно способствуя поступле-
нию метана в атмосферу (см. гл. 32).
Каким образом простейшие, переваривающие
древесные частицы, столь эффективно отделяют
целлюлозный компонент древесины от лигнина,
пока неясно. Согласно более ранним данным, лиг-
нин активно разлагается в кишечнике термита,
даже при кажущемся отсутствии молекулярно-
го кислорода. В настоящее время известно, что
кислород проникает в просвет кишки и может
использоваться для частичной деполимеризации
лигнина, но большая часть лигнина выделяется с
фекалиями. В микрофлоре задней кишки присут-
ствуют также в большом количестве спирохеты,
метаболизм которых не изучен, поскольку не уда-
ется получить их культуры.
В связи с тем, что древесина крайне бедна азо-
том, особого внимания заслуживает азотный ме-
таболизм питающихся древесиной термитов. Из-
лишек аммиака превращается у них, как и у всех
насекомых, в мочевую кислоту, запасаемую в тка-
ни жирового тела. Мочевая кислота не выделя-
ется, но высвобождается в заднюю кишку, где
немедленно гидролизуется большой популяцией
(108 клеток/мл объема кишки) бактерий-бродиль-
щиков. Таким образом, азот может полностью
рециклизоваться в теле насекомого-хозяина, и
лишь незначительное количество связанного азо-
та (<0,05% сухой массы) теряется с фекалиями.
Ряд термитов способен фиксировать азот за
счет нитрогеназной активности микробиоты ки-
шечника. Как показывают измерения, в некото-
рых случаях этой активности достаточно для то-
го, чтобы обеспечить рост целой колонии насе-
комых связанным азотом, происходящим из Кг;
в других случаях определяемая нитрогеназная
активность явно слишком незначительна, чтобы
вносить существенный вклад в азотное питание.
Глава 31. Местообитания прокариот 301
У высших термитов пищеварительная систе-
ма устроена значительно сложнее и состоит из
нескольких отделов. Расширенная задняя кишка
является бродильной камерой, доступ кислорода
в которую ограничен. Цел л юлозо литических про-
стейших в заднем отделе кишечника высших тер-
митов не обнаруживается, независимо от харак-
тера питания. Известны питающиеся древесиной
высшие термиты, которые обладают собственны-
ми целлюлазами и не зависят в этом отношении
от микробов. Высшие термиты, питающиеся поч-
вой, усваивают органическое вещество из погло-
щаемой почвы, которое они получают путем ее
растворения; этим они сходны с земляными чер-
вями, обитающими в зоне умеренных широт. Фи-
зиология и биохимия этого типа питания пока еще
мало изучены, однако установлено, что поглощен-
ная почва подвергается вначале щелочной обра-
ботке, после чего поступает в заднюю кишку, где
ее трансформируют микробы.
31.5.4. Микробы ассоциированы и с иными
типами специализированного питания
Известны также различные другие варианты вы-
сокоспециализированных ассоциаций насекомых
с кишечными или внешними микроорганизмами
для переваривания трудноразлагаемых источни-
ков питания. Термиты Macrotermes выращивают
в своих гнездах на кучках древесного материала
«грибные сады», а именно грибы Termitomyces,
продуцирующие целлюлазы, и поедают расти-
тельную массу вместе с грибным мицелием.
Рогохвост Sirex cyaneus откладывает яйца в зре-
лую древесину и закладывает вместе с ними спо-
ры гриба Amylosterium sp., образующего целлю-
лазы и ксиланазы (споры находятся у самки в
специальной сумке рядом с яйцекладом); грибная
биомасса служит пищей для растущих личинок
этой осы.
Интересный тип симбиотической ассоциации
обнаружен у так называемых корабельных чер-
вей. На самом деле это моллюски (Bivalvia:
Teredinidae), которые проделывают ходы в бор-
тах деревянных кораблей и обитают в них, пита-
ясь древесиной и уничтожая большую ее часть,
но оставляя целыми стенки бортов, так что снару-
жи проявлений их жизнедеятельности не заметно.
В конце концов ставшая тонкой внешняя обшив-
ка борта ломается, что приводит к разрушению
судна. У этих животных от пищевода ответвля-
ется парный орган, исходно описанный как «же-
леза Дишейеса»; к настоящему времени установ-
лено, что он заполнен практически чистой куль-
турой неизвестной микроаэрофильной бактерии,
образующей целлюлазы. Благодаря этому про-
исходит разложение целлюлозного компонента
древесины в пищеварительном тракте моллюска.
Бактерия, кроме того, фиксирует молекулярный
азот, обеспечивая хозяина связанным азотом при
его крайне бедном древесном рационе.
Ассоциации червей и моллюсков с симбиотиче-
скими бактериями, окисляющими соединения се-
ры или метан, упоминались при описании глубо-
ководных гидротермальных вентов (разд. 31.1.7).
К настоящему времени известно много приме-
ров такого рода и среди организмов, обитающих
в донных осадках на прибрежных мелководьях,
в переходной зоне между их восстановленными
и окисленными слоями. Животное-хозяин обес-
печивает партнеру организованную среду обита-
ния с оптимальным одновременным поступлением
кислорода и сероводорода либо метана — за счет
циркуляции воды через свою нору или за счет
кровообращения — и при этом питается органиче-
скими выделениями симбионта либо его клетками
путем их переваривания.
Некоторые нематоды, например Stibonemati-
пае, обитающие в переходной зоне кислород/се-
роводород в морских донных осадках на мел-
ководьях, покрыты окисляющими сероводород
бактериями, поразительно компактно располо-
женными на поверхности их тела (рис. 31.18).
Нематода мигрирует вверх и вниз через кисло-
родный и бескислородный слои осадков, при-
водя бактерии поочередно в контакт с Ог или
сероводородом. Клетки бактерий защищают
нематоду от токсичного сероводорода, а также ча-
стично поедаются нематодой, которая, возможно,
сбрасывает их с себя. Анализ с использованием
радиоизотопа 13С показал, что хозяин питается
почти исключительно этими автотрофными се-
робактериями. Прикрепленные к нематодам бак-
терии пока не удалось получить в культуре; по
данным исследований с применением 16S-pPHK-
зондов, они филогенетически близки к роду Thio-
microspira.
Часть VIII. Прокариоты в биосфере
Рис. 31.18 Ассоциация литотрофных бактерий, окисляющих серу, с поверхностью тела нематод (Stilbonematinae).
Микрофотографии демонстрируют высокоупорядоченное пространственное расположение клеток бактерий. Шкала
10 мкм.
А. Бактерии в форме коротких палочек на поверхности тела Catanema sp., кзади от расширенного, не покрытого
бактериями воротничка, предохраняющего бактериальные клетки от сбрасывания.
Б. Бактерии, прикрепленные к кутикуле Eubostrichus parasitiferus. Клетки, фиксированные на поверхности обоими
концами, варьируют от палочек длиной около 5 мкм до нитей длиной 30 мкм. Фото любезно предоставлены J. Ott
и М. Polz.
31.6.
31.6.1. Светящиеся бактерии
в ассоциациях с рыбами
Способностью к люминесценции обладают бак-
терии родов Photobacterium и Vibrio, относящие-
ся к сем. Enterobacteriaceae. Это грамотрицатель-
ные, факультативно анаэробные организмы, осу-
ществляющие в анаэробных условиях брожение
смешанного типа с образованием уксусной, мо-
лочной, янтарной и муравьиной кислот, этанола,
ацетоина и диоксида углерода. Все они типично
морские бактерии, нуждающиеся в солености сре-
ды по меньшей мере 1-2% (масса/объем). Био-
химический механизм люминесценции описан в
разд. 11.6. Экологическая функция свечения оста-
ется предметом дискуссий. Светящиеся бактерии
можно выделить из морской воды, где они при-
сутствуют в небольшом, но относительно посто-
янном количестве (1-100 клеток/мл), по крайней
мере до глубины 500 м. Они быстро накапливают-
ся на поверхности рыб и моллюсков, помещенных
в морскую воду с низкой температурой (15 °C).
Свободноплавающие отдельные клетки не испус-
кают света. Эти бактерии выделяют то или иное
Другие ассоциации с животными
низкомолекулярное лактонное соединение (на-
пример, Н-/3-кетокапроилгомосеринлактон), на-
зываемое аутоиндуктором, которое стимулирует
свечение при пороговой плотности клеток (эф-
фект «кворум-сенсинг»), т. е. в зависимости от
его концентрации. Как только концентрация ауто-
индуктора достигает пороговой величины (см.
разд. 25.2, 25.3, 27.7.3 и рис. 20.17), включается
механизм люминесценции. Такая регуляция пре-
пятствует напрасной трате энергии на свечение,
т. е. обеспечивает свечение только тогда, когда
плотность клеток достаточна, чтобы вспышка све-
та была видимой. Люминесценция имеет место
либо в специфических световых органах опреде-
ленных видов рыб, где, очевидно, поддержива-
ются чистые культуры, например Photobacterium
phosphoreum, Р. leiognathi или Vibrio fischeri с
высокой плотностью клеток. Поскольку икринки
рыб первоначально стерильны, остается неясным,
каким образом световой орган селективно ипо-
кулируется и затем чистота культуры поддержи-
вается на протяжении всей жизни рыбы. Такие
бактерии выделяют соединения наподобие анти-
Глава 31. Местообитания прокариот 303
биотиков, возможно для регуляции этих микроб-
ных популяций.
Светящиеся бактерии других типов обитают в
пищеварительном тракте рыб. Они накапливают-
ся в средней кишке до плотности клеток, кото-
рая обеспечивает испускание света. В этом слу-
чае свет может фокусироваться вниз плаватель-
ным пузырем, уменьшая видимость рыбы на фоне
неба и таким образом предохраняя ес от съеде-
ния хищником. Кишечные светящиеся бактерии
выделяются с фекалиями и при большой плотно-
сти клеток в них продолжают светиться. Такие
светящиеся комочки экскрементов с большей ве-
роятностью могут быть проглочены другими ры-
бами, т. е. это свечение способствует возвращению
бактерий в предпочтительное для них местообита-
ние. По-видимому, свободноплавающие в морской
воде клетки светящихся бактерий представляют
лишь промежуточное состояние между периода-
ми ассоциации с рыбами, в организме которых им
обеспечено селективное преимущество.
Роды Xenorhabdus и Photorhabdus — назем-
ные грамотрицательные факультативно анаэ-
робные бактерии, относящиеся к сем. Entero-
bacteriaceae, — ассоциированы с нематодами: род
Xenorhabdus с нематодами Steinernema, род
Photorhabdus — с нематодами Heterorhabditis. Бак-
терии Photorhabdus — это светящиеся организмы,
подобные описанным выше морским светящимся
бактериям. Представители Xenorhabdus и Photo-
rhabdus обитают в пищеварительном тракте мо-
лодых нематод, поражающих личинки насеко-
мых. Бактерии-симбионты попадают в гемоцель
личинок, интенсивно размножаются и вызывают
гибель насекомого-хозяина под действием свое-
го токсина, создавая таким образом благопри-
ятные условия для размножения нематод. Через
1-2 нед несколько сотен молодых нематод, каж-
дая из которых содержит в своем кишечнике эти
бактерии, покидает насекомое и ищет нового хо-
зяина. Нематоды, лишенные бактерий-симбион-
тов, не убивают личинки и не могут эффективно
размножаться. Остовы насекомых, инфицирован-
ных Heterorhabditis и Photorhabdus, приобрета-
ют красный цвет и испускают свет вследствие
биолюминесценции бактерий. Система Xenorhab-
dus / Photorhabdus-нематода перспективна в каче-
стве средства борьбы с вредными насекомыми
биологическим методом.
Бактерии родов Xenorhabdus и Photorhabdus
образуют на инфекционной стадии жизненного
цикла вторичные метаболиты, обладающие анти-
биотическим действием, и два типа белковых кри-
сталлов, функция которых пока неизвестна. Эти
кристаллы не участвуют в поражении насеко-
мого-хозяина, чем отличаются от кристаллов бел-
ка — предшественника инсектицидного токсина,
которые содержит бактерия Bacillus thuringiensis
(см. разд. 34.4.2).
31.6.2. Микроорганизмы, населяющие
кожу человека
Кожа человека не является однородной средой
обитания для микробов. Большая часть поверх-
ности кожи покрыта сухим слоем отмерших кле-
ток эпидермиса, на которых невозможен сколько-
нибудь существенный рост бактерий. Только в
определенных защищенных частях тела, таких
как подмышки, складки между пальцами ног
или в области гениталий, поверхность кожи име-
ет достаточную влажность для того, чтобы на
ней могли расти бактерии. Наибольшая микроб-
ная активность приурочена к фолликулам волос
и потовым протокам, где имеется достаточно
субстратов и обеспечена защита от механиче-
ского удаления. Внутри самих этих капилляр-
ных пространств микробов обычно нет. Доступ
в них защищен разнообразными молочнокислы-
ми бактериями, среди которых доминируют ви-
ды рода Staphylococcus. В числе присутствую-
щих здесь бактерий отмечены также виды ро-
дов Micrococcus, Corynebacterium, Acinetobacter,
Alcaligenes и Propionibacterium. Молочнокислые
бактерии выделяют кислоту, и кислые условия
препятствуют размножению других, не являю-
щихся специфичными для кожи микроорганиз-
мов. Излишнее мытье уничтожает эту нормаль-
ную кожную флору и способствует заселению
потенциально патогенных организмов, напри-
мер дрожжей Candida albicans. Повышенная
влажность и ограниченный доступ кислорода
способствуют развитию анаэробов-бродилыциков,
таких как бактерии родов Propionibacterium и
Clostridium, образующих характерные для них
продукты. Вид Propionibacterium acnes обычно
является безвредным обитателем кожи, но спосо-
бен вызывать сильное воспаление сальных желез
и волосяных фолликулов, т. е. образование угрей.
304 Часть VIII. Прокариоты в биосфере
31.7. Микробы и растения
Микробы могут образовывать различного рода
ассоциации с высшими растениями, локализу-
ясь в их побегах, цветках или корнях. Ассоци-
ации микробов с растениями, как и с животны-
ми, могут быть благоприятными для хозяина или
неблагоприятными, вызывающими болезни, увя-
дание и гибель растения. Последние случаи от-
носятся к области фитопатологии; наибольшее
значение в качестве фитопатогенных орган измов
имеют грибы, а также бактерии родов Erwinia,
Xanthomonas и др. (см. разд. 34.3). Здесь рассмат-
риваются ассоциации непатогенных микробов с
высшими растениями.
Поверхность побегов у высших растений по-
крыта микроорганизмами, среди которых встре-
чаются как временно, так и постоянно присут-
ствующие виды. В наибольшем количестве микро-
флора присутствует на нижней стороне листьев,
где находятся устьица, поскольку вокруг них со-
здается повышенная влажность и на поверхность
выделяются растворенные сахара. Здесь обита-
ют преимущественно бактерии-бродилыцики ро-
дов Lactobacillus и Leuconostoc, а также виды
Propionibacterium, Xanthomonas и Pseudomonas.
Благодаря свойству кислотообразования эти бак-
терии препятствуют развитию в области устьиц
фитопатогенных микроорганизмов, аналогично
тому что имеет место на кожных покровах жи-
вотных (см. разд. 34.4). Микробные сообщества
поверхности листьев меняются в зависимости от
времени года. Весной доминируют бактерии, то-
гда как осенью, с увеличением влажности ли-
стьев, начинают преобладать грибы. Внутренние
полости листовой ткани, как считается, свободны
от живых микроорганизмов, хотя отмечены и ис-
ключения.
Чашечки цветков содержат нектар — сахари-
стую жидкость, которая служит селективной
средой для осмофильных микроорганизмов, в
первую очередь дрожжей. В пробах такого нек-
тара, по ряду сообщений, в виде чистой культуры
обнаруживается Candida reukaufii.
31.7.1. Ризосфера — особая среда обитания
почвенных микроорганизмов
Ризосферой называют участки почвы, находя-
щиеся в тесном контакте с поверхностью кор-
ней (рис. 34.1). Толщина ризосферного слоя мо-
жет составлять от нескольких миллиметров до
нескольких сантиметров в зависимости от почвен-
ных условий и типа растений.
В ризосферу поступают выделяемые корня-
ми растворенные органические вещества (малат,
сукцинат, ацетат, гликолат, а также сахара). Эти
вещества служат источниками питания для мик-
робного сообщества ризосферы, довольно специа-
лизированного в зависимости от вида растения.
В результате слущивания и обмирания клеток
слизистых слоев поверхности корня и корневого
чехлика в почву поступает органический мате-
риал в виде частиц, также поддерживающий пи-
тание комплексной микробиоты. Растения выде-
ляют до 20% образуемого ими органического уг-
лерода в прикорневую зону и этим сдвигают в
ней соотношение азот/углерод до таких значений,
которые для роста микроорганизмов означают
условия относительной азотной недостаточнос-
ти. Поэтому в ризосфере обитают главным обра-
зом азотфиксирующие бактерии, которые успеш-
но развиваются в этой пространственно высокоор-
ганизованной экосистеме и поставляют связанный
азот в общий азотный баланс ассоциации. Бакте-
рии ризосферы могут также поддерживать благо-
приятные условия для питания растения-хозяина
благодаря выделению ими хелатобразующих со-
единений (сидерофоров), которые мобилизуют тя-
желые металлы, например железо, и переводят
их в форму, доступную для использования рас-
тениями. Корни растений в определенной степени
регулируют состав микробного сообщества ризо-
сферы посредством своих поверхностных глико-
протеинов, называемых лектинами. Лектины рас-
познают как микробные клетки, поддерживаю-
щие рост растения, так и клетки потенциально
патогенных микроорганизмов, обеспечивая при-
крепление только клеток благоприятных видов.
Кооперация азотфиксирующих бактерий с
высшими растениями может быть развита в
большей или меньшей степени (см. разд. 34.2).
Почва вокруг корней некоторых однодольных
растений, например райграса, растущего на пес-
чаных пляжах, и белокрыльника (каллы), рас-
тущего на засоленных латеритных почвах, спе-
цифически обогащена бактериями, относящимися
к роду Azospirillum-, их клетки свободно ассоци-
Глава 31. Местообитания прокариот 305
ироваиы с поверхностью корней. Эти высокопо-
движные, довольно специализированные спирил-
лы, не прикрепляясь к корням и не образуя каких-
либо совместных структур с растением, использу-
ют выделяемые им органические вещества и обо-
гащают ризосферу связанным азотом. Сахарный
тростник образует симбиоз с азотфиксирующей
бактерией Acetobacter diazotrophicus, присутству-
ющей в межклеточных пространствах стеблей.
Другой хорошо известный тип кооперации
между растениями и микробами — это микори-
за, ассоциация корней деревьев и травянистых
растений с грибами. Многие базидиомицеты и ас-
комицеты образуют такие ассоциации с корнями
сосны, лиственницы, ели, а также широколиствен-
ных пород, например дуба. Мицелий проникает в
корневые волоски, и постепенно развивается ком-
плексная структура из тканей корпя и гиф гриба,
которая высокоэффективно поглощает минераль-
ные вещества и воду.
Особым местообитанием для микробов служат
корни растений в гидроморфных почвах. В поч-
ве под рисом или тростником, периодически за-
тапливаемой водой и поэтому бедной кислородом,
но богатой органическими субстратами, создают-
ся полностью восстановительные условия в ре-
зультате активности бактсрий-бродильщиков, же-
лезобактерий или сульфатредукторов, а также
метаногенов. Ткани корней выдерживают анаэ-
робные условия в течение коротких периодов,
осуществляя бродильный метаболизм (спиртовое
брожение). При длительном сохранении анаэро-
биоза корневая ткань снабжается кислородом из
стебля через газообменную систему, которая пе-
реносит также метан через стебель в атмосфе-
ру. Переходная зона между восстановленной поч-
вой и снабжаемой кислородом корневой тканью
с резкими градиентами концентраций H2S, Fe(II)
и СН4 служит местообитанием литотрофных и
метанотрофных бактерий, которым благоприят-
ствует тесное соседство их субстратов, гради-
енты концентраций которых имеют противопо-
ложную направленность, в зоне протяженностью
всего нескольких микрон. Перенос кислорода воз-
духа посредством вентиляции в стеблях круп-
постебельных травянистых растений, например
тростника, используется для очистки воды па
специальных тростниковых грядах (см. гл. 36).
Заросли таких трав относятся к наиболее про-
дуктивным экосистемам, известным к настоя-
щему времени; их продуктивность превышает
250 г углерода на 1 м2 в год, чему способству-
ет активность азотфиксирующих бактерий сем.
Enterobacteriaceae (роды Klebsiella, Enterobacter),
обитающих в тесной ассоциации с болотными тра-
вами, например осокой Carex elata.
Сходным образом ассоциированные энте-
робактерии способствуют корневому питанию
растений риса. Большую роль в повышении уро-
жайности рисовых полей играют также азотфик-
сирующие цианобактерии. Особый случай коопе-
рации растения с микроорганизмом — это симбиоз
цианобактерии Anabaena azollae с водным папо-
ротником Azolla (см. рис. 34.12).
31.7.2. Синдром мокрой древесины
Отмершая древесина внутри крупных стволов де-
ревьев может заселяться грибами, вызывающи-
ми ее гниение, причем видимых признаков та-
кого поражения долгое время не наблюдается.
Другое поражение, называемое синдромом мок-
рой древесины, вызывают аэробные бактерии и
бактерии-бродилыцики, внедряющиеся во внут-
реннюю часть ствола в местах, где были обломаны
или спилены ветви, через морозобойные трещины
или повреждения корней. Это смешанное микроб-
ное сообщество распространяется внутрь ствола
в живую ткань, разлагая при этом пектин в сре-
динных пластинках и ситовидных трубках. Дере-
во утрачивает способность регулировать поступ-
ление воды, и его ткани насыщаются водой, по-
ступающей из почвы под действием капиллярных
сил; древесина становится мокнущей. Брожение
внутри тканей растения может сопровождаться
образованием летучих жирных кислот (например,
в случае дуба, сосны и пихты). У деревьев с мяг-
кой древесиной, таких как тополь и ива, брожение
может идти дальше до стадии образования мета-
на, который накапливается внутри ствола с по-
вышением давления до нескольких бар. При этом
деревья повреждаются лишь незначительно и вы-
живают при таких проявлениях бактериального
повреждения в течение десятилетий. Синдром
мокрой древесины часто отмечается у деревьев в
состоянии стресса, вызванного другими внешни-
ми факторами (сухостью или подкислением поч-
вы, излишним поступлением азота); он имеет эко-
номическое значение, поскольку сильно снижает
качество древесины.
306 Часть VIII. Прокариоты в биосфере
Дополнительная литература
Austin В. (1988). Marine microbiology. Cambridge:
Cambridge University Press.
Bartlett D.H. (1992). Microbial life at high pressures.
Sci. Prog. 76: 479-496.
Breznak J. A. (1994). Acetogenesis from carbon dioxide
in termite guts. In: Drake H. L. (ed.) Acetogenesis,
New York: Chapman & Hall; 303-330.
Breznak J. A., Brune A. (1994). Role of microorganisms
in the digestion of lignocellulose by termites. Annu.
Rev. Entomol. 39: 453-487.
Brock T.D., ed. (1986). Thermophiles. General mole-
cular and applied biology. New York: Wiley-Inter-
science.
Burns R. G. (1983). Extracellular enzyme-substrate
interactions in soil. In: Slater J.H., Whittenberry R.,
Wimpenny .1. W. T. (eds.). Microbes in their natural
environments. Cambridge: Cambridge University
Press; 249-298.
Conrad R. (1995). Soil microbial processes involved in
production and consumption of atmospheric trace
gases. In: Jones J. G. (ed.). Advances in microbial
ecology, vol. 14. New York: Plenum Press; 207-250.
Des Marais D. J. (1995). The biogeochemistry of hypersa-
line microbial mats. In: Jones J. G. (ed.). Advances in
microbial ecology, vol. 14. New York: Plenum Press;
251-274.
Edwards C., ed. (1990). Microbiology of extreme envi-
ronments. New York: McGraw-Hill.
Hastings J. W., NealsonK.H. (1992). The luminous
bacteria. In: Balows A., Triiper H. G., Dubikin M.,
Harder W., Schleifer К. H. (eds.). The prokaryotes,
2nd edn. Berlin Heidelberg; New York: Springer; 625-
639.
Hungate R. E. (1985). Anaerobic biotransformations of
organic matter, In: Lead better E. R., Pointedex-
ter J.S. (eds.). Bacteria in nature, vol. 1. New York:
Plenum Press; 39-95.
Jannasch H. W. (1989). Litho-autotrophically sustained
ecosystems in the deep sea. In: Schlegel H. G.,
Bowien B., (eds.). Biology of autotrophic bacteria.
Madison, Wise.: Science Tech. Publishers; 147-166.
Jprgensen В. В. (1980). Mineralization and the bac-
terial cycling of carbon, nitrogen and sulfur in
marine sediment. In: Ellwood D. C., Hedger J. N.,
Latham M. J., Lynch J. M., Slater J. H., (eds.). Con-
temporary microbial ecology. New York London:
Academic Press; 239-251.
Killham K. (1994). Soil ecology. Cambridge: Cambridge
University Press.
Lynch J. M., HobbieJ.E. (1988). Microorganisms in
action: concepts and applications in microbial
ecology. Oxford London: Blackwell.
NealsonK.H., Schmidt T.M., Bleakley B. (1990). Phy-
siology and biochemistry of Xenorhabdus. In: Gaug-
lerR., Kaya H. K., (eds.). Entomopathogenic nema-
todes in biological control. Boca Raton, Flor.: CRC
Press.
Paul E. A., Clark F.E. (1989). Soil microbiology and
biochemistry. New York London: Academic Press.
Polz M., Felbeck H., Novak R., Nebelsick M., OttJ.
(1992). Chemoautotrophic, sulfor-oxidizing symbiotic
bacteria on marine nematodes: morphological and
biochemical characterization. Microbial Ecol. 24:
313-329.
Revsbech N.P., Sprensen J. (1991). Denitrification in soil
and sediment. New York: Plenum Press.
Stumm W., Morgan J. J. (1981). Aquatic chemistry, 2nd
edn. New York: Wiley.
Tannock G.W. (1995). Normal microflora: an introduc-
tion to microbes inhabiting the human body. London:
Chapman & Hall.
Tate R. L. (1995). Soil microbiology. New York: Wiley.
Watanabe I., Furusaka C. (1980). Microbial ecology of
flooded rice soils. Adv. Microbial Ecol. 4: 125-168.
Wetzel R.G. (1983). Limnology, 2nd edn. Philadelphia:
Saunders.
Источники рисунков
1. Pfennig N. (1967). Photosynthetic bacteria. Annu.
Rev. Microbiol. 21: 285-324.
2. Nicholson J. A. M., Stolz J. F., Pierson B.K. (1987).
Structure of a microbial mat at Great Sippewissett
Marsh, Cape Cod, Massachusetts. FEMS Microbiol.
Ecol. 45: 343-364.
3. Jannasch H. W., Taylor C.D. (1984). Deep-sea mic-
robiology. Annu. Rev. Microbiol. 38: 487-514.
4. Blochl E., BurggrafS., Fiala G., Laucrer G., Hu-
ber R., Rachel R., Segerer A., Stetter К. O., Volkl P.
(1995). Isolation, taxonomy and phylogeny of hyper-
thermophilic microorganisms. World J. Microbiol.
Biotechnol. 11: 9-16.
Глава 32
Глобальные биогеохимические циклы
Превращения химических веществ па Земле в
значительной мере определяются биологически-
ми процессами. Растительные организмы, в том
числе одноклеточные водоросли, и цианобакте-
рии образуют органическое вещество, используя
СОг и другие неорганические соединения, в так-
же воду как источник электронов, и выделяя мо-
лекулярный кислород (оксигенный фотосин-
тез, первичная продукция). Образующееся
органическое вещество используется частично са-
мими продуцентами при дыхании и частично жи-
вотными и человеком (консументами), которые
окисляют его до СО2 (потребление). Раститель-
ные остатки и экскременты животных разлагают-
ся микроорганизмами, в первую очередь бакте-
риями и грибами: в присутствии кислорода — до
СО2, в анаэробных условиях—до СО2 и метана
(разложение, минерализация). Азот, сера и
фосфор, входящие в состав биомассы, высвобож-
даются в основном в форме аммиака, сероводоро-
да и фосфата соответственно, после чего претер-
певают дальнейшие превращения (см. разд. 30.1).
Таким образом, основная роль микроорганизмов
в биосферных процессах состоит в минерализа-
ции органического вещества, и большинство из-
вестных прокариот — гетеротрофы. Автотрофные
прокариоты участвуют в первичной продукции
(цианобактерии) или вторичной первичной про-
дукции (большинство аноксигенных фототроф-
пых бактерий; см. разд. 31.1.5). Последние осу-
ществляют фотосинтез органического вещества,
но при этом используют такие доноры электронов
(H2S, Н2, Fe2+, органические соединения), обра-
зование которых обычно связано с трансформа-
цией органических веществ, синтезируемых пер-
вичными продуцентами. То же относится к хемо-
литотрофным прокариотам: они окисляют доно-
ры электронов (например, Н2, NH3, H2S, Fe2+ и
СО), в большинстве случаев восстановленные при
окислении органического вещества, и таким об-
разом зависят от восстановителей, действующих
как промежуточные носители электронов в про-
цессе разложения органического вещества. В со-
ответствии с этим мнение, что экосистемы в зонах
морских гидротермальных вентов основаны пол-
ностью на хемосинтетической первичной продук-
ции и не зависят от фотосинтеза, следует считать
некорректным, поскольку хемосинтезирующис
организмы используют в качестве акцептора элек-
тронов молекулярный кислород — продукт фото-
синтеза, осуществляемого фитопланктоном в по-
верхностном слое морской воды, наземными рас-
тительными организмами и цианобактериями.
Циклы превращений элементов могут замы-
каться в границах определенной экосистемы, т. е.
не включать обмен промежуточными продукта-
ми цикла между экосистемой и окружающей сре-
дой. Однако большинство экосистем — это откры-
тые системы; между ними и окружающей средой
происходит обмен химическими веществами. Та-
кая экосистема (озеро, океан, участок почвы) вы-
ступает как источник или как акцептор химиче-
ских соединений, обычно переносимых воздухом
или током воды. Оценка глобальных потоков хи-
мических веществ основана на многократном из-
мерении динамики результирующих потоков ве-
ществ между различными компартментами при-
родной среды.
32.1. Цикл углерода поддерживается
Углеродные ресурсы па Земле составляют шесть
основных резервуаров: 1) неорганические карбо-
наты в осадочных породах и осадках, 2) органи-
ческий восстановленный углерод биогенного иро-
фотосинтезом
исхождепия в виде ископаемых — каменного угля,
природного газа, нефти и осадков, 3) карбонаты,
бикарбонаты и растворенный СО2 в морской во-
де, 4) органический углерод в составе почвенно-
308 Часть VIII. Прокариоты в биосфере
го гумуса, 5) СО2 в атмосфере и 6) органический
углерод в составе живой и отмершей биомассы.
В круговороте углерода участвуют главным об-
разом последние четыре пула, и на самом деле
это цикл диоксида углерода, зависящий от фо-
тосинтетической активности наземных и водных
растений (рис. 32.1), в том числе водорослей, и
микроорганизмов. Они образуют органические со-
единения на свету, но затем окисляют примерно
одну треть связанного углерода при дыхании,
главным образом ночью. Разность между коли-
чеством синтезированного и потребленного ими
органического вещества составляет 60 Пг углеро-
да, и эта масса органического вещества служит
источником питания для консументов и минера-
лизаторов, которые в конечном итоге возвраща-
ют углерод в окисленной форме в атмосферу, за-
мыкая цикл и поддерживая содержание СО2 в
биосфере на уровне примерно 0,035% (об./об.),
что эквивалентно 350 млн.-1 (объемное соотно-
шение). Общая масса живых организмов, в кото-
рой происходят превращения углерода, оценива-
ется примерно как 600 Пг органического углеро-
да и имеет продолжительность жизни, в среднем
близкую к 25 годам. Преимущественно эту био-
массу составляют растительные организмы; па
консументов и минерализаторов приходится лишь
незначительная часть общей живой биомассы —
менее 2%.
Дополнительно СО2 поступает в атмосферу в
количестве примерно 5,5 Пг при сжигании чело-
Рис. 32.1. Общий цикл углерода. Резервуары и пото-
ки приведены в Пг углерода. (1 Пг = 1015 г = 109 т).
Резервуары указаны в рамках, потоки — в виде стрелок.
РОУ — растворенный органический углерод.
веком горючих ископаемых — угля, нефти и при-
родного газа. Эти запасы связанного углерода, на-
копившиеся в ранние геологические эпохи в ре-
зультате трансформации растительных остатков,
составляют свыше 7 • 107 Пг С, с учетом биогенно-
го метана, связанного в глубоководных осадках в
виде газовых гидратов. Ископаемым запасам ор-
ганического углерода соответствует накопленный
благодаря оксигенпому фотосинтезу запас Ог в
атмосфере, составляющий 107 Пг.
Сжигание горючих ископаемых в качестве
топлива — это главная причина медленного, но
постоянного возрастания содержания диоксида
углерода в атмосфере, которое в начале 20 в. со-
ставляло 300 млн.-1, а в конце его приблизилось к
350 млн.-1 (объемное соотношение). В определен-
ной мере этот процесс связан, вероятно, с круп-
номасштабным уничтожением влажных тропиче-
ских лесов, приводящим не только к снижению
общей фотосинтетической продукции и живой
биомассы, но также к деградации почвы с окис-
лением ее органического вещества.
В океане фотосинтез и минерализация взаим-
но сбалансированы, и уровень СО2 в морской воде
довольно стабилен. Запас СО2 в океанах служит
мощным буфером, поддерживающим уровень
СО2 в атмосфере вследствие интенсивного обмена
углекислотой между атмосферой и океаном.
В упрощенной схеме круговорота углерода,
представленной на рис. 32.1, минерализация не
разделена па относительные доли участия аэроб-
ного окисления и анаэробных процессов. Оце-
пить их можно на основании данных, приведен-
ных в табл. 32.1. Поступление биогенного мета-
на в атмосферу вносит в общий поток примерно
0,3 Пг С в год, что соответствует приблизительно
1% общей интенсивности минерализации углерод-
ных соединений. На основании этого можно бы-
ло бы сделать вывод, что анаэробные процес-
сы вносят лишь небольшой вклад в минерали-
зацию биомассы. Однако эти данные отражают
только количество метана, выделяемое в атмо-
сферу, без учета того, сколько сго подверглось
реокислению на поверхности земли. Кроме то-
го, метаногенез — это лишь один, завершающий
этап анаэробной биодеградации; он происходит,
когда другие анаэробные процессы уже сыграли
свою роль. Учитывая, что почти у всех живот-
ных обмен веществ основан на участии анаэроб-
ных бактерий-бродильщиков в их пищеварении
(разд. 31.5), можно предполагать, что от 20 до
Глава 32. Глобальные биогеохимические циклы 309
Таблица 32.1. Количество СЩ, выделяемого в атмо-
сферу за год
Источники Выделение СНд, Тг С/год
в среднем диапазон
Биотические
источники
Затопляемые природные 90 75-150
земли
Рисовые поля 75 45-130
Жвачные 60 50-75
Термиты 40 20-100
Места захоронения 30 20-60
отходов
Океаны 8 4-15
Пресные воды 4 1-20
Биогенные источники 307 ~ 77%
в целом
Абиотические
источники
Сжигание биомассы 45 40-80
Добыча газа, выход его из 30 20-40
скважин, утечка из газо-
проводов
Добыча угля 10 8-30
Гидраты метана 5? Возрастает
Вулканы 0,5
Автомобили 0,5
Абиотические источни- 91 SS 23%
ки в целом
Всего 398
Данные приведены в расчете на массу углерода. (1 Тг =
Ю12 г = 106 т). По Cicerone R. J., Oremland R. S. (1988)
Global Biogeochem. Cycles 2: 299-327.
50% всего связанного углерода разлагается внача-
ле анаэробно, и уже продукты этого первичного
сбраживания окисляются с участием молекуляр-
ного кислорода (см. рис. 30.4).
32.1.1. С выделением метана связан
парниковый эффект
Метан —это второй из наиболее важных угле-
родных компонентов атмосферного воздуха. Со-
держание этого газа в атмосфере возросло с
0,7 млн.-1 (объемное соотношение) в конце 18 в.
до 1,7 млн.-1 в настоящее время. Наиболее быст-
ро оно увеличивалось в последние 70 лет. Ме-
тан образуется, прежде всего, при анаэробном
разложении органических соединений совместно
бактериями-бродилыциками и метаногенными ор-
ганизмами (см. разд. 12.1.7 и 30.7.1). Их актив-
ность обнаруживается во всех местообитаниях,
где большое количество органического вещества
разлагается в анаэробных условиях (табл. 32.1).
Основными источниками атмосферного метана
служат природные переувлажненные земли, в том
числе заболоченные и низинные почвы, такие
как тундровые, а также антропогенные экосисте-
мы, например рисовые поля и места захороне-
ния отходов. Существенный вклад в обогащение
атмосферы метаном вносят и высшие животные,
особенно жвачные и термиты в результате про-
цессов брожения в кишечнике (см. разд. 31.5).
Оксаны, хотя они покрывают более чем две тре-
ти поверхности Земли, поставляют лишь совсем
незначительное количество метана в атмосферу.
Как описано в разд. 30.2 и 31.2, интенсивность
метаногенеза в морских осадках низка, посколь-
ку в среде в избытке присутствует сульфат —
энергетически более предпочтительный акцептор
электронов. Важный источник образования мета-
на в морских осадках — метилированные амины,
образуемые рыбами как антифриз и, очевидно,
не окисляемые бактериями-сульфатредукторами.
Небольшое количество метана, выделяющееся из
морских осадков, образуется главным образом в
результате метаногенеза в богатых органически-
ми остатками прибрежных донных осадках или в
процессе сбраживания пищи в кишечнике у мор-
ских животных в открытом океане.
Пресноводные озера не вносят существенно-
го вклада в обогащение атмосферы метаном, так
как составляют лишь около 2% общей водной по-
верхности Земли. Кроме того, пресноводные озе-
ра в основной продуктивный сезон обычно стра-
тифицированы: метан, продуцируемый в осадках,
весьма активно реокисляется в зоне хемоклина
(разд. 31.1.4) и только небольшая его доля выхо-
дит в атмосферу в период осеннего перемешива-
ния. Таким образом, хорошо структурированная
среда выделяет лишь малую фракцию образуемо-
го метана, поскольку основная его часть реокис-
ляется в пределах самой системы.
То же относится и к другим метаногенным ме-
стообитаниям. Так, в гнездах термитов и в ри-
зосфере у корней растений риса высока числен-
ность метанокисляющих бактерий и в результате
выделение метана в этих местообитаниях незна-
чительное. Если глубина залегания грунтовых вод
310 Часть VIII. Прокариоты в биосфере
в затопляемых или тундровых почвах понижает-
ся в результате периодических изменений клима-
та, эти территории могут стать скорее областью
утилизации, а не источником метана благодаря
возрастанию активности метанокисляющих бак-
терий.
Абиотические источники образования метана,
по сравнению с упомянутыми биологическими,
имеют лишь небольшое значение, поставляя в
целом менее одной четверти поступающего в ат-
мосферу метана (табл. 32.1). Хотя диапазон из-
меренных потоков метана из различных источни-
ков весьма широк и выделение метана из некото-
рых небиологических источников (например, из
подземных областей залегания гидратов метана)
может быть значительным, принято считать, что
наблюдаемое возрастание уровня метана в атмо-
сфере — это следствие расширения посевных пло-
щадей под рисом и повышения численности жвач-
ных животных, особенно овец, в развивающихся
странах.
Примерно до 80% атмосферного метана разла-
гается в результате химических реакций в верх-
них слоях атмосферы, главным образом путем
окисления гидроксил-радикалом; около 20% ат-
мосферного метана окисляется в почве. Как ука-
зано в разд. 31.3.2, кинетика потребления мета-
на в почве такова, что его нельзя объяснить про-
сто активностью классических метанокисляющих
бактерий, поскольку пороговые характеристики и
константы полунасыщения процесса, осуществля-
емого этими бактериями, значительно выше, чем
концентрация метана в атмосфере. Хотя можно
утверждать, что окисление атмосферного метана
в почве — это биологический процесс, ответствен-
ные за него организмы пока неизвестны.
32.1.2. Монооксид углерода и водород
присутствуют в атмосфере
в следовых количествах
Содержание монооксида углерода (СО) в
атмосферном воздухе составляет в среднем
100 млрд.-1 (объемное соотношение), сильно раз-
личаясь при этом в Северном и Южном полу-
шариях, над сушей и океаном. Этот газ образу-
ется главным образом при горении древесины,
промышленном окислении не содержащих метан
углеводородов, ряде других производственных
процессов и работе транспорта, а также в резуль-
тате окисления атмосферного метана (табл. 32.2).
Биологический источник образования СО —это
растения, высвобождающие СО при фотодыха-
нии или фотоокислении компонентов своих кле-
ток. В процессе разложения порфиринов, фла-
воноидов, кверцетина и рутина в клетках жи-
вотных, растений, грибов и бактерий из метино-
вых групп выделяется СО. Основная часть оксида
углерода окисляется гидроксил-радикалом в пре-
делах тропосферы; небольшое количество его до-
стигает стратосферы. Примерно 12% атмосфер-
ного СО окисляется за счет биологической ак-
тивности в почве. Как и в случае окисления
метана в почве, микроорганизмы, осуществ-
ляющие эту активность, неизвестны. Изучен-
ные аэробные карбоксидотрофные и анаэробные
СО-окисляющие бактерии не имеют достаточно
высокого сродства к этому субстрату, чтобы по-
глощать его при атмосферной концентрации (см.
разд. 10.9). По-видимому, микроорганизмы, осу-
ществляющие окисление СО в почве, отличаются
от уже известных; их еще предстоит выделить и
описать.
Молекулярный водород поступает в атмосфе-
ру как продукт процессов микробного брожения и
побочный продукт фиксации азота. Как и в слу-
Таблица 32.2. Общий цикл монооксида углерода
Поток, Тг С/год
Источники
Сжигание биомассы 430
Р астительность 32
Почва 7,5
Окисление углеводородов (исключая метан) 385
Промышленность, быт, транспорт 274
Океаны 43
Окисление атмосферного СНд 257
Всего 1428
Приемники
Выделение в стратосферу 47
Окисление почвой 167 12%
Окисление в тропосфере Баланс
Данные приведены в пересчете на углерод (1 Тг = 1012 г
= 10б т) По R. Conrad (1988) In: Marshall K.S. ed. Advances
in microbial ecology, vol. 10. New York: Plenum Press: 231- 283.
Глава 32. Глобальные биогеохимические циклы 311
чае СО, известные аэробные бактерии, окисля-
ющие водород, а также использующие Н2 анаэ-
робы не способны поглощать водород при тех
его низких концентрациях, которые имеются в
атмосфере. Тем не менее водород поглощается
почвой при этих низких концентрациях за счет
биологической активности, чувствительной к ав-
токлавированию, но не подавляемой антибиоти-
ками и другими ингибиторами метаболических
процессов. Важную санитарную функцию поч-
вы — поглощение различных газов, присутствую-
щих в воздухе в следовых количествах, включая
производные азота и серы, — отражают данные,
приведенные в табл. 31.7.
Прокариоты и другие микробы выполняют
ключевую роль в минерализации органического
углерода и превращении его в диоксид углеро-
да в аэробных и анаэробных метаболических про-
цессах, причем вклад анаэробов в минерализа-
цию намного более значителен, чем считалось
ранее. Основной процесс ассимиляции СО2 — ок-
сигенный фотосинтез. Аноксигенные фототрофы
и хемотрофные бактерии вносят лишь несуще-
ственный вклад в фиксацию СО2- Метан выделя-
ется в атмосферу главным образом в результате
активности свободноживущих микроорганизмов
и прокариот — симбионтов животных; окисление
метана происходит в основном как небиологиче-
ский процесс. Монооксид углерода присутствует
в атмосфере в следовом количестве; в его образо-
вании и окислении микробная активность играет
незначительную роль. Важная роль почвы состо-
ит в поглощении ею атмосферных газов — метана,
монооксида углерода и молекулярного водорода —
и их окислении за счет не идентифицированной
пока биотической активности. Наблюдающееся в
последние столетия возрастание в атмосфере кон-
центраций диоксида углерода и метана связано во
многом с деятельностью человека.
32.2. Прокариоты участвуют во всех этапах цикла азота
Второй из наиболее важных биогенных эле-
ментов — это азот. Валентность его меняется
в цикле (см рис. 32.2) от —III до +V в
зависимости от преобладающих окислительно-
восстановительных условий. Молекулярный азот
(N2) используют только азотфикскрующие про-
кариоты, обладающие нитрогеназой. Такие ор-
ганизмы существуют как свободноживущие фор-
мы или как сил бионты растений (см. разд. 8.5
и 34.2). Азот в восстановленной форме— аммиак
(или аммоний, NH4, при pH 7,0) — ассимилиру-
ют микробы (разд. 7.3 и 8.4) и растения; в той же
форме он высвобождается при минерализации ор-
ганического вещества. Животные выделяют ли-
бо непосредственно аммиак (рыбы, другие вод-
ные животные), либо синтезированную мочевину
(млекопитающие, большинство наземных живот-
ных) или мочевую кислоту (птицы, насекомые);
два последние соединения выделяются как менее
гигроскопичные формы азота и затем гидролизу-
ются до аммиака, главным образом в результате
микробного разложения.
Растения и аэробные микроорганизмы мо-
гут также потреблять нитрат, если обладают ас-
симиляционной нитратредуктазной активностью
Окислительно-
восстановительное
состояние
+V Нитрификация
+111
Денитрификация
[NO]
-> [N2O]
Ассимиляци- ДИССИ1
онная онная
нитратредукция
NOj
N;
Фиксация Ц
О
Нитрификация
-III
Мочевина,
мочевая кислота
Ассимиляция Органические
NH^ т * азотсодержащие
Минерализация соеДинения
Рис. 32.2. Ключевые реакции в цикле соединений азота.
Степень окисления азота указана слева. Реакции, осу-
ществляемые исключительно прокариотами, отмечены
звездочками.
(разд. 8.4). Избыток аммиака может окисляться в
присутствии кислорода нитрифицирующими бак-
териями через нитрит до нитрата (разд. 10.5); Ог
участвует в этом процессе как косубстрат началь-
ной монооксигеназной реакции. Недавно откры-
то независимое от кислорода окисление аммония
нитратом, биохимический механизм которого по-
ка не установлен. Нитрат служит не только ис-
312 Часть VIII. Прокариоты в биосфере
точником азота для растений и микробов, но так-
же акцептором электронов для микроорганизмов
в анаэробных или микроаэрофильных условиях
(разд. 12.1). При диссимиляционной нитратредук-
ции образуется либо аммоний (аммонификация
нитрата), либо N2 (через нитрит, NO и N2O; де-
нитрификация); таким образом молекулярный
азот возвращается в цикл. В незначительном ко-
личестве NO и N2O могут выделяться в атмосфе-
ру как побочные продукты денитрификации; по-
сле окисления в тропосфере и стратосфере они
выпадают с осадками на Землю наряду с други-
ми оксидами азота (NOX), образующимися, напри-
мер, при молниях, промышленном сжигании топ-
лива и работе автомобильных двигателей. Общие
резервуары и потоки разных форм азота указа-
ны в табл. 32.3, из которой видно, что в океане
биологические процессы связывания и высвобож-
дения N2 весьма сбалансированы, тогда как на су-
ше связывание N2 преобладает над денитрифика-
цией. Баланс достигается в результате выделения
аммиака в атмосферу, где он в реакциях окисле-
ния превращается в формы N0x, которые возвра-
щаются на поверхность Земли с осадками. Вслед-
ствие работы химических производств по синте-
зу аммиака (в реакции Харбера-Боша), а также
интенсификации скотоводства количество связан-
ного азота в воздухе и на твердых поверхностях
может существенно повышаться на значительной
территории; аммиак в диапазоне концентраций
50-500 мкМ и нитрат в диапазоне 5-40 мкМ от-
мечаются в пробах дождевой воды в Германии и
Нидерландах. Окисление атмосферного аммиака
до азотистой кислоты — одна из основных причин
коррозии зданий (см. разд. 30.5.6).
Большинство окислительно-восстановительных
процессов с участием соединений азота проте-
кают исключительно как катализируемые про-
Таблица 32.3. Общие пулы и потоки различных форм
азота
Суша Океаны
Пг N
Пулы
Растения 12 0,3
Животные 0,2 017
Органические остатки 300 550
Растворенный неорганичес- 160 577
кий N
N2 в атмосфере 1 000 000 2 700 000
Суша Океаны
Пг N/год
Потоки
Биологическая фиксация N2 0,14 0,10
Промышленная фиксация N2 0,06 —
Окисление N2 при молниях, 0,004 0,004
сжигании топлива
Ренитрификация 0,12 0,09
Выделение NH3 в атмосферу 0,075 —
Данные приведены в пересчете на массу азота. (1 Пг =
1015 г = 109 т) По SCOPE Report 21: Bolin В ., Cook R. В.,
eds. 1983. The major biochemical cycles and their interaction.
Paris: International Council of Scientific Unions.
кариотами. Связывание молекулярного азота из
атмосферы уравновешивается денитрификацией;
значительное поступление в атмосферу аммиака
антропогенного происхождения ведет к повышен-
ному накоплению азота в дождевой воде и поч-
ве. Хсмолитотрофные бактерии окисляют аммиак
до нитрита и нитрата; нитрат используется
как акцептор электронов в условиях недостатка
кислорода.
32.3. Прокариоты участвуют во всех этапах цикла превращений серы
Сера — еще один важный биогенный элемент —
присутствует в земной коре главным образом в
литосфере и морских донных осадках в составе
пирита и гипса, а также FeS (табл. 32.4). Образо-
вание пирита из FeS и H2S в осадках описано вы-
ше (разд. 30.1.5 и 31.2.2). Важный резервуар серы
представляет собой морская вода, поскольку она
содержит сульфат в концентрации 28 мМ. Кон-
тинентальные ресурсы серы значительно меньше;
здесь наиболее важный пул серы содержится в
Глава 32. Глобальные биогеохимические циклы 313
Таблица 32.4. Резервуары серы на Земле
Резервуар Основная форма(-ы) серы Общая масса, Тг S
Литосфера FeSz, CaSO4 2,4 - IO10
Морские осадки Морская вода Морская биота CaSO4, FeSz, FeS SQ2- Восстановленная 2,5 109 1,3 - 109 30
Почвенная и наземная биота Озера и реки Восстановленная SO*- 2,4 • 105-2,4 107 300
Атмосфера OCS, SO*-, SO2, ДМС, H2s 4,8
Данные приведены в пересчете на массу серы. (1 Тг = 1012 г = 10б т.) По SCOPE Report 21 (см. табл. 32.3) и 48: Howarth R.W., Stewart J. W. В., Ivanov M.V., eds. (1992) Sulphur cycling on the continents. Wetlands, terrestrial ecosystems and associated water bodies. Paris: International Council of Scientific Unions. OCS — карбон и л сульфид; ДМС — диметилсуль- фид.
почве и наземной биоте. Озера и реки имеют лишь
небольшое значение как резервуары серы. В ат-
мосфере также присутствуют соединения серы,
главным образом карбопилсульфид (OCS), суль-
фат (в основном в аэрозолях, морских брызгах),
диоксид серы, диметилсульфид и сероводород.
Участие микроорганизмов в круговороте соедине-
ний серы показано на рис. 32.3. Сульфат — наибо-
лее обильно представленная в биосфере форма се-
ры, усваиваемая живыми организмами, — восста-
навливается до H2S в процессе диссимиляционной
сульфатредукции бактериями родов Desulfovibrio,
Archaeoglobus и многих других (см. разд. 12.3) или
в процессе ассимиляционной сульфатредукции
растениями и микроорганизмами (разд. 8.3). При
синтезе серусодержащих компонентов клеток (ци-
стеин, метионин, кофермент А, биотин, тиамин,
липоевая кислота) используется сера в восстанов-
ленной форме; минерализация биомассы приво-
дит к высвобождению серы также в восстановлен-
ной форме. 13 анаэробных условиях происходит
окисление H2S фототрофными бактериями (зеле-
ными и пурпурными) до молекулярной серы, ко-
торая откладывается внутри или снаружи клеток,
и далее до сульфата (разд. 31.1.5). Молекуляр-
ная сера может также восстанавливаться до H2S
бактериями, осуществляющими диссимиляцион-
ное восстановление серы (Desulfuromonas spp.,
Wolinella spp., Pyrodictium spp. и Th.crmoproteus
spp.). Аэробные серные бактерии (Thiobacillus
spp., Beggiatoa spp.) окисляют H2S до сульфата
с использованием О2 как акцептора электронов
(разд. 10.6); некоторые представители этой груп-
пы (Thiobacillus denitrificans, Thioploca spp.) мо-
гут сочетать окисление серы с восстановлением
нитрата. Аэробное окисление молекулярной серы
описано у нескольких штаммов Thiobacillus. По-
чти все отмеченные реакции, за исключением ас-
симиляционной сульфатредукции, осуществляют
исключительно прокариоты (рис. 32.3). Эукарио-
ты непосредственно не участвуют в этих превра-
щениях серы; для некоторых животных известен
симбиоз с аэробными сульфидокисляющими бак-
териями (см. разд. 31.1.7 и 31.5.4).
Основные реакции превращений серы в при-
роде (рис. 32.3) известны давно, по некоторые
их аспекты были раскрыты лишь в последнее
время. Так, установлено, что окисление серово-
Окислительно-
Рис. 32.3. Ключевые реакции в круговороте соединений
серы. Степень окисления серы указана слева. Реакции,
осуществляемые исключительно прокариотами, отмече-
ны звездочками.
314 Часть VIII. Прокариоты в биосфере
дорода в осадках ведет прежде всего к образова-
нию тиосульфата и следовых количеств сульфита,
а не сульфата; некоторые сульфатвосстанавлива-
ющие бактерии способны осуществлять реакцию
диспропорционирования тиосульфата и сульфита
с образованием сероводорода и сульфата.
Среди газообразных соединений серы, при-
сутствующих в атмосфере, довольно стабильным
компонентом, как выяснилось, является диметил-
сульфид, образующийся главным образом в мор-
ских местообитаниях при микробном расщепле-
нии осмолитика диметилсульфониопропионата с
образованием диметилсульфида и акрилата:
(СНз)28+СН2СН2СОО- ->
— (CH3)2S + СН2=СНСОСГ + Н+ (32.1)
Эта реакция может протекать как чисто хи-
мическая в щелочных условиях, например в
микробных матах при недостатке С02, или—-
значительно эффективнее — как осуществляемая
микроорганизмами при нейтральном значении
pH. Предположительно до 95% диметилсульфида
атмосферы образуется в результате расщепления
диметилсульфониопропионата. Недавно был от-
крыт еще один источник образования диметил-
сульфида: гомоацетогенные бактерии переносят
метильные группы из метилированных фено-
лов (например, компонентов лигнина) на серо-
водород; при этом образуются метилмеркаптан
и диметилсульфид. Геохимические последствия
этой ранее неизвестной микробной активности по-
ка неясны; она может играть роль в основном
в наземных местообитаниях. Диметилсульфид и
метилмеркаптан химически окисляются в атмо-
сфере гидроксил-радикалом до метилсульфоната
(CH3SO3). Аэробные и фототрофные бактерии
способны окислять диметилсульфид до диметил-
сульфоксида [(СНз)28=О], который вновь восста-
навливают многие бактерии-бродилыцики, а так-
же аэробные микроорганизмы (см. разд. 30.2.3).
Аэробные метилотрофы и анаэробные метаноге-
ны или гомоацетогенные бактерии способны деме-
тилировать диметилсульфид или метилмеркаптан
с образованием сероводорода. Окисленные формы
серы в атмосфере имеют большей частью поляр-
ную природу и вымываются из нее осадками.
Диметилсульфид образуется, как описано вы-
ше, преимущественно в морской среде. Метил-
сульфонат и сульфат действуют как ядра кон-
денсации для образования облаков. Карбонил-
сульфид и дисульфид углерода —это побочные
продукты биохимического и химического преоб-
разований цистеина, гомоцистеина и других орга-
нических соединений серы.
Вклад различных потоков соединений серы
между сушей, морем и атмосферой над этими дву-
мя средами показан на рис. 32.4. В общем цикле
Рис. 32.4. Общий цикл серы. Числа означают потоки серы (в Tr; 1 Тг = 1012 г = 10б т). Стрелки вверху означают
(слева направо): выделение серы в результате вулканической активности, жизнедеятельности наземной биоты и
хозяйственной деятельности человека; отложение серы в почве; попадание серы с суши в реки и озера; поступление
сульфата из морской воды с брызгами в атмосферу; высвобождение из морской воды в виде газообразных соеди-
нений (главным образом H2S и диметилсульфида); отложение серы в океане. Стрелки внизу — выветривание серы
из горных пород с переходом в наземную биоту и в реки, а также отложение серы в морских осадках, орг. S —
органические серусодержащие соединения.
Глава 32. Глобальные биогеохимические циклы 315
В общем цикле серы существенную роль играет
антропогенный фактор, а именно сжигание угля
и нефти, содержащих серу, а также термическое
окисление компонентов сульфидных руд (напри-
мер, FeS2, PbS, ZnS и HgS); эти процессы приво-
дят к выделению серы в атмосферу в виде SO2.
Более 50% общего выделения серы с поверхности
суши обусловлено деятельностью человека.
За исключением ассимиляционной сульфатре-
дукции, почти все этапы цикла серы зависят от
активности прокариот. В анаэробных условиях
происходит восстановление сульфата до серово-
дорода; окисление сероводорода осуществляют в
отсутствие кислорода фототрофные и нитратрс-
дуцирующие бактерии, в присутствии кислорода
— аэробные сульфидокисляющие бактерии, кото-
рые окисляют также молекулярную серу. Неко-
торые фототрофные бактерии образуют моле-
кулярную серу; она может подвергаться либо
восстановлению вновь до сероводорода, либо
окислению до сульфата. Летучие метилирован-
ные сульфиды (например, метилмеркаптан и
диметилсульфид) образуются в основном в ре-
зультате активности водорослей и прокариот и
взаимодействуют различным образом с климати-
ческими эффекторами.
32.4. Циклические превращения других элементов
Фосфор, еще один важный элемент в биоти-
ческих процессах, присутствует в живых орга-
низмах почти исключительно в степени окисле-
ния +5, в виде фосфата (разд. 7.3; 8.6 и 30.1.6).
Доступность его в природе лимитирована в ос-
новном низкой растворимостью фосфатов каль-
ция и магния и способностью фосфата эффектив-
но адсорбироваться на органических и неоргани-
ческих полимерах. В водных экосистемах фосфат
мобилизуется из неорганических полифосфатов и
из органических фосфатов (производные нуклеи-
новых кислот, нуклеотиды) под действием фосфа-
таз, которыми обладают прокариоты и водоросли.
В почве сходную активность осуществляют также
грибы.
Окислительно-восстановительные процессы,
в которых участвуют различные формы же-
леза и марганца, рассмотрены в гл. 30 (см.
разд. 30.1.7).
Дополнительная литература
ButcherS. S., Charlson R. J., OriansG.H., Wolfe G.V.,
eds. (1992). Global biogeochemical cycles. New York
London: Academic Press.
Conrad R. (1995). Soil microbial processes involved in
production and consumption of atmospheric trace
gases. In: Jones J. G. (ed.). Advances in microbial
ecology, vol. 14. New York: Plenum Press; 207-250.
Kelly D.P., Smith N. A. (1990). Organic sulfur com-
pounds in the environment: biogeochemistry, micro-
biology, and ecological aspects. In: Marshall К. C.,
(ed.). Advances in microbial ecology, vol. 11. New
York: Plenum Press; 345-385.
KingG.M. (1992). Ecological aspects of methane oxi-
dation, a key determinant of global methane dyna-
mics. In: Marshall К. C., (ed.). Advances in microbial
ecology, vol. 12. New York: Plenum Press; 431-468.
Taylor B. F. (1993). Bacterial transformations of organic
sulfur compounds in marine environments. In: Orern-
landR. S., (ed.). Biogeochemistry of global change.
London: Chapman & Hall; 745-781.
Часть IX
ПРИКЛАДНАЯ
МИКРОБИОЛОГИЯ
В предыдущих частях книги рассмотрены раз-
личные аспекты биологии прокариот — морфо-
логия, физиология, пути метаболизма, основы
генетики, регуляторные механизмы, рост и диф-
ференцировка клеток. Все это — интенсивно раз-
рабатываемые области исследований, в которых
достигнуты значительные успехи. Разнообразие
прокариот и их роль в биосфере изучены значи-
тельно слабее, но тем не менее сведения о био-
логии прокариот уже весьма обширны и благо-
даря развитию биотехнологии они используются
для решения некоторых проблем жизнеобеспече-
ния человека. Значение прокариот для медици-
ны, сельского хозяйства, промышленного произ-
водства и экологических процессов рассматрива-
ется в этой заключительной части книги.
Использование микроорганизмов человеком
началось в глубокой древности. Тысячи лет на-
зад люди научились приготавливать пиво, вино,
уксус, сыр и хлеб, нс зная ничего о микробах, и
лишь относительно недавно были открыты про-
цессы, лежащие в основе этих давно известных
пищевых производств. Например, к настоящему
времени подробно изучены процессы образования
бактериями уксусной и молочной кислот. В на-
стоящее время для получения продуктов броже-
ния применяют чистые культуры, чтобы обеспе-
чить контролируемое сбраживание определенных
веществ. Благодаря успехам, достигнутым в фи-
зиологии, биохимии и генетике микроорганизмов,
раскрыты метаболические сети и их регуляция, и
это существенно способствует развитию различ-
ных направлений применения прокариот —в про-
мышленности, сельском хозяйстве и охране окру-
жающей среды, а также совершенствованию ме-
дицинской диагностики и способов лечения вы-
зываемых микроорганизмами заболеваний. Пять
последующих глав книги посвящены обзору важ-
нейших достижений прикладной микробиологии
и перспектив ее развития в ближайшем будущем.
В гл. 33 рассматриваются вопросы меди-
цинской микробиологии, связанные с защитой
населения от инфекционных болезней. Кратко
описывается то, что известно о высокой из-
менчивости патогенных микроорганизмов, т. е.
возникновении новых вариантов возбудителей
инфекций, а также о взаимодействии между воз-
будителями и организмами-хозяевами (роль фак-
торов вирулентности, механизмов защиты хозяи-
на и противодействия им патогенных микробов).
Описаны новые молекулярные методы, применяе-
мые для изучения микробной патогенности, и рас-
смотрены вопросы диагностики, терапии и про-
филактики инфекционных заболеваний.
Роли прокариот в сельском хозяйстве посвяще-
на гл. 34. В ней прослеживаются сложные взаи-
мосвязи между микроорганизмами и растениями,
в соответствии с которыми микробы выступают
как симбионты либо как паразиты и возбудители
болезней. Изучение симбиозов и механизмов фи-
топатогепности пока находится в начальной ста-
дии, по некоторые бактерии уже используются на
практике, например флуоресцирующие псевдомо-
нады в качестве средств биологической защиты и
318 Часть IX. Прикладная микробиология
клубеньковые бактерии для стимуляции симбио-
тической фиксации азота у бобовых. Имеется и
другой опыт применения почвенных бактерий в
сельском хозяйстве. В этой главе описаны, кро-
ме того, подходы к идентификации и мониторин-
гу почвенных микроорганизмов, как природных,
так и искусственно внесенных, генетически моди-
фицированных штаммов.
В гл. 35 описываются современные дости-
жения в области промышленного применения
микробов и возможности оптимизации бактери-
альных штаммов методами скрининга и генной
инженерии для повышения их продуктивности и
эффективности использования субстратов. Обла-
дая разнообразными метаболическими возможно-
стями, не встречающимися у других организмов,
бактерии служат ценным источником получения
специфических веществ, например пищевых ком-
понентов и антибиотиков, а также ферментов,
имеющих важное применение в промышленности,
аналитических методах и терапии.
Помимо способности синтезировать ценные
химические соединения, важное значение для
хозяйственной деятельности человека имеет спо-
собность микробов разлагать разнообразные ор-
ганические субстраты, в том числе трудномине-
рализуемые. Глава 36 посвящена использованию
бактерий для влияния па природные процессы,
например с целью биологического восстановления
плодородия почв, очистки бытовых и промышлен-
ных стоков и обезвреживания газообразных вы-
бросов. Эта область применения микробов пред-
ставляет особый интерес, поскольку борьба с за-
грязнением окружающей среды приобретает все
большое значение в промышленно развитых стра-
нах. Свойства бактериальных ферментов, напри-
мер их способность связывать специфические со-
единения, используются при создании биосенсо-
ров. В этой глав уделено также внимание роли
прокариот в биологическом выщелачивании руд.
По мере развития методов генетической ин-
женерии в прикладной микробиологии происхо-
дят существенные изменения. Глава 37 посвя-
щена перспективам ее развития, в том числе
такому важному аспекту, как использование ре-
зультатов секвенирования геномов, открывающе-
го новые возможности для изучения биологиче-
ского потенциала прокариот и возможностей его
использования в сельском хозяйстве, химической
промышленности и охране окружающей среды, а
также его значения для медицины. Обсуждаются
перспективы применения современных методов, в
том числе молекулярных, для анализа экологи-
ческих процессов, биоразнообразия и структуры
популяций. Внедрение указанных подходов, как
ожидается, будет способствовать более глубоко-
му изучению природных микробных сообществ, о
которых известно пока лишь очень немногое, по-
скольку их разнообразие весьма велико, а возмож-
ности культивирования узко ограничены. В этой
последней главе затронут также вопрос о рис-
ке, связанном с использованием методов генети-
ческой инженерии для получения новых штам-
мов микроорганизмов с целью их применения
в сельскохозяйственных и промышленных техно-
логиях.
Глава 33
Медицинская микробиология
Эта глава посвящена важнейшему аспекту при-
кладной микробиологии — изучению микроорга-
низмов как возбудителей инфекционных заболе-
ваний. К микробам — возбудителям инфекцион-
ных болезней относятся патогенные вирусы и
бактерии, а также представители эукариот — гри-
бы; паразитические простейшие и гельминты вы-
зывают инвазионные болезни (табл. 33.1 и 33.2).
В данной главе рассматриваются главным об-
разом патогенные бактерии. Одна из основных
задач медицинской и ветеринарной микробиоло-
гии состоит в изучении взаимодействий между
патогенными микроорганизмами и их хозяева-
ми, включая выявление факторов вирулентности
и соответствующих генов. Новые методы моле-
кулярной биологии позволяют изучать регуля-
торные механизмы, контролирующие экспрессию
генов вирулентности. Помимо фундаментальных
исследований, эти методы находят применение в
диагностике, терапии и профилактике инфекций.
33.1. Значение и особенности инфекционных болезней
33.1.1. Инфекционные болезни как глобальная
проблема здравоохранения
Примерно 1,5-2 млрд, человек па земном шаре
страдают тяжелыми инфекционными болезнями.
В некоторых странах Африки, Азии, Централь-
ной Америки и Южной Америки они являются
наиболее частой причиной смерти (30-50%). Как
видно из табл. 33.1, примерно 1 млрд, человек
в год переносят кишечные заболевания, сопро-
вождающиеся диареей, половину случаев которых
вызывают бактерии (например, Escherichia coli и
Таблица 33.1. Инфекционные и инвазионные заболевания, наиболее распространенные в Африке, Азии и Южной
и Центральной Америке
Инфекционные/инвазионные заболевания Число случаев, млн 1 Возбудитель заболевания Тип организма
Желудочно-кишечные заболевания Другие тропические болезни Малярия Шистосомоз (бильгарциоз) Онхоциркоз («речная слепота») Болезнь Чагаса (южноамериканский трипаносомоз) Лейшманиоз Проказа 1000 в год 267 200 100 16-18 12 11 Vibrio cholerae Escherichia coli (кишечные штаммы) Entamoeba histolytica Plasmodium falciparum Schistosoma mansoni Onchocerca volvulus Trypanosoma cruzi Leishmania major Leishmania donovanii Mycobacterium leprae Бактерия Бактерия Простейшее Простейшее Гельминт Гельминт Простейшее Простейшее Простейшее Бактерия
1 По данным Всемирной организации здравоохранения (ВОЗ).
320 Часть IX. Прикладная микробиология
Vibrio cholerae) либо вирусы и столько же —
эукариоты, например простейшее Entamoeba
histolytica. Помимо того, не менее 500 млн. че-
ловек страдают тропическими болезнями, вы-
зываемыми паразитами, например таким, как
Plasmodium falciparum — возбудитель малярии.
Вплоть до конца 19 в. большая часть насе-
ления Европы и Северной Америки умирала от
инфекционных болезней, вызываемых «класси-
ческими» патогенными бактериями, таки-
ми как Vibrio cholerae, Salmonella enterica ce-
ровар Typhi (возбудитель брюшного тифа) и
Mycobacterium tuberculosis (возбудитель тубер-
кулеза) (табл. 33.2). Эти бактерии относятся к
облигатно патогенным, специализированным
видам, инфицирующим высшие организмы.
В развитых странах заболеваемость этими инфек-
ционными болезнями существенно снизилась бла-
годаря распространению гигиенических навыков,
внедрению вакцинации и средств химиотерапии.
В настоящее время лишь 2-4% населения Европы
и Северной Америки умирает от инфекционных
болезней. Наиболее часто в промышленно разви-
тых странах встречаются инфекции дыхательных
путей, вызываемые главным образом вирусами,
такими как вирус гриппа, и инфекции мочевыво-
дящих путей, вызываемые бактериями, например
уропатогепными штаммами Е. coli (табл. 33.2).
В последние десятилетия все большее ме-
дицинское значение приобретает группа мик-
роорганизмов, называемых факультативно
патогенными или оппортунистическими воз-
будителями инфекций. В противоположность
«классическим» патогенным организмам, оп-
портунистические возбудители относятся к нор-
мальной микрофлоре человека или присутству-
ют в окружающей среде. При определенных
обстоятельствах (ослабленная иммунореактив-
ность организма-хозяина, беременность, наруше-
ние состава нормальной микрофлоры) некоторые
штаммы оппортунистических возбудителей могут
вызывать тяжелые инфекции. К группе оппорту-
нистических возбудителе!! относятся в том чис-
ле штаммы бактерий Pseudomonas aeruginosa и
Staphylococcus epidermidis, а также гриб Candida
albicans, входящие в состав нормальной микро-
флоры организма, и обитающая во внешней среде
бактерия Legionella pneumophila. Факультативно
патогенные организмы часто вызывают инфек-
ции у лиц с иммунодефицитом, например обу-
Таблица 33.2. Инфекционные заболевания, наиболее распространенные в Европе и Северной Америке
Инфекционное заболевание Возбудитель Тип организма
Ранее 20 века
Холера Vibrio cholerae Бактерия
Брюшной тиф Salmonella enterica серовар Typhi Бактерия
Дифтерия Corynebacterium diphtheriae Бактерия
Туберкулез Mycobacterium tuberculosis Бактерия
Чума Yersinia pestis Бактерия
Натуральная оспа Вирус натуральной оспы Вирус
В 20 веке
Синдром приобретенного иммунодефицита (СПИД) Вирус иммунодефицита человека (ВИЧ) Вирус
Инфекции дыхательных путей Вирус гриппа Bordetella pertussis Вирус Бактерия
Инфекции мочевыводящих путей Escherichia coli (уропатогенные штаммы) Бактерия
Кишечные заболевания Salmonella enterica Escherichia coli (кишечные штаммы) Ротавирус Бактерия Бактерия Вирус
Внутрибольничные инфекции Staphylococcus aureus Staphylococcus epidermidis Pseudomonas aeruginosa Candida albicans Бактерия Бактерия Бактерия Дрожжи
Глава 33. Медицинская микробиология 321
словленным применением лекарственных средств,
таких как противораковые препараты или имму-
нодепрессанты (при пересадке органов), либо ин-
фекционными болезнями [например, ВИЧ (вирус
иммунодефицита человека)-инфекцией, вызыва-
ющей синдром приобретенного иммунодефицита,
СПИД]. При лечении в больнице лица с имму-
нодефицитом нередко подвергаются заражению
внутрибольничными инфекциями. В Герма-
нии ежегодно отмечается более 1 млн. случаев
внутрибольничных инфекций.
Инфекционные заболевания, особенно в разви-
вающихся странах, во многих случаях приводят к
гибели больных. В индустриально развитых стра-
нах все большее значение приобретают инфекции,
вызываемые факультативно патогенными микро-
организмами. Инфекции, распространяющиеся в
больницах, называют внутрибольничными.
33.1.2. В основе медицинской микробиологии
лежат постулаты Коха
Представления о микроорганизмах как возбуди-
телях инфекционных болезней сформировались
к концу 19 в. благодаря в первую очередь ра-
ботам Луи Пастера и Роберта Коха. На основе
изучения возбудителей сибирской язвы (Bacillus
anthracis) и туберкулеза Кох сформулировал сле-
дующие критерии (впоследствии названные по-
стулатами Коха) для отнесения того или иного
микроорганизма к возбудителям инфекций.
1. Присутствие данного микроорганизма
должно коррелировать с определенной бо-
лезнью.
2. Исследуемый микроорганизм должен быть
выделен в виде чистой культуры из матери-
ала, взятого от больного.
3. Выделенный микроорганизм должен вызы-
вать патологию, сходную с исследуемой бо-
лезнью, у экспериментальных животных и
должен быть выделен вновь из эксперимен-
тально инфицированного животного. По-
следний постулат не может быть выполнен
в случае патогенных микроорганизмов, спе-
цифичных только к одному хозяину.
Дополнение 33.1. Работы Коха заложи-
ли основы медицинской микробиологической
терминологии.
Симбиоз □ Взаимодействие между адап-
тированными друг к другу организмами раз-
ных видов, обычно специфичное, благоприят-
ное для каждого из них.
Комменсализм □ Взаимодействие меж-
ду организмами разных видов, при кото-
ром только один из партнеров получает пре-
имущество, не оказывая положительного или
отрицательного воздействия на другого парт-
нера.
Паразитизм □ Взаимодействие между
организмами разных видов, при котором
один организм (паразит) обитает на по-
верхности или внутри другого организма
(хозяина), нанося последнему вред.
Хозяин □ Организм, в котором обитает
паразитический вид.
Инфекция □ Рост внедрившихся бакте-
рий внутри организма-хозяина.
Облигатно/факультативно патоген-
ный организм □ Причиняющий вред (па-
разитический) организм, возбудитель инфек-
ции (и болезни).
Патогенность □ Способность организма
вызывать инфекционную болезнь.
Вирулентность □ Степень патогенности
микроорганизма.
Факторы вирулентности или патоген-
ности □ Свойства или вещества, обуслов-
ливающие патогенность (вирулентность) или
способствующие ей.
В противоположность симбиозу и комменса-
лизму как безвредным взаимоотношениям между
организмами разных видов, паразитизм означает
поражение организма-хозяина. Микробы класси-
фицируют в качестве паразитических, или па-
тогенных, только в связи с определенными хо-
зяевами. Некоторые из возбудителей, например
Salmonella enterica серовар Typhi, патогенны ис-
ключительно для человека, тогда как другие —
только для определенных животных, но не чело-
века. Термин патогенность как способность мик-
роорганизма вызывать заражение (инфекцию) ис-
пользуют для характеристики определенных ви-
дов микроорганизмов. Он указывает, что данный
322 Часть IX. Прикладная микробиология
вид способен вызывать инфекционную болезнь
у соответствующего хозяина. Термин вирулент-
ность, в отличие от этого, обозначает количе-
ственную категорию, и используется для указа-
ния степени патогенности штаммов. Так, бак-
терия Salmonella enterica серовар typhimurium
способна заражать мышей и описывается как па-
тогенная, но при этом ее летальная доза LD50, вы-
зыващая гибель 50% зараженных мышей, зависит
от штамма (например, у некоторых штаммов она
составляет 103 клеток, тогда как в случае других
штаммов —108 клеток).
Свойства или продукты патогенных микроор-
ганизмов, определяющие их патогенность и ви-
рулентность, называют факторами вирулент-
ности или патогенности. К таким факторам
относятся молекулы адгезии, необходимые для
прикрепления микроорганизмов к тканям хозя-
ина, токсины, способные повреждать клетки хо-
зяина, а также капсулы, липополисахариды или
специфические ферменты, обеспечивающие защи-
ту внедрившихся микроорганизмов от действия
иммунной системы хозяина. К патогенности име-
ет отношение в том числе и система поглощения
железа. Молекулярная природа факторов виру-
лентности бактерий подробно рассматривается в
разд. 33.3.
Для идентификации микроорганизма как ин-
фекционного агента необходимо, чтобы ре-
зультаты его изучения удовлетворяли критериям,
называемым постулатами Коха. В качестве пато-
генных микроорганизмы должны описываться в
отношении определенных хозяев.
капельным путем, часто вызывают инфекции
верхних и нижних дыхательных путей. Возбуди-
тели скарлатины (Streptococcus pyogenes) и диф-
терии (Corynebacterium diphtheriae), локализуясь
в верхних дыхательных путях, образуют токсины,
которые распространяются по организму и оказы-
вают воздействие в других его участках. Некото-
рые возбудители пневмонии, такие как Mycobac-
terium tuberculosis, способны размножаться внут-
ри альвеолярных макрофагов.
Микроорганизмы, поражающие кишечник, —
это типичные примеры возбудителей, которые
распространятся фекально-оральным путем, по-
падая в организм человека с загрязненной пи-
щей, водой и т. д. Большинство патогенных бакте-
рий кишечной группы, включая V. cholerae, виды
Shigella и Salmonella enterica, инфицирует исклю-
чительно желудочно-кишечный тракт. Бактерия
Helicobacter pylori специфически поражает желу-
док человека, вызывая образование язв. В то же
время возбудители инфекций мочевыводящих пу-
тей, в частности уропатогенные штаммы Е. coli,
могут происходить из собственной кишечной мик-
рофлоры больного, откуда они попадают в мо-
чевой пузырь или почки. К патогенным микро-
организмам, распространяющимся исключитель-
но через половые контакты, относятся Neisseria
gonorrhoeae и Treponema pallidum — возбудители
гонореи и сифилиса соответственно.
Bordetella pertussis
Mycobacterium tuberculosis
Фекально-оральный
Shigella spp.
Salmonella enterica
33.1.3. Патогенные бактерии инфицируют
различные участки тела хозяина
Инфекционные агенты могут распространять-
ся либо непосредственно передачей от одного
лица другому, либо через источники в окру-
жающей среде. Пути распространения патоген-
ных организмов представлены на рис. 33.1.
Участки внедрения и соответствующие возбу-
дители показаны на рис. 33.2. Микроорганиз-
мы, проникающие в организм человека воздушно-
Neisseria gonorrhoeae
Treponema pallidum
Укусы кровососущих
животных (например.
Воздух
Вода
Пища
Почва
Yersinia pestis
Borrelia burgdorferi
Legionella pneumophila
Aeromonas sobria
Salmonella enterica
Clostridium botulinum
Clostridium tetani
Рис. 33.1. Пути передачи патогенных микроорганизмов.
Справа указаны примеры патогенных бактерий.
Глава 33. Медицинская микробиология 323
Центральная нервная система
Neisseria meningitidis
Haemophilus influenzae
Желудочно-кишечный тракт
Helicobacter pylori
Vibrio cholerae
Salmonella enterica
Shigella spp.
Энтеропатогенные
штаммы Escherichia coli
Мочевыводящие пути
Уропатогенные штаммы
Escherichia coli
Pseudomonas aerug.nosa
Половые органы ----
Neisseria gonorrhoeae
Treponema pallidum (сифилис)
Кровь
Salmonella enterica (брюшной тиф)
Yersinia pestis (чума)
Дыхательные пути
__Streptococcus pyogenes (скарлатина)
Corynebacterium diphtheriae (дифтерия)
Bordetella pertussis (коклюш)
Pseudomonas aeruginosa
Легкие
Enterococcus (Streptococcus) pneumoniae
Mycobacterium tuberculosis (туберкулез)
Legionella pneumophila (болезнь легионеров)
— Кожа
Staph ylococcus aureus
Pseudomonas aeruginosa
Borrelia burgdorferi (лаймская болезнь)
Рис. 33.2. Инфекционные болезни, вызываемые важными в медицинском отношении патогенными бактериями и
поражаемые ими участки организма.
Один из путей заражения связан с укусами
членистоногих. Так, членистоногими распро-
страняются возбудители чумы (Yersinia pestis) и
лаймской болезни (Borrelia burgdorferi). Болез-
ни, для которых характерен такой источник ин-
фекции, называют зоонозами. Некоторые воз-
будители, переносимые членистоногими (напри-
мер, Y. pestis), способны размножаться в крови,
вызывая системную инфекцию. Другие бактерии
(например, Neisseria meningitidis и Haemophilus
influenzae) вызывают инфекции, поражающие
центральную нервную систему (ЦНС). Помимо
того, источником инфекции могут быть техниче-
ские приспособления, такие как кондиционеры
воздуха или системы искусственного орошения.
Возбудитель болезни легионеров Legionella pneu-
mophila присутствует в большинстве природных
водоемов, но только распространение его в аэрозо-
лях приводит к заражению. Анаэробные почвен-
ные бактерии, например Clostridium tetani, спо-
собны инфицировать раны. Некоторые бактерии,
такие как Staphylococcus aureus и Pseudomonas
aeruginosa, известны как инфицирующие различ-
ные участки тела, например кожу и дыхательные
пути.
Микроорганизмы способны заселять и ин-
фицировать различные участки тела человека.
Они распространяются разнообразными путями и
вызывают различные типы инфекционных болез-
ней.
33.1.4. Постоянно возникают новые варианты
патогенных бактерий
Среди огромного многообразия прокариот пато-
генными считаются примерно 200 видов. Боль-
шинство этих патогенных микроорганизмов из-
вестны давно, и их рассматривают в качестве
«старых», «традиционных» возбудителей. Однако
помимо того выявляются и «новые» инфекцион-
ные агенты, причем некоторые из них относят к
группе «вновь появившихся патогенных микроор-
ганизмов». За последние 20 лет приблизительно
30 видов были описаны как новые возбудители ин-
фекций.
Свойства некоторых «старых» патогенных
бактерий довольно постоянны, тогда как патоген-
ность многих новых вариантов связана с измене-
нием их важных характеристик. Гены факторов
вирулентности часто локализованы в плазмидах
или даже транспозонах. Другие гены вирулент-
ности, в частности те, которые кодируют токсины,
могут быть локализованы в бактериофагах или
в особых нестабильных областях бактериальных
хромосом, называемых островами патогенности.
Все эти гены могут передаваться бактериям дру-
гих видов или даже родов путем горизонтального
переноса. В результате приобретения новых генов
вирулентности могут возникать новые варианты
патогенных организмов.
Показательным примером «традиционного»
патогенного организма с новыми свойствами
324 Часть IX. Прикладная микробиология
может служить энтерогеморрагический вариант
Е. coli (ЕНЕС), вызывающий геморрагический
колит и гемолитический уремический синдром.
Штаммы ЕНЕС впервые были описаны в 1982 г.
Такие штаммы Е. coli несут Slt-конвертирующий
профаг (Sit — от Shiga-like toxin, шигоподобный
токсин) и плазмиду, содержащую гены другого
токсина (гемолизина ЕНЕС, e-hly) плюс ген фак-
тора адгезии (см. также разд. 33.3.1 и 33.3.3).
В хромосоме у этих штаммов локализованы осо-
бый остров патогенности, включающий ген дру-
гого адгезина, а также гены белков, участвующих
в инвазии (рис. 33.3; см. цв. вклейку). Наличием
и комбинацией указанных генов обусловлено по-
явление энтерогеморрагического варианта Е. coli
как нового возбудителя, неизвестного ранее.
Изменение свойств наблюдается и у других
«старых» возбудителей, способных вследствие
этого вызывать инфекционные болезни с более
высокой частотой, чем ранее (табл. 33.3). Приме-
рами могут служить штаммы S. aureus, образу-
ющие токсины синдрома токсического шока, изо-
ляты Salmonella enterica серовар Enteritidis фа-
готипа (РТ)4 и штаммы V. cholerae О-серотипа
(0139), которые приобрели новые гены rfb. Поми-
мо изменчивости возбудителей, важной медицин-
ской проблемой стало распространение устойчи-
вости микроорганизмов к лекарственным препа-
ратам. Все большее число штаммов, вызывающих
туберкулез и пневмонию (например, Enterococcus
pneumoniae), приобретает устойчивость к тем
или иным антибиотикам. Это обусловлено ли-
бо точковыми мутациями в генах-мишенях, ли-
бо переносом генов, продукты которых придают
устойчивость к определенным антибиотикам (см.
разд. 33.5.3).
Возникновение «новых» патогенных микроор-
ганизмов (табл. 33.4) связано с изменениями са-
нитарных стандартов, а также образа и условий
жизни населения земного шара. В то же вре-
мя выявление этих «новых» патогенных микро-
бов стало возможным благодаря совершенствова-
нию методов диагностики. Такие возбудители, как
Н. pylori, Chlamydia pneumoniae и В. burgdorferi,
открытые в последние 10-15 лет, относят к тем
возбудителям, которые существовали и ранее, но
не могли быть обнаружены. Кроме того, нараста-
ющее распространение ВИЧ-инфекции привело к
Таблица 33.3. Патогенные бактерии с «новыми» свойствами
Возбудитель инфекции Ген Кодируемое соединение (или свойство) Механизм приобретения Вызываемое заболевание
Энтерогеморрагический вариант Escherichia coli sit Шигоподобные токсины Перенос фага Энтерогеморрагический колит
(ЕНЕС)
e-My Гемолизин ЕНЕС Перенос плазмиды Синдром гемолитической уремии
Salmonella enterica серо- aer Аэробактин Перенос плазмиды Кишечная инфекция
вар Enteritidis фаго- тип 4
Vibrio cholerae 0139 rfb О-антиген 0139 Перенос хромосомных генов Холера
Staphylococcus aureus tss Токсины токсического шока Перенос фага Синдром токсического шока
mecA Устойчивость к мети- циллину Перенос хромосомных генов Внутрибольничные ин- фекции
Streptococcus pyogenes speA Суперантиген Перенос фага Синдромы, подобные токсическому шоку
Mycobacterium tuberculosis rpoB Устойчивость к рифам- пицину Точковые мутации в гене РНК-полиме- разы Туберкулез
Enterococcus pneumoniae pbp2b Белок, связывающий пе- нициллин; устойчи- вость к пенициллину Перенос хромосомных генов Пневмония
Глава 33. Медицинская микробиология 325
Таблица 33.4. Недавно открытые «новые патогенные
бактерии»
Патогенные бактерии Вызываемые заболевания
Legionella pneumophila Helicobacter pylori Chlamydia pneumoniae Borrelia burgdorferi Нетипичные микобак- терии Ehrlichia chaffeensis Bartonella henselae Болезнь легионеров (пневмо- ния) Гастрит, язва желудка Пневмония Лаймская болезнь Ассоциированные со СПИДом болезни дыха- тельных путей Эрлихиоз человека Болезнь кошачьих царапин, бациллярный ангиоматоз
появлению группы инфекций, ассоциированных
со
СПИДом. Инфекционные агенты, вызывающие
вторичные инфекции у ВИЧ-инфицированных
лиц, значительно реже выявляются как причина
заболеваний ВИЧ-отрицательных лиц.
Следует различать варианты патогенных орга-
низмов, возникающие из «старых» возбудителей в
результате приобретения новых свойств патоген-
ности, и «новые» возбудители — бактерии, пато-
генный потенциал которых усилился вследствие
изменений условий среды или был открыт лишь
в последнее время.
33.1.5. Для изучения патогенных бактерий
используются молекулярные методы
В последние годы клонированы и охарактери-
зоаны на молекулярном уровне гены многих
белков, связанных с патогенностью. Клониро-
ванные гены используются как зонды в мето-
дах гибридизации ДНК-ДНК или ДНК-РНК
при идентификации штаммов с неизвестным ге-
номом и/или для определения экспрессии и
контроля транскрипции генов вирулентности, на-
пример генов токсина у S. aureus или генов, участ-
вующих у Р. aeruginosa в образовании альги-
ната под контролем двухкомпонентной регуля-
торной системы в ответ на сигналы из внешней
среды (разд. 33.4.3). Для изучения на молекуляр-
ном уровне различных этапов развития инфек-
ции в клетках организма-хозяина с успехом при-
меняются методы ультраструктурного анали-
за и иммунологические подходы, например в
случае внутриклеточно локализующихся возбуди-
телей шигеллеза (Shigella flexneri) и листериоза
(Listeria monocytogenes).
Изучение патогенных организмов стало сти-
мулом для новых исследований в других облас-
тях биологии. Так, токсины применяются как
инструмент для анализа феноменов клеточной
биологии. Например, установлено, что на по-
лимеризацию актина влияют токсины бактерии
Clostridium difficile, вызывающей кишечную ин-
фекцию, а также то, что адгезины, такие как
М-белки Streptococcus pyogenes, взаимодейству-
ют с белками внеклеточного матрикса. Подроб-
но изучено связывание бактериальных адгезинов
(например, G-адгезина Р-фимбрий Е. coli) или
токсинов (например, В-субъединицы холерного
токсина) с рецепторами углеводов на поверхно-
сти эукариотических клеток. Анализ путей сек-
реции белков, таких как путь III типа у энтеро-
патогенных бактерий Salmonella enterica, Shigella
flexneri и Yersinia enterocolitica, а также путь
а-гемолизина в случае уропатогенного варианта
Е. со И, представляет интерес для выяснения мо-
лекулярно-биологических механизмов. При изу-
чении структурно-функциональных взаимосвязей
между молекулами используются трехмерные мо-
дели токсинов или адгезинов и аналоги их ре-
цепторов. Кроме того, изучается координирован-
ная регуляция генетических сетей, в том числе
генов, связанных с вирулентностью (например, у
V. cholerae и Bordetella pertussis). В настоящее
время с участием многих лабораторий исследует-
ся экспрессия таких генов in vivo. Разработанный
недавно метод маркерного транспозонного мута-
генеза (см. разд. 33.6) послужит, вероятно, важ-
ным подходом к идентификации тех генов Salmo-
nella typhimurium и других патогенных микробов,
которые экспрессируются только после взаимо-
действия этих бактерий с клетками хозяина.
Для изучения различных сторон патогеннос-
ти микробов применяются молекулярно-генети-
ческие методы. Выявляемые факторы патоген-
ности используются как инструмент в исследова-
ниях клеточных механизмов.
326 Часть IX. Прикладная микробиология
33.2. Защитные механизмы хозяина
33.2.1. Проникновению патогенных микробов
в организм-хозяин препятствуют
неспецифические механизмы
Способность микробов инфицировать организм-
хозяин зависит от чувствительности/устой-
чивости хозяина. Патогенные микробы должны
конкурировать с его нормальной микрофлорой,
которая препятствует их росту. Чувствительность
хозяина зависит в том числе от рациона пита-
ния, возраста и воздействия стрессовых факто-
ров. Неспецифическую защитную роль выполня-
ют физические барьеры, такие как реснички
на клетках эпителия слизистых оболочек. Кро-
ме того, инфицирующий агент должен преодолеть
неспецифические химические барьеры, к ко-
торым относятся низкий pH кожи и некоторых
ворот инфекции (таких как влагалище или желу-
док), вызывающий гибель большого числа пато-
генных микроорганизмов, и химические соедине-
ния— компоненты жидкостей организма (напри-
мер, лизоцим, гидролизующий муреиновый слой
микробных клеточных стенок). В кишечнике рост
бактерий ограничивается присутствием желчных
солей, анаэробными условиями и воздействием
протеаз, а также других катаболических фермен-
тов.
В слизистых оболочках, выстилающих ды-
хательные пути, пищеварительный тракт и мо-
чевыводящие пути, присутствуют клетки многих
типов, способные взаимодействовать с проника-
ющими микробами. Слизь, покрывающая сли-
зистые оболочки, содержит гликопротеины, свя-
зывающие и элиминирующие микроорганизмы.
Помимо выделяющих слизь эпителиальных кле-
ток, в слизистой оболочке присутствуют М-клет-
ки, поверхность которых, обращенная в про-
свет полости, образует микроскладки, а про-
тивоположная поверхность — карманы. М-клстки
переносят проникающие микробы к находящим-
ся в таких карманах макрофагам. Эти макрофа-
ги представляют собой антигенпрезентирующие
клетки (АПК), экспонирующие микробные анти-
гены на своей поверхности. Презентация анти-
генов на АПК иццуцирует специфический Т- и
В-клеточный ответ, приводящий к образованию
секреторных иммуноглобулинов A-класса (slgA)
(разд. 3.2.2). Структура слизистой оболочки пред-
ставлена на рис. 33.4 (см. цв. вклейку).
Первый активный защитный барьер хозяина
составляют различные типы клеток и гумораль-
ных факторов иммунной системы, которые «напа-
дают» на проникающие микроорганизмы. Неспе-
цифичные клеточные компоненты иммунной
системы представлены профессиональными
фагоцитами. Эти клетки поглощают и лизи-
руют патогенные микробы, очищая организм от
инородных объектов. Фагоцитарные клетки диф-
ференцируются из стволовых клеток костного
мозга и делятся на три типа: полиморфно-
ядерные гранулоциты, из которых наиболее
многочисленны нейтрофилы (ПМН), моноци-
ты и тканевые макрофаги (рис. 33.5, А; см. цв.
вклейку).
Фагоцитарные клетки осуществляют фаго-
цитоз— связывание микробов на своей поверх-
ности и их поглощение. Внутри фагоцитов на
микробные клетки воздействуют бактерицидные
механизмы (рис. 33.5, Б). В поглощении мик-
робных клеток участвуют рецепторы поверхно-
сти фагоцитарной клетки, которые опосредуют
также взаимодействие различных компонентов
иммунной системы хозяина. Так, Fc-рецепторы
связывают комплексы бактерии—антитела. Ре-
цепторы к компоненту комплемента СЗЬ способ-
ны связывать бактерии, к поверхности которых
прикрепились молекулы СЗЬ (см. ниже). Этот
процесс связывания с микробами посредством
опсонинов (например, антител и белка ком-
племента СЗЬ), стимулирующий фагоцитоз, на-
зывают опсонизацией. Фагоцитированные мик-
робные клетки оказываются внутри особой
вакуоли — фагосомы. Фагосома сливается с ли-
зосомами, образуя фаголизосому, в которой
микроорганизмы подвергаются воздействию бак-
терицидных механизмов, зависимых и не зави-
симых от кислорода. Так, в фагосоме образу-
ются токсичные формы кислорода — супсроксид-
анион (0^*), пероксид водорода (Н2О2), син-
глетный кислород (г0г) и гидроксил-радикал
(НО*), которые наряду с другими антимик-
робными соединениями и оксидами азота (на-
пример, NO2, NO3) вызывают гибель мик-
робных клеток. Патогенные бактерии, размно-
жающиеся внутриклеточно, способны избегать
действия этих бактерицидных механизмов (см.
разд. 33.3.2).
Глава 33. Медицинская микробиология 327
Внедрению патогенных микроорганизмов
в организм-хозяин препятствуют неспецифиче-
ские физические и химические барьеры. Проник-
шие в организм микробные клетки поглощаются
фагоцитами в процессе фагоцитоза и подверга-
ются лизису. Фагоцитозу способствует опсониза-
ция — связывание с поверхностью микробных кле-
ток антител и компонентов комплемента.
Система комплемента относится к неспеци-
фическим механизмам гуморального имму-
нитета. Она включает 26 сывороточных белков,
большинство из которых имеет обозначение С1,
С2, СЗ и т. д. Они действуют по каскадному меха-
низму, т. е. активация одного компонента вызыва-
ет активацию другого (рис. 33.6). Имеется два пу-
ти активации комплемента — классический
и альтернативный. Активация системы компле-
мента обеспечивает разнообразные эффекты им-
мунной системы.
1. Продукты расщепления компонентов СЗ и
С5 — СЗа и С5а — привлекают в очаг ин-
фекции лейкоциты.
2. Компонент СЗЬ действует как опсонин,
стимулируя фагоцитоз.
Рис. 33.6. Система комплемента. Белки системы ком-
племента активируются либо по альтернативному пу-
ти, т. е. непосредственно микробными продуктами,
такими как липополисахарид (ЛПС), липотейхоевая кис-
лота (ЛТК) и полианионы, либо по классическому
пути — комплексами антиген-антитела (Аг—Ат). Белки
комплемента (Cl, С2, СЗЬ, С5, C5f, С9) активируются
по каскадному механизму и могут вызывать лизис кле-
ток патогенных бактерий.
3. Терминальный комплекс С5—С9 дей-
ствует как мембраноатакующий ком-
плекс, образуя в бактериальной мембране
поры и тем самым вызывая свободную диф-
фузию растворенных веществ внутрь и на-
ружу. Устойчивые к компонентам сыворот-
ки возбудители способны выживать в при-
сутствии комплемента (см. разд. 33.3.8).
Комплемент — это комплекс белков сыворот-
ки, активируемых микробными клетками. Акти-
вация комплемента вызывает различные эффек-
ты иммунной системы, приводящие к поврежде-
нию мембран бактериальных клеток, их лизису и
элиминации возбудителя.
33.2.2. В иммунном ответе участвуют
В- и Т-лимфоциты
Высшие организмы, в том числе человек, обла-
дают способностью к специфической реакции на
чужеродные молекулы и клетки, называемой им-
мунным ответом. В иммунном ответе участ-
вуют В- и Т- лимфоциты — клетки иммунной
системы, предшественниками которых служат
стволовые клетки костного мозга. В-клетки при
активации антигеном превращаются в плазмати-
ческие клетки, продуцирующие антитела — бел-
ки сыворотки, представляющие собой гумораль-
ный фактор иммунитета и обладающие
специфичностью к антигенам. При диф-
ференцировке В-лимфоцитов в плазматические
клетки некоторые В-лимфоциты, не достигая ее
конечного этапа, остаются в организме как клетки
иммунологической памяти. При повторной сти-
муляции тем же антигеном они возобновляют
дифференцировку, превращаясь в плазматиче-
ские клетки, т. е. реагируют на антигены быстрее,
чем впервые стимулированные В-клетки.
Секретируемые В-лимфоцитами антитела, или
иммуноглобулины, 1g, подразделяются на пять
основных классов: IgG, IgM, IgA, IgE и IgD.
Антитела класса IgG представлены в сыворот-
ке в наибольшем количестве и являются прото-
типом всех 1g. Молекулы IgG состоят из четы-
рех полипептидов: двух тяжелых цепей, содер-
жащих по 450 аминокислотных остатков, и двух
легких цепей, состоящих из 212 аминокислот-
ных остатков (рис. 33.7). Участки молекул ан-
тител, специфичные к антигену, локализованы в
328 Часть IX. Прикладная микробиология
Рис. 33.7. Строение молекулы иммуноглобулина G (IgG).
Показаны фрагменты Fab и Fc, образующиеся при рас-
щеплении 1g папаином. S—S — дисульфидный мостик.
их вариабельных областях, входящих в состав
Fab-фрагмента 1g. Константные области мо-
лекул 1g весьма сходны у антител различной спе-
цифичности; константные области тяжелых цепей
подразделяются еще на три области, и две из них
образуют Fc-фрагмент 1g.
Дополнение 33.2. Иммунологические тер-
мины, используемые при описании иммунно-
го ответа.
Антиген □ Молекулы, взаимодействую-
щие со специфическими антителами и Т-кле-
точными рецепторами. Антигенами могут
служить компоненты клеток патогенных
микробов, такие как белки, липопротеины
или полисахариды.
Антигенная детерминанта (эпитоп) □
Участок молекулы антигена, взаимодейству-
ющий со специфическими антителами и
Т-клеточным рецептором. Обычно состоит
из 5-10 аминокислотных или 4-5 углеводных
остатков.
Антитела (иммуноглобулины) □ Бел-
ки, секретируемые активированными В-клет-
ками и специфически связывающие данный
антиген (см. рис. 33.7).
Антисыворотка □ Сыворотка крови, со-
держащая антитела. При наличии в сыворот-
ке антител различной специфичности ее на-
зывают поликлональной антисывороткой.
Моноклональные антитела (мАт) □
Антитела одной специфичности, продуциру-
емые иммортализованной (бессмертной) ги-
бридной клеточной линией (гибридомой);
служат важным средством для изучения
и диагностики микробных инфекций (см.
разд. 33.5.1).
Молекулы IgM — это крупные структуры, со-
стоящие из пяти единиц IgG-типа. Молекулы IgA
образуют в жидкостях тела димеры. Секреторные
IgA важны для удаления внеклеточных возбуди-
телей, заселяющих слизистые оболочки, напри-
мер желудочно-кишечного тракта. Молекулы IgE
участвуют в аллергических реакциях. Антитела
класса IgD, подобно IgM, присутствуют на по-
верхности В-клеток, где функционируют как ре-
цепторы антигенов. Взаимодействие антигенов с
иммуноглобулинами на В-клеточной поверхности
необходимо для стимуляции В-клеток и образова-
ния ими антител. Антитела играют важную роль
в устранении внеклеточных возбудителей. Кроме
того, нейтрализующие антитела способны инак-
тивировать токсины (например, токсин дифтерии
и коклюшный токсин) и некоторые вирусы.
При В-клеточном иммунном ответе В-лимфо-
циты, активированные антигеном, секретируют
антитела (иммуноглобулины, 1g). Среди пяти
классов 1g в наибольшем количестве в сыворотке
крови присутствуют IgG.
Т-лимфоциты выполняют основную роль в
специфическом клеточном иммунном от-
вете. Существует две основные субпопуляции
Глава 33. Медицинская микробиология 329
Т-клеток — цитотоксические Т-клетки (Тц),
способные уничтожать инфицированные или
трансформированные клетки хозяина, и хелпер-
ные Т-клетки (Тх), секретирующие цитоки-
ны (см. разд. 33.3.3). Цитокины стимулируют
другие клетки иммунной системы, такие как
Тц-клетки, В-клетки и макрофаги. Т-клетки раз-
личных субпопуляций несут на своей поверхности
специфические CD-маркеры (маркеры диф-
ференцировки) — CD3, CD4 и CD8. Маркеры CD3
присутствуют на всех Т-клетках, тогда как CD4-
и СЭ8-маркеры специфичны для Тх- и Тц-кле-
ток соответственно (рис. 33.8; см. цв. вклейку).
Т-клетки способны распознавать специфические
микробные антигены в ассоциации с молекулами
МНС —главного комплекса гистосовмести-
мости (см. ниже). Подобно В-клеткам, Т-клетки
несут на поверхности специфические рецепторы к
антигенам, называемые Т-клеточными рецеп-
торами (ТкР). По структуре ТкР сходны с им-
муноглобулинами; они представляют собой гете-
родимерные молекулы, в которых два полипепти-
да соединены дисульфидными связями.
Т-клеточный рецептор не способен распозна-
вать антигены как свободные молекулы, но рас-
познает их в комплексе с молекулами МНС на
поверхности антигенпрезентирующих клеток
(АПК) хозяина, например макрофагов. Молеку-
лы МНС присутствуют на поверхности эукарио-
тических клеток всех типов и специфичны для
определенных видов, штаммов и особей. Каждый
эукариотический организм обладает молекулами
МНС двух классов — I и II. Молекулы МНС клас-
са I локализованы на поверхности всех клеток,
имеющих ядра, класса II — только на клетках им-
мунной системы, включая макрофаги.
Молекулы МНС связывают антиген после его
внутриклеточного процессинга. Обычно хелпер-
ные Т-клетки активируются антигенами, презен-
тированными в комплексе с молекулами МНС
класса II, тогда как цитотоксические Т-лимфо-
циты — антигенами, ассоциированными с молеку-
лами МНС класса I. Так называемые суперанти-
гены, в противоположность обычным антигенам,
способны параллельно связываться с вариабель-
ной областью Т-клеточного рецептора и с молеку-
лой МНС класса II, инициируя в результате неспе-
цифическую активацию Тх-клеток. В качестве
суперантигенов могут выступать некоторые ток-
сины, такие как энтеротоксины Staphylococcus
aureus и эритрогенные токсины Streptococcus pyo-
genes. В форме Т-клеточного ответа развива-
ется иммунная реакция на вирусы и внутри-
клеточно размножающиеся бактерии, например
Mycobacterium tuberculosis и Listeria monocyto-
genes.
Т-лимфоциты выполняют важную роль в
клеточном иммунном ответе, особенно против ви-
русов и внутриклеточно размножающихся бакте-
рий. Цитотоксические Т-клетки уничтожают ин-
фицированные клетки, тогда как Т-хелперные
клетки обеспечивают активацию других клеток
иммунной системы. Т-клетки активируются ан-
тигенами, презентированными на макрофагах в
комплексе с молекулами главного комплекса ги-
стосовместимости (МНС).
33.2.3. Различные компоненты иммунной
системы хозяина взаимодействуют
между собой
Компоненты иммунной системы хозяина действу-
ют не независимо, но, напротив, в тесной взаи-
мосвязи. В их кооперации большую роль играют
цитокины — гормоноподобные гликопротеины,
секретируемые лейкоцитами и иногда другими
эукариотическими клетками и участвующие в
стимуляции, дифференцировке и пролиферации
клеток иммунной системы. Цитокины, продуци-
руемые лимфоцитами, называют также лимфоки-
нами; те цитокины, которые участвуют в переда-
че сигналов между клетками иммунной системы,
названы интерлейкинами (ИЛ).
К настоящему времени описано не менее
15 интерлейкинов и несколько других типов ци-
токинов.1 Некоторые важные цитокины указаны
в табл. 33.5. Эти цитокины синтезируются пре-
имущественно Т-клетками, моноцитами и макро-
фагами. Сеть клеток и молекул, регулируемая ци-
токинами, представлена на рис. 33.9.
Различные компоненты иммунной системы ор-
ганизма-хозяина при иммунном ответе на инфи-
цирующий микроорганизм действуют координи-
рованно благодаря участию цитокинов, выполня-
ющих важную роль сигнальных молекул.
1 Ко времени выпуска перевода данной книги число обнаруженных интерлейкинов возросло до 29. См. «Русско-
английский толковый словарь по иммунологии». М.: Мир, 2005. — Прим. вед. ред.
330 Часть IX. Прикладная микробиология
Таблица 33.5. Молекулы цитокиновой сети
Название Продуцирующие клетки Функция
Интерлейкин (ИЛ)-1 Интерлейкин (ИЛ)-2 Интерлейкин (ИЛ)-4 Интерлейкин (ИЛ)-6 а-Интерферон (ИФа) 7-Интерферон (ИФ7) Фактор некроза опухолей (ФНО)-а (кахек- тин) Фактор некроза опухолей (ФНО)-^З (лимфо- токсин) Гранулоцитарно-макрофагальный колоние- стимулирующий фактор (ГМ-КСФ) Гранулоцитарный колониестимулирующий фактор (Г-КСФ) Макрофагальный колониестимулирующий фактор (М-КСФ) Макрофаги Т-клетки Т-клетки Различные клетки Макрофаги, полиморфно- ядерные лейкоциты Т-клетки Макрофаги Моноциты Т-клетки Т-клетки Макрофаги Макрофаги Активация В-клеток и Т-клеток Активация Т-клеток и В-клеток Активация В-клеток, Т-клеток и макрофагов Дифференцировка В-клеток Антивирусное действие Активация макрофагов Уничтожение клеток; активация гранулоцитов Уничтожение клеток Стимуляция роста гранулоцитов и макрофагов Стимуляция роста гранулоцитов Стимуляция роста макрофагов
Рис. 33.9. Взаимодействия между различными компо-
нентами иммунной системы хозяина. Показаны основ-
ные типы клеток (фагоциты, Т-клетки, В-клетки) и
гуморальные факторы (белки комплемента, цитокины)
иммунной системы и их взаимодействия. АПК — анти-
генпрезентирующая клетка; ИЛ — интерлейкин; ИФ7 —
7-интерферон; ФИО — фактор некроза опухолей.
33.3. Бактериальные факторы вирулентности
Патогенные микробы способны продуцировать
факторы вирулентности (патогенности), способ-
ствующие колонизации ими оргапизма-хозяина,
повреждению и разрушению его клеток. Кроме
того, эти соединения помогают инфицирующему
агенту «обходить» защитные механизмы хозяи-
на. В следующих разделах описываются структу-
ра факторов вирулентности и их взаимодействие
с клетками хозяина. Особое внимание уделено ор-
ганизации генов, имеющих отношение к вирулент-
ности, и структуре их продуктов.
33.3.1. Адгезины способствуют колонизации
бактериями тканей хозяина
Молекулы адгезии обеспечивают прикрепление
микробных клеток к эукариотическим клеткам,
Глава 33. Медицинская микробиология 331
необходимое для внедрения патогенных бактерий
в ткани хозяина (см. также разд. 28.8). Инфици-
рование бактериями часто начинается с неспе-
цифической агрегации их клеток на основе
гидрофобного взаимодействия между структура-
ми бактерий и клеток хозяина. В отличие от это-
го адгезия имеет характер высокоспецифическо-
го связывания. Некоторые бактериальные адге-
зины специфичны не только к хозяину, но и к
ткани, и обеспечивают направление инфицируе-
мого агента в определенный участок организма
хозяина. Клетки уронатогенного варианта Е. coli
специфически связываются с клетками мочеполо-
вых путей, I. cholerae — с клетками желудочно-
кишечного тракта.
Большинство бактериальных адгезинов — это
белки, распознающие углеводные структуры-
рецепторы на эукариотических клетках, на-
пример эпителиальных клетках, фагоцитарных
клетках или эритроцитах (рис. 33.10; см. цв.
вклейку). Кроме того, бактериальные адгезины
способны связываться с гликопротеинами вне-
клеточного матрикса, такими как фибролак-
тин, ламинин или интегрины. Простым способом
выявления у бактериальных штаммов способно-
сти к прикреплению служит тест на гемагглю-
тинацию. Факторы прикрепления бактерий мо-
гут быть подразделены на адгезины фимбрий
и нефимбриальные адгезины. Адгезины фим-
брий образуют тонкую и гибкую нить на конце
фимбрий, состоящих из основных субъединиц и
минорных субъединиц (см. рис. 2.20, 33.10 и 33.11,
а также разд. 23.8).
По имеющимся генетическим и биохимиче-
ским данным, у некоторых микроорганизмов бе-
лок, связывающийся с углеводами, — это белок
основной субъединицы фимбрий (адгезии как
основная субъединица). Например, такие дан-
ные имеются для энтеротоксигенного варианта
Е. coli (штаммы К88 и К99; см. табл. 33.6).
В других случаях фимбрии, например типов I,
Р и S у кишечной формы Е. coli, связывают-
ся с углеводами посредством минорных субъеди-
ниц (адгезины как минорные субъединицы).
Нефимбриальные адгезины известны у разнооб-
разных микроорганизмов. Функцию адгезива спо-
собна выполнять липотсйхосвая кислота в составе
клеточной оболочки Streptococcus pyogenes. Кроме
того, адгезивными свойствами обладают экзоли-
пополисахариды различных организмов, напри-
мер Staphylococcus epidermidis и Р. aeruginosa.
Рис. 33.11. Электронная микрофотография клетки па-
тогенного штамма Escherichia coli с фимбриями.
Бактериальные адгезины способны распозна-
вать рецепторные молекулы (например, углевод-
ные компоненты гликопротеинов) па клетках хо-
зяина. Связываться с углеводами могут основные
или минорные субъединицы фимбрий. Адгезив-
ными свойствами обладают также нефимбриаль-
ные адгезины, такие как липотейхоевая кислота и
экзолипополисахариды.
Подробно изучены кластеры генов фимбри-
альных адгезинов у патогенных вариантов Е. coli
и гены, кодирующие фимбрии IV типа у раз-
личных других организмов, в том числе Neis-
seria gonorrhoeae, V. cholerae и Р. aeruginosa
(табл. 33.6). В случае Е. coli гены адгезинов фим-
брий входят в состав крупных оперонов, содержа-
щих примерно 10 т.п.н. Такой оперон состоит из
структурных генов, кодирующих основную и ми-
норные субъединицы фимбрий, а также генов бел-
332 Часть IX. Прикладная микробиология
Таблица 33.6. Адгезины патогенных бактерий
Тип адгезина Сокращенное название Бактерия Клеточная структура
Тип I Fim Escherichia coli, другие энтеро- бактерии Фимбрии
Р-фимбрии Pap Внекншечные штаммы Е. coli Фимбрии
S-фимбрии Sfa Внекишечные штаммы Е. coli Фимбрии
К88 Fae Кишечные штаммы Е. coli Фимбрии
К99 Fan Кишечные штаммы Е. coli Фимбрии
Тип III Mrk Klebsiella pneumoniae Фимбрии
Тип IV Pil Neisseria gonorrhoeae Фимбрии
Tcp Vibrio cholerae Фимбрии
Pil Pseudomonas aeruginosa Фимбрии
М-белок Emm Streptococcus pyogenes Тонкие фибриллы
Нитевидный гемагглютинин Fha Bordetella pertussis Нефимбриальный адгезии
Липотейхоевая кислота LTA Streptococcus pyogenes Клеточная оболочка
ков, участвующих в транспорте этих субъединиц
через периплазматическое пространство и наруж-
ную мембрану (см. также разд. 19.4 и 23.8).
Фимбрии IV типа, образуемые разнообразны-
ми грамотрицательными бактериями, сходны по
строению с фимбриями, образуемыми патогенны-
ми штаммами Е. coli. Однако в случае фимбрий
IV типа гены адгезинов часто не сгруппирова-
ны в кластеры, а распределены по хромосоме.
Адгезины фимбрий подвержены фазовой вариа-
ции и антигенной изменчивости, т. е. один бак-
териальный штамм способен переключаться с
синтеза одного адгезина на синтез другого ад-
гезина или продуцировать адгезины с различны-
ми антигенными свойствами. Молекулярные ме-
ханизмы, регулирующие экспрессию адгезинов,
рассматриваются в разд. 33.4.1 и 33.4.2. Один
из наиболее изученных нефимбриальных адгези-
нов — М-белок Streptococcus pyogenes — способен
связываться с различными рецепторными струк-
турами, например с фибронектином. Кроме то-
го, он может взаимодействовать с фактором Н —
ингибитором активации комплемента, что
обеспечивает устойчивость бактерий к сыворо-
точным факторам (см. разд. 33.3.8). М-белки об-
наруживают изменчивость по длине полипептид-
ной цепи. К настоящему времени описано более
60 различных М-белков стрептококков.
Адгезины фимбрий кодируются крупными
кластерами генов, экспрессия которых является
вариабельным признаком.
33.3.2. Внедрение патогенных бактерий
происходит с участием инвазинов
Многие патогенные микробы не размножаются
вне клеток хозяина, но внедряются внутрь его
клеток, где способны выживать и даже размно-
жаться. Процесс, инициируемый такими возбуди-
телями и приводящий к их поглощению и обита-
нию внутри клеток хозяина, называют инвазией,
и факторы вирулентности, участвующие в про-
никновении, — инвазинами.
Ряд патогенных бактерий способен размно-
жаться как вне, так и внутри клеток организма-
хозяина. Бактерии, предпочтительно размно-
жающиеся внутри клеток эукариот, называют
факультативно внутриклеточными возбу-
дителями (табл. 33.7 и рис. 33.12). Некото-
рые из них (в том числе Shigella flexneri) внед-
ряются в непрофессиональные фагоцитар-
ные клетки, например эпителия, тогда как
другие (в частности, Mycobacterium tuberculosis и
Legionella pneumophila) — в профессиональные
фагоциты, например макрофаги. Возбудители,
полностью приспособленные к внутриклеточной
локализации, называют облигатно внутрикле-
точными; к ним относятся, например, Chlamydia
trachomatis и виды Rickettsia.
Факультативно внутриклеточные возбу-
дители инфекций способны выживать и размно-
жаться и вне, и внутри клеток хозяина, тогда
как облигатно внутриклеточные возбудите-
ли размножаются только внутри клеток.
Глава 33. Медицинская микробиология 333
Таблица 33.7. Внутриклеточно размножающиеся пато-
генные бактерии
Патогенные бактерии Вызываемое заболевание
Факультативно внутри- клеточные Salmonella typhimurium Yersinia enterocolitica Энтеропатогенные штаммы Escherichia coli Shigella spp. Salmonella enterica серовар Typhi Listeria monocytogenes Mycobacterium tuberculosis Legionella pneumophila Yersinia pestis Облигатно внутриклеточ- ные Rickettsia rickettsii Rickettsia prowazekii Coxiella burnetii Chlamydia trachomatis Mycobacterium leprae Гастроэнтерит Кишечная инфекция Гастроэнтерит Шигеллез Брюшной тиф Листериоз Туберкулез Болезнь легионеров Бубонная чума Пятнистая лихорадка Скалистых гор Вшиный сыпной тиф Лихорадка Q Трахома Проказа
Дополнение 33.3. Инвазия бактериаль-
ных клеток в клетки хозяина включает сле-
дующие этапы (рис. 33.13; см. цв. вклейку).
1. Прикрепление к клетке хозяина.
Прикрепление к клеткам хозяина, опи-
санное в разд. 33.3.1, служит условием
внедрения, однако оно не обязательно
ведет к проникновению патогенного мик-
роба внутрь клетки. Многие внутрикле-
точно размножающиеся возбудители спо-
собны связываться с рецепторами клеток
хозяина, участвующими в передаче, сиг-
налов, такими как интегрины (предста-
вители обширного семейства трансмем-
бранных молекул адгезии, экспрессируе-
мых разнообразными эукариотическими
клетками). В норме интегрины участву-
ют в межклеточных взаимодействиях,
связываясь с белками внеклеточного
матрикса, например фибронектином или
ламинином. В случае фибронектинов
связывание происходит посредством име-
Рис. 33.12. Электронная микрофотография клетки гра-
мотрицательной бактерии до (А) и после (Б, В) внедре-
ния в клетку эпителия. Я — ядро эпителиальной клетки;
Ц — цитоплазма эпителиальной клетки. Шкала 0,5 мкм.
ющейся в их молекулах аминокислотной
последовательности Arg-Gly-Asp. Такой
RGD-мотив имеется также в молекуле ни-
тевидного гемагглютинина (Fha) клеток
Bordetella pertussis, который участвует в
их связывании и поглощении, и в молеку-
ле адгезивного белка Enterococcus faecalis.
Другие патогенные бактерии используют
для адгезии «молекулы-мостики», такие
как белок комплемента СЗЬ (Legionella
pneumophila, Mycobacterium tuberculosis)
или фибронектин (Treponema pallidum),
334 Часть IX. Прикладная микробиология
которые одновременно связываются с ад-
гезивами возбудителя и интегринами на
поверхности клеток хозяина.
2. Передача сигнала и проникновение
в клетку. Прикрепление микробов к
клеткам хозяина индуцирует процес-
сы передачи сигнала, вызывающего
в случае непрофессиональных фагоци-
тов поглощение микробной клетки, в
случае профессиональных фагоцитов —
стимуляцию фагоцитоза. При этом внут-
риклеточно размножающиеся патогенные
бактерии способны экспрессировать бел-
ки, влияющие на передачу сигнала в
эукариотических клетках (табл. 33.8).
Так, иерсинии продуцируют белок YopH
с тирозинфосфатазной активностью, ха-
рактерной также для передающих сигнал
молекул эукариот. InvA-белок Salmonella
typhimurium способен связываться с
рецептором фактора роста эпидермиса
(РФРЭ) и влиять на передачу сигнала
в клетки хозяина, в результате того что
РФРЭ активирует ассоциированную с
микротрубочками протеипкиназу. По-
следняя активирует фосфолипазу А2,
вследствие чего открываются кальциевые
каналы, мембраны сморщиваются и про-
исходит поглощение бактерий. Особые
инвазины, идентифицированные у
внутриклеточно размножающихся энте-
робактерий, не содержат sec-зависимой
сигнальной последовательности, но пере-
носятся через бактериальную мембрану
посредством транспортного механизма,
называемого системой секреции III типа.
Белки этой системы, присутствующие у
Shigella flexneri, Salmonella typhimurium,
Yersinia enterocolitica и энтеропатогенных
штаммов E. coli, обнаруживают высокое
сходство между собой и с белками, участ-
вующими в секреции белков жгутиков
(см. разд. 19.4).
3. Выживание и персистенция внутри
клеток хозяина. После проникнове-
ния в клетки хозяина внутриклеточные
возбудители должны избежать воз-
действия бактерицидных механизмов эу-
кариотических клеток, особенно в слу-
чае активированных макрофагов (см.
разд. 33.2.1). Внутриклеточно локали-
зующиеся патогенные бактерии облада-
ют рядом свойств, обеспечивающихся
их выживание внутри клеток хозяина.
Некоторые из этих бактерий, например
Legionella pneumophila, Chlamydia tracho-
matis и Mycobacterium tuberculosis, нахо-
дясь внутри фагосомы (см. рис. 33.13),
подавляют ее слияние с лизосомами, бла-
годаря чему в фагосому не высвобож-
даются бактерицидные ферменты и не
происходит вспышки окислительной ак-
тивности. Это дает воз можность микроб-
ным клеткам выживать и размножать-
ся внутри фагосом. Возбудитель лепры
Mycobacterium leprae может, вероятно, со-
храняться и размножаться и внутри фа-
гол изосом, не подвергаясь лизису. Дру-
гие патогенные бактерии способны поки-
дать фагосому и размножаться внутри
цитоплазмы клеток хозяина. Процессы,
ведущие к выживанию микроорганизмов
в цитоплазме клеток хозяина, подробно
изучены на Listeria monocytogenes и Shi-
gella flexneri. Оба эти организма спо-
собны лизировать мембрану фагосомы
посредством своих токсинов (листерио-
лизина и IpaB-гемолизина). Оказавшись
в цитоплазме, эти бактерии индуциру-
ют полимеризацию F-актина. Микрофи-
ламенты актина связываются с одной сто-
роной поверхности бактериальной клетки
и опосредуют ее внутриклеточное и меж-
клеточное перемещение.
Внутриклеточно локализующиеся пато-
генные микробы различными путями внедря-
ются в клетки организма-хозяина. После связы-
вания на поверхности клеток хозяина и погло-
щения в фагосоме некоторые из них выделяют
факторы, подавляющие слияние фагосом с ли-
зосомами, и избегают таким образом лизиса; от-
дельные возбудители способны выживать внутри
фаголизосом. Другие возбудители выходят в ци-
топлазму и способны распространяться в другие
клетки.
Глава 33. Медицинская микробиология 335
Таблица 33.8. Факторы вирулентности, участвующие в инвазии
Факторы вирулентности Организмы Свойства
InvA Yersinia pseudotuberculosis Yersinia enterocolitica Связывание с /31-интегрином
YopH Yersinia pseudotuberculosis Yersinia enterocolitica Т ирозинфосфатаза
Mip Legionella pneumophila Chlamydia trachomatis Белок, связывающий антибиотик такролимус (FK506)
InvA Salmonella typhimurium Связывание с рецептором фактора роста эпидермиса (РФРЭ)
SpaL-T Salmonella typhimurium Перенос системой секреции III типа
ActA Listeria monocytogenes Вызывает полимеризацию актина
IcsA Shigella flexneri Вызывает полимеризацию актина
MxiA, C Shigella flexneri Перенос системой секреции III типа
SpaM-S Shigella flexneri Перенос системой секреции III типа
EaeB Энтеропатогенные штаммы E. coli Фосфорилирование остатков тирозина в Нр 90
SepA-C Энтеропатогенные штаммы E. coli Перенос системой секреции III типа
33.3.3. Экзотоксины повреждают клетки хозяина
Токсины — это растворимые соединения, нару-
шающие нормальный метаболизм клеток хозяина
и способные вызывать его гибель. Они подразде-
ляются па экзо- и эндотоксины. Экзотоксинами
называют белки, секретируемые в среду; эндо-
токсины представляют собой липополисахариды
наружной мембраны грамотрицательных бакте-
рий, высвобождающиеся после лизиса их клеток
(см. разд. 23.2 и 33.3.6).
Некоторые патогенные бактерии, такие как
Staphylococcus aureus, Streptococcus pyogenes к
Pseudomonas aeruginosa, способны продуциро-
вать множество разнообразных токсинов, и уча-
стие отдельных из них в инфекционном про-
цессе трудно оценить. Другие возбудители про-
дуцируют единственный или основной токсин,
который определяет симптомы болезни. Приме-
рами таких токсинов могут служить холерный
токсин (Vibrio cholerae), дифтерийный токсин
(Corynebacterium diphtheriae), столбнячный ток-
син (Clostridium tetani) и ботулиновый токсин
(Clostridium botulinum). Белковые токсины отно-
сятся к наиболее сильнодействующим биологиче-
ски активным веществам. Например, всего один
грамм ботулинового токсина может вызвать ги-
бель до 10 млн. человек.
Гены, кодирующие экзотоксины, часто лока-
лизованы в фагах или плазмидах. Так, гены хо-
лерного, дифтерийного, шигоподобного и ботули-
нового токсинов, а также эритрогенного токси-
на (Streptococcus pyogenes) входят в геномы кон-
вертирующих бактериофагов. Гены энтеротокси-
нов Е. coli, столбнячного токсина, токсина, вы-
зывающего кожную реакцию при скарлатине, и
других токсинов несут плазмиды (табл. 33.9).
Гены ST-энтеротоксина Е. coli находятся в транс-
позонах. Вследствие такой локализации гены
токсинов способны передаваться нетоксигенным
штаммам.
Экзотоксины подразделяют на группы в со-
ответствии с участком их действия. К груп-
пе энтеротоксинов относят экзотоксины, дей-
ствующие на кишечник, вызывающие обильную
секрецию жидкости в его просвет и в резуль-
тате диарею. Образование энтеротоксинов ха-
рактерно для бактерий, вызывающих кишечные
инфекции — Staphylococcus aureus, Е. coli, Vibrio
cholerae, Salmonella enterica серовар Enteritidis и
Bacillus cereus. В отличие от этого нейроток-
сины оказывают эффект на клетки нервной си-
стемы. Экзотоксины с таким действием образуют
Clostridium tetani и Clostridium botulinum.
Экзотоксины — это секретируемые патоген-
ными микробами белки, способные повреждать
или даже разрушать клетки хозяина. Экзотокси-
ны подразделяют на группы по участку и меха-
низму действия.
336 Часть IX. Прикладная микробиология
Таблица 33.9. Особо опасные бактериальные токсины
Токсин Продуцирующий организм Заболевание Характер действия Локализация гена
Токсин токсического шока 1 Staphylococcus aureus Раневые инфекции, кожные инфекции Суперантиген Бактериофаг
Эритрогенный ток- син А Streptococcus pyogenes Септицемия Суперантиген Бактериофаг
а-Гемолизин Escherichia coli Инфекция мочевыво- дящих путей Образование пор Хромосома/плаз- мида
а-Токсин Staphylococcus aureus Раневые инфекции, кожные инфекции Образование пор Хромосома
О-стрептолизин Streptococcus pyogenes Скарлатина, фарин- гит Образование пор Хромосома
Пневмолизин Streptococcus pneumoniae Пневмония Образование пор Хромосома
Лецитиназа Clostridium perfringens Газовая гангрена Фосфолипаза Хромосома
Фосфолипаза С Pseudomonas aeruginosa Кожные инфекции, инфекции дыха- тельных путей Фосфолипаза Хромосома
Экзотоксин А Pseudomonas aeruginosa Кожные инфекции, инфекции дыха- тельных путей ADP-рибозилирование Хромосома
Дифтерийный токсин Corynebacterium diphtheriae Дифтерия А DP-рибозил ирование Бактериофаг
Холерный токсин Vibrio cholerae Холера ADP-рибозилирование Бактериофаг
LT-энтеротоксин Escherichia coli Гастроэнтерит ADP-рибозилирование Плазмида/хро- мосома
Коклюшный токсин Bordetella pertussis Коклюш А DP-рибозил ирование Хромосома
Шиготоксин Shigella dysenteriae Дизентерия 288-РНКаза Хромосома
Шигоподобный токсин Escherichia coli Гастроэнтерит 288-РНКаза Бактериофаг
Столбнячный токсин Clostridium tetani Столбняк Протеаза Плазмида
Токсин ботулизма Clostridium botulinum Ботулизм Протеаза Бактериофаг
Суперантигены (sAg), такие как энтероток-
сины Staphylococcus aureus и эритрогенный ток-
син Streptococcus pyogenes, образуют мостик меж-
ду молекулами МНС класса II на макрофа-
гах и Т-клеточными рецепторами (на хелперных
Т-клетках), что приводит к неспецифической сти-
муляции иммунного ответа (см. также разд. 33.2.2
и рис. 33.8).
Порообразующие токсины □ Некоторые
цитолизины называют также «гемолизинами»,
поскольку они вызывают лизис эритроцитов. По-
добные токсины активны также по отношению к
другим клеткам, например лейкоцитам и клеткам
эпителия. По характеру действия их называют
порообразующими токсинами (рис. 33.14, А;
см. цв. вклейку). Они способны встраиваться
в гидрофобные участки мембраны эукариоти-
ческой клетки, нарушая ее целостность. Важ-
ный класс порообразующих токсинов составля-
ют токсины с повторами (Rtx). Их продуцируют
грамотрицательные бактерии, такие как Е. coli
(о-гемолизин), Pasteurella haemolytica (лейкоток-
сины) и виды рода Proteus. Молекулы Rtx-ток-
синов содержат общий мотив из повторяющих-
ся аминокислотных остатков. Эти токсины транс-
портируются через бактериальную мембрану
системой секреции I типа, включающей перенос-
чики, сходные с белками множественной устой-
чивости к лекарственным препаратам (multi-drug
resistance, MDR), известными у эукариот. Осо-
Глава 33. Медицинская микробиология 337
Рис. 33.15. Электронные микрофотографии молекул по-
рообразующих токсинов.
А. Фрагмент эритроцита кролика, лизированного ста-
филококковым а-токсином. Стрелки показывают струк-
туры размерами 10 нм, образованные о-токсинами.
Б. Изолированные гексамеры токсина в растворе детер-
гента.
В. Лецитиновые липосомы с внедрившимися в них гек-
самерами ct-токсина (показаны стрелками). Звездочкой
отмечена липосома, не затронутая а-токсином.
Г. Негативно окрашенная мембрана эритроцита, лизи-
рованная 0-стрептолизином. Стрелками показаны спе-
цифичные к 0-стрептолизину поры в мембране эритро-
цита.
Д. Отрицательно окрашенные изолированные олигоме-
ры в виде искривленных палочек, аналогичные встреча-
ющимся в мембранах, обработанных токсином.
Е. Очищенные комплексы 0-стрептолизина, вновь внед-
рившиеся в лишенные холестерола лецитиновые ли-
посомы. Стрелками показаны очищенные комплексы
0-стрептолизина (р — вид поражения сбоку). Шкала
100 нм. По [1].
бый бифункциональный токсин представляет со-
бой циклаза/гемолизин Bordetella pertussis — ком-
плекс из аденилатциклазы и порообразующего
токсина. Другие важные в медицинском отно-
шении порообразующие токсины — это а-токсин
Staphylococcus aureus, пневмо лизин Streptococcus
pneumoniae и образуемый Streptococcus pyogenes
О-стрептолизин, который относится к группе
тиол-активируемых токсинов. На рис. 33.15 при-
ведены электронные микрофотографии молекул
порообразующих токсинов.
Известны также гемолизины и цито-
лизины с ферментативными свойствами
(рис. 33.14, Б). Эти ферменты повреждают фос-
фолипидный бислой в мембране клеток хозяи-
на. Поскольку субстратом при этом часто слу-
жит фосфолипид лецитин (фосфатидилхолин),
такие ферменты называют лецитиназами или
фосфолипазами. Фосфолипаза С, образуемая
несколькими патогенными бактериями, например
Clostridium perfringens, Listeria monocytogenes,
Pseudomonas aeruginosa и Staphylococcus aureus,
вызывает повреждение тканей.
Особые цитолизины (гемолизины) образуют
поры в мембране эукариотических клеток, что ча-
сто приводит к гибели клеток хозяина. Фермента-
тивные цитолизины способны гидролизовать фос-
фолипиды мембран, вызывая значительное повре-
ждение тканей.
А—В токсины □ В отличие от цитолизинов,
воздействующих на клетки хозяина с поверхно-
сти путем разрушения мембраны, A-В токсины
действуют внутри клеток хозяина, нарушая важ-
ные клеточные функции. В большинстве случаев
эти токсины состоят из двух субъединиц —
А-субъединицы (от active, активная), облада-
ющей ферментативной активностью и вызы-
вающей нарушения внутри клеток хозяина, и
В-субъединицы (от binding, связывающая), ко-
торая специфически связывается с рецепторны-
ми молекулами на поверхности клеток хозяина,
обеспечивая проникновение в них субъединицы А
(рис. 33.14, В). Ряд токсинов А-В-типа облада-
ет способностью к ADP-рибозилированию раз-
нообразных субстратов. Вызываемые ими нару-
338 Часть IX. Прикладная микробиология
шения зависят от субстрата и затрагивают син-
тез белка, процессы регуляции и полимериза-
цию актина. К ADP-рибозилирующим токсинам
относятся дифтерийный токсин D (ДТ) и хо-
лерный токсин X (XT). Вслед за связыванием
В-субъединицы ДТ с рецептором на клетке хозяи-
на А-субъединица катализирует связывание NAD
с фактором элонгации 2 (EF2) эукариотических
рибосом хозяина. Последующее ADP-рибозили-
рование резко подавляет активность EF2 и вслед-
ствие этого синтез белка. С дифтерийным токси-
ном сходен экзотоксин A Pseudomonas aeruginosa,
действующий аналогичным образом.
Холерный токсин воздействует на эпите-
лий тонкого кишечника (рис. 33.14, Г). В-субъ-
единица XT связывается с СМ1-ганглиозидом
клетки хозяина, в результате чего гуанидин-
связывающий белок связанного с мембраной ком-
плекса инактивируется путем ADP-рибозилиро-
вания и возрастает активность адепилатцикла-
зы. Вызванное этим повышение концентрации
сАМР стимулирует активную секрецию электро-
литов в просвет кишечника. Изменение ионного
баланса ведет к выделению в просвет большо-
го количества воды. Тот же механизм действия
характерен для термолабильного (ТЛ) энтеро-
токсина Е. coli. Другие А—В-токсины, такие
как шиго- и шигоподобные токсины, а также ней-
ротоксины действуют иным путем, отличным от
ADP-рибозилирования. Шиготоксин I типа (ShT),
образуемый Shigella dysenteriae, и шигоподобный
токсин I (SLT I) гомологичны на 99%, тогда
как SLT II и ShT только на 55-57%. Токсины
SLT-типа образуют эптерогеморрагические
(ЕНЕС) и некоторые энтеропатогенные (ЕРЕС)
штаммы Е. coli (см. разд. 33.1.4) и другие эн-
теробактерии. Механизм действия этих токси-
нов не связан с внедрением и внутриклеточным
ростом бактерий, но обусловливает тяжелое те-
чение болезни. Входящая в состав этих токси-
нов субъединица А отщепляет один адениновый
остаток от 28S-PHK рибосом хозяина, обладая
N-гликозидазной активностью, и подавляет тем
самым элонгацию пептидной цепи.
Возбудители столбняка способны расти в
анаэробных условиях, создающихся внутри ран,
продуцируя при этом столбнячный токсин. Он
воздействует на центральную нервную систе-
му посредством связывания с нервными синап-
сами. Этот токсин представляет собой цинк-
содержащую протеазу и блокирует высвобожде-
ние нейромедиаторов (например, 7-аминомасля-
ной кислоты и глицина). Это ведет к подавлению
синаптической связи и нерегулируемой возбуди-
тельной синаптической активности (спазматиче-
ский паралич). Ботулиновый токсин часто при-
сутствует в контаминированных пищевых продук-
тах, где имеются анаэробные условия для роста
Clostridium botulinum (консервы). Таким образом,
ботулизм представляет собой исключительно ин-
токсикацию. Ботулиновый токсин действует так
же, как цинковая протеаза и связывается с мем-
бранами в пресинаптическом окончании на участ-
ке нервно-мышечного соединения. Тем самым он
препятствует передаче сигнала, нарушая высво-
бождение нейромедиатора ацетилхолина из си-
наптических везикул и вызывая паралич.
Токсины, состоящие из двух компонентов
(A-В), способны проникать внутрь эукариоти-
ческих клеток и оказывать повреждающее дей-
ствие. Некоторые из этих токсинов обладают
ADP-рибозилирующей активностью.
33.3.4. В распространении патогенных бактерий
участвуют факторы распространения
Патогенные бактерии способны продуцировать
разнообразные полипептиды, которые не пред-
ставляют собой токсины как таковые (не имеют
клеток-мишеней), но тем не менее участвуют в
патогенезе, действуя как факторы распро-
странения инфицирующих агентов. Известно
несколько таких факторов, участвующих в раз-
рушении внеклеточного матрикса соединитель-
ных тканей. Так, фермент стафилокиназа,
продуцируемый Staphylococcus aureus, способен
растворять фибриновую сеть, стрептокиназа
Streptococcus pyogenes расщепляет плазминоген
с образованием плазмина, который в свою оче-
редь расщепляет фибрин. Клетки Bacillus fragilis
и Clostridium perfringens продуцируют коллаге-
назу (называемую х-токсином С. perfringens),
которая непосредственно разрушает коллаген —
основной компонент внеклеточного матрикса.
Продуцируемая S. aureus и С. perfringens гиалу-
ронидаза гидролизует входящую в состав клеток
соединительной ткани гиалуроновую кислоту.
Глава 33. Медицинская микробиология 339
Некоторые патогенные бактерии, такие как
Streptococcus pneumoniae, Clostridium perfringens,
Bacillus fragilis, Vibrio cholerae и Salmonella ty-
phimurium, образуют фермент нейраминидазу,
который разлагает гликопротеины, содержащие
остатки сиаловых кислот. Этот фермент спосо-
бен лизировать сывороточные белки — компонен-
ты иммунной системы. Кроме того, грамполо-
жительные (например, Listeria monocytogenes и
Bacillus cereus) и грамотрицательные (например,
Legionella pneumophila и Pseudomonas aeruginosa)
патогенные бактерии образуют высококонсер-
вативные ципк-содержащие металлопротеазы.
Такой фермент, продуцируемый Р. aeruginosa,
участвует в разложении эластина, в соответствии
с чем назван эластазой.
Патогенные бактерии, поражающие желу-
док (Helicobacter pylori) и мочевыводящие пу-
ти (Proteus mirabilis, Staphylococcus saprophyticus),
синтезируют фермент уреазу, который гидроли-
зует мочевину с образованием аммиака и диок-
сида углерода. В мочеточнике аммиак, повышая
pH, способствует образованию камней; в желудке,
также вызывая подщелочение, аммиак защищает
клетки Н. pylori от воздействия кислой среды.
Патогенные бактерии продуцируют ферменты,
способствующие их распространению в организ-
ме-хозяине.
33.3.5. Системы обеспечения железом
как факторы бактериального роста,
связанные с вирулентностью
Железо, необходимое бактериям для роста как
компонент, например, цитохромов и железо-
серных центров, в случае патогенных форм име-
ет особое значение, поскольку концентрация сво-
бодного железа в организме человека очень низка
(например, ЫО-1£ М в сыворотке крови). У эу-
кариот имеются белки, прочно связывающие
железо, такие как лактоферрин (в секреторной
жидкости), трансферрин (в сыворотке крови),
ферритин и гемин, и этим объясняется его низ-
кое содержание в жидкостях организма. В то же
время бактериям для роста требуется концентра-
ция железа 0,4-1 мкМ. Таким образом, патоген-
ные бактерии, особенно размножающиеся внекле-
точно, должны конкурировать с клетками хозя-
ина за железо и поэтому обладают несколькими
механизмами снабжения железом (см. разд. 8.8).
Железо имеет очень важное значение для роста
бактерий и вирулентности. У патогенных бакте-
рий действует несколько механизмов обеспечения
железом.
Из систем поглощения железа наиболее по-
дробно изучены сидерофоры — низкомолекуляр-
ные соединения (500-1500 Да), обладающие вы-
соким сродством к железу и образующие с ним
хелаты. Выделяют два основных класса сиде-
рофоров: катехоловый тип и гидроксамат-
ный тип. Прототипом сидерофоров катехоло-
вого типа является энтеробактин, продуцируе-
мый большинством патогенных и непатогенных
энтеробактерий. Распространенным сидерофором
гидроксаматного типа является аэробактин; к об-
разующим его бактериям относятся многие па-
тогенные штаммы Е. coli, главным образом изо-
ляты, выделенные из культур крови. Следует
отметить, что гены аэробактина (аег) могут быть
локализованы в плазмидах либо в бактериальной
хромосоме. Генный кластер аег фланкирован ин-
серциопными последовательностями IS1, предпо-
ложительно способными переносить аег в каче-
стве транспозона.
Микробные клетки выделяют сидерофоры в
среду, где эти молекулы образуют хелатные ком-
плексы с Fe3+. Поглощение железа в хелатирован-
Hoii форме описано в разд. 8.8. Некоторые бакте-
рии могут использовать сидерофоры, продуциру-
емые бактериями других видов.
Помимо сидерофоров существуют также иные
системы обеспечения железом. Некоторые пато-
генные бактерии (например, Neisseria gonorrhoeae
и Haemophilus influenzae) способны использовать
в качестве источника железа связывающие же-
лезо белки эукариот, такие как трансферрин,
лактоферрин, ферритин или гемин, присоединяя
их посредством своих поверхностных структур.
Другие патогенные бактерии, такие как Listeria
monocytogenes и Legionella pneumophila, секре-
тируют железоредуктазу, способную восста-
навливать ионы Fe3+ до Fe2+; в двухвалентной
форме железо может поглощаться их клетками.
Кроме того, в обеспечении бактерий железом
участвуют экзотоксины (см. разд. 33.3.3). Как
указано в предыдущем разделе, экзотоксины вы-
340 Часть IX. Прикладная микробиология
зывают гибель клеток хозяина; тем самым они
способствуют высвобождению железа, которое в
результате может быть использовано инфицирую-
щим организмом. Примечательным образом в ре-
гуляции генов, кодирующих некоторые токсины и
сидерофоры, участвует железо. Молекула репрес-
сора, обозначаемого Fur (от англ, ferric uptake
regulator, регулятор поглощения железа), подав-
ляет активность этих генов при связывании с Fe2+
(см. разд. 33.4.2). Комплекс Fur-Fe2+ способен
подавлять активность нескольких генов, в том
числе кодирующих шиготоксин, шигоподобный
токсин I, гемолизин Serratia и аэробактин.
Образуемые бактериями сидерофоры — это
низкомолекулярные соединения, связывающие
железо. В качестве источников железа бактерии
могут также использовать связывающие железо
белки эукариот и железо, высвобождающееся в
результате лизиса клеток хозяина под действием
бактериальных экзотоксинов.
33.3.6. Во многих патогенных процессах
участвуют эндотоксины
Эндотоксины представляют собой компонент ли-
пополисахарида (ЛПС), основного компонента на-
ружной мембраны грамотрицательных бактерий
(о структуре и синтезе ЛПС см. разд. 23.2). ЛПС
состоит из трех компонентов: липида А (токсич-
ный компонент), олигосахаридного остова (гены
rfa) и О-специфического полисахарида (гены rfb).
В отличие от экзотоксинов, эндотоксины не син-
тезируются специально для повреждения других
клеток, но представляют собой молекулы поверх-
ности (защитных покровов) бактериальных кле-
ток.
ЛПС обнаруживает несколько биологических
активностей, проявляемых им как в связанной с
клеткой форме, так и после высвобождения из
бактериальных клеток. Будучи важным компо-
нентом бактериальной клеточной стенки, ЛПС
может вносить вклад в бактериальную устой-
чивость к сыворотке, т. е. к действию компле-
мента. Одни типы ЛПС способны предотвращать
связывание белков комплемента СЗЬ и С5Ь с клет-
ками бактерий и тем самым формирование мем-
браноатакующего комплекса (см. разд. 33.2.1).
ЛПС других типов содержат длинные повто-
ряющиеся единицы, стерически препятствующие
формированию этого комплекса на поверхности
бактериальных клеток. Кроме того, ЛПС, содер-
жащие сиаловые кислоты, подавляют образова-
ние конвертазы СЗ, что также способствует устой-
чивости к сывороточным белкам комплемента.
При гибели бактериальных клеток эндотокси-
ны высвобождаются. В малом количестве ЛПС
может вызывать в организме хозяина пироген-
ный эффект, тогда как в большой дозе он
индуцирует развитие септического шока — кри-
зисного состояния организма-хозяина. Часто сеп-
тический шок возникает при септицемии, вызван-
ной грамотрицательпыми бактериями. Причина
его развития состоит в том, что ЛПС индуци-
рует высвобождение макрофагами цитокинов, та-
ких как ИЛ-1 или ФНО (см. табл. 33.5). При
этом наблюдается также повышение концентра-
ции других цитокинов, например ИЛ-6 и ИЛ-8
(см. разд. 33.2.3). Эти цитокины и другие компо-
ненты иммунной системы вызывают образование
медиаторов воспаления, например простагланди-
нов и лейкотриенов, а также активацию компле-
мента и каскадов коагуляции.
Липополисахарид (ЛПС, эндотоксин)
включает три фрагмента: липид А (токсичный
компонент), олигосахаридный остов и О-специфи-
ческий полисахарид из повторяющихся тетра- и
пентасахаридных единиц. Присутствуя в клеточ-
ной стенке, ЛПС вносит вклад в устойчивость гра-
мотрицательных бактерий к действию сыворотки.
При высвобождении из бактериальных клеток эн-
дотоксин вызывает развитие патологических про-
цессов в организме хозяина, в том числе септиче-
ский шок.
33.3.7. Капсулы патогенных бактерий
служат им защитным барьером
Капсула представляет собой поверхностную
структуру из полимерных молекул, в большин-
стве случаев полисахаридов (см. разд. 23.4).
Среди патогенных бактерий капсулы харак-
терны главным образом для внутриклеточных
возбудителей, например вызывающих менингит
Глава 33. Медицинская микробиология 341
или сепсис. К этой группе относятся Neisseria
meningitidis, Haemophilus influenzae и штаммы
Е. coli, образующие капсулу К 1-типа. Кроме то-
го, капсулой обладают бактерии, способные вы-
зывать пневмонию, например Streptococcus pneu-
moniae и Klebsiella pneumoniae. Особый вариант
Pseudomonas aeruginosa, идентифицированный
как возбудитель инфекции дыхательных путей
у больных муковисцидозом, образует капсулопо-
добный экзополисахарид, называемый альгина-
том. Капсулой обладают также уропатогенные
штаммы Е. coli.
Некоторые капсулы представляют собой по-
лимер сиаловой кислоты. Так, полимер, образую-
щий капсулу К 1-типа у Е. coli, состоит из остатков
N-ацетилнейраминовой кислоты, соединенных
а-2,8-связью; ему идентичен полисахарид кап-
сулы N. meningitidis. Перекрестную реактивность
обнаруживают также капсулы других микроор-
ганизмов. Например, капсулы К18 и К100 Е. coli
сходны с капсулой Н. influenzae Ь. Капсулы защи-
щают патогенные микроорганизмы от иммунных
механизмов хозяина следующим образом.
1. Покров в виде капсулы противодей-
ствует активации комплемента (см.
разд. 33.2.1), поскольку комплекс СЗВЬ
не может сформироваться на поверхности
покрытой ею бактериальной клетки. Таким
образом обладающие капсулой возбудители
избегают лизиса, опосредованного компле-
ментом.
2. Полимеры капсул имитируют молеку-
лярные структуры организма-хозяина.
Так, полисиаловая кислота капсул К1-типа
Е. coli и N. meningitidis сходна по строению
с углеводным концевым компонентом эмбрио-
нального «адгезина» нервных клеток (neural
cell adhesion molecule, n-CAM; табл. 33.10).
Капсулы этих типов маскируют клетки воз-
будителя, который в результате не вызывает
иммунного ответа, в том числе образования
опсонизирующих антител.
В большинстве случаев капсулы бактерий со-
стоят из полисахаридов, препятствующих воздей-
ствию на их клетки неспецифических защитных
механизмов хозяина, таких как активация ком-
племента и опсонизация.
Таблица 33.10. Компоненты капсул бактерий, имеющие
сходство с компонентами эукариотических структур
Вид К-тип Состав Сходным эукариоти- ческий компонент
E. coli KI 8-a Neu NAc-2 n-Cam
K4 Fru-Glc-Gal NAc Хондроитин
K5 Glc-Glc NAc Гепарин
Neisseria meningitidis b 8-o Neu NAc-2 n-Cam
33.3.8. Патогенные бактерии обладают
различными защитными свойствами
Для противодействия антимикробным механиз-
мам хозяина патогенные бактерии обладают ря-
дом защитных свойств. Молекулы поверхности
бактериальных клеток (некоторые из этих со-
единений называют эвазинами) могут предот-
вращать связывание патогенных бактерий с фа-
гоцитарными клетками и белками комплемента.
Другие механизмы защищают бактерии от связы-
вания с их клетками иммуноглобулинов и также
содействуют инфицированию.
Антифагоцитарные компоненты микроб-
ных клеток □ Определенные молекулы поверх-
ности бактериальных клеток, например М-белок
Streptococcus pyogenes (см. разд. 33.3.1), способ-
ны блокировать отложение на них опсонизи-
рующего белка СЗЬ комплемента. М-белки по-
давляют взаимодействие СЗЬ с рецепторами на
фагоцитарных клетках, таких как полиморфно-
ядерные нейтрофилы (см. разд. 33.2.1), и за счет
этого избегают опсонизации. Белковый S-слой
бактериальных клеточных стенок (см. рис. 2.6),
как установлено, предотвращает связывание СЗЬ
с клетками Campylobacter fetus и, возможно, свя-
зан с вирулентностью у патогенного для рыб вида
Aeromonas salmonicida.
Супероксиддисмутазы (СОД); катала-
зы □ Эти ферменты бактерий осуществляют де-
токсикацию высокореакционноспособных форм
кислорода, образующихся в фаголизосомах (см.
разд. 33.2.1 и 11.6) и тем самым играют важную
роль в патогенезе инфекционных болезней, напри-
мер вызываемых Staphylococcus aureus, Listeria
monocytogenes и Shigella flexneri.
342 Часть IX. Прикладная микробиология
Факторы устойчивости к сыворотке кро-
ви □ Патогенные бактерии, особенно размножа-
ющиеся вне клеток, должны обладать устойчи-
востью к комплементу (см. разд. 33.2.1). Спо-
собность выживать в сыворотке крови человека
(устойчивость к сыворотке крови) относится
к факторам вирулентности многих патогенных
бактерий, в том числе уропатогенных. У гра-
мотрицательных бактерий устойчивости к сыво-
ротке содействуют, наряду с ЛПС и капсулами,
белки наружной мембраны. Устойчивость к
сыворотке крови обусловливают: белок Ail
(от attachment invasion locus, локус прикрепле-
ния при инвазии) Yersinia enterocolitica-, коди-
руемый плазмидой белок Rck (от resistance to
complement killing, устойчивость к лизису под
действием комплемента) Salmonella enterica серо-
вар typhimurium-, кодируемые плазмидами белки
(ТгаТ, Iss) Е. coli и белки Вог, кодируемые фа-
гом Л. Белки Ail и Rck, а также Lorn (фаг А),
OmpX (Enterobacter cloacae) и PagC (Salmonella
enterica, см. разд. 33.3.2) относятся к группе бел-
ков мол. массой 16-18 кДа, образуемых грамотри-
цательными бактериями и способствующих виру-
лентности посредством повышения устойчивости
клеток к сыворотке крови.
Мимикрия □ Капсулы могут содержать уг-
леводы, сходные с углеводными компонентами
молекул хозяина, благодаря чему обладающие
ими бактерии вызывают лишь слабый иммун-
ный ответ. Этот механизм маскировки называ-
ют мимикрией. Кроме того, и другие бакте-
риальные продукты (например, М-белки Strepto-
coccus pyogenes) содержат эпитопы, сходные со
структурами хозяина. Некоторые бактерии, та-
кие как Staphylococcus aureus и S. pyogenes, про-
дуцируют белки, способные связывать рас-
творимый фибронектин, — гликопротеин, при-
сутствующий в крови, па поверхности клеток и
во внеклеточном матриксе тканей организма-хо-
зяина, вследствие чего вокруг поверхности бакте-
рии образуется покров из структур хозяина, обла-
дающий лишь слабой иммуногенностью.
Разложение комплемента □ S. pyogenes
способен продуцировать С5а-протеазу, которая
специфически разлагает белок С5а комплемента.
Этот фермент обеспечивает антихемотаксический
эффект и позволяет инфицирующей бактерии из-
бежать опсонизации белками комплемента.
Белки, связывающие антитела □ Белки
различных микроорганизмов могут действовать
подобно Fc-рецепторам, т. е. специфически свя-
зывать иммуноглобулины. Из факторов виру-
лентности, относящихся к этому особому клас-
су, наиболее изучен белок A Staphylococcus aureus.
Кроме того, связывать антитела классов IgA и
IgG способны так называемые «М-подобные бел-
ки» S. pyogenes. Белки бактерий, связывающие
антитела, предотвращают специфическое распо-
знавание клеток возбудителей антителами и та-
ким образом защищают микроорганизмы от оп-
сонизации.
Секреторные IgA-протеазы □ Отдельные
патогенные микроорганизмы заселяют слизистые
оболочки, где присутствуют секреторные имму-
ноглобулины класса IgA (slgA). Некоторые из
этих бактерий секретируют протеазы, специфи-
чески расщепляющие молекулы slgA 1 типа.
slgA-1-протеазы— это важные факторы виру-
лентности, которые защищают бактерии от дей-
ствия IgAl в слизистых оболочках. IgA-про-
теазы образуют бактерии, вызывающие менин-
гит или пневмонию, такие как N. meningitidis,
Н. influenzae и Е. pneumoniae, а также N. допог-
rhoeae — возбудитель гонореи.
Патогенные микроорганизмы различны-
ми способами избегают действия защитных
механизмов хозяина. Фагоцитарной активно-
сти клеток хозяина и опсонизации комплемен-
том или иммуноглобулинами препятствуют бак-
териальные факторы вирулентности. К этим
факторам относятся белки, связывающие антите-
ла, а также протеазы, специфически расщепляю-
щие белки комплемента или IgAl.
Глава 33. Медицинская микробиология 343
33.4. Изменчивость и регуляция генов, связанных с вирулентностью
Активность генов, ассоциированных с вирулент-
ностью, строго регулируется. Изменения в уровне
их экспрессии могут происходить как независимо
от условий среды, так и в ответ на внешние воз-
действия.
33.4.1. Изменение вирулентности, фазовая
вариация и антигенная изменчивость
обусловлены мутациями
и перестройками генома
Патогенные микроорганизмы обладают способ-
ностью к смене компонентов клеточной поверх-
ности. Такая изменчивость позволяет избегать
воздействия со стороны иммунной системы ор-
ганизма-хозяина. Один из типов подобной из-
менчивости, называемый фазовой вариацией,
заключается в том, что на поверхности клетки
поочередно экспрессируются определенные ком-
поненты, взаимозамена которых носит, по-види-
мому, характер случайного процесса. В отли-
чие от этого антигенная изменчивость, другой
тип изменения характеристик поверхности, — это
модификация в молекуле того или иного поверх-
ностного маркера, например адгезина или мем-
бранного белка (рис. 33.16; см. цв. вклейку). На-
ряду с фазовой вариацией и антигенной измен-
чивостью, которые, как правило, обратимы, у
патогенных бактерий описаны необратимые ге-
нетические процессы, определяющие изменение
вирулентности. Все перечисленные обратимые
и необратимые изменения обусловлены мутаци-
ями или геномными перестройками, такими как
дупликация, амплификация, делеция или транс-
локация.
Амплификация и делеция генов виру-
лентности □ Для некоторых генов, связанных
с вирулентностью, например генов токсинов, ха-
рактерно увеличение количества копий пе-
ред инфекцией или во время инфекции (см.
рис. 14.15). Продукция холерного токсина (ген
ctx) и шигоподобного токсина (ген sit) энтеробак-
терий возрастает в результате амплификации их
генов (табл. 33.11), вызванной индукцией кон-
вертирующих лизогенных бактериофагов. Кроме
того, к изменениям вирулентности могут приво-
дить небольшие или крупные делеции. Так, ге-
ны, кодирующие М-белок у Streptococcus pyogenes,
содержат повторы, подверженные внутригенной
рекомбинации, в результате которой происходит
изменение иммунологических свойств продукта.
У Haemophilus influenzae может делетироваться
из генома крупный участок капсульного оперона
(длиной 1,5 т.п.н.); в этом случае клетка утрачи-
вает капсулу.
Из хромосом уропатогенных штаммов Е. coli,
Y. pestis и Y. enterocolitica могут делетировать-
ся острова патогенности. Образующиеся ва-
рианты бактерий с измененной вирулентностью
Таблица 33.11. Амплификация или делеция генов, ведущая к изменению вирулентности
Бактерии Фактор вирулентности Ген(-ы) Генетический механизм
Энтерогеморрагические варианты Escherichia coli (ЕНЕС) Vibrio cholerae Streptococcus pyogenes Haemophilus influenzae b Уропатогенные варианты Escherichia coli Yersinia pestis Yersinia enterocolitica Шигоподобный токсин Холерный токсин М-белок Капсула Гемолизин Р-фимбрии Цитотоксический некротизи- рующий фактор Накопление гемина Поглощение железа Поглощение железа sit ctx emm сор bexA hly prf cnf hms fyuA, irp fyuA, irp Амплификация Амплификация Внутригенная делеция Дупликация Делеция Делеция Делеция Делеция
344 Часть IX. Прикладная микробиология
лишены способности синтезировать токсины, ад-
гезины (в случае Е. coli), пигменты и системы
поглощения железа (в случае Y. pestis и Y. en-
terocolitica). У Y. pestis острова патогенности,
состоящие из 102 т.п.н., могут быть делетирова-
ны вследствие рекомбинации фланкирующих их
элементов IS100. В случае уропатогенных штам-
мов Е. coli острова патогенности локализованы в
генах тРНК и фланкированы двумя короткими
прямыми повторами длиной 16-18 п.н., один из
которых исчезает в результате рекомбинации и
последующей делеции. Процессы необратимого
изменения вирулентности могут представлять со-
бой у некоторых видов механизмы адаптации для
образования вариантов с повышенной (вследствие
амплификации) или пониженной (в результате де-
леции) вирулентностью.
Фазовая вариация вследствие инвер-
сии сегмента ДНК □ ДНК Фимбрии I ти-
па энтеробактерий (например, Е. coli) подвер-
жены фазовой вариации (см. разд. 33.3.1). Рай-
он главного промотора оперона fim, кодирую-
щего эти фимбрии, входит в сегмент длиной
314 п.н., расположенный перед структурным ге-
ном fimA (рис. 33.17, Л). Это инвертируемый сег-
мент, подверженный исключению и реинтеграции.
Когда данный промотор находится в ориента-
ции, обеспечивающей активность, инициируется
транскрипция структурных fim- генов и образо-
вание фимбрий. При противоположной ориента-
ции промотора фимбрии I типа не формируются.
Продукты генов /im-оперона — FimB и FimE —
представляют собой сайт-специфические реком-
биназы; FimB ориентирует инвертируемый эле-
мент в положение активности, тогда как FimE —
в положение, исключающее активность. Сходные
процессы были описаны для жгутиковых антиген-
ных белков (Hag) сальмонелл (см. разд. 18.11.1)
и для фимбрий патогенной для животных бакте-
рии Moraxella bovis (в этом случае инвертируемый
фрагмент содержит структурные гены фимбрий).
Мелкие делеции, вставки и мутации со
сдвигом рамки считывания □ Фазовая вари-
ация и антигенная изменчивость могут также
быть результатом небольших делеций или вста-
вок одной или нескольких пар нуклеотидов из-за
«проскальзывания цепи» и ошибочного спари-
вания в ходе репликации. Так, в промоторном
районе /итг-генов Bordetella pertussis, кодирую-
щих белки фимбрий, содержится сегмент поли-С
(рис. 33.17, Б), в котором происходит делеция
Рис. 33.17. Молекулярные механизмы фазовой вариа-
ции и антигенной изменчивости.
А. Фазовая вариация фимбрий I типа у Escherichia coli в
результате инверсии фрагмента ДНК, содержащего про-
мотор. Ген fimA кодирует основную субъединицу фим-
брий; гены fimB и fimE кодируют рекомбиназы, от ко-
торых зависит вставка промоторного элемента.
Б. Фазовая вариация фимбрий (ген fim) у Bordetella
pertussis вследствие небольших делеций в промоторной
области гена fim. Белок BvgA действует как активатор.
В. Антигенная изменчивость белков Ора у Neisseria
gonorrhoeae. В Б'-концевой области генов ора проис-
ходят небольшие делеции пентануклеотидов (СТТСТ),
что устанавливает или сбивает открытую рамку считы-
вания.
нескольких пар нуклеотидов, изменяющая длину
отрезка между участком —10 и районом связы-
вания белка BvgA, активирующего премоторную
область генов fim (см. разд. 33.4.3). Делеция при-
водит к переходу промотора из активного состо-
яния в неактивное. Сходные процессы обусловли-
вают фазовую вариацию фимбрий у Haemophilus
influenzae и антигенную изменчивость липопроте-
инов Vlp (variable lipoproteins) у патогенной для
животных Mycoplasma hyorhinis.
В результате делеций и вставок может так-
же изменяться количество повторяющихся мо-
тивов, расположенных в б'-области некоторых
структурных генов со сдвигом рамки считыва-
ния. Так, эффект антигенной изменчивости по-
верхностных белков у Neisseria gonorrhoeae, назы-
ваемых Ора, обусловлен изменением количества
СТТСТ-повторов на б'-конце кодирующей обла-
Глава 33. Медицинская микробиология 345
сти гена ора (рис. 33.17, В). В случае, когда в
5х-концевой области имеется девять СТТСТ-эле-
ментов, лидерный пептид белка Ора находится
в одной рамке считывания с остальной частью
белка. При уменьшении числа СТТСТ-элементов
до восьми последовательность, кодирующая ли-
дерный пептид, находится вне рамки считывания
остальной части гена данного белка, что исклю-
чает синтез белка. При этом из 8-12 имеющихся
у N. gonorrhoeae ора-генов одновременно актив-
ны лишь один или два. Сходные механизмы фа-
зовой вариации и антигенной изменчивости обна-
ружены для ряда факторов вирулентности, таких
как PilC-адгезин N. gonorrhoeae, /г с-гены, кодиру-
ющие ЛПС у Н. influenzae, и sap-гены, кодирую-
щие S-слой у Campylobacter fetus.
Геномные перестройки генов вирулент-
ности □ Пили N. gonorrhoeae подвержены ан-
тигенной изменчивости в результате перестроек
структурных рг/-генов. В хромосоме присутству-
ют различные варианты структурных генов pH,
кодирующих белки основной субъединицы пилей
у N. gonorrhoeae (рис. 33.18). Один из вариан-
тов этого гена, рНЕ, находится в экспрессиру-
емом сайте и транскрипционно активен, тогда
как другие варианты, например pilS, — это мол-
чащие гены, которые не содержат премоторной
области и 5х-концевой последовательности.
Структурные р?/-гены включают константные
и вариабельные участки ДНК. Новые вариан-
ты белка пилина возникают в результате крос-
синговера между константными областями генов
рНЕ и pilS. При внутриштаммовой рекомбинации
ей подвергаются хромосомные ру'/ гены данного
изолята. Для N. gonorrhoeae характерна природ-
ная трансформация, т. е. возможно поглощение
нативными клетками ДНК из лизированных кле-
ток. В результате этого возможна также реком-
бинация генов рНЕ и pilS из разных штаммов.
Фазовая вариация липопротеинов Vlp (variable
lipoprotein) у Mycoplasma hyorhinis и белков Vmp
(от variable major protein) у Borrelia hermsii, воз-
будителя возвратной лихорадки, сопровождается
также антигенными изменениями в результате
перестроек ДНК.
Патогенные микроорганизмы обладают спо-
собностью к периодическому изменению поверх-
ностных структур, представляющих собой фак-
торы вирулентности. Эти изменения, называемые
изменением вирулентности, фазовой вариацией
рНЕ (экспрессируемый ген)
pilS (новый вариант молчащего гена)
pilE (новый вариант экспрессируемого гена)
Рис. 33.18. Фазовая вариация пилей (гены р/7) у
Neisseria gonorrhoeae. Молчащая копия (pilS) гена ос-
новной субъединицы и его экспрессируемая копия (рИЕ)
подвергаются взаимной рекомбинации, что приводит к
образованию новой разновидности основной субъеди-
ницы. Константные области р/7-генов отмечены чер-
ным, вариабельные — заштрихованными и серыми пря-
моугольниками.
и антигенной изменчивостью, позволяют пато-
генным бактериям избегать воздействия иммун-
ной системы организма-хозяина. Вариабельность
факторов вирулентности обусловлена мутациями
и геномными перестройками.
33.4.2. На транскрипцию генов вирулентности
влияют внешние стимулы
Многие патогенные бактерии (например, Vibrio
cholerae и Yersinia enterocolitica) в природной
среде вне организма-хозяина находятся в состо-
янии выживания (поддержания жизнеспособно-
сти). При инфицировании они начинают размно-
жаться внутри организма-хозяина и даже внут-
ри его клеток. Другие патогенные бактерии,
такие как Yersinia pestis и Borrelia burgdorferi,
имеют двух хозяев (например, членистоногого и
позвоночного). Таким образом, активность па-
тогенных микроорганизмов определяется усло-
виями внешней среды. Факторы, оказывающие
влияние на активность генов вирулентности, при-
ведены в табл. 33.12, однако о факторах, которые
влияют на экспрессию генов вирулентности в ор-
ганизме хозяина — человека или животного — све-
дений пока очень мало.
Во многих случаях связанные с вирулентно-
стью гены регулируются в ответ на определен-
ные внешние стимулы. Эти стимулы трансфор-
346 Часть IX. Прикладная микробиология
Таблица 33.12. Общие регуляторные белки, контролирующие экспрессию генов вирулентности
Общий регулятор Бактерии Обозначение гена Внешний стимул Регулируемый фак- тор вирулентности
Сгр Патогенные штаммы Escherichia coli сгр Источник углерода Р-фимбрии
Сгр Pseudomonas aeruginosa сгр Источник углерода Альгинат
Lrp У ропатогенные штаммы Escherichia coli lrp Температура Р-фимбрии S-фимбрии
Lrp Энтеротоксигенные штаммы Escherichia coli lrp Температура Адгезины К99
AraC-подобный белок Yersinia enterocolitica virF Температура Белки Yop
AraC-подобный белок Shigella flexneri virF Температура Белки 1ра Белок Vir-B
AraC-подобный белок Энтеротоксигенные штаммы cfaD Температура Адгезины CFA I
Escherichia coli ms Температура Адгезины CFA I
Lys-R-подобный белок Salmonella enterica серовар Dublin spvR Стационарная фа- за роста Белки Spv
H-NS Shigella flexneri virR Температура Белки 1ра
H-NS Уропатогенные штаммы Escherichia coli drdX Температура Р-фимбрии S-фимбрии
H-NS Yersinia enterocolitica yrnoA Температура Белки Yop
H-NS Энтеротоксинные штаммы Escherichia coli hns Температура Адгезины CFA I
Fur Патогенные штаммы Escherichia coli fur Железо Аэробактин Энтеробактин Шигоподобный токсин Су пероксиддисмутаза
? Yersinia enterocolitica Кальций Белки Yop
мируются в сигналы, передаваемые на регуля-
торные белки; некоторые из них приведены в
табл. 33.12. Регуляторные белки влияют на тран-
скрипционную активность генов вирулентности,
которые могут быть организованы в опероны и
регулоны. Один общий регулятор способен акти-
вировать или репрессировать другой регулятор-
ный ген, что приводит к регуляции по каскадному
механизму внутри «сетей патогенности». Эти
принципы регуляции описаны в гл. 20.
Дополнение 33.4. Некоторые гены или
опероны вирулентности регулируются за-
кодированным в них активатором и/или ре-
прессором. Пример такой регуляции рар-оае-
рона, кодирующего Р-фимбрии у Е. coli,
иллюстрирует рис. 33.19. Уровень экспрес-
сии рар-оперона зависит от нескольких фак-
торов, таких как температура, источник уг-
лерода, наличие плотной среды. Кроме того,
оперон рар подвержен фазовой вариации. Бе-
лок основной субъединицы кодируется геном
рарА\ гены рарВ и papl кодируют два белка-
активатора, один из которых, рарВ, спосо-
бен связываться с промоторной областью ге-
на рар. Как и в случае многих других ге-
нов вирулентности, специфичные к оперону
регуляторы действуют совместно с общими
регуляторами. Таким общим регулятором,
участвующим в экспрессии гена рар, служит
белок — репрессор катаболизма (Сгр).
Помимо РарВ, Рар! и СгР, важную роль в
экспрессии рар-оперона выполняет лейцин-
зависимый регуляторный белок (Lip), акти-
вирующий рар-гены в ответ на внешние
стимулы, а также участвующий в фазовой
вариации Р-фимбрий. Участки связывания
Lip в регуляторной области рар-оперона
перекрываются двумя GATC-сайтами —
участком действия дезоксиадепозинметила-
зы (Dam). Если Lrp связан с сайтами 1, 2 и 3,
GATC-сайт II закрыт для метилирования,
Глава 33. Медицинская микробиология 347
Рис. 33.19. Регуляторная область рар-оперо-
на у Escherichia coli, кодирующего Р-фимб-
рии. подверженные фазовой изменчивости.
Представлены гены рарА (кодируют основ-
ную субъединицу фимбрий), рарВ и papl
(кодируют регуляторные белки). Указаны
сайты связывания белков Lrp (черные круж-
ки), Сгр (серый прямоугольник) и РарВ (за-
штрихованные прямоугольники). Сайты свя-
зывания Н-NS пока не идентифицированы;
GATC — сайты связывания метилазы Dam.
Перечислены различные факторы; подроб-
ности см. в дополнении 33.4.
вследствие чего рар-оперон «выключен». Ес-
ли же Lrp связывается с регулятором Papl,
его сродство к сайтам 1, 2 и 3 падает и может
происходить метилирование GATC-сайта,
необходимое для транскрипции рар-оперона.
Помимо перечисленных выше факторов
(РарВ, Papl, Сгр, Lrp и Dam), в термоза-
висимой регуляции экспрессии рар-оперона
участвует гистоноподобный белок H-NS.
На транскрипционную активность генов ви-
рулентности многих микроорганизмов вли-
яют также общие регуляторы, относящиеся
к семейству белков AraC, LysR и Fur. Ре-
гулирующий поглощение железа белок Fur
способен связывать ионы железа, действу-
ющие в данном случае как корепрессоры.
Комплекс Fur-Fe2+ подавляет активность ге-
нов, кодирующих сидерофоры, токсины, су-
пероксиддисмутазу и ряд других генов (см.
разд. 33.3.5). Железо служит также коре-
гулятором экспрессии дифтерийного токси-
на, продуцируемого грамположительной бак-
терией Corynebacterium diphtheriae. Другим
внешним стимулом, влияющим на экспрессию
генов (например, у Y. enterocolitica), служит
кальций.
Кроме того, в экспрессии генов вирулентно-
сти могут участвовать сг-факторы. Большин-
ство генов вирулентности транскрибируется
с участием обычного сг-фактора, ст70 (ProD),
и лишь некоторые — с участием альтернатив-
ных факторов. Часть из них экспрессиру-
ется в ответ на внешние воздействия: теп-
ловой шок (RpoH), условия азотфиксации
(RpoN), определенная температура (RpoF).
Примечательно, что экспрессия некоторых
генов вирулентности зависит от наличия
а-фактора RpoS, который преимуществен-
но используется в стационарной фазе роста.
Влияние сг-факторов на регуляцию генов ви-
рулентности демонстрирует, что изменения
свойств бактерий в ходе инфекции сходны
с процессами дифференцировки, такими как
споруляция у бацилл и фазы развития мик-
собактерий, в которых также участвуют аль-
тернативные сг-факторы и другие регуляторы
(см. гл. 25).
Гены, связанные с вирулентностью, регулиру-
ются активаторами и/или репрессорами в ответ
на внешние стимулы. Эти гены организованы в
оперопы, регулопы и модулоны, которые могут
формировать «сети патогенности». На экспрессию
генов вирулентности влияют разнообразные регу-
ляторы, специфичные к онеронам, и факторы об-
щей регуляции. Многие регуляторы и альтерна-
тивные (7-факторы действуют совместно.
33.4.3. В регуляции экспрессии генов
вирулентности участвуют
двухкомпонентные системы
В контроле факторов вирулентности у многих па-
тогенных бактерий участвуют двухкомпонентные
регуляторные системы (см. разд. 20.4). Эти систе-
мы широко распространены у прокариот и извест-
ны у ряда эукариот. Некоторые двухкомпопепт-
ные системы известные у патогенных бактерий,
указаны в табл. 33.13 и на рис. 33.20. Например,
белок BvgS Bordetella pertussis реагирует на
различные воздействия и активирует ответный
регулятор BvgA путем фосфорилирования. Бе-
348 Часть IX. Прикладная микробиология
Таблица 33.13. Двухкомпонентные системы, контролирующие экспрессию генов вирулентности
Бактерия Двухкомпонентная система (сенсор / регулятор) Внешний стимул Контролируемые факторы вирулентности
Bordetella pertussis Pseudomonas aerugi- nosa Vibrio cholerae Salmonella enterica серовар Typhimurium Escherichia coli, другие кишечные бактерии Staphylococcus aureus Streptococcus pyogenes BvgS/BvgA AlgQ/AlgR ToxR, ToxS, ToxT PhoQ/PhoP EnvZ/OmpR AgrB/AgrA ?/VirR (Mry) Температура, никотино- вая кислота, MgSO4 Осмолярность, нитрат pH, температура, осмо- лярность Фосфат, магний Осмолярность pH, фаза роста Температура, анаэробиоз Нитевидный гемагглютинин, коклюш- ный токсин, аденилатциклазный гемо- лизин, фимбрии Альгинатная капсула Холерный токсин, Тср-пили, дополни- тельный фактор колонизации Белок PagC, другие рад- и ргд-коди- руемые белки Другие мембранные белки, ОгпрС, OmpF а-Токсин, коагулаза, белок А, фибро- нектинсвязывающий белок Белок М, пептидаза С5а
Температура Никотиновая с фат
, кислота f
р W ^|bvg| Регуляция
BvgA
Нитевидный
> гемагглютинин
Фимбрии
* Петрактин
д-Факторы
* адгезии
Ж! --------
— Токсины
\Jtordetella pertussis
Коклюшный
токсин
Циклолизин
Рис. 33.20. Двухкомпонентная регуляторная система
Bvg (Bordetella virulence genes) у В. pertussis. Различ-
ные внешние стимулы воздействуют на транскрипцию
нескольких оперонов, определяющих синтез факторов
вирулентности, через сенсор — киназу BvgS и ответный
регулятор BvgA. fha — ген нитевидного гемагглютинина;
fim — гены фимбрии; ргп — гены пертактина; ptx — ген
коклюшного токсина; суа — ген циклолизина; Р — фос-
форилирование.
лок BvgA—это ДНК-связывающий белок, непо-
средственно активирующий ряд генов вирулент-
ности. Помимо белков BvgS и BvgA, в передаче
сигнала у В. pertussis участвует также ряд дру-
гих регуляторов.
В регуляции генов вирулентности в ответ на
внешние стимулы у многих патогенных бактерий
участвуют двухкомпонентные регуляторные си-
стемы.
Дополнение 33.5. Примером двухком-
понентной системы, взаимодействующей
с другими регуляторами, может служить
AlgQ/AlgR-система продукции альгината у
Pseudomonas aeruginosa. Инфекциям, вы-
званным Р. aeruginosa, подвержены больные
муковисцидозом (см. разд. 33.3.7). Штаммы
Р. aeruginosa, выделенные у таких больных,
образуют альгинатные капсулы, предохраня-
ющие их клетки от фагоцитоза. а/д-Оперон
активируется при высокой осмолярности с
участием сенсора AlgQ и ответного регуля-
тора AlgR. В регуляции синтеза альгината
участвуют также и другие факторы, напри-
мер альтернативный <7-фактор AlgU (гомолог
RpoE).
33.4.4. Экспрессия генов вирулентности
регулируется также
на посттранскрипционном уровне
Экспрессия многих факторов вирулентности ре-
гулируются также на посттранскрипционном
уровне (см. разд. 18.13 и гл. 19). Ниже описыва-
ются типичные примеры такой регуляции.
Эффективность трансляции □ Гены ctxA
и ctxB, кодирующие субъединицы А и В холерного
токсина, расположены в одном опероне, действу-
ющем под контролем одного промотора. Сайт свя-
зывания с рибосомой (Rbs) в молекуле мРНК, ко-
Глава 33. Медицинская микробиология 349
дирующей В-субъединицу, характеризуется более
высокой эффективностью по сравнению с Rbs в
мРНК— продукте гена ctxA. Это приводит к син-
тезу этих двух субъединиц токсина в различных
количествах.
Трансляционная пауза □ Гены argU и
1еиХ, кодирующие редко используемые аргинино-
вую и лейциновую тРНК, участвуют в экспрессии
фимбрий I типа у Е. coli и S. typhimurium, веро-
ятно посредством того, что вызывают трансляци-
онную паузу.
Антисмысловая РНК □ Белки ОтрС и
OmpF наружной мембраны выполняют суще-
ственную роль в вирулентности энтеробактерий,
например S. typhimurium. Экспрессия кодирую-
щих эти белки генов контролируется двухкомпо-
нентной системой EnvZ/OmpR (см. рис. 20.18).
На противоположной гену отрС цепи ДНК с
промотора, регулируемого совместно с промото-
ром отрС, транскрибируется небольшая по раз-
мерам РНК MicF. Это антисмысловая РНК, ко-
торая препятствует инициации трансляции мРНК
гена ompF.
Посттрансляционный процессинг бел-
ков, важных для вирулентности □ Приме-
рами посттрансляционного процессинга белков
(см. разд. 19.3) могут служить N-метилирование
основной субъединицы фимбрий IV типа
V. cholerae, Р. aeruginosa и других патогенных
бактерий, активация токсинов А-В-типа у раз-
личных видов бактерий путем протеолитического
расщепления и ацилирование о-гемолизина в слу-
чае уропатогенных штаммов Е. coli.
Синтез многих белков, определяющих виру-
лентность, зависит от различных механизмов
посттранскрипционной регуляции и посттранс-
ляционного процессинга.
33.5. Диагностика, терапия и профилактика: проблемы и новые подходы
Точная и быстрая идентификация патогенных
бактерий и выявление их свойств становятся все
более важны для борьбы с инфекционными забо-
леваниями. Эти и другие практические аспекты
медицинской микробиологии рассматриваются в
данном разделе.
33.5.1. Способы идентификации возбудителей
инфекций совершенствуются благодаря
применению новых методов
В клинической микробиологии существенное зна-
чение имеет идентификация патогенных мик-
роорганизмов в исследуемом материале, напри-
мер образцах крови, мочи, кала или тканей.
При исследовании необходимо быстро опреде-
лить присутствие в образце патогенных орга-
низмов и их систематическую принадлежность.
Классические методы идентификации микроор-
ганизмов включают окрашивание и микроско-
пию препаратов, а также посев образцов на
селективные среды и дифференциальную диа-
гностику полученных культур на основе биохи-
мических тестов (см. разд. 29.3). Существуют
специальные способы окрашивания (например,
по Цилю-Нильсену для идентификации микобак-
терий) и специальные среды (например, агар
Макконки, эозин-метиленовый агар и обогащен-
ный бульон, ENB), облегчающие идентификацию.
С целью выявления анаэробных возбудителей за-
сеянные среды инкубируют в условиях без до-
ступа кислорода. Для постановки биохимических
тестов применяют специальные тестовые наборы
(всего в наборе может быть до 80 тестовых сред, в
том числе, например, для определения способно-
сти к сбраживанию глюкозы, образованию серо-
водорода или использованию цитрата), которые
помогают определять дифференцирующие при-
знаки микроорганизмов.
Кроме того, для идентификации патогенных
микроорганизмов разработаны иммунологичес-
кие тесты. В них используются флуоресцентно
окрашенные поликлональные и моноклональные
антитела (см. разд. 33.2.2) против молекул по-
верхности бактериальных клеток (например, бел-
ков наружной мембраны, жгутиков или фимбрий)
(рис. 33.21). Флуоресцентная микроскопия осо-
бенно полезна для идентификации труднокуль-
тивируемых возбудителей, таких как Legionel-
350 Часть IX. Прикладная микробиология
Рис. 33.21. Флуоресцентно окрашенные клетки пато-
генного штамма Escherichia coli. Культура Е. coli IHE
303, выделенная от новорожденного, больного менинги-
том ;окраска с применением конъюгированных с изотио-
цианатом антител против вещества капсулы К1-типа.
la pneumophila, Chlamydia trachomatis и Bacillus
anthracis. Напротив, антигены (в том числе ре-
комбинантные белки) используют для определе-
ния антител, специфичных к тем или иным воз-
будителям, в жидкостях тела, например в сыво-
ротке крови. В целях диагностики применяются
также метод Вестерн-блоттинга, анализ с приме-
нением связанного с ферментом иммуносорбента
(ELISA, от enzyme-linked immunosorbent assays) и
радиоиммунологический анализ (РИА). С помо-
щью фенотипических тестов, например на гемаг-
глютинацию и гемолиз, оценивают патогенный
потенциал бактерий. Это важно для проверки
факультативно патогенных бактерий на образова-
ние факторов вирулентности, чтобы можно было
быстро отличить их от безопасных штаммов того
же вида.
Для идентификации патогенных организмов,
помимо прочего, используются методы, основан-
ные на технологии рекомбинантной ДНК, в том
числе метод гибридизации in situ с использо-
ванием рРНК-специфичных зондов в ком-
плексе с флуоресцентным красителем. Произве-
сти идентификацию возбудителей в образцах от
больных позволяет метод полимеразной цепной
реакции (ПЦР; см. рис. 17.18) с применением
олигонуклеотидных праймеров против видоспе-
цифичных областей генов рРНК или других ви-
доспецифичных генов. Этот метод полезен, на-
пример, для идентификации некультивируемых
микроорганизмов, таких как нетипичные ми-
кобактерии, путем гибридизации с указанными
праймерами in situ, а также для выявления па-
тогенных бактерий в окружающей среде. Некото-
рые микроорганизмы присутствуют в природной
среде как жизнеспособные, но некультивиру-
емые формы (viable, but not culturable, VBNC),
т. e. в таком состоянии, которое представляет со-
бой способ выживания. В частности, это харак-
терно для грамотрицательных бактерий в бедной
среде (см. гл. 28) и наблюдается у таких патоген-
ных бактерий, как V. cholerae, Shigella dysenteriae
и Salmonella enterica', в этом случае они могут
быть идентифицированы только с помощью ме-
тода ПЦР, гибридизации in situ или иммунологи-
ческих методов.
Для идентификации патогенных микроор-
ганизмов в образцах от больных и для опреде-
ления факторов вирулентности применяют раз-
нообразные методы, в том числе окраши-
вание, микроскопию, посев на диагностические
среды и иммунологические тесты. С целью опре-
деления патогенного потенциала бактерий про-
водят фенотипические тесты. Для идентифи-
кации некультивируемых микроорганизмов (см.
разд. 29.4 и 29.5) используют молекулярные мето-
ды, основанные на применении олигонуклеотид-
ных зондов.
К важным эпидемиологическим задачам от-
носится выявление источников и путей распро-
странения патогенных микроорганизмов. Особое
значение это имеет для борьбы с внутриболь-
ничными инфекциями, а также инфекционными
болезнями, вызванными бактериями из окружа-
ющей среды (например, болезнью легионеров).
При вспышках инфекционных заболеваний для
определения возбудителя используют такие
классические методы, как серотппирование, ли-
зотипировапие и бактериоципотипирование, а
также определение антигенов наружной мем-
браны и изоэлектрофокусирование ферментов.
В последнее время получили развитие методы
молекулярной эпидемиологии, основанной
на анализе генома. Это комплексный подход
к дифференциации штаммов бактерий, вклю-
чающий, в том числе, фингерпринтинг (ана-
лиз последовательностей) плазмид. Кроме того,
этот подход предполагает использование мето-
да ПДРФ (анализ полиморфизма длины рест-
рикционных фрагментов) и Саузерн-блот-гиб-
ридизацию с применением специфичных зон-
Глава 33. Медицинская микробиология 351
Таблица 33.14. Распространенные антибиотики, используемые в терапии, и их мишени
Мишень/Название Химическая природа Микроорганизмы, против которых эффективен данный антибиотик
Синтез клеточной стенки Ампициллин Метициллин Оксациллин Пенициллин G Цефотаксим Ванкомицин Тейкопланин Синтез белка Гентамицин Канамицин Стрептомицин Эритромицин Кларитромицин Хлорамфеникол Доксициклин Синтез нуклеиновых кислот Офлоксацин Ципрофлоксацин Рифампицин Метаболизм Триметоприм Пенициллин (/3-лактам) Пенициллин (Д-лактам) Пенициллин (/3-лактам) Пенициллин (/3-лактам) Цефалоспорин (/3-лактам) Циклический гликопептид Циклический гликопептид А миногликозид Аминогликозид А миногликозид Макролид Макролид Ароматическое соединение Тетрациклин Хинолон Хинолон Комплексный поликетид 2,4-Диамино-5- (3,4,5-три- метоксибензи л) пиримидин Грамотрицательные бактерии (например, Escherichia coli) Грамположительные бактерии (например, стафи- лококки) Грамположительные бактерии (например, стафи- лококки) Enterococcus pneumoniae Грамотрицательные бактерии Грамположительные бактерии (например, Staphylococcus aureus, Clostridium difficile) Грамположительные бактерии (например, Staphylococcus aureus, Clostridium difficile) Грамотрицательные бактерии Грамотрицательные бактерии Грамотрицательные бактерии Грамположительные бактерии, Legionella spp. Грамположительные бактерии Грамотрицательные бактерии Микоплазмы Грамотрицательные бактерии Грамотрицательные бактерии Грамположительные бактерии (например, Staphylococcus epidermidis, микобактерии) У ропатогенные бактерии
дов (см. разд. 29.4). Весьма важен для эпи-
демиологических исследований анализ генома
штаммов с помощью гель-электрофореза в пуль-
сирующем поле (см. разд. 29.4). Этот метод
включает расщепление ДНК рестрицирующими
эндонуклеазами на крупные фрагменты и их по-
следующее разделение с помощью электрофореза.
Для анализа генома используют также различ-
ные методики ПЦР с применением консерватив-
ных олигонуклеотидных праймеров, позволяю-
щие быстро дифференцировать штаммы одного
вида. Используя подобные методы, можно опре-
делять патогенные бактерии в природных об-
разцах (например, Legionella pneumophila), в пи-
щевых продуктах (например, Salmonella enterica
серовар Enteritidis), в различных пробах для вы-
явления возбудителей внутрибольничных инфек-
ций (например, Staphylococcus epidermidis) и др.
Присутствие патогенных бактерий в окружаю-
щей среде и в больницах определяют с примене-
нием методов анализа генома, в том числе гель-
электрофореза в пульсирующем поле.
33.5.2. Для лечения бактериальных
инфекционных болезней
применяют антибиотики
Антибиотики — это продуцируемые микроорга-
низмами низкомолекулярные соединения, вызы-
352 Часть IX. Прикладная микробиология
вающие гибель или подавление роста других
организмов, например бактерий. Большинство
антибиотиков, используемых в медицине, про-
дуцируется бактериями, главным образом рода
Streptomyces, и грибами (см. гл. 27). Антибио-
тики, вызывающие гибель бактерий, называют
бактерицидными веществами, антибиотики,
подавляющие их рост — бактериостатически-
ми веществами. Эффективными в качестве ле-
карственных препаратов считаются антибиотики,
которые воздействуют на широкий круг микро-
организмов и при этом обладают лишь мини-
мальной токсичностью для человека, т. е. ми-
шенями их действия являются преимущественно
молекулы, отсутствующие у эукариот. Большин-
ство антибиотиков, используемых в медицине
(табл. 33.14), действует на специфические бакте-
риальные мишени (см. рис. 33.22, А на цв. вклей-
ке и разд. 15.3.4).
Синтез клеточной стенки □ Одна из ос-
новных мишеней действия антибиотиков — это
бактериальная клеточная стенка, специфическая
для прокариот, а именно процессы ее синтеза.
Многие антибиотики подавляют синтез пептидо-
гликанов. /3-Лактамные антибиотики (например,
пенициллины и цефалоспорины) подавляют реак-
цию транспептидации — этап перекрестного свя-
зывания при биосинтезе пептидогликана (см.
разд. 23.1). Гликопептидные антибиотики, на-
пример ванкомицин и тейкопланин, подавляю-
щие другие этапы синтеза пептидогликана (см.
разд. 23.1), особенно важны для лечения инфек-
ционных болезней, вызванных различными штам-
мами Staphylococcus aureus и другими грамполо-
жительными патогенными бактериями.
Синтез белка □ Мишенью действия многих
антибиотиков являются бактериальные 708-ри-
босомы и соответственно синтез белка. Будучи
специфичными только к 708-рибосомам, эти ан-
тибиотики не действуют на 808-рибосомы млеко-
питающих. Механизмы действия таких антибио-
тиков, например стрептомицина и других ами-
ногликозидов, тетрациклинов, хлорамфеникола и
макролидов, описаны в разд. 15.3.4.
Синтез нуклеиновых кислот у бактерий
также может подавляться антибиотиками. Ан-
тибиотики хинолоны, используемые для лече-
ния инфекционных болезней, вызываемых гра-
мотрицательными бактериями, связываются с
В-субъединицей ДНК-гиразы, подавляя таким об-
разом репликацию ДНК (см. разд. 14.1). Хино-
лоны более интенсивно, чем большинство других
антибиотиков, проникают в макрофаги и грану-
лоциты и, следовательно, эффективны для ле-
чения болезней, возбудители которых выжива-
ют в фагоцитах. Рифампицин — один из немногих
антибиотиков, эффективных для лечения тубер-
кулеза, — действует путем подавления ДНК-зави-
симых РНК-полимераз.
Метаболизм □ Другие антибиотики дей-
ствуют как ингибиторы ферментов, участвую-
щих в метаболизме бактерий. Например, тримето-
прим подавляет образование тетрагидрофолиевой
кислоты. Сходным образом действуют синтети-
ческие антибактериальные препараты семейства
сульфамидов.
Антибиотики — это низкомолекулярные со-
единения, вызывающие гибель бактерий или по-
давляющие их рост. Синтез антибиотиков осу-
ществляют некоторые бактерии и грибы. Анти-
биотики действуют на специфические мишени,
ингибируя синтез клеточной стенки, белка или
нуклеиновых кислот.
33.5.3. Появление устойчивых к антибиотикам
патогенных бактерий вызывает
необходимость разработки новых
лекарственных препаратов
Для проведения лечения важно располагать дан-
ными о чувствительности возбудителей к про-
тивомикробным препаратам. Чувствительность
определяют с помощью дисков из фильтроваль-
ной бумаги, пропитанных растворами антибио-
тиков в известных концентрациях. Эти диски
помещают на агаровую среду в чашках Петри,
засеянную анализируемым микроорганизмом.
Чтобы определить минимальную ингибиру-
ющую концентрацию (МИК) антибиотика,
используют его серийные разведения. В низких
концентрациях препараты антибиотиков не влия-
ют на рост, тогда как в более высоких подавляют
размножение бактерий.
Многие патогенные бактерии, вызывающие
тяжелые инфекционные болезни, способны при-
обретать устойчивость к противомикробным
препаратам. Так, грамотрицательные бактерии,
например Е. coli или Р. aeruginosa, могут об-
наруживать устойчивость к одному или несколь-
ким антибиотикам (мультирезистентность). В по-
Глава 33. Медицинская микробиология 353
следнее время у все большего числа, грамположи-
тельных возбудителей выявляется устойчивость
к метициллину (пример — Staphylococcus aureus)
или ванкомицину (пример— Enterococcus faecalis).
Другая медицинская проблема связана с возрас-
танием числа устойчивых к пенициллину пневмо-
кокков. Кроме того, относительно большое число
патогенных микобактерий обладает устойчиво-
стью к рифампицину или изониазолу. Механиз-
мы устойчивости различаются в зависимости от
противомикробных препаратов и конкретных ор-
ганизмов.
Ферментативная инактивация антибио-
тиков □ Один из основных механизмов устой-
чивости грамположительных бактерий к /?-лак-
тамным антибиотикам — это действие (3-лактамаз,
расщепляющих ^-лактамное кольцо и таким об-
разом инактивирующих антибиотик. Гены, коди-
рующие /3-лактамазы (Ыа), локализованы в плаз-
мидах устойчивости (R-плазмиды) или в хромо-
соме, где они могут подвергаться амплификации,
приводящей к повышению уровня /3-лактамазы.
Устойчивость некоторых бактерий к аминоглико-
зид ным антибиотикам обусловлена инактивацией
их модифицирующими ферментами (например,
хлорамфеникол-ацетилтрансферазой, ХАТ), при-
соединяющими к молекулам антибиотиков специ-
фические группы (фосфорильную, ацетильную и
ДР-)-
Модификация мишеней антибиотиков □
В случае чувствительных бактерий /?-лактамные
антибиотики связываются с так называемы-
ми пенициллин-связывающими белками (РВР) в
бактериальной клеточной стенке. Устойчивость
стафилококков к метициллину обусловлена при-
сутствием у них модифицированного РВР2
(кодируемого геном тес А), который нс спосо-
бен связываться с антибиотиком. Устойчивость
к ванкомицину обусловлена наличием одного из
двух оперонов — иапА и иапВ, которые у энте-
рококков регулируются двухкомпонентной систе-
мой. Включение Ала-D-гидроксибутирата вместо
D-Ала-В-Ала в пептидогликан приводит к по-
явлению устойчивых к ванкомицину штаммов.
Модификация 23S-pPHK в составе рибосом
и рибосомных белков (например, L11 в слу-
чае устойчивых к стрептомицину мутантов
Е. coli) обусловливает устойчивость патоген-
ных бактерий к антибиотикам-макролидам и
тетрациклину. Кроме того, устойчивость может
быть обусловлена точковыми мутациями в гене
В-субъединицы ДНК-гиразы (в случае хиноло-
нов) и в гене В-субъединицы РНК-полимеразы
(в случае рифампицина).
Активное выведение антибиотиков □
Устойчивость к тетрациклину может обеспечи-
ваться механизмом выведения его из цитоплазмы.
Сходный механизм обнаружен у стафилококков,
устойчивых к антибиотикам-макролидам.
Точковые мутации □ Одной из причин
устойчивости к определенному антибиотику яв-
ляется наличие точковых мутаций у отдельных
штаммов. Например, в больницах могут распро-
страняться штаммы Е. coli, ставшие устойчивыми
к хинолонам в результате мутации. Встречаются
также мультирезистентные штаммы.
Горизонтальный пренос генов □ Мульти-
резистентные штаммы могут образовываться в
результате горизонтального переноса генов при
трансформации, обмене копъюгативными плаз-
мидами или фагами (см. разд. 14.3.2 и 14.4.2).
Так, повышенная устойчивость к пенициллину
у клинических изолятов Enterococcus pneumoniae
возникает вследствие распространения (путем
трансформации) хромосомных генов, кодирую-
щих модифицированный пенициллинсвязываю-
щий белок.
Конъюгативные транспозоны и плазми-
ды □ Гены устойчивости (например, tetM, коди-
рующий устойчивость к тетрациклину, или опе-
рон г ап В, ответственный за устойчивость к ванко-
мицину) могут входить в состав конъюгативных
транспозонов. Такие транспозоны размерами
65-160 т.п.н. локализованы в хромосоме у грам-
положительных бактерий и некоторых штаммов
грамотрицательных бактерий рода Bacteroides.
Они подвергаются сайт-специфическому выре-
занию, затем образуют ковалентно замкнутое
кольцо и в этой форме переносятся в клетки
других штаммов, где могут интегрироваться в
хромосому. Плазмиды, несущие гены устой-
чивости к антибиотикам (R), часто распро-
страняются посредством конъюгации. У многих
бактерий R-плазмиды имеют комплексный состав
(рис. 33.23; см. цв. вклейку) и включают ком-
плексные транспозоны, такие как транспозон
класса I Tn/б, состоящий из гена устойчиво-
сти к тетрациклину и двух элементов IS10, или
транспозоны класса II, такие как Тп21. У отдель-
ных штаммов гены устойчивости входят в состав
интегронов — генных кассет, несущих гены
устойчивости и гены интегразы. Гены интегра-
354 Часть IX. Прикладная микробиология
зы обеспечивают активацию генов устойчивости
посредством сайт-специфической рекомбинации.
Предположительно некоторые из генов устойчи-
вости к антибиотикам могут происходить из бак-
терий — продуцентов антибиотиков, таких как ви-
ды родов Streptomyces или Bacillus. Например,
фермент 6-аминогликозид-фосфотрансфераза,
которым обусловлена устойчивость Е. coli к ами-
ногликозидным антибиотикам, в высокой степени
гомологичен этому ферменту Streptomyces fradiae.
Распространение генов устойчивости к ан-
тибиотикам среди патогенных бактерий резко
ускоряется в результате горизонтального пере-
носа генов. Наиболее серьезную проблему для
клинической медицины представляют мультире-
зистентные штаммы.
В целом лишь небольшая доля бактерий устой-
чива к антибиотикам. Однако в больницах чис-
ло устойчивых штаммов весьма значительно в
результате интенсивного отбора. Одним из спо-
собов борьбы с этим может быть введение бо-
лее жестких правил гигиены в больницах, по осо-
бенно важно в связи с ростом числа случаев
внутрибольничных инфекций использовать для
лечения комбинации различных препаратов и из-
бегать употребления их без необходимости, на-
пример при лечении вирусных инфекций. Для
предотвращения дальнейшего отбора устойчивых
штаммов следует также резко сократить исполь-
зование антибиотиков как добавку в корма для
животных.
С целью поиска новых противомикробных
соединений осуществляются программы скри-
нинга, в соответствии с которыми исследуются
образцы почв, пробы морской воды, насекомые,
тропические растения и другие экзотические объ-
екты. Кроме того, поиск новых антибактери-
альных соединений производится в химических
библиотеках. Одно из направлений исследова-
ний — это разработка препаратов, поражающих
новые мишени в микробных клетках, например
жизненно важные ферменты клеточного мета-
болизма (такие как АТРазы) или структурные
белки клеточной поверхности. Помимо веществ,
обладающих бактерицидным или бактериоста-
тическим действием, исследуются новые лекар-
ственные препараты, способные прерывать па-
тогенез (рис. 33.22, Б). Такие препараты могут
непосредственно препятствовать действию фак-
торов вирулентности (например, путем блокады
колонизации, обусловленной адгезией, или подав-
ления ферментативной активности токсинов; см.
разд. 33.2.1 и 33.2.3) либо их секреции (например,
путем воздействия на секрецию факторов инвазии
III типа; см. разд. 33.2.2). Кроме того, как потен-
циальные мишени исследуются регуляторы тран-
скрипции и путей передачи сигналов (например,
гистидипкиназы или фосфатазы двухкомпонент-
ных регуляторных систем и фосфотрансферазных
систем).
Разработка новых подходов к поиску новых
противомикробных веществ и альтернативных
мишеней действия антибиотиков позволит, воз-
можно, создать новые препараты для лечения ин-
фекционных болезней.
33.5.4. Вакцины как средство защиты
от возбудителей инфекций
Эффективным способом защиты населения от ин-
фекционных болезней служит вакцинация. Со
времени опытов, проведенных Э. фон Берингом
(von Behring), который доказал роль «антиток-
синов» в предупреждении дифтерии, разработа-
но множество вакцин. Осуществление программ
вакцинации помогло существенно ограничить рас-
пространение инфекционных болезней. Тем не
менее существует острая потребность в новых
вакцинах против основных инфекционных заболе-
ваний. Создание вакцин против патогенных бак-
терий осуществляется по разным направлениям,
с учетом того что иммунитет к возбудителям ин-
фекций может быть индуцирован двумя путями.
1. Пассивная иммунизация. Этот метод со-
стоит во введении антисыворотки против воз-
будителя инфекции или потенциального фак-
тора вирулентности, например антисыворотки
против столбнячного токсина. Пассивная им-
мунизация служит средством терапии.
2. Активная иммунизация. Производится пу-
тем инъекции антигена, вызывающего образо-
вание защитных антител и/или Т-клеток, на-
пример инактивированного столбнячного ток-
сина (называемого анатоксином). Активная
иммунизация ведет к выработке иммунитета
и служит средством профилактики.
Глава 33. Медицинская микробиология 355
Таблица 33.15. Примеры вакцин против инфекционных заболеваний, вызываемых бактериями
Возбудитель заболевания Заболевание Тип вакцины
Corynebacterium diphtheriae Clostridium tetani Bordetella pertussis Salmonella typhi Mycobacterium tuberculosis Haemophilus influenzae b Neisseria meningitidis Enterococcus pneumoniae Дифтерия Столбняк Коклюш Брюшной тиф Туберкулез Менингит Менингит Пневмония Анатоксин Анатоксин Инактивированные бактерии Инактивированные бактерии; аттенуированные живые бактерии Ослабленные живые бактерии (Mycobacterium bovis штамм BCG) Конъюгат полисахарида с белком Конъюгат капсульного полисахарида с белком Конъюгат капсульного полисахарида с белком
Материал, используемый для индукции ак-
тивного иммунитета, называется вакциной.
В идеале вакцина должна быть безопасной для
человека, эффективной и простой в применении.
Кроме того, она должна подходить для использо-
вания в комбинации с другими вакцинами. Разра-
ботаны разнообразные стратегии применения вак-
цин. Перечень имеющихся вакцин, используемых
для иммунизации против бактериальных инфек-
ций, приведен в табл. 33.15.
В качестве вакцин используют: очищенные
препараты компонентов микробных клеток,
например полисахариды клеточных стенок; хи-
мически обезвреженные токсины (анатокси-
ны); инактивированные микроорганизмы,
т. е. интактные, но нежизнеспособные клетки (так
называемые убитые вакцины) и живые аттенуи-
рованные (ослабленные) микроорганизмы,
представляющие собой либо штамм возбудителя
с ослабленной (в результате мутации) вирулент-
ностью (например, Salmonella typhi Ту21а, вакци-
на против брюшного тифа), либо вид, родствен-
ный возбудителю данной инфекции (например, М.
bonis шт. BCG, противотуберкулезная вакцина).
Ослабленные штаммы Salmonella enterica, несу-
щие мутации в генах ферментов метаболизма (на-
пример, агоА, ригЕ) или в регуляторных генах
(phoP, сгр), используются в качестве штаммов-
носителей для экспрессии чужеродных антигенов.
Значительные усилия сосредоточены на созда-
нии новых вакцин, в частности, против возбу-
дителей инфекций желудочно-кишечного тракта
Vibrio cholerae и Helicobacter pylori (табл. 33.16).
При этом все шире применяются молекулярные
методы. В качестве материала для вакцин исполь-
зуют синтетические пептиды, представляю-
Таблица 33.16. Примеры бактериальных инфекционных
болезней, против которых создаются вакцины
Заболевание Возбудитель
Кишечные инфек- ции Проказа Язва желудка Лаймская болезнь Менингит Пневмония Vibrio cholerae Shigella spp. Патогенные штаммы Escherichia coli Salmonella enterica Mycobacterium leprae Helicobacter pylori Borrelia burgdorferi Neisseria meningitidis (совер- шенствование вакцины) Streptococcus pneumoniae (совер- шенствование вакцины)
щие собой эпитопы определенных антигенов,
или рекомбинантные антигены. Векторами
для экспрессии антигенных фрагментов служат
ослабленные штаммы бактерий, несущие сайт-
специфические интродуцированные мутации, т. е.
живые векторы. Кроме того, разрабатываются
вакцины из нуклеиновых кислот, а именно
последовательностей ДНК, содержащих клониро-
ванные гены сильных антигенов. Как установле-
но на животных, при введении таких рекомби-
нантных ДНК в организм-хозяин кодируемые ими
антигены экспрессируются, присутствуют на по-
верхности антигенпрезентирующих клеток и вы-
зывают развитие иммунитета.
Вакцинацию применяют для того, чтобы вы-
звать активный иммунитет против инфекцион-
ных агентов. Пассивный иммунитет индуциру-
356 Часть IX. Прикладная микробиология
ют путем введения антисыворотки (сыворотки
крови, содержащей защитные антитела). Для ак-
тивной иммунизации против различных патоген-
ных организмов применяют вакцины в виде ком-
понентов микробных клеток, убитых клеток или
живых клеток микроорганизмов.
33.6. Прокариоты и медицина: тенденции и направления
дальнейших исследований
Благодаря развитию и применению методов мо-
лекулярной биологии наши знания о возбудите-
лях инфекций и факторах их вирулентности су-
щественно расширились. Наибольшие успехи до-
стигнуты в изучении факторов вирулентности
(разд. 33.3) и регуляции генов, связанных с ви-
рулентностью (разд. 33.4). Подходы, развиваемые
в клеточной биологии, будут полезны для иссле-
дования путей передачи сигналов, индуцируемых
патогенными микроорганизмами в клетках хозяи-
на. В то же время необходим поиск более глубоких
подходов к исследованию экспрессии генов виру-
лентности in vivo и факторов организма-хозяина,
влияющих на передачу сигнала и регуляцию ге-
нов, ассоциированных с вирулентностью. Для вы-
явления генов, участвующих в вирулентности in
vivo, проводят селекцию штаммов с использова-
нием живых организмов-хозяев.
Применяемый при этом метод IVET (от in
vivo expression technology — технология экспрес-
сии in vivo) основан на слиянии гена ригА
Salmonella typhimurium (ключевой ген домашнего
хозяйства, участвующий в метаболизме нуклеоти-
дов) с промоторами исследуемых генов, функция
которых неизвестна (см. разд. 20.1.3). При их вве-
дении мышам должны выживать только те бак-
терии, у которых гены риг А транскрибируются,
т. е. данный промотор активен в организме хозя-
ина. С помощью этого подхода выделен ряд ге-
нов, однако, как и ожидалось, большинство из
них кодирует белки с метаболическими функци-
ями. Метод получения транспозонных мутантов с
введением маркеров (signature-tagged mutagenesis,
STM; рис. 33.24) позволяет производить отбор
мутантов, которые не способны выживать в ор-
ганизме мыши после мутагенеза с применением
транспозонов. Каждый мутант несет при этом в
качестве маркера специфическую последователь-
ность, позволяющую выявлять его после введения
мышам. Таким путем выявлен ряд неизвестных
ранее генов S. typhimurium, по-видимому выпол-
няющих ключевую роль в вирулентности in vivo
и способных служить новыми мишенями лекар-
ственных препаратов.
Весьма перспективны программы секвени-
рования геномов патогенных бактерий. Пер-
вым был полностью секвенирован геном патоген-
ного для человека вида Haemophilus influenzae
и вслед за ним геномы других патогенных ви-
дов, таких как Mycoplasma genitalium, Helicobacter
pylori, Escherichia coli и Staphylococcus aureus.
Проводится секвенирование геномов Enterococcus
pneumoniae, Treponema pallidum и Mycobacterium
tuberculosis. Эти работы служат источником но-
вых данных о генах, связанных с синтезом, транс-
портом и регуляцией факторов вирулентности.
Применение новых методов расширит наши
знания о взаимодействии организма-хозяина с
возбудителями инфекций и будет способство-
вать разработке новых лекарственных препара-
тов, вакцин и средств диагностики.
Некоторые патогенные бактерии попадают в
организм человека из окружающей среды — либо
через «технические векторы» (например, конди-
ционеры воздуха в случае Legionella pneumophila)
и загрязненную воду или пищу (например,
Vibrio cholerae, сальмонеллы) либо при уча-
стии организмов-переносчиков (как, например,
Borrelia burgdorferi). Кроме того, во внешней
среде могут сохраняться штаммы, вызывающие
внутрибольничные инфекции. Сведения об эко-
логии патогенных микроорганизмов весь-
ма ограничены, и требуется интенсивная разра-
ботка этого направления, в том числе вопросов,
касающихся природных местообитаний патоген-
ных бактерий (например, шигелл), а также вза-
имосвязей в природных экосистемах между па-
тогенными и непатогенными микроорганизмами
Глава 33. Медицинская микробиология 357
Рис. 33.24. Схема метода маркерно-
го транспозонного мутагенеза (signature-
tagged mutagenesis, STM). Синтезируют
олигонуклеотиды, используемые в каче-
стве маркеров, и амплифицируют их с
помощью полимеразной цепной реакции
(ПЦР). Каждый такой маркер состоит
из специфической центральной последо-
вательности и фланкирующих ее краевых
участков, общих для всех маркеров. Прай-
меры А и В обеспечивают возможность
амплификации центрального участка и
его радиоактивного мечения для исполь-
зования в качестве зонда. ДНК-маркеры
сшивают с транспозоном и обрабатыва-
ют полученными вариантами транспозо-
нов исследуемый штамм патогенной бак-
терии (транспозонный мутагенез). Клетки
мутантных штаммов вносят в лунки план-
шета для микротитрования. Объединен-
ным пулом мутантов заражают животное.
Анализ блот-гибридизации с использова-
нием радиоактивно меченных ДНК-мар-
керов из инокулята (входной пул) и из
колоний бактерий, выделенных из зара-
женного животного (возвратный пул) поз-
воляет идентифицировать мутанты, ли-
шенные вирулентности (не выжившие в
организме-хозяине). По [3].
Встраивание
ДНК-маркеров в транспозон
Мутагенез
Патогенный штамм,
несущий пул
маркерных транспозонов
Внесение
транспозонных мутантов
в лунки планшета
для микротитрования
Входной пул мутантов
Получение реплик
на мембранах 1 и 2
*
Праймер А
Праймер В
Инвариабельный Вариабельный Инвариабельный
краевой участок участок краевой участок
Транспозон
Заражение
хозяина
Входной
пул
Возвратный
Амплификация
маркеров с
использованием
праймеров А и В
Радиоактивно
меченные
ДНК-маркеры
(зонды)
Посев из ткани
инфицированного
хозяина
— Идентификация
авирулентных мутантов
(например, амебами) как факторами выживания
возбудителей инфекций вне организма-хозяина.
Накопление сведений об экологии патогенных
бактерий позволит разрабатывать новые способы
лечения и профилактики (например, путем воз-
действия на природные источники возбудителей
инфекций).
Дополнительная литература
Aktories К., ed. (1997) Bacterial toxins. London: Chap-
man & Hall.
Amabile-Cuevas C. F., Chicurel M. E. (1992) Bacterial
plasmids and gene flux. Cell 70: 189-199.
Amann R., Ludwig W., Schleifer K.-H. (1995) Phyloge-
netic identification and in situ detection of individual
microbial cells without cultivation. Microbiol. Rev.
59: 143-169.
Bhakdi S., Tranum-Jensen J. (1991) Alpha-toxin of Sta-
phylococcus aureus. Microbiol. Rev. 55: 733-751.
Brubaker R. R. (1985) Mechanisms of bacterial virulence.
Annu. Rev. Microbiol. 39: 21-50.
Dorman C. J. (1994) Genetics of bacterial virulence.
Oxford. London: Blackwell.
Dougan G. (1994) The molecular basis for the virulence
of bacterial pathogens: implication for oral vaccine
development. Microbiology 140: 215-224.
Falkow S. (1988) Molecular Koch’s postulates applied
to microbial pathogenicity. Rev. Infect. Dis. 10
(Suppl. 2): 274-276.
Falkow S., IsbergR. R., Portnoy D. A. (1992) The inter-
action of bacteria with mammalian cells. Annu. Rev.
Cell Biol. 8: 333-363.
Finley B.B., Falkow S. (1989) Common themes in
microbial pathogenicity. Microbiol Rev. 53: 210-230.
Hensel M., Holden D. W. (1996) Molecular genetic app-
roaches for the study of virulence in both pathogenic
bacteria and fungi. Microbiology 142: 1040-1058.
Isenberg II. D. (1988) Pathogenicity and virulence:
another view. Clin. Microbiol. Rev. 1: 40-53.
Miller W., Kapcr J., Portnoy D. A., IsbergR. R. (1994)
Molecular genetics of bacterial pathogenesis. A tri-
bute to Stanley Falkow. Washington DC: ASM Press.
358 Часть IX. Прикладная микробиология
Mims С. A., Dimock N., Nash A., Stephen J. (1995) Pa-
thogenesis of infectious disease, 4th edn. New York
London: Academic Press.
Muhldorfer I., Hacker J. (1994) Genetic aspects of Esche-
richia coli virulence. Microb. Pathog. 16: 171-181.
Roth J. A., Bolin C. A., Brogden K. A., Minion F. C.,
Wannemuehler M..J. (1998) Virulence mechanisms of
bacterial pathogens. Washington DC: ASM Press.
Salyers A. A., Whitt D. D (1994) Bacterial pathogenesis.
A molecular approach. Washington DC: ASM Press.
Schaechter M., Medoff G., Schlessinger D. (1989) Mecha-
nisms of microbial disease. Baltimore: Williams &
Vogt P. K., Mahan M. J. (eds.) (1998) Bacterial infec-
tions; Close encounters at the host pathogen interface.
Curr. Topics Microbiol. Immunol, vol. 225. Berlin
Heidelberg New York: Springer.
Источники рисунков
1. Bhakdi S., Tranum-.lensen J. (1991) Microbiol. Rev.
59: 143-169.
2. Amabile-Cuevas C. F., Chicurel M. F. (1992) Cell
70: 189-199.
3. Hensel M., Holden D.W. (1996) Microbiology 142:
Глава 34
Прокариоты в сельском хозяйстве
Роль прокариот в сельском хозяйстве весьма
значительна — они участвуют в биогехимических
циклах важнейших элементов, таких как С, N, S,
и в меньшей степени Р, Fe и Мп, поддерживают
плодородие и структуру почвы, а также непосред-
ственно или косвенно взаимодействуют с расте-
ниями (см. гл. 30 и 31). Прокариоты составляют
наибольшую фракцию почвенной микробной био-
массы, варьирующей от 450 до 7000 кг/га (мас-
са пахотного слоя почвы на площади один гектар
составляет 2400-2700 т). Распределение бактерий
в почве носит неравномерный характер; прикреп-
ляясь посредством внеклеточных полимерных ве-
ществ к частицам минеральных или органических
субстратов, они образуют микроколонии, т. е. оби-
тание в почве в виде отдельных клеток для них не
характерно. В некоторых почвах плотность бак-
терий может достигать 108 колониеобразующих
единиц (КОЕ) па 1 г сухой почвы, например в ри-
зосфере. Термин ризосфера, введенный в 1904 г.
Л. Хильтнером (Hiltner), обозначает узкую зону
почвы вокруг корня растения в диапазоне при-
мерно нескольких миллиметров, испытывающую
влияние корневой системы. Непосредственно по-
верхность корня — ризоплана — также обильно за-
селяется бактериями (рис. 34.1).
В конце 20 в. для повышения урожайности
культур и плодородия почв в сельском хозяйстве
начали применять живые чистые культуры мик-
Рис. 34.1 Колонизация корней растения бактериями.
Особую часть ризосферы составляет ризоплана — по-
верхность корня, на которой бактерии остаются прочно
прикрепленными после многократного отмывания. Мик-
рофотография корня пшеницы с бактериями ризопла-
ны. Шкала 10 мкм.
роорганизмов в качестве инокулятов (новый ме-
тод по сравнению с использованием смешанных
культур в форме «удобрений»). С каждым годом
использование бактериальных инокулятов увели-
чивается на значительных площадях (табл. 34.1),
и, как ожидается, их роль будет возрастать в
дальнейшем в особых системах землепользова-
Таблица 34.1. Применение микробных инокулятов для производства продуктов питания и улучшения почв
М и кроорга н изм ы Функция Обрабатываемые культуры Инокулированная площадь в среднем за год, га
Anabaena Биоудобрение Рис 2- 106
Azospirillum Биоудобрение Зерновые (в основном Triticum durum и Zea mays) и кормовые злаки 1,5-2 • 105
Rhizobium Биоудобрение Кормовые бобовые и зернобобовые 2-2,4 • 107
Frankia Биоудобрение Деревья не из семейства бобовых (Alnus, Casuarina, Myrica) 0,5-1 103
Bacillus subtilis В. thuringiensis Pseudomonas Средство биологической борьбы с вредителями Различные сельскохозяйственные культуры и деревья 0,5-1 105
360 Часть IX. Прикладная микробиология
ния, таких как рациональное сельское хозяйство
или биологическое земледелие, а также в ме-
роприятиях по очистке почв от загрязнений и
восстановлению ландшафтов. В связи с этим в
качестве потенциальных инокулятов будет созда-
ваться все больше генетически модифицирован-
ных штаммов, и поскольку их применение требует
соответствующего контроля, первый раздел этой
главы посвящен описанию методов выявления и
учета (мониторинга) прокариот в почве.
34.1. Бактерии можно определять в почве различными методами
Возможности метода рекомбинантной ДНК
для получения генетически модифицированных
штаммов с целью применения в сельском хозяй-
стве в качестве инокулятов уже продемонстриро-
ваны на бактериях родов Agrobacterium, Brady-
rhizobium, Clavibacter, Pseudomonas и Rhizobium
(табл. 34.2). При рассмотрении вопроса о внесе-
нии в окружающую среду микроорганизмов ди-
кого типа или генетически модифицированных
микроорганизмов необходимо иметь в виду, что
условиями внесения должны быть надежный, по-
стоянный и эффективный контроль за поведени-
ем интродуцированного микроорганизма и оценка
его влияния на природную экосистему, а также
возможного риска для нес (см. дополнение 34.1).
34.1.1. Для выявления и количественного учета
почвенных бактерий применяется
чашечный метод
С целью выявления, контроля и количественного
учета местных и интродуцированных микробов,
присутствующих в природных образцах, широко
используется метод подсчета бактерий путем вы-
сева разведений почвенной суспензии на агаризо-
ванные среды в чашках Петри.
Методы накопления □ Для накопления
присутствующих в почвенных образцах бакте-
рий и их количественного учета пробы куль-
тивируют на селективных средах, содержащих
такие компоненты, которые обеспечивают рост
только определенных бактерий либо подавляют
рост нежелательных микроорганизмов. Часто в
селективные среды включают антибиотики, к
которым исследуемые микроорганизмы устойчи-
вы. Для питритокисляющих бактерий селектив-
ной служит среда с KNO2 в качестве един-
ственного источника азота; для свободножи-
вущих азотфиксирующих бактерий, таких как
Azotobacter,— среда без источника связанного
азота, содержащая D-манпитол. Различные виды
Rhizobium устойчивы к теллуру, селену или на-
лидиксовой кислоте, поэтому селективными сре-
дами для Rhizobium meliloti или R. legumino-
sarum служат среды с различными комбинаци-
ями ионов металлов и антибиотиков. Обычно
Таблица 34.2. Штаммы бактерий, генетически модифицированные для использования в сельском хозяйстве
Микроорганизм Модификация Цель генетической модификации
Agrobacterium radiobacter Виды Clavibacter и Pseudomonas Bradyrhizobium japonicum Pseudomonas syringae Rhizobium meliloti Делеция генов tra из плазмиды pAgK84 Введение гена эндотоксина из Bacillus thuringiensis Введение дополнительных копий т/-генов Делеция inaZ (геи кристаллизации воды) Введение дополнительных копий т/-генов или генов усиленного транспорта дикар- боновых кисло г (гены det) Безопасность применения для борьбы с корончатым галлом Предотвращение повреждения растений насекомыми (см. разд. 34.4.2) Усиление фиксации N2 Борьба с повреждением расте- ний морозом Усиление фиксации N2
Глава 34. Прокариоты в сельском хозяйстве 361
эти среды содержат также антибиотики, подав-
ляющие рост грамположительных бактерий, пеп-
тахлорнитробензол для подавления роста актино-
мицетов и фунгициды.
Дополнение 34.1. С целью маркировки
бактерий в них вводят маркерные гены,
обычно применяя для этого гены lacZ и
gusA из Е. coli, обеспечивающие использо-
вание лактозы и ^-галактозидов или глюку-
ронидов (Gur) соответственно. Кодируемые
этими генами ферменты (/?-галактозидаза и
j0-глюкуронидаза) отщепляют также хромо-
генную группу от окрашенных субстратов
(X-Gal или X-Gur), что приводит к высвобож-
дению красителя и развитию синей окрас-
ки. В результате маркированные бактерии
можно идентифицировать по их способно-
сти образовывать на средах, содержащих
X-Gal или X-Gur, синие колонии. Согласно
имеющимся данным, в случае Pseudomonas
aureofaciens, помеченного lacZ, чувствитель-
ность описанного метода может составлять 10
клеток/г почвы. В качестве репортерного ге-
на для маркировки бактерий используют так-
же ген xylE из Pseudomonas. Этот ген кодиру-
ет катехол-2,3-диоксигеназу, активность ко-
торой обеспечивает развитие желтой окраски
в присутствии определенных окрашенных
субстратов. Еще одна удобная репортер-
ная система для генетической маркиров-
ки— это /их-гены. Кодируемые ими фермен-
ты катализируют реакции свечения — биолю-
минесценции (см. разд. 11.6). Помеченные
/ш;-генами бактерии можно выявить по флу-
оресценции, измеряемой с помощью сцинтил-
ляционного счетчика или методом радиоавто-
графии.
Для подсчета и выявления бактерий, как в
культурах, так и in situ, можно также приме-
нять ген inaZ, кодирующий белок наружной
мембраны бактерий, который вызывает об-
разование центров кристаллизации льда (см.
разд. 34.4.3). Имеются сообщения о том, что
этот метод позволяет обнаружить популяцию
бактерий величиной примерно 104 клеток на
поверхности корня.
Количественный учет □ Для контроля за
количеством микробов, внесенных в почву, необ-
ходимо, чтобы они несли генетическую метку, поз-
воляющую отличить интродуцированные микро-
бы от местной микрофлоры. Наиболее часто для
маркировки используют гены устойчивости к ан-
тибиотикам, причем не менее двух таких генов
одновременно, поскольку вероятность спонтанно-
го возникновения подобной устойчивости доволь-
но высока и, кроме того, возможен перенос генов
устойчивости. В качестве других маркеров часто
вводят репортерные гены, позволяющие опреде-
лять бактерии по той или иной ферментативной
активности, выявляемой преимущественно на ос-
нове цветной реакции или свечения (см. дополне-
ние 34.1).
Во многих случаях для подсчета бактерий
применяют чашечный метод с высевом разве-
дений на селективные среды; к его основным
преимуществам относятся простота, экономич-
ность и возможность статистического анализа
получаемых данных. Кроме того, данный метод
достаточно чувствителен (102 клеток на 1 г почвы
или ткани) для решения многих задач. Основные
недостатки метода подсчета колоний на агаровой
среде связаны с тем, что условия его эффективно-
сти (маркированный микроорганизм должен быть
способен к росту в виде культуры и маркерный
ген должен экспрессироваться) далеко не всегда
реально достижимы, поскольку многие бактерии
в природе находятся в таком физиологическом со-
стоянии, при котором они жизнеспособны, по не
могут расти на искусственных питательных сре-
дах (жизнеспособные, но некультивируемые фор-
мы). Считается, что подсчет клеток, образующих
колонии, позволяет обнаружить лишь 1-10% ви-
дов, присутствующих в природной микробной по-
пуляции, так как клетки остальных микроорга-
низмов находятся в покоящемся состоянии (см.
разд. 28.5). К тому же на точность подсчета мо-
жет влиять агрегация клеток и другие факторы,
вызывающие ошибки разведения.
34.1.2. Для прямого подсчета используют также
иммунологические и биохимические
методы
Теоретически любой клеточный компонент, спе-
цифичный для той или иной таксономической
группы, пригоден как маркер, позволяющий вы-
являть и учитывать данные микроорганизмы (см.
разд. 29.3). Эффективным и надежным инстру-
362 Часть IX. Прикладная микробиология
ментом для определения генетически модифици-
рованных микроорганизмов в окружающей сре-
де могут служить поликлональные или моно-
клональные антитела. Чувствительность имму-
нологических методов существенно повышается
благодаря использованию конъюгированных ан-
тител. Схема иммунологических тестов приведе-
на на рис. 34.2 (см. цв. вклейку). Метод ELISA
(enzyme-linked immunosorbent assay, твердофаз-
ный иммуноферментный анализ) основан на
применении антител, связанных с ферментом, на-
пример с пероксидазой или щелочной фосфата-
зой хрена, которые обусловливают специфиче-
скую цветную реакцию при добавлении субстрата.
Этот метод позволяет определять искомые клет-
ки колориметрическим методом и быстро прово-
дить скрининг сотен колоний. В равной степени
эффективны и сходные методы, основанные на ис-
пользовании антител, меченных радиоактивными
изотопами (радиоиммуиоанализ, РИА). Однако
оба эти подхода имеют ограничения в случае их
применения для прямого подсчета в природных
образцах. В отличие от этого метод флуоресцент-
ных антител (антител, конъюгированных с флу-
оресцентным красителем) в определенной степе-
ни перспективен для изучения микроорганизмов
в природных местообитаниях. Специфические ан-
титела, связанные с флуоресцентным красите-
лем, таким как флуоресцеинизотиоцианат, позво-
ляют видеть клетки, на которых они адсорбирова-
лись, во флуоресцентном микроскопе. Этот метод
успешно применяется для подсчета клубеньковых
бактерий, актиномицетов, бактерий, относящихся
к Nitrobacter и другим родам, в ризосфере и иных
природных местообитаниях.
34.1.3. Все шире используются
геномные характеристики таксонов
Методы идентификации, основанные па опреде-
лении специфических и консервативных после-
довательностей ДНК, находят все большее при-
менение и совершенствуются далее для повы-
шения чувствительности и расширения области
возможного использования. Данные, полученные
с использованием молекулярно-генетических мар-
керов и метода ПДРФ (анализ полиморфизма
длины рестрикционных фрагментов ДНК), про-
извели переворот в представлениях о генети-
ческом родстве различных таксонов прокари-
от и тем самым в системе классификации (см.
разд. 29.4 и рис. 29.17). Первоначально ПДРФ-ха-
рактеристики получали с помощью электрофоре-
за в геле и последующей Саузерн-гибридизации,
по впоследствии процедура существенно упрости-
лась благодаря использованию метода ПЦР для
амплификации полиморфных участков ДНК (см.
разд. 17.4.3). Применению этих методов, однако,
часто препятствует отсутствие данных о после-
довательностях ДНК, необходимых для создания
специфических праймеров.
К настоящему времени разработана моди-
фикация основного метода ПЦР, нс требую-
щая использования праймера со специфиче-
ской последовательностью. Это метод произволь-
но запущенной ПЦР (arbitrarily primed PCR,
AP-PCR), направляемой только одним олиго-
нуклеотидным праймером со случайной нуклео-
тидной последовательностью; он позволяет по-
лучать характерный набор амплифицированных
фрагментов ДНК для анализа степени сходства
штаммов. Имеется несколько вариантов этого
метода, различающихся главным образом в от-
ношении последовательности и длины исполь-
зуемого случайного праймера: амплификация
со случайными праймерами (RAPD-анализ, от
random amplified polimorphic DNA; см. разд. 29.4)
и фингерпринтинг амплифицированной ДНК
(DAF-анализ, от DNA amplification fingerprin-
ting). Метод AP-PCR является значительно более
быстрым и экономичным, чем анализ ПДРФ, по-
скольку позволяет осуществлять амплификацию
па основе общей фракции ДНК, выделенной непо-
средственно из почвы. Таким образом, этот метод
применим также с целью идентификации бакте-
рий, которые невозможно получить в культуре.
Для слежения (мониторинга) за бактери-
ями в почве разработаны сложные методы, при-
емлемые вместе с тем по затратам времени и
средств. Классический метод подсчета колоний на
агаровой среде в чашках Петри с высевом разве-
дений используется и сейчас, но его все больше
вытесняют современные иммунологические, био-
химические и молекулярные методы. Эти методы
чрезвычайно полезны для определения численно-
сти бактерий, а также идентификации отдельных
штаммов, культиваров, специфически маркиро-
ванных штаммов и генетически модифицирован-
ных микроорганизмов.
Глава 34 Прокариоты в сельском хозяйстве 363
34.2. Бактерии могут использоваться как биоудобрения
Биоудобрепиями называют вносимые в почву
микробные инокуляты, заменяющие химические
удобрения. В качестве биоудобрений применяют
свободноживущие, обитающие в ассоциациях или
симбиотические азотфиксирующие прокариоты,
а также эукариотические микроорганизмы, та-
кие как микоризные грибы. Грибы обеспечивают
главным образом доступность для растений фос-
фата, тогда как азотфиксирующие бактерии удо-
влетворяют потребность растений в азоте и дела-
ют их, таким образом, отчасти независимыми от
наличия в почве связанного азота.
Способность восстанавливать молекулярный
азот (N2) до аммиака (NH3) встречается только
у прокариот и широко распространена как среди
бактерий, так и среди архей (см. разд. 8.5). Одна-
ко лишь немногие бактерии образуют симбиозы с
высшими растениями, обеспечивая их азотом.
34.2.1. Клубеньковые бактерии фиксируют азот
в условиях внутриклеточного симбиоза
с бобовыми (Fabaceae;
прежнее название — Leguminosae)
Клубеньки □ Для симбиоза между бактериями
сем. Rhizobiaceae и бобовыми растениями харак-
терно образование специализированных органов
(обычно на корнях растения), называемых клу-
беньками (рис. 34.3). Клубеньковые бактерии
(Rhizobium) фиксируют молекулярный азот из
воздуха с образованием аммиака, большая часть
которого усваивается растением. Процесс форми-
рования симбиоза включает сложную последова-
тельность высокоспецифичных сигналов, которы-
ми обмениваются партнеры. Эти сигналы обес-
печивают взаимодействие только определенных
видов Rhizobium с определенными видами бобо-
вых растений (см. рис. 34.4 на цв. вклейке и
табл. 34.3).
Более 100 сельскохозяйственных бобовых рас-
тений, включая важные зернобобовые культуры
(горох, бобы, соя) и кормовые культуры (люцер-
на, клевер), относится к нескольким трибам сем.
Рис. 34 3. Симбиоз Rhizobium и бобового растения.
Показана корневая система растения Vicia faba (боб
конский) с клубеньками, образованными соответствую-
щим микросимбионтом Rhizobium leguminosarum биовар
viciae. Биовары различаются рядом физиологических
свойств.
Papilionaceae (Fabaceae). Масштаб фиксации азо-
та бобовыми растениями составляет примерно
100 кг на 1 га в год; при интенсивном земледелии
достигаются и более высокие скорости фиксации
(300-600 кг на 1 га в год). Таким образом, сим-
биотические ассоциации Rhizobium/бобовые пред-
ставляют наиболее важный для земледелия био-
логический механизм поступления азота в систе-
му почва/растение.
Бактероиды □ Последовательный обмен мо-
лекулярными сигналами между бактерией Rhi-
zobium и растением-хозяином (рис. 34.4) с уча-
стием растительных веществ-индукторов и бак-
териальных факторов нодуляцпи обеспечивает
в итоге образование на корнях растения вы-
сокодифференцированных органов — клубеньков.
Бактерии инфицируют центральные ткани расте-
ния, проникая в них по инфекционным нитям, из
которых затем внедряются в цитоплазму расти-
тельных клеток, где происходит их деление и диф-
ференцировка в азотфиксирующие бактероиды.
Бактероиды отделены от цитозоля растительных
клеток перибактероидной мембраной, имеющей
растительное происхождение. В зрелом клубень-
ке клетки растения полностью заполнены бакте-
роидами (рис. 34.5). Они получают от растения
питательные вещества, образующиеся при фото-
синтезе в листьях, и в свою очередь обеспечива-
ют растение связанным азотом в форме аммиака.
1 Это ошибочное замечание. Данное семейство относится к числу тех немногих семейств, для которых допускается исполь-
зование более одного научного названия (т. е. так называемых альтернативных названий); поэтому название Leguminosae,
как и Papilionaceae, не является «прежним». — Прим, перев.
364 Часть IX. Прикладная микробиология
Таблица 34.3. Виды Rhizobium и их растения-хозяева. Таксономическая классификация внутри сем. Rhizobiaceae
постоянно совершенствуется. Например, некоторые ризобии из фасолевой группы, вызывающие образование клу-
беньков у Phaseolus vulgaris и Leucaena sp., отнесены в настоящее время к новому виду—Rhizobium tropici. Для
фотосинтезирующих ризобиев, выделенных из стеблевых клубеньков Aeschenomene, предложен новый род Photorhi-
zobium. Приведенный список видов Rhizobium и их растений-хозяев неполный
Род/вид Растен и я-хозяева Русские названия растений
Rhizobium leguminosarum биовар viciae биовар phaseoli биовар trifolii Rhizobium meliloti (= Sinorhizobium meliloti) Rhizobium loti Rhizobium galegae Rhizobium spp. Bradyrhizobium japonicum Bradyrhizobium spp. Azorhizobium caulinodans Sinorhizobium fredii Pisum, Lens, Vida Phaseolus Trifolium Medicago, Melilotus, Trigonella Lotus Galcga Leucaena, Acada, Robinia Glycine Cajanus, Vigna, Arachis, Macroptilium Стеблевые и корневые клубеньки Sesbania Glycine Горох, чечевица, вика Фасоль Клевер Люцерна, донник Лядвенец Акация Соя Вигна, арахис Сесбания Соя
Со временем клубеньки стареют, т. е. бактероиды
и клетки растения-хозяина подвергаются процес-
сам деградации.
Строение и физиологические характеристи-
ки клубенька обеспечивают поддержание в нем
низкой концентрации кислорода. Убедитель-
но доказано существование физического барье-
ра для диффузии кислорода из наружных сло-
ев клубенька. Наличие этого барьера вместе с
высокой дыхательной активностью бактероидов
приводит к снижению концентрации кислорода
внутри клубенька до 30 нМ (вне клубенька опа
составляет 250 мМ). Чтобы обеспечить бактерои-
ды достаточным для дыхания количеством кис-
лорода, непосредственно после начала азотфик-
сации растение инициирует синтез специального
белка — леггемоглобина, обладающего высоким
сродством к кислороду.
Гены нодуляции (nod) □ Гены клубенько-
вых бактерий, ответственные за образование спе-
цифических факторов нодуляции (образования
клубеньков), называют nod-генами. Соответству-
ющие опероны не обособлены и часто находятся
среди других генов, таких как nif и fix. Стро-
ение nod-регулона у Rhizobium meliloti показа-
но на рис. 34.6 (см. цв. вклейку). Так называе-
мые общие nod-гены (nodABCIJ) обнаружены
у всех видов Rhizobium и функционально взаи-
мозаменяемы. Продукты этих генов ответствен-
ны за образование основных структур факто-
ров нодуляции, которые являются липоолиго-
сахаридами, содержащими хитоолигосахаридную
цепь с тремя-пятью /3-1,4-связапными остатками
N-ацетилглюкозамина (GlcNAc) (рис. 34.7). Бе-
лок NodC обладает ацетилглюкозаминацилтранс-
феразной активностью и предположительно ка-
тализирует образование олигосахаридпой цепи из
остатков GlcNAc, связанных (3- 1,4-связью. Про-
дукт гена nodA обладает N-ацилтрансферазной
активностью; продукт nodB представляет со-
бой N-деацетилазу. Возможно, эти два фермен-
та участвуют в замене N-концсвой ацетильной
группы на ацильную группу в нередуцирующем
остатке GlcNAc. В экспрессии фактора подуля-
ции, по имеющимся данным, участвуют белки
Nodi и NodJ.
Специфичность фактора нодуляции в отноше-
нии хозяина обусловливают специфические мо-
дификации; ответственные за них гены нодуля-
ции, присутствующие не у всех видов Rhizobium,
обозначают как hsn-гены (от host specific nodu-
lation — модуляция, специфичная в отношении хо-
зяина). Примеры подобных модификаций приве-
дены на рис. 34.7 и в дополнении 34.2.
Nod-факторы вызывают ответ у бобовых
растений-хозяев, присутствуя в концентрациях
Глава 34. Прокариоты в сельском хозяйстве 365
Рис. 34.5. Внутренняя структура клубенька.
А. Продольный срез 21-суточного клубенька, индуциро-
ванного Rhizobium leguminosarum биовар viciae на рас-
тении Vicia hirsuta. Инфицированные клетки растения
(видны как темные) целиком заполнены бактериями
(окрашены толуидиновым синим); немногие клетки рас-
тения (видны как белые) не инфицированы. Внутри ин-
фицированной ткани видны зоны, схематически пред-
ставленные в части Б. М — меристематическая зона;
ЗИФ — зона инфицирования, содержащая инфекцион-
ные нити; РСЗ — ранняя симбиотическая зона, в кото-
рой бактерии дифференцируются в бактероиды; ЗАФ —
зона азотфиксации, в которой бактерии фиксируют
азот; ЗС — зона старения.
СН
,сн=сн
СН
сн,
CO CH
A c-
сн
сн
сн
(СНг)3
(СН2),
Rhizobium meliloti
Rhizobium
leguminosarum
биовар viciae
R1
R2
R3
Обозначение
so;
so:
Ac
Ac
Ac
С,
C,
C,
NodRml
NodRm-IV(S)
NodRm-IV(Ac, S)
NodRlv-IV(Ac)
NodRlv-V(Ac)
Рис. 34.7. Химическое строение факторов образования
клубеньков у Rhizobium.
А. Основная структура хитоолигосахаридной цепи из
/3-1,4-связанных остатков N-ацетилглюкозамина.
А, Б. Специфичность этой молекулы в отношении хозя-
ина обеспечивают специфические модификации остат-
ков R1 (SO^ или Н), R2 (Н или Ас) и боковых жирно-
кислотных цепей (R3), которые могут различаться дли-
ной и степенью ненасыщенности. Поскольку из данного
вида или биовара могут быть выделены различные фак-
торы Nod, предложена унифицированная номенклату-
ра, согласно которой NodRml теперь обозначают как
NodRm-IV(S), причем Rm означает R. meliloti, IV — че-
тыре остатка глюкозамина и S — наличие сульфатной
группы на редуцирующем конце молекулы. У R. legumi-
nosarum биовар viciae (Rlv) факторами нодуляции могут
быть либо тетра-(1У), либо пента-(У)-олигосахариды,
состоящие из остатков глюкозамина. Последние ацети-
лированы (Ас) на нередуцирующем конце и не несут
сульфатной группы.
Б
2
2
2
3
Н
H
H
от пико- до наномолярных. Они проявляют ак-
тивность на поверхности эпидермальных клеток
М. sativa и корневых волосках V. hirsuta, индуци-
руя деформацию и ветвление корневых волосков,
а также образование инфекционной нити. Однако
те же факторы способны инициировать и деле-
ние кортикальных клеток или образование зача-
точных клубеньков. Соответствующие рецепторы
и регуляторные гены растений пока не выявлены.
Регуляция nod- генов □ Экспрессия nod-re-
нов у Rhizobium не носит конститутивного харак-
тера, но индуцируется под действием веществ, вы-
деляемых корнями бобовых растений. В случае
Rhizobium и Bradyrhizobium индукторами nod-ve-
нов выступают различные флавоноиды и изо-
флавоноиды соответственно (рис. 34.8). В ассо-
циации люцерна//?, meliloti индукторами актив-
ности nod-генов служат бетаины тригонемин и
стахидрин (М,Ы-диметилпролин). Различные бо-
бовые секретируют различные флавоноидные ин-
дукторы, и одно растение на разных стадиях раз-
вития может синтезировать разные индукторы.
>66 Часть IX Прикладная микробиология
Флавоны
Лютеолин: 3',4',5,7-Тетрагидроксифлавон
Апигенин: 4',5,7-Тригидроксифлавон
Флаваноны
Нарингенин: 4',5,7-Тригидроксифлаванон
Гесперитин: 3',5,7-Тригидрокси-4'-
метоксифлаванон
Изофлавоны
Даидзеин:
Генестеин:
4',7-Дигидроксмизофлавон
4'. 5,7-Тр и ги дро кси изофла вон
ис. 34.8. Флавоноиды и изофлавоноиды из корней бо-
>вых, активирующие транскрипцию генов nod. Наибо-
;е активные индукторы содержат гидроксильные груп-
>1 при С3/- или С4'-атомах В-кольца и гидроксильную
>уппу или гликозидную связь при С7-атоме А-кольца.
лавоны и флаваноны наиболее эффективны при ин-
/кцги генов nod у Rhizobium; изофлавоноиды индуци-
/ют экспрессию генов nod у Bradyrhizobium и действу-
т как антагонисты в отношении экспрессии генов nod
Rhizobium meliloti и R. leguminosarum.
1екоторые флавоноиды могут также вызывать
юложительный хемотаксис и стимуляцию роста
лубеньковых бактерий, являясь, таким образом,
ютенциально регуляторами динамики почвенной
{икрофлоры.
Дополнение 34.2. Синтезируемый R. me-
liloti фактор нодуляции NodRm-1
представляет собой сульфатированный
/3-1,4-тетра-В-глюкозамин, содержащий три
ацетилированных аминогруппы и остаток
ненасыщенной жирной кислоты Сщ на нере-
дуцирующем конце. Продукты генов nodH
(сульфотрансфераза) и nodPQ (АТР-сульфу-
рилаза), обнаруженные только у R. meliloti,
участвуют в сульфатировании остатка са-
хара на редуцирующем конце. В молекулах
других факторов нодуляции сульфатная
группа отсутствует; по-видимому, она важна
для распознавания растений люцерны. Фак-
торы Nod, продуцируемые R. leguminosarum
биовар viciae, характеризуются наличием
6-О-ацетильной группы у нередуцирующего
сахара; предположительно ее присоединение
катализирует продукт гена nodL. Гены nodFE
встречаются у различных видов Rhizobium,
но не являются функционально взаимозаме-
няемыми. Они участвуют в синтезе жирно-
кислотных боковых цепей в составе факторов
нодуляции; эти цепи варьируют в различ-
ных факторах по длине и степени нена-
сыщенности. Например, фактор NodRm-1
содержит жирную кислоту Сщ с двумя двой-
ными связями, тогда как фактор, синтезиру-
емый R. leguminosarum биовар viciae, — оста-
ток жирной кислоты С is с четырьмя двойны-
ми связями (NodRlv).
Для активации nod-генов, опосредованной
растительными индукторами, необходим белок
NodD, выполняющий функцию регулятора транс-
крипции. У некоторых видов (например, R. me-
liloti) имеются множественные аллели nodD,
что, видимо, позволяет распознавать различные
молекулы-индукторы, специфичные в отношении
хозяина (рис. 34.6). Связывание и специфичность
флавоноидов в значительной степени опреде-
ляются С-концевыми участками NodD-белков,
варьирующими у различных штаммов. Более
консервативные N-концевые участки предпо-
ложительно участвуют в связывании белков с
высококонсервативными последовательностями
(nod-боксами), расположенными выше инду-
цибельных nod-генов. Регуляция экспрессии
nodD-генов может быть различной: у некоторых
бактерий ген nodD не регулируется, у других под-
вергается положительной регуляции (индукция
флавоноидами растения) или отрицательной ре-
гуляции (например, путем ауторепрессии).
Условием фиксации азота бактероидами
Rhizobium является низкая концентрация кисло-
рода в центральной части клубенька; вероятно,
это служит физиологическим сигналом для ини-
циации экспрессии соответствующих генов. Ре-
гуляция направлена на дерепрессию генов фик-
сации азота (nif и fix), обеспечивающую начало
синтеза ферментов азотфиксации. В качестве
примера на рис. 34.9 (см. цв. вклейку) показаны
механизмы регуляции генов nif и fix у R. meliloti.
Глава 34. Прокариоты в сельском хозяйстве 367
Восстановление молекулярного азота (N2) до
аммиака (NH3), ассимилируемого живыми орга-
низмами, осуществляется согласно уравнению:
N2 + 16АТР + 8е“ + 8Н+ ->
-> 2NH3 + Н2 + 16ADP + 16Pi (34.1)
(Подробнее об этом см. разд. 8.5). Эту реакцию
катализирует нитрогеназа — физиологически и
функционально консервативный фермент у раз-
личных азотфиксирующих организмов. Он состо-
ит из двух компонентов: MoFe-белка и Fe-болка.
MoFe-белок, называемый также динитрогеназой,
представляет собой о2/32-тетрамер; его ш-субъеди-
ницы кодируются геном nifD, /3-субъединицы —
геном nifK. Этот тетрамерный белок связан
с MoFe-кофактором (FeMoCo), выполняющим
роль каталитического сайта восстановления N2.
Fe-белок, называемый также редуктазой динитро-
геназы, представляет собой гомодимер; его субъ-
единицы кодируются геном nifH. Оба компонента
нитрогеназы весьма чувствительны к кислоро-
ду и в его присутствии необратимо инактиви-
руются (для FeMo-белка время снижения актив-
ности на 50%, ti/2, составляет 8 мин, для Fe
белка — 30 с). Дополнительные гены nif и fix свя-
заны с обеспечением процесса энергией (АТР) и
восстановительными эквивалентами или с биосин-
тезом FeMoCo (осуществляемого при участии бел-
ков NifB, NifE, NifN). Продукты оперона fixABCX,
возможно, участвуют в транспорте электронов к
нитрогеназному комплексу. Белки, кодируемые
опероном fixNOQP, предположительно образуют
мембраносвязанную цитохромоксидазу, которая
может входить в состав специфичной для бакте-
роидов дыхательной цепи, обеспечивающей воз-
можность дыхания при низкой концентрации кис-
лорода.
Координированно с дерепрессией генов nif и
fix (см. дополнение 34.3) происходит экспрессия
гена det А (от dicarboxylate transport, транспорт
дикарбоновых кислот). Этот ген кодирует специ-
фическую пермеазу, участвующую в транспорте
дикарбоновых кислот в азотфиксирующий бакте-
роид. При экспрессии генов nif, fix и det ассимиля-
ция бактероидом аммиака подавляется и большая
часть образующегося при азотфиксации в бакте-
роидах аммиака поступает в растение.
Регуляция экспрессии генов nif и fix □
Ключевые регуляторные белки, отвечающие на
концентрацию кислорода в бактероиде, функцио-
нируют как каскадная система, подчиненная об-
щей регуляторной сети (см. гл. 20). Основной
регуляторный белок — продукт гена nifА — ак-
тивирует транскрипцию генов nif/fix и синтез
РНК-полимеразы, содержащей альтернативный
сигма-фактор ст54 (Rpon), обнаруженный у всех
азотфиксирующих организмов. Организация
структурных и функциональных доменов белков
NifA у Rhizobium показана на рис. 34.10 (см. цв.
вклейку). Активность белков NifA регулируется
концентрацией кислорода; механизм этой актива-
ции пока не вполне ясен. Поскольку чувствитель-
ность к кислороду коррелирует с присутствием
в белке типичного цистеинового мотива, кото-
рый может представлять собой металл-(Бе)-свя-
зывающий участок, высказано предположение,
что окислительно-восстановительное состояние
металла, связанного с остатками цистеина, воз-
можно влияет на конформацию и, следовательно,
на активность этого белка. Помимо такой регуля-
ции кислородом на уровне белка, у многих, но не
всех клубеньковых бактерий низкая концентра-
ция кислорода служит фактором регуляции экс-
прессии гена nifА. Следовательно, концентрация
кислорода выполняет роль регуляторного факто-
ра, влияющего на экспрессию гена nifА и регули-
рующего все NifA-зависимые гены nif и fix.
Дополнение 34.3. У R. leguminosarum,
Bradyrhizobium japonicum и Azorhizobium cau-
linodans идентифицированы гены nif и fix,
идентичные описанным у Rhizobium meliloti,
но с иной организацией и локализацией.
У R. leguminosarum гены nif и fix присутству-
ют в виде кластера в плазмиде и чередуют-
ся с генами nod. У В. japonicum и, видимо, у
A. caulinodans гены nif и fix, а также гены nod
локализованы в хромосоме. У Bradyrhizobium
и Azorhizobium обнаружены также системы
FixLJ, ие участвующие непосредственно в ак-
тивации гена nifА, зависимой от содержания
кислорода.
На каскадный характер регуляции экспрессии
генов nif и fix у R. meliloti указывает зависи-
мость экспрессии регуляторных генов nifА и fixK
(последний кодирует активатор транскрипции
/а-кластера II, например fixNOQP', см. рис. 34.9)
от двух регуляторных белков — FixL и FixJ, ко-
торые активируют свои гены-мишени в ответ на
микроаэробные условия. Белки FixL и FixJ при-
368 Часть IX. Прикладная микробиология
надлежит к семейству белков двухкомпонентных
регуляторных систем (см. разд. 20.4). Гемопроте-
ин FixL выполняет роль сенсора в отношении кон-
центрации кислорода и аутофосфорилируется в
условиях его низкой концентрации. Белок FixJ яв-
ляется эффекторным, фосфорилируется посред-
ством FixL и действует как активатор транскрип-
ции генов nifA и fixK.
Представители сем. Rhizobiaceae образуют
внутриклеточные видоспецифичные симбиозы с
растениями сем. Fabaceae. Ризобии (клубенько-
вые бактерии) заражают корневые волоски и
индуцируют образование кортикальных слоев ме-
ристемы корня растения, что приводит к образо-
ванию высокоорганизованных структур — корне-
вых клубеньков. В условиях низкого парциально-
го давления кислорода в клубеньках и отсутствия
связанного азота инициируется синтез ферментов
азотфиксации. После фазы эффективной фикса-
ции молекулярного азота бактерии и клетки хо-
зяина дегенерируют. Развитие азотфиксирующих
симбиозов зависит от интенсивного обмена хими-
ческими сигналами между симбионтами и регуля-
ции бактериальных генов nod, nif и fix факторами
общей регуляторной сети.
34.2.2. Актиномицеты рода Frankia образуют
внутриклеточные азотфиксирующие
симбиозы со многими
покрытосеменными
Свыше 200 видов покрытосеменных, относящихся
к 8 семействам, способны формировать внутри-
клеточные азотфиксирующие симбиотические об-
разования в виде корневых клубеньков с актино-
мицетами рода Frankia в качестве эндосимбион-
тов. В число этих растений входят многолетние
кустарники и деревья, распространенные по все-
му земному шару.
Наиболее изучена ассоциация Frankia с оль-
хой (род Alnus\ рис. 34.11). В этом случае об-
разуются многолетние клубеньки коралловидной
структуры, называемой актинориза, иногда зна-
чительных размеров, с дихотомическим ветвлени-
ем. В отличие от клубеньков бобовых, актинориза
представляет собой модифицированные боковые
корни, характеризующиеся наличием центрально-
го сосудистого пучка (рис. 34.11, Б}.
Клетки Frankia проникают в корни ольхи че-
рез корневые волоски и индуцируют в гиподер-
ме и кортексе деление клеток, образующих зача-
ток клубенька. Сам клубенек развивается таким
же образом, как и боковой корень. Образуе-
мые актиномицетом вегетативные гифы диа-
метром 0,5-1,5 мкм пролиферируют и проника-
ют в клетки развивающейся ткани клубенька.
При фиксации азота возникают специализирован-
ные структуры — везикулы (диаметром 4-6 мкм),
обычно как терминальные вздутия боковых от-
ветвлений гиф. Зрелые азотфиксирующие вези-
кулы характеризуются структурированной слои-
стой оболочкой, которая отделяет эндосимбионт
от цитоплазмы растения-хозяина. Оболочка
содержит необычные соединения — гопаноидные
липиды (см. разд. 7.10.4 и дополнение 29.4), ино-
гда образующие многочисленные липидные слои
вокруг везикулы. Число слоев коррелирует с кон-
центрацией кислорода в окружающей среде. Эти
липидные слои, возможно, функционируют как
барьер для диффузии кислорода, обеспечивая его
низкую концентрацию, необходимую для синтеза
нитрогеназы.
Азотфиксирующие актиномицеты рода Frankia
образуют с разнообразными покрытосеменны-
ми растениями симбиотические внутриклеточные
ассоциации, при которых формируются корне-
вые клубеньки. В противоположность симбиозу
Rhizobium с бобовыми, клубеньки, образуемые
в ассоциации актиномицетов Frankia с ольхой,
представляют собой видоизмененные боковые
корни и имеют структуру, называемую актино-
ризой. Растения, образующие симбиоз с актино-
мицетами рода Frankia, распространены по все-
му земному шару, и фиксация азота актиноризой
вносит существенный вклад в обогащение почвы
азотом.
Нитрогеназный комплекс Frankia идентичен
описанному у Rhizobium, и соответственно у
Frankia также идентифицированы структурные
гены нитрогеназы nifHDK, дополнительные гены
(такие, как nifE и nifВ) и регуляторный ген
nifA. Присутствие генов nod у Frankia достоверно
не установлено, но предполагается, что факторы
Nod у Frankia имеются; из элюатов семян Alnus
выделены и очищены соединения флавоноидного
типа.
Интенсивность фиксации азота с участием
Frankia варьирует в пределах, характерных и для
клубеньковых бактерий, составляя 40-350 кг на
Глава 34. Прокариоты в сельском хозяйстве 369
Рис. 34.11. Клубеньки, образованные на корнях ольхи
актиномицетом из рода Frankia.
А. Типичные коралловидные клубеньковые структуры,
или актинориза.
Б. Внутренняя структура одной из лопастей этих клу-
беньков. Показаны зоны от апикальной до базальной
части: М — меристема; ЗИФ — зона инфицирования, со-
держащая гифы; ЗАФ — зона азотфиксации с активны-
ми везикулами; ЗС — зона старения; СП — центральный
сосудистый пучок.
1 га в год. Учитывая широкое распростране-
ние (от Арктики до тропиков) растений — хозяев
Frankia, можно считать, что фиксация азота акти-
норизами несомненно служит важным фактором
обогащения почвы азотом и играет важнейшую
роль в его геохимическом цикле.
34.2.3. Азотфиксирующие цианобактерии
образуют внеклеточные симбиозы
Диазотрофные цианобактерии, способные фикси-
ровать азот, представлены как свободноживущи-
ми формами, так и симбиотическими, образующи-
ми ассоциации с различными эукариотическими
организмами, в том числе с высшими растени-
ями — голосеменными, покрытосеменными, папо-
ротниками, печеночниками и аитоцеровыми. Из
покрытосеменных симбиоз с азотфиксирующими
цианобактериями (Nostoc) образуют только пред-
ставители рода Gunnera; нити Nostoc проникают
в их стебли через специальные железы и обита-
ют внутриклеточно. За исключением ассоциации
Gunnera/Nostoc, во всех других симбиозах ци-
анобактерии локализованы внеклеточно.1 У голо-
семенных (Cycadaceae) они заселяют кораллоид-
ные корни; пучки этих отрицательно геотропных
корней возникают от подсемядольного колена,
но остаются межклеточными. В случае симбио-
за с папоротниками Azolla нитчатые цианобакте-
рии обитают в специальных полостях в листьях.
Сходным образом у печеночников и антоцероса
они встречаются в полостях таллома гаметофита.
Водные папоротники рода Azolla образуют
симбиотическую ассоциацию с Anabaena azollae.
Спорофиты Azolla (рис. 34.12, А), плавающие на
поверхности воды, имеют ветви, несущие очеред-
ные двулопастные листья. Каждый лист имеет
спинную воздушную (содержащую хлорофилл) и
брюшную, погруженную в воду лопасти. В верх-
ней лопасти имеются специальные полости, где
находятся нити цианобактерий, дифференциро-
ванные в азотфиксирующие микросимбионты —
цианобионты (рис. 34.12, Б). Как и у свобод-
поживущих форм, дифференцировка отдельных
клеток A. azollae в азотфиксирующие сопровож-
дается морфологическим превращением их в ге-
тероцисты и перестройкой генов nif и fix (см.
разд. 24.3), однако регуляция экспрессии этих ге-
нов у симбиотических и у свободноживущих ци-
1 Это ошибочное утверждение. Существует также симбиотический организм Geosiphon pyriforme, у которого нити ци-
анобактерии обитают внутри гиф гриба. Некоторые авторы относят его к лишайникам, однако у типичных лишайников
симбиоз внеклеточный. — Пргш. перео.
370 Часть IX. Прикладная микробиология
Рис. 34.12. Симбиотическая ассоциация между Anaba-
епа azollae и водным папоротником Azolla.
А. Плавающий на поверхности воды спорофит Azolla,
в симбиозе с которым обитает азотфиксирующая ци-
анобактерия Anabaena azollae. Фото любезно предостав-
лено М. Grilli-Caiola.
Б. Строение листа папоротника. Показаны дорсальные и
вентральная лопасти листа и развитие симбиоза. Нити
Anabaena проникают в открытые поры листа, и их ве-
гетативные клетки дифференцируются в гетероцисты.
В зрелых полостях до 50% цианобактериальных клеток
дифференцированы в гетероцисты и фиксируют азот.
анобактерий различна. Доля гетероцист в нити
цианобионта выше, чем у цианобактерии в свобод-
ноживущей форме (до 50% против 10%); индук-
ция образования гетероцист при симбиозе может
не зависеть от строгой регуляции уровнем свя-
занного азота. Возможно, у симбиотических ци-
анобактерий дифференцировку индуцируют, по
крайней мере отчасти, сигналы растения, а не
только факторы внешней среды.
Цианобактерии в листовых полостях Azolla ас-
социированы с бактериями. При разрушении этих
полостей-«карманов» цианобактерии и ассоции-
рованные с ними бактерии высвобождаются в сли-
зистом матриксе, богатом аминокислотами,
и полисахаридами. Среди ассоциированных бак-
терий из листовых полостей и спорокарпов ря-
да видов Azolla неизменно выделяются различ-
ные виды Ai throbacter. Таким образом, в случае
Azolla, по-видимому, имеет место трехкомпонеит-
ный симбиоз, т. е. более сложный, чем считалось
ранее. Роль ассоциированных бактерий предпо-
ложительно состоит в удалении Ог за счет их
высокой дыхательной активности, благоприят-
ствующей образованию микроаэробных ниш. Воз-
можно также, что клетки Arthrobacter, образуя
ауксины, влияют на гормональный баланс в на-
чале развития ассоциации.
Водные папоротники Azolla распространены
по всему земному шару, однако в наибольшем ко-
личестве они встречаются в теплых водах в тро-
пическом и субтропическом поясах. Эти растения
используются в сельском хозяйстве на корм до-
машним животным и как зеленое удобрение (глав-
ным образом при выращивании риса), благодаря
тому что способны быстро заселять водные ме-
стообитания, особенно прохладные, слабо аэри-
руемые воды, где папоротники Azolla образуют
плотную поверхностную пленку, препятствуя ро-
сту сорной растительности и размножению насе-
комых. Уровень фиксации N2 в симбиотической
ассоциации Azolla/Anabaena варьирует в зависи-
мости от времени года и условий обитания, в сред-
нем составляя 50-100 кг азота на 1 га в год.
Цианобактерия Anabaena azollae способна об-
разовывать гетероцисты (см. разд. 24.3) и фикси-
ровать азот в симбиозе с водным папоротником
Azolla. В противоположность симбиотическим ас-
социациям Rhizobium/боБоьые и Frankia/Alnus,
в ассоциации Anabaena/ Azolla микросим-
бионт локализован внеклеточно, а не внутрикле-
точно. И
Глава 34. Прокариоты в сельском хозяйстве 371
34.3. Бактерии могут вызывать болезни растений
Болезни растений, вызываемые фитопатогенны-
ми бактериями, приносят меньший экономиче-
ский ущерб, чем болезни, вызываемые грибами и
вирусами, но также могут служить причиной су-
щественных потерь урожая в поле и при хране-
нии. В качестве примеров можно привести бак-
териальные болезни увядания картофеля, томата
и других сельскохозяйственных культур; сообще-
ния о сильном повреждении урожая в результа-
те бактериального заражения имеются для основ-
ных пищевых культур, таких как рис, пшеница,
соя и картофель. Важные болезни растений и вы-
зывающие их фитопатогенные бактерии приведе-
ны в табл. 34.4.
34.3.1. Фитопатогенные бактерии обладают
разнообразными, строго регулируемыми
механизмами патогенности
и вирулентности
Для инфицирования растений патогенные микро-
бы обладают механизмами прикрепления, внед-
рения и инактивации защитных систем растения.
В целом свойство патогенности у бактерий обес-
печивают более 100 генов. К настоящему времени
некоторые из них идентифицированы и подразде-
лены па три группы: гены патогенности, гены ви-
рулентности и гены, определяющие круг хозяев
(определения терминов вирулентность и патоген-
ность см. в гл. 33).
Гены патогенности обеспечивают рост бак-
терий на поверхности или внутри растения. Осо-
бый класс среди них составляют гены hrp (от
hypersensitive responce and pathogenity, реакция
гиперчувствительности и патогенность), образу-
ющие крупные кластеры (до 24 генов). Помимо
основных функций патогенности, таких как коло-
низация и рост, гены hrp участвуют в образова-
нии белковых сигнальных молекул, вызывающих
защитную реакцию гиперчувствительности в рас-
тениях, не относящихся к хозяевам данного фито-
патогенного микроорганизма. Эти белки, называ-
емые гарпинами, секретируются с участием дру-
гих продуктов генов hrp (HrpH, HrpI).
Взаимодействия между фитопатогенными
бактериями и растениями-хозяевами можно раз-
делить на две основные категории. Совмести-
мое взаимодействие между вирулентными
возбудителями и чувствительными растениями-
хозяевами приводит к полному развитию симпто-
мов болезни. При несовместимом взаимодей-
ствии происходит слабое развитие симптомов бо-
лезни или они отсутствуют, поскольку бактерии
индуцируют у растения защитный ответ. В этом
случае растение обладает устойчивостью и па-
тогенный организм авирулентен. Несовместимое
взаимодействие характеризуется реакцией ги-
перчувствительности (HR, от hypersentitive
response) инфицированного растения, которая
приводит в месте внедрения возбудителя к быст-
ро наступающей (через 12-24 ч) локальной гибе-
ли клеток растения. Параллельно этой реакции
развиваются защитные реакции, обеспечивающие
инактивацию или ограничение роста и распро-
странения возбудителя внутри растения.
Дополнение 34.4. У многих бактерий экс-
прессия факторов вирулентности коорди-
нированно контролируется общими регулято-
рами. Например, у Pseudomonas solanacearum
синтез и внеклеточных полисахаридов, и
целлюлазы регулируется посредством белка
PhcA. Другой общий регулятор, белок PheN,
обнаружен у Р. tolaasii. Этот белок необходим
для синтеза токсина и протеазы, а также для
регуляции подвижности, хемотаксиса и обра-
зования сидерофоров. Синтез PheN, в свою
очередь, подвержен отрицательной регуля-
ции на уровне транскрипции при высокой
плотности популяции, что позволяет предпо-
лагать участие механизма «кворум-сенсинг»
(см. гл. 20). У Erwinia carotovora внекле-
точные ферменты эндопектат-лиаза, целлю-
лаза, полигалактуроназа и протеаза согла-
сованно регулируются двумя активаторами
транскрипции, АерА и АерВ (от activate
extracellular protein production, активация
синтеза внеклеточного белка) в ответ на при-
сутствие компонентов растительных клеток.
У Erwinia chrysanthemi синтез ферментов,
участвующих в разложении пектина, нахо-
дится под контролем репрессора транскрип-
ции KdgR (рис. 34.13). Посредством регуля-
торного белка HrpS осуществляется регуля-
торная связь Лгр-генов с некоторыми генами
вирулентности и агт-генами.
372 Часть IX. Прикладная микробиология
Таблица 34.4. Важные болезни растений, вызываемые бактериями
Симптомы Примеры болезней Возбудители
Пятнистость и ожог Рябуха бактериальная (табак) Бактериоз угловатый (фасоль) Ожог бактериальный цитрусовых Пятнистость листовая (фасоль) Ожог бактериальный (рис) Ожог бактериальный (зерновые) Пятнистость черная бактериальная (томат, стручковый перец) Pseudomonas syringae патовар tabaci 1 Pseudomonas syringae патовар phaseolica Pseudomonas патовар syringae Pseudomonas syringae патовар syringae Xanthomonas campestris патовар oryzae Xanthomonas campestris патовар translucens Xanthomonas campestris патовар vesicatoria
Сосудистое увядание (вертициллез) Гниль клубней кольцевая (картофель) Увядание вертициллезное (томат) Увядание бактериальное (кукуруза) Ожог бактериальный (семечковые) Болезнь «Мокко» (банан) Сосудистый бактериоз (гниль черная бакте- риальная; крестоцветные) Clavibacter michiganensis патовар sepedo- nicum Clavibacter michiganensis патовар michiga- nensis Erwinia slewartii Erwinia amylovora Pseudomonas solanacearum Pseudomonas solanacearum Xanthomonas campestris патовар campestris
Мягкая гниль Мягкие гнили (многочисленные болезни) «Черная ножка» бактериальная (карто- фель) Гниль клубней бактериальная (картофель) Гниль наружных пленок бактериальная (пук) Erwinia carotovora патовар carotovora Erwinia carotovora патовар atroseptica Pseudomonas marginalis Pseudomonas cepacia
Рак Рак бактериальный (косточковые) Рак бактериальный (цитрусовые) Pseudomonas syringae патовар syringae Xanthomonas campestris патовар citri
Галлы 1 Патовар — разновидное! Галл корончатый бактериальный (много- численные болезни) Косматый (волосяной) корень Туберкулез (зубоватость) (маслина) ь фитопатогенного микроорганизма. Agrobacterium tumefaciens Agrobacterium rhizogenes Pseudomonas syringae патовар savastanoi
Гены вирулентности способствуют агрес-
сивности фитопатогенной бактерии и необходимы
для развития симптомов заболевания. Продук-
ты этих генов — факторы общей вирулентности —
включают разнообразные токсины, внеклеточ-
ные полисахариды, гормоны роста растений, а
также протеазы, целлюлазы, пектинолитические
и другие ферменты, разрушающие раститель-
ную клеточную стенку. Экспрессия этих факторов
вирулентности обычно строго регулируется с уча-
стием общей регуляторной сети на уровне тран-
скрипции в ответ на специфические внешние сиг-
налы (см. дополнение 34.4 и рис. 34.13 па цв.
вклейке).
Гены, определяющие круг хозяев (инфи-
цируемых видов и сортов растений), кодируют
факторы, действующие в отношении патогеннос-
ти положительно (специфические факторы виру-
лентности) или отрицательно (гены авирулент-
ности). В отличие от факторов общей вирулентно-
сти, которые обусловливают поражение широкого
круга растений, гены специфичной к хозяину ви-
рулентности (hsv, от host-specific virulence genes)
определяют патогенность только по отношению
к некоторым растениям-хозяевам. Внутривидовая
категория растений, специфично реагирующих на
данный патовар, представляет собой сорт. Гены
авирулентности (aur-гены) соответствуют генам
Глава 34. Прокариоты в сельском хозяйстве 373
устойчивости хозяина и ограничивают круг хо-
зяев той или иной расы бактерий определенны-
ми сортами растений. Продукты пгг-генов могут
секретироваться и выделяться в клетки хозяина с
участием белков Игр.
34.3.2. Важнейшие патогенные для растений
бактерии относятся к немногим родам
Бактерии, вызывающие болезни растений, от-
носятся главным образом к родам Agrobacte-
rium, Pseudomonas, Xanthomonas, Erwinia, Co-
rynebacterium, Mycoplasma и Spiroplasma. Неко-
торые из этих микробов являются облигатно
фитопатогспными и не способны выживать в поч-
ве в отсутствие хозяина, но большинство из них
относится к почвенным сапротрофам. Характер-
ные возбудители болезней растений и вызывае-
мые ими поражения (см. табл. 34.4) описываются
ниже.
Патогенные виды Erwinia □ Род Erwinia
включает патогенные для растений виды, разли-
чающиеся по характеру вызываемых ими заболе-
ваний. Возбудители мокрой гнили, Е. carotovora
и Е. chrysanthemi, образуют различные пектино-
литические ферменты (рис. 34.13), а также дру-
гие внеклеточные гидролитические ферменты, та-
кие как целлюлазы, протеазы и ксиланазы, вы-
зывающие разделение клеток растения хозяина
(мацерацию) и тем самым разрушение ткани, ко-
торая при этом размягчается и становится мок-
нущей. Другие виды рода Erwinia относятся к
некрогенам, т. е. индуцируют локальное отмира-
ние клеток (некроз), который внешне выглядит
как пятнистость, ожог или раковое поражение.
Вид Е. amylovora вызывает наиболее тяжелые за-
болевания груши и других плодовых деревьев.
В этом случае единственными известными факто-
рами патогенности являются экзополисахариды и
фактор некроза (см. дополнение 34.5).
Фитопатогенные представители рода
Pseudomonas □ Возбудители болезней расте-
ний, относящиеся к роду Pseudomonas, обычно
обнаруживают строгую специфичность в отно-
шении хозяев, но при этом поражают широкий
круг растений. Большинство из них относится к
виду Р. syringae, который далее подразделяет-
ся на натовары. Патогенные псевдомонады пре-
имущественно оказывают некрогеппое действие
и вызывают возникновение на листьях и пло-
дах растений-хозяев мокнущих участков, окру-
женных хлоротическими ореолами (пятнистость,
ожоги, раковые поражения). Псевдомонады про-
дуцируют ряд факторов патогенности и виру-
лентности, в том числе внеклеточные полисаха-
риды, факторы некроза и разнообразные токсины
(например, сирингомицин и фазеолотоксин). Бак-
терия Р. syringae патовар savastanoi образу-
ет индолилуксусную кислоту, которая вызывает
пролиферацию растительных клеток на стеблях
маслины и олеандра (болезнь наростов масли-
ны). Среди нефлуоресцирующих видов Pseudo-
monas экономически наиболее важен, особенно
в тропиках и странах с теплым климатом, вид
Р. solanacearum, вызывающий увядание пасле-
новых. В этом случае фактором вирулентности
также служат внеклеточные полисахариды. Воз-
будитель бурой пятнистости шляпок шампиньо-
на Р. tolaasii выделяет толаасин — внеклеточный
токсин с фитотоксическим действием, предполо-
жительно образующий поры в клетках-мишенях.
Кроме того, он действует как поверхностно-
активное вещество, которое может способствовать
распространению бактерий в организме-хозяине.
Дополнение 34.5. Анализ мутантов с
ослабленной вирулентностью (Rvi, от reduced
virulence) позволил выделить среди них три
основных типа: 1) мутанты с нарушения-
ми секреции внеклеточных ферментов (Out),
2) мутанты с нарушениями подвижности
(Мор) и 3) мутанты с нарушениями синтеза
экзоферментов.
У Е. carotovora образование всех экзофер-
ментов, включая антибиотик карбапепем, за-
висит от плотности популяции (см. разд.
20.1.4). Искусственно их синтез можно вы-
звать внесением Кт-(3-оксо1хжсаноил)-гомосе-
ринлактона (ГСЛ) в культуру Е. carotovora.
У этой бактерии обнаружены белки Ехр!
или RexI, гомологичные белку LuxI Vibrio
fischerv, мутант Ехр1~ не вирулентен для
клубней картофеля и не способен колонизи-
ровать растения картофеля. Добавление ГСЛ
к клеткам мутанта ЕхрГ изменяет этот фе-
нотип— мутант приобретает патогенность и
способность к колонизации. Роль регулятор-
ного механизма «кворум-сенсинг» в синтезе
экзоферментов и развитии болезни связана с
тем, что образование экзоферментов зависит
от концентрации ГСЛ и тем самым от плот-
374 Часть IX. Прикладная микробиология
ности популяции бактерий. Такая система ре-
гуляции, по видимому, широко распростране-
на среди бактерий; возможно, она определяет
синтез противогрибных метаболитов и экзо-
ферментов у видов рода Pseudomonas, а так-
же конъюгацию у видов рода Agro bacterium.
Кроме того, синтез бактериальных экзо-
ферментов регулируют, вероятно, специфи-
ческие растительные компоненты. Культу-
ры Е. carotovora, выращенные в минераль-
ной среде, не синтезируют экзоферменты в
определяемом количестве. Внесение экстрак-
та сельдерея в культуру этих бактерий приво-
дит к значительному возрастанию синтеза эк-
зоферментов. Данный ответ зависит от при-
сутствия генов аерА и аерВ. Зависимостью
от растительных компонентов может объяс-
няться тот или иной круг растений-хозяев,
характерный для возбудителя. Если данное
растение не содержит определенного соеди-
нения, синтеза экзофермента не происходит
и болезнь не развивается.
Патогенные бактерии рода Xanthomo-
nas □ Среди представителей рода Xanthomonas
имеются важные в хозяйственном отношении воз-
будители болезней растений, поражающие широ-
кий круг хозяев. Так, Xanthomonas campestris, по-
добно Р. syringae, вызывает бактериальные ожоги
и пятнистость у многих растений, а также сосуди-
стое увядание в результате поражения сосудистой
системы. Появление симптомов может коррелиро-
вать с синтезом внеклеточных полисахаридов и
факторов некроза, а также частично с наличием
пектинолитических ферментов.
Среди грамположительных бактерий фитопа-
тогенными являются главным образом корине-
формныебактерии (Corynebacterium, Clavibacter),
а также некоторые стрептомицеты. Патовары
Clavibacter michiganensis заселяют сосуды ксиле-
мы, продуцируют внеклеточные полисахариды и
вызывают сосудистое увядание, будучи основны-
ми возбудителями этой болезни. Виды Strepto-
myces вызывают часто встречающуюся актиноми-
козную паршу картофеля и других сельскохозяй-
ственных культур, образующих корнеплоды.
Некоторые штаммы бактерий родов
Pseudomonas, Xanthomonas, Erwinia, Corynebac-
terium и Streptomyces инфицируют и колони-
зируют растительные ткани, нанося вред рас-
тению-хозяину. Патогенность и вирулентность
детерминированы у них большим набором ге-
нов, регулируемых, как правило, посредством
общей регуляторной сети. Существует также тон-
кая взаиморегуляция бактериальных генов ави-
рулентности с генами устойчивости растений; эта
регуляция определяет круг хозяев [гипотеза ген-
на-ген, предложенная Г. Флором (Flor)]. Взаи-
модействие по механизму ген-на-ген предпо-
лагает, что для каждого гена, обеспечивающего
устойчивость растения-хозяина, имеется соответ-
ствующий ген возбудителя, определяющий виру-
лентность.
34.3.3. Наиболее подробно изучена
болезнь корончатый галл,
вызываемая Agrobacterium
Фитопатогенная бактерия A. tumefaciens индуци-
рует у растения-хозяина неопластическую транс-
формацию с образованием галлов, или опухолей
(болезнь корончатый галл). Галлы представля-
ют собой неструктурированные ткани, рост ко-
торых в культуре происходит в отсутствие гор-
монов роста. Корончатый галл наносит суще-
ственный урон плодовым и ореховым деревьям в
Австралии и Калифорнии. Трансформация тка-
ней растения-хозяина под действием возбудителя
обусловливается переносом фрагмента его ДНК
(Т-ДНК, от tumor, опухоль) в растительную клет-
ку; перенесенный фрагмент включается в геном
растения (рис. 34.14; см. цв. вклейку). Гены в
составе Т-ДНК влияют на синтез растительных
гормонов, индуцируя образование опухоли. Кроме
того, Т-ДНК содержит гены ферментов, катали-
зирующих синтез необычных соединений — опи-
нов, которые A. tumefaciens может использовать
в качестве источника С и N.
Клетки A. tumefaciens прикрепляются к клет-
кам растения с участием продуктов генов chvA,
chvB, pscA (или exo С) и att. Мутанты по этим ло-
кусам не обладают патогенностью. Белок ChvA
входит в состав плазматической мембраны и схо-
ден с другими белками, участвующими в экс-
порте молекул. У мутантов chvA полисахарид
/?-1,2-глюкан образуется, но выделения его не про-
исходит. В связи с этим предполагается, что бе-
лок ChvA участвует в транспорте /3-1,2-глюкана
в периплазму. В отличие от мутаций chvA, мута-
376 Часть IX. Прикладная микробиология
лизирующие образование опинов (продуктов кон-
денсации аминокислоты и оксокислоты или са-
хара; см. рис. 34.15) из растительных продуктов
в опухоли. В зависимости от типа Ti-плазмиды,
из которой происходит Т-ДНК, опухолевые клет-
ки образуют опины различных типов (например,
октапин, попалин, лейцинопин или агроцинопин).
Опины, синтезируемые в опухолевой ткани, мо-
гут использоваться в качестве источников энергии
и азота только клетками A. tumefaciens внутри
опухоли. Бактериальные гены, необходимые для
поглощения и катаболизма опинов, локализованы
в Ti-плазмиде, и поэтому опины могут исполь-
зоваться только штаммами A. tumefaciens, несу-
щими соответствующую Ti-плазмиду (например,
нопалин-типа или октопин-типа), но нс другими
почвенными бактериями. Таким образом, штам-
мы Agrobacterium способны создавать себе бла-
гоприятные условия для роста, заставляя клетки
растения делиться и синтезировать источники уг-
лерода и азота для размножения и выживания са-
мой бактерии («молекулярное фермерство»).
Болезнь волосяной (косматый) ко-
рень □ Эта болезнь, вызываемая Agrobacterium
rhizogenes, связана с модификацией генома рас-
тения. Клетки Agrobacterium rhizogenes содер-
жат Ri-плазмиду (root-inducing plasmid), кото-
рая несет Т-ДНК и оперон vir. Молекулярный
механизм трансформации клеток растения под
действием A. rhizogenes аналогичен описанному
выше для A. tumefaciens. Гены vir у двух этих
видов взаимозаменяемы, однако Т-ДНК в составе
Ri-плазмиды отличается от Т-ДНК в Ti-плаз-
миде, поскольку содержит гены rol, предполо-
жительно участвующие в активации конъюгатов
цитокининов.
Последовательность Т-ДНК, представляющая
собой природную систему переноса генов между
прокариотами и высшими растениями, использу-
ется для создания генных векторов с целью введе-
ния рекомбинантной ДНК в растения. При этом
Октопин
NH,
HN=C
'nh- (СН2)3~СН -СООН
NH
I
сн3 -сн-соон
Нопалин
znh2
HN = Cx
NH— (СН2)3-СН-СООН
NH
Атропин Н2 HOOC-(CH2)2-СН-СООН
НОН2С(СНОН)3НС "С" NH
О_ ,CH(CH2)2CONH2
II
О
Маннопин
НОН2С(СНОН)4СН2
NH
HOOCCH(CH2)2CONH2
Рис. 34.15. Структура некоторых важных опинов — про-
изводных аминокислот, замещенных по a-N-остатку ли-
бо пируватом (например, в случае октопина), либо
а-кетоглутаратом (например, в случае нопалина). Аг-
ропин и маннопин образует Agrobacterium rhizogenes.
гены Т-ДНК заменяют маркерными генами и зна-
чительно уменьшают размеры исходной вектор-
ной Ti-плазмиды (см. разд. 16.2.5 и 17.7).
Фитопатогепные бактерии рода Agrobacterium
обладают уникальным свойством — способностью
модифицировать геном растения-хозяина, перено-
ся в него фрагмент своей ДНК (Т-ДНК). Моди-
фикация приводит к неконтролируемому делению
клеток хозяина и образованию ими особых соеди-
нений — опинов, метаболизировать которые спо-
собны только данные паразитические бактерии.
Т-ДНК-системы A. tumefaciens и A. rhizogenes
представляют собой естественный механизм пе-
реноса генов между прокариотами и высшими
растениями; в генетической инженерии Т-ДНК
используется в настоящее время для создания
трансгенных растений.
34.4. Бактерии могут способствовать росту и устойчивости растений
Многочисленные почвенные микроорганизмы
стимулируют рост растений и способствуют повы-
шению урожайности сельскохозяйственных куль-
тур, благодаря, например, выделению одного или
нескольких веществ, действующих непосредствен-
но как стимуляторы роста. Бактерии, ускоряю-
щие рост растений, в литературе часто называют
фитосгимуляторами. Благоприятное влияние на
Глава 34. Прокариоты в сельском хозяйстве 377
рост растений оказывают также бактерии, подав-
ляющие рост фитопатогенных микроорганизмов
(агенты биологического контроля).
34.4.1. Бактерии-фитостимуляторы
продуцируют гормоны роста растений
К фитостимуляторам относятся разнообразные
микроорганизмы, обладающие таким важным
для сельскохозяйственного производства свой-
ством, как образование одного или нескольких
веществ, непосредственно стимулирующих рост
растений. Ряд ризоценозов — биоценотических
взаимосвязей между микроорганизмами и корня-
ми растений — обнаружен у дикорастущих злаков,
например ризоценоз Azotobacter с многолетним
злаком Paspalum или Campylobacter со Spartina
(злак, обычный для маршей), а также у важных
сельскохозяйственных культур, например ризоце-
ноз Acetobacter с сахарным тростником или ба-
татом, Achromobacter— с рисом, Azospirillum— со
многими зерновыми культурами (ячменем, рисом,
сорго, пшеницей) или представителями семейств
Cactaceae, Compositae, Papilionaceae и Solanaceae.
Бактерии Herbaspirillum образуют ризоценоз со
злаками (кукурузой, рисом, сорго, пшеницей) в
районах теплого климата, Klebsiella — с рисом и
бататом.
Наиболее подробно исследованы ризоценозы с
участием пяти видов Azospirillum: A. amazonense,
A. brasiliense, A. halopraefaerens, A. irakense и
A. lipoferum. Эти бактерии в зависимости от
почвенно-климатических условий могут заселять
ризосферу растений или проникать в корень,
оставаясь в межклеточных пространствах (эндо-
ризосфере). При этом плотность бактерий мо-
жет достигать 105-108 колониеобразующих еди-
ниц на 1 г высушенных корней. Описаны много-
численные варианты влияния азоспирилл, при-
сутствующих внутри корневой системы или во-
круг нее, на морфологию корня и физиологиче-
ское состояние растения (табл. 34.5). В тропиках
и субтропиках клетки Azospirillum способны фик-
сировать атмосферный азот, снабжая, таким об-
разом, растения связанным азотом, но в насто-
ящее время считается, что положительное влия-
ние этих бактерий на растения, по крайней мере
частично, обусловлено образованием ими стиму-
лирующих рост соединений, например индоли-
луксусной кислоты (ИУК). У мутантов с нару-
шениями или отсутствием синтеза ИУК способ-
ность влияния на рост растений сильно снижена.
Стимулирующее воздействие азоспирилл па рас-
тения используется в сельском хозяйстве; эти бак-
терии, наращиваемые в промышленных количе-
ствах, вносят в почву в качестве инокулятов. При
использовании A. brasiliense, A. lipoferum или их
смеси в качестве инокулятов для обработки семян
Triticum aestivum, Т. durum, Т. turgidum, Oryza
sativa, Sorghum bicolor или Zea mays отмечалось
повышение урожая на 10-30%. Во многих случа-
ях при внесении бактерий и одновременном сни-
жении количества вносимых азотных удобрений
(до 50-70% обычной дозы) урожай оставался на
обычном уровне.
34.4.2. Бактерии-антагонисты подавляют
патогенные для растений организмы
Способность некоторых природных почв подав-
лять болезни растений может быть объяснена
благоприятным влиянием местной микрофлоры
в ризосфере. Отмечен ряд бактерий, способных
существенно подавлять развитие болезней расте-
ний; среди этих бактерий имеются представители
Таблица 34.5. Описанные эффекты инокуляции Azospirillum в почву под растениями
Влияние на корни Культуры
Увеличение диаметра корня и длины и густоты корневых волосков Увеличение числа и длины корневых волосков Увеличение общей корневой поверхности на ранних фазах роста Увеличение ассимиляции питательных веществ, образования биомассы (в пересчете на сухое вещество) и содержания Fc Повышение скорости дыхания и ферментативной активности Томат Пшеницы твердых сортов Кукуруза Сорго, пшеница твердых сортов Кукуруза
378 Часть IX. Прикладная микробиология
родов Streptomyces, Agrobacterium, Enterobacter,
Erwinia, Bacillus и Serratia, а также флуорес-
цирующие штаммы Pseudomonas. Характер воз-
действия бактерий-антагонистов на патогенные
организмы трудно установить. Одним из видов
влияния может быть непосредственное уничтоже-
ние или подавление роста патогенного организ-
ма, другим — непрямое взаимодействие, например
конкуренция за питательные вещества или по-
давление заселения возбудителя за счет усиления
конкуренции или большей экологической приспо-
собленности антагониста.
Бактериальные биопестициды □ Почвен-
ные бактерии образуют различные низкомоле-
кулярные соединения и в их числе потенциаль-
ные биопестициды, подавляющие развитие гри-
бов, бактерий или насекомых (табл. 34.6). Эти
вещества можно рассматривать как вторичные
метаболиты, накапливаемые преимущественно в
конце фазы роста. Такая трактовка согласует-
ся с мнением о том, что синтез противомикроб-
ных веществ мог возникнуть в ходе эволюции как
защитный механизм для подавления конкурен-
тов в стрессовых условиях, например при недо-
статке питательных веществ (см. разд. 27.7). По-
давление болезней растений флуоресцирующими
псевдомонадами, возможно, определяется выде-
лением микробных продуктов, таких как сидеро-
форы, хелатирующие железо, или метаболиты с
антимикробными свойствами. Псевдомонады об-
разуют ряд хелатирующих железо соединений,
в том числе салициловую кислоту, пиохелины, а
также флуоресцирующие соединения — псевдо-
бактины и пиовердины (см. разд. 8.8). Флуорес-
цирующие сидерофоры обнаруживаются в поч-
ве, и, по имеющимся биохимическим и генетиче-
ским данным, играют роль в стимуляции роста
растений и предотвращении их болезней. Салици-
ловая кислота — предшественник пиохелина и си-
дерофор — относится к гормонам растений. Этот
метаболит участвует в индукции системной устой-
чивости, т. е. защитных механизмов растения,
обеспечивающих устойчивость по отношению к
большому числу возбудителей.
Образуемые псевдомонадами 2,4-диацетил-
флороглюцинол и пиолютеорин (рис. 34.16) в
значительной степени ответственны за предот-
вращение болезни грибной корнеед, поражающей
проростки сахарной свеклы и хлопчатника (возбу-
дитель — Phytium ultimum-, см. также табл. 34.6).
Как потенциально важные метаболиты для
подавления фитопатогенных микроорганизмов
можно рассматривать летучие соединения, напри-
мер аммиак и HCN, образуемые многими ризо-
сферными бактериями. Виды рода Pseudomonas
могут продуцировать в культуре HCN в концен-
трациях, токсичных для определенных патоген-
ных грибов (например, Thielaviopsis basicola), пре-
дупреждая, таким образом, черную гниль кор-
ней табака. В то же время HCN в высокой
концентрации токсична для некоторых растений,
и как предполагается, флуоресцирующие псевдо-
монады — продуценты HCN — способны вызывать
снижение урожая некоторых сельскохозяйствен-
ных культур (например, картофеля).
Инсектицидные токсины □ Бактерия Ba-
cillus thuringiensis образует несколько токсичных
для насекомых соединений, в том числе экзо-
Таблица 34.6. Некоторые примеры специфических микробных метаболитов, препятствующих развитию
сельскохозяйственных культур
Болезнь Возбудитель Эффективный метаболит
Гниль корней пшеницы Бурая пятнистость пшеницы Полегание сахарной свеклы, хлопчат- ника и др. Черная гниль корней табака Галл корончатый плодовых деревьев Фузариозное увядание льна Gaeumannomyces graminis var. tritici Pyrenophora tritici Pythium sp. Thielaviopsis basicola Agrobacterium tumefaciens Fusarizim oxyspozum Феназины 2,4-Диацетилфлороглюцинол Пирролнитрин Аммиак Пиолютеорин 2,4-Диацетилфлороглюцинол HCN 2,4-Диацетилфлороглюцинол Агроцин 84 Псевдобактин В10
Глава 34. Прокариоты в сельском хозяйстве 379
Рис. 34.16. Структуры бактериальных метаболитов,
обладающих активностью против насекомых-вредите-
лей и фитопатогенных микроорганизмов. Продуцируе-
мые флуоресцирующими псевдомонадами метаболиты
2,4-диацетилфлороглюцинол, пирролнитрин и пиолю-
теорин подавляют рост фитопатогенных грибов. Син-
тезируемый Agrobacterium radiobacter агроцин-84 спе-
цифически подавляет рост фитопатогенной бактерии
Agrobacterium tumefaciens. Пирроломицин — инсекти-
цид, продуцируемый Streptomyces fumanus.
токсины и эндотоксины. В значительной мере
инсектицидные свойства данного организма обу-
словлены образованием эндотоксинов. Эти бел-
ки—ВТ-токсины—входят в семейство поли-
пептидов мол. массой 130-140 кДа, в молекулах
которых имеются консервативные и вариабель-
ные домены, определяющие их активность про-
тив отдельных видов насекомых. В виде таких
пре-токсинов, обычно локализованных на поверх-
ности экзоспоры, указанные белки поглощаются
личинками насекомых, и в щелочном содержимом
настоящего желудка восприимчивых личинок вы-
свобождается активный токсин (белок мол. мас-
сой 30-80 к Да).
В течение последних 30 лет В. thuringiensis
используется как средство для борьбы с вред-
ными чешуекрылыми. Препараты, получаемые с
использованием этого микроорганизма, составля-
ют основную долю (90%) биопестицидов на миро-
вом рынке. За время применения в сельском хо-
зяйстве и лесоводстве препараты В. thuringiensis
(ВТ) подверглись многочисленным доработкам,
позволившим усовершенствовать их состав (для
оптимизации концентрации действующего аген-
та и способа применения препарата), и исполь-
зовать новые штаммы, активные против других
групп насекомых (Coleoptera и Diptera), а также
нематод, печеночных сосальщиков (Trematoda) и
клещей (Acari). Генетические исследования позво-
лили с помощью новых подходов (например, мо-
дификации плазмид с целью удаления генов пиз-
коактивных эндотоксинов и переноса плазмид для
повышения токсичности и расширения специфич-
ности) создать новые штаммы В. thuringiensis с
улучшенными для практических целей свойства-
ми. В последнее время с применением методов
генетической инженерии стало возможным вво-
дить гены, кодирующие эндотоксин, в растения и
грамотрицательные ризосферные бактерии. Опы-
ты в теплицах с ризосферными псевдомонадами,
несущими встроенный ген ВТ-токсина, показы-
вают эффективное подавление ими вредителей-
мишеней без побочного действия на полезные ви-
ды (например, пчел). Однако имеются сведения
о том, что возможно возникновение устойчивости
насекомых к ВТ-токсину.
Другие грамположительные бактерии пер-
спективны как средства борьбы с грибными за-
болеваниями сельскохозяйственных культур. На-
пример, некоторые штаммы В. subtilis образуют
ряд токсичных метаболитов и, подобно В. thurin-
giensis, могут служить объектом для промышлен-
ного культивирования и получения устойчивых к
хранению препаратов, содержащих споры и мета-
болиты. Клетки В. subtilis обладают активностью
в отношении ряда фитопатогенных грибов, в том
числе Rhizoctonia solani и Botrytis cinerea, однако
природа этой активности пока не вполне ясна.
Вид Agrobacterium radiobacter образует низ-
комолекулярное антимикробное соединение (бак-
териоцип), называемое агроцин-84; в течение
нескольких лет он успешно применяется для борь-
бы с возбудителями корончатого галла, посколь-
ку токсичен для вирулентных штаммов Agro-
bacterium tumefaciens. На молекулярном уровне
действие агроцина-84, представляющего собой
двузамещенный нуклеотид (рис. 34.16), предпо-
ложительно состоит в терминации синтеза ДНК.
Агроцин-84 проникает в клетку-мишень с уча-
380 Часть IX. Прикладная микробиология
стием опин-пермеазы, кодируемого Ti-плазмидой
вирулентности A. tumefaciens, т. е. только штам-
мы Л. tumefaciens, несущие Ti-плазмиду, спо-
собны поглощать агроцин-84. Синтез и устой-
чивость к агроцину-84 у A. radiobacter также
кодируются генами плазмиды (pAgK84). В лабо-
раторных условиях эта плазмида способна с высо-
кой частотой переноситься в клетки вирулентно-
го штамма A. tumefaciens в присутствии опинов.
Трансконъюгаты A. tumefaciens, несущие плаз-
миду pAgK84, или штаммы, лишенные Ti-плаз-
миды, приобретают устойчивость к агроцину-84.
Гены копъюгативного переноса pAgK84 делстиру-
ются по механизму, сходному с тем, который был
использован для получения 1се~-бактсрий (см.
разд. 34.4.3). Такой мутантный штамм успешно
интродуцируется как генетически модифициро-
ванный инокулят для борьбы с корончатым гал-
лом.
34.4.3. Мутанты эпифитных бактерий способны
препятствовать кристаллизации льда
Некоторые эпифитные бактерии вызывают у
сельскохозяйственных растений повреждения в
результате образования льда при относительно
высокой температуре (примерно —2 °C). Расте-
ния, на которых нет этих бактерий, выдерживают
температуру примерно до —6 °C. Согласно под-
счетам, только в США убытки от повреждения
холодом сельскохозяйственных культур составля-
ют более 1 млрд, долларов в год. Поражение мо-
розом может быть связано с бактериями различ-
ных таксонов, в том числе Pseudomonas syringae,
Р. fluorescens, Erwinia herbicola и Xanthomonas
campestris патовар translucens. Штаммы, вызыва-
ющие обморожение, способствуют усиленной кри-
сталлизации льда и в лабораторных условиях (фе-
нотип 1се+). Ответственные за активность кри-
сталлизации льда гены (ina, от ice nucleation
activity) клонированы и секвенированы. За прояв-
ление в фенотипе индукции кристаллизации льда
отвечает белковый продукт гена та А. Этот бе-
лок (1200 аминокислотных остатков, мол. мас-
са 118 кДа) содержит нерегулярно повторяющий-
ся октапептид Ala-Gly-Tyr-Gly-Ser-Thr-Leu-Thr,
присутствующий в нем в количестве 122 еди-
ниц. Периодичность повторения этой последова-
тельности дает основание предполагать, что дан-
ный белок связывает воду упорядоченным об-
разом, вызывая образование льда. С помощью
методов генной инженерии получен 1се“-мутант
Р. fluorescens, возможности использования ко-
торого после полевых опытов широко обсужда-
лись в печати. Впоследствии 1се~-штамм был ис-
пользован как инокулят для защиты чувстви-
тельных к холоду растений. Как предполагалось,
вносимые 1се“-бактерии будут конкурировать с
местной популяцией бактерий за ограниченные
участки для колонизации на поверхности листьев.
С увеличением соотношения между количеством
вносимых бактерий и размерами местной попу-
ляции тяжесть поражения растений холодом зна-
чительно снижалась. Проведенная с этим объек-
том работа может служить отличным примером
использования принципа конкурентного исключе-
ния ниши путем применения бактериальных ино-
кулятов в сельском хозяйстве.
Среди бактерий имеются экономически важ-
ные возбудители болезней растений, и в то же
время некоторые бактерии могут способствовать
оздоровлению растений и повышению урожайно-
сти. Механизмом благоприятного влияния бак-
терий на растения может быть непосредствен-
ное воздействие па их рост путем образования
гормонов или косвенный эффект защиты в ре-
зультате подавления патогенных грибов, бакте-
рий и насекомых. Продуцируемый Bacillus thu-
ringiensis токсин ВТ обусловливает инсектицид-
ные свойства этого организма и применяется
для борьбы с вредными чешуекрылыми; бакте-
риоцин агроцин-84, синтезируемый Agrobacterium
radiobacter, позволяет успешно бороться с корон-
чатым галлом.
34.5. Бактерии участвуют в биоразложении загрязнений почвы
Интенсивное землепользование требует значи-
тельных затрат па борьбу с вредными орга-
низмами, такими как сорные растения, насеко-
мые, нематоды и возбудители болезней растений.
С этой целью широко применяются химические
пестициды — гербициды, инсектициды и фунги-
циды. Как известно, в большом количестве в поч-
венных экосистемах присутствуют также отходы
Глава 34. Прокариоты в сельском хозяйстве 381
промышленных производств. Дальнейшая судьба
этих загрязнений вызывает все большее беспокой-
ство общественности, в частности возможность их
побочного влияния на плодородие почвы, а так-
же на здоровье человека и животных. В связи
с этим разрабатываются способы биологическо-
го оздоровления, биоремедиации, на основе тех-
нологического использования живых организмов
(бактерий и грибов) для детоксикации химиче-
ских загрязнений или снижения их концентрации
в окружающей среде.
34.5.1. Загрязняющие вещества варьируют
от легкоразлагаемых
до весьма устойчивых к биодеградации
Структура большинства синтетических пестици-
дов представляет собой относительно простой уг-
леводородный скелет (ароматический или али-
фатический) с разнообразными заместителями,
такими как галогены, фосфатные группы или
нитрогруппы (рис. 34.17). Некоторые из этих
искусственно созданных соединений сходны с
природными веществами и могут подвергаться
воздействию микробных ферментов с дальней-
шим использованием микроорганизмами в каче-
стве субстратов. Однако другие вещества — ксе-
нобиотики — содержат структуры, неизвестные
в природе, и многие из этих молекул устойчивы
к биотрансформации. Соединения-ксенобиотики
подразделяются на два типа.
1. Вещества (сейчас наиболее широко использу-
емые), которые разлагаются быстро, обычно
в течение одного вегетационного периода. На-
пример, полное разложение 2,4-D в почве про-
исходит за 4-6 нед.
2. Устойчивые пестициды, сохраняющиеся в
окружающей среде в течение длительного вре-
мени (месяцев или лет). Например, инсекти-
циды паратион и ДДТ, которые широко ис-
пользовались начиная с 1930-х гг. и до вве-
дения запрета на их применение в 1979 г.,
сохраняются в почве дольше 15 лет. Устойчи-
вые метаболиты (производные) ДДТ обнару-
живаются в почве, грунтовых водах и даже в
организме человека.
Рис. 34.17. Химические структуры некоторых важ-
ных гербицидов (Д) и инсектицидов (Б). Примеры
галогенированных соединений (Д) гербициды 2,4-D
(2,4-дихлорфеноксиуксусная кислота), 2,4,5-Т (2,4,5-
трихлорфенолуксусная кислота), атразин (2-хлор-4-эти-
ламин-б-изопропиламинотриазин) и дикамба (3,б-ди-
хлор-2-метоксибензойная кислота) и (Б) инсектицид
ДДТ (дихлордифенилтрихлороэтан). Инсектицид пара-
тион (О.О-диэтил-О-р-нитрофенилфосфотионат) (Б) —
пример фосфорорганического пестицида.
Устойчивость к биоразложению обусловлена
главным образом необычными химическими свя-
зями или заместителями в составе ксенобио-
тика, которые блокируют реакции окисления.
После удаления этих заместителей, стабилизиру-
ющих электроны, углеродный скелет легко под-
вергается минерализации многими почвенными
микроорганизмами. В то же время простые струк-
турные изменения, такие как добавление в моле-
кулу одного атома хлора, могут превратить лег-
коразлагаемый субстрат (например 2,4-Д, транс-
формируемый за 4-6 нед.) в более устойчивое
соединение (например, 2,4,5-Т, разлагаемое лишь
за 20 нед.).
34.5.2. Бактерии способны разлагать
ряд ксенобиотиков
Разлагать пестициды и другие ксенобиотические
соединения способны несколько групп бактерий,
382 Часть IX. Прикладная микробиология
в том числе грамотрицательные аэробы (преиму-
щественно виды Pseudomonas) и факультативные
анаэробы (например, Enterobacteriaceae), а так-
же грамположительные бактерии (например, ро-
да Bacillus и сем. Corynebacteriaceae). Бактерии,
разлагающие хлорароматические пестициды, от-
носятся к типичным обитателям почвы. Напри-
мер, препарат 2,4-D могут быстро утилизировать
представители родов Achromobacter, Arthrobacter,
Corynebacterium, Flavobacterium, Pseudomonas,
Alcaligenes и других. Препарат 2,4,5-T полностью
минерализуют штаммы Pseudomonas cepacia. Ви-
ды рода Pseudomonas разлагают также атра-
зин и дикамбу — химически устойчивый гербицид,
используемый для борьбы с широколиственной
сорной растительностью и некоторыми травяни-
стыми сорняками, но, к сожалению, поражаю-
щий и определенные полезные растения (напри-
мер, сою). В полевых исследованиях, проводив-
шихся на различных природных почвах, штаммы
Pseudomonas были способны полностью минера-
лизовать дикамбу, внесенную в высокой концен-
трации, и защищать от воздействия этого пре-
парата сою. Повсеместно распространены и бак-
терии, способные разлагать полихлорированные
бифенилы (ПХБ)—токсичные вещества, попада-
ющие в окружающую среду со стоками и вы-
бросами некоторых промышленных предприятий
и ставшие опасными загрязнением. Метаболиче-
ские пути их разложения, изученные у различных
псевдомонад, показаны на рис. 34.18 и рассмотре-
ны в разд. 9.17.
Активными компонентами многих используе-
мых в настоящее время инсектицидов и некото-
рых гербицидов служат фосфорорганические
соединения, например паратион (рис. 34.17) —
препарат, широко использовавшийся для борьбы
с насекомыми, но сейчас запрещенный или, по
крайней мере, используемый в ограниченных мас-
штабах. Из природной среды выделены штаммы
Arthrobacter, Flavobacterium и Pseudomonas, спо-
собные использовать паратион как источник угле-
рода и разлагать его в течение нескольких недель
до n-нитрофенола. У большинства этих бакте-
рий ответственные за разложение фосфороргани-
ческих соединений гены opd (от organophosphate
degradation), локализованы в плазмиде.
34.5.3. Потенциал микробной биодеградации
может быть повышен благодаря
кометаболизму и применению
методов генетической инженерии
Многие органические вещества антропогенного
происхождения могут полностью минерализо-
ваться микроорганизмами, тогда как другие не
способны служить источниками углерода и энер-
гии, но разлагаются бактериями в присутствии
кометаболитов, т. с. других веществ, обеспечива-
ющих микробный рост. Частичное или полное
разложение ксенобиотиков (не поддерживающих
рост) бактериями, растущими за счет использо-
вания других органических веществ, относится к
Рис. 34.18. Биодеградация хлорирован-
ных бифенилов. Показаны пути разложе-
ния хлорбифенилов, осуществляемого ря-
дом бактерий, в том числе Pseudomonas
pseudoalcaligenes. Общие размеры оперона
bph у Р. pseudoalcaligenes KF707 составля-
ют примерно 10 т.п.н. Гены приведены не в
масштабе. По [2] и [3].
Глава 34. Прокариоты в сельском хозяйстве 383
процессам кометаболизма (см. разд. 30.7). Как
правило, кометаболические процессы протекают
относительно медленно, но их экологическое зна-
чение очень велико.
Вместе с тем продукты неполного разложения
могут быть не менее опасны, чем исходные загряз-
нения, и хотя некоторые их них способны далее
разлагаться другими бактериями, все же продук-
ты неполного разложения накапливаются в почве,
например в составе гумуса. Поэтому желательно
создание микробных консорциумов или рекомби-
нантных штаммов, способных осуществлять пол-
ное разложение загрязняющих веществ.
Некоторые искусственно синтезируемые хи-
мические вещества, попадая в почвенную эко-
систему в результате сельскохозяйственной или
промышленной деятельности человека, могут
частично или полностью разлагаться микро-
организмами. Биодеградацию ксенобиотических
соединений, в том числе пестицидов, способ-
ны осуществлять бактерии нескольких родов,
в частности Achromobacter, Alcaligenes, Bacillus,
Flavobacterium и Pseudomonas. Анализ соответ-
ствующих путей катаболизма на генетическом и
биохимическом уровнях, возможно, позволит по-
лучать рекомбинантные штаммы, обладающие
альтернативными механизмами утилизации ста-
бильных, устойчивых к биоразложению ксенобио-
тических соединений, для применения с целью
биовосстановления среды, загрязненной токсич-
ными химическими веществами.
Выделяемые из природных образцов штаммы
способны, как правило, разлагать лишь несколь-
ко определенных загрязняющих веществ. Это
ограничение связано, главным образом, со стро-
гой специфичностью первого фермента пути де-
градации, атакующего только узкоспецифиче-
ский субстрат (например, 3-хлорбензоат, но не
4-хлорбензоат).
Следовательно, получение штаммов с новы-
ми катаболическими свойствами должно быть на-
правлено на расширение набора субстратов, ути-
лизируемых первым ферментом. Этого можно
достичь с помощью мутагенеза или введения ге-
нов, кодирующих ферменты других метаболиче-
ских путей. Например, в результате интродук-
ции гена, кодирующего 1,2-диоксигеназную ак-
тивность, был создан рекомбинантный штамм
Pseudomonas, способный окислять как 3-хлорбен-
зоат, так и 4-хлорбензоат. Другая стратегия по-
вышения потенциала биодеградации — это клони-
рование и комбинация структурных и регулятор-
ных генов, относящихся к различным путям ка-
таболизма. Конструирование новых путей ката-
болизма химических соединений, загрязняющих
природную среду, представляется весьма перспек-
тивным способом получения желаемых свойств
биодеградации у микроорганизмов для использо-
вания их как агентов биологического восстанов-
ления среды.
Дополнительная литература
Atlas R. М., Bartha R. (1993) Microbial ecology: fun-
damentals and applications. Redwood City, Calif.:
Benjamin/Cummings.
BarrasF., van Gijsegem F., Chatterjee A. К. (1994)
Extracellular enzymes and pathogenicity of soft-rot
Erwinia. Annu. Rev. Phytopathol. 32: 201-234.
Chaudhry G. R., ed. (1994) Biological degradation and
bioremediation of toxic chemicals. London: Chapman
& Hall.
CorkD..!., Krueger .I. P. (1991) Microbial transforma-
tions of herbicides and pesticides. In: Neidleman S. L,
Laskin A. I. (eds.) Advances in applied microbiology,
vol. 36. New York: Academic Press; 1-63.
Dangl I.L, ed. (1994) Bacterial pathogenesis of plants
and animals. Molecular and cellular mechanisms.
Berlin Heidelberg New York: Springer.
Denny T. P. (1995) Involvement of bacterial polysaccha-
rides in plant pathogenesis. Annu. Rev. Phytopathol.
33: 173-198.
Gresshoff P. M., ed. (1990) Molecular biology of symbio-
tic nitrogen fixation. Boca Raton, Flor.: CRC Press.
Handelsman .1., StabbE. V. (1996) Biocontrol of soil-
borne plant pathogens. Plant Cell 8: 1855-1869.
Head I. M. (1998) Bioremediation. Microbiol. 144: 599-
688.
LongS. R., Staskiawicz B. J. (1993) Prokaryotic plant
parasites. Cell 73: 921-935.
Lynch J. M., ed. (1990) The rhizosphere. New York:
Wiley.
O’Gara F., Dowling D.N., Boesten B., eds. (1994)
Molecular ecology of rhizosphere microorganisms.
Weinheim: VCH.
Pueppke S. G. (1996) The genetic and biochemical basis
for nodulation of legumes by rhizobia. Annu. Rec.
Biotechnol. 16 1-51.
384 Часть IX. Прикладная микробиология
Источники рисунков
1. Barras F., van Gijsegern F., Chatterjee A. K. (1994)
Annu. Rev. Phytopathol. 32: 201-234.
2. Furukawa K. (1994) Genetic systems in soil bacteria
for the degradation of polychlorinated biphenyls.
In: Chaudhry G. R. (ed.) Biological degradation and
bioremediation of toxic chemicals. London: Chapman
& Hall.
Silvestre M., Sondossi M. (1994) Selection of en-
hanced polychlorinated biphenyl-degrading bacte-
rial strains for bioremediation: consideration of
branching pathways. In: Chaudhry G. R. (ed.) Bio-
logical degradation and bioremediation of toxic
chemicals. London: Chapman fc Hall.
Глава 35
Прокариоты в промышленных технологиях
Не зная ничего о природе микробных процессов
брожения, только на основе практики наши пред-
ки тысячелетиями использовали эти процессы для
сохранения продуктов питания (например, путем
изготовления сыра и применения уксуса) и улуч-
шения их потребительских свойств (например, с
помощью хлебопечения), а также для получения
пива и вина. Хронологически развитие микробной
биотехнологии можно разделить на пять частич-
но перекрывающихся этапов (табл. 35.1).
До начала работ Пастера научных представ-
лений о природе используемых человеком био-
логических явлений не существовало. Открытие
Пастером в 1863 г. активной роли живых мик-
робов в брожении стало первым шагом па пути
от чисто описательных исследований к выяс-
нению механизмов микробных процессов. Рабо-
ты Пастера заложили основу для последующе-
го развития промышленного микробиологическо-
го производства бутанола, ацетона, бутапдиола,
изопропанола и других соединений. Разработка
технологий для производства этих органических
растворителей существенно способствовала раз-
витию методов промышленного культивирования
микроорганизмов и проложила путь для успеш-
ного внедрения в практику аэробного культиви-
рования в стерильных условиях в 1940-х гг. Свой
вклад в развитие микробиологической промыш-
ленности, в частности производства антибиоти-
ков, внесли, помимо микробиологии, биохимия и
технические пауки. Как только выяснилось зна-
чение пенициллина для медицины, фармацевти-
ческие компании начали проводить работы по
изучению и производству антибиотиков. Кроме
получения антибиотиков, большим вкладом мик-
робиологической промышленности в медицину
стало использование микроорганизмов для осу-
ществления высокоспецифических реакций фер-
Таблица 35.1. Этапы развития биотехнологии (примеры получаемых продуктов)
Допастеровский период (до 1865 г.)
• Спиртные напитки (пиво, вино)
• Молочные продукты (сыры, йогурт)
• Другие продукты, получаемые на основе брожения (уксус)
Пастеровский период (1865 1940 гг.)
• Промышленное культивирование (для получения продуктов брожения этанола, бутанола, ацетона, глицерола)
• Производство органических кислот (уксусной, лимонной, молочной)
Начало производства антибиотиков (1940—1960 гг.)
• Промышленное производство антибиотиков (пенициллина, стрептомицина, хлортетрациклина и др.)
• Микробное превращение стероидов (получение кортизона, тестостерона, эстрогена)
Расширение круга промышленно производственных микробных продуктов (1960—1975 гг.)
• Микробиологическое производство аминокислот (L-глутамата, L-лизина)
• Разработка методик производства микробного белка
• Производство ферментов (протеаз, амилаз, глюкозоизомсраз)
• Промышленное применение иммобилизованных ферментов (глюкозоизомераза)
• Производство бактериальных полисахаридов (ксантана)
Развитие синтетической биотехнологии (с 1975 г. по настоящее время)
• Разработка технологии рекомбинантной ДПК (1974 г.)
• Поступление на рынок первых продуктов в 1982 г. (вакцины против диареи животных, инсулина человека)
386 Часть IX. Прикладная микробиология
ментативного превращения при производстве сте-
роидных гормонов.
Накопление знаний о микробном метаболиз-
ме способствовало расширению применения бак-
терий для получения разнообразных метаболи-
тов и ферментов. Крупным достижением ста-
ло производство ферментов для использования,
например, в составе моющих средств и в промыш-
ленном получении глюкозы и фруктозы из крах-
мала. Быстрый рост производств на основе неф-
ти в 1960-е гг. позволил использовать доступные в
изобилии нефтяные фракции (например, алканы,
газойль и метанол) в качестве субстратов для по-
лучения микробной биомассы, предназначенной
на корм скоту (производство микробного кормо-
вого белка).
В 1980-е гг. началось активное развитие при-
кладной микробиологии, связанное с внедрени-
ем технологии рекомбинантной ДНК. Если до
этого времени методы мутагенеза и селекции ис-
пользовались лишь для повышения уровня ак-
тивности, присущей микробным клеткам, то при-
менение методов генетической инженерии поз-
волило придавать клеткам совершенно новые
синтетические способности, например способ-
ность к синтезу гормонов человека бактерии
Escherichia coli. Вначале работы по промыш-
ленному применению технологии рекомбинантной
ДНК ограничивались сферог! производства бел-
ков. По мере дальнейшего развития молекулярно-
генетических методов стало возможным клониро-
вание генов, связанных с разнообразными путями
метаболизма, и это позволило свести к миниму-
му набор бактерий, используемых в промышлен-
ном производстве. Таким образом, микробиоло-
гия и биотехнология на протяжении 20 в. прошли
путь развития от эмпирических до количествен-
ных дисциплин, открывающих новые перспек-
тивы практического использования микроорга-
низмов.
35.1. Для промышленного использования важен отбор
ограниченного числа оптимизированных штаммов
Из всего многообразия известных видов бактерий
в промышленности используется относительно
небольшое их число. Некоторые важные промыш-
ленно получаемые соединения и продуцирующие
их организмы приведены в табл. 35.2. Несмотря на
то, что этот перечень далеко не полон, он в доста-
точной мере охватывает области применения бак-
терий в биотехнологии. Все важнейшие бактерии-
продуценты относятся к хемоорганотрофам, т. е.
используют в качестве источника энергии и уг-
лерода органические вещества. В приведенном
списке широко представлены грамположительные
организмы: аэробные спорообразующие бактерии
рода Bacillus, некоторые коринеформные бакте-
рии (Corynebacterium) и нитчатые бактерии, в
частности рода Streptomyces. Грамотрицательные
бактерии представлены уксуснокислыми бактери-
ями и видами Xanthomonas. Для промышленного
использования штамм-продуцент должен харак-
теризоваться следующими свойствами:
- способностью расти в чистой культуре (не со-
держащей фагов) и генетической стабильно-
стью;
— отсутствием патогенности и токсинов;
- высокой скоростью роста при массовом куль-
тивировании и способностью синтезировать
продукт в большом количестве за период не
более 3 сут и
- устойчивостью к загрязнению (например, бла-
годаря подкислению им среды, способности к
росту при высокой температуре или к синтезу
антибиотиков).
Выделенные из природы штаммы микроор-
ганизмов используются, за исключением пище-
вой промышленности, лишь в нескольких про-
мышленных технологиях. В остальных случаях
применяются оптимизированные штаммы, полу-
чение которых составляет важную часть раз-
Глава 35. Прокариоты в промышленных технологиях 387
Таблица 35.2. Продукты, получаемые промышленными способами с помощью прокариот
Продукты Микроорганизмы
Пищевые продукты Соления и маринады Йогурт и кисломолочные продукты Уксус Leuconostoc, Pediococcus, Lactobacillus Lactobacillus, Streptococcus Acetobacter aceti
Пищевые и кормовые добавки Глутамат, лизин и другие аминокислоты Инозиновая кислота и рибонуклеотиды Витамины Corynebacterium glutamicum, Brevibacterium flavum Corynebacterium glutamicum Различные бактерии
Ферменты Протеазы о-Амилазы Глюкозоизомераза Пенициллинацилаза Bacillus licheniformis Bacillus amyloliquefaciens, Bacillus licheniformis Actinoplanes missouriensis, Streptomyces spp. Escherichia coli
Промышленные реагенты Этанол n-Бутанол, ацетон Молочная кислота Zymomonas mobilis Clostridium spp. Lactobacillus spp.
Полисахариды Ксантан Декстран Альгинаты Xanthomonas campestris Leuconostoc mesenterotdes Azotobacter vinelandii
Лекарственные препараты Стероиды Антибиотики Микобактерии и родственные бактерии Актиномицеты и Bacillus spp.
работки технологии микробиологического синте-
за. Оптимизация штаммов позволяет понизить
стоимость производства благодаря повышению
их продуктивности, приобретению способности к
росту на дешевых субстратах или более специфи-
ческих свойств.
До настоящего времени микроорганизмы с по-
вышенной активностью синтеза основных или
вторичных метаболитов получают методами му-
тагенеза и селекции. За последние годы были
разработаны автоматизированные процедуры с
применением роботов и микропроцессоров, позво-
ляющие существенно ускорить тестирование му-
тантов. Таким образом, получение большинства
высокопродуктивных штаммов было основано на
чисто эмпирических приемах (метод «проб и оши-
бок»). Дальнейшее повышение продуктивности
штаммов во многом зависит от подробного изу-
чения метаболических путей и механизмов их ре-
гуляции.
Наиболее эффективный современный метод
получения штаммов с желаемым генотипом состо-
ит в том, что в микробные клетки вводят опре-
деленные гены, полученные с использованием
технологии рекомбинантной ДНК. Введение гете-
рологичных генов и регуляторных элементов поз-
воляет конструировать новые пути метаболизма с
выгодными для производства характеристиками.
Такой подход к оптимизации клеточной активнос-
ти — изменение ферментативных, транспортных и
регуляторных свойств бактерий с использованием
технологии рекомбинантной ДНК — получил на-
звание метаболическая инженерия.
Одним из первых успехов на этом пути стало
получение рекомбинантного штамма с изменен-
ным азотным метаболизмом и повышение благо-
388 Часть IX. Прикладная микробиология
даря этому выхода биомассы, используемой в ка-
честве кормового микробного белка (КМБ).
Подобная процедура была осуществлена компа-
нией ICI (Великобритания) для получения КМБ с
применением метанола в качестве субстрата. В ос-
нову се разработки были положены следующие
сведения. Ассимиляция аммиака у метилотроф-
ной бактерии Methylophilus methylotrophus проис-
ходит с участием аминотрансферазы и глутамин-
синтетазы; процесс протекает с затратой 1 моль
АТР па I моль асиммилированного аммиака. В то
же время у Е. coli в ассимиляции аммиака участ-
вует только глутаматдегидрогеназа (Gdh) и про-
цесс не требует затраты АТР. С учетом этого
ген gdh из Е. coli был клонирован и введен в
лишенные глутаминсинтстазы мутантные клетки
М. methylotrophus. При экспрессии этого гена в
таких клетках урожай, благодаря экономии АТР,
был па 5% выше, чем в случае родительского
штамма.
Клонирование с последующим введением в
клетки и экспрессией гетерологичных генов мо-
жет использоваться для расширения катаболи-
ческих возможностей микроорганизма и соответ-
ственно спектра используемых им субстратов.
Например, Zac-оперон Е. coli был использован
для создания утилизирующих лактозу штаммов
Alcaligenes eutrophus, Corynebacterium glutamicum
и Xanthomonas campestris. Возможно также при-
менение технологии рекомбинантной ДНК для пе-
рестройки путей метаболизма и повышения за
счет этого продуктивности штаммов в результате
перенаправления метаболических потоков. Неко-
торые примеры осуществления таких подходов
будут приведены в этой главе.
Основными методами оптимизации использу-
емых в биотехнологии штаммов микроорганиз-
мов служат мутагенез и селекция. Новые до-
полнительные возможности целенаправленного
изменения микробного метаболизма открывает
метаболическая инженерия — применение в
промышленной микробиологии метода рекомби-
нантной ДНК.
35.2. Способ промышленного культивирования микроорганизмов
зависит от осуществляемого процесса
Благодаря последним достижениям молекуляр-
ной биологии масштабы биотехнологических про-
цессов стали четко определяться их характером.
Так, дорогостоящий продукт, например гормон
роста человека, может производиться в одном
200-литровом биореакторе и получаемое при этом
количество препарата обеспечивает имеющуюся
в нем потребность. В то же время традицион-
но получаемые микробные продукты, например
аминокислоты и антибиотики, требуется синте-
зировать в биореакторах объемом 200-400 м3.
Биореактором или ферментером называют
установку для биотехнологического культивиро-
вания микроорганизмов. Она должна обеспечи-
вать оптимальные условия для роста и метаболи-
ческой активности продуцента и в то же время
защиту от внешнего загрязнения.
35.2.1. Принципы устройства биореакторов
и условия культивирования
Стерильность □ Первый крупномасштабный
микробиологический процесс в фармацевтиче-
ской промышленности был осуществлен в био-
реакторе, представлявшем собой чан с мешал-
ке й, и несмотря на то, что с тех пор разработано
несколько типов промышленных биореакторов,
наиболее часто используемым остался именно тип
бака с перемешиванием. Как видно из рис. 35.1,
такой биореактор имеет цилиндрическую форму
с несколько выпуклым или плоским дном. В ка-
честве материала для изготовления биореакторов
обычно используют высококачественную нержа-
веющую сталь, чтобы исключить коррозию и по-
падание токсичных компонентов металла в куль-
Глава 35. Прокариоты в промышленных технологиях 389
туральную жидкость. Основное условие успешно-
го культивирования — это стерильность процесса,
поэтому перед инокуляцией внутренние поверхно-
сти биореактора, как и питательную среду, стери-
лизуют. Стерильным должен быть также воздух,
подаваемый в ферментер. Обычно среду стери-
лизуют внутри биореактора путем пропускания
пара через контуры и рубашки охлаждения. Воз-
дух, подаваемый в культуру, стерилизуют путем
пропускания через фильтры.
Аэрация □ Поскольку большинство биотех-
нологических процессов осуществляется в аэроб-
ных условиях, важную часть биореактора состав-
ляет система аэрации. Быстрорастущая культура
требует подачи большого количества кислорода.
Например, при росте с использованием глюкозы
как субстрата для образования 1 г сухой биомас-
сы требуется примерно 50U мл О?. Основная про-
блема при снабжении культуры кислородом свя-
зана с низкой растворимостью этого газа в вод-
ных растворах. В одном литре воды при 20 °C
и давлении 1 атм (101 кПа) при смешивании во-
ды с воздухом растворяется лишь 0,3 мМ кисло-
рода, что соответствует 9 мг Ог/л. Задачу ослож-
няет и то, что растворимость 0-2 снижается при
повышении температуры и ионной силы раство-
ра. В случае крупномасштабного культивирова-
ния, при высокой плотности культуры необходи-
мое бактериям количество кислорода может быть
обеспечено лишь путем принудительной аэрации.
На практике ее осуществляют путем пропускания
через культуральную жидкость стерильного воз-
духа. Эффективность перехода кислорода из воз-
душных пузырьков в жидкую фазу в основном за-
висит от соотношения между' площадью поверхно-
сти пузырьков и их объемом, а также от времени
пребывания пузырьков в жидкости. Чем меньше
пузырек, тем выше отношение площади его по-
верхности к объему и, соответственно, тем выше
эффективность перехода кислорода в жидкость.
При этом чем дольше пузырек находится в жид-
кости, тем большее количество кислорода диф-
фундирует в раствор. Один из способов уменьше-
ния размеров пузырьков состоит в пропускании
воздуха через рассекатель со множеством мель-
чайших отверстий, и такой способ предпочтитель-
нее подачи воздуха через одну трубку большого
диаметра. Увеличению насыщения среды кисло-
родом способствует также энергичное перемеши-
вание культуральной жидкости. Для наиболее эф-
фективного механического перемешивания лопас-
Рис. 35 1. Промышленный биореактор для культиви-
рования микроорганизмов. Часто используются специ-
ально сконструированные биореакторы, способные обес-
печивать как аэробные, так и анаэробные условия.
Добавка компонентов в среду, отбор проб и контроль
процесса осуществляются с сохранением стерильности.
ти мешалки устанавливают по вертикали вокруг
центрального стержня. Перемешивание и аэрация
культуральной среды могут приводить к сильно-
му вспениванию, в связи с чем необходим строгий
контроль пспообразования. Поскольку аэрация и
перемешивание требуют больших энергозатрат, в
настоящее время разрабатывается ряд других си-
стем, например биореактор сифонового типа.
Источники углерода □ Питательная среда
должна содержать все компоненты, необходимые
для процессов биосинтеза и получения требуемого
продукта. Поскольку от 25 до 70% общих затрат
на культивирование приходится на источник уг-
лерода и энергии, в промышленности чаще всего
применяют смешанные субстраты неопределенно-
го состава. Например, одним из наиболее деше-
вых источников углеводов, используемых в про-
мышленности, служит меласса, отход сахарного
производства. Помимо большого количества са-
харозы и рафинозы, меласса содержит азотистые
соединения, витамины и микроэлементы. Однако
большим недостатком этого субстрата является
непостоянство его состава в зависимости от ис-
ходного материала (сахарная свекла или сахар-
390 Часть IX. Прикладная микробиология
ный тростник), используемого при получении са-
хара. Хорошим источником углерода и энергии
при выращивании многих мицелиальных грибов,
дрожжей и актиномицетов служит солодовый экс-
тракт. Часто применяется также патока (глюкоз-
ный сироп) — продукт осахаривания крахмала пу-
тем ферментативного гидролиза.
Источники азота □ В качестве источника
азота часто используют кукурузный экстракт,
остающийся при получении из кукурузы крах-
мала. Этот концентрированный экстракт содер-
жит азот в количестве примерно 4%, в основ-
ном в составе аминокислот, таких как аланин,
аргинин, глутаминовая кислота, изолейцин, трео-
нин, валин и фенилаланин. При культивирова-
нии микроорганизмов для получения антибио-
тиков обычно используют соевую муку, остаток
соевых бобов после отжима масла. Этот комплекс-
ный субстрат, содержащий до 50% белка и 30% уг-
леводов, усваивается медленно, и углеродная ка-
таболитная регуляция при его использовании не
проявляется.
Конструкция биореакторов (ферментеров) для
промышленного культивирования микроорганиз-
мов обеспечивает создание оптимальных усло-
вий роста, включая концентрацию кислорода и
субстратов, pH среды и температурный режим,
а также исключает возможность загрязнения
культур.
35.2.2. Современные биотехнологические
установки регулируют по меньшей мере
pH среды, содержание кислорода
и температуру
В природе рост бактерий определяется множе-
ством внешних факторов, таких как количество
кислорода, температура, pH, наличие источников
углерода и азота, а также микроэлементов (см.
гл. 30). Данные о влиянии каждого из этих фак-
торов накапливаются в результате физиологиче-
ских и биохимических исследований микроорга-
низмов. В промышленности наиболее важно по-
лучить максимальную продуктивность штаммов,
и это достигается путем контроля за факторами,
определяющими активность клеток. В биореак-
торах имеются датчики, регистрирующие изме-
хения различных параметров, что позволяет на
основе анализа получаемых данных оптимизиро-
вать процесс. Физические и химические парамет-
ры (см. табл. 35.3) определяют либо непосред-
ственно в биореакторах, либо в отобранных из них
пробах. Скорость поглощения кислорода в биоре-
акторе измеряют как разницу концентраций кис-
лорода на входе и выходе газовых потоков с по-
мощью парамагнитного кислородного анализато-
ра или масс-спектрометра; кроме того, для этого
используются кислородные электроды (рис. 11.1).
С помощью селективного электрода можно также
определять уровень СО2, растворенного в жид-
кой среде. Газообразный СО2 определяют мето-
дом спектрофотометрии, газовой хроматографи-
ей или масс-спектрометрии. Образование тепло-
ты, выделяющейся в результате перемешивания,
аэрации и метаболических окислительных процес-
сов (примерно 50-80 кДж при образовании 1 кг
биомассы/ч), компенсирует охлаждающая систе-
ма. Для Этого биореактор снабжен множеством
термодатчиков. В результате метаболизма при
культивировании большинства микроорганизмов
изменяется pH культуральной жидкости. Обыч-
но значение pH в среде определяют с помощью
pH-электрода, и постоянный уровень этого па-
раметра поддерживают путем добавления кисло-
ты или щелочи. Применяются также автомати-
ческие устройства для постоянного контроля за
концентрацией продукта и других компонентов,
определяемых методами газовой и жидкостной
хроматографии. Биохимические параметры, пере-
численные в табл. 35.3, измеряют в пробах, за ис-
ключением уровня NADH2, содержание которого
определяют непосредственно в реакторе с исполь-
зованием флуорометрических методов.
Многоцелевое применение находят в процес-
сах промышленного культивирования микроор-
ганизмов компьютеры. Они обеспечивают ана-
лиз хода процесса, представление данных в гра-
фическом виде, хранение данных и управление
работой насосов и вентилей. Расчеты, выполня-
емые компьютером, включают, например, опре-
деление скоростей процессов, выхода биомассы,
продуктивности и дыхательной активности. Для
создания полностью компьютеризированной си-
стемы культивирования требуется иметь подроб-
ные математические модели процессов, позволяю-
щие определять пороговые уровни параметров и
регулировать физиологическое состояние культу-
ры и продуктивность. Знание в геханизмов регуля-
ции биосинтеза и транспорта данного метаболита
Глава 35. Прокариоты в промышленных технологиях 391
Таблица 35.3. Параметры, измеряемые при биотехнологических процессах
Физические параметры Химические параметры Биологические параметры
Температура Давление Энергопотребление Вязкость Скорости потоков воздуха и жидкости Мутность Масса ферментера pH Растворенный О2 О2 и СО2 в выходящем газе Окислительно-восстановительный потенциал Концентрация субстрата Концентрация продукта Ионная сила раствора Метаболиты Ферментативные активности Содержание ДНК и РНК Содержание АТР и NADH2 Содержание белка
позволяет находить пути увеличения его продук-
ции. В настоящее время разрабатываются методы
определения in vivo потоков углерода и их регу-
ляции в микробных клетках.
Инструментарий биореакторов обеспечива-
ет измерение и регуляцию уровня многих фак-
торов, влияющих на активность микроорганиз-
мов. С целью анализа и контроля за параметрами
культивирования используются компьютеры. Для
осуществления метаболической инженерии важно
иметь сведения о поглощении субстрата, метабо-
лических путях его использования и выделении
продукта, как основу для применения методов мо-
лекулярной инженерии и разработки математиче-
ских моделей процессов.
35.3. Важная область биотехнологии связана с пищевой промышленностью
В течение многих веков человек использует мик-
роорганизмы для приготовления пищевых про-
дуктов. Получение пищевых продуктов и напит-
ков с помощью различных процессов брожения
составляет важнейший сектор пищевой промыш-
ленности. В этой главе описаны некоторые спо-
собы применения процессов брожения для про-
изводства кисломолочных продуктов, обработки
мяса и получения уксуса. Виноделие как отрасль,
в которой используются исключительно дрожжи,
здесь не рассматривается.
35.3.1. Разнообразные кисломолочные продукты
получают с применением
молочнокислого брожения
Среди микробиологических производств получе-
ние молочных продуктов по объему продукции
уступает лишь производству алкогольных на-
питков. Сбраживание молока, обычно осу-
ществляемое различными видами Streptococcus и
Lactobacillus, как правило, заключается в пре-
вращении лактозы в молочную кислоту. Другие
реакции, которые могут происходить в ходе ос-
новного брожения или после пего, используются
для образования разнообразных кисломолочных
продуктов: твердых и мягких сыров, йогуртов,
сметаны, пахты, кефира и пр. Качество конеч-
ного продукта зависит как от осуществляющего
брожение организма, так и от характера и интен-
сивности протекающих ферментативных реакций.
При сбраживании молока образуется в качестве
основных продуктов брожения несколько кислот:
молочная, пропионовая, лимонная, уксусная и
масляная. Наиболее важный продукт любого мо-
лочнокислого брожения — это молочная кислота.
Присутствующая в молоке лактоза гидролизует-
ся бактериями с образованием глюкозы и галак-
тозы, которые затем превращаются в L-, D- или
DL-молочную кислоту. При снижении pH (в
результате повышения концентрации молочной
кислоты) до изоэлектрической точки казеина
392 Часть IX. Прикладная микробиология
(pH 4,6) образуется творог — исходный продукт
в производстве сыров. Благодаря низкому pH в
скисшем молоке не происходит протеолиза и свя-
занной с ним порчи продукта. Пропионовокислое
брожение используется в производстве швейцар-
ских сыров; образующиеся при нем пропионовая
кислота и диоксид углерода придают сыру специ-
фический вкус и вызывают образование характер-
ных «дырок». Особый вкус пахты и сметаны обу-
словлен продуктами лимоннокислого брожения и
определяется соотношением диацетила, пропио-
новой и уксусной кислот, а также ряда других
компонентов.
Молочнокислое брожение, используемое чело-
веком уже в чеченце тысячелетий, осуществля-
ют бактерии, присутствующие в самом молоке.
В настоящее время для приготовления различных
кисломолочных продуктов используются стар-
товые культуры (отобранные штаммы) с более
предсказуемыми свойствами и характеристиками.
Использование штаммов, нечувствительных к
фагам, в той или иной степени решает проблему
возможной фаговой инфекции. Поступающие на
рынок стартовые культуры для производства мо-
лочнокислых продуктов содержат различные мо-
лочнокислые бактерии (табл. 35.4).
Производство сыров —одно из старейших
бродильных производств. Этот способ переработ-
Таблица 35.4. Примеры основных молочнокислых
бактерий, используемых в технологиях сбраживания
молока
Продукт Организм
Йогурт Эммептал некий (швейцарский) сыр Сметана, простокваша Сыры Гауда и Эдам Кефир Lactobacillus delbrueckii subsp. bulgaricus, Streptococcus thermophilus Lactobacillus helveticus Lactococcus lactis subsp. lactis, Lactococcus lactis subsp. lactis биовар diacetylactis, Lactococcus lactis subsp. cremoris, Leuconostoc lactis, Leuconostoc mesenteroides subsp. cremoris Те же, что для сметаны Lactobacillus kefir, Lactobacillus kefiranofaciens, Lactococcus lactis
ки молока в продукт длительного храпения был
описан еще древними греками и римлянами. При
всем широком разнообразии сортов сыра их про-
изводство основано на ряде общих стадий. Первая
стадия — это пастеризация молока и засев в него
стартовой культуры. За ней следует стадия ство-
раживания молока, вызванного как его подкисле-
нием в результате образования молочной кисло-
ты, так и добавлением свертывающих молочные
белки ферментов, например сычужного фермента
реннина, выделяемого из желудка телят. Сверты-
вающие молоко ферменты характеризуются спо-
собностью гидролизовать к-казеиповую фракцию
молока, не затрагивая другие основные фракции
казеина. к-Казеин в коллоидной суспензии в при-
сутствии ионов кальция стабилизирует мицеллы
казеина. После свертывания молока створожен-
ную массу отделяют от сыворотки, солят и прес-
суют в формах. Для получения различных сор-
тов сыра используют различные дополнительные
процедуры, такие как инокуляция спорами плес-
невых грибов или бактериями. Созревание сы-
ров сопровождается гидролизом жиров, белков
и других компонентов створоженной массы под
действием бактерий и внеклеточных ферментов.
Продукты разложения этих веществ придают сы-
рам их характерный вкус. Созревание сыра может
быть ускорено путем добавления ферментов (про-
теаз и липаз) или мутантных бактерий, продуци-
рующих большое количество этих ферментов.
Йогурт приготавливают из термически обра-
ботанного молока путем его заражения куль-
турами Streptococcus thermophilus и Lactobacillus
bulgaricus в приблизительно равных количе-
ствах, обеспечивающих достижение желаемых
консистенции, вкуса и запаха. Сбраживание при
42-45 °C в течение 4 ч приводит к достаточному
подкислению (до pH ~4,0), благодаря которому
возможно хранение натурального йогурта. На со-
временных крупных производствах йогурты полу-
чают в ферментерах из нержавеющей стали объ-
емом до 10 000 л.
Наиболее важные кисломолочные продук-
ты, такие как твердые и мягкие сыры, йогурт
и сметана, производят с помощью промышлен-
ных стартовых культур, содержащих смесь мо-
лочнокислых бактерий. Виды родов Streptococcus
и Lactobacillus сбраживают лактозу с образовани-
ем молочной кислоты, а также продуктов, обла-
дающих специфическим вкусом.
Глава 35. Прокариоты в промышленных технологиях 393
35.3.2. Молочнокислые бактерии
сквашивают капусту
Хорошо известным примером природного броже-
ния, осуществляемого смесью бактерий на об-
щем субстрате, служит сквашивание капусты.
Чтобы началось брожение, измельченную капу-
сту, к которой добавлен 2,5% NaCI, помещают
в емкость с небольшим отверстием и плотно
уминают, обеспечивая создание анаэробных усло-
вий. Микроорганизмы в этой смеси представле-
ны главным образом кишечными и в меньшем
количестве молочнокислыми бактериями. Пол-
ностью бескислородные условия создаются за
счет дыхания растительных клеток и потребления
кислорода аэробными микроорганизмами. Внача-
ле в микрофлоре возрастает число энтеробакте-
рий как факультативно анаэробных форм. По-
скольку биомасса капусты по обладает высокой
буферной емкостью, в ходе молочнокислого бро-
жения происходит снижение pH, которое инак-
тивирует энтеробактерии и стимулирует дальней-
ший рост молочнокислых бактерий, таких как
Leuconostoc mesentcroides. По мере роста этой
гетероферментативной молочнокислой бактерии,
наряду с другими бактериями (см. разд. 12.2.2),
образуются молочная кислота, уксусная кисло-
та, этанол, D-маннитол, декстран, эфиры, СОг
и другие соединения. Эти вещества стимулируют
рост гомоферментативной молочнокислой бакте-
рии Lactobacillus plantarum и ингибируют разви-
тие нежелательных организмов, таких как дрож-
жи. На последней стадии квашения всегда про-
исходит рост L. plantarum (см. разд. 12.2.2), что
приводит к повышению концентрации молочной
кислоты до конечной величины 1,7%. Клетки
L. plantarum используют также маннитол, чем
уничтожается горький привкус капусты. Кваше-
ние служит примером микробного природного
сбраживания твердого субстрата. При этом пет
необходимости в использовании стартовой куль-
туры, поскольку доминирующим организмом в
конце квашения является Lactobacillus plantarum,
независимо от присутствия или отсутствия стар-
товой культуры.
Квашение капусты — пример природного
брожения, осуществляемого смесью энтеробакте-
рий и молочнокислых бактерий. На последней
стадии процесса доминирующим организмом все-
гда является гомоферментативная молочнокис-
лая бактерия Lactobacillus plantarum.
35.3.3. Брожение используют при изготовлении
мясных продуктов
Основные мясные продукты, получаемые с ис-
пользованием брожения,—это сухие и варено-
копченые колбасы. В качестве стартовых куль-
тур для бродильной ферментации мяса исполь-
зуют молочнокислые бактерии; образование ими
молочной кислоты необходимо для получения
определенного вкуса и снижения pH. Благодаря
подкислению увеличивается сочность продукта и
происходит денатурация белков мяса, что необ-
ходимо для формирования определенной тексту-
ры колбасы. Кроме того, кислая реакция пре-
пятствует развитию некоторых патогенных бак-
терий, таких как Salmonella и Staphylococcus
aureus. Добавление стартовой культуры приво-
дит также к снижению уровня гистамина и
увеличивает срок хранения продукта. Для об-
работки мяса часто используют промышленные
штаммы Pediococcus, образующие в достаточ-
ном количестве молочную кислоту. В производ-
стве сухих колбас применяют непатогенный вид
Staphylococcus carnosus, не образующий коагула-
зу. Виды Micrococcus обладают способностью вос-
станавливать нитраты до нитритов и подавлять
развитие Clostridium botulinum. Таким образом,
стартовые культуры могут быть использованы
при производстве бекона для удаления остаточ-
ного количества нитрита в целях предотвраще-
ния образования канцерогенных нитрозаминов
при жарке. Технологию ферментации мяса при-
меняют и при изготовления продуктов, обычно
не обрабатываемых с использованием брожения,
с целью улучшения их вкусовых свойств, увеличе-
ния срока хранения, предотвращения заражения
патогенными микроорганизмами и присутствия
токсичных веществ. Исследования в этой обла-
сти направлены па получение быстро образую-
щих кислоту штаммов Pediococcus и Lactobacillus
для сокращения времени ферментации при ва-
рьировании температуры в широком диапазоне
(20-45 °C).
В производстве сухих колбас важную роль иг-
рает применение молочнокислых бактерий, по-
скольку молочная кислота необходима для прида-
ния вкуса этим продуктам и для подавления роста
патогенных бактерий.
394 Часть IX. Прикладная микробиология
35.3.4. Уксус производят из жидкостей,
содержащих этанол
Уксус — водный раствор уксусной кислоты — по-
лучают путем бактериального окисления этано-
ла в его разведенных растворах. Древние гре-
ки и римляне, использовавшие разведенный уксус
в качестве освежающего напитка, получали его,
оставляя вино открытым на воздухе. Уксус может
образовываться в любой содержащей спирт жид-
кости; обычно его получают из вина или сидра,
но их может заменить разведенный очищенный
этанол. Уксус используется в качестве пищевой
добавки, а также как консервант для сохранения
мясных и овощных продуктов. Ежегодно в мире
производится примерно 1,6 • 109 л уксуса.
Облигатно аэробные уксуснокислые бактерии
близких родов Acetobacter и Gluconobacter, окис-
ляющие этанол до уксусной кислоты, могут
расти при низких значениях pH. В настоящее
время получены высокоэффективные промыш-
ленные штаммы, толерантные к высокой концен-
трации кислоты. Образование уксусной кислоты
этими организмами происходит в результате
неполного окисления этанола (см. разд. 9.18), при
котором кислород используется в качестве акцеп-
тора электронов. Как показано па рис. 35.2, этот
процесс включает превращение этанола в аце-
тальдегид с участием алкогольдегидрогеназы и
гидратированного ацетальдегида в уксусную кис-
лоту под действием ацетальдегиддегидрогепазы.
Таким образом, из 1 моль этанола образуется
1 моль уксусной кислоты, или из 1 л 12% (по
объему) этанола— 1 л 12,4% (по объему) уксусной
кислоты. Чтобы получить высокий выход продук-
та, требуется обеспечить достаточное содержание
в среде кислорода, необходимого для окисления
NADH2 в дыхательной цепи.
Существует три различных биотехнологиче-
ских способа производства уксуса. Первоначаль-
но разработанный метод открытого чана, или
Орлеанский метод, до сих пор используется
во Франции. Он состоит в том, что вино поме-
щают для большего контакта с воздухом в мел-
кие широкие чаны, где уксуснокислые бактерии
формируют топкий слой на поверхности жидко-
сти. Процесс протекает при этом довольно мед-
ленно, поскольку в контакте и с воздухом, и
с субстратом бактерии находятся лишь на по-
верхности. Другой способ основан на использо-
вании проточной системы, где контакт между
бактериями, воздухом и этанолом обеспечивается
путем пропускания раствора этанола через дре-
весные стружки (рис. 35.3; см. цв. вклейку). Бак-
терии растут на поверхности стружек, воздух про-
дувают через биореактор снизу вверх. В этом
случае 90% добавленного этанола превращает-
ся при 30 °C в уксусную кислоту и получение
12% уксусной кислоты занимает около трех суток.
Третий способ, широко используемый в промыш-
ленном производстве, основан па применении так
называемого ацетатора Фрингса. Он представ-
ляет собой закрытый биореактор большого объ-
ема с перемешиванием со дна для интенсивной
аэрации. Обычный промышленный процесс по-
лучения 12-15% уксусной кислоты осуществля-
ется полунепрерывным способом. Концентрации
уксусной кислоты и этанола в начале цикла со-
ставляют 7-10% и 5% соответственно. Брожение
происходит при температуре 27-32 °C. Когда кон-
центрация этанола уменьшается до 0,1-0,3%, при-
мерно 1/3 объема уксуса сливают и ферментер за-
полняют новым раствором, содержащим 0-2% ук-
сусной кислоты и 12-15% этанола, после чего цикл
повторяют. Для оптимального роста Acetobacter
необходимы как этанол, так и уксусная кислота.
Количество этанола является важным фактором:
при его концентрации ниже 0,2% возрастает ско-
рость отмирания бактерий, и в то же время мак-
симальная безопасная концентрация составляет
5%. Эффективность описанного процесса весьма
высока: 90-98% спирта превращается в уксусную
кислоту.
Производство уксуса основано па окислении
этанола до уксусной кислоты аэробными бакте-
риями родов Acetobacter и Gluconobacter, устой-
чивыми к повышенной кислотности среды и тре-
бующими для роста интенсивности аэрации.
Этанол
сн3сн2он
CHjCHO
CHjCH(OH),
NAD NADH2
Алд
CHjCOOH
Ацетальдегид
Ацетальдегидгидрат
Уксусная кислота
Рис. 35.2. Окисление этанола до уксус-
ной кислоты бактерией Acetobacter aceti.
Адг — алкогольдегидрогеназа; Алд — аце-
тальдегиддегидоогеназа.
Глава 35. Прокариоты в промышленных технологиях 395
35.4. Получение L-аминокислот и витаминов
не относится к классическим бродильным производствам
В отличие от описанных выше бродильных про-
изводств, методы получения L-аминокислот и ви-
таминов разработаны на основе тщательного изу-
чения путей метаболизма и селекции штаммов.
35.4.1. Сверхпродукция и выделение
L-аминокислот Corynebacterium
glutamicum происходит
в селективных условиях
Потребность в аминокислотах возрастает в
настоящее время в связи с расширением производ-
ства лекарственных препаратов, а также нищевых
и кормовых добавок. В медицине аминокисло-
ты используются в виде растворов для вливания
и как препараты для других терапевтических
целей. Производные аминокислот используются
в химической промышленности при изготовле-
нии косметических средств, искусственной кожи,
поверхностно-активных веществ, фунгицидов и
пестицидов. Все известные методы производства
аминокислот можно классифицировать следую-
щим образом: 1) гидролиз белков, 2) химический
синтез, 3) микробиологический синтез, например
из глюкозы или из химически синтезированных
предшественников и 4) ферментативный синтез.
При химическом синтезе, как правило, образуется
рацемическая смесь D- и L-аминокислот, требую-
щая дальнейшего разделения; два последних спо-
соба позволяют получать оптически гомогенные
препараты аминокислот. В этой главе будет опи-
сана технология синтеза промышленно наиболее
важных аминокислот — L-глутамиповой кислоты
и L-лизина.
Многие бактерии способны расти на простых
минеральных средах, содержащих глюкозу в ка-
честве единственного источника углерода и энер-
гии, аммоний и фосфат, и синтезируют все необ-
ходимые клеточные компоненты из этих простых
веществ. Многочисленные исследования показа-
ли, что при таких условиях роста содержание ос-
новных клеточных компонентов примерно следу-
ющее: белок —60%, нуклеиновые кислоты — 20%,
углеводы — 10% и липиды 10% в расчете на сухое
вещество. При столь высоком содержании белка
клетки должны обладать способностью к быстро-
му и эффективному синтезу аминокислот. Одна-
ко, как правило, уровень их синтеза не превыша-
ет потребности в них, т. е. сверхпродукции и вы-
деления аминокислот в культуральную жидкость
не происходит. Как было установлено в биохи-
мических и молекулярно-биологических исследо-
ваниях, бактерии обладают механизмами регуля-
ции (репрессии синтеза и регуляции по механизму
обратной связи с участием конечного продукта),
обеспечивающими экономную продукцию и выде-
ление метаболитов.
L-глутаминовая кислота □ В связи с воз-
растанием потребности в глутамате натрия
как вкусовой добавке в середине 1950-х гг.
в Японии была выделена аэробная бакте-
рия Corynebacterium glutamicum, продуцирую-
щая большое количество L-глутаминовой кисло-
ты. Клетки этой грамположительной бактерии,
представляющие собой короткие палочки, способ-
ны расти на простой минеральной среде с добав-
лением глюкозы и биотина. Максимальная про-
дукция L-глутаминовой кислоты с выделением
ее в среду достигается при концентрации био-
тина 0,5 мкг/г сухого вещества клеток, что ни-
же оптимальной концентрации для роста бакте-
рий. Избыток биотипа, вызывающий интенсив-
ный рост, одновременно снижает уровень на-
копления L-глутамиповой кислоты. Биотин слу-
жит коферментом ацетил-СоА-карбоксилазы —
фермента, участвующего в биосинтезе жирных
кислот (рис. 35.4). Вследствие этого лимитирова-
ние роста биотином вызывает изменения в жирно-
кислотном составе мембраны. Общее количество
жирных кислот, а также содержание фосфоли-
пидов в глутамат-продуцирующих клетках вдвое
меньше, чем в непродуцирующих клетках, рас-
тущих в среде с избытком биотина. На основа-
нии этого предполагается, что липидный состав
клеточной мембраны непосредственно влияет на
регуляцию выделения L-глутаминовой кислоты.
Как установлено, L-глутамат пересекает мембра-
ну не путем пассивной диффузии, но с участием
переносчика по механизму активного транспорта
(рис. 35.4). Таким образом, скорость продукции
396 Часть IX, Прикладная микробиология
Рис. 35.4. Влияние биотина на выделе-
ние L-глутамата клетками Corynebacterium
glutamicum. При лимитировании роста био-
тином снижается содержание фосфолипи-
дов в плазматической мембране и возрас-
тает продукция L-глутамата (см. рис. 7.2 и
7.13).
L-глутаминовой кислоты культурой С. glutamicum
коррелирует с высоким уровнем выделения этой
аминокислоты, индуцируемого при лимитирую-
щей концентрации биотина в среде.
Глюкоза метаболизируется С. glutamicum в
основном по гликолитическому пути с образо-
ванием СЗ- и С2-соединений. Ключевым пред-
шественником L-глутаминовой кислоты служит
сьоксоглутарат (а-кетоглутарат), образующийся
в цикле лимонной кислоты. Он превращается в
L-глутамат в реакции восстановительного амини-
рования, катализируемой NADP-зависимой глу-
таматдегидрогеназой. Промышленные штаммы-
продуценты обладают очень низкой ськстоглу-
таратдегидрогеназной активностью, благодаря
чему лишь небольшая часть ct-кетоглутарата ути-
лизируется в цикле лимонной кислоты и в ос-
новном он трансформируется в L-глутаминовую
кислоту. Данных о регуляции этих двух фермен-
тов у С. glutamicum пока, однако, очень мало.
Оксалоацетат образуется в реакции карбоксили-
рования фосфоенолпирувата; у мутантов с по-
вышенной активностью этого фермента повышен
и уровень продукции L-глутамата. Суммарный
процесс образования L-глутаминовой кислоты из
D-глюкозы отражает следующее уравнение.
С6Н12О6 + NH3 + 1,5О2 -*
-» C5H9O4N + СО2 + ЗН2О (35.1)
Таким образом, максимальный теоретический вы-
ход составляет 1 моль L-глутаминовой кислоты
на 1 моль утилизированной глюкозы, что соответ-
ствует 100% по молярному содержанию или 81,7%
но массе превращению D-глюкозы в L-глутамат.
L-глутаминовую кислоту получают в закры-
тых перемешиваемых биореакторах объемом до
150 м3. При этом требуется строгий контроль за
охлаждением, количеством растворенного кисло-
рода и значением pH. Оптимальные значения тем-
пературы составляют 30-35 °C, pH 7,0-8,0. Недо-
статок кислорода приводит к низкому выходу
L-глутамата и образованию молочной и яблочной
кислот, тогда как при его избытке накапливается
а-кетоглутарат. Реальный выход L-глутаминовой
кислоты через 2-3 сут инкубации составляет при-
мерно 50-60% массы внесенной глюкозы с конеч-
ной концентрацией продукта около 100 г/л. Еже-
годный объем мирового производства глутамата
превышает 800 тыс. т, и все это количество в ви-
Глава 35. Прокариоты в промышленных технологиях 397
де натриевой соли используется главным образом
в качестве вкусовой добавки в пищевой промыш-
ленности.
В норме бактерии не секретируют аминокис-
лоты в культуральную жидкость в значитель-
ных количествах, поскольку обладают система-
ми регуляции их синтеза и секреции. В случае
С. glutamicum высокий уровень продукции
L-глутаминовой кислоты может быть инду-
цирован при лимитировании роста уровнем био-
тина, необходимого для роста этой бактерии.
Активность цикла лимонной кислоты у это-
го организма ограничена на этапе п-кетоглута-
ратдегидрогеназной реакции, что также способ-
ствует выделению L-глутаминовой кислоты.
L-лизин □ Необходимая для питания челове-
ка и животных аминокислота L-лизип, получае-
мая промышленным способом, в основном исполь-
зуется в качестве кормовой добавки. Кроме того,
она применяется при создании сбалансированных
аминокислотных диет. В настоящее время в ми-
ре производится более 300 тыс. т L-лизина в год с
использованием штаммов С. glutamicum. Штам-
мы дикого типа этой бактерии не секретируют
L-лизин в культуральную жидкость, но получе-
ны мутантные штаммы — продуценты этой амино-
кислоты, характеризующиеся ауксотрофностью и
устойчивостью к антиметаболитам.
Путь биосинтеза L-лизина у С. glutamicum
показан на рис. 35.5 (см. также рис. 7.15 и
разд. 19.2). Активность первого фермента это-
го пути, аспартаткиназы, согласованно регулиру-
ется по механизму обратной связи L-треонином
и L-лизином. L-треонин ингибирует также по
механизму обратной связи активность гомосе-
риндегидрогеназы, L-метионин подавляет син-
тез этого фермента. Следовательно, ауксотроф-
ный по гомосерину или двойной ауксотрофный
по треонину и метионину штамм С. glutamicum
имеет пониженный внутриклеточный пул трео-
нина, что ослабляет ингибирование аспартат-
киназы и вызывает сверхпродукцию L-лизипа
(15-30 г/л). Другим эффективным подходом для
получения штаммов-продуцентов L-лизина слу-
жит отбор штаммов, мутантных по механизмам
регуляции. Рост С. glutamicum подавляет ана-
лог L-лизина Б-(2-аминоэтил)Ш-цистеин (АЭЦ).
Это ингибирование существенно усиливается под
действием L-треонина и устраняется L-лизином,
Рис. 35.5. Пути биосинтеза L-лизина, L-треонина и
L-изолейцина и их регуляция у Corynebacterium glu-
tamicum. Регуляция происходит по механизму обрат-
ной связи — путем ингибирования ферментов продук-
тами и подавления активности соответствующих генов.
Подробности см. в тексте.
т. е. АЭЦ вызывает ложную регуляцию путем ин-
гибирования аспартаткиназы по механизму об-
ратной связи. Некоторые мутанты, способные рас-
ти в присутствии и АЭЦ, и L-треонина, содержат
нечувствительную к их совместному ингибирую-
щему эффекту аспартаткиназу и при этом осу-
ществляют сверхпродукцию L-лизина (в количе-
стве 30-35 г/л). Используемый для образования
L-лизина L-аспартат образуется из оксалоацетата
в реакции карбоксилирования фосфоенолпирува-
та. Типичная динамика образования L-лизина в
культурах таких мутантов С. glutamicum пред-
ставлена на рис. 35.6. Концентрация L-лизина в
культуре достигает примерно 44 г/л, при этом
эффективность превращения сахара составляет
30-40%. При совместной сверхэкспрессии аспар-
таткиназы и дигидродипиколипатсинтазы про-
дукция L-лизина повышается на 10-20%.
398 Часть IX. Прикладная микробиология
Рис. 35.6. Динамика образования L-лизина мутантным
штаммом Corynebacterium glutamicum. О — Продукция
лизина, г/л; • — сухое вещество клеток, л/г; А — по-
требление глюкозы, %.
Рис. 35.7. Предполагаемый механизм выделения L-ли-
зина из клеток Corynebacterium glutamicum. Переносчик
(С) связывает субстраты L-лизин (Lys+) и ОН- в цито-
плазме и затем, после переориентации сайта связыва-
ния, высвобождает продукты во внешнюю среду. Цикл
переноса регулируется на разных стадиях мембранным
потенциалом (Д^), градиентом pH (ДрН) и градиентом
L-лизина (ALys).
Выделение L-лизина из клеток происходит не
путем пассивной диффузии через мембрану, а с
участием специфичного к L-лизину переносчи-
ка по механизму симпорта с двумя ионами ОН
(рис. 35.7). Нагруженная субстратом и свобод-
ная молекулы переносчика различаются по заря-
ду. Скорость выделения L-лизина зависит от ряда
факторов, влияющих на различные стадии пере-
носа через мембрану, а именно от мембранного по-
тенциала, градиента pH и градиента лизина. Эта
высокоспецифичная транспортная система обла-
дает следующими свойствами.
1. Переносчик характеризуется высоким значе-
нием /<м для L-лизина (20 мМ) на цитоплаз-
матической стороне мембраны, что предот-
вращает выход лизина из клеток при его низ-
кой внутренней концентрации.
2. Перенос сопряжен с транспортом в проти-
воположном направлении Н+ и ОН- (см.
табл. 5.2).
3. Свободная молекула переносчика несет поло-
жительный заряд, и благодаря этому мем-
бранный потенциал может направлять секре-
цию L-лизина.
С использованием технологии рекомбинант-
юй ДНК были получены штаммы С. glutamicum
: амплифицированными генами пути биосинтеза
u-треонина, что позволило повысить продукцию
u-лизина. Увеличение числа копий генов фермен-
’ов, нечувствительных к ингибированию по ме-
ханизму обратной связи, гомосериндегидрогена-
зы и гомосеринкипазы, у штамма—продуцента
L-лизина способствует направлению потока уг-
лерода от интермедиата — аспартатсемиальдеги-
да— к гомоссрину и вследствие этого высокому
накоплению L-треонина. Конечная концентрация
L-лизина уменьшается с 65 до 4 г/л, тогда как
содержание L-треонина возрастает с 0 до 52 г/л
(рис. 35.8).
Рис. 35.8. Разделение потока углерода при амплифи-
кации thr-оперона биосинтеза L-треонина у штамма —
продуцента L-лизина Corynebacterium glutamicum. Asa
— аспартатполуальдегид; Hom — гомосерин; ThrA —
гомосериндегидрогеназа; ThrB — гомосеринкиназа;
ThrA- — нечувствительная к ингибированию по меха-
низму обратной связи гомосерин дегидрогеназа; ThrC —
треонинсинтаза; ThrB —нечувствительная к ингибиро-
ванию по механизму обратной связи гомосеринкиназа.
Глава 35. Прокариоты в промышленных технологиях 399
Для получения L-лизина выделены штаммы
С. glutamicum, лишенные активности гомосерин-
дегидрогеназы или имеющие нарушение регуля-
ции аспартаткиназы. Выделение L-лизина проис-
ходит с участием специфической системы экспор-
та.
35.4.2. Микробиологическое производство
витаминов С и В12 имеет
экономически важное значение
Витамины как кофакторы роста широко исполь-
зуются в качестве пищевых и кормовых добавок,
в виде лекарственных и общеукрепляющих препа-
ратов. Микроорганизмы синтезируют разнообраз-
ные витамины, но промышленным способом в на-
стоящее времени получают с помощью бактерий
лишь витамин В12 и аскорбиновую кислоту. Ви-
тамин В12 (б'-дезоксиаденозилкобаламин) в при-
роде синтезируется только бактериями (рис. 35.9).
Животные получают этот витамин с пищей или
благодаря усвоению его как продукта жизнедея-
тельности кишечных бактерий. Человек получает
витамин В12 лишь с пищей, поскольку синтези-
рующие его бактерии заселяют у него тот отдел
кишечника, где всасывания не происходит. Пре-
парат витамина В12, нашедший применение в ле-
чебных целях и как пищевая добавка, впервые
был получен в качестве побочного продукта син-
теза антибиотиков штаммами Streptomyces. Вы-
ход витамина при этом составлял лишь 1 мг/л.
При возрастании потребности в нем были выделе-
ны для промышленного производства высокопро-
дуктивные штаммы пропионовокислой бактерии
Propionibacterium freudenreichii и Pseudomonas
denitrificans.
Микроаэрофильные виды Propionibacterium в
определенных средах (содержащих мелассу или
жидкость от замачивания кукурузы) с добавле-
нием кобальта в анаэробных условиях синтезиру-
ют корриноиды кобальта. Поскольку в аэробных
условиях эти бактерии способны синтезировать
5,6-диметилбензимидазол, был разработан дву-
стадийный процесс. На первой, анаэробной ста-
дии (2-4 сут) бактерии растут и образуют
5-дезоксиаденозилкобаламид (рис. 35.9). Затем
условия меняют на аэробные (аэробная стадия
3-4 сут), после чего начинается синтез 5,6-диме-
тилбснзимидазола, который может превращаться
в 5-дезоксиаденозил кобаламин (кофермент В12),
продуцируемый в количестве до 40 мг/л. Культу-
ра Р. denitrificans используется в одностадийном
процессе. Синтез ею витамина В12 происходит па-
раллельно с ростом бактерий в присутствии кис-
лорода; кобальт и 5,6-диметилбензимидазол вно-
сят в среду. С помощью мутагенеза и отбора уда-
Рис. 35.9. Структура витамина В12 и некоторых других кобаламинов
400 Часть IX. Прикладная микробиология
лось получить штаммы, продуцирующие витамин
В12 в количестве примерно 150 мг/л. В настоящее
время мировое производство этого витамина со-
ставляет приблизительно 12 т в год.
Витамин С (L-аскорбиновая кислота) как
важный элемент питания человека и животных
используется в медицине, а также в пищевой про-
мышленности в качестве антиоксиданта. Мировой
уровень продукции витамина С составляет при-
мерно 70 тыс. т в год. Технологию производства
называют синтезом Райхштайна-Грюсснера. Про-
цесс состоит из нескольких химических и одной
микробиологической стадий. На первой стадии
из D-глюкозы путем химического восстановле-
ния получают D-глюцитол (сорбитол). Затем сор-
битол окисляют до L-сорбозы микробиологиче-
ским способом с помощью Gluconobacter oxydans
в условиях интенсивного перемешивания куль-
туры и при достаточном уровне кислорода. Ко-
личественное превращение 200 г D-глюцитола/л
происходит в течение примерно 24 ч. Образовав-
шуюся L-сорбозу осаждают ацетоном с образо-
ванием сорбозодиацетона, окисляемого далее до
диацетон-2-кето-L-гулоновой кислоты, из которой
получают L-аскорбиновую кислоту. Другие про-
мышленные микробиологические технологии ос-
нованы на использовании смешанных культур
(Bacillus megaterium и Gluconobacter sp.) для пре-
вращения L-сорбозы непосредственно в 2-кето-Ь-
гулоновую кислоту. Помимо синтеза Райхштайна-
Грюсснера разработан двустадийный микробио-
логический синтез (рис. 35.10). На его первой
стадии глюкоза окисляется до 2,5-дикето-В-глю-
коната штаммами Erwinia с образованием в ка-
честве промежуточных продуктов D-глюконата
и 2-кето-В-глюконата. Вторая стадия заключа-
ется в превращении 2,5-дикето-Б-глюконата в
2-кето-Ь-гулонат, осуществляемом с использова-
нием различных видов Corynebacterium. Сте-
реоспецифическое восстановление в положении
С5 катализирует NADPH-зависимая 2,5-дикето-Ь-
глюконатредуктаза. С целью проведения процес-
са превращения D-глюкозы в 2-кето-Ь-гулонат в
одну стадию метаболические возможности штам-
мов Erwinia были расширены с помощью ме-
тода рекомбинантной ДНК. В клетки Erwinia
был введен клонированный ген 2,5-дикето-Ь-глю-
копатредуктазы из клеток Corynebacterium. При
оптимальных условиях культивирования реком-
бинантный штамм Erwinia производит примерно
120 г 2-кето-Ь-гулоната/л за 120 ч. Молярный вы-
ход продукта при использовании бактериями глю-
козы составляет примерно 60%. Поскольку такой
процесс существенно проще, чем многостадийный
химический синтез или двустадийный путь, пре-
вращение глюкозы в 2-кето-Ь-гулонат с использо-
ванием рекомбинантных штаммов Erwinia может
давать значительную экономию при производстве
витамина С.
Витамин (цианкобаламин) в природе син-
тезируют исключительно бактерии. Для его про-
мышленного производства используются штам-
мы Propionibacterium freudenreichii, Р. shermanii и
Pseudomonas denitrificans. Производство витами-
на С (аскорбиновой кислоты) включает несколь-
ко химических и одну микробиологическую ста-
дию, которая состоит в окислении D-глюцитола
(сорбитола) с помощью Gluconobacter oxydans.
К настоящему времени получены рекомбинант-
ные штаммы Erwinia, превращающие глюкозу
непосредственно в 2-кето-гулонат.
Рис. 35.10. Углеводные метаболиты, участ-
вующие в микробиологической трансфор-
мации D-глюкозы в 2-кето-1_-гулоновую
кислоту. Вверху: двустадийный последо-
вательный процесс ферментации; внизу:
одностадийный процесс с использованием
рекомбинантной бактерии. Glc — D-глюкоза;
Gnt — D-глюконовая кислота; 2-KDG —
2-кето-0-глюконовая кислота; 2,5-DKG —
2,5-дикето-0-глюконовая кислота; 2-KLG
— 2-кето-1_-гулоновая кислота; rDKGR —
ди кето- D- гл юкон ат редуктаза. клонированная
из Corynebacterium sp. и экспрессирован-
ная в Erwinia herbicola для получения
одностадийного процесса трансформации
Глава 35. Прокариоты в промышленных технологиях 401
35.5. Бактерии способны осуществлять специфические превращения
стероидов и стеролов в определенные гормоны
Технологические процедуры, в которых микро-
организмы превращают субстрат в структурно
сходный продукт, называют процессами биотранс-
формации. Обычно биотрансформация включает
одну или несколько ферментативных реакций, та-
ких как гидроксилирование, дегидроксилирова-
ние, эпоксидирование, окисление, восстановление,
гидрогенирование, дегидрогенировапие, этерифи-
кация, гидролиз эфиров и изомеризация. Исполь-
зовать микроорганизмы в этих процессах гораздо
выгоднее, чем применять химические методы,
особенно когда требуется высокоспецифичпо воз-
действовать на определенную часть молеку-
лы субстрата и получить определенный изомер
продукта. Подобные превращения, чрезвычайно
сложные для химической технологии, легко осу-
ществляются микроорганизмами, и выход про-
дукта при этом превышает 90%. К преимуще-
ствам биотрансформации следует также отнести
низкую затрату энергии, умеренные температур-
ные условия (20-40 °C), безопасность процесса
(не требующего применения вредных химических
веществ) и доступность продуктов отхода для
биодеградации.
Ключевую роль микроорганизмы выполняют
в промышленном синтезе кортикостероидных гор-
монов — кортикостерона, кортизона, гидрокорти-
зона и их терапевтически более эффективных
аналогов — преднизона, преднизолона и триамци-
нолона. Путем биотрансформации осуществляет-
ся специфическое гидроксилирование С 11-атома
стероидной структуры. Кортизон, впервые выде-
ленный в 1930-х гг., уже в 1949 г. был успешно
применен как эффективное средство для лечения
ревматического артрита. В связи с потребностью
разработать синтетический способ его получения
как более эффективный, чем экстракция из над-
почечников быка, был разработан путь химиче-
ского синтеза из дезоксихолиновой кислоты, но
он включал 37 стадий и стоимость 1 г продукта
составляла 200 долларов. В 1952 г. был предло-
жен метод 11 а-гидроксилирования прогестерона
в одну стадию с использованием гриба Rhizopus
arrhizus. Включение этой стадии микробного пре-
вращения позволило уменьшить общее количе-
ство стадий в синтезе кортизона до 11 и снизить
стоимость продукта до 6 долларов за грамм. Та-
ким образом, эта разработка стала решающей для
создания пути экономичного синтеза адренокор-
тикотропных гормонов и открыла широкие воз-
можности для получения производных кортико-
стероидов.
В настоящее время в промышленном про-
изводстве используются четыре реакции био-
трансформации (рис. 35.11). Реакцию 11л-гид-
роксилирования прогестерона теперь проводят
с помощью Rhizopus nigricans, получая выход
lla-гидроксипрогестерона свыше 85%.. Реакцию
16л-гидроксилирования стероидов осуществляет
Streptomyces argenteolus. Эта реакция в основ-
ном используется при получении триамциноло-
на, обладающего противовоспалительной актив-
ностью производного 9а-фторкортизола. В ходе
реакции 11/3-гидроксилирования, впервые описан-
ной у грибов Cunningharnella blakesleeana и Сиг-
vularia lunata, происходит 11/3-гидроксилирование
соединения S (11-дезоксикортизол) в гидрокор-
тизон с выходом продукта 60-70%. Таким обра-
зом, прогестерон более нс служит единственным
субстратом для этой реакции гидроксилирования;
для нее используют также соединение S и мно-
гие другие стероиды. Важное преимущество мик-
робных процессов трансформации стероидов со-
стоит в их широкой субстратной специфичности,
позволяющей подбирать наиболее удобные интер-
медиаты для гидроксилирования с целью после-
дующего химического или микробиологического
синтеза конечного продукта. Микробные реак-
ции гидроксилирования обеспечивают непосред-
ственное присоединение гидроксильной группы к
атому С в определенном положении. Участвую-
щие в этом гидролазы представляют собой инду-
цибельпые, NADPH- и Ог-зависимые ферменты.
Введение двойной связи в стероидное кольцо А
(С1-дегидрогенирование стероидов) с высокой эф-
фективностью осуществляют культуры бактерий
Streptomyxa affinis или Arthrobacter simplex. Эта
реакция необходима в синтезе преднизолона и
преднизона (рис. 35.12).
При растущей потребности в стероидных пре-
паратах возник дефицит их предшественников,
используемых для биотрансформации, например
стерола диосгенина, получаемого из Dioscorea
composite. Благодаря интенсивным исследовани-
402 Часть IX. Прикладная микробиология
Рис. 35.11. Микробиологическая трансформация прогестерона. Диосгенин экстрагируют из корней Dioscorea
composita. Стигмастерол выделяют из Glycine max. Модификации отмечены полужирным.
ям, предпринятым с целью применения деше-
вых стеролов, таких как холестерол, Д-ситостс-
рол животного происхождения и стигмастерол
из Glycine max, были получены мутанты My-
cobacterium sp. с неактивной С 1-дегидрогеназой
и/или 9а-гидрокси лазой, обладающие способ-
ностью превращать перечисленные стеролы в
андростендион и андростадиеидион, важные ин-
термедиаты синтеза эстрогенов. На основе опи-
санных реакций микробиологического синтеза
производится ряд медицински важных кортико-
идов (рис. 35.12). Прогестерон, получаемый в ре-
зультате химического превращения стигмастеро-
ла, трансформируется в Па-гидроксипрогестерон
с помощью Rhizopus nigricans. Далее На-гидро-
ксипрогестерон химически модифицируют в гид-
рокортизон и кортизон или дегидратируют с по-
мощью Streptomyxa affinis в положении С1 с
образованием преднизолона и преднизона, обла-
дающих высокой противовоспалительной актив-
ностью. При другом способе диосгенин химически
превращают в соединение S Райхштайна, подвер-
гаемое затем 11Д-гидроксилированию с исполь-
зованием Curvularia lunata для получения гид-
рокортизона, который с помощью Arthrobacter
simplex превращают в преднизолон.
В настоящее время промышленность потреб-
ляет примерно 2000 т диосгенина, используемого
для получения, на основе химических и микро-
биологических процессов, продуктов общей стои-
мостью более 1 млрд, долларов. Получаемые та-
ким путем эстрогены, прогестерон и андрогены
используются в терапевтических целях, производ-
ные прогестерона и эстрогенов — в качестве кон-
трацептивов. Кроме того, стероиды применяют
как седативные препараты, средства противоопу-
холевой терапии и лекарственные препараты в ве-
теринарии. Глюкокортикоиды входят также как
необходимые компоненты в состав многих других
лекарственных препаратов. По вкладу в произ-
водство медикаментов микробная трансформация
стероидов уступает лишь синтезу антибиотиков.
Глава 35. Прокариоты в промышленных технологиях 403
11а-Гидроксипроге стерон
11₽-Г идроксипрогестерон
16а-Г идроксипрогестерон
1-Дегидропрогестерон
Рис. 35.12. Микроорганизмы, используемые в производ-
стве стероидных препаратов.
Микробная трансформация составляет важней-
шую часть экономичных технологий получения
медицински важных стероидов. Микроорганиз-
мы осуществляют стереоспецифическое гидрокси-
лирование различных стероидов, катализируемое
NADPH- и Ог-зависимыми гидроксилазами.
35.6. Антибиотики представляют собой микробные продукты,
подавляющие метаболизм других организмов
В отличие от первичных, основных метаболи-
тов, необходимых для жизнедеятельности и ро-
ста клеток, так называемые вторичные метабо-
литы не являются, по-видимому, необходимыми
для вегетативного роста микроорганизмов. Каж-
дое соединение, относящееся к вторичным мета-
болитам, продуцируют лишь немногие микроор-
ганизмы, и синтез его зависит от определенных
внешних условий. В связи с этим взамен терми-
нов вторичный метаболизм и вторичные метабо-
литы недавно были введены термины индивиду-
альный метаболизм и индивидуальности. Фермен-
ты, участвующие в синтезе индивидуальностей,
регулируются совместно с процессами дифферен-
цировки, но отдельно от ферментов основного
метаболизма (см. гл. 27). Один из классов вто-
ричных метаболитов составляют антибиотики —
микробные продукты, подавляющие различные
метаболические процессы у других организмов.
Первым из них был открыт пенициллин, благо-
даря обнаруженному в 1929 г. Александром Фле-
мингом подавлению роста стафилококка грибом
Penicillium notatum.1 Это открытие и разработка
способов промышленного производства пеницил-
лина положили начало эре антибиотиков. К на-
стоящему времени описано свыше 9000 антибио-
тических соединений, и ежегодно становятся из-
вестны сотни новых.
Наиболее важное применение антибиотики
имеют в качестве противомикробных средств для
лечения инфекционных болезней человека. Кроме
того, их применяют как цитотоксические агенты
против определенных типов опухолей, а также в
ветеринарии, фитопатологии, пищевой промыш-
ленности (для консервации продуктов) и сельском
хозяйстве (в качестве стимуляторов роста расте-
ний). Промышленное получение антибиотиков ос-
новано главным образом на применении мицели-
альных грибов (Aspergillaceae и других Moniliales)
и бактерий, в основном родов Streptomyces и
404 Часть IX. Прикладная микробиология
Таблица 35.5. Примеры важных антибиотиков, производимых путем промышленного культивирования продуцентов
Группа антибиотиков (класс химических соединений) Пример Продуцирующий организм Применение
Полипептиды А миногликозиды Макролиды Полиеновые макролиды Тетрациклины Бацитрацин Стрептомицин Эритромицин Кандидин Хлортстрациклин Bacillus lichcniformis Streptomyces griseus Streptomyces erythreus Streptomyces viridoflavus Streptomyces aureofaciens Только локальное в связи с ток- сичностью Главным образом при туберкулезе Особенно эффективен против Staphylococcus и возбудителя дифтерии; малотоксичен Широко используется при грибко- вых заболеваниях в тропиках При инфекциях, вызванных грам- положительными или грамотри- цательными бактериями
Bacillus. Примерно 120 типов антибиотиков про-
изводится с помощью промышленного культиви-
рования продуцентов, и, кроме того, разработаны
способы получения свыше 50 подобных антибио-
тикам полусинтетических соединений, также на-
шедших применение в медицине. Годовой объем
мирового производства антибиотиков превышает
100 тыс. т, и общая рыночная стоимость этой про-
дукции оценивается в 5 млрд, долларов. Важные
антибиотики, получаемые на основе промышлен-
ного культивирования микроорганизмов, приве-
дены в табл. 35.5 (см. также гл. 27).
35.6.1 Поиск антибиотики осуществляют
путем скрининга штаммов
Большинство новых антибиотиков открывают,
производя скрининг микробных штаммов, выде-
ленных из природных образцов. Он состоит в
том, что чистые культуры (природные изоляты),
получаемые в качестве предполагаемых проду-
центов антибиотиков, проверяют на способность
подавлять рост других микроорганизмов. Клас-
сический метод поиска антибиотической актив-
ности— это тест с диффузией в агаровой среде.
Чувствительную тест-бактерию высевают на ага-
ризованную среду в чашках Петри в таком ко-
личестве, чтобы она образовала газон, и затем
помещают поверх агара кружки фильтровальной
бумаги, пропитанные фильтратами культур те-
стируемых микроорганизмов. Если в фильтрате
присутствует антибиотик, вокруг кружка бума-
ги через 1-2 сут инкубации наблюдается зона по-
давления роста. При стандартизированных усло-
виях диаметр зоны подавления роста пропорцио-
нален логарифму концентрации антибиотика; та-
ким образом, этот тест можно использовать и для
количественного определения концентрации анти-
биотика. Изоляты, явно обнаруживающие способ-
ность к образованию антибиотиков, исследуют да-
лее на предмет того, относятся ли продуцируемые
ими антибиотики к уже известным или должны
быть описаны как новые.
Успех процедуры скрининга зависит от разра-
ботки «умных» тестов, позволяющих исключать
известные или нежелательные антибиотики и вы-
являть соединения с желаемыми свойствами. На-
пример, для поиска ингибиторов ^-лактамазы —
фермента, расщепляющего /?-лактамное кольцо и
таким образом обеспечивающего устойчивость к
пенициллину (препараты этого фермента приме-
няют при лечении пенициллином в случае устой-
чивых возбудителей), супернатанты тестируемых
культур помещают в чашки Петри с агаризован-
ной средой, содержащей пенициллин и засеянной
штаммом бактерии, продуцирующей /?-лактамазу.
Таким образом, ингибиторы (3-лактамазы могут
быть выявлены по признаку подавления роста
этого штамма.
Поскольку многие патогенные бактерии спо-
собны приобретать устойчивость к большинству
обычных антибиотиков, необходим поиск новых
антибиотиков или производных уже известных
антибиотиков. Проверка новых антибиотиков тре-
бует тестирования их на токсичность, канцероген-
Глава 35. Прокариоты в промышленных технологиях 405
ность и побочные эффекты (например, аллерги-
ческие реакции), что повышает издержки, поэто-
му часто предпочтительнее получать производ-
ные уже известных продуктов.
Антибиотики — это вторичные метаболиты,
или индивидуальности, которые подавляют рост
других микроорганизмов. К настоящему време-
ни известно свыше 9000 антибиотических соедине-
ний, и ежегодно становятся известны еще несколь-
ко сотен новых антибиотиков, открываемых с
использованием различных процедур скрининга
микробных штаммов, выделяемых из природной
среды.
35.6.2. Первым из аминогликозидных
антибиотиков был открыт стрептомицин
Открытие стрептомицина 3. Ваксманом в 1944 г.
стало большим вкладом в медицину, поскольку
это был первый антибиотик, успешно использо-
ванный для лечения туберкулеза. Стрептомицин
относится к аминогликозидным антибиотикам;
его молекула включает остаток аминоциклогек-
сапола, соединенный гликозидной связью с остат-
ком метилпентозы, в свою очередь связанным с
остатком N-метилглюкозамина. (см. рис. 27.18).
К настоящему времени известно свыше 100 ами-
ногликозидов, продуцируемых штаммами Strepto-
myces', из них в медицине, помимо стрептомицина,
используются канамицин, гентамицин и неоми-
цин, прежде всего при инфекциях, вызываемых
грамотрицательными бактериями. Эти антибио-
тики подавляют синтез белка; например, стрепто-
мицин связывается с белком S12 (ген rpsL) в со-
ставе 308-субъединицы рибосом, что приводит к
существенному нарушению процесса трансляции.
Штаммы Streptomyces продуцируют разнооб-
разные амипогликозидные антибиотики, молеку-
лы которых содержат в качестве агликонов амп-
ноциклогексанолы. Эти антибиотики подавляют
синтез белка.
35.6.3. Тетрациклины как важные антибиотики,
широко применяемые в медицине
Первым из тетрациклинов был открыт хлор-
тетрациклин, выделенный из фильтратов куль-
тур Streptomyces aureofaciens в 1945 г. Молеку-
лы тетрациклинов представляют собой систе-
му нафтаценовых колец (см. разд. 27.3.1) с
разнообразными заместителями. Так, хлортетра-
циклин содержит атом хлора, окси тетрациклин
— дополнительную гидроксильную группу. Му-
тантный штамм Streptomyces, у которого блокиро-
вана реакция хлорирования, в качестве основного
продукта выделяет тетрациклин. Тетрациклины
как антибиотики с широким спектром действия
подавляют рост почти всех грамположительных и
грамотрицательных бактерий. Они действуют на
активность 308-субъединицы рибосом, ингибируя
связывание амипоацил-тРНК с A-сайтом в про-
цессе трансляции (см. разд. 15.3.4).
Путь биосинтеза хлортетрациклина включает
образование 72 промежуточных соединений, в том
числе на начальном этапе — малонамоил-СоА,
связанного с ферментным комплексом аптрацен-
синтазой. Малопамоил-СоА конденсируется с во-
семью молекулами малонил-СоА, что приводит
к циклизации с образованием в конечном ито-
ге хлортетрациклина. Штаммы с высоким выхо-
дом тетрациклина характеризуются пониженной
скоростью гликолиза, и образованию тетрацикли-
на может способствовать использование ингиби-
тора гликолиза бензилтиоцианата. В этих усло-
виях повышается активность пентозофосфатного
цикла. Ферментом, лимитирующим скорость био-
синтеза тетрациклина, может быть апгидротетра-
циклипоксидаза — предпоследний фермент в пути
биосинтеза. По-видимому, скорость синтеза анти-
биотика пропорциональна активности этого фер-
мента. В свою очередь его синтез подавляется
фосфатом и стимулируется бензилтиоцианатом.
Имеется также обратная связь между внутрикле-
точным уровнем аденилатов и активностью это-
го фермента. Уровень АТР или общий уровень
аденилатов, по-видимому, выполняет роль мета-
болического эффектора в катаболитной регуля-
ции биосинтеза тетрациклинов.
Концентрация тетрациклинов в культураль-
ной жидкости при их промышленном производ-
стве составляет примерно 20 г/л. Поскольку путь
биосинтеза весьма сложен, увеличение продуктив-
ности штаммов может быть достигнуто только с
помощью методов мутагенеза и селекции. В каче-
стве другого подхода к повышению продуктивно-
сти проводят отбор штаммов, устойчивых к про-
дуцируемому антибиотику. Среда для культиви-
рования продуцентов обычно содержит сахарозу,
406 Часть IX. Прикладная микробиология
кукурузный отвар, фосфат аммония и минераль-
ные соли; pH ее составляет 5,8-6,0; температуру
инкубации поддерживают па уровне 28 °C. При
культивировании необходима усиленная аэрация,
особенно на стадии роста биомассы. Если в каче-
стве субстрата используется глюкоза, необходимо
ее постоянное добавление. Поскольку синтез тет-
рациклинов подавляется фосфатом, культивиро-
вание проводят в условиях лимитирования роста
концентрацией фосфата. Процесс выращивания
стрептомицета для получения хлортетрациклина
в погруженной культуре можно подразделить на
три фазы. В первой фазе происходит быстрый
рост биомассы с интенсивным потреблением пи-
тательных веществ. Во время этой фазы мицелий
имеет вид толстых базофильных гиф; отмечается
высокое содержание РНК в биомассе. Во второй
фазе скорость роста падает, иногда рост прекра-
щается, происходит синтез антибиотика с макси-
мальной скоростью и начинается процесс диффе-
ренцировки. Гифы становятся тонкими; содержа-
ние РНК в них падает. В заключительной фазе
скорость синтеза антибиотика падает, происходит
фрагментация и лизис мицелия.
Синтез хлортетрациклина представляет со-
бой сложный метаболический процесс, включа-
ющий образование 72 интермедиатов и участие
большого числа генов. Поскольку процесс синте-
за подавляется фосфатом, питательная среда, ис-
пользуемая при промышленном производстве, со-
держит его в лимитирующей концентрации.
35.6.4. Перестройка путей синтеза антибиотиков
с использованием технологии
рекомбинантной ДНК
В биосинтезе любого антибиотика участвует боль-
шое число генов, поэтому получение высоко-
продуктивных штаммов-продуцентов с помощью
молекулярно-генетических методов представляет
собой весьма сложную процедуру. Применение
метода рекомбинантной ДНК направлено не толь-
ко на повышение выхода и скорости синтеза анти-
биотиков, но также на получение модифицирован-
ных и даже новых антибиотиков. О первой рабо-
те такого рода сообщили Д. Хопвуд (Hopwood) с
коллегами в 1985 г. Они ввели часть генов, участ-
вующих в синтезе актинородина у Streptomyces
coelicolor, в штамм Steptomyces, который проду-
цирует медермицин (рис. 35.13). Рекомбинантный
штамм продуцировал химерный антибиотик, на-
званный медерродином. Использованная реком-
бинантная плазмида содержала ген фермента,
катализирующего /3-гидроксилирование актино-
родина. Благодаря широкой субстратной спе-
цифичности этот фермент в клетках рекомби-
нантного штамма гидроксилировал медермицин в
аналогичном положении с образованием медер-
родина. Подобно этому в мутантный штамм
Saccharopolyspora erythraea с прерванным на ран-
ней стадии биосинтезом эритромицина была вве-
дена библиотека ДНК Streptomyces antibioticus —
продуцента олеандомиципа. Один из полученных
рекомбинантных штаммов образовывал соедине-
ние с антибиотической активностью, названное
2-норэритромицином. Оно представляет собой мо-
дифицированную структуру, лишенную по срав-
нению с молекулой эритромицина одной функци-
ональной группы (—СНз).
В каждом из описанных примеров культуры
приобретали способность к синтезу модифициро-
Рис. 35.13. Структура актинородина, медермицина и ме-
дерродина.
Глава 35. Прокариоты в промышленных технологиях 407
ванных структур с заменой группы у одного ато-
ма углерода. Более широкие возможности полу-
чения новых антибиотиков открывает путь изме-
нения основной структуры метаболита. Так, при
введении в клетки Streptomyces galilaeus, в нор-
ме продуцирующие аклациномиципы А и В, гена
поликетидсинтазы — фермента синтеза актиноро-
дина— были получены клоны, продуцирующие
антрахинон, антибиотик с ранее неизвестной
структурой. В будущем, вероятно, появятся спо-
собы изменения структуры антибиотиков рацио-
нальным образом. Чтобы достичь этой цели, важ-
но также модифицировать специфичность био-
синтетических ферментов путем сайт-направлен-
ного мутагенеза и/или генетической инженерии.
Технология рекомбинантной ДНК может ис-
пользоваться как для повышения выхода и ско-
рости синтеза антибиотиков, так и для получения
новых антибиотиков.
35.7. Промышленное производство бактериальных ферментов
Уже в древности человек эмпирическим путем
нашел способы использования ферментов в виде
грубых экстрактов животного или растительно-
го материала либо продуктов жизнедеятельности
микробов для практических целей (например в та-
ких процессах, как сыроварение и выделка кожи).
Открытие в начале 20 в. активности ферментов в
бесклеточных экстрактах положило начало раз-
работке методов применения ферментных препа-
ратов в промышленности, аналитических методах
и медицине. Для получения ферментов использу-
ются в том числе микроорганизмы, способные вы-
делять их в окружающую среду для разложения
сложных органических субстратов (белковой, ли-
пидной или углеводной природы), которые иначе
не могут быть использованы как источник пита-
тельных веществ.
Промышленное производство ферментов на-
чалось с получения грибной амилазы, использу-
емой в качестве лекарственного препарата (при
нарушениях пищеварения) в США еще с 1894 г.
В 1915 г. О. Ремом (Roehm) был запатентован
«способ стирки всех типов одежды с использова-
нием добавок триптических ферментов». Благо-
даря совершенствованию методов стерилизации и
промышленному получению антибиотиков стало
возможным массовое культивирование микробов
в виде чистых культур, и тогда же, примерно 25-
30 лет назад, началось производство микробных
ферментов. Эти ферменты (см. табл. 35.6), раз-
лагающие различные биополимеры, находят при-
менение в разнообразных областях. Специфич-
ность действия и высокие скорости реакций при
мягких условиях их протекания делают приме-
нение подобных препаратов более выгодным по
сравнению с химическими способами. Ферменты
получают главным образом с помощью штаммов
Bacillus и Aspergillus. Поскольку они выделяют
ферменты в культуральную жидкость, получение
их препаратов не представляет особых трудно-
стей (см. разд. 19.4). Как правило, выход фер-
мента в процессе культивирования бактерий ро-
да Bac>,U.us с использованием дешевых источни-
ков углерода и азота составляет примерно 20 г
вещества на 1 л среды за относительно короткое
время. Это свидетельствует о способности штам-
мов Bacillus продуцировать значительное коли-
чество ферментов при доступной стоимости про-
изводства. С внедрением механических методов
промышленного выделения белков из микро-
организмов широкое применение в пищевой,
фармацевтической и химической промышлен-
ности нашли внутриклеточные ферменты, в
частности глюкозоизомераза, применяемая для
производства сиропов с высоким содержани-
ем фруктозы, и пспициллинацилаза, удаляющая
боковые цепи из молекул пенициллинов (необхо-
димый этап для последующего производства по-
лусинтетических пенициллинов). Другие фермен-
ты, например глюкозооксидаза, широко исполь-
зуются для клинических анализов. К настоящему
времени товарооборот промышленно получаемых
ферментов составляет свыше 1 млрд, долларов
в год.
408 Часть IX. Прикладная микробиология
Таблица 35.6. Промышленное применение ферментов
Ферменты Механизм действия Применение
Протеазы а-А ми лазы Глюкозоизомераза Пектиназы Целлюлазы Липазы Неспецифический гидролиз белков Специфический гидролиз казеина Разложение крахмала до олигосаха- ридов Изомеризация глюкозы во фруктозу Гидролиз пектинов Гидролиз целлюлозы Расщепление триацилглицеролов Добавки к детергентам, выделка кожи, хлебопечение Производство сыра Обработка крахмала, хлебопечение, получение крах- мального сиропа, проклеивание текстиля, произ- водство бумаги и картона Производство глюкозо-фруктозных сиропов Обработка фруктов и овощей Мацерирование и сушка растительного сырья Добавки к детергентам
Ферменты находят широкое применение в
промышленности, поскольку специфичность дей-
ствия и высокая скорость реакции при мягких
условиях проведения делают их использование
более выгодным, чем применение химических ме-
тодов. Значительное количество гидролитических
ферментов способны выделять в культуральную
жидкость клетки различных штаммов Bacillus.
35.7.1. Растворимые ферменты иммобилизуют
для промышленного применения
Иммобилизация ферментов обеспечивает ряд пре-
имуществ для их применения: 1) возможность
восстановления и повторного использования фер-
ментов в поточных процессах или 2) возможность
создания непрерывно действующих ферментных
систем по аналогии с системами непрерывного
культивирования микроорганизмов и 3) возмож-
ность использования млогоферментпых систем.
При иммобилизации фермент стабилизируется, но
при этом не исключена утрата его активности.
Существует три способа иммобилизации фермен-
тов (рис. 35.14; см. цв. вклейку).
1. Связывание фермента с твердым носи-
телем, таким как пористое стекло, керамиче-
ские шарики, оксид алюминия, синтетические
полимеры или целлюлоза. Для прикрепления
ферментов к носителю применяют методы, за-
имствованные из химии пептидов и белков.
При этом предпочтительно образование кова-
лентных связей, поскольку они не нарушают-
ся в зависимости от pH, ионной силы или при-
роды субстрата. Однако в некоторых случаях
ковалентное связывание вызывает частичную
или полную инактивацию фермента.
2. Сшивка молекул фермента через би-
функциональные агенты □ Возможно
осуществить связывание молекул фермен-
тов друг с другом посредством химическо-
го взаимодействия с бифункциональным пе-
рекрестносвязывающим агентом, например
глутаровым альдегидом, реагирующим с ами-
ногруппами в составе ферментов. Это способ
иммобилизации одной молекулы фермента на
другой.
3. Включение ферментов в микрокапсулы,
гели или волокнистые полимеры, имеющие по-
ры. Размеры пор должны быть такими, чтобы
молекулы фермента не могли вымываться, но
в то же время могла происходить диффузия
низкомолекулярных субстратов и продуктов.
При использовании в промышленных процессах
ферменты часто требуется иммобилизовать путем
связывания с твердым носителем или заключения
в полимеры.
Ниже описываются некоторые ферментатив-
ные процессы, используемые в промышленных
производствах.
35.7.2. Глюканогидролазы превращают крахмал
в моносахариды
Наиболее важные ферменты, участвующие в про-
цессе осахаривания крахмала, — это 1,4~а-1Э-глю-
Глава 35. Прокариоты в промышленных технологиях чиу
^-D-фруктоза
Глюкозоизомераза
a-D-глюкоза
Рис. 35.15. Ферментативный гидролиз крахмала и превращение глюкозы во фруктозу. о-Амилаза катализирует
гидролиз крахмала до декстринов (олигосахаридов), которые далее гидролизуются до глюкозы глюкоамилазой.
Изомеризацию глюкозы во фруктозу катализирует глюкозоизомераза.
кап-глюканогидролаза (ЕС 3.2.1.1; а-амилаза) и
1,4-q-D-глюкан-глюкогидролаза (ЕС 3.2.1.3; глю-
коамилаза). л-Амилаза катализирует эндогидро-
лиз а-1,4-глюкозидных связей в амилозе и ами-
лопектине, как и других полимерах глюкозы, с
образованием олигосахаридов. Термостабильные
а-амилазы могут быть использованы при высо-
котемпературных условиях. Фермент из Bacillus
amyloliquefaciens имеет температурный оптимум
70 °C, фермент из В. licheniformis — 90 °C. По-
следний может кратковременно использоваться
при температурах до 110 °C, причем ионы каль-
ция и высокие концентрации субстрата стабили-
зируют его активность. Для обработки крахмал
разводят в воде (готовят 40% раствор), осуществ-
ляют частичный ферментативный гидролиз при
105 °C в течение 5 мин (чтобы уменьшить вяз-
кость) и затем гидролизуют в течение 1 ч при
90 °C.
После этого первого этапа расщепления обра-
зовавшиеся олигосахариды обрабатывают глюко-
амилазой, которая отщепляет от них последова-
тельно концевые остатки глюкозы. В промыш-
ленном масштабе глюкоамилазы получают из
выращиваемых культур грибов Aspergillus niger
или Rhizopus niveus. Эти ферменты обладают низ-
кой специфичностью (помимо а-1,4-связей гидро-
лизуют также о- 1,6-связи, но с меньшей скоро-
стью), стабильны в широком диапазоне pH и об-
ладают максимальной активностью при 75 °C, но
обычно их используют при 65 °C. Наиболее важ-
ное применение глюкоамилазы находят при изго-
товлении сиропов с высоким содержанием глю-
козы (90-97%), используемых для производства
кристаллической глюкозы, или сиропов с высоким
содержанием фруктозы (глюкозо-фруктозные си-
ропы). Ферментативное превращение крахмала в
глюкозу и фруктозу иллюстрирует рис. 35.15.
Разработка способа изомеризации глюкозы
иммобилизованной глюкозоизомеразой для про-
изводства сиропов с высоким содержанием фрук-
тозы (глюкозо-фруктозные сиропы) стала одним
одним из достижений последних 15 лет. Глюко-
зу превращают в более сладкую фруктозу пол
действием глюкозоизомеразы из Bacillus соади-
Ians, Streptomyces rubiginosus, Actinoplanes missou-
riensis или Flavobacterium arborescens. Этот фер-
мент активен при 60-65 °C и обеспечивает об-
разование почти эквивалентной смеси глюкозы f
фруктозы. Получаемые таким способом глюкозо-
410 Часть IX. Прикладная микробиология
фруктозные сиропы заменили тростниковый или
свекольный сахар во многих важных случаях
применения, поскольку фруктоза имеет даже бо-
лее сладкий вкус, чем сахароза. Только в США
ежегодно производится более 2 млн. т глюкозо-
фруктозных сиропов.
Технология ферментативного гидролиза крах-
мала с образованием глюкозы и последующего по-
лучения глюкозо-фруктозных сиропов нашла ши-
рокое применение в пищевой промышленности.
35.7.3. Протеазы включают в качестве добавок
в моющие средства
Среди наиболее важных в промышленном отно-
шении ферментов второе место после амилаз за-
нимают в настоящее время протеазы. Ежегодно в
мире производится примерно 500 т этих фермен-
тов, используемых прежде всего в производстве
моющих средств. Огромным достижением для
промышленности стало внедрение способа полу-
чения протеаз из Bacillus licheniformis, в первую
очередь субтилизипа. К копну 1960-х гг. проте-
азы включали в состав примерно 50% всех детер-
гентов, производимых в Европе и США. Посто-
янно продолжаются исследования, направленные
на усиление ферментативной активности протеаз,
их способности к удалению пятен и стабилизацию
активности в мыльной пене. Для промышленно-
го производства требуются штаммы, дающие вы-
сокий выход внеклеточных протеаз. Поскольку
продуктивность штаммов дикого типа низка для
промышленных целей, проводятся интенсивные
исследования с целью ее повышения. Кроме то-
го, клонированы гены нескольких протеаз и с
помощью методов генетической инженерии полу-
чены штаммы Bacillus, продуцирующие модифи-
цированные сериновые протеазы. Например, за-
мена в них аминокислотного остатка Met-222 на
остаток одной из неокисляемых аминокислот поз-
волила получить протеазы, значительно более
устойчивые к действию Н2О2- Продукция вне-
клеточных протеаз регулируется главным обра-
зом составом среды (см. разд. 7.3 и 19.4). Так,
ее подавляют ионы аммония и аминокислоты, в
связи с чем при промышленном культивировании
продуцентов в основном используют технологию
с постоянной подачей питательных веществ в био-
реактор, чтобы поддерживать в среде низкую кон-
центрацию этих источников азота. Синтез про-
теаз начинается в конце экспоненциальной фазы
роста культуры. Содержание добавок протеаз в
моющих средствах составляет 0,5%, при этом вно-
симый препарат содержит активный фермент в
количестве 3%. Такая относительно низкая кон-
центрация фермента в детергенте вполне доста-
точна благодаря высокому сродству фермента к
субстрату.
Протеазы получают промышленным способом с
использованием выделяющих их в большом коли-
честве штаммов Bacillus. Эти ферменты использу-
ют в качестве добавок, вносимых в моющие сред-
ства.
35.7.4. Ферменты применяют
как лекарственные препараты
Один из примеров наиболее успешного использо-
вания ферментов в качестве лекарственных пре-
паратов — это лечение ими некоторых типов зло-
качественных заболеваний, в том числе острого
лимфоцитарного лейкоза аспарагиназой. При
этой болезни опухолевые клетки не способны син-
тезировать аспарагин и путем поддержания низ-
кого уровня этой аминокислоты в организме с по-
мощью введения аспарагиназы можно подавить
их рост, не вызывая побочного действия, а имен-
но влияния на нормальные клетки. Для промыш-
ленного производства этого фермента использу-
ют мутантные штаммы Escherichia coli, Serratia
marcescens или Erwinia carotovora.
Важное значение для медицины имеет также
получение фибринолитических ферментов. Они
применяются при инфарктах, вызванных заку-
поркой кровеносного сосуда тромбом. В норме
процессы образования и растворения фибрина, из
которого в основном состоит тромб, в крови и тка-
нях тонко сбалансированы. Процесс фибринолиза
включает превращение плазминогена в протеоли-
тиноский фермент плазмин, который воздейству-
ет на фибрин. В связи с этим лечение включает
прием активатора плазминогена, в качестве кото-
рого часто используют стрептокиназу, продуци-
руемую ^-гемолитическими стрептококками.
Глава 35. Прокариоты в промышленных технологиях 411
35.8. С помощью технологии рекомбинантной ДНК
получают гетерологичные белки
В число соединений, получаемых с помощью
генетически модифицированных бактерий, вхо-
дят белки человека, обладающие терапевтиче-
ским действием (табл. 35.7). Многие из этих
белков синтезируются в организме в следовых
количествах, и до разработки технологии реком-
бинантной ДНК получение их препаратов пред-
ставляло значительные трудности. Промышлен-
ное производство низкомолекулярных белков, не
требующих гликозилирования для проявления ак-
тивности, основано на клонировании генов и вве-
дении их в бактерии, где они экспрессируются
с образованием белкового продукта. Для получе-
ния гликозилированных белков слож] юй структу-
ры более пригодны культуры тканей.
Чаще всего для получения гетерологичных
белков используют Е. coli, биология и генетика
которой хорошо изучены. В течение последних
15 лет штаммы этой бактерии служат объектом
для введения разнообразных клонированных ге-
нов с целью их экспрессии. При благоприятных
условиях содержание в клетках Е. coli гетероло-
гичного белка может составлять до 30% общего
белка. Часто, однако, чужеродные и особенно
сверхпродуцируемые белки в Е. coli становят-
ся мишенью для внутриклеточного протеолиза
или формируют нерастворимые агрегаты («тель-
ца включения»). Альтернативным организмом
для интродукции клонированных генов служит
В. subtilis. Преимущество штаммов Bacillus в ка-
честве продуцентов гетерологичных белков состо-
ит в том, что чужеродные белки могут выделять-
ся ими в культуральную жидкость. Количество
продуцируемых бактериями гетерологичных бел-
ков быстро возрастает; некоторые из них описы-
ваются ниже.
35.8.1. Первым из лекарственных средств
с помощью технологии рекомбинантной
ДНК был получен человеческий инсулин
Гормон инсулин, продуцируемый поджелудочной
железой, жизненно важен для регуляции метабо-
лизма углеводов в организме человека. Недоста-
точность этого гормона обусловливает развитие
диабета, различными формами которого страда-
ют 1-2% населения Европы и США. После того,
как в 1922 г. инсулин был впервые использован
для лечения, этот гормон с целью применения как
лекарственного препарата начали выделять из
поджелудочной железы животных (быков и сви-
ней). Как бычий, так и свиной инсулин несколько
отличается по аминокислотной последовательно-
сти от инсулина человека, и в результате этого у
больных, принимающих животный инсулин, вы-
рабатываются противоинсулиновые антитела.
Таблица 35.7. Некоторые белки с терапевтическим действием, получаемые промышленным способом на основе
технологии рекомбинантной ДНК с использованием бактерий
Продукт Комментарий Фирмы-производители
Человеческий инсулин («гу- мулин») Гормон роста человека Колониестимулирующий фак- тор (КСФ) Интерлейкин-2 Гамма-интерферон Поступает в продажу; применяется для лечения диабета Поступает в продажу; применяется для лечения карликовости Стимулирует дифференцировку гранулоцитов; может быть эффективен при лечении лейкоза в сочетании с химиотерапией для восстанов- ления иммунокомпетентности Применим при лечении рака в комбинации с ЛАК-клетками или лимфоцитами, инфиль- трирующими опухоль Применяется как антивирусный и противоопу- холевый препарат Eli Lilly, Genentech, Novo Eli Lilly, Genentech, KABI Amgen, Immunex, Genetics Institute, Cetus Amgen, Cetus, Immunex Amgen, Biogen, Genentech
412 Часть IX. Прикладная микробиология
В активной форме инсулин представляет со-
бой димер из полипептидов А (21 аминокислот-
ный остаток) и В (30 аминокислотных остатков),
соединенных двумя дисульфидными мостиками.
Эти два полипептида кодируются двумя раздель-
ными частями одного гена инсулина. Ген инсулина
кодирует 1) препроинсулип — полипептид, содер-
жащий сигнальную последовательность для экс-
креции белка, 2) полипептиды А и В, образу-
ющие активный инсулин, и 3) соединительный
полипептид, отсутствующий в зрелом белке. Ин-
сулин образуется в результате ферментативного
процессинга препроинсулина через этап образова-
ния проипсулина.
Технология производства человеческого ин-
сулина с использованием бактерий, разработан-
ная совместно компаниями Eli Lilly и Genentech,
потребовала первоначально конструирования по-
следовательности ДНК, соответствующей извест-
ной аминокислотной последовательности инсули-
на. Затем был осуществлен химический синтез ге-
нов цепей А и В (рис. 35.16). По разработанной
в дальнейшем процедуре, каждый из этих генов,
содержащих метиониновый кодон на б'-конце и
терминирующую последовательность на З'-конце,
был встроен в отдельную плазмиду pBR322, а
именно в lacZ-ген Е. coli, (кодирующий часть мо-
лекулы Д-галактозидазы) с образованием гена хи-
мерного белка. (Ген lacZ локализован в плазми-
де pBR322.) Каждую из этих плазмид ввели в
отдельный штамм Е. coli. Трансформированные
таким образом бактерии продуцируют химерные
белки, содержащие цепь А или В соответствен-
но. После лизиса бактерий производят обработку
экстракта бромцианом, расщепляющим белка по
остаткам метионина, для отделения цепей А и В
от фрагментов Д-галактозидазы (молекула инсу-
лина не содержат остатков метионина). Получен-
ные полипептиды А и В очищают и подвергают
рекомбинации с образованием нативной двухце-
почечной молекулы инсулина. Получаемый пре-
парат, не содержащий белков Е. coli, эндотоксинов
и пирогенов, химически и физиологически экви-
валентен человеческому инсулину из поджелудоч-
ной железы и полностью обладает его биологиче-
ской активностью. Компания Eli Lilly осуществ-
ляет продажу этого препарата с 1982 г.
Позднее был разработан альтернативный спо-
соб синтеза инсулина, па основе введения в Е. coli
гена проипсулина. Полученный проинсулин после
его очистки подвергают для образования натив-
Синтез ДНК, кодирующей В-цепь,
и встраивание ее в /acZ-ген
в составе плазмиды pBR322
Синтез ДНК, кодирующей А-цепь,
и встраивание ее в lacZ-ген
в составе плазмиды pBR322
Трансформация рекомбинантной
плазмидой клеток Е. coli
Трансформация плазмидой
клеток Е. coli
белка бромцианом
A-цепь инсулина Очистка В-цепь инсулина
ГОкисление
S S
S S
Инсулин
Рис. 35.16. Принцип производства человеческого ин-
сулина с использованием технологии рекомбинантной
ДНК. Химически синтезированные гены А- и В-цепей
инсулина по отдельности встраивают в ген lacZ (коди-
рующий Д-галактозидазу) в составе плазмиды pBR322.
Полученными гибридными плазмидами трансформиру-
ют клетки Е. coli, продуцирующие в результате химер-
ные белки, включающие фрагмент Д-галактозидазы це-
пи и A-цепь или В-цепь инсулина. После отщепления А
и В-цепи рекомбинируют, получая нативный двухцепо-
чечный инсулин.
пого инсулина химической обработке, включаю-
щей Д-расщепление трипсином и карбоксипепти-
дазой’, последовательность собственно инсулина
эти ферменты не затрагивают. В 1992 г. объем
продаж человеческого инсулина составил пример-
но 625 млн. долларов.
35.8.2. Интерфероны используются как
антивирусные и противоопухолевые
агенты
Одной из наиболее выдающихся разработок в
области применения технологии рекомбинантной
ДНК стал синтез полипептида, обладающего ак-
Глава 35. Прокариоты в промышленных технологиях 413
тивностыо человеческого интерферона, в клет-
ках Е. coli. Интерфероны — это белки, продуци-
руемые клетками большинства позвоночных в
ответ на вирусную инфекцию. Они вызыва-
ют устойчивость к вирусу инфицированных или
индуцированных клеток, обусловленную синте-
зом ряда белков de novo. Кроме того, интерфе-
роны обладают свойствами подавления пролифе-
рации клеток и модуляции иммунной системы.
Интерфероны различных классов кодируют-
ся разными генами и обладают специфически-
ми функциями. В организме они присутствуют
в чрезвычайно малых количествах, с чем связа-
на основная трудность их выделения для тера-
певтического использования. С целью промыш-
ленного получения интерферона был синтезиро-
ван и встроен в плазмиду ген а-интерферона
человека (длиной 514 п.н.). Этой плазмидой
трансформировали клетки Е. coli, что позволило
в результате выделять «-интерферон в необходи-
мом количестве. Получены также штаммы Е. coli,
продуцирующие /3- и 7-интерфероны, сохраняю-
щие антивирусную активность, хотя, в отличие
от природных интерферонов, они не являются
гликозилированными белками. В настоящее вре-
мя ряд фармацевтических фирм производит а- и
7-интерфероны с использованием рекомбинант-
ных штаммов Е. coli, и эти препараты находят
применение в медицине как обладающие антиви-
русным и противоопухолевым действием. Миро-
вой уровень продажи препаратов интерферонов в
1992 г. составил 600 млн. долларов.
35.8.3. Вирусные антигены, продуцируемые
рекомбинантными бактериями,
используют для создания вакцин
Многие вирусы в инактивированном виде исполь-
зуются для создания вакцин, но при их примене-
нии всегда существует потенциальная опасность
того, что вирус не был обезврежен полностью. Ан-
тигенным компонентом противовирусных вакцин
служат белки оболочки вирусов. С помощью ге-
нетической инженерии гены различных вирусных
белков были клонированы и введены для их экс-
прессии в бактерии, что позволило получать без-
опасные и эффективные вакцины.
Гены вирусов человека экспрессируют в Е. coli.
Примером могут служить гены вируса гепати-
та В — возбудителя сывороточного гепатита, со-
ставляющего серьезную проблему для здраво-
охранения во всем мире. Изучение этого вируса
существенно затруднялось тем, что невозможно
было получать его в достаточном количестве и
выращивать в клетках культур тканей. Для по-
лучения экспрессии генов этого вируса в Е. coli
фрагменты сго ДНК были клонированы и вве-
дены в плазмиду pBR322, которой затем были
трансформированы бактерии. Клетки, содержа-
щие рекомбинантные плазмиды, исследовали на
предмет синтеза сердцевинных белков вируса и
поверхностных антигенов методом радиоиммуно-
автографии с использованием антител, меченных
[1251]. При введении кроликам экстракты положи-
тельных клопов вызывали образование антител к
вирусу. В результате многочисленных пересевов
выход сердцевинного антигена при экспрессии в
Е. coli удалось повысить. Таким образом был со-
здан безопасный источник получения данного ан-
тигена для использования, например, с целью ди-
агностики.
У многих вирусов геном представлен моле-
кулой РНК, и у некоторых пикорнавирусов, та-
ких как вирус полиомиелита и вирус ящура,
эта РНК транслируется с образованием очень
крупного полипептида, из которого затем в ре-
зультате процессинга образуются белки вирусно-
го капсида. Один из них, белок VP#1 вируса
ящура, представляет особый интерес, посколь-
ку стимулирует синтез нейтрализующих анти-
тел и может вносить вклад в антигенную из-
менчивость, в высокой степени характерную для
данного вируса. Клонирование и анализ соответ-
ствующего этому белку сегмента вирусного ге-
нома открыли возможность получения альтерна-
тивного источника вирусного белка для создания
вакцины. Процесс синтеза на матрице одноце-
почечпой РНК вируса ящура с помощью обрат-
ной транскриптазы двухцепочечной кДНК с це-
лью ее последующего клонирования и введения
в плазмиду для экспрессии в Е. coli, показан на
рис. 35.17 (см. цв. вклейку). Продукт данного гена
(белок VP#1) после очистки обнаруживает имму-
ногенный эффект при введении животным.
Эти два примера демонстрируют возможно-
сти использования технологии рекомбинантной
ДНК для получения с помощью бактерий чув-
ствительных диагностических реагентов и про-
тивовирусных вакцин. Однако некоторые вак-
цины, полученные путем экспрессии вирусных
414 Часть IX. Прикладная микробиология
генов в Е. coli, обладают лишь слабой иммуноген-
ностью. При размножении многих вирусов в клет-
ках хозяина белки вирусной оболочки подверга-
ются посттрансляционному процессингу, обычно
путем гликозилирования. Соответствующие ре-
комбинантные белки, продуцируемые Е. coli, не
гликолизированы, из-за чего, по-видимому, они
не обладают полной иммунологической активно-
стью. Тем не менее вакцины, полученные с помо-
щью методов генетической инженерии, будут на-
ходить все более широкое применение как более
безопасные, чем вакцины на основе ослабленных
или инактивированных вирусов, и более воспро-
изводимые благодаря контролю исходной генети-
ческой структуры.
Многие белки млекопитающих, обладающие те-
рапевтическим действием, могут производиться
в необходимом для практического использования
количестве с помощью бактерий. Первым был по-
лучен таким образом в клетках Е. coli человече-
ский инсулин. Кроме того, с помощью рекомби-
нантных штаммов Е. coli получают а- и 7-интер-
фероны, а также вирусные антигенные белки для
противовирусных вакцин.
Дополнительная литература
Bailey.I.E. (1991) Toward a science of metabolic
engineering. Science 252: 1668.
Banward G. J. (1989) Basic food microbiology, 2nd edn.
New York: Van Nostrand Reinhold.
Crueger W., Crueger A. (1990) Biotechnology: a text-
book of industrial microbiology, 2nd edn. Brock R. D.
(ed) Sunderland, Mass: Sinauer Associates.
Demain A. L, Solomon N. A., eds. (1986) Manual of
industrial microbiology and biotechnology. Washing-
ton, DC: ASM Press.
Eikmanns B., Eggeling L, Sahm H. (1993) Molecular
aspects of lysine, threonine, and isoleucine biosyn-
thesis in Corynebacterium glutamicum. Antonie Van
Leeuwenhoek 64: 145-163.
Enei H., Yokozeki K., Akashi K. (1989) Recent progress
in microbial production of amino acids. Amsterdam:
Gordon and Breach.
Frazer W.C, WesthoffD. C. (1988) Food microbiology,
4th edn. New York: McGraw-Hill.
Glazer A. N., Nikaido H. (1995) Microbial biotechnology:
fundamentals of applied microbiology. New York:
Freeman.
Glick B.R., Pasternak .1. .1. (1994) Molecular biotech-
nology: principles and applications of recombinant
DNA. Washington, DC: ASM Press.
Hollenberg С. P., Sahm H., eds. (1987) Microbial genetic
engineering and enzyme technology, Biotec 1. Stutt-
gart, New York: Gustav Fischer.
Hugo W. B., Russel A. D. (1992) Pharmaceutical micro-
biology, 5th edn. Oxford, England: Blackwell.
Kramer R. (1994) Systems and mechanisms of amino acid
uptake and secretion in prokaryotes. Arch. Microbiol.
162: 1-13.
LeathamG.F., Himmel M.E., eds. (1991) Enzymes in
biomass conversion. Washington, DC: American Che-
mical Society.
McDaniel R., Ebert-Khosla S., Hopwood D. A., Khos-
la C. (1995) Rational design of aromatic polyketide
natural products by recombinant assembly of enzy-
matic subunits. Nature 375: 549-554.
Meyers R. A., ed. (1995) Molecular biology and biotech-
nology: a comprehensive desk reference. Weinheim:
VCH.
Omura S., ed. (1992) The search for bioactive compounds
from microorganisms. Berlin, Heidelberg, New York:
Springer.
Primrose S. B. (1991) Molecular biotechnology, 2nd edn.
Oxford, England: Blackwell.
Sahm H., ed. (1993) Biological fundamentals. In: Bio-
technology, vol 1. Rehm H.-J., Reed G. (eds.) Wein-
heim: VCH.
Sahm H., Eggeling L, Eikmanns B., Kramer R. (1995)
Metabolic design in amino acid producing bacterium
Corynebacterium glutamicum. FEMS Microbiol. Rev.
16: 243-252.
Sikyta B. (1995) Techniques in applied microbiology,
vol. 31. Progress in industrial microbiology. Amster-
dam: Elsevier.
Tombs M. P. (1990) Biotechnology in the food industry.
Buckingham: Open University Press.
Ward О. P. (1989) Fermentation biotechnology: princip-
les, processes and products. Chichester: Wiley.
Глава 36
Прокариоты и окружающая среда
Микроорганизмы, в первую очередь прокариоты
и низшие грибы, выполняют в природе функцию
основных минерализаторов органического веще-
ства и ключевую роль в глобальных циклах всех
биоэлсментов (см. гл. 30, разд. 32.2 и гл. 34).
Продукция, потребление и минерализация орга-
нического вещества на земном шаре поддержи-
ваются в относительно стабильном равновесии;
исключение из этого общего правила составляет
органический углерод в виде угля, нефти и горю-
чих сланцев, скорость накопления которого ниже
скорости потребления. Для разлагающей актив-
ности микрофлоры характерна четкая регуляция;
она возрастает при поступлении субстрата (мик-
робный рост) и снижается при его исчерпании.
Адаптивная способность микробиоты возрастает
по мере увеличения населения Земли; проблемы
загрязнения возникают только в плотно заселен-
ных регионах, где скорость накопления отходов
в результате деятельности человека превышает
минерализующий потенциал почвенных и водных
микроорганизмов. В Древнем Риме существова-
ла совершенная для того времени канализаци-
онная система, по которой отходы и нечистоты
через cloaca maxima (большой канализационный
канал) отводились в Тибр и затем в Средиземное
море. Известно о сооружении каналов подобного
типа в древних Афинах (Греция) и городах Егип-
та. В средние века эти технические достижения
были в основном забыты и отходы, в том числе
нечистоты, скапливались на узких улицах, откуда
их удаляли лишь изредка. Часто происходило за-
грязнение источников питьевой воды и вызванное
этим распространение кишечных инфекционных
болезней, таких как холера, брюшной тиф и амеб-
ная дизентерия, возбудители которых передаются
через воду. С изобретением в 1807 г. в Англии ва-
терклозета нечистоты стали удалять преимуще-
ственно с помощью воды; сточные воды отводи-
ли за городскую черту на поля орошения. С ро-
стом городов и возникновением обширных про-
мышленных областей (например, Рурской обла-
сти в Германии) во второй половине 19 в. нача-
лись повторяющиеся эпидемии кишечных заболе-
ваний; это вызвало необходимость последователь-
ной обработки сточных вод при полном исключе-
нии их контакта с источниками питьевой воды.
Вначале сточные воды собирали в закрытые ем-
кости (колодцы Эмшера). В первой половине 20 в.
были разработаны системы интенсивной очистки
сточных вод (поля орошения, фильтры, установ-
ки для аэробной очистки), используемые в таком
виде и поныне. Цель очистки сточных вод ранее
состояла главным образом в предотвращении за-
ражения питьевой воды патогенными микробами.
Поддержание в сравнительно чистом состоянии
воды рек и озер представляло тогда лишь второ-
степенный интерес, по со временем стало настоя-
тельно необходимым для сохранения источников
чистой питьевой воды. Разработка чувствитель-
ных аналитических методов, позволяющих выяв-
лять загрязнения в воздухе и почве, послужи-
ла стимулом для начала работ, направленных на
очистку воздуха и почвы с использованием мик-
робных процессов. Микробные клетки и фермен-
ты применяются при разработке сенсоров для вы-
явления загрязнений, а также тех или иных ме-
таболитов в микробиологических производствах.
Активность хемолитотрофов уже давно применя-
ется для извлечения металлов из бедных руд в
горнодобывающей промышленности.
Дополнение 36.1. В технологии очистки
сточных вод используется ряд специаль-
ных терминов. Биологическое потребле-
ние кислорода (ВПК) служит показате-
лем общего количества содержащихся в сточ-
ных водах органических и неорганических
загрязнений, окисляемых микроорганизма-
ми. Поскольку обычно невозможно детально
проанализировать органическую фракцию в
составе сточных вод, по значению ВПК оце-
нивают общее количество кислорода, которое
потреблялось бы, если бы сточные воды по-
ступали без очистки в природный водоем, на-
пример в реку или озеро. Для определения
значений ВПК (мг Ог/л или кг сточных вод)
пробы сточных вод инкубируют со смешан-
ным сообществом микроорганизмов, напри-
416 Часть IX. Прикладная микробиология
мер активным илом, и измеряют поглоще-
ние кислорода в течение 5 сут (БПК5) при
постоянной температуре. За это время про-
исходит окисление главным образом органи-
ческих веществ; аммиак окисляется позже и
его содержание БПК5 не отражает. На ры-
нок поступают автоматизированные системы
(например, «Sapromat») для определения сте-
пени загрязненности воды. Если состав сточ-
ных вод известен, потребление кислорода при
очистке можно рассчитать по уравнениям со-
ответствующих реакций. В случае, когда ор-
ганическое вещество сточных вод составляют
в основном фракции углеводов и белков, ве-
личина БПК примерно соответствует коли-
честву сухого вещества растворенных и сус-
пендированных загрязнений. При более вы-
сокой степени восстановления компонентов
загрязнений (например, если это жиры, ли-
пиды и углеводороды), значения БПК вы-
ше. Величина БПК служит также критери-
ем для оценки затрат на очистку стоков про-
мышленных предприятий, необходимую для
того, чтобы они не наносили вред окружа-
ющей среде. Типичные значения БПК для
различных типов сточных вод приведены в
табл. 36.1.
Термин химическое потребление кис-
лорода (ХПК) означает количество кисло-
рода (также мг Ог/л или кг сточных вод),
требуемое для полного химического окисле-
ния компонентов сточных вод до СО2, на-
пример путем окисления бихроматом калия
в концентрированной серной кислоте при
160 °C. ХПК отражает полное химическое
окисление, тогда как БПК —только окисле-
ние компонентов, которые доступны для раз-
ложения биологическими объектами за дан-
Таблица 36.1. Типичные значения БПК для различных
типов сточных вод
Происхождение сточных вод Биохимическое потребление кис- лорода (БПК), мг Огл-1
Бытовые стоки Химическая промышленность Пивоварение, переработка фрук- тов Сахарная промышленность, приго- товление спиртных напитков Бумажная и текстильная промыш- ленность Мясобойни 300-550 1000-50 000 10 000-20 000 50 000-100 000 80 000-100 000 80 000-150 000
ное время инкубации. Различие между эти-
ми двумя показателями соответствует той ча-
сти органического вещества и неорганических
компонентов сточных вод, которые не могут
быть эффективно окислены в результате мик-
робной активности.
Термин летучее суспендированное
твердое вещество (ЛСТВ) обозначает ту
часть общего суспендированного материала
сточных вод, которая улетучивается при сжи-
гании (температура 600-650 °C). ЛСТВ —это
суспендированные вещества в виде частиц, а
также живая биомасса. Вместе с золой (мине-
ральными солями) ЛСТВ составляет общее
суспендированное твердое вещество
(ОСТВ). Величина ЛСТВ обычно связа-
на с метаболическими характеристиками
содержимого метантенка (например, скорос-
тью потребления кислорода и скоростью
образования метана).
36.1. Поступление сточных вод интенсифицирует
природные процессы биодеградации
Когда в ручей с относительно чистой водой попа-
дают сточные воды, наблюдается следующая ти-
пичная последовательность событий (рис. 36.1).
В результате поступления большого количества
разлагаемого органического вещества в воде рез-
ко падает содержание кислорода и возрастает чис-
ленность бактерий. При разложении комплексно-
го органического вещества происходит выделение
Глава 36. Прокариоты и окружающая среда 417
Рис. 36.1. Динамика биодеградации и изменения сооб-
щества организмов при загрязнении чистой воды ручья
сточными водами. Стрелкой указан момент загрязне-
ния. На верхнем графике приведены относительные кон-
центрации растворенного органического углерода, ам-
миака, кислорода и нитрата; на нижнем—относитель-
ная численность бактерий, простейших (питающихся
бактериями), растений и водорослей. Протяженность
потока может достигать нескольких сотен метров.
аммиака, который далее окисляется до нитрата
только после почти полного исчерпания органи-
ческого вещества и возрастания содержания в во-
де кислорода. Бактериальное сообщество выеда-
ется простейшими, численность которых при этом
возрастает, тогда как количество бактерий посте-
пенно уменьшается. Содержание различных форм
связанного азота (и фосфата) возрастает, в ре-
зультате чего начинается массовое развитие водо-
рослей и высших водных растений и содержание
кислорода в воде вновь повышается.
В установке для очистки сточных вод
происходит та же цепь событий, что и в ручье при
его загрязнении. Благодаря интенсивной аэрации
интенсифицируется разлагающая активность
аэробных микроорганизмов, образующих много-
численное и разнообразное микробное сообщество
и полностью разлагающих органическое веще-
ство сточных вод. В современных установках для
очистки сточных вод из них удаляются не толь-
ко органические соединения, но также связанный
азот и фосфат.
Типичный состав бытовых стоков, поступаю-
щих в городские установки для очистки сточ-
ных вод, приведен в табл. 36.2. Фракцию ор-
ганического вещества составляют главным обра-
зом углеводы, белки, мочевина и жироподобные
вещества, преимущественно детергенты из мыла
Таблица 36.2. Состав бытовых стоков и необходимая
степень очистки 1
Органическое вещество ВПК 300-550 мг О2 • л-1
Углеводы 50%
Белки и мочевина 40%
Жиры и моющие средства 10%
Органическое вещество, суспендированное в виде час-
тиц 30% (примерно)
Неорганические вещества
Фосфат 20 мг Р-л-1
Аммиак и нитрат 80 мг N-л-1
Микроорганизмы
106 *-108 клеток бактерий • мл-1, в том числе
104-106 клеток Escherichia coli -мл-1
$С10 клеток патогенных бактерий -мл-1
101 * 3-105 клеток низших грибов, дрожжей -мл 1
Необходимая степень очистки
ВПК С 20 мг Ог-л-1
Общий азот 18 мг N-л-1
Суспендированное твердое вещество 30 мг-л—1
Бактериальные клетки 105 л-1
Клетки Escherichia coli 10 л-1
1 Варьирует в зависимости от местных законов; ВПК —
биохимическое потребление кислорода.
и моющих средств. Неорганические компоненты
происходят отчасти из пищевых отходов и по-
верхностных стоков. Среди микробных компонен-
тов сточных вод доминируют непатогенные бак-
терии, главным образом Pseudomonas fluorescens,
Pseudomonas aeruginosa, Proteus vulgaris, Bacillus
cereus, Bacillus subtilis, Klebsiella pneumoniae, En-
terobacter cloacae и Zoogloea ramigera. Индика-
тор фекального загрязнения — Escherichia coli —
составляет по численности менее 1% этого бак-
териального сообщества. Патогенные бактерии
присутствуют лишь в очень незначительном ко-
личестве.
36.1.1. Развитие активного ила как непрерывной
культуры с рециклизацией
В соответствиями со значениями БПК для бы-
товых сточных вод (см. табл. 36.1) полное мик-
робное окисление их компонентов требует интен-
сивной аэрации, поскольку содержание кислоро-
да в чистой воде на воздухе составляет лишь
10-12 мг Ог/л (см. табл. 30.2). Обработка сточ-
418 Часть IX. Прикладная микробиология
ных вод обычно включает три этапа (рис. 36.2;
см. цв. вклейку). При начальной механиче-
ской обработке отсеиваются основные включе-
ния, суспендированный материал либо осаждает-
ся на дно (седиментация), либо всплывает (флота-
ция жиров и масел) и в результате на этом этапе
удаляется до 30% общей массы загрязнений.
Центральный, второй этап эффективной
очистки сточных вод — это биологический
этап, в большинстве установок для очистки сточ-
ных вод осуществляемый с помощью так называ-
емого активного ила в интенсивно аэрируемом
бассейне, аэротенке, содержимое которого переме-
шивается путем усиленного продувания воздуха
и в ряде случаев перемешивания. Подачу воздуха
регулируют таким образом, чтобы поддерживать
содержание кислорода в иле на уровне 10-40%
насыщения воздухом. Растворенное и суспенди-
рованное вещество сточных вод окисляется ком-
плексным микробным сообществом, которое уда-
ляет до 99% органического вещества. Очищенную
воду и активный ил, главным образом состоящий
из микробной биомассы, разделяют в отстойнике,
из которого вода либо удаляется непосредственно
в водоем-приемник, либо поступает на дальней-
шую химическую очистку (этап 3) для удале-
ния фосфата. Микробная биомасса довольно эф-
фективно осаждается, и 70-95% ее возвращают
обратно в аэротенк. Эта рециклизация активного
ила, отличающая способ его развития от системы
непрерывного культивирования в лабораторном
масштабе, отвечает трем важным целям.
1. В результате рециклизации ила время удер-
жания ила и время удержания воды различа-
ются. Если время удержания воды составля-
ет 4-12 ч, то время удержания ила варьиру-
ет от нескольких суток до нескольких недель,
и этот срок обеспечивает поддержание в нем
медленнорастущих организмов.
2. Рециклизация ила позволяет существенно по-
вышать количество активной биомассы в
аэротенке по сравнению с концентрацией по-
ступающего субстрата (см. разд. 30.3.2). Этим
обеспечивается повышение скорости окисле-
ния для поддержания микробного сообщества
в активном состоянии и повышение кажуще-
гося сродства ила к растворенным субстратам
(v0 = vmax/Ks-, см. разд. 30.4.1).
3. Рециклизация ила поддерживает эффектив-
ность его осаждения, поскольку те организ-
мы, которые быстро осаждаются, поступают
обратно в систему, тогда как микробы, кото-
рые остаются суспендированными в очищен-
ной воде, из нее выходят. Развитие активно-
го ила зависит от эффективности его осажде-
ния, одного из ключевых механизмов регуля-
ции этой системы.
Эффективность данной системы очистки обес-
печивается путем поддержания тонкого балан-
са между рециклизацией ила и удалением его
избыточного количества. При недостаточной ре-
циклизации снижается микробное разнообразие
в иле, поскольку эти условия благоприятствуют
только быстрорастущим организмам и отрица-
тельно влияют на эффективность осаждения. Из-
быточная рециклизация приводит к избыточно-
му накоплению ила и снижению метаболиче-
ской активности. Микрофотографии активного
ила (рис. 36.3) показывают агрегаты бактери-
альных клеток, в том числе нитчатых, при-
сутствие простейших и в некотором количестве
свободноплавающих бактериальных клеток. Про-
стейшие (например, ресничные инфузории родов
Paramaecium и Vorticella, а также амебы), как и
коловратки, нематоды и иногда олигохеты, пита-
ются главным образом свободноплавающими бак-
териальными клетками. Тем самым они способ-
ствуют избирательному развитию бактерий, обра-
зующих агрегаты, и поддерживают численность
свободноплавающих бактерий в очищенной воде
на низком уровне. Таким образом, эти питаю-
щиеся бактериями организмы помогают поддер-
живать эффективность осаждения активного ила
и выполняют важную функцию «оздоровления»
очищенных сточных вод, удаляя возможные па-
тогенные формы и бактерии фекального загряз-
нения, такие как Escherichia coli. Как предпола-
гается, простейшие не только способствуют преоб-
ладанию бактерий, образующих агрегаты, выедая
свободноплавающие клетки, но также выделяют
сигнальные соединения, вызывающие прикрепле-
ние бактерий к поверхностям.
В бактериальном сообществе активного ила
доминирует образующий агрегаты вид Zoogloea
ramigera (и родственные виды), а также нит-
чатые бактерии родов Leucothrix и Thiothrix.
В целом это микробное сообщество имеет весь-
ма разнообразный состав, и большинство входя-
щих в него бактерий еще не идентифицирова-
но и не выделено в культуре. Недавние исследо-
Глава 36. Прокариоты и окружающая среда 419
вания с применением специфических рРНК-зон-
дов показали, что помимо известных типичных
бактерий сточных вод в них встречаются пред-
ставители родов Paracoccus, Caulobacter, Hypho-
microbium, Nitrobacter, Acinetobacter, Sphaerotilus,
Aeromonas, Pseudomonas, Cytophaga, Flavobacte-
rium, Flexibacter, Haliscomenobacter, Arthrobacter,
Corynebacterium, Microthrix, Nocardia и Rhodo-
coccus, а также в незначительном количестве —
Bacillus, Clostridium, Lactobacillus и Staphylococ-
cus. Сложный микробный состав активного ила в
настоящее время анализируется с помощью груп-
поспецифичных олигонуклеотидных рРНК-зон-
дов (см. разд. 29.4).
Активный ил не во всех случаях эффек-
тивно осаждается, т. е. иногда происходит его
нежелательное вспухание, при котором биомасса
всплывает к поверхности воды и поступает в вы-
ходящую воду. Этот эффект обусловлен присут-
ствием в большом количестве нитчатых бактерий,
образующих непрерывную сеть между агрегата-
ми бактерий (рис. 36.3, В). Причиной массового
развития нитчатых бактерий, главным образом
нокардиоформных актиномицетов, может быть,
например, несбалансированное содержание пита-
тельных веществ в поступающих сточных водах
или сдвиг pH, а также влияние многих других
факторов. Поскольку идентифицировано не более
5% компонентов микрофлоры активного ила, по-
ка трудно установить, какие условия вызывают
доминирование нитчатых бактерий.
Избыток активного ила наряду с материа-
лом, собранным во втором резервуаре для оса-
ждения, обычно подвергают анаэробной пост-
обработке или непосредственно вносят на поля,
занимаемые сельскохозяйственными культурами.
В анаэробном реакторе биомасса активного ила
и другие компоненты, доступные для разложе-
ния, превращаются в метан и диоксид углерода,
при среднем времени удержания 3-5 нед и тем-
пература 30-35 °C. Осуществляют также разло-
жение активного ила термофильными микроор-
ганизмами при 50-65 °C, при котором процесс
завершается уже через 2-3 нед благодаря более
высокой метаболической активности термофилов
по сравнению с мезофилами; однако эта обработка
требует существенных расходов на изоляцию со-
держимого метантенка от контакта с воздухом и
нагревание. Образующаяся при повышенной тем-
пературе смесь газов — так называемый биогаз —
содержит 65-70% СН4 и 25-30% СО2, а также в
Рис. 36.3. Микрофотографии образцов активного ила
(темнопольная микроскопия).
А и Б. Хорошо функционирующий активный ил со сба-
лансированным соотношением агрегатов клеток и нит-
чатых бактерий. На рис. Б видна инфузория сувойка
(Vorticella sp.) (организм, питающийся свободноплава-
ющими бактериальными клетками).
В. Сваливающийся в комки ил с преобладанием нитча-
тых бактерий Шкала 50 мкм.
следовом количестве N2 и H2S. Часть выходящ. -
го газа используют для поддержания температу-
ры в метантенке, остальное его количество сжига-
420 Часть IX. Прикладная микробиология
ют или используют в качестве горючего. На боль-
шинстве установок средних размеров, применяе-
мых с целью очистки сточных вод в Центральной
Европе, использование этого газа может обеспе-
чивать 30-100% энергии, необходимой для подачи
воздуха в аэротенки.
Активный ил представляет собой сложное мик-
робное сообщество, поддерживаемое в виде непре-
рывной культуры в активном состоянии с высо-
ким сродством к субстратам. Возврат в систему
(рециклизация) биомассы активного ила повыша-
ет эффективность разложения субстрата, а также
содействует поддержанию в нем медленнорасту-
щих микроорганизмов.
36.1.2. Альтернативные способы очистки
Для небольших городов очистка сточных вод с ис-
пользованием активного ила может быть непри-
менимой. В качестве других способов исполь-
зуют пропускание предварительно обработанных
сточных вод небольшой струей через филь-
тры из дробленого пористого камня или шла-
ка. На поверхности этих фильтров развивается
сложная по составу биопленка из бактерий и дру-
гих организмов, в том числе грибов РепгсгШитп,
Aspergillus и Leptomitus, разлагающая раство-
ренное органическое вещество; в этом случае
эффективное разложение осуществляют только
прикрепленные микроорганизмы. Микрофлора
таких биопленок может быть довольно разнород-
ной по составу, и разложение ею субстратов воз-
можно в аэробных условиях, при ограниченном
доступе кислорода и в анаэробных условиях (см.
разд. 30.5.3). Наиболее активный верхний слой
этих биопленок имеет толщину всего примерно
200 мкм. В качестве еще одного метода очистки
применяют открытые «каналы окисления», в ко-
торых сточные воды перемешиваются вращающи-
мися дисками, покрытыми активными биоплен-
ками. Третий альтернативный метод очистки
сточных вод, чаще используемый на сельскохо-
зяйственных территориях, состоит в том, что
сточные воды пропускают через обширную трост-
никовую гряду. Растения тростника обеспечива-
ют аэрацию благодаря своей системе воздухооб-
мена (см. разд. 31.7.1) и таким образом снабжают
кислородом комплексное микробное сообщество в
своей ризосфере. Органическое вещество разлага-
ется отчасти аэробно и отчасти анаэробно, причем
некоторая часть образуемого микробами метана
высвобождается в атмосферу через растения.
36.1.3. Удаление азота происходит
в результате процессов окисления
и восстановления
Основная цель очистки сточных вод состоит в
удалении органического углерода. Дальнейший
этап — это окисление NH3 и удаление растворен-
ного связанного азота для предотвращения рас-
хода кислорода в природной воде, принимающей
сточные воды. Аммиак, выделяющийся при раз-
ложении белка и гидролизе мочевины в аэротенке,
окисляют до нитрита и затем до нитрата нитри-
фицирующие бактерии (см. разд. 10.7). Посколь-
ку развитие этих бактерий обычно подавляется
растворенным органическим веществом, полная
нитрификация может быть достигнута только при
его низком содержании в аэротенке или на от-
дельной стадии аэрации после процедуры отстаи-
вания. Образующийся нитрат в анаэробных усло-
виях может восстанавливаться до N2 в процессе
денитрификации (см. разд. 12.1). Кроме анаэ-
робных условий для этого необходимо присут-
ствие неорганических или органических доноров
водорода, которые добавляют либо в виде хими-
ческих веществ (водород, метанол, этанол), ли-
бо вводят с некоторым количеством сточных вод
под строгим контролем. Пользу денитрифика-
ции для очистки воды лимнологи считают сомни-
тельной, поскольку поверхностные воды обычно
бедны фосфатом и нитрат может служить альтер-
нативным акцептором электронов в озерных осад-
ках. Недавние исследования показали, что не сле-
дует понимать нитрификацию и денитрификацию
как взаимоисключающие процессы: и то, и другое
может происходить одновременно в условиях де-
фицита кислорода, когда содержимое очистного
сооружения недостаточно перемешивается, и на
этом этапе возможно даже некоторое накопление
фосфата в биомассе (см. ниже).
Связанный азот удаляется из сточных вод в
результате окисления аммиака до нитрата и вос-
становления нитрата до молекулярного азота. Эти
Глава 36. Прокариоты и окружающая среда 421
процессы окисления и восстановления могут про-
исходить в одном и том же очистном бассейне в
условиях ограниченного доступа кислорода; как
правило, удаление азота сопровождается увеличе-
нием численности бактерий, накапливающих фос-
фат.
36.1.4. Фосфат может быть удален
после его накопления в бактериях
Удаление растворенного фосфата рекомендуется
производить, особенно в тех случаях, когда водо-
ем, куда поступают стоки, стоячий и обогащение
его фосфатом может вызвать излишнюю эвтро-
фикацию. Вместе с тем этот этап очистки в на-
стоящее время уже не имеет существенного значе-
ния, так как большинство моющих средств теперь
не содержит полифосфатов. При обычной очист-
ке сточных вод фосфат осаждается солями желе-
за или алюминия в виде FePO4 или AIPO4 соот-
ветственно на конечном третьем этапе (рис. 36.2).
Химическая очистка происходит в соответствии
с законом действующих масс: для удаления ма-
лого количества фосфата (в пределах нескольких
миллиграммов на литр) требуется значительный
избыток осаждающего агента. Эффективность
удаления фосфата может быть существенно по-
вышена благодаря процессу биологического на-
копления фосфата. Аэробные бактерии, такие как
Acinetobacter spp. и грамположительные бакте-
рии с высоким содержанием G + С, накаплива-
ют фосфат в форме внутриклеточных полифос-
фатов, выполняющих функцию запасания энер-
гии (см. разд. 9.4). При дефиците кислорода,
когда окислительное фосфорилирование блокиро-
вано, полифосфаты мобилизуются с образовани-
ем АТР. Синтез полифосфатов, источником ко-
торых служит неорганический фосфат из среды,
протекает в условиях достаточного обеспечения
источником энергии, тогда как гидролиз — в анаэ-
робных условиях (рис. 36.4). Инкубация активно-
го ила на различных этапах очистки в присут-
ствии и в отсутствие кислорода благоприятна для
накопления фосфата бактериями и обеспечивает
весьма эффективное его удаление из среды — либо
с биомассой ила, либо путем осаждения в анаэроб-
ных условиях, когда содержание фосфата в воде
существенно повышается (рис. 36.4).
Рис. 36.4. Схема потока и накопления фосфата в про-
цессе биологического устранения фосфата. В присут-
ствии кислорода клетки Acinetobacter sp. и другие бак-
терии накапливают Pi в виде полифосфатов (поли-Р)
в качестве энергетического источника и в бескислород-
ных условиях высвобождают фосфат. Избыток фосфата
можно либо удалять вместе с биомассой ила, либо оса-
ждать химически в анаэробном бассейне.
Фосфат не может «разлагаться» биологиче-
ски, но бактериальные клетки накапливают его в
виде полифосфатов — запасных высокоэнергети-
ческих соединений. Такое биологическое накопле-
ние фосфата используется для эффективного уда-
ления его из сточных вод.
36.1.5. Возможен первичный этап анаэробной
очистки, особенно при высоком
содержании органических веществ
Первичная очистка сточных вод в условиях аэра-
ции— хорошо отработанная технология, однако
она имеет определенные недостатки. Аэробное
окисление требует обильного поступления кисло-
рода, т. е. дополнительных затрат на аэрацию, в
том числе ее регулирование, и на удаление из-
бытка активного ила, необходимое в связи с тем,
что при аэробном разложении 30-50% органиче-
ских веществ преобразуется в материал клеток.
С распространением установок для очистки сточ-
ных вод быстро увеличивается количество ее от-
ходов в виде активного ила, и его удаление, даже
после дальнейшей очистки в анаэробных услови-
ях, стало насущной проблемой, особенно в густо-
населенных регионах. В качестве альтернативы
422 Часть IX. Прикладная микробиология
аэробной очистке используют первичную анаэроб-
ную очистку, наиболее эффективную при сильной
загрязненности сточных вод (см. табл. 36.1). В та-
ких случаях ее преимущество совершенно очевид-
но: затраты на аэрацию и удаление ила могут
быть сведены к минимуму и к тому же большую
выгоду представляет образование метана. В ре-
зультате первичной анаэробной очистки органи-
ческие загрязнения превращаются в СЩ и СО2,
и цель последующей очистки в аэробных услови-
ях заключается только в окислении аммиака и се-
роводорода. Вместе с тем для анаэробной очистки
требуются специальные технологии, так как анаэ-
робные микробные сообщества растут значитель-
но медленнее, чем аэробные, и чтобы эффек-
тивно использовать преимущества анаэробного
разложения, необходимо применить особые при-
способления для максимального удержания био-
массы в системе, т. е. разделения оборота воды
и оборота биомассы. Просто перевести развитие
активного ила (рис. 36.2, этап 2) в анаэробные
условия невозможно, так как анаэробные простей-
шие недостаточно интенсивно питаются, чтобы
обеспечить осаждение ила. Эффективный способ
очистки сточных вод с образованием метана ос-
нован на использовании свойства микробных кле-
ток прикрепляться к поверхностям; он осуществ-
ляется в реакторах с фиксированным наполни-
телем и с плавающим наполнителем (рис. 36.5;
см. цв. вклейку), где микробная биомасса при-
крепляется к носителю, например гравию, пла-
стиковым гранулам, глине или частицам песка.
Реактор с фиксированным наполните-
лем представляет собой анаэробный капельный
фильтр; со временем он забивается и требует пе-
риодической промывки. Этот недостаток систе-
мы преодолен в установке с плавающим напол-
нителем, где образующаяся биомасса постоянно
смывается, но активные молодые клетки остаются
прикрепленными к частицам наполнителя. Наи-
более удачной установкой для анаэробной очист-
ки служит реактор восходящего тока с анаэ-
робным покровным слоем ила (UASB, от
upflow anaerobic sludge blanket), в котором бакте-
риальные клетки прикрепляются одна к другой,
образуя плотные агрегаты диаметром несколько
миллиметров. Вместе с пузырьками газа эти аг-
регаты всплывают вверх и вновь оседают в ре-
зультате повышения их плотности, вызываемого
отложением внутри них карбоната кальция. Обра-
зование таких легко оседающих агрегатов клеток
является основным условием действия подобной
системы. Как только плотные частицы ила обра-
зуются, они поддерживаются в этой системе и их
отбирают для дальнейшего размножения. Такие
UASB-реакторы в настоящее время применяют-
ся во всем мире, как и реакторы с фикси-
рованным наполнителем и реакторы с плаваю-
щим наполнителем, преимущественно для очист-
ки сильно загрязненных сточных вод, которые
дают существенный выход метана; выход био-
массы анаэробного активного ила при этом низ-
кий (5-10% общей органической фракции), и про-
блемы удаления остаточного ила не возникает.
Различные модификации реакторов этих типов,
снабженные устройствами внутренней рецикли-
зации, предназначены, например, для поддержа-
ния кислотно-щелочного баланса. Разрабатыва-
ются также способы применения анаэробной тех-
нологии для очистки слабо загрязненных вод,
таких как городские стоки, и, возможно, в бли-
жайшие годы в установках для очистки сточ-
ных вод будет осуществляться первичная анаэ-
робная обработка и последующий аэробный этап.
Хотя эффективность биодеградации загрязнений
в этих условиях зависит в основном от тесной
кооперации между различными трофическими
группами участвующих в ней микроорганизмов
(см. разд. 12.1.7 и 30.7), очистку иногда предпо-
чтительно осуществлять в два отдельных этапа:
1) образование главным образом летучих жирных
кислот и лактата (кислотообразование) и 2) пре-
вращение этих промежуточных продуктов в ме-
тан и СО2. Такой способ выбирают, если субстрат
поступает неравномерно (например, только в пе-
риод переработки сахарной свеклы) или обуслов-
ливает быстрое кислотообразование, например в
случае высокого содержания в нем легкосбражи-
ваемых сахаров. В других случаях более эффек-
тивна очистка по одноэтаппой схеме, при условии
что летучие жирные кислоты, разложение кото-
рых составляет лимитирующий этап в общем про-
цессе, образуются лишь в незначительном коли-
честве.
Первичная анаэробная очистка сточных вод
целесообразна также для некоторых промышлен-
ных стоков, например богатых галогенсодержа-
щими органическими соединениями. Чем боль-
ше степень галогенирования этих соединений, тем
вероятнее их использование в качестве акцепто-
ров электронов анаэробными бактериями. Пен-
тахлорфепол, хлоргексан, хлорированные бифе-
Глава 36. Прокариоты и окружающая среда 423
нилы, трихлорэтилен, тетрахлорэтилен и другие
соединения в восстановительных условиях в
первую очередь дегалогенируются и затем могут
подвергаться окислению на завершающем аэроб-
ном этапе очистки.
Анаэробная очистка особенно целесообразна в
тех случаях, когда сточные воды содержат боль-
шое количество органических веществ и могут
давать значительный выход газообразного мета-
на без применения дорогостоящей системы кон-
троля. По причине низкой скорости роста мно-
гих анаэробных бактерий такой процесс очистки
протекает медленно, однако применение эффек-
тивных способов удержания биомассы во многих
случаях делает анаэробную очистку отходов не
менее или даже более выгодной по сравнению с
аэробной.
36.2. Компостирование вновь получает распространение
Компостирование — аэробный процесс окисления
биомассы, протекающий со значительным вы-
делением теплоты, — применяется в настоящее
время в широком масштабе для переработки
твердых и полутвердых бытовых отходов. В ком-
постных кучах или установках для компости-
рования органическое вещество разлагается бла-
годаря активности грибов и бактерий, вызыва-
ющей разогрев обрабатываемого материала до
65-70 °C. На первой стадии важную роль могут
играть грибы наряду с мезофильными бактерия-
ми. С увеличением скорости окисления и повы-
шением температуры (до 40-65 °C) среди актив-
но функционирующих микроорганизмов начина-
ют преобладать виды родов Thermoactinomyces,
Micropolyspora и Thermomonospora. При еще более
высокой температуре (65-75 °C) доминирующи-
ми становятся Bacillus stearothermophilus, Bacillus
subtilis, Bacillus licheniformis, Clostridium thermo-
cellum и виды рода Thermus. Образование тепло-
ты как побочный эффект метаболической актив-
ности микроорганизмов имеет важное значение
для обеззараживания материала, особенно инак-
тивации потенциально патогенных бактерий, па-
разитических простейших, грибов и яиц гельмин-
тов. Особую важность представляет уничтожение
Aspergillus fumigatus — гриба, который развивает-
ся на ранней стадии процесса при температуре
35-50 °C. Его споры высокоаллергенны и могут
вызывать тяжелую реакцию у чувствительных
лиц или у лиц с поражениями легких.
Компостирование — это процесс аэробного
разложения органического материала с выделе-
нием значительного количества теплоты, кото-
рое способствует обеззараживанию материала.
Продукт разложения, богатый гуминовыми ве-
ществами, может использоваться, например, для
удобрения почвы под плодовыми культурами.
В настоящее время разрабатываются также аль-
тернативные компостированию технологии анаэ-
робной очистки.
Сходный с компостированием процесс пред-
ставляет собой самовозгорание недостаточно
высушенного сена — выделяющийся при нем во-
дород иногда воспламеняется, из-за чего воз-
никают пожары в хранилищах и на фермах.
Во всех этих случаях при разложении домини-
руют гетеротрофные вторичные термофилы (см.
разд. 31.4.1).
Как альтернатива компостированию разра-
батываются способы анаэробной обработки
полутвердых бытовых отходов. Преимущества
анаэробной очистки состоят в том, что при та-
ком способе из бытовых отходов можно получать
метан и их обеззараживание происходит более эф-
фективно. Если в материале, подлежащем лик-
видации, содержание сухого вещества превыша-
ет 50%, обычно рекомендуется его сжигание
в мусоросжигательной печи без предварительной
биологической обработки.
424 Часть IX. Прикладная микробиология
36.3. Питьевая вода также может требовать
предварительной микробной обработки
Потребности в питьевой воде в промышленно раз-
витых странах в значительной мере удовлетво-
ряются за счет грунтовых вод или поверхност-
ных вод рек и озер. Вода поступает в систему
водоснабжения после предварительной флотации
гуминовых веществ и фильтрования через слой
песка, в котором следовые органические загряз-
нения удаляются разнообразными прикрепленны-
ми олиготрофными аэробными бактериями и про-
стейшими. В некоторых редких случаях питьевая
вода должна пройти специальную предваритель-
ную микробную обработку, например, для удале-
ния избытка нитрата в присутствии добавленных
органических субстратов. До того, как очищен-
ная вода поступит в систему водоснабжения, она
должна быть подвергнута антимикробной обра-
ботке путем хлорирования с применением NaClO
либо, что чаще применяется в настоящее время,
путем озонирования. Оба эти способа позволя-
ют очистить воду от большей части присутствую-
щих в ней микробных клеток. Однако такая окис-
лительная обработка может также активировать
следовые органические загрязнения (гуминовые
вещества, фульвокислоты), присутствие которых
способно послужить причиной микробного роста
в воде, поступившей в систему водоснабжения, и
даже образования хлорсодержащих ароматичес-
ких веществ как новых и иногда канцерогенных
загрязнений. Поэтому хлорирование и озонирова-
ние следует применять только при условии, что
вода практически не содержит органических за-
грязнений.
36.4. Очистка газообразных отходов — еще одна сфера применения
аэробных бактерий
Очистка газообразных отходов становится обя-
зательной для промышленных производств, на
которых происходит выделение токсичных или
биологически активных летучих соединений в ат-
мосферу. Например, выбросы предприятий по
производству красителей требуется очищать от
органических растворителей, предприятий хим-
чистки и производств, на которых производит-
ся обезжиривание, — от летучих хлорированных
углеводородов, плодоовощных складов —от эти-
лена, образующегося в созревающих плодах
при хранении. В качестве сорбентов для та-
ких загрязнений вначале были предложены
древесный уголь или почва, на поверхности
которых образуется пленка из аэробных бакте-
рий, активно разлагающих вредные вещества.
В настоящее время применяют синтетические
носители, измельченную древесину или древес-
ную кору, торф либо почву, через слой ко-
торых пропускают загрязненный воздух после
его предварительного увлажнения. Растущая на
сорбенте биопленка в определенной степени вы-
едается животными организмами, и благодаря
этому необходимость в очистке и промывании та-
ких систем весьма невелика. Используются так-
же установки для пропускания промышленных
газообразных отходов, содержащих токсичные
вещества, через жидкость в промывных каме-
рах, где обеспечивается интенсивный газо- и
водообмен. Промывные воды затем отдельно
очищают путем микробного окисления загряз-
нений.
36.5. Биологическое восстановление почв находит все большее применение
После воды и воздуха как важный компарт-
мент биосферы, значительное загрязнение кото-
рого приносит ущерб разнообразных организмам,
была определена почва (см. также разд. 34.5).
Однако в связи со структурной неоднородностью
почвы трудно оценивать степень ее загрязнения,
а также осуществлять меры по очистке. Безна-
казанный выброс в окружающую среду промыш-
Глава 36. Прокариоты и окружающая среда 425
ленных отходов за последние 50-100 лет привел к
тому, что давно работающие промышленные объ-
екты, неконтролируемые отвалы, свалки, бензо-
колонки и участки химического загрязнения, воз-
никшие по причине тех или иных аварий, пред-
ставляют опасность как источники загрязнения
грунтовых вод и требуют соответствующей обра-
ботки в ближайшем будущем. Более 50% загряз-
нений на земном шаре связано с нефтью. Обычно
загрязнение начинается с поверхности почвы; за-
грязняющие вещества проникают через не насы-
щенную водой зону почвы и достигают погранич-
ного слоя, контактирующего с водоносным слоем.
В зависимости от плотности загрязняющего ма-
териала возможны различные варианты процес-
са. Некоторые из компонентов загрязнений могут
всплывать на поверхность водного слоя и таким
образом переноситься с ним, другие способны в
определенной степени растворяться в грунтовых
водах. Компоненты типа смол могут опускаться в
нижнюю часть слоя воды, где будут перемещать-
ся очень медленно. Таким образом, загрязнения
разделяются на составляющие компоненты, и для
удаления каждого из них требуется отдельный ме-
тод очистки.
К настоящему времени разработано пять ос-
новных способов очистки загрязненной почвы.
1. Почву оставляют па месте; выкачивают грун-
товые воды и очищают их от растворенных
загрязнений, после чего возвращают в почву.
При этом в почве могут остаться загрязнения
с низкой растворимостью (рис. 36.6).
2. Производят обработку почвы на месте внесе-
нием в нее окислителей (О2, NO3‘), косубстра-
тов или эмульсификаторов, чтобы усилить ли-
бо перенос липофильных загрязнителей, либо
доступность их для биологических объектов.
Добавки вносят через трубы в газообразном
состоянии или в жидком виде, и для больше-
го эффекта производят вспашку поверхности
почвы. Эта обработка требует относительно
небольших затрат, но полное ее осуществле-
ние может занять годы или даже десятилетия.
3. Почву извлекают и ссыпают в кучи или ва-
лы, в которые помещают трубы для аэрации,
чтобы интенсифицировать аэробное разложе-
ние загрязнений. Такая обработка занимает
несколько лет, в зависимости от типа загряз-
нения.
Рис. 36.6. Очистка почвы, загрязненной нефтью, на ме-
сте путем откачивания грунтовых вод и извлечения из
них загрязняющих веществ на поверхности земли. Пре-
вентивное прокачивание незагрязненных грунтовых вод
обеспечивает защиту незагрязненной почвы (слева).
4. Почву извлекают и промывают, в некоторых
случаях с внесением поверхностно-активных
добавок, и экстрагированные загрязнения по-
следовательно разлагают путем биологиче-
ской обработки промывных вод.
5. Почву извлекают полностью и прожигают в
специальных печах. Это наиболее дорогостоя-
щий способ обработки, и он приводит к полной
стерилизации почвы, но в то же время явля-
ется наиболее быстрым методом очистки.
Выбор той или иной из вышеупомянутых про-
цедур обработки зависит в значительной степени
от конкретного загрязнения, а также от площади
и глубины его распространения. В соответствии
с фактурой почвы определяют, целесообразно ли
применять процедуру промывания; значительное
содержание органического вещества или мелких
частиц (например, в глине) может сделать такую
меру полностью бесполезной. Если геологические
условия в загрязненном участке предотвраща-
ют загрязнение грунтовых вод, а поверхность
почвы не будет непосредственно использоваться,
например для строительства, предпочтительна
длительная биологическая обработка, а не значи-
тельно более дорогостоящие физико-химические
способы, которые занимают меньше времени, но
приводят к значительно большему нарушению
почвы.
426 Часть IX. Прикладная микробиология
36.5.1. Микробная активность как фактор
биологического восстановления почв
Поскольку в основном загрязнение почвы связано
с нефтью и окисление углеводородов значительно
эффективнее происходит в присутствии кислоро-
да, обычно микробное разложение загрязнений in
situ лимитировано кислородом. С целью его ин-
тенсификации в глубокие слои почвы можно по-
давать под давлением кислород через систему ме-
таллических труб, однако летучие углеводороды
(например, бензол, толуол или ксилол) при этом
высвобождаются в воздух, и поэтому обычно вы-
бирают обратную процедуру: отсасывают воздух
из почвы и затем его обрабатывают. Введение кис-
лорода и экстракция загрязнений из грунтовых
вод могут осуществляться в системе циркуляции,
где интенсивное окисление in situ сочетается с экс-
тракцией и обработкой ex situ (рис. 36.6). Какой
тип обработки будет подходящим, в значитель-
ной мере определяют геологические и гидрологи-
ческие условия участка, а также природа и харак-
тер использования окружающей территории.
В участках, где присутствуют сильно окис-
ленные загрязняющие вещества, такие как пента-
хлорфенол (применяемый для консервации древе-
сины), нитроароматические соединения (отходы
производства взрывчатых веществ) или сильно
хлорированные алканы либо алкены (хлороформ,
тетрахлорметан, трихлорэтилен или тетрахлор-
этилен, применяемые при химической чистке
одежды и для обезжиривания в промышленнос-
ти), с целью интенсификации восстановительных
процессов может потребоваться внесение доноров
электронов; в случае загрязнения углеводородами
потребности в этом не возникает. С циркулиру-
ющей водой можно вносить недорогие источники
электронов (метанол, этанол или мелассу) и затем
обрабатывать частично восстановленные загряз-
няющие вещества ex situ обычными методами.
Загрязнения в виде полианнелированных аро-
матических углеводородов вызывают особые про-
блемы из-за их малой растворимости в воде.
Биологическая обработка в этом случае крайне
неэффективна, не столько из-за отсутствия у мик-
робов способности к разложению этих загрязняю-
щих веществ, сколько из-за структуры частиц за-
грязнений, снижающей доступность их для мик-
роорганизмов. В случае любых нерастворимых в
воде загрязнений переход их в растворенное или
каким-либо другим образом облегчающее диффу-
зию состояние обычно является фактором, ли-
митирующим разложение; это относится также к
жидким углеводородам. Абсорбция органических
загрязнений на поверхности минеральных частиц
и особенно органических компонентов почвы еще
более затрудняет очистку. Чем более комплекс-
ными являются субстраты, тем менее вероятно,
что они будут разлагаться полностью; в большин-
стве случаев образуются их активированные (т. е.
гидроксилированные) производные, которые ко-
валентно связываются с органическим веществом
почвы, в частности с гуминовыми веществами.
Может возникать вопрос, почему обширные
участки загрязнения почвы вообще сохраняются
в таком виде, хотя в почве имеются микробы,
способные эффективно разлагать почти все типы
загрязнений? В большинстве случаев стабиль-
ность загрязнений обусловлена той же причиной,
по которой нефть не исчезает в океане: несмот-
ря па достаточное количество нефтеокисляющих
бактерий, этот процесс идет медленно, поскольку
осуществляется только на границе нефть—вода и
часто лимитирован уровнем О2, связанного азо-
та или фосфата. Особенно это характерно для
процессов разложения малорастворимых в воде
загрязнений. В других случаях (например, при
фенольном загрязнении) микробному разложе-
нию может препятствовать токсичность загрязня-
ющих веществ при слишком высокой концентра-
ции их in situ. В любой ситуации для усиления
процесса природного разложения в почве необ-
ходимы рассредоточение и растворение загрязне-
ний, а также внесение косубстратов. Те же усло-
вия способствуют очистке морских акваторий от
разлившейся нефти. Засев в зараженный участок
бактерий, способных разлагать соответствующий
загрязнитель, дает эффект только в очень немно-
гих, исключительных случаях; обычно фактором,
лимитирующим микробное разложение in situ, яв-
ляется доступность субстрата, и па организмы,
вносимые извне, влияют те же ограничения.
В очистке сточных вод и воздуха, ликвида-
ции органических отходов и очистке участков за-
грязнения почвы основную роль выполняют мик-
роорганизмы, главным образом бактерии. Ско-
рость разложения загрязнений во всех случаях
лимитируется доступностью субстрата или необ-
ходимых косубстратов (например, кислорода либо
минеральных солей). Эти ограничения легко пре-
Глава 36. Прокариоты и окружающая среда 427
одолимы с помощью технических средств для
обработки воды и воздуха, но создают серьез-
ные проблемы при необходимости восстановления
почвы. Во многих случаях вместо традиционных
аэробных способов очистки могут быть использо-
ваны анаэробные методы.
36.6. Применение биосенсоров основано на специфичности
и разнообразии осуществляемых ими биохимических реакций
Все чаще для непрерывного или периодического
контроля за протеканием различных процессов в
реакторах или в окружающей среде применяют
биосенсоры. В противоположность химическим
регистрирующим системам, обычно основанным
на осуществлении химической реакции для каче-
ственного и количественного определения раство-
ренного реагента, функционирование биосенсоров
обеспечивают прежде всего биологические или
биохимические реакции, благодаря которым опре-
деленная концентрация субстрата или ее изме-
нение индуцирует в конечном итоге химический,
электрический либо физический сигнал. Этот сиг-
нал, тем или иным способом усиливаемый, пред-
ставляется затем в электронной форме. Элементы
биосенсорной системы изображены на рис. 36.7.
Биосенсор простого типа — это, например, элек-
трод, с помощью которого определяют концентра-
цию глюкозы в биореакторе. В этом случае биоло-
гический компонент представлен иммобилизован-
ной глюкозооксидазой, катализирующей следую-
щую реакцию:
D-глюкоза + О2 —* D-глюконо-1,4-л актов + Н2О2
Лактон легко гидролизуется с образованием глю-
коновой кислоты, сигналом же служит изменение
концентрации кислорода, влияющее па скорость
деполяризации амперометрического электрода, с
которого поступает электрический сигнал. В каче-
стве биосенсора могут использоваться совместно
иммобилизованные ферменты, катализирующие
цепь реакций, результат которой преобразуется
в физический или химический сигнал. Другие
типы биосенсоров — это иммобилизованные бак-
териальные клетки, антитела или клеточные
органеллы (см. табл. 36.3). Сигналы могут вос-
приниматься различными датчиками, преобразу-
ющими их для получения информации в элек-
тронной форме и ее дальнейшей обработки.
Преимущество биосенсоров перед химическими
воспринимающими системами состоит в высокой
специфичности и большом разнообразии биоло-
гических реакций. Проблемы разработки биосен-
соров связаны, главным образом, со стабилиза-
цией биологических компонентов, их включени-
ем в механически стабилизированный матрикс
(например, гель или мембрану), сопряжением с
электронными системами и защитой от вредных
внешних воздействий (токсичности), в том числе
возможности биодеградации (пестери л ьности).
В общем случае биосенсоры действуют лишь огра-
ниченный срок — от суток до нескольких месяцев.
Современные способы компьютерной обработки
данных и физические методы преобразования
данных (например, оптоэлектронные), а также
новейшие разработки хромогенных химических
сенсоров в качестве передатчиков открыли новые
возможности для применения биосенсоров. В на-
стоящее время биосенсоры широко используются
для контроля за химическими и биологическими
процессами, протекающими в реакторных систе-
мах, и для мониторинга за состоянием окружа-
ющей среды, в частности уровнем метаболитов,
гормонов или токсинов.
Биосенсоры могут также применяться для
оценки свежести рыбы по содержанию в ней АТР
(метод на основе люциферин-люциферазпой ре-
акции). Другая область их применения — меди-
цинская диагностика: постоянный контроль за
концентрацией глюкозы, определение следовых
количеств лекарственных препаратов либо ток-
сичности и мутагенности лекарственных средств
(в последнем случае с помощью иммобилизован-
ных мутантных клеток, которые после реверсии
могут быть выявлены по химически определяемой
активности).
428 Часть IX. Прикладная микробиология
Стимул Биологический компонент Передатчик сигнала Усиливающее устройство * Компьютерный анализатор сигнала
Рис. 36.7. Работа биосенсора. Слежение за стимулом
(например, концентрацией реагента) осуществляется с
помощью биологической системы (такой, как фермент
или бактериальные клетки), связанной с передатчи-
ком (например, кислородным электродом). Генерируе-
мый передатчиком сигнал после усиления поступает в
электронный анализатор.
Таблица 36.3. Типы биосенсоров
Биологический компонент Передатчик Определение
Иммобилизованные ферменты Клетки Антитела Клеточные органеллы Потенциометрические электроды Амперометрические электроды Полевые транзисторы Фотоусилители, связанные с волоконной оптикой Фотодиоды со светоизлучающими диодами 1NH+, Н+, СО2 о2, н2 Н+, NH3 Фотоэмиссия, люминесценция Поглощение света
Биосенсоры, обеспечивающие контроль за
концентрацией веществ, используются в технике,
медицине, пищевой промышленности и в обла-
сти охраны окружающей среды. Осуществляемые
ими высокоспецифичные биохимические реакции
сопряжены с возникновением химических или фи-
зических сигналов, которые благодаря специаль-
ным устройствам в конечном итоге преобразуют-
ся в электронную информацию. Благодаря боль-
шому разнообразию биологических сенсорных си-
стем и новым химическим и оптическим методам
мониторинга использование биодатчиков стано-
вится перспективной областью прикладной мик-
робиологии.
36.7. Литотрофные бактерии извлекают металлы из руд
В средах, где восстановленные соединения серы
взаимодействуют с атмосферным кислородом, на-
пример в вулканических горячих источниках и
фумаролах (см. разд. 31.4.1, 31.4.3), окисление мо-
лекулярной серы и H2S ведет к образованию сер-
ной кислоты и тем самым к сильному подкисле-
нию среды. Это повышает растворимость многих
металлов, таких как железо, медь, уран, цинк,
свинец и алюминий. Кислые истечения из гор-
ных пород, богатых серой и металлами, токсичны
для многих жизненных форм из-за сильно кис-
лой реакции и высокого содержания растворен-
ных тяжелых металлов. Каменный уголь содер-
жит не только серу, связанную с органическим уг-
леродом, но и значительное количество сульфидов
металлов, в первую очередь FeS2 (пирита), лег-
ко распознаваемого по его латунно-желтым кри-
сталлам. Окисление пирита железоокисляющи-
ми и серными бактериями, например Thiobacillus
ferrooxidans, приводит к образованию Fe3+ и сер-
ной кислоты (см. разд. 31.4.3), что осложняет до-
бычу каменного угля в связи с трудностью уда-
ления токсичных и кислых сточных вод (кислый
дренаж).
Микробное окисление сульфидов металлов с
образованием серной кислоты и растворенных
ионов металлов нашло использование как деше-
вый метод выщелачивания бедных металлических
руд. Этот способ наиболее разработан для добы-
чи меди из руд, содержащих ее в незначительном
количестве. Сульфид меди окисляется аэробно в
два этапа в следующих реакциях:
2Cu2S + О2 + 4Н+ -> 2CuS + 2Cu2+ + 2Н2О
2CuS + 4О2 -» 2Cu2+ + 2SO7 (36.1)
Первый этап — окисление Си+ до Си2+ —явля-
ется исключительно микробным; второй этап —
Глава 36. Прокариоты и окружающая среда 429
окисление сульфида до сульфата — протекает от-
части за счет микробной активности и отчасти
как химический. Окисление сульфида меди может
быть сопряжено с восстановлением Fe2+ до Fe3+:
CuS + 8Fe3+ 4- 4Н2О ->
Cu2+ + 8Fe2+ 4- SO1~ 4- 8H+ (36.2)
Железо используется для дальнейшей обработки,
при которой Fe2+ вновь окисляется Thiobacillus
ferrooxidans.
Ионы Cu2+ могут осаждаться в виде металли-
ческой меди при контакте с железным ломом в
результате следующ ?й реакции:
Fe° + Cu2+ -+ Cu° 4- Fe2+ (36.3)
Таким путем железный лом используют для по-
лучения высококачественной меди из бедных руд;
образующаяся при этом кислая жидкость вновь
поступает в цикл. В систему добавляют H2SO4,
чтобы ускорить протекание первого этапа, на ко-
тором используются протоны (см. выше).
Поскольку технология микробного выщела-
чивания руд требует интенсивного поступления
кислорода, она наиболее эффективна в отвалах
бедных руд, так как в кучах руды обычно име-
ется достаточно каналов и трещин, обеспечиваю-
щих аэрацию. Сходным образом могут извлекать-
ся из соответствующих сульфидных руд цинк и
свинец с небольшим расходом серной кислоты для
поддержания высокой скорости экстракции в за-
мкнутой перколяционной системе. Другие метал-
лы, такие как уран, могут биологически окислять-
ся [уран (IV) —> уран (V)] в присутствии сульфа-
та трехвалентного железа, при этом Thiobacillus
ferrooxidans, по-видимому, действует как соката-
лизатор. Процесс окисления описывается уравне-
нием:
2UO2 4- О2 4- 2SO^“ 4- 4Н+
-> 2UO2SO4 4- 2Н2О (36.4)
Существует предположение, что на самом деле
происходит следующее: клетки Thiobacillus окис-
ляют двухвалентное железо до трехвалентного и
образующиеся ионы Fe3+ окисляют UO2 в ре-
акции, сходной с выщелачиванием пирита (см.
разд. 31.4.3).
Для биологического выщелачивания марганца
требуется восстановительное превращение нерас-
творимого МпО2 в растворимый в воде Мп2+; этот
процесс может протекать в присутствии органи-
ческих отходов. В этом случае выщелачивание
сопряжено с восстановлением, а не с окислени-
ем. Наконец, можно микробиологическим спосо-
бом извлекать из руд золото и серебро путем окис-
лительного удаления солей железа из пирита и ар-
сенопиритов, содержащих золото-железные руды,
или путем восстановительного удаления марганца
из содержащих марганец серебряных руд. В обо-
их случаях руда обогащается в отношении благо-
родного металла по мере удаления оксида менее
ценного металла-примеси.
Дополнительная литература
Agate A. D. (1996) Recent advances in microbial mining.
World .J. Microbial. Biotechnol. 12: 487-495.
Ahring B.K. (1995) Methanogenesis in thermophilic bio-
gas reactors. Antonie van Leeuwenhoek 67: 91-102.
Aston W. J., Furner A. E. F. (1984) Biosensors and bio-
fuel cells. Biotechnol. Gen. Engineering Rev. 1: 89-
120.
Eikelboom D.H. (1975) Filamentous organisms observed
in activated sludge. Water Res. 9: 365-388.
Kortstee G. J. J., Appeldorn K. .1., Bonting C. F. C., van
Niel E. W..L, van Veen H. W. (1994) Biology of po-
lyphosphateaccumulating bacteria involved in enhan-
ces biological phospohorus removal. FEMS Microbiol.
Rev. 15: 137-153.
Lettinga G. (1995) Anaerobic digestion and wastewater
treatment systems. Antonie van Leeuwenhoek 67:
3-28.
Swanell R. P.Lee K., McDonagh M. (1996) Field eva-
luation of marine oil spill bioremediation. Microbiol.
Rev. 60: 342-365.
Toerien D. F., Gerber A., LotterL. H., CloeteN. E.
(1990) Enhanced biological phosphorus removal in
activated sludge systems. In: Marshall К. C., ed.
Advances in Microbial Ecology, vol. 11. New York:
Plenum Press; 173-229.
Verstraete W., de Beer D., Pena M., Lettinga G., Lens P.
(1996) Anaerobic bioprocessing of organic wastes.
World J. Microbiol. Biotechnol. 12: 221-238.
Zehnder A. J. B., Ingvorsen K., Marti T. (1982) Micro-
biology of methane bacteria. In: Hughes D.E., Staf-
ford D. A., Wheatley В. I., BaaderW., Lettinga G.,
Nyns E. .L, Verstraete W. (eds.) Anaerobic digestion.
Amsterdam: Elsevier Biomedical: 45-68.
Глава 37
Прокариоты и человек: возможности, перспективы
и опасности
Микробы уже в течение тысячелетий использу-
ются человеком в процессах получения пищевых
продуктов, например в хлебопечении, сыроделии,
пивоварении и виноделии. Во второй половине
19 в. благодаря пионерским работам Л. Пастера,
Р. Коха и других выдающихся микробиологов
стала проясняться лежащая в основе этих про-
цессов деятельность микроорганизмов. В даль-
нейшем применение чистых микробных культур
позволило значительно усовершенствовать техно-
логии промышленного производства таких про-
дуктов, как молочная кислота, лимонная кислота,
этанол и глицерол, в которых до этого рост неже-
лательных микробов можно было подавить толь-
ко путем создания селективных для организма-
продуцента условий. Открытие случайным обра-
зом в 1929 г. первого антибиотика — пеницилли-
на— положило начало новому этапу в получе-
нии продуктов микробного синтеза. Со временем
стало известным большое число разнообразных
антибиотиков и других выделяемых микроор-
ганизмами продуктов, таких как аминокислоты
или витамины. Однако несмотря на эти достиже-
ния, микробиология в течение многих десятиле-
ний оставалась по существу описательной наукой;
развитие ее прикладных направлений в основном
базировалось на методе «проб и ошибок», а не
на рациональном подходе, обеспеченном глубоким
знанием механизмов соответствующих процессов
(см. табл. 35.1).
37.1. От прошлого к будущему: секвенирование бактериальных геномов
приведет к перевороту в прикладной микробиологии
Новая эра биотехнологии, основанной на исполь-
зовании микробов, началась с установлением ро-
ли ДНК как носителя наследственной информа-
ции. Развитие молекулярной генетики привело
к разработке первых методов генетической ин-
женерии в приложении к Escherichia coli. При-
менение этих методов помогло сделать важные
открытия в биохимии и физиологии микроорга-
низмов и разработать новые способы получения
штаммов-продуцентов. До этого для улучшения
свойств таких штаммов могли быть использованы
только методы мутагенеза, требующие больших
затрат времени и средств. Новейшие технологии
с применением рекомбинантной ДНК позволяют
быстро и эффективно получать микроорганизмы,
обладающие совершенно новыми или оптимизиро-
ванными свойствами. К настоящему времени из-
вестно большое число микроорганизмов, которые
могли бы стать объектами генетической модифи-
кации с целью использования в качестве биологи-
ческих «фабрик» для производства белков и дру-
гих соединений.
С 1976 г. в практику исследований вошло
определение нуклеотидных последовательностей
ДНК, и это открыло большие возможности для
выяснения функций генов и развития генетиче-
ской инженерии. Вначале процедура секвениро-
вания ДНК была чрезвычайно сложной, но посте-
пенно ее удалось значительно усовершенствовать
в направлении уменьшения затрат материалов и
времени. Теперь ее осуществляют с помощью ав-
томатизированных приборов и крупномасштабное
секвенирование ДНК, например полного бакте-
риального генома, занимает менее года. Наибо-
лее обширный проект в этой области — полное
секвенирование генома человека (3 млрд. п.н.).
Информация, получаемая в ходе осуществления
подобных проектов на микроорганизмах, про-
ливает свет на их эволюцию и весьма важна
для физиологических и экологических исследо-
ваний. В частности, она позволяет выявлять об-
щие регуляторные сети путем сравнения нуклео
тидных последовательностей у различных мик-
роорганизмов. Первым был секвенирован геном
Глава 37. Прокариоты и человек: возможности, перспективы и опасности 431
Таблица 37.1. Обзор проектов расшифровки геномов бактерий и архей
Микроорганизм Размеры генома, м.п.н. Важные особенности объекта Область применения данных
Завершенные проекты
Haemophilus influenzae 1,83 Возбудитель тяжелых инфекций у детей Медицина
Helicobacter pylori 1,7 Возбудитель язвы желудка Медицина
Mycoplasma genitalium 0,58 Наименьший геном, быстрое эволюционирование Медицина
Mycoplasma pneumoniae 0,8 Возбудитель пневмонии Медицина
Staphylococcus aureus 2,8 Возбудитель раневых инфекций Медицина
Synechocystis sp. 3,6 Модельный организм, оксигенный фотосинтез Научные исследования
Methanococcus jannaschii 1,7 Строго анаэробная автотрофная гипертермо- фильная, барофильная, метаногенная архея Промышленность, науч- ные исследования
Bacillus subtilis 4,2 Модельный организм, промышленный продуцент ферментов Промышленность, наука
Escherichia coli 4,7 Модельный организм, продуцент сложных хими- ческих соединений и белков, условно-патоген- ный организм Научные исследования, промышленность, ме- дицина
Текущие проекты
Aquifex thermophilus 1,6 Гетерогенный таксон термофильных, строго хемо- литоавтотрофных бактерий Промышленность, науч- ные исследования
Archaeoglobus fulgidus 1,7 Гипертермофильная, барофильная, сульфатвос- станавливаюгцая архея; относится к древнейшей эволюционной ветви архей Промышленность, научные исследования
Borrelia burgdorferi 0,95 Возбудитель лаймской болезни Медицина
Clostridium beijerinckii 6,7 Патогенный организм; продуцент органических растворителей Медицина, промышлен- ность
Deinococcus radiodurans 3,6 ДНК высокоустойчива к повреждению под дей- ствием радиации или химических веществ Научные исследования
Methanobacterium thermoautotrophicum 1,7 Морская архея из ила сточных вод, участвующая в биопревращении СОг в СН4 Промышленность, охра- на окружающей среды
Mycobacterium leprae 2,4 Возбудитель проказы Медицина
Mycobacterium tuberculosis 4,4 Возбудитель туберкулеза Медицина
Pyrobaculum sp. 1,8 Гипертермофильная архея, родственная общему предку прокариот и эукариот Промышленность, науч- ные исследования
Pyrococcus furiosus 2,0 Гипертермофильная гетеротрофная архея, мо- дельный организм Промышленность
Rickettsia prowazekii 1,1 Облигатный клеточный паразит, возбудитель сыпного тифа Медицина
Sulfolobus solfataricus 3,1 Термофильная серуокисляющая архея Промышленность
Synechococcus sp. 2,7 Термофильная морская цианобактерия; произво- дит 5-15% мирового запаса кислорода Промышленность, охра- на окружающей среды
Thermotoga maritima 2,0 Термофильная бактерия, отдельная эволюционая ветвь Промышленность, науч- ные исследования
Treponema pallidum 1,05 Возбудитель сифилиса Медицина
Haemophilus influenzae, и к настоящему време-
ни расшифрованы геномы нескольких бактерий
(табл. 37.1). Выбор этих организмов объясняет-
ся их известной или предполагаемой ролью в
экологии, медицине либо промышленности. На-
копление данных о последовательностях ДНК
будет способствовать более быстрому выяснению
регуляторных или структурных функций иден-
тифицируемых генов. Одним из примеров такого
установления функций гена может служить иден-
тификация генов фитопатогенности у штаммов
Pseudomonas и Xanthomonas по сходству их нук-
432 Часть IX. Прикладная микробиология
леотидных последовательностей с хорошо изучен-
ными генами патогенных для человека бактерий
из рода Yersinia. Такой подход позволяет плани-
ровать дальнейшие эксперименты. В перспекти-
ве можно ожидать, что изучение каждого ново-
го микроорганизма будет начинаться с расшиф-
ровки всей нуклеотидной последовательности его
генома.
37.2. Будущие медицинские аспекты изучения прокариот: создание
новых лекарств, вакцин и способов диагностики будет основываться
на знании молекулярных механизмов
После того как Пастер и Кох установили, что
инфекционные болезни вызывают микроорганиз-
мы, началось изучение механизмов их патоген-
ности. К настоящему времени с использованием
микробиологических и генетических методов уда-
лось установить, что течение и исход инфекцион-
ного процесса определяются сложным, связанным
с обменом сигналами взаимодействием между па-
тогенными бактериями и клетками организма-
хозяина (см. гл. 33).
В дальнейшем исследования в медицинской
микробиологии должны быть направлены на бо-
лее детальное выяснение этих взаимодействий и
разработку новых лекарственных средств, вак-
цин и способов диагностики. Если ранее анализ
каждого возбудителя для выяснения механиз-
ма его патогенности требовал трудоемких мик-
робиологических и молекулярно-генетических
исследований, то в ближайшем будущем эта за-
дача существенно упростится благодаря накоп-
лению результатов геномного секвенирования
(табл. 37.1). Расшифровка генома проведена к
настоящему времени для следующих прокари-
от: Staphylococcus aureus (возбудитель раневых
инфекций), Haemophilus influenzae (возбудитель
тяжелых детских инфекций), Helicobacter pylori
(бактерия, вызывающая развитие язвы желудка)
и Methanococcus jannaschii (первый изученный в
этом плане представитель архей). Продолжаются
работы по секвенированию генома Mycobacterium
leprae (возбудитель проказы) и Mycobacterium tu-
berculosis (возбудитель туберкулеза).
Важно понимать, что выяснение полных нук-
леотидных последовательностей геномов патоген-
ных микроорганизмов представляет не только
чисто научный интерес. Эти данные весьма необ-
ходимы, например, для раскрытия механизмов
патогенности и тем самым разработки спосо-
бов его лечения. На основе сравнения нуклео-
тидных последовательностей геномов различных
возбудителей инфекций можно составить предпо-
ложение о механизме патогенности исследуемого
микроорганизма и затем проверить его па подхо-
дящих модельных организмах; это должно спо-
собствовать разработке или совершенствованию
способов терапии. Кроме того, данные о полной
геномной последовательности важны для анали-
за регуляторных сетей, имеющих отношение к
патогенности, и таким образом для выявления
новых мишеней действия создаваемых лекарств
или вакцин. В частности, па это направлен
анализ генома микобактерий, вызывающих тя-
желые, часто неизлечимые болезни человека
(табл. 37.1).
37.3. Будущие сельскохозяйственные аспекты изучения прокариот:
необходимы более детальные исследования фитопатогенных
и полезных бактерий
К прокариотам, имеющим сельскохозяйственное
значение, относятся фитопатогенные бактерии и
бактерии, способствующие росту растений. По-
лезные для растений бактерии все в большем
масштабе используются в качестве биоудобрений,
фитостимуляторов или средств биологического
контроля в сельском хозяйстве и лесоводстве (см.
гл. 34).
В связи с этим проводится изучение слож-
ных взаимодействий между микробами и растени-
ями, анализ бактериальных сообществ и различ-
ных аспектов популяционной генетики бактерий.
Выяснению механизмов взаимодействия микроор-
ганизмов с растениями поможет использование
молекулярных методов, например основанных на
применении полимеразной цепной реакции или
Глава 37. Прокариоты и человек: возможности, перспективы и опасности 433
введении маркерных генов для слежения за бак-
териями в природной среде (рис. 37.1; см. также
гл. 34). Пути обмена сигналами между патоген-
ным микроорганизмом и растением, в результа-
те которого возникает либо благоприятный, либо
патогенный эффект, весьма слабо изучены, и это
направление исследований следует считать весь-
ма важным. На основе селекции и оптимизации
штаммов, в том числе с использованием мето-
да рекомбинантной ДНК, будет осуществляться
модификация свойств бактерий для усиления их
положительного эффекта при использовании в
сельском хозяйстве. Помимо этого, необходимы
исследования по выяснению механизмов патоге-
неза, которые позволят совершенствовать методы
борьбы с болезнями растений.
Рис. 37.1. Эксперимент по инокуляции бактерий в почву
(Сельскохозяйственная исследовательская станция Бра-
уншвейг, Германия, 1994). Штаммы Rhizobium meliloti,
генетически меченные путем инсерции в хромосому гена
люциферазы из светляка Photinos pyralis, инокулирова-
ли в небольшие почвенные колонки, закрытые снизу для
задержки воды. Перед инокуляцией культуру клубенько-
вых бактерий, выделенных из торфяной почвы, смеши-
вали в лаборатории с почвой, взятой из колонок. Эту
смесь помещали в верхний слой колонок. Для изучения
взаимодействия с растением в этих колонках выращи-
вали бобовое растение-хозяин (люцерну).
37.4. Будущие направления использования прокариот для очистки
окружающей среды связаны с изучением биоразнообразия,
анализом структуры сообществ и поиском условий культивирования
Антропогенное влияние на окружающую среду в
настоящее время стало представлять серьезную
угрозу для будущих поколений, и возникающие в
связи с этим проблемы требуется решать с учетом
естественных процессов, протекающих в природ-
ных экосистемах. При таком подходе возрастает
необходимость в использовании природных про-
цессов для биотехнологической очистки окружа-
ющей среды (например, использовании прокариот
с целью биологического разложения органических
отходов и обезвреживания ксенобиотиков). Учи-
тывая огромное разнообразие микроорганизмов,
можно ожидать, что будут обнаруживаться их
новые метаболические свойства, полезные для
биотехнологии. К настоящему времени лишь при-
мерно 0,1% микроорганизмов, обитающих в на-
земных экосистемах, удается культивировать в
лабораторных условиях, и лишь малая доля их
может быть отнесена к тому или иному известно-
му виду (см. гл. 29, 30, 31 и 36).
Помимо подбора методов культивирования,
для оценки структуры природных микробных
сообществ может быть использован подход с при-
менением полимеразной цепной реакции (ПЦР).
Использование специфических ПЦР-праймеров
позволяет амплифицировать таксономически
важные последовательности рибосомной ДНК в
природных образцах, даже если эти структуры
присутствуют в минимальных количествах. Та-
ким способом ДНК тех или иных организмов ста-
434 Часть IX. Прикладная микробиология
новится доступной для детального анализа (см.
гл. 29). В последние годы был разработан метод
рестрикционного анализа амплифицированной
рибосомной ДНК (ARDRA; см. гл. 29), который
может оказаться полезным для описания разнооб-
разия сложных природных популяций. Этот ме-
тод, основанный на получении видоспецифичных
микробных фингерпринтов, рассматривается как
перспективный способ быстрого и достоверного
анализа структуры сообществ (рис. 37.2). На ос-
нове данных о последовательности рДНК могут
быть получены специфические, флуоресцентно
меченные ПЦР-праймеры, пригодные для целей
гибридизации in situ и тем самым для выяснения
пространственного распространения исследуемо-
го микроорганизма. Эта информация может быть
полезна как для выяснения таксономического по-
ложения данного организма, так и для подбора
условий, при которых нс поддающиеся пока куль-
тивированию организмы можно будет выделять в
культуру. Таким образом, разнообразие микробов
Рис. 37.2. Процедура изучения бактериального сообще-
ства с использованием метода рестрикционного анализа
амплифицированной рибосомной ДНК (ARDRA). Бак-
териальные клетки отделяют от природного субстрата
(например, почвы) и после концентрации на филь-
тре выделяют из них общую ДНК. Используя прайме-
ры ПЦР (полимеразной цепной реакции), комплемен-
тарные консервативным участкам генов бактериальной
165-рДНК, амплифицируют и клонируют участки ДНК,
представляющие таксономический интерес. Продукты
амплификации 165-рДНК обрабатывают рестриктаза-
ми, и полученные фрагменты разделяют методом элек-
трофореза в геле, результаты которого представляют
собой видоспецифичные ДНК-фингерпринты организ-
мов, присутствовавших в образце. Создаваемая на осно-
ве этих результатов компьютерная база данных ARDRA
позволяет идентифицировать новые фингерпринты (см.
гл. 29).
в будущем послужит, вероятно, источником от-
крытия новых продуктов, имеющих значение для
биотехнологии.
Природный образец
(например, почва)
Выделение
микроорганизмов
Выделение обшей ДНК
из собранных микро-
организмов
ПЦР-амплификация с
165-рДНК-праймерами
Клонирование
продуктов ПЦР
Реамплификация клони-
рованных продуктов ПЦР
с праймерами uni3 и rev3
Обработка продуктов
ПЦР рестриктазой Л
Электрофорез в геле
для получения
ARDRA-фингерпринтов
Кластеризация
ARDRA-фингерпринтов;
создание базы данных
37.5. Перспективы промышленного использования прокариот:
штаммы-продуценты можно будет генетически модифицировать
в желаемом направлении
Основная цель конструирования микробных
штаммов для промышленного применения состо-
ит в том, чтобы придать им способность к росту
на простых и дешевых средах и обеспечить их
высокую продуктивность.
Ранее новые штаммы получали на основе нена-
правленного мутагенеза и последующего отбора
мутантов по определенным признакам (так назы-
ваемый метод проб и ошибок). Подобные эмпири-
ческие методы требуют больших затрат времени
Глава 37. Прокариоты и человек: возможности, перспективы и опасности 435
и средств, не позволяя при этом осуществлять на-
правленное изменение свойств организма. Кроме
того, «избыточный» мутагенез иногда приводит
к нестабильности штаммов в результате метабо-
лического дисбаланса. Известное преимущество и
основная причина популярности этого метода со-
стоит в том, что при его использовании практиче-
ски не требуется подробных сведений о генетике
и метаболизме штамма-продуцента, как и о свой-
'твах желаемого продукта.
Методы генетической инженерии позволяют
направленно улучшать свойства организма для
получения регулируемой сверхэкспрессии гена
данного продукта в обход узких мест в мета-
болических путях. Например, соответствующие
гены могут быть модифицированы in vitro для
удаления сайтов связывания, опосредующих по-
давление синтеза продукта по механизму обрат-
ной связи и затем рекомбинантная ДНК мо-
жет быть вновь встроена в геном продуцента.
В организм могут быть также введены чу-
жеродные гены, обеспечивающие функциониро-
вание новых метаболических путей (получение
«трансгенных организмов»), которые поз-
волят штамму-продуценту использовать более
дешевые субстраты или синтезировать новые про-
дукты. Таким образом, штаммы можно констру-
ировать как в направлении изменения метаболиз-
ма (бихимическая, или метаболическая, инжене-
рия), так и в направлении их приспособления к
особым требованиям технологического процесса
(технологическая инженерия).
Как уже отмечалось, генетическое констру-
ирование высокопродуктивных штаммов требует
глубокого знания генетики используемого мик-
роорганизма. В настоящее время полное секве-
нирование генома данного вида бактерий или
архей можно осуществить за несколько месяцев
(табл. 37.1). Среди бактерий наиболее изучен-
ным грамотрицательным организмом является
Escherichia coli, используемая как модельный объ-
ект для анализа регуляции метаболических по-
токов и как «рабочая лошадка» для получения
рекомбинантных белков и тонкого синтеза неко-
торых соединений (например, витаминов и амино-
кислот). Второй, грамположительный модельный
организм — это Bacillus subtilis, продуцент разно-
образных внеклеточных протеаз, используемых
как добавки в моющие средства. Осуществляет-
ся анализ генома Corynebacterium glutamicum —
промышленного продуцента аминокислот и нук-
леотидов (рис. 37.3).
В качестве объектов для секвенирования ге-
нома выбраны и многие бактерии, обитающие в
экстремальных условиях, например при темпера-
турах выше точки кипения воды, при высоком
давлении или высокой солености среды. Ожида-
ется, что эти организмы можно будет исполь-
зовать для получения новых высокостабильных
ферментов с целью применения в промышлен-
ности. Пример таких организмов — Archaeoglobus
fulgidus (табл. 37.1). Это микроорганизм актив-
но растет при высокой температуре и высоком
давлении, характерных для глубоких нефтяных
Рис. 37.3. Физическая карта хромосомы бактерии
Corynebacterium glutamicum — продуцента аминокислот.
Кольцевая карта получена путем анализа фрагментов
хромосомы после ее обработки рестрицирующей эндо-
нуклеазой Swal. Рестрикционные фрагменты пронуме-
рованы в соответствии с их размерами. Кроме повторя-
ющихся последовательностей, которые кодируют рибо-
сомную РНК (rrf, rrl, rrs) или инсерционные элементы
(ISCgr), указаны гены, связанные с биосинтезом амино-
кислот (отмечены серым).
436 Часть IX. Прикладная микробиология
скважин. Образуемые им ферменты могут най-
ти применение в технологиях очистки промыш-
ленных или военных объектов в экстремальных
средах или могут оказаться полезными для пере-
работки бытовых отходов либо получения различ-
ных продуктов, перспективных в плане использо-
вания в хозяйственных или аналитических целях.
Данные, получаемые при секвенировании геномов
бактерий, обеспечат качественный скачок в разви-
тии промышленной микробиологии.
37.6. Возможный риск применения генетически модифицированных бактерий
и пути его преодоления: во всем мире разрабатываются
соответствующие правила и законы
Технология рекомбинантной ДНК становится
незаменимым инструментом в разнообразных
микробиологических исследованиях. В области
прикладной микробиологии она открывает огром-
ные возможности для оптимизации свойств бакте-
рий с целью применения их в медицине, сельском
хозяйстве и промышленности. Однако несмот-
ря на широкие перспективы применения генети-
ческой инженерии, ответственные генетики уже
в самом начале ее развития высказывали обос-
нованное беспокойство по поводу потенциаль-
ного риска, возникающего при использовании
молекулярно-генетических методов. В связи с
этим в 1975 г. была проведена Азиломарская кон-
ференция по вопросам технологии рекомбинант-
ной ДНК (табл. 37.2), принявшая рекомендацию
о наложении моратория на определенные экспери-
менты до тех пор, пока не будет достаточно оце-
нен их возможный риск. В частности, было при-
нято требование предотвращать случайное или
сознательно допускаемое попадание в окружаю-
щую среду организмов, подвергшихся обработке
методами генетической инженерии, — генетиче-
ски измененных организмов (ГИО), которые
в результате неконтролируемого роста могли бы
стать, например, «бактериями-убийцами». Спо-
собность размножаться после попадания в окру-
жающую среду, отличающая ГИО от других опас-
ных агентов (например, физических, таких как
радиация, и химических, таких как яды), а также
возможность переноса генов от ГИО в любой дру-
гой организм, в том числе человека, и экспрессии
в нем этих генов (т. е. не планируемое возникнове-
ние трансгенных организмов) были и остают-
ся двумя главными факторами риска, связанного
с применением рекомбинантных ДНК.
Таким образом, решения Азиломарской кон-
ференции наметили в общих чертах физические
и биологические ограничительные стандарты для
экспериментов с рекомбинантными ДНК. На ос-
новании этих решений в 1976 г. в США вновь
созданным Национальным институтом здоровья
(National Institute of Health, NIH) и Комитетом по
надзору за работами с рекомбинантной ДНК был
определен первый перечень указаний для иссле-
дований с применением метода рекомбинантной
ДНК (табл. 37.2). Эти указания определили набор
мер безопасности как физического, так и биологи-
ческого характера. При их разработке эксперты
исходили в основном из многолетнего опыта ла-
бораторной работы с особо опасными патогенны-
ми микроорганизмами. Меры безопасности посто-
янно пересматриваются, прежде всего для ослаб-
ления ограничений, уже не рассматриваемых как
насущные, а также для корректировки с учетом
накопившегося опыта и результатов контрольных
экспериментов.
В последующие годы и в других странах бы-
ли разработаны системы надзора и необходимые
рекомендации. В Японии эксперименты, связан-
ные с технологией рекомбинантной ДНК, регу-
лируются рядом директив, направленных на кон-
троль за свойствами генетически модифицирован-
ных организмов. Японские директивы, довольно
строго следующие рекомендациям OECD и NIH,
считаются простыми для применения и, кроме то-
го, весьма гибкими. В последние годы они были
еще более упрощены. В отличие от этого подхо-
да, ориентированного на контроль за конечным
результатом, меры по регулированию применения
методов рекомбинантной ДНК, принятые в Евро-
пе, направлены па контроль самой этой техноло-
гии. Необходимые директивы и предписания бы-
ли введены в действие в ряде европейских стран,
вначале в Германии в 1978 г. Первый законода-
тельный акт, касающийся генной технологии, был
Глава 37. Прокариоты и человек: возможности, перспективы и опасности 437
Таблица 37.2. Этапы принятия государственных решений и законов о контроле за применением технологии реком-
бинантной ДНК в США, Японии и Европе
Страна Событие, директивы
США 1972 1973 1974 1975 1976 Япония 1979 1986 1989 1991 Европа 1978 1986 1989 1990 1990 1993 Первые эксперименты с рекомбинантной ДНК Гордонская исследовательская конференция по нуклеиновым кислотам: первое обсуждение риска, свя- занного с генной инженерией Опубликование Полом Бергом письма с предложением о введении моратория на определенные экспе- рименты Азиломарская конференция: спонтанный мораторий на определенные эксперименты, связанные с тех- нологией рекомбинантной ДНК Первые указания для исследований с применением рекомбинантной ДНК, опубликованные Националь- ным институтом здоровья «Указания для экспериментов с рекомбинантной ДНК», разработанные Агенством науки и технологии и Министерством образования «Указания для промышленного применения технологии рекомбинантной ДНК», разработанные Мини- стерством внешней торговли и промышленности и Министерством здравоохранения «Указания для применения организмов с рекомбинантной ДНК в сельском, лесном и рыбном хозяйствах и других, родственных сферах хозяйственной деятельности», разработанные Министерством сельского, лесного и рыбного хозяйства «Указания для оценки безопасности продуктов питания и пищевых добавок, создаваемых с применением метода рекомбинантной ДНК», разработанные Министерством здравоохранения «Указания для защиты от опасности, связанной с рекомбинантной ДНК in vitro», разработанные пра- вительством Федеративной Республики Германии «Акт об окружающей среде и генной технологии» в Дании «Законодательство о работе в области генетики» в Великобритании Директивы Европейского сообщества, касающиеся ограничения использования генетически модифи- цированных организмов (90/219/ЕЕС) и произвольного высвобождения их в окружающую среду (90/220/ЕЕС) Принятие германского «Акта о генной инженерии» Первое исправление германского «Акта о генной инженерии»
принят в Дании в 1986 г. В 1990 г. за ним последо-
вал Германский акт по генной инженерии. В связи
с созданием Европейского Союза в 1990 г. в нацио-
нальные законодательства были введены соответ-
ствующие директивы Европейского сообщества.
Европейское сообщество и ряд национальных
правительств выработали программы исследова-
ний с целью обеспечения безопасности при ис-
пользовании технологии рекомбинантной ДНК.
По мере накопления опыта работы и данных о по-
ведении рекомбинантной ДНК в живых клетках
предписываемые техникой безопасности процеду-
ры несколько раз перерабатывались, поскольку
вначале они были довольно жестко ограничитель-
ными и требовали значительного времени для
осуществления даже при работе с организмами,
классифицированными как безвредные. Ослабле-
ние требований безопасности привело к быстрому
внедрению метода рекомбинантной ДНК в прак-
тику исследований. Однако споры о безопасно-
сти продолжаются, часто переходя с одной го-
рячей темы на другую. В настоящее время они
сосредоточены в основном на двух вопросах. Пер-
вый из них — это вопрос о том, как следует от-
носиться к пищевым продуктам, которые содер-
жат ГИО или продукты их жизнедеятельности.
Второй вопрос — какие требуются меры, чтобы
предотвратить случайное попадание ГИО, преж-
438 Часть IX. Прикладная микробиология
де всего генетически измененных микроор-
ганизмов (ГИМ), в окружающую среду. Пер-
вый вопрос, по-видимому, возникает в связи с лю-
бым новым пищевым продуктом («не является
ли он аллергенным?»). Второй вопрос требуется
решать в связи со способом культивирования,
независимо от того, найден ли новый продукт в
результате обычной селекции организмов или по-
лучен с использованием технологии рекомбинант-
ной ДНК.
С самого начала объектом применения тех-
нологии рекомбинантной ДНК в целях безопас-
ности служили генетически дефектные микроб-
ные штаммы, а именно ауксотрофные мутанты,
не способные расти в отсутствие того или ино-
го питательного вещества, редко встречающегося
в природной среде, или температурочувствитель-
ные мутанты, не способные расти в организме теп-
локровных хозяев. Такое биологическое ограниче-
ние должно способствовать элиминации ГИМ при
случайном попадании в окружающую среду.
В настоящее время ГИМ можно было бы
использовать для решения различных задач, свя-
занных с окружающей средой. К ним отно-
сятся проблемы биодеградации загрязнений и
повышения урожайности сельскохозяйственных
культур. Урожайность предполагается повышать
либо путем введения в растения азотфиксирую-
щих бактерий, либо путем применения микроор-
ганизмов, препятствующих поражению растений
вредителями и возбудителями болезней. Однако
при этом возникает вопрос о потенциальной опас-
ности для экосистем, возникающей в результате
внесения тех или иных объектов в окружающую
среду. Чтобы снизить экологический риск, жела-
тельно использовать микроорганизмы, сконстру-
ированные таким способом, который обеспечива-
ет их отмирание после выполнения отведенной
роли. Для этого в последние годы разработаны
дополнительные способы биологического ограни-
чения, т. е. использования не просто генетически
дефектных штаммов, но штаммов, несущих ге-
ны самоубийства, которые экспрессируются сто-
хастически или проявляют активность в опреде-
ленных условиях. Первая стратегия применима
только в некоторых условиях, поскольку генети-
ческий дефект препятствует проявлению актив-
ности штаммов в полевых условиях. Основной
недостаток второй стратегии состоит в том, что
определенная фракция клеток неизбежно выхо-
дит из-под контроля в результате спонтанных
мутаций. Эксперименты по оценке безопасности
показывают, что в принципе биологическое огра-
ничение ГИМ возможно. Однако основным на-
правлением исследований для будущего исполь-
зования ГИМ в биотехнологических методах вме-
шательства в окружающую среду должно быть
получение штаммов с предсказуемым поведени-
ем в полевых условиях. Природная среда пред-
ставляет собой чрезвычайно сложную систему с
большим набором физико-химических и биоти-
ческих параметров, влияющих на разнообразие
бактериальных популяций, и при внесении в нее
не местных или генетически модифицированных
микроорганизмов следует помнить, что эти бакте-
рии нельзя будет собрать обратно. Следователь-
но, опыты по внесению должны удовлетво-
рять двум условиям: 1) эксперименты следует осу-
ществлять поэтапно, вначале в лаборатории и в
теплице, чтобы располагать необходимыми дан-
ными до внесения объектов в природную среду,
и 2) необходимо применять только биологически
ограниченные в отношении роста организмы.
В качестве основного фактора риска, вызыва-
емого использованием рекомбинантных бактерий,
рассматривается горизонтальный перенос ге-
нов, наиболее вероятный между представителями
различных видов бактерий. К настоящему време-
ни достоверно установлено, что горизонтальный
перенос генов играет существенную роль в при-
родных популяциях бактерий, и этот феномен по-
ложен в основу концепции коллективного бак-
териального генома (см. гл. 15 и 29) как суммы
всех генов, доступных для клеток того или иного
вида бактерий. Из области «бактериальной архео-
логии» известны прямые и косвенные свидетель-
ства обильного переноса генов в природе (в эво-
люционном масштабе времени). Перенос плазмид
и мобилизация интродуцированной ДНК наблю-
даются в почве, водных экосистемах, биоплен-
ках и активном иле (в системах очистки сточных
вод). Однако несмотря на то, что естественный
обмен генами относительно широко встречается
среди прокариот, не следует придавать слишком
большое значение потенциальной опасности пере-
носа генов между ГИМ и другими бактериями,
так как очевидно, что решающее значение име-
ют природа переносимых генов и признаков, а не
перенос генов сам по себе. Тем не менее соглас-
но общепринятому мнению, для того чтобы сни-
зить начальную скорость распространения гена в
окружающей среде, соответствующий ген должен
Глава 37. Прокариоты и человек: возможности, перспективы и опасности 439
быть встроен в клеточную хромосому, а не ло-
кализован на плазмиде или мобильном элементе.
В общем, необходим анализ каждого конкретного
случая, чтобы свести к минимуму неоправданный
риск в экспериментах с внесением ГИМ в природ-
ную среду.
Обычно революционно новые технологии, осо-
бенно вначале, вызывают столкновения проти-
воположных мнений. Одни высказывают опа-
сения, что эти технологии могут представлять
неконтролируемую опасность или угрожать тра-
диционным ценностями и методам. Другие убеж-
денно доказывают, что революционные подходы
весьма перспективны и поэтому необходимо обес-
печить их беспрепятственное развитие. Большин-
ство генетиков и биологов других специальностей,
использующих метод рекомбинантной ДНК, со-
ставляют третью, более нейтральную группу, счи-
тая, что генная технология — это не что иное, как
логическое продолжение предшествующего пути
развития генетики. Они убеждены, что отмечен-
ный выше биологический риск не представляет
собой чего-либо коренным образом нового и со-
ответственно преодолим при соблюдении разум-
ных предосторожностей. Согласно их точке зре-
ния, генная технология уже имеет чрезвычайно
важное значение для фундаментальных исследо-
ваний и еще оправдает возлагаемые на нее надеж-
ды в прикладной сфере.
В связи с генной технологией неизбежно бу-
дут вставать важные вопросы в области этики,
экономики, жизни общества и законодательства
из-за ее возможного влияния на живые организ-
мы, в том числе человека. Однако при более де-
тальном рассмотрении большинство из них, если
не все, окажутся вопросами с тысячелетней ис-
торией, которые, возможно, будут задавать еще
тысячелетиями, так как, вероятно, па них нельзя
ответить окончательно и они будут возникать пе-
ред каждым новым поколением, пока существует
человеческий род.
Дополнительная литература
Ciba Foundation (1990) Science, law and ethics. Human
genetic information. Ciba Foundation Symposium
149 Chichester: Wiley.
Davis B. D. ed. (1991) The genetic revolution: scientific
prospects and public perceptions. Baltimore London:
John Hopkins University Press.
Glick B.R., Pasternak J. J. (1994) Molecular biotech-
nology: principles and applications of recombinant
DNA. Washington, DC: ASM Press. Имеется рус-
ский перевод: Глик Б., Пастернак Дж. Молекуляр-
ная биотехнология. М.: Мир. 2002.
Lee Т. F. (1993) Gene future: the promise and perils of
the new biology. New York: Plenum Press.
Old R. W., Primrose S.B. (1994) Principles of gene
manipulation: an introduction to genetic engineering.
5th edn. Oxford London: Blackwell.
Tudge C. (1993) The engineer in the garden. Genes and
genetics: form the idea of heredity to the creation of
life. London: Cape.
Указатель латинских названий
Acanthurus nigrofuscus I: 45
Acetobacter I: 121, 291, 292; II: 289, 377, 394
- aceti I: 46, 291; II: 387, 394
— diazotrophicus II: 305
— pasteurianum I: 28, 63
— xylinum I: 242
Acetobacterium I: 356; II: 234
— woodii I: 358; II: 248, 250
Achromatium I: 63, 308
— oxaliferum I: 63
Achromobacter II: 377, 382, 383
Acidaminococcus fermentans I: 389, 395
Acidianus I: 307, 308, 311; II: 167, 169
— brierleyi I: 321
— inf emus II: 286, 290
Acidiphilium II: 166, 170
— cryptum I: 322; II: 290
Acidobacterium II: 195
Acidovorax avenae II: 203
— facilis I: 318
Acinetobacter I: 50, 63, 282, 320; II: 303, 419, 421
— johnsonii I: 63
Actinomadura I: 253
Actinomyces I: 245
— israeli II: 242
— naeslundii II: 242
Actinomycetales II: 196
Actinoplanes missouriensis II: 387, 409
Aerobacter I: 24, 28
Aeromonas I: 249, 258, 323; II: 215, 419
— salmonicida II: 341
Aeschenomene II: 364
Afipia II: 163
Agrobacterium I: 492; II: 163, 186, 197, 291, 360, 373,
374, 376, 378
— radiobacter II: 360, 379, 380
— rhizogenes II: 117, 372, 376
— tumefaciens I: 23, 441, 589, 595, 610; 372,
374-376, 378-380
Alcaligenes I: 245, 308, 331, 349, 351, 588; II: 263, 280,
382, 383, 303
— carboxydus I: 320
- eutrophus I: 43, 50, 62, 63, 213, 294, 301, 302, 318,
319, 351; II: 388
— hydrogenophilus I: 318
— latus I: 318
— paradoxus I: 318
— ruhlandii I: 318
Alicyclobacillus II: 168
Alnus I: 227; II: 359, 368, 370
Alteromonas I: 249
— espejiano II: 74
Aminobacter aminovorans II: 203
Amoebobacter I: 63; II: 265
— pendens I: 49
Amycolatopsis I: 491
— mediterranei II: 104, 105
Amylosterium II: 301
Anabaena I: 27, 64, 66, 227, 549, 624; II: 48-52, 261;
359, 370
- azollae I: 227; II: 305, 369, 370
— flos-aquae I: 62
— variabilis I: 413
Anabaenopsis II: 290
Anacystis nidulans I: 413
Aphanizomenon I: 63; II: 261
Aphanothece halophytica II: 292
Aquaspirillum autotrophicum I: 318
— itersonii I: 63
— magnetotacticum I: 63, 330
Aquifex II: 194, 195
— pyrophilus I: 318, 319; II: 287
— thermophilus II: 431
Arabidopsis I: 611, 611
Archaea I: 197; II: 190, 191
Archaeoglobus I: 215, 364, 366, 367;
II: 169, 313
- fulgidus II: 287, 288, 431, 435
— profundus II: 287
Armillaria mellea I: 253
Artemia salina II: 292
Arthrobacter I: 63, 249, 282, 318, 320, 322, 323;
II: 178, 215, 279, 290, 370, 382, 419
— simplex II: 401, 402
Aspergillus II: 407, 420
— fumigatus II: 423
— niger II: 409
— oryzae I: 515
Asticcacaulis I: 48; II: 239
Aureobasidium pullulans I: 246
Azoarcus I: 227, 390
Azolla I: 227; II: 305, 369, 370
Azomonas I: 320
Azorhizobium I: 227; II: 367
— caulinodans II: 364, 367
Azospirillum II: 304, 359, 377
— amazonense II: 377
— brasiliense II: 377
— halopraefaerens II: 377
— irakense II: 377
Указатель латинских названий 441
— hpoferum I: 318, 320; II: 377
Azotobacter I: 28, 224, 225, 320, 342; II: 280, 360, 377
— arthrospora I: 66
— chroococcum I: 27, 36
— vinelandii I: 55, 67; II: 387
Bacillus I: 63, 66, 131, 170, 188, 192, 245, 247, 249, 258,
292, 323, 349, 354, 376, 377, 567, 572, 573, 575,
585, 589, 602; II: 20, 54, 55, 69, 113, 119, 120,
156, 177, 185, 195, 279, 280, 284-286, 290-292,
354, 378, 382, 383, 386, 387, 404, 407, 408, 410,
411, 419
— acidocaldarius II: 135, 290
— alcaliphilus I: 121
— amyloliquefaciens II: 409, 387
— anthracis I: 21, 23, 36, 49; II: 321
- brevis II: 107, 116, 120, 121
- cereus I: 330; II: 241, 335, 339, 417
— coagulans II: 409
— fragilis II: 338, 339
— laterosporus I: 63
— licheniformis II: 30, 120, 387, 404, 409,
410, 423
— medusa I: 63
— megaterium I: 33; II: 400
— pasteurii II: 135
— polymyxa I: 63, 67
— schlegelii I: 318, 320
— stearothermophilus I: 49, 104-106, 131, 568,
569, 570; II: 284, 423
- subtilis I: 21, 31, 63, 189, 190, 255, 339, 380,
381, 435, 436, 451, 452, 473-475, 507, 536,
540, 541, 545-548, 574, 575, 591, 602,
603, 610, 623, 624;
II: 10, 17-19, 54, 55, 57, 58, 60, 62, 63, 65, 69,
74, 114, 120, 141, 359, 379, 411, 417, 423,
431, 435
— thuringiensis I: 29, 63; II: 359, 379, 380
— tusciae I: 318
Bacteria I: 197; II: 190, 191, 194-201
Bacterium I: 32
— aerogenes I: 31
— coli commune I: 24
— radicicola I: 27
— rubescens I: 21
Bacteroides I: 246, 247, 610; II: 168, 195-198, 353
— distasonis II: 298
— fragilis II: 298
— ovatus II: 298
— ruminicola II: 296
— thetaiotaomicron II: 298
— vulgatus II: 298
Barkera propionica I: 396
Bartonella henselae II: 325
Bdellovibrio I: 47, 47; II: 197
— bacteriovorus I: 47
Beggiatoa I: 24, 25, 36, 63, 294, 308, 312, 313;
II: 218, 245, 246, 268, 269, 273, 313
Bifidobacterium adolescentis II: 298
- bifidum I: 371, 374, 375
Blastobacter II: 195
Bordetella I: 589; II: 348
- pertussis I: 492, 583, 610; II: 320, 325, 332, 333, 336,
337, 344, 347, 348, 355
Borrelia I: 436, 437
- burgdorferi II: 323-325, 345, 355, 356, 431
Botrytis cinerea II: 379
Bradyrhizobium I: 227, 329, 330, 342, 589; II: 163, 360,
364-367
— japonicum I: 339, 610; II: 42, 360, 364, 367
Brevibacterium II: 292
— flavum II: 387
Brevundimonas II: 163, 166, 173
— diminuta II: 163, 203
Brucella II: 163, 197
— abortus I: 267
Burkholderia II: 166, 173
— cepacia I: 436; II: 203
Butyrivibrio I: 246
— fibrisolvens II: 296
Butyrobacterium I: 356
Campylobacter II: 377
— fetus II: 341, 345
Candida albicans II: 303, 320
Capnocytophaga II: 168
— gingivalis II: 242
Carex elata II: 305
Caseobacter I: 52
Casuarina II: 359
Caulobacter I: 48, 585; II: 5, 6, 18, 38, 39, 113, 127,
224, 239, 419
— crescentus I: 624; II: 20, 36, 38, 39
Caulococcus I: 323
Cellulomonas I: 245
Cephalosporium acremonium II: 100
Chamaesiphon I: 66
Chlamydia pneumoniae II: 324, 325
— psittaci I: 47
— trachomatis II: 333, 335, 350
Chlamydomonas nivalis II: 288
Chlorella I: 28; II: 290
Chlorobium I: 47, 55, 214, 412, 414; II: 44, 196,
198, 199
— limicola I: 57, 413; II: 265
— phaeobacteroides II: 266
Chlorochromatzum aggregatum II: 255
Chloroflexus I: 412, 413; II: 188, 195, 198, 199
442 Указатель латинских названий
— aurantiacus I: 57, 208, 216, 407; II: 286
Chloroherpeton II: 196, 199
Chloropseudomonas ethylica II: 254
Chromatiaceae I: 49
Chromatium 1: 21, 27, 47, 63, 307; II: 265
— okenii I: 21, 35, 43
— vinosum I: 411, 413, 415; II: 55
Chromobacterium I: 249, 258
— violaceum II: 118
Chryseomonas luteola II: 203
Citrobacter I: 548; II: 173
Cla thro chlor is II: 199
Clavibacter II: 360, 374
— michiganensis II: 372, 374
Clonothrix I: 322, 323
Clostridium I: 28, 45, 46, 66, 246-249, 356; II: 54, 177;
II: 195, 280, 284, 286, 303, 387, 419
— aceticum I: 44, 54, 356
— acetireducens I: 387
— acetobutyricum I: 371, 380
— acidiurici I: 399
— aminobutyricum I: 396
— aminophilum I: 395
— aminovalericum I: 398
- barkeri I: 376, 399-401
— beijerinckii II: 431
- bifermentans I: 46
— botulinum II: 335, 338, 393
— butyricum I: 46, 63; II: 249
— cochlearium I: 63, 395
— cocleatum I: 46
— crescentus II: 38-41
— difficile II: 351
— formicoaceticum I: 67, 356, 358
— kluyveri I: 385, 386, 396, 635
— limosum I: 395
— locheadii II: 296
— malenominatum I: 395
— oroticum I: 353, 399
— pasteurianum I: 27, 28, 36, 63, 379, 380, 394
— perfringens I: 63, 348; II: 336-339
— propionicum I: 383, 387, 391, 393, 394
— rubescens I: 21
— sporogenes I: 387, 389
— sporosphaeroides I: 395
— sticklandii I: 394
— subterminale I: 393, 396
— symbiosum I: 395
- tetani I: 395; II: 323, 335, 336, 355
— tetanomorphum I: 395
— thermoaceticum I: 358
— thermocellum II: 423
— uracilium I: 399
— vinosum I: 21
— violascens I: 21
— viride I: 398
— weissei I: 21
Comamonas II: 173
— acidovorans II: 203
Corynebacterium I: 52, 282; II: 164, 290, 303, 373, 374,
382, 386, 400, 419
— diphtheriae II: 320, 322, 335, 347, 355
— glutamicum I: 371; II: 387, 388, 395-398, 435
Coxiella burnetii II: 333
Crenothrix I: 322
Cunninghamella blakesleeana II: 401
Curvularia lunata II: 401, 402
Cyanidioschyzon II: 290
Cyanidium caldarium II: 290
Cylindrospermum I: 67; II: 48, 50
Cytophaga I: 249; II: 166, 168, 195-198, 263, 419
Dehalospirillum multivorans I: 367, 367
Deinococcus II: 195
— radiodurans II: 431
Deleya II: 292
— marina II: 203
Derxia gummosa I: 318
Desulfobacter I: 214, 366, 364
Desulfobacterium I: 215, 364
Desulfobulbus I: 364
— propionicus I: 142
Desulfococcus I: 364
Desulfohalobium II: 292
Desulfomicrobium I: 364
Desulfomonile tiedjei I: 367
Desulfonema I: 364
Dcsulfosarcina I: 364
Desulfotojnaculum I: 364; II: 195, 200
— nigricans I: 49
Desulfovibrio I: 364; II: 197, 200, 234, 292, 313
— desulfuricans I: 294
- sulfodismutans I: 294
— thermophilus II: 286
— vulgaris I: 142, 365; II: 250
Desulfurella acetivorans I: 366
Desulf urococcus II: 194
Desulfurolobus II: 169
Desulfuromonas I: 366; II: 197, 313
— acetoxidans II: 254
Dioscorea composita II: 401, 402
Diplodinium I: 245
Drosophila II: 125
- melanogaster I: 471
Dunaliella salina II: 292
Ectothiorhodospira II: 290
— mobilis I: 55
444 Указатель латинских названий
— palleronii I: 318
— pseudofiava I: 318, 320
Hyphomicrobium 1: 308, 322, 323, 349; 239,
255, 419
Hyppophae I: 227
Klebsiella I: 24, 28, 225, 227, 247, 332, 583;
II: 27, 28, 30, 31, 223, 305, 377
— aerogenes I: 142
— pneumoniae I: 49, 60, 63, 108, 110, 113, 226, 535, 557,
613, 635; II: 417, 341, 342
Kuznetsovia I: 323
Lachnospira multiparus II: 296
Lactobacillus I: 121, 377; II: 201, 297, 304, 387,
391-393, 419
— buchneri I: 114
— bulgaricus II: 392
— casei I: 545
— delbrueckii II: 392
— helveticus II: 392
— kefir II: 392
— kefiranofaciens II: 392
— lactis I: 635
— plantarum II: 393
Lactococcus lactis I: 104, 105, 107, 114; II: 392
Lamprocystis I: 63
— roseopersicina I: 29
Lampropedia hyalina I: 46
Legionella II: 166, 186, 351
— pneumophila II: 320, 325, 333-335, 339, 351, 356
Leishmania donovanii II: 319
— major II: 319
Leptomitus II: 420
Leptospira II: 194
Leptospirillum I: 321; II: 195
— ferrooxidans I: 321
Leptothrix I: 294, 322, 323
— ochracea I: 21
Leucaena II: 364
Leuconostoc II: 304, 387
— cremoris I: 385
— lactis II: 392
— mesenteroides II: 387, 392, 393
Leucothrix I: 46; II: 418
Lieskeella I: 322
Listeria monocytogenes II: 42, 325, 329, 333, 335, 337,
339, 341
Lyngbya I: 57
Macromonas I: 308, 312
— mobilis I: 63
Macrotermes II: 301
Marinomonas II: 292
Megasphaera elsdenii I: 383, 394; II: 296
Metallogcnium I: 322, 323
Metallosphaera sedula I: 321
Methanobacillus omelianskii II: 248, 249, 251
Methanobacterium II: 191
— thermoautotrophicum I: 294; II: 194, 431
Methanobrevibacter ruminantium II: 296
Methanococcus igneus II: 287
— jannaschii I: 64, 436, 507; II: 287, 431, 432
Methanogenium marisnigri I: 49, 52
Methanomicrobium mobile II: 296
Methanoplanus endosymbiosus II: 253
Methanopyrus I: 358
— kandleri II: 287
Methanosarcina I: 63, 188, 362; II: 162
— barkeri 1: 363; II: 162, 248
— masei I: 54
Methanospirillum II: 234
— hungatei I: 43, 49; II: 250
Methane thermus sociabilis II: 286
Methanothrix I: 362, 363
Methylobacterium II: 170, 173
— mesophilicum II: 203
Methylococcus II: 255
Methylocystis I: 66
Methylomonas I: 294
Methylophilus methylotrophus II: 388
Methylosinus I: 66
— trichosporium I: 66
Metopus striatus II: 253
Microbispora I: 246
Micrococcus I: 37, 323; II: 178, 292, 303, 393
— amylovorus I: 23
— luteus I: 63; II: 30
Microcoleus chthonoplastes II: 268, 292
Microcyclus aquaticus I: 318
Microcystis I: 63; II: 261
— aeruginosa I: 62
Micromonospora I: 491; II: 110, 112, 118, 186
— sagamiensis II: 112
Micropolyspora II: 423
Microsporidia II: 204
Microthrix II: 419
Monas I: 21, 32
— okenii I: 29, 36
— prodigiosa I: 21
Moraxella I: 258; II: 215
— bovis II: 344
Mycobacterium I: 52, 282; II: 156, 164, 402
— genitalium I: 507
— gordonae I: 318
- leprae II: 319, 333, 334, 355, 431, 432
- tuberculosis I: 554, 554; II: 320, 324, 329, 332, 333,
Указатель латинских названий 445
355, 356, 431, 432
Mycoplasma Г. 507; II: 10, 373
— genitalium II: 356, 431
— hyorhinis II: 344, 345
— pneumoniae II: 431
Myrica И: 359
Myxobacterium I: 66
Myxococcus I: 64, 66, 573, 585; II: 66, 69
- xanthus I: 48, 575, 578, 610, 624; II: 54, 66,
68, 69, 117
Natronobacterium II: 172, 191
Natronococcus II: 172
Naumanniella I: 322
Neisseria I: 63; II: 30, 32, 127
— gonorrhoeae I: 474; II: 322, 332, 339, 344, 345
— meningitidis II: 323, 341, 355
Neocallimastix I: 245
Neuvospora II: 99, 100, 101
— crassa I: 35, 37, 467
Nilaparavata lugens II: 119
Nitrobacter I: 36, 315, 316, 339-341;
II: 163, 362, 419
— agilis I: 316
— hamburgensis I: 54, 314, 316
— vulgaris I: 314
— winogradskyi I: 294, 314; II: 190
Nitrococcus mobilis I: 314
Nitrosococcus oceanus I: 314
Nitrosolobus multiformis I: 46, 314
Nitrosomonas I: 36, 63, 315, 341
— europaea I 142, 294, 314
— oceanus I: 58
Nitrosospira briensis I: 314
Nitrosovibrio tenuis I: 314
Nitrosrina gracilis I: 314
Nitrosrira marina I: 314
Nocardia I: 52, 282, 283, 323; II: 118, 164, 169, 419
— autotrophica I: 318
Nocardwides II: 166
Nostoc I: 27, 227; II: 48, 369
— punch for me I: 26
Ocennospirillum I: 323
Ochrobium I: 322
Onchocerca volvulus II: 319
Ophidomonas I: 21
— jenensis I: 36
Oryza saliva II: 377
Oscillatoria I: 63, 64
— limnetica I: 418
Oscillochlons Г 412
Oxalobacter formigenes I: 105, 114, 403
Paracoccus I: 308, 331, 336, 337, 349;
II: 178, 223, 419
- denitrificans I: 142, 294, 300, 301, 307, 311, 318,
335-339, 351
Paramaecium II: 418
Paspalum II: 377
Pasteurella haemolytica I: 583; II: 336
Pediococcus II: 387, 393
Pedomicrobium I: 322, 323
Pelobacter II: 251
— acetylenicus II: 250
Pelochromatium II: 255, 265, 266
Pelodictyon I: 63
— clathratiforme II: 265
Pelonema I: 63
Peloploca I: 63
Penicillium II: 420
— glaucum I: 30
— notatum I: 18; II: 403
Peptococcus II: 177, 195
— prevotii II: 298
Peptostreptococcus I: 356
— asaccharolyticus I: 395, 399
- productus II: 298
Phanerochaete chrysosporium I: 253
Phaseolus vulgaris II: 364
Phormidium I: 57, 624
Photinus pyralis I: 344; II: 433
Photobacterium I: 47, 249, 343
— phosphoreum II: 302
Photorhabdus II: 303
Phy Hum ultimum II: 378
Plagiopyla frontata II: 254
Planctomyces I: 322; II: 194
Plasmodium falciparum II: 319, 320
Plectonema I: 57; II: 290
Pleurocapsa I: 66
Pneumococcus I: 18, 35, 37, 425
— pneumoniae I: 35
Propionibacterium I: 258, 348, 383, 396; II: 303, 399
— acnes II: 303
— arabinosum I: 28, 37
— freudenreichii II: 399, 400
Propionigenium modestum I: 110, 142, 403
Prosthecochloris II: 224
— aestuarii I: 413
Proteus I: 64, 595, 615; II: 173, 336
- mirabilis I: 48; II: 339
— vulgaris II: 417
Pseudomonas I: 47, 63, 233, 236, 246, 247, 249, 253, 258,
282, 283, 308, 323, 331-333, 349, 354, 441, 477,
483, 567, 568, 583, 589; II: 32, 33, 110, 127,
172, 173, 178, 195, 202, 203, 215, 263, 288, 290,
292, 304, 359-361, 372-374, 378, 382, 383,
419, 431
446 Указатель латинских названий
— acidovorans II: 203
— aeruginosa I: 63, 105, 351, 557, 595; II: 118, 173,
202, 203, 320, 331, 332, 337, 339, 346, 348, 349,
352, 417
— aminovorans II: 203
— aureofaciens II: 361
— avenae II: 203
— capsulata II: 173
— carboxydohydrogena I: 320
— carboxydovorans I: 294, 320
- cepacia II: 173, 203, 372, 382
— compransoris I: 320
— denitrificans II: 399, 400
— diminuta II: 173, 203
— facilis I: 64
— flava II: 203
— fluorescens I: 142; II: 417
— gazotropha I: 320
— luteola II: 203
— maltophilia II: 203, 173
— marginalis II: 372
— marina II: 203
— mesophilica II: 203
— mixta II: 203
— oryzihabitans II: 203
— paucimobilis II: 203
— pseudoalcaligenes II: 382
— putida II: 155
— radiora II: 173
— saccharophila I: 318
— solanacearum II: 371-373
- syringae II: 129, 360, 372-374 , 380
— thermocarboxydovorans I: 320
— tolaasii II: 371, 373
Pyrenophora tritici II: 378
Pyrobaculum II: 169, 431
— aerophilum II: 286
— islandicum II: 286
— organotrophum II: 169
Pyrococcus I: 247, 263
— furiosus I: 264; II: 431
Pyrodictium II: 313
— occultum I: 122; II: 287
Pythium II: 378
Renobacter vacuolatum I: 318
Reticulitermes flavipes II: 299, 300
Rhizobium I: 47, 226, 227, 320, 329, 330, 342, 441, 595;
II: 127, 163, 186, 197, 280, 291, 359, 360,
363-368, 370
— galegae II: 364
— japonicum I: 318, 320
— leguminosarum II: 363-365, 360, 366, 367
— loti II: 364
— lupini I: 44
- meliloti I: 610, 624, 557; II: 360, 364-367, 433
Rhizoctonia solani II: 379
Rhizopus arrhizus II: 401
— nigricans II: 401, 402
— niveus II: 409
Rhodobacter I: 332, 617, 624; II: 165
- capsulatus I: 55, 102, 409, 417, 495; II: 43-45, 47
- sphaeroides I: 56, 213, 339, 415, 421, 623; II: 42
Rhodococcus I: 52, 437; II: 419
— opacus I: 318
Rhodocyclus gelatinosus I: 386
Rhodomicrobium vannielii I: 66; II: 219
Rhodopseudomonas I: 390; II: 195
— acidophila I: 410, 411, 421
— blastica II: 165
— gelatinosa I: 384
— palustris I: 55, 56, 407, 411; II: 163, 189
- viridis I: 407, 413; II: 42, 47, 163
Rhodospirillum I: 27, 35, 47
— molischianum 1: 55, 421
- rubrum I: 46, 211, 213, 417; II: 42, 47, 48
Rhodovulum II: 165
Rickettsia II: 332
— prowazekii II: 333, 431
— rickettsii II: 333
Rochalimaea II: 197
Roseobacter II: 165, 170
Ruminococcus I: 246
— albus II: 296
Saccharomyces cerevisiae I: 378, 471; II: 17
Saccharopolyspora I: 491
- erythraea II: 406
Saccharothrix II: 166
Salmonella I: 33, 463, 547, 548, 558, 616;
II: 24, 26, 74, 163, 164, 173, 393
— anatum II: 26, 27
- enterica II: 320-325, 333, 335, 342, 346, 348, 350,
351, 355
— typhi II: 320, 355
- typhimurium I: 109, 110, 113, 145, 466, 479, 529,
533, 534, 557, 564, 564, 610; II: 56, 90, 126,
325, 333-335, 356
Saprospira grandis I: 63
Scenedesmus I: 28
Schistosoma mansoni II: 319
Schizosaccharomyces pombe II: 17
Selenomonas acidaminophila I: 396
— lactilytica II: 296
— ruminantium II: 296, 296
Serratia I: 28, 64, 249, 258, 354, 548, 583, 595, 615;
II: 74, 173, 340, 378
— marcescens I: 21, 35, 63, 380, 381; II: 118, 410
Указатель латинских названий 447
Shewanella II: 216
— putrefaciens I: 354
Shigella I: 548, 589; II: 74, 172, 322, 333, 355
— dysenteriae II: 180, 336, 338, 350
- flexneri I: 34; II: 325, 332, 334, 335, 341, 346
Siderocapsa I: 322
Siderococcus I: 322
Sinorhizobium fredii II: 364
— meliloti II: 364
Sirex cyaneus II: 301
Sorghum bicolor II: 377
Spartina II: 220, 377
Sphaerotilus I: 322; II: 419
— natans I: 46, 48, 63
Sphingobacterium II: 168
Sphingomonas II: 168, 173
— paucimobilis II: 203
Spirillum I: 32, 617; II: 233
— volutans I: 63
Spirochaeta I: 32; II: 178
Spiroplasma II: 373
Spirulina II: 290
Sporolactobacillus I: 66
Sporomusa I: 66, 67, 356
Sporosarcina I: 66
Staphylococcus I: 258, 489, 589; II: 21, 178, 303,
404, 419
- aureus I: 491, 552; II: 14, 23, 29, 135, 320, 323-325,
329, 335-338, 341, 342, 348, 351-353, 356,
393, 431, 432
— camosus II: 393
— epidermidis II: 320, 331, 351
— saprophyticus II: 339
Steinemema II: 303
Stella II: 224
Stenotrophomonas II: 173
— maltophilia II: 203
Stibiobacter I: 294
Stigmatella I: 66
Streptococcus I: 377, 490; II: 30, 31, 201, 242, 297, 387,
391, 392
— bovis II: 296
— coelicolor I: 555
— faecalis I: 552
— intestinalis II: 298
- lactis I: 22, 36, 385
— pneumoniae I: 473, 475, 35; II: 337, 339, 355
- pyogenes I: 490; II: 28, 322, 324, 325, 329, 331, 332,
335, 336, 338, 341-343, 348
— thermophilus II: 392
Streptomyces I: 66, 66, 246, 247, 253, 258, 320, 323, 436,
491, 552; II: 10, 54, 61-64, 69, 100, 101, 115,
118, 185, 352, 354, 374, 378, 386, 387, 399,
403, 405
— alboniger II: 120
— antibioticus II: 99, 101, 406
— argenteolus II: 401
— aureofaciens II: 102, 404, 405
— bikiniensis II: 115
— cacaoi II: 99, 100
— cinnamonensis II: 105
— clavuligerus II: 100, 107, 114
— coelicolor II: 63-65, 66, 120, 406
— erythreus II: 404
— fradiae II: 114, 354
— fumanus II: 379
— galilaeus II: 407
- griseus II: 62, 63, 67, 115, 118, 120, 139, 404
— lavendulae II: 98
— lincolnensis II: 97, 98
— lipmanii II: 108
— lividans I: 555, 491; II: 66, 286
— pilosus II: 116
— platensis II: 99
— refuineus II: 98, 100
— rubiginosus II: 409
— venezuelae II: 97
— viridoflavus II: 404
Streptomyxa affinis II: 401, 402
Streptoverticillium I: 46
Succinimonas amylolytica II: 296
Sulfobacillus thermosulfidooxidans I: 321
Sulfolobus I: 265, 307, 308, 311, 312; II: 167, 194
— acidocaldarius I: 122, 309, 321; II: 194, 286, 290
— ambivalens II: 169
— solfataricus I: 321; II: 169, 431
Synechococcus I: 227; II: 52, 431
— lividus II: 286, 288
Synechocystis II: 431
Synergistes II: 195
Syntrophobacter wolinii I: 401; II: 250
Syntrophomonas wolfei I: 401; II: 250
Syntrophospora bryantii I: 401
Syntrophus buswellii II: 250
Telluria mixta II: 203
Termitomyces II: 301
Thauera I: 349, 390
— aromatica I: 349, 402
Thermoactinomyces I: 66; II: 423
— vulgaris II: 284
Thermoanaerobacter I: 246, 247; II: 286
— brockii II: 286
Thermoanaerobacterium thermosulfurigenes I: 51, 59
Thermoanaerobium brockii II: 251
Thermodesulfobacterium II: 195
Thermomicrobium II: 199
Thermomonospora I: 246, 247, 253, 491; II: 423
Thermoplasma I: 265; II: 169, 191, 194
448 Указатель латинских названий
— acidophilum I: 53; II: 167, 290
Thermoproteus I: 214; II: 169, 194, 313
Thermothrix I: 308
Thermotoga II: 196
— maritima II: 186, 287, 431
— thermarum II: 286
Thermus I: 247; II: 194, 197, 198, 423
— aquaticus II: 284, 286
— thermophilus I: 518
Thielaviopsis basicola II: 378
Thiobacillus I: 63, 206, 300, 307, 308, 309, 311, 313, 321,
349, 195, 218, 233, 290, 313, 429
— acidophilus I: 309, 310; II: 135
— denitrificans I: 309-311; II: 218, 313
- ferrooxidans 1: 121, 294, 299, 309, 310, 311, 312, 318,
321-323, 339; II: 218, 289, 428, 429
— intermedins I: 309
— neapolitanus I: 62, 309, 312; II: 233
— novellus I: 267, 309
— tepidarius I: 309
— thiooxidans I: 294, 309, 311
— thioparus I: 294, 309—311
— versutus I: 309, 310
Thiobacterium I: 308, 312
Thiocapsa pfennigii I: 55
— roseopersicina I: 55
— thiozymogenes I: 367
Thiocystis violacea I: 56
Thiodictyon I: 63
Thiomicrospira I: 308, 311, 313; II: 270
— denitrificans I: 294, 310
— pelophila I: 309
Thiopedia II: 265
— rosea I: 46
Thioploca I: 308, 312, 313; II: 269, 273, 313
Thiosphaera I: 308, 332
— pantotropha I: 300, 301, 309, 311
Thiospirillum I: 63
— jenense I: 21
Thiothrix I: 63, 308, 312, 313; II: 418
Thiovulum I: 63, 308; II: 246
Toxothrix I: 322
Treponema II: 242
— pallidum II: 322, 333, 356, 431
Trichoderma I: 245
Trimyema compressum II: 254
Triticum aestivum II: 377
— durum II: 359
Trypanosoma cruzi II: 319
Veillonella I: 384; II: 296
— atypica II: 242
— parvula I: 348, 353; II: 296
Vibrio I: 32, 249, 343, 344, 477, 589, 595, 615;
II: 156, 224, 290, 292
— alginolyticus I: 108
- cholerae II: 319, 320, 322, 324, 331, 332, 335, 336,
339, 343, 348-350, 355, 356
- fischeri I: 344, 610; II: 302, 373
Vida faba II: 363
— hirsuta II: 365
Vorticella II: 418, 419
Westiella I: 66
Wolinella I: 368; II: 234, 313
— succinogenes I: 348, 350, 353-355; II: 250
Xanthobacter I: 320; II: 280
— autotrophicus I; 318
— fiavus I: 213, 318
Xanthomonas I: 253; II: 304, 373, 374, 386, 431
- campestris I: 250; II: 119, 372, 374, 380, 387, 388
Xenorhabdus I: 258; II: 119, 303
Xeromyces bisporus II: 292
Yersinia I: 589; II: 173, 432
— enterocolitica II: 333-335, 342, 343, 345-347
- pestis II: 320, 323, 343-345
— pseudotuberculosis II: 335
Zea mays II: 377
Zoogloea ramigera I: 46; II: 417, 418
Zostera II: 220
Zymomonas I: 371, 372, 377-379
- mobilis I: 104, 105, 114; II: 387
Предметный указатель
Абортивная инициация I: 452
Автоклав I: 22, 131
Автолиз, репрессор LexA I: 578
Автоматизированные системы сбора данных II: 157
Автотрофия I: 24
Автотрофная фиксация СОг I: 206-217
Автотрофные бактерии I: 124, 127, 208-217; II: 307
Автохтонные микроорганизмы I: 32; II: 208
Агар I: 22, 131, 137
Агматин I: 201
Агрегация, вещество I: 490
— неспецифическая II: 331
Агроцин-84 II: 117
Адаптация I: 31. См. также Экстремальные
среды обитания
— к условиям среды I: 31, 618; II: 125-126
— немедленная I: 237
— SOS-реакция I: 471; II: 19
Адвекция II: 243
Адгезины I: 65; II: 34, 35, 238
— распознавание рецептора II: 331
— фимбрий И: 331, 332
Адгезия II: 238, 331
— и экзоферменты I: 240
— сайты I: 475
Аденилатциклаза I: 583, 598
— фосфотрансферазная система I: 599-600
Аденилилтрансфераза I: 571
Аденилирование I: 570
Адениловые остатки, перенос I: 161
Аденин I: 426
Адениннуклеотиды как аллостерические
эффекторы I: 568
Аденозилкобаламин I: 391
S-Аденозилметионин I: 160, 168, 558
Аденозиндифосфат (ADP) I: 76, 77
— фосфорилирование I: 369
Аденозин-б'-монофосфат (AMP) I: 180, 181
Аденозинтрифосфат (АТР) I: 161
— выход I: 73-75
--при аэробном катаболизме I: 332
--при брожении I: 370
— и рестрицирующая эндонуклеазная активность
I: 501
— и синтрофное окисление жирных кислот
II: 251-252
— образование при брожении I: 369, 629
— общее содержание II: 227
— синтез в процессах катаболизма I: 140
— потребление I: 72
— регенерация из ADP I: 161
— роль в реакциях биосинтеза I: 161
— синтез I: 72-75, 84
и изменение свободной энергии I: 75
и электрохимический протонный потенциал I: 86
У фототрофных бактерий I: 93
энергетическая эффективность I: 74
— трата на синтез малых молекул I: 161
Аденозин-5'-фосфосульфат I: 229
Азиломарская конференция II: 436, 436
Азот I: 151-156, 612-614; II: 276
— и вторичный метаболизм II: 114
— источники в промышленных процессах II: 390
— как компонент биомассы II: 212
— как субстрат II: 212
— молекулярный I: 226, 304, 315; II: 212
---фиксация I: 26, 223, 225; II: 363-366
— перенос через мембрану I: 151
— потребность I: 128
— превращение в аммиак I: 441; II: 363
— превращения И: 213
— путь ассимиляции I: 304
— удаление из сточных вод II: 420
— цикл II: 311
Азота диоксид I: 347
— соединения I: 305
Азотная кислота II: 289, 312
Азотпый метаболизм I: 571
Азотфиксация I: 26, 31, 224, 441; II: 363-366
— бактероиды II: 366
— в почве II: 281
— в симбиозе с бобовыми II: 363-368
— гены I: 225-228
— гетероцисты цианобактерий II: 48-52
— интермедиаты I: 348
— нитрогеназа II: 261
— распространение I: 225
- симбиотическая I: 227; II: 368
Азотфиксирующие бактерии I: 27; II: 50, 304, 363
Азоферредоксин. См. Fe-Белок
Аквапорин И: 125
Акинеты I: 26; И: 48, 224
Активатор транскрипции FlbD И: 40
Активаторы I: 524-526
— ингибирование репрессором I: 538-539
— общие I: 534-535
— связывающиеся с энхансером I: 534
— транскрипции I: 534
Активация интерфазная I: 258
— сайты I: 524, 533
450 Предметный указатель
Антропогенный фактор, выделение диоксида серы
II: 315
--накопление СО2 II: 308
транс-Активные элементы I: 448
Активный ил II: 417-423
--микрофлора II: 251
--нитчатые бактерии II: 418
Актин F II: 334
Актиновые микрофиламенты И: 334
Актиномицеты, ингибиторы прорастания II: 120
— как внутриклеточные азотфиксирующие
симбионты II: 368, 369
— классификация II: 196
Актиномицины, ароматическое ядро II: 100
— биосинтез II: 114
Актинориза II: 368, 368
Актинородин II: 406
Акцепторы электронов I: 186, 346; II: 215
--анаэробное дыхание I: 635
--брожение I: 368
--вторичные I: 415
--окислительно-восстановительный потенциал
I: 368-368
--регенерация I: 210
Аланин I: 169
— сбраживание I: 393, 394
Аланиндегидрогеназа I: 153
Алармоны I. 594, 598, 606-608
— индикаторы стресса II: 130
— регуляторные эффекты II: 51, 62
— синтез I: 605
— AppppA II: 124, 130
- ppGGpp I: 542, 605-606
Алкалитолерантные микроорганизмы II: 284
Алкалифильныс бактерии 1:121; 11:132,133,135,
284; II: 290
Алканы I: 281-283
Алкены I: 283
Алкиламины II: 167
Алкилмалонаты II: 102
Алкогольдегидрогеназы I: 291
Аллостерические ферменты I: 565, 566
— эффекторы II: 124
Аллостерический контроль активности ферментов
I: 561-570
--анаболизма I: 562-568
--катаболизма I: 568-570
--стратегии I: 562, 564
Аллохтонные микроорганизмы II: 208
— популяции I: 32
Альдегиддегидрогеназы I: 291
Альдегиды, окисление I: 76
Альдозы, окисление альдегидной группы I: 162
Альдолаза КД ГФ I: 265
Альдолазы I: 375
Альдольная конденсация I: 216, 217
Амебы II: 225
— антибактериальные механизмы II: 118
Амидотрансферазы I: 154
Амилазы I: 239, 246
— у грибов П: 407
Амилоза I: 246
Амилопектин I: 246
Аминоацил-тРНК I: 161
Аминоацил-тРНК-синтетаза I: 545
4-Аминобензоат I: 173
-у-Аминобутиратный путь, сбраживание глутамата
I: 395
5-Амнновалерат I: 398
Аминогликозиды II: 109-112, 405
Аминокислоты I: 145. См. также Строительные
блоки
— аммиак-лиазы I: 269
- ароматические I: 169-174, 271
— ауксотрофные мутанты I: 129
- в рубце II: 296
— /3-гидроксилирование II: 97
- дегидрогеназы I: 268
— дезаминирование I: 267-269
— декарбоксилирование 1: 269, 403
— и вторичный метаболизм II: 97-99
— и рост I: 129
— как субстраты I: 267-271
— как таксономические маркеры II: 166
— конденсация в олигопептиды II: 96
— образование 2-оксокислот I: 389-392
— образование из метаболитов-предшественников
I: 165-175
— оксидазы I: 268
— опероны синтеза I: 543-544, 553
— разложение I: 267-269
— с разветвленный цепью I: 169, 170, 270, 271
------поглощение I: 113
— сбраживание I: 371, 387-399
— семейства I: 165
--глутамата I. 166
— трансаминирование I: 268-270
— L-форма I: 188
--промышленное производство II: 395-400
— удаление аминогруппы I: 389
— /3-элиминация I: 274
— 7-элимипация I: 269
< 5-Аминолевулиновая кислота I: 202
Аминолипиды II: 166
Амииосахара I: 261
Аминоциклитолы II: 109
Аммиак I: 153, 154, 571; II: 311
— анаэробное окисление II: 219
— ассимиляция II: 311
— в донных осадках И: 275
Предметный указатель 451
— в сточных водах II: 420
— дефицит I: 571
— как источник азота I: 341
---лиаза I: 353
---монооксигеназа I: 314
— образование из N2 I: 223-228, 441; II: 367
— окисление II: 219, 311
Аммоний, выделение при минерализации II: 311
— и вторичный метаболизм II: 114
— как сельскохозяйственное удобрение I: 317
— окисление
---нитрифицирующими бактериями I: 314-317
---при очистке сточных вод I: 316
---ферменты I: 314
Аммонификация I: 347-352
— ассимиляционная/диссимиляционная I: 347
Анаболизм I: 72
— ферменты I: 142
Анаболические пути I: 562, 564
---аллостерическая регуляция I: 564-568
Анаплеротические реакции карбоксилирования
I: 164, 302
Анатоксин II: 354, 355
Анаэробная деградация органических соединений
II: 308
— пищевая цепь II: 249-250
Анаэробное дыхание I: 628, 628, 635, 635
---двухкомпонентные регуляторные системы I: 635
---регуляторная сеть I: 635-638
---электронтранспортное фосфорилирование I: 346
— окисление, реокисление продуктов литотрофами
II: 218-219
Анаэробные бактерии I: 24, 293
---ассимиляция Ci-субстратов I: 221
---методы культивирования I: 125
---облигатные I: 125, 329
---пути ассимиляции СО2 I: 213-217
---рост I: 125
---устойчивые к кислороду I: 329
---факультативные I: 125, 329
---пути метаболизма с высоким выходом АТР
I: 331
---реакция на кислород I: 331
---регуляция метаболизма I: 331, 332
— местообитания, богатые сульфатом II: 249
— окислительно-восстановительные процессы,
брожение I: 368-402
— процессы I: 346
— условия I: 125, 296
Анаэробный синтез жирных кислот I: 192
Андрогены II: 402
Анзамицины И: 103
Аноксигенные фототрофные бактерии
I: 405-418; II: 265-266
Антарктика II: 292
Антирепрессор CI И: 89
Антибиотики I: 28; II: 95
— активное выведение II: 353
— аминогликозидные II: 109-112
— биосинтез II: 97-99
--на рибосомах II: 106
--тиоматричный механизм II: 106-109
— в медицине II: 351-352
— гены I: 441
— действие на трансляцию I: 458-460
— и метаболизм нуклеозидов II: 99-100
— и микрофлора толстой кишки II: 298
— и синтез белка II: 352
— и техника рекомбинантной ДНК II: 406
— как переносчики металлов II: 118
- мишени действия II: 352
— модификация мишеней II: 353
— олигосахаридные II: 110-112
— поликетидные цепи II: 102-105
— полипсптидные II: 106—109
— превращения аминокислот при синтезе II: 99
— промышленное производство II: 403-407
— скрининг штаммов II: 404-405
— ферментативная инактивация II: 353
— устойчивость к ним, и плазмиды I: 440
Антигенная изменчивость II: 332, 343, 344
Антигенные детерминанты II: 328
Антигенпрезентирующие клетки II: 326
Антигены II: 328
— вирусные II: 413-414
— и дифференцировка II: 327
— рекомбинантные II: 355, 413
Антикодон I: 454
Антиметаболиты I: 28
Антимикробные вещества II: 326
Антисмысловые РНК I: 438, 551; II: 349
--и подавление трансляции I: 550-552
--и регуляция I: 444
Антисыворотки II: 328
Антитела И: 328
— связывающие белки II: 342
— экспрессия с помощью фагмид II: 93
Антитерминатор I: 453; II: 89
Антитерминация I: 453, 454, 542, 545
— и лямбдоидныс фаги I: 547
— фактор-зависимая I: 547
— факторы I: 453
Антифагоцитарныс вещества II: 341
Антрамицин II: 97, 98
Антранилат I: 274
Апатиты II: 214
Апоактиватор/коактиватор, стратегия регуляции
I: 524, 526
Апоморфные признаки II: 154
Апорспрессор BirA I: 529
Апорепрессор/корепрессор, стратегия регуляции
I: 524, 526
Апорепрессоры I: 529
Аргинин I: 270
I— биосинтез I: 166
--путь I: 564-566
--роль карбамоилфосфата I: 566
— гидролиз I: 396-397
Ароматические катион-радикальные интермедиаты
1: 254
— кислоты, сбраживание 1:402
— соединения,анаэробное окисление I: 277-278
--разложение I: 271-278
— углеводороды полианнелированные II: 426
Аррениуса уравнение I: 122
Арсенат II: 220
Архебактерии II: 190-191
Археи I: 33, 189; II: 190-191, 204
— жгутикование I: 65; II: 36-37
— и серные бактерии I: 307
— клеточные стенки I: 52
— липиды I: 197, 199
— метаногенез I: 358, 363
— пути ассимиляции СО2 I: 214-217
— серное дыхание I: 353
— таксономические характеристики II: 194
— соотношение с эукариотами и бактериями
II: 192, 193
— эпигенетические свойства II: 193-194
Асемантические молекулы II: 155
Аскорбиновая кислота. См. Витамин С
Аспарагин I: 168
— дезаминирование I: 270
Аспарагиназа I: 270, 353; II: 410
Аспарагиновая кислота I: 152, 168, 270 , 353, 420
--биосинтез I: 567
--полу альдегид I: 168
--семейство аминокислот I: 167, 168, 170, 270
--фосфорилирование I: 572
Аспартат-карбамоилтрансфераза I: 564
Аспартат-транскарбамилаза I: 564
Аспартатфосфат I- 181
Аспартаткиназа I: 567
Ассоциации микроорганизмов пищеварительного
тракта II: 293-302
------гоацина II: 297
------жвачных И: 294-297
------специализация функций II: 301
--термитов
-- человека
--с животными
--с растениями
— Alnus—Frankia
Атмосферные газы I: 305; II: 281
N-Ацетил-D-глюкозамин II: 161
II: 299-301
II: 297-299
II: 270, 293-304
II: 304, 305
II: 368-370
М-Ацстил-Е-талозаминуроновая кислота I: 187
N-Ацетилглюкозамин-б-фосфат I: 584
N-Ацетилглюкозаминидаза I: 248
Аттенуация I: 542
— как механизм регуляции I: 545
— транскрипции I: 552-553
Аттенуированные организмы II: 355
Аттрактанты I: 617
Ауксотрофы I: 129, 467
Аутоиндуктор II: 302
Аутоиндукция I; 595, 596
Аутокиназная активность I: 621
Ауторегуляторные факторы II: 62
Ауторегуляция I: 527
— белок CI I: 537
— гены R-белков I: 551
— ДНК-гираза I: 539
— топоизомераза I I: 539
Ауторепрессорная модель II: 16
Аутофосфорилирование 1: 609
Ацетальдегид I: 378
Ацетат, активация I: 287
— межвидовой перенос II: 252
— окисление I: 82
— расщепление I: 362
— сбраживание глицерола I: 383
— энергетика образования I: 358
Ацетатор Фрингса II: 394
Ацетилглюкозамин, активированный UDP I: 186
Ацетилмурамовая кислота, активированная UDP
I: 188
Ацетилсерин I: 159, 230
Ацетилфосфат I: 370
Ацстил-СоА I: 80
— активация ацетата I: 287
— ассимиляция строгими анаэробами I: 216, 218
— в метаболизме гипертермофилов II: 288
- в сериновом пути I: 220, 219
— в синтезе N-ацетилированных сахаров I: 177
— в синтезе нейтральных липидов I: 196
— высвобождение из насыщенных жирных кислот
I; 280
— гомоферментативное молочнокислое брожение
I: 377
— и 3-гидроксипропионатный цикл I: 216
— и пути фиксации формальдегида I: 220-221
— как предшественник жирных кислот I: 189, 190
— метаболизм I: 632
— образование АТР I: 358
— окисление I: 83, 259
Ацетил-СоА-карбоксилаза I: 190
Ацетил-СоA-путь I: 302
— восстановительный Г 214-215
Ацетил-СоА-синтаза I: 356
Ацетогены I: 356
Предметный указатель 453
Ацетоин I: 28, 381
Ацетолактатсинтаза I: 382
Ацетосирингон II: 375
Ацидофилы I: 121; II: 132, 284
Ацидофильные бактерии II: 134
Ацилирование I: 167, 570
Ацилированные белки I: 580
Ацилпсрспосящий белок (АПБ) I: 189; II: 134
Ацил фосфаты I: 78, 80
Аэрация I: 123; II: 389
Аэрированная вода I: 326
Аэробпая/анаэробная зоны, граница раздела I: 209
Аэробное дыхание I: 325, 334-337, 628, 629
— образование активных форм кислорода
I: 641-643
— коэффициент Н+/2е~ 1: 339
— протондвижущая сила I. 336
---регуляция I: 638-641
Аэробные бактерии I: 296; II: 212
— пероксиданс-групна I: 291
— субоксидапс-группа I: 291
- дыхательные цепи I: 334-337
- условия I: 296
Аэротаксис I: 30, 615, 623
- положительный/отрицательный I: 328, 332-333
ADP-глюкоза I: 199
ADP-DnaK-комнлскс И: 131
ADP-рибозилирование II: 337, 338
АТРаза I: 84, 87-91, 108
- выделение I: 110
— ингибиторы II: 120
ATP-синтаза. См. РСГРъзъ.
АТР-цитрат-лиаза I: 366
Базальная пластинка I: 412
---и фаги II: 75
Базальное тельце II: 38
Бактерии Г. 33; II: 191, 204. См. также Аэробные
бактерии; Анаэробные бактерии; Грамотри-
цательные бактерии; Грамположительные
бактерии; Пурпурные бактерии; Серные бак-
терии; Фототрофные бактерии
- барофильпые I: 125; II: 267, 284, 292
- бродильщики II: 216, 248-249
- внутриклеточно локализующиеся патогенные
И: 332
• гомоацетогенные II: 233, 248, 298
«градиентные» II: 245-247
конкуренция II: 231, 233
нитчатые II: 418
патогенный потенциал II: 350
поведение при голодании II: 223-225
почвенные II: 283
прорастание I: 66
— светящиеся I: 343-344
— систематические группы II: 199
— спорообразующие I 66
— неспециализированные I: 127; II: 208
Бактериородопсин I: 53, 54, 95, 108, 419-420,
624; II: 193
Бактериостатические вещества II: 352
Бактериофагии) I: 33-34, 62; II: 71
— адсорбция II: 80, 79
— белки оболочки II: 79
— бляшки Г. 448; II: 87
— вегетативные II: 86
— взаимодействие с хозяином, ранние этапы И: 79
перенос генов II: 90
изменение круга хозяев I: 548
мутации круга хозяев II; 80
роль рекомбинации II: 92
— вирулентные II: 77-85
— генетическая рекомбинация II: 91
— донор-специфичсские I: 483
— и генетическая инженерия II: 92-93
— классификация II: 73
— клопы И: 71
— кодирующие РПК-полимеразу I: 541
— компоненты II: 73, 79
— контроль бактериальных популяций II: 226
— концевая избыточность I: 495; II: 84
— круг хозяев I: 548; II: 80
— латентная фаза II: 73
— лизирование клеток II: 77
— лизогения И: 77, 87-89
— литический цикл II: 87
— механизм транспозиции II: 85
— модификация I: 34
— морфология II: 72
- морфопоэз II: 82
— мутантные I: 448
— нитевидные I: 514; II: 75, 76
— поздние функции II: 78, 86
— развитие II: 77
— ранние функции II: 78
— рецепторы II: 80
— сайты прикрепления II: 77, 86
- сборка частиц I: 494-495; II: 82-84
— связывание с многофункциональными
рецепторами I: 232
— способы выращивания II: 71-73
— тени II: 83
— титрование II: 72
- трансдуцирующие II: 90
— умеренные II: 77, 85-90
— фенотипы II: 73-74
— формирование отростка II: 224
— хелперные II: 91
— экспрессия генов I: 519, 541; II: 87 _ -
454 Предметный указатель
- А I: 494; П: 76
--антитерминация I: 547; И: 87
--включение в геном II: 86-89
--и клонирование генов II: 92
--индукция II: 87
--как вектор I: 506
--компоненты И: 86
--липкие концы I: 507; И: 84, 86
--литический цикл II: 85
--поздние гены I: 457
--умеренный II: 85-89
--упаковка ДНК II: 84
- </>С31 II: 66
- <дХ174 II: 75-77, 92
-Mu I: 445; II: 85
--изменение круга хозяев I: 548
--система рекомбинации II: 91
- М13 II: 92
--как вектор I: 514
- Р-1 II: 85
- Pl I: 494
- Р22 I: 494
- Т1 I: 232
- Т4 II: 76-77, 81
--белки, подавляющие трансляцию I: 551
--кофакторы И: 80, 79
--сборка головки II: 82-84
--синтез ДНК II: 82-84
--тени II: 83
--цикл развития II: 80, 81
- Т5 II: 78
- Т7 I: 509; II: 92
Бактериофеофитин I: 413
Бактериохлорофилл(-ы) I: 202, 406, 624; II: 46
— как таксономический критерий II: 170
— синтез II: 44-46
Бактерицидные вещества II: 352
Бактериоциногенные плазмиды I: 441
Бактсриоцины I: 441; II: 117
Бактероиды II: 363-364
Бактоптерип I: 320
Бактопренол. См. Ундекапренолфосфат
Бациллы, неполное окисление глюкозы I: 292
Бацитрацин II: 23, 120
Белки. См. также Белок; Фосфобелки
— адгезины II: 238
- буферные I: 130
— выделение I: 579-584
— деградация I: 256, 575
— запасные I: 200
— и хемотаксис I: 618
— интегральные в составе мембраны I: 53
— как субстраты I: 254-256
— каналообразующие I: 100-102
— киназы I: 574
— клеточной стенки II: 21
— клеточные I: 147
— компартментация I: 579-58Г
— кристаллические I: 53
— метил-акцептирующие, хемо!
I: 618-619, 626
— мечение I: 580-583
— переносчики I: 94; II: 35
— периплазматические I: 579
— порообразующис II: 32
— посттрансляционный процесс
— профили II: 170, 174-177
— расщепление I: 254
— свертывание молекулы II: 1
— связывающие одноцепочечну
487, 488
— семейство Hsp60 и IIsp70 II:
— синтез при голодании II: 22
— структурные II: 32
— теплового шока И: 130-131
— терминация I: 436
— трансляция I: 458, 550-552
— фосфорилирование I: 572-5
— функции домашнего хозяйсг
— функциональные домены I:
- химерные I: 509
— шепероны I: 580; II: 130
---периплазматические II: 31
---у экстремальных термофиг
- Fix.I, FixL I: 227
- G I: 459
— IlagA и HagB I: 548
- M II: 325, 332, 341
- Mclr II: 336
- Min II: 15
- Mpf I: 487
- Nar I: 350, 635, 641
- Nif I: 226
- NtrB/NtrC I: 534, 612-614
— Pap II: 35
— RegA и RegB II: 45
— Sap II: 63
-Sec I: 581-583
---функции II: 41
Белок. См. также Белки
— пилил II: 41
— регулятор трансмембранной
— связывающийся с углеводамг
- А I: 51; II: 342
- Ail II: 342
- AspKI-III I: 567
- BgsA I: 578
- CcpA I: 574, 603
Предметный указатель 455
-Сгр I: 532 533, 600
- DivK II: 40
- DnaA II: 17
мутантный II: 18
праймосома I: 433
- DnaK II: 130-131
- Fe I: 225
- Fill А I: 634
- Fis I: 548
- Far I: 630-631
- Fur I: 233; II: 340, 347
— gpXis II: 87
- HflA II: 90
— Ilis-tag I: 510
- IIFr I: 111, 574
- Hsd I: 500
- Htrl I: 625
- IHF II: 90
— LamB I: 102
- Lrp I: 537; II: 346
— LysR I: 537
- MoFe I: 225
— NarL-фосфат I: 637
— NarP-фосфат I: 637
- P-582 I: 365
- PA II: 99
- PatA II: 51
- РЬрЗ II: 14
- pBR322 I: 504-505
- PleC II: 40
- Rck II: 342
- RcsA I: 578
- RelA I: 605
- Rep I: 438
— Rho I: 453
- RP4 I: 481, 486, 489, 504
- SulA I: 578
- TnpR I: 445
- Ton I: 232
- Tra I: 480, 485
- TraM I: 485
- Tus II: 12
- VP#1 II: 413
Бензоил-СоА I: 277, 402
— восстановление кольца I: 277
Бензотиофенхиноны И: 169
Беспозвоночные, симбиоз с бактериями II: 119
Бетаин I: 167; II: 138-141
Бикарбонат/карбопатный буфер I: 121
Бикарбонат/СОг-буфер I: 130
Бинарное деление 1:117
Биовосстановление почвы II: 221, 318, 380, 424-427
Биогаз II: 419
Биогеохимические циклы II: 307
--цикл серы II 312-315
--цикл углерода И: 307-311
Биодеградация I: 320
— загрязнений II: 380-383
Биоиндикация загрязнений II: 417
Биологическая защита растений II: 117, 376-380
Биолюминесценция I: 595
— аутоиндуктор I: 344
— биохимический механизм I: 343-344
— световые органы рыб II: 302
Биома II: 208
Биомасса II: 227
— измерение I: 132-135
— минерализация II: 275
— мониторинг в турбидостате I: 140
— показатель роста I: 140
— рециклизация при очистке сточных вод I: 316
— учет в природных образцах II: 227
Биопестициды бактериальные II: 378-379
Биопленки II: 240-242, 420
— зубной налет II: 241-242
— очистка сточных вод II: 420
--газообразных отходов И: 424
Биополимеры, разложение I: 236, 241, 259
Биореакторы II: 388-390, 422
Биосенсоры II: 427-428
Биосинтетические процессы
--образование С—P-связей I: 228
--образование С—С-связей I: 216, 252
Биосфера II: 207-208
Биота II: 208
Биотехнология, развитие II: 385-386
Биотин I: 159; II: 395
Биотрансформация, стероидные гормоны II: 401-403
Биоудобрения II: 363-370
Биохимический показатель потребности в кислороде
II: 415-416
Биохимическое единство жизни I: 28
Биоценоз II: 208
Бобовые I: 26
Болезни инфекционные человека II: 415
— растений II: 372, 374-376
--волосатость корня II: 376
--гнили I: 253
--корончатый галл II: 374-376
--синдром мокрой древесины II: 305
Болота IF 282, 305
— как местообитания II: 283
— метаногенез II: 252
Брожение I: 20, 23, 346, 628
— акцепторы электронов I: 368
— бесклеточное I: 27
— в кишечнике человека II: 298
— в рубце II: 296
— в слепой кишке II: 299
— восстановление углерода I: 369
456 Предметный указатель
— вторичные метаболиты II: 114
— выделение водорода II: 310
— выход АТР I: 370
— гетероферментативное молочнокислое I: 378
— гомоферментативное молочнокислое I: 377
— доноры электронов I: 368
— контроль промышленных процессов II: 391
— координация с метаболизмом азотистых
соединений I: 635
— номенклатура типов I: 371
— образование молочной кислоты I: 635; II: 391-393
— окислительно-восстановительные процессы
I: 368-402
— пируват как интермедиат I: 375
— продукты I: 370, 635
— пропионовокислое I: 383
— пути I: 369
— регулируемое II: 317
— регуляция генной экспрессии I: 630-635
— синдром мокрой древесины II: 305
— синтрофное, связанное с метаногенезом I: 401
— сквашивание капусты II: 393
— смешанного типа I: 380-381
— спиртовое I: 378-387
— субстраты
--аланин I: 393
--аминокислоты I: 387-399
--ароматические кислоты I: 403
--гетероциклические соединения I: 399-401
--молоко II: 391-392
--мясо И: 393
--пиримидины I: 399
--пурины I: 399
Бромфеноловый синий I: 121
7-Бутиролактон II: 63, 115
Буферная емкость протоплазмы II: 133
Буферы I: 121, 130
Бытовые отходы, переработка И: 424
Вакуоли II: 326
Вакцины И: 354-356, 413-414, 432
Валин, синтез I: 169-170
Валиномицин I: 88
Ванадий I: 225
Ванилин I: 356
Вегетативный рост II: 114
Векторы, геномная библиотека I: 505-507
— живые II: 355
— технические И: 323
— экспрессии I: 509-511
Вестиментифера, симбиотическая ассоциация II: 270
Вид, геномная характеристика II: 174-181
— концепция II: 180-181
Виноградского колонка I: 25
Виолацсин И: 118
Вирулентность I: 595; II: 321, 343, 345
Вирус II: 413
— гепатита В II: 413
— полиомиелита II: 413
Вирусные антигены II: 413-414
Вирусы бактерий I: 33-34. См. также Бакте-
риофаги
— геном I: 447
Витамин Вб I: 287
- Bi2 I: 233
--и рост Е. coll I: 129
--производство II: 399-400
--структура молекулы II: 399
- С
--производство II: 400
Витамины I: 28, 129, 146
— производство II: 395, 399-400
ВИЧ-инфекция II: 325
Включения внутриклеточные I: 61, 199, 509
— спороподобные I: 29
Внеклеточные факторы II: 67
— ферменты, выделение I: 238, 239, 579
--разложение полимерных субстратов Г. 238-249
--и адгезия I: 240
Внеклеточный матрикс И: 325, 331
Внутриклеточный pH II: 132-134
Внутрицитонлазматические мембраны I: 53-58
--нефотосинтезирующие бактерии I: 55
--фотосинтезирующие бактерии I: 55; II: 43
--цианобактерии Г. 57
Вода, активность I: 120, 124
— аномалии плотности II: 258
— давление II: 267
— загрязнение И: 416
— как переносчик возбудителей инфекций И: 415
— НгОшластохинон-оксидоредуктаза I: 418-419
— очистка I: 320; II: 415, 420
— питьевая, контаминация II: 415
--микробиологическая предобработка II: 424
--очистка II: 239
— теплопроводность II: 258
— химические и физические свойства II: 258
— электропроводность II: 259-260
Водная микробиология II: 258
Водные экосистемы, пищевая цепь II: 262
Водоемы, первичная продукция И: 261
— перемешивание II: 259-260
Водород атмосферный II: 310
— выделение в гидрогеносомах II: 253
— и микробная активность II: 311
— использование метаногенами II: 236
— межвидовой перенос I: 401; II: 251
— молекулярный I: 305, 358, 367, 370
— оборот II: 236
Предметный указатель 457
— окисление I: 317-320
---при сульфатредукции I: 299-301
---окислительно-восстановительные полуреакции
I: 295
— парциальное давление II: 248
— потребность в нем I: 128
Водородные бактерии I: 317-320
Волютин I: 29, 200
Воски I: 52
Восстановительные эквиваленты I: 81-83
Восстановительный заряд I: 162
— цикл трикарбоновых кислот I: 214
Время генерации I: 117; II: 9, 603, 604
Всеядные животные II: 293
Вторичная продукция И: 261
Вторичные метаболиты II: 403
---активные против высших растений И: 118
---и антагонизм II: 118
---и дифференцировка II: 120
---и фаза роста II: 113
---образование антибиотиков II: 118
---образование поликетометиленовых цепей
II: 101-105
---пути биосинтеза II: 95
---трансформация аминокислот II: 98
---функции в природе II: 117-121
Вторичный метаболизм II: 95, 403
---инициация споруляции II: 119
---регуляция II: 113-117
---углеродная катаболитная репрессия II: 114
---ферменты II: 95
---химическая дифференцировка II: 119
Вторые посредники I: 626
Выделение веществ клетками I: 105, 579
— белков I: 584
Выедание бактерий II: 225, 261
Высокоэнергетические соединения I: 77-79
Выхлопные газы II: 424
Вышерасположенная активирующая область I: 452
Выщелачивание металлов из руд I: 317, 322,
323; II: 428
Газовая фаза в почве II: 278
— хроматография II: 161
Газовые вакуоли I: 29
— везикулы I: 62, 63
Газы, растворимость I: 123
Галактоза D I: 261
/З-Галактозидаза I: 592, 598
Галактозидазы специфические I: 260
Галактозил-трансфераза I II: 25
Галобактерии II: 139
Галогенированные соединения, разложение I: 289
---расщепление связи углерод—галоген I: 290
Галородопсин I: 107, 624; II: 193
Галотолерантность I: 125; II: 284
Галофильные микроорганизмы II: 284, 291
Гарпины II: 371
Гексозы I: 259-263
Гексонаты I: 262-265
Гексулозофосфатный путь I: 220
Гексурониды I: 262, 265
Гексуроновые кислоты I: 262, 265
Геликаза I: 432-434
Гелиобактерии, фотосинтез I: 406-409
Гем(-ы) I: 91, 202
— биосинтез I: 342
— хинолоксидазы I: 338
Гем-мсдь-содержащие ферменты I: 339
Гемагглютинин II: 333
Гемин II: 339
Гемицеллюлаза I: 245, 248
Гемицеллюлоза I: 242-247
Гемолизин(-ы) I: 233, 256, 583; II: 324, 336, 349
Гемопротеины I: 252
Ген(-ы) I: 448
— авирулентпости II: 372
— цис-активные элементы I: 448
— Р-белков I: 551
— вирулентности II: 343-349, 371, 375
— горизонтальный перенос I: 424, 473,
477; II: 353, 438
— домашнего хозяйства I: 436; II: 52
— и реакция на осмотичесий стресс II: 141
— идентификация I: 507-509
— клонирование I: 505; II: 92
— компетентности (com) I: 475
— лидерной области I: 488-489
— маркерные II: 361
— образования клубеньков (nod) II: 364-366
— ответа на холодовой шок II: 129
— перестройка I: 549
— плазмиды R I: 440
— продукты, локализация II: 41
протеолиз I: 555
— регуляторные I: 42, 519
--soxRS I: 642
— регуляция экспрессии I: 555-558
— слияние I: 591
— структура I: 448
— структурные I: 42, 461
— транскрипционные единицы I: 448
— устойчивости к антибиотикам I: 443; II: 354
— ферментов биосинтеза I: 545
— фотосинтеза И: 44-45
— функция адаптации II: 142
— число копий на клетку II: 11
— abrB II: 57
— act I: 631
458 Предметный указатель
— adhE, экспрессия I: 633
— afsA II: 63
— afsR II: 63
- ard I: 488
- bchZ II: 44
— cha II: 15
— che I: 620-621
— cps I: 578
— сгр I: 630
— dam, продукт I: 540
— det, экспрессия II: 367
— envA II: 15
-fix II: 366-367
— fnr I: 638
- ftsZ II: 15, 18
— gerE II: 60
- glnALG I: 612
— gusA II: 361
— hep A II: 51
— hetR II: 51
— hsn II: 364
- hsv II: 372
- lac I: 104, 450
— mob I: 489
— тик II: 13
— narGHJI I: 637
- nif I: 225-228; II: 50, 364
— oxy RS I: 642
— psi А и psiB I: 488
— put A 1: 529
- rfb II: 26-30
— rep I: 438
- rol II: 28
— rpl I: 455
- rpoS II: 143
- spoT I: 606-607
- ter II: 12
— trbK I: 484
- trfA I: 479
— tyrS, лидерная область I: 546
— umuCD I: 471
- vir I: 492-493; II: 375, 376
Ген-маркер lacZ II: 361
Генетическая инженерия II: 318
--законодательство II: 436-439
--придание новых свойств бактериям II: 438
--придание новых свойств организмам И: 379, 436
--риск II: 436-439
— информация I: 447, 448; II: 151
— трансформация I: 473-476
Генетические карты I: 436, 478
Генетический код I: 450, 461-467
Геном I: 423, 436, 447; II: 151
— бактерий I: 442
— коллективный I: 446
— секвенирование II: 430-436
— стабильность I: 469-470
Геномная характеристика II: 174-180, 362
Геномные библиотеки I: 503-511
--векторы I: 505-507
--идентификация генов I: 507-509
--скрининг I: 512
— перестройки, гены вирулентности II: 345
Генотип II: 151
Гентамицин II: 110-112
Гентизиновая кислота I: 271
Генцианвиолет II: 23
Геохимические циклы Г. 305
Гербициды II: 380-382
Гетерологичные белки II: 411-414
Гетерополисахариды II: 162
Гетеротрофные бактерии, вторичная продукция
II: 261
Гетеротрофы I: 127
Гетероциклические соединения I: 287
--сбраживание I: 399
Гетероцисты I: 26, 224; II: 48-52, 255
Гиалуронидаза II: 338
Гиалуроновая кислота, синтез II: 31
Гиббса свободная энергия I: 73, 296
Гибель клеток, вызванная плазмидами I: 439
--кинетика I: 131
--периодическая культура I: 118
--при голодании II: 225-226
--скорость при стерилизации I: 131
Гидрогеназа, гены I: 319
— мембраносвязанпая I: 318
— метаногенные археи I: 362
— типы I: 318-319
- NAD+ -зависимая I: 318
Гидрогепосомы И: 253
Гидроксибутират I: 396
Гидроксибутирил-СоА I: 386
Гидроксиглутарил-СоА I: 390
2-Гидроксикислоты, восстановление I: 389
Гидроксил-радикал I: 254, 325, 641
Гидроксиламин Г. 341, 347
/3-Гидроксилирование II: 98
Гидроксилирования реакции I: 160
Гидроксипропионатный цикл I: 216, 302
Гидротермальная жидкость II: 271
Гидротермальные венты I: 210; II: 269-271, 287, 307
--биоценоз II: 286
Гипертермофилы I: 122; II: 284, 287
Гипотеза неоднозначного соответствия I: 461
Гипс II: 213, 312
Гираза I: 432
Гистидин, биосинтез I: 161
— дезаминирование I: 271
— метаболизм I: 584
Предметный указатель 459
— путь синтеза I: 174, 181
— сбраживание 1: 396
— фосфорилирование I: 572
Гистидип/гистамип-антипорт-система I: 114
Гистоноподобные белки (H-NS) I: 432, 437; II: 127
Главный комплекс гистосовместимости II: 329
Гликаны II: 21-22, 162
— NDP-активировапные I: 186
Гликоген I: 199-200
— как компонент клеток I: 148
— разложение I: 241-242
Гликозамин-О-гликаны I: 188
Гликозаминогликаны II: 36
Гликозидазы I: 249
Гликозил гидролазы I: 249
Гликозилирование I: 188
Гликокаликс I: 184; II: 239
Гликолат I: 288
Гликолиз I: 76-77, 149, 163, 264
— аллостерическая регуляция I: 568
Гликолипиды I: 189, 194
— как таксономические маркеры II: 165
— поверхности, археи II: 36-37
Гликопротеины поверхности клеток I: 188
Глиоксилат I: 216-218, 288
Глиокси латный цикл I: 303
— шунт I: 572
Глицеральдегид-З-фосфат I: 76-78, 177
Глицератный путь I: 288
Глицерол, окисление I: 281
— роль в синтезе липидов I: 193, 194
— сбраживание I: 383-385
Глицерол-З-фосфат I: 190, 338; II: 29
Глицеролдегидратаза I: 383
Глицеролкипаза I: 575, 601
Глицин I: 171
— дезаминирование I: 271
— сбраживание I: 371, 393
Глицинредуктаза I: 388-389
Глутамат I: 152-153
— активированный UDP I: 188
— биосинтез I: 166
— буферная способность II: 133
— дезаминирование I: 270
— и регуляция тургора II: 139-141
— поглощение I: 113
— сбраживание I: 388, 392, 395
— семейство I: 270
— синтез I: 166
Глутаматдегидрогеназа I: 153; II: 396
Глутаматсиитаза I: 153
Глутамин I: 152-154, 270
Глутаминсинтетаза I: 156, 567, 571, 614
Глюканогидролазы II: 408
Глюкановые полимеры I: 246
Глюкоамилазы II: 409
Глюкоза I: 261
— использование I: 30
— как предшественник антибиотиков II: 109
— катаболитная репрессия I: 115, 599; II: 114
— облегченная диффузия I: 105
— окисление I: 259-265
--в окислительном пентозо-фосфатном цикле
I: 266
--неполное I: 291
--частичное до глутамата I: 371
— превращение во фруктозу II: 409
— разложение I: 73-77
--выход АТР I: 81
— сбраживание I: 28, 75, 371, 380
Глюкозамин как предшественник антибиотиков
II: 109, 112
Глюкозамип-6-фосфат-синтетаза I: 584
Глюкозидазы I: 240, 247
Глюкозиды, транспорт I: 260
Глюкозилтрансфераза II: 25
Глюкозо-6-фосфатдегидрогеназная реакция I: 79
Глюкозоизомераза II: 407—409
Глюкозооксидаза II: 407
Глюкокортикоиды II: 402
Глюкоманнаны I: 243
Глюконатдегидрогеназы I: 265
Глюконеогенез I: 149, 163, 259, 568, 584
Гниение I: 20
Голодание II: 142-144, 223
Гомеостатические системы II: 123
Гомогепотизация I: 515
Гомогентизат I: 274
Гомологии II: 153
Гомология последовательностей II: 184
--выравнивание II: 184
--определение II: 153-154
Гомоплазия II: 153
Гомоацетогенные бактерии II: 233, 250, 298
Гомоцистеин I: 168
Гомоцитрат, синтез I: 228
Гопаноиды I: 53, 189, 196; II: 168
Гормогонии II: 48
Гормоны растений II: 375
Горные породы II: 428
Горовица принцип I: 629
Горячие источники II: 285-286
--вулканического происхождения II: 428
--кислые II: 290
Градиентные культуры II: 245
Градиенты концентрации II: 244
Грамицидин II: 120
- S II: 106, 116, 120
Грамотрицателыгые бактерии, катаболитная
репрессия I: 599
460 Предметный указатель
--клеточная стенка I: 50-51
--наружная мембрана I: 50
--плазмиды I: 439
--энергозависимый транспорт веществ I: 233
Грамположительные бактерии, катаболитная
регуляция I: 602
--систематическое положение II: 197
--клеточная стенка I: 51
--питательные потребности I: 574
Грибы И: 226, 293
— возбудители белой гнили I: 253
--бурой гнили I: 253
Гуанин I: 426
Гуанозин метилированный I: 464
Гуанозип-З-фосфат (GTP) I: 458; II: 62
Гуапозиндифосфат. См. Алармон ppGpp
Гуанозинмонофосфат (GMP) I: 181-180
Гумнн И: 277
Гуминовые кислоты И: 211-214
Гумусовые вещества II: 211
Гумус 11:211,277
Давление отбора I: 464
— влияние па рост I: 125
Движение I: 64-65
— кувыркание-пробежка I: 617-618, 623
— скользящее I: 64, 616
— типы I: 615
Двуслойный агар I: 134
Двухкомпонсптные системы I: 590, 608 614
--и гены вирулентности II: 347, 348
--RssB II: 144
ДДТ II: 381
Деацетооксицефалоспорин С-синтаза II: 108
Дегалогенирование I: 289-290
— восстановительное II: 219
Дегидратазы I: 269
Дегидрогеназа NADH I: 337, 339
Дегидрогеназы I: 334-335; II: 228
Дезаминазы II: 136
Дезаминирование I: 270
Дезоксиарабиногептулозонатфосфат I: 171
Дезоксигексозы I: 185
Дезоксинуклеозиды I: 262, 426
Дезоксинуклеотидтрифосфаты (dNTP) I: 508
Дезоксинуклеотиды I: 426
Дезоксирибонуклеиновая кислота. См. ДНК
Дезоксирибонуклеотиды I: 178, 179, 182
Дезоксистрептамин II: 109-112
Дезоксиуридиптрифосфат (dUTP) I: 182
Дезоксиэритронолид В II: 103, 104
Декарбоксилазы I: 403
Декарбоксилирование а-аминокислот I: 270
Декоинин II: 62
Дендрограммы II: 185-186
Денитрификация I: 31; II: 312
— в почве II: 281
— получение энергии I: 349
— при очистке сточных вод II: 420
— ферменты I: 350-352
Денитрифицирующие бактерии, нитратное дыхание
I: 333
Деполимеризация II: 249
Десульфовиридин I: 365
Десульфонирование I: 290
Десульфорубсрип I: 365
Дссульфофусцидин I: 365
Детергенты II: 410
Детоксицирующие ферменты I: 642
Детрит II: 262
— осаждение в оксане II: 267
— пищевая цепь II: 262, 264
Дехлорирование I: 367
Диагенез II: 276
Диазотрофия I: 223
Диамипопимелиновая кислота I: 169, 187; II: 33
Диауксия I: 31, 115, 119, 298, 597; II: 233
Диацетил I: 385
Диацетилфлороглюципол II: 378
Диацил глицерол I: 258
Дигидроксиацетонфосфат I: 267
Дигпдросирогидрохлорин I: 203
Дигидрострсптоза II: 110
Дидезокси нуклеотиды I: 513
Диимид I: 226
Дикарбоновые кислоты I: 231, 280; II: 166, 167
Диметилсульфид I: 355; II: 314
Диметилсульфоксид II: 220
— как акцептор электронов I: 635, 355
Диметилсульфоксидредуктаза I: 637
Динамика потоков метаболитов II: 244
Диоксигеназы I: 274, 328, 341
Диоксид углерода, ассимиляция. См. Диоксид
углерода, фиксация
---биогаз II: 419
---восстановление I: 354, 359
---изотопный анализ включения I: 213
---ископаемые остатки II: 308
---необходимость для роста I: 124
---превращение в №-мстилтетрагидрофолат I: 356
---синтез ацетата I: 356-357
---фиксация автотрофная I: 24, 28, 206-217,
302-303
---в водоемах II: 269
---водородными бактериями I: 319
---гетеротрофная I: 28, 164
---идентификация генов I: 214
---изучение регуляции I: 214
---механизмы 1: 208-213, 217
Предметный указатель 461
--фотосинтез I: 25-26, 209
--цикл II: 307-308
Диолы длинноцепочечные II: 167
Диосгенин II: 401-402
Дипиколиповая кислота I: 168
Диплогеноты I: 463, 478
Дисахарид-пентапептид II: 22
Дисахариды I: 261
— активированные UDP I: 188
Дифференцировка II: 5
— лимфоцитов II: 327
— общие регуляторные сети I: 589-590
— полярная II: 42
— программа II: 127
— химическая II: 95
— у Caulobacter II 36-39
Дифференцирующие признаки II: 157, 193
Диффузия в клетку растворенных веществ
I: 98-102, 112
— вихревая II: 243
— газов II: 243
— градиенты II: 243
— облегченная I: 99, 114
Диффундирующие факторы II: 62
Дихлоруксусная кислота II: 97
ДНК I: 59-61, 256, 425-436. См. также Репликация;
Транскрипция
— амплификация И: 170, 176, 362
— бактериофагов I: 432, 495
— впрыскивание II 79
— геномные библиотеки I: 503—511
— гибридизация I: 517; II: 179
— гомология II: 180
— лигаз I: 432
--праймаз I: 430
--сайт-специфичных эндонуклеаз I: 554
--топоизомераз I: 439
— делеции I: 442, 463, 515; II: 344
— дупликации I: 442, 463
— замыкание цепи I: 486
— затравочные механизмы репликации I: 433
— зонды I: 512; II: 325
- изгибание I: 428, 535, 539-540, 548, 556
— изменения последовательности I: 463
— инверсия, и фазовая вариация II: 344
— клоны I: 505
— количественная характеристика II: 177-178
— комплементарная (кДНК) I: 507-509
— лидерная цепь I: 430
— липкие концы I 507; II: 84, 86
— метилирование I 540
— модификация I: 499
— надоперонные структуры II: 44
— неметилированная I: 500
— образование петель I: 529; II: 84
— общее содержание II: 227
— одноцепочечная I: 471, 493, 511
— перенос при конъюгации I: 476-493
----трансформации I: 473
--с репликацией I: 486
— полу мети лированная I: 500
— разделение молекул II: 11-14
— разрезание I: 498-501
— регуляторные элементы I: 524
— регуляция инициации транскрипции I: 539-540
— рекомбинация и переключение генов I: 547-548
— репарация I: 428, 469-471
— репликация I: 432-435, 439
--влияние на частоту мутаций II: 18
--перекрывающиеся циклы II: 9-10
--полу консервативная I: 428
--при инициации споруляции II: 56
— рециниентные клетки I: 487
- 16S-pPHK II: 186, 189-190
— сайты активации I: 524
--разрезания I: 503
--связывания рибосомы I: 523
— сателлитная I: 34
— сверхспирализовапиая I: 432, 539; II: 126
— свободная I: 473-476
— связывание с белками I: 474, 556-558
— секвенирование I: 511-514; II: 430
— синтез I: 430-432, 446
— синтез при конъюгации I: 486
— содержание G + С II: 177, 287
— структура I 427-427
— топология II: 126, 141
- упаковка в фаговые частицы II: 83, 84, 92, 93
— урацильные остатки I: 515
— фаговая II: 79, 93
— фингерпринтинг II; 362
— A-форма I: 427
— В-форма I: 427-428
— Z-форма I: 427
— фрагментация I: 474
— чужеродная, защита I: 498-501
ДНК-белковые взаимодействия I: 555-558
ДНК-геликаза I 431
ДНК-гираза I: 539
ДНК-гликозилаза I: 470
ДНК-метилтрансфераза II: 39
ДНК-полимераза I: 429
ДНК—РНК-гибриды I: 451
ДНК—рРНК-дуплексы II: 180
ДНК-связывающие белки II: 127
Т-ДНК II: 374-376
— перенос I: 492-493
Долихолдифосфат II: 37
Долихолфосфат I: 186
Долихол I: 196
462 Предметный указатель
Домен Archaea I: 197; II: 190-191
- Bacteria I: 197; II: 190-191, 194-201
- Eukarya I: 33, 197; II: 191, 204
Домены прокариот II: 190-194
Доноры электронов, брожение I: 368
--неорганические I: 339-341
--у гелиобактерий I: 415
Дренаж кислых руд II: 428
Дрожжевой экстракт I; 129
Дубление I: 255
Дыхание. См. Аэробное дыхание;
Анаэробное дыхание
Дыхательная защита I: 224, 342
— электронтраиспортная цепь I: 334-337; II: 42, 136
Ендиол I: 212
Еиоил-СоА I: 389-392
Жаккарда коэффициент II: 159
Жгутики I: 30, 41; II: 21, 38
— археи II: 36
— вращение I: 64, 618, 625
— и движение бактерий I: 615-617
— и хемотаксис I: 64
— мотор I: 333, 618-620
— сборка II: 36, 40
— сложные I: 615
— структура I: 41, 65, 615; II: 36
— фактор переключения I: 626
— экспрессия генов II: 37-40
Железо, восстановление I: 354
— железистый слой II: 200
— закисное I: 299; II: 218
--как донор электронов I: 339
— и вторичный метаболизм II: 116
— как акцептор электронов II: 216
- комплексы Fe(III) I: 231-233
--[Ее(Ш)]-сидерофор I: 231
- окисление I: 321-323; II: 218, 242, 246
— окислительно-восстановительные процессы
II: 214-215, 315
— поглощение I: 230-233; II: 340, 347
---в организме-хозяине II: 340
— редуктаза И: 339
— связывающие белки I: 233
— фосфат II: 214
Железо-серные белки I: 352
— кластеры I: 225, 318, 350, 414, 415
- центры I: 415; II: 200
Железовосстанавливающие бактерии II: 216
Железоокисляющие бактерии I: 321-323; II: 428
---ацидофильные I: 321
---нейтрофильные I: 322
Желудок жвачных II: 296
— человека, защита от бактерий II: 303
Жидкостная хроматография II: 161
Жирные кислоты I: 189, 192
---антпеизо I: 192
---активация I: 279
---алициклические I: 189
---биосинтез II: 101
---в составе наружной мембраны II: 163
---гидроксикислоты I: 288
---длинноцепочечные I: 190, 279
---как таксономические маркеры II: 166
---насыщенные I: 280
---ненасыщенные I: 194, 280
---номенклатура I: 189
---общее содержание I: 195
---/3-окисление I: 277-279
---полигидроксикислоты I: 189
---предшественники I: 190
---профили II: 228
---разложение II: 251
---с разветвленной цепью I: 195
---сбраживание в рубце II: 296-297
---синтез I: 189-194; II: 101, 102
---синтрофное окисление II: 251
---структура I: 189, 193
---типы I: 189-194
---транспорт I: 279
---циклопропановые I: 194
Жировые включения I: 29
Загрязнения, биодеградация II: 380, 422
- окружающей среды I: 289
Запасные белки I: 242
— вещества I: 199-200, 242
Зеаксантин II: 165
Зеленые водоросли, спектры поглощения II: 265
— фотосинтезирующие бактерии, группы I: 412
---серные I: 405; II: 265
---фотосинтез I: 409-417
Зимогенные микроорганизмы. См. Автохтонные
микроорганизмы
Зона смены окислительно-восстановительных
условий И: 266
Зоны отсутствия роста в газоне Г. 491; II: 66
Зоонозы II: 323
Зубной налет II: 241-242
Идентификация метаболически активных клеток
II: 226
— прокариот II: 155, 432
Идиофаза I: 119; II: ИЗ
Известняк, колонизация бактериями И: 242
Предметный указатель 463
— разложение I: 317 Интерференционная микроскопия I: 42
Изо лейцин I 168-170 Интерфероны II: 412
Изология И: 153 Интродукция бактерий II: 435
Изомеразы I: 177 Интроны I: 550; II: 204
Изомеризация I: 452 Инфекционные болезни II: 319-325
Изопенициллин II: 107 внутрибольничные инфекции II: 321
Изопентилдифосфат I: 196 диагностика возбудителей II: 349-351
Изопреновые спирты I: 189 дыхательных путей, возбудители II: 322
Изопреноидные цепи I: 53 защитные системы хозяина II: 326-329
Изопреноиды I: 195 иммунология II: 325
Изотопный анализ I: 237; II: 236 передающиеся половым путем II: 322
Изоферменты I: 149, 334 персистенция возбудителя II: 334
Изофлавоноиды II: 365 проникновение возбудителя II: 332-334
Изохинолин I: 287 терапия II: 351
Изоцитратдегидрогсназа, фосфорилирование I: 572 Инфекция, взаимодействие возбудитель-хозяин
Иммунизация II: 354 II: 371
Иммунный ответ II: 327-329 Инфракрасное излучение II: 209
Иммуноглобулины II: 327, 341 Инфузории II: 225
Иммунологические методы, использование для учета — метаноген-содержащие II: 253
почвенных бактерий II: 361 — перенос водорода II: 253
— тесты II: 349 Иммуноцитохимия I: 45 Инвазины II: 332-334 Инвазия II: 332 Инверсии I: 442, 548, 463 Инвертированные повторы I: 442 Ингибирование метаболизма II: 352 механизм обратной связи I: 31, 562, 569; II: 123 — роста И: 120 Ингибиторы метаболизма II: 352 Ионные каналы, стресс-реакция II: 124-125 Исключение профага I: 494 — индуктора I: 598, 600 Ископаемые остатки II: 308, 315 Йогурт II: 391
Кадаверин I: 201
— прорастания II: 120 Калий, регуляция тургора II: 139
Индикаторы I: 121 — транспорт II: 133, 135
Индол I. 287 Кальций, роль в регуляции клеточного цикла II: 16
Индолилуксусная кислота II: 373 Каналообразующие белки I: 100, 102
Индукторы I: 524 Каналы, активируемые растяжением II: 125
Индукция II: 87 Канамицин II: 116
Инициаторный белок I 432 Капиины II: 168
Инициация транскрипции I: 456 Капсиды бактериофагов II: 73, 83
критическая масса II: 17 Карбамоилфосфат I: 152, 155, 181
Инозии-б'-монофосфат I: 181 — высокоэнергетический I: 403
Инокуляция, в сельском хозяйстве II 359 Карбамоилфосфатсинтаза I 156, 566
Инсектицидные токсины II: 378-380 Карбоксибиотин I: 403
Инсектициды II: 380-383 Карбоксидисмутаза I: 212
Инсерции I: 463, 515-516 Карбоксилаза I: 209
— генов вирулентности II: 344 Карбоксилирование I: 210
Инсерционные последовательности (IS) I: 34, 423, — анаплсротические реакции I: 302
442-446, 479 Карбоксильные группы, восстановление I: 210
Инсулин II 411-412 Карбоксисомы I: 62-63, 209
Интасомы II: 86 Карбонат кальция II: 272
Интеграция ДНК I: 475 Карбонаты, озера с жесткой водой II: 272
Интегрины II: 333 Карбоновые кислоты в составе буферов I 130
Интегроны II: 353 с разветвленной цепью I: 193
Интеины I 554 Кардиолипин I. 190
Интерлейкины II: 24, 329 Карликовость II: 224-225
Интермедиаты в культуральной жидкости I: 237 Каротиноиды I: 189, 195-196, 408; II: 164
464 Предметный указатель
Катаболизм I: 72
— пути I: 563, 568-570
— синтез ферментов I: 596
— ферменты I: 142-143
Катаболитная репрессия I: 575, 596-603; II: 113, 114
--исключение индуктора I: 598
--регуляция сАМР I: 599-602
--с участием фосфотрансферазной системы
I: 599, 600
Каталаза Г. 329, 343; II: 341
Катехол I: 271, 273
Кворум-сенсинг I: 589, 595; II: 68, 115-117, 302, 371
Кератин I: 255
Кероген И: 276
Кето-3-дезокси-6-фосфоглюкоиат (КДФГ) I: 265-266
Кетолаза I: 375
Кинурениновая кислота I: 274
Кислые среды обитания И: 289-290
Кислород атмосферный II: 200
— в морских осадках II: 244
— включение в клеточные компоненты I: 151
— и получение энергии I: 333-341
— измерение концентрации II: 260
— источники I: 160
— как акцептор электронов I: 333
--косубстрат I: 341
--регуляторный сигнал I: 331
--субстрат II: 211-212
— метаболические функции I: 327-333
— образование I: 327, 418
--радикалов II: 212
— окислительно-восстановительные полуреакции
I: 295
— парциальное давление, эффекты II: 42-48
— потребление I: 327
— при промышленном культивировании II: 390
— реакционноспособные формы I: 325
— реакция бактерий I: 329-331
— световые реакции II: 212
— скорость поглощения I: 124
— таксис I: 622
— токсические формы I: 342-343, 642; II: 326
— триплетный I: 325
— удаление I: 126
— чувствительность бактерий I: 223
Кислородный электрод I: 326
Кислотность среды I: 120-121
--адаптация бактерий II: 132-137
--влияние на клетки I: 122
--измерение II: 260
--контроль при промышленном культивировании
И: 390
--низкая, и выживание бактерий II: 136
Кислотные дожди II: 312
Кислотоустойчивые микроорганизмы II: 284, 289
Клайзена конденсация I: 216, 217
Классификация прокариот I: 32; II: 147-153
---анализ семаитофорных молекул II: 204
---естественная I: 32
---кластеры видов II: 156-161
---комплексный подход II: 201-203
---компьютерные методы И: 157
---ошибочная II: 202
- - по 16S-pPHK II: 165, 199
---с выделением трех царств II: 190-191
---системный подход II: 150-151
---современная II: 154
Кластеризация иерархическая II: 159-160
— неиерархическая II: 160
Кленова фрагмент I: 429, 517
Клетки прокариот, агрегаты I: 46
--визуализация с помощью флуоресцентных
красителей I: 42; И: 226
---включения I: 61-63
---голодание II: 142-143
---компартменты I: 40, 579-585
---лизис I: 118
---в цикле развития фага II: 77
---оболочка I: 48-58
---распознавание партнера I: 65
-- рост I: 117-119; II: 5-6, 115
---синхронные популяции II: 9
---сортировка по возрасту II: 8
---структура I: 40-45, 58-63, 145
---химическая характеристика И: 161-174
---химические маркеры II: 227
---число генов I: 42
---швермерные I: 615
B-Клетки II: 327
Е+-Клетки I: 478
M-Клетки И: 326
T-Клетки II: 327, 330
Клеточная оболочка I: 186, 195
----обратимая модификация I: 476
— поверхность, выросты I: 583
----изменения у патогенных бактерий II: 345
----рецепторы II: 34-36
----сборка II: 21
----электрический заряд II: 238
— стенка I: 41, 48
----архей I: 52; II: 36, 37
----белки II: 21
----грамотрицательных бактерий I: 50-51
----грамположительных бактерий I: 51
----компоненты, гексозамины I: 186
----как таксономические маркеры II: 161-162
----непептидогликанового типа I: 188
----полиолсодержащие II: 28-29
----растительная I: 243
----синтез II: 352
Предметный указатель 465
- - S-слой I: 49-52; II: 36, 341
Клеточное деление. См. Клеточный цикл
Клеточные мембраны I: 94-95
— покровы I: 48-58
— химические маркеры II: 227
T-Клеточные рецепторы II: 329
Клеточный цикл II: 7
---гипотеза нуклеоидной преграды И: 19
---и дифференцировка II: 38, 42, 54
---регуляция II: 9, 15-20
---функция Sec-белка II: 41
Клетта единицы I: 133
Клон II: 114
— бактериофага II: 71, 73
Клонирование ДНК I: 501-505; II: 92
Клубеньковые бактерии I: 26, 342; II: 363-365
Коактиваторы I: 524
Кобаламины II: 399-400
Ковалентная модификация I: 561, 562, 570
Ковалентное связывание I: 508
Ковалентный процессинг белков I: 561-562
Кодоны I: 454, 461, 554-555
— взаимодействие с антикодонами I: 547
— распознавание I: 461
Кожа человека II: 303
Коинтеграты I: 446
Колбаса II: 393
Колинеарность I: 458
Колициногенные факторы I: 477
Колицины I: 441, 583
Количественный учет микроорганизмов I: 135
Коллаген I: 255
Коллагеназа II: 338
Коллективные бактериальные геномы I: 446; II: 438
Колоииеобразующие единицы (КОЕ) I: 132, 134
Колонии бактерий II: 241
— подсчет I: 133
Кометаболизм I: 238, 298; II: 235, 382
Комменсализм II: 248, 321
— ассоциации клеток прокариот I: 47
Компартментация I: 561, 584-585
— и посттрансляционный контроль I: 579
Компетентность I: 473
Комплекс Opp И: 56
Комплемент И: 327
— системы защиты бактерий И: 341
Компост II: 423
Конвекция II: 212-215, 243, 246
Конвергенция II: 154
Конверсионная гипотеза II: 188-190
Конденсация ацетат-малонагных единиц II: 96
Конкатемеры I: 434
Коикатенаты II: 84
Конкуренция I: 29
— бактерий II: 230-233
Консенсусные последовательности I: 452
Консорции II: 248, 254, 266
Консервирование I: 143
Константа аффинности II: 231
— полу насыщения II: 230
— сродства к субстрату I: 138
Контроль эффективности посева I: 134
Конформационая защита I: 224
— супрессия I: 592
Копъюгативные пили I: 482
— транспозоны (CTn) I: 423, 490
Конъюгативный перенос Тп916 I: 492
Конъюгация I: 35, 473, 476-493, 595
— перенос ДНК I: 489-493
---плазмидной ДНК I: 481-490
— прерванная I: 478
— сигнал I: 486
— функция переноса I: 440
— Hfr-штаммы I: 477—479
Конъюгированные производные ферментов II: 157
Кооперация микроорганизмов II: 247-255
Копеподы II: 225
Копиотрофные бактерии II: 223
Копрофагия II: 299
Корепрессор I: 233
Корепрессор-апорепрессор, система регуляции
I: 526, 529
Корневая система, вентиляция II: 282
Корриноиды I: 202
Коррозионные процессы II: 242
Коррозия зданий II: 312
Кортизон, синтез II: 401
Космидные векторы I: 507
Коумермиции I: 432
Кофактор FeMo I: 228
Кофакторы I: 146
Кофермент В12 I: 391-393
— F430 I: 202, 359, 361
- F420 I: 359; И: 288
Коферменты, ароматические соединения I: 173
— синтез I: 129-129
— участие в метаногенезе II: 193
---в биосинтезе II: 99-100
---в деградации I: 236
Коха постулаты I: 23; II: 321
Коэффициент кофенетической корреляции II: 159
— поддержания II: 222
- P/О I: 85
Красные ложа II: 201
Крахмал I: 246; II: 408—410
Криофильные микроорганизмы И: 284
Кротонил-СоА I: 387, 390, 395
Ксантомонадии II: 165
Ксенобиотики I: 289-290; II: 235, 381-382
Ксенология II: 153
466 Предметный указатель
Ксерофилы I: 125; II: 292
Ксиланазы I: 244
Ксиланы I: 243, 247
Культивирование II: 227, 388
— диализное I: 143
— непрерывное I: 137-143; II: 218
— периодическое I: 143
Лаг-фаза роста I: 119
Лазерная конфокальная микроскопия II: 229
Лайиуивера-Берка график I: 99
(3-Лактамаза I: 239
— ингибиторы II: 404
(3-Лактамные антибиотики II: 107, 351-353
Лактат, выделение I: 403
— образование I: 75, 631
Лактатоксидаза I: 327
Лактоза, гидролиз I: 260
— переносчик I: 600
— сенсорная система I: 590
— транспорт I: 97, 103
Лактоферрин II: 339
Ламберта-Бэра закон I: 132
Лантибиотики II: 106
Леваисахараза I: 239
Леггемоглобии I: 224; И: 364
Лед II: 129
Лейкотриены II: 24
Лейкоциты, привлечение II: 327
Лекарственная устойчивость, маркеры II: 361
Лектины И: 304
Лецитиназа И: 337
Лиазы, расщепляющие С~P-связи I: 157
Либиха принцип II: 222
Лигнин, разложение I: 238, 243, 250, 341; II: 210
Лигнинпероксидаза I: 254
— последовательность I: 527
Лидерный пептид I: 523
HFT-Лизаты I: 494
Лизин I: 168; И: 397
— сбраживание I: 396
Лизис клеток. См. Клетки
Лизогения I: 33, 494; И: 77
— механизмы II: 85-89
Лизогенные бактерии I: 33; II: 87
Лизосомы II: 326, 334
Лизофосфатидовые кислоты I: 258
Лизофосфолипиды I: 258
Лизоцим II: 296
Лимнология II: 258
Лимфокины II: 329
Лимфоциты. См. B-Клетки; Т-Клетки
Линкеры I: 509
Линкомицин II: 97
Липазы I: 239, 257
Липид А I: 195; II: 24, 27, 163
Липиды архей I: 197
— биосинтез I: 189-199
— и реакция на внешние факторы I: 194
— и текучесть мембраны II: 129
— клеточной стенки I: 51
— мембран I: 257
— нейтральные I: 195
— перенос через мембрану I: 186
— пигменты II: 164
— плазматической мембраны II: 164
— полярные II: 165-166
— полярные группы I: 189, 195
— участие в сборке полисахаридов II: 32
— простые эфиры II: 166
Липоат I: 80
Липополисахариды I: 30; II: 21, 340
— биосинтез II: 24-28
— как таксономические маркеры II: 162
— липид А II: 163
— R-мутантов II: 24-25
— наружной мембраны I: 49
— олигосахаридный остов II: 24-25
— О-специфический полисахарид И: 24-27
— S-форм II: 24
Липопротеины I: 189, 195, 582; II: 21
— Е. coli II: 32
Липосомы I: 88
Липотейхоевые кислоты I: 51
Листериолизин И: 334
Литоавтотрофия I: 24-25
Литоральная зона II: 260
Литотрофы I: 127; II: 218, 428
Лишайники И: 292
Люминесценция II: 302
— гены I: 343
Люцифераза I: 343
Люциферин-люциферазная реакция И: 427
Магнитосомы I: 62
Магнитотаксические бактерии I: 330, 615; II: 247
Магний И: 116, 214, 315
Макрокапсулы I: 48
Макромолекулы, сборка I: 160
— секреция I: 115
Макрофаги II: 326
Макроэлементы I: 206, 230
Малат I: 288
Малат/лактат-антипорт I: 105
Малил-СоА I: 219
Малонат II: 96
Мальтоза, поглощение I: 109
Манноза I: 261
Предметный указатель 467
Марганец II: 216
Марганец-окисляющие бактерии I: 321-323
Марганецсодержащие пероксидазы I: 252
Марши II: 268
Масляная кислота I: 288
--образование I 379, 385-386
Маслянокислое брожение I: 28
Медермицин И: 406
Медерродин II: 406
Медицина И: 317, 319. См. также Инфекционные
болезни
— направления развития II: 432
Международный кодекс номенклатуры бактерий
II: 204
Межклеточные контакты I: 35, 476-494, 589
Мезелсона-Сталя эксперимент II: 10-12
Мезосомы I: 56
Мезофильные бактерии I: 123
Мел. См. Карбонат кальция
Меланины II: 97
Мелибиоза I: 260
Мембранные фильтры I: 134
Мембранный потенциал, у алкалифилов II 136
Мембраны, атипичные компоненты II: 167
— белки I: 94
— биогенез II: 21
— и дифференцировка II: 42-48
— сайты адгезии II: 28
- структура I: 186-189
— транспорт протонов 1: 87
— электрическая емкость I: 87
Менахин I: 415
Менахинон I: 92, 173
Менахиноны как таксономические маркеры II: 169
Мерогенота I: 478
Меродиплоиды I: 450
Местообитания прокариот I: 119-120; II: 208, 257
— водные II: 257-273
— почва II: 276-283
— термофилов II 285
Метабиоз И: 248
Метаболизм избытка II. 142
Метаболическая инженерия II: 387
Метаболический коэффициент I: 142
Металимнион II: 259
Металлопротеазы I: 583
Металлсодержащие тетрапирролы I: 202
Металлы, окисление бактериями I: 305
— окислительно-восстановительные полуреакции
I: 295
— прикрепление к поверхности II: 242
— транспорт с участием антибиотиков II: 118
Метан I: 284
— анаэробное окисление II: 219, 275
— атмосферный И: 297, 309
— аэробное окисление II: 264
— биогенного происхождения II: 308
— и очистка сточных вод II: 419, 423
— образование I: 293, 358-363; II: 216, 252.
См. также Метаногенез
--в кишечнике человека II 298
--рисовые поля II: 282
--Рубец жвачных И: 295
--термиты II: 300
--тундры II: 282
— окисление I: 293; И: 219
— разложение II: 309
Метанмонооксигеназа I: 316
Метаногенез, археи I: 359
— в осадках II: 282
— и получение энергии I: 363
— и синтрофные бактерии I: 401
— коферменты I: 359; II: 193
— путь углерода I: 360
— участие фактора F430 II: 170
Метаногены II: 161, 216, 249
— конкуренция с сульфатредукторами I: 366
— кооперативное действие II’ 248
— кооперация с простейшими II: 253
— межвидовой перепое водорода II: 251
— симбиотические II: 253
— эндосимбионты II: 253
Метанокисляющие бактерии II: 235, 301
Метанол I: 356
Метанотрофы I: 293
Метанохондроитин II: 162
Метахроматические гранулы I: 29
Метилакцептирующие рецепторы хемотаксиса I: 575
Метил-ЩМП I: 362
Метилазы I: 500
Метиламин I: 285
Метиласпартатный путь Г. 395
Метилглиоксаль I: 253; II: 135
Метилглюкозамин II: 110
Метилентетрагидрофолат I: 182
Метилирование I: 570, 575
- dam I: 444, 469-470; II: 12, 347
Метилмалонат И: 96
Метилмалонил-СоА I: 164, 287
Метилмеркаптан II: 314
Метиловый красный I: 122
Метилотрофные бактерии I: 219-222, 284; И: 388
Метилпентозы I: 262
Метилтетрагидрофолат I: 356
Метилцитозины I: 470
Метильная группа, перенос I: 403
Метионин I: 168, 169
Метод наиболее вероятного числа I: 134; II: 227
— определения полиморфизма длины рестрикцион-
ных фрагментов (ПДРФ) II: 175, 350, 362
468 Предметный указатель
— попарного группирования с певзвешенпым
средним II: 159
— ПЦР модифицированный II: 362
— разведений I: 137
— рекомбинантной ДНК I: 503; II: 386, 406, 430
----и получение вакцин II: 413
— экспрессии in vivo II: 356
— элюции с мембраны II: 8
- ARDRA II: 175, 176
- BRENDA II: 175
Методы выделения чистых культур 1: 136
Микобациллин II: 120
Миколовые кислоты I: 52; И: 164
Микориза II: 305
Микроаэробные бактерии I: 329-333
— местообитания I: 329
Микроаэрофилы I: 123
— пути ассимиляции СО2 I: 214-217
Микробная петля II: 262, 264
Микробное выщелачивание I: 306
Микробные маты I: 312; II: 268
— популяции И: 226-230
Микробный белок I: 284; II: 388
Микрокапсулы I: 48
Микроорганизмы, кооперация II: 247-255
— почвенные II: 279
— совместное разложение субстратов I: 236
Микроскопия I 42-45
Микроскопы I: 19, 66-67
— конфокальный лазерный сканирующий
микроскоп I: 43; II: 229
Микрофлора II: 208
— кишечника человека II: 297-299
— кожи человека II: 303
— на листьях растений II: 304
Микроэлементы Г 128-129, 230-235
Миксобактерии, хищничество II: 117
Миксоспоры II. 67, 224
Миксотрофный рост I: 208, 298, 311-313
Мимикрия II: 342
Минерализация I: 31; II: 307-311
Мини-клетки, лишенные ДНК II: 15
Мини-хромосомы И: 10, 17
Минимальная ингибирующая концентрация II: 352
Миссеис-мутации I 462
Михаэлиса-Ментен уравнение I: 99; И: 231
Мицелий воздушный II: 63
Миогоклеточиость II: 69
Множественная лекарственная устойчивость I: ПО,
443; II: 336
Множественность инфицирования II: 73
Модели регуляции I: 31
Модель с разведением ингибитора II: 16
Модулон(-ы) I: 520, 527, 559, 594
— строгого/слабого контроля I: 591
- RelA/SpoT I: 603-608
— arc I: 641
- ArcA I: 631, 632
— ccpA I: 602
- сгр I: 587, 598
- fnr I: 630-632
— NarL и NarP I: 637
— pho I 157
- soxS I: 642
Молибдат, и регуляция анаэробного дыхания I: 636
Молибден I: 225
— как кофактор I: 234, 637
Молибденсодержащие ферменты I: 351
Молибдоптерин I: 350, 360
Молоко, сбраживание II: 391
Молочная кислота И: 317
— образование при брожении II 391-393
Молочнокислые бактерии I: 329; II: 392
--на коже человека II: 303
Молочные продукты II: 391-392
Монепзин А II: 105
Моно уравнение I: 138
Моноклональные антитела II: 328
Монооксигеназы I: 276, 298, 328, 341
Монооксид углерода, дегидрогеназа. См. Ацетил-
СоА-синтаза
--окисление бактериями I: 320-321
--цикл II: 310-311
Мопотерпепоиды I: 283
Моноциты II: 326
Морская вода, содержание серы II: 312
Морские осадки, диффузия кислорода II: 244
— прокариоты I: 125
Морской снег II: 263
Морфогенез II: 5
Морфологическая дифференцировка II: 95
Морфопоэз II: 5, 40, 82
Мочевая кислота II: 311
Мочевина II: 311
Мультибелковые комплексы, сборка II: 131
Мультигенныс семейства, регуляция I: 595
Мурамовая кислота II: 29, 161
Муреин I: 147, 186; II: 21
Мутагенез I: 463-466
— адаптивная реакция I: 471
— кассетный I: 516
— локализованный I: 467, 514-518
— непрямой I: 466, 471
— сайт-направлепный I: 511; II: 355
Мутагены I: 464, 465
Мутазы I: 177
Мутанты I: 34
— выделение I: 467
— и бактериофаги I: 448
— изучение I: 238
Предметный указатель 469
— селекция I: 462-467
— скрининг I: 468
— условно-летальные I: 468
— утрата функций II: 13
- bld II: 64-65
— су а А I: 598
- fts II: 15
- Par” II: 13
— rel I: 591
— relA I: 606-608
- Ts II: 18
— whi II: 64
Мутагорные штаммы I: 464
Мутации, амплификации I: 442
— генов вирулентности [I: 344
— горячие точки I: 464
— делеции I: 464
— жизненно важных генов I: 468
— инсерции I: 464, 517
— использование в генетике бактерий I: 467
— классификация I: 462
— миссенс I: 462
— молчащие I: 462
— направленные I: 514
— нейтральные I: 462
— нонсенс I: 464
— по второму сайту I: 463
— случайный характер I: 464
— со сдвигом рамки I: 463
— точковые I: 462-463
--и устойчивость к антибиотикам II: 353
— хромосомные I: 463
- bof II: 59
— spo I: 608
Накопительные культуры I: 23, 136-137; II: 360
Налидиксовая кислота I: 432
Наружная мембрана I: 50-51; II: 32, 163
--область R II: 164
Натриевые каналы II: 134
Натрий, транспорт ионов I: ПО
— цикл ионов II: 133-134
Нейраминидаза II: 339
Нейротоксины II: 335
Нейтрализм I: 47
Нейтрофилы I: 121; II: 132, 134-136
Нектар II: 304
Некультивируемые формы II: 350, 361
Нематоды II: 225, 301-303
Неорганическая сера как субстрат II: 213
Неорганические вещества, восстановление I: 293
--необходимые для роста I: 127, 128
--окисление I: 24-25, 293-297
Нефелометрия I: 133
Нефтяное загрязнение II: 425
Низин II: 106
Никотинамиддинуклеотид (NAD) I: 77, 78, 85, 300,
302, 568
— восстановление I: 302
— зависимые реакции восстановления I: 162
Никотинамиддинуклеотидфосфат (NADP) I: 79
— восстановленный, NADPH I: 160-162, 177
Никотиновая кислота I: 399; II: 99
Нитрат, анаэробное дыхание I: 333, 346, 635
— восстановление I: 222, 346, 358; II: 213, 215
— и цветение воды I: 317
Питратредуктаза I: 347, 351
Нитратредукция. См. Нитрат, восстановление
Нитрит II: 213, 215
— восстановление I: 222, 301
— как акцептор электронов I: 635
— как донор электронов I: 339
— окисление I: 314
— участие в дыхании I: 347-352
Нитритредуктазы I: 350
— регуляция I: 637
Нитрификация I: 31, 348
— в почве II: 281
— гетеротрофная I: 315
Нитрифицирующие бактерии I: 314-317
Нитрогруппа, образование II: 97
Нитроароматические соединения II: 220
Нитробактерии I: 315
Нитрогеназа I: 223-226, 342, 634; II: 311, 367
— система защиты от кислорода II: 255
Номенклатура прокариот II: 151, 154
Нонил продигинип II: 165
Нонсенс-мутации I: 463
Нуклеиновые кислоты I: 286.
См. также ДНК; РНК
--азотистые основания I: 178, 182
--и вакцины II: 355
--профили II: 174-177
--синтез II: 352
Нуклеозиддифосфат I: 178, 184
Нуклеозиддифосфатсахара I: 175, 184
Нуклеозидмонофосфат I: 179, 183
Нуклеозидтрифосфаты I: 178
Нуклеозиды I: 179, 182, 262
Нуклеоид I: 40, 437; II: 13, 81
— динамика структуры I: 61
— организация I: 58-61
— процессинг II: 13
Нуклеопротеин RecA I: 471, 497 498
Нуклеотиды I: 145, 161. См. также Строительные
блоки
Нумерическая таксономия II: 156
--ошибка метода II: 158
470 Предметный указатель
Обратная генетика I: 593
— гираза II: 287
— транскриптаза I: 451; II: 413
— транскрипция I: 447
Общие регуляторные сети I: 520, 587-596
----иерархия компонентов I: 594-596
----методы идентификации I: 591-594
Озера II: 257
— амиктические II: 259
— аталассогалинные II: 291-292
|— димиктические II: 259
— дистрофные II: 26 Д 266
|— гиперэвтрофные II: 261
— гиполимнион II: 259
— меромиктические II: 260
— монолимнион II: 260
— мопомиктические И: 259
— пелагиаль II: 260
— образование метана II: 309
— олиготрофные И: 263, 274
— осадки И: 271
— продуктивность И: 261
— с жесткой водой II: 259
— с мягкой водой II: 259
— соленые II: 291
— талассогалинные И: 291
— эвтрофные II: 261, 274
--фаза раздела аэробные/анаэробные условия
И: 264
--цикл фосфата И: 275
Океаны II: 266-269
— баланс фотосинтез/минерализация II: 308
— насыщение воды кислородом II: 267
— прибрежные районы II: 268
— продуктивность II: 261
Окислительно-восстановительные процессы
II: 215-219
— реакции у хемолитотрофов I: 295
Окислительно-восстановительный потенциал I: 84,
125, 296, 352, 368, 637; И: 214, 214, 220, 274
Окислительное фосфорилирование I: 84
Окислительные процессы в осадках 11:274
Окислительный пентозофосфатный цикл I: 212, 266
- стресс I: 343, 641, 642; II: 130
Окрашивание по Граму I: 42
Оксалат I; 289, 403
Оксалат/формиат, система антипорта I: 114
Оксалоацетат I: 168, 383
Оксалоацетатный путь I: 288
Оксигеназы I: 274, 328, 332
Оксидазный тест I: 334
Оксидазы I: 328, 335
Оксидоредуктазы I: 335
Оксистат I: 325
Оксоадипииовый путь Г. 274
Оксоглутарат I: 166, 331
Оксо-З-дезоксиоктоновая кислота (ОДО) II 25
Оксокислоты (кетокислоты) I; 193, 291, 389
Олигонуклеотиды I: 514
— как ДНК-зонды I: 593; II: 176
Олигопептиды II: 96
Олигосахариды I: 260
— в составе липополисахаридов II: 24-27
— транспорт через мембрану I: 195
Олиготрофные бактерии II: 223
Оператор I: 524, 529, 594
Операционные таксономические единицы II: 157-160
Оперон(-ы) I: 31, 520, 559, 586
— генов вирулентности II: 346
--фотосинтеза И: 44
— компоненты I: 522-526
— котранскрипция цистронов I: 448
— объединение в модулон I: 586
— определение I: 594
— полярные эффекты экспрессии I: 542
— рибосомных (R) белков I: 551
— синтеза аминокислот I: 543, 553
— транскрипционные единицы I: 451
— функции I: 522
— экспрессия I: 607
— araBAD I: 530, 531
- deo I: 530-531, 538
— erm I; 552
— fim II: 344
- galETKM 1. 530, 531, 543
— his I: 174
- lac I: 450, 528, 587, 590, 591
- lacl I: 450
- pfl I: 631, 638
— pif I: 480
— puf II: 44
— pyrBI I: 543-545
— spoIIA II: 57
— spoIIG II; 57
— spoIVFB II: 59
— tra I: 491
— trp I: 174, 529
- pap II. 346-347
Опины II: 375
Оппортунистические инфекции II: 320
Опсонизация II: 326
Опсонины И: 327
Оптическая плотность I: 132
Органические кислоты I: 287
— растворители II: 424
— субстраты II: 210-212
--окисление I: 236
----неполное I: 291
Органическое вещество почвы II: 276
Органотрофы I: 127
Предметный указатель 471
Оротат I: 181, 399
Ортология II: 153
Ортофосфат I: 228
Осадки донные И: 271-276
---метаногенез II: 252, 282
---микробная минерализация II: 273
---микробные метаболиты II: 275
---питательные вещества II: 261
---пресноводные II: 252
---сульфатредукция II: 275
Осадочные породы II: 272
Осморегуляция I: 612; II: 137-140
Осмотаксис I: 615
Осмотический стресс II: 137-141
— шок I: ПО
Осмотическое давление I: 124
Осмофилы I: 124
Острова патогенности I: 423; II: 343
Ответные реакции II: 5
— регуляторы I: 608-611
Открытые рамки считывания I: 454, 467
Охлаждение I: 123
Палеохимическая летопись И: 199
Память бактерий I: 622
— клеточная II: 327
Памамицин II: 63, 120
Папоротники Azolla II: 369-370
Паразитизм II: 321
— в ассоциациях прокариот I: 47
Паразитические бактерии I: 127, 441; П: 332
Паралогия II: 153
Паратион II: 381
Парниковый эффект II: 309
Пастеризация I: 132
Патогенность II: 321, 346, 371
Патогенные бактерии II: 371-376
---взаимодействие с организмом-хозяином II: 372
---внедрение II: 340
---внутриклеточно локализующиеся II: 333-334
---возбудители желудочно-кишечных инфекций
И: 322
---респираторных инфекций II: 322
---ворота инфекции II: 326
---диагностика И: 349-351
---изменчивость II: 323
---имитация структур хозяина II: 341
---классические II: 320-320
---круг хозяев И: 372
---локализация II: 322
---облигатные II: 320
---перенос членистоногими II: 323
---смена поверхностных структур И: 345
---способы изучения II: 324
--устойчивость к антибиотикам II: 352-354
--к защитным системам хозяина И: 340, 342
--факультативные II: 320
--экология II: 356
— ксантомонады И: 372
— псевдомонады II: 373-378
Патогенный потенциал II: 350
Пектиназа I: 249
Пектин-лиаза I: 249
Пектин, пути расщепления I: 249
Пенициллин I: 28; II: 23, 107-108
Пенициллинацилаза II: 407
Пентитолы I: 261
Пентозофосфатный цикл I: 149, 163, 175
Пентозофосфаты I: 177
Пентозы I: 261-262
Пептидилтрансфераза I: 458
Пептидогликан I: 186; II: 161
— сборка II: 21-37
Пептиды синтетические II: 355
Первичная продукция II: 264, 307
— хемоавтотрофы I: 209
Передача сигнала I: 614
Перекрестная регуляция I: 611
Перенос ацильных цепей I: 191, 193
— веществ через мембрану. См. Транспорт
— нуклеотидных остатков I: 161, 175, 178
Переносчик ABC I: 158; II: 28
Периодическая культура I: 118, 143
Периплазматические фибриллы I: 65
Периплазматический гель I: 51
Перисепталыюе кольцо II: 14, 21
Периферический метаболизм I: 271, 277
Пермеаза лактозы I: 97, 105-107
Пермеазы I: 94
Пермутация циклическая II: 84
Пероксид водорода I: 325, 641
Пероксидазы I: 252, 343
Перта уравнение I: 141
Перхлорэтен I: 367
Петри чашка I: 18
Пигменты I: 43, 406; И: 164
— фотосинтетические. См. Светособирающие
системы
Пили I: 65, 441; II: 41
— конъюгативные I: 482
— НР4-специфические I: 483
— экспрессия генов II: 41
— Caulobacter И: 38, 41
- F I: 483
Пиоцианип I: 43
Пиридин ну клеотид-зависимая оксидоредуктаза
I: 162
Пиридиннуклеотиды, окислительно-восстановительные
•полуреакции I: 295
472 Предметный указатель
Пиридины, деградация I: 287
Пиридоксаль, деградация I: 287
Пиридоксальфосфат I: 165
Пиридоксамин I: 287
Пиридоксин I: 287
Пиримидины I: 286
— в составе нуклеиновых кислот I: 399, 426
— и контроль аттенуации I: 545
— и модификация нуклеотидов II: 99
— рибонуклеотиды I: 181
— сбраживание I: 399
— синтез I: 341
--регуляция I: 181
--роль карбамоилфосфата I: 566
— фотоипдуцированные димеры I: 470
Пирит I: 321; II: 213, 289, 312, 428
— образование И: 200
Пиролизная масс-спектрометрия И: 171
Пирофосфат I: 157, 161, 174, 178
Пиррольное кольцо, образование I: 202
Пируват I: 73, 169, 383
— интермедиат брожения I: 375
— окисление I: 80, 259
— предшественник аминокислот I: 168-169
— реакции расщепления I: 631-632
Пируватдегидрогеназа I: 80
— подавление синтеза I: 331
Пируваткиназная реакция I: 375
Пируват:формиат-лиаза I: 332, 382, 383, 631, 638
Пируват:фосфат-дикиназа I: 164
Питание I: 117
Питательные вещества I: 127-131. См. также
Субстраты
--в осадках II: 261
--и общие регуляторные сети I: 588
--исчерпание, и инициация споруляции И: 55
--недостаток II: 142
- среды I: 22, 127-131; II: 148-149
--минимальные I: 130
--неопределенного состава I: 130
--плотные I: 22
--селективные I: 136
--сложные I: 130
--стерилизация I: 131
--pH I: 120-123
Питьевая вода II: 424
Пищеварение у человека, микробная активность
II: 297-299
Пищевая цепь анаэробная II: 248
Пищевые продукты II: 318, 359, 391-393
Плазматическая мембрана I: 40, 48, 53-58, 94-95
--аппарат дыхания I: 336; II: 42
--ионные каналы II: 125
--липиды И: 164
--перенос белков I: 581; II: 131
--проницаемость II: 132
--таксономические маркеры II: 164-167
--термофилов II: 287
Плазмида(-ы) I: 34, 432, 437-441, 476, 519
— бактериоциногенные I: 441
— векторы I: 504-506
— генетическая информация I: 447
— гены ssb I: 488
— гибель клеток I: 439
— деградативные I: 441
— и образование антибиотиков I: 440
— как векторы экспрессии I: 509
— коиыогативные I: 478; II: 353
— круг хозяев I: 439
— медицинское значение I: 440-441
— мобилизуемые I: 476, 480
— модули I: 440
— несовместимость I: 439
— номенклатура I: 437
— область переноса I: 482
— паразитические I: 441
— F-подобные I: 478
— полу трансмиссивные I: 480
— производные I: 504
— размеры II: 10
— репликация I: 438-440; II: 10, 13
— сайт-специфическая рекомбинация I: 439
— сверхспиральность I: 487
— семейство pUC I: 506
— системы сродства I: 439
--распределения Г. 439-440
— устойчивости к антибиотикам I: 440; II: 353
— фингерпринты И: 174, 176, 350
— хелперная oriT I: 480
— хслперные функции I: 480
— число копий I: 438-440
— эффект противоядия I: 439
— ColEl-типа I: 438, 441
- F I: 477-478
- IncP I: 479-480, 489
- pGOl I: 489
- R100 I: 440
- R I: 440, 477-479, 504
- Ti I: 441; II: 375-376
Плазминоген, активатор II: 410
Пластохиноны как таксономические маркеры II: 169
Пластоцианин :ферредоксин-оксидоредуктаза I: 419
Плеоморфизм I: 21
Плодовые тела I: 585
Плотность популяции, регуляторные эффекты.
См. Кворум-сенсинг
Поверхностно-активные вещества I: 257, 281
Поверхностное исключение I: 484
Поверхностные взаимодействия II: 238
Поверхностный стресс II: 137
Предметный указатель 473
Поверхность клеток. См. Клеточная поверхность
Поглощение ионов I: 230-235
— микроэлементов I: 230-235
— света I: 132
Подвижность I: 30, 595
Подсчет бактерий в почве И: 361
— живых клеток I: 134
— клеток под микроскопом II: 226
Покоящееся состояние И: 142
Покоящиеся клетки I: 28
Поли-/3-гидроксимасляная кислота I: 29, 320
Полиамины I: 201
— буферная способность И: 133
— как таксономические маркеры II: 170
— термофилов II: 287
Полигидроксиалканоаты I: 199-200, 241, 320
Полиглюкоза I: 199, 241
Полиизопреноиды I: 197
Поликетиды И: 102-105
Поликетометилен II: 101-105
Полимеразная цепная реакция I: 516; II: 229
Полимиксин М II: 119
Полиморфноядерные гранулоциты II: 326
Полиоксин II: 100
Полиолы I: 281
Полипептидные цепи, расщепление I: 255
Полисахариды I: 29
— архей I: 52
— внеклеточные II: 372, 374
— гранул I: 63
- капсул I: 49; II: 21, 30-31, 340-341
— клеточной стенки I: 188
сборка II: 32
— О-специфические II: 24-28
Полисомы I: 58, 451, 455; II: 131
Полисульфиды I: 353
Политионаты I: 310
Полифосфаты I: 63, 200, 200, 241
Полихлорированные бифенилы II: 382
Полицеллюлосомы I: 245
Полиэфиры ионофорные II: 103
Половые пили I: 482
— феромоны I: 66, 489
Положительный контроль I: 531-535
Полуметилирование I: 445, 470, 500, 540
Полунепрерывная культура I: 143
Полюса клетки, дифференциация II: 38
Полярность I: 450
— естественная I: 542
— мутационная I: 542
Популяционный эффект II: 117. См. также
Кворум-сенсинг
Порины I: 50, 232; II: 33
— мальтозоспецифические I: ПО
— транспортная функция I: 102
Порообразующие токсины II: 336
Порфирины, таксономическое значение II: 170
Посевной материал I: 136
Последовательности CCTAGG I: 470
- СТТСТ II: 345
Постсинаптические реакции I: 496, 498
Посттрансляционный контроль I: 561-562, 576-585
— процессинг I: 570-579
Почва II: 276-283
— биовосстановление II: 318, 424-427
— биодеградация загрязнений И: 380-383
— восстановление II: 424
— гидроморфная II: 305
— метод фумигации II: 227
— минеральные компоненты II: 277
— подкисление I: 317
— способы очистки II: 425
— улучшение II: 359
— фиксация азота II: 281
Почвенные бактерии II: 304-305
--биохимические методы учета II: 361
--мониторинг II: 360-362
Почкование I: 45; II: 224
Праймазы I: 430
Праймер I: 508, 518
Праймосомы I: 433
Пре-белки I: 580
Предспора II: 55
Пренильные единицы I: 196
Пресинаптические реакции I: 496
Пресноводные местообитания II: 257
Префенат I: 171
Прикрепительная пята I: 48; II: 38
Прикрепление к поверхности II: 237-238
--биопленки II: 240
--металлы II: 242
--устойчивость к дезинфектантам II: 239
Прогенот И: 192-193, 203
Прогестерон II: 401
Продигиозин II: 118
Продуктивность водоемов II: 260
Прокариоты I: 33. См. также Бактерии;
Классификация прокариот;
Микроорганизмы
— ассоциации I: 45-48
— определение вида И: 148
— молекулярные отличия от эукариот II: 189
— оксигенные II: 200
— разнообразие II: 148
— структурные особенности I: 40
Пролин I: 270, 389; II: 138
— биосинтез I: 166
— поглощение I: 113
— ферменты метаболизма I: 529
Промотор PR I: 536
Промоторы I: 451-452, 523, 526-527,
540, 547
Промышленное культивирование, источник
углерода II: 389
---компьютерный контроль И: 390-391
I— производство II: 385-386
---аминокислот II: 395-398
---биореакторы II: 388
---витаминов II: 399-400
---гетерологичных белов II: 411-414
---массовое культивирование II: 388-391
---пищевые технологии II: 391
---разработки II; 434-436
---селекция штаммов И: 387
---стероидных гормонов II: 401
---управление процессом II: 390
---ферментов II: 407-410
Пропандиол I: 384
Пропионат I: 287, 383, 396
Пропионил-СоА I: 280
Пропионовокислые бактерии I: 164
Простагландины II: 24
Простейшие II: 253-254, 296
Простеки. См. Стебельки
Простековые (стебельковые) бактерии II: 38
Протеаза Clp I: 578
— Lon I: 576
Протеазы I: 239, 255
— как факторы вирулентности I: 256
— промышленное использование II: 410
Протеолиз I: 570, 579
— генных продуктов I: 555
Протеолитический процессинг I: 576-579
Протокатехат I: 271, 356
Протондвижущая сила I: 88, 103, 161, 297, 416
---генерация у анаэробов I: 350
---и аэробное дыхание I: 336
---и окисление водорода I: 299
---как сопрягающий агент I: 385
---создаваемая транспортом электронов I: 92
Протонная помпа I: 299-300
---светозависимая I: 419-420
Протонные помпы I: 336
Протонный электрохимический потенциал.
См. Протондвижущая сила
Протоны, восстановление синтрофными бактериями
I: 402; II: 217
— сопряженный перенос I: 92
— транспорт I: 86
— циркуляция II: 133
Протопорфирин I: 203
Прототрофы I: 127, 467
Проточная цитометрия II: 8, 9
Профаг II: 77, 85
Псевдомуреин I: 52, 186; II: 162
Психротолерантные микроорганизмы
I: 122; II: 284, 288
Психрофилы I: 122; II: 284, 288
Птерин, переносчик молибдена I: 320
Птерины I: 359
Пуассона распределение I: 134
Пуллулан I: 246
Пуллуланаза I: 239, 247, 583
Пуринрибонуклеотиды I: 179
Пурины I: 286, 399, 426
- модификация II: 99
Пурпурные бактерии I: 21, 25; II: 266
---внутрицитоплазматические мембраны I: 55
---спектры поглощения II: 265
---фиксация азота I: 27
---фотосинтез I: 409-418
---фотосинтетический аппарат I: 410-411
— мембраны I: 53-54
Путресцин I: 201
Радиоавтография II: 226
Радиоиммуноанализ II: 362
Радиореспиромстрия I: 176
Разложение органических соединений I: 236-237
---анаэробное II: 309
---внеклеточные этапы I: 238
---неполное I: 291
---очистка сточных вод II: 416-420
— древесины II: 299-301
Рапидосомы I: 61
Растворенное органическое вещество II: 211, 263-267
Растворимые клеточные компоненты I: 201-203; II: 294
— совместимые осморегуляторные вещества
И: 137-141
Растения, повышение устойчивости И: 376-380
— стимуляция роста II: 376, 377, 380
Расхождение хромосом II: 13
Реактор анаэробной очистки сточных вод II: 422
Реакция гемагглютинации II: 331
— гиперчувствительности II: 371
Реверсия I: 463
Регулон(-ы) I: 520-529, 559, 586, 596
— генов вирулентности II: 346
— bio I: 529
- glp I: 587
— kil-kor I: 480
— tyrR I: 174
Регуляторные белки I: 536; II: 346
— двухкомпонентные системы I: 608-614
— ответные реакции I: 604; II: 143
— последовательности I: 448
— сети II: 44-45
Регуляторный белок I: 571
— сигнал I: 331-333
Предметный указатель 475
— элемент II: 126
Регуляция анаболизма I: 567
— ДНК-связывающие белки I: 556-558
— на уровне транскрипции, дифференцировка
гетероцист II: 51
— Ada-метилирование I: 534
— механизм репрессия/индукция I: 524, 528
— популяционные эффекты. См. Кворум-сенсинг
— spoO-путь II: 56
— строгий ответ I: 604
— численности бактерий, озера II: 263
Редуктаза Fe(III) I: 354
Редуктазы I: 335
Редфилда соотношение II: 214; 260
Резол ьваза I: 445
Резорцинол I: 278
Рекомбинантные белки II: 435
Рекомбинация I: 442, 448, 473-475, 494-498,
549; И: 85, 86, 87, 91
— Кэмпбелла II: 87
— сайт-специфическая I: 494
Релаксаза I: 481
Релаксосомы I: 480, 485
Репарация ошибок спаривания оснований I: 470
Репелленты I: 617
Репликационная вилка I: 435
Репликация ДНК I: 430-435; II: 9, 11, 19
--инерционная II: 11
--методы изучения II: 10
--механизм катящегося кольца I: 434
— плазмид I: 439
— хромосом II: 39
--инициация II: 11, 18
--превращения нуклеоида II: 13-14
Репликоны I: 432-440; II: 16
— слияние I: 442
Реплисомы I: 423; II: 11-12
Репортерные гены I: 239
Репрессоры I: 233, 524, 526, 529; II: 87
- CI II: 88-89, 536
- СП II: 90
- CytR I: 538
- LacI I: 509, 528, 587-591
— Lex A I: 578
Рестриктаза EcoRl I: 503
Рестрикции/модификации системы I: 441, 498-501
Рестрикционные фрагменты ДНК I: 504
Рестрикционный анализ рДНК II: 434
Рестрикция использования кодонов I: 554
Рестрицирующие эндонуклеазы I: 500, 503
Ретикулярные тельца I: 48
Ретиналь I: 419, 624
Ретрорегуляция II: 89
Реутилизация I: 182
Рецептор сигнала I: 609
Рецепторы комплемента II: 327
Рибитол И: 29
Рибитолфосфат II: 28
Рибозо-5-фосфат I: 184
Рибонуклеиновая кислота. См. РНК
Рибонуклеотиды I: 178
Рибосомный белок I: 576
Рибосомы I: 40, 59, 437, 455
— A-сайт I: 458
— сдвиг рамки считывания I: 553
— синтез белка I: 457-458, 603
— 308-субъединица I: 456
— 708-субъединица II: 352
Риботипирование II: 176
Рибулозо-1,5-бисфосфат-карбоксилаза I: 211
Рибулозомонофосфатный цикл I: 220
Ризобии II: 364
— регуляторные белки II: 367
Ризосфера II: 304, 359
Риса растения II: 305
Рисовые поля II: 282
Рифамицин В II: 104
РНК I: 256
— антисмысловая I: 551
— вирусный геном I: 447
— действие метилазы I; 553
— и регуляция метаболизма I: 549
— ингибирование синтеза I: 607
— лидерная I: 523
— матричная (мРНК) I: 424, 451-452
--вторичная структура I: 457
--период полу жизни I: 454, 507
--полицистропная I: 448
--процессинг у бактериофагов I: 549
--расщепление эндонуклеазами I: 454
--сплайсинг I: 550
--стабилизация I: 454
--стабильность II: 45
--транскрипция I: 448
--трансляция I: 447, 448, 550
— праймеры I: 430, 434
— профили II: 176
— процессинг I: 549
— синтез I: 451-454
— структура I: 544-547
- 16S II: 199-200, 228
РНКаза III I: 549
- Е I: 454
- HI: 508
РНК-полимераза I: 423-424, 437, 451
— активность I: 541-545
— инициация транскрипции I: 527
— сигма-субъединицы I: 451-452, 541; II: 52, 127-127
— стимуляция активности I: 532
— структурные изменения II: 127
476 Предметный указатель
рРНК I: 549; II: 179-184, 228
— специфические последовательности II: 350
тРНК I: 451, 458, 460, 549
тРНК-синтетаза I: 455, 462
Родопсины галобактерий I: 624
Родохинопы, таксономическое значение II: 169
Рост I: 117-119. См. также Скорость роста
— анаэробы I: 125
— диауксический I: 115, 119
— динамика I: 119; II: 222
— емкость II: 222
— и активность воды I: 124
— и потребность в аминокислотах I: 129
--в витаминах I: 129
--в минеральных веществах
I: 128-129
--в полиаминах I: 201
— и осмотическое давление I: 124
— измерение I: 132-135
— ингибиторы I. 144
— кинетики в природных экосистемах II: 222-230
— линейный I: 119
— метаболические показатели I: 133
— непрерывная культура II: 185-187, 222
- периодическая культура II: 222
— сбалансированный I: 117-118
— скорость II: 9
— стационарная фаза I: 118
— фазы I: 117-119
— физико-химические факторы I: 119-126
Рубец жвачных, микрофлора II: 294-297
Рубредоксин I: 282
Сагамицин II: 110
Самовозгорание II: 423
Саузерн-блоттинг II: 350
Сахара активированные, транспорт на акцепторы
I: 186
— взаимопревращения I: 185
— пути деградации I: 267
— синтез I: 184-188
--нуклеотидов I: 184-188
— фосфорилированные I: 175-178
--пути деградации I: 371-375
Свертывание крови II: 410
Сверхрепликация II: 19
Свет как экологический фактор II: 209, 260
— и образование кислородных радикалов И: 212
— интенсивность И: 42-48
— использование прокариотами I: 127, 405-421
— квант I: 93
— освещенность в водоемах II: 260
— поглощение I: 132
--фикобилисомами I: 418
— рассеяние I: 132
—--эмиссия при биолюминесценции I: 343
Светозависимая протонная помпа I: 419
Светопреломляющие тельца I: 61
Светорассеяние, синий свет II: 210
Светособирающие антенны I: 410-413
реакционного центра I типа I: 415-416
реакционного центра II типа I: 413
у зеленых бактерий I: 412-413
функции II: 43
— системы I: 55, 406-411; II: 48
--фотосинтетические пигменты I: 406
Светящиеся бактерии I: 343
Свободная энергия, изменение I: 75, 77
--окислительно-восстановительные реакции
II: 217
Секвенирование ДНК I 512, 514
Секреция I: 580-583
— экзоферментов I: 240
Сексдукция I: 478
Селективные среды I: 136
Селекция мутантов I: 468
— сине-белая I: 506
Селен, ассимиляция I: 233
Селенат II: 220
Селенид I: 234
Селенит II: 220
Сел енол I: 234
Селеноцистеин I: 235, 461, 634
Ссленсодержащие белки I: 234
Селитра I: 317
Сельское хозяйство II: 317, 359, 432
Семантиды II: 155
Ссмантофорные молекулы II: 193
Сенсор ArcB I; 638-640
Сенсорные родопсины I: 624
— системы Г. 590
Сенсоры I: 608-611, 619
Септический шок II: 340
Сера I: 242
— ассимиляция I: 230
— в горячих источниках И: 285
— включение в клеточные компоненты I: 151,
157-159
— восстановленные соединения II: 265
--пути окисления I: 308-311
— источники I: 229-230
— как акцептор электронов II: 216
- молекулярная I: 158, 310, 353; II: 213
— переносчики I: 157, 158
- синтез метаболитов-предшественников I: 151
— синтрофное потребление II: 254, 255
— участие в дыхании I: 353-354
— цикл I: 305
Серин, деградация I: 271
Предметный указатель 477
— декарбоксилирование I: 193
— сбраживание I: 394
— синтез I: 171
Сериновые протеазы II: 410
— протеинкиназы I: 572—575
Сериновый путь I: 219
Серная кислота II: 289, 428
Сернистая кислота I: 143
Серные бактерии I: 25, 298, 307-313; II: 428.
См. таксисе Пурпурные бактерии
--бесцветные I: 307, 308
--в симбиотических ассоциациях I: 47
--зеленые I: 47, 412; II: 265
--источники энергии I: 310
--кооперативные взаимосвязи II: 302
--метаболические типы I: 307
--симбиотические I: 313
--факультативные I: 311-313
Сероводород I: 128, 158; II: 213, 218
— образование I: 363; II: 245
— окисление I 293, 313
--в донных осадках II: 312
Сибирская язва I: 23
Сигма-факторы I: 452; II: 57, 59, 347
- а32 II: 130, 131
- ст38 II: 143, 144
--и голодание II: 143
--и экспрессия генов I: 136, 137
54
— а , экспрессия генов вирулентности
I: 226
- а55 I: 535
- а70 I: 452
- аЕ II: 58
- <тЕ II: 59
- ctf II: 57
- crG И: 58
- II: 57
- I: 549; II: 59
Сигналы, передача I: 586 -595, 608-621
--внеклеточные ферменты I: 241
--двухкомпонентпые системы I 570, 612
--при инвазии II: 334
--система Arc I: 640
--хемотаксис I: 614-626
— ядерной локализации I: 493
Сигнальная последовательность I: 580
Сигнальные пептидазы I: 581
Сидерамины II: 118
Сидерофоры I 231-233; II: 118, 214, 339
Сизомицин II: 110-111
Симбиоз, азотфиксирующие актиномицеты
II: 368-369
— бактерий с беспозвоночными II: 119
— и азотфиксация II: 364
— и инфекционные болезни II: 321
— корабельный червь II: 301
— метаногены II: 253
— определение I: 47
— серные бактерии I: 313
Симбиотические бактерии I: 127, 441
Симпорт. См. Транспорт
Синапоморфия И: 154
Синезеленые водоросли. См. Цианобактерии
Синтрофизм II: 248
Синтрофная кооперация II: 239
Синтрофные ассоциации II: 251-252
— бактерии I: 401-402
— бактерии-бродилыцики И: 217
— партнеры I: 127
Синхронные популяции II: 9
Сирогем I: 202, 222, 351, 365
Сиропы I: 247; II: 409
Систематика II: 150—155. См. также Таксономия
Сквален I: 189, 195-196
/З-Складчатые структуры I: 556, 558
Скорость роста I: 132
--адаптивная реакция II: 142-144
--зависимость от концентрации субстрата
I: 139; II: 230
--зависимость от субстрата I: 132-139
--удельная I: 118
Слепая кишка И: 294, 299
Слизистые оболочки II: 326
Слизь I: 48, 49, 64; II: 225, 240
Слюна II: 241
Снег детритный II: 263
Ci-Соединения I: 149, 165, 283-285
— ассимиляция I: 151, 159, 219-221
— восстановление I: 358-359
— метаболизм II: 285
— окислительно-восстановительные полуреакции
I: 295
— перенос I: 159
- степень окисления I: 360
Са-Соединения I: 165
— ассимиляция I: 218
Соленые среды обитания II: 268, 290-292
Солеустойчивые микроорганизмы II: 139
Сообщества И: 208
— прикрепленные II: 239
Сорбоза I: 261
Спермидин I: 201
Специализированные прокариоты
I: 127; II: 269, 283-292
СПИД-ассоциированные инфекции II: 325
Спирохеты, движение I: 64, 65
Спирт I: 144. См. также Этанол
Споруляция I: 585, 595; II: 54-61
— гены II: 58, 64-66
— и образование антибиотика II 120
478 Предметный указатель
— инициация II: 55-57, 119-144
— компартментализованная экспрессия генов
II: 57-60
— морфологические этапы II: 54
— мутанты И: 55
— образование оболочки споры II: 60
— передача сигналов II: 59
— участие <7-факторов II: 58
— факторы регуляции II: 55-56
Споры I: 66
— выживание при голодании II: 224
— образование II: 55, 60
— прорастание II: 120
Среда культивирования. См. Питательные
среды
— обитания II: 207. См. также Экстремальные
среды обитания
высокое давление II: 292
изменения II: 433
кислотность II: 289
разнообразие II: 150
соленость II: 290
щелочность II: 289
Средовые стимулы, и гены вирулентности II: 345
Сродство к субстрату II: 212, 217, 222, 230-233
Стафилокиназа II. 338
Стационарное состояние культуры I: 138
Стебельки I: 48; II 38-41, 224
Стерилизация облучением I: 132
— оборудования I: 132
— промышленные технологии II: 388
— сред Г 131, 132
— фильтрованием I: 132
Стероиды, биотрансформация II: 401-403
Стигмастерол II: 402
Стикленда реакция I: 369; II: 251
Стимулон I: 520, 595, 596
— голодания II: 143
— осмотического стресса II: 141
— стресса II: 123
Стимуляция роста растений II: 376-380
Столбнячный токсин II: 335
Сточные воды I 306, 313; II: 415-427
/С Стратеги И: 230
r-Стратеги II: 230
Стрептидин II: 109
Стрептокиназа I 256, II: 338, 4 0
Стрептолидин II: 98
Стрептомицеты, вторичный метаболизм II: 62,
97-105, 405-406
— дифференцировка II: 61-66
Стрептомицин I: 459; II: 405
— биосинтез II: 110-112, 120
Ьтрептотрицин F II: 98
Стресс, индикаторы II: 130
— толерантность II: 141
Стресс-реакция I: 588; II: 122-128, 144
Строгий контроль. См. Строгий ответ
- ответ I: 604-608; II: 123, 144
Строительные блоки, активация I: 145, 160
---аминокислоты I: 151
---белков I; 145, 165
---гексозамины I: 186
---липиды I: 189
---метаболические пути I: 163-165
---нуклеиновые кислоты I: 178-183
---нуклеотиды I: 151
---полимеризация I: 160
---полимеры I: 259
---сахара I: 174, 184-188
----синтез I: 145, 160, 162
----углеводы I: 259
----фенилпропан I: 250
----фосфаты углеводов I: 174-177
----центральные метаболиты-предшественники
I: 146, 151
Структура спираль-виток-спираль Г 556-558
Субстраты II: 230—237. См. также Органические
субстраты; Питательные вещества;
Сродство к субстратам
— в природных местообитаниях II 222, 245
— лимитирование II: 209-215
— оборот II: 231
— одновременное использование II: 233-234
— поглощение микробным сообществом II: 234
- полимерные, разложение I: 242-250; II: 237, 249
— пороговые концентрации II: 234-235
— поступление II: 233
— пул II: 236
— структурные аналоги I: 29
Субтилизин I: 256; II: 410
Субтилин II: 106
Сукцинат I: 634
— восстановление до бутирата у Clostridium I: 386
Сукципатдегцдрогеназа I: 82
Сукцинатное дыхание I: 85
Сукцинил-СоА I: 331
Сульфаниловая кислота I. 29
Сульфат II: 213
— в морской воде II: 313
— восстановители II: 200
--конкуренция с метаногенами I: 366
— восстановление I: 158, 296, 363—366; II: 275
--обратимость I: 366-367
— диффузия в осадки И: 274-275
— как источник серы I: 157-159
— транспорт I: 158
Сульфатредукция ассимиляционная I: 229
— диссимиляционная I: 365
Сульфатредуцирующис бактерии I: 365; П: 216
480 Предметный указатель
Транзиции I: 462
Трансальдолаза I: 177
Трансальдолаза/кетолаза, пути с участием
I: 371, 374
Трансамидаза II: 23
Трансаминирование аминокислот I: 268-270
Трансверсии I: 462
Трансгенные организмы II: 435, 436
Трансглюкозилирование I: 199
Трансдукция I: 473, 493-495; II: 90
Транскетолаза I: 177
Транскрипция I: 447, 448, 451-454, 522-527
— антитерминация I: 547
— аттенуация I: 543-545
— метилирование ДНК I: 540
— отрицательный контроль I: 528
— регуляция I: 522-523, 539-547
— сайты активации I: 532-534
— сопряжение с трансляцией I: 437
Транслоказа I: 581
Трансляция I: 448, 454, 459-460; II: 348
— регуляция I: 550-555
— сдвиг рамки считывания I: 459
— сопряжение с транскрипцией I: 437
— стоп-кодон I: 459, 461
— эффективность И: 348
Транспозаза I: 443
Трапспозирующиеся элементы ДНК I: 34, 423, 442
Транспозиция I: 442, 442-446, 464; И: 85-91
Транспозоны I: 34, 440-446, 464, 476
- ТпЮ I: 444-445
- Tn5 I: 444
Транспорт веществ через мембрану I: 94, 96, 101-112
— антипорт I: 101, 103, 105, 114
— зависимый от связывающих белков I: 95,
96, 109-110, 112
— калия И: 139
— переносчики I: 98-100, 105
— протонов, и фотофосфорилирование I: 93
--сопряженный с электронным транспортом
I: 91-93
— связывающие белки I: НО
— симпорт I: 101, 103, 105
— субстратов II: 244-247
— с присоединением группы I 111
— унипорт I: 101, 103, 105
— участие белков I: 94, 96
— электронов и фосфорилирование I: 161, 380.
См. таксисе Электронтранспортные цепи
--и фотофосфорилирование I: 93
--компоненты цепи II: 169
--обратный I: 301, 339
--при дыхании I: 417
--сопряжение с транспортом протонов I: 92-93
--фотосинтетический I: 416-417
Транспортные системы I: 94-98
--ATP-зависимые I: 232
--зависимые от связывающих белков I: 109-110
--зачистки I: 115
--поглощение электролитов I: 230-235
--разнообразие I: 112-115
--регуляция I: 112-115
--с низким/высоким сродством I: 156
--секреции макромолекул I: 115
--цитоплазматические ферменты I: 115
Трансферрин II: 339
Трансформация I: 35, 473
Трансформосомы I: 475
Трегалоза II: 138-139
Треонин I: 168-170
— дезаминирование I: 270
— сбраживание I: 394-395
Треониновые протеинкиназы I: 572
Трикарбоновые кислоты I: 231
Триметиламин I: 285
Триметиламин-К-оксид I: 355, 635; II: 220
Триметиламин-ЬГ-оксидоредуктаза I: 637
Триптофан I: 171-172, 287
— деградация I: 274, 547
Трисахариды I: 261
Трихлорфенолуксусная кислота II: 381
Трофогенные слои II: 262-263
Трофосома II: 270
Трофофаза I: 119; II: 99, 113, 116
Тундры И: 282
Туникамицин II: 23
Турбидиметрия I: 132
Турбидостат I: 139
Тургор II: 124, 139-140
Убихинол I: 414, 416
Убихинон I: 82, 92, 173, 416; И: 168
— биосинтез I: 341
Углеводороды I: 278-283
Углеводы, метаболические взаимопревращения
I: 184
— образование олигосахаридов II: 96, 109-112
— окисление I: 259-267
— рецепторы И: 331
— синтез переносчиков I: 596
— строительные блоки I: 259
Углерод как элемент питания I: 127
— дефицит II: 142
— запасы И: 308
Углеродное голодание I: 598
Углеродные единицы, номенклатура I: 252
Углеродный метаболизм, гипертермофилы II: 288
--ферменты I: 597
— скелет, восстановление при брожении I: 388
Предметный указатель 481
--перестройки I: 211-211
Угольная кислота II: 136
Угри II: 303
Удобрения II: 280
Уксус, производство И: 394
Уксуснокислые бактерии I: 291; II: 394
Ультразамораживание I: 135
Ультраструктурпый анализ II: 325
Ультрафиолет И: 209
Ундекапренол I: 196; II: 21-22, 28-29
Ундекапренолфосфат I: 186; II: 27
Урацил I: 234, 286, 399, 471, 515
Уреаза II: 339
Уридилилтрансфераза I: 613
Уридилирование I: 570
Уридиндифосфат (UDP) I: 185
Уридинмонофосфат (UMP) I: 181
Уридинтрифосфат (UTP) I: 543, 545
Урожай клеток I: 140-142
Уроновые кислоты I: 185-185
Уропорфириноген III I: 203
Устойчивость к антибиотикам I: 440, 477; II: 80, 324,
326; II: 352-354, 376-380. См. также
Множественная лекарственная устойчивость
--гены I: 443
--горизонтальный перенос генов II: 353
--и аттенуация трансляции I: 552-553
--R-плазмиды I: 477
--приобретение патогенности II: 354
--скрининг штаммов II: 354
--точковые мутации II: 353
Фаголизосомы II: 334
Фагосомы II: 326, 334
Фагоцитарные клетки II: 326, 332
Фагоцитоз II: 326
Фазовая вариация I: 548, 616; II: 332, 343-345
Фазово-контрастная микроскопия I: 42
Фактор высвобождения I: 459
— интеграции хозяина I: 432, 491
— компетентности (CF) I: 475
— некроза II: 373
--опухолей II: 24
— А, общий контроль вторичного метаболизма
И: 115, 117
— А, связывающий белок II: 63
— A, Myxococcus xanthus И: 67
- В II: 63
— С, Myxococcus xanthus II: 68
- F I: 477
— F430 П: 170
- FP I: 477
Факторы вирулентности I: 441; II: 144, 322-342, 356
--адгезины II: 322
--инвазины II: 332-334
--протеазы I: 256
--системы обеспечения железом II: 339
--экзотоксины II: 335-338
--экзоферменты I: 238
--экспрессия II: 372
--эндотоксины II: 340
— процессинга I: 453
— распространения II: 338
— роста I: 28, 129, 146
— транскрипции II: 192
Фекальное загрязнение, индикация II: 417
Феназин II: 118
Фенетические данные И: 151-152, 156
Фенилаланин I: 171, 274
Фенилпропан I: 250
Феноксазинонсинтаза II: 114
Фенольные соединения I: 271
Феном II: 151
Фенотип II: 151
Фентона реакция I: 254
Феофитин I: 202
Ферментный иммуносорбентный анализ (ELISA)
И: 362
Ферменты I: 24, 31. См. также Экзоферменты;
Эндоферменты
— автолиза I: 534
— активность И: 129
— аллостерические, Т/Р-состояния I: 565, 566
— аллостерический контроль I: 564-570
— анаболизма I, 142
— включение II: 408
— внутриклеточные I: 241
— вторичного метаболизма II: 95
— гидролитические I: 238
— гипертермофилов II: 287
— иммобилизация II: 408
— инактивация антибиотиками II: 353
— ингибирование по механизму обратной связи
I I: 123
— как добавки в стиральные порошки II: 407
— как лекарственные препараты II: 410
— катаболизма I: 142
— клеточные I: 241
— лигнолитические I: 253
— микробные II: 407-410
— нековалентная модуляция активности I: 561
— перекрестное связывание II: 408
- посттрапсляционный контроль I: 579-585
— почвы II: 280
— промышленное применение И: 318, 408
— протеолитические I: 254
— связывание II: 408
— сыра II: 392
— фибринолитические II: 410
482 Предметный указатель
— целлюлозолитические I: 243
- AlvI I: 503
— dUTPasa I: 515
— £ах>Ш I: 515
- I (El) I: 111, 622
- II (ЕИ) I: 622
- pH 6 I: 382
Феромоны I: 595; И: 62
Ферредоксин I: 163, 223, 228; И; 50, 253
Ферриоксамин I: 231
Ферритин II: 339
Феррихромы I: 231
Фертильность, подавление I: 481
Фибрин II: 410
Фибронектин-связывающие белки II: 342
Фибронектины И: 332
Фика закон II: 243
Фикобилины I: 202, 408
Фикобилипротеины I: 57, 408, 418
Фикобилисомы I: 55, 57, 418
Филогенетические деревья И: 180-187
— маркеры II: 181-184
Фимбрии I: 65; II: 34, 331. См. также Пили
Фингерпринтинг I: 504, 516
— плазмид II: 176, 350
Фитоагрессины II: 118
Фитоалексины II: 118
Фитопатогенные бактерии I: 23; II: 117, 304, 374-376
--несовместимость с хозяином II: 372
Фитостимуляторы II: 376
Фитотоксины И: 118
Флаводоксин I: 223
Флавоноиды II: 365-366
Флавопротеины I: 350
Флагеллин I: 64-65
— антигенные свойства I: 548
Флексирубин II: 165
Флороглюцинол I: 277
Флуоресцентная эпимикроскопия I: 42
Флуоресцентное окрашивание II: 349
Флуоресцентные антитела I: 43, 45; И: 228, 362
— красители II: 226
Флуоресценция метаногенных эндосимбионтов
И: 254
Фоботаксис I: 617
Фолат I: 182
Формальдегид I: 283-284
— пути фиксации I: 220
Формиат I: 284
— метаболизм I: 633-634
— образование I: 383
— перенос между видами И: 252
Формиат-нитратный путь I: 637
Формиат-гидроген-лиаза I: 633
Формилтетрагидрофолат I: 160
Фосфат I: 128, 228; И: 220
— аккумулирующие бактерии П: 421
— в сточных водах И: 421
— и вторичный метаболизм II: 115
— источники I: 157
— транспорт I: 156
— уровень в водоемах II: 260, 275
Фосфатидил глицерол I: 193
Фосфатидилэтаноламин I: 193
Фосфатидовая кислота I: 193
Фосфатный буфер I: 130
Фосфит II: 220
Фосфоаденозин-5'-фосфосульфат I: 229
Фосфобелки I: 572
— фосфо-(серил)-НРг I: 575
— фосфо-CheA I: 621
— фосфо-CheY I: 622
Фосфогликолат I: 212
Фосфоглицерат I: 212
Фосфоглюконатдегидратаза I: 265
Фосфо енол пируват I: 171
— брожение I: 629
— карбоксилирование I: 302
— накопление I: 568
— образование сукцината I: 634
Фосфое?(олпируват-зависимая фосфотрансферазная
система I: 111, 599
Фосфо енолпируваткарбоксил аза I: 164
Фосфоенолпируватсинтетаза I: 164
Фосфокетолазный путь I: 373
Фосфолипазы II: 337
Фосфолипиды I: 189; II: 42
— как таксономические маркеры II: 165-166
— липидный состав I: 194
— сайты расщепления I: 258
- типы I: 193
Фосфонаты, утилизация I: 228
Фосфониевые кислоты I: 157
Фосфономицин II: 23
Фосфопереносящие белки I: 572
Фосфопротеинфосфатаза I: 602
Фосфор, ассимиляция I: 228
— включение в клеточные компоненты I: 151,
156-157
— источники I: 156-157
— микробное восстановление II: 220
— переносчик I: 156
— цикл II: 315
Фосфорибозилпирофосфат I: 174-181
Фосфорибозилтрансферазы I: 183
Фосфорибулокиназа I: 212
Фосфорилирование I: 73-77, 570
— изменение свободной энергии I: 84
— сопряжение с электронным транспортом I: 346
— субстратное I: 72, 300
Предметный указатель 483
Фосфорные минералы II: 214
Фосфоролитическое расщепление I: 260
Фосфорорганические вещества II: 382
Фосфотрансацетилаза I: 633
Фосфотрансферазная система I: 95, 96, 112, 260, 570,
574, 599-603
--зависимая регуляция I: 601-602
Фосфофруктокиназа I 568, 584
Фотохимические реакционные центры I: 413-416
Фото-лиаза I: 470
Фотолитоавтотрофные бактерии I: 210
Фотореактивация I: 470
Фотосинтез I: 25. См. также Диоксид углерода
— аноксигенный I: 406, 409-417
— методы изучения I: 421
— оксигенный I: 330, 405, 417-419, 641; II: 307
— пигменты I: 406-408
— уравнение I: 26
— цикл углерода II: 307-311
Фотосинтетический аппарат II: 42
--внутрицитоплазматические мембраны II: 42
--сборка II: 46
Фотосистема I I: 415-419
- II I: 418-419
Фототаксис I: 25-26, 30, 615, 624
Фототрофные бактерии I: 53, 127
--аноксигенные I: 209, 406; И: 266
--в ассоциациях И: 254
--дифференцировка мембран II: 42-48
--оксигенпые I: 26
--спектры поглощения света II: 265
Фототрофы I: 126, 127
- цианобактерии I: 417
Фотофосфорилирование I: 93
Фотохимические стимулы I: 626
Фруктаны I: 247
Фруктоза D I: 261
Фруктозо-1,6-дифосфат I: 75, 602
Фруктозо-6-фосфат I: 154-177, 210, 220, 569
Фульвокислоты II: 210, 263, 277
Фумараза I: 353
Фумарат I: 352, 626, 634-637
Фумаролы II: 285, 428
Фумигация II: 227
Харбера-Боша реакция I: 223; II: 312
Хелперные Т-клетки II 329
— фаги II: 91
Хемокинез I: 623
Хемолитоавтотрофы I: 294
— ассимиляция углерода I: 302
— аэробные/анаэробные I: 209
— облигатные I: 298, 303
--окисляющие аммоний и нитрит I: 316
— окисляющие железо I: 321
— факультативные I: 298, 303, 320-321
Хемолитогетеротрофы I: 298
Хемолитотрофный метаболизм I: 302-304
Хемолитотрофы I: 294-295
— адаптация к среде I: 304-306
— метаболизм II: 290
— окисление неорганических соединений I: 293-297
— получение энергии I: 299-302
— субстратное фосфорилирование I: 300
— типы метаболизма I: 298
— углеродный метаболизм I: 302-304
— факультативные I: 298, 311
— электронтранспортные цепи I: 300-302
— энергодающие реакции I: 294
Хемосенсоры II: 119
Хемостат I: 137-139; II: 222
Хемотаксис I: 590, 615, 617-619
— и жгутики I: 64
— компоненты клеток I: 624
— метил-акцептирующие белки I: 618-619, 626
— механизм II: 41
— отрицательный I: 224
— передача сигнала I: 611-626, 622
— рецепторы I: 611
— стресс-реакция II: 128
— фосфорилирование белков I: 618-620
— экспрессия генов II: 41
Хемотаксономия И; 161-174
Хемотрофы I: 127; II: 254, 261-264
Химическая дифференцировка II: 95
Химическое потребление кислорода II: 416
Хинол I: 91
Хинол:цитохром с-оксидоредуктаза I: 91, 334
Хинолин I: 287
Хинолоксидаза I: 335-338
Хинолоны И: 352
Хиноны I 53, 196, 271
— как таксономические маркеры II: 168
— окислительно-восстановительные полуреакции
I: 295
— цикл I: 336
Хитин I: 248-249
Хитиназы I: 248, 249
Хитозаназы I: 248
Хищники II: 293
Хламидии I: 47
Хлорамфеникол I: 459; II: 97, 116
Хлорат II: 220
Хлорбензоат, разложение II: 383
Хлорин II: 424
— обработка воды II: 239
Хлоросомы I: 57, 412-416
Хлорофиллы I: 202, 406
Хлорсодержащие углеводороды II: 424
484 Предметный указатель
Хлортетрациклин, синтез II: 405-406
Холлидея структуры I: 496-498
Хоминг I: 554
Хоризмовая кислота I: 172-173
Храпение культур I: 135
Хромат II: 220
Хромосомы I: 35, 59, 423, 436, 447
— асинхронная инициация II: 12
— внутриклеточная организация I: 436
— дочерние II: 13, 19
— кольцевые I: 436; II: 11
— линейные I: 436; II: 10
— метод картирования I: 507-508
— разделение И: 13-14
— репликация II: 11-13, 40
— сверхспирализованпые участки I: 437
Целлобиоза I: 243
Целлодекстрин 1: 245
Целлюлазы I: 239, 243
— промышленное применение I: 245
Целлюлоза II: 211
— разложение I: 242, 250; II: 248
— структура I: 242
Целлюлозолитические микроорганизмы I: 245
Целлюлосомы I: 239, 244, 245
Центральные метаболиты-предшественники
I: 149-151, 177
— метаболические пути I: 149-151
----аллостерическая регуляция I: 164
Церуленин II: 25
Цефалоспорины II: 107-108
Цефамицины II: 107-108
Цианобактерии I: 26, 209; II: 50, 52
— диазотрофия II: 369
— клеточная стенка I: 51
— нитчатые I: 227; II: 255
— окисление глюкозы I: 267
— спектры поглощения II: 265
— строение клеток I: 57
— фикобилисомы I: 55, 57
— фиксация азота II: 369-370
— фотосинтез I: 417-419
— фотосистемы I 418-419
— хроматическая адаптация I: 419
Циапобионты II: 369
Цианофицин I: 63, 200; II: 50
Цикл Кальвина I: 207-212
--водородные бактерии I: 319
--ключевые ферменты I: 211
--термофилы II: 288
--хемолитоавтотрофы I: 302-302
— лимонной кислоты I: 81-83, 149, 163. См. также
Цикл трикарбоповых кислот
--восстановительный I: 213-214
----У факультативно анаэробных бактерий I: 330
— серы I: 306; II: 312-315
— трикарбоновых кислот I: 150, 302-303, 319,
568, 572
— углерода II: 307-311
Циклический АМР как алармон II: 124
--регуляция внутриклеточной концентрации
I: 598-602
--рецепторный белок I: 532, 538
--связывающий белок I: 587
--фосфотрапсферазная система 1: 599 600
Циклоалифатические соединения I: 283
Циклогексан, разложение I: 283
Циклодекстрин I: 246
Циклопропаповые жирные кислоты I: 194
Циклосерин II: 23
Циклы холостые I: 584
— элементов II: 307
--роль прокариот И: 415
Цинк, роль во вторичном метаболизме II: 116
Цинковые металлопротеазы II: 339
— «пальцы» Г. 556, 558
Цистеин I: 157, 171
— биосинтез I: 230
— разложение I: 271
— сбраживание I: 394
— синтез I: 146, 158, 171
— удаление серы 1: 171
— фосфорилирование I: 572
Цистропы I: 448, 523
— кодирующие белки I: 451
Цисты II: 224
Цитозин I: 286, 426
Цитокиновая сеть II: 329
Цитолизины II: 337
Цитоплазма, буферная способность II: 133
- pH II: 132-134
--поддержание II: 135
--регуляция II: 132-134
Цитотоксические Т-клетки II: 329
Цитохром b I: 301, 358
- с I: 91-92, 301, 310, 334
- cch I: 351
- C553 I: 415
- ch I: 351
Цитохром с-оксидоредуктаза I: 91, 335-337
Цитохромоксидаза I: 91, 416
Цитохромы как таксономические маркеры II: 168
— окислительно-восстановительные реакции I- 295
Цитрат, поглощение I: 113
— сбраживание I: 384-385
Цитратсинтаза I: 81
— у сульфатредукторов I: 366
Частицы, распознающие сигнал I: 583
Червь корабельный II: 301
Черные курильщики II: 270
Чехлы I: 46
Чистые культуры I: 22, 136
Чувствительность хозяина II: 326
Шамберлана свечи I: 23
Шикимовая кислота I: 171, 174, 193
Шиффовы основания I: 373, 420
Штаммы II: 174-181
— дикого типа I: 462
- Hfr I: 477-479
ГЦелочная фосфатаза I: 239
Щелочноземельные металлы I: 230
Щелочные среды обитания II: 289 290
Эвазины И: 341
Экзергонические реакции I: 99; II: 221
Экзоглюканазы I: 244
Экзоны II: 204
Экзополисахариды II: 373
Экзоспоры II: 61
Экзотоксины II: 335
Экзоферменты I: 238, 239
^Экзохитнназа I: 248
Экологические ниши II: 208-209
Экология I: 32; II: 207-208, 356
Экофизиология II: 209
Экспрессия генов I: 447, 519
- оперопов, полярные эффекты I: 543
Экстейны I: 554
Экстремальные среды обитания II: 283-293, 435.
См. также Экстремофилы
---выживание прокариот II: 148
---голодание II: 142-144
---осмотический стресс II: 138-141
L-- pH II: 149
---температурная адаптация II: 128
Экстремофилы I: 121; II: 283-293
к облигатные II: 122
ЕЭктоип II: 138-139
Эластаза I: 256
Эластин I: 255
Электронная микроскопия I: 44-45
Электронно-микроскопическая иммуноцитохимия
I: 45
Электронов источник I: 127
Электронтранспортпая система II: 217, 219
фектроптранспортное фосфорилирование I: 73,
Электронтранспортныс цепи I: 84
---в митохондриях I: 339
---зависимый таксис I: 623
---у хемолитотрофов I: 300
Электропорация I: 476
Электрофильные агенты II: 143
Электрофорез в геле I: 593
— в денатурирующем геле II: 229
Электрохимический потенциал ионов I: 103
— протонный потенциал I: 84
------и синтез АТР I: 86
------и транспорт электронов I: 92
Элементарное тело I: 48
Элонгация белковой цепи I: 543-545, 553
— цепей жирных кислот II: 102
Эмбдена-Мейергофа-Парнаса путь I: 73, 76, 150, 177,
263-265
------маслянокислое брожение I: 379
------молочнокислое брожений I: 377
------образование пирувата I: 375
------окислительные этапы I: 371
------регуляция I: 568
------у гипертермофилов II: 288
Эндергонические реакции I: 99; II: 221
Эндонуклеаза II II: 81
Эндонуклеазы I: 256, 454
Эпдопротеазы I: 576
Эндосимбионты-метаногены II: 253
Эндотоксины II: 335, 340
Эидохптипаза I: 248
Энергетический заряд I: 161
— метаболизм I: 72
Энергия поддержания I: 141
— получение I: 73, 628
---в окислительно-восстановительных реакциях
I: 367
---гипертермофилы И: 288
---при аммонификации I: 348
---при восстановительном дехлорировании I: 367
---при денитрификации I: 349
— рассеяние II: 44
— свет как источник I: 127
Энтеробактерии, реакция на химический стимул
II: 128
— сбраживание глицерола I: 383-385
— хемотаксономия II: 172
Энтеротоксины I: 441; II: 335
— стафиллококков I: 52
Энтерохелин I: 173
Энтнера-Дудороеа путь I: 163, 176, 265-266
---модифицированный I: 265; II: 193
---разложение фосфосахаров I: 371
---спиртовое брожение I: 378
---у гипертермофилов II: 288
486 Предметный указатель
Энхансеры I: 534-535
— ftr II: 40
Эпибионты II: 255
Эпидемии I: 19; И: 415
Эпидемиология молекулярная II: 350
Эпилимнион II: 259-263
Эпимеризация I: 184
Эписемантические молекулы II: 155
Эписомы I: 438, 478
Эпитоп И: 328
Эпифитные бактерии II: 380
Эргостерол И: 228
Эритрозо-4-фосфат I: 171-174
Эритромицин I: 459
— синтез И:103-104
Эспрессия генов, и адаптация к стрессу II: 125-128
--и метаболизм РНК I: 549-550
--и топология ДНК II: 126
--кислотоиндуцируемая И: 136
--компартмент-специфическая И: 41
--регуляция I: 522
--сопряжение транскрипции с трансляцией I: 437
Эстуарии II: 268
Этан, окисление II: 235
— оксидоредуктаза I: 642
— сбраживание I: 378-385
Этанол, окисление II: 248
Этанол амин I: 193
Этиленгликоль I: 289
Эукариоты I: 33
— молекулярные отличия от прокариот II: 191
Эффекторы I: 524-526, 566
Ядерный магнитный резонанс, спектроскопия I: 165
Оглавление
Часть VI. Рост и дифференцировка клеток...................................... 5
Г. Древе, Й. Лепгелер. Перевод И. В. Алферовой
Глава 22. Клеточный цикл бактерий............................................ 7
К. Нордстрём. Перевод И. В. Алферовой
22.1 Фазы вегетативного клеточного цикла определяются ключевыми собы-
тиями ............................................................ 7
22.2 Стратегии репликации ДНК хромосом и плазмид........... 10
22.3 Нуклеоид прокариотической клетки эквивалентен ядру эукариотической
клетки................................................. 13
22.4 Клеточный цикл обеспечивают регулируемые и координируемые про-
цессы 15
22.5 Заключение............................................ 19
Глава 23. Сборка структур клеточной поверхности................................. 21
К. Янн, Б. Янн. Перевод И. В. Алферовой
23.1 Пептидогликан формируется из активированных предшественников. 21
23.2 Липополисахарид синтезируется в плазматической мембране из строи-
тельных блоков................................................... 24
23.3 Тепхоевые и липотейхоевые кислоты представляют собой полиолсодержа-
щие компоненты клеточной стенки грамположительных бактерий...... 28
23.4 Тейхуроповые кислоты — компоненты поверхности грамположительных
бактерий, содержащие гексуроновую кислоту........................ 30
23.5 Клеточные капсулы у многих грамположительных и грамотрицательных
бактерий состоят из кислых полисахаридов......................... 30
23.6 Сборка полисахаридов сопряжена с циклом ундекапренолфосфата.. 32
23.7 Наружная мембрана грамотрицательных бактерий содержит порообразу-
ющие белки (порины) и структурные белки.......................... 32
23.8 Нитевидные фимбрии взаимодействуют с поверхностными рецепторами
клетки...................................................... 34
23.9 Сборка жгутиков происходит двумя путями.................... 36
23.10 Поверхность клеток и жгутики некоторых архей состоят из гликопро-
теинов ......................................................... 36
488 Оглавление
Глава 24. Процессы клеточной дифференцировки.......................................... 38
Г. Древе. Перевод И. В. Алферовой
24.1 Образование роящихся (швермерпых) клеток и стебельковых клеток у
Caulobacter связано с клеточным циклом.......................... 38
24.2 Дифференцировка мембран у факультативно фототрофных бактерий за-
висит от изменений концентрации кислорода и интенсивности света. 42
24.3 Гетероцисты цианобактерий — специализированные клетки, осуществля-
ющие фиксацию N2................................................ 48
Глава 25. Споруляция и клеточная дифференцировка...................................... 54
Л7. Марахиел, 17. Дубер. Перевод А. В. Лебединского
25.1 Процесс образования эндоспор у Bacillus subtilis включает большое число
генетически детерминированных этапов............................ 54
25.2 Стрептомицеты образуют при споруляции экзоспоры.................... 61
25.3 Развитие многоклеточных структур у общественного организма Мухосос-
cus xanthus..................................................... 66
Глава 26. Бактериофаги как модели дифференцировки...................................... п
Б. Кемпер. Перевод И. В. Алферовой
26.1 Введение и экспериментальные методы............................... 71
26.2 Классификация бактериофагов основана на их морфологии............. 73
26.3 Для вирулентных фагов характерно развитие по литическому пути. 78
26.4 Лизогения — альтернативный способ существования умеренных фагов... 85
26.5 Фаги служат важным инструментом генетических исследований..... 90
Глава 27. Вторичный метаболизм: пути образования антибиотиков,
регуляция и функции .......................................................... 95
Дж. Ланчини, А. Демейн. Перевод И. В. Алферовой
27.1 Синтез большинства вторичных метаболитов обеспечивают всего несколь-
ко биосинтетических путей....................................... 96
27.2 Низкомолекулярные антибиотики синтезируются с участием интермеди-
атов основного метаболизма...................................... 97
27.3 Вторичные метаболиты некоторых классов образуются из поликетомети-
леновых цепей.................................................. 101
Оглавление 489
27.4 Синтез полипептидных антибиотиков происходит по двум механизмам по-
лимеризации .................................................... 106
27.5 Аминогликозидные антибиотики, образуемые актипомицетами, синтези-
руются путем олигомеризации углеводов........................... 109
27.6 Вторичный метаболизм, как и другие процессы дифференцировки, тонко
регулируется.................................................... 113
27.7 Вторичные метаболиты выполняют важные функции в природных экоси-
стемах.......................................................... 117
Глава 28. Адаптация к экстремальным средам....................................... 122
А. Бут. Перевод И. В. Алферовой
28.1 Адаптация к стрессу сопряжена с изменением физиологического состоя-
ния клеток и экспрессии генов................................... 122
28.2 Адаптация к экстремальной температуре....................... 128
28.3 Бактерии способны адаптироваться к экстремальным значениям pH .... 132
28.4 Выживание при осмотическом стрессе обеспечивается у бактерий одним
общим механизмом................................................ 137
28.5 Изменения скорости роста вызывают адаптивный ответ.......... 142
28.6 Заключение: стресс-реакция — это усиленный нормальный ответ. 145
Часть VII. Разнообразие и систематика.............................................147
Глава 29. Разнообразие и систематика прокариот................................... 148
Э. Штаккебрандт, Б. Тиндалль, В. Лудвиг, М. Гудфеллоу.
Перевод К. Л. Тарасова. Спец. род. канд. биол. наук Т. П. Турова
29.1 Систематика бактерий — одно из начал сравнительной биологии.. 150
29.2 Нумерическая (численная) таксономия как подход для кластеризации
штаммов на основе большого набора невзвешепных фенетических данных 156
29.3 Анализ химических признаков клеток как инструмент таксономии. 161
29.4 Геномные характеристики штаммов и видов..................... 174
29.5 Филогенетические деревья и их интерпретация................. 181
29.6 От ранних форм жизни к современным видам прокариот.......... 187
29.7 Комплексный подход к систематике бактерий................... 201
490 Оглавление
Часть VIII. Прокариоты в биосфере................................................207
Б. Шинк. Перевод К. Л. Тарасова
Глава 30. Экофизиология и экологические ниши прокариот ......................... 209
Б. Шинк. Перевод К. Л. Тарасова
30.1 Количество субстратов в природе обычно лимитировано........ 209
30.2 Бактерии осуществляют окислительно-восстановительные превращения
субстратов...................................................... 215
30.3 Кинетика микробного роста в природных экосистемах.......... 222
30.4 Скорость потребления субстрата определяется кинетиками его деполиме-
ризации и поглощения............................................ 230
30.5 Для многих бактерий характерно прикрепление к поверхностям.. 237
30.6 Перенос веществ обусловлен конвекцией и диффузией по градиенту кон-
центраций ...................................................... 243
30.7 Микроорганизмы вступают в различные кооперативные взаимодействия 247
Глава 31. Местообитания прокариот............................................... 257
Б. Шинк. Перевод К. Л. Тарасова
31.1 Вода как идеальная среда обитания для микроорганизмов...... 257
31.2 Донные осадки как «органы переваривания» и «исторические доку-
менты» ......................................................... 271
31.3 Почва обычно представляет собой сухую и гетерогенную среду обитания 27б
31.4 В экстремальных средах обитают специализированные микробы... 283
31.5 Ассоциации с пищеварительными системами животных........... 293
31.6 Другие ассоциации с животными.............................. 302
31.7 Микробы и растения......................................... 304
лава 32. Глобальные биогеохимические циклы................................... 307
Б. Шинк. Перевод К. Л. Тарасова
32.1 Цикл углерода поддерживается фотосинтезом.................... 307
32.2 Прокариоты участвуют во всех этапах цикла азота........... 311
32.3 Прокариоты участвуют во всех этапах цикла превращений серы.. 312
32.4 Циклические превращения других элементов................... 315
Оглавление 491
Часть IX. Прикладная микробиология...........................................зхт
А. Пюхлер. Перевод К. Л. Тарасова
Глава 33. Медицинская микробиология......................................... 319
Й. Хаккер. Перевод К. Л. Тарасова
33.1 Значение и особенности инфекционных болезней................ 319
33.2 Защитные механизмы хозяина.................................. 326
33.3 Бактериальные факторы вирулентности......................... 330
33.4 Изменчивость и регуляция генов, связанных с вирулентностью.. 343
33.5 Диагностика, терапия и профилактика: проблемы и новые подходы. 349
33.6 Прокариоты и медицина: тенденции и направления дальнейших исследо-
ваний ......................................................... 356
Глава 34. Прокариоты в сельском хозяйстве....................................... 359
Ф. OTapa, У. Прифер, Д. Доулинг, М. Нути. Перевод К. Л. Тарасова
34.1 Бактерии можно определять в почве различными методами....... 360
34.2 Бактерии могут использоваться как биоудобрения.............. 363
34.3 Бактерии могут вызывать болезни растений.................... 371
34.4 Бактерии могут способствовать росту и устойчивости растений. 376
34.5 Бактерии участвуют в биоразложении загрязнении почвы........ 380
Глава 35. Прокариоты в промышленных технологиях................................. 385
X. Сахм. Перевод К. Л. Тарасова
35.1 Для промышленного использования важен отбор ограниченного числа оп-
тимизированных штаммов......................................... 386
35.2 Способ промышленного культивирования микроорганизмов зависит от
осуществляемого процесса....................................... 388
35.3 Важная область биотехнологии связана с пищевой промышленностью... 391
492 Оглавление
35.4 Получение L-аминокислот и витаминов не относится к классическим бро-
дильным производствам............................................... 395
35.5 Бактерии способны осуществлять специфические превращения стероидов
и стеролов в определенные гормоны................................... 401
35.6 Антибиотики представляют собой микробные продукты, подавляющие
метаболизм других организмов........................................ 403
35.7 Промышленное производство бактериальных ферментов............ 407
35.8 С помощью технологии рекомбинантной ДНК получают гетерологичные
белки............................................................... 411
Глава 36. Прокариоты и окружающая среда .......................................... 415
Б. Шинк. Перевод К. Л. Тарасова
36.1 Поступление сточных вод интенсифицирует природные процессы биоде-
градации ........................................................... 416
36.2 Компостирование вновь получает распространение............... 423
36.3 Питьевая вода также может требовать предварительной микробной обра-
ботки .............................................................. 424
36.4 Очистка газообразных отходов — еще одна сфера применения аэробных
бактерий............................................................ 424
36.5 Биологическое восстановление почв находит все большее применение.... 424
36.6 Применение биосенсоров основано на специфичности и разнообразии осу-
ществляемых ими биохимических реакций............................... 427
36.7 Литотрофпые бактерии извлекают металлы из руд................ 428
Глава 37. Прокариоты и человек: возможности, перспективы и
опасности .......................................................................... 4зо
А. Пюхлер. Перевод К. Л. Тарасова
37.1 От прошлого к будущему: секвенирование бактериальных геномов приве-
дет к перевороту в прикладной микробиологии........................ 430
37.2 Будущие медицинские аспекты изучения прокариот: создание новых ле-
карств, вакцин и способов диагностики будет основываться на знании мо-
лекулярных механизмов.............................................. 432
37.3 Будущие сельскохозяйственные аспекты изучения прокариот: необходимы
более детальные исследования фитопатогенных и полезных бактерий ... 432
Оглавление 493
37.4 Будущие направления использования прокариот для очистки окружаю-
щей среды связаны с изучением биоразнообразия, анализом структуры
сообществ и поиском условий культивирования.................. 433
37.5 Перспективы промышленного использования прокариот: штаммы-проду-
центы можно будет генетически модифицировать в желаемом направле-
нии ......................................................... 434
37.6 Возможный риск применения генетически модифицированных бактерий
и пути его преодоления: во всем мире разрабатываются соответствующие
правила и законы............................................. 436
Указатель латинских названий............................................... 440
Предметный указатель....................................................... 449