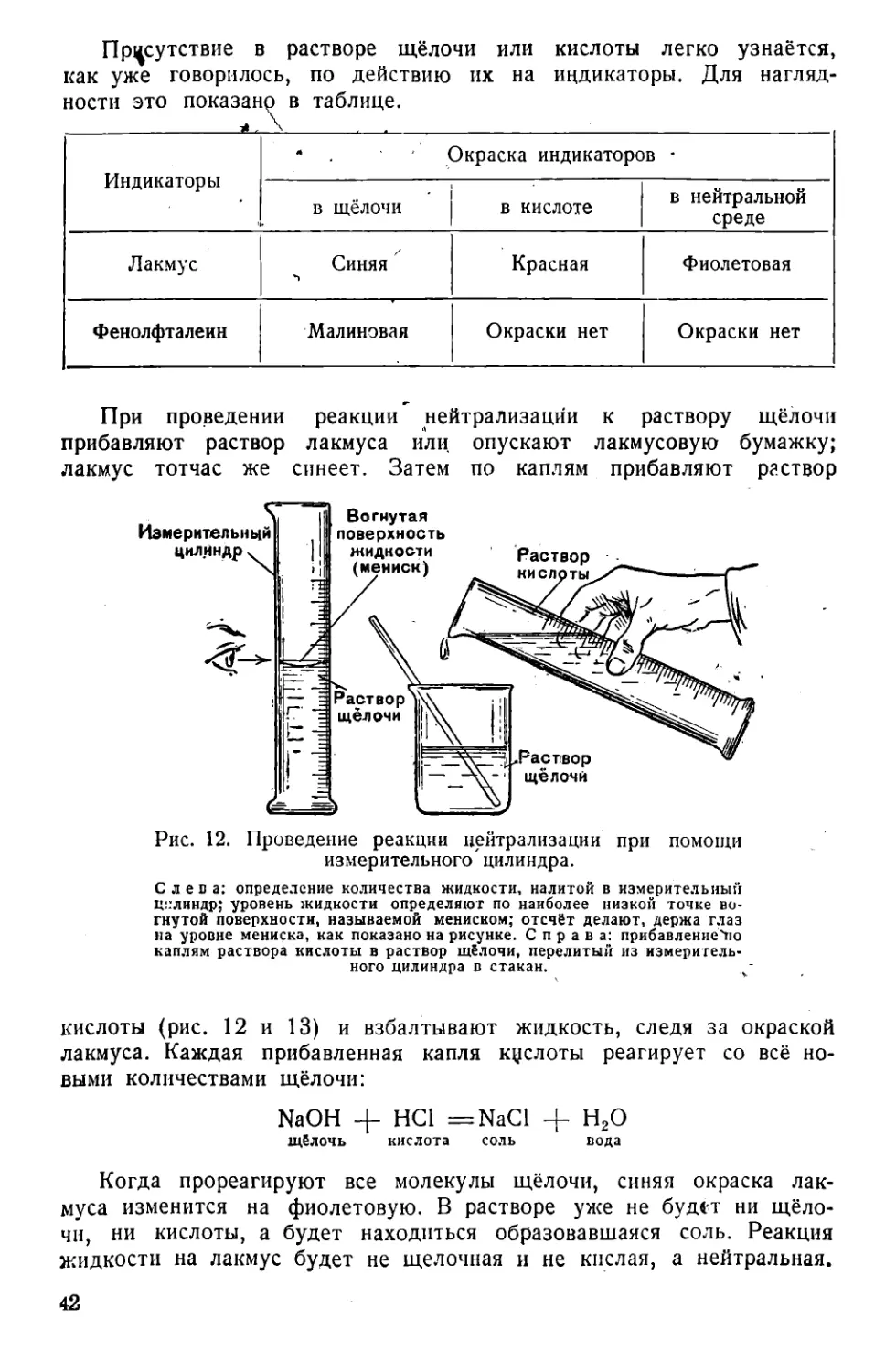
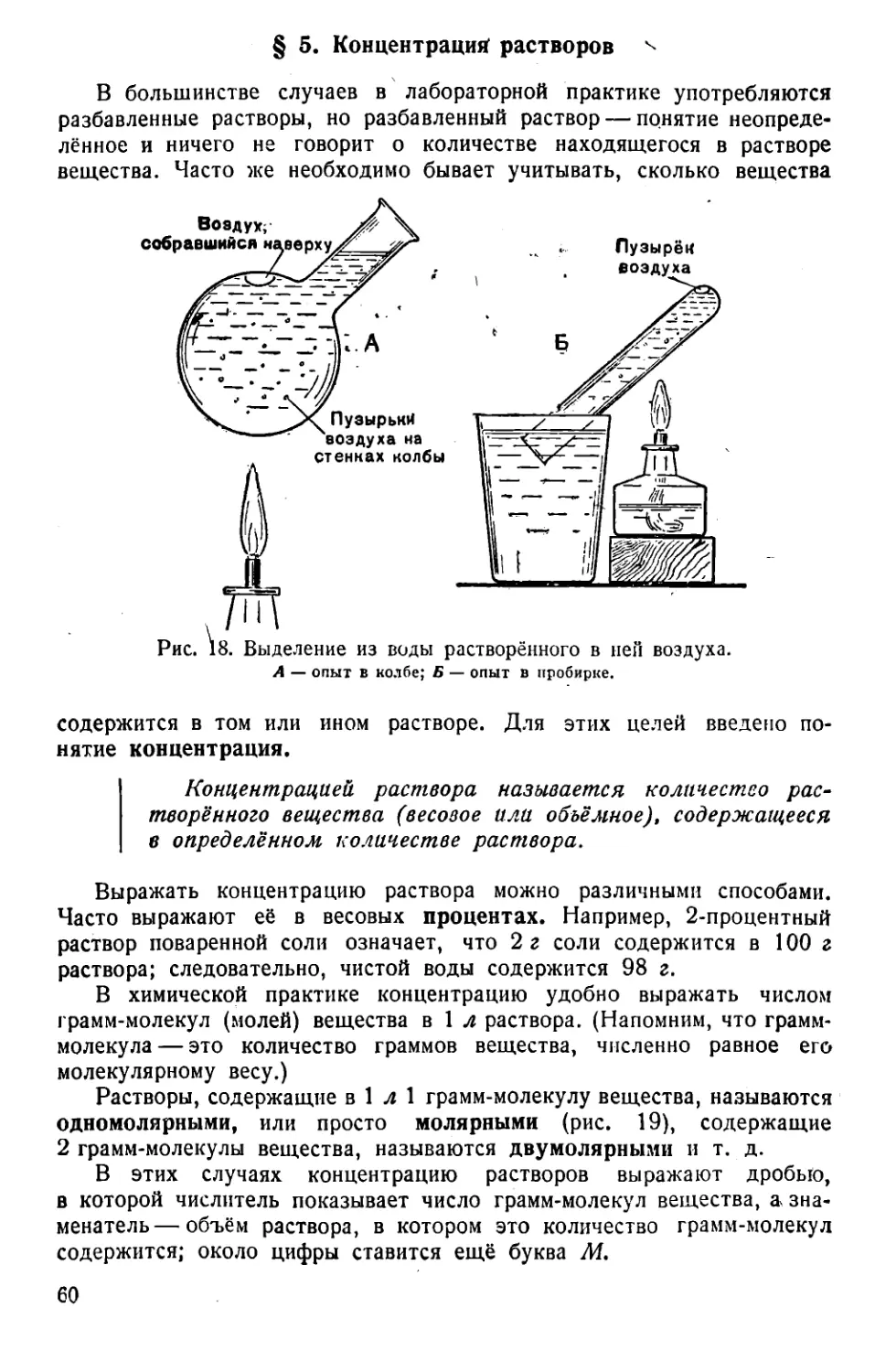
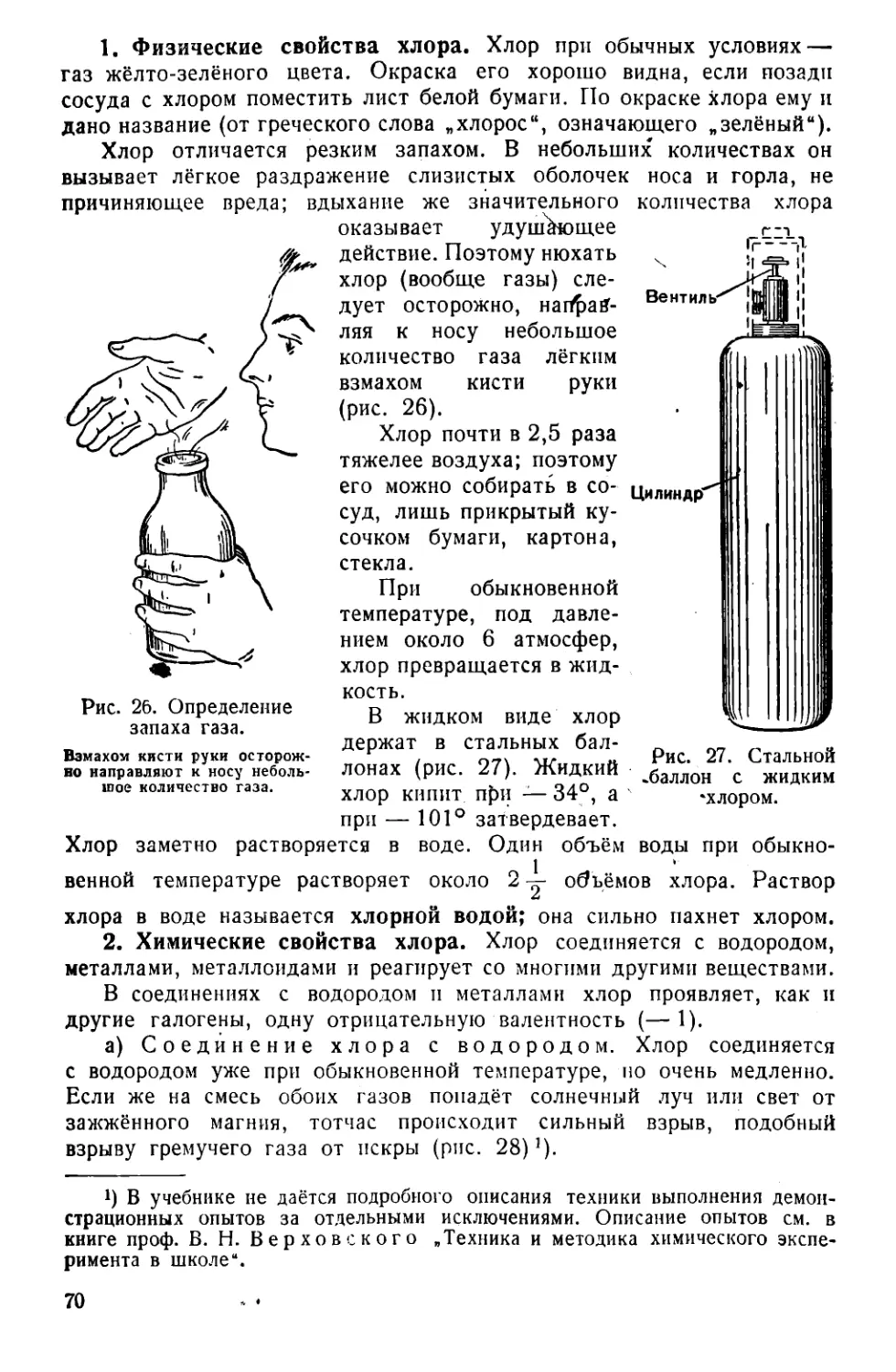
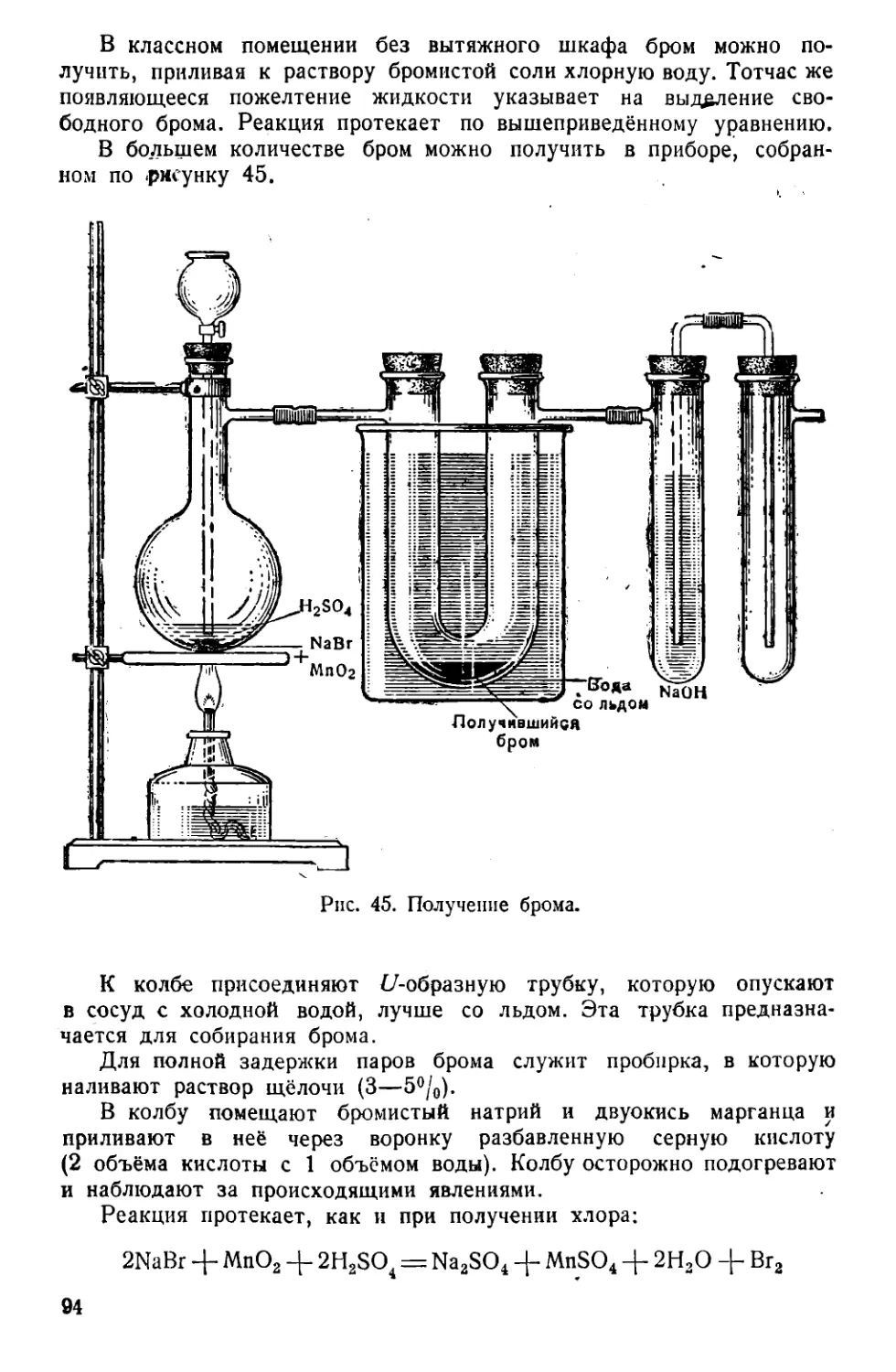
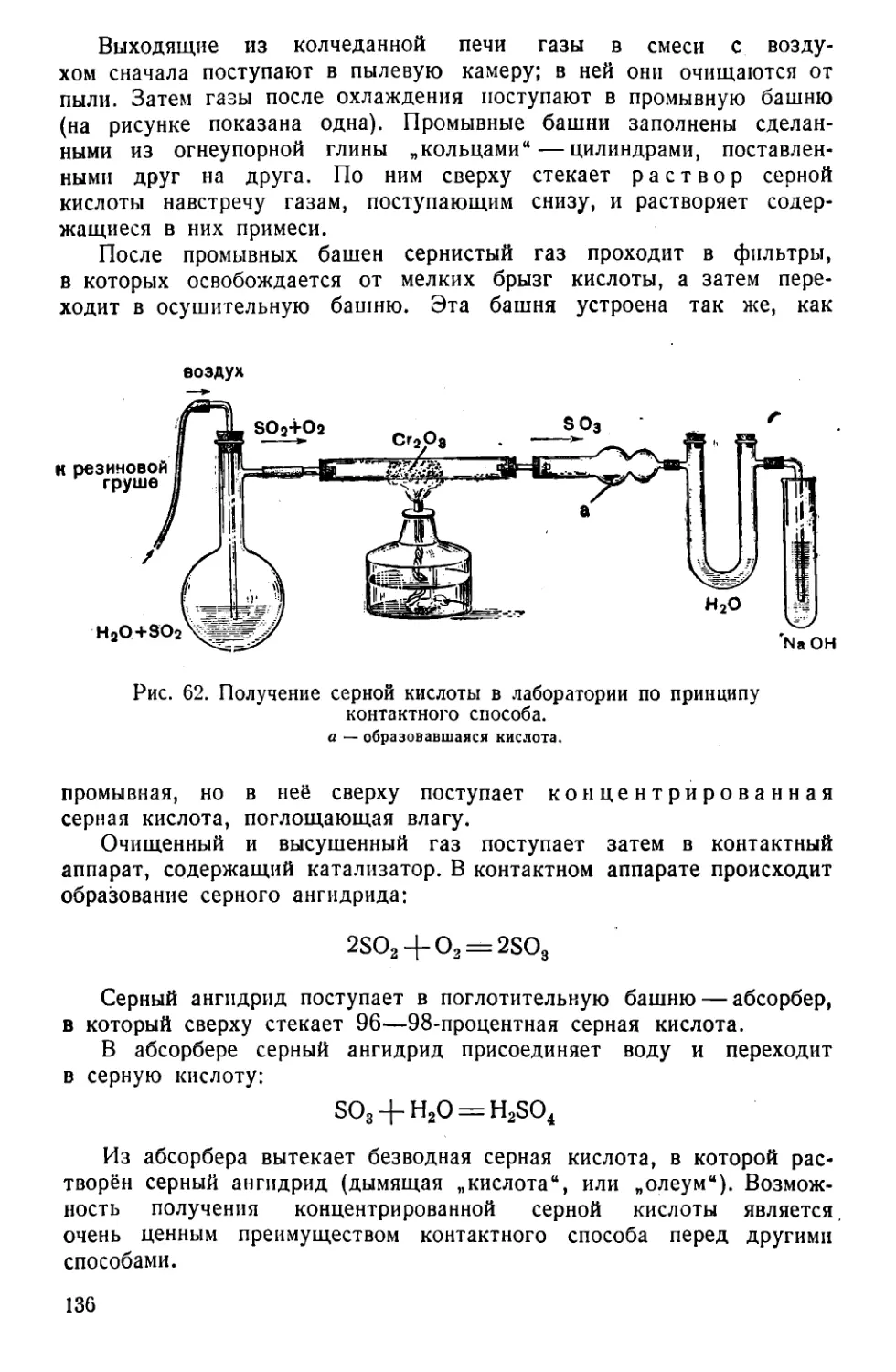
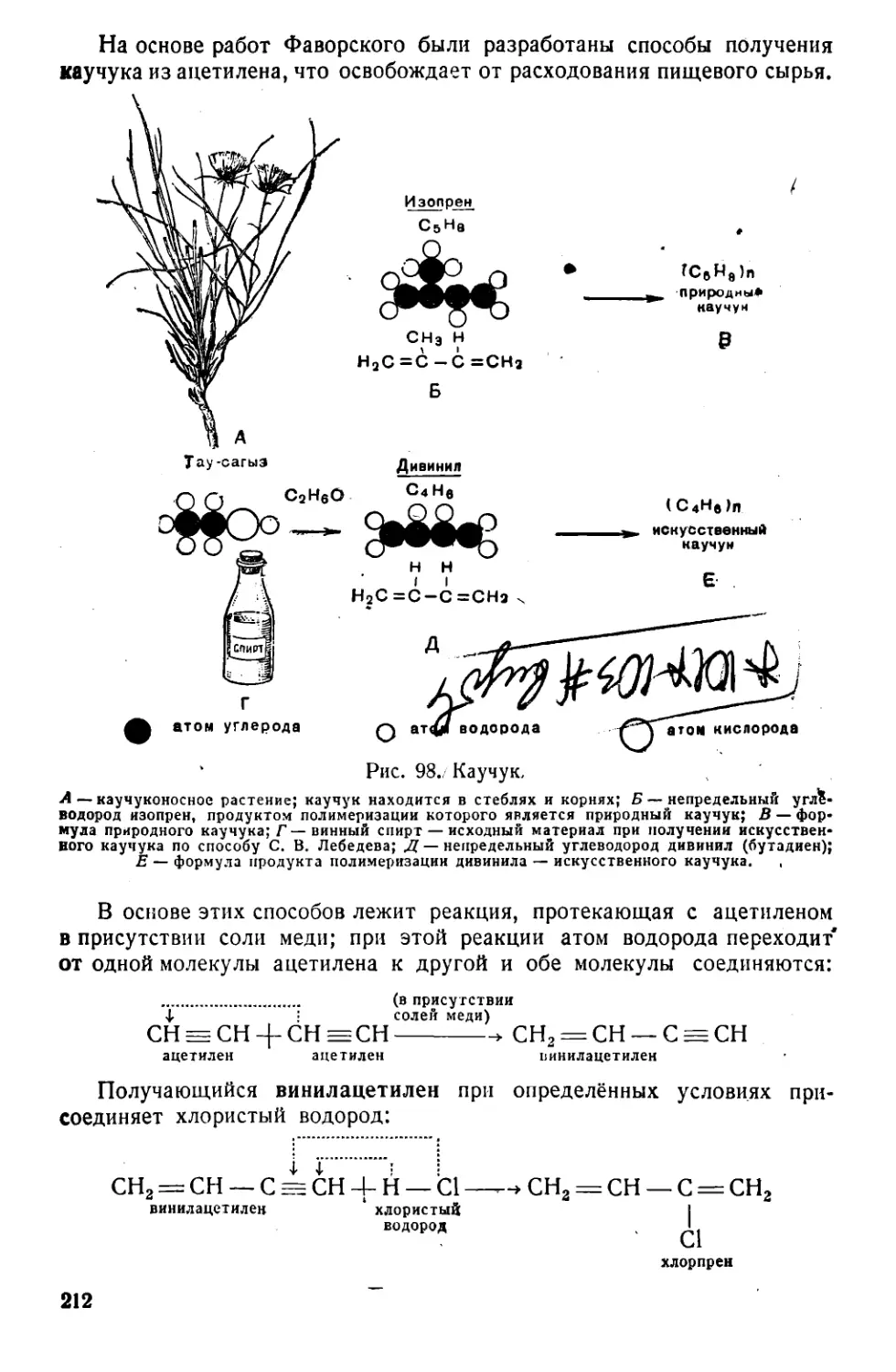
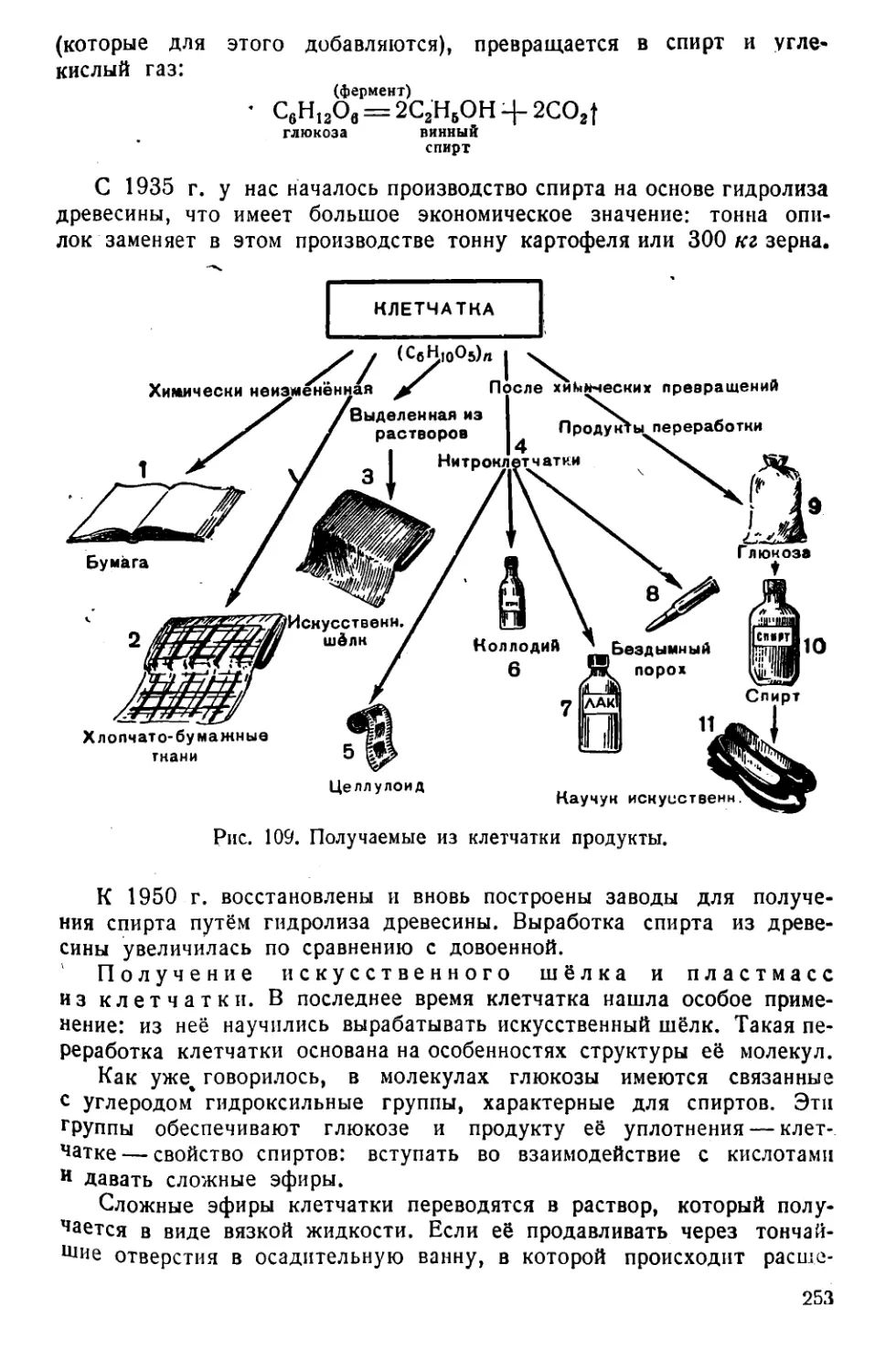
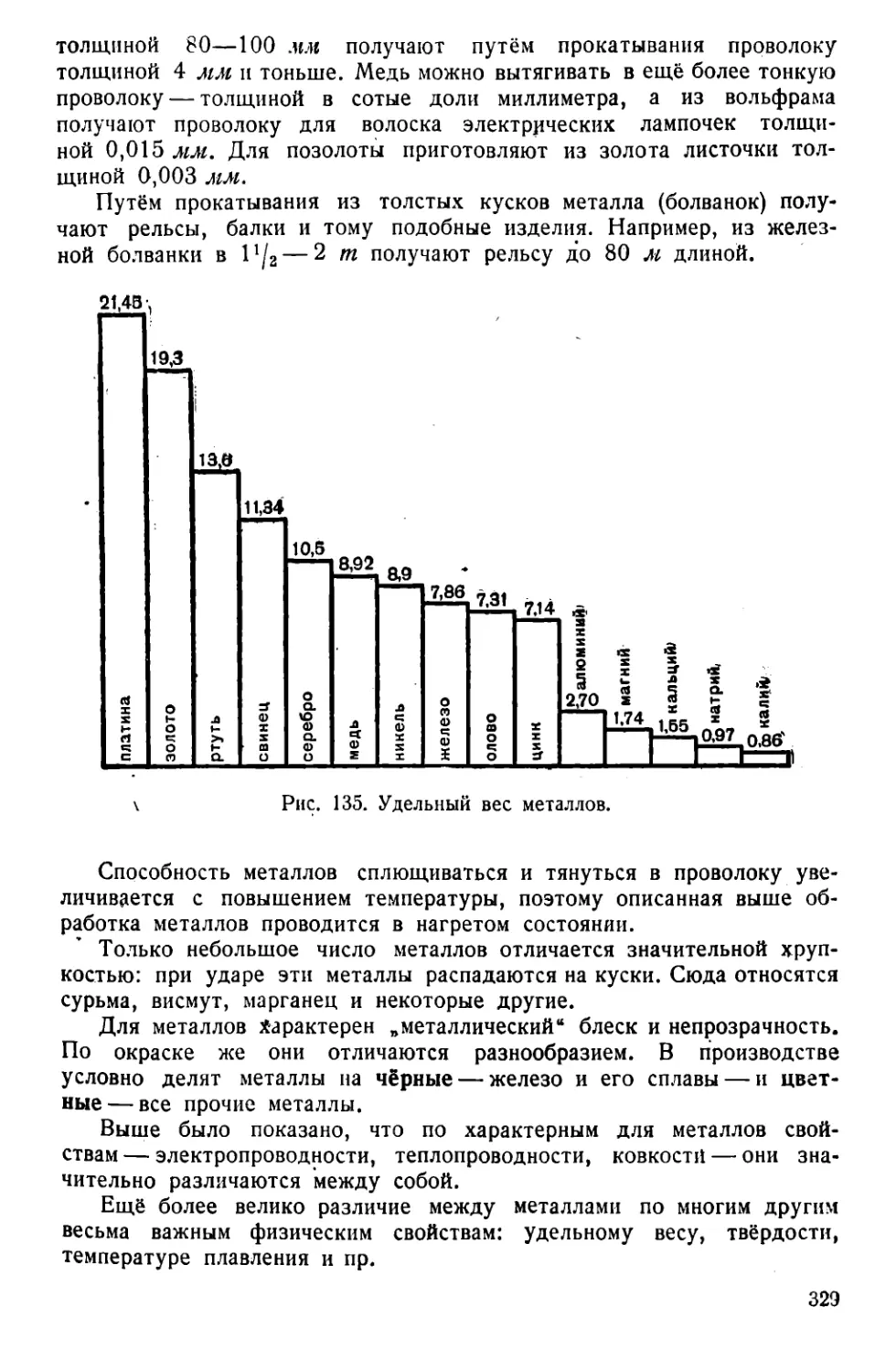
Текст
http://biotex.ibss.org.ua
УЧЕБНИК
для 8 1О КЛАССОВ
СРЕДНЕЙ ШКОЛЫ
УЧПЕДГИЗ
1 9 5*4
Доктор химических наук проф. В. В. ЛЕВЧЕНКО,
М. А. ИВАНЦОВА, Н. Г. СОЛОВЬЁВ и В. В. ФЕЛЬДТ
химия
УЧЕБНИК ДЛЯ VIII—X КЛАССОВ
СРЕДНЕЙ ШКОЛЫ
Под редакцией
доктора химических наук проф. С. А. БАЛЕЗИНА
Утверждён
Министерством просвещения РСФСР
ИЗДАНИЕ СЕДЬМОЕ
ГОСУДАРСТВЕННОЕ
УЧЕБНО-ПЕДАГОГИЧЕСКОЕ ИЗДАТЕЛЬСТВО
МИНИСТЕРСТВА ПРОСВЕЩЕНИЯ РСФСР
Москва — 1954
ПРЕДИСЛОВИЕ
В учебнике по каждой теме сначала излагается теоретический
материал с широким привлечением демонстраций опытов. После
теоретической части приводятся вопросы для повторения.
Теоретический материал при описании элементов и их соедине-
ний даётся во всех случаях по одному плану. Это способствует
систематизации получаемых на уроке знаний, более резкому отте-
нению индивидуальных особенностей веществ на фоне общих свойств
веществ одного класса, обеспечивает сознательное усвоение изучае-
мого материала, облегчает его запоминание.
Изучение химии может быть полноценным только в том случае,
если учащиеся на проводимых ими самими опытах знакомятся с ве-
П ществами и их превращениями. Поэтому выполнение практических
работ по каждой изучаемой теме является непременным условием
/ успешного изучения химии.
__ Практические работы даются во второй части книги. Они по-
добраны так, что учащиеся, выполняя их, приобретают не только
знания о веществах, их свойствах и превращениях, но и навыки хи-
мического экспериментирования.
Исходя из образовательной и воспитательной ценности работ
с малыми количествами веществ, ряд опытов даётся именно в такой
постановке. В тех случаях, когда это целесообразно, предлагается
проведение их с бблыпими количествами веществ.
Иногда в учебнике даётся описание опытов в нескольких вари-
антах разной степени сложности. Это делается для того, чтобы
учитель, исходя из имеющихся возможностей, мог сделать выбор.
Более сложные опыты могут быть проведены на кружковых занятиях.
Всех читателей авторы просят сообщить свои замечания и по-
желания.
3
ВВЕДЕНИЕ
1. Задачи советской химии. Химическая промышленность
в дореволюционной России, несмотря на работы отдельных гени-
альных русских учёных-химиков, без которых невозможно предста-
вить развитие современной химии, занимала одно из сайых послед-
них мест в народном хозяйстве страны.
Мощный подъём химической промышленности начался в годы
советской власти, особенно в годы сталинских пятилеток. За это
время в Советском Союзе заново построена химическая промыш-
ленность, созданы десятки крупных научно-исследовательских ин-
ститутов, занимающихся вопросами химии, подготовлены тысячи
инженеров-химиков, с успехом работающих в нашей промышленности.
Характеризуя эти успехи химической промышленности, И. В. Сталин
говорил: „У нас не было серьёзной и современной химической про-
мышленности. У нас она есть теперь" *)•
Советское правительство и Коммунистическая партия уделяют
большое внимание развитию химии. Это вполне понятно, так как
трудно сейчас найти такую отрасль промышленности, где бы химия
ие имела места. Наши мощные металлургические заводы являются
комплексным производством по химической переработке сырья, в ре-
зультате которой получается такой необходимый для страны мате-
риал, как металл. Самый процесс выплавки чугуна основан на хими-
ческой реакции восстановления окислов железа.
Электрохимия даёт такой прекрасный лёгкий металл, как алюми-
ний; твёрдые и прочные сплавы металлов, необходимые для самолё-
тов и других сложных машин; нержавеющую сталь, нужную гдля
нашей машиностроительной и оборонной промышленности.
Из отбросов производства химики готовят ценные продукты. Так,
например, при выплавке меди улавливаются тысячи тонн сернистого
газа, из которого получаются такие необходимые для народного хо-
зяйства продукты, как сера и серная кислота.
Больших успехов химическая промышленность достигла за по-
следние годы в области производства азотной кислоты и её солей.
Продукты этой промышленности широко применяются в качестве
!) Сталин, Вопросы ленинизма, изд. 11, стр. 373.
4
удобрений - в сельском хозяйстве. Без азота нет пороха, большинства
взрывчатых веществ, анилиновых красителей, целого ряда медика-
ментов и т. д.
Не так давно сырьём для азотной промышленности служили
залежи чилийской селитры, находящейся в Южной Америке. Страны,
где не было залежей азотных солей, находились в зависимом по-
ложении от Америки. В то же время необъятным источником азота
является воздух, но азот воздуха не был доступен промышленности.
Усилиями химиков найдены были способы получения „связанного"
азота из воздуха.
Для нас получение связанного азота из воздуха есть прежде
всего задача повышения урожая совхозных и колхозных полей, изго-
товления медикаментов и продуктов повседневного обихода, а также
развития оборонной промышленности.
Раньше необъятные леса нашей страны хищнически вырубались
помещиками царской России, причём только всей древесины
использовалась в качестве полезного материала, а остальные 2
оставались в лесу в виде отбросов — хвои, листьев, сучьев, пней,
коры и т. д.; пропадало большое количество древесины и при
окончательной обработке дерева — опилки, щепа; теперь, пользуясь
методами современной химии, из древесины и её отбросов выраба-
тывается целлюлоза — основной материал для производства бумаги
и искусственного шёлка. Сухая перегонка дерева даёт скипидар —
продукт, необходимый для лако-красочной промышленности, уксус-
ную кислоту, древесный спирт и т. д. Из коры дерева получаются
дубильные экстракты.
Сотни тысяч тракторов и автомобилей работают на совхозных
и колхозных полях, они нуждаются в горючем и смазочном
материалах. Для удовлетворения этих потребностей при помощи
химических методов переработки нефти, малоценных бурых углей
изготовляется в нужном количестве горючее и смазочное для
моторов.
Автомобили и самолёты требуют большого количества каучука
и резины. Добыча натурального каучука, несмотря на её большой
рост, не могла удовлетворить всей потребности в резиновых изде-
лиях. Перед химиками стояла задача получения синтетического
каучука, и эта задача успешно была разрешена советскими хими-
ками.
„У нас имеется в стране всё, кроме разве каучука. Но через
год-два и каучук мы будем иметь в своём распоряжении" Так
определил задачу советских химиков И. В. Сталин в своём высту-
плении на первой Всесоюзной конференции работников социалисти-
ческой промышленности 4 февраля 1931 г.
Эту задачу советские химики с честью выполнили. Советская
промышленность синтетического каучука теперь полностью удовле-
творяет потребности нашей страны в каучуке.
9 Сталин, Вопросы ленинизма, изд. 11, стр. 324.
5
Получение высококачественного металла, жидкого топлива, повы-
шение урожайности, искусственного каучука, искусственного волокна,
новых источников продуктов питания, медикаментов и пр. — вот.
основные задачи химии в нашем социалистическом хозяйстве.
Дальнейшее развитие получила промышленность органичешотш
синтеза на базе переработки углей и побочных продуктов нефте’
переработки.
По пятилетнему плану восстановления и развития народного хо-
зяйства намечалось увеличить уровень производства химической про-
мышленности по сравнению с довоенным в 1,5 раза. Эт.о в первую оче-
редь относилось к производству минеральных удобрений: фосфорных,
азотных, калийных и т. д. Созданы новые отрасли химической про-
мышленности на основе переработки углей и нефтепродуктов, обеспе-
чивающие широкий выпуск полупродуктов для промышленности пласти-
ческих масс, анилинокрасочной, лако-красочной и фармацевтической^
Пятилетний план предусматривал создание новых химических
заводов, на основе внедрения новой техники, непрерывных методов
производства и интенсификации химических процессов.
Большое место в пятилетием плане занимала промышленность
по производству синтетического каучука, искусственного шёлка, по
переработке древесины на целлюлозу, изготовлению из отходов
лесной промышленности спирта, скипидара, уксусной кислоты й
других продуктов.
Итоги пятилетнего плана показывают, что всё перечисленное выше
выполнено с превышением.
Важнейшие открытия в области химии сделали её одним из
основных факторов развития производительных сил народного
хозяйства и источником новых средств материальной культуры.
Химическая промышленность и химическая наука в нашей стране
служат одним из могучих средств в деле успешного построения
коммунистического общества, в то время как в капиталистических
странах химия является средством обогащения отдельных капита-
листов и широко используется для разрушительных целей в войнах,
подготовляемых империалистами всех стран.
Химия — замечательная наука. Она открывает не только новые про-
дукты и новые источники сырья для их получения, но даёт и неограни-
ченные возможности в развитии всех отраслей народного хозяйства.
2. Роль русских химиков в развитии химической
науки и промышленности. Великие достижения советских
химиков имеют славные традиции своих предшественников.
Основателем химии как науки является гениальный русский учё-
ный М. В. Ломоносов (1711 — 1765). Нет области знания, с ко-
торой бы не было связано имя этого поистине богатыря науки.
Он является создателем русского литературного языка, первым
геологом, географом, физиком, астрономом, химиком и металлургом.
М. В. Ломоносову принадлежит открытие одного из фундамен-
тальных законов химии — закона сохранения веса вещества, с кото>
рым вы уже познакомились в VII классе.
6
М. В. Ломоносов является также создателем атомно-молекуляр-
ного учения о строении вещества. Усилиями Ломоносова была создана
первая научно-учебная химическая лаборатория (1748), где он выполнил
много научных исследований в области химии и физики, а также обучал
химии своих учеников.
С именем Ломоносова связано у нас создание ряда таких отраслей
промышленности, как стекольная промышленность, фарфоровая, изго-
товление цветных стёкол, красок и т. д.
Современную химическую науку нельзя себе представить без работ
великого русского учёного Д. И. Менделеева (1834—1907).
Менделеев, подобно Ломоносову, работал не только в области химии,
но и в области физики, метеорологии, экономики промышленности.
Особенно большое внимание Менделеев уделял разработке вопросов,
связанных с переработкой нефти и с её использованием в народном
хозяйстве. Все помыслы его были направлены к укреплению и развитию
отечественной промышленности.
Величайшим достижением химической науки является открытие
Менделеевым периодического закона и создание на основе этого закона
периодической системы химических элементов, носящей имя её созда-
теля. Мы с полным правом можем называть Д. И. Менделеева отцом
современной химии.
Если Менделееву принадлежит создание одного из основных
законов в области химии, в частности в области неорганической
химии, то развитие современной органической химии нельзя себе
представить без работ другого выдающегося русского химика
А. М. Бутлерова (1828—1886).
А. М. Бутлеров первый разработал теорию строения органических
соединений, которая позволила привести в систему бесчисленное коли-
чество органических веществ, а также дала в руки химиков метод
получения новых соединений.
Продолжатели работ Бутлерова русские учёные: В. В. Марков-
ников, А. Е. Фаворский, С. В. Лебедев, Н. Д. Зелинский
и многие другие — оказали огромное влияние на создание современной
химии органических соединений. Современная промышленность синте-
тического каучука, получение разнообразного количества пластических
масс развиваются на работах этих великих учёных. Русские и советские
учёные внесли неоценимый вклад и в развитие химической промыш-
ленности.
Русский учёный Н. Н. Бекетов, открывший реакцию восста-
новления окислов порошкообразным алюминием, положил основу
алюминотермии, широко применяемой в металлургической промышлен-
ности.
Н. Н. Зинин, открывший реакцию получения анилина, является
основоположником анилинокрасочной промышленности.
А. Е. Фаворский и С. В. Лебедев своими работами заложили
фундамент для производства бесчисленных реакций полимеризации,
которые положены в основу современного производства синтетического
каучука и пластических материалов.
7
Д. И. Менделеев, В. В. Марковников и советский учёный
Н. Д. Зелинский своими работами по изучению нефти создали основу
современной нефтеперерабатывающей промышленности.
Н. Д. Зелинский своими работами в области адсорбции много
сделал для разработки метода изготовления активированных углей,
нашедших применение не только в производстве противогазов, но и
в ряде других отраслей химической промышленности и медицины.
Русский народ с полным правом может гордиться великими творе-
ниями лучших своих представителей.
Советские химики, опираясь на славные традиции великих русских
учёных, превратили химическую науку в передовую область знаний,
обогатили её новыми открытиями и достижениями.
t
ЧАСТЬ ПЕРВАЯ
ГЛАВА I
ВЕЩЕСТВО И ЕГО СТРОЕНИЕ
(Повторение материала VII класса, с дополнениями)
Материя и вещество. Когда мы говорим о материальном
мире, то имеем в виду окружающий нас мир, познаваемый нами через
ощущения органов чувств — зрение, осязание, обоняние и т. д.
„Материя есть то, что, действуя на наши органы чувств,
производит ощущение; материя есть объективная реальность,
данная нам в ощущении.. !).
Рассматривая выставленную на столе химическую посуду: пробирки,
колбы, воронки, стаканы, мы видим, что все эти тела различны по,
своим размерам и форме, но все они состоят из одного и того же
материала, из одного и того же вещества — стекла. Определённые,
конкретные проявления материи, например стекло, железо, вода, воз-
дух, мел и т. д., мы называем веществами. Вещества, ограниченные
друг от друга в пространстве, имеющие форму, мы называем телами.
Материя находится в вечном движении. Ещё Ломоносов писал, что
никакое изменение тел не может происходить без движения.
„Движение есть форма бытия материи. Нигде и никогда не
бывало и не может быть материи без движения** 2).
Формы движения материи разнообразны. Так, например, при ударе
молота о железо железо расплющивается и нагревается. От удара
стали о кремень вылетает искра, от сильного трения тела нагреваются.
Здесь механическое движение (удары, трение) переходит в свет и
тепло, но само вещество не изменяется. В таких случаях говорят
о физических формах движения материи, изучение которых является
предметом науки физики.
Совсем другое получается, когда кусок блестящей стали длитель-
ное время находится во влажной атмосфере. На поверхности стали
появляются желтовато-бурые пятна. Вместо блестящего твёрдого ме-
талла — хрупкие жёлто-бурые кусочки ржавчины, по своим физическим
и химическим свойствам отличные от первоначального вещества—стали.
х) Ленин, Соч., т. XIII, изд. 3, стр. 119.
2) Ф. Энгельс, Анти-Дюринг, 1948, стр. 56.
9
В данном случае изменилась не только внешняя форма тела, но из-
менилось и вещество.
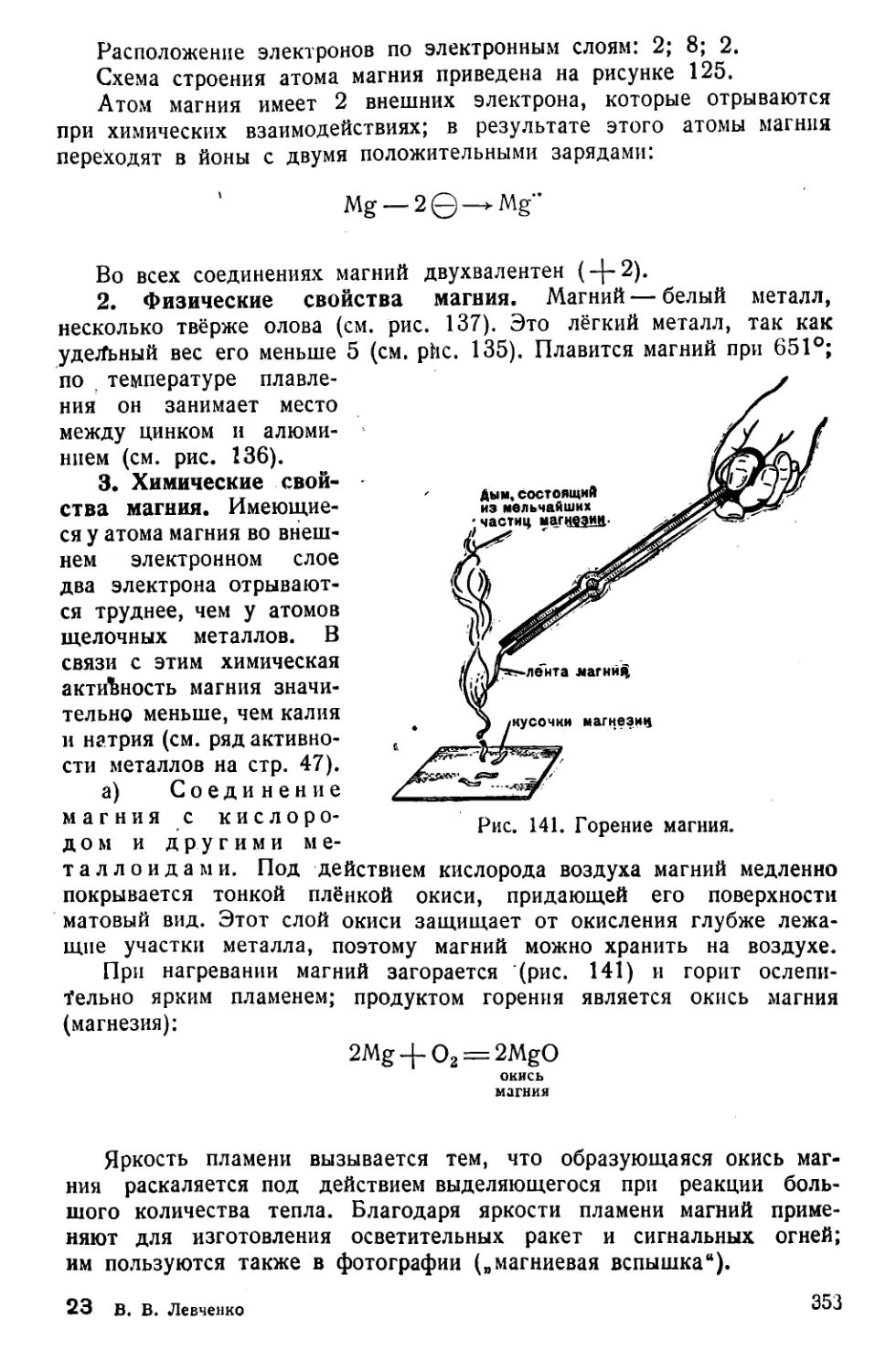
Если взять ленту металлического магния и поджечь её — магний
сгорает с ослепительно ярким светом, а в результате горения обра-
зуется новое вещество — белый порошок, окись магния.
Такие формы движения материи, когда коренным образом изме-
няется, превращается вещество, называются химическими формами
движения, или химическими реакциями.
Следовательно, химия — наука, изучающая свойства веществ,
их превращения, а также явления, сопровождающие эти превра-
щения.
Для правильного понимания превращений, происходящих с веще-
ствами, необходимо иметь и правильное представление прежде всего
о строении вещества. Наши знания о веществах, об их строении
развивались постепенно благодаря трудам многих поколений учёных,
исследовавших природу.
В деле развития химической науки, как мы уже говорили, осо-
бенно велики заслуги наших русских и советских учёных, начиная
с М. В. Ломоносова. (
§ 1. Молекулярно-атомистическое учение
Ещё в древности греческим философом Демокритом и др. (V в.
до н. э.) было высказано предположение о том, что все тела природы
состоят из мельчайших, далее неделимых частиц — атомов (слово
„атом" в переводе означает „неделимый").
Представление о существовании отдельных частиц, из которых
состоят все вещества — твёрдые, жидкие и газообразные,— сначала
применялось для объяснения физических явлений.
М. В. Ломоносов, далеко опередивший учёных своего времени,
ввёл в химию учение об атомах и молекулах.
Исходя из представлений о корпускулярном (молекулярном — по-
современному) строении вещества, он дал правильное объяснение
явлениям, которые даже виднейшие учёные того времени толковали
совершенно превратно.
Михаил Васильевич Ломоносов родился в 1711 г. в деревне Денисовке на
Северной Двине в семье рыбака. В те времена путь к науке для людей про-
стого звания был чрезвычайно затруднён. Большая одарённость, поразительная
любовь к науке, настойчивость и трудолюбие помогли Ломоносову, выходцу
из простого народа, стать великим учёным и мыслителем, далеко опередившим
виднейших заграничных учёных того времени.
В 1730 г., обучившись грамоте у дьячка, Ломоносов отправился с зимним
обозом в Москву учиться. Благодаря исключительным способностям и настой-
чивости он добился принятия в Славяно-греко-латинскую академию и почти
20-летним юношей стал учиться вместе с десятилетними мальчиками. Ломоносов
проявил такие успехи в науках, что впоследствии был командирован в Петербург
в Академию наук.
Для дальнейшего усовершенствования в пауках Ломоносова послали за
границу, где он усвоил всё, чему могли его научить виднейшие учёные того
времени.
in
М. В. Ломоносов
(1711—1765).
В 1741 г. Ломоносов вернулся в Россию, и тогда началась его кипучая
научная и практическая деятельность. Она всё время сопровождалась борьбой
с академическим начальством, состоящим из немцев по происхождению. Они
тормозили работу Ломоносова, не создавали ему необходимых условий, не пе-
чатали его научных трудов.
Несмотря на это, в различных научных областях он намного опередил
своих заграничных учителей. М. В. Ломоносов по праву считается основопо-
ложником и создателем многих наук — химии, физики, геологии, географии,
истории и др.
В области химии он открыл закон сохранения веса веществ, дал объяснения
многим физическим и химическим явлениям, в частности процессам горения и
ржавления металлов, положил начало новой в то время науке — физической
химии — и первый стал работать в этой области.
Много он сделал для развития отечественной прикладной химии. В 1742 г.
написал первую на русском языке книгу по металлургии, разработал рецепты
цветных стёкол и построил фабрику, где изготовлялись мозаичные картины.
11
Кроме того, он знаменит как поэт и преобразователь русского литера-
турного языка.
Ломоносов был членом российской, шведской и болонской академий наук.
Умер он в 1765 г.
Значение Ломоносова в истории русской, культуры исключительно велико.
Он был гений, вышедший из народа и служению ему посвятивший свою
жизнь; он показал, какие неисчерпаемые возможности таятся в народах, насе-
ляющих нашу родину.
Современники Ломоносова объясняли горение существованием осо-
бого „вещества огня" — „флогистона" (название от греческого слова,
означающего „горючий"). Они были убеждены, что при прокали-
вании металлов и при горении веществ из них выделяется фло-
гистон.
Учение о флогистоне в начале своего зарождения (около 1700 г.)
имело определённое положительное значение, так как давало хоть
какое-либо объяснение большому количеству накопившихся разроз-
ненных наблюдений. Кроме того,— что особенно важно,— оно по-
буждало к попыткам выделить в свободном виде „вещество огня"
путём постановки всё новых и новых опытов. Эти опыты хотя и не
приводили к получению „вещества огня", Йо обогащали науку но-
выми весьма ценными наблюдениями и открытиями.
Ко времени начала научной деятельности Ломоносова учение
о флогистоне стало уже тормозить дальнейшее развитие химической
науки. Настало время отказаться от него, однако это учение сдела-
лось настолько привычным и общепринятым, что большинство учё-
ных предпочитало давать явлениям, противоречащим этому учению,
искусственные объяснения, лишь бы не отказываться от привычных
взглядов. Необходим был гений такого учёного, как Ломоносов,
чтобы смело отбросить признаваемые всеми мнения и заменить их
новыми.
Ломоносов решительно отверг учение о таинственном „веидестве
огня" и дал своё объяснение химическим явлениям, происходящим
при прокаливании металлов и горении.
Он на основании своих опытов утверждал, что при горении и
прокаливании металлов вовсе не выделяется какой-то таинственный
флогистон, а происходит присоединение к горящему веществу частиц
из воздуха. Ломоносов не знал, что это за содержащееся в воздухе
вещество, частицы которого присоединяются к металлам и горящим
телам (состав воздуха и кислород тогда ещё не были известны), но
сущность рассматриваемых явлений он объяснил правильно, вопреки
господствовавшим в то время представлениям.
Выводы Ломоносова настолько просто и ясно разрешали труд-
нейшие вопросы современной ему физики и химии, что один из
крупнейших учёных того времени, русский академик Эйлер, после
ознакомления с его трудами дал им такую характеристику: „Все
записи его по части физики и химии не только хороши, но превос-
ходны, ибо он с такой основательностью излагает любопытнейшие
совершенно неизвестные и необъяснимые для величайших гениев
12
предметы, что я вполне убеждён в верности его объяснений*.
Позднее Эйлер отметил у Ломоносова „счастливое умение расширять
пределы истинного познания природы. Нынче такие гении весьма
редки; они большей частью останавливаются на одних опытах и не
хотят даже рассуждать о них, или впадают в такие нелепые рас-
суждения, которые противоречат всем началам здравого нравоучения*
(т. е. смысла).
На много лет позже английский физик и химик Дальтон
(1766—1844) опубликовал работу (1808), в которой, исходя из
представления об атоме, излагал стройную гипотезу (предположение)
о сущности процессов, происходящих с веществами при химических
превращениях. Эту гипотезу стали применять для объяснения вновь
открываемых явлений, проверять опытным путём; постепенно выясни-
лось, чтб в представлениях Дальтона соответствует действительности
и чтб является ошибочным.
Благодаря трудам многих учёных создалось наше знание о веще-
стве и из гипотезы развилась научная теория, получившая название
молекулярно-атомистической теории. Эта теория имеет для химии
первостепенное значение.
Сущность молекулярно-атомистической теории заключается в сле-
дующем:
1. Все вещества состоят из молекул.
I Молекулы — это наименьшие частицы данного вещё-
I ства, сохраняющие его состав.
2. Молекулы состоят из ещё меньших частиц — атомов.
I Атомы — это наименьшие частицы, из которых со-
I стоят молекулы.
3. Атомы и молекулы находятся в беспрерывном движении.
§ 2. Основные химические понятия
1. Химический элемент. В природе существуют различные атомы,
как бы виды или сорта атомов; они различаются атомным весом,
способностью соединяться с другими атомами и прочими свойствами.
I Определённый вид атомов с одинаковыми химическими
I свойствами называется химическим элементом.
Под названием „химический элемент* следует подразумевать
определённый вид (сорт) атомов независимо от того, свободны они
или соединены в молекулах. Например, название „элемент кислород*
одинаково относится к атомам кислорода, взятым в отдельности,
и к атомам кислорода, входящего в состав молекул, например
воды.
13
2. Простые и сложные вещества. Из атомов образуются моле-
кулы простых и сложных веществ.
Простыми веществами называются такие вещества,
молекулы которых состоят из атомов одного элемента.
Например, водород и кислород — простые вещества; молекулы
каждого из них образованы атомами только одного элемента того же
названия.
Молекулы простых газообразных веществ в большинстве случаев
состоят из двух атомов; например, молекулы водорода: Н2, кисло-
рода: О2, азота: N2.
Сложными веществами называются такие вещества,
молекулы которых состоят из атомов разных элементов.
Например, вода — сложное вещество; молекулы её образованы
атомами двух разных элементов — водорода и кислорода.
3. Атомный вес. Для элементов одним из характерных’ свойств
является атомный вес.
Учёными было, потрачено мног^ труда, чтобы найти способы
определения веса атомов. В настоящее время удалось установить вес
атомов всех элементов. •
Выражать вес атомов в граммах неудобно, так как грамм по
сравнению с весом атомов слишком большая величина.
Например, вес атома водорода равен
0,000 000 000 000 000 000 000 001 663 г;
первая значащая цифра в этой дроби стоит в 24-м десятичном
знаке. !
Вес атома кислорода равен дроби, в которой первая значащая
цифра стоит в 23-м десятичном знаке:
0,000 000 000 000 000 000 000 026 608 г.
Ради практического удобства за единицу меры веса атомов при-
1
нята Уб часть веса атома кислорода.
Эта единица меры веса атомов получила название „кислородной
единицы"; краткое обозначение её: к. е.
I Атомным весом элемента называется вес его атома,
I выраженный в кислородных единицах.
Например, атомный вес серы равен 32,06 к. е.
Атомный вес показывает, во сколько раз атом данного элемента
1 .
тяжелее части веса атома кислорода. Атомные веса элементов
указаны в таблице элементов, помещённой на рисунке 25.
4. Молекулярный вес.
Молекулярным весом вещества называется вес его мо-
лекулы, выраженный в кислородных единицах.
14
Например, молекулярный вес водорода Н2 округлённо равен 2.
Молекулярный вес воды Н2О равен 18.
Зная атомные веса элементов, легко подсчитать молекулярный
вес любого химического соединения по его формуле. Например,
молекулярный вес серной кислоты H2SO4 будет равен (атомные веса
элементов берутся в круглых цифрах):
вес двух атомов водорода 2Н
„ одного атома серы S
„ четырёх атомов кислорода 40
равен 1 X 2— 2
равен 32 X 1 = 32
равен 16X4 = 64
Молекулярный вес серной кислоты равен 98.
Числа, выражающие атомный или молекулярный вес, обычно
даются без указания единицы измерения. Необходимо помнить, что
они означают число кислородных единиц.
5. Грамм-атом и грамм-молекула.
Грамм-атом — это количество граммов элемента, чис-
ленно равное его атомному весу.
Например, атомный вес водорода равен 1,0078; грамм-атом водо-
рода равен 1,0078 г. Атомный вес кислорода равен 16; один грамм-
1г-ат, железа 1г-ат. цинка 1 г-ат. свинца
Рис. 1. Грамм-атомы некоторых металлов.
атом кислорода равен 16 г. Атомный вес железа равен 55,8; грамм-
атом железа равен 55,8 г (рис. 1).
Так как грамм-атом — это количество граммов элемента, численно
равное его атомному весу, то в грамм-атоме каждого эле-
мента содержится одно и то же число атомов.
I Грамм-молекула (сокращённо — моль) — это количество
| граммов вещества, численно равное его молекулярному весу.
Например, молекулярный вес водорода Н2 округлённо равен 2;
грамм-молекула водорода округлённо равна 2 г.
Молекулярный вес кислорода О2 равен 32; грамм-молекула кисло-
рода равна 32 г.
15
Г-мол. волы Г-мол. серной
кислоты
Рис. 2. Грамм-молекула воды и
серной кислоты (в стаканах).
Молекулярный вес воды Н2О равен 18; грамм-молекула воды
равна 18 г. Молекулярный вес серной кислоты H2SO4 равен 98;
грамм-молекула серной кислоты равна 98 г* (рис. 2).
Так как грамм-молекула — это количество граммов вещества,
численно равное его молекулярному весу, то в грамм-молекуле
каждого вещества содержит-
ся одно и то же число моле-
кул.
Выражение количества веществ в
грамм-атомах и в грамм-молекулах'
сильно упрощает различные расчёты
научного и практического характера.
6. Физические и химические
явления. Химические реакции. При
физических явлениях состав молекул
не изменяется и взятые вещества со-
храняются, хотя внешний вид тел мо-
жет резко меняться, например при переходе твёрдого тела в жид-
кость, а жидкости в пар и обратно.
При химических явлениях состав молекул изменяется; взятые
вещества превращаются в новые вещества с новыми свойствами.
Процессы, сопровождающиеся превращениями веществ,
называются химическими явлениями, или химическими
реакциями.
Всякое изменение состава молекул приводит к превращению взя-
того вещества в новое вещество с новыми свойствами.
Различают следующие три типа химических реакций:
1. Реакция разложения, в результате которой из одного веще-
ства получаются два или больше других веществ. [
2. Реакция соединения, в результате которой 'из двух или
нескольких веществ получается меньшее число веществ.
3. Реакция замещения, в результате которой атомы молекул
простого вещества замещают атомы какого-либо элемента в мо-
лекулах сложного вещества.
§ 3. Химические законы
1. Закон сохранения веса веществ. М. В. Ломоносов, первый
из химиков широко применявший взвешивание при изучении хими-
ческих явлений, в результате своих многочисленных опытов устано-
вил, что вес веществ, вступивших в реакцию, равен весу веществ,
получившихся в результате реакции.
Таким образом, Ломоносовым был установлен один из основных
законов химии, вошедший в науку под названием закона сохране-
ния веса веществ (рис. 3). Этот закон применим во всех случаях
химических превращений.
16
При всех химических превращениях веществ все атомы молекул
веществ, вступающих в реакцию, переходят в молекулы образую-
щихся веществ. Это, естественно, приводит к закону сохранения веса
вещества, открытого Ломоносовым опытным путём.
2. Закон постоянства состава. Опытным путём, в результате
анализов различных химических соединений, французским химиком
Прустом (1755—1826) было установлено,
имеет строго определённый и по-
стоянный качественный и количе-
ственный состав.
Это означает, что каждое опреде-
лённое вещество, независимо от того,
как оно получено, всегда состоит из
что каждое вещество
одних и тех же элементов, соеди-
нённых друг с другом в строго опре-
делённых весовых количествах. Напри-
мер, вещество вода всегда состоит из
двух элементов: водорода и кислорода,
причём на 2 весовые части водорода
всегда приходится 16 весовых частей
кислорода.
С точки зрения молекулярно-
атомистической теории закон постоян-
ства состава объясняется тем, что
каждое чистое вещество состоит из
молекул, имеющих один и тот же
атомный состав.
Открытие основных химических за-
конов (закона сохранения веса веществ,
Рис. 3. Простейший опыт по
проверке закона сохранения
веса вещества:
А — два стакана с растворами, урав-
новешенные на весах. А1 — после сли-
вания растворов вес не изменился,
хотя образовалось новое вещество
(появился осадок).
закона постоянства состава) и установление молекулярно-атомистиче-
ских представлений о веществе обеспечили быстрое развитие химии
как точной науки.
4 . Химический язык
1. Химические знаки. Химическими знаками называются обозна-
чения атомов химических элементов первыми буквами (одной-двумя)
их латинских названий.
Химический знак элемента показывает:
1—название элемента;
2 — один атом его;
3 — весовое количество элемента, выражаемое атомным весом.
Например, знак Н обозначает: 1) водород, 2) один атом его,
3) весовую часть, равную атомному весу, т. е. 1,0078 кислородных
единиц.
Знак О обозначает: 1) кислород, 2) один атом его, 3) 16 кисло-
родных единиц. 2
2 В. В. Левченко
17
Знак N обозначает: 1) азот, 2) один атом его, 3) 14 кислород-
ных единиц.
В таблице, приведённой в конце книги (см. приложение), даны
для важнейших элементов химические зна^и и произношение их.
2 . Химические формулы. Химической формулой называется изо-
бражение состава молекулы при помощи химических знаков.
Химическая формула обозначает:
1—одну молекулу вещества; / $
2 — качественный состав молекулы;
3 — количественный состав молекулы; i„-'
4 — весовое количество, равное молекулярному десу. •
Условились количество содержащихся в молекуле атомов каждого
элемента указывать маленькой цифрой, проставляемой справа/от хи-
мического знака внизу (индекс). Таким образом, формула М2О озна-
чает: 1) одну молекулу воды, 2) что в состав её входят элементы:
водород и кислород, 3) что в молекулу входят 2 атома водорода,
весящие 2 кислородные единицы, и 1 атом кислорода, весящий
16 кислородных единиц, 4) что молекулярный вес воды равен 18 к. е.
Если надо показать, что в реакции участвуют несколько молекул,
впереди формулы ставится соответствующее число, имеющее тот же
смысл, что и коэффициент в математике.
Например, ЗН2О означает три молекулы воды; 2H2SO4 означает
две молекулы серной кислоты; 20 означает два атома кислорода;
2О2 означает две молекулы кислорода.
Количество атомов в молекулах определяется умножением индекса
на коэффициент. Например, в 3 молекулах серной кислоты 3HaSO4
содержится: 2/3 = 6 атомов водорода, 3X1=3 атома серы,
3X4=12 атомов кислорода.
§ 5. Валентность
1. Первое понятие о валентности. При образовании химических
соединений к атому одного элемента может присоединяться только
определённое число атомов другого элемента. Например, в молекуле
хлористого водорода НС1 к одному атому хлора присоединён один
атом водорода; в молекуле воды Н20 к одному атому кислорода
присоединено два атома водорода. Если знать, какое количество ато-
мов одного элемента присоединяется к атому другого элемента, легко
можно составлять формулы химических соединений этих элементов.
Нет необходимости помнить, какое число атомов того или иного
элемента присоединяет атом каждого другого элемента. Достаточно
знать, какое число атомов водорода способны присоединять атомы
разных элементов или сколько атомов водорода они способны заме-
щать. Для этого необходимо знать их валентность („валентность"—
латинское слово, означающее по-русски „ценность").
Выражают валентность числом, которое показывает, сколько атомов
водорода (или другого одновалентного элемента) может присоединять
пли замещать атом данного элемента.
18
2. Природа валентности. Только в сравнительно недавнее время
удалось установить природу валентности. Подробнее это будет рас-
смотрено в дальнейшем, так как для полного понимания валентности
необходимы определённые знания из курсов физики и химии. Однако
некоторое представление о природе валентности может быть дано и
теперь. Трудами большого числа учёных было установлено, что
атомы способны переходить в особое состояние, при котором они
становятся электриче-
ски заряженными по-
ложительно или отри-
цательно.
' Согласно современ-
ным данным науки,
атомы имеют сложное
строение, напоминаю-
щее солнечную си-
стему.
Рис. 5. Схема строения атома углерода.
В центре атома находится ядро с 6 положительными заряда-
ми. Вокруг ядра вращается 6 электронов. Общий отрица-
тельный заряд электронов (— 6) уравновешивает положитель-
ный заряд ядра (+ 6), и атом электронейтрален. Электроны
расположены двумя электронными слоями: в первом слое —
2 электрона; во втором слое — 4 электрона (валентные элект-
роны). (В результате отрыва четырёх электронов проявляется
положительный заряд ядра, равный -f- 4; в результате
присоединения четырёх электронов атом приобретает заряд,
равный — 4.)
Рис. 4. Схема строения
атома водорода.
В центре атома находится ядро
с одним положительным заря-
дом (+). Вокруг ядра вращает-
ся один электрон (—). Пункти-
ром показан путь движения
электрона. (В результате отры-
ва электрона проявляется по-
ложительный заряд ядра, рав-
ный + 1.)
В центре атома (рис. 4 и 5) находится весьма малого размера
ядро, имеющее положительный заряд. Вокруг ядра вращаются с боль-
шой скоростью электроны (наименьшие частицы отрицательного
электричества). Число вращающихся вокруг, ядра электронов и их
суммарный отрицательный электрический заряд равны заряду ядра;
поэтому атомы в свободном состоянии электронейтральны.
Электроны располагаются вокруг ядра слоями, причём во внеш-
нем слое больше 8 электронов не бывает. От этих электронов в пер-
вую очередь зависит валентность элементов, почему они называются
валентными электронами (рис. 4 и 5).
Атомы, у которых во внешнем слое имеется до 4 электронов,
сравнительно легко теряют их и вследствие этого заряжаются
2* 19
положительно (рис. 4 и 5); те же атомы, у которых во внешнем
слое имеется 4 и больше электронов, могут в зависимости от усло-
вий реакции или терять свои, или присоединять лишние электроны;
в последнем случае они заряжаются отрицательно (рис. 6).
Атомы, перешедшие в заряженное состояние, называются Йонами.
Таким образом (рис. 6), в положительно заряженное состояние
(в положительный йон) атомы переходят .вследствие потери части
принадлежащих им электронов; в отрицательно заряженное состоя-
ние (в отрицательный йон) атомы переходят вследствие присоеди-
нения к ним лишних «электронов.
Рис. 6. Схема образования молекулы хлористого натрия.
Чёрным кружком показано ядро атома и около него заряд (положительный). Кру-
гами показаны электронные слои; цифрами указано число электронов в слое. В атоме
натрия во внешнем слое имеется один электрон (валентный электрон); в атоме
хлора во внешнем слое имеется семь электронов (валентных электронов). Стрел-
ками показано превращение атомов в ионы, в результате перескока электрона от
атома натрия к атому хлора.
Как известно из физики, тела, заряженные разноимённым электри-
чеством, притягиваются, а заряженные одноимённым электриче-
ством— отталкиваются. Многие химические реакции вызываются тем,
что в определённых условиях атомы приобретают разноимённые
заряды, поэтому притягиваются и объединяются в молекулы. Это
происходит при образовании молекул многих сложных веществ,
например хлористого натрия (рис. 6). Иначе происходит образо-
вание молекул простых веществ, состоящих из атомов одного
элемента, как Н2; О2; N2 и т. д., и молекул сложных веществ,
относящихся к так называемым органическим веществам,
20
например молекул сахара, жира, белка и пр. Образование молекул
этих веществ будет рассматриваться в дальнейшем.
Атомы кислорода способны заряжаться отрицательно, а атомы
водорода положительно. Поэтому они легко соединяются и образуют
молекулу воды:
2НЦ-О = Н2О
Атомы металлов способны заряжаться только положительно. По-
этому металлы более или менее легко соединяются с кислородом.
Атомы металлоидов, например серы, способны заряжаться и по-
ложительно, и отрицательно, поэтому они способны соединяться как
с кислородом, так и с водородом и металлами.
В свете современных представлений под валентностью
понимают число электрических зарядов (того или другого
знака), которыми заряжаются атомы при образовании
химических соединений.
Таким образом, валентность выражается положитель-
ным или отрицательным целым числом.
Валентность водорода выражается положительным числом (-J-1),
валентность кислорода выражается отрицательным числом (— 2).
В свободном состоянии атомы представляют собой незаряженные
частицы. Заряжаются они в процессе химической реакции и сохра-
няют свои заряды, находясь в составе молекул. Разноимённо заря-
женных атомов в молекуле должно содержаться такое количество,
при котором общее число положительных зарядов равняется общему
числу отрицательных зарядов. Благодаря этому молекулы электро-
нейтральны, т. е. в целом представляют собой незаряженные
частицы.
Этим руководствуются при составлении формул химических со-
единений.
Если в составленной формуле число зарядов противоположного
знака одинаково, молекула, изображаемая указанной формулой, электро-
нёйтральна и формула написана правильно.
Для проверки формулы по правилу электронейтральности над ато-
мами ставят их заряды. Например, в формуле окиси алюминия А12Од,
4-3 — 2
подставляя заряды, получают: А12О3; затем подсчитывают общее
число зарядов одинакового знака, умножая заряд атома на число
атомов:
для алюминия получается (Ц- 3) X 2 =-|- 6;
для кислорода получается (—2)ХЗ — — 6.
Число зарядов противоположного знака получилось здесь одина-
ковое; следовательно, молекула, изображаемая указанной формулой,
электронейтральна и формула правильна.
3. Составление структурных формул химических соединений.
Для того чтобы наглядно представить, как соединяются атомы при
образовании молекул, около химического знака элемента ставят
21
условные обозначения — чёрточки по числу валентностей. Например,
образование молекулы воды может быть представлено так:
Элементы . . . . .......
Валентность их ..........
Химические знаки элементов
с чёрточками по числу ва-
лентности ..................
Соединение атомов между
собой согласно их валент-
ности .............л . . .
Водород (Н)
1
Н—
Н—х
ЪО или
Н—7
Кислород (О)
2
/°
Н
/°
н
Формулы, изображаемые в таком виде, называются структурными.
Структурные формулы' доказывают не только какие • атомы и
в каком количестве содержатся в молекуле, но и в каком порядке
соединены между собой. Например, из структурной формулы воды
видно, что в молекулах её ^томы водорода соединены с атомами
кислорода, но не между собой. 1
Структурную формулу воды можно изображать в разном виде,
сохраняя тот же смысл: ч
Н\
уО или: Н — О — Н
Н7
Во всех случаях образования молекул валентности атомов
соединяющихся элементов должны быть взаимно насыщены.
Поэтому в правильно составленной структурной формуле не
должно оставаться свободных чёрточек и число их около каждого
знака элемента должно равняться его валентности.
Для примера ниже приводятся структурные и обычные формулы
кислородных соединений элементов с разной валентностью.
Элемент Валент- ность Название соединений Структурные формулы Обычные формулы
Натрий 1 Окись натрия Nax Na/° Na2O
Кальций 2 Окись кальция Са = О СаО
Алюминий 3 Окись алюминия > > ООО А120д
Углерод 4 Двуокись углерода /£> с< ^0 со2
22
Элемент Валент- ность Название соединении Структурные формулы Обычные формулы
Фосфор 5 Пятиокись фосфора "О тз ^н\/пч. О О О О О Р2О5
ж 6. Химические уравнения
Химическим уравнением называется изображение химических реак-
ций при помощи химических формул и химических знаков.
Уравнение химической реакции отражает закон сохранения веса
вещества.
В химическом уравнении слева от знака равенства указываются
формулы и число молекул веществ, вступающих в реакцию, а справа —
формулы и число молекул веществ, получающихся в результата
реакции.
1. Составление химических уравнений. Химические уравнения
составляются на основании закона сохранения веса веществ.
В правильно составленном уравнении количество атомов каждого
элемента с обеих сторон знака равенства должно быть одинаковым.
Этим правилом пользуются при составлении уравнений химических
реакций.
Пример 1. Уравнение реакции соединения алюминия с кисло-
родом составляют путём следующих последовательных действий:
1) пишут химические знаки вступающих в реакцию элементов,
ставят стрелку и после неё — формулу получаемого вещества:
А1-4-О—А12О3
2) проставляют коэффициенты для уравнивания числа атомов сна-
чала одного элемента, а затем другого:
2А1-[-0—> А12О3 (уравнено число атомов алюминия)
2А1 30 —► А12О3 (уравнено число атомов кислорода)
3) так как в реакцию вступают молекулы кислорода 02, проста-
вляют их. в запись:
2А1ЗО2 —> А12О3
и удваивают коэффициенты при всех остальных формулах:
4А1-j-ЗО2 —> 2А)2О3
Последняя запись удовлетворяет закону сохранения веса веществ
и уже представляет собой равенство:
4А1 4-ЗО2 = 2А12О3
23
Пример 2. При составлении уравнения реакции разложения
бертолетовой соли сначала пишут его в таком виде:
1^С1О3 = КС14-ЗО
Затем указывают вместо атомов кислорода молекулы кислорода
и ставят соответствующие коэффициенты:
2КСЮ3^= 2КС1 + ЗО2
В обеих частях написанного уравнения число атомов калия, хлора
и кислорода одинаково: следовательно, уравнение составлено пра-
вильно.
Несложные расчёты, подобные приведённым, производятся в уме,
и химические уравнения обычно записывают без указания промежу-
точных стадий.
Приведённая запись читается так: два калий-?-хлор — О — тр1Г
равняется два калий — хлор плюс три .О — два.
При чтении химических уравнений следует уметь не только
произносить формулы, но и записанные этими формулами названия
веществ. Например: в данном случае уравнение читается так: из двух
йолекул бертолетовой соли образуются две молекулы хлористого калия
и три молекулы кислорода.
2. Расчёты по формулам и уравнениям. Химическая формула
выражает состав молекул данного вещества, поэтому, исходя из
химических формул, можно производить различные расчёты.
1. Вычисление весового содержания элемента в определённом
количестве вещества.
Задача. Сколько граммов алюминия содержится в 408 г окиси
алюминия?
Решение. В задаче спрашивается, сколько граммов элемента
алюминия содержится в 408 г сложного вещества — окиси алюминия.
Вещество окись алюминия состоит из одинаковых молекул. По-
этому для решения задачи пишут формулу одной молекулы окиси
алюминия и вычисляют её молекулярный вес (для краткости будем
обозначать его 44). Так как в задаче спрашивается о количестве
алюминия в граммах, то, пользуясь этой формулой, вычисляют грамм-
молекулярный вес окиси алюминия (для краткости обозначают
его ГМ)'.
А12О3
41=544-48 = 102
ГЖ=102 г.
Теперь рассуждают так:
в 102 г окиси алюминия содержится 54 г алюминия;
в 408 г я „ в х г „ .
Составляют пропорцию:
х___408
54“ 102*
9Л
Вычисляют неизвестное:
54-408 о,о
х = —102~ = 21Ь г алюминия.
Ответ. В 408 г окиси алюминия содержится 216 г алюминия.
2. Вычисление весового количества вещества, содержащего опре-
делённое количество элемента.
Задача. В скольких граммах воды содержится 8 г кислорода?
Эта задача решается подобно предыдущей:
Н2О
2И=24-16 = 18
ЛИ=18 г.
В 18 г воды содержится 16 г кислорода;
х г „ п 8г п •
Составляют пропорцию:
х ___8
18 —16*
Вычисляют неизвестное:
18-8 о
х = -гег- = 9 г воды.
10
Ответ. 9 г воды содержат 8* г кислорода.
3. Вычисление процентного состава сложного вещества.
Очень часто и особенно при анализе сложных веществ требуется
выразить в процентах элементарный состав сложного вещества.
Задача. Вычислить процентный состав воды, т. е. узнать,
сколько процентов водорода и сколько процентов кислорода содер-
жится в воде.
Решение. Записывают молекулярный и грамм-молекулярный вес
воды;
Н2О
М = 2 4- 16 = 18
ГЖ=18 г.
Вычисляют содержание кислорода в 100 г воды:
в 18 г воды содержится 16 г кислорода;
в100г„ „ х г „
х___100 .
16 —
16^100 = 88,88 г.
1о
Следовательно, в воде содержится 88,88°/0 кислорода.
25
Вычисляют содержание водорода в 100 г воды:
в 18 г воды содержится 2 г водорода;
в 100 г , „ . х z
* л:__100.
2 — 18 ’
Следовательно, в воде содержите? 11„12о/о водорода.
Ответ. В воде содержится 88,880/0 кислорода и 11,120/0 водорода.
4. Вычисление весового количества вещества, необходимого для
получения определённого количества продукта реакции.
Задача. Сколько граммов серной кислоты потребуется для по-
лучения х644 г сернокислого цинка?
Решение. Сначала пишут уравнение реакций между серной
кислотой и цинком и вычисляют молекулярные и грамм-молекулярные
веса тех веществ, о которых спрашивается -в задаче.
При расчётах по уравнениям реакций не рекомендуется писать
здесь же вычисления молекулярного веса, как показано при расчё-
тах по формулам, а производить вычисления на стороне и в записи
под соответствующей формулой проставлять вычисленный молекуляр-
ный вес вещества:
H2SO4 4- Zn = ZnSO4 4- Н2
Л4=98 161
ГЛ4=98 г 161 г.
Теперь рассуждают так:
для получения 161г сернокислого цинка треб. 98 г серной кислоты;
« » 644 г „ „ „ х г „ „
Составляют пропорцию:
х___644
98 ~ 161 '
Вычисляют неизвестное:
644-98 9ПО
х = 161 = 392 г серной кислоты.
Ответ. Для получения 644 г сернокислого цинка требуется 392 г серной
кислоты.
Подобным же путём можно вычислить весовое количество полу-
чающегося продукта, если дано определённое количество исходного
вещества.
§ 7. Вычисление объёмов газообразных веществ
Вещества в газообразном состоянии (например, изученные в VII
классе водород, кислород, углекислый газ и др.) отличаются той осо-
бенностью, что расстояния между их молекулами относительно очень
велики; промежутки между молекулами во много раз превышают раз-
меры самих молекул (рис. 7 и 8). Вследствие этого число молекул
26
в каком-либо объёме газа зависит не от величины молекул, а от рас-
стояния между ними. Если температуры и давление одинаковы, рас-
стояния между молекулами разных газов тоже одинаковы. Практи-
чески можно считать, что
в равных объёмах любых газов при одинаковых условиях
содержится одинаковое число молекул.
Итальянский физик Авогадро (1776—1856) впервые высказал
это соображение в виде гипотезы; в науку оно вошло под названием
закона Авогадро.
Из закона Авогадро следует очень важный вывод об объёме
грамм-молекулы любого газа.
В равных объёмах газов при одинаковых условиях содержится
одинаковое число молекул; справедливо и обратное утверждение:
Рис. 7. Сравнительные размеры промежутков между
молекулами в твёрдом теле и в газе.
Изображения даны в сильно увеличенном масштабе. Для газа
показано среднее расстояние между молекулами при нормаль-
ных условиях, т. е. при температуре, равной 0°, и давлении,
разном 1 атм.
одинаковое число молекул газообразных веществ при одинаковых
условиях занимает одинаковый объём (рис. 9).
В грамм-молекулах любых веществ содержится одинаковое число
молекул (стр. 16). Это относится и к грамм-молекулам газов. Отсюда
следует, что грамм-молекулы газов при одинаковых условиях занимают
одинаковый объём.
Этот объём легко высчитать, зная вес 1 л газа. Например, при
нормальных условиях, т. е. при температуре, равной 0°, и давлении,
равном 1 атмосфере (760 мм ртутного столба), вес 1 л кислорода
О2 равен 1,4285 г; грамм-молекула кислорода равна 32 г. Отсюда
27
объём, занимаемый грамм-молекулой кислорода при нормальных усло-
32
ВИЯХ, равен ^-^ = .22,4 л- -
Вес \л азота щри нормальных условиях равен 1,2506 г, грамм-мо-
\ лекула азота равна 28 г.
Отсюда .объём, зани-
маемый грамм-молеку-
28
Лой азота, = rw =
—22,4 л. ,
То же' получается
для водорода
(вес 1 л = 0,0899 г),
углекислого газа
(вес 1 >2=1,977 г)ит.д.
Все эти вычисления
Рис. 8. Схема, показывающая поведение молекул
газа в замкнутом пространстве.
Стрелками показано направление движения молекул. А — газ
при меньшем давлении; Б — газ при большем давлении.
Перемещая подвижную крышку, т. е. изменяя давление,
можно заставить газ занимать любой объём. Можно также
изменять объём газа, сохраняя постоянным давление, но из-
меняя температуру; поэтому сравнивать объёмы газов мож-
но только при одинаковом давлении и одинаковой темпера-
туре, т. е. при одинаковых условиях.
полностью подтвер-
ждают вывод из за-
кона Авогадро, что
грамм-молекулы газов
при одинаковых усло-
виях занимают одина-
ковый объём.
При нормальных условиях, т. е. при 0° С и давлении
в I атмосферу (760 мм), грамм-молекулы газов занимают
объём, равный 22,4 л1).
Объём 22,4 л называется грамм-молекулярным объёмом (рис. 10).
1. Объёмные расчёты по формулам. При помощи химических
формул можно вычислять не только грамм-молекулярный вес вещества,
Рис. 9. Равные объёмы двух газов при
одинаковых условиях (температуре и да-
влении).
Так как число молекул в обоих случаях одинаково,
вес равных объёмов газов пропорционален молеку-
лярным весам взятых веществ. Объём кислорода
в 16 раз тяжелее равного объёма водорода (молекула
кислорода в 16 раз тяжелее молекулы водорода).
Рис. 10. Объём грамм-молекулы
газа при нормальных условиях
(температура равна 0°; давле-
ние равно 760 мм). В этом
объёме содержится 6,024-1023
молекул.
1) Этой цифрой пользуются при практических расчётах с газообразными
веществами.
28
но для газообразных веществ также и грамм-молекулярный объём и
применять эти вычисления для решения задач следующих типов.
1. Вычисление объёма, занимаемого определённым весовым ко-
личеством газообразного вещества. .
Задача. Какой объём при нормальных условиях занимают 7 г
азота?
Решение. Пишут формулу одной молекулы азота и вычисляют
её молекулярный вес (Ж). Так как в задаче спрашивается об объёме,
занимаемом при нормальных условиях 7 г азота, вычисляют также
грамм-молекулярный вес азота и грамм-молекулярный фбъём, который
условно при решении задач обозначают ГМУй: 1
44=28
™ = 28г
ГЛ4У0 = 22,4 л.
Далее рассуждают так:
28 г азота занимают объём 22,4 л\
7 г п „ п х л.
Составляют пропорцию:
х _1
22,4 — 28’
Вычисляют неизвестное:
7-22,4 _ с
* = —2g-= 5,6 Л.
О.твет. 7 г азота при нормальных условиях занимают объём, равный
5,6 л.
2. Вычисление веса определённого объёма газообразного веще-
ства.
Задача. Сколько граммов весит при нормальных условиях 1 Л
азота?
Решение. Рассуждают, подобно предыдущему:
22,4 л азота весят 28 г\
1 „ „ весит х г.
Составляют пропорцию:
х___ 1
28 — 22J *
Вычисляют неизвестное:
1-28 , QC-
Х 22,4 — ,25 г'
Ответ. 1л азота весит 1,25 г.
29
2. Объёмные расчёты по уравнениям реакций.
Задача. Сколько литров водорода (условия нормальные) полу-
чится при взаимодействии 2,7 г алюминия с серной кислотой?
Решение. Дл§ решения задачи Пишут уравнение реакции алю-
миния с серной кислотой, вычисляют атомный вес (А) и ?рамм-атом-
ный вес (ГА) алюминия, молекулярной вес (Л4) и грамм-молекулярный
вес (ГМ), а также грамм-молекулярный объём (ГМУц) водорода:
2А14- 3H2SO4 = A12(SO4)3 + ЗН2
' 2А = 54 3M=i= 6
* 2ГА = 54г ЗГМ = 6 г
ЗГМУ0 = 67,2 л.
6 г водорода — это три грамм-молекулы водорода; при нормаль- _
ных условиях они занимают объём 22,4 л X 3 = 67,2 л. Далее рас-
суждают так:
при реакции 54 г алюминия с серн. кисл. получается 67,2 л водорода;
„ „ 2,7 г „ „ „ „ х л водорода.
Составляют пропорцию:
х _______________________________2,7
67/2— "54 ‘
Вычисляют неизвестное:
v _ 2,7’67,2 _ q
54 ’ ,
Ответ. При взаимодействии 2,7 г алюминия с серной кислотой выде-
ляется 3,36 л водорода (при нормальных условиях).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В чём сущность молекулярно-атомистической теории?
2. Что происходит с веществами при физических и химических пре-
вращениях (с точки зрения молекулярно-атомистической теории)?
3. Что следует понимать под названием „элемент"?
4. Какие вещества называются простыми? сложными?
5. Что называется атомным весом?
6. Что называется молекулярным весом?
7. Что называется грамм-атомом?
8. Что называется грамм-молекулой (молем)?
9. Как формулируется закон сохранения веса веществ?
10. Как формулируется закон постоянства состава?
11. Как объясняется в свете молекулярно-атомистических представлений
закон сохранения веса веществ? Закон постоянства состава?
12. Что называется химическим уравнением?
13. Что обозначают химические уравнения?
14. Какие задачи можно решать, исходя из формул?
15. Какие задачи можно решать, исходя из химических уравнений?
16. Как формулируется закон Авогадро?
17. Какой объём занимают грамм-молекулы газообразных веществ?
18. Какие расчёты можно производить, исходя из грамм-молекулярного
объёма газов?
30
ГЛАВА II
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
(Повторение материала VII класса с дополнениями)
Классификация неорганических веществ даётся в нижеприводимой
таблице. .
Вещества Подразделения веществ
I. Простые вещества Металлы Металлоиды
II. Сложные вещества Окис- лы 1. Несолеобразующие
1. Вещества, в состав молекул которых входят атомы како- го-либо элемента и кислорода 2. Солеобразующие '
Основные окислы Кислотные окис- лы, или ангидри- ды
2. Вещества, в состав молекул которых входят атомы метал- ла, кислорода и водо- рода (гидроксильные группы) Основа- ния; из них раствори- мые в воде— щёлочи
3. Вещества, в состав молекул которых входят атомы водо- рода, способные за- мещаться атомами металла, в результате чего образуются соли Кислоты: 1) кислородсодер- жащие 2) бескислородные
4. Вещества, в состав молекул которых входят атомы метал- ла и кислотные остатки Соли: 1) средние 2) кислые
Указанные в таблице вещества будут дальше рассматриваться
подробнее.
I. Простые вещества. Среди простых веществ различаются ме-
таллы металлоиды.
Металлы при обычных условиях твёрдые вещества (только ртуть
находится в жидком состоянии). Отличаются металлы характерным
металлическим блеском, ковкостью, тягучестью, хорошей электро-
проводностью, теплопроводностью.
Для металлов характерен также их значительный удельный вес.
Только небольшое число металлов имеет малый удельный вес. Ме-
таллы литий, натрий и калий имеют удельный вес меньше 1 и пла-
вают на воде (в то же время реагируя с ней). Все прочие металлы
31
имеют удельный вес больше 1. Металлы с удельным весом меньше
5 условно называются лёгкими; к ним относятся из металлов тяже-
лее воды: кальций, магний', алюминий и некоторые другие. Боль-
шинство металлов имеет удельный вес больше 5; эти металлы назы-
ваются тяжёлыми.
Атомы металлов имеют во внешнём электронном слое небольшое
число электронов (чаще* 2); они легко теряют эти электроны при
взаимодействии с другими элементами. Этот . процесс ведёт к обра-
зованию * заряженные частиц — йонов. Йоны металлов заряжены по-
ложительно; заряд их численно равен числу потерянных электронов.
Металлоиды не обладают характерными для металлов свой-
ствами. Некоторые из них при обычных условиях являются газообраз-
ными веществами (водород, кислород и
ДР.)
Твёрдые металлоиды
отличаются сравнительно
небольшим удельным ве-
сом, хрупкостью (напри-
мер, сера), плохо прово-
дят тепло и электриче-
ство.
Атомы металлоидов
имеют во внешнем слое
сравнительно большое
число электронов (до 7).
Они способны приобре-
тать электроны извне
до образования слоя, со-
стоящего из 8 электро-
нов. Это избыточное ко-
личество электронов при-
водит к образованию Йона
с отрицательным заря-
дом, равным числу при-
соединённых электронов
(см. рис. 6).
выраженными свойствами
металлоидов; существуют
Рис. 11. Диаграмма распространения элемен-
тов в наружной оболочке Земли.
В природе имеются элементы с резко
металлов и резко выраженными свойствами
также элементы с промежуточными свойствами; поэтому резкую
границу между металлами и металлоидами провести нельзя (примеры
будут рассмотрены дальше).
Металлы и металлоиды распространены в земной коре очень не-
равномерно (рис. И). Как видно из рисунка, в земной коре больше
всего (около 75°/0) содержится металлоидов — кислорода и кремния.
На долю всех остальных элементов приходится лишь около 25°/р.
П. Сложные вещества. Из сложных веществ чаще всего при-
ходится иметь дело с окислами, основаниями, кислотами и солями.
Ниже приводится таблица, указывающая классы химических соеди-
нений и продукты взаимодействия между веществами из этих классов.
32
Этой таблицей следует пользоваться при дальнейшем изучении
веществ.
Исходные вещества Металлоид 'Кислотный окисел, или ангидрид Кислота Соль
Металл Соль, не со- держащая кислорода — Соль и водород Новая соль и но- вый металл
Основной окисел — Соль, содер- жащая ки- слород Соль и вода —
Основание — Соль и вода Соль и вода Новое основание и новая соль (одно из веществ нерас- творимое)
Соль — — Соль и новая кислота (одно из веществ не- растворимое или кислота ле- тучая) Две новые соли, из которых одна нерастворимая
Металлы и металлоиды могут вступать во взаимодействие. Про-
дукт реакции — соли, не содержащие кислорода. Типичный случай
такой реакции представляет взаимодействие натрия с хлором, в резуль-
тате которого образуется поваренная соль:
2Na + С12 = 2NaCl
При взаимодействии большинства металлов и металлоидов с ки-
слородом образуются окислы.
§ 1. Окислы
1. Определение.
Окислами называются сложные вещества, молекулы
которых состоят из атомов кислорода и атомов какою-
либо другого элемента.
Например, окисел магния MgO, окисел углерода СО2, окисел
фосфора Р2Об.
2. Формулы окислов. В молекулах окислов атомы кислорода и
связанного с ним элемента находятся в таком количестве, что их
Q4
3
JlentlAMWn
валентности взаимно насыщены (чдодр отрицательных зарядов всех
атомов кислорода равно числу положительных зарядов всех атомов
другого элемента). Например, в состав молекулы окисла трёхвалент-
ного алюминия входят 2 атома алюминия и 3 атома кислорода^
4-з —2 \
А12О3; структурная формула! О
.А1/
:О ,
В состав молекулы окисда четырёхвалентного углерода входят
1 атом углерода и 2 атома кислорода:,
+4 —2 ,£>
С02» структурная формула! СС
В состав молекулы окисла пятивалентного фосфора входят 2 атома
фосфора и 5 атомов кислорода: ‘
//°
Р = 0
+5 —2 \
Р20б; структурная формула О
Р = 0
3. Классификация окислов. По химическим свойствам окислы
делятся на солеобразующие и несолеобразующие.
Солеобразующими окислами называются такие окислы,
которые в результате определённых химических реакций
образуют соли.
Примерами солеобразующих окислов могут служить окислы, с ко-
торыми проводились опыты в VII классе; окись меди СиО и дву-
окись углерода или углекислый газ С02.
В проводившихся опытах углекислый газ обнаруживался по
действию его на известковую воду — прозрачный раствор гидрата
окиси кальция Са(ОН)2; в растворе появлялась муть от выпавшего
в осадок продукта реакции — нерастворимой соли углекислого
кальция СаСО3.
С02 Са (0Н)2
углекислый газ гидрат окиси
(двуокись углерода) кальция
= СаСО3 , Н20
соль: углекислый
кальций (белый
осадок)
Я4
В опыте взаимодействия окиси меди СиО с серной кислотой
H2SO4 также получалась соль — сернокислая медь CuSO4, легко рас-
познаваемая по синей окраске:
СиО H2SO4 = CuSO4 +н2о
окись меди серная кислота соль: сернокислая
медь
Несолеобразующими окислами называются такие окислы,
которые не образуют солей. *
Несолеобразующих окислов существует немного; примером их
может служить окись углерода, или угарный газ СО.
Солеобразующие окислы делятся на основные и кислотные.
4. Основные окислы.
Основными окислами называются такие окислы, кото-
рым соответствуют гидратные соединения (гидраты окис-
лов), относящиеся к классу оснований.
Основными окислами являются, например: окись натрия Na2O,
которой соответствует основание NaOH; окись кальция, или негашё-
ная известь СаО, которой соответствует основание Са (ОН)2; окись
меди СиО, которой соответствует основание Си(ОН)2; окись железа
Fe2O3, которой соответствует основание Fe (ОН)3, и др.
Все основные окислы являются твёрдыми веществами.
а) Названия основных окислов. По проявляемой валентности
металла основные окислы называются закисями и окисями. Окислы—
общее название соединений элементов с кислородом. Окись — назва-
ние окисла, чаще всего основного, если элемент образует только
один окисел. Примерами могут служить: окись магния MgO, окись
алюминия А12О3; никаких других окислов эти металлы не образуют,
так как проявляют всегда одну и ту же валентность.
Если элемент проявляет переменную валентность и образует
несколько соединений с кислородом, название окись сохраняется
за тем окислом, в котором элемент проявляет большую валентность
(бывают и отступления от этого правила). Кислородному соединению,
в котором элемент проявляет валентность меньшую, чем в его окиси,
даётся название закись. Например, железо образует два окисла;
в одном окисле оно проявляет три валентности, и этот окисел назы-
+3 —2
вается окисью: Fe2O3—окись железа. В другом окисле оно прояв-
4-2 —2
ляет две валентности, и этот окисел называется закисью:. FeO —
закись железа.
Кроме указанных названий, иногда употребляются для соедине-
ния с низшей валентностью название окись, для соединения с высшей
валентностью — название двуокись.
Примером могут служить: окись свинца РЬО, двуокись свинца РЬО2.
б) Взаимодействие основных окислов с водой. Окислы тяжё-
лых металлов с водой не реагируют. Во взаимодействие с ней вступают
3* 35
лишь окислы лёгких металлов — калия, натрия, кальция, магния,
бария и некоторых других.
При этой реакции происходит соединение окисла с водой; продук-
том реакции является гидрат окиси, представляющий собой раствори-
мое в воде основание, т. е. щёлочь.
При взаимодействии с водой окиси натрия получается гидрат
окиси натрия, или едкий натр (натр — старинное название окиси
натрия). - '
Образование гидрата окисЬ натрия можно наглядно представить,
записывая формулы веществ в структурном виде:
Na—О Н Na—О—Н
Na О—Н Na—О—Н
окись натрия вода
Запись уравнения реакции в обычном вид^:
Na2O4-H2O = 2NaOH
окись гидрат окиси
натрия натрия
(едкий натр)
Взаимодействие с водой окиси калия происходит точно 1ак .же;
конечный продукт реакции КОН — гидрат окиси калия, или едкое
кали (кали — старинное название окиси калия).
То же происходит при взаимодействии с водой окиси кальция;
единственная особенность заключается в том, что кальций*'—двух-
валентный элемент:
СаО + Н2О = Са(ОН)2
окись кальция гидрат
(негашёная окиси кальция
известь) (гашёная известь)
В технике присоединение воды к извести называется „гашением“
извести, а получаемый продукт — гидрат окиси кальция — назы-
вается гашёной известью. В сухом виде гашёная известь — белый
порошок.
Гидрат окиси кальция (гашёная известь) значительно хуже раство-
ряется в воде, чей гидрат окиси натрия и калия. Раствор гашёной
извести, называемый известковой водой, не проявляет таких силь-
ных едких свойств, как растворы едкого натра и едкого кали.
Вода взаимодействует также с окисью магния. Окись магния
представляет собой белое вещество, называемое обычно магнезией.
При взбалтывании с водой порошка магнезии образуется гидрат
окиси магния, хотя и слабо, но всё же растворимый в воде; это
видно по окрашиванию лакмуса в синий цвет от действия получив-
шегося раствора.
Магний, как и кальций,— двухвалентный элемент, поэтому уравне-
ния реакций и формулы образующихся веществ в обоих случаях
сходны:
Mgo + H2o = Mg(OH)a
окись гидрат описи
магния магния
36
в) Взаимодействие основных окислов с кислотами. Основ-
ные окислы могут реагировать с кислотами; в результате реакции
образуются соль и вода:
слабое нагревание
CuO + H2SO4 = CuSO4 + Н2О
окись меди сернокислая
медь
5. Кислотные окислы.
Кислотными окислами называются такие окислы,
которым соответствуют гидратные соединения, относя-
щиеся к классу кислот.
Для кислотных окислов употребляется ещё название ангидрид
(что означает „безводный1*). Это название дано потому, что кислот-
ные окислы (ангидриды) можно получать путём отнятия воды от
соответствующих кислородсодержащих кислот:
(нагревание)
H2SO4 = SO, + Н2О
серная серный
кислота ангидрид
Названия ангидридам даются, исходя из названий кислот.
Для бескислородных кислот, конечно, нет соответствующих им
ангидридов. Кислотные окислы бывают твёрдые (Р2О5 и др.) и газо-
образные (SO2 и др.).
а) Взаимодействие кислотных окислов с водой. Большин-
ство кислотных окислов соединяется с водой; в результате реакции
образуется кислота.
Реакция заключается в присоединении воды, элементы которой
входят в состав молекулы получающейся кислоты. Это показано на
примере соединения с водой сернистого ангидрида:
Н+<Х Н—Ок
I ^s=O-> >s=o
J-J_Q сернистый Ы______QZ,
ангидрид
вода сернистая
кислота
Уравнение реакции в обычном виде:
SO24-H2O = H2SO3
Некоторые кислотные окислы с водой не реагируют. Например,
кремниевый ангидрид SiO2, широко распространённый в природе
в виде песка, с водой не соединяется; следовательно, таким путём
кремниевую кислоту получить нельзя (получение её см. дальше).
б) Взаимодействие кислотных окислов (ангидридов) с ос-
новными окислами. Кислотные окислы могут реагировать с основ-
ными окислами; в результате реакции образуется соль (содержащая
кислород):
(при сплавлении)
СаО SiO2 = CaSiO8
кремниевый кремнекислый
ангидрид (песок) кальций
Эта реакция используется в производстве для получения стекла.
37
в) Взаимодействие кислотных окислов с основаниями.
Кислотные окислы могут реагировать с основаниями; в результате
реакции получаются соль и вода:
SO2 + 2NaOH = Na2SO3 + Н2О
сернистый» сернистокислый
ангидрид натрий
Рассмотренные выше подразделения окислов для наглядности
представлены* в виде таблицы:
Класс веществ - Подразделения Примеры Соответствующие гидратные соединения
Окислы Несоле- образующие — СО Нет
Солеобра- зующие Основные СаО Основание Са (ОН)2
Кислотные, или ангидриды SO3 Кислота H2SO4
§ 2. Основания
1. Определение. Из оснований ранее ' уже рассматривались
(в VII классе): едйи^ натр NaOH, едкое кали КОН\ гашёная известь
Са (ОН)/ и др. . (
Исходя из приведённых формул, можно заключить, что в состав
молекул оснований входят: атом металла и одновалентная группа
атомов — ОН; состоит эта группа из одного атома кислорода
и одного атома водорода; называется она гидроксильной группой,
или гидроксилом. Гидроксильную группу можно рассматривать
как молекулу воды без одного атома водорода. Молекула воды:
Н2О, или Н—О—Н; гидроксильная группа: —О—Н; её называют
также водным остатком.
Из сказанного следует, что:
основаниями называются сложные вещества, молекулы
которых состоят из атома металла и связанных с ним
гидроксильных групп (— ОН).
2. Формулы оснований. Формулы оснований составляются
исходя из того, что гидроксильная группа проявляет одну свобод-
ную валентность (один отрицательный заряд); это изображают
—1
так: ОН. Над знаком ОН ставят черту, а над ней — цифру; черта
показывает, что обозначенный таким образом заряд (валентность)
относится не к одному атому, а ко всей группе атомов, стоящих
под чертой. Так поступают и в других подобных случаях.
38
С атомом металла соединяется столько гидроксильных групп,
сколько единиц валентности проявляет металл.
Если в молекулу основания входит атом одновалентного металла,
он присоединяет к себе одну гидроксильную группу. Например:
+i_-i
NaOH; структурная формула: Na — ОН
Если в молекулу основания входит атом двухвалентного металла,
он присоединяет две гидроксильные группы. Например:
4-2 -1 .ОН
Са (ОН)2; структурная формула: Са<^
ХОН
Трёхвалентный алюминий присоединяет три гидроксильные группы:
4-з -1 /ОН
А1 (ОН)3; структурная формула: А1^-ОН
\ОН
3. Названия оснований. Названия оснований составляются из^
названия металла и поставленных перед ним слов: гидрат окиси или*
гидрат закиси.
Ниже приводятся дня примера названия некоторых оснований:
NaOH — гидрат окиси натрия (едкий натр)
кон- , , калия (едкое кали) ’
Са(ОН)2— , „ кальция (гашёная известь)
А1 (ОН)3 - , „ алюминия
Fe(OH)3 — „ железа
Fe (ОН)2 - . закиси железа
Основания называются гидратами окисей (что означает водные
окиси), или гидратами закисей, потому что некоторые из них
получаются путём соединения окисла металла с водой. Большинство
оснований, однако, не может быть получено соединением окислов
с водой, но условно все основания называются „гидратами окислов
металлов".
4. Физические свойства оснований и классификация их. Все
основания — твёрдые вещества. Многие из них различаются окра-
ской. Например, гидрат окиси натрия NaOH, гидрат окиси калия КОН,
гидрат окиси кальция Са (ОН)2 — белого цвета; гидрат окиси меди
Си (ОН)2 — голубого цвета; гидрат окиси железа Fe (ОН)3 — красно-
бурого цвета и т. д.
39
Растворимость в воде оснований различна. Только небольшое
число их более или менее хорошо растворяется в воде.
| Растворимые 'в воде основания называются щелочами.
Щелочами являются следующие основания: гидрат окиси натрия,
или едкий натр NaOH; гидрат окиси калия, или едкое кали КОН;
гидрат окиси кальция, или гашёная известь Са (ОН)2 и некоторые
другие.
Большинство оснований в воде практически не растворяется. Не-
растворимыми являются гидраты окисей тяжёлых металлов: железа,
меди, олова, свинца и др.
Если говорится, что вещество относится к классу оснований,
это не даёт указаний на то, растворимо оно в воде или нет; если
же говорится, что вещество является щёлочью, это означает, что
оно представляет собой растворимое в воде основание.
Для гидрата окиси натрия и гидрата окиси калия характерно
сильное разъедающее действие их на кожу. Отсюда произошло об-
щее название для них: едкие щёлочи. Вследствие разъедания верх-
него (рогового) слоя кожи смоченные щелочным раствором пальцы
при трении друг о друга скользят, как от мыла.
5. Химические свойства оснований, а) Действие основа-
ний (щелочей) на 'индикаторы. Для распознавания раствори-
мых в воде оснований, т. е. щелочей (а также кислот), пользуются
особыми сложными веществами, которые в щелочной и кислой среде
отличаются характерной окраской.
Обычно употребляются для этих целей: лакмус (водный настой,
получаемый из особого сорта лишайников после переработки его),
спиртовой раствор фенолфталеина (искусственно получаемое веще-
щество) и др.
В щелочной среде лакмус окрашивается в синий цвет (в кислой
среде — в красный цвет). Фенолфталеин в щелочной среде — малино-
вого цвета (в кислой среде — бесцветный).
Лакмус, фенолфталеин и другие подобные им вещества получили
название индикаторы (что означает „указатели").
В качестве индикаторов можно пользоваться также отваром крас-
ной свёклы, красной капусты. Окраска всех этих растворов от дей-
ствия кислот становится красной или розовой; от действия щелочей
эти растворы принимают зелёную окраску разных оттенков.
б) Взаимодействие оснований с кислотными окис-
ла м и. Основания могут реагировать с кислотными окислами; в ре-
зультате реакции образуются соль и вода.
Примером может служить реакция, происходящая при накалива-
нии смеси твёрдого гидрата окиси натрия и песка, являющегося
окисью кремния (это — кислотный окисел; соответствующая ему ки-
слота, называемая кремниевой, будет изучаться дальше):
прокаливание
2NaOH 4- SiO2 =Na2SiO3 -f- H2O
гидрат окиси двуокись кремнекислый
натрия кремния натрий
40
Гидрат окиси натрия реагирует с углекислым газом:
2NaOH
гидрат окиси
натрия
(обычные условия)')
+ СО2 = Na2CO3 + H2O
углекислый
натрий
Эта реакция объясняет, почему щёлочи (NaOH, КОН и др.) нельзя
хранить в открытых сосудах; щёлочи будут взаимодействовать с
содержащимся в воздухе углекислым газом (угольным ангидридом)
и превратятся в углекислую соль.
Так же происходит реакция взаимодействия углекислого газа с
гашёной известью (гидратом окиси кальция); при взаимодействии
углекислого газа с раствором гашёной извести (известковой водой)
образуется нерастворимый в воде углекислый кальций, который вы-
падает в осадок. ।
Са(ОН)2 + СО2 = СаСО3 + Н2О
гидрат окиси i
кальция (известно- углекислый
вая вода) кальций
Этой реакцией обычно пользуются для обнаружения углекислого
газа.
в) Взаимодействие оснований и кислот друг с
другом. Реакция нейтрализации. Основания и кислоты
могут вступать во взаимодействие.
При этой реакции гидроксильные группы оснований соединяются
с атомами водорода кислоты и образуют молекулы воды. Остатки
же от молекул основания и кислоты соединяются в молекулы соли.
В этом случае, как и при взаимодействии оснований с кислотными
окислами, получаются соль и вода:
NaOH 4- НС1 = NaCl + Н2О
гидрат окиси соляная хлористый
натрия кислота натрий
Реакция взаимодействия основания с кислотой, в ре-
зультате которой получаются соль и вода, называется
реакцией нейтрализации.
Это название означает: „ни тот, ни другой"; дано оно потому,
что в результате реакции нейтрализации не остаётся свободных ни
щёлочи, ни кислоты (ни того, ни другого вещества).
Если реакция нейтрализации проводится с основанием, раство-
римым в воде, т. е. со щёлочью, легко установить момент окончания
реакции, пользуясь индикатором.
1) В дальнейшем, если над знаком равенства не указываются условия
течения реакции, следует понимать так, что реакция протекает при обыч-
ных условиях. г
41
Присутствие в растворе щёлочи или кислоты легко узнаётся,
как уже говорилось, по действию их на индикаторы. Для нагляд-
ности это показано в таблице.
л
Индикаторы “ Окраска индикаторов •
в щёлочи в кислоте в нейтральной среде
Лакмус Синяя ъ Красная Фиолетовая
Фенолфталеин Малиновая Окраски нет Окраски нет
При проведении реакции нейтрализации к раствору щёлочи
прибавляют раствор лакмуса или опускают лакмусовую бумажку;
лакмус тотчас же синеет. Затем по каплям прибавляют раствор
Рис. 12. Проведение реакции нейтрализации при помощи
измерительного'цилиндра.
Слева; определение количества жидкости, налитой в измерительный
ц:.линдр; уровень жидкости определяют по наиболее низкой точке во-
гнутой поверхности, называемой мениском; отсчёт делают, держа глаз
на уровне мениска, как показано на рисунке. Справа: прибавление'по
каплям раствора кислоты в раствор щёлочи, перелитый из измеритель-
ного цилиндра в стакан.
кислоты (рис. 12 и 13) и взбалтывают жидкость, следя за окраской
лакмуса. Каждая прибавленная капля кцслоты реагирует со всё но-
выми количествами щёлочи:
NaOH 4- НС1 =NaCl + Н2О
щёлочь кислота соль вода
Когда прореагируют все молекулы щёлочи, синяя окраска лак-
муса изменится на фиолетовую. В растворе уже не будет ни щёло-
чи, ни кислоты, а будет находиться образовавшаяся соль. Реакция
жидкости на лакмус будет не щелочная и не кислая, а нейтральная.
42
г) Взаимодействие щелочей с солями. Щёлочи могут
реагировать с содями; в результате реакции образуются новое осно-
вание и соль.
замещении металлов
Сущность реакции заключается во взаг
друг другом в молекулах двух веществ.
Подобные реакции называются реакциями
обмена.
2NaOH 4- CuSO4 = Cu(OH)2-|-Na2SO4
J
гидрат окиси меди
3NaOH 4- FeCl3 = Fe(OH)3 4- 3NaCl
J
гидрат окиси Железа
(стрелка под формулой означает, что ве-
щество выпадает в осадок).
Эта реакция обычно применяется для
получения гидратов окислов тяжёлых
металлов, плохо растворимых в воде.
Если взять гидрат окиси натрия и
хлористый калий, уравнение реакции
может быть представлено в таком виде.
NaOH 4- KCl^zKOH 4- NaCl
гидрат окиси хлористый гидрат окиси хлористый
натрия калий калия натрий
Однако при сливании растворов этих
веществ никаких признаков образова-
ния осадка не замечается. То же будет,
если взять соли натрия и кальция. Объ-
ясняется это тем, что образующиеся ве-
щества хорошо растворяются в воде и,
взаимодействуя между собой, снова дают
прежние вещества.
В уравнении реакции это показано
поставленными вместо знака равенства
двумя стрелками, направленными в обе
стороны. В растворе здесь одновременно
присутствуют все четыре вещества, и реакция протекает в обоих
направлениях. Такие реакции называются обратимыми.
Реакции обмена бывают необратимыми, т. е. проходят в одну
сторону до конца, если какое-либо из образующихся веществ
выделяется в виде осадка (как в приведённых выше двух приме-
рах) или в виде газа (например, реакция взаимодействия кислоты
с содой).
д) Действия нагревания на основания. При нагрева-
нии основания распадаются на воду и окисел металла.
Таким путём получают окислы металлов, непосредственно не
соединяющихся с кислородом.
Рис. 13. Проведение реакции
нейтрализации с помощью
бюретки.
Приливание раствора кислоты из
бюретки; зажим (или кран) приот-
крывают так, чтобы жидкость
стекала по каплям.
43
С гидратом окиси меди, например, эта реакция происходит уже
при слабом нагревании (ниже температуры кипения воды):
(слабое нагревание)
Си(ОН)2 = СиО-|“Н2О
*. гидрат окиси меди- окись меди
(голубого цвета) (чёрного цвета)
Eqm получить осадок гидрата окиси меди, прилив к раствору
щёлочи2 * 4 раствор медной соли, а затем нагреть его, то голубой
оЛдок гидрата окиси меди превращается в чёрный осадок окиси
меди.
Некоторые гидраты окисей разлагаются только при сильном про-
каливании (Са(ОН)2 и др.).
Едкие щёлочи не разлагаются даже при высоких температурах;
NaOH и КОН могут быть расплавлены, но никакого разложения при
этом не происходит.
§ 3. Кислоты
1. Определение. Из кислот уже рассматривались (в VII классе):
серная кислота H2SO4
азотная кислота HNO
соляная кислота НС1
В состав молекул кислот как непременная составная часть их
входят атомы водорода; в состав молекул многих кислот . входят
ещё атомы кислорода (кислород не является обязательной составной
частью молекул кислот).
В VII классе рассматривались также реакции взаимодействия
кислот с металлами:
Zn-|-H2SO4 = ZnSO4 4-Н2ф
сернокислый
цинк (соль)
Zn-|-2HC1 = ZnCl2 +Н2*
хлористый
цинк (соль)
Для кислот является характерным содержание в их молекулах
атомов водорода, способных замещаться атомами металлов, в резуль-
тате чего получаются твёрдые вещества — соли.
Кислотами называются сложные вещества, в молеку-
лах которых содержатся атомы водорода, способные за-
мещаться атомами металлов, в результате чего полу-
чаются соли.
2. Формулы кислот. Если в молекуле кислоты не содержится
атомов кислорода, атомы водорода находятся в непосредственном
соединении с атомом металлоида в соответствии с его валентностью,
например:
+i -1
Соляная кислота Н С1; структурная формула её: Н—С1.
44
4-1 —2 К
Сероводородная кислота Н2 S; структурная формула её:
н/
Если в молекуле кислоты содержится кислород, атомы водорода
находятся в соединении с атомами кислорода, а последние — уже
с атомом металлоида. Например, молекула серной кислоты H2SO4
имеет следующее строение:
Н—Оч ..О
Н—СИ
Формулы кислот всегда изображают так: водород — на первом
месте, металлоид—на втором, а кислород — на третьем (такое изобра-
жение кислот, как будет показано ниже, имеет глубокий смысл).
3. Названия кислот. Если в кислоте образующий её элемент
проявляет высшую валентность, употребляется название с оконча-
4-6
нием „ная“. Например, серная кислота H2SO4. Если образующий
кислоту элемент проявляет меньшую валентность (в молекуле ки-
слоты содержится меньше кислорода), употребляют название с окон-
4 4
чанием „истая**. Например, сернистая кислота H2SO3.
Названия бескислородных кислот составляются из названия ме-
таллоида с прибавлением слова „водородная**. Например, научное на-
звание для соляной кислоты НС1 — хлористоводородная кислота.
4. Кислотные остатки. При образовании солей от молекулы
кислоты остаётся вся часть, находившаяся в соединении с атомами
водорода. Эта часть молекулы кислоты целиком переходит в моле-
кулу соли; например, пр*и реакции
H2SO4 4- Zn = ZnSO4 + Н2 ф
группа атомов SO4 из молекулы серной кислоты переходит без из-
менения в молекулу сернокислого цинка. Такие группы, остающиеся
от молекул кислоты, называются кислотными остатками.
Кислотные остатки — это группы атомов, входящие
в состав молекул кислоты и обычно сохраняющиеся в
реакциях как одно целое (иногда — это одиночные атомы).
Для сравнения приводятся молекулы и кислотные остатки серной
я соляной кислот:
молекула кислотный остаток
серной кислоты серной кислоты
H2SO4 =so4
структурные формулы;
молекула
соляной кислоты
НС1
кислотный остаток
соляной кислоты
—С1
Н—С1
структурные формулы:
—С1
45
Из сказанного следует, чтр молекулы всякой кислоты могут рас-
сматриваться как состоящие из двух частей: 1) атомов водорода,
способных замещаться на металл, и 2) кислотного остатка.
Атомы водорода в соединениях проявляют по одному положи-
тельному заряду, кислотные же остатки заряжены отрицательно;
количество отрицательных зарядов их равно, общему числу положи-
тельных зарядов водородных атомов. Например, кислотный остаток
cejSVio^f кислоты не£ёт 2 отрицательных заряда (—2); ими уравно-
вешиваются 2 положительных заряда двух атомов водорода.
Для наглядности формулы главнейших кислот и кислотных остат-
ков в обычной записи и в структурном виде приводятся в следующей
таблице:
Формулы кислот Число ато- мов Н (основ- ность к-ты) Формулы кислот с обо- значением валентности (зарядов) частей молекул Структурные формулы кислот формулы кис- лотных остат- ков отдельно Структурные формулы кис- лотных остат- ков
Н2СО3 угольная кислота 2 4-2 —2 н2 со3 Н - Оч >С = О Н — О7 —2 со3 1 1 О О О II о
H2SO3 сернистая кислота 2 :+2 —2 н2 so3 Н-Оч >s=o Н — О7 —2 so3 1 -О\ >s=o — О7
H2SO4 серная кислота 2 4-2 —2 н2 so4 О о о. о 1 1 г г —2 so; 1 1 о о сл о о \
HNO3 азотная кислота 1 ±1 •н NO, и 1 о 1 о о —1 NO3 1 о 1 2 . - о о
Н3РО4 фосфорная кислота 3 4-з —з Н3 РО4 о II IX /|\ —3 РО4 о IX /|\ ООО 1 1 1
НС1 соляная кислота 1 4-1 -1 Н С1 Н-С1 — 1 Cl - С1
H2S сероводород- ная кислота 2 4-2—2 (нГ s нч >s н7 s >
Кислоты бывают твёрдые (борная, фосфорная и др.) и жидкие
(серная, азотная и. др.); некоторые кислоты представляют собой
растворы в воде газообразных веществ (соляная, сероводородная).
5. Классификация кислот. Кислоты пб их составу делятся на
кислородные и бескислородные.
Общие свойства кислот обусловлены содержанием в их молеку-
лах атомов водорода, способных замещаться на металл.
Присутствие кислорода в молекулах кислот придаёт им только
особые специфические свойства, которые будут рассмотрены при
изучении каждой из них.
Число атомов водорода кислоты, способных замещаться на ме-
талл, определяет основность кислоты. По основности кислоты де-
лятся на одноосновные, двухосновные и т. д.
НС1 и HNO3 — одноосновные кислоты, так как в молекулах их
содержится по 1 атому водорода, замещаемому на металл; H2SO4 —
двухосновная кислота, так как в молекулах её содержатся 2 таких
атома водорода.
Существуют кислоты, в молекулах которых кроме атомов водо-
рода, способных замещаться на металл, имеются ещё атомы водо-
рода, на металл не замещающиеся, так как они прочно связаны
с кислотным остатком в одно целое. К таким кислотам, например,
относится уксусная кислота Н«СН3СО2; кислотный остаток её —
СН3СО2. Так как в уксусной кислоте способен замещаться на
металл только один атом водорода, она является кислотой одно-
основной.
6. Химические свойства кислот, а) Действие кислот на
индикаторы. Кислоты в растворе распознаются, подобно щелочам,
при помощи индикаторов. В кислых растворах лакмус принимает
красную окраску, фенолфталеин остаётся бесцветным.
б) Взаимодействие кислот с металлами. Кислоты мо-
гут реагировать с металлами, способными вытеснять водород; в ре-
зультате реакции образуется соль и выделяется свободный водород:
Zn-[-H2SO4 = ZnSO4 -j- Н2 ф
сернокислый
цинк
Вытеснять водород из кислот могут только металлы, химически
более активные, чем водород.
По своей химической активности металлы могут быть располо-
жены в ряд, получивший название ряда активности металлов.
Этот ряд был установлен русским химиком — академиком Н. Н. Беке-
товым ещё в 60-х годах прошлого века. Ряд приводится в сокра-
щённом виде:
Ряд активности металлов
К, Na, Са, Mg, Al, Zn, Fe, Pb, H, Cu, Hg, Ag, Au
Направление уменьшения химической активности
47
В начале ряда стоит наиболее активный металл, в конце ряда —
наименее активный металл.
Металлы, стоящие до водорода, способны вытеснять его из кис-
лот; металлы, стоящие после водорода, т. е. медь, ртуть, серебро,
золото, не способны вытеснять его из кислот.
в) Взаимодействие кислот с основными окисла-
ми. Кислоты реагируют с основными окислами; в результате реак-
ции образуется соль и вода: •
(слабое нагревание)
H2SO4+ CuO = CuSO4 4-Н2О
окись меди сернокисдая
медь
Эта реакция протекает, почти со всеми окислами; лишь для не-
большого числа окислов она практически неосуществима, например
для окиси хрома, употрёбляюиДейёя в качестве прочной зелёной ма-
сляной краски (окраска крыш).
г) Взаимодействие кислот с основаниями. Кислоты
реагируют с основаниями; в результате реакции образуются соль и
вода, т. е. те же продукты, что и при взаимодействии кислот с
окислами, только в этом случае молекул воды образуется вдвое
больше:
(слабое нагревание)
H2SO4+ Си (ОН)2 = CuSO4 +2Н2О
гидрат окиси сернокислая
меди медь
д) Взаимодействие кислот с солями. Кислоты легко
реагируют с солями, если в результате реакции получается новая
летучая кислота или плохо растворимая соль.
(нагревание)
2NaNO3 4- H2SO4 = Na2SO4 L 2HNO3f
азотнокислый серная кислота , сернокислый азотная кислота z
натрий (нелетучая) натрий (летучая)
AgNO3 4- НС1 = AgCl 4- HNO3
4-
Первая реакция обычно применяется в лаборатории для получе-
ния кислот (летучих) из их солей.
е) Действие нагревания на кислоту. При нагревании
кислородсодержащие кислоты разлагаются на воду . и кислотный
окисел (ангидрид).
Многие кислоты проявляют значительную устойчивость; например,
серная кислота разлагается только при достаточно сильном нагревании:
(нагревание)
h2so4 = s(\ 4-н2о
серная кислота серный ангидрид
Угольная кислота разлагается очень легко; уже при низкой тем-
пературе она распадается на воду и углекислый газ:
Н2СО3 =Н2О4- СО2
угольная угольный
кислота ангидрид
(углекислый газ)
48
Поэтому при действии соляной или другой кислоты
лые соли выделяющаяся угольная кислота тотчас же
с выделением углекислого газа:
на углекис-
разлагается
Na2CO8 + 2НС1 = 2NaCl + Н2СО3
углекислый угольная кислота
натрий
Н2о СО2|
§ 4. Соли
1. Определение и формулы солей.
Солями называются сложные вещества, молекулы
которых состоят из атомов металла и кислотных
остатков.
Атомы металла и кислотные остатки находятся в молекулах солей
в таком количестве, что все их валентности взаимно насыщены (коли-
чество положительных зарядов всех атомов металла равно количеству
отрицательных зарядов всех кислотных остатков). Например, в состаз
молекулы сернокислого алюминия входят 2 атома алюминия (заряд
одного атома равен 3) и 3 остатка серной кислоты (заряд кислот-
ного остатка равен — 2);
SO4
Al(f
+3 ~2
A1,(SO4)3 или s0«
А1<
so4
2. Названия солей. Если соль содержит кислород, название
её составляется из названия кислоты (кислородсодержащей) и
названия металла; например, для соли Na2SO4 даётся название серно-
кислый натрий, для соли NaNO3 даётся название азотнокислый
натрий.
Кроме того, употребляются также названия солей, образованные
из корней латинских названий металлоидов. Например, для серно-
кислого натрия употребляется ещё название сульфат натрия (латин-
ское название серы — сульфур); для азотнокислого натрия упо-
требляется название нитрат натрия (латинское название азота —•
нитрогениум).
Если соль не содержит кислорода, перед названием металла
указывается название металлоида с окончанием „истый" („истое").
Например, NaCl — хлористый натрий; AgCl— хлористое серебро.
Такие соли называются ещё иначе: к корню названия металлоида
присоединяется окончание „ид", например для NaCl употребляется
название хлорид натрия, для AgCl — хлорид серебра.
4 В. В. Левченко 49
Если металл с переменной валентностью образует с металлоидом
соли, то для названия соли с меньшей валентностью металла берётся
окончание „истый" („истое“1, а для названия соли с большей валент-
ностью металла берётся окончание „ный“ (,,ное“); при названиях
солей, производимых от латинских названий металлоидов, в скобках
проставляется валентность металла.
Например:
4- 2
FeCl2— хлористое железо, или хлорид железа (2);
4-з
FeCl3 — хлорное железо, или хлорид железа (3).
3. Физические свойства солей. Соли — твёрдые вещества;
часто образуют правильной формы кристаллы; многие из них окра-
шены. f
Растворимость солей различна. Некоторые соли настолько плохо
растворяются в воде, что практически считаются нерастворимыми.
Растворимость важнейших солей указана на приводимой таблице
(стр, 51). х
4. Классификация солей. Если в молекулах кислот содержится
несколько атомов водорода, способных замещаться на металл, такие
кислоты с. одним и тем же металлом образуют несколько солей.
В этих случаях соли могут бПть средние и кислые.
Средними солями называются такие соли, в молекулах
которых содержатся атомы металла и кислотные (Тстащ-
ки. (Все атомы водорода в кислоте замещены на металл.)
Кислыми солями называются такие соли, в молекулах
которых, кроме атомов металла, содержатся ещё один
или несколько атомов водорода, способных замещаться на
металл. z
Например, средняя соль: Na2SO4 — сернокислый натрий (суль-
фат натрия);
кислая соль: NaHSO4 — кислый сернокислый натрий (бисуль-
фат натрия).
При названиях кислых солей впереди ставится слово „кислый"
(например: кислый сернокислый натрий) или приставка „би" (напри-
мер: бисульфат натрия).
5. Химические свойства солей, а) Взаимодействие солей
с металлами. Соли ’могут взаимодействовать с металлами; в резуль-
тате реакции образуются новая соль и свободный металл.
При этой реакции происходит вытеснение металла, входящего
в состав соли, свободным металлом по правилу: химически более
активный металл вытесняет из соединений химически менее актив-
ный металл (см. ряд активности металлов на стр. 47).
В ряду активности металлов каждый предыдущий металл вытес-
няет последующие металлы из их солей.
50
Таблица растворимости оснований и солей в воде
Связанные с металлом группы Me таллы
4-1 К 4-1 Na 4-2 Ва t2 4-2 Mg 4-з А1 4-3 Сг te2 4“ 2 Мп 4-2 Zn 4-1 Ag 4-1 Hg 4-2 Hg 4“2 Си £ь2 4-3 Bi + 2 Sn
Гидроксильная группа он р Р Р м м н н н н и н — — — н н н н
Кислотные остатки Соответствующие им кислоты
Название Формула
— 1 С! Соляная НС1 р Р Р р р Р р р р р р н н Р р м — Р
— 2 S Сероводород- ная HaS р Р Р м р — — и — н н н н н н н н н
— 2 SO, . Сернистая H2SO3 р Р н н н — — н — н н н н н н н н —
— 2 SO4 Серная H2SO4 р Р н м р Р р р р р р м м р р н р р
— 3 РО4 Фосфорная Н3РО4 р Р н н н н н н и н н н н н н н н н
— 2 со3 Угольная Н2СО3 р Р н н н — — н н н н н н н н н н —
— 2 SiO3 Кремниевая H2SiO3 р Р н н н н н н н н н н — — н н — —
— 1 NO3 Азотная HNO3 р Р р р р р р р р р р р р р р р р р
Примечание. Цифры указывают валентность; буква „р“ означает растворимое в воде вещество; буква ,н“ — нераство-
римое; буква „м“ — малорастворимое; черта в клетке означает, что данное вещество не существует или разлагается водой.
Примером этого могут служить вытеснения меди более активными
металлами — железом, цинком, магнием:
CuSO4 Fe = FeSO4 Си
сернокислая сернокислое
медь железо
CuSO4 Zn = ZnSO4 -|- Си
сернокислый
цинк
CuSO4 4- Mg = MgSO4 + Си
сернокислый
магний
Свинец вытесняется из солей более активным цинком:
Pb (NO3)2 + Zn = Zn (NO3)2 + Pb
азотнокислый азотнокислый
свинец цинк
б) Взаимодействий солей со щелочами. Соли могут
реагировать со щелочами; в результате реакции образуются новое
основание и новая соль, если что-либо из них нерастворимо.
CuSO4 4- 2NaO Н = Cu(OH)2 4~ Na2SO4
сернокислая едкий । сернокислый
медь натр гидрат окиси натрии
меди
• (основание)
в) Взаимодействие солей с кислотами. Соли могут
реагировать с кислотами; в результате реакции образуется новая
соль и новая кислота:
(нагревание)
2NaCl 4- H2SO4 = Na2SO4 4~ 2НС11
хлористый конц. сернокислый 1
натрий натрий
г) Взаимодействие солей с солями. В растворах соли
могут реагировать с другими солями; в результате реакции обра-
зуются две новые соли:
(в растворе)
Na2CO3 4- СаС12 = СаСО3 4- 2NaCl
углекислый хлористый хлористый
натрий кальций углекислый натрий
кальций
Эти реакции являются ярким примером реакций обмена, о кото-
рых говорилось при рассмотрении реакций взаимодействия щелочей
с солями. Для любой пары солей можно составить уравнение реакции,
замещая металлы один другим; однако от растворимости образую-
щихся солей зависит, пройдёт ли реакция до конца.
Если взять соли хлористый натрий и сернокислый магний, реак-
ция не доходит до конца, так как обе получающиеся соли хорошо
растворимы в воде:
(в растворе)
2NaCl 4- MgSO4 Г MgCl2 4~ Na2SO4
хлористый сернокислый хлористый сернокислый
натрий магний магний натрий
52
При сливании растворов этих солей ни осадка, ни каких-либо
других признаков реакции не наблюдается. В растворе одновременно
находятся все четыре соли, так как образовавшиеся соли, взаимо-
действуя между собой, образуют взятые соли. Реакция проходит
здесь в обоих направлениях и является обратимой.
Чтобы узнать, получится ли при взаимодействии двух взятых
солей осадок (нерастворимая соль), пользуются таблицей раствори-
мости (стр. 51). На таблице, например, указано, что сернокислый
барий в воде нерастворим. Из этого следует, что реакции
обмена, при которых образуется сернокислый барий, доходят
до конца:
(в растворе)
ВаС12 Na2SO4 = BaSO4 -|- 2NaCl
хлористый сернокислый 7 хлористый
барий натрий сернокислый натрий
барий
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что называется химическим элементом?
2. Чем отличаются металлы от металлоидов?
3. Какие вещества называются окислами?
‘4. В каких случаях окислы называются „окись', „закись”?
5. Как составляются структурные и обычные формулы окислов? Пока-
жите это на примере окислов — натрия, кальция, алюминия, железа, серы,
углерода.
6. Какие окислы называются основными и кислотными?
7. Какие вещества называются ангидридами?
8. Выведите формулы ангидридов из формул кислот — сернистой, сер-
ной, азотной, фосфорной.
9. Какие вещества называются основаниями?
10. Приведите обычные и структурные формулы оснований — натрия,
кальция, железа, алюминия.
11. Что означает название „гидрат окиси”? Приведите примеры.
12. Какие основания называются щелочами? Приведите формулы изучен-
ных щелочей.
13. Какие вещества называются кислотами?
14. Какие различаются кислоты?
15. Приведите формулы обычные и структурные важнейших бескисло-
родных и кислородсодержащих кислот.
16. Какие вещества называются солями?
17. Как составляются формулы солей, исходя из валентности металла и
кислотного остатка?
18. Составьте формулы солей хлористых, азотнокислых, сернокислых,
углекислых, фосфорнокислых следующих металлов: натрия, калия, магния,
кальция, цинка, алюминия, железа.
19. Как распознаются щёлочи и кислоты?
20. Какие вещества называются индикаторами?
21. Что представляет собой негашёная известь? гашёная известь?
22. Для каких металлов может быть осуществлён непосредственный
переход к основанию? Покажите это уравнениями реакций.
23. Для каких металлоидов может быть осуществлён непосредственный
переход к кислоте? Покажите это уравнениями реакций.
24. Что представляет собой песок?
25. Можно ли, действуя на песок водой, получить кремниевую кислоту?
26. Какие реакции характерны для кислот?
53
27. Что происходит при взаимодействии кислоты с металлами?
28. Напишите уравнения реакций взаимодействия растворов кислот —
серной, соляной с металлами — цинком, алюминием, железом.
29. Что происходит при взаимодействии кислот с окисью металла?
Напишите уравнения реакций взаимодействия указанных в 28-м вопросе
кислот с окисями цинка, алюминия, железа.
30. Что происходит при взаимодействии кислоты с гидратом окиси
металла? Напишите уравнение реакций взаимодействия указанных в 28-м во-
просе кислот, а также и фосфорной кислоты с гидратами окисей натрия,
калия, кальция, цинка, алюминия, железа.
31. Что представляет собой реакция нейтрализации? Приведите пример.
32. Что происходит при взаимодействии солей с солями?
33. Какие реакции называются реакциями обмена?
34. При каких условиях реакция обмена является необратимой?
35. Напишите уравнения необратимых реакций, при которых происходит
образование осадка, выделение .газообразного вещества.
36. Напишите уравнения реакций, при помощи которых могут быть
получены окислы — основные и» кислотные.
37. Напишите уравнения реакций, при помощи которых могут быть
получены основания (пользуйтесь таблицей на стр. 33).
38. Напишите уравнения реакций, при помощи которых могут быть
получены кислоты (пользуйтесь таблицей на стр. 33).
39. Напишите уравнения реакций, при помощи которых могут быть
получены соли (пользуйтесь таблицей на стр. 33).
ГЛАВА III
РАСТВОРЫ
§ 1. Отличие растворов от взвесей (суспензий и эмульсий)
Явление растворимости всем хорошо известно из практики обы-
дённой жизни. Если бросить в воду щепотку поваренной соли (лучше
химически чистого хлористого натрия), соль постепенно растворится
в воде и, наконец, перейдёт в раствор. Жидкость при этом останется
совершенно прозрачной и однородной. Обнаружить в полученном
растворе присутствие соли можно 'специальными химическими реак-
циями или выпариванием жидкости. Как видно на приведённом при-
мере с поваренной солью, раствор представляет собой чистую,
прозрачную и совершенно однородную жидкость. В растворе рас-
творённое вещество распределено в растворителе в настолько
раздроблённом виде, что не даёт никакой мути (независимо> от того,
получается ли раствор бесцветный или окрашенный); кроме того,
растворённое вещество не выделяется из раствора в виде осадку при
любом длительном стоянии, если только не происходит испаренця
растворителя. В растворах молекулы растворённого вещества равно-
мерно распределены между молекулами растворителя. Отсюда
употребляемое название их — молекулярные (или истинные) рас-
творы.
Раствором называется однородная смесь, состоящая из
растворителя, растворённого вещества и продуктов их
взаимодействия.
54
Отсутствие мути или, иначе говоря, однородность является
основным признаком растворов; от них следует отличать суспен-
зии и эмульсии, которые являются взвесями — мутными жидкостями.
I Суспензия — это жидкость, в которой рассеяны мел-
I кие частицы (скопления молекул) твёрдого вещества.
При отстаиваний суспензий взвешенное вещество выделяется в
виде осадка.
I Эмульсия — это жидкость, в которой рассеяны мелкие
I капельки другой жидкости.
Примером эмульсии может служить молоко, содержащее во взве-
шенном состоянии капельки жира. Составные части эмульсии также
разделяются при стоянии (отделение сливок в молоке).
§ 2. Значение растворов при проведении химических
реакций
Химические процессы заключаются в превращениях молекул
одних веществ в молекулы других веществ. В большинстве случаев
эти превращения происходят в резуль-
тате взаимодействия не менее чем
двух молекул.
Химические силы, вызывающие
взаимодействие между молекулами,
проявляются только на весьма близком
расстоянии (порядка размеров самих
молекул); поэтому для возникновения
реакции необходимо тесное сближение
между молекулами реагирующих ве-
ществ. Легче всего достигается оно в Рис- 14. Измельчение веществ
газообразных веществах, молекулы ко- в стУпке-
торых перемещаются свободно, а ПОЭТО- Вещество растирать, но не толочь!
му легко перемешиваются и сближаются.
В жидкостях перемешивание молекул происходит также доста-
точно легко; оно ускоряется взбалтыванием и нагреванием. Труднее
всего достигается соприкосновение молекул в твёрдых телах. Здесь
необходимо измельчение реагирующих веществ, превращение их
в тонкий порошок и тщательное перемешивание смеси; обычно в ла-
бораториях этого добиваются растиранием веществ в фарфоровой
ступке (рис. 14).
Для проведения реакций между твёрдыми веществами лучше всего
переводить их в раствор, так как в растворах молекулы растворён-
ных веществ разъединены и поэтому легко сталкиваются друг с дру-
гом. Растворы затем сливают, взбалтывают или размешивают.
55
§ 3. Тепловые явления при растворении
причине, что и при испарении.
Iiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiwiim
Во многих случаях растворение веществ в воде сопровождается
значительным поглощением тепла. Например, при растворении в воде
азотнокислого калия, азотнокислого аммония и некоторых других
веществ наблюдается заметное охлаждение жидкости (рис. 15, А).
Это явление используется для получения низких температур; так,
например, при растворении азотнокислого аммония в равном по весу
количестве воды раствор охлаждается до — 27°. (Раствор после
употребления можно выпаривать и снова пользоваться полученной
твёрдой солью.)
Понижение температуры ₽ри растворении происходит по той же
Вещество при растворении дробится
до отдельных молекул и пе-
реходит в бблыиий объём,
распределяясь во взятом рас-
творителе. Такие процессы
сопровождаются поглощением-
тепла. Например, при испа-
рении жидкости всегда на-
блюдается охлаждение. Если
поместить на Ьуку каплю
спирта, а ещё лучше эфира,
охлаждение от испаряющейся
жидкости бывает ясно заметно.
После купанья, если не обте-
реться досуха, испаряющаяся
на теле вода вызывает значи-
тельное охлаждение. '
В некоторых случаях при
растворении наблюдается вы-7
деление тепла. Если раство-
рять в воде твёрдую щёлочь
(едкое кали, едкий натр) или
осторожно приливать в воду концентрированную серную кислоту,
можно заметить значительное повышение температуры (рис. Ч5, Б).
Выделение тепла является результатом процессов химического
характера. При образовании растворов происходит не механическое
только смешение растворяющегося вещества с, растворителем (водой),
но и некоторое химическое взаимодействие между ними. К молеку-
лам растворяющегося вещества притягиваются молекулы воды, между
ними устанавливается некоторая связь, у разных веществ в различ-
ной степени прочная. Этот процесс взаимодействия между растворя-
емым веществом и водой в определённой мере приближается к хими-
ческим процессам, при которых выделяется тепло, что было уста-
новлено знаменитым русским химиком Д. И. Менделеевым (1887).
При растворении одновременно происходят два процесса:
1) дробление растворяющегося вещества на отдельные молекулы
Рис. 15. Тепловые явления при раство-
рении.
А — понижение температуры при растворении
азотнокислого аммония; стакан примёрз к смо-
ченной водой дощечке; Б—повышение темпера-
туры при растворении едкого натра; вода в опу-
щенной в жидкость пробирке сильно нагрелась.
56
и распределение их в большем объёме, что сопровождается погло-
щением тепла;
2) некоторое объединение между молекулами растворяющегося
вещества и молекулами воды под влиянием взаимного притяжения,
что сопровождается выделением тепла.
При растворении веществ, в зависимости от химической природы
их, перевес берёт то один процесс, то другой; в результате этого
наблюдается или охлаждение, или разогревание раствора.
Растворы во многих отношениях занимают некоторое среднее
положение между смесями и химическими соединениями, они отли-
чаются большой устойчивостью, не разделяются при отстаивании, как
суспензии и эмульсии; в отличие же от типичных химических соединений
количественный состав растворов в большинстве случаев может быть
очень разнообразным, и к ним не приложим закон постоянства со-
става.
§ 4. Растворимость разных веществ
Растворимостью называется способность одного вещества равно-
мерно распределяться в другом. Растворимость зависит от химиче-
ской природы растворяемого веще-
ства и растворителя.
В воде растворяются многие
твёрдые тела, жидкости и газы.
При растворении разных веществ
наблюдаются случаи, когда веще-
ство растворяется в любом количе-
стве; например, винный спирт (алко-
голь) и глицерин растворяются в
воде в любых отношениях.
Большинство веществ может рас-
творяться в воде (и других рас-
творителях) только до определён-
ного предела.
1. Насыщенные и ненасыщен-
ные растворы. Если при раство-
рении какого-либо вещества при
определённой температуре всё оно
не растворилось во взятом количе-
стве воды (или другого раство-
рителя), несмотря на перемешивай
вается насыщенным (рис. 16).
Рис. 16. Получение насыщенного
раствора при нагревании.
:, полученный раствор назы-
Насыщенным раствором называется такой, раствор,
в котором при данных условиях не может больше рас-
творяться взятое вещество.
Для растворения остающегося в осадке вещества при той же
температуре необходимо дополнительно подливать воду. Если воды
57
взять больше, чем требуется для полного растворения взятого коли-
чества вещества, получается ненасыщенный раствор.'
Ненасыщенным раствором называется такой раствор,
в котором при данных условиях может раствориться
ещё некоторое количество взятого вещества.
В большинстве случаев растворы приготовляют со значительным
избытком воды, т. е. ненасыщенные.
Кроме указанных названий растворов (насыщенные, ненасыщен-
ные), употребляются ещё и другие, менее точные названия: концен-
трированный и разбавленный. Название „концентрированный"
часто даётся растворам, в которых содержится достаточно много
вещества, хотя полной насыщенности может не быть.
Название „разбавленный" даётся растворам, в которых содер-
жится сравнительно мало вещества.
2. Количественное выражение растворимости веществ. Раство-
римость часто выражают числом граммов вещества, дающим при
данной температуре насыщенный раствор в 100 г растворителя.
Совершенно нерастворимых веществ в природе нет, но раствори-
мость многих из них настолько мала, что в большинстве случаев ек)| мож-
но пренебрегать. Такие вещества называют обычно „нерастворимыми".
К веществам, считающимся „нерастворимыми", относятся, напри-
мер, мел (углекислый кальций), каломель (хлористая ртуть) и др.
В 100 г воды при температуре 18°С растворяется:
мела 0,0013 г,
• каломели 0,00021 г.
3. Влияние температуры на растворимость. Растворимость
большинства веществ сильно изменяется с изменением температуры.
В таблице приведена растворимость некоторых веществ, с кото-
рыми приходится сталкиваться в обыдённой жизни.
Название В 100г воды растворяется граммов вещества при температуре
0° 20° 1О0°
1. Борная кислота 2,6 4,9 28,1
2. Бертолетова соль (хлорноватокислый калий) 3,3 7,3 56,2
3. Английская соль (сернокислый магний) . 24,7 35,5 68,4
4. Селитра калийная (азотнокислый ка- лий) 13,1 31,7 246
5. Поваренная соль (хлористый натрий) . . 35,7 35,9 39,1
6. Гипс (сернокислый кальций) 0,18 0,21 0,07
Из данной* таблицы видно, что растворимость большинства твёр-
дых тел сильно увеличивается при нагревании. Лишь в редких
58
случаях растворимость мало зави-
сит от температуры (у поварен-
ной соли) или понижается (у гипса).
Для того чтобы наглядно
представить влияние темпера-
туры на растворимость разных
веществ, вычерчивают в опре-
делённом масштабе кривые рас-
творимости. Для этого на клет-
чатой бумаге по горизонталь-
ной линии откладывают тем-
пературу, а по вертикальной
линии — растворяющееся количе-
ство вещества (рис. 17).
В воде и других жидко-
стях растворяются не только
твёрдые и жидкие вещества, но
и газы.
Растворимость газов зави-
сит от природы газов, темпе-
ратуры, а также от давления.
При повышении температуры
растворимость газов умень-
шается. Это легко обнаружить
при нагревании обыкновен-
Рис. 17. Кривые растворимости.
ной воды. Прежде чем вода закипает, на стенках сосуда всегда
появляются пузырьки газа (рис. 18). Эти пузырьки представляют
собой газы воздуха, находившиеся в воде в растворённом состоянии.
Растворимость газов уменьшается также при уменьшении
давления.
Взвешивание газов сопряжено с большими практическими труд-
ностями, поэтому растворимость газов обычно выражают не весом,
а числом объёмов газа при нормальных условиях, т. е. приведённых
к 0°С и 760 мм давления.
Растворимость разных газов различна, что видно из нижеприве-
дённой таблицы.
В одном объёме воды растворяется при нормальных условиях
ниже указанное количество объёмов газа;
При темпе- ратуре Кислорода Азота Водорода Углекислого газа Аммиака
0° 0,0492 0,0235 0,0215 1,713 1176
20° 0,0310 0,0154 0,0182 0,878 702
У кислорода, азота, водорода растворимость невелика; у углекис-
лого газа и аммиака значительно большая. Слишком большая рас-
творимость газа указывает на взаимодействие его с водой.
69
§ 5. Концентрация растворов
В большинстве случаев в лабораторной практике употребляются
разбавленные растворы, но разбавленный раствор — понятие неопреде-
лённое и ничего не говорит о количестве находящегося в растворе
вещества. Часто же необходимо бывает учитывать, сколько вещества
Рис. 18. Выделение из воды растворённого в ней воздуха.
А — опыт в колбе; Б — опыт в пробирке.
содержится в том или ином растворе. Для этих целей введено по-
нятие концентрация.
Концентрацией, раствора называется количество рас-
творённого вещества (весовое или объёмное), содержащееся
в определённом количестве раствора.
Выражать концентрацию раствора можно различными способами.
Часто выражают её в весовых процентах. Например, 2-процентный
раствор поваренной соли означает, что 2 а соли содержится в 100 г
раствора; следовательно, чистой воды содержится 98 г.
В химической практике концентрацию удобно выражать числом
грамм-молекул (молей) вещества в 1 л раствора. (Напомним, что грамм-
молекула — это количество граммов вещества, численно равное его
молекулярному весу.)
Растворы, содержащие в 1 л 1 грамм-молекулу вещества, называются
одномолярными, или просто молярными (рис. 19), содержащие
2 грамм-молекулы вещества, называются двумолярными и т. д.
В этих случаях концентрацию растворов выражают дробью,
в которой числитель показывает число грамм-молекул вещества, а зна-
менатель— объём раствора, в котором это количество грамм-молекул
содержится; около цифры ставится ещё буква М.
60
Например: M — одномолярный раствор, или просто молярный,
2Л1—двумолярный раствор, 1/10Л1 или 0,12И—децимолярный раствор
(содержащий одну грамм-молекулу вещества в 10 л раствора, или,
иначе, Wq грамм-молекулы вещества в 1 л раствора).
Так как вещества, взятые в количестве грамм-молекул, содержат
одинаковое число молекул, то и в литре молярных растворов содер-
жится одинаковое число
молекул растворённых ве-
ществ; вообще, в равных
объёмах равномолярных
растворов количество
молекул растворённых
веществ одинаково.
Молярные растворы
очень удобны для поль-
зования, так как, беря
определённые объёмы их,
мы легко достигаем нуж-
ного нам соотношения
— Жидкости
— 1 литр
® Вещества
1 граммг
молекула
Б
Рис. 19. Приготовление раствора точной
концентрации.
между молекулами реаги-
рующих веществ. Напри-
мер, нам нужно, чтобы с
А — мерная колба на 1 л (1000 мл); Б — молярный раствор,
находящейся в растворе содой (углекислым
натрием) прореагировали полностью находящиеся в растворах кислоты:
соляная, серная, фосфорная (все растворы одинаковой молярной
концентрации).
Исходим из уравнений реакций:
1) Na2CO3 + 2HCl = 2NaCl + H2O4-CO2t
2) Na2CO3-j-H2SO4 = Na2SO4 + H2O + CO2f
3) 3Na2CO3 4- 2Н3РО4 = 2Na3PO4 -f- 3H2O + 3CO2 f
Согласно первому уравнению, на 1 объём молярного раствора
соды надо взять 2 объёма молярного раствора соляной кислоты.
Согласно второму уравнению, на 1 объём молярного раствора
соды надо взять 1 объём молярного раствора серной кислоты.
Согласно третьему уравнению, на 3 объёма молярного раствора
соды надо взять 2 объёма молярного раствора фосфорной кислоты.
§ 6. Кристаллизация веществ
1. Процесс кристаллизации. Если взять ненасыщенный раствор
какой-либо соли и оставить его в открытом сосуде (рис. 20), вода
будет испаряться, и концентрация раствора будет возрастать. В ре-
зультате продолжающегося испарения воды через некоторое время
раствор сделается насыщенным. При дальнейшем испарении воды он,
оставаясь всё время насыщенным, будет выделять избыток растворён-
ной соли в виде кристаллов, т. е. твёрдых тел правильной формы
(кристаллы, например, поваренной соли имеют форму кубиков).
61
Такое выделение вещества из раствора называется кристаллиза-
цией. Кристаллизация происходит и в том случае, если насыщенный
при нагревании раствор оставить охлаждаться. Растворимость боль-
шинства солей уменьшается с понижением температуры, поэтому при
охлаждении насыщенных растворов происходит частичное выделение
солей — кристаллизация их (рис. 21), •
Остающийся раствор называется ма- 1
точным раствором, [
Рис. 21. Кристаллизация
при охлаждении горячего
насыщенного раствора.
Рис. 20. Кристаллизация при мед-
ленном испарении растворителя.
2. Кристаллизационная вода. Выделяющиеся из водного рас-
твора кристаллы многих веществ содержат, кроме самого вещества,
ещё воду, вошедшую в состав кристаллов. Эту воду легко обнару-
жить, если нагреть совершенно сухие на вид кристаллы сернокислой
меди (медного купороса), квасцов и др. (рис. 22).
Содержащаяся в кристаллах вода находится в соединении с мо-
лекулами вещества в строго определённых количественных соотно-
шениях. Например, в кристаллах медного купороса каждая молекула
сернокислой меди соединена с пятью молекулами воды; изображается
это так: CuSO4-5H2O.
При нагревании кристаллов медного купороса они теряют воду
и превращаются в безводную соль белого цвета (рис. 22, Б).
(нагревание)
CuSO4 • 5Н2О = CuSO4 4- 5Н2О
синего цвета белого цвета
Если на прокалённый порошок медного купороса подействовать
водой, происходит обратный процесс — присоединение воды, и синяя
окраска восстанавливается:
CuSO4 + 5Н2О = CuSO4 • 5Н2О
белого цвета синего цвета
При этом соль сильно разогревается, что легко обнаружить, при-
кладывая палец (сравнить с разогреванием жидкости при растворе-
нии, стр. 56).
62
Вода, соединяющаяся с веществом при образовании кристаллов,
называется кристаллизационной водой, а содержащие её кристаллы
называются кристаллогидратами.
Обычно при составлении уравнений химических реакций пишут
формулы солей без кристаллизационной воды. Делают это потому,
что кристаллизационная вода в реакциях обычно не участвует.
Многие кристаллогидраты отличаются малой прочностью и более
или менее легко отдают кристаллизационную воду, находясь в доста-
точно сухом воздухе. Например, кристаллы соды МазСОзДОНзО при
Рис. 22. Выделение кристаллизационной воды при
прокаливании.
А — прокаливание порошка квасцов; соль, выделяя воду,
сильно вспучивается; Б — прокаливание порошка медного
купороса при беспрерывном размешивании (во избежание
перегрева и разложения соли до окиси меди).
хранении в открытом сосуде уже при комнатной температуре выделяют
кристаллизационную воду, становятся мутными, а затем рассыпаются
в порошок. Такой процесс разрушения кристаллов на воздухе назы-
вается выветриванием.
3. Гигроскопическая вода. От кристаллизационной воды следует
отличать воду гигроскопическую. Так называют воду, более или
Менее прочно удерживающуюся на поверхности и в порах твёрдых
веществ, особенно порошкообразных. Исследования показывают, что
всякое тело, находясь в соприкосновении с наружным воздухом
(всегда содержащим пары воды), покрывается на поверхности тонким
слоем влаги. Количество гигроскопической воды, находящейся
в разных веществах, не подчиняется закону постоянства состава и
находится в зависимости не от веса поглощённого вещества, а от его
поверхности.
Гигроскопическая вода может быть удалена посредством нагревания
До 100—105°. Для такого нагревания употребляется сушильный шкаф
(рис. 23). Высушиваемое вещество помещают на полочку шкафа,
63
Тигель
Фарфоровая
пластинка с
отверстиями
Крышка
эксикатора
Концентрированная
серная кислота '
Рис. 24. Эксикатор.
закрывают дверцу и нагревают шкаф под-
ставленной снизу горелкой. Сверху в шкаф
вставлен термометр, по которому следят
за температурой; её поддерживают на нуж-
ной высоте, регулируя пламя горелки.
Имеются такке шкафы с саморегулирую-
щим прЛпособлением и электрическим на-
гревом. *
Для того чтобы не допустить погло-
щения воды из воздуха высущенным
веществом, его помещают в особый со-
суд— эксикатор ’(рис., 24). В нижнюю
часть эксикатора помещают вещество,
жадно, поглощающее влагу: Концентриро-
ванную серную кислоту или порошок
безводного хлористого кальция и др.
Сверху эксикатор прикрывают хорошо пришлифованной крышкой.
Благодаря этому в эксикаторе получается атмосфера, Аочти пол-
ностью лишённая паров воды, и помещённое в нём высушенное
вещество остаётся сухим.
§ 7. Решение задач на приготовление растворов разной
концентрации
1. Определение весовых количеств, растворимого вещества и
растворителя в растворе определённой процентной концентрации.
Задача. Сколько граммов соли и воды надо взять для получе-
ния 600 г 15-процентного раствора?
Решение. Выражение концентрации раствора в процентах
показывает, сколько граммов растворённого вещества находится
в 100 г раствора.
Для решения задачи рассуждают так:
в 100 г 15-процентного раствора содержится 15 г соли;
в 600 г „ и » х г „ »
Составляют пропорцию:
л__600
15 —100 ’
Вычисляют неизвестное:
15-600 пп
х = 00 = 90 г соли.
Для того чтобы узнать, сколько воды должно содержаться в дан-
ном растворе, необходимо из общего веса раствора (600 г) отнять
вес соли (90 г).
600 — 90 = 510 г воды.
Ответ. Для получения 600 г 15-процентного раствора необходимо взять
90 г соли и 510 г воды.
64
2. Определение процентной концентрации по количеству рас-
творённого вещества
• Задача. Какова процентная концентрация раствора, получен-
ного путём растворения 50 г соли в 750 г воды?
Решение. Узнают вес раствора путём сложения весового коли-
чества растворённого вещества с весовым количеством воды:
50 г Ц- 750 г — 800 г раствора.
Для определения процентной концентрации раствора узнают,
сколько граммов соли содержится в 100 г раствора:
в 800 г раствора содержится 50 г соли;
в 100 г „ „ х г соли.
Составляют пропорцию:
_ 100 .
50 — 800 •'
Вычисляют неизвестное:
__50-100__ с qr 1 ЛЛ
•v= - олл - = 6,25 г соли в 100 г раствора.
oUU
Ответ. 50 г соли в 800 г раствора составляют концентрацию раствора,
равную 6,25°/о-
3. Определение весового количества растворённого вещества
содержащегося в растворе определённой молярной концентрации
Задача. Сколько граммов фосфорной кислоты содержится в
400 мл 2-молярного раствора (27И)?
Для решения этой задачи прежде всего вычисляют, сколько грам-
мов составляют 2 моля фосфорной кислоты. Для этого пишут фор-
мулу фосфорной кислоты, вычисляют молекулярный вес (Af), вес
одного моля (ГАГ) и вес двух молей (2Г/И).
Н3РО4
М= 98
ГМ= 98 г
2ГМ= 196 г
Так как 2-молярным раствором называется такой раствор,
в 1л (1000 мл) которого сццержится 2 моля растворённого веще-
ства, то рассуждают так:
в 1000 мл 2-молярного раствора содержится 196 г фосфорной кислоты;
в 400 лл „ „ х г' „ ,
Составляют пропорцию:
х ____ 400
196—1000’
6 В. В. Левченко
65
Вычисляют неизвестное:
196-400 „о л л ж «
х = JQQQ- — 78,4 г фосфорной кислоты.
Ответ. В 400 мл 2-молярного раствора содержится 78,4 г фосфорной
кислоты.
4. Приготовление раствора заданной^ концентрации
Задача 1. Приготовить 30 г 3-процентного раствора поварен-
ной соли. Сначала вычисляют, сколько граммов соли должно содер-
жаться в 30 г 3-процентного раствора.
Рассуждают так же, как при решении первой задачи:
в 100 г 3-процентного раствора содержится 3 г соли;
В 30 2 „ „ я X 2 я »
Составляют пропорцию:
х ____________________________30 г
Т юб *
Вычисляют неизвестное:
30-3 п „
х =-jog =0,9 г соли.
Отвесив на весах 0,9 г поваренной соли, вносят эту соль в ста-
кан, в который приливают 30—0,9 = 29,1 г воды. Размешивают
жидкость стеклянной палочкой до полного растворения соли.
Таким путём получают 30 г 3-процентного раствора поваренной
соли.
Задача 2. Приготовить 200 мл 0,1 М раствора поваренной
соли.
Сначала вычисляют, чему равен вес 0,1 моля поваренной соли.
NaCl
Л4=58,5
ЛИ=58,5 г
0,1 ГМ= 5,85 а
Затем вычисляют, сколько граммов поваренной соли потребуется
для приготовления 200 мл 0,1-молярного раствора.
Рассуждают так:
для приготовления 1000 мл децимолярн. раств. треб. 5,85 г соли;
» и 200 мл й я х г ц *
Составляют пропорцию:
х ____ 200
5,85 1 ООО ‘
Вычисляют неизвестное:
5,85-200 .
х = ~Т000 ~ = * ’ *' г поваРенн°й соли.
«0
Отвесив 1,17 г поваренной соли, высыпают её в мерную колбу
объёмом в 200 мл, добавляют немного воды и, встряхивая, раство-
ряют соль. Когда вся соль растворится, доливают в колбу столько
воды, чтобы общий объём раствора был равен 200 мл, т. е. жидкость
доходила до метки.
Таким путём получают 200 мл децимолярного раствора поварен-
ной соли.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что представляет собой раствор? суспензия? эмульсия? Приведите
примеры их.
2. Какие тепловые явления наблюдаются при растворении и чем они
вызываются? •
3. На чём основано практическое применение охладительных смесей?
4. Чем отличаются растворы от химических соединений?
5. Что называется растворимостью?
6. Как выражается растворимость?
7. Какие растворы называются насыщенными? ненасыщенными?
8. Как влияет изменение температуры на растворимость твёрдых ве-
ществ, газов?
9. Приведите примеры твёрдых веществ, растворимость которых сильно
увеличивается при нагревании; слабо увеличивается при нагревании; умень-
шается при нагревании.
10. Что называется процентной концентрацией?
11. Что называется молярной концентрацией?
12. Сколько вещества надо взять, чтобы получить одиомолярный раствор
азотнокислого калия? сернокислого магния?
13. Сколько надо взять вещества, чтобы получить 1л 0,1 М раствора
поваренной соли? соды?
14. Сколько надо взять вещества, чтобы получить 1 л 0,3 М раствора
сернокислого натрия? хлористого алюминия?
15. Сколько граммов вещества содержится в 50 мл растворов: поварен-
ной соли —0,1 М? медного купороса — 2 7И? едкого натра — 0,3 М? едкого
кали — 0,05 Л4?
Б*
ЧАСТЬ ВТОРАЯ
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
И ИХ СОЕДИНЕНИЯ
Периодическая система элементов Д. И. Менделеева
и периодический закон
(Первое ознакомление)
Все вещества состоят из элементов. Каждый элемент характери-
зуется определённым атомным весом и рядом химических свойств:
валентностью и др.
Гениальный русский химик Д. И. Менделеев в 1869 г. сделал
открытие, имеющее первостепенное значение в пауке. Он установил
зависимость между атомным весом и свойствами элементов. Менде-
леев показал, что если расположить элементы в порядке возраста-
ния их атомных весов, то химические и некоторые физические свой-
ства элементов и их соединений повторяются через определённые
интервалы, определённые периоды.
Как видно по рисунку 25 (вклейка к стр. 65), расположенный
в 3-м ряду элемент литий является металлом и проявляет валент-
ность, равную +1; эти же свойства проявляются у элемента
натрия, расположенного в 11-м ряду, затем у элемента*калия, рас-
положенного в 19-м ряду; то же наблюдается и дальше, если про-
следить весь ряд элементов, расположенных в порядке возрастания
их атомного веса.
Открытый Д. И. Менделеевым закон природы получил название
.периодический закон"; подробнее он рассматривается дальше (часть
третья). На основе периодического закона Д. И. Менделеев создал
таблицу химических элементов, приведённую на рисунке 25 внизу.
Благодаря особому способу изображения химических знаков, на
рисунке 25 наглядно видно расположение в таблице Д. И. Менде-
леева металлов и металлоидов.
Сходные по своим свойствам элементы в Таблице Д. И. Менде-
леева расположены в вертикальных столбцах — группах.
Ознакомление с одним представителем группы элементов позво-
ляет судить о многих свойствах других элементов этой группы.
Изучение элементов будет проводиться нами по группам таблицы
Д. И. Менделеева. При изучении же отдельных элементов мы будем
придерживаться следующего плана (который может видоизменяться
при описании свойств отдельных элементов и их соединений):
68
1. Название элемента, его химический знак, атомный вес.
2. Физические свойства элементов в свободном состоянии: физическое
состояние, цвет, запах, удельный вес (для газов плотность по воз-
духу), растворимость, температура плавления и кипения (не для за-
поминания).
3. Химические свойства элемента; способность к взаимодействию
с водородом, кислородом, металлами, металлоидами, сложными веще-
ствами; особые свойства.
4. Нахождение элемента в природе: в виде простого вещества
и в составе сложных веществ.
5. Способы получения элемента: в лаборатории, в технике.
6. Применение элемента.
При рассмотрении сложных веществ будут указываться:
1) Название вещества — научное и техническое; химическая фор-
мула, молекулярный вес.
2) Способы’ получения.
3) Физические свойства.
4) Химические свойства.
5) Применение.
ГЛАВА I
ГАЛОГЕНЫ
Группу сходных по химическим свойствам элементов составляют
фтор, хлор, бром, йод. В таком порядке они располагаются, если
принять во внимание их атомный вес.
Фтор — наиболее лёгкий элемент, йод — наиболее тяжёлый элемент.
Эти четыре элемента получили общее название галогены, что
означает солероды. Такое название дано потому, что они образуют
соли, непосредственно соединяясь с металлами.
Галогены расположены в VII группе таблицы Менделеева. Во
внешнем электронном слое у них имеется 7 электронов (валентные
электроны). Атомы галогенов легче присоединяют электроны, чем
отдают. Они способны присоединять только 1 электрон (до образо-
вания во внешнем электронном слое устойчивой системы из 8 электро-
нов). Поэтому все галогены 'проявляют одну отрицательную валент-
ность (заряд йона равен — 1).
I. ХЛОР И ЕГО СОЕДИНЕНИЯ
А. ХЛОР
Химический знак: С1 (читается: хлор).
Атомный вес равен 35,5.
В свободном состоянии образует молекулы из двух атомов: С12.
. 1774Р пеРвый из галогенов, полученный в свободном состоянии
л Я1г» \Г Сначала его считали сложным веществом, и только позже
* г.) было установлено что он является элементом.
69
1. Физические свойства хлора. Хлор при обычных условиях —
газ жёлто-зелёного цвета. Окраска его хорошо видна, если позади
сосуда с хлором поместить лист белой бумаги. По окраске хлора ему и
дано название (от греческого слова „хлорос", означающего „зелёный").
Хлор отличается резким запахом. В небольших количествах он
вызывает лёгкое раздражение слизистых оболочек носа и горла, не
причиняющее вреда; вдыхание же значительного
оказывает удушающее
действие. Поэтому нюхать
хлор (вообще газы) сле-
дует осторожно, натфа£-
ляя к носу небольшое
количество газа лёгким
взмахом кисти руки
(рис. 26).
Хлор почти в 2,5 раза
тяжелее воздуха; поэтому
его можно собирать в со- ।
суд, лишь прикрытый ку-
сочком бумаги, картона,
стекла.
При обыкновенной
температуре, под давле-
нием около 6 атмосфер,
хлор превращается в жид-
кость.
В жидком виде хлор
держат в стальных бал-
лонах (рис. 27). Жидкий
хлор кипит п|)и — 34°, а
Рис. 26. Определение
запаха газа.
Взмахом кисти руки осторож-
но направляют к носу неболь-
шое количество газа.
при — 101° затвердевает.
количества хлора
Вентиль
Цилиндр:
Рис. 27. Стальной
-баллон с жидким
'хлором.
Хлор заметно растворяется в воде. Один объём воды при обыкно-
венной температуре растворяет около 2 объёмов хлора. Раствор
хлора в воде называется хлорной водой; она сильно пахнет хлором.
2. Химические свойства хлора. Хлор соединяется с водородом,
металлами, металлоидами и реагирует со многими другими веществами.
В соединениях с водородом и металлами хлор проявляет, как и
другие галогены, одну отрицательную валентность (— 1).
а) Соединение хлора с водородом. Хлор соединяется
с водородом уже при обыкновенной температуре, но очень медленно.
Если же на смесь обоих газов попадёт солнечный луч или свет от
зажжённого магния, тотчас происходит сильный взрыв, подобный
взрыву гремучего газа от искры (рис. 28) ’).
1) В учебнике не даётся подробного описания техники выполнения демон-
страционных опытов за отдельными исключениями. Описание опытов см. в
книге проф. В. Н. Верховского „Техника и методика химического экспе-
римента в школе “.
70
Рис. 28. Взрыв смеси хлора с водородом под действием света.
А — установка с предохранительным стеклом (вид спереди); Б — проведение опыта
(вид сбоку).
Рис. 29. Взрыв смеси хлора с водородом под действием нагревания.
А и Б — цилиндры с газами; В — цилиндры, поставленные один на другой;
Г — цилиндры после удаления перегородки из стеклянных пластинок
и многократного переворачивания для перемешивания газов; Д — поджигание
смеси газов в одном из цилиндров.
Такой же взрыв происходит и при поджигании смеси хлора с во-
дородом. В результате реакции образуется газообразное вещество —
хлористый водород:
ч (при поджигании,
при действии света)
Н24-С12 = 2НС1
хлористый
водород
Наблюдать взрыв хлора при поджигании можно на следующем вполне
безопасном опыте (при употреблении совершенно чистых сосудов).
Наполняют один цилиндр хлором, а другой водородом и закры-
вают их стеклянными пластинками (рис. 29, А и Б).
71
Ставят цилиндры отверстиями один на другой (рис. 29, В). Затем
(при рассеянном свете) удаляют пластинки (рис. 29, Г) и смеши-
вают газы, перевёртывая цилиндры.
Когда газы перемешаются, разнимают цилиндры вблизи горелки
и быстро подносят к пламени поочерёдно один и другой (рис. 29, Д)*
Рис. 30. Проверка чистоты водорода,
А — собирание водорода в пробирку; Б — поджигание водорода в про-
бирке; загорание почти без хлопка — водород чист! В — горение
чистого водорода, выходящего из трубки.
В каждом цилиндре происходит взрыв в результате соединения
хлора с водородом. Тотчас же быстро приливают в цилиндры по 5 —
Рис. 31. Горение водорода в хлоре.
А — прибор для получения водорода. После про-
верки чистоты выходящего из трубки водорода
(рис. 30) газ поджигают; Б — сосуд с хлором, в
который опущена газоотводная трубка с горя-
щим водородом.
10 мл воды, накрывают их и
встряхивают.
К жидкости в цилиндрах
добавляют раствор синего
лакмуса, который тотчас же
окрашивается в красный цвет
от действия образовавшегося
раствора хлористого водоро-
да (представляющего собой
кислоту).
Благодаря способности со-
единяться с хлором, водо-
род горит в нём, образуя хло-
ристый водород по вышепри-
ведённому уравнению реак-
ции.
Для наблюдения этого явле-
нйя к прибору для получения
водорода присоединяют со-
гнутую трубку с оттянутым концом (рис. 30, А).
Получают водород и, как обычно, проверяют его чистоту, соби-
рая в пробирку и поднося её к пламени (рис. 30, А и Б).
72
Когда из трубки начнёт выходить чистый водород, его поджи-
гают (рис. 30, В) и опускают в сосуд с хлором (рис. 31); водород
продолжает гореть в хлоре, образуя пламя с зеленоватой окраской.
Для обнаружения получающегося продукта реакции — хлористого
водорода — смачивают водой синюю лакмусовую бумажку и, сдвинув
покрышку, опускают бумажку в сосуд. Она тотчас же становится
красной от действия образовавшегося в ней раствора хлористого
водорода.
Реакция соединения хлора с водородом (также соединения кисло-
рода с водородом), вызываемая поджиганием смеси этих газов,
является примером реакций, происходящих со взрывом. Исследова-
ния советского учёного — академика Н. Н. Семёнова — вскрыли слож-
ную природу процессов, происходящих при таких реакциях, а также
при реакциях горения и др. Эти исследования имеют очень большое
научное и практическое значение (подробнее здесь они не рассмат-
риваются).
б) Соединение хлора с металлами. Хлор соединяется
со всеми металлами, со многими — очень легко, особенно в нагретом
состоянии. Поэтому многие
металлы горят в хлоре. При-
мером может служить горе-
ние натрия в хлоре; в ре-
зультате реакции образуется
соль — хлористый натрий
(поваренная соль):
(горение)
2Na 4- С12 = 2NaCl
хлористый
натрий
Натрий
Железная
-ложечка
Рис. 32. Горение
натрия в хлоре.
чоИ
тонной
медной
ПрОБОЛОНИ
Для наблюдения этого
явления помещают в чистую
ложечку для сжигания тща-
тельно очищенный от ке-
росина маленький кусочек
металлического натрия, на-
гревают его до загорания
Рис. 33. Горение
меди в хлоре.
и
с хлором (рис. 32).
ярким пламенем. На
... ____г_...... вносят в сосуд
Натрий разгорается в хлоре и горит в нём
стенках сосуда и в ложечке появляется белый налёт хлористого натрия.
Медь также горит в хлоре. В результате реакции образуется
соль хлорная медь (медь в этом соединении двухвалентна):
(горение)
Cu4-C12 = CuC12
хлорная
медь
Для проведения опыта берут тонкую медную проволоку (лучше
пучок проволок от оголённого мягкого электрического провода),
гревают докрасна и быстро опускают в сосуд с хлором (рис. 33).
73
.Образовавшуюся хлорную медь обнаруживают следующим обра-
зом. Приливают в сосуд немного воды (3—5 мл), закрывают проб-
кой и встряхивают; в результате получается раствор хлорной меди
зелёного цвета.
В хлоре горит также железо с образованием хлорного железа
(железо при'этих условиях проявляет валентность, равную 3):
(горение)
2Fe4-3Cl2 = 2FeCl3
хлорное
железо .
Опыт проводят в. банке,, на-^дно которой цасьцтан слой песка
(рис. 34)» чтобы не лопнуло стекло. Железо берут в виде опилок.
Опилки нагревают возможно сильнее в железной ложечке и высы-
Рис. 34. Горение железа в хлоре.
трёххлористая сурьма) и
пятивалентной
пают в банку небольшими пор-
циями. Опилки загораются в
хлоре, рассыпаясь красивым
пучком искр. Сосуд наполняется
бурым дымом, состоящим из
мельчайших частиц хлорного
железа.
Такой же опыт можно про-
вести с порошком сурьмы; она
реагирует с хлором ещё энер-
гичнее, и подогревать порошок
не нужно. Опыт удобнее про-
водить, как показано, на ри-
сунке 35.
В результате реакции по-
лучается смесь соединений сурь-
мы трёхвалентной (SbCl8 —
(SbCl 5 — пятихлористая
сурьма)1).
в) Соединение хлора с металлоидами. Хлор вступает
в соединение также с металлоидами, легче всего с фосфором, труд-
нее с серой. С кислородом хлор прямо не соединяется; но кисло-
родные соединения его существуют; получаются они особыми спосо-
бами, которые здесь не рассматриваются.
г) Взаимодействие хлора со сложными веществами.
Хлор вступает в реакции со многими сложными веществами, содержа-
щими водород.
В основе этих реакций лежит процесс присоединения к хлору
водорода, отрываемого от сложного вещества (образование хлори-
стого водорода). Например, при действии хлора на скипидар, пред-
ставляющий собой соединение углерода с водородом (С10Н1в),
2) Соединения эти ядовиты, поэтому сосуд следует открывать и мыть только
после того, как весь дым осядет на стенках.
74
происходит образование хлористого водорода, а углерод остаётся
свободным и выделяется в виде угля (сажи):
С10Н16 4-8С12 = 16НС14-1 ОС
скипидар хлористый уголь
водород
.. 4
в сосуд с хлором (рис. 36) опускают
пробке полоску фильтровальной бумаги,
подогретым скипидаром. Вся бумажка
Для проведения опыта
прикреплённую к широкой
смочив её предварительно
слоем сажи, а в сосуде образуется дымящийся
газ — хлористый водород. (Если хлор был сухой
и без примеси воздуха, а скипидар — высоко-
качественный, бумажка может загореться.)
В хлоре может гореть также свеча (рис. 37)
другие вещества, содержащие
быстро покрывается
н
Рис. 35. Горение сурьмы
в хлоре.
Сурьму высыпают в банку,
встряхивая пробирку. Банка всё
время остаётся закрытой, и ядо-
витые парыиевыходятнаружу.
водород.
Фильтроваль-
ная бумажна,
смоченная
скипидаром
Рис. 36. Горение скипи-
дара в хлоре.
С12
Рис. 37.
Горение свечи
в хлоре.
В отличие от горения в кислороде, при горении в хлоре с ним
соединяется только водород, но не углерод.
д) Взаимодействие хлора с водой. Как уже указывалось,
Хлор растворяется в воде; свежеприготовленная „хлорная вода“
представляет собой обыкновенный раствор, содержащий молекулы
хлора С^, равномерно распределённые между молекулами воды Н2О.
Она пахнет хлором. Однако при стоянии происходит медленный
процесс химического взаимодействия между обоими веществами;
С12 4- Н2О = 2НС14- О
атом
кислорода
Освобождающиеся атомы кислорода затем соединяются в мо-
лекулы:
20 = 0,
Реакция взаимодействия хлора с водой ускоряется под действием
света, особенно прямых солнечных лучей.
751
в хлорной воде и в
Рис. 38. Взаимодействие
хлора с водой. Выделе-
ние кислорода при дей-
ствии света на хлорную
воду.
Если пробирку или колбу с хлорной водой поместить вверх
дном (рис. 38) и выставить на прямой солнечный свет, через корот-
кое время станут заметны пузырьки выделяющегося газа. При дли-
тельном стоянии колбы в ярко освещённом месте можно собрать газ
в достаточном количестве и установить при помощи тлеющей лу-
чинки, что .это кислород. Оставшаяся жидкость хлором теперь не
пахнет.
Образование в растворе соляной кислоты можно установить при
помощи лакмуса.
Белящее действие хлора. Реакция взаимодействия хлора
с водой объясняет белящее действие хлора., Это действие проявляется
хлоре, но-^только влажном. р Заключается оно
в обесцвечивании красок, относящихся к осо-
бой группе веществ, называемых органиче-
скими.
Для наблюдения этого явления смачивают
хлорной водой кусочки цветной буйаги и
цветных тряпочек; быстро происходит более
или менее полное обесцвечивание их.
Если смочить хлорной водой кусочек
газетной бумаги, запачканной чернилами,
хлорная вода обесцветит чернила (органиче-
ская краска), а печатные буквы останутся
без изменения (неорганическая краска).
Белящим действием хлора пользуются
в производствах при белении бумаги, тканей
и т. п.
Разрушение красок происходит от дей-
ствия не самого хлора, а кислорода, выде-
ляемого хлором из воды (см. на "стр. 75
уравнение реакции). Характерно, что кислород воздуха не оказы-
вает такого действия на красящие вещества. Это явление объясняется
тем, что выделяющиеся при реакции атомы кислорода {атомарный,
кислород} особенно энергично проявляют способность к химическому
взаимодействию с легко окисляющимися веществами.
Молекулы кислорода не проявляют такой энергичной способности
к реагированию, так как атомы в них уже связаны между собой.
Чтобы молекулы вступили в химическое взаимодействие, в них сна-
чала должна разорваться или хотя бы ослабиться связь между
атомами. Эта связь ослабляется нагреванием, светом и другими воз-
действиями, которые обычно применяются, чтобы вызвать начало
химической реакции.
Свободные атомы элементов наблюдаются в момент их выделения
из химических соединений. Поэтому элементы „в момент выделения*
реагируют гораздо энергичнее, чем в обычном — молекулярном со-
стоянии.
Выделение кислорода в хлорной воде происходит в обычных
условиях медленно. Если же в хлорную воду попадают вещества,
76
способные окисляться, процесс протекает быстро; поэтому опущен-
ная в хлорную воду цветная ткань обесцвечивается „на глазахкак
наблюдалось в описанных опытах. _
При реакции взаимодействия хлора с водой (см. приведённое
выше уравнение реакции) получается соляная кислота НС1; после
беления её необходимо отмыть водой, чтобы она не разрушила ткань.
Обеззараживающее действие хлора. Выделение ато-
марного кислорода из воды под действием хлора объясняет обезза-
раживающее (дезинфицирующее) действие его.
Уже небольшая примесь хлора .в воде убивает болезнетворных
микробов, вызывающих тяжёлые желудочные заболевания (брюшной
тиф, дизентерию, холеру и пр.). Поэтому для обеззараживания водо-
проводной воды её хлорируют, т. е. пропускают в неё небольшое
количество хлора. Образующееся в хлорированной воде небольшое
количество соляной кислоты совершенно безвредно, и такая вода
вполне пригодна для питья и варки пищи.
Дезинфицирующее действие оказывает также небольшая примесь
газообразного хлора в воздухе, так как в этом случае он реагирует
с парами воды и тоже выделяет из неё атомарный кислород.
Вдыхание воздуха с небольшой примесью хлора предохраняет
от заболевания гриппом, ангиной и способствует также излечиванию
этих болезней.
3. Хлор в природе. Хлор довольно широко распространен
в природе, но он не встречается в свободном виде. Происходит это
потому, что, как уже говорилось, он легко вступает в соединения
с другими элементами, особенно с металлами. С ними хлор образует
различные природные соединения, относящиеся к классу солей.
Особенно распространены в природе: соединение хлора с натрием —
хлористый натрий NaCl (поваренная соль), затем хлористый маг-
ний MgCl2, хлористый калий КС1 и др. Хлор содержится также
в телах живых организмов. Животные получают соединения хлора
с пищей, а человек ещё добавочно вводит поваренную соль. По-
требность в соли особенно велика при употреблении растительной
пищи, содержащей меньше хлористого натрия, чем пища животная.
4. Получение хлора, а) Получение хлора в лаборато-
рии. В лабораториях хлор обычно получают из соляной кислоты,
представляющей собой раствор в воде хлористого водорода НС1.
Для того чтобы получить свободный хлор из хлористого водо-
рода, надо от молекул хлористого водорода оторвать атомы водо-
рода. Это может быть достигнуто посредством атомарного кисло-
рода, т. е. кислорода в момент выделения из сложного вещества.
Схема реакции:
атомарный хлористый водород
кислород (соляная кислота)
Для получения атомарного кислорода можно пользоваться раз-
ными веществами; удобно применять марганцевокислый калий
(вещество, употребляемое в лечебных целях для полоскания при за-
болеваниях рта, горла и пр.).
При взаимодействии марганцевокислого калия с соляной кислотой
сначала выделяется кислород. В приведённом ниже уравнении реак-
ции (не для запоминания) над знаками атомов калия и марганца
в правой части уравнения поставлена валентность этих металлов
в получившихся соединениях. Это сделано для того, чтобы было
понятно количество присоединяемых к ним атомов хлора, который
в соединениях с металлами и водородом всегда одновалентен (— 1);
2КМпО4 4- 6НС1 = 2КС14- 2МпС12 4- ЗН2О 4- 50
Атомы кислорода сразу же взаимодействуют с молекулами соля-
ной кислоты, которая берётся в избытке.
50 4-10НС1 == 5Н2О 4-5С12
В лаборатории часто получают хлор, нагревая соляную кислоту
с двуокисью марганца.
Реакция протекает;
МпО2 4- 4НС1 = МпС12 4- С12 4- 2Н2О
Чтобы значительные количества хлора не попадали в воздух, по-
лучение и наблюдение за его свойствами удобно проводить в легко
собираемом приборе с поглощением избытка газа.
Прибор собирается из колб, как показано на рисунке 39 (ча-
стично баночек, в крайнем случае пробирок). ♦
Первая колба служит для получения хлора путём взаимодействия
соляной кислоты с марганцевокислым калием.
Тотчас после приливания в колбу небольшого количества доста-
точно концентрированного раствора соляной кислоты происходит
выделение хлора, что заметно по окраске газа, заполняющего первую
и вторую колбы.
Из второй колбы хлор поступает в третью — с водой и кусоч-
ками цветной материи.
При наблюдении за проходящими через воду пузырьками можно
Заметить растворение хлора, так как пузырьки если и доходят до
поверхности воды, то в значительно уменьшенном размере. При
этом окраска материи постепенно становится бледнее, затем проис-
ходит полное обесцвечивание её.
В четвёртой колбе хлор взаимодействует с гашёной известью,
а избыток его переходит в пятую колбу с водным раствором фуксина,
который постепенно обесцвечивается.
Хлор, прошедший через весь ряд сосудов, попадает, наконец,
в шестую колбу со щёлочью, в которой полностью поглощается.
78
Когда фуксин обесцветится, в первую колбу приливают почти
доверху воду, чтобы прекратить выделение хлора, и разбирают при-
бор; каждую колбу плотно закрывают пробкой.
Полученные вещества: хлор (во второй колбе), хлорная вода
(в третьей и пятой колбах) и хлорная известь (в четвёртой колбе;
см. о ней дальше), используются для опытов на уроке и лаборатор-
ных занятиях. Щёлочь в последней колбе сохраняют и употребляют
в дальнейших опытах для поглощения
соответствующих газов.
б) Получение хлора в техни-
ке. В технике хлор получают из пова-
ренной соли путём разложения водных
растворов её электрическим током.
Выделяющийся хлор пропускают в
сушильные аппараты для освобождения
Рис. 39. Получение хлора.
J — колба для получения хлора; 2—пустая колба; 3 — колба с водой; 4 — колба с тонким
слоем гашёной извести на дне; 5 — колба с раствором фуксина; 6 — колба с раствором щёлочи.
от паров воды, а затем проводят в газоприёмники. Предназна-
чаемый для других производств хлор после сушки сгущают
под давлением в жидкость и наполняют жидким хлором стальные
баллоны (см. рис. 27). В них хлор остаётся жидким 'при комнатной
температуре и выше, так как он находится под большим давлением.
При открывании крана (вентиля) хлор выбрасывается давлением
паров через доходящую до дна трубку (сифон).
5. Применение хлора. Кроме указанных случаев применения
свободного хлора и хлорной воды как белящего средства (беление
тканей, бумаги, соломы, употребляемой для различных изделий,
И т. д.х), хлор находит ещё следующее применение.
а) Применение хлора в борьбе с вредителями сель-
ского Хозяйства. При незначительном содержании хлора в воз-
духе, когда ощущается лишь слабый запах его (например, при стирке
белья с хлорной известью и пр.), вреда не наблюдается. Наоборот,
присутствие в воздухе небольшого количества хлора оказывает
обеззараживающее действие (убивает микробов) и предупреждает
заболевания дыхательных путей — насморк, грипп, ангину. Однако
Длительное вдыхание воздуха со значительным содержанием хлора
79
вызывает сильное раздражение дыхательных путей, а очень большое
количество его может привести к смерти от удушья.
В связи с этим хлор находит. широкое применение в борьбе
с вредителями сельского хозяйства. Для уничтожения, например, су-
сликов хлор из баллона пропускают в норку в течение 1—2 секунд.
Затем норку выдерживают закрытой около минуты.
Хлор применяется также в борьбе с амбарными вредителями.
б) Роль хлора в производстве отравляющих ве-
ществ. Хлор относится к . группе удушающих веществ. Он был
первым отравляющим веществом,, применённым немцами во время
первой мировой войны. Для боевых целей хлор*’ употреблялся в виде
облака, пускаемого на противника по направлению ‘ветра. Такое
облако хлора при благоприятном ветре, сохраняя ядовитое действие,
может проникнуть вглубь атакуемого района на расстояние до 30 км.
Хлор как СлВ сначала применялся в чистом виде, но в дальнейшем
его стали применять в смеси с другими, более сильно действую-
щими веществами. Очень многие отравляющие вещества являются
соединениями хлора.
Действие ОВ на организм различно. Одни из них, как хлор,
поражают, главным образом, органы дыхания (удушающие ОВ), дру-
гие преимущественно поражают глаза и вызывают сильное слезото-
чение (слезоточивые ОВ), некоторые вызывают нарывы. на коже,
(нарывные ОВ); вредное действие ОВ может также заключаться
в отравлении организма веществом, проникающим в кровь через
слизистые оболочки (отравляющие ОВ).
Хлор входит в состав отравляющих веществ всех вышеуказанных
категорий: ядовитые (фосген и др.), слезоточивые (хлорпикрин и др.),
нарывные (иприт, льюизит), удушающие (свободный хлор, фосген).
Сложные отравляющие вещества наряду с хлором находят яри,
менение в сельском хозяйстве для борьбы с вредителями.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Как можно получить хлор в лаборатории?
2. Как получают хлор в заводских условиях?
3. Укажите физические свойства хлора.
4. Какую валентность проявляет хлор в соединениях с водородом и ме-
таллами?
5. При каких условиях хлор реагирует со свободным водородом? Что
при этом получается?
6. На каких опытах можно наблюдать соединение хлора с металлами
(уравнение реакции)? К какому классу соединений относятся получаемые
вещества?
7. Какая реакция и при каких условиях протекает между хлором и
водой?
8. Что содержится в свежеприготовленной, в долго стоявшей хлорной
воде?
9. Для чего применяется хлорная вода?
10. Какое применение находят хлор и его соединения? \
11. Какое действие оказывают хлор и другие боевые отравляющие веще-
ства на организм?
\
80
Б. СОЕДИНЕНИЕ ХЛОРА С ВОДОРОДОМ
§ 1. Хлористый водород НС1
Молекулярный вес равен 36,5.
1. Получение хлористого
быть получен путём синтеза
хлор непосредственно со-
единяются между собой:
водород горит в хлоре
(рис. 31), а хлор горит
в водороде:
Н24-С12 = 2НС1.
Этим способом полу-
чают хлористый водород
при новейшем способе про-
изводства. Кроме того, хло-
ристый водород получают
также из поваренной соли.
На неё действуют серной
кислотой при нагревании
(рис. 40).
В лабораторных усло-
виях, вследствие недоста-
точно сильного нагрева-
ния, реакция останавли-
вается на первой стадии,
и в результате получается
водорода. Хлористый водород может
из элементов, так как водород и
кислая соль и хлористый Рис. 40. Получение хлористого водорода,
водород:
(слабое нагревание)
NaCl + H2SO4 = NaHSO4 + НС1 j
КИСЛЫЙ
сернокислый
натрий
В производственных условиях реакция протекает при более высо-
кой температуре, и в серной кислоте замещаются натрием оба атома
водорода; в результате получается средняя соль и хлористый водород:
(нагревание до красного каления)
NaCl + NaHSO4 = Na2SO4 + HClf
Суммированное уравнение реакции:
2NaCl + H2SO4 = Na2SO4 -f- 2HC1|
сернокислый
натрий
6 В . В. Левченко
81
2. Физические свойства хлористого водорода. Хлористый водо-
род— бесцветный газ с острым запахом. Он в 1,3 раза тяжелее
воздуха; поэтому его можно собирать в открытый сосуд, лишь
прикрыв его сверху картоном или ватой.
На воздухе хлористый водород „дымит"; объясняется это тем,
что он энергично притягивает всегда находящиеся в воздухе пары
Рис. 41. Растворимость в воде хло-
ристого водорода.
А — склянка с хлористым водородом (резино-
вая трубка сжата зажимом); Б — фонтан воды
в склянке (зажим удалён, резиновая трубка
открыта).
воды и образует туманное обла-
ко, состоящее из мельчайших
капелек.
Растворимость в воде хло-
ристого водорода 'очень вели-
ка: 1 объём воды при 0°' рас-
творяет около 500 объёмов
газа. Для ' наблюдения этого
явления берут заранее напол-
ненную хлористым водородом'
склянку (рис. 41, Л), плотно
закрытую пробкой со стеклян-
ной трубкой. На конец стеклян-
ной трубки надета ещё рези-
новая трубка, плотно сдавлен-
ная зажимом.
Для проведения опыта пе-
реворачивают склянку дном
вверх, опускают её в банку с
водой и удаляют зажим. Первые
капли воды, попавшие в склян-
ку, тотчас же растворяют боль-
шое количество находящегося в ней газа, и в склянке понижается
давление; вследствие этого вода из банки с силой вгоняется в неё
давлением наружного воздуха и бьёт красивым фонтаном (рис. 41,5).
Если к воде в банке добавить раствор синего лакмуса, то жид-
кость в склянке становится красной от действия на лакмус образо-
вавшейся соляной кислоты.
Из этого опыта понятно, что для получения соляной кислоты
газопроводные трубки нельзя погружать в воду; в противном случае
вода будет втянута внутрь прибора, в котором получается хлори-
стый водород.
3. Химические свойства хлористого водорода. Хлористый водо-
род— прочное химическое соединение. В сухом виде он химически
очень мало активен; вступает в некоторые реакции только при высо-
ких температурах. Малейшая примесь воды резко повышает химиче-
скую активность хлористого водорода.
Водный раствор хлористого водорода называется соляной
кислотой.
4. Установление формулы хлористого водорода. На примере
хлористого водорода удобно рассмотреть вопрос о способах уста-
новления молекулярных формул сложных веществ.
Исходя из весового состава вещества, т. е. зная количественное
соотношение элементов, образующих это вещество, легко вычислить
соотношение между числом атомов в молекуле. Например, в хлори-
стом водороде водород и хлор содержатся в отношении 1:35,5,
Деля эти части на атомные веса соответствующих элементов, полу-
1 35,5 . .,
чают соотношение между числом атомов в молекуле:
1 иЭ,0
это означает, что в молекуле хлористого водорода на 1 атом водо-
рода приходится 1 атом хлора. Отсюда простейшая возможная фор-
мула для хлористого водорода: НС1. Соотношению 1:1 будут соот-
ветствовать также формулы: Н2С12, НаС13, Н4С14 и т. д. Простейшая
формула не всегда является правильной. Она отвечает действитель-
ности в случаях воды, хлористого водорода и многих других веществ,
но в ряде случаев оказывается неправильной.
Чтобы установить истинную формулу вещества, необходимо знать
его молекулярный вес. Легче всего определяется он для газообраз-
ных веществ.
Определение молекулярного веса газообразных
веществ. Определение молекулярного веса газообразных веществ
стало возможным после установления закона Авогадро (см. стр. 27).
Путём взвешивания равных объёмов газов и водорода легко уста-
новить, во сколько раз взятый газ тяжелее водорода, т. е. узнать
плотность газа по водороду; эту величину обозначают буквой D.
Например, плотность по водороду хлористого водорода:
£>нш = 18,25.
Плотность по водороду показывает, во сколько раз одинаковые
объёмы, а следовательно, и одинаковые количества молекул газа и
водорода тяжелее один другого; отсюда следует, что во столько же
раз тяжелее одна другой и молекулы этих веществ (рис. 9). Плот-
ность по водороду хлористого водорода, равная 18,25, показывает,
что молекула хлористого водорода в 18,25 раза тяжелее молекулы
водорода; отсюда молекулярный вес НС1 равен молекулярному весу
водорода, умноженному на плотность по водороду НС1.
Молекулярный вес водорода равен 2; следовательно, молекуляр-
ный вес любого газообразного вещества (М) равен его плотности
по водороду (D), умноженной на 2. Это выражается формулой:
M=2D.
Для хлористого водорода молекулярный вес, исходя из его плот-
ности по водороду, получается:
7Инс1 = 2-18,25 = 36,5.
Это даёт для хлористого водорода формулу НС1, так как сумма
атомных весов при этой формуле даёт тот же молекулярный вес:
1 4- 35,5 = 36,5.
6*
83
Определение плотности газа, исходя из его моле-
кулярного веса. Формула 2W 2Z) даёт возможность определять
плотность газа по его молекулярному весу; из этой формулы сле-
дует, что
т. е. плотность газа по водороду равняется молекулярному весу
газа, делённому на 2.
Если необходимо определить плотность газа по воздуху (обозна-
чается знаком £>)), надо молекулярный вес разделить на 2 и на 14,5
(так как плотность воздуха по водороду равна 14,5):
_ М _М
2-14,5 29 •
Для вычисления плотности газа по воздуху молекулярный вес*
газа делят на 29.
36 5
Например, плотность по воздуху хлористого водорода = -^- = 1,3.
Это означает, что хлористый водород в 1,3 раза тяжелее воздуха.
§ 2. Соляная кислота
Ъ Получение соляной кислоты. „В промышленности соляную
кислоту получают растворением хлористого водорода в воде. Хло-
ристый водород получается или непосредственным соединением хлора
с водородом С12 •-[- Н2 = 2НС1, так называемый синтетический метод,
или взаимодействием поваренной соли с серной кислотой при силь-
ном нагревании:
2NaCl 4- H2SO4 = Na2SO4 -|- 2НС1,
Этот метод называется сульфатным. В первом случае взаимодействие
хлора и водорода производится в особой печи, где хлор сжигается
в токе водорода. Во втором случае в так называемых сульфатных
печах идёт нагревание смеси серной кислоты с поваренной солью;.. “ 1).
Получающийся газ (хлористый водород) проходит в промывную
башню. Из неё очищенный хлористый водород поступает в поглоти-
тельные сосуды — целлариусы (рис. 42, Б). Целлариусы последова-
тельно соединены друг с другом в ряд. Газ в них проходит над
водой и растворяется в ней (рис. 42, В).
Избыток газа, не поглощённый в целлариусах, поступает в погло-
тительную башню, в которой сверху стекает вода, поступающая затем
в целлариусы.
х) От названия получающегося продукта — сульфата натрия — произошло
название печи (сульфатная печь). Сульфат является ценным побочным про-
дуктом солянокислотного производства. По мере накопления он автоматически
удаляется из печи через специальный канал.
84
Как показано на рисунке, газ и вода движутся навстречу друг
другу, благодаря этому происходит интенсивное поглощение газа и
образуется концентрированный раствор его в воде — соляная кислота.
Принцип противотока является очень существенным при многих про-
изводственных процессах.
, В лаборатории соляную кислоту можно получить действием сер-
ной кислоты на поваренную соль при нагревании.
Рис. 42. Получение соляной кислоты в производстве.
А — общая схема завода; Б — строение целлариуса; В — соединение целлариусов.
Для этого собирают прибор, как показано на рисунке 43. Первая
банка соответствует очистительной башне в производственных уста-
новках.
Две следующие банки (вторая и третья) соответствуют в завод-
ских установках целлариусам; в них хлористый водород проходит над
водой и, растворяясь в ней, даёт соляную кислоту. Четвёртая банка
является предохранительной; в неё при пониженном давлении в системе
85
(ослабление нагрева и т. и,) перебрасывается жидкость из пятой банки,
в которую налит для полного поглощения хлористого водорода
раствор щёлочи (NaOH или КОН) с 1 — 2 каплями, раствора фенол-
фталеина.
Получающийся в колбе хлористый водород сначала вытесняет воз-
дух из колбы, затем поступает в банки. Наблюдают растворение его во
второй и третьей банках (хорошо замет-
ное движение возникающих в жидкости
струй) и обесцвечивание окрашенного
фенолфталеином раствора щёлочи в 'по-
следней банке. Когда раствор щёлочи
обесцветится, т. е. произойдёт полная
нейтрализация её, прекращают нагревание
колбы, удаляют последнюю (пятую) банку
и вместо неё ставят новую с разбавлен-
ным раствором щёлочи для поглощения
остатков газа. Затем отделяют, вторую и
третью банки и соединяют первую непо-
средственно с четвёртой.
Рис. 43. Получение соляной кислбты в лаборатории.
1 — пустая склянка; 2, 3 — склянки с водой; 4 — предохранительная склянка;
о — скляпка со щёлочью для поглощения избытка газа.
Полученную во второй и третьей банках соляную кислоту
используют для проведения опытов, иллюстрирующих свойства соля-
ной кислоты.
2. Физические свойства соляной кислоты. Соляная кислота —
бесцветная жидкость. Обычно употребляемая концентрированная
соляная кислота (с удельным весом 1,19) содержит 37°/0 хлористого
водорода; это означает, что в 100 г такой кислоты содержится 37 г
хлористого водорода и 63 г воды. Такая кислота дымит на воздухе,
так как выделяет хлористый водород; поэтому она называется
дымящей.
Часто применяют разбавленную кислоту, содержащую 1Оо/о и
меньше хлористого водорода.
86
Соляная кислота может служить примером летучих кислот, так
как при нагревании она улетучивается.
3. Химические свойства соляной кислоты. Соляная кислота
проявляет все свойства, характерные для кислот. Она является силь-
ной кислотой; энергично вступает в реакции и образует соли обыч-
ными для кислот способами:
1) При взаимодействии с металлом:
Zn + 2НС1 = ZnCl2 Н2 f
цинк хлористый
цинк
2) При взаимодействии с окисью металла:
CuO + 2НС1 = СиС12 -|- Н2О
окись меди хлорная
медь
3) При взаимодействии с гидратом окиси металла:
А1 (ОН)3 4- ЗНС1 = А1С18 4- ЗН2О
гидрат окпси хлористый
алюминия алюминий
4) При взаимодействии с солью:
Na2CO3 4- 2НС1 = 2NaCl_ 4- Н2СО3
углекислый хлористый
натрий натрий Н2О С02
Для распознавания соляной кислоты и отличия её от других
кислот пользуются действием на лакмус и реакцией её с азотно-
кислым серебром:
НС14- AgNO3 = AgCl 4- HNO3
азотнокислое ।
серебро хлористое
серебро
(белый творо-
жистый осадок)
При этой реакции выпадает характерный белый творожистый осадок
хлористого серебра, не растворимый в воде и разбавленной кислоте.
Реакция с азотнокислым серебром очень чувствительна; посредством
её можно обнаруживать весьма небольшие примеси соляной кислоты
и её солей.
4. Применение соляной кислоты. В лаборатории соляная кислота
применяется для получения хлора, а в технике — для получения её
солей. Применяется она также в кожевенной промышленности (спе-
циальная обработка кож), в медицине и в других случаях. Примене-
ние соляной кислоты в медицине связано с важной ролью её в про-
цессах пищеварения.
У животных и человека в стенках желудка особые железы выра-
батывают из получаемой в пище поваренной соли соляную кислоту,
являющуюся непременной составной частью желудочного сока. При
недостаточном количестве соляной кислоты в желудке (заболевание)
нарушается нормальное пищеварение, и это тяжело отражается на
87
здоровье; поэтому таким больным а качестве лекарства прописывают
для ежедневного приёма разбавленный раствор соляной кислоты.
Повышение концентрации соляной кислоты в желудочном соке
также очень вредно; такое заболевание требует специального лече-
ния и обязательного уменьшения количества употребляемой в пище соли.
§ 3. Соли соляной кислоты
Соли соляной кислоты называются хлористыми; называют их*
также хлоридами.
Соли соляной кислоты представляют собой твёрдые кристалли-
ческие вещества, в большинстве случаев хорошо растворяющиеся
в воде.
Нерастворимой солью является хлористое серебро, о котором уже
говорилось, и некоторые другие соли.
Реакция образования хлористого серебра служит для распозна-'
вания не только соляной кислоты, но и её солей. При смешивании
растворов, содержащих соляную кислоту или её соль, с раствором
азотнокислого серебра тотчас же выпадает характерный осадок хло-
рйстого серебра:
А1С1, + 3AgNOs = 3AgCl + Al (NO,),
хлористый азотнокислое 7
алюминий серебро хлористое
серебро
(белый творо-
жистый осадок)
В питьевой воде азотнокислое серебро тоже даёт более или менее
заметную муть вследствие присутствия в ней хлористого натрия и
других хлоридов. Поэтому раствор азотнокислого серебра необхо-
димо приготовлять на дистиллированной воде.
Наибольшее практическое значение имеют следующие хлористые
соли.
Хлористый натрий; хлорид натрия, поваренная соль NaCl.
Хлористый натрий содержится в морской воде (около 3°/0), а также
во многих озёрах и источниках. Залегает он и в земной коре в виде
отложений, образовавшихся в результате высыхания когда-то бывших
здесь морских бассейнов. Хлористый натрий в таком виде называется
каменной солью.
В СССР каменная соль залегает мощными пластами в различных
местах и подвергается разработке, подобно горным породам. До-
бывается она на Украине, на юге Урала и в других местах — в Закав-
казье, в Казахстане, в Сибири. Каменная соль добывается из-под
земли, а в некоторых местах — прямо открытой горной выработкой.
Добывается поваренная соль также из морской воды (у нас
на Чёрном и Азовском морях). Морскую воду для получения соли
проводят в отгороженные мелкие бассейны, где она испаряется;
выделяющуюся соль сгребают в бурты и вывозят.
Главнейшим источником для добычи поваренной соли в СССР
являются соляные озёра, расположенные в Нижнем Поволжье. Здесь
88
находится до 700 соляных озёр. Наибольшее промышленное значе-
ние имеют Баскунчакское и Эльтонское озёра. Малое количество
осадков в этих местностях не восполняет убыль воды от испарения;
поэтому естественное испарение воды в озёрах приводит к осажде-
нию соли. Такая соль называется самосадочной. Раньше добыча
её производилась исключительно вручную, что являлось очень тяжё-
лым видом труда. Теперь введена механизированная добыча соли.
Поваренная соль расходуется в огромном количестве — на хозяй-
ственно-пищевые потребности и для нужд промышленности. В про-
мышленности поваренная соль используется для получения натрия,
хлора, в производстве соды и различных хлорсодержащих продуктов
(соляной кислоты, белильной извести и др.).
Хлористый калий; хлорид калия КС1.
Хлористый калий распространён в природе вместе с другими хло-
ристыми 'солями. Добывается он из находящихся в земной коре зале-
жей содержащих его минералов.
У нас в СССР находятся богатейшие в мире залежи минералов,
содержащих хлористый калий. Это Соликамские месторождения, рас-
положенные между верховьями Камы и предгорьями Урала. Добывание
здесь хлористого калия началось с 1933 г. Получается он в таких
количествах, что удовлетворяются все наши потребности, а излишки
вывозятся за границу.
Хлористый калий применяется в сельском хозяйстве в качестве
очень ценного удобрения; он используется также для приготовления
других соединений калия; в стекольной промышленности применяется
для получения высококачественного стекла (химическая посуда) и пр.
Хлористый цинк; хлорид цинка ZnCl2.
Хлористый цинк находит обширное применение. Он употребляется
в медицине — входит в состав зубных цементов, употребляется
в промышленности органических красителей, применяется при
лаянии и пр.
Для получения хлористого цинка при паянии действуют цинком
на соляную кислоту. В результате энергично идущей реакции обра-
зуется соль и свободный водород:
Zn + 2HCl = ZnCl2-LH2t
хлористый
цинк
Процесс этот называется в технике травлением кислоты, а по-
лучающийся раствор хлористого цинка — травленой кислотой, или
паяльной жидкостью. Ею смазывают поверхность металла, чтобы
к нему мог пристать припой.
Без такой обработки накладываемый припой к металлу не пристаёт
из-за покрывающего его слоя окислов. Одного механического очище-
ния металла обычно бывает недостаточно, так как очищенная поверх-
ность тотчас окисляется; раствор же хлористого цинка не только
растворяет налёт окислов, но образует защитный покров из расплав-
ленной соли, под которым происходит запаивание.
89
Хлористое серебро; хлорид серебра AgCl. #
Об очень плохой растворимости хлористого серебра и об исполь-
зовании реакции образования его для распознавания соляной кислоты
и её солей уже говорилось.
Хлористое серебро особенно интересно тем, что очень чувстви-
тельно к действию света. Белый цвет соли сохраняется только в тем-
ноте, а от света она темнеет, и тем быстрее, чем ярче свет. Это
явление объясняется разложением соли и выделением свободного
серебра, которое в мелко раздроблённом виде имеет чёрный цвет.
Реакцию легко наблюдать, если свежеполученный осадок хлористого
серебра поместить на освещённое солнцем окно. Осадок темнеет
в, течение нескольких минут. Для сравнения следует второй сосуд
с осадком продержать в полной темноте (в коробке). Сравнение обоих
осадков сделает особенно наглядной разницу между ними.
Светочувствительность наблюдается у соединений серебра с дру-
гими галогенами. Благодаря этому соли серебра (преимущественно
бромистое серебро) используются в фотографии для изготовления
светочувствительных пластинок и бумагй.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. При каких условиях происходит соединение хлора с водородом и как
называется получаемое вещество? '
2. Как называется раствор хлористого водорода в воде?
3. Что общего в молекуле соляной кислоты и в молекулах других кислот?
4. Как называются соли соляной кислоты?
5. Перечислите изученные хлориды и укажите их применение.
6. Как отличить соляную кислоту и её соли от других кислот и солен?
В. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ХЛОРА
Хлор с кислородом непосредственно в соединение не вступает.
Однако различными путями могут быть получены кислородсодержащие
соединения его: оКислы, кислоты и их соли.
Хлор образует несколько окислов. В высшем окисле он проявляет
положительную валентность, равную семи (-|-7)' С12Ог— хлорный
ангидрид. Ему соответствует хлорная кислота НСЮ4.
Структурная формула её:
О
Н — О — С|£о
ч
И ангидрид, и кислота — соединения нестойкие.
1. Соли кислородсодержащих кислот хлора. Бертолетова соль.
Более стойкими являются соли кислородсодержащих кислот хлора,
например хлорнокислый калий КС1О4.
Практическое применение находит не эта соль, а другая, содер-
жащая в молекуле на один атом кислорода меньше,— хлорновато-
кислый калий или бертолетова соль КСЮд (ей соответствует хлор-
90
новатая кислота НС1(>3). Эта соль даже в разбавленных растворах
убивает болезнетворных микробов и поэтому применяется в медицине.
Бертолетова соль при нагревании разлагается, выделяя кислород:
(нагревание)
2КС1О3 = 2КС1-[-ЗО2
бертолетова хлористый
соль калий
Некоторые кислородсодержащие соединения хлора ещё легче
отдают кислород. К ним относится хлорная, или белильная, известь,
имеющая большое практическое значение.
2. Хлорная известь (белильная известь). Хлорная известь полу-
чается при взаимодействии гашёной извести с хлором:
Са(ОН)2 + С1г-
гашёная хлор
известь
,ci
Са< * 4-Н2О
\ОС1
хлорная
(белильная)
известь
Хлорная известь обладает сильными белящими свойствами, поэтому
она называется также белильной известью. Она употребляется для
беления хлопка, льна, бумаги, дезинфекции выгребных ям и в дру-
гих случаях. Действие белильной извести, как и действие хлор-
ной воды и влажного хлора, объясняется выделением атомарного
кислорода:
/С1
Са<^ = СаС12 О
^001 хлористый
кальций
Для обнаружения белящего действия хлорной извести её засыпают
в колбочку, приливают воду и бросают в неё кусочки цветной
материи, цветные бумажки: наблюдается быстрое обесцвечивание их.
3. Хлорная известь как средство против ОВ. Боевые отрав-
ляющие вещества являются в большинстве случаев сложными соеди-
нениями, сравнительно легко разрушающимися под действием атомар-
ного кислорода. Поэтому хлорная известь является удобным сред-
ством для обезвреживания ОВ. Заражённую местность для этих целей
посыпают тонким слоем хлорной извести.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какую высшую валентность проявляет хлор в кислородных соедине-
ниях?
2. Какая кислота соответствует окислу С12О7?
3. Напишите формулу и расскажите о свойствах бертолетовой соли.
ч 4. Напишите формулу и расскажите о свойствах хлорной извести.
91
II. БРОМ И ЕГО СОЕДИНЕНИЯ
А. БРОМ
Химический знак: Вг (читается: бром).
Атомный вес равен 80.
В свободном состоянии образует молекулы из двух атомов: Вг2.
Бром был открыт в первой четверти XIX в, (1825).
Название ему было дано по резкому неприятному запаху (от гре-
ческого слова „бромос", означающего „зловонный").
1. Физические свойства брома. Бром при обычных условиях —
тяжёлая краснобурая жидкость с удушливым неприятным запахом
(рис. 44, А).
Удельный вес брома равен 3,14, т. е. он более чем в 3 раза
тяжелее воды. При температуре 58°,8 бром кипит, образуя бурые
пары; при — 7°,3 затвердевает.
Рис. 44. Бром.
А — склянка с бромом; Б — колба с водой и бромом; В — пробирка с бромной водой и бензи-
ном; Г — та же пробирка после встряхивания (содержавшийся в водном растворе бром пере-
шёл в бензин).
I
Бром слабо растворим в воде; при 20° насыщенный раствор
оранжевого цвета, называемый бромной водой, содержит 3,4°/0 бро-
ма (рис. 44, Б).
Значительно лучше растворяется бром в бензине (керосине),
в бензоле и некоторых других жидкостях. Пользуясь ими, можно
извлечь бром из водного раствора, взятого в значительно большем
объёме, чем эти растворители.
Для наблюдения этого в пробирку наливают слабо окрашенную
бромную воду; приливают в неё немного бензина или бензола, и, закрыв
отверстие пальцем, сильно встряхивают. После отстаивания отделив-
шийся от воды слой бензина (или бензола) оказывается окрашенным
в интенсивный оранжевый цвет, так как в него перешла большая
часть содержавшегося в воде брома (рис. 44, В и Г).
2. Химические свойства брома, а) Соединение брома
с водородом, металлами и металлоидами. Бром, по-
92
добно хлору, соединяется с водородом, металлами и металлоидами;
при этом он проявляет одну отрицательную валентность (—1):
нагревание
Н24-Вг2==2НВг
бромистый
водород
Mg-^Br2 = MgBr2
бромистый
магний
Способность брома соединяться с металлами можно наблюдать
на примере реакции с магнием (или цинком). Для опыта удобно брать
вместо брома бромную воду, так как в ней свободный бром сохра-
няется долгое время, особенно при хранении в темноте. Для проведения
опыта взбалтывают бромную воду с порошком металла и после от-
стаивания наблюдают обесцвечивание раствора вследствие перехода
брома в химически связанное состояние (образование бесцветного бро-
мистого магния или бромистого цинка).
С металлоидами (фосфором, серой) бром соединяется труднее,
чем хлор.
Бром вызывает тяжёлые ожоги, поэтому обра-
щаться с чистым бромом надо осторожно.
б) Взаимодействие брома с водой. Бром, подобно
хлору, вступает во взаимодействие с водой. Поэтому бромная вода
тоже проявляет окислительное действие, хотя и слабее, чем хлорная
вода. В ней выделяется атомарный кислород по такому же уравнению
реакции и при тех же условиях (см. стр. 75):
Вг2 + Н2О = 2НВг 4- О
в) Вытеснение брома из его солей. Если к раствору
бромистой соли прилить хлорную воду, тотчас же наблюдается по-
явление жёлтой окраски вследствие вытеснения хлором брома и вы-
деления его в свободном состоянии:
2КВг 4- С12 = 2КС1 + Вг2
бромистый хлористый
калий калий
3. Бром в природе. В природе бром, подобно хлору, в сво-
бодном виде не встречается, а находится только в виде соединений
с металлами, главным образом с натрием (NaBr), калием (КВг), маг-
нием (MgBr2).
ч Бромистых соединений в природе гораздо меньше, чем хлори-
стых. Они находятся вместе с хлористыми соединениями в морской
воде (около О,2°/о), в некоторых минеральных источниках и озёрах
(например, в Крыму), а также в некоторых соляных месторождениях.
4. Получение и применение брома. В технике бром получают
из бромистых солей действием электрического тока или путём вы-
теснения свободным хлором по уравнению реакции:
2NaBr С12 = 2NaCI 4~ Вг2
93
В классном помещении без вытяжного шкафа бром можно по-
лучить, приливая к раствору бромистой соли хлорную воду. Тотчас же
появляющееся пожелтение жидкости указывает на выделение сво-
бодного брома. Реакция протекает по вышеприведённому уравнению.
В большем количестве бром можно получить в приборе, собран-
ном по рисунку 45.
Рис. 45. Получение брома.
К колбе присоединяют {/-образную трубку, которую опускают
в сосуд с холодной водой, лучше со льдом. Эта трубка предназна-
чается для собирания брома.
Для полной задержки паров брома служит пробирка, в которую
наливают раствор щёлочи (3—5°/0).
В колбу помещают бромистый натрий и двуокись марганца и
приливают в неё через воронку разбавленную серную кислоту
(2 объёма кислоты с 1 объёмом воды). Колбу осторожно подогревают
и наблюдают за происходящими явлениями.
Реакция протекает, как и при получении хлора:
2NaBr 4- МпО2 4- 2H2SO4 = Na2SO4 4- MnSO4 4~ 2Н3О 4~ Вг2
94
Колба наполняется бурыми парами брома, которые проходят
в Сообразную трубку. Здесь пары сгущаются в тёмную жидкость,
собирающуюся на дне трубки.
Когда брома соберётся достаточное количество, нагревание пре-
кращают, отделяют Сообразную трубку с собравшимся бромом и
быстро присоединяют колбу к пробирке. В таком виде прибор остав-
ляют до конца занятий, а отверстия Сообразной трубки закрывают
пробками.
Рассматривают полученный бром и знакомятся с его внешним
видом. Потом вынимают одну пробку и приливают воду. Снова за-
крывают отверстие пробкой и, покачивая трубку, наблюдают раство-
рение брома в воде.
После занятий, в вытяжном шкафу или на открытом воздухе,
осторожно переливают бромную воду с остатками брома в склянку,
лучше с притёртой пробкой. В склянку добавляют воду и сохраняют
полученный бром для дальнейших опытов.
Весь прибор осторожно заполняют водой для полного поглоще-
ния остающихся в нём паров брома. Воду льют через воронку, пока
она не заполнит все части прибора. После этого прибор разбирают
и моют.
Пробки и резиновые трубки обычно сильно разъедаются бромом
и могут даже прийти в полную негодность.
Бром применяется для получения лекарственных веществ, неко-
торых красителей, бромистого серебра, в больших количествах упо-
требляемого в фотографии, и пр.
Б. СОЕДИНЕНИЕ БРОМА С ВОДОРОДОМ
Бромистый водород и бромистоводородная кислота НВг
Молекулярный вес равен 80,9.
1..Получение и свойства. Получается бромистый водород дей-
ствием серной кислоты на бромистые соли:
(нагревание) |
H2SO4 4- 2NaBr = Na2SO4 + 2HBrf
Образующийся при этой реакции бромистый водород претерпевает
заметное разложение с выделением свободного брома. Поэтому для
получения чистого бромистого водорода применяются другие методы,
здесь не рассматриваемые.
Бромистый водород по физическим и химическим свойствам сходен
с хлористым водородом. Это бесцветный газ с резким запахом; на
воздухе дымит; хорошо растворим в воде.
Водный раствор его является кислотой; называется она бромисто-
Водородной кислотой.
Бромистый водород — менее прочное соединение, чем хлористый
водород.
95
Бромистоводородная кислота применяется сравнительно редко —
в научных работах.
2. Соли бромистоводородной кислоты. Соли бромистоводород-
ной кислоты называются бромистыми, или бромидами. Большинство
их хорошо растворимо в воде, например: бромистый натрий NaBrj
бромистый калий КВг.
Нерастворимой является содь серебра — бромистое серебро AgBr.
От хлористого серебра эта соль отличается желтоватой окраской;
NaBr + AgNO3 = AgBr NaNO6
бромистое серебро
(желтоватого цвета)
• Бромистые соли применяются в фотографии, в красочной про-
мышленности, а также в медицине (бромистый натрий NaBr и бро-
мистый калий КВг).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Как получается бром?
2. Какую валентность проявляет бром в соединениях с водородом и ме-
таллами? Приведите формулы этих соединений.
3. Какая реакция протекает в бромной воде?
4. Что содержится в свежеприготовленной и в долго стоявшей бромной
воде? » « •• . _
5. Почему вместо чистого брома можно пользоваться бромной водой?
6. Что происходит при взаимодействии бромной воды с магнием? Как при
этом опыте изменяется внешний вид жидкости и почему?
7. Что происходит при действии на раствор бромистой соли хлорной воды?
На что указывает это явление?
III. ЙОД, И ЕГО СОЕДИНЕНИЯ
А. ЙОД
Химический знак: J (произносится: ёд).
Атомный вес равен 127.
В свободном состоянии образует молекулы из двух атомов: J2.
Йод был впервые получен в начале XIX в. (1811).
Название дано по фиолетовой окраске его паров (от греческого
слова „йодес“, означающего „фиолетовый").
1. Физические свойства йода. Йод при обычных условиях —
твёрдое кристаллическое вещество темнофиолетового цвета с метал-
лическим блеском. Удельный вес его 4,93, т. е. он почти в 5 раз
тяжелее воды.
Йод обладает резким запахом; уже при обычной температуре он
заметно испаряется, поэтому его необходимо хранить в хорошо заку-
поренном сосуде.
При нагревании в обычных условиях йод, не плавясь, переходит
в пар фиолетового цвета; при нагревании же под давлением он пла-
вится около 114°.
96
Для наблюдения окраски паров йода в колбу помещают несколько
кристалликов йода и нагревают. Йод, не плавясь, переходит в паро-
образное состояние. После образования фиолетовых паров дают колбе
остыть. По мере остывания пары йода переходят в твёрдые кри-
сталлы, также минуя жидкое состояние. Здесь происходит явление,
называемое возгонкой. При возгонке твёрдое вещество, не плавясь,
сразу переходит в пар, который снова превращается в твёрдое ве-
щество, минуя жидкое состояние.
Йод в воде растворяется в очень небольшом количестве. При 20°
растворяется его только О,О8°/0. Растворимость йода сильно повы-
шается в присутствии его солей.
Если в воду бросить немного йода и размешать жидкость, полу-
чается слабожёлтого цвета раствор; большая часть взятого йода
остаётся на дне сосуда и в воду не переходит. Если добавить в эту
жидкость немного какой-либо соли йода, например йодистого калия,
и размешать раствор, он тотчас же окрашивается в темнокрасный цвет;
объясняется это образованием непрочного соединения йода с молеку-
лами соли; получающееся соединение настолько непрочно, что связан-
ный с молекулами соли йод проявляет все свойства свободного йода.
Так как йод очень плохо растворим в воде, для практических
целей часто пользуются раствором, содержащим, кроме йода, неко-
торое количество йодистой соли (йодистого калия).
Хорошо растворяется йод в спирте, в бензине (керосине), в бен-
золе и некоторых других жидкостях; посредством их он легко может
быть извлечён из водных растворов. При встряхивании водного
светложёлтого раствора йода с небольшим количеством бензина (или
других указанных растворителей) почти весь йод переходит в бен-
зин; после отстаивания бензин оказывается окрашенным от пере-
шедшего в него йода.
Для обнаружения в растворе небольшого количества йода удобно
пользоваться следующим приёмом.
В раствор добавляют несколько капель разбавленного крахмаль-
ного клейстера; появление характерной синей окраски указывает на
присутствие в растворе свободного йода.
2. Химические свойства йода. а) Соединение йода
с водородом, металлами и металлоидами. Йод, подобно
хлору и брому, соединяется с водородом, металлами и металлоидами.
В соединениях с водородом и металлами он проявляет одну отри-
цательную валентность (— 1):
(высокая температура)
йодистый
водород
(в воде)
Zn ^2 = ZnJ2
ЙОДИСТЫЙ
цинк
Стрелки указывают, что эта реакция обратима.
В. В. Левченко 97
Соединение йода с цинком можно наблюдать, встряхивая в воде
небольшое количество йода с порошком цинка; цинк добавляют
до полного обесцвечивания раствора.
Йод из всех галогенов проявляет наименьшую способность реа-
гировать с металлоидами. Он соединяется непосредственно только
с фосфором.
б) Взаимодействие йода с водой. Йод реагирует с во-
дой подобно другим галогенам, но значительно слабее. Йодная вода
проявляет окислительное действие ещё более слабое, чем бромная
вода. Реакция протекает так же:
J2Н2О = 2HJ-J-О
в)’ Вытеснение йода из его солей. Если в бесцветный,
раствор йодистой соли прилить хлорную воду, раствор тотчас же
окрашивается вследствие вытеснения йода хлором:
2KJ4-C12 = 2KC1H- J2
йодистыи хлористый
калий калий
Вытесняется йод также бромом:
*2KJ 4- Вг2= 2KBr + J2 ' ,
3. Йод в природе. Йод встречается в природе в виде соедине-
ний с натрием и другими металлами (NaJ, KJ). Вместе с хлором и
бромом йод содержится в морской воде, минеральных источниках,
соляных озёрах, но в ещё меньших количествах, чем бром. Кроме
того, соединения йода находятся в некоторых соляных месторожде-
ниях и в водах буровых скважин в нефтеносных районах.
Йод содержится также в живом организме в виде сложных со-
единений. У животных и человека он накапливается в щитовидной
железе. Йод выполняет важную роль в процессах обмена веществ;
при недостатке его у человека развивается тяжёлое заболевание (зоб).
Внешне болезнь проявляется в увеличении щитовидной железы; она
может настолько увеличиваться в объёме, что выпячивается в виде
большой опухоли. В организме при этом происходят тяжёлые рас-
стройства нервной системы и пр. Больным дают лекарства, содержа-
щие свободный йод или его соединения.
4. Получение йода. Йод добывают из золы морских водорослей,
в которой содержатся йодистые солих), а также из нефтяных вод,
содержащих йод в свободном виде (около О,ОО5°/о).
Йод из соединений может быть выделен тем же способом, что и
бром, т. е. действием хлора на раствор его соли:
(в растворе)
2NaJ-|-Cl2 = 2NaC14-J2
х) Например, в золе водоросли ламинарии, употребляемой в пищу насе-
лением Японии и Китая, содержится йода до 2—3%.
98
Йод может быть получен также дей-
ствием на его соль серной кислоты в при-
сутствии двуокиси марганца.
Реакция по стадиям:
1. 2KJ4-H2SO4 = K2SO44-2HJ
2. MnO2 —4HJ = MnJ2 —2Н2О —J2
Реакцию можно наблюдать, поместив
на дно колбы немного указанных веществ
(порошок йодистого калия в объёме около
3 горошин, столько же двуокиси марганца
и 1 — 2 мл концентрированной серной
кислоты). Палочкой всё перемешивают
и вводят в колбу пробирку с налитой
в неё холодной водой (рис. 46).
При подогревании колбы появляются
фиолетовые пары йода; на холодных стен-
ках пробирки они переходят в твёрдое
состояние образуя красивые кристаллы р„с 46 Пол ,е йода_
(возгонка).
5. Применение йода. Йод в спирто-
вом (1О°/о) растворе под названием йодная настойка применяется
в медицине как хорошее обеззараживающее средство; он входит также
в состав ряда сложных лечебных препаратов (йодоформ и др.).
Кроме того, соединения йода применяются в фотографии, при
производстве некоторых красок и для других целей.
Б. СОЕДИНЕНИЕ ЙОДА С ВОДОРОДОМ
Йодистый водород и йодистоводородная кислота HJ
Молекулярный вес равен 127,9.
1. Получение и свойства. Получается йодистый водород при дей-
ствии серной кислоты на йодистые соли:
2KJ + H2SO4 = K2SO4 4- 2HJf
При этом происходит также выделение свободного йода ещё
в большем количестве, чем брома, при соответствующей реакции. По-
этому для получения чистого йодистого водорода применяются дру-
гие, здесь не рассматриваемые методы.
Йодистый водород по физическим и химическим свойствам схо-
ден с хлористым и бромистым водородом. Это бесцветный газ с рез-
ким запахом; на воздухе дымит; хорошо растворяется в воде.
Йодистый водород — ещё менее прочное соединение, чем броми-
стый водород.
Водный раствор йодистого водорода представляет собой кислоту.
Называется она йодистоводородной кислотой. Йодистоводородная
кислота подобна соляной и бромистоводородной. Применяется она
сравнительно редко — в научных работах.
2. Соли йодистоводородной кислоты. Соли йодистоводородной
кислоты называются йодистыми, или йодидами.
Йодистые соли сходны с солями бромистыми и хлористыми. Боль-
шинство их хорошо растворимо в воде; нерастворимой является соль
серебра: йодистое серебро AgJ жёлтого цвета:
KJ + AgNOt = AgJ 4- KNO3
I
Пользуясь реакцией образования солей серебра, легко можно
различать хлористые, бромистые и йодистые соли. Для этого к рас-
творам солей галогенов прибавляют немного раствора азотнокислого
серебра; окраска выпадающего осадка указывает на природу соли:
AgNO3 + NaCl = AgCl-{- NaNO»
I
белого цвета
хлористое
серебро
AgNO3 + NaBr = AgBr +NaNO3
1 I
желтоватого
- цвета бромистое
серебро- t
AgNQ;4~NaJ= AgJ -[-NaNO3 '
4
жёлтого цвета
йодистое се-
ребро ’
Под действием света все эти соли темнеют вследствие выделения
свободного серебра:
2AgCl = 2Ag-|-Cl2
2AgBr = 2Ag-|-Br3
2AgJ = 2Ag4-J2
Из йодистых солей важнейшими являются: йодистый натрий NaJ,
йодистый калий KJ. Они применяются в медицине.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Как получается йод?
2. Что представляет собой йод в свободном состоянии?
3. Какова растворимость йода в воде и спирте?
4. Для чего применяется свободный йод?
5. Какую валентность проявляет йод в соединениях с водородом и метал-
лами?
6. Приведите формулы соединений йода с водородом и металлами.
7. На каком опыте можно наблюдать соединение йода с цинком?
8. Как действует на растворы солей йода хлорная и бромная вода?
9. Как можно обнаружить небольшие количества свободного йода?
10. Как распознать соли хлора, брома и йода?
100
IV. ФТОР И ЕГО СОЕДИНЕНИЯ
А. ФТОР
Химический знак: F (произносится: фтор).
Атомный вес равен 19.
В свободном состоянии . образует молекулы из двух атомов: Fa.
Впервые фтор был получен в конце XIX в. (1886). Название „фтор“
происходит от греческого слова „фторное", означающего „разрушаю-
щий" (дано в связи с чрезвычайно сильно выраженной химической
активностью фтора).
1. Физические и химические свойства фтора. Фтор при обыч-
ных условиях — газ, очень слабо окрашенный в зеленовато-жёлтый
цвет. При охлаждении до — 188° превращается в жидкость, затверде-
вающую при — 223°.
Во всех соединениях фтор проявляет одну отрицательную валент-
ность (—1). Он энергичнее, чем остальные галогены, вступает во
взаимодействие с водородом, металлами и водородсодержащими слож-
ными веществами.
а) Соединение фтора с водородом и металлами.
Хлор соединяется с водородом со взрывом под действием солнеч-
ного света, смесь же фтора с водородом взрывается даже в темноте
Н2 4- F2 = 2HF
фтористый
водород
Многие металлы горят в нём.
Фтор обладает настолько большой химической активностью, что
даже такие химически мало активные металлы, как золото и платина,
предварительно накалённые, соединяются с ним.
Фтор также энергично соединяется с металлоидами: фосфором,
серой, углеродом.
б) Взаимодействие фтора с водой и другими
сложными веществами. Фтор очень энергично реагирует с ве-
ществами, содержащими водород, образуя при этом фтористый водо-
род. Например, он бурно реагирует с водой даже в темноте (срав-
ните с действием хлора и других галогенов):
F2 + H2O = 2HF4-O
Поэтому фтор энергично действует и на ткани организма, вызы-
вая разрушение их.
2. Фтор в природе. Получение фтора. Фтор в природе нахо-
дится, как и прочие галогены, главным образом, в виде соединений
с металлами. Наиболее распространён минерал плавиковый шпат,
представляющий собой фтористый кальций CaF2; вместе с фосфором
фтор содержится также в минерале апатите. Входит он в состав
костей и зубов; относительно много содержится его в зубной эмали.
Получают фтор, разлагая электрическим током жидкий фтористый
водород, к которому добавлен фтористый калий.
101
Б. СОЕДИНЕНИЕ ФТОРА С ВОДОРОДОМ
§ 1. Фтористый водород и плавиковая кислота HF
Молекулярный вес равен 20.
Получение фтористого водорода. Фтористый водород получают
действием серной кислоты на фтористый кальций:
(нагревание)
CaF2 + H2SO4 = CaSO4 + 2HF|
Реакцию проводят в платиновых пли свинцовых сосудах, гак как
на эти металлы фтористый водород не-действует.
Свойства фтористого водорода. Фтористый водород при темпе-
ратуре выше 19°,5 является газом. Он хорошо растворим в воде.
Водный раствор фтористого водорода, как и прочих галогено-
водородов, является кислотой. Называется она плавиковой кислотой.
Плавиковую кислоту держат в каучуковых или парафиновых
сосудах, так как эти материалы не разъедаются ею.
Плавиковая кислота проявляет все общие свойства кислот.
Характерной особенностью плавиковой кислоты является способ-
ность реагировать с соединениями элемента кремния, в том числе и
с песком, представляющим собой двуокись кремния SiO2.
При этом происходит растворение, так как продуктами реакции
являются газообразный фтористый кремний и вода:
SiO2 4-4HF=SiF4 | Ц-2Н2О
двуокись кремния фтористый
(песок) л кремний .
Подобным образом действует . плавиковая кислота на. стекло,
в состав которого входит смесь разных соединений кремния. Этим
пользуются для вытравливания на стекле рисунков, надписей. Стекло
сначала покрывают слоем воска или парафина, на которые плавико-
вая кислота не действует; затем снимают этот слой в тех местах
стекла, где должен получиться след от кислоты, и подвергают стекло
её действию. После удаления воска на стекле остаются более или
менее глубоко разъеденные участки, образующие надпись или ри-
сунок.
§ 2. Соли плавиковой кислоты
Соли плавиковой кислоты - называются фтористыми, или фтори-
дами. Из них применение находят: фтористый натрий, главным обра-
зом для борьбы с вредителями сельского хозяйства, фтористый каль-
ций (плавиковый шпат) для получения плавиковой кислоты и др.
V. ОБЩАЯ ХАРАКТЕРИСТИКА ГРУППЫ ГАЛОГЕНОВ
Фтор, хлор, бром и йод сходны между собой во многих отноше-
ниях. В свободном состоянии все они химически активны, поэтому встре-
чаются в природе только в виде соединений. Соединяются они с боль-
шинством элементов и проявляют при этом одинаковую валентность.
102
в соединениях с водородом и металлами все эти элементы одно-
валентны (валентность их равна—1).
Для всех галогенов характерна способность непосредственно
соединяться с водородом и давать газообразные вещества:
фтористый водород HF, бромистый водород НВг,
хлористый водород HCI, иодистыи водород HJ.
Все эти вещества хорошо растворяются в воде} водные растворы
их являются кислотами. Формулы этих кислот те же самые, что и
соответствующих газов;
фтористоводородная кислота (плавиковая) HF,
хлористоводородная , (соляная) НС1,
бромистоводородиая „ НВг,
йодистоводородная , HJ.
Все галогены легко соединяются с металлами и образуют веще-
ства, относящиеся к классу солей.
Наряду со сходством у галогенов наблюдаются и определенные
различия как в физических, так и в химических свойствах; главней-
шие из них показаны в таблице.
Элементы Химические знаки Молекулярная формула Атомный вес Физическое состояние Окраска Соединения с водородом Соед. с метал. Прочность соеди- нений с водоро- дом и металлами
формула условия образова- ния при синтезе из элементов 1 формула
Фтор F F2 19,0 Газ Зелено- вато-жел- тая HF Даже в темноте NaF Наиболь- шая
Хлор С1 С12 35,5 Газ Желто- зеленая НС1 На свету NaCl
Бром Вг Вг2 80 Жид- кость Красно- бурая НВг При на- гревании NaBr
Йод J J2 127 Твёр- дый Чё^но- фиолето- вая HJ • * NaJ Наимень- шая
Галогены различаются атомным весом. В приведённой таблице они
расположены в порядке увеличения атомных весов. Самый лёгкий из
них фтор расположен вверху — первым, самый тяжёлый йод располо-
жен внизу —- последним.
В соответствии с разным атомным весом у галогенов различны
ИХ физические свойства. Более лёгкие фтор и хлор при обычных
условиях являются газообразными веществами; более тяжёлый бром—
зтпАКОСТЬЮ' самый тяжёлый йод — твёрдым телом. С увеличением
спг™°Г0 ^еса изменяется также окраска галогенов в свободном
состоянии (см. таблицу).
103
В химическом отношении особенно интересна разница в способ-
ности галогенов переходить из свободного состояния в химически
связанное, т. е. вступать в соединения с другими элементами. С водо-
родом наиболее энергично реагирует самый лёгкий элемент— фтор; по
мере увеличения атомного веса способность к реагированию Умень-
шается. Это наглядно видно при сравнении условий, необходимых
для образования соединений галогенов с водородом (см. таблицу).
То же наблюдается в отношении способности соединяться с метал-
лами: наиболее энергично реагирует фтор, наименее — йод. Соответ-
ственно этому различна прочность образующихся соединений.
Соединения фтора с водородом (фтористоводородная кислота) и
с, металлами (фтористые соли) получаются в результате очень
энергично идущих реакций; они отличаются наибольшей прочностью.
Соединения йода с водородом (йодпстоводородная кислота) и
с металлами (йодистые соли) наименее прочны. Йодистоводородная
кислота, например, легко окисляется даже кислородом воздуха, по-
этому при хранении окрашивается в тёмный цвет от выделяющегося
свободного йода. Йодистые соли при длительном хранении, осо-
бенно в освещённом месте, желтеют по той же причине.
По мере увеличения атомного веса уменьшается способность
галогенов к переходу из свободного состояния в химически связан-
ное; это проявляется в 1ом, что лёгкий галоген вытесняет из хими-
ческих соединений более тяжёлый: фтор вытесняет хлор, бром и йод;
хлор вытесняет 6j>om и йод; бром вытесняет йод.
ч
VI. ЕСТЕСТВЕННЫЕ ГРУППЫ ЭЛЕМЕНТОВ
Как видно из сравнения свойств фтора, хлора, брома и йода,
у этих элементов проявляется существенное сходство во многих
отношениях.
Давно уже делались попытки группировать элементы на основа-
нии сходства в тех или иных свойствах их. Однако такие попытки
не имели большого научного значения, так как группировки эти
носили в значительной мере сл^айный характер и были искус-
ственны: в группы объединялись элементы на основании сходства
в несущественных свойствах.
Только Д. И. Менделееву удалось создать своей знаменитой
периодической системой элементов естественную классификацию
элементов. Элементы, расположенные в вертикальных столбцах таб-
лицы Д. И. Менделеева, один под другим, составляют естественные
группы элементов. Например, элементы фтор, хлор, бром и йод,
как показала изучение их, сходны между собой по многим суще-
ственным свойствам: они составляют естественную группу элементов,
известную под названием „галогены" и находящуюся в VII группе
таблицы Д. И. Менделеева.
Номер группы элементов в таблице Д. И. Менделеева указывает
число валентных электронов. Атомы всех галогенов имеют 7 валент-
ных электронов; расположены они во внешнем электронном слое.
101
При образовании соединений с кислородом атомы элемента те-
ряют валентные электроны, которые присоединяются к атомам ки-
слорода, и элемент всегда проявляет положительную валентность.
Высшая положительная ' валентность, проявляемая в резуль-
тате потери атомом всех валентных электронов, численно равна
номеру группы в таблице Д. И. Менделеева.
Высшая положительная валентность галогенов = 7. Высшие окислы
+7-2
галогенов имеют состав, отвечающий общей формуле: R2O7 (под знаком
R подразумевается галоген, образующий соединение с кислородом).
При образовании соединений с водородом атомы элемента при-
соединяют электроны, отрываемые от атомов водорода, и заряжаются
отрицательно (атомы водорода заряжаются положительно).
Атомы элемента могут присоединять электроны в количестве,
необходимом для образования устойчивого слоя их. Устойчивым
является внешний слой из 8 электронов; поэтому атомы присоеди-
няют столько электронов, сколько недостаёт их до этого числа во
внешнем электронном слое.
Отрицательная валентность элемента, проявляемая им в ре-
зультате присоединения к нейтральному атому электронов, равна
разности между числом 8 и номером группы. Водородные соеди-
нения всех галогенов имеют состав, выражаемый общей формулой
-1-1
HR, так как отрицательная валентность любого галогена равна 8—7
(номер группы) = 1.
В группах таблицы Менделеева выше расположены элементы
более лёгкие, ниже — более тяжёлые. В связи с этим наблюдается
определённое закономерное различие в свойствах элементов и их соеди-
нений по мере перехода к элементам, ниже расположенным, т. е. более
тяжёлым, как это было показано при изучении галогенов.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1, Перечислите свойства, общие для фтора, хлора, брома и йода.
2. Почему эти элементы объединяются в одну группу под названием
галогенов?
3. Чем отличаются между собой галогены? Наблюдается ли какая-либо
зависимость между различиями в свойствах галогенов и их атомным весом?
4. Какие галогены вытесняют йод из его соединений с металлами?
вытесняют бром? вытесняют хлор?
5. Какая наблюдается связь между атомным весом галогенов и их спо-
собностью вытеснять друг друга?
6. Какой учёный создал таблицу элементов, в которой они расположены
по естественным группам?
7. Как узнать на основании таблицы Менделеева высшую положительную
валентность элемента, т. е. валентность его в высшем солеобразующем окисле?
покажите это па примере хлора.
8. Как узнать на основании этой таблицы отрицательную валентность
лемента, т. е. валентность его в соединениях с водородом и металлами?
Кд Ж1|1е это на примере хлора и других галогенов.
от ч Приведите примеры изменения свойств галогенов по мере перехода
п1гпЛеМентов’ ВЬ!ше расположенных в таблице Менделеева, к элементам, ниже
расположенным.
105
ГЛАВА И ‘
ГРУППА КИСЛОРОДА
Подобно галогенам, группу сходных элементов образуют: кисло-
род О, сера S, селен Se, теллур Те. В таблице Менделеева эти эле-
менты расположены в VI группе. По названию самого левого из
них они объединяются в“*„группу кислорода". Из элементов этой
группы мы будем изучать только кислород и серу.
Атомы элементов группы кислорода во внешнем > электронном
слое имеют ,6 электронов (валентные электроны).
Они могут терять все или часть валентных электронов и заря-
жаться положительно (высший положительный заряд равен 6).
Атомы могут также присоединять 2 лишних электрона (недостаю-
щее число их до 8) и заряжаться отрицательно (в этом случае заряд
образующихся Йонов равен — 2).
В высших кислородных соединениях эти элементы проявляют
валентность (положительную), равную номеру группы, т. е. 6. Общая
-1-6—2
формула высших окислов их RO3. ,
В водородных соединениях эти элементы проявляют валентность
(отрицательную), равную 8—6') = 2. Общая формула водородных
+1-2
соединений H2R. х -
Явление аллотропии у элементов группы кислЬрода
Элементы группы кислорода в свободном состоянии, как и неко-
торые другие элементы, проявляют способность образовывать не-
сколько простых веществ (состоящих из одинаковых атомов). На-
пример, элемент кислород образует два простых вещества,' для
которых точно установлены молекулярные формулы. Одно веще-
ство— это обыкновенный кислород, находящийся в воздухе; моле-
кулы его образованы двумя атомами и, следовательно, формула их О2.
Кроме того, во время грозы от действия электрического разряда
и в других случаях атомы кислорода соединяются по' три в моле-
куле (О3) и образуют простое вещество, получившее название „озон".
Таким образом, элемент кислород образует два простых вещества:
обыкновенный кислород, или просто кислород, и озон.
I Свойство химического элемента образовывать не-
| сколько простых веществ называется аллотропией.
(Слово „аллотропия" произведено от греческих слов „аллос" —
„другой" и „тропос"— „свойство"; оно означает „другие свойства".)
Различные простые вещества, образованные одним элементом,
называются аллотропическими видоизменениями этого элемента.
1) Номер группы, в которой расположены эти элементы.
106
Аллотропические видоизменения различаются количеством со-
держащихся в молекулах атомов (иногда — расположением их).
В зависимости от различия в молекулярном строении аллотропические
видоизменения проявляют различные физические, а часто и химиче-
ские свойства (различное качество).
I. КИСЛОРОД И ЕГО СОЕДИНЕНИЯ
Химический знак: О (читается: О).
Атомный вес равен 16.
Атомы кислорода имеют во внешнем электронном слое 6 электро-
нов. Они обладают особенностью: почти во всех случаях (кроме
соединений со фтором) не проявляют положительной валентности
(т. е. не теряют электроны). Они могут только принимать два
электрона и заряжаться в результате этого отрицательно; поэтому
кислород во всех соединениях всегда имеет заряд, равный—2.
В свободном состоянии кислород образует два аллотропических
видоизменения:
1) кислород О2, 2) озон О3
Открытие кислорода относится к XVIII в. (1774).
Название, означающее „родит кислоту", было дано ему потому,
что он был обнаружен в кислотах (бескислородные кислоты в то
время не были известны).
А. КИСЛОРОД
О2. Молекулярный вес равен 32.
1. Физические свойства кислорода. Кислород представляет
собой бесцветный газ без запаха и вкуса. Плотность по воздуху
D, = g =1,1053;
кислород лишь немного тяжелее воздуха.
При температуре — 119° и давлении 50 атм кислород превра-
щается в жидкость темноспнего цвета; под атмосферным давлением
он кипит при температуре —182°. При температуре —220° кисло-
род затвердевает в снегообразную массу. В воде кислород раство-
ряется при 20° в количестве 3,1 объёма на 100 объёмов воды.
Растворённый в природных водах кислород обеспечивает дыхание
водных организмов.
2. Химические свойства кислорода. Кислород образует соеди-
нения почти со всеми элементами. В этих соединениях он прояв-
ляет отрицательную валентность, равную — 2.
107
Реакции соединения веществ с кислородом называются реакциями
окисления.
Такое определение не является исчерпывающим; существуют и
другие реакции, также относящиеся к процессам окисления; они
будут рассмотрены дальше. Пока же термин „окисление" будет при-
меняться в тех случаях, когда в реакции участвует кислород. Про-
цессы окисления и большинстве случаев сопровождаются выделением
больших количеств тепла.
Реакции, -при которых ' выделяется тепло, называются экзо-
термическими. Название „экзотермический" произведено от двух
греческих слов: „экзо" и „термос", означающих „наружу" и „тепло".
Существует большое число реакций, которые протекают с погло-
щением тепла.
Реакции, при которых поглощается тепло, называются эндо-
термическими. Название „эндотермический" произведено от грече-
ских слов „эндо" и „термос", означающих „внутрь" и „тепло".
А
Рис. 47. Горение веществ в кислороде.
Л — горение натрия; Б — горение железа; В — горение угля; Г — горение серы.
а) Взаимодействие кислорода с водородом. Кисло-
род соединяется с водородом при поджигании; дальнейшее течение
реакций происходит за счёт тепла, выделяющегося при самой реакции.
На
Если поджигается смесь обоих газов (гремучий газ),
соединение их сопровождается сильным взрывом; чистый,
водород горит в кислороде совершенно спокойно (рис. 48).
Продукт реакции — вода:
(поджигание)
2Н2О2 = 2Н2О
Необходимо всегда соблюдать предосторожность при
Рис. 48. получении водорода и поджигании его. Всегда следует
Горение собрать в пробирку выделяющийся водород и в пробирке
водорода поджечь его. Только в случае, если не послышится
роде. хлопка (водород чист, нет примеси кислорода), выделяю-
щийся газ можно поджигать.
б) Взаимодействие кислорода с металлами и ме-
таллоидами. Многие металлы и металлоиды непосредственно
108
соединяются с кислородом (рис. 47); некоторые соединяются с ним
уже при обычной температуре, другие только при нагревании:
(на холоду)
2Са 4- О2 = 2СаО
(при накаливании)
2СиЦ-О2 = 2СиО
Кислород
02
Горение
и дыхание
животных
и растений
Питание
(фотосинтез)
только зелёных
растений на свету
со.
газ
Углекислый
С
Углерод,
остающийся
в растениях
Рис. 49. Круговорот кислорода в природе.
целей используется горение углеродсо-
каменного угля и др.
Кислород в свободном виде, т. е. как
Подробнее это будет рассматриваться при изучении отдельных
элементов.
в) Взаимодействие кислорода со сложными веще-
ствами. Многие сложные вещества реагируют с кислородом (окис-
ляются) при обычной темпе-
ратуре, хотя и медленно. Та-
кое окисление происходит,
например, при гниении, при
процессах, происходящих в
организме, и др.’
Во многих случаях реак-
ция вещества с кислородом
начинается только после под-
жигания и сопровождается
выделением большого коли-
чества тепла и образованием
пламени (горение). Этими
процессами пользуются в
обыдённой, жизни и технике
для получения тепла и света.
Главным образо!ч для этих
держащих веществ: дерева,
3. Кислород в природе,
простое вещество, находится в атмосферном воздухе: здесь он сме-
шан с азотом и некоторыми другими газами. Кислорода содержится
в воздухе по объёму почти 21°/0 (по весу 23°/0).
В химически связанном виде кислород входит в состав воды,
а также в состав большей части минералов и горных пород, обра-
зующих земную кору. Кислород является также составной частью
главнейших веществ, образующих тела растений и животных.
В земной коре (считая до 16 км глубины и включая воду и
атмосферу) кислорода содержится до 5О°/о, т. е. больше, чем какого-
либо другого элемента.
Таким образом, кислород является наиболее распространённым на
земле элементом.
Круговорот кислорода в природе. При участии расте-
ний и животных в природе совершается круговорот кислорода,
поддерживающий постоянное содержание кислорода в воздухе
(Рис. 49).
109
Животные и растения в процессе дыхания поглощают кислород.
В организме он расходуется на окисление углеродсодержащих
веществ, а образующийся углекислый газ переходит в воздух. Зелё-
ные растения в процессе питания (фотосинтез) поглощают угле-
кислый газ и отдают в воздух кислород, снова идущий на дыха-
ние. Так протекает круговорот кислорода (и углерода), поддержи-
вающий постоянное содержание в воздухе кислорода на уровне 21°/0
и углекислого газа на уровне 0,03°/0.
Для круговорота кислорода .и других элементов большое значе-а
ние имеют также вызываемые микробами процессы гниения. Благо-
Рис. 50. Получение и собирание кислорода.
В пробирке — порошок марганцевокислого калия. Нагревают пробирку,
водя пламенем вдоль неё; кислород собирают в банку.
даря им происходит превращение органических веществ погибших'
растений и животных в минеральные вещества: углекислый , газ,'
воду и пр. В результате всех этих процессов в воздух посту-
пает углекислый газ, в почву — азотнокислые и другие соли,
служащие материалом для нового построения растениями живого
тела.
4. Получение кислорода. В технике кислород получают из
воздуха при помощи особых машин. В этих машинах воздух подвер-
гается сжижению путём охлаждения при повышенном давлении; затем
ему дают испаряться при низкой температуре. Температура кипения
азота ниже, чем кислорода, поэтому сначала улетучивается азот, а
кислород остаётся в жидком виде.
Для хранения полученный кислород накачивают в стальные бал-
лоны— ябомбы“ (рис. 27) под давлением 100—150 атм,
ПО
В лаборатории кислород можно получать из многих содержа-
щих его соединений. Для этой цели удобно пользоваться марганцево-
кислым калием КМпО4 (рис. 50). Эта соль частично выделяет ки-
слород уже при умеренном нагревании. При очень сильном нагре-
вании, выше 200°, происходит разложение её по следующему урав-
нению (реакция даётся не для запоминания):
4КМпО4 = 2К2О
марганцевокислый окись
калий калия
4МпО2
двуокись
марганца
зо2
Из приведённого уравнения реакции видно, что часть химически
связанного кислорода остаётся в твёрдых продуктах разложения:
в окиси калия и в двуокиси марганца.
Рис. 51. Разложение бертолетовой соли в присутствии катализатора.
А — бертолетова соль, нагретая до плавления; кислород не выделяется; Б — в расплавленную
соль брошено немного двуокиси марганца; происходит энергичное выделение кислорода;
лучинка с тлеющим на конце угольком загорается.
Большой интерес представляет реакция разложения бертолетовой
соли, приводящая к полному выделению всего содержащегося в ней
кислорода:
2КС1О3
хлорновато-
кислый калий
(бертолетова
соль)
(нагревание)
2КС1 +
хлористый
калий
зо2[
5. Катализаторы. Разложение чистой бертолетовой соли требует
высокой температуры, а при менее сильном нагревании оно проис-
ходит медленно. Если же к бертолетовой соли прибавить немного
порошка двуокиси 'марганца МпО2, разложение соли резко уско-
ряется (рис. 51), причём количество двуокиси марганца остаётся без
111
изменения. В этом случае дзуокнсь марганца является только уско-
рителем реакции разложения бертолетовой соли.
Вещества, изменяющие скорость течения реакции, но
сами после реакции "Остающиеся количественно неизменён-
' ними, называются катализаторами.-
(Название от греческого слова, означающего „разлагать".)
Реакции, происходящие под влиянием катализаторов, называются
каталитическими, само явление—'катализом.
Б В
Рис. 52. Резка и сварка металла.
Z — горелка в разрезе; Б —разрезание железной плиты; В—сваривание шва. Проволока,
которую мастер держит в руке, плавится и заполняет шов.
Характерной особенностью катализаторов является то, что по
окончании реакции они остаются в том же количестве, в каком были
взяты. Катализаторы, ускоряя химический процесс, ‘сами при этом
не расходуются. Благодаря этому небольшое количество катализа-
торов может ускорять реакцию большого количества вещества. Такое
действие катализаторов широко используется в технике.
Большое научное и практическое значение имеют работы по
исследованию каталитических явлений, проведённые академиком
И. Д. 3 е л и н с к и м.
112
6. Применение кислорода. Благодаря возможности получать
кислород в больших количествах он применяется теперь в таких
производствах, как выплавка чугуна из руд. Продувание в доменную
печь кислорода (точнее обогащённого им воздуха) значительно повы-
шает температуру пламени, благодаря чему ускоряется процесс
плавки и резко увеличивается производительность печи. Приоритет
этого открытия принадлежит великому русскому химику Д. И. Me н-
делееву. Только в условиях социалистического строя мечта Мен-
делеева была осуществлена в грандиозном масштабе.
Кислород используется также для резки и сварки металлов.
Для этих целей употребляют специальную горелку, изображённую
на рисунке 52, А. По внутреннему каналу горелки пропускают
кислород, а по наружному — горючий газ: водород, ацетилен; газ
горит в атмосфере кислорода и даёт пламя с высокой температурой
(пламя водорода до 3000°, пламя ацетилена до 3500°). Если, регу-
лируя краны, дать избыток кислорода, металл будет не только
плавиться в нагреваемом месте, но и сгорать в избытке кислорода;
благодаря этому получается разрез по месту проведения пламенем
(рис. 52, Б).
Если пропускать в избытке горючий газ, расплавленный припой
не будет окисляться вследствие недостатка кислорода, и произойдёт
сварка металла (рис. 52, В).
Кислород применяется также в специальных масках для дыхания
при работах в атмосфере вредных газов (подземные работы, работы
под водой), высотных полётах, для поддержания ослабевающего ды-
хания и в других случаях.
Б. ОЗОН
О3. Молекулярный вес равен 48.
1. Физические свойства озона. Озон — газ с сильным запахом;
от этого он получил своё название, означающее „пахучий".
Небольшая примесь озона к воздуху создаёт ощущение приятной
свежести. Этим объясняется приятный запах воздуха после грозы,
а также запах воздуха в сосновых лесах; в обоих случаях обра-
зуются небольшие количества озона.
В воде озон растворяется значительно лучше обыкновенного
кислорода: в 100 объёмах воды при 0° растворяется 49 объёмов
озона. Различие в свойствах кислорода и озона, зависящее от разного
числа атомов в молекулах этих веществ, является ярким примером
проявления важнейшего закона природы — перехода количества
в качество.
2. Химические свойства озона. Озон проявляет значительно
более сильное окислительное действие, чем обыкновенный кислород.
Это объясняется нестойкостью его молекул.
Молекулы обыкновенного кислорода состоят из двух атомов (О2);
молекулы озона — из трёх атомов (О3). Учитывая, что атомы кисло-
® В. В. Левченко ? 113
рода всегда проявляют две валентности, строение молекул кисло-
рода и озона может быть представлено в таком виде:
\
О
0 = 0 о^-^о ,
кислород озон ’ t
(2 атома) (3 атома) *
\
Реакция образования озона из кислорода происходит по урав-
нению:
(электрические
разряды)
ЗО2 = 2О3
Из трёх молекул кислорода образуется две молекулы озона; при
этом в озон превращается лишь небольшая часть кислорода
(в объёме не более 5—6°/0). Молекулы озона очень нестойки. Они
легко распадаются, причём от каждой молекулы отрывается по
одному атому кислорода:
03 = 02 О
молекула молекула атом
. озона кислорода кислорода
Так как при этом превращении образуется атомарный кислород,
озон и оказывает сильное окислительное действие. Он окисляет при
обычной температуре вещества, на которые обыкновенный кислород
в тех же случаях не действует.
Трудно окисляющиеся металлы, как ртуть, серебро, сравнительно
легко окисляются при действии озона. Окисляются озоном также
металлоиды.
Органические краски от действия озона быстро разрушаются,
а микроорганизмы погибают; поэтому озон оказывает белящее и
сильно дезинфицирующее действие.
Вдыхание воздуха с небольшой примесью озона очень полезно,
особенно для лёгочных больных; этим объясняется лечебное дей-
ствие воздуха в хвойных лесах, где в заметных количествах всегда
присутствует озон. ' ?
3. Озон в природе. Озон в небольшом количестве находится
в воздухе. В природных условиях он образуется при действии на
кислород электрических разрядов, поэтому много его появляется
в воздухе во время грозы. Образуется он также при окислении мно-
гих органических веществ, особенно скипидара. Этим объясняется
значительная примесь его в воздухе сосновых лесов (в смоле хвой-
ных деревьев содержится скипидар).
4. Получение и применение озона. Удобнее всего получать
озон в так называемом „озонаторе" (рис. 53). Проволоку, обвиваю-
щую стеклянную трубку снаружи, и проволоку, проходящую внутри
трубки, присоединяют к индуктору. Через трубку пропускают ток
сухого кислорода. Часть кислорода превращается в озон, и кисло-
род выходит с содержанием его до 15°/0.
Озон образуется также при некоторых химических реакциях
в виде примеси к кислороду. В лаборатории получить озон можно
действием крепкой серной кислоты, на марганцевокислый калий или
перекись бария.
В сухой химический стакан (рис. 54) помещают небольшое ко-
личество порошка марганцевокислого калия (в объёме 1—2 горошин).
Большее количество брать нельзя, так как может произойти взрыв.
Озонированный
кислород
К индуктору
Проволока снаружи
стеклянной трубки
Проволока внутри
стеклянной трубки
Рис. 54. Получение
озона при химической
реакции.
f |—Кислород
К индуктору
Рис. 53. Простейший
озонатор.
На порошок пускают из пипетки несколько капель концентри-
рованной серной кислоты; сразу бывает видно вспучивание тёмной
массы, иногда разбрызгивание её.
Выделение озона устанавливают по запаху (нюхать надо осто-
рожно), а также опуская в стакан смоченную раствором йодистого
калия фильтровальную бумагу (ещё лучше смочить бумагу сильно
разбавленным крахмальным клейстером, к которому добавлен раствор
йодистого калия). Под действием озона из йодистого калия выделяется
йод. Выделившийся в свободном виде йод окрашивает бумагу в бу-
рый цвет, а если был взят крахмальный клейстер (йодокрахмальная
бумага),— в синий цвет.
Реакция выделения йода из йодистого калия под действием озона может
быть представлена в виде следующих двух последовательных уравнений:
1) О8=О2 + О;
2) 2KJ + Н2О + О = 2КОН -1-
Для практического использования озонированный воздух получают в со-
бранных в батареи озонаторах.
Озон применяется в качестве окислителя для обработки лаков, -
высыхающих масел (в производстве масляных красок), для отбели-
вания воска, сахара и пр.
В качестве дезинфицирующего вещества озон ^применяется для
обезвреживания питьевой воды, обеззараживания воздуха, дезинфек-
ции помещений.
В. СОЕДИНЕНИЯ КИСЛОРОДА С ВОДОРОДАМ
1. Вода и перекись водорода. Важнейшее соединение кислорода
с водородом — вода Н2О. Молекулярный вес её равен 18.
Кроме воды существует ещё другое соединение водорода с кисло-
родом — перекись водорода. В молекуле перекиси водорода содер-
жится два атома кислорода, соединённые с двумя атомами водорода
(в ней на одну весовую часть водорода приходится не 8, как в воде,
а 16 весовых частей кислорода). Молекулярный вес перекиси водо-
рода равен 34; формула её Н2О2. Исходя из того, что кислород
всегда проявляет две валентности, а водород — одну, следует
представлять строение молекулы перекиси водорода в следующем
виде:
Н—О—О—Н
2. Получение перекиси водорода. Перекись водорода в технике
и в лаборатории получают действием разведённой серной кислоты
на перекись натрия или перекись бария:
Na2O2 + H2SO4 = Na2SO4 + Н2О2
перекись перекись
натрия водорода
ВаО2 4- H3SO4 = BaSO4 -J- Н2О2
перекись i
бария
При проведении реакции с перекисью бария образующийся серно-
кислый барий выделяется в осадок, а перекись водорода остаётся
в растворе и легко отделяется фильтрованием.
3. Физические свойства перекиси водорода. Перекись водорода
представляет собой бесцветную жидкость с вяжущим вкусом. В чи-
стом виде она почти в 1,5 раза тяжелее воды.
Обычно употребляются водные растворы перекиси водорода: 3°/0
и ЗО°/0; последний называется пергидролем.
При действии на тело концентрированный раствор перекиси
водорода вызывает ожоги.
4. Химические свойства перекиси водорода. Перекись водорода,
подобно озону, легко разлагается; из неё выделяется часть кисло-
рода, и она превращается в воду:
н2о2=н2о4-о
116
Такое разложение происходит медленно; оно значительно уско-
ряется на свету и при нагревании (поэтому хранить перекись водо-
рода надо в тёмной склянке и в холодном месте).
Разложение перекиси водорода резко ускоряется под влиянием
порошкообразных тел (порошка серебра, платины, двуокиси мар-
ганца, стекла и пр.), которые действуют в качестве катализаторов.
Если, например, в стакан с перекисью водорода насыпать немного
двуокиси марганца, тотчас же происходит бурное выделение пузырь-
ков кислорода, который легко обнаружить по вспыхиванию тлею-
щей лучинки.
5. Применение перекиси водорода. Так как перекись водорода
выделяет атомарный кислород, она является хорошим окислителем.
Подобно озону, она разрушает органические вещества и обесцвечи-
вает органические краски. На этом основано её применение в тех-
нике для беления шёлка, пера, рога, меха, соломы, употребляемой
для изделий, и пр.
Подобно озону, перекись водорода быстро убивает микробов и
является хорошим дезинфицирующим средством. Поэтому слабые
растворы её употребляются для промывания ран, полоскания горла
при заболеваниях и пр. Перекись водорода употребляется также
в качестве кровоостанавливающего средства (она вызывает свёрты-
вайие кровц).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какую валентность проявляет кислород, вступая в химические соеди-
нения?
2. Что представляют собой процессы горения и дыхания?
3. Почему кислород сохраняется в воздухе в постоянном количестве, хотя
он всё время расходуется?
4. Из каких процессов слагается круговорот кислорода в природе?
5. Как получается кислород в лаборатории и технике?
6. Какое техническое применение находит кислород?
7. Почему одна и та же горелка служит для сварки и резки металлов?
Как достигается столь различное действие её?
8. Что представляет собой озон?
9. При каких условиях образуется озон?
10. Как построена молекула озона?
И. Что называется аллотропией?
12. Какими свойствами озон отличается от кислорода как простого
вещества?
13. Какое практическое применение находит озон?
14. Как построена молекула перекиси водорода?
15. Какими свойствами отличается перекись водорода от воды?
16. Приведите пример окислительного действия перекиси водорода.
17. Как получается перекись водорода?
18. Какое практическое применение находит перекись водорода?
19. Какое явление называется катализом?
20. В чём заключается особенность каталитического действия веще-
ства?
21. Приведите примеры каталитического действия двуокиси марганца.
11/
//. СЕРА И ЕЁ СОЕДИНЕНИЯ
А. СЕРА
Химический знак: S (читается: эс).
Атомный вес равен 32.
Атомы серы имеют во внешнем электронном слое шесть элек-
тронов. Они могут принимать два электрона й заряжаться отрица-
тельно (—2) при взаимодействии с элементами, легко отдающими
электроны (водородом и металлами). Могут они терять^ электроны и
заряжаться положительно (высший заряд -J-6).
Сера известна с глубокой древности благодаря тому, что встре-
чается в природе в свободном виде.
Сера в свободном состоянии образует несколько аллотропических
видоизменений.
1. Физические свойства серы. Сера при обычных условиях —
твёрдое кристаллическое вещество жёлтого цвета, в 2 раза тяжелее
воды. Отличается она хрупкостью и легко измельчается в порошок.
При нагревании сера плавится (при 119°) и превращается в жёл-
тую жидкость. При дальнейшем нагревании расплавленной серы в ней
наблюдаются изменения, вызываемые превращением её в новые алло-
тропические видоизменения.
При температуре около 160° жидкая сера начинает темнеть и
густеть, а затем становится настолько густой, что не выливается
из сосуда (200—250°). Выше 260° сера снова начинает разжижаться
и к 330° становится совсем жидкой, а при 444°,6 закипает, выде-
ляя пары оранжевого цвета.
Пары серы при быстром охлаждении, минуя жидкое состояние,
превращаются в порошок, состоящий из мельчайших кристалликов
обычной серы (возгонка). Такой порошок называется серным цве-
том. Если над парами серы подержать холодный предмет (кусок
стекла, лезвие ножа), на нём появляется налёт серного цвета.
Если нагретую выше 330° серу вылить в холодную воду (рис. 55),
она застывает в виде прозрачной тягучей массы, подобной резине.
Такая сера называется пластической; она представляет собой смесь
разных аллотропических видоизменений её. Пластическая сера до-
вольно быстро изменяется: становится непрозрачной, желтеет и за-
твердевает, превращаясь в обычную серу.
Установлено, что в молекулах обычной серы содержится 8 ато-
мов (S8).
При нагревании происходит уменьшение количества атомов в мо-
лекулах. В жидкой сере, начинающей густеть, образуется видоизме-
нение с четырьмя атомами в молекуле (S4), отличающееся большой
вязкостью. Наибольшее количество этого видоизменения образуется
при 200°. В парах серы, нагретых выше 2000°, появляются одиноч-
ные атомы.
2. Химические свойства серы. В химическом отношении сера
сходна с кислородом. Подобно ему, она вступает в соединения
118
с водородом и металлами и проявляет валентность, равную — 2;
в соединениях с кислородом сера проявляет высшую валентность,
равную —[—6.
а) Взаимодействие серы с водородом. При нагрева-
нии сера способна непосредственно соединяться с водородом. Для
наблюдения этого Qepy кипя-
тят в колбочке (рис. 56) или
пробирке и пропускают в cep-
сера
Рис. 55. Получение пласти-
ческой серы.
Сера, нагретая в пробирке почти
до кипения, выливается тонкой
струёй в воду.
ные пары водород. У выходного отверстия вскоре же ощущается
запах тухлых яиц, характерный для сероводорода:
(нагревание)
h24-s = h2s
сероводород
Соединение серы с водородом H2S соответствует соединению
кислорода с водородом Н2О.
б) Взаимодействие серы с металлами. Со многими ме-
таллами сера вступает в реакции при обыкновенной температуре.
В результате этого образуются соединения, называемые сернистыми
металлами (сульфиды). Например, при натирании серебра порошком
серы, помещённым на влажную тряпочку, получается чёрный налёт
сернистого серебра:
2Ag-j-Ag2S
сернистое
серебро
119
При растирании в ступочке влажного порошка серы со ртутью
(берутся по расчёту согласно уравнению реакции) получается чёрный
порошок сернистой ртути:
Hg + S= HgS
сернистая ртуть
Это соединение при нагревании в пробирке возгоняется и обра-'
зует красное видоизменение, называемое киноварью.
С алюминием, железом, цинком, медью и другими металлами сера
тоже соединяется, но в этих случаях нужно нагревание, .пока не
начнётся реакция; дальше она продолжается уже & счёт выделяю-
щегося при этом тепла:
(нагревание до начала реакции)
Fe-j- S = FeS
сернистое железо
(нагревание до начала реакции).
2A14-3S = A12S3
сернистый алюминий
в) Взаимодействие серы с кислородом и другими
металлоидами. Сера легко соединяется с кислородом. Подож-
женная, она горит в чистом кислороде ярким голубым пламенем
(см. рис. 47, Г); на воздухе горение её происходит значительно слабее.
При горении серы образуется двуокись серы, или сернистый
газ (сернистый ангидрид), в котором она проявляет 4 валентности
(+4).
(горение)
S —о2 = so2
, сернистый газ
Сера способна давать с кислородом и другое соединение, про-
являя высшую валентность (равную —6),— трёхокись серы, или
серный ангидрид SO3; Этот окисел при определённых условиях
может получаться путём дальнейшего окисления сернистого ангид-
рида, что подробнее будет рассмотрено дальше.
Сера может соединяться с некоторыми другими металлоидами:
фосфором, хлором и пр.
3. Сера в природе. В значительных количествах сера встречается
в природе в свободном состоянии (самородная сера) вблизи потухших
и действующих вулканов и в других местах земного шара. Богатые
месторождения серы находятся в СССР: в пустыне Кара-Кум, в
Узбекистане, на Кавказе, на Камчатке, в некоторых местах по бере-
гам Волги.
В виде сложных соединений сера находится в природе как
составная часть многих минералов (CaSO4, MgSO4 и др.) и руд
(ZnS, PbS и др.); различные соединения её находятся в почве и
в морской воде.
Сера принадлежит к числу элементов, имеющих особенно важное
значение для жизненных процессов, так как она входит в состав
120
белковых веществ (вместе с углеродом, водородом, кислородом и
азотом).
4. Добывание серы. Добывают серу главным образом из само-
родных отложений её, в которых она механически перемешана
с различными породами. Чтобы отделить от примесей, самородную серу
нагревают в печах и переводят в пар, который затем охлаждается
в обширной камере; при этом сера прямо из паров переходит в твёр-
дое состояние и оседает на стенках камеры в виде очень мелкого
порошка — серного цвета. При поднятии температуры в камере
выше 119° сера плавится и собирается на дне камеры; из камеры
жидкая сера выпускается в формы, в которых застывает в виде ци-
линдрических брусков (черенковая сера).
Добывают серу также из глубоко лежащих пластов её. Этот
способ заключается в пропускании в пласты серы по железным
трубам нагретой под большим давлением воды (до температуры
около 160°).
Сера плавится глубоко под землёй; под действием нагнетаемого
горячего воздуха расплавившаяся сера подымается вверх и вытекает
на поверхность земли.
В Советском Союзе значительное количество серы получают из
самородных отложений её, а также различных соединений (H2S, SO3
и 'др.), образующихся в качестве побочных продуктов при различных-
производствах (коксование угля, выплавка меди и т. п.). Этот спо-
соб получения серы был разработан у нас в Институте прикладной
минералогии и осуществлён на Урале.
5. Применение серы. Свободная сера находит разнообразное
применение. Значительное количество её расходуется для борьбы
с вредителями сельского хозяйства (порошком серы посыпают расте-
ния для уничтожения филлоксеры — вредителя виноградников,— раз-
личных плесневых грибков и т. д.). Применяется сера как лечебное
средство (противочесоточные мази). В резиновом производстве она
вводится в каучук (вулканизация) для придания ему нужной стой-
кости против колебаний температуры и большей прочности. Благо-
даря горючести сера применяется при изготовлении чёрного дымного
пороха (смесь серы, угля и селитры), при изготовлении спичек (вхо-
дит в состав спичечных головок).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В каком виде сера встречается в природе?
2. Как добывается сера?
3. Какие изменения происходят при плавлении серы?
4. Для чего употребляется сера?
5. Какую валентность проявляет сера в соединениях с водородом и ме-
таллами?
6. При каких условиях сера соединяется с водородом? Что получается?
7. При каких условиях сера соединяется с металлами? Что получается?
8. При каких условиях сера соединяется с кислородом? Что полу-
чается?
101
Б. СОЕДИНЕНИЕ СЕРЫ С ВОДОРОДОМ
§ 1. Сероводород
H2S; структурная формула:
Молекулярный вес равен 34.
Кислота-
Пламя горящего
сероводорода
h2s
Пробка
с отверстием
Отверстие
в дне пробирки
Б
___Пробирка
с пробитым
дном
F4.S
Рис. 57. Приборы для получения сероводорода.
А — аппарат Киппа; Б — самодельный прибор из пробирки с пробитым
дном (показано горение сероводорода).
1. Получение сероводорода. Сероводород гГолучают действием
разведённой серной или соляной кислоты на сернистое железо. Для
этого пользуются приборами, как при добывании водорода (рис. 57),
FeS-|-H2SO4
= FeSO4 + H2Sf
сернокислое
железо
FeS4-2HCl = FeCl2 + H2S|
хлористое
железо
2. физические свойства сероводорода. Сероводород предста-
вляет собой газ с запахом тухлых яиц (образуется при гниении бел-
ковых веществ). Плотность его по воздуху равна 1,172; он
лишь немного тяжелее воздуха.
Сероводород довольно хорошо растворим в воде; при 20°
в 1 объёме воды растворяется 2,4 объёма сероводорода. Раствор
называется сероводородной водой.
122
3. Химические свойства сероводорода. Сероводород при нагре-
вании выше 300° заметно разлагается на водород и серу; реакция
обратима:
(нагревание)
h2s х н2 + s
Сероводород — горючий газ. При поджигании он загорается на
воздухе (рис. 57, Б) и горит голубоватым пламенем; смесь его
с воздухом при поджигании взрывает. При свободном доступе воз-
духа происходит полное сгорание сероводорода:
(полное горение)
2Н25Ц-ЗО2 = 2H2O4-2SO2
В образовании сернистого газа при горении сероводорода легко
убедиться, если подержать над пламенем смоченную водой лакмусо-
вую бумажку: благодаря образованию сернистой кислоты синяя окраска
лакмуса быстро изменяется на красную.
Если внести в пламя сероводорода холодный предмет (кусок стекла,
лезвие ножа), на нём появляется жёлтый налёт серы, подобно тому
как пламя свечи даёт налёт угля (копоть). Выделение серы происходит
в результате неполного сгорания сероводорода; в этом случае с кис-
лородом соединяется только водород:
(неполное горение)
2H2S4-O2 = 2H2O-j-2S
Незначительные примеси сероводорода в воздухе оказывают на
живой организм отравляющее действие: вызывают раздражение сли-
зистых оболочек глаз, носа, горла; при длительном вдыхании серо-
водорода перестаёт ощущаться его запах, что указывает на пора-
жение органов обоняния (начинающееся резкое отравление).
Вредное действие сероводорода устраняется на свежем воздухе.
Предупреждается оно также вдыханием небольших количеств хлора,
который взаимодействует с сероводородом. Для этих целей удобно
получать хлор в чашечке взаимодействием небольшого количества
марганцевокислого калия I в объеме — у горошины I и соляной
кислоты. В воздухе должен ощущаться слабый запах хлора.
Вследствие ядовитости сероводорода опыты с ним следует про-
водить или в вытяжном шкафу, или в замкнутых установках, как
будет описано дальше.
4. Сероводородная кислота. Сероводород в водном растворе
проявляет кислотные свойства и представляет собой, подобно соля-
ной кислоте, бескислородную кислоту. Называется она сероводо-
родной кислотой (сероводородная вода).
Получают её пропусканием сероводорода в холодную воду.
Физические и химические свойства сероводород-
ной кислоты. Сероводородная кислота — прозрачная жидкость
с сильным запахом сероводорода.
123
По химическим свойствам сероводородная кислота проявляет
общие свойства кислот, хотя является кислотой слабой.
Как и другие кислоты, она реагирует с основными окислами,
основаниями и солями:
PbO-|-H2S = PbS-J-H2O
2NaOH 4- H2S = Na2S Ц- 2Н2О
сернистый натрий
(в растворе)
Pb(NO3)2 + H2S = PbS 4- 2HNO3
4 -ч.
сернистый свинец
(чёрного цвета)
Сероводородная кислота проявляет ряд особенностей, связанных
с лёгкой окисляемостью сероводорода.
Под действием, -воздуха происходит окисление её с выделением
серы:
2H2S4-O2 = 2H2O4-2S
4
От выделяющейся серы сероводородная вода при хранении мут-
неет. Природные воды, содержащие сероводород, по этой же причине
бывают мутные.
Сероводородная вода в присутствии кислорода действует на такие
химически малоактивные металлы, как медь, серебро и некоторые
другие; изделия из них от сероводородной воды или газообразного
сероводорода покрываются чёрным налётом сернистого соединения:
4Ag4~ 2H2S4- О, = 2Ag2S4-2H2O
сернистое серебро
(чёрного цвета)
5. Соли сероводородной кислоты. Соли сероводородной кислоты
называются сернистыми, или сульфидами.
Многие из них нерастворимы в воде и поэтому выпадают в оса-
док при действии сероводорода или сернистого натрия на растворы
солей:
CuSO4 4- H2S = CuS 4- H2SO4
4
сернистая медь
(чёрного цвета)
FeSO44-Na2S = FeS 4~ Na2SQ4
4
сернистое железо
(чёрного цвета)
Сернистые соединения многих металлов отличаются различной
окраской. В нижеприводимой таблице указана окраска некоторых
сернистых соединений (сульфидов):
124
1
Соли 1 Осаждающий реактив Формула полу- чаемого осадка Цвет осадка
Железа Сернистый натрий FeS Чёрный
Марганца MnS Розовый
Цинка Сероводород и сернистый натрий ZnS Белый
Меди CuS Чёрный
Кадмия. CdS Жёлтый
Свинца PbS Чёрный
Сурьмы Sb2Sg Оранжевый
Чёрный цвет сернистого свинца является причиной происходя-
щего с течением времени потемнения картин, писанных масляными
красками; объясняется это тем, что некоторые масляные краски,
в том числе белая, содержат соединения свинца. Постоянно находя-
щаяся в воздухе небольшая примесь сероводорода постепенно дей-
, ствует на свинцовые соединения в красках и переводит их в сер-
нистый свинец чёрного цвета.
Такое действие сероводорода легко можно наблюдать, если
смочить раствором какой-либо свинцовой соли фильтровальную бумагу,
.дать ей высохнуть, а затем смочить сероводородной водой. Бумага
от действия сероводорода окрашивается в чёрный цвет — в результате
образования сернистого свинца.
Получившийся на бумаге сернистый свинец может быть снова
переведён в белый сернокислый свинец посредством окисления,
например, перекисью водорода. Почерневшую свинцовую бумагу сма-
чивают перекисью водорода, и она тотчас же белеет в результате
реакции:
PbS 4- 4Н2О2
сернистый
свинец
(чёрного цвета)
= PbSO4 4- 4Н2О
сернокислый
свинец
(белого цвета)
Поэтому перекисью водорода смачивают потемневшие картины
и таким путём добиваются оживления красок.
Сероводородную воду и сероводород специально получают в лабора-
ториях; они применяются при анализе минеральных веществ. (Для
этих целей используется разная растворимость сернистых металлов
и разная окраска их.)
6. Сероводород в природе. Сероводород встречается в природе
в свободном виде.
125
Как уже говорилось, в состав белков входит сера. При гниении
органических остатков белковые вещества разлагаются и сера выде-
ляется из них в виде сероводорода. Именно ему обязаны своил*
запахом тухлые яйца. Сероводород содержится в виде примеси
в воздухе, особенно в местах гниения органических остатков; обра-
зуется он также в природных условиях Ь связи с вулканической
деятельностью. Встречая природные воды, сероводород растворяется
в них; таким путём получаются сероводородные источники, приме-
ром которых может служить источник в Мацесте, вблизи курорта
Сочи.
Сероводородные воды обладают целебными свойствами и широко
используются в лечебных целях (при ревматизме, ТЮдагре и пр.).
В значительных количествах сероводород выделяется на дне
морей и океанов. На дне Чёрного
Рис. 58. Круговорот серы в природе.
моря происходит постоянное
выделение сероводорода, кото-
рый, не доходя до поверхно-
сти воды, разлагается живу-
щими здесь особыми серными
бактериями. Эти бактерии по-
лучают энергию, необходимую
для их жизнедеятельности,
окислением сероводорода. Оки-
сление бактериями сероводо-
рода происходит по уравнению:
(медленное окисление)
2H2S 4- О2 = 2Н2О 4- 2S
Серные бактерии держатся в тех слоях жидкости, куда сверху
проникает кислород, а снизу — сероводород,'’ т. е. на определённой
глубине от поверхности. В Чёрном море они держатся на глубине
около 180 м. Бактерии играют важную роль в поддержании круго-
ворота серы в природе. Весь круговорот её происходит в следующем
виде (рис. 58): высшие растения получают серу из почвы в виде
сернокислых солей и переводят её в состав органических соединений
(белки). Животные, питаясь растениями, получают серу в белковых
соединениях, которые перерабатываются и используются для построе-
ния их тела. В процессе гниения органических веществ (трупов,
отбросов) сера переводится в сероводород, который затем оки-
сляется в серную кислоту. Задерживаясь в почве в виде сернокис-
лых солей, сера попадает снова в растения, повторяя весь выше-
описанный путь.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. С какими металлами сера вступает в соединения при обычных усло-
виях?
2. При каких условиях сера непосредственно соединяется с водородом?
3. Какую валентность проявляет сера в соединениях с металлами и
водородом?
19R
4. Где встречается сероводород в природе?
5. Как происходит круговорот серы в природе?
6. Как действует сероводород на живой организм?
7. Каким путём можно устранить вредное действие избытка сероводо-
рода?
8. Что образуется прй горении сероводорода — при достаточном доступе
воздуха? при недостаточном доступе воздуха?
9. Как в лабораторных условиях получают сероводород?
10. Что такое сероводородная вода?
11. Почему в сероводородной воде при стоянии появляется муть и что
эта муть'собой представляет?
12. Что образуется при нейтрализации сероводорода щёлочью?
13. Что происходит при действии сероводорода на соли свинца, меди,
цинка?
14. Чем объясняется потемнение старинных масляных картин?
15. Как можно обновить потемневшие масляные картины?
В. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ СЕРЫ
§ 1. Сернистый ангидрид (двуокись серы, сернистый газ)
//Q
SO2; структурная формула:
Молекулярный вес равен 64.
'Сера в этом окисле проявляет валентность, равную -|-4.'
1. Получение сернистого ангидрида. Сернистый ангидрид, как
уже говорилось, образуется при горении серы:
S О2 = SO2
В лаборатории его часто получают действием серной кислоты
на сернистокислые соли:
Na2SO3 + H^SO4 = Na2SO4 + H2SO3
сернисто- сернокис- сернистая
кислый лый натрий кислота
натрий
НаО SO2 f
В технике сернистый ангидрид получают прокаливанием на воз-
духе („обжиганием") сернистых руд, например серного колчедана:
4FeS2 + 1102 = 2Fe2O3 -f- 8SO2
серный
колчедан
(пирит)
2. Физические свойства сернистого ангидрида. Сернистый
ангидрид — бесцветный газ с резким удушливым запахом.
Плотность его по воздуху равна ^ = 2,26; он более чем в 2 раза
г
тяжелее воздуха.
127
При охлаждении в смеси поваренной соли со снегом или льдом *)
сернистый ангидрид превращается в жидкость (рис. 59), кипящую
при—10° и замерзающую при — 72°,7.
Давая испаряться жидкому сернистому газу при определённых
условиях, можно получать температуру до — 50°.
Сернистый ангидрид довольно хорошо растворим в воде. При 20°
один объём воды растворяет около 20 объёмов сернистого газа.
3. Химические свойства серни-
стого ангидрида. Сернистый ангидрид
проявляет все химические свойства ан-
гидридов. Он вступает во взаимодействие
с водой, образуя сернистую кислоту:
SO24-H2O
= H2SO3
сернистая кислота
реагирует с основными окислами и осно-
ваниями, образуя сернистокислые соли:
SO2 + СаО
= CaSO3
сернистокислый
кальций
(сульфит кальция)
SO2-|-2NaOH = Na2SO34-H2O
сернистокислый
натрий
(сульфит натрия)
с солью
Рис. 59. Сжижение сернистого
газа.
А —колба, в которой получаемся сер-
нистый газ; Б — склянка с концентри-
рованной серной кислотой для промы-
вания газа; В — сосуд с охладительной
смесью; Г — пробирка (закрытая ко-
мочком ваты), в которой происходит
сжижение сернистого газа.
Такая реакция легко
например двуокиси азота:
4. Особые свойства сернистого
ангидрида. В сернистом ангидриде сера
проявляет только 4 валентности. В соот-
ветствующих условиях сернистый ангид-
рид способен присоединять кислород и-
переходить в серный ангидрид SO3,
в котором сера проявляет высшую ва-
лентность, равную -|-6.
происходит при действии окислителей.
so2 +
сернистый
ангидрид
NO2 = SO, +
двуокись серный
азота ангидрид
NO
окись
азота
или при действии
(платины и др.):
кислорода воздуха в присутствии ‘катализаторов
(катализатор)
2SO2 4- О2 = 2SO3
сернистый серный
ангидрид ангидрид
Сернистый газ оказывает, подобно хлору, белящее действие:
обесцвечивает некоторые органические краски (рис. 60). Однако
1) Соли берётся 1 весовая часть, льда или снега 3 весовые части.
128
химический процесс в обоих случаях разный. Белящее действие
хлора вызывается, по существу, атомарным
выделяется из воды при взаимодействии её
с хлором. Белящее действие сернистого ангид-
рида происходит в результате соединения его
с красящим веществом и образования нового,
более сложного бесцветного соединения.
Иногда образующееся бесцветное веще-
ство бывает нестойким и легко разлагается;
в этом случае окраска восстанавливается. На-
пример, обесцвеченные сернистым газом цветы
снова окрашиваются, если их смочить серной
кислотой.
5. Применение сернистого ангидрида.
Сернистый ангидрид убивает микробов, по-
этому горящая сера употребляется для окури-
вания помещений в целях дезинфекции. Бла-
годаря белящему действию на органические
краски он применяется в бумажном произ-
водстве для беления бумажной массы и в тек-
стильной промышленности для беления тканей.
кислородом, который
Рис. 60. Окуривание
цветов сернистым
газом.
Цветы теряют окраску.
. В больших количествах сернистый газ используется в производ-
стве серной кислоты, о чём подробнее будет сказано дальше.
§ 2. Сернистая кислота
H2SO3; структурная формула:
Н—Ох
>s=o
Н—О/
Молекулярный вес равен 82.
В сернистой кислоте сера, как и в сернистом ангидриде, прояв-
ляет 4 валентности.
1. Получение сернистой кислоты; её физические свойства.
Сернистая кислота получается растворением в воде сернистого газа:
SO24-H2O^ H2SO3
сернистая
кислота
Сернистая кислота существует только в разбавленных растворах,
так как молекулы её непрочны и легко разлагаются обратно на воду
и сернистый газ:
H2SO3^H2O-|-SO2t
Раствор сернистого газа в воде содержит мало молекул кислоты
и много молекул сернистого газа, который, выделяясь, обусловливает
запах раствора.
2. Химические свойства сернистой кислоты. Сернистая кислота
проявляет все общие свойства кислот и образует соли обычными
® В. В. Левченко 129
способами. Соли её называются сернистокислыми, или сульфв?
тами.
С ней непосредственно реагируют только более активные металлы,
например магний:
Mg4-H2so3= Mgso8 + H2f
сернистокислый
магний
(сульфит магния)
Реагирует она, как и все кислоты, с основными окислами
и основаниями:
CaO-|“H2SO3= CaSO3 Н2О
сернистокислыи
кальций
(сульфит кальция)
2NaOH4-H2SO8^s Na2SO3 + 2Н2О
сернистокислый
натрий
(сульфит натрия)
Особенностью сернистой кислоты является её способность окис-
ляться. Окисляется она, хотя и медленно, уже при хранении в откры- '
том сосуде:
2H2SO3-|-О2 — 2H2SO4
сернистая серная
кислота кислота
ВОПРОСЫ для ПОВТОРЕНИЯ
1. Какую валентность проявляет сера в кислородных соединениях?
2. Что образуется при горении серы в кислороде и на воздухе?
3. Для чего применяется сернистый газ?
4. Как получается сернистый газ в лабораторных условиях?
5. Как действует сернистый газ на краски?
6. Чем отличается действие на краски SO2 от действия хлора?
7. Что представляет собой водный раствор сернистого газа?
8. Почему сернистая кислота существует только в виде растворов?
9. Как изображается структурная формула сернистой кислоты? Чему
равна валентность серы в сернистой кислоте?
10. Что образуется при окислении сернистой кислоты?
§ 3. Серный ангидрид (трёхокись серы)
//Q
SO3; структурная формула: O=S<f
Молекулярный вес равен 80.
Сера в этом окисле проявляет высшую валентность, равную 4~6.
Серный ангидрид получают окислением сернистого ангидрида
кислородом воздуха в присутствии катализаторов при нагревании
около 450°:
(катализатор
и нагревание)
2SO2 + О2= 2SO3
сернистый серный
ангидрид ангидрид
130
Серный ангрдрид— твёрдое вещество с точкой плавления около 17°;
соединяясь с водой, он образует серную кислоту!
8О3 + Н2О = H2SO4
* серная кислота
Как кислотный окисел серный ангидрид реагирует в основными
окислами и основаниями, образуя сернокислые соли: '
CaO + SO3 = CaSO4
сернокислый
кальцин
2NaOH + SOg = Na2SO4 4-Н2О
сернокислый
натрий
§ 4. Серная кислота
И—(X //0
H2SO.; структурная формула:
Н—О/
Молекулярный вес равен 98.
В серной кислоте сера, как и в серном ангидриде, проявляет
6 валентностей (заряд равен -]-6).
Получается серная кислота путём соединения серного ангидрида
е водой (см. вышеприведённое уравнение реакции).
1. Физические свойства серной кислоты. В чистом виде серная
кислота — бесцветная маслянистая жидкость, растворяющаяся в воде
в любых отношениях.
При нагревании безводная серная кислота (так называемый „моно-
гидрат11) выделяет серный ангидрид — кислота дымит вследствие раз-
ложения:
(нагревание)
H2SO4 = H2O + SOg
При температуре 338° кислота кипит без дальнейшего разложения.
Обычно употребляемая концентрированная серная кислота пред-
ставляет собой почти 98-процентный раствор её с удельным
весом 1,84.
Обращаться с концентрированной серной кислотой надо очень
осторожно; брызги её не должны попадать на платье, тело (особенно
в глаза), так как она разрушает ткани и причиняет опасные ожоги.
2. Химические свойства серной кйслоты. Серная кислота
в водном растворе проявляет все свойства, характерные для кислот
(для опытов применяется 20-процентный раствор её). Она реагирует
9*
141
с металлами, окисями металлов, гидратами окисей металлов и солями,
образуя сернокислые соли:
Zn + H2SO4= ZnSO4-|-H2t
сернокислый
цинк
CuO + H2SO4= CuSO4 +Н2О
сернокислая
медь
Си (ОН)2 + H2SO4 = CuSO4 + 2Н2О
Na2CO3 + H2SO4 = Na2SO4 4-H2O + CO2f
сернокислый
натрий
Характерной реакцией для водного раствора серной кисйоты и её
солей является взаимодействие- её с растворимыми солями 'бария;
в результате реакции образуется нерастворимый в воде и кислотах
белый осадок сернокислого бария:
H2SO4 + ВаС12 = BaSO4 4-2НС1
I
сернокислый
барий
3. Отношение серной кислоты к воде. Концентрированная сер-
ная кислота отличается характерной особенностью: растворение её
в воде сопровождается выделением большого количества тепла.
Объясняется это образованием достаточно стойких соединений моле-
кул кислоты с молекулами воды (гидратов).
Растворять серную кислоту надо с большой осторожностью,
чтобы не происходило слишком быстрого разогревания и разбрызги-
вания жидкости. Следует держаться правила: приливать кислоту
небольшими порциями в воду, а не наоборот (!); в этом случае
если и произойдёт разбрызгивание, то капель разбавленного раствора.
Жидкость следует взбалтывать после каждого прибавления кислоты.
Если в воду опустить термометр, можно наблюдать повышение темпе-
ратуры по мере приливания кислоты.
Серная кислота жадно притягивает влагу из воздуха, поэтому
хранить её надо в плотно закупоренной склянке. Свойством серной
кислоты притягивать влагу пользуются в лабораториях: её наливают
в эксикаторы (см. рис. 24) для высушивания помещаемых над ней
веществ.
Высушивающим действием серной кислоты пользуются также
в обыдённой жизни. Её помещают зимой в стаканах между рамами;
кислота поглощает пары воды и благодаря этому в морозные дни
стёкла не потеют и не покрываются льдом.
4. Действие серной кислоты на некоторые органические веще-
ства. Концентрированная серная кислота реагирует с такими веще-
ствами, как сахар, крахмал, дерево. От молекул этих веществ
серная кислота отщепляет водород и кислород, оставляя незатрону-
тым только углерод; вследствие этого происходит обугливание.
132
Если опустить в концентрированную серную кислоту лучину,
то смоченная часть дерева обугливается (чернеет); то же происходит
с бумагой и бумажными тканями (с платьем) от капли кислоты.
Эти явления можно наблюдать, пользуясь также раствором сер-
ной кислоты; только этом случае смоченные раствором кислоты
дерево или бумагу следует поместить высоко над пламенем, чтобы
заставить испариться воду. Как только вода испарится, начинается
обугливание дерева или бумаги от действия кислоты (держать,
конечно, надо высоко над пламенем, чтобы обугливание не вызы-
валось действием высокой температуры).
В случае попадания серной кислоты на тело или платье её надо
возможно быстрее смыть большим количеством воды (при малом
количестве воды может произойти сильное разогревание, усиливаю-
щее действие ожога) или раствором соды.
5. Окислительное действие серной кислоты. Серная кислота,
в отличие от соляной, является кислородсодержащей кислотой; при
определённых условиях от неё может отделяться кислород; благо-
даря этому концентрированная серная кислота является достаточно
энергичным окислителем.
Это свойство концентрированной серной кислоты проявляется при
взаимодействии с металлами, которые окисляются концентриро-
ванной серной кислотой; например, медь не реагирует с соляной
кислотой и разбавленной серной кислотой, но реагирует при на-
гревании с концентрированной серной кислотой, действующей
окисляющим образом. При этой реакции от молекул серной кис-
лоты отделяется кислород и переходит к меди, а сама серная
кислота восстанавливается до сернистой кислоты, которая распа-
дается на воду и сернистый газ:
4 6 (нагревание) -44
Cu + H2SO4 = CuO + H2SO3
концентри-
рованная тт za nA .
кислота 112'^' 'э'-'2 I
Сера при этом процессе из шестивалентной переходит в четырёх-
валентную.
Образовавшаяся окись меди реагирует затем с избыточным коли-
чеством серной кислоты, как обычно:
CuO + H2SO4 = CuSO4 + Н2О
сернокис-
лая медь
Оба процесса могут быть представлены в виде объединённого
уравнения:
Си + 2H2SO4 = CuSO4 + £Н2О + SO2f 6
6. Применение серной кислоты. Основная химическая про-
мышленность. Серная кислота находит разнообразное применение.
нлй°ЛЬШИХ количествах она используется в так называемой „основ-
химической промышленности", к которой относятся производства
133
кислот, щелочей, солей и хлора. Особенно много расходуете^
серной кислоты в производстве минеральных удобрений и в про-
изводстве взрывчатых веществ. Употребляется она также при
очистке природных органических веществ (керосина и др.), при пере-
работке их для получения искусственных соединений, при изготовле-
нии красок и пр. Вообще почти нет отраслей химической промы-
шленности, где бы не применялась серная кислота.
Производство серной кислоты у нас развивается очень быстрыми
темпами. В 1913 г. производство её составляло всего 121 тыс. т\
в 1936 г. оно достигло уже 1206 тыс. т\ а перед Великой Отече-
ственной войной увеличилось в 17 раз по сравнению с 1913 г.
Теперь производство серной кислоты и других химических про-
дуктов достигло у нас очень больших размеров на вновь созданных
мощных химических комбинатах. Наши сернокислотные заводы, по-
строенные по оригинальным конструкциям, разработанным . совет?,
скими учёными, в настоящее время полностью обеспечивают всё
возрастающую потребность социалистического хозяйства в серной
кислоте.
7. Производство серной кислоты. Процесс получения серной
кислоты слагается из трёх последовательных стадий:
1 — получение сернистого ангидрида;
2 — превращение его в серный ангидрид;
3 — соединение серного ангидрида с водой, ведущее к обра-
зованию серной кислоты.
а) Получение сернистого ангидрида. При производ-
стве серной кислоты сернистый ангидрид получают из содержащей
серу железной руды, называемой железным, или серным колчеданом,
или пиритом FeS2.
3
Структурная формула его: Fe<^ |; железо в этом соединении двух-
валентно.
Пирит в измельчённом виде обжигают в особых колчеданных
печах и получают сернистый газ, а в остатке окись железа (кол-
чеданные огарки):
(обжигание)
. 4FeS2+ 1102 = 2Fe2O3-|-8SO2
серный окись
колчедан железа
б) Превращение сернистого ангидрида в серный
ангидрид. Присоединение к сернистому ангидриду кислорода и
образование серного ангидрида в обычных условиях происходит
очень медленно. Для быстрого образования серного ангидрида не-
обходимо действие окислителя; реакция ускоряется также катали-
заторами.
^Контактный способ получения серной кислоты.
При этом способе получения серной кислоты окисление сернистого
газа проводится с участием катализатора.
134
Как уже говорилось, катализаторы, ускоряя реакцию, сами в ко-
нечном итоге остаются количественно без изменения.
Катализаторы, о которых говорилось при получении кислорода
из бертолетовой соли и при разложении перекиси водорода, уско-
ряют реакцию разложения. Сначала были известны вещества, уско-
ряющие только реакции разложения, поэтому им и было дано на-
звание катализаторы (от греческого слова, означающего „разлагать").
В настоящее время известно большое количество катализаторов,
ускоряющих реакции соединения.
Вместо названия „катализатор" часто употребляется теперь назва-
ние контактное вещество (от слова „контакт" — „соприкосновение");
это название указывает, что действие катализаторов связано с про-
so,+o.
Колче-
дан
< soa+o;
Промывная
башня
Огарки Воздух
Колчеданная ™оТ
печь намерз
Образов. SO2
Избыток воздуха
Рис. 61. Схема завода для производства серной кислоты
по контактному способу.
Разбавленная
кислота
SOj+O?
Концентр,
““кислота
96-98*
кислота
Контактный
аппарат
25О2+Ог=»
s=2SO,
Осушительная
башня
Удаление
влаги
Абсорбер I
SO3+H2O=/
=H2SO4 f
Кислота
на склад
цессами, происходящими на их поверхности, т. е. в месте соприкос-
новения их с молекулами реагирующих веществ (у многих катали-
заторов механизм действия иной).
От слов „контактное вещество" произошло название „контакт-
ный способ получения серной кислоты".
Окисление сернистого газа очень хорошо происходит в присут-
ствии мелкораздроблённой платины, а также окислов некоторых метал-
лов, которые обычно употребляются в качестве контактных веществ:
(катализатор)
2SO2 4-О2 = 2SO3
Контактный способ получения серной кислоты в последнее время
получил широкое распространение. Схема производственной уста-
новки показана на рисунке 61.
При этом методе очень большое значение имеет очистка серни-
стого газа от примесей соединений мышьяка, фосфора и др., так
как даже в малом количестве они прекращают действие катализа-
тора— „отравляют" его.
Пирит содержит различные примеси, способные „отравить" ката-
лизатор; поэтому получаемый из него сернистый газ пропускают
через сложную систему очистительных сооружений.
135
Выходящие из колчеданной печи газы в смеси с возду-
хом сначала поступают в пылевую камеру; в ней они очищаются от
пыли. Затем газы после охлаждения поступают в промывную башню
(на рисунке показана одна). Промывные башни заполнены сделан-
ными из огнеупорной глины „кольцами"—цилиндрами, поставлен-
ными друг на друга. По ним сверху стекает раствор серной
кислоты навстречу газам, поступающим снизу, и растворяет содер-
жащиеся в них примеси.
После промывных башен сернистый газ проходит в фильтры,
в которых освобождается от мелких брызг кислоты, а затем пере-
ходит в осушительную башню. Эта башня устроена так же, как
воздух
Рис. 62. Получение серной кислоты в лаборатории по принципу
контактного способа.
а — образовавшаяся кислота.
промывная, но в неё сверху поступает концентрированная
серная кислота, поглощающая влагу.
Очищенный и высушенный газ поступает затем в контактный
аппарат, содержащий катализатор. В контактном аппарате происходит
образование серного ангидрида:
2SO2 Ц-О2 = 2SO3
Серный ангидрид поступает в поглотительную башню — абсорбер,
в который сверху стекает 96—98-процентная серная кислота.
В абсорбере серный ангидрид присоединяет воду и переходит
в серную кислоту:
SO3 + H2O = H2SO4
Из абсорбера вытекает безводная серная кислота, в которой рас-
творён серный ангидрид (дымящая „кислота", или „олеум"). Возмож-
ность получения концентрированной серной кислоты является
очень ценным преимуществом контактного способа перед другими
способами.
136
Получение серной кислоты по принципу контактного способа можно
провести в приборе, собранном, как показано на рисунке 621).
В колбу наливают насыщенный раствор сернистого газа в воде,
а в трубку помещают катализатор (свежеприготовленную окись
хрома Сг2О3, полученную нагреванием двухромовокислого .аммония).
В колбу нагнетают при помощи резиновой груши воздух. Насы-
щенный сернистым газом, он проходит над катализатором, который
нагревают. Получающийся серный ангидрид образует белый туман,
быстро заполняющий пространство внутри трубок.
При достаточно длительном опыте в хлоркальциевой трубке со-
бирается несколько капель концентрированной серной кислоты,
а в U-образной трубке получается раствор её.
Рис. 63. Башенный сернокислотный завод (модель).
Получение серной кислоты при помощи окис-
лов азота (нитрозный способ). Серную кислоту получают
при действии двуокиси азота на сернистую кислоту, при этом дву-
окись азота превращается в окись азота, а сернистая окисляется до
серной. Окись азота сейчас же окисляется кислородом воздуха
до двуокиси, которая может быть снова использована в производ-
стве серной кислоты.
Производится нитрозный процесс в башнях специальной конструк-
ции (рис. 63).
Как показано на схеме (рис. 64), сернистый газ после пылеуло-
вительной установки попадает в продукционные башни — на рисунке
башни Гловера. Эти башни заполнены неплотно уложенным кисло-
тоупорным кирпичом. Сверху по кирпичам стекает серная кислота,
насыщенная окислами азота (так называемая нитроза); содержащиеся
в ней окислы азота реагируют с сернистым газом.
Постановка опыта в таком виде предложена химиком П. Н. Федосеевым.
137
В башнях происходит процесс окисления сернистого ангидрида
в серный ангидрид:
4-4 4-4 4 6 4-2
so24-no2=so3+no
серии- дву- сер- окись
стый окись ный азота
газ азота ангид-
рид
При этой реакции сера из четырёхвалентной окисляется до шести-
валентной, а азот восстанавливается из четырёхвалентного до двух-
валентного, как показано в приведённом уравнении реакции. Образо-
вавшийся серный ангидрид взаимодействует здесь с водой и даёт
серную кислоту:
SO3 + Н2О = H2SO4
Полученная серная кислота выпускается из башен по трубам,
а окись азота переходит в поглотительные башни — на рисунке
башни Гей-Люссака. В них окись азота окисляется кислородом воз-
духа и переходит в двуокись азота:
- 2NO4-O2 = 2NO2
Таким образом, окись азота является переносчиком кислорода.
Она теоретически не расходуется, а только способствует быстрому
течению реакции (как катализатор).
H2so«
На склад
Рис. 64. Схема производства серной кислоты башенным способом.
В поглотительных башнях окислы азота растворяются в стекающей
сверху серной кислоте (образование „нитрозы") и вновь переводятся
в продукционные башни. Практически часть окислов азота выхо-
дит из круговорота и уносится с отходящими газами через вывод-
ную трубу; поэтому в продукционные башни время от времени до-
полнительно вводят азотную кислоту.
Преимуществом башенного способа перед камерным является
значительно бблыпая производительность его.
138
§ 5. Соли серной кислоты
Так как серная кислота содержит в молекуле два атома водо-
рода, то она образует два ряда солей:
средние (сульфаты):
Na2SO4 — сернокислый натрий
K2SO4 — сернокислый калий
кислые (бисульфаты):
NaHSO4 — кислый сернокислый натрий
KHSO4 —кислый сернокислый калий
Образование тех пли других солей зависит от условий, при
которых происходит реакция.
Большинство сернокислых солей довольно хорошо растворимы
в воде. Практически нерастворимыми являются сернокислый ба-
рий BaSO4 и сернокислый свинец PbSO4. Мало растворим в воде
сернокислый кальций CaSO4.
Особый интерес представляет сернокислый барий тем, что он не-
растворим в кислотах; другие нерастворимые в воде соли бария:
углекислый барий ВаСО3, сернистокислый барий BaSO3, фосфорно-
кислый барий Ва3(РО4)2 — в кислотах растворяются легко. Этим
пользуются для распознавания серной кислоты и её солей.
В исследуемый раствор приливают раствор хлористого бария.
В случае появления осадка можно предполагать, что это серно-
кислый барий. Для проверки приливают соляную пли азотную кис-
лоту; если осадок не растворился, это является доказательством того,
что он представляет собой сернокислый барий, и, следовательно,
в исследуемом растворе находится серная кислота или её соль.
Многие соли серной кислоты находят практическое применение.
Сернокислые соли натрия Na2SO4, магния MgSO4, алюминия A12(SO4)3
и железа FeSO4 будут рассмотрены в главе о металлах. Кроме
указанных солей, применяются и другие. Главнейшие из них сле-
дующие:
Сернокислый цинк, сульфат цинка ZnSO4; с кристаллизационной
водой ZnSO4-7H2O — цинковый купорос. Купоросами называют
некоторые содержащие кристаллизационную воду соли серной кислоты,
от старинного названия серной кислоты—„купоросное масло". Это
название было дано серной кислоте потому, что древний способ её
получения — прокаливание сернистых руд меди, называющейся по-
латыни „купрум".
Сернокислый цинк — белое кристаллическое вещество; приме-
няется в медицине как рвотное средство и в виде глазных капель,
в технике — для пропитки шпал в целях предохранения их от гниения,
для изготовления белой краски (цинковые белила) и для других целей.
» Сернокислая медь, сульфат меди CuSO4; с кристаллизационной
одой CuSO4-5H2O — медный купорос.
139
Медный купорос — синее кристаллическое вещество; приме-
няется в сельском хозяйстве для протравливания семян, для борьбы
с вредителями и болезнями растений, для изготовления медных
красок (синих, зелёных), для протравы при окраске тканей и для
других целей.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Как изображается структурная формула серной кислоты? Чему равна
в ней валентность серы?
2. Чем отличается серная кислота от сернистой?
3. Как следует приготовлять раствор серной кислоты? Какая необходима
предосторожность и почему?
4. Что происходит при действии серной кислоты на дерево, бумагу,
ткань?
5. Какие свойства серной кислоты являются общими для всех кислот?
Какие характерны только для неё?
6. Какие бывают соли серной кислоты и как они называются?
7. Напишите реакции взаимодействия серной кислоты с металлом
(цинком, железом, алюминием), окисью и гидратом окиси металла.
8. Почему медь нс реагирует с разбавленной серной кислотой и "как
она реагирует с концентрированной серной кислотой?
9. Какую роль в этой реакции играет серная кислота? Как изменяется
валентность серы и меди?
' 10. Какие существуют методы получения серной кислоты?
И. В чём сущность контактного метода (уравнение реакции)?
12. В чём сущность камерного и башенного метода? Какую роль играют
окислы азота (ур. р.)1)?
ГЛАВА III
ГРУППА АЗОТА
Подобно галогенам и элементам группы кислорода, азот N,
фосфор Р, мышьяк As, сурьма Sb, висмут Bi представляют собой
группу сходных по химическим свойствам элементов. Помещаются
они в V группе таблицы Менделеева. Из этих элементов мы будем
изучать только азот и фосфор. Называется эта группа элементов
по названию самого лёгкого из них „группой азота*1.
Атомы элементов группы азота во внешнем электронном слое
имеют 5 электронов (валентные электроны). Они могут терять часть
или все 5 электронов и заряжаться положительно. (Высший заряд
равен 5.) Атомы могут присоединять 3 электрона и заряжаться от-
рицательно. (В этом случае заряд равен —3.)
В высших кислородных соединениях эти элементы проявляют
валентность (положительную), равную номеру группы, т. е. 5. Общая
45-2
формула высших окислов их R2O5.
В водородных соединениях эти элементы проявляют валентность
(отрицательную), равную 8 — 5 = 3. Общая формула водородных
-3+1
соединений RH3.
1) Уравнение реакции.
140
I. АЗОТ И ЕГО СОЕДИНЕНИЯ
А. АЗОТ
Химический знак: N (читается: эн).
Атомный вес равен 14.
Атомы азота имеют во внешнем электронном слое пять электронов.
Атомы азота могут принимать три электрона и заряжаться отрица-
тельно (— 3). Могут они терять часть или все электроны и заряжаться
положительно (высший заряд —|—5). В свободном состоянии азот обра-
зует молекулы из двух атомов: N2.
Азот был известен раньше других химиков Ломоносову (1756).
Благодаря характерному свойству — не поддерживать горение и дыха-
ние,— он получил название, означающее в переводе с греческого: „не
поддерживающий жизнь".
1. Физические свойства азота. Азот является составной частью
воздуха; в чщтом виде он представляет' собой бесцветный газ, не
имеющий ни запаха, ни вкуса.
28
Плотность азота по воздуху равна £9 = 0,96; следовательно, азот
немного легче воздуха.
. Растворимость его в воде очень мала. В 100 объёмах воды при
20° растворяется азота 1,54 объёма, тогда как кислорода раство-
ряется 3,1 объёма. Благодаря этому растворённый в воде воздух бо-
гаче кислородом, чем воздух атмосферный; этим облегчается дыхание
водных растений и животных.
2. Химические свойства азота. Азот при обычных условиях
не вступает в соединение с другими элементами. Такая устойчивость
его объясняется большой прочностью связи атомов азота в моле-
куле. Благодаря малой химической активности он сохраняется в воз-
духе без изменения.
Азот не поддерживает ни горения, ни дыхания. Свеча, внесённая
в атмосферу азота, тотчас же гаснет, а животное немедленно поги-
бает. Гибель животного происходит не вследствие ядовитости азота,
а из-за отсутствия кислорода.
Только при высокой температуре азот способен соединяться с во-
дородом, металлами, кислородом и другими металлоидами.
В соединениях с водородом и металлами азот проявляет валент-
ность, равную —3; в соединениях с кислородом и другими метал-
лоидами он проявляет переменную валентность; высшая валентность
равна -J-5.
а) Соединение азота с водородом и металлами,
оединение азота с водородом может происходить только при строго
определённых условиях (присутствие катализатора, определённые тем-
пература и давление):
(высокая температура,
давление, катализатор)
N24-3H2^±2NH3
аммиак
141
Реакции соединения с металлами для азота не характерны. Соеди-
няется он только с некоторыми металлами при высокой температуре,
например;
(высокая температура)
N2 + 3Mg = Mg8N,
азотистый магний
Это соединение в небольшом количестве всегда образуется при
горении магния наряду с окисью.
б) Соединение азота с кис лоро дом. Азот с кислородом
соединяется с трудом; этим объясняется возможность нахождения его
в воздухе в смеси с кислородом. С кислородом он может соединяться
при очень высокой температуре, которая возникает при электрических
разрядах;
* (электрическая искра)
N2 + О2 2NO
окись азота
Реакция эта обратимая, и поэтому при ней получается лишь не-
большое количество окиси азота.
Образование таким путём окиси азота происходит в природе во
время грозы.
3. Азот в природе. Азот в свободном состоянии находится в воз-
духе в смеси с кислородом и некоторыми другими элементами (так
называемыми „инертными газами"). В воздухе содержится азота 78,16°/0
по объёму и 75,5°/0 по весу.
В химически связанном виде азот содержится в природных солях,
иногда образующих мощные отложения (азотнокислый натрий); азотно-
кислые соли находятся также в небольших количествах в почве (чем
больше находится в почве азотнокислых солей, тем она плодо-
роднее).
Азот входит в состав белковых веществ, образующих тела рас-
тений и животных. Клеточная протоплазма в основном состоит из
белков — азотсодержащих веществ.
4. Получение и применение азота. В технике азот получают из
воздуха. Сначала воздух переводят в жидкое состояние, а затем дают
ему испаряться. При испарении жидкого воздуха прежде всех других
его составных частей улетучивается азот; его собирают и хранят в
стальных „бомбах", как и хлор (см. рис. 27). .
В противоположность кислороду, применение свободного азота
ограничено. Используется он в электротехнической промышленности:
им наполняют так называемые „полуваттные лампы". Это применение
азота основано на том, что он не вступает в соединение с материа-
лом нити.
Главным образом азот употребляется для получения аммиака и
некоторых других соединений.
142
В. СОЕДИНЕНИЕ АЗОТА С ВОДОРОДОМ
§ 1. Аммиак
/Н
NH3; структурная формула: N(-H
' \н
Молекулярный вес равен 17»
1. Получение аммиака. В технике для получения аммиака исполь»
зуется реакция соединения азота с водородом. Так как искусственное
получение сложйых веществ из более простых называется синтезом
(что означает в переводе с греческого „ созидание “), то получаемый
непосредственно из элементов аммиак называется синтетическим.
При получении синтетического аммиака для ускорения реакции
применяют катализаторы (металлическое железо с небольшой при-
Непрореаги*
ровавшие
На и Na
Рис. 65. Схема производства синтетического аммиака.
месью некоторых окислов и др.). Процесс ведут при высокой тем-
пературе (выше 40р°) и большом давлении (100—1000 атмосфер).
Схема заводской установки показана на рисунке 65. Смесь из 1 объ-
ёма азота и 3 объёмов водорода сжимается до нескольких сот атмо-
сфер; затем для очистки от загрязнений переводится в маслоотдели-
тель и фильтр, наполненный прокалённым углем. Только после такой
тщательной очистки смесь газов поступает в контактный аппарат
с катализатором (нагреваемый только в начале пуска; дальше процесс
идёт за счёт выделяемого при реакции тепла). Здесь происходит
образование аммиака:
N2 + 3H2^2NH3
Из контактного аппарата аммиак с остатками непрореагировавших
а^ота и водорода поступает в холодильник; здесь он сжижается.
Жидкий аммиак поступает в резервуар, из которого оставшиеся
143
водород и азот засасываются обратно в маслоотделитель и фильтр и снова
попадают в контактный аппарат. Жидкий аммиак через периодически
открывающийся кран переводится из резервуара, в котором поддер-
живается большое давление, в сборник с меньшим давлением. Сборник
снабжён водомерным стеклом, показывающим уровень собравшегося
жидкого аммиака. Через расположенный внизу сборника кран жидкий
аммиак выпускается в баллоны для хранения.
В лабораторных /словиях аммиак обычно получают (рис. 66) из
хлористого аммония (нашатыря). Эту соль смешивают с гашёной
Рис. 66. Получение аммиака в лаборатории.
А — опыт в колбе; Б — опыт в пробирке.
известью; уже при обычной температуре происходит выделение амми-
ака; при нагревании реакция резко ускоряется:
(нагревание)
2NH4C1 Са (ОН)2 = СаС12 + 2NHt -|- 2Н2О
хлористый аммоний аммиак
(нашатырь)
Для поглощения выделяющейся воды при получении аммиака
обычно берут так называемую „натронную известь"—прокалённую
смесь гашённой извести и едкого натра.
2. Физические свойства аммиака. Аммиак при обычных усло-
виях— бесцветный газ с резким специфическим запахом. При охлаж-
дении до —33°,4 он превращается в жидкость, которая при —78°
затвердевает.
17
Плотность аммиака равна 29 = 0,59.
,144
Аммиак почти в два раза легче воздуха, поэтому его нужно со-
бирать в сосуд, расположенный вверх дном (рис. 66). ,
Аммиак хорошо растворим в воде. При обычных условиях в 1 объ-
ёме воды растворяется свыше 700 объёмов аммиака.
3. Химические свойства аммиака, а) Взаимодействие
аммиака с кислородом. Аммиак вступает во взаимодей-
ствие с кислородом. На воздухе он не горит, но может гореть
в чистом кислороде. Для наблюдения этого узкую трубку, прово-
дящую аммиак, помещают в более широкую; в неё пропускают
кислород (рис. 67) и поджигают
аммиак. Аммиак горит в атмосфере
кислорода бледным зеленоватым пламе-
нем. При горении образуются свобод-
ный азот и вода:
(горение)
4NH3 4- ЗО2 = 6Н2О + 2N2
При участии катализаторов (платины
и др.) с кислородом соединяется так-
же и образующийся азот; в этом слу-
чае получаются вода и окись азота.
Эту сложную реакцию можно изобра-
зить суммарным уравнением:
(катализатор)
4NH3 4- 5О2 = 6Н2О + 4NO
окись азота
Последняя реакция, как будет изло-
жено ниже, применяется для полу-
чения азотной кислоты.
б) Взаимодействие аммиа-
ка с водой. Часть растворяющего-
ся в воде аммиака вступает в химическое взаимодействие с нею.
При этой реакции к молекуле аммиака присоединяется от молекулы
воды один атом водорода, в результате чего образуется одновалент-
ная группа атомов NH4; эта группа получила название аммоний.
Аммоний присоединяет остающуюся от молекулы воды гидроксиль-
ную группу, и получается соединение аммония: гидрат окиси ам-
мония.
(на холоду)
NH,4-H,O---------->NH1 ОН
(при нагревании) группа гидроксильная
амония группа
гидрат окиси аммония
Аммонием называется одновалентная группа атомов
которая в различных соединениях играет роль одно-
валентного металла.
Ю В. В. Левченко
145
Соединение NH4OH проявляет все свойства оснований (гидратов
окисей металлов), растворимых в воде, т. е. щелочей; оно получило
название гидрата окиси аммония, также гидроокиси аммония, едкого
аммония,
Реакция взаимодействия аммиака с водой является обратимой.
В обратном направлении она идёт тем быстрее, чем выше темпера»
тура раствора; образовавшиеся молекулы гидрата окиси аммония
распадаются на воду и аммиак, что легко установить по запаху.
Большую растворимость аммиака в воде и образование гидрата
окиси аммония можно наблюдать, если отверстие трубки от сосуда
с собранным, аммиаком опустить в воду (рис. 68), в которую Добав-
Б
Рис. 68. Растворение
аммиака в воде.
ммиака
Рис. 69. Соединение аммиака
с хлористым водородом.
А — опыт в колбе; Б — опыт в пробирке.
дым .состоящий
а частиц
NH4CI
соляная
-кислота
лен красный раствор лакмуса. Вода быстро заполняет сосуд, обра-
зуя фонтан, и весь аммиак переходит в раствор; красная окраска
лакмуса изменяется на синюю под действием гидрата окиси аммония.
Так как аммиак вызывает резкое раздражение в носу, раствор его
дают нюхать при потере сознания, чтобы вызвать реакцию организма
на его запах и этим привести пострадавшего в чувство.
Водный раствор аммиака называют также нашатырным спиртом.
Хотя группа аммония в свободном состоянии неустойчива и распа-
дается на аммиак и водород, в химически связанном состоянии она
достаточно прочна и образует, подобно металлам, основание (гидрат
окиси аммония) и соли (соли аммония).
в) Взаимодействие аммиака с кислотами. Аммиак
легко реагирует с кислотами. При этих реакциях к аммиаку присо-
единяется водород кислоты и образуется группа аммония, входящая
в состав соли. Например, при соединении аммиака с соляной кислотой
получается соль аммония — хлористый аммоний:
NH34-HC1 = NH4C1
хлористый аммоний
146
Образование хлористого аммония можно наблюдать на таком
эффектном опыте. Небольшое количество концентрированного рас-
твора аммиака наливают на дно колбы и опускают в неё (ряс. 69)
трубку с каплей концентрированной соляной кислоты. ^Оба раствора
выделяют соответствующие газы, и между ними происходит приведён-
ная выше реакция: колба наполняется клубами густого дыма, состоя-
щего из мельчайших кристалликов хлористого аммония.
§ 2. Соли аммония
Солями аммония называются сложные вещества, мо-
лекулы которых состоят из одновалентной группы аммо-
ния NHi и кислотного остатка.
По строению молекул соли аммония сходны с солями одновалент-
ных металлов.
1. Получение солей аммония. Соли аммония получаются при
взаимодействии аммиака с кислотами:
nh3 + hno3=nh4no3
азотнокислый
аммоний
2NH3 + H2SO4 = (NH4)2SO4
сернокислый
аммоний
' Соли аммония получаются также при взаимодействии с кислотами
гидрата окиси аммония (водного раствора аммиака):
nh4oh+hno3 =nh4no34-h2o
2NH4OH + H2SO4 = (NH4)2SO4 4- 2H2O
3NH4OH + H3PO4 = (NH4)3PO4 + 3H2O
2. Химические свойства солей аммония. Соли аммония про-
являют все общие свойства солей. Они реагируют со щелочами,
с кислотами и с другими солями:
(в растворе, при
нагревании)
NH4C14- NaOH == NaCl 4~ NH4OH
хлористый
аммоний
(нагревание)
2NH4C14- Нз8О4 = (NH4)2SO4 4- 2НС11
(твёрд.) (конц.} сернокислый хлористый
аммоний водород
(в растворе)
(NH4)2SO4 4- ВаС12 = BaSO4 + 2NH4C1
4-
сернокислый хлористый сернокислый хлористый
аммоний барий барий аммоний
NH3fH2O
10*
147
Реакцией взаимодействия со щёлочью пользуются для распозна-
вания солей аммония. Для этого в пробирку помещают испытуемую
соль, приливают раствор щёлочи и слабо подогревают. Выделение
аммиака устанавливают по запаху и по действию на красную лакму-
совую бумажку, подносимую к отверстию пробирки.
3. Действие нагревания на соли аммония. Хлористый аммоний
при нагревании разлагается на аммиак и хлористый водород.
Продукты разложения, охлаждаясь, снова соединяются; поэтому
конечным результатом нагревания является возгонка хлористого
аммония:
(нагревание) (охлаждение)
NH4C1 = NH8 + HC1 = NH4C1 .
Если немногб порошка хлористого аммония поместить в сухую
колбу, ’закрыть отверстие ватой ‘и нагреть, он будет возгоняться,
и оседать на холодных стенках колбы в виде белого налёта. Способ-
ностью хлористого аммония возгоняться пользуются для очистки его
от невозгоняющихся примесей.
Так как при нагревании образуется хлористый водород, хлористый
аммоний, обычно называемый в технике нашатырём, применяется
для очистки паяльника.
Паяльник, изготовляемый из меди, при нагревании покрывается
налётом окиси меди, и поэтому припой к нему не пристаёт. Для
очистки нагретого паяльника от окиси им проводят по куску хлори-
стого аммония (нашатыря) или опускают на короткое время в насы-
щенный раствор его. Поверхность паяльника тотчас же становится
блестящей. Это можно наблюдать, беря вместо паяльника кусок меди
или медную проволоку.
Очистка паяльника от налёта окиси меди происходит в результате
реакции:
(нагревание)
СиО 4- 2НС1 = СиС12 4- Н2О
хлорная
медь
От образующейся хлорной меди остаток хлористого аммония
окрашивается в зелёный цвет. Употребление нашатыря при паянии
не даёт избытка соляной кислоты, которая мешает закреплению при-
поя на металле.
Углекислый аммоний при нагревании разлагается без остатка.
Разложение его происходит уже при обычных условиях с выделе-
нием аммиака, почему соль отличается резким запахом. Хранить её
необходимо в плотно закупоренном сосуде, иначе она полностью раз-
ложится на воду, аммиак и углекислый газ:
(NH4)2COs = 2NH„t + H2COS
углекислый
аммоний
t
Н2ОСО2
148
Разложение углекислого аммония на летучие продукты исполь-
зуете^ при выпечке кондитерских изделий. Он добавляется в тесто;
выделяющиеся при нагревании газы вызывают поднятие теста и при-
дают ему пористость.
4. Применение аммиака и соединений аммония. Большие ко-
личества синтетического аммиака используются для приготовления
азотной кислоть! и азотных удобрений. Кроме того, он применяется
в холодильных машинах и др.
Водный раствор аммиака (нашатырный спирт) широко применяется
в лабораториях, в медицине и домашнем быту (при стирке белья,
для выведения жирных пятен) и пр.
Солй аммония применяются в качестве удобрений (сернокислый
аммоний и др.), длй изготовления некоторых взрывчатых веществ,
например аммонала, применяемого в горном деле. В состав его вхо-
дят уголь и алюминий, азотнокислый аммоний (откуда произошло
название аммонал).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В каком виде азот находится в природе?
?. Как получается и для чего применяется азот?
3; Какие химические свойства характерны для азо|а?
4- Какое соединение даёт азот с водородом и какова валентность азота
в нём?
5; Какие химические процессы лежат в основе промышленных способов
получения аммиака?
6. Как получается аммиак в лабораторных условиях?
7. Что называется аммонием?
8. Что представляет собой нашатырный спирт и как он образуется?
9. В чём проявляются щелочные свойства нашатырного спирта?
10. Что происходит при взаимодействии аммиака с кислотами? Приведите
уравнейця реакций для кислот: соляной, серной, фосфорной.
11. Что происходит при взаимодействии нашатырного спирта с кислотами?
Приведите примеры реакций с кислотами: соляной, серной, фосфорной.
12. Что происходит с хлористым аммонием при нагревании?
13. На каких свойствах хлористого аммония рсновано применение его
в паяльном деле?
14. На каких свойствах углекислого аммония основано применение его
в кондитерском деле?
В. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
§ 1. Окислы азота
Азот образует пять окислов: N2O — закись азота, NO — окись
азота, N2O3 — азотистый ангидрид, NO2 — двуокись азота, N2O5 —
азотный ангидрид.
Закись и окись азота — несолеобразующие окислы; остальные —
солеобразующие окислы.
Азотистый ангидрид образует с водой азотистую кислоту:
N2O34-H2O = 2HNO2
азотистый азотистая
ангидрид кислота
149
Азотный ангидрид образует с водой азотную кислоту!
N2O6 + Н2О == 2HNO,
азотный азотная
ангидрид
кислота
Двуокись азота образует с водой две кислоты — азотистую п
азотную:
2NO2 4--Н3О = HNO2 4- HNO3
двуокись азотистая азотная
азот^ кислота кислота
Из окислов азота
двуокись азота.
1. Окись азота,
ный вес равен 30.
а) Получение
реакции взаимодействия с медью не
подробнее будут рассмотрены только окись и
NO; структурная формула: N = O.' Молекуляр-
окиси азота.
NO
Рис. 70. Получение' окиси азота.
Окись азота получается при
слишком концентрированной
азотной кислоты (рис. 70).
Происходящий процесс бу-
дет рассмотрен при изуче-
нии азотной кислоты.
б) Физические и хи-
мические свойства
окиси азота. Окись азо-
та — бесцветный газ, не-
много тяжелее воздуха, не-
растворимый в воде.
По химическим
ствам окись
солеобразующий
Сохраняется
та только в
кислорода; с кислородом же
она вступает в соединение
бурого цвета:
свой-
азота — не
окисел.
окись азо-
отсутствие
и превращается в двуокись азота — газ
2NO О2 = 2NO2
окись азота двуокись азота
(бесцветный газ) (газ бурого цвета)
Это легко можно наблюдать на опыте. Если сосуд с собранной
окисью азота (рис. 71, А, Б) открыть, хорошо бывает видно, как
начинающееся сверху побурение постепенно распространяется книзу.
Через некоторое время всё пространство оказывается заполненным
бурой двуокисью азота.
Окись азота участвует в процессе получения серной кислоты,
о чём уже говорилось; она же является промежуточным продуктом
при заводском способе получения азотной кислоты.
150
2. Двуокись азота.
NO2; структурная формула:
N<^ . Молеку-
Получается
ной кислоты:
химические свойства двуокиси
при обычной температуре — газ бурого
Рис. 71. Переход окиси азота в двуокись азота.
А — сосуд с окисью азота (закрыт куском стекла):
Б — открытый сосуд с окисью азота; появление бурой
окраски двуокиси азота, распространяющейся сверху
вниз; В — растворение двуокиси азота в воде (сосуд
после полного перехода окиси азота в двуокись закрыт
и опрокинут в воду; после удаления покрышки вода мед-
ленно входит в сосуд).
лярный вес равен 46.
а) Получение двуокиси азота. Двуокись азота, как уже
говорилось, образуется из окиси азота в результате соединения её
2NO + О2 = 2NO2
она также при прокаливании некоторых солей азот-
(нагревание)
2Pb (NO3)2 = 2РЬО 4- 4NO2 + Оа
азотнокислый » двуокись
свинец
б) Физические и
азота. Двуокись азота
цвета, в Р./г Раза тяже-
лее воздуха.
При охлаждении
смесью снега с солью Дву-
окись азота превращается
в желтоватую жидкость,
которая при— 10° засты-
вает в бесцветную кри-
сталлическую массу.
Двуокись азота очень
хорошо растворяется в
. воде. Это можно наблю-
дать, если сосуд с дву-
окисью азота (рис. 71, В),
закрыв отверстие его,
опрокинуть в воду; после
открывания отверстия во-
да медленно входит в сосуд по мере растворения газа. Если в со-
суде не было примеси воздуха, он весь заполняется водой.
Двуокись азота не только растворяется в воде, но и соединяется
с ней, образуя две кислоты: азотистую и азотную.
Образование их легко обнаружить по действию получившегося
в описанном опыте раствора на синий лакмус; он тот час же изменяет
окраску на красную.
§ 2. Азотная кислота
HNO3; структурная формула; Н — О —
Молекулярный вес равен 63.
1. Получение азотной кислоты. В настоящее время азотную
кислоту получают окислением синтетического аммиака с применением
катализаторов (платины и др.).
151
Весь путь от элементов к азотной кислоте состоит из следующего
ряда последовательных реакций.
1) Синтез аммиака:
N24-3H2 = 2NH,
азот водород аммиак
2) Окисление аммиака в окись азота:
4NH3 4- 5О2 = 4NO + 6Н2О
аммиак окись
азота
3) Окисление окиси азота в двуокись:
2NO + О2 = 2NO2
окись двуокись
азота азота
4) Действие воды на двуокись азота:
2NO2 + Н2О = HNO3 + HNO2
двуокись азотная азотистая
азота кислота кислота
В производственных условиях образующаяся азотистая кислота
в результате дальнейшего окисления полностью переходит в азотную
кислоту.
На рисунке 72 дана схема производства азотной кислоты окисле-
нием аммиака. Аммиак и воздух поступают в смеситель, а из него —
башня . башня
HNO3
Рис. 72. Схема заводской установки для получения азотной
кислоты окислением аммиака.
в контактный аппарат. Образовавшаяся в нём окись азота перехо-
дит в окислительную башню, в которой окисляется и превращается
в двуокись азота. Двуокись азота поступает в поглотительную башню
и в ней, взаимодействуя с водой, образует азотную и азотистую ки-
слоты; последняя полностью окисляется в азотную. Готовая кислота
из этой башни поступает, на склад.
152
В лабораторных условиях азотную кислоту получают из ей соли,
действуя на неё серной кислотой (рис. 73) при нагреваний;
(нагревание)
NaNO3 + H2SO4 = NaHSO4 + HNO3
азотнокислый
натрий (селитра)
кислый сернокислый азотная
натрий кислота
2. Физические свойства азотной кислоты. Чистая азотная кис-
лота — бесцветная жидкость с едким запахом; удельный вес её 1,52.
При температуре -{-86° она кипит, а при —41 °,3 затвердевает
в бесцветное кристал-
лическое вещество.
Азотная кислота
очень гигроскопична.
Пары её притягивают
влагу и образуют об-
лако из мельчайших
капелек жидкости;
поэтому она сильно
„дымит “ на воздухе
(дымящая кислота).
Обычная продаж-
ная концентрированная
кислота (удельный вес
1,4) представляет собой
Рис. 73. Получение азотной кислоты из селитры.
Д—реторта, в которой получается азотная кислота; Б —
колба, в которой собирается азотная кислота; В — кристал-
лизатор с холодной водой.
65-процентный раствор.
3. Химические свойства азотной кислоты, а) Взаимо-
действие с основными окислами, основаниями
и солями.
В разбавленных растворах азотная кислота проявляет все общие
свойства кислот. (Некоторые особенности представляют реакции
взаимодействия её с металлами, которые будут рассмотрены дальше.)
Как и все кислоты, азотная кислота реагирует с основными окис-
лами, основаниями, солями:
СиО 4- 2HNO3 = Cu(NO3)2 4- Н2О
окись меди азотнокислая
медь
Си(ОН)2 4- 2HNO3 = Cu(NO3)3 4~ 2Н2О
гидрат окиси
меди
СаСО3 4- 2HNO3 = Ca(NO3)2 4~ Н2СО3
углекислый кальций
(мел)
азотнокислый
кальций
Н,0 CO2f
б) Неустойчивость молекул азотной кислоты,
арактерной особенностью азотной кислоты является неустойчивость
ее молекул: связь между атомами азота и кислорода легко нарушается,
и молекулы азотной кислоты распадаются с выделением свободных
153
атомов кислорода. Такой распад происходит уже под действием света(
нагревания:
(свет, нагревание)
2HNOB =Н2О+ 2NO2 +0; 2О = О2
двуокись азота
(бурого цвета)
Рис. 74. Горе-
ние угля в азот-
ной кислоте.
Образующаяся двуокись азота остаётся в растворе и придаёт ему
жёлто-бурую окраску. Для предупреждения разложения азотной кислоты
её необходимо хранить в темноте и в холрдном месте,
в) Окислительное действие азотной
кислоты. Так как от азотной , кислоты легко
отделяется кислород в виде отдельных атомов'—,
атомарный кислород (сравнить с перекисью водоро-
да, стр. 116), азотная кислота является сильно дей-
ствующйм окислителем.
Если, например, опустить в нагретую кислоту
тлеющий уголёк (рис. 74), он загорается ярким
пламенем за счёт выделяемого
кислотой кислорода.. Реакцию
можно представить по стадиям
таким образом:
1. 4HNO3 = 2H2O4-4NO2+O2
2. С —|— 02 = С02
Азотная кислота окисляет
также многие органические
вещества. Капля скипидара,
пущенная в азотную кислоту, _
„ Рис. 75. Вспышка
сгорает с яркой вспышкой скипидара в азотной
(рис. 75). Бумага и ткани раз- кислоте,
рушаются концентрированной
азотной кислотой вследствие окисления образующих эти мате-
риалы веществ. По той же причине красящие вещества, например
фуксин и др., обесцвечиваются. Из всего этого следует, что с кон-
центрированной азотной кислотой надо обращаться с большой
осторожностью (беречь глаза). Брызги её на теле и платье надо
смывать большим количеством воды, а ещё лучше смачивать рас-
твором соды.
г) Взаимодействие с металлами. Концентрированная азот-
ная кислота, а также её водные растворы не выделяют водород в сво-
бодном состоянии при взаимодействии с металлами, способными его
вытеснять (см. ряд активности металлов на стр. 47). Происходит это
потому, что водород окисляется азотной кислотой в воду.
При взаимодействии азотной кислоты с металлами, не вытесняю-
щими водород, выделяются различные окислы азота. Как идёт реак-
ция в каждом случае, зависит от степени активности металла, кон-
центрации кислоты, температуры и других причин.
Например, при взаимодействии с медью концентрированной азот-
ной кислоты выделяется двуокись азота:
1-я стадия реакции:
2HNO3 +Cu = CuO + H2O + 2NO2t
концентрированная двуокись
азотная кислота азота
2-я стадия реакции:
2HNO3 + CuO == Cu(NO3)2 + Н2О
Суммированное уравнение реакции:
4HNO3 4- Си = Cu(NO3)2 + 2Н2О + 2NO2+
Если взять кислоту, разбавленную двумя объёмами воды, реак-
ция идёт с выделением окиси азота.
1-я стадия реакции:
2HNO3 4- ЗСи = ЗСиО 4- Н2О 4- 2J4O f
2-я стадия реакции:
6HNO3 4-ЗСиО = 3Cu(NO3)2 4-ЗН2О
Суммированное уравнение реакции:
8HNO3 4-3Cu=3Cu(NO3)24-4HaO4-2NOf
разбавленная окись азота
азотная кислота
Окислительное действие азотной кислоты особенно усиливается
в присутствии соляной кислоты благодаря образованию продуктов
взаимодействия их, отличающихся сильным окислительным действием
(подробнее здесь не рассматривается). На практике пользуются смесью
из одного объёма азотной кислоты и трёх объёмов соляной кислоты.
(Эта смесь носит старинное название „царская водка", так как в ней
растворяется даже золото—„царь металлов", не растворяющееся
в других кислотах.)
4. Применение азотной кислоты. Азотная кислота является важ-
нейшим продуктом основной химической промышленности.
Она необходима для изготовления азотистых удобрений, искус-
ственного волокна, красок, многих лекарственных веществ, взрыв-
чатых веществ. Отсюда ясно, насколько велико значение азотной
промышленности для успешного развития народного хозяйства и обо-
роноспособности нашей родины.
Развитие азотной промышленности у нас началось с пуска пер-
вого завода синтетического аммиака в 1928 г. В течение следующих
сталинских пятилеток у нас была создана мощная азотная промыш-
ленность. Благодаря этому наша страна была обеспечена веществами,
необходимыми для мирного строительства и для защиты от посяга-
тельств врагов нашей родины.
155
На основе дальнейшего роста азотной промышленности по пяти-
летнему плану восстановления и развития народного хозяйства СССР
предусматривалось в 1550 г. увеличить производство азотных удобре-
ний по сравнению с довоенным в 1,8 раза. Фактически в 1950 г.
довоенный уровень превышен в 2,2 раза.
§ 3. Соли азотной кислоты
t Соли азотной кислоты называются азотнокислыми, или нитра-
тами.
Азотнокислые соли натрия, калия, аммония и кальция на практике
называются ещё селитрами.
NaNO3 — азотнокиЛый натрий, натриевая селитра.
KNO3 — азотнокислый калий, калиевая селитра.
HN4NO3 — а|ртнок-ислый аммоний, аммиачная селитра.
Ca(NO3)2 — азбтнокислый кальций, кальциевая селитра.
Получаются азотнокислые соли действием азотной кислоты на ме-
таллы, окислы их и основания.
Все азотнокислые соли хорошо растворимы в воде.
Характерной особенностью азотнокислых солей является непроч-
ность их; при нагревании они сравнительно легко разлагаются с вы-
делением кислорода.
Азотнокислые соли более активных металлов при нагревании пере-
ходят в азотистокислые:
(нагревание)
2NaNO3 = 2NaNO2 -|-О2
азотнокислый азотистокислый
натрий натрий
Азотнокислые соли менее активных металлов распадаются на окись
металла, двуокись азота и кислород:
(нагревание)
2Cu(NO3)2= 2CuO 4-4NO24-O2
азотнокислая окись меди
медь (голубого (чёрного цвета)
цвета)
(нагревание)
2Pb(NO3)2 = 2РЬ0 + 4NO2 + О2
азотнокислый окись свинца
свинец (жёлтого цвета)
(белого цвета)
Выделение двуокиси азота сразу же видно по её жёлто-бурой
окраске. Кислород же может быть обнаружен по вспыхиванию лучинки
с тлеющим на конце угольком.
Благодаря выделению кислорода азотнокислые соли при высокой
температуре оказывают сильное окисляющее действие.
Если в селитру, нагретую в пробирке до плавления, бросить
тлеющий уголёк (рис. 76), он сгорает, испуская яркий свет. Если.
156
имеются горючие ве-
Рис. 76. Горение угля
на расплавленной
селитре.
убрав горелку, бросить в ту же пробирку с горящим угольком кусо-
чек серы, горение настолько усиливается, что стекло плавится.
Благодаря указанному свойству селитра (KNO3) применяется для
изготовления чёрного (дымного) пороха, представляющего собой
смесь селитры, угля и серы. При поджигании вся масса пороха
быстро воспламеняется, так как в этой смеси
щества — уголь и сера и достаточное количе-
ство кислорода, непрочно связанного с азотом
в молекуле селитры.
Происходящие здесь реакции сложны; про-
дуктами реакции являются газообразные веще-
ства— углекислый газ СО2, свободный азот N2,
а также твёрдые вещества — сернистый калий
K2S и некоторые другие.
Выделяющееся при реакции большое коли-
чество тепла приводит к тому, что образовав-
шиеся газы расширяются до объёма, почти
в 2000 раз большего по сравнению со взятым
объёмом пороха; от этого и происходит взрыв.
Разбрасывающиеся частицы твёрдых веществ
образуют наблюдающееся при взрыве пороха
облако дыма.
Для изготовления пороха употребляется
только калийная селитра, так как натриевая
селитра гигроскопична, т. е. притягивает влагу;
приготовленный из неё порох легко сыреет.
Для изготовления взрывчатых веществ употребляется ещё азотно-
кислый аммоний NH4NO3; он входит в состав взрывчатого вещества
аммонала (смесь: NH4NO3 Al -|- С), сгорающего без дыма.
Азотнокислые соли, особенно азотнокислый аммоний и азотно-
кислый кальций, широко используются в качестве удобрений.
§ 4. Круговорот азота в природе. Значение азотных
удобрений
Уже указывалось на значение азота для живых организмов. Он
является одним из главных элементов, входящих в состав веществ,
образующих живое тело растений и животных. В процессах
жизненной деятельности эти вещества беспрерывно расходуются,
и жизнь не может продолжаться без возобновления их. Восстанов-
ление расходуемых веществ организма обеспечивается регулярным
питанием.
Животные не могут усваивать азот ни в свободном виде, ни
в виде минеральных соединений. Для питания им необходим азот,
связанный с углеродом, водородом, кислородом и серой в сложных
соединениях, объединяемых под общим названием белки.
Белковые вещества образуются из минеральных соединений азота
только в растениях. Животные не могут существовать, не получая
157
в пище готовых белковых веществ; получают же они их с раститель-
ной и животной пищей. Без мира растений мир животных суще-
ствовать не может.
Растения получают соединения азота из почвы (рис. 77) в виде
азотнокислых солей: другие азот содержащие вещества они не могут
усваивать.
Азотнокислые соли образуются в почве из гниющих остатков
растений и животных. В этом процессе большую роль играют нахо-
дящиеся в почве особые бактерии; они переводят образующийся
при гниении растительных и животных остатков аммиак в азотную
Рис. 77. Круговорот азота в> природе.
кислоту. Получившаяся таким путём азотная кислота реагирует
с веществами почвы и превращается в азотнокислые соли, которые
усваиваются растениями.
Однако не весь азот, содержащийся в растительных и животных
остатках, переходит в почву и попадает в растения. Значительная
часть его попадает в воздух. Происходит это при гниении, горении,
при действии некоторых бактерий, содержащихся в почве, и т. д.
В результате происходит обеднение почвы азотом (рис. 77, пра-
вая сторона).
В противовес этому целый ряд процессов переводит свободный
азот воздуха в связанное состояние, снова возвращает его в почву
и делает доступным для растений (рис. 77, левая сторона). К этим
процессам относится образование окислов азота при грозах. С дож-
девой водой окислы вносятся в почву и задерживаются в ней, пре-
вращаясь в азотную кислоту, а затем в азотнокислые соли.
Большую роль играют также находящиеся в почве особые бакте-
рии, способные усваивать атмосферный азот. Эти бактерии бдли
158
с клубеньками
Рис. 78. Азотусваивающие бак-
терии.
А — клубеньки на корнях бобового расте-
ния; Б — бактерод находящиеся внутри
клубеньковых клеток (Нод микроскопом).
открыты и изучены русским микробиологом Н. Д. Виноградским.
Бактерии проникают из почвы в клетки корней бобовых растений и
поселяются в них. На корнях образуются наросты в виде неболь-
ших утолщений — клубеньков (рис. 78, А), клетки в них буквально
набиты бактериями (рис. 78, Б). Эти бактерии переводят атмосфер-
ный азот в сложные вещества, которые после их отмирания идут на
питание растения. Благодаря этому
растать на истощённых почвах; в то
азотсодержащими веществами, так
остаются в ней и там сгнивают.
Рассмотренной особенностью бо-
бовых растений объясняется исклю-
чительное значение их в севообороте.
Очень большое значение в сель-
ском хозяйстве имеет внесение в
почву специальных, содержащих азот
удобрений. Это объясняется тем, что
растения уносят из почвы очень
большие количества азота. По при-
близительным подсчётам, во всём
мире культурные растения уносят
из почвы около 25 млн. т азота в
связанном виде. Только небольшое
количество азота возвращается в
почву с навозом, 1 т которого со-
держит только около 5 кг азота.
Вследствие этого почва постепенно
* истощается.
Только у нас при социалистическом хозяйстве, благодаря забо-
там партии и правительства, стало возможным осуществление всей
совокупности мероприятий, обеспечивающих увеличение плодородия
почвы и увеличение урожаев. Достигается это проведением в обще-
государственном масштабе широчайших мероприятий, намеченных
передовой советской агрономической наукой на основе работ
советских учёных-новаторов: В. Р. Вильямса, И. В. Мичурина,
Т. Д. Лысенко. Сюда относятся: лесные насаждения по строго про-
думанному плану, соответствующая обработка почвы, строгий сево-
оборот с применением специальных удобрений, посев сортовыми
семенами, дальнейшее улучшение ценных качеств культурных расте-
ний, создание новых сортов их и пр.
бобовые растения могут произ-
же время они обогащают почву
как корни их
ВОПРОСЫ для ПОВТОРЕНИЯ
наивысшую валентность проявляет азот в кислородных соеди-
лсНИЯХг *
2. Приведите структурную формулу азотной кислоты и её ангидрида.
кислоты аизИеаммиака?еСКИе пРоцессы происходят при получении азотной
159
4. В каких реакциях проявляется окислительное действие азотной
кислоты?
5. Как реагирует концентрированная азотная кислота с медью?
6. Как называются соли азотной кислоты?
7. Какое значение имеет селитра в качестве составной части пороха?
8. Какое применение находят соединения азота?
// ФОСФОР И ЕГО СОЕДИНЕНИЯ
А. ФОСФОР
Химический знак: Р (читается: пэ).
Атомный вес равен 31.
Атомы фосфора имеют во внешнем электронном слое пять
электронов. Они могут заряжаться отрицательно (— 3) и поло-,
жительно (4~5)> н0 У них более ярко выражено последнее свой-
ство.
Фосфор был получен в середине XVII в. (1669). Название он
получил благодаря способности светиться в темноте (фосфор в пере-
воде с греческого означает „светоноситель").
Фосфор в свободном состоянии образует несколько аллотропи-
ческих видоизменений. Из них легче получаются два видоизменения:
белый фосфор 41 красный фосфор.-
1. Физические свойства. Ниже приводятся физические свойства
аллотропических видоизменений фосфора (стр. 161).
Аллотропические видоизменения фосфора различаются числом
атомов в молекулах (а также их расположением). Установлено, что
молекула белого фосфора состоит из 4 атомов (Р4). В красном
фосфоре молекулы состоят из большего числа атомов, точно пока
не установленного. Здесь ярко проявляется общий закон природы:
„переход количества в качествоизменение количества атомов в моле-
кулах фосфора приводит к образованию аллотропических видоизме-
нений его, проявляющих разные свойства (см. табл, на стр. 161).
Вследствие лёгкой воспламеняемости белого фосфора (он может
загореться даже от лёгкого трения) его хранят под водой.
При обычной температуре белый фосфор мягок, как воск, и
легко режется ножом. Но резать его следует только под водой,
иначе он может загореться и причинить опасные ожоги.
2. Химические свойства. Главнейшие химические свойства,
характерные для аллотропических видоизменений фосфора, приведены
в таблице.
Особенностью белого фосфора является его способность све-
титься на воздухе, что хорошо видно в темноте. Свечение фосфора'*1
связано с медленным окислением его.
Из указанных в таблице химических свойств видно, что обра-
щаться с белым фосфором надо очень осторожно не только потому,
что он легко воспламеняется, но и из-за сильной ядовитости: уже
0,1 г его при приёме внутрь приводит к смерти.
160
Свойства Белый фосфор Красный фосфор
Физическое состояние Твёрдое кристаллическое вещество Порошкообразное вещество
Твёрдость Небольшая (легко ре- - жет^я ножом)
Цвет Бесцветный, в толстых слоях желтоватый Темномалиновый
Запах Чесночный Без запаха
Удельный вес 1,8 2,3
Растворимость в воде Не растворяется Не растворяется
Растворимость в серо- углероде и жидких маслах Растворяется хорошо Не растворяется
Температура плавления 44° Не плавясь, переходит в пар
Температура кипения 281°
Температура воспламе- нения 40°; в мелкораз- дроблённом состоянии самовоспламеняется Около 240°
Окисляемость Легко окисляется на воздухе даже при низкой температуре Трудно окисляется
Свечение Светится на воздухе Не светится
Превращения Превращается в крас- ный (на свету, при сла- бом нагревании без доступа воздуха) Превращается в белый (после перехода в паро- образное состояние)
Действие на организм Сильный яд Не ядовит
Ядовитостью фосфора объясняется очень трудное заживление ран
при ожогах горящим фосфором, так как при этом происходит
отравление клеток окружающих тканей.
Белый фосфор при хранении медленно превращается в красный фос-
фор, поэтому окраска его обычно бывает не белая, а желтоватая. Под
действием света превращение белого фосфора в красный ускоряется.
Красный фосфор при нагревании превращается в пар, который,
охлаждаясь, даёт белый фосфор.
Превращения аллотропических видоизменений фосфора одного
в другое показаны на схеме:
белый фосфор
красный фосфор
Наблюдать эти превращения фосфора в классных условиях безо-
пасно при проведении опыта в трубке с малым количеством фосфора.
Берут красный фосфор, а если его нет, счищают на лист бумаги
порошок со спичечной коробки (для этого достаточно 1—2 коробок).
В длинную стеклянную трубку при помощи лучинки или стек-
лянной палочки помещают на середину её очень немного красного
Рис. 79. Опыт с превращением крас-
ного фосфора в белый.
фосфора или наскобленного по-
рошка (рис. 79). Одно отверстие
трубки плотно закрывают про-
бочкой (можно смоченным водой
комочком бумаги), а другое от-
верстие оставляют открытым.
Нагревают трубку в том ме-
сте, . где находится порошок, со-
блюдая следующее правило: сна-
чала вращают трубку, держа её
высоко над пламенем, пока стекло
не нагреется равномерно по всей
окружности; затем опускают труб-
ку ниже и сильнее нагревают
участок с порошком. Наблюдают появление небольшого количества
паров фосфора, которые тотчас же вспыхивают; появившийся огонёк,
однако, быстро гаснет из-за недостатка кислорода.
Продолжают нагревание трубки. Новые количества красного
фосфора превращаются в пар; этот пар оседает на холодных частях
трубки по обе стороны от нагреваемого места в виде кольцевидного
налёта светложёлтого цвета. Этот налёт — белый фосфор.
Как только появится хорошо заметный налёт белого фосфора,
отводят трубку от огня, гасят его и затемняют помещение.
162
Наблюдают свечение белого фосфора: благодаря свечению оба
кольцевые налёта белого фосфора хорошо заметны. Свечение это
продолжается 2—3 минуты, а затем постепенно затухает, так как
небольшое количество кислорода, находящегося в трубке, полностью
соединяется с фосфором, и реакция окисления прекращается. Если
удалить пробочку, свечение снов5 появляется.
В кислородных соединениях фосфор, как и азот, проявляет
высшую валентность, равную —5.
В соединениях с водородом и металлами фосфор проявляет
валентность, равную — 3.
а) Соединения фосфора с водородом и металлами.
* Фосфор образует с водородом соединение, аналогичное аммиаку,—
фосфористый водород РН3.
Получается он при взаимодействии с водой некоторых фосфо-
ристых металлов:
Са3Р2 + 6Н2О = ЗСа (ОН)2 + 2РН3
фосфористый
водород
Фосфористый водород по свойствам близок к аммиаку.
Кроме РН3, существуют и другие соединения фосфора с водо-
родом, содержащие больше фосфора; отличаются они самовоспла-
меняемостью. Такой самовоспламеняющийся фосфористый водород
образуется при гниении трупов. Поэтому на могилах иногда наблю-
даются огоньки, представляющие собой не чудесное явление, как
думают суеверные люди, а горение выделившегося из трупа фосфо-
ристого водорода.
При высокой температуре фосфор соединяется также с металлами.
Для фосфора соединения с водородом и металлами не харак-
терны; практического значения они не имеют. Поэтому подробнее
эти соединения здесь не рассматриваются.
б) Взаимодействие фосфора с кислородом. Хими-
ческая активность свободного фосфора зависит от его аллотропи-
ческого состояния. Белый фосфор реагирует с кислородом очень
легко; уже при обычных условиях он окисляется на воздухе, испуская
свет; загорается он при слабом нагревании и трении, образуя фос-
форный ангидрид:
' (горение)
4Р + 5О2 = 2РаО5
фосфорный
ангидрид
Красный фосфор загорается только при нагревании выше 240°.
Ещё энергичнее, чем с кислородом, реагирует фосфор с хлором:
(горение)
2Р —|— 5С12= 2РС1б
Соединяется он также с другими металлоидами, хотя и менее энергично.
3. Фосфор в природе. В противоположность азоту, фосфор не
встречается в природе в свободном состоянии. Объясняется это его
большой химической активностью.
11*
163
В химически связанном состоянии фосфор содержится в раз-
личных минералах и горных породах. Наибольшее значение имеют:
фосфорит, представляющий собой фосфорнокислый кальций Са3(РО4)2,
и апатит, содержащий, кроме фосфорнокислого кальция, ещё фтори-
стый кальций CaF2 или хлористый кальций СаС12. Открытые у нас
в 1928 г. залежи апатита в Хибинских тундрах являются богатей-
шими в мире.
Фосфор входит в состав тел живых организмов — растений и
животных. Особенно много содержится его в костях позвоночных
животных в виде фосфорнокислого кальция, придающего костной
ткани прочность.
Богаты соединениями фосфора из растительных продуктов бобы,
горох, фасоль, чечевица, а йз животных — мозг, икра рыб.
4. Получение фосфора. Фосфор в свободном виде получают
из природных соединений (фосфорнокислого кальция) путём нака-
ливания его в смеси с углем и песком. В настоящее время для получе-
ния фосфора пользуются электрическими печами. Происходящий про-
цесс может быть представлен в виде двух последовательных реакций:
1. Образование фосфорного ангидрида при взаимодействии крем-
ниевого ангидрида (песка) с фосфорнокислым кальцием:
(нагревание)
Са3(РО4)2 3SiO2 = 3CaSiO3 -|— Р2О5
фосфорнокислый кремниевый кремнекислый фосфорный
кальций ангидрид кальций ангидрид
(песок)
2. Выделение фосфора из ангидрида действием угля:
(нагревание)
Р2Об 4- 5С = 2Р + 5COt
фосфорный уголь фосфор окись
ангидрид углерода
При сложении обоих уравнений получается:
(нагревание)
Са3(РО4)2 4- 3SiO2 4- 5С = 3CaSiO3 4" 2Р + 5cot
Таким путём фосфор получают в виде белого аллотропического
видоизменения.
5. Применение фосфора. Фосфор в свободном состоянии имеет
ограниченное применение. Употребляется он, главным образом, в спи-
чечном производстве.
Ещё в 30-х годах прошлого века лёгкая воспламеняемость белого
фосфора была использована для изготовления спичек. Для этого
кончик спичечной палочки сперва погружался в расплавленную серу,
а затем покрывался тонким слоем белого фосфора и слоем лака для
защиты от кислорода воздуха. Такие спички назывались фосфор-
ными.
При трении фосфорной спички о любую поверхность она заго-
ралась благодаря воспламенению фосфора. Фосфорные спички опасны,
так как легко могут загораться сами при случайном разрушении
164
поверхностного слоя лака; кроме того, они ядовиты. Из-за этого
в дальнейшем перешли к спичкам, не содержащим белого фосфора.
Для зажигания этих спичек необходима поверхность, покрытая
слоем особого состава; этот состав представляет собой смесь красного
фосфора с некоторыми добавками (с Дернистой сурьмой и др.) и клея.
При трении об этот слой спичечной, головки происходит разогревание,
вызывающее переход крупинок красного фосфора в белый, который
воспламеняется на ограниченном участке; этого воспламенения бывает
достаточно, чтобы загорелась головка спички, содержащая в своём
составе серу и вещества, легко отдающие ей кислород (бертолетову
соль иадр,). Такие спички не ядовиты и не могут сами загораться,
подобно фосфорным спичкам.
Фосфор применяется также в военном деле при создании дымовых
зазес, так как при горении его образуется густой белый дым, состоя-
щий из мелких частиц фосфорного ангидрида.
Кроме того, фосфор находит применение как зажигательное сред-
ство для наполнения артиллерийских снарядов и зажигательных мин.
Б. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ФОСФОРА
Наибольшее значение имеют кислородные соединения фосфора,
в которых он проявляет высшую валентность, равную -|-5: фосфор-
ный ангидрид и соответствующая ему фосфорная кислота.
§ 1. Фосфорный ангидрид
Р2О6; структурная формула: Р=О
Р=О
Молекулярный вес равен 142.
1. Получение фосфорного ангидрида. Фосфорный ангидрид по-
лучается при горении фосфора в кислороде или воздухе:
4Р4-5О2 = 2Р2О5
Для наблюдения горения фосфора его сжигают под колоколом,
опущенным в широкий сосуд с водой (рис. 80). Фосфор горит под
колоколом до тех пор, пока не израсходуется весь кислород. Горение
фосфора сопровождается выделением настолько густого белого дыма,
что через него ничего нельзя увидеть. Дым этот, состоящий из мел-
ких частиц фосфорного ангидрида, жадно соединяется с водой, об-
разуя фосфорную кислоту; через некоторое время он полностью в ней
растворяется. Отлив воду в стакан, устанавливают посредством лак-
муса присутствие в ней кислоты.
2. Физические и химические свойства фосфорного ангидрида.
Применение. Фосфорный ангидрид представляет собой твёрдое снеж-
нобелое вещество.
Характерной особенностью его является весьма энергично про-
текающая реакция соединения с водой. Брошенный в неё фосфорный
ангидрид растворяется с шипением, выделяя большое количество
тепла. Продуктом реакции является фосфорная кислота.
Существует несколько фосфорных кислот, соответствующих фос-
форному ангидриду Р2Об. По
составу молекул они различаются между
собой количеством присоединившейся
к ангидриду воды.
Если фосфорный ангидрид раство-
рять в холодной воде, к молекуле его
присоединяется одна молекула воды
и образуются две молекулы кислоты:
НРО3; эта кислота называется мета-
фосфорной кислотой:
Р2О5 + Н2О = 2НРО3
(холодная метафосфорная
вода) кислота
Рис. 80. Сжигание фосфора под Если, фосфорный ангидрид раство-
колоколом. рять в горячей воде, к молекуле его
присоединяются три молекулы воды,
и образуются две молекулы кислоты: Н3РО4. Называется эта кислота
ортофосфорной, или просто фосфорной кислотой:
Р2О, + ЗН2О = 2НаГО4
(горячая ортофосфорная
вода) кислота
Фосфорный ангидрид жадно поглощает влагу из окружающего про-
странства; поэтому он применяется в лабораториях как превосходное
осушающее средство. Его помещают в эксикатор вместо серной кислоты
(см. рис. 24), если нужно высушить вещества, для которых высуши-
вающее действие серной кислоты недостаточно.
а
§ 2. Ортофосфорная кислота (фосфорная кислота)
н—0^
Н3РО4; структурная формула: Н—О—Р=О
н—о/
Молекулярный вес равен 98.
Ортофосфорная кислота и её соли имеют наибольшее практическое
значение.
1. Получение ортофосфорной кислоты. Физические и хими-
ческие свойства. Для технической цели фосфорную кислоту полу-
166
чают действием серной кислоты на фосфорнокислый кальций (фос-
фориты):
(нагревание)
Са3(РО4)2 + 3H2SO4 = 3CaSO4 -ф- 2Н3РО4
I
В чистом виде ортофосфорная кислота представляет собой про-
зрачные кристаллы, отличающиеся сильной гигроскопичностью.
Обычно имеют дело с концентрированным сиропообразного вида
раствором, содержащим 70—85°/0 кислоты. Ортофосфорная кислота
не ядовита: этим она резко отличается от ядовитой метафосфорной
кислоты НРО3.
(Ортофосфорная кислота реагирует с металлами, основными окис-
лами, *основаниями и солями, образуя фосфорнокислые соли.
§ 3. Соли ортофосфорной кислоты
а) Молекулярный состав. Физические и хими-
ческие свойства. Соли фосфорной кислоты называются фос-
форнокислыми, или фосфатами.
В молекуле ортофосфорной кислоты содержится 3 атома водо-
рода, способных замещаться металлами. Они могут замещаться ме-
таллами в количестве одного, двух и трёх; вследствие этого орто-
фосфорная кислота образует 3 ряда солей: первые два ряда — кислые
соли, последний ряд—средние соли.
Называются эти соли первичными, вторичными и третичными.
Ниже приведены эти ряды солей для металлов с разной валент-
ностью.
В солях содержатся оставшиеся от молекул кислоты группы атомов:
-Н2РО4 = нро4 =РО4
Названия солей:
Кислые соли Средние соли
первичные вторичные третичные
NaH2PO4 Са(Н2РО4)2 А1(Н2РО4)з Na2HPO4 СаНРО4 А12(НРО4)з Na3PO4 Ca^POJa aipo4
Из средних фосфорнокислых солей в воде хорошо растворимы
только соли натрия, калия и аммония.
167
б) Применение фосфорнокислых солей и других
соединений фосфора. Соединения фосфора в виде солей и
более сложных соединений (органические соединения фосфора) при-
меняются в медицине. Это применение их основано на том, что
фосфор, как уже говорилось, наряду с азотом является необходимой
составной частью веществ, входящих в состав живого тела. Обедне-
ние организма человека фосфором приводит к понижению работо-
способности, утомляемости, нервности, раздражительности; в этих
случаях прописывают лекарства, содержащие те или иные соединения
фосфора.
Главное применение соединений фосфора — употребление их в ка-
честве удобрений.
Растения нуждаются в фосфоре щ не получая его, не могут нор-
мально развиваться. Недостаток фосфора в почве сильно отражается
на урожае, особенно зерновых*культур.
§ 4. Фосфорные удобрения
Производство искусственных удобрений (туковая промышленность)
является одной из самых крупных отраслей основной химической
промышленности. У нас имеются большие достижения в области
применения различных удобрений для повышения урожайности со-
циалистических полей. Эти достижения — результат успехов совет-
ской агрохимии, основоположниками которой являются академики
Д. Н. Прянишников и В. Р. Вильямс.
На, почвах, имеющих кислый характер, растениями довольно хо-
рошо усваивается фосфор непосредственно из нерастворимого в воде
тонко размолотого фосфорита (фосфоритной муки). Однако для боль-
шинства почв в качестве удобрений мало пригодны трудно раствори-
мые соли; на этих почвах они плохо усваиваются растениями. Более
пригодными являются кислые соли — первичный фосфат кальция
Са(Н2РО4)2, растворимый в воде, и вторичный фосфат кальция
СаНРО4, растворимый в находящихся в почве кислотах.
Первичную соль получают, обрабатывая мелко размолотый при-
родный фосфорит или апатит серной кислотой, которую берут в ко-
личестве, соответствующем уравнению реакции:
Сау(РО4)2 + 2H2SO4 = 2CaSO4 + Са(Н2РО4)2
фосфорнокислый сернокислый фосфорнокислый
кальций — третич- кальций кальций — первич-
ный (фосфорит) ный
(суперфосфат)
Получающаяся смесь двух солей: сернокислого кальция (гипса)
и первичного фосфорнокислого кальция — называется суперфосфа-
том; он является одним из важнейших фосфорных удобрений.
Вторичный фосфорнокислый кальций употребляется в качестве
удобрения под названием преципитат. Для приготовления его сначала
163
получают из фосфорита свободную фосфорную кислоту, беря соот-
ветствующее количество серной кислоты:
(нагрегание)
Са3(РО4)2 + 3H2SO4 = 3CaS.O4 -J- 2Н3РО4
I
фосфорнокис- сернокислый фосфорная
лый кальций кальций кислота
(фосфорит) / (в осадке) (н растворе)
Раствор сливают и обрабатывают известковым молоком, т. с.
разболтанной в воде известью, которую берут в количестве, соответ-
ствующем уравйению реакции:
* H3PO4-f-Ca(OH)2 = CaHPO4-|-2H2O
* фосфорнокислый
кальций —
вторичный
Вторичный фосфорнокислый кальций, присоединяя одну молекулу
кристаллизационной воды (СаНРО4«Н2О), выпадает в осадок. Эта
выделившаяся соль и является преципитатом.
Особенно ценными являются сложные удобрения, содержащие
несколько нужных растениям элементов, например аммофосы, пред-
ставляющие собой фосфорнокислые соли аммония:
(NH4)2HPO4 и NH4H2PO4
В этом' удобрении растению сразу даются азот и фосфор, т. е.
элементы, которых чаще всего нехватает в почве.
. Производство удобрений в СССР за годы сталинских пятилегок
выросло до весьма больших размеров. Наши мощные заводы уже
опередили лучшие иностранные заводы.
Согласно пятилетнему плану восстановления и развития народного
хозяйства в 1950 г. производство фосфатных удобрений увеличилось
в 1,9 раза по сравнению с 1940 г.
Широкое использование удобрений вместе с другими мероприя-
тиями по повышению урожайности, проводимыми партией и прави-
тельством, обеспечивает высокую урожайность колхозных полей.
Валовой урожай зерна в 1950 г. превысил уровень 1940 г. на
345 миллионов пудов; при.этом производство пшеницы увеличилось
против довоенного уровня на 376 миллионов пудов. В 1949 и 1950 гг.
урожайность зерновых культур была на 13°/0 выше, чем в 1940 г.
Валовой урожай картофеля в 1950 г. превысил довоенный уро-
вень на 21°/0.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Почему фосфор не встречается в природе в свободном состоянии?
2. Какие вы знаете видоизменения фосфора и каковы их свойства?
3. Как получается фосфор?
4. Для чего применяется фосфор?
169
5. Как изготовляют безопасные спички?
6. Какое употребление находит фосфор в военном деле?
7. Какой продукт, образуется при горении фосфора (ур. р.)?
8. Какая кислота образуется при растворении фосфорного ангидрида
в холодной воде? в горячей воде?
9. Напишите структурные формулы фосфорного ангидрида, метафосфор-
пой и ортофосфорной кислот.
10. Какие фосфорнокислые соли употребляются в качестве удобрений? •
ГЛАВА IV
ГРУППА УГЛЕРОДА
Углерод С, кремний Si, германий Ge, олово Sn, свинец РЬ пред-
ставляют собой группу сходных по химическим свойствам элементов.
Расположены они в IV группё*таблицы Менделеева. Из этих элемен-
тов мы будем изучать только углерод и кремний. .
У элементов группы углерода во внешнем электронном слое
имеется 4 электрона (валентные электроны).
Атомы этих элементов могут терять 4 электрона и заряжаться
положительно (высший заряд равен —]— 4).
Могут атомы присоединять 4 электрона и заряжаться отрицательно
(в этом случае заряд равен —4).
В высших кислородных соединениях элементы группы углерода
проявляют валентность (положительную), равную номеру группы,
т. е. 4.
+ 4 — 2
Общая формула высших окислов их: RO2.
В водородных соединениях эти Элементы проявляют валентность
1)
(отрицательную), равную 8 — 4 = 4. Общая формула водородных
-4+1
соединений их: R Н4.
Z. УГЛЕРОД И ЕГО СОЕДИНЕНИЯ •
А. УГЛЕРОД
Химический знак: С (читается: це).
Атомный вес равен 12.
Атом углерода имеет во внешнем электронном слое четыре элек-
трона. Атомы углерода могут соединяться друг с другом с образова-
нием длинных цепей (иногда с различными ответвлениями) и колец,
чем объясняется огромное количество соединений углерода (органиче-
ских соединений). Валентность углерода почти всегда равна четы-
рём (кроме окиси, где углерод двухвалентен).
г) Номер группы.
170
Элемент углерод образует аллотропические видоизменения: алмаз,
графит и аморфный углерод (древесный уголь, сажа).
Углерод в виде угля и сажи известен с древних времён.
В дальнейшем было установлено, что алмаз и графит тоже со-
стоят из углерода, так как при сжигании в кислороде дают только
углекислый газ.
1. Физические свойства аллотропических видоизменений угле-
рода. Алмаз в чистом виде — бесцветное прозрачное вещество, сильно
преломляющее свет. Встречается в природе в виде кристаллов.
Алмаз — довольно тяжёлое вещество: в 3,5 раза тяжелее воды
(удельный вес равен 3,5). Он твёрже всех других природных тел
(твёрдость его обозначают числом 10, а твёрдость прочих тел—
соответственно меньшими числами).
Графит представляет собой непрозрачное жирное на ощупь мелко-
кристаллическое вещество темносерого цвета. Удельный вес его 2,2,
т. е. меньше, чем у алмаза. В противоположность последнему, графит
настолько мягок, что легко царапается ногтем и им можно писать
на бумаге. Твёрдость графита выражается числом 0,5—1.
Поразительное различие в свойствах алмаза и графита объясняется
тем, что атомы углерода расположены в них по-разному. Как
показали позднейшие исследования, в алмазе все атомы углерода
расположены на одинаковом расстоянии друг от друга, образуя
весьма прочную структуру. В графите же они расположены слоями.
Расстояния' между атомами в слоях одинаковы, но между атомами
соседних слоёв — значительно большие; поэтому графит легко
расщепляется на тонкие слои („чешуйки") и может оставлять на
•бумаге след.
2. Химические свойства углерода. Углерод в виде алмаза п гра-
фита почти не вступает в химические реакции. Оба эти вещества
проявляют способность лишь к соединению с кислородом при очень
высокой температуре.
При обычной температуре уголь тоже химически мало активен;
при нагревании же легко вступает в соединение с кислородом. При
очень высокой температуре он способен соединяться также с водоро-
дом, многими металлами и металлоидами (серой и др.).
а) Соединение углерода с водородом и металлами.
Углерод в виде древесного угля (сажи) соединяется с водородом
только при нагревании выше 1200°, образуя газообразное вещество
метан и др.;
(сильное
нагревание)
С4-2Н2 = СН4
метан
При ещё более высоких температурах углерод соединяется с ме-
таллами, образуя углеродистые металлы:
(сильное
нагревание)
Са-|~2С = СаСв
карбид
кальция
б) Соединение углерода с кислородом и другим'и
металлоидами. При горении угля в кислороде или воздухе обра-
зуется высший окисел — двуокись углерода, или углекислый газ:
(горение при избытке кислорода)
Cq-O3 = CO2
двуокись
углерода
В углекислом газе углерод четырёхвалентен. При недостатке
кислорода образуется окисел с меньшим содержанием кислорода —
окись углерода, или угарный газ:
(горение при недостатке
’ кислорода)
2С 4-О2 = 2СО-
ОПИСЬ
углерод^
Углерод в этом окисле двухвалентен.
При высокой температуре уголь реагирует со многими метал-
лоидами. Например, при пропускании паров серы через раскалённый
уголь образуется сероуглерод:
окись меди с углем
Рис. 81. Восстановление меди углем.
(нагревание)
C4-2S = CS2
сероуглерод
Сероуглерод представляет со-
бой жидкость, употребляемую
в качестве растворителя жиров,
масел, смолистых веществ и для
других целей.
в)Взаимодействиеугле-
рода со сложными веще-
ствами. Углерод при высокой
температуре способен отрывать
кислород от содержащих его
как восстановитель. Этим поль-
кислород руду
сложных веществ, т. е. действовать
зуются для получения металлов из руд. Содержащую
нагревают с углем; кислород присоединяется к углероду, а металл
выделяется в свободном состоянии.
Восстановительное действие углерода удобно наблюдать на опыте
с получением меди из окиси меди.
Для этого нагревают хорошо перемешанную смесь порошка окиси
меди с четырёхкратным количеством порошка древесного угля; обра-
зующийся газ пропускают в известковую воду (рис. 81). При нагре-
вании происходит восстановление меди:
(нагревание)
2CuO-|-С = 2СиСО2
Углекислый газ обнаруживается по помутнению известковой
воды, а выделившаяся свободная медь видна при рассматривании
высыпанного на бумагу порошка.
172
3. Углерод в природе. Наиболее чистым углеродом, встречаю-
щимся в природе, являются алмаз и графит. Алмаз встречается
сравнительно редко — в виде отдельных кристаллов небольшой
величины. Крупные алмазы встречаются очень редко. Самый круп-
ный из найденных до настоящего времени алмазов весит немного
более 600 г.
Графит, в противоположность алмазу, встречается в виде сплош-
ных мощных отложений. У нас богатые залежи графита находятся
в Сибири в Алтайских горах и других местах.
Углерод широко распространён в природе в виде сложных соеди-
нений. В виде углекислого газа он находится в воздухе, в виде солей
угольной кислоты — в земной коре (известняки-и др.), в виде особенно
сложных соединений — в телах растений и животных.
Смесь сложных соединений углерода представляет собой нефть —
природное жидкое топливо.
Особенно богато углеродом природное твёрдое топливо — различ-
ные виды каменного угля. Каменный уголь встречается в различных
местах земного шара. Богатейшие залежи его имеются в СССР.
Образовался он в давно прошедшие геологические эпохи из деревьев,
которые массами попадали на дно водоёмов. Деревья заносились
леском, глиной и другими породами и медленно разлагались без
доступа воздуха.
Газообразные и жидкие продукты разложения удалялись, а в
остатке получалась твёрдая масса, обогащённая углеродом. Чем боль-
ше времени прошло от начала этого процесса (т. е. чем древнее
уголь), тем больше в нём содержится углерода, тем он плотнее и
темнее окрашен. Поэтому уже по внешнему виду различаются угли
более древние: антрацит (содержащий до 96°/0 углерода), каменный
уголь (содерхсащнй до 82°/0 углерода) и менее древний бурый уголь
(содержащий до. 72°/0 углерода). В сухом дереве в среднем содер-
жится 50°/0 углерода.
В природе подобный процесс происходит также с растительным
покровом болет, в основном состоящим из мха. В этом случае обра-
зуется торф, находящий широкое применение в качестве топлива
(содержание углерода в нём доходит до 57°/0).
Растительное происхождение торфа бывает ясно видно по сохра-
нившимся в нём не успевшим разложиться остаткам растений.
4. Применение углерода. Лучшие сорта алмазов, в обработанном
виде называемые бриллиантами, применяются для украшений как дра-
гоценные камни. Худшие сорта алмазов используются, благодаря
большой твёрдости, для бурения горных пород, резки стекла, шли-
фовки драгоценных камней.
Графит, отличающийся большой огнестойкостью (температура пла-
вления около 3500°), используется в смеси с глиной для изготовления
огнеупорных тиглей („графитовые тигли“). Благодаря способности
оставлять на бумаге след, он употребляется для изготовления каран-
дашей, а в виде тонкого порошка (иногда вместе с машинным маслом)
применяется как смазочный материал для машин.
173
Каменный уголь и торф употребляются в качестве топлива, но
неизмеримо большее значение они имеют (особенно каменный уголь)
как сырьё, из которого получают весьма ценные Сложные вещества,
идущие на приготовление красителей, лекарственных веществ, взрыв-
чатых веществ и др.
Получаемый при обжиге дерева древесный уголь употребляется
в качестве горючего материала.
Особое применение имеет древесный уголь как поглотитель газо-
образных и растворимых в
воде веществ.
Уже в обыдённой жизни можно
наблюдать эти свойства угля. Напри-
мер, при кипячении воды для питья
(чай и пр.) в кастрюле, в которо^й
перед этим варился обед, вода
обычно принимает неприятный при-
йкус и запах от примеси жира и
других веществ. Для уничтожения
такого запаха и привкуса в кипяток
следует бросить несколько чистых
древесных угольков, и вода станет
приятной и годной для питья. Проис-
ходит это потому, что уголь погло-
-щает, или, как иначе говорят, адсор-
бирует жпр и другие примеси.
Адсорбция углем подробно изуча-
лась советским учёным, академиком
Н. Д. Зелинским.
Н. Д. Зелинский родился в 1861 г.
в г. Тирасполе. Крупнейший советский
т_т « тт О « химик. Один из основоположников совре-
Николаи Дмитриевич Зелинскии. менного органического катализа. Им
открыто много реакций с органическими
веществами, имеющих очень большое теоретическое и практическое значение.
С именем Н. Д. Зелинского связаны работы по использованию и переработке'
нефти. С 1929 г.— действительный член Академии наук СССР. В 1945
присвоено звание Героя Социалистического Труда.
Явление адсорбции порошкообразным углем было открыто русским
миком Товием Егоровичем Ловицем ещё в конце XVIII в.
Особенно подробно это явление изучено Н. Д. Зелинским и его
ками. Эти' исследования имеют большое теоретическое и практическое
значение, так как уголь широко применяется в технике: в сахарной про-
мышленности, при производстве винного спирта, для осветления мутных
- жидкостей и пр.
г. ему
акаде-
учени-
Зелинский в первую мировую войну предложил использовать акти-
вированный уголь для изготовления универсальных угольных противо-
газов. Противогаз Зелинского нашёл широкое применение и спас много
жизней русских солдат. В настоящее время этот противогаз значи-
тельно усовершенствован.
Как показано на рисунке 82, коробка противогаза наполняется
углем, через который проходит вдыхаемый воздух. Уголь для этих
174
целей берется специально обработанный. Его нагревают без доступа
воздуха (в особых сосудах) до высокой температуры, причём время
от времени пропускают горячий пар. Пропускание пара и после-
дующее накаливание угля придают ему большую пористость;
благодаря этому увеличивается его поглотительная способность.
Получаемый после такой обработки уголь называется активирован-
ным. Такой уголь и употребляется в противогазе академика Зелин-
ского.
Уголь и нефть (о ней будет сказано
дальше) являются основным видом топлива,
которое необходимо фабрикам и заводам.
По образному выражению В. И. Ленина,
они „хлеб промышленности11.
Царская Россия по добыче угля зани-
мала шестое место в мире, пятое в Европе.
При советской власти положение в
угольной промышленности резко измени-
лось. В первой же пятилетке вступили
в строй новые угольные бассейны: Кара-
ганда в Средней Азии, Ткварчели в За-
кавказье и др.
Во второй пятилетке были освоены:
мощный Кузнецкий бассейн, Черемховский
и Буреинские каменноугольные копи в
Восточной Сибири; было также положено
начало разработке каменного угля на Край-
нем Севере.
Ко второй мировой войне добыча
угля в капиталистических странах сохра-
нилась на уровне 1913 г., а в СССР
она возросла в 4,6 раза ш, что особенно
важно, было механизировано 9О°/о добычи
угля.
Добыча угля в 1950 г. составила
1О4°/о к заданию пятилетнего плана и
увеличилась по сравнению с довоенным
уровнем на 57°/0. Восстановлены уголь-
ные шахты в пострадавших от войны
Рис. 82. Противогаз.
1 —маска; 2—очки; 3—край маски,
плотно охватывающий голову;
4—тройник; 5—клапан для выхода
выдыхаемого воздуха; б — трубка;
7 — коробка противогаза; 8 — раз-
рез коробки; 9 — решётки, разде-
ляющие слои поглощающих ве-
ществ (угля и др.); 10 — клапан
для прохода вдыхаемого воздуха.
районах. Шахты Донбасса
дают угля больше, чем до войны, и больше, чем предусмотрено
пятилетним планом. Добыча угля в Подмосковном бассейне увели-
чилась по сравнению с довоенным уровнем в 3 раза. Наряду с вос-
становлением Донбасса и Подмосковного бассейна продолжалось
развитие угольной промышленности на Урале, в Кузбассе, в Кара-
гандинском бассейне и в других районах страны. На Востоке
в 1950 г. добыто угля в два с лишним раза больше, чем
в довоенное время. Значительно расширена новая угольная
база — Печорский бассейн. Превышен довоенный уровень добычи
торфа.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какие существуют видоизменения свободного углерода и чем объясняется
их различие?
2. Как доказано, что уголь, алмаз и графит состоят из атомов одного
и того же элемента?
3. Что представляют собой каменный уголь, торф?
4. Где находит применение активированный уголь?
Б. СОЕДИНЕНИЯ УГЛЕРОДА С ВОДОРОДОМ
§ 1. Метан, болотный газ
н
СН4; структурная формула: Н—С—Н
Н
Молекулярный вес равен 16.
Метан — простейшее соединение углерода с водородом.
1. Получение метана. В лабораторных условиях метан получают
(рис. 83, Л) нагреванием смеси уксуснокислого натрия (лучше уксусно-
кислого калия) и натронной извести. Реакция происходит между
уксуснокислым натрием и едким натром из натронной извести, кото-
рая представляет собой смесь едкого натра и гашёной извести. Реак-
ция протекает по уравнению:
(нагревание)
CH3COONa 4- NaOH = Na2CO3 -f- CH4
уксуснокислый углекислый метан
натрий натрий
2. Физические свойства метана. Метан — газ без цвета и за-
паха; в воде практически не растворяется; почти вдвое легче воздуха.
3. Химические свойства метана. При обычных условиях метан —
устойчивое вещество. В чистом виде при поджигании спокойно горит
на воздухе (рис. 83, Б), образуя углекислый газ и воду:
(горение)
СН4 4- 2О2 = СО2 4- 2Н2О
Смесь метана с воздухом при поджигании взрывается с большой
силой, подобно гремучему газу; поэтому собирать метан для опытов
можно только совершенно чистый — без примеси воздуха — во избе-
жание взрыва. Для определения того, достаточно ли чистый метан
выходит из трубки, его пропускают в воду и поджигают появляю-
щиеся на поверхности воды пузыри. Если они сгорают спокойно, ме-
тан можно собирать в сосуд (рис. 83, А).
Если заполнить метаном только у-g объема сосуда, а в остальную
часть дать войти воздуху, то при поджигании смеси происходит
176
сильный взрыв. При проведении
опыта склянку необходимо
предварительно обернуть поло-
тенцем (рис. 83, В), так как
иначе опыт опасен.
4. Метан в природе. При-
родные газы. Метан обра-
зуется в природных условиях.
Он является главной составной
частью природных горючих га-
зов, выделяющихся в некото-
рых местах из земли и нзвёст-
ных под названием рудничного
и болотного газа.
Метан образуется на дне
болот и вообще стрячих водоё-
мов в результате разложения
гниюших веществ (болотный газ)
янно наблюдается в болотах; есл
собрать газ (рис. 84) и установить его
Рис. 84. Собирание болотного газа.
Рис. 83. Метан.
А — получение метана; Б — горение метана;
в цилиндр наливается вода для вытеснения ме-
тана. В — взрыв смеси метана с воздухом.
Выделение пузырьков этого газа посто-
[ пошевелить дно болота палкой, можно
горючесть (рис. 83, Б).
Большую опасность
представляет рудничный
газ, накапливающийся в
каменноугольных рудни-
ках при плохой вентиля-
ции их. Образующаяся
с воздухом взрывчатая
смесь легко воспламе-
няется от огня шахтёр-
ских ламп. Это нередко
приводило к ужасным ка-
тастрофам с человечески-
ми жертвами. Предотвра-
ти n. R ,Пр
177
щение их стало возможным только после изобретения англичанином
Деви (1817) специальной лампы (рис. 85, Л).
В этой лампе огонь отделяется от наружного пространства гу-
стой медной сеткой. Благодаря хорошей теплопроводности меди
сетка рассеивает тепло в пространство; поэтому снаружи лампы не
получается пламени или перегрева воздуха (рис. 85, Б), отчего
мог бы произойти взрыв, В настоящее
А
время в шахтах пользуются электрическим
светом.
В некоторых местах земного шара в
глубинных слоях находятся большие запасы
горючего газа, главной составной частью
которого является метан. Такой газ исполь-
зуется в качестве очень ценного топлива.
Например, в Дагестане на природном газе
работает большой стекольный завод. В на-
стоящее время проведён газопровод Сара-
тов— Москва для широкого использования
в промышленных и бытовых целях бога-
тейших запасов са-
ратовского газа.
Москва полу-
чает по газопрово-
ду около 1500 тыс.
кубометров газа
ежедневно. Газо-
вым топливом мож-
но заменить за год
3 млн. 150 тыс.
кубометров дров.
Построен и вве-
Рис. 85. Рудничная лампа.
А — лампа в разрезе; Б — опыт с сеткой: пламя не
проходит через сетку.
дён в действие так-
же газопровод Да-
шава — Киев. Он
передаёт газ из га-
зовых месторождений западных областей Украины. Ежесуточно по
этому газопроводу поступает 2,5 млн. кубометров газа.
Построен и введён в действие ещё газопровод Кохтла — Ярве—
Ленинград.
Газообразное топливо позволяет получать наиболее высокие
температуры, так как при сжигании легко достигается полное смеше-
ние горючего газа с кислородом воздуха.
При употреблении в бытовых условиях газообразного топлива
необходимо строго следить за исправностью горелок, кранов и не
допускать малейшей утечки газа, так как он образует с воздухом
взрывчатую смесь, а кроме того ядовит.
Соединений углерода с водородом — углеводородов — существует
большое количество. Простейший из них — метан.
178
Углеводороды относятся к большой группе соединений углерода,
объединяемых под общим названием органические вещества. По-
дробнее они будут рассматриваться дальше.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Приведите формулу метана.
2. Как получается в лаборатории метан (ур. р.)?
3. Укажите физические свойства метана.
4. Укажите главнейшие химические свойства метана.
5. Что происходит при поджигании чистого метана и смеси его с воз-
духом?
6. Какие продукты образуются при горении метана?
7. Где в природных условиях встречается метан?
8. Что называется рудничным газом и какую он представляет опасность?
9. Какие принимаются меры для предотвращения возможности взрыва
газа в шахтах?
В. СОЕДИНЕНИЯ УГЛЕРОДА С КИСЛОРОДОМ
• о
§ 1. Окись углерода (угарный газ)
СО; структурная формула: С = О
Молекулярный вес равен 28.
Углерод в окиси углерода проявляет только две валентности-
(2) из возможных четырёх.
1. Получение окиси углерода. Окись углерода, или угарный
'газ, получается при взаимодействии углекислого газа с раскалённым
углем:
(высокая температура)
- CO2-j-C = 2CO
двуокись угле- окись углерода
рода (углекис- (угарный газ)
лый газ)
Окись углерода образуется также при сгорании угля или угле-
родсодержащего топлива в условиях недостаточного доступа воз-
духа. Поэтому образование её наблюдается в домашних условиях
при преждевременном закрывании печи. В технике окись углерода
получают, продувая воздух через толстый слой раскалённого угля
2. Физические свойства окиси углерода. Окись углерода —
бесцветный газ; не имеет запаха. При—191 °,5 сгущается в жидкость,
замерзающую при —205°.
Окись углерода немного легче воздуха; плотность её по воздуху,
28
вычисляемая по молекулярному весу, равна = 0,965.
3. Химические свойства окиси углерода. Окись углерода —
несолеобразующий окисел. Для окиси углерода характерна способ-
ность к реакциям присоединения, так как в ней углерод проявляет
не все возможные валентности (только 2 из возможных 4).
12*
179
а) Взаимодействие окиси углерода с кислородом
и ок ислам и металлов. Окись углерода способна присоединять
кислород — гореть, превращаясь в углекислый газ:
(горение1
2СО + О2 = 2СО2
Горение окиси углерода можно наблюдать при топке печей. Под
конец топки над раскалёнными углями обычно вспыхивают бледно-
голубые огоньки; это и есть пламя сгорающей окиси углерода.
Окись углерода способна отнимать кислород от его соединений.
При нагревании она реагирует с окислами металлов и восстанавли-
вает металл до свободного состояния:
(нагревание)
рьо-|-со=рь+со2
окись свинца свинец
(нагревание)
Fe2O3ЗСО = 2FeЗСО2|
окись железа железо
б) Действие окиси углерода на организм.. Проявляе-
мая окисью углерода большая химическая активность объясняет
сильное ядовитое действие её на организм.
При вдыхании она попадает в кровь и быстро срединяется
с красящим веществом кровяных клеток — гемоглобином. Как из-
вестно, гемоглобин поглощает поступающий через стенки лёгких
кислород воздуха и разносит его по всему телу. Этим он обеспе-
чивает внутриклеточное дыхание, без чего жизнь организма невоз-
можна. Соединившись же с окисью углерода, гемоглобин теряет
способность поглощать кислород, и от этого происходит быстрая
смерть. Окись углерода настолько ядовита, что примесь её к воздуху
О,2°/о вызывает потерю сознания, а около 1°/0 — приводит к смерти.
В случае образования её в бытовых условиях (в печи, в самоваре),
люди, как говорят, „угорают"; от этого произошло название газа
„угарный газ“. При лёгком отравлении дело может ограничиться
головной болью, рвотой; при более сильном — привести к смерти.
Первой мерой при отравлении угарным газом является перене-
сение отравленного на свежий воздух; в тяжёлых случаях необходим
срочный вызов врача.
в) Взаимодействие окиси углерода с хлором. Окись
углерода способна присоединять не только кислород, но и другие
металлоиды, например хлор; продуктом реакции является газооб-
разное вещество фосген:
СО4-С12 = СОС12
фосген
/С1
Структурная формула этого соединения; С=О
180
Соединение хлора с окисыа углерода легко происходит на сол-
нечном свету или в присутствии активированного угля, играющего
роль катализатора.
Фосген очень ядовит, и в первую мировую войну немцы при-
менили его в качестве боевого отравляющего вещества. Он приме-
няется также в производстве'красителей.
4. Применение окиси углерода. Окись углерода находит разно-
образное применение. Она используется как горючий материал,
являясь составной частью
искусственно получаемого
газообразного топлива — ге-
нераторного и водяного
газов. Служит она также
исходным материалом для
получения разнообразных
органических веществ.
а) Генерат’орный
газ. Генераторным* га?ом
называется газ, получаю-
щийся в особых печах и со-
держащий в качестве горю-
чего вещества окись угле-
рода.
Употребляемые для по-
лучения его печи называют-
ся газогенераторами (что
означает рождающий газ).
В газогенераторной печи
(рис. 86) через высокий
слой раскаленного угля про-
дувается воздух. В нижней
с образованием углекислого
Рис. 86. Газогенератор.
части печи происходит сгорание угля
газа:
С -J- О2 — СО2
Выделяющееся тепло нагревает вышележащие слои угля до крас-
ного каления, и здесь происходит образование окиси углерода:
СО24-С = 2СО
В получающемся газе содержатся: окись углерода до 29°/0,
азот из воздуха до 7О°/о, остальное — углекислый газ и некоторые
другие газообразные вещества.
Генераторный газ как содержащий окись углерода очень ядо-
вит, и это приходится иметь в виду при пользовании им.
Применяется генераторный газ при выплавке металлов из руд,
в газогенераторных автомашинах и в других случаях.
В 1950 г. производство газа из угля и сланцев по пятилетнему
плану в количестве 1 млрд. 900 млн. кубометров выполнено.
181
Построены газосланцевые заводы на территории Эстонской ССР и
в «Ленинградской области.. В результате Ленинград получает около
3 млн. 500 тыс. кубометров газа в сутки.
Д. И. Менделеев в 1888 г. впервые высказал мысль о возмож- \
ности получения газообразного топлива непосредственно в подзем-
ных отложениях каменного угля. Подземная газификация угля, кото-
рой придавал большое значение В. И. Ленин, могла быть осуще-
ствлена только в условиях социалистического планового хозяйства.
Сущность подземной газификации угля заключается в том, что
под землёй поджигается выделенный участок угля и за счёт частич-
ного сгорания его получается горючий газ, подобный генераторному.
По предварительно проделанному каналу в этот участок с поверх-
ности подаётся под давлением обогащённый кислородом воздух,
а по другим каналам выходят продукты неполного сгорания угля,
представляющие собой горючий газ. Впервые в мире . подземная
газификация угля в промышленных масштабах была осуществлена
в 1937 г. в Донбассе. Слой угля был подожжён на глубине 130 м.
По пятилетнему плану продолжаются работы по подземной гази-
фикации угля и выработка газа подземной газификации доведена до
920 млн. кубометров в год.
б) Водяной газ. Водяным газом называется газ, образую-
щийся при пропускании водяного пара через слой накалённого угля.
Он представляет собой смесь равных объёмов окиси углерода и
водорода, получающихся в результате реакции:
Н2О + С = СО4-Н2
В водяном газе в качестве примесей содержатся ещё: углекислый
газ (до 5°/0), азот (до 5°/0) и некоторые другие вещества. Он даёт
больше тепла, чем генераторный газ.
Водяной газ применяется не только в ’ качестве топлива; он
используется также для получения водорода в производстве синте-
тического аммиака.
§ 2. Двуокись углерода (угольный ангидрид, углекислый газ)
//Q
СО2; структурная формула: С\
^0
Молекулярный вес равен 44.
Углерод в этом соединении проявляет высшую положительную
валентность, равную-}-4.
1. Получение углекислого газа. Углекислый газ может быть
получен разными способами. Он образуется при следующих реакциях:
а) При горении угля и всех углеродсодержащих горючих веществ:
(горение)
C-|-O, = CO2t
СН4 4- 2О2 = 2Н2О 4- СО2 f
182
б) При действии кислот на соли угольной кислоты, например
известняк (мел, мрамор):
СаСО3 4- 2НС1 = СаС12 + Н2О + СО2 f
углекислый кальций
(изрестняк)
Пользуясь этой реакцией, углекислый газ получают в лаборатор-
ных условиях в таких же прибора'х, как и водород.
в) При обжиге известняка (проводимом в больших размерах для
получения извести):
в (накаливание)
СаСО3 = СаО + СО2 f
известняк известь
# негашёная
газа. Углекислый газ —
2. Физические свойства углекислого
вещество без цвета и запаха.
Рис. 87. Получение углекислого газа.
А — собирание углекислого газа; Б — горящая лучина в углекислом газе
погасла; В — горение магния в углекислом газе.
Плотность его по воздуху (вычисляемая, исходя из молекуляр-
> 44
ного веса) равна gg = 1 ,52; отсюда следует, что он приблизительно
в П/2 раза тяжелее воздуха. Благодаря этому его можно собирать
в сосуд, лишь прикрытый сверху куском стекла или картона
(рис. 87, Л)’.
При давлении около 60 атм без дополнительного охлаждения
углекислый газ превращается в бесцветную жидкость. В жидком
состоянии его хранят в стальных цилиндрах („бомбах", рис. 27).
При сильном охлаждении, которое можно получить, давая жидкому
углекислому газу возможность свободно испаряться, он превра-
щается в твёрдое тело, по внешнему виду похожее на снег. Эту
снегообразную массу прессуют, так как в таком виде она испаряется
183
сравнительно медленно. Под названием „сухой лёд" твёрдый угле-
кислый газ применяется как охлаждающее вещество.
В воде углекислый газ растворяется довольно хорошо: 1 объём
воды при обычных условиях растворяет около 1 объёма газа.
В природе встречаются источники, содержащие углекислый газ
(например, „нарзан"), употребляемый для питья. Такая вода вызывает
усиленное выделение желудочного и кишечного сока и способствует
пищеварению. При повышении давления растворимость СО2 значи-
тельно увеличивается; этим пользуются при изготовлении шипучих
напитков. Если открыть бутылку с водой, насыщенной под давлением
углекислым газом (газированная вода), из неё с шипением будет
выходить избыток газа. Углекислый газ, попадая в желудок, действует
как лёгкое возбуждающее средство и этим способствует пищеварению.
3. Химические свойства углекислого - газа. Углекислый газ не
горит и не поддерживает горения большинства веществ. Не под-
держивает он также дыхания. Горящая лучина или свеча, погружён-
ная в сосуд с углекислым газом, тотчас гаснет (рис. 8,7, Б).
Углекислый газ является прочным соединением; только химически
достаточно активные металлы могут оторвать от него кислород и
выделить углерод (уголь) в свободном виде. Например, зажжённая
лента магния продолжает гореть в углекислом rase (рис. 87, В)
с образованием окиси магния и выделением углерода:
СО2 4- 2Mg = 2MgO -f- С.
окись магния ’
Углекислый газ является кислотным окислом — ангидридом уголь-
ной кислоты.
Если пропускать углекислый газ в воду, в которую добавлен
раствор синего лакмуса или помещена синяя лакмусовая бумажка
окраска лакмуса изменяется в красную от действия образующейся
кислоты.
Как ангидрид углекислый газ вступает в реакцию с основными
окислами и основаниями, образуя углекислые соли:
СаО 4-СО2= СаСО3
окись кальция углекислый кальций
2NaOH 4- СО2 == Na2CO3 4~ Н2О
гидрат окиси углекислый
натрия натрий
Са(ОН)2 4- СО2 = СаСО3 Н2О
гидрат окиси ।
кальция т
углекислый
кальций
Последняя реакция, как уже говорилось, применяется для обна-
ружения углекислого газа, так как при ней получается нераствори-
мый в воде осадок (углекислый кальций).
4. Применение углекислого газа. Углекислый газ применяется
для получения соды Na2CO3, приготовления газированных вод, сухого
льда, для тушения пожаров и в других случаях.
184
§ 3. Угольная кислота
Н—(X
Н2СО3; структурная формула: j>C = O
Н—(X
Молекулярный вес равен 62.
1. Получение угольнбй кислоты и её свойства. Угольная кисло-
та получается при растворении в воде углекислого газа:
СО2-1-Н2О^Н2СО3
В раствору, однако, может находиться только весьма небольшое
количество молекул угольной кислоты, так как она легко распадается
обратно на вбду и углекислый газ:
H2CO3ztH2O4-CO2t
Вследствие нестойкости молекул угольной кислоты её не удаётся
выделить в свободном виде. Соли же её достаточно прочны.
§ 4. Соли угольной кислоты
Соли угольной кислоты называются углекислыми, или карбона-
тами.
Угольная кислота содержит в молекуле два атома водорода,
способных замещаться металлами; поэтому она образует два ряда со-
лей — средние (карбонаты) и кислые (бикарбонаты).
В. солях содержатся оставшиеся от молекул кислоты группы атомоз: !
= СО, ° - НСО3
. Соли
средние кислые
Названия солей
углекислые; карбонаты кислые углекислые; двууглекислые; бикарбонаты
Формулы Технические названия Формулы Технические названия
Na2CO3 Сода углекислая NaHCO3 Сода двууглекислая
К2СО3 Поташ КНСО3
(NHJoCO-; NH4HCO3
СаСО3 Са(НСО3)2
185
В средних солях замещены металлом оба атома водорода, а в
кислых солях замещён только один атом водорода.
1. Физические и химические свойства углекислых солей. Угле-
кислые соли — твёрдые кристаллические вещества, отличающиеся
различной растворимостью. В воде хорошо растворимы средние и
кислые соли натрия, калия и аммония, а также кислые соли двухва"
лентных металлов: магния Mg(HCO3)2, кальция Са(НСО3)2, желе-
за Fe(HCO3)2 и некоторых других. Средние же соли этих металлов
и все соли других металлов в воде практически нерастворимы (см.
таблицу растворимости, стр. 51).
Углекислые соли проявляют все общие свойства солей; они всту-
пают во взаимодействие с основаниями, кислотами, солями:
Na2CO3 4-Са(ОН)2 = СаСО3 + 2NaOH
углекислый натрий ’•
углекислый
кальций
Na2CO3 4-2НС1 = 2NaClН2О + СО21
Na2CO3 4- СаС12 = СаСО34~ 2NaCl
I
При второй реакции вследствие непрочности угольной кислоты
происходит выделение углекислого газа. По этому признаку легко
распознаются углекислые, соли, так как эта реакция происходит
также с солями, нерастворимыми в воде. Это является характерной
особенностью солей угольной кислоты.
Углекислые соли кальция, магния и других менее активных ме-
таллов разлагаются при нагревании на углекислый газ и окись
металла;
(нагревание)
MgCOs = MgO + CO2t
(нагревание) 1
СаСО3 = СаО СО2 f
Разложением природного углекислого кальция — известняка — при
накаливании пользуются для получения негашеной извести и угле-
кислого газа.
Некоторые углекислые соли разлагаются гораздо легче известняка.
Например, минерал малахит, представляющий собой основную углекис-
лую медь, разлагается уже при сравнительно слабом нагревании.
В молекулах этой соли содержится, кроме кислотного остатка
ещё гидроксильная группа. Такие соли называются основными. Для
простоты их можно представить в виде соединённых между собой
молекул средней соли и гидрата окиси. Формулу малахита, например,
изображают в следующем виде:
СиСО3.Си(ОН)2
186
При нагревании малахит разлагается с выделением воды и угле-
кислого газа; в остатке получается окись меди чёрного цвета:
(нагревание)
CuCO3-Cu(OH)2 = 2CuO 4-H2O4-CO2f
основная углекислая окись меди
медь (малахит) (чёрного цвета)
2. Важнейшие углекислые соли. Углекислый кальций,
карбонат кальция <СаСО3. Из углекислых солей особый инте-
рес представляет углекислый кальций, широко распространённый в
природе. Образованные им минералы носят общее название извест-
няков. Разновидностями известняка являются: строительный извест-
няк, мрамор, мел и др.
Углекислый ^ау1ьций может переходить в кислую соль и обратно.
При пропускании углекислого газа в известковую воду сначала обра-
зуется осадок нерастворимой в воде средней соли:
СО2 + Са(ОН)2 = СаСО3 + Н2О
I
углекислый
" кальции
При дальнейшем пропускании углекислого газа осадок раство-
ряется вследствие перехода средней соли в кислую соль:
СаСО3 -f- СО2 + Н2О = Са(НСО3)2
» углекислый кислый углекислый
| кальций кальций
Если полученный прозрачный раствор прокипятить, он снова
мутнеет вследствие обратного превращения кислой соли в нераство-
римую среднюю соль:-
(нагревание)
Са(НСО3)2 = СаСО3 + Н2О СО2 f
кислый углекислый 7
кальций т
углекислый
кальций
Эти процессы происходят в природных условиях. Воды, насы-
щенные углекислым газом, соприкасаются с известняковыми поро-
дами и переводят углекислый кальций в растворимый кислый угле-
кислый кальций. Попадая затем в другие условия, выходя на
поверхность земли и испаряясь, эти воды выделяют углекислый
газ, а содержащийся в них углекислый кальций отлагается в виде
Г средней соли; таким путём происходит постоянный перенос из-
вестняка из одних мест земной коры в другие.
Вода, содержащая в растворе сравнительно много кислого угле-
кислого кальция, является жёсткой. Она неприятна на вкус; мыло
в ней не даёт пены и плохо отмывает грязь. При кипячении такой
воды кислый углекислый кальций переходит в углекислый по при-
187
ведённому выше уравнению реакции и выделяется в осадок. В ре-
зультате этого вода становится мягче, вкус её улучшается, она
становится более пригодной для питья и стирки. Жёсткость воды,
вызываемая кислым углекислым кальцием, устраняется кипячением
и поэтому называется временной жёсткостью.
Выпадающий в осадок углекислый кальций образует всем из-
вестную накипь (в самоварах, чайниках, паровых котлах). При дей-
ствии кислоты на накипь выделяется углекислый газ, т. е. происходит
то же, что и с известняком.
Природные разновидности известняка находят разнообразное
применение. Грубые сорта употребляются в качестве строительного
материала (строительный камень), а также для получения извести и
углекислого газа путём обжига в специальных печах; мрамор идёт для
облицовки зданий и различных изделий; мел употребляется для шту-
катурки и побелки помещений. Бесцветные и прозрачные разновид-
ности известняка (известковый шпат или кальцит) употребляются
для изготовления некоторых оптических приборов.
Углекислый натрий, карбонат натрия Na2CO3. Угле-
кислый натрий называется обычно содой.
Сода широко применяется при стирке белья.
Роль её при стирке заключается в смягчении жёсткой воды.
Содержащийся в такой воде кислый углекислый кальций реаги-
рует с содой и превращается в углекислый калйций, выпадающий
в осадок:
Са (НСО3)2 -J- Na2CO3•= СаСО3 + 2NaHCO3
кислый углекислый сода 7
кальций (в жёсткой углекислый
воде) кальций
Жёсткость воды вызывается также сернокислыми солями, глав-
ным образом кальция CaSO4. При кипячении сернокислые соли не
изменяются, поэтому кипячением воды вызываемая ими жёсткость
не устраняется; такая жёсткость называется постоянной. Сода смяг-
чает и такую воду, так как переводит сернокислый кальций в не-
растворимый углекислый кальций, выпадающий в осадок;
CaSO4 Na2CO3 = СаСО3 Na2SO4
сернокислый сода J
кальций углекислый
кальций
Применяется сода в больших количествах в производстве мыла
при изготовлении стекла, выделке бумаги и во многих других произ-
водствах.
Сода находит применение также в огнетушителях. Схема устройства
огнетушителя дана на рисунке 88. В металлическом цилиндре поме-
щается раствор соды, над ним в тонком стеклянном сосуде распо-
лагается раствор кислоты. Для приведения огнетушителя в действие
188
его опрокидывают и ударяют о пол подвижным штифтом, который
разбивает сосуд с кислотой. Кислота реагирует с содой, в результате
реакции выделяется углекислый газ; газ вспенивает жидкость, и под его
давлением она выбрасывается через отверстие сильной струёй, которую
направляют в пламя. Огонь тушится не только водой, но и образую-
щимся облаком углекислого газа.
Кислый углекислый натрий, бикарбонат натрия
NaHCO3. Кислый углекислый натрий называется ещё питьевой содой,
так как он употребляет-
ся для питья в лечебных
целях.
Принятая внутрь питье-
вая сода взаимодействует
с содержащейся в же-
лудочном соке .соляной
кислотой и уменьшает её
концентрацию.. Поэтому
соду прописывают боль-
ным, страдающим по-
выщенной кислотностью;
У' них железы желудка
вырабатывают слишком
много соляной кислоты,
что является вредным
для здоровья (ощущение
изжоги, .(боли в желудке
и пр.).
Совершенно аналогич-
но соде соединение ка-
Рис. 88. Огнетушитель.
Налево — в готовом виде; направо — в действии;
А — раствор соды; Я — верхняя часть огнетушителя;
Н — выходное отверстие; Р — металлическая сетка, удер-
живающая сосуд с кислотой (7); Ш—штифт, ударяющий
в сосуд с кислотой при введении огнетушителя в действие.
лия — К2СО3 — поташ.
3. Круговорот углерода в природе. В природе всё время со-
вершается круговорот " углерода в тесной связи с круговоротом
кислорода (см. рис. 49). В основе этого процесса лежит способ-
ность зелёных растений на свету поглощать углекислый газ и вы-
делять кислород. Углерод усваивается растением и идёт на по-
строение сложных соединений, являющихся пищевыми веществами,
в первую очередь сахара, крахмала (органические вещества).
В процессе дыхания углерод возвращается в воздух в виде угле-
кислого газа.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какие соединения образуют углерод с кислородом?
2. В каких случаях при горении получается угарный газ и чем он
опасен?
3. Что представляют собой генераторный и водяной газы и для чего
они применяются?
4. При каких реакциях получается углекислый газ?
5. Для чего применяется углекислый газ?
6. Как образуется угольная кислота?
189
7. Приведите структурные формулы угольной кислоты и ее ангидрида.
8. В чём проявляется непрочность угольной кислоты?
9. Какими особенностями отличаются углекислые соли?
10. Как действует нагревание на углекислые соли?
11. Приведите примеры средних и кислых углекислых солей.
12. Как распознаются углекислые соли?
13. Какие минералы представляют Собой углекислую соль?
14. Что происходит при действии кислоты на известняки?
15. На чём основано действие огнетушителя?
Г. ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
§ 1. Общие сведения
1. Органические вещества. Органическими веществами назы-
ваются содержащие углерод вещества, способные гореть. Они обра-
зуются в телах растений и животных, а также получаются искус-
ственным путём.
Важнейшие органические вещества всем известны по пищевым
продуктам: крахмалу, сахару, жирам, белкам и др. Название „орга-
нические вещества" стало употребляться после того, как был открыт
целый ряд таких веществ в середине XVIII в., а раздел химии,
изучающий их, стал называться органической химией.
Некоторые органические вещества были известны ещё в глубо-
кой древности, хотя в чистом виде' они были 'получены гораздо
позже. ,
Ещё в доисторические времена были известны способы получения
из сладких растительных соков и мёда опьяняющих напитков, дей-
ствие которых вызывается органическим веществом — спиртом. Древ-
ним народам был известен уксус, получаемый при скисании вина.
Умели в те времена также добывать природные краски и применять
их для крашения тканей. Найденные в древних египетских гробни-
цах окрашенные ткани, не потерявшие окраски до сих пор, указы-
вают на довольно высокую технику крашения того времени. Всё
это, однако, только отдельные случаи использования органических
веществ.
Открытие большого числа подобных веществ, выделение кх
в чистом виде и систематическое изучение началось только 'с сере-
дины XVIII в.
Искусственно получать (синтезировать) какие-либо органические
вещества сначала не умели и думали, что для их образования необ-
ходимо воздействие какой-то чудесной „жизненной силы".
Дальнейшее развитие науки показало, что вера в „жизненную
силу", как и вообще во всё чудесное, является заблуждением, вызы-
ваемым недостатком знаний или упорством, поддерживаемым в поли-
тических целях.
2. Первые синтезы органических веществ. В 1828 г. учению
о „жизненной силе" был нанесён первый удар. Немецкий химик Вёлер
неожиданно для себя получил искусственным путём органическое
вещество — мочевину, образующуюся в теле животных и человека
190
и выделяющуюся с мочой. Образование мочевины произошло при
простом кипячении раствора минерального вещества — цианово-
кислого аммония. Оказалось, что это вещество и образующаяся
в телах животных мочевина состоят из одних и тех же атомов,
только иначе расположенных (рис. 89). При кипячении произошла
перегруппировка атомов, и они расположились так, как в моле-
кулах мочевины.
Виталисты (так назывались учёные, признававшие, что образование
органических веществ возможно только при наличии особой „жиз-
ненной силы*1), защищая свои взгляды, стали утверждать, что моче-
вину удалось получить только потому, что она является отбросом
живого организма. Что касается веществ, входящих в состав самого
Неорганическое
ее щество
циановокислый
аммоний
Органическое
вещество
Кипячение мочевина
Атом кислорода
Атом азота
О Атом водорода
Рис. 89. Первый синтез органического вещества.
Перегруппировка атомов в молекулах циановокислого аммония привела
к превращению его в новое вещество — мочевину.
живого тела, то, по мнению виталистов, их никогда не удастся по-
лучить без участия „жизненной силы".
Этот спор продолжался, пока не был осуществлён ряд синтезов
органических соединений, встречающихся только в телах растений и
животных. В середине XIX в. (1854) французскому химику Вертело
удалось искусственным путём получить соединения, относящиеся
к группе жиров, а русский химик ’Бутлеров впервые получил веще-
ство, относящееся к группе сахаров (1861).
После этого принципиальная возможность синтезировать все
органические вещества стала общепризнанной.
В настоящее время почти нет таких соединений, |<акие не могли
бы быть приготовлены искусственно. Если же в ря*р случаев поль-
/ зуются ещё природными соединениями, то только потому, что искус-
ственное получение, т. е. синтез их, или очень дорог, или ещё недо-
статочно изучен.
Получено теперь также большое количество веществ (красок,
лекарственных веществ и др.), которые в природе не встречаются.
Таким образом, благодаря научным исследованиям была установлена
191
ложность учения виталистов об органических веществах как про-
дуктах деятельности „жизненной силы11.
Учение о „жизненной силе", которая якобы создаёт в живом теле
органические вещества, является идеалистическим учением.
Установление правильных материалистических представлений при-
вело к пониманию истинной причины своеобразия органических веществ,
открыло пути к более глубокому изучению и искусственному полу-
чению их.
Так рушилась искусственно созданная виталистами граница между
минеральными (неорганическими) и органическими веществами, и для
„жизненной силы" не осталось теперь места. В связи с этим само
название „органические вещества" потеряло свой первоначальный
смысл; оно сохранилось до настоящего времени только как опреде-
q атом водорода
Рис. 90. Явление изомерии.
А—соль циановой кислоты; Б и В—два вещества, различие в свойствах которых вызывается
разным расположением атомов в молекулах; Г — взрыв соли гремучей кислоты (ртутной,
серебряной) от слабого удара; Д — ружейный патрон, содержащий в капсюле гремучую
ртуть.
ление, к которому все привыкли. Вместо него правильнее употреблять
название „соединения углерода", так как во все „органические
вещества" входит углерод как непременная составная часть их. Кроме
углерода, в состав органических веществ входит водород, а во мно-
гие из них также кислород, азот, сера, фосфор и другие элементы.
3. Изомерия. Превращение циановокислого аммония в моче-
вину представляло большой интерес ещё и в другом отношении:
оно наглядно показывало возможность существования совершенно
различных веществ, состоящих из одних и тех же атомов. Различие
в свойствах таких веществ, как мы теперь знаем, зависит от разного
расположения атомов в молекулах. В то время это не было изве-
стно, так как с подобными веществами только впервые начали зна-
комиться. Лишь незадолго до опыта с искусственным получением
мочевины удалось установить состав так называемой гремучей кислоты.
При этом обнаружилось поразительное явление: состав гремучей
кислоты оказался таким же, как и состав циановой кислоты (рис. 90).
192
Оставалось только признать возможность неожиданного явления—
существования двух разных веществ с совершенно одинаковым соста-
вом Причина этого явления оставалась неясной в течение ряда лет.
Только после установления целого ряда подобных явлений окон-
чательно пришли к выводу, что во всех этих случаях дело заклю-
чается в разном расположении атомов в молекулах. Это явление
было названо изомерией (от греческих слов „изос" и „мерос",
означающих „равный" и „мера"), а вещества с одинаковым составом,
но с разными свойствами были названы изомерами.
Изомерия — это явление, заключающееся в том, чтЬ
вещества с одинаковым качественным и количественным
составом имеют разное строение молекул, а поэтому разли-
чаются по физическим и химическим свойствам.
Изомеры — это вещества с одинаковым составом, но
с разным строением молекул.
Циановокислый аммоний и мочевина (см. рис. 89), циановая ки-
слота и гремучая кислота (см. рис. 90) являются изомерами.
Явление изомерии весьма широко распространено среди органи-
ческих соединений и является одной из причин существования очень
большого количества их. В то время как неорганических соедине-
ний насчитывается в настоящее время несколько десятков тысяч,
соединений углерода известно несколько сотен тысяч, и с каждым
днём число их растёт благодаря проведению новых синтезов.
Установление явления изомерии со всей очевидностью вскрыло
необходимость изучения строения молекул, особенно в случае орга-
нических соединений; строение молекул не только, приводит к пони-
манию свойств сложного соединения, но и указывает пути к его
искусственному получению (синтезу).
4. Молекулярные формулы органического вещества. Способы
их определения. Для органических веществ характерна более или
менее значительная сложность молекулярного состава. В большинстве
случаев молекулярные формулы их отличаются от эмпирических,
выводимых на основании определения качественного и количествен-
ного состава веществ. Благодаря закону Авогадро (см. стр. 83),
стало возможным определение молекулярного веса органических
веществ — газообразных или без разложения переходящих в парооб-
разное состояние.
Например, для газообразного вещества этана опытным путём
установлено содержание углерода, равное 8О°/о, содержание водо-
рода, равное 2О°/о; соотношение между ними равно 80:20. Отсюда
соотношение между количеством атомов углерода и водорода равно
80.20_ 1
12 * 1 — 3 *1 — 1 '6'
Это указывает, что на 1 атом углерода в этане приходится 3 атома
водорода, и простейшая формула его будет СН3. Молекулярный вес этана
13 в. в. Левченко
193
(так как это газообразное вещество) вычисляется по формуле M=2Dt
где D — плотность газа по водороду, находимая опытным путём.
Плотность этана по водороду равна 15; отсюда молекулярный
вес его 2 •15 = 30. Этому молекулярному весу отвечает удвоен.-
А. М. Бутлеров.
пая простейшая формула,
т. е. С2Н0.
Разработаны также
способы определения мо-
лекулярных весов для ве-
ществ, способных раство-
ряться в каких-либо жидко-
стях (эти способы здесь
рассматриваться не бу-
дут).
Для высокомолеку-
лярных веществ, не даю-
щих _ истинных раство-
ров, определение молеку-
лярного веса значительно
усложняется. В этих слу-
чаях применяются особые
методы, позволяющие по-
лучать лишь приблизи-
тельные значения молеку-
лярного веса. По этой при-
чине для таких веществ не
удаётся установить точ-
ные молекулярные фор-
мулы.
5. Теория строения органических соединений. Знаменитый
русский химик Бутлеров (1828—1886) создал и разработал теорию
строения органических соединений, обеспечившую дальнейшее успеш-
ное развитие органической химии.
Теория строения — это учение о взаимной связи, рас-
положении и взаимном влиянии атомов в молекулах
Органических веществ.
Александр Михайлович Бутлеров родился 25 августа 1828 г. в гор. Чи-.
стополе Казанской губернии. Окончил Казанский университет, где слушал
лекции выдающихся учёных-химиков того Времени — профессоров Зинина и
Клауса. Под их влиянием А. М. Бутлеров увлекается химией и впоследствии
становится одним из выдающихся химиков, без работ которого нельзя пред-
ставить развития современной органической химии.
До Бутлерова бесчисленное количество органических соединений не было
связано между соВЬй. Каждое вновь полученное соединение изучалось
вне связи с другими. Бутлеров, исходя из четырёхвалентности атома угле-
рода, создал теорию строения органических соединений, которая дала воз-
можность не только привести в стройную систему все органические соеди-
нения,. но и предвидеть образование новых соединений и объяснить их
194
Двойства. Бутлеров не только создал теорию строения органических соеди-
нений, но своими работами экспериментально доказал её правильность. Он
создал и химии научную школу, которая получила название Казанской бут-
леровской школы химиков.
Бутлерову принадлежит открытие ряда новых химических соединений,
в частности уротропина — дрчебного препарата; он первый получил искус-
ственное соединение из класса сахаров и т. д.
Характеризуя научную и общественную деятельность Бутлерова,
д, И. Менделеев писал: „А. М. Бутлеров — один из замечательнейших рус-
ских учёных. Он русский и по учёному образованию, и по оригинальности
трудов- Ученик знаменитого нашего академика Н. Н. Зинина, он сделался
химиком не в чужйх краях, а в Казани, где и продолжает развивать само-
стоятельную химическую школу. Направление учёных трудов А. М. не соста-
вляет продолжения или развития идей его предшественников, но принадлежит
ему самому. В химии существует бутлеровская школа, бутлеровское направ-
ление".
Бутлеров не только был гениальным учёным, создателем нового направ-
ления в химии, но и выдающимся общественным деятелем и педагогом.
Он много уделял внимания распространению химических знаний среди
народа.
Его учебник „Введение в органическую химию", в котором органическая
химия была изложена на основе теории строения, сыграл исключительную
роль в распространении новых взглядов не только в России, но и во всём
мире.
Сущность теории строения заключается в следующем:
1. В молекулах атомы связаны один с другим в определённой
последовательности.
2. Соединение атомов друг с другом происходит согласно валент-
ности их. Валентности всех атомов в молекуле взаимно насыщены,
т. е. I затрачены на соединение атомов между собой; поэтому в моле-
кулах свободных валентностей нет.
3. Свойства вещества зависят не только от его состава, но и
от строения его молекул (в этом проявляется взаимное влияние
атомов). Поэтому, исходя из свойств вещества, мы можем делать
заключения о строении его молекул, и обратно: исходя из строения
молекул, мы можем заключать о существенных свойствах вещества.
Органические вещества представляют собой соединения углерода.
В простейшем случае они могут быть образованы только двумя
элементами: углеродом и водородом.
Углерод четырёхвалентен, т. е. проявляет способность соеди-
няться с четырьмя атомами водорода (или с соответствующим коли-
чеством других элементов). Строение простейшего соединения —
Н
метана СН4, или Н—С—Н
Н
Если в молекуле содержится несколько углеродных атомов, они
соединяются между собой, что является характерной особенностью
атома углерода. Остальные валентные связи атомов углерода насы-
аются атомами водорода (или другого элемента). Например, близкий
13*
195
к метану газообразный углеводород этан имеет следующее строение
молекул:
Н
Н—С—Н СН3
С,Н6; структурная формула: | или |
н—С—н сн3
I
н
В молекулах большинства органических веществ содержится
несколько, часто большое количество атомов углерода, соединённых
друг с другом. Они образуют как бы скелет молекулы в виде длин-
ных цепей — прямых (рис. 91, Л), разветвлённых (рис. 91, Б), зам-
кнутых кольцеобразно (рис. 91,* В).
Чтобы показать взаимную связь атомов в молекулах, при рас-
смотрении органических соединенйй обычно пользуются структур-
Q Атом водорода
Рис. 91. Углеводороды, содержащие в молекулах 6 атомов углерода
(находятся в разных сортах бензина).
На рисунке даны: химические формулы веществ, модели молекул, цепи углеродных атомов
в молекулах (углеродные скелеты). А — прямая цепь углеродных атомов; Б — разветвлённая
цепь углеродных атомов; В — кольцеобразно замкнутая цепь углеродных атомов.
Т кип. 80*
ными формулами в сокращённом виде, как показано для гексана
(рис. 92).
В последнем случае в формуле указывается связь только между
группами атомов, которые называют радикалами. Во всех случаях
черта или точка в формулах обозначает одну валентную связь для
каждого атома.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какие вещества называются органическими?
2. Какое явление называется изомерией? В чём оно заключается?
3. Какие вещества называются изомерами?
196
4. Сходны ли молекулярные формулы органических веществ с эмпири-
ческими формулами? Как устанавливаются молекулярные формулы?
5. Почему для некоторых органических веществ не установлены моле-
кулярные формулы?
6. В чём сущность теории строения?
7. Какому учёному принадлежит заслуга создания и развития теории
строения?
I I I I I I
Б Н—С С С С С С—Н
I I I I I Н
н н н н н н
В СНз-СНг-СНг-СНг-СНг-СНз
Гексан
Ркс. 92. Разные способы изображения молекул
органических веществ.
Л — формула молекулярная (показывает качественный и
количественный состав вещества); Б — формула струк-
турная (показывает связь между атомами); В — формула
структурная в сокращённом виде (показывает связь
между группами атомов — радикалами). На рисунке 91
приведена модель молекулы этого вещества.
§ 2. Предельные углеводороды. Гомологический ряд метана
(парафины)
< • Общая формула: СлН2л+2.
Большая группа органических соединений состоит только из угле-
рода и водорода, вследствие чего такие соединения получили общее
название: углеводороды.
1. Строение молекул предельных углеводородов. Выше было
указано, что разный количественный состав и разная структура моле-
кул обусловливают различия в свойствах веществ, поэтому соедине-
ния даже только двух элементов могут быть очень многочисленны.
Простейшим представителем углеводородов является метан, содер-
жащий в молекуле один атом углерода. Существуют соединения,
содержащие в молекуле два, три и более углеродных атомов:
Метан: СНО Этан: СаНб, Пропан: СаН8,
или или или
НН н
Й—С—Н Н—С—Н СН3 Н—С—н сня
о о
I | или | I I
Н Н—С—Н СН3 H—С—Н или СН2
I I I
н н—с—н сн3
I
н
197
При содержании в молекуле 4 атомов углерода уже становится
возможной изомерия в результате разного расположения атомов
углерода:
Бутан: С4Н10 1-й изомер 2-й изомер
СН3 (5i3
сн2 НС—сн3
сн2 сн3
> СН3
. Т. КИП. 1° т. кип. — 10°
Различаются эти изомеры температурой кипения и другими свой-
ствами.
При содержании в молекуле 4 атомов углерода может быть
только два изомера; по мере же увеличения числа углеродных ато-
мов число возможных изомеров быстро растёт.
При содержании в молекулах 5 углеродных атомов изомеров
может быть три.
Пентан: 1-й изомер 2-й изомер 3-й изомер
С6Н13 СН3 СН3 СН3
сн2 НС—СН8 Н3С—С—СН3 1
сн2 1 сн2 1 снй о
сн2 сн3
сн3 т. кип. 4-36° т. кип.-]-28° т. кип. —9,5°
У углеводородов с 7 углеродными атомами может быть уже
9 изомеров, с 8 атомами—18 изомеров, с И атомами—159 изоме-
ров, с 14 атомами— 1855 изомеров; у углеводородов с 20 углерод-
ными атомами изомеров может быть громадное число — 21 595.
В строении молекул приведённых выше углеводородов наблю-
дается существенное сходство. Во всех случаях атомы углерода
связаны между собой одинарной или простой связью (одна черта),
а все прочие валентности их до предела насыщены атомами водорода.
Углеводороды, в которых атомы углерода связаны
между собой одинарной связью, называются предельными,
или насыщенными углеводородами.
198
При такой структуре молекулы отличаются значительной проч-
ностью, отсутствием способности к реакциям присоединения; поэтому
предельные углеводороды получили ещё название парафины, что
означает „малодеятельные".
Ряд веществ, характеризующихся определёнными общими свой-
ствами и отличающихся друг от друга на определённую группу
атомов, называют гомологическим рядом (что означает „подобный
ряд"). В данном случае мы имеем дело с гомологическим рядом
метана (гомологическим рядом предельных углеводородов, или пара-
финов).
Если сравнить формулы членов гомологического ряда- метана (или,
как иначе говорят, гомологов метана): СН4, С2Н0, С3Н8, С4Н10,
СбН12 и т. д., легко заметить, что каждый углеводород гомологиче-
ского ряда отличается от предыдущего на 1 атом углерода и на 2 атома
водорода, т. е. на группу СН2, называемую гомологической раз-
ностью.
Формулы отдельных углеводородов этого гомологического ряда
отвечают общей * формуле: СпН2п+2, где п — число углеродных атомов.
При подстановке вместо знака п числа 1 получается формула
простейшего углеводорода метана СН4; при подстановке числа 2
получается формула следующего члена гомологического ряда — этана
СоНв и т. д. Подставляя вместо п то или иное число, можно полу-
чать формулу любого члена гомологического ряда.
2. Физические свойства предельных углеводородов. Количест-
венное изменение состава молекул углеводородов приводит к опреде-
лённым качестзенным различиям членов гомологического ряда. По
мере количественного усложнения молекул повышаются температура
кипения и температура плавления углеводородов; увеличивается удель-
ный вес; соответственно изменяется агрегатное состояние их. Угле-
водороды, содержащие в молекуле от 1 до 4 углеродных атомов,
при обычных условиях — газы, например простейший углеводород
метан СН4, являющийся главной составной частью природных газов.
Углеводороды, содержащие от 5 до 15 углеродных атомов,—
жидкости, например углеводороды, содержащиеся в керосине.
Углеводороды, содержащие 15 и более углеродных атомов,—
твёрдые тела; смесь этих углеводородов носит техническое назва-
ние— парафин.
Таким образом, здесь наблюдается яркий случай перехода коли-
чества в качество: количественное усложнение состава молекул при-
водит к качественному изменению их свойств.
3. Химические свойства предельных углеводородов. Как уже
говорилось, предельные углеводороды отличаются малой химической
активностью.
При обычных условиях предельные углеводороды реагируют
только с галогенами (хлором, бромом). При этом происходит реакция
замещения;
CH^d^CHgClJ-HCl
хлористый
метил
199
или а структурном виде:
Н Н
I . I
Н—С—НЦ-С1—Cl—.Н—С—C1-J-HC1
В молекуле метана атом водорода замещается атомом хлора,
который соединяется с остатком молекулы — радикалом метилом;
образуемый продукт замещения называется хлористый метил; вы-
делившийся водород соединяется со вторым атомом хлора в моле-
кулу хлористого водорода. Процесс этот не останавливается на ука-
занной в уравнении стадии; в конечном итоге он может привести
к замещению всех 4 атомов врдорода хлором и образованию четырёх-
хлористого угЛерода СС14 (четырёххлористый углерод — негорючая
жидкость, с точкой кипения 77°; имеет большое техническое значе-
ние как очень хороший растворитель «органических веществ).
Взаимодействие хлора с метаном происходит спокойно только
в темноте или на рассеянном свету. Под действием же прямого сол-
нечного света реакция протекает бурно — со взрывом.
Все углеводороды — горючие вещества, но, подобно метану, при
обычной температуре с кислородом не реагируют; чтобы началось
горение, необходимо поджигание их.
4. Углеводороды и проблема жидкого топлива. Углеводороды
представляют большой технический интерес как прекрасное топливо,
так как оба составляющие их элемента — углерод и водород, соеди-
няясь с кислородом, выделяют большое количество тепла.
Как уже указывалось, в зависимости от количества атомов угле-
рода, содержащихся в молекулах углеводородов, последние нахо-
дятся при обычных условиях в газообразном, жидком или твёрдом
состоянии.
Наибольший тепловой эффект даёт сжигание газообразного топ-
лива, благодаря возможности полного смешения его с поддерживаю-
щим горение кислородом воздуха. Этим объясняется широкое при-
менение в качестве топлива природных и искусственно получаемых
горючих газов.
Не менее ценным является также жидкое топливо. Проблема
жидкого топлива имеет особенно большое значение в наш век широ-
кого развития автомобильного и авиационного транспорта.
5. Нефть. Нефть — маслянистая жидкость с резким запахом. Она
встречается во многих местах земного шара, пропитывая пористые
горные породы на различной глубине (рис. 93).
Основную часть нефти составляет смесь углеводородов разной
степени сложности и разной структуры молекул. Посредством нагре-
вания можно произвести разделение нефти на части, кипящие в опре-
делённых пределах температуры.
Процесс этот, называемый дробной перегонкой, проводится на
нефтеперегонных заводах. Основан он на том явлении, что соеди-
200
нения с бблыпим числом углеродных атомов в молекулах кипят п,
следовательно, перегоняются при более высокой температуре.
Таким лутём из нефти получают жидкие продукты: бензин (по-
гон до 150°, содержащий углеводороды с 6—8 углеродными атомами
в молекулах); керосин (погон от 150 до 300°, содержащий углево-
дороды с 9—16 углеродными атомами в молекулах).
Остаток нефти после отгонки из неё бензина и керосина назы-
вается мазутом. Употребляется мазут в качестве топлива или исполь-
зуется для дальнейшей переработки, в результате которой получают
Рис. 93. Геологический разрез нефтеносной местности.
1, 2, 3, 4 — буровые вышки.
смазочные масла и полужидкий продукт — вазелин (представляю-
щий собой смесь жидких и твёрдых углеводородов).
Из некоторых сортов нефти получают ещё твёрдый продукт —
парафин (смесь твёрдых углеводородов).
После выделения из мазута смазочных масел в остатке получается
смолообразная масса — гудрон, широко применяемый в качестве ма-
териала' для покрытия мостовых.
В связка с, разной температурой кипения бензина и керосина наблю-
дается разное отношение их к огню. Бензин, все сорта которого ки-
пят ниже 150°, испаряется настолько легко, что над поверхностью
его всегда находится значительное количество легко воспламеняю-
щихся паров. Поэтому, если поднести к бензину огонь, тотчас же
происходит вспышка (отсюда огнеопасность бензина!). С керосином
этого не наблюдается, если он хорошо очищен и не содержит при-
меси бензина. Применение бензина в приборах, предназначенных для
керосина,—керосиновых лампах, керосинках для нагревания, в при-
мусах и пр., очень опасно, так как легко может произойти
взрыв.
Как уже говорилось, нефть наряду с каменным углем имеет боль-
шое значение для всего народного хозяйства. В текущем пятилетии
значительно увеличивается количество выпускаемых нашими заводами
201
автомобилей, тракторов, тепловозов, речных и морских судов, само-
лётов и различных двигателей, потребляющих нефтепродукты. В связи
с этим значительно увеличивается потребность в продуктах, получа-
емых из нефти.
По запасам- нефти наша страна стоит на первом месте. Особенно
широкого развития достигла нефтяная промышленность при совет-
ской власти.
В 1940 г. по сравнению с 1913 г. добыча нефж возросла в 3
раза, В 1950 г. добыча нефти составила 1О7°/о к заданию пятилет-
него плана и была на 22°/0 больше, чем до войны.
Крекинг нефти. В результате бурного развития автомобиль-
ного транспорта и авиации, бензина, получаемого перегонкой нефти,
нехватает для покрытия всех нужд, так как в лучшем случае из
нефти удаётся получать бензина • до 2О°/о; остальное — высококипя-
щие продукты. В связи с этим перед химией встала задача: найти
способы получения бензина в большем количестве. Удобный путь для
решения этой задачи был найден, исходя из созданной Бутлеровым
теории строения.
Высококипящие продукты разгонки нефти не пригодны для упо-
требления в качестве моторного топлива. Высокая температура кипе-
ния кх зависит от того, что молекулы содержащихся в них углеводо-
родов представляют собой слишком длйнные углеродные цепи. Если
расщепить крупные молекулы на мелкие части, чтобы образовались
молекулы, содержащие до 8 углеродных атомов, получатся низкоки-
пящие продукты типа бензина.
Этим путём пошёл русский инженер В. 1\ Шухов, который в 1891 г.
разработал метод расщепления сложных углеводородов, названный
впоследствии крекингом (что означает расщепление). При крекинге
нефть или остающийся после первичной разгонки мазут подвергают
сильному нагреванию без доступа воздуха (до 600°). В этих усло-
виях происходит разрыв длинных углеродных цепей и образуются
молекулы с меньшим числом углеродных атомов; в результате получа-
ются низкокцпящее моторное топливо (бензин) и другие ценные про-
дукты (рис, 94).
У нас переработка нефти с применением крекинга проводится
в широких масштабах. Крекинг чрезвычайно сильно повысил выход
бензина. Из нашей грозненской нефти, например, получается путём
разгонки 16°/0 бензина и 59°/0 мазута. Крекинг мазута даёт допол-
нительно ещё 58°/0 бензина. Таким образом, общий выход бензина
получается выше 7О°/о.
В течение послевоенной сталинской пятилетки полностью восста-
новлена и технически перевооружена разрушенная во время войны
нефтяная промышленность Майкопского и Грозненского нефтяных
районов и нефтяная промышленность Западной Украины.
Крекинг имеет большое значение ещё потому, что получаемый
бензин является моторным топливом, лучшим, чем обычный бензин.
В связи с ограниченными запасами природного источника жидкого
топлива — нефти, перед учёными встала задача: получить искусст-
202
венное жидкое топливо. В настоящее время эта сложная проблема
разрешена: жидкое топливо может быть синтезировано из угля и во-
дорода. Присоединение водорода к углероду (гидрирование угля) про-
исходит при ’высокой температуре в- присутствии особых катали-
заторов.
В период послевоенной сталинской пятилетки промышленность по
переработке угля в жидкое топливо получила широкое развитие.
Рис. 94. Переработка нефти и главнейшие направления
использования получающихся продуктов.
Согласно закону о пятилетием плане восстановления и развития на-
родного хозяйства СССР на 1946—1950 гг., намеченный план выра-
ботки жидкого топлива из угля и сланцев выполнен; развёрнуто
строительство двух заводов гидрирования угля и одного завода син-
теза бензина.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. При каком числе углеродных атомов в молекуле предельные углеводо-
роды при обычных условиях находятся в газообразном состоянии? в жидком?
в твёрдом?
2. В каких природных и технических продуктах содержится метан и
другие газообразные углеводороды? жидкие углеводороды? твёрдые углево-
дороды? ,
3. Что такое нефть? бензин? керосин? смазочные масла? мазут?
4. Из каких веществ состоит вазелин?
5. Из каких веществ состоит парафин?
6. Что означает слово „крекинг “?
7. Что происходит при крекинге нефти и какие образуются продукты?
203
§ 3. Непредельные углеводороды
Существует значительное число органических соединений^ в ко-
торых углеродные атомы соединены с меньшим количеством атомов
водорода или другого элемента, чем это нужно для полного насы-
щения валентностей углерода. В этих случаях остающиеся свобод-
ными валентности соседних атомов углерода взаимно насыщают друг
друга и между углеродными атомами возникают вторая и третья
связи. В структурных формулах это показывают соЛветствующим
числом чёрточек между атомами.
Если до полного насыщения нехватает двух атомов водорода,
атомам углерода приходится взаимно насыщать две валентные связи
(двойная связь); этот случай имеется в углеводороде — этилене:
Н—С—Н . СН2
|| или || или: С2Н4
н—с—н сн2
и в гомологическом ряду этиленовых углеводородов, отвечающих
общей формуле: С„Н2п.
Если до полного насыщения нехватает четырёх атомов водорода,
атомам углерода приходится взаимно насыщать три- валентные связи
(тройная связь); этот случай имеется в углеводороде — ацетилене:
С—Н
III или: С2Н2
С—н
и в гомологическом ряду ацетиленовых углеводородов, отвечающих
общей формуле СлН2и_2.
Углеводороды с двойными и тройными связями между углерод-
ными атомами получили название ненасыщенных, или непредельных.
Простейшие непредельные соединения, формулы которых были
приведены выше — этилен и ацетилен, как и соответствующий им
предельный углеводород этан, являются газообразными горючими ве-
ществами. При поджигании в чистом виде они горят спокойно, в смеси
же с воздухом дают очень сильный взрыв.
Н—С—Н СН2
1. Этилен С2Н4; структурная формула: || или: ||
Н—С—н сн2
Этилен горит на воздухе светящимся пламенем (рис. 95, Б), образуя
углекислый газ и воду:
(горение)
С2Н4-(-ЗО2=2СО2-|-2Н2О
(этилен)
Процентное содержание в нём углерода больше, чем в метане,
поэтому часть углерода не успевает сгорать внутри пламени и вы-
деляется в виде частиц угля, которые, раскаляясь, делают пламя
204
светящимся. Наблюдать горение чистого этилена удобно, поджигая
его в цилиндре, как в опыте с метаном (см. рис. 83, Б). (Все опыты
с этиленом требуют большой осторожности, так как смесь его с воз-
духом взрывается с очень большой силой и сосуд разрывается на
мелкие куски.)
В лабораторных условиях этилен получают из винного спирта
путём нагревания его вместе с серной кислотой. Уравнение происхо-
дящей реакции будет рассмотрено ниже (стр. 238).
Для технических целей обычно употребляется этилен, получаю-
щийся в качестве побочного продукта при крекинге нефти (см. рис. 94).
/Д\Бледное
U ।/несветя-
W/ щееся
П пламя
с2н4
Яркое
сильно
коптящее
пламя
Q Атомы водорода
ацетилен
В
Рис. 95. Углеводороды с двумя углеродными атомами в молекулах, но с раз-
ным числом водородных атомов (разное число валентных связей между
н, атомами углерода).
На рисунке показан характер пламени э^их газов; яркость его увеличивается с увеличением
относительного содержания углерода. А — этан; Б — этилен; В — ацетилен.
\
Этилен применяется как сырьё для синтезов многих веществ: вин-
ного спирта, растворителей, взрывчатых веществ.
В первую мировую войну немцы применяли его для получения
одного из опаснейших боевых отравляющих веществ — иприта (гор-
чичный газ, дихлор-диэтил-сульфид).
Иприт представляет собой вязкую жидкость с характерным запа-
хом горчицы и чеснока. Он относится к стойким ОВ, заражает мест-
ность на долгое время. Ядовиты не только пары его, но и капли,
вызывающие на коже воспаление и трудно заживающие язвы. Для
защиты необходимы противогаз и особая одежда.
Интересное действие оказывает этилен на незрелые плоды (по-
мидоры, лимоны); в атмосфере воздуха, содержащего небольшую
примесь этилена, они быстро дозревают, поэтому этилен применяется
Для этих целей.
205
CH
2, Ацетилен C2H2; структурная формула: ||1
СН
Ацетилен горит, образуя углекислый газ и воду:
, ( горение)
2С2Н2+5О2=4СОг+2Н2О
ацетилен »
Горит ацетилен (рис. 95, В) очень ярким коптящим ^ламенем, так
как содержит большой процент углерода (92^/q).
При горении его выделяется большое количество тепла, поэтому
он применяется при автогенной сварке и резке металлов вместо водо-
рода (см, рис. 52).
Обращаться с ацетиленом надо с большой осторожностью, так
как в смеси с воздухом он даёт весьма сильный взрыв, а кроме
Отверстие в . Вода
дне пробирки
Рис. 96. Прибор для получения ацетилена.
А — прибор в готовом виде (пробирка установлена над водой); Б — прибор в действии (про-
бирка опущена в воду на нужную глубину); В — пропускание ацетилена в бромную воду (или
в раствор марганцевокислого калия).
того, очень ядовит. По этой причине светильный газ, всегда содер-
жащий ацетилен, подвергается на заводах тщательной очистке для
полного освобождения от примеси ацетилена.
В лабораторных условиях, как и для технических целей, ацети-
лен получают взаимодействием с водой карбида кальция, который
получают сплавлением в электрической печи извести с углем.
СаОЦ-ЗС=СаС2-[-СО f
карбид
кальция
Для получения ацетилена в лабораториях удобно пользоваться
прибором, изображённым на рисунке 96, А; изготовляется он из про-
бирки с пробитым дном. Для приведения прибора в действие нижнюю
206
часть пробирки с карбидом кальция опускают в воду; тотчас же про-
исходит выделение ацетилена:
CaC2-|-2H2O=C2H2f-|-Ca (ОН)2
ацетилен
Для прекращения реакции пробирку подымают выше уровня воды.
Пользуясь этим прибором, можно и поджигать ацетилен, но сначала
надо прдождать, пока вытеснится из пробирки весь воздух (для без-
опасности перед поджиганием сосуд следует обернуть полотенцем).
Опыты с ацетиленом следует проводить в вытяжном шкафу, а
если его нет, прибор с горящим ацетиленом надо вынести из класс-
ной комнаты и там уже погасить пламя, подняв пробирку выше
уровня воды. •
Структурная формула карбида кальция: Са |||
Из формулы видно, что карбид кальция представляет собой про-
дукт замещения в молекулах ацетилена двух атомов водорода двух-
валентным кальцием. В молекуле ацетилена водород может заме-
щаться также медью, серебром и др. Это является своеобразной осо-
бенностью ацетилена.
Продукты замещения водорода в ацетилене серебром и медью:
C-Ag
С—Ag
ацетиленистое
серебро
С—Си
С—Си
ацетиленнстая
медь
(медь в этом соединении одновалентна).
207
Ацетиленистое серебро и ацетиленистая медь отличаются сильной
взрывчатостью. Поэтому техническая аппаратура, употребляющаяся
для получения ацетилена, если она делается из меди, внутри покры-
вается полудой (оловом, не вступающим во взаимодействие с ацетиленом).
Благодаря лёгкости получения карбида кальция ацетилен является
легко доступным материалом, что обеспечивает возможность широ-
кого его использования. Он применяется для освещения (рис. 97),
автогенной сварки и резки металлов (см. рис. 52) и для различных
синтезов органических веществ: винного спирта, уксусной кислоты,
боевого отравляющего вещества (люизита), а в последнее время —
для искусственного получения каучука.
Использование этилена и ацетилена для различных синтезов осно-
вано на общей для все’х непредельных соединений повышенной спо-
собности к химическому взаимодействию с другими веществами.
3. Общие химические свойства непредельных соединений.
а) Реакция присоединения. Характерной особенностью
непредельных соединений является способность их присоединять по
месту двойной или тройной связи атомы водорода или других эле-
ментов; в результате этого они превращаются в насыщенные (пре-
дельные) соединения.
Присоединение водорода к этилену и ацетилену, происходящее
при нагревании в присутствии катализатора (никеля и др.), приводит
к образованию одного и того же конечного продукта — этана:
prj (нагревание, pi/
'-,п2 катализатор)
II +н2
сн2
втилен
СН
СН
ацетилен
Реакцию присоединения можно
ствия с бромом; эта реакция легко
' СН3
t этан
(нагревание, т т
катализатор)
[2 = |
сн3
этан
наблюдать на примере взаимодей-
происходит при обычных условиях;
Н
Н—С—Н
Н—С—Вг
Н—с—Н
Н—С—Вг
н
Вг
С—Н
Н—С—Вг
III +2Вг2= |
С—Н Н—С—Вг
Вг
208
Для опыта применяется бромная вода. При взаимодействии с не-
предельным веществом, например с ацетиленом, жёлтая окраска бром-
ной воды тотчас же исчезает, так как образующиеся продукты
бесцветны.
б) Реакция окисления. Непредельные соединения легко
окисляются. Если этилен или ацетилен - пропускать в раствор
марганцевокислого калия (розового цвета), окраска тотчас же
исчезает ' (процесс обесцвечивания лучше протекает в кислой
среде).
Обесцвечивание происходит потому, что от марганцевокис-
лого калия отрывается кислород, идущий на окисление непре-
дельного соединения, причём получаются бесцветные продукты
реакции.
Эта реакция является быстрым и верным средством обнаружения
непредельных соединений.
Способность непредельных соединений к реакциям присоединения
указывает на 'интересное явление: прочной связью между атомами
углерода является только одинарная связь, двойные и тройные связи
непрочны и легко рвутся, переходя в одинарные. Поэтому молекулы
непредельных соединений способны присоединять дополнительное ко-
личество новых атомов. Эти атомы присоединяются по месту разрыва
связи.
Установление этого факта открыло перед химиками пути к про-
ведению интереснейших синтезов, имеющих большое практическое
значение.
-в) Синтезы на основе реакций присоединения. Под
действием катализаторов легко происходит присоединение к этилену
воды по месту разрыва двойной связи, в результате реакции обра-
зуется винный спирт:
Н
н—С—н II н Ь 1 (катализатор) H2SO4 Н—С—Н
н—с—н он н—С—он
этилен вода
С2Н4 н2о н винный спирт СН3СН2ОН
Эту реакцию впервые осуществил А. М. Бутлеров, приме-
нив в качестве катализатора серную кислоту. Техническое ис-
пользование её осуществилось только в наши дни, когда был
НнафДе) ДешёВЫ^ источник этилена (получение его при крекинге
В настоящее время широко используется также открытая рус-
ским учёным М. Г. Кучеровым реакция присоединения воды к аце-
В. в. Левченко 209
тилену, происходящая в присутствии солей ртути, которые оказы-
вают каталитическое действие:
н
СН
Ш +н2о
СН
ацетилен
с2н2
(соли ртути) *1 — С — Г1
= I
с=о
г
н • •
уксусный
альдегид
//Q
СН3-С<
Продукт реакции — уксусный альдегид — используется затем для
получения уксусной кислоты, ацетона и других веществ, имеющих
большое практическое значение (об этих веществах подробнее будет
сказано дальше).
г) Реакции полимеризации. Большой практический инте-
рес представляет способность непредельных соединений к особым
превращениям. За счёт ненасыщенных связей молекулы их могут
соединяться друг с другом, образуя длинные цепи или кольца. Это
явление получило название полимеризации (от греческих слов, озна-
чающих „много" и „частица").
Схематически полимеризацию можно представить в следующем
виде:
(С„Н2„ + С„Н2„ + - • + С„Н2„ = (С„Н2„)х
х молекул одна молекула
Явление полимеризации лежит в основе процессов, приводящих
к образованию каучука.
4. Каучук. Каучук добывается из млечного сока тропических ра-
стений, произрастающих в Америке, Африке, Индии, и из растений,
произрастающих в СССР: кок-сагыза, тау-сагыза (рис. 98, А), гваюлы
и др. (Средняя Азия).
Каучук представляет собой продукт полимеризации непредельного
углеводорода с 5 углеродными атомами — изопрена, молекула кото-
рого содержит две двойные связи (рис. 98, Б).
Если нагревать в пробирке каучук, он разлагается на жидкие и
газообразные, более простые непредельные соединения; непредель-
ность их легко установить по обесцвечиванию бромной воды или
раствора марганцевокислого калия. Благодаря выяснению состава
каучука появилась возможность разрешить проблему искусствен-
ного получения его. Работы советских учёных — академиков
А. Е. Фаворского, С. В. Лебедева и др.— положили начало произ-
водству синтетического каучука в СССР раньше, чем в других
странах.
31 е
Алексей Евграфович Фаворский
(1860—1945).
Знаменитый русский химик-орга-
ник. Прославился своими работами
в области изомеризации ацетиленовых
и других непредельных соединений.
Разработал способ получения син-
тетического каучука. Работы и идеи
А. Е. Фаворского в существенной сте-
пени способствовали и определили
дальнейшие успехи химии в промыш-
ленной реализации процессов синтеза
каучука и многих других.синтезов, в
которых исходным веществом берутся
ацетилен и его производные.
С 1929 г. он — действительный
член Академии наук СССР, с 1940 г.—
лауреат Сталинской премии. В 1945 г.
ему присвоено звание Героя Социали-
стического Труда.
Сергей Васильевич Лебедев
(1874—1934).
Разработал промышленный метод
получения синтетического каучука из
дивинила (бутадиена), получаемого из
винного спирта.
Им выполнен ряд классических
работ в области гидрогенизации и по-
лимеризации непредельных углеводо-
родов.
В 1932 г. был избран действи-
тельным членом Академии наук
СССР.
Опытный завод для получения
синтетического каучука по способу
С. В. Лебедева был лущен в 1930 г.
Вскоре начали работать крупные за-
воды, и в 1935 г. было получено син-
тетического каучука высокого каче-
ства уже 25 тыс. т.
Для получения синтетического каучука по способу С. В. Лебе-
дева исходным материалом служит винный спирт (рис. 98, Г). Из него
путём химических превращений в присутствии специальных катали-
заторов сначала получается непредельный углеводород — дивинил;
большое число молекул дивинила под действием катализаторов по-
лимеризуется в крупные молекулы синтетического каучука (СК).
СК не только не уступает по качеству натуральному каучуку, но
по целому ряду технических свойств превосходит его.
Получение синтетического каучука по способу С. В. Лебедева
связано с расходом большого количества спирта, получаемого из пи-
щевого сырья — картофеля, зёрен, злакоз.
14* 211
На основе работ Фаворского были разработаны способы получения
каучука из ацетилена, что освобождает от расходования пищевого сырья.
‘ Рис. 98., Каучук,
Л — каучуконосное растение; каучук находится в стеблях и корнях; Б — непредельный угле-
водород изопрен, продуктом полимеризации которого является природный каучук; В — фор-
мула природного каучука; Г—винный спирт — исходный материал при получении искусствен-
ного каучука по способу С. В. Лебедева; Д — непредельный углеводород дивинил (бутадиен);
Е — формула продукта полимеризации дивинила — искусственного каучука. ,
В основе этих способов лежит реакция, протекающая с ацетиленом
в присутствии соли меди; при этой реакции атом водорода переходит
от одной молекулы ацетилена к другой и обе молекулы соединяются:
............. (в присутствии
4- солей меди)
СН = СН4-СН=СН---------------сн2 = сн —с = сн
ацетилен ацетилен винилацетилен
Получающийся винилацетилен при определённых условиях при-
соединяет хлористый водород:
СН2 = СН — С = СН4-Н — Ь1—СН2 = СН —с = сн2
винилацетилен хлористый
водород
С1
хлорпрен
212
В результате реакции получается хлорпроизводное дивинила —
хлорпрен. Хдорпрен полимеризуется и даёт синтетический каучук,
по некоторым свойствам превосходящий натуральный каучук.
Согласно пятилетнему плану, производство синтетического кау-
чука из непищевого сырья в 1950 г. увеличено по сравнению с до-
военным уровнем.* Наряду с этим организовано в крупных размерах
производство натурального каучука. /
В области получения синтетического каучука .русским учёным при-
надлежит приоритет. Работы их, начиная с работ Александра Михай-
ловича Бутлерова (по уплотнению изобутилена), обеспечили в данное
время успешное разрешение этой важнейшей проблемы синтетической
химии
ч ВОПРОСЫ для повторения.
1. Какие соединения называются ненасыщенными?
2. Почему ненасыщенные соединения способны к реакциям присоедине-
ния и легко окисляются? *
3. Посредством каких реакций легко обнаружить непредельное соеди-
нение?
4. Какова общая формула гомологического ряда этилена?
5. Почему этиленовые углеводороды относятся к группе ненасыщенных
углеводородов?
6. Что получается при присоединении к этилену водорода?
7. Как получается этилен и для чего применяется?.
8. Какова общая формула гомологического ряда ацетилена?
9. Как получается и для чего применяется ацетилен?
10. Почему ацетилен применяется для освещения и для сварки и резки
металлов?
11. Какие предосторожности необходимы при пользовании ацетиленом и
почему?
12. Почему ацетилен способен к реакциям присоединения?
13. Что получается при взаимодействии ацетилена с серебром? медью?
14. Каким характерным свойством отличается ацетиленистое серебро?
медь?
15. Почему ацетилен нельзя йропускать через медные трубы?
16. Что называется полимеризацией?
17. Какие углеводороды способны к реакциям полимеризации?
18. В чём заключается процесс полимеризации?
19. Что представляет собой каучук?
20. Что происходит при нагревании каучука?
21. Как получается искусственный каучук? '
§ 4. Циклические углеводороды
Кроме углеводородов, молекулы которых представляют собой от-
крытые длинные цепи, существуют углеводороды с молекулами коль-
цеобразного, или, как иначе говорят, циклического строения.
Примером может служить циклогексан С6Н12 (строение молекулы
его показано на рисунке 91, В).
Многие циклические соединения отливаются большой прочностью,
подобно предельным углеводородам с открытой цепью.
213
Циклогексан и другие подобные ему углеводороды содержатся
в определённых сортах нефти, откуда они были выделены учеником
А. М. Бутлерова профессором В. В. Марковниковым (1838—1904).
Он же предложил для них название нафтены. Особенно много их
в кавказской и галицийской нефти. Большие исследования по изуче-
нию нафтенов и их превращений в жирные кислоты, в ароматические
углеводороды и другие соединения сделаны в дальнейшем академиков
Н. Д. Зелинским и его учениками.
§ 5. Ароматические углеводороды
1. Бензол. Среди соединений с замкнутей цепью углеродных
атомов особый интерес представляет углеводород бензол.
В молекуле бензола содержится 6 атомов углерода, соединённых
кольцеобразно, и 6 атомов водорода. Формула его: С6Н6. До пол-
ного насыщения в молекуле бензола нехватает 6 атомов водорода.
Отсюда следует, что углеродные атомы в молекуле бензола должны
быть связаны между собой более чем одной валентной связью; моле-
кула бензола имеет следующее строение;
СН
НС СН
НС СН
СН
Физические и химические свойства бензола^ Бен-
зол— бесцветная жидкость с характерным запахом, кипящая при 80°.
В ненасыщенных соединениях с открытой цепью двойные связи
легко рвутся, но образованное 6 атомами углерода бензольное кольцо
отличается большой прочностью. Это видно из того, что бензол не
обесцвечивает ни бромную воду, ни раствор марганцевокислого калия.
По химическим свойствам бензол сходен с предельными углево-
дородами. Как и для них, для бензола характерны реакции замеще-
ния. Например, при действии брома на бензол в присутствии железа,
играющего роль катализатора (рис. 99), происходит замещение атома
водорода атомом брома:
(катализатор)
C6H6 + Br2 = CtH5Br + HBrf
бензол бромбензол бромистый водород
В показанном на рисунке приборе бромистый водород выделяется
из трубки в виде лёгкого дыма; как тяжёлый газ, он оседает и рас-
творяется в воде. Образовавшаяся в растворе бромистоводородная
кислота может быть обнаружена действием на неё азотнокислого се-
ребра (образование жёлтого осадка бромистого серебра).
214
Бромбензол остаётся в колбе (пробирке). Чтобы лучше рассмотреть
бромбензол, содержимое сосуда выливают в стакан с холодной водой;
бромбензол собирается на дне в виде тяжёлой жидкости, окрашенной
в тёмный цвет примесью брома (рис. 99, В).
Прочность бензольного кольца проявляется в его сохранении при
различных реакциях, -приводящих к замене атомов водорода в моле-
куле бензола другими атомами или группами атомов — радикалами.
В молекулы многих органических веществ входит бензольное кольцо.
А — лабораторная установка; Б — упрощённая установка; В — стакан с полученным
бромбензолом (под слоем воды).
Для краткости молекулу бензола изображает условно в виде ше-
стиугольника без указания атомов углерода и водорода:
ИЛИ
Производные бензола изображают шестиугольником, около углов
которого указывают атомы элементов или группы их, заместившие
водород. Например, бромбензол С6Н6Вг можно изображать следую-
щими структурными формулами:
СВг
НС^СН
II I
НС сн
Вг
сн
Бензол и его производные объединяются под общим названием —
ароматические соединения. Название „ароматические" эти вещества
получили потому, что некоторые из них обладают приятным запахом.
215
2. Гомологи бензола. Бензол является простейшим представите-
лем ароматических углеводородов.
Гомологический ряд бензола может быть выведен путём замены
атомов водорода в бензоле углеводородными радикалами. Простейшие
гомологи получаются при замене водорода одновалентным радикалом
метилом — СН3, представляющим собой молекулу метана без одного
атома водорода.
При замещении в бензольном кольце метильной группой одного
или нескольких водородных атомов образуются разные гомологи
бензола:
Бензол:
Толуол:
Ксилол:
кипения 80*4
кипения 110°
точка кипения 142°
/ - ।
Различаются эти вещества характерном для каждого из них за-
пахом и другими свойствами. Различие в химических свойствах бен-
зола и его гомологов можно установить по действию этих веществ
на раствор марганцевокислого калия, подкисленный серной кислотой.
Бензол не вызывает обесцвечивания раствора даже при нагревании,
так как бензольное кольцо не подвергается окислению. Это является
наиболее существенным отличием бензола от ненасыщенных углево-
дородов с открытой цепью.
Толуол же и ксилол обесцвечивают раствор марганцевокислого
калия очень быстро, так как происходит окисление связанных с бен-
зольными кольцами радикалов.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Напишите структурную формулу бензола.
2. Какие реакции характерны для бензола?
3. Что представляет собой реакция бромирования?
4. Что называется бензольным кольцом?
5. Как называются соединения, в молекуле которых содержится бензольное
кольцо?
6. Какая часть молекулы производных бензола легко подвергается окисле-
нию — ядро или боковая цепь?
216
* §.6. Сухая перегонка каменного угля
Большое число ароматических углеводородов получается при сухой
перегонке каменного угля (нагревание угля без доступа воздуха).
Рис. 100. Схема использования продуктов, получаемых при сухой перегонке
каменного угля.
При сухой перегонке угля образуются различные продукты: газооб-
разные, жидкие и в остатке твёрдые (рис. 100).
Получающийся газ раньше применялся для освещения, отчего и
произошло его название — светильный газ. Теперь он применяется,
главным образом, как топливо в быту и на производстве. Светильный
газ используется в печах металлургических заводов, для топки паро-
вых котлов п пр.
217
Главную часть светильного газа составляют водород и метан,
в виде примесей находятся: азот, амиак, угарный и углекислый газы,
предельные углеводороды (главным образом, этан), непредельные угле-
водороды (этилен, ацетилен), бензол и многие другие вещества,,
среди которых имеются очень ядовитые (синильная кислота). Отсюда
видно, что перед использованием в быту каменноугольный газ должен
быть очищен от вредных для здоровья примесей. f
Жидкими продуктами сухой перегонки каменного угля являются:
аммиачная вода и каменноугольная смола. »
Аммиачная вода содержит аммиак и в качестве примесей некото-
рые органические вещества, сероводород и др.; она является важным
источником получения аммиака. а
Каменноугольная смола содержит большое количество разных
веществ. В настоящее время установлено более 100 соединений; из
них большая часть относится к ароматическим веществам, т. е. является
производными бензола. Каменноугольная смола служит главным источ-
ником получения ароматических соединений.
Получающийся в остатке твёрдый продукт — кокс — является
ценным восстановителем, широко применяемым в металлургическом
производстве.
Переработка каменноугольной смолы, Каменно-
угольную смолу подвергают разгонке подобно тому, как было описано
для нефти. Отгоняющиеся продукты собирают в пределах опреде-
лённой температуры. *
До 170° собирается так называемое „лёгкое маслоВ нём
содержится, главным образом, бензол СвН6 и его гомологи — толуол
СвН5-СН3, ксилол С6Н4(СН3)2 и др.
В пределах от 170 до 230° собирается „среднее масло". В нём
содержится фенол С6НБОН и всем известный по употреблению в быту
нафталин. Молекула нафталина состоит из двух соединённых бензоль-
ных колец:
При охлаждении масла нафталин выделяется в твёрдом виде.
Выше 230° собираются отгоны, содержащие более сложные аро-
матические соединения.
Получаемые масла подвергаются дальнейшей переработке для
выделения содержащихся в них веществ.
Каменноугольная смола является исходным материалом для раз-
личных отраслей химической промышленности — для получения краси-
телей, лекарственных веществ, пластмасс, ВВ и др. (рис. 100).
Согласно пятилетнему плану, на базе сильно увеличивающейся
добычи каменного угля произошло значительное увеличение зависящих
218
от уего отраслей химической промышленности. Пятилетний план по
производству красителей перевыполнен. Количество выпускаемых
марок красителей возросло до 320 наименований в 1950 г. про-
тив 186 в 1940 г.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какие Газообразные вещества получаются при сухой перегонке камен-
ного угля?
2. Какой при этом получается жидкий продукт?
3 ., Что получается в остатке после сухой перегонки каменного угля?
4 .' Какие главнейшие химические продукты получаются при разгонке
каменноугольного дёгтя (смолы)?
5 . Какое значение имеет для химических производств каменноугольная
смола?
§ 7. Классификация органических соединений.
Органические радикалы и функциональные группы
В основу' классификации органических соединений положено
строение их молекул. При# всём многообразии органических веществ
можно отметить два основных типа в структуре молекул (рис. 91):
1) длинные открытые цепи углеродных' атомов — прямые или раз-
ветвлённые; 2) замкнутые кольца или циклы атомов.
В связи с этим органические вещества делятся на:
1) соединения с открытой цепью или соединения жирного ряда
(последнее название дано потому, что к этому типу соединений От-
носятся распространённые в природе вещества — жиры);
\2) циклические соединения.
Многие природные органические вещества и в том числе вещества,
образующие ткани живого тела,— белки, жиры и углеводы, отно-
сятся к соединениям с открытой цепью.
Некоторые природные и большинство искусственных соедине-
ний— лекарственных веществ, красящих, взрывчатых — относятся
к циклическим соединениям чаще всего в сочетании с цепями разной
фЬрмы.
Изучение органических соединений вскоре же привело к заклю-
чению, что определённые группы атомов сохраняются при реакциях
без изменения и целиком переходят из одних соединений в другие.
Такие группы атомов, как уже говорилось, были названы радикалами
(от латинского слова „радикс", означающего „корень"). Обозначаются
они буквой /?.
В молекулах различных веществ содержатся особые группы
атомов, определяющие принадлежность этих веществ к опреде-
лённому классу соединений: такие группы атомов называются
Функциональной группой данного класса веществ. От функциональ-
ной группы зависят характерные свойства веществ данного
класса.
Ниже будут рассмотрены главнейшие классы органических веществ
и их функциональные группы.
219
§ 8. Спирты
Общая формула: R — ОН.
* /
Уже в глубокой древности человек узнал опытным путём, что
сахаристые вещества, содержащиеся в соке винограда и других пло-
дах, способны, превращаться в результате так называемого „броже-
ния" в особое вещество, вызывающее опьянение. Вещество это было
выделено в чистом виде только в XI в. и получило название спирта
(от латинского слова „спиритус", что означает дух: смысл назвайия—
„дух вина"). За летучесть и горючесть оно было наздано также
алкоголем (арабское слово, обозначающее летучие вещества вообще).
Спиртовое брожение, как доказал французский учёный Пастер,
происходит под действием попадающих из воздуха микроскопи-
ческих дрожжевых грибков. В сахаристой жидкости они быстро
размножаются и вызывают распад молекул сахара на молекулы
спирта и углекислого газа. Выделяющееся при этой реакции тепло
идёт на поддержание жизненной деятельности дрожжей. Процесс
брожения имеет для них то же значение, что и процесс дыхания для
высших организмов: служит источником энергии, необходимой для
поддержания жизни.
Получающийся при брожении винный спирт относится к боль-
шому классу веществ, объединяемых под общим названием спирты.
В молекулах спиртов содержится характерная для них группировка
атомов, состоящая из гидроксила ОН, соединённого с углеводород-
ным радикалом.
Спиртами называются органические вещества, в моле-
кулах которых содержится гидроксил, связанный, с угле-
водородным радикалом.
1. Метиловый (древесный) спирт СН3ОН; структурная формула:
Н
I
н—С—ОН
I
н
Метиловый, или древесный, спирт является простейшим предста-
вителем спиртов. Получается он при сухой перегонке дерева (раз-
ложение дерева без доступа воздуха).
Теперь получают его также из окиси углерода и водорода (во-
дяного газа, к которому добавляют водород). Реакция ведётся в при-
сутствии катализаторов (окись цинка и др.) под давлением в не-
сколько сот атмосфер и высокой температуре (около 300°):
(катализатор)
СО + 2Н2 = СН3ОН
В этом спирте радикалом, связанным с гидроксильной группой
является остаток метана — метил; в связи с этим древесный спирт
226
получил научное название — метиловый спирт. Метиловый спирт —
бесцветная с характерным запахом жидкость, кипящая при 64°,5.
С водой он смешивается во всех отношениях.
Метиловый спирт употребляется как горючее для двигателей, как
растворитель в лакокрасочной промышленности, при изготовлении
органических красок и пр. (рис. 101),
2. Этиловый (винный) спирт С2НбОН; структурная формула;
Н Н
I I
Н—С—С—ОН или СН3СН2ОН
I I
н н
Молекула винного спирта отличается от молекулы древесного
спирта тем, что в углеводородном радикале её содержатся два угле-
родных атома.
Радикалом, связанным с гидроксильной группой, здесь является
остаток этана — этил; поэтому спирт этот получил научное название —
этиловый спирт.
Этиловый спирт — бесцветная с характерным запахом жидкость,
кипящая при 78°,3. С водой он смешивается в любых отношениях.
СПИРТЫ
Рис. 101. Схема использования спиртов: древесного и винного.
Применяется винный спирт (рис. 101) как горючее, как раство-
ритель для изготовления некоторых химических, в частности меди-
цинских препаратов (хлороформа, йодоформа и др.), для консерви-
рования, а также в спиртных напитках. Выше упоминалось об исполь-
зовании винного спирта как сырья для получения синтетического
каучука.
Различие в составе молекул рассмотренных спиртов приводит
к определённым различиям в их свойствах. Различие это хорошо
221
заметно, например, по действию на организм. Винный спирт оказы-
вает на организм вредное действие при злоупотреблении им; дре-
весный же спирт особенно ядовит; даже в небольших дозах он
действует отравляюще, в частности на зрительный нерв: он вызы-
вает в нём стойкие изменения, приводящие к'слепоте.
Резко отличаются от винного спирта спирты, содержащие боль-
шее число углеродных атомов в углеводородном радикале. Такие спирты
(содержащие до 5 углеродных атомов) получаются при спиртовом
брожении вместе с винным спиртом; они отделяются при очистке
его в виде отброса, называемого сивушным маслом. Спир1ы сивуш-
ного масла очень ядовиты, поэтому очень вредно употреблять для
питья неочищенный спирт (сырец).
Сивушное масло отличается сильным и настолько раздражающим
запахом, что непродолжительное вдыхание его паров приводит к спазма-
тическому удушающему кашлю.
Столь резкое различие в свойствах спиртов вызвано только раз-
ным количеством углеродных атомов в углеводородном радикале; в то
же время у них сохраняются общие свойства, определяемые присут-
ствием спиртовой группы.
3. Химические свойства спиртов. Спирты по строению молекул
могут быть сравнены с водой:
Н-ОН— вода
СН3-ОН— метиловый спирт
С2Нб-ОН— этиловый спирт
С3Н7>ОН— пропиловый спирт и т. д. , t
Общий тип молекулы: /?-ОН.
Во всех этих случаях имеется гидроксильная группа, связанная
в воде с атомом водорода, а в спиртах — с углеводородным ра-
дикалом. *
Гидроксильная группа, в воде и в спиртах проявляет во многих
отношениях сходные свойства. Например, водород гидроксильцой
группы способен замещаться на металл и в том случае, когда она
входит в состав воды и когда она входит в состав спиртов. Поэтому
спирты, подобно воде, реагируют с химически наиболее активными
металлами — натрием, калием. В результате взаимодействия этих ме-
таллов с водой получается щёлочь, а в результате взаимодействия
со спиртами получаются твёрдые продукты, называемые алкоголятами.
Названия алкоголятам даются по названию соответствующего им спирта.
Реакция с водой:
2Н OH-|-2Na = 2H ONa-]-H2]
(Н2О) (NaOH)
292
Реакция со спиртами:
2СН30Н 2Na = 2CH3ONa + Н21
метиловый метилат
спирт натрия
2С2Н5ОН + 2Na = 2C2H5ONa 4~ Н21
этиловый этилат *
спирт натрия
При этом наблюдаются следующие различия как результат влия-
ния углеводородного радикала на гидроксильную группу: 1) реакция
со спиртами протекает значительно менее энергично, чем с водой;
2) алкоголяты не могут существовать в водных растворах; под дей-
ствием воды они тотчас же разлагаются на щёлочь и спирт;
\
CH3ONa 4- Н2О = СН3ОН 4~ NaOH
метилат метиловый едкий
натрия спирт натр
Горение спиртов. Спирты являются хорошим горючим мате-
риалом, поэтому метиловый и этиловый спирты широко применяются
для этих целей. Уравнения реакций;
(горение)
2СН3ОН 4- ЗО2 = 2СО2 4- 4Н2О
метиловый
спирт
(горение)
С2Н6ОН 4- ЗО2 = 2СО2 4- ЗН2О
этиловый
спирт
4. Глицерин. Кроме спиртов с одной гидроксильной группой
существуют спирты с несколькими гидроксильными группами. Из
них особый интерес представляет глицерин С3Н5(ОН)3; структурная
формула:
Н
Н—С—ОН
I
н—С—ОН
н—с—он
I
н
СН2ОН
или СНОН т. кипения 290°
СН2ОН
а) Физические свойства глицерина. Глицерин — про-
зрачная бесцветная маслянистая жидкость, сладковатая на вкус.
В технике получается из жиров.
223
б) Химические свойства глицерина. Глицерин, каки
другие спирты, способен реагировать со щелочными металлами, об-
разуя глицераты (подобные алкоголятам натрия, калия);
СН,ОН CH2ONa
2СНОН 4- 6Na = 2 CHONa + 3H2|e
СН2ОН CH2ONa
глицерин глицерат
натрия .
В то же время в химических свойствах глицерина наблюдается
особенность, вызванная большим количеством гидроксильных групп
в молекуле; эта особенность проявляется в новом качественном яв-
лении — в способности глицерина вступать во взаимодействие с ги-
дратами окислов некоторых металлов (меди, свинца):
СН2ОН .
I
СНОН4-£и (ОН)2
I
СН2ОН
улицерин
сн2оч
| >Си4-2Н2О
= СНО /
I
СН2ОН
глицерат
меди
Реакция эта соответствует реакции взаимодействия кислот с осно-
ваниями и показывает, что глицерин проявляет в некоторой мере
кислотные свойства. На- этом примере видно, что накопление
в молекуле групп ОН увеличивает подвижность атома водорода
в гидроксиле.
Применение глицерина весьма разнообразно. Благодаря большой
вязкости, маслянистой консистенции, устойчивости к холоду, он при-
меняется для изготовления мазей и разных паст, для смазки про-
кладок в холодильных машинах, для наполнения гидравлических прес-
сов, для погашения отката орудий при стрельбе; применяется он
также при изготовлении типографских и штемпельных красок.
В больших количествах глицерин применяется в качестве исход-
ного вещества для производства взрывчатых веществ, что будет
рассмотрено дальше.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какая функциональная группа характерна для спиртов?
2. Какое сходство имеется в строении молекул спиртов и воды? в хими-
ческих свойствах их?
3. Приведите формулу древесного спирта. Как он иначе называется?
4. Как получается древесный спирт?
5. Для чего применяется древесный спирт?
6. Приведите формулу винного спирта. Как он иначе называется?
7. Как получается винный спирт?
8. Для чего применяется винный спирт?
224
9. Что образуется при взаимодействии спиртов со щелочными металлами?
Покажите это на примере метилового и этилового спиртов.
10. Как действует вода на алкоголяты?
11. Приведите формулу глицерина.
12. Какие у глицерина проявляются свойства, не наблюдающиеся у спир-
тов, содержащих в молекуле одну гидроксильную группу?
13. Для чего применяется глицерин?
§ 9. Фенолы
Фенолы —это производные ароматических, углеводоро-
дов, в которых один или несколько атомов водорода бен-
зольного ядра замещены гидроксильной группой.
Фенолы соответствуют спиртам, но проявляют ясно выраженные
особенности по сравнению с соответствующими соединениями с от-
крытой цепью; здесь наблюдается заметное влияние бензольного
кольца.
Простейший представитель фенолов — фенол, или карболовая
кислота.
Фенол (карболовая кислота):
ОН
С6НБОН; структурная формула:
Фенол при обычных условиях — твёрдое кристаллическое веще-
ство, плавящееся при 4“41°. Он обладает сильным характерным за-
пахом. В воде фенол растворяется в ограниченном количестве.
Если к фенолу прилить воду, получаются два слоя жидкости:
нижний — раствор воды в феноле и верхний — раствор фенола в воде.
При нагревании растворимость фенола сильно увеличивается, и
оба слоя превращаются в один раствор; при охлаждении жидкости
избыток фенола выделяется, и снова появляются два слоя.
Фенол (карболовая кислота) является хорошим дезинфицирую-
щим средством и широко применяется в медицине. Многие болезне-
творные микробы погибают уже в полупроцентном растворе фенола,
отсюда произошло название фенол (от греческого слова „фэнэ“—
убивать).
Фенол проявляет" ясно выраженные кислотные свойства (отличие
от спиртов). Он реагирует со щелочами, как кислота;
ОН
фенол
ONa
4- NaOH == Н2О 4-
фенолят
натрия
15
Ь. Левченко
225
Продуктом реакции является фенолят — вещество, сходное с со-
лями.
Фенолят хорошо растворим в воде; поэтому при приливании
к фенолу щёлочи получается прозрачный раствор. При действии кис-
лоты на фенолят выделяется обратно фенол:
ONa-
ОН
натрия
Фенол с солями трёхвалентного железа образует соединение фио-
летового цвета. Этим можно пользоваться для обнаружения фенола.
К жидкости приливают раствор хлорного железа; в присутствии фе-
нола появляется фиолетовое окрашивание. • ,
По силе кислотных свойств фенол соответствует слабым кисло-
там. Образуемые им соли — феноляты — разлагаются даже такой
слабой кислотой, как угольная.
Проявление гидроксильной группой фенола ясных кислотнцх
свойств, которые не обнаруживаются в спиртах, является резуль-
татом влияние на неё бензольного кольца. Влияние радикалов
всегдд, бывает взаимным: гидроксильная группа, в свою очередь,
влияет на свойства бензольного кольца. Это влияние проявляется
в более лёгкой способности бензольного кольца к реакциям заме-
щения.
Замещение водорода бромом в бензоле происходит с трудом;' как
было показано на опыте, для проведения этой реакции требуется
влияние катализатора. В феноле подобная же реакция происходит
очень легко даже в водном растворе, без нагревания и без катали-
затора. При приливании к раствору фенола бромной воды тотчас ж&
образуется белый осадок трибромфенола, который имеет указанное
строение молекул:
ОН ОН
фенол gj.
трибромфенол
Трибромфенол применяется в качестве обеззараживающего сред-'
ства. Сам фенол, кроме непосредственного применения в медицине
для дезинфекции, в большом количестве употребляется для изготов-
ления лекарственных веществ, красящих веществ, пластмасс, а также
взрывчатых веществ.
226
ВОПРОСЫ для ПОВТОРЕНИЯ
1. Напишите формулу фенола.
2. Для чего применяется фенол?
3. Какие свойства отличают фенол от спиртов?
4. Что получается при взаимодействии фенола со щёлочью?
5. Какие свойства отличают феноляты от алкоголятов?
6. Чем объясняется появление кислотных свойств у фенола?
7. Какую цветную реакцию даёт фенол с хлорным железом?
8. Как фенол реагирует с бромом?
§10. Альдегиды
Общая формула: R — или R-CHO
\Н
Спирты способны достаточно легко окисляться под действием
различных окислителей и превращаться в альдегиды.
В конечном итоге происходит отрыв от молекулы спирта двух
атомов водорода*и образование двойной связи между атомом угле-
рода и атомом кислорода:
Н
О
муравьиный
альдегид
н
метиловый
спирт
н
этиловый спирт
или СН3—С
уксусный альдегид
Получаемые продукты образуются в результате потери молеку-
лой спирта двух атомов водорода. От этого они получили название
альдегиды; слово „альдегид" составлено из начальных слогов трёх
слов: алкоголь, де (в переводе с латинского без), гидрогениум (ла-
тинское название водорода); смысл названия: спирт, у которого от-
нят водород.
Альдегидами называются органические вещества, в мо-
лекулах которых содержится функциональная группа
//Q
(альдегидная группа)'. — Сс
15*
227
Образование альдегидов можно наблюдать, пользуясь в качестве
окислителя нагретой окисью меди.
Из тонкой медной проволоки свёртывают спираль и нагревают её
над огнём; поверхность проволоки покрывается окисью меди. После
этого накалённую проволоку быстро опускают в спирт, налитый
в пробирку. Происходит реакция окисления спирта и восстановления
меди;
CH3OH4-CuO =Cu-4-H —--ЬН3О
метиловый накалённая медь ’ \Н *
спирт окись меди
муравьиный
^альдегид
В результате реакции медная проволока становится блестящей, а
образовавшийся альдегид выделяется; узнаётся он по резкому запаху.
При окислении винного спирта реакция протекает по уравнению:
СН3-СН2ОН
этиловый спирт
//°
CuO = Cu4-CH3 — се
накалённая
окись меди .
уксусный альдегид
4-н»о
Выделяющийся альдегид узнаётся по запаху.
1. Муравьиный альдегид (формальдегид):
//°
Н — С" или Н-СНО
Ж
Продукту окисления древесного спирта дано название муравьи-
ный альдегид, или формальдегид, потому что при дальнейшем окис-
лении он превращается в муравьиную кислоту, содержащуюся в му-
равьях (первая часть слова „формальдегид" происходит от корня
латинского названия муравьёв).
Муравьиный альдегид — газообразное вещество с резким непри-
ятным запахом, в воде хорошо растворимое. Водный раствор его
называется формалином; обычно он содержит 4О°/о формальдегида.
В технике формальдегид получают окислением древесного спирта,
как в вышеописанном опыте.
Применяется формальдегид для разнообразных целей (рис. 102).
Так как даже в малой концентрации он убивает возбудителей
заразных болезней, его применяют для дезинфекции помещений,
в водном растворе (формалин)—для дезинфекции хирургических
инструментов; применяется он также для обмывания (протравливания)
посевных семян с целью уничтожения спор паразитирующих грибков.
Кроме того, формалин применяется для дубления кож, как исход-
ное сырьё, для изготовления многих красителей и лекарственных
веществ. В последнее время формалин стал широко применяться для
изготовления пластических масс (пластмасс), которые, имея пре-
красные механические свойства, применяются для изготовления самых
разнообразных изделий.
228
2. Уксусный альдегид (ацетальдегид):
* О
СН8—C<f или СН3 СНО
\н
Продуктом окисления винного спирта является уксусный альдегид. Это
название дано ему потому, что при дальнейпТем окислении он превращается
в уксусную кислоту.
Уксусный 'альдегид, или ацетальдегид (первая часть слова происходит от
латинского названия уксусной кислоты', представляет собой хорошо раствори-
<АЛЬДЕГИДЫ
Рис. 102. Главнейшие случаи применения альдегидов: муравьиного
и уксусного.
мую в .воде жидкость с резким запахом, кипящую при 21° и затвердевающую
при —123°. Уксусный альдегид получают для технических целей из ацетилена
по реакции Кучерова (см. стр. 210). Уксусный альдегид используется, главным
образом, для получения уксусной кислоты.
3. Окисление альдегидов. Для альдегидов характерным является
их лёгкая окисляемость, которую можйо наблюдать на примере форм-
альдегида. При этом альдегид, сам окисляясь, восстанавливает дру-
гое участвующее в реакции вещество. Так он действует на окись
серебра и гидрат окиси меди.
Для наблюдения этого явления осаждают в пробирке или кол-
бочке окись серебра, действуя на раствор азотнокислого серебра
разбавленным (2°/0) нашатырным спиртом:
AgNO3 4- NH4OH = AgOH 4- NH4NO
2AgOH = AggO 4- H2O
4
Осадок окиси серебра растворяют в избытке нашатырного спирта
” прибавляют небольшое количество формалина. При нагревании
к формальдегиду переходит кислород от окиси серебра, а металл
229
выделяется в свободном состоянии. Если стенки стеклянного сосуда
чисты, серебро оседает на них блестящим слоем: получается сере-
бряное зеркало:
//° //°
Н—С" _|_Ag2O = 2Ag + H —С/
"Г Ч)Н
муравьиный муравьиная
альдегид кислота
Эта реакция называется реакцией „серебряного зеркала".
Для проведения опыта с медью к 2-процеитноцу раствору, медя-
ного купороса прибавляют такой, же объём -формалина и’ 10-процент-
ный раствор едкого натра; кипятят смесь. Формальдегид окисляется,
а образовавшийся гидрат окиси меди превращается в закись меди,
выпадающую в виде осадка красного цвета:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
/ft /7®
H —C" + 2Cu(OH)2 = Cu2O 4- 2H2O -|- H — C<f
\H - "T" \OH
муравьиный муравьиная
альдегид кислота
Обе эти реакции обычно применяются для обнаружения соедине-
ний, содержащих альдегидную группу.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какая группа атомов характерна для альдегидов?
2. Какая реакция происходит при превращении спиртовой группы в аль-
дегидную?
3. При помощи каких реакций обнаруживаются альдегиды?
4. Что называется формалином?
5. Для чего применяется формалин?
§ 11. Карбоновые кислоты
//°
Общая формула: R—С\ или R-COOH
\ОН
Как
щаются
уже говорилось, в результате окисления альдегиды превра-
в кислоты:
7/°
н—c<f
хон
муравьиная
кислота
Н—C(f 4-0
\Н !
муравьиный
альдегид
СНз-С^ 4-0 —
\Н i
уксусный
альдегид
//Q
сн3—с/
хон
уксусная
кислота
230
Группа —(изображаемая иначе в более простом виде:
\ОН
СООН) называется карбоксильной Труппой, пли, сокращённо, карбо-
ксилом; она проявляет кислотные свойства и входит в состав орга-
нических карбоновых кислот. ' ч
Карбоновыми кислотами, называются органические ве-
щества, в молекулах которых содержится карбоксильная
//°
группа —
Ч)Н.
Ниже будут рассмотрены только одноосновные карбоновые ки-
слоты, т. е. содержащие одну карбоксильную группу (так называемые
жирные кислоты). Карбоновые кислоты проявляют все общие свой-
’ ства кислот: изменяют синюю окраску лакмуса в красную, взаимо-
действуют с металлами,окисями металлов и основаниями, образуя соли.
Как уже говорилось, они являются продуктами окисления сшф-
тов. Весь ряд превращений спиртов на примере образования уксус-
ной кислоты представляется в таком виде:
//° //°
СН3-СН2ОН ——->СН3— СС -i^CH3—С/
этиловый спирт — НгО \н 'ОН
уксусный уксусная
альдегид кислота
Эти же превращения в общем виде:
Н
’ I //0 /70
R—С—OH^t2_^R_с/ _±^R—C'f
I “Нг0 \Н \ОН
J-I альдегид кислота
спирт J
1. Муравьиная кислота:
//Q
Н—С<( или Н-СООН
Ч)Н
Муравьиная кислота — бесцветная жидкость, кипящая при 101°;
с острым запахом; сильно разъедает кожу тела; хорошо растворяется
в воде.
Она содержится в муравьях, в волосках крапивы; от неё зависит
,,х обжигающее действие на кожу. ’Находится она также в незрелом
винограде и других растениях.
а) Получение муравьиной кисло т ы. Муравьиную
кислоту получают в технике из окиси углерода (угарного газа). При
231
высокой температуре и повышенном Давлении окись углерода соеди-
няется с едким натром и образует муравьинокислый натрий:
/£>
С = О4-NaOH —>Н—или Н-COONa
^ONa
Из полученной соли свободная муравьиная кислота как летучее
вещество выделяется действием разбавленной серной кислоты:
Н • COONa 4- H2SO4 = НСООН f 4- NaHSO4
б) Химические свойства муравьиной кислоты. Му-
равьиная кислота проявляет все общие свойства кисЛЬт. Она реаги- *•
рует с металлами, основными окислами, основаниями, солями:
Zn 4- 2Н - СООН = (Н • COO)2Zn 4- Н2 f
муравьинокислый
цинк
' СиО 4- 2Н. СООН = (Н • СОО)2 Си 4- Н2О
___ > муравьинокислая
медь
NaOH 4-Н • СООН = Н • COONa 4-Н2О
муравьинокислый
натрий
Na2CO3 + 2Н • СООН = 2Н • COONa 4- Н2О 4- СО. f
в) Особые свойства муравьиной кислоты. Муравьи-
ная кислота проявляет особые свойства, которыми она отличается
от других карбоновых кислот. Особые свойства муравьиной кислоты
вызываются тем, что в молекуле её карбоксильная группа соединена
не с углеводородным радикалом, а с атомом водорода. Вследствие
этого в молекуле муравьиной кислоты присутствуют кислотная и
в то же время альдегидная группы; это ясно видно, если формулу
её написать так, чтобы выявлялась та или другая функциональная
группа:
Н—С/ или НО—С"
ХОН \н
карбоксильная группа, альдегидная группа, '
соединённая с атомом соединённая с гид-
водорода роксилом
Благодаря этой особенности муравьиная кислота проявляет не
только общие свойства кислот, но, подобно альдегидам, даёт реак-
цию „серебряного зеркала“.
г) Применение муравьиной кислоты. Применяется му-
равьиная кислота при крашении тканей, при выделке ценных сортов
кожи, иногда как дезинфицирующее средство (рис. 103) и пр.
232
2. Уксусная кислота:
Н
1 //Q
Н—С—С" или СН,.СООН
I \эн
н
Уксусная кислота в безводном состоянии представляет собой твёр-
дую, похожую на лёд массу; в таком виде она называется „ледяной"
уксусной кислотой. Плавится она при 16°,5, кипит при 118°, сме-
шивается с водой в любых отношениях. Всем известный уксус пред-
ставляет собой 3—5-процентный водный раствор уксусной кислоты.
кислоты
муравьиная к-та
Рис. 103. Главнейшие случаи применения органических кислот:
муравьиной и уксусной.
Небольшое количество её в виде свободной кислоты и соедине-
ний содержится в растительных и животных организмах.
Уксусная кислота проявляет все общие свойства кислот, но реа-
гирует значительно слабее минеральных кислот. Это обстоятельство
делает возможным применение уксуса как приправы к пище. Однако
при уже имеющейся повышенной кислотности желудочного сока
(хроническое заболевание) употребление уксуса, конечно, недопу-
стимо.
Уксусная кислота применяется (рис. 103), кроме пищевых целей,
Для изготовления ряда лекарственных веществ (аспирина и др.), мно-
гих малярных красок, лаков, растворителей; она применяется также
при изготовлении особых сортов искусственного шёлка, невоспламе-
няющейся плёнки для кино и других целей; алюминиевые и желез-
ные уксуснокислые соли применяются при окраске тканей.
233
Для распознавания солей уксусной кислоты применяются соли
железа, так как образование в растворе уксуснокислого железа легко
узнаётся по появлению темнобурой окраски.
Применение в лаборатории и технике находит также уксусно-
кислый свинец РЬ (СН3-СОО)2. Раствор этой соли имеет сладкий
вкус, откуда произошло название „свинцовый сахар*4, однако, эта
соль ядовита и пробовать её на вкус нельзя. Уксуснокислый свинец
в лабораториях применяется как хорошо растворимая в воде свин-
цовая соль, а в технике для изготовления белой краски — свинцовых
белил, представляющих собой углекислый свинец.
Получение уксусной кислоты. Получается уксусная
кислота при так называемом „уксусном брожении вина*4. При этом
процессе содержащийся в вине спирт окисляется под влиянием осо-
бых бактерий, и из вина получается „уксус44, содержащий до 11%
уксусной кислоты. а
Уксусная кислота, получаемая при брожении спирта, используется
для пищевых целей. Для технического использования в последнее
время основное количество уксусной кислоты готовится синтетически
из ацетилена.
Как уже говорилось, русский учёный М. Г. Кучеров установил,
что ацетилен в присутствии солей ртути, играющих роль катализа-
тора, при невысокой температуре (около 80°) присоединяет воду и
образует уксусный альдегид:
pjj (катализатор
'“'П — соли ртути)
III +н20 =
СН
ацетилен
сн3
уксусный
альдегид
Таким путём получают сначала уксусный альдегид, а затем его
окисляют в кислоту кислородом воздуха в присутствии катализаторов
(окисей некоторых металлов).
Весь путь превращений при синтетическом получении уксусной
кислоты может быть представлен схематически так:
С -J- СаО —► СаС2
уголь карбид
кальция
±^сн±^сн3±2
III 1^0
СН с"
ацетилен 'Н
снч
|//°
\эн
уксусный уксусная
альдегид кислота
Такими схемами часто пользуются в органической химии для
изображения ряда превращений, вместо того чтобы писать несколько
последовательных уравнений. Конечно, по всем таким схемам надо
уметь писать соответствующие им уравнения реакций в полном виде.
Уксусная кислота получается также при сухой перегонке дерева (дре-
весный уксус) вместе с большим числом других органических веществ.
234
§ 12. Сухая перегонка дерева
Сухой перегонкой дерева называется разложение его путём на-
гревания без доступа воздуха; сложные органические вещества, вхо-
дящие в состав дерева, разлагаются, но образующиеся горючие про-
дукты сгорать не могут из-за отсутствия воздуха. При процессе
сухой перегонки дерева образуются газообразные, жидкие и твёрдые
вещества.
В лабораторных условиях опыт можно проводить в приборах раз-
ной степени сложности, показанных на рисунке 104.
Рис. 104. Сухая перегонка дерева.
А — опыт в пробирке; Б и В — опыт в трубках.
<Во всех случаях назреванию подвергаются мелкие лучинки в ко-
личестве, определяемом размером прибора, в котором производится
перегонка.
•Образующиеся газообразные вещества’выходят через отверстие
трубки.' Как только они появляются в виде белого дыма, их поджи-
гают. Горят они светящимся пламенем.
Газообразные продукты состоят из 21—35°/0 метана с примесью
более богатых углеродом соединений.
Жидкие продукты собираются в специальном сосуде (или в хо-
лодном участке трубки). Хорошо бывает заметно расслоение их на
водный слой и смолу. Легко установить кислотный характер нахо-
дящихся в водном слое веществ. Для этого смачивают каплей водного
слоя синюю лакмусовую бумажку: тотчас же происходит изменение
синей окраски в красную под влиянием образовавшейся уксусной кис-
лоты СН3СООН. Полученная жидкость называется древесным уксусом.
Кроме уксусной кислоты, в жидкости содержатся также древесный
спирт СН3ОН, ацетон и другие продукты.
235
Ацетон — низкокипящая жидкость (т. кип. 57°) с характерным
запахом. Применяется в качестве растворителя и для синтезов неко-
торых ценных веществ^
Формула ацетона:
СН3
С=:О
сн3
В молекуле ацетона, как и в молекулах альдегидов, имеется
группа С = О, но в молекуле ацетона при углероде этой группы
i
нет атома водорода; атом углерода здесь связан с двумя углеводо-
родными радикалами. Соединения такого строения носят общее назва-
ние кетоны.
Для сравнения приводятся формулы альдегидов и кетонов в об-
щем виде:' •
R
альдегид кетон
Из получающейся при сухой перегонке дерева смолы (дёгтя),
в зависимости от породы взятого дерева, извлекают различные слож-
ные вещества, находящие важное применение.
Из смолы хвойных деревьев отгоняют всем известный скипи-
дар, который применяется в качестве растворителя при производстве'
лаков.
Из смолы бука получают ценные дезинфицирующие средства
(креозот, гваякол), применяемые также в лечебных целях, и др.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какая группа атомов характерна для карбоновых кислот?
2. Напишите структурные формулы муравьиной и уксусной ки-
слот.
3. Покажите на уравнениях реакций переход от древесного и винного
спиртов к соответствующим кислотам.
4. Как получаются в технике муравьиная и уксусная кислоты?
5. Как распознаются уксуснокислые соли?
6. Для чего применяются уксусная кислота и её соли?
7. Что называется сухой перегонкой дерева?
8. Какие вещества получаются при сухой перегонке дерева?
236
§ 13. Взаимодействие спиртов между собой
и с кислотами. Эфиры
1. Простые эфиры.
Общая формула: R— О—R
При химическом взаимодействии молекул спиртов (в определённых
условиях) из двух гидроксильных групп выделяется молекула воды,
а остающийся кислородный атом связывает вместе два остатка мо-
лекул. Реакция протекает под действием водоотнимающего средства,
обычно — концентрированной серной кислоты. Образующийся продукт
называется простым эфиром. Происходящая реакция может быть
изображена следующим образом: *
метиловый спирт
СН3ОН
(оодоотнимающее вещество)
(H2SO4)
метиловый ефир
СНз-О-СНз
ИЛИ
сн8
/°
снв
он
О-Н
СН3-СН2-
СНз-СНз-
этиловый спирт
С2Ц6ОН
(HaSO.)
сн3.сн2
^>0
СН3-СН2
этиловый эфир
С2Нв-О-С2Н5
Простыми эфирами называются органические веще-
ства, молекулы которых состоят из двух углеводород-
ных радикалов, соединённых между собой через атом
кислорода.
Этиловый эфир (неправильно называемый серным эфиром) пред-
ставляет собой жидкость с характерным запахом, кипящую при 35°,
заметно растворяющуюся в воде. Эфир является хорошим раствори-
телем жиров, масел, смол и других веществ.
237
'Пары эфира в смеси с воздухом легко воспламеняются и при
поджигании дают сильный взрыв. Эфир огнеопасен и должен хра-
ниться в плотно закрытом сосуде вдали от огня.
Этиловый эфир всдедствии большой летучести вызывает значи-
тельное охлаждение 14а смоченном им участке тела.
Он применяется в технике и лаборатории как растворитель, в
медицине — при хирургических операциях.
При проведении реакции с этиловым спиртом (в зависимости от
создаваемых условий) процесс может проходить иначе, чем было
указано; может происходить не образование эфира, а потери моле-
кулой спирта молекулы воды, в результате чего получается
этилен:
Н
Н—С—Н Н—С—Н
I (H2SO<) II
Н—С-гОН = Н2О + Н—С—Ы
| этилен с
Н '
вгиловый спирт
Этой реакцией пользуются для получения этилена в лаборатор-
ных условиях (см. стр. 205).
2. Сложные эфиры.
Z/0
Общая формула: R—О—С—Rj или R-O-CO-R!
(под R и Rj подразумеваются разные радикалы).
Если описанная выше реакция происходит между молекулами
спирта и кислоты, образующийся эфир называется сложным эфи-
ром, а происходящий процесс — этерификацией (от латинского слова
пэтер“—эфир).
Например, npi$ взаимодействии винного спирта и уксусной кислоты
получается сложный эфир:
этиловыи спирт
сн3-сн2—о[н
(H2SO4)
О—Н
ХО
уксусная кислота
н2о 4- сн3сн2
СН3С = О <
уксусноэтило-
ВЫЙ эфир
Сложными эфирами называются- органические веще-
ства, молекулы которых состоят из углеводородного ра-
дикала, связанного с кислотным остатком.
238
Взаимодействие спиртов с кислотами приводит к получению
продуктов, многие из которых имеют большое практическое значение
благодаря приятному запаху. Например, уксусноэтиловый эфир, по-
лучаемый п(^ приведённому выше уравнению реакции, имеет прият-
ный освежающий запах и применяется под названием „туалетного
уксуса".
Из спиртов сивушного масла, отвратительный запах которого
вызывает удушающий кашель, получаются разные искусственные
фруктовые эссенции с приятным ароматом. Таким путём получается
грушевая эссенция из уксусной кислоты и спирта сивушного масла
с 5 углеродными атомами (изоамилового спирта):
(H2SO.)
сбнпон + сн3.со.он = c5hu.o-co-ch34-h2o
изоамиловый уксусная изоамиловый эфир
спирт кислота уксусной кислоты
(грушевой эссенции)
Из того же спирта и изовалериановой кислоты получается яблоч-
ная эссенция:
(HjSO,)
C5HltOH + C4H9.CO.OH = С5Нп-О-СО-С4Н94-Н2О
изоамиловый спирт изовалериановая изоамиловый эфир
кислота изовалериановой кислоты
(яблочная эссенция)
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какие соединения называются простыми эфирами и как они полу-
чаются?
2. Что представляет собой этиловый эфир? Как он получается? Приведите
структурную формулу его.
3. Какие соединения называются сложными эфирами?
4. Как получаются сложные эфиры?
5. Что представляет собой уксусноэтиловый эфир? Как он получается?
Структурная формула его.
6. Какое применение находят эфиры?
§.14. Жиры
1. Состав жиров. Веществами, совершенно не похожими на опи-
санные ароматные эссенции (грушевую, яблочную и др.), являются
жиры, но строение их молекул относится к тому же типу.
Жиры представляют собой сложные эфиры, т. е. являются про-
изводными спирта и кислоты.
В состав жирбв входит трёхатомный спирт — глицерин. Кислоты
Же> образующие жиры, отличаются содержанием большого числа
Углеродных атомов в углеводородном радикале (обычно 15 или 17).
Отсюда произошло общее название для одноосновных карбоновых
кислот — жирные кислоты.
239
Примером кислот, образующих жиры, может служить стеарино'
вая кислота С17Н35-СООН— твёрдое вещество, всем хорошо извест-
ное по стеарину свечей. Стеарин в основном состоит из этой ки*
слоты с примесью другой подобной же кислоты — пальмитиновой,
содержащей 15 атомов углерода в углеводородном радикале:
С16НзГ СООН. В коровьем масле содержится жир, образованный ма-
сляной кислотой С3Н7СООН.
Жиры — это сложные эфиры глицерина и жирных
кислот.
Структурная формула жиров может быть представлена в таком
виде:
°ч
н,с—о—с—с17нзв
« 1 I оо
°ч
НС—О—С—с17н35
I °ч
Н2С—О—С—С„На5
остаток остатки стеа-
глицерина риновой кислоты
Установление природы жиров позволило ’произвести их синтез'
ещё в половине прошлого столетия. Однако при всём ббльшом тео-
ретическом значении практического значения синтез жиров до на-
стоящего времени не имеет из-за высокой стоимости получаемого
продукта. Зато обратный процесс — получение из жиров глицерина
и жирных кислот — применяется в большом масштабе, так как полу-
чаемые продукты находят широкое применение.
2. Переработка жиров, а) Получение глицерина и жир-
ных кислот. При кипячении жира с водой в присутствии кислоты,
действующей каталитически, происходит взаимодействие молекул воды
с молекулами жира и расщепление е^о йа свободный глицерин и
соответствующую жирную кислоту:
%
н2с—о—с—с17н35 н,с—он
й 1< ии &
I г\ (кислота) I
I °ч I
нс—О—С—С17Нз5 4- ЗН2О = НС—ОН 4- 3 Сj 7н35 • СООН
О' I стеариновая
( кислота
Н2С—О—С—С17нзв Н2С—ОН
жир глицерин
240
В приведённой реакции с участием воды происходит процесс,
обратный образованию эфира, т. е. этерификации (см. стр. 238). Этот
процесс называется омылением (так как им пользуются для полу-
чения мыла).
Подобные реакции, в которых 'вода является реагирующим ве-
ществом, называются реакциями гидролиза (что означает разложе-
Клеевое мыло
(до 90£ воды)
Рис. 105. Переработка жиров на стеарин и мыло.
ние 1юдой). Реакции гидролиза в процессах превращения органиче-
ских веществ играют большую роль.
Расщепление жиров производится в промышленных масштабах
путём кипячения их в воде с небольшой примесью катализаторов.
Таким'путём получают необходимые для различных технических нужд
глицерин и стеарин (смесь твёрдых жирных кислот).
б) Получение мыла. Жирные кислоты, как и все кислоты,
образуют соли в результате замены водорода кислотной группы
металлом. Это можно наблюдать на следующем опыте. Немного
стеарина растворяют в эфире и прибавляют в него каплю раствора
фенолфталеина. Затем по каплям прибавляют раствор едкого натра.
В. в. Левченко 241
Первые капли щёлочи не вызывают окрашивания фенолфталеина,
так как щёлочь нейтрализуется находящейся в растворе стеариновой
кислотой:
С17Н35 • СООН NaOH = С17Н35 • COONa + Н2О
стеариновая стеариновокислый
кислота натрий
Та же соль образуется при кипячении стеарина с едким натром.е
Соли высокомолекулярных жирных кислот называются мылами.'
Обыкновенное мыло представляет собой смесь натриевых соле#
нескольких высокомолекулярных жирных кислот. Натриевые соли
образуют твёрдое мыло, а калиевые соли — жидкое мыло.
Обычное мыло получают непосредственно из жиров путём кипя-
чения со щёлочью; в этом случае ' образуются не свободные жирные
кислоты, как при кипячении жира с водой в присутствии кислоты,
а натриевые или калиевые соли их, в зависимости от взятой щё-
лочи (рис. 105):
%
Н2С—О—С—с17н35 Н2СОН
। (кипячение) |
НС—О—С—С17НзБ 4- 3NaOH = НСОН + ЗС17Н35 • COONa
I гч I стеариновокислый натрий
| | (мыло)
Н2С—О—С—с17н35 Н2СОН
жир глицерин
По окончании варки мыла можно дать застыть всей массе; в этом
случае получается мыло, содержащее до 9О°/о воды; называется оно
Рис. 106. Схема моющего действия
мыла.
клеевым мылом. При хранений
в сухом месте такое мыло очень
сильно усыхает.
Для освобождения мыла от из-
лишней воды в жидкость, получен-
ную после варки, прибавляют пова-
ренную соль. Мыло в этом случае
всплывает на поверхность и после
застывания образует плотную не-
усыхающую массу обезвоженного
мыла — ядровое мыло. Процесс эт^от
называется высаливанием.
Употребление мыла для мытья
основано на следующем явлении.
Под действием воды (рис. 106)
мыло распадается на свободную стеариновую кислоту и щёлочь:
С17Н35-СОО
мыло
= C17H35.COOH4-NaOH
стеариновая едкий
кислота натр
942
Щёлочь, остающаяся в воде, удаляет с поверхности тела жир и
другие загрязнения, а свободная кислота образует пену, которая
захватывает частички грязи и вместе с ними уносится током воды.
Из сказанного следует, что чем больше образуется при мытье пены,
тем лучше происходит отмывание грязи.
Если в воде содержится много солей кальция (жёсткая вода),
освобождающаяся жирная кислота образует нерастворимую кальциевую
соль и выпадает в осадок:
2С17НЗЬ • СООН Ц- Са (НСО3)2 = Са (Ci7H35• СОО)2 + 2Н2СО3
стеариновая кислый * । t
кислота углекислый стеариновокислый 2Н О2СО
кальции кальций 2 2
Вследствие образования нерастворимой соли жирной кислоты
пена почти не образуется и грязь с тела не смывается. Прибавление
соды смягчает воду (см. дальше) и увеличивает моющее действие
мыла. х
Производство мыла у нас достигло больших размеров и будет
увеличиваться дальше. В 1950 г. производство мыла увеличилось
на 16°/0 по сравнению с довоенным.
3. Жиры в питании. Жиры являются непременной составной ча-
стью пищи животных и человека.
В процессе пищеварения с жирами происходят превращения, ана-
логичные вышеописанным. В тонких кишках под действием выделяю-
щегося кишечного сока они расщепляются на глицерин и соли жирных
кислот. В кишечном соке содержатся необходимая для этого процесса
щёлочь и вещества, ускоряющие реакцию, т. е. действующие ката-
литически (ферменты).
Происходящее при пищеварении превращение жиров в глицерин
и соли жирных кислот имеет большое значение для организма, так
как через стенки кишечника неизменённые жиры проходить не могут.
Поэтому при нарушении процессов пищеварения жиры проходят через
кишечник, не усваиваясь организмом.
Из жиров легче переваривается коровье масло; поэтому оно при-
меняется для питания желудочных больных.
4. Гидрогенизация жиров. Как известно, жиры бывают твёрдые
(баранье и говяжье сало) и жидкие, обычно называемые маслами
(большинство растительных жиров).
Твёрдые жиры образованы в основном твёрдыми кислотами —
стеариновой кислотой, пальмитиновой кислотой; жидкие жиры образо-
ваны жидкими кислотами, например олеиновой кислотой С17Н33СООН.
В Углеводородном радикале её содержится на 2 атома водорода
меньше, чем в стеариновой кислоте С17Н35СООН.
В углеводородном радикале жидких жиров имеется одна или не-
сколько двойных связей; следовательно, жидкие жиры являются непре-
дельными соединениями.
Таким образом, наблюдающееся различие между жидким и твёр-
м жиром вызывается, главным образом, тем, что в молекулах
16*
243
первого содержится на несколько атомов водорода меньше, чем в мо-
лекулах второго,— яркий пример зависимости качественных свойств
веществ от количественного состава.
Установление этого обстоятельства открыло путь к превращению
представляющих меньшую ценность жидких жиров в более ценные
твёрдые жиры. Это превращение осуществляется в производственных
масштабах путём присоединения к жидким жирам водорода, недо-
стающего им до полного насыщения валентных связей:
Н2С—О—С—С17Н„Ч н2с—о—с—с17нзв
6 1I со а 17 «О
I q (нагревание, I
I катализатор) |
НС—О—С—С17нзз + зн, = нс—о—с—с17нзб
I °ч
н2с—о—с—c17rtg3
I %
Н2С----О---С---ClyHgJ
I I
остаток олеиновой
кислоты
I________________I.
остаток стеариновой
кислоты
жидкий жир
твёрдый жир
Присоединение водорода к жидким жирам, называется гидро-
генизацией жиров (от латинского названия водорода „гидроге-
ниум“).
Процесс этот проводится в присутствии металлов—никеля и др.,
оказывающих каталитическое действие (рис. 107). Получаемые из
жидких масел твёрдые жиры используются для производства мыла,
свечей, а в очищенном и переработанном виде—для изготовления пи-
щевых продуктов (маргарина).
Таким путём лабораторные изыскания привели к новым успехам:
менее ценные жидкие жиры, как подсолнечное масло, хлопко-
вое масло и др., химики научились превращать в хорошее ядро-
вое мыло, в стеарин и пищевые продукты, подобные салу и маслу
(маргарин).
б. Высыхающие масла. Среди растительных жиров особую
группу составляют высыхающие масла (льняное, конопляное). Они
образованы непредельными кислотами, в углеводородном радикал^
которых до полного насыщения нехватает не менее 4 атомов водо-
рода (содержат не менее двух двойных связей в молекуле). При-
соединяя кислород воздуха по месту двойных связей, эти масла
превращаются в твёрдые продукты окисления, образующие плотную
поверхностную плёнку.
Благодаря этому такие масла применяются для изготовления масля-
ных красок. Чтобы ещё более ускорить процесс высыхания (окисле-
ния), масло варят с окислителями — кислородными соединениями
244
свинца и др.; таким путём получают технический продукт — ча-
стично окисленное масло — олифу, на которой затирают минеральные
краски.
Рис. 107. Установка для гидрогенизации
жиров (частично в разрезе).
Через трубу а вливается масло, через б — вносится
катализатор. Водород насосом вдувается снизу.
Через в — удаляется избыток водорода.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что представляет собой стеарин?
2. К какому классу органических соединений относятся жиры?
3. Из каких веществ образуются жиры? .Приведите реакцию образова-
ния жира из стеариновой кислоты.
4. Что происходит при варке жира в присутствии кислоты? Какие по-
лучаются продукты?
5. Что получается при варке жира в щелочном растворе? Какие полу-
чаются продукты?
6. Из каких продуктов можно получать мыло?
7. Что называется клеевым мылом? ядровым мылом? Какое из них более
ценно и почему?
8. Что представляет собой твёрдое мыло? жидкое мыло?
9. Что происходит с мылом при стирке? Какие образуются продукты?
Какую они играют роль в процессе очистки от грязи?
10. Что представляет собой мыльная пена и каково её значение?
11. Почему в жёсткой воде не проявляется моющее действие мыла?
12. Чем отличаются по физическим свойствам жиры, содержащие пре-
дельные кислоты? непредельные кислоты?
13. Чем отличаются по химическим свойствам жидкие жиры от твёрдых?
14. Каким путём превращают жидкие жиры в твёрдые и для чего это
Делается?
15. Чем отличаются по химическому составу жиры, способные высыхать?
Для чего они применяются?
16. В чём заключается процесс высыхания масляной краски?
245
§ 15. Сложные эфиры минеральных кислот. Нитроглицерин.
Динамит
Сложные эфиры могут получаться при взаимодействии спиртов
с минеральными кислотами.
При действии на глицерин азотной кислоты образуется обладаю-
щий очень большой взрывчатой силой нитроглицерин:
Н2С— :OH4-H!O-NO2
Н2С—O-NO2 '
НС—
О • no2 = НС—О • NO2 4- ЗН2О
Н2с— j ОНЦ-Н о • no2
глицерин
азотная
кислота
н2с—o-no2
нитроглицерин
C3H5(O-NO2)3
Нитроглицерин, смешанный с инертными веществами для пре-
дупреждения самовзрывания, широко применяется под названием дина-
мита при прорытии туннелей, шахт и т. п.
Впервые предложил использовать нитроглицерин кагё взрывчатое
вещество русский учёный Н. Н. Зийин.
При взрыве нитроглицерина атомы азота отрываются от молекул
и, соединяясь попарно, выделяются в виде свободного газа (N2),
а атомы углерода и водорода соединяются с освободившимися ато-
мами кислорода и образуют конечные продукты горения — углекис-
лый газ и воду; из двух молекул нитроглицерина при этом выде-
ляется ещё один свободный* атом кислорода:
(нагревание, удар)
2С3Н5 (ONO2)3 = 3N2 -f- 6СО2 + 5К.0 4~ о
нитроглицерин
При взрыве нитроглицерина выделяется большое количество тепла,
по не образуется твёрдых веществ (отличие от чёрного пороха). Рас-
ширение же газообразных продуктов от высокой температуры придаёт
взрыву особенно большую разрушительную силу.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Приведите формулы нитроглицерина.
2. Что происходит при взрыве нитроглицерина?
3. Чем отличается взрыв нитроглицерина от взрыва пороха?
4. Что представляет собой динамит?
246
§ 16. Углеводы
Всем известный сахар откосится к обширной группе веществ,
образованных тремя элементами: углеродом, водородом и кислородом.
Вещества эти объединяются под общим названием углеводы. Такое
название дано потому, что в молекулах большинства этих веществ
водорода содержится вдвое больше, чем кислорода (как и в воде).
Название „углеводы" было дано в прежнее время, когда думали, что
в молекулах всех этих веществ водорода содержится вдвое больше,
чем кислорода. В дальнейшем, однако, было найдено много веществ,
которые по химической природе должны быть отнесены к углеводам,
но содержат водород и кислород в ином соотношении, чем в воде.
Имеются также вещества с тем же соотношением водорода и кисло-
рода, но по химическим свойствам не относящиеся к углеводам,
поэтому следует иметь в виду, что название „углеводы" не отвечает
сути дела, а сохранилось по традиции.
Относящиеся**к углеводам вещества играют чрезвычайно важную
роль в жизни живых организмов и широко используются в тех-
нике.
1. Простые сахара, или моносахариды. Примером сравнительно
более простых углеводов может служить глюкоза, или виноградный
сахар. Название „глюкоза" происходит от греческого слова „глюкос",
что значит „сладкий”, и указывает на сладкий' вкус этого вещества.
Глюкоза в значительном количестве содержится в соке вино-
града и в других сладких плодах, а в небольших количествах — во
всех тканях организмов животных и растений. Роль глюкозы в жи-
вом теле очень велика: при окислении её выделяется тепло —
энергия, которую организм использует в процессах жизнедеятель-
ности.
В свободном виде глюкоза широко применяется в кондитерском
деле, а также в медицине и пр.
Состав молекулы глюкозы выражается формулой: С6Н12Ов. Как
впервые показал знаменитый русский учёный А. М. Бутлеров (1861 г.),
сахаристое вещество, подобное глюкозе, при особых условиях может
превращаться в формальдегид Н—Ск
г ХН
В дальнейшем было установлено, что здесь происходит соедине-
ние ц одну крупную молекулу шести молекул формальдегида. Слу-
чай этот показывает, какие поразительные превращения могут про-
исходить в результате полимеризации, т. е. соединения друг с другом
одинаковых молекул: газообразное вещество с резким неприятным
запахом и вкусом превращается в совершенно не сходное с ним твёр-
дое вещество, по вкусу не отличающееся от природного сахара.
Как и в других случаях (сравнить с синтезом каучука), молекулы
исходного вещества — формальдегида СН2О — являются как бы
247
„кирпичиками", из которых образуются в результате взаимодействия
между ними молекулы конечного продукта — сахара:
(полимеризация)
6СН2О = С9Н12Ов
формаль- сахар
дегид
В молекулах сахаров содержатся гидроксильные группы. Их легко
обнаружить по образованию сахаратов, подобных глицератам. Если
в известковое молоко (взвесь извести в воде) прибавлять концентри-
рованный раствор глюкозы, жидкость становится прозрачной, вслед-
ствие перехода гидрата окиси кальция в кальциевый сахарат, хорошо
растворимый в воде.
В молекулах глюкозы, кроме того, содержится альдегидная группа,
поэтому глюкоза, как все альдегиды, даёт реакции с аммиачным
раствором окиси серебра и гидратом окиси меди. Многие сахара вместо
альдегидной группы содержат кетонную группу, например содержа-
щийся в плодах и мёде сахар — фруктоза.
Для примера приводятся формулы глюкозы и фруктозы:
н 1 н 1
н—с—он н—с—он 1
1 н—с—он 1 Н—С—он
Н—С—он Нт-С—он 1
1 н—с—он 1 н—с—он 1
н—с—он 1 1 с=о 1
1 с = о 1 н—с—он 1
1 1 н
н фруктоза
глюкоза
На основании приведённых формул углеводам можно дать такое
определение:
Углеводы — это органические вещества, молекулы кото-
рых содержат альдегидную или кетонную группу и гидро-
ксильные группы.
Другими словами, углеводы — это альдегидоспирты, или кетопо-
спирты.
Глюкоза является представителем простых сахаров, или „моносаха-
ридов" (греческое слово „монос" означает „один").
Моносахаридов существует много (различные изомеры).
248
2. Дисахариды. Молекулы простых сахаров обладают способно-
стью соединяться в более крупные образования, причём происходит
изменение физических и химических свойств. Так, например, в расте-
ниях под влиянием ферментов две молекулы простого сахара теряют
молекулу воды и образуют молекулу более сложного сахара:
(ферменты)
2C6H12Oe = С12Н22О11 “I- Н2О
моносахарид дисахарид
Такие сахара являются по сравнению с глюкозой как бы двой-
ными сахарами, почему им дали название дисахариды (греческое слово
„ди“ означает „дважды").
Примером может служить обычный, употребляемый в пищу сахар
(сахароза); называется он свекловичным или тростниковым, так как
его получают из сока сахарной свёклы и сахарного тростника. Со-
став молекулы свекловичного сахара выражается формулой
Свекловичный сахар значительно слаще глюкозы. '
Свекловичный сахар не даёт реакции на альдегидную группу.
Если же сахар нагреть до плавления и продолжать нагревание до
-появления красной окраски, происходит частичное разложение его;
образующиеся продукты разложения дают реакции на альдегидную
группу.
То же происходит при кипячении раствора свекловичного сахара
с кислотой, вызывающей гидролиз (кислота играет роль катали-
затора):
(кипячение с кислотой)
С12Н22О11 Н2о = СвН12Ов сбн12ов
свекловичный глюкоза фруктоза
сахар (дисахарид) моносахариды
3. Полисахариды. В растениях под влиянием особых ферментов
большое количество молекул глюкозы, теряя по молекуле воды
и уплотняясь, образует уже мало похожее на сахар, всем известное
пищевое вещество крахмал. Так как не установлено количество мо-
лекул глюкозы, образующих молекулу крахмала, формулу его пред-
ставляют в виде: (С6Н10О5) п. Значок п после скобки означает какое-то
большое число повторений указанной в скобке группы. Уравнение
реакции перехода глюкозы в крахмал может быть представлено в та-
ком виде:
, (ферменты)
• п C6H12Oe = п Н2О -|- (CeH10O6) ft
п молекул одна молекула
глюкозы крахмала
Описанный процесс может идти и в обратном направлении: к моле-
кулам крахмала присоединяется вода (т. е. происходит процесс гидро-
лиза), и получаются молекулы глюкозы: крахмал превращается в са-
хар. Такой процесс происходит под влиянием особых ферментов,
' 249
а также при кипячении крахмала в воде с небольшим количеством
кислоты, действующей каталитически:
(кипячение с кислотой)
(С-бН10О6) п -р /гН2О = лСвН12О6
крахмал сахар
(глюкоза)
В растениях превращения глюкозы могут приводить также
к образованию клетчатки, или целлюлозы (последнее название взято
от латинского слова „целлюла"—клетка). Из клетчатки построены
стенки растительных клеток. Формула клетчатки та же, что и крах-
мала: (СбН10О5) п, но число уплотнившихся молекул caxhpa в ней
гораздо больше, чем в крахмале. Примером довольно чистой клет-
чатки может служить вата, менее чистой — белая фильтровальная
бумага.
Клетчатка, присоединяя воду, может переходить в глюкозу, как
и крахмал; такой переход может вызываться искусственно.
Крахмал и клетчатка как вещества, образуемые соединением
большого количества молекул простого сахара {моносахаридов),
объединяются под общим названием полисахаридов (греческое слово
„поли" означает „много").
4. Образование углеводов в растениях. Фотосинтез. Образо-
вание, т. е. синтез, глюкозы и описанные процессы превращений
происходят в растениях. Глюкоза^ образуется в зелёных листьях под
воздействием света, отчего этот процесс получил название фото-
синтеза. Материал для образования глюкозы растения' получают из
всасываемой корнями почвенной воды и из углекислого газа,. посту-
пающего в листья из воздуха.
. Процесс фотосинтеза и роль зелёного вещества — хлорофилла,
содержащегося в хлорофилловых зёрнах, были разгаданы после
многолетних упорных исследований великим советским учёным
К. А. Тимирязевым.
КЛИМЕНТ АРКАДЬЕВИЧ ТИМИРЯЗЕВ
Великий русский учёный Климент Аркадьевич Тимирязев, обессмертив-
ший своё имя классическими исследованиями процесса фотосинтеза, с кото-
рым связано существование растений и всего животного мира. Он доказал,
что растения под влиянием солнечной энергии усваивают углекислый газ
воздуха; в результате этого из углекислого газа и воды в растениях обра-
зуются сложные молекулы углеводов; что закон сохранения энергии приме-
ним к явлениям жизни, и навсегда покончил с реакционной идеалистической
теорией о .жизненной силе".
К. А. Тимирязев гармонически сочетал в своём творчестве теорию с прак-
тикой, горячо поддерживал введение в севооборот клевера, пропагандировал
применение минеральных удобрений, искусственное орошение, глубокую
вспашку земли как меру борьбы с засухой и т. д.
К. А. Тимирязев был истинный учёный-гражданин. Он с огромной ра-
достью приветствовал Великую Октябрьскую социалистическую революцию,
давшую власть в руки рабочих и крестьян. Два с половиной года, прожи-
250
тые им при советской власти, были годами исключительного подъёма его
научной и общественной деятельности. Несмотря на болезнь, он принял дея-
тельное участие в работе Московского Совета как его депутат.
На схеме (рис. 108.) по-
казаны главнейшие стадии
процесса фотосинтеза.
В хлорофилловых зёрнах,
находящихся в клетках ли-
ста, на свету происходит по-
глощение углекислого газа
и выделение кислорода об-
ратно в воздух; углерод
же остаётся в продуктах син-
теза, превращающихся затем
в глюкозу. Глюкоза из
листьев переходит по сосу-
дам в различные частй* расте-
ния и отлагается там в за-
пас, превращаясь, как выше
описано, в крахмал. Таким
путём получаются отложе-
ния крахмала в корнях (мор-
ковь), клубнях (картофель),
семенах (злаки).
Отложенный в запас
крахмал, присоединяя воду,
обратно превращается в саха
К. А. Тимирязев (1843—1920).
р; это происходит, например, при про-
растании, отчего появляется сладкий вкус у прорастающих зёрен,
у прорастающего картофеля. Превращением крахмала в сахар объяс-
няется сладкий вкус также мороженого картофеля.
Образование глюкозы в листьях и все дальнейшие превращения
её происходят под действием специальных ферментов (органических
катализаторов). В листьях такое действие оказывает зелёное веще-
ство— хлорофилл; в незелёных частях растения, не имеющих хлоро-
филла, глюкоза не образуется.
х 5. Значение углеводов в питании животных. Углеводы, как и
жиры, должны входить в состав пищи животных и человека. Взрослый
человек должен принимать в сутки достаточно углеводов в виде сахара
и крахмала (в хлебе, картофеле, в изделиях из различной крупы
и др.). Сахар усваивается организмом непосредственно, а крахмал
в процессе пищеварения должен превратиться в сахар. Это превра-
щение начинается уже во рту под влиянием особого фермента слюны,
почему при длительном разжёвывании хлеба чувствуется сладковатый
вкус. Заканчивается переваривание крахмала в кишечнике под влия-
нием ферментов кишечного сока.
В царской России производство сахара (1913 г.) составляло
999 тыс. т. В Советском Союзе в 1928 г. было произведено его
251
Рис. 108. Схема фотосинтеза (образова-
ние глюкозы в зелёном листе).
1300 тыс. т, в 1940 г.— 2151 тыс. т. В 1950 г. довоенный
уровень производства сахара превзойдён на 17 процентов. Были
использованы полностью восстановленные и вновь выстроенные
заводы.
6. Техническая переработка углеводов. Описанные выше заме-
чательные превращения углеводов происходят в результате гидро-
лиза при кипячении их с водой в присутствии кислоты. Это сделало
возможным использование гид-
ролиза крахмала и клетчатки
в производственных условиях
(рис. 109).
Получение глюкозы
из более сложных угле-
водов. В большом размере
используется возможность пре-
вращения крахмала в глюкозу.
Для этого крахмал кипятят с
водой, в которую прибавлено
небольшое количество кислоты
(соляной, серной), ускоряющей
процесс присоединения воды
(т. е. гидролиза). Получаемый
из крахмала сладкий продукт
неполного гидролиза — пато-
ка — или конечный продукт —
тлюкоза — употребляется для
технических нужд или (после
тщательной очистки) в каче-
стве пищевого вещества.
Таким же путём получают
глюкозу из клетчатки, в част-
fl указанном направлении пред-
ставляет особый интерес благодаря дешевизне исходного материала;
однако в дереве клетчатка загрязнена различными примесями, кото-
рые осложняют технологию процесса и удорожают его. Несмотря
на это, осахаривание древесины начинает приобретать всё большее
значение.
В Советском Союзе создана мощная гидролизная промышлен-
ность.
Получение спирта из углеводов. В большом размере
проводится в технике процесс превращения глюкозы в спирт
(винокуренное производство). Обычно в качестве исходного про-
дукта берут не дорогостоящий сахар, а крахмал (содержащие
его продукты: муку, кукурузу, картофель и пр.). При этом крахмал
сначала превращается в глюкозу под влиянием фермента, вводи-
мого в заготовленную смесь со специально прибавляемым соло-
дом— проросшими зёрнами ячменя. Затем образовавшаяся глюкоза
под влиянием другого фермента, вырабатываемого дрожжами
ности из дерева. Переработка дерева
252
(которые для этого добавляются), превращается в спирт и угле-
кислый газ:
(фермент)
• С6Н,2ОЛ = 2СаН6ОН -|- 2СОа(
глюкоза винный
спирт
С 1935 г. у нас началось производство спирта на основе гидролиза
древесины, что имеет большое экономическое значение: тонна опи-
лок заменяет в этом производстве тонну картофеля или 300 кг зерна.
Рис. 109. Получаемые из
клетчатки продукты.
К 1950 г. восстановлены и вновь построены заводы для получе-
ния спирта путём гидролиза древесины. Выработка спирта из древе-
сины увеличилась по сравнению с довоенной.
Получение искусственного шёлка и пластмасс
из клетчатки. В последнее время клетчатка нашла особое приме-
нение: из неё научились вырабатывать искусственный шёлк. Такая пе-
реработка клетчатки основана на особенностях структуры её молекул.
Как уже. говорилось, в молекулах глюкозы имеются связанные
с углеродом гидроксильные группы, характерные для спиртов. Эти
группы обеспечивают глюкозе и продукту её уплотнения — клет-
чатке — свойство спиртов: вступать во взаимодействие с кислотами
и давать сложные эфиры.
Сложные эфиры клетчатки переводятся в раствор, который полу-
чается в виде вязкой жидкости. Если её продавливать через тончай-
шие отверстия в осадительную ванну, в которой происходит расше-
253
пление эфира и выделение свободной клетчатки (или её производного),
получаются достаточно прочные нити.
Таким путём вырабатывается искусственное волокно, по внеш-
нему виду и другим свойствам соперничающее с натуральным шёлком.
Сходство здесь, конечно, только внешнее, так как натуральный
шёлк, выделяемый желёзками шелковичного червя, представляет
собой белковое вещество, а искусственный шёлк является углеводом.
Это, однако, не мешает некоторым сортам искусственного шёлка не
уступать натуральному ни по виду, ни по прочности, особенно при
новейших способах его выделки.
Искусственный шёлк можно получать, переводя клетчатку (вату,
бумажную массу) в эфир — нитроклетчатку, путём обработки её
смесью азотной и серной кислот. Нитроклетчатку затем растворяют
в смеси спирта с эфиром (этиловым) и подвергают обработке.
Можно растворять клетчатку, обрабатывая её щёлочью и серо-
углеродом;- получаемый этим методом шёлк носит название вискозы.
Клетчатка растворяется также в аммиачном растворе гидрата
окиси меди; в этом случае получается так называемый медноаммиач-
ный шёлк, особенно высококачественный. Во всех этих случаях нити,
получаемые после проведения через осадительную ванну с последую-
щей дополнительной обработкой, состоят из обратно выделенной
чистой клетчатки.
При новейшем способе производства клетчатка' обрабатывается
уксусным ангидридом. Получаемый эфир^—ацетилклет«атка (название
эфира — от латинского слова „ацетум“, означающего уксус) без раз-
ложения сразу даёт в осадительной ванне нити искусствейнс)го шёлка.
Получаемый в этом случае высококачественный шёлк (ацетатный шёлк)
является не клетчаткой, а сложным эфиром. Такой эфир не образуется
в природных условиях.
Эфиры клетчатки находят разнообразное применение (рис. 109).
Особенно широко используется нитроклетчатка.
Нитроклетчатка, получаемая при взаимодействии клетчатки с не-
достаточным количеством азотной кислоты, сплавляется с камфорой
(твёрдым пахучим веществом, получаемым из особой породы де-
ревьев— камфарного дерева, а также приготовляемым синтетически).
Сплавленный продукт после механической обработки образует пла-
стический материал — целлулоид; употребляется он для различных
поделок, а главным образом для изготовления целлулоидных кине-
матографических лент.
Растворённая в смеси спирта с эфиром нитроклетчатка даёт продукт^
называемый коллодием. По испарении растворителя коллодий остав-
ляет достаточно прочную плёнку из нитроклетчатки; благодаря этому
он употребляется в медицине для приклеивания небольших повязок.
Нитроклетчатка в последнее время широко применяется также для
изготовления высококачественных лаков (окраска автомобилей и пр.).
Подобное же применение находит ацетилклетчатка. Из неё изго-
товляют лаки и целлулоидоподобные пластические материалы. Послед-
ние имеют ценное преимущество перед целлулоидом — значительно
OR4
меньшую воспламеняемость; благодаря этому они употребляются для
изготовления трудновоспламеняющейся кинематографической, ленты.
В качестве пластического материала применяется также вискоза.
При продавливании её через узкие щели получают прозрачные тонкие
листы, получившие название целлофана; эти листы применяются для
упаковки пищевых продуктов и для других целей.
Производство искусственного шёлка началось в СССР в 1925 г.;
тогда было выработано 100 т. Через 10 лет было выработано уже
5600 т. Согласно пятилетнему плану завершилось строительство
4 фабрик искусственного волокна и строительство 3 новых. В 1950 г.
значительно расширено и освоено производство новых видов продук-
ции для промышленности искусственного волокна.
Увеличилось также производство лаков. В послевоенной пятилетке
построены новые лакокрасочные заводы. Лаки являются самым надёж-
ным средством защиты металлов от порчи под действием внешних
условий. Выпускаются лаки самого различного назначения: электро-
изоляционные лаки, лаки для защиты от света, воды, огнеупорные
лаки и т. д. \
Получение взрывчатых веществ из клетчатки.
Тот же самый тип реакций, который лежит в основе описанных
выше способов получения искусственного шёлка, может быть приме-
нён для получения взрывчатых веществ, значительно превосходящих
по разрушительной силе чёрный порох.
" Если проводить реакцию с избытком азотной кислоты, получается
тринитроклетчатка, в молекулах которой, как показали исследования
её, содержится наибольшее количество нитрогрупп ЫО2 (по 3 нитро-
группы на 6 углеродных атомов).
Для ясности формулу клетчатки (СбН10О6) п можно изобразить
с указанием гидроксильных групп:
ZOH~
(С6Н7О2)^ОН
\он
п
Уравнение реакции взаимодействия её с избытком азотной кис-
лоты можно представить в таком виде:
/ОН-
(С6Н7О2)(-ОН 4-3/zHO .NO2=3nH2O+
^он2 п
/O-NO2-
(С„Н.0.,)-0 • no2
\o-no2_
тринитроклетчатка
П
В неустойчивых молекулах тринитроклетчаткп объединены остатки
клетчатки •— горючего вещества и нитрогруппы, легко отщепляющие
кислород. В результате этого тринитроклетчатка не только легко
вспыхивает при поджигании, но и взрывается при ударе. Обработанная
определённым образом нитроклетчатка под названием пироксилин
применяется для изготовления бездымного пороха. Последнее назва-
ние дано потому, что при взрыве его не образуется твёрдых веществ,
Дающих дым. Пироксилин также применяется в горном деле.
255
ВОПРОСЫ для ПОВТОРЕНИЯ
1. Какие соединения называются углеводами?
2. Как построена молекула глюкозы? Какие в ней содержатся функцио-
нальные группы?
3. Каким образом доказывается присутствие альдегидной группы?
4. Что происходит при спиртовом брожении и чем вызывается этот
процесс?
5. Почему свекловичный (тростниковый) сахар относится к дисахаридам?
6. Как выводится формула дисахарида из формулы простого сахара
(моносахарида)?
7. Как можно вызвать расщепление свекловичного сахара на простые
сахара и доказать это?
8. Как можно вывести формулу крахмала, исходя из формулы простого
сахара?
9. Каков путь образования углеводов в растениях?
10. Чем вызывается гидролиз крахмала в организме?-в технике?
11. Какие конечные продукты образуются при гидролизе крахмала?
12. Какое применение находит клетчатка?
13. Как используются эфиры клетчатки?
14. Что представляет собой целлулоид и как он получается?
15. Что представляет собой коллодий и как он получается?
16. Как получается искусственный шёлк?
§17. Азотсодержащие органические соединения
1. Нитробензол. Выше были рассмотрены органические вещества,
содержащие азот: нитроглицерин и нитроклетчатка. Оба эти вещества
являются сложными эфирами азотной кислоты. Получаются они
в результате взаимодействия молекул азотной кислоты ' с гидро-
ксильными группами, содержащимися в молекулах органического
вещества (глицерина, клетчатки). В этих соединениях нитро/руппа
//О
(—Nx. , или —NO2) связана с углеродными атомами через атом
ХО
кислорода.
Нитрогруппа может быть введена также в молекулы веществ, не
содержащих спиртовых групп, а именно: в молекулы бензола и его
производных.
Реакция протекает по следующему уравнению (формулы реаги-
рующих веществ даны в структурном виде):
СН НС
Hc/^iC—NO,
НО^СН
НС ’
бензол
С:Н (в присутствии
: . : серной кислоты)
4-;ho:no2=h3o-u
азотная
кислота
нитробензол
Реакция проходит в присутствии концентрированной серной
кислоты, действующей в качестве водоотнимающего средства. В этой
256
реакции от бензольного кольца отделяется водородный атом и обра-
зует с группой ОН кислоты молекулу воды; остатки же от обеих
молекул соединяются вместе. В этом случае азот нитрогруппы не-
посредственно присоединяется к углеродному атому бензольного
кольца. Такие соединения называются нитросоединениями, а реакция
называется нитрованием. В молекулах этих соединений, в отличие
от эфиров, между атомами азота и углерода нет мостика из атома
кислорода.
При нитровании, т. е. при обработке азотной кислотой бензола,
получается светложёлтая жидкость — нитробензол.
Нитробензол обладает приятным запахом горького миндаля; при-
меняется в парфюмерии, а также как исходный материал при син-
тезах других производных бензола.
Подобно бензолу, могут нитроваться производные его — толуол,
фенол и др.
2. Нитросоединения как взрывчатые вещества. В молекуле
нитробензола содержится хэдна нитрогруппа. Это соединение вполне
устойчиво. Молекулы ароматических соединений, содержащие не-
сколько нитрогрупп, неустойчивы.
Нитрование производных бензола — толуола, фенола и др.—
приводит к получению сильно взрывчатых соединений, нашедших
применение в военном деле.
При нитровании фенола образуется твёрдый кристаллический про-
дукт жёлтого цвета — тринитрофенол:
С—ОН
С—ОН
Нс/^СН O2N—С,/ ^iC—NO2
Ч ' 4-3HO.NO2 = 3H2O-|-
нс'^сн н<\^!сн
СН с—no2
фенол тринитрофенол
он
Тринитрофенол хорошо растворяется в воде, образуя раствор
с интенсивной жёлтой окраской.
Тринитрофенол проявляет более сильные, чем фенол, кислотные
•свойства; называется он обычно пикриновой кислотой; соли её
t называются пикратами.
Пикриновая кислота обладает свойствами красителя: окрашивает
шерсть и шёлк в жёлтый цвет; однако в качестве красителя она
теперь не применяется, а употребляется, главным образом, в качестве
взрывчатого вещества.
17
В. В. Левченко
257
Путём
тротил:
нитрования толуола получается тринитротолуол, или
СН8 *
’ I
O2N-/\-NO2
^NOa
Тротил менее опасен в обращении по сравнению с пикриновой
кислотой и обходится дешевле. По этой причине он чаще пикрино-
вой кислоты применяется как взрывчатое вещество. Использование
производных бензола для получения взрывчатых веществ сближает
это производство с производством красящих веществ, так как по-
следние получаются из тех же сырьевых материалов и сходными
методами. 4
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какая группа содержится в молекулах нитросоединений?
2. Как получается нитробензол и что он собой представляет?
3. Для чего применяется нитробензол?
4. Как получается тринитрофенол?
5. Как получается тринитротолуол?
6. Для чего применяются тринитрофенол и тринитротолуол? >
§18. АнилиИ
При восстановлении атомарным водородом нитробензола нитро-
группа NO2 превращается в аминогруппу NH2. Аминогруппу можно
рассматривать как остаток аммиака (молекулу аммиака без одного
атома водорода). В результате реакции образуется новое вещество —*
анилин:
нитро- анилин
бензол
Для восстановления нитробензола его помещают в раствор со-
ляной кислоты, в который добавляют железные стружки. При взаимо-
действии железа с кислотой выделяется водород в атомарном состоя-
нии; он и восстанавливает нитробензол в анилин.
Анилин является тем исходным материалом, от которого можно
перейти к красящим веществам разной степени сложности.
258
Возможность’ получения анилина из нитробензола впервые была
'установлена русским учёным Зининым.
Николай Николаевич Зинин (1812—1880) профессор Казанского уни-
верситета, затем С.-Петербургской медико-хирургической академии и член
Академии наук. В 1842 г. получил анилин из нитробензола, что имеет огром-
ное значение для промышленного производства органических красок. Им,
кроме того, был осуществлён
ряд других весьма ценных син-
тезов органических веществ.
Но и одного синтеза анилина
было достаточно, чтобы Зинин
стал знаменитым. «Если бы
Зинин не сделал ничего более,
кроме превращения нитробен-
зола в анилин,— писал о нём
один из его современников,—
то и тогда имя его осталось
бы записанным золотыми бук-
вами в истории химии". Уче-
ник Н. Н. Зинина, знаменитый
А. М. Бутлеров характеризует
его «как глубокого патриота,
преданно любившего Россию,
понимавшего и принимавшего
к сердцу её интересы, отстаи-
вавшего автономию русской
науки".
В дореволюционной Рос-
открытие Зинина не
органических красок. Им,
Н. Н. Зинин.
сии
было широко использовано
на практике. Только при
советской власти по ука-
занию товарища Сталина
была создана у нас мощная синтетическая промышленность,
числе
диетического хозяйства.
Анилин — бесцветная маслянистая жидкость, с точкой кипения
184°, замерзает при — 6°, в воде растворяется в незначительном коли-
в том
анилокрасочная, полностью обеспечивающая потребности социа-
честве, ядовит. 1
Под действием воздуха анилин быстро темнеет вследствие оки-
сления и образования темноокрашенных продуктов.
Как вещество, содержащее аминогруппу NH2, т. е. остаток
аммиака, анилин проявляет основные свойства, но более слабые,
чем аммиак. С кислотами он образует хорошо растворимые в воде
соли:
NH2 NHo-HCl
А А
анилин
17
259
Из концентрированных растворов соль выпадает в виде кристал-
лического осадка. При действии на раствор соли щёлочи обратно
выделяется анилин: *
анилин
ЫН2.НС1
хлористоводородный
анилин
В результате влияния аминогруппы на бензольное кольцо анилин
легко вступает в реакции замещения (сравнить с фенолом1). Например,
при приливании к водному раствору анилина бромной воды сразу же
выпадает белый осадок — триброманилин, имеющий следующее
строение молекул:
3Br2 = 3HBr-j-
анилин
триброманилин
Так же легко подвергается анилин окислению. Уже говорилось, что
потемнение анилина на воздухе является результатом его окисления.
Путём окисления анилина получаются окрашенные вещества,
используемые в качестве красителей. Например, при действии на
анилин в качестве окислителя двухромовокислого калия КгСг2От
образуются окрашенные вещества сначала зелёного цвета, затем
синего и, наконец, чёрного (в зависимости от степени окисления).
Конечный продукт — чёрный анилин — является хорошим краси-
телем для хлопчатобумажной ткани и кожи.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что представляет собой анилин? Приведите формулу его.
2. Как получается анилин? Кем он был впервые получен?
3. Каковы химические свойства анилина? В каких реакциях они про-
являются?
4. Как получить соль анилина? Обратно — анилин йз его соли?
5. Что получается при окислении анилина (без формул) и для чего
употребляется образующийся продукт?
6. Для какого производства анилин является основным сырьём?
§ 19. Белки
Наиболее сложную группу органических соединений составляют
белки, примером которых может служить белок куриного яйца.
В состав белков входят элементы: углерод, водород, кислород и азот,
а в состав некоторых — ещё сера и фосфор.
260
Белки являются главной составной частью протоплазмы клеток;
без белков нет жизни. Белки образуют также кожу животных, шерсть,
волосы, перья, рога, копыта, когти. Белки вместе с жирами и угле-
водами должны обязательно входить в состав пищи животных
и человека. Взрослый человек должен получать в сутки около 80 г
белковых веществ.
1. Состав белков. Аминокислоты. До настоящего времени фор-
мулы белков полностью ещё не установлены; выяснено только, что
молекулы их отличаются большой величиной и состоят из отдельных
звеньев — так называемых аминокислот. Молекулы аминокислот
содержат кислотную группу СООН и группу со щелочными свойст-
вами— аминогруппу NH2.
Благодаря группам с противоположными свойствами молекулы
аминокислот могут соединяться друг с другом и таким путём со-
ставлять большие белковые молекулы.
Белки — это органические вещества, молекулы кото-
рых состоят из соединённых в большом количестве остат-
ков различных аминокислот.
Молекулы белков построены подобно молекулам сложных угле-
водов (крахмала, клетчатки), т. е. из сравнительно мелких группи-
ровок атомов, многократно повторяющихся.
Только в молекулах крахмала и клетчатки повторяются одни
и те же группировки (С6Н10ОБ), а в состав белков входят груп-
пировки из различных аминокислот. До настоящего времени
удалось выделить из белков более трёх десятков отдельных амино-
кислот.
Для примера приводится формула простейшей аминокислоты —
гликокола (аминоуксусной кислоты):
Н2С НН2(аминогруппа)
СООН(карбоксильная группа)
гликокол
Присутствие в молекулах аминокислот карбоксильной группы
придаёт им кислотные свойства. Благодаря этому аминокислоты
способны, например, реагировать со спиртами и давать сложные
эфиры:
Н2С—NH2 н2с—nh2
‘ I I
СООН + С2НБОН = Н2О 4- со • о • С2Н5
гликокол этиловый СЛОЖНЫЙ эфир
спирт гликокола и эти-
лового спирта
Присутствие в молекулах аминокислот аминогруппы придаёт им
261
основные свойства. Благодаря этому аминокислоты реагируют с кис-
лотами и образует соли:
Н2С — NH2 4- НС1 = Н2С — NH2 • НС1
I 1*1
соон соон
гликокол соляная хлористоводородный
кисЛота гликокол (соль)
Таким образом, аминокислоты отличаются двойственными свойст-
вами, или, как иначе говорят, амфотерными (что означает „двойст-
венный"). Амфотерные свойства проявляются также в белках.
2. Молекулярный вес белков. Определение молекулярного веса
белков, проводимое разными методами, даёт очень < большие вели-
чины. Для более простых белков получаются цифры около ЭД ООО;
для белка, содержащегося в молоке, получается: 75 000—37р ООО;
для некоторых белков, выделенных из растений,— до 2 000 000. Так
как точный молекулярный вес белков неизвестен, не может быть дана
и их формула.
3, Разнообразие белков. Различные белки отличаются составом
и количеством содержащихся в их молекулах аминокислот; в связи
с-этим физические и химические свойства их различны.
По приблизительным подсчётам из двух десятков аминокислот
может быть образовано более 2 000 000 000 000 разных комбинаций их.
Возможность существования столь большого количества комби-
наций аминокислот делает понятной значительную разницу в свой-
ствах белков из разных организмов. По этой же причине чужеродный
белок, например белок куриного яйца, введённый в кровь другого
животного организма, действует на него как яд. Ядовитое действие
чужеродных белков не проявляется при употреблении их в пищу.
В процессе пищеварения (в тонких кишках) белки пищевых продук-
тов расщепляются на отдельные аминокислоты, которые проходят
через стенки кишечника; в организме аминокислоты снова. соеди-
няются, но уже в той комбинации, какая свойственна данному орга-
низму, и образуют нужные ему белки.
4. Физические и химические свойства белков, а) Раствори-
мость белков. Коллоидные растворы. Для растворения
в воде некоторых белков необходимо добавление небольшого коли-
чества поваренной соли. Такие белки, например, содержатся в кури-
ном яйце, в чём легко убедиться на опыте.
Осторожно разбивают скорлупу яйца так, чтобы не повредить
желток, выливают в стакан один белок и приливают до половины
стакана воды. При размешивании хорошо видно, что отдельные сгустки
белка плавают в воде, не растворяясь в ней. Если же прибавить
в жидкость немного поваренной соли, можно видеть, как весь белок
переходит в раствор и получается однородная жидкость, хотя и
слабо мутная; полной прозрачности здесь добиться не удаётся.
Такие растворы получили название коллоидных растворов. Веще-
ства, образующие подобные растворы, называются коллоидами (что
означает „подобные клею").
262
В отличие от коллоидных растворов, обычные растворы, в ко-
торых вещество находится в виде отдельных молекул, называются
молекулярными растворами (их называют ещё „истинными рас-
творами").
Иногда коллоидные растворы могут казаться совершенно про-
зрачными, но отличить их от
молекулярных растворов легко;
для этого надо пропустить че-
рез раствор луч света (рис. 110).
В молекулярном растворе луч
не виден, а в коллоидном рас-
творе хорошо заметна светлая
полоса.
Происходит это потому, что
коллоидные частицы, являю-
щиеся скоплениями молекул,
настолько велики, что рассеи-
вают свет. Здесь происходит
то же явление, какое наблю-
дается при прохождении луча
о растворами
Рис. НО. Луч света в молекулярном
и коллоидном растворах.
А — молекулярный раствор (сахара); луч неви-
ден; Б — коллоидный раствор (белка); луч виден.
света через пыльную комнату, только
в коллоидном растворе частицы Мельче, чем пылинки в комнате,
и различить их в отдельности не удаётся.
Описанное явление известно под названием луча Тиндаля (назва-
ние дано по имени учёного, его открывшего).
б) Действие солей на белок. Поваренная соль в неболь-
шом количестве способствует растворению белка, концентрированные
же растворы её оказывают обратное действие.
При приливании к раствору белка насыщенного раствора поваренной
соли частицы белка объединяются в более крупные образования,
и белок начинает выделяться из раствора. Если прилить чистой воды,
помутневший раствор снова становится светлее.
Поваренная соль вызывает в растворе белка обратимые процессы:
в зависимости от количества её белок то растворяется, то выделяется
из раствора. Такое же действие оказывает поваренная соль на белок
в живой протоплазме.
Совершенно иное действие, чем поваренная соль, оказывают на
белок соли тяжёлых металлов, например меди, свинца и др.
Прибавленный к раствору белка медный купорос вызывает
выделение его в осадок; при разбавлении водой этот осадок уже
не растворяется, что указывает на необратимое изменение белка.
В связи с этим соли тяжёлых металлов являются для протоплазмы
ядами.
в) Де'йствие нагревания на белок. В растворённом со-
стоянии белок может оставаться только при температуре до 52—54°.
Более высокая температура вызывает свёртывание его и выпадение
в осадок вследствие глубоких изменений в белковых молекулах. То
же самое происходит с белками в живой протоплазме, поэтому
высокая температура смертельна для всего живого.
263
г) Гидролиз белков. Белки способны подвергаться гидро-
лизу и, присоединяя воду, распадаться на отдельные аминокислоты.
Такой процесс происходит при пищеварении в тонких кишках под
действием особых ферментов. *
В лабораторных условиях гидролиз белков может быть вызван
кипячением их в воде в присутствии кислоты или щёлочи, действую-
щих каталитически.
Виднейшим исследователем белков и аминокислот является ака-
демик Н. Д. Зелинский. Со школой своих учеников он разработал
оригинальный метод гидролиза белков при нагревании под высоким
давлением. За работу по изучению белков Н. Д. Зелинскому и
Н. И. Гаврилову была присуждена Сталинская премия 1-й, степени.
д) Цветные реакции белков. При действии на белки не-
которых реактивов образуются вещества с характерной окраской.
Например, при действии на раствор белка щёлочи и медного купо-
роса жидкость окрашивается в красно-фиолетовый цвет (эта реакция
называется биуретовой).
При действии на раствор белка концентрированной азотной кислоты
выпадает осадок белого цвета, при нагревании быстро окрашивающийся
в жёлтый цвет (ксантопротеиновая реакция). Если после охлаждения
прибавить избыток нашатырного спирта, осадок окрашивается в оран-
жевый цвет. V
Указанные реакции применяются для обнаружения 'бёлков.
5. Применение белковых веществ. Сравнительно более простым
белком является желатина, получаемая путём выварки костей, хрящей,
отходов кожи; применяется она в пищу (студень) и в технических
целях (клей, пластические массы и пр.). Значительно более сложный
состав имеет белковое вещество, содержащееся в молоке и выделяю-
щееся при створаживании — казеин.
Кроме пищевых целей (творог, сыр), казеин широко применяется
тля приготовления пластмасс, склеивающих составов (в производстве
фанеры, бумаги и др.).
Широкое применение находят также материалы, главным образом,
животного происхождения, состоящие из белковых веществ и не
требующие сложной химической обработки — шерсть, шёлк, рог,
кожа. Употребление их общеизвестно.
6. Искусственное получение белков. Искусственное получение
белковых веществ является особенно трудной задачей ввиду большой
сложности строения их молекул, о чём можно судить по данным
анализа яичного белка. Как удалось установить, в молекуле его
содержится 228 аминокислот. -Это делает понятным, почему синтез
белков до сих пор полностью не осуществлён.
Пока удалось синтезировать вещества путём соединения 20 ами-
нокислотных остатков.
Полученные синтетические продукты далеко ещё не являются
столь же сложными, как природные белки, но они проявляют те же
химические свойства, так же образуют коллоидные растворы, под-
вергаются гидролизу, дают цветные реакции, характерные/ для
264
белков, п т. д. Вообще они так сходны с белковыми веществами, что
если бы они были найдены в природе, их причислили бы, несомненно,
к белкам.
Таким образом, состав белков теперь перестал быть загадкой,
и путь к синтезу их открыт, что является большим торжеством
научной мысли.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что представляют собой белки? Каков их состав?
2. Какой конечный продукт получается при гидролизе белков?
3. Что представляют собой аминокислоты и почему они проявляют амфо-
терные свойства?
4. Что происходит с белком в процессе пищеварения?
5. Приведите примеры белковых веществ.
6. Из чего получается казеин и для чего он применяется.
§ 20. Краткие сведения об успехах органического синтеза
Выше уже приводились различные примеры органического син-
теза, имеющие большое практическое значение: получение каучука,
пластмасс, шёлка, взрывчатых веществ и др.
1. Получение пластмасс. Пластические массы в настоящее время
распространены очень широко благодаря их прекрасным механиче-
ским качествам. Они могут заменять даже металл в самых разнооб-
разных изделиях. О получении пластмасс уже было сказано выше.
Получают их ещё и другими способами.
В одних случаях в основе процессов, приводящих к образованию
пластмасс, лежат явления полимеризации (т. е. соединение в одно
целое большого числа одинаковых молекул). Как и при образовании
каучука, такие процессы происходят с веществами, в молекулах
которых имеются двойные связи. Полимеризация происходит в ре-
зультате разрыва этих связей и присоединения по их месту новых
молекул. Подобный процесс имеет место при образовании широко
употребляемой сейчас бесцветной прозрачной пластической массы,
очень похожей на стекло, — небьющееся органическое стекло; полу-
чается оно полимеризацией производных непредельной акриловой
• КИСЛОТЫ.
В других случаях образование пластмасс происходит на основе
реакции. конденсации, т. е. соединения разных молекул. Например,
^ценная пластмасса получается при взаимодействии формалина с кар-
боловой кислотой; называется она карболитом.
Пластмасса эта всем хорошо известна по изготовляемым из неё
предметам: телефонным трубкам, электрическим штепселям и другим
принадлежностям электрического оборудования, пуговицам и пр.
Пластмассы применяются не только для мелких изделий, но и
как заменители металла (броня, различные детали машин); в связи
с этим они всё более и более зовоёвывают место в машинострои-
тельной промышленности. Получаются теперь пластмассы из самых
265
разнообразных материалов: из продуктов крекинга нефти, из отхо-
дов производства синтетического каучука и пр.
Успешные работы в этом направлении советских учёных, инже-
неров-химиков обеспечили быстрое развитие у нас производства
пластмасс. За период с 1927 по 1937 г. это производство увеличи-
лось в 18 раз.
За период послевоенной пятилетки в нашей стране построены
новые заводы пластических масс и синтетических - смол, а также орга-
низовано производство новых видов пластмасс. *
2. Получение красящих веществ. До второй половины XIX в.
для окраски тканей употреблялись исключительно природные веще-
ства, главным образом растительного происхождения, извлекаемые
из листьев, коры, древесины. В отдельных случаях применялись и
вещества животного происхождения. Например, драгоценная красная
краска древних народов—пурпур — добывалась из особых морских
моллюсков. Красивая и очень прочная природная краска „кошенилв“
и сейчас ещё добывается из особого вида тлей, разводимых на какту-
совых плантациях в центральной Америке (особенно в Мексике).
Для получения природных красок необходима затрата большого
количества времени и труда. Растительные краски требуют возделы-
вания обширных плантаций растения. До недавнего времени, напри-
мер, ценная краска ализарин добывалась ид корней марены или
краппа на юге Франции и в других странах. Г1од культурой этого
растения были заняты громадные площади, обслуживаемые десят-
ками тысяч людей.
Так же обстояло дело с синей, природной краской — индиго,
которую добывали из листьев южных растений (разновидностей
индигоферы) и культивировавшегося в Европе растения вайды. Необ-
ходимость в разведении всех этих растений в настоящее "время
отпала, так как найдены способы искусственного получения «е
только природных красящих веществ, но и веществ, в природе не
встречающихся; при этом искусственные красители затмевают при-
родные краски яркостью и разнообразием тонов.
Всё это стало возможным благодаря точному установлению струк-
туры молекул красящих веществ и разработке способов получения
необходимых для их синтеза исходных продуктов.
Синтез красящих веществ стал осуществляться только во второй
половине XIX в., после работ русских учёных-академиков Фриче и
особенно Зинина, разработавших методы получения из каменноуголь-
ной смолы бензола и его производных — анилина и др.; главное
значение имело получение Зининым анилина из нитробензола.
Анилин является тем исходным материалом, от которого можно
перейти к красящим веществам разной степени сложности. По глав-
ному исходному веществу — анилину — все эти красители получили
название анилиновых.
Развитие этой новой области синтетической химии пошло быстрым
темпом. Вскоре были получены синтетическим путём такие ценные
природные красители, как ализарин и индиго. После этого разведе-
266
ние растений для добывания из них этих красителей потеряло смысл.
В настоящее время искусственные красители вытеснили естественные,
удовлетворяя спрос на любые цвета и оттенки.
Производство искусственных красителей имеет значение не только
для удовлетворения запросов мирного времени. Анилинокрасочное
производство тесно связано с производством взрывчатых веществ.
В обоих случаях используется одно и то же сырьё: вещества, полу-
чаемые из каменноугольной смолы; приёмы обработки их в обоих
случаях также сходны.
Производство синтетических красителей у нас особенно быстро
стало развиваться при советской власти. В 1935 г. по сравнению
с 1913 г. производство красителей увеличилось почти в 6 раз.
В 1939 г. наша анилинокрасочная промышленность по объёму продук-
ции заняла третье место в мире и второе в Европе. По после-
военному пятилетнему плану производство красителей тоже воз-
росло. Пятилетний план по производству красителей перевыполнен.
3. Синтез лекарственных веществ. С глубокой древности и до
середины XVI в. в качестве лекарств применяли только природные
вещества, главным,образом в виде лекарственных трав. В дальней-
шем для лечебных целей стали употреблять и химические препараты.
Сначала применялись в качестве лекарств неорганические соеди-
нения. Затем, с развитием органической химии и блестящими успе-
хами в области органического синтеза, стало возможным приготовле-
ние органических лекарственных препаратов, заменяющих соответ-'
ствующие природные лечебные средства.
Получаемое новое соединение теперь исследуют в отношении
действия его на организм сначала животного, а в случае интересных
результатов — и на организм человека, конечно, с соблюдением необ-
ходимых предосторожностей. Благодаря этому медицина получила
большое количество искусственных лекарственных веществ: жаро-
понижающих, снотворных, противоревматических, обеззараживающих,
кожных и т. д. При этом тщательными исследованиями удалось
установить характер лечебного действия тех или иных группировок
атомов (радикалов), входящих в лекарственные вещества. Оказалось,
например, что во многие жаропонижающие средства входит остаток
уксусной кислоты.
4. Синтез гормонов и витаминов. Синтетической химии в на-
стоящее время стало под силу изготовление очень сложных веществ,
образующихся в организме и имеющих исключительно важное значе-
ние для нормального течения жизненных процессов.
Вещества эти — гормоны (название дано от греческого слова,
обозначающего „двигать0, „возбуждать0). Гормоны влияют на работу
органов тела, регулируют и направляют их деятельность, обеспечи-
вают согласованность разнообразных процессов в организме и его
нормальную жизнедеятельность.
Гормоны образуются в особых органах — жёлезах, выделяющих
свои соки непосредственно в кровь и поэтому названных железами
внутренней секреции, т. е. внутреннего выделения. В организме
267
имеется большое число желез внутренней секреции, образующих
различные гормоны с различным действием. Нарушение нормальной
деятельности этих желез приводит к недостаточной или избыточной
выработке соответствующих гормонов, что вызывает в организме тя-
жёлые изменения (заболевания). *
В настоящее время многие- гормоны выделены в чистом виде и
изучены; некоторые же получены синтетическим путём, что облег-
чило применение их в лечебных целях.
Только в недавнее время выяснилось, что для нормальной дея-
тельности организма необходимы, кроме гормонов, ещё особые веще-
ства, образующиеся исключительно в растениях.
Вещества эти, как жизненно необходимые, получили ^название
витаминов (от латинского слова „вита“, что значит „жизнь").
Недостаток витаминов вызывает тяжёлые расстройства организма.
В 1933 г. был синтезирован первый витамин. Затем было полу-
чено синтетическим путём ещё несколько витаминов, имеющих боль-
шое значение для сохранения здоровья. Достигнутые советскими
учёными успехи в области изучения витаминов способствовали созда-
нию у нас передовой витаминной промышленности.
Таким образом, блестящие успехи химии позволяют все ближе и
ближе подходить к полному освещению процессов, связанных с самым
сложным явлением природы — жизнью, дают средства для предупре-
ждения заболеваний и лечения.
II. КРЕМНИЙ И ЕГО СОЕДИНЕНИЯ
А. КРЕМНИЙ
Химический знак: Si (читается: силициум).
Атомный вес равен 28.
В свободном состоянии кремний впервые был получен в первой
четверти XIX в.
В таблице Менделеева кремний находится вместе с углеродом
в IV группе и проявляет в своих соединениях ту же валентность, что
и углерод. В высшем кислородном соединении он четырёхваленте.н
(положительная валентность равна 4); в соединениях с водородом он
тоже четырёхвалентен (отрицательная валентность равна 8 — 4*) = 4).
1. Физические свойства кремния. Кремний получается в сво-
бодном состоянии в аморфном или в кристаллическом виде, в зави-
симости от условий его выделения. •
Аморфный кремний представляет собой порошок бурого цвета,
кристаллический кремний — твёрдые хрупкие кристаллы серого цвета.
2. Химические свойства кремния. Атомы кремния имеют во
внешнем электронном слое 4 электрона. Благодаря большему размеру
атомы кремния легче отдают своп электроны, чем атомы углерода.
1) Номер группы.
268
Наиболее стойкими являются соединения кремния с кислородом, где
кремний четырёхвалентен (4~4).
Аморфный кремний, подобно углероду, химически более акти-
вен, чем кристаллический.
а) Взаимодействие кремния с водородом и метал-
лами. Соединения кремния с воДородом (кремневодороды, или си-
ланы) получаются только косвенным путём и отличаются непроч-
ностью. Простейшее соединение: кремнистый водород SiH4 — газо-
образное вещество, самовоспламеняющееся на воздухе:
(самовоспламенение)
S1H4 4- 2О2 = SiO2 + 2Н2О
кремнистый двуокись
водород кремния
Практического значения кремневодороды не имеют.
При высокой температуре кремний соединяется с некоторыми
металлами, образуя кремнистые металлы (силициды) разного состава.
б) Взаимодействие кремния
с кислородом и другими ме-
таллоидами. Кремний энергично
реагирует со многими металлоидами.
Нагретый, он сгорает в кислороде,
образуя двуокись кремния:
/ (горение)
Si —О2 = SiO2
двуокись
кремния
В тех же условиях кремний со-
единяется с серой, хлором, бромом;
с фтором соединяется без нагревания.
При высокой температуре кремний
соединяется с углеродом, образуя проч- р„с )п Получеиие
кремния.
ное соединение S1C — карбид кремния.
Карбид кремния находит практиче-
ское применение. Получают его накаливанием в электрической печи
до 2000° смеси песка SiO2 и угля:
(2000”)
SiO2 4- ЗС = Si С 4- 2СО f
песок карбид угарный
кремния газ
Карбид кремния, называемый обычно карборундом, предста-
вляет собой кристаллическое вещество, плавящееся около 1600°.
Отличается карборунд большой твёрдостью, лишь немного уступаю-
щей твёрдости алмаза. Благодаря этому он применяется для изгото-
вления шлифовальных и точильных камней.
3. Кремний в природе. После кислорода кремний является самым
распространённым элементом в природе.
269
В свободном состоянии он не встречается, а содержится в раз-
личных минералах, под которыми понимают природные тела опре-
делённого химического состава.
Содержащие кремний минералы образованы или двуокисью крем-
ния SiO2, или кремнекислыми солями, часто с примесью различных
других веществ.
Из содержащих кремний минералов образованы главнейшие гор-
ные породы, слагающие земную кору (горными породами называются
разнообразные природные массы, образующие более или менее мощ-
ные пласты в земной коре). (
4. Получение кремния. В свободном виде кремний можно полу-
чить действием магния на кремнезём. Для этого мелко растёртый
песок (3—4 г) смешивают с порошком магния (5 г), смесь насы-
пают в поставленный на кирпич железный тигель, втыкают в смесь
кусок ленты магния (рис. 111) и поджигают её. Реакция протекает
по уравнению:
SiO2 4- 2Mg = Si 4- 2MgO
По окончании реакции и охлаждении получившейся массы её
вытряхивают из тигля и небольшими порциями бросают в стакан
с разбавленной соляной кислотой. Окись магния растворяется в кис-
лоте, а кремний остаётся на дне в виде коричневого порошка.
В полученной в тигле массе всегда содержится ещё некоторое
количество образующегося при реакции силицида магния Mg2Si. При
взаимодействии его с кислотой получается кремнистый водород, само-
воспламеняющийся на воздухе:
Mg2Si 4- 4НС1 = 2MgCI2 4- SiH4 f
Поэтому при описанном опыте всегда наблюдается выделение
пузырьков газа, самовоспламеняющегося и сгорающего с выделением
белого дыма, состоящего из частиц SiO2:
(самовоспламенение)
SiH4 4- 20, = SiO2 4- 2Н2О
двуокись
кремния
В технике кремний получают нагреванием смеси кремнезёма (песка)
с углем в электрических печах:
(нагревание)
SiO34-2C = Si4-2CO |
5. Применение кремния. Кремний применяется, главным образом,
в различных сплавах: с железом, медью, алюминием, свинцом. Он
придаёт металлам устойчивость против действия кислот и другие
ценные свойства.
270
Б. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ КРЕМНИЯ
В соединениях с кислородом кремний проявляет переменную ва-
лентность (4~2 и 4“ 4) и образует два окисла: окись кремния SiO
и двуокись кремния SiO2.
Окись кремния SiO соответствует окиси углерода СО; она не
является характерным для кремния соединением.
Наибольший интерес представляет двуокись кремния, являющаяся
исходным материалом для получения всех прочих соединений
кремния.
§ 1. Двуокись кремния, кремнезём, кремниевый ангидрид
z^O
SiO2; структурная формула: Si(^
^О
Молекулярный вес равен 60,
1. Двуокись кремния в природе. Двуокись кремния (кремнезём)
широко распространена в природе в виде разнообразных минералов
и горных пород. ~ / .
Песок в основном состоит из двуокиси кремния. Грубые непро-
зрачные разновидности кремнезёма, окрашенные примесями в разные
цвета, называются кремнем, с полосатой структурой — агатом;
чистые разновидности кремнезёма называются кварцем; кристалли-
ческие образования неокрашенные — горным хрусталём, окрашенные
примесями в фиолетовый цвет — аметистом, в дымчатый цвет — дым-
чатым хрусталём.
Вместе с другими минералами кварц входит в состав широко
распространённых горных пород — гранита, гнейса и др.
2. Физические свойства двуокиси кремния. Чистая двуокись
кремния — бесцветное вещество. Окраска образованных ею минера-
лов зависит от различных примесей. Природная двуокись кремния
отличается значительной твёрдостью. В шкале твёрдости, в которой
алмаз как самое твёрдое тело обозначается числом 10, твёрдость
двуокиси кремния (кварца) обозначается числом 7.
Чистый кварц плавится при 1710°. В воде он практически не-
растворим.
3. Химические свойства двуокиси кремния. Двуокись кремния
(кремнезём) является кислотным окислом, ангидридом кремниевой
кислоты H2SiO3. В отличие от большинства ангидридов, кремнезём
в воде практически не растворяется и с ней не соединяется; каж-
дому приходилось иметь дело с песком, и это свойство кремнезёма
всем хорошо известно. Вследствие этого кремниевую кислоту нельзя
получить непосредственным соединением кремнезёма (песка) с водой.
Для кремниевого ангидрида неосуществима реакция взаимодей-
ствия с водой, 'Типичная для большинства ангидридов. Все же про-
чие общие свойства кислотных окислов проявляются в кремниевом
271
ангидриде. При высокой температуре он взаимодействует с основ-
ными окислами и основаниями:
(сплавление)
SiO2 СаО = CaSiO3
кремниевый окись кремнекислый
ангидрид кальция цальций
(песок) (известь)
(сплавление)
SiO24-2NaOH = Na2SiO3^-H2O
гидрат кремнекислый
окиси натрий
натрия
Особенностью кремнезёма является его нелетучесть. Как нелету-
чий ангидрид он способен вытеснять при прокаливании летучие
ангидриды из соответствующих солей. Этим пользуются для полу-
чения солей кремниевой кислоты; прокаливая кремнезём (песок) с
содой или известняком (мелом), получают: 4
(сплавление)
SiO2 4- Na2CO8 = Na2SiO84-CO2f
углекислый кремне-
натрий кислый
(сода) натрий
(сплавление)
SiO2 4- СаСО3 = CaSiO3 4-CO2t
углекислый кремне-
кальций кислый
(мел) кальций
4. Применение кремнезёма. Кремнезём в. виде песка приме-
няется в строительном деле, при изготовлении строительных мате-
риалов (цемента и др.), для получения различных соединений крем-
ния. В последнее время из чистого кремнезёма (чистых сортов
песка, кварца) изготовляется специальное кварцевое стекло. Квар-
цевое стекло отличается стойкостью против резких колебаний тем-
пературы; сделанную из него посуду можно в нагретом состоянии
опустить в холодную воду, и она не лопнет. Объясняется это незна-
чительным расширением кремнезёма при нагревании. ,
§ 2. Кремниевая кислота
Н—Ок
H2SiO3; структурная формула: \Si = O
Н—о/
Молекулярный вес равен 78.
1. Получение кремниевой кислоты. Как уже говорилось, крем-
ниевую кислоту нельзя получить непосредственным соединением её
ангидрида SiO2 с водой. Она может быть получена только из её
растворимых солей (кремнекислого натрия или кремнекислого калия).
272
Для этого на раствор кремнекислой соли действуют соляной или
серной кислотой; кремниевая кислота как нерастворимое вещество
выпадает в осадок в виде студенистой массы:
(в растворе)
Na2SiO3 4- 2НС1 = H2SiO8 -|- 2NaCI
кремнекислый |
натрий кремниеваи
кислота
2. Физические и химические свойства кремниевой кислоты.
Кремниевая кислота не растворяется в воде с образованием молеку-
лярных растворов, поэтому с ней не могут быть произведены
реакции, типичные для растворов 'кислот.
В воде кремниевая кислота может образовывать только коллоид-
ный раствор, подобно крахмалу и белковым веществам. Поэтому
при выделении кремниевой кислоты из растворов её солей она вы-
падает в виде студенистого осадка, содержащего непостоянное коли-
чество воды. При высушивании этот осадок по мере увеличения
температуры постепенно обезвоживается и при прокаливании пол-
ностью превращается в кремниевый ангидрид:
(прокаливание)
H2SiO3 = SiO2 -|- Н2О
кремниевая кремниевый
кислота ангидрид
Реакция эта необратимая: кремниевый ангидрид (песок) с водой
не соединяется, а поэтому получить кремниевую кислоту непосред-
ственно из ангидрида нельзя; получить же ангидрид из кремниевой
кислоты можно, подвергая её достаточно сильному нагреванию.
Особенностью кремниевой кислоты является её нелетучесть (отли-
чие от азотной кислоты, уксусной и др.).
§ 3. Соли кремниевой кислоты
Соли кремниевой кислоты, называются кремнекислыми или сили-
катами.
Силикаты широко распространены в природе. Земная кора со-
стоит в основном из кремнезёма и различных силикатов.
Многие минералы (полевой шпат, слюда, асбест и др.), драго-
ценные камни (изумруд, топаз, аквамарин и др.) являются силика-
тами.
Только в простейшем случае формулы силикатов могут быть
выведены из формулы H2SiO3. Сюда относятся кремнекислый нат-
рий Na2SiO3, кремнекислый калий KaSiO3.
Большинство природных силикатов отличается более сложным
составом; в молекулах их содержится несколько атомов кремния.
Такие силикаты представляют собой соли так называемых поли-
кремниевых (т. е. многокремниевых) кислот.
18 В. В. Левченко
273
В целях упрощения формул состав таких силикатов обычно изо-
бражают в виде соединения основных и кислотных окислов. При
таком способе изображения формула кремнекислого натрия NajSiOg
принимает вид: Na2O-SiO2; формула кремнекислого калия K2S1O3
изображается в виде: K2O*SiO2; формула очень распространён-
ного в природе силиката — полевого шпата — изображается так:
K2O-Al2O3-6SiO2 (формула, написанная в обычном виде: Al2Si6Oie);
формула всем известной глины (каолина): А12О3‘2SiO2-2Н2О.
Как видно из формул, в состав полевого шпата, глины и многих
других природных силикатов входит ещё алюминий. Такие соеди-
нения называются алюмосиликатами.
1. Получение кремнекислых солей. В связи с нерастворимостью
кремниевой кислоты в воде кремнекислые соли не могут быть полу-
чены способами, применяемыми для кислот, растворимых' в воде.
Кремнекислые соли можно получать, сплавляя с песком окислы,
основания пли соли, как было показано выше (см. стр. 272).
2. Физические и химические свойства силикатов. Из солей
кремниевой кислоты только кремнекислый натрий Na2SiO3 и кремне-
кислый калий К2$Ю3 растворимы в воде и отличаются сравнительно
низкой температурой плавления. 1
Остальные силикаты практически в воде нерастворимы и отличаются
тугоплавкостью. (Они представляют собой огнеупорные материалы.)
Силикаты проявляют все общие свойства солей. По сравнению
с другими солями особенностью здесь является только то, что
кремниевая кислота в воде нерастворима. Поэтому при взаимодей-
ствии с кислотами растворимых силикатов кремниевая кислота выпа-
дает в осадок (см. получение её).
При взаимодействии растворимых силикатов с солями реакция
протекает, как обычно, и в осадок выпадает нерастворимая соль:
(в растворе)
Na2SiO3 CuSO4 = CuSiO3 Na2SO4
1 z
кремнекис-
лая медь
3. Силикаты в природе. Почвообразование. Слагающие земнуй
кору горные породы в основном состоят из силикатов. Самыми
древними горными породами, простирающимися до исследованных
в настоящее время глубин, являются граниты и гнейсы. Во многих
местах земного шара эти породы выходят на поверхность, образуя
отдельные горы и мощные горные хребты.
Граниты и гнейсы состоят из перемешанных кристаллов кварца,
полевого шпата и слюды.
Горные породы не сохраняются без изменения, но беспрерывно
подвергаются разрушению под действием воды и воздуха. Эти изме-
нения получили общее название „выветрирание“. При выветривании
происходят физические и химические процессы. Физические процессы
заключаются в измельчении горных пород, а химические — в измене-
нии химического состава слагающих эти породы минералов.
274
Легче всего подвергается выветриванию полевой шпат. Кристаллы
полевого шпата на свежем изломе гранита отличаются гладкими
и блестящими поверхностями, на старой же поверхности имеют
тусклый вид и сплошь испещрены бороздками.
Объясняется это тем, что под влиянием воды и воздуха поле-
вой шпат претерпевает химические изменения. При этих изменениях
он теряет твёрдость и рассыпается в порошок, превращающийся
в конце концов в глину (каолин):
К2О • Д12О3 • 6SiO2 + СО2 + 2Н2О =
полевой шпат
= К2СО3 + 4SiO2 + А12О3 • 2SiO2 • 2Н2О
кремнезём каолин
Подобное же изменение происходит со слюдой.
Под влиянием указанных процессов гранит распадается на всё
более и более мелкие части и, наконец, разрушается совершенно,
давая в виде конечных продуктов распада глину — каолин (из поле-
вого шпата и слюды) и песок, представляющий собой мельчайшие
частицы кварца.
При первых признаках разрушения горных пород на доселе
голых скалах поселяются такие неприхотливые растения, как лишай-
ники. Они усваивают первые продукты разрушения камней и,
отмирая, прибавляют к их неорганическим веществам свои органи-
ческие остатки (перегной). Благодаря этому такие участки посте-
пенно становятся пригодными для высших растений.
Так шло и в настоящее время продолжает идти образование
почвы из бесплодных камней.
4. Применение силикатов. Силикаты имеют большое значение
в народном хозяйстве. >
В технике находят широкое применение растворимые силикаты
Na2SiO3 и K2SiO3. Они получили техническое название — раствори-
мое стекло. Водные растворы их под названием жидкое стекло
употребляются для пропитки тканей и дерева, чтобы сделать их
несгораемыми.
Если дерево или ткань около часа выдержать в достаточно
концентрированном растворе жидкого стекла, а затем высушить, то
в огне они не горят; при долгом же действии огня лишь слабо
изменяются.
жидкое стекло употребляется также для приготовления вяжу-
щих материалов, огнеупорных замазок и в ряде других производств.
Стекольная промышленность. Особенно широко исполь-
зуются силикаты в виде обычного стекла. Оконное стекло и стекло,
идущее на изготовление обыкновенной посуды, представляет собой
однородную массу, состоящую из силикатов натрия и кальция
с избытком кремнезёма. Обе соли необходимы для того, чтобы
стекло отличалось твёрдостью, прочностью, устойчивостью против
воды (влияние силиката кальция) и в то же время не особенно
высокой температурой плавления (влияние силиката натрия). В соот-
18*
275
ветствии с указанным составом такое стекло получают сплавлением
в особых печах песка, мела и соды.
Происходящие при варке стекла реакции могут быть представ-
ленй в виде следующих уравнений:
Na2CO3 —SiO2 == Na2SiO3 —j— СО21
сода песок кремнекислый
СаСО3 SiO2 = CaSiO3 -|- СО21
мел песок кремнекислый
кальций
Если вместо соды берётся поташ К2СО3, получается стекло,
содержащее силикат калия K2SiO3 и силикат кальция CaSiO3.
Такое стекло плавится при более высокой температуре. Химическая
посуда, отличающаяся тугоплавкостью, изготовляется из.этого стекла.
Изготовляют также стекло, содержащее силикат калия I^SiOg
и силикат свинца PbSiO3. Отличается такое стекло большим луче-
преломлением; при шлифовке приобретает сильный блеск. Употреби
ляется оно для изготовления оптических стёкол и художественной
посуды (хрусталь).
Если в употребляемом для варки стекла песке содержатся при-
меси железа, стекло получается с зелёной окраской. Такое стекло
употребляется для изготовления дешёвой стеклянной посуды (бутылки
для вина и пр.).
Всякое стекло, благодаря присутствию в нём натриевой или
калиевой соли, хотя и в малой мере, всё же растворимо в воде.
Если же стекло измельчить в порошок, вода из него будет извле-
кать заметные количества щёлочи, .и её легко обнаружить индика-
тором (лучше всего фенолфталеином).
Как уже говорилось, стекло легко подвергается действию пла-
виковой кислоты (см. стр. 102), чем пользуются для нанесения на
него надписей, рисунков и пр.
К 1950 г. восстановлены и построены новые заводы по произ-
водству стекла. Производство стекла в 1950 г. увеличилось в 1,9 раза
по сравнению с довоенным.
Керамическая промышленность. Разнообразное приме-
нение находит глина, проявляющая весьма ценное свойство: размочен-
ная в воде, она даёт пластический материал, легко принимающий лю-
бую форму; после же обжигания она превращается в твёрдую прочную
массу, на которую вода уже не действует.
Благодаря этому глина употребляется для изготовления разно-
образных изделий (керамическая промышленность). Сюда отно-
сится изготовление кирпича, черепицы, гончарной посуды, труб
и пр.; из чистой белой глины (каолина) изготовляются фарфоровые
изделия.
Глина является также материалом, необходимым для изготовле-
ния цемента. Цемент получают прокаливанием смеси глины с извест-
няком. Цемент, смешанный с песком и водой, под названием
цементного раствора применяется как связывающий материал при
276
всевозможных строительных работах. В смеси с гравием, щебнем
и тому подобными материалами он образует бетон, из которого
делаются своды, арки, мосты, жилые дома и прочие массивные
сооружения.
Для достижения ещё большей прочности употребляют железо-
бетон; в этом случае в основу сооружений кладутся железные
балки, стержни.
По производству цемента задание пятилетнего плана на 1950 г.
выполнено на 101°/0, что обеспечивает наше бурно растущее строи-
тельство.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Каковы физические свойства кремния?
2. Какое простейшее соединение образует кремний с водородом? Имеет
ли оно практическое значение?
3. Какое соединение образует кремний с кислородом? Какое оно имеет
практическое значение?
4. Какова валентность кремния в двуокиси кремния? Изобразите струк-
турную, {формулудвуокиси кремния и укажите все названия её.
5. Каковы химические свойства двуокиси кремния? К какому классу
соединений она относится? ,
х 6. Чем отличается'' двуокись кремния от других ангидридов? Какая реак-
ция, типичная для ангидридов, неосуществима с кремниевым ангидридом?
7. Приведите формулу кремниевой кислоты.
8. Можно ли получить кремниевую кислоту из кремниевого ангидрида,
действуя на него водой?
9. Как может быть получена кремниевая кислота?
10. В чём главное отличие кремниевой кислоты от других кислот?
11. Как могут быть получены кремнекислые соли?
12. Какие силикаты растворимы в воде?
13. Назовите главнейшие природные силикаты.
14. Из. каких минералов образован гранит?
15. Каким изменениям подвергаются силикаты в природных условиях?
Что называется выветриванием?
16. Какие химические изменения происходят при выветривании поле-
вого шпата? что получается?
17. Что представляет по своему химическому составу песок? глина?
18. Что называется жидким стеклом и для чего оно применяется?
19. Что представляет собой обыкновенное стекло и как оно изготовляется?
20. Для чего употребляете? глина?
21. Как изготовляется цемент? бетон?
ГЛАВА V
ГРУППА ИНЕРТНЫХ ГАЗОВ
В конце прошлого века было открыто несколько элементов, пред-
ставляющих собой при обычных условиях газообразные вещества:
аргон, гелий, неон, криптон и ксенон.
Атомы этих элементов во внешнем электронном слое имеют
устойчивую систему электронов (гелий — 2, остальные элементы по 8).
Они не теряют и не присоединяют электроны.
Инертные газы отличаются от всех прочих элементов почти пол-
ной неспособностью вступать в химические соединения. По этой
277
причине они были названы инертными (недеятельными) газами. В таб-
лице -Менделеева они помещены в нулевой группе, что указывает на
неспособность их проявлять какую-либо валентность (валентность
их равна нулю).
Содержатся эти газы в небольшом количестве в воздухе (рис. 112).
Получают их из жидкого воздуха, подобно кислороду и азоту
(см. стр. 110 и 142); выделение и разделение этих газов возможно
благодаря тому, что в жидком состоянии они кипят при разной тем-
пературе.
В настоящее время инертные газы находят практическое приме-
нение. Они особенно пригодны для наполнения электроламп, так как
Инертные газы 0,94% |
Углекислый газ 0,03%
Прочие газы 0,03%
Рис. 112. Диаграмма объёмного состава воздуха.
не вступают в химические соединения. Применяется для этих целей
инертный газ аргон (название от греческого слова, означающего
„недеятельный**), большей частью в смеси с азотом; особенно же
пригодны более тяжёлые инертные газы: криптон (название, озна-
чающее „скрытый") и ксенон (название, означающее „чуждый“)4
Благодаря малой теплопроводности и инертности этих газов напол-
ненные ими „полуваттные лампы" . дают гораздо больше света при
том же расходе электроэнергии, и они значительно долговечнее пу-
стотных ламп.
Аргоном, а также неоном (название, означающее „новый") запол-
няют стеклянные трубки с впаянными на концах электродами. При
пропускании электрического тока эти газы испускают яркие лучи:
неон — красного цвета, аргон — синего цвета. Придавая трубкам
форму букв, их применяют для рекламных целей. Свечёние этих
газов настолько ярко, что хорошо видно в темноте на далёком рас-
стоянии. Красный свет неоновых ламп сравнительно слабо задержи-
вается туманом, поэтому такие лампы особенно пригодны для маяков.
Самый лёгкий из инертных газов гелий (название от греческого
слова „гелпос"—солнце — дано ему потому, что он был сначала
обнаружен на солнце путём спектрального анализа). Гелий находит
разнообразное применение. Его прибавляют вместо азота к кисло-
роду, подаваемому водолазам для дыхания. Гелий не оказывает тех
вредных влияний на организм, какие наблюдаются при употреблении
кислорода в смеси с азотом. Благодаря этому удлиняется срок пре-
278
бывания водолазов под водой и ослабляются болезненные ощуще-
ния, происходящие от изменения давления при работе на больших
глубинах.
В атмосфере гелия достигается почти полная безопасность сушки
и хранения легко взрывающихся веществ. Объясняется это тем, что
гелий отличается большой теплопроводностью; вследствие этого
в, помещении поддерживается равномерность нагрева, устраняющая
опасность взрыва.
Гелий применяется также для заполнения дирижаблей. Полная
его инертность исключает опасность взрыва, что крайне важно, осо-
бенно в военных условиях.
Для наполнения дирижаблей нужны большие количества гелия,
которые получить из воздуха практически невозможно. В недавнее
время найдены новые источники гелия: выделяющиеся в некоторых
местах природные газы содержат значительную примесь его; из них
гелий выделяют для использования в указанных целях. В СССР
имеются богатые месторождения таких газов.
Позже других был открыт самый тяжёлый из инертных газов
]£адон. Благодаря особому свойству—радиоактивности (о чём будет
сказано дальше) он применяется в медицине для лечебных целей.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Какие элементы называются инертными газами? ।
2. В какой группе таблицы Менделеева они расположены? ,
3. Где находятся эти газы в природе и как они добываются?
4. Какое применение находят инертные газы?
ЧАСТЬ ТРЕТЬЯ
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ
СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА.
СТРОЕНИЕ АТОМОВ
ГЛАВА I
ПЕРИОДИЧЕСКИЙ ЗАКОН
§ 1. Классификация элементов
Исходя из различия физических свойств простых веществ, эле-
менты раньше всего стали делить на металлы и металлоиды.
При дальнейшем расширении знаний об элементах выяснилось,
что резкую грань между металлами и металлоидами провести нельзя,
так как существуют элементы с ясно выраженными свойствами того
и другого характера. Например, элемент хром образует основной
окисел, основание и соли, по строению молекул (формулам) и свой-
ствам сходные с соответствующими соединениями металла алюминия.
Соединения алюминия:
AI2Os. А1(ОН)„ A12(SO4)3
Соединения хрома:
Сг2О3, Сг (ОН)3, Сг2 (SO4)3
В то же время хром образует также кислотный окисел, кислоту
и соли её, сходные с соответствующими соединениями металлоида
серы.
Соединения серы:
SO3, H2SO4, K2SO4
Соединения хрома:
СгО3, Н2СгО4, К2СгО4
Это показывает, что хром проявляет и металлические, и метал-
лоидные свойства. Названия „металл“ и „металлоид“ условны и
означают только то, что в данном элементе преобладают одни или
другие свойства. В хроме, например, преобладают металлические
свойства, и его поэтому относят к металлам.
Неоднократно делались попытки объединить элементы, исходя
из сходства в их химических свойствах. Например, хлор, бром и
йод были объединены в группу галогенов и т. д. Здесь не будут
подробнее рассматриваться предлагавшиеся отдельными учёными
классификации разного рода.
280
д. И. Менделеев (1834—1907).
Уже говорилось, что ДО конца 60-х годов прошлого века не было пай- '
депо единого принципа, которым можно было бы руководствоваться, класси-
ФИЦХ^ТрМинцТип был найден в 1869 г. гениальным русским учёным
Д' Дм^триТиваХ’ич Менделеев родился в 1834 г. в семье директора
Тобольской гимназии. По окончании гимназии он поступил в Петербургский
педагогический институт и, будучи студентом, проявил большие ^способности и
трудолюбие, уже в то время им были написаны дВе работы по минералогии.
По окончании института Д. И- Менделеев в течение двух лет работал учите-
лем сначала в Симферопольской, а потом в Одесской ^имназиях. Затем он пере-
в Петербург и стал читать лекции в университете; в то же время
усиленно занимался научной работой и успешно защитил диссертацию.
В 1860 г Д И. принял участие во всемирном химическом съезде в Карлсруэ.
281
В 1861 г. он снова стал читать лекции в университете и других высших учеб-
ных заведениях. Здесь же он начал работать над вопросом о классификации
химических элементов и после длительного напряжённого труда пришёл к от-
крытию периодического закона, опубликованного им в 1869 г.
Д. И. Менделеев был гениальным учёным с очень широким кругозором.
Он интересовался не только химией, но и широким кругом других вопросов,
имевших большое научное, экономическое и политическое значение. Он много
работал над изучением природных богатств России, горячо интересовался Се-
верным морским путём и непрестанно указывал на исключительное экономиче-
ское и политическое значение его. Зарождавшееся тогда воздухоплавание
привлекло внимание учёного открывающимися возможностями изучения верх-
них слоёв атмосферы, и он в преклонном возрасте один поднялся на аэро-
стате. Такой подъём в то время был сопряжён со значительной опасностью и
представлял собой выдающийся подвиг учёного.
Д. И. Менделеев за этот подъём получил почётный диплом от Парижской
аэронавигационной академии.
Научные труды Д. И. Менделеева очень разнообразны. Мировую славу
ему доставили не только открытие периодического закона, но также иссле-
дования газов, растворов, а также написанный им оригинальный труд
«Основы химии”. Особо следует отметить, что многочисленные работы Мен-
делеева направлены в сторону разрешения как теоретических, так и практиче-
ских вопросов.
Вообще практическим вопросам Д. И. Менделеев в течение всей своей дея-
тельности уделял много внимания, так как ясно сознавал нербходимость связи
теории с практикой и горел желанием принести пользу своей родине. „Наука и
промышленность — вот тут мои мечты’,— писал он. Однако царское прави-
тельство не ценило Менделеева, и он не мог плодотворно работать в тех направ-
лениях, какие привлекали его.
Даже чисто научные заслуги Д. И. Менделеева умалялись царским прави-
тельством. Передовая русская интеллигенция, передовые учёные ценили и
чтили его как творца периодического закона. Ему была вручена золотая медаль
им. Фарадея, которой награждались учёные за великие открытия; он был почёт-
ным членом большинства научных организаций мира, а у себя на родине
в результате происков реакционно настроенной части учёных-чиновников не
был избран членом Академии наук.
Своим ходатайством перед министром об улучшении положения студентов
Д. И. Менделеев вызвал недовольство правительства и в 1890 г. вынужден
был оставить работу в университете. Он перешёл в Палату мер и весов, ко-
торая в то время не имела лабораторий и не была приспособлена для научной
работы. Д. И. Менделеев развил и здесь кипучую деятельность, создал лабо-
раторию и продолжал научную работу до Глубокой старости. Умер Д. И. Мен-
делеев в 1907 г.
Только после Великой Октябрьской социалистической революции сбылись
мечты Менделеева: теперь наша родина обладает мощной химической про-
мышленностью, передовой химической наукой, двери высших учебных заве-
дений широко открыты перед молодёжью, и для неё созданы все условия,
обеспечивающие возможность получения высшей специальности всеми, кто
к ней стремится.
282
§ 2. Периодический закон Менделеева
В своих исканиях Менделеев пришёл к выводу, что свойства эле-
ментов должны быть тесно связаны с количеством вещества, заклю-
чённым в атомах, т. е. атомным весом.
Стремясь выявить зависимость свойств элементов от атомного веса,
он написал на карточках химические знаки элементов, атомные веса
Их И, кроме того, ещё обозначил главнейшие свойства: металлический
Или металлоидный характер, валентность и пр. Эти карточки он рас-
положил в один ряд в порядке увеличения атомных весов.
На рисунке ИЗ1) сверху приведено начало этого ряда. Для пол-
ноты в нём указаны элементы, известные в настоящее время. Менделееву
при работе над этим вопросом были известны далеко не все
Элементы: однако их было достаточно, чтобы он заметил характер-
ную особенность: по всему ряду металлы через определённое число
элементов сменяются металлоидами. Другими словами, свойства эле-
ментов в ряду повторяются через определённые промежутки, т. е.
периодически.
На приведённом рисунке вверху указана положительная и отрица-
тельная валентность элементов; просматривая её в ряду элементов,
можно видеть, что положительная валентность в направлении слева
направо сначала х растёт, а затем сразу падает до 0, и так повто-
ряется периодически; так как в то время не были известны элементы
с нулевой валентностью (инертные газы), то Менделеев установил
периодическое падение валентности до единицы.
Менделеев блестяще разрешил задачу, над которой бились вид-
нейшие учёные, и открыл важнейший закон природы. Этот закон он
назвал периодическим законом. Менделеев сформулировал его так:
„Свойства простых тел, а также формы и свойства соединений
элементов находятся в периодической зависимости от величины
атомных весов элементов0, или короче:
Свойства элементов находятся в периодической зависи-
мости от величины их атомных весов.
Периодическое изменение свойств элементов в зависимости от
атомного веса выражается в ряде важнейших явлений. Сюда отно-.
сятся:
1) периодическое увеличение до определённого предела наи-
большей валентности в соединениях с кислородом (положительной
валентности);
2) периодическое уменьшение валентности в соединениях с водо-
родом (отрицательной валентности);
3) периодическое ослабление металлических свойств;
4) периодическое усиление металлоидных свойств.
Периодические изменения этих свойств можно проследить на при-
мере легко доступных для наблюдения элементов, начиная с натрия.
J) Рисунки 113 и 114 (таблицы) приложены в конце книги.
283
Примеры периодического изменения свойств. Расположенные
в порядке увеличения атомных весов элементы — от натрия и до
хлора — проявляют возрастающую высшую валентность в кислород-
ных соединениях от 1 до 7. Это видно из формул их высших
окислов:
Элементы Na Mg Al Si P S Cl
Валентность 1 2 3 4 5 6 7
Окислы Na2O MgO A12O3 ,SiO2 p2o5 SO8 C12O7
। Могут быть получены окислы и гидраты окислов всех этих эле- \
ментов и прослежены их химические' свойства.
Сжигая на воздухе или в кислороде кусочек натрия и растворяя
в воде продукт реакции (окисел Na2O и др.), получают сильно ще-
лочной раствор NaOH.
Сжигая на воздухе ленту или порошок магния, получают мало
растворимый в воде окисел MgO.
При взбалтывании его с водой получают раствор Mg(OH)2, про-
являющий слабые щелочные свойства.
Прокаливая на воздухе порошок алюминия, получают практически
почти нерастворимый в воде окисел А12О3.
Гидрат окиси алюминия легко получают из соли алюминия, при-
бавляя к раствору её по каплям раствор щёлочи:
' A12(SO4)3 + 6KOH = 2A1(OH)3 + 3K2SO4
I
Если прилить избыток щёлочи, гидрат окис"и алюминия реагирует
с ней, и происходит образование нового х вещества (алюмината),
хорошо растворимого в воде (растворение осадка):
А1(ОН)3 + КОН = 2Н2О + каю2
Образующееся в результате реакции вещество — алюминат калия
КА1О2 — относится к классу солей. Таким образом, гидрат окиси
алюминия, реагируя со щёлочью, проявляет кислотные свойства. В то
же время он легко реагирует с кислотами (растворяется в них), обра-
зуя обычные соли:
А1(ОН)3 + ЗНС1 = ЗН2О + А1С13
хлористый
. алюминий
В этой реакции гидрат окиси алюминия проявляет основные свой-
ства, подобно гидрату окиси натрия NaOH и гидрату окиси магния
Mg(OH)2, хотя и более слабые.
284
Эти опыты наглядно показывают, что в ряду элементов Na, Mg,
Al у элемента с ббльшим атомным весом — алюминия — основные
свойства сильно ослаблены и что в гидрате окиси алюминия наряду
с основными свойствами ясно проявляются также и кислотные
свойства.
Гидрат окиси алюминия одновременно является слабым основанием
и слабой кислотой. Он одновременно принадлежит к двум классам
химических соединений и в зависимости от условий реакции проявляет
то одни, то другие свойства; такие вещества называются двойствен-
ными, или амфотерными.
Элемент, следующий за алюминием в порядке увеличения атом-
ного веса,— кремний — проявляет уже преимущественно металлоид-
ные свойства. Гидрат окиси его является настоящей кислотой H2SiO3,
образующей соли при взаимодействии с основаниями. Кислотами
являются гидраты окислов всех элементов от кремния, кончая
хлором:
H2SiO<t; Н3РО4; H.,SO4; НС1О4
а о" О 4' и 4* 4
Изменение свойств в рассматриваемом ряду элементов показано
следующей наглядной схемой:
Усиление металлических Усиление металлоидных
I свойств • свойств
Элементы Na Mg Al Si P s Cl
Окислы Na2O MgO Al2O3 SiO2 P2O5 so3 C12O7
Г идраты ' окислов NaOH Mg(OH)2 A1(OH)3 или H3A1O3 H2SiO3 H3PO4 H2SO4 HC1O4
Усиление основных свойств
Усиление кислотных свойств
Следующий элемент после хлора — инертный газ аргон, с нуле-
вой валентностью, — Менделеев поместил в свою таблицу позднее —
после открытия инертных газов.
После аргона Менделеев поместил калий, хотя атомный вес его
несколько меньше атомного веса аргона. Он поступил так, исходя
из химических свойств аргона и калия, требующих именно такой
последовательности в расположении этих элементов. Менделеев здесь
допустил исключение из принятого им общего правила: располагать
элементы в порядке увеличения атомного веса. Причину несоответ-
ствия между величинами атомных весов и свойствами калия и аргона
(также йода и теллура) Менделеев не знал, но он решился допу-
стить эти исключения, будучи уверенным, что они не умаляют зна-
чения открытого им закона. (После установления строения атомов
285
бти и другие кажущиеся нарушения периодического закона получили
естественное объяснение, полностью подтверждающее периодический
закон.)
С калия начинается ряд элементов, снова повторяющий в опреде-
лённой мере свойства элементов рассмотренного выше ряда. *
Калий повторяет свойства металла натрия, следующий за ним
кальций повторяет свойства магния и т. д. Окислы этих элементов
имеют те же формулы, что и окислы элементов выше рассмотренного
ряда: К2О, СаО и т. д.
Начиная с калия, повторяется не только валентность элементов,
но и прочие свойства. В этом легко убедиться, проводя с калием
и кальцием опыты, описанные выше для натрия и магния.
Далее в ряду располагаются металлы, подобно алюминию, про-
являющие заметные двойственные свойства. Примером может служить
хром. С солью его может быть проведён тот же опыт, что и с солью
алюминия, доказывающий щелочные и кислотные свойства гидрата
окиси хрома.
В ряду, начиная с элемента, проявляющего положительную валент-
ность, равную -р 5 (отрицательную валентность, равную — 3), распо-
лагаются металлоиды: мышьяк, селен, бром, в значительной мере
повторяющие свойства металлоидов выше рассмотренного ряда: фос-
фора, серы, хлора.
Всё это отдельные примеры периодической повторяемости свойств
элементов в зависимости от атомного веса, дающие наглядное пред-
ставление о сущности периодического закона.
Величайшее значение закона Менделеева заключается в том, что
он вскрыл важнейшую особенность процесса развития вещества; он
показал, что увеличение количества вещества в атоме привело
к образованию разнообразных элементов со всем своеобразием их
свойств (качеств).
В периодическом законе Менделеева особенно ярко и наглядно
проявляется общий основной закон природы, которому подчиняются
все происходящие в мире явления: закон перехода количества
в качество.
ГЛАВА II
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
§ 1. Периоды и ряды
Исходя из своего открытия, Менделеев дал естественную класси-
фикацию элементов в виде разработанной им таблицы. Построение
её было проведено следующим путём.
Ряд элементов, расположенный в порядке увеличения атомных
весов (рис. ИЗ, сверху), он разбил на части, которые начинаются
элементом с металлическими свойствами. Эти части являются перио-
дами; в каждом последующем периоде свойства элементов повто-
286
ряются. Водород при этом оказался стоящим отдельно; с ним в ряд
в дальнейшем был помещён позже открытый гелий.
Затем Менделеев поместил периоды элементов один под другим
так, чтобы элементы со сходным^ свойствами (одинаковой валентно-
стью и пр.) расположились друг под другом. Получилась таблица,
приведённая на рисунке 113, внизу (периоды приведены в полном
виде вместе с позже открытыми элементами).
Периоды 1-й, 2-й и 3-й получили название малых, начиная же
с 4-го — больших периодов.
В больших периодах ясно замечается периодичность ещё внутри
них (см. валентность элементов). Большие периоды, таким образом,
слагаются из двух частей. В связи с этим Менделеев отделил вто-
рые части больших периодов и поместил под первыми, расположив
элементы их несколько в стороне от вертикальной линии, соединяю-
щей элементы первых частей больших периодов. Таблица приняла
окончательный вид, показанный на рисунке 114. В больших периодах
получилось теперь по 2 ряда, а всего в таблице 10 рядов.
§ 2. Группы элементов
Получившиеся в таблице вертикальные столбцы элементов были
названы группами. В первых таблицах Дмитрия Ивановича Менде-
леева групп было 8; он их занумеровал в порядке соответственно
высшей валентности элементов в кислородных соединениях; I, II,
III ... VIII группы.
После открытия инертных газов (в 90-х годах прошлого века)
в/ таблице элементов Менделеев прибавил ещё девятую группу, которую
обозначил как нулевую группу, в соответствии с валентностью этих
элементов, равной 0 (см. таблицу на рис. 114).
Элементы, помещённые в одном вертикальном столбце таблицы,
т. е. в одной группе, имеют в известной мере сходные свойства;
сходство состоит прежде всего в том, что проявляемая в кислородных
соединениях высшая валентность (положительная) у всех элементов
группы одинакова и равна номеру группы. Вследствие этого для
элементов каждой группы формулы высших солеобразующих окис-
лов одинаковы. Они указаны в таблице, представленной ниже
(на стр. 288).
Одинакова также проявляемая элементами одной группы валент-
ность (отрицательная) в водородных соединениях (газообразных), если
они образуются. Эту валентность легко вычислить; для этого надо,
как уже говорилось, от числа 8 отнять число, равное номеру группы,
т. е. валентности элемента в кислородных соединениях (объяснение
этому будет дано ниже).
Таким образом, формулы окислов и формулы водородных
соединений элементов одной группы совершенно одинаковы. Они при-
ведены ниже (под знаком R подразумевается любой элемент данной
группы):
287
делеева расположен какой-либо элемент (см. табл, в конце книги),
сразу можно установить его валентность и написать формулу выс-
шего окисла, формулы соответствующих ему соединений, формулу
водородного соединения (газообразные водородные соединения обра-
зуют, как правило, только металлоиды IV—VII групп).
Например, для алюминия, исходя из положения его в III группе
таблицы Менделеева, можно установить следующее:
1. Валентность его в кислородных соединениях (положительная)
равна 3.
2. Окисел его: А12О3.
3. Так как алюминий — металл, он образует основание и соли,
в них он трёхвалентен.
Основание: А1(ОН)3; соли: А1С13; A12(SO4)3.
4. С водородом не соединяется.
Для селена, исходя из положения его в таблице Менделеева в VI
группе, можно установить следующее:
1. Валентность его в кислородных соединениях (положительная)
равна 6.
2. Высший солеобразующий окисел его SeO3 (аналогичен SO3).
3. Ему соответствует кислота H2SeO4 (аналогичная серной H2SO4).
4. В водородных соединениях он двухвалентен: 8 — 6 = 2; соеди-
нение его с водородом H2Se (аналогичное H2S).
§ 3. Подгруппы элементов
В каждой группе таблицы имеются элементы, расположенные
правее или левее в зависимости от того, принадлежат ли они к пер-
вой половине больших периодов или ко второй половине их. Вслед-
ствие этого в каждой группе различаются две подгруппы: главная
и побочная. Побочные подгруппы начинаются с 4-го ряда (рис.'114).
Элементы, относящиеся к одной подгруппе, проявляют наибольшее
сходство между собой. Как общее правило, можно отметить, что в
288
элементах подгрупп, расположенных левее, сильнее проявляются ме-
таллические свойства по сравнению с элементами подгрупп, располо-
женных правее.
Особенно резко это различие можно видеть на подгруппах VII
группы. В правой подгруппе расположены уже изучавшиеся метал-
лоиды — галогены. В левой подгруппе находятся металлы, пред-
ставителем которых может служить марганец.
Элементы этих обеих подгрупп проявляют одинаковую высшую
валентность в кислородных соединениях, равную 7. Высшие окислы
их имеют одинаковую формулу типа: R2Or Например, хлорный ан-
гидрид С12О7, марганцевый ангидрид Мп2О7. Ангидридам соответ-
ствуют кислоты одинакового молекулярного строения: хлорная кис-
лота НС1О4 (соль её КС1О4), марганцевая кислота НМпО4 (соль
её "КМпО4).
При всём этом сходстве имеются существенные различия: гало-
гены — типичные металлоиды, а марганец и прочие элементы левой
подгруппы являются металлами, хотя и проявляющими некоторые
металлоидные свойства. Как металлы они не образуют соединений
с водородом, в отличие от элементов правой подгруппы — галогенов.
Соответствующее преобладание металлических или металлоидных
свойств, хотя и не такое резкое, можно проследить в левых и правых
подгруппах всех групп.
§ 4. Изменение свойств элементов в группах
В группах наблюдаются определённые закономерные изменения
свойств элементов: в элементах, ниже расположенных, т. е. с бдлъ-
1 шим атомным весом, сильнее проявляются металлические свой-
ства и слабее металлоидные.
В IV группе, например в главной подгруппе, наверху располо-
жены уже изучавшиеся элементы — углерод и кремний, являющиеся
металлоидами; внизу же находятся всем хорошо известные металлы —
олово и свинец. То же наблюдается в остальных группах.
В главной подгруппе VII группы находятся только металлоиды—
галогены, но и 'здесь наблюдается ясное ослабление металлоидных
свойств у элементов с большим атомным весом. Проявляется это в
ослаблении прочности водородных соединений.
Для элементов с резко выраженными металлоидными свойствами
(типичных металлоидов) характерна способность давать прочные газо-
образные водородные соединения. Элементы с резко выраженными
металлическими свойствами (типичные металлы) не способны давать
газообразных водородных соединений. Поэтому уменьшение прочно-
сти водородных соединений указывает на ослабление металлоидных
свойств элементов. Это отчётливо наблюдается у галогенов. Распо-
ложенные внизу группы галогены — бром и йод (с большим атомным
весом) водородные соединения образуют, но значительно менее проч-
ные, чем хлор и фтор.
В. В. Левченко 299-
§ 5. Значение таблицы Менделеева
для определения характерных свойств элементов.
Пользование таблицей
Как выше было указано, в группах свойства элементов с уве-
личением их атомного веса (т. е. в направлении сверху вниз) изме-
няются в сторону ослабления металлоидных свойств и усиления
металлических свойств.
В рядах свойства элементов (в направлении слева направо) изме-
няются в сторону ослабления металлических свойств и усиления
металлоидных свойств.
Изменения свойств элементов в зависимости от положения в таб-
лице Менделеева для наглядности показаны на рисунке 114.
Связь между свойствами элементов и их положением в таблице
в основном выражается в следующем:
1. Слева и внизу таблицы расположены металлы; сильнее всего
выражены металлические свойства у элемента цезия.
2. Сверху и справа таблицы, не считая восьмой и нулевой групп,
расположены металлоиды; сильнее всего выражены металлоидные
свойства у элемента фтора.
3. Среднюю часть таблицы занимают элементы, проявляющие
в своих соединениях одновременно металлические и металлоидные
свойства.
Положение элемента в таблице Менделеева достаточно полно оп-
ределяет существеннейшие его свойства; в этом глубокий смысл таб-
лицы (см. таблицу в конце книги).
Как выше было показано (стр. 288), исходя из положения эле-
мента в таблице Менделеева, можно сделать заключение о валент-
ности; этого элемента. Ниже на примере не изучавшегося нами эле-
мента — сурьмы — показано более полно, какие сведения о свойствах
элементов можно черпать из таблицы Менделеева.
Пользуясь ею, легко установить:
1. Высшую валентность элемента в кислородных соедине-
ниях (положительную валентность). Эта валентность равна номеру
группы. Для сурьмы (V группа) валентность равна-}-5.
2. Формулу высшего окисла. Для сурьмы эта формула отвечает
общей формуле для элементов V группы: R2O6; отсюда высший
окисел сурьмы: Sb2O5.
3. Химические свойства высшего окисла. Сурьма является ме-
таллом, но в таблице располагается ближе к середине. Поэтому
следует ожидать у неё проявления металлоидных свойств и кислот-
ного характера высшего окисла.
Формула соответствующей кислоты (выводится из формулы окисла):
HSbO3 — сурьмяная кислота.
Так как сурьма расположена внизу группы, следует ожидать
ослабления металлоидных свойств и усиления металлических свойств
её по сравнению с1 выше расположенными элементами (As, Р, осо-
бенно N). Действительно, кислородные соединения сурьмы отли-
290
чаются значительно большей прочностью по сравнению с соединения-
ми выше стоящих элементов, в чём и проявляется ослабление метал-
лоидных и усиление металлических свойств.
4. Способность элемента соединяться с водородом. Эта спо-
собность проявляется, начиная с IV группы, и только у элементов
главных подгрупп. Так как сурьма расположена в главной подгруппе
V группы, она должна давать- соединение с водородом.
5. Валентность элемента в соединениях с водородом (отрица-
тельная валентность). Эта валентность равна разности между числом 8
и номером группы. Так как сурьма находится в V группе, её валент-
ность в соединениях с водородом: 8 — 5 = 3.
6. Формула соединения с водородом. Для сурьмы эта формула
отвечает общей формуле для элементов V группы: #Н3; отсюда
формула сурьмянистого водорода: SbH3.
7. Прочность водородного соединения. Так как сурьма распо-
ложена внизу группы, сурьмянистый водород значительно менее проч-
ное соединение, чем водородные соединения выше стоящих элементов,
особенно азота; аммиак — прочное соединение, а сурьмянистый водо-
род разлагается уже при сравнительно слабом нагревании (ослабление
металлоидных свойств у ниже стоящих элементов).
§ 6. Предсказание Менделеевым существования неизвестных
в то время элементов. Место в таблице для открытых
впоследствии инертных газов
Как сообщалось выше, при составлении Д. И. Менделеевым
таблицы довольно много элементов ещё не было открыто. Менде-
леев, руководствуясь периодическим законом, оставил в таблице пус-
тые места, которые в дальнейшем были заполнены вновь открытыми
элементами (места под номерами 21, 31, 32). Заполнение этих мест
явилось блестящим подтверждением правильности идей гениаль-
ного учёного.
Как Менделеев руководствовался периодическим законом, остав-
ляя в таблице пустые места для элементов, которые должны быть
открыты в будущем, можно видеть на примере открытого впослед-
ствии элемента скандия. Если не оставлять для него в таблице места
и располагать в порядке увеличения атомных весов известные в то
время элементы Ti, V, Сг, то получается следующее расположение
их в III, IV, V группах и во 2, 3, 4-м рядах.
Ряды Группы
III IV У
2 В С N
3 А1 Si Р
4 Ti V Сг
19*
291
При этом условии под алюминием (окисел А12О8) оказывается
совершенно непохожий на него титан (окисел TiO2), под кремнием
(окисел SiO2) оказывается совершенно непохожий на него ванадий
(окисел V2O6), под фосфором (окисел Р2О6) оказывается совершенно
непохожий на него хром (окисел СгО8).
Из периодического закона следует, что должно наблюдаться сход-
ство в свойствах и составе (формулах) соединений элементов одной
группы. При таком же расположении элементов сходства в формулах
окислов нет. Это казалось совершенно непонятным, если считать
периодический закон правильным. Менделеев в нём не сомневался
и сделал гениальную догадку: должен существовать ещё неизвест-
ный элемент, которому место в III группе, в 4-м ряду.
•Придя к этому выводу, Менделеев передвинул вправо титан, ва-
надий, хром и оставил пустое место для неизвестного элемента:
Ряды Группы
III IV V
2 В С N
3 А1 Si Р
4 ? Ti V
При таком расположении валентность и другие свойства титана
и ванадия в основном совпали со свойствами других элементов IV
и соответственно V групп.
Менделеев не только оставил места для элементов, которые, по
его мнению, должны быть открыты, но в 1871 г. с большой точ-
ностью предсказал свойства некоторых из них, руководствуясь
периодическим законом и созданной им таблицей.
„Есть возможность, — писал он, — предугадать свойства неизвест-
ных ещё элементов, особенно тогда, когда они окружены извест-
ными".
Ни один из известных в то время элементов по величине атом-
ного веса и по свойствам не мог занять места, отмеченные на таб-
лице (рис. 114) номерами 21, 31, 32. Руководствуясь периодическим
законом и свойствами соседних элементов по горизонтальному и
вертикальному направлениям, Менделеев описал свойства трёх эле-
ментов, которые, по его мнению, должны занять оставленные им
в таблице пустые места после элементов кальция и цинка.
Через несколько лет предвидение Менделеева полностью оправ-
далось, когда были открыты предсказанные им элементы: галлий
(в 1875 г.), скандий (в 1879 г.), германий (в 1885 г.).
Предсказанные Менделеевым свойства этих элементов порази-
тельно совпали со свойствами, установленными опытным путём после
того, как элементы были открыты. Особый интерес представляет
292
история открытия в 1875 г. первого из предсказанных Менделеевым
элемента, для которого им было оставлено место в Ш группе,
в 5-м ряду (клетка 31). Открывший этот элемент французский хи-
мик Лекок де Буабодран назвал его галлием в честь своей родины
(Галлия—древнее название Франции). Все свойства галлия, установ-
ленные Лекок де Буабодраном, совпали с поразительной точностью
с предсказанными Менделеевым для элемента, который он предвари-
тельно назвал экаалюминием: расхождение было только в величине
удельного веса. Лекок де Буабодран нашёл его равным 4,7, а Мен-
делеев вычислил равным 6.
Уверенный в правильности своих вычислений, основанных на
периодическом законе, Менделеев немедленно сообщил в Парижскую
академию наук, что галлий — это предсказанный им элемент экаалю-
миний. Его атомный вес близок к 68, удельный вес около 6.
Когда Лекок де Буабодран сообщил, что он нашёл удельный вес
галлия равным 4,7, Менделеев был уверен в ошибке и настаивал
на повторении определений с лучше очищенным веществом.
Лекок де Буабодран снова повторил определения на более чистом
материале и убедился, что Менделеев прав: удельный вес галлия
в самом деле оказался равным 5,9.
По поводу открытия предсказанных им элементов Менделеев
писал: „Отсюда уже видно, что периодический закон не только от-
вечает известной действительности, но и позволяет проникать хотя
понемногу в неизвестную сущность химических элементов".
После открытия предсказанных Менделеевым элементов перио-
дический закон был признан основным законом химии, а теперь он
признаётся основным законом всего естествознания.
Большое значение для подтверждения правильности идей Менде-
леева имело также то, что открытые в 90-х годах инертные газы
нашли соответствующее место в его таблице. Об этом он писал
сам: „В то время (1869 —1871), когда устанавливался периоди-
ческий закон, совершенно были неизвестны и вовсе непредвидимы
такие недеятельные в химическом смысле элементы, как аналоги
аргона (Не, Ne, Аг, Кг и Хе), а потому место для них в системе
других элементов послужило весьма важнейшим средством для укре-
пления понятий, этим законом выставленных. Действительно, судя по
тому, что аргоновые элементы не вступают в соединения, по смыслу
закона периодичности их должно поместить в нулевую группу".
§ 7. Исправление Менделеевым атомных весов
некоторых элементов
Периодический закон и составленная Менделеевым таблица по-
зволили ему также произвести исправления атомных весов целого
ряда элементов, что имело большое научное и практическое значение.
Основываясь на химических свойствах элемента и необходимости
поместить его в определённую группу, он исправил атомные веса
тория, церия, индия и некоторых других.
• 293
Не останавливаясь детально на многообразном значении таблицы*
можно сказать, что она стала могучим орудием дальнейшего развития
химической науки.
В последнее время таблица Менделеева приобрела ещё больший
смысл в связи с разрешением вопроса о строении атома.
Постановка и разрешение этого вопроса являются величайшим
достижением науки начала XX в., приведшим к полному отказу от
установившихся прежних представлений о неделимости атома.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. При каком расположении элементов проявляется периодичность в изме-
нении их свойств?
2. Что определяет свойства элементов согласно закону Д. И. Менде-
леева?
3. Какой общий закон природы проявляется в законе Менделеева?
4. Что, называется периодом?
5. Какими свойствами обладают первые и последние элементы в пе-
риодах? предпоследние элементы? Какова валентность этих элементов?
6. Как изменяется положительная валентность элементов в периодах
с увеличением атомного веса?
7. Как изменяется отрицательная валентность?
8. Какие периоды называются малыми? большими?
9. Чем отличаются большие периоды от малых периодов?
10. Сколько имеется больших периодов и как Менделеев расположил их
в таблице?
11. Что называется рядом в таблице Менделеева?
12. Что называется группой, подгруппой?
13. Какие имеются общие свойства у элементов, стоящих в одной группе?
В чём заключается сходство и различие между элементами, находящимися в
одной группе, но в разных подгруппах?
14. Как определить валентность элемента (положительную и отрицательную),
пользуясь таблицей Менделеева?
15. Как изменяются металлические и металлоидные свойства элементов
при переходе по таблице Менделеева слева направо и сверху вниз?
ГЛАВА III
РАДИОАКТИВНОСТЬ
До конца XIX в. держалось представление об атомах как о неиз-
меняемых и неделимых частицах вещества. Это представление счита-
лось абсолютной истиной, и не допускалась даже возможность поста-
новки вопроса о внутриатомном строении.
Решительный удар укоренившемуся убеждению в неизменяемости
атомов был нанесён замечательными открытиями, последовавшими
одно за другим в конце XIX в.
Началось со случайно сделанного французским физиком А. Бек-
керелем открытия (1896). Он обнаружил, что соединения элемента
урана испускают особые лучи, которые проходят через светонепро-
ницаемую бумагу и действуют на фотографическую пластинку.
294
В то время в лаборатории
работала М. Кюри-Склодовская.
большие способности экспе-
риментатора, предложил ей
заняться подробным иссле-
дованием открытого им явле-
ния.
Мария Кюри-Склодовская ро-
дилась в Варшаве в 1867 г. Отец её
был профессором математики и фи-
зики в высшей школе. Д. И. Мен-
делеев, который был знаком с её
отцом, оценил способности моло-
дой Склодовской и предсказал ей
великое будущее, если она посвя-
тит себя химии.
Девушкой Мария приняла го-
рячее участие в революционном
кружке, который был организован
учениками её отца. После провала
этого кружка и ареста некоторых
его членов Мария была вынуждена
покинуть Варшаву. В возрасте
24 лет она приехала в Париж
(1891) и несмотря на тяжёлые ма-
териальные условия стала учить-
ся в университете. В 1895 г. она
вышла замуж за физика П. Кюри,
бывшего тогда ассистентом.
В 1896 г. она совместно с мужем занялась изучением веществ, испускаю-
щих особые лучи, открытые незадолго перед этим физиком А. Беккерелем.
В результате проведённой упорной работы в 1898 г. были открыты
Рис. 115. Отпечаток, полученный на
фотографической пластинке под дей-
ствием лучей радия. Лучи радия ока-
зали действие через чёрную бумагу,
в которую была завёрнута пластинка.
Сорбонны (университета в Париже)
Беккерель, видевший проявляемые ею
Мария Кюри-Склодовская
(1867—1934).
два новых элемента — полонии и ра-
дий. Уже после смерти П. Кюри
(1906) М. Кюри-Склодовская полу-
чила в 1910 г. чистый радий. Она
посвятила всю свою жизнь изучению
радиоактивных элементов и является
единственным учёным, получившим
два раза Нобелевскую премию (в 1903
ив 1911 гг.).
Склодовская совместно со сво-
им мужем, физиком П. Кюри,
с жаром взялась за работу. Уже
через 2 года после упорного и
кропотливого труда ей удалось
обнаружить новый элемент, испу-
скающий открытые Беккерелем
лучи во много раз интенсивнее,
чем уран. Этот элемент Склодов-
ская назвала в честь своей роди-
ны — Польши — полонием. Даль-
нейшее продолжение работы при-
295
вело к открытию второго нового элемента, ещё оолее интенсивно испу-
скающего лучи, чем полоний. Этот элемент был назван радием (от латин-
ского слова „радиус11, означающего „луч“).
В чистом виде и в соединениях радий
беспрерывно испускает лучи, действующие
на фотографическую пластинку (рис. 115).
Исследованиями М. Склодовской и ряда
других учёных было затем установлено,
что в окружающем радий пространстве
появляются не находившиеся в нём элемен-
ты: гелий и до того времени неизвестный
элемент, позднее названный эманацией,
Рис. 116. Вещества, обра-
зующиеся в результате рас-
пада радия. а затем радоном. Точными опытами было
установлено, что гелий и радон обра-
зуются из радия, т. е. был доказан распад элемента радия на два
новых элемента (эис. 116).
После этих открытий пришлось признать:
1) что атом не является чем-то неизменным, что он способен
распадаться и, следовательно, имеет сложный состав,
2) что возможно превраще-
ние одних элементов в другие.
Испускаемые радием лучи ока-
зывают определённое действие на
живой организм, на живую ткань
и в настоящее время применяются
в лечебных целях (лечение на-
кожных болезней и др.).
Изучение испускаемых радием
невидимых лучей в магнитном и
электрическом поле показало,
что они неоднородны (рис. 117).
В состав их входят: 1) лучи,
подобные лучам Рентгена; полу-
чили они название гамма (у)-лу-
чей; 2) поток отрицательно за-
ряженных частиц (электронов);
получил он название бета (^-лу-
чей; 3) поток положительно за-
ряженных частиц; получил он
название альфа (а)-лучей. Эти
частицы вылетают из атомов с
очень большой скоростью. Час-
тицы а-лучей, попадая в воздух,
теряют заряды и превращают-
ся гв атомы элемента гелия
(рис. 118).
Свойство элемента непрерыв-
но и самопроизвольно испускать
Рис. 117. Отклонение лучей радия
между наэлектризованными пластин-
ками (схема).
Радий помещён в коробочке из свинца, за-
держивающею все его излучения; лучи про-
ходят только через маленькое отверстие в
верхней стенке коробочки. Кроме указанных
лучей, в воздух переходит газообразное ве-
щество — элемент радон, в который превра-
щается радий после происшедших с ним из-
менений.
296
невидимые глазу лучи было названо по предложению Кюри радио-
активностью. Явление радиоактивности показало, что в состав атома
входят положительно и отрицательно
шем оказалось, что радиоактивный
распад не является редкостью; боль-
шое число элементов, хотя и в сла-
бой степени, тоже проявляет радио-
активные свойства. Открытие явле-
ния радиоактивности значительно
расширило наши знания о происхо-
дящих в природе процессах.
Кроме химических процессов,
при которых полностью сохраняются
заряженные частицы. В дальней-
Рис. 118. Схема распада радия.
атомы реагирующих веществ, в природе происходят также радио-
активные процессы; при них атомы претерпевают коренные изме-
нения, распадаются и превращаются в атомы новых элементов с меньшим
атомным весом. На рисунке 119 схематически показаны установленные
в настоящее время радиоактивные превращения радия и образующихся
из него веществ.
Скорость радиоактивного распада атомов разных элементов раз-
лична. В одних случаях она очень велика, в других — крайне мала.
Обычно эта скорость определяется временем, в течение которого
первоначальное количество атомов данного элемента уменьшается
наполовину. Это время называется периодом полураспада и является
постоянной и характерной величиной для каждого радиоактивного
элемента. На рисунке 119 под обозначениями элементов указан период
полураспада их.
Конечным продуктом радиоактивного распада является устойчи-
вый элемент — свинец. Сам радий является продуктом радиоактивного
распада более тяжёлого элемента — урана (ат. в. 238).
19,5 НИИ. 0,000 001 сен 16 лет 4,86 сутон 136,6 суток устойчив
Рис. 119. Превращения радия и продуктов его распада.
Под названием элементов указан их атомный вес. Если вес не изменяется, превра-
щение элементов является результатом потери их атомами отрицательно заряжен-
ной ^-частицы (электрона), незначительный вес которой ( тД- ) на весе атома
практически не отражается. При потере положительно заряженной а-частицы с атом-
ным весом, равным 4, вес нового элемента уменьшается на 4.
297
Ряд радиоактивных превращений дают также элементы торий
(ат. в. 232) и актиний (ат. в. 227).
Таким образом, в противоположность прежним представлениям
об атоме как об абсолютно неизменной частице, в настоящее время
мы должны рассматривать атом одновременно неделимым и де-
лимым.
Атом неделим в смысле наименьшей частицы вещества, участвую-
щей в химических реакциях и полностью при них сохраняющейся;
в то же время он делим, так как является сложной частицей, распа-
дающейся при радиоактивных процессах.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В чём заключается явление радиоактивности? Почему дано ему такое
название?
2. Какие лучи излучает радий? Что они собой представляют?
3. На какие вещества распадается радий?
4. Как изменило наши представления об атомах открытие явления радио-
активности?
ГЛАВА IV
СТРОЕНИЕ АТОМА
§ 1. Составные части атома
Благодаря трудам ряда учёных наука располагает в настоящее
время достаточно богатым экспериментальным материалом по вопросу
Рис. 120. Схема строения атома
водорода.
о внутреннем строении атома.
Большая заслуга в этом на-
правлении принадлежит со-
ветским учёным. Согласно
современным представлениям,
атом по своему строению подо-
бен солнечной системе (рис.
120).
В центре атома находится
весьма маленькое по сравнению
с самим атомом положительно
, заряженное ядро, в котором
заключена почти вся масса
/ атома. Вокруг ядра на рас-
стояниях, во много раз ббль-
ших его диаметра, вращаются отрицательно заряженные частицы —
электроны, подобно тому как вокруг солнца вращаются планеты
(отсюда название — планетарная модель атома).
Были найдены способы определения величин положительных за-
рядов ядер, и оказалось, что наименьший заряд, равный 1, имеют
ядра атомов простейшего элемента — водорода (рис. 120); эти ядра
298
состоят из частицы, получившей название протона (от греческого
слова „протос", что означает „первый*4).
Масса протона равна 1. Ядро атома водорода состоит из одного
протона, а ядра атомов более тяжёлых элементов содержат большее
количество протонов и ещё
особые незаряженные частицы
нейтроны с массой, тоже рав-
ной 1.
Вращающийся вокруг ядра
электрон — это отрицательно
заряженная частица с зарядом,
по величине равным заряду
протона, но противоположным
по знаку (—1). Масса элек-
1
трона равна массы атома
водорода.
В атоме число электро-
орбиты двух
электронов
Рис. 121. Схема строения атома гелия.
Заряд ядра равен 4-2. Вокруг ядра вращаются
два электрона. А — изображение строения атома
с указанием орбит электронов; Б — упрощённое
изображение строения атома. Оба электрона по-
казаны на одной окружности, изображающей
энергетический уровень (электронный слой).
нов, вращающихся вокруг ядра,
точно равно। числу единиц положительного заряда ядра (рис. 121—124);
благодаря этому атомы в сво
•Т«)и:(ЛЛ м«О1<
стоянии
ведут себя как элек-
трически незаряженные тела.
Заряд, равный 2, имеют атомы гелия (рис. 121); наибольший
заряд из хорошо изученных элементов имеют атомы урана; равен
Рис. 122. Схема строения атома лития.
Заряд ядра равен -f-З. Вокруг ядра вращаются 3 электрона.
А — схема строения атома с изображением орбит электронов;
Б — упрощённая схема строения атома с изображением энерге-
тических уровней (электронных слоёв). Первые два электрона
находятся на первом энергетическом уровне; третий электрон
находится на втором энергетическом уровне.
он 92. В последнее время открыты элементы, которые должны быть
помещены в таблице Менделеева за ураном; это трансурановые эле-
менты („транс" означает „за") с зарядом ядра до 100 (см. таблицу
Менделеева).
Электроны вращаются вокруг ядра каждый по своей орбите, как
показано для атома гелия на рисунке 121, для атома лития — на
299
рисунке 122, для«атома углерода — на рисунке 123, для атома натрия —
на рисунке 124.
Два ближайших к ядру электрона (рис. 122—1241.—движущи еся
каждый по своей орбите, характеризуются одинаковым запасом энер-
гии. Для обозначения
~этого'~~~ говорят, что
эле к троны находятс я
на одинаковом энер-
гетическом уровне
{выданном случае—пер-
вом).
латающиеся дальше
п ёрвых двух эле к-
тронов (в числе до 8;
Рис. 123. Схема строения атома углерода.
Заряд ядра равен -J-6. Вокруг ядра вращаются 6 электронов. А — изображение с указанием
орбит электронов; Б — упрощённое изображение с указанием энергетических уровней (элек-
тронных слоёв). Электроны расположены двумя электронными слоями: в первом слое
2 электрона; во втором слое 4 электрона.
рис. 124), характеризуются уже большим запасом энергии; эти
электроны находятся на втором энергетическом уровне. В атоме
ч.________________________________ ------------------—
А Б
Рис. 124. Схема строения атома натрия.
Заряд ядра равен 4-11. Вокруг ядра вращаются 11 электронов. А — схема строения ато^а
с изображением орбит электронов. /* — Is —орбиты электронов, вращающихся на первом
энергетическом уровне (в первом электронном слое) (см. рис. Б — Г); 21 —2е —орбиты
электронов, вращающихся на втором энергетическом уровне (см. рис. Б — H)j 3* — орбита
электрона, вращающегося на третьем энергетическом уровне (см. рис. Б —III)’, Б — схема
строения атома с изображением энергетических уровнен (электронных слоёв); I—первый
энергетический уровень (электронный слой) с 2 электронами; 11 — второй энергетический
уровень (электронный слой) с 8 электронами; /// — третий энергетический уровень (электрон-
ный слой) с 1 электроном.
300
лития на этом уровне вращается только один электрон (рис. 122);
в атоме углерода-—4 (рис. 123), в атоме натрия—8 (рис. 124).
Дальше следует третий, энергетический уровень. На этом уровне
вращаечся в ашМё-тГЛтрш! (рис. 124) юльни один ыцсх т р о н.
* Энергетические уровни иначе—называются ешё электронными
слоями. При изображении строения атомов с указанием только энер-
гетических уровней (электронных слоёв) их изображают концентри-
ческими окружностями; на этих окружностях указывают электроны,
находящиеся на данном энергетическом уровне. Такие изображения
атомов просты (рис. 121, 122, 123, 124 под буквой Б)\ они очень
удобны для сравнения между собой строения атомов и вытекающих
отсюда свойств их. Необходимо только помнить, что при данном
способе изображения круги — не орбиты электронов, а условные
изображения энергетических уровней (электронных слоёв), и что
каждый электрон вращается вокруг ядра по своей собственной орбите,
как показано на рисунках 121—124 под буквой А.
§ 2. Строение атомов и периодический закон
Vbce элементы могут быть расположены в ряд в порядке воз-
растания величины заряда ядер атомов, начиная с водорода (у кото-
рого заряд ядра равен 1).
В этом ряду (рис. 125) заряд ядра каждого элемента на единицу
больше заряда ядра предыдущего элемента; расположение элементов
точно совпадает с расположением их в таблице Менделеева. Благо-
даря этому порядковый номер элементов, показываемый на таблице
Менделеева цифрой над химическим—знаком, численно равен вели-
ЧЙпе^ОЛОЖИТелЬНОГО заряда ядра и. слрппндтрпьнл^ числу вращающихся
вокруг ядра электронов, от чего зависят свойства элементов.
Таким образом, существует численное равенство между тремя
величинами: порядкозым номером элемента, числом положительных
зарядов ядра элемента и числом электронов, вращающихся вокруг ядра.
Порядковый номер элемента равен числу положитель-
I/ ных зарядов ядра атома элемента, равен числу вращаю-
щихся вокруг ядра электронов.
При этом в строении атомов наблюдается периодическое повто-
рение структуры внешнего электронного слоя, числа электронов
в нём. Таблица Менделеева (см. таблицу в современном виде в конце
книги, стр. 450—451) приобрела теперь новый глубокий смысл,
так как стала выражением внутреннего строения атомов. В связи
с этим периодический закон теперь следует формулировать так:
свойства всех химических элементов, состав и свойства образованных
ими соединений изменяются периодически в зависимости от величины
заряда ядер их атомов (порядкового номера элементов), или короче:
v / i свойства элементов находятся в периодической Зависимости
v I от величины заряда ядер их атомов.
301
ГРУППА
20 Са
19 К
IV период
39,098
40,008
Рис. 125. Строение атомов, расположенных в порядке увеличения
заряда ядер.
Цифры _наверху порядковый помер элемента. Цифры вияэу—атомный вес эле-
ента. цифры внутри положительный заряд ядра. Цифры на окружностях —
число электронов в электронном слое.
Исходя из положения элемента в таблице Менделеева, легко уста-
новить величину заряда его ядра и количество вращающихся вокруг
ядра электронов. Например, для кальция, расположенного в табли-
це двадцатым (порядковый номер его 20), можно утверждать: 1) что
положительный заряд его ядра равен -|-20 и 2) что вокруг ядра
вращается 20 электронов (см. схему строения его атома на рис. 125).
§ 3. Зависимость свойств элементов от строения атомов
1. Природа валентности. Зависящее от заряда ядра количество
электронов, вращающихся вокруг него, и их расположение опре-
деляют химические свойства элементов.
В образовании валентных связей между атомами принимают уча-
стие прежде всего электроны, расположенные во внешнем, т. е.
наиболее отдалённом
от ядра слое (иногда
и расположенные в бо-
лее глубоком слое).
Валентность элемен-
т ов -— это проявлени е
способности~~ПХ атбмов
терятьили прпсоеди-
н ять^элекТротгПТ4
валентные электроны
ООО
атом
алюминия .
(нейтральный,
йон алюминия,
проявляющий
(3 положитель-
ных заряда
степени проч-
электронных
атом инертного
газа неона
(нейтральный)
Рис. 126. Потеря атомом алюминия валентных
электронов.
В результате потери электронов образовался положительно
заряженный йон. Внизу под Йоном алюминия для сравнения
изображён атом инертного газа неона. Количество и рас-
положение электронов у них одинаковы, но у йона алюми-
ния заряд ядра не равен общему числу зарядов всех остав-
шихся электронов; поэтому йон алюминия заряжен (-f- 3),
а атом неона нейтрален.
—ПшерЗГ и присо-
единение электрона за-
висят от
ности
структур. У инертных
jgaoB (нулевая~~труттйа
т аблицы Менделеева)
электронные сТоуКту-
рьГлтгЛичаются очень
большой-ттроч ностью и
нё~~подйёргаются изме-
нейпям-в'-условиях хи-
мических—реакций? по-
этому эти элементы в
химические-еоедине н ия
це вступают.- Структу-
ра^атомов инертных газов Не, Ne, Аг показана на рисунке 125.
Устойчивость этих элементов объясняется присутствием в наиболее
отдалённом от ядра или, как обычно говорят, во внешнем слое прочной
системы из 8 электронов (только в случае гелия — из 2 электронов).
Если атом в наружном слое обладает меньшим числом электронов,
то этот атом более или менее легко может потерять часть или даже
все внешние электроны; в результате этого наружным становится
следующий внутренний слой электронов, состоящий из 8 электронов
или из 2 электронов у элементов 2-го периода (рис, 125).
303
Электроны, отрывающиеся от атома при химических реакциях,
называются валентными, так как от них зависит валентность эле-
мента. ----------______
Атомы в свободном состоянии электронейтральны: положитель-
ные заряды ядра уравновешиваются равным числом вращающихся
вокруг ядра электронов. При отрыве от атома определённого числа
электронов соответствующее число единиц положительного заряда
ядра становится теперь неуравновешенным (рис. 126) и проявляет
своё действие в окружающем пространстве.
Таким образом, при отрыве электронов нейтральные атомы пе-
реходят в положительно заряженное состояние — и в этом причина
йон серы,
проявляющий
6 положитель-
ных зарядов
Рис. 127. Переход атома серы (элемента VI группы) в Йоны.
Наверху — потеря атомом серы шести электронов и образование
положительно заряженного Йона (S + 6). Внизу — присоединение к
атому серы двух электронов и образование отрицательно заряжен-
ного Йона (S-3).
проявления элементами положительной валентности (валентности
в кислородных соединениях).
Атомы в электрически заряженном состоянии, как уже говорилось,
называются Йонами. Потеря валентных электронов может происхо-
дить в зависимости от условий реакции полностью или по частям,
в результате чего образуются Йоны с соответствующим числом поло-
жительных зарядов. Этим объясняется переменная положительная
валентность, проявляемая многими элементами.
В устойчивое состояние может перейти атом, не только теряя, но
и присоединяя электроны в количестве, необходимом для образования
устойчивого слоя (слоя из 8 электронов). В результате присоедп-
304
нения электронов вокруг ядра начинает вращаться больше электронов,
чем обычно; число их теперь превышает число положительных заря-
дов ядра, и такой атом становится отрицательно заряженным Йоном;
величина отрицательного заряда его соответствует числу присоеди-
нённых электронов. В этом заключается причина проявления элемен-
тами отрицательной валентности (валентность в соединениях с водо-
родом).
На рисунке 127 показана схема процессов, приводящих атом серы
в состояние положительно заряженного Йона и отрицательно заря-
женного йона.
Потеря атомом электронов превращает его в поло-
жительно заряженный йон (проявление положительной
валентности).
Присоединение атомом электронов превращает его
в отрицательно заряженный йон (проявление отрицатель-
ной валентности).
2. С троение атомов и проявление ими валентности. Сравнивая
строение атомов из разных групп (рис. 125) по числу электронов
во внешнем слое (валентных электронов), можно видеть, что
число валентных электронов соответствует номеру
группы в таблице Менделеева.
В атомах элементов, относящихся к главным подгруппам, все
валентные электроны расположены во внешнем слое, как видно по
рисунку 125; в атомах же элементов, относящихся к побочным под-
группам и к VIII группе, часть валентных электронов расположена
в более глубоком слое, что подробно здесь не рассматривается
(в наружном слое у атомов этих элементов имеется в большинстве
случаев только 2 электрона, которые они теряют легче всего и по-
этому проявляют положительную валентность, равную 2).
Номер группы в таблице Менделеева (см. стр. 450) равен высшей
положительной валентности элементов этой группы; он равен числу
валентных электронов, а для элементов главных подгрупп I—VII групп
равен числу электронов во внешнем электронном слое.
Электроны могут лтрыяяткгя от атомов элементов всех групп
(проявление положительной валентности), кроме нулевой. ИрТГсоеди-
я«цч>ся~~яге электро ны^как. "правило,_могут только в тех ''случаях,
йогда^ не менее Четырёх
«своих электронов; следовательно, присоещшёнйа^^дектрипив (про-
явление отри цательной валентности} может происходить7~йШ?~правйло,
5Сэлементбв~~главных подгрупп ТУ—УН—грушГ (см. рис. 114 и Т25).
11ри(юединяться ~элёкТр'оны^могут~Утт7ТКко до образования устой-
чивой структуры во внешнем слое, состоящей из 8 электронов
(рис. 128). Поэтому чпгпп пригпепиняемых электронов равно раз-
jHocTn- междус числом 8 и числом имеющихся электронов во внешнем
20 в. В. Левченко " 305
^электронном слое (числом^__ивьцмжщдщим высшую положительную
йялентнпгть группы). Этим объясняете*- явЛенйе; -на Которое
указываяесь-уже^на стр?105. ___ """
Присоединять электроны могут также и атомы водорода. Поэтому водо-
род способен соединяться с наиболее активными металлами, образуя гид-
риды. Например, гидрид натрия NaH, гидрид кальция СаН2. В этих соедине-
ниях водород проявляет отрицательную валентность, равную — 1 (подобно
галогенам), поэтому его иногда помещают в VII группе таблицы Менделеева.
При образовании гидридов металлов атом водорода присоединяет один
электрон и переходит в отрицательно заряженный йон (Н ). Этот йон имеет
устойчивую систему электронов, подобно атомам гелия (рис. 121). Водород
с металлами соединяется при высокой температуре. Отличаются эти соеди-
нения неустойчивостью: разрушаются от действия воды и воздуха.
3. О собенности редкоземельных элементов. При химических реакциях
изменения происходят только во внешних электронных слоях. Электроны,
расположенные в более глу-
боких слоях, при химиче-
ских процессах не затраги-
ваются; в связи с этим на
химические свойства эле-
ментов они влияют в слабой
мере. Этим объясняется
очень большое сходство в
свойствах 14 элементов, рас-
полагающихся в порядке
атомных весов за лантаном
(порядковый номер кото-
рого 57).
Лантан и следующие за
ним элементы (порядковые
номера до 71) проявляют,
как правило, наибольшую
валентность, равную -f-З, и
очень сходны между собой,
этим их помещают в одну клетку с лантаном в III группе,
элементы общее название — редкоземельные элементы (так
редко встречаются) или лантаниды. В таблице элементов их
обычно выделяют и
В соответствии
элементов на один
но расположены у
а не во внешних.
положено по 2 электрона. Вступая в соединения, атомы отдают, кроме двух
внешних электронов, ещё один электрон из предпоследнего электронного
слоя; поэтому эти элементы проявляют, как правило, одинаковую валент-
ность, равную -f- 3.
Рис. 128. Внешние электронные слои у атомов
элементов IV—VII групп.
Заштрихованные кружки — валентные электроны; число
их равно высшей положительной валентности, проявля-
емой элементом. Стрелками показаны присоединяемые
электроны, изображённые светлыми кружками; число их
равно отрицательной валентности элемента. Сумма чи-
сел, выражающих высшую положительную н отрицатель-
ную валентность, равна 8, т. е. количеству электронов,
образующих во внешнем электронном слое устойчивую
систему (см. внешний электронный слой инертных газов,
кроме гелия).
В связи с
Получили эти
как они очень
помещают отдельно внизу.
с увеличением заряда ядра у атомов каждого из этих
электрон больше, чем у атомов предыдущего элемента,
них эти электроны во внутренних электронных слоях,
Во внешнем же слое у атомов каждого из них рас-
§ 4. Атомы в химических процессах. Строение атомного
ядра. Изотопы
Образование Йонов из атомов и обратный переход Йонов в ней-
тральные атомы происходит в условиях химических реакций и не
затрагивает ядра атомов. Поэтому эти процессы не нарушают пред-
ставления об атоме как о наименьшей частице элемента, сохраняю-
щейся неизменной при химических превращениях,
306
Даже при потере атомом всех окружающих ядро электронов, что
может быть вызвано очень высокой температурой (существующей на
звёздах), атом сохраняется, так как носителем свойств данного эле-
мента является ядро с присущим ему зарядом. Под действием за-
ряда ядра происходит присоединение к нему соответствующего числа
электронов и полностью восстанавливаются все особенности нейтраль-
ного атома данного элемента.
Вопрос о 1 строении атомного ядра подробно рассматривается
в высшей школе. Здесь же об этом может быть сказано только
кратко. Согласно предположению, впервые высказанному советским
физиком Д. Д. Иваненко, впоследствии подтверждённому другими
учёными, в состав ядра входят следующие частицы: протоны с массой,
равной 1, зарядом, равным -J-1 и нейтроны — частицы с такой же
массой, но электронейтральные.
Число всех этих частиц в ядре определяет массу ядра и его заряд.
Ядро атомов водорода образовано одним протоном, поэтому
масса ядра равна 1, а заряд равен 1. Ядра всех остальных атомов
образованы несколькими протонами и несколькими нейтронами. Ней-
троны — электронейтральные частицы, поэтому они не влияют на
заряд ядра, а только на его массу. При одном и том же числе про-
тонов в ядрах может быть разное число нейтронов: в этом случае
ядра атомов име^от одинаковый заряд, но разную массу.
Как уже говорилось, заряд ядра определяет химические свойства
атомов; от заряда ядра зависит число вращающихся вокруг него
электронов и, следовательно, принадлежность атомов к определён-
ному элементу. Поэтому атомы с разным содержанием в ядре ней-
тронов, но с одинаковым числом протонов (т. е. с одинаковым
зарядом, но с разной массой — разным атомным весом) относятся
к одному и тому же элементу и должны помещаться в одном и том
же месте таблицы Менделеева; от этого они получили название
изотопы (что означает: занимающие одно и то же место).
Например, кроме водорода с атомным весом, равным 1, установ-
лено существование ещё изотопа водорода с атомным весом, рав-
ным 2 (тяжёлый изотоп водорода). В ядрах атомов каждого из изо-
топов водорода содержится по одному протону, поэтому заряд
ядер атомов обоих изотопов равен 1 и порядковый номер равен 1;
в таблице Менделеева они должны занимать одно и то же место,
но в ядрах атомов тяжёлого изотопа водорода содержится ещё
по одному нейтрону, а всего 2 частицы: один протон и один
нейтрон; поэтому атомный вес его равен 2. (Тяжёлому изотопу во-
дорода дано название дейтерий, от греческого слова, означающего
«второй"; лёгкому изотопу дано название протий, от греческого слова,
означающего „простой".)
В обычно получаемом водороде содержится изотоп с ат. в. 1 и
небольшая примесь изотопа с ат. в. 2. Поэтому определение атом-
ного веса получаемого водорода даёт число 1,008, т. е. промежу-
точное между 1 и 2. (Искусственно получен ещё третий изотоп
водорода — тритий с атомным весом, равным 3.)
20*
307
В настоящее время установлено существование изотопов почти
у всех элементов. Большинство простых веществ является смесью
изотопов соответствующего элемента. Атомные веса элементов — это
средние величины, зависящие от содержания в простых веществах
отдельных изотопов с разным атомным весом. Этим объясняется, почему
в некоторых случаях Менделееву пришлось нарушить последователь-
ность расположения элементов в таблице и расположить (например,
аргон и калий, теллур и йод) не в порядке увеличения атомного
веса. У этих элементов увеличение атомного веса не соответствует
увеличению заряда ядер из-за присутствия в заметном количестве
слишком тяжёлого изотопа (у аргона, теллура).
§ 5. Превращение элементов
Сложностью состава ядер атомов полностью объясняются радио-
активные процессы и проводимые в последнее время опыты с искус-
ственным превращением одних элементов в другие. Эти превращения
элементов происходят в результате действия на них потока быстро
летящих а-частиц (также протонов, нейтронов). Под действием этих
частиц изменяется состав ядер взятого элемента и получается другой
элемент. Внутриядерные превращения давно уже изучаются совет-
скими физиками и химиками, которые внесли ценный вклад в реше^
ние вопроса о строении атомного ядра. Так как эти явления уже
находятся за пределами химии, подробнее останавливаться на них
мы не будем; укажем только, что при радиоактивных превращениях
выделяются неизмеримо ббльшие количества энергии (внутриатомная
энергия), чем при любых химических превращениях. На явлениях
распада атомов основано, в частности, действие атомной бомбы.
Открытие явлений распада атомов представляет собой величай-
шее достижение науки нашего времени, но оно должно быть направ-
лено на благо человечества; распад атомов должен быть использован
в качестве мощного и дешёвого источника энергии в мирном строи-
тельстве, а не для разрушительных целей войны.
§ 6. Образование молекул
Атомы металлов характеризуются способностью только терять
электроны и, следовательно, проявлять только положительную ва-
лентность. Для атомов металлоидов характерна способность присо-
единять лишние электроны, причём в определённых условиях они
могут также и терять свои собственные электроны; следовательно,
они способны проявлять и отрицательную, и положительную валент-
ность.
При взаимодействии металлов с металлоидами проявляются их
противоположные свойства: способность металлов терять электроны
и способность металлоидов присоединять электроны.
Например, если в сосуд с хлором (см. рис. 32) поместить на
ложечке горящий металлический натрий, он продолжает гореть
808
в хлоре с образованием белого дыма, состоящего из частиц хлори-
стого натрия.
Наблюдаемая реакция является результатом того, что атомы хлора
присоединяют электроны, оторванные от атомов натрия, и заря-
жаются отрицательно (превращаются в отрицательно заряженные
йоны СГ):
ci + э = сг
атом электрон йон хлора
хлора (заряжен отрицательно)
Атомы натрия при этом, как теряющие свои электроны, заря-
жаются положительно (превращаются в положительно заряженные
йоны Na + ):
Na — 0 = Na +
атом йон натрия
натрия (заряжен положительно)
Образовавшиеся противоположно заряженные йоны натрия и хлора
притягиваются и образуют молекулы химического соединения — хло-
ристого натрия:
Na+ + С1“ = NaCl
йон йон молекула хлористого
натрия хлора натрия (поваренная соль)
Образование молекулы хлористого натрия представляет собой яркий
пример, когда соединяются атомы, из которых один (натрий)
сравнительно., легко отдаёт свой
электрон, а другой (хлор)
очень энергично присоединяет
электрон. В этом случае ва-
лентный электрон одного эле-
мента (натрия) совершенно те-
ряет связь с ядром атома это-
го элемента, переходит исклю-
чительно в сферу действия ядра
другого элемента (хлора) и на-
чинает вращаться вокруг него.
Это схематически показано на
рисунке 129. Оба образовав-
шихся йона совершенно само-
стоятельны. В молекулу же они
объединяются потому, что удер-
живаются друг около друга си-
лой электростатического притя-
жения; здесь происходит при-
мерно то же, что с двумя ша-
риками, заряженными разно-
имённо.
Так как такая молекула со-
стоит из разноимённо заряжен-
ных йонов, она называется
йонной.
Рис. 129. Схема образования молекулы
хлористою натрия.
£€9
Примерами йонных молекул являются соли галогеноводородных
кислот.
Иное получается строение молекулы, если ядра обоих соединяю,
щихся атомов с одинаковой силой притягивают электрон, необходи-
мый для построения устойчивого внешнего слоя. Это наблюдается,
например, при образовании молекулы из двух одинаковых атомов,
которые, конечно, проявляют совершенно одинаковые свойства.
Например, при столкновении двух атомов водорода одинаковое
притяжение ядрами электронов приводит к тому, что электроны
этих атомов начинают вращаться вокруг
обоих ядер; оба электрона становятся
общими для двух атомов (рис. 130),
превращающихся таким путём в одно,
целое — в молекулу. В такой молекуле
нет йонов и, следовательно, нет проти-
воположных участков, проявляющих про-
тивоположные заряды; такая молекула
называется неполярной.
Неполярными молекулами являются
молекулы простых газообразных веществ:
Н2, О2, N2, С12 и др., а также моле-
кулы многих сложных веществ, напри-
мер: СО2, СН4, молекулы многих орга-
нических веществ.
Связь между атомами в йонной мо-
лекуле, образующаяся вследствие пол-
ного перехода электронов к одному из
атомов, называется йонной или электро-
валентной.
в неполярной молекуле, где электроны
становятся общими для обоих атомов, называется ковалентной (что
означает: совместно валентной).
В молекулах, образованных более чем двумя атомами разных
элементов, могут иметься и йонные, и ковалентные связи.
Характер связи между атомами в молекулах объясняет весьма
важные явления, происходящие в растворах солей, оснований и
кислот, которые рассматриваются в следующей главе.
молекула водорода
На
Рис. 130. Схема образования
молекулы водорода.
Кружок со знаком плюс — ядро
атома; кружок со знаком минус —
электрон. В молекуле водорода
вокруг каждого ядра вращаются
два электрона, г. е. образовалась
устойчивая структура электрон-
ного слоя инертного газа гелия.
Связь между атомами
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что по современным представлениям находится в центральной части
атома?
2. Где сосредоточен положительный заряд атома?
3. Что является носителем отрицательного заряда?
4. Почему атомы в свободном состоянии электронейтральны (заряд
равен нулю)? '
5. Как, пользуясь таблицей Менделеева, можно узнать заряд ядра атома
любого элемента? Как узнать число электронов, вращающихся вокруг ядра?
6. Что представляет собой электрон? Какова его масса? заряд?
7. Что представляет собой протон? Чему равца его масса? заряд?
310
8. Б каком состоянии находятся электроны в атоме?
9. Что называется электронным слоем и как он изображается?
10. При каком числе электронов в наружном слое образуется устойчи-
вое их сочетание? Как это отражается на валентности элемента?
И. Что может происходить с атомом, если число электронов в наружном
слое меньше необходимого для образования устойчивой системы их? Как это
отражается на валентности элемента?
12. Какова способность к потере и присоединению электронов у метал-
лов, металлоидов я инертных газов? В связи с этим какова их валентность?
13. Какое дополнение внесло в закон Д. И. Менделеева современное
учение о строении атома? Как следует теперь формулировать периодический
закон?
14. Как изменяется валентность элементов (положительная, отрицатель-
ная) и их свойства в первом, втором и остальных периодах? В какой это
находится связи со строением атомов?
15. Как, исходя из строения атомов, объясняется отсутствие валентности
у последних элементов в периодах, т. е. у элементов нулевой группы?
16. Что такое положительная и отрицательная валентность, в каких
соединениях элементов она проявляется и как объясняется, исходя из строе-
ния атомов?
17. Что определяется порядковым номером элемента и какие свойства эле-
ментов характеризуют номер группы?
18. Как, исходя из строения атома, объясняется переменная валентность?
19. Как происходит образование йонной молекулы? Покажите это на при-
мере образования молекулы хлористого натрия?
20. Как происходит образование неполярной молекулы? Покажите это на
примере образования молекулы водорода.
21. Какая связь называется электровалентной, ковалентной?
22. Приведите примеры веществ с йонными молекулами и с неполярными
"Молекулами.
ЧАСТЬ ЧЕТВЁРТАЯ
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
§ 1. Теория электролитической диссоциации
Изучение свойств водных растворов кислот, щелочей и солей
показало, что они хорошо проводят электрический ток. Эти вещества
в отличие от веществ, не проводящих электрического тока, назы-
ваются электролитами.
Электролитами называются
вещества (твёрдые или жидкие),
проводящие электрический ток
в растворённом или расплав-
ленном состоянии, а не прово-
дящие тока — неэлектроли-
тами.
Было также установлено,
что растворы кислот, щелочей
и солей, т. е. растворы, про-
водящие электрический ток, по
сравнению с не проводящими
ток растворами одинаковой
молярной концентрации про-
являют ряд особенностей (за-
мерзают при более низкой тем-
пературе, кипят при боле^ вы-
сокой и т. д.). Эти особенности
Сванте Аррениус
(1859—1927).
Родился в Упсале (Швеция). Выска-
зал гипотезу, вошедшую в науку под
названием теории электролитической дис-
социации.
Известен также работами по электро-
проводности растворов.
(здесь подробно не рассматри-
ваемые) указывают на то, что
в растворах электролитов как
будто содержится больше
частиц растворённого веще-
ства, чем то, которое соответ-
ствует взятому весовому коли-
честву его (взятому количе-
ству молекул).
Шведский ученый Аррениус в 1887 г. дал объяснение этим явле-
ниям на основе высказанной им гипотезы. Эта гипотеза была про-
верена, укреплена и развита рядом других учёных, в том числе
русскими (Коноваловым, Каблуковым). Она вошла в науку под назва-
нием теории электролитической диссоциации.
312
§ 2. Основные положения теории электролитической
диссоциации
В растворах кислот, оснований и солей молекулы растворённых
веществ распадаются на отдельные противоположно заряженные
частицы — ионы. (Название йон в переводе с греческого означает
„ стра нству ющий “.)
Йонов, заряженных положительно и отрицательно, всегда обра-
зуется столько, что общее количество противоположных зарядов полу-
чается одинаковое; вследствие этого раствор остаётся электронейтраль-
ным. Образующиеся частицы свободно перемещаются в жидкости.
Распад молекул на Йоны получил название диссоциации (что
означает разъединение); этот процесс является обратимым процессом.
Образующиеся в результате диссоциации противоположно заряженные
Йоны сталкиваются и могут вновь соединяться в молекулы. Это
можно схематически записать так: . Знаками К+ и А“
обозначены Йоны с соответствующими зарядами. Так как диссоциация
на йоны происходит только в растворах электролитов, этот процесс
был назван электролитической диссоциацией.
Молекулы распадаются на несколько Йонов (не менее двух); поэтому
в таких растворах получается отдельных частиц (Йонов и остающихся
целыми молекул) больше, чем было взято молекул растворяемого ве-
щества. Исходя из этого, все особенности растворов, проводящих
электрический ток, т. е. растворов электролитов, получили исчерпы-
вающее объяснение.
§ 3. Электролиз
Прохождение электрического тока через раствор электролитов со-
провождается разложением растворённого вещества. Например, если
опустить угольные стержни в раствор хлорной меди (рис. 132) и про-
Рис. 131. Пропускание тока через растворы.
Водные растворы основании, кислот, солей проводят
алектрический так — лампочка горит. Водные растворы
сахара, глицерина, спирта ток не проводят — лампочка
не горит.
Рис. 132. Электролиз
.хлорной меди.
313
пустить электрический ток, то на катоде (отрицательном полюсе)
выделится медь и покроет уголь хорошо заметным слоем, а на аноде
выделится хлор, который легко обнаружить по запаху:
на катоде на аноде
СиС12 = Сп| -|- С121
Это явление получило название электролиза (что означает раз-
ложение электричеством).
§ 4. Явления электролиза в свете теории электролитической
диссоциации
Теория электролитической диссоциации полностью объясняет явле-
ние электролиза.
Электролиз — это разложение вещества под действием
электрического тока.
Электролиз происходит при пропускании электрического тока
в раствор или в расплав электролита.
Например, в растворе хлорной меди СиС12 по этой теории проис-
ходит следующее:
1) При растворении в воде молекулы хлорной меди диссоциируют
на йоны меди и хлора:
(диссоциация)
CuCl2 = Си++ +2СГ
молекула бон два Йона
хлорной меди хлора
меди
Из уравнения видно, что при диссоциации из каждо^*Ъюлекулы
получаются: один йон меди, несущий 2 положительных заряда, и два
йона хлора, несущие по 1 отрицательному заряду, а всего 2 отри-
цательных заряда. Положительных и отрицательных зарядов полу-
чается одинаковое количество, а поэтому раствор остаётся электро-
нейтральным, хотя в нём присутствуют заряженные частицы.
2) При опускании в раствор электродов, соединённых с источни-
ком электрического тока, йоны, находившиеся до этого в беспорядоч-
ном движении (рис. 133, Л), под действием электрической силы
направляются в зависимости от их заряда в сторону того или иного
полюса (рис. 133, Б).
Положительно заряженные йоны (в данном случае йоны меди)
направляются в сторону катода; поэтому их назвали катионами.
Отрицательно заряженные йоны (в данном случае йоны хлора) на-
правляются в сторону анода; поэтому их назвали анионами.
314
На катоде происходят следующие процессы: находящиеся на нём
в избытке электроны переходят к приблизившимся до соприкосно-
вения катионам; катионы присоеди-
няют недостающие электроны и пре-
вращаются в нейтральные атомы:
Си++4- 20
катион электроны,
(положительно перешедшие
заряженный с катода
йон меди)
= Си
нейтральный
атом меди
Образующиеся атомы меди оседают
на электроде в виде слоя металла.
На аноде происходят следующие
процессы: подошедшие до соприкосно-
вения с ним анионы теряют находящиеся
у них избыточные электроны, которые
переходят на анод; в результате этого
анионы тоже превращаются в нейтраль-
ные атомы:
С1~ = С1 +
анион нейтральный
(отрицательно атом хлора
заряженный
йон хлора) _
электрон,
переходящий
на анод
Рис. 133. Схема процессов,
происходящих при электро-
лизе.
Выделяющиеся атомы хлора попар-
но соединяются и образуют молекулы:
2С1 = С12. Молекулы хлора выделяются
из раствора в виде газа, легко обнару-
живаемого по запаху.
Подобно этому происходит электро-
А — электролит без пропускания элек-
трического тока; хаотическое движе-
ние Йонов. Б — электролит при про-
пускании электрического тока; на-
правленное движение Йонов: катио-
нов (-|~) в сторону катода (отрица-
тельного полюса), анионов (—) в сто-
рону анода (положительного полюса).
лиз соляной кислоты. В растворе её
содержатся йоны водорода и хлора. Йоны водорода на катоде пе-
реходят в нейтральные атомы, соединяющиеся затем в молекулы:
Н+4-е = Н, 2H = H2f;
с Йонами хлора происходят на аноде указанные выше изменения.
В результате этих процессов при электролизе соляной кислоты
происходит разложение её на водород и хлор, которые выделяются
в свободном состоянии.
Из приведённых примеров наглядно видно, что электрический ток
не является причиной образования йонов из молекул, т. е.
диссоциации. Наоборот, присутствие в растворе свободных йонов
является причиной того, что раствор проводит электрический ток.
Действие же электрического тока проявляется в том, что он: 1) за-
ставляет йоны приближаться к электродам и 2) переводит йоны
в нейтральные атомы, т. е. производит процесс электролиза — раз-
ложения вещества.
315
Электролиз применяется для получения металлов. Для этих, целей
часто электролизу подвергают не водный раствор, а вещество в рас-
плавленном состоянии. Натрий, калий и кальций, например, получают
при помощи электролиза расплавленных солей или оснований этих
металлов.
Рис. 134. Покрытие серебром медного предмета.
Электролизом пользуются также для покрытия металлических
предметов другими металлами, не изменяющимися на воздухе —
никелем, серебром, золотом (рис. 134).
§ 5. Теория электролитической диссоциации в свете
представлений о строении атомов
Учение о строении атомов и молекул внесло в теорию электро-
литической диссоциации ещё большую ясность. Стало понятным,
почему в растворе происходит процесс диссоциации молекул на йоны
п почему диссоциации подвергаются не все вещества.
Диссоциация происходит в растворах солей, оснований и кислот.
Во всех этих случаях в молекулах имеются йонные связи, подобные
связи в молекулах поваренной соли (рис. 129).
Мелекулы этих веществ состоят из положительных Йонов металла
(соли и основания) или водорода (кислоты) и отрицательных йонов,
образованных остальной частью молекулы.
Вода в 81 раз ослабляет притяжение между электрическими за-
рядами. Поэтому в водных растворах связь между йонамц^образую-
щими молекулу, становится настолько непрочной, что йоны легко
расходятся и перемещаются в общей массе жидкости в достаточной
мере независимо друг от друга (рис. 133, А). Процесс этот может
быть изображён уравнением в общем виде:
(диссоциация в растворе)
к+ • А-^К+ + А" \
катион анион катион анион
ионная молекула отдельные ионы
Стрелки, направленные в разные стороны, показывают, что процесс
может идти в обоих направлениях: столкнувшиеся йоны соединяются
в молекулы, а молекулы, в результате очень слабого притяжения
между Йонами, распадаются на отдельные йоны (диссоциируют),
316
Уже сообщалось, что имеются вещества, в молекулах которых
(рис. 130) атомы связаны общими электронами (ковалентная связь).
Связь эта наиболее прочная; поэтому такие вещества, как сахар,
глицерин, спирт и др., не диссоциируют на йоны, и растворы их
электрический ток не проводят.
§ 6. Диссоциация оснований, кислот и солей
Теория электролитической диссоциации дала новое освещение
происходящим в растворах процессам.
Реакции в растворах кислот, оснований и солей происходят между
Йонами; поэтому большое значение имеет выяснение вопроса, на какие
именно йоны диссоциируют эти вещества.
При диссоциации молекулы разделяются на положительно заря-
женные йоны — катионы и отрицательно заряженные йоны — анионы.
При изображении образующихся в растворе Йонов заряды их
обычно обозначаются: положительные — вместо знака плюс (-|-)
точкой (•), а отрицательные вместо знака минус (—) штрихом (').
При этих обозначениях приведённое выше общее уравнение диссо-
циации изображается так:
КА К + А'
молекула катион с одним
положительным
анион с одним
отрицательным
зарядом зарядом
Путём исследования продуктов, получающихся при электролизе
оснований, кислот и солей, установлено, что они диссоциируют сле-
дующим образом:
1. Диссоциация оснований. При диссоциации оснований всегда
образуются в качестве анионов гидроксильные йоны ОН' (с одним
отрицательным зарядом):
NaOH Na -J- ОН'
бон натрия бон гидроксила
КОН К' + ОН'
бон калия бон гидроксила
nh4oh nh; + он'
бон аммония бон гидроксила
Са(ОН)2 Са" + 2ОН'
бон кальция два бона
с двумя гидроксила
положительными
зарядами
При составлении уравнений диссоциации оснований следует руко-
водствоваться правилом: число положительных зарядов катиона
равно числу образовавшихся гидроксильных ионов.
Основные (щелочные) свойства в растворе вызываются Присут-
ствием только гидроксильных йонов; образующиеся вместе с ними
катионы в этом отношении значения не имеют.
317
Исходя из этого, основаниям должно быть дано следующее опре-
деление:
Основания — это вещества, диссоциирующие в водных
растворах с образованием в качестве анионов только
гидроксильных йонов (ОН').
2. Диссоциация кислот. При диссоциации кислот всегда обра-
зуются в качестве катионов йоны водорода: Н’ (с одним положи-
тельным зарядом):
НС1 Н* + С1'
йон йон
водорода хлора
HNO8 Н- + NO3
йон йон
водорода азотной
кислоты
H2SO4 ;=* 2Н‘ + SOJ
два иона йон серной
водорода кислоты с двумя
отрицательными
зарядами
н3ро4 зн’ 4- рог
три йона йон фосфорной
водорода кислоты с тремя
отрицательными
зарядами
Если в молекуле кислоты содержится несколько атомов водо-
рода, диссоциация в этом случае происходит постепенно: сначала
отделяется один йон водорода, затем второй и т. д., в соответствии
с этим сначала появляются анионы с одним зарядом, затем с двумя
и т. д.:
H2so4^±H-+Hso;T=t 2H‘4-so;"
н3ро4 н- + н2ро; 2Н’+нро; зн* + ро;*
Первый йон водорода отщепляется легче всего, второй — труд-
нее и т. д. Поэтому в растворе, например, фосфорной кислоты
содержится больше всего анионов Н2РО4, меньше анионов НРО4
и ещё меньше анионов РО4.
С этим связана способность таких кислот образовывать кислые
соли. х
При составлении уравнений диссоциации кислот следует руко-
водствоваться правилом: число отрицательных зарядов аниона
равно числу образовавшихся йонов водорода.
Кислотные свойства в растворе вызываются присутствием
только йонов водорода; образующиеся вместе с ними анионы в этом
отношении значения не имеют.
318
Исходя из этого, кислотам должно быть дано следующее опре-
деление:
J Кислоты — это вещества, диссоциирующие в водных
растворах с образованием в качестве катионов только
ионов водорода (Н").
3. Диссоциация солей. При диссоциации средних солей обра-
зуются в качестве катионов йоны металла, а в качестве анионов —
йоны соответствующих кислотных остатков (не содержащие водо-
рода):
NaCl ; Z± Na + Cl' йон натрия йон хлора
MgSO4 ; мг- + so: йон магния йон с двумя поло- серной кислоты жительными зарядами
A1(NO3)3 : АГ” 4- 3NO3 йон алюминия три Йона с тремя поло- азотной кислоты жительнымн зарядами
При диссоциации кислых солей образуются йоны металла и со-
держащие водород анионы, диссоциирующие дальше с образованием
йонов водорода:
- NaHSO4
кислый
сернокислый
натрий
Na 4- HSOi
It
H’+so;
4. Окраска йонов. Некоторые йоны отличаются окраской, кото-
рой объясняется окраска содержащих эти йоны растворов. Например,
йон меди голубого цвета, йон марганца розового цвета, йон никеля
зелёного цвета и т. д.
Сравнивая окраску разных растворов, легко решить, какой йон
вызывает ту или иную окраску. Например, раствор сернокислого
калия K2SO4 бесцветен, раствор сернокислой меди CuSO4 синего
цвета, раствор марганцевокислого калия КМпО4 фиолетового цвета.
Составляя уравнения диссоциации этих веществ и сравнивая окраску
растворов, делают вывод об окраске йон&в:
Выводы:
1) k2so4 раствор бесцветный z=* 2К‘ бесцветный йон 4- so: бесцветный йон Раствор бесцветен, так как оба йона бесцветны
2) CuSO4 раствор синий Си*' йон синего цвета SO4 бесцветный йон Раствор синего цвета; окраска его вызывается окраской йона меди Си-
3) КМпО4^± К’ раствор бесцветный фиолетовый йон - MnOi йон фиоле- тового цвета Раствор фиолетового цве- та; окраска его вызывает- ся окраской йона МпО'
319
Из сравнения окраски растворов указанных веществ видно, что
йоны калия К’ и серной кислоты SO4 бесцветны (вывод из первого
уравнения); йон меди Си" синего цвета (вывод из сравнения вто-
рого уравнения с первым); йон марганцевой кислоты МпО4 фиолето-
вого цвета (вывод из сравнения третьего уравнения с первым).
§ 7. Сильные и слабые электролиты
1. Зависимость электролитической диссоциации от условий.
Процесс диссоциации является обратимым. Молекулы распадаются на
йоны:
NaCl->Na4-Cr,
а сталкивающиеся йоны обратно соединяются в молекулы:
Na-I-Cl' —NaCl
Оба эти процесса происходят одновременно:
NaCl Na СГ
От особенностей строения Йонов зависит сила притяжения между
ними, а от неё зависит, какой из противоположных процессов берёг
перевес: диссоциация молекул на йоны или соединение Йонов в мо-
лекулы.
Если сила притяжения между Йонами проявляется слабо, перевес
будет на стороне процесса, показанного стрелкой слева направо;
в этом случае в растворе будет находиться много Йонов и мало
молекул.
Разбавление раствора водой, т. е. уменьшение концентрации
вещества, способствует диссоциации. В разбавленном растворе йоны
реже сталкиваются между собой, реже соединяются в молекулы;
поэтому в разбавленном растворе сохраняется Йонов больше, чем
в концентрированном.
Так как прохождение электрического тока зависит от коли^*ства-
Йонов, в разбавленном растворе электропроводность ббльшая, чем
в концентрированном.
Если в приборе (см. рис. 131) пропускать ток через концентриро-
ванную серную кислоту, лампочка не загорается; если в кислоту
приливать небольшими порциями воду, лампочка разгорается всё
ярче по мере прибавления воды, пока не наступит полная диссоциа-
ция электролита.
Если сравнивать электропроводность растворо? разных электро-
литов при одинаковой концентрации веществ, можно убедиться, что
способность- к диссоциации у них различна. В связи с этим электро-
литы делят на сильные и слабые.
Сильные электролиты хорошо диссоциируют; уже в доста-
точно концентрированных растворах они диссоциированы полко-
стью. К сильным электролитам относятся щёлочи; едкое кали КОН,
320
едкий натр NaOH; кислоты: соляная НС1, серная H2SO4, азотная HNO3,
фосфорная Н3РО4; соли — почти все.
Например, в 0,1 М растворах NaOH, КОН, НС1, HNO3 диссоции-
ровано около 90—95°/0 молекул.
Слабые электролиты плохо диссоциируют; полная диссоциация
их наступает только в очень разбавленных растворах. В растворах же,
с которыми обычно приходится иметь дело, содержится очень мало
ионов, а ббльшая часть вещества находится в виде молекул.
К слабым электролитам относятся щёлочи: гидрат окиси аммония
(нашатырный спирт) NH4OH; кислоты: угольная Н2СО3, сероводород-
ная H2S, уксусная СН3-СООН.
Например, в 0,1 М растворах NH4OH, СН3СООН диссоциировано
только 1,4°/0 молекул.
Особенно слабым электролитом является вода. В чистой воде
свободных Йонов (Н‘ и ОН') настолько мало, что только особыми,
очень чувствительными приборами удаётся установить ничтожную
электропроводность её.
2. Различия в течении реакций, происходящих с участием
сильных и слабых электролитов. Значение силы электролита.
Чем сильнее электролит, тем энергичнее протекают йонные реакции.
Это легко можно наблюдать на примере реакции вытеснения водо-
рода в кислоте металлом.
В растворы кислот одинаковой концентрации: соляной, серной,
уксусной бросают по приблизительно одинаковому кусочку цинка;
через некоторое время ясно бывает видно, что в растворах сильных
кислот (соляной и серной) пузырьки водорода выделяются в большем
количестве, чем -в ~растворе слабой кислоты (уксусной).
Сущность происходящей реакции заключается в следующем:
1) Кислота диссоциирует на йоны:
сильная кислота НС1^Н*4-СГ
соляная ионов много
кислота
слабая кислота СН3СООН X Н’ -f- СН3СОО'
уксусная ионов мало
кислота
2) Атомы цинка сравнительно легко теряют по 2 электрона
(цинк — двухвалентный элемент) и превращаются в йоны:
Zn —20 Zn"
атом электроны бон
Приблизившиеся к поверхности цинка йоны водорода присоединяют
электроны, оторвавшиеся от атомов цинка; йоны водорода, присо-
единив по одному электрону, превращаются в атомы, которые попарно
соединяются в молекулы и выделяются в пузырьках газа:
Н’ + 0 Н; 2Н = Н2 f
йон электрон атом молекула
водорода водорода водорода
21
В. В. Левченко
321
Q6a эти процесса могут быть выражены уравнением!
Zn 4- 2Н' = 2Н + Zn"
атом йоны атомы йон
И f 4“ ^п'*
молекула йор
вбдорода цинка
цинка водорода водорода цинка
©тот процесс происходит тем энергичнее (а следовательно, тем
больше выделяется водорода), чем больше йонов водорода под-
ходит к поверхности кусочка цинка за один и тот же промежуток
времени. Йонов же будет подходить к цинку тем большее количество,
чем больше их содержится в растворе, т. е. чем лучше диссоциирует
взятая кислота. Таким образом, слабое выделение водорода в рас-
творе уксусной-кислоты наглядно показывает, что она является слабой1
кислотой, а кислоты соляная и серная-— сильными кислотами,
Значение концентрации электролита. Пользуясь
описанной реакцией, можно также наблюдать влияние, концентрации
электролита на процесс диссоциации.
Если в концентрированную серную кислоту бросить несколько
кусочков цинка, то не наблюдается выделения водорода.
Затем приливают небольшими порциями воду и размешивают
жидкость. После разбавления, вызвавшего усиление процесса диссо*
циации, начинается выделение пузырьков газа. Наиболее энергично
идёт реакция в кислоте, разбавленной до 20-процентной концентрации)
поэтому серная кислота обычно употребляется в таком разведении.
Употребление разбавленных кислот, конечно, имеет значение
только тогда, когда реакция протекает с участием йонов. Если
в реакции участвуют молекулы (реакции окисления кислородсодер-
жащими кислотами и др.), необходимо применять концентрирован*
ную кислоту; с разбавленными кислотами такие реакции могут вовсе
не проходить.
§ 8. Химическиеиреакции между электролитами.
Йонные реакции
При взаимодействии электролитов реакции происходят между
Йонами, на которые эти электролиты диссоциируют; поэтому эти
реакции получили название ионных реакций.
Теория электролитической диссоциации углубила наше понима-
ние свойств оснований, кислот, солей и процессов, происходящих
при взаимодействиях между ними. В новом свете теперь представ-
ляются реакции обмена.
При взаимодействии растворов электролитов происходят столкно-
вения между Йонами, образующимися из взятых веществ^ При этом
могут быть случаи, когда какие-либо пары йонов соединяются в моле-
кулы, которые затем не подвергаются диссоциации. В результате
этого реакция доходит до конца, т. е. становится необратимой.
Происходит это в следующих случаях:
1. При образовании плохо растворимых веществ, выпадающих
в осадок.
322
2. При образовании летучих веществ, выделяющихся в* виде
газа.
3. При образовании плохо диссоциирующих веществ (воды и др.).
Эти случаи наблюдаются при взаимодействии оснований, кислот
и солей между собой.
Ниже рассматриваются в свете теории электролитической дис-
социации примеры этих случаев.
1. Реакции с образованием осадка. Если слить растворы
щёлочи и медной соли, например, едкого натра и сернокислой меди,
в растворе будут находиться следующие йоны:
2NaOH4-CuSO4 2Na -|-2OH' + Cu” + SO4'
Сталкиваясь между собой, они соединяются в следующих ком-
бинациях;
Na 4- ОН' NaOH 1
п •• 1 ел" -v ? прежние вещества
Си —р" SO4 CuoU41
2Na'4-SO4 Na2SO4 1
Си” + 2ОН'-Си(ОН)2 / Н0Вые веЩеСТва
Из образующихся четырёх веществ одно вещество Си (ОН)2
в воде нерастворимо; поэтому образовавшиеся молекулы его соеди-
няются в более крупные скопления и выпадают в осадок;
Си*’ + 2ОН' = Си (ОН)2
нерастворимое
В воде, выпадаю*
щее в осадок
вещество
Образование молекул Си (ОН)2 и выпадение осадка продолжается
до тех пор, пока не израсходуются все йоны Си” или ОН'.
Вследствие этого реакция является необратимой и приводит
к образованию новых веществ: нового основания — гидрата окиси
меди (в осадке) и новой соли — сернокислого натрия (в растворе).
Запись уравнения реакции в молекулярной форме:
2NaOH 4- CuSO4 = Си (OH)2-f- Na2SO4j
Ф
нерастворимое
вещество
в йонной форме;
2Na’ 4- 2ОН' 4- Си* + SO4 = Си (ОН)2 2Na* + SO4
Причиной необратимости этой реакции является образование не-
растворимого вещества.
Такие реакции могут происходить также при взаимодействии солей
с кислотами и солями. Этими реакциями пользуются для распознава-
ния определённых йонов в кислотах и солях.
21*
323
Реакция распознавания соляной кислоты и её солей, т. е. аниона СГ,
производится с помощью катиона Ag':
1. НС1 + AgNO3 = AgCl 4- HNO3
I
или:
н' + сг + Ag + NO3==AgCl 4- н + NO3
4-
2. • NaCl 4- AgNO3 = AgCl 4- Na* 4- NO3
I
или:
Na* 4- СГ 4- Ag 4- NO3 = AgCl 4- Na 4~ NO3
I
Применяя те же реакции, конечно, можно легко обнаружить
с помощью аниона СГ катион Ag".
Реакция распознавания серной кислоты и её солей, т. е. аниона SO4,
производится с помощью катиона Ва".
1. H2SO44-BaCl2 = BaSO44-2HCl
4-
или:
2Н‘ 4- SO4 4- Ва" 4- 2СГ = BaSO4 4- 2Н 4- 2СГ
2. Na2SO4 4~ ВаС12 = BaSO4 4~ 2NaCl
4.
или:
2Na’ 4- SO4 4- Ва" 4~ 2СГ = BaSO4 4- 2Na 4- 2СГ
i
Катион Ва" в свою очередь легко обнаруживается с помощью
аниона SO4 при тех же реакциях.
2. Реакция с выделением газообразного вещества. Если слить
концентрированные растворы серной кислоты и хлористого натрия,
в растворе будут находиться следующие йоны:
H2SO4 4- 2NaCl X 2Н 4- SO4 4~ 2Na + 2СГ
Сталкиваясь между собой, эти йоны соединяются в следующих
комбинациях:
+ SO4 H2SO4 1 прежние вещества
Na4-Cl'XNaCl \ л
Н’4-СГ^НС1 | ?
ом • I хт е/л ? новые вещества
2Na 4" SO4 X Na2SO4 j “
Из всех этих веществ хлористый водород — летучее вещество,
поэтому при ведении опыта с нагреванием он улетучивается:
(нагревание)
H2SO4 4- 2NaCl = Na2SO4 4- 2НС1 f
324
Вследствие этого реакция становится необратимой и приводит
к образованию новых веществ: хлористого водорода (улетучивающе-
гося) и новой соли (сернокислого натрия) — в растворе.
Запись реакции в йонной форме:
2Н’ + SO4 + 2Na' 4- 2СГ = 2Na'l + SO4 + 2НС1 f
В этом случае причиной необратимости реакции является обра-
зование летучего вещества.
3. Реакции с образованием слабо диссоциирующего вещества.
Этот случай наблюдается при взаимодействии оснований и кислот.
Кислоты диссоциируют с образованием Йонов водорода Н’, а основа-
ния— с образованием Йонов гидроксила ОН'.
При столкновениях эти йоны соединяются в очень плохо диссо-
циирующие молекулы воды:
Н‘4-ОН' = Н2О;
процесс продолжается, пока не израсходуются все йоны Н* или ОН'.
В этом состоит сущность реакции нейтрализации, приводящей
к исчезновению в растворе кислотных и основных свойств.
Уравнение реакции нейтрализации в обычном и йонном виде;
1. HCl + NaON = N2O4-NaCl
2. H’ + Cl' + Na+OH'==H,O + Na4-Cl'
очень плохо
диссоциирующие
молекулы воды
Запись уравнения реакции в йонном виде показывает сущность
происходящего процесса: противоположно заряженные йоны водо-
рода и гидроксила соединяются в плохо диссоциирующие молекулы
воды; остающиеся в растворе йоны натрия и хлора образуют соль,
получающуюся при выпаривании раствора в виде твёрдого остатка;
(выпаривание раствора)
Na + Cl' = NaCl
твёрдая
соль
В приведённой реакции причиной необратимости её является об-
разование плохо диссоциирующего вещества (воды).
Бывают случаи, когда при реакции образуются слабо диссоции-
рующие вещества, кроме того, очень легко распадающиеся на летучие
продукты. Например, при действии кислоты на углекислую соль
происходит реакция:
H2SO4 + Na2CO3 = Н2СО3 + Na,SO4
Из образующихся продуктов реакции угольная кислота — слабо
диссоциирующее и нестойкое вещество; она, по мере образования,
распадается на воду и углекислый газ:
2Н 4- СОз = Н2СО3 = Н2О 4- CO2f
325
Запись реакции в йонной форме:
2Н‘ + SO; + 2Na 4- СО3' = Н2СО3 + 2Na’ SOj
H2o CO2f
Такое же явление происходит при действии щёлочи на соль ам-
мония:
NH4C14- NaOH = NH4OH 4- NaCl
H2O NH3f
NH*4 + Cl' + Na + OH' = NH4OH + Na + Cl'
H^O NH3f
4. Обратимые реакции. Если при взаимодействии электролитов
не наблюдается одного из рассмотренных выше трёх случаев, реакция
является обратимой.
Например, при сливании растворов гидрата окиси натрия и хло-
ристого калия в растворе будут находиться четыре йона:
NaOH 4- КС1 X Na + ОН' + К + С1'
Эти йоны могут сталкиваться и соединяться в молекулы в сле-
дующих комбинациях:
Na’ + OH'^NaOH )
1 v прежние вещества
Na' 4- Cl' X NaCl ]
к-+ОН'-КОН Iновые вещества
х Во всех этих случаях образуются молекулы веществ, которые хо-
рошо растворимы в воде и хорошо диссоциируют. Поэтому все ве-
щества остаются в растворе и обратно диссоциируют на те же йоны;
реакция является обратимой:
NaOH 4- КС1 4: NaCl 4~ КОН
К’4-С1'ХКС1
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Как называются вещества, в растворённом или расплавленном
состоянии проводящие электрический ток? не проводящие электрический
ток?
2. Чем объясняется способность растворов проводит^ электриче-
ский ток? >
3. Что понимают под названием „электролитическая диссоциация"? По-
чему дано такое название? I
4. Растворы каких веществ являются электролитами? неэлектролитами?
5. Какие молекулы называются йонными? Как называется связь, соеди-
няющая атомы в таких молекулах?
6. Какие молекулы называются неполярными? Как называется связь, соеди-
няющая атомы в таких молекулах?
326
7. Какие молекулы способны диссоциировать в водных растворах на йоны
и почему?
8. Что называется электролизом?
9. Покажите на примере хлорной меди, что происходит с Йонами при
пропускании электрического тока. Во. что они превращаются? Почему?
10. Какое практическое применение находит электролиз?
11. Почему раствор, содержащий йоны, остаётся электронейтральным?
12. На какие йоны диссоциируют щёлочи, кислоты, соли?
13. Какие йоны характерны для кислот, щелочей?
14. Какие электролиты называются сильными? слабыми? В чём заклю-
чается различие между ними? Приведите примеры тех и других.
15. Чем отличается сильный электролит от слабого электролита при оди-
наковой концентрации раствора?
16. Как влияет разбавление на процесс диссоциации? Почему?
17. В растворе какой кислоты одинаковой концентрации, уксусной или
соляной, реакция взаимодействия с цинком происходит энергичнее? Почему?
18. Какие реакции называются йонными?
19. В каких условиях йонные реакции являются необратимыми?
20. Приведите в молекулярном и йонном виде уравнение реакции получе-
ния гидрата окиси тяжёлого металла. Чем вызывается в этом случае необра-
тимость реакции?
21. Приведите в молекулярном и йонном виде уравнение реакции полу-
чения летучей кислоты из её соли. Чем вызывается в этом случае необрати-
мость реакции?
22. Приведите в молекулярном и йонном виде уравнения реакций обнару-
жения йонов соляной и Серной кислот. Чем вызывается в этом случае необра-
тимость реакций?
23. Приведите в молекулярном и йонном виде уравнение реакций нейтра-
лизации. Чем вызывается в этом случае необратимость реакций?
24. Укажите, в каких из приведённых ниже случаев следует пользоваться
разбавленными и в каких случаях концентрированными кислотами и почему.
а) Получение водорода из серной кислоты взаимодействием её с цинком.
б) Получение сернистого газа взаимодействием серной кислоты с медью.
В каком из указанных случаев реакция происходит между Йонами и в ка-
ком случае — между молекулами?
ЧАСТЬ ПЯТАЯ
МЕТАЛЛЫ
ГЛАВА I
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
§ 1. Положение металлов в периодической системе элементов.
Строение атомов
В периодической системе элементов металлы располагаются, главным
образом, в начале каждого периода и полупериода (рис. 114). Они
расположены в 1 и II группах, в III группе ниже бора, в IV группе
ниже кремния, в V группе ниже мышьяка и во всей побочной под-
группе, в VI группе ниже теллура и во всей побочной подгруппе,
в побочной подгруппе VII группы и во всей VIII группе.
Строение атомов металлов первых трёх периодов показано на
рисунке 125. Для металлов характерно меньшее, чем у металлоидов,
количество внешних электронов. Атомы типичных металлов не спо-
собны присоединять электроны.
Для всех металлов характерна способность их атомов сравни-
тельно легко отщеплять электроны и переходить в положительно
заряженные йоны (катионы). Эта особенность металлов проявляется
че только в химических, но и в их физических свойствах.
§ 2. Физические свойства металлов
1. Электропроводность и теплопроводность. В куске всякого
металла имеется некоторое количество оторвавшихся от атомов сво-
бодных электронов. Эти свободные электроны перемещаются * под
влиянием уже небольшой разности потенциалов; благодаря этому для
металлов характерна хорошая электропроводность.
Подвижностью свободных электронов в кусках металлов объяс-
няется также хорошая теплопроводность их.
Таким образом, электропроводность и теплопроводное™ зависят
от одной и той же причины (перемещения свободных электронов).
2. Ковкость и другие свойства. По ковкости, т. е. способности
сплющиваться, прокатываться и т. п., металлы располагаются в сле-
дующий ряд (в порядке увеличения этой способности):
железо, цинк, свинец, олово, медь, алюминий, серебро, золото.
Способность металлов сплющиваться и растягиваться позволяет
приготовлять из них проволоку. Например, из железного бруска
328
толщиной 80—100 зги получают путём прокатывания проволоку
толщиной 4 мм и тоньше. Медь можно вытягивать в ещё более тонкую
проволоку — толщиной в сотые доли миллиметра, а из вольфрама
получают проволоку для волоска электрических лампочек толщи-
ной 0,015 мм. Для позолоты приготовляют из золота листочки тол-
щиной 0,003 мм.
Путём прокатывания из толстых кусков металла (болванок) полу-
чают рельсы, балки и тому подобные изделия. Например, из желез-
ной болванки в I’/a — 2 т получают рельсу до 80 м длиной.
Способность металлов сплющиваться и тянуться в проволоку уве-
личивается с повышением температуры, поэтому описанная выше об-
работка металлов проводится в нагретом состоянии.
Только небольшое число металлов отличается значительной хруп-
костью: при ударе эти металлы распадаются на куски. Сюда относятся
сурьма, висмут, марганец и некоторые другие.
Для металлов Характерен „металлический" блеск и непрозрачность.
По окраске же они отличаются разнообразием. В производстве
условно делят металлы на чёрные — железо и его сплавы — и цвет-
ные— все прочие металлы.
Выше было показано, что по характерным для металлов свой-
ствам — электропроводности, теплопроводности, ковкости — они зна-
чительно различаются между собой.
Ещё более велико различие между металлами по многим другим
весьма важным физическим свойствам: удельному весу, твёрдости,
температуре плавления и пр.
329
3. Удельный вес. Удельные веса важнейших металлов даны на
диаграмме (рис. 135). Из неё видно, что имеются металлы с большим,
чем у воды, удельным весом и с меньшим (натрий, калий).
330
По удельному весу все металлы условно делят на лёгкие (уд. вес
менее 5) и тяжёлые (уд. вес больше 5). Самый тяжёлый металл
осмий; удельный вес его 22,5.
4. Температура плавления. Очень значительное различие наблю-
дается в температуре плавления металлов (рис. 136). Ртуть плавится
при температуре — 3§° и при обычных условиях находится в жидком
состоянии. Все прочие металлы в обычных условиях — твёрдые тела;
многие из них плавятся при температурах выше 1000°. Самый туго-
плавкий металл — вольфрам, из которого приготовляют нити для
электрических лампочек. Температура плавления его 3370°.
5. Твёрдость. По твёрдости металлы располагаются в ряд, при-
ведённый на рисунке 137. Из металлов, находящихся в чистом виде
и имеющих практическое применение, самыми мягкими являются свинец
(царапается ногтем), затем олово. Наиболее твёрдый металл — хром.
§ 3. Химические свойства металлов
По химическим свойствам металлы отличаются от металлоидов
тем, что атомы металлоидов могут терять и присоединять электроны,
а атомы типичных металлов могут только терять электроны. Атомы
металлов теряют (валентные) электроны и переходят в положительно
заряженные йоны в большинстве случаев достаточно легко. Про-
цесс, приводящий к потере атомом электронов, называется окисле-
нием, а вещества, вызывающие этот процесс, называются окисли-
телями. 4
Металлоиды, присоединяя электроны, играют роль окислителей и
тем более энергичных, чем энергичнее атомы их срывают электроны
с атомов реагирующего с ними элемента. Наиболее энергичными
окислителями являются кислород и галогены, поэтому металлы с ними
в большинстве случаев легко соединяются при непосредственном
взаимодействии:
4Na + О2 = 2Na2O
2Na 4- Cl2 = 2NaCl
Ббльшая или меньшая лёгкость отрыва электронов от атомов
определяет степень химической активности металла. Выше уже
приводился ряд активности металлов (стр. 47), пользуясь кото-
рым легко сравнивать металлы по их способности отдавать элек-
троны.
От химической активности металла, т. е. от лёгкости отрыва
электронов от атомов, зависит способность его соединяться с кисло-
родом при непосредственном взаимодействии с ним. Наиболее хими-
чески активные металлы — калий, натрий — соединяются с кислородом
при действии на них воздуха в обычных условиях. Значительно менее
химически активные металлы — медь, ртуть — соединяются с кисло-
родом только при нагревании на воздухе. Серебро, золото, платина
не соединяются с кислородом и в накалённом состоянии.
331
Атомы металлов, расположенных в ряду активности левее, легче
теряют валентные электроны, чем атомы металлов, расположенных
в ряду правее; Это проявляется в способности металлов вытеснять из
химических соединений другой металл, расположенный в ряду актив-
ности правее его; например:
ю
1. Zn^-Pb(NO3)2 = Pb + Zn (NO3)2
УравнеЗ^е реакции в йонном виде:
Zn' 4- Pb" + 2NO' = Pb 4- Zn” 4- 2no;
2e
I 4
2. Fe 4~ CuSO4 = Cu 4~ FeSO4
Уравнение реакции в йонном виде:
Fe 4-Си" 4-SO^ = Си 4-Fe” 4-SO’
Металлы, стоящие левее водорода, способны вытеснять его из
кислот и воды. Наиболее активные металлы, как калий, натрий,
вытесняют водород из воды при обычных условиях. Менее активные
металлы, стоящие левее водорода, вытесняют водород из воды только
при высокой температуре, а при обычных условиях вытесняют его
из кислот.
Металлы, расположенные в ряду активности правее водорода, не
вытесняют его, так как атомы их труднее, чем атомы водорода,
теряют электроны. Поэтому, например, с медью реагируют только
кислородсодержащие кислоты достаточно концентрированные и только
при нагревании; они производят окисление металла, а затем реагируют
с образовавшимся окислом; водород при этих реакциях не выделяется,,
а получается вода:
1 -я стадия: Си 4~ H2SO4 = СиО 4~ H2SO3
н2о so2
2-я стадия: СиО 4~ H2SO4 = CuSO4 4~ Н2О
Уравнение реакции в суммированном виде; t
Си 4- 2H2SO4 = CuSO4 4- 2Н2О 4- SO2 f
С бескислородными кислотами, например с соляной, эти металлы
вовсе не реагируют.
Процесс присоединения электронов к атому называется восста-
новлением, а вещества, вызывающие этот процесс, называются вос-
становителями.
332
Благодаря способности отдавать электроны металлы в химических
процессах играют роль восстановителей. Они являются восстанови-
телями в реакциях вытеснения водорода и менее активного металла
из его соли (см. вышеприведённые реакции).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Чем объясняется электропроводность и теплопроводность металлов?
2. Как различаются металлы по удельному весу? Какие металлы называются
лёгкими и какие — тяжёлыми? ,
3. Какие физические свойства металлов имеют особое значение в техни-
ческом отношении?
4. В чём существенное различие в способности атомов переходить в со-
стояние йонов у металлов и металлоидов?
. 5. Каков знак заряда йонов, образующихся из атомов металла?
6. Чем характеризуются металлы, расположенные в начале и в конце ряда
активности металлов?
7. Какие металлы способны вытеснять водород из кислот? не способны
вытеснять его?
8. Какие металлы легко соединяются с кислородом непосредственно при
взаимодействии с ним?
9. Какие металлы непосредственно с кислородом не соединяются?
10. Какие металлы реагируют с разбавленными кислотами? Какие получа-
ются продукты реакции?
11. При каких условиях медь реагирует с кислотами и какими кислотами?
12. Какие продукты получаются при взаимодействии меди с концентриро-
ванной серной кислотой? Почему не выделяется водород?
§ 4. Сплавы
В технике применяются металлы, главным образом, не в чистом
виде, а в виде сплавов, т. е. продуктов, получаемых сплавлением
нескольких твёрдых веществ. Сплавы имеют громадное народнохозяй-
ственное значение. Они могут быть получены с разными физически-
ми и химическими свойствами.
Свойства сплавов могут значительно отличаться от свойств чистых
металлов, входящих в их состав. В частности, очень резко может
изменяться температура плавления. Как правило, примеси понижают
температуру плавления твёрдых тел; поэтому сплавы плавятся при
более низкой температуре, чем чистые металлы. Например, если
к олову добавлять свинец, получаются сплаву, плавящиеся значи-
тельно легче олова. Часто можно подобрать такое соотношение ме-
таллов в сплаве, что температура плавления его будет ниже темпе-
ратуры плавления всех введённых в сплав чистых металлов.
Указанную способность сплавов можно наблюдать на примере
„третника"—сплава олова со свинцом, употребляемого для паяния
при жестяных работах.
Температура плавления свинца 328°, а олова 232°, сплав же из
1 части свинца и 2 частей олова — „третник"—плавится при 181°,
т. е. при значительно более низкой температуре, чем чистые олово
и свинец.
333
Академик Н. С. К у р и а к о в является творцом нового отдела об-
щей химии — физико-химического анализа. Работы Н. С. Курнакова дали
в руки химиков-теоретиков и инженеров-практиков новый метод исследования
веществ.
Его работы по металлическим сплавам внесли много нового в уче-
ние о сплавах. Теоретическое и практическое значение его исследований
очень велико; они широко исполь-
вуются в нашей металлургической
промышленности.
Н. С. Курнаков был также круп-
нейшим исследователем в области
соляного дела. Его работы открыли
путь к познанию процессов происхо-
ждения соляных месторождений в
природе. На основании его работ
были обнаружены богатейшие место-
рождения калиевых солей в Соли-
камске, обеспечивающие потребность
-в калийных удобрениях нашего сель-
ского хозяйства.
Н. С. Курнаков был выдающимся
деятелем-новатором отечественной на-
уки и промышленности.
В некоторых употребляемых
в технике металлических сплавах
содержатся не только несколько
разных металлов, но и некоторые
Николай Семёнович Курнаков
(1860—1941).
металлоиды (углерод, кремний
и др.).
Примесь в металле посторон-
них веществ даже в небольшом
количестве может резко изменять его существенные свойства. Примесь
может затруднять перемещение свободных электронов и вследствие
этого понижать электропроводность и теплопроводность металла, что
обычно и наблюдается. Примесь может также затруднять перемеще-
ние атомов и катионов при механическом воздействии на металл и
благодаря этому увеличивать его твёрдость.
В приводимой таблице указана твёрдость некоторых металлов и
их сплавов (твёрдость выражена в условных единицах).
Твёрдость некоторых
Свинец ...................... 4
Олово........................ 5
Баббит (сплав свинца с оло-
вом и некоторыми другими
металлами)...............15—25
Цинк....................... 30
Медь...................... 35
Латунь (сплав меди с цин-
ком) .....................90—120
металлов и сплавов
Бронза (сплав меди с оловом) 100—150
Железо . . . . '........50—80
Чугун (сплав железа с угле-
родом) ................ 230—410
Закалённая инструменталь-
ная сталь (сплав железа
с углеродом, хромом и др.) 450—700
Из таблицы видно, что сплавы удаётся получать с твёрдостью
большей, чем твёрдость каждого из составляющих сплав веществ.
Так же резко могут улучшаться в сплавах и другие практически
334
ценные свойства (физические, химические), на что подробнее б^дет
указано при рассмотрении отдельных металлов.
В области изучения сплавов чрезвычайно большое научное и
практическое значение имеют работы академика Н. С. Курнакова
и его учеников. Исследования Курнакова обеспечили возможность
получения на советских заводах высококачественных сталей, пре-
вышак)щих заграничные сорта. Работы Курнакова приобрели мировую
известность.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Почему чаще всего применяются не чистые металлы, а сплавы? _
2. Какие технически ценные свойства могут приобретать сплавы?
3. Чем отличается температура плавления сплава от температуры пла-
вления составляющих сплав чистых металлов? Какое это имеет практическое
значение?
4. Какова твёрдость сплавов по сравнению с твёрдостью входящих в их
состав чистых металлов?
5. Сравните твёрдость латуни, бронзы, чугуна, стали с твёрдостью входя-
щих в их состав чистых металлов. Какое это имеет значение?
§ 5. Коррозия металлов и борьба с ней
Большинство металлов под действием воздуха и воды подвер-
гается коррозии (т. е. разъедании?). Металлические изделия, особенно
из железа, приходят в негодность, и это причиняет громадный ущерб
народному хозяйству. Было приложено много усилий для выяснения
причин коррозии и способов предупреждения её.
Явление коррозии заключается в потере атомами металла электро-
нов и переходе атомов в йоны; в результате этого металл переходит
из свободного состояния в химически связанное. Например, при дей-
ствии влажного воздуха на железо электроны переходят от атомов
железа к Йонам водорода, всегда находящимся (хотя и в очень малом
количестве) в воде:
' 2е
Fe + 2Н* + 2ОН' = Н2 f 4- Fe(OH)2
4----------v---' гидрат закиси
2На0 железа
Под действием кислорода воздуха происходит дальнейшая потеря
железом электронов — окисление закисного железа в окисное. В ре-
зультате этих процессов образуется ржавчина, близкая по составу
к гидрату окиси железа Fe(OH)3.
Явление коррозии очень сложно, и многое в нём еще не вполне
выяснено. Однако достигнутые в настоящее время благодаря трудам
советских учёных успехи в этой области приносят ежегодно тысячи
тонн экономии железа и других металлов.
Большое значение для сохранения металлических изделий имеет
характер образующегося на металле налёта ржавчины. На железе
ржавчина образует непрочный рыхлый слой; поэтому процесс порчи
железа распространяется на всю толщу металла и может совершенно
разрушить железный предмет. Алюминий, цинк и олово изменяются
335
только в очень тонком поверхностном слое; в глубину изменение не
распространяется, так как эти металлы покрываются тонкой, но плот-
ной защитной плёнкой окислов. В связи с этим, цинком и оловом
обы’Щ^ пользуются для защиты железа от коррозии: железо покры-
вают слоем цинка (оцинкованное железо) или слоем олова (белая
жесть). Большую устойчивость против коррозии проявляет также
никель; поэтому железные предметы покрывают никелем (никелируют).
Предохрайять от коррозии надо и медь, потому что она покры-
вается во влажном воздухе зелёным налётом. Этот налёт представ-
ляет собой основную углекислую медь СиСО3 • Си(ОН)2, отличающуюся
значительной ядовитостью. Поэтому употребляемую для варки пищи
различную медную посуду (кастрюли, самовары и пр.) лудят, т. е.
покрывают с внутренней стороны слоем олова (полудой).
Для защиты металлических изделий от воздействия воздуха и
влаги их часто покрывают также масляной краской (окраска частей
машин, железных крыш и пр.). Кроме того, применяют ещё разные
специальные Способы обработки поверхностного слоя металла. Тща-
тельная полировка металлического изделия является важным средством
предупреждения коррозии, так как гладкая поверхность значительно
труднее поддаётся действию воздуха и воды, чем шероховатая.
Металлы, атомы которых легче теряют электроны, т. е. химически
более активные металлы (расположенные левее в ряду активности,
см. стр. 47), легче подвергаются коррозии. Поэтому такие металлы,
как натрий, калий, кальций, в чистом виде вовсе непригодны для из-
готовления каких-либо изделий и могут применяться только в Качестве
добавок к сплавам.
Большое влияние на подверженность металла коррозии оказывают
примеси. Химически чистое железо (в компактном куске) вполне устой-
чиво к воздействию влажного воздуха; способность же обычного
железа легко ржаветь объясняется влиянием содержащихся в нём
примесей. Однако в последнее время удалось получить сплавы же-
леза, вовсе не подвергающиеся коррозии. Таким сплавом является
нержавеющая сталь, широко используемая в технике. Получение её
является большим достижением советских металлургов.
Для уменьшения растворимости металлов в кислотах (кислотная
коррозия) советские учёные синтезировали ряд веществ, тормозящих
(замедляющих) этот процесс в сотни раз. Эти вещества делают неко-
торые металлы и их сплавы практически нерастворимыми в кислотах.
В народном хозяйстве эти вещества, так называемые „ингибиторы"
(присадки), находят широкое применение.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что называется коррозией металлов?
2. При каких условиях происходит коррозия?
3. Какая наблюдается связь между положением металла в ряду активности
и подверженностью его коррозии?
4. Какие металлы устойчивы против коррозии?
5. Какие применяются способы предохранения металлов от коррозии и на
чём основано их действие?
336
§ 6. Металлы в природе. Руды
Металлы, непосредственно не соединяющиеся с кислородом, как
платина, золото, серебро, встречаются в природе в свободном со-
стоянии (самородные металлы), В свободном состоянии, хотя и
редко, встречается также медь, но при доступе воздуха и воды
к отложениям свободной меди она переходит в химические соедине-
ния. Все прочие металлы, а медь большей частью, находятся в при-
роде в виде соединений с другими
элементами. Химические соединения
металлов, встречающиеся в природе,
называются руд’ами, если в них ме-
талл содержится в таком количестве,
что добывание его экономически
выгодно.
А. Е. Ферсман — основатель но-
вой науки — геохимии. Он разработал
новые физико-химические- представле-
ния о сущности процессов минерало-
образования, имеющие большое научное
и практическое значение. Отечествен-
ная промышленность редких металлов
и других ископаемых создавалась при
его активном участии. Он написал много
трудов по минералогии.
А. Е. Ферсман лично участвовал во
многих экспедициях, был председателем
экспедиционных исследований, председа-
телем совета по изучению производи-
тельных сил Советского Союза, вёл
разнообразную научную и общественную
работу.
Александр Евгеньевич Ферсман
(1883—1945).
Он широко и неустанно пропагандировал научные знания среди широких
кругов населения и молодёжи. Научно-популярные книги его — „Самоцветы
России11, „Занимательная геохимия", „Воспоминания о камне" — пользуются
большой популярностью у молодёжи.
Изучением распространения элементов в земной коре занимается
особая наука — геохимия. Работы советских учёных —И. А. Кар-
пинского, В. И. Вернадского, А. Е. Ферсмана и др.—
в области геохимии являются ведущими в мировой науке. Благодаря
их исследованиям разведаны недра нашей родины. Найдены богатей-
шие запасы ценных ископаемых, обеспечивающие быстрое развитие
различных отраслей социалистического хозяйства и обороноспособ-
ность нашей родины.
Руды являются материалом для получения металлов (в чистом
виде добываются из земной коры только платина и золото).
Находящиеся в земной коре руды обычно не бывают чистыми,
а содержат ббльшие или меньшие количества примесей различных
минералов. Эти примеси называются „пустой“ породой.
При использовании руды для получения металла необходимо воз-
можно полнее удалить из неё пустую породу. Такое очищение руды,
пл
** В. В. Левченко
337
т. е. освобождение её от лишних примесей, называется обогащением
руды; так как пустая порода во многих случаях имеет меньший
удельный вес, чем руда, то обогащение руды можно производить при
помощи воды. Руду измельчают и пускают на неё поток воды: лёгкая
порода выносится, а тяжёлая руда остаётся.
§ 7. Общие способы получения металлов
* Выделение металла в чистом виде из его соединений происхо-’
дит в «результате присоединения к Йонам металла недостающих элек-
тронов:
АГ4-3(Э->.А1
металл в металл в
соединениях свободном «•
состоянии \
Процесс присоединения электронов называется восстановлением,
а процесс отдачи электронов называется окислением.
При выделении металлов из соединений происходит восстановле-
ние их. Вещество же, отдающее электроны, окисляется. Оба про-
цесса — восстановление и окисление — связаны между собой и проте-
кают одновременно.
Если металл химически мало активный, т. е. трудно отдаёт
электроны, то его йон легко присоединяет электроны, легко вос-
станавливается. Иногда для этого бывает достаточно одного на-
гревания.
1. Восстановление металла при нагревании его соединения.
Для восстановления ртути из окиси ртути достаточно, например,
одного нагревания:
(нагревание) ‘
HgO = Hg-[-O; 2О = О2
Таким же способом получают ртуть в технике из её руды —
киновари, представляющей собой сернистое соединение;
2© j© (нагревание)
4 \/_£
HgS + O2 = Hg + SOs
Для восстановления более активных металлов недостаточно одного
нагревания их соединений, а необходим ещё дополнительный источ-
ник электронов. Источниками электронов могут служить элементы,
отдающие электроны легче, чем металл: благодаря этому они восста-
навливают металл, переводят его в свободное состояние.
2. Восстановление металла действием угля при нагревании.
Хорошим восстановителем металлов может служить уголь, так как
атомы углерода довольно легко отдают свои электроны. В технике
уголь широко применяется для выплавки железа и цветных метал-
338
лов. При получении металлов из сернистых руд, например цинковой
руды ZnS (цинковая обманка), руду сначала обжигают:
12е
I ____1 (нагревание)
2ZnS-]~ ЗО2 = 2ZnO 4- 2SO2
Полученную окись цинка нагревают а углем в особых печах:
2е
I | (нагревание) '
ZnO4-G=Zn-j-CO
3. Восстановление металла действием окиси углерода. При
выплавке железа в доменной печи восстановителем является непо-
средственно не углерод, а окись углерода:
бе
; ZJ
Fe2O3 + ЗСО = 2Fe 4-ЗСО2
Железо в этой реакции восстанавливается (присоединяет электро-
ны), а углерод окисляется (отдаёт электроны).
4. Восстановление металла действием водорода. Очень энер-
гичным восстановителем является водород. Им пользуются, например,
для получения чистого порошкообразного железа („железо, восста-
новленное водородом"). Водород пропускают над нагретым порош-
ком гидрата окиси железа:
бе
| |_(нагревание)
2Fe (ОН)3 4- ЗН2 = 2Fe -j- 6Н2О
При этой реакции железо восстанавливается и выделяется в сво-
бодном состоянии, а водород окисляется и входит в состав молекул
воды.
5. Восстановление металла действием более активного металла.
Примером этого способа получения металла может служить процесс,
основанный на реакции вытеснения алюминием менее активных метал-
лов из их окислов. Этой реакцией пользуются не только для сварки
железных изделий, но и для получения тугоплавких металлов, (хрома,
марганца и др.):
12е
I I (поджигание)
4А14- ЗМпО2 = 2А12О3 4- ЗМп
В этих реакциях алюминий, как химически более активный металл,
отдаёт электроны (окисляется), а менее активный металл (хром) при-
соединяет недостающие электроны (восстанавливается).
6. Восстановление металла путём электролиза его соединений.
Наиболее активные металлы легче всего удаётся восстановить путём
электролиза. Электролизом получают натрий, калий, алюминий
11 др.
22* ' 339
При электролизе металл восстанавливается за счёт электронов
переходящих с катода, на котором имеется избыток их:
(на катоде)
АГ-р-ЗЭ-А!
Электролиз применяется для получения в чистом виде также не-
которых металлов с малой химической активностью, так как другие
способы Восстановления их дают продукт более или менее загряз-
нённый примесями; путём элетролиза получают чистую меЯь, се-
ребро и др.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Что называется рудой?
2. Какие реакции происходят при получении металла из его 'соединения?
3. Приведите пример выделения металла из его соединения при дей-
ствии только нагревания.
4. Приведите пример выделения металла из руды путём нагревания
руды с углем.
5. Приведите пример выделения металла из руды действием окиси
углерода.
6. Приведите пример восстановления металла водородом.
7. Приведите пример восстановления металла действием более активного
металла.
8. Приведите пример получения металла посредством электролиза.
ГЛАВА II
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Щелочными металлами называются элементы главной подгруппы
I группы таблицы Д. И. Менделеева. К ним относятся литий Li, нат-
рий Na, калий К, рубидий Rb, цезий Cs. Самое нижнее место в этой
подгруппе, относящееся к 10-му ряду, до последнего времени
оставалось незанятым; соответствующий элемент (под № 87) франций
был получен только недавно.
Общее название „щелочные металлы" дано этим элементам в связи
с тем, что окислы их при взаимодействии с водой образуют сильные
щёлочи. Из щелочных металлов здесь будут рассматриваться только
натрий и калий, как имеющие наибольшее практическое значение.
§ 1. Натрий и калий
Химический знак натрия: Na (читается: натрий).
Атомный вес равен 23.
Химический знак калия: К (читается: калий).
Атомный вес равен 39.
Натрий и калий в свободном состоянии были впервые получены
в начале XIX в. посредством электролиза их соединений в расплавлен-
340
ном состоянии. Название „натрий“ происходит от названия вещества,
получавшегося в древности из золы и применявшегося .;при стирке
(„натрон").
Название „калий" происходит от древнего названия золы мор-
ского растения („алкали").
1. Положение натрия и калия в периодической системе эле-
ментов и строение атомов натрия и калия. Натрий в периоди-
ческой системе элементов занимает 11-е место (порядковый номер
равен И). Это указывает, что заряд ядра атома натрия равен И
положительным единицам электричества (-|-П) и что вокруг ядра
вращается 11 электронов. Суммарный заряд всех этих электронов
равен 11 .отрицательным единицам электричества (— И), т. е. по
величине равен заряду ядра, но противоположен по знаку; вслед-
ствие этого атом является электрически нейтральным. Схема строе-
ния атома натрия приведена на рисунке 124. Вращающиеся вокруг
ядра электроны располагаются по электронным слоям: в 1-м слое
2 электрона; во 2-м слое 8 электронов; в 3-м слое 1 электрон. Бо-
лее кратко порядок распределения их по электронным слоям может
быть выражен так: 2; 8; 1.
Калий в периодической системе элементов занимает 19-е место
(порядковый номер 19). Заряд ядра атома калия равен 19. Во-
круг ядра вращается 19 электронов’. Как видно из схемы строения
атома калия (см. рис. 125), электроны распределены по электронным
слоям следующим образом: 2; 8; 8; 1.
В атомах натрия и калия во внешнем электронном слое имеется
только один электрон. При химических взаимодействиях этот един-
ственный внешний электрон легко отрывается, и атом переходит
в положительно заряженный йон:
Na - ©
атом электрон
натрия
Na'
йон натрия с одним
положительным
зарядом
К'
к
атом
калия
электрон
йон калия с одним
положительным
зарядом
Число положительных зарядов образующегося Йона равно числу
оторвавшихся от атомов электронов; в данном случае и для натрия,
и для калия оно равно 1. Это означает, что натрий и калий в своих
соединениях проявляют положительную валентность, равную -|-1.
Атомы натрия и калия не присоединяют электроны и не прояв-
ляют отрицательной валентности.
2. Физические свойства натрия и калия. Натрий и калий
являются самыми мягкими из всех металлов (см. рис. 137). Они настолько
мягки, что легко режутся ножом.
341
Для того чтобы наблюдать чистую поверхность натрия и калия,
следует продавить небольшой слой металла в стеклянную трубку *).
Через стенку трубки (рис. 138, Л) хорошо видна блестящая серебри-
сто-белая поверхность металла.
Натрий и калий отличаются малым удельным весом (см. рис. 135).
Они легче воды и плавают на
мически взаимодействуют с ней).
поверхности её (в то же время хи-
Блестящая
поверхность
Б натрия
А
Блестящая
поверхности
натрия
Слой ОКИСЛОВ1
Рис. 138. Трубка с натрием (калием) внутри.
А — недавно изготовленная трубка; Б — трубка, пролежавшая несколько дней.
гНалбт углекис-» Слой'онислое
лого натрия КаИли раствора»
едкого'натра
Натрий
Вода
Рис. 139. Взаимодействие
натрия^ водой.
Стакан прикрыт воронкой для
задержки возможных брызг.
Отличаются эти металлы низкой температурой плавления — ниже
100° (рис. 136). Поэтому при взаимодействии с водой они обычно
плавятся от выделяющегося при реакции тепла и принимают шаро-
образную форму капли (рис. 139).
3. Химические свойства натрия и
калия. Имеющийся на внешнем электрон-
ном слое единственный электрон отры-
вается особенно легко, поэтому натрий и
калий отличаются способностью энергич-
но вступать в химические соединения;
они химически очень активны.
В атомах натрия внешний электрон на-
ходится в третьем электронном слое, в ато-
мах калия — в четвёртом электронном слое
(см. рис. 125). Чем дальше от ядра атома
расположен электрон, тем слабее притя-
жение его к ядру, тем легче он может
отрываться. Поэтому от атомов калия
внешний электрон отрывается легче, чем
от атомов натрия. Калий ещё более хи-
мически активен, чем натрий; в связи
с этим при проведении опытов с ним
надо проявлять ещё большую осторож-
ность.
а) Соединение натрия и калия с кислородом и дру-
гими металлоидами. Натрий и калий настолько легко окисляются,
что хранить их необходимо под слоем керосина.
i) Такие трубки удобно заготовить заранее на занятиях химического
кружка, как описано в практических работах.
342
Процесс соединения этих элементов с кислородом идёт даже
при низкой температуре; при этом образуются окислы:
(медленное окисление)
2е .
I__ 4 4-1- 2
2Na-4-O = Na2O
ОКИСЬ
натрия
(медленное окисление)
t__ 'I' 4-1— 2
2К + О=К2О
ОКИСЬ
калия
(Кроме окисей, при окислении натрия и калия образуются ещё пере-
киси, о чём будет сказано дальше.)
Лёгкую окисляемость натрия’и калия можно наблюдать, рассма-
тривая поверхность этих металлов на свежем разрезе: блестящая
поверхность быстро тускнеет и покрывается слоем окислов. Окисле-
ние этих металлов очень удобно наблюдать в трубках (рис. 138).
В этом случае белый налёт продуктов окисления появляется только
на концах столбиков металла, а средняя часть столбиков, прилегаю-
щая к стеклу, долго ещё. остаётся блестящей.
Если в течение нескольких дней рассматривать трубки с натрием и
кадием, можно проследить, как окисление постепенно проникает
в более глубокие слои металла и всё более и более увеличивается
толщина белого налёта окислов с обоих концов столбиков, что
видно по рисунку 138 А и Б.
Нагретые- натрий и калий горят на воздухе, а ещё энергичнее
в чистом кислороде. Натрий горит жёлтым пламенем, а калий фио-
летовым.
Натрий и калий энергично соединяются с хлором (рис. 32);
продуктами реакции являются хлористые соединения;
(горение)
2е
I__ _J_ 4-1 — 1
2Na-{-Cl2 =2NaCl
хлористый
натрий
(горение)
. 2е
I__ —L 4-1-1
2К + С12 = 2КС1
хлористый
калий
Энергично реагирует натрий, а особенно калий, с другими ме-
таллоидами. В некоторых случаях реакция протекает со взрывом,
например калия с бромом, натрия и калия с серой.
б) Взаимодействие натрия и калия со сложными
веществами. Атомы натрия и калия теряют внешние электроны
343
значительно легче атомов водорода и атомов других металлов.
Вследствие этого натрий и калий способны вытеснять водород и
металлы из их соединений. Этим объясняется взаимодействие натрия
и калия с водой;
Для опыта берут кусочек натрия величиной не больше горо-
шины (его отрезают от куска ^натрия, тщательно очищенного от
керосина и слоя окислов). Кусочек бросают в воду (рис. 139).
Натрий тотчас же начинает реагировать с водой. От выделяющегося
от этой реакции тепла он плавится и превращается в шарик, начи-
нающий быстро бегать по поверхности воды (дрижение его объясняется
неравномерным течением реакции с разных сторон шарика).
При задержке натрия, плавающего на воде, выделяющийся водо-
род тотчас же загорается. Горит он жёлтым пламенем (окраска от
примеси сгорающих частиц натрия). Лицо при опыте следует держать
подальше (лучше покрыть сосуд воронкой, как показано на рисунке).
Под конец опыта обычно слышится резкий звук от растрескивания
остатка натрия; при этом может произойти лёгкое разбрызгивание
жидкости.
По окончании pq^tiiiH в воду пускают несколько капель красного
раствора лакмуса или раствора фенолфталеина. Изменение окраски
индикаторов указывает на появление в растворе гидроксильных
йонов (образование щёлочи).
Наглядно представляется этот процесс, если изобразить воду
в виде йонов (диссоциация воды, хотя и в слабой степени, всё же про-
исходит). <
е
I i
Na4-H2O=Na'-|-OH'4-H; 2H = H2f .
tl
н- + OH'
В атоме4 водорода электрон находится в первом электронном
слое, а поэтому притягивается ядром сильнее, чем в атоме натрия,
где он находится в третьем электронном слое. По этой причине при
взаимодействии натрия с водой электрон от атома натрия переходит
к йону водорода, а атом натрия превращается в йон:
Na —Э - Na;
йон водорода, присоединив электрон, превращается в атом:
н'+е - н .
То же происходит при взаимодействии калия с водой, только
реакция протекает гораздо энергичнее. Эта реакция в сокращённом
виде может быть изображена так:
К + Н2О = К +ОН' 4-Н; 2H = H2f
tl
н- -ь он'
Опыт проводят с ещё большей осторожностью. Кусочек калия
берут по объёму меньше горошины. При реакции с калием
344
выделяется больше тепла, чем при реакции с натрием; поэтому выде-
ляющийся водород тотчас же загорается. Горит он фиолетовым
пламенем от примеси частиц калия. Под конец реакции всегда про-
исходит лёгкий взрыв с разбрызгиванием мелких кусочков калия;
поэтому необходимо отгораживаться стеклом в вообще не держать
лицо вблизи сосуда. В воду прибавляют раствор лакмуса или фе-
нолфталеина и убеждаются в появлении щёлочи.
4. Натрий и калий в природе. Как весьма химически активные
металлы, натрий и калий в свободном состоянии находиться в при-
роде не могут. В виде же соединений они широко распространены.
Хлористый натрий находится в воде морей и океанов, а во многих
местах земного шара образует мощные отложения, известные под
названием каменной соли.
В СССР имеются неисчерпаемые запасы каменной соли. Наибо-
лее мощные отложения её находятся в Донецком бассейне, на Урале,
на Кавказе и в других местах.
Огромные количества сернокислого натрия (сульфата натрия),
имеющего большое промышленное значение, содержатся в воде
залива Кара-Богаз-Гол Каспийского* моря; соль осаждается на дне
залива мощным слоем.
В верхних слоях некоторых отложений каменной соли содер-
жатся также значительные количества соединений калия (хлористый
калий и др.). В СССР имеются богатейшие месторождения калийных
солей в Соликамске, обнаруженные проф. А. С. Преображен-
ским на основании работ акад. Н. С. К у р н а кова.
5. Получение натрия и калия. В свободном виде натрий был
впервые получен при пропускании электрического тока в расплав-
ленный едкий натр. При этом на отрицательном полюсе появились
небольшие шарики металла с ярким блеском, с виду в высшей сте-
пени похожие на ртуть; некоторые из них сейчас же сгорали со
взрывом и ярким пламенем, другие оставались, но поверхность их
тускнела и покрывалась белой плёнкой.
Эти шарики — кусочки натрия в расплавленном состоянии.
При действии электрического тока на расплавленное едкое кали
был получен в свободном виде калий.
Путём электролиза получают натрий и калий в настоящее время.
При этом происходят следующие процессы. В расплавленном со-
стоянии гидрат окиси диссоциирует на йоны:
NaOH^Na'0 ОН'
При пропускании электрического тока на катоде (— 1 йоны нат-
рия присоединяют электроны, переходящие с катода (на котором
имеется избыток их):
Na' 4- 0 -► Na
йон электрон атом
натрия (переходит натрия
с катода)
345
На аноде (-J-) йоны гидроксила теряют электроны, переходящие
на анод (на котором недостаток их). Выделяющиеся свободные гидро-
ксильные группы соединяются попарно и образуют воду и кислород:
ОН' —0 ОН; 2ОН = Н2О0О; 2О = О2
электрон
(уходит
на анод) \
В результате электролиза выделяются: на катоде металл, на
аноде кислород. В ’ общем виде реакция электролиза может быть
изображена так:
(электролиз
расплава) на катоде на аноде
2NaOH = 2Na + Н2О -f- О; 20 = Oaf
(электролиз
расплава)
2КОН = 2К + Н2О + О; 2O = O2f
6. Применение натрия и калия. Практическое применение
в свободном состоянии находит пока преимущественно натрий. Он
применяется, главны!|$5бразом, для получения некоторых его соеди-
нений. В небольших количествах натрий вводят в некоторые сплавы
для изготовления подшипников. Применяют его также при синтезах
многих органических соединений.
§ 2. Кислородные соединения натрия и калия
Натрий и калий образуют два ряда главнейших соединений
с кислородом: окиси и перекиси.
Как видно из структурных формул, в окисях и перекисях валент-
ность металл| одинакова. Различие же этих окислов заключается
Окиси Перекиси
Молекулярная формула Структурная формула Название Молекулярная формула Структурная формула Название
Na2O Na4 N^° Окись натрия Na2O2 Na - 0 Na —О Перекись натрия
К20 Кч >0 Окись К2О2 к-о Перекись
к/ калия К-0 калия
в том, что в перекисях атомы кислорода соединены между собой,
образуя группировку: — О — О — (калий образует, главным образом,
перекись состава К2О2 или К2О4).
346
Окиси образуются (вместе с другими окислами) в случаях мед-
ленного окисления металлов при невысокой температуре. Представ-
ляют они собой порошкообразные вещества белого цвета.
При горении натрия и калия на воздухе или в чистом кислороде
образуются, главным образом, перекиси в виде порошков жёлтого
цвета;
(горение)
2Na -f- О2 = Na2O2
перекись
натрия
(горение)
2К + 2О2 = КА
* гНфекись калия
Таким путём эти перекиси получаются в технике.
Окиси натрия и калия — это основные окислы; при взаимодействии
с водой 'они переходят в гидраты окисей, представляющие собой
основания;
Na,0 + Н2О = 2NaOH
гидрат окиси
натрия, едкий натр
К20 4-Н2О = 2КОН
гидрат окиси
калия, едкое кали
При взаимодействии с водой перекисей тоже образуются гидраты
окисей, а кроме того выделяется ещё кислород:
Na2O24-H2O = 2NaOH-LO; 2О = О2|
* К2О2 4- Н2О = 2КОН + О; 2О = О2|
Выделяющийся атомарный кислород оказывает сильное окисли-
тельное действие. Благодаря этому перекись натрия применяется для
отбелки тканей, соломы, перьев и пр.
§ 3. Гидраты окисей натрия и калия
Гидраты окисей натрия и калия получаются, как выше говори-
лось, при взаимодействии окислов с водой, а также металлов с водой.
В технике получают их путём электролиза водных растворов
солей — хлористого натрия и хлористого калия.
В растворе соль диссоциирована:
NaClz+Na-|-Cl'
Кроме этих йонов, в растворе находятся также, хотя и в неболь-
шом количестве, йоны, образующиеся вследствие диссоциации воды:
Н2О;±Н'4-ОН'
При пропускании электрического тока к катоду (—) направ-
ляются йоны Na’ и Н‘; к аноду направляются йоны СГ и ОН'.
347
Рис. 140. Схема установки для
получения едкого натра.
С катода электроны переходят к йонам водорода, так как они
притягивают электроны сильнее, чем йоны натрия. Вследствие этого
на катоде выделяется водород:
' (на катоде)
2H = H2f
Йоны натрия остаются в растворе.
На аноде теряют электроны йоны хлора, так как они удержи-
вают их слабее, чем гидроксильное йоны; поэтому здесь происхо-
дит выделение хлора:
(на аноде)
СГ — 0 — Cl; 2Cl = Cl2f
Йоны натрия и гидроксила остаются в растворе.
В технических условиях катодное и анодное ^пространства раз-
деляют пористой глиняной перегородкой (рис 140), чтобы воспре-
пятствовать взаимодействию
хлора с образующейся щё-
лочью.
Таким образом, в ре-
зультате электролиза пова-
ренной соли на катоде по-
лучается раствор едкого
натра и водород, а на ано-
де хлор. Газы отводятся
по трубам, а выпускаемый
из катодного пространства
раствор выпаривают. Сна-
чала выкристаллизовывает-
ся из раствора оставшаяся
в нём поваренная соль; по-
сле отделения её остав-
шийся почти чистый рас-
твор едкого натра выпари-
вают до полного удаления
воды; расплавленную щё-
лочь выливают в формы.
Физические и химические
свойства гидрата окиси нат-
рия, или едкого натра
NaOH, и гидрата окиси ка-
лия, или едкого кали КОН,
см. на стр. 39 — 44.
сильными щелочами; в рас-
творе они полностью диссоциируют:
NaOH = Na'Ц-ОН'
КОН = К' + ОН'
Едкий натр и едкое кали вступают во все реакции, характерные .
для оснований.
и едкое кали являются
Едкий
348
Как очень хорошо растворимые основания едкие щёлочи приме-
няются обычно для нейтрализации кислот:
2NaOH + H2SO4 = Na2SO4 + 2Н2О
или, изображая уравнение реакции в йонном виде:
2Na + 2ОН' 4- 2Н + SO4 = 2Н2О + 2Na 4- SO4
Едкие щёлочи применяются также для получения гидратов окисей
тяжёлых металлов (практически нерастворимых в воде):
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
4
2Na" + 2OH' 4- Cu" 4- SOj = Cu(OH)2 4- 2Na 4- SO4
4
Едкий натр является важнейшим продуктом основной химической
промышленности. Техническое название его „каустическая сода"
(что означает едкая сода).
В больших количествах он применяется в нефтяной промышлен-
ности для очистки от кислотных^ примесей продуктов переработки
нефти (см. стр. 203). Много идёт его для мыловарения (см. стр. 242).
Применяется он также при переработке клетчатки и в других
производствах.
Едкое кали, как более дорогой продукт, применяется реже едкого
натра. Главным образом, едкое кали применяется для получения
жидкого мыла (см. стр. 242).
§ 4. Соли натрия и калия
Соли натрия находят широкое применение.
Хлористый натрий, хлорид натрия, поваренная соль NaCl (см.
стр. 88), применяется в качестве приправы к пище, для предо-
хранения от порчи пищевых продуктов (мяса, масла и др.); служит
сырьём для производства хлора, соляной кислоты, едкого натра
и др.; применяется также в мыловаренном и в других производствах.
По пятилетнему плану намечено увеличение добычи поваренной
соли на 1,4 млн. т в год, что полностью удовлетворит потребность
в ней пищевой промышленности и химических производств.
Хлористый калий, хлорид калия КС1 (см. стр. 89), является
основой калийных удобрений, имеющих важнейшее значение. При
недостатке в почве калия задерживается рост растений, резко пони-
жается урожай. Некоторые культурные растения особенно сильно
истощают почву, извлекая из неё соли калия в больших количествах;
к таким растениям относятся лён, конопля, подсолнечник, разные
корнеплоды и др.
Значительная часть извлекаемого из почвы калия отлагается в
стеблях растений. Поэтому внесение в почву навоза, содержащего
349
перегнившие стебли растений, восполняет в ней убыль калия; этому
способствует также правильно проводимый севооборот, но главнейшее
значение имеет внесение в почву калийных удобрений.
В 1950 г. производство калийных удобрений превысило довоен-
ный уровень и обеспечило возросшую потребность в них нашего
сельского хозяйства.
Сернокислый натрий, сульфат натрия Na^Oi; с кристаллиза-
ционной водой Na2SO4*10H2O— глауберова соль. Применяется в
медицине в качестве слабительного.
Безводная соль применяется в стекольном производстве и др.
Азотнокислый натрий, нитрат натрия, натриевая селитра NaNO3.
Отличается сильной гигроскопичностью. Широко используется в каче-
стве минерального удобрения (см. стр. 159). Применяется для лабора-
торного получения азотной кислоты.
Азотнокислый калий, калийная селитра KNO3. Калийная селитра
негигроскопична. Она (употребляется в качестве составной части
некоторых комбинированных удобрений и применяется для изготов-
ления чёрного пороха (см. стр. 157).
Углекислый натрий, карбонат натрия, сода Na2CO3; кристалло-
гидрат Na2CO3- 10Н2О.
Сода — один из главных продуктов основной химической про-
мышленности. В больших количествах сода (безводная, кальциниро-
ванная) употребляется в производствах втекла, мыла и др. Приме-
няется она также для смягчения жёсткости воды и поэтому употреб-
ляется при стирке белья (см. стр. 188).
1фслый углекислый натрий, или двууглекислый натрий, бикар-
бонат натрия, двууглекислая сода (питьевая сода) NaHCO3 (см.
стр. 189).
Двууглекислая сода получила название питьевой, так как при-
меняется в медицине для приёма внутрь с целью понижения повышен-
ной кислотности желудка.
В 1950 г. произведено едкого натра и безводной (кальциниро-
ванной) соды такое количество, которое полностью удовлетворило
потребность соответствующих производств.
Углекислый калий, карбонат калия, поташ К2СО3. Применяется
поташ в производстве особого стекла (тугоплавкого), для получения
жидкого мыла и в других производствах.
При растворении в воде соды у поташа наблюдается следующая
особенность: частично происходит реакция взаимодействия этих
солей с водой (гидролиз), так как Н2СО3 — слабая кислота, реакция
эта обратима и не приводит к накоплению Н2СО3 и её распаду на
Н2О и СО2:
Na2CO3 + 2Н2О 2NaOH -f- Н2СО3
ж
2Na + СО' + 2H2O^2Na‘ + ОН' -|- Н2СО3
И
2Н 4- 2ОН'
350
Из образующихся продуктов реакции угольная кислота как очень
слабый электролит находится в растворе, главным образом, в виде
молекул, а гидрат окиси натрия как сильный электролит — в виде
йонов. Поэтому раствор соды (и поташа), содержащий гидроксильные
йоны, проявляет щелочные свойства и окрашивает лакмус в синий
цвет.
Соли, образованные анионом сильной кислоты и катионом силь-
ного основания (щёлочи), не подвергаются гидролизу; поэтому рас-
творы хлористых, сернокислых, азотнокислых солей щелочных метал-
лов имеют нейтральную реакцию.
§ 5. Общая характеристика щелочных металлов
Щелочные металлы как элементы первой группы периодической
системы элементов Менделеева проявляют в соединениях одну валент-
ность (заряд йонов равен1). Общая формула кислородных соеди-
нений! ^О1). Общая формула гидратов окисей /?ОН. Гидраты окисей
являются основаниями,. хорошо растворимыми в воде (сильные
щёлочи); при этом происходит образование гидроксильных йонов.
Общая схема диссоциации:
/?ОН^±^4-ОН'
Способность атома терять электроны и переходить в однозаряд-
ный йон проявляется тем легче, чем больше атомный вес щелочного
металла, т. е. чем ниже расположен он в таблице элементов Мен-
делеева (внешний электрон находится дальше от ядра). В связи
с этим самый лёгкий щелочной металл литий (атомный вес равен
6,94) проявляет меньшую химическую активность, а наиболее тяжё-
лый из известных щелочных металлов цезий (атомный вес равен
182,91) проявляет наибольшую химическую активность (атомы его
легче, чем атомы всех прочих элементов, теряют электроны).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В какой группе элементов таблицы Менделеева помещаются натрий
И калий?
2. Изобразите схемы строения их атомов.
3. Сколько электронов в атомах этих элементов находится во внешнем
электронном слое?
4. Какую валентность проявляют натрий и калий?
5. Что происходит при переходе атомов этих металлов в йоны?
6. Каковы характерные физические свойства этих металлов?
7. Какова химическая активность натрия и калия и какое место они
занимают в ряду активности металлов?
8. Чем объясняется, что калий химически более активный элемент,
чем натрий?
9. Как перемещаются электроны при образовании соединений натрия
и калия с хлором?
10. Что происходит при взаимодействии натрия и калия с водой?
1) 7? — любой щелочной металл.
351
•И. Какие соединения натрия и калия встречаются в природе?
12. Как получают натрий и калий в свободном состоянии?
13. Для чего применяются натрий и. калий?
14. Какие окислы и при каких условиях образуют натрий и калий?
15. Каковы химические свойства окислов натрия и калия?
16. Приведите формулы и все названия гидратов окисей натрия и калия.
17. Какими способами могут быть получены гидраты окисей натрия и
калия?
18. Каковы химические свойства гидратов окисей натрия и калия? Как
они диссоциируют в растворе?
19. Почему натрий и калий называются щелочными металлами?
20. Для чего применяются гидраты окисей натрия и калия?
21. Каковы важнейшие соли натрия и калия? Приведите формулы и все
названия их.
22. Для чего применяются поваренная соль, хлористый калий, селитра,
сода углекислая и двууглекислая, поташ, глауберова соль?
23. Какие ещё элементы относятся к группе щелочных металлов и что
у них общего?
ГЛАВА III
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
В главной подгруппе II группы таблицы Менделеева находятся
элементы: бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва,
радий Ra.
Общее название „щёлочноземельные металлы" было дано ещё
в средневековую эпоху элементам: кальцию, стронцию, барию; это
название было дано им по той причине, что образуемые этими эле-
ментами окислы („земли" по тогдашнему названию), хотя и плохо
растворяются в воде, всё же придают ей щелочные свойства.
Из элементов II группы здесь будут рассматриваться только
магний и кальций. ч
/. МАГНИЙ И ЕГО СОЕДИНЕНИЯ
§ 1. Магний
Химйческий знак: Mg (читается: магний).
Атомный вес равен 24.
Магний в свободном состоянии был впервые получен посред-
ством электролиза его соединений (1808 г.). Название „магний"
происходит от слова „магнезия" — старинного названия окиси этого
элемента.
1. Положение в периодической системе элементов и строе-
ние атома магния. Магний в периодической системе занимает 12-е
место (порядковый номер равен 12). Это указывает, что заряд ядра
атома магния равен 12 и что вокруг ядра вращается 12 электро-
нов (суммарный заряд их равен —12).
352
Расположение электронов по электронным слоям: 2; 8; 2.
Схема строения атома магния приведена на рисунке 125.
Атом магния имеет 2 внешних электрона, которые отрываются
при химических взаимодействиях; в результате этого атомы магния
переходят в йоны с двумя положительными зарядами:
Mg — 2@—>Mg”
Во всех соединениях магний двухвалентен (~|~2).
2. Физические свойства магния. Магний — белый металл,
несколько твёрже олова (см. рис. 137). Это лёгкий металл, так как
удеЯьный вес его меньше 5 (см. phc. 135). Плавится магний при 651°;
по температуре плавле-
ния он занимает место
между цинком и алюми-
нием (см. рис. 136).
3. Химические свой-
ства магния. Имеющие-
ся у атома магния во внеш-
нем электронном слое
два электрона отрывают-
ся труднее, чем у атомов
щелочных металлов. В
связи с этим химическая
активность магния значи-
тельно меньше, чем калия
и натрия (см. ряд активно-
сти металлов на стр. 47).
а) Соединение
м а г н и я с к и с л о р о- Рис. ш г магния.
дом и другими ме-
таллоидами. Под действием кислорода воздуха магний медленно
покрывается тонкой плёнкой окиси, придающей его поверхности
матовый вид. Этот слой окиси защищает от окисления глубже лежа-
щие участки металла, поэтому магний можно хранить на воздухе.
При нагревании магний загорается (рис. 141) и горит ослепи-
тельно ярким пламенем; продуктом горения является окись магния
(магнезия):
2Mg -р О 2 = 2MgO
ОКИСЬ
магния
Яркость пламени вызывается тем, что образующаяся окись маг-
ния раскаляется под действием выделяющегося при реакции боль-
шого количества тепла. Благодаря яркости пламени магний приме-
няют для изготовления осветительных ракет и сигнальных огней;
им пользуются также в фотографии („магниевая вспышка").
23 В. В. Левченко
353
Магний легко соединяется с галогенами, отдавая им электроны,
например с бромом:
I I +2 -1
Mg-|-Br2 = MgBr2
При нагревании магний соединяется с серой, азотом.
б) Взаимодействие магния со сложными веще-
ствами. Магний, как химически достаточно активный металл, реаги-
рует со сложными кислородсодержащими веществами, отнимая от них
кислород. Например, он продолжает гореть в углекислом газе, выде-
ляя из него углерод:
4е
!_ 4-
2Mg 4- со2=2Mgo + а
Магний реагирует также с водой, но значительно труднее, чем
щелочные металлы. Реакция заметно протекает только при нагрева-
нии (ещё лучше в доведённой до кипения воде)!
2е
I _(при нагревании)
Mg -1-217 + 2ОН' = Mg(OH)2 + Н21
ад -
4. Магний в природе. Магний находится в природе только
В химически связанном состоянии.
Широко распространённым соединением является углекислый
магний, образующий минерал магнезит MgCO3 и входящий в состав
минерала доломита CaCO3-MgCO3.
В виде мощных отложений (у нас в Соликамске) встречается мине-
рал карналлит KCl«MgCl2-6Н2О, служащий сырьём для получения
металлического мЖ&ия. 4
Соли магния содержатся в морской воде, которой придают горь-
кий вкус; они содержатся также в почве. Магний — необходимый
для жизни растений элемент: он входит в состав зелёного вещества —
хлорофилла.
5. Получение магния и применение его. Магний получают
электролизом расплавленного хлористого магния; на катоде происхо-
дит выделение свободного магния:
(на катоде)
м£” + 2ё = м£
На аноде происходит выделение свободного хлора!
(на аноде)
СГ — @ = С1; 2С1 = С12
Уравнение реакции в общем виде:
на на
катоде аноде
MgCla = Mg+Cla
351
Главное применение магния — приготовление лёгких сплавов.
Особенно ценным сплавом магния является сплав „электрон" (в нём
содержится около 9О°/о магния; остальное — другие металлы: алю-
миний, цинк, медь, олово, марганец, титан, бериллий и др.). Этот сплав
отличается большой твёрдостью, вязкостью и малым удельным весом
(1,8); широкое применение он получил в авиа- и автостроении.
1
§ 2. Окись и гидрат окиси магния
Окись магния — белое тугоплавкое вещество. Техническое назва-
ние её „жжёная магнезия".
Окись магния образуется при горении магния (см. выше); обычно
получают её путём прокаливания минерала магнезита MgCO3:
(прокаливание)
MgCO3 = MgO + CO2>|<
Из окиси магния, благодаря её высокой температуре плавления
(около 2600°), изготовляются огнеупорные тигли, трубы, кирпичи.
Окись магния — основной окисел; с водой реагирует слабо, обра-
зуя плохо растворимое основание:
MgO4-H2O = Mg(OH)a
Если порошок окиси магния взболтать с водой, то при помощи
индикаторов (лакмуса, фенолфталеина) можно обнаружить щелоч-
ную реакцию раствора, указывающую на появление гидроксильных
йонов:
Mg(OH)2^Mg-4-2OH'
Гидрат окиси магния, благодаря его плохой растворимости, можно
получить действием щёлочи на соли магния:
. MgSO4 + 2KOH = Mg(OH)2 + K2SO4
Ф
Mg" 4- SO4 + 2К + 2ОН' = Mg(OH)2 4- 2К’ 4- SO4
Ф
§ 3. Соли магния
Углекислый магний, карбонат магния MgCO3.
Углекислый магний встречается в природе в виде минерала маг-
незита. Он практически нерастворим в воде.
Значительно лучше растворима кислая соль — кислый углекис-
лый магний, или бикарбонат магния Mg(HCO3)2. Эта соль магния
содержится в жёсткой воде.
Сернокислый магний, сульфат магния MgSO4; кристаллогидрат
MgSO4« 7Н2О — горькая соль.
Эта соль хорошо растворима в воде; применяется в медицине
в качестве слабительного.
23*
355
Природные силикаты магния:
Тальк 3MgO«4SiO2«H2O. Совместно с другими минералами
образует горные породы, широко распространённые в природе.
Находит разнообразное применение. Употребляется он в качестве огне-
упорного материала при устройстве доменных печей.
Порошок талька применяется в технике для смазки машин, в ме-
дицине— в качестве детских пирсыпок.
Асбест СаО • 3MgO • 4SiO2 находит широкое применение в тех-
нике в качестве прекрасного изолирующего от тепла материала,
к тому же дающего мягкие нити. Из него изготовляют огнеупорные
ткани и различные изделия, которые должны отличаться огнеупор-
ностью (плиты, трубы и т. п.).
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Каковы характерные физические свойства магния?
2. В какой .группе элементов таблицы Менделеева помещается магний?
3. Изобразите схему строения атома магния. Сколько электронов в атоме
магния находится во внешнем электронном слое?
4. Какую валентность проявляет магний? Что происходит при переходе
атомов магния в йоны?
5. Назовите природные соединения магния?
6. Как получают магний в свободном состоянии? Для чего он приме-
няется?
7. Какой окисел образует магний? Как он может быть получен?
8. Какое техническое название получила окись магния?
9. Как можно получить гидрат окиси магния?
10. Каковы химические свойства гидрата окиси магния?
11. Назовите главнейшие соли магния. Для чего они применяются?
7/. КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ
§ 1. КаЛьций -
%.
Химический знак: Са (читается: кальций).
Атомный вес равен 40.
Кальций в свободном состоянии был впервые получен посред-
ством электролиза его соединений (1808). Название „кальций*
произведено от латинского слова „калькара", означающего „известь*.
1. Положение в Периодической системе элементов и строе-
ние атома кальция. Кальций в периодической системе элементов
занимает 20-е место (порядковый номер равен 20). Это указывает,
что заряд ядра атома кальция равен -|-20 и что вокруг ядра вращается
20 электронов (суммарный заряд их равен — 20).
Расположение электронов: 2; 8; 8; 2.
Схема строения атома кальция приведена на рисунке 125.
Атом кальция имеет 2 внешних электрона, которые отры-
ваются при химических взаимодействиях; в результате этого атомы
кальция переходят в йоны с двумя положительными зарядами:
Са —20—>Са”
356
Во всех соединениях, кальций двухвалентен (2).
2. Физические свойства кальция. Кальций — белый металл, не-
сколько твёрже магния (см. рис. 137). Как и магний, он относится к лёг-
ким металлам (см. рис. 135). Плавится кальций при 851° (см. рис. 136).
3. Химические свойства кальция. Атомы кальция теряют внеш-
ние электроны легче, чем атомы магния, так как они расположены
дальше от яд£>а (в четвёртом электронном слое). Поэтому химическая
активность кальция больше, чем магния, и в ряду активности ме-
таллов он занимает место перед магнием.
а) Соединение кальция с кислородом и другими
металлоидами. Кальций энергичнее, чем магний, окисляется на
воздухе и быстро покрывается рыхлым слоем окиси; хранить
его • необходимо в хорошо закупоренном сосуде. Нагретый кальций
сгорает в кислороде ярким красноватым пламенем, превращаясь
в окись:
(на воздухе
и при горении)
2Са —J- О22СаО
Кальций легко соединяется также с галогенами, серой, азотом.
б) Взаимодействие кальция со сложными веще-
ствами. Кальций энергичнее, чем магний, реагирует с водой; уже
на холоде он вытесняет водород, образуя гидрат окиси кальция:
I_ 1
• Ca-|-2H+ 2ОН' = Ca(OH)24-H2f
н^о
4. Кальций в природе. Кальций в природе находится только
в химически связанном состоянии. Соединения его в виде минералов и
горных пород широко распространены в природе. Углекислый каль-
ций СаСО3 образует в земной коре мощные отложения в виде из-
вестняка, мела, мрамора; сернокислый кальций CaSO4 распространён
в виде гипса; фосфорнокислый кальций Са3(РО4)2 входит в состав
фосфоритов и апатита. Кальций содержится также в природных во-
дах в виде кислого углекислого кальция Са(НСО3)2 и сернокислого
кальция CaSO4.
Углекислый кальций СаСО3 и фосфорнокислый кальций Са3(РО4)2
являются главнейшими составными частями костной ткани, придаю-
щими ей прочность.
5. Получение кальция и применение его. Кальций получают
электролизом расплавленного хлористого кальция:
на на
катоде аноде
CaCl, = Ga —С12
Применяется кальций в небольшие количествах (около 1°/0)
в сплавах со свинцом, употребляемых для заливки подшипников.
357
§ 2. Окись и гидрат окиси кальция
Окись кальция СаО — белое огнестойкое вещество. Техническое
название её — негашёная известь или жжёная известь.
Окись кальция получается при окислении кальция; в технике
получают её путём прокаливания известняков:
(прокаливание)
СаСО3 = СаО -|- СО2^
Окись кальция жадно соединяется с водой и превращается в ги-
драт окиси кальция:
СаО + Н2О = Са(ОН)2
Этот процесс, называемый гашением извести, протекает с выде-
лением большого количества тепла (рис. 142).
Налево — обливание водой негашёной извести. Направо — процесс гашения; известь
увеличивается в объёме. Выделяющееся при реакции тепло нагревает воду, и часть её пре-
вращается в пар.
Окись кальция проявляет и другие хими ческие свойства основных
окислов — реагирует с ангидридами и кислотами:
СаО 4~ СО2 = СаСО3
СаО 4- 2НС1 = СаС12 + Н2О
Ш1драт окиси кальция, гашёная известь Са(ОН)2,— твёрдое ве-
щество белого цвета, растворимое в воде. Растворимость Са(ОН)2
невелика (1,56 г в \ л воды при 20°у.
Раствор гидрата окиси кальция называется известковой водой.
В ней содержится гидрат окиси в диссоциированном состоянии:
Са(ОН)2 s=± Са‘+ 2ОН'
Гашёная известь проявляет все общие свойства щелочей.
Как и едкие щёлочи (КОН и NaOH), она очень легко вступает
во взаимодействие с содержащимся в воздухе углекислым газом:
Са(ОН)2 4- СО2 = СаСО3 4~ Н2О
Ф.
358
Этой реакцией пользуются для обнаружения углекислого газа,
так как образующийся углекислый кальций вызывает помутнение
известковой воды. Поэтому нельзя хранить известковую воду в от-
крытом сосуде.
Гашёная известь находит широкое применение в строительном
деле. Она служит для скрепления кирпичей при кладке стен, а также
в качестве штукатурки. Для этих целей применяется смесь извести
с песком и водой под названием „извёстки44.
Извёстка становится твёрдой в результате приведённой выше
реакции взаимодействия гидрата окиси кальция с углекислым газом.
Образующийся углекислый кальций приводит к затвердеванию всей
массы.
§ 3. Соли кальция
Углекислый кальций, карбонат кальция СаСО3, образует широко
распространённые минералы и горные породы (известняки, мел, мра-
мор и др.). Углекислый кальций — твёрдое вещество, практически не-
растворимое в воде. При прокаливании разлагается на окись кальция
и углекислый газ, как показано выше; служит исходным материалом
для получения извести, а также углекислого газа. ‘
Кислый углекислый кальций, бикарбонат кальция Са(НСО3)2.
Эта соль довольно значительно растворима в воде. Она содер-
жится в природных водах, так как образуется при взаимодействии
известняков с углекислым газом и водой:
СаСО3 + СО2 4- Н2О = Са (НСО3)2
Природные воды, содержащие* значительное количество этой соли,
являются жёсткими; это временная жёсткость воды, устраняемая кипя-
чением (см. стр. 188).
Сернокислый кальций, сульфат кальция CaSO4; кристаллогидрат
CaSO4- 2Н2О — гипс.
Гипс заметно растворим в воде. Природные воды, содержащие гипс,
также являются жёсткими; это постоянная жёсткость воды, не устра-
няемая кипячением (см. стр. 188).
Сернокислый кальций довольно широко распространён в природе
в виде минерала гипса, представляющего еЬбой кристаллогидрат
CaSO4‘2H2O. При прокаливании до 180° происходит неполное обезво-
живание гипса и получается жжёный гипс, или алебастр (CaSO4)2«H2O:
(прокаливание до 180°)
2CaSO4 • 2Н2О = (CaSO4)2 • Н2О + ЗН2О
Если алебастр смешать с водой в жидкое тесто, оно вскоре затвер-
девает вследствие обратно протекающей реакции:
(CaSO4)a • Н2О + ЗН2О = 2CaSOr 2Н2О
359
Благодаря этому свойству алебастра его применяют для отливки
различных фигур и пр., а также в качестве добавки к извести при
штукатурке стен, потолков.
При полном обезвоживании гипса он теряет способность соеди-
няться с водой. Такой гипс называется „мёртвым"; он непригоден для
каких-либо изделий.
§ 4. Общая характеристика щёлочноземельных металлов
Щёлочноземельные металлы, как элементы, находящиеся во
II группе таблицы Менделеева, в соединениях проявляют две поло-
жительные валентности (-|-2). Атомы их теряют два имеющихся у них
внешних электрона и превращаются в йоны с двумя положительными
зарядами. Все эти элементы образуют основные окислы типа RO,
гидраты окисей типа /?(ОН)2.
Гидраты окисей являются щелочами, диссоциирующими по схеме:
/?(ОН)2Х/?”+2ОН'.
По химическим свойствам окисей и гидратов окисей щёлочно
земельные металлы сходны со щелочными металлами. В обоих слу-
чаях гидраты окисей могут получаться непосредственным соединением
окисей с водой. Растворимость же гидратов окисей щёлочноземельных
металлов меньшая, чем у щелочных металлов.
При переходе к щёлочноземельным металлам с большим атомным
весом растворимость гидратов окисей заметно увеличивается. Гидрат
окиси бария растворяется лучше, чем гидрат окиси кальция; раствор
его, называемый „баритовой водой", является часто употребляемым
в лабораториях реактивом.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. Каковы физические свойства кальция?
2. В какой группе элементов таблицы Менделеева помещается кальций?
3. Изобразите схему строения атома кальция.
4. Сколько электронов у атома кальция находится во внешнем электрон-
ном слое?
5. Какую валентность проявляет кальций и что происходит при переходе
атомов кальция в йоны?
6. Назовите природные соединения кальция.
7. Как получают кальций в свободном состоянии? Для чего он приме-
няется? 7 ч
8. Какой окисел образует кальций? Как он может быть получен?
9. Как в технике получают окись кальция?
10. Какое она получила техническое название?
11. Что называется гашёной известью и как она получается?
12. Как диссоциирует гидрат окиси кальция в растворе и как такой рас-
твор называется?
13. Для чего применяется гашёная известь?
14. Что называется извёсткой?
15. Какой химический процесс происходит при затвердевании извёстки?
16. Приведите формулы углекислых и двууглекислых солей кальция.
17. Как может переходить углекислая соль в двууглекислую и обратно?
$ 18. Приведите формулу сернокислой соли. Какое опа находит применение?
3G0 *
19. Какой состав имеет природный гипс и применяемый в строительном
деле алебастр?
20. Что происходит при затвердевании алебастра в смеси с водой?
21. Что называется .мёртвым" гипсом и чем он отличается по составу и
свойствам от алебастра?
22. Какая вода называется жёсткой?
23. Какая жёсткость называется временной? постоянной?
24. Как может быть устранена временная жёсткость?
25. Как может быть устранена сразу и временная, и постоянная жёст-
кость?
26. Какие металлы объединяются под общим названием щёлочноземельных?
Что у них общего?
Г Л А В А IV
АЛЮМИНИЙ И ЕГО СОЕДИНЕНИЯ
§ 1. Алюминий
Химический знак: А1 (читается: алюминий).
Атомный вес равен 27.
В свободном состоянии алюминий был получен в 1827 г. путём
нагревания металлического калия с безводным хлористым алюминием.
Название „ алюминий * происходит от латинского названия квасцов
(„алюмен") — вещества, содержащего алюминий и известного с древ-
них времён.
1. Положение в периодической системе элементов и строение
^тома алюминия. Алюминий находится в III группе периодической
системы элементов и занимает 13-е место (порядковый номер равен 13).
Это указывает, что заряд ядра атома алюминия равен Ц-13 и что
вокруг ядра вращается 13 электронов (суммарный заряд которых
равен—13). Схема строения атома алюминия приведена на рисунке 125.
Расположение электронов по электронным слоям: 2; 8; 3.
Атомы алюминия при химических взаимодействиях теряют три
внешних электрона и превращаются в йоны с тремя положительными
зарядами:
А1 — 3@-► АГ"
2. Физические свойства алюминия. Алюминий — серебристо-белый
металл; он принадлежит к числу лёгких металлов (удельный вес меньше 5;
см. рис. 135). Чистый алюминий немного мягче меди (см. рис. 137);
плавится при 660° (см. рис. 136), обладает хорошей электропро-
водностью.
Алюминий проявляет весьма ценные в техническом отношении
свойства: большую тягучесть, значительное сопротивление разрыву;
благодаря этому его можно вытягивать в проволоку, прокатывать
в тонкие листы. Особенно ценным свойством является малый удельный
вес алюминия; поэтому он входит в состав лёгких сплавов в качестве
главной составной части их.
3. Химические свойства алюминия. Алюминий в соединениях
всегда трёхвалентен (-[-3). Атомы алюминия теряют электроны труд-
361
нее, чем атомы магния,- но значительно легче, чем атомы цинка (см-
ряд активности на стр. 47). В связи с этим алюминий является доста-
точно химически активным металлом.
а) Соединение алюминия с кислородом и другими
металлоидами. Алюминий (в виде порошка) при нагревании
до 700° сгорает с образованием окиси А12О8; при этом выделяется боль-
шое количество тепла:
(высокая
температура)
4А1ЗО2 = 2А12О3
ОКИСЬ
алюминия
Окисление алюминия происходит и при низкой температуре;
поэтому блестящая, свеже очищенная поверхность его довольно быстро
становится тусклой, покрываясь слоем окиси. Слой окиси алю-
' миния образует на поверхности
сплошную плотную плёнку, пре-
пятствующую проникновению ки-
слорода воздуха вглубь металла.
Благодаря этой особенности алю-
миний не изменяется на воздухе
и может употребляться для изго-
товления различных изделий,
а также для покрытия изделий из
железа.
Если нарушить защитную плён-
ку алюминия, кусок его может
полностью окислиться на воздухе
и превратиться в порошок окиси.
Это явление легко наблюдать,
натерев алюминиевую проволоку
или пластинку порошком окиси
ртути. После удаления порошка
и вытирания дочиста поверхности
алюминия, которая покрылась обра-
Рис. 143. Алюминиевая проволока,
лишённая защитного слоя.
А — на воздухе: быстрое окисление и обра-
зование „щвтки** из нарастающих нитей
окиси; Б — в воде: выделение водорода.
зовавшейся амальгамой алюминия, на ней появляется налёт окиси в виде
довольно быстро растущей щётки из тонких нитей окиси (рис. 143, А).
При высокой температуре алюминий соединяется также с другими
металлоидами — серой, хлором, бромом, азотом.
б) Взаимодействие алюминия со сложными веще-
ствами. Алюминотермия. Алюминий вытесняет менее активные
металлы из их соединений (см. ряд активности металлов на стр. 47).
Особый практический интерес представляет реакция вытеснения алю-
минием менее активных металлов из их кислородных соединений.
Если порошок алюминия смешать с порошком окиси железа и
поджечь смесь при помощи магния, происходит энергичная реакция:
60
I I______ ' •
2А1 -4- Fe,O3 —> А12О3 4- 2Fe
362
При реакции выделяется большое количество тепла, которое на-
гревает образующиеся продукты до температуры выше 2000°. Же-
лезо при этой температуре плавится, а окись алюминия всплывает
на поверхность его в виде шлака.
Этот метод получения металла из его окиси с помощью алюми-
ния был открыт русским химиком проф. Н. Н. Бекетовым
(1827—1911); впоследствии он получил название алюминотермии.
Алюминотермией пользуются для получения в свободном состоянии
некоторых тугоплавких металлов (хрома, марганца, ванадия и др.), а
также для сварки отдельных металлических частей: концов трамвайных
рельсов и пр. х
• Для сварки употребляется смесь из порошков алюминия и закиси-
окиси железа, представляющей собой соединение закиси железа FeO
и окиси Fe2O3 с общей формулой Fe3O4; смесь эта получила назва-
ние „ термит Производимая при её помощи сварка называется тер-
митной сваркой.
Установка для проведения термитной сварки показана на рисунке 144.
Свариваемый участок, например стык рельсов, окружают кожухом из
Рис. 144. Установка для термитной сварки (схематический
разрез).
Над свариваемым участком помещён тигель с отверстием в дне.
А — тигель после окончания реакции; Б — образовавшееся расплавлен-
ное железо заполнило свариваемый участок; В — шлак вытек в сторону.
огнеупорного материала; в тигель помещают термит; его поджигают;
получающееся при реакции расплавленное железо стекает вниз к кон-
цам рельсов и сваривает их.
в) Взаимодействие алюминия с водой. Алюминий
в воде сохраняется без изменения благодаря защитному слою окиси,
покрывающему его поверхность. Если же в воду опустить алюминий,
лишённый этого защитного слоя (предварительно прокипячённый ко-
роткое время в растворе щёлочи, а затем промытый водой), он вы-
тесняет из воды водород и превращается в гидрат окиси алюминия
(рис. 143, Б)-.
60 (после удаления
j защитной плёнки
2А14-6Н2О °=И) 2А1(ОН)з4-ЗН2ф
гидрат окиси
алюминия
363
Образующийся гидрат окиси алюминия выделяется в виде хлопьев
белого цвета.
г) Взаимодействие алюминия с кислотами. Алюминий
реагирует с кислотами (разбавленной соляной, серной), выделяя из
них водород:
60
__l_ J.___
2А16НС1 = 2А1С13 4-3H2f
хлористый
алюминий
2А1 + 3H2SO4 = A 12(SO4)3 + ЗНа|
сернокислый
/ алюминий
д) Взаимодействие алюминия со щелочами. Алю-
миний реагирует с раствором щёлочи, вытесняя водород. Реакция про-
текает по следующим стадиям.
Сначала происходит растворение в щёлочи защитной плёнки окиси
алюминия. Затем освобождённый от защитной плёнки алюминий реа-
гирует с водой, образуя гидрат окиси и выделяя водород, как было
рассмотрено выше (стр. 363).
Образовавшийся при этой реакции гидрат окиси алюминия раство-
ряется, реагируя со щёлочью (уравнения этих реакций будут рассмот-
рены на стр. 366 и 367).
4. Алюминий в природе. Алюминий является самым распро-
странённым в природе металлом (см. рис. И). Он находится только
в виде соединений: входит в состав глины, полевых шпатов и многих
других минералов.
Важнейшие соединения алюминия, представляющие собой алюми-
ниевые руды: криолцт, содержащий фтористый алюминий вместе
с фтористым натрием AlF3«3NaF, и боксит, явлющийся водной окисью
алюминия А12О3‘2Н2О.
В СССР имеются богатейшие месторождения бокситов на Урале,
в Башкирии, в Казахской ССР.
5. Получение алюминия. В настоящее время алюминий получают
из выделенной из бокситов и других руд чистой окиси алюминия, ко-
торую подвергают электролизу в расплавленном состоянии (в смеси
с криолитом для понижения температуры плавления):
на катоде на аноде
2А1,О3 = 4А1 4-ЗОЛ
ха о I й |
Электролиз ведут при высокой температуре (около 1000°) и боль-
шой силе тока (около 20 000 а) в железных ящиках, выложенных
внутри графитовыми плитами (рис. 145).
В дореволюционное время алюминиевых заводов у нас не было.
Только в 1932 г. был пущен первый завод, через два года — вто-
364
рой, а в настоящее время СССР занимает одно из первых мест в мире
по производству алюминия.
6. Применение алюминия. Алюминий в виде сплавов весьма
широко применяется в авиационной и автомобильной промышлен-
ности. Особенно ценные технические качества имеет сплав, полу-
чивший название „дюралюминий" (что означает „твёрдый алюминий").
В этом сплаве содержится около 94°/0 алюминия и небольшое коли-
чество меди, магния, марганца. Алюминий легко поддаётся обра-
ботке, отличается твёрдостью, прочностью и в то же время лёгкостью. *
В последнее время алюминий начинает вытеснять медь в электро-
технической промышленности в качестве дешёвого и удобного мате-
риала для проводов.
Тепловая
ИЗОЛЯЦИЯ*
графитовая
набойка—
+(анодУ
орка застыв-
шего электро-
лита
-электролит
(окись алюми-
ния с криоли-
том)
^^-(катод)/
Рис. 145. Схема электрической печи для выплавки алюминия.
слой глинозёма
расплавленный алюминий
канал
для выпуск
расплавленн
гр металл а -
Широко применяется алюминий для изготовления кастрюль, ложек
и других предметов домашнего обихода. Применяется он для изготов-
ления термита и выплавки тугоплавких металлов (стр. 363), для из-
готовления аммонала (стр. 157). В виде тонких листов (фольги) алю-
миний применяется для упаковки различных кондитерских изделий
(шоколада, конфет и пр.).
В годы сталинских; пятилеток у нас была создана мощная алюми-
ниевая промышленность. Вступили в строй Волховский алюминиевый
завод в Ленинградской области, Днепропетровский завод на Украине,
заводы на Урале — Североуральский и Богословский. Появилась алю-
миниевая промышленность также в Кузбассе.
В 1950 г. в области цветной металлургии в результате строитель-
ства новых рудников, обогатительных фабрик и заводов, а также
улучшения работы действующих предприятий производство меди,
алюминия, никеля, свинца, цинка и других цветных и редких метал-
лов значительно превысило довоенный уровень. Однако растущие
потребности народного хозяйства требуют ещё более быстрого роста
производства цветных металлов.
265
§ 2. Окись алюминия, глинозём
А12О3; структурная формула:
А1
А1
Алюминий образует с кислородом только одно соединение А12О8.
Окись алюминия, называемая также глинозёмом, встречается в природе
в виде минерала корунда, по твёрдости уступающего только алмазу.
Корунд бывает в виде прозрачных окрашенных кристалов; корунд,
окрашенный в красный цвет, называется рубином; окрашенной в синий
цвет, называется сапфиром. Рубин и сапфир — драгоценные камнщ
Непрозрачные кристаллы корунда, содержащие много примесей, назы-
ваются наждаком и употребляются для изготовления наждачной бумаги.
Окйсь алюминия получается при прокаливании гидрата окиси алю-
миния (см. дальше), при горении алюминия, при медленном окислении
его; она отлагается в виде тонкого сплошного налёта на поверхности
алюминиевых изделий.
Окись алюминия в обычных условиях с водой' не соединяется и
в гидрат окиси не превращается. Как уже говорилось, она образует
защитную плёнку на поверхности металла и предохраняет его от даль-
нейшего действия воздуха и воды.
Окись алюминия реагирует с кислотами; в результате реакции
образуется соль алюминия:
(нагревание)
А1аО, + 3H2SO4 = A12(SO4)2 + ЗН2О
сернокислый
алюминий
Окись алюминия реагирует также со щелочами, в результате
реакции образуются алюминаты, т. е. соли „алюминиевой" кислоты:
(сплавление)
А12О3 + 6КОН = 2К3А1О3 + ЗН2О
алюминат калия
Окись алюминия является примером амфотерных окислов — окислов,
реагирующих и с кислотами, и с основаниями.
§ 3. Гидрат окиси алюминия *
/ОН
А1 (ОН)3; структурная формула: А1^-ОН
ХОН
Гидрат окиси алюминия в воде растворяется очень плохо. Он
может быть получен взаимодействием щёлочи с солью алюминия:
А1С13 4-3NaOH = А1 (ОН)33NaCl
♦
366
Уравнение реакции в Йонном виде:
АГ” 4- ЗСГ 4- 3Na‘ 4~ ЗОН' = А1 (ОН)3 4- 3Na 4~ ЗСГ
Гидрат окиси выпадает в виде белого студенистого осадка, мало
растворимого в воде.
Характерной особенностью гидрата окиси алюминия является спо-
собность его реагировать с кислотами и щелочами (растворяться в
кислотах и щелочах).
В первом случае гидрат окиси алюминия реагирует как осно-
А1 (ОН)3 4-ЗНС1 = ЗН2О 4-А1С13
_ хлористый
алюминий
Уравнение реакции в йонном виде:
аг" 4- зон' 4- зн* 4- зсг = зн2о 4- аг 4- зсг
Во втором случае гидрат окиси алюминия реагирует как кислота,
и формулу его можно изобразить соответственно формулам кислот
(водород на первом месте): Н3А1О3. При этом обычно выделяется
молекула воды:
н3аю3=наю24-н2о
Уравнение реакции в этом случае представляется в таком виде:
Н3А1О3 4- NaOH = 2Н2О 4- NaA102
алюминат натрия
Уравнение реакции в йонном виде:
ЗН’ 4- АЮ'" 4-Na 4- ОН' = 2Н2О 4- Na 4~ А1О'
Таким образом, гидрат окиси алюминия проявляет амфотерные
свойства: в зависимости от условий реакции он реагирует или как
основание, или как кислота, диссоциируя в обоих направлениях;
как основание
• // АГ + зон'
А1 (ОН),
как кислота
х зн* 4- АЮз" zih’4 АЮг 4- н2о
Выше было указано, что свободный алюминий реагирует с кис:
лотами и со щелочами. Эта особенность алюминия связана с прояв-
лением амфотерных свойств гидратом окиси.
§ 4. Соли алюминия
Хлористый алюминий, хлорид алюминия А1С13; кристаллогидрат
А1С13*6Н2О. Белый кристаллический порошок, сильно гигроскопичный.
Хорошо растворяется в воде. Хлористый алюминий получают путём
непосредственного соединения элементов. Применяется безводный
367
хлористый алюминий в качестве катализатора при различных органи-
ческих синтезах.
Сернокислый алюминий, сульфат алюминия A12(SO4)3; кристал-
логидрат Al2 (SO4)3- 18Н2О.
Белый кристаллический порошок; хорошо растворяется в воде.
Сульфат алюминия получают действием серной кислоты при
нагревании на глинозём А12О3 или на чистую глину — каолин
Al2O3-2SiO2-2H2O.
Применяется сульфат алюминия в писчебумажной промышленности
при проклейке бумаги и в других случаях.
Двойная соль — сернокислый калий алюминий KAI (SO4)2; кристал-
логидрат К Al (SO4)2 • 12Н2О — алюмокалиевые квасцы.
Эта соль образует большие прозрачные кристаллы. В холодной
воде мало растворима, но очень хорошо растворяется в горячей
(в 100 г воды при 10° растворяется 9,5 г квасцов, при 90°—209 г,
при 100°—450 г). Раствор имеет вяжущий вкус П£и нагревании
квасцы легко плавятся, а затем теряют кристаллизационную воду;
при этом сильно вспучивают (см. рис. 22, А).
Квасцы являются примером двойных солей. При диссоциации та-
ких солей образуются катионы двух металлов:
KAI (SO4)2 К’ + АГ" + 2so;
Применяются квасцы в большом количестве для дубления кожи,
в качестве протравы при окраске хлопчатобумажных тканей.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В какой группе элементов таблицы Менделеева помещается алюминий?
2. Изобразите схему строения атома алюминия.
3. Сколько электронов у атома алюминия находится во внешнем элек-
тронном слое?
4. Какую валентность проявляет алюминий?
5. Что происходит при переходе атомов алюминия в йоны?
6. Каковы характерные физические свойства алюминия?
7. Какое место занимает алюминий в ряду активности металлов?
8. Почему алюминий сохраняется на воздухе при обычных условиях?
9. При каком условии алюминий энергично реагирует с кислородом воз-
духа? Что получается?
10. Что называется алюминотермией и для чего применяется эта реак-
ция?
11. При каком условии алюминий реагирует с водой? Что получается?
12. Что происходит при взаимодействии алюминия с кислотами? со щело-
чами? Какие вещества образуются в обоих случаях?
13. Какие свойства проявляются гидратом окиси алюминия? Какие он
образует йоны?
14. Приведите в молекулярном и йонном виде уравнения реакций взаимо-
действия гидрата окиси алюминия с кислотой и щёлочью.
15. Какие гидраты окислов называются амфотерными?
16. Приведите формулы солей алюминия.
17. Что представляют собой квасцы? Как они диссоциируют в растворе?
368
Г/IABAV
ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ
§ 1. Железо
Химический знак: Fe (читается: феррум).
Атомный вес равен 56.
Железо известно с глубокой древности.
' 1. Положение в периодической системе элементов и строение
атома железа. Железо занимает в периодической системе 26-е место
(порядковый номер равен 26). Это указывает, что заряд ядра атомов
железа равен -ф- 26 и что вокруг ядра вращается 26 электронов
(общий заряд их равен —26). Расположение электронов по элек-
тронным слоям: 2; 8; 14; 2.
Железо находится в VIII группе элементов, и можно было бы
ожидать проявления им восьми положительных валентностей. Однако
во внешнем электронном слое атома железа находится только
2 электрона, которые легко отрываются; в результате этого атомы
железа переходят в йоны с двумя положительными зарядами:
Fe — 20 Fe"
Достаточно легко может отрываться и третий электрон с пред-
последнего электронного слоя; в этом случае атом железа переходит
в йон с тремя положительными зарядами:
Fe — 30Fe"
С предпоследнего внутреннего электронного слоя может отры-
ваться и больше электронов. Известны соединения железа, в которых
оно шестивалентно, но эти соединения образуются при особых усло-
виях и не стойки; соединения восьмивалентного железа пока не полу-
чены. Обычно приходится иметь дело с соединениями железа двух-
валентного и трёхвалентного.
2. Физические свойства железа. Чистое железо — блестящий
с сероватым оттенком белый металл, твёрдый (см. рис. 137), тяжёлый
(см. рис. 135); плавится при высокой температуре (выше 1500°; см.
рис. 136).
Железо отличается ценными техническими свойствами (ковкостью,
тягучестью и др.). Ценным свойством чистого железа является способ-
ность намагничиваться и размагничиваться.
Сильное влияние на свойства железа оказывают примеси других
металлов и металлоидов.
3. Химические свойства железа. Железо является достаточно
химически активным металлом и в ряду активности помещается левее
водорода (см. ряд активности на стр. 47).
а) Соединение железа с кислородом и другими ме-
таллоидами. Железо достаточно легко соединяется с кислородом
и поэтому изменяется на воздухе (особенно влажном). Нагретое до
24 В. В. Левченко 369
высокой температуры, оно горит в кислороде и воздухе,/ превращаясь
в закись-окись:
(горение)
3Fe2О2 = FesO4 (или FeO-Fe2O3)
закись-окись
железа
♦
Железо легко соединяется также с металлоидами, энергично при-
соединяющими электроны, например с серой (см. стр. 120):
I I
Fe-J-S = FeS
сернистое
железо
^Энергично соединяется оно с хлором (см. стр. 74):
2Fe4-3Cl2 = 2FeCl3
хлорное
железо
Соединяется также с бромом, фосфором.
б) Взаимодействие железа с водой. При высокой
температуре железо реагирует с водой, вытесняя водород:
(высокая температура)
2Fe + ЗН2О == Fe2O3 Ц- 3H2f
Этой реакцией пользуются в технике для получения водорода.
При обычной температуре железо не вытесняет водород из воды.
Однако под совместным действием воды, кислорода воздуха и угле-
кислого газа оно подвергается коррозии, т. е. разъеданию, и пре-
вращается в ржавчину, представляющую собой гидрат окиси железа.
По. составу ржавчина приблизительно отвечает формуле:
Fe2O3-H2O
Ржавчина располагается рыхлым, пористым слоем на поверхности
металла и не предохраняет его от окисления на всю глубину; поэтому
изделие из железа при хранении в сыром месте может полностью
превратиться в ржавчину.
в) Взаимодействие железа с кислотами. Железо реа-
гирует с разбавленными кислотами; вытесняя из них водород, оно
превращается в йон с двумя положительными зарядами; сущность
реакции заключается в переходе электронов от атомов железа к Йонам
водорода:
2е
। _±_
Fe + 2H = Fe" 4-2H; 2H = H2f
370
В результате реакции получаются соли железа.
При взаимодействии с соляной кислотой:
Fe4-2HCl = FeCl24-H2f
хлористое
железо
Уравнение реакции в йонном виде:
Fe 4- 2Н‘ 4- 2СГ •== Fe" + 2СГ + H2f
При взаимодействии с серной кислотой:
Fe 4-H2SO4 = FeSO4H2f
’ сернокислое
железо
Уравнение реакции в йонном виде:
Fe — 2Н 4-SO7 = Fe” 4-SO4 4-H2f
г) Взаимодействие с солями. Железо при взаимодействии
с солями менее активных металлов вытесняет металл и переходит
в йон с двумя положительными зарядами:
* , 2е
। ।
Fe 4- CuSO4 = Си 4- FeSO4
сернокислая сернЬкислое
медь ' железо
Уравнение реакции в йонном виде:
• Fe 4- Си 4~ SO4 = Си 4~ Ре 4-SO4
4. Сплавы железа. Железо образует ряд сплавов. Сплавами,
имеющими наибольшее практическое значение, является чугун, сталь
и ковкое железо. В сплавах железа мы имеем яркий пример влияния
примесей на свойства металла.
Сплав железа, содержащий углерода от 1,7°/0 и более, называется
чугуном. Чугун отличается большой твёрдостью и хрупкостью.
Сплав железа, содержащий углерода меньше 1,7°/0 (до О,3°/о), на-
зывается сталью. Сталь отличается твёрдостью, упругостью. Осо-
бенно ценным свойством стали является её способность изменять
физические свойства в зависимости от способа охлаждения. Если на-
греть стальную проволоку или иглу докрасна и дать ей медленно
охладиться на воздухе, её можно сгибать, как проволоку из мягкого
железа. Сталь в такой состоянии называется „отпущенной“ и легко
поддаётся нужной обработке (сгибается, куётся и т. д.).
Если отпущенную сталь (например, иглу) после указанной выше
обработки снова нагреть докрасна и быстро охладить, опустив в воду,
сталь снова приобретает твёрдость, упругость и прочие характерные
для неё свойства. Такая сталь называется „закалённой".
24*
371
Если в железе содержится углерода меньше О,3°/0, сплав отли-
чается ковкостью и легко сгибается, не ломаясь: называется он
ковким железом.
Таким образом, от содержания в железе углерода зависят физи-
ческие его свойства: хрупкость, ковкость, способность свари-
ваться и пр.
Введение в сталь различных металлов позволяет получать разные
сорта её, удовлетворяющие самым разнообразным требованиям. По-
добно тому как содержание в железе углерода придаёт ему новые
свойства, так и добавка к стали других металлов сообщает ей
специальные свойства, весьма ценные в техническом отношении. Это
так называемые „ специальные4 стали, находящие широкое применение
в технике.
Каждый сорт специальной стали имеет свои достоинства. Сталь,
содержащая никель (никелевая сталь), отличается прочностью, хромо-
вая и хромоникелевая стали отличаются твёрдостью и прочностью
(эти сорта идут для машиностроения), хромовая и хромовольфра-
мовая стали отличаются наивысшей твёрдостью и идут на приготов-
ление инструментов. (Хромовая — для ударных инструментов: зубила,
штампы; хромовольфрамовая— для режущих: свёрла, резцы, фрезера.)
Сталь с определённым содержанием никеля и хрома приобретает
исключительную устойчивость в отношении различных химических
воздействий; это — нержавеющая сталь. Применяется она для изго-
товления частей аппаратуры химических заводов, а также ложек,
ножей, вилок и других изделий.
Имеются, однако, вещества, примесь которых сообщает железу
технически весьма вредные качества. Особенно вредна примесь серы,
увеличивающая твёрдость металла, но в то же время делающая его
„красноломким4 (такое железо не выдерживает обработки в нагре-
том состоянии и плохо сваривается). В связи с этим примесь серы
в хорошем железе не должна превышать О,О5°/о. Введение в сталь
марганца ослабляет вредное действие серы.
Одной из вреднейших примесей является фосфор. Он делает же-
лезо хрупким и „холодноломким4 (такое железо не поддаётся обра-
ботке в холодном состоянии).
5. Железо в природе. Железо после алюминия — самый распростра-
нённый в природе металл. В свободном состоянии оно бывает только
в падающих на землю метеоритах (осколках небесных тел). В земной
же коре железо встречается в виде различных соединений (с кисло-
родом, серой и другими элементами). Многие природные соединения
железа являются рудами; металл в них содержится в таком коли-
честве, что добывание его экономически выгодно.
Важнейшие руды железа следующие.
Магнитный железняк — руда, представляющая собой закись-окись
железа FeO«Fe2O3, или Fe3O4; она названа магнитным железняком за
проявляемые ею магнитные свойства.
Руда, представляющая собой окись железа Fe2O3, встречается
в разных формах. Руда яснокристаллического строения носит назва-
£72
ние железного блеска; руда скрытокрпсталлического строения назы-
вается красным железняком. (В мелко истолчённом виде красный
железняк применяется как красная краска под названием „мумия".)
Бурый железняк — руда, представляющая собой соединение окиси
с гидратом окиси железа: Fe2O3-2Fe(OH)3.
Сидерит — углекислое железо FeCO3.
Распространённым в природе соединением железа является также
железный колчедан, или пирит FeS2. В этом соединении железо и
сера двухвалентны, и
формулу пирита можно
структурную
представить
в таком виде:
Пирит используется в производстве
серной7 кислоты, о чём уже говори-
лось (стр. 134).
Наша страна располагает громадней-
шими залежами железных руд, кото-
рые находятся на Урале в Кривом
Роге, в Крыму. Кроме того, имеются
большие рудные залежи в районе так
называемой „Курской магнитной ано-
малии “ (район, где наблюдается не-
обычное отклонение магнитной стрелки)
и в других местах.
6. «Выплавка железа из руд. По-
лучение металла из руды является
сложным процессом. Проще получать
металл из кислородсодержащих руд.
В этом случае от руды должен быть
отнят кислород. В опыте с восстанов-
лением окиси меди кислород отнимался
водородом.
В технических условиях для отня-
тия кислорода удобнее пользоваться
Рис. 146.
Общий вид доменной печи.
углем. Таким именно способом получают из руд железо в особых
больших печах—„доменных печах", или „домнах" (рис. 146).
Домны бывают до 30 м в вышину и более 6 м в ширину.
Доменная печь (рис. 147) механически загружается коксом, ру-
дой и флюсом, которые располагают слоями: слой кокса, слой руды,
слой флюса и т. д.
В нижней части доменной печи происходит полное сгорание
угля:
горение
С + о2 = со.
373
дымовая
Рис. 147. Схема работы доменной печи.-
Подымаясь выше, углекислый газ соприкасается с раскалённым
углем и, реагируя с ним, переходит в окись углерода:
(при высокой
температуре)
С4-СО2 = 2СО
Ещё выше происходит взаимодействие между окисью углерода
и раскалённой рудой:
Fe2O8-|-CO = 2FeO-]-CO2t; FeO 4~CO = Fe + CO2f
Восстановленное железо сплавляется с углем, в результате чего
образуется чугун; он плавится и стекает в нижнюю часть домны.
Выпускают его’ через специальное отверстие—„лётку" (рис. 147).
Руда обычно содержит примеси „пустой" породы (высокоплав-
ких минералов — кварца и др.). Эти примеси усложняют выплавку
металла, так как для плавления их нужно слишком сильное нагре-
вание. Поэтому к руде при загрузке её в домну прибавляют так
называемые „флюсы", или „плавни" (чаще всего известняк); плавни,
соединяясь с пустой породой, образуют легко плавящиеся соединения,
получившие название „шлак".
Процесс образования шлака может быть представлен в виде сле-
дующих реакций.•Известняк, добавляемый к руде в качестве плавня,
разлагается:
(высокая тем-
пература)
СаСО3= CaO-pCOj4
Образующаяся окись кальция соединяется с двуокисью кремния,
содержащейся в „пустой" породе:
(высокая тем-
пература) г
CaO -|- SiO2 = CaSiO3
Образующийся кремнекислый кальций является шлаком. Он легче
расплавленного металла и поэтому собирается над ним. Выпускают
его через особое отверстие, расположенное выше отверстия для вы-
пуска чугуна.
Шлак, остывая, образует стекловидную массу. Он употребляется
в качестве строительного материала и перерабатывается в цемент.
Выделяющийся из домны газ, называемый , колошниковым газом,
содержит, кроме азота воздуха и углекислого газа, значительное
количество окиси углерода СО. Окись углерода делает колошнико-
вый газ ценным топливом, поэтому он отводится из домны по осо-
бой трубе и используется для предварительного нагревания каналов
в особых цилиндрических башнях — кауперах, показанных на
рисунке 147. Затем через нагретые кауперы пропускают воздух,
направляемый в домну. Таким путём осуществляется регулярный
обогрев поступающего в печь воздуха.
375
Пущенная в работу доменная печь действует непрерывно в тече-
ние нескольких лет. Руду, уголь и флюсы периодически добавляют
через верхнее отверстие печи (Колошник).
Царская Россия по разработке железных руд п по выплавке
чугуна занимала 5-е место в мире. Первая мировая и гражданская
войны резко отразились на хозяйстве страны; в 1916 г. потухли 36 до-
менных печей. В 1920 г. чугуна было выплавлено в 42 раза меньше,
чем в 1913 г. В сталинские пятилетки под руководством партии и
при величайшем энтузиазме масс народное хозяйство начало быстро
восстанавливаться; в конце первой пятилетки выплавка чугуна до-
стигла уже 147°/0 от уровня 1913 г. '
Не только была реконструирована южная металлургия, но и со"
здана по инициативе товарища Сталина новая угсййьно-металлургиче"
Рис. 148. Конвертор для выплавки стали из чугупа.
А — частично в разрезе; Б — в действии. /
ская база на востоке — Кузнецкий бассейн; были построены Магни-
тогорский и Кузнецкий металлургические заводы, которые явились
самыми крупными заводами в мире.
К 1934 г. СССР уже довёл выработку чугуна до 10 млн. т.
Во второй пятилетке вршли в строй 20 новых доменных печей;
были построены новые ^металлургические заводы и новые мощные
домны, которые по мощности и оборудованию не уступали лучшим
американским домнам. /
7. Переработка чугуна в ковкое железо и сталь. В доменной
печи получается не чистое железо, а сплав его с углеродом — чугун.
Для получения ковкогб железа и стали чугун надо подвергать даль-
нейшей обработке с целью освобождения его от излишнего количе-
376
подогреватель N°1 подогреватель №2
Рис. 149. Регенеративная печь для выплавки
стали из чугуна.
Внизу печи: камеры-регенераторы, служащие для
нагрева поступающих в печь воздуха и горючего
газа (подогреватель № 1); в подогреватель № 2 отве-
дены продукты горения, нагревающие его до высокой
температуры.
ства углерода. Достигается это различными способами. При более
старом способе жидкий чугун заливают в особую печь, имеющую
форму груши (конвертор Бессемера). Эта печь представляет собой
железный (клёпаный) сосуд, выложенный внутри огнеупорным кир-
пичом (рис. 148). Вмещает он 10—15 т и более чугуна.
В дне сосуда имеется ряд отверстий, через которые продувается
в него воздух. Он пронизывает расплавленную массу чугуна тонкими
струйками.
За счёт кислорода воздуха в чугуне выгорает углерод, и чугун
превращается в сталь или железо.
Выгорание углерода сопровождается выделением такого количе-
ства тепда, что температура поднимается выше 1700°. Из отвер-
стие конвертора вырывается
пламя с оглушающим гро-
хотом, и так продолжается,
пока не закончится выгора-
ние примесей.
Процесс переработки чу-
гуна в железо и сталь по
этому способу происходит
в течение короткого вре-
мени (15—20 мин.). Гото-
вое железо или сталь вы-
ливают в ковши, для чего
конвертор поворачивают.
Более совершенным спо-
собом является выплавка
железа и стали в так на-
зываемой „регенеративной
мартеновской печи“. Схема устройства её дана на рисунке 149.
Собственно печь помещается в верхней части сооружения. Выло-
жена она огнеупорным кирпичом. В неё загружают полученный
в домне чугун.
В нижней части сооружения находятся подогреватели (1 и 2),
состоящие каждый из двух камер. Для получения в печи высокой
температуры в неё подаются нагревшиеся в подогревателе (на ри-
сунке— в подогревателе № 1) горючий газ и воздух. Горение про-
исходит в самой печи и доводит температуру её до 1800°. Тепло
раскалённых отходящих газов используется для нагревания каналов
во втором подогревателе (на рисунке — в подогревателе № 2). Через
некоторое время (20—30 мин.) отходящие газы поворотом клапанов
(не показанных на рисунке) направляются в успевший охладиться
подогреватель (№ 1), а воздух и горючие газы направляются в на-
гревшийся подогреватель (№ 2). Так попеременно подогреватели
работают подобно кауперам доменной печи.
Емкость печей бывает различная: от 10 до 300 т.
Производство железа и стали в мартеновских печах может вестись
различными способами. Пуская избыток воздуха, можно постепенно
377
выжигать из расплавленного чугуна примеси, как в конверторе.
Можно также прибавлять к чугуну различный железный лом, негод-
ное ржавое железо и руду. Кислород добавляемых окислов также
идёт на выжигание из чугуна примесей, а прибавляемое железо
сплавляется с чугуном и понижает содержание углерода в общей
массе металла. Пользуясь этим, можно получить сталь требуемого
сорта. Можно переплавлять в печи и просто железный лом, превра-
щая его в годное железо, что имеет громадное экономическое зна-
чение и делает эти печи особенно выгодными.
Рис. 150. Схема электрической печи для
выплавки специальных сталей.
При производстве стали
этим способом можно добав-
лять в печь любые металлы
и получать специальные
сорта стали. Так как про-
цесс продолжается несколь-
ко часов, легкс^ можно сле-
дить за изменением сплава
и получать его с нужными
свойствами.
В последнее время осо-
бенно важное значение
приобрела выплавка ста-
ли в электрических печах
(рис. 150). Ход переработки
здесь по существу тот же,
что и в мартеновской печи,
только нужная температу-
ра получается посредством
электрического тока. При
электрической плавке мож-
но особенно точно регулировать течение процессов и благодаря
этому получать сталь высокого качества.
Таким путём теперь получают инструментальную сталь и разные
специальные сорта её (хромоникелевую и др.).
В СССР грандиозные успехи электрификации обеспечивают самое
широкое применение электрического способа получения стали и дру-
гих металлов.
В Советском Союзе получили небывалый размах машинострои-
тельная и металлообрабатывающая промышленность. В итоге выполне-
ния второй пятилетки мы стали производить больше продукции, чем
любая другая европейская страна. Товарищ Сталин в отчётном докладе
на XVIII съезде партии отметил, что по технике производства и тем-
пам роста нашей промышленности мы уже догнали и перегнали ка-
питалистические страны.
В 1940 г. было произведено чугуна в 3,6 раза больше, чем
в 1913 г., а стали — в 4,4 раза больше.
К началу Великой Отечественной войны вторая металлургическая
база, созданная на востоке страны по указанию товарища Сталина,
378
была настолько мощной, что смогла обеспечить возросшие потреб-
ности в металле военного хозяйства. И во время войны здесь про-
должалось дальнейшее её развитие: были построены и пущены в дей-
ствие новые заводы качественной стали, новые крупнейшие в Европе
домны, введён в действие трубопрокатный завод, построен крупней-
ший автомобильный завод, значительно расширен ряд других заводов.
За период послевоенной сталинской пятилетки восстановлен,
построен и введён в действие ещё ряд доменных и мартеновских
печей, конверторов, электропечей, коксовых батарей.
В 1950 г. производство чёрных металлов в целом превысило
довоенный уровень на 45°/0. Выплавка чугуна увеличилась на 29°/0,
стали — на 49°/0, производство проката — на 59°/0. Если бы из всей
стали, полученной в 1950 г., изготовить рельсы, из них можно было
бы построить железнодорожный путь, который 5 раз опояшет по
экватору земной шар.
В 'нашей стране заводы оснащены высокопроизводительным обо-
рудованием; технологические процессы значительно улучшены; ши-
роко применяется в доменном производстве дутьё воздухом, обога-
щённым кислородом. Труд рабочих становится более производитель-
ным и более лёгким.
§ 2. Окислы железа
Закись железа
FeO; структурная формула;
Fe —О
Окись железа
Fe2O3; структурная формула:
Окись железа получается, если накалить железо докрасна и быстро
опустить в воду. Железо покроется тонким налётом окиси железа}
(высокая
температура)
2Fe + ЗН2О = Fe2O3 + 3H2f
окись железа
Окись 4 железа — порошок красного цвета, не соединяющийся
е водой и трудно реагирующий с кислотами.
Закись железа образуется вместе с окисью при прокаливании
железа на воздухе, при горении железа в кислороде;
2Fe + О2 = 2FeO
закись железа
4Fe ЗО2 = 2Fe2O3
т окись железа
379
Оба окисла соединяются и образуют закись-окись железа:
Fe2O3*FeO, или Fe3O4
Этот окисел образуется также при ковке раскалённого железа
(так называемая „железная окалпна“).
Закись железа в чистом виде может быть получена путём восста-
новления водородом окиси железа. Представляет она собой чёрный
порошок; закись железа легко окисляется и переходит в окись.
Как уже говорилось, окись железа Fe2O3 и закись-окись желе-
за Fe3O4 образуют ценные железные руды.
Закись и окись железа являются основными окислами; им соот-
ветствуют основания: гидрат закиси железа и гидрат окиси железа.
§ 3. Гидраты окислов железа
Гидрат закиси железа Гидрат окиси железа
Fe(OH)2; структурная формула: Fe(OH)3; структурная формула:
ЮН ЮН
Fe/ Fe/oH
°н \он
Гидраты окислов железа — нерастворимые в воде основания.
Гидрат закиси железа получается при действии щёлочи на соли
двухвалентного железа:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
I
Уравнение реакции в йонном виде:
Fe" + SO; 4- 2Na* + 2ОН' = Fe(OH)2 + 2Na' + SO;
Гидрат закиси железа получается в виде хлопьевидного осадка
белого цвета; на воздухе он быстро окисляется в гидрат окиси же-
леза бурого цвета. Поэтому сразу после выделения осадок гидрата
закиси железа окрашивается в голубой, затем сине-зелёный и, нако-
нец, бурый цвет гидрата окиси железа.
Гидрат окиси железа получается при действии щёлочи на соль
трёхвалентного железа: ,
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
I
Уравнение реакции в йонном виде:
Fe"' + ЗС Г + 3Na‘ + ЗОН' = Fe(OH)3 3Na* + 3C1'
Гидрат окиси железа получается в виде хлопьевидного осадка
краснобурого цвета. Свежеосаждённый гидрат окиси железа легко
реагирует с кислотами, проявляя свойства сгснований.
580
Гидрат, окиси железа при прокаливании выделяет воду и пере-
ходит в окись:
(нагревание)
2Fe (ОН)3 = Fe2O3 + ЗНаО
§ 4. Соли железа
Железо образует два ряда солей соответственно проявляемой им
валентности.
Соли двухвалентного железа
(соли закиси); йон Fe”
FeCl2
хлористое
железо
Соли трёхвалентного железа
(соли окиси); йон Fe”
FeCl3
хлорное
железо
FeSO4
сернокислое же-
лезо закисное;
сульфат железа
(П)
Fe2(SO4)s
сернокислое
железо окисное;
сульфат железа
(Ш)
Наибольшее практическое значение имеет сернокислое железо
закисное FeSO4; кристаллогидрат FeSO4-7H2O называется обычно
железным купоросом; он образует светлозелёные кристаллы, хорошо
растворимые в воде.
На воздухе кристаллы теряют кристаллизационную воду (выве-
триваются); в то же время- происходит окисление соли и превраще-
ние её в сернокислое железо окисное. В результате этих процессов
кристаллы теряют зелёную окраску и рассыпаются в желтобурый
порошок. Железный купорос получают растворением железных об-
резков в серной кислоте:
Fe + H2SO4 = FeSO4 + H2f
Уравнение реакции в йонном виде:
Fe + 2Н‘ + SO" = Fe” + SO" + H2f
Железный купорос применяется для борьбы с вредителями сель-
ского хозяйства, в производстве некоторых минеральных красок, при
окраске тканей и пр.
Соли трёхвалентного железа (Fe”) легко отличить от солей двух-
валентного железа (йон Fe”), пользуясь бесцветным раствором рода-
нистого рлия KCNS (соль роданистой кислоты HCNS).
381
При добавлении к раствору соли трёхвалентного железа одной-
двух капель раствора роданистого ^<алия тотчас появляется кроваво-
красное окрашивание вследствие образования окрашенной соли —
роданового железа:
FeCl3 + 3KCNS = Fe (CNS)3 + ЗКС1
родановое
железо
(красного цвета)
Эта реакция позволяет обнаруживать весьма малые количества
солей трёхвалентного железа.
Вместо роданистого калия можно пользоваться растворами других
роданистых солей, например роданистого аммония NH4CNS.
ВОПРОСЫ ДЛЯ ПОВТОРЕНИЯ
1. В какой группе элементов таблицы Менделеева помещается железо?
2. Сколько электронов в атомах железа находится во внешнем электрон-
ном слое?
3. Какую валентность проявляет железо?
4. Что происходит при переходе атомов железа в двухвалентный йон?
в трёхвалентный йон?
5. С какого электронного слоя отрывается третий электрон при переходе
атома железа в трёхвалентный йон?
6. Какой окисел образуется при горении железа в кислороде?
7. При каких условиях происходят реакции соединения железа с серой?
хлором?
8. При каких условиях железо вступает во взаимодействие с водой?
9. Приведите уравнение реакции взаимодействия железа с разбавленными
кислотами — соляной, серной.
10. Что происходит при взаимодействии железа с солью менее активного
металла? Приведите пример.
11. Какие применяются сплавы железа?
12. Какое влияние оказывает на железо примесь углерода?
13. Какие сплавы называются чугуном? сталью?
14. Что представляет собой ковкое железо?
15. Какими свойствами отличается закалённая сталь? отпущенная
сталь?
16. Как влияют на свойства железа примеси серы, фосфора?
17. В каком состоянии встречается железо в природе?
18. Назовите главнейшие руды железа. Приведите формулы их.
19. Какие химические процессы происходят в доменной печи? Как про-
исходит восстановление, железа? Почему получается не чистое железо,'
а чугун?
20. Какими способами получают из чугуна сталь и ковкое железо?
21. Какие окислы образует железо и как они получаются?
22. Какие образуются гидраты окислов и как они получаются? Каковы их
химические свойства?
23. Какие два ряда солей образует железо?
24. Приведите формулы и названия важнейших солей железа двухвалент-
ного и трёхвалентного.
25. Как распознаются соли трёхвалентного железа и соли двухвалентного
железа?
ПРАКТИЧЕСКИЕ РАБОТЫ
1. ОБЩИЕ УКАЗАНИЯ К ПРОВЕДЕНИЮ ПРАКТИЧЕСКИХ РАБОТ
Для успешного изучения веществ необходимо овладеть на практике
соответствующими приёмами работы. Надо уметь правильно проводить
опыты и наблюдать происходящие явления, выделяя из них самое существен-
ное. Приобретение навыков достигается практическим путём; только про-
Рис. 151. Стандартный набор на рабочем столе ученика.
7 — колба (или простая склянка) с водой; 2—банка для сливания отбросов; 3 —стойка с про*
бирками; 4 — спиртовая лампочка; 5 — штатив с кольцом и держателем; о — сетка; 7— кони-
ческая колба; 8—плоскодонная колба; 9—химический стакан; 10 — лоточек для дополнитель-
ных предметов (щёточки для мытья пробирок, стеклянной палочки, трубок и пр. — по содер-
жанию работы).
водя самостоятельно опыты, можно закрепить навыки химического экспери-
ментирования. Необходимо не только знать, как выполняется тот или иной
процесс, но и уметь выполнять его с соблюдением всех указываемых ниже
детальных требований. Необходимо при этом выработать умение работать
спокойно и аккуратно, без лишней спешки, по и без чрезмерной медли-
тельности; движения производить точно и уверенно; соблюдать на рабочем
столе (рис. 151) образцовую чистоту и порядок; посуду после работы тща-
тельно мыть (рис. 152) и высушивать (рис. 153). Тщательное соблюдение
всего этого обеспечивает успешное выполнение опытов и их безопасность.
383
Ведение записей
Необходимо вести краткую, но точную запись (протокол) выполняемых
практических работ. Запись необходимо делать во время самой работы, но
не в дальнейшем — по памяти и придерживаться такой схемы ведения её:
1. Тема работы. Дата выполнения работы.
2. Исходные вещества (какие вещества взяты для реакции).
3. Условия реакции.
4. Какие вещества получились в результате реакции.
5. Уравнения происходящих реакций.
6. Схематический рисунок проделанных опытов.
7. Выводы из проделанной работы.
Приёмы работы
1. Нагревание. В лабораториях
спиртовыми лампочками (спиртовками).
Спиртовая лампочка, когда она не
Рис. 152. Щётки для мытья
посуды.
А — щётка для мытья пробирок; Б —
щётка для мытья коло; В — мягкая
проволока с комочком ваты на конце
для мытья трубок.
для нагревания обычно пользуются
горит, должна быть покрыта колпачком
(рис. 151, 4), чтобы не испарялся
спирт с фитиля (иначе её трудно
будет зажечь).
Зажигать лампочку надо только
спичкой или зажжённой лучиной. Ни-
когда не следует зажигать её от другой горящей лампочки, так как легко
можно пролить спирт и вызвать пожар.
’Гушить лампочку всегда следует только покрывая её колпачком. Ни
в коем случае нельзя дуть на пламя лампочки, так как это может вызвать
загорание спирта в лампочке и тоже привести к пожару.
Нагреваемый' предмет следует располагать над пламенем; если нужно
более сильное нагревание, то вести его надо в наиболее горячей — верхней
части пламени (пламя должно едва касаться нагреваемого предмета).
’ Если нагревание ведётся на голом огне, надо следить, чтобы стекло но
коснулось фитиля, иначе сосуд лопнет.
384
Всегда следует держать отверстие нагреваемого сосуда в сторону от
работающих, так как жидкость при перегреве может быть выброшена из
сосуда. Нарушение этого правила может привести к опасным ожогам; осо-
бенно важно* беречь глаза!
2. Растворение твёрдого вещества. Взбалтывание жидкости. На ри-
сунке 154 показаны приёмы растворения. В зависимости от количества упо-
требляемого вещества выбирается соответствующая посуда: колба, пробирка,
согнутая стеклянная трубка.
Рис. 154. Приёмы растворения.
А — растворение в колбе: для ускорения растворения жидкость взбал-
тывают; для этого колбу покачивают поворотами кисти руки; Б — рас-
творение в пробирке: для ускорения растворения пробирку встря-
хивают ударами среднего пальца; В — растворение в согнутой трубке:
для ускорения растворения трубку покачивают движением кисти руки.
Для ускорения растворения жидкость взбалтывают, двигая сосудом, как
показано на рисунках, и, если нужно, нагревают. Чтобы при нагревании
стекло не треснуло, сосуд держат высоко над пламенем и беспрерывно
перемещают поперёк пламени короткими движениями пальцев (ри<;. 155) или
всей кисти руки (рис. 156).
Нагревать колбу непосредственно над огнём опасно, так как она легко
трескается; поэтому лучше помещать её на металлическую сетку, как пока-
зано на рисунке 157.
В химических лабораториях пользуются особыми „химическими стака-
нами", отличающимися от обычных тем, что стенки их очень тонки. Благо-
даря тонким стенкам стаканы эти не лопаются при резких переменах темпе-
ратуры; в них можно нагревать и кипятить жидкость. Однако эти стаканы
очень хрупки, легко ломаются при надавливании, толчке и поэтому требуют
осторожного обращения. Нагревать их можно только на сетке (рис. 158).
Для ускорения растворения жидкость в стакане перемешивают. В лабо-
ратории это делают стеклянной палочкой. Чтобы не разбить при этом ста-
кана, на конец стеклянной палочки надевают небольшой кусочек резиновой
25 В. В. Левченко
385
трубки. Трубка эта должна прочно держаться на палочке и немного выда-
ваться за конец её; тогда при размешивании о стекло будет ударяться не
сама палочка, а резиновый наконечник и опасность повреждения стакана
будет исключена.
3. Отстаивание и сливание жидкости. Приготовляемые растворы часто
получаются мутными от взвешенных нерастворимых примесей.
Освобождение мутного раствора от нерастворимых примесей в ряде
случаев может быть достигнуто путём отстаивания. Для этого жидкость
оставляют в покое на длительное время, пока тяжёлые частицы мути не
осядут на дно. Получившийся
Рис. 155. Нагревание жидкости
в пробирке.
А — пробирка, верхняя часть ко тор oft
охвачена свёрнутой в полоску бума-
гой; Б — нагревание пробирки, удер-
живаемой за охватывающую её бу-
мажную полоску; В — деревянная дер-
жалка для пробирок, заменяющая бу-
мажную прокладку, показанную на
рисунке А. Назревая пробирку, еЛ
беспрерывно перемещают поперёк
пламени, иначе закупающая жидкость
может быть выброшена давлением
пара, образовавшегося у раскалённого
дна. (Не держать отверстие пробирки
в сторону лица — своего или соседа!}
прозрачный раствор осторожно сливают по
палочке (во избежание разбрызгивания),
как показано на рисунке 159, следя
за тем, чтобы не был затронут осадок;
последние порции жидкости оставляют.
Приём сливания жидкости с осадка
называют декантацией (от латинского
слова „деканто", означающего «сли-
ваю").
В пробирку наливают жидкость по
стенкам (рис. 160).
4. Фильтрование. Отстаивание тре-
бует длительного времени. Для более
Рис. 156. Нагревание жидкости
в согнутой трубке.
Трубку беспрерывно покачивают дви-
жением кисти руки.
быстрого освобождения мутного раствора от нерастворимых примесей его
фильтруют, т. е. пропускают через фильтр — материал, который задержи-
Baet нерастворимые частицы (крупные скопления молекул) и пропускает
раствор, состоящий из отдельных молекул.
В лабораториях обычно применяют особую, фильтровальную бумагу.
Она отличается от писчей бумаги тем, что не подвергается дополнительной
обработке — пропитке клеящими веществами, закрывающими её поры.
В фильтровальной бумаге поры остаются открытыми, поэтому она не только
впитывает жидкость, но и пропускает её сквозь себя.
386
Задерживаются фильтровальной бумагой только частицы, размер которых
Для лабораторных нужд изготовляется
превышает величину пор бумаги.
Рис. 157. Нагревание жидкости
в колбе на сетке.
Рис. 158. Нагревание жидкости
в химическом стакане.
Стакан помещают на сетку. Жидкость раз-
мешивают стеклянной палочкой с наконеч-
ником из кусочка резиновой трубки (чтобы
не разбить стакан при размешивании).
Для большей устойчивости гордо колбы за-
крепляют в зажиме держателя штатива.
Рис. 159. Декантация.
Жидкость сливают с осадка, не взму-
чивая его. Сливание ведётся по па-
лочке.
Рис. 160. Наливание жидкости
в пробирку.
Жидкость наливают по стенке; при проведе-
нии опытов все прилитые растворы должны
занимать не более */< — Ча объёма про-
бирки.
фильтровальная бумага с порами различной величины. Обычная промока-
тельная бумага отличается от лабораторной — фильтровальной бумаги —
лишь ббльшими размерами пор и более грубой выделкой.
25*
387
Фильтрование через фильтровальную бумагу требует определённого
уменья и прежде всего уменье складывать фильтр.
а) Складывание фильтра. На рисунке 161 показано, как
складывается фильтр. При изготовлении фильтра необходимо исходить из
размера употребляемой воронки. t
Фильтр следует складывать из приблизительно квадратного куска филь-
тровальной бумаги, стороны которого по размерам немного больше двойной
глубины воронки. Этот квадрат складывают вчетверо (рис. 161, 1—3) и, как
показано на рисунке 161,4, прикладывают к внутренней стороне стенки воронки;
при этом фильтр не должен вводиться на всю глубину воронки. Фильтр,
помещённый внутрь воронки указанным образом, прижимают пальцами
левой руки к стенке воронки, а пальцами правой руки отгибают его края,
выступающие за край воронки. В результате такой обработки на фильтре
Рис. 161. Приготовление фильтра.
получается отпечаток края воронки (рис. 161, 5). После этого фильтр выни-
мают из воронки и обрезают ножницами по оставшемуся на нём следу от
края воронки; в результате получается сложенный вчетверо круг
(рис. 161, 6).
Отгибают один слой вчетверо сложенного фильтра и получают конус
(рис. 161, 7), который вводят в воронку. Как показано на рисунке 162, вло-
женный в воронку фильтр не должен доходить до края воронки на 5—6 мм.
Нельзя, чтобы он был вровень с краем воронки, а тем более выдавался
над ним. Если фильтр слишком велик, раствор будет подниматься по бумаге
и стеклу и переходить за край воронки.
б) Процесс фильтрования. Перед тем как налить раствор,
фильтр по всей поверхности необходимо смочить чистым растворителем.
Если работа идёт с водным раствором, фильтр должен быть смочен водой,
а излишек воды слит через край воронки. Если фильтр не смочить, прохо-
дящий через него раствор, или, как его обычно называют, фильтрат, не
388
помещают на дно
освободится полностью от взвешенных примесей (они пройдут через фильтр
вместе с первыми порциями воды), и жидкость останется мутной.
Наливать раствор в фильтр также надо с соблюдением ряда правил.
Чтобы жидкость не разбрызгивалась, её следует наливать по стеклянной
палочке, как показано на рисунке 162.
Жидкости надо наливать столько, чтобы она не доходила до края
фильтра на 3—5 мм, иначе она будет всасываться фильтровальной бумагой
вместе с мутью переходить за край. бумаги и попадать в фильтрат. Ещё
сильнее будет загрязняться фильтрат, если жидкость наливается до краёв
фильтра или выше. При соблюдении же всех вышеуказанных правил мутный
раствор после фильтрования даёт совершенно прозрачный фильтрат.
В тех случаях, когда взвешенные в жидкости частицы не особенно
мелки, от них можно освободиться фильтрованием через вату. Комок ваты
энки и смачивают водой; края ваты должны пристать
к стенкам воронки. После этого осто-
рожно направляют на вату по палочке
струю фильтруемой жидкости.
задок
Сливать
жидкость с
осадка,не
взмучивай ат»
Жидкость на
ливать не до
самого нрав
фильтра
Рис. 163. Выпаривание жидкости
в чашке на сетке.
Жидкость перемешивают стеклянной палочкой
(энергичнее к концу выпаривания) для преду-
преждения разбрызгивания.
Рис. 162. Декантация И фильтро- р;е держать близко лщо! Беречь глаза от
ВЗНИе. возможных брызг!
5. Выпаривание. Выпаривание обычно проводят в фарфоровой чашке,
которая отличается огнестойкостью. Выпариваемый раствор следует нали-
вать не более чем на сантиметр ниже края чашки, иначе жидкость будет
выплёскиваться при кипении.
Нагревание обычно не ведут непосредственно на огне из-за опасности
перегрева; при перегреве всё содержимое чашки может быть выброшено
с большой силой и причинить опасные ожоги близко стоящим (!).
а) Выпаривание в чашке на сетке (рис. 163). Более спокойно
идёт выпаривание, если между чашкой и огнём поместить металлическую
сетку. Однако и в этом случае необходимо беспрерывно размешивать рас-
твор стеклянной палочкой и беречь глаза, держа лицо подальше. Особенно
энергично следует размешивать раствор под конец выпаривания, когда
389
начинает выделяться осадок, так как в этом случае разбрызгивание жидко-
сти может происходить легче всего.
При выпаривании раствора поваренной соли надо считаться ещё
с одной особенностью. Когда выделившаяся соль начинает высыхать,
а чашка сильно нагрета, мелкие кристаллики соли растрескиваются и раз-
летаются в стороны; в результате этого в чашке может ничего не остаться,
а вся соль окажется разбросанной на столе, иногда даже на далёком рас-
стоянии (опасность ожога глаз раскалёнными крупинками соли!).
Размешивание в данном случае не устраняет разбрасывания высыхаю-
щей соли; единственное средство — не допускать нагрева чашки выше 100°.
Для достижения этого рекомен-
Рис. 164. Выпаривание в чашке
на самодельной водяной бане.
дуется под конец выпаривания
применять следующий приём, ко-
торым хорошо пользоваться и во
всех других случаях выпаривания
в чашке. Когда воды останется
стекло прохладней
Рис. 165. Выпаривание капли
жидкости на куске стекла.
Поддерживать слабый н равномерный на*
грев, держа стекло высоко над пламенем
и всё время двигая им в направлении
стрелок.
так мало, что выделившаяся твёрдая соль ею уже не покрывается, надо
прекратить нагревание и, продолжая размешивать, дать воде испаряться
от тепла нагревшейся чашки.
б) .Выпаривание в чашке на водяной бане. Лучшим, хотя
и медленным, способом выпаривания является выпаривание на водяной бане.
Достаточно удобно пользоваться самодельной [водяной баней, в качестве
которой может служить жестяная банка (консервная), подобранная по раз-
меру чашки, как показано на рисунке 164. В этом случае чашка нагре-
вается водяным паром, который имеет температуру 100°.
Так как при таком нагреве чашка не перегревается, устраняется опас-
ность разбрызгивания жидкости и разбрасывания высыхающего вещества;
особого ухода за выпариванием здесь не требуется, надо только время
от времени подливать в баню воду по мере её выпаривания.
390
в) Выпаривание на стекле. В тех случаях, когда надо устано-
вить, содержатся ли в жидкости какие-либо нелетучие вещества, доста-
точно выпарить только одну каплю. Это удобно делать на куске простого
стекла.
Выпаривать на стекле надо с большой осторожностью, так как при
сильном нагревании .стекло может лопнуть. Чтобы этого не случилось,
стекло надо держать высоко над пламенем (рис. 165) и всё время двигать
поперёк пламени для обеспечения равномерного нагревания всей поверх-,
ности. Держать стекло надо пальцами за угол, обернув его в несколько
раз сложенным кусочком бумаги.
II. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ОКИСЛЫ, ОСНОВАНИЯ,
' КИСЛОТЫ, СОЛИ«1)
§ 1. Основания
1. Ознакомление с основаниями. Растворимость их. Взаимодействие
с индикаторами
Поместите (рис. 166, 167, 168) в 6 пробирок по 5—10 капель воды
или на кусок стекла отдельно друг от друга 6 капель воды.
Внесите в каждую пробирку или каждую каплю на стекле (рис. 169)
одно из указанных ниже веществ. Для капли па стекле возьмите вещество
в объёме около спичечной головки, а для воды в пробирке возьмите веще-
ство в большем количестве (в 5—10 раз больше).
Рис. 167. Перенесение капель
жидкости трубкой.
1 — опустив трубку в жидкость, закрыть
указательным пальцем е8 отверстие; вы-
нуть трубку, не отнимая пальца; 2—при-
поднимая палец, выпустить нужное- коли-
чество капель.
Рис. 166. Перенесение капель
жидкости пипеткой с резиновым
наконечником.
1 — сдавить резиновый наконечник и, раз-
жав пальцы, набрать жидкость в пипетку;
2—сжимая наконечник, выдавить нужное
количество капель жидкости.
1) Для проведения опытов с малым количеством веществ Главснабиросом выпущен набор
необходимой посуды.
391
Возьмите следующие вещества: едкий натр, едкое кали, гидрат окиси
кальция, гидрат окиси меди, гидрат окиси железа и др. Стеклянной палочкой
разотрите эти вещества в воде.
Рис. 168. Перенесение капли
жидкости стеклянной палочкой.
1 — опустить палочку в жидкость;
2— быстро вынуть палочку и, держа
её наклонно, перенести каплю в нуж-
ное место.
Рис. 169. Перемещение твёрдого вещества
в каплю жидкости.
А — кусочки твёрдого вещества расположены рядом
с каплей жидкости; вещество перемещается с по-
мощью палочки в каплю жидкости; Б — на стекле
слева — остатки твёрдого вещества; справа — кру-
пинки твёрдого вещества в капле жидкости.
Прикоснитесь к каждой капле красной лакмусовой бумажкой и бесцвет-
ной фенолфталеиновой бумажкой. Отметьте изменение окраски индикаторов
в первых трёх случаях, указывающее на растворимость в воде этих
Рис. 170. Получение углекислого газа
и пропускание его в жидкость.
Л—приборчик для получения углекислого газа;
Б — пропускание углекислого газа в раствор.
оснований (щёлочи). Сохранение
окраски индикаторов без измене-
ния в пробирках или каплях с гид-
ратом окиси меди и с гидратом оки-
си железа укажет на нераствори-
мость в воде этих оснований.
Потрогайте пальцем растворы
едкого кали и едкого натра; потри-
те смоченный палец другим паль-
цем — какое чувствуется ощу-
щение?
Смочите этими растворами бу-
магу и оставьте на некоторое вре-
мя. Отметьте пожелтение бумаги,
разрушающейся под действием едкой
щёлочи.
2. Взаимодействие оснований с кислотными окислами
Соберите приборчик для получения углекислого газа (рис. 170, Л). На-
лейте в согнутую трубку или пробирку немного известковой воды и про-
пускайте в неё углекислый газ (рис. 170, Б) до появления мути (ур. р.) 1),
1) Уравнение реакций.
392
3. Взаимодействие оснований с кислотами
а) Поместите в согнутую трубку (рис. 154, В) или в пробирку порошок
гидрата окиси меди в объёме 1—2 спичечных головок и 3—4 капли рас-
твора серной кислоты. Если опыт проводится в пробирке, поместите в неё
указанных веществ в 5 раз больше.
Взболтайте жидкость* как показано на рисунке 154.
Отметьте образование голубого раствора, указывающее на растворение
взятого основания с образованием соли голубого цвета — сернокислой меди
(ур. р.). Поместите на стекло каплю получившегося раствора и нагрейте её
(см. рис. 165) до испарения воды. Наблюдайте выделение твёрдой соли.
б) Проделайте такой же опыт с другими основаниями, например с гид-
ратом окиси железа, и беря разные кислоты — серную, соляную (ур. р.).
4. Реакция нейтрализации
Налейте в колбочку разбавленный раствор щёлочи и прибавьте 1—2 капли
фенолфталеина до интенсивного окрашивания жидкости.
Прибавляйте в жидкость,
всё время взбалтывая её, по ка-
плям раствор серной кислоты
из бюретки (см. рис. 13) или
мензурки (см. рис. 12).
Как только жидкость обес-
цветится, перелейте её в чашку
(или одну каплю поместите на
стекло) и выпарьте (см. рис. 163,
164, 165). Рассмотрите выделив-
шиеся кристаллы соли (ур. р.).
5. Взаимодействие щелочей
Рис. 171. Проведение реакции на куске
стекла между каплями растворов.
с солями
Поместите на стекло (рис.
171) по капле (или в пробирки
по 10—20 капель) растворов медного купороса и щёлочи. Соедините капли
на стекле при помощи стеклянной палочки (рис. 171) или слейте вместе рас-
творы, налитые в пробирках (см. рис. 160); наблюдайте выпадение осадка
гидрата окиси меди голубого цвета (ур. р.).
Проделайте то же с сернокислым магнием, сернокислым железом и др.
Наблюдайте выпадение осадков соответствующих гидратов окисей (ур. р.), не
растворимых в воде.
§ 2. Кислоты
1. Ознакомление с кислотами. Взаимодействие кислот с индикаторами
а) Возьмите в заранее подготовленных пробирках по 3—4 капли концен-
трированных кислот: серной, азотной, соляной. Для каждой кислоты запишите
название, формулу, физическое состояние, цвет, запах (нюхать осторожно, как
показано на рисунке 26).
393
Наблюдайте выделение „дыма" в пробирках с кислотами азотной, соляной
(дымящие кислоты).
Исходя из наличия запаха и „дыма", отметьте летучие и нелетучие
кислоты.
Стеклянной палочкой перенесите каплю каждой жидкости на бумагу.
Через несколько минут (5—10) отметьте окраску пятна и изменение проч-
ности бумаги, для чего пробуйте прорывать её палочкой (после каждой ки-
слоты палочку обмывайте водой и насухо вытирайте).
б) Прибавьте в пробирки по 5—10 капель воды и взболтайте жидкости
(см. рис. 154, Б). Смочите полученными растворами кислот синюю лакмусовую
бумажку и наблюдайте её покраснение. * *
2. Взаимодействие кислот с металлами
В пробирки с полученными в предыдущей работе растворами кислот
поместите по 5—6 маленьких кусочков цинка или железа или перенесите
на стекло по капле кислот из пробирок; в капли поместите по 2—3 кусочка
металла примерно в объёме спичечной головки (рис. 172).
раствор
твёрдое вещество
Рис. 172. Проведение реакции между
твёрдым веществом и каплей
жидкости.
Рис. 173. Проведение реакции
между твёрдым веществом и
жидкостью в трубке.
Наблюдайте течение реакции; подбавляйте кусочки металла по мере их
растворения (часть металла должна остаться неизрасходованной по окончании
реакции).
Когда реакция полностью прекратится, осторожно подогрейте капли рас-
твора на стекле высоко над пламенем (см. рис. 165); наблюдайте образование
кристаллов соли по краям капель по мере испарения воды.
3. Взаимодействие кислот с основным окислом
В согнутую трубку (рис. 173) или пробирку поместите немного окиси
меди (в объёме 2—3 спичечных головок) и прибавьте 3—5 капель разбав-
ленной* 1) серной кислоты (в пробирку реактивов возьмите в 5 раз больше).
Нагрейте жидкость почти до кипения в наблюдайте растворение окиси меди.
Дайте жидкости охладиться, добавьте равный объём воды и наблюдайте
голубую окраску раствора от образовавшегося медного купороса (ур. р.).
') Кислоту берут в разбавлении: на 2 части концентрированной кислоты (по объёму)
1 часть воды. Это обычно показывают таким обозначением; (2:1).
Так будет показываться в дальнейшем разбавление кислот, употребляемых в опыте.
894
4. Взаимодействие кислот с солями
а) Налейте в пробирку 1 мл раствора серной кислоты и прибавьте не-
сколько капель раствора хлористого бария или поместите на стекло по капле,
обоих растворов; соедините капди (см. рис. 171).
Наблюдайте появление осадка при соединении растворов (ур. р.).
б) Проделайте то же, взяв растворы соляной кислоты и азотнокислого
серебра (ур. р.).
в) Поместите в пробирку немного соды и раствора кислоты или поме-
стите на стекло немного соды, а рядом — каплю разбавленной кислоты,
(рис. 169); стеклянной палочкой перенесите в кислоту несколько крупинок соды.
Наблюдайте выделение пузырьков углекислого газа, образующегося
в результате выделения угольной кислоты (ур. р.), которая распадается н<"
углекислый газ и воду (ур. р.).
§ 3. Соли
1. Взаимодействие солей с металлами
а) Поместите на стекло отдельно две капли почти насыщенного рас-
твора медного купороса или в две пробирки по 10—20 капель; - положите
в один раствор (см. рис. 172) хорошо вычищенный кусочек цинка, а в другой —
железа (проволочку, гвоздик). Наблюдайте покрытие металлов медью и
изменение окраски растворов (при более длительном стоянии) в результате
образования новых солей: бесцветного сернокислого цинка (ур. р.) и зеленова-
того цвета сернокислого железа (ур. р.).
б) Проделайте то же, взяв раствор азотнокислого свинца и кусочек цинка
(ур. Р-)> раствор азотнокислого серебра и медную проволоку (ур. р.).
2. Взаимодействие солей с солями
Налейте в пробирки по 1 мл растворов двух из указанных ниже солей
или поместите на стекло рядом по капле этих растворов и соедините капли
(см. рис. 171).
Для опыта возьмите растворы следующих солей: хлористого бария и
сернокислого натрия, азотнокислого калия и хлористого натрия, азотноки-
слого серебра и хлористого натрия, сернокислой меди и азотнокислого калия,
сернокислого натрия и азотнокислого калия. Наблюдайте выпадение осадков
в отдельных случаях (ур. р.). Какие реакции были обратимыми? Какие — необ-
ратимыми?
Ш. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „РАСТВОРЫ"
1. Получение растворов
В одну пробирку поместите 3—5 кристалликов марганцевокислого калия,
в другую 3—5 кристалликов поваренной соли, в третью — немного глины
(в объёме горошины), в четвёртую 2—3 капли жидкого масла (или керосина).
В каждую пробирку прилейте воды по 3—5 мл. Наблюдайте за растворением.
В какой пробирке оно заметно?
Для ускорения растворения взбалтывайте жидкость. В каких случаях
жидкость получилась прозрачная и в каких мутная?
895
Оставьте пробирки в покое и дайте жидкости отстояться. Что наблю-
дается в каждой пробирке после отстаивания? В каких случаях произошло рас-
творение взятого вещества в воде? Где образовались суспензия и эмульсия?
Какие признаки отличают раствор от суспензии и эмульсии?
2. Тепловые явления при растворении
Поместите в одну пробирку кусочек твёрдой щёлочи (в объёме четверти
горошины), а в другую — азотнокислого аммония (в объёме горошины). В каж-
дую пробирку прилейте около 1 мл воды.
Приложите руку к дну пробирки; отметьте изменение температуры рас-
твора в каждом случае. ♦
Объясните, чем вызывается охлаждение раствора, разогревание рас-
твора.
3. Влияние температуры на растворимость твёрдого вещества
Налейте в пробирку 3—5 мл воды. Растворите в ней селитру или дру-
гую соль, прибавляя её небольшими порциями и всё время взбалтывая
Рис. 174. Фильтрование небольшого коли-
чества жидкости.
жидкость. Когда селитра пере-
станет растворяться и присы-
панная порция её останется на
дне, т. е. получится насы-
щенный раствор, нагрейте
жидкость. Наблюдайте полное
растворение оставшейся на дне
селитры. Прибавьте ещё не-
сколько порций селитры и, на-
гревая, добейтесь полного рас-
творения. После этого поставьте
пробирку в стойку, а в другой
пробирке проделайте то же с
поваренной солью.
Дайте остыть обоим рас-
творам и наблюдайте выделе-
ние кристаллов. В каком слу-
чае растворимость сильнее из-
меняется при изменении тем-
пературы?
Поместите на стекло по капле полученных насыщенных растворов после
их охлаждения. Наблюдайте выделение кристаллов по мере испарения воды.
4. Очистка от нерастворимых примесей загрязнённой поваренной соли
Стадии работы:
а) Соберите по рисунку 174 нужное для работы оборудование.
б) Приготовьте в колбочке или в пробирке раствор загрязнённой соли;
для ускорения растворения жидкость взбалтывайте или нагревайте; колбочку
нагревайте на сетке, а пробирку — непосредственно над огнём.
396
в) Приготовьте фильтр из фильтровальной бумаги (см. рис. 161).
г) Смочите его водой.
д) Профильтруйте приготовленный раствор соли (рис. 174), соблюдая ранее
указанные правила (см. стр. 388).
е) Налейте в фарфоровую чашку немного профильтрованного раствора
и выпарьте его на водяной бане (см. стр. 390).
Соберите на бумагу полученную очищенную соль и сравните её с неочи-
щенной солью. Как изменился внешний вид соли после очистки?
5. Очистка загрязнённого медного купороса
Проведите очистку „медного купороса таким же путём, как делалось
в предыдущей работе с поваренной солью. Выпаривание в этом случае можно
провести, нагревая чашку на сетке с соблюдением ранее указанных прави"
(см. стр. 389).
Когда полностью исчезнет го-
Рис.
6. Выделение кристаллизационной воды из медного купороса
Немного медного купороса измельчите в порошок растиранием в фар-
форовой ступке и прокалите его на конце сломанной наискось стеклянной
трубки (рис. 175).
Наблюдайте побеление порошка и выделение паров воды, оседающих
в виде капель на холодных частях трубки,
лубая окраска (ур. р.), прекратите
нагревание и дайте порошку остыть.
Рассмотрите получившийся безвод-
ный медный купорос, высыпав его
на кусок стекла.
Поместите на стекло рядом с по-
рошком безводного медного купо-
роса каплю воды, переместите в неё
порсшэк и наблюдайте быстрое по-
синение его (ур. р.). Прикоснитесь
пальцем и отметьте разогревание.
Если порошок был нагрет выше
653°, могло произойти более глубокое
разложение медного купороса с образованием чёрного продукта — окиси
меди. В этом случае смачивание водой уже не приводит к восстановлению
первоначального вещества и синяя окраска не появляется.
175. Прокаливание твёрдого
вещества на конце трубки.
IV. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ХЛОР*
1. Получение хлора в малых количествах
а) Простейший опыт. Поместите на стекло каплю разбавленной
соляной кислоты; в неё поместите 5—6 кристалликов марганцевокислого
калия (см. рис. 169).
Наблюдайте выделение пузырьков газа. Понюхайте его и отметьте
характерный запах.
397
Подержите над каплей кусочек бумаги, смоченной раствором фуксина,
и наблюдайте обесцвечивание его. Стекло сразу же после опыта опустите
в сосуд с водой для прекращения выделения хлора.
б) Опыт в трубке. Поместите в согнутую трубку (рис. 176, Л)
немного марганцевокислого калия (в объёме 5—7 спичечных головок). Плотно
закройте отверстие длинного колена трубки пальцем или бумажной пробочкой.
Прибавьте через короткое колено трубки (рис. 176, Б) 3—5 капель разбавлен-
ной соляной кислоты (1:1) и наблюдайте выделение пузырьков хлора (ур. р.).
Осторожно понюхайте выделяющийся газ.
Рис. 176. Получение хлора в малом количестве.
А — первая стадия работы; Б — вторая стадия работы; В — действие выделяющегося газа на
смоченную фуксином бумагу, поднесённую к отверстию трубки.
Рассмотрите окраску газа, поместив за трубкой лист белой бумаги.
Приложите к отверстию трубки кусочек бумаги, смоченной раствором
фуксина (рис. 176, В). Отнимите бумажку и убедитесь в обесцвечивании
фуксина (белое пятно на красном фоне). Приложите к отверстию трубки смо-
ченный водой кусочек цветной материи и наблюдайте обесцвечивание её.
в) Опыт в пробирке. В пробирке опыт проводится с тем же коли-
чеством веществ.
2. Получение хлора в большем количестве
Соберите прибор по рисунку 177 (удобнее собирать его, пользуясь при-
способлением к пробирке, указанным на рисунке 178, или пробирками с боко-
вой отводной трубкой, показанной на рисунке 179).
Собрав прибор, испытайте, держит ли он. Для этого приложите к колбе
ладонь руки. Если через жидкость начнут проходить пузырьки воздуха,
398
расширяющегося от тепла руки,— это покажет, что прибор держит. В про-
тивном случае проверьте, плотно ли вставлены пробки, нет ли в них щелей
и пр., и устраните обнаруженные недочёты.
Рис. 177. Прибор из пробирок для получения хлора в больших
количествах. Установка в готовом виде.
В колбочку положите немного марганцевокислого калия и прилейте соля-
ной кислоты (1; 1), как показано на рисунке.
Обратите внимание в начале опыта
проходя через воду в
-газоотводная
труби а
L-резиновая
1 тру бна
что пузырьки хлора,
объёме,
цвет.
5—10 минут от-
вытяжной шкаф
& S’-об разная трубм!
Д (разрез)
Рис. 178. Приспособление
к пробирке для сборки
приборов. Приспособле-
ние из Т-образной труб-
ки, позволяющее обхо-
диться одним отверстием
в пробке.
начале опыта на то,
четвёртой пробирке, уменьшаются в
а вода окрашивается в желтозелёный
Объясните это явление. Через
делите колбу,
или наружу и
доверху воду
ния реакции.
бирки одну от другой.
В первую пробирку с хло-
ром присыпьте цемного нагре-
того возможно сильнее по-
рошка железа и наблюдайте
происходящую реакцию (ур. р.).
(Пробирки после проведения
опыта тотчас же опускайте
в чашку с водой.)
Во вторую пробирку
стите раскалённую тонкую
ную проволочку (ур. р.).
В третью пробирку
стите полоску фильтровальной
бумаги, смоченную скипидаром
(УР- Р-).
перенесите её в
прилейте в неё
для прекраще-
Отделите про-
опу-
мед-
опу-
Рис. 179. Пробир-
ка с боковой
трубкой, более
удобная для сбор-
ки приборов.
399
В четвёртую пробирку опустите смоченные водой полоски цветной
материи.
Объясните причину белящего действия хлора (ур. р.).
3. Получение хлористого водорода и соляной кислоты
в малых количествах
Закройте отверстие длинного колена согнутой трубки (рис. 180) бумаж-
ной пробочкой. Через короткое колено насыпьте в трубку немного поварен-
ной соли (в объёме 3 5 спичечных головок) и прибавьте 3—5 капель кон-
центрированной серной кислоты. Наблюдайте выделение хлористого водо-
рода (ур. р.). Для усиления выделения газа трубку можно слабо подогреть.
серная
ислота
поваренная соль
Рис. 180. Получение хлористого
водорода в трубке.
синяя лакмусовая
бумажка
Рис. 181. Растворение выделяющегося
газа в капле воды.
Поднесите к отверстию трубки смоченную водой синюю лакмусовую
бумажку; почему изменилась её окраска?
Поднесите к отверстию трубки палочку с каплей воды (рис. 181).
Подержите её 1/2—1 минуту, а затем перенесите каплю на стекло.
Трубку погрузите в чашку с водой для прекращения реакции. Смочите
помещённым на стекле водным раствором хлористого водорода лакмусовую
бумажку. Как изменилась её окраска? Почему?
Положите в каплю 2—3 крупинки соды. Наблюдайте выделение пузырь-
ков углекислого газа (ур. р.).
4. Получение хлористого водорода в большем количестве
а) Насыпьте в пробирку (рис. 182) немного поваренной соли и прилейте
немного серной кислоты (2:1), чтобы соль была только покрыта ею. Про-
бирку закройте пробкой с газоотводной трубкой. Конец трубки опустите
в сухую пробирку; отверстие её закройте комочком ваты. Нагрейте
осторожно пробирку с поваренной солью и наблюдайте происходящую
реакцию (ур. р.).
Когда из второй пробирки через вату начнёт выходить белый „дымок*,
прекратите нагревание и медленно выньте трубку из пробирки. Отверстие
пробирки закройте пальцем (рис. 182, Б). Рассмотрите собравшийся в про-
бирке хлористый водород.
б) Переверните пробирку и опустите её вверх дном в сосуд с водой
(рис. 182, В). Отнимите палец и наблюдайте подъём воды в пробирке.
Объясните наблюдаемое явление.
400
Рис. 182. Получение хлористого водорода (опыт в пробирке).
А — прибор в готовом виде: а — пробирка, в которой проводится реакция; б — пробирка для
собирания хлористого водорода; Б — пробирка с собранным газом; В — пробирка с газом
в опрокинутом виде опущена в стакан с водой: газ растворяется в воде, и жидкость
заполняет пробирку.
5. Распознавание соляной кислоты и её солей
Указанные ниже опыты проведите, соединяя на стекле капли растворов
перечисленных веществ или сливая растворы в пробирке.
а) Проведите реакции взаимодействия между раствором азотнокислого се-
ребра и растворами следующих кислот: соляной, серной, азотной. Отметьте
образование осадка только при действии раствора соляной кислоты (ур. р.) и
отсутствие осадка при действии растворов других кислот.
б) Проведите реакции взаимодействия между раствором азотнокислого се-
ребра и растворами следующих солей: хлористого натрия, азотнокислого натрия,
сернокислого натрия, углекислого натрия.
Отметьте выделение осадков хлористого серебра (ур. р.) и углекислого
серебра (ур. р.).
Подействуйте на осадки разбавленной азотной кислотой (1:1) (на стекло
добавьте по капле её, а в пробирки по 1 мл). Наблюдайте растворение только
осадка углекислого серебра (ур. р.); осадок хлористого серебра остается без
изменения.
Как распознаются соляная кислота и её соли?
V. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „БРОМ*
1. Извлечение брома из бромной воды
Налейте в пробирку немного бромной воды, а затем 1/2 мл бензина (бен-
зола или керосина).
Зажав пальцем отверстие, встряхните и дайте отстояться жидкости. Исходя
из окраски обоих слоёв жидкости, объясните, где находится большая часть
брома.
26 в. В. Левченко
401
2. Получение брома в небольшом количестве
h) Поместите в согнутую трубку (рис. 183) немного порошка бромистого
натрия, в объёме 3—5 спичечных головок, столько же порошка двуокиси мар-
ганца и 3—4 капли концентрированной серной кислоты. Присоедините два
приёмника с водой (воду возьмите в количестве, указанном на рисунке). Слабо
нагрейте и наблюдайте выделение бурых паров брома (ур. р.).
Нагревайте трубку, пока вода в первом приёмнике не окрасится в оран-
жевый цвет.
Отделите приёмники с получившейся в них бромной водой, а трубку
опустите в чашку с водой для прекращения реакции.
б) В первый приёмник прибавьте 1—2 капли бензина (керосина или бен-
зола); зажав отверстие пальцем, встряхните. Отметьте окраску бензина, в ко-
торый перешла бблыпая часть брома. *
в) Во второй приёмник прибавьте немного порошка магния и, зажав от-
верстие пальцем, встряхните. Отметьте обесцвечивание раствора в результате
перехода брома в связанное состояние (ур. р.).
Рис. 183. Получение брома в малом количестве.
В согнутой трубке реагирующие вещества NaBr, МпО3, H2SO4.
В первом приёмнике вода налита до половины высоты просвета
трубки; во втором приёмнике вода закрывает просвет трубки.
Каплю обесцвеченного раствора перенесите на стекло и нагрейте, держа
высоко над пламенем!, до испарения жидкости. Рассмотрите оставшуюся
соль.
г) Оставшуюся во втором приёмнике жидкость слейте в пробирку так,
чтобы в неё не попало ни одной крупинки магния. Добавьте в неё с помощью
тонкой трубки 1—2 капли хлорной воды (см. рис. 167) и наблюдайте появление
жёлтой окраски от выделившегося в свободном состоянии брома (ур. р.). До-
бавьте сюда 1—2 капли бензина и встряхните.
3. Вытеснение брома из его соли
Налейте в пробирку раствор бромистого калия и прилейте немного хлорной
поды. Встряхните жидкость; объясните причину пожелтения её.
Прибавьте !/г мл бензина (бензола, керосина) и встряхните жидкость, зажав
отверстие пальцем. Дайте отстояться жидкости. Удалось ли обнаружить сво-
бодный бром?
408
4. Получение нерастворимой бромистой соли
а) Поместите на стекло каплю раствора бромистого калия или другой бро-
мистой соли и каплю раствора азотнокислого серебра. Соедините капли и на-
блюдайте выпадение осадка бромистого серебра (ур. р.). Опишите его окраску.
Отличается ли она от окраски хлористого серебра?
б) При проведении этого опыта в пробирке налейте в неё около 1—2 мл
раствора бромистой соли, а раствор азотнокислого серебра прибавляйте каплями
до образования хорошо заметного осадка.
VI. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ЙОД*
1. Возгонка йода
Поместите посередине прямой трубки или в пробирку несколько кристал-
ликов йода и нагрейте их (рис. 184). Наблюдайте образование фиолетовых паров
и осаждение кристаллов йода на холодных частях стекла. Дайте трубке (про-
бирке) остыть и наблюдайте за переходом паров йода в твёрдые кристаллы,
минуя жидкое состояние (возгонка).
Рис. 184. Возгонка малого количества йода. Рис. 185. Получение йода.
Опыт в трубке.
2. Получение йода
Поместите в пробирку (рис. 185) немного йодистого калия (в объёме
3—5 спичечных головок), столько же двуокиси марганца и 3—5 капель кон-
центрированной серной кислоты. Осторожно нагрейте и наблюдайте появление
фиолетовых паров и осаждение кристаллов йода на холодных стенках пробирки.
Дайте остыть. Прилейте 1 мл бензина (или керосина) и, зажав пальцем
отверстие, встряхните. Отметьте окраску бензина, в который перешла большая
часть йода.
3. Растворимость йода
В три пробирки поместите по небольшому количеству йода. В первую про-
бирку прилейте до х/2 воды, во вторую — немного спирта, в третью — бензина
(керосина или бензола).
Встряхните пробирки и наблюдайте растворение йода во взятых раство-
рителях.
26*
403
В каком растворителе йод растворяется лучше?
Водный раствор йода слейте в другую пробирку, прибавьте немного
бензина (бензола, керосина) и встряхните, зажав отверстие пальцем. Дайте
отстояться. В слое какой жидкости оказалось большее количество йода.
4. Получение йодистого серебра
Поместите в пробирку или на стекло каплю раствора йодистого калия и
каплю раствора азотнокислого серебра; капли на стекле соедините. Наблюдайте
выпадение осадка йодистого серебра (ур. р.). Для сравнения получите осадки
бромистого и хлористого серебра (ур. р.). Отметьте окраску осадков, характер-
ную для этих солей.
Полученные осадки поместите в возможно более светлое . место и наблю-
дайте постепенное потемнение их от действия света (ур. р.).
5. Вытеснение йода хлором и бромом
Налейте в две пробирки по — 1 мл раствора йодистой соли.
В одну пробирку прилейте несколько капель хлорной воды, а в другую —
бромной и наблюдайте появление окраски от выделившегося в обоих случаях
йода (ур. р.).
В каждую пробирку добавьте 1—2 капли крахмального клейстера и на-
блюдайте появление характерной для йода синей окраски.
VII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „КИСЛОРОД"
1. Роль катализатора при разложении бертолетовой соли
В пробирку (см. рис. 51, А) поместите немного бертолетовой соли (в объёме
5—6 спичечных головок) и нагрейте её до плавления. Обратите внимание на
отсутствие каких-либо признаков, указывающих на разложение соли.
Отведите пробирку от огня и всыпьте в расплавленную соль немного
порошка двуокиси марганца (в объёме х/2 спичечной головки); тотчас же про-
исходит бурное разложение соли (ур. р.). Быстро введите в пробирку заранее
приготовленную лучинку с тлеющим угольком на конце (рис. 51, Б). Лучинку
должен держать наготове второй ученик, время от времени поджигая её
конец.
Объясните причину вспыхивания уголька и роль двуокиси марганца в этой
реакции.
2. Разложение перекиси водорода под действием катализатора
В пробирку или на стекло поместите перекись водорода, 3-процентную или
более концентрированную (на стекло поместите одну каплю); бросьте в жидкость
несколько мелких крупинок двуокиси марганца.
Наблюдайте образование пузырьков газа у поверхности каждой крупинки.
Обратите внимание на то, что даже мельчайшие крупинки двуокиси марганца
полностью сохраняются и в процессе реакции не расходуются.
По окончании реакции слейте жидкость (со стекла удалите её фильтро-
вальной бумагой). Прибавьте свежую перекись водорода и наблюдайте разло-
жение её той же двуокисью марганца. Таким путём убедитесь в полном со-
хранении двуокисью марганца способности к каталитическому действию.
404
VIII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „СЕРА“
1. Плавление серы
Кусочек серы величиной в 3—4 спичечные головки поместите в пря-
мую трубку (рис. 186, А) на расстоянии 2—3 см от края. Противоположное
отверстие трубки закройте бумажной пробочкой и нагревайте серу, держа
трубку высоко над пламенем. Наблюдайте за происходящими с серой изме-
нениями.
Наблюдайте, как сера плавится и кусочек её превращается в светложёлтую
каплю. Чтобы убедиться, что сера в этом состоянии представляет собой под-
расплав^вшаяся вижную жидкость, вращением трубки заставьте
_______________________ каплю стечь в сторону.
il -ZL / Продолжайте нагревание, приближая труб-
ку к пламени, и наблюдайте постепенный пере-
А ход светложёлтой окраски капли в темнобурую.
АА Чтобы убедиться, что при этом уменьшается
чУ текучесть серы и она превращается в густую
д вязкую массу, время от времени вращайте
трубку; когда расплавленная сера загустеет,
при всех поворотах трубки капля останется
на месте.
горящие пары
Рис. 186. Нагревание серы в трубке.
А — первая стадия опыта — сера расплавилась; Б— вторая стадия опыта —
сера загустела; В — третья стадия опыта — сера закипела.
Нагревайте трубку сильнее (приблизив к огню) и отметьте увеличение
текучести при сохранении тёмной окраски. Чтобы легче заметить это, после
того как капля загустела, держите трубку наклонно (рис. 186, 5); при таком
положении трубки будет видно, как при дальнейшем нагревании капля начинает
стекать вниз. Когда это произойдёт, снова расположите трубку горизонтально
и продолжайте нагревание (рис. 186, В). Сильно нагретая сера снова превра-
щается в легко подвижную жидкость.
Наблюдайте, как при дальнейшем нагревании сера закипает и пары её,
выходящие наружу через оставшееся открытым отверстие трубки, заго-
раются (дают лёгкую вспышку). Дальнейшее нагревание после этого прек-
ратите.
27 в. В. Левченко
405
Обратите внимание на осевший на холодных местах трубки по обеим
сторонам от капли жёлтый налёт твёрдой серы — серный цвет, получившийся
непосредственно из паров, минуя жидкое состояние (возгонка).
Наблюдайте за изменениями в капле серы, происходящими при охлаждении.
Вращайте трубку и следите за изменением вязкости; отметьте повторение всех
указанных выше изменений, но в обратном порядке.
Объясните наблюдавшиеся явления.
2. Получение пластической серы
Расплавьте в трубке, как описано в предыдущей работе, небольшое коли-
чество серы до жидкого состояния, наступающего после стадии загустения.
Введите в трубку тонкую проволочку или тонкую стеклянную палочку, захватите
каплю расплавленной серы и, быстро вынув, опустите в воду.
Выньте из воды и рассмотрите остывшую массу. Убедитесь, что она
осталась полупрозрачной, полужидкой и вязкой: прилипает к пальцу, тянется
нитями. Наблюдайте, как получившаяся резинообразная масса (пластическая
сера) через некоторое время теряет свою пластичность, становится жёлтой и
хрупкой.
Что представляет собой пластическая сера?
Чем объясняются дальнейшие изменения пластической серы?
3. Получение соединения серы с железом
Возьмите заранее приготовленную смесь из 7 г порошка железа (лучше
восстановленного водородом) с 4 г серы. В прямую трубку на расстоянии х/3
от её края поместите столько смеси, чтобы она заняла пространство около
одного сантиметра, как показано на рисунке 187, А.
кислота
Б
Рис. 187. Получение соединений серы с металлами.
А — получение соединения серы с железом; Б — исследование полученного продукта;
В—получение соединения серы с цинком.
Нагрейте смесь с одного края. Как только нагреваемый участок смеси
накалится, отнимите трубку от огня. Наблюдайте, как от раскалившегося
участка смеси накал распространяется по всей смеси.
Когда закончится реакция, стеклянной палочкой вытолкните из трубки на
стекло (рис. 187, Б) получившийся продукт реакции. На это же стекло поме-
стите немного смеси, которая бралась для опыта.
406
Сравните по внешнему виду смесь и полученный продукт реакции. Около
них поместите на стекло по капле разбавленной соляной кислоты. Стеклянной
палочкой перенесите в кислоту немного смеси и немного полученного про-
дукта. Отметьте в обоих случаях выделение пузырьков газа. Понюхайте газ
и отметьте резкую разницу в запахе. Объясните причину этой разницы, для
чего напишите уравнения происходивших реакций: 1) при взаимодействии
серы с железом, 2) полученного продукта с кислотой и 3) железа с ки-
слотой.
4. Получение соединения серы с цинком
бумага,смоченная
раствором соли
свинца
нислота'
‘сернистсэ
железо
Возьмите заранее приготовленную смесь из 3 г порошка серы и 6 г по-
рошка цинка (цинковой пыли). Немного* этой смеси (в объёме 2—3 спичечных
головок, но ни в коем случае не больше!) поместите внутрь трубки посередине
её (рис. 187, Z?) и, не закрывая отверстий трубки, нагрейте участок её, где
расположена смесь.
Когда произойдёт лёгкая вспышка, тотчас же отведите трубку от огня
и рассмотрите осевший на стенках белый налёт образовавшегося продукта
реакции — сернистого цинка (ур. р.). Стеклянной палочкой снимите немного
этого налёта и поместите на стекло. Дальше поступайте так, как описано
в предыдущем опыте.
5. Получение соединения серы
с алюминием
Возьмите заранее приготовленную смесь
5 г серы с 3 г порошка алюминия. Про-
делайте опыт точно так же, как описано
в опыте с цинком.
6. Получение сероводорода
Поместите в согнутую трубку (рис. 188)
немного сернистого железа (в объёме 2—3
спичечных головок). Отверстие длинного ко-
лена трубки закройте бумажной пробочкой. Рис.
Прибавьте 3—5 капель разбавленной 0
соляной кислоты (1:2) и наблюдайте выделе- ра7гЕ
ние пузырьков газа (ур. р.).
Осторожно понюхайте газ у открытого отверстия трубки; отметьте сход-
ство запаха сероводорода с запахом тухлых яиц.
Приложите к отверстию трубки смоченную водой синюю лакмусовую бу-
мажку (рис. 188, Л); на что указывает изменение окраски лакмуса?
Прикладывайте к отверстию трубки фильтровальные бумажки, смоченные
растворами солей свинца, меди, цинка, кадмия, сурьмы. Отметьте в каждом
случае окраску образующихся сернистых металлов (ур. р.).
Опустите внутрь трубки, не касаясь её стенок, тонкую трубку с каплей
воды (рис. 188, Б)', подержите её с полминуты, выньте и смочите получившейся
R /V-напля
/ воды
188. Проведение в трубке
1ытов с сероводородом.
бнаружение сероводорода; Б —
зрение сероводорода в капле воды.
27*
407
сероводородной водой синюю лакмусовую бумажку. Трубку с сернистым же-
лезом после этого опустите в чашку с водой. Опыт в пробирке проводят так
же и с теми же количествами веществ.
7. Получение сероводорода и сернистых соединений (групповая работа
на уроке или в кружке) *
Соберите прибор, как показано на рисунке 189. В первую пробирку на-
лейте воду до уровня, показанного на рисунке; во вторую пробирку тоже на-
лейте воду, бросьте в неё немного азотнокислого свинца (в объёме 5—6 спи-
чечных головок) и взболтайте до растворения; в третьей пробирке так же
приготовьте раствор сернокислого цинка; в четвёртую пробирку налейте раствор
щёлочи (5—10-процентный) для поглощения сероводорода.
Рис. 189. Получение сероводородной воды и сернистых
соединений.
Поместите в колбу немного мелких кусочков сернистого железа и прилейте
через воронку разбавленную соляную кислоту.
Наблюдайте медленное прохождение пузырьков газа через воду в первой
пробирке, образование чёрного осадка сернистого свинца во второй пробирке
и образование белого осадка сернистого цинка в третьей пробирке.
Отделите колбу от остальных частей прибора и быстро поместите её в вы-
тяжной шкаф или вынесите на воздух. Жидкость вылейте в склянку (она может
быть использована для выделения из неё соли железа на занятиях химического
кружка). Оставшееся сернистое железо промойте водой и сохраните для даль*
нейших опытов.
После этого разберите прибор. Слейте в склянку жидкость (сероводород-
ную воду) из первой пробирки и плотно закройте. Используйте её в дальней-
ших опытах.
408.
8. Окисление сернистого свинца действием перекиси водорода
Поместите на стекло маленький кусочек фильтровальной бумаги и на
него нанесите каплю раствора свинцовой соли, а затем каплю сероводород-
ной воды. Наблюдайте образование чёрного осадка сернистого свинца (ур. р.)_
Если на стекле оказался избыток жидкости, удалите его кусочком фильтро-
вальной бумаги. На бумагу с чёрным осадком сернистого свинца поместите
каплю перекиси водорода и наблюдайте исчезновение чёрной окраски в ре-
зультате окисления сернистого свинца в сернокислый (ур. р.).
9. Образование сернистого газа при горении серы
Подожгите на конце стеклянной трубки (рис. 190) очень маленький ку-
сочек серы. Осторожно понюхайте получающийся сернистый газ (ур. р.).
Подержите над горящей серой смоченную водой синюю лакмусовую бумажку
и наблюдайте покраснение её. Объясните наблюдающееся явление (ур. р.).
Рис. 190. Сжигание серы Рис. 191. Получение сернистого
на воздухе. газа. Опыт в согнутой трубке.
10. Получение сернистого газа
Поместите в согнутую трубку (рис. 191) немного порошка сернистокис-
лого натрия. Отверстие длинного колена трубки закройте бумажной пробоч-
кой и прибавьте в трубку 1—2 капли концентрированной серной кислоты.
Наблюдайте течение реакции (ур. р.). Осторожно понюхайте газ, выхо-
дящий нз отверстия короткого колена трубки, отметьте сходство запаха
с запахом газа, образующегося при горении серы. Приложите к отверстию
трубки смоченную водой синюю лакмусовую бумажку и отметьте покрасне-
ние её, вызванное действием образовавшейся сернистой кислоты (ур. р.).
Опыт в пробирке проводят так же и с теми же количествами веществ.
11. Ознакомление с сернистой кислотой и её свойствами
1. Налейте в три пробирки по 1 мл раствора сернистой кислоты (воз-
можно более концентрированного раствора в воде сернистого газа). Осто-
рожно понюхайте жидкость. Чем объясняется её запах (ур. р.)?
2. Поместите в пробирку немного магния или цинка и наблюдайте тече-
ние реакции (ур. р.).
3. В другую пробирку с сернистой кислотой прилейте немного раствора
едкого натра (или едкого кали) до исчезновения запаха сернистого газа
(УР- Р-)-
Добавьте сюда около 1 мл раствора серной кислоты (2:1) и подод'ре^те
до появления запаха сернистого газа. Почему запах опять появился (ур. р.)?
12. Окисление сернистой кислоты в серную
1. Поместите в согнутую трубку (рис. 192, Л) немного азотнокислого
свинца (в объёме 5—8 спичечных головок). Отверстие длинного колена за-
кройте бумажной пробочкой, а в приёмник 'поместите столько раствора сер-
нистой кислоты, чтобы жидкость закрывала просвет трубки, как показано на
рисунке. Нагрейте азотнокислый свинец и наблюдайте его разложение с вы-
делением бурых паров двуокиси азота (ур. р.).
Рис. 192. Окисление сернистой кислоты в серную.
А — проведение опыта в трубке; Б — исследование полученного продукта.
Сернистая Раствор из
Б
Наблюдайте исчезновение окраски двуокиси азота при прохождении её
через раствор сернистой кислоты (ур. р.).
Для обнаружения образовавшейся серной кислоты поместите на стекло
рядом каплю сернистой кислоты и каплю полученного раствора (рис. 192, Б).
Около обеих капель поместите по капле раствора хлористого бария. Соеди-
ните капли и наблюдайте появление осадка только в капле раствора, обра-
батывавшегося двуокисью азота (ур. р.).
2. Налейте в две пробирки по i/2 мл раствора сернистой кислоты.
В новую пробирку поместите 5—6 кристалликов марганцевокислого
калия и прилейте до 1j2 её воды. Взболтайте жидкость. Полученный крас-
ный раствор приливайте небольшими порциями в одну из пробирок с сер-
нистой кислотой и наблюдайте исчезновение окраски марганцевокислого калия.
Обнаружьте происшедшее превращение сернистой кислоты в серную.
Для этого прилейте раствор хлористого бария сначала в раствор сер-
нистой кислоты, к которой не добавлялся марганцевокислый калий, и убедитесь,
что никакого осадка не получается. Затем прилейте раствор хлористого бария
в пробирку, в которую добавлялся раствор марганцевокислого калия; в ней
410
тотчас же выпадает осадок сернокислого бария, не растворимый в кислотах.
Проверьте это, добавляя соляную или азотную кислоту.
Напишите уравнение реакции окисления сернистой кислоты атомарным
кислородом, выделившимся из марганцевокислого калия.
13. Свойства серной кислоты
1. Налейте в пробирку по J/2—1 мл воды и концентрированной серной
кислоты (рис. 193).
Потрогайте стекло рукой и убедитесь в разогревании раствора.
Рис. 193. Взаимодействие серной
кислоты с водой.
а) Смочите в полученном растворе
серной кислоты тонкую лучинку. По-
держите её так высоко над пламенем
(рис. 194), чтобы дерево не могло обуг-
литься от действия огня, и дайте испа-
риться воде. Наблюдайте почернение лу-
чинки. Объясните, почему это произошло.
Рис. 194. Высушивание лучинки,
смоченной серной кислотой.
б) При помощи лучинки, смоченной раствором серной кислоты, сделайте
на бумаге какую-нибудь надпись. Подсушите над пламенем эту надпись и
наблюдайте появление темноокрашенных знаков. Объясните это явление.
2. Положите на стекло небольшие кусочки тканей — хлопчатобумажной
льняной, шерстяной, шёлковой — и на каждую из них поместите по капле
концентрированной серной кислоты. Наблюдайте за действием кислоты, при-
касаясь стеклянной палочкой к смоченному участку ткани.
Если была взята не чисто шерстяная ткань, обратите внимание на то,
что бумажные нити в ней разрушились, а шерстяные сохранились. Какие
ткани можно распознать этим способом?
14. Получение сернокислых солей разных металлов путём
взаимодействия металла с кислотой
а) Поместите на стекло пять капель раствора серной кислоты (1:2) и
положите в капли по маленькому кусочку (в объёме спичечной головки)
следующих металлов: магния, алюминия, цинка, железа, меди. (Если опыт
411
проводится в пробирках, указанных веществ возьмите в 5 раз больше.)
Наблюдайте процесс реакции. Обратите внимание на разницу в скорости
выделения пузырьков водорода: уменьшение этой скорости во взятом ряду
металлов в сторону железа и полное отсутствие реакции кислоты с медью.
Рассмотрите положение этих металлов в ряду активности (см. стр. 47) и
объясните разницу в способности их реагировать с кислотой.
б) Удалите медь и снимите бумажкой или тряпочкой эту каплю кислоты
со стекла, остальные капли с металлами оставьте до окончания реакции (при
избытке металла); если металл израсходовался весь, добавьте ещё 1—2 ку-
сочка его.
По окончании выделения водорода (при избытке металла) капли жидко-
сти выпарьте на стекле, держа его высоко над пламенем.
Рассмотрите оставшиеся на стекле соли (ур. р.).
15. Взаимодействие серной кислоты с медью
Поместите в пробирку мл или в согнутую трубку (рис. 191) 4—5 ка-
пель концентрированной серной кислоты и введите в неё свёрнутую в ма-
ленький коь.очек тонкую медную проволочку.
Осторожно нагрейте (не держите отверстие в сторону лица!).
Понюхайте выделяющийся газ и убедитесь по запаху, что это сернистый
газ (ур. р.). Продолжайте нагревание, пока реакция не станет достаточно
энергичной. После этого прекратите нагревание и дайте жидкости остыть.
После охлаждения прибавьте в неё вдвое больший объём воды. Наблюдайте
появление голубой окраски, указывающей на присутствие в растворе серно-
кислой меди (ур. р.). Почему серная кислота не реагировала с медью в пре-
дыдущем опыте?
16. Отличие серной кислоты и её солей от других кислот и их солей.
Поместите в пробирки по 1 мл или на стекло по капле растворов следую-
щих солей: углекислого натрия, азотнокислого натрия, фосфорнокислого нат-
рия, сернистокислого натрия, сернокислого натрия, хлористого натрия. В эти
жидкости добавьте по капле раствора хлористого бария и наблюдайте выпа-
дение осадков солей бария: углекислого, фосфорнокислого, сернистокислого
п сернокислого (ур. р.). Добавьте по капле (в пробирки больше) разбавлен-
ной азотной или соляной кислоты и наблюдайте растворение всех, осадков
ур. р.), кроме сернокислого бария.
IX. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „АЗОТ*
1. Получение аммиака
а) Поместите на стекло истёртую в порошок гашёную известь в объёме
горошины и такое же количество порошка хлористого аммония. Палочкой
перемешайте оба порошка и понюхайте полученную смесь. Отметьте резкий
запах, указывающий на выделение аммиака (ур. р.).
б) Поместите смесь в согнутую трубку, в приёмник которой введите
воду до закрывания просвета, как показано на рисунке 195. Плотно закройте
отверстие трубки бумажной пробочкой и нагревайте смесь в течение 1—2 ми-
нут. После этого перенесите из приёмника получившийся в нём раствор
412
аммиака в воде (нашатырный спирт) на стекло. Понюхайте раствор; отметьте
сильный запах аммиака. Смочите раствором красную лакмусовую бумажку.
Посинение её укажет на образование щёлочи — гидрата окиси аммония (ур. р.).
2. Получение аммиака и концентрированного раствора его (групповой
опыт в классе или в химическом кружке)
Соберите прибор по рисунку 196. В колбу поместите до г/з её объёма
смесь хлористого аммония с гашёной известью. Первую пробирку заполните
кусочками натронной извести для сушки газа; вторую — оставьте пустой,
третью, направленную дном вверх, тоже оставьте пустой, четвёртую до 3/4
наполните водой, а в U-образную трубку налейте раствор соляной кислоты
(1:1) до закрывания просвета труб- Смвсь хлористого аммония
КИ ИЛИ выше на несколько МИЛЛИ С гашенрй известью
метров.
Нагревайте колбу и наблюдайте
происходящие в пробирках явления.
Сначала видно прохождение пузырь-
ков воздуха в четвёртой пробирке
и в U-образной трубке.
Когда весь воздух будет вытеснен
и начнёт проходить аммиак, пузырьки
больше появляться не будут вслед-
малом количестве.
* Вод
Рис. 195. Получение аммиака
в
ствие растворения аммиака в воде.
Уровень воды, в трубке, проходящей в четвёртую пробирку, начинает с этого
момента подниматься вверх скачками в связи с
уменьшением давления вну-
три системы.
Когда этот подъём станет совершенно отчётливым, прекратите нагре-
вание колбы для уменьшения выделения аммиака и наблюдайте появление
фонтана в помещённой вверх дном пробирке. Переходящая в эту пробирку
жидкость стекает во вторую пробирку и в ней остаётся. Потрогайте рукой
колбу и убедитесь, что она не успела охладиться и что перебрасывание
жидкости из четвёртой пробирки во вторую не может быть объяснено сокра-
щением объёма газа в результате охлаждения; уменьшение давления в при-
боре произошло вследствие растворения аммиака в воде.
После наблюдения фонтана и перехода жидкости во вторую пробирку
отделите третью пробирку и присоедините непосредственно вторую пробирку
к четвёртой. Обе эти пробирки опустите в сосуды (стакан, банку) с холод-
ной водой, лучше со льдом, и продолжайте нагревать колбу. Процесс ведите
до тех пор, пока во второй пробирке получится насыщенный раствор амми-
ака и жидкость вытеснится давлением газа обратно в четвёртую пробирку;
в ней теперь будет наблюдаться непрерывный ток пузырьков газа, более не
поглощаемого водой.
Как только это произойдёт, прекратите нагревание колбы, отделите все
пробирки кроме первой, которую (для поглощения продолжающего выделяться
газа) присоедините к U-образной трубке.
Насыщенный раствор аммиака (нашатырный спирт) из обеих пробирок
перелейте в склянку и употребите для дальнейших опытов.
413
3. Соединение аммиака с кислотами
а) Поместите в пробирку каплю концентрированного нашатырного спирта.
Не касаясь её стенок, внесите тонкую лучинку или стеклянную палочку,
смоченную концентрированной соляной кислотой (рис. 69, Б).
Рис. 196. Получение аммиака и концентрированного раствора его.
Наблюдайте образование белого дыма, состоящего из мелких кристалликов
хлористого аммония (ур. р.).
б) Повторите опыт, но лучинку смочите азотной кислотой. Наблюдайте
и в этом случае образование белого дыма, состоящего из мелких кристалли-
ков азотнокислого аммония (ур. р.).
414
4. Реакция между нашатырным спиртом и кислотами
а) Поместите на стекло каплю нашатырного спирта и нагрейте её. Убе-
дитесь, что нашатырный спирт полностью улетучивается без остатка.
То же проделайте с каплями соляной и азотной кислот.
б) Поместите на стекло рядом каплю нашатырного спирта и каплю соля-
ной кислоты. Соедините капли. Осторожно нагрейте стекло, держа его высоко
над пламенем, до полного удаления воды, и отметьте заметный остаток обра-
зовавшейся соли — хлористого аммония (ур. р.).
в) Повторите опыт, взяв азотную кислоту. Рассмотрите получившуюся
соль — азотно-кислый аммоний (ур. р.).
г) Повторите опыт, взяв серную кислоту. Нашатырный спирт возьмите
в избытке, чтобы после смешения капель чувствовался запах аммиака.
Рассмотрите получившуюся соль — сернокислый аммоний (ур. р.).
5. Реакция обмена солей аммония с другими солями
Поместите в пробирку по 1/2 мл или на стекло по капле раствора серно-
кислого аммония и раствора хлористого бария. На стекле соедините капли,
наблюдайте выпадание осадка сернокислого бария (ур. р.).
6. Реакция обмена солей аммония со щёлочью и кислотой
а) Поместите в пробирку немного порошка хлористого аммония и рас-
твора едкого натра (рис. 197). Нагрейте раствор над пламенем спиртовки.
Поднесите к отверстию смоченную водой красную лакмусовую бумажку.
Отметьте её посинение от выделившегося аммиака (ур. р.)
Рис. 197. Действие щёлочи на
соли аммония.
Рис. 198. Возгонка хлористого
аммония.
б) Повторите предыдущий опыт, взяв вместо щёлочи серную кислоту
(2:1), а к отверстию поднесите смоченную водой синюю лакмусовую бумажку.
Отметьте её покраснение от выделившейся соляной кислоты (ур. р.).
415
7. Возгонка хлористого аммония
Поместите в прямую трубку (рис. 198) или в пробирку немного хлори-
стого аммония (нашатыря) и нагрейте. Наблюдайте полное улетучивание
соли и отложение её на холодных частях трубки (ур. р.).
8. Действие хлористого аммония на окись меди
На стекло насыпьте немного хлористого аммония. Медную проволоку
(можно от звонкового провода) нагрейте над пламенем горелки до образова-
ния на ней тёмного налёта окиси меди и в накалённом состоянии быстро по-
грузите её в хлористый аммоний. Выньте проволоку, снимите приставшие
крупинки соли и убедитесь в полном исчезновении налёта окиси.
Объясните наблюдающееся явление и приведите соответствующие урав-
нения реакций.
9. Разложение углекислого аммония при нагревании
Нагрейте в трубке или пробирке немного углекислого аммония. Наблю-
дайте полное улетучивание соли, разлагающейся на газообразные вещества
(ур. р.).
10. Получение азотной кислоты
В трёхколенчатую трубку (рис. 199) поместите селитру в объёме б—8
спичечных головок и введите туда же 4—6 капель концентрированной
серной кислоты. Вся селитра должна быть смочена кислотой, но около '/.з
просвета трубки должно оставаться свободным, чтобы при нагревании
жидкость не выбрасывалась в приёмник. Отверстие трубки плотно закройте
бумажной пробочкой. Часть трубки, служащую приёмником, погрузите в ста-
кан с холодной водой (со льдом).
Рис. 199. Получение азотной кислоты в малом количестве.
Нагревайте селитру и наблюдайте за выделением азотной кислоты (ур. р.)
собирающейся в приёмнике в виде окрашенной в жёлтый цвет жидкости.
Когда реакция закончится, прекратите нагревание и на короткое время при-
откройте пробочку, чтобы при охлаждении собравшаяся в приёмнике кислота
не была втянута внутрь трубки. Полученную кислоту используйте в после-
дующих опытах.
416
11. Свойства азотной кислоты
а) Смочите концентрированной азотной кислотой тонкую стеклянную
палочку, держите её в воздухе и наблюдайте выделение „дыма“ (дымящая
кислота).
б) Перенесите палочкой на стекло каплю азотной кислоты и рядом поме-
стите каплю раствора фуксина. Соедините капли и наблюдайте обесцвечива-
ние жидкости.
в) Смочите стеклянную палочку кислотой и прикоснитесь к окрашенной
материи и лакмусовой бумажке. Наблюдайте обесцвечивание. Объясните,
почему это происходит?
Палочку обмойте в воде, помещённой на стекло (капля) или в пробирку.
Полученным разбавленным раствором кислоты смочите синюю лакмусовую
бумагу. Объясните, почему в отличие от концентрированной азотной кислоты
разбавленная кислота не обесцвечивает лакмус, а окрашивает его в красный
цвет, как и другие кислоты.
12. Действие нагревания на соли азотной кислоты
а) Нагрейте в пробирке немного селитры (рис. 200, Л). Когда она рас-
плавится и появятся пузырьки газа (признак разложения соли), зажгите
тонкую лучинку, погасите огонь и с тлеющим на конце угольком опустите
её в расплавленную селитру (рис. 200, Б) и быстро выньте. Наблюдайте
вспыхивание уголька. Объясните это явление (ур. р.).
Рис. 200. Разложение селитры при нагревании.
А — нагревание селитры; Б — вспыхивание раскалённого уголька.
б) Нагрейте в пробирке немного предварительно просушенного зелёного
порошка азотнокислой меди. Наблюдайте изменение окраски порошка в чёр-
ную (образование окиси меди) и выделение бурого газа — двуокиси азота.
Опустите в пробирку тонкую лучинку ,с тлеющим на конце угольком,
как делалось в предыдущем опыте, и убедитесь в выделении кислорода
(ур. р.).
417
13. Роль селитры как составной части пороха
На середину прямой трубки поместите кусочек угля; одно отверстие
закройте бумажной пробочкой и нагрейте участок с угольком (рис. 201).
Обратите внимание на отсутствие каких-либо изменений с углем. Трубку
можно нагреть до размягчения стекла, но с кусочком угля ничего не проис-
ходит. Объясняется это тем, что небольшие частицы угля, приставшие
к стенкам, в начале же нагревания сгорают, что иногда можно заметить по
появляющимся блёсткам; вследствие этого в трубке сразу же образуется
атмосфера углекислого газа, исключающая возможность дальнейшего го-
рения.
Дайте трубке остыть и с обеих сторон уголька введите в неё немного
порошка селитры (рис. 202). Нагревайте теперь трубку. Когда селитра рас-
плавится и начнёт разлагаться с выделением кислорода, уголёк тотчас же
вспыхивает, при этом он подбрасывается то в одну, то в другую сторону
Уголь
Рис. 201. Нагревание в трубке
кусочка угля.
Рис. 202. Нагревание в трубке угля
и селитры.
вследствие бурно идущей реакции. После этого отведите трубку от огня и
наблюдайте продолжающееся явление. Уголёк может пристать к верхней
стенке трубки; тогда вращайте её до смачивания уголька расплавленной
селитрой, и горение снова возобновится.
X. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ФОСФОР"
1. Превращение красного фосфора в белый. Свечение фосфора
Возьмите красный фосфор, а если его нет, наскребите ножом на лист
бумаги немного коричневого порошка со спичечной коробки (для этого до-
статочно 1—2 коробок).
В стеклянную трубку (0,4—0,7 см в диаметре) при помощи лучинки или
стеклянной палочки протолкните на середину её немного красного фосфора
или наскобленного порошка (примерно в объёме 5—10 булавочных головок,
рис. 203). Одно отверстие трубки плотно закройте свёрнутым комочком
бумаги, а другое оставьте открытым.
Нагрейте трубку в том месте, где находится порошок, соблюдая следую-
щее правило: сначала вращайте трубку, держа её высоко над пламенем, пока
стекло не нагреется равномерно по всей окружности; затем опустите трубку
418
помещение или поместите на дно
Рис. 203. Опыт с превращением
красного фосфора в белый.
ниже и, держа неподвижно, нагревайте участок с порошком. Наблюдайте
появление небольшого количества паров фосфора, которые тотчас же
вспыхивают; появившийся огонёк, однако, быстро гаснет из-за недостатка
кислорода.
Продолжайте нагревание трубки. Новые количества красного фосфора
превращаются в пар; этот пар оседает на холодных частях трубки по обе
стороны от нагреваемого места в виде кольцевидного налёта светложёлтого
цвета. Этот налёт — белый фосфор.
Как только появится хорошо заметный налёт белого фосфора, отведите
трубку от огня и перенесите её в тёмное
картонной коробки, в крышке которой
проделано отверстие для глаза (около
1 см в диаметре). Глядя через это отвер-
стие, наблюдайте свечение белого фос-
фора: благодаря свечению оба кольце-
вых налёта белого фосфора хорошо за-
метны в тёмном пространстве коробки.
Свечение это продолжается 2—3 минуты,
а затем постепенно затухает, так как
небольшое количество образовавшегося
белого фосфора полностью соединяется
с проникающим в трубку кислородом воздуха. После наблюдения свечения
выньте бумажную пробочку и оставьте трубку до следующего занятия, т. е.
на несколько дней, чтобы полностью окислился весь получившийся белый
фосфор.
2. Получение фосфорной кислоты (продолжение предыдущей работы)
В трубку, оставленную после первого опыта, введите пипеткой 4—5 ка-
пель воды. Наклоняя трубку то в одну, то в другую сторону, заставьте
столбик воды несколько раз пройти вдоль трубки для растворения образо-
вавшегося в ней фосфорного ангидрида (ур. р.). Затем поместите на стекло
4 капли полученного раствора и проделайте следующие опыты.
1. В первую каплю поместите кусочек синей лакмусовой бумаги, покрас-
нение её укажет на присутствие в растворе кислоты, образовавшейся из
фосфорного ангидрида (ур. р.).
2. Возле второй капли поместите каплю нашатырного спирта (для ней-
трализации кислоты) и каплю раствора хлористого кальция. Стеклянной
палочкой или лучинкой соедините сначала каплю полученного раствора
с каплей нашатырного спирта и перемешайте их; затем присоедините,
не перемешивая, каплю хлористого кальция. В месте соединения капель наблю-
дайте образование белого осадка фосфорнокислого кальция (ур. р.).
3. Рядом с третьей каплей поместите каплю нашатырного спирта и каплю
раствора азотнокислого серебра. Соедините капли в том же порядке, какой
указан в предыдущей работе, и наблюдайте образование белого осадка мета-
фосфорнокислого серебра (ур. р.).
4. Рядом с четвёртой каплей насыпьте немного порошка соды. Палочкой
перенесите крупинки соды в жидкость и наблюдайте выделение углекислого
419
газа. Продолжайте так до тех пор, пока не прекратится появление пузырь-
ков газа при прибавлении крупинки соды.
Выпарьте каплю и рассмотрите твёрдый остаток образовавшейся соли
(ур. р.).
3. Получение ортофосфорной кислоты из костяной золы
В колбочку насыпьте около 10 г костяной золы.
Составьте уравнение реакции получения фосфорной кислоты путём
взаимодействия третичного фосфорнокислого кальция с серной кислотой.
Исходя из него, вычислите, сколько надо взять по весу серной кислоты на
10 г соли.
Вычислите, сколько надо взять по объёму серной кислоты, взятой в раз-
бавлении 1:2, исходя из того, что в таком растворе содержится 46°/0 чистой
кислоты.
Вычисленное количество раствора прилейте в колбочку и прокипятите
2—3 минуты.
После охлаждения профильтруйте раствор в другую колбочку.
Испытайте действие на лакмус полученного раствора фосфорной кислоты
Налейте его в четыре пробирки по 2—3 мл в каждую.
В первую пробирку присыпьте немного порошка магния и наблюдайте
происходящую реакцию (ур. р.).
Во вторую пробирку присыпьте немного извести и, взбалтывая жидкость,
наблюдайте растворение извести (ур. р.).
В третью пробирку прилейте немного раствора соды и наблюдайте про-
исходящую реакцию (ур. р.).
' В четвёртую пробирку прилейте раствор азотнокислого серебра (около
0,5 лгл) и взболтайте жидкость; затем медленно по стенкам прилейте разба-
вленного раствора аммиака, не взбалтывая, Утобы получилось два слоя жид-
кости. Наблюдайте выделение на границе этих слоёв жёлтого осадка орто-
фосфорнокислого серебра (ур. р.).
XI. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „УГЛЕРОД"
1. Приготовление активированного угля
Поместите в колбочку мелкие кусочки древесного угля слоем в 1—\1/2 см
и прилейте горячей воды до г/3 колбочки; прокипятите жидкость в течение
3—5 минут. Дайте жидкости охладиться. Обратите внимание на то, что уголь
стал тяжёлым, так как он впитал воду.
Слейте через вату в воронке жидкость, соберите оставшийся на вате
уголь и поместите его одним слоем в железную коробочку (из-под сапож-
ной мази), закройте её крышкой и возможно лучше прокалите.
Дайте коробочке полностью охладиться. После такой обработки уголь
стал активированным.
2. Проверка поглощающей способности активированного угля
а) Налейте в пробирку до 1/1 воды и прибавьте 1—2 капли раствора
аммиака. Взболтайте жидкость; она должна слабо пахнуть аммиаком. Поме-
стите теперь в пробирку немного активированного угля и, зажав пальцем,
420
энергично встряхивайте жидкость несколько минут, пока не исчезнет запах
аммиака. То же проделайте с кусочками обыкновенного древесного угля.
Сравните поглощающую способность угля в обоих случаях.
б) Налейте в пробирку до х/4—1/3 воды, слабо подкрашенной чернилами
(фиолетовыми, красными). Поместите в неё немного активированного угля а
встряхивайте, пока жидкость не обесцветится. То же проделайте с простым
углем и проведите сравнение.
3. Поглощение углем хлора
Опыт проведите в трубке (рис. 204), согнутой под прямым углом с ко-
ленами равной длины. В одно колено введите маленький кусочек ваты, кааг
показано на рисунке; поверх ваты насыпьте слой активированного угля »
1—1х/2 см толщиной, можно и простого дре-
весного угля, но свежеприготовленного и
раздроблённого на кусочки величиной в про-
сяное зерно.
Через свободное колено насыпьте в
трубку марганцевокислый калий в объёме
3—5 спичечных головок и добавьте рас-
твор соляной кислоты (2:1) в таком коли-
честве, чтобы просвет трубки не был ею рис. 204. Поглощение углей
закрыт. Тотчас же введите в свободное хлора.
колено трубки такой же кусочек ваты, какой
введён в первое колено, а поверх его всыпьте слой крупнозернистого песлж
такой же толщины, как и слой угля.
Закройте пальцем отверстие колена с у1*лем и приложите к другому от-
верстию бумажку, смоченную раствором йодистого калия. Побурение от вы-
деляющегося йода, вытесненного хлором, укажет на свободное прохождение
хлора через вату и песок.
Закройте теперь пальцем отверстие колена с песком и приложите к от-
верстию колена с углем бумажку с йодистым калием. Она останется без из*
менения, так как хлор полностью поглощается углем.
4. Получение метана
В согнутую трубку (рис. 205) поместите смесь уксуснокислого калия
или натрия и патронной извести в объёме 1—2 горошин. (Смесь пригото-
вляется заранее из 1 части по весу уксуснокислого калия или плавленного
уксуснокислого натрия и 2 частей натронной извести; смесь тщательно пере-
мешивается и растирается в тонкий порошок.)
Отверстие длинного колена трубки закройте бумажной пробочкой, а на
короткое колено наденьте маленькую пробирочку, как показано на рисунке.
Нагрейте смесь в пламени спиртовки; время от времени снимайте пробк-
рочку и подносите к огню. Когда пробирочка наполнится метаном, он ст
пламени спиртовки загорится и будет гореть слабо светящимся пламенем:
(УР- Р-)-
42L
Высыпьте остаток из трубки на стекло. Рядом поместите каплю рас-
твора кислоты. Перенесите палочкой крупинки остатка в кислоту и наблю-
Рис. 205.
Получение метана в малом количестве.
А — собирание метана; Б — поджигание метана.
дайте выделение углекислого
газа, вытесняемого кислотой
из образовавшейся при реак-
ции соды (ур. р.).
5. Получение углекислого
газа
Поместите на дно стакана
или баночки несколько мелких
кусочков мела (мрамора) и на-
лейте немного раствора кисло-
ты. Наблюдайте за выделением
пузырьков газа (ур. р.).
Опустите в стакан заж-
жённую лучинку и убедитесь,
что газ не поддерживает горе-
ния.
Опустите в стакан стеклянную трубку с каплей известковой воды и
наблюдайте её помутнение (ур. р.).
6. Действие углекислого газа на известковую воду
Соберите прибор по рисунку 170 и пропустите углекислый газ в извест-
ковую воду, налитую 'в пробирку. Наблюдайте образование осадка углекис-
лого кальция (ур. р.). Продолжайте пропускать углекислый газ дальше и на-
блюдайте полное растворение осадка. Объясните наблюдающееся явле-
ние (ур. р.).«
Прекратите пропускание газа.
Нагрейте получившуюся прозрачную жидкость и наблюдайте выпадение
осадка. Объясните это явление (ур. р.).
Прибавьте в жидкость с осадком 1—2 капли соляной кислоты и наблюдайте
растворение осадка (ур. р.).
Какие получились в этих опытах соли? Дайте им полные названия.
7* Действие нагревания на
соли угольной кислоты.
Разложение малахита
Малахит
Рис. 206. Разложение малахита.
Внутрь прямого участка со-
гнутой трубки (рис. 206) поместите
немного порошка малахита. От-
верстие трубки закройте плотно
бумажной пробочкой. В согнутую
часть трубки введите несколько
капель известковой воды в количестве, показанном на рисунке. Нагрейте ма-
лахит и наблюдайте: 1) превращение его в чёрную окись меди, 2) образование
422
капелек воды в правой части трубки и 3) помутнение известковой воды.
(Опыт в пробирке производят, собрав прибор по рисунку 81.)
8. Действие кислот на соли угольной кислоты
Поместите в пробирки или на стекло понемногу (в объёме 1—2 спичеч-
ных головок) углекислых солей натрия, калия, магния, кальция, меди. Кап-
ните на каждую соль разбавленной соляной кислотой и наблюдайте выделе-
ние углекислого газа (ур. р.).
Повторите опыт, взяв вместо соляной кислоты серную кислоту. Отметьте,
что при действии этой кислоты на углекислый кальций выделение углекислого
газа вскоре прекращается вследствие образования плохо растворимого серно-
кислого кальция, прекращающего доступ кислоты к соли (ур. р.).
9. Распознавание известняков
Поместите капли кислоты на разные камни, которые удастся достать
(строительный камень, кусочки камней, идущих на мощение мостовых, троту-
аров и пр.). Установите, в каких случаях наблюдается выделение пузырьков
газа (углекислого газа) и, следовательно, какие камни оказались известняком.
Соберите коллекцию известняков.
XII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „КАЧЕСТВЕННЫЙ
АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ*
1. Обнаружение углерода и водорода
В горизонтальную часть трубки (рис. 207) поместите немного истёртой
в порошок смеси сахара с окисью меди (окиси меди по весу взять вдвое
Смесь сахара
с окисью меди
Рис. 207. Обнаружение в органическом веществе
углерода и водорода.
больше сахара). В приёмник введите столько раствора известковой воды, чтобы
просвет трубки был ею закрыт. Отверстие горизонтальной части трубки плотно
закройте бумажной пробочкой.
Нагрейте смесь и наблюдайте за действием выделяющегося газа на
известковую воду. Отметьте образование белой мути — осадка углекислого
423
калышя, указывающего на присутствие в продуктах реакции углекислого газа
(доказательство содержания углерода во взятом веществе).
Рассмотрите холодные участки трубки и отметьте налёт из капель воды —
второго продукта реакции (доказательство содержания водорода во взятом
веществе).
Опыт в пробирке проводят, собрав прибор по рисунку 81.
2. Обнаружение азота
В пробирку (рис. 208) поместите немного смеси мочевины с натронной
известью (равные количества по весу) и нагрейте. Приложите к отверстию
смоченную водой красную лакмусовую
бумажку. Отметьте посинение её, ука-
Рис. 208. Обнаружение в орга-
ническом веществе азота.
Рис. 209. Разгонка нефти (упрощён-
ный опыт).
бывающее на выделение аммиака. Убедитесь в выделении аммиака по запаху
^(доказательство содержания азота во взятом веществе).
ХШ. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „УГЛЕВОДОРОДЫ"
1. Разгонка нефти
Поместите в согнутую трубку 5—6 капель нефти (рис. 209), нагрейте
в к отверстию короткого колена трубки приложите кусочек белой бумаги.
Образующиеся при нагревании нефти пары летучих веществ будут конденси-
роваться на холодной бумаге и дадут на ней пятно. Когда пятно станет
хорошо заметным, бумагу отнимите и вместо неё приложите другую. Когда
на второй бумажке станет заметно пятно, отнимите её и приложите новую.
Так же постукайте и дальше. По мере отгонки низкокипящих фракций темпе-
ратура жидкости будет повышаться и отгоняться будут продукты всё с более
а более высокой температурой кипения.
Наблюдайте за исчезновением пятен на бумажках вследствие испарения
жидкости; отметьте на каждой бумажке, через какое время пятно исчезло.
Быстрее всего исчезают пятна от низкокипящих фракций бензина (отгоны
до 150°), и долго держится пятно от керосина (отгоны в пределах 150—300°).
124
Когда на бумаге перестанут получаться пятна, хотя кипение жидкости
будет продолжаться, это покажет, что полностью отогнались все низкоки-
пящие составные части нефти. кТогда прекратите нагревание и рассмотрите
остаток в трубке. Он представляет собой смесь высококипящих составных
частей нефти.
2. Свойства продуктов, получаемых из нефти
а) На лист белой бумаги поместите капли бензина и керосина и отметьте,
через сколько времени в каждом случае полностью исчезает след от капли.
Сравните с данными, полученными при разгонке нефти.
б) Захватите концом прямой трубки (рис. 210) каплю керосина и, держа
трубку горизонтально, быстро внесите в каплю конец горящей тонкой лу-
чинки, спички, как показано на
рисунке. Лучинка погаснет, а керо- _______==^==_ А
син не загорится. Q ----
Повторите то же, взяв вместо " керосин
керосина бензин (сосуд с бензи-
ном закройте пробкой и поместите Рис. 210. Сравнение воспламеняемости
подальше); бензин в трубке тотчас бензина и керосина,
же вспыхнет.
Повторите опыт с керосином, но каплю его предварительно осторожно
слабо нагрейте высоко над плгциенем. Нагретый до 30—40° керосин загорится
от внесённой в него горящей лучины.
Можно ли держать бензин в открытом сосуде? Почему бензин огне»
опаснее керосина даже при обычной температуре?
3. Получение ацетилена
а) Поместите на стекло (рис. 211) кусочки карбида кальция величиной
со спичечную головку, а рядом с ними каплю воды. Возьмите в одну руку
Рис. 211. Получение ацетилена (опыт в капле воды).
зажжённую лучину, а другой рукой при помощи палочки переместите кар-
бид кальция в каплю воды и тотчас же подожгите выделяющийся газ
(УР- Р-)- Обратите внимание на яркость пламени и выделение обильной ко-
поти (ур. р.).
28 в. В. Левченко '
б) Соберите приборчик, как показано на рисунке 212.
В согнутую трубку поместите кусочек карбида кальция. В первый при-
ёмник прилейте 5—6 капель бромной воды, а во второй приёмник — розовый
раствор марганцевокислого калия, подкисленный серной кислотой» Введите
в трубку с карбидом кальция 3—5 капель воды и быстро закройте отверстие
трубки заранее подготовленной бумажной пробочкой. Наблюдайте за обес-
Резиновая трубка //
ВрДа —:—\ __ / /
Нарбид кальция Бромная . МарГайцево*
вода кислый калий
Рис. 212. Получение ацетилена (опыт в трубке).
цвечиванием бромной воды (ур. р») и за обесцвечиванием раствора маргай-
цевокислого калия.
По окончании опыта трубку тотчае же перенесите в вытяжной шкаф или
вынесите из комнаты.
4. Разложение каучука
В прямую часть согнутой трубки (рис. 213). поместите несколько ма-
леньких кусочков каучука (можно обрезков резиновой трубки). В согнутую
часть трубки прилейте до за-
крывания просвета бромную воду
или розового цвета раствор мар-
ганцевокислого калия, слабо под-
кисленный серной кислотой. От-
верстие трубки плотно закройте
бумажной пробочкой и нагрейте
резину. Наблюдайте разложение
её с образованием газообразных
Рис. 213. Разложение каучука при
и жидких продуктов. Обратите нагревании.
внимание на обесцвечивание жид-
кости. На какое свойство продуктов разложения указывает обесцвечивание
ими бромной воды (раствора марганцевокислого калия)?
К каким соединениям относятся эти продукты?
5. Ознакомление с бензолом и его гомологами
Поместите на кусочки белой бумаги по капле бензола, толуола, ксилола.
Понюхайте эти капли и отметьте различие в запахе. Сравните быстроту
испарения по исчезновению на бумаге следов от капель.
6. Химические свойства бензола и его гомологов
Опыт проводите в пробирке или в согнутой трубке без нагревания.
При проведении опытов в пробирке реактивы берите по 1 мл, всё осталь-
ное делайте, как указано ниже.
426
а) Поместите в согнутую трубку (рис. 154, В) 1—2 капли бензола и
5—6 капель бромной воды. Взболтайте жидкость и дайте ей отстояться; от-
метьте растворение бр^ма в бензоле и отсутствие реакции между ними.
б) Поместите в согнутую трубку 2—3 капли бензола и 3—5 капель рас-
твора марганцевокислого калия розового цвета, слабо подкисленного сер-
ной кислотой. Взболтайте жидкости и отметьте отсутствие реакции.
Бензол не реагирует с марганцевокислым калием ни на холоду, ни при на-
гревании.
в) Повторите то же, но вместо бензола возьмите толуол, а затем ксилол.
Отметьте быстрое исчезновение окраски марганцевокислого калия, указы-
вающее на лёгкую окисляемость гомологов бензола в отличие от самого
бензола.
XIV. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „СПИРТЫ*
1. Получение алкоголятов
а) В согнутую трубку (рис. 214) поместите 2—3 капли метилового или
этилового спирта (или в пробирку 1 мл)\ бросьте в спирт кусочек натрия
величиной в 3—4 спичечные головки.
При опыте в трубке отверстие длин-
ного колена её плотно закройте бумаж-
ной пробочкой и соберите в пробирочку
выделяющийся из другого отверстия
водород (ур. р.). Поднесите пробирочку
к огню и наблюдайте вспышку. Затем
подожгите водород у отверстия трубки.
Когда прекратится реакция, проволоч- Спирт-^Я|7
кой удалите оставшийся натрий (если Натрий
натрия нехватило, добавьте ещё). Рас- рис 2И Полученне алкоголята.
смотрите в трубке (или в пробирке) по-
лучившийся алкоголят натрия.
Прибавьте к нему воды и убедитесь в разложении алкоголята и в обра-
зовании щёлочи, для чего смочите полученным раствором красную лакмусо-
вую или фенолфталеиновую бумажку.
б) В пробирку поместите 1 мл голубого раствора медного купороса;
прибавьте в избытке раствора щёлочи. К выпавшему голубому осадку
гидрата окиси меди прибавьте немного глицерина. Встряхните жидкость;
гидрат окиси меди растворится в глицерине с образованием глицерата меди
синего цвета (ур. р.). Если глицерат меди не получился, добавьте ещё щёлочи
и глицерина.
2. Растворимость фенола в воде
В пробирку поместите немного фенола (в объёме х/2 горошины) и при-
бавьте 2—3 мл воды. Взболтайте и рассмотрите получившуюся мутную
жидкость (эмульсию). Отметьте плохую растворимость фенола в воде. Слабо
подогрейте жидкость до полного посветления, т. е. до полного раство-
рения фенола; затем дайте ей охладиться и наблюдайте обратное выде-
23* 427
ление фенола (помутнение жидкости). Объясните наблюдающиеся явления.
Жидкость Сохраните для следующего опыта.
3. Получение фенолята натрия
К полученной в предыдущем опыте эмульсии фенола в воде прибавьте
1**2 капли раствора едкого натрия и взболтайте. Объясните, почему жид-
кость тотчас же становится прозрачной. Что образуется при этой реакции
(УР- Р )?
Прибавьте к прозрачному раствору фенолята 2—3 капли соляной кислоты
и взболтайте жидкость. Объясните, почему жидкость снова мутнеет (ур. р.).
4. Реакция фенола с хлорным железом
В пробирку поместите несколько капель разбавленного (2-процентного)
раствора фенола и прибавляйте по каплям раствор хлорного железа до появ-
ления характерного фиолетового окрашивания.
5. Получение трибромфенола
В пробирку поместите несколько капель 2-процентного раствора фенола
и прибавляйте по каплям бромную воду до образования белого осадка три*
бромфенола (ур. р.).
XV. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „АЛЬДЕГИДЫ И КИСЛОТЫ"
1. Получение альдегидов окислением спиртов
а) В пробирку поместите 3—4 мл метилового спирта. Из тонкой мед-
ной проволоки сверните спираль, намотав проволоку на спицу или тонкий
гвоздь. Накалите эту спираль и быстро опустите в спирт.
Понюхайте выделяющийся газ; резкий характерный запах укажет на
выделение формальдегида (ур. р.).
б) Повторите то же с этиловым спиртом (ур. р.). '
2. Окисление альдегидов
а) Приготовьте аммиачный раствор серебра. Для этого в пробирку на-
лейте немного 5-процентного раствора азотнокислого серебра и 2-процент-
ного раствора нашатырного спирта; если появился осадок, растворите его
в избытке нашатырного спирта.
б) Прокипятите разбавленный раствор щёлочи в пробирке; затем вылейте
щёлочь. Пробирку хорошенько промойте водой и вытрите насухо снаружи
чистой тряпочкой.
Налейте в эту пробирку (рис. 215) 3—4 мл приготовленного, кйк описано
выше, аммиачного раствора серебра и 1—2 мл формалина (40-процентный
раствор формальдегида). Слегка нагрейте жидкость. Наблюдайте потемне-
ние раствора от выделившегося металлического серебра (ур. р.); на стекле,
если пробирка была достаточно чистая, получится блестящий зеркальный
налёт серебра.
428
Этот опыт можно проделать в колбочке, предварительно прокипятив
в ней раствор щёлочи для очистки стекла от загрязнений.
в) Проведите следуюп^й опыт в пробирке.
Налейте в неё по 1 мл следующих реактивов: формалина, 2-процент-
ного раствора медного купороса (раствор светлоголубого цвета) и 10-про-
центного раствора едкого натра. Прокипятите раствор. При кипячении про-
изойдёт окисление формальдегида и восстановление двухвалентной меди до
одновалентной, которая выделится в виде закиси меди (ур. р.) — осадка
красного цвета (при неясной реакции добавьте ещё щёлочи).
Рис. 215. Обнаружение
альдегидной группы.
Рис. 216. Выделение уксус-
ной кислоты из её соли.
3. Получение уксусной кислоты из её соли.
В пробирку (рис. 216) поместите немного уксуснокислого натрия и
прибавьте 2—3 капли концентрированной серной кислоты. Слабо на-
грейте.
Осторожно понюхайте выделяющийся газ. Запах его укажет на выде-
ление свободной уксусной кислоты (ур. р.).
4. Реакция с солями уксусной кислоты
а) Поместите в пробирку немного концентрированного раствора уксусно-
кислого натрия и 1 каплю раствора азотнокислого серебра. В результате
реакции выпадает белый осадок уксуснокислого серебра (ур. р.).
б) Поместите в пробирку немного разбавленного раствора уксусно-
кислого натрия и прибавьте 1—2 капли раствора хлорного железа. Появ-
ляющееся красное окрашивание укажет на образование уксуснокислой
соли железа (ур. р.).
5. Сухая перегонка дерева
В прямую трубку (рис. 104, В) или дважды согнутую (рис. 104, Б)
поместите кусочки тонких лучинок длиной в 2 — 3 см (лучинки должны
быть плотно набиты в трубку). Закройте одно отверстие трубки.
429
Нагревайте трубку в пламени спиртовки, как показано на рисунке, и
наблюдайте за явлениями, происходящими в трубке. Когда из отверстия
трубки появится белый дым, поднесите к нему огонь; получившийся све-
тильный газ загорится маленьким, но ярким пламенем. Рассмотрите собрав-
шиеся в трубке жидкие продукты: смолу и подсмолённую воду. Перенесите
эти продукты на стекло и смочите подсмолённой водой кусочек синей лакму-
совой бумажки; бумажка покраснеет от получившейся при сухой перегонке
дерева уксусной кислоты.
(Трубка при этой работе загрязняется и трудно отмывается. Поэтому для
сухой перегонки дерева следует иметь отдельные трубки и употреблять их
только для этой работы; загрязнение не мешает проведению повторных работ
цо сухой перегонке дерева.)
XVI. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ЭФИРЫ"
1. Получение этилового эфира
В пробирку (рис. 217) поместите 10 капель этилового спирта и 10—15
капель концентрированной серной кислоты. (Реактивов брать не больше
Осторожно нагрейте жидкость, держа про-
указанного количества!)
Рис. 217. Получение
эфира.
бирку высоко над пламенем и всё время встряхи-
вая её.
Когда появятся пузырьки газа, потушите огонь
и понюхайте выделяющийся газ у отверстия про-
бирки.
Характерный запах укажет на образование
эфира (ур. р.).
2. Получение уксусноэтилового эфира
Поместите в пробирку 1 мл этилового спирта,
столько же 80-процентной уксусной кислоты и П/2 мл
концентрированной серной кислоты. Смесь про-
кипятите в течение 3—5 минут. После охлаж-
дения прибавьте 1 мл насыщенного раствора
поваренной соли; образовавшийся эфир соберётся
в верхнем слое жидкости (ур. р.). Обратите внимание
на его запах.
3. Получение уксусноизоамилового эфира
В пробирку поместите 2 мл изоамилового спирта, столько же уксус-
ной кислоты и 1 мл концентрированной серной кислоты. Нагрейте смесь до
пожелтения жидкости. После охлаждения прибавьте 1 мл воды. Образовав-
шийся эфир соберётся в верхнем слое жидкости (ур. р.). Обратите внимание
на его запах, сходный с запахом груши.
430
4. Получение солей стеариновой кислоты
а) Поместите маленький кусочек стеарина в пробирку, прибавьте в неё
10—15 капель воды и нагрейте до плавления стеарина. Когда стеарин
расплавится, прибавляйте по каплям раствор едкого натра, всё время
взбалтывая жидкость, *до полного растворения стеарина. Затем прибавьте
к раствору (до насыщения) твёрдой поваренной соли: на поверхность
жидкости всплывут хлопья мыла — стеариновокислого натрия (ур. р.).
б) Приготовьте снова, как описано выше, раствор мыла и, не прибавляя
поваренной соли, добавьте известковой воды; на дно осядет нерастворимое
в воде кальциевое мыло (ур. р.).
5. Получение жирных кислот из мыла
В пробирку налейте 1—2 мл предварительно приготовленного 0,5-про-
центного раствора мыла в воде (кусочек мыла растворяют в дистиллиро-
ванной или прокипячённой воде). Добавьте к раствору 2—3 капли соляной
кислоты и жидкость взболтайте. Дайте отстояться; на поверхность всплывут
твёрдые жирные кислоты, входящие в состав мыла (ур. р.).
6. Получение нерастворимого мыла
1. Поместите в пробирку немного раствора мыла и прибавьте 2—3 капли
раствора хлористого кальций; выпадает осадок нерастворимой кальциевой
соли жирных кислот (ур. р.).
2. Повторите опыт, взяв вместо хлористого кальция раствор уксусно-
кислого свинца; выпадает осадок нерастворимой свинцовой соли жирных
кислот (ур. р.), употребляемой в медицине для изготовления пластыря,
(свинцовый пластырь).
XVII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „УГЛЕВОДЫ"
1. Разложение углеводов при нагревании
Поместите в пробирку или прямую трубку немного сахара и нагрейте
(рис. 218). Что наблюдается? Повторите опыт с крахмалом, куском ваты.
2. Обнаружение альдегидной группы в молекулах глюкозы
1. Поместите в пробирку (рис. 219) следующие растворы: 2 мл разбав-
ленного раствора медного купороса и 2 мл концентрированного раствора
глюкозы.
Нагрейте жидкость до кипения, беспрерывно встряхивая пробирку, и
пипеткой прибавьте несколько капелек 10-процентного раствора едкого натра:
тотчас же выпадает красный осадок закиси меди. Объясните это явление.
2. В пробирке (рис. 219) нагрейте немного раствора, заранее приготов-
ленного смешением 3—4 мл аммиачного раствора серебра (см. работу 2
на стр. 428) с 1 — 2 мл 1-процентного раствора глюкозы. После нагревания
431
жидкость почернеет от выделившегося металлического серебра, а если стекло'
было чистое, то серебро осядет на нём в виде зеркального налёта (ур. р.).
Рис. 218. Нагревание вещества
посередине прямой трубки.
Что доказывается этими опытами? Какая функциональная группа
имеется в молекулах глюкозы?
3. Химические свойства свекловичного сахара
1. а) Проделайте со свекловичным сахаром, как было описано для глю-
козы, опыт с восстановлением меди. Убедитесь, что свекловичный сахар этой
реакции не даёт.
Рис. 219. Нагревание
жидкости в пробирке.
б) В тщательно вымытую пробирку поместите
немного сахара и нагрейте его до побурения (обра-
зования карамели). Затем дайте остыть жидкости
и добавьте немного воды. Подогрейте её до рас-
творения карамели и дальше проделайте с получен-
ным раствором карамели опыт восстановления меди.
Реакция получится такая же, как и в опыте с глю-
козой. Объясните, почему?
2. В пробирку (рис. 219) поместите 1 мл кон-
центрированного раствора сахара, добавьте 1 мл
раствора серной или соляной кислоты и проки-
пятите 3—5 минут, беспрерывно встряхивая про-
бирку.
После этого прибавьте 1 мл раствора медного
купороса и щёлочи до полного выделения гидрата
окиси меди. Если не образовался сразу же красный
осадок закиси меди, жидкость снова нагрейте до
кипения.
Какие
кислоты?
На что указывает образование закиси меди?
изменения произошли со свекловичным сахаром под действие
4. Химические свойства крахмала
а) Поместите в пробирку немного заранее приготовленного крахмального
клейстера и каплю разбавленной водой йодной тинктуры (светложёлтого
цвета); тотчас же появится синее окрашивание, характерное для крах-
мала.
432
б) Поместите в пробирку (рис. 219) 1—2 мл крахмального клейстера, при-
бавьте 3—4 капли раствора серной кислоты и прокипятите 5—6 минут,
беспрерывно взбалтывая жидкость. Затем дайте жидкости остыть и перене-
сите одну каплю на стекло. Присоедините к ней каплю йодного раствора.
Отсутствие окраски укажет на превращение крахмала в новое вещество,
не дающее окраски « йодом.
К оставшейся в пробирке жидкости прибавьте несколько капель раствора
медного купороса и раствора щёлочи до полного выделения гидрата окиси
меди. Нагрейте жидкость до кипения, беспрерывно взбалтывая её.
Образование красного осадка закиси меди укажет на присутствие глю-
козы, образовавшейся в результате гидролиза крахмала (ур. р.).
5. Гидролиз клетчатки
Поместите на стекло кусочек фильтровальной бумаги величиной в 1—2 мм9
и поместите на неё каплю концентрированной серной кислоты. Стеклян-
ной палочкой разотрите бумагу в капле кислоты в кашицу и перенесите
эту кашицу в пробирку. Затем прилейте 1 мл воды и, всё время взбалтывая
прокипятите жидкость в течение 5 минут.
После этого прибавьте к жидкости 5 капель сильно разбавленного рас-
твора медного купороса (слабо голубого цвета) и щёлочи до полного выде-
ления гидрата окиси меди, а затем снова нагрейте до кипения. Выпадение
красного осадка закиси меди укажет на присутствие глюкозы, образовав-
шейся из клетчатки (ур. р.).
XVIII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ
„НИТРОСОЕДИНЕНИЯ44
1. Получение нитробензола
В пробирку, охлаждаемую холодной водой (рис. 220), поместите 2 мл
концентрированной серной кислоты и 1 мл концентрированной азотной кис-
лоты. Беспрерывно взбалтывая жидкость, прибавьте по каплям 1 мл (20 ка-
пель) бензола. Когда будет прилит весь бензол, перенесите пробирку в стакан
с горячей водой и энергично встряхивайте её, пока весь бензол не раство-
рится. После этого вылейте жидкость в стаканчик с небольшим количеством
воды и дайте ей отстояться. Нитробензол соберётся на дне. Отметьте запах
горького миндаля, характерный для него.
2. Получение пикриновой кислоты
В маленькую колбочку поместите 5 мл заранее приготовленного раствора
азотной кислоты (5 частей концентрированной кислоты и 2 части воды) и,
взбалтывая, прибавьте по каплям (осторожно!) 1 мл жидкого фенола. Дайте
жидкости охладиться. Появление жёлтой окраски и кристаллического
осадка укажет на образование тринитрофенола (пикриновой кислоты)
(ур. р.).
433
3. Получение соли анилина и выделение из неё анилина
а) Поместите в пробирку 1 лсл концентрированной соляной кислоты
и 1/2 мл анилина. Дайте охладиться разогревшейся смеси (рис. 220).
Рис. 220.
Получение нитро-
бензола (также
анилина).
Наблюдайте выделение кристаллов хлористо-
водородной соли анилина (ур. р.) при охлаждении жид-
кости.
б) Слейте лишнюю жидкость с кристаллов и
прибавьте немного воды для их растворения. За-
тем, всё время взбалтывая, прибавьте по каплям
избыток щёлочи; наблюдайте выделение свободного
анилина (ур. р.).
4« Реакция анилина с бромом
Поместите в пробирку немного насыщенного рас-
твора анилина в воде и прибавьте несколько капель
бромной воды.
Взболтайте жидкость и наблюдайте выпадение
осадка триброманилина (ур. р.).
5. Окисление анилина
Налейте пробирки разбавленного раствора серной кислоты и раство-
рите в ней 1—2 капли анилина.
Прилейте к полученной жидкости раствор двухромовокислого калия и
наблюдайте выделение осадка зелёного (или синего, чёрного) цвета.
6. Окрашивание ткани анилиновым красителем
Кусочек полотняной тряпочки прокипятите в воде с небольшим количеством
соды и хорошенько промойте водой.
Налейте в колбочку 100 мл воды и растворите в ней 1 г двухромово-
кислого калия. Затем прибавьте в жидкость 0,5 мл серной кислоты, столько же
соляной кислоты, 0,5 мл анилина и взболтайте. В полученную жидкость
опустите тряпочку и нагрейте до кипения. Выньте тряпочку, ополосните
водой и высушите. Убедитесь в прочности получившейся чёрной окраски.
XIX. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „БЕЛКИ«
1. Обнаружение в белке азота и серы
1. Поместите в пробирку около 1 мл неразбавленного водой белка и
около 1 г твёрдого едкого натра или натронной извести. Осторожно на-
грейте её (не держите отверстие пробирки в сторону чьего-либо лица!).
Приложите к отверстию смоченную водой красную лакмусовую бумажку.
Отметьте посинение её, указывающее на выделение аммиака. Убедитесь
в этом также по запаху.
434
2. Данте пробирке остыть и добавьте около 1—2 мл воды. Взболтайте
жидкость и добавьте в неё несколько капель раствора какой-либо соли
свинца. Тотчас же выпадает чёрный осадок; если'белка было взято мало,
произойдёт только потемнение жидкости от образовавшегося сернистого
свинца.
2. Приготовление раствора яичного белка
Осторожно разбейте скорлупу яйца и, не повреждая желток, вылейте
в стакан белок; затем долейте до i/2 стакана воды, бросьте немного (на
кончике ножа) поваренной соли и всё хорошенько размешайте.
Обратите внимание на то, что раствор получился слегка мутный. Чем
это объясняется?
3. Действие на раствор белка поваренной соли
1. Исследуйте, как влияет на раствор белка концентрированный раствор
соли. Для этого налейте в пробирку 1—2 мл приготовленного раствора белка
и прибавьте до половины пробирки насыщенного раствора поваренной
соли. Встряхните раствор и обратите внимание на образование заметной
мути.
2. Отлейте в другую пробирку немного полученной мутной жидкости и
долейте почти доверху чистой воды. Взболтайте жидкость и наблюдайте
(хотя и неполное) исчезновение мути.
4. Действие на раствор белка солей тяжёлых металлов
Налейте в пробирку на 1/3 водного раствора белка и прилейте к нему
немного раствора медного купороса или уксуснокислого свинца. Обратите
внимание на образование хлопьевидных осадков белка.
Попробуйте растворить выпавший белок в большом количестве воды.
Для этого переместите жидкость с осадком в колбочку и прилейте воду.
Происходит ли растворение осадка?
5. Действие на белок нагревания
Налейте небольшое количество раствора белка в пробирку (3—5 мл)
и медленно подогревайте над пламенем спиртовки. Следите за происхо-
дящими в жидкости изменениями. Когда появятся хлопья, прекратите
нагревание. Нужно ли для выделения белка доводить жидкость до
кипения?
Попробуйте растворить выпавший белок, добавляя воду. Растворяется ли
он? Как назвать эту реакцию — обратимой или необратимой?
6. Цветные реакции на белки
Биуретова реакция. Небольшое количество раствора белка (5—б мл)
поместите в пробирку, прилейте равный объём 10-процентного раствора
435
едкого кали или едкого натра и хорошенько взболтайте. После этого добавьте
2—3 капли 3-процентного раствора медного купороса и слабо нагрейте (не
доводя до кипения, иначе опыт не удастся). Появление фиолетового окра-
шивания укажет на присутствие белка.
Ксантопротеиновая реакция. К небольшому количеству раствора белка
в пробирке (1—2 мл) прибавьте в 10 раз меньше по объёму концентриро-
ванной азотной кислоты и слабо нагрейте. Наблюдайте выпадение жёл-
того осадка.
Дайте раствору охладиться и добавьте нашатырного спирта до щелоч-
ной реакции. Наблюдайте переход окраски осадка в оранжевую.
7.~ Обнаружение белковых веществ в пищевых продуктах
1. Прокипятите в пробирке с небольшим количеством воды кусочек
мяса и обнаружьте в растворе белок с помощью биуретовой реакции.
2. Прокипятите в пробирке,немного волос в растворе щёлочи (осторожно)
до их растворения и обнаружьте в растворе белок при помощи вышеука-
занных реакций.
XX. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „КРЕМНИЙ"
1. Свойства кремниевого ангидрида
В пробирку или в колбочку поместите немного чистого песка (предва-
рительно хорошо промытого водой). Прилейте дистиллированной воды и
прокипятите в течение 1—2 минут.
Каплю жидкости поместите на стекло и выпарьте её досуха. Обратите
внимание на полное отсутствие какого-либо остатка, если, конечно, вода и
песок были чистые —без каких-либо примесей.
То же повторите с мелкими кусочками кварца и других кварцевых
пород; убедитесь в полной нерастворимости кремниевого ангидрида в воде.
2. Получение кремниевой кислоты и кремниевого ангидрида
а) Поместите в пробирку немного свежеприготовленного насыщенного
раствора кремнекислого натрия (продажного жидкого стекла). Прибавьте
2 капли концентрированной соляной кислоты. Наблюдайте образование
сгустка в месте соприкосновения растворов. Встряхивая, перемешайте рас-
творы и наблюдайте загустение всей массы от выделившейся кремниевой
кислоты (ур. р.).
б) Поместите немного полученной кремниевой кислоты на конце трубки
и прокалите. Рассмотрите получившийся кремниевый ангидрид — двуокись
кремния (ур. р.). Поместите в каплю воды и отметьте отсутствие реакции
между кремниевым ангидридом и водой. Таким путём убедитесь, что полу-
чить кремниевую кислоту непосредственным соединением её ангидрида (SiO2)
с водой нельзя,
436
XXI. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ПЕРИОДИЧЕСКИЙ ЗАКОН
И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ*
1. Сравнение свойств элементов и их соединений в рядах
таблицы Менделеева
1. Сравните св<>йства гидратов окисей металлов 3-го ряда: магния и
алюминия.
Опыты проведите в пробирке, беря указанные ниже реактивы в коли-
честве ]/г—1 мл>
а) Налейте в две пробирки раствор какой-либо соли магния и в каждую
пробирку добавляйте йО каплям раствор щёлочи (1—2-процентного до выпа-
дения осадка гидрата окиси магния (ур. р.).
Затем в одну пробирку с выпавшим осадком гидрата окиси магния при-
лейте 1—2 мл раствора кислоты, а в другую пробирку прилейте раствор
щёлочи. Наблюдайте быстрое и полное растворение гидрата окиси магния
в кислоте с образованием соли магния (ур. р.) и отсутствие реакции между
гидратом окиси магния и щёлочью.
Какие свойства проявляет гидрат окиси магния, если он реагирует с кисло-
той и не реагирует со щёлочью?
б) Проделайте с солью алюминия опыт, описанный для соли магния.
В две пробирки налейте по 2—3 мл раствора какой-либо соли алюми-
ния, например сернокислого алюминия, и добавьте в каждую пробирку по
нескольку капель разбавленного раствора щёлочи (1—2-процентного до обра-
зования студенистого полупрозрачного осадка гидрата окиси алюминия (ур. р.).
Добавьте в первую пробирку ещё щёлочи и взболтайте жидкость; на-
блюдайте растворение осадка в избытке щёлочи вследствие образования
алюмината (ур. р.). Если осадок не растворился, добавьте ещё щёлочи.
Прилейте во вторую пробирку немного раствора кислоты. Взболтайте
жидкость и наблюдайте растворение осадка вследствие образования соли
алиминия (ур. р.).
Какие свойства проявляет гидрат окиси алюминия, если он реагирует
со щёлочью? если он реагирует с кислотой? Как называются такие
вещества?
Какие свойства проявляются в гидрате окиси алюминия (элемента
с бблыпим атомным весом), отсутствующие в гидрате окиси магния (элемента
с меньшим атомным весом)?
2. Сравните устойчивость водородных соединений металлоидов 3-го ряда
серы и хлора.
Поместите в одну пробирку немного сероводородной воды, а в другую
пробирку немного раствора соляной кислоты. В каждую пробирку пустите
по 1—2 капли раствора йода в йодистом кали.
Наблюдайте исчезновение окраски йода в пробирке с сероводородной
водой и выделение в ней свободной серы в виде белой мути. В пробирке
с соляной кислотой никакой реакции не происходит и окраска йода не
исчезает.
Опыт показывает, что хлористый водород — прочное соединение и не
окисляется под действием йодной воды.
437
Сероводород — соединение менее прочное, и йодная вода легко окисляет
его с образованием воды и свободной серы. Напишите уравнение реакции
окрсления сероводорода, присоединяя к нему атомарный кислород (послед-
ний выделяется йодной водой по уравнению реакции, приведённому на
стр. 98).
На усиление каких свойств указывает большая прочность молекул хлористого
водорода?
Как изменяются металлические и металлоидные свойства элементов в рядах
таблицы Менделеева в направлении слева направо?
2. Сравнение свойств элементов и их соединений
в группах таблицы Менделеева
Поместите в пробирки понемногу (в объёме горошины) порошков хлори-
стого' натрия, бромистого натрия и йодистого натрия.
В каждую пробирку пустите по 1—2 капли концентрированной серной
кислоты и наблюдайте происходящие явления.
Обратите внимание на выделение хлористого водорода, бромистого водо-
рода и йодистого водорода (ур. р.). ’Все эти вещества — бесцветные газы;
однако обратите внимание на то, что в пробирке с выделившимся бромистым
водородом появилось жёлтое Окрашивание; оно указывает на выделение сво-
бодного брома, образующегося вследствие окислительного действия серной
кислоты на бромистый водород. Обратите также внимание на появление бурой
окраски в пробирке с выделившимся йодистым водородом. Это указывает на
образование свободного йода в результате окислительного действия серной
кислоты на йодистый водород.
Исходя из наблюдаемого, сделайте вывод, какие галогеноводороды легче
подвергаются окислительному действию серной кислоты. Какие являются более
прочными соединениями? менее прочными соединениями?
На ослабление каких свойств указывает уменьшение устойчивости водо-
родных соединений галогенов с ббльшим атомным весом?
Как изменяются металлоидные и металлические свойства элементов в груп-
пах в направлении сверху вниз, т. е. в сторону увеличения атомного веса
элементов?
ХХП. ПРАКТИЧЕСКИЕ РАБОТЫ
ПО ТЕМЕ „ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ"
1. Диссоциация электролитов в водных растворах
Растворите в воде и напишите уравнения диссоциации нижеуказанных
веществ; запишите окраску их растворов и решите в каждом случае, какие
йоны и как окрашены.
Вещества: кислоты — соляная, азотная, серная, уксусная; гидраты оки-
сей — натрия, калия, кальция, аммония; соли — медь хлорная, сернокислая,
азотнокислая, калий сернокислый, марганцевокислый КМпО4, хромовокислый
КгСгО4, сернокислый хром C^fSOJs, сернокислый никель NiSO4.
438
2. Сильные и слабые электролиты
В три пробирки налейте (до Vi) растворов кислот одинаковой концентра-
ции: в первую — соляной, во вторую — серной, в третью — уксусной; положите
в каждую пробирку по одинаковому кусочку цинка. Наблюдайте за интен-
сивностью выделения водорода. Какая существует связь между силой элек-
тролита и его химической активностью? Что такое сильный и слабый
электролит?
3. Зависимость диссоциации электролита от концентрации
В две пробирки поместите по небольшому, приблизительно одинаковому,
кусочку цинка и налейте по 1 мл: в одну — концентрированной (98-процент-
ной) серной кислоты, а в другую — разбавленной (20-процентной) серной
кислоты. Какая кислота энергичнее реагирует с цинком? В каком из этих
двух растворов содержится больше Йонов, чем молекул? больше молекул, чем
Йонов? Почему?
Какое влияние на диссоциацию оказывает разбавление раствора?
Можно ли сделать вывод, что разбавленная кислота всегда реагирует энер-
гичнее, чем кислота более концентрированная? При каких реакциях следует
употреблять разбавленную серную кислоту? концентрированную серную
кислоту?
4. Йонные реакции
а) Испытайте на лакмус растворы кислот: соляной, серной, азотной и
уксусной. Какой йон вызывает переход окраски лакмуса в красную?
Проделайте аналогичный опыт с растворами оснований: едкого натра,
едкого кали и гидрата окиси аммония. Какой йон вызывает переход окраски
лакмуса в синюю?
б) Налейте в 3 пробирки по 1 — 2 мл раствора хлористого бария и при-
лейте в первую пробирку немного разведённой серной кислоты, во вторую —
сернокислого натрия, в третью — сернокислого аммония. Какое вещество выпа-
дает в осадок во всех трёх пробирках?
Напишите уравнения реакций в молекулярном и йонном виде. Какие йоны
принимают участие в этих реакциях?
Можно ли в этом опыте заменить хлористый барий какой-либо другой
растворимой солью бария? Проделайте опыт с азотнокислым барием.
в) Налейте в 2 пробирки растворы: в первую — хлористого натрия, во вто-
рую — соляной кислоты. В каждую пробирку прибавьте по нескольку капель
раствора азотнокислого серебра.
Рассмотрите выпавшие осадки хлористого серебра. Напишите в молеку-
лярном и в йонном виде уравнения реакций.
г) Напишите в молекулярном и йонном виде уравнения следующих реак-
ций нейтрализации;
едкий натр 4»соляная кислота;
едкое кали +серная кислота;
гидрат окиси аммония -f- азотная кислота.
В чём сущность реакции нейтрализации с ионной точки зрения?
439
XXIII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „МЕТАЛЛЫ"
1. Вытеснение металлов друг другом
а) Налейте в пробирку немного разбавленного раствора медного купороса.
Погрузите в раствор проволочку или кусочек металла, стоящего в ряду актив-
ности левее меди: магния, алюминия, цинка, железа. Вынимая металл из раствора,
наблюдайте отложение на нём меди (ур. р.).
б) Проделайте то же, взяв раствор свинцовой соли.
Какой металл теряет электроны, присоединяет электроны (в проделанных
опытах) и почему?
2. Вытеснение металлом водорода из кислот
Налейте в пробирку немного разбавленного раствора какой-либо кислоты
(соляной, серной, уксусной) и опускайте в неё поочерёдно проволочки или
кусочки металлов, расположенных в ряду активности левее водорода и пра-
вее водорода (медь). Отметьте наблюдающиеся особенности и объясните их,
исходя из положения металла в ряду активности. Для всех случаев выделения
водорода напишите уравнения реакции в молекулярном и йонном виде.
3. Взаимодействие металла, не вытесняющего водород,
с концентрированной кислородсодержащей кислотой
Налейте в пробирку 1 мл концентрированной серной кислоты и внесите
в неё свёрнутую в комочек тонкую медную проволочку. Осторожно (не держать
отверстия пробирки в сторону лица своего или соседа!) нагрейте её, всё время
взбалтывая жидкость, держа её высоко над пламенем.
Когда кислота нагреется, понюхайте выделяющийся газ. По запаху уста-
новите, что выделяется не водород, а сернистый газ.
Осторожно продолжайте нагревание, пока реакция не станет достаточно
энергичной. После этого прекратите нагревание и дайте жидкости остыть.
Добавьте к ней 1 мл воды. Наблюдайте появление голубой окраски, указы-
вающей на появление в растворе йонов меди. Напишите уравнение реакции
в виде двух последовательных процессов и в суммированном виде.
XXIV. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ЩЕЛОЧНЫЕ МЕТАЛЛЫ"
1. Приготовление трубок с калием и натрием для проведения
наблюдений над этими металлами
При всех работах с натрием надо соблюдать следующее условие: вблизи
не должно быть воды; руки и все предметы должны быть совершенно сухи.
Возьмите отрезанный от стеклянной трубки (диаметром 5—7 мм) кусок
длиной около 15 — 20 см. Трубка должна быть хорошо вымыта, особенно
внутри. Для удаления следов грязи внутри трубки нужно при помощи стек-
лянной палочки несколько раз продвинуть вдоль канала трубки влажные
комочки бумаги; после мытья трубка должна быть хорошо высушена. Концы
трубки оплавлять не следует.
После того как будет заготовлена трубка, подготовьте натрий. Кусок его
выньте из керосина и возможно лучше оботрите тряпочкой или куском
440
таким путём кусок поместите на лист
затем вырежьте из куска пластинку
на чистый лист бумаги и вдавите
221). Кусок натрия при этом следует удерживать
фильтровальной бумаги. Осушенный
бумаги и со всех сторон срежьте корку,
толщиной 5—8 мм, положите её плашмя
в неё стеклянную трубку (рис.
двумя пальцами через полоски бу-
маги, а трубку надавливать не
очень сильно, чтобы она не сло-
малась и Йе поранила руку; для
облегчения продавливания следует
всё время медленно вращать
трубку, сохраняя в то же время
вертикальное положение её.
Когда пластинка металла бу-
дет продавлена насквозь, подни-
мите трубку вместе с вогнанным
в неё столбиком металла (рис.
222, Я) и протолкните его стек-
лянной палочкой до середины
трубки (рис. 222, Б). Затем, не
вынимая стеклянной палочки,
вставьте с другой стороны трубки
вторую палочку, и, держась рука-
ми за обе палочки (рис. 222, В),
Рис. 221. Продавливание трубки
в пластинку натрия (калия).
Справа— трубка с продавленным
в неё металлом.
надавите с двух сторон на
металлический столбик; медленно вращайте палочки, чтобы возможно плот-
нее пригнать металл к стенке трубки. Таким путём обжатый столбик натрия
Рис. 222. Введение натрия (калия) в трубку.
А — 1-я стадия: трубка с продавленным в неё металлом; Б — 2-я стадия: проталкивание
металла внутрь трубки; В — 3-я стадия: обжимание столбика металла с двух сторон.
или калия долгое время сохраняет блестящую поверхность в месте сопри-
косновения со стеклом.
Проведите за металлами в трубках длительное наблюдение (см. рис. 138)
Периодически рассматривайте их и наблюдайте: появление слоя окислов по
бокам столбиков металла, где он соприкасается с воздухом (ур. р.), затем через
некоторое время появление капель щёлочи, образовавшейся в результате
29 В. В. Левченко
441
взаимодействия окислов с проникшей в трубку влагой (ур. р.), еще позже — по-
явление твёрдого белого налёта углекислой соли, образовавшейся в результате
взаимодействия щёлочи с содержащимся в воздухе углекислым газом (ур.р.).
2. Сода водная и безводная
Поместите немного кристаллической соды в пробирку или у края стек-
лянной трубки (см. рис. 175) и нагрейте её. Наблюдайте плавление соды
в кристаллизационной воде. Продолжайте нагревать, пока не будет удалена
вся вода и не получится безводная (кальцинированная) сода (ур. р.).
3. Двууглекислая сода
Поместите в согнутую трубку (см. рис. 206) немного двууглекислой соды
иприлейте в приёмник 3—5 капель свежеприготовленной известковой воды.
Закройте отверстие трубки, нагрейте соду и наблюдайте помутнение извест-
ковой воды от выделяющегося углекислого газа (ур. р.).
4. Получение поташа из золы
Поместите в пробирку немного золы (в объёме горошины) и прибавьте
немного воды (около 2—3 мл). Нагрейте жидкость до кипения (см. рис. 155).
Дайте охладиться и отстояться жидкости и перенесите на стекло
каплю её.
Выпарьте каплю (см. рис. 165) и рассмотрите остаток, представляющий
собой извлечённый из золы поташ. Поместите на него каплю разбавленной
кислоты и наблюдайте выделение пузырьков углекислого газа (ур. р.).
XXV. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „МАГНИЙ"
1. Взаимодействие магния с водой
Поместите в пробирку немного кусочков или порошка магния и при-
бавьте 2—3 мл воды. Нагрейте воду почти до кипения (см. рис. 155), удалите
огонь и наблюдайте выделение пузырьков водорода (ур. р.).
Перенесите каплю жидкости на стекло и смочите ею красную лакмусо-
вую бумажку или бесцветную фенолфталеиновую бумажку. На присутствие
каких Йонов в растворе указывает изменение окраски индикаторов? Какое
образовалось вещество (ур. р.)?
2. Взаимодействие магния с кислотами
Поместите на стекло капли разбавленных растворов разных кислот и вне-
сите в них маленькие кусочки магния (см. рис. 169).
Наблюдайте выделение водорода (ур. р.). Когда выделение водорода пре-
кратится (магния должно быть столько, чтобы часть его осталась непрореаги-
ровавшей), выпарьте капли и рассмотрите твёрдые остатки образовавшихся
солей (см. рис. 165).
3. Получение окиси и гидрата окиси магния
Поместите на конце прямой трубки (см. рис. 175) немного порошка магния
и нагрейте над пламенем. Наблюдайте вспышку.
Высыпьте на стекло и рассмотрите образовавшуюся окись магния (ур. р.).
Поместите на стекло каплю воды и разотрите в ней с помощью стеклян-
ной палочки немного полученной окиси (см. рис. 100),
442
Смочите получившимся раствором красную лакмусовую бумажку. На при-
сутствие каких йонов в растворе и на образование какого вещества указывает
посинение лакмуса (ур. р.)? Проверьте это, смочив раствором бесцветную
фенолфталеиновую бумажку.
XXVI. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „КАЛЬЦИЙ"
1. Взаимодействие кальция с водой
Поместите в пробирку несколько кусочков кальция и прибавьте немного воды.
Наблюдайте выделение пузырьков водорода (ур. р.).
По окончании реакции перенесите каплю жидкости на стекло и смочите
ею красную лакмусовую бумажку и бесцветную фенолфталеиновую бумажку.
На что указывает изменение окраски индикаторов? Какие в растворе
находятся йоны (ур. р.)?
2. Взаимодействие кальция с кислотами
Проведите опыт, как описано для магния (опыт 2 на стр. 442), но вместо
кусочков магния возьмите кусочки кальция (ур. р.).
3. Получение окиси кальция
Поместите в трубку, около её края (см. рис. 175), маленький кусочек
кальция и нагрейте над пламенем. Высыпьте на стекло и рассмотрите образо-
вавшуюся окись кальция (ур. р.).
4. Получение гидрата окиси кальция
Поместите в пробирку немного негашёной извести (полученной в преды-
дущем опыте) и пустите иа порошок каплю воды. Наблюдайте соединение
окиси кальция с водой — гашение извести (ур. р.). Отметьте выделение тепла
(потрогайте стекло пальцем). Рассмотрите получившийся порошок — гидрат
окиси кальция (гашёную известь).
Прибавьте воду в избытке и взболтайте в ней полученный гидрат окиси.
Получившуюся белую жидкость — известковое молоко — оставьте отстояться
1—2 минуты.
После отстаивания слейте в другую пробирку прозрачный раствор —
известковую воду. Смочите ею красную лакмусовую бумажку. На что указы-
вает посинение лакмусов? Проверьте ещё фенолфталеиновой бумажкой. Какие
в растворе находятся йоны (ур. р.)?
5. Гипс '
а) Поместите на стекло немного порошка алебастра и размешайте с не-
сколькими каплями воды до образования негустого теста. Придайте тесту
какую-либо форму и оставьте на 5—10 минут.
б) Поместите в трубку у её конца (см. рис. 175) немного алебастра и
посильнее прокалите его в пламени спиртовки. Прокалённый алебастр по-
местите на стекло и, смешав с небольшим количеством воды, сделайте тесто,
как и в первом случае. Оставьте его на 5—10 минут.
29* 443
Сравните результаты обоих опытов. Почему в первом случае тесто из
алебастра затвердело (ур. р.), а после прокаливания (ур. р.) осталось без
изменения?
в) Поместите на стекло 2 капли разбавленной соляной кислоты. В одну
каплю положите маленький кусочек минерала гипса, а в другую — извест-
няка. Наблюдайте выделение углекислого газа (ур. р.) во втором случае и
отсутствие реакции в первом (отличие гипса от известняка).
6. Жёсткость воды
а) Приготовьте приборчик для получения углекислого газа, как показано
на рисунке 170.
В пробирку или согнутую трубку налейте свежеприготовленной известко-
вой воды и пропустите в неё углекислый газ. Наблюдайте за изменением
известковой воды. Отметьте её помутнение от образовавшегося углекислого
кальция. Продолжайте пропускание углекислого газа (ур. р.), пока не исчезнет
муть вследствие перехода углекислого кальция в лучше растворимую кислую
соль — кислый углекислый кальций (ур. р.).
б) Перенесите на стекло каплю полученного прозрачного раствора
(остальную часть раствора сохраните для следующей работы). Положите
в каплю маленький кусочек мыла и разотрите его палочкой. Отметьте
отсутствие пены и образование тяжёлых хлопьев кальциевой соли жирных
кислот (ур. р.).
7. Смягчение жёсткой воды
а) Поместите на стекло (см. рис. 171) каплю полученного в предыдущей
работе раствора (жёсткой воды), а рядом — каплю раствора соды; соедините
капли; наблюдайте выпадение осадка средней соли углекислого кальция (ур. р.).
б) Оставшуюся в пробирке прозрачную жидкость нагрейте до кипения.
Наблюдайте выпадение осадка углекислого кальция, образовавшегося в резуль-
тате разложения кислой соли (ур. р.).
в) Поместите на стекло каплю раствора гипса, обусловливающего жёст-
кость, не устраняемую кипячением. Рядом поместите каплю раствора соды.
Соедините капли и наблюдайте выпадение осадка углекислого кальция (ур. р.).
XXVII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „АЛЮМИНИЙ"
1. Взаимодействие алюминия с кислотой и щёлочью
Поместите на стекло (см. рис. 172) каплю раствора щёлочи и отдельно
каплю разбавленного раствора соляной (или серной) кислоты. В капли поло-
жите по кусочку очищенной алюминиевой проволоки.
Наблюдайте в обоих случаях реакцию с выделением водорода.
Для ускорения реакции стекло можно немного подогреть (см. рис. 165).
После прекращения выделения водорода (при избытке металла) выпарьте
капли и рассмотрите оставшиеся в твёрдом виде алюминат (ур. р.) и соль
алюминия (ур. р.).
2. Взаимодействие алюминия с разными кислотами
Повторите опыт, описанный для магния (опыт 2 на стр. 442), но вместо
магния возьмите кусочки алюминия.
444
3. Защитная роль плёнки окиси алюминия
а) Налейте в пробирку до половины её высоты раствор щёлочи и опу-
стите в него алюминиевую проволоку. Подержите её в щёлочи, пока не нач-
нётся реакция алюминия со щёлочью с выделением водорода. Для ускорения
реакции пробирку слабо подогрейте.
Когда щёлочь растворит защитный слой окиси алюминия, покрывающий
металл сплошной плёнкой, и станет заметно обильное выделение водорода,
выньте проволоку и промойте в пробирке с водой её конец, находившийся
в щёлочи. Проволоку вытрите насухо. Очищенный щёлочью конец проволоки
протрите порошком окиси ртути, насыпав её в небольшом количестве на
бумагу. '
После этого обработанный конец проволоки снова вытрите фильтровальной
бумагой или цистой тряпочкой. Положите проволоку на стекло и наблюдайте
за окислением алюминия: проволока в течение 1—2 минут покрывается рыхлым
белым налётом окиси алюминия, продолжающим увеличиваться ещё долгое
время (ур. р.).
б) Снимите с проволоки кусочком бумаги образовавшуюся окись и опустите
проволоку в пробирку с водой. Наблюдайте взаимодействие с водой алюминия,
лишённого защитного слоя окиси. Обратите внимание на выделение
водорода и появление в воде хлопьев гидрата окиси алюминия
(ур. р.).
4. Амфотерность гидрата окиси алюминия
Повторите опыт с солью алюминия, описанный на стр. 437 (опыт 1, б).
Напишите в молекулярном и йонном виде уравнения происходивших
реакций.
XXVIII. ПРАКТИЧЕСКИЕ РАБОТЫ ПО ТЕМЕ „ЖЕЛЕЗО"
1. Взаимодействие железа с различными кислотами
Повторите опыт, описанный для магния (опыт 2 на стр. 442), но вместо
магния возьмите маленькие кусочки железа (ур. р.).
2. Получение гидрата закиси железа и его окисление
Поместите в пробирку немного свежеприготовленного раствора желез-
ного купороса (полученного растворением в разбавленной серной кислоте
кусочков железа, взятых в избытке). Добавьте в жидкость несколько капель
щёлочи. Наблюдайте выпадение осадка гидрата закиси железа почти белого
цвета; осадок быстро окисляется на воздухе в гидрат окиси железа
с изменением окраски через промежуточные серо-зелёные тона в буро-
красную.
3. Получение гидрата окиси железа
Поместите в пробирку немного растворов хлорного железа и щёлочи.
Наблюдайте выпадение осадка гидрата окиси железа бурого цвета (ур. р.).
445
4. Распознавание солей двухвалентного и трёхвалентного железа
1. Налейте в пробирку 4—5 мл раствора соляной кислоты (1:1) и поме-
стите в неё мелкие кусочки железа (кусочки проволоки, мелкие гвозди).
Дайте прореагировать железу (ур. р.). Для ускорения реакции пробирку
можно слабо подогреть (не до кипения жидкости). Железо должно быть
взято в избытке, чтобы после прекращения выделения водорода часть железа
оставалась неизрасходованной.
2. Когда закончится реакция, слейте жидкость в четыре пробирки (iio^am
в каждую).
- В одну пробирку прилейте раствор щёлочи и наблюдайте выпадение белого
осадка гидрата закиси железа, постепенно буреющего в результате окисления
под действием кислорода воздуха.
В другую пробирку добавьте в жидкость 1—2 капли роданистого калия
и отметьте отсутствие каких-либо изменений в жидкости.
3. В ктретью пробирку добавьте немного свежеприготовленной хлорной
воды; взболтайте раствор. После этого добавьте роданистого калия и наблю-
дайте появление красного окрашивания. На присутствие какого йона железа
это указывает (ур. р.)?
В четвёртую пробирку прилейте хлорной воды, взболтайте и добавьте
немного раствора щёлочи. Наблюдайте выпадение бурого осадка гидрата окиси
железа.
Наиболее употребительные элементы с их химическими знаками
' и атомными весами
Русское название Латинское название Произношение латинского названия Химич, знак печатный Химич, знак рукописи. Произношение химич. знака К 2 « < я
азот алюминий барий бор бром водород гелий железо золото йод калий кальций кислород кремний магний марганец медь мышьяк натрий, ртуть свинец сера серебро углерод фосфор фтор хлор хром цинк Nitrogenium Aluminium Baryum Borum Bro mu m Hydrogenium Helium Ferrum Aurum Jodum Kalium Calcium Oxygenium Sllicium Magnesium Manganum Cuprum Arsenicum Natrium Hydrargyrum Plumbum Sulfur Argentum Carboneum Phosphorus Fluorum Chlorum Chromium Zincum нитрогениум алюминиум бариум борум бромум гидрогениум гелиум Феррум аурум йодум калиум кальциум оксигениум силициум магнезиум манганум купрум арсеникум натриум гидраргирум плюмбум сульфур аргентум карбонеум фосфорус флуорум хлорум хромиум цинкум N А1 Ва В Вг Н Не Fe Au J К Са О Si Mg Мп Си As Na Hg Pb S Ag С Р F С1 Сг Zn N Al Ва В Вг Н Не Fe Аи J К Са О Si Mg Мп Си As Na Hg Pb S Ac‘ p F Cl Cr Zn эн алюминий барий бе бром аш гелий Феррум аурум ёд калий кальций О силиций магний марганец купрум арсеникум натрий гидраргирум плюмбум эс аргентум це ПЭ фтор хлор хром цинк 14,008 26,97 137,36 10,82 79,916 1,008 4,003 55,85 197,2 126,9 39,096 40,08 16,00 28,06 24,32 54,93 63,54 74,91 23,00 200,61 207,21 32,06 107,88 12,01 30,98 19,0 35,46 52,01 65,38
446
V
АЛФАВИТНЫЙ УКАЗАТЕЛЬ
Адсорбция 174
Азот 141
— в природе 142
Азотная кислота 154
— окислительное действие 154
Активированный уголь 175
Алебастр 359
Алкоголгты 222
Аллотропия 106
Аллотропические видоизмене-
ния 106
Алмаз 171
Алюминаты 284, 366
Алюминий 361
— гидрат окиси 366
— окись 366
Алюминотермия 362
Альдегиды 227
Аммиак 143
Аминокислоты 261 f
Аммоний 145
Амфотерность 285
Ангидрид 37
— азотистый 149
— азотный 149
— сернистый 127
— серный 130
— угольный 182
— фосфорный 165
Анилин 258
Анионы 314
Апатиты 164
Аргон 278
Ароматические углеводороды
214
Атомный вес 14
Атом 13
— строение 19, 298
Ацетилен 205
Ацетон 235
Баббит 334
Бактерии аэотусваивающие 158
Башенный способ производства
серной кислоты 137
Башня Гей-Люссака —
Гловера 137, 138
Бекетов 47, 363
Беление сернистым газом 128
Беление хлором 76
Белки 260
Бензин 201
Бертолетова соль 90, 111
Бетон 277
Бикарбонаты 185
Бром 92
Бромистый водород 95-
Бронза 334
Бутлеров 194
Валентность 18, 303
Валентные электроны 304
Вернадский 337
Вес атома 14
— грамм-молекулярный 15
— молекулярный 14
Вещество простое 14
— сложное 14
Витамины 267
Виноградский 159
Вода 116
— гигроскопическая 63
— жёсткая 187
— известковая 358
— кристаллизационная 62
— смягчение жёсткости 188
Водород, горение 108
— испытание чистоты 72
— перекись 116
— получение 72
Восстановление 332
Газ болотный 177
— водяной 182
— генераторный 181
— колошниковый 375
— природный 177
— рудничный 177
— светильный 217
— сернистый 127
— углекислый 182
Газы инертные 277
Галогены 69
Гашёная известь 358
Гелий 278
Гидраты окислов металлов 38
Гидроксил 38
Гидрогенизация жиров 243
Гидролиз белков 264
— клетчатки 253
— жиров 241
— углеводов 252
Гипс 359
Глинозём 366
Глицерин 223
Горелка кислородо-водород-
ная ИЗ
Горение 109
— водорода в кислороде 108
Гомологи 199
Гомологический ряд 199
Гормоны 267
Горный хрусталь 271
Грамм-атом 15
Грамм-молекула 15 ,
Графит 171
Группа элементов 287
Дальтон 13
Двуокись азота 151
— углерода 182
Динамит 246
Дисахариды 249
Доменная печь 373
Дюралюминий 365
Дыхание 109
Едкие щёлочи 40
Едкий натр 40, 347
Едкое кали 40, 347
Железняк бурый 373
— красный 372
— магнитный 372
Железо 369
— закись 379
— ковкое 371
— окись 379
— сернистое 373
— хлорное 370
Железобетон 277
Жёсткост^ роды 188
— смягчейиё 188
Жиры 239
Закись железа 379
Закон Авогадро 27
— Ломоносова 16
— Менделеева 280
— постоянства состава 17
— сохранения веса вещества
16
Зелинский 174
Зинин 259
Известняк 187
Известь 358
— белильная 91
— гашёная 358
— жжёная 358
Изомерия 142
Индикаторы 90
Инертные газы 277
Йод 96
Йодистый эддород 90
Йонные реакций 322
Йоны 304, 313
Иприт 205
Калий 340
Кальций 356
карбид 206
Камерный сцособ произв.
серной кислоты 137
Карболовая кислота 225
Карпинский 337
Катализ 1Ц
Катализатор 111
Катионы 314
Каучук 210
Кварц 271
Кетоны 236
Квасцы 368
Кислород 107
— аллотропические видоизме-
нения 106
»— в природе 109
447
Кислоты 44, 318
— азотистая 150
— азотная 151
— бромистоводородная 95
— диссоциация 318
— йодистоврдородная 99
— кремниевая 272
— метафосфорная 166
— муравьиная 231
— Ортофосфорная 166
— основность 47
— плавиковая 102
— серная 131
— сернистая 129
— сероводородная 123
— соляная 84
— стеариновая 240
— угольная 185
— уксусная 233
— фосфорная 166
Кислотный остаток 45
Кислоты бескислородные 47
— карбоновые 230
— сильные 321
— слабые 321
Классификация кислот 47
— окислов 34
— оснований 39
— солей 50
— элементов 31, 280
Клетчатка 250
Коллоидный раствор 262
Красители 266
Крахмал 249
Кокс 218
Конвертор 376
Контактный способ получения
серной кислоты 134
Концентрация растворов 60
Коррозия 335
Крекинг нефти 202
Кремнезём 271
Крейний 268
Кристаллогидраты Ь2
Круговорот азота 157
Купорос медный 139
— железный 381
Курнаков 334
Кучеров 209
Кюри-Склодовская 295
Лакмус 40
Латунь 334
Лебедев 211
Лекарственные вещества 26/
Ломоносов М. В. 10
Лучи радия 296
Магнезия жжёная 355
Магний 352
Магнитный железняк 372
Мартеновская печь 377
Масла высыхающие 244
Медный купорос 139
Мел 187
Менделеев Д. И. 281
Металлоиды 31, 280
Металлы 328
— валентность 303
— вытеснение друг другом 47
— добывание из руд 338
— ряд активности 47
— физические свойства 328
— химические свойства 331
— цветные 329
— чёрные 329
— щёлочноземельные 352
— щелочные 340
Метан 176
Метиловый спирт 220
Молекула 13
Молекулярно-атомистическое
учение 10
Молярный раствор 60
Моносахариды 247
Мрамор 187
Мыло 241
Муравьиный альдегид 228
Натрий 340
Натр едкий 347
Нашатырный спирт 146
Нашатырь 148
Нейтроны 307
Непредельные углеводороды
204
Неон 277
Нефть 200
Нитробензол 256 ।
Нитроглицерин 246
Нитроклетчатка 253
Огнетушитель 189
Овоп 113
Озонатор 115
Окисление 331
Окислы 38
— азота 149
— классификация 34
— несолеобразующие 34
— солеобразующие 34
Окись азота 150
— алюминия 366
— железа 379
— калия 346
— кальция 358
— магния 355
— натрия 346
— углерода 179
Органические вещества 190
Основания 38
— диссоциация 317
— сильные 320
— слабые 320
Основность кислоты 47
Отравляющие вещества 80
Отстаивание 386
Охлаждение при растворении
56
Паяльная жидкость 89
Парафин 199
Парафины 197
Перегонка каменного угля 217
Перекись водорода 176
— натрия 347
Периодический закон 280
Периоды большие 287
Периоды малые 287
Пирит 373
Пироксилин 255
Плавиковая кислота 102
Плавни 375
Пластические массы 265
Полимеризация 210
Полисахариды 249
Порох бездымный 255
— чёрный 157
Предельные углеводороды 197
Поташ 185, 189, 350
Прибор для получения водо-
рода 72
— кислорода ПО
— соляной кислоты 86
— хлора 79
Применение азота 142
— азотной кислоты 155
— аммиака 149
— брома 93
Применение йода 99
— кислорода 113
— серной кислоты 133
— сероводорода 125
— серы 121
— соляной кислоты 87
— фтористого водорода 102
— хлора 79
Противогаз 175
Проток 299
Процесс доменный 373
Радий. 296
Радикалы 219
Радиоактивность 294
Радон 279
Растворы 54
—г коллоидный 263
— молярный 60
— насыщенный 57
Растворение 385
— охлаждение при растворе*
нии 56
— разогревание при раство*
рении 56
Растворимость 57
— газов 59
— жидкостей 59
• — оснований 39
— солей 50
— твёрдых тел 58
Расчёты по формулам и урав»
нениям 24, 29
Реактив на йод 97
— серную кислоту 139
— соляную кислоту 87
Реакция восстановления 338
— замещения 16
— нейтрализации 41
— нейтральная 41
— обмена 43
— обратимая 43
— окисления 338
— полимеризации 210
— разложения 16
— соединения 16
Реакция экзотермическая 107
— эндотермическая 108
Резка металла 112
Руда 337
Сахар виноградные 247
— свекловичный 249
Сварка железа 112
Семёнов 73
Селитра 156
Сера 118
Серная кислота 131
— производство камерным
способом 137
— производство башенным
способом 137
— производство контактным
способом 134
Сероводород 122
Сероуглерод 172
Силикатная промышленность
276
Силикаты 273
Синтез аммиака 143
— органических веществ 190,
265
Синтетический каучук 210
Смола каменноугольная 218
Сода 188, 350
Соли 49
— азотной кислоты 156
— аммония 147
— диссоциация 319
— кислые 50
448
Соля кремниевой кислоты 273
Соли магния 355
— натрия 349
— основные 187
— растворимость 51
— серной кислоты 139
— угольной кислоты 185
— фосфорной кислоты 167
Соль бертолетова 90
— глауберова 350
— горькая 355
— Каменная 88
Поваренная 88
Спирты 220
toC плавы 333
Сталь '371
— закалка 371
— нержавеющая 372
Стекло 275
— кварцевое 272
— растворимое 275
Стекольная промышленность
275
Строение атома 298
Суперфосфат 168
Суспензия 55
Сухая перегонка дерева 235
Су1Ця перегонка каменного
уёля 217
Теория строения 194
Таблица Менделеева 286
Термит 363
Тимирязев 250
Торф 173
Тротил 258
Угарный газ 179
Углерод 170
Углеводороды 195
— ароматические 214
Углеводы 247
Уголь активированный 175
Уголь древесный 174
— каменный 173
Удобрения азотные 157
— фосфорные 168
Уксус 233
Уравнения химические 23
Фаворский 211
Фенол' 225
Феноляты 226
Ферсман 337
Фильтр 386
Фильтрование 388
Флюсы 375
Фосген 180
Фосфаты 169
Фосфор 160
— белый 160
— красный 160
— применение 164
Фосфориты 164
Фосфорные кислоты 166
Фотосинтез 251
Фтор 101
Фтористый водород 102
Химические уравнения 23
Хлор 69
Хлористый водород 81
Хлорная вода 75
Хрусталь горный 271
Целлариусы 85
Цемент 276
Циклические углеводороды 213
Цинковый купорос 139
Чугун 371
Шкаф сушильный 63
Шлак 375
Щёлочи 39
Эксикатор 64
Электролиз поваренной соли
347
Электролиты 312
Электрон 299
Электропроводность раство-
ров 312
Элемент химический 13
— классификация 280
— радиоактивные 296
— редкоземельные 306
Эмульсия 55
Этилен 204
Этиловый спирт 221
Эфиры 237
Явление Тиндаля 263
ПЕРИОДИЧЕСКАЯ СИСТЕМА
ПЕРИОДЫ РЯДЫ группы
1 II ill IV V
1 1 1,0080 Н ВОДОРОД
II 2 6.940 Li ЛИТИЙ 9.013 ВС БЕРИЛЛИЙ 5 О ' 10,82 D БОР 12,010 С УГЛЕРОД 14,008 N АЗОТ
III 3 22.997 Na НАТРИЙ 24.32 Mg МАГНИЙ ' '26,97 А1 АЛЮМИНИЙ 28,06 S1 КРЕМНИЙ 15 D 30.98 Г ФОСФОР
IV 4 19 If 39.096 НАЛИЙ 40.08 С а НАЛЬЦИЙ 245,10 Sc СНАНДИЙ Т1 47.902 ТИТАН V 50, эГ ВАНАДИЙ,
5 CU 63,54 МЕДЬ ZU 65.38 ЦИНК G а 69.72 ГАЛЛИЙ 72,60 G С ГЕРМАНИЙ 374,91 Ав МЫШЬЯК
V 6 85 48Rb РУБИДИЙ «.63 Sr СТРОНЦИЙ 39 У/ 88,92 I ИТТРИЙ Zr«° ЦИРКОНИЙ МЬ 92,91* НИОБИЙ
7 Ag]07.880 СЕРЕБРО ecu;: КАДМИЙ In 114,76^ ИНДИЙ 118,70 Sn ОЛОВО 121,76 Sb СУРЬМА. .
VI 8 132.91 С S ЦЕЗИЙ 137. зб В а БАРИЙ 138,92 La ЛАНТАН Hf П8.6 ГАФНИЙ Та 180.88 ТАНТАЛ
9 All 197.2 ЗОЛОТО Hg200,61 РТУТЬ Т 1204,3*9 ТАЛЛИЙ 207,21РЬ СВИНЕЦ 209,00 В1 ВИСМУТ ,
VII 10 8(223) PF ФРАНЦИИ 226,05 Ra РАДИЙ 8(227) АС АНТИНИЙ T'l-o 90 1 П 232.12 ТОРИЙ Ра 23191 ПРОТАКТИНИЙ
ВЫСШИЕ СОЛЕОБРАЗУЮЩИЕ ОНИСЛЫ r2o RO RXX ro2 r2o;
выСшие ГАЗООБРАЗНЫЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ RH RU
ЛАНТАНИДЫ 58 59 |-j 60 Ж|1 61 Г> 140.13 СО 140,92 г Г 144,27 IN С1 (147) НГЛ ЦЕРИЙ ПРАЗЕОДИМ НЕОДЦМ ПРОМЕТИЙ 62 с 150,43 ЭГП САМАРИЙ 63 -> 152,0 til ЕВРОПИЙ
-- — ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ wi 93 гъ 94 IN р (237) Г U (239) НЕПТУНИЙ ПЛУТОНИЙ А 95 Ат (241) АМЕРИЦИЙ >> 96 СП1 (242) НЮРИЙ В к (243) БЕРНЛИЙ
450
ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
элементов
VI VII VIII 0
(Н) 4,003 Не ГЕЛИЙ
, 16.0000 0 / НИСЛОРОД ’.9.0Q F ФТОР 20,18з№е НЕОН
16 с : 32.066 о СЕРА 35,45? С1 ХЛОР 39,944 АГ АРГОН
Сг52.оГ ХРОМ Мп 54,93 МАРГАНЕЦ FesU’Cose.e” Niseis ЖЕЛЕЗО НОБАЛЬТ НИНЕЛЬ
78 96 S© СЕЛЕН 79 .91$ В Г БРОМ “шКг НРИПТОН
М О 95.95 МОЛИБДЕН ТС (99?3 ТЕХНЕЦИИ Rll 101.7 Rh 102,91 Pd 106.7 РУТЕНИЙ РОДИЙ ПАЛЛАДИЙ
^,6.Те ТЕЛЛУР 53 | 126,92 J иод 5в1,з Хе НСЕНОН
W.83.9? ВОЛЬФРАМ RC186,3?15 РЕ^ЙЙ OS 190.2 1 Г 193,1 Pt 195,23 ОСМИЙ ИРИДИЙ ПЛАТИНА
8(210) РО ПОЛОНИЙ 8(211) At АСТ,АТИЙ 8(222) Rfl РАДОН
I | *•) 92 238,07 /РАН
RO, R2O, RO.
rh2 RH
64 । 65 67 «в 156,9 U (1 159,2 1 О 162,461? V 164,94 ПО ГАДОЛИНИЙ ТЕРНИЙ ДИСПРОЗИЙ гольмий 58 167,2 LГ ЭРБИЙ 169.4Tll| 173,04УЬ 174,99 Lil ТУЛИЙ (ИТТЕРБИЙ ЛЮТЕЦИЙ
cf Л НАЛИФОРНИЙ А ’’ А П(248) АФИНИЙ г юо t(248) ЦЕНТУРИЙ
451
ОГЛАВЛЕНИЕ .
Стр.
Предисловие.......................................... 3
Введение ............................... .......... 4
Часть 1 t
Гл а в а I. ВЕЩЕСТВО И ЕГО СТРОЕНИЕ . . . . >.... 9—30
Молекулярно-атомистическое учение (10). Основные химические
понятия в свете молекулярно-атомистических представлений (13).
Химические законы (16). Химический язык (17). Валентность (18).
Химические уравнения (23). Вычисление объёмов газообразных
веществ- (26).
Глава II. КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ...................31—54
Простые вещества (31). Сложные вещества (32). Окислы (33).
Основания (38). Кислоты (44). Соли (49).
Глава III. РАСТВОРЫ .............................................54—67
Отличие растворов от взвесей (суспензий и эмульсий) (54).
Значение растворов при проведении химических реакций (55).
Тепловые явления при растворении (56). Растворимость разных
веществ (57). Концентрация растворов (60). Кристаллизация ве-
ществ (61). Решение задач на приготовление растворов разной
концентрации (64).
Часть II
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
Периодическая система элементов Д. И. Менделеева и периоди-
ческий закон. (Первое ознакомление.)........................ 68
Глав а I. ГАЛОГЕНЫ..............................................69—105
I. Хлор и его соединения. Хлор (69). Соединение хлора с водо-
родом. Хлористый водород (81). Соляная кислота (84). Соли соляной
кислоты (88). Кислородные соединения хлора (90).
II. Бром и его соединения. Бром (92). Соединение брома с во-
дородом. Бромистый водород и бромистоводородная кислота (95).
III. Йод и его соединения. Йод (96). Соединение йода с водоро-
дом. Йодистый водород и йодистоводородная кислота (99).
IV. Фтор и его соединения. Фтор (101). Соединение фтора с во-
дородом. Фтористый водород и плавиковая кислота (102). Соли
плавиковой кислоты (102).
V. Общая характеристика группы галогенов (102).
VI. Естественные группы элементов (104).
Глава II. ГРУППА КИСЛОРОДА ....................................106—140
Явление аллотропии у элементов группы кислорода (106).
I. Кислород и его соединения (107). Кислород (107). Озон (113).
Соединения кислорода с водородом (116).
452
Стр.
II. Сера и её соединения. Сера (118). Соединение серы с водо-
родом. Сероводород (122). Кислородные соединения серы. Сернистый
ангидрид (127). Сернистая кислота (129). Серный ангидрид (130).
Серная кислота (131). Соли серной кислоты (139).
Глава Ш. ГРУППА АЗОТА..........................................140—169
I. Азот и его соединения. Азот (141). Соединение азота с водо-
родом. Аммиак (143). Соли аммоний (147). Кислородные соединения
азота. Окислы азота (149). Азотная кислота (151). Соли азотной
кислоты (156). Круговорот азота в природе. Значение азотных
удобрений (157).
II. Фосфор и его соединения. Фосфор (160). Кислородные соеди-
нения фосфора. Фосфорный ангидрид (16$к Ортофосфорная ки-
слота (166). Соли ортофосфорной кислоты (167). Фосфорные удобре-
ния (168).
Глава IV. ГРУППА УГЛЕРОДА...................................... 170—27®
I. Углерод и его соединения. Углёрод (170). Соединения угле-
рода с водородом. Метан, болотный газ (176). Соединения угле-
рода с кислородом. Окись углерода (179). Двуокись углерода (182).
Угольная кислота (185). Соли угольной кислоты (185).
Органические вещества .... ................................190—268
1. Общие сведения. Органические вещества (190). Первые
синтезы органических веществ (190). Изомерия (192). Молекуляр-
ные формулы органических веществ (193). Теория строения орга-
нических соединений (194).
2. Предельные углеводороды. Гомологический ряд метана (197).
Углеводороды и проблема жидкого топлива. Нефть (200).
3. Непредельные углеводороды (204). Этилен (204). Ацети-
лен (206). Общие химические свойства непредельных соедине-
ний (208). Каучук (210).
4. Циклические углеводороды (213).
5. Ароматические углеводороды. Бензол (214). Гомологи бен-
зола (216).
6. Сухая перегонка каменного угля (217).
7. Классификация органических соединений. Органические ра-
дикалы и функциональные группы (219).
8. £пирты (220). Метиловый (древесный) спирт (220). Этиловый
(винный) спирт (221). Глицерин (223).
9. Фенолы. Фенол (карболовая кислота) (225).
10. Альдегиды (227). Муравьиный альдегид (228). Уксусный аль-
дегид (229). Окисление альдегидов (229).
11. Карбоновые кислоты (230). Муравьиная кислота (231). Уксус-
ная кислота (233).
12. Сухая перегонка дерева (235).
13. Взаимодействие спиртов между собой и с кислотами. Эфиры.
Простые эфиры (237). Сложные эфиры (238).
14. Жиры. Состав жиров (239). Переработка жиров (240). Полу-
чение мыла (241). Жиры в питании (243). Гидрогенизация жиров (243).
Высыхающие масла (244).
15. Сложные эфиры минеральных кислот. Нитроглицерин. Ди-
намит (246).
16. Углеводы (247). Простые сахара, или моносахариды (247).
Дисахариды (249). Полисахариды (249). Образование углеводов в ра-
стениях. Фотосинтез (250). Значение углеводов в питании живот-
ных (251). Техническая переработка углеводов (252).
17. Азотсодержащие органические соединения. Нитробензол (256).
Нитросоединения как взрывчатые вещества (257).
18. Анилин (258).
453
19. Белки (260). Состав белков. Аминокислоты (261). Применение
белковых веществ (264). Искусственное получение белков (264).
20. Краткие сведения об успехах органического синтеза. Полу-
чение пластмасс (265). Получение красящих веществ (266). Синтез
лекарственных веществ (267). Синтез гормонов и витаминов (267).
II. Кремний и его соединения. Кремний (268). Кислородные
соединения кремния. Двуокись кремния, кремнезём, кремниевый
ангидрид (271). Кремниевая кислота (272). Соли кремниевой кис-
лоты (273). Силикаты в природе. Почвообразование (274). Приме-
нение силикатов. Стекольная промышленность (275). Керамическая
промышленность (276).
Глава. V. ГРУППА ИНЕРТНЫХ ГАЗОВ........................... 277—279
Часть III
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА
ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМОВ
Глава I. ПЕРИОДИЧЕСКИЙ ЗАКОН..............................280—286
Классификация элементов (280). Периодический закон Менде-
леева (283).
Глава II. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ.................286—294
Периоды и ряды (286). Группа элементов (287). Подгруппы эле-
ментов (288). Изменения свойств элементов в группах (289). Значение
таблицы Менделеева для определения характерных свойств элемен-
тов. Пользование таблицей (290). Предсказание Менделеевым суще-
ствования неизвестных в то время элементов. Место в таблице для
открытых впоследствии инертных газов (291). Исправление Менде-
леевым атомных весов некоторых элементов (293).
Глава III. РАДИОАКТИВНОСТЬ................................ 294—298
Глава IV. СТРОЕНИЕ АТОМА.................................. 298—311
Составные части атома (298), Строение атомов и периодический
закон (301). Зависимость свойств элементов от строения атомов (303).
Атомы в химических процессах. Строение атомного ядра. Изо-
топы (306). Превращение элементов (308). Образование молекул (308).
Часть IV
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Теория электролитической диссоциации (312). Основные по-
ложения теории электролитической диссоциации (313). Электро-
лиз (313). Явления электролиза в свете теории электролитической
диссоциации (314). Теория электролитической диссоциации в свете
представлений о строении атомов (316). Диссоциация оснований,
кислот и. солей (317). Сильные и слабые электролиты (320). Хими-
ческие реакции между электролитами. Йонные реакции (322).
Часть V
МЕТАЛЛЫ
Глава Т. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ.................... 328—340
Положение металлов в периодической системе элементов. Строе-
ние атомов (328). Физические свойства металлов (328). Химические
свойства металлов (331). Сплавы (333). Коррозия металлов и борьба
с нею (335). Металлы в природе. Руды (337). Общие способы полу-
чения металлов (338).
554
Стр.
Глава П, ЩЕЛОЧНЫЕ МЕТАЛЛЫ ,............................ 340—352
Натрий и калий (340). Положение натрия и калия в периодической
системе элементов и строение атомов (341). Физические свойства
натрия и калия (341). Химические свойства натрия и калия (342).
/ Натрий и калий в природе (345). Получение натрия и калия (345).
Кислородные соединения натрия и калия (346). Гидраты окисей
натрия и калия (347). Соли натрия и калия (349). Общая характери-
стика щелочных металлов (351).
Глава III. ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ....................... 352—361
I. Магний и его соединения. Магний (352). Положение в перио-
дической системе элементов и строение атома магния (352). Физи-
ческие свойства магния. Химические свойства магния (353). Магний
в природе (354). Получение магния и применение его (354). Окись
и гидрат окиси магния (355). Соли магния (355).
II. Кальций и его соединения. Кальций. Положение в перио-
дической системе элементов и строение атома кальция (356). Физи-
ческие и химические свойства кальция (357). Кальций в природе
(357). Получение кальция и применение его (357). Окись и гидрат
окиси кальция (358). Соли кальция (359). Общая характеристика
щёлочноземельных металлов (360).
Глава IV. АЛЮМИНИЙ ЩЕГО СОЕДИНЕНИЯ........................ 361—368
Алюминий. Положение в периодической системе элементов и
строение атома алюминия (361). Физические свойства алюминия.
Химические свойства алюминия (361). Алюминий в природе (364).
Получение алюминия (364). Применение алюминия (365). Окись
алюминия, глинозём (366). Гидрат окиси алюминия (366). Соли
алюминия (367).
Глава V. ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ.......................... 369—382
Железо (369). Положение в периодической системе элементов и
строение атома железа (369). Физические свойства железа. Химиче-
ские свойства железа (369). Сплавы железа (371). Железо в природе
(372). Выплавка железа из руд (373). Переработка чугуна в ковкое
железо и сталь (376). Окислы железа (379). Гидраты окислов железа
(380). Соли железа (381).
ПРАКТИЧЕСКИЕ РАБОТЫ
I. Общие указания к проведению практических работ . . 383—391
Ведение записей (384). Приёмы работы (384). Растворение
твёрдого вещества. Взбалтывание жидкости (385). Отстаи-
вание и сливание жидкости (386). Фильтрование (386). Выпа-
ривание (389).
II. Практические работы по теме: Окислы, основания, кислоты,
СОЛИ 391
III. ff . Растворы 395
IV. ff п „ Хлор 397
V. я я . Бром . . . . 401
VI. я » Иод 403
VII. м , Кислород 404
VIII. ц „ Сера 405
IX. Я „ • я Азот 412
X. я 1 .. . Фосфор 418
XI. я » , Углерод 420
XII. 9 ,9 „ Качественный анализ орга- нических соединений . . 423
455
Стр.
XIII» Практические работы по теме: Углеводороды 424
XIV. Спирты 427
XV. Альдегиды и кислоты.... 428
XVI. Эфиры 430
XVII. Углеводы 43]
XVIII. Нитросоединения 433
XIX. Белки 434
XX. Кремний 436
XXI. Периодический закон. Перио- дическая система элементов 437
XXII. Электролитическая диссоциа- ция 438
XXIII. Металлы 440
XXIV. Щелочные металлы —
XXV. Магний 442
XXVI. Кальций ... 443
XXVII. Алюминий 444
XXVIII. Железо 445
Таблица наиболее употребительных элементов с их химическими зна-
ками и атомными весами...........~........................... 446
Алфавитный указатель..........................................447
Периодическая система элементов Д. И. Менделеева......... 450—451
Редактор Г. В. Дмитриенко
Техн, редактор Н. Н. Махова Корректор 3. Шабхи
Подписано к печати 4/VII 1953 г. А03396. Бумага бОхЭЗ1/»#. Бумажных листов 14,25+0,5 6. л.
вкл. Печ. л. 28,5+1 л. вкл. Учётно-изд. л. 31,45+0,55 вкл. Тираж 500 тыс. (200 001—500 000) экз.
Цена без переплёта 4 р. 15 к. Переплёт бум. 75 к., переплёт коленкоровый 1 р. 50 к.
Зак. № 2382.
Набрано и сматрицировано в 1-й Образцовой типографии им. А. А. Жданова Союзполи-
графпрома Главиздата Министерства культуры СССР. Москва, Валовая, 28.
Отпечатано 3-й типографией «Красный пролетарий» Союзполиграфпрома Главиздата
Министерства культуры СССР. Москва, Краснопролетарская, 16.