Автор: Яковлев М.С.
Теги: математика естественные науки иллюстрации эмбриология растений эмбриологические признаки характеристики
Год: 1983
Текст
АКАДЕМИЯ
Н А у К.
СССР
СРАВНИТЕЛЬ V
ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ
АКАДЕМИЯ НАУК СССР
БОТАНИЧЕСКИЙ ИНСТИТУТ им. В. Л. КОМАРОВА
ACADEMY OF SCIENCES OF THE USSR
KOMAROV BOTANICAL INSTITUTE
COMPARATIVE
EMBRYOLOGY
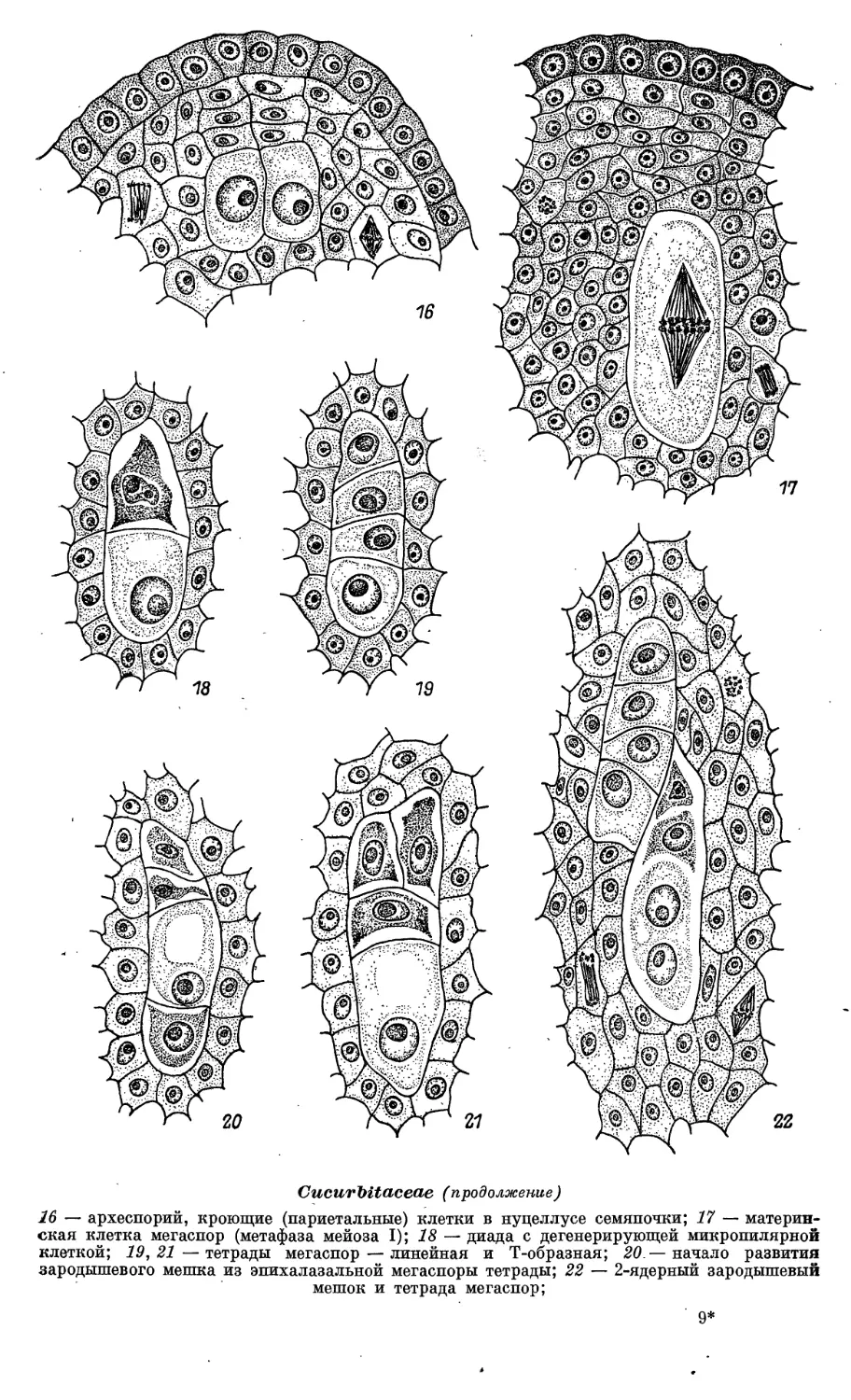
OF FLOWERING
PLANTS
t - »
PHYTOIACCACEAE-THYMEIAEACEAE
LENINGRAD
«NAU4K A»
LENINGRAD BRANCH
19 8 3
СРАВНИТЕЛЬНАЯ
ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ
РАСТЕНИЙ
». _9
PHYTOIACCACEAE-THYMELAEACEAE
ЛЕНИНГРАД
«НАУКА»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
19 8 3
УДК 5S1.3+582 Л1У
Сравнительная эмбриология цветковых растений. Phytolaccaceae—Thymelaeaceae / Отв*
ред. М. С. Яковлев.— Л.: Наука, 1983.—364 с.
В книге, которая является вторым томом многотомного издания по сравнительной
эмбриологии цветковых растений, даны эмбриологические характеристики 94 семейств
покрытосеменных, составленные на основании имеющихся литературных сведений и в ряде семейств
дополненные оригинальными данными, иллюстрированные рисунками и микрофотографиями
на световом и электронном уровнях. Лит. — 2075 назв., ил. — 79 (73 рис.+6 табл.-вкл.).
Авторы:
Г. К. АЛИМОВА, Г. М. АНИСИМОВА, Т. Б. БАТЫГИНА, Л. Е. БЕЛЯЕВА, В. А. ВЕРЕЩАГИНА,
A. К. ДЗЕВАЛТОВСКИЙ, Г. Я. ЖУКОВА, Г. М. ИЛЬИНА, Р. У. КАДЫРОВА, Г. В. КАМАЛОВА,
О. П. КАМЕЛИНА, Г. Е. КОЛЕСОВА, В. И. КОНЫЧЕВА, С. Н. КОРОБОВА, Т. Б. МАМЕТЬЕВА,
Т. Е. МАТЮЦИНА, В. Ю. МАНДРИК, Т. Н. НАУМОВА, 3. И. НИКИТИЧЕВА, Е. С. НИКОЛАЕВА,
B. А. ПОДДУБНАЯ-АРНОЛЬДИ, Г. Б. РОДИОНОВА, Г. И: САВИНА, Т. Б. СОКОЛОВСКАЯ,
М. П. СОЛНЦЕВА, Э. С. ТЕРЕХИН, Д. Ю. ТУРСУНОВ, Т. Е. ФРЕЙБЕРГ, И. А. ЧАБАН, Л. Я.
ЯКОБСОН, М. С. ЯКОВЛЕВ
Редакционная коллегия:
Г. Я. ЖУКОВА, О. П. КАМЕЛИНА (ответственный секретарь),^
В. А. ПОДДУБНАЯ-АРНОЛЬДИ, А. Л. ТАХТАДЯШН, М. С. ЯКОВЛЕВ (ответственный редактор)
Рецензенты:
В. Н. ТИХОМИРОВ, Н. Н. ЦВЕЛ ЕВ, А. А. ЧЕБОТАРЬ
Authors:
G. К. ALIMOVA, G. M. ANISIMOVA, Т. В. BATYGINA, L. E. BELYAYEVA, I. A. CHABAN, А. К. DZE-
VALTOVSKY, Т. Е. FREIBERG, G. M. ILYINA, R. U. KADYROVA, G. V. KAMALOVA, О. Р. КАМЕ -
LINA, G. E. KOLESOVA, V. I. KONYCHEVA, S. N. KOROBOVA, Т. В. MAMETYEVA, V. YA. MAN-
DRICK, Т. Е. MATYUNINA, Т. N. NAUMOVA, Z. I. NIKITICHEVA, E. S. NIKOLAYEVA, V. A. POD-
DUBNAYA-ARNOLDI, G. В. RODIONOVA, G. I. SAVINA, Т. В. SOKOLOVSKAYA, M. P. SOLNTSEVA,
Е. S. TERYOKHIN, D. ZH. TURSUNOV, V. A. VERESHCHAGINA, L. YA. YAKOBSON. M. S. YAKOV-
LEV, G. YA. ZHUKOVA
Editorial board:
О. P. KAMELINA (SECRETARY), V. A. PODDUBNAYA-ARNOLDI, A. L. TAKHTAJAN, M. S. YAKOV-
LEV (EDITOR), G. YA. ZHUKOVA »
Reviewers:
A. A. CZEBOTAR, V. N. TIKHOMIROV, N. N.TSVELEV
© Издательство «Наука», 1983 i\
2004000000-653 л
С 291-83 — //
042(02)-83
ПРЕДИСЛОВИЕ
В предыдущий том «Сравнительной эмбриологии цветковых растений»
(1981) вошли характеристики семейств от Wintheraceae до Juglandaceae,
относящиеся к 3 подклассам: Magnoliidae, Ranunculidae и Hamamelididae.
Последние 2, согласно А. Л. Тахтаджяну (1980), берут начало от Magnoliidae и в то же
время имеют явные филогенетические связи с остальными подклассами.
Эмбриологически все семейства, вошедшие в первый выпуск, оказались сравнительно
однородны. Все они характеризуются рядом примитивных признаков, такими
как секреторный тапетум, 2-клеточная пыльца, анатропная и крассинуцеллят-
ная семяпочка, зародышевый мешок Polygonum-типа, нуклеарный эндосперм.
Однако среди представителей 25 порядков резко выделились водные: Nym-
phaeales и Nelumbonales. У них впервые появился совершенно новый признак —
наличие хлорофилла в зародыше. Этот пигмент наблюдается в зародыше хлоро-
эмбриофитов начиная с ранних фаз его развития. Наличие хлорофилла в
зародыше свидетельствует о глубоких функциональных различиях в
эмбриогенезе цветковых, характеризующихся способностью (хлороэмбриофиты) или
неспособностью (лейкоэмбриофиты) к синтезу хлорофилла в этот период
онтогенеза, Признак этот важен также для целей филогенетической систематики
растений.
Настоящий том включает эмбриологические характеристики представителей
следующих 2 подклассов — Caryophyllidae и Dilleniidae, филогенетически
связанных, по Тахтаджяну, с исходным подклассом Magnoliidae. Основные
эмбриологические признаки, характерные для Magnoliidae, сохраняют свое
значение и для Caryophyllidae и Dilleniidae, но наряду с этим здесь появляются
совершенно новые, не имеющие ни гомологов, ни аналогов среди других видов
цветковых. Ярким примером служат Paeoniaceae, эмбриогенез которых
является уникальным, поскольку первое и последующие деления ядер зиготы не
сопровождаются цитокинезом,. Возникает предэмбриональная ценоцитная
структура, на основе которой в дальнейшем формируется зародыш. Другим, также
уникальным примером, служат виды семейства Dilleniaceae, у которых зигота
окружена своеобразной желеобразной оболочкой (мантией) полисахаридной
природы. Очевидно, что данные сравнительной эмбриологии позволяют выявить
ряд новых признаков, Которые возникают в процессе прогрессивной эволюции
у представителей тех или иных порядков.
Эмблемой для первого выпуска послужило семя лотоса, у которого зародыш
хорошо дифференцирован, а его почечка обладает ярко выраженной зеленой
окраской. Для второго выпуска эмблемой послужили пионы с их уникальной
ценоцитной свободноядерной структурой.
Во второй том вошли эмбриологические характеристики 94 семейств (от
Phytolaccaceae до Thymelaeaceae). Принцип составления описания и
иллюстраций тот же, что и в первом томе. В работе по второму тому кроме сотрудников
Лаборатории эмбриологии ВИН АН СССР принимали участие эмбриологи из
других учреждений: В. А. Поддубная-Арнольди (Москва, ГБС), В. А.
Верещагина (Пермь, Университет), Л. Е. Беляева (Запорожье, Медицинский ин-т),
А. К. Дзевалтовский (Киев, Ботанический сад КГУ), Г. М. Ильина (Москва,
5
МГУ), В. И. Конычева, Р. У. Кадырова, Д. Ю. Турсунов и Т. Е. Матюнина
(Ташкент, Ин-т ботаники АН УзССР), Г. В. Кама лова (Ташкент, Ин-т
экспериментальной биологии растений), В. Ю. Мандрик (Ужгород, Университет),
Е. С. Николаева (Ворошиловград, Педагогический ин-т), Г. Б. Родионова
(Москва, МГПИ), И. А. Чабан (Москва, Ин-т прикладной молекулярной
биологии и генетики ВАСХНИЛ), Л. Я. Якобсон (Рига, Ботанический сад АН
ЛатвССР).
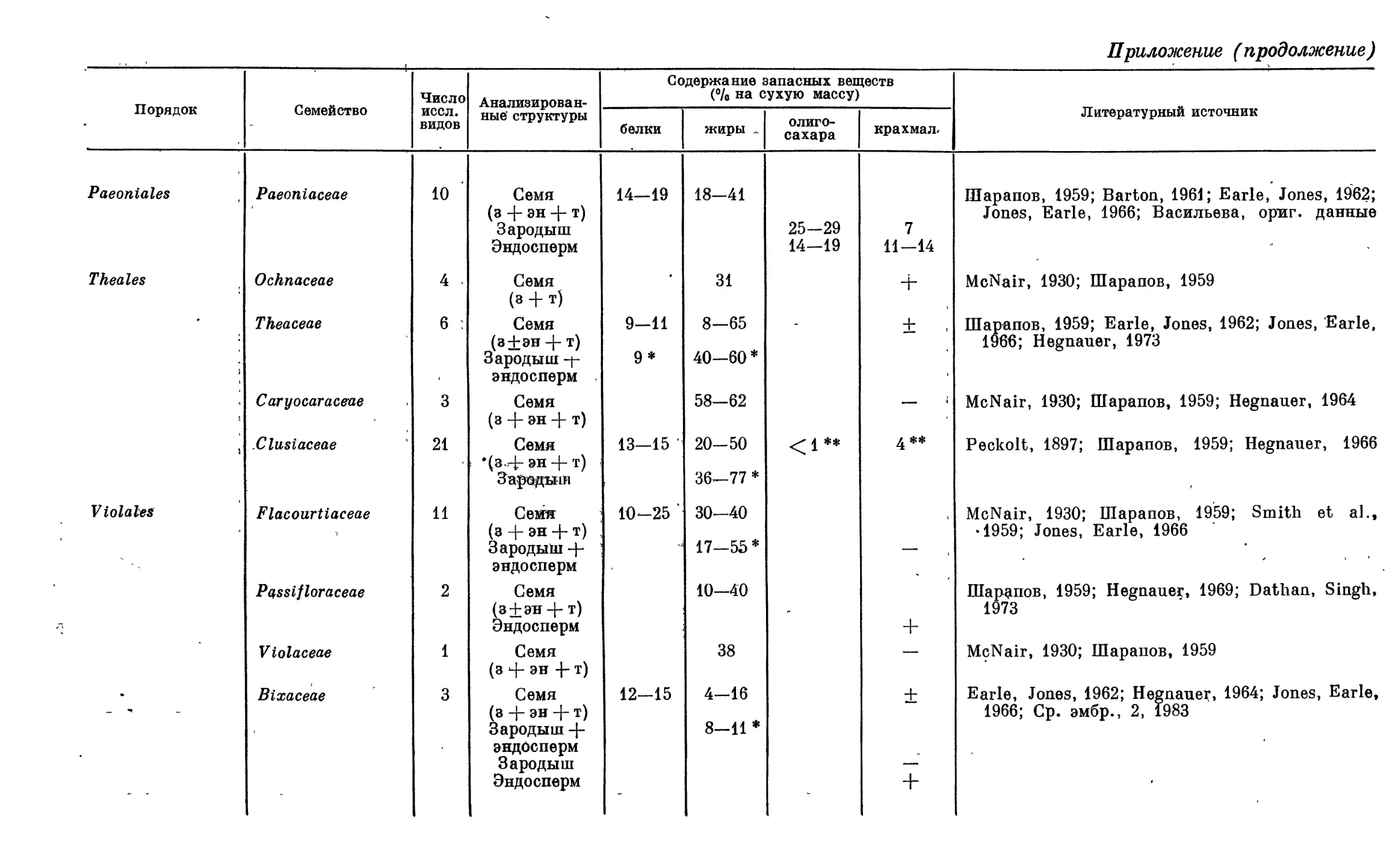
В конце книги в виде сводной таблицы (см. Приложение, с. 285) приведены
данные по запасным питательным веществам зародыша и эндосперма для
семейств, вошедших в первый и второй тома. Зародыш и эндосперм, составляющие
основу семени, являются главным источником белков, жиров и углеводов для
человека. Поэтому успех практических работ, связанных с поиском новых,
ценных в этом отношении видов дикорастущей флоры и отбором форм для
введения в культуру, зависит от уровня наших знаний о разнообразии
биохимического состава семян в различных таксономических группах. В соответствии
с этим было признано целесообразным дополнить эмбриологические
характеристики семейств сведениями о запасных питательных веществах. На
основании обобщения литературных и использования экспериментальных данных
В. Е. Васильевой была составлена таблица (см. Приложение, с. 285), в которой
представлен диапазон изменений содержания белков, жиров и углеводов в
целом семени и отдельно в зародыше и эндосперме (там, где это было возможно)
для каждого исследованного семейства. Следует отметить, что в работах,
посвященных анализу питательных резервов семени, часто используется термин
«ядро» (т. е. семя без жестких покровов) без указания эмбриологических
структур, его составляющих. Однако «ядро» может включать различные структуры:
оно может быть представлено одним зародышем {Calycanthaceae, Fagaceae и др.),
либо зародышем с эндоспермом (Magnoliaceae, Caricaceae и мн. др.)» либо
зародышем с периспермом (Hernandiaceae), либо зародышем с эндоспермом и
периспермом (Piperaceae). Поэтому мы считали необходимым расшифровать
структуру семени и «ядра». В таблице указано также число изученных видов и
литературные источники.
Копии рисунков из опубликованных работ выполнены художницей Р. А. Лей-
киной и частично Т. Б. Маметьевой; оригинальные рисунки выполнены
авторами. В иллюстративный материал отдельных семейств включены оригинальные
рисунки авторов, представивших их для публикации: по сем. Cdryophylla-
сеае — О. П. Камелиной и Г\ В. Яковлевой, по сем. Malvaceae — В. А. Руми,
по сем. Theaceae — Ц. А. Микатадзе-Панцулая. Материал для исследования
собирался в Батумском, Сухумском и Никитском ботанических садах, в
оранжереях и саду ВИН АН СССР, в природных условиях Средней Азии,
Ленинградской обл.
Составители и редакционная коллегия выражают благодарность за помощь
в приготовлении препаратов и техническую работу при составлении и
оформлении данного тома, его библиографии, указателя и иллюстраций — Н. А. Жин-
киной, Н. Г. Тучиной, И. И. Шамрову, Л. М. Ротенфельд, О. Б.
Проскуриной, А. В. Драгуновой, И. И. Глезер; всем сотрудникам, помогавшим
собирать и фиксировать материал.
Порядок 26. CARYOPHYLLALES
Семейство PHYTOLACGAGEAE
Пыльник 4-гнездный, раскрывается продольно; гнезда сближены попарно
в 2 теки. Перед вскрытием гнезда в теках сливаются в результате полного
растворения перегородки между ними. По нашим данным, у Phytolacca
americana, как и у других ранее исследованных видов, стенка пыльника формируется
центростремительно по типу однодольных. Археспориальные клетки, делясь
периклинально, отделяют кнаружи первичный париетальный слой, а ковнутри—
спорогенный. Первичный париетальный слой периклинальным делением
образует эндотеций и вторичный париетальный слой, который снова делится
периклинально, в результате чего возникают тапетум и средний слой.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, среднего слоя
и тапетума. Тапетум клеточный секреторный, однослойный. Внутренний
тапетум дифференцируется еще до образования наружного тапетума, но в
дальнейшем он становится морфологически однородным. Клетки его крупные, 1 —
2-ядерные (Ph. americana, Gisekia pharnaceoides) или многоядерные (Flueckigera
purpurea). У Ph. americana на стадии одноядерных микроспор на наружных
стенках тапетума хорошо различимы мелкие орбикулы. Лизис тапетума
проходит довольно быстро и на стадии 2-клеточных пыльцевых зерен его уже не
бывает. Средний слой чрезвычайно эфемерный, дезинтегрирует во время мейоза
в микроспороцитах. В эндотеций на ранних стадиях наблюдается
незначительное количество крахмала, а с момента лизиса тапетума — образование
фиброзных поясков. Фиброзный слой располагается с наружной стороны каждого
гнезда пыльника. Эпидермис сохраняется в зрелом пыльнике, клетки его
достаточно крупные, наружная поверхность покрыта кутикулой. В зрелом
пыльнике стенка состоит из эпидермиса и фиброзного эндотеция. Спорогенная ткань
2-слойная, многоклеточная. Образование микроспор происходит симультанно,
расположение их в тетрадах тетраэдральное и изобилатеральное. Микроспо-
роциты и тетрады микроспор в каллозных оболочках. В нашем материале
у Ph. americana в вакуолизированных одноядерных пыльцевых зернах наблюдались
крупные кристаллы оксалата кальция, которые по мере уменьшения вакуоли
в 2-клеточном пыльцевом зерне, когда генеративная клетка находится еще
у стенки зерна, уменьшаются в размерах. В 2-клеточном пыльцевом зерне с
генеративной клеткой в центре зерна и с отсутствующими вакуолями кристаллов
обнаружить уже не удается. Спермиогенез проходит в пыльцевом зерне,
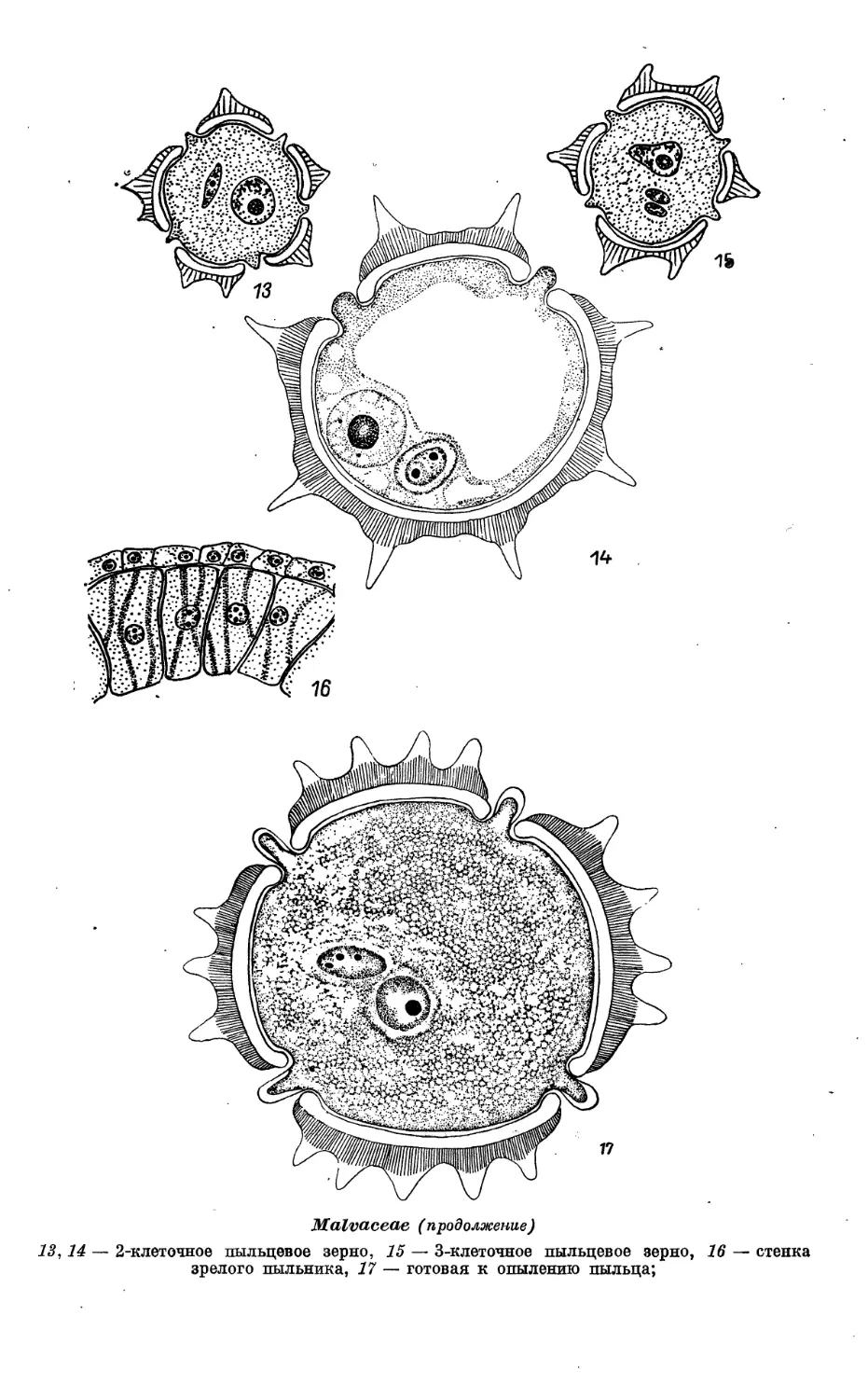
находящемся в пыльнике. Зрелые пыльцевые зерна одиночные, 3-клеточные. Спермин
овальные, небольших размеров, с различимой цитоплазмой. Запасные
вещества в пыльцевом зерне — белки и липиды.
Семяпочка анакампилотропная (Gisekia, Anisomeria, Microtea, Agdestis), орто-
кампилотропная (Ercilla), амфитропная (Flueckigera, Phytolacca, Hilleria,
Trichostigma, Schindleria, Seguieria, Rivina, Petiveria, Monococcus и др.),
с 2 интегументами, крассинуцеллятная. Микропиле сформировано
внутренним интегументом, направлено в большинстве случаев вниз. Интегументы
равной длины или внутренний слегка выступающий (Phytolacca, Ercilla
и Anisomeria). Толщина интегументов — 2—5-слойный наружный и
2-слойный внутренний. У F. purpurea в наружном интегументе отме-
ченр наличие, кристаллов оксалата кальция (Карагьозова, 1969). У Ph.
americana клетки наружного эпидермиса наружного интегумента
увеличиваются в размерах, в них и в наружном эпидермисе внутреннего интегумента
накапливаются танины. Проводящий пучок, в котором дифференцируются
сосудистые.элементы, доходит до халазы. У отдельных видов развивается
ариллус (Barbeuia). Гипостаза не выражена. Халаза массивная. У Rivina
и Ercilla отмечен плацентарный, а у Phytolacca — плацентарный и
фуникулярный обтураторы из длинных сосочковидных клеток. Археспорий
одноклеточный, 2-клеточный (Villamilla) или многоклеточный (Ph. octandra) —-
7
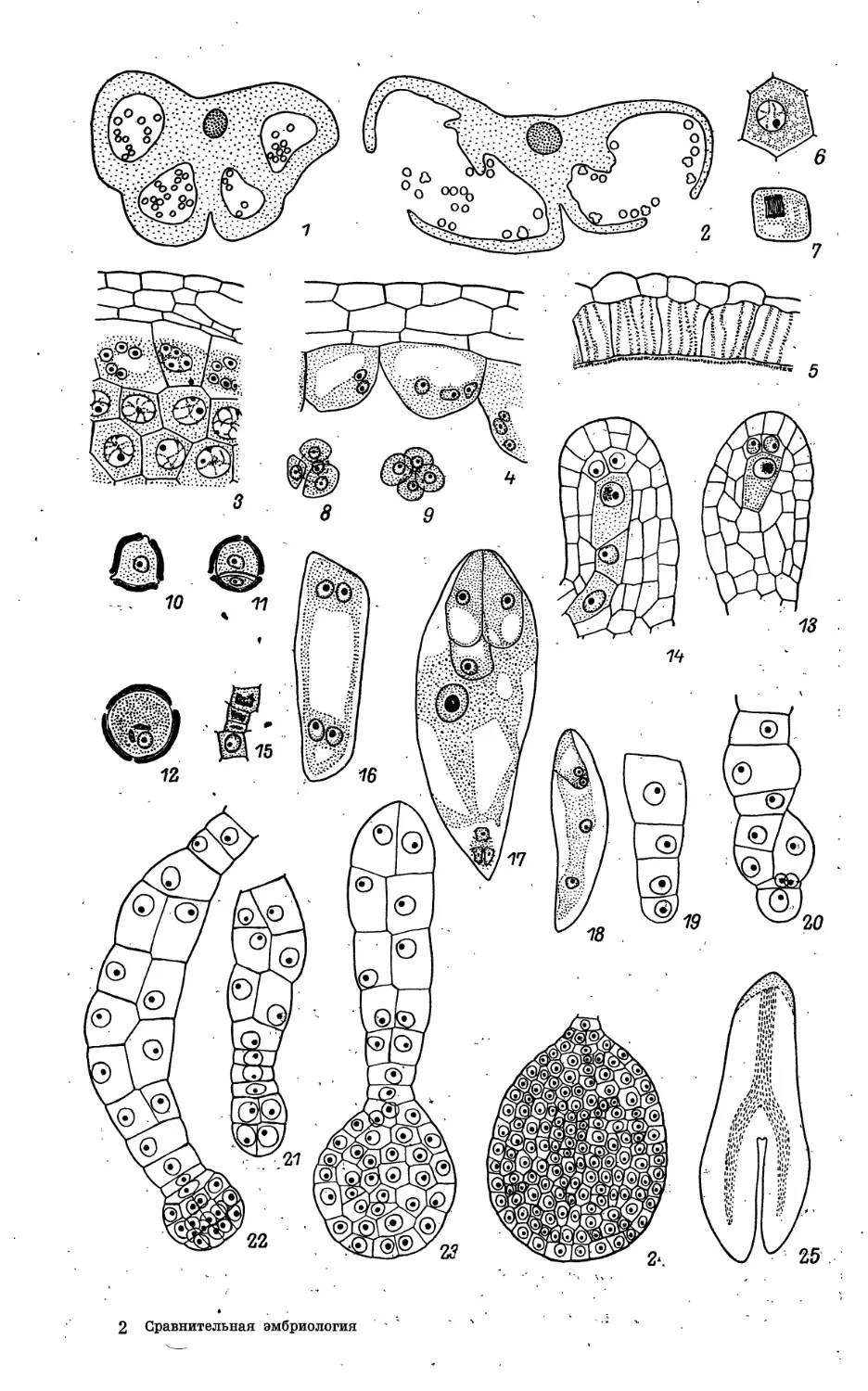
Phytolaccaceae
1—11 — Phytolacca americana, 12—19, 28—32 — Petiveria alliacea, 20—22 — Rivina brasi-
liensis, 23, 24 — Villamilla peruviana, 25—27, 33—43 — Rivina humilis, 44—49 —
Phytolacca dioica, 50—66 — Gisekm pharmbceoides.
Ь—7 — развитие пыльника и пыльцевого зерна: 1 — завершение формирования стенки
пыльника, спорогенной ткани; дифференциация внутреннего тапетума, 2 — фрагмент
пыльника с одноядерными микроспорами, 2а — поперечный срез этого пыльника, 3 —
одноядерное пыльцевое зерно с крупными кристаллами, 4 — 2-клеточное пыльцевое зерно, 5 —
фрагмент пыльника »а стадии 2-клеточных пыльцевых зерен, 5а — Поперечный срез этого
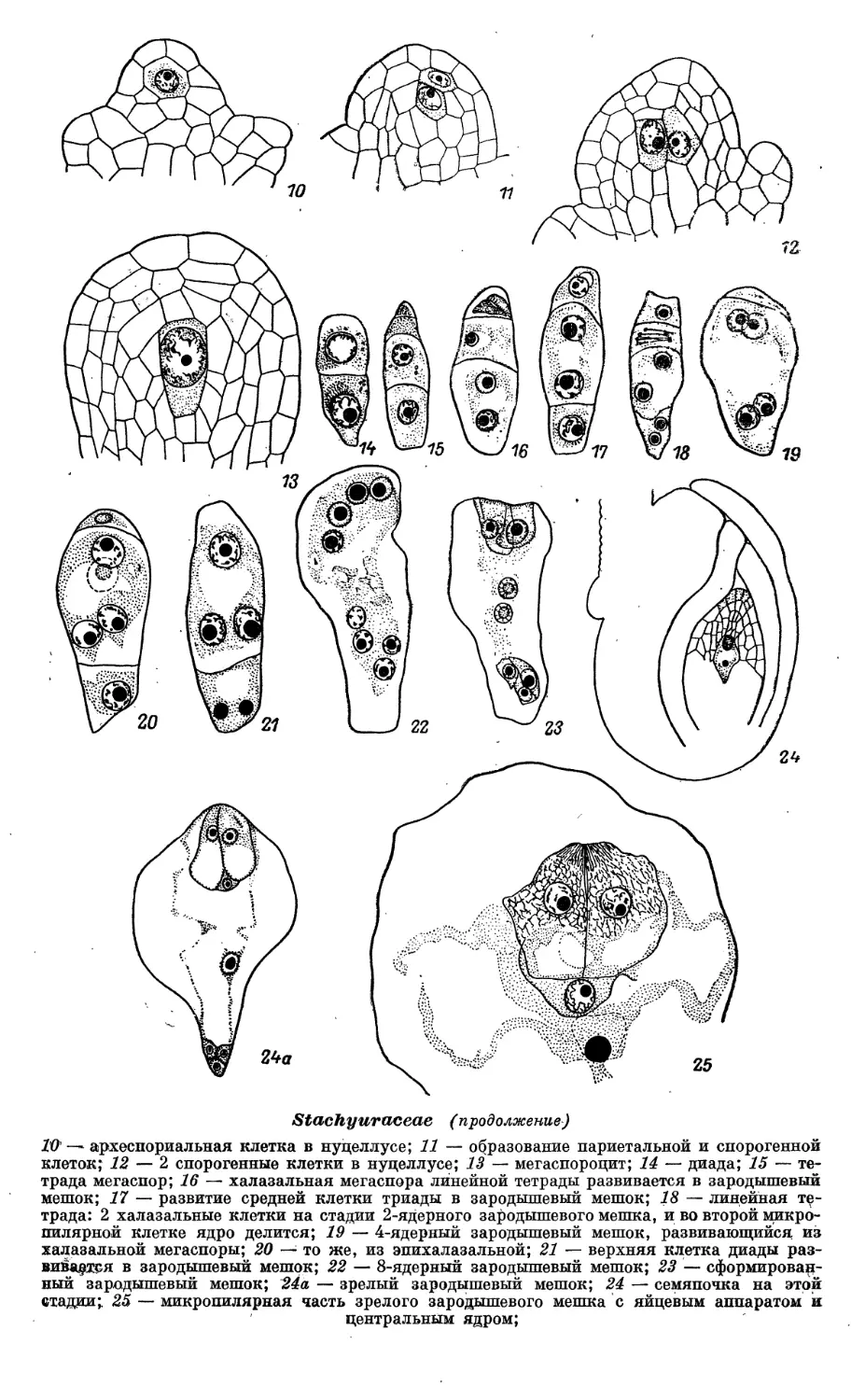
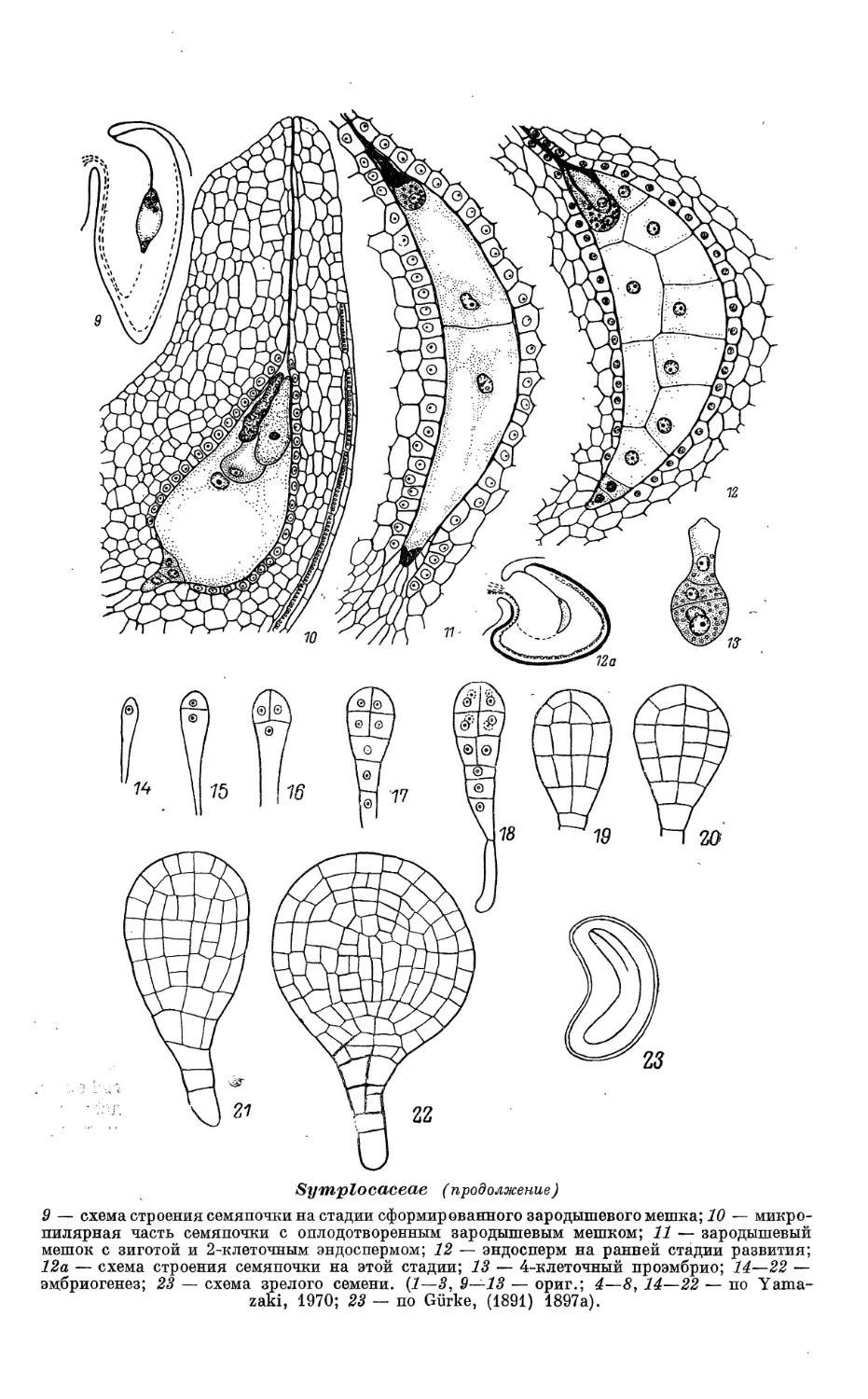
Phyiolaccaceae (продолжение)
8 — мегаспороцит на стадии профазы мейоза; начало формирования париетальной ткани
и нуцеллярного колпачка, 8а —"схема семяпочки на этой стадии; 9 — схема, семяпочки на
стадиШзрелого зародышевого мешка; зачернен наружный .эпидермис интегумента,*
заполненный танином; 1G — сформированный зародышевый мешок; 11 — зрелый зародышевый
■ мешок%: дифференцированными элементами;
до 5—15 клеток. Археспориальная клетка отчленяет кнаружи париетальную,;
которая делится антиклинально и, периклинально, образуя 2—4-слойную
(у Ph. americana 8-слойную) париетальную ткань. Характерная особенность -~
развитие массивного нуцеллярного колпачка, который образуется в результате
деления эпидермиса нуцеллуса. Так, у Petiveria он насчитывает до 6—8, а у Ri-
vina — видов Phytolacca и Villamilla — до 8—17 слоев клеток (]\/[auritzon, 1934).
Однако у Ph. americana нуцеллярный колпачок не очень массивный, 4—6-
слойный, ayfi. pharnaceoides он только 3-слойный (Joshi, Rao, 1936). Несмотря
на различное количество спорогенных клеток становится мегаспороцитом: и
вступает*в мейоз во всех случаях только одна. Мегаспороцит делится,
образуется диада, а затем тетрада мегаспор, реже — триада, когда ядро верхней
клетки диады делцтся без цитокинеза.- Функциональной является халазальная
мегаспора." : • :
пыльника; показана топография фиброзного слоя, 6 — 2-клеточное пыльцевое ,зерно% (более
поздняя фаза), 7 — фрагмент зрелого пыльника с 3-клеточными пыльцевыми лзерндми,
7а — поперечный срез этого пальника;
9
Phytolaccaceae (продолжение)
12 — мегаспороцит; IS — тетрада мегаспор; 14 — 2-ядерный и 15 — 4-ядерный зародышевый
мешок; 16 — зрелый зародышевый мешок; 17 — зигота и первичное ядро эндосперма; 18 —
семяпочка; 19 ^- проэмбрио и ядра эндосперма; 20 — семяпочка; 21, 22 — зародышевый
мешок; 23 — мегаспороцит; 24 — функционирующая халазальная мегаспора тетрады;
25 -— двойное оплодотворение; 26 — проэмбрио и ядерный эндосперм; 27 — антиподы;
%. ■ 28—32 — развитие зародыша (ранние стадии);
ч
Зародышевый мешок развивается по Polygonum-типу. Элементы яйцевого
аппарата в зрелом зародышевом мешке, хорошо дифференцированы.
Яйцеклетка и синергиды довольно крупных размеров и с крупными ядрами. Синер-
гиды без нитчатого аппарата, с выступами-зацепками. У Gisekia отмечена ва-
ршбелшость вакуолизации в синергидах и наличие нитчатого аппарата (Joshi,
.Rao, 1936), Полярные ядра сливаются перед оплодотворением. В цитоплазме
.центральной клетки имеется крахмал, но у G. pharnaceoides он отсутствует.
10
Phytolaccaceae (продолжение)
38—41 — последовательные стадии развития зародыша (Ghenopodiad-тип эмбриогенеза);
42 — суспензор; 43 — зрелое семя с изогнутым зародышем, скудным эндоспермом и
периспермом, занимающим центральную часть семени; 44—49 — отдельные стадии развития
зародыша (Garyophyllad-тип, Phytolacca-вариация эмбриогенеза); 50—52 — ранние стадии
развития пыльника; 53 — тетрада микроспор;
Phytolaccaceae (продолжение)
54 — мегаспороцит; 55, 56 — формирование тетрад мегаспор; 57 — сформированный
зародышевый мешок; 58 — двойное оплодотворение; 59—66 — развитие зародыша. (1—11 —
ориг.; 12—24, 28—32 — по Mauritzon, 1934; 25—27, 33—49 — по Kajale, 1954a; 50—66 — по
Joshi, Rao, 1936).
Антиподы — 3 эфемерные клетки, но у Rivina humilis число их может
увеличиваться до 6. Они присутствуют и после оплодотворения, иногда занимая
латеральное положение (Kajale, 1954). У Ph. americana антиподы расположены в
линейный ряд? дегенерировать начинают до оплодотворения. Оплодотворение
порогамное, двойное. Остатки пыльцевой трубки, одна, а иногда 2 синергиды,
наблюдаются в зародышевом мешке до раннего эмбриогенеза (Kajale, 1954).
Эндосперм нуклеарный. Свободноядерная стадия наблюдается до
формирования сердечковидного зародыша, затем, начиная с микропилярной части,
проходит клеткообразованде. Эндосперм приобретает форму подковообразной
трубки, лишь у Petiveria он прямой. В зрелом семени эндосперм сохраняется
в; незначительном количестве, окружая в виде чехла зародышевый корень в
одним слоем — весь зародыш. В его клетках имеется незначительное количество
крахмала. Запасающая ткань в семени — перисперм, расположенный у
большинства видов в центре семени и только у Petiveria — по обеим сторонам
зародыша. В клетках перисперма содержится крахмал.
Развитие зародыша, описано у Ph. decandra (Lewis, 1905), G. pharnaceoides
(Joshi, Rao, 1936), J?, humilis и Ph. dioica (Kajale, 1954a), у Ph. americana (Vignon,
1970). Отмечены разные типы эмбриогенеза: у Ph. decandra — близкий к Муо-
surus-чвариации Onagrad-типа (Johansen, 1950), у Ph. dioica — Caryophyllad-
тип и выделена особая Phytolacca-вариация, у R. humilis— Ghenopodiad-тип
(Kajale, 1954). Для зародышей большинства исследованных видов характерно
развитие массивного многорядного короткого подвеска, но у Р. ЫЫасеа он
длинный и однорядный (Mauritzon, 1934). Очевидно и эмбриогенез у этого вида
соответствует иному типу. Зрелый зародыш крупный, дифференцировалный,
изогнутый в виде кольца или подковы, с 2 закрученными семядолями. Однако
у Petiveria и Monococcus зародыш прямой, с крючковидно загнутыми семядолями.
У Ph. decandra описан единичный случай полиэмбрионии за счет образования
дополнительного зародыша из клеток нуцеллуса (Grebe, 1947).
Исследованные виды. Flueckigera purpurea, Gisekia pharnaceoides,
Petiveria alliacea, Phytolacca americana, Ph. decandra, Ph. dioica, Ph. octandra,
Rivina brasiliensis*, R. humilis, Villamilla peruviana.
Литература. Hegelmaier, 1885; Lewis, 1905; Walter,, 1909; Dahlgren,
1916; Woodcock, 1925;» Rocen, 1927; Mauritzon, 1934; Joshi, 1936; Joshi, Rao,
1936; Kajale, 1944, 1954a, 1954b; Crete, 1947; Dambroise, 1947; Buxbaum, 1949;
Карагьозова, 1969; Vignon, 1970; Corner, 1976; Камелина (ориг. данные).
Семейство ACHATOCARPACEAE
Эмбриологически не изучено.
Семяпочка кампилотропная.
Зар»одыш в семени сильно- согнут; имеется перисперм.
Jlrrepafypa. Тахтаджян, 1966.
Семейство NYCTAGINACEAE
Пыльники 4-гнездные. Развитие стенки пыльника происходит по основному
типу. Сформированная стенка пыльника состоит из эпидермиса, эндотеция,
2 (у Boerhaavia diffusa иногда 3) средних слоев и тапетума. Секреторный тапетум
2-ядерный, у Oxybaphus micranthus многоядерный. По нашим данным, у Mirabilis
jalapa на внутренних стенках тапетума имеются орбикулы. К моменту
образования зрелых пыльцевых зерен в клетках эндотеция развиваются фиброзные
утолщения. Изобилатеральные и тетраэдральные тетрады микроспор форми-
pvютcя по симультанному типу. Зрелые пыльцевые зерна очень крупные,
у большинства видов 2-клеточные, у О. micranthus и О. nyctagineus — 3-клеточт
яые. У Bougainvillea glabra на стадии микроспор происходит дегенерация ядра
ж цитоплазмы, что приводит к образованию стерильной пыльцы (Cooper, 1932).
Семяпочка анакампилотропная (Boerhaavia repanda,' В. diffusa, Bougainvillea
glabra и О. nyctagineus) или кампилотропная (Mirabilis), интёгументов от одного
(Abronia и Boerhaavia) до 2 (Bougainvillea, Mirabilis, Oxybaphus и Pisonia),
крассинуцеллятная. Единственный интегумент В. repanda 5—6-слойный (Bhar-
gava, 1932). В 2-покровных семяпочках внутренний интегумент состоит обычно
из 2 слоев клеток, однако у В. glabra часть интегумента, образующая микропиле
(оперкулум), может состоять из 4—5 слоев (Cooper, 1932). Наружный
интегумент обычно состоит из 3—4, у М. jalapa — из 4—6 слоев клеток (Woodcock,
1929). Клетки эпидермиса нуцеллуса в области микропиле делятся периклй-
жально, образует клювовидный нуцеллярный колпачок. Археспорийj
одноклеточный. Образование мегаспороцита происходит с отделением париетальной
клетки, производные которой образуют у Mirabilis.иOxybaphus 3—5, у Abroriia,
Boerhaavia ж-Bougainvillea 8—14 слоев клеток. Тетрада мегаспор линейная.
1В
1—5 — Mirabilis jalapa, 6, 17—24 — Oxybaphus nyctagineus, 7—IS, 25 — Boerhaavia repanda,
16 — Oxybaphus micranthus.
1—6 — развитие пыльника: 1 — начальный этап формирования стенки пыльника и споро-
генных клеток; периклинальное деление в первичном париетальном слое, 2 —
сформированная стенка пыльника; тапетум секреторный, 2-ядерный; материнская клетка микроспор
в телофазе первого деления мейоза, 3 — дегенерация среднего слоя стенки пыльника; в
эпидермисе, эндотеции, наружном среднем слое — крахмал; тетраэдральная тетрада микроспору
4 — фрагмент стенки пыльника на стадии одноядерной пыльцы; в эндотеции фиброзные
утолщения; дегенерация наружного среднего слоя и тапетума; на внутренних стенках
клеток тапетума — орбикулы (ор), 5 — 2-клеточное пыльцевое зерно перед вскрытием
пыльника, 6 — 3-клеточное пыльцевое зерно;
Моноспорический зародышевый мешок развивается из халазальной
мегаспоры по Polygonum-типу. У Boerhaavia, Bougainvillea ж Oxybaphus иногда
развивается несколько мегаспор, которые часто дегенерируют на разных
стадиях развития. Яйцеклетка крупная, грушевидной формы, с большой вакуолью
в верхней части. У М. jalapa (Дьякова, 1962) в цитоплазме яйцеклетки
обнаружено большое количество полисахаридов типа декстрин, находящихся в строме
пластид. Синергиды грушевидной формы, с крючковидными выростами. У
Boerhaavia овя сохраняются долго и разрушаются после оилоДотвореция. У Mirabilis
U
23 » \ $ / 25
Nyetaginaceae (продолжение)
7—10 — мегаспорогенез; 11—15 — развитие зародышевого мешка; 16 — клювовидный
нуцеллярный колпачок; 17—24 — раавитие зародыша;, 25 — 2 дополнительных зародыша,
развившихся из синергид. (1—5 — ориг.; 6, 17—24 — по Cooper, 1949; 7—15 — по Bhar-
gava, 1932; 16 — по Rocen, 1927; 25 — по Kajale, 1938).
сянергиды небольшие ж ^фем^рны, разрушаются часто к мсшенту созревания
зародышевого мешка. Обычно имеются 3 очень большие антиподы, долго
сохраняющиеся. После оплодотворения они делятся, формируя 5—7, но чаще 4
клетки. У В. repanda антиподы делятся иногда до оплодотворения (Bhargava, 1932).
У АЪгопга антиподы после оплодотворения становятся 2-ядерными (Rocen,
1927). Полярные ядра сливаются перед оплодотворением. Двойное
оплодотворение происходит по премртотическому типу.
Эндосперм нуклеарный, Образование клеток происходит только в микро-
пилярной области. В процессе развития эндосперм, интенсивно поглощается
растущим зародышем. В зрелом семени он представлен в виде колпачка вокруг
зародышевого корешка. Для представителей семейства характерно наличие
в зрелом семени перисперма, в клетках которого находится большое количество
крахмала.
Для изученных видов семейства указываются различные типы развития
зародыша (Maheshwari, 1929; Kajale, 1936, 1938; Cooper, 1949; Дьякова, 1962,
и др.). Наиболее подробно эмбриогенез изучен у Oxybaphus viscosus и О. nyctagi-
neus. Соответствует он Asterad-типу (Soueges, 1938; Cooper, 1949). Зародыш в
зрелом семени изогнут в области гипокотиля или семядолей. Он имеет длинные
семядоли, почечку, гипокотиль и массивный корешок с чехликом.
У В. repanda отмечены случаи полиэмбрионии. Дополнительные зародыши
образуются из синергид (Kajale, 1937, 1938).
Исследованные виды. Abronia umbellata, Boerhaavia diffusa,
В. repanda, B\ verticillata, Bougainvillea glabra, Mirabilis froebelii, M. jalapa,
M. longiflora, M. multiflora, M. uniflora, Oxybaphus micranthus, O. nyctagineus,
0. viscosus, Pisonia aculeata.
Литература. Hofmeister, 1858; Fischer, 1880; Guignard, 1882; Hegel-
maier, 1885; Heimerl, 1887; Tischler, 1908; Fiedler, 1910; Dahlgren, 1916; Rocen,
1924, 1927; Yamaha, 1926; Maheshwari, 1929; Woodcock, 1929; Cooper, 1931,
1932, 1933, 1949; Hedemann, 1931; Bhargava, 1932; Showalter, 1935; Kajale,
1936, 1937, 1938; Soueges, 1938; Dambroise, 1947; Venkateswarlu, 1947; Mage-
shwari, Johri, 1950; Устинова, Дьякова, Щедрина, 1961; Дьякова, 1962; Nair N. С,
Nair V. I., 1963; Vignon, 1970; Rohwoder, Huber, 1974; Vijendra, Ramakrishnan,
1974; Анисимова (ориг. данные).
Семейство AIZOACEAE
Пыльники 4-гнездные, вскрываются продольно. Стенка пыльника у Sesu-
vium portulacastrum формируется по основному типу и состоит из 5 слоев
клеток: эпидермиса, эндотеция, 2 средних слоев и тапетума. У остальных
исследованных видов стенка пыльника 4-слойная. Во всех случаях средние слои
эфемерны; в эндотеции развиваются фиброзные утолщения. Тапетум клеточный
секреторный, первоначально одноядерный, в мейотический период — 2-много-
Aizoaceae
1—25 — Aptenia cordifolia.
1,2 — поперечные сечения пыльников на различных стадиях развития (схема); 3
—фрагмент сформированного пыльника с микроспороцитами и слоями стенки; 4 — фрагмент
пыльника <с вакуолизированными многоядерными клетками тапетума и другими слоями стенки;
j — ^часток стенки вскрывшегося пыльника (см. 2); видны эпидермис и фиброзные
утолщения в эндотеции; 6,7 — мейоз I в микроспороцитах; 8, 9 — тетраэдральные и
крестообразные Тетрады микроспор; 10—12 — 1— 2—3-клеточные пыльцевые зерна; 13, 14
—материнские ^Дэтки мегаспор; над ними две париетальные клетки; 15 — линейная тетрада мегаспор;
3 мик^юпилярные мегаспоры дегенерируют; 16 — 4-ядерный зародышевый мешок; 17 —
сформиррванный зародышевый мешок; яйцевой аппарат (2 синергиды и яйцеклетка);
полярные ядра слились; антиподы дегенерируют; обильный крахмал вокруг вторичного ядра;
2S — 2-клеточный проэмбрио и 2-ядерный эндосперм; 19 — линейный однорядный пррэмбрио;
20 — линейный проэмбрио, показывающий почкование подвеска; 21—24 — стадии,
приводящие к формированию шаровидного зародыша; виден длинный подвесок; 25 — зрелый
зародыш. (1—25 — по Prakash, 1967).
16 ;':..; ...
2 Сравнительная эмбриология
ядерный вследствие повторных митотических делений, не сопровождаемых
цитокинезом. Характерны также слияния ядер в клетках тапетума и формирование
полиплоидных реституционных ядер. У Hereroa hesperantha описаны орбикулы.
Стенка зрелого пыльника состоит из эпидермиса и фиброзного эндотеция.
Спорогенная ткань, как правило, многослойная. В результате микроспороге-
неза, проходящего по симультанному типу, формируются тетраэдральные и
крестообразные тетрады микроспор в кал лозных оболочках. Зрелые пыльцевые
зерна одиночные, 3-клеа очные, с обильным крахмалом; спермин веретеновидной
формы, со слабовыраженной цитоплазмой.
В каждом гнезде завязи развиваются, как правило, многочисленные
семяпочки; у Tetragonia tetragonoides — одиночные, висячие. Семяпочки анакампи-
лотропные, с 2 интегументами и длинной семяножкой, крассинуцеллятные;
проводящий пучок заканчивается в халазе. Оба интегумента 2-слойные, у 7W-
anthemaportulacastrum внешний интегумент 3-слойный. У Т. tetragonoides, Triant-
hema argentina и Delosperma cooperi в халазальном конце семяпочки между
внешним и внутренним интегументом имеется воздушный промежуток.
Микропиле формируется только внутренним интегументом, разрастающимся в зоне
микропиле и образующим 5—6-слойный оперкулум. У представителей
подсемейства Aizoideae имеется 2-елойный фуникулярный ариллус, полностью
окружающий семя, тогда как Mesembryanthemoideae и Tetragonioideae лишены его.,
Характерны наличие фуникулярого {Tetragonia) или плацентарного (Aptenia
и Hereroa) обтуратора и формирование нуцеллярного колпачка. У Tetragonia
в клетках нуцеллуса обнаружены крупные друзы. Часть нуцеллуса сохраняется
в зрелом семени, образуя перисперм, в клетках которого накапливается крахмал.
Археспорий, как правило, многоклеточный, реже 1—2-клеточный.
Функционирует только одна археспориальная клетка, остальные сохраняются некоторое
время под материнской клеткой мегаспор и на более поздних стадиях не
отличаются от окружающих клеток нуцеллуса. В исключительных случаях
дополнительная археспориальная клетка может развиться в тетраду мегаспор
(Н. hesperantha) и даже в зародышевый мешок (D. cooperi). Функционирующая
археспориальная клетка отчленяет париетальную клетку, производные которой
образуют массивную париетальную ткань. Тетрады мегаспор линейные. В
некоторых случаях в результате подавления цитокинеза в верхней клетке диады
вместо тетрады формируется «триада» мегаспор (Tetragonia).
Для подавляющего большинства A izoaceae характерен моноспорический
зародышевый мешок Polygonum-типа. Исключением является!), cooperi,
показывающая одновременно 5 типов развития зародышевого мешка — Polygonum,
Endymion, Drusa, Penaea и Adoxa. Сообщение об этом подтверждено изучением
растений в их естественных условиях. Раннее сообщение об Adoxa-типе развития
зародышевого мешка у Mesembryanthemum pseudotruncatellumB.yyKRdLeTcn в
переисследовании. Полярные ядра сливаются до оплодотворения вблизи клеток
яйцевого аппарата. У Sesuvium описаны крючкообразные выросты у синергид.
3 антиподальные клетки эфемерны, дегенерируют ко времени оплодотворения.
В зрелом зародышевом мешке обычно имеются крахмальные зерна, особенно
обильные вокруг первичного ядра эндосперма. У Tetragonia вокруг яйцевого
аппарата нередко обнаруживаются крупные кристаллы. Для Т. portulacastrum
характерны порогамия и вхождение пыльцевой трубки в зародышевый мешок
через 24 ч после опыления. Наблюдались картины двойного оплодотворения.
Сразу после оплодотворения обе синергиды разрушаются.
Эндосперм нуклеарный и опережает в своем развитии зародыш. Характерно
формирование халазального гаустория зародышевого мешка на стадии нукле-
арного эндосперма с густой цитоплазмой и крупными гипертрофированными
ядрами. Прогрессирующая активность этой структуры сопровождается
удлинением и искривлением зародышевого мешка в халазальной части, внедряющейся
в нуцеллус и приобретающей подковообразную (Delosperma и Tetragonia) или
складчатую (Aptenia) конфигурацию. Формирование клеточных стенок в
эндосперме имеет место на поздней шаровидной стадии проэмбрио по всему эндосперму
(Delosperma) или ограничено только микропилярной частью (Aptenia и
Tetragonia). Однако халазальный вырост' долгое время остается свободноядерным.
18
В зрелом семени эндосперм полностью (Hereroa, Aptenia и Delosperma) или почти
полностью (Trianthema) потребляется зародышем.
Развитие зародыша происходит по Solanad-типу и соответствует Linum-
вариации, по Джогансену, или III м^гархитипу серии «А» II периода эмбрио-
генетической системы, по Суэжу. Характерно формирование длинных
массивных подвесков с расширенными базальными клетками. У Trianthema и Aptenia
отмечены случаи почкования подвеска, но зрелые семена всегда с одним
зародышем. Зрелый зародыш занимает почти весь периметр семени, 2-дольный,
Слегка изогнутый. Лейкоэмбриофит.
Исследованные виды. Aptenia cordifolia, Delosperma coopefi,
Hereroa hesperantha, Mesembryanthemum pseudotruncatellum, Sesuvium portula-
castrum, Tetragonia tetragonoides, Trianthema argentina, T. monogyna (=T. por-
tulaeastrum).
Литература: Jonsson, 1879—1880; Guignard, 1882; Hubert, 1896;
Dahlgren, 1916, 1927; Schmid, 1925; Woodcock, 1931; Bhargava, 1935; Kajale,
1940; Lebegue, 1955; Gocucci, 1961; Narayana, 1962; Dnyansagar, Malkhede,'
1963; Prakash, 1964, 1966, 1967a, 1967b, 1967c; Kapil, Prakash, 1966.
Семейство CACTAGEAE
Пыльники 4-гнездные. Сформированная стенка пыльника состоит из
эпидермиса, эндотеция, среднего слоя и тапетума. К периоду созревания в эн^о-
теции формируются фиброзные утолщения, клетки тапетума становятся 2-
или многоядерными. Средний слой эфемерный. Тапетум секреторного типа.
Тетрады' микроспор тетраэдральные, цитокинез симультанного типа. Зрелые
пыльцевые зерна 2—3-клеточные у Opuntia dillenii, О. elata, О. ficus-indica
и Hylocereus undulatus и 3-клеточные у Pereskia amapola var. argentina.
Семяпочки гемицирцинотропные, цирцинотропные или кампилотропные^
с 2 хорошо развитыми интегументами, крассинуцеллятные. Микропиле
формируется внутренним интегументом. Характерная особенность строения — нали-
чие воздушного пространства между внутренним и наружным интегументами
в халазальной части семяпочки. Археспорий одноклеточный, реже возможно
заложение 2 археспориальных клеток. В результате первого деления
образуются спорогенная и париетальная клетки. Спорогенная клетка увеличивается
в размерах, превращается в мейоцит и вступает в мейоз, формируя линейную
или Т-образную тетраду мегаспор. Возможно также образование вместо тетрады —
триады мегаспор из-за отсутствия цитокинеза в верхней клетке диады у Rhipsa-
lis cassutha, R. cappiliformis, R. virgata (Mauritzon, 1934), Astrophytum my-
riostigma (Engleman, 1960) иуО, dillenii (Tiagi, 1954). Цитокинез не
наблюдался также и в нижней клетке триады, в результате чего она оставалась 2-
ядерной у О. dillenii (Tiagi, 1954) и у О. aurantiaca (Archibald, 1939). У Phyl-
locactus цитокинез в мейозе отсутствовал полностью (Hubert, 1896).
Зародышевый мешок у большинства представителей семейства образуется
из халазальной клетки тетрады. Редко могут функционировать 2 мегаспоры.
Зародышевый мешок в этих случаях моноспорический, далее он
последовательно проходит 2—4—8-ядерные стадии развития, что соответствует
Polygonum-типу. Биспорические зародышевые мешки были описаны у О. aurantiaca
(Archibald, 1939) и О. dillenii (Tiagi, 1954). Данные первого из авторов
подвергались критике (Maheshwari, 1950). Переисследование показало, что
зародышевые мешки у О. aurantiaca моноспорические Polygonum-типа (Chopra,
1957). Тетраспорические зародышевые мешки Adoxa-типа описаны у Phyllocac-
tus (Hubert, 1896). Таким образом, у кактусовых описана возможность
образования моноспорических, биспорических и тетраспорических зародышевых мешков,
в процессе развития которых обнаружены отклонения от нормы. На ценоцит-
ных фазах мегагаметогенеза были отмечены нарушения в распределении ядер
по полюсам у Mammillaria tenuis (Tiagi, 1957). У Astrophytum myriostigma,
2* 19
* Cactaceae
1, 6\ 9. 11, 14—16 — O.puntia dillenii, 2—4, 5,7 — Mammillaria carnea, 8, 17—22, 24—32 —
Opantia elata, 10, 12, 13 — O. aurantiaca, 23, 33—41 — O. ficus-indica, 42—50 — Rhipsdlis
cassytha.
1 — пыльник с микроспороцитами; 2 — микроспороцит; 3 — тетрада микроспор; 4 —
одноядерное пыльцевое зерно; 5 — 2-клеточное пыльцевое зерно; 6 — 3-клеточное пыльцевое
зерно; 7 — стенка зрелого пыльника; 8 — зрелое пыльцевое зерно; 9 — семяпочка с 2 споро-
генными и кроющими клетками; 10 — семяпочка с мегаспороцитом; 11 — деление мега-
спороцита; 12, 13 — диада и тетрада мегаспор; 14—№ — развитие зародшпевого мешка;
17 — семяпочка с археспориальной клеткой; 18, 19 — семяпочки с мейоцитами и кроющими
клетками над ними; 20 — микропилярная часть семяпочки с 2-ядерным зародышевым
мешком; 21 — схема строения семяпочки на стадии зрелого зародышевого мешка; 22 — зрелый
-зародышевый мешок и окружающие его клетки нуцеллуса; 23 — момент двойного
оплодотворения; 24 — зародышевый мешок с зиготой и ядерным эндоспермом; 25, 26 —
микропилярная часть семяпочки: 25— о, неоплодотворёнными .элементами зародышевого мешка
вскоре после цветения, . :
СасШсеае (продолжение)
Thelocactus bicolor и
Toumeya papyracantha
наблюдалась депрессия халазаль-
ного конца у зародышевых
мешков Polygomim-типа,
что сопровождалось
дегенерацией халазальных ядер
и отсутствием клеток-ан-
типод. Зрелые
зародышевые мешки в этих
случаях были
редуцированными 4-клеточными 4—
5-ядерными (Engleman,
1960). Зрелый, нормально
р азвитый з ар одышевый
мешок Polygonum-типа
имеет 7 клеток и 8 ядер.
Клетки яйцевого аппарата
дифференцированы на
яйцеклетку и 2 синергиды.
Яйцеклетка крупнее си-
нергид, которые имеют
26 — с дегенерировавшим яйцевым аппаратом и ядерным эндоспермом; клетки нуцеллуса
в микропилярной области мелкие, густоплазменные, активно делящиеся (через 2—3 недели
после цветения); 27 — более поздняя стадия развития такой семяпочки; вблизи эндосперма
формируются эмбриональные клетки; 28 — фрагмент семяпочки с ядерным эндоспермом,
нуцеллусом и 2 рядами эмбриональных клеток незадолго до начала развития нуцеллярных
проэмбрио; 29 — схема семяпочки в период формирования нуцеллярных проэмбрио;
выделена активная зона нуцеллуса; 30 — множество нуцеллярных проэмбрио, формирующихся
из эмбриональных клеток; 31 — нуцеллярные проэмбрио на более поздних стадиях развития;
32 — 2 рядом расположенных зародыша, находящихся на разных стадиях развития; в
крупном зародыше сформирована эмбриодермэ;
нитчатый аппарат и крючковидные выросты. Полярные ядра сливаются
до оплодотворения. Антиподы эфемерны. Двойное оплодотворение наблюдали
у A. myriostigma (Engleman, 1960), О. ficus-indica и О. elata (Наумова, Яковлев,
1978; Наумова, ориг. данные). В первом случае оно осуществляется через
24 ч после опыления, во втором — через 2—3 сут. У О. ficus-indica тип
оплодотворения промежуточный, период «покоя» зиготы около 4—5 сут.
Предполагается двойное оплодотворение также у Th. bicolor, Toumeya papyracantha
(Engleman, 1960), О. dillenii (Maheshwari, Chopra, 1955) и М. tenuis (Tiagi, 1957).
Эндосперм нуклеарный; позднее становится клеточным; свободноядерная
стадия очень продолжительна. Ранее считалось, что эндосперм у кактусовых
на протяжении всего развития остается свободноя'дерным и к клеткообразова-
нию не приступает (Tiagi, 1970). Однако исследования по О. elata и О. ficus-
indica показали, что клеткообразование в эндосперме происходит (Наумова,
19786; Наумова, Яковлев, 1978). Ядра халазальной зоны эндосперма намного
крупнее микропилярных. Эндосперм наряду с периспермом сохраняется вплоть
до созревания у Echinocactus papyracanthus (Martin, 1946), Toumeya
papyracantha, Th. bicolor, A. myriostigma (Engleman, 1960). У видов же, для которых
характерна нуцеллярная эмбриония и развитие в семени множества
зародышей, эндосперм потребляется на более ранних стадиях развития. В зрелых
семенах у этих видов сохраняется только перисперм*
Сведения по эмбриогенезу цемнцгачисленны. Имеются лишь некоторые
данные по развитию зародыша у Rhipsalis cassytha (Mauritzon, 1934) и О. ficus-
indica (Наумова, 1978в; Наумова, Яковлев, 1978): Упоследнего зигота делится
поперечной перегородкой, но в дальнейших делениях нет четкой последовательности-
Эмбриодерма дифференцируется лишь у многоклеточных шаровидных проэмбрио.
Cactaceae (продолжение)
22
Cactaceae (продолжение)
Cactciceae (продолжение)
33—35 — дальнейшее развитие и дифференциация нуцеллярных зародышей;
Эмбриогенез О. ficus-indica соответствует типу позднодиффенирующихся
зародышей. Строение зрелого семени у представителей семейства различно. У родов
Opuntia, Pereskiq^PereskiopsisjiNopaleas^eRbiessi^ojiumiL крупные, с нормально
развитыми семядолями, гипокотилем и корешком, почечка же выражена плохо.
У родов Astrophytum, Mammillaria и Cereus и некоторых других семядоли
сильно редуцированы, а гипокотиль, почечка и корешок дифференцированы
слабо.,
Нуцеллярная эмбриония распространена в семействе довольно широко. Она
описана у всех исследованных видов опунций и маммиллярий: М. tenuis, Pereskias
24
43 44^ 45 46 47 &1 49 50
" Cactaceae (продолжение)
36—42 — развитие зиготических зародышей; 43—50 — развитие проэмбрио. (в. ин —
внутренний интегумент, д. я. а — дегенерирующий яйцевой аппарат, з. м — зародышевый
мешок, н — нуцеллус, н. ин — наружный интегумент, н.'п — нуцеллярные проэмбрио,
п. т — пыльцевая трубка, с — синергиды, ф — фуникулус, э. к — эмбриональные клетки,
эн — эндосперм). (1, 6, 9—11, 14—16 — по Tiagi, 1954; 2—5, 7 — по Tiagi, 1958; 8,17—20,
22, 24—28, 30—32 — ориг.; 10, 12, 13 — по Chopra, 1957; 21, 29, 33—35 — по Наумовой,
1978а; 23, 36—42 — по Наумовой, Яковлеву, 1978; 43—50 — по Mauritzon, 1934).
О. dillenii, О. ficus-indica, О. vulgaris, О. leucantha, СЬ aurantiaca, О. elata,
а у 0\ tortispina и О. rafinesquii установлена на основании изучения
проростков, дающих по 2—3 всхода. Формированию нуцеллярных зародышей
у опунций предшествует интенсивное разрастание нуцеллуса в микропиляр-
ной области и образование вдоль центральной клетки обычно 2—3-рядного слоя
густоплазменных активных клеток, из которых в дальнейшем будут развиваться
нуцеллярные зародыши. На первых этапах развития таких проэмбрио каждая
из клеток слоя, граничащего с эндоспермом, начинает интенсивно делиться
и формирует собственно проэмбрио. Клетки слоя, прилежащего к нуцеллусу,
выполняют, очевидно, роль подвеска нуцеллярных проэмбрио, они длительное
> 25
время не делятся. Такой способ образования нуцеллярных зародышей у
покрытосеменных описан нами впервые. На начальных стадиях развития у
нуцеллярных проэмбрио отсутствует закономерность и последовательность клеточных
делений; однако у некоторых из них эмбриодерма образуется довольно рано.
Зрелые нуцеллярные зародыши нормально дифференцированы и по строению
не отличаются от половых зародышей. Зрелые семена видов с нуцеллярнож
эмбрионией очень часто имеют несколько зародышей.
Исследованные виды. Astrophytum myriostigma, Cereus jamacarr
Echinocactus papyr acanthus, Ferocactus wislizeni, Hylocereus undatus, Mammilla-
via carnea, M. tenuis, Nopalea, Opuntia aurantiaca, 0. dillenii, 0. elata, O. ficus-
indica, O. fulgida, O. glaucophylla, 0. leucantha, 0. monacantha, O. rafinesquiir
Opuntia, 0. tortispina, 0. vulgaris, Pereskia amapola var. argentina, Pereskiopsis,
Phyllocactus, Rhipsalis cassytha, R. capilliformis, R. gonocarpa, i?. virgatar
Thelocactus bicolor, Toumeya papyracantha.
Литература. Hofmeister, 1858; Braun, I860; Jonsson, 1879—1880;
Guignard, 1886; Hubert, 1896; Ganong, 1898a, 1898b; Montemartini, 1899;
Hull, 1915; Johnson, 1918; Huber, 1929, 1937; Schnarf, 1929; Johansen, 1933;
Mauritzon, 1934; Neumann, 1935; Maheshwari, 1936, 1950; Archibald, 1939;
Martin, 1946; Buxbaum, 1948, 1977; Banerji, Sen, 1954; Maheshwari, Chopra,
1954, 1955; Tiagi, 1954a, 1954b, 1956, 1957, 1958, 1967, 1970; Chopra, 1957;
Engleman, 1960; Тиаги, 1960; Sachar, 1963; Kapil, Prahash, 1967, 1969; Haccius,
Bhandari, 1975; Наумова, 1978a, 19786, 1978в, 1978г и ориг. данные; Наумова,
Яковлев, 1978.
Семейство PORTULACACEAE
Пыльники 4-гнездные. Стенка пыльника развивается по типу однодольных.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, среднего
слоя и тапетума. Эндотеций имеет фиброзные утолщения. Средний слой
эфемерный. Тапетум однослойный (Davis, 1966), по данным Роцена (Rocen, 1927) —
многослойный; при этом начало его дегенерации совпадает с образованием
тетрад. У Portulaca oleracea в процессе развития тапетум становится 2-ядерным
(Cooper, 1935; Davis, 1966), у P. tuberosa — многоядерным (Rocen, 1927; Ragha-
van, Srinivasan, 1941). По нашим данным, у P. grandiflora отмечается наличие
одного слоя тапетума, который в процессе развития становится многоя^дерным.
На стадии тетрад микроспор некоторые ядра тапетума сливаются, образуя
полиплоидное ядро. Ядра тапетума обычно многоядрышковые. Первые признаки
дегенерации тапетума отмечаются лишь на стадии микроспоры; полная
дегенерация происходит к стадии образования 3-клеточных пыльцевых зерен.
У P. grandiflora стенка пыльника представлена всеми слоями (эндотеций,
средний слой, тапетум) как с ее внешней стороны, так и со стороны связника. Однако-
неравномерное образование эндотеция отмечается со стороны связника.
Тапетум секреторного типа с орбикулами. Для всего семейства характерно
однослойное расположение микроспороцитов в пыльнике. Тип образования
микроспор симультанный. У P. oleracea в тетрадах формируются тонкие (Cooperr
1935), а у P. grandiflora — мощные каллозные оболочки. Дискуссионным
является вопрос о формировании клеточных перегородок в тетрадах (Rocenr
1927; Cooper, 1935; Raghavan, Srinivasan, 1941). Тетрады микроспор изобила-
теральные или тетраэдральные. В результате деления ядра микроспоры у P.
oleracea (Cooper, 1935) и P. grandiflora (наши данные) образуется веретенообразная
генеративная клетка с относительно большим количеством цитоплазмы и
вегетативная клетка. Зрелые пыльцевые зерна у P. tuberosa (Davis, 1966) и Clayto-
nia sibirica (Rocen, 1927) 2-клеточные, у других представителей этого семейства,
например у P. oleracea — 3-клеточные(Cooper, 1935). Спермин богатоплазменные.
В пыльцевых зернах имеется крахмал.
Семяпочка у разных представителей сем. Portulacaceae варьирует: у Calan*
drinia и Anacampseros она плейрокампилотропная, у Montia и Cluytonia —
26
Portulacaceae
1—12, 17 — Portulaca grandiflora, 13—16, 19, 31—41 — P. oleracea, 18 — Montia rivularis,
20—30 — Qlaytonia uirginica.
1—6 — развитие пыльника и пыльцевого зерна;
эпи- и апотропно-кампилотропная (Rooen, 1927), у P. oleracea — анатропно-
кампилотропная (Cooper, 1940). Согласно^ Рагавану с соавторами (Raghavan,
Srinivasan, 1941) и нашим данным, для P. tuberosa и P. grandiflora характерен
кампилотропный тип семяпочки. Семяпочка с 2 интегументами, крассинуцел-
лятная. В начале своего развития они 2-слойнц;е; к моменту созревания
зародышевого мешка внутренний, образующий микропиле интегумент становится
многослойным, но только в микропилярной его части. Внутренний интегумент
образует эндостом. Археспорий одноклеточный. Дифференциация археспори-
27
Portulacaceae (продолжение)
7-13- мегаспорогенез и развитие зародышевого мешка;
альной клетки происходит в период начала формирования интегументов. Архе-
спориальндя клетка делится периклинально, образуя париетальную и споро-
генную клетки; в дальнейшем развивается париетальная ткань, состоящая из 3—
4 слоев. Клетки нуцеллярного эпидермиса Удлиняются в апикальной части
и делятся в латеральной. Имеется нуцеллярный колпачок. По нашим данным,
у P. grandiflora в микропилярном районе нуцеллуса дифференцируются
специфические удлиненные клетки на стадии формирования зародышевого мешка.
Нуцеллярный колпачок не обнаружен. Тетрады мегаспор бывают линейными
и Тт-образными; последние отмечаются у Montia (Rocen, 1927). Характерной
особенностью для семейства в целом является то, что при формировании тетрад
деление в микропилярной клетке
диады всегда запаздывает по сравнению
с халазальной.
Зародышевый мешок моноспори-
ческий, Polygonum-типа. На 2-ядер-
ной стадии развития зародышевого
мешка у Montia и P. oleracea
появляются вакуоли в базальной его
части и большое количество
крахмала, сосредоточенного вокруг
ядер. В удлиненном, несколько
расширенном в микропилярной части
зрелом зародышевом мешке яйцевой
аппарат представлен 2
грушевидными синергидами и яйцеклеткой,
которая значительно крупнее синер-
гид. Синергиды крючковидные (Р.
grandiflora), с нитчатым аппаратом.
В апикальной части синергид
обнаруживаются большие вакуоли; в
базальной, где располагается ядро,
сосредоточена основная масса
плотной цитоплазмы; в яйцеклетке
имеется большая базальная вакуоль;
ядро расположено в сильно вакуо-
лизированной цитоплазме. По нашим
данным, у P. grandiflora, а также у
других видов полярные ядра
обычно сливаются перед
оплодотворением. Дэвис (Davis, 1966)
отмечает случаи слияния полярных ядер и во время оплодотворения. Антиподаль-
ные клетки обычно образуют осевой ряд, они эфемерны и дегенерируют еще перед
оплодотворением. В зрелом зародышевом мешке в яйцеклетке и в центральной
клетке отмечается большое количество сложных крахмальных зерен. В
антиподах и синергидах крахмал не обнаруживается. В районе полярных ядер
и зиготы у P. grandiflora, по нашим данным, имеется большое количество темно-
окрашенных глыбок. Двойное оплодотворение обычно происходит через
несколько часов после опыления. Пыльцевая трубка у одних представителей
(С sibirica и P. grandiflora) идет по проводниковой ткани, у других {Calandri-
nia caulescens) — в канале столбика,. У Claytonia perfoliata и у Portulaca
отмечается разветвление пыльцевой трубки в микропилярной части зародышевого
мешка. Клетки нуцеллярного колпачка, между которыми проходит пыльцевая
трубка, сильно ослизняются. У С. caulescens и С. perfoliata синергиды
дегенерируют сразу после оплодотворения, в то время как у Montia rivularis и P.
oleracea сохраняются целыми вплоть до образования многоклеточного зародыша.
Содержимое пыльцевой трубки проходит между синергидами и яйцеклеткой
или изливается в обе синергиды (наши данные). У P. oleracea слияние спермин
с яйцеклеткой, судя по рисункам Купера (Cooper, 1935), происходит по пост-
митотическому типу. Обычно деление вторичного ядра эндосперма происходит
29
Portulacaceae (продолжение)
14—17 — процесс двойного оплодотворения; 18 — начальная стадия развития эндосперма
иуклеарного типа; 19 — халазальный эндоспермальный гаусторий; 20—41 — развитие
раньше деления зиготы. Однако у М. rivularis деление зиготы происходит раньше,
чем первое деление в эндосперме (Rocen, 1927). Зародышевый мешок
значительно увеличивается после оплодотворения.
Для семейства характерен эндосперм нуклеарного типа. Однако в роде
Portulaca, по мнению одних исследователей (Raghavan, Srinivasan, 1941), он цел-
люлярный, по мнению других (Cooper, 1935) — нуклеарный. У P. oleracea
отмечен расположенный в халазальной части семяпочки эндоспермальный гаусторий,
в котором сосредоточено большое число ящер эндосперма, а в зрелом семени
наблюдается зона «свободноядерного» эндосперма в виде «халазальной шапочки»,
окружающей верхушки семядолей. Для большинства представителей семейства
характерно наличие в зрелом семени большого количества эндосперма и
перисперма.
Эмбриогенез у Portulaca Solanad-типа; у Claytonia virginica — Caryophyllad-
типа (Johansen, 1950; Davis, 1966). В результате первых делений у большинства
представителей сем. Portulacaceae формируется Т-образная тетрада. Все
изученные представители имеют хорошо выраженный широкий суспензор,
состоящий из 8—12 клеток, за исключением P. oleraceae, у которой отмечен случай
формирования узкого суспензора (Cooper, 1935). Эмбриодерма
дифференцируется обычно на глобулярной стадии развития зародыша. У большинства
представителей семейства 2 семядоли закладываются.одновременно, напротив друг
друга. На более поздних стадиях развития одна из семядолей, лежащая около
перисперма, отстает в развитии. В зрелом семени обнаруживается зародыш
с 2 неравными семядолями. Точка роста дифференцируется на стадии заложения
бугорков семядолей. Зародыш изогнутый, образует дугу, в результате чего
апикальная часть семядолей и верхушка гипокотиля находятся на одном уровне.
Интересным исключением (в частности по числу семядолей) в сем.
Portulacaceae является род Claytonia: одни исследователи (Rocen, 1927;
Davis, 1966) считали, что зародыш Claytonia — однодольный, другие (Cook,
1903; Goebel, 1933; Soueges, 1945) полагали, что в зрелом семени зародыш имеет
одну хорошо развитую семядолю, а другую редуцированную. Детальное цито-
эмбриологическое и анатомическое исследование зародыша и проростка
С. virginica, проведенное Хациус (Haccius, 1954), выявило, что закладывается
и развивается единственная семядоля; никакого следа от 2-й семядоли нет.
Кроме того, автору удалось установить, что одна семядоля не является
результатом слияния 2. Анатомия проростка показала большое сходство с
проростками настоящих однодольных, которое выявляется, в частности, в большой
активности основания семядоли, которое, как у однодольных, так и у С.
virginica, в виде влагалища окружает точку роста. Таким образом, в сем.
Portulacaceae встречаются зародыши как с 2, так и с одной семядолей. Специфическая
особенность зародыша P. oleracea состоит в том, что на стадии инициации
семядолей (0.12 мм) он становится автономным (White, 1932; Batygina, Vasiljeva»
1981).
У P. oleracea обнаружена полиэмбриония (Davis, 1966).
Исследованные виды. Anacampseros arachnoides, Claytonia ca-
roliniana, C. lanceolata, C. perfoliata, C. sibirica, C. virginica, Calandrinia andrew-
sii, C. caulescens, C. discolor, С grandiflora, С speciosa, Montia fontana, M.
rivularis, Portulaca grandiflora, P. micronata, P. oleracea, P. pilosa, P. tuberosa, Ta-
linium patens.
Литература. Hofmeister, 1958; Meunier, 1890; Brandegee, 1894;
Hubert, 1896; Cook, 1903; Holm, 1908, 1911, 1914; Dalhgren, 1916; Rocen, 1924r
1927, 1929; Jamaha, 1926; Netolitsky, 1926; Woodcock, 1926; Poellnitz, 1932;
зародыша: 20—24 — продольный срез зародыша на ранних стадиях развития, 25, 26 —
зародыш на стадии инициации и формирования единственной семядоли, 26а, 27, 28 — общий,
вид зародыша на разных стадиях развития, 29 — продольный срез через корень, гипокотиль
и точку роста проростка, 30 — схема поперечного среза зародыша на уровне точки роста►
(1—12, 17 — ориг.; 13, 31—41 — по Cooper, 1940; 14—16, 18—19 — по Rocen, 1927; 20—
30 — по Haccius, 1954, с изменениями).
31
White, 1932; Goebel, 1933; Cooper, 1935, 1940; Soueges, 1938,1945,1948; Ragha-
van, Srinivasan V. K., 1941; Kajale, 1942; Johansen, 1950; Haccius, 1954; Davisfj
1966; Batygina, Vasiljeva, 1981; Батыгина (ориг. данные).
Семейство HECTORELLACEAF
Эмбриологически почти не изучено.
Пыльник 2-гнездный.
Семяпочка кампилотропная.
Зародыш изогнутый вокруг перисперма.
Литература. Philipson, Skipworth, 1961.
Семейство BASELLACEAE
Пыльники 4-гнездные. Стенка пыльника развивается по типу однодольных.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция с
фиброзными утолщениями и звездчатыми кристаллами, а также секреторного тапетума,
клетки которого на поздних стадиях развития становятся многоядерными.
Микроспороциты располагаются в один ряд у Ullucus, в 1—2 ряда у Boussin-
gaultia и в несколько рядов у Basella. Мейоз сопровождается цитокинезом
симультанного типа. Тетрады микроспор изобилатеральные или тетраэдральные.
Зрелые пыльцевые зерна 3-клеточные; ядро вегетативной клетки дегенерирует
до начала прорастания пыльцевого зерна. У Ullucus и Basella описано
образование пыльцевых зерен разных размеров и дегенерация наиболее мелких из них
на одноядерной стадии (Rocen, 1927; Maheshwari, Pullaiah, 1975).
Семяпочки кампилотропные, анакампилотропные или амфитропные,
с 2 интегументами, крассинуцеллятные. Наружный интегумент у Basella
4—6-слойный в халазальной части и 2-слойный в микропилярной; внутренний
интегумент состоит из 2—4 слоев клеток, микропилярная же его часть
многослойная, клювовидно вытянутая. Между интегументами в халазальной области
сохраняется свободное пространство. Археспорий одноклеточный, изредка
он может быть 2-клеточным. Археспориальная клетка закладывается субэпи-
дермально, при делении ее образуются кроющая клетка и мегаспороцит. В
дальнейшем, кроющая клетка делится еще несколько раз. Клетки эпидермиса
микропилярной зоны нуцеллуса формируют нуцеллярный колпачок, который, часто
вдается в микропилярный канал. Мегаспороцит вступает в мейоз, в результате
которого образуется линейная тетрада мегаспор. Тетрады часто аномальны
и дегенерируют. Возможно формирование триад мегаспор из-за отсутствия
деления микропилярной клетки диады.
Зародышевый мешок образуется из халазальной мегаспоры и развивается
по Polygonum-типу. Возможна дегенерация зародышевых мешков в процессе
их развития. У Ullucus отмечено развитие в одной семяпочке 2 зародышевых
мешков', возникающих, вероятно, из мегаспор разных тетрад (Rocen, 1927).
Зрелый зародышевый мешок 8-ядерный, 7-клеточный. Клетки яйцевого
аппарата нормально дифференцированы. Синергиды грушевидные, с крупной ва-
Basellaceae
1—6, 11, 12, 15—24 — Basella rubra, 8, 10, 14 — Ullucus tuberosus, 7,9 — Basella alba,
13 — Вoussingaultia baselloides.
1—3 — последовательные этапы формирования стенки пыльника и спорогенных клеток;
4 — пыльник с тетрадами микроспор; 5 — пыльник с одноядерными пыльцевыми зернами;
тапетум дегенерирует; в эндотеции фиброзные утолщения; наружные оболочки клеток
эпидермиса сильно утолщены; .£ — зрелое пыльцевое зерно; 7,8 — схемы семяпочек; 9 —
семяпочка с мегаспороцитом и кроющей клеткой; 10 — семяпочка с зародышевым мешком, ядро
которого делится; 11 — 4-ядерный зародышевый мешок; 12, 13 — 8-ядерные зародышевые
32
мешки; 14 — 2 зародышевых мешка в одной семяпочке; 15 — зародышевый мешок во время
двойного оплодотворения; 16 — зародышевый мешок с 2-клеточным проэмбрио и нуклеарным
.эндоспермом; 17—24 — стадии эмбриогенеза. (1—6,11,12,15—24 — по Maheshwari, Pulliah,
1975; 7—10, 13, 14 — по Rocen, 1927).
3 Сравнительная эмбриология
куолью в терминальном конце клетки. Яйцеклетка гораздо крупнее синергид
и дорастает до середины зародышевого мешка; вакуоль расположена в базаль-
ном конце клетки. Центральная клетка с 2 полярными ядрами, которые
располагаются в центре и сливаются до оплодотворения. Антиподальные клетки
мелкие, располагаются Т-образно,, эфемерны и дегенерируют до слияния
полярных ядер. Перед оплодотворением зародышевый мешок сильно увеличивается
в объеме. У Ullucus и Bassella до оплодотворения обнаружено накопление
крахмала в зародышевом мешке. Для представителей семейства характерна
клейстогамия, хазмогамных цветков мало. Пыльцевая трубка растет порогамно.
Вегетативное ядро остается в пыльцевой трубке после излияния ее содержимого
в одну из синергид. Сингамия и тройное слияние происходят почти
одновременно. Отмечено, однако, что оплодотворения часто не происходит, и семяпочки
остаются стерильными (Roctn, 1927). После оплодотворения деления в зиготе
и в центральной клетке начинаются почти одновременно, но в дальнейшем
ядра эндосперма делятся более интенсивно.
Эндосперм нуклеарный. Позднее, когда зародыш становится глобулярным,
в эндосперме начинается клеткообразование в направлении от микропилярного
конца к халазальному, где он длительное время остается ядерным. Согласно
одним данным (Rocen, 1927; Maheshwari, Pulliah, 1975), зрелое семя лишено
эндосперма, но в нем присутствует перисперм; согласно другим (Bogle, 1969) —
в семенах представителей этого семейства сохраняется обильный эндосперм,
но это нуждается в подтверждении.
Эмбриогенез Basella rubra соответствует Chenopodiad-типу. Первое деление
зиготы поперечное; 4-клеточный проэмбрио линейной формы. Зрелый зародыш
имеет сильно развитые гипокотиль и семядоли; он кольцеобразно изогнут
или спирально закручен.
У Basella alba обнаружена партенокарпия (Roc'n, 1927).
Исследованные виды. Basella alba, В. rubra, Boussingaultia
baselloides. Ullucus tuberosus.
Литература. Kmith, 1898; Dahlgren, 1916; Roc'n, 1927; Dambroise,
1947; Sharma, 1961; Bogle, 1969; Maheshwari, Pullaiah, 1975.
Семейство DIDIEREACEAE
Пыльник 4-гнездный. Сформированная стенка пыльника состоит из 4 слоев
клеток, средних слоев 1—2. Микроспороциты чаще располагаются в один ряд.
Тетрады микроспор тетраэдральные. Цитокинез осуществляется по
симультанному типу. В зрелом пыльнике сохраняются лишь эпидермис и эндо-
ций, который имеет фиброзные утолщения. Тапетум секреторного типа;,
клетки его могут быть 2-ядерными с несколькими ядрышками. Зрелые
пыльцевые зерна 3-клеточные. V Didierea madagascarinensis иногда встречаются очень
крупные пыльцевые зерна с 2—4 клетками, что обусловлено аномалиями при
образовании тетрад микроспор.
Семяпочки от гемитропной до анакампилотропной, с 2 интегумен-
тами, крассинуцеллятные. Микропиле образуется внутренним интегумен-
том. У основания наружного интегумента формируется ариллус. Оба интегу-
мента 2—3-слойные, они неплотно прилегают "друг к другу, между ними
имеется щель. Особенно хорошо она заметна у Alluaudia comosa. У основания фуни-
кулуса имеется обтуратор. Проводящий пучок проходит по всему фуникулусу
и достигает основания наружного интегумента. Археспорий одноклеточный.
При делении археспориальной клетки образуются кроющая и спорогенная
клетки. Спорогенная клетка разрастается, превращается в мегаспороцит и
вступает в мейоз, образуя линейную триаду или тетраду мегаспор. Кроющая клетка
делится антиклинально на 2 клетки. Позднее кроющие клетки дегенерируют,
и зародышевый мешок непосредственно граничит с клетками эпидермиса ну-
целлуса, которые в этой зоне сильно вытянуты. Общий объем нуцеллуса к
стадии зрелого зародышевого мешка сильно увеличивается.
34
9
Didiereaceae
1,5 — Alluaudia dumosa, 2, 3, 4—A. procera, 6, 10, 11 — Didierea rnadagascariensis, 7, 8 —
Alluaudia humbertii, 9—A, montagnacii.
1 — 2-клзточяое пыльцевое зерно; 2 — семяпочка с мегаспроцитом и 2 кроющими клетками;
3 — триада мегаспор; 4 — 4-ядерный зародышевый мешок; 5 —- семяпочка со зрелым
зародышевым мешком; 6 — семяпочка после оплодотворения с 7-клеточным зародышем и
ядерным эндоспермом; 7,8 — развитие зародыша; 9 — 10-клеточный проэмбрио; 10, 11 —
дифференцирующиеся зародыши. (1—11 — по Rauh, Scholch, 1965).
3*
Начало зародышевому мешку дает халазальная мегаспора. Развитие его
соответствует Polygonum-типу. Зрелый зародышевый мешок 7-клеточный, 8-
ядерный/ халазальная часть его сильно удлинена. Антиподы эфемерны.
Полярные лдра сливаются до оплодотворения. Яйцевой аппарат занимает обычно*
микрошшярное положение. Яйцеклетка несколько меньшего размера, чем си-
нергиды, она имеет „густую цитоплазму, слабоокрашивающееся ядро с крупным
ядрышком и вакуоль в зауженном микропилярном конце клетки. Синергиды
удлиненно-грушевидной формы, с нитчатым аппаратом и крючковидными
выростами. Пыльцевая трубка растет в завязи по проводниковой ткани фунику-
луса, затем между вытянутыми клетками нуцеллуса и доходит до одной иа
синергид. Процесс двойного оплодотворения детально не изучался.
Эндосперм нуклеарный; начинает развиваться несколько раньше, чем
зародыш. На более поздних фазах развития в эндосперме происходит клеткооб-
разование и накопление крахмала. В зрелом семени эндосперм сохраняется
в виде одного ряда клеток; перисперм отсутствует.
Эмбриогенез соответствует Chenopodiad-типу (у Didierea madagascarinensis)»
Несколько иное развитие зародыша у Alluaudia montagnacii, где суспензор
варьирует по длине и ширине; гаусториальная часть его приобретает округлую
форму. Зрелый зародыш искривлен и занимает почти весь объем семени.
Семядоли часто неравные по величине и длиннее, чем гипокотиль. В качестве
запасных веществ в зародыше откладываются жиры и алейроновые зерна»
В пределах семейства размеры зрелых зародышей могут варьировать.
Исследованные виды. Alluaudia comosa, A. dumosa, A. humbertii^
A. montagnacii, A. procera, Alluaudiopsis fiherenensis,Didiereamadagascarinensis*
Литература. Scholch, 1963; Rauh, Scholch, 1965.,
Семейство STEGNOSPERMATACEAE *
Семейство MOLLUGINACEAE
Пыльник 4-гнездный. Стенка пыльника развивается по типу однодольных.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция с
фиброзными утолщениями, эфемерного среднего слоя и тапетума. Тапетум
секреторного типа, клетки.его содержат 2—3 ядра. Археспорий 2—4-клеточный. У Orygia
decumbens наблюдаются тельца Убиша. Образование микроспор происходит
по симультанному типу. Расположение их в тетрадах тетраэдральное, изо-
билатеральное или крестообразное. Пыльцевые зерна 3-клеточные.
Семяпочек в завязи от 2 и более. Семяпочки кампилотропные или анакам-
пилотропные, редко анатропные, с 2 интегументами, крассинуцелятные.
Микропиле образуется только внутренним интегументом. У представителей родов
Glinus и Ытеит имеется фуникулярный обтуратор, у Mollugo и Orygia —
плацентарный обтуратор, у некоторых Mollugo — ариллус. Археспорий
состоит из одной или нескольких клетрк. Археспориальная клетка отделяет
париетальную клетку, в результате деления которой "образуются 1—2 слоя
париетальной ткани. Апикальная клетка нуцеллярного эпидермиса делится,,
давая начало 2—3-слойному нуцеллярному колпачку. Тетрады мегаспор
расположены линейно или Т-образно. Функционирует халазальная мегаспора»
Зародышевый мешок моноспорический, Polygonum-типа, 7-клеточный.
Полярные ядра перед оплодотворением сливаются. Наблюдаются различные
сроки наступления дегенерации антипод: перед слиянием полярных ядер или
во время образования 2—3-клеточного проэмбрио. Для Mollugo nudicauliz
отмечено отсутствие в зародышевом мешке крахмала. Оплодотворение поро-
* Материал для исследования был получен, когда рукопись уже была в наборе,,
поэтому характеристика этого семейства помещена на с. 284—285.
36
Molluginaceae
1—30 — Limeum indicum, 31—39 — Mollugo nudicaulis.
1—4 —часть лопасти пыльника, последовательные этапы развития; 5, 6 — тетраэдральная
и крестообразная тетрады микроспор; 7 — одноядерная микроспора; 8—11 — стадии
развития кампилотропной семяпочки; 12 — обтуратор; 13 — Т-образная тетрада; 14 т-
функциональная мегаспора; 25, 16 — сформированный и зрелый зародышевые мешки; 17 —
оплодотворенный зародышевый мешок; 18 — зародыш и несколько ядер эндосперма; антиподы
еще не разрушены;
гамное, осуществляется нормально. Продолговатые мужские ядра при
контакте с женскими ядрами изменяют свою форму и становятся сферическими.
Эндосперм нуклеарный. У Limeum indicum наблюдается синхронность
деления ядер эндосперма на ранних этапах развития и асинхронность их
деления на поздних этапах. Показано, что стенки клеток эндосперма начинают
закладываться на микропилярном конце зародышевого мешка, затем этот процесс
распространяется к халазальному полюсу. Во время* развития эндосперма
зародышевый мешок сильно удлиняется и искривляется. Вокруг первичного
ядра эндосперма, а позднее в клетках эндосперма происходит накопление
крахмала. В зрелом семени почти весь эндосперм используется растущим
зародышем; исключение составляет небольшая его часть на микропилярном
конце в виде небольшого колпачка темноокрашенных клеток. Отмечен
перисперм, содержащий крахмал.
Развитие зародыша осуществляется по Caryophyllad- или Solanad-типу.
Деление зиготы происходит поперечно, в дальнейшем ходе эмбриогенеза
наблюдается образование подвеска. Зрелый зародыш искривлен, в клетках его
содержится крахмал.
37
Molluginaceae (продолжение)
19—39 — стадии развития зародыша. (1—30 — по Narayana, Jain, 1962; 31—39 — по Bhar-
gava, 1934).
Исследованные виды. Glinus indicium, Mollugo cerviana,
M. disticha, M. lotoides, M. nudicaulis, M. oppositifolia, M. stricta, M. verticillatar
Orygia decumbens, Polycarpaea corymbosa.
Литература. . Bhargava, 1934; Payne, 1935; Raghavan, Srinivasan,.
1940; Оксшк, 1946; Kshirsagar, 1960; Narayana, Lodha, 1961, 1963A 1972; Na-
rayana, Jain, 1962; Davis, 1966; Тахтаджян, 1966; Rao S., 1975.
Семейство CARYOPHYLLACEAE
Пыльник 4-гнездный; гнезда объединены попарно, раскрываются интрорзно.
Развитие стенки пыльника происходит центробежно по типу двудольных у
Dianthus subulosus и D. armeria (Гусейнова, 1980). По нашим данным, у видов
Acanthophyllum формирование стенки пыльника происходит по основному типу.
Сформированная стенка пыльника состоит из 5 слоев: эпидермиса, эндотеция,
2 средних слоев и тапетума. У Stellaria aquatica стенка пыльника 4-слойная
(Pal, 1974). Тапетум секреторного типа, одно-, 2- и многоядерыйн (Saponaria
Caryophyllaceae
1—4а .— Acanthophyllym microcephalum, 5, 15—17 — A. krascheninnikovii, 6—14, 35, 37 —
A. elatius, 12 — A. sarawschanicum, 18—20, 25—27, 30—33 — Dianthus caryophyllus, 21—24t
28—29, 34 — Saponaria officinalis, 36 — Acanthophyllum albidium, 38—49 — A. cyrtostegium,
50 — A. paniculatum, 51 — Gypsophila paniculata.
1—17 — развитие пыльника и пыльцевого зерна: 1—5 — развитие стенки пыльника,
39
Caryophyllciceae (продолжение)
в—11 — микроспорогенез, 12 — фрагмент пыльника с 2-клеточными пыльцевыми зернами;
тапетум с орбикулами, 13—16 — развитие пыльцевого зерна, 17 — фрагмент пыльника
со зрелой 3-клеточной пыльцой;
officinalis), с хорошо выраженными орбикулами, дегенерирует на стадии 2-
клеточной пыльцы. Средние слои эфемерные. В эпидермисе и эндотеции
содержится крахмал, который исчезает к моменту образования 3-клеточной пыльцы.
В зрелом пыльнике стенка состоит из эпидермиса и фиброзного, эндотеция.
В молодом гнезде археспорий многорядный. Внутри одного пыльника мейоз
протекает синхронно, в пределах же одного цветка наблюдается асинхронность.
Микроспорогенез симультанного типа, тетрады тетраэдральные, иногда изо-
билатеральные. Зрелые пыльцевые зерна 3-клеточные, у Stellaria ," aquatica
2-клеточные (РаЬ 1974), одиночные. Спермин удлиненной палочковидной
формы. В родах Dianthus^ Silene, Elisanthe, Stellaria, Gypsophila, Viscaria,
Coronaria, Moehriiigia, Arenaria и Acanthophyllum отмечены случаи образования
гинодиэцичных форм, возникающих в результате редукции тычинок* различных
нарушений в микроспорогенезе и в развитии пыльцевых зерен (Турсунов, 1966,
1969; Демьянова, 1977; Глущенко, 1978). Лонг (Long, 1965) в пыльниках у Ро-
lycarpaea nebulosa наблюдал прорастание части пыльцевых зерен, которые
в дальнейшем дегенерируют. Непроросшие пыльцевые зерна, попавшие на
рыльце, прорастают на нем нормально.
В завязи представителей рода Acanthophyllum закладываются 4 семяпочки,
у Gypsophila paniculata и G. perfoliata — 4—17, у Saponaria officinalis — 45—
70. Семяпочка кампилотропная, ортокампилотропная, амфитропная, с
2двуслойными йнтегументами, крассинуцеллятная. Микропиле сформировано
внутренним интегументон. В семяпочках имеется гипостаза, проводящий пучок хорошо
развит и доходит по фуникулусу до халазы. В субэпидермисе нуцеллуса
дифференцируется одна, 2 или несколько археспориальных клеток;
многоклеточный археспорий отмечен у Coronaria flos-cuculi (Мейер, 1962), у Acanthophyllum
paniculatum и у A. gypsophiloides (Турсунов, 1969). Первичная археспориаль-
ная клетка образует париетальную и спорогенную клетки. Последняя
становится мегаспороцитом. При наличии в семяпочке многоклеточного
археспория у Dianthus amurensis развиваются 2 зародышевых мешка (Werner, Zenkteler,
1973). Первичная париетальная клетка дает начало массивной париетальной
ткани, насчитывающей 6—12 слоев. В результате периклинальных делений
эпидермиса нуцеллуса в микропилярной части образуется нуцеллярный колпачок,
насчитывающий 5—8 слоев клеток (Rocen, 1927; Камелина, Яковлева, 1982).
У видов рода Dianthus в клетках нуцеллуса накапливается большое
количество крахмальных зерен, которые исчезают после оплодотворения (Buell, 1952).
Зародышевый мешок моноспорический, развивается из халазальной це-
гаспоры по Polygonum-типу. Зрелый зародышевый мешок изогнутой формы,
с яйцеклеткой грушевидной формы и удлиненными синергидами с крючковид-
ными выростами, иногда выполняющими гаусториальную функцию.
Полярные ядра сливаются до или после оплодотворения. В цитоплазме центральной
клетки и яйцеклетки присутствует крахмал. Антиподы эфемерные. У видов
Tunica saxifraga, Saponaria officinalis и Gypsophila perfoliata отмечено
вытягивание халазального конца зародышевого мешка, названного га-
усторием (Rocen, 1927). У Cerastium triviale наблюдается увеличение количества
и размера ядер в антиподах, развитие наподобие яйцевого аппарата,
значительное увеличение количества ядер в зародышевом мешке без признаков
вакуолизации в цитоплазме наряду с полной потерей дифференциации зародышевого
мешка как в микропилярном, так и в ха лаза льном конце, (Зафийовская,
1939). Всем видам свойственна порогамия и двойное оплодотворение.
Пыльцевая трубка, разрушая одну из синергид, изливает содержимое между
яйцеклеткой и вторичным ядром (Мейер, 1962). У Dianthus amurensis отмечается
(Werner, Zenkteler, 1973) содержимое пыльцевой трубки в обеих синергидах
или между яйцеклеткой и оболочкой зародышевого мешка. У Gypsophila
paniculata, б. trichotoma, Saponaria officinalis и Acanthophyllum elatius
оплодотворение происходит по премитотическому, у А. paniculatum по постмитотическому,
а у A. krascheninnikovii по пре- и постмитотическому типам (Турсунов, Савинова,
1979). Редко в полости зародышевого мешка встречаются 2, 3 и более
дополнительные пыльцевые трубки, которые сохраняются до проэмбриональной стадии
(Турсунов, Матюнина, Савинова, 1978).
41
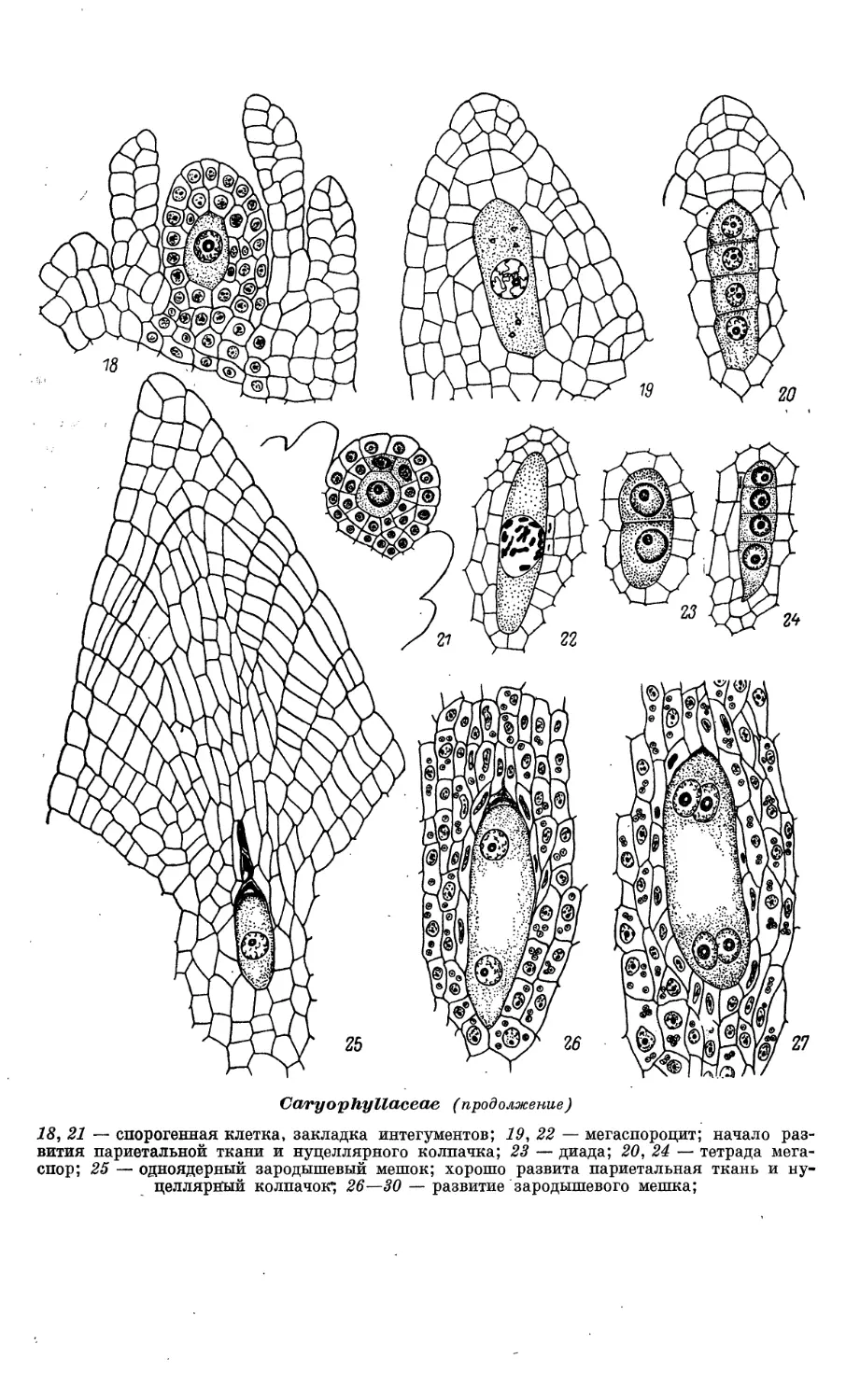
Caryophyllaceae (продолжение)
18, 21 — спорогенная клетка, закладка интегументов; 19, 22 — мегаспороцит; начало
развития париетальной ткани и нуцеллярного колпачка; 23 — диада; 20, 24 — тетрада
мегаспор; 25 — одноядерный зародышевый мешок; хорошо развита париетальная ткань и ну-
целлярный колпачок"; 26—30 — развитие зародышевого мешка;
Эндосперм нуклеарного типа. На основании способов перехода ядерной
стадии развития в клеточную выделены Silene-, Melandrium- и Heliosperma-
вариации развития эндосперма (Rocen, 1927). Описано образование бокового
(«divertikal») гаусюрия, развивающегося у Gypsophila до оплодотворения,
у Saponaria — после 2-го деления ядер эндосперма, у Melandrium — на более
поздней стадии формирования эндосперма (Rocen, 1927). У Coronaria flos-
cuculi эндоспермальный гаусторий отмечен в микропилярном и халазальном
концах зародышевого мешка (Мейер, 1962); у Acanthophyllum glandulosum
массивные, червеобразные, различной формы многочисленные гаустории
имеются в боковых частях зародышевого мешка (Турсунов, Савинова, 1979).
ХалазалЪный гаусторий сохраняется во время формирования зародыша. В
зрелом семени 1—2 (4—6) слоя одноядерных клеток эндосперма в виде колпачка
окружают кончик корешка зародыша. Запасающей тканью является
перисперм, располагающийся в центре семени. Клетки его содержат крахмал.
Зародыш развивается по Caryophyllad-типу с вариацией у Sagina procum-
bens (Soueges, 1924). Первая горизонтальная перегородка делит зиготу на ба-
зальную и апикальную клетки. Базальная клетка, как правило, не делится и
становится суспензором, разрастаясь иногда (С. flos-cuculi) до гигантских
размеров, выполняет гаусториальную функцию и сохраняется до начала
дифференциации зародыша (Мейер, 1962). После 2 делений апикальной клетки образуется
линейная тетрада. У представителей трибы Dianthacea {Gypsophila elegans)
подвесок 2- и многоклеточный, образуется в результате деления производных
апикальной клетки (Guignard, 1966). По нашим данным, такой же
многоклеточный подвесок образуется у Acanthophyllum cyrtostegium, A. krascheninnikovii,
A. elatius, A, gypsophyloides и A. glandulosum. В отличие от этого у Spergularia
marginata многоклеточный суспензор образуется в результате деления базаль-
ной клетки (Vignon, 1966). В эмбриогенезе Cerastium obscurum наряду с
доминантной линейной формой тетрад встречаются Т-образные тетрады с вертикальной
или косой верхней перегородкой. Зародыш в зрелом семени согнутый,
дифференцированный, состоит из 2 семядолей, почечки, гипокотиля и корня; прокам-
биальные пучки хорошо выражены. Лейкоэмбриофит (Яковлев, Жукова,
1973). ,
У Spergula arvensis отмечена проэмбриональная, гаметофитно-спорофитная
полиэмбриония (Терзийски, 1974).
4В
Caryophyllaceae (продолжение)
31, 32, 34 — дифференциация яйцевого аппарата; 33 — семяпочка на стадии зрелого
зародышевого мешка;
Исследованные виды. Acanthophyllwnalbidum, A. cyrtostegium,
A. elatius, A. glandulosum, A. gypsophiloides, A. krascheninnikovii, A. leiostegiumr
A. microcephalum, A. paniculatum, A. pulchrum, A. pungens, A. sarawschanicum,
Agrostemma githago, Alsine laricifolia, A. media, Ammannia baccifera, Ammo-
denia peploides, Anychia dichotoma, Arenaria controversa, A. fendleri, A. musci-
formis,A. serpyllifolia, Cerastium glomeratum, С obscurwn, C, pwnilum, C« tomen-
tosum, C. triviale, C. vulgatum, Corrigiola littoralis, Cucubalus baccifer, Dianthus
amurensis, D. armeria, D.'caryophyllus, D. gramineus, D. plumarius, D. subulosus,
D. versicolor, Drymaria cordata, Dry pis spinosa, Gypsophila elegans, G. paniculata,
G. perfoliata (=trichotoma), Heliosperma alpestre, Herniaria glabra, Holosteum um-
bellatum, Honckenya peploides, Lepyrodiclis holosteoides, Lychnis alba, L. chalcedo-
nica, L. flos-cuculi, L. flos-jovis, L. viscaria, Melandrium album, M. diurnum,
M. rubrum, M. vespertinum, Moehringia lateriflora, M. muscosa, M. pentandra,
M. trinervia, Paronychia arabica, P. chilensis, Polycarpaea nebulosa, Polycarpon
tetraphyllum, Sagina maritime, S. procumbens, S. subulata, Saponaria cerastoides,
S. officinalis, Schiedeaspergulina, Scleranthus annuus, S. perennis, Silene acaulis,
S. armeria, S. conoidea, S. friwaldskyana, S. maritima, S. nutans, S-. otites
(=Cucubalus otites), S. tatarica, S. vallesia, S. venosa, Spergula arvensis, S. canina,
*
44
Caryophyllaceae (продолжение)
35 — зародышевый мешок; 36, 37 — образование червеобразного халазального и боковых
эндоспермальных гаусториев;
S. pentandra, Spergularia marginata, Stellaria aquatica, S. glauca, S. holostea,
S. media, S. uliginosa, Telephium imperati, Thylacospermum rupifragum, Tissa
(=Spergularia) marginata,\ Tunica prolifera, T. saxifraga, Vaccaria parviflora,
V. segetalis, V. vaccaria, Viscaria viscosa, Wahlbergella (=Lychnis) affinis.
Литература. Hofmeister, 1849, 1858a, 1858b; Tulasne, 1855; Strasbur-
ger, 1877, 1884; Vesque, 1878; Warming, 1878; Elfving, 1879; Fischer, 1880;
Guignard, 1882; Hegelmaier, 1885; Cook, 1903, 1909; Gibbs, 1907; Nemec,
1910; Compton, 1912; Perotti, 1913a, 1913b; Dahlgren, 1916, 1940; Kraft, 1917;
Schurhoff, 1921, 1925; Soueges, 1922a, 1922b, .1924, 1945; Rocen, 1926, 1927;
Woodcook, 1926, 1928; Schnarf, 1929, 1931; Joshi, 1936a, 1936b; Зафийовская,
1939; Crete, 1947, 1948, 1949; Dambroise, 1947; Devine, 1950; Pal N., 1951, 1952;
Buell, 1952a, 1952b, 1953; Nirawian, 1952; Руденко, 1957, 1959; Bocguet, 1958,
1959a, 1959b, 1960; Гвинианидзе, 1958; Гусейнов, 1959; Moeliono, 1959; Kshir-
45
Caryophyllaceae (продолжение)
38—49 — развитие зародыша: 45—49 — образование многоклеточного подвеска; 50, 51 —
зрелое семя с нормально дифференцированным зародышем и периспермом. (1—17 — ориг.,
18—20, 25—27, 30—33 — по Камелиной, Яковлевой, 1982; 21—29, 34 — по Турсунову,.
1972; 35—51 — рис. Д. Турсунова).
sagar, 1960; Tohda, 1960, 1965; Creasy, 1961; Barkovdan, 1962; Chandra, 1962;
Мейер, 1962; Nagl, 1962; Wein, 1962; Фурсов, Беспаев, 1963; Guignard, 1963a,
1963b, 1965, 1966a, 1966b, 1967a, 1967b, 1968; Rohweder, 1963, 1965, 1967, 1970,
1971; Имс, 1964; Pritchard, 1964; Prokopova, 1964; Vishnu-Mitre, Gupta, 1964;
Erbrich, 1965; Long, 1965; Vignon, 1965, 1966; Vignon, Lebeque, 1965, 1966,
1969; Zenkteler, 1965, 1967; Crang, 1966, 1968, 1972; Davis, 1966; Longevialle,
1966, 1967, 1968,1970,1971; Nair, 1966; Турсунов, 1966, 1967, 1969a, 19696.1971,
1972, 1973, 1974a, 19746, 1975, 1976, 1977,, 1980a, 19806, 1981; Cuignard,.Mestre,
1967a, 1967b, 1968; Кондратьева-Мельвиль, 1967; Mestre, Cuignard, 1967; Cuig-
nard, Mestre, Payrastre, 1968; Lebeque, Vignon, 1968; Crang, Bruce, 1969; Petria,
1971, 1975, 1976; Grand, Millay, 1972; Pal S., Murty, 1972; Яковлев, Жукова,
1973; Newcomb, Fowke, 1973, 1974; Werner, Zenkteler, 1973; Глушенко, 1974;
Pal S., 1974, 1975; Терзийски, 1974; Heslop-Harrison J., Heslop-Harrison Y.,
1975; Ramji, 1975; Speta, 1975; Турсунов, Матюнина, 1975,1977, 1978,1979,1982;
Oostenink, 1976; Веселова, 1977, 1981; Демьянова, 1977; Демьянова, Поката-
. ева, 1977; Турсунов, Савинова, 1977, 1979; Candau, Talavera, 1978; Chaudhry,
Narayana, 1978; Cyndon, 1978; Турсунов, Матюнина, Савинова, 1978; Яковлева,
1978; Гусейнова, 1980; Сафарян, Далакян, 1980; Kudlicka, Kuras, 1980; Audran,
Batcho, 1981; Демьянова, 1981; Kohler, Hecker, 1981; Kudlicka, Kuras, Rodkie-
wicz, 1980, 1981; Бабасюк, Здруйковская-Рихтер, 1982; Камелина, Яковлева,
Семейство AMARANTHACEAE
Пыльник 4-гнездный (A maranthoidea) или 2-гнездный (Gomphrenoidea). Стенка
пыльника развивается по типу однодольных и состоит из эпидермиса,
эндотеция с фиброзными утолщениями (отсутствие его отмечено у Digera
arvensis), эфемерного среднего слоя и секреторного тапетума. Клетки тапетума могут
содержать от-2 до 5 ядер; на внутренней стороне клеток тапетума наблюдаются
орбикулы. Образование микроспор симультанное. Расположение их в тетрадах
тетраэдральное, изобилатеральное или крестообразное. Пыльцевые зерна
одиночные, как правило 3-клеточные, у D. arvensis 2-клеточные. Спермин имеют
удлиненную форму, нередко искривлены. У Alternanthera в зрелых пыльцевых
зернах наблюдается крахмал,
В завязи обычно содержится одна семяпочка. В пределах семейства у разных
<его представителей встречаются разные типы семяпочек: анакампилотропныи
(Aerva tomentosa и Achyranthes aspera), цирцинотропный (Psilostachys sericea и
Gomphrena celosioides), кампилотропный (Alternanthera sessilis и Amaranthus
caudatus). Семяпочки с 2 интегументами, крассинуцеллятные. В образовании
микропиле участвуют или один внутренний (P. sericea и A. caudatus), или оба
интегумента (G. celosioides). Для представителей семейства характерно наличие
воздушной полости в халазальном районе между 2 интегументами. Исключение
представляет D. arvensis, где этой полости не наблюдается. Археспорий
представлен одной или несколькими клетками; отмечается образование
париетальной ткани (до 5 слоев). У некоторых видов (A. aspera) в результате деления
апикальных клеток нуцеллярного эпидермиса образуется нуцеллярный колпачок.
Деление мегаспороцита приводит к возникновению тетрады мегаспор, ряда из
3 или диады клеток. Расположение мегаспор в тетраде линейное или Т-образное.
Функциональной является халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Снергиды имеют крючкообразные выросты; иногда проявляют яйцеклеткопо-
добную вакуолизацию (A. aspera). У ряда представителей синергиды
эфемерные и дегенерируют на ранней стадии развития (Aerva tomentosa) или после
оплодотворения (D. arvensis). Полярные ядра обычно сливаются до
оплодотворения, но иногда остаются автономными. Антиподы быстро дегенерируют или
могут существовать до ранних стадий развития зародыша. У A. aspera, A.
sessilis ж у некоторых других видов антиподы вначале расположены на хал аза
льном конце зародышевого мешка, затем в ходе дальнейшего роста они
оказываются на боковой стороне. У Pupalia lappacea отмечено формирование до 30—40
47
Amaranthaceae
I — 24 — Achyranthes asp era.
1 —3 — различные стадии развития пыльника; 4, 5 — пыльцевые зерна; 6 — часть
продольного среза зрелой стенки пыльника; 7 — мегаспороцит в состоянии деления; 8 — мега-
спорогенез: ряд из 3 клеток; 9 — начало развития зародышевого мешка; 10 — продольный
срез через завязь с семяпочкой, содержащей 2-ядерный зародышевый мешок; 11 — микро-
пилярная часть зародышевого мешка; двойное оплодотворение; видны дополнительные
спермин; 12 — начало'развития эндосперма; зигота еще не приступила к делению; 13—23 —
развитие зародыша; 24 — продольный срез через зрелое семя. (1—24 — по Kajale, 1937).
ме'лких, обычно лишенных вакуолей клеток антипод. Оплодотворение порогам-
ное. Наблюдается вхождение в зародышевый мешок дополнительных
пыльцевых трубок. Вегетативное ядро не входит в пыльцевую трубку и дегенерирует
в пыльцевом зерне. В процессе слияния половых ядер удлиненные ядра спер-
миев изменяют свою форму и становятся сферическими; объединение половых
ядер осуществляется медленно.
Эндосперм нуклеарный. Стенки клеток эндосперма закладываются вначале*
на микропилярном, затем на халазальном конце. У A. sessilis эндосперм
остается свободноядерным в халазальной части. Только небольшая его часть в виде-
тонкого слоя клеток, окружающих почечку и гипокотиль, сохраняется в
зрелом семени. Хорошо развит и перисперм, клетки которого богаты крахмалом.
Развитие зародыша проходит по Chenopodiad- или Solanad-типу. Зигота
делится горизонтально; затем терминальная и базальная клетки делятся
в том же плане, что приводит к образованию нитевидного проэмбрио. В ходе
дальнейшего развития возникает подвесок; он может быть однорядным (A. aspera}
или массивным, состоящим из нескольких рядов клеток (D. arvensis). Зрелый
зародыш имеет подковообразную форму. В его клетках содержатся запасы
крахмала; особенно много крахмальных зерен в семядолях.
У A. tomentosa почти.20% семяпочек абортируют из-за дегенерации
яйцеклетки. В большинстве случаев яйцеклетка у этого вида развивается партено-
генетически, наблюдается нормальное формирование зародыша, эндосперма>
семян.
Полиэмбриония отмечена у Celosia cristata и Gomphrena decumbens.
Исследованные виды. Achyranthes aspera, Aerva lanata, A. to-,
mentosa, Alternanthera sessilis, Amaranthus blitum, A. caudatus, A. hypochondria-
cus, A. spinosus, A. viridis, Celosia argentea, С cristata, Cyathula tomentosa, Digera
arvensis, Gomphrena celosioides, G. decumbens, Psilostachys sericea, Pupalia lap-
pacea.
Литература. Hofmeister, 1859; Braun, 1860; Fisher, 1880'; Cuignard,
1882; Winkler, 1882; Woodcock, 1931; Naithani, 1933; Joshi, Rao, 1934; Kajale,
1935, 1937a, 1937b, 1940; Puri, Singh, 1935; Joshi, 1936; Joshi, Kajale, 1937;
Soueges, 1937a, 1937b; Maheshwari, 1941; Dambroise, 1947; Bakshi, 1952; Chow-
dhuri, 1955; Sachar, Murgai, 1958,1959; Padhye, 1962; Davis, 1966; Тахтаджян,
1966; Pal, 1969. , .
Семейство CHENOPODIACEAE
Пыльник 4-гнездный; гнезда объединены попарно, раскрываются интрорзно..
Стенка пыльника развивается центростремительно, по типу однодольных.
Сформированная стенка состоит из 4 (у Beta vulgaris из 5) слоев. Тапетум
секреторного типа, одно, 2- и многоядерный (Haloxylon), дегенерирует на стадии 2-кле-
точной пыльцы. Средний слой эфемерный. В эндотеции фиброзные утолщения
имеются в стенке пыльника и со стороны связника. Стенка зрелого пыльника
состоит из эпидермиса и эндотеция. В молодом гнезде спорогенная т'кань
многорядная. С ростом пыльника идут митозы, число спорогенных клеток
увеличивается, их количество различно у видов и зависит от размеров гнезд пыльников.
Образование микроспор происходит симультанно, тетрады тетраэдральные,
редко изобилатеральные. Зрелые пыльцевые зерна 3-клеточные. У В, vulgaris
и видов Haloxylon, Salsola, Aellenia, Kochia и Nanophyton в результате
неправильного деления в микроспороцитах образуются монады, диады, полиады,
а в пыльцевых зернах могут быть 2—8 мелких и крупных ядер; в цитоплазме
• нормальной пыльцы обнаружены дыхательные ферменты, цитохромоксидаза,
дегидразы и пероксидаза, крахмал, жиры, гетероауксин, сахара, сульфгидриль-
ные соединения, аскорбиновая кислота, азот аминокислот, белки, каротин.
Спермин удлиненные (у В. vulgaris округлые), часто серповидной формы.
, У В. vulgaris отмечена цитоплазматическая стерильность пыльцы; у Kochia
prostrata вследствие стерилизации пыльников или семяпочек наряду с
обоеполыми имеются функционально женские и мужские цветки.
4 Сравнительная эмбриология
49
Chenopodiaceae
1—4, 28—34 — Salsola orientalis, 5—20 — Haloxylon aphyllum, 21—27 — Salsola arbuscula,
35—39 — S. aperta.
1 — деление первичного париетального слоя; 2 — деление клетки вторичного
париетального слоя с образованием среднего слоя и тапетума; 3 — начало дегенерации среднего
слоя; тапетум 2-ядерный; 4 — строение стенки зрелого пыльника; 3-клеточное пыльцевое
зерно; 5—10 — I деление и 11—13 — II деление мейоза; 14 — тетрада микроспор; 15—20 —
развитие пыльцевого зерна.
В завязи одна, редко 2 (у К. prostrata) семяпочки. Тип семяпочки анатроп-
ный (Ceratoides, Ceratocarpus и Haloxylon), анакампилотропный (Salsola, Kochia,
Aellenia, Anabasis и Suaeda), анаамфитропный (Halimocnemis, Gamanthus и
Nanophyton), ортоамфитропный (A trip lex), цирцинотропный (Girgensohnia).
Семяпочки на длинном, часто закручивающемся фуникулусе, с 2 интегументами,
крассинуцеллятные. В семяпочке Halimocnemis и Gamanthus имеется гипостаза
из удлиненных тонкостенных клеток, у Salsolasclerantha и Girgensohnia oppo-
sitiflora — нуцеллярный колпачок, у Ceratocarpus — интегументальный
обтуратор. Проводящий пучок оканчивается в халазе. Наружный и внутренний
интегументы 2-слойные, ближе к микропиле — 3-, 4- и многослойные.
Микропиле образовано внутренним интегументом, который слабо или сильно выдается
из наружного покрова, иногда края спирально закручены (Gamanthus). В
покровах обнаружены зерна крахмала. Париетальных клеток у разных видов от
6 до 14 рядов. В семяпочке многоклеточный археспорий (4—8клеток), одна или
2 клетки которого становятся мегаспороцитами. Тетрада мегаспор (одна или 2)
линейная.
50
Chenopodiaceae (продолжение)
21, 22 — одна и 2 тетрады мегаспор, 23—25 — 2-, 4- и 8-ядерные зародышевые мешки;
26, 27 — микропилярный и халазальный концы зрелого зародышевого мешка; 28—34 —
развитие зародыша многолетнего вида; 35—39 — развитие зародыша однолетнего вида.
(1—39 — ориг.).
Зародышевый мешок в семяпочке один ( у Haloxylon aphyllum и Salsola
orientalis часто 2), моноспорический, развивается из халазальной или эпихала-
зальной мегаспоры по Polygonum-типу, у Suaeda fruticosa — по Allium-типу
(Mahabale, Solanky, 1953). Зародышевый мешок небольшой, прямой (Girgensoh-
nia, Kochia, Salsola richteri и S. arbuscula) или удлиненный, слегка изогнутый
(£. orientalis и S. gemmascens), или сильно удлиненный, 2-сторонне изогнутый
(Halimocnemis, Gamanthus и Atriplex). Яйцеклетка округло-удлиненная или
грушевидная с крупным ядром и вакуолью в базальной части. Крючковидные си-
нергиды описаны у Arthrocnemum indicum, Chenopodium album, Ch. ambrosioi-
des, Kochia scoparia и S. fruticosa. Полярные ядра обычно сливаются перед
оплодотворением (не сливаются у G. oppositiflora). 3 клетки антипод (у В. vulgaris
более 3) располагаются линейно или Т-образно, эфемерны, но у В. vulgaris,
4*
51
К. scoparia, S. richteri, S. arbusculajK S. sclerantha с признаками дегенерации они
присутствуют и в зрелом зародышевом мешке. У S. orientalis иногда встречается
яйцеклеткоподобная антипода. У родов Beta и КосЫа халазальный конец
зародышевого мешка вытянут, превращен в гаусторий. В конце фазы протогинии
в завязях видов Ceratocarpus; а также S. orientalis, Iljinia regelii и Arthrophytum
balchaschense отмечены повышенная активность ферментов терминального
дыхания (рксидаз, дегидраз), присутствие аскорбиновой кислоты, жиров, Сахаров,
аминокислот. Всем видам свойственна порогамия и двойное оплодотворение,
которое проходит по цремитотическому типу. Вначале делится первичное ядро
эндосперма, зигота делится при наличии в зародышевом мешке 4—6 ядер
эндосперма.
Эндосперм нуклеарный, у однолетних видов на 5-й день, у многолетних через
1—4 мес становится целлюлярным в микропилярной и средней частях,
оставаясь ядерным в халазальном районе зародышевого мешка. У Halimocnemis и
Gamanthus эндосперм целлюлярный. Зрелые семена без эндосперма, обычно с
периспермом (подсем. Cyclolobeae) или его следами (подсем. Spirolobeae). В
эндосперме обнаружены аскорбиновая кислота, белки, сахара, в перисперме —
крахмал.
Зародыш развивается по Ghenopodiad-типу. Первая перегородка
закладывается горизонтально, иногда наклонно. У многолетних видов образуется
однорядный или 2-рядный суспензор, состоящий из 7—19 клеток, после чего
формируется собственно зародыш, развитие которого идет довольно медленно: 2 мес
у Ceratoides и S. richteri, 4 мес у Nanophyton и S. gemmascens, 5—6 мес у S.
orientalis, S. arbuscula и Haloxylon. У однолетних видов суспензор 2—8-клеточный,
с крупной базальной клеткой; зародыш развивается 18—20 дней. В семействе
имеются хлоро- и лейкоэмбриофиты (Яковлев, Жукова, 1973). Зрелые зародыши
согнутые или спирально скрученные, с семядолями и почечкой,
дифференцированной у разных видов в разной степени. Основные запасные питательные вещества
в зародыше — жиры, белковые соединения, крахмал.
Редуцированный партеногенез, апомиксис с генной стерильностью
пыльцы обнаружены у В. vulgaris, полиэмбриония — у В. vulgaris и S.
orientalis.
Исследованные виды. Aellenia glauca, Anabasis eriopoda, A. salsa,
Arihrocnemum indicum, Arthrophytum balchaschense, Atriplex hymenelytra, Beta
vulgaris, Ceratocarpus arenarius, Cf utriculosus, Ceratoides ewersmanniana, Cheno-
podiwn album, Ch. ambrosioides, Ch. bonus-henricus, Ch. murale, Gamanthus ga-
mocarpus, Girgensohnia oppositiflora, Halimocnemis longifolia, Haloxylon am-
modendron, H. aphyllum, H. persicum, Iljinia regelii, Kochia childsii, K. prostrata,
K. scoparia, Sxlsola aperta, S. arbuscula, S. arbusculiformis, S. gemmascens,
S. orientalis, S. paulsenii, S. richteri, S. sclerantha, Spinaciaoleracea, Suaeda fru-
ticosa, S. maritima.
Литература. Warming, 1878; Fischer, 1880; Hegelmaier, 1885; Cole,
1895; Stomps, 1911; Matthysen, 1912; Gohn, 1914; Dahlgren, 1916; Romell, 1919;
Soueges, 1920; Artschwager, 1927a, 1927b, 1933, 1946, 1947; Оксиюк, 1927, 1928,
1955; Rocen, 1927; Favorsky, 1928; Tuschnjakowa, 1929; Williams, 1932;
Billings, 1934; Cooper, 1935; Bhargava, 1936; Бочанцева, 1944, 1949,1951a, 19516;
Witkus, 1945; Dambroise, 1947; Mahabale, Solanky, 1953a, 1953b, 1954a,
1954b, 1954c; Miller, Kline, 1959; Конычева, 1962, 1963, 1965, 1968, 1971,
1973, 1974, 1976, 1977, 1979a, 19796, 1982; Fischer, 1962; Hindmarsh, 1965;
Зайковская, Белоус, 1965; Зайковская, 1966, 1967, 1968; Кульмагамбетов,
1968; Hoeferb, 1969, 1971; Калягин, 1970, 1976; Зайковская, Жужжалова,
1971; Мешкова, Сапожкина, 1971; Ширяева, 1971, 1982; Купцоу, 1972; Marin,
Dengler, 1972; Шевчук, Конычева, 1973; Яковлев, Жукова, 1973;
Александровский, 1974; Демьянова, 1975; Maheswari Devi, Rao, 1976; Зайковская,
Перетятько, Ширяева, Ярмолюк, 1978; Конычева, Кадырова, 1978, 1981; Голу-
бева, 1979; Wilms, 1980a, 1980b, 1981a, 1981b, 1981c, 1981d; Орел и др., 1982.
Порядок 27. POLYGONALES
Семейство POLYGONAGEAE
Пыльники 4-гнездные, раскрываются щелью, объединены попарно в 2 теки;
перед созреванием пыльника теки сливаются. Археспориальные клетки
закладываются субэпидермально; после периклинального деления образуются
париетальные и спорогенные клетки. Последние развиваются 2 путями: 1) становятся
непосредственно материнскими клетками микроспор (у Fagopyrum esculentum,
Koenigia islandica, Polygonum perforatum из Polygoneae и у Pterostegiadrymarioi-
des из Erigonoideae), и тогда спорогенный комплекс представлен только одним
рядом клеток; 2) делятся дальше, в результате чего на поперечном срезе гнезда
пыльника насчитывается 4—9 клеток, а по длине его образуется до 15—20
клеток (Oxyria digyna). Увеличившиеся в размерах микроспороциты приступают
к мейозу. Париетальные клетки после деления образуют кнаружи слой, который
в дальнейшем становится эндотецием, а внутрь формируют 2 слоя — средний и
тапетум. Развитие стенки пыльника идет по типу однодольных. В эндотеции
в период формирования 2-ядерной пыльцы начинают возникать фиброзные
утолщения. Средних слоев может быть один (F. esculentum) или 2 (О. digyna).
В клетках тапетума во время мейоза микроспороцитов ядра делятся без
цитокинеза один или 2 раза. Ядра 4-ядерных ценоцитов сливаются, и клетки вновь
становятся 2-ядерными (Edman, 1929). Дальнейшие слияния ядер тапетальных
клеток приводят к появлению одноядерных клеток с особо крупными рысоко-
подиплоидными ядрами. Редукционное деление у большинства видов идет
правильно, но не всегда синхронно. Отмечено, что во время синапсиса у одних видов
(F. esculentum) микроспороциты содержат одно ядрышко, другие (О. digyna)
всегда имеют 2 ядрышка. Число ядрышек во время мейоза микроспороцитов
у этих видов не связано с их плоидностью. У большинства исследованных видов
мейоз протекает правильно. Однако у некоторых видов (Atraphaxis frutescens)
происходят нарушения (Edman, 1931). Это приводит в мейозе I к образованию
в одних случаях полиплоидных реституционных ядер, в других — к
неправильному расхождению хромосом и образованию анеуплоидных ядер и микроядер.
При мейозе II может происходить объединение соседних фигур деления, и тогда
реституционные ядра образуются в результате слияния несестринских ядер.
Иногда в пыльниках встречалось образование «зародышевых мешков», которые
развивались до 4-ядерной стадии. Довольно часто нарушения в мейозе
наблюдались у Rumexangiocarpus(2n--~li),R. tenuifolius (2тг=28) и R. acetosella (2n=i2),
хотя у диплоидного вида (R. angiocarpus) они встречаются реже, чем у
полиплоидов (Love, 1943). Иногда формируются реституционные ядра и «тетрады»
с разным числом клеток и ядер в клетке. Тем не менее у этих видов пыльца
жизнеспособна на 93—100%. У R. tenuifolius в последнем предмейотическом
митозе обнаружен цитомиксис, причиной которого считается воздействие
пониженных температур. У гетеростильных растений (F. esculentum) развитие мужских
репродуктивных структур в цветках разных типов идет одинаково. У видов
с триморфными цветками (Rumexconfertus) эмбриональные структуры
развиваются различными темпами. У женской формы дегенерация тканей тычинки
начинается на стадии археспория, хотя в некоторых случаях развитие
продолжается до стадии одноядерных микроспор (Салахова, 1973, 1982). Тип образования
тетрад микроспор симультанный, расположение клеток тетраэдральное, зрелое
пыльцевое зерно 3-клеточное, у Antigonon leptopus — 2-клеточное.
Семяпочка ортотропная, только в родах Antigonon (A. leptopus) и Brunni-
chia (В. cirrhosa) — анатропная.* Однако Лаубенгаер (Laubengayer, 1937)
считает, что у В. cirrhosa висячая семяпочка образовалась не в
результате разрастания фуникулуса, а за счет центральной плаценты, и поэтому такую
семяпочку следует считать тоже ортотропной. Семяпочка 2-покровная, крас-
синуцеллятная, микропиле формируется внутренним интегументом. Нуцеллус
у некоторых видов образует на апексе клювовидный вырост (Polygonum bi-
53
Polygonaceae
1—4, 7, 14, 17—19, 206—29 — Fagopyrum esculentum, 5, 6, 21, 30—35 — Oxyria digyna, 8 —
Rumex acetosella, 9, 20a — Antigonon leptopus, 10, 12, 13 — Rumex angiocarpus, 11 — Л. te-
nuifolius, 15 — Polygonum perforatum, 16, 20 — Calligonum mongolicum.
1,2 — формирование гнезд и стенки пыльников; 3 — 4-слойная стенка пыльника;
микроспороциты в стадии синапсиса; 4 — фрагмент пыльника (продольный срез); микроспороциты
расположены в один ряд; -5 — 5-слойная стенка пыльника и многорядное расположение
микроспороцитов; в — фрагмент пыльника; микроспороциты в стадии синапсиса;
Polygonaceae (продолжение)
7 — пыльник (продольный срез) с одноядерными пыльцевыми зернами; 8 -— пыльник
с 2-ядерными пыльцевыми зернами; 9 — вскрывшееся гнездо пыльника (поперечный срез);
10 — микроспороцит в профазе I мейоза; 11 — метафазы II мейоза; 12 —анафаза II и 13 —
телофазы II мейоза; 14 — ортотропная семяпочка с мегаспороцитом на стадии профазы
мейоза; 15 — мегаспороцит в стадии синапсиса и формирование париетальной ткани; 16 —-
диада мегаспор и 2 ряда кроющих клеток; 17 — семяпочка с тетрадой мегаспор; 18 —
тетрада с увеличенной халазальной клеткой; ядро в профазе деления; 19 — 2-ядерный
зародышевый мешок;
го 5
Polygonaceae (продолжение) -
20 — нуцеллус с 4-ядерным зародышевым
мешком, 20а — анатропная семяпочка на стадии
зрелого зародышевого мешка и 206 — ортотроп-
ная семяпочка; 21 —зрелый зародышевый
мешок и 21а — антиподы (фрагмент); 22 —
микропилярная часть того же зародышевого
мешка; 23 — зародышевый мешок во время
оплодотворения и 23а — то же (фрагмент); слияние
спермия с ядром яйцеклетки; 24 — завершение
объединения ядра яйцеклетки и спермия; в
центральной клетке образовались 2 ядра
эндосперма; 25 — то же (фрагмент); завершение
объединения ядер гамет;
storta). Археспорий от одноклеточного (Fagopyrum) до многоклеточного (Oxyria).
Обычно только одна из его клеток отделяет кроющую. У P. perforatum кроющие
клетки претерпевают 4—6 делений. Мейоз при заложении нескольких мегаспо-
роцитов происходит несинхронно. Тетрады линейные (Antigonon ж Polygonum)
или Т-образные (Rheum жЯитех), или одновременно и те и другие (Oxyria).
Зародышевый мешок Polygonum-типа, развивается из халазальной
мегаспоры. Очень часто образуются множественные зародышевые мешки. В зрелом
зародышевом мешке полярные ядра сливаются; яйцевой аппарат хорошо
дифференцирован; иногда встречаются яйцеклеткоподобные синергиды. Синергиды
имеют нитчатый аппарат. Антипод 3, одноядерные, затем становятся 2-ядерными
'(О. digyna), а у некоторых (Rumex, Koenigia и Pterostegia) ядра многократно
делятся, образуя ценоцитные клетки, которые долго сохраняются (Edman,
1929). Обычно антиподы эфемерны и дегенерируют на' начальных этапах
развития эндосперма. Двойное оплодотворение установлено у ряда видов.
Пыльцевая трубка проникает в зародышевый мешок порогамно. Тип
объединения ядер яйцеклетки и спермия точно не установлен. Судя по
рисункам Махони (Mahony, 1935), оплодотворение протекает по промежуточному
-типу, так как при этом происходит значительное увеличение контактирующего
ядра спермия, в нем выделяется ядрышко и долгое время сохраняется зона,
разделяющая ядра гамет. Однако автором указано, чта такие жартины
наблюдались через 48—60 ч после искусственного опыления (но температура
воздуха не отмечена). Такое позднее оплодотворение могло наблюдаться
при слишком низкой температуре воздуха и при иллегитимном опылении. В нашем
жатериале у F. esculentum через 6 ч после легитимного опыления тетраплоидной
Polygonaceae (продолжение)
26—29 — Последовательные стадии объединения ядра яйцеклетки и спермия; 30—35
-—последовательные стадии развития зародыша. (1—9, 14, 16, 17, 20—25 — ориг.; 10—13— по
Love, 1943; 15, 30—35 — по Edman, 1929; 18, 19, 26—29 — по Mahony, 1935).
57
формы ядро спермия контактирует с ядром яйцеклетки, а через 24 ч оно
полностью погружается в женское ядро (+25 +28 °С), т. е. наблюдается преми-
тотический тип оплодотворения.
Первое деление зиготы у диплоидной формы F. esculentum наступает через
2—3 ч после оплодотворения и через 10—12 ч — у тетраплоидной (Жебракт
1962).
Эндосперм нуклеарный, возникает до деления зиготы; свободноядерное
состояние эндосперма довольно длительное. Позднее эндосперм становится
клеточным. У F. esculentum халазальная часть остается свободноядерной.
Эндосперм гладкий, как исключение руминированяый (у Coccoloba unifera); тип ру-
минации не установлен. В зрелом семени эндосперм сохраняется.
Зародыш развивается по Aster ad-типу: из базальной клетки формируется
длинный подвесок. Зрелый зародыш крупный, имеет хорошо развитую точку
роста, большие семядоли и зародышевый корень.
Апомиксис отмечен у A. frutescens. Апоспорические зародышевые мешки
возникают в семяпочках или рядом с гибнущими диадами, или в центре
семяпочки над гипостазой (Edman, 1931; Ситников, ориг. данные). У до-
следних развитие зародышевых мешков идет неправильно; при первом делении
ядра отходят к одному полюсу и мешки остаются 4-ядерными лишь с
яйцеклеткой или яйцеклеткой и синергидой; центральное ядро формируется
из всех оставшихся ядер. Зародыши могут развиваться без
оплодотворения. Плоидность зародышевых мешков обоих типов не установлена.
Эдман (Edman, 1931) считает, что у A. frutescens встречается адвентивная эм-
бриония, однако, судя по его рисункам, подобные картиныполиэмбрионии очень
сходны с развитием зародышей из множественных зародышевых мешков.
Некоторые авторы предполагали апомиксис в роде Rumex, но специально
предпринятые цитоэмбриологические исследования (Love, 1943) не подтвердили его
наличия в данном роде.
У A, frutescens известна полиэмбриония. Одновременно может развиваться
несколько (редуцированных или нередуцированных) зародышевых мешков и
в каждом из них может развиваться зародыш и эндосперм (Edman, 1931). 2
зародыша встречались также в семенах F. esculentum (Алексеева, Паушева, 1979).
Исследованные виды. Antigonon leptopus, Atraphaxis sp., A.
frutescens, Brunnichia cirrhosa, Calligonum mongolicum, Coccoloba unifera, С populi-
folia, Emex spinosa, Koenigia islandica, Fagopyrum esculentum, F. sagittatum,
Oxyria digyna, 0. elatior, Polygonum aviculare, P. bistorta, P. divaricatumy
P. orientale, P. perforatum, P. persicaria, P. viviparum, Pterostegia dryma-
roides, Rheum compactum, Rh. franzenbachii, Rh. officinale, Rh. rhaponticumr
Rh. ribes, Rh. sanguineum, Rh. webbianum, Rumex acetosella, R. angiocarpus,
R. confertus, R. crispus, R. flexuosus, R. salicifolius, R. tennuifolius, R. tur-
kestanicus, R. verticillatus.
Литература. Hofmeister, 1849; Strasburger, 1877; Warming, 1878;
Effing, 1879; Hegelmaier, 1885; Fink, 1899; Roth, 1906; Wefelscheid, 1911;
Stevens, 1912a, 1912b; Tischler, 1912; Woodcock, 1914; Dudgeon, 1918; Soueges,
1919a, 1919b, 1919c; 1920a, 1920b; Bauer, 1922; Lonay, 1922a, 1922b, 1923;
Kihara, Ono, 1923; Hagerup, 1926; Jaretzky, 1927, 1928; Ono, 1928, 1935; Edman,
1929, 1931; Schnarf, 1929, 1931; Schoch-Bodmer, 1934; Mahony, 1935, 1936;
Rao, 1936; Laubengayer, 1937; Love, 1943, 1940; Модилевский, 1945, 1947, 1951;
Фролова, Сахаров, Мансурова, 1946; Поддубная-Арнольди, 1948; Doida, 1957,
1960, 1962; Bhargava, Sawhney, 1958; Прянишникова, 1959; Жебрак, I960,
1961, 1962, 1963; Марьяхина, Микулович, Балева, 1961; Periasamy, 1962, 1964;
Кудрявцева, 1963,1965; Алексеева, 1966; Davis, 1966; Guignard, 1966; Etheridge,
Herr, 1968; Салахова, 1968, 1973, 1978, 1981, 1982; Борзова, Сладков,
1969; Neubauer, 1971; Mukherjee, 1972; Kirsten, 1973; Rao В. A., Mukherjee,
1973; Nair, Rehman, Saxena, 1976; Салахова, Смирнов, 1976, 1978; Galle, 1977;
Исомиддинова, 1978, 1980; Соколов, Исомиддинова, 1978; Алексеева, Паугаева»
1979; Солнцева (ориг. данные). _.
Порядок 28. PLUMBAGINALES
Семейство PLUMB AGIN AGE AE
Пыльник 4-гнездный. Сформированная стенка пыльника 4-слойная. Эндо-
теций с фиброзными утолщениями. Тапетум секреторного типа, с 1—4 ядрами
в каждой клетке. Образование микроспор — по симультанному типу.
Расположение микроспор в тетраде тетраэдральное или изобилатеральное. Зрелые
пыльцевые зерна 2- и 3-клеточные.
Семяпочка анатропная или цирцинотропная {Plumbago, Vogelia), с 2 инте-
гументами, крассинуцеллятная. Микропиле образовано внутренним интегу-
ментом. Археспорий одноклеточный (Armeria, Statice). У видов Plumbago
(P. capensis, P. еигораеит) наряду с одноклеточным нередко встречается
2-клеточный археспорий. Субэпидермальная археспориальная клетка делится
периклинально, образуя спорогенную клетку, которая становится мегаспоро-
цитом, и париетальную клетку, которая дает начало 2—3 слоям париетальной
ткани. Мейоз не сопровождается цитокинезом — зародышевый мешок тетра-
спорический. Обычно развивается один зародышевый мешок, однако у P.
capensis описано развитие 2 лежащих рядом зародышевых мешков, которые,
по-видимому, развились из материнских клеток, производных 2 археспориальных
клеток, описанных выше.
В семействе Plumbaginaceae встречаются 5 типов развития зародышевого
мешка. Это биполярные зародышевые мешки Fritillaria-, Adoxa- и Plumbagella-
типов и тетраполярные — Plumbago- и Penaea-типов. Для Р, capensis, P. zey-
lanica, P. scandens, P. coccinea, Ceratostigma plumbaginioides, C. willmottiana
и Vogelia характерен Plumbago-тип развития зародышевого мешка; для Plum-
bagella micrantha соответственно Plumbagella-тип, а для Limonium eu-limonium—
Репаеа-тип. Fritillaria-тип описан у некоторых видов Limonium, Armeria vulgaris
и A. bupleuroides. Adoxa-тип встречается у A. vulgaris и Limonium transwallianum.
Для , развития зародышевых мешков по Fritillaria- и Plumbagella-типам
характерен феномен Карано-Бамбичиони, когда на первично-4-ядерной стадии
происходит слияние 3 халазальных ядер, вследствие чего ядра халазальнои
части зародышевого мешка (ядра антипод и нижнее полярное ядро) становятся
триплоидными, тогда как ядра яйцеклетки, синергид и верхнее полярное ядро
остаются гаплоидными.
В развитии зародышевых мешков Plumbaginaceae нередко происходят
различные отклонения, так что число ядер и клеток и их расположение в зрелых
зародышевых мешках может быть различно. Характерной особенностью видов
с Plumbago- и Plumbagella-типами развития зародышевого мешка является
тенденция к дегенерации тех клеток (и ядер), которые не участвуют
непосредственно в акте оплодотворения. В самом крайнем случае это ведет к тому, что
вместо тетраполярного 8-ядерного зародышевого мешка Plumbago или
биполярного 4-ядерного — Plumbagella ко времени оплодотворения остаются
однополюсные 2-клеточные зародышевые мешки, состоящие лишь из яйцеклетки
и центральной клетки (Dahlgren, 1916; Boyes, 1939a; Boyes, Battaglia, 1951).
Существуют промежуточные между крайними вариациями формы. Например,
однополюсный 4-клеточный зародышевый мешок нередко встречается у
Plumbago еигораеит. Наблюдаются случаи нетипичного расхождения ядер при
формировании зародышевого мешка, запаздывания или отсутствия делений в роде
Plumbago (Haupt, 1934; D'Amato, 1940). У некоторых представителей семейства,
в зародышевых мешках которых отсутствуют синергиды, в яйцеклетках
обнаружен нитчатый аппарат (P. capensis, P. zeylanica). По мнению авторов,
описавших это явление (Cass, 1972a, 1972b; Russel, 1980), яйцеклетка в таких случаях
принимает на себя физиологические функции синергиды. Однако в отличие от
того, что происходит с синергидой, пыльцевая трубка не проникает внутрь
такой яйцеклетки, она лишь внедряется в ее нитчатый аппарат и далее растет
59
Plum Ъадгпасеае
1—25, 51—61 — Plumbago europaeum, 26—34a — Armeria vulgaris, 35—41 — Plumbago
coccinea, 42—50 — Plumbagella micrantha.
1—4—развитие стенки пыльцевого гнезда; 5—10 — микроспорогенез; 11—161—развитие
пыльцевого зерна; * ^
Plumbaginaceae (продолжение)
17 — продольный разрез семяпочки с археспориальной клеткой; 18, 19 — мегаспор о дит-
и париетальная клетка, образовавшиеся при делении археспориальной клетки; 20 — 2 мега-
спороцита в одной семяпочке; 21 —мегаспороцит в профазе мейоза; 22 — 2-ядерный
зародышевый мешок; 23 — 4-ядерный зародышевый мешок; 24 — однополюсный 4-клеточный.
зародышевый мёЧпок, готовый к оплодотворению; 25 — нетипичное (разбросанное)
положение клеток яйцевого аппарата;
в толще оболочки яйцеклетки, изливая затем свое содержимое вместе со спер-
миями и вегетативным ядром между яйцеклеткой и центральной клеткой (Rus-
sel, 1980).
Эндосперм нуклеарный. У Р. еигораеит клеткообразование начинается
ко времени заложения семядолей зародыша. В зрелом семени эндосперм почти
нацело поглощен зародышем.
Развитие зародыша представляет собой вариации Solanad-типа (базальная
клетка 2-клёточного зародыша участвует в формировании очень крупного
61
Plumbaginaceae (продолжение)
Plumbaginaceae (продолжение)
26—28 — Adoxa-тип развития зародышевого мешка; 29—34а — Fritillaria-тип развития
зародышевого мешка; 35—41 — 'Plumbago-тип развития зародышевого мешка; 42—50 —
Plumbagella-тип развития зародышевого мешка, начиная с первичной 4-ядерпой стадии
(48 — микропилярная часть зародышевого мешка со спермиями в излившемся содержимом
пыльцевой трубки); 51—55 — начальные стадии развития зародыша; 56 — продольный разрез
семяпочки; зародыш и постенно расположенный ядерный эндосперм; 57—61 — развитие
зародыша. (1—25, 55—61 — ориг.; 26—34а —по D'Amato, 1940; 35—41 — по Boyes, Battaglia,
1951; 42—45 — по Boyes, 1939a; 46—47, 49—50 — по Dahlgren, 1916; 48 — по Dahlgren,
1915—1917; 51—54 — по Vaillet-Bartoszewska, 1958).
63
подвеска). Зрелый зародыш очень крупный, прямой, с хорошо
дифференцированными семядолями (Р. еигораеит).
Исследованные виды. Armeria sp., A. bupleuroides, A. planta-
ginea, A. vulgaris, A. vulgaris var. maritima, Ceratostigma plumbaginioides,
C. willmottianum(=willmottiana),Limonium sp., L. eu-limonium, L.< oleafolium
var. confusum, L. transwallianum, Plumbagella sp., P. micrantha, Plumbago sip.,
P. capensis, P. coccinea, P. еигораеит {^europaea), P. pulchella, P. scandens,
P. zeylanica, Psylliostachys suvorovii, Statice sp.,, S. japonica, -S. oleafolia var.
confusa, S. sinuata, Vogelia sp., V. indica.
Литература. Jonsson, 1879—1880, 1881; Billings, 1901; Dahlgrent
1915a, 1915b, 1916, 1937; Glaussen, 1919; Haupt, 1934; Soueges, 1937; Fagerlind,
1938, 1939a, 1939b; Boyes, 1939a, 1939b, 1959; D'Amato, 1940a, 1940b, 1943,
1949; Mathur, 1940; Mathur, Khali, 1941; Ya-E, 1941; Boyes, Battaglia, 1951a,
1951b; Veillet-Bartoszewska, 1958; Hjelmquist, Grazi, 1964; Cass, 1972a, 1972b;
Cass, Karas, 1974; Беляева, 1977; Erben, 1978; Russel, 1980; Russel, Cass, 1981;
Коробова (ориг. данные).
Порядок 29. DILLENIALES
Семейство DILLENIACEAE
Пыльник 4-гнездный. Сформированная стенка пыльника состоит из
эпидермиса, 2 средних слоев и тапетума. Тапетум секреторный, ко времени
формирования микроспор становится 2-ядерным. У Wormia Петов (Paetow, 1931) относит
тапетум к периплазмодиальному типу, но Свами и Периасами (Swamy, Peria-
samy, 1965) отрицают наличие подобного рода развития тапетума и считают,
что Петов допустил методическую ошибку и его данные являются артефактом.
В зрелом пыльнике остается только эпидермис и эндотеций с фиброзными
утолщениями (слабо выражены), остальные слои дезинтегрируют. Эпидермис с темно-
коричневым включением (по-видимому дубильные вещества) — характерной
особенностью Dilleniaceae. Деление микроспороцитов происходит центрипе-
тально по симультанному типу, тетрады микроспор тетраэдральные, изобила-
теральные или линейные. Зрелые пыльцевые зерна 2-^леточные, спермиогенез
происходит в пыльцевой трубке.
Семяпочка амфитропная, с 2 интегументами, с прокамбиальным пучком,
доходящим до основания нуцеллуса, крассинуцеллятная. Внутренний интегу-
мент почти смыкается, наружный доходит до ариллуса с его многоядерными
ценоцитными клетками. Экзо- и эндостом располагаются не по оси, а образуют
зигзагообразное микропиле. У Acrotrema arnottianum субэпидермальная архе-
спориальная клетка делится периклинально и образует париетальную и мега-
спороцитную клетки. Первые продолжают делиться, в то время как вторая —
мегаспороцитная — увеличивается лишь в линейных размерах и оказывается
погруженной в глубину нуцеллуса. Одновременно происходит и деление эпи-
дермальных клеток с образованием нуцеллярного колпачка. Число
париетальных слоев достигает 8. В результате мейоза из мегаспороцита образуется
линейная тетрада мегаспор, 3 из них дезинтегрируют, а халазальная служит
инициальной клеткой зародышевого мешка.
Зародышевый мешок развивается по Polygonum-типу. До оплодотворения
он небольшой — около 80 мкм, но после того как произойдет оплодотворение
быстро увеличивается за счет разрушения прилегающих к нему клеток
нуцеллуса. Одновременно с этим идет разрастание зиготы (в 3—4 раза) и меняется
характер ее оболочки, она становится утолщенной. На это необычное
обстоятельство впервые обратил внимание Петов (Paetow, 1931) у Wormia suffruticosa,
а затем его подробно исследовали Свами и Периасами (Swamy, Periasamy,
1955) у Acrotrema arnottianum и Шастри (Sastri, 1958) у Hibbertia acicularis.
Иоффе и Жукова (1974) провели исследование у Dillenia suffruticosa, D. phil-
ippinensis, D. ovata, D. retusa и D. pteropoda.* В результате было установлено,
что у всех исследованных видов начиная с самых ранних стадий оболочка зиготы
становится утолщенной, образуя своеобразный чехол. Наружная поверхность
имеет извилистые очертания и начинает давать разветвленные выросты в
глубину цитоплазмы эндосперма. Данные электронно-микроскопического
исследования (Иоффе, Жукова, 1974) подтвердили, что эти гроздевидные ответвления
являются органической частью оболочки зиготы. Основным ее компонентом
служат полисахариды, среди которых значительное место занимают кислые
полисахариды пектиновой природы. В процессе развития зародыша такой
своеобразный чехол, или мантия, исчезает и поглощается развивающимся
зародышем. После оплодотворения синергиды и антиподы разрушаются.
Эндосперм нуклеарный. Первичное ядро эндосперма делится раньше зиготы;
в результате синхронных делений по периферии зародышевого мешка
образуется нуклеарный эндосперм. К моменту формирования проэмбрио происходит
заложение клеточных стенок, и эндосперм становится клеточным. Запасными
* Виды Dillenia были зафиксированы М. С. Яковлевым в Богорском ботаническом
саду (Индонезия).
5 Сравнительная эмбриология 65
1—7, 11—14 — Acrotrema arnottianum, 8—10 — Dillenia suffruticosa.
1 — одно из 4 гнезд молодого пыльника; срединная часть занята микроспороцитами,
окружена тапетумом, к нему примыкают 2 слоя клеток среднего слоя; эпидермис хорошо
выражен; 2 — гнездо зрелого пыльника с пыльцевыми зернами; клетки эпидермиса заполнены
темным содержимым; 3 — зрелое 2-клеточное пыльцевое зерно; 4 — семяпочка с
зигзагообразным микропиле; наружный интегумент примыкает к ариллусу; 5 — зрелая семяпочка
с зародышем и эндоспермом; ариллус хорошо развит; 6 — нуцеллус с мегаспороцитом и
нуцеллярным колпачком; 7 — образование тетрады мегаспор; апикальные клетки
дегенерируют; базальная материнская клетка зародышевого мешка; 8 — вполне сформированный
зародышевый мешок; синергиды с нитчатым аппаратом; полярные ядра слились, образовав
ядро центральной клетки; антиподы в базальной узкой части зародышевого мешка;
Dilleniaceae (продолжение)
9 — зигота; в апикальной части появляются утолщения оболочки; 10 — поздняя фаза
развития зиготы; оболочка значительно утолщена, с большими, неравномерно разросшимися
выростами; 11, 12 — 2- и 8-клеточный проэмбрио в окружении разбухшего чехла зиготы;
выросты проникают в эндосперм; 13 — конец проэмбриональной фазы; выросты чехла
главным образом в базальной части проэмбрио; 14 — зародыш с инициальными бугорками
семядолей; базальная часть имеет многоклеточный суспензор, вокруг которого видны остатки
чехла. (1—7, 11—14 — по Swamy, Periasamy, 1955; 8—10 — по Иоффе, Жуковой, 1974).
Ш^щ^л
'Щ&&.
11
13
1к
веществами являются жиры и цитоплазменные белки. Эндосперм у D. suf-
fruticosa руминирован (Dulcy, Lakshmanan, 1981).
Первое деление зиготы поперечное, базальная и апикальная клетки снова
делятся в поперечном направлении, возникает 4-клеточный проэмбрио, в
котором 3 апикальные клетки принимают участие в формировании зародышевых
структур, а базальная выполняет роль подвеска. Развитие проэмбрио и
зародыша не прослежено. Предположительно его можно отнести к Onagrad-типу.
Исследованныевиды. Acrotrema amottianum, Dillenia indica,
D. ovata, D. pentagina, D. philippinensis, D. pteropoda, D. retusa, D. suffruticosa,
Hibbertia acicularis, H. dentata, Wormia suffruticosa.
Литература. Paetow, 1931; Rao, 1955; Swamy, Periasamy, 1955;
Sastri, 1958; Иоффе, Жукова, 1973, 1974; Dulcy, Lakshmanan, 1981.
родышевый мешок;
68
Семейство GROSSOSOMATAGEAE
Пыльники 4-гнездные. Сформированная стенка пыльника представлена
эпидермисом, эндотецием, 3 средними слоями и секреторным тапетумом.
Последний вначале одноядерный, а ко времени формирования микроспор 2—4-
ядерный, наблюдается слияние ядер с образованием одного полиплоидного
ядра. Пыльцевые зерна 2-клеточные; спермогенез происходит в пыльцевой
трубке.
Семяпочка кампилотропная, с 2 интегументами, крассинуцеллятная. В
апикальной зоне нуцеллуса из субэпидермальных клеток формируется
многоклеточный археспорий с образованием 6—7-клеточного слоя париетальной ткани
и нескольких мейоцитов в глубине нуцеллуса (Kapil, Vani, 1963). В результате
мейоза I и II возникают линейные тетрады мегаспор, из которых халазальная
становится инициальной клеткой зародышевого мешка Polygonum-типа.
Как правило, в нуцеллусе формируется только один зародышевый мешок,
поскольку все другие мегаспоры, возникшие за счет дополнительных
мейоцитов, дезинтегрируют. В процессе оплодотворения одна из синергид разрушается,
другая сохраняется некоторое время; антиподы 2—5-клеточные. Полярные
ядра сливаются перед оплодотворением.
Эндосперм нуклеарный, но вскоре в микропилярной зоне зародышевого
мешка центрипетально начинают формироваться клеточные стенки и ко времени
образования шарообразного проэмбрио эндосперм заполняет всю полость
зародышевого мешка и служит местом отложения запасных веществ.
Зигота начинает делиться лишь после того, как число эндоспермальных ядер
достигает значительной величины. Первое деление поперечное, апикальная
клетка — са — маленькая", примерно 1/3 зиготы, базальная — cd— большей
величины, делится поперечно, образуя 2 клетки, одна из которых принимает
участие в формировании базальной части проэмбрио, а вторая служит
небольшим подвеском. Из апикальной клетки формируются квадранты, а затем октанты
проэмбрио. После этого происходит формирование эмбриодермы и переход
проэмбрио к эмбриональной фазе с последующим заложением меристемных
очагов семядолей, точки роста эпикотиля, эпифизнса и гипокотилярной зоны.
Зрелый зародыш хорошо развит и занимает большую часть семени, слегка
изогнут.
Исследованный вид. Crossosoma californicak
Литература. Lemesle, 1948; Hutchinson, 1959; Kapil, Vani, 1963.
7 — семяпочка; в зародышевом мешке видна зигота и по периферии свободные ядра
эндосперма; 2 интегумента, клетки ариллуса, прокамбиальный тяж проходит из фунику-
луса к халазе и к наружному интегументу; 8—11 — развитие проэмбрио; 12 — зрелый
, зародыш. (1—12 — по Kapil, Vani, 1963).
Порядок 30. PAEONIALES
Семейство PAEONIAGEAE
Пыльники 4-гнездные, экстрорзные. На ранней стадии у только что зало-
жившегося бугорка гнезд пыльников четко выражены эпидермис и субэпидер-
мальный слой археспориальных клеток, из которых в результате первых
периклинальных делений образуются париетальные и спорогенные клетки.
Париетальные дважды делятся и дают начало 4-слойной стенке молодого
пыльника, которая в дальнейшем может утолщаться за счет образования средних
слоев. Сформированная стенка состоит из 6 слоев: эпидермиса, эндотеция,
3 (4) средних слоев и тапетума. Тапетум секреторный, в его клетках
наблюдается эндомитоз, что приводит к образованию полиплоидных ядер. Ко времени
созревания пыльника тапетум разрушается; этот процесс захватывает и
прилегающие клетки среднего слоя. В эндотеции и оставшихся 2 слоях клеток
средних слоев образуются фиброзные утолщения. Мейоциты формируются
в глубине 4 гнезд пыльника с последующим образованием тетрады по
симультанному типу. Зрелое пыльцевое зерно имеет слегка дегенерированное
вегетативное ядро и генеративную клетку с фёльген-положительным ядром в виде
полумесяца. Образование спермиев происходит при прорастании пыльцы на
рыльце пестика, где плодолистики не только не срастаются, на даже и не
смыкаются, поэтому пыльцевые трубки легко попадают на внутреннюю
поверхность плодолистика. Полость плодолистика заполнена жидкостью, что
способствует успешному росту пыльцевых трубок. Спермин в пыльцевых трубках
в зоне микропиле имеют вид червеообразных, несколько уплощенных тел,
сильно хроматизованных, с четкой реакцией на ДНК. Тапетальные клетки
пыльников Paeonia в премитотической стадии богаты РНК и белками, в мито-
тической — в цитоплазме увеличивается только содержание РНК. В это время
на эндоплазматической сети образуются многочисленные «цитоплазматические
пузырьки» и одновременно увеличивается число митохондрий. В постмитоти-
ческой стадии содержание РНК и белка продолжает увеличиваться, а на стенках
откладываются зерна спорополленина, так называемые тельца Убшпа. Все это
свидетельствует о сходстве клеток тапетума с типичными секреторными
клетками, всегда насыщенными эргастоплазматическими элементами (Marquardt
et al., 1968).
Семяпочки многочисленные (до 20), возникают на плаценте по обеим
сторонам шва плодолистика, со слаборазвитым ариллусом, анатропные, с 2 инте-
гументами, с экзо-эндостомным микропиле, крассинуцеллятные. Проваскуляр-
ный пучок из фуникулуса следует в наружный интегумент, где разветвляется
и образует густую сеть проводящей системы (Gamp, Hubbard, 1963). В
апикальной части нуцеллуса из субэпидермальных клеток формируется целый комплекс
мейоцитов. Одновременно с этим идет формирование апикальной зоны
нуцеллуса за счет деления париетальных клеток. Большее число мейоцитов создает
возможность для возникновения нескольких линейных тетрад и, следовательно,
образования дополнительных зародышевых мешков. Однако не все мейоциты
завершают мейоз и, как правило, дезинтегрируют.
Инициальной клеткой зародышевого мешка служит халазальная
мегаспора, 3 другие дегенерируют. В результате последовательных митотических
делений возникает 8-ядерный ценоцит, на основе которого формируется 7-
клеточный зародышевый мешок Polygonum-типа, где микропилярная группа
представлена 2 синергидами и яйцеклеткой, халазальная — 3 антиподами
и центральная клетка с одним ядром, возникшим в результате слияния 2
полярных ядер. Оплодотворение протекает по премитотическому типу, при
котором объединение мужских и женских половых ядер происходит до первого
митоза. Объединение спермиев в яйцеклетке и центральном ядре зародышевого
мешка идет синхронно, но заканчивается быстрее в. центральной клетке, поэтому
70
Paeoniaceae
1—20 — Paeonia anomala, 21—29 — P. lactiflora, 23 — P. officinalis.
2—IS — развитие пыльника и микроспорогенез: 1 — начало формировавия париетального
и спорогенного слоев, 2 — образование многослойной стенки пыльника; дифференциация
тапетума и микроспороцитов в гнезде, 3 — микроспороциты перед мейозом; появление
полиплоидных ядер в клетках тапетума, 4 — профаза; начало мейоза, 5, б — метафаза и телофаза
I мейоза, 7 — телофаза II мейоза, 8 — тетрада микроспор, 9 —пыльцевые зерна в гнезде
пыльника, 10—13 — гаметогенез; образование 2-клеточного пыльцевого зерна; генератив-
' ная клетка имеет серповидную форму;
Paeoniaceae (продолжение)
14 — семяпочка с большим числом мейоцитов перед мейозом; начало образования нуцелляр-
ного колпачка; 15 — мегаспороциты в стадии профазы I мейоза; 16 — в некоторых клетках
мейоцитов протекает мейоз, другие дезинтегрируют, а одна (базальная) представляет собой
материнскую клетку зародышевого мешка;
до окончания первого деления зиготы ядра эндосперма успевают поделиться
несколько раз.
Эндосперм нуклеарный, его развитие начинается с ценоцитной фазы и
заканчивается образованием клеточных стенок от периферии к центру.
Запасными веществами являются алейроновые зерна и липиды в дисперсном
состоянии. Крахмал отсутствует. В зрелом семени эндосперм массивный.
Эмбриогенез пионов не был известен и лишь в начале 50-х годов М. С.
Яковлев (1951) опубликовал краткое сообщение. Впервые было показано, что
развитие зародыша происходит по уникальному, ранее неизвестному Paeoniad-
типу (Яковлев, 1958). Оказалось, что после оплодотворения яйцеклетки первое
деление ядра зиготы, так же как и последующие, не сопровождается
заложением клеточных перегородок. Возникает свободноядерная, или ценоцитная,
предэмбриональная структура. Такая своеобразная начальная фаза развития
зиготы оказалась, по предварительным данным (Яковлев, 1951), характерна
для Paeonia anomala, P.albiflora (=lactiflora), P.suffruticosa(~moutan), P.tenui-
folia, P. veitchii (—beresowckii) и Р. officinalis. В дальнейшем Яковлев и Иоффе
72
Раеопгасеае (продолжение)
17 — зрелый зародышевый мешок перед оплодотворением; слева он же при малом
увеличении;
(1957а, 1961, 1965) провели более детальное изучение указанных видов на
материале, собранном с экземпляров, произрастающих как в условиях парка
БИН АН СССР,- так и в местах их естественного обитания: P. anomala —
Казахстан, P. tenuifolia и P. wittmanniana — Кавказ. Во всех случаях деление
зиготы идет на основе ценоцитной структуры. Кроме того, удалось установить
наличие 2 фаз в развитии зародыша. Первая начинается с образования свободно-
ядерной фазы со все возрастающим числом ядер, которое зависит от степени
синхронных делений и может достигать тысячи и более, аналогично тому,
что наблюдается в нуклеарном эндосперме. Первая фаза заканчивается
заложением между этими ядрами клеточных оболочек. Затем наступает вторая
фаза, когда в некоторых местах по периферии клетки начинают усиленно
делиться, в результате чего возникают меристематические очаги, дающие начало
самим зародышам. Таких очагов возникает несколько (до 25), но
преимущественное развитие получает обычно один, который в конечном счете и развивается
в хорошо сформированный и вполне дифференцированный зародыш с развитыми
семядолями и проваскулярной системой, идущей из гипокотиля. Зрелый
зародыш дифференцирован, но занимает сравнительно небольшую часть семени.
Лейкоэмбриофит.
Открытие нового типа эмбриогенеза привлекло внимание советских
(Жгенти, 1974) и зарубежных эмбриологов. Некоторые из них, в част-
73
ности Мургай (Murgai, 1959), переисследовав эмбриогенез пионов, пришли
к противоположным выводам. Другие же (Cave et al., 1961), исследовав
калифорнийские пионы, подтвердили наши данные. При этом отметили, что
эмбриогенез P. californica и P. brownii совпадает с эмбриогенезом P. anomala, P. moutan
и P. wittmanniana, описанным нами. Ошибки Мургай обусловлены
неправильной интерпретацией клеток яйцевого аппарата и прилегающих к яйцеклетке
ядер эндосперма. Позже Мургай (Murgai, 1962) пересмотрела свою позицию,
В зрелом семени P. anomala, по данным В. Е. Васильевой, содержание олиго-
сахаров (% на сухую массу): в зародыше 24.8—28.6, в эндосперме 13.6—19.4,
в семенной оболочке 0.4—0.7, в плодовой оболочке 2.9—3.4. При этом в
зародыше обнаружена только сахароза, в то время как в эндосперме помимо моно-
Раеопгасеае (продолжение)
18 — процесс двойного оплодотворения; один спермий в контакте с ядром яйцеклетки,
второй достиг ядра центральной клетки; в синергиде, в которую вошла пыльцевая трубка,
видно вегетативное ядро и деформированное ядро самой синергиды; вторая синергида не
разрушена; 19 — зигота в стадии профазы, над нею 2 синергиды; одна почти полностью
дегенерировала, вторая — на пути к разрушению; ниже — ядра эндосперма;
74
гч
Раеопгасеае (продолжение)
20—24 — развитие свободноядерной
пред эмбриональной структуры: 2—4- и
мыогоядерный ценоциты;
Раеопгасеае (продолжение)
25—27 -—переход от свободноядерного к клеточному типу развития; начало образования
на периферии меристематических эмбриональных закладок;
и дисахаров имеются сахара рафинозной группы, которые являются запасными
питательными веществами.
Исследованные виды. Paeonia albiflora (=lactiflora), P. anomala,
P. brownii, P. californica, P. caucasica, P. delavayi, P. lutea, P. majko, P.
officinalis, P. suffruticosa (=moutan), P. tenuifolia, P. veitchii (=beresowski),
P. wittmanniana.
76
Paeoniaceae (продолжение)
28, 29 — эндосперм в период отложения запасных веществ: 28 — периферическая и 29 —
центральная части эндосперма. (1—22, 24—29 — по Яковлеву, Иоффе, 1965; 23 — по
Яковлеву, 1951).
Литература. Sax, 1932; Stern, 1946; Яковлев, 1951, 1958; Davezac,
1957; Яковлев, Иоффе, 1957а, 19576, 1960, 1965; Murgai, 1959, 1962; Cave,
Arnott, Cook, 1961; Matthiessen, 1962; Walters, 1962; Camp, Hubbard, 1963;
Carniel, 1967; Жгенти, 1971, 1978; Ли Маохие, 1982.
Порядок 31. THEALES
Семейство OCHNACEAE
Пыльники 4-гнездные. Сформированная стенка пыльника состоит из
эпидермиса, эндотеция, среднего слоя и тапетума. Тапетум секреторный, клетки
его имеют от 1 до 3 ядер. Эндотеций зрелого пыльника с фиброзными
утолщениями. Пыльцевые зерна при созревании 2-клеючные. В результате мейоза
образуется тетраэдральная тетрада микроспор. При изучении развития
пыльцевых зерен отмечены многочисленные аномалии, заключающиеся в дегенерации
материнских клеток микроспор и в аномалиях мейоза, приводящих к
образованию пыльцевых зерен с непостоянными числами хромосом — от 21 до 27 —
при 2п=35. Возможно также образование в результате мейоза и последующих
митозов из одного микроспороцтаа до 8 клеток микроспор. Кроме того,
отдельные микроспороциты могут силшйеЬ разрастаться, вакуолизироваться и
превращаться в пыльнике в структуры, сходные с зародышевыми мешками.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. В нуцеллусе
субэпидермально закладывается одна, реже — 2 археспориальные клетки,
которые увеличиваются в размерах и непосредственно становятся мегаспороци-
тами. Одна из клеток вступает в мейоз, в результате которого образуется
Т-образная тетрада мегаспор. Халазальная мегаспора дает начало
зародышевому мешку, который развивается по Polygonum-типу.
Зрелый зародышевый мешок 7-клеточный, 8-ядерный. Клетки яйцевого
аппарата дифференци|р|&ны на 2 синергиды и яйцеклетку. Синергиды
удлиненные, с отчетливо выраженным нитчатым аппаратом. Яйцеклетка несколько
крупнее синергид. В центральной клетке находятся 2 полярных ядра. Анти-
подальных клеток 3, они очень крупные, часто с гипертрофированными ядрами.
В процессах мегаспоро- и мегагаметогенеза у Ochna serrulata обнаружены
значительные отклонения от нормы (Chiarugi, Francini, 1930). Часто
образовавшиеся одна или обе археспориальные клетки минуя мейоз увеличиваются
в размерах, вакуолизируются и дают начало зародышевым мешкам Antennaria-
типа (генеративная апоспория). Кроме того, как спорогенные клетки, так
и тетрады мегаспор могут дегенерировать. В этих случаях зародышевые мешки
у О. serrulata способны формироваться из клеток нуцеллуса по Hieracium-
типу (соматическая апоспория). Отмечено, что в семяпочке одновременно могут
развиваться зародышевые мешки как нормального типа, так и апоспорические.
На ценоцитных стадиях развития гаплоидных зародышевых мешков Polygonum-
типа и апоспорических диплоидных обнаружены нарушения в распределении
ядер по полюсам и отсутствие постоянного числа их делений. В связи с этим
многие зародышевые мешки дегенерируют в процессе развития, а те, которые
остаются, могут иметь от 5 до 11 ядер. Возможно образование многополюсных
зародышевых мешков, у которых число клеток яйцевого аппарата и антипод
непостоянно и колеблется от 1 до 3. В центральной клетке при этом может
находиться от 2 до 6 ядер. Яйцевой аппарат часто расположен латерально.
Ochnaceae
1—19, 21, 23—36 — Ochna serrulata, 20, 22 — О. squarrosa, 37, 39 — О. multiflora, 38 —
О. atropurpurea.
1 — микроспороциты на стадии синапсиса; 2 — тетрада микроспор, 2а — пыльцевое^ зерно
с вегетативной и генеративной клетками; 3 — поперечный разрез пыльника на стадии микро-
спороцитов; некоторые из микроспор трансформировались в структуры, напоминающие
зародышевые мешки; 4—7 — нормальный мегаспорогенез; 8—16 — формирование
апоспорических зародышевых мешков по Antennaria-типу: 8—12 — вакуолизация; увеличение
размеров мегаспороцитов и переход их к мегагаметогенезу, минуя мейоз, 13—16 — развитие
апоспорических зародышевых мешков от 1—8-ядерной стадии; 17 — дегенерация тетрады
мегаспор; латерально расположенные клетки нуцеллуса увеличились в размерах, вакуоли-
зировались и превратились в апоспорические зародышевые мешки Hieracium-типа;
78
Ochnaceae (продолжение)
18—20 — стадии развития зародышевых мешков Polygonum-типа; 21 — микропилярная
часть семяпочки с 2-ядерным зародышевым мешком, лишенным поляризации, и одноядерным
зародышевым мешком, возникшим по типу соматической апоспории; 22 — 7-клеточный
зародышевый мешок Polygonum-типа; 23—28 — различающиеся по строению и размерам
зрелые зародышевые мешки Polygonum-типа;
Ochnaceae (продолжение)
29, 30 — семяпочки с несколькими зародышевыми мешками разной природы; 31 —
зародышевый мешок с дегенерировавшими синергидами, 2-клеточным проэмбрио, крупными
клетками антипод и центральной клеткой, в которой нет эндосперма; по размерам этот
зародышевый мешок меньше других; 32 — зародышевый мешок с 3 неповрежденными клетками
яйцевого аппарата, одной дегенерировавшей антипод ой и развивающимся ядерным
эндоспермом; 32а — одно из ядер эндосперма, в метафазе, число его хромосом равно 140 (2п=35);
33 — зародышевый мешок с неповрежденными клетками яйцевого аппарата, 2 антиподами
и ядерным эндоспермом; 34, 35 — начальные этапы формирования интегументальных
проэмбрио; в центральной клетке присутствует эндосперм; 36 — микропилярная часть
зародышевого мешка с дегенерировавшей синергидой, 3-клеточным проэмбрио из неоплодотво-
ренной яйцеклетки, имеющим 35 хромосом, и 2-клеточным интегументальным проэмбрио;
ядра эндосперма в стадии телофазы; в микропиле видны остатки пыльцевой трубки;
Q Сравнительная эмбриология
Ochnaceae (продолжение)
37 — микропилярная часть семяпочки с внутренним интегументом и ядерным эндоспермом
незадолго до начала формирования интегументальных проэмбрио; 38 — интегументальный
проэмбрио и окружающие его ткани; 39 — зрелый зародыш. (1—19, 21, 23—36 — по
Chiarugi, Francini, 1930; 20, 22 — Chikkanniah, 1954; 37—39 — ориг.).
Яйцеклетки и синергиды апоспорических зародышевых мешков нередко имеют
атипичное строение. Зрелые зародышевые мешки также сильно различаются
по размерам. Данные по процессу двойного оплодотворения отсутствуют.
Эндосперм нуклеарный, на поздних стадиях развития он становится
клеточным. Образуется эндосперм у О. serrulata, вероятно, апомиктически, так как
при наличии в центральной клетке ядерного эндосперма клетки яйцевого
аппарата остаются неразрушенными. Подсчитано число хромосом эндосперма,
равное 140 (Chiarugi, Francini, 1930). В зрелом семени эндосперм отсутствует.
Зародыши О. serrulata имеют разное происхождение (Chiarugi, Francini,
1930). Они могут развиваться без оплодотворения из диплоидной яйцеклетки
(нередуцированный партеногенез) или из клеток внутреннего интегумента
(интегументальная эмбриония). Эмбриогенез детально не изучен. Отмечена,
однако, дегенерация как диплоидных яйцеклеток, так и начавших развиваться
проэмбрио (Chiarugi, Francini, 1930). Возможна гаметофитно-спорофитная
82
долиэмбриония за счет формирования в одном семени нескольких интегумен-
тальных зародышей. Зародыш зрелого семени нормально дифференцирован,
семядоли крупные, почечка с зачаточными листочками, корневой апекс также
хорошо развит, выделяется корневой чехлик. Зародыш занимает весь объем
зрелого семени.
Данные относительно образования археспориальной клетки во внутреннем
интегументе (Ghosh, 1964) сомнительны.
Исследованные виды. Ochna atropurpurea, О. multiflora, О. ser-
rulatdy О. squamosa.
Литература. Francini, 1928; Chiarugi, Francini, 1929, 1930; Schnarf,
1929; Chikkanniah, 1954; Ghosh, 1964; Pause, 1972; Наумова (ориг. данные).
Семейство SAUVAGESIACEAE
Эмбриологически не изучено.
Семяпочка анатропная, с 2 интегументами.
Зародыш в зрелом семени небольшой, прямой, окружен эндоспермом,
содержащим алейроновые зерна.
Литература. Corner, 1976.
Семейство STRASBURGERIACEAE
Эмбриологически не изучено.
Зрелое семя Strasburgeria calliantha имеет дифференцированный зародыш
с крупными, почти эллиптическими семядолями.
Литература. Engler, 1925.
Семейство DIEGODENDRACEAE
Эмбриологически не изучено.
Пыльники 2-гнездные, интрорзные, вскрываются продольными трещинами.
Семяпочка анатропная.
Зрелый зародыш дифференцированный, имеет листовидные толстые
семядоли эллиптической формы, почти круглые, с глубокими узкими выемками
в основании.
Литература. Capuron, 1963, 1965.
Семейство ANCISTROCLADACEAE
Эмбриологически исследовано слабо.
Пыльники 4-гнездные, интрорзные, раскрываются продольно. Гнезда
объединены попарно в 2 теки, перед созреванием пыльника гнезда в теках сливаются
вследствие разрушения перегородки между ними. Развитие стенки пыльника
не исследовано. Стенка зрелого пыльника состоит из эпидермиса, фиброзного
эндотеция с очень крупными клетками и остатков одного, иногда 2 средних
слоев (Keng, 1967).
Семяпочка одиночная, на коротком фуникулусе, гемитропная, с 2
интегументами: наружный довольно толстый, внутренний имеет только 2—3 слоя.
Эндосперм целлюлярный, в зрелом семени обильный, сильно руминирован-
ный, с содержанием крахмала.
Эмбриогенез не описан. Зрелый зародыш относительно маленький, прямой,:
с тонкими, листовидными расходящимися семядолями.
6* 83
1, 2, 5 —' Ancistrocladus tectorius, 3, 4 — A, hamatus,
14 2 — молодой и зрелый пыльники в поперечных срезах (схемы, сделанные по фото автора);
3 — зародыш; 4 — продольный срез через зародыш и эндосперм; 5 — продольный срез
через семя. (1, 2, 5 — по Keng, 1967; 3, 4 — по Gilg, 1925).
Исследованные виды. Ancistrocladus hamatus, A. tectorius.
Литература. Tieghem van, 1903; Gilg, 1925; Steenis, 1948; Leonard,
1949; Hutchinson, 1959; Тахтаджян, 1966; Keng, 1967; Rao, 1969; Corner, 1976.
Семейство DIONCOPHYLLACEAE
Эмбриологически изучено слабо. Имеются сведения по Triophyllum peltatum.
Пыльники 4-гнездные, интрорзные, раскрываются продольно.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Внутренний
интегумент более длинный, чем наружный, со стороны фуникулуса не заклады-
1—11 — Triophyllum peltatum,
1 — начало поворота семяпочки в момент закладки одного интегумента; 2 — анатропная
семяпочка с 2 интегументами; 3 — семяпочка на стадии зрелого зародышевого мешка; 4 —
семяпочка на стадии образования «шляпки»; 5 — молодое семя грибообразной формы; 6 —
нуцеллус со спорогеннои и кроющей клетками; 7 — нуцеллус семяпочки с тетрадой мегаспор
и париетальной тканью; 8 — зрелый, зародышевый мешок; 9 — участок созревающего
семени с эндоспермом и молодым зародышем; 10 — зародыш с 2 семядолями; 11 — зародыш
с раздвоенными семядолями. (1—11 — по Schmid, 1964).
84
вается. Микропиле сформировано внутренним интегументом, который имеет
на верхушке клювовидный вырост. В определенный момент развития семяпочки
наружный интегумент образует покрывало. Единственная археспориальная
клетка отделяет кроющую, которая позднее делится, образуя 2-слойную
париетальную ткань. Шмид (Schmid, 1964), исследовавший Т. peltatum, считает, что
семяпочка этого типа — полутенуинуцеллятная. Мегаспороцит в результате
редукционного деления образует линейную тетраду. Микропилярные клетки
тетрады постепенно дегенерируют, а халазальная развивается в зародышевый
мешок. Иногда халазальная клетка дегенерирует, а зародышевый мешок
развивается из какой-либо клетки тетрады.
Зародышевый мешок, развивающийся по Polygonum-типу, 8-ядерный,
имеет нормальное строение. Яйцевой аппарат представлен яйцеклеткой и 2 си-
нергидами; в центре зародышевого мешка располагаются полярные ядра; в ха-
лазальной части зародышевого мешка 3 антиподы, рано дегенерирующие.
Зрелый зародышевый мешок крупный, достигает 80 мкм.
Эндосперм, вероятно, изначально нуклеарный, а затем становится целлю-
лярным. Сначала он заполняет центральную клетку и разрастается в микро-
пилярно-халазальном направлении. Позднее, в связи с образованием у
семяпочки покрывала («шляпки»), зародышевый мешок и, следовательно, эндосперм
вытягиваются перпендикулярно этому направлению. Запасное вещество
эндосперма -— крахмал.
Тип эмбриогенеза не установлен. Зародыш приобретает шаровидную форму,
затем маргинально закладываются 2 бугорка будущих семядолей. Семядоли
вначале цельные, но позднее края их раздваиваются. Семядоли тонкие, воронко-
видные, раздвоенные, при дальнейшем развитии покрывают друг друга.
Исследованный вид. Triophyllum peltatum.
Литература. Schmid, 1964.
Семейство ТНЕАСЕАЕ
Пыльники 4—6-гнездные, гнезда объединены в 2 теки. Развитие стенки
пыльника протекает по основному типу. Сформированная стенка пыльника
состоит из эпидермиса, эндотеция, 2 "средних слоев и тапетума. Иногда
развиваются один или 3 средних слоя. Средние слои эфемерны. Тапетум
секреторный, париетального происхождения. В начале мейоза клетки тапетума 1—2-
ядерные, позже — многоядерные. Ко времени созревания пыльцы тапетум
дегенерирует. Стенка зрелого пыльника состоит из эпидермиса и эндотеция.
Эндотеций долго сохраняется. Спорогенные клетки, преобразующиеся в микро-
спороциты, заполняют все гнездо пыльника. Образование микроспор происходит
симультанно. Тетрады микроспор тетраэдральные, изредка изобилатеральные.
Зрелые пыльцевые зерна 2-клеточные, одиночные. Спермин образуются в
пыльцевой трубке, овальные или немного удлиненные. Цитоплазма пыльцевой
трубки содержит большое количество крахмала (Микатадзе-Панцулая, 1979).
Наблюдается дегенерация микроспороцитов и микроспор на стадии тетрад,
а также зрелых пыльцевых зерен. Изредка обнаруживается фрагментация
ядер спермиев в пыльцевых трубках. .
Количество семяпочек в завязи 8—12, но нормально развиваются 2—3.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Проводящий
пучок по фуникулусу доходит до халазы, а после оплодотворения достигает
вершины наружного интегумента (Bala Bawa, 1970). Микропиле прямое,
образуется внутренним интегументом; халаза массивная. Интегументальный
тапетум отсутствует, гипостаза хорошо развита. Археспорий одно-многоклеточный
(Микатадзе-Панцулая, 1979), дифференцируется в субэпидермисе нуцеллуса,
клетки его непосредственно становятся мегаспороцитами. В мейоз вступает
один, реже несколько мегаспороцитов. Образуется линейная тетрада мегаспор
или диада с 2-ядерными клетками (когда в мейозе II не закладываются
перегородки). Функционирующей является халазальная мегаспора.
85
13 ъ '"'i:K'"ib 16 'it
Theaceae
1—39 — Thea sinensis (= Camellia sinensis).
1—11 — микроспорогенез: 1—4 — профаза мейоза I, 5,6 — метафаза, 7—9 — анафаза и
телофаза, 10 — метафаза мейоза II, 11 — телофаза; 12 — тетрада микроспор; 12а —
одноядерные микроспоры, продолжительное время сохраняющие положение тетрад; 13 — зрелое
2-клеточное пыльцевое зерно; 14—17 — деление генеративной клетки в пыльцевой трубке;
Зародышевый мешок моноспорический, Polygonum-типа (Simura, Oosone,
1956) или биспорический, Allium-типа. В последнем случае у Thea sinensis
на 4-ядерной стадии зародышевого мешка 2-ядерная верхняя клетка
диады дегенерирует (Kapil, Sethi, 1963; Микатадзе-Панцулая, 1975, 1979).
Этот же тип развития зародышевого машка описан и у Camellia sasanqua
(Mathew, 1978). Зародышевый мешок удлиненный, иногда слегка овальный.
Синергиды с нитчатым аппаратом, эфемерны или во время оплодотворения
дегенерирует только одна из них. Однако известны случаи, когда
синергиды морфологически и физиологически сходны с яйцеклеткой, как правило,
не дегенерируют и могут формировать синергидный ценоцит
(Микатадзе-Панцулая, 1978,1979). Антиподы удлиненные, их ядра могут делиться, в результате
86
Theaceae (продолжение)
18 — фрагмент пыльника во время формирования стенки пыльника и спорогенной ткани;
19 — фрагмент пыльника — тапетум и симультанный тип образования тетрад микроспор;
20—22 — спермии в пыльцевой трубке (in vitro): 20 — вегетативное ядро движется рядом
со спермиями, 21, 22 — фрагментация ядер спермиев (в условиях Закарпатья); вегетативное
ядро движется перед спермиями; 23 — мегаспороцит и деление клетки в халазальной зоне
нуцеллуса; 24 — диада; 25—27 — развитие зародышевого мешка; 28 — зрелый
зародышевый мешок; 29 — 2 мегаспороцита в семяпочке;
чего антиподы становятся 2—3-ядерными ценоцитами. При наличии в семяпочке
нескольких мегаспороцитов могут развиваться дополнительные зародышевые
мешки. Оплодотворение порогамное, премитотического типа (Мандрик, 1960).
В условиях Закарпатья и Грузии оплодотворение происходит осенью. Сингамия
и тройное слияние протекают одновременно (Simura, Oosone, 1956; Sethi,
1965) или тройное слияние протекает быстрее, чем сингамия (Микатадзе-Пан-
цулая, 1970).
Эндосперм нуклеарный. После 6 делений, на 64-ядерной стадии «осенний»
* эндосперм прекращает деление и перезимовывает вместе с зиготой. Наблюдается
дегенерация незначительного числа ядер «осеннего» эндосперма. Ядра
эндосперма, сохранившиеся до весны, дают начало «весеннему» эндосперму, который
на стадии 256 ядер становится клеточным. Гаустории отсутствуют. Эндосперм
в зрелом семени скудный.
Зародыш развивается по Solanad-типу. Первое деление зиготы —
поперечное. Оно приводит к образованию более крупной базальной клетки и меньшей
87
Theaceae (продолжение)
30 — многоклеточный яйцевой и антиподальный аппараты в зародышевом мешке; 31 —
одновременное оплодотворение яйцеклетки и центрального ядра; 32 — тройное слияние; 33 —
ядерный эндосперм и первое деление ядра зиготы; 34—36 — начальные стадии зародыша;
36—38 — полиэмбриония: 36 — зародыш из яйцеклетки и адвентивный зародыш из клеток
внутреннего интегумента, 37 — зародыши, -развившиеся из яйцеклетки и яйцеподобной
синергиДы, 38 — адвентивная полиэмбриония; зародыши образуются из клеток внутреннего
интегумента; 39 — зрелый^ дифференцированный зародыш. (1—11, 12а, 14—22 — по Ман-
дрик, 1959; 12, 13 — рис. Микатадзе-Панцулая; 23—29 — по Мандрик, 1957; 30—35 — ориг.;
36—38 — по Cavara, 1899; 39 —по Sethi, 1965).
по'размерам — апикальной. Обе клетки делятся поперечно и образуют
Линейную тетраду — 4-клеточный нитчатый [проэмбрио. Производные базальной
клетки дают начало подвеску, а апикальной — проэмбрио. Клетки подвеска
могут быть многоядерными (Cavara, 1899). Зрелые зародыши крупные,
дифференцированные, с хорошо развитыми семядолями. Лейкоэмбриофит.
У Т. sinensis и Т. japonica отмечены случаи апомиксиса и полиэмбрионии:
развитие зародышей из неоплодотворенных синергид (редуцированная апога-
метия), из синергид вследствие их оплодотворения, интегументальная эмбрио-
88
ния, при которой образуется 3—4 адвентивных зародыша, и ложная полиэм-
бриония — при наличии в семяпочке нескольких зародышевых мешков.
Большинство добавочных зародышей погибает.
Исследованные виды. Camellia oleosa, С. sasanqua, Cleyera inte-
grifolia, Thea japonica, Th. sinensis (=C. sinensis), Tutcheria shinkoensis.
Литература. Braun, 1860; Cavara, 1899; Buschmann, 1914; Cohen-
Stuart, 1916, 1921; Fagerlind, 1939; Johnston, 1941; Venkataramani, 1950; Si-
mura, Oosone, 1956; Мандрик, 1957а, 19576, 1959, 1960a, 19606, 1964; Tomo,:
Fuchinoue Y., Fuchinoue H., 1958; Wu, 1960; Мирианашвили, 1961; Keng,
1962; Kapil, Sethi, 1963; Sethi, 1965; Цао Хуэйузюань, 1965; Bala Bawa, 1970;
Микатадзе, 1973,1974a, 19746,1975; Кутубидзе, 1974; Mathew, 1978; Микатадзе-
Панцулая, 1978а, 19786, 1979.
Семейство ONCOTHECACEAE
Эмбриологически не изучено.
Семейство PENTAPHYLACACEAE
Эмбриология изучена слабо.
Развитие пыльника и пыльцевого зерна не исследовано.
Семяпочка (Pentaphylax euryoides) анатропная или слабокампилотропная,
с 2 интегументами. Внутренний интегумент образует микропиле. При делении
археспориальной клетки образуются мегаспороцит и первичная париетальная
клетка, которая дает начало нескольким клеткам париетальной ткани.
Данных о развитии зародышевого мешка не имеется. Зрелый зародышевый
мешок 8-ядерный, изогнутый.
Развитие эндосперма и еародыша также неизвестно.
Исследованный вид. Pentaphylax euryoides.
Литература. Kumazawa, 1935; Mauritzon, 1936.
Семейство TETRAMERISTACEAE
Эмбриология не изучена.
Пыльник с раздельными теками, раскрывается продольно.
Завязь 4-гнездная; в каждом гнезде ее развивается одна анатропная
семяпочка.
Литература. Тахтаджян, 1966.
Семейство CARYOCARACEAE
Эмбриологически не изучено.
Пыльники 4-гнездные, вскрываются продольно.
Семяпочка анатропная, с 2 интегументами.
Эндосперм в зрелом семени скудный, в 2—3 слоя клеток у халазы,
тонкостенный, содержит жиры.
Зародыш у Сагуосаг с сильно утолщенным гипокотилем и маленькими,;
крючковидно изогнутыми семядолями. Мясистый клубневидный гипокотиль
Сагуосагасеае
1 — Caryacar glabrum, 2,3 — Anthodiscus
obovatus.
1 — зрелый зародыш в семени; 2 — семя-
3 почка; 3 — зародыш, спирально
закрученный в семени. (1—3 — по Pilger, 1925).
89
Marcgraviaceae
1—9 — Marcgravia umbellata, 10—14 — M. purpurea.
1—3 — развитие зародышевого мешка; 4, 5 — отдельные стадии эмбриогенеза; 6,7 —
развитие эндосперма; 8, 9 — верхняя и нижняя части эндосперма на поздних стадиях развития
семяпочки; 10 — археспориальная клетка; заложение внутреннего интегумента; 11 — мега-
спороцит; 12 — семяпочка с тетрадой мегаспор; 13 — семяпочка со зрелым зародышевым
пронизан проводящими пучками, продолжающимися и заходящими в семядоли;
в них различаются ксилемные и флоэмные элементы. Гипокотиль выполняет
запасающую функцию в семени; клетки его заполнены белками и жирами.
Крахмал не обнаружен. У Anthodiscus зародыш тонкий, длинный, спирально
свернутый, дифференцированный, с немного более длинной наружной семядолью.
Литература. Czyszylowicz, 1895; Pilger, 1925; Blank, 1939;
Corner, 1976*
Семейство ASTEROPEIACEAE
Эмбриологически не изучено.
Семяпочки висячие, эпитропные.
Эндосперм в зрелом семени скудный.
Зародыш согнутый.
Литература. Тахтаджян, 1966.
Семейство MARCGRAVIACEAE
Пыльник 4-гнездный. Сформированная стенка пыльника состоит из
эпидермиса, эндотеция с фиброзными утолщениями, 3—4 эфемерных средних слоев
и тапетума. Тапетум секреторного типа, клетки его одноядерны. Образование
микроспор симультанное. Пыльцевые зерна одиночные, 2-клеточные. Многие
пыльцевые зерна прорастают внутри пыльника.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Микропиле
образуется только внутренним интегументом. Археспориальная клетка
функционирует непосредственно как мегаспороцит. Мегаспоры в тетрадах обычно
расположены линейно, хотя встречаются и Т-образные тетрады.
Функциональной является халазальная мегаспора.
Зародышевый мешок моноспорический, Polygonum-типа, содержит 8 ядер.
У Marcgravia umbellata и М. polyantha синергйды маленькие, не имеют
крючкообразных выростов; полярные ядра сливаются до оплодотворения.
Антиподы в виде ядер у Marcgravia cuyuniensis и )М. purpurea, в виде клеток —
у М. umbellata. Они дегенерируют вскоре после их формирования;
одновременно наблюдается усиленный рост зародышевого мешка в длину. Отмечено
слабое развитие эндотелия. Двойное оплодотворение осуществляется нормально.
Эндосперм целлюлярный. Деление его клеток происходит вначале в
поперечном плане, далее, когда образуется 7—8 линейно расположенных клеток,
направление делений изменяется, закладываются вертикальные и косые
перегородки. У М. cuyuniensis и М. purpurea клетка эндосперма в микропилярном
районе проявляет гаусториальный характер. Отмечено, что у этих видов ха-
лазальные и микропилярные клетки эндосперма имеют меньшие размеры, чем
клетки эндосперма, расположенные в центре.
Последовательные стадии развития зародыша не исследованы, тип
эмбриогенеза не определен. Отмечено, что зародыш у М. cuyuniensis и М. purpurea
имеет подвесок, базальная клетка которого, разрастаясь, принимает вид трубки
и внедряется в гаусториальную клетку эндосперма. Зрелый зародыш занимает
все пространство в полости семени и имеет хорошо развитый гипокотиль и
семядоли. У М. umbellata и М. polyantha не отмечено гаусториальных
образований ни в зародыше, ни в эндосперме.
Исследованные виды. Marcgravia cuyuniensis, M. polyanthat
М. purpurea, M. umbellata.
• Литература. Juel, 1887; Schnarf, 1931; Mauritzon, 1939; Davis, 1966;
Тахтаджян, 1966.
мешком, в котором полностью дегенерировали антиподы; 14 — микропилярный район
семяпочки с зародышем на длинном подвеске и эндоспермом. (1—9 — по Mauritzon, 1939; 10—
14 — по Swamy, 1948).
91
Семейство PELLICERIACEAE
Эмбриологически не изучено.
Семяпочка кампилотропная.
Зрелое семя без эндосперма, с 2 крупными и очень широкими семядолями
(6.8 см в ширину, 5.5 см в длину и 3.5 см в толщину). Изогнутая почечка часто
с 2—3 небольшими листьями.
Исследованный вид. Pelliciera rhizophorae.
Литература. Szyszylowicz, 1895; Kobuski, 1951; Тахтаджян, 1966;
Collins, Berkelhamer, Mesler, 1977.
Семейство QUIINACEAE
Эмбриологически не изучено.
Пыльники вскрываются продольно.
Семяпочка анатропная.
Зародыш в зрелом семени дрямой, с очень толстыми семядолями и небольшой
почечкой. Семя без эндосперма.
Литература. Engler, 1925; Gottwald, Parameswaran, 1967.
Семейство MEDUSAGYNACEAE
Эмбриологически не изучено.
Пыльники вскрываются продольно. Тетрады микроспор тетраэдральные.
Семяпочка ацатропная, с длинным фуникулусом (у Medusagyne oppositifolia).
Medusagynaceae
Medusagyne oppositifolia.
Продольный срез завязи с семяпочками. (По Engler, Melchior, 1925).
Литература. Engler, Melchior, 1925.
Семейство BONNETIACEAE
Пыльники 4-гнездные. Сформированная стенка пыльника состоит из
эпидермиса, эндотеция, 2 средних слоев и тапетума. Эндотеций в зрелом пыльнике
с фиброзными утолщениями. Тапетум секреторного типа, его клетки к началу
мейоза в микроспороцитах становятся 2-ядерными. В клетках эпидермиса й
вокруг связника откладывается танин. Тетраэдральные или крестообразные
тетрады микроспор формируются по симультанному типу. Вокруг материнских
клеток микроспор откладывается каллоза. Зрелые пыльцевые зерна 2-клеточные.
Семяпочки анатропные, с 2 интегументами, тенуинуцеллятные. Микропиле
образовано обоими интегументами. Наружный интегумент состоит из 3,
внутренний — из 2 слоев клеток. Археспориальная клетка становится мегаспоро-
цитом без отделения кроющей клетки. Тетрада мегаспор линейная либо
Т-образная. Из халазальной мегаспоры развивается зародышевый мешок
Polygonum-типа. Клетки-антиподы не формируются. 3 ядра в антиподальном конце
зародышевого мешка дегенерируют до или после слияния полярных ядер. Обе
92
синергиды разрушаются после прохождения пыльцевой трубки в зародышевый
мешок.
Эндосперм нуклеарного типа.
Эмбриогенез не исследован. Отмечено лишь, что зигота делится поперечной
перегородкой. Зародыш в зрелом семени прямой, с 2 короткими семядолями и
длинным гипокотилем и корешком.
Исследованный вид. Ploiarium alternifolium.
Литература. Kobuski, 1948; Prakash, Lau, 1976.
Семейство CLUSIACEAE
Пыльник 2-гнездный (Rao, 1957). По нашим данным, у Hypericum hookerianum
пыльник 4-гнездный. Сформированная стенка пыльника состоит из, эпидермиса
с темноокрашенными гранулами, эндотеция, в клетках которого образуются
фиброзные утолщения, 1 или 2 эфемерных средних слоев и 2 ядерного тапетума
секреторного типа. Образование микроспор симультанное. Тетрады
тетраэдральные, изобилатеральные, иногда крестообразные. Зрелые пыльцевые зерна
2-клеточные.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. У Hypericum
patulum и Н. mysorense микропиле образовано обоими интегументами. У Garcinia
livingstonii мйкропиле длинное, узкое, почти полностью образовано наружным
интегументом. Внутренний интегумент у данного вида 3-слойный, наружный —
4—-5-слойный (Puri, 1939). У Н. patulum и Н. mysorense на ранних стадиях
развития семяпочки оба интегумента 2-слойные, позже внутренний интегумент
становится 5—6-слойным. Приблизительно на 4-ядерной стадии зародышевого
мешка внутренний эпидермис внутреннего интегумента дифференцируется
в интегументальный тапетум, становится наиболее заметным на стадии зрелого
зародышевого мешка (Rao, 1957). Обычно археспориальная клетка одна и
непосредственно становится мегаспороцитом. Иногда у Н. patulum1 H. mysorense
и G. livingstonii закладывается группа археспориальных клеток, что приводит
к образованию нескольких зародышевых мешков, но только один из них
достигает зрелости. Париетальные клетки отсутствуют. Тетрада мегаспор линейная.
Как правило, халазальная мегаспора образует зародышевый мешок; у Н.
mysorense отмечено несколько случаев, когда верхняя или эпихалазальная мегаспоры
развивались в зародышевый мешок (Rao, 1957).
Зародышевый мешок Polygonum-типа. Элементы зародышевого мешка
крупные. Синергиды грушевидной формы, полярные ядра сливаются до
оплодотворения. Антиподы эфемерные, но у Hypericum gentianoides и Н. punctatum на
ранних стадиях эмбриогенеза можно встретить до 7 антипод. В зрелом
зародышевом мешке Н. mysorense и Н. hookerianum обнаружены крахмальные зерна.
У Н. virginicum отмечены апомиктичные зародышевые мешки, развивающиеся
из апоспорических клеток нуцеллуса (Myers, 1964). Характерны порогамия и
двойное оплодотворение.
Эндосперм нуклеарный. У Hypericum первичное ядро эндосперма
располагается в центре зародышевого мешка вблизи зиготы. 2 дочерних ядра расходятся
к противоположным полюсам зародышевого мешка и дважды или более делятся,
образуя 8 или 16 ядер. Одно из них локализуется в халазальном конце,
содержащем густую цитоплазму, и некоторое время находится в состоянии покоя.
Позже оно делится, образуя 16—32 ядра. Эндоспермальное ядро в микропиляр-
ной части зародышевого мешка также делится несколько раз; ядра
располагаются по периферии зародышевого мешка. Более широкая верхняя часть
эндосперма в халазальной части зародышевого мешка начинает растягиваться,
отдельные ядра сливаются друг с другом, образуя крупные ядра с
многочисленными ядрышками. В конце концов эндосперм халазальной части сливается
с основным эндоспермом. Клеткообразование начинается с микропилярного
конца. В зрелом семени эндосперма нет.
93
1—6, 11, 12, 16, 18—21 — Hypericum hookerianum, 7, 8, 10, 13-r-U, 22—28, 31—33 — H. pa-
tulum, 9 — Garcinia Uvingstonii, 17, 29, 30 — Hypericum mysorense.
1—5 — микроспорогенез и развитие пыльцевого зерна (2 — участок стенки пыльника с
микроспорами; клетки эпидермиса и отдельные клетки эндотеция заполнены темноокрашенными
гранулами); 6 — зрелый 4-гнездный пыльник; 7 ^— семяпочка с 2 интегументами; 8 — 2 мега-
спороцита; 9 — 2 мегаспороцита и диада; 10 — линейная тетрада мегаспор; 11 — 2-ядерный
зародышевый мешок; 12 -^- 4-ядерный зародышевый мешок; 13 — 2 зародышевых мешка
в одной семяпочке; 14 — нуклеарный эндосперм; 15 — зрелый зародышевый мешок; 16 —
микропилярныи конец зрелого зародышевого мешка с крахмальными зернами; 17 — циноцит
в халазальной части эндосперма;
3Z
Clusiaceae (продолжение)
18—30 — отдельные стадии развития зародыша; 31 — зародыш и нуклеарный эндосперм;
32 — зародыш и целлюлярный эндосперм; 33 — зрелый зародыш. (1—6, 11, 12, 16, 18—
21 — ориг.; 7, 8, 10, 13—15, 17, 22—33 — по Rao, 1957; 9 — по Puri, 1939).
Эмбриогенез соответствует Solanad-типу. Первое деление зиготы поперечное.
Суспензор у Н. mysorense состоит из 12—14 клеток, -у Н. patulum — из 5—6
клеток (на стадии зрелого зародыша). У Н. hookerianum на стадии октантов и
образования гипофизарной клетки суспензор состоит из 9—10 клеток. Зародыш
прямой или согнутый, с хорошо развитыми семядолями.
У Н. maculatum встречается синергидная полиэмбриония. У Garcinia mango-
stana адвентивные зародыши образуются из клеток нуцеллуса (Нога,; 1940),
95
У Н. tetrapterum адвентивные зародыши могут возникать из выростов,
образующихся на суспензоре (Bugnicourt, 1971).
Исследованные виды. Androsaemum officinale, Garcinia livings-
tonii, G. mangostana, Hypericum acutum, H. gentianoides, H. hookerianum, H. ja-
ponicum, H. kalmianum, H. maculatum, H. mysorense, H. officinale, H. patulum,
H. perforatum, H. punctatum, H. tetrapterum, H. virginicum.
Литература. Braun, 1860; Vesque, 1878; Guignard, 1893; Goebel,
1900; Treub, 1911a, 1911b; Schnarf, 1914; Palm, 1922; Dahlgren, 1923; 1927a,
1927b; Soueges, 1925; 1936a, 1936b; Hoar, 1932; Crete, 1936; Stenar, 1938; Noack,
1939; Puri, 1939; Horn, 1940; Swamy, 1946; Govindappa, 1956; Rao, 1957; Myers,
1964; Bugnicourt, 1971a, 1971b, 1971c; Соколовская (ориг. данные).
. Семейство ELATINACEAE
Пыльник у Elatine hydropiper 2-гнездный; у Е. hexandra пыльники тычинок
наружного круга 3—4-гнездные, а пыльники тычинок внутреннего круга в
основном 2-гнездные, но могут встречаться 3—4-гнездные; у Е. triandra в хазмо-
гамных цветках пыльники 4-гнездные, а в клейстогамных 2-гнездные, реже
3-гнездные (Frisendahl, 1927). Сформированная стенка пыльника состоит из
эпидермиса, эндотеция, 2—3 средних эфемерных слоев и секреторного тапетума.
Стенка зрелого пыльника Bergia capensis состоит из эпидермиса и фиброзного
эндотеция, а у Elatine — из эпидермиса и эндотеция без фиброзных утолщений.
Образование микроспор происходит симультанно. Тетрады микроспор
тетраэдральные или изобилатеральные. Зрелые пыльцевые зерна 2-клеточные
(В. capensis) или 3-клеточные (Elatine); в клейстогамных цветках Е. triandra
прорастание пыльцевых зерен происходит in situ.
Самяпочка анатропная, с 2 интегументами, крассинуцеллятная.
Внутренний интегумент В. capensis 3-слойный, наружный — 2-слойный. Во внутреннем
интегументе Elatine содержатся дубильные вещества. Микропиле образовано
обоими интегументами. Археспорий, многоклеточный у Elatine (Frisendahl,-
1927) и В. capensis (Raghavan, Srinivasan, 1940) и одноклеточный у В>ammanoides
и В. odorata (Dathan, Singh D., 1971). Археспориальная клетка Bergia делится
периклинально, образуя париетальную клетку и спорогенную, преобразующуюся
в мегаспороцит. Обычно париетальная клетка делится антиклинально, образуя
однослойную париетальную ткань. Изредка у В. odorata париетальная клетка
может подвергаться одному или 2 периклинальным делениям. У В. capensis
образуется нуцеллярный колпачок. Тетрада мегйспор линейная или Т-образная.
Зародышевый мешок Polygonum-типа, развивается из халазальной
мегаспоры. Синергиды у Elatine дегенерируют перед оплодотворением, а у В. capensis
сразу же после оплодотворения. Полярные ядра сливаются до оплодотворения.
Их слияние у 5. capensis происходит в центре или ближе к халазальному концу
зародышевого мешка. Антиподы В. capensis — эфемерные. У Elatine время су-
Elatinaceae
1, 2, 6, 9—15 — Bergia capensis, 3, 4, 16—20 — Elatine hidropiper, 5,7,8 — E. triandra,
21—27 — Bergia ammanoides.
1 — образование париетальных клеток; 2 — сформированная стенка пыльника; 3,4 —
образование тетрад микроспор; 5 — 3-клеточное пыльцевое зерно; 6 — зрелое 2-клеточное
пыльцевое зерно; 7 — гнездо пыльника на стадии 2-клеточного пыльцевого зерна; 8 —
зрелый пыльник; прорастание пыльцы; 9, 10 — мегаспороцит и париетальные клетки; развитие
интегументов; 11 — линейная тетрада мегаспор; 12—14 — 2-, 4*-' и 8-ядерные зародышевые
мешки; 15 — семяпочка <со зрелым зародышевым мешком, париетальной тканью и
дегенерировавшим внутренним слоем клеток внутреннего интегумента; 16 — зрелый зародышевый
мешок; 17 — 6-ядерный зародышевый мешок; 18 — 16-ядерный зародышевый мешок; 19 —
2-клеточный зародыш и нуклеарный эндосперм; 20 — целлюлярный эндосперм в
халазальной части зародышевого мешка; 21—26 — отдельные стадии развития зародыша; 27 —
зрелый зародыш. (1, 2, 6, 9—15 — по Raghavan, Srinivasan, 1940; 3, 4, 16—20, 5,7,8 — по
Frisendahl, 1927; 21—27 — по Dathan, Dalbir Singh, 1971).
96
7 Сравнительная эмбриология
ществования, форма и величина антипод чрезвычайно изменчивы, особенно
у Е. triandra. Они или эфемерные и дегенерируют еще на ядерной стадии, или
по своей форме напоминают яйцевой аппарат и видны уже после
оплодотворения. У Elatine наблюдается отклонение в строении зародышевых мешков:
наряду с нормальными 8-ядерными встречаются и 4-ядерные зародышевые мешки>
в этом случае ядро мегаспороцита делится только дважды, образуя яйцевой
аппарат и полярное ядро. Наблюдаются также 16- и даже 32-ядерные
зародышевые мешки, что происходит в результате слияния нескольких зародышевых
мешков (Frisendahl, 1927).
Эндосперм нуклеарный, позднее становится целлюлярным. Образование-
клеток у Bergia начинается после того, как зародыш достигнет глобулярной
стадии, а у Elatine — на стадии заложения семядолей. Клеткообразование
начинается в микропилярном (В. capensis) или в хал аза льном конце {Elatine).
В зрелом семени Elatine эндосперма почти нет, ауВ. ammanoides, В. aestivosa
и В. odorata эндосперм сохраняется.
Эмбриогенез соответствует Solanad-типу. Первое деление зиготы поперечное.
Суспензор нитчатый, 3—5-клеточный (Frisendahl, 1927; Dathan, Singh, 1971).
Зародыш в зрелых семенах прямой (В. aestivosa, B. odorata) или, реже, более*
или менее изогнутый (В. ammanoides). У В. aestivosa, В. ammanoides и В. odorata
зародыш занимает большую часть семени.
Исследованные виды. Bergia aestivosa, В. ammanoides, В. capensisr
В. odorata, Elatine alsinastrum, E. hexandra, E. hidropiper, E. ortosperma, E.
triandra.
Литература. Muller, 1847; Jonsson, 1879—1880, 1881; Frisendahl,
1927; Lemesle, 1929; Kajale, 1939; Raghavan, Srinivasan, 1940; Dathan, Singh,
1970, 1971.
Порядок 32. VIOLALES
Семейство FLACOURTIAGEAE
Пыльник 4-гнездный. Стенка пыльника формируется по основному типу.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, 1—2
средних слоев и секреторного тапетума. В клетках эндотеция с наружной
стороны пыльника образуются фиброзные утолщения. Средние слои эфемерны.
Клетки тапетума густоплазменные., 2—3—4-ядерные. Во время дифференциации
пыльцы на внутренней стенке тапетума наблюдаются орбикулы. Спорогенная
ткань первоначально однорядная, в результате делений становится многорядной.
Исключением является Caloncoba echinata (Endress, Voser, 1975), где
спорогенная ткань закладывается в виде прерывистого ряда клеток и разделяется
поперечными перегородками из стерильной ткани. Эти поперечные перегородки
сохраняются в зрелом пыльнике. Симультанный тип образования тетрад
микроспор. Тетрады микроспор тетраэдральные или изобилатеральные. Зрелые
пыльцевые зерна 2-клеточные.
Описано несколько морфологических типов семяпочек: ортотропная (Casearia
sp., Oncoba spinosa), анатропная (Arechavaletaia Uruguayensis, Berberidopsis со-
rallina, Caloncoba glauca, Camptostylus mannii, Dasylepis brevipedicellata, Hydno-
carpus laurifolia, Kiggelaria africana, Lindackeria dendata, Peterodendron ovatum,
Scottellia mimfiensis) и гемианатропная (Idesia polycarpa). У Flacourtia indica
{Dathan, Singh, 1973) в пределах одной завязи встречаются 2 типа семяпочек:
анатропные и гемианатропные. Семяпочки с 2 интегументами, крассинуцеллят-
ные. Интегументы закладываются почти одновременно, первоначально 2—3-слой-
вые, позже число слоев в них увеличивается: у F. indica (Dathan, Singh, 1973)
до 4—5 слоев, у К. africana (Heel, 1979) наружный интегумент становится 7-
слойным, а внутренний — 4-слойным. Микропцле образовано обоими интегу-
ментами (A. Uruguay ensis, К. africana и L. dendata), одним наружным (В. coral-
Una и Н. laurifolia) или внутренним (F. indica, О. spinosa). Нуцеллус сильно
развит. В оплодотворенных семяпочках нуцеллярные клетки подвергаются
разрушению, сохраняются лишь клетки нуцеллуса, лежащие ниже зародышевого
мешка. Они делятся, аккумулируют танин и в зрелом семени образуют
постамент. Один или 2 слоя клеток халазы, лежащие непосредственно ниже танинсо-
держащей ткани, образуют гипостазу. Клетки гипостазы имеют утолщенные
оболочки и лигнифицируются. Единственный васкулярный пучок семяпочки
ъ районе халазы неправильно ветвится. Археспорий одноклеточный, реже 2—3-
тслеточный. Делясь периклинально, он отделяет париетальную клетку и мега-
спороцит. Первичная париетальная клетка при делении образует массивную
париетальную ткань. Мегаспороцит в результате мейоза формирует линейную
•тетраду мегаспор.
8-ядерный зародышевый мешок Polygonum-типа формируется, как правило,
из халазальной мегаспоры. У Flacourtia ramontschii нами отмечена возможность
образования зародышевого мешка из любой мегаспоры тетрады. Зрелый зароды-
дпевый мешок имеет яйцевой аппарат, 2 полярных ядра и 3 эфемерные антиподы.
Синергиды имеют крючковидные выросты. Полярные ядра сливаются перед
оплодотворением (Н. laurifolia) или во время оплодотворения (F. indica).
Размеры зародышевых мешков, расположенных в одной завязи у F. indica (Dathan,
Singh, 1973), очень различаются в анатропных и гемианатропных семяпочках,
хотя заметного различия в размерах этих 2 типов семяпочек найдено не было.
Более крупные зародышевые мешки обнаружены в анатропных семяпочках.
Для ряда представителей семейства характерно заметное удлинение
зародышевых мешков. У Idesia polycarpa (Tohda, 1971) зародышевый мешок проникает
в канал микропиле и V3 мешка находится в контакте с клетками интегумента.
У К. africana (Mauritzon, 1936) зародышевый мешок по мере роста выходит из
нуцеллуса и достигает экзостома микропиле. У Caloncoba glauca, Camptostylus
jnannii и L. dendata наблюдалось сильное удлинение зародышевого мешка в район
7* . 99
Flacourtiaceae
1—2,15 — Azara microphylla, 3—14, 16, 17 — Flacourtia ramontschii, 18 — Caloneoba glaucar
19 — Arechaualetaia Uruguayensis, 20—25 — Idesia polycarpa,
1,2 — развитие стенки пыльника и спорогенной ткани; 3 — сформированная стенка
пыльника и спорогённая ткань; 4 — образование тетрад микроспор; 5 — стенка пыльника и
микроспоры; 6 — стенка зрелого пыльника и пыльцевое зерно; •
халазы, где он формирует абсорбирующую полость, которую в литературе
(Maheshwari, 1950; Johri, 1963) называют гаусторием зародышевого мешка,,
или слепым отростком (caecum). Двойное оплодотворение набдюдалось у /.
polycarpa (Tohda, 1971) через 15 дней после полного цветения. В оплодотворенном
зародышевом мешке К. africana (Mauritzon, 1936) отмечался крахмал.
Эндосперм нуклеарный. Первичное ядро эндосперма начинает делиться
сразу после оплодотворения и образует многочисленные свободные ядра. В мик-
ропилярном районе эндосперма наблюдались многочисленные, чаще
безъядерные цитоплазматические выросты, которые сливаются друг с другом и
окончательно соединяются с общей цитоплазмой эндосперма. У Caloneoba^ Camptostylus
и Idesia эндосперм не образуется в области гаустория зародышевого мешка,
заходящего в базальную часть нуцеллуса. Многочисленные крахмальные зерна
наблюдались на начальных стадиях развития эндосперма; позднее они исчезают.
Формирование стенок в эндосперме носит центростремительный характер.
100
Flacourtiaceae (продолжение)
7 — продольный срез через семяпочку; 2-клеточный археспорий; 8 — выделение мёгаспого-
цита и париетальной ткани; 9 — тетрада мегаспор; 10 — развитие зародышевого М€нка,
из микропилярной мегаспоры; 11 — развитие зародышевого мешка из халазальнои ьега-^
споры; 12 — одноядерный зародышевый мешок; 13 — 2-ядерный зародышевый мешок;
14 ^— зрелый зародышевый мешок; 15 — клетки яйцевого аппарата и полярные ядра цен:
тральной клетки; 16 — зигота; 17 — многоядерный эндосперм в халазальнои части зароДы-*
шевого мешка; ;,'t
Flacourtiaceae (продолжение)
18 — разрез через созревающее семя, где хорошо видна абсорбирующая полость «caecum»
в халазальной части; 19 — проникновение зародышевого мешка в район микропиле; 20—
25 — стадии развития зародыша. (1—17 — ориг.; 18 — по Heel, 1977; 19 — по Ventura,
1938; 20—25 — по Tohda, 1971).
Ко времени созревания семян клетки эндосперма имеют толстые извилистые
стенки и содержат жиры и единичные мелкие кристаллы оксалата кальция (3—4
кристалла на клетку). В зрелом семени эндосперм сохраняется.
У /. polycarpa (Tohda, 1971) развитие зародыша соответствует Medicago-
вариации Caryophyllad-типа. Первое деление зиготы происходит через 10 дней
после оплодотворения. Зигота делится поперечной стенкой, образуя 2 клетки.
Базальная клетка 2-клеточного проэмбрио никогда не делится и не принимает
участия в формировании зародыша. Апикальная клетка 2-клеточного проэмбрио
делится поперечно на 2 клетки, из которых верхняя порождает собственно
зародыш, а нижняя формирует суспензор. Эпифизис и гипофизис не образуются.
У F. indica (Dathan, Singh, 1973) большой процент абортивных семяпочек
(только в 30% семяпочек развивается зародыш). Зигота делится поперечно.
Глобулярный зародыш имеет короткий многоклеточный суспензор. Зрелый
зародыш лопатчатый, с хорошо развитым гипокотильным районом и 2 большими
семядолями. Лейкоэмбриофит.
Исследованные виды. Arechavaletaia uruguayensis, Azara micro-
phylla, Berberidopsis corallina, Caloncoba echinata, C. glauca, Camptostylus mannii,
Casearia tomentosa, Dasylepis brevipediccellata, Flacourtia cataphracta, F. indica,
F. ramontschii, Hydnocarpus laurifolia, Idesiapolycarpa, Kiggelaria africana, Linda-
ckeria dendata, Oncoba spinosa, Peterodendron ovatum, Scaphocalys spathacear
Scottellia mimfiensis.
102
Литература. Mauritzon, 1936; Ventura, 1938; Gopinath, 1946; Corti,
1948; Narayanaswami, 3awhney, 1959; Heel, 1970, 1973, 1974, 1977, 1979; Tohda,
1971; Dathan, Singh, 1972, 1973, 1979; Яковлев, Жукова, 1973; Endress, Voser,
1975; Алимова (орйг. данные).
Семейство PASSIFLORACEAE
Пыльники 4-гнездные. Формирование стенки пыльника происходит по
основному типу. Сформированная стенка пыльника состоит из эпидермиса, эндотеция,
2—3 средних слоев и секреторного тапетума. Клетки эпидермиса наружных
гнезд вблизи места вскрытия пыльника оказываются радиально вытянутыми
по сравнению с остальными клетками эпидермиса. В клетках эндотеция
образуются фиброзные утолщения, которые наблюдаются и в клетках связника,
прилегающих к пыльнику. Средние слои эфемерны. Клетки тапетума сильно
вырастают в радиальном направлении. Ядра их претерпевают 2 деления: реже об*-
разуются 4-ядерные, а чаще 1—2-ядерные клетки в результате слияния
образовавшихся ядер. У Passiflora calcarata отмечен в некоторых местах пыльника
2-слойный тапетум. Стенка зрелого пыльника состоит из эпидермиса и
фиброзного эндотеция. Клетки спорогенной ткани митотически делятся, сильно
увеличиваются в размерах, образуя микроспороциты. Мейоз в микроспороцитах
проходит нормально. Цитокинез симультанный. Расположение микроспор
в тетраде обычно тетраэдральное, но иногда встречается изобилатеральное.
У P. calcarata (Raju, 1956) отмечались отдельные случаи дегенерации
пыльцевых зерен. Стерильные пыльцевые зерна деформированы, прижаты к стенке
пыльника. В цитоплазме их сильно выделяются вакуоли, ядра
гипертрофированы. Зрелые фертильные пыльцевые зерна 2-клеточные.
Семяпочки анатропные, с 2 интегументами, крассинуцеллятные.
Исключением является P. calcarata (Raju, 1956), где отдельные семяпочки в гнезде
завязи остаются ортотропными. Заложение интегументов симультанное, но
наружный интегумент растет быстрее, чем внутренний. Наружный и внутренний
интегументы представлены равным числом слоев (3 слоями) у Passiflora и Adenia
(Netolitzky, 1926). У Tacsonia mollissima (Dathan, Singh, 1973) наружный
интегумент 4-слойный, а внутренний 3-слойный. Оба интегумента принимают участие
в образовании микропиле. Проводящий пучок семяпочки доходит до халазы,
где сильно разветвляется в форме перевернутого зонтика. Археспорий обычно
представлен одной клеткой. Падхи и Деспанд (Padhye, Deshpande, 1960)
наблюдали многоклеточный археспорий у P. foetida. Согласно их данным, только
одна археспориальная клетка развивалась дальше, тогда как остальные
дегенерировали. Функционирующая археспориальная клетка делится, образуя
париетальную клетку и мегаспороцит. Первичная париетальная клетка в результате
многочисленных периклинальных и антиклинальных делений формирует
многослойную париетальную ткань (15—20 слоев у P. foetida). У P. coerulea нами
были отмечены семяпочки, в которых встречалось по нескольку мегаспороцитов
на ранних стадиях мейоза. Но дальнейшего развития проследить не удалось.
Обычно мегаспороцит в результате мейотических делений формирует линейную
тетраду мегаспор, из которых 3 верхние дегенерируют, а самая нижняя,
развивается в зародышевый мешок Polygonum-типа.
Зародышевые мешки вытянутые. Яйцеклетка значительно больше синергид.
Синергиды грушевидные, крючковидные, с нитчатым аппаратом. 2 полярных ядра
объединяются ниже яйцеклетки. Согласно нашим данным, у P. coerulea
полярные ядра поднимаются к яйцеклетке и лежат непосредственно под ней, не
сливаясь. Антиподы эфемерны. Оплодотворение порогамное. Двойное оплодотворение
у P. adenophylla наблюдал Кук (Cook, 1909), а у P. calcarata — Раю (Raju,
1956). Интересной чертой семейства является необычное поведение большинства
пыльцевых трубок, которые, не разрушаясь, продолжают свой рост в
зародышевом мешке. Кук (Cook, 1909) у P. adenophylla наблюдал зародышевый
мешок, полностью заполненный растущей пыльцевой трубкой. Раю (Raju, 1952,
103
Passifloraceae
1, 11, 12, 15—31— Passiflora foetida, 2—10, 13, 14 — P. coerulea.
1, — поперечный срез через гнездо пыльника; формирование стенки пыльника и спорогенная
ткань; 2, 3 — то жз, 'более поздние стадии; 4 — сформированная стенка пыльника и микро-
спороцигы; 5 — стенка пыльника и тетрада микроспор;
Passifloraceae (продолжение)
б — стенка зрелого пыльника; фиброзный эндотеций; радиальное удлинение эпидермальных
клеток ближе к месту вскрытия пыльника; 7 — зрелое пыльцевое зерно; 8 — поперечный
срез через семяпочку, содержащую однослойную париетальную ткань и мегаспороцит;
9 — то же, 2 мегаспороцита и 2-слойная париетальная ткань; 10 — анафаза в мегаспоро-
ците; 11 — поперечный срез через семяпочку; микропиле образовано 2 интегументами;
12 — 2-ядерный зародышевый мешок; дегенерация 3 верхних мегаспор; 13 — 8-ядерный
зародышевый мешок; 14 — яйцевой аппарат; полярные ядра, лежащие под яйцеклеткой;
IS — участок ядерного эндосперма и цитоплазматические выросты; 16 — периферийная
часть клеточного эндосперма g радиально расположенными клетками; 17 — эндосперм
с поверхности; 18 — поперечное деление в зиготе; 19—23 — развитие зародыша по Piperad-
типу; 24—31 —развитие зародыша соответствует Myosurus-вариации Onagrad-типа. (1, 11*
12 — по Padhye, Deshpande, 1960; 15—17, 24—31 — по Singh, 1962; 18—23 — по Padhye,
1963; 2—10,13, 14 — ориг.).
Ш
1956) сообщал о подобном росте пыльцевой трубки у P. leschenaultii и P. calca-
rata, а Синг (Singh, 1962) — у P. foetida.
Эндосперм нуклеарный. Свободные ядра выстраиваются по периферии,
а центр зародышевого мешка занят большой вакуолью. Были описаны
скопления ядер в густой цитоплазме на обоих концах зародышевого мешка (Raju,
1956; Singh, 1962). Синг наблюдал безъядерные цитоплазматические скопления
на обоих концах зародышевого мешка у P. foetida, а Раю описал
цитоплазматические скопления в халазальной части зародышевого мешка у P. calcarata,
которые затем окончательно сливаются с общей цитоплазмой. Формирование
стенок в эндосперме центростремительное. Клетки эндосперма по периферии
подобны меристематическим, тогда как его центральные клетки вакуолизиро-
ваны. Позднее клетки эндосперма заполняются жиром, крахмалом и
протеиновым содержимым. Зрелый эндосперм руминированный, причем руминация
происходит на конечных этапах его развития. Руминация эндосперма у Passiflora-
сеае может быть отнесена к Spigelia-типу (Dahlgren, 1922) или Passiflora-типу
(Periaswamy, 1962), хотя эти оба типа Тамамшян (1951) включает в тип
настоящей руминации, которая вызывается изменениями в структуре халазы и инте-
гумента. В зрелом семени эндосперм сохраняется.
Эмбриогенез известен только у P. foetida (Singh, 1962; Padhye, 1963). Согласно
Сингу (Singh, 1962), развитие зародыша соответствует Myosurus-вариации
Onagrad-типа, тогда как Падхи (Padhye, 1963) нашел, что у 70% семяпочек
зигота делится продольной стенкой и что развитие зародыша соответствует
Piperad-типу, а у остальных 30% первое деление зиготы поперечное,
образуются 2 клетки, которые делятся вертикально стенкой. У Т. mollissima (Dathan,
Singh, 1973) зигота делится поперечной стенкой. Зрелый зародыш 2-семядоль-
ный и лежит в середине семени, окруженный эндоспермом. Его васкулярное
снабжение прокамбиальной природы. Лейкоэмбриофит.
Исследованые виды. Adenia, Passiflora adenophylla, P. alba,
P. calcarata, P. coerulea, P. edulis, P. foetida, P. leschenaultii, P. quadrangularis,
P. suberosa, P. trifasciata, Tacsonia mollissima.
Литература. Hofmeister, 1848, 1856, 1858, 1867; Warming, 1878;
Strasburger, 1889; Williams, 1899; Cook, 1909; Juel, 1915; Kratzer, 1918; Neto-
litzky, 1926; Raju, 1952, 1956; Padhye, Deshpande, 1960; Singh, 1961, 1962,
1970; Dathan, Singh, 1962, 1973; Padhye, 1963; Kloos, Bouman, 1979; Алимова
(ориг. данные).
Семейство STACHYURACEAE
Пыльник 4-гнездный; гнезда объединены в 2 теки и перед созреванием
пыльника сливаются в результате разрушения перегородки между ними.
Пыльник раскрывается продольно, при этом его стенки разворачиваются. Тип
формирования стенки не определен. По нашим данным, у Stachyurus praecox*
сформированная стенка пыльника состоит из 6—7 слоев: эпидермиса, эндотеция,
3—4 средних слоев и тапетума. Тапетум секреторный, нерегулярно 2-слойный,
2-ядерный, с хорошо различимыми на поздних стадиях орбикулами. Средние
слои постепенно дегенерируют и в зрелом пыльнике не сохраняются. На ранних
стадиях в эндотеции и в средних слоях имеется крахмал. В клетках эндотеция
образуется густая сеть фиброзных утолщений. В зрелом пыльнике стенка
состоит из эпидермиса, покрытого тонкой зубчатой кутикулой, и эндотеция.
Фиброзный слой расположен с наружной стороны каждой теки. Спорогенная
ткань многослойная. Микроспороциты и тетрады микроспор заключены в
толстые каллозные оболочки. Мейоз протекает без нарушений и сопровождается
* Материал собран в Батумском ботаническом саду.
106
St ac hyuraceae
1—9 — Stachyurus praecox, 10—23, 25—36 — S. chinensis, 24, 24a — S. praecox var. praecox*
1 — фрагмент пыльника со сформированной стенкой и спорогенной тканью; 2, 2а —
пыльник и его фрагмент с микроспороцитами в профазе мейоза I; 3 — телофаза мейоза I; 4 —
тедофаза мейоза II в микроспороцитах; 5 — фрагмент пыльника с тетрадами микроспор;
в — на стадии одноядерных микроспор; 7, 7а — пыльник с 2-клеточной пыльцой, с еще
не слившимися гнездами; 8, 8а — зрелый пыльник; 9 — зрелое пыльцевое зерно (1—8а ~-
поперечные срезы);
Stachyuraceae (продолжение)
W* — археспориальная клетка в нуцеллусе; 11 — образование париетальной и спорогенной
клеток; 12 — 2 спорогенные клетки в нуцеллусе; 13 — мегаспороцит; 14 — диада; 15 —
тетрада мегаспор; 16 — халазальная мегаспора линейной тетрады развивается в зародышевый
мешок; 17 — развитие средней клетки триады в зародышевый мешок; 18 — линейная
тетрада: 2 халазальные клетки на стадии 2-ядерного зародышевого мешка, и во второй микро-
пилярной клетке ядро делится; 19 — 4-ядерный зародышевый мешок, развивающийся из
халазальной мегаспоры; 20 —• то же, из эпихалазальной; 21 — верхняя клетка диады раз-
вийяда&я в зародышевый мешок; 22 — 8-ядерный зародышевый мешок; 23 —
сформированный зародышевый мешок; 124а — зрелый зародышевый мешок; 24 — семяпочка на этой
стадии;. 25 — микропилярная часть зрелого зародышевого мешка с яйцевым аппаратом и
центральным ядром;
Stachyuraceae (продолжение)
26—31 — отдельные стадии эмбриогенеза; 32 — зрелый зародыш; 33—36 — полиэмбриония.
(2—9 — ориг.; 10—23, 25—36 — по Mathew, Chaphekar, 1977; 24, 24а — по Satd, 1976).
симультанным цитокинезом. Тетрады микроспор тетраэдральные, реже изо-
билатеральные. Отмечена асинхронность в развитии пыльников одного цветка.
Так, наблюдались стадии от микроспороцита в профазе мейоза I до тетрад
микроспор в одном и том же цветке или II мейоз, тетрады и одноядерные микроспоры.
Зрелая пыльца одиночная, 2-клеточная; генеративная клетка овальной формы,
с ярко красящимся ядром; цитоплазма пыльцевого зерна заполнена запасными
белком и липидами.
В функционально женских цветках этого вида пыльники до начала мейоза
развиваются нормально, формируя стенку пыльника и спорогенную ткань.
Однако сразу после этого, еще перед мейозом, начинается дегенерация тапетума.
Микроспороциты, увеличившиеся в размерах, не покрываются каллозной
оболочкой и дегенерируют не вступая в мейоз, либо не завершая его. В тех
редких случаях, когда мейоз завершается и образуются микроспоры, они
нежизнеспособны, деформируются, ядра в них дегенерируют очень рано.
Пыльники этих цветков полностью стерильны.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
зигзагообразное, формируется обоими интегументами, с эндостомом и экзо-
стомом. Интегументы состоят из 4—5 слоев клеток. Вырост апикальной части
109
фуникулуса развивается в ариллус, который дорастает до халазальной части
семяпочки, не покрывая ее целиком. Проводящий пучок из фуникулуса доходит
до халазы. Имеется фуникулярный обтуратор-из сосочковидных клеток.
Археспорий одноклеточный, иногда 2—7-клеточный (Mauritzon, 1936). Археспо-
риальная клетка делится периклинально на париетальную и спорогенную клетки.
Париетальная клетка претерпевает последующие периклинальные деления и
формирует 4—8-слойную париетальную ткань. В результате периклинального
деления эпидермиса нуцеллуса образуется 2—3-слойный нуцеллярный
колпачок. Спорогенная клетка преобразуется в мегаспороцит. Даже при наличии
в нуцеллусе нескольких мегаспороцитов в мейоз вступает только один, а
остальные постепенно дегенерируют. В результате мейоза образуются линейные или
Т-образные тетрады мегаспор, иногда триады, когда верхняя клетка диады не
делится. В редких случаях в мейозе II не закладываются перегородки, что даег
предпосылку для развития биспорического зародышевого мешка (Mathew r
Chaphekar, 1977). В большинстве случаев функциональной становится хала-
зальная мегаспора, но отмечалось развитие и субхалазальной, причем в обеих
мегаспорах развитие зародышевых мешков может идти одновременно до 4-ядерной
стадии, но формирования и зрелости достигает только нижний зародышевый
мешок, а верхний постепенно дегенерирует (Sato, 1976).
В семействе описано развитие моноспорического зародышевого мешка по
Polygonum-типу и одновременно с этим наблюдалось в семяпочках одной и
той же завязи развитие биспорического зародышевого мешка Endymion-типа^
когда микропилярная клетка диады становится материнской клеткой
зародышевого мешка (Mathew, 1972; Mathew, Ghaphekar, 1977). Зрелый зародышевый
мешок 8-ядерный, 7-клеточный, с дифференцированными элементами,
расширенной микропилярной и суженной халазальной частями. Синергиды грушевидные,.
с крючковидными выступами, с хорошо выраженным нитчатым аппаратом..
Яйцеклетка длиннее синергид, грушевидная, с крупным ядром. Полярные ядра
сливаются до оплодотворения, располагаются в центре зародышевого мешка
или в нижней его части. Антиподы — 3 небольшие клетки, дегенерируют до
оплодотворения. Оплодотворение порогамное.
Эндосперм нуклеарный. Свободные ядра вначале располагаются в тонком
периферическом слое цитоплазмы. Позднее эндосперм заполняет всю полость
центральной клетки и становится клеточным. В зрелом семени
сохраняется.
Эмбриогенез соответствует Solanad-типу. Деление зиготы поперечное,
тетрада линейная. Суспензор развит. Зрелый зародыш прямой, с 2
широкоовальными семядолями, заключающими почечку, с коротким цилиндрическим ги-
покотилем ^зародышевым корнем, с хорошо развитой прокамбиальной
системой.
У Stachyurus chinensis описаны 2 типа полиэмбрионии, возникающей в
результате: 1) почкования зиготического проэмбрио и 2) развития зиготического
и синергидного зародышей (Mathew, Ghaphekar, 1977).
Исследованные виды. Stachyurus chinensis, S. praecox, S. praecox
var. praecox и var. matsuzakii/
Литература. Mauritzon, 1936; Mathew, 1972; Sato, 1976; Mathewj.
Chaphekar, 1977; Камелина (ориг. данные).
ПО
Семейство VIOLACEAE
Пыльники сидячие, 4-гнездные, со связником, разрастающимся в
перепончатый листовидный придаток. Гнезда пыльников образуют попарно 2 теки.
Стенка пыльника многослойная; ко времени обособления микроспороцитов она
состоит из недифференцированных паренхимных клеток. Тапетум секреторный,
его дифференциация связана с началом мейоза. В клетках тапетума
увеличивается число ядер путем митоза без цитокинеза. Тапетальные клетки со стороны
связника становятся 4—6-ядерными ценоцитами, со стороны наружной стенки
они 2-ядерны. Резорбция тапетума начинается в период обособления тетрад
микроспор; в это же время клетки эндотеция вытягиваются в радиальном
направлении и приобретают фиброзные утолщения, а клетки эпидермиса
уплощаются. Сингх и Гупта (Singh, Gupta, 1963) обнаружили появление фиброзных
утолщений также в субэпидермальном слое придатка пыльника у Viola odorata.
Фиброзные утолщения у V. collina, V. epipsila и V. mirabilis 2 типов: в клетках
дорсальной стороны пыльника они представляют собой толстые целлюлозные
тяжи, располагающиеся по углам контактирующих клеток; в вентральной части
пыльника, прилегающей к стомиуму, клетки содержат фиброзные утолщения
в виде многочисленных тонких балочек на радиальных стенках клеток. Граница
между клетками эндотеция с разными типами утолщений хорошо выражена в
верхней части пыльника (если рассматривать пыльник по длине), в средней
наблюдается постепенный переход одного типа в другой, а в нижней части пыльника
фиброзных утолщений нет. Между тапетумом и эндотецием лежат несколько
средних слоев, дегенерирующих ко времени созревания пыльцы. Образование
микроспор происходит симультанно, тетрады микроспор тетраэдральные.
У V. mirabilis, V. collina и V. epipsila иногда наблюдаются полиады из 4—5
микроспор. У V. odorata количество микроспор в одной материнской клетке
может доходить до 10. В этом случае клетки резко варьируют по размеру.
У Viola и Ionidium зрелая пыльца 2-клеточная. Спермин образуются в
пыльцевой трубке. В клейстогамных цветках пыльцевые трубки прорастают в полости
пыльника. Их прорастание начинается с образования выпячиваний цитоплазмы
из всех 3 пор. Пыльцевая трубка прорастает через ту из них, в которую
перемещается вегетативное ядро. Образование спермиев происходит в пыльцевой
трубке, когда она покидает цределы пыльника. Пыльцевые трубки, приходя
в контакт со стенкой пыльника, изменяют направление своего роста,
изгибаются, но не прорастают через нее. Выход пыльцевых трубок из пыльника
осуществляется через разрыв его стенки. Пыльцевые трубки раздвигают клетки
Violaceae
1, 15, 17, 21, 25 — Viola mirabilis, 2, 3, 18, 19, 23, 24 — V. соЩпа, 4—6, 16, 20, 22 —
V. epipsila, 7—14 — Ionidium suffruticosum, 26—39 — Viola tricolor.
7—9 — мегаспорогенез; 10—13 — развитие зародышевого мешка (12, 13 — зрелый
зародышевый мешок); 14 — семяпочка;
111
Violaceae (продолжение)
2—4 __ развитие пыльника и пыльцы; 5,6 — прорастание пыльцы в клейстогамных цветках;
Violaceae (продолжение)
15,16 — мегаспорогенез; 17—20 — развитие зародышевого мешка; 21 — зрелый
зародышевый мешок; 2%, 23 — двойное оплодотворение; 24 — зигота и 2 ядра эндосперма; 25 —
первое деление зиготы и нуклеарныи эндосперм;
8 Сравнительная эмбриология
Violaceae (продолжение)
.26 — зигота и 2 ядра эндосперма; 27 — деление ядер эндосперма; 28 — нуклеарный эндо-
хперм; 29—39 — развитие зародыша. (1—6, 15—25 — ориг.; 7—14 — по Mukherjee, Ve-
nugopalan, 1957; 26—39 — по Singh, 1961).
.стенки в верхней части пыльника, где соединяются клетки эндотеция
вентральной и дорсальной частей. Здесь стенка пыльника образует угол, занятый
несколькими тонкостепными клетками, которые к этому времени подвергаются
частичной деструкции. Стомиум пыльника прикрыт пленкой из остатков
отмерших клеток средних слоев и не является местом выхода пыльцевых трубок.
В клейстогамных цветках часть пыльцы стерильна; встречаются полностью
стерильные гнезда и пыльники. Причины стерильности неизвестны: У Melicytus
fasciger, Hymenanthera latifolia и H. dentata наблюдается стерилизация пыльников
и завязей в обоеполых цветках, в результате чего образуются диэцичные формы.
Семяпочки анатропные, крассинуцеллятные, 2-покровные, с одним сосудисто-
проводящим пучком, который оканчивается в халазе. У Ionidium и Viola
микропиле образуют оба интегумента, у Hybanthus только один — внутренний. У Ну-
banthus нуцеллус снабжен 2-слойным нуцеллярным колпачком. Интегументы
закладываются в виде 2-слойных валиков; ко времени образования тетрады
мегаспор в основании интегументов закладывается 3-й слой, образующийся в
результате тангентальных делений клеток внутреннего эпидермиса. Тетрада
мегаспор линейного типа или Т-образная.
Зародышевый мешок развивается по Polygonum-типу. У Hybanthus 3 мик-
ропилярные мегаспоры функционируют, пока зародышевый мешок не становится
4-ядерным. Зародышевый мешок 7-клеточный, полярные ядра сливаются до
оплодотворения или после слияния одного из них со спермием (V. epipsila, V. ri-
viniana и V. tricolor). У V. collina и V. epipsila развиваются иногда 2—3
зародышевых мешка в одной семяпочке. Оплодотворение двойное, порогамное.
Образованию зиготы предшествует образование первичного ядра эндосперма.
Эндосперм нуклеарный, клеткообразование происходит на стадии
шаровидного зародыша. Эндосперм сохраняется в зрелом семени.
Зародыш у Viola и Ionidium развивается по Aster ad-типу. Своеобразно
развитие зародыша у Hybanthus (Mauritzon, 1936): яйцеклетка сначала делится
поперечно; после 2-го деления образуется 3-клетОчный проэмбрио. 2 его микро-
дилярные клетки увеличиваются и претерпевают несколько ядерных делений
XU
без образования стенок. Одновременно клетки и ядра увеличиваются в
размерах. Позднее в клетках образуются вакуоли, занимающие центральное
положение; вокруг вакуолей располагаются многочисленные ядра (до 30). Деление
3-й, апикальной клетки приводит к образованию собственно зародыша, а
увеличенные многоядерные клетки представляют собой гаусториальные клетки
суспензора. Зрелый зародыш Viola прямой, дифференцированный. Хлороэмбрио-
фит.
Исследованные виды. Hybanthus calycinus, Hymenanthera dentata,
H. latifolia, Ionidium suffruticosum, Melicytus fasciger, Viola cinerea var. stocksii,
V. collina, V. epipsila, V. mirabilis, V. odorata, V. riviniana, V. tricolor.
Литература. Andrews, 1910; Bliss, 1912; Schnarf, 1922; Gorczynski,
1929; Madge, 1929; West, 1930; Mauritzon, 1936; Soueges, 1937; Gershoy, 1940;
Singh, 1956,1961, 1963b; Mukherjee, Venugopalan, 1957; Raju, 1958; Beuzejiberg,
1961; Singh, Gupta, 1963, 1967; Dathan, Singh, 1973; Kuta, 1978; Верещагина,
1980.
Семейство BIXACEAE
Пыльник 4-гнездный, но ввиду того что в процессе развития он изгибается
в виде подковы и около середины его изогнутые половинки срастаются и
объединяются в общую массу, на поперечном медианном срезе видны 8 гнезд (Venka-
tesh, 1956). По этой причине некоторые авторы, в том числе и Дэвис (Davisr
1966), называют его 8-гнездным. Сформированная стенка пыльника состоит иа
эпидермиса с папиллами, эндотеция, среднего слоя и секреторного тапетума.
Средний слой эфемерный. Внутренние. тангентальные и радиальные стенки
тапетума покрыты орбикулами. Образование микроспор происходит симультанно.
Тетрады микроспор тетраэдральные, иногда крестообразные. Зрелые пыльцевые
з ерна 2—3-к л еточные.
Семяпочка анатропная, с 2-интегументами, с нуцеллярным колпачком, крас-
синуцеллятная. Внутренний интегумент 6—7-слойный, наружный — 4-слой-
ный. Археспорий одноклеточный. Париетальная ткань массивная. Тетрада
мегаспор линейная, изредка Т-образная. Часто встречаются тетрады мегаспор,
расположенные друг над другом (парами), и функционирующая мегаспора в
каждой тетраде может достичь 2-ядерной стадии зародышевого мешка. В некоторых
случаях не только халазальная, но и эпихалазальная мегаспора может
развиваться до 2-ядерной стадии зародышевого мешка. Обычно только один
зародышевый мешок достигает зрелости.
Зародышевый мешок Polygonum-типа. Элементы зародышевого мешка
крупные. Полярные ядра сливаются до оплодотворения. Синергиды с клювовидным
выростом. Одна из них разрушается после оплодотворения, в то время как
другая увеличивается и продолжает существовать до ранних стадий эмбриогенеза.
Антиподы эфемерные, они обычно дегенерируют перед оплодотворением. Для
данного семейства характерна порогамия и двойное оплодотворение.
Эндосперм нуклеарный, позже становится целлюлярным. Клеткообразова-
ние идет от микропилярного конца к халазальному. Запасное питательное
вещество — крахмал. В зрелом семени эндосперм сохраняется.
Зигота делится поперечной перегородкой, образуя 2 клетки. Затем обе клетки
2-клеточного проэмбрио делятся вертикально. В делении 4-клеточного проэмб-
рио не наблюдается каких-либо определенных закономерностей, и в результате
образуется глобулярный зародыш, в котором 5 клеток крупнее, чем остальные.
Дальнейшая дифференциация глобулярного зародыша совершенно нормальная.
Эмбриогенез не согласуется с каким-либо определенным типом. Зрелый
зародыш прямой, с хорошо развитыми семядолями и^ прокамбиальной системой.
Запасные питательные вещества — белки. Лейкоэмбриофит.
Исследованный вид. Bixa orellana.
Литература. Mauritzon, 1936; Venkatesh, 1956; Chopra, Kaur, 1965;
Kaur, 1967, 1969, 1970; Dathan, Singh, 1972.
8* 115
Bixaceae
1—36 — Bixa orellana.
1—4a — развитие пыльника; 5—7 — срезы пыльника на разных уровнях (6 — медианный
срез); 8—14 — микроспорогенез; 15—20 — мегаспорогенез; 21—23 •— развитие
зародышевого мешка; 24 — семяпочка;
JBixaceae (продолжение)
£5, 26 — нуклеарный эндосперм; 27—35 — эмбриогенез; 36 — схема соотношения
эндосперма и зародыша в зрелом семени. (1—4, 8—23 — по Kaur, 1969; 5—7 — по Venkatesh,
1956; 24 — по Mauritzon, 1936; 25—35 — по Kaur, 1969; 36 — по Dathan, Singh, 1972).
Семейство CISTACEAE
Пыльник 4-гнездный. Сформированная стенка пыльника состоит щ
эпидермиса, фиброзного эндотеция, эфемерного среднего слоя и секреторного
2—4-ядерного тапетума. Иногда ядра в клетках тапетума сливаются, образуя
одно крупное ядро с несколькими ядрышками (Cistus). Тетрады микроспор
изобилатеральные, крестообразные или тетраэдральные. Зрелые пыльцевые
зерна 2-клеточные.
Семяпочка атропная, с 2 интегументами, с нуцеллярным колпачком, красси-
пуцеллятная. Археспорий представлен единственной клеткой у Fumana, Hali-
mium, Tuberaria, Helianthemum ledifolium и у большинства видов рода Cistus
(Kapil, Maheshwari, 1964). Многоклеточный археспорий отмечен у
Helianthemum alpestre, H. apenninum и Н. chamaecistus (Chiarugi, 1925), а также у Н. vul-
gare (Kapil, Maheshwari, 1964). Париетальная ткань представлена 1—3 слоями
клеток. Мейоз в мегаспороцитах протекает нормально. Тетрада мегаспор
линейная.
У рода Cistus функционирует только халазальная мегаспора, которая
развивается в зародышевый мешок Polygonum-типа (Романова, 1970). У
Helianthemum halimifolium и Tuberaria guttata может функционировать не только
халазальная, но и эпихалазальная мегаспора линейной тетрады, образуя 2-
и 4-ядерные зародышевые мешки; однако только один зародышевый мешок
достигает зрелости (Chiarugi, 1925). У Helianthemum vulgare мегаспороциты
лодвергаются мейозу, образуя линейные тетрады, халазальные мегаспоры кото-
117
Cistaceae
1—26 — Cistus monspeliensis, 27—30, 32—40 — Helianthemum apenninum, 31 — H. alpestre^
41, 42 — H. vulgare.
1 — стенка мододого пыльника и спорогенные клетки; 2—5 — фазы мейоза микроспороци-
тов; 6 — тетрада микроспор; 7,8 — лизис тапетума и молодая пыльца; 9—13 — стадии
развития ядра микроспоры; 14 — гаметогенез; 15 — первичная археспориальная клетка;:
16 — вторичная археспориальная клетка; 17 — мегаспороцит; 18, 19 — мегаспорогенез;.
20—23 — стадии развития зародышевого мешка; 24 — зрелый зародышевый мешок; 25, 26 —
двойное оплодотворение; 27 — синапсис мегаспороцитов; 28 — тетрады мегаспор; 29 —
стадии развития зародышевого мешка;
Cistaceae (продолжение)
ЖО — зародышевый мешок; 31 — зрелый зародышевый мешок; 32—40 — стадии развития
зародыша; 41 — схема соотношения эндосперма и зародыша в зрелом семени; 42 —
двусемядольный зародыш. (1—26. — по Романовой, 1970; 27—40 — по Chiarugi, 1925; 41, 42 —
по Kapil, Maheshwari, 1964).
|рых развиваются в зародышевые мешки Polygonum-типа, но зрелости достигает
-только один зародышевый мешок, остальные редуцируются. Полярные ядра
«сливаются до оплодотворения. Синергиды с хорошо развитым нитчатым
аппаратом, иногда он закрывает собою почти половину клетки (Cistus). Структуры,
подобные колпачку, развиваются в основании синергид Н. vulgare (Kapil,
Maheshwari, 1964). Яйцеклетка грушевидной формы. Антиподы эфемерные, они
дегенерируют до оплодотворения. Для данного семейства характерна поро-
гамия и двойное оплодотворение.
Эндосперм вначале нуклеарный, затем становится целлюлярным. Клетко-
-образование начинается на стадии заложения семядолей. Запасное питательное
вещество — крахмал.
Первое деление зиготы поперечное. Развивается зародыш в соответствии
'С Solanad-типом. Зародыш хорошо дифференцирован: в нем различаются
семядоли, точка роста и гипокотиль. Хлороэмбриофит,
119
Исследованные виды. Clstus albidus, С. ladaniferus, С. lauri-
folius, С. monspeliensis, С. silvifolius, С. tauricus, С. villosus, Fumana arabica,
F. procumbens, Halimium halimifolium, Helianthemum alpestre, H. apenninum,
H. chamaecistus, H. guttatum, H. ledifolium, H. rhodax, H. vulgare, Tuberaria
guttata.
Литература. Brongniart, 1831; Tulasne, 1855; Braun, 1860; Warming,.
1878; Elfving, 1879; Strasburger, 1879a, 1879b; Fischer, 1880; Janchen, 1909;
Chiarugi, 1924, 1925; Soueges, 1937; Boursnell, 1950; Snoad, 1954; Kapil,.
Maheshwari, 1964; Kapil, 1967; Романова, 1968, 1970.
Семейство PERIDISCACEAE
Эмбриологически не исследовано.
В зрелом семени очень маленький зародыш окружен массивным эндоспермом^.
Литература. Тахтаджян, 19бб.
Семейство SCYPHOSTEGIACEAE
Эмбриологически изучено недостаточно.
Пыльники 4-гнездные. Развитие стенки пыльника не исследовано.
Микроспоры образуются симультанно. Пыльцевые зерна одиночные, данных об их.
строении нет.
Семяпочка анатропная, прямостоячая, с 2 интегументами, крассинуцеллят-
ная. Микропиле направлена вниз, образовано обоими интегументами, с
длинным эндостомом и менее длинным 5-лопастным экзостомом. Интегументы
толщиной по 3-4 слоя каждый; утолщаются в районе микропиле. Фуникулус
с характерными выступами близ
основания, которые после оплодотворения
разрастаются в ариллус. Наружный:
интегумент в районе микропиле (экзо-
стома) также разрастается, образуя*
ариллоид. Такой сложный ариллус окру-
Scyphostegiaceae
1—3 — Scyphostegia borneensis.
1 — семяпочка со зрелым зародышевым мешком;.
2 — семяпочка с зиготой и ядерным
эндоспермом; 3 — семя и зародыш, (i, 2 — по Heel, 1967;,
3 — по Hutchinson, 1926).
жает базальную часть бемени. Проводящий пучок, в котором дифференцируются
ксилемные элементы, доходит до халазы, к основанию нуцеллуса, но в
интегументы и нуцеллус не входит. Халаза с характерным выростом, гипостаза не-
выражена. Эпидермис нуцеллуса делится периклинально, образуя
многослойный нуцеллярный колпачок, 4 слоя которого сохраняются над зрелым
зародышевым мешком и в зрелом семени. Археспорий одноклеточный. Тетрада
мегаспор линейная. Халазальная мегаспора становится материнской клеткой
зародышевого мешка.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Сформированный зародышевый мешок удлиненной формы, 8-ядерный, с
яйцевым аппаратом, 2 полярными ядрами и 3 антиподальными клетками. Имеет
место оплодотворение.
Эндосперм нуклеарный на ранней стадии развития, а затем становится
клеточным, образуя радиальные слои клеток. В молодых плодах в семяпочках
фуникулус, внутренний интегумент и эндосперм светло-зеленые, что говорит-
120
о присутствии в них хлоропластов. В зрелом семени эндосперм сохраняется,
окружая зародыш, содержит жиры, В качестве питательной ткани толщиной
в 2 слоя в семени продолжительное время присутствует перисперм, в зрелом
-семени представленный остатками сжатых клеток под семенной кожурой.
Эмбриогенез не исследован. Зрелый зародыш прямой, дифференцированный,
с овальными семядолями^ по длине занимающий более половины семени. Лейко-
эмбриофит.
Исследованный вид. Scyphostegia borneensis.
Литература. Hutchinson, 1926; Swamy, 1953; Heel, 1967; Corner,
1976.
Семейство DIPENTODONTACEAE
Эмбриологически не изучено.
Семейство TURNERACEAE
Пыльники 4-гнездные. Формирование стенки происходит по основному
типу. Стенка пыльника состоит из эпидермиса, эндотеция с фиброзными
утолщениями, 2 эфемерных средних слоев и тапетума. Максимального развития
эндотеций с фиброзными утолщениями достигает к моменту вскрытия пыльника.
Средние слои эфемерны и дегенерируют во время мейоза микроспороцитов.
^Эпидермис делится антиклинально, а в период созревания пыльника, клетки
его сильно вытянуты. Тапетум секреторный, клетки его крупные, с заметными
ядрами и густой цитоплазмой. Одновременно с мейотическими делениями
в микроспороцитах наблюдаются митотические деления в тапетальных клетках,
в результате которых в каждой клетке образуется от 2 до 3 ядер. Ко времени
образования тетрад микроспор тапетальные клетки теряют контакт друг с
другом. Они сильно вакуолизированы и дегенерируют на стадии пыльцевых зерен.
До образования микроспороцитов первичные спорогенные клетки подвергаются
нескольким митотическим делениям. Микроспорогенез сукцессивного типа.
Микроспоры расположены в тетраде тетраэдрально или крестообразно.
Возможно образование полиспор в результате нарушений в расхождении хромосом
в ходе мейоза. Зрелое пыльцевое зерно 2-клеточное. Наблюдается прорастание
пыльцевых зерен в полости пыльника.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Оба инте-
гумента развиваются приблизительно одинаково, вырастают выше нуцеллуса
ж образуют микропиле. Внутренний интегумент 3-слойный, наружный —
2-слойный. Гипостаза образована толстостенными клетками. В районе
гипостазы проходят васкулярные пучки, идущие из фуникулуса. Археспорий
многоклеточный. Археспориальные клетки делятся на париетальную клетку
и мегаспороцит. Париетальные клетки подвергаются периклинальным и
антиклинальным делениям, в результате чего мегаспороциты оказываются
отделенными от нуцеллярного эпидермиса 3—4 слоями клеток. При наличии
нескольких материнских клеток мегаспор мейотические деления наблюдаются не более
чем в 2 клетках. Формируется линейная тетрада мегаспор. Из халазальной
мегаспоры образуется зародышевый мешок Polygonum-типа. В семяпочке обычно
развивается один зародышевый мешок; дополнительные зародышевые мешки
случайны.
Зародышевый мешок 8-ядерный. Яйцеклетка меньше синергид. Синергиды
имеют крючковидные образования. Оба полярных ядра занимают срединное
положение и сливаются в ядро центральной клетки. Положение антипод
варьирует и они перед оплодотворением дегенерируют. Оплодотворение порогамное.
После оплодотворения зародышевый мешок сильно удлиняется и доходит до
халазальной части нуцеллуса. Пыльцевая трубка сохраняется до поздних стадий
развития^ зародыша.
121
Turneraceae
'- 1—30 — Turnera ulmifolia.
1 — поперечный срез через микроспорангий, 2 археспориальпые клетки; 2—4 —
формирование стенки пыльника и спорогенной ткани; 5 — микроспороциты, тапетальные клетки;
6 — диада микроспор; 7 — тетрада микроспор; 8 — полиспора; 9 — 2-клеточное пыльцевое
зерно, прорастающее in situ; 10 — 2 мегаспороцита в семяпочке; 11 — деления в клетках
диады, причем нижняя клетка крупнее верхней; 12 — триада мегаспор с развивающейся
халазальной мегаспорой; IS — тетрада мегаспор, где средняя мегаспора развивается в
зародышевый мешок; 14 — 4-ядерный зародышевый мешок; 15 — срез через семяпочку, на
стадии 8-ядерного зародышевого мешка; 16 — 8-ядерный зародышевый мешок; 17 — зрелый
зародышевый мешок; 18 — зигота; 19—29 — последовательные стадии развития зародыша;
ВО — срез через семя. (2—7, 9 — по Mahalingappa, 1975; 8 — по Vijayaraghavan, Каш\
1966; 10 — ориг.; 11—14, 16, 17 — по Mauritzon, 1933; 15, 18—30 — по Raju, 1956).
Эндосперм нуклеарный. В
эндосперме большее число ядер и сильное
скопление цитоплазмы наблюдаются вокруг
развивающегося проэмбрио и на хала-
зальном конце зародышевого мешка.
Формирование стенок в эндосперме
центростремительное. В зрелом семени
эндосперм сохраняется.
Зигота после длительного периода
локоя делится поперечной стенкой,
образуя апикальную и базальную
клетки. Развитие зародыша Turner a
ulmifolia var. angustilia происходит
ло Onagrad-типу (Johansen, 1950). Су-
спензор зародыша очень короткий,
представлен 2 клетками и
сохраняется на более поздних стадиях
развития зародыша. Зрелый зародыш
прямой, 2-семядольный. В зародышевом
корешке хорошо развит корневой
-чехлик.
Исследованные виды. Turnera ulmifolia (=T. angustifolia).
Литература. Hofmeister, 1858; Dahlgren, 1928; Mauritzon, 1933, 1936;
Johansen, 1950; Raju, 1956; Vijayaraghavan, Kaur, 1966; Kaur, 1970; Maha-
lingappa, 1975; Kloos, Bouman, 1979; Алимова (ориг. данные).
Семейство MALESHERBIACEAE
Эмбриологически не изучено.
Пыльники 4-гнездные.
Семяпочки анатропные, плевротропные, с 2 интегументами, крассинуцел-
лятные. Наружный интегумент состоит из 2 слоев клеток, а в области микро-
пиле 3-слойный. Внутренний представлен 3 слоями клеток. Микропиле образо-
Malesherbiaceae
1 — Malesherbia scarlatiflora, 2 — M. lirana.
продольный срез через семяпочку; 2 — продольный срез семени. (1, 2
1967).
до Ricardi,
123
вано обоими интегументами. Халаза массивная, формирует вырост,
напоминающий гребень.
Семена с обильным эндоспермом, содержащим алейроновые зерна и
жировые глобулы. Центральная часть семени занята прямым 2-семядольным
зародышем.
Исследованные виды. Malesherbia scarlatiflora, M. lirana.
Литература. Harms, 1897, 1925; Netolitzky, 1926; Ricardi, 1967.
Семейство ACHARIACEAE
Эмбриологически не исследовано.
Пыльники 4-гнездные.
Семяпочки анатропные, с микропиле, направленные вниз и внутрь.
Семена с маленьким прямым зародышем, имеющим семядоли и корешокг
и с обильным мясистым эндоспермом.
Литература. Harms, 1897, 1925.
Семейство CARICACEAE
Пыльники 4-гнездные. Стенка пыльника формируется по основному типу,-
состоит из эпидермиса, фиброзного эндотеция, одного среднего слоя и
секреторного тапетума. Согласно нашим данным, у Carica papaya в сформированной
стенке наблюдаются 3 средних слоя. По мере созревания пыльника происходит
их дегенерация. К началу мейоза в микроснороцитах отмечается уплощение
клеток среднего слоя, ближайшего к тапетуму. Клетки тапетума к этому
времени уже 2-ядерные, заметно вырастают в направлении короткой оси
пыльника. В эндотеции фиброзные утолщения образуются на стадии микроспор
и только в наружной стенке пыльника. В это время наблюдается агглютинация
ядер в клетках тапетума. Из средних слоев жизнеспособным остается средний
слой, лежащий непосредственно под эндотецием. Стенка зрелого пыльника
состоит из эпидермиса и эндотеция. Мейоз в микроснороцитах проходит без*,
нарушений. Тетрады микроспор образуются симультанно, тетраэдральные.
У С. papaya наблюдаются одиночные крестообразные тетрады микроспор.
Зрелое пыльцевое зерно 2-клеточное.
Семяпочки прямые, анатропные, с 2 интегументами, крассинуцеллятные.
На ранних стадиях развития семяпочки гемианатропные; внутренний интегу-
мент растет быстрее и становится выше наружного, но на более поздних стадиях
наружный интегумент опережает в росте внутренний. Наружный интегуменг
6—8-слойный, внутренний — 4—8-слойный на стадии зрелого зародышевого
мешка. Оба интегумента участвуют в образовании микропиле. Нуцеллярные*
клетки под^ зародышевым мешком становятся толстостенными и образуют
гипостазу. В зрелых семяпочках проводящий пучок хорошо дифференцированг
от фуникулуса проходит вблизи наружного интегумента и доходит до халазыг
где сильно разветвляется. Археспорий одноклеточный, исключением является
Carica candamarcensis (Dathan, Singh, 1970), в семяпочках которого были
отмечены случаи одновременного присутствия 2 археспориальных клеток. Архе-
спориальная клетка делится периклинально, образуя первичную
париетальную клетку и мегаспороцит. Первичная париетальная клетка делится
периклинально и антиклинально, формируя массивную париетальную ткань..
В результате мейоза в мёгаспороците образуется линейная тетрада мегаспор..
Хелборн (Heilborn, 1921) отрицает наличие меротических делений в мегаспоро-
ците Carica и считает, что мегаспороцит непосредственно сам образует
зародышевый мешок. Согласно данным большинства исследователей, функционирует
халазальная мегаспора, остальные 3 дегенерируют. По данным Кратцера
(Kratzer, 1918), и халазальная, и микропиллярная мегаспоры могут стать
функционирующими. Ядро функционирующей мегаспоры подвергается 3 по-
124
1—13 — Carica papaya, 14—22 — С. candamarcensis.
1 — формирование С1енки пыльника и спорогенной ткани; 2 — сформированная стенка
пыльника, одноядерный, изредка 2-ядерный тапетум, спорогенная ткань; 3 — стенка
пыльника, 2-ядерный тапетум, микроспороциты; 4 — стенка пыльника, тетрады микроспор;
5 — стенка пыльника и одноядерная микроспора; 6 — стенка пыльника, в эндотеции
фиброзные утолщения, одноядерная микроспора; 7 — стенка зрелого пыльника и 2-клеточные
пыльцевые зерна;
следовательным митотическим делениям, образуя 2-, 4- и 8-ядерные
зародышевые мешки.
Зародышевый мешок, согласно данным большинства исследователей, моно-
сдорический, Polygonum-типа. Сформированный зародышевый мешок состоит
из яйцеклетки, 2 синергид, 2 полярных ядер, которые сливаются до
оплодотворения и лежат вблизи яйцевого аппарата, и 3 эфемерных антипод. Синер-
гиды грушевидные, с нитчатым аппаратом. Яйцевой аппарат небольшой по
12$
Caricaceae (продолжение)
Я — нуцеллус с мегаспороцитом и париетальной тканью; 9 — профаза в мегаспороците;
10 — диада мегаспор; 11 — функционирующая халазальная мегаспора и дегенерации 3
верхних мегаспор; 12 — 8-ядерный зародышевый мешок; 13 — зрелый зародышевый мешок;
14 — семяпочка на стадии сформированного зародышевого мешка; 15 — оплодотворенный
зародышевый мешок; зигота, ядерный эндосперм; 16 — участок зрелого клеточного
эндосперма; 17—21 — отдельные стадии развития зародыша; 22 — зрелый зародыш. (1—7 —
оряг.; 8—13 — по Foster, 1943; 14—22 — по Dathan, Dalbir Singh, 1970).
сравнению с большим зародышевым мешком и массивной семяпочкой. Имеется
*единственное сообщение (Heilborn, 1929), где описаны тетраспорические
зародышевые мешки у 4 видов Carica, и автор, наблюдая 5-ядерные зародышевые
мешки, классифицировал их, относя к редуцированному Lilium- или Plumba-
gella-типам. Оплодотворение порогамное, происходит приблизительно через
13—15 дней после опыления. Описаны случаи проникновения в зародышевый
jviemoK дополнительной пыльцевой трубки, которая имеет бульбообразный конец
и лежит вблизи зиготы и многоклеточного зародыша; ей приписывают гаусто-
риальную функцию.
Эндосперм нуклеарный. На ранних стадиях развития он распределяется
но периферии зародышевого мешка, центральную часть которого занимает
вакуоль. Позднее цитоплазма и ядра эндосперма аккумулируются в микро-
лилярном и халазальном концах зародышевого мешка. Параллельно в микро-
лилярном районе эндосперма образуются многочисленные, чаще безъядерные,
реже бедноядерные цитоплазматические выросты, которые сливаются друг
с другом и окончательно соединяются с общей цитоплазмой эндосперма.
Переход к клеточному состоянию в эндосперме осуществляется после накопления
в нем большого числа ядер. Формирование стенок начинается на микропиляр-
ном и халазальном концах и продвигается к центру, носит центростремительный
126
характер. Эндосперм становится полностью клеточным ко времени закладкиг
семядолей в зародыше. Клетки эндосперма первоначально вакуолизированы,
позднее начинают заполняться жирами и протеинами, но крахмал в них
отсутствует. В зрелом семени эндосперм сохраняется.
Зигота делится поперечной перегородкой. Ранние стадии эмбриогенеза'
соответствуют Onagrad-типу, но на более поздних стадиях наблюдаются
отклонения от этого типа. Согласно"Джогансену (Johansen, 1950), эмбриогенез у Са-
rica обнаруживает некоторое сходство с Trifolium-вариацией Onagrad-типа.
Зрелый зародыш тонкий, лопатчатый, с многоклеточным суспензором.
Проводящие тяжи в семядолях хорошо дифференцированы. Лейкоэмбриофит.
Семейству Caricaceae свойственна партенокарпия.
Исследованные виды. Carica candamarcensis, С. cauliflora, С. chry-
sopetala, С. papaya, С. pentagona, С. quecifolia, Jaracatia conica.
Литература. Schacht, 1858; Tieghem, 1903; Usteri, 1907; Tischler,*
1913; Kratzer, 1918; Heilborn, 1921, 1929; Sugiura, 1925, 1927; Asana, Sutaria,-
1929; Agharkar, Banerji, 1933; Schaffner, 1935; Traub, O'Rork, 1936, 1939;
Foster, 1943; Johansen, 1950; Erdtman, 1952; Singh, 1960, 1961, 1970; Vasil,
1962; Allan, 1963a, 1963b; Eng Low Lee, Rao, 1968; Dathan, Singh, 1969, 1970y
1976; Fischer, 1980; Алимова (ориг. данные).
Семейство GUCURBITACEAE
Пыльники одногнездные; попарно сросшиеся тычинки соответственно
содержат 4 пыльника и 4 микроспорангия (Cucumis, Melo, Citrullus и др.).
Сформированная стенка пыльника, развитие которой осуществляется по основному
типу, состоит из эпидермиса, однослойного эндотеция, в клетках которого по
мере созревания пыльника появляются фиброзные утолщения, 2—3 (изредка
одного) эфемерных средних слоев и однослойного тапетума. Тапетум
секреторного типа; клетки его в процессе развития становятся 2—3-ядерными.
Полиплоидные ядра в клетках тапетума наблюдаются редко. Клетки спорогенной ткани
становятся непосредственно микроспороцитами. Мейоз последних завершается
симультанным формированием тетрад как путем возникновения
центростремительных перетяжек в многоядерном микроспороците, так в ряде случаев и при
помощи вакуолей. Последние, постепенно возникая в цитоплазме микроспоро-
цита, а затем сливаясь, формируют своеобразные щели, разделяющие эту
клетку на отдельные микроспоры (Cucumis, Melo и др.). Тетрады микроспор
тетраэдральной, реже — изобилатеральной формы. Обычно они довольно рано
распадаются на отдельные одноядерные микроспоры; у отдельных видов
Gumma, Citrullus, Anguria и Dieudonnaea часть микроспор, а впоследствии и
пыльцевых зерен, длительное время остается соединенными в тетрады.. Отдельные
нераспадающиеся тетрады пыльцевых зерен наряду с массой одиночных
пыльцевых зерен наблюдаются у Lagenaria vulgaris, Bryonia dioica, Cucurbita pepo-
и Cyclanthera explodens. Зрелые пыльцевые зерна 2-клеточные. Генеративная
клетка в пыльцевом зерне обычно формируется вблизи поры и, находясь в
пристенном положении, первоначально имеет линзовидную форму. При
погружении генеративной клетки в цитоплазму вегетативной она приобретает
эллиптическую, яйцевидную или веретеновидную форму. Образование спермиев
происходит, как правило, в пыльцевой трубке.
Семяпочки у представителей Cucurbitaceae, количество которых в завязи:
тможет быть от одной (у Sechium edule и Sicyos angulatus) до 500 и более (у Melo,
Citrullus, Cucumis и др.), анатропные, с 2 интёгументами, крассинуцеллятные..
У видов рода Melo и ряда других имеется многоклеточная гипостаза. Микропиле
обычно прямое, формируется внутренним или же обоими интегументами. У
видов Melo микропиле в сформированной семяпочке бывает зигзагообразным.
Сосудистый пучок, проходя через фуникулус, входит в наружный интегумент
семяпочки и почти достигает микропилярной части последнего. Археспорий
127
Cucurbitaceae
1—8, 9—20, 22—26, 80—44 — Melo sativus (2X), 27, 28 — M. sativus (4X), 45—47 — Cucu-
mis sativus, 21, 29 — Citrullus vulgaris.
1—3 — развитие стенки пыльника в соответствии с этапами микроспорогенеза и
формирования пыльцевых зерен;
Cucurbitaceae (продолжение)
4—8 — микроспорогенез (4—6 — мейоз I, 7, 8 — мейоз II);
9 Сравнительная эмбриология
Cucurbitaceae (продолжение)
9 — симультанное разделение протопласта 4-ядерного микроспороцита при участии в этом
процессе вакуолей; 10, 11 — тетраэдральная и изобилатеральная тетрады микроспор;
12—14 — развитие пыльцевого зерна; 15 — зрелое пыльцевое зерно;
Cucurbitaceae (продолжение)
16 — археспорий, кроющие (париетальные) клетки в нуцеллусе семяпочки; 17 —
материнская клетка мегаспор (метафаза мейоза I); 18 — диада с дегенерирующей микропилярнои
клеткой; 19,21—тетрады мегаспор — линейная и Т-образная; 20 — начало развития
зародышевого мешка из эпихалазальной мегаспоры тетрады; 22 — 2-ядерный зародышевый
мешок и тетрада мегаспор;
9*
Cucurbitaceae (продолжение)
23, 24 — 4- и 8-ядерный зародышевые мешки; 25 — зрелый зародышевый мешок; 26 —
семяпочка со зрелым зародышевым мешком в нуцеллусе, зигзагообразное микропиле;
Cucurbitaceae (продолжение)
27 — 2 горизонтально расположенных мегаспороцита; 28 — 2 вертикально расположенных
мегаспороцита, разделенных колонкой кроющих клеток, производных нижнего
мегаспороцита; 29 — двойное оплодотворение:
Cucurbitaceae (продолжение)
SO—33 — стадии развития эндосаериа;'
Cucurbitaceae (продолжение)
34—43 — эмбриогенез; 44 — зрелый зародыш;
СисигЫШсеае (продолжение)
45 — развивающийся непосредственно из первичной археспориальной клетки одноядерный
генеративно-апоспорический зародышевый мешок; 46 — дифференцированный апоспориче-
екий зародышевый мешок, расположенный непосредственно под эпидермой нуделлуса
семяпочки, лишенного клювовидного микропилярного отростка; 47 — семяпочка, в нуделлусе
которой находится представленный на 46 апоспорический зародышевый мешок. (1—47 —
ориг.).
может быть либо типичным одноклеточным, либо потенциально МйШоклеточ-
ным. Первичная археспориальная клетка, как правило, отделяет париетальную
клетку, дающую начало многослойной париетальной ткани, принимающей
участие в формировании микропилярного клювовидного отростка нуцеллуса.
Мейоз мегаспороцита^ завершается обычно формированием линейной тетрады
мегаспор. В отдельных случаях (у Momordica charantia, L. vulgaris, Citrullus
vulgaris, у представителей рода Melo и некоторых других Cucurbitaceae) наряду
с линейной, наблюдается также Т-образная, обратно-Т-образная, а изредка
м изобилатеральная тетрады мегаспор. В случаях линейной или Т-образной
тетрады зародышевый мешок развивается обычно из халазальной мегаспоры
тетрады. Изредка (у Сucurbita maxima, у представителей рода Melo, у L.
vulgaris, Luffa cylindrica и Cucumis sativus) его формирование может происходить
и из эпихалазальной мегаспоры. Иногда зародышевые мешки развиваются
одновременно из халазальной и эпихалазальной мегаспор.
Зародышевый мешок развивается по Polygonum-типу, за исключением
Benincasa hispida и Citrullus fistulosus, у которых его формирование происходит
по АШит-^ипу. Отдельные случаи такого типа формирования в качестве
своеобразной аномалии наблюдались у диплоидов и колхициновых тетраплоидов
С. sativus. Яйцевой аппарат характерного строения. Синергиды имеют нитчатый
аппарат и на уровне ядер снабжены латеральными зубовидными выростами.
Яйцеклетка вытянуто-грушевидной формы, с ядром в апикальной и вакуолей
в базальной частях. Полярные ядра до оплодотворения не сливаются. Антиподы
у большинства видов эфемерные. Их бывает обычно 3, однако у S. angulatus
в редких случаях их может быть 4—5. В цитоплазме центральной клетки,
а иногда и яйцеклетки наблюдаются крахмальные зерна. Сформированный
зародышевый мешок, как правило, относительно мал по сравнению с общими
размерами нуцеллуса и расположен обычно у основания его микропилярного
клювовидного отростка. Исключением являются представители родов Thladiantha
и Biswarea, у которых зрелый зародышевый мешок занимает значительную
часть нуцеллуса. Для представителей семейства характерна порогамия.
Оплодотворение двойное и протекает по премитотическому типу.
Эндосперм формируется по нуклеарному типу. Сформированная полностью
эндоспермальная ткань почти у всех исследованных видов этого семейства
состоит из собственно эндосперма, приобретающего впоследствии клеточное
строение, и халазального эндоспермального гаустория (сикема). У Melothria
heterophylla гаусторий чрезвычайно мал и имеет вид небольшого выпячивания
в халазальной части эндосперма, у Corallocarpus conocarpus и у Ctenolepis garcini
такой гаусторий, как правило, не образуется. Процесс перехода эндосперма
из свободноядерной фазы в клеточную начинается в микропилярной его зоне
около зародыша и постепенно продвигается по направлению к халазальной
части.. У одних видов эндоспермальный халазальный гаусторий остается сво-
бодноядерным, тогда как у других приобретает клеточное строение. В
отдельных клетках собственно эндосперма, а также в гаустории иногда имеет место
явление эндомитотической полиплоидизации ядер. В цитоплазме клеток
эндосперма и в гаустории иногда наблюдается отложение небольшого количества
крахмальных зерен. В зрелом семени эндосперм отсутствует.
Развитие зародыша осуществляется преимущественно по Solanad-типу.
Для отдельных Cucurbitaceae (представители рода Citrullus и др.) характерен
и Onagrad-тип эмбриогенеза. У С. sativus и у отдельных видов рода Melo
наблюдались как Onagrad-, так и Solanad-типы. Зародыш хорошо дифференцирован.
Подвесок зародыша обычно 2-клеточный с одноядерными клетками. Зрелый
зародыш крупный, прямой, занимает весь объем семени. Лейкоэмбриофит.
В семействе отмечены различные типы апомиксиса и других аномальных
явлений. У экспериментальных полиплоидов С. sativus, С. vulgaris и некоторых
видов рода Melo в редких случаях имеет место развитие пыльцевых зерен
прямым путем из спорогенных клеток без мейоза. Явления редуцированного
партеногенеза отмечены у В. dioica, S. angulatus, а также у отдельных
представителей рода Cucurbita. Редуцированная апогаметия имеет место у С. sativus,
Melo sativus (—Cucumis melo) и М. charantia. Развитие апоспорических зароды-
137
шевых мешков только из спорогенных клеток наблюдается у триплоидов
С- vulgris и С. sativus, из спорогенных и археспориальных клеток удиплоидов
С. sativus шМ. charantia, а также у колхициновых тетраплоидов С. vulgaris.
Развитие апоспорического зародышевого мешка из клетки нуцеллуса
наблюдалось у Cucumis metuliferus. Луцеллярная эмбриония имеет место у S. angu-
latus и М. charantia. Синергидная полиэмбриония характерна для М. sativus,
Hodgsonia heteroclita, С. sativus и М. charantia.
Исследованные виды. Actinostemma tenerum, Apodanthera undu-
lata, Benincasa hispida, Biswarea tonglensis, Blastania fimbristipula, Bryonia
alba, B. dioica, B. melanocarpa, Bryonopsis laciniosa, Citrullus colocynthis,
С colocynthoides, C.fistulosus (=Praecitrullus fistulosus), С vulgaris (=C. la-
natus), Coccinia cordifolia, C. indica (—Cephalandra indica), Corallocarpus cono-
carpus, C. epigaeus, Ctenolepis cerasiformis, С garcini (—Blastania garcini),
Cucumis anguria, C. callosus, С ficifolius, Q. metuliferus, С myriocarpus,
С. prophetarus, С sativus, Cucurbita ficifolia, С. maxima, С mixta, С moschata,
С pepo, Cyclanthera explodens, C. pedata, Dactyliandra welwitschii, Dicoelo-
spermum ritchiei, Ecballium elaterium, Echinocystiswrightii, Edgaria darjeelingen-
sts, Fevillea cordifolia, Gymnopetalum cochinchinense, Herpetospermum caudigerum,
IT. pedunculosum, Hodgsonia heteroclita, Lagenaria vulgaris, Luff a acutangula,
L. cylindrica, L. echinata, L. graveolens, L. hermaphrodita, Marah macrocarpusy
Melo agrestis, M. ameri, M. chandalak, M. sativus, M. zard, Melothria hetero-
phylla, M. leiosperma, M. leucocarpa, M. maderaspatana, M. pendula, M. scabra,
Micrampelis lobata, Momordica balsamina, M. charantia, M. cochinchinensis,
Sechium edule, Sicyos angulatus, Thladiantha calcarata, T. dubia, Trichosanthes
anguina, T. bracteata, T. cucumerina, T. dioica, T. lobata.
Литература. Brongniart, 1827; Mirbel, 1829; Nageli, 1842; Facchini,
1844; Schleiden, 1844; Garreau, 1849; Hofmeister, 1849; Luerssen, 1869;
Warming, 1873; Hohnel, 1876; Longo, 1901, 1903a, 1903b, 1904; Lloyd, 1904; Kirk-
wood,. 1905, 1906, 1907; Bitter, 1906; Tillman, 1906; Mont anelli,. 1907; Kratzer,
1918; Reiche, 1921; Hagedoorn A. C, Hagedoorn A. L., 1924; Castetter, 1926,
Heimlich, 1927a, 4927b, 1929* Judson, 1929; Miller, 1929; Passmore, 1930; Asana,
Sutaria, 1932; Banerji, Das, 1937; Soueges, 1939; Traub, O'Rork, 1939; Gustaf-
son, 1942; Mann, 1943; Scott, 1943a, 1943b, 1953; Young, 1943; Charkavorty,
1947; Lauber, 1947; McLean, 1947; Mann, Robinson, 1950; Paliwal, 1950; Алиева,
1952; Singh В., 1952, 1953; Chopra, 1953a, 1953b, 1954, 1955, 1965; Tschermak-
Woess, Hasitschka, 1953, 1954; Гуляев, 1955, 1961, 1962, 1963; Singh D., 1955a,
1955b, 1956, 1957, 1961a, 1961b, 1963, 1964a, 1964b, 1964c, 1965a, 1965b, 1967,
1971, 1972; Vazart, 1955; Weiling, Schagen, 1955; Schagen, 1956; Agrawal, Singh,
1957;> Johri, Ghowdhury, 1957; Ghorpa, Agarwal, 1958, 1960; Crete, 1958a, 1958b,
1960, 1962; Schloms, 1958; Singh S. N., 1958; Turala, 1958, 1960, 1962, 1963,
1966a, 1966b, 1969, 1971a, 1971b; Vasil, 1960, 1962;' Дзевалтовский, 1961,
1963a, 19636, 1963b, 1964, 1965, 1967, 1968a, 19686, 1968b, 1968r, 1969a, 19696,
1970a, 19706, 1970b, 1971a, 19716, 1971b, 1972, 1973, 1974, 1975, 1976, 1977a,
19776, 1979a, 19796, 1980, 1981; Enzenberg, 1961; Kubicki, 1962; Medina, 1962;
Zahur, 1962; Раси-Заде, 1964, 1965, 1966, 1967, 1974; Загорчева, Молхова,
1965, 1976; Чалахян, 1965; Пащенко, 1966; Mihov, Zagorcheva, 1966; Dzeval-
tovsky, 1968a, 1968b; Михов, Загорчева, Генчев, 1968, 1971; Дзевалтовский,
Шайтан, 1969; Загорчева, 1969а, 19696, 1972, 1976; Молхова, Загорчева, 1969;
Дзевалтовский, Санкин, 19.71; Худяк, Попова, 1971; Varghese, 1971; Ашурме-
тов, Саидов, 1972,1975; Жалалов, 1972, 1973; Singh D., Dathan, 1972a, 1972b,
1973а, 1973b, 1974a, 1974b, 1976; Худяк, Заславський, 1972; Ашурметов,
1973, 1974а, 19746; Дзевалтовский, Литвиненко, 1973; Дзевалтовский,
Муратов, Жалалов, 1973а, 19736, 1973в; Жалалов, Дзевалтовский, 1973, 1975;
Муратов, Дзевалтовский, Жалалов, 1973; Яковлев, Жукова, 1973; Саидов,
Ашурметов, Дзевалтовский, 1975; Дзевалтовский, Ашурметов, 1976;
Дзевалтовский, Жалалов, 1976, 1978; Кордюм, Глущенко, 1976; Кордюм, 1978;
Попов, 1978; Санкин, Рыжов, 1978; Загорчева, Михов, Александрова, 1978;
Дзевалтовский (ориг, данные).
Порядок 33. BEGONIALES
Семейство DATISCACEAE
Пыльник 4-гнездный, очень симметричный на поперечном срезе,
раскрывается продольно. Гнезда объединены в 2 теки и перед созреванием пыльника
попарно сливаются в результате разрушения перегородки между ними.
По нашим данным, у Datisca cannabina * стенка пыльника развивается по
основному типу. Археспориальные клетки, делясь периклинально, отделяют
кнаружи первичный париетальный слой, формирующий стенку пыльника, а ко-
внутри — спорогенный. Первичный париетальный слой делится периклинально
на 2 вторичных париетальных слоя, которые в свою очередь делятся
периклинально и формируют 4 слоя: тапетум, 2 средних слоя и эндотеций. В тапетуме
проходят антиклинальные деления, увеличивающие число клеток в слое, а в
среднем слое, примыкающем к тапетуму, — периклинальные, увеличивающие
число средних слоев. Сформированная стенка пыльника состоит из эпидермиса,
эндотеция, 2—3 средних слоев и тапетума. Тапетум клеточный секреторный,
морфологически однородный по всей окружности гнезда пыльника,
однослойный, клетки его становятся 2-ядерными на стадии профазы мейоза в микро-
спороцитах. Средний слой, примыкающий к тапетуму (или 2 слоя), эфемерный,
а слой, примыкающий к эндотецню, сохраняется и в зрелом пыльнике; на
ранних стадиях в них имеется крахмал: Эндотеций состоит из крупных, рано
дифференцирующихся клеток, в них вначале наблюдается крахмал, а на поздних
стадиях — липиды и танины. Фиброзные утолщения образуются в эндотеций,
в сохраняющемся среднем слое и в ткани связника, непосредственно
расположенной под гнездами. Таким образом, фиброзные слои окружают каждую теку
со всех сторон. В эпидермисе на ранних стадиях имеется крахмал, на более
поздних — наружная поверхность его покрывается кутикулой, имеющей
зубчатый профиль. В зрелом пыльнике стенка состоит из эпидермиса и фиброзных
эндотеция и среднего слоя. Спорогенные клетки многократно делятся митоти-
чески и формируют массивную ткань. С прекращением митозов клетки^споро-
генной ткани и их ядра увеличиваются в размерах, в оболочках постепенно
откладывается каллоза^ они становятся микроспороцитамии вступают в мейоз.
Тетрады микроспор образуются симультанно, причем мейоз проходит синхронно
в пыльниках всего цветка. Тетрады тетраэдральные, реже изобилатеральные.
Деление ядра микроспоры происходит, когда они еще не разобщены из тетрад,
но уже имеют каждая свою оболочку. Зрелые пыльцевые зерна одиночные или
в рыхлых тетрадах, 2-клеточные. Генеративная клетка удлиненной формы,
с ярко красящимся ядром, расположена рядом с ядром вегетативной клетки.
Цитоплазма пыльцевого зерна , заполнена липидами.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
сформировано обоими интегументами, с экзостомом и эндостомом,
расположенными зигзагообразно. Интегументы тонкие — по 2 слоя каждый, слегка
утолщающиеся в районе микропиле. Клетки наружного эпидермиса наружного
жнтегумента уже со стадии мегаспороцита увеличиваются и вакуолизируются.
В семяпочке со зрелым зародышевым мешком они особенно крупные, с
утолщенными оболочками. Имеется фуникулярный обтуратор, представленный
крупными вакуолизированными клетками. Проводящий пучок, в котором
дифференцируются кольчатые сосуды, по фуникулусу доходит до халазы. Халаза
нормальная, гипостаза не выражена. Археспорий одноклеточный (в редких
случаях 2-клеточный). Археспориальная клетка отчленяет париетальную клетку,
которая делится периклинально и образует 3—5-слойную париетальную ткань,
и спорогенную, непосредственно становящуюся мегаспороцитом. Апикальные
клетки эпидермиса нуцеллуса делятся периклинально один раз, образуя 2-слой-
* Материал собран Р. В. Камелиным в Таджикистане в 1979 и 1980 гг.
№
Datiscaceae ч
1—45 — Datisca саппаЫпа.
T—T2 — развитие пыльника и пыльцевого зерна: 1, 2 — начало формирования стенки
пыльника и спорогенной ткани, 3, 4 — завершение формирования стенки пыльника и
многоклеточной спорогенной ткани, дифференциация тапетума, За, 4а — поперечные срезы
пыльников на этих стадиях,
вый* нуцеллярный колпачок (Mauritzon, 1936; Crete, 1952a). Однако подобного
явления, мы не наблюдали в нашем материале. Здесь одна или 3 клетки
эпидермиса нуцеллуса, расположенные под микропиле, увеличиваются, разрастаясь
радиально, становятся густоплазменными и заметно отличаются от остальных
клеток нуцеллуса уже со стадии 4—8-ядерного зародышевого мешка. В
результате мейоза I образуется диада, мейоз II не сопровождается цитокинезом,
и: халазальная клетка диады становится материнской клеткой биспорического
зародышевого мешка, развивающегося по Allium-типу.
Зародышевый мешок 8-ядерный, 7-клеточный. Клетки яйцевого аппарата
даафференцированы, довольно крупных размеров. Синергиды грушевидные,
с выступами-аацепками и хорошо выраженным нитчатым аппаратом. Полярные
140
* Datiscaceae (продолжение)
о— фрагмент пыльника и 5а — поперечный его срез на стадии микроспороцито.в,
слои стенки дифференцированы, тапетум с 2-ядерными клетками, 6—8 — мейоз I в микро-
спороцитах, окруженных каллозной оболочкой, 9 — фрагмент пыльника и 9а — его
поперечный срез на стадии одноядерных микроспор, сохраняющих положение тетрад, 10—
отдельная тетрада микроспор, 11 — фрагмент зрелого вскрывшегося пыльника, в стенке —
фиброзные эндотеций и средний слой, 11а — поперечный срез этого пыльника,
штриховкой показано положение фиброзных слоев, 12 — зрелое 2-клеточное пыльцевое зерно;
Datiscaceae (продолжение)
13 — археспориальная клетка в нуцеллусе семяпочки; 14 — отделение париетальной клетки;;
15—19 — мегаспорогенез (16 — семяпочка со спорогенной клеткой, 17 — семяпочка с
мегаспор оцитом);
ядра вступают в контакт в центре или в нижней трети зародышевого мешка,,
но перед слиянием они всегда располагаются под яйцевым аппаратом, сливаются
перед или во время оплодотворения. Антиподы — 3 маленькие эфемерные
клетки. Отмечено развитие 2 зародышевых мешков в семяпочке до 2-ядерной
стадии, что объясняется преобразованием 2 спорогенных клеток в равноценные
мегаспороциты (Crete, 1952a). Имеют место порогамия и двойное оплодотворение.
Эндосперм нуклеарный. Ядерная стадия наблюдается до момента выделения
в проэмбрио гипофизарной клетки. Клеткообразование в эндосперме
начинается с микропилярной части. В зрелом семени эндосперм отсутствует.
Эмбриогенез соответствует Onagrad-типу. Развитие зародыша чрезвычайно
регулярное и точно прослеживается. Дифференциация в зародыше четкая,,
сходна с таковой у Capsela bursa-pastoris, но отличается наличием короткого
(2—3-клеточного) суспедзора (Crete, 1952b). Зрелый зародыш прямой, с
выраженной точкой роста, корешком, семядолями и прокамбиальными тяжами.
Зародыш занимает весь объем семени. Лейкоэмбриофит.
Исследованные виды. Datisca cannabina, Tetrameles nudiflorct
(фрагментарно).
142
ш
Datiscaceae (продолжение)
20—24 — развитие зародышевого мешка Allium-типа; 25 — семяпочка со зрелым
зародышевым мешком;
Datiscaceae (продолжение)
26 — оплодотворение; 27—43 — развитие зародыша; 44 — зрелый зародыщ в семени►
(в, т — внутренний тапетум, н. т — наружный тапетум, п. с — париетальный слой, с. ш —
спорогенная ткань, с. с — средний слой, энд — эндотеций). (1—12, 16, 17, 20—24, 25 —
ориг.; 13—15, 18, 19, 26 — по Crete, 1952а; 24 — по Mauritzon, 1936; 27—43 — по Crete,
1952b; 44 — по Montemartini, 1905).
Литература. Montemartini, 1905; Himmelbaur, 1909; Sandt, 1921;
Mauritzon, 1936; Crete, 1951, 1952a, 1952b; Erdtman, 1964; Leins, Bonnery-
Brachten, 1977; Камелина (ориг. данные).
Семейство BEGONIACEAE
Пыльники 4-гнездные, вскрываются продольно, редко порами.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, 2 средних слоев,
и тапетума. В клетках эндотеция образуются фиброзные утолщения. Тапетум
секреторный, 2-ядерный. Средние слои нерегулярные, эфемерны. По нашиж
данным, у Begonia manicata * развитие стенки пыльника происходит по
основному типу. В клетках эпидермиса, эндотеция, в некоторых клетках,
окружающих связник, идет постепенное накопление дубильных веществ, и к моменту
созревания пыльника эти клетки полностью заполнены танинами. На
внутренних стенках тапетума обнаруживаются орбикулы. Тетрады микроспор
тетраэдральные, реже крестообразные, формируются по симультанному типу.
Зрелые пыльцевые зерна одиночные, 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Наружный,
и внутренний интегументы состоят из 2 слоев клеток. Микропиле образовано*
обоими интегументами. Нуцеллус представлен 2 слоями клеток вокруг
материнской клетки мегаспор. По мере развития зародышевого мешка клетки внутрен-
* Материал собран в оранжерее БИН АН СССР (Ленинград).
144
Ведопгасеае
1—18 — Begonia manicata, 19—24, 37 — В. crenata, 25—36 — В. semperflorens.
1—6 — формирование стенки пыльника, микроспор огенез и развитие-пыльцевого зерна;
7 — схема пыльника, на которой отмечено расположение клеток, заполненных танинами;..
Ю Сравнительная эмбриология
Begoniaceae (продолжение)
ft—J8 — развитие семяпочки, мегаспор огенез и развитие зародышевого мешка;
Begoniaceae (продолжение)
19—24 — развитие эндосперма; 25—86 — развитие зародыша; 87 — поперечный срез
зрелого семени. (1—18 — ориг.; 19—24, 37 — по Swamy, Parameswaran, 1960; 25—36 — по
Soueges, 1939).
него слоя нуцеллуса дегенерируют, сохраняясь лишь в области антипод.
Боковые клетки наружного слоя нуцеллуса радиально удлиняются и
функционируют продолжительное время. Археспорий одноклеточный, делясь перикли-
нально образует спорогенную клетку, которая становится непосредственно
мегаспороцитом, и первичную париетальную клетку. Тетрада мегаспор
линейная, у В. manicata (по нашим данным) — Т-образная.
Моноспорический зародышевый мешок развивается из халазальной
мегаспоры по Polygonum-типу. Зрелый зародышевый мешок удлиненно-овальной:
формы с узким халазальным концом. Яйцевой аппарат дифференцирован.
10* 147-
Яйцеклетка имеет базальную вакуоль; синергиды грушевидные, с апикальными
вакуолями.и нитчатым аппаратом. В яйцеклетке имеется крахмал. Антиподы —
3 небольшие клетки, сохраняются до оплодотворения. Полярные ядра сливаются
перед оплодотворением и располагаются вблизи яйцевого аппарата.
Эндосперм нуклеарный. После первых 2—3 делений ядра эндосперма
располагаются на полюсах в равных количествах и окружены густой цитоплазмой.
Цри последующих делениях ядра более или менее равномерно распределяются
в периферическом слое цитоплазмы. Клеткообразование в эндосперме
начинается при наличии 30—40 свободных ядер. Сначала возникает один
периферический слой эндосперма, клетки которого затем делятся периклинально,
формируя второй слой. Наружный слой эндосперма позднее дифференцируется в
алейроновый. Производные внутреннего слоя интенсивно делятся, заполняя посте-
ценно всю полость клетками. В процессе развития зародыш поглощает весь
эндосперм, за исключением алейронового слоя.
Развитие зародыша исследовано у В. semperflorens (Soueges, 1939) и В. сге-
jiata (Swamy, Parameswaran, 1960) и соответствует Lythrum-вариации Onagrad-
-типа. Зародыш в зрелом семени имеет крупные семядоли, которые занимают
весь объем семени.
Исследованные виды. Begonia crenata, В. cuculata, В. dregei,
В. floeberi, В. heracleifolia, В. hirtella, В. incana, В. manicata, В. richmondiana,
J5. scharfii, В. schmidtiana, В. semperflorens, В. thuberhybrida, В. tuberosa, Hil-
lebrandia sandwicensis.
Литература. Miiller, 1847; Hofmeister, 1849; Warming, 1878; Elfving,
1879; Jonsson, 1879—1880; Soltwedel, 1882; Goebel, 1886; Wille, 1886; Sandt,
1921; Pastrana, 1932; Mauritzon, 1936a; Mereminski, 1936; Soueges, 1939; Swamy,
Parameswaran, 1960; Preil, Keyser,; 1976; Анисимова (ориг. данные).
Порядок 34. GAPPARALES
Семейство TOVARIACEAE
Эмбриологически исследовано недостаточно. Пыльники 2-гнездные.
Развитие стенки пыльника не описано. Тапетум секреторный. Образование микроспор
симультанное. Зрелая пыльца 2-клеточная.
Семяпочка с 2 интегументами, крассинуцеллятная. Шюрхоф (Schurhoff, 1926)
определяет семяпочку Tovaria pendula как анатропную, а Мауритцон (Maurit-
zon, 1934) как кампилотропную. По рисункам, приводимым Мауритцоном, можно
заключить, что с*емяпочка Tovaria анакампилотропная с длинным фуникулусом,
а после оплодотворения становится анаамфитропной. Наружный интегумент
;2-слойный, внутренний 3-слойный. Микропиле зигзагообразной формы,
образовано 2 интегументами.
Археспориальная клетка отделяет первичную париетальную, которая в
дальнейшем многократно делится. Мегаспороцит один. Тетрада мегаспор линейная.
Зародышевый мешок Polygonum-типа, развивается из халазальной мега-
юпоры. Синергиды с боковым клювовидным выростом и нитчатым аппаратом.
Полярные ядра сливаются вблизи яйцевого аппарата. 3 небольшие антиподы
^эфемерны. Зрелый зародышевый мешок окружен по бокам 3 слоями нуцеллуса.
Эндосперм нуклеарный. В зрелом семени сохраняется.
IB результате первых 2 делений зиготы образуются 3 проэмбриональные
-клетки, расположенные линейно. Дальнейшее развитие проэмбрио и зародыша
не исследовано. В зрелом семени зародыш крупный, изогнутый, содержит
„масло и окружен толстым слоем эндосперма.
Исследованный вид. Tovaria pendula.
Литература. Schurhoff, 1926; Mauritzon, 1934; Hutchinson, 1973,
Tovariaceae
1—6 — Tovaria pendula.
Ш — одноядерный зародышевый мешок; 2—3 — нуцеллус с 4-ядерным и зрелым
зародышевым мешком (антиподы .разрушены); 4—6 — развитие семяпочки'. (1—6 — по Mauritzon,
1934).
149
Семейство CAPPARACEAE
Пыльники 4-гнездные, с интрорзной ориентацией, вскрываются продольно^
В каждом гнезде дифференцируется многоклеточный субэпидермальный
археспорий, клетки которого, делясь периклинально, формируют первичный
париетальный слой и спорогенные клетки. После ряда периклинальных делении
первичные париетальные клетки образуют от 4 до 7 слоев стенки под
эпидермисом пыльника, а из спорогенных клеток развиваются микроспороциты. Стенка
пыльника у Cleome viscosa формируется по двудольному типу (Fathima, Kumarir
1970), а у Gynandropsis pentaphy Па т&петум является конечным продуктом
дифференциации париетальных слоев, т. е. развитие соответствует однодольному
типу (Raghavan, 1938). Сформированная стенка пыльника состоит из
эпидермиса, 1—2 (у CI. viscosa, CI. monophilla, CI. iberica ж G.pentaphyПа) или 3—5
средних слоев (у Crataeva nurvala и Capparis decidua) и тапетума. Эндотеций
однослойный, фиброзный. У Cadaba indica фиброзные утолщения развиваются также
в клетках среднего слоя, прилежащего к эндотецию (Narayana, 1965), что
наблюдается у Capparis spinosa и Gynaridropsis speciosa (наши данные). У CI. viscosa
все клетки со стороны связника имеют фиброзные пояски (Fathima, Kumarir
1970). Средние слои обычно эфемерны, и первым разрушается внутренний:
слой, граничащий с тапетумом. Тапетум клеточный секреторный, 2—4-ядерный^
с вариациями у различных видов. На поздних стадиях наблюдаются ядерные»
слияния и образование полиплоидных ядер. У Cadaba и Crataeva тапетум
нерегулярно 2-слойный. Наличие орбикул на внутренних стенках тапетума
обнаружено нами у G. speciosa. Стенка зрелого пыльника состоит из эпидермиса и
эндотеция. Образование микроспор симультанное, тетрады тетраэдральные или
крестообразные. По нашим данным, у G. speciosa тетрады окружены каллозным;
чехлом. Зрелая пыльца 2-клеточная (Cadaba и Crataeva) или 3-клеточнаяг
(у CI. viscosa, иногда у Crataeva), изредка, как у С. decidua, прорастает in situ
(Narayana, 1962), содержит крахмал.
Семяпочки анакампилотропные, кроме Crataeva (Narayana, 1965) и G.
speciosa (наши данные), где семяпочки анатропные, с 2 интегументами, красси-
нуцеллятные. Внутренний интегумент дифференцируется первым, но
впоследствии отстает в росте от наружного, растущего быстрее на дорсальной стороне-
семяпочки. Наружный интегумент остается постоянно 2-слойным, кроме области:
вблизи фуникулуса и микропиле, где он многослойный, или разрастается
незначительно (Crataeva). Внутренний 3-слойный интегумент впоследствии
разрастается в толщину. В наружном слое внутреннего интегумента у CI. iberica^
и CI. lypskyi после оплодотворения нами отмечено наличие кристаллов
щавелевокислого кальция. Микропиле загзагообразной формы, образуется обоими
интегументами или только наружным — у С. spinosa (наши данные), у которого
края внутреннего интегумента смыкаются после оплодотворения. У С. decidua
наблюдалось развитие 2 семяпочек на одном фуникулусе и 2 нуцеллусов
с общими покровами (Narayana, 1962). 2 семяпочки описаны также для Isomeric
arborea (Khan, 1950). У С. decidua и Crataeva дифференцируется гипостаза.
Проводящий пучок доходит до халазы. У 3 родов в семействе обнаружено
несколько трахеид, рассеянных по нуцеллусу (Имс, 1964). Эпидермис нуцеллуса
у микропиле формирует нуцеллярный колпачок, сохраняющийся в зрелом
семени. Археспорий одноклеточный у большинства видов или многоклеточный:
у Crataeva, С. decidua (Narayana, 1962, 1965) и G. speciosa (наши данные). Пер-
Саррагасеае
1, 12, 17—18, 23 — Capparis spinosa, 2—11, 13—16 — Crataeva nurvala, 19—21, 25, 26, 33 —
Capparis decidua, 22, 27—32 — Cadaba indica, 24, 34—41 — Cleome iberica.
1 — фрагмент пыльника со сформированной стенкой и с пор огенной тканью; 2 — часть*
пыльника на стадии материнских клеток микроспор; 3 — стенка пыльника на стадии тетрад,
микроспор; 4, 5 — I и II деления мейоза; 6,7 — тетраэдральная и крестообразная тетрады
микроспор; 8 — ядро микроспоры в делении; 9 — 2-клеточная пыльца; 10 — 3-клеточная:
пыльца; 11 — схема строения пыльника после вскрывания (отмечено место растрескивания)^
.750
Capparaceae (продолжение)
12 — стенка зрелого пыльника и зрелая 2-клеточная пыльца; 13—16 — различные стадиж
развития семяпочки; 17 — часть семяпочки с мегаспороцитом и 3 париетальными клетками;;
18 — семяпочка, на стадии тетрад мегаспор; 19—21 — развитие зародышевого мешка; 22 —
зрелый зародышевый мешок; 23 — схема семяпочки на стадии зрелого зародышевого мешка;;
24 — схема строения семяпочки на стадии зиготы и многоядерного эндосперма; 25 —
зародышевый мешок с зиготой и первичным ядром эндосперма; 26 — 8-ядерный эндосперм;
27^—32 — различные стадии эмбриогенеза Garyophyllad-типа; 33 — продольный разрез?
зрелдго семени;
■•:-v.:;.VV.:::--- 47
Capparaceae (продолжение)
«34—39 —^ различные стадии эмбриогенеза Onagrad-типа; 40 — микропилярная часть
семяпочки на стадии зиготы; 41 — то же на стадии шаровидного зародыша; в наружном слое
внутреннего интегумента видны кристаллы щавелевокислого кальция. (1, 12, 17, 18, 23—24,
«34—41 — ориг.; 2—11, 13—16, 22, 27—32 — по Narayana, 1965; 19—21, 25, 26, 33 — по
Narayana, 1962).
вичные париетальные клетки отделяются ко времени дифференцировки
инициален интегументов и, делясь периклинально, образуют от 2,до 7 слоев
париетальной ткани. Мегаспороцит один. Тетрады мегаспор линейные или
Т-образные. Описаны случаи образования триад вследствие ранней дегенерации
верхней клетки диады (Raghavan, 1938; Maheshwari, Khan, 1953; Narayana, 1962).
Зародышевый мешок Polygonum-типа, развивается из халазальной
мегаспоры. У CL spinosa отмечено развитие двух 2-ядерных зародышевых мешков
153
из микропилярной и халазальной мегаспор одной тетрады, а также двух 4-ядер-
ных, лежащих рядом (Mauritzon, 1934). Зрелый зародышевый мешок расширеш
в микропилярной части и сужен в халазальной, реже он имеет эллиптическую»
форму (Cadaba), всегда приурочен к микропилярной части нуцеллуса.
Антиподы небольшие и дегенерируют перед оплодотворением (Crataeva, Cadaba,.
С. decidua) или вскоре после него. Синергиды с нитчатым аппаратом и боковым
выростом. Полярные ядра сливаются вблизи яйцевого аппарата. В центральной:
клетке зародышевого мешка отмечено наличие крахмала (Capparis frondosa,^
С. rupestris., G. peritaphylla, Crataeva, CI. viscosa). Двойное оплодотворение
наблюдалось у С. nurvala (Narayana, 1965). Характерна порогамия. Одна из синергид:
разрушается после вхождения пыльцевой трубки, вторая может существовать,
до деления первичного ядра эндосперма или до шаровидной стадии зародыша
(Crataeva).
Эндосперм нуклеарный. Первичное ядро эндосперма делится вскоре после
оплодотворения, перемещаясь перед этим в нижнюю часть зародышевого мешка.
Первые деления ядер синхронны, позднее синхронность нарушается. Клетко-
образование начинается в микропилярной части на стадии заложения периблемы
и плеромы в зародыше (Cadaba и Crataeva) или на поздней глобулярной стадии;
(Capparis). В зрелом семени сохраняется от 3 до 12 слоев эндосперма со стороны
внутренней кривизны семени и от 2 до 6 слоев в других местах, запасное
вещество — крахмал.
Зигота продолжительное время находится в состоянии «покоя»,
незначительно разрастаясь в длину. Описаны различные типы эмбриогенеза: Onagrad-
тип Capsella-вариации для CI. chelidonii (Raghavan, 1937) и наблюдается, по
нашим данным, у CI. iberica; у CI. graveolensnG. pentaphylla в связи с
отклонениями в способе дифференциации гипофиза эмбриогенез Onagrad-типа
соответствует Myosurus-вариации (Crete, 1951; Phouphas, 1952); Solanad-тип
наблюдался у Crataeva (Narayana, 1965) и Isomeris (Sachar, 1956); Caryophyllad-тип
был отмечен для Cadaba (Narayana, 1965). Кроме того, в эмбриогенезе С.
decidua обнаружена комбинация нескольких типов: нитевидный 4-клеточный
предзародыш соответствует Solanad-типу, дифференцировка квадрантов следует^
по Onagrad-типу, а большая часть тела зародыша развивается по Caryophyl-
lad-типу (Narayana, 1962). В зрелом семени зародыш крупный, согнутый,
занимает почти все семя. Семядоли сложены и свернуты или закручены спирально^
(Capparis). Хлороэмбриофит.
У С. frondosa обнаружена нуцеллярная полиэмбриония (Mauritzon, 1934).
Исследованные виды. Cadaba indica, Capparis aphylla, C.
decidua, С. frondosa, С. galeata, С. horrida, С. rupestris, С. sepiaria, С. spinosa, Cleome-
aspera, CI. canescens, CI. chelidonii, CI. graveolens, CI. iberica, CI. lypskyi, CI. rno-
nophylla, CI. serrata, CI. spinosa, CI. tenella, CI. violacea, CI. viscosa, Crataeva
nurvala, Dactylaena micrantha, Gynandropsis pentaphylla, G. speciosa, Isomeric
arborea, Maerua arenaria, Polanisia graveoles, P. trachysperma.
Литература. Mauritzon, 1934; Hedayetullah, 1935; Rao V. S., 1936aT
1936b; Raghavan, 1937, 1938; Rao A. V., 1937; Rai, 1939; Khan, 1950; Crete,.
1951; Phouphas, 1952; Maheshwari, Khan, 1953; Maheshwari, Sachar, 1954,
1955; Sachar, 1956; Vaidya, 1961; Narayana, 1962, 1965, 1970; Fathima, Kumari,.
1970; Rao P. S., Rao В. Н., 1975, 1976; Родионова (ориг. данные).
Семейство BRASSICACEAE (CRUCIFERAE).
Пыльники 4-гнездные, объединены попарно в 2 теки, раскрываются
продольно по интрорзному или же наружные по интрорзному, а внутренние по
экстрорзному типу (Diplotaxis и Berteroa). Формирование стенки пыльника
проходит как в центростремительном — по типу однодольных (Heliophila), так и
в центробежном — по типу двудольных (Hesperis, Eruca, Lepidium и Syrenia)>
направлениях. Сформированная стенка пыльника состоит из эпидермиса, эн~
154
Brassicaceae (Cruciferae)
1—10, 20—23 — Alliaria officinalis, 11, 28, 29 — Hesperis steveniana, 12, 14 — Bunias orien-
ialis, 13, 44—47 — Lunaria annua, 15 — Berteroa incana, 16—19 — Heliophila amplexicaulis,
24 — Isatis tinctoria, 25 — Erysimum pannonicum, 26, 27, 48 — Syrenia сапа, 30—43 —
Arabidopsis thaliana.
1—3, 5 — развитие пыльника; 4—9 — микроспорогенез и микрогаметогенез; 10 — фрагмент
зрелого пыльника с 3-клеточными пыльцевыми зернами; 11 — поперечный срез части пыль-
яика с развитием стенки по типу двудольных; 12 — фрагмент, пыльника, где тапетум
реорганизован в ложный периплазмодий;
Brassicaceae (продолжение)
13—15 — продольно-осевые срезы развивающихся семяпочек с одним и 2 мегаспор оцитами^
и многоклеточным археспорием; 16,17 — продольный разрез нуцеллуса с Т-образной
тетрадой мегаспор и на стадии 7-клеточного зародышевого мешка; 18 — зрелый зародышевый
мешок; 19 — семяпочка на стадии зрелого зародышевого мешка; видны первые 2-ядерньга-
клетки внутреннего интегумента;
дотеция, 1—2 средних слоев и тапетума. В клетках эндотеция образуются
фиброзные утолщения. Средний слой эфемерный и лизируется обычно к концу
мейоза. При наличии 2 средних слоев их дезинтеграция осуществляется
неодновременно или же разрушается только внутренний, а клетки наружного
приобретают фиброзные утолщения и сохраняются в зрелом пыльнике (Diplotaxisr
I satis, Hesperis и Lunaria). Тапетум секреторного типа, одноядерный, 2-ядер-
ный или многоядерный, однослойный со стороны эпидермиса пыльника и 1 —
2-слойный со стороны связника. У большинства исследованных видов клеточное-
строение тапетума сохраняется до образования 2-клеточной пыльцы. У
отдельных видов (Arabisr Bunias и Hesperis) в постмейотический период происходит
реорганизация клеточного секреторного тапетума в ложный периплазмодий.
У Alliaria officinalis остатки клеток тапетума наблюдаются до начала
образования 3-клеточной пыльцы. У большинства видов стенка зрелого пыльника
2-слойная, состоит из эпидермиса и эндотеция, реже 3-слойная (эпидермис,,
фиброзный эндотеций и средний слой). В клетках стенки пыльника содержатся
пластиды и крахмал (Berteroa и Alliaria). Спорогенная ткань пыльников
многослойная. В результате симультанного микроспорогенеза формируются
тетраэдральные, крестообразные, реже изобилатеральные тетрады микроспор.
Каллозные оболочки различной толщины, часто образуют кристы {СгатЪе
15Т
Brassicaceae (продолжение)
.24 — семяпочка на стадии зрелого
-зародышевого мешка; 25 — развитие
нескольких зародышевых мешков
в одном нуцеллусе; 26, 27 — двойное
оплодотворение; 28, 29 — микропи-
лярная часть зародышевого мешка
с 2 пыльцевыми трубками и одним
из 2 первых ядер эндосперма; в ядре
яйцеклетки идет погружение спер-
мия; 29 — схема того же
зародышевого мешка;
30\ / 31
Brassicaceae (продолжение)
30—43 — последовательные этапы развития
зародыша по Onagrad-типу Capsella-ва-
риации;
JBrassicaceae (продолжение)
44—47 — эмбриогенез, отклоняющийся от Capsella-вариации и приближающийся к Myosu
Tus-вариации; 48 — полиэмбриония. (1—10,15, 20—24, 26, 27, 48 — рис. Беляевой; 11—14Г
16—19, 25, 28, 29, 44—47 — рис. Родионовой; 30—43 — по Яковлеву, Алимовой, 1976)'
abyssinica и A. officinalis). Зрелые пыльцевые зерна 3-клеточные, содержат
крахмал, жир, флавоноиды. Спермин с телофатическими ядрами, веретеновид-
ной формы или слегка изогнутые, длиной от 3 до 6 мкм. Вегетативное ядро всегда
выходит в пыльцевую трубку. Из аномалий отмечена возможность
формирования пыльцевых гнезд в лепестках венчика (Matthiola incana и Erysimum mar-
Achallianum).
Семяпочек в завязи от 1 —2 (Bunias, Crambe, Megacarpaea и Succowia) до
нескольких десятков (Diplotaxis, Erysimum и Sisymbrium). Семяпочка анаам-
фитропная (Arabidopsis, Isatis и Lepidium), анакампилотропная (Hesperis,
Arabis, Bunias, Biscutella, Eruca, Lunaria и др.), с 2 интегументами, тенуину-
целлятная, крассинуцеллятная или переходного типа. Микропиле
зигзагообразной формы, различной длины, образовано 2 интегументами. Сосудистый
-пучок, входящий через фуникулус, заканчивав! ся в хал азе. При формировании
■семени происходит разрастание в толщину внутреннего интегумента, тогда как
наружный интегумент может оставаться 2-слойным (Cardamine, Erysimum,
Megacarpaea, Arabis и Berteroa) или 2—4-слойным у большинства исследо-
160
ванных видов. Степень разрастания внутреннего, изначально 2-слойного ин-
тегумента различна: от 3—6 слое<в (Berteroa, Erysimum, Arabis и Megacarpaea)
до 20 слоев и более (Lunaria). У многих видов формируется эндотелий, коюрый
на поздних стадиях преобразуется в пигментный слой. После оплодотворения
в клетках интегумента появляется крахмал, который ассимилируется по мере
развития зародыша. В эндотелии обнаружены дубильные вещества и флаво-
ноиды. У видов Syrenia, Erysimum и Isatis в субэпидермальном слое халазаль-
ной части наружного интегумента наблюдаются идиобласты или специфические
клетки, заполненные гликозидсодержащими веществами. Особым способом,
ранее не описанным для покрытосеменных, происходит развитие внутреннего
интегумента у Н. amplexicaulis, клетки которого интенсивно разрастаются,
а ядра многократно синхронно делятся. Ко времени первого деления зиготы
внутренний интегумент кроме 2 наружных мелкоклеточных слоев содержит
крупные разросшиеся клетки, в которых насчитывается до сотни свободных ядер.
В процессе развития эндосперма и зародыша эти клетки разрушаются и к
моменту заложения бугорков семядолей от внутреннего интегумента остается
2 наружных мелкоклеточных слоя, входящих затем в состав семенной кожуры
(Родионова, 1972). В сформированном нуцеллусе выделяются апикальная и
базальная части, дезинтегрирующие у разных видов с различной скоростью.
У всех видов окончательно дифференцированный -зародышевый мешок полно-
* стью разрушает апикальную часть нуцеллуса, причем это происходит быстрее
у Arabis, Erysimum, Eruca, Alliaria, Lepidium и Cardamine и медленнее у Macro-
podium, Lunaria и Diplotaxis. Нуцеллус вытесняется у Erysimum и Arabis
к первому делению зиготы, и у Bunias — ко времени образования 2—4-клеточ-
ного зародыша. У Macropodium, Hesperis и Lunaria небольшая часть основания
нуцеллуса существует значительно дольше; клетки ее заполняются густой
цитоплазмой и содержат слабохроматизированные ядра, которые разрушаются
лишь после наступления клеткообразования в эндосперме. Археспорий
многоклеточный (Cardamine, Sisymbrium, Erysimum pannonicum, Alliaria, Isatis и
Berteroa), 2- или 3-клеточный (Eruca, Brassica и Hesperis), одно-, редко 2-клеточ-
ный (Macropodium, Heliophila, Crambe, Syrenia, Lepidium, Diplotaxis и
Erysimum canescens). Кроющая клетка наблюдалась у Alyssum macropodium, Lunaria
annua, Eruca, Hesperis и Macropodium. Для рода Brassica- отмечалось
образование одной (Sulbcha, 1957) или даже нескольких париетальных клеток (Pearson,
1933). Тетрады мегаспор линейные или Т-образные.
Зародышевый мешок развивается из халазальной мегаспоры по
Polygonum-типу. Синергиды у ряда видов с крючковидными выростами и нитчатым
аппаратом. В яйцеклетке содержатся крахмал и белок. Полярные ядра
сливаются до оплодотворения или в момент оплодотворения. Ядро центральной
клетки расположено вблизи яйцевого аппарата; в цитоплазме имеется крахмал.
Антиподы эфемерны. У Diplotaxis и Arabidopsis они дегенерируют до вхождения
пыльцевой трубки в зародышевый мешок, у Arabis, Heliophila и Berteroa —
в момент оплодотворения, у Erysimum, Hesperis и Syrenia — с началом развития
ядерного эндосперма. Наблюдалось одновременное развитие 2 халазальных
мегаспор (Syrenia сапа), наличие 2 (Eruca, Bunias, Lunaria, Brassica junceat
Syrenia и Е. cheiranthoides) или многих (Е. pannonicum) зародышевых мешков,
находящихся на разных стадиях развития, а также 2 яйцеклеток в одном
зародышевом мешке (Diplotaxis tenuifolia). Всем видам присущи порогамия и
двойное оплодотворение. Пыльцевая трубка вносит свое содержимое в одну из си-
нергид. Редко наблюдается вхождение дополнительной пыльцевой трубки, что
приводит к гибели второй синергиды. Оплодотворение осуществляется по
премитотическому типу. При этом объединение половых ядер в центральной
клетке завершается быстрее, тогда как в яйцеклетке этот процесс более
растянут во времени.
Эндосперм нуклеарного типа. В своем развитии он проходит 2^ стадии:
ценоцитную и клеточную (Яковлев, Алимова, 1976). В средней части
зародышевого мешка ядра эндосперма расположены постенно и в цитоплазменных
тяжах, пересекающих крупную вакуоль. В микропилярном и халазальном
районах образуются скопления эндоспермальных ядер. Первые деления ядер
11 Сравнительная эмбриология
161
проходят синхронно; в дальнейшем синхронность нарушается. Митозы
возникают в центре зародышевого мешка и распространяются последовательно или
волнообразно к обоим его концам. Начиная со^ стадии шаровидного зародыша
в эндосперме обнаруживаются хлоропласты, крахмал и жир (Иоффе, 1952,
1957). В зрелом семени эндосперм сохраняется 1—3 периферическими слоями,
содержащими белок и жир. Ядро* зиготы долгое время пребывает в состоянии
относительного покоя. В это время зигота значительно видоизменяется по
сравнению с яйцеклеткой. Чаще всего она резко вытягивается в длину.
Ядро.зиготы смещено вакуолью в апикальный густоплазменный конец. Короткая
зигота отмечена у Armor acta rusticana и Н. amplexicaulis и у некоторых других
видов. Когда в нуклеарном эндосперме насчитывается 8 или несколько десятков
ядер, в зиготе наблюдается первое деление поперечной стенкой на 2 неравные
клетки: маленькую густоплазменную апикальную са и большую йакуолизиро-
ванную базальную cb. Следующее поперечное деление происходит в базальной
клетке и делит ее на среднюю клетку т и микропилярную ci, в то время как
апикальная клетка делится вдоль, в результате чего возникаем Т-образный
4-клеточвый проэмбрио. В дальнейшем апикальный ярус са дает начало всем
основным частям зародыша, семядолям, гипокотилю, точке роста стебля и
инициалям центрального стебля согласно формуле: ca—pco-^pvt-\-phy-\-icc.
Базальная клетка образует гипофиз из средней клетки т, из которого
развиваются инициали центрального цилиндра корня, чехлик и однорядный
многоклеточный суспензор: cb=iec-\-co+c. Формула развития зародыша позволяет
отнести эмбриогенез Brassicaceae к IV мегархитипу I периода классификации
Суэжа (Soueges, 1939; Яковлев, 1958), или к Onagrad-типу Gapsella-вариации
(Johansen, 1950). Эмбриогенез L. annua резко отличается от Gapsella-вариации
по способу дифференциации гипофизарного образования, а также по скорости
сегментации базального яруса, который на ранних этапах обгоняет апикальный
и близок к Myosurus minimus-вариации (Родионова, 19666).
Клетки суспензора по сравнению с клетками зародыша сильно вакуолизи-
рованы и содержат больше диктиосом, эндоплазматическогоретикулума, меньше
рибосом, белка, нуклеиновых кислот., Вокруг ядер концентрируются
крахмальные зерна (Diplotaxis и Raphanus). У разных видов существуют различия в числе
клеток суспензора (от 5 до 20), в форме базальной клетки — вздутой
пузыревидно, как у Capsella, или слегка расширенной на конце или почти неизменной.
Апикальный ярус в своем развитии проходит стадии квадрантов, октантовг
после чего путем периклинальных делений отчленяются внутренние клетки
и наружные — инициали эмбриодермы. Частые клеточные деления на
противоположных концах периферической .зоны верхнего яруса шаровидного
зародыша приводят к заложению инициалей семядолей, после чего зародыш
становится сердцевидным, а затем удлиненным. Разрастание зародыша
сопровождается его изгибанием в соответствии с формой зародышевого мешка.
С момента дифференциации зародыша в его клетках наблюдаются
хлоропласты, однако в зрелых семенах они отсутствуют. В зрелых зародышах
обнаруживаются запасные белки, жир, аминокислоты и флавоноиды. Последние
локализуются преимущественно в клетках, расположенных вдоль прокамбиаль-
яых тяжей, а также в кожуре семени. Зрелые зародыши спинкокорешковые
с прямыми, сложенными или скрученными семядолями, краекорешковые
(Arabis и Macropodium) или кососпинкокорешковые (Erysimum, Syrenia и
Sisymbrium).
Полиэмбриония отмечена у Syrenia, Diplotaxis, Arabis и Brassica, но в
зрелом семени всегда обнаруживается один зародыш.
Исследованные виды. Alliaria officinalis, Alyssum macrocarpumy
A. maritimum, Arabidopsis thaliana, Arabis allionii, A. alpina, A. caucasica>
A. halleriy A. hirsuta, A. holboellii, A. hornung\ana, A. lyallii,A. planisiliqua,
A. sagittata, Armoracia rusticana, Aubrietia croatica, Barbarea vulgaris, Berteroa
incana, Biscutella eilphifolia, Brassica alba, B. campestris var. gelLow, B. campe-
stris var. toria, B. chenopodifolia, B. insularis, B. juncea, B. napus, B, napus-
var. oleifera f. biennis, B. nigra, B. oleracea v%v. capitata, B. pekinensis, B. rapa
.162
"var. oleifera, Bunias orientalis, Cakile maritima, Camelina sativa, Capsella bursa-
pastoris, Cardamine amara, С bulbifera, C. chenopodifolia, C. hirsuta, C. impatiens,
C. pentaphylla, С pinnata, С polyphylla, С pratensis, С silvatica, Cheiranthus
cheiri, Cochlearia officinalis, Coronopus didymus, Crambe abyssinica, C. maritima,
С pontica, Diplotaxis erucoides, D. tenuifolia, Draba verna, Erophila verna, Eruca
sativa, Erysimum canescens, E. cheiranthoides, E. incana,' E. marschallianum,
E. pannonicum, Fibigia clypeata, Heliophila amplexicaulis, H. longifolia, Hesperis
fragrans, H. matronalis, H. steveniana, Iberis amara, /. umbellata, lonopsidium
acaule, I. saviamim, I satis tinctoria, Lepidium campestre, L. draba, L. perfoliatum,
L. sativum, Lunafia annua, L. bipartita, Macropodium nivale, Malcolmia africana,
Matthiola annua, M. incana, M. tricuspidata, Megacarpaea orbiculata, Moricandia
urvensis, Ptilotrichum spinosum, Raphanus sativus var. radicula, Sinapis alba,
S. arvensis, Sisymbrium irio, S. officinale, S. taraxacifolium, S. thalianum, S. stri-
etissimum, Smelowskia calycina, Succowia balearica, Syrenia сапа, Teesdalia nu-
dicaulis, Thlaspi arvense, T'.. perfoliatum, Turritis glabra.
Литература. А. Р. De Candolle, 1824; Tulasne, 1849, 1855; Hofmeister,
1858; Schacht, 1858; Braun, 1860; Hahstein, 1868, 1870; Warming, 1873; Kny,
1874; Westermaier, 1876; Strassburger, 1877, 1884; Vesque, 1878, 1879; Elfing,
4879; Фаминцын, 1879; Guignard, 1881, 1882, 1893, 1902a, 1902b; Heinricher,
1886; Monnier, 1887; Riddle, 1898; Sargant,- 1900; Coulter, Chamberlain, 1903,
1908; Tieghem van, 1903; Oliva, 1905; Schaffner, 1906; Vandendries, 1909, 1912;
Treub, 1911; Baur, 1912; Grriesinger, 1912; Soueges, 1914a, 1914b, 1916, 1919;
1932, 1936a, 1936b, 1937, 1939, 1948, 195Г; Juel, 1915; Farr, 1916; Schwarzenbach,
1922; Bannier, 1923; Jaretzky, 1928a, 1928b, 1929, 1932; Schnarf, 1929, 1931;
Corti, 1930; Gorczynsky, 1930, 1935; Sutaria, 1930; Pearson, 1933; Thompson,
1933; Geitler, 1935; Wieler, 1943; Cernohorsky, 1947; Lebegue, 1948, 1949a, 1949b,
1950, 1952a, 1952b, 1966, 1967; Johansen, 1950; Калинин, 1950, 1956; Bocher,
1951, 1954, 1966, 1969; Иоффе, 1952, 1957; Rijven, 1952; Soueges, Crete, 1952;
Высокоостровская, 1953; Maheshwari, Sachar, 1954, 1963; Ahuja, 1955; Stokes.,
1955; Wardlaw, 1955; Ahuja, Bhaduri, 1956; Hakansson, 1956; Henry, 1956,
1957, 1958; Robbslen, 1956; Hulbary, Rao, Michel, 1957; Lebegue, Sarrazin,
1957a, 1957b; Roth, 1957; Sarrazin, 1957; Sulbcha, 1957; Swamy, Ganapathy,
1957; Henry, 1958; Кавецкая, 1958а, 1958b, 1960a, 1960b; Цингер, 1958;
Яковлев, 1958, 1960, 1972; Christ, 1959; Boquet, 1959; Cruse, 1960; Kubo, 1960; Ty-
таюк, 1960; Беляева, 1962, 1963a, 19636, 1963в, 1964, 1967a, 19676, 1968;
Беляева и др., 1968а, 19686, 1970, 1971, 1973, 1977а, 19776, 1977в, 1978а, 19786,
1978в, 1978г, 1978д, 1979а, 19796, 1982; Bijok, 1962, 1966; Ильина, 1962; Ниси,
Хираокг, 1962; Rondent, 1962; Corsi, 1963, 1972; Cuiet, 1963,1969; Johri, 1963;
Pollock, Jensen, 1963, 1964; Raghavan, Torrey, 1963,1964; Guedes, 1964; Kroh,
1964; Полякова, 1964; Vijok, 1964, 1967; Lloyd, 1965; ПэнЦиншэн, 1965; Davis,
1966; Родионова, 1966a, 19666, 1966b, 1967a, 19676, 1968a, 19686,1971a, 19716,
1971b, 1971г, 1971д, 1972, 1973, 1975, 1976a, 19766, 1978a, 19786, 1978b, 1979a,
19796, 1982; Deschamps, Lebegue, 1967; Жукова, 1967, 1969, 1979; Haccius,
1967; Korbar-Smid, 1967; Kroh, Munting, 1967; Lebegue, Deschamps, 1967;
Mestre, 1967; Edwards, 1968; Кордюм, 1968; Rathore, Singh, 1968; Schulz,
Jensen, 1968a, 1968b, 1968c, 1969, 1971, 1973, 1974; Cela, 1969; Gerlach-Cruse,
1970; Ивасаки Фулйо, Хосода Толио, 1970; Puri, 1970; Смыченко, 1970, 1971;
Смыченко и др., 1970, 1971, Чайка и др., 1970, 1971; Miannay, 1971; Jensen,
1972, 1974; Pare, 1972; Rest, Vaghan, 1972; Алимова, 1973; Eigner, 1973;
Dickinson, Lewis, 1973; Максюк, Нарбут, Смирнов,ч 1973; Mackiewicz, 1973a,
1973b; Яковлев, Жукова, 1973; Bouman, 1974, 1975; Czapik, 1974; Hakki, 1974;
Ismail, 1974; Simoncioli, 1974; Шнайдер, Сильверс, 1974; Guignard, 1975;
Ивашкина, 1975; Lamba, 1975; Pacini, Simoncioli, Cresti, 1975; Sedgley, 1975;
Соколов, 1975; Чайка, 1975; Monnier, 1976; Smith, 1976; Thomas, Monnier,
1976; Tykarska, 1976, 1979; Viegi, Pagni, Corsi, Cela, 1976; Яковлев, Алимова,
1976; Arena, Villari et al., 1977; Prasad, 1977a, 1977b, 1979; Ponzi, Pizzolongo,
Caputo, 1977, 1978; Szweczyk, Ryczkowski, 1977; Green, 1978; Kallarackal, 1978;
Kurus, 1978; Мишина и др., 1978; Carevon, Favarger, 1979; Stead, Roberts,
11* 168
Dickinson, 1979; Bergfeld, Kunhnl, Schopfer, 1980; Yakovlev, Zhukova, 1980;
Dickinson, Roberts, 1981; Fougere-Rifot, 1981; Парфенов, Абрамова, 1981; Фурса
и др., 1982; Беляева (ориг. данные — Alliaria); Родионова (ориг. данные —
Megacarpaea, Succowia, Cardamine).
Семейство RESEDACEAE
Пыльники 4-гнездные, вскрываются продольно. Стенка пыльника
формируется по типу однодольных и состоит из эпидермиса, эндотеция, среднего слоя
и секреторного 2-ядерного тапетума. Клетки эндотеция содержат крахмал,
а к моменту образования пыльцы в них появляются фиброзные утолщения.
К этому времени средний слой отмирает, но тапетум сохраняется долго, до
полного созревания пыльцы. Спорогенная ткань многорядная. Мейоз в микро-
спороцитах протекает нормально. Образование микроспор симультанное.
Тетрады тетраэдральные и редко изобилатеральные. Зрелые пыльцевые зерна
2-клеточные, одиночные. Генеративная клетка удлиненная, располагается
в цитоплазме вегетативной клетки недалеко от ее ядра. Образование спермиев
происходит в пыльцевой трубке.
Семяпочка кампилотропная (Оксиюк, 1935, 1937; Manant, 1958) или анакам-
пилотропная (Singh, Gupta, 1968); по Савченко (1973), ее.можно определить
как анаамфитропную. С 2 интегументами, внутренний — 3-слойный, на
верхушке становится многослойным, наружный — всегда 2-слойный. Микропиле
изогнутое — экзостом расположен под прямым углом к эндостому. В клетках
интегументов обильно накапливается крахмал. У Reseda inodora Оксиюк (1937)
описал семяпочку с 3 интегументами. Нуцеллус крассинуцеллятный (Davis,
1966), но в связи с тем, что кроющих клеток обычно образуется 1 или 2 и они
быстро отмирают, Оксиюк (1937) относит нуцеллус у Resedaceae к тенуинуцел-
лятному типу; по его данным, париетальные клетки отмечены для Reseda media,
R. phyteuma, R. odorata, R. lutea, R. cristallina и R. luteola. У R. glauca, также
как и у видов Astrocarpus, париетальные клетки не образуются. По мере
развития зародышевого мешка большая часть клеток нуцеллуса разрушается. На ми-
кропиллярном конце у большинства видов остается лишь эпидермис, клетки
которого заполнены слизью и он наподобие колпачка довольно долгое время
покрывает микропилярную зону зародышевого мешка. Однако у некоторых
видов (R. alba, R. glauca и Astrocarpus sesamoides) разрушается и эпидермис, и
яйцевой аппарат граничит с внутренним интегументом (Hannig, 1930; Оксиюк,
1935). В халазальной же части сохраняется примерно х/4 нуцеллуса. Большая
часть его клеток, примыкающих к эндосперму, содержит многочисленные
крахмальные зерна, а основание этой зоны со стороны халазы представляет собой
несколько слоев мелких клеток меристематического характера, постоянно
делящихся и в то же время содержащих хлоропласта. Эту своеобразную зону
нуцеллуса резедовых определяют как нуцеллярную меристему, дающую
начало специфической ткани, в.которой временно аккумулируется крахмал
(Manant, 1958). В самом основании нуцеллуса резедовых на уровне внутреннего
интегумента находится группа клеток с утолщенными стенками — гипостаза
(Manant, 1958; Singh, Gupta, 1968). Проводящий пучок доходит до халазы, где
и заканчивается. Археспорий обычно одноклеточный, изредка 2—3-клеточный
или многоклеточный (R. alba). У большинства видов семейства археспориаль-
ная клетка отчленяет париетальную, образующую 2 кроющие клетки и одну
спорогенную, которая становится мегаспороцитом. У некоторых видов архе-
спориальная клетка непосредственно переходит к редукционному делению, не
отделяя кроющей клетки (R. alba, R. glauca, Astrocarpus sesamoides и Oligome-
ris glaucescens). Мегаспороцит в результате первого мейоза формирует диаду.
Второе деление происходит только в нижней клетке диады, а верхняя либо
больше не делится, либо процесс деления в ней не заканчивается и она вскоре
начинает дегенерировать. Таким образом, вместо обычной тетрады у резедовых,
как правило, образуется триада. Шизнеспособной всегда оказывается нижняя
мегаспора.
164
Resedaceae?
1—45 — Reseda lutea.
1—12 — фазы формирования стенки пыльника и микроспорогенеза: 1 — поперечный срез
молодого пыльника, периклинальные деления клеток в первичном париетальном слое,
2 — периклинальное деление во вторичном париетальном слое; образование среднего слоя
и тапетума, 3 — поперечный срез молодого пыльника со сформированной стенкой и группой
микроспороцитов; тапетум 2-ядерный, 4— профаза I мейоза в микроспороцитах, 5 —
метафаза I мейоза, 6 — телофаза I мейоза, 7 — метафаза II мейоза, 8 — образование тетрады
микроспор, 9 — фрагмент пыльника на стадии тетрад микроспор, 10 — одноядерное
пыльцевое зерно, 11 — фрагмент стенки пыльника на стадии 2-клеточных пыльцевых зерен,
12 — зрелое пыльцевое зерно;
Resvdaceae (продолжение)
23—24 — мегаспорогенез и развитие зародышевого мешка: 13 — продольный срез через
семяпочку; археспориальная клетка, 14 — образование кроющей клетки, 15 — профаза
I мейоза в мегаспороците и 2 кроющие клетки, 16 — телофаза I мейоза, 17 — метафаза
II мейоза в нижней клетке диады; верхняя клетка начинает дегенерировать, не делясь,
Зародышевый мешок моноспорический, Polygonum-типа. Как исключение
у отдельных образцов R. alba и R. modora были описаны 16-ядерные
зародышевые мешки, возникшие за счет 2 мегаспор одной тетрады (Оксиюк, 1929, 1935).
Процесс формирования 8-ядерного зародышевого мешка происходит в
результате 3 последовательных митозов. Деление верхних и нижних ядер происходит
не всегда синхронно (Hennig, 1930; Manant, 1958). Характерная особенность
яйцевого аппарата большинства резедовых — маленький размер ядра
яйцеклетки. Грушевидные синергиды с базальными вакуолями и нитчатым
аппаратом содержат крупные ядра. У некоторых видов (A. sesamoides и О. glaucescens)
ядра синергид имеют такие же размеры, как ядро яйцеклетки, отличаясь лишь
более крупными ядрышками (Оксиюк, 1935, 1938). Полярные ядра сливаются
до оплодотворения вблизи яйцеклетки. Антиподы эфемерны, разрушаются до
166
Resedaceae (продолжение)
18 — триада мегаспор, 19 — одноядерный зародышевый мешок, 20 — 2-ядерный
зародышевый мешок; в эпидермисе нуцеллуса начинается отложение сдизи на клеточных стенках,
21 — 4-ядерный зародышевый мешок,
оплодотворения. Для всех исследованных резедовых характерна порогамия.
В зародышевый мешок пыльцевая трубка входит через одну из синергид,
которая при этом разрушается. Объединение половых ядер в яйцеклетке и в
центральной клетке начинается синхронно и протекает по премитотическому типу.
После оплодотворения первичное ядро эндосперма сразу же начинает делиться,
а первое деление зиготы происходит примерно через 2 сут, когда эндосперм
представляет собой 64-ядерный ценоцит.
Эндосперм нуклеарного типа^ На 4—5-е сут после оплодотворения
начинается заложение клеточных стенок сначала в микропилярной, а затем в халазаль-
ной зонах зародышевого мешка. Для эндосперма R. lutea (другие виды в этом
отношении не исследовались) характерна зеленая окраска в связи с наличием
в нем хлоропластов, которые обнаруживаются на самых ранних стадиях и
сохраняются почти до полного созревания семени. В зрелом семени сохраняется
один слой эндоспермальных клеток вокруг зародыша, а также участок эндо-
167
Resedctceae (продолжение)
22 — 8-ядерный зародышевый мешок, 23 — сформированный зародышевый мешок: яйцевой
аппарат с маленькой яйцеклеткой, 2 полярных ядра, 3 антиподы, 24 — зрелый зародышевый
мешок: яйцеклетка с небольшим ядром, синергиды -с крупными ядрами, вторичное ядро
зародышевого мешка, отмирающие антиподы; 25 — процесс оплодотворения;
сперма (9—10 слоев) внутри полости, образованной подковообразно.изогнутым
зародышем. Запасные вещества в эндосперме — белки и липиды.
Эмбриогенез всех исследованных резедовых протекает по Onagrad-типу.
Первое деление зиготы поперечное, затем следует продольное деление
апикальной клетки и несколько позже — поперечное — в базальной клетке. В
результате последующих делений из апикальной клетки образуется основное тело
зародыша, а базальная дает небольшой подвесок и гипофизарную клетку, из
которой возникают инициальные клетки коры корня и чехлика. Зрелый за-
168
Resedaceae (продолжение)
26'— 2-ядерный эндосперм; 27 — 8-ядерный эндосперм;
родыш занимает почти весь объем семени, изогнут, хорошо дифференцирован
на семядоли и гипокотиль. Запасные вещества — белки и липиды. Хлоро-
эмбриофит.
Исследованные виды. Astrocarpus sesamoides, Oligomeris glau-
cescens, Reseda alba, R. crystallina, R. glauca, R. inodora, R. lutea, R. luteola,
R. media, R. odorata, R. phyteuma.
Литература. Hofmeister, 1858a, 1858b; Strasburger, 1880; Guignard,
1893, 1900; Morstatt, 1902; Orr, 1921; Оксиюк, 1929, 1935a, 19356, 1937, 1938;
169
Resedaceae (продолжение)
28—39 — эмбриогенез: 28—32 —фазы развития проэмбрио, 33 — вычленение эмбриодермы
и деление гипофизарной клетки, 34—37 — фазы глобулярного зародыша и закладка
основных его инициалей, 38 — начало роста семядолей, 39 — сердцевидный зародыш;
j Resedaceae (продолжение)
40—45 — некоторые фазы развития семени: 40 — зигота и 64-ядерный эндосперм, 41 —
ранний глобулярный зародыш и нуклеарный эндосперм, 42 — глобулярный зародыш и
формирование клеточного эндосперма, 43 — закладка семядолей в зародыше, 44 — торпедо-
видный зародыш, 45 — зрелое семя. {1—12, 24, 46 — ориг.; 13—23, 25—27 — по Чабан,
Яковлеву, 1974; 28—39 — по Яковлеву, Чабан, 1979; 40—45 — по Чабан, 1979).
Hennig, 1930; Eigsti, 1935, 1937; Soueges, 1935, 1939; Lebegue, 1952; Crete,
1955; Александров, Яковлев, 1957; Gori, 1957; Manant, 1958; Chhonkar, 1961;
Davis, 1966; Singh, Gupta, 1968; Чабан, Яковлев, 1974; Чабан, 1975, 1979;
Leins, Sobick, 1977; Яковлев, Чабан, 1979; Чабан (ориг. данные).
Семейство MORINGACEAE
Пыльники 2-гнездные, вскрывающиеся продольно. Описаны также 4-гнезд-
ные пыльники (Puri, 1941). Стенка пыльника формируется по основному типу
(Dutt, 1978a) и состоит из 4—6 слоев: эпидермиса, эндотеция, одного или
нескольких средних слоев и тапетума. Тапетум секреторный, клетки его,
находящиеся на внутренней стороне гнезд, в 2—3 раза крупнее клеток,
расположенных с внешней стороны, содержат большое число ядер и более вакуолизированы.
Тапетальные клетки 2-ядерные, а более крупные клетки имеют 3—4 ядра.
На поздних стадиях отмечено слияние ядер и появление орбикул. Стенка
зрелого пыльника представлена эпидермисом и фиброзным эндатецием. Спороген-
ная ткань многослойная и многоклеточная. Микроспороциты имеют кал лозную
оболочку; цитокинез,у них симультанный. Тетрады микроспор тетраэдральные,
изобилатеральные или крестообразные. Зрелые пыльцевые зерна 2-клеточные
{Dutt, 1978a), изредка 3-клеточные (Puri, 1941).
Семяпочки в завязи многочисленные, анатропные, с 2 свободными
интервентами, крассинуцеллятные. Наружный интегумент растет быстрее
внутреннего, закладывается 5—6-слойным, впоследствии разрастается до 12—14 слоев
в бескрылой части семени и до еще большего числа слоев в области крыльев.
Внутренний интегумент вначале 3—4-слойный, разрастается незначительно —
до 5—6 слоев. После оплодотворения и разрушения нуцеллуса образуется
эндотелий, местами 2—3-слойный. Позже внутренний интегумент полностью
разрушается, а в зрелом семени он остается в виде тонкого мембранообразного слоя.
В клетках обоих интегументов и в халазе отмечены хлоропласты (Puri, 1941;
Dutt, 1979). Микропиле образовано обоими интегументами и имеет
зигзагообразную форму. В основании зародышевого мешка развивается небольшая
гипостаза. Описан случай наличия 2 нуцеллусов в одной семяпочке, каждый со своим
собственным интегументом (Puri, 1941). Одна или 2 археспориальные клетки
дифференцируются субэпидермально, а затем делятся, отделяя спорогенную
и париетальную клетки. Последняя может делиться периклинально и
антиклинально, образуя 2—4 слоя париетальной ткани (Puri, 1941; Dutt, 1979)
или не более 3 (Hedaytullah, 1935). Материнских клеток мегаспор одна или 2.
Тетрады мегаспор линейные или Т-образные.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. В нем первыми дифференцируются небольшие антиподы, в последнюю
очередь — яйцеклетка. Синергиды с зубовидными выростами и слабовыражен-
ным нитчатым аппаратом. Полярные ядра располагаются вблизи яйцевого
аппарата.. Описано (Puri, 1941); их слияние со спермием. Антиподы эфемерны и
дегенерируют очень рано*; иногда остатки их различимы после оплодотворения.
Сформированный зародышевый; мешок содержит крахмальные зерна, которые
встречаются ц, в клетках яйцевого аппарата. Он имеет расширенную форму
на микропилярном конце и суженную — в халазальном. После оплодотворения
халазальный его конец также расширяется. Описаны (Puri, 1941) случаи 2
зародышевых мешков в одной семяпочке. Оплодотворение двойное. Слияние
€пермия с ядром яйцеклетки происходит раньше, чем с полярными ядрами.
Для Moringa concanensis и М. oleifera описана порогамия (Dutt, 1979);
пыльцевая трубка входит в зародышевый мешок, разрушая одну из синергид.
Наблюдалось (Puri, 1941) попадание пыльцы и прорастание ее непосредственно в
канале столбика.
ч Эндосперм нуклеарный. Первые деления ядер синхронные. Заложение
клеточных перегородок начинается с микропилярного конца и достигает
халазальной части ко времени поздней шаровидной стадии зародыша. Клетки
эндосперма одноядерные (Narayana, 1962; Dutt, 1979), редко многоядерные
172
16 77 "
Moringaceae
1—33 — Moringa oleifera. %y:
1 — поперечный разрез 2-гнездного пыльника с неравномерным развитием тапетума; 2 —
орбикулы на стенках тапетальных клеток; 3 — одноядерное пыльцевое зерно; 4 — 2-ядер-
ное пыльцевое зерно; 5 — схема семяпочки на стадии мегаспороцита; 6 — продольный
разрез нуцеллуса с 2 археспориальными клетками; 7 — часть нуцеллуса с материнскими
клетками мегаспор и париетальной тканью; 8 — мегаспороцит перед делением; 9,10 —
Т-образная и линейная тетрады мегаспор; 11—14 — развитие зародышевого мешка; 15 —
зародышевый мешок с зиготой и 2-ядерным эндоспермом; 16 — синхронные деления ядерного
эндосперма; 17 — зигота и микропилярное скопление эндосперма;
Moringaceae (продолжение)^
18, 19 — схема продольного разреза семени с клеточным эндоспермом вмикропилярной части
и ев об одноядерным в остальной; 19а — клетки эндосперма при большем увеличении; 20—
31 — развитие зародыша; 32 — продольный разрез зрелого семени; 33 — зрелый зародыш.
(1—15, 17 — по Puri, 1941; 16, 18—33 — по Narayana, 1962>.
(Puri, 1941), заполнены крахмальными зернами. В зрелом семенг эндосперм
отсутствует или представлен очень скудно.
Первое деление зиготы М. oleifera происходит ко времени образования
300—400 свободных ядер эндосперма. Базальная и терминальная клетки более
или менее одинаково участвуют в построении зародыша. Терминальная клетка
са делится вертикально, в то время как плоскость деления ев может быть
поперечной, в результате чего формируются ярусы т и ci, или вертикальной. 2 клетки
са претерпевают второе вертикальное деление под прямым углом к первому,,
формируя квадрант д. Поперечное деление компонентов ведет к организации
октантов в 2 яруса— I и V'. Эмбриодерма выделяется при периклинальном
делении клеток октантов. Внутренние клетки в дальнейшем образуют инициали
периблемы м. плеромы. Ярус I производит 2 семядоли и апекс побега, ярус V
формирует короткий гипокотиль. Производные клетки т образуют корень,
a ci — корневой чехлик. Джогансен (Johansen, 1950), основываясь на
исследованиях Пури (Puri, 1941), относит эмбриогенез М. oleifera к Asterad-типу
Penaea-вариации. У зародыша М. oleifera отсутствует ясно выраженный
подвесок, корцевои чехлик хорошо различим и гипокотиль короткий. Подобные
черты эмбриогенеза соответствуют Asterad-типу, но не относятся к Репаеа-
вариации, а могут служить (Narayana, 1962) прообразом новой вариации
зародыша без подвеска. У М. concanensis развивается хорошо выраженный подвесок,
и эмбриогенез этого вида (Dutt, 1978b) соответствует Myosurus-вариации Опа-
grad-типа. Зрелый зародыш прямой, с массивными семядолями, содержащими
большое количество крахмальных зерен и занимающими более чем 3/4 семени.
Почечка несет несколько листовых примордиев. Хлороэмбриофит (Yakovlev.
■ Zhukova, 1980).
Исследованные виды: Moringa concanensis, M. oleifera^ M. ptery-
gosperma.
Литература. Rutgers, 1923; Puri, 1934, 1941; Hedayetullan, 1935;
JNTarayana, 1962, 1970; Dutt, 1978a, 1978b, 1979; Yakovlev, Zhukova, 1980.
Порядок 35. TAMARIGALES
Семейство FRANKENIACEAE
Пыльники 4-гнездные. Гнезда объединены в 2 теки и перед созреванием
сливаются в результате разрушения перегородки между ними. Сформированная
стенка пыльника состоит из эпидермиса, эндотеция, 1--2 средних слоев и та-
петума. Тапетум секреторный, нерегулярно 2-слойный, 2-ядерный, с хорошо
выраженными орбикулами. Средние слои эфемерны, дегенерируют на стадии
одноядерных микроспор. В эндотеции образуется густая сеть фиброзных
утолщений; эпидермис сохраняется, наружная стенка его кутинизируется, иногда
и в нем образуются фиброзные утолщения. В зрелом пыльнике стенка 2-слой-
ная — эпидермис и эндотеции. Спорогенная ткань многорядная. Перед началом
мейоза микроспороциты покрываются каллозной оболочкой. Мейоз, как
правило, протекает нормально. Образование микроспор происходит симультанно.
Тетрады микроспор тетраэдральные, крестообразные или изобилатеральные,
образуются перешнуровыванием. Иногда в мейозе наблюдаются нарушения —
появляются удлиненные хромосомы и хроматиновые мосты, растянутые в
цитоплазме (Walia, Kapil, 1965). Спермиогенез протекает в пыльцевых зернах,
находящихся в пыльнике. Зрелые пыльцевые зерна 3-клеточные, содержат
2 маленьких овальных спермия и крупное, часто неправильной формы
вегетативное ядро. Цитоплазма заполнена белком и липидами.
Семяпочка анатропная, с 2 интегументами, по 2—3 слоя каждый, на длинном
тонком фуникулусе, крассинуцеллятная (или * псевдокрассинуцеллятная —
по Davis, 1966). Микропиле изогнуто, образуется внутренним интегументом,
который разрастается в оперкулум. Проводящий пучок по фуникулусу доходит
до хал азы. В. нуцеллусе не развиваются париетальная ткань и колпачок, но
значительно разрастается халазальная часть. Эпидермис нуцеллуса в микро-
пилярном • районе значительно отличается от остальных клеток густой
цитоплазмой и более крупными ядрами. Перед оплодотворением клетки его ради-
ально вытягиваются, а некоторые из них периклинально делятся. Халаза
нормальная, гипостаза хорошо выражена и состоит из упорядоченно
расположенных лигнифицированных клеток. Археспорий одноклеточный. Археспори-
альная клетка непосредственно становится мегаспороцитом. В результате
2 последовательных делений мейоза образуются диада и тетрада мегаспор —
линейная или Т-образная. Функционирующей является халазальная мегаспора.
Зародышевый. мешок развивается по Polygonum-типу. Сформированный
зародышевый мешок 7-клеточный, 8-ядерный. Клеткообразованйе в первую
очередь проходит в халазальном конце. 3 клетки яйцевого аппарата хорошо
дифференцированы: яйцеклетка с крупным ядром и вакуолью над ним, синер-
гиды — с ядрами в центре клетки, вакуолями под ними, с выступами-зацепками
и хорошо выраженным нитчатым аппаратом. Полярные ядра объединяются
до оплодотворения или после' него, расположены под яйцевым аппаратом.
В цитоплазме центральной клетки имеется значительное количество крахмала.
3 одноядерные антиподальные клетки строением напоминают яйцевой аппарат,
но значительно меньших-размеров, дегенерируют перед оплодотворением или
сразу после него. Семейству свойственна порогамия. Остатки пыльцевой трубки
продолжительное время наблюдаются в микропиле. Двойное оплодотворение —
сингамия и тройное слияние — проходит почти одновременно.
Эндосперм нуклеарный. Клеткообразованйе начинается в халазальной части
зародышевого мешка, где впоследствии наблюдается слой из крупных
многоядерных клеток. Как показали Валиа и Капил (Walia, Kapil, 1965), в микро-
пилярной части зародышевого мешка ядра остаются свободными, окружены
густой цитоплазмой, токи которой имитируют структуру нитчатого аппарата
синергид. Упомянутые выше авторы рассматривают эти образования как
эндосперма л ьные микропилярные гаустории. Появляющиеся в них клеточные стенки
формируют 2- или 4-клеточные структуры с многочисленными ядрами, которые
175
1—21 — Frankenia hirsuta, 22—41 — F. pulverulenta.
1, la — фрагмент пыльника и поперечный срез его на стадии микроспороцитов; 2, 3 — мейоз
в микроспор оцитах; 4—6 — тетраэдральная, изобилатеральная и крестообразная тетрады
микроспор; 7, 7а — поперечный срез и фрагмент пыльника на стадии одноядерных
пыльцевых зерен; тапетум с орбикулами; в эндотеции — тонкие фиброзные пояски; 8—10 —
развитие пыльцевого зерна; 11,11а — поперечный срез и фрагмент вскрывшегося пыльника
со зрелой 3-клеточной пыльцой; 12—15 — мегаспор огенез: 12 — археспориальная клетка
в нуцеллусе, 13 — мегаспороцит и 13а — семяпочка на этой стадии, 14 — диада, 15 —
тетрада мегаспор; 16 — 2-ядерный. 17 — 4-ядерный, 18 — 8-ядерный зародышевые мешки;
19 — семяпочка;
* Fvanheniaceae (продолжение)
20 — зрелый зародышевый мешок; 21—25 — развитие эндосперма: 21 — зигота и несколько
ядер эндосперма, дегенерирующие синергиды, 22, 23 — ядерный эндосперм; начало
образования зндоспермального гаустория, 24, 24а — микропилярный гаусторий и клеточный
эндосперм; на всех стадиях виден колпачок «нитчатого аппарата» в микропилярнои части
зародышевого мешка,
12 Сравнительная эмбриология
w
/<э
Q) 1
Sj»JJ
1 >p
1®J
J / (д) ]
1 1 £•) *
/жз
чЩ/
29: 30
Fvankeniaceae (продолжение)
25 — микропилярный гаусторий на торпедовидной стадии развития зародыша; 26—39 —
развитие зародыша; 40 — продольный срез семени с зародышем и эндоспермом; 41 — точка
роста зрелого зародыша. (1, 1а, 7, 7а, 11, Па, 13, 13а, 15, 19, 20—24а, 40, 41 — ориг.;
2—в, 8—10, 12, 14, 16—18, 25-39 — по Walia, Kapil, 1965).
еще могут делиться. Эти структуры сохраняют активность до созревания
зародыша. Наши исследования тех же видов — Frankenia hirsuta и F. pulverulenta* —
подтвердили наличие в эндосперме микропилярного гаустория, характерной
чертой которого является складчатость стенки# его базальной части, подобная
нитчатому аппарату. Она прослеживается в виде колпачка в узком микропиляр-
ном конце зародышевого мешка на всех стадиях развития, вплоть до созревания
семени. Густоплазменный многоядерный гаусторий, структурой напоминающий
крупные синергйды, чрезвычайно отличается от основной массы эндосперма, в
нем не накапливается крахмал. Эндосперм в зрелом семени сохраняется,
содержит крахмал и кристаллы оксалата кальция.
Эмбриогенез соответствует Solanad-типу. Зигота перед делением заметна
удлиняется, делится поперечной перегородкой; тетрада линейная. Проэмбриа
глубоко погружен в эндосперм в результате развития длинного нитевидного»
подвеска. Зрелый зародыш прямой, с 2 семядолями, дифференцированный,,
окружен эндоспермом.
Исследованные виды. Frankenia hirsuta,, F. pulverulenta.
Литература. Dahlgren, 1928; Mauritzon, 1933; Walia, Kapil, 1965;;
Камелина (ориг. данные).
Семейство TAMARICACEAE
Пыльник 4-гнездный. Перед созреванием гнезда попарно объединяются
в результате разрушения перегородки между ними. По нашим данным, у Тата-
rix hohenackeri ж Т. ramosissima** стенка пыльника развивается по типу
двудольных. Сформированная стенка, как и у ранее исследованных видов, состоит
из 5 слоев: эпидермиса, эндотеция, 2 средних слоев и тапетума. Клетки
секреторного тапетума становятся 2—4-ядерными, иногда в них наблюдаются
крупные полиплоидные ядра неправильной формы, а на поздних стадиях появляются
орбикулы. Средний слой, примыкающий к тапетуму, дегенерирует рано, а
второй средний слой, примыкающий к эндотецию, сохраняется до стадии
образования 2-клеточных пыльцевых зерен. В эндотеции образуются фиброзные
утолщения; эпидермис покрывается кутикулой. Стенка зрелого пыльника состоит
из эпидермиса и фиброзного эндотеция, окружающего каждую теку.
Микроспоры образуются симультанно. Тетрады микроспор тетраэдральные, реже
изобилатеральные. Зрелые пыльцевые зерна 2-клеточные. Спермиогенез
проходит в пыльцеврм зерне перед самым его прорастанием на рыльце (Бочанцева,
Романович, 1956) или в пыльцевой трубке. Спермин веретеновидные, с четко
выделяющейся цитоплазмой. У Tamarix gallica отмечена полиспория (Battaglia,
1941).
Семяпочка анатропная, с 2 двуслойными интегументами, крассинуцеллятная.
Микропиле образовано внутренним интегументом, который на концах
утолщается. Проводящий пучок из фуникулуса доходит до халазы. Халаза
массивная, заметно удлиняется после оплодотворения, а эпидермальные клетки ее
образуют характерные длинные волоски, которые формируют хохолок на
поверхности семени. Археспорий одноклеточный (реже 2-клеточный). Археспо-
риальная клетка отчленяет париетальную, которая делится антиклинально,
образуя единственный париетальный слой, и спорогенную, непосредственно
становящуюся мегаспороцитом. Мейоз в мегаспороците не сопровождается
цитокинезом, в результате чего образуются 4 мегаспориальных ядра
(первичный 4-ядерный зародышевый мешок).
Зародышевый мешок тетраспорический, и развитие его происходит по
разным типам, что определяется распределением мегаспориальных ядер в
первичном 4-ядерном зародышевом мешке и числом митозов. Наиболее часто
встречается Fritillaria-тип. Распределение мегаспориальных ядер 1+3* В первом
* Материал собран Е. П. Жоголевой в 1979 г. в южном Таджикистане.
** Материал собран в местах естественного произрастания видов в Таджикистане и
Узбекистане.
12* 179
Tamaricaceae
1—7, 10, 11 — Tamarix hohenackeri, 8, 9 — T. ramosissima, 12, IS, 53 — Myricaria germanica,
14—18 — Tamarix dioica, 19—26, 28—30 — T. odessana, 27 — T. parviflora, 31—33 — T. pen-
tandra, 34—37, 43—52 — T. ericoides, 38—42 — T. troupii.
1—11 — развитие пыльника и пыльцевого зерна: 1—3 — формирование стенки пыльника
и спорогенной ткани, 4 — начало мейоза; тапетум с 2—4-ядерными клетками, 4а — схема
поперечного среза пыльника на этой стадии, 5 — метафаза II деления мейоза, 6 — тело-
фаза мейоза II, 7,7а — стадия тетрад микроспор, 8 — пыльник с вакуолизированными
одноядерными пыльцевыми зернами; тапетум с орбикулами, 9, 9а — с 2-клеточными
пыльцевыми зернами, 10, 10а — зрелый пыльник, 11 — зрелое пыльцевое зерно;
Татаггсасеае (продолжение)
12 — семяпочка до оплодотворения; 13 — семяпочка после оплодотворения; 14 — нуцеллус
с археспориальной клеткой; 15 — образование париетальной и спорогенной клеток; 16 —
мегаспороцит; 17, 18 — мегаспорогенез; 19—21 — развитие зародышевого мешка по Fri-
tillaria-типу; 22 — семяпочка со зрелым зародышевым мешком; 23—27 — развитие
зародышевого мешка по Chrysanthemum cinerariaefolium-типу;
Tamaricaceae (продолжение)
28, 29 — Plumbagella-тип зародышевого мешка; 30, 31 — Drusa-тип зародышевого мешка;
32, 33 — Adoxa-тип зародышевого мешка; 34 — двойное оплодотворение; 35 — ядерная
стадия развития эндосперма; 36 — клеточный эндосперм; 37 — 2 мегаспороцита в одной
семяпочке;
митозе 3 халазальных ядра объединяются и образуют 2 триплоидных ядра
(эффект Бамбачиони). Поэтому во вторичном 4-ядерном зародышевом мешке
всегда заметно различие между 2 меньшими с одним ядрышком, гаплоидными
микропилярными ядрами и более крупными, с несколькими ядрышками, три-
плоидными халазальными ядрами. Зрелый зародышевый мешок этого типа
имеет различные полярные ядра: нижнее — триплоидное и всегда больше,
обычно с несколькими ядрышками, а верхнее — гаплоидное, с одним
ядрышком. Антиподы — 3 клетки, триплоидны, с тенденцией к ранней дегенерации.
Отмечен этот тип у всех исследованных видов Tamarix и у Myricaria germanica*
182
Tamaricaceae (продолжение)
38—47 — эмбриогенез; 48—50, 52 — полиэмбриония; 51, 53 — зрелый зародыш в семени.
(1—11 — ориг.; 12, 13, 53 — по Mauritzon, 1936; 14—18, 22 — по Joshi, Kajale, 1936;
19—21,23—30 — по Hjelmqvist, Grazi, 1964; 31—33, 36, 36,.38—48, 51, 52 — по Johri,
Как, 1954; 34, 37, 49, 50 — по Sharma, 1939).
Adoxa-тип — все 4 ядра первичного зародышевого мешка (при распределении
ядер 2+2) делятся один раз, образуя 8 ядер по 4 на каждом полюсе.
Сформированный, зародышевый мешок этого типа обычного строения: 3 клетки
яйцевого аппарата, 2 полярных ядра и 3 антиподы. Этот тип также довольно часто-
встречается в семействе, а у Г. pcentandra он даже преобладает (Johri, Kakr
1954).
Chrysanthemum cinerariaeiolium-тип, или Chrysanthemum cinerariaefolium-
форма Drusa-типа (по Романову, 1981), встречается не очень часто. Он
распознается на 4-ядерной стадии первичного зародышевого мешка, когда мегаспориаль-
ные ядра располагаются по схеме 1 —|—2 —f-1 с вакуолями между группами. 2
средних ядра сливаются, и первое митотическое деление приводит к образованию
6 ядер: 2 диплоидных в центре зародышевого мешка и по 2 гаплоидных на
полюсах. Сформированный зародышевый мешок этого типа 12-ядерный, с 7
антиподами (3 диплоидные и 4 гаплоидные), диплоидным и гаплоидным полярными
ядрами и 3-клеточным гаплоидным яйцевым аппаратом. Однако число антипод
может быть меньшим, если не все ядра в халазальной части зародышевого мешка
делятся. Этот тип преобладает у Г. africana (Battaglia, 1941).
Drusa-тип. Деление ядер после первичной 4-ядерной стадии (с
распределением ядер 1 4-3) приводит к образованию 2 ядер в микропилярном конце и 6 в ха-
лазалыюм; все ядра гаплоидные. Следующее деление ядер может привести
к образованию 16-ядерного зародышевого мешка, но чаще некоторые ядра в
халазальной части 8-ядерного зародышевого мешка не делятся, поэтому числа
халазальных ядер и антипод в сформированном зародышевом мешке
варьирует от (5) 8 до 11 (12). Этот тип описан у Т. pentandra, Т. africana, Т. gallicar
Т. odessana и Т. parviflora.
В редких случаях зародышевый мешок развивается по Plumbagella-типу *
(Hjelmqvist, Grazi, 1964). Ядра первичного зародышевого мешка (с
распределением 14-3) делятся один раз, образуя вторичный 4-ядерный зародышевый
мешок (как и в Fritillaria-типе), но в дальнейшем ядра больше не делятся и
сформированный зародышевый мешок 4-ядерный, с яйцеклеткой, 2 полярными
ядрами и одной антиподой (Т. odessana и Т. parviflora).
Кроме этих основных 5 типов развития зародышевого мешка у видов Татпа-
rix. описаны различные переходные формы и аномалии в, организации
зародышевых мешков (Puri, 1939; Battaglia, 1941; Johri, Как, 1954; Hjelmqvist,
Grazi, 1964, и др.). Отмечено образование 2 зародышевых мешков в одной
семяпочке из 2 мегаспороцитов (Sharma, 1939). 9
Зрелый зародышевый мешок обычно имеет 3-клеточный яйцевой аппарат*
(только в Plumbagella-типе — одноклеточный), 2—5 (7) полярных ядер и (1) 3—
11 (12) антипод. Яйцеклетка крупная, синергиды широкие, с крючковидными
выступами, часто подобны яйцеклетке, что отмечалось у М. germanica (Frisen-
dahl, 1912), Г. ericoides (Sharma, 1939), T dioica (Joshi, Kajale, 1936), T. pen-
tandra и T: troupii (Johri, Как, 1954). Нитчатый аппарат в синергидах
наблюдался только у М. germanica. Верхнее полярное ядро всегда гаплоидно, но нижнее'
может быть гаплоидным (Adoxa- и Drusa-типьг), диплоидным
(Chrysanthemum cinerariaefolium-тип) или триплоидным (Fritillaria- и Plumbagella-типы).
Иногда в центральное ядро объединяются не 2, а большее количество ядер (до 7)
(Пащенко, 1956). Антиподы обычно остаются одноядерными, но иногда
становятся 2-ядерными (у Г. pentandra — Johri, Как, 1954), чаще дегенерируют
до оплодотворения или сразу же после него. У Т. tetrandra они вакуолизиру-
ются, разрастаются и присутствуют на ранних стадиях эмбриогенеза
(Mauritzon, 1936). Оплодотворение порогамное. Отмечались случаи вхождения в
зародышевый мешок дополнительных пыльцевых трубок и оплодотворение синергид
(Johri, Как, 1954).
Эндосперм нуклеарный. Клеткообразование проходит на стадии
глобулярного или серде^чковидного зародыша. Только у М. germanica и Т. chinensis*
эндосперм не становится клеточным и поглощается на ядерной стадии (Frisen-
dahl, 1912; Puri, 1939). У Т. tetrandra наряду с нуклеарным имеется и целлю-
лярный эндосперм (Mauritzon, 1936). В процессе созревания семени эндосперм
расходуется полностью, и зрелое семя не содержит эндосперма. Эпидермис
*
184
нуцеллуса сохраняется на всем протяжении развития зародыша и в зрелом
семени (Sharma, 1939; Johri, Как, 1954).
Зародыш развивается по Solanad-трпу эмбриогенеза. Зигота делится
поперечной перегородкой; тетрада линейная. Четко прослеживаются все
последующие стадии. Характерной особенностью, является развитие массивного сус-
пензора, клетки которого на поздних стадиях содержат крахмальные зерна.
Зрелый зародыш прямой, дифференцированный, занимает практически весь
объем семени. Лейкоэмбриофит.
У Т. ericoides отмечена полиэмбриоыия. Дополнительные зародыши
развиваются из одной и даже 2 оплодотворенных синергид (Sharma, 1939; Johri,
Как, 1954).
Исследованные виды. Myricaria germanica, Tamarix aestivalis,
Т. africana, Т. androssovii, Т. arceuthoides, Т. chinensis, Т. dioica, T'. gracilis,
Т. elongata, Т. ericoides, Г. florida, Т. gallica, Т. hispida, Т. hohenackeri, Т. kot-
shyi, Т. Iqxa, Т. leptostachys, Т. odessana, Т. pallasii, Т. parviflora, Т. pentandra,
Т. ramosissima, Т. tetrandra, Т. troupii.
Литература. Frisendahl, 1912; Joshi, Kajale, 1936; Mauritzon, 1936;
Zabban, 1936; Puri, 1938, 1939; Paroli,. 1939; Sharma, 1939, 1940; Battaglia,
1941, 1943; Johri, 1954; Johri, Как, 1954; Бочанцева, Романович, 1956; Пащенко,
1956; Hjelmqvist, 1964, 1968; Hjelmqvist, Grazi, 1964; Москова, Христов, 1969;
Беляева Н., 1977; Камелина (ориг. данные).
Семейство FOUQUIERIACEAE
Эмбриологически изучено недостаточно полно. Развитие стенки пыльника,
микроспорогеыез и развитие пыльцевого зерна не описаны. 0
Семяпочка анатропная, с 2 интегументами — массивным (из 8 слоев)
внутренним и тонким (4-слойным) наружным, тенуинуцеллятная. Микропиле
образуется внутренним интегументом. Проводящий пучок из фуникулусэ доходит
до халазы. Внутренний эпидермис внутреннего интегумента развивается в ин-
тегументальный тапетум, который после лизиса нуцеллуса примыкает
непосредственно к зародышевому мешку. Клетки его над микропиллярной частью
зародышевого мешка становятся удлиненно-вытянутыми, впоследствии
заполняются суберином. Клетки наружного эпидермиса наружного интегумента
удлиняются и разрастаются, образуя бахрому, покрывающую всю поверхность
семяпочки. Археспорий одноклеточный; археспориальная клетка становится
непосредственно мегаспороцитом.
О типе развития зародышевого мешка единого мнения не существует, по-
видимому, этот вопрос нуждается в переисследовании. Его описывают и тетра-
спорическим (Johansen, 1936), и моноспорическим (Mauritzon, 1936; Khan,
1943, цит. по: Davis, 1966). Причем в первом случае показано, что мейоз
протекает, не сопровождаясь цитокинезом; распределение мегаспориальных ядер
осуществляется по схеме 2+2, а в результате их митотического деления
формируется 8-ядерный зародышевый мешок. Такое развитие соответствует Adoxa-
типу. Однако лишь у Fouquieria splendens наблюдалось образование 8-ядерного
зародышевого мешка, а у F. burragei и F. peninsularis зрелый зародышевый
мешок всегда 5-ядерный: до 4-ядерной стадии развитие идет идентично, но в
митоз вступает только одно из микропилярных ядер. В результате образуются
2 синергиды, яйцеклетка (из неподелившегося ядра), а 2 халазальных ядра
поднимаются вверх и, сливаясь, образуют ядро центральной клетки. У F.
splendens Джогансен описал также большое число аномалий в организации
зародышевого мешка — 6- и 5-ядерные зародышевые мешки с отсутствующей
яйцеклеткой или с единственным полярным ядром и т. д. Однако Мауритцон у этого
же вида — F. splendens — наблюдал образование тетрады мегаспор, из которых
функциональной оставалась халазальная, а 3 микропилярные постепенно
дегенерировали, и развитие зародышевого мешка по Polygonum-типу. В 8-ядерном
зародышевом мешке яйцевой комплекс дифференцирован, но в синергидах
185
1—4, 5—9, 12—15 — Fouquieria splendens, 10 — F, burragei, 11, 16—31 — F. peninsularis.
1 — мегаспороцит; 2—4 — развитие тетраспорического зародышевого мешка; 5 — тетрада
мегаспор; 6—9 — развитие моноспорического зародышевого мешка; 10 — зародышевый
мешок с дифференцированными элементами яйцевого аппарата, отсутствующими антиподами
и латеральным выростом; 11 — зрелый зародышевый мешок с дегенерирующими синерги-
дами и гаусториальным латеральным выростом; 12—15 — развитие эндосперма; 16—31 —
развитие зародыша. (1—4, 10, И, 16—31 — по Johansen, 1936; 5—9, 12—15 — по Mauritzon,
1936).
отсутствуют вакуоли и нитчатый аппарат; они часто дегенерируют до
оплодотворения. Антиподы — 3 маленькие клетки, также эфемерны; полярные ядра
сливаются до оплодотворения. Характерная особенность зародышевого мешка,
о которой пишут оба автора, — образование латерального выроста. Однако,
если Джогансен показывает, что этот вырост образуется еще до оплодотворения,
то Мауритцон считает, что он появляется с началом развития эндосперма как
его гаусторий. Оплодотворение порогамное.
Эндосперм целлюлярный. Деление ядра происходит вблизи зиготы, при этом
отделяются маленькая микропилярная и.большая халазальная клетки. Ядро
последней опускается вниз и заходит в латеральный отросток, где и остается,
не делясь. Дальнейшее развитие эндосперма идет за счет делений микропиляр-
ной клетки. В зрелом семени эндосперм скудный, с запасными липидами.
Развитие зародыша описано Джогансеном (Johansen, 1936). Зигота делится
поцеречно; тетрада линейная. Дальнейшие деления четкие: прослеживается
стадия квадрантов и октантов и выделение гипофизарных инициалий и эмбрио-
дермы. Подвесок длинный, состоит из линейного ряда в 6—14 клеток. Зародыш
обычно опускается глубоко в эндосперм. Тип эмбриогенеза в дальнейшем
автором определен как Polygonum-вариация Asterad-типа (Johansen, 1950).
Зрелый зародыш прямой, дифференцированный, с 2 широкими семядолями,
точкой роста, корешком и прокамбиальными пучками. *
Исследованные виды. Fouquieria burragei, F. peninsularis,
F. splendens.
Литература. Reiche, 1*921; Johansen, 1936, 1950; Mauritzon, 1936;
Khan, 1943; Davis, 1966; Govil, 1970.
Порядок 36. SALICALES
г Семейство SALICACEAE
Пыльники 4-гнездные; раскрываются продольно; интрорзные и экстрорз-
ные; гнезда объединены попарно в 2 теки. Развитие стенки пыльника протекает
по однодольному типу. Сформированная стенка состоит из 4—5 слоев:
эпидермиса, эндотеция, одного или 2 средних слоев и тапетума; средние слои эфемерны.
В эндотеции образуются фиброзные утолщения. Тапетум клеточный
секреторный, 2-ядерный. Стенка зрелого пыльника 2-слойная: эпидермис и эндотеции.
В клетках стенки и связника имеются вещества полифенольно-дубильного
комплекса. Образование микроспор происходит симультанно, реже, у тополей,
сукцессивно (Варна, 1969). Тетрады микроспор тетраэдральные, реже изоби-
латеральные. Зрелые пыльцевые зерна 2-клеточные; их запасные вещества —
жиры. Спермиогенез проходит в пыльцевой трубке. Спермин овальные,
короткие.
Семяпочка овальная, анатропная, крассинуцеллятная, с хорошо
выраженным фуникулусом, у видов Salix и Chosenia с одним интегументом, у Populus
deltoides, P. canadensis, P. canescens и P. pruinosa с 2 интегументами, внутренний
развит слабее по сравнению с наружным. Проводящий пучок из фуникулуса
заходит в интегумент и проходит по его дорсальной стороне. Микропиле
образовано только наружным интегументом. В субэпидерма льном слое нуцеллуса
у видов Salix и Chosenia (Шанайда, Варна, 1978) закладывается одна, реже 2,
а у некоторых видов Populus от одной до 4 археспориальных клеток (Graf,
1921; Kimura, 1952, 1955; Nagaraj, 1952). Археспориальная клетка становится
непосредственно мегаспороцитом или чаще вначале отделяет париетальную
клетку; последняя в результате периклинального, а иногда и антиклинального
деления образует 3—4-слойную париетальную ткань. Тенденция к
образованию многоклеточного археспория и более развитой париетальной ткани
наиболее характерна для тополей секции Tacamahacae (Коц, 1972). Тетрада
мегаспор в большинстве случаев линейная, но наблюдалась и Т-образная,
и тетраэдральная. В случае многоклеточного археспория в мейоз вступает
один мегаспороцит и обычно развивается только один зародышевый мешок.
Известны случаи развития 2 зародышевых мешков в одной семяпочке
(Nagaraj, 1952; Варна, 1967, 1969), но нормально функционирует только один
из них.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу, имеет овально-вытянутую форму, в микропилярном районе выступает
из нуцеллуса и соприкасается с клетками интегумента. Элементы зародышевого
мешка до оплодотворения хорошо дифференцированы. Яйцеклетка грушевидной
формы, с большим ядром в апикальной части и вакуолью — в базальной;
синергиды с нитчатым аппаратом. Полярные ядра сливаются до оплодотворе-
Salicaceae
1—3 — Populus nigra, 4—8 — P. pyramidalis, 9 — P. tremula, 10, 13—17, 25, 27—37 —
Salix caprea, 11, 18, 19—24 — Populus sp., 12 — P. alba, 26 — -P. balsamifera.
1—9 — микроспор огенез и развитие пыльцевого зерна: 1 — поперечный срез пыльника.
2,3 — фрагменты стенки пыльцевого гнезда со спорогенной тканью, 4—8 — микроспоро-
генез, 9 — зрелое пыльцевое зерно; 10—18 — мегаспор огенез и развитие зародышевого
мешка (продольные срезы): 10 — спорогенная и париетальная клетки, 11 — 2-клеточный
археспорий; 12 — тетрада мегаспор; 13 — материнская клетка зародышевого мешка и
3 дегенерирующие мегаспоры; 14—16 — развитие зародышевого мешка; 17 — зрелая
семяпочка с зародышевым мешком; 18"— микропилярный район семяпочки с яйцевым аппаратом
и вторичным ядром;
188
,ЯШ'
22
Salicaceae (продолжение)
19—37 — развитие зародыша и эндосперма: 19 — 2 ядра эндосперма и первое деление
зиготы; 20 — 2-клеточный проэмбрио и нуклеарный эндосперм; 21—36 — эмбриогенез; 23 —
халазальный эндоспермальный гаусторий; 37 — зрелое семя. (4—8 — по Варна, 1969;
1—3, 9—37 — ориг.).
ния, образуя центральное ядро, располагающееся ближе к яйцеклетке. 3
антиподы небольших размеров, эфемерны, дегенерируют после, а иногда до
оплодотворения. Характерна порогамия и двойное оплодотворение. Только у Populus
tremula и P. canescens отмечены случаи халазогамии (Graf, 1921; Варна, 1968).
Первой оплодотворяется яйцеклетка, затем центральное ядро. Зигота
приступает к делению при наличии 2—4, иногда 8 ядер эндосперма.
Эндосперм нуклеарный и больше развит у тополей, чем у ив. В период
образования семядольных бугорков у зародыша в эндосперме в микропилярном
районе происходит клеткообразование; в х^лазальном районе образуются
ядерные1 гаустории. В зрелом семени эндосперм не сохраняется.
Зародыш развивается обычно по Aster ad-типу, но у P. deltoides отмечен
Onagrad-тип (Nagaraj, 1952). Первое деление зиготы поперечное, апикальной
зародышевой клетки — продольное, базальной клетки — поперечное. Зрелые
зародыши прямые, дифференцированные, с хорошо развитыми семядолями
и прокамбиальной системой. Запасные питательные вещества зародыша —
жиры. В клетках субэпидермального слоя зародыша имеются вещества поли-
фенольно-дубильного комплекса, наиболее выраженные в его гипокотильной
части. Хлороэмбриофит. Начиная с заложения семядолей зародыш зеленеет.
У Sa'lix зародыши в зрелом состоянии остаются зелеными, у Populus —
становятся желтоватыми.
У тополей известны случаи полиэмбрионии (Nagaraj, 1952); у ив — апо-
миксиса (Ikeno, 1922); зародыши развиваются или партеногенетически, или
из клеток нуцеллуса.
Исследованные виды. Populus alba, P. balsamifera, P. bolleana,
P. canadensis, P. candicans, P: canescens, P. deltoides, P, densa, P. diversifolia,
P. hybrida, P. italica, P. maximowiczii, P. nigra, P. pruinosa, P. pyramidalis,
P. sieboldi, P. species, P. suaveolens, P. tremula, P. tremuloides, P. trichocarpa,
Salix acutifolia, S. alba, S. aurita,S.caprea, S. chaenomeloides, S. cinerea, S. cor-
data, S. discolor, S. fragilis, S. glauca, S. glaucophylla,, S. integra,, S. komarovii,
S. lasiolepis, S. leiolepis, S. multinervis, S. myrsinifblid, S. neocinerea, S. nigri-
191-
cans, S. pentandra, S. petiolaris, S, purpurea, S. reticulata, S. tetrasperma, S. tri-
andra, S. tristis. S. viminalis, S. vulpina.
Л итер атур a. Chamberlain, 1897j Tieghem van, 1900; Graf, 19215
Ikeno, 1922; Nohara, 1923; Soueges, 1923; Netolitzky, 1926; Schnarf, 1929, 1931;
Maheschwari, Roy, 1951; Устинова, 1951, 1952, 1958; Kimura, 1952, 1955a,
1955b, 1963; Nagaraj, 1952; Зонова, 1953; Hakansson, 1954; Николаева, 1959,
1962, 1963, 1964, 1971, 1973, 1975a, '19756, 1978; Gampo, 1963; Коц, 1964, 1967,
1972a, 19726; Варна, 1965, 1966, 1967, 1968, 1969a, 19696, 1969b, 1970, 1972,
1975, 1977; Davis, 1966; Pospisil, 1066; Скворцов, 1968; Яковлев, Жукова,
1973; Поддубная-Арнольди, 1976; Шанайда, Варна, 1978.
Порядок 37. ERICALES
л Семейство AGTINIDIACEAE
Пыльник 4-гнездный; гнезда объединены в 2 теки; при созревании гнезда
в каждой теке сливаются попарно (Actinidia и Clematoclethra). Вскрываются
пыльники посредством образования продольной щели у Actinidia или через апи-
кальные поры у Clematoclethra. Развитие стенки пыльника происходит центро-
бежно, по типу двудольных. Сформированная стенка пыльника Actinidia
состоит из 5--6 слоев: эпидермиса, эндотеция, средних слоев и тапетума. Клетки
эпидермиса заполнены танином. Эндотеций однослойный, простирается вокруг
всего пыльника, за исключением района, где при созревании происходит
разрыв стенки пыльника. По нашим данным, фиброзные утолщения образуются
в эндотеций уже после высвобождения микроспор из тетрад. В клетках
эндотеция встречаются кристаллы оксалата кальция. 2—3 средних слоя эфемерны.
Тапетум однослойный, клеточный секреторный, с крупными ядрами и
вакуолями; ядра претерпевают повторные деления и сливаясь становятся
полиплоидными. Клетки тапетума дегенерируют на стадии созревания тетрад микроспор
(Vijayaraghavan, 1965). Стенка зрелого пыльника 2-слойная: эпидермис и
фиброзный эндотеций. Спорогенная ткань многоклеточная. Мейоз в микроспоро-
цитах протекает нормально и в результате симультанного цитокинеза
образуются тетраэдральные щга изобилатеральные (редко)' тетрады микроспор. По
нашим данным, у A. chinensis в результате неравного деления в микроспоре
образуется крупное вегетативное ядро и линзовидная генеративная клетка. В
зрелом пыльцевом зерне довольно крупная генеративная клетка приобретает
веретенообразную форму, имеет четко видимый слой цитоплазмы вокруг ярко
окрашивающегося богйтого хроматином удлиненного ядра и располагается
в центре пыльцевого зерна или в районе поры прЪрастания. Ядро вегетативной
клетки заметно беднее хроматином и часто имеет неправильную
подковообразную или амебоидную фор>му. Пыльцевые зерна высвобождаются на 2-клеточной
стадии. -
Известно, что у Actinidia цветки двудомные или полигамные. Гермафродит-
ные цветки (функционально женские) имеют нормально развитые пыльники,
но пыльца в последних к моменту их созревания полностью стерильна.
Тычиночные цветки (функционально мужские) имеют недоразвитую завязь без
семяпочек. По нашим данным, развитие стенки пыльника у обоих типов цветков
происходит сходным образом. У гермафродитных цветков на стадии мйкроспоро-
цита эндотеций еще не дифференцирован. Однослойный тапетум б несколькими
ядрами (до 4) и крупной вакуолью, оттесняющей ядра и цитоплазму к стенке
клеток, обнаруживает признаки дегенерации. На стадии тетрады хорошо
заметна каллозная оболочка, окружающая микроспоры. Тапетум хохраняется
в виде слоя клеток с дегенерирующими ядрами. Фиброзные утолщения.в
эндотеций еще отсутствуют. Стенка зрелого пыльника 2-слойная: сильно танинизи-
рованный эпидермис и эндотеций с хорошо развитыми фиброзными
утолщениями; иногда во вскрывшемся пыльнике сохраняется один из средних слоев.
Тапетум полностью исчезает. Микроспорогенез у обоих типов цветков
протекает на начальных стадиях, включая мейоз, без нарушений (Rizet, 1945; наши
данные); высвобождение микроспор из тетрад происходит также нормально.
Далее обнаруживаются различия в развитии: микроспоры из пыльников
функционально женских цветков остаются на одноядерной стадии, теряют
способность к митотическому делению; ядра их приобретают неправильную
«звездчатую» форму и постепенно обесцвечиваются; цитоплазма сохраняется некоторое
время в виде тонкого слоя, окружающего ядро. Процесс дегенерации
микроспор происходит несинхронно — в разных пыльниках в пределах одного цветка
обнаруживаются последовательные стадии дегенерации микроспор — от тетрад,
отдельных микроспор и полностью дегенерированных зерен. В зрелых пыльни-
13 Сравнительная эмбриология
193
Actinidiaceae
: 1, 2, 5—10, 13—17, 22—35 — Actinidia chinensis, 3, 4, 11, 12, 18—21 — A. polygama.
1—10 — развитие пыльника: 1 — поперечный срез пыльника на стадии микроспороцитов
(схема), 2 — сформированная стенка этого пыльника: эндотеций еще мало дифференцирован;
микроспороциты в профазе, мейоза I (синапсис), 3,4 — II деление мейоза (метафаза II)
в микроспороцитах и образование тетрад микроспор в пыльнике мужского цветка, 5 —
поперечный срез зрелого (вскрывшегося) пыльника; сплошной черной линией показано
положение фиброзного/ слоя, 6 — зрелый пыльник из мужского цветка: -мощно развитый
эндотеций с фиброзными утолщениями; сохраняется один из средних слоев, 7 — зрела
пыльцевое зерно на 2-клеточной стадии из пыльника мужского цветка, 8—10 — отдельные стадии
развития пыльника гермафродитного цветка: 8 — тетраэдрические и изобилатеральные
тетрады микроспор, окруженные каллозной оболочкой, не показывают еще нарушения
развития, 9 — сформированная стенка пыльника с дегенерирующим средним слоем;
микроспоры остаются на одноядерной стадии; ядра их с признаками дегенерации, 10 — более
поздняя стадия: тапетум дегенерирован; нежизнеспособные пыльцевые зерна почти лишены
ядерного хроматина и цитоплазмы;
Actinidiaceae (продолжение)
11—19 — мегаспорогенез и развитие зародышевого мешка: 11, 12 — дифференциация архе-
спориальной клетки и интегумента, 13 — мегаспороцит в профазе мейоза I (синапсис);
однослойный нуцеллус без признаков дегенерации, 14 — линейная тетрада мегаспор; инте-
гументальный тапетум полностью дифференцирован, 15 — одноядерный зародышевый
мешок, развивающийся из халазальной мегаспоры; 3 остальные дегенерируют;
ках гермафродитных цветков сохраняются лишь сморщенные оболочки
пыльцевых зерен, лишенных ядра и цитоплазмы.
Семяпочка анатропная, с одним интегументом, возникающим вскоре после
дифференциации археспория, тенуинуцеллятная. Нуцеллус разрушается очень
рано. По нашим данным, дегенерация его заметна уже на стадии тетрады; ко
времени созревания зародышевого мешка нуцеллус сохраняется только в хала-
зальном районе семяпочки в виде слоя дегенерированных клеток у гипостазы.
Число семяпочек в плодолистике варьирует: 10—20 у Actinidia и 10 у Clemato-
clethra. Васкулярный пучок проходит через фуникулус к халазальному концу
зародышевого мешка-; Гипостаза хорошо выражена. Археспорий 2—3-клеточ-
ный, но функциональной является только одна археспориальная клетка,
которая становится непвсредшвенно мегаспороцитом, не отчленяя париетальной
клетки. В результате мейоза образуется линейная тетрада мегаспор, из которых
халазальная посредством 3 последовательных митозов развивается в моноспорй-
13* 195
Actinidiaceae (продолжение)
16, 17 — 2- и 4-ядерный зародышевый мешок; 18, 19 — 8-ядерный и зрелый зародышевый
мешок;
ческий зародышевый мешок Polygonum-типа. По нашим данным, иногда вместо
халазальной развивается эпихалазальная мегаспора.
Зрелый зародышевый мешок овально-удлиненной формы, окружен отчетлива
выраженным интегументальным тапетумом, с* характерными вытянутыми
призматическими клетками, представляющими собой видоизмененный внутренний
эпидермис интегумента. По нашим данным, начало дифференциации интегу-
ментального тапетума наблюдается уже на стадии диады мегаспор, когда клетки
внутреннего эпидермиса интегумента уже значительно отличаются от соседних
слоев клеток более интенсивным окрашиванием цитоплазмы и ядерных
структур, а также радиально-удлиненной формой клеток. На стадии 2-ядерного
зародышевого мешка интегументальный тапетум вполне дифференцирован.
В зрелом семени он сохраняется в виде тонкого слоя танинсодержащих клеток.
Яйцевой аппарат мало дифференцирован; полярные ядра сливаются до
оплодотворения; синергида, оставшаяся неповрежденной, и 3 клетки антипод
сохраняются некоторое время в оплодотворенном зародышевом мешке. Отмечен
единственный случай развития биспорического зародышевого мешка у Actinidia
arguta (Vijayraghavan, 1970).
Эмбриогенез Solanad-типа. Зигота делится поперечно, когда эндосперм
уже достаточно развит, образуя клетки терминальную са и базальную св. Ба-
зальная клетку вытягивается, вынося проэмбрио глубоко в эндосперм. 3—7-кле-
точный суспензор образуется только дериватами базальной клетки.
Дальнейшие поперечные и продольные деления в ярусах I и V приводят к образованию
глобулярного зародыша. На*этой стадии происходит вычленение эмбриодермы,
196
Actinidiaceae (продолжение)
20 — зигота и 2-клеточный эндосперм; 21 — зигота и многоклеточный эндосперм; 22—35 —
последовательные стадии эмбриогенеза; 36 — полиэмбриония. (1, 2, 5—17, 19 — ориг.;
3, 4, 18, 20, 21 — по Vijayaraghavan, 1965; 22-Г-35 — по Soueges, 1943; 36 — по Crete, 1944).
а позднее дифференцируются периблема и плерома. Зрелый зародыш имеет
крупные семядоли. Лейкоэмбриофит.
Для зародыша A. chinensis на 2-клеточной стадии отмечен период покоя
продолжительностью не менее 60 дней, после чего развитие зародыша
возобновляется, заканчиваясь к 110-му дню от начала цветения (Hopping, 1976).
Полиэмбриония встречается у A. chinensis за счет деления клеток суспензора
и относится к типу гаметофитно-спорофитной полиэмбрионии (Яковлев, 1957).
Исследованные виды, Actinidia arguta, A. chinensis, A. poly-
gama, Clematoclethra (частично).
Литература. Tieghem van, 1899; Lechner, 1915; Schnarf, 1924; Шаш-
кин, 1937; Soueges, 1943; Crete, 1944a, 1944b; Rizet, 1945; Li, 1952; Яковлев,
1957; Vijayaraghavan, 1965, 1970; Головач, 1969, 1970; Колбасина, 1969; Dic-
kison, 1972; Brundell, 1975a, 1975b; Термена, 1976, Hopping, 1976; McKay,
1977; Schmid, 1978a, 1978b; Hopping, Jerram, 1979; Фрейберг (ориг. данные).
db
Clethraceae
1—8, 11—13 — Clethra barbinervis, 9, 10, 14—31 — C. alnifolia.
1—10 — развитие пыльника и пыльцевого зерна: 1 — поперечный срез молодого пыльника
(схема), 2 — срез через гнездо этого пыльника; дифференциация спорогенных клеток, 3 —
микроспор оциты в профазе мейоза I; образование 2-слойного тапетума; 4—4д — отдельные
стадии мейоза I и II, показывающие симультанное образование микроспор, 5 — фрагмент
сформированной стенки пыльника (продольный срез): начало образования фиброзных
утолщений; 2-слойный тапетум, микроспор оциты, окруженные каллозной оболочкой, 6 — стенка
Семейство CLETHRACEAE
Пыльник 4-гнездный; раскрывается апиКально, короткой щелью; тнезда
объединены попарно, в 2 теки. Перегородка между соседними гнездами каждой
теки разрушается незадолго до высвобождения зрелой пыльцы, и гнезда
сливаются попарно. Развитие стенки пыльника центробежное, по типу двудольных.
Сформированная стенка пыльника состоит из 5 слоев: эпидермиса, эндотеция,
средних слоев и тапетума. Клетки эпидермиса пыльника, а также часть клеток
связника и отдельные клетки эндотеция заполнены танином. В эндотеции ко
времени обособления микроспор образуются фиброзные утолщения. Они
возникают во всех клетках этого слоя, за исключением небольшого пространства
между 2 теками в районе связника и в области растрескивания пыльника, где
имеются мелкие тонкостенные клетки. 2 средних слоя эфемерны. Тапетум
однослойный, клеточный секреторный, 2-ядерный. По нашим данным, у Clethra
barbinervis тапетум нерегулярно 2-слойный, становится 2-ядерным во время
мейоза в микроспороцитах. Дезинтеграция клеток тапемума наблюдается на
стадии одноядерных микроспор, при этом происходит нарушение целостности
тапетального слоя, его клетки приобретают неправильную форму, цитоплазма и
ядра частично лизируют. Сведения о строении стенки зрелого пыльника
отсутствуют. Спорогенная ткань многоклеточная. Мейоз обычно протекает без
нарушений, можно отметить только некоторую асинхронность протекания
отдельных его фаз — от профазы первого деления мейоза до сформированных
тетрад микроспор в 2 соседних гнездах одного пыльника, что встречается
довольно редко, или же наличие в одном гнезде меиоцитов, находящихся на
последовательных стадиях мейоза. К началу первого деления мейоза вокруг
микроспороцитов образуется каллозная оболочка; наибольшего развития она
достигает на стадии тетрад. В результате симультанного цитокинеза образуются
тетраэдральные тетрады микроспор. По нашим данным, встречаются и изоби-
латеральные тетрады. Деление ядра микроспоры приводит к образованию
крупного ядра вегетативной клетки, в цитоплазме которой располагается небольшое
округлое ядро генеративной клетки. Зрелая пыльца одиночная и, очевидно,
2-клеточная. Для южноамериканских видов Clethra отмечена высокая степень
стерильности пыльцы как возможный результат генетической гибридизации
(Sleumer, 1967).
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. Инте-
гумент достигает полного развития и формирует микропиле ко времени перехода
семяпочки к анатропному положению (на стадии созревания мегаспороцита).
Внутренний эпидермис интегумента преобразуется в интегументальный
тапетум с узкими столбчатыми железистыми клетками, который охватывает 2/3
зародышевого мешка с халазального конца. "Сосудистый пучок входит в
семяпочку через фуникулус и заканчивается в халазе в области гаустория.
Археспорий одноклеточный. Археспориальная клетка становится непосредственно
мегаспороцитом, не отчленяя париетальной. В результате мейоза образуется
линейная тетрада мегаспор; халазальная мегаспора посредством 3
последовательных митотических делений развивается в моноспорический 8-ядерный
зародышевый мешок Polygonum-типа. Иногда вместо халазальной развиваемся
эпихалазальная мегаспора.
Зрелый зародышевый мешок узкий, веретенообразный, слегка расширенный
в своей верхней части; занимает немного больше половины всей длины семяпочки.
Яйцевой аппарат мало дифференцирован; яйцеклетка овально-округлой формы
находится в тесном контакте с 2 небольшими синергидами. Яйцевой аппарат
внедряется в микропиле, смещая и отчасти разрушая примыкающие эпидер-
мальные клетки интегумента. Полярные ядра сливаются до оплодотворения.
3 клетки антипод располагаются линейно-вертикально; большая из них обычно
■ г— ,
пыльника и тетрады микроспор, 7, 7 а — поперечный срез пыльника (схема) и фрагмент его
на стадии одноядерных микроспор; дезинтеграция клеток тапетума, 8 — одноядерное
пыльцевое зерно,
199
самая удаленная от микропиле. В интегументе и халазе вокруг концов
зародышевого мешка после оплодотворения выделяются зоны с плотноокрашивающимися
зернистыми клетками. Артопус (Artopoeus, 1903) рассматривает их как
питающие области для эндоспермальных г&усториев. По мере созревания семени они
облитерйруют. Оплодотворение порогамное.
Эндосперм целлюлярный; первые 4 клетки располагаются линейно.
Имеются микропилярный и халазальный гаустории.
Эмбриогенез Asterad:Tnna или IV мегархитипа I периода классификации
Суэжа. При этом первое деление зиготы поперечное, происходит только после
вырастания ее из микропилярного гаустория и приводит к образованию
терминальной клетки са и базальной сЪ. Последующие деления базальной клетки сЪ
образуют ярус ci, который дает начало суспензору и гипофизу (ярус т).
Из терминальной клетки са последовательно образуются 2 яруса октантов I
и V. Первые перегородки здесь вертикальные или косые. Никогда не
наблюдалось в этих октантах периклинальных делений, которые рано определяли бы
образование эмбриодермы, что часто встречается у Ericaceae. Верхние октанты
дают начало семядольной части рсо, нижние V образуют гипосемядольный
участок pky. Зрелый зародыш маленький, с 2 короткими семядолями. Лейкоэмбрио-
фит.
Исследованные виды. Cletra acuminata (частично), С. alnifolia,
С. arborea, С barbinervis.
200
Clethraceae (продолжение)
9 — фрагмент стенки пыльника, показывающий фиброзные утолщения в эндотеции, 10 —
2-клеточное пыльцевое зерно; 11—19а — развитие семяпочки, мегаспор огенез и зародышевый
мешок: 11 — археспориальная клетка в нуцеллусе, 12, 13 — мегаспороцит и развитие
интегумента, 14 — тетрада мегаспор; начало дифференциации интегументального та-
петума, 15 — развивающаяся халазальная мегаспора; начало дегенерации остальных,
16—18 — 2-, 4- и 8-ядерный зародышевый,мешок, 19 — зрелый зародышевый мешок, 19а —
семяпочка на стадии зрелого зародышевого мешка; на полюсах его отмечены области темно-
окрашивающихся клеток; проводящий пучок оканчивается в халазе; 20—31 — отдельные
стадии эмбриогенеза. (1—8, 11—13 — ориг.; 9—10, 14—19а — по Kavaljian, 1952; 20—31 —
по Veillet-Bartoszewska, 1960).
Литература. Artopoeus, 1903; Peltrisot, 1904; Samuelsson, 1913;
Lechner, 1915; Hagerup, 1928; Copeland, 1933, 1938; Crete, 1951; Kavaljian,
1952; Veillet-Bartoszewska, 1960; Leins, 1964; Sleumer, 1967a, 1967b; Ganapathy,
1970; Фрейберг (ориг. данные).
Семейства ERICACEAE
Подсемейства RHODODENDROIDEAE, ERICOIDEAE,
VACCINIOIDEAE *
Пыльники 4-гнездные, интрорзные, раскрываются при помощи апикальных
пор и коротких трещин, а у Erica hirtifolia, Loiseleuria procutnbens и Leiophyllum
buxifolium — продольными трещинами. Развитие стенки пыльника у
Rhododendron происходит по основному типу. Сформированная стенка пыльника
состоит из эпидермиса, эндотеция, 4—5 средних слоев и тапетума. Эндотеций не
дифференцирован, фиброзные утолщения в нем не образуются. У остальных
видов формируются 2—3 средних слоя в стенке пыльника. У Gaultheria ovatifolia,
G. procumbens ж*&. shallon развитие стенки пыльника протекает по
редуцированному типу. Редуцированный эндотеций встречается у Bejaria, Enkianthus, Kal-
mia, Phyllodocem. Rhodothamnus. Средние слои эфемерные. Тапетум гетерогенный,
клеточный, многоядерный (в отдельных его клетках происходит до 3 митозов),
развивается соответственно секреторному типу без реорганизации. Со стороны
связника тапетум 2-слойный. Стенка зрелого пыльника 2-слойная: эпидермис
и эндотеций. Спорогенные клетки после возникновения совершают до 4—
5 митозов (Rhododendron), образуя спорогенную ткань. Деление в микроспороци-
тах (мейоз) происходит симультанно. Тетрады микроспор изобилатеральные или
тетраэдральные, в каллозных оболочках. Зрелые пыльцевые зерна 2- или 3-
клеточные, заполнены крахмалом или жирами, остаются в тетрадах, за
исключением Enkianthus и Erica stricta, у которых зрелые пыльцевые зерна одиночные.
У Enkianthus perulatus пыльца часто прорастает in situ. Спермин (Rhododendron)
после образования представляют собой клетки с интерфазными ядрами, однако
в процессе развития их цитоплазма постепенно редуцируется, а в ядрах
происходит конденсация хроматина.
Семяпочки анатропные, гемианатропные или кампилотропные, с одним
интегументом, многочисленною, тенуинуцеллятные. Имеется интегументальный
тапетум, примыкающий к зародышевому мешку. Проводящий пучок из фуни-
кулуса заходит в интегумент, проходит по дорсальной стороне и заканчивается
в халазе. Семяпочка нормально халазовая, с расположением зародышевого
мешка в центральной части. Микропиле узкое и прямое. У Arctostaphylos uva-ursi
я A. alpina развивается ариллус. В субэпидермисе нуцеллуса дифференцируется
одна археспориальная клетка, становящаяся непосредственно мегаспороцитом.
Кроющие клетки отсутствуют. Тетрада мегаспор линейная, изредка Т-образная.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. У Cassiope mertensiana, С. lycopodioides и С. tetragona зародышевый мешок
развивается по Allium-типу. Зародышевые мешки мелкие, вытянутые в длину.
Цитоплазма центральной клетки у многих видов содержит крахмал. Синергиды
растут в сторону микропиле. Дифференциация яйцевого аппарата достигает
высокой степени. Полярные ядра сливаются до или во время оплодотворения.
Антиподы обычно мелкие и дегенерируют вскоре после оплодотворения, но
у Gaultheria, Chiogenes, Calluna и Vaccinium антиподы достигают значительного
развития. У Leucothoe racemosa и L. recurva в антиподах происходят
дополнительные деления. В процессе развития зародышевого мешка нуцеллус
постепенно дезорганизуется и ко времени оплодотворения почти полностью исчезает.
Веем видам свойственны порогамия и двойное оплодотворение. Пыльцевая
трубка через микропиле проходит в одну из синергид и изливает в нее 2 спермия
и ядро вегетативной клетки. Оплодотворение проходит по промежуточному
* Раздел написан Л. Я. Якобсон.
202
Ericaceae
1—5, 6, 7, 8—15, 36—38 — Orthilia secunda, 4 — Vaccinium serratum, 5,18—20 — Rhodp*
dendron mucronulatum, 16, 21, 28—35, 39—41 — Rh. , luteum, 17 — Enkianthus cernuus,
22—26 — Hypopitys monotropa, 27, 42 — Rhododendron catawbiense, 43—45 — Pyrola rotun-
difolia, 46—56 — Tripetaleia bracteata, 57 — Vaccinium angustifolium.
1—7 — формирование гнезда пыльника; 8—14 — микроспор огенез;
Ericaceae (продолжение) ^ i
15—17 — зрелые пыльцевые зерна; 18—20 — формирование мужских гамет в пыльцевой
трубке; 21—25 — развитие семяпочки и зародышевого мешка;
типу. Интервал между опылением и оплодотворением -^v4--10 дней. Зигота
сильно удлиняется перед первым делением.
Эндосперм у большинства видов целлюлярный. При первом и втором
делениях перегородка закладывается поперек зародышевого мешка. У Vaccinium,
Rhododendron mucronatum и Rh. japonicum эндосперм нуклеарный.
Формирование клеточных стенок происходит в 4-, 6- или 8-ядерной фазе. Развивается по
4 микропилярных и по 4 халазальных гаустория. В них содержатся несколько
свободных ядер. В зрелом семени массивный эндосперм окружает зародыш со
всех сторон.
Зарсщыш развивается в соответствии с Solanad-типом. При первом и втором
делениях закладываются поперечные перегородки. Тетрада линейная. Сус-
пензор нитевидный. Зрелый зародыш небольшой, прямой, с недоразвитыми
семядолями, с гипокотилем корневого типа строения. Относительно крупные
зародыши встречаются у Arbutus с гипокотилем стеблевого типа. Длина зрелого
зародыша у Andromeda polifolia 0.77 мм, длина семядолей 0.14 мм. У Harrimanella
hypnoides длина зародыша 0.25 мм, длийа семядолей 0.07 мм.
204
Ericaceae (продолжение)
26, 27 — сформированная семяпочка и зрелый зародышевый мешок; 28—35 — двойное
оплодотворение (28—31 — слияние спермия с полярными ядрами, 32—35 — слияние спер-
мия'с ядром яйцеклетки); 36—42 — начальные этапы развития эндосперма;
Ericaceae (продолжение)
43—45 — развитие проэмбрио; 46—56 — развитие зародыша; 57 — зрелое семя. (1—Зг
6—15, 43—45 — рис. Терёхина; 4 — по Venkateswarlu, Maheshwari Devi, 1973;
5 — ,по Якобсон, 19686; 16 — по Kondratovics, Jakobsone, 1968; 17 — по Safijowska, 1960;
18—20 — по Якобсон, 1968а; 21, 27—35, 39—42 — по Якобсон, 1976; 22—26 — по
Терёхину, 1963; 36—38 — по Терёхину, 1977, 46—56 — по Jamazaki, 1975, 57 — по Bell, 1957).
Подсемейства PYROLOIDEAE, MONOTROPOIDEAE *
Пыльники 4-гнездные; гнезда пыльников объединены попарно в 2
латеральные теки. Дифференциация стенки пыльцевого гнезда происходит
центростремительно, по типу Ericaceae (Батыгина и* др., 1963). Сформированная стенка
пыльцевого гнезда состоит из эпидермиса, эндотеция, 3 средних слоев и тапетума
{1—2 слоя). Клетки секреторного тапетума обычно 2-ядерные. Денегерация
тапетума происходит после окончания редукционного деления в микроспороцитах.
Копланд (Gopeland, 1937) отметил более раннюю дегенерацию тапетума у Pleu-
ricospora fimbriolata. Во время мейоза дегенерирует и примыкающий к тапетуму
средний слой. В стенке зрелого микроспорангия сохраняются 2 слоя:
эпидермис и эндотеций. Фиброзные утолщения в эндотеции, как правило, отсутствуют.
Они встречаются лишь в отдельных клетках эндотеция Chimaphila umbellata и
Orthilia secunda. Оболочки клеток эпидермиса ко времени созревания пыльника
значительно утолщаются. Образование микроспор происходит симультанно.
Тетрады микроспор тетраэдрального типа. У Moneses uniflora и Pyrola rotuti-
difolia пыльцевые зерна остаются объединенными в тетрады. У Hypopitys
monotropa, О. secunda и у представителей большинства других изученных родов
пыльцевые зерна одиночные, а у Ch. umbellata они образуют массулоподобные
соединения. Зрелые пыльцевые зерна 2-клеточные.
Семяпочки многочисленные, тенуинуцеллятные, анатропные (Pyrola и др.)
или гемианатропные (Pityopus californica) с одним интегументом из 2 (Allotropa,
Chimaphila, Hypopitys, Moneses, Orthilia и Pyrola) или 3 (Pleuricospora, Ptero-
spora и Pityopus) клеточных слоев. По данным Копланда (Copeland, 1933),
у Sarcodes sanguinea интегумент состоит ко времени оплодотворения из 3 слоев,
позднее в нем образуются еще 2 клеточных слоя. У Pterospora andromedea из
халазальной части семяпочки развивается крыловидный вырост. Сосудистый
пучок в семяпочки не входит. Обычно образуется одна археспориальная клетка,
преобразующаяся непосредственно в мегаспороцит у большинства
исследованных видов (Н. monotropa, О. secunda и др.). По данным Оливера (Oliver, 1891)
и Копланда (Copeland, 1933), у S. sanguinea археспорий перед мейозом
отделяет'кроющую клетку. У Pyrola chloranthauu наблюдали образование в
отдельных семяпочках 2 клеток археспория. Тетрады мегаспор линейные или
Т-образные.
Зародышевый мешок Polygonum-типа, развивается из халазальной
мегаспоры. Интегументальный тапетум однослойный. Его формирование
начинается на стадии образования 2-ядерного зародышевого мешка. Полярные
ядра центральной клетки зародышевого мешка сливаются перед
оплодотворением; иногда слияние полярных ядер и спермия происходит одновременно.
В цитоплазме центральной клетки зародышевого мешка у некоторых вертляниц
и грушанок (Н. monotropa и Pyrola) еще до оплодотворения накапливается
крахмал в виде мелких гранул специфической формы. Антиподы эфемерны и
исчезают ко времени второго деления в эндосперме. Оплодотворение двойное.
Эндосперм целлюлярный, с терминальными гаусториями. Центральная
клетка зародышевого мешка дважды делится поперечными перегородками,
давая начало 2 терминальным гаусториям и зачатку собственно эндосперма.
Халазальный и микропилярный гаустории обычно одноклеточные и
одноядерные. Однако у М. uniflora мы наблюдали иногда образование 2-ядерного
одноклеточного халазального гаустория, а у Pyrola minor — 2-клеточного халазаль-
ного гаустория с одним ядром в каждой клетке. У Allotropa virgata и Н.
monotropa одноклеточный халазальный гаусторий образуется в результате
поперечного деления терминальной клетки 4-клеточного эндосперма. В зрелом
•семени эндосперм окружает зародыш одним слоем клеток (в халазальном конце
<семени эндосперм состоит из 2—3 слоев).
Зигота делится поперечно, в терминальном конце, после относительно
длительного периода врастания в ткань эндосперма. Терминальная и базальная
клетки 2-клеточного проэмбрио также делятся поперечными перегородками,
* Раздел написан Э. С. Терёхиным.
207
формируя линейную тетраду бластомеров. В делениях дочерних от са клеток
у разных видов грушанок и вертляниц наблюдаются вариации в границах
единого типа "эмбриогенеза. У Н. monotropa базальная клетка, как правило, далее
не делится, что связано с крайней редукцией зародыша у этого вида. По данным
Суэжа (Soueges, 1939), развитие зародыша Pt rotundifolia относится к III ме-
гархитипу серии А II периода. Основываясь на этих данных, Джогансен (Jo-
hansen, 1950) отнес развитие зародыша грушанок к Caryophyllad-типу. По
нашим данным (Терёхин, 1962), бластомер п проиетодит не из апикальной клетки
2-клеточного проэмбрио (как считал Суэж), а из его Назальной клетки. В связи
с этим эмбриогенез грушанок и вертляниц (Ch. umbellata, О, secunda и др,)
должен быть отнесен к Chenopodiad-типу, а по системе Суэжа — к V мегархи-
типу серии С II периода. Для всех изученных видов грушанок и вертляниц
характерна редукция зародышей. Наиболее редуцированы зародыши A. vir-
gata, H. monotropa и Monotropa uniflora. В зрелых семенах этих растений
зародыш состоит всего из 2—5 клеток.
Полиэмбриония наблюдалась нами у Р, chlorantha, где второй зародыш
развивался из синергиды.
По данным эмбриологии, грушанки и вертляницы разделяются на 3 группы.
1. Зародыш и эндосперм зрелого семени из 30—40 клеток. Интегумент
3-слойный: Pleuricospora, Pterospora, Pytiopus, Sarcodes.
2. Зародыш и эндосперм зрелого семени из 30—40 клеток. Интегумент
2-слойный: Chimaphila, Moneses, Orthilia, Pyrolg,.
2. Зародьцд зрелого семени из 2—5 клеток,4 эндосперм из 9—10 клеток.
Интегумент 2-слойный: Allotropa, Hypopitys, Monotropa.
Исследованные виды. Allotropa virgata, Andromeda glaucophylla,
A. polifolia, Arbutus andrachne, A. menziesii,- A. unedo, Arctostaphylos alpinar
A. glauca, A. pungens, A. uva-ursi, A. viscida, Bruckenthalia spiculiflora, Bryanthus
empetriformis, B. taxifolius, Calluna vulgaris, Cassiope hypnoides, C. lycopodioides7
С mertensiana, C. tetragona, Chamaedaphne calyculata, Chimaphila menziesii 7
С umbellata, Daboecia cantabrica, D. polifolia, Diplycosia ciliolata, Enki-
anthus campanulatus, E. cernuus, E. nikoensis, E. perulatus, Erica arborea7
E. ciliaris, E. cinerea, E. hirtifolia, E. mediterranea, E. sicula, E. stricta, E. tet-
ralix, E. willmoreana, Gaultheria microphylla, G. miqueliana, G. ovatifolia, G*
procumbens, G. punctata, G. shallon, Gaylussacia dumosa, Harrimanella hypnoides7
Hypopitys monotropa, Kalmia angustifolia, K. glauca, K. hirsuta, K. latifolia,
K. myrtifolia, K. polifolia, K. polifolia var. microphylla, Ledum groenlandicum,
L. palustre, Leiophyllumt buxifolium, L. lyoni, Leucothoe axillaris, L. catesbaei7
L. racemosa, L. recurva, Loiseleuria procumbens, Lyonia ligustrina, L. marianar
Menziesia pentandra, Moneses uniflora, Monotropa uniflora, Orthilia secunda7
Oxycoccus macrocarpus, O. quadripetalus, Oxydendrum arboreum, Pernettya mac-
rostigma, P. mucronata, Phyllodoce aleutica, P. breweri, P. caerulea, P.
empetriformis, P. glanduliflora, P. nipponica, Pieris bracteata, P.floribunda, P. japonica,
Pityopus californica, Pleuricospora fimbriolata, Pterospora andromedea, Pyrola
chlorantha, P. media, P. minor, P. rotundifolia, Rhododendron canadense, R. cata-
wbiense, R. ferrugineum, R. intermedium, R. japonicum, R. kamtschaticum, R. kot-
schyi, R. lapponicum, R. luteum, R. molle, R. mucronatum, i?. mucronulatum%
R. ponticum, R. punctatum, i?. sinense, Rhodothamnus leachianus, Sarcodes sangui-
nea, Tripetaleia bracteata, T. paniculata, Vaccinium angustifolium var. laevifolium9
V. corymbosum, V. hirsutum, V. leschenaultii, V. myrtillus, V. nummularia, V. penn-
sylvanicum, V. retussum, V. serratum, V. uliginosum, V. vitis-ideaea, Zenobia
speciosa.
Литература. Brisseau-Mirbel, 1815; Purkinje, 1830; Fritzsche, 1832;
Hofmeister, 1858, 1859; Chatin, 1870; Vesque, 1878; Warming, 1878; Elfwing,
1879; Vesque, 1879; Jonsson, 1879—1880; Koch, 1880, 1882; Strasburger, 1884;
Campbell, 1889; Oliver, 1891; Hubert, 1896; Shibata, 1902a, 1902b; Artopoeus,
1903; Coulter, Chamberlain, 1903; Peltrisot, 1904; Rubel, 1908; Stevens, 1911,
1919; Samuelsson, 1913; Matthews, Knox, 1926; Schurhoff, 1926; Matthews, Taylor,
1927; Hagerup, 1928; Bovers, 1931; Schnarf, 1931; Copeland, 1933, 1934, 1935,
208
1937, 1938, 1939, 1941, 1943, 1947; Soueges, 1939; Beijerinck, 1940; Doyel, Goss,
1941; Doyel, 1942; Руденко, 1947, 1960, 1964; Crete, 1951; Palser, 1951, 1952,
1954, 1958, 1959, 1961, 1964; Ghou, 1952; Hagerup, 1954; Сладков, 1954; Bell,
Burchill, 1955; Creech, 1955; Safijowska, 1955, 1960; Bell, 1957; Veillet-Bartos-
zewska, 1957, 1959a, 1959b, 1960a, 1960b, 1961, 1963; Терёхин, 1962а, 19626,
1963, 1977; Шилова, 1962; Батыгина, Терёхин, Алимова, Яковлев, 1963; Budel,
1964; Ganapatky, Leins, 1964; Eaton, Jamol, 1966; Reddy Murty, Narayana,
1966; Rousi, 1966; De Gaetana Anna, 1967; K^dratovics, Jakobsone, 1968;
Якобсон, 1968a, 1968b, 1969, 1974, 1976; Venkateswarlu, Maheswari Devi, 1973;
Yamazaki, 1975; Александрова, Беляева, 1976, 1981; Villamil, Palser, 1980;
Mirick, Guinn, 1981; Терёхин, Якобсон (ориг. данные).
Сешйетво EMPETRACEAE
Пыльник 4-гнездный; гнезда овтединанэи в 2 теки. Перегородка между 2
соседними гнездами каждой теки перед созреванием лизирует, и гнезда
сливаются попарно. Пыльники вскрываются продольными щелями. Строение стенки
пыльника до настоящего времени изучено недостаточно. По данным Семуэльсбна
(Samuelsson, 1913), сформированная стенка'пыльника имеет эпидермис, от
одного до 3 средних слоев и тапетум. На примере Empetrum nigrum и Согета
album автор делает вывод об отсутствии эндотеция в семействе Empetraceae.
По нашим данным, сформированная стенка Е. nigrum состоит из 4—5 слоев —
эпидермиса, эндотеция, 1—2 средних слоев и тапетума. В клетках эпидермиса
и эндотеция на стадии одноклеточных микроспор откладывается крахмал,
расходующийся по мере созревания пыльника; средние слои эфемерны; тапетум
однослойный, но может быть нерегулярно 2-слойным со стороны связника,
секреторный, одноядерный в начале своего развития, далее начиная со стадии
микроспороцита 4—5-ядерный; отмечается полиплоидизация ядер. Тапетум
сохраняет свою физиологическую активность в течение всего микроспорогенеза,
его клетки полностью лизируют лишь ко времени образования 2-клеточных
микроспор. Стенка зрелого Пыльника 2-слойная, содержит эпидермис и
нормально развитый эндотеций с крупными изодиаметрическими клетками, но без
фиброзных утолщений. По-видимому, функцию эндотеция осуществляет
эпидермис, в клетках которого нами отмечены слабо развитые утолщения. Кроме
того, раскрыванию пыльника способствует значительное разрастание клеток
стенки в районе стомиума, при этом клетки приобретают особую рубчатую^струк-
туру. Спорогенная ткань многоклеточная; тетраэдральные тетрады микроспор
образуются симультаннр, имеют массивные каллозные оболочки; встречаются и
изобилатеральные тетрады. Зрелые пыльцевые зерна 2-клеточные, остаются
объединенными в тетрады.
Семяпочка одна, кампилотропная, с одним массивным интегументом,
полностью сформированным к моменту образования тетрады мегаспор, тенуинуцел-
лятная. Фуникулус, разрастаясь, образует вырост, сходный с обтуратором и
тесно примыкающий к микропиле. НуцеллГус рано дегенерирует, его остатки
можно видеть на стадии зрелого зародышевого мешка только в халазальном
районе семяпочки. Внутренний эпидермис интегумента преобразуется в инте-
гументальный тапетум (Empetrum, С. album, Ceratiola ericoides). Археспорий
одноклеточный. Археспориальная клетка закладывается субэпидермально
и становится непосредственно мегаспороцитом. Париетальная ткань
отсутствует. В результате 2 делений мейоза образуется линейная тетрада
мегаспор, халазальная становится функциональной.
Зародышевый мешок моноспорический, развивается по Polygonum-типу,
удлиненной формы, с несколько расширенным микропилярным концом.
Лицевой аппарат хорошо дифференцирован; синергиды имеют отчетливо
выраженный нитчатый аппарат и крючковидные выросты; полярные ядра сливаются до
оплодотворения; 3 клетки антипод дегенерируют вскоре после или даже до
оплодотворения. Семейству свойственна порогамия. Эндосперм целлюлярный.
2 последовательных деления первичного ядра эндосперма, сопровождающихся
цитокинезом, приводят к образованию линейного ряда из 4 эндоспермальных
$4 Сравнительная эмбриология
209
Empetraceae
1—19, 29 — Empetrum nigrum, 20—28 — Corema album.
1—7 — развитие пыльника: 1 — поперечный £рез сформированного молодого пыльника;
деления во вторичном париетальном слое; спорогенная ткань, 2 — 4-слойная стенка
пыльника; дифференциация тапетума, микроспор оциты перед профазой мейоза, 3 — отдельные
стадии мейоза в микроспороцитах, 4 — фрагмент пыльника на стадии одноклеточных
микроспор, 5 — поперечный срез через зрелый пыльник (схема), 6 — фрагмент этого пыльника:
2-слойная стенка; фиброзные утолщения в эпидермисе, 7, 7а — тетрады 2-клеточных
микроспор;
Empetraceae (продолжение)
S—14 — развитие семяпочки, мегаспорогенез и формирование зародышевого мешка: S, 8а —
образование одноклеточного археспория, 9 — мегаспороцит в профазе мейоза и развитие
интегумента, 10 — линейная тетрада мегаспор: халазальная развивается в одноядерный
зародышевый мешок, остальные 3 дегенерируют; тут же дифференциация интегументального
тапетума, 11 — 2-ядерный зародышевый мешок; в микропилярном отделе видны остатки
дегенерировавших мегаспор, 12 — кампилотропное положение семяпочки на стадии зрелого
зародышевого мешка, 13 — зрелый зародышевый мешок; синергиды с нитчатым аппаратом,
вторичное ядро цешральной клетки, грушевидные антиподы, 14 — оплодотворенный
зародышевый мешок; спермий на ядре яйцеклетки, тройное слияние, дегенерирующие
антиподы;
14*
19a
1©у
(Ol
m
19
Empetraceae (продолжение)
15—28 — отдельные стадии развития эндосперма и эмбриогенез: 15 — 2-клеточный
эндосперм, 16 — первые 4 клетки эндосперма располагаются линейно, 17 — 2-клеточный про-
эмбрио и многоклеточный эндосперм; на полюсах зародышевого мешка эндоспермальные
гаустории, 18 — схема расположения гаусториев в развивающемся семени, 19, 19а — микро-
нилярный (19) и халазальный (19а) гаустории "на стадии шаровидного зародыша.
Empeiraceae (продолжение)
20—27 — отдельные стадии эмбриогенеза, 28 — зрелее семя, (1, 2, 4—14, 18, 19, 19а —
ориг.; 3 — по Hagerup, 1927; 15—17 — па Samuelsson, 1913; 20—28 — по Veillet-Bartos-
zewska, 1959). " #
клеток, что характерно для всего порядка Ericales. При дальнейших перикли-
нальных и антиклинальных делениях эндосперма на полюсах его начинают
выделяться богатодлазменные, сильно окрашивающиеся клетки, которые
организуются в микропилярный и халазальный .гаустории. Микропилярный
гаусторий крупнее, размером и физиологически более активен. В начале своего
развития гаустории; многоклеточные, далее стенки клеток лизируют, и
образуется единая цитойлазматическая масса гаустория. Ядра их делятся,
по-видимому, амитотически; встречаются также гипертрофированные ядра. По мере
роста зародыша и эндосперма гаустории сильно вакуолизируются; в зрелом
семени сохраняются их ясные следы. Наличие эндоспермальных гаусториев
характерна для всех 3 родов семейства. Зрелый эндосперм содержит белки и
глобулы жира.
Эмбриогенез изучен на примере С. album и соответствует Solanad-типу (II
период мегархитипа III по классификации Суэжа). У Е. nigrum отмечены
случаи полиэмбрионий, возможно, как результат расщепления проэмбрио на
ранних стадиях его развития (Samuelsson, 1913).
И с с л е.д ованные виды. Ceratiola ericoides (частично), Corema album,
Empetrum germaphroditum, E. nigrum.
Литература. Samuelsson, 1913; Hagerup, 1922, 1927, 1928, 1941,
1946; Crete, 1951; Veillet-Bartoszewska, 1959; Васильев, 1961; Антонова, 1971;
Кайгородова, 1975; Фрейберг (ориг. данные).
Семейство EPACRIDACEAE
Пыльник 2-гнездный. Развитие стенки пыльника не описано. Эндотеций
без фиброзных утолщений. Тапетум секреторного типа, одноядерный (Styphelia
longifolia). Образование микроспор происходит по симультанному типу. У
представителей трибы Styphelieae обычно функционирует лишь одна микроспора из
тетрады, а 3 остальные дегенерируют. Если сохраняются все микроспоры, то
они остаются соединенными в тетрады. Зрелые пыльцевые зерна 3-клеточные,
содержат пластиды и крахмальные зерна (Leucopogon juniperinus).
Семяпочка анатропная, с одним интегументом, тенуйнуцеллятная. Гипо-
дермальная археспориальная клетка непосредственно становится мегаспоро-
цитом. В результате ме.йоза образуется линейная тетрада мегаспор. Как правило,
в качестве материнской клетки зародышевого мешка функционирует халазаль-
ная мегаспора. Однако имеются данные (Brough, 1923) о развитии зародышевого
мешка из микропилярной мегаспоры у S. longifolia. Браф (Brough, 1923, 1924)
213
Epacridaceae
1—10,13 — Styphelia longifolia, 11,12,14 — Epacris impressa, 15—21 —• Dracophyllum se+
cundum.
1—4 — развитие стенки пыльцевого гнезда и микроспор; 5 — семяпочка с археспориальной
клеткой; 6 — тетрада мегаспор; 7—10 — развитие зародышевого мешка; 11—14 — развитие-
эндосперма;
Epacridaceae (продолжение)
15—21 — развитие зародыша, (an — антиподы, з — зародыш, м. г — микропилярный эндо-
спермальный гаусторий, п. ж — нефункционирующие мегаспоры, х. г — халазальный эндо-
спермальный гаусторий, и. я — ядро центральной клетки зародышевого мешка, эн —г
эндосперм). (1—4, 6,8, 9 — по Brpugh, 1924; 5, 7, 10, IS — по Brough, 1923; 11, 12,14 — по
Samuelsson, 1913; 15—21 — по Veillet-Bartoszewska, 1961).
считает нефункционирующими халазальными мегаспорами 3 крупные клетки,
долго сохраняющиеся под халазальным концом зародышевого мешка,
который, как полагает автор, развился из микропилярной мегаспоры. Копланд
(Copeland, 1954), наблюдавший подобные клетки в этом же месте у Epacris
obtusifolia, Leucopogon vigratus, L. pedicullatus и L. ericoides, полагает, что это
антиподы. Однако развитие зародышевого мешка у этих видов автором
прослежено не было. Поскольку имеются данные о быстрой дегенерации антипод
у некоторых представителей Epacridaceae (Epacris impressa — по: Samuelsson,
1913), то не исключено, что, не зная развития зародышевого мешка, можно,
рассматривая его лишь в зрелом состоянии, принять за антиподы халазальные
нефункционирующие мегаспоры, лежащие на месте дегенерированных антипод.
Патерсон (Paterson, 1961) также описывает развитие зародышевого мешка как
из халазальной, так и из микропилярной мегаспоры.
Зародышевый мешок развивается по Polygonum-типу. В синергидах имеется
нитчатый аппарат. Полярные ядра сливаются до оплодотворения. 2/3
зародышевого мешка (с халазальной стороны) окружены эндотелием (Е. obtusifolia).
Эндосперм целлюлярный; образует гаустории. У Epacris, Brachyloma, Le-
betanihus и Sprengelia формируются как микропилярный, так и халазальный
гаустории (у Brachiloma халазальный гаусторий рудиментарен). У Styphelia
развивается только микропилярный гаусторий.
Зародыш развивается по Caryophyllad-типу, но у Dracophyllum secundum
наблюдается сходство с Solanad-типом.
И с с л е,д,х) ванные виды. Brachyloma sp., Dracophyllum secundum,
Epacris sp., E. impressa, E. obtusifolia, Lebetanthus sp., Leucopogon ericoides,
L. juniperinus, L. pedicullatus, L. vigratus, Sprengelia sp., Styphelia sp., S. longi-
folia.
Литература. Payer, 1857; Hofmeister, 1859; Atropoeus, 1903;
Samuelsson, 1913; Brough, 1923, 1924; Crete, 1951; Gopeland, 1954; Smith-White, 1955a,
1955b, 1959; Paterson, 1961; Veillet-Bartoszewska, 1961; Venkata, 1961; McGlone,
1978.
Семейство DIAPENSIAGEAE
Пыльник 2-гнездный, редко одногнездный (Galax); однако иногда
наблюдаются 4-гнездные пыльники (G. aphylla). Эндотеций с фиброзными утолщениями.
В сформированном пыльнике стенка кроме эпидермиса и эндотеция содержит
2—3 средних слоя (Diapensia); клетки секреторного тапетума 2-ядерные.
Зрелые пыльцевые зерна 3-клеточные.
Семяпочка различных, типов — от анатропной до амфитропной, иногда кам-
пилотропная, с одним интегументом, тенуинуцеллятная. Археспориальная
клетка дифференцируется непосредственно в мегаспороцит. В результате мейоза
образуется линейная тетрада мегаспор.
Халазальная мегаспора развивается в зародышевый мешок по Polygonum-
типу. В синергидах имеется нитчатый аппарат (Diapensia); полярные ядра сли-
215
Diapensiaceae
1—11 — Diapensia lapponica.
1 — поперечный разрез 2-гнездного пыльника; 2 — продольный разрез зачатка семяпочки
с гиподермальной археспориальной клеткой; 3 — тетрада мегаспор; 4 — 2-ядерный
зародышевый мешок; 5 — зрелый 7-клеточный зародышевый мешок; 6—8 — развитие клеточного
эндосперма; 9—11 — развитие зародыша. (1—11 — по Samuelsson, 1913).
ваются до оплодотворения; 3 антиподы сохраняются до ранних стадий
эмбриогенеза. У Shortia антиподы размножаются, образуя до 40 клеток (S. galacifo-
lia). В некоторых случаях отмечено формирование интёгументального тапетума.
Эндосперм целлюлярный. Первая перегородка может закладываться в
любом направлении — от поперечного до продольного.
Зародыш развивается, вероятно, по Solanad-типу. В зрелом семени зародыш
прямой или слегка изогнутый.
Исслед а ванные виды. Diapensia sp.^ D. lapponica, Galax sp.,
G. aphylla, Pyxidanthera brevifolia, Shortia sp., S. galacifolia, S. uniflora.
Литература. Petersen, 1912; Samuelsson, 1913; Takenoshin, 1923;
Hagerup, 1928; Шишкин, 1952; Graef, 1958; Safijowska, 1960; Palser, 1963;
Crete, 1964; Yamazaki, 1966; Reynolds, 1968.
Семейство GYRILLACEAE
Пыльник 4-гнездный; гнезда объединены в 2 теки; перед созреванием гнезда
в теках сливаются попарно. Пыльник вскрывается 2 продольными щелями
(Cyrilla ж Cliftqnia) или терминальными порами (Purdiaea). Развитие стенки
пыльника происходит по типу двудольных (центробежно). Сформированная стенка
пыльника 4-слойная: эпидермис, эндотеций, средний слой и тапетум (Cyrilla
и Cliftonia); иногда у Cliftonia monophylla вследствие дополнительных перикли-
нальных делении среднего слоя стенка пыльника становится 5-слойной. Это
явление наблюдается и у Cyrilla racemiflora. Клетки эпидермиса, эндотеция,
среднего слоя и некоторые клетки связника содержат танин. Эндотеций
однослойный; фиброзные утолщения в нем, а также в отдельных клетках связника
образуются незадолго перед раскрыванием пыльников (С. racemiflora). Тапетум
секреторный, однослойный, 2-ядерный со стадии микроспороцита. Начало
дегенерации тапетума у С. racemiflora наблюдается на стадии тетрад; у С. monophylla
тапетум дегенерирует на стадии одноклеточных пыльцевых зерен. Стенка
зрелого пыльника 2-слойная у Cyrilla—эпидермис и фиброзный эндотециц; у
Cliftonia на стадии" одноядерной пыльцы имеется еще средний слой и тапетум.
Сведения о количестве слоев в стенке зрелого пыльника отсутствуют.
Симультанный цитокинез в микроспороцитах приводит к образованию тетраэдральных
у С. racemiflora или тетраэдральных и крестообразных тетрад у С. monophylla.
В результате деления ядра микроспоры образуются маленькая линзовидная
генеративная клетка и крупная вегетативная. Зрелые пыльцевые зерна
высвобождаются на 2-клеточной стадии.
В каждом гнезде 2—5-гнезднрй завязи на плаценте закладывается
одна (у Cliftonia) или от 1 до 3 (у Cyrilla) анатропных семяпочек; у Purdiaea
развивается одна висяче-ортотропная семяпочка. Во всех случаях
семяпочки тенуинуцеллятные или слабо крассинуцеллятные (Matiritzon, 1936),
с одним массивным интегументом, дифференцирующимся на стадии
образования археспориальной клетки; .на стадии зрелого зародышевого мешка
интегумент 5—6-слойный, с длинным и узким микропиле. Внешний эпидермис
интегумента заполнен танином, за исключением небольшой группы клеток
в районе микропиле; внутренний эпидермис на стадии тетрады мегаспор-
преобразуется в интегументальный тапетум с радиально-удлиненнымй крупными,
сильно вакуолизированными клетками; он целиком окружает зародышевый
мешок. Нуцеллус однослойный и рано дегенерирует — на стадии одноядерного-
зародышевого мешка у С. racemiflora и немного позднее у С. monophylla.
Археспорий одноклеточный. У С. racemiflora отмечено развитие 2 археспориальных
клеток (Vijayaraghavan, Dhar, 1978). Археспориальная клетка закладывается
субэпидермально и становится непосредственно мегаспороцитом; париетальная
ткань отсутствует. В результате 2 делений мейоза образуется линейная тетрада
мегаспор, в которой функциональной является халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Зрелый зародышевый мешок у Cliftonia длинный и узкий; у Cyrilla он имеет
широкий микропилярный и узкий халазальный концы. Яйцевой аппарат
дифференцирован; синергиды имеют хорошо выраженный нитчатый аппарат и крюч-
ковидные выросты. Дегенерирующие синергиды долго сохраняются в
оплодотворенном зародышевом мешке. Полярные ядра равной величины; они,
по-видимому, сливаются до оплодотворения; вторичное ядро располагается вблизи
яйцеклетки у Cyrilla или в центре зародышевого мешка у Cliftonia. Крупные
одноядерные антиподы расположены линейно или Т-образно. Часто в
семяпочках наблюдается дегенерация как яйцеклетки, так и зиготы (Cyrilla и Cliftonia).
Зигота значительно удлиняется перед делением. У С. monophylla отмечен
случай проникновения зиготы почти до халазального конца зародышевого мешка.
У С. monophylla на стадии мегаспороцита в халазальном районе семяпочки
дифференцируются клетки, отличающиеся крупными размерами, увеличенными
ядрами и плотной цитоплазмой. Судьба этих клеток различна — часть из них
дегенерирует в процессе развития зародышевого мешка, в других происходят
217
СугЩасеае
1, 2, 4, 6, 10, 11, 14—18, 20—22 — Cyrilla racemiflora, 3, 5, 7—9, 12, 13, 19, 23—26 — Clifto
nia monaphylla.
1—9 — развитие пыльника: 1 — поперечный срез через гнездо молодого пыльника, споро-
генная ткань; деление во вторичном париетальном слое, 2 — сформированная стенка
пыльника, 3 — та же стадия, добавочные периклинальные деления в среднем слое, 4 — фрагмент
гнезда пыльника на стадии тетрад; начало лизиса тапетума, 5 — стенка пыльника на стадии
одноклеточных микроспор; сохраняется средний слой и лизирующий тапетум; развит
фиброзный эндотеций, 6 — поперечный срез через гнездо зрелого пыльника; танин в стенке
пыльника; фиброзные утолщения в эндотеций и клетках связника, 7 — отдельные стадии
мейоза в микроспороцитах, 8, 9 — одноклеточное и 2-клеточноепыльцевое зерно; 10—25 —
мегаспорогенез и развитие зародышевого мешка: 10 — археспориальная клетка в нуцеллусе,
11 — мегаспороцит и развитие интегумента, 12, 13 — диада и тетрада мегаспор, 14 —
одноядерный зародышевый мешок, остатки дегенерирующих мегаспор, дифференциация инте-
гументального тапетума, 15—17 — стадии развития зародышевого мешка,
Cyrillaceae (продолжение)
18 — зрелый зародышевый мешок; антиподы дегенерируют до оплодотворения, 19 —
зародышевый мешок с разрушенной в процессе оплодотворения синергидой и
дегенерирующими антиподами, 20 — зигота, жлетки эндосперма и образование микропилярного и хала-
зального гаусториев, 21, 22 — дальнейшее развитие эндосперма и гаусториев (схема),
23—25 — развитие в халазальном районе семяпочки многоядерных ценоцитных структур
(апоспорические зародышевые мешки — по Vijayaraghavan, Dhar, 1978); 26 — 2-семядоль-
ный зародыш. (1—26 — по Vijayaraghavan, Dhar, 1978).
митозы, что приводит к образованию ценоцитных структур с варьирующим
числом свободных ядер (от 2 до 8). Иногда эти структуры трактуются как
апоспорические зародышевые мешки (Vijayaraghavan, Dahr, 1978). В них
отсутствует клеткообразование, нарушена полярность, лишь в отдельных случаях
наблюдалось распределение ядер, сходное с Polygonum-типом зародышевого
мешка. По мере развития эндосперма эти структуры дегенерируют. По-видимому,
трактовка подобных ценоцитных структур в качестве апоспорических
зародышевых мешков является спорной.
Эндосперм целлюлярный. 2 последовательных периклинальных деления
первичного ядра эндосперма приводят к образованию линейного ряда из 4
клеток. Антиклинальные деления в 2 средних клетках этого ряда дают начало
собственно эндосперму. 2 микропилярные клетки, сливающиеся в одну, —
у Cyrilla или одна у Cliftonia и халазальная клетка увеличиваются в
размере, становятся 2-ядерными (иногда до 4—6 ядер) и организуются в микропи-
лярный и халазальный гаустории. Микропилярный гаусторий особенно
активен, обильно ветвится и проникает в клетки фуникулуса. Оба гаустория
сохраняются долго: еще на стадии 2-семядольного зародыша можно наблюдать сильно
вакуолизированный, уже лишение ядер микропилярный гаусторий и остатки
халазального.
Эмбриогенез не изучен. Наблюдали только отдельные стадии глобулярного
ж 2-семядольного зародыша.
219
Исследованные виды, Cliftonia monophylla, Cyrilla racemiflora.
Литература. Mauritzon, 1936; Copeland, 4953; Thomas, 1960, 1961;
Vijayaraghavan, 1969, 1970, 1978.
, Семейство GRUBBIACEAE
Развитие и структура пыльника и пыльцевого зерна не исследованы;
известно, что зрелые пыльцевые зерна у Grubbia tomentosa одиночные. .
Завязь 2-гнездная, с единственной анатропной, с одним- интегументом,
тенуинуцеллятной семяпочкой в каждом гнезде. Массивный интегумент
образует длинный микропилйрный канал.
Археспорий одноклеточный. чАрхеспорияльная клетка
становится непосредственно мегаспороцитом;
париетальная ткань не образуется. В результате
мейоза образуется линейная тетрада мегаспор;
халазальная развивается в моноспорический
зародышевый мешок по Polygonum-типу.
Grubbiaceae
Grubbia tomentosa.
Продольный срез через семя: дифференцированный
зародыш, массивный эндосперм, остатки микропилярного
и халазального гауетбриев. (По Rain, 1970).
Микропилярный конец зародышевого мешка внедряется в микропиле,
разрушая при этом эпидермис нуцеллуса. Данные о структуре элементов
зародышевого мешка отсутствуют. Отмечено развитие интегументального тапе-
тума.
Ранние стадии эндоспермогенеза не изучены; на поздних стадиях
эндосперм целлюлярныи, массивный, с эпидермисом, покрытым толстой
кутикулой. Хорошо развиты микропилярный и халазальный гаустории. Запасные
вещества эндосперма — белки.
Эмбриогенез не описан. Зрелый зародыш почти равен длине семени,
прямой, дифференцированный.
Исследованный вид. Grubbia tomentosa (частично).
Литература. Tieghem van, 1896; Harms, 1935; Fagerlind, 1947;
Johri, Bhatnagar, 1960; Ram, 1970; Garlquist, 1977, 1978.
Порядок 38. EBENALES
Семейство STYRACACEAE
Пыльник у представителей родов Siyrax (Manshard, 1936)," AlniphyHum,
Halesia и Pterostyrax*. (наши данные) 4-гнездный, с 2 теками. Характерен
массивный цилиндрический связник, снабженный сосудистым пучком. В
созревшем пыльнике гнезда тек объединяются вследствие частичного
разрушения'перегородки между ними. Удлиненные теки вскрываются продольными, щелями ^
интрорзно. Формирование стенки пыльцевого гнезда, происходит по
двудольному типу. Сформированная стенка состоит из 4—5 слоев клеток: эпидермиса,
эндотеция, 1—2 средних слоев и тапетума. Тапетум секреторный,
однослойный, 2-ядерный. В период созревания пыльцы клетки тапетума вакуолизиру-
ются, и тапетальный слой сжимается до тонкой пленки перед раскрыванием
пыльника. Стенка зрелого пыльцевого гнезда представлена эпидермисом и эндо-
тецием. В эндотеции развиты фиброзные утолщения: у Pterostyrax hispidus
во всем слое (за исключением клеток со стороны связника), у Styrax dasyantha
только в 1/3 слоя, прилежащей к основаниям тек. Клетки эпидермиса имеют
выпуклую внешнюю стенку, покрытую восковым слоем. Спорогенная ткань
в гнезде имеет форму цилиндра.- М%йоз симультанного типа. Тетрада
микроспор обычно тетраэдральная, заключена в каллозную оболочку. Зрелые
пыльцевые зерна одиночные, 2-клеточные.
Семяпочки анатропные (реже гемианатропные), с 2 {Styrax) или с одним
(AlniphyHum, Halesia, Pterostyrax) интегументом, тенуинуцеллятные.
Эпидермис нуцеллуса дегенерирует во время развития зародышевого мешка, а базаль-
ная часть нуцеллуса сохраняется в виде небольшого постамента в-
оплодотворенной семяпочке во время раннего эндоспермогенеза. Закладка интегументов
и поворот семяпочки совпадают со временем подготовки мейоцита к мейозу.
Для семяпочек видов Styrax характерна массивная халаза и значительная
область срастания интегументов. По нашим данным, у S. obassia внутренний
интегумент 5—7-слойный, наружный — многослойный (10—15 слоев), в его
эпидермисе накапливаются танины. В готовой к оплодотворению семяпочке
у видов Styrax интегументы равны по высоте и только внутренний формирует
микропиле. Позднее наружный интегумент перерастает внутренний и
смыкается над ним, образуя длинный канал. Характерна дегенерация слоев
внутреннего интегумента, окружающих зародышевый мешок; в области срастания
с наружным интегументом. Микропилярная часть внутреннего интегумента
сохраняется над зародышевым мешком в виде колпачка, состоящего из клеток
с утолщенными и лигнифицированными оболочками. По нашим данным,
единственный интегумент у Pterostyrax corymbosusn P. hispidus-состоят в дорсальной
части из 8—10, у Halesia Carolina — из 10—12, у Alniphyllum fortunei— из
12—14 слоев клеток. У последнего вида клетки наружного эпидермиса
интегумента очень сильно разрастаются и образуют специализированный
воздухоносный слой семенной кожуры. У Pterostyrax и Alniphyllum внутренний
эпидермис интегумента специализирован в эндотелий, отличающийся
упорядоченным расположением более толстостенных таблитчатых клеток. Сосудистый пучок
семяпочки проходит по фуникулусу, он или заканчивается в халазе
(Alniphyllum, Halesia и Pterostyrax), или дает ответвления в наружный интегумент
(Styrax). В зрелой семяпочке ткани интегумента, халазы и плаценты богаты
запасным крахмалом. Археспорий одноклеточный или состоит из нескольких
клеток; только одна из них преобразуется в мегаспороцит (без отделения
кроющей клетки). После мейоза образуется линейная (редко Т-образная) тетрада
мегаспор; халазальная мегаспора развивается в зародышевый мешок Polygo-
* Представители родов Alniphyllum, Halesia и Pterostyrax эмбриологически
исследованы нами. Материал собран в Батумском ботаническом саду.
221
7
Styracaceae
1—3, 6—11 — Halesia Carolina, 4 — Styrax dasiantha, 5, 5a, 12, 17, 17a — Pterostyrax hispidus*
13,13a, 18, 20—27 — Styrax obassia, 14—16 — Alniphyllum fortunei, 19 — Styrax japonicm*
1 — участок пыльцевого гнезда со сформированной "стенкой и микроспороцитами; 2 —
участок пыльцевого гнезда с тетрадами микроспор; 3 — схема строения сформированного
пыльника; 4, 5 — участок стенки пыльцевого гнезда на стадии сформированной пыльцы; 4а, £i& —
схема пыльников; 6 — семяпочка с археспорием; 7, 7а — одна и 2 м&йоцитные клетки в ну-
целлусе;
Sty r acaceae^J продолжение)
8 — тетрада мегаспор; 9, 10 — 2-й 4-ядерные
стадии развития зародышевого мешка; 11 —
сформированный зародышевый мешок; 11а —
схема семяпочки; 12 — семяпочка со зрелым
зародышевым мешком; 13 — оплодотворенный 'За
зародышевый мешок; 13а — схема семяпочки;
Styracaceae (продолжение)
14 — зигота и первичная клетка эндосперма; i5, 16 — 2- и 3-клеточный эндосперм; 16а
схема семяпочки;
Styracaceae (продолжение)
17 — микропиляфная часть эндосперма и зародыш; 17а, 18 — схемы семяпочек; 19, 19а —
схема строения зрелого семени с зародышем в разных плоскостях; 20—27 — эмбриогенез
(1—18 — ориг.; 19, 19а — по Yamazaki, 1970; 20—27 — по Veillet-Bartoszewska, 1960).
15 Сравнительная эмбриология
num-тица. У S. obassia (Manshard, 1936) иногда наблюдалось деление ядер во
всех мегаспорах.
Зрелый зародышевый мешок 7-клеточный, 8-ядерный. У Styrax japonicus
и P. corymbosus он узкий,, вытянутый в длину, у S. obassia и P. hispidus — более
широкий. Синергиды довольно крупные, особенно у Pterostyrax, грушевидной
формы, с выраженным нитчатым аппаратом. Яйцеклетка у всех исследованных
видов содержит крахмальные зерна. Антиподальный аппарат из 3 небольших
клеток, расположенных рядом, линейно или Т-образно, обычно дегенерирует
до или во время оплодотворения. В центральной клетке зрелого зародышевого
мешка много крахмала. Полярные ядра сливаются только при контакте со
спермием (Styrax). Детально процесс двойного оплодотворения не изучен.
Эндосперм целлюлярный; первое деление в эндосперме поперечное,
следующее может быть поперечным или продольным в микропилярной клетке и обычно
поперечное в халазальной. Последующие перегородки не имеют определенной
ориентации. Клетки эндосперма в период их митотической активности очень
крупные, сильно вакуолизированные, с небольшим ядром. По нашим
наблюдениям, клетки периферических слоев эндосперма у видов Styrax более мелкие
и густоплазменные по сравнению с внутренними клетками. Эндосперм в зрелом
семени имеет эллипсоидальную форму на продольном срезе, состоит из
тонкостенных клеток, содержащих липиды и белковые соединения.
Эмбриогенез S. о &ass£a (Veillet-Bartoszewska, 1960) отнесен к V мегархитипу
II периода системы Суэжа, а эмбриогенез S. japonicus (Yamazaki, 1970, 1972) —
к Chenopodiad-типу системы Джогансена. Развитие зародыша исследованных
видов Styrax характеризуется линейной тетрадой бластомеров, образованной:
поперечными делениями зиготы, а затем обеих ее производных (са и сЪ).
Апикальная клетка ее 4-клеточного проэмбрио образует квадранты и октанты,,
в которых происходит отделение эмбриодермы. Из октантов в дальнейшем
образуются семядоли, точка роста и гипокотиль. Клетка сЪ не дает вклада
в собственно зародыш, а образует только суспензор (Veillet-Bartoszewska,
1960; Yamazaki, 1970). На основании анализа указанных данных мы считаем,,
что эмбриогенез представителей рода Styrax следует отнести к Solanad-типу
или к VI мегархитипу серии С. В зрелом семени зародыш хорошо дифференци- _
рован, с 2 крупными семядолями. Виды Styrax — лейкоэмбриофиты (Яковлевг
Жукова, 1973).
Исследованные виды. Alniphyllum fortunei, Halesia carolinar
Pterostyrax corymbosus, P. hispidus, Styrax japonicus, S. obassia, S. officinalis,
S. officinalis var. californica.
Литература. Baillon, 1891; Giirke, (1891) 1897b; Netolitzky, 1926;
Manshard, 1936; Gopeland, 1938; Veillet-Bartoszewska, 1960; Davis, 1966;
Yamazaki, 1970, 1972; Яковлев, Жукова, 1973; Никитичева (ориг. данные).
Семейство SYMPLOCACEAE
Пыльники у Symplocos 4-гнездные, раскрываются 2 продольными щелями,
при этом гнезда объединяются попарно. Развитие стенки пыльцевого гнезда
происходит по типу двудольных. Сформированная стенка состоит из 4—6
клеточных слоев: эпидермиса, эндотеция, 1—3 средних слоев и тапетума.
Однослойный тапетум секреторного типа, состоит из крупных 2—4-ядерных клеток..
Микроспорогенез симультанный. Тетрады микроспор обычно тетраэдральные,,
окружены каллозной оболочкой. Пыльцевые зерна при рассеивании 2-клеточ-
ные. В зрелом пыльнике сохраняются эпидермис и эндотеций. В клетках
эндотеция развиты фиброзные утолщения. Наружная стенка клеток эпидермиса
покрыта кутикулой, в клетках накапливается танин.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. Нуцел-
лус разрушается в процессе развития зародышевого мешка. Интегумент из
6—10 клеточных слоев, сильно вытянут в микропилярной части и образует
226
1—3, 0, 10 — Symplocos japonica, . 11—13 — S. paniculata, 4—8, 14—22 — S. chinensisy
23 — S. crataegoides.
I — схема строения сформированного пыльника; 2 — поперечный срез пыльцевого гнезда
<е тетрадами микроспор; 3 — схема строения вскрывшегося пыльника; За — участок стенки
-этого пыльника с фиброзными утолщениями в эндотеции; 4 — часть семяпочки с археспо-
риальной клеткой в нуцеллусе; 5 — тетрада мегаспор; 6—8 — стадии развития
зародышевого мешка;
длинный микропилярный канал. По нашим данным, в семяпочку входит
сосудистый пучок, разветвляющийся в интегументе. В сформированной семяпочке
внутренний эпидермис интегумента дифференцируется в интегументальный
тапетум. Он отличается упорядоченным расположением изодиаметрических
жлеток и тесно прилегает к зародышевому мешку, а позднее к эндосперму.
В оплодотворенной семяпочке густоплазменные клетки эндотелия значительно
отличаются от сильно вакуолизированных неправильной формы крупных
клеток средних слоев интегумента. Единственная археспориальная клетка
закладывается в нуцеллусе субэпидермально. Без деления она преобразуется в мега-
спороцит. Мейоз заканчивается образованием линейной тетрады мегаспор.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Сформированный зародышевый мешок 7-клеточный, вытянутый по оси
семяпочки, с более узким микропилярным концом, постепенно расширяющийся
б халазальной части. Яйцевой аппарат 3-клеточный, хорошо
дифференцированный. Синергиды удлиненные, с заостренными терминальными концами.
Полярные ядра сливаются перед оплодотворением, и центральное ядро приближается
15*
227
Symplocaceae (продолжение)
9 — схема строения семяпочки на стадии сформированного зародышевого мешка; 10 — микро-
пилярная часть семяпочки с оплодотворенным зародышевым мешком; 11 — зародышевый
мешок с зиготой и 2-клеточным эндоспермом; 12 — эндосперм на ранней стадии развития;
12а — схема строения семяпочки на этой стадии; 13 — 4-клеточный проэмбрио; 14—22 —
эмбриогенез; 23 — схема зрелого семени. (1—3, 9—13 — ориг.; 4—8, 14—22 — по Yama-
zaki, 1970; 23 — по Giirke, (1891) 1897а).
к яйцевому аппарату, где и объединяется со спермием. 3 небольшие антиподы
располагаются в узком выступе на халазальном конце зародышевого мешка,
который внедряется в хорошо выраженную гипостазу. По данным Ямазаки
(Jamazaki, 1970), антиподы у Symplocos chinensis быстро дегенерируют, но мы
наблюдали у 5. paniculata сохранившиеся антиподы во время формирования
эндосперма. Оплодотворение порогамное. Пыльцевая трубка входит в одну
из синергид. Остатки разрушенной синергиды некоторое время сохраняются
в зародышевом мешке наряду с довольно крупной неповрежденной синергидой. .
Эндосперм целлюлярного типа. Первая перегородка делит инициальную-
удлиненную клетку эндосперма поперечно на 2 почти равные клетки. 2
последующих деления обычно также поперечные. В ходе дальнейшего эндоспермо-
генеза продольные деления чередуются с поперечными. В период митотиче-
ской активности клетки эндосперма крупные, с тонкими клеточными
оболочками, вакуолизированной цитоплазмой и небольшим ядром. В зрелом семени
клетки эндосперма содержат жиры.
Эмбриогенез происходит в соответствии с V мегархитипом системы Суэжа
или по Ghenopodiad-типу системы Джогансена. Зигота делится,, когда
эндосперм достигает многоклеточного состояния. Первая перегородка в зиготе
поперечная, сдвинута в апикальную часть клетки. Характерна стадия октантов
и вычленение эмбриодермы на ранней стадии эмбриогенеза. Клетка са дает
начало инициалям центрального цилиндра и коры корня, семядолям, точке
роста побега и гипокотилю. Из клетки сЪ формируется только подвесок и
корневой чехлик (Jamazaki, 1970). -У Symplocos klotzschii отмечена адвентивная
интегументальная полиэмбриония (Ghirtoiu, 1918), что, требует дальнейшей
проверки.
Зрелый зародыш изогнутый, с 2 короткими семядолями и развитым гипо-
котилем, занимает центральное положение в семени и окружен многослойным
эндоспермом.
Исследованные виды. Symplocos chinensis, S. cochinchinensis,
S. foliosa, S. japonica, S. klotzschii, S. macrophylla, S. paniculata, S. racemosa,
S. spicata var. attenuata.
Литература. Gurke, (1891) 1897a; Warming, 1913; Ghirtoiu, 1918;
Schnarf, 1931; Jamazaki, 1970; Gulati, Ravishankar, 1980; Никитичева (ориг.
данные).
Семейство LISSOCARPACEAE
Эмбриологически не изучено.
Завязь у Lissocarpa 4-гнездная, в каждом гнезде развиваются 2 висячие
семяпочки.
Семя с обильным эндоспермом. Зародыш прямой, с радикулой и валькова-
тыми семядолями.
Литература. Baillon, 1891; Gurke, (1891) 1897с; Тахтаджян, 1966.
Семейство EBENACEAE
Пыльники 4-гнездные, при раскрывании перегородка между гнездами
каждой теки разрушается и гнезда объединяются. Развитие стенки пыльцевого
гнезда происходит центробежно, по типу двудольных, но в деталях не просле-
' жено. Сформированная стенка состоит из 4—5 слоев: эпидермиса, эндотеция,
1—2 средних слоев и тапетума. Тапетум секреторного типа, однослойный,
состоит из 1—2-ядерных или многоядерных клеток. В зрелом пыльнике
сохраняются эпидермис и эндотеций. У Diospyros в клетках эндотеция, а также во
229
ЕЬепасеае
1, 2, 8, 8а, 12—33 — Diospyros kaki, 3, 7 — D. lotus, 4, 4a, 9—11 — D. virginiana, 5, 5a —
Royena. lucida, 6 — Diospyros glaucifolia.
1 — схема строения пыльника; 2 — часть теки с 2 пыльцевыми гнездами, содержащими
одноклеточную «шльцу; 3 — участок стенки зрелого пыльника; 4 —* семяпочка с мегаспоро-
цитом; 5 — часть семяпочки со зрелым зародышевым мешком; 4а, 5а — схемы
соответствующих стадий развития семяпочек;
ЕЪепасеае (продолжение)
6 — эндосперм и 2-клеточный зародыш; 7 — схема семяпочки на этой стадии; 8 — схема
семяпочки на стадии проэмбрио; 8а — проэмбрио;
многих клетках связника накапливаются дубильные вещества. Микроспоро-
генез протекает симультанно; образовавшиеся микроспоры располагаются
тетраэдрально. Зрелые пыльцевые зерна почти сферические, 2-клеточные, иногда
одноклеточные у D. каЫ и D. lotus. Деление генеративной клетки и образование
спермиев происходят в пыльцевой трубке.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Слой нуцел-
луса, окружающий мегаспороцит, дегенерирует во время развития
зародышевого мешка. Базальная часть нуцеллуса длительно сохраняется в виде
небольшой колонки или постамента у D. virginiana, D. каЫ и D. glaucifolia. Микро-
231
ЕЪепасеае (продолжение)
9—11 — мегаспорогенез; 12—15 — развитие зародышевого мешка; 16—18 — ранние стадии
развития эндосперма; 19—32 — эмбриогенез; 33 — схема строения зрелого семени. (1—8а,
33 — ориг.; 9—11 — по Hague, 1911; 12—32 — по Yamazaki, 1972).
пилярный канал значительной длины, формируется только внутренним инте-
гументом. Последний образован несколькими (около 10) клеточными слоями.
Его самый внутренний слой из мелких изодиаметрических клеток с густой
цитоплазмой и крупным ядром является интегументальным тапетумом. Он
окружает постамент нуцеллуса и зародышевый мешок с развивающимся
эндоспермом, а также частично выстилает микропилярный канал. Паренхимные клетки
внутреннего интегумента в период эндоспермогенеза сильно увеличиваются
в размере, опустевают, а их оболочки пропитываются целлюлозой. У D. kaki
внутренний интегумент со стороны эндосперма имеет волнистые очертания за
счет неравномерности разрастания его клеток. Это вызывает слабую румина-
цию эндосперма в определенный период его развития и увеличивает
поверхность соприкосновения эндосперма и интегумента. В период созревания семени
внутренний интегумент дегенерирует. Массивный наружный интегумент имеет
от 7 до 40 слоев клеток и снабжен сосудистым следом. Несколько слоев с
232
внутренней стороны интегумента имеют упорядоченную структуру и состоят
из мелких изодиаметрических клеток. Позднее они используются
развивающимся эндоспермом. В нескольких слоях с наружной стороны интегумента
цитоплазма заполняется танинами, а клеточные стенки приобретают лигни-
фицированные утолщения. Единственная археспориальная клетка
дифференцируется в субэпидермисе слабо развитого нуцеллуса и непосредственно (без
деления) преобразуется в мегаспороцит. После мейоза образуется линейная
или Т-образная тетрада мегаспор. Халазальная мегаспора развивается в
зародышевый мешок Polygonum-типа. Нередко в отдельных семяпочках
Diospyros зародышевый мешок дегенерирует.
Зрелый зародышевый мешок 8-ядерный, 7-клеточный, овально-удлиненный.
Яйцевой и антиподальный аппараты 3-клеточные. Небольшие антиподы,
расположенные в линейный ряд, вклиниваются в постамент нуцеллуса. Отмечена
ранняя дегенерация клеток антипод. Оплодотворение порогамное, двойное.
Пыльцевая трубка проникает в зародышевый мешок, разрушая одну из синер-
гид,' другая синергида. сохраняется во время раннего эндоспермогенеза. В этот
период тккже видна пыльцевая трубка в микропилярном канале.
Эндосперм целлюлярного типа. Первое деление в клетке эндосперма
поперечное. Образовавшиеся микропилярная и халазальная клетки обычно
делятся также поперечно. Дальнейшие деления в линейном ряду клеток
происходят как в продольном, так и в поперечном направлениях. Когда эндосперм
приобретает овальную или почти шаровидную форму, митотические деления
в нем затухают. В этот период, цо нашим наблюдениям, микропилярный и ха-
лазальный концы эндосперма отличаются более мелкими густоплазменными
клетками от центральной части эндосперма с крупными вакуолизированными
клетками. Для некоторых видов Diospyros характерна руминированность эндосперма
в молодом семени (Annona-тип — по классификации Periasamy, 1962), которая
обычно сглаживается при созревании (по мере дегенерации внутреннего
интегумента). В зрелом семени эндосперм массивный, без руминации или слабо-
руминированный, содержит липиды.
Эмбриогенез соответствует Chenopodiad-типу с замедленной
дифференциацией (Yamazaki, 1972). Зигота содержит крахмальные зерна; она имеет
длительный период покоя и делится после того, как эндосперм становится массивной
тканью, содержащей несколько сотен клеток. Перед делением зигота
становится широкоовальной. Первая перегородка в ней поперечная, несколько
сдвинута в апикальную часть клетки. Второе деление также поперечное в клетке
сЪ, из которой образуются в дальнейшем подвесок и инициали корня зародыша.
Подвесок из 5—8 этажей клеток, от 2 до 4 клеток в толщину. Из клетки са
формируются квадранты и октанты. В последних происходит отделение эмбрио-
дермы. В зрелом семени зародыш хорошо дифференцирован, прямой, с
листообразными семядолями, выраженным апексом побега, массивным гипокотилем
и зачатком корешка. Прокамбиальный тяж развит в гипокотиле и семядолях.
Исследованные виды Diospyros — лейкоэмбриофиты.
Исследованные виды. Diospyros kaki% D. lotus, D. virginiana.
Литература. Chatin, 1870; Tamari, 1901; Wettstein, 1908; Longo;
1909; Hague, 1911; Woodburn, 1911; Warming, 1913; Yasui, 1915;?Schnarf,
1931; Periasamy, 1962; Тутаюк,-My радов, 1967,1969; Yamazaki, 1972; Яковлев,
Жукова, 1973; Мурадов, 1974; Sobajima, Ishida, Inaba, 1975; ^Corner, 1976;
Никитичева (ориг. данные).
Семейство SAPOTACEAE
Пыльники 4-гнездные, с 2 теками, раскрывающимися продольными щелями.
Развитие пыльника исследовано у Mimusopselengi. Археспорий в каждом гнезде
представлен однослойной гиподермальной пластиной клеток. После перикли-
нальных делений клеток археспория образуются первичные париетальный
и спорогенный слои. Сформированная стенка пыльцевого гнезда —
производят
Sapotaceae
1—13 —Pouteria obovata var. dubia, 14 — Bumelia lanuginosa, 15 — Achras sapota (Sapota
Achras), 16 — Sideroxylon globosum.
1, 2 -^-нуцелпус с мегаспороцитом и тетрадой мегаспор; 3 — 2-ядерный зародышевый
мешок; 4 — зрв!ый зародышевый мешок; 5 — схема семяпочки на этой стадии; 6—12 —
эмбриогенез; 13 — молодое семя с эндоспермом и зародышем; 14—16 — зародыш и эндосперм
в зрелом семени ((7—13 — по Yamazaki, 1971; 14—16 — no«Baillon, 1891(1892)).
ная париетального слоя — состоит из эпидермиса, эндотеция, 3—4 средних
слоев и секреторного тапетума. Тапетальные клетки становятся 2—4-ядерными
на стадии материнских клеток микроспор,, а позже, в результате слияния
ядер, — полиплоидными. Эндотеций с фиброзными утолщениями, которые
могут возникать также в примыкающих к нему клетках связника. Отмечено
наличие аномоцитных устьиц на лопастях пыльника и связнике. Спорогенная
ткань многослойная. Образование микроспор происходит по симультанному
типу, тетрады тетраэдральные, крестообразные и изобилатеральные.
Пыльцевые зерна с толстой экзиной и тонкой интиной, рассеиваются на 2-клеточной
стадии.
Семяпочка анатропная, тенуинуцеллятная, одяопокровная. Микропиляр-
ная часть нуцеллуса дегенерирует во время развития зародышевого мешка,
халазальная часть дольше сохраняется в виде небольшого постамента.
Единственный интегумент массивный, у Pouteria — из 15—18 клеточных слоев. Уже
после I делениямейоза в мегаспороците края интегумента смыкаются и образуют
микропилярный канал значительной длины. В оплодотворенной семяпочке
клетки нескольких внутренних слоев интегумента увеличиваются в размерах
234
и вакуолизируются. В них накапливаются липиды. Сосудистый пучок
семяпочки разветвляется в халазе на несколько ветвей, пронизывающих массивный
интегумент. Археспориальная клетка закладывается в небольшом бугорке
нуцеллуса субэпидермально и без деления преобразуется в мегаспороцит. Мейоз
заканчивается образованием линейной (реже Т-образной) тетрады мегаспор,
из них халазальная дает начало зародышевому мешку Polygonum-типа.
Зрелый зародышевый мешок 7-клеточный. Яйцеклетка крупная, синергиды
с нитчатым аппаратом (М. elengi) или без него. Центральная клетка вакуоли-
зирована, полярные ядра перед оплодотворением приходят в контакт и
сливаются. 3 антиподальные клетки (Bhatnagar, Gupta, 1970; Yamazaki, 1971)
лежат в узком халазальном конце зародышевого мешка, внедряющемся,
вероятно, в постамент нуцеллуса или в халазу. По более ранним сведениям
(Murthy, 1941), антиподы представлены ядрами. По имеющимся данным,
антипода льный аппарат эфемерен. Процесс двойного оплодотворения не изучен.
Эндосперм нуклеарный. В первичной клетке эндосперма образуется большое
число свободных ядер (до тысячи у М. elengi), прежде чем наступает процесс
клеткообразования. Он происходит в центрипетальном направлении, начинаясь
от микропилярного конца зародышевого мешка. В результате центральная
вакуоль постепенно заполняется клетками, более крупными в центре, чем на
периферии эндосперма. В зрелом семени у представителей разных родов
эндосперм окружает зародыш более или менее тонким слоем или совсем
отсутствует. Наиболее массивный «слой» эндосперма отмечен у представителей родов
Sideroxylon, Chrysophyllum жМапИкага.УPouteria и Bumelia эндосперм
сохраняется в виде тонкого «слоя» или полностью исчезает, как у Lobatiachrysophylli-
folia (Radlkofer, 1884).
Эмбриогенез отнесен к Chenopodiad-типу с медленной дифференциацией
(Yamazaki, 1972), хотя, судя по формуле, данной для Pouteria (Yamazaki,;
1971), он ближе к Solanad-типу. Зигота удлиняется перед делением, первая
перегородка Закладывается поперечно. Апикальная клетка са делится также
поперечно на ее и cd; Из производных ее образуются в дальнейшем семядоли,
точка роста, гипокотиль, из cd — центральный цилиндр и корневой чехлик.
Из базальной клетки сЪ 2-клеточного проэмбрио формируется массивный
многоклеточный суспензор. Его клетки одноядерные, варьируют по размерам.
В зрелом семени большая его часть занята крупным прямым зародышем
с листообразными семядолями, имеющими развитую васкулярную систему и
систему млечников, содержащих гутту, В тойстых семядолях Labatia и Pouteriu
много крахмальных зерен. В зародыше морфологически выражена точка роста,
гипокотиль или хорошо развит (Sideroxylon globosum), или укорочен
(Bumelia lanuginosa). Изученные представители родов Achras, Lucuma, Palaquiumf
Mimusops — лейкоэмбриофиты (Яковлев, Жукова, 1973).
Исследованные виды. Achras sapota, Bassia latifolia, Manil-
kara hexandra, Mimusops elengi, Pouteria obovata var. dubia.
Литература. Radlkofer, 1884; Engler, 1890; Baillon, 1891 (1892);
Warming, 1913; Schnarf, 1931; Murthy, 1941; Wood, Channel, 1960; Davis,
1966; Bhatnagar, Gupta, 1970; Yamazaki, 1971, 1972; Яковлев, Жукова, 1973;
Corner, 1976.
Порядок 39. PRIMULALES
^ Семейство MYRSINACEAE
Пыльники 4-гнездные, у Aegiceras — 2-гнездные (Hutchinson, 1959), интрорз-
ные, вскрываются продольно или апикальными порами. У Aegiceras и Ardisia
elliptica гнезда пыльников с поперечными перегородками. По нашим данным,
сформированная стенка пыльника у Ardisia walichii состоит из эпидермиса,
эндотеция, 2 средних слоев и тапетума. У Maesa dubia (Sankara, Rao, 1971)
отмечался только один средний слой. В отдельных клетках эпидермиса,
эндотеция, средних слоев и клетках связника у A. walichii накапливаются
дубильные вещества. Тапетум и эндотеций нерегулярно 2-слойные. Клетки секрзтор-
ного тапетума 1—2-ядерные. В эндотеций и клетках средних слоев у A.
walichii и М. dubia развиваются фиброзные утолщения. У Myrsine и Badula
эндотеций без фиброзных поясков. У A. walichii гнезда пыльника окружены 3-слой-
ным фиброзным слоем с наружной стороны и 2-слойным со стороны связника,
втенка зрелого пыльника у этого вида представлена эпидермисом, фиброзным
эндотецием и 2 средними слоями. Микроспороциты в результате мейоза
формируют тетраэдральные тетрады микроспор. Зрелые пыльцевые зерна одиночные,
2-клеточные. Генеративная клетка овально-удлиненная.
Семяпочки многочисленные (Maesa, Aegiceras) или в небольшом количестве
(Myrsine), анатропные, гемитропные или кампилотропные, тенуинуцеллятные,
с двумя 2—3-слойными интегументами (у A. walichii, по нашим данным,
внутренний интегумент более массивный) или с одним 4—5-слойным
(Aegiceras), У Maesa rubiginosa, M. dubia и М. indica наблюдается образование инте-
гументального тапетума, примыкающего к зародышевому мешку. У М. indica
в интегументальном тапетуме имеются дубильные вещества. У Aegiceras corni-
culatum, Ardisia crispa и Myrsine africana интегументальный тапетум
отсутствует. Микропиле образовано одним внутренним или обоими (М. dubia)
интегументами. В субэпидермисе нуцеллуса дифференцируются археспориальные
клетки в количестве от одной до нескольких, одна из которых функционирует
непосредственно как мегаспороцит. Париетальные клетки отсутствуют. В
результате мейоза в мегаспороците, как правило, формируется тетрада мегаспор.
У Aegiceras majus отмечается образование' 3 мегаспор вместо обычных 4 (Каг-
sten, 1891). Тетрада мегаспор линейная. Однако у М. dubia отмечен случай
образования изобилатеральной тетрады. Наблюдалось также отсутствие
синхронности при дегенерации мегаспор.
Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры по Polygonum-типу. У A. crispa отмечаются 2- и 4-ядериые
зародышевые? мешки. Яйцевой аппарат в них обычно отсутствует (Jaensch, 1905). Зрелый
зародышевый мешок очень крупный. У М. dubia он состоит из яйцевого
аппарата с крупной яйцеклеткой, большого центрального ядра и 3 антиподальных
клеток. У A. majus зародышевый мешок эллиптической формы. У A. crispa
он веретеновидной формы, слегка изогнут и приблизительно в 8 раз длиннее
своей ширины. У М. dubia (Sankara Rao, 1971) на 4-ядерной стадии халазаль-
ный конец зародышевого мешка начинает усиленно расти, удлиняться и
формирует сильно развитый гаусторий. Впоследствии зародышевый мешок
развивает 2 латеральных отростка, один из которых интенсивно внедряется в
интегумент. Оплодотворение не описано.
Myrsinaceae
1—4, 7—17 — Maesa dubia, 5—66, 18 — Ardisia walichii, 19, 21—23 — Aegiceras majus,
20 — Maesa indica, 24 — Embelia ribes, 25 — Myrsine africana.
1 — часть пыльцевого гнезда, показывающая эпидермис, эндотеций, средний слой,
одноядерный тапетум и микроспороциты; 2 — часть стенки пыльника с эпидермисом,
фиброзным эндотецием и фиброзным средним слоем; 3 — тетраэдральное расположение микроспор;
236
Myrsinaceae (продолжение)»
4 — 2-клеточное пыльцевое зерно; 5 — поперечный срез пыльника (схема) и его фрагмент
(5а) со сформированной стенкой и 2-клеточной пыльцой; 56 — 2-клеточное пыльцевое зерно
с линзовидной генеративной клеткой при большем увеличении; 6 — зрелый вскрывшийся
пыльник и фрагмент этого пыльника (6а); 66 — зрелое пыльцевое зерно при большем
увеличении; 7 — семяпочка с археспориальной клеткой; 8 — семяпочка с 2 археспориальными
клетками; 9 — семяпочка с 4 археспориальными клетками; 10 — мегаспороцит; 11 — диада;
12 — линейная тетрада мегаспор; 13 — линейная тетрада мегаспор; верхние 3 —
дегенерирующие; 14 — тетрада со 2-й и 3-й мегаспорами, расположенными бок о бок по отношению
друг к другу; 15 — 4-ядерный зародышевый мешок, показывающий халазальный рост;
16 — сформированный зародышевый мешок с халазальным гаусторием; 17 — зародышевый
мешок с латеральным гаусториальным выростом; 18 — зрелый зародышевый мешок; 19 —
радиальный срез семени; 20 — молодой зародыш; 21 — молодой зародыш, внедряющийся
в эндосперм; 22 — шарообразный зародыш с суспензором; 23 — радиальный срез семени;
24, 25 — продольный срез семени. (1—4, 7—17 — по Sankara Rao, 1971; 5—66,18 — ориг.;
22 — по Karsten, 1891t 19, 21, 23 — по Carey, Fraser, 1932; 20 — по Dahlgren, 1916; 24, 25 —
по Baillon, 1892, фрагменты).
Эндосперм нуклеарный, позднее он становится клеточным и в некоторых
случаях руминированным (Myrsine, Maesa и Embelia). Иногда у Maesa в
клеточном эндосперме наблюдаются многоядерные клетки. У AFmajus (Haberlandt,
1895) отмечены эндоспермальные гаустории, которые активно растут в
направлении фуникулярной ткани. Эндосперм маслянистый. У Maesa крахмал
отсутствует. В зрелом семени обильный эндосперм. Редко зрелые семена без
эндосперма (Aegiceras).
Эмбриогенез протекает по Onagrad-типу. Формируется суспензор.
У М. indica (Dahlgren, 1916) он состоит из единственного ряда клеток.
Зрелый зародыш прямой или слегка согнутый. В зрелом зародыше A. majus
зародышевый корешок и почечка остаются недифференцированными до
прорастания. Существует значительное разнообразие в форме семядолей у
представителей различных родов. Семядоли свободные или сросшиеся в трубку
вокруг почечки (Aegiceras); иногда они слегка скручены вокруг друг друга;
могут быть короткие и мясистые (A. majus), эллиптические, выемчатые (Ardi-
sia polycephala), маленькие раздвоенные (A. mamillata), овальные (A. japonica).
Основные запасные питательные вещества у А. majus — белки и крахмал в виде
238
сложных зерен. Ardisia crenata, A. japonica и A. tuberculata характеризуются
бесхлорофилльностью зародыша.
Распространена полиэмбриония. Для Ardisia характерна адвентивная
эмбриония.
Исследованные виды. Aegiceras corniculatum, A. majus,
Ardisia crispa, A.elliptica, A. walichii, Maesa dubia, M. indica, M. rubiginosa, Myr-
sine africana. .
Литература. Hofmeister, 1858; Braun, 1860; Chatin, 1870; Warming,
1878, 1913; Karsten, 1891; Baillon, 1892; Haberlandt, 1895; Lubbock, 1896;
Mez, 1902; Jaensch, 1905; Dahlgren, 1916; Schurhoff, 1926a, 1926b; Schnarf,
1931; Carey, Fraser, 1932; Johansen, 1950; Hutchinson, 1959; Davis, 1966;, Tax-
таджян, 1966; Sankara Rao, 1972; Яковлев, Жукова, 1973; Corner, 1976; Ma-
метьева (ориг. данные).
Семейство THEOPHRASTACEAE
Пыльники 2-гнездные, раскрываются продольно, экстрорзные. Развитие
стенки пыльника и пыльцевых зерен не описано, но у Deherainia smaragdina
{Schnarf, 1931) тапетум многослойный.
Завязь одногнездная. Количество семяпочек варьирует. Семяпочка ана-
тропная, гемианатропная или кампилотропная, с 2 интегументами, тенуину-
целлятная. Внутренний интегумент толще, чем наружный. Наружный —
у Deherainia и Jacquinia — состоит из 2 слоев и отличается от внутреннего мно-
1, 3, 7, 17 — Clavija longifolia, 2, 14 — Deherainia smaragdina, '4, 6, 8, 15 — Jacquinia auran-
tiaca, 5, 9—13, 16 — Theophrasta macrophylla, 18 — Clavija ornata, 19 — Jacquinia ruscifolia.
1 — нуцеллус с археспориальной клеткой; 2, 3 — семяпочка с мегаспороцитом; 4 — мега-
спороцит; 5 — диада в делении; 6 — тетрада мегаспор; 7 — образование^ клеток мегаспор
вместо обычной тетрады; 8 — семяпочка с 2-ядерным зародышевым мешком; 9,10 — 2-ядер-
жый зародышевый мешок; 11,12 — верхняя часть сформированного зародышевого мешка;
13 — верхняя часть зародышевого мешка после оплодотворения; 14—17 — семяпочки;
18, 19 — продольный срез через семя. (1, 7 — по Dahlgren, 1916; 2—6, 8—17 — по Maurit-
zon, 1936; 18, 19 — по Baillon, 1892, фрагменты).
239
1—3, 6—9, 11—13 — Anagallis pumila, 4, 4a, 5, 5a, 24, 26 — Androsace carnea, 10, 14—11V
20—23, 25, 38 — Primula floribunda, 18, 19 — Primula officinalis, 27—36 — Samolus va-
lerandi, 37 — Trientalis eurppaea.
1 — часть пыльника с первичным париетальным и спорогенным слоями; 2 — часть
пыльника со сформированной стенкой и спорогенной тканью; 3 — более поздняя стадия; 4 —
поперечный срез пыльника и его фрагмент (4а) на стадии 2-клеточных пыльцевых зерен; 5 —
поперечный срез зрелого пыльника и его фрагмент (5а) со зрелыми пыльцевыми зернами и
стенкой пыльника, состоящей из эпидермиса и фиброзного эндотеция; 6—8 — микроспоро-
енез; 9 — тетрада микроспор; 10 — крестообразная тетрада микроспор; 11 — одноядерная*
микроспора;
гослойного. У Theophrasta и Clavija наружный интегумент 4-слойный, но ко
времени оплодотворения или позже граница между обоими интегументами почти
неразличима (Mauritzon, 1936). Микропиле образовано обоими интегументами,
В субэпидермисе нуцеллуса дифференцируется археспориальная клетка,
которая без образования париетальной клетки становится непосредственно мега-
спороцитом. В результате мейоза в мегаспороците, как правило, образуются
4 мегаспоры. У Clavija longifolia наблюдалось образование 3 мегаспор вместо*
обычных 4 (Dahlgren, 1912). Тетрада мегаспор линейная или Т-образная.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. На 2-ядерной стадии у Theophrasta macrophylla отмечается сильное
разрастание зародышевого мешка. Синергиды крючковидной формы (Mauritzon,
1936). Полярные ядра сливаются перед оплодотворением. 3 антиподальные
клетки дегенерируют в зрелом зародышевом мешке. Оплодотворение не описано.
Эндосперм нуклеарный. В зрелых семенах эндосперм обильный, нерумини-
рованный. У Deherainia зрелые семена без эндосперма (Mauritzon, 1936).
Эмбриогенез не исследован. Зрелый зародыш прямой или слегка согнутый^
с хорошо развитыми семядолями.
Исследованные виды. Clavija longifolia, С. ornata, Deherainia:
smaragdina, Jacquinia aurantiaca, J. ruscifolia, Theophrasta macrophylla.
Литература. Baillon, 1892; Mez, 1903; Warming, 1913; Dahlgren,.
1916; Schnarf, 1931; Mauritzon, 1936; Hutchinson, 1959; Davis, 1966; .Тахта-
джян, 1966; Corner, 1976.
Семейство PRIMULACEAE
Пыльники 4-гнездные, интрорзные, вскрываются продольной щелью.
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, среднего слоя
и тапетума. Тапетум секреторный, с одноядерными, иногда многоядернымис
клетками. Средний слой эфемерный, в эндотеции образуются фиброзные
утолщения. Отдельные клетки эпидермиса, иногда и эндотеция (Androsace cornea),.
заполнены танином. Стенка зрелого пыльника представлена эпидермисом и эн-
дотецием. Образование микроспор симультанное. Тетрады микроспор
тетраэдральные, иногда крестообразные. Зрелые пыльцевые зерна 2-клеточыые.
У Primula officinalis (Dahlgren, 1916) образование спермиев происходит как
в пыльцевом зерне, находящемся на рыльце пестика, так и в пыльцевой трубке.
Семяпочка анатропная или полуанатропная, с 2 интегументами, тенуину-
целлятная. Наружный интегумент 2-слойный, внутренний — 2—3- или
многослойный. У большинства родов наблюдается образование интегументального
тапетума, примыкающего к зародышевому мешку. Обычно в нем и в наружном
слое наружного иытегумента накапливаются дубильные вещества. У Trienta-
Usb тапетальных клетках они никогда не наблюдались. У Cyclamen и, вероятно,
у С oris интегументальный тапетум отсутствует. Микропиле узкое, образовано
обоими интегументами. В субэпидермисе нуцеллуса дифференцируются архе-
спориальные клетки в количестве от одной до нескольких, но обычно только
одна из них функционирует непосредственно как мегаспороцит. У P.
officinalis (Dahlgren, 1916) наблюдались 2 полностью развитых зародышевых мешка
в одной семяпочке, образованных из 2 мегаспороцитов. Париетальные клетки
отсутствуют. В результате мейоза в мегаспороците формируется линейная или
иногда Т-образная тетрада мегаспор.
Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры по Polygonum-типу. Зрелый зародышевый мешок крупный, бедный цито-
12 — первое деление в микроспоре; 13 — 2-клеточное пыльцевое зерно; 14 — нуцел-
л ус с 2 археспориальными клетками; 15 — мегаспороцит; 16 — диада в делении;
17 — линейная тетрада мегаспор; 18,19 — тетрады мегаспор; 20 — 2-ядерный зародышевый
мешок; 21 — 4-ядерный зародышевый мешок; 22 — 8-ядерный зародышевый мешок;
16 Сравнительная эмбриология
241
Primulaceae (продолжение)
23, 24 — зрелые зародышевые мешки; 25 — зигота и эндоспермальные ядра; отмечен инте-
гументальный тапетум с густым содержимым; 26 — зародыш и эндоспермальные ядра;
27—36 — последовательные стадии эмбриогенеза; 37 — молодой зародыш; 38 —
продольный срез через семя. {1—3, 6—9, 11—13 — по Raju, 1952; 4, 4а, 5, 5а, 24, 26 — ориг.;
10,14—17, 20—23, 25, 38 — по Subramanyam, Narayana, 1968; 18, 19, 37 — по Dahlgrei),
1916; 27—36 — по Soueges, 1937).
плазмой, удлиненный, слегка серпообразной формы или шаровидный. Клетки
яйцевого аппарата имеют грушевидную форму. Полярные ядра сливаются до,
во время или после оплодотворения. Антиподы большей частью незначительные
по размеру и эфемерные. В зрелом зародышевом мешке они обычно не
наблюдаются. Часто их дегенерация наступает без предварительного образования
клеток. У рода Lysimachia антиподы сформированы довольно хорошо, иногда
достигают очень крупных размеров (Lysimachia vulgaris и L. ephemerum).
Вероятно, эти гигантские антиподы — следствие полиплоидии их ядер,
вызывающей гипертрофию клеток. Всем родам свойственна порогамия и двойное
оплодотворение.
Эндосперм нуклеарный, но, после деления зиготы начинается формирование-
стенок, и ткань становится клеточной. У Anagallis обычно образуются 8 ила
16 свободных ядер, у P. officinalis — около 1000 ядер перед формированием
стенок. У P. officinalis и Hottonia palustris наблюдаются многоядерные
эндоспермальные клетки. В некоторых случаях отмечается руминация. В зрелом
семени эндосперм сохраняется и содержит запасные белки и жиры. У многих
видов эндоспермальные клетки имеют очень толстые амилоидные стенки, что»
является дополнительным видом резервного питания.
Эмбриогенез протекает по Caryophyllad-типу или в соответствии с III ме-
гархитипом II периода системы Суэжа. Первое деление зиготы поперечное,
базальная клетка 2-клеточного проэмбрио формирует суспензор, состоящий
из одного ряда клеток. Зрелый зародыш прямой, почечка не дифференцирована..
Лейкоэмбриофит.
Полиэмбриония отмечается у Primula auricula.
Исследованные виды. Anagallis arvensis, A. pumila, Androsace
carnea, A. maxima, A. pubescens, Cortusa mathioli, Cyclamen europaeum, Glaur
maritima, Qregoria vitaliana, Hottonia palustris, Lysimachia ephemerum, L.
vulgaris, Primula auricula, P. denticula, P. elatior, P.floribunda, P. minima, P.
officinalis, P. sinensis, P. veris, P. vulgaris, Samolus valerandi, Soldanella alpina,.
S. hungarica, Trientalis europaea.
Литература. Hofmeister, 1858; Scott, 1864; Chatin, 1870; Vesquev
1878, 1879a, 1879b; Warming, 1878, 1913; Elfving, 1879; Jonsson, 1879-1880,
1881; Pax, 1882; Soltwedel, 1882; Baillon, 1892; Hubert, 1896; Billings, 1901;;
Brokschmidt, 1904; Dahlgren, 1914, 1915, 1916; Farr, 1916; Schurhoff, 1926;
Schnarf, 1931; Soueges, 1937; Johansen, 1950; Raju, 1953; Veillet-Bartoszewskar
1957a, 1957b, 1963; Lebegue, 1958; Hutchinson, 1959; Руденко, 1960; Woodell,
1960; Davis, 1966; Тахтаджян, 1966; Subramanyam, Narayana, 1968; Пашук,
1969; Каграманова, 1972; Яковлев, Жукова, 1973; Richards, Ibrahim, 1982;
Маметьева (ориг. данные).
16*
Порядок 40. MALVALES
Семейство ELAEOGARPAGEAE
Пыльник 4-гнездный. У Muntingia calabura сформированная стенка
пыльника состоит из эпидермиса, эндотеция, 1—2 средних слоев и тапетума.
Эпидермис сохраняется и его клетки могут заполняться танином. У Elaeocarpus
клетки субэпидерма л ьного слоя преобразуются в каменистые клетки, но у
других представителей семейства формируется эндотеций с фиброзными
утолщениями. Средние слои эфемерны. Тапетум секреторного типа, клетки 2-ядерные.
Elaeocarpaceae
1—3, 6—14 — Muntingia calabura, 4 — Aristotelia maqui, 5 — Л. racemosa.
1—3 — отдельные фазы мегаспорогенеза и формирования париетальной ткани; 4, 5 —
зрелый зародышевый мешок; 6—12 — развитие зародыша; 13 — часть зрелого зародыша
(продольный срез); видны корневой и стеблевой (с почечкой) апексы, гипокотиль и корневой
чехлик; 14 — продольный срез зрелого семени. (1—3, 6—14 — по Venkata Rao, 1952b; .
4, 5 — по Mauritzon, 1935).
244
Образование микроспор происходит симультанно. Тетрады микроспор
тетраэдральные. Зрелые пыльцевые зерна 2-клеточные. Спермин образуются в
пыльцевой трубке.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
зигзагообразное, формируется обоими интегументами. Археспорий
одноклеточный. У М. calabura отмечено заложение многоклеточного археспория. Архе-
спориальная клетка отделяет париетальную клетку, которая образует 5—6-слой-
ную париетальную ткань. У М. calabura и видов Aristotelia делений в
эпидермисе нуцеллуса не обнаружено; нуцеллярный колпачок не образуется.
Семяпочка М. calabura имеет гипостазу. У Elaeocarpus дифференцируются гипостаза
и эндотелий. У М. calabura тетрада мегаспор линейная. Жизнеспособной обычно
является халазальная мегаспора. У Aristotelia maqui и A. racemosa
наблюдаются Т-образные тетрады, а функционирует обычно третья от микропиле
мегаспора (субхалазальная).
Зародышевый мешок моноспорический, 'Polygonum-THna. Синергиды
Elaeocarpus и Muntingia с крючкообразным выростом. У Aristotelia крючкообразные
выросты не отмечены. Полярные ядра сливаются перед самым оплодотворением
б средней части зародышевого мешка (Aristotelia, Muntingia). Слияние
полярных ядер Elaeocarpus происходит близ антиподальных клеток. Формируются
3 антиподальные клетки, которые чрезвычайно эфемерны. Полная их
дегенерация происходит еще до оплодотворения. В зрелом зародышевом мешке
наблюдаются отдельные крахмальные зерна. Описана порогамия (Venkata Rao, 1952).
Эндосперм нуклеарыого типа.
Развитие зародыша у М. calabura проходит по Onagrad-типу. Зрелый
зародыш М. calabura прямой, крупный, с хорошо развитыми семядолями и
стеблевым апексом. Окружен приблизительно 3 слоями клеток эндосперма.
Перисперма нет. Клетки эндосперма, как и клетки зародыша, включая прокамбий,
заполнены крахмальными зернами. У Elaeocarpus описаны 2 типа зрелого
зародыша — с прямыми и изогнутыми семядолями (Weibel, 1968). Зарод >i и
Elaeocarpus содержит хлороиласты.
Исследованные виды. Aristotelia maqui, A. racemosa,
Elaeocarpus hookerianus, E. sikkiminensis, Muntingia calabura.
Литература. Mauritzon, 1935; Venkata Rao, 1951, 1952, 1953; Weibel,
1968; Яковлев, Жукова, 1973.
Семейство TILIACEAE
Пыльник 2-гнездный (Entelea palmata — no Stenar, 1925) или 4-гнездный
(Triumfetta rhomboidea — no Rao V. С, Rao К. V. S., 1952). Сформированная
стенка пыльника состоит из эпидермиса, эндотеция, одного среднего слоя и та-
петума. В эндотеции зрелого пыльника Е. palmata и Triumfetta rhomboidea
отмечены фиброзные утолщения. Средний слой эфемерен. Тапетум
секреторного типа (Е. palmata, Sparmannia africana, Tilia cordata, Т. platyphyilos и
Т. ulmifolia). Клетки тапетума обычно 2-ядерные (Т. platyphyilos, Т. ulmifolia
и S. africana), у Т. rhomboidea изредка вс1речаются 3- или 4-ядерные.
Образование микроспор происходит симультанно (Е. palmata и S. africana). Тетрады
микроспор тетраэдральные; изобилатеральные встречаются редко. Зрелые
пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2-интегументами, крассинуцеллятная.
Микропиле неоплодотворенных семяпочек формируется только наружным интегумен-
том. После оплодотворения замыкается и внутренний интегумент; микропиле
становится зигзагообразным. Археспорий одноклеточный, субэпидермального
происхождения (Corchorus olitorius, E. palmata, S. africana и Т. cordata). Ap-
хеспориальная клетка отделяет обычно париетальную клетку, которая
образует 4—8-слойную париетальную ткань. Апикальные клетки эпидермиса нут-
целлуса также претерпевают одно или 2 периклинальных деления и дают
начало нуцеллярному колпачку в 2 или 3 слоя клеток (Е. palmata, S. africana,
Т. cordata, T. platyphyilos и Triumfetta rhomboidea). У Corchorus capsularis,
С. olitorius, С. trilocularis и у других видов наблюдали 2 смежных мегаспоро-
245
1, 2, 5—12, 14 — Entelea palmata, 3, 4, 13 — Sparmannia africana, 15 — Tilia tomentosaY
16 — T. cordata, 17—22 — Corchorus olitorius, 23—41 — Tilia platyphyllos.
1 — фрагмент продольного среза молодого пыльника во время профазы I мейоза в микро-
спороцитах; 2 — тетрада микроспор; 3 — одноядерная микроспора; 4 — субэпидермальная
археспориальная клетка; 5, 6 — археспориальная клетка и образование париетальной
ткани; 7—12 — развитие зародышевого мешка Polygonum-типа; 13 — готовый к
оплодотворению зародышевый мешок; 14 — 2 археспориальные клетки; 15 — 2 одноядерных
зародышевых мешка; 16 — оплодотворенный зародышевый мешок; 17—37 — эмбриогенез (на 21
видно выделение эмбриодермы и дифференциация периблемы и плеромы);
цита в одной семяпочке (Stenar, 1925; Banerji, 1932); дальнейшее развитие
одного из них, однако, подавляется. У Т. rhomboidea археспорий
многоклеточный; 4—5 клеток функционируют до образования тетрад (Rao V. С, Rao К. V. S.,
1952). Описаны линейные и Т-образные тетрады. Жизнеспособной, как правило,
является халазальная мегаспора.
Зародышевый мешок моноспорический, Polygonum-типа. Яйцеклетка
грушевидной формы и, как правило, несколько глубже вдается в зародышевый
мешок, чём синергиды. Полярные ядра расположены близ яйцевого аппарата
в тесном контакте друг с другом. Их слияние происходит, по-видимому, во
время оплодотворения или сразу же после него. Антиподы эфемерны. У С. oli-
tortus, E. palmata, S. africana, Г. cordata и Т. tomentosa это 3 одноядерные
клетки. В зародышевом мешке, готовом к оплодотворению, наблюдаются лишь
продукты их дегенерации или вообще нет никаких следов (С. olitorius). Для
зрелого зародышевого мешка всех исследованных Tiliaceae характерно
наличие крахмальных зерен. Особенно велико содержание крахмала в зародышевых
мешках Tilia и Sparmannia. У С trilocularis и S. africana появление
крахмальных зерен отмечено уже в 4-ядерном зародышевом мешке. Описаны порогамия
ж двойное оплодотворение (Banerji, 1932; Rao V. С, Rao К. V. S., 1952).
Эндосперм нуклеарного типа.
Эмбриогенез Asterad-тида. Зрелый зародыш крупный, прямой,
дифференцированный. Зародыш окружен клетками эндосперма. У С. capsularis описана
трикотилия (Datta, 1954). Относительно полиэмбрионии в семействе данные
противоречивы: по одним данным (Datta, 1960), у С. olitorius полиэмбрионии
гнаблюдается, по другим данным (Banerji, 1932), она не отмечена.
Все исследованные до настоящего времени представители семейства
Tiliaceae являются хлороэмбриофитами (Clappertonia ficifolia, Colona scabra, Grewia
acuminata, T. cordata, T. petiolaris, T. platyphyllos, T. rubra, T. tomentosa).
Хлоропласта семядолей зародыша Т. platyphyllos отличаются рядом
своеобразных ультраструктурных черт по сравнению с хлоропластами зародыша
;хлороэмбриофитов других семейств. Внутренняя мембранная система хлоро-
пластов этого вида развита слабо. Центральная ее часть представлена
главным образом трубчатыми комплексами, а также мелкими гранами (2—3 тила-
коида) и редкими межгранными тилакоидами. Супергран и проламеллярных
тел не отмечено. Периферическая мембранная система состоит из очень редких
247
периферических тилакоидов и периферического ретикулума в виде отдельных,
вытянутых мешочков. На отдельных срезах встречаются трубочки пластид..
Форма хлоропластов амебоидная, часты крупные инвагинации пластид. Эва-
гинации перистромия отсутствуют. Характерной чертой хлоропластов этога
вида является формирование концентрических мембранных образований и
ассоциации с ЭР. Наблюдаются контакты,хлоропластов с митохондриями.
Распределение в протопласте ансамблевое., Включения в виде крахмала и редких
пластоглобул. При созревании семени наблюдается трансформация хлоропластов
в лейкопласты с большим количеством мелких пластоглобул. ,
Исследованные виды. Clappertonia ficifolia, Colona scabra,
Corchorus acutangulus, С capsularis, C. olitorius, С siamensis, C. siliquosus,
C. trilocularis, C. urticaefolius, Entelea palmata, Grewia acuminata, Sparmannia
africana, Tilia cordata, T. petiolaris{ T. platyphyllos, T. rubra, T. tomentosa,
T. ulmifolia, T. vulgaris, Triumfetta rhomboidea.
Литература. Warming, 1878; Strasburger, 1884; Brandza, 1891;
Juel, 1915; Stenar, 1925; Schnarf, 1931; Banerji, 1932, 1933; Mauritzon, 1934r
Soueges, 1941; Battacharya, Mitra, 1952; Rao V. C, Rao K. V. S., 1952; Datta,
1954, 1955, 1957, 1960; Sulbha, Swaminathan, 1959; Choudhury, 1961; Iyer,
Sulbha, Swaminathan,. 1961; Panda, Datta, 1961; Iyer, 1962; Datta, Mukherjee,
1969; Жукова, 1972, 1974, 1975, 1978, 1979, 1982; Яковлев, Жукова, 1973;
Guggenheim,j]l975; Hesse, 1978.
Семейство STERGULIACEAE
Пыльник 4-гнездный. У большинства представителей семейства развитие
стенки пыльника происходит по типу двудольных, у Pterospermum и Sterculio.
отмечен основной тип развития. Сформированная стенка пыльника состоит
из 4—5 слоев: эпидермиса, эндотеция с фиброзными утолщениями, 1—2
средних слоев и тапетума. Тапетум секреторного типа. У Waltheria indica, Gua-
zuma tomentosa и Melochia corchorifolia наблюдается реорганизация
клеточного тапетума в ложный периплазмодий. В клетках тапетума содержится от
одного до 14 ядер. У М. corchorifolia на поздних стадиях развития в клетках
тапетума отмечено образование многочисленных крахмальных зерен. В
гнездах пыльника у различных представителей семейства формируется от 3 до 14
спорогенных клеток. Образование микроспор симультанное. Тетрады
микроспор обычно тетраэдральные, редко билатеральные. Пыльцевые зерна
одиночные, 2-клеточные. У Sterculia alata в некоторых пыльцевых зернах отмечена
деление генеративной клетки и образование 2 веретеновидных спермиев.
Зрелое пыльцевое зерно содержит крахмальные зерна.
Семяпочка анатропная, с 2 интегументдми,' крассинуцелятная. На
определенных этапах развития клетки интегументов (внешний слой наружнога
и внутренний слой внутреннего) заполняются слизью и танином. Микропиле
у большинства видов образуется 2 интегументами и имеет зигзагообразную
форму. У G. tomentosa и Abroma augusta в образовании микропиле участвует
только наружный интегумент, внутренний покрывает 3/4 нуцеллуса. В
клетках нуцеллуса содержатся крахмальные зерна. У некоторых представителей
семейства (Pterospermum heyneanum, P. suberifolium и М. corchorifolia)
отмечена хорошо выраженная гипостаза, у Pterospermum acerifolium ее не
наблюдается. У Buettneria herbacea выявлен плацентарный обтуратор. У ряда видов
группы клеток под антиподальным концом зародышевого мешка сильно
красятся благодаря наличию в них танина. Арх<еспорий многоклеточный, в
большинстве случаев функционирует только одна клетка, которая делится, отделяя
Sterculiaceae
1—5 — Sterculia fоetida, 6, 16, 18, 19 — Pentapetes phoenicea, 7 — Guazuma tomentosa, 8, 9,
17, 20, 21, 24—36 — Abroma augusta, 10, 22, 23 — Helicteres isora, 11, 15 — Kleinhovia ho-
spita, 12—14 — Buettneria herbacea.
248
>
i, 7, 8, 13 — поперечные срезы лопасти пыльника; 2 — клетки тапетума; спорофлт в тело-
фазе; 3 — формирование билатеральной тетрады; 4,5 — стадии развития пыльцевого зерна;
6 — продольный срез лопасти пыльника; 9—12 — зрелые пыльцевые зерна; 14 — зрелый
зародышевый мешок; вокруг его халазальной части видна гипостаза; 15 — семяпочка,
содержащая сформированный зародышевый мешок; над ним виден нуцеллярный колпачок;
в центральной клетке зародышевого мешка — крахмальные зерна; 16 — семяпочка со
зрелым зародышевым мешком; в верхней части семяпочки виден нуцеллярный колпачок, в
нижней гипостаза, клетки которой содержат танин;
Sterculiaceae (продолжение)
17 — вхождение пыльцевой трубки в зародышевый мешок; 18, — верхняя часть
зародышевого мешка; виден глобулярный зародыш и делящиеся ядра эндосперма; 19 — нижняя
часть зародышевого мешка; видны полиплоидные ядра эндосперма, некоторые из них
делятся; 20 — нижняя часть зародышевого мешка, окруженная толстостенными клетками,
в которых образуется танин и крахмал, в эндосперме — ядерные слияния; 21 — клеточный
эндосперм; видно большое дегенерирующее ядро на нижнем конце зародышевого мешка;
22, 23 — формирование клеток в эндосперме; 24—35 — различные стадии развития
зародыша; 36 — продольный разрез зрелого семени. (По Vencata Rao, 1953).
париетальную клетку; у P. acerifolium и P. heyneanum начинают развитие
10—15 археспориальных клеток, причем только гиподермальные отделяют
париетальную клетку, которая, делясь, дает 3—6 слоев; субгиподермальные
клетки функционируют непосредственно как мегаспороциты. В результате
деления нуцеллярного эпидермиса образуется нуцеллярный колпачок. В
некоторых случаях при затрудненных условиях роста семяпочки клетки
нуцеллярного эпидермиса не делятся периклинально, а радиально вытягиваются.
Мегаспоры в тетраде расположены линейно или Т-образно. Функциональной
является халазальная мегаспора. Иногда в семяпочке наблюдается развитие 10
или более зародышевых мешков, но до 8-ядерного состояния развиваются 1 —
2 зародышевых мешка.
Зародышевый мешок моноспорический, развивается по нормальному
Polygonum-типу, содержит, как правило, 8 ядер. Синергиды имеют крючкообразные
выросты. У P. heyneanum, P. acerifolium, Dombeya spectabilis ж W. indica в синер-
гидах не наблюдается нитчатого аппарата. У Pentapetes phoenicea и A. augusta
отмечено наличие в микропилярном конце синергид сильно красящихся
участков, предполагаемых аналогов нитчатого аппарата. Полярные ядра находятся
в тесном контакте, но не сливаются перед оплодотворением. Антипода л ьные
клетки перед оплодотворением дегенерируют. В зародышевом мешке
зафиксировано наличие крахмальных зерен, наибольшая часть их сосредоточена
вокруг полярных ядер. У некоторых представителей семейства (P. heyneanum,
P. acerifolium и Theobroma cacao) в редких случаях наблюдается развитие
аномальных зародышевых мешков, содержащих 16 ядер и более. Предполагается,
что они возникают в результате слияния лежащих рядом зародышевых мешков.
Пыльцевая трубка проникает в зародышевый мешок порогамно, через
микропиле. Процесс двойного оплодотворения осуществляется нормально. В ходе
оплодотворения спермин изменяют свою форму: как отмечено у Th. cacao,
вначале они веретенообразны, затем принимают вид обычного ядра. Мужское
ядро в центральной клетке в большинстве случаев объединяется сначала с
одним из полярных ядер, затем происходит слияние образовавшегося ядра с
другим полярным ядром. Первичное ядро эндосперма имеет крупные размеры и
содержит несколько ядрышек.
Эндосперм нуклеарный. У ряда видов наблюдается скопление ядер
эндосперма в микропилярном и халаза льном концах. В ха лаза льном районе ядра
часто сливаются, в результате чего возникают крупные полиплоидные
образования. У W. indica отмечен волнообразный характер деления ядер эндосперма,
которое начинается в микропилярном конце зародышевого мешка. Клеткооб-
разование в эндосперме происходит поздно, у некоторых видов — перед
образованием зачатков семядолей в зародыше. Зрелое семя содержит эндосперм,
клетки которого заполнены крахмальными зернами.
Развитие зародыша осуществляется по Asterad-типу. У Th. cacao отмечена
полиэмбриония. У некоторых представителей семейства (Pterospermum
heyneanum, P. acerifolium, Th. cacao) в редких случаях наблюдается развитие
аномальных зародышевых мешков, содержащих 16 и болев' ядер. Предполагается,
что они возникают в результате слияния рядом лежащих зародышевых мешков.
Существуют противоречивые мнения о наличии партенокарпии у Th. cacao
(Kuijper, 1914; Cheesman, 1927; Hakanson, 1947).
Исследованные виды. Abroma augusta, Buettneria herbacea,
Dombeya mastersii, D. spectabilis, Guazuma tomentosa, Helicteres isora, Kleinhovia
hospita, Melochia corchorifolia, Pentapetes phoenicea, Pterospermum acerifolium,
P. heyneanum, P. suberifolium, Sterculia alata, S. colorata, S. factida, Theobroma
cacao, Waltheria indica.
Литература. Warming, 1878; Wright, 1907; Kuyjper, 1914; Cheesman,
1927; Stahel, 1928; Heyn, 1930; Schnarf, 1931; Sharma, 1938; Banerji, 1941;
Hakanson, 1947; Miitzing, 1947; Rao, 1948, 1949, 1950, 1951, 1952a, 1952b,
1953; Davis, 1966; Тахтаджян, 1966; Heel, 1970; Duncan, Fold, 1972;
Martinson, 1972; Jaenicke, 1973.
251
Семейство HUACEAE
Эмбриологически не изучено. )
Семейство' SCYTOPETALACEAE
Семейство эмбриологически слабо изучено. Имеются сведения лишь по
эмбриологии Scytopetalum tieghemii (Vijayaraghavan, Dhar, 1976).
Пыльник 4-гнездный, раскрывается у Brazzeia longipedicellata порами.
Стенка развитого пыльника у S. tieghemii обычно 4-, редко 5-слойная. Состоит
из эпидермиса, эндотеция, 1 или 2 средних слоев и тапетума. Тапетум
секреторного типа, сначала одноядерный, а затем 2-ядерный и редко 3-ядерный.
На стадии тетрад микроспор средние слои дегенерируют. Стенка зрелого
пыльника состоит из эпидермиса и эндотеция с фиброзными утолщениями. Споро-
9 ' 10 11 1Z
Scytopetalaceae
1—12 — Scytopetalum tieghemii.
1,2 — поперечный срез стенки пыльника; 3 — стенка пыльника на стадии одноядерного-
пыльцевого зерна; 4—6 — мейоз, симультанный тип образования микроспор; 7 — 2-клеточ-
ное пыльцевое зерно; 8 — поперечный срез семяпочки во время профазы мейоза мегаспоро-
цита; 9 — часть семяпочки на стадии тетрады; 10, 11 — 2- и 4-ядерные зародышевые мешки;
12 — зрелый зародышевый мешок. (1—12 — по Vijayaraghavan, Dhar, 1976).
252
генная ткань многослойная. Микроспороциты во время мейоза имеют каллоз-
ные оболочки, которые наиболее сильно развиваются к стадии тетрад. Мейоз
проходит правильно. Формирование микроспор идет по симультанному типу.
Тетрады тетраэдральные. Зрелые пыльцевые зерна одиночные, 2-клеточные.
Семяпочка анатропная, 2-покровная, тенуинуцеллятная. Сообщение об
однопокровности семяпочки у Scytopetalaceae, вероятно, ошибочно.
Внутренний интегумент у зрелой семяпочки более длинный, чем наружный. До
оплодотворения наружный интегумент состоит из 5—6 слоев клеток, а после
оплодотворения число слоев увеличивается до 10—11. Внутренний интегумент к
моменту образования тетрад мегаспор насчитывает 4—5 слоев клеток. На стадии
2- и 4-ядерного зародышевого мешка число слоев его увеличивается до 7. К
моменту формирования зрелого зародышевого мешка эпидермис внутреннего ин~
тегумента преобразуется в интегументальный тапетум, его клетки одноядерныег
имеют густую цитоплазму, делятся в основном антиклинально, но иногда и пе-
риклинально. Микропиле образуется только внутренним интегументом. Ну-
целлус одно- или 2-рядный, но вскоре клетки верхней части нуцеллуса
отмирают и зародышевый мешок с 4-ядерной стадии контактирует с интегументаль-
ным тапетумом. Клетки нуцеллуса, расположенные под зародышевым мешкомг
узкие и длинные, делятся и формируют гипостазоподобный тяж. К стадии
зрелого зародышевого мешка они полностью дегенерируют. Археспорий
одноклеточный, гиподермальная археспориальная клетка без отделения кроющей
становится мегаспороцитом. В результате мейоза формируется диада, а затем
линейная тетрада мегаспор.
Зародышевый мешок моноспорический, развивается из халазальной мегас-
споры по Polygonum-типу. Зрелый зародышевый мешок узкий, длинный,
содержит 3-клеточный яйцевой аппарат, 2 полярных ядра и 3 антиподы. Синер-
гиды имеют крючковидные выросты и нитчатый аппарат. Антиподы эфемерны.
Об оплодотворении и типах развития зародыша и эндосперма нет сведений.
Эндосперм обильный. У Scytopetalum и Rhaptopetalum — руминированныйг
а у Oubanguia, Brazzeia и Pierrina — гладкий.
Зрелый зародыш маленький, прямой, с 2 широкими семядолями.
Исследованный вид. Scytopetalum tieghemii.
Литература. Verdcourt, 1950, 1968; Cronquist, 1968; Vijayaraghavany
Dhar, 1976; Поддубная-Арнольди, 1982.
Срмейство DIPTEROCARPACEAE
Пыльник 4-гнездный. Гиподермальные археспориальные клетки, делясь
периклинэльно, образуют первичный париетальный и первичный спороген-
ный слои. Последующие деления париетальных клеток формируют все слои
(за. исключением эпидермиса) стенки пыльцевого гнезда. Сформированная
стенка пыльника 6-слойная. Она состоит из эпидермиса, эндотеция без
фиброзных утолщений, 3 эфемерных средних слоев и слоя 2-ядерных тапетальных
клеток. Клетки спорогенного слоя, претерпев несколько делений, дают начало
микроспороцитам. Образование микроспор происходит по симультанному
типу. Расположение микроспор в тетраде изобилатеральное, тетраэдральное
или крестообразное. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образуется внутренним интегументом. Гиподермальная археспориальная клетка
делится с образованием мегаспороцита и первичной париетальной клетки,,
которая впоследствии формирует до 5 слоев клеток париетальной ткани.
Отмечены случаи дифференциации 2 и даже 3 археспориальных клеток (Vateria
indica). В результате мейоза образуется линейная или Т-образная тетрада
мегаспор. У Hopea racophloea, Shorea robusta и V. indica— оба типа тетрад.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Синергиды имеют крючкообразные выросты. Полярные ядра обычно
сливаются перед оплодотворением. 3 антиподы дегенерируют вскоре после него.
253
После оплодотворения (иногда и ранее) зародышевый мешок у V. indica
разрастается в сторону халазы, образуя узкую длинную структуру,
пронизывающую нуцеллус. Достигнув основания нуцеллуса, зародышевый мешок
некоторое время продолжает расти и внедряется в область халазы. Полагают (Rao>
1955b), что зародышевый мешок в таком виде играет роль гаустория.
Эндосперм нуклеарный. Первое его деление происходит после того, как
конец зародышевого мешка достигает халазы. Первоначально ядра эндосперма
довольно равномерно распределяются по периферии зародышевого мешка,
который продолжает расти в ширину, разрушая остатки нуцеллуса. После
полного исчезновения нуцеллуса растущий многоядерный эндоспермальный
ценоцит начинает разрушать прилегающие к нему слои клеток внутреннего
интегумента, внедряясь в него своими многочисленными выростами. В эти
выросты перемещаются ядра эндосперма. Клеткообразование начинается в ми-
кропилярной части и очень медленно распространяется в сторону халазаль-
ного района. Свободные ядра в халазальном конце эндосперма можно видеть
даже в зрелом семени. Лишь на очень поздней стадии созревания плода
эндосперм полностью становится целлюлярным.
Развитие зародыша у S. robusta сходно с Asterad-типом. У остальных
изученных представителей Dipterocarpaceae тип развития зародыша не ясен.
Первые 2 деления сходны. Первая перегородка закладывается поперечно.
Вертикальные или косые перегородки 2-го деления ведут к образованию глобулярной
тетрады клеток. Дальнейшие деления несинхронны и в направлении
делений нельзя усмотреть какую-либо закономерность. Однако на более поздних
стадиях, описанных Pao (Rao, 1955b), у V. indica ясно видны зоны семядолей,
гипокотиля, подвеска, хотя четкой границы между ними не имеется. Зрелый
зародыш V. indica хорошо дифференцирован, его семядоли достигают
значительной длины; имеется первичный корешок с корневым чехликом.
У некоторых представителей Dipterocarpaceae (Hopea odorata, Shorea, Dry о-
balanops) описана полиэмбриония (Maury, 1970a, 1970b).
Исследованные виды. Dryobalanops sp., Hopea odoratar
H. racophloea, H. wightiana, Shorea sp., S. robusta, S. talura, Vateria indica.
Литература. Rao, 1953, 1955a, 1955b, 1956, 1962; Maury, 1970a,
1970b, 1980; Kaur, 1977.
Семейство SARCOLAENACEAE
Эмбриологически не изучено.
Зародыш в семени прямой; семя содержит обильный перисперм.
Литература. Тахтаджян, 1966.
^Семейство SPHAEROSEPALACEAE
Эмбриологические процессы не изучены. Пыльник о широким железистым
связником, с 2 теками, раскрывающимися интрорзно продольными щелями.
В завязи закладывается варьирующее число семяпочек, но обычно только одна
(редко 2) развивается в семя.
Dipterocarpaceae
1—3, 11—13 — Shorea robusta, 4—5, 14—35 — Vateria indica, 6—10 — Hopea racophloea*
1 — сформированная стенка пыльника; 2—4 — типы тетрад микроспор; 5 — 2-клеточное
пыльцевое зерно; 6,7 — формирование мегаспороцита и париетальной ткани; 8, 9 —
тетрады мегаспор; 10—12 — развитие зародышевого мешка; 13,14 — разрастание первичной
клетки эндосперма после оплодотворения; 15 — 2-ядерный эндоспермальный ценоцит;
16,17 — многоядерный эндоспермальный ценоцит; 18,19 — образование лЪпастей
многоядерного эндоспермального ценоцита, врастающих в ткань внутреннего интегумента; 20,
21 — начало клеткообразования в микропилярном конце эндосперма; 22, 33 — развитие
зародыша. (1—3,10—12 — по Rao, 1956; 4—5, 13—33 — по Rao, 1955b; 6—9 — по Rao,
1962).
255
Sphaerosepalaceae
1,2 — Rhopalocarpus lucidus, 3,4 — R. thouarsianus, 5 — Dialyceras parvifolium,
1,3, 5 — зародыш, извлеченный из зрелого семени; 2, 4—- продольный срез семени.
(1—5 — по Gapuron, 1962).
Семяпочки анатропные, с массивной халазой, содержащей танины. У боль -
шинства видов рода Rhopalocarpus (Sphaerosepalum) из секции Laeves (Gapuron,
1962) внутренний слой интегумента имеет гладкую поверхность. У 3 видов
рода из секции Ruminati — R. lucidus, R. similis и R. triplinervius —
внутренний слой интегумента образует более или менее длинные выросты конической
или цилиндрической формы, внедряющиеся в эндосперм. Вследствие этого
образуется сильная руминация эндосперма. В зрелом семени у Rhopalocarpus
ж Dialyceras эндосперм обильный, гладкий или руминированньтй.
Зародыш в зрелом семени крупный, с заметным гипокотилем и зачатком
корня, с 2 листообразными семядолями, сердцевидными в основании и
лопастными по краям. У видов с сильно руминированным эндоспермом семядоли
расчленены на несколько крупных лопастей, в свою очередь разветвленных
на тонкие дольки. У других видов Rhopalocarpus семядоли менее ветвистые,
ауй. thouarsianus они 2-лопастные с бахромчатыми краями. Сходное строение
имеет зародыш Dialyceras.
Исследованные виды. Dialyceras parvifolium Rhopalocarpus
lucidus, R. thouarsianus.
Литература. Gapuron, 1962; Тахтаджян, 1966.
Семейство ВОМВАСАСЕАЕ
Пыльник у Ochroma lagopus 2-гнездный. Данных по другим видам нет. Ниже
каждого гнезда лизигенно образуется слизистый мешок. Он увеличивается
€ ростом пыльника и в конце концов разрывается. Иногда несколько или все
микроспороциты в гнезде . пыльника дегенерируют; в таких случаях гнездо
превращается в слизистый мешок, подобный расположенному ниже. В
перегородке между гнездами пыльника наблюдаются друзы. Сформированная
стенка пыльника состоит из 5—7 слоев: эпидермиса, эндотеция, 2—4 средних
слоев и секреторного тапетума. Эпидермальные клетки заполнены танином.
256
1, 2, 7, 10, 17, 18, 21, 22, 25—32 — Ochroma lagopus, 3, 14, 20 — ВотЪах malabaricum, 8, 9,
15, 23, 24 — Eriodendron anfractuosum, 5,6 — Adansonia digitata, 4, 11—13, 16, 19 — Pa-
chira aquatica.
1 — начало формирования гнезд пыльника; 2 — гнездо пыльника с полостью, заполненной
слизью; 3 — пыльник со сформированной стенкой; дегенерация микроспороцитов; I — та-
петальные клетки со слизистыми внутренними стенками и микроспороцит; 5 — фрагмент
пыльника с микроспороцитом; 6 — тапетальные клетки и тетрада микроспор; 7 — фрагмент
пыльника; орбикулы на внутренних стенках тапетальных клеток и одноядерное пыльцевое
зерно; 8, 9 — стадии развития пыльцевого зерна; 10 — зрелый пыльник с фиброзным эндо-
тецием и полостями, заполненными слизью; 11 — многоклеточный археспорий в нуцеллусе
семяпочки; 12 — начало образования париетальной ткани и нуцеллярного колпачка; 13 —
стадия одноядерного зародышевого мешка, нуцеллярный колпачок и париетальная ткань;
14,15 — типы тетрад; 16 — 2 тетрады; 17 — образование 2-клеточного зародышевого мешка
из халазальной мегаспоры;
17 Сравнительная эмбриология
ВотЬасасеае (продолжение)
18 — зрелый зародышевый мешок; синергиды с нитчатым аппаратом; крахмальные зерна
в центральной клетке; 19 — синергиды с округлым углублением в микропилярной части;
20 — продольный срез семяпочки; 21 — микропилярная часть семяпочки; клетки
наружного интегумента заполнены танином и зернами крахмала; 22 — халазальная часть
семяпочки, постамент и гипостаза, клетки которой заполнены танином и зернами крахмала;
23 — эндосперм халазальной части зародышевого мешка; 24 — эндосперм микропилярной
части зародышевого мешка с полиплоидными ядрами; 25—30 — отдельные стадии развития
зародыша; 31 — зрелое семя; 32 — зрелый зародыш. (1—14, 16—32 — по Vencata Raor
1954; 15 — по Thirumalachar, Khan, 1941).
В эндотеции образуются фиброзные утолщения, средние слож разрушаются.
Клетки тапетума на ранней профазе микроспороцитов обычно 2-ядерные.
Позже, путем свободноядерных делений, некоторые из них становятся 3—4-ядер-
ными {Bombax). Иногда ядра сливаются, образуя единственное крупное
полиплоидное ядро (Ochroma). На внутренних стенках тапетальных клеток у Ochroma
наблюдаются орбикулы, а у Pachira стенки становятся желатинообразными.
Стенка зрелого пыльника состоит из эпидермиса и фиброзного эндотеция.
Микроспорогенез симультанного типа. Тетрады микроспор тетраэдральные.
Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная, с нуцелляр-
ным колпачком, зигзагообразным микропиле, образованным 2 интегументами;
наружный интегумент 2—3-слойный, за исключением Pachira aquatica, у
которой он 5-слойный. На ранних стадиях развития семяпочки в эпидермисе
наружного интегумента накапливается танин. В клетках внутреннего интегумента
он может аккумулироваться после оплодотворения. Обычно между
интегументами находится воздушное пространство. Наблюдается отложение танина и
крахмала в халазальном районе семяпочки. В основании нуцеллуса выражен
постамент. Археспорий многоклеточный, за исключением Bombacopsis glabra,
у которого он одноклеточный, но обычно функционирует только одна клетка.
Э-га клетка отдедяет париетальную, которая дает начало 8—12 слоям
париетальной ткани. Тетрады мегаспор линейные и Т-образные.
Зародышевый мешок Polygonum-типа, образуется из халазальной
мегаспоры. Синергиды у О, lagopus с нитчатым аппаратом, а у Pachira rosea вблизи
жикропйлярного конца синергиды образуется округлое углубление, через
которое проникает пыльцевая трубка. Полярные ядра сливаются до
оплодотворения; к этому же времени происходит дегенерация антипод. В зародышевом
жешке О. lagopus обнаружены крахмальные зерна. После оплодотворения
несколько слоев клеток вокруг халазального конца зародышевого мешка
становятся толстостенными, образуют массивную гипостазу. Для данного
семейства характерна порогамия и двойное оплодотворение.
Эндосперм нуклеарный, позже становится целлюлярным. У Eriodendron
эндоспермальные ядра м:икропилярной части зародышевого мешка сливаются
и образуют полиплоидные ядра. Они крупнее и более хроматизованы, чем ядра
халазальной части. Зрелые семена Ochroma содержат обильный эндосперм,
клетки которого заполнены крахмальными зернами. У P. aquatica семена без
эндосперма.
Развитие зародыша соответствует Asterad-типу Urtica-вариации. Зигота
у Bombax malabaricum и Bombacopsis glabra длительное время находится в
состоянии покоя. Так, например, у В. glabra через 6 дней после открытия цветка
эндосперм уже целлюлярный, а зигота еще не делится. Первое деление зиготы
поперечное. Образовавшаяся при этом базальная клетка В. glabra становится
суспензором и не подвергается дальнейшему делению. В зрелых семенах Ock-
iroma зародыш прямой. У Adansonia и В. glabra зародыши крупные, со
свернутыми листоподобными семядолями. Хлороэмбриофит.
У некоторых видов отмечены апомиксис и полиэмбриония. Адвентивные
зародыши образуются из клеток нуцеллуса вблизи от микропиле. К таким
видам относятся: В. glabra, Bombax kimuenzae и Pachira oleaginea. Зародыши,
как половой, так и адвентивный, сходны. Рост адвентивных зародышей
опережает рост полового, поэтому они крупнее. Обычно количество адвентивных
зародышей около 5, максимально — 15. Следует отметить, что в семенах,
содержащих только 1 зародыш, — он может быть адвентивным по своей природе.
Исследованные виды. Adansonia digitata, Bombacopsis glabra,
Bombax kimuenzae, B. malabaricum, Durio zibethinus, Eriodendron anfractuosumt
Ochroma lagopus, Pachira aquatica, P. oleaginea, P. rosea.
Литература. Decaisne, 1880; Lynch, 1880; Thirulamachar, Khan,
1941; Banerji, 1942; Vencata Rao, 1954; Baker, 1959, 1960; Robins, 1959; Rao,
1964; Duncan, 1970; Davis, Ghosh Sukhendu, 1976; Soepadmo, 1977.
17*
259
Семейство MALVACEAE
Пыльник 2-гнездный. Развитие стенки пыльника протекает центробежне*
по типу двудольных. Сформированная стенка пыльника состоит из 4 слоев:
эпидермиса, эндотеция, среднегосслоя и тапетума. У видов Hibiscus стенка
пыльника состоит из 5 слоев: эпидермиса, эндотеция, 2 средних слоев и тапетума.
Клетки эндотеция в зрелом пыльнике с внутренней стороны имеют широкие
лентовидные одревесневшие фиброзные утолщения. Тапетум у видов Hibiscus
секреторного типа. У видов Gossypium и Cienfuegosia происходит реорганизация
в амебоидный, а у большинства мальвовых наблюдается реорганизация
клеточного тапетума в ложный периплазмодий. Клетки тапетума 2—4- и
многоядерные, у отдельных видов насчитывается до 18—20 ядер. Стенка зрелого
пыльника состоит из 2 слоев: эпидермиса и эндотеция. Спорогенные клетки у
большинства видов (Abutilon indicum, A. theophrasti, Lavatera trimestris, L. thurin-
giaca, Malva alcea, M. moschata, Sidalcea Candida, Anoda cristata, Gossypium
herbaceum, Cienfuegosia heterophylla, C. sulphurea, C. hildebrandtii и др.)
расположены в один ряд. У видов Althaea officinalis, Malvastrum capense, Sida napaea
и Abutilon indicum спорогенные клетки располагаются в 2 или, реже, в
несколько рядов. Образование микроспор происходит симультанно.
Расположение тетрад микроспор изобилатеральное и тетраэдральное. Изредка у видов
Althaea broussonetifolia, Alcea rosea, Hibiscus cannabinus наблюдается линейное
расположение, тетрад. Зрелые пыльцевые зерна 2-клеточные. У Hibiscus mani-
hot и Kydia calycina наряду с 2-клеточными пыльцевыми зернами встречаются
и 3-клеточные. Спермин овальные, эллипсоидные. Пыльцевые зерна у
мальвовых в основном полисифонные, у A. rosea и Malva rieglecta образуется до 12—14
и 20—30 пыльцевых трубок, Пыльцевые трубки Н. cannabinus и Н. trionum
при прорастании в ткани нуцеллуса образуют разветвления.
Семяпочка анатропная, амфитропная, кампилотропная, ортокампилотроп-
ная, с 2 интегументами, крассинуцеллятная. Оба интегумента начинают
образовываться тогда?, когда идет дифференциация археспория. У большинства
видов наружный интегумент состоит из 2—3 слоев, в то время как внутренний
образуется из 4—8 слоев клеток. У Thespesia populnea наружный интегумент
состоит из 5—6, а внутренний из 10—12 слоев клеток. Семяпочки Т. populnear
видов Gossypium и Cienfuegosia в отличие от остальных родов с хорошо
развитой проводящей системой в наружном интегументе. Проводящий пучок
проходит по семяножке к халазе и продолжается в наружном интегументе; концы
проводящих пучков достигают микропиле. В интегументах локализуется
значительное количество крахмала, жиров, ферментов и физиологически
активных веществ. Микропиле образуется обоими интегументами; обычно имеет
зигзагообразную форму. У большинства видов имеется хорошо развитая гипостаза
(Gassypium hirsutum, G. herbaceum, Th. populnea, A. rosea, A. broussonetifolia
и др.). Нуцеллус может быть прямым (К. calycina, Th. populnea, виды
Gossypium и Cienfuegosia), слегка изогнутым (Urena lobata, Maluchra capitata и Pa-
vonia zeylanica) или значительно изогнутым, как у видов Sida, Abutilon, Alcea
и Hibiscus. Женский археспорий одноклеточный (Hibiscus, Sida и у большинства
видов Malva), 2—3-клеточный (Л. rosea, L. thuringiaca) и многоклеточный (U*
lobata, Th. populnea, К. calycina и Malvaviscus arboreus). Над археспориальными
клетками имеется несколько кроющих клеток — 1—2 (A. rosea, H. manihoty
Н. grandiflorus, H. cannabinus и Н. syriacus), 1—4 (G. hirsutum, G. herbaceum r
G. barbadense, C. heterophylla, C. sulphurea и др.), 8 (Plagianthus pulchellus).
У некоторых видов (Th. populnea и U. lobata) в результате периклинальных
делений эпидермальных клеток .образуется нуцеллярный колпачок. Тетрада
мегаспор линейная, изредка Т-образная (Gossypium и Pavonia). У видов
Gossypium и Cienfuegosia отмечается большая изменчивость числа археспориальных
клеток, поскольку наряду с одноклеточным наблюдается 2—3- и
многоклеточный археспорий. В последнем случае мейоз происходит в 2—3.—4 мегаспоро-
цитах. Для семейства характерна дифференциация дополнительных
археспориальных клеток, которые начинают развиваться во время мейоза остальных
мегаспороцитов (Романов, 1960).
260
mm
Malvaceae
1 — Sida napaea, 2, 18 — Hibiscus syriacus, 3, 21, 22 — Cienfuegosia sulphurea, 4, 5, 9, 14,
17, 23, 26—30, 32, 33 —■ Gossypium kirsutum, 6 — Althaea broussonetifolia, 7 — Cienfuegosla
hildebrandtii, 8, 16 — Hibiscus grandiflorus, 10, 24 — Gossypium arboreum, 11, 12, 25, 31 —
G. herbaceum, 13, 15, 34 — Hibiscus manihot, 19 — Cienfuegosia heterophylla, 20 — Alcea
1 rosea, 35—43 — Althaea officinalis.
1—17 — развитие стенки пыльника, микроспор огенез и пыльцевое зерно: 6—8 — клетки
тапетума, 12 — одноядерное пыльцевое зерно,
Malvaceae (продолжение)
13^ 24 — 2-клеточное пыльцевое зерно, 15 — 3-клеточное пыльцевое зерно, 16 — стенка
зрелого пыльника, 17 — готовая к опылению пыльца;
Malvaceae (продолоюение)
18—31 — мегаспорогенез и развитие зародышевого мешка: 18,19 — одноклеточный и
многоклеточный археспорий и образование париетальной ткани, 20—22 — мегаспороциты, 23—
25 — тетрады мегаспор, 26—29 — развитие зародышевого мешка, 30 — схематическое
изображение зрелого зародышевого мешка, 31 — антиподы: каждая клетка разделилась
на 2 клетки;
Зародышевый мешок развивается по Polygonum-типу. Зародышевые мешки
крупные, удлиненные, длина их* во много раз превышает ширину. В кампило-
тропных семяпочках зародышевый мешок начинает изгибаться на 2—4-ядер-
ной стадии (L. thuringiaca и A. indicum) и с ростом зародышевого мешка это
искривление увеличивается. Яйцеклетка и синергиды удлиненной,
грушевидной, дудкообразной, реже округлой формы. У A. rosea они характеризуются
нормальной поляризацией. Яйцеклетка видов Alcea и Н. trionum крупнее
263
Malvaceae (продолжение)
32—43 — двойное оплодотворение и развитие зародыша: 32 — микропилярный конец
зародышевого мешка в момент двойного оплодотворения (схема), 33 — контакт одного из
спермиев со вторичным ядром зародышевого мешка, 34 — контакт сшрмия с одним из не-
слившихся полярных ядер, 35—43 — эмбриогенез. (1—3, 6—8,13, 15,16,18—22, 33, 34 —
ориг.; 4, 5, 9, 12, 14,17 — по Руми, 1960; 10,11 — по Joshi et al., 1967; 23—32 — по
Романову, 1960; 35—43 — по Mortier, 1969).
синергид и более вытянута, с более крупным ядром. В яйцеклетке G. hirsutum
пластид относительно мало. Это амилопласты с несколькими мелкими
крахмальными зернами. Они содержат также рибосомы, отдельные короткие тила-
коиды, фитоферритин и одно или несколько сферических телец неизвестной
природы. Митохондрии многочисленные, с умеренным числом крист. Аппарат
Гольджи малоактивен. На апикальном полюсе яйцеклетки G. hirsutum поли-
сахаридная клеточная оболочка отсутствует. Плазмалемма яйцеклетки находится
в контакте с плазмалеммой центральной клетки. Синергиды часто клювовидные
(A. rosea, A. broussonetifolia, Н. manihot, Sida, Th. populnea и др.). Нитчатый
аппарат описан в синергидах G. hirsutum, Н. manihot, Sida carpinifolia, S.
cordifolia, S. napaea и др. УН. trionum вторая синергида сохраняется после
оплодотворения довольно продолжительное время. Полярные ядра до
оплодотворения не сливаются. Исключение составляют A. rosea, Lavatera (Venkata
Rao, 1954) и M. arboreus. Протопласт центральной клетки G. hirsutum
характеризуется хорошо развитым ЭР, большой активностью диктиосом. Его
амилопласты и митохондрии сходны с таковыми синергид и отличаются от пластид
и митохондрий яйцеклетки. Антиподы мальвовых одноядерные (Hibiscus solandra,
Kydia calycina, Malvaviscus arboreus, Sida veronicifoUa) и многоядерные
(Abutilon indicum, Hibiscus hirtus, H. micranthus); рано дегенерируют у Cienfuegosia
heterophylla, Gossypium hirsutum, Hibiscus cannabinus, H. solandra, Kydia
calycina, Malvaviscus arboreus и Sida veronicifoUa и долго сохраняются у Abutilon
264
indicum, A. theophrasti, Alcea rosea, Althaea broussonetifolia, Gossypium herbaceum,
Hibiscus manihot, H. micranthus, Lavatera thuringiaca uMabachra capitata. В
яйцеклетке Thespesia populnea (Venkata Rao, 1954) и Gossypium hirsutum (Jensen,
1965, 1968) отмечены крахмальные зерна. Наличие крупных крахмальных
зерен характерно и для яйцеклетки Alcea rosea (Жукова, 1981). Описаны
двойное оплодотворение и порогамия "(Guignard, 1904). У Gossypium hirsutum
(Jensen, 1967) и Hibiscus costatus (Ashley, 1972) зигота перед делением уменьшается
вдвое. После оплодотворения долгое время наблюдаются остатки пыльцевой
трубки (Alcea rosea и Hibiscus trionum).
Эндосперм нуклеарного типа.
Эмбриогенез Asterad-типа. Зрелый зародыш крупный, изогнутый,
дифференцированный. Семядоли, как правило, складчатые. У Alcea rosea почечка с 2
примордиальными листьями. Особенностью строения зародыша этого вида
является сильное развитие в семядолях прокамбиальных пучков не только
средней, но и боковых жилок, а также развитие в зародышевом корешке креста
материнских-к леток мета- и протоксилемы (Василевская, 1961). Семя A. rosea
и представителей трибы Hibisceae без эндосперма (запасные вещества в зародыше).
Основными запасными веществами являются жиры и белки. В зародышах трибы
Gossypeae (Gossypium, Thespesia, Cienfuegosia, Kokia, Cephalohibiscus и Lebron-
necia) в отличие от других родов мальвовых имеются пигментные железки,
которые обладают способностью синтезировать госсипол. У Malva sylvestris
и М. moschata отмечена полиэмбриония (Mortier, 1966).
Исследованные мальвовые являются хлороэмбриофитами. Для
Cienfuegosia, Gossypium и Thespesia требуются дополнительные исследования (Яковлев,
Жукова, 1973). В составе пигментов зародыша Alcea rosea обнаружены хдоро-
филлы а и б, лютеин, виолаксантин, каротин, неоксантин, предположительно
лютеин-эпоксид, а также пигмент 4 Г (или х-ксантофилл) (Жукова, 1967). Для
хлоропластов мезофилла семядолей зародыша A. rosea характерно деление
внутренней мембранной системы на центральную и периферическую.
Центральная часть состоит из гран и межгранных тилакоидов. Суперграны (до 40 тила-
коидов) и проламеллярные тела очень редки. Периферическая часть
внутренней мембранной системы хорошо развита и представлена периферическими
тилакоидами. В эвагинациях перистромия наблюдаются системы трубочек.
Форма хлоропластов амебоидная преимущественно за счет эвагинаций
перистромия; инвагинации встречаются редко. Ассоциации с ЭР и микротелами
практически отсутствуют, но контакты с митохондриями наблюдаются.
Распределение хлоропластов в протопласте ансамблевое. Из включений отмечены
только крахмал и пластоглобулы. При созревании семени происходит
трансформация хлоропластов в амилопласты.
} Исследованные виды. Abelmoschus esculentus, Abutilon avicen-
пае, A. indicum, A. populifolium, A.theophrasti, Alcealenkoranica,A.litwinovii,
A. nikitinii, A. rosea, A. rugosa, Althaea broussonetifolia, A. cannabina, A. cristata,
A. officinalis, A. sulphurea, Anoda delleniana, A. lavateroidea, A. triangularis,
A. wrightii, Cephalohibiscus, Cienfuegosiadrummondii, С heterophylla, С. hildebrand-
tii, C. sulphurea, Gossypium abtusifolium, G. anomalum, G. arboreum, G. armouria-
num, G. australe, G.barbadense, G. bickii, G.davidsonii, G.herbaceum,G. hirsutum,
G. klotzschianum, G. stocksii, G. sturtii, G. tomentosum, G. tricuspidatum, G. tri-
lobum, Hibiscus cannabinus, H. costatus, H. esculentus, H.grandiflorus,H. hirtus,
H. manihot, H. micranthus, H. militaris, H. ponticus, H. rosa-sinensis, H. sol-
andra, H. syriacus, H. trionum, Kitaibelia vitifolia, Kokia, Kydia calycina,
Lavatera arborea, L. thuringiaca, L. trimestris, Lebronnecia, Malachra capitata,
Malope trifida, Malva alcea, M. crispa, M. heterophylla, M.. limensis, M.
mauritiana, M. mohileviensis, M. moschata, M. neglecta, M. oxyloba, M. pal-
mata, M. parviflora, M. pusilla, M. sylvestris, M. verticillaia, M. walthe-
rifolia, Malvastrum campanulatum, M. capense, M. peruvianum, Malvaviscus
arboreus, Modiola caroliniana, Modiolastrum malvifolium, Pavonia sepium, P.
spinifex, P. zeylanica, Plagianthus pulchellus, Sida carpinifolia, S. cordifolia,
265
S. napaea, S. veronicifolia, Sidalcea Candida, S. neomexicana, Thespesia lampas,
T. populnea, Urena lobata.
Литература. Hofmeister, 1849, 1858, 1859; Jonsson, 1879—1880,
1881; Guignard L., 1882; Strasburger, 1884; Hegelmaier, 1885; Hubert, 1896;
Guignard M. L., 1900, 1904; Coulter, Chamberlain, 1903; Woycicki, 1911, 1917,
1922, 1923; Lantis, 1912; Juel, 1915; Soueges, 1922; Denham, 1924; Stenar, 1925;
Yamaha, 1926; Banerji, 1929; Gore, 1932; Reeves, Valle, 1932; Reeves, Beasley,
1935; Harlandt, 1936; Reeves, 1936a, 1936b; Романов, 1936а, 19366, 1937a,
19376, 1954, 1955, 1960; Журбин, 1937; Райкова, Канаш, 1937; Iyengar, 1938;
Yamada, 1939; Silow, Stephens, 1944; Venkata Rao, 1952, 1954, 1955; Lebegue,
1954; 1955; Ерамян, Weaver, 1957,1958; Власова, 1959, 1962, 1967, 1975a, 19756;
Руми, 1960, 1964a, 19646, 1966a, 19666, 1967, 1969; Winter, 1960; Василевская,
1961; Саакян, 1962; Vasil, 1962; Беляева, 1963а, 19636, 1965, 1982;
Никифоров, 1964; Pollock, Jensen, 1964; Дариев, 1965; Jensen, 1965a, 1965b, 1965c,
1967, 1968a, 1968b, 1968c, 1969; Engleman, 1966; Камалова, 1966, 1976, 1978,
1979a-, 19796; Jensen, Fisher, 1967 (1968), 1968a, 1968b, 1970; Jensen, Fisher,.
Ashton, 1968; Камалова, Руми, 1975; Руми, Власова, Раджабова, 1982; Руми,
Камалова, 1975; Камалова, Серебрякова, Пантелеева, 1976, 1979; Руми,
Камалова, Серебрякова, 1976; Руми, Серебрякова, Камалова, 1976; Руми, Скокова,,
Асриян, 1976; Jensen, Schulz, Ashton, 1977; Камалова, Пантелеева, 1979;
Камалова, Руми, Пантелеева, 1978; Mortier, 1966, 1969; Mortier, Lebegue,
1966,Joshi,Wadhawani, Johri, 1967; Жукова, 1967, 1975, 1978, 1979, 1981,1982;
Fisher, Jensen, 1969; Агаев, Алиев, 1971, 1974a, 19746; Трухалева, 1971; Ashley,
1972, 1975a, 1975b; Яковлев, Жукова, 1973; Chandra, 1975a, 1975b, 1976;
Schulz, Jensen, 1977, 1978; Умарова, 1977; Усанов, 1977; Плиско, 1980, 1982;
Datta, Chowdhury, 1981.
Порядок 41. EUPHORBIALES
Сёйейство EUPHORBIAGEAE
Пыльники обычно 4-гнездные, образуют 2 теки. Однако у Acalypha, Chro-
zophora, Euphorbia dracunculoides и Е. microphylla пыльники 2-гнездные. Стенка
пыльника развивается по типу двудольных у Euphorbia, по типу однодольных —
у Acalypha и Phyllanthus. Стенка сформированного пыльника состоит из
эпидермиса, эндотеция, средних слоев и тапетума. Эпидермис у Euphorbia millii
сильно вакуолизирован. У Acalypha indica оболочки его клеток утолщены
(Johri, Kapil, 1953), ayi. fallax в стенке зрелого пыльника эпидермис
практически отсутствует (Banerji, 1949). В эндотеции формируются фиброзные
утолщения. По нашим данным, у Е. millii * фиброзные утолщения в эндотеции
образуются перед созреванием пыльника. Число средних слоев варьирует у
представителей разных родов. У большинства видов Euphorbia (Kapil, 1961), а также
у Micrococca mercurialis (Rao, 1962a) один средний слой, у Baliospermum, Cicca,
Croton, Neopeltandra, Phyllanthus, Sauropus, Acalypha, Excoecaria и Hura 1 —
2 слоя (Davis, 1966), у Hevea brasiliensis, Sebastiana chamaelearsL Tragia involu-
crata 2 средних слоя (Davis, 1966). У Е. millii имеются З средних слоя,
равномерно окружающих гнездо со всех сторон. Средние слои эфемерны? ^
Euphorbia dulcis они дегенерируют на стадии одноядерной пыльцы (Kapil, 1:961);
у Е. millii начало дегенерации средних слоев наблюдается на стадии микроспо-
роцитов. Тапетум однослойный, у большинства исследованных видов
секреторного типа. У Е. millii (ориг.) и A. indica (Johri, Kapil, 1953; Rao, 1970)
тапетум секреторный, однако, по даннымКапила (Kapil, 1960), у A. indica образуется
ложный периплазмодий. В процессе развития клетки тапетума большинства
видов становятся 2—3-ядерными. В роде Euphorbia тапетум характеризуется
наличием 1—2 ядер ъ клетках, у М. mercurialis — только 2.^У Е. dulcis
тапетум, как цравило, дегенерирует уже на стадии одноклеточной пыльцы. У Е.
millii клетки тапетума густоплазменные, на стадии микроспороцита 1—2-ядерные;
начиная со стадии редукционного деления они становятся 2—4-ядерными.
На стадии одноклеточного пыльцевого зерна число ядер обычно уменьшается
'до 2—3, а их размеры увеличиваются, что связано, по-видимому, с их слиянием
и образованием полиплоидных ядер. На этой стадии развития на внутренней
поверхности тапетума появляются темноокрашенные орбикулы. Наличие орби-
кул характерно для всего семейства. Археспорий представлен единственным
рядом клеток у Baliospermum, Cicca, Croton, Neopeltandra, Phyllanthus и
Sauropus и несколькими рядами — у Acalypha, Excoecaria и Hura, По нашим данным,
у Е. millii археспори%представлен 10—12 р*||^ми клеток. Тип образования
микроспор симультанный. Тетрады микроспор тетраэдральные, изобилатераль-
ные и крестообразные, у Е. millii в мощных каллозных оболочках. В микроспо-
рогенезе наблюдаются нарушения в протекании мейоза, связанные с
неравномерным расхождением и неравноценным разделением хромосом и т. д.
Следствием этого является широкое распространение стерильности пыльцы,
проявляющейся на разных стадиях развития-. Капил (Kapil, 1961) отмечает, что
у Е. dulcis фертильные пыльцевые зерна вообще не образуются: на стадии
тетрад отмечаются первые признаки дегенерации микроспор, на стадии
одноклеточной пыльцы происходит их полная дегенерация. В роде Acalypha
дегенерация пыльцевых зерен начинается- на стадии 2—3-клеточной пыльцы.
Зрелые пыл-ьцевые зерна у Acalypha lanceolata, E. millii и Hura crepitans 2-кле-
точные, у Amlygha brachystachya и A. indica 3-клеточные.
Семяпочки анатропные, с 2 интегументами, крассинуцеллятные; ортотропные
у Breynia patens (Thathachar, 1953а) и Melanthesa rhamnoides, гемианатропные
у Chrozophora rottleri (Kapil, 1956b), Cicca acida, Phyllanthus debilis, Ph. odonto-
deniyus и Sauropus quadrangularis (Rao, 1970). Обычно имеется обтуратор пла-
* Материал собран в оранжереях БИН АН СССР.
267
Euphorbiaceae
I—9 — Euphorbia millii, 10—14 — Hura crepitans, 15—22, 41—63, 102—107a — Acalypha
brachystachya, 23—27,110 —- Chrozophora rottleri, 28—32, 39 — Codiaeum variegatum var.
pictum, 33—38, 88—101 — Euphorbia dulcis, 40 — Euphorbia procera, 64—69 — Micrococca
Euphorbiaceae (продолжение)
mercurialis, 70—78 — Euphorbia microphylla, 79—87, 108,109 — Croton bonplandianum.
1—14 — развитие пыльника и пыльцевого зерна (10 — поперечный срез через среднюю
часть мужского цветка);
у so \^/ 31
Euphorbiaceae (продолжение)
Euphorbiaceae (продолжение)
15—38 — мегаспорогенез и развитие зародышевого мешка (15—22 — Репаеа-типа, 23—27 —
Polygonum-типа, 28—32 — Garcinia-типа, 33—38 — Fritillaria-типа); 39, 40 — процесс
двойного оплодотворения;
центарного происхождения. В роде Acalypha обтуратор состоит из удлиненных
вакуолизированных паренхиматозных клеток, полностью покрывает выступ
нуцеллуса и входит в микропиле. Клетки обтуратора обычно содержат крахмал.
В роде Acdtypha формирование обоих интегументов отмечается на стадии
дифференциации материнской клетки мегаспоры/ При этом у A. indica (Maheshwari,
Johri, 1941), A. ciliaia (Kajale, Murthy, 19M), A. malabarica (MukherjW, 1958)
ж A. lanceolata (Thathachar, 1952) внешний интегумент растет быстрее
внутреннего; у A. fallax (Banerji, 1949) внутренний закладывается раньше наружного.
Микропиле может быть образовано обоими интегументами, как у Н. crepitans
ш Mallvtus roxburghianus, или только наружным (экзостом), как у Acalypha,
Excoecaria agallocha, Euphorbia geniculata, E. tiruncallii, Pedilanthus tithymaloi-
de% и Tragia involucrata. У ряда видов микропиле отсутствует (Baliospermum
montanum, Croton bonplandianum, С. klotzschianus, Neopeltandra suberosa и Sauro-
pus quadrangularis). Характерным признаком семействга является образование
клювообразной структуры, возникающей в результате разрастания клеток
нуцеллуса, выходящей из микропиле и достающей до обтуратора. Нуцеллярный
клюв не был обнаружен у Ch. rottleri (Srivastava, Agarwal, 1953). Характерно
наличие гипостазы. У Ch. rottleri она блюдцеобразна и обычно дифференци-
271
ЕирНогЫасеае (продолжение)
Jf—87 — развитие зародыша (41—78 — по Onagrad-типу, Euphorbia-вариации, 79—87
по Gli cine-типу);
руется после оплодотворения. У A. indica и A. brachystachya клетки гипостазы?
толстостенные и сохраняются в зрелом семени. Археспорий многоклеточный.
Каждая его клетка отделяет первичную париетальную клетку, в дальнейшем
формируется мощная париетальная ткань. Однако только одна из клеток
археспория претерпевает дальнейшее развитие. Тетрады мегаспор линейные (М. тег-
curialis и Ch. rottleri).
Существуют нескрлько типов развития зародышевого мешка: моноспориче-
ский, биспорический, тетраспорический. Развитие идет в основном по
Polygonum-типу и встречается в родах Micrococca, Agineia, Jatropha, Euphorbia?.
Phyllanthus, Sebastiana и Tragia. Кроме Polygonum-типа известны 6 других::
Allium-, Drusa-, Fritillaria-, Adoxa-, Penaea- и Peperom'ia (P.hispidula\ — в
родах Acalypha, Euphorbia и Mallotus (Johri, Kapil, 1953; Mukherjee, 1958, 1964;.
Kapil, 1960, 1961; Dang Van Liem, 1962; Rao, 1970). Однако тип зародышевого
мешка в пределах одного рода и вида часто является дискуссионным, что,
вероятно, связано с варьированием строения самого зародышевого мешка. Так,,
согласно Мукхерджи (Mukherjee, 1958), Penaea-тип зародышевого мешка
является признаком рода Acalypha. Другие типы — производные от этого типа
путем уменьшения числа клеток в халазальной и микропилярыой частях
зародышевого мешка и образования большего числа свободных ядер в
центральной клетке. Нисло свободных ядер варьирует, о чем говорит различная плоид-
ность эндосперма (см. ниже). Махешвари и Джори (Maheshwafi, Johri, 1941)*
считают тип зародышевого мешка A. indica, A. fallax и A. ciliata
промежуточным между Penaea- и Plumbago-типами, когда более чем 4 ядра образуют
вторичное ядро эндосперма. У A. lanceolata дифференцируются только
яйцеклетка и единственная синергида, а оставшиеся 14 полярных ядер сливаются
в центре зародышевого мешка (Peperomia hispidula-тип). У Ch. rottleri Вентура
(Ventura, 1940) обнаружил Allium-тип зародышевого мешка. Однако Капил
(Kapil, 1955, 1956b) показал, что развитие зародышевого мешка у этого вида,
как и у Ch. obliqua, идет по Polygonum-типу. Имеются данные, что даже в
пределах одного вида встречаются различные типы зародышевых мешков. Так,
у Е. dulcis зародышевый мешок развивается в основном по Fritillaria-типу,
но встречается и Drusa-тип. Синергиды часто крючковидные, нитчатый аппарат
отмечен только у Mallotus philippemis. Полярные ядра сливаются до или после
оплодотворения. Антиподальные клетки обычно эфемерны, у Jatropha gossy-
pifolia происходит их вторичное деление (до 4—5 клеток). В зародышевом:
мешке имеется крахмал. У некоторых видов вскоре после организации
зародышевого мешка наблюдаются признаки дегенерации яйцевого аппарата..
Первыми разрушаются синергиды, затем яйцеклетка. У А.. indica боковые
и халазальные группы клеток зародышевого мешка дегенерируют задолго до*
оплодотворения, хотя их остатки могут сохраняться вплоть до деления ядра
первичного эндосперма. Оплодотворение порогамное. Сингамия обычно
предшествует тройному слиянию. В роде Acalypha отмечается двойное
оплодотворение. У Е. dulcis вследствие стерильности пыльцы и дегенерации яйцевого-
аппарата сингамии и тройного слияния не происходит. У* Е. corollata (Lyon,
1898) и Mallotus japonicus (Ventura, 1934) тройное слияние отсутствует.
Эндосперм нуклеарного типа различной плоидности в зависимости от типа
зародышевого мешка (2—15-плоидный): у Mallotus albus — триплоидный
(Raju, Rao, 1953), у Euphorbia pulcherrima (Donati, 1912; Sharma, 1955^x3--
5-плоидный, у Acalypha tricolor (Swamy, Balakrishna, 1946) и A. rhomboicfea
(Landes, 1946) -— 5-плоидный, у A. ciliata (Kajale, Murthy, 1954) — 8—9-пло-
идный, у A. lanceolata (Thathachar, 1952) — 15-плоидный ит. д. Yi. ciliata
полярные ядра иногда могут сливаться в 2 группы, образуя 2 разных ядра
эндосперма. Как правило, ядро первичного эндосперма приступает к делению
раньше, чем зигота, исключая род Breynia, где деления зигсты и эндосперма
происходят одновременно (Thathachar, 1953a). Обычно 2 первых ядра
эндосперма мигрируют к халазальному полюсу зародышевого мешка. Особенностью»
развития эндосперма является также синхронность деления ядер на ранних
стадиях его развития. У A. indica (Johri, Kapil, 1953) и A., lanceolata
(Thathachar, 1952) синхронность делений продолжается до стадии 32 ядер, у Chrozop-
18 Сравнительная эмбриология
27$
hora obliqua (Kapil, 1956) — 16 ядер, у E. geniculata (Bhatnagar, 1970)
завершается на более раннем этапе развития. Отмечена агрегация большого числа
ядер эндосперма вокруг проэмбрио у Ch. rottleri, Ch. obliqua, Aleurites fordii
и у других молочайных, что обусловливает высокую активность микропилярной
части зародышевого мешка (МсСапп, 1945; Kapil, 1956a, 1956b). Реже подобное
явление наблюдалось в его халазальной части, например у A. indica (Johri,
Kapil, 1953). При этом размер ядер в халазальной части эндосперма
сравнительно меньше, чем в микропилярной. Для рода Croton (3*его видов — С. spar-
siflorus (=C: bonplandianum), С. klotzschianus — Venkateswarlu, Rao, 1963 и
С. oblongifolius — Pal, Aruna, 1972) свойственно образование халазального
ценоцитного эндоспермального гаустория, достигающего в длину более ЮООмкм.
У С. oblongifolius гаусторий исчезает в зрелом семени, в противоположность
С. bonplandianum, у которого он сохраняется в виде мешкообразной структуры
с дегенерировавшими ядрами. У видов, лишенных гаусториев {Euphorbia pro-
сега и. A. brachystachya), эндоспермальные клетки в халазальной области
зародышевого мешка (вблизи гипостазы) часто имеют более крупные размеры и
содержат гипертрофированные ядра, выполняя, вероятно, функцию гаустория.
Образование клеточных стенок идет обычно центрипетально и начинается на
глобулярной стадии развития зародыша, завершаясь на стадии сердечковидного
зародыша. У Phyllanthus maderaspatensis (Mukherjee, Padhye, 1964) клеточные
стенки в эндосперме начинают закладываться на стадии 8-клеточного
проэмбрио, у Ch. rottleri (Kapil, 1956b) — на стадии сердечковидного зародыша.
У Aleurites, Chrozophora, Euphorbia, Hevea и Ricinus образование клеточных
стенок идет по направлению от микропилярного к халазальному концу зароды-
шевдго мешка. У Acalypha malabarica, A. ciliata и A. indica клеточные стенки
закладываются одновременно по периферии зародышевого мешка. Клетки
эндосперма тонкостенные, сильно вакуолизированы, крупнее в центре и более
мелкие по периферии. В зрелом семени остается лишь несколько слоев клеток
эндосперма. Они содержат жиры, крахмал, белки. У Ch. obliqua (Kapil, 1956a),
Euphorbia hypercifolia (Kapil, 1958) и Е. splendens (Bhatnagar, 1970) "клетки
периферического слоя эндосперма лишены каких-либо питательных веществ.
У A. rhomboidea и Euphorbia maculata (Landes, 1946) запасных веществ лишен
слой клеток, лежащих в тесном контакте с сохраняющимися клетками нуцел-
луса в халазальной области. У Acalypha, Chrozophora и Euphorbia несколько
слоев нуцеллуса в халазальной области могут функционировать как перисперм
{Singh, 1969; Kapil, Bhatnagar, 1972, и др.).
Для изучения потенциальных возможностей эндосперма различной плоид-
ности и его метаболизма был использован метод культуры in vitro (La Rue,
1944; Mohan Ram, Satsangi, 1963; Johri, Bhojwari, 1965; Srivastava, 1971a,
1971b, 1971c; Kapil, Bhatnagar, 1972, и др.). Установлено, что морфогенетиче-
ские потенции эндосперма различных представителей сем. Euphorbiaceae
разнообразны и, согласно нашей классификации (Батыгина и др., 1978; Батыгина,
Бутенко, 1981), проявились в 3 путях морфогенеза: эмбриоидогенезе,
органогенезе (ризогенезе, геммогенезе и гемморизогенезе) и гистогенезе. Например,
в каллусной культуре триплоидного эндосперма С. bonplandianum, Jatropha
panduraefolia и Putranjiva roxburghii наблюдалось образование корней (ризоге-
нез) и целых растений (гемморизогенёз).
У большинства мдлочайных деление зиготы происходит на стадии 4—
8 ядер эндосперма (у Aleurites fordii — через 68 ч после оплодотворения; МсСапп,
1945). Исключение составляет Euphorbia splendens, у которой зигота делится на
Euphorbiaceae (продолжение)
88--101 — развитие адвентивного нуцеллярного зародыша; 102—107а — развитие
эндосперма нуклеарного типа; 108, 109 — формирование халазального эндоспермального
гаустория; 110 — схема строения зародыша и эндосперма в зрелом семени. (1—14 — ориг.; 15—22,
41—63,102—107а — по Kapil, 1960; 23—27, ПО — по Kapil, 1956; 28—32, 39 — по Ga-
limberti, 1963; 33—38, 88—101 — по Kapil, 1961; 40 — по Modilewski, 1909; 64—69 — по
. Rao, 1962; 70—78 — по Mukherjee, 1961; 79—87, 108, 109 — по Rao, 1970).
274
стадии 32—64-ядерного эндосперма (Weniger, 1917). Развитие зародыша идет
в основном по Onagrad-типу Euphorbia-вариации (Johansen, 1950; Venkate-
swarlu, Rao, 1967), или IV мегархитипу серии А I периода, согласно схеме
•Суэжа (Crete, 1963). Кроме Сказанного типа встречаются также Asterad-,
Chenopodiad- и Solanad-типы (Rao, 1970)..Дискуссионным является
существование Piperad-типа. У Euphorbia rothiana и Е. preslii, согласно Дэвис (Davis,
1966), эмбриогенез протекает по Piperad-типу; по данным Венкатесварлу и Рао
(Venkateswarlu, Rao, 1967) — по Onagrad-типу. У С. bonplandianum
установлен GHeine-тип (Davis, 1966). Начальные этапы развития зародыша у
представителей молочайных различны как по характеру протекания первых
делений, так и по строению, отдельных его структур. У одних видов суспензор
слабовыраженный, одно- или многоклеточный (М. mercurialis и С.
bonplandianum), у других — образован клетками специфической «дольчатой» формы
(A. brachystachya). Эмбриодерма дифференцируется у различных видов на
разных стадиях развития: у A. brachystachya и Е. microphylla — на ранней
глобулярной стадии, у Croton — на поздней глобулярной или сердечковидной.
У некоторых видов описано образование гипофиза (A. brachystachya) и эпифи-
зиса (С. bonplandianum). На сердечковидной стадии развития зародыша
дифференцируются плерома и периблема, на последующих стадиях формируются
гипокотиль и семядоли. В зародыше имеются млечники. В зрелом семени
зародыш полностью дифференцирован, с хорошо развитой проводящей
системой (особенно в семядолях), имеется эндосперм и остатки дегенерировавшего
нуцеллуса.
В сем. Euphorbiaceae встречается апомиксис: адвентивная эмбриония и
апогаметия. Полиэмбриония была описана у Euphorbia rosea (Petit-Thouars,
1808), у Е. dulcis (Hegelmaier, 1901, 1903; Kapil, 1961), у Alchornea (Schnarf,
1931) и у Hevea brasiliensis (Mendes, 1947).
Нуцеллярные зародыши могут образовываться в микропилярных, хала-
зальных и боковых участках нуцеллуса (например, у Е. dulcis). Клетки
нуцеллуса, производными которых являются нуцеллярные зародыши, богатоплазмен-
ные и могут наблюдаться.уже на 4-ядерной стадии зародышевого мешка.
Деления клеток зародышей нерегулярные. Число нуцеллярных зародышей
варьирует от 2 до 13. Некоторые из них дифференцируются в нормальный 2-семядоль-
ный зародыш, а остальные дегенерируют. Форма и размеры зародышей зависят
от размеров зародышевого мешка. У Е. dulcis нуцеллярная эмбриония
обусловлена стерильностью пыльцы, отсутствием оплодотворения и дегенерацией
яйцевого аппарата. У Е. helioscopia и Е. platyphylla (Scnurhoff, 1926) отмечена
апогаметия, т. е. развитие зародыша из синергиды.
Исследованные роды и виды. Acalypha alnifolia, A. austra-
lis, A. brachystachya, A. ciliata, A. fallax, A. indica, A.lanceolata, A. malabarica,
A. paniculata, A. rhomboidea, A. tricolor, Agineia, Alchornea, Aleurites fdrdii,
Baliospermum axillary, B. montanum, Breynia patens, Chrozophora obliqua, Ch. pro-
strata var. parvifolia, Ch. rottleri, Cicca acida, Codiaeum variegatum var. pictum,
Croton bonplandianum, C. ciliatoglanduliferus, C. klotzschianus, C. oblongifolius,
C. sparsiflorus, Euphorbia altimma', E. amygdaloides, E. characias, E. coralloides,
E. corollata, E. cyparissias, E. dracunculoides, E. dulcis, E. exigua, E. falcata
var. acuminata, E. geniculata, E. gerardiana, E. globosa, E. helioscopia, E. hetero-
phylla, E. hibernica, E. hirta, E. hypericifolia, E. ipecacuanha, E. lagascae, E. lat-
hyris, E. maculata, E. mauritanica, E. meloformis, E. microphylla, E. millii,
E. oreophylla, E. palustris, E. paralias, E. peplus, E. pithyusa\sx. ovalifolia,
E. plathyphylla, E. preslii, E. procera, E. prolifera, E. pubescens, E. pulcherrima,
E. rosea, E. rothiana, E. salicifolia, E. spinosa,E. splendens,E. terracina, E. thu-
miflora, E. tiruncallii, E. variegata, E. virguta, E. wallichii, Excoecaria agallocha^
Gelonium multiflorum, Hevea brasiliensis, Homonia retusa,Hura crepitans, Jatropha
gossypifolia, J. panduraefolia,- Mallotus albus, M. japonicus, M. philippensis,
M. roxburghianus, Melanthesa rhamnoides, Micrantheum ericoides, Micrococca
jjiercurialis, Neopeltandra suberosa, Neoscortechinia arborea, Pedilanthus tithyma-
loides, Phyllanthus angustifolius, Ph. debilis, Ph. maderaspatensis, Ph. odontodenius
276
Ph. reticulatus, Poinsettia pulcherrima, Putranjiva-roxburghii, Ricinus communis
Sauropus quadrangularis, Scepasma buxifolia, Sebastiana chamaelea, Securinega
ramiflora, StachyStemon vermicularis, Tragia involucrata, Trewia nudi flora, Tri-
gonostemon.
Литература: Roeper, 1824; Candolle, 1827; Moquin-Tandon, 1841;
Schacht, 1850; B'raun, 1857, 1860; Baillon, 1858; Hofmeister,, 1858; Masters,
1869; Hanstein, 1877; Strasburger, 1877, 1878, 1909, 1910; Elfving, 1879; Joi^sson,
1879—1880, 1881; Guignard, 1882; Hegelmaier, 1885, 1901, 1903; Wille, 1886;
Clarke,. 1887; Kayser, 1892, 1893; Hubert, 1896; Lyon, 1898; Schlotterbeck, 1898;
Schweiger, 1905.; Schmidt, 1907; Modilewski, 1909, 1910, 1911; Sykes, 1909;
Malte, 1910; Arnoldi, 1911, 1912; Dessiatoff, 1911; Donati, 1912, 1913; Markow-
ski, 1912; Garano, 1915, 1925, 1926; Weniger, 1917; Heusser, 1919; Kenoyer,
1919; Maas, 1919; Pax, Hoffmann, 1919; Jorgensen, 1923; Bohn, 1924; Schtir-
hoff, 1924, 1926; Soueges, 1924, 1925; Tbteishi, 1927; Mathe, 1928; Py, 1929;
Lundberg, 1931; Schnarf, 1931; Ventura, 1933, 1934, 1940; Johri, 1936, 1952;
Maheshwari, Ghowdhury, 1937; Sanchez, 1938; Amato, 1939, 1946; Dickey,
Reuther, 1940; Maheshwari, Johri, 1940, 1941; Martinoli, 1940; Bhalla, 1941a,
1941b; Landes, 1941, 1946; Maheshwari, 1942, 1945a, 1945b, 1946, 1950; McCann,
1942; 1945; Dutt, 1943; Kajale, Rao, 1943; Banerji, Dutt, 1944; LaRue, 1944;
Swamy, Balakrishna, 1946; Bambacioni-Mezzetti, 1947; Mendes, 1947; Banerji,
1949, 1951; Gopinath, Gopalkrishnan, 1949; Johansen, 1950; Srivastava P. K.,
1952; Thathachar, 1952, 1953a, 1953b; Johri, Kapil, 1953; Moore, Lindsay, 1953;
Raju, Rao, 1953; Srivastava, Agarwal, 1953; Vindt, 1953; Kajale, 1954; Kajale,
Murthy, 1954; Muzik, 1954; Singh, 1954, 1956, 1959, 1962, 1965a, 1965b, 1968,
1969, 1970a, 1970b, 1972; Kapil, 1955,1956a, 1956b, 1958, 1960, 1961; Sharma,
1955, 1956; Rao A. N., 1956, 1964; Mukherjee, 1957, 1958, 1961a, 1961b, 1962,
1964, 1965; Dang Van Liem, 1959, 1960, 1961, 1962; Deshpande, 1959; Kelkar,
1962; Mani, 1960; Bouharmont, 1961, 1962; Cejsca, 1961, 1969; Кордюм, Заець,
1962; Rao P. N., 1962a, 1962b; 1970; Crete, 1963; Dnyansagar, Malkhede, 1963;
Galimberti, 1963; Jennings, 1963; Mohan Ram, Satsangi, 1963; Nair, Abraham,
1963; Nair, Maitreyi, 1963; Venkateswarlu, R$o, 1963, 1967, 1975; Mukherjee,
Padhye, 1964; Johri, Bhojwari, 1965; Singh, Jain, 1965; Davis., 1966; Dnyansagar,
Tiwari, 1966; Singh, Nair, 1968; Singh, Pal, 1968; Chopra, Singh, 1969; Magoon
et al., 1969; Bhatnagar, 1970; Chopra, 1970; Singh, Chopra, 1970; Conagin
Candida, 1971; Gori, Sarfatti, Cresti,. 1971; Srivastava P. S., 1971a, 1971b, 1971c;
Kapil, Bhati^fir, 1972; Pal Aruna, 1972; Schwarzenbach, 1972; Bor, Bouman,
1974; Rao P. S. P., Rajeswari, 1974, 1975, 1977; Venkateswarlu, Rao P.N.,
Rao S. D., 1974; Bor, Kapil, 1975,1976; Rajeswari, Rao P. S. P., 1975; Gori, 1976,
1977, 1978; Rao P. N., Rao S. D., 1976; Батыгина и др., 1978; Bruni, Tosi, 1978;
Bruni, Vannini, Fasulo, 1978; Jimenez, Domingo, 1978; Mieras, 1978; Dehgan,
Webster, 1979; Frean, 1979; Morrow, 1979; Батыгина, Бутенко, 1981; Leconte,
1981; Батыгина, Колесова (ориг. данные).
Семейство PANDACEAE
Эмбриологически^не изучено. :
Пыльники вскрываются продольно. Гинецей состоит из 2—5 плодолистиков.
В мужских цветках имеется редуцированный гинецей.
Завязь 2—5-гнездная с одним висячим, ортотропным 2-покровным
семязачатком в каждом гнезде.
Зародыш прямой, с тонкими плоскими семядолями. Зрелые семена с
обильным эндоспермом, богатым жирами.
Литература. Тахтаджян, 1966; Forman, 1966; Vaughan, Rest, 1969;
Corner, 1976.
277
Семейство DIGHAPETALAGEAE
Семейство ,Dichapetalaceae эмбриологически изучено недостаточно. Данные*
по развитию и строению пыльника и пыльцевых зерен в литературе
отсутствуют.
В каждом гнезде закладываются 2 висячие семяпочки, но только одна из;
них формируется в семя, другая дегенерирует. Семяпочка анатропная, тенуину-
целлятная. У большинства представителей (Dichapetalum toxicarum, D. оЫоп-
gum, D. mombuttense, Tapura africana, T. boequetiana) обнаружены 2 интегумента
(Van Thieghem, 1903; Schnarf, 1931; Boesewinkel, Bouman, 1980). У D. mom-
buttense и других исследованных видов внутренний и наружный интегументы
закладываются одновременно на стадии дифференциации археспориальнойг
клетки (Boesewinkel, Bouman, 1980). Вначале они 2—3-слойные, после
оплодотворения становятся многослойными: до 6—8 слоев клеток — внутренний
и до 20 слоев — наружный интегумент. Внутренний интегумент аккумулирует
заметное количество крахмала; наружный интегумент асимметричен, короче
внутреннего и беден крахмалом. Микропиле образовано только внутренним
интегументом и почти сформировано ко времени, когда семяпочка еще гемйана-
тропна.
У Г. africana клетки внутреннего эпидермиса наружного интегумента на
ранних стадиях развития семяпочки несколько удлиняются в радиальном
направлении. Аналогичное явление наблюдается в клетках внутреннего
эпидермиса внутреннего интегумента после оплодотворения у D. mombuttense (Boese-
vWinkel, Bouman, 1980). В семяпочке у изученных видов хорошо развита прои
водящая система. Особенность ее развития — дифференциация в наружном
интегументе еще на стадии формирования археспориальной клетки. Она
проходит в халазальную часть семяпочки и достигает максимального развития
в зрелом семени; в наружном интегументе в это время представлена прокам-
биальными тяжами с элементами ксилемы. По мере формирования семени
внутренний интегумент и часть наружного дегенерируют. Эпидермис наружного-
интегумента в зрелом семени покрыт кутикулой, клетки его имеют утолщенные
оболочки и богаты таниноподобными веществами. Вследствие разрастания
278
наружного интегумента образуется карункула. Характерная черта развития
семяпочки — ранняя резорбция нуцеллуса (на стадии сформированной
семяпочки). У D. mombuttense присутствует обтуратор фунйкулярного
происхождения, который состоит из коротких многоклеточных волосков, богатых
цитоплазмой, и выявляется на поздних стадиях развития семяпочки. Гипостаза
отсутствует. Археспорий одноклеточный. Дифференциация археспориальной
клетки происходит в субэпидермисе в период начала формирования интегумен-
тов. Археспориальная клетка превращается непосредственно в мегаспороцит.
Тетрады мегаспор линейные.
Зародышевый мешок моноспорическии, развивается из халазальной
мегаспоры по Polygonum-типу.
Эндосперм нуклеарного типа. В зрелом семени представлен лишь одним
слоем клеток. На внешней поверхности эндосперма образуется кутикула.
Зрелый зародыш D. mombuttense большой, прямой, эллипсоидной формы,;
дифференцированный. Семядоли плоско-выпуклые. Эпикотиль и гипокотиль
вместе составляют околЬ 1 мм длины. Характерная особенность строения
семядолей зародыша — наличие межклетников. Семядоли богаты крахмалом, бедны
жирами и содержат хлорофилл в периферических слоях клеток. Хлороэм-
бриофит.
Изученные виды. Dichapetalum bangii, D. cymulosum, D. guineense%
D. madagascariense, D. mombuttense, D. oblongum, D. pallidium, D. toxicarium,
Tapura africana, T. amazonica, T. bouquetiana, T. ivorensis.
Литература. Engler, 1896; Tieghem van, 1901, 1903; Netolitzky,
1926; Engler, Krause, 1931; Hutchinson, 1964; Melchior, 1964; Ward, Hull,
Peters, 1964; Тахтаджян, 1966; Prance, 1972; Breteler, 1973; Punt, 1975, 1976;
Boesewinkel, Bouman, 1980.
Семейство AEXTOXICACEAE
Данные по развитию пыльника и пыльцевых зерен отсутствуют, \
Семяпочка 2-покровная, анатропная, крассинуцеллятная. Микропиле
образовано только внутренним интегументом, который у Aextoxicon punctatum
располагается значительно выше наружного; имеется массивный нуцеллярный
колпачок и многослойная париетальная ткань.
Развитие зародышевого мешка, эндосперма и зародыша не исследовано.
Изученный вид. Aextoxicon punctatum.
Литература. Mauritzon, 1936; Davis, 1966.
Порядок 42. THYMELAEALES
. Семейство THYMELAEACEAE
Пыльники 4-гнездные, ко времени созревания гнезда в теках сливаются-
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, в
котором появляются фиброзные утолщения, 1—3 средних слоев и секреторного*
тапетума. Средние слои эфемерны; клетки тапетума на поздних стадиях
развития имеют до 3 ядер или больше; возможно, образование полиплоидных ядер.
Со стороны связника тапетум может быть 2-рядным. Спорогенная ткань состоит*
из нескольких слоев клеток. Микроспороциты многочисленны, ядра их могут
иметь по 2 ядрышка и сгустки гетерохроматина. Цитокинез симультанного
типа. Тетрады микроспор изобилатеральные или тетраэдральные. На стадии
тетрад микроспор в цитоплазме клеток тапетума у Daphne присутствуют
многочисленные митохондрии, достаточно много пластид и диктиосом, развит эндо-
плазматичеекий ретикулум, присутствуют везикулы, хлоропласты с
отчетливыми гранами, ламеллами и липидными включениями.. Начиная со стадии
обособления микроспор в тапетуме наблюдаются признаки дегенерации:
цитоплазма вакуолизируется, видоизменяются митохондрии, эндоплазматический
ретикуйум, в хлоропластах разрушаются граны и ламеллы, более длительное
время сохраняются в них липидные , включения. Зрелые пыльцевые зерна
3-клеточные, заполнены запасными питательными веществами; спермин медкие,
червеобразные. Лишь Дальгрен (Dahlgren, 1915) сообщил о наличии 2-клеточ-
ных зрелых пыльцевых зерен у Daphne mezereum. В процессе мейоза у Daphne
odora обнаружены отклонения, приводящие к формированию микроспор,
отличающихся по размерам и характеру цитоплазмы. Возможно также
образование из одного микроспороцита до 7 клеток микроспор в результате аномалий
в мейозе. Они часто дегенерируют на одноядерной стадии; большая часть
пыльцевых зерен у этого вида стерильна (Osawa, 1913).
В завязи одна анатропная или гемитропная семяпочка, с 2 интегумен-
тами, крассинуцеллятная. Она имеет обтуратор с сосочкообразными
клетками по периферии и гипостазу. Микропиле образовано внутренним интегумен-
том. В периферийной зоне нуцеллуса обнаружены трахеиды. Наружный интё-
гумент однослойный, а внутренний состоит из 5—6 слоев клеток. Археспорий
одноклеточный, при делении археспориальной клетки образуются кроющая
клетка и мегаспороцит. Кроющая клетка делится переклинально и
антиклинально и образует париетальную ткань, до 8 слоев клеток у Wikstroemia и до
14 — у Daphne. Клетки микропилярной зоны эпидермиса нуцеллуса
формируют нуцеллярный колпачок у Wikstroemia и Daphne. Мегаспороцит сильна
разрастается и вступает в мейоз. Тетрада мегаспор линейная или Т-образная.
Начало зародышевому мешку дает халазальная мегаспора тетрады, осталь-.
ные дегенерируют. У Daphne наблюдались также случаи разрастания микро-
Thymelaeaceae
1—4, 11, 12, 16, 24, 25 — Wikstroemia indica, 5— 7', 10, 23 — Daphne laureola, 8, 9, 13—IS,
17', 18 — D. odora, 19 — Dirca palustris, 20 — Passerina filiformis, 21 — Gnidia tomentosa,
22 — Daphnopsis swartzii, 26—32 — Thymelaea arvensis, 33—38 — Daphne mesereum.
1 — гнездо молодого пыльника с материнскими клетками микроспор; 2 — стенка
пыльника и мейоз в микроспороцитах; 3 — тетрада микроспор; 4 — стенка пыльника и
одноядерные пыльцевые зерна; 5 — одноядерное пыльцевое зерно; 6 — 2-клеточное пыльцевое-
зерно; 7 — 3-клеточное пыльцевое зерно; 8, 9 — нормальные и аномальные тетрады
микроспор; 10 — семяпочка с археспориальной клеткой; 11, 12 — семяпочки с мегаспороцитом,
мощной париетальной тканью и нуцеллярным колпачком; 13 -^ одноядерный зародышевый
мешок, 3 верхние мегаспоры дегенерируют; 14 — тетрада с увеличившимися в размерах
микропилярной и халазальной мегаспорами; средние мегаепоры дегенерируют; 15 —
тетрада с увеличившейся микропилярной мегаспорой; 16 — 2-ядерный зародышевый мешок;
17 — 4-ядерный зародышевый мешок; 18,19 — зрелые зародышевые мешки;
280
Thymelaeaceae (продолжение)
20—22 — схемы семяпочек; 23 — зародышевый мешок с 2-клеточным проэмбрио и ядерным
эндоспермом; 24 — схема семяпочки с развивающимся зародышем половой природы; видны
остатки пыльцевой трубки; 25 — семяпочка с адвентивным зародышем; 26—-32 —
эмбриогенез;
Thymelaeaceae (продолжение)
33—38 — развитие зародыша. (1, 4, 25 — по Winkler, 1905; 10 — по Fuch, 1938; 5—9 ,
13—15,17—19, 23 — по Osawa, 1913; 20—22 — по Guerin, 1916; 26—32 — по Venkates-
warlu, 1947a; 33—38 — по Soueges, 1942; 2, 3, 11, 12, 16, 24 — ориг.).
лилярнои мегаспоры и микропилярнои и халазальнои мегаспор одновременно
(Osawa, 1913). Зародышевый мешок развивается по Polygonum-типу.
Яйцеклетка по размерам значительно крупнее синергид, которые имеют
грушевидную форму, часто лишены вакуоли и отчетливо выраженного нитчатого аппарата.
Центральная клетка имеет 2 полярных ядра, сливающихся до оплодотворения.
Антиподальных клеток сначала 3, но в дальнейшем их число может увеличи-
288
ваться до 5 у D. odora и до 30 и более у других представителей семейства.
Исчезают антиподы к стадии развития глобулярного зародыша. 8-ядерные
зародышевые мешки у Daphne не образуются во многих случаях; очень часто они
дегенерируют на разных этапах в процессе развития (Osawa, 1913).
Пыльцевая трубка подходит к семяпочке порогамно. Двойное оплодотворение не
изучено. Лишь у D. laureola показан: момент слияния спермия с ядром яйцеклетки
(Fuchs, 1938), а у Phaleria capitata (Soerodikoesoemo, 1970) — зигота с 2
ядрышками, дегенерировавшие синергиды и 2-ядерный эндосперм.
Эндосперм нуклеарный, начинает развиваться раньше зиготы. Позднее он
становится клеточным. Ядра эндосперма триплоидные у D. laureola. В зрелом
семени в 'незначительном количестве сохраняются эндосперм и перисперм.
Зародыш у Thymelaea arvensis развивается по Asterad-типу Erodium-вариации
(Venkateswarlu, 1947). У Daphne mezereum эмбриогенез также близок к
Asterad-типу (Soueges, 1942). Зародыш зрелого семени прямой, нормально
дифференцирован, имеет массивные семядоли, короткий корешок и слаборазвитую
почечку. Он занимает весь объем семени. У Wikstroemia indica отмечено
образование партеногенетических зародышей, а также адвентивных зародышей из;
нуцеллуса (Winkler, 1906). Однако эти вопросы не исследовались автором
детально и не подтверждены достоверными рисунками. Проведенные нами
исследования заставляют сомневаться в возможности развития у тимелиевых
нуцеллярных зародышей. Во всех наблюдаемых случаях зародыши у W.
indica имели половую природу; были видны остатки пыльцевых трубок и
разрушенные синергиды. Крупных клеток в нуцеллусе, характерных для видов;
с нуцеллярной эмбрионией, у W. indica мы не наблюдали.
И с с л е д ав анные виды. Chymococca empetroides, Daphne blagayanar
D. cneorum, D. kiusiana, D. laureola, D. mezereum, D. odora, D. pseudo-mezereumr
D. striata, Daphnopsis swartzii, Diarthron vesiculosum, Dirca palustris, Drymisper-
mum {Phaleria) revolutum,' Gnidia tomentosa, Passerina filiformis, P. pectinatay
Phaleria capitata, Thymelaea arvensis, Th. passerina, Wikstroemia indica.
Литература. Hofmeister, 1849; Prohaska, 1883, 1884; Strasburgery
1884, 1885, 1909; Winkler, 1904, 1906; Guerin, 1913, 1916; Osawa, 1913; Dahl-
greii, 1915; Palm, 1915; Yamaha, 1926; Joshi, 1937; Fuchs, 1938; Fagerlind, 1940;
Kausik, 1940; Soueges, 1942; Venkateswarlu, 1945, 1946, 1947a, 1947b; Martin,
1946; Garagaty-Feissly, 1969 (1970); Soerodikoesoemo, 1970; Беляева H., 1977;
Tan, 1980; Наумова (ориг. данные).
ДОПОЛНЕНИЕ
Семейство STEGNOSPERMATACEAE
Эмбриологически изучено недостаточно.
По нашим данным, у Stegnosperma halimifolia * пыльники 4-гнездные,
раскрываются продольно; гнезда объединены в 2 теки и в процессе созревания
пыльника попарно сливаются в результате разрушения перегородки между
ними. Сформированная стенка пыльника состоит из эпидермиса, эндотеция,,
2 средних слоев и тапетума. Тапетум клеточный секреторный, нерегулярна
2-слойный, с 2—4-ядерными клетками, с хорошо выраженными орбикулами,
которые различаются уже со стадии одноядерной пыльцы. Лизис тапетума
осуществляется постепенно и ко времени образования 2-клеточной пыльцы
от него остается лишь пленка с орбикулами. К этому же времени в эндотещш
появляются фиброзные пояски. Средние слои дегенерируют несколько позже.
Стенка зрелого пыльника состоит из крупных, покрытых кутикулой клеток
эпидермиса, и эндотеция с фиброзными утолщениями. Микроспорогенез не
изучен. Пыльцевые зерна одиночные. Спермиогенез осуществляется в пыльниках.
Зрелая пыльца 3-клеточная, с 2 мелкими каплевидными, с заостренным кон-
* Материал собран в Миссурийском ботаническом саду и любезно предоставлен нам
д-ром П. Равеном (Missuri Bob. Gard. Desert House, 8 Sept. 1982, P. Raven, 26372).
284
чиком спермиями, цитоплазма которых неразличима; хроматиновые нити
в их ядрах густо переплетены и ядрышки не видны. Ядро вегетативной клетки
неправильной формы, цитоплазма заполнена запасным белком и липидами.
Завязь 5-гнездная, в каждом гнезде которой по одной, базально
прикрепленной семяпочке. Семяпочка амфитропная, с 2 интегументами, крассинуцел-
лятная. Интегументы тонкие, 3-слойный наружной и 2-слойный внутренний,
утолщающийся в области микропиле до 4 слоев и выступающий за наружный.
В клетках эпидермиса наружного интегумента и внутреннем слое внутреннего
накапливается танин. Между интегументами в халазальной части семяпочки
имеется небольшой воздушный промежуток. Микропиле образовано
внутренним интегументом, направлено вниз и изогнуто в противоположную от фуни-
кулуса сторону. Халаза массивная. Фуникулус широкий, с характерным
выступом в основании семяпочки, который после оплодотворения разрастается
и формирует ариллус. Имеется плацентарный обтуратор, представленный,
вытянутыми сосочковидными .клетками. Проводящий пучок с сосудистыми
элементами по фуникулусу заходит в халазу к основанию нуцеллуса, далее^
по нуцеллусу к зародышевому мешку дифференцируется прокамбиальный тяж.
Нуцеллус массивный, изогнутый. В нем очень четко различается нуцеллярнын
колпачок, возникший в результате периклинальных делений эпидермиса
и состоящий из 3 слоев клеток, которые в микропилярной части радиально
вытянуты. Особенно сильно разрастается базальная часть нуцеллуса. В
клетках нуцеллуса имеются крахмальные зерна. Археспорий одноклеточный."
Археспориальная клетка делится на париетальную, которая образует 2—3-слой-
ную париетальную ткань, и спорогенную клетку, превращающуюся в мега-
спороцит. В оболочке последнего откладывается каллоза. Со стадии 4-ядерного*
зародышевого мешка париетальная ткань начинает дегенерировать и
полностью разрушается в процессе роста зародышевого мешка. Мегаспорогенез*
завершается образованием линейной или Т-образной тетрады мегаспор. Иногда
образуется триада, когда ядро верхней клетки диады дегенерирует не делясь
или делится без цитокинеза. Функциональной является халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Зрелый зародышевый мешок овальный, с расширенной микропилярной и узкой-
халазальной частью, с дифференцированными элементами. Синергиды с крючко-
•видными выступами, без нитчатого аппарата, яйцеклетка крупнее 'синергид.
Ядро центральной клетки, образовавшееся в результате слияния полярных
ядер, располагается недалеко от яйцевого аппарата. Антиподы — 3 маленькие-
клетки, эфемерны, дегенерируют до оплодотворения. Оплодотворение поро-
гамное.
Эндосперм нуклеарный. В зрелом семени запасающей тканью является;
перисперм.
Эмбриогенез не исследован.
Исследованный вид. Stegnosperma halimifolia.
Литература. Walter, 1909; Corner, 1976; Hofmann, 1977; Камелшш
(ориг. данные).
Приложение
Содержание запаснкх питательных вёщеётв в зрелом семени покрытосеменных растений
Порядок
Magnoliales
llliciales
Laurales
Aristolochiales
Семейство
Magnoliaceae
Annonaceae
Myristlcaceae
Illiciaceae
Schisandraceae
Calycanthaceae
Lauraceae
Hernandiaceae
Aristolochiaceae
Число
ИССЛ.
видов
3
1 4
16
3
1
2
21 |
•3
1
Анализированные структуры
Семя
(з + эн + т)
Зародыш +
эндосперм
Семя
(з -j- эн + т)
Зародыш +
эндосперм
Эндосперм
Семя
(з + эн + т)
Зародыш +
эндосперм
Эндосперм
Семя
(з + эн + т)
Зародыш +
эндосперм
Эндосперм
Семя
(з + т)
Семя
(з + т)
Зародыш
Семя
(з + п + т)
Зародыш +
перисперм
Семя
(з + эн + т)
Эндосперм
Содержание запасных веществ
(% на сухую массу)
белки
5-16
0-30
14—19 *
5-20
8-26*
23—34
5-35
21*
21
жиры
23-56
60*
24
40—50 *
31-71
27—83*
8-30
34*
36-48
12-60
24—75 *
34-51
8—51*
12—23
олиго-
сахара
крахмал
—'
±
0-13
+
—
+
—
+
+
±
Литературный источник
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Благовещенский, 1965; Jones, Earle,
1966; Hegnauer, 1969
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Hegnauer, 1964; Corner, 1976
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Jones, Earle, 1966; Hegnauer, 1969
Шарапов, 1959; Hegnauer, 1973-
Шарапов, 1959; Corner, 1976
Earle, Jones, 1962; Jones, Earle, 1966
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Jones, Earle, 1966; Hegnauer, 1966
McNair, 1930; Hegnauer, 1966
Hegnauer, 1964; Jones, Earle, 1966; Corner, 1976
Приложение (продолжение)
Порядок
Nymphaeales
Nelambonales
Ranunculales
Papaverales
Eapteleales
Hamamelidales
Семейство
Nymphaeaceae
Ceratophyllaceae
N elumbonaceae
Lardizabalaceae
Menispermaceae
Berberidaceae
Ranunculaceae
Papaveraceae
Eupteleaceae j
Hamamelldaceqe I
Platanaceae
Daphniphyllaceae
^
Buxaceae
Число
ис*сл.
видов
1
1
3
3
2
68
15
1
3
* 1
2
2
Анализированные структуры
!
Семя
(з + ЭН + П + Т)
Зародыш
Семя
(з + эн + т)
Зародыш
Семя
(з + эн + т)
Семя
(з + эн + т)
Зародыш +
эндосперм
Семя
(з + эн + т)
Эндосперм
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(3 + ЭН + П + Т)
Зародыш +
эндосперм
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(з + эн + т)
Содержание
белки
15-20
18
16
13—17**
20
10-32
12-25
7 .
12-35
с
9-14
15-18
21
запасных веществ
(% на сухую массу)
жиры
2
3
19-39
15—17
62*
12—15
7-47
30-47
11
52*
4-8
35-37
14-45
олиго-
сахара
0.5
11
0.2
2-4
крахмал
44-47
+
40
+
—
±
—
2
—
—
—
Литературный источник
Smith et aL, 1959; Hegnauer, 1969
Шамров, Васильева, ориг. данные; Шамров,
1982
Васильева, ориг. данные; Овчаров, Д976; Баты-
гина, Васильева, 1979, 1981
Шарапов, 1959; Hegnauer, 1966; Jones, EarJe,
1966; Ср. эмбр., 1, 1981
McNair, 1930; .Earle, Jones, 1962; Jones, Earle,
1966; Hegnauer, 1969
Шарапов, 1959; Earle, Jones, 1962; Ср. эмбр.,
1, 1981
McNair, 1930; Tietz, 1953; Шарапов, 1959;
Smith et aL, 1959; Jones, Earle, 1966
D.uperon, 1954; Шарапов, 1959; Smith et aL,
1959; Jones, Earle, 1966; Johri, Maheshwari,
1966; Понтович, 1973
Earle, Jones, 1962
McNair, 1930; Шарапов, 1959; Earle, Jones,
1962; Jones, Earle, 1966
McNair, 1930; Jones, Earle, 1966
Kleiman et aL, 1965
Ueno, Matsushima, 1956; Шарапов, 1959; Earle,
Jones, 1962
Приложение (продолжение)
Порядок
Hamamehdales
Eucommiales
Urticales
Casuarinales
Fa gales
Myricales
Juglandales
Семейство
Simmondsiaceae
Eucommiaceae
Ulmaceae
Moraceae
Cannabaceae
Urticaceae
Casnarinaceae
Fagaceae
Betulaceae
Myricaceae
Juglandaceae
Число
иссл.
видов
2
1
9
18
5
4
6
7
И
4
J2
Анализированные структуры
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(з+эн + т)
Зародыш
Семя
(з±эн + т)
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(з + т)
Семя
(з + т)
Зародыш
Семя
(з + эн + и + т)
Зародыш +
эндосперм +
перисперм
Семя
(з + т)
Зародыш
Семя
•(в + т)
Зародыш
Содержание запасных веществ
(% на сухую массу)
белки
16
26
10—42
10-47
17-35
20-21
44-49
. 3-45
12-40
11-18*
5-7
5—41
19—23*
жиры
45—50
43
5-50
25—50*
1—49
19-38
16-30
31-42
1-50
5—7*
10-65
68-73 *
13—35
28—43
12-76
54-81 *
о л иго-
сахара
4—19
5
3—18*
1.5-4.0 **
крахмал
! —
±
—
—
16-34
61
3-11*
0.4-2.0**
Литературный источник
Шарапов, 1959; Jones, Earle, 1966
Колобкова, 1972а
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Earle, Jones, 1962; Hegnauer, 1973
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Earle, Jones, 1962; Jones, Earle, 1966;
Колобкова, 1972а
Шарапов, 1959; Smith et al., 1959; Колобкова,
1972a
Шарапов, 1959; Earle, Jones, 1962; Jones, Earle,
1966
McNair, 1930; Jones, Earle, 1966; Колобкова,
1972a
Туркевич, 1955; Rader-Roitsch, 1958; Шарапов,
J959; Колобкова, 1964, 19726; Hegnauer, 1966;
Jones, Earle, 1966; Корнеева, 1966;
Жуковский, 1971
Cerbulis, 1955; Eubel, 1956; Шарапов, 1959;
Earle, Jones, 1962; Hegnauer, 1964;
Колобкова, 1964; Jones, Earle, 1966; Cassagne, Ba-
raud, 1969
McNair, 1930; Шарапов, 1959; Harlow et al.,
1965; Jones, Earle, 1966
Eubel, 1956; Лопушанский, Молотковский, 1956;
Шарапов, 1959; Smith et al., 1959; Полищук,
1961; Колобкова, 1964; Дементьев, 1966; Jones,
Earle, 1966; Овчаров, 1976
Cactaceae
1,2 — Opuntia elata.
1 — нуцеллус и центральная клетка с развивающимся в ней эндоспермом; ткань нуцеллуса
неоднородна, морфологически выделяется эмбриональная нуцеллярная ткань (э. н. т),
возникшая после цветения и состоящая пз мелкпх густоплазменных клеток; она
располагается вдоль зародышевого мешка и ее клетки впоследствии дают нуцеллярные проэмбрио;
2 — нуцеллус и нуцеллярные проэмбрио, внедряющиеся в центральную клетку с ядерным
эндоспермом (я. э). (1, 2 — ориг.).
1li I Сравнительная эмбриология
* -* W * •* ~ ft# ^ *
♦е- >-' *д„
г#_
'*
•у «
V
Раеопгасеае (1—3) и Brassicaceae (Cruciferae) (4, 5)
1—3 —■ Paeonia suffruticosa.
1 — клеточный эндосперм и глобулярный зародыш с остатками ценоцитного предзародыше-
вого образования; 2 — более поздняя стадия развития семени; зародыш в момент закладки
меристемных очагов будущих семядолей; все еще виден остаток ценоцитной структуры;
3 — хорошо развитый зародыш с 2 семядолями, точкой роста, гипокотилем и корневым
апексом; видны прокамбиальные тяжи. (1—3 — по Яковлеву, Иоффе, 1965).
4,5 — Heliophila amplexlcaulis.
4 — многоядерная клетка внутреннего ин^егумента с ядрами, делящимися синхронно,
наверху видны. 2 наружных мелкоклеточных слоя внутреннего интегумеята и наружный 3-слой-
ный пнтегумент; 5 — семяпочка на стадии многоклеточного зародыша, после отделения
инициалей эмбрподермы; наружный интегумент 3-слойный, внутренний интегумент, кроме
2 наружных мелкоклеточных слоев, состоит из крупных многоядерных клеток. (4, 5 — по
Родионовой, 1972).
Datiscaceae
1—6 — Datisca cannabina.
Развитие пыльника: 1 — поперечный срез молодого пыльника, 2 — гнездо этого пыльника
со сформированной сменкой и спорогенной тканью, 3 — фрагмент пыльника с микроспоро-
цитами, 4 — фрагмент пыльника во время мейоза в микроспороцптах, 5 — поперечный срез
пыльника на стадии тетрад микроспор; 6 — участок этого пыльника. {1—6 — ориг.).
i/j l Сравнительная эмбриология
?чцк
-Reserfaccoe
1—9 — Reseda lutea.
1—3 — фаза раннего глобулярного зародыша: 1 — общий вид (Х1200);
К' * / *
I — гипофизаряая зона (Х7500), 3 — клетки из апикальной з.оны (Х7500);
6
4 — фрагмент клетки глобулярного зародыша (Х8500); 5,6 — фаза торпедовидного
зародыша: 5 — фрагменты клеток из зоны пшокотиля (хлоропласты с крахмальными зернами
Х9000), в — фрагмент клетки семядольной зоны (хлоропласты без крахмала, Х7500);
8 ■ 9
7—9 — хлоропласты в эндосперме: 7 — фрагмент эндосперма в зоне зиготы (Х7000), 8 —
эндосперм перед клеткообразованием (Х16 000), 9 — фрагмент клеточного эндосперма
(Х38 000). (а — вакуоль, в. с — везикулярная структура, г — грана, д — диктиосома,
к. о — клеточная оболочка, кр — крахмал, л — лейкопласт, лг. к — линзовидная клетка,
л. к — липпдная капля, м — митохондрия, пдв — подвесок, п. п. р — периферический
пластинный ретикулум, т — тонопласт, хл — хлоропласт, энд — эндосперм, э. р — эндо-
плазматический ретикулум, я — ядро, ядр — ядрышко). (1—6 — по Яковлеву, Чабан,
1979; 7—9 — по Чабан, 1979).
.■■". - :i4 ■ -
V .
J
TiUaceae
'л: "'Г."*.
,:.-?■
, ~ ■?—S — ГШа platyphyllos.
«™Т«!/-Хы\ио™™1^ТТГ,Мва0фШ,а Ce"™0MS "WW™ ■MP»™'»
зародыша зрелого воздушно-сухого семени, (ев — вакуоль, гр — грана, к. з —
крахмальное зерно, к. м. о — концентрическое мембранное образование, в. о — клеточная оболочка,
о. х — оболочка хлоропласта, п — пластида, пг — пластоглобула, п. р — периферический
ретпкулум, т. к — трубчатый комплекс). Масштабная линейка — 1 мкм. (1, 4—6, 8 —
ориг.; 2 — по Жуковой, 1975; 3, 7 — по Жуковой, 1979).
if'
•Ж-'
Malvaceae
1—8 — Alcea rosea.
1,2 — 2 среза яйцевого аппарата (1 — синергиды, 2 — яйцеклетка); 3
4 — лейкопласты проэмбрио;
проэмбрио;
KJ
5 — хлоропласт основной меристемы зародыша с примордиями семядолей; 6—8 — хлоро-
пласты и фрагменты хлоропластов мезофилла семядолей зародыша незрелого семени.
.(б. т —белковоетело, гр — грана, к. з — крахмальное зерно, к. о — клеточная оболочка,
Лш к — липпдная капля, пг — пластоглобула, о. х — оболочка хлоропласта, сг —
суперграна, т. п — трубочки пластид, т. п. с — тилакоид периферической мембранной системы,
т. с — тилакоиды стромы). Масштабная линейка — 1 мкм. (1—3, 5—8 — ориг.; 4 — по
Жуковой, 1978).
Приложение (продолжение)
Порядок
Caryophyllales
ч
Polygonales
Plumbaginales
Семейство
Phytolaccaceae
Nyctaginaceae
Aizoaceae
Cactaceae
Portulacaceae
,Molluginaceae
' Caryophyllaceae
Amaranthaceae
Chenopodiaceae
I
Polygonaceae
Plumbaginaceae J
.._
Число
иссл.
видов
2
3
2 ,
3
1
1
18
17
21
22
1
Анализированные структуры
Семя
(з + эн + п+т)
Зародыш
1 Эндосперм
Семя
(з + эн+ п + т)
Семя
(з + эн + п + т)
Зародыш
Эндосперм
Семя
(з + эн + п + т)
Семя
(з + эн + п + т)
Зародыш
. Эндосперм
Семя
(з + эн + п + т)
Семя.
[з + эн+п + т)
Зародыш
Эндосперм
Семя
[з + эн + п + т)
Семя
(з + эн + п + т)
За роды иг
Эндосперм
Семя
(з + эн + т)
Эндосперм
Семя
(з + эн + т)
Содержание
белки
10
15-22
12-31
0-30
13-25
13
• 10-24
15-20
5-40
7—24
32—37
запасных веществ
(% на сухую массу)
' жиры
11-14
0.4—7.0
5-8
17-32
19
< 16
3-7
5-17
2-22
2-7
5—10
» олиго-
сахара
10
1
5—47***
0—64***
крахмал
+
18
+
±
+
'
+
+
23-63
0-5
40-60
+
±
Литературный источник
McNair, 1930; Ueno, Matsushima, 1956; Earle,
Jones, 1962; Jones, Earle, 1966
Earle, Jones,' 1962; Jones, Earle, 1966;
Hegnauer, 1969
McNair, 1930; Earle, Jones, 1962; Jones, Earle,
1966
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Earle, Jones, 1962; Corner, 1976
McNair, 1930; Earle, Jones, 1962
Jones, Earle, 1966
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Pilgrim, 1961; ЕагДе, Jones, 1962; Jones
Earle, 1966
Шарапов, 1959; Smith et al., 1959; Hegnauer,
1964; Jones, Earle, 1966; Downton, 1973; Opu-
te, 1979
White et al., 1955; Шарапов, 1959; Smith et
al., 1959; Hegnauer, 1964; Jones, Earle, 1966;
Овчаров, 1976
t
Smith et al., 1959; Earle, Jones, 1962; Jones,
Earle, 1966; Corner, 1976; Овчаров, 1976
Earle, Jones, 1962; Jones, Earle, 1966
Приложение (продолжение)
Порядок
Paeoniales
Theales
г
\
Violates
Семейство
Paeoniaceae
Ochnaceae
Theaceae
Caryocaraceue
.Clusiaceae
Flacourtiaceae
Passifloraceae
Violaceae
Bixaceae
Число
иссл.
видов
10 '
4 .
6 :
3
21
11
2
1
3
Анализированные* структуры
Семя
(з -|- эн + т)
Зародыш
Эндосперм
Семя
(з + т)
Семя
(з±эн + т)
Зародыш -\-
эндосперм
Семя
(з + эн + т)
Семя
За$н5дшн
Семи
(з + эн + т)
Зародыш +
эндосперм
Семя
(з + эн + т)
Эндосперм
Семя
(з + эн -)~т)
Семя
(з + эн + т)
Зародыш +
эндосперм
Зародыш
Эндосперм
Содержание запасных веществ
(% на сухую массу)
белки
14—19
*
9-11
9*
13—15
j 10-25'
12-15
жиры .
18-41
31
8-65
40-60*
58-62
20-50
36—77 *
30-40
17-55*
10-40
38
4-16
8-11*
олиго-
сахара
25-29
14-19
<1**
-
крахмал,
7
11-14
+
± ,
— к
4 **
—
+
—
±
+
Литературный источник
Шарапов, 1959; Barton, 1961; Earle, Jones, 1962;
Jones, Earle, 1966; Васильева, оржг. данные
McNair, 1930; Шарапов, 1959
Шарапов, 1959; Earle, Jones, 1962; Jones, Earle,
1966; Hegnaiier, 1973
McNair, 1930; Шарапов, 1959; Hegnauer, 1964
Peckolt, 1897; Шарапов, 1959; Hegnauer, 1966
McNair, 1930; Шарапов, 1959; Smith et al.f
•1959; Jones, Earle, 1966
Шарапов, 1959; Hegnauer^ 1969; Dathan, Singh,
1973
McNair, 1930; Шарапов, 1959
Earle, Jones, 1962; Hegnauer, 1964; Jones, Earle,
1966; Ср. эмбр., 2, 1983
Приложение (продолжение)
Порядок
Violates
Capparales
Tamaricales
Семейство
Cistaeeae
Caricaceae
\
1
\ Cucurbitacepe
|
1
I Capparaceae
i
[
i Morin^aceae
Brassicaceae
1
Hesedaceae
TamariQaceae
lit
3
1
48
11
3
115
3
1
Анализированные структуры
,Семя
(з + эн-J-t)
Зародыш
Эндосперм
Семя
(з + эн + т)
Зародыш +
эндосперм
Семя
(з + т)
Зароды mi
Семя
(з + эн+п + т)
Зародыш -\-
эндосперм ±
перисперм
Семя
(з+эн + т)
Зароды и±
эндосперм
Семя
(э + эн + т)
Семя
(з + эн + т)
Семя
• (з -И)~ -
Содержание запасных веществ
(% на сухую массу)
белки
15-23
25-30
10-45
17-73*
10-42
37—40 *
45-50
12-45 I
18—20
26-37
жиры
2-5
50*
11-48
30-69 *
1-45
30-45 *
31-38
44—49 *
2-50
26-37
5-17
олиго-
сахара
2—60***
1-12
- - - -
крахмал
+
—
65
+
0-2
1
Литературный источник
McNair, 1930; Jimes, Earl*, 1966
McNair, 1930; Hegnauer, 1964; Jones, Earle, 1966
Chowdhury et al., 1953; Клименко, Костик,
1955; Chowdhury, Bagchi, 1956; Sengupta,
Chakrabarty, 1957; Алексеева, 1958; Шарапов,
1959; Smith et al., 1959; Earle, Jones, 1962;
Jones, Earle, 1966; Бывших, 1967; Овчаров,
1976
Шарапов, 1959; Smith et'al., 1959; Hegnauer,
1964; Jones, Earle, 1966
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Hegnauer, 1969
Duperon, 1954; Шарапов, 1959; Smith et al.,
1959; Jones, Earle, 1966; Khan et al., 1973;
Харченко, 1973; Norton, Haris, 1975; Rakow,
McGregor, 1975; Bergfeld et al., 1980
McNair, 1930; Шарапов, 1959; Jones, Earle, 1966
Jones, Earle, 1966
Приложение (продолжение)
Порядок
Tamaricales
Ericales
Ebenales
i
Primulales
Mai vales
Семейство
Fouquieriaceae
Actinidiaceae
Ericaceae
Styracaceae
Symplocaceae
Ebenaceae
Sapotaceae
Myrsinaceae
Theophrasta ceae
Primulaceae
Tiliaceae
Число
иссл.
видов
1
3
9
2
1
5
17
1
1
1
6
Анализированные структуры
Семя « f
(з + эн + т)
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(3 + ЭН + Т)
Семя
(з + эн + т)
Семя
(э + эн + т)
Семя
(з±эн + т)
Зародыш +
эндосперм
Эндосперм
Семя
(з + эн + т)
Зародыш
Эндосперм
Семя
(з + эн + т)
Семя
(з + эн + т)-
Семя
(з + эн + т)
Эндосперм
Содержание запасных веществ
(% на сухую массу)
белки
29
16-16
2-32
17—19
22
7-10
5—15
9—17*
7
10-12
15
10-30
18-25
жиры
18
7—34
3-55
42-47
52
1—33
1-23
1 9-60*
1-5
10
17
10-36
15-20
олиго-
сахара
9-10
крахмал
—
—
—
+
+
±
ТТ———.—>—— ._ **. —
Литературный источник
Earle, Jones, 1962
Earle, Jones, 1962; Hegnauer, 1964
McNair, 1930; Миронова, 1958; Шарапов, 1959;
* Smith et al., 1959; Jones, Earle, 1966
McNair, 1930! Earle, Jones, 1962; Jones, Earle,
1966
Earle, Jones, 1962
McNair, 1930; Шарапов, 1959; Earle, Jones, 1962;
Jones, Earle, 1966
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Earle, Jones, 1962; Jones, Earle, 1966;
Hegnauer, 1973
McNair, 1930; Earle, Jones, 1962
Earle, Jones, 1962; Jones, Earle, 1966
McNair, 1930; Jones, Earle, 1966
Шарапов, 1959; Smith et al., 1959; Qudrat-i-
Khuda et al., 1963; Jones, Earle, 1966; Ra-
decke, 1967
Приложение (продолжение)
Порядок
ЩаЫиэ
-
Eaphorbiales
Thymelaenles
Семейство
Ste'rculiaceae
Dipterocarpaceae
ВотЪасасеае
Malvaceae
Euphorbiaceae
Pandaceae
Thymelaeaceae
* t 1
15
! 7
8
57
119
1
3
Анализированные структуры
Семя
(з+эн + т)
Зародыш -f-
эндосперм
Семя
, (з + эн + т)
Зародыш +
эндосперм
Семя
(з±эн-{-т)
Зародыш +
эндосперм
Семя
(з -|- эн-j- т)
Зародыш
Эндосперм
Семя
(з + эн + т)
Зародыш + !
эндосперм.
Эндосперм
Семя
(з + энЧ-т)
Семя
(з + эн + п + т)
Зародыш
Содержание
(% на (
белки
5-37
20-36 *
5-10
6*
15-40
17*
5-53
27-33 |
5-50
16—39*
18-20
30
24*
жиры
*7-55
30-52 *
22-27
15-76 *
31-44
44*
7—48
40-44'
3—75
36-70 *
46-48
37
55-65 *
запасных веществ
зухую массу)
олиго-
сахара
31***
1-2
4-6
1—2
крахмал
20—24
+
+
+
15 ***
6
±
±
+
—
Литературный источник
McNair, 1930; Шарапов, 1959; Smith et al., 1959;
Jones, Earle, 1966; Hegnauer, 1973
McNair, 1930; Raymond et al., 1954; Шарапов,
1959; Smith et al., 1959; Hegnauer, 1966
McNair, 1930; Шарапов, 1959; Smith et al.,
1959; Earle, Jones, 1962; Hegnauer, 1964
Gambhir, Joshi, 1952; Шарапов, 1959; Smith
et al., 1959; Frampton et al., 1960; Кривкина,
1961; Тер-Аванесян, 1962; Шадманов, 1964а,
6; Jones, Earle, 1966; Ермаков, 1980
Duperon, 1954; Raymond et al., 1954; Шарапов,
. 1959; Smith et al., 1959; Earle, Jones, 1962;
Canvin, 1963, 1965; Cocucci, 1964; Kleiman
et al., 1965; Jones, Earle, 1966; Соболев и др.,
1972; Хвостова, 1981
Hegnauer, 1969
McNair, 1930; Шарапов, 1959; Earle, Jones,
1962; Jones, Earle, 1966; Hegnauer, 1973
Примечание, з — зародыш, эн— эндосперм, п — перисперм, т — теста (семенная кожура); ± — наличие или отсутствие вещества или структуры; * — результаты
"анализов, отнлсящиеся к «ядру» семени, согласно терминологии авторов; ** —расчет данных на сырукх массу; *** — суммарное содержание олигосахаров и крахмала.
ИССЛЕДОВАННЫЕ ВИДЫ
(К ПРИЛОЖЕНИЮ «СОДЕРЖАНИЕ ЗАПАСНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ
В ЗРЕЛОМ СЕМЕНИ ПОКРЫТОСЕМЕННЫХ РАСТЕНИЙ»)
Magnoliaceae: Magnolia grandiflora, M. hypoleuca, М. macrophylla. Annonaceae:
Annona muricata, A. reticulata, A. squamosa, Asimina triloba. Myristicaceae: Myristica
angolensis, M. argentata, M. bicuhyba, M. canariformis, M. malabarica, M.'ocuba, M.
officinalis, M. otoba, M. platy&perma,- M. surinamensis, Pycnanthus kombo, Scyphocephalium ochocoa,
Staudtia kamerunensis, Virola guatemalensis (= Myristica guatemalensis), V. micheli, V. vene-
zuelensis. Illiciaceae: Illicium anisatum, I. religiosum, I.* verum. Schisandraceae: Schi-
sahdra chinensis. Calycanthaceae: Calycanthus floridus, Chimonanthus praecox. Lauraceae:
Actinadaphne angustifolia, A. hookeri, Acrodiclidium machuba, A. sprucei, Cinnamomum cam-
phora, C. cecidodaphne, C. glanduliferum, C. pedunculatum, Cryptocarya latifolia, Laurus nobilis,
Lepidadenia wightiana, Lindera benzoin, L. praecox, L. sericea, L. triloba, Litsea glajicesdens,
L. zeylanica, Machilus thunbergii, Persea indica, Sassafras albidum, Umbellularia californica.
Hemandiaceae:t Hernandia ovigera, H. peltata, H. sonora. Aristolochiaceae: Aristo-
lochia bracteata (==A. тацгогит). Nymphaeaceae: Nuphar lutea, Nymphaea alba, N'. lotus.
Oeratophyllaceae: Ceratophyllum pentacanthum. Nelumbonaceae: Nelumbo nucifera.
Lardizabalaceae: Akebia cobata, A. quinata, A. trifoliata. Menispermaceae: Anamirta
cocculus, Coc'culus carolinus, Menispermum canadense. Berberidaceae: Berberis vulgaris,
Nandina domesiica. Manunculaceae: Aconitum anthora, A. barbatum, Д. excelsum, A. kus-
nezofjii, A . moldavicum, A . soongoricum, Actaea acuminata, A . spicata, Adonis aestivalis, Anemone
bianniense, A. faiciculatum, Aquilegia glandulosa, A. sibirica, A. vulgaris, A tragene sibirica,
Caltha polypetala, Ceratocephala orthoceras, Cimicifuga racemosa, Clematis glabra, C. florida,
C. heracleifolia, C. integrifolia, C. recta, C. sericea, C. serratifolia, C. songarica, Delphinium aja-
cis, D. biternatum, D. brunnonianum, D. consolida, E. elatum, D. flexuosum,D. iliense, D. kor-
chimkyanum, D. laxiflorum, D. laximculum, D. orUntalis,D. pallasii, D. persica, D. scopulorum,
Nigella arvsmi>. N. damascena, N. sat\va,'Pulsatilla campanella,Ranunculus^.aaei\ R. urverisis,
R\ auiicomus, R. borealLs, R. chius, R. Constantinopolitanus, R. lanuginosus, R. muricatus,
R. polyanthenos, R. repens, R. sceleratus, R. stevenii, R. trachy carpus, Thalictrum angustifolium,
Th. aqu Isgifolium, Та. dipterocarpum, Th. foetidum, Th.- glaucum, Th. minus, Th. simplex,
Trpllius altaicus, T. a*iaticus, T. europaeus, T. ledebourii. Papaveraceae: Adlumia fungosa,
Argemone albifloia, A. hispida, A. hunnemanii, A. intermedia, A. mexicana, Bocconia arborea,
Chelidonium majus, Eachscholzia californica, Glauciurri luteum, Papaver macrostomum, P. orientate,
P. rhoea , P. soirimjerum, Papaver sp. Eupteleaceae: Euptelea polyandra. Hamamelidaceae:
Disanthuj_ cerciaijolia, Hamamelis virginiana. Liquidambar Uyraciflua.- -Platanaceae:
Platanus occidentalis. Daphniphyllaceae: Daphniphyllum humile, D. macropodum. JBuxa-
ceae: Buxus microphylla, B. tempervirens. Simm,ondsiaceae: Simmondsia californica,
S. chinensi . E ucommiaceae: Eucommia ulmoides._ Ulmaceaej Chaetachme microcarpa,
CeltU mis'sisippien is, C.~ occidentalis, Holoptelea integrifolia, Trema guineensis, Ulmus americana,
U. foliacea, 0. mberosd, Ze.kjva serrata. Moraceae: Antiaria africana, A. welwitschii, Arto-
carpus hirbuta, A. itegiifolia, Brosimum alicastrum, Broussonetia papyrifera, Cudrania conchin-
chinemis, С tricuspiaata, Ficus caiica, F. cunia, F. erecta, F. macrophylla, Madura aurantica,
M. pomifera. Morus alba, M. mongolica, M. nigra, M. rubra. Cannabaceae: Cannabis rude-
ralis, C. satita, Humulus japonicus, U. lupulus, H. scariciens. Urticaceae: Boehmeria. cylind-
rica, Urtica cannabina, U. pilulifera, U. urens. Casuarinaceae: Casuariha cunninghamiana,
C. decusSata, C. equUeUfolia, C. pusilla, C. stricta, C. torulosa. Fagaceae: Castanea sativa,
Castanop^is, Fagus orientalis, F. t>ylvatica, Nothofagus, Queicus catesbaei, Q. versicolor. Betula-
ceae: Alnus coraijolia, A. glutino*a, A. incana, Betula platyphylla, B-.-pubescens, Carpinus be-
tulus, Con/lus avdlana. C. colurna, C. heterophylla, C. rostrata, Corylus sp. Myricacede:
Myrica carolinensis, M. cerifeia, M. mexicana, M. pensylvanica. Juglandaceae: Gary a ama.ra,
C. illinoensis, C. olivaeformis, C. ovata, C. pecan, Juglam cinerea, J. mandshurica, J. nigra,
J. regia, J. sieboldiana, Juglans sp.} Pteiocarya stenoptera. Phytolaccaceae: Anisomhria
coriaceae, Phytolacca americana. Nf^e'tif^inaceae: Mirabilis dichotoma; M. *jalap a,
M. nyctaginea. Afaoaccae: Mesembryatithemum cry^tallinum, Tetragonia arbuscula. \Cacta-
ceae: Ferocactus sp., Opuntia ficus-inuica, Pachycereus pectenaboriginum. Portulacaceae:
Portulaca oleraceu. Mollnginaceae: Mollugo verticillata. Caryophyllaeeae: Agrostemma
294
githago, Cerastium perfoliatum^ Ci "tompntosurrv, C. viscosum, Dianthus barbatus, D, chinensis,
Gypsophila .elegans, G. 'porrigens, Lychnis chalcedonica, L. vistaria, Saponaritt ocymoides, S.
officinalis, S'. viscosa, Silene aniirrhina,<S. densiflora, S. noctiflora, &. supina, S. vulgaris.. Avttw-
vanthaceae: Achyranthes bidentata, Atnida cannabina, Amaranthus arthropurpureus, A . jcauda-
tus, A. edulis, A. gangeticus, A.hybridus, A. hypochondriacus, A. paniculatus, A. polygamus,
A. retroflexus, A. ^spinosus, A. tricolor, A. viridis, Celosia argentea, C. cristata, Froelichia flo-
ridana. Chenopodiaceae: Agriophyllum arenarium, A. latifolium, A. minus, Atriplex canes-
cens, A. lentiformis, Atriplex sip., Beta vulgaris,-Chenapodium album, Ch. ambrosioides, Ch. lep-
tophyllum, Ch. pallidicaule, Ch. quinoa, Chenopvdium^sp., Corispermum marsckallii, Kochia
scoparia, Salsola pestifer, S. ruthenica, Salsola sp., Spinacia oieracea, Suaeda altissima, S, ma-
ritima. Polygonaceae: Antigonon leptopus, Eriogonum alatum, Fagopyrum esculentum, F. tata-
ricum, Polygonum cespitosum var. longisetum, P. convolvulus, P. kitaibelianum, P. lapathifolium,
P. orientate, P. pensylvanicum, P. punctatum, P. ramosissimum, Rumex acetosella, R. altissi-
mus, R. crispus, R. obtusifolius, R. pulcher, R. salicifolius, R. tcutatus, Rumexsp.,R. venosu-s,
•Ruprechtia coriacea. Plumbaginaceae: Armeria pseudarmeria, Limonium sinuatum, L. tatari-
cum. Paeoniaceae: Paeonia albiflora, P. anomala, P. brownii, P. moutan. P. paradoxa,
P. peregrina, P. suffruticosa, P.tenuifolia, P. triternata, P. wittmanniana. Ochnaceae: Lophira
alata, L. procera, Ochna pulchra, Ouratea parviflora. Theaceae: Camellia japonic a, C.oleiferar
C. sasanguar Pyrenaria acuminata, Thea sinensis, Wicksti oemia viriaiflora. Caryocaraceae:
Caryocar nuciferum, C. tomentosum, C. villosum. Clusiaceae: Allanblackia floiibunda,
A. kisonghi, A. .klainei, A. oleifera, A. sacleuxii, A. stuhlmanii, Culophyllum inophyllum,
С wightianum, Garcinia cambogia, G. canranana, G. indica, G. morella, G. tonkinensis,
Hypericum cistifolium, H. tetrapterum, Mesua ferrea, Pentadesma bulyracea, P.. M'erstingii, hlatonia
insignis, Symphohia fasciculata, S. globulifeia. Flacourtiaceae: Asteriostigma тасгосагрл,
Gynocardia odorata, Hydnocarpus anthelmintica, H'„ suhfalcata, Idesia polycarpa, Oncoha echi-
nata, O. klanii, O. spinosa, O. welwitschii, Pangium edule, Taractogenos kurzii. Passiflorqtceaei
Passiflora edulis, Tetrapathaea tetrandra. Violaceae: Viola arvensis. Bixaceae: Amoreuxia
palmatifida, Bixa orellana, Cochlospermum vitifolium. Cistaceae: Helianthemum nummu-
larium var. mutabile, Lechea tenuifolia, L. villoma. Caricaceae: Carica' papaya. Cucur-
bitaceae: Acanthosicyos horrida, Actinostemma lobatum, Apodanthera undulata, Benincasa
cerifera, Bryonia alba, B. dioica, Cayaponia cabocla, Citrullus colocynthis, C. lanatus,
C. naudianus, C.^vulgaris, Cucumis melo, C. sativus, Cucurbita digitata, C. ficifolia, С foetidis-
sima, C. lundelliana, C. maxima, C. mixta, C. moschata, C. okeechobeensis, C. palmata, C. pepo,
Echinocystis fabacea, E. oregana, Fevillea co'rdifolia, Hpdgsonia carpinocarpa, H. kadam, Lage-
naria siceraria, L. vulgaris, Luffaiaegyptica, L. amara, L. cylindrica, L. echinata, L. graveolens,
Marah gilensis, M. macrocarpa, Maximowiczia sonorae, Momordica balsamind, M. charantia,,
M. cochinchinensis, M. dioica, Sicydium monospermum, Sicyos angulata, Telfairia occidentalism
T. pedata, Trichosanthes anguina, T. cucumeioices. Capparaceae: Boscia octandra, Capparis
spinosa, C. tomentosa, Courbonia virgata, Cleome serrulata, C. spinosa, С. tenuis, Isomeris arbe-
rea, Polanisia trachysperma, Polanisia sp., P. viscosa. Moving aceae: Moringa aptera, M~
oleifera, M. pterygosperma. Brassicaceae: Alliaria officinalis, Alyssum campestre, A. desertorum,
A. dasycarpum, A. minimum, A. saxatile, A. saxatile var. luteum, A. tortuosum, Arabis alpirva,
A. bellidifolia, A. glabra, A. laevigata, Arabis sp., Bailaiea arcuta, В. ргаесох, В. vulgaris,
Berteroa incana, Boreava orientalis, Brassica arvensis, B. campesiris, B. carimata, B. elongata,
B. funcea, B. napus, B. nigra, B. oleifera, B. oieracea, B. oieracea var. capitata, B. ?apa, Cakile
edentula, С luxina, Calepina irregulaiis, Camelina albiflora (=С. lumelica), C. glabiata, C. li-
nicola, C. microcarpa, C. sativa, Capsella buna-pastoiis. Cochlearia aimoracia, С officinalis,
Conringia orientalis, C. planisiliqua, Crambe abyssinica, C. armena, C. coidifolia, C. juncea,
С orientalis, C. pontica, C. tataria, Cheiranthus cheiii, Descuiainia pinnata, D. pinnata var.
ochroleuca, D. sophia, Dithyrea wislizenii, Eruca sativa, Erysimum cheiranthoides, E. cuspiaatum,
E. perofskianum, E. sessiliflora (=Syrenia sessiliflora), Farsetia macropteia, Fibigia clypeata,
Hesperis matronalis, Iberis amara, I. umbellata, Isatis aucheri, I. subraaiata, I. tinctoria, Lepi-
dium angustifolium, L. draba, L. lasiocarpum, L. montanum var. angustifolium, L. perfoliatum^
L. ruderale, L. sativum, L. virginicum, Lesquerella angustifolia, L. argyraea, L. densipila, L. en-
gelmannii, L. fendleri, L. globosa, L. gordonii, L. gracilis, L. grandiflora, L. lasiocarpa, L. Us-
curii, L. lindheimeri, L. ovalifolia, L. pinetorum, Lobularia maritima, Lunaria annua, Malcol-
mia maritima, Matthiola bicornis, Megarpaea megalocarpa, Myagrum sativum, Nastuitium
officinale, Nerisyrenia camporum, Neslia paniculata, Notoceras canariense, Raphanus raphanistrum,
R. sativum, Rapistrum rugosum, Selenia grandis, Sibara virginica, Sinapis alba, S. arvensis,
S\ dissecta, Sisymbrium confertum, S. irio, S. loeselii, S. officinale, Sisymbrium sp.y Thelypodium
texanum, Thlaspi arvense, Th. perfoliatum. Resedaceae: Reseda lutea, R. luteala,*R. odorata,
Tamaricaceae: Tamarix gallica. Fouquieriaceae: Fouquieria splenaens. - Actinidia-
ceae: Actinidia arguta, A. chinensis, A. polygama. Ericaceae: Arbutus menziesii,
A. unedo, Arctostaphylos glauca, A. pungens, A. uva-ursi, Vaccinium myrtillus, V. oxycoccus,
V. uliginosum, V. vitis idaea. Styracaceae: Styrax americanus, S. obassia. Symplocaceae:
Sуmplocos paniculata. Ebenaceae: Diospyros anisandra, D. kaki, D. lotus, D. texana, D. vir-
giniana. Sapotaceae: Achras sapota, Argania sideroxylon, Bassia longifplia, B. mottleyana,
Butyrospermum parkii, Calocarpum mammosum, Madhuca butyracea, Mimusops ajave, M. elengi,
M. hookeri, Omphalocarpum boyankombo, Palaquium formosanum, P. oblongijolium, P. oleosum,
P. pisang, Sideroxylon angustifolium, S. tementosum. Myrsinaceae: Ardisia crenulata.
Theophrastaceae: Jacquinia pungens. Primulaccae: Anagallis arvensis. Tiliaceae:
Corchorus capsularis, С olitorius, Tilia americana, T. cordata, T. parvifolia, Triumfetta brevipes.
Sterculiaceae: Brachychiton acerifolium, B. populneum, Firmiana simplex, Heritiera lito-
295
ralis, Melochia hirsute/,, Pterospermum acerifolium, P. appendiculatum, Sterculia apetala, S. ap-
pendiculata, S. barteri, S. foetida, S, parviflora, S. tomentosa, Theobroma bicolor, Th. cacao.
Dipterocavpaceae: Dryobalanops oblongifolia, Hopea aspera, Pentacme siamensis, Shorea
aptera, S. robusta, S. stenoptera, Vateria indica. Bombacaceae: Adansonia baillonii, A. di-
gitata, A. grandidieri, A. madagascariensis, Bombax pentandrum, Ceiba acuminata, C. pentandra,
Ceiba sp. Malvaceae: Abutilon americanum, A. avicennae, A. incanum, A. indicum, A. theo-
phrasti, Alcea, Althaea hirsuta, A. rosea, A. rugosa, Anoda cristata, Gossypvum africanum, G. ar-
boreum, G. barbadense (=G. jumelianum), G. darvinii, G. davidsonii, G. herbaceum, G. hirsutum,
G. nanking, G. obtusifolium, G. peruvianum, Gossypium sp., G. thurberii, G. trilobium, G. virnar,
Hibiscus abelmoschus, H. africans, H. cannabinus, H. diver si folius, H. esculentus, H. grandiflorus,
H. lasiocarpus, H. militaris, H. moscheutos, H. palustris, H. platanifolius, H. syriacus, H. trionum,
Kosteletzkya virginica, Lavatera assurgentiflora, Lavatera sp., L. thuringiaca, L. trimestris, Ma-
lachra capitata, Malope trifida, Malva crispa, M. parviflora, M. rotundifolia, M. sylvestris,
Malva sp., Modiola caroliniana, Pavonia, Sida corymbosa, S. linifolia, S. spinosa, Sphaeralcea
coccinea, Thespesia populnea, Urena lobata. Euphorbiaceae: Aleurites cordata, A. fordii,'
A. mollucana, A. montana, A. triloba, A. trisperma, Breynia rhamonides, Bridelia stipularis,
Caperonia palustris, Caryodendron orinocense, Chrozophora hierosolymitana, Ch. plicata, Ch. tin-
ctoria, Ch. verbascifolia, Cluytia affinis, Cnidoscolus angustidens, С elasticus, C. marcgravii,
Cnidoscolus sp., С tepiquensis, Croton capitatus, С corymbulosus, C. elliotianus, C. fragilis,
С gracilis, C. megalobotrys^ C. sebifera, C. sparsiflorus, С texensia, C. tiglinum, Dimocarpus
longan, Elateriospermum tapos, Eremocarpus setigerus, Euphorbia amygdaloides, E. anacampseros,
E. bicolor, E. biglandulosa, E. calcicola, E. clavigera, E. cornigera, E. cuphosperma, E. cybirensis,
E. cyparissias, E. dracunculoides, E. elastica, E4 eriophora, E. erythrina, E. esula, E. exigua,
E. falcata, E. geniculata, E. gregaria, E. helioscopia, E. heterophylla, E. kotschyana, E. lagascae,
E. lathyris, E. marginata, E. mauritanica, E. medicaginea, E. myrsinites, E. palustris, E. para-
lias, E+ parryi, E. platyphyllos, E. pungens, E. salicifolia, E. segetalis, E. serrata, Euphorbia sp.,
E. terraevna, E. thamnoides, E. tinctoria, E. verrucosa, E. virgata, Garcia nutans, Hevea brasili-
ensis, Jatropha cordata, J. curcas, J. glandulifera, J. hestata, J. macrorhiza, J. mahafalensis,
/. multifida, J. oligandra, J. spatulata, J. stimulosa, Joannesia heveoides, J. princeps, Mallotus
japonicus, M. philippinensis, Manihot carthaginensis, M. dichotoma, M. glaziovii, M. isolobd,
M. pianhyensis, M. rubricaulis, M. tweedieana, M. utilissima, Manniophyton fulvum, Mercurialis
annua, M. perennis, Omphalea megacarpa, Pedilanthus macrocarpus, Phyllanthus abnormis, Phyl-
lanthus sp., Plukenetia conophora, Reverchonia arenaria, Ricinoden$ron africanum, R. rautanenii,
Ricihus communis, R. sanguineus, R. zanzibarinus, Sapium haematospermum, S. montevidense,
S. sebiferum, Sebastiana ligustrina, Tetracarpidium conophorum,- Tragia incana. Pandaceae:
Panda oleosa. Thymelaeaceae: Daphne m?zereum, D. pontica, Phaleria amhigua.
ЛИТЕРАТУРА
А гаев Ю. М., Алиев А. А. Ультраструктура
эндосперма в недозрелом семени
хлопчатника. — Докл. ВАСХНИЛ, 1971, № 9,
с. 22—23.
А гаев Ю. М., Алиев А. А.
Электронно-микроскопическое исследование развития
зародыша и эндосперма хлопчатника. —
В кн.: Электронная микроскопия в бот.
исследованиях. Петрозаводск, 1974а,
с. 23—25.
А гаев Ю. М., Алиев А. А. Некоторые
данные электронно-микроскопического
исследования ультраструктуры зародыша
хлопчатника на начальных и промежуточных
этапах развития. —, Тр. Ин-та генетики
и селекции АН АзССР. Баку,-19746, т. 7,
с. 159—170. . .
Александрова А. В., Беляева М. А. К
вопросу о развитии цветка и пыльцы у
клюквы четырехлепестной. — В кн.: Сб.
науч. тр. Ярослав, пед. ин-та, 1976,
вып. 159, с. 35—40.
Александрова А. В., Беляева М* А, Анатомо-
эмбриологические особенности клюквы
болотной. — Анатомия, морфол. и экол.
культ, и дикораст. раст., Тула, 1981,
с. 50—58.
Александровский Е. С. К изучению
эмбриологии черного саксаула (Haloxylon aphyl-
lum (Minkw.) Iljin.), — Узб. биол. журн.,
1974, № 4, с. 32—36.
Алексеева Е. С, Паушева 3. Я. Генетика,
селекция и семеноводство гречихи. Киев,
1979. 200 с.
Алексеева М. В. Белки семян видов рода
тыкв (Cucurbita). — Тр. по химии прир.
сое д. Кишинев, ун-та, 1958, № 1, с. 103—
108.
Алиева А. Г, Наблюдения над ростом
пыльцевых трубок у арбузов. — В кн.: Сб.
науч. работ по бахчевым культурам.
Ташкент, .1952, с. 151—161.
Алимова Г, К. Процесс двойного
оплодотворения и эмбриогенез у Arabidopsis tha-
liana (L.). — В кн.: Половой, процесс
и эмбриогенез растений. М., 1973, с. 7.
(Матер. Всесоюз. симп.).
Антонова В. И. Большой жизненный цикл
вороники черной (Empetrum nigrum
L. s, 1.) в борах северной тайги. — Науч.
докл. высш. школы. Биол. н., 1971,
вып. 10, с. 57—64.
(Арнолъди В.) Arnoldi V. Zur Embryologie
einiger Euphorbiaceen. — Bull. Acad. Sci.
deSt. Petersbourg, 1911, t.5,ser.6, p. 966.
(АрнЬлъди B.J Arnoldi V. Zur Embryologie
einiger Euphorbiaceen. — Trav. Mus. Bot.
Acad. St. Petersbourg, 1912, t. 9, s. 136—
154.
Ашурметов А. А., Саидов Д. К. Микро-
спорогенез и развитие мужского гамето-
фита у некоторых сортов дынь
Узбекистана. — ДАН УзССР, 1972, № 4, с. 54—56.
Ашурметов А. А. Микроспорогенез у
Bryonia melanocarpa Nab. — В кн.: Половой
процесс и эмбриогенез растений. М., 1973,
с. 11—12. (Матер. Всесоюз* симп.).
Ашурметов А. А. Микроспорангий,
микроспорогенез и развитие мужского гамето-
фита у Melo agrestis Pang. — Узб. биол.
журн., 1974а, № 2, с. 68—71.
Ашурметов А. А. Развитие пыльника,
микроспорогенез и формирование пыльцы
у Bryonia melanocarpa Nab. — В кн.:
Морфобиологические особенности
дикорастущих растений Узбекистана. Ташкент,
19746, с. 18—24.
Ашурметов А. А., Саидов Д. К. Строение
семяпочки и развитие женского гамето-
фита у дикой сорнополевой дыни. —
ДАН УзССР, 1975, № 5, с. 54—56.
Вабасюк М. С, Здруйковская-Рихтер А. И.
Жизнеспособность зародышевых мешков
и возможности оплодотворения
ремонтантной гвоздики группы Wiliam Sim. при.
опылении пыльцой других групп. — В кн.:
Матер. Всесоюз. совещ. по опылению
и оплодотворению у растений. Киев, 1982,
с. 280—282.
Варна Н. Н. Заложение и дифференциация
генеративных почек у осины (Populus
tremula L.). — В кн.: Матер. 5-й науч.
конф. аспирантов и молодых ученых
УкрНИИЛХА. Харьков, 1965, с. 210—
214. (Тез. докл.).
Варна Н. Н. Цитоэмбриологические
исследования у осины (Populus tremula L.)
в естественных условиях. — В кн.: Матер.
науч. конф. Харьков, с.-х. ин-та. Харьков,
1966, вып. 5, с. 58—59.
Варна Н. Н. Эмбриогенез некоторых видов
рода Populus L. — Совещ. по лесной
генетике, селекции и семеноводству.
Петрозаводск, 1967, с. 15—17. (Тез. докл.).
Варна Н. Н. Морфогенез генеративных
органов и эмбриональное развитие осины'. —
В кн.: Лесоводство и агролесомелиорация.
Киев, 1968, вып. 15, с. 126—135.
Варна М. М. Ембр1олопчне досл1дження
тoпoлi трамидально! (Populus pyrami-
dalis Roz.). — Укр. ботатчний журн.,
1969а, т. 24, № 1, с. 93—100.
297
Барна Н. Н. Розвиток тичинок та мшро-
спорогенез у деяких представншив роду
тополя. — В кн.: Матер. IV з'Узду Укр.
бот. товариства. Кигв, 19696, с. 58—59.
Барна Я. Н. Цитоэмбриологическое
исследование некоторых видов рода Populus L.
в связи с гибридизацией. Автореф. канд.
дис. Киев, 1969в. 24 с.
Барна Н. Н. Микроспорогенез топол1 nipa-
мидально! (Populus pyramydalis Roz.). —
В кн.: Досягнення бот. науки на У крапп
1967—1968 р. р. Ки1в, 1970, с. 27—28.
Барна Н. Н. Макроспорогенез i розвиток
жшочого гаметоф1ту топол1 6moi. — В кн.:
Матер. V зЧзду Укр. бот. товариства.
Ужгород, 1972. 196 с. ' . ' .
Барна Н. Н. Сравнительная эмбриология
видов Salicaceae в связи с их филогенией
и эволюцией. — В кн.: Тез. докл. XII
МБК. Л.-, 1975; т. 1, с. 243.
Барна Я. Я. Розвиток тичинок та мшроспо-
рогенез у м1жвидових ri6piniB роду
Populus L. — В кн.: Матер. VI зЧзду Укр.
бот. товариства. Кшв, 1977,< с. 139—140.
Батыгина Т. Б., Бутенко Р. Г. Морфоге-
нетические потенции зародышей
покрытосеменных растений (на примере рода Раео-
nia сем. Paeoniaceae). — Бот. журн., 1981,
т. 66, № 11, с. 1531—1548.
Батыгина Т. Б., Васильева В. Е. Поведение
зародышей некоторых покрытосеменных
в культуре in vitro. — 3-я Всесоюз. конф.
культуры клеток растений. Ереван, 1979,
с. 129—130. (Тез. докл.).
Батыгина Т. Б., Васильева В. Е.) Batygina
Т. В., Vasilyeva V. E. Experimental study
of embryo differentiation in Angiosperms. —
• Acta Soc. bot. pol., 1981, v. 50, N 1—2,
p. 257—264.
Батыгина Т. Б., Васильева В. Е:, Маметъ-
ева Tt Б. Проблемы морфогенеза in vivo
и in vitro. Эмбриоидогенез покрытосемен-
' ных растений. — Бот. журн., 1978, т. 63,
№ 1, с. 87—111.
Батыгина Т. Б., Терехин Е. С, Алимова
Г. К., Яковлев М. С. Генезис мужских
спорангиев Graminae и Ericaceae. — Бот.
журн., 19684 т. 48, № 8, с. 1108-—1120.
Беляева Л. Е. Биология цветения, опыления,
оплодотворения и накопления эргастиче-
ских веществ у крамбе абиссинской. —
В кн.: Матер. II науч. конф. Запорож.
фарм. ин-та. Запорожье, 1962, с. 19—21.
Беляева Л. Е. Розвиток чолов1чого та ж1-
ночого гаметофтв, запилення зашпднення
л у крамбе абиннського. — Укр. бот. журн.,
1963а, т. 20, № 6, с. 24-31.
Беляева Л. Е. Изучение процесса
оплодотворения и формирования зародыша и
эндосперма у крамбе абиссинского,
выращиваемого в различных условиях. — В кн.:
Матер. II науч. конф. Запорож. фарм.
ин-та. Запорожье, 19636, с. 40—41.
Беляева Л. Е. Эмбриология крамбе
абиссинской, выращиваемой в условиях
Запорожской области. — В кн.: Матер. IV совещу
эмбриологов. М.; Л., 1963в, с. 45.
Беляева Л: Е. Развитие зародыша,
эндосперма, кожуры семени и накопления эрга-
стических веществ у катрана
абиссинского. — Укр. бот. журн., 1964, т. 21,
№ 1, с. 58—66.
Беляева Л. Е. Микроспорангий, микроспора,
мужской гаметофит желтушника левкой-
ного. — В кн.: Матер, итоговой науч.
конф. Запорож. фарм. ин-та. Киев, 1967а,
с. 66—67.
Беляева Л. £. Биология цветения и цито-
эмбриология катрана абиссинского. —
Автореф. канд. дис. Одесса, 19676. 19 с.
Беляева Л. Е. Развитие мужского и женского
гаметофитов желтушника левкойного. —
Укр. бот. журн., 1968, т. 25, № 5, с. 54—
59.
Беляева Л. Е., Смыченко А. А. Развитие
мужского и женского гаметофитов
желтушника левкойного и желтушника
серого. — В кн.: Матер. Всесоюз. симп.
по эмбриологии растений. Киев, 1968,
с. '26—28.
Беляева Л. Е., Смыченко А. А. Развитие
зародыша и эндосперма желтушника се-
рото. — В. кн.: Матер, итоговой науч.
конф. Запорож. мед. ин-та. Киев, 1970,
с. 38—39.
Беляева Л. Е., Смыченко А. А. Локализация
гликозидов в тканях генеративных
органов сирени сизой и желтушника серого. —
В кн.: Половой процесс и эмбриогенез
растений. М., 1973, с. 16—17. (Матер.
Всесоюз. симп.).
Беляева Л. Е., Смыченко А. А.,.Чайка Е. А.
Эмбриология сирени сизой. — В кн.:
Матер. V Всесоюз. совещ. по эмбриологии
растений. Кишинев, 1971, с. 17—18.
Беляева Л. Е.*, Смыченко А. А., Чайка Е. А.,
Мишина А. С, Фурса Н. С.
Тератологические изменения цветков некоторых
видов семейства Brassicaceae. — В кн.: Тез.
докл. VII Всесоюз. симп. по эмбриологии
растений. Киев, 1978, ч. 1, с. 6—7.
Беляева Л. Е., Фурса Н. С. Розвиток пиляка,
пилкових зерен, i Зародкових MinntiB
Syrenia сапа (Pill, et Mitt.) Neilr. — Укр.
боташчний журн., 1978а, т. 35, № 3,
с. 241—245.
Беляева Л. Е., Фурса Н. С. К вопросу
эволюционного развития семяпочки в
семействе Brassicaceae. — В кн.: Тез. докл.
VII Всесоюз. симп. по эмбриологии
растений. Киев 19786, ч. 1, с. 5—6.
Беляева Л. Е., Фурса Н. С.
Эмбриологическое и фитохимическое изучение
лекарственных растений различных триб
семейства Brassicaceae. — В кн.: Тез. докл.
III съезда фармацевтов УССР. Харьков,
1979а, с. 245—246.
Беляева Л. Е., Фурса Н. С. Формування чо-
лов1чих та жшочих структур кв1тки Вег-
teroa incana DC. — Укр. боташчний журн.,
19796, т. 34, № 6, с. 574—577.
Беляева Л. Е., Фу-рса Н. С. Эмбриология
Alliaria officinalis (Brassicaceae). I.
Формирование ' мужских и женских структур
цветка и изучение состава их флавонои-
дов. — Бот. журн., 1982, т. 67, № 7,
с. 959—968.
Беляева Л. Е., Фурса Н. С, Смыченко А. А.
Бюлопя цвтння та плодоутворення Isa-
tis tinctoria L. — Укр. боташчний журн.,
1977а, т. 34, № 4, с. 351—356.
Беляева Л. Е., Фурса Н. С, Смыченко А. А.
Эмбриология Syrenia сапа (Pill, et Mitt.)
Neilr. Brassicaceae). 1. Развитие зароды-,
ша'и эндосперма. — Бот. журн., 19776,
т. 62, № 10, с. 1453—1461.
Беляева Л. Е., Фурса Л. С, Смыченко А. А.
Ембршлопчне досл1дження Lepidium рег-
298
io Latum L, — Укр. богашчний журн.,
1971'в, т. 34, № 3, с. 257-262.
Беляева Л. Е., Чайка Е. А. Развитие
зародыша и эндосперма желтушника левкои-
ного. — В кн.: Матер. Всесоюз. симп. по
эмбриологии растений. Киев, 1968, с. 28—
29.
Беляева Л. Е., Чайка Е. А., Фурса Н. С.
Розвиток пиляка, насшного зачатка i га-
метогенез Diplotaxis tenuifolia DC. —
Укр. боташчний журн., 1978а, т. 35, № 2,
с. 175—179.
Беляева Л. Е., Чайка Е. А., Фурса Н. С.
Зашпднення i розвиток насшини у
Diplotaxis tenuifolia DC. — Укр. боташчний
журн., .19786, т. 35, № 5, с. 484—488.
Беляева Н. С. Цитологическое изучение
процесса созревания сформированного
зародышевого мешка хлопчатника. — Изв.
АН ТССР. Сер. биол. н., 1963а, № 3,
с. 27—34.
Беляева Н. С. К вопросу оплодотворения
у хлопчатника. — Изв. АН ТССР. Сер.
биол. н., 19636, № 5, с. 39—45. .
Беляева Н. С. О некоторых изменениях в
зародышевом мешке и тканях семяпочки
хлопчатника после оплодотворения. —
Изв. АН ТССР. Сер. биол. н., 1965, № 4,
с. 3-10.
Беляева Н. С. Развитие зародышевого мешка
и оплодотворение у покрытосеменных (на
примере представителей флоры
Туркмении). Дисс. Л., 1977. 288 с.
Беляева Н. С. Некоторые закономерности
двойного оплодотворения и проблема
трудных скрещиваний. — В кн.: Матер.
Всесоюз. совещ. по опылению и
оплодотворению у растений. Киев, 1982, с. 203—206.
Благовещенский А. В. О белковых
комплексах семян некоторых древнейших групп
цветковых растений. — Тр. Моск. о-ва
испыт. природы. Отд-ние биол., 1965,
т. 13, с. 7—13.
Бочанцева 3. П. Материалы по биологии
цветения и эмбриологии черного саксаула
Haloxylon ammodendron Bge. — Бот.
журн., 1944, т. 29, № 1, с. 36—48.
Бочанцева 3. П. Материалы по биологии
и эмбриологии черкеза Salsola richteri
Kar. — Тр. Бот. сада АН УзССР, 1949,
вып. 1, с. 132—148.
Бочанцева 3. П. Эмбриологический очерк
солянки Палецкого. — Тр. Бот. сада
АН УзССР, 1951а, вып. 2, с. 108—117.
Бочанцева 3. П. Биология цветения и
эмбриология Salsola subaphylla С. А. М. —
Тр. Бот. сада АН УзССР, 19516, вып. 2,
с. 99—106.
Бочанцева 3. П., Романович Т. А. Биология
цветения и развития генеративной сферы
гребенщика. — Тр. бот. сада АН УзССР,
1956, вып. 5, с. 109—118.
Бывших Н. А. Изменения в азотистом и
белковом обмене созревающих семян тыквы. —
Науч. докл. высш. школы. Биол. н.,
1967, № 1, с. 401—105.
Василевская В. К. О связи между строением
корня и жилкованием семядолей.
(Анатомическое строение проростка Althea
rosea L.) — Вестн. ЛГУ, 1961, № 21, сер.
биол., вып. 4, с. 14—22.
Васильев В Н. Род Empetrum. M.; Л.,,1961.
132 с. ,
Верещагина В. А. Эмбриология некоторых
клейстогамных фиалок. — Бот. жури.,
1980, т. 65, № 8, с. 1147—1156.
Веселова Т. Д. О природе плаценты у Gypso-
philla altissima L. — В кн.: Матер, совещ.
по филогении центросемелных. М,, 1977,
с. 9—11.
Веселова Т.Д. Развитие аыдроцея в
обоеполых и женских цветках Cerastium bieber-
steinii DC. — Биол. науки, 1981, № 8,
с. 61—66.
Власова М. Л. Отклонение в поведении
антипод в зародышевом мешке
хлопчатника. — ДАН УзССР, 1962, № 5, с. 59—60.
Власова Н. А. Развитие семени и семенной
кожуры хлопчатника. — Узб. биол. журн.,
1959, № 1, с. 27-36.
Власова Н. А. Об оплодотворении и развитии
зародыша хлопчатника. — Уз&. биол.
журн., 1967, № 3, с. 59—64.
Власова Н. А. Дифференциация эпидермиса
в онтогенезе семяпочки хлопчатника. —
В кн.: Генетика и селекция растений.
Ташкент, 1975а, с. 105—108.
Власова Н. А. Развитие семени и волоконец
хлопчатника. Автореф. докт. дис. Ташкент,
19756. 52 с.
Высокоостровская И. Б. Некоторые данные
по изучению процесса оплодотворения
. у краснокочанной капусты при инцухте,
перекрестном опылении и инцухте с
добавлением чужеродной пыльцы. — Уч.
зап. ЛГУ, 1953, № 165, вып. 33, с. 34—44.
Гвинианидзе Э. И. К изучению плацентации
у представителей трибы Lychnideae A. Br.
сем. гвоздичных. — Сообщ. АН ГССР,
1958, т. 22, № 6, с. 723—728.
Глущенко Г. Т. Цитоембршлопчне досл1д-
ження смшки широколисто! (Silene lati-
folia (Mill.) Rendle et Britt.) у зв'язку
з питаниям стерильность — Укр.
боташчний журн., 1974, т. 31, № 2, с. ,155—
159.
Головач А. Г. Актинидия полигамная в
Ленинграде. — Бюл. Гл. ботан. сада. АН СССР,
1969, вып. 72, с. 15—19.
Головач А. Г. Актинидия коломикта — Acti-
nidia kolomikta (Rupr.) Maxim. — Тр.
Ботан. ин-та АН СССР, 1970, вып. 10,
с. 75—92.
Голубева Е. А. Особенности
ультраструктуры пыльников сахарной свеклы при
ЦМС. — В кн.: Цитоплазматическая
мужская стерильность и селекция растений.
Киев, 1979, с. 103—105.
Гуляев В. А. Применение сравнительно-
эмбриологического метода к систематике
рода Citrullus Schrad. — Тр. Плодоовощи,
ин-та им. Мичурина, 1955, т. 8, с. 331—
354.
Гуляев В. А. К описанию процесса
оплодотворения у Citrullus vulgaris Schrad. —
Бюл. Всес. ин-та растениеводства, 1961,
№ 9, с. 27—30.
Гуляев В. А. О типе зародышевого мешка
Praecitrullus fistulosus (Stecks.) Pang. —
ДАН СССР, 1962, т. 146, № 5, с. 1216—
1219.
Гуляев В. А. Сравнительная эмбриология
Cucurbitaceae и ее значение для
систематики семейства. — Бот. журн., 1963, т. 28,
№ 1, с. 80—85.
Гусейнов М. М. Аномалия цветка гвоз*
дики. — Изв. АН АзССР. Сер. биол.
и с.-х. н., 1959, № 6, с. 41—42.
299
Гусейнова Н. А. К эмбриологии •
гвоздичных. — Бюл. Гл. ботан. сада. АН СССР,
1980, вып. 116, с. 93—96.
Дариев А. С. Строение зародыша и проростка
некоторых видов Gossypium. — Бот.
жури., 1965, т. 50, № 5, с. 655—662.
Дементьев Г. С. Динамика образования
азотсодержащих веществ ♦ в семенах грецкого
• ореха (Juglans regia L.). — Тр. по химии
природн. соединений. Кишинев, ун-т,
1966, № 6, с. 64—70.
Демьянова Е. И. Гистохимическая
характеристика генеративных органов некото-
' рых маревых каменистой пустыни. —
• В кн.: Экология растений. Пермь, 1975,
вып. 2, с. 85—98.
Демьянова Е. И. О гинодиэции в семействе
гвоздичных. — В кн.: Матер, совещ. по
филогении центросеменных. М., 1977,
с. 19-21.
Демьянова Е. И., Покатаева Н. В. Некото-
• рые данные о гинодиеции у Dianthus aci-
cularis Fisch. (Caryophyllaceae). — Бот.
журн., 1977, т. 62, № 10, с. 1469-1479.
Демьянова Е. И. К изучению гинодиэции
в роде Dianthus (Caryophyllaceae). —
Бот. журн., 1981, т. 66, № 1, с. 65-75.
Дзевалтовский А. К. Морфолопчш i цито-
ембриолопчш особливост1 розвитку нор-
мальних та схильних до партенокарпп
сорт1в опршв. — Укр. боташчний журн.,
1961, т. 18, № 1, с. 33-41.
Дзевалтовский А, К. Особливоси розвитку
жшочого гаметоф1та у Momordica cha-
• rantia L. — Укр. боташчний журн.,
1963а, т. 20, № 2, с. 53-60.
Дзевалтовский А. К. Цитоембрюлоичт
досл1дження деяких представнишв родини
гарбузових. — Укр. боташчний журн.,
19636, т. 20, № 3, с. 16-29.
Дзевалтовский А. К. Розвиток жшочого га-
метофша у Benincasa hispida Thunb.
(Benincasa cerifera Savi.). — В кн.:
Питания ф1зшлоги, цитоембрюлогп i флори
Украши. Ктв, 1963в, с. 60—71.
Дзевалтовский А. К. Особливост1 розвитку
жшочого гаметоф1та у Lagenaria vulgaris
Ser. та Luffa cylindrica (L.) Roeih. —
В кн.: Питания експериментальшл бо-
ташки. Ниш, 1964, с. 88—95.
Дзевалтовский А. К. До ембрюлоги orip-
ка — пирскача (Ecballium elaterium (L.)
A. Rich.). — Укр. боташчний журн.,
1965, т. 22, № 4, с. 15—22.
Дзевалтовский А. К. Эмбриологические
исследования представителей семейства
тыквенных. — Цитология и генетика, 1967,
т. 1, № 2, с. 32-41.
Дзевалтовский А. К. Редукционное деление
при макроспорогенезе у триплоидной
формы арбуза Асахи Ямато. — Цитология
• и генетика, 1968а, т. 2, № 5, с. 425—435.
Дзевалтовский А. К. Исследование
генеративного процесса у экспериментальных
триплоидов арбуза. — В кн.: Матер. Все-
, союз. симп. по эмбриологии растений.
Киев, 19686, с. 57—59.
Дзевалтовский А. К. Апоспория у триплоид-
ного огурца. — В кн.: Матер. II совещ.
по проблеме апомиксиса у растений и
животных. Новосибирск, 1968в, с. 20—21.
(Тез. докл.).
Дзевалтовский А. К. Изучение влияния
колхицина на развитие зародышевых мешков
У огурца. — В кн.: Maiep. Всесоюз.
симп. по эмбриологии растений. Киев,
1968г, с. 59—62.
{Дзевалтовский А. К.) Dzevaltovsky А. К.
Megasporogenesis in triploid watermelon. —
J. Mysore Univ. (India). New Series, B,
19686, v. 21, N 1—2, p. 11—17.
{Дзевалтовский A. K.) Dzevaltovsky A. K.
Abnormalities in embryo sac formation of
triploid watermelon. — J. Mysore Univ.
(India). New Series, B, 1968e, v. 21, N 1—2,
p. 18-23.
Дзевалтовский А. К. Особенности развития
женского гаметофита у триплоидной формы
арбуза Асахи Ямато. — Цитология и
генетика, 1969а, т. 3, № 1, с. 7—16.
Дзевалтовский А. К. Особливост! мшроспо-
рогенезу та розвитку чолов1чого гамето-
ф1та у деяких експериментально-полшло1д-
них представнишв родини гарбузових. —
В кн.: Матер. IV съезда УБО. Khib,
19696, с. 119—121.
Дзевалтовский А. К. Особенности
формирования пыльцы у
экспериментально-полиплоидного арбуза. — Цитология и
генетика, 1970а, т. 4, № 5, с. 411—416.
Дзевалтовский А. К. Розвиток нормальних
та партенокаршчних плод1в у ряду штро-
дукованих представнишв родини
гарбузових. — В кн.: 1нтродукщя та акимати-
защя рослин на Украшь Кшв, 19706,
с. 140—149.
Дзевалтовский А. К. Деяш особливоси
редукщйного подшу при мшроспороутво-
ренш в експериментально-полшло1дно*1
форми кавуна. — Укр. боташчний журн.,
1970в, т. 27, № 4, с. 425—430.
Дзевалтовский А. К. Некоторые особенности
цитоэмбриологии экспериментально-те-
траплоидного огурца. — Цитология и
генетика, 1971а, т. 5, № 2, с. 154—161.
Дзевалтовский А. К. Некоторые
особенности развития женского гаметофита у
огурца (Gucumis sativus L.),
обусловленные воздействием колхицина. —
Цитология и генетика, 19716, т. 5, № 1,с. 23—28.
Дзевалтовский А. К. Псевдоапоспория у
представителей семейства тыквенных. —
В кн.: Матер. V Всесоюз. совещ. по
эмбриологии растений. Кишинев, 1971в,
с. 48—49.
Дзевалтовский А. К. Аномалп при мшро-
спорогенез1 та формуванш чoлoвiчoгo га-
метоф1та у тетрапло1дно1 форми отрка. —
В кн.: Матер. V съезда УБО. Ужгород,
1972, с. 203. (Тез. докл.).
Дзевалтовский А. К. Естественная и стиму-
лятивная апоспория у представителей
семейства тыквенных. — В кн.: Проблемы
апомиксиса у растений и животных.
Новосибирск, 1973, с. 96—105.
Дзевалтовский А. К. Генеративна апоспор1я
у деяких гарбузовых. — В кн.: Бот. сади
By3iB УРСР — наущ i народному
государству. Киев, 1974, с. 54—60.
Дзевалтовский А. К. Цитоэмбриологические
исследования полиплоидных форм
культивируемых тыквенных. — В кн.: Тез.
докл. XII МБК. Л., 1975, т. 1, с. 248.
Дзевалтовский А. К. Цитоембршлопчш до-
слщження ряду експериментальних по-
лшлодав гарбузових. — В кн.: Охорона,
вивчення та збагачення рослинного свиу.
Кшв, 1976, вып. 3, с. 26—31.
300
Дзевалтовский А, К. Особливост1 цитоем-
бршлогп експериментальних тетраплоццв
кавуна (Gitrullus vulgaris Scbrad). — Укр.
ботатчний журн., 1977а, т. 34, «Na 1,
с. 13—18.
Дзевалтовский А. К. Апомштичний розвиток
зародкових м1штв у експериментальних
тетраплоЗДв кавуна. — Укр. ботатчний
журн., 19776, т. 34, № 2, с. 146—151.
Дзевалтовский А. К. Особливост1 макроспо-
рогенезу у тетраплощних форм диш (Melo
Adans.)- — Укр. ботатчний журн.,
1979а, т. 36, № 2, с. 135-140.
Дзевалтовский А. К. Розвиток зародкового
MiniKa у експериментальних тетраплоццв
дит (Melo Adans.). — Укр. ботатчний
журн., 19796, т. 36, № 3, с. 229—234.
Дзевалтовский А. К. Цитолого-эмбриологи-
ческая характеристика семейства
тыквенных (Cucurbit асеае). — В кн.: Охрана,
изучение и обогащение раст. мира. Киев,
1980, вып. 7, с. 117—125.
Дзевалтовский А. К. Изучение
жизнеспособности пыльцевых зерен у диплоидных и те-
траплоидных форм дыни (Melo Adans.)
и огурца (Cucumis L.). — В кн.: Охрана,
изучение и обогащение раст. мира. Киев,
1981, вып. 8, с. 110—124.
Дзевалтовский А. К., Ашурметов А. А.
Некоторые особенности микроспорогенеза
и развития мужского гаметофита у тетра-
плоидного огурца (Cucumis sativus L.). —
В кн.: Биол. и морф, особенности
полезных растений Узбекистана. Ташкент,
1976, с. 63—72.
Дзевалтовский А. К., Жалалов Г. До ембрш-
логп малотрп жорсткувато! (Melothria
scabra Naud,) — Укр. ботатчний журн.,
1976, 1. 33, № 3, с, 287-290.
Дзевалтовский А. К., Жалалов Г. Случаи
генеративно-апоспорического развития
зародышевых мешков у тетраплоидной формы
арбуза (Citrullus vulgaris Schrad.). —
В кн.: Апомиксис и цитоэмбриология
растений. Саратов, 1978, вып. 4, с. 26—29.
Дзевалтовский А. К., Литвиненко Н. М.
Формирование пыльцевых зерен у экспе-
риментально-тетраплоидной формы
огурца. — В кн.: Половой процесс и
эмбриогенез растений. М., 1973, с. 63—65.
(Матер. Всесоюз. симп.).
Дзевалтовский А. К., Муратов 3. М.,
Жалалов Г. Апомиксис у представителя
семейства тыквенных Momordica charantia
L. - ДАН УзССР, 1973а, № 5, с. 70-71.
Дзевалтовский А. К., Муратов 3. М.,
Жалалов Г. Явление апомиксиса у
некоторых представителей семейства Cucurbita-
сеае. — Узб. биол. журн., 19736, № 5,
с. 35-37.
Дзевалтовский А. К., Муратов 3. М.,
Жалалов Г. Деяш дат до вивчення розвитку
чолов1чо1 генеративно*! сфери ,у антшь-
ского опрка (Cucumis anguria L.). —
В кн.: Вот. сади вуз1в УРСР — наущ
i народному господарству. Киев, 1973в,
с. 84—94.
Дзевалтовский А. К., Санкин Л, С. Експе-
римешальный синтез тетраплощноК форми
дит та вивчення ^розвитку у nei чолов1чого
гаметоф^а. — Укр. ботатчний журн.,
1971, т. 28, № 1, с. 42—48.
Дзевалтовский А. К., Шайтан, И. М. Ви-
падки апоспорного утворення зародкових
MiniKiB у трипло1*дно1 форми кавуна
Acaxi Ямато (Asahi Jamato). — Укр.
ботатчний журн., 1969, т. 26, № 1, с. 84—92.
Дьякова М. И. Процесс оплодотворения
у Mirabilis jalapa. — Бюл. Моск. о-ва
испыт. природы. Отд. биол., 1962, т. 67,
№ 3, с. 145.
Ёрамян Е. Н. К изучению пыльцевых зерен
кавказских представителей семейства
мальвовых, (Malvaceae). — В кн.: Науч.
тр. Ереван, ун-та. Ереван, 1955, т. 49,
сер. биол. наук, вып. 5., с. 211—228.
Ермаков А. И. Закономерности накопления
и превращения веществ при созревании
семян важнейших масличных и маслично-
прядильных культур. — Тр. по прикл.
ботан., генет. и селекции, 1980, т. 66, № 3,
с. 3—27.
Жалалов Г. Микроспорогенез и развитие
мужского гаметофита у Momordica
charantia L. — Науч. тр. Ташкент, ун-т,
1972, вып. 398, с. 48—49.
Жалалов Г. К вопросу изучения развития
элементов мужской генеративной сферы
у бенинказы волосистой (Benincasa ni-
spida (Thunb.) Cogn.). — Науч. тр.
Ташкент, ун-т, 1973, вып. 439, с. 273—267.
Жалалов Г., Дзевалтовский К. А. К
эмбриологии эхиноцистиса шиповатого (Echino-
cystis lobata) (Michx.) Torr. ex A. Gray. —
Науч. тр. Ташкент, ун-т, 1973, вып. 439,
с. 288—291.
Жалалов Г., Дзевалтовский А. К. К цито-
эмбриологии антильского огурца
(Cucumis anguria L.). — Узб. биол. журн.,
1975, № 3, с. 41—43.
Жгенти Л. П. Выделение хроматиноподоб-
ных веществ из ядер эндосперма у видов
Paeonia. — В кн.: Матер. V Всесоюз.
совещ. по эмбриологии растений.
Кишинев, 1971, с. 52—53.
Жгенти Л. П. Апомиксис у видов рода
Paeonia. — Вестн. Груз. бот. о-ва
АН ГССР, 1978, № 7, с. 113—126.
Жебрак Э. К. Эмбриогенез у диплоидной
и тетраплоидной гречихи. — ДАН СССР,
1960, т. 135, № 2, с. 475—477.
Жебрак Э. К. Эмбриологическое и
гистохимическое изучение процесса
оплодотворения у диплоидной и тетраплоидной
гречихи. — Бюл. Гл. ботан. сада. АН СССР,
, 1961, вып. 41, с. 73—79.
Жебрак Э. А. Эмбриологическое изучение
переопыления между диплоидной и
тетраплоидной гречихой. — ДАН СССР, 1963,
т. 150, № 3, с. 657—660.
Жукова Г. Я. О качественном составе
пигментного комплекса пластид зеленого
зародыша некоторых покрытосемянных. —
Бот. журн., 1967, т. 52, № 8, с. 1085—1096.
Жукова Г. Я. Электронномикроскопическое
исследование хлоропластов зародыша Ibe-
ris umbellata V. — В кн.: Тез. докл. VII
Всесоюз. конф. по электронной
микроскопии. Л., 1969, с. 162.
Жукова Г. Я. О форме хлоропластов
зародыша некоторых видов покрытосеменных
и ее значение. — Бот. журн., 1972, т. 57,
№ 3, с. 290—298.
Жукова Г. Я. Электронномикроскопическое
исследование хлоропластов семядолей
зародыша Tilia platyphyllos. — В кн.:
Матер III Всесоюз. симп. по применению
электронной микроскопии в ботан. ис-
$01
следованиях. Петрозаводск, 1974, с. 147—
150.
Жукова Г. Я. Пластидный аппарат зародыша
хлоро- и лейкоэмбриофитов и его
функциональное значение. — ДАН СССР, 1975,
т. 224, № 6, с. 1425—1427.
(Жукова Г. Я.) Zhukova G. Y. Ultrastructural
aspects of formation of some storage
substances in the embryo of angiosperms. —
Proc. Indian Nat. Sci. Acad. Pt. B, 1978,
, v. 44, N 3, p. 133—140.
Жукова Г. Я. Особенности пластидного
аппарата зародыша и хлороэмбриофитов
и лейкоэмбриофитов. — В кн.: Актуальные
вопросы эмбриологии покрытосеменных.
Л., 1979, с. 104—120.
(Жукова Г. Я.) Zhukova G. Y. Embryogenesis
of angiosperms: ultrastructural
transformations of plastids. — Acta Soc. bot. pol.,
1981, v. 50, N1/2, p. 303—306.
Жукова Г. Я. Зигота покрытосеменных
растений и ее пластидный аппарат. — В кн.:
Матер. Всесоюз. совещ. по опылению
и оплодотворению у растений. Киев, 1982,
с. 362—365.
Жуковский П. М. Культурные растения и их
• сородичи. Л., 1971. 751 с.
Журбин А. И. Развитие пыльцы
хлопчатника. — В кн.: Строение и развитие
хлопчатника. М.; Л., 1937, с. 22—23.
Загорчева Л. Цитоэмбриологични изследова-
ния на геномни мутанти у Gucumis sati-
vus. L. I. Причини за намаления ферти-
литет на една автотетраплоидна форма. —
' Генет. и селекция (НРБ), 1969а, т. 2,
№ 2, с. 99—413.
Загорчева Л. Цитоембриологични изследова-
ния на геномни мутантдЛ Gucumis sativus L.
П. Развитие на семе;н|1|#,след реципрочни
кръстования между дйплоидни и тетра-
плоидни форми. — Генет. и селекция
(НРБ), 19696, с. 2—4, с. 313—324.
Загорчева Л. Отклонения в устройство™ на
женския гаметофит на инцухт — линия
в Gucumis sativus L. и някои особенности
на макроспорогенеза в този вид. — Генет.
и селекция (НРБ), 1972, т. 5, № 3,
с. 211— 220.
Загорчева Л. Макроспорогенезис и макро-
гаметогенезис на Cucumis sativus L. и
состояние на женския гаметофит и женските
Цветове. — Генет. и селекция (НРБ), 1976,
т. 9, № 5, с. 386-399.
Загорчева Л., Михов А., Александрова М.
Мейозис на спонтанни полиплоидии
мутанти при GuGumis sativus L. — Генет. и
селекция (НРБ), 1978, т. И, № 1, с. 23—32.
Загорчева Л., Молхова Е. Проучване на ем-
бриосака, опрашването и оплождането при
Cucumis sativus L. — Градин, и лозарска
наука, 1965, т. 2, № 3, с. 285—295.
Загорчеёа Л., Молхова Е. Развитие и
кариология на ендосперма на диплоидна и те-
траплоидна форма и на реципрочните им
кръстоски в Gucumis sativus L. — Генет.
и селекция (НРБ), 1976, т. 9, № 4, с. 303—
315.
Зайковская Н. Э. Изучение микроспоро-
генеза и развитие семян у сахарной
- свеклы с ЦМС. — В кн.: Селекция
растений с использованием ЦМС. Киев, 1966,
с. 354—368. . .
Зайковская Я. Э. Биология цветения, цито-
302 ~
логия и эмбриология сахарной свеклы.
- Автореф. $окт. дис. Киев, 1967. 35 с.
.Зайковская М* Э. Биология цветения,
цитология и эмбриология сахарной свеклы. —
В кн.: Биология и селекция сахарной
светлы. М., 1968, с. 137—207.
Зайковская Н.Э., Белоус В. Е. Особенности
развития зародышевого мешка у
односемянной тетраплоидной сахарной
свеклы. — Докл. ВАСХНИЛ, 1965, № 7Г
с. 11—15.
Зайковская Н. Э., Жужжалова Т. П.
Цитология и эмбриология сахарной свеклы. —
В кн.: Вопросы генетики, селекции и
цитологии сахарной свеклы. Киев, 1971 г
с. 178—182.
Зайковская Н. Э., Перетятъко Н. А.,
Ширяева Э. И., ЯрмолюклГ. И. Апомиксис
у форм сахарной свеклы с генной
стерильностью пыльцы. — В кн.: Апомиксис и ци-
тоэмбриология растений. Киев, 1978г
вып. 4, с. 39—40.
Зафийовская Л. Д. До ембриологп родини
Caryophyllaceae. — Пращ науково-до-
слщного шституту бшлогп. Кшв, 19&9,
т. 2, с. 119—132.
Зонова Е. С. К эмбриологии некоторых
представителей семейства ивовых (Salicaceae
LindL). Автореф. канд. дис. Л., 1953. 16 с,
Ивасаки Фулио, Xособа Толио. Изучение при
помощи морфологического и
гистохимического метода развития органов цветка
у растения рапса (Brassica napus L.),
обладающих мужской стерильностью. —
Jap. J. Breed., 1970, v. 20, N 5, p. 282—
286.
Ивашкина Л. А. Анатомическое
исследование Arabidopsis thaliana (L.) Heynh. —
Уч. зап. Перм. пед. ин-та, 1975,' т. 141,
с. 56—62.
Ильина Г. М. Эмбриологическое
исследование горчицы Brassica juncea (L.) Czern. —
Вестн. МГУ, 1962, № 1, с. 34—35.
Имс А. Морфология цветковых растений.
М., 1964. 461 с. ,
Иоффе М. Д. О наличии хлорофилла в
эндосперме крестоцветных. — ДАН СССР,
1952, т. 82, .№ 3, с. 473—476.
Иоффе М. Д. Развитие зародыша и
эндосперма у пшёниЦж,. конских бобов и
редиса. — Тр. Ботшкин-та АН СССР, сер. 7Г
1957, вып. 4, с. 211,-269.
Иоффе М. Д., Жукова Г. Я. Некоторые
особенности формирования оболочки зиготы
и клеток проэмбрио в сем. Dilleniaceae. —
В кн.: Половой процесс и эмбриогенез
растений. М., 1973, с. 88—89. (Матер.
Всесоюз. симп.).
Иоффе М. Д., Жукова Г* Я. Модификация
оболочки зиготы в процессе ее развития
в' роде Dillenia (Dilleniaceae). — Бот.
журн., 1974, т. 59, № 10, с. 1409—1416.
Исомиддинова Дж. Анатомия и
морфология зародыша и проростков Polygonum
coriarium Grig, и P. panjutinii Charkev
(Polygonaceae). — Бот. журн., 1978, т. 63г
„ № 10, с. 1498—1510.
Исомиддинова Дж. Сравнительное
морфологическое и анатомическое изучение
некоторых видов рода Polygonum L. Автореф.
канд. дис. Л., 1980. 17 с.
Кавецкая Г. А. Эмбриология, озимого pi-
пака. — Укр. боташчний журн., 1958а,
т. 15, № 1, с. 37—47.
Кавецпая Г. А, Цитологические наблюдения
над накоплением питательных веществ
в семенах рапса. — Укр. боташчнийжурн.,
19586, т. 15, № 4, с. 24—31.
Кавецпая А. А. Эмбриология рапса
и'динамика накопления питательных веществ
в семени. — Науч. тр. Укр. с.-х. акад.,
1960а, т. 10, с. 113—119.
Ка'вецкая А. А. Цитоэмбриологические
исследования рапса. Автореф. канд. дис.
Киев, 19606. 16 с. ;*»
Каграманова Ф. В.
Сравнительно-эмбриологическое исследование первоцветов
разноцветного и Воронова. — В кн.: Цито-
эмбриологическое исследование растений
флоры Азербайджана. Баку, 1972, с. 82—
92.
Кайгородова М. С. К антэкологии Empetrum
hermaphroditum Hagerup. — В кн.:
Экология опыления. Пермь, 1975, вып. 1,
с. 37-42.
Калинин Ф. Д. Некоторые закономерности
развития зародыша редьки Khaphanus
sativum L. на материнском растении. —
ДАН СССР, 1950, т. 71, № 5, с. 945—948.
Калинин Ф. Л. Физиолого-биохимические
особенности эмбриологического развития
растений. Автореф. докт. дис. М., 1956.
30 с.
Калягин Ю. Н. Микроспорогенез и развитие
мужского гаметофита у Kochia prostrata
(L.) Schrad. — В кн.: Структурные и
функциональные особенности дикорастущих
растений Узбекистана. Ташкент, 1970,
с. 66—72.
Калягин Ю. Н. Макроспорогенез,
формирование женского гаметофита и зародыша
у Kochia prostrata (L.) Schrad. — В кн.:
Биол. и морф, особенности полезных
растений Узбекистана. Ташкент, 1976,
с. 88-93.
Камалова Г. В. Морфологические и
гистологические особенности пыльцевых зерен
видов мальвовых. — В кн.: Вопросы
генетики и эмбриологии хлопчатника.
Ташкент, 1966, с. 33—40.
Камалова Г. В. О макроспорогенезе у
Hibiscus manihot L. — Узб. биол. журн.-, 1976,
№ 2, с. 56—58.
Камалова Г. В. Цитоэмбриология видов рода
Cienfuegosia Cav. (Malvaceae). — В кн.:
Тез. докл. VII Всесоюз. симп. по
эмбриологии растений. Киев, 1978, ч. 2, с. 23—24.
Камалова Г. В. О строении пыльника
мальвовых и роли тапетума в развитии
пыльцевых зерен. — В кн.: Генетика и
цитоэмбриология хлопчатника. Ташкент,
1979а, с. 18—25.
Камалова Г. В. О развитии женского
археспория у Malvaceae. — Узб. биол. журн.,
19796, № 5, с. 63—66.
Камалова Г. В., Пантелеева А. П. О микро-
спорогенезе у Cienfuegosia sulphurea (s.
t. H.) Garcke. — Узб. биол. журн., 1979,
№ 6, с. 58—62.
Камалова Г. В., Руми )В. А. О хлорофилло-
носности зародыша видов сем.
Malvaceae. — ДАН УзССР, 1975, № 4.
Камалова Г. В., Руми В. А., Пантелеева
А. П. Цитоэмбриологические
исследования двух видов Cienfuegosia Cav. — Узб.
биол. журн., 1978, № 4гс. 68—72.
Камалова Г. В., Серебрякова Л. Е.,
Пантелеева А. П. Цитоэмбриологические
исследования некоторых мальвовых з связи
- -с отдаленной гибридизацией. ^— В кн.:
Генетика и селекция хлопчатника/
Ташкент, 1976, с. 54—55.
Камалова Г. В., Серебрякова Л. Е., Панте-
леева А. П. Микроспорогенез и развитие
мужского гаметофита у Althea broussone-
tiifolia. — В кн.: Генетика и цитоэмбрио-
" логия хлопчатника. Ташкент, 1979, с. 46—
52.
• Камелина О. П., Яковлева Г. В. Мегаспоро-
генез и развитие зародышевога мешка
, у Dianthus caryophyllus L. (Caryophyl-
laceae). — Бот. журн., 1982, т. 67, № 1,
с. 80—87.
Карагъозова М. Д. Цитоембрйологично изуча- —
ване на Flyeckigera purpurea Kuntze. —
Изв. Ботан. ин-та Бълг. АН, 1969] кн. 19,
с. 117—126.
Карташова 3. П. Строение зародыша и
проростков культурной и дикой гречихи'. —
Вестн. ЛГУ, 1968, № 15, с. 66—70.
Клименко В. Г., Костик Е. И. Белки семян
семейства тыквенных (Cucurbitaceae). —
Уч. зап. Кишинев, ун-та, 1955, т. 20,
с. 149—156. •
Колбасика Э. И. Органогенез соцветия и
цветка Actinidia kolomikta Maxim. —
Бот. журн., 1969, т. 54, № 9, с. 1397—
1400. •
Колобкова Е. В. О филогенезе и эволюции
белков порядка Fagales. — В кн.:
Эволюционная биохимия растений. М., 1964,
с. 81—127.
Колобкова Е. В. Эволюция белковых
комплексов семян порядков Urticales и Casu-
arinales; — В кн.: Биохимия и филогения
растений. М., 1972а, с. 9—32.
Колобкова, Е. В. О филогенезе и эволюции
белков порядка Fagales. — В кн.:
Биохимия и филогения растений. М., 19726,
с. 32—37.
Кондратъева-Мелъвилъ Е. А, Развитие
структуры куколя в его онтогенезе. I.
Проросток. — Вестн. ЛГУ, сер. .биол., 1967,
вып. 2, № 9, с. 62—68.
КонЫчева В. И. К биологии цветения и
эмбриологии Salsola rigida Pall. — Узб.
биол. жури:, 1962, № 6, с. 43—48.
Конычева В. И. К биологии цветения и
плодоношения Salsola arbuscula Pall. — Узб.
биол. журн., 1963, № 2, с. 22—25.
Конычева В. И. О пыльце некоторых
. пустынных полукустарников. — Докл.
АН УзССР, 1964, № 5, с. 49—52.
Конычева В. И. К вопросу о биологии
цветения и эмбрцологии Salsola gemmascens
Pall. — Узб. биол. журн., 1965, № 5, с.
58—63.
Конычева В. И. К биологии и эмбриологии
нанофитона ежового. — Узб. биол. журн.,
1968, №.5, с. 78—79.
Конычева В. И. Биологические и
эмбриологические особенности эллений. — Узб. биол.
журн., 1971, № 5, с. 33—36.
Конычева В, И. Строение зародышевого
мешка некоторых маревых в тычиночную
фазу цветения. -— В кн.:. Биологические
и структурные особенности полезных
растений Узбекистана. Ташкент, 1976,
с. 93—101.
Конычева В. И. О цветении и эмбриологии
Salsola richteri Kar. — В кн*: Биологиче-
203
:;сздае и с^ру&тзф&ые #собе1*жос^и.лощезных
' рас^емий Тз&ешс5№аа. З&шкшт, 1Ш7,
Конычта В^ И. О 1^т&якй ^що».^Ща Сега-
tocarpus. —, В ет.: Биййшги^шежйе^четдак-
турные особенности ташзжых :^а;стешш
Узбекистана. Ташкент, 19t$a, с* 79—80.
Конычева В. И. Развитие микроспорангия
и пыльцы у многолетних солянок. —
В кн.: Биологические и структурные
особенности полезных растений Узбекистана.
Ташкент, 19796, с. 81—85,
Конычева В, И. Жизнеспособность мужского
и женского гаметофитов кормовых
растений семейства Ghenopodiaceae. — В кн.:
Матер. Всесоюз. совещ. по опылению
и оплодотворению у растений. Киев, 1982,
с. 306—308.
Конычева В, И., Кадырова Р. У. К
эмбриологии сем. Ghenopodiaceae. — В кн.: Тез.
докл. VI Делегат, съезда ВБО. Л., 1978а,
с. "79—80.
Конычева В. И., Кадырова Р. У.
Эмбриологические особенности некоторых
представителей сем. Chenopodiaceae. — В кн.: Тез.
докл. VII Всесоюз. симп. по эмбриологии
растений. Киев, 19786, ч. 2, с. 26—27.
Конычева В. И., Кадырова Р. У. О
направлении специализации генеративных
органов в семействе Ghenopodiaceae. — В кн.:
Матер. VI Моск. совещания по филогении
растений. М., 1981, с. 60—61.
Конычева В. И., Шевчук Л. П. Исследование
генеративного процесса у растений Юго-
Западного Кызылкума. — В кн.: Половой
процесс и эмбриогенез растений. М.,
1973а, с. 110—111. (Матер. Всесоюз,
симп.).
Конычева В, И., Шевчук Л. П. Биологические
и эмбриологические особенности Haloxy-
lon aphyllum (Minkw.) Iljin. — В кн.:
Морфогенез растений аридной зоны.
Ташкент, 19736, с. 60—68.
Конычева В. Л., Шевчук Л. П. Эмбриология
терескена. — В кн.: Морфобиологические
особенности дикорастущих растений
Узбекистана. Ташкент, 1974, с. 115—
121.
Кордюм Е. Л. Особенности раннего
онтогенеза семяпочек с различным типом
археспория у ряда представителей
покрытосеменных. — Цитология и генетика, 1968,
№ 5, с. 415—424.
Кордюм Е. Л. Эволюционная цитоэмбриоло-
гия покрытосеменных растений. Киев,
1978. 220 с.
Кордюм Е. Л., Глущенко Г. И. Цитоэмбрио-
логические аспекты проблемы пола
покрытосеменных. Киев, 1976, 198 с.
Кордюм Е. Л., Заецъ В. О. До ембрюлогп
молочаю щербиковидного (Euphorbia per-
lis L.). — Укр. ботатчний журн., 1962,
т. 19, № 5, с. 42—48.
Корнеева А. М. Липиды желудей дуба. I.
Количественное содержание и изменение
липидов в процессе хранения желудей. —
Науч. докл. высш. школы. Биол. н.,
1966, № 3, с. 174—177.
Коц 3. П. Развитие и строение зародышевого
мешка тополя белого. — В кн.: Селекция,
интродукция и семеноводство древесных
лесных пород. Киев, 1964, с. 60—63.
(Матер, расширенной сессии секции
лесоводства).
Коц 3. П. Эмбриологические исследования
тополя €еи©го в-«визй *с гибридизацией. —
-В кн.: Летаводеяавд и агролесомелиорация.
Киев, 1967, шт. 9, с. Ш—115.
Коц в. П. Розеттой нахйкневих зшатюв ira
жМ^нрго^гржесзш©р1я Bj>o#i Populus L. —
Укр. бшаихчний -журн^ 1972а, т. 29,
№ 1, с. т-^М.
КОЦ 3. П. РоЗВИТОК ЖШОЧ01 ЖВШШ ТОШЛ1
сизо!' (Populus pruinosa). — Укр.
ботатчний журн., 19726, т. 29, № 2, с. 228—
232.
Кривкина #. 77. Об углеводном обмене и на-
. коплении жира в семенах различных по
скороспелости сортов хлопчатника. —
Бюл. науч.-техн. информ. НИИ с.-х.
ТаджССР, 1961, № 1, с. 47—54.
Кудрявцева В, М. Изучение
жизнеспособности пыльцы горца (Polygonum veyrichii
F. Schmidt) и горца забайкальского
(Polygonum divaricatum L.) методом
проращивания. — Изв. АН СССР. Сер. биол.,
1963, № 4, с. 40—43.
Кудрявцева В. М. К причине
неплодоношения гречихи сахалинской (Polygonum sa-
chalinense Schmidt.) в условиях БССР-
(Некоторые данные по эмбриогенезу). —
ДАН БССР, 1965, т. 9, № 3, с. 194—
196.
Кулъмагамбетов Ш. К. К изучению
макроспор огенеза сахарной свеклы в условиях
Алма-Атинской обл. — Изв. АН КазССР*
Сер. биол., 1968, № 6, с. 20—21.
Купцоу М. С. К микроспорогенезу и гамето-
генезу сахарной свеклы. — Изв. АН БССР.
Сер. биол. науки, 1972, № 4, с. 49—55.
Курсанов А. Л. Некоторые итоги сессии по
физиологии и биохимии семян. — В кн.:
Биологические основы повышения
качества семян сельскохозяйственных
растений. М., 1964, с. 270—273.
Кутубидзе В. В. Явление полиэмбриовии
в чайном растении. — Субтроп, культуры,
1974, № 1, с. 15—18.
Ли Маохие. Пыльцевой диморфизм и андро-
генез у Paeonia in vivo. — Чжиу сюэбао,
Acta hot. sinica, 1982, v. 24, N 1, p. 17—
20.
Лопушанский 77. И,, Молотковский Г. X.
Явления полярности и динамика
накопления жира и витамина С в надземной
части грецкого ореха. — Бюл. Моск. о-ва
испыт. природы. Отд-ние биол., 1956,
т. 61, № 1, с. 61—67.
Максюк Н. А., Нарвут С. И., Смирнов А. Ф,
К вопросу о различиях спермиев в
пыльцевом зерне редиса. — Вестн. ЛГУ, 1973г
вып. 3, № 15, с. 123—131.
Мандрик В. Ю. К эмбриологии чайного ра-
стевия в условиях Закарпатья. — В кн.:
Тез. докл. II Всесоюз. совещ. эмбриологов
СССР. М., 1957а, с. 106—107.
Мандрик В. Ю. Макроспорогенез и развитие
женского гаметофита у чайного
растения. — Науч. зап. Ужгород, ун-т, 1957бу
т. 23, с. 69—88.
Мандрик В. Ю. Микроспорогенез и развитие
мужского гаметофита у чайного
растения. — Науч. зап. Ужгород, ун-т, 1959,
т. 41, с. 271—281.
Мандрик В. Ю. Оплодотворение и
эмбриогенез у чайного растения. — В кн.: Тез»
докл. III Всесоюз. совещ. эмбриологов.
М., 1960а, с. 102—103.
304
Мандрип В. Ю. Эмбри©з*огия чайного
растения в условиях Закарпатья. Автореф.
канд. дис. Ужгород, 19вдЬ. 19 с.
Мйндрик В. Ю. К эмбриологии чайного
растения в условиях Вакафтштья. — В кн.:
Проблемы современной эмбриологии. М.,
1964, с. 148—452.
Маръязсина П. Я., -Мямкулович Т. П.,
Ваяет СВ. 1^т^эжортоЭ1огйчеекая
характеристика Bfа^ов <э>ршншен%за '* гречихи
в^евяэи1з гетербстилией. —.Bjkh.:
Морфогенез растений. М., 1961, т. 1, <~ БМ—
304.
Мейер К. И. К эмбриологии Coronaria flos-
cticuli (L.) A. Br. — Бот. журн., 1962,
т. 47, № 6, с. 847—852.
Мешкова Л. 3., Сапожника В. И. К вопросу
онтогенеза пыльников и развития мужского
гаметофита сахарной свеклы. — Тр.
Казан, с.-х. ин-та, 1971, вып. 64, с. 78—87.
Микатадзе Ц. А. Микроспоро- и гаметоге-
нез у некоторых форм чайного растения,
разводимого в Грузии. — Субтроп,
культуры, 1973 № 5, с. 10—12.
Микатадзе Ц. А. К изучению зародышевых
мешков у некоторых форм Thea sinensis L.,
распространенных в Грузии. — Сообщ.
АН ГССР, 1974а, т. 74, № 3, с. 673—
675.
Микатадзе Ц. А. К цитоэмбриологическому
исследованию некоторых форм Thea
sinensis. L. — В кн.: Матер. VIII Науч.
конф. молод, ученых, посвященной 250-
летию АН СССР. Тбилиси, 19746.
Микатадзе Ц. А. Макроспорогенез и
развитие женского гаметофита у некоторых форм
Thea sinensis L. — Сообщ. АН ГССР,
1975, т. 78, № 3, с. 677—680.
Микатадае-Панцулая Ц. А. Явление поли-
эмбрионии у форм Thea sinensis L.,
распространенных в Грузии. — Сообщ.
АН ГССР, 1978а, т. 89, № 1, с. 173-175.
Микатадзе-Панцулая Ц. А. К изучению
процесса оплодотворения и эмбриогенеза
у некоторых распространенных в Грузии
форм Thea sinensis L. — В кн.: Тез. докл.
VII В'сесоюз. симп. по эмбриологии
растений. Киев, 19786, ч. 3, с. 57—59.
Микатадзе-Панцулая Ц. А. Биология и ци-
тоэмбриология некоторых сортов и форм
чая, разводимых в Грузии. Автореф. канд.
дис. Тбилиси, 1979, 24 с.
Мирианашвили Е. И. Структурные
изменения, сопровождающие «развитие зародыша
в семени чайного куста. — В кн.:
Морфогенез растений. М., 1961, т. 2, с. 366—370.
Миронова Т. Н. Содержание жирных масел
и каротина в семенах некоторых древесно-
кустарниковых растений. — Тр. Сиб. ле-
сотехн. ии-та, 1958, сб. 18, вып. 2, с. 7—14.
Михов А., Загорчева Л., Генчев С. Цитоем-
бриологично и генетично проучване на
избирателността про оплождането на кра-
ставицата (Cucumis sativus L.). — Генет.
и селекция(НРБ), 1968, т. 1, № 2, с. 85—99.
Михов А., Загорчева Л., Генчев С. Цитоем-
бриологичко и генетично проучване на
избирателността при оплождането на ин-
цухт-линия в Cucumis sativus L. — Генет.
и селекция (НРБ), 1971, т. 4, № 1, с. 45—
53.
Мишина А. С, Фурса Н. С, Беляева Л. Е.
Формирование гаметофитов Erysimum
marschallianum Andr. — В кн.: Тез. докл.
ТН Фсесоюз. симп. по эмбриологии
растений. "Киев, 1978, ч. 1, с. 36—37.
(Модилевский Я. С.) Modilewski /. S. Zur
Embriobildung von Euphorbia procera. —
Ber. Dtsch. bot. Ges., 1909, Bd 27, S. 21 —
26.
(Модилевский Я. С.) Modilewski /. S. Wei-
tere Beitrage zur Embriobildung einiger
Euphorbiaeeen. — Ber. Dtsch. bot. Ges.,
1910, Bd 28, S. 413-418.
(Модилевский Я. С.) Modilew&ki J. S. Uber
die anomale Embryosackbildung bei
Euphorbia palustris L. und ahderen Euphorbia-
vmi. — Ber. Dtsch. bot. Ges., 1911, Bd 29,
S. 430-436.
Модилевский Я. С. Опыление у гречиха. —
дан ссср, 1946, т. а; № г, &. ш— т.
Модилевский Я. С. Эмбриология Fagopyrum
esculentum Moench. — Укр. бот. журн.,
1947, т. 4, № 1-2, с. 3-13.
Модилевский Я. С. Цитоэмбриологическая
характеристика плодов посевной гречихи,
преждевременно прекративших свое
развитие. — Укр. бот. журн.; 1951, т. 8,
№ 3, с. 3-15.
Молхова Е., Загорчева Л. Някои особености
при формирането на ендосперма и заро-
диша в диплоидни и тетраплоидни форми
Cucumis sativus L. — Генет. и селекция
(НРБ), 1969, т. 2, № 2, с. 87—97.
Москов И. В. О развитии зародыша у
некоторых видов пеонов. — Бот. журн.,
1964, т. 49, № 6, с. 887—894.
Москова Р., Христов М. А. Върху ембрио-
логията на разпространени у нас видове
от рода Tamarix L. — Науч. тр. Высш.
селскостоп. ин-Т «Г. Димитров». Агрон.
факт. Сер. растениевъдство, 1969, т. 20у
с. 61-86.
Мурадов А. Т. Развитие репродуктивных
органов и ранний эмбриогенез хурмы
восточной (Diospyros kaki L.) в условиях
западной зоны Азербайджана. — Автореф.
канд. дис. Баку, 1974, 35 с.
Муратов 3. М., Дзевалтовский А. К., Жа-
лалов Г. Исследование эмбриологии дынь
Узбекистана. — В кн.: Половой процесс
и эмбриогенез у растений. М., 1973,
с. 160—161. (Матер. Всесоюз. симп.).
Наумова Т. Н. Половой процесс, нуцелляр-
иая и интегументальная эмбриопия у
представителей сем. Celastraceae A. Br. и Са-
ctaceae Juss. — В кн.: Тез. докл. VII
Всесоюз. симп. по эмбриологии растений.
Киев, 1978а, ч. 3, с. 59—61.
Наумова Т.Н. Особенности развития нуцел-
лярной ткани и нуцеллярная полиэмбрио-
ния у Opuntia elata (Cactaceae). — Бот.
журн., 19786, т. 63, № 3, с. 344-355.
Наумова Т. Н. Эмбриогенез половых и ну-
целлярных зародышей у опунций. — В кн.:
Тез. докл. VI Делегат, съезда ВБО. Л.,
1978в, с. 87—88,
(Наумова Т. Н.) Naumova Т. N. Apomictic
and sexual reproduction in Opuntia. —
In: Embryology of crop plants. New Delhi,
1977, 1978, p. 25—26. (Indo-Soviet Symp.).
Наумова Т. Н., Яковлев М. С. Половое
воспроизведение Opuntia ficus-indica
(Cactaceae). — Бот. журн., 1978, т. 63", № 4,
с. 548—55^
Никифоров Ю. Л. Развитие мужского
гаметофита хлопчатника. — Изв. АН ТССР, Сер.
биол. н.. 1964, № 5, с. 54—67.
20 Сравнительная эмбриология
305
Николаева Е. С. К эмбриологии ивы козьей. —
Уч. зап., сер. естеств.-географ. • и физ.-
мат. наук. Луганск, 1959, т. 9, с. 71—89.
Николаева Е. С. К вопросу об анатомо-физи-
ологической характеристике семян
некоторых ивовых. — В кн.: Тез. докл. и со-
общ. на итоговой науч. конф. за 1961 г.
Луганск, 1962, с. 60—61.
Николаева Е. С. К эмбриологии ивы пятиты-
чинковой. — В кн.: Тез. докл. науч.
конф. Луган. пед. ин-та. Луганск, 1963,
с. 59—61. .
Николаева Е. С. К эмбриологии тополя. —
Бот. журн., 1964, т. 49, № 11, с. 1644—
1649.
Николаева Е. С. К вопросу о хлорофиллонос-
ности зародышей у некоторых
покрытосеменных растений. — В кн.: Матер. V
Всесоюз.* совещ. по эмбриологии растений.
Кишинев, 1971, с. 116—117.
Николаева Е. С. Позеленение зародышей
в онтогенезе семени у некоторых Angio-
spermae. — В кн.: Половой процесс и
эмбриогенез растений. М., 1973, с. 168—169.
(Матер. Всесоюз. симп.).
Николаева Е. С. О позеленении зародышей
некоторых Angiospermae. — Бот. журн.,
1976а, т. 60, № 4, с. 517—522.
Николаева Е. С. Позеленение зародыша
некоторых Angiospermae. — В кн.: Тез. докл.
XII МБК. Л., 19756, т. 1, с. 258.
Николаева Е. С. К эмбриологии некоторых
представителей ивовых (Salicaceae
Lindl.). — В кн.: Тез. докл. VII Всесоюз.
симп. по эмбриологии растений. Киев,
' , 1978, ч. 2, с. 40—42.
* Лиси Садао, Хираокг Тацуя.
Цитологическое изучение развития зародыша у Bras-
sica campestris L. сорт кататсу, вызванного
псевдогамией. — Bull. Horticult. Res.
Stat., 1962, N 1, p. 95—110.
Овчаров .К. Е. .Физиология формирования
и прорастания семян. М., 1976. 255 с.
Оксиюк П. Ф. Эмбрюлогия цукрового буряка
(Beta vulgaris) — BicH. Кшв. бот. саду,
1927, № 5—6, с. 148—165.
Оксиюк П. Ф. Аномалп в развитку зародко-
вого мшка в Reseda alba L. — Тр. ф1з.-
мат. в1д УАН, 1929, т. 15, с. 37—50.
Оксиюк П. До цитологи та ембршлогп Re-
sedaceae. — Журн. Ин-та ботан. АН УССР,
1935а, № 4 (12), с. 15—18.
Оксиюк П. Ф. Пор1вняльно-ембршлог!чне
та цитолог1Чне дослцгження роду
Reseda. — BicTi УАН, 19356, т. 8, № 8—10,
с. 00.
Оксиюк П. Сравнительное цитолого-эмбрио-
логическое исследование сем. Resedaceae.
I. Reseda и Astrocarpus. — Журн. Ин-та
ботан. АН УССР, 1937, № 12, с. 2—
46.
Оксиюк П. Пор1вняльне циголого-ембрш-
лопчне дослщження родини Resedaceae. —
Журн. Ин-та ботан. АН УССР, 1938,
№ 26—27.
Оксиюк П. Ф. До ембршлогп Mollugo cer-
viana Ser. — Бот. журн., 1946, т. 3, № 3—
4, с. 88—94.
Оксиюк П. Ф. Об оплодотворении у свеклы
в связи с так называемым соматическим
оплодотворением. — Бот. журн., 1955,
т. 12, ЖЦ, с. 44—51.
Орел Л. И., Огородникова В. Ф., Голубева
Е. А., Константинова Л. Н. Цитологиче-
' ские особенности пыльников растений
с секреторным и плазмодиальным тапету-
мом. — В кн.: Матер. Всесоюз. совещ. по
опылению и оплодотворению у растений.
Киев, 1982, с. 369—371.
Парфенов Г. П., Абрамова В. М. Цветение
и созревание семян арабидопсиса в
невесомости. Эксперимент на биоспутнике «Кос-
мос-1129». — ДАН СССР, 1981, т. 256,
№ 1, с. 254—256.
Пашу к X. Т. Развиток чоловЧчого та жь
ночного гаметофшв у сольданели yropcbKoi
(Soldanella hungarica Simk.). — Укр. бот.
ж., 1969, т. 26, № 4, с. 76—81. , *
Дащенко 3. М. Биология цветения и
эмбриология некоторых видов рода Тата-
рих L. — Тр. Бот. сада АН УзССР, 1956,
вып. 5, с. 119—126.
Пащенко 3. М. Морфо-биологические
особенности пыльцы дынь, арбузов и тыкв. —
Тр. Ташкент, ун-та, 1966, вып. 301,
' с. 3-14.
Плиско М. А. Ультраструктура нуцеллуеа
у Alcea rosea L. (Malvaceae). — Бот.
журн., 1980, т. 65, № 6, с. 775—782.
Плиско М. А. Некоторые особенности
дегенерации клеток нуцеллуеа. — Бот. журн.,
1982, т. 67, № 11, с. 1469-1478.
Поддубная-Арнольди В. А. Общая эмбрио- ?
логия покрытосеменных растений. М.,
1964, 482 с. .
Поддубная-Арнольди В. А. Цитоэмбриология
покрытосеменных растении. М., 1976.
508 с.
Поддубная-Арнольди В. А. Сравнительно-
эмбриологическое исследование
диплоидных и тетраплоидных форм гречихи. —
. Бот. журн., 1948, т. 33, № 2, с. 181—194.
Полищук Л. К. Биохимический состав ядер
грецкого ореха на Украине. — Биохимия
плодов и овощей, 1961, сб. 6, с. 197—
207.
Полякова Т. Ф. Развитие мужского и
женского гаметофитов у Arabidopsis, thaliana
(L.) Heynh. — В кн.: Исследования по
генетике. Л., сб. 2, 1964, с. 125—133.
Понтович В. Э. Поглощение глюкозы и
ацетата семенами масличного мака на разных
этапах их роста- и отложения в запас. —
Тр. Биол.-почв. ин-та. Дальневост. науч.
центр АН СССР, 1973, т. 20 (123), с. 269—
275.
Попов В. В. Изучение индуцированного
апомиксиса у тыквенных культур. —
В кн.: Апомиксис и цитоэмбриология
растений. Саратов, 1978, вып. 4, с. 99—100.
Прянишникова 3. Д. Анатомическое
исследование зародыша и проростков гречихи
(Fagopyrum sagittatum Lilib.) — Докл.
Моск. с.-х. акад. им. К. А. Тимирязева,
1959, вып. 46, с. 213—216.
Пэн Циншэн. Эмбриогенез у Brassica na-
pus L. — Acta bot. sinica, 1965, v. 13,
N. 2, p. 172—178.
Райкова И. А., Канаш М. С. Семя
хлопчатника, его строение и прорастание. —
В кн.: Строение и развитие хлопчатника.
М.; Л., 1937, с. 7—8.
Раси-заде Г. М. Особенности развития
зародышевого мешка тетраплоидного
огурца. — ДАН АзССР, 1964, т. 20, № 11,
с. 47-51.
Раси-заде Г. М. Исследование характера
нарушения оплодотворения при самоопы-
306
лении диплоидных растений огурца сорта
Телеграф. — ДАЦ АзССР, 1963, т. 21,
№ 2, с. 67—70.
Раси-заде Г, М. К вопросу изучения
оплодотворения у огурцов (2пХ2п, 4пХ4а,
ЗпХЗп, 4пХ2п, 2пХ4п). — Тр. Ин-та
генет. и сел. АН АзССР, 1966, т. 4, с. 196—
209.
Раси-заде Г. М. Микроспорогенез у тетра-
плоидных форм огурца. — Тр. Ин-та генет.
и сел. АН АзССР, 1967, т. 5, с. 214—220.
Раси-заде Г. М. Особенности мейоза при
микро- и макроспорогенезе у триплоидных
огурцов. — Тр. Ин-та генет. и сел.
АН АзССР, 1974, т. 7, с. 171—184.
Родионова Г. Б, Относительно эмбриогенеза
Lunnaria annua L. — Бот. журн., 1966а,
т. 51, № 10, с. 1506—1511.
Родионова Г. Б, Эмбриологическое
исследование Eruca sativa Lam. — Вест. МГУ.
Биол., почвовед., 19666, № 1, с. 61—67.
Родионова Г. Б. Мегаспорогенез у Hesperis
steveniana DC. — Вест. МГУ. Биол.,
почвовед., 1966в, № 5, с. 68—72.
Родионова Г. Б.
Сравнительно-эмбриологическое исследование семейства
крестоцветных (Cruciferae Juss.). — Автореф. канд.
дис. М., 1967а, 19 с.
Родионова Г. Б. Оплодотворение у Hesperis
steveniana DC. — Науч. докл. высш.
школы биол. н., 19676, № 12, с. 73—78.
Родионова Г. Б. О развитии женского
археспория в семействе крестоцветных. —
В кн.: Рефераты докл. Всесоюз. межвуз.
конф. по морфологии растений. М., 1968а,
с. 244-245.
Родионова Г. Б. О строении семяпочек
крестоцветных. — В кн.: Матер. Всесоюз.
симп. по эмбриологии растений. Киев,
19686, с. 186—187.
Родионова Г. Б. Эмбриологическое развитие
Erysimum pannonicum Crantz. — Вестн.
МГУ. Биол., почвовед., 1971а, №5, с. 52—
57.
Родионова Г. Б. Эмбриология Lunaria
annua L. — Вестн. МГУ.* Биол., почвовед.,
19716, № 4, с. 59-63.
Родионова Г. Б. Эмбриологическое
исследование Hesperis steveniana DC. — В кн.:
Морфология цветковых растений. М.,
1971в, с. 34—54.
Родионова Г. Б. Развитие семяпочки и ин-
тегументов у Heliophila amplexicaulis L. —
Бот. журн., 1972, т. 57, с. 1153—1161.
Родионова Г. Б. Эмбриологическое развитие
Heliophila amplexicaulis L. в связи с ее
положением в системе крестоцветных
(Cruciferae Juss.). — В кн.: Эмбриология
покрытосеменных растений. Кишинев, 1973,
с. 70.
(Родионова Г. Б.) Rodionova G. В,
Embryology of Cruciferae compared with related
families. — В кн.: Тез. докл. XII МБК.
* Л., 1975, т. 1, с. 231.
Родионова Г. Б. Филогенетические связи
Cruciferae и взаимоотношения семейств
порядка Rhoeadales по данным
эмбриологии. — В кн.: Матер. V совещ. по
филогении растений. М., 1976а, с. 144—146.
Родионова^ Г. Б. Эмбриологическое развитие
Macropodium (Pall.) R. Br. из семейства*
крестоцветных. — В кн.: Рост растении
и пути его регулирования. М.\ 19766,
с. 126—139.
Родионова Г. Б. Особенности развития и
основные пути эволюции в эмбриологии
крестоцветных. — В кн.: Тез. докл.
VII Всесоюз. симп. по эмбриологии
растений. Киев, 1978а, ч. 3, с. 79—81.
Родионова Г. Б, О развитии кроющих
клеток в семействе крестоцветных (Brassica-
сеае). — В кн.: Тез. докл. VI Делегат,
съезда ВБО. Л., 19786, с. 110.
Родионова Г. Б. Развитие микроспорангиев
и мужского гаметофита у Bunias и Arabis
(Cruciferae Juss.). — В кн.: Рост растений
и пути его регулирования. М., 1978в,
с. 78—82.
Родионова Г, Б.) Rodionova G. В. Peculiar
features of ontogenesis of the ovule in
Heliophila (Cruciferae Juss) before and after
fertilization. — Bull. Soc. bot. France,
1978г, v. 125, N 1—2, p. 279—283.
Родионова Г. Б, Развитие женских
эмбриональных структур, эндосперма и зародыша
у свербиги восточной. — Бюл. Гл. ботан.
сада. АН СССР, 1979а, вып. 113, с. 90—95.
Родионова Г. Б. Эмбриология резухи
кавказской. — Бюл. Гл. ботан. сада.
АН СССР, 19796, вып. 111, с. 98—106.
Родионова* Г. Б, Эмбриология семейства
Саррагасеае. — Докл. МОИП, Зоол. и бот.
(1979), 1981, с. 114—118.
Родионова Г. Б. Положение крестоцветных
и родственных семейств в системе
покрытосеменных по данным эмбриологии. —
В кн.: Матер. VI совещ. по филогении
растений. М., 1982, с. 110—111.
Романов И. Д. Сравнительная эмбриология
рода Gossypium. — В кн.: Краткое
содержание и направление
исследовательских работ ЦСС Союз НИ ХИ. Ташкент,
1936а, с. 55.
Романов И. Д. Развитие зародышевого мешка
в роде Gossypium. — В кн.: Вопросы
цитологии и анатомии хлопчатника. Ташкент,
19366, с. 17—35.
Романов И. Д. Развитие зародыша и
эндосперма. — В кн.: Строевие и развитие
хлопчатника. М.; Л., 1937а, с. 25—27.
Романов И. Д. Развитие семяпочки,
зародышевого мешка, оплодотворение. — В кн.:
Строение и развитие хлопчатника. М.;
Л., 19376, с. 23—25.
Романов И. Д. Эмбриологические
исследования хлопчатника. I. Развитие спорообра-
зующих клеток в семяпочках. — Тр.
Среднеаз. ун-та, 1964, вып. 53, биол. н.,
кн. 17, с. 3—58.
Романов И. Д. .Эмбриологические
исследования хлопчатника. П. Макроспорогенез
. и изменчивость формы тетрад
макроспор. — Тр. Среднеаз. ун-та, 1955, вып. 73,
биол. н.,- кн. 20, с. 3—46.
Романов И. Д. Развитие семяпочек и заро-
* дышевого мешка..— В кн.: Хлопчатник.
Ташкент, 1960, с. 326—355.
Романова Г. С. Опыление и оплодотворение
у ладанника (Cistus L.). — Бюл. Никитск.
ботан. сада, 1968, вып. 1 (7), с. 60—65.
Романова Г. С. Цитоэмбриологические
исследования некоторых видов цистуса. —
Тр. Никитск* ботан. сада, 1970, т. 46,
с. 184—193.''
Руденко Ф. Е. Строение мужского
гаметофита покрытосеменных. — Науч.'зап.
Ужгород, ун-т* 1957, т. 23, с. 3—35.
Рудепка Ф< Е. Значение мужского гамето-
20*
307
фита для , систематики
покрытосеменных. — Бот. журн., 1959, т. 44, № 10,
с. 1467—1475.
Руденко Ф. Е. Некоторые данные о процессе
оплодотворения у высокогорных растений
Карпат. — В кн.: Проблемы современной
эмбриологии. М., 1964, с. 106—110.
Руденко X. Ю. Макроспорогенез у Pyrola
rotundifolia — Науч. зап. Ужгород, ун-та,
1947, вып. 1, с. 30—40.
Руденко X. Ю. Зашпднення у деяких висо-
копрних рослин Карпат. — Укр. ботан.
журн., I960, т. 17, № з, с. 34—41.
Руми В. А. Развитие пыльцы и мужского
, гаметофита хлопчатника. — В кн.:
Хлопчатник. Ташкент, 1960, с. 305—325.
Руми В. А. Процесс образования
генеративной клетки у хлопчатника. — Узб. биол.
журн., 1964, № 1, с. 78—82.
Руми В. А. О спермиогенезе. у
хлопчатника. — Узб. биол. журн., 1964, № 4,
' с. 71—76.
Руми В. А. Об образовании и роли тапе-
тальной ткани в пыльниках
хлопчатника. — В кн.: Вопросы генетики и
эмбриологии хлопчатника. Ташкент, 1966а,
с. 41—48.
Руми В. А. Морфология пыльцы четырех
видов хлопчатника. — В кн.: Вопросы
генетики и эмбриологии хлопчатника.
Ташкент, 19666, с. 25—33.
Руми В. А. Обзор работ по цитоэмбриологии
хлопчатника в институте
экспериментальной биологии растений АН УзбССР. —
Бот. журн., 1967, т. 52, № 1, с. 109—115.
Руми В. А. Эмбриология хлопчатника.
Ташкент, 1969. 200 с.
Руми В. А., Власова И. А., Раджабова Д. X.
Микроспорогенез и формирование пыльцы
у отдаленных гибридов хлопчатника. —
В кн.: Матер. Всесоюз. совещ. по
опылению и оплодотворению у растений. Киев,
1982, с. 123—125.
Руми В. А.,• Камалова Г. В. О хлорофил-
лоносности зародышей мальвовых. —
ДАН УзСССР, 1975, № 4, с. 63—64.
Руми В. А., Камалова Г. В., Серебрякова
Л. Е. О микроспорогенезе у Hibiscus
rhanihot L. — Цитология и генетика, 1976,
т. 10, № 2, с. 107—110.
Руми В. А., Серебрякова Л. Е., Камалова
Г. В. Биология цветения, оплодотворение
и эмбриогенез у Althea broussonetiifo-
lia. — Узб. биол. журн., 1976, № 1,
с. 67—69.
Руми В, А., Скокова А. А., Асриян Н. С.
Процесс оплодотворения й развитие
зародыша у новосветских диких видов
хлопчатника. — Узб. биол. журн., 1976, № 3,
с. 63—64.
Саакян Т. А. Эмбриологическое изучение
процесса оплодотворения хлопчатника при
разных способах опыления. — Изв.
АН АрмССР, биол. н., 1962, т. 15, № 7,
с. 59—65.
Савченко М. И. Морфология семяпочки
покрытосеменных растений. Л., 1973. 110 с.
Саидов Д. К., Ашурметов А. А., Дзевалтов-
ский А. К. Семяпочка и венский гамето-
фит у переступня черноплодного '(Bryonia
melanocarpa Nat.) — ДАН УзССР, 1975,
№ '6, с. 45—47.
Салахова Г. Б. О некоторых особенностях
микроспородагеза и развития мужского
308
гаметофита у конского щавеля (JRumex
confertus WillcL)- в связи с неполным
диморфизмом его цветков. — В кн.: Сб.
кратк. сообщ. Казан. ун:та. Ботан.,
почвовед., 1968, вып. 1, с. 35—37.
Салахова Г. Б. Микроспорогенез и мужской
гаметофит Rumex confertus Willd. в связи
с сексуализацией его особей. — В кн.:
Половой процесс и эмбриогенез растений.
" М., 1973, с. 207—209. (Матер. Всесоюз.
симп.).
Салахова Г. Б. Макроспорогенез, женский
гаметофит и оплодотворение Rumex
confertus Willd. в связи с особенностями его
сексуализации. — В кн.: Тез. докл. VII
Всесоюз. симп. по эмбриологии растений.
Киев, 1978, ч. 1, с. 48—50.
Салахова Г. Б. Морфологическое и цитоэм-
бриологическое исследования Rumex
confertus Wild, в связи с его половым
полиморфизмом. Автореф. канд. дис.
Кишинев, 1982. 17 с.
Салахова Г. Б., Смирнов А. Г. Некоторые
особенности строения цветков конского
щавеля в связи с формирующимся половым
полиморфизмом. — В кн.: Матер. V Мо-
сков. совещ. по филоген. раст. М., 1976,
с. 149—151.
Салахова Г. Б., Смирнов А. Г. О некоторых
аномалиях в строении цветков у конского
щавеля. — В кн.: Аспирантские работы.
Казань, 1978, с. 24—30.
Санкин Л. С, Рыжов А. В. Выявление
гаплоидного сеянца среди полиэмбрионов
дыни. — В кн.: Апомиксис у растений
и животных. Новосибирск, 1978, с. 148—
151. (Тр. Биол. ин-та СО АН СССР).
Сафарян И. М., Далакян Л. Н.
Самооплодотворение у гвоздики шабо. — Биол.
журн. Армении, 1980, т. 33, с. 664—667.
Скворцов А. К. Ивы СССР. М., 1968. 30 с.
Сладкое А. Н. Морфологическое описание
пыльцы грушанковых, вертляницевых,
вересковых, брусничных и ворониковых
европейской части СССР. — Тр. Ия-та геогр.
АН СССР, 1954, т. 61, с. 119-156.
Смыченко А. А. Гистохимическое
исследование пыльцы и пыльцевых трубок
желтушника серого, выращенных на
искусственной среде. — В кн.: Матер, итоговой науч.
конф. Запорож. мед. ин-та. Киев, 1970,
с. 37—38.
Смыченко А. А. Биология цветения, плодо-
образования и накопление сердечных гли-
козидов в генеративных органах
желтушника серого. Автореф. канд. дис. Одесса,
1971. 16 с.
Смыченко А. А., Ткаченко В. Г., Беляева
Л. Е. Лoкaлiзaцiя глiкoзидiв в тканинах
генеративних оргашв жовтушника ci-
рого. — Укр. боташчний журн., 1970,
т. 27, № 6, с. 768—770.
Смыченко А. А., Ткаченко Г. В., Беляева Л. Е.
Бшлопя цвтння i зашпднення
жовтушника cipyeaToro (Erysimum canescens
Roth.). — Укр. боташчний журн., 1971,
т. 28, № 6, с. 721—726.
Соболев А. М., Суворов В. И., Сафонова
М. П., Прокофьев А. А. Изучение образо- \
вания запасных белков в эндосперме
созревающих семян клещевины. — Физиол.
растений, 1972, т. 19, № 5, с. 1047—1052.
Соколов И, Д. Розвиток насшного зачатка
у Arabidopsis thaliana (L.) Heynh. — Укр.
боташчний журн., 1975, т. 32, № 4,
с. 518-521.
Соколов П. Д., Исомиддинова Дж. О
строении плода и семени некоторых видов
Polygonum L. — Узб. биол, журн., 1978,
№ 2, с. 35—39.
Тахтад'жян А. Л. Система и филогения
цветковых растений. М.; Л., 1966. 611 с.
Тер-Аванесян Д. В. Индийские
хлопчатники. — Бюл.. Всесоюз. ип-та
растениеводства, 1962, № 10, с. 18—24.
Терёхин Э. С. Развитие эндосперма и
характер роста зиготы у европейских груша-
нок. — Бот. журн., 1962а, т. 47, № 2,
с. 254—258.
Терёхин Э. С. О развитии зародышей у
некоторых Pyrolea—Monotropoideae. — Бот.
журн., 19626, т. 47, № 12, с. 1811—1816.
Терёхин Э. С. Развитие семяпочки и
женского гаметофита у Pyroleae и Monotro-
реае. — Бот. журн., 1963, т. 48, № 3,
с. 406—414.
Терзийски Д. Въху някои особенности на
ембриогенните процеси и характера на
полиембрииониято при Spergula arven-
sis L. — Генет. и селекция (НРБ), 1974,
т. 7, № 4, с. 322—330.
Тер мена Б. Бюлогичт особливост! цвтыня
та плодоношения актишдп гостро'1 (Acti-
nidia arguta). — В кн.: 1нтродукщя та
акл1матизащя рослин на Украшь Киев,
1976, вып. 8, с, 43—48.
Тиаги Я. Д. Эмбриологические и
анатомические исследования Cactaceae в связи
с положением семейства в системе
покрытосеменных - растений. — Вести. МГУ.
Биол. почвовед., 1960, № 4, с. 21—31.
Трухалева Н. А. Некоторые
морфологические и биологические особенности Alcea
lenkoranica Iljin. — Растительи. ресурсы,
1971, т. 7, вып. 2, с. 186—192.
Туркевич М. В. Особливост1 насшня з р1зних
частин кропи дерева. — Наук. зап. Ки-
1вськ. ун-ту, 1955, т. 13, № 15, с. 109—117.
Турсунов Д. Ю. Особенности цветения и
плодоношения Gypsophila paniculata. —
В кн.: Матер, по физиол. и экол. раст.
Средней Азии. Ташкент, 1966, с. 100—104.
Турсунов Д. Ю. Микроспорогенез и спермио-
генез у мыльнянки лекарственной. —
ДАН УзССР, 1967, № 10, с. 52-54.
Турсунов Д. Ю. Биология цветения и цито-
эмбриология видов '«мыльного корня».
Автореф. канд. дис. Ташкент, 1969а. 17 с.
Турсунов Д. Ю. Микроспорогенез и снер-
миогенез у Gypsophila paniculata L. —
ДАН УзССР, 19696, № 6, с. 55—57.
Турсунов Д. Ю. Цитоэмбриология
Gypsophila paniculata и Gypsophila tricho-
toma. — В кн.: Матер. V Всесоюзн. совещ.
по эмбриологии растений. Кишинев, 1971,
с. 179-180.
Турсунов Д. Ю. Развитие женского
гаметофита у мыльнянки лекарственной. —
ДАН УзССР, 1972, № 3, с. 60—62.
Турсунов Д. Ю. Опыление и оплодотворение
у колючелистника метельчатого и качимо-
видного. — В кн.: Половой процесс и
эмбриогенез растений. М., 1973, с. 239—
240. (Матер. Всесоюз. симп.).
Турсунов Д. Ю. Развитие женской
генеративной сферы у колючелистника качимо-
видного — Acanthophyllum gypsophiloi-
des Rgl. — В кн.: Морфобиологические
особенности дикорастущих растений
Узбекистана. Ташкент, 1974а, с. 108—111.
Турсунов Д. Ю. Семяпочка и женский гаме-
тофит у Gypsophila paniculata L. и G. tri-
chotoma Wend. — В кн.: Морфобиологи-
ческие особенности дикорастущих
растений Узбекистана. Ташкент, 19746, с. 111 —
115.
Турсунов Д. Ю. Эмбриология некоторых
представителей сем. Caryophyllaceae. —
В кн.: Тез. докл. XII МБК. Л., 1975, ч. 1,
с. 266.
Турсунов Д. Ю. Развитие мужской
генеративной сферы у Acanthophyllum gypso-
philoides Rgl. — В кн.: Биологические
и морфологические особенности полезных
растений Узбекистана. Ташкент, 1976,
с. 80—84.
Турсунов Д. Ю. К эмбриологии рода
Acanthophyllum С. А. Меу. — В кн.: Матер,
совещ. по филогении центросеменных. М.,
1977, с. 58-60.
Турсунов Д. Ю. О диморфизме цветков
у Gypsophila paniculata и L. perfo-
liata L. - ДАН УзССР, 1980а, № 4,
с. 57—58.
Турсунов Д. Ю. Жизнеспособность мужского
и женско""го гаметофитов у Acanthophyllum
paniculatum Rgl. (сем. Caryophyllaceae). —
ДАН УзССР, 19806, № 8, с. 58—59.
Турсунов Д. Ю. К изучению эндосперма рода
Acanthophyllum С. А. Меу.
(Caryophyllaceae). — В кн.: Матер. VI Моск.
совещания по филогении растений. М., 1981,
с. 125—127.
Турсунов Д. Ю., Матюнина Т. Е.
Микроспорогенез и развитие мужского
гаметофита у Acanthophyllum krascheninnicovii
Schischk. и A. elatius Bge. — В кн.:
Перспективные сапониносные растения и опыт
их культуры. Ташкент, 1976, с. 72—
82.
Турсунов Д. Ю., Матюнина Т. Е. Развитие
женской генеративной сферы у
колючелистника Крашенинникова —
Acanthophyllum krascheninnikovii Schischk. и
колючелистника высокого — A. elatius
Bge,— В кн.: Биологические и
структурные особенности полезных растений
Узбекистана. Ташкент, 1977, с. 109—113.
Турсунов Д. Ю., Матюнина Г. Е. О строении
стенки пыльника у некоторых
представителей рода Acanthophyllum С. А. Меу. —
В кн.: Эколого-биологические особенности
важнейших сырьевых растений в
культуре. Ташкент, 1978,, с. 72—78.
Турсунов Д. Ю., Матюнина Т. Е. Развитие
мужской генеративной сферы
Acanthophyllum subglabrum Schischk. и A. leioste-
gium Vved. — В кн.: Биологические
и структурные особенности полезных
растений Узбекистана. Ташкент, 1979,
с. 87—91.
Турсунов Д. Ю., Матюнина Т. Е. Опыление
и оплодотворение важнейших
представителей сапониноносных растений рода
Acanthophyllum С. А. Меу. — В кн.:
Матер. Всесоюз. совещ. по опылению
и оплодотворению у растений. Киев,
1982, с. 267—269.
Турсунов Д. Ю., Матюнина Т. Е.,
Савинова Г. Ю.
Сравнительно-эмбриологическое исследование важнейших представи-
309
телей сапонинонос'ных растений рода
Acanthophyllum С. А. Меу. — В кн.:
с Матер. VII Всесоюз. симп. по
эмбриологии растений. Киев, 1978, с. 57—59.
Турсунов Д. Ю., Савинова Г. Ю. Процесс
оплодотворения у Acanthophyllum elatius
Bge. и * A. krascheninnikovii Schischk. %—
В кн.: Биологические и
структурные особенности полезных растений
Узбекистана. Ташкент, 1977, с. 105—
109.
Турсунов Д. Ю., Савинова Г. Ю. Эндоспермо-
эмбриогенез у колючелистника
железистого. — В кн.; Биологические и
структурные особенности полезных растений
Узбекистана. Ташкент, 1979, с. 101—104.
Тутаюк В. X. Строение махровых цветков.
Баку, 1960. 227 с.
Тутаюк В. X, Филогенетическое значение
тератологических изменений органов
цветка. — В кн.: Проблемы онкол. и те-
ратол. растений. Л., 1975, с. 30—32.
Тутаюк В. X., Мурадов А. Т. Хирник (Dio-
spyros kaki L.) де мегаспорокинез вэ диши
гатетин инкишафы. — Уч. зап. Аз. с.-х.
ин-та, 1967, № 2, с. 142-149.
Тутаюк В. X., Мурадов А. Т. Развитие
тычинок и микроспорогенез у восточной
хурмы. — Учен. зап. Азерб. с.-х. ин-та
им. Агамалиоглы, сер. агроном., 1969,
№ 4, с. 10—13.
Ужарова Т. В. К эмбриологии красной
махровой формы шток-розы. — В кн.: Вопросы
ботанических исследований в
Узбекистане. Ташкент, 1977, с. 78—80. (Тез.
докл. I Республ. конф. молодых ученых).
Усанов М. Ультраструктура клеток
семяпочек и стенки пыльников хлопчатника. —
В кн.: Генетика, основы мед. и селекции
растений и животных организмов.
Ташкент, 1977, с. 26-32.
Устинова Е. И. К физиологии прорастания
пыльцы лиственных древесных пород. —
ДАН СССР, 1951, т. 80, № 3, с. 457—460.
Устинова Е. И. Биология цветения
лиственных древесных пород. — Лес. х-во, 1952,
- № 1, с. 57—58.
Устинова Е. И. О ритме развития
цветочных почек у лиственных древесных по-
4 род. — Бюл. Моск. о-ва испыт. природы.
Отд-ние биол., 1958, т. 63, № 6, с. 107—
115.
Устинова Е. И., Дьякова М. И., Щедрина
Р. Н. Развитие зародыша и эндосперма
у Mirabilis jalapa L. при ограниченном
опылении. — Науч. докл.» высш. школы.
Биол. н., 1961, № 3, с. 173—179.
{Фаворский Н.) Favorsky N. Materialen zur
Biologie und Embryologie der Zucker-
rtibe. — Trudy Nauch. Inst. Selek., 1928,
Bd 2, S. 1—18.
Фаминцин А. Эмбриологические
исследования. — Зап. Рос. АН, 1879, т. 7, № 26
(10), с. 1-19.
Фурса Н. С, Беляева Л. Е., Чайка Е. А.
Биохимические особенности процессов
опыления и оплодотворения ,
лекарственных» растений семейства Brassicaceae,., —
В кн.: Матер. Всесоюз. совещ. по
опылению и оплодотворению у растений. Киев,
' 1982, с. 196—198.
Фурсов В. П., Беспаев С. Б. Некоторые
цитоэмбриологические данные
колючелистника качимовидного. — Тр. Алма-Ат.
ботан. сада АН КазССР, 1963, т. 7, с. 121 —
124.
Харченко Л. Н. Обмен липидов в процессе
созревания семян сарептской горчицы. —
Физиол. растений, 1973, т. 20, № 1,
с. 123—129.
Хвостова И. В. Изменение состава белков
и липидов семян клещевины в
зависимости от температуры выращивания
растений. — Физиол. растений, 1981, т. 28,
№ 4, с. 797—801.
Худяк М. И., Заславский В- А. Особливост!
утворення ендоспермальыого гаустор1я
Cucurbita pepo L. i С. maxima Duch. та
при ix схрещуваннь — В кн.: Матер.
V съезда УБО. Ужгород, 1972, с. 235.
(Тез. докл.).
Худяк М. И., Попова А. Ф. Формирование
гибридных семян при реципрокных
скрещиваниях Cucurbita maxima с Cucurbita
pepo. — В кн.: Матер. V Всесоюз. совещ.
по эмбриологии растений. Кишинев, 1971 у
с. 191—193.
Цао Хуэйцзюанъ. Эмбриология Camellia
oleosa Rehd. — Acta bot. sinica, 1965,
v. 13, N 1, p. 44-53.
Цингер Н. В. СемЯ, его развитие и
физиологические свойства. М., 1958. 286 с.
Чабан И. А. Эмбриогенез и эндоспермогенеа
Reseda lutea L. и Chelidonium majus L.
по данным световой и электронной
микроскопии. Автореф. канд. дис. Л., 1975.
26 с.
Чабан И. А. Электронномикроскопическое
исследование эндосперма у Reseda
lutea L. — В кн.:. Актуальные вопросы
эмбриологии покрытосемянных растений.
-Л., 1979, с. 58—70.
Чабан И. А., Яковлев М. С. Эмбриология
Reseda lutea L. I. Мегаспорогенез и
развитие зародышевого мешка. — Бот. журн.,
1974, т. 59, № 1, с. 24-37.
Чайка Е. А. Биология цветения, плодообра-
зования двурядки тонколистной и
содержание в ее органах некоторых
микроэлементов. Автореф. канд. дис. Одесса, 1975.
18 с.
Чайка Е. А., Беляева Л. Е. Развитие гаме-
тофитов двурядки тонколистной. — В кн.:
Матер, итоговой науч. конф. Запорож.
мед. ин-та. Киев, 1970, с. 48—49.
Чайка Е. А., Беляева Л. Е., Смыченко А. А.
К эмбриологии двурядки тонколистной. —
В кн.: Матер. V Всесоюз. совещ. по
эмбриологии растений. Кишинев, 1971,
с. 194—195.
Чалахян Л. Н. Данные
цитоэмбриологических исследований некоторых
представителей семейства тыквенных Армянской
ССР — Уч. зап. Ереван, ун-та, 1965,
вып. 97, с. 3—9.
Шадманов Р. К. Сравнительная
характеристика белковых комплексов семян
представителей родов семейства Malvaceae. —
В кн.: Эволюционная биохимия растений.
М., 1964а, с. 128—137.
Шадманов Р. К. Белковые комплексы семян
некоторых видов рода Hibiscus — Бюл.
Гл. ботан. сада, АН СССР, 19646, вып. 52,
с. 98-100.
Шамров И. И. Эмбриология семейства Се-
- ratophyllaceae (роголистниковые) в связи
с его систематическим положением.
Автореф. канд. дис. Л., 1981. 20 с.
Я10
Шанайда Н. Д., Барна И. Н. Развитие
семяпочек pi формирование женского ар-
хеепория у чозении крупночешуйчатой-. —
В кн.: Тез. докл. VII Всесоюз. симп. по
эмбриологии растений. Киев, 1978, ч. 3,
с. 110—112.
Шарапов Н. И. Масличные растения и масло-
образовательный процесс. М.; Л., 1959.
441 с.
Шашкин И. Н. Актинидии, их свойства,
сорта и перспективы культуры. — В кн.:
Восточноазиатские виды косточковых
актинидий. М., 1937, с. 86—169.
Шевчук Л. П., Конычева В. И.
Микроспорангий, микроспорогенез и , развитие
мужского гаметофита у- саксаула
безлистного. — В кн.: Морфогенез растений
аридной зоны. Ташкент, 1973, с. 55—60.
Шилова Н. В. Строение зародыша и
проростка в подсемействе Andromedoideae
(Drude) E. Buch. — Бот. жури., 1962,
т. 47, № 3, с. 344—353.
Ширяева Э. И. Гистохимическое изучение
ди- и тетраплоидной сахарной свеклы. —
Цитология и генетика, 1971, т. 5, №4,
с. 364—367.
Ширяева Э. И. Цитолого-эмбриологические
и гистохимические особенности опыления
и оплодотворения у разных форм сахарной
свеклы. — В кн.: Матер. Всесоюз. совещ.
по опылению и оплодотворению у
растений. Киев, 1982, с. 269—272.
Шишкин Б. К. Диапенсиевые — Diapensia-
ceaeLundl. — Флора СССР. М.; Л., 1952,
т. 18, с. 105—108.
Шнайдер Т:, Силъвере А . П. Полиэмбриония
у рапса. — Изв. АН ЭССР. Биол.; 1974,
т. 23, с. 267—270.
Якобсон Л. Я. Спермиогенез у Rhododendron
mucromelatum Turcz. — Науч. докл.
высш. школы. Биол. п., 1968а, № 6,
с. 65—71.
Якобсон Л. Я. Развитие пыльников у
рододендронов. — Изв. АН ЛатвССР, 19686,
т. 257, № 12, с. 101—109. .
Якобсон Л. Я. Образование и развитие спер-
миев у Rhododendron luteum Sweet. —
В кн.: Вопросы биологии. Рига, 1969,
с. 41—46.
Якобсон Л. Я. Развитие тапетума пыльника
и особенности микроспорогенеза у
рододендронов. — В кн.: Интродукция
растений в ботанических садах Прибалтики.
Рига, 1974, с. 56—62.
Якобсон Л. Я. Эмбриологические
исследования рододендронов. — Изв. АН
ЛатвССР, 1976, т. 352, № 11, с. 84—96.
Яковлев М. С. О единстве эмбриогенеза
покрытосеменных и голосеменных
растений. — Тр. Ботан. ин-та АН СССР. Сер. 7,
1951, вып. 2, с. 356—363.
Яковлев М. С. Основные типы полиэм&рио-
нии высших растений. — Тр. Ботан. ин-та
АН СССР. Сер. 7, 1957, вып. 4, с. 201 —
210.
Яковлев М. С. Принципы выделения
основных эмбриональных типов и их значение
для филогении покрытосеменных. — В кн.:
Проблемы ботаники. Л., 1958, вып. 3,
с. 168—195.
Яковлев М. С. Эмбриогенез и его значение для
филогении растений. М.; Л., 1960. 40' с.
Яковлев М. С, Алимова Г. К. Эмбриогенез
у Arabidopsis thaliana (L.) Heynh. (Cru-
ciferae). — Бот. журн.,, 1976, т. 61, № 1,
с. 12—24. > ' --
Яковлщ M\-'G.\ Жукова Г. Я.
'Покрытосеменные растения с зеленым и бесцветным
зародышем (хлоро- и лейкоэмбриофиты).
Л., 1973. 100 с.
(Яковлев М. С:, Жукова Г. Я-.) Yakovlev
М. S., Zhukova G. Ya. Chlorophyll iri
embryos of angiosperan seeds, a~ review. —
Bot. Jiotis., 1980, v. 133, p. 323—336.
Яковлев M. С., Иоффе М- Д. Особенности
эмбриогенеза рода Paeonia. — Бот. журн.,
1957а, т. 42, с. 1491—1502.
(Яковлев М. С., Иоффе М. Д.) Yakoblev
M.S., Yofje M. D. On some peculiar
features in the embryogeny of Paeonia L. —
Phytomorphology, 19576, v. 7, N 1, p. 74—
82.
'(Яковлев М. С, Иоффе M. Д.) Yakovlev
M.S., Yoffe M. D. New type of embryo-
genesis in Paeonia L. — IX Intern. Bot.
„ Congr. Monreal, 1959, v. 2, p. 437—438.
Яковлев М. С, Иоффе М. Д. Мегаспорогенез
у Paeonia anomala L. — В кн.: Вопросы
эвол., биогеогр., генет. и сел. М.; Л.,
1960, с. 320—325.
Яковлев М. С, Иоффе М. Д. Эмбриология
некоторых представителей рода Paeonia. —
В кн.: Морфология цветка и
репродуктивный процесс у покрытосеменных растений.
М.; Л., 1965, с. 140—176. (Тр. Ботан.
ия-та АН GCCP).
Яковлев М. С, Чабан И. А.
Ультраструктурные аспекты эмбриогенеза Reseda lu-
tea L. — В кн.: Актуальные вопросы
эмбриологии покрытосемянных растений. Л.,
1979, с. 96-104.
Яковлева Г. В. Оплодотворение у
ремонтантной гвоздики. — В кн.: Тез. докл.
VII Всесоюз. симп. по эмбриологии
растений. Киев, 1978, ч. 2, с. 69—70.
Agharkar S. P., Banerji I. The development
of the embryo sac in Carica papaya. — J.
Dept. Sci. Univ. Calcutta, 1933, v. 10,
p. 1—8.
Agrawal J. S., Singh S. P. Nucellular poly-
embryony in Momordica charantia Linn. —
Sci. and Cult., 1957, v. 22, N 11, p. 630—
631.
Ahuja J. R. Environment and rate of growth
of embryo in Brassica campestris var. to-
ria. — Curr. Sci., 1955, v. 24, p. 205—206.
Ahuja J. R., Bhaduri P.N. The embryology
of Brassica campestris var. toria Duth.
et Full. — Phytomorphology, 1956, w. 6,
N 1, p. 63-67.
Allan P. Pollen studies in Carica papaya.
1. Formation, development, morphology
and production of pollen. — S. Afr. J. Agr.
Sci., 1963a, v. 6, p. 517—530.
Allan P. Pollen studies in Carica papaya. 2.
Germination and storage of pollen. — S.
Afr. J. Agr. Sci., 1963h v. 6, p. 613—624.
Amato F. di. Ricerche embryologiche e caryo-
logiche sul genere Euphorbia. — N. G. Bot.
Ital., 1939, v. 46, p. 470—509.
Amato F. di. Nuovo ricerche embryologiche
e caryologiche sul genere Euphorbia. —
N. G. Bot. Ital., 1946, v. 53, p. 405—
436.
Amato F. di. Triploidia e apomissia in Sta-
tice oleaefolia Scop. var. confusa Godr. —
Caryologia, 1949, v. 2, N 1, p. 71—84.
Andrews F. M. The development of the em-
311
bryo saq of Hybanthus concolor. — Bull.
Tqrrey Bot, Club, 191Q, v. 37, p. 447-478.
Archibald E. B. A. Tlje development of the
ovule and seed of jointed castus (Opuntia
aurautiaca ЫпсЦеу). — S. Afr. J. Sci.,
193$, v. Щ, p. 195^-211.
Агеца jjf.? Villari if. et al. Variazioni delle
svilu/ppo del gametofitp femminile in Mori-
candia arvetfsjs! (t.) DC. — Inform. Bot.
Hal., 1977, v, 9, N 1, p. 31—35.
Artschwager P. Bevelppment of flowers and
seed in the sugar £eet. — J. Agr. Res.,
1927a, v. 34, p. lr-25.
Artschwager Д. Micro- and macrosporogenesis
.in sugar ЬеД w|th special reference to the
problem @,f inpojnpatibility. — Mem. Hort.
Soc. N. Y., 1927b, v. 3, p. 295-297.
Artsch\pdger E, pbUen degeneration in male-
sterile sugar beets, with special reference
to the jtap^taj plasmodium. — Amer. J.
B()t., 1946, f. 33, p. 817.
Artschwagqr E< РоДеп degeneration in male-
sterile sugar fceeis, with special reference
to the tapetal plasmodium. — J. Agr. Res.,
19m, vi 75, p, 191—197.
Artschwager E., Starrett R. С The time factor
in fertilization and embryo development in
the sugar beet- — J. Arg. Res., 1933, v. 47,
p. 823-843.
Artopoms A, Pber den Bau und die Offnungs-
Wffse der Antheren und die Entwicklung
der Samen $er Erikaceen. — Flora, 1903,
Bd 92, H, 3? $. 309-345.
Asana /. /.'i Qutaria R. N. A cytological study
of pollen development in Carica papaya
Linn. — J.' Indian Bot. Soc, 1929, v. 8,
p. 235-244,
Анапа J. J,, Sutaria R. N. Microsporogenesis
in Luff a aegyptica Mill. —J. Indian Bot.
Soc:, 19$?, y. 11, N 3, p. 181-187.
As[hley T. Zygote shrinkage and subsequent
development in some Hibiscus hybrids. —
Planta, 1972, v. 108, N 4, p. 303-317.
Ashley T. Fine structure of early endosperm
development in Hibiscus. — Caryologia,
1975a, v. 28, N 1, p. 63—71.
Ashley T. Alterations in the fine structure of
developing endosperm of Hibiscus
hybrids. — Caryologia, 1975b, v. 28, N 1,
p.' 73-80.
Audran J.-C, Batcho M. Microsporogenesis
and pollen grains in Silene dioica (L.) Cl.
and alterations in its anthers parasited by
Ustilago violaceae (Pers.) Rouss. (Ustila-
ginales). — Acta Soc. bot. pol., 1981, v. 50,
N 1—2, p. 29—32.
Baillon H. Etude generale du group des Euphor-
biacees. Paris, 1858. 684 p.
Baillon H. Styracaceae. — In: Histoire des
plantes. Paris, 1877, t. 11, p. 414—416,
458, 461.
Baillon H. E. Sapotacees. — In: Histoire des
plantes. Paris. 1891 (1892), t. 11, N 104,
p. 255-304.
Baillon H. E. Zissocarpa. — In: Histoire des
plantes. Paris, 1891 (1892), t, 11, p. 460.
Baillon H. E. Primulacees. — In: Histoire
des plantes. Paris, 1892, t. 11, p. 305—346.
Baker H. G. Adventitious embrуony in Pachira
(Bombacaceae) and its taxonomic
consequences. — Proc. IX Intern. Bot. Congr.,
1959, v. 2, abstracts, resumes, p. 14.
Baker H. G. Apomixis and polyembryony in
312
Pachira oleaginea (Bombacaceae). — Amer.
J. Bot., 1960, v. 47, N 4, p. 296—302.
Bakshi T. S. Floral morphology and
embryology of Psilostachys sericea Hook. f. —
Phytomorphology, 1952, v. 2, N 2, p. 151—
161.
Bala Bawa S. Theaceae. —Bull. Indian Nat»
Sci. Acad., 1970, N 41, p. 75—77.
Bambacioni-Mezzetti V. Sul Pembriologia
della Fritillaria messanansis e sull'oppor-
tunita di distinguere una serie Fritillaria
nel tipo Euphorbia dulcis. — Ann. bot.
(Ital.), 1947, v. 23, p. 1—23.
Banerji I. Studies in cotton pollen. — Agr.
J. Ind.,-1929, v. 24, p. 332—340.
Banerji I. The development of the embryo
sac and fertilization in jute. — J. Indian.
Bot. Soc, 1932, v. 11, N 3, p. 228—242.
Banerji I. The development of the flower and
pollen in jute. — Indian J. Agr. Sci.,
1933, v. 3, p. 116—126.
Banerji I. A note on the development of the
female gametophyte in Abroma augusta
and Pentapetes phoenicea. — Curr. Sci.„
1941, v. 10, p. 30.
Banerji I. The development of the female
gametophyte and floss in Bombax malabari-
cum. — Proc. Indian Acad. Sci. B, 1942r
v. 16, N 6, p. 205—211.
Banerji I. A contribution to the life history
of Acalypha fallax Muell. — Bull. Bot.
Soc. Bengal., 1949, v. 3, p. 29—32.
Banerji I. Pollen ,and embryo sac of two
Euphdrbiaceae. — Proc. Indian Acad. Sci.
B, 1951, v. 34, p. 172—181.
Banerji I., Das K. L. A note on the
development of the embryo sac in Trichosanthes
dioica. — Curr. Sci., 1937, v. 5, p. 427—
428.
Banerji I., Dutt M. K. The development of
the female gametophyte in some memrers
of the Euphorbiaceae. — Proc. Indian Acad.
Sci., 1944, v. 20, p, 51—60.
Banerji I., Sen S. A contribution to the
cytology and embryology of Hylocereus undatus
(Haw.) Br. — Bull. Bot. Soc. Bengal,
1954, v. 8, N 1-2, p. 18-23.
Bannier J. P. Untersuchungen uber apogamie-
Fortpflanzung bei einigen elementaren Arte»
von Erophila verna. — Rec. trav. Neerl.,.
1923, Bd 20, S. 1—106.
Barkovdan Y. J. Arevision of Gypsophilla
Bolanthus ankyropetulum and phruna.
Amsterdam, 1962, p. 17—22.
Barton L. V. Biochemical studies of dormancy
and after-ripening of seeds. II. Changes in
oligobasic organic acids and
carbohydrates. — Contribs. Boyce Thompson Inst.r
1961, v. 21, N 3, p. 147—161.
Battacharya S. S., Mitra J. N. The
development of the female gametophyte in Trium-
fetta rhomboidea. — Sci. and Cult., 1952r
v. 17, p. 343—344.
Battaglia E. Contributo all'embriologia delle
Tamaricaceae. — N. G. Bot. Ital., .J941r
v. 48, p. 575—612.
Battaglia E. Alcune osservazione sullo svi
luppo del gametofito femmineo della My-
ricaria germanica. — N. G. Bot. Ital.,
1943, v. 49, p. 464—467.
Bauer R. Entwicklungsgeschichtliche
Untersuchungen an Polygonaceen—Bluten. —
Flora, 1922, NF, Bd 115, H. 4, S. 272—292.
Baur E. Die Entstehung der elementaren Ar-
ten von Erophila verna. — Z. Abst. Ve-
rerb. Lehre, 1912, Bd 6. S. 186.
Beijerinck W. Galluna: a monograph of the
Scotch heather. — Kon. Ned. Acad. Wett.
Verh., 1940, v. 38, p. 1—180.
Bell H. В., Burchill F. Winter resting atages
of certain Ericaceae. — Can. J. Bot.,
1955, v. 33, N 6, p. 547—561.
Bell H. P. The development of the Bluebery
seed.— Can. J. Bot., 1957, v. 35, N 2,
p. 139-154.
Bergfeld R., Kiihnl Т., Schopfer P. Formation
of protein storage bodies during embryoge-
nesis in cotyledons of Sinapis alba L. —
Planta, 1980, v. 148, N 2, p. 146-156.
Beuzenberg E.I. Observation on sex
differentiation and cytotaxonomy of the New
Zealand species of the' Hymenantherinae (Vio-
laceae). — N. Z. J. Sci., 1961, v. 4, N 2,
p, 337—349.
Bhalla V. Life history of Euphorbia heliosco-
, pia. — Proc. 28th. Indian Sci. Congr.,
1941a, v. 3, p. 161.
Bhalla V. Sterility in Euphorbia royleana. —
Proc. 28th. Indian Sci. Congr., 1941b, v. 3,
p. 162.
Bhargava H. R. Contribution to the
morphology of Boerhaavia repanda. — J. Indian
Bot. Soc, 1932, v. 11, N 4, p. 303—326.
Bhargava H. R. Contribution to tfye
morphology of Mollugo nudicaulis Lamk. — Proc.
Indian Acad. Sci., 1934, v, 1, N 1, p. 271—
278.
Bhargava H. R. The life history of Trianthema
monogyna Linn. — Proc. Indian Acad. Sci.
B, 1935, v. 2, N 1, p. 49—58.
Bhargava H. R. The life history of Chenopo-
dium album. — Proc. Indian Acad. Sci.,
1936, v. 4, p. 179—200.
Bhargava H. R., Sawhney R. H.
Morphological studies in the Polygonaceae. I.
Contribution to the life history of Rumex denta-
tus. — J. Univ. Saugar,-i05S, v, 7, N 1,
p. 2—28.
Bhatnagar A. K. Embryological studies on
Euphorbia geniculata Orteg. and E. splen-
dens Boj. — M. Sc. (Hons. School) thesis.
Panjab Univ., 1970.
Bhatnagar S. P., Gupta M. Morphology and
embryology of Mimusops elengi L. — Bot.
notis., 1970, v. 123, N 4, p,- 455—473.
Bijok K. Cyto-embryological studies in
species Crambe abissinica Hochst. — Acta
I Soc. bot. pol., 1962, v, 31, N'l, p. 119—134.
J Bijok K. Badania cyto-embriologiczne nad
| gatunkiem Brassica juncea (L.) Czern. —
| Zesr. nauk. Wyzszej szkol. roln. Olsztynie,
[ 1966, v. 22, N 1, p, 108—122.
| Bijok K. Studia cyto-embryologiczne nad ga-
f tunkiem Crambe maritima L. — Zesz. nauk.'
I Wyzszej szkol. roln. Olsztynie, J966, v. 22,
I -N 1, p. 123-126.
I Billings F. H. Beitragfc zur Kenntnis der Sa-'
I menentwicklung. — Flora, 1901, , Bd 88,
1 S. 253—318.
I Billings F. H. Male gametophyte of Atriplex
t hymenelytra. — Bot. Gaz., 1934, v. 95,
I p. 477—484.
I Bittier G. Parthenogenesis und Variabitat
| der Bryonia dioica. — Abh. Naturwiss.
I Ver. Bremen, 1906, Bd 18, S. 99—107.
I Blank F. Beitrag zur Morphologie von Caryo-
car nuciferum L. — Ber. Schweiz. bot.
Ges., 1939, Bd 49, S, 437—494.
Bliss M. C. A contribution to the life history
of Viola. — Ann. Bot., 1912, v. 26, p. 155—
163.
Bocquet G. La structure de la colonne placen-
taire de l'ovaire des Garyophyllacees. —
Actes Soc. helv. Sci. Natur., 1958, t. 138,
p. 137-138.
Bocquet G. The structure of the placental
column in the genus Melandrium (Caryophyl-
laceae). — Phytomorphology, 1959, v. 9,
N 3, p. 217—221.
Bocquet G. The campylotropous ovule. — Phy-
tomorphology, 1959, v. 9, N 3, p. 222—227.
Bocquet G. Photoperiodisme et formation de
Tandrocee chez le Cerastium tomentosum
L. et le Melandrium diurnum (Miller)
Garcke (Caryophyllaceae). — Ber. Schweiz.
bot. Ges., 1960, Bd ?0, S. 163—170.
Bocher T. W. Cytological and embryological
studies in the amphiapomict Arabis hol-
boellii complex. — Kgl. danske vid. selsk.
biol., 1951, v. 6* N 7, p. 1—59.
Bocher T. W. Experimental taxonomical
studies in the Arabis holboellii complex. —
Sven. bot. tidskr., 1954, v. 48, p. 31—44.
Bocher T. W. Experimental and cytological
studies on plant species. IX. Some atretic
and montane Crucifers. — Kgl. danske vid.
selsk. biol. skrM 1Ш, v. 14, N 7, p. 1—74.
Bocher T. W. Further studies in Arabis
holboellii and allied species. — Bot. tidsskr.,
^1969, v. 64, p. 141—161.
Boesewinkel F. D., Bouman F. Development
of ovule and seed—coat of Dichapetalum
mombuttense Engl, with notes on other
species. — Acta bot, neer., 1980, v. 29> N 2/3,
p. 103—115.
Bogle A. L. The genera 0f Portulaceae and
Basellaceae in the Southeastern United
States. — J. Arnold Arboretum, 1969,
v. 50, N 4, p. 566—599.
Bohn P. R. Sur le sac embryonaire des Euphor-
bes. — Bull. Soc. bot. France, 1924, t. 71,
p. 576—579.
В or J., Bouman F.' Development of ovule and
integuments in Euphorbia millli and Co-
dieum variagatum. — Phytomorphology,
1974, v. 24, N 3—4, p. 280—296.
В or /., Kapil R. N. Euphorbia geniculata
ovule to seed. — Acta bot. heer 1975,
v. 24, N 3-4, p. 257-268.
Bor J., Kapil R. N. Anatropy and ontogeny
of the bitegmic ovule in Chrozophora
A. H. L. Jussien (Euphorbiaceae). — Acta
bot. neer., 1976, v. 25, N6, p. 385—400.
Bouharmont I\ Note sur la pollinisation na-
turelle de l'Hevea a Yafagambi. — Agr.
Congo, 1961, v. 52, p. 245—264.
Bouharmont I. Fecondation de Tovule at de-
veloppement de la graine apres croisement
et aiutopollinisation chez Hevea brasilien-
sis. — Cellule, 1962, t. 62, p. 119—130.
Bouman F. Developmental studies of the
ovule, integuments and seed in some angio-
sperms. Naarden, Bock en offset drukker.
Los., 1974. 179 p.
Bouman F. Integument initiation and testa
development in some Cruciferae. — Bot.
J. Linn. Soc; 1975, v. 70, N 3, p. 213-229.
Boursnell J. G. The symbiotic seed-borne fungus
in Cistaceae. 1. Distribution and function
of the fungus in the seedling and in the tis-
313
sues of the mature plant. — Ann. Bot.,
1950, v. 14, N 54, .p. 217—243.
Bovers С G. The development of pollen and
viscin strands in Rhododendron catawbie-
ase. — Bull. Torrey Bot. Club, 1931, v. 57,
p. 285-314.
Boyes /. W. Eembryo sac development in
Plumbagella. — Proc. Nat. Acad. Sci.
' (USA), 1929', v. 25, N 3, p. 141—145.
Boyes J. W. Development of embryo sac of
Plumbagella micranta. — Amer. J. Bot.,
1939, v. 26, N 6, p. 539-547.
Boyes J. W. Demonstration of embryo sac
development of Plumbagella micranta. —
In: Congr. Intern. Bot. 9th, 1959, v. 2,
p. 43—44.
Boyes J. W., Battaglia E. The tetrasporic
embryo sacs of Plumbago coccinea, P. scan-
dens and Ceratostigma willmottianum. —
Bot. Gaz., 1951a, v. 112, • N 4, p. 485—
489.
Boyes /. W., Battaglia E. Embryo sac
development in the Plumbaginaceae. — Caryo-
logia, 1951b, v. 3, N 3, p. 305-310.
Brandegee K. Studies in Pdrtulaceae. — Proc.
Calif. Acad., 1894, Ser. 4, p. 86.
Brdndza M. Developpment des teguments de la
graine. — Rev. gen. bot. (Paris), . 1891,
t. 3,p. 1—32, 71—84, 103—126, 150—165,
22^—240...
Braun A. Uber Parthenogenesis bei Pflan-
zen. — Abh. К oh. Akad. Wiss. Berlin,
Phys., 1857, Abt. 1, S. 311—376.
Braun A. fiber Polyembryonie und Keimung
von Goelobogyne. Ein Nachtrag zu der Ab-
handlung uber Parthenogenesis der Pflan-
zen. — Abh. К on. Akad. Wiss! Berlin,
phys. Abt., 1860, S. 107—263.
Breteler F. G. The african Dichapetalaceae. —
Med. Landbonwhogecshool Wageningen,
1973, v. 73, N 13,„pv 1-124.
Brisseau-Mirbel C. F. Elements de physiologie
vegetale et de botanique. Paris,<1815.
Brokschmidt O. Morphologische, anatomische
und biologische Untersuchungen uber Hot-
tonia palustris. Diss. Erlangen, 1904.
Brongniart A. Memoire sur la generation et
developpement de Tembryon dans les ve-
getaux phanerogamen. — Ann. Sci. Nat.,
1827, t. 12, p. 14-296.
Brongniart A. Observation sur le mode de fe-
condation des Orchidees et des Cistinees. —
Ann. Sci. Nat., 1831, ser. 1, v. 24, p. 113—
130.
Brough P. Preliminary note on the embryo
sac of Styphelia longifolia. — Proc. Linn.
Soc. N. S. W., 1923, v. 48, part 4, N 193,
p. 674—680.
* Brough P. Studies in the Epacridaceae. I. The
life history of Styphelia longifolia. — Proc.
Linn. Soc, N. S. W., 1924, v. 49, part 2,
N 196, p. 162—178.
Brundell D. /. Flower development of the
Chinese gooseberry (Actinidia chinensis.
Planch.). 1. Development of the flowering
shoot. — N: Z. J. Bot., 1975a, v. 13, N 3,
p. .473-483.
Brundell D. Г. Flower development of the
Chinese gooseberry (Actinidia chinensis
Planch.). 2. Development of flower bud. —
N. Z. J. Bot., 1975b, v. 13, N 3, p. 485—
496.
BruniA., Tosi B. Distribuzione, morphologie
e composizione chimica dei laticiferi em-
314
tbrionali di Euphorbia marginata. — G. BoU
Ital., 1978, v. 112, N 4, p. 312—313.
Bruni A., Vannini G. L., Fasulo M. P:
Anatomy of the latex system in the dormant
embryo of Euphorbia, marginata Purch:
Correlative analysis of the histological
organization and topographic distribution*
of laticifers. — Ann. Bot., 1979, v. 42,.
N 187, p. 1099—1108.
Budel B. Untersuchungen der Antherenent-
wicklung einiger Bliitenpflanzenu — Z. Bot.r
1964, Bd 52, H. 1, S. 1-28.
Buell К. М. Developmental morphology in
. Dianthus. 1. Structure of the. pistil and seed
development. — Amer. J. Bot., 1952ar
v. 39, N.3, p. 194-210.
Buell К. М. Developmental morphology in
Dianthus. 2. Starch accumulation in
ovule. — Amer. J. Bot., 1952b, v. 39, N lr
p. 458-467.
Buell К. М. Developmental morphology in
Dianthus. 3. Seed failure following inter-r
specific crosses. — Amer. J. Bot., 1953\
v. 40, N 3, p. 116.—123.
Bugnicourt M. Embryogenie des Hypericacees.
. Developpement de. l'embryon chez l'Hype-
ricum tetrapterum Fries. — Bull. Soc.
bot. France, 1971a, v. 118, N 5—6, p. 319—
334.
Bugnicourt M. Bourgeonnement du suspenseur
chez Г Hypericum tetrapterum Fries. —
Bull. Soc. bat. France, . 1971b, v. 118,
N 5-6, p. 335-340.
Bugnicourt M. Polyembrionie resultant de la
concrescence de deux ou de plusiers ovules
• chez quelques especes du gerne
Hypericum. — Ann. Univ. et ARERS, 1971c,
• v. 9, N 3, p. 306.
Buschmann E. Zur Untersuchung der Ent-
wicklungsgeschichte von Thea sinensis. —
Arch. Pharm., 1914, Bd 252, S. 412—420.
Buxbaum F. Zur Klarung der phylogeneti-
schen Stellung der Aizoaceae und Gactaceae
im Pflanzenreich. — Jahrb. Schw- Kakt.
Ges., 1948, Bd 2, S. 3—16. •
Buxbaum F. Vorlaufer des Kakteen-Habitus
in den Phytolaccacean. — Osterr. bot. Z.r
1949, Bd 96, N 1, S. 5—14.
Buxbaum F. Kakteensamen unter Lupe und
Microskop. II. Die Steinharten Same»
der Opuntioideen. — Mikrokosmos, 1977\
Bd 66, N 10, S. 307-309.
Camp W. H., Hubbard Mary M. Vascular
supply and structure of the ovule and aril
in peony of the aril in nutmeg. — Amer.
J. Bot., 1963, v. 50, N 2, p. 174—178.
Campbell D. H. Monotropa uniflora as a
subject fbr demonstrating the embryo sac. —
Bot., Gaz., 1889, v. 14, p. 83.
Campo EUda. Morfogenesi de flore ed embryo-
logia di un Populus deltoides bisessuale. —
Giorn. Bot. Ital., 1963, t. 70, p. 212—219.
Candau P., Talavera S, Polen у semillas d$ les
especies * de Silene, sect. Erectorefractae
Chowdhuri. — Lagascalia, 1978, v. 8, N 2,
p. 127—133.
Canvin D. T. Formation of oil in the seed of
Ricinus communis L. — Can. J. Biochem.,
1963, v. 41, N 9, p. 1879-^1885.
Canvin D. T. The effect of temperature on the
oil content and fatty acid ^composition of
the oils from several oil seed crops. —
Can. J. Bot., 1965, v. 43, N 1, p. 63—69.
Capuren R. Revision des Rhopalocarpacees. —
Adansonia, 1962, t. 11, -N 2. p. 228—267.
Capuron R. Type de la nouvelle famille des
Diegodendraceae. — Adansonia, Nouvelle
serie, 1963, t. 3, N 3, p. 385—392.
Capuron R. Description des fruits du Diego-
dendron humberti. — Adansonia, 1965,
i. 5, N 4, p. 503—505.
Carano E. Sull'embriologia di Poinsettia pul-
cherrima. — Ann. bot. (Ital.), 1915, t. 13,
p. 343-^350.
Carano E. Sil partocolare sviluppa del gameto-
fito о di Euphorbia dulcis. — G. R. Accad.
Lincei Roma, 1925, t. 6, N 1, p. 633—635.
Carano E. Ulteriori osservazioni su Euphorbia
dulcis in rapporto col suo comportamento
apomittico. — Ann. bot. (Ital.), 1926, v. 17,
p. 50—79.
Carey G., Fraser L. The embryology and
seedling development of Aegiceras ma jus. —
Proc. Linn. Soc, N. S. W., 1932, v. 57,
N 5/6, p. 341—360.
Carlquist S. A revisions of Grubbiaceae. —
J. S. Afr. Bot., 1977, v. 43, pt 2, p. 115—
128.
Carlquist S. Vegetative anatomy and syste-
matics of Grubbiaceae. — Bot. notis., 1978,
v. 131, iss. 1, p. 117—126.
Carniel K. Uber die Embryobildung in der
Gattung Paeonia. — Osterr. bot. Z., 1967,
Bd 114, S. 4—19.
Carwon P., Favarger C. Groisements experi-
mentaux dans le genre Erysimum. — Plant
Syst. und Evol., 1979, v. 131, N 1—2,
p. 53—71.
Cass D. D. Occurrence and development of
a filiform apparatus in the egg of Plumbago
capensis. — Amer. J. Bot., 1972, v. 59,
N 3, p. 279—283.
Cass D. D. Ultrastructure of the egg og
Plumbago zeylanica. — Airier. J. Bot., 1972b,
• v. 59, N 6, p. 648.
Cass D. D., Karas I. Ultrastructural
organization of the egg of Plumbago zeylanica. —
Protoplasma, 1974, v. 81, N 1, p. 49—62.
Cassagne C, Baraud J. Oleogenese et
formation des acides grass chez diverses varietes
de nosetiers. — Qual. plant, et mater, veg.,
1969, t. 17, N 3, p. 235—247.
Castetter E. F. Gytological studies in the
Gucurbitaceae. I. Microsporogenesis in Cu-
curbita maxima. — Amer. J. Bot., 1926,
v. .13, N 1, p. 1—10.
Cavara F. Studi sul the richerche intorno
alio svilluppo^l frutto della «Thea chi-
nensis» sims., culjivata nel orto botanico
di Pavia. — Atti 1st. Bot. Univ. Pavia.
Ser. 2, 1899f v. 5, p. 265—326.
Cave M. S., Arnott H. J.', Cook S. A.
Embryogeny in the California p§pnis with reference
to their position. — Ara^, J. Bot., 1961,
v. 48, N 5, p. 397—404..
Cerbulis J. Carbohydrates in Jiazel (Corylus
sp.). 1. Major sugar component in turkisch
hazelmit kernel. — J. Amer. ^hem. Soc,
1955, v. 77, N 22, p. 6054—6|56.
Cefnohorsky L. Graines des Grucifere^de Bo-
heme. Etude anatomique et morp^logi-
que. —Opera Bot., 1947, v. 5, p*. 1—92.
Cesca G. Ricerche cariologiche ed embrioloj^-
• che sulle Euphorbiaceae. 1. Su alcunibio-
tipi di Ejuphbrbia dulcis della Toscana. —
Garyologia, 1961, v. 14, p. ,79—96.
Cesca G. Gytological and embryological
studies in the genus Euphorbia: Euphorbia
epiphimoides L. — Proc. Nat. Inst. Sci.
India, B, 1969, v. 35, N 2, p. 139—152.
Chakravorty A. K. The development of female
gametophyte and seed of Coccinia indica. —
J. Indian Bot. Soc, 1947, v. 25, p. 95—104.
Chamberlain C. J. Contribution to the life
history of Salix. — Bot. Gaz., 1897, v. 23,
N 3, p. 147—178.
Chanda S. On the pollen morphology of some
Scandinavian Caryophyllaceae. — Grana
palynol., 1962, v. 3, p. 67—69.
Chandra S., Bhatnagar S. P. Pollination and
nucellus in Abelmoschus esculentus. — Biol,
plant., 1975, v. 17, N 2, p. 154—155.
Chandra S., Bhatnagar S. P. Seed
development of Abelmoschus esculentus
(Malvaceae). — Plant Syst. and Evol., 1975,
v. 123, N 4, p. 255—262.
Chandra S., Bhatnagar S. P. Reproductive
biology of Abelmoschus esculentus. IV.
Ovule, fertilization, endosperm and embryo
development. — J. Indian Bot. Soc.T 1976,
v. 55, N 1, p. 1—13.
Chatin A. L'anthere. Recherches sur le de-
veloppement, la structure et les fonctions
de ses tissues. Paris, 1870, 135 p.
Chaudhry I. P., Narayana H. S. Studies on
the development and structure of seed in the
Garyophyllaceae. I. Spergula arvensis L. —
J. Indian Bot. Soc, 1978, v. 57„p. 46—52.
Cheesman E. E. Fertilization and embryogeny
in Theobroma cacao.' — Ann. Bot., 1927,
v. 41, p. 107—126. }
Chhonkar U. P. S. Seed coat development Дп
Reseda odorata. — Proc. 48th Indian Sci.
Congr., 1961, v. 3, p. 275. .
Chiarugi A. Embryologia delle Cistaceae. —
G. R. Acad. Kincei, Roma, 1924', v. 33,
p. 103-105.
Chiarugi A. Embriologia delle «Cistaceae». —
Nuovo Giorn. Bot. Ital., nuova ser., 1925,
v. 32, p. 223—316.
Chiarugi A., Francini E. Apomissia in Ochna
serrulata Walp. — Atti Soc. ital. pro;gr.
sci., 18 Riunione, Firenze, 1929.
Chiarugi A., Francini #. Apomissia in «Oxmna
serrulata» Walp. — Nuovo Giorn. Bot.
Ital., nouva ser., 1930, v. "37, N 1^—2,
p. 1—250.
Chikkanniah D. S. The embryo sac of Ochna
squarrosa Linn. — Curr. Sci., 1954, v. 23,
N 7, p. 232v
Chirtoiii M. Recherches sur les Lacistemacees
etles Symplocacees. — Univ. Geneve-Inst.
Bot., 1918, 9 ser., f. 11, these N 610, p. 1—
50.
Chopra R..N. Endosperm haustoria in some
Gucurbitaceae. — Proc 40 th Indian Sci.
Congr. (Lucknow), 1953a, v. 97, p. 5—21.
Chopra R. N. The endosperm in some Cucur-
bitaceae. — Curr. Sci. (India), 1953b, v. 22,
N 2, p. 383-384.
Chopra R. N. Occurence of endosperm
haustoria in some Cucurbitaceae. — Nature, 1954,
v. 173, N 4399, p. 352—353.
ChapraR. N. Some observation on endosperm
development in the Cucurbitaceae. — Phy-
tomorphology, 1955, v. 5, N 2—3, p. 219—
230.
Chopra R. N: The mode of embryo sac
development in Opnntia aurahtiaca. Lindl.
A reinvestigation. — Phytomorphology,
Щ7< v. 7, N 3-4, p. 403—406.
315
Chopra R. N. Female gametophyte and
endosperm of some membres of the Cucurbita-
ceae. — Phytomorphology, 1965, v. 15,
N 3, p. 217—223.
Chopra R. N., Agarwal S. Somefuther
observation on the endosperm haustoria in the
Cucurbitaceae. — Phytomorphology, 1958,
v. 8, N 1—2, p. 494—201.
Chopra R. N'., Agarwal S. The female
gametophyte of Benincasa cerifera Savi. — Bot.
nolis. (Lund), 1960, v. 113, N 2, p. 192—
202.
Chopra R. N., Kaur H. Embryology of Bixa
orellana Linn. — Phytomorphology, 1965,
v. 15, N 2, p. 211-214.
Chopra S. Development of female
gametophyte in Sapium sebiferum Roxb. — Gurr.
Sci. (India), 1970, v. 39, N 1, p. 17—18.
Chopra S., Singh R. P. Structure and
development of seed in Phyllanthus urinaria
L. — J. Indian Bot. Soc, 1969, v. 48,
N 3—4, p. 212—216.
Chou Y. L. Floral morphology of three
species of Qaultheria*. — Bot. Gaz., 1952,
v. 114, N 2, p. 198—221.
Choudhury M. R. On tjie structure of the
embryo sac in 4n Gorchorus capsularis. —
Indian Agr., 1961, v. 5, N 1, p. 29—31.
Chowdhury D. K., Bagchi R. Composition of
the seed fat of Cucumis melo. — Natur-
wissenschaften, 1956, Bd 43, N 15,
S. 350—351.
Chowdhury D. K., Chakrabarty M. M., Mukhe-
rji В. K. Studies on some seed fats of
Cucurbitaceae family. — Sci. And. Cult.,
1953, v. 19, N 3, p. 163—164.
Chowdhury N. The antipodals in Amarantha-
ceae. — Sci. and Cult., 1955, v. 20, N 12,
p. 611.
Christ B. Entwicklungsgeschichtliche und
physiologische Untersuchungen iiber die
Selbststerilitat von Cardamine pratensis. —
Z. Bot., 1959, Bd 47, S. 88—112.
Clarke С. В. On Acalypha indica. — Ann.
Bot., 1887, v. 1, p. 359—360.
Claussen P. Bemerkungen zu der Arbeit Dahl-
grens iiber den Embryosack von Plumba-
gella. — Sitzungsber. Ges. naturforsch.
Freunde Berlin, 1919, Bd 8, S. 347—345.
Cochen-Stuart С. Р. Sur le developpement
des cellules generatices de Camellia thei-
fera (Griff) Dyer. — Ann. Jard. Bot. Bui-
tenzorg, Ser. 15, 1916, t. 30, p. 1—22.
Cochen-Stuart C. P. «De Thee». — Batavia,
1921. 32 p.
Cocucci A. E. Embryologia de Trianthema
argentina (Aizoaceae). — Kurtziana, 19Ы,
t. 1, p. 105—122.
Cocucci S. Variazioni di metaboliti nel seme
di ricino in fase di maturazione. — Giorn.
Bot. Ital., 19,64 (1965), v. 71, N 3—5,
p. 459-468.
Cohn F. M. Beitrage zur Kenntnis der Chenopo-
diaceen. -? Flora, 1914, Bd 106^ S. 51—89.
Cole 7. F. Polyerqbryony. — Nature,, 1895,
v. 51, p. 558.
Collins J. P.* Berkelhamer R. C.,Mesler^M\
Notes on the natural history of the
mangrove Pelliciera rhizophorae Tr. et PL (Thea-
ceae). — Brenesra, 1977, N10/11, S. 17—
29.
Compton M. H. Note on a,case of doubling
of embryo sac* .pollen tube and embryo. —
Ann. Bot., 1912, t. 26, p. 243—244.
316
Conagin Candida H. T. Microsp orogeneses
em olones normais 1 tetraploides de Hevea
brasiliensis Muell. — Arg. «Bragantia»r
1971, v. 30, N 1, p. 11—17.
.Cook M. T. The development of the embryo»
sac and embryo of Claytonia virginiana. —
Ohio Nattir., 1903, v. 3, p. 349—353. *
Cook M. T. The development of the em bryo-
sac and embryo-of Agrostemma githago.. —
Ohio Natur., 1903, v. 3, p. 453—477.
Cook M. T. Notes on the embryo sac of Pas-
siflora adenophylla. — Bull. Torrey BoU
Club, 1909a, v. 36, p. 273—274.
Cook M.'T. Notes on the embryology of the
Caryophyllaceae. — Ohio Natur., 1909bT
v. 9, p. 477—481.
Cooper D. C. Microsporogenesis in Bougain-
villea glabra. — Amer. J. Bot., 1931r
v. 18, N 5, p. 337-358.
Cooper D. C. The anatomy and .development
of the floral organs of Bougainvillea
glabra. — Amer. J. Bot., 1932, y. 19, N 10r
p. 814-822.
Cooper D. C. Nuclear divisions in the tapetal
cells of certain Angiosperms. — Amer. J.
Bot., 1933, v. 20, N 5, p. 358—364.
Cooper D. C. Microsporogenesis and the
development of the male gametes in Portulaca
oleracea. — Amer. J. Bot., 1935, v. 22r
, N 4, p. 453-459.
Cooper D. C. Macrosporogenesis and
embryology of Portulaca oleracea. — Amer. J.
Bot., 1940, v. 27, N 5, p. 326—330.
Cooper D. C. Flower and seed development
in Oxybaphus nyctagineus. — Amer. J.
Bot., 1949, v. 36, N 4, p. 348—355.
Cooper G. O. Cytological studies in the Che-
nopodiaceae. I. Microsporogenesis and
pollen development. — Bot. Gaz., 1935, v. 97 r
p. 169-178.
Copeland H. F. The development of seeds m
certain Ericales. — Amer. J. Bot., 1933,
v. 20, N 8, p. 513-517.
Copeland H. F. The structure of the flower
of Nevberrya. — Madrofio, 1934, v. 2, N 17r
p. 137—142.
Copeland H. F. On the genus Pityopus. —
Madrono, 1935, v. 3, N 12, p. 154—168.
Copeland H. F. The reproductive structure
of Pleuricospora. — Madrono, 1937, v. 4,
N 1, p. 1—16.
Copeland H. F. The Styrax of northern
California and the relationships of the Styra-
caceae. — Amer. J. Bot., 1938, v. 25,
p. 771—780.
Copeland H. F. The structure of Allotropa. —
Madrono, 1938, v. 4, N 5, p. 137—153.
Copeland H. F. The structure and the
classification of the Monotropoidea. — Madrono,
1939, v. 5, N 4, p. 105—119.
Copeland H. F. Further studies on Monotro-
poideae. — Madrono, 1941, v. 6, N 4,
p. 97—119.
C-opMand #v F. A study anatomical and taxo-
nomic of the genera oi Rhododendroidoae. —
Amor. Midland Naturalist, 1943, v. 30,
N 3, p. .533—025.
Copeland И. F. Observation: oil the structure
and -classification of the Pymleae* —
Madrono, Л947, v. 9*'N 3, p. 65—102.
Copeland H. F. Observations on the Cyril-
laceaa particularly on the reproductive
structures of the North American species. —
Phytomorphology, 1953, v. 3, N 4, p. 405—
411.
Copeland H. F. Observations on certain Epa-
cridaceae. — Amer. J. Bot., 1954, v. 41,
N 3, p. 215-222.
Corner E. J. H. The seeds of dicotyledons.
Cambridge, London—New
York—Melbourne, 1976, v. 1, 212 p.; v. 2, 552 p.
Corsi G. Cytologia, embriologia e distribu-
zione geografica di Brassica insularis
Moris, endemismo sardo-corso. — Ann. Bot.
(Ital.), 1963, v. 27, N 3, p. 419—430.
Corsi G. The suspensor of Eruca sativa Miller
(Cruciferae) during embryogenesis in
virto. — J. Bot. Ital., 1972, v. 106, N 1,
p. 41—54.
Corti R. Embriologia del gen ere Jonopsidium
Rchb. (Cruciferae). — Nuovo Giorn. Bot.
Ital., 1930, v. 37, p. 510—526.
Corti R. Sul dioicismo di Idesia polycarpa. -*-
Nuovo Giorn. Bot. Ital., 1948, v. 55,
p. 446-495.
Coulter J. M., Chamberlain С 7. Morphology
of the angiosperms. New York, 1903, 471 p.
Coulter J. M., Chamberlain C. J. Relation
of megaspores to embryo sacs in
angiosperms. — Bot. Gaz., 1908, v. 45, p. 361—
366.
Crang R. A fine structural study of in vivo
pollen tube penetration in Lychnis alba. —
Frans. Am. Microsc. Soc, 1966, v. 85,
p. 564-570.
Crang R. Pollem tube plugs in Lychnis alba.* —
Ohio J. Sc*., 1966, v. 268, N 2, p. 121—122.
Crang R. E., Miles L. B. An electron
microscope study of germinating Lychnis alba
pollen. — Amer. J. Bot., 1969, v. 56, N 4,
p. 398-405.
Crang R. E., Millay M. A. Microscopical
studies of Lychnis alba pollen walls during
germination. — Grana, 1972, v. 12, N 2,
p. 87—92.
Creasy W. D. Development of the megaspore,
megagametophyte and embryo of Arenaria
fenlleri var. fendlerL — Castenea, 1961,
v. 26, N 4, p. 140—146.
Creech F. L. An embryological study in the
Rhododendron subgenus Anthodendron
Endl. — Bot. Gaz., 1955, v. 116, N 3,
p. 234—243.
Crete P. Transformation de Г ovule en grain
chez l'Androsaemum officinale. — Bull.
Soc. bot. France, 1936, t. 83, p. 654—657.
Crete P. Polyembryonie chez l'Actinidia chi-
nensis. — Bull. Soc. bot. France, 1944a,
t. 91, p. 89—92.
Crete P. Recherches anatomiques sur la semi-
nogenese de l'Actinidia chinensis Planch.
Affinites des Actinidiacees. — Bull. Soc.
bot. France, 1944b, t. 91, p. 153—160.
Crete P. Un cas de polyembryonie chez le
Phytolacca decandra L. — Bull. Soc. bot.
France, 1947, t. 94, N 7—8, p. 304—305.
Crete P. Embryogenie des Caryophyllacees.
Developpement de I'embryon chez le Stel-
laria uliginosa Murr. — C. r. Acad. sci.
(Paris), 1947, t. 225, p. 588—590.
Crete P. Developpement de I'embryon chez
le Saponaria officinalis L. — С r. Acad,
sci. (Paris), 1948, t. 226, p. Ш—113.
Crete P. Embryogenie des fia^pparid^cees.
Developpement de Vembrytm phez le T^epme
,grav£olens Rafto. — С т. Acad. sci. {Pa-
* tb), 1951a, t. 283, N 9, p. 562—564.
Crete P. Repartition et interet phylogenetique
des albumens a formations haustoriares
chez les angiosperms et plus particuliere-
ment chez Gamopetales. — Ann. sci. na-
tur., 1951b, ser.2, t. 12, p. 131—191.
Crete P. Contribution а Г etude embryologi que
des Datiscacees. L'origine du sac embryon-
naire et la transformation de Г ovule en gra-
ine chez le Datisca cannabina. — Bull.
Soc. bot. France, 1952a, t. 99, N 4—6,
p. 152—156.
Crete P. Embryogenie des Datiscacees.
Developpement de I'embryon ( chez le Datisca
cannabina L. — C. r. Acad. sci. (Paris),
1952b, t. 234, N 10, p. 1082—1084.
Crete'P. Embryogenie des Resedacees.
Developpement d*e I'embryon chez le Reseda
glauca L. — C. r. Acad. sci. (Paris), 1955,
t. 240, N 6, p. 645—647.
Crete P. Embryogenie des Cucurbitacees.
Developpement de Г albumen et de
I'embryon - chez le Sicyos angulata. — C. r.
Acad. sci. (Paris), 1958a, t. 246, p. 456—
459.
Crete P. La parthenogenese chez le Sicyos
angulata. — Bull. Soc. bot. France, 1958b,
t. 105, p. 18—19.
Crete P. Embryogenie des Cucurbitacees.
Developpement de I'embryon chez l'Ecballium
elaterium A. Rich. — C. r. Acad. sci.
(Paris), 1960, t. 251, N 7, p. 968—977.
Crete P. Embryogenie des Cucurbitacees.
Developpement de I'embryon chez le Cyc-
lanthera explodens Naud. — C. r. Acad,
sci. (Paris), 1962, t. 254, N 19, p. 3411—
3412.
Crete P. Embryo. — In: Maheshwari P. (Ed.).
Recent advances in the embryology of
angiosperms. Delhi, 1963, p. 171т-222.
Crete P. L'embryogenie et son role dans les
essais de classification phylogenetique. —
Phytomorphology, 1964, v. 14, p. 70—78.
Crete P., Ianot M. M. Action de deux
substances de croissance sur Г embryogenie
du Lychnis githago Scop. — C. r. Acad.
sci. (Paris), 1949, t. 228, p. 336—338.
Cronquist A. The evolution and classification
of flowering plants. London, 1968. 396 p.
Cruse A. Polyembryony in Brassica napus
var. rapifere L. and Beta vulgaris L. —
Kgl. Veterin. Zandbo hojskole Arsser.,
• 1960, p. 37—46.
Cyndon Д. F. Flower development in Silene
morphology and sequence of initiation of
primordia. — Ann. Bot., 1978, v. 43,
N 182, p. 1343—1348.
Czapik R. Embryology of five species of the
Arabis hirsuta complex. — Acta biol. crac.
Ser. bot., 1974, v. 17, N 1, p. 13—25.
Czyszylowiez /. Caryocaraceae. — In: Eng-
ler A., PrantL K. Die naturlichen Pflan-
zenfamilien. Leipzig, 1895, 3 Teil, 6 Abt.,
S. 153—157.
Dahlgren K. V. O. Einige morphologische und
biologische Studien uber Primula
officinalis Jacq. — Bot. notis., 1914, H. 4, S. 161 —
176.
Dahlgren K. F. O. Uber die Uberwinterangs-
stadien der Pollensacke und der Samenan-
lagen bei einigen Angfospermen. — Sven.
bot. Tidskr., 1915, Bd 9, S. 1—12.
Dahlgren K. V. Q» Zytolofische und embryo-
logische Studien uber die, T^eichen Primula-
les und Plumbaginales. — Kgl. sven. ve-
317
tenskapsakad. handl., 1916, Bd 56, H. 4,
S. 1—80.
Dahlgren K. V. 0. Notes on the ab unitio
cellular endosperm. — Bot. notis., 1923,
p. 1—24.
Dahlgren K. V. 0. Uber das Vorkommen von
Starke in den Embryosacken der Angio-
spermen. — Ber. Dtsch. bot. Ges., 1927a,
Bd 45, S. 374—384.
Dahlgren K. V. 0. Die Morphologie des Nu-
zellus mit besonderer Berucksichtigung der
deckzellosen Tipen. — Jahrb. Wiss. Bot.,
1927b, Bd 67, S, 374—426.
Dahlgren K. V. 0. Uber das Vorkommen von
Srarke in den Embryosacken der Angio-
spermen. — Ber. Dtsch, bot. Ges., 1927c,
Bd 45, S. 374—384.
Dahlgren K. V. 0. Hakenformige Leistenbil-
dungen bei Synergiden. — Ber. Dtsch. bot.
Ges., 1928, Bd. 46, S. 434—444. ?
Dahlgren K. V. 0. Die Entwicklung des Em-
bryosackes bei Plumbago zeylanica. — Bot.
notis., 1937, S. 487—498.
Dahlgren K. V. 0. liber den Gunazeumbauder
Gattung Scleranthus. — Bot. notis., 1940,
p. 231, 236.
D'Amato F. Apomissia in Statice oleaefolia
Scop. var. confusa Godr. — N. G. bot.
Ital., 1940, v. 47, N 2, p. 504—505.
D'Amato F. Nuovo contributo alia embrio-
logia delle Plumbaginaceae. — N. G. bot.
Ital., 1943, v. 50, N 1, p; 79—99.
Dambroise R. Contribution a Thistoire de
Talbumen vrai chez les Centrospermens.
J)iss. Paris, 1947. 155 p. (Bull. Soc. bot.
France, 1957, t. 5—6, p. 151—155).
Dang Van Liem. Embryogenie des Euphorbia-
cees. Developpement de ГетЬгуоп chez
l'Euphorbia palustris L. — C. r. Acad,
sci., 1959, t. 249, N 22, p. 2378—2380.
Dang Van Liem. Embryogenie des Euphorbia-
cees. Developpement de ГетЬгуоп chez
le Mercurialis perennis L. — C. r. Acad,
sci., 1960, t. 250, N 19, p. 3217—3219.
Dang Van Liem. Embryogenie des Euphorbia-
cees. Developpement de ГетЬгуоп chez
le Phyllanthus grandifolius L. — С. г.
Acad, sci., 1961, \. 252, N 3, p. 443—445.
Dang Van Liem. Recherches sur l'embryoge-
nie des Tricoques. Paris, 1962. (These).
Dathan A. S. R., Singh D. Development
of female gametophyte. and seed of Tacsonia
mollissima. H. Д. К. — Proc. 56th. Indian
Sci. Congr., 1969a, part 3 (4), p. 382—390.
Dathan A. S. R., Singh D. Female
gametophyte and seed of Carica candamarensis
Hook F. — Proc. 56th. Indian Sci. Congr.,
1969b, part 3 (4), p. 394—395.t
Dathan A. S., Singh D. Development and
structure of female gametophyte and seed
of Bergia odorata Edgew. — Proc. 57th
Indian Sci. Congr., 1970a, part 3 (4), p. 254—
255.
Dathan A. S., Singh D. Female gametophyte
and seed of Caryca candamarensis Hook
F. — Plant Sci., 1970b, v. 2, p. 52—60.
Dathan A. S. R., Singh D. Embryology and
seed development in Bergia L. — J.
Indian Bot. Soc, 1971, v. 50, N 4, p. 362—
370. ,
Dathan A. S. R., Singh D. Female
gametophyte and endosperm of Hydnocarpus lau-
rifolia (Dennst.) Sleumer. — Gurr. Sci.
(India), 1972, v. 41, N 17, p. 647—649.
Dathan A. S. R., Singh D. Development of
embryo sac and seed in Bixa L. and Co-
chlospermum Kunth. — J. Indian Bot. Soc,
1972, v. 51, N 3, p. 254—266.
Darhan A. S. R., Singh D. Development and
structure of seed in Tacsonia Juss. and Pas-
siflora L. — Proc. Indian Acad. Sci. B,
1973, v. 77, N 1, p. 5—18.
Dathan A. S. R., Singh D. Structure and
development of ovule and seed in Flacourtia
indica (Burn. F) Merrill. — Proc. Indian
Natur., Sci. Acad, pt B, 1973, v. 39,
N 2, p. 172-179.
Dathan A. S., Singh D. Structure and
development of seed coat in Viola spp. — J.
Indian. Bot. Soc, 1973, v. 52, p. 119—126.
Dathan A. S., Singh D. Embryological
studies on Papaya and mountain Papaya. —
In: Indo-Soviet Symposium. New Dehli,
1976, p. 8—9.
Dathan A. S. R., Singh D. Structure and
development of female gametophyte and seed
in Hydnocarpus laurifolia (Dennst.)
Sleumer. — J. Indian Bot. Soc, 1979, v. 59,
N 3, p. 256—263.
Datta P. C, Chowdhury A. Anatomy of pre-
germination to postgermination embryos
of Hibiscus cannabinus. — Flora, 1981,
Bd 171, N 3, S. 266—279. .
Datta R. M. Tricotyledony in Corchorus
capsulars Linn. — Sci., and Cult., 1954,
v. 20, N 5, p. 240—241.
Datta R. M. Male gametophyte in cultivated
jute. — Curr. Sci., 1955, v. 24, p. 104.
Datta R. M. Comparative studies on the
genesis of sperms in the pollen tubes of two
cultivated jute species. — Cellule, .1957, t. 58,
N 3, p. 287—304.
Datta R. M. Polyembryony in Corchorus oli-
torius. — Sci. and Cult., 1960, v. 25, p. 642.
Datta R. M., Mukherjee P. Comparative
studies on the rate of the pollen tube growth
of two wild jute species (Corchorus urticae-
folius W. et A. and C. siamensis Craib.). —
Beitr. Biol. Pflanz., 1969, Bd 46, H. 1,
S. 155—158.
Davis G. L. Systematic embryology of the an-
giosperms. New York—London—Sydney,
1966. 528 p.
Davis T. A. G., Sukhendu S. Morphology of
Adansonia digitata. — Adansonia, 1976,
N 4, p. 471—479.
Davezac Th. La place systematique du genre
Paeonia et forme de jeuaess de P. lusitanica
Mill. — Bull. Soc. hist, natur. Toulouse,
1957, t. 92, fasc 3—4, p. 197—201.
Decaisne J. Examen des especes des genres.
Bombax et Pachira. — El. serres et Jard.
de TEurope. Ser. 2, 1880, t. 13, p. 43—52.
De Candolle A. P. Systematis naturalis regni
vegetabilis. Paris, 1824, t. 1.
De Candolle A. P. Organographie vegetale.
Paris, 1827, t. 2.
De Gaetano A. Observazioni suH'embryologia
di una specie rara di Erica: E. sicula
Guss. — Giorn. Bot.. Ital., 1967, v. 101,
N 1, p. 33—39.
De Hubert E. Recherches sur la sac embryo-
naire des plantes grasses. ■s— Ann. sci. nat.
Bot., 1896, t. 8, N 2, p. 37—12&*
Dehgan В., Webster G, L., ,Morphal@g$; аш!
intrageneric relationships of the genus
Jatropita (l^pliodDdaeeae)^ — UhIw €Mif.
Pubis. Bofc., ШЩ v. 74. 73 p.
m
Denham H. J. The cytology of the cotton
" plant. I. Microspore formation in Sea
Island cotton. — Ann. Bot., 1924, y. 38,
p. 407—438.
Deschamps R., Lebegue A. Embryogenie des
Gruciferes. Developpement de Tembryon
* chez les cakilinees. — G. r. Дcad. sci.,
1967, t. 264, N-4, p. 588-591.
Deshpande P. K. Contribution to the
embryology of Kirganellia reticulata. — J. Biol.
Sci., 1959, v. 2, p. 76—83.
Dessiatoff N. Zur Entwicklung des Embryo-
sackes von Euphorbia virgata. — Ber.
Dtsch. Bot. Ges., 1911, Bd 29, 'S. 33—39.
Devine V. Embryogeny of Lychnis alba. —
Amer. J. Bot., 1950, v. 37, p. 197—208.
Dickey R. D., Reuther W. Flowering, fruiting,
yield and growth habits of tung trees. —
Fla Agt. Expt. Sta, Bull., 1940, p. 343.
Dickison W. С Observations of the floral
morphology of some species of Saurauia,
Actinidia and Clematoclethra. — J. Eli-
sha Mitchell Sci. Soc, 1972, v. 88, N 1,
p. 43—54.
Dickinson H. G., Lewis D. Cytochemical and
ultrastriictural differences between
interspecific compatible and incompatible
pollinations in Raphanus. — Proc. Roy. Soc.
London, 1973, v. 183B, p. 21—38.
Dickinson H. G., Roberts I. N. A molecular
basis for the selfincompatibility system
operating in Brassica sp. — Acta Soc. bot.
*pol4 1981, v. 50, N 1—2, p. 223—227.
Dnyankugar V. R., Malkhede S. R.
Development of the seed of Trianthema portulaca-
эШйь — Proc. Indian Acad. Sci. B, 1963,
v.5'7, N 6, p. 343-355.
Dnydnsagar V. R., Tiwari H. N. Development
of Seed of Euphorbia rothiana Spreiig. —
J. Biol. Sci., 1966, v. 9, N 1-2, p. 1—7.
%Doida Y. On the pollen grain formation in
genus Polygonum. — Bot. Mag. (Tokyo),
1957, v. 70, К 824, p. 31—37.
Doida Y. Development studies in the genus
Polygonum. 1. Microsporogenesis in
Polygonum persicaria. — Ann. Rep. Nat. Inst.
Genet. (Japan), 1958a, N 9, p. 58—59.'
Doida Y. Heterostyly and pollen grain
number in buckwheat. — Ann. Rep. Nat. Inst.
Genet. (Japan), 1958b, N 9, p. 57—58.
Doida Y. Developmental studies in the genua
Polygonum. 1. Miemsporogenesis of
Polygonum persicaria. — B©t. Mag- (Tokyo),
1960, v. 73, N865—866, p. 278—282.
Doida Y. Gytological studies in Polygonum
and related genere. — Bot. Mag. (Tokyo),
1960, v. 73, N 867, p. 337—341.
Doida Y. Consideration on the intrageneric
differentiation in Polygonum. — J. Jap.
Bot., 1962, v. 37, N 1, p. 3—12.
Donati G. Di alcune particolarita
embriologiche in Poinsettia pulcherrima. — С R.
Accad. Lincei (Roma), 1912, t. 21, p. 512—
514.
Donati G. Richerche embriologiche sulle Eup-
horbiaceae. — Ann. Bot. (Roma), 1913,
t. 11, p. 395—399.
Downton W. J. S. Amaranthus edulis: a high
* lysine grain amaranth. — World Crops,
1973, v. 25, N 1, p. 20—21.
Doyel R. E:, Goss L. M. Some details of the
' reproductive structures of Sarcodes. —
\Ma.dtafio, 1941, v. 16, N 1, p. 1—7.
Doyel В. Е. Some features of the structure of
Aretostaphylos viscida. — Amer. J. Bot.,
1942; v. 29, p. 254—259.
Duccy'l. E., Lakshmanan K. Ruminate endo-
- sperm in Dillenia suffruticosa (Griff.)
Martelli. — Curr. Sci., 1981, v. 50, N 21,
p. 965—966.
Dudgeon W. Morphology of Rumex crispus. —
• Bot. Gaz., 1918, v. 66, N 5, p. 393—421.
Duncan E.J. Ovule and embryo ontogenesis
in Bombakopsis glabra (Pasg.) A. Ro-
byns. — Ann. Bot.(Gr. Brit.), 1970, v. 34,
N 136, p. 677—683.
Duncan E. J., Fodd A. W. Structure of the
mature embryo of Theobroriia cacao L. —
Ann Bot., 1972, v. 36, N 148, p. 939—945.
Duperon R. Les glucides des graines oleagi-
neuses. Leur role au cours de la
germination. — Rev. gen. bot., 1954, t. 61, N 723,
p. 261-284.
Dutt M. K. Development of the microspores
and the nuclear behavior in tapetal cells
of Putranjiva roxburghii. — Sci. and Cult.,
1943, v. 8, p. 309—310.
Dutt В. S. M. Anther in Moringa concanensis
Nimmo. — Curr. Sci. (India), 1978a, v. 47,
N 16, p. 589.
DuttB. S. M. Embryo development in Moringa
concanensis Nimmo. —- Curr. Sci., 191'8b,
v. 47, N 18, p. 693.
Dutt В. S. M. Ovule and seed of Moringa
concanensis Nimmo. — Curr. Sci. (India), 1979,
v. 48, N 14, p. 652—654.
Earle F. R., Jones O. Analysis of seed samples
from 113 plant families. — Econ. Bot.,
1962, v. 16, N 4, p. 221-250.
Eaton G. W., Famot A. Megagametogenesis
in Vaccinium corymbosum L. — Can. J.
Bot., 1966, v. 44, N 5, p. 712—714.
Edman G. Zur Entwicklungsgeschichte der
Gattung Oxyria Hill, nebst zytologischen,
embryologischen und systematischen Be-
merkungen iiber einige andere Polygona-
ceen. — Acta horti. berg., 1929, Bd 9,
N 7, S. 165—291.
Edman G. Apomeiosis und Apomixis bei At-
rephaxis frutescens. — Acta hort. berg.,
1931, Bd 11, N 2, S. 13-66.
Edwards M. M. Dormancy in seeds of char»
lock. Developmental anatomy of the seed. —
J. Exp. Bot., 1968, v. 19, N 60, p. 575—582.
Eigner J. Zur Stempel- und Fruchtentwick-
lung ausgewahlter Brassicaceae (Cruciferae)
unter neueren Gesichtspunkten der Bliiten-
morphologie und der Systematik. — Beitr.
Biol. Pflanz., 1973, Bd 49, H. 3, S. 359—
427.
Eigsti O. I. A morphological and cytological
investigation of certain members of the
Resedaceae. — An abstract of a thesis,
Univ. Illinois. Urbana, 1935.
Eigsti O. I. Pollen tube behavior in
self-fertile and interspecific pollinated
Resedaceae. — Amer. Natur., 1937, v. 71, p. 520—
521.
Elfving F. Studien iiber die Pollenkorner der
Angiospermen. — Jen. Zeit. Nat., 1879,
Bd 13, S. 1-28.
Elfving F. Studien iiber die Pollenkorner der
Angiospermen. — Quart. J. Micros. Sci.,
1880, Bd 20, S. 19-35.
Endress P. K., Voser P. Zur Androeciumanlage
und Antherenentwicklung bei Caloncoba
echinata (Flacourtiaceae). — Plant Syst.
and Evol., 1975, Bd 123, N 4, S. 241—253.
319
Eng Low Lee, Rao A.N. Pollen germanation
and formation of callose plugs in papaya
pollen tubes. — Curr. Sci., 1968, v. 37,
N 24, p. 690—692.
Engell K. A preliminary morphological, cyto-
logiGal and embryological investigation in
Polygonum viviparum. — Bot. tidsskr.,
1973, Bd 67, N 4, p. 305-316.
Engleman E. M. Ovule and seed development
in Certain cacti. — Amer. J. Bot., 1960,
v. 47, N 6, p. 460—467.
Engleman E. M. Ontogeny of aleurone grains
in cotton embryo. — Amer. J. Bot., 1966,
v. 53, N 3, p. 231—237.
Engler A. Beitrage zur Kenntnis der Sapota-
ceae. — In: Engler's Botan. Jahrb.
Leipzig, 1890, Bd 12, S. 496—525.
Engler A. Dichapetalaceae. — In: Engler A.,
Plantl K. Die naturlichen Pflanzenfami-
lien. Leipzig, 1896, Teil 3, Abt. 4, S. 345—
351.
Engler A. Strasburgeriaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenfami-
lien. Leipzig, 1925a, Bd 21, S. 87—89.
Engler A. Quiinaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenfami-
lien. Leipzig, 1925b, Bd 21, S. 106—108.
Engler A., Krause K. Dichapetalaceae. —In:
Engler A., Prantl K. Die naturlichen
Pflanzefamilien, 1931, Bd 2, Aufl. 19G,
S. 1-11.
Engler A., Melchior K. Medusagynaceae. —
In: Engler A., Prantl K. Die naturlichen
Pflanzenfamilien. Leipzig, 1925, Bd 21,
S. 50—52.
Enzenberg U. Beitrage zur Karyologie des
Endosperms. — Osterr. bot. Z., 1961, Bd 108,
S. 245—285.
Erben M. Die Gattung Limonium im sudwest-
mediterranium Raum. — Mitt. bot. Sta-
atssamml. Munchen, 1978, Bd 14, S. 361—
631.
Erbrich P. Uber Endopolyploidie und Kern-
strukturen in Endospermhaustorien. —
• Osterr. bot. Z., 1965, Bd 112, H. 3, S. 197—
262.
Erdtman G. Pollen morphology and plant
taxonomy. Stockholm, 1952. 539 p.
Eubel J. Allgemeine Zusammensetzung und
Aminosauren des Eiwei|3es von Hasel- und
Walnussen. — Zeitschr. Lebensmittel-
uptersuch. und Forsch., 1956, Bd 104,
H. 6, S. 429—434.
Facchini F. Amicis. results on a study of Cu-
curbita pepo. — Flora, 1844, Bd 27,
S. 359—360.
Fagerlind F. Wo kommen tetrasporische durch
drei Teilungsschritte vollenwickelte Em-
bryosacke unter den Angiospermen vor? —
Bot. notis., 1938, H. 1—3, S. 461—498.
Fagerlind F. Embryo sack von Plumbagella
und Plumbago. — Arkiv bot., 1939a,
Bd 29B, N 1, S. 1-8.
Fagerlind F. Drei Beispiele des Fritillaria-
Typus. — Sven. bot. tidskr., 1939b, Bd 33,
H. 2, S, 188—204.,
Fagerlind F. Kritische und revidierende Un-
* tersuchungen uber das Vorkommen des
Adoxa («Lilium» — Typus). —Acta horti
berg., 1939c, N.. 13, p. 1—49.
Fagerlind F. Zytologie und Gametophyten-
bildung'in der Gattung Wikstroemia. —
' Hereditas, 1940, Bd 26, S. 23—50.
Fagerlind F. Die systematische Stellung der Fa-
milie Grubbiaceae. — Sven. bot. tidskr.,
1947, Bd 41, H. 3, S. 315—320.
Farr С. Н. Cytokinesis of the pollen mother
cells of certain dicotyledons. — Mem. New
York Bot. Gard., 1916, v. 6, p. 253—317.
Fathima Т., Kumari P. K. Embryological
studies in Gapparidaceae. I. Sporogenesis and
the development of gametophytes in Gleume
viscosa Linn. — Proc. Indian Acad. Sci. B,
1970, v. 72, N 5, p. 207—215.
Fiedler V. Beitrage zur Kenntnis der Nycta-
giniaceen. Diss. Halle, 1910, S. 572^605.
Fink B. Contribution to tie life history of
Rumex". — Minn. Bot. Stud., 1899, v. 2,
ser. 2, p. 137—153.
Fischer A. Zur Kenntnis der Enibryosackent-
wicklung einiger Angiospermen. — Jen.
Zeit. Nat., 1880, Bd 7, S. 9—132.
Fischer Д. В., Jensen W. A. Cotton embryoge-
nesis: the identification, as nuclei, of the
x-bodies in the degenerating synergid. —
Planta (Berl.), 1969, Bd 84, H. 1, S. 122—
133.
Fischer H. E. Gigaspollen infojge ausbleiben-
der Zytokinese bei Beta vulgaris. — Zuch-
ter. Dtsch., 1962, Bd 32, S. 307—311.
Fischer J. B. The vegetative and reproductive
structure of Papaya (Carica papaya). —
Lyonia, 1980, v. 1, N 4, p. 191—207.
Forman L. L. The re-instatement of Galearia
Zool. et Мог. and Microdesmis Hook. f.
in the Pandaceae. — Kew Bull., 1966,
v. 20, p. 309.
Foster L. T. Morphological and cytological
studies on Carica papaya. — Bot. Gaz.,
1943, v. 105, N 1, p. 116—126.
Fougere-Rifot M. Intercellular relations and
wall structures in mature embryo sac of four
species of angiosperms. — Acta Soc. bot.
pol., 1981, v. 50, N 1—2, p. 131—138.
Frampson V. L., Pons W. A., Kerr Th. A
comparison of chemical properties of. seeds of
Gossypium species. — Econ. Bot., 1960,
v. 14, N 3, p. 197-199.
Frean M. L. Cytoplasmic changes during
microsp orogenesis in Euphorbia obesa
Hook, f. — Prac. Electron. Microscopy Soc.
South. Afr., 1979, v. 9, p. 87—88.
Frisendahl A. Cytologische und entwicklung-
geschichtliche Studien uber Myricaria ger-
manica Desv. — Kgl. sven. vetenskaps
akad. handl., 1912, Bd 48, N 7, S. 1—62.
Frisendahl A. Uber die Entwicklung chasmo-
gamer und kleistogamer Bliiten bei der
Gattung Elatine. — Acta horti Gotheb., 1927\
Bd 3, S. 99—142.
Fritzsche J. Beitrage zur Kenntnis der Pollen.
Berlin, 1832. 50 S.
Fuchs A. Beitrage. zur Embryologie der Thy-
melaeaceae. — Osterr. bot. Z., 1938, Bd 8,
H. 1, S. 1—41.
Galimberti Z. Embriologia di Codiaeum varie-
gatum var. pictum. N. G. — Giorn. bot.
ital., 1963, v. 70, p. 21—32.
Galle P. Untersuchungen zur Bliitenentwick-
lung der Polygonaceen. — Bot. Jahrb.
Syst. Pflanzengesch. und Pflanzengeogr.,
1977, Bd 98, N 4, S. 449—489.
Gambhir I. R., Joshi S. S. Chemical
examination of the seeds of Abutilon indicum,
G. Don. — J. Indian Chem. Soc, 1952,
v. 29, N 6, p. 451—454.
320
Ganapathy P. Clethraceae. — Bull. Indian
Nat. Sci. Acad., 1970, N 41, p. 239—240.
Ganapathy P. S., Palser B. F. Studies of
floral morphology in the Ericales. VII.
Embryology in the Phyllodoceae. — Bot. Gaz.,
1964, v. 125, N 4, p. 280—297.
Ganong W. F. Upon polyembryony and its
morphology in Opuntia vulgaris. — Bot.
Gaz., 1898a, v. 25, N 4, p. 221—228.
Ganong W. F. Contribution to a knowlege of
the morphology and ecology of the Cacta-
ceae. 2. The comparative morphology of the
embryos and seedlings. — Aim. Bet.,
1898b, v. 12, N 48, p. 423—474.
Garagaty-Feissly C. Sur les modifications de
Pultrastructure des cellules tapetales du
genre Daphne au cours du developpement
des grains de pollen. — Ber. Schweiz, bot.
Ges., 1969/1970, Bd 79, с 221—228.
Gareau L. Nature de la cuticle ses relations
avec Г ovule. — Ann. Sci. Nat., 1849,
v. 3, N 13, p. 304—315.
GeitlerL. Beobachtungen iiber die erste Teilung
1 im Pollenkorn der Angiospermen. —
Planta, 1935, Bd 24, S. 361—386.
Gerlach-Cruse D. Experimentelle Auslosung
von Semigamie bei Arabidopsis thaliana
(L.) Heyn. — Biol. Zbl., 1970, Bd 89,
N 4, S. 435—456.
Gershoy A. The male gametophyte in some
species of Violets. — Amer. J. Bot., 1940,
v. 27, N 4.
Ghosh R. B. Supernumerary archesporial cell
in Ochna atropurpurea. — Curr. Sci.,
1964, v. 33, N 4, p. 116—117.
Gibbs L. S. Notes on the development and
structure of the seed in the Alsinoideae. —
Ann. Bot., 1907, v. 21, p. 25—55.
Gilg E. Ancistrocladaceae. — In: Engler A.,
Prantl K. Die natiirlichen Pflanzenfami-
lien. Leipzig, 1925, 2 Anfl., Bd 21, S. 589—
592.
Goebel K. Beitrage zur Kenntnis gefullter
Bluthen. — Jahrb. Wiss. Bot., 1886, Bd 17,
H. 2, S. 207—294.
Goebel K. Bemerkung zu vorstehende Mit-
teilung. — Biol. Zbl., 1900, Bd 20, S. 571—
572.
Goffwald H., Paramesuaran N. Beitrage zur
Anatomie und Systematik der Quiina-
ceae. — Bot. Jahrb. Syst. Pflanzengesch.
und Pflanzengeogr., 1967, Bd 87, H. 3,
S. 361—381.
Gopinath D. M. Development of the female
gametophyte in Flacourtia cataphracta and
F. ramontchili. — Proc. Indian Sci. Congr.
33, 1946, v. 3, p. 109.
Gopinath D. M., Gopalkrishnan K. S. The
ovule and the development of the female
gametophyte in Homonia retusa and
Euphorbia oreophylla. — Amer. Midland Natur.,
1949, v. 41, p. 759—764.
Gorczynski T. Badania histo-cytologiczne' nad
kwiatami kleistogamicznemi u Lamium
amplexicaule, Oxalis acetosella i Viola
odorata. — Acta Soc. bot. pol., 1929,
Bd 6, S. 248—298.
Gorczynski T. Continuation des recherches sur
la cleistogamie. 2. Cardamine chenopodi-
folia. — Acta Soc. bot. pol., 1930, v. 12,
. . p. 257-274.
Gorczynski T. Untersuchumgen iiber Kleisto-
gamie. 4. Entwicklung der Archesporge-
webe und der Befruchtungsvorgang bei
Cardamine chenopodiifolia. — Acta Soc. bot.
pol., 1935, v. 12, p. 257—274.
Gore U. R. The development of the female
gametophyte and embryo in cotton. — Amer.
J. Bot., 1932, v. 19, N 10, p. 795—807.
Gori C. Sull'embriologia e citologia di alcune
specie del genera Reseda. — Caryologia,
1957, v. 10, p. 391—401.
Gori P. Protein bodies in the nucellus of
Euphorbia helioscopia. — J. Ultrastruct.
Res., 1976, v. 54, N 1, p. 53—58.
Gori P. Wall ingrowths in the embryo sac
of Euphorbia helioscopia. — Isr. J. Bot.,
1977, v. 26, N 4, p. 202—208.
Gori P., Sarfatti G., Cresti M. Development
of spherical organelles from the endoplasmic
reticulum in the nucellus of some
Euphorbia species. — Planta, 1971, v. 99, N 2,
p. 133—143.
Govil С. М. Fouquieriaceae. — Bull. Indian
Nat. Sci. Acad., 1970, N 41, p. 244—245.
Govindappa D. A. Morphological study of
Hypericum japonicum. — Mysore Univ.,
ser. B, 1956, v. 15, p. 69—79.
Graef P.E. The ovule and embryo sac of Galax
aphylla. — Virginia J. Sci., 1958, v. 9,
p. 319—322.
Graf J. Beitrage zur Kenntnis der Gattung
Populus. — Beih. Bot. Centrbl., 1921,
Bd 38. H. 1, S. 405—454.
Green M. W. A nomarski interference study
of megasporogenesis and megagametogene-
sis in Smelowskia calycina (Crucif erae). —
Amer. J. Bot., 1978, v. 65, N 3, p. 353—
358.
Grriesinger R. Zytologische und
experimentelle Untersuchungen an Erophila verna. —
Flora, 1912, Bd 129, S. 363—379.
Guedes M. Le genecee des Cruciferes septum et
stigmates. — С r. Acad. sci. (Paris), 1964,
t. 259, N 12, p. 2292—2295.
Guerin P. Le tegument seminal et les trachees
nucellaires des Thymeleacees. — С. г. Acad,
sci. (Paris), 1913, t. 156, p. 398—400.
Guerin P. Reliquiae Treubianae. I. Recherches
sur la structure anatomique de Povule et
de la graine des Thymeleacees. — Ann.
Jard. Bot. Buitenzorg., ser. 2, 1916, v. 14,-
p. 1—35.
Guggenheim R. Rasterelektronenmikroskopi-
scjie und morphometrische Untersuchungen
des Tilia-Pollens. Ein Beitrag zur Artun-
terscheidung von Tilia platyphyllos Scop,
und Tilia cordata Mill, in der Palynolo-
gie. — Flora, 1975, Bd 164, H. 4—5,
S. 287—338.
Guiet M. С Sur la signification du tegument
interne de Povule des Crucif eres et son ho-
mologie avec les scyphies merophylles du
Burgenia crassifolia Moench. — С. г. Acad,
sci. (Paris), 1969, ser. D, t. 268, N 2,
p. 322—324.
Guignard J. L. Embryogenie des Caryophyl-
lacees. Developpement de Pembryon chez
le Dianthus armeria L. — C. r. Acad. sci.
(Paris), 1963a, t. 256, N 3, p. 756—758.
Guignard J. L. Developpement de Pembryon
chez le Moehringia pentandra J. Gay (Ca-
ryophyllaceae). — С r. Acad. sci. (Paris),
1963b, t. 257, N 18, p. 2694—2697.
Guignard /. L. Embryogenie des Caryophyl-
laceae. Developpement de Pembryon chez
le Lychnis viscaria L. — C. r. Acad. sci.
(Paris), 1965, t. 260, N 11, p. 3144—3147.
lU 21 Сравнительная эмбриология
321
Guignard /. L. Embryogenie des Garyophyl-
lacees. Developpement de l'embryon chez
le Gerastium glomeratum Thuill. — G. r.
Acad. sci. (Paris), 1966a, t. 263, N 12,
p. 856—859.
Guignard /. L. Embryogenie des Caryophyl-
lacees. Developpement de Г embryon chez
le Gypsophylla elegans Bieb. — G. r. Acad,
sci. (Paris), 1966b, t. 262, N 26, p. 2718—
2721.
Guignard /. L. Embryogenie des Polygonacees.
Developpement de Г embryon chez le Rumex
aquaticus L. — Bull. Soc. bot. France,
1966c, t. 113, N 5—6, p. 224—226.
Guignard J. L. Embryogenie des Caryophyl-
lacees. Developpement de Г embryon chez
le Silene armeria L. — G. r. Acad. sci.
(Paris), 1967, t. 264, N 7, p. 907—910.
Guignard J. L. Embryogenie et classification
embryogenique. — Bull. Soc. bot. France,
1975, t. 122, N 7--8, p. 281—294.
Guignard J. L., Mestre J. C. Embryogenie
des Garyophyllacees. Developpement de
Г embryon chez le Gerastium pumilum
Curt. — G. r. Acad. sci. (Paris), 1967,
t. 265, N 1, p. 111—114.
Guignard J, L., Mestre J. C, Payrastre M. F.
Le devenir des cellules de Гарех caulinaire
lors de la germination du Cerastium
glomeratum Thuill. — G. r. Acad. sci.
(Paris), 1968, t. 266, N 12, p. 1246—1247.
Guignard L. Sur rorigine du sac embryonnaire
et le r61e des antipodes. — Bull. Soc. bot.
France, 1881, t. 28, p. 197—201.
Guignard L. Recherches sur le sac
embryonnaire des phanerogames angiospermes. —
Ann. sci. natur. Bot., 1882, ser. 6, t. 13,
p. 136-199.
Guignard L. Observations sur les ovules et la
fecondation des Cactees. — Bull. Soc. bot.
France, 1886, t. 33, p. 276—280.
Guignard L. Note sur rorigine et la structure
du tegument seminal chez les Capparidees,
Resedacees, Hypericacees, Balsaminees et
Lihacees. — Bull. Soc. bot. France, 1893a,
ser. 2, t; 40, p. 56.
Guignard L. Recherches sur le developpement
de la graine en particulier du tegument
seminal. — J. Bot., 1893b, v. 16, p. 361—
368.
Guignard L. Nouvelles recherches sur la
double fecondation chez les vegetaux
angiospermes. — G. r. Acad. sci. (Paris), 1900,
t. 131, p. 153—160.
Guignard L. La double fecondation chez les
Gruciferes. — J. Bot., 1902a, t. 16, N 11,
p. 361—368.
Guignard L. Sur la double fecondation chez les
Gruciferes. — G. r. Acad. sci. (Paris), 1902b,
t. 135, p. 497-499.
Guignard M. L. Nouvelles recherches sur la
double fecondation chez les vegetaux
angiospermes. — G. r, Acad. sci. (Paris),
1900, t. 131, p. 153—160.
Guignard M: L. La double fecondation chez
les Malvacees. — J. Bot., 1904, t. 18,
p. 296—308.
Gulati M., Ravishankar S. Studies in Symplo-
caceae. I: Microsporangium, microsporoge-
nesis and male gametophyte. — Phytomor-
phology, 1980, v. 30, N 2—3, p. 189—195.
Giirke M. Symplocaceae. — In: Engler A.,
Prantl K. Die natiirlichen Pflanzenfamilien.
Leipzig, 1897a, Teil 4, Abt. 1, S. 165—172.
822
Giirke M. Styracaceae. — In: Engler A,,
Prantl K. Die natiirlichen
Pflanzenfamilien. Leipzig, 1897b, Teil 4, Abt. 1, S. 172.
Qiirke M. Lissocarpa. — In: Engler A., Prantl
K. Die natiirlichen Pflanzenfamilien.
Leipzig, 1897c, Teil 4, Abt. 1, S. 180.
Gustafson F. G. Parthenocarpy natural and
artifical. — Bot. Rev., 1942, v. 8, N 9,
p. 599—654...
Haberlandt G. Uber die Ernahrung der Keim-
linge und die Bedeutung des Endosperms
bei viviparen Mangrovepflanzen. — Ann.
Jard. Bot. Buitenzorg, 1895, Bd 12, S. 105—
114.
Haccius B. Embryologische und histogeneti-
sche Studien an «monokotylen Dikotylen».
1. Glaytonia virginica. — Osterr. bot. Z.,
1954, Bd 101, H. 3, S. 285.
Haccius B. Occurence of oligo-or apetaly and
other malformations in Arabidopsis
flowers as a result of phenylboric acid (PhB)
treatment. — Arabid. Inf. Serv (Gottin-
gen), 1967, N 4, p. 18—19.
Haccius В., Bhandari N. Delayed histogen
differentiation as a common primitive
character in all types of non-zygotic embryos. —
Phytomorphology, 1975, v. 25, N 1, p. 91—
94.
Hagedoorn A. C, Hagedoorn A. L.
Parthenogenesis in Gucurbita. — Zeitschr. Ind.
Abstr. Vererb. Lehre, 1924, Bd 34, H. 3,
S. 186—213.
Hagerup O. Om Empetrum nigrum. — Bot.
tidsskr., 1922, Bd 37, S. 253—304.
Hagerup O. Konsdelenes bygning of udvikling
hos Koenigia islandica. — Medd. Gr0nland,
1926, Bd 58, S. 199—204.
Hagerup O. Empetrum hermaphroditum
(Lange) Hager. A new tetraploid Bisexual
species. — Dan. bot. ark., 1927, Bd 5,
N 2, S. 1-17.
Hagerup O. Morphological and cytological
studies of Bicornes. — Dan. bot. ark.,
1928, Bd6, N1, S. 1—26.
Hagerup O. Zytookologische Bicornes-Stu-
dien. — Planta, 1941, Bd 32, H. 1, S. 6—
14.
Hagerup O. Studies on the Empetraceae. —
Kl. Dansk. vid. selsk. biol. Medd., 1946,
Bd 20, N 5, S. 1-49.
Hagerup O. Autogamy in some drooping
Bicornes flowers. — Bot. tidsskr., 1954,
v. 51, N 1, p. 103-116.
Hague S. M. A morphological study of Dio-
spyros virginiana. — Bot. Gaz., 1911,
v. 52, N 1, p. 34-44.
Hakanson A. Some observation on the seed
development in Ecuadorian Cacao. — He-
reditas, 1947, v. 33, N 4, p. 526—538.
Hakansson A. Endosperm formation in Sa-
lix. — Bot. notis., 1954, H. 3, S. 326—332.
Hakansson A. Seed development of Brassica
oleracea and B. rapa after certain reciprocal
pollinations. — Hereditas, 1956, v. 42,
p. 373—396.
Hakki Madjlt Ismail. Embryologische und
morphologische Beobachtungen an Succo-
wia balearica (L.) Medik. (Brassicaceae). —
Bot. Jahrb, Syst. Pflanzengesch. und Pflan-
zengeogr., 1974, Bd 94, N 3, S. 360—382.
Hanstein /. Die Scheitelzellgruppe im vege-
tationspunkt der Phanerogamen. — Fest-
scher. Wiedenheim. Ges. Natur. u. Heil-
kunde, 1868, S. 109—143.
Hanstein J. Die Entwicklung des Keimes
der Monokotylen und Dikotvlen. — Bot.
Abhandl., Bonn, 1870, Bd 1, H. 1, S. 1 —
112.
Hanstein /. Die Parthenogenesis von Coelo-
bogyne ilicifolia. — Bot. Abhandl., Bonn,
1877, Bd 3, S. 1—56.
Ilarland S. С Haploids in polyembryonic
seeds of sea Island cotton. — J. Hered.,
1936, v. 27, N 6, p. 229-231.
Harlow R. D., Litchfield C, Hwei Choung Fu,
Reiser R. The triglyceride composition of
Myrica carolinensis fruit coat fat (bayberrv
tallow). — J. Aw. Oil Chemists Soc, 1965,
v. 42, N 9, p. 747—750.
Harms H. Malesherbiaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenfami-
lien. Leipzig, 1897, N. S., S. 253.
Harms H. Achariaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenfami-
lien. Leipzig, 1897, N. S., S. 256—257.
Harms H. Malesherbiaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenfami-
lien. 2 Aufl. Leipzig, 1925a, Bd 21, S. 467—
470.
Harms H. Achariaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenf ami-
lien. 2 Aufl. Leipzig, 1925b, Bd 21, S. 507—
510.
Harms H. Grubiaceae. — In: Engler A.,
Prantl K. Die naturlichen Pflanzenjami-
lien. 2 Aufl. Leipzig, 1935, Bd 166, S. 46—
51.
Haupt A. W. Ovule and embryo sac of
Plumbago capensis. -* Bot. Gaz., 1934, v. 95,
N 3, p. 649—659.
Hedayetullah S. The development of female
gametophyte in Moringa pterygosperma
Gaerth. — Proc. 22nd Indian Sci. Congr.
(Calcutta), 1935, pt 3, Abstr., p. 258.
Hedemann E. Uber experimentelle Erzeugung
von Adventivembryonen bei Mirabilis uni-
flora und Mirabilis froebelii. — Biol. Zbl.,
1931, Bd 51, H. 11, S. 647—652.
Heel W. A. Anatomical and ontogenetic
investigations on the morphology of the
flowers and the fruit of Scyphostegia bor-
neensis Stapf. (Scyphostegiaceae). — Blu-
mea, 1967, v. 15, N 1, p. 107—125.
Heel W. A. Distally lobed integuments in
some angiosperms ovules. — Blumea, 1970,
v. 18, N 1, p. 67—70.
Heel W. A. Flowers and fruits in Flacourtia-
ceae. 1. Scaphocalyx spathacea Ridley. —■
Blumea, 1973, v. 21, N 2, p. 259—279.
Heel W. A. Flowers and fruits in Flacourtia-
ceae. 2. The seeds of Pongium edule Reinw.—
Blumea, 1974, v. 22, N 1, p. 15—19.
Heel W. A. Flowers and fruits in Flacourtia-
ceae. 3. Some Oncobeae. — Blumea, 1977,
v. 23, N 2, p. 349—369.
Heel W. A. Flowers and fruits in Flacourtia-
ceae. 5. Hydnocarpus spp. Kiggelaria afri-
cana L., Casearia spp., Berberidopsis co-
rallina Hook. F. — Blumea, 1979, v. 25,
N 2, p. 519—529.
Hegelmaier F. Untersuchungen uber die Mor-
phologie des Dikotyledonen Endosperms. —
Nova acta Acad. С L. С G, Nat. Cur.,
1885, Bd49, S. 1—104.
Hegelmaier F. Untersuchungen uber die
Morphologie des Dikotyledonen
Endosperms. — Nova acta Ksl. Dtsch. Akad.
Nat., 1887 (1885), Bd 49, H. 1, S. 3-104.
Hegelmaier F. Uber einen neuen Fall von
Habitueller Polyembryonie. — Ber. Dtsch.
bot. Ges., 1901, Bd 19, S. 489—499.
Hegelmaier F. Zur Kenntnis der
Polyembryonie von Euphorbia dulcis (purpurata). —
Ber. Dtsch. bot. Ges., 1903, Bd 21, S. 6—
19.
Hegnauer R. Chemotaxonomie der Pflanzen.
Dicotyledoneae : Acanthaceae—Cyrillaceae.
Basel—Stuttgart, Birkhauser, 1964, Bd 3.
743 S.
Hegnauer R. Chemotaxonomie der Pflanzen.
Dicotyledoneae: Daphniphyllaceae—Lyth-
raceae. Basel—Stuttgart, Birkhauser, 1966,
Bd 4. 551 S.
Hegnauer R. Chemotaxonomie der Pflanzen.
Dicotyledoneae: Magnoliaceae— Quiinaceae.
Basel—Stuttgart, Birkhauser, 1969, Bd 5.
506 S.
Hegnauer R. Chemotaxonomie der Pflanzen.
Dicotyledoneae: Rafflesiaceae—Zygophyl-
laceae. Basel—Stuttgart-, 1973, Bd 6. 882 S.
Heilborn O. Taxonomical and cytological
studies on cultivated Ecuadorian species
of Carica. — Ark. bot., 1921, v. 17, p. 1—
16.
Heilborn O. Taxonomical and embryological
notes on Carica. — Acta horti berg., 1929,
Bd 9, N 5, p. 105—108.
Heimerl A. Beitrage zur Anatomie der Nicta-
gineen. 1. Zur Kenntnis des Blutenbaues
und Fruchtentwicklung einiger Nyctagi-
neen (Mirabilis jalapa und longiflora, Oxy-
baphus nyctagineus Sweet). — Denkschr.
Akad. Wiss. Wien, 1887, Bd 53, N 2,
S. 61—78.
Heimlich L. F. Microsporogenesis in the
cucumber. — Proc. Nat. Acad. Sci. USA,
1927a, v. 13, p. 113—115*
Heimlich L. F. The development and anatomy
of the staminate flower of the cucumber. —
Amer. J. Bot., 1927b, v. 14, N 5, p. 227—
237.
Heimlich L. F. Microsporogenesis in Cucumis
sativus. — Cellule, 1929, v. 39, p. 7—24.
Heinricher E. Die Eiweisschlauche der Cruci-
feren und verwandte Elemente in der
Rhoedinen—Reihe. — Mitt. Bot. Inst.
Graz., 1886, Bd 1, S. 1-92.
Henning L. Beitrage zur Kenntnis der Re-
sedaceen Bliite und Frucht. — Planta, 1930,
Bd 9, S. 507—563.
Henry A. Recherches morphologiques et
' cytologiques sur la transformation de
Г ovule en graine chez le Capsella bursa-
pastoris L. — D. E. S. pres la Faculte des
Sci. de Lille, 1956. 46 p.
Henry A. Observations sur la croissance de
la silicule et de Г ovule chez le Capsella
bursa-pastoris. — Bull. Soc. bot. France,
1957, t. 104, N 7—8, p. 484—489.
Henry A. Formation du gametophyte femelle
chez le Capsella b. p. — Bull. Soc. bot.
France, 1958, t. 105, N1—2, p. 20-26.
Heslop-Harrison /., Hespop-Harrison V. Enzy-
mic removal of the profeinaceous pelliche
of the stigma papilla prevents pollen tube
entry in the Caryophyllacees. — Ann. Bot.,
1975, v. 39, N 159, p. 163-165.
Hesse M. Entwicklungsgeschichte und Ultra-
struktur des Pollenkitts bei Tilia (Tilia-
ceae). — Plant Syst. and Evol., 1978,
v. 129, N 1—2, p. 1—11.
V2 21 Сравнительная эмбриология
323
Heusser С. Over de voortplantingsorganen van
Hevea brasiliensis. — Arch. Rubberkult.
Ned-Ind., 1919, v. 3, p. 455—514'.
Heyn A.N.J. Die Befruchtung bei Theobro-
ma cacao. — Kon. Acad. Wet. Amsterdam,
1930, v. 33, p. 533—541.
Himmelbaur W. Eine blutenmorphologische
Studie iiber Datisca cannabina. — S. B.
Akad. Wiss. Wien, 1909, Bd 118, S. 92—
113.
Hindmarsh G. J. An embryological study of
five species of Bassia. — Proc. Linn. Soc.
' N. S. W., 1965, v. 90, p. 274-289.
Hjelmquist H. Variations in embryo sac
development. — Phytomorphology, 1964,
v. 14, N 2, p. 186—196.
Hjelmqvist H. The origin of the Plumbagella— •
type. — Phytomorphology, 1967 (1968),
v. 17, N 1-4, p. 211-214.
Hjelmqvist H., Grazi F. Studies on variation
in embryo sac development.4— Bot. notis.,
1964, v. 117, fasc. 2, p. 141—166.
Hoar C. S., Haertl E.J. Meiosis in the genus
Hypericum. — Bot. Gaz., 1932, v. 93,
p. 197—204.
Hoefert L. L. Fine structure of sperm cells
in pollen grain of Beta. — Protoplasma,
1969, v. 68, N 1—2, p. 237—240.
Hoefert L. L. Ultrastructure of tapetall cell
ontogeny in Beta. — Protoplasma, 1971,
v. 73, N 3—4, p. 397—406,
Hofmann U. Die Stellung von Stegnosperma
innerhalb der Gentrospermen. — Ber. Dtsch.
bot. Ges., 1977, Bd 90, H. 1/2, S. 39—52.
Hofmeister W. Uber die Entwicklung des
Pollens. — Bot. Z., 1848, Bd 6, S. 425—434,
649—658, 670—674.
Hofmeister W. Die Entstehung des Embryo
der Phanerogamen. Eine Reihe mikrosko-
pischer Untersuchungen. Leipzig, 1849.
89 S.
Hofmeister W. Ubersicht neuerer Beobachtun-
gen der Befruchtung und Embryobildung
der Phanerogamen. — Ber. sachs. Ges.
Wiss. math.-nat. CI., 1856, S. 77—102.
Hofmeister W. Neuere Beobachtungen iiber
die Embryobildung der Phanerogamen. —
Jahrb. Wiss. Bot., 1858a, Bd 1, S. 82—190.
Hofmeister W. Embryobildung der
Phanerogamen. — Jahrb. Wiss. Bot., 1858b, Bd 1,
S. 101—103.
Hofmeister W. Neue Beitrage zur Kenntnis
der Embryobildung der Phanerogamen. 1.
Dikotyledonen mit ursprunglich einzelli-
gen, nur durch Zellenteilimg wachsendem
Endosperm. — Abhandl. Kgl. sachs. Ges.
Wiss., 1859, Bd 6, S. 535—672.
Hofmeister W. Lehre von der Pflanzenzelle,
Leipzig, 1867. 110 S.
Hohnel F. Morphologische Untersuchungen
iiber die Samenschalen der Cucurbitaceen
und einiger verwandten Familien. — Sit-
zungber. Akad. Wiss. Wien, 1876, Bd 73,
S. 297—337.
Holm Th. Observations on seedlings of north
american Phaenogamous plants. — Ottawa
Nat., 1908, v. 22, p. 235.
Holm Th. Claytonia gronov. A morphological
and anatomical study. — Mem. Nat. Acad.
Sci. Washington, 1911, v. 10, p. 27.
Holm Th. Types of Claytonia Gronov. K.0-
benhavn, 1914.
Hopping M. E. Structure and development
of fruif and seeds in Chinese gooseberry
(Actinidia chinensis Planch.). — N. Z. J.
Bot., 1976, v. 14, N 1, p. 63—68.
Hopping M. E., Jerram E. M. Pollination
of kiwifruit (Actinidia chinensis Planch.):
Stygma-style structure and pollen tube
growth. — N. Z. J. Bot., 1979, v. 17, N 3r
p. 233—240.
Horn С. К. Existence of only one variety of
cultivated mangosteen, explained by ase-
xually formed «seed». — Science, 1940,
v. 92, N 2385, p. 237—238.
Huber I. A. Bliiten und Samenentwicklung der
Kakteen und ihre Bedeutung fur deren
systematische Stellung. — Mschr. Dtsch»
Kakt. Ges., 1929, Bd 1, S. 175—190.
Huber I. A. Die Entwicklung der Samen bei
den Kakteen. — Cactaceae, 1937, t. lr
p. 9—12.
Hubert E. de. Recherches sur le sac embryon-
naire des plantes grasses. — Ann. Sci.
Nat. Bot., 1896, t. 8, N 2, p. 37—128.
Hulbary R. L., Rao A. N., Michel В. Е.
The development of flowers within the
ovary of Raphanus sativus L. — Proc.
Jowa Acad. Sci., 1957, v. 64, p. 127—131.
Hull E. D. Polyembryony in Opuntia ra-
finesguii. — Amer. Bot., 1915, v. 21, N 2Л
p. 56-57.
Hutchinson J. Families of flowering plants.
Ed. 1. Oxford, 1926, v. 1. 229 p.
Hutchinson J. The families of flowering plants.
Ed. 2. Oxford, 1959a, v. 1. 510 p.
Hutchinson J. The families of flowering plants.
Ed. 2. Oxford, 1959b, v. 2, p. 511—792.
Hutchinson J. Dichapetalaceae. — In: The
genera of flowering plants. Oxford, 1964,
v. 1, p. 216—219.
Ikeno S. On hybridization of some species
of Salix. — Ann. Bot., 1922, v. 36, p. 175—
191.
Iyer R. D. Embryological studies in relation
to interspecific hybridization in jute. —
In: Plant embryology. A symposium С S.
J. R. New Delhi, 1962, p. 49—54.
Iyer R. D., Sulbha K., Swaminathan M. £.
Fertilization and seed development in
crosses between G. olitorius and C. capsula-
ris. — Indian I. Genet, and Plant Breed.t
1961, v. 21, N 3, p. 191—200.
Jaenicke J. Electronenmicroscopische
Untersuchungen an Embryonen von Theobroma
cacao L. wahrend der Embryogenese und
Samenkeimung. Diss. Dokt. Hannover,
1973. (Naturwiss. Fak. Math, und Natur-
wiss. techn. Univ.).
Jaensch O. Beitrag zur Embryologie von
Ardisia crispa. Diss. Breslau, 1905. 35 S.
Jamaha G. Uber die Zytokinese bei der Pol-
lentetradenbildung, zugleich weitere
Beitrage zur Kenntnis iiber die Zytokinese in
Pflanzenreich. — Jap. J. Bot., 1926, v. 3,
p. 2.
Janchen E. Randbemerkungen zu grossers
Bearbeitung der Cistaceen. — Osterr. bot.
Z., 1909, Jahr. 59, N 5, S. 194—201.
Jaretzky R. Die Degenerationserscheinungen
in den Bliiten von Rumex flexuosus. —
Jahrb. Wiss. Bot., 1927, Bd 68, H. 3,
S. 301—320.
Jaretzky R. Bildungsabweichungen in Cruci-
feren Bliiten. — Planta, 1928a, Bd 5, N 3,
S. 444-463.
Jaretzky R. Untersuchungen iiber Chromoso-
men und Phylogenie bei einiger Crucife-
324
ren. — Jahrb. Wiss. Bot., 1928b, Bd 68,
N 1, S. 1-45.
Jaretzky R. Histologische und karyologische
Studien an Polygonaceen. — Jahrb. Wiss.
Bot., 1928c, Bd 69, H. 3, S. 357—490.
Jaretzky R. Die Chromosomenzahlen in»der
Gattung Mattiola. — Ber. Dtsch. bot. Ges.,
1929, Bd47, S. 82, 85.
Jaretzky R. Beziehungen zwischen Chromo-
somenzahl und Systematik bei den Cruci-
feren. — Jahrb. Wiss. Bot., 1932, Bd 76,
-S. 485—527.
Jennings D. L. Variation in pollen and ovule
fertility in varieties of cassava and the
effects of interspecific crossing on
fertility. — Euphyitica, 1963, v. 12, p. 69—
76.
Jensen W. A. The composition and ultra-
structure of the nucellus in cotton. — J.
Ultrastruct. Res., 19бЪа, v. 13, N 1—2,
p. 112-128.
Jensen W. A. The ultrastructure and
histochemistry of the synergids of cotton. —
Amer. J. Bot., 1965b, v. 52, N 3, p. 238—
256.
Jensen W. A. The ultrastructure and
composition of the egg and central cell of cotton. —
Amer. J. Bot., 1965c, v. 52, N 8, p. 781—
797.
Jensen W. A. Changes in the zygote between
formation and division in cotton. — Amer.
J. Bot., 1967, v. 54, N 5, p. 636.
Jensen W. A. Cotton embryogenesis: the
zygote. — Planta (Berl.), 1968, Bd 79, H. 4,
S. 346—366.
^Jensen W. A. Cotton embryogenesis: the tube
containing ER. — J. Ultrastruct. Res.,
1968a, v. 22, N 3—4, p. 296—302.
Jensen W. A. Cotton embryogenesis :
polysome formation in the zygote. — J. Cell
Biol., 1968b, v. 36, N 2, p. 403—406.
Jensen W. A. Cotton embryogenesis : pollen
tube development in the nucellus. — Can.
J. Bot., 1969, v. 47, N3, p. 383—386.
Jensen W. A. The embryo sac and
fertilization in angiosperms. Hawaii. Univ. Hawaii,
1972. 48 p.
Jensen W. A. Reproduction in flowering
plants. — Dyn. aspects Plant Ultrastr.
London e. a., 1974, p. 481—503.
Jensen W. A. The role of cell division in
angiosperms embryology. — Cell. Div.
Higher Plants, London, e. a., 1976, p. 391 —
405.
Jensen W. A., Fischer D, B. Cotton
embryogenesis: double fertilization. — Phytomor-
phology, 1967 (1968), v. 17, N 1—4, p. 261—
269.
Jensen W. A., Fischer D. B. Cotton
embryogenesis: the entrance and discharge of the
pollen tube in the embryo sac. — Planta
(Berl.), 1968a, Bd 78, H. 2, S. 158—183.
Jensen W. A., Fisher D. B. Cotton
embryogenesis: the sperm. — Protoplasma, 1968b,
v. 65, N 3, p. 277-286.
Jensen W. A., Fischer D. B. Cotton
embryogenesis: the pollen tube in the stigma and
style. — Protoplasma, 1970, v. 69, N 2,
p, 215-220.
Jensen W. A., Fischer D. В., Ashton M. E.
Cotton embryogenesis: the pollen
cytoplasm. — Planta (Berl.), 1968, Bd 81, H. 2,
S. 206—228.
Jensen W. A., Schulz P., Ashton M. E.
An ultrastructural study of early
endosperm development and synergid changes
in unfertilized cotton ovules. — Planta
(Berl.), 1977, v. 133, N 2, p. 179—189.
Johansen D. A. Recent work on the cytology
of Cacti. — Cactus and Succul. J., 1933,
v. 4, p. 356.
Johansen D. A. Morphology and embryology
of Fouquieria. — Amer. J. Bot., 1936,
v. 23, p. 95—99.
Johansen D. A. Plant embryology. Waltham,
Mass. U. S. A., 1950. 305 p.
Johnson D. S. The fruit* of Opuntia pulgida.
A study of perennation and proliferation
in the fruit of certain Cactaceae.
Washington, 1918. 62 p.
Johnston O. W. Cytological studies of male
gamete formation in certain angiosperms. —
Amer. J. Bot., 1941, v. 28, p. 306—319.
Johri В. M. The life history of Butomopsis
lanceolata Kunth. — Proc. Indian Acad.
Sci. B, 1936, v. 4, p. 139—162.
Johri В. М. Endosperm and embryo
development in Aealypha indica. — Proc. 39th
Indian Sci. Congr., 1952.
Johri В. М. The endosperm of Tamarix. —
Proc. 41th Indian Sci. Congr., 1954, v. 3,
p. 139—140.
Johri В. М. Embryology and taxonomy. —
In: Recent advances in the embryology of
angiosperms. Delhi, 1963, p. 395—444.
Johri В. М., Bhatnagar S. P. Embryology
and taxonomy of the Santalales. 1. —
Proc. Nat. Inst. Sci. India, B, 1960, v. 26,
p. 199—220.
Johri В. М., Bhojwari S. S. Growth response
of mature endosperm in cultures. —
Nature, 1965, v. 208, p. 1345—1347.
Johri В. М., Как D. The embryology of
Tamarix Linn. — Phytomorphology, 1954,
v. 4, N 1/2, p. 230—247.
Johri В. М., Kapil R. N. Contribution to
the morphology and life history of
Aealypha indica L. — Phytomorphology, 1953,,
v. ,3, p. 137—151.
Johri M. M., Maheshwari S. С Changes
in the carbohydrates, proteins and nucleic
acids during seed development in opium
poppy. — Plant a. Cell Physiol., 1966,
v. 7, N 1, p. 35—47/
Johri S. M., Chowdhury Ch. R. A
contribution to the embryology of Citrullus colo-
cynthis Schrad. and Melothria madera-
spatana Cogn. — New Phytol., 1957, v. 56,
N 1, p. 51—60.
Jones R., Earle F. R. Chemical analyses of
seeds. 2. Oil and protein content of 759
species. — Econ. Bot., 1966, v. 20, N 2,
p. 127—155.
Jonsson B. Om embryosackens utveckling
hos Angiosperma. — Lunds. univ. Arsskr.,
1879—1880, t. 16, p. 1—86.
Jonsson B. Utterligare bidrag till kannedomen
om Angiospermernas embryosackutve-
ckling. — Bot. notis., 1881, N 6, S. 169—
187.
Jorgensen C. A. Studies on Callitrichaceae. —
Bot. tidsskr., 1923, Bd 38, S. 81—126.
Joshi A. C. A contribution to the embryology
and cytology of Rivina humilis Linn. —
J. Indian Bot. Soc, 1936, v. 15, p. 91—103.
Joshi A. C. A note on the antipodals in Di-
gera arvensis Forsk. — Curr. Sci., 1936,
v. 4, N 10, p. 741—742.
21* 325
Joshi A. C. A study of pollen in the Thyme-
laeaceae. — Proc. 24th Indian Sci. Gongr.,
1937.
Joshi A. C. Venkata Rao C. A contribution
to the anatomy, morphology and cytology
of the flower of Digera arvensis Forsk. —
J. Indian Bot. Soc, 1934, v. 13, N 1,
p. 201—236.
Joshi A. C., Rao V. R. The embryology of
Gisekia pharnaceoides L. — Proc. Indian
Acad. Sci. B, 1936, v. 3, p. 71—92.
Joshi A. C., Kajale L. B. A note on the
structure and development of the embryo sac,
ovule and fruit of Tamarix dioica Roxb. —
Ann. Bot., 1936, v. 50, p. 421—426.
Joshi A. C., Kajale L. B. Fertilization and
seed development in Amaranthaceae. —
Proc. Indian Acad. Sci. B, 1937, v. 5, N 3,
p. 91—100.
Joshi P. C, Wadhwani A. M., Johri В. M.
Morphological and embryological studies of
Gossypium L. — Proc. Nat. Inst. Sci.
India B, 1967, v. 33, N 1—2, p. 37—93.
Judson J. E. The morphology and vascular
anatomy of the pistillate flower of the
Cucumber. — Amer. J. Bot., 1929, v. 16,
N 2, p. 69—86.
Juei H. O. Beitrage zur Anatomie der Marc-
graviaceen. — Kgl. sven. vetenskapsakad.
handl., 1887, Bd 12, S. 1—28..
Juel H. O. Untersuchungen iiber die Auflo-
sung der Tapetenzellen in den Pollensacken
der Angiospermen. — Jahrb. Wiss. Bot.,
1915, Bd 56, S. 337—364.
Kajale L. B. The female gametophyte of
Alternanthera sessilis. — Proc. Indian
Acad. Sci., 1935, B2, p. 476—480.
Kajale L. B. Embryo development in Boerha-
avia diffusa. — Gurr. Sci., 1936, v. 4,
N 10, p. 743.
Kajale L. B. A case of polyembryony in the
Nyctaginaceae. — Curr. Sci., 1937a, v. 5,
N 8, p. 429.
Kajale L. B. Embryology of Achyranthes
aspera Linn. — Proc. Indian Acad. Sci.
B, 1937b, v. 5, N 5, p. 195—205.
Kajale L. B. The antipodals of Pupalia lap-
pacea Juss. — Gurr. Sci., 1937c, v. 6, N 5,
p. 222.
Kajale L. B. Embryo and seed development
in the Nyctaginaceae. 1. Studies in the
genus Boerhaavia. — J. Indian Bot. Soc,
1938, v. 17, N 4, p. 243—254.
Kajale L. B. A contribution to the life history
of Bergia ammanioides. — J. Indian Bot.
Soc, 1939, v. 18, p. 157—167.
Kajale L. B. A contribution to the embryology
of the Amaranthaceae. — Proc. Nat. Inst.
Sci. India, 1940a, v. 6, p. 597—625.
Kajale L. B. Structure and development of
male and female gametophytes of Sesuvium
portulacastrum L. — Proc Nat. Acad. Sci.
India B, 1940b, v. 10, p. 82—89.
Kajale L. B. A contribution to the
embryology of the genus Portulaca. — J. Indian
Bot. Soc, 1942, v. 21, p. 1—19.
Kajale L. B. A contribution to the
embryology of the Phytolaccaceae. 1. Studies in the
genus Phytolacca. — Patha Univ. J., 1944,
v. 1, p. 10—21.
Kajale L. B. A contribution to the
embryology of the Phytolaccaceae. 2. Fertilization
and the development of embryo, seed and
fruit in Rivina humilis and Phytolacca
dioica. — J. Indian Bot. Soc, 1954a,
v. 33, N 3, p. 206—225. -
Kajale L. B. Development of the embryo,
endosperm and seed coat in two species
of the Phytolaccaceae. — Proc Indian Sci.
Gongr., 1954b, v. 41, p. 140.
Kajale L. B. Fertilization and the
development of embryo and seed in Euphorbia
hirta Linn. — Proc. Nat. Inst. Sci. India
B, 1954c, v. 20, p. 353—360.
Kajale L. В., Murthy^ K. S. N. The embryo
sac of Acalypha ciliata Forsk. — J. Indian
Bot. Soc, 1954, v. 33, N 4, p. 417—422.
Kajale L. В., Rao G. V. Pollen and embryo
sac of two Euphorbiaceae. — J. Indian
Bot. Soc, 1943, v. 22, p. 229—236.
Kallarackal J. Integument initiation and
seed coat development in Lunaria bipartita
(Vent) Willd. — Bot. Jahrb., 1978, v. 99,
N 4, p. 579-585.
Kapil R. N. A contribution to the embryology
of Euphorbia esula and Ghrozophora obli-
qua. — Proc 42nd Indian Sci. Gongr., 1955,
v. 3, p. 234—235.
Kapil R. N. A futher contribution to the
morphology and life history of Ghrozophora
Neck. — Phytomorphology, 1956a, v. 6,
p. 278—288..
Kapil R. N. Development of the embryo sac
and endosperm in Ghrozophora rottleri:
a reinvestigation. — Bot. Gaz., 1956b r
v. 117, p. 242—247.
Kapil R. N. Morphological and embryological
studies in some Euphorbiaceae together
with a discussion on the systematic position
of the family. — Ph. D. Thesis, Delhi
Univ., 1958.
Kapil R. N. Embryology of Acalypha L. —
Phytomorphology, 1960, v. 10, p. 174—189.
Kapil R. N. Some embryological aspects of
Euphorbia dulcis L. — Phytomorphology,
1961, v. 11, p. 24—36.
Kapil R. N. Grossosomataceae. — Bull. Indian
Nat. Sci. Acad., 1970, N 41, p. 63—68.
Kapil R. N., Bhatnagar A. K. Endosperm
in Euphorbiaceae a critical appraisal. —
Adv. PI. Morph., 1972, p. 376—393.
Kapil R. N., Maheshwari R. Embryology of
Helianthemum vulgare. —
Phytomorphology, 1964, v. 14, N 4, p. 547—557.
Kapil R. N., Prakash N. Coexistence of mono-,
bi-, and tetrasporic embryo sacs in Delo-
sperma cooperi (Hook, f.) L. Bol. (Aizoa-
ceae). — Beitr. Biol. Pflanz., 1966, Bd 42,
H. 3, S. 379—391.
Kapil R. N., Prakash N. Morphology,
embryology and systematic position of the
Cactaceae. — Proc 54th Indian Sci. Congr.
(Hyderabad), 1967, pt 3, Abstr., p. 306.
Kapil R. N., Prakash N. Embryology of
Cereus jamacarn and Ferocactus wislizeni
and comments on the systematic position
of the Cactaceae. — Bot. notis., 1969,
v. 122, N 3, p. 409—426.
Kapil R. N., Sethi S. B. Development of
male and female gametophytes in Camellia
sinensis (L),0. Kuntze. — Proc Nat. Inst.
Sci. India, 1963, v. 29, N 5, p. 567—574.
Kapil R. N., Vani R. S. Embryology and
systematic position of Crossosom califor-
nicum Nutt. — Curr. Sci., 1963, v. 32, •
p. 493—495.
Karsten G. tlber die Mangrove-Vegetation im
Malayischen Archipel. Eine morphologisch-
826
biologische Studie. — Bibl. Bot., 1891,
H. 22, S. 18—20.
Kaur H. Embryological investigations on
Bixa orellata Linn. — Proc. Nat. Inst. Sci.
India B, 1969, v. 35, N 6, p. 487—506.
Kaur A, Embryological and cytological
studies on some members of the Dipterocarpa-
ceae. Ph. D. Thesis University of
Aberdeen, 1977.
Kaur D. Turneraceae. — Bull. Indian Nat.
Sci. Acad., 1970, N41, p. 194—198.
Kaur H. Bixaceae. — Bull. Indian. Nat.
Sci. Acad., 1970, N 41, p. 205—207.
Kausik S. B. Structure and development of
the ovule and embryo sac of Lasiosiphon
eriocephalus. — Proc. Nat. Inst. Sci. India,
1940, v. 6, p. 117—132.
Kavaljian L. The floral morphology of Glethra
alnifolia with some notes on G. acuminata
and G. arborea. — Bot. Gaz., 1952, v. 113,
N 4, p. 392—413.
Kayser G. Beitrage zur Entwicklungsgeschi-
chte der Samendecken bei den Euphorbia-
ceen mit besonderer Berucksichtigung von
Ricinus communis. — Ber. Pharmac. Ges.,
1892, Bd 2, S. 5—19.
Kayser G. Untersuchungen uber das eigenartige
Verhalten des Nucellus der Samenanlagen
von Groton flaveus var. balsamifer. —
Ber. Dtsch. bot. Ges., 1893, Bd 11, S. 61.
Kelkar S. S. The female gametophyte of
Euphorbia tirucalla. — Sci. and Cult.,
1960, v. 25, p. 633—635.
Kemesle R. Embryologie des Elatinacees.
Developpement de l'embryon chez l'Ela-
tine alsinastrium. — G. r. Acad. sci.
(Paris), 1929, t. 184, p. 1569.
Keng H. Comparative morphological studies
in Theaceae. — Univ. Calif. Pubis. Bot.,
1962, v. 33, p. 269—384.
Keng H. Observations on Ancistrocladus
tectorius. — Gard. Bull. Singapore, 1967,
v. 22, part 1, p. 113—121.
Kenoyer L. Dimorphic carpellate flowers of
Acalypha indica. — J. Indian Bot. Soc,
1919, v. 1, p. 1—5.
Khan F. R., Saleemuddin M., Siddigi M.
Correlation between isocitrate lyase, lipids
and carbohydrate content of germinating
seeds of flax (Linum usitatissinium L.) and
mustard (Brassica campestris var. R. L. —
18). — Symp. Gontr. Mech. Cell. Process.
Bombay, 1978, Abstr., S. 1, s. a, p. 73.
Khan R. The ovules and embryo sac of Fou-
quieria. — Proc. Nat. Inst. Sci. India B,
1943, v. 9, p. 253—256.
Khan R. A case of twin ovules in Isomeris
arborea. — Curr. Sci., 1950, v. 19, p. 326.
Kihara H. Т. O. Cytological studies on Ru-
mex L. Chromosomes of Rumex acetosa L.
2. On the relation on chromosome number
and sexes in Rumex acetosa. — Bot. Mag.,
1923, v. 37, N 1, p. 35—36.
Kimura C. On the embryo sac of Populus
italica Moench. — Sci. Repts Tohoku Univ.
Biol., 1952, v. 16, p. 354—356.
Kimura C. The embryo sac of Populus siebol-
dii Miquel. — Sci. Repts Tohdku Univ.
Biol., 1955a, v. 21, N 1, p. 122—125.
Kimura C. On the embryo sac of three Japanese
species of Salix. — Sci. Repts Tohoku Univ.
Biol., 1955b, v. 21, p. 126—130.
Kimura С On the embryo sac formation of
some members the Salicaceae. — Sci. Rep.
Tohoku Univ. Biol., 1963, v. 29, p. 393—
398.
Kirkwood J. E. The comparative embryology
of the Gucurbitaceae. — Bull. N. Y. Bot,
Gard., 1905, v. 3, p. 313—402.
Kirkwood J. E. The pollen tube in some of
the Cucurbitaceae. — Bull. Torrey Bot*
Club, 1906, v. 33, N6, p. 327—341.
Kirkwood J. E. Some features of pollen
formation in the Cucurbitaceae. — Bull.-
Torrey Bot. Club, 1907, v. 34, N 5, p. 221-
242.
Kirsten E. A preliminary morphological,-
cytological and embryological investigation*
in Polygonum viviparum. — Bot. tidsskr.r
1973, v. 67, N 4, p. 305—316.
Kleiman R., Smith C. R., Yates S. G. Search
for new industrial oils. XII. Fifty-eight
Euphorbiaceae oils, including one rich in
vernolic acid. — J. Amer. Oil Chem. Soc,
1965, v. 42, N3, p. 169—172.
Kloos A., Bouman F. Case studies in aril
development Passiflora suberosa L. and
Turnera ulmifolia L. — Beitr. Biol. Pflanz.,
1979, Bd 55, H. 1, S. 49-66.
Knuth P. Uandbuch der Blutenbiologie.
Leipzig, 1898. 697 S.
Kny L. Wandtafeln fur den naturwiss Unter-
richt. Berlin, 1874, S. 20—22.
Kobuski С. Е. Studies in the Theaceae. XVII.
A review of the genus Bonnetia. — J.
Arnold Arboretum, 1948, v. 29, N 4, p. 393—
413.
Kobuski C.E. Studies in the Theaceae. XXIII.
The genus Pelliciera. — J. Arnold
Arboretum, 1951, v. 32, N 3, p. 256—262.
Koch L. Uber die Entwicklung des Samens
von Monotropa hypopitys L. — Verhandl.
Naturmedic. Vereins., Heidelberg, 1880,
Bd 2, S. 53-59.
Koch L. Die Entwicklung des Samens von
Monotropa hypopitys. — Jahrb. Wiss. Bot.,
1882, Bdl3, S. 1-52.
Kohler K.-H., Becker M. Biochemical
changes in embryos of dormant and after-
ripened seeds of Caryophyllaceae. — Acta
Soc. bot. pol., 1981, v. 50, N 1—2, p. 279—
288.
Kondratovics R., Jakobsone L. Biological
peculiarities in the formation of seeds of
some species of Rhododendron L. in the
Latvien SSR. — Internat. symp. on seed
physiology of woody plants. Kornik, 1968,
p. 167—173.
Korbar-Smid J. Anatomia in histokemiya
semena kranjeskega sebenika Erysimum
cariolica Doll. — Farm, vestn., 1967, N 9—
12, p. 214-221.
Kraft E. Experimentelle und Entwicklungsge-
schichte Untersuchungen an Caryophylla-
ceen-Bluten. — Flora, 1917, Bd 109,
S. 283—356.
Kratzer J. Die verwandtschaftlichen Be-
ziehungen der Cucurbitaceen auf Grund ihrer
Samenentwicklung (Mit spezieller
Berucksichtigung der Caricaceen, Passifloraceen,
Aristolochiaceen und Loasaceen). — Flora,
1918, Bd 110, S. 275-343.
Kroh M. An electron microscopic study of
the behavior of Cruciferae pollen after
pollination. — In: Zinskens H. F. Pollen
physiology and fertilization. Amsterdam,
1964, p. 221—224.
Kroh M., Munting A. J. Pollen germination
327
and pollen tube growth in Diplotaxis te-
nuifolia after cross-pollination. — Acta bot.
neer., 1967, v. 16, N 5, p. 182—187.
Kshirsagar B. G. Contributions to the
embryology of Polycarpaea corymbosa and
Mollugo stricta (M. pentaphylla). — Proc.
47th Indian Sci. Congr., 1960, v. 3, p. 357.
Kubicki B. Investigations on pollen
germination «in vitro» in diploid and tetraploid
muskmelons(Gucumismelo). — Genet, pol.,
1962, v. 3, N 2, p. 181—188.
Kubo A. On the germination of pollen of
Brassica napus L. — Bot. Mag. (Tokyo),
1960, v. 73, N 869—870, p. 453—457.
Kudlicka K., Kuras M. Ultrastruktura roz-
wivajacegosie gametofitu zenskiego u Stel-
laria. — Spraw. czyn. i pos. nduk. 1. Т. М.,
1980, v. 34, N 5, p. 1—9.
Kudlicka K., Kuras M., Rodkiewicz B. The
ultrastructure of the nucellus and the ga-
metophyte in developing ovules of Stellaria
media. — Acta med. pol., 1980, v. 21, N 4,
p. 363—364.
Kudlicka K., Kuras M., Rodkiewicz B.
Embryo sac development in Stellaria media. —
Acta Soc. bot. poL, 1981, v„ 50, N 1—2,
p. 143-^146.
Kumazawa M. The structure and affinities
of Paconia. — Bot. Mag. (Tokyo), 1935,
v. 49, N 581, p. 306—315.
Kuras M. Activation of embryo during rape
(Brassica napus L.) seed germination. —
Acta Soc. Bot. pol., 1978, v. 47, N 1—2,
p. 65—82.
Kuta P. Badania cy to-embri ologiczne nad
przedstawicielami rodzaja Viola L. sekcija
Nomimium Ging. z obzaru Polski. — Fragm.
florist, et geobot., 1978, v. 24, N 1, p. 23—
91.
Kuyjper /. Die Entwicklung des weiblichen
Geschlechtsapparats bei Theobroma
cacao. — Rec. trav. bot. neer., 1914, v. 11,
p. 37—43.
Lamba L. C. Structure and development of
seed in Brassica nigra Koch. — J. Indian
Bot. Soc, 1975, v. 54, N 3—4, p. 225—233.
Landes M. The embryo sac of Acalypha in-
dica L. — Beih. Bot. CtbL, 1941, Bd 16A,
S. 125—136.
Landes M. Seed development in Acalypha
rhomboidea and some other Euphorbia-
ceae. — Amer. J. Bot., 1946, v. 33, p. 562—
568.
Lantis V. Development of the microsporangia
and microspores of Abutilon theophrasti. —
Bot. Gaz., 1912, v. 54, p. 330—335.
La Rue C. D. Regeneration of endosperm of
gymnosperms and angiosperms. — Amer.
J. Bot., 1944, v. 31, p. 45.
Laubengayer R. A. Studies in the anatomy
and morphology of the Polygonaceous
flower. — Amer. J. Bot., 1937, v. 24, N 6,
p. 329—343.
Lauber #. Untersuchungen iiber das Wach-
stum der Fruchte einiger Angiospermen un-
ter endomitotischer Polyploidisierung. —
Osterr. bot. Z., 1947, Bd 94, S. 30—60.
Lebegue A. Embryologie des Gruciferes: Poly-
embryonie chez l'Arabis lyalii. S. Wats. —
Bull. Soc. bot. France, 1948, t. 95, N 7—9,
p. 250—252.
Lebegue A. Le proembryon de Gardamine pra-
tensis L. Le suspenseur et la differenciation
328
de l'hypophyse. — Bull. Soc. bot. France,
1949a, t. 96, N 7—9, p. 205—206.
Lebegue A. La differenciation du suspenseur
et 1'origine de l'hypophyse chez le
Sisymbrium irio L. — Bull. Soc. bot. France,
1949b, t. 96, N 7—9, p. 239—240.
Lebegue A. Le developpement de I'embryon
et la differenciation de l'hypophyse chez
le Draba verna L. — Bull. Soc. bot. France,
1950, t. 97, N 4—6, p. 103—105.
Lebegue A. La polyembryonie chez les angio-
spermes. — Bull. Soc. bot. France, 1952a,
t. 99, p. 329—367.
Lebegue A. Recherches embryogeniques sur
quelques Dicotyledones Dialypetales. —
Ann. sci. nat ur. Bot. et Biol, veget.,
11 ser., 1952b, t. 13, p. 1—150.
Lebegue A. Embryogenie des Malvacees.
Developpement de 1 embryon chez les Lava-
tera. — G. r. Acad. Sci. (Paris), 1954, t. 239,
N 25, p. 1838-1840.
Lebegue A. Embryogenie des Mesembryanthe-
macees.i Developpement de I'embryon chez
le Mesembryanthemum canaliculatum. —
C. r. Acad. sci. (Paris), 1955, t. 240, N 4,
p. 450—452.
Lebegue A. Nouveaux aspects d'une
classification embryologique. — Bull. Soc. bot.
France, 1966, t. 113, p. 129—133.
Lebegue A., Deschamps R. Embryogenie des
Cruciferes. Developpement de I'embryon
chez les Cakilinees. — C. r. Acad. sci.
(Paris), 1967, t. 264, N 4, p. 588—591. .
Lebegue A., Sarrazin P. L'embryogenese du
Teesdalia nudicaulis R. Br. et de l'Aubrie-
tia croatica Schott. — Bull. Soc. bot.'
France, 1957a, t. 104, N 5—6, p. 242—245.
Lebegue A., Sarrazin P. Les modalites du
developpement embryonnaire chez quelques
Gruciferes. — Bull. Soc. bot. France,
1957b, t. 104, N 7—8, p. 466—472.
Lebegue A., Vignon F. Contribution a Г
embryogenie des Caryophyllaceae. Le
developpement de I'embryon chez le Melandrium
album (Mill.) Garcke. (Lychnis alba). —
С. г. 93 Congr. Nat. Soc. savantes, sec. Sci.,
Tours, 1968, t. 3, p/485—507.
Lebegue M. A. Developpement de I'embryon
chez le Primula denticula S. M. — Bull.
Soc. bot. Nord France, 1958, t. 11, N 4,
p. 173—175.
Lechner S. Anatomische Untersuchungen iiber
die Gattungen Actinidia, Saurania, Clethra
und Clematoclethra mit besonderer Be-
rucksichtigung ihrer Stellung im System. —
Beih. Bot. CtbL, 1915, Bd 32, Abt. 1,
S. 431—467.
Leconte A. La fecondation chez l'hevea chemi-
nement des tubes polliniques dans Г ova-
ire. — Rev. Gen. Caoutch. Plast., 1981,
t. 58, N 616, p. 85—86.
Leins P. Entwicklungsgeschichtliche studien
an Ericales-Bluten. — Bot. Jahrb., 1964,
Bd 83, H. 1, S. 57—88.
Leins P., Bonnery-Brachten R.
Entwicklungsgeschichtliche Untersuchungen an Bliiten
von Datisca cannabina. — Beitr. Biol.
Pflanz., 1977, v. 53, p. 142—155.
Lemesle R. Position phylogenetique de Г
Hydrastis canadensis L. et Crossosoma califor-
nica Hutt., d'apres les particularites histo-
logiques du xylem. — G. r. Acad. sci.
(Paris), 1948, t. 227, p. 221—223.
Le Monnier. Sur la valeur morphologique de
Г albumen chez les Angiospermes. — J. Bot.,
1887, N 1, p. 140.
Lenkteler M. Test tube fertilization in Dian-
thus caryophyllus Linn. — Naturwissen-
schaften, 1965, Bd 52, N 23, S. 645—646.
Leonard I. Une nouvelle et curieuse famille
pour la flore Phanerogamique du Congo
Beige: les Ancistrocladaceae. — Bull. Soc.
roy. bot. Belg., 1949, t. 82, fasc. 1, p. 27—
40.
Lawis J. F. Notes on the development of
Phytolacca decandra L. — J. Hopkins Univ.
Girc, 1905, v. 178, p. 34—42.
Li H. L. A taxonomic review of the genus
Actinidia. — J. Arnold Arboretum, 1952,
v. 33, N 1, p. 1—61.
Lloyd DiG. Evolution of self-compatibility
and racial differentiation in Leavenworthia
(Gruciferae). — Gontr. Gray Herbarium,
1965, v. 195, p. 3—134.
Lloyd F.N. The pollen tube in the Cucurbi-
taceae and Rubiaceae. — Torreya, 1904,
v. 4, p. 86—91.
Lonay H. Genese et anatomie des pericarpes
et des spermodermes chez les Polygonacees.
1. Polygonum aviculare. — Mem. Soc. R.
Sci. Liege (3), 1922, v. 12, p. 1—88.
Lonay H. Contribution a l'etude des relations
entre la structure des differentes parties
de Г ovule et la nutrition generale de celui-ci
avant et apres la fecondation. — Bull. Sci.
Acad. Roy. Belg., ser. 5, 1922, t. 8, N 1,
p. 24—45.
Lonay H. L'ovule du Polygonum aviculare. —
Bull. Soc. Roy. Bot. Belg., 1923, t. 55, f. 2,
p. 175—177.
Long R. W. Aberrant microgametogenesis and
pollen tube growth in Polycarpaea nebulosa,
Garyophyllaceae. — Bull. Torrey Bot.
' Club,- 1965, v. 92, N 1, p. 46—50.
Longevialle M. Embryogenie des Caryophyl-
lacees. Developpement de l'embryon chez
l'Arenaria controversa Boiss. — G. r. Acad,
sci. (Paris), 1966, t. 263, N 17, p. 1205—
1208.
Longevialle M. Embryogenie des Caryophyl-
lacees. Developpement de Tembryon chez
le Gucubalus baccifer L. — C. r. Acad. sci.
(Paris), 1967, t. 264, N 2, p. 268-271.
Longevialle M. Embryogenie des Caryophyl-
lacees. Developpement de l'embryon chez
le Silene otites Sm. — C. r. Acad. sci.
(Paris), 1968, t. 266, p. 2071—2074.
Longevialle M. Embryogenie des Caryophyl-
lacees. Developpement de l'embryon chez
Silene laeta (A. f) A. Br.; etude d'embryons
en coupe et d'embryons extrais. — Bull.
Bot. France, 1970 (1971), t. 117, N 7—8,
p. 8367—8371.
Longevialle M. . Embryogenie des Caryophyl-
lacees. Developpement de l'embryon chez
Honkenya peploides Ehrh. Etude
d'embryons extraits. — G. r. Acad. sci. (Paris),
1971, t. 273, N 22, p. 2067—2070.
Longo B. La mesogamia mella commune zucca
(Gucurbita pepo). — C. r. Accad. naz.
Lindcei (Roma), 1901, v. 10, p. 168—172.
Longo B. Recherche sulle Cucurbitaceae e il
significo del percorso intercellulare (endo-
tropico) del tubetto pollinico. — Mem. R.
Accad. naz. Lindcei (Roma), 1903a, v. 4,
p. 523-549.
Longo B. La nutrizione dell embrione della
Gucurbita mezzo del tubetto pollinico. —
Mem. R. Accad. naz. Lindcei (Roma),
1903b, v. 5, p.
Longo B. La nutrizione dell'embrione delle
Gucurbita operate per mezzo del tubetto
pollinico. — Ann. Bot. (Roma), 1904, v. 1,
p. 71-74.
Longo B. La parthenocarpia nel Diospyros
virginiana. — C. f. Acad. naz. Lincei
(Roma), 1909, v. (5), 18, p. 632—635.
Love A. Cytogenetic studies in Rumex. III.
Some notes on the Scandinavian species
on the genus. — Heriditas, 1942, Bd 28,
H. 3—4, S. 289—296.
Love A. Cytogenetic studies on Rumex
subgenus Acetosella. — Hereditas, 1943, Bd 30,
H. 1, S. 1-136.
Lubbock I. A contribution to our knowledge
of seedlings. Ed. 2. London, 1896.
Luerssen С Zur Controverse iiber Einzellig-
keit oderMehrzelligkeit des Pollens der Ona-
graceen, Gucurbitaceen und Corylaceen. —
Jahrb. Wiss. Bot., 1869, Bd 7, S. 34—60.
Lundberg F. Bemerkungen iiber die Embryo-
sackentwiklung bei Godiaeum. — Bot. no-
tis., 1931, S. 346—349.
Lynch R. I. On the seed structure and
germination of Pachira aquatica. — J. 'Linn.
Soc. London (Bot.), 1880, v. 17, p. 147—
148.
Lyon F. M. A contribution to the life history
of Euphorbia corollata. — Bot. Gaz., 1898,
v. 25, p. 418—426.
Mass J. G. T. A. De bloembiologie van Hevea
brasiliensis? — Archiv rubber-culture Ned.
Indie Rubberserie, 1919, v. 22, p. 288—
312.
Mackiewicz T. Gametogenesis, embryo sac
development and pollen grain morphology
in Brassica oleracea var. caritata L. x B.
oleraceae var. acephala DC. hybrid-as
compared with the parental forms. — Genet,
pol., 1973a, v. 14, N 1, p. 1—10.
Mackiewicz T. Fertilization, endosperm and
embryo development in Brassica oleracea
var. capitata L.XB. oleracea var. acephala
DC. hybrid— as compared with the
parental forms. — Genet, pol., 1973b, v. 14,
, N 1, p. 11—19.
Madge M. A. Spermatogenesis and fertilization
in the cleistogamous flower of Viola odo-
rata var. praecox Gregory. — Ann. Bot.,
1929, v. 43, N 171, p. 545—577.
Magoon M. L., Krishnan R., Vijaya В. К.
Morphology of the pactytene chromosomes
and meiosis in Manihot esculenta Crantz. —
Cytologia, 1969, v. 34, N 4, p. 612—626.
Mahabale T. S., Solanky I. N. Studies in
Ghenopodiaceae. 1. Embryology of Suaeda
fruticosa. — J. Univ. Bombay, 1953a,
v. 21, p. 81—92.
Mahabale T. S., Solanky I. N. Studies in
Chenopodiaceae. 3. Embryology of Kochia
scoparia. — J. Univ. Bombay, 1953b, v. 22,
p. 18—25.
Mahabale T. S., Solanky I. N. Studies in
Ghenopodiaceae. 4. Embryology of Chenopodium
ambrosioides Linn. — J. Univ. Bombay,
1953c, v. 22, p. 31—42.
Mahabale T. S., Solanky I. N. Studies in
Ghenopodiaceae. 2. Embryology4 of Arthro-
cnemum indicum. — J. Univ. Bombay,
1953d, v. 23, p. 93—100.
Mahabale T. S., Solansky I. N. Studies in
329
Chenopodiaceae. 2. Emlryology of Arthro-
cnemum indicum. — Proc Indian Acad.
Sci. B, 1954a, v. 39, p. 212—222.
Mahabale T. S., Solansky I. N. Studies in
Chenopodiaceae. 5. Embryology of Cheno-
podium murale. — J. Univ. Bombay,
1954b, v. 23, p. 25—37. ,
Mahalingappa M.S. Anther and male gemeto-
phyte development in Turner a ulmifolia
Linn. (var. angustifolia Willd.). — Curr.
Sci. (India), 1975, v. 44, N 17, p. 640—
641.
Maheshwari Devi #., Rao R. M. S.
Embryology of Suaeda maritima (Linn.) Dumort. —
Curr. Sci. (India), 1976, v. 45, N 10, p. 383—
385.
Maheshwari P. Contribution to the
morphology of Boerhaavia diffusa. 1. — J. Indian
Bot. Soc, 1929, v. 8, N 4, p. 219—
234.
Maheshwari P. A review of Newmann's paper
on «Die Entwicklung des Pollens, der Samen-
nalage und des Embryosackes von Pereskia
amopola var. argentina». — J. Indian Bot.
Soc, 1936, v. 15, p. 333—334.
Maheshwari P. A note on Dr. Kajale's recent
paper on the Amaranthaceae. — Curr. Sci.,
1941, v. 10, N 3, p. 182.,
Maheshwari P. The development of the embryo
sac of Euphorbia heterophylla: a
reinvestigation. — Proc. Indian Acad. Sci. B, 1942,
v. 15, p. 158—166.
Maheshwari P. Embryology of angiosperms
as a field of research. — Nature, 1945a,
v. 156, p. 354—355.
Maheshwari P. The place of angiosperm
embryology in research and teaching. — J.
Indian Bot. Soc, 1945b, v. 24, p. 25—41.
Maheshwari P. The Fritillaria type of embryo
sac: a critical review. — J. Indian Bot.
Soc, M. 0. P. Icengar Comm., 1946, v. 8,
p. 101—119.
Maheshwari P. An introduction to the
embryology of angiosperms. New York, 1950,
p. 453.
Maheshwari P., Chopra R. N. Polyembryony
in Opuntia dillenii. — Curr. Sci., 1954,
v. 23, N 4, p. 130—131.
Maheshwari P., Chopra R. N. The structure
and development of the ovule, and seed of
Opuntia dillenii Haw. — Phytomorpho-
logy, 1955, v. 5, N 1, p. 112-122.
Maheshwari P., Chowdhury O. R. A note on
the development of the embryo sac in
Phyllanthus niruri. — Curr. Sci., 1937,
v. 5, p. 535—536.
Maheshwari P., Johri В. М. A note on the
embryo sac of Acalypha indica. — Curr.
Sci., 1940, v. 9, p. 322—323.
Maheshwari P., Johri В. М. The embryo sac
of Acalypha indica.— Beih. Bot. Gtbl.,
1941, Bd 61A, S. 125—136.
Maheshwari P., Johri В. М. The occurrence
of persistent pollen tubes in Hydrilla, Ot-
telia and Boerhaavia, together with a
discussion of the possible significance of this
phenomenon in the life history of
angiosperms. — J. Indian Bot. Soc, 1950, v. 29,
N 1, p. 47—51.
Maheshwari R., Khan R. Development of the
embryo sac, endosperm and embryo in
Isomeris arborea. — A reinvestigation. —
Phytomorphology, 1953, v. 3, p. 446—459.
Maheshwari P., Roy S. K. The embryo sac
of Salix. — Phytomorphology, 1951, v. 1,
N 12, p. 70—72.
Maheshwari P., Sachar R. C. A
reinvestigation of the embryology of Isomeris
arborea. — Curr. Sci., 1954a, v. 23, p. 61—63.
Maheshwari P., Sachar R. С The»endosperm
nodules of Capsella bursa-pastoris Moench.—
Sci. and Cult., 1954b, v. 19, N 8, p. 413—
414.
Maheshwari P., Sachar R. C. So-called
endosperm embryos in Isomeris arborea. —
Nature, 1955, v. 176, p. 470—472.
Maheshwari P., Sachar R. C.
Polyembryony. — In: Maheshwari P. (ed.). Recent
advances in the embryology of angiosperms.
Delhi, 1963, p. 265—296.
Mahony K. L. Morphological and cytological
. studies of Fagopyrum esculentum. — Amer,
J. Bot., 1935, v. 22, N 4, p. 460—47.5.
Mahony K. L. Morphological and cytological
studies on Fagopyrum esculentum. II.
Embryogeny. — Amer. J. Bot., 1936, v: 23,
N 2, p. 129—133.
Malte M. O. Embryologiska och cytologiska
undersokningar ofver Mercurialis annua.
Diss. Lund, 1910.
Manant P. Observations sur le developpement
des annexes embryonnaires chez quelques
Resedacees. — Bull. Soc bot. Nord France,
1958, t. 11, N 4, p. 179—189.
Mani A. P. Development of ovule and embryo
sac in Croton bonplandianum. — Sci. and
Cult., 1960, v. 25, p. 439—440.
Mann L. K. Fruit shape of watermelon as
affected by placement of pollen on stigma. —
Bot. Gaz., 1943, v. 105, N 2, p. 257—262.
Mann L. K., Robinson J. Fertilization, seed
development and fruit growth as related
to fruit set in the cantalopupe (Cucumis
melo L.). — Amer. J. Bot., 1950, v. 37,
N 9, p. 685—697.
Manshard E. Embryologische Untersuchungen
an Styrax obassia Sieb. et Zuss. — Planta,
1936, Bd 25, H. 3, S. 364—383.
Marin L., Dengler R. E. Granal plastids in
the cotyledons of the dry embryo of Kochia
chilolsii. — Can. J. Bot., 1972, v. 50,
N 10, p. 2049—2052.
Markowski A. Beitrage zur Kenntnis der Gat-
tung Pedilanthus. Diss. Halle, 1912.
Marquardt II., Barth О. М., Uta von Rahden.
Zytophotometrische und elektronenmikro-
skopische Beobachtungen tiber die Tape-
tumzellen in den Antheren von Paeonia
tenuifolia. — Protoplasma, 1968, v. 65,
p. 407—421.
Martin A. C. The comparative internal
morphology of seeds. — Amer.. Midi, and Na-
tur., 1946, v. 36, N 3, p. 513—660.
Martinoli G. La priorita della denominazione
«tipo Euphorbia dulcis» (1927), sulla
denominazione «tipo Fritillaria» (1937). —
N. G. Bot. Ital., 1940, v. 47, p. 464—468,
Martinson V. Polyembryony in Theobroma
cacao L. — Ann. Bot., 1972, v. 36, N 148,
p. 947—951.
Masters N. T. Vegetable teratology. London,
1869. 534 p.
Mathe O. Developpement autonome de Г
albumen de Ricin. Etude cytologique. —
Bull. Soc. hist, natur. Anvergne, 1928,
p. 41—62.
Mathew С J. Embryological studies in the
family Stachyuraceae and other supposedly
330
related families with respect to taxonomy.—
Ph. D. thesis. Univ. London, U. K., 1972.
Mathew C. J. Development of male and female
gametophytes in Camellia sasanqua. —
Phytomorphology, 1978, v. 28, N 3,
p. 262—269.
Mathew C. J., Chaphekar M. Development of
female gametophyte and embryogeny in
Stachyrus chinensis. — Phytomorphology^
1977, v. 27, N 1, p. 68—79.
Mathur J. M. S. The «in vivo» mechanism of
lypolysis of pea-nut and cotton seed fats. —
Gurr. Sci. (India), 1966, v. 35, N 12,
p. 302—303.
Mathur K. L. A note on the development of
the embryo sac of Vogelia indica. — Gurr.
Sci., 1940, v. 9, N 2, p. 180—182.
Mathur K. L., Khan R. The development
of the embryo sac in Vogelia-indica. — Proc.
Indian Acad. Sci. B, 1941, v. 13, N 3,
p. 360—368.
Matthews J. R., Knox E. M. The comparative
morphology of the stamen in the
Ericaceae. — Trans, and Proc. Bot. Soc.
Edinburgh, 1926, v. 29, p. 243—281.
Matthews J. R., Taylor G. The structure and
development of the stamen in Erica hirti-
folia. — Trans, and Proc. Bot. Soc.
Edinburgh, 1927, v. 29, p. 235—242.
Matthiessen A. A contribution to the
embryogeny of Paeonia. — Acta horti berg., 1962,
v. 20, N 2, p. 57—61.
Matthysen J. D. Gytologische und anatomi-
sche Untersuchungen an Beta vulgaris. —
Z. vergl. Dtsch. Zuckerind., 1912, Bd 49,
S. 137—151.
Mauritzon J. Uber die Embryologie der/Tur-
neraceae und Frankeniaceae. — Bot. notis.,
1933 («Lund 1933), H. 1—6, S. 543—554.
Mauritzon J. Zur Embryologie einiger Lyth-
raceen. — Acta horti Goteb., 1934, Bd 9,
S. 2-21.
Mauritzon J. Die Embryologie einiger Gap-
paridaceen sowie von Tovaria pendula. —
Ark. bot., 1934, Bd 26A, N 15, S. 1-14.
Mauritzon J. Ein Beitrag zur Embryologie
der Phytolaccaceen und Gactaceen. — Bot.
notis., 1934, S. 111—135.
Mauritzon J. Zur Embryologie der Elaeocar-
paceae. — Ark. bot., 1935, Bd 26A, N 10,
S. 1—8.
Mauritzon /. Zur Embryologie einiger Parieta-
les-Familien. — Sven. bot.. tidskr., 1936,
Bd 30, H. 1, S. 79-113.
Mauritzon J. Embryologische Angaben uber
Theophrastaceen. — Ark. bot., 1936,
Bd 28B, N 1, S. 1-4.
Mauritzon J. Zur Embryologie und systema-
tischen Abgrenzung der Reihen Terebin-
thales und Gelastrales. — Bot. notis., 1936,
S. 161—212. ..
Mauritzon J. Uber die Embryologie von
Marcgravia. — Bot. notis., 1939, H. 1,
S. 249-255.
Maury G. Pseudo-polyembryonie chez trois
dipterocarpacees africaines. — Bull. Soc.
hist, natur. Toulouse, 1970a, 1.106, p. 277—
381.
Maury G. Differents types de polyembryonie
chez quelques dipterocarpacees asiati-
ques. — Bull. Soc. hist, natur. Toulouse,
1970b, t. 106,p. 282—288.
Maury G. Interet systematique et phylogeni-
que des caracteres juveniles (germination,
embryon, mur, plantules) chez les
Dipterocarpacees. — Bull. Soc. bot. Fr.> 1980,
t. 126, N 3, p. 13—21.
McCann L. P. Development of the pistellate
flower and structure of fruit of turg, Aleuri-
tes fordii. — J. Agr. Res., 1942, v. 65,
p. 361-378.
McCann L.P. Embryology of the Tung tree. —
J. Agr. Res., 1945, v. 71, p. 215—229.
McGlone M.S. Pollen structure of the New
Zealand members of the . Styphelieae
(Epacridaceae). — N. Z. J. Bot., 1978,
v. 16, N 1, p. 91—101.
McKay S. A. Pollination and other factors
affecting fruit set and size of kiwi fruits. —
M. S. Thesis, Univ. California, Davis, 1977.
McLean D. M* Stamen morphology in
flowers of the muskmelon. — J. Agr. Res.,
1947, v. 74, N 2, p. 49—54.
McNair J. B. The taxonomic and climatic
distribution of oil and starch in seeds in
relation to the physical and chemical
properties of both substances. — Amer. J. Bot.,
1930, v. 7, N 7, p. 662—668.
Medina D. M. Macrosporogenese, formacSa de
saco embrionario desenvolimento de endo-
sperma e de embrido em uma ferma tetra-
ploide de melancia (Citrullus vulgaris
Schrad.). — Bragantia (Brazil), 1962, V. 21,
N 8, p. 83—105.
MelchiorH. Dichapetalaceae. — In: Engler A.
Syllabus der Pflanzenfamilien, Berlin,
1964, Bd 2.
Mendes L. О. T. Poliembrionia em Hevea
brasiliensis. — Rev. Agr., 1947, v. 22,
p. 161-164.
Mendoza Sister Rosalinda. Embryogenesis in
Amaranthus spinosus L. and Amaranthus
virdis L.'— Philipp. J. Sci., 1973, v. 103,
N 4, p. 243—268.
Mereminski M. Uber Embryosackentwicklung
bei Begonia incana Lindl. (Ein Beitrag zur
Embryologie der Gattung Begonia). —
Bull. Internal. Acad. Polon. Sci. a. Lett.,
Ser. В (1), 1936, N 3, S. 53—92.
Mestre J. С La signification phylogenetique
de Tembryogenie. — Rev. gen. bot., 1967,
v. 74, N 877, p. 273—324.
Mestre /. C, Guignard S. La mise en place
des meristemes caulinaire et' radiculaire
au cours de Tembryogenese du Cerastium
pumilum Curt. — Bull. Soc. bot. France,
1967, t. 114, N 9, p. 387—396.
Meunier A. Les teguments seminaux des Cy-
elospermees. I. — Cellule, 1890.
Mez C. Myrsinaceae. — In: Engler A. Das
Pflanzenreich. Berlin, 1902, H. 9
(IV. 236), S. 1—437.
Mez C. Theophrastaceae. — In: Engler A.
Das Pflanzenreich. Berlin, 1903, H. 15
(IV. 236a), S. 1—48.
Miannay N. Embryologie des Cruciferes
polyembryonie chez l'Arabis hirsuta Scop,
et TArabis halleri L. — Bull. Soc. bot.
France, 1972, t. 118, N 5—6, p. 341—344.
MierasJ. Impotency with Euphorbia obesa. —
Succulenta, 1978, v. 57, p. 150.
Mihov A., Zagorcheva L. A case of apogamy
in Cucumis sativus L. — С R. Acad. Bul-
gare Sci., 1966, v. 19, N 6, p. 527—529.
Miller W. L. Staminate flower of Echinocys-
tis lobata. — Bot. Gaz., 1929, v. 88,
p. 262—284.
Miller H. A., Kline H. /. The development
331
of the androecium, the gynoecium and the
embryo of Ghenopodium ambrosioides. —
Congr. Internate, 9th, 1959, v. 2, p. 263—
264.
Mirbel C. F. B. Nouvelles recherches sur la
structure et le developpement de Г ovule
vegetale. — Ann. sci. natur., 1829, t. 17,
p. 302—318.
Mirick S., Guinn J. A. Some observation on
the reproductive biology of Gaultheria pro-
cumbens (Ericaceae). — Amer. J. Bot.,
1981, v. 68, N 10, p. 1298—1305.
Misra R. C. Contribution to the embryology
of Arabidopsis thalianum (Gay and
Mom). — Arga Univ. J. Res.-Sci., 1962,
v. 11, pt 3, p. 191—200.
Misra R. C. Morphological studies on
Sisymbrium irio Linn. — J. Indian Bot. Soc,
1966, v. 46, N 1—2, p. 14—23.
Moeliono'B. M. A preliminary note on the
placenta of Stellaria media (L) Vill. and
Stellaria graminea L. a possible axil origin
of ovule. — Acta bot. neer., 1959, t. 8,
N 3, p. 392-393.
Mohan Ram H. Y., Satsangi A. Induction
of cell divisions in mature endosperm of
Ricinus communis during germination. —
Gurr. Sci., 1963, v. 32, p. 28—29.
Monnier M. Effect of the oxygen pressure on
the development of the embryo of Gapsella
bursa—pastoris cultivated in vitro. — G. r.
Acad. sci. (Paris), ser. D, 1976, t. 282,
N 10, p. 1009—1012.
Montanelli R. Sulla divisione cellule madri
del polline nelle Gucurbitaceae. — Bull.
Soc. Bot. Ital., 1907, p. 116—119.
Montemartini L. Contribute alio studio dell'
anatomia del frutto e del seme delle Opun-
zie. — Atti. Inst. bot. Univ. Pavia, 1899,
ser. II, v. 5, p. 59—68.
Montemartini L. Studio anatomico sulla Da-
tisca cannabina. — Ann. bot. (Roma), 1905,
v. 3, p. 101—112.
Moore R. J., Lindsay D. R. Fertility and
polyploidy of Euphorbia cyparissas in
Canada. — Can. J. Bot., 1953, v. 31, p. 152—
163.
Morris M. R. Cytogenetic studies on
buckwheat. — Heredity, 1951, v. 42, p. 85—89.
Morrow L. A. Studies in the reproductive
biology of leafy spurge (Euphorbia esula
L.). — Ned. Sci., 1979, v. 27, p. 106—109.
Morstatt H. Beitrage zur Kenntnis der Rese-
daceen. Diss. Heidelberg, 1902.
Mortier /. Embryologie des Malvacees. Poly-
embryonie chez ,le Malva. silvestris L. et
le Malva moschata L. — Bull. Soc. bot.
r France, 1966, t. 113; N 5—6, p. 229—232.
Mortier J. Embryogenie des Malvacees.
Developpement de Tembryon chez Г Althaea
officinalis L. — Bull. Soc. bot. France,
1969, t. 116, N 9, p. 505—510.
Mortier /., Lebegue A. Embryogenie des
Malvacees. Developpement de Fembryon chez
les Malva. — C. r. Acad. sci. (Paris), 1966,
t. 263, N 22, p. 1706—1709.
Moquin-Tandon A. Elements de Teratologic
vegetale ou Histoire abregee des anomales
de Г organisation dans les vegetaux. Paris,
1841. 403 p.
Mukherjee P. K. Studies in the embryology
of Euphorbia hypericifolia Linn. — Bull.
Bot. Soc. Univ. Saugar, 1957, v. 9, p. 7—18.
Mukherjee P. K. The female gametophyte of
Acalypha malabarica Muoll, with a brief
discussion on the Penaea type of embryo
sac. — J. Indian Bot. Soc, 1958, v. 37,
p. 504—508.
Mukherjee P. K. Embryology of two Euphor-
biaceae. — Proc. Indian Acad. Sci. B,
1961a, v. 53, N 5, p. 217—229.
Mukherjee P. K. Study of mature embryo, seed
coat and fruit wall in Euphorbia cristata. —
J. Biol. Sci. Bombay, 1961b, v. 4, p. 1—5.
Mukherjee P. K. Gametophytes of three
Euphorbiaceae. — Bull. Bot. Soc. Coll.
Sci. Nagpur, 1962, v. 3, p. 10—14.
Mukherjee P. K. Futher contribution to the
embryology of the genus Acalypha Linn. —
Proc. Nat. Acad. Sci. India, 1964, 34B,
p. 129—141.
Mukherjee P. K. Contribution to the
embryology of Euphorbia peltata Roxb. — Proc.
Nat. Acad. Sci. India, 1965, 35B, p. 327—
337.
Mukherjee P. K. Embryological studies in
Polygonum barbarum L. — J. Indian. Bot.
Soc, 1972, v. 51, N 2, p. 106—112.
Mukherjee P. K., Padhye M. D. Contribution
to the embryology of the genus Phyllanthus
Linn. — Proc. Acad. Sci. India, 1964, 34B,
p. 117—128.
Mukherjee P. K., Venugopalan P. Male and
female gametophytes of Ionidium suffruti-
cosum Ging. — J. Indian Bot. Soc, 1957,
v. 36, N 4, p. 513-518.
Miiller K. Beitrage zur Entwicklungsgeschi-
chte des PfIanzen—Embryo. — Bot. Zeit.,
1847, Jahrb. 5, S. 42—44, 737—742, 753—
761, 769—778.
Muntzing A. Some observations on
pollination and fruit setting in Ecuaderian
Cacao. — Hereditas, 1947, v. 33, N 3, p. 397—
404.
Murgai Prem. The development of the embryo
in Paeonia — a reinvestigation. — Phyto-
morphology, 1959 (1960), v. 9, N 3,
p. 275—277.
Murgai Prem. Embryology of Paeonia
together with a discussion on its systematic
position. — Plant, embryology, a
symposium, 1962, p. 215—223.
Murthy S. N. Morphological studies on the
Sapotaceae. 1. Embryology of Bassia la-
tifolia and related genera. — J. Mysore
Univ., B. 2, 1941, p. 67—80.
Muzik T. J. Development of fruit, seed,
embryo and seedling of Hevea braziliensis. —
Amer. J. Bot., 1954, v. 41, p. 39—43.
Myers O. Megasporogenesis, megagameto-
phyte development and endosperm
development in Hypericum virginicum. — Amer.
J. Bot., 1964, v. 51, p. 664 (Abstract).
Nagaraj M. Floral morphology of Populus
deltoides and P. tremuloides. — Bot. Gaz.,
1952, v. 114, N 2, p. 222—243.
Nageli K. Zur Entwicklungsgeschichte des
Pollens bei den Phanerogamen. Zurich, 1842.
Nagl W. Uber Endopolyploidie, Restitution-
skernbildung und Kernstructuren im Su-
r spensor von Angiospermen und einer Gym-
* nospermen. — 5sterr. bot. Z., 1962, Bd 109,
S. 431—494.
Nair N. С Floral morphology of Agrostem-
ma. — J. Indian Bot. Soc, 1966, v. 45,
N 3-4, p. 371-374.
882
Nair N. С, Abraham V. A contribution to the
morphology and embryology of Micrococca
mercurialis. — J. Indian Bot. Soc, 1963,
v. 42, p. 583—593.
Nair N. C, Maitreyi M. Morphology and
embryology of Sebastiania chamelea. — Bot.
Gaz., 1963, v. 124, N 1—2, p. 58-68.
Nair N. C, Nair V. J. Floral morphology of
Boerhaavia verticillata. — Curr. Sci., 1963,
v. 32, N 7, p. 322—324.
Naithani S. P. A contribution to the
morphology of Digera arvensis. — Bull. Acad.
Sci. U. P. India, 1933, v. 3, N 2, p. 119—
128.
Nakai T. Diapensiaceae. — In: Flora sylva-
tica Koreana. Seul, 1923, pt 13, p. 1—6.
Narayana H. S. Seed structure in the Aizo-
aceae. — In: Proc. Summer School of
Botany. Darjeeling, 1960, New Delhi, 1962,
p. 220—230.
Narayana H. S. Postfertilization study on
Moringa oleifera'Lam. — Phytomorphology,
1962, v. 12, N 1, p. 65-69.
Narayana H. S. Studies in the Capparidaceae.
I. The embryology of Gapparis decidua
(Forsk.) Pax. — Phytomorphology, 1962,
v. 12, N 2, p. 167—177.
Narayana H. S. Studies in Gapparidaceae.
II. Floral morphology and embryology of
Cadaba indica Lamk. and Crataeva nurvala
Buch.-Ham. — Phytomorphology, 1965,
v. 15, N 2, p. 158—175.-
Narayana H. S. Moringaceae. — Bull. Indian
Nat. Sci. Acad., 1970, N 41, p. 81—83.
Narayana H. S.^ Jain K. A contribution to
the embryology of Limeum indicum. —
Lloydia, 1962, v. 25, N 2, p. 100—108.
Narayana H. S., Lodha В. С. Contribution
to the development of male and female
gametophytes of Glinus lotoides. — Proc.
48th Indian Sci. Congr., 1961, N 3, p. 274.
Narayana H. S., Lodha В. С Embryology
• of Orygia decumbens. — Phvtomorphology,
1963, v. 13, p. 54—59.
Narajana H. S., Lodha B.C. Embryology of
Glinus lotoides L. — Proc. Indian Acad.
Sci., 1972, v. 75B, N 2, p. 77—85.
Narayanaswami S., Sawhney S. Microsporo-
genesis and embryo sac development in
Casearia tomentosa Roxb. — Rev. Intern.
Bot. Exptl., 1959, v. 13, p. 133—144.
Nemec B. Das Problem der Befruchtungsvor-
gange und andere eytologische Fragen.
. Berlin, 1910.
Nesque J. Developpement du sac embryon-
naire des phanerogames angiospermes. —
Ann. Sci. nat. Bot., 1878, ser. 6, N 6,
p. 237—285.
Nesque K. Nouvelles recherches sur le
developpement du sac embryonnaire des
Phanerogames Angiospermes. — Ann. Sci. nat.
Bot., 1879, ser. 6, N 8, p. 261^-390.
Netolitzky F. Anatomie der Angiospermen-
Samen. Berlin, 1926. 364 S.
Neubauer B. F. The development of the achene
of Polygonum pensylvanicum: embryo,
endosperm and pericarp. — Amer. J. Bot.,
1971, v. 58, N 7, p. 655—664.
Neumann M. Die Entwicklung des Pollens,
der Samenanlage und des Embryosackes von
Pereskia amapola var. argentina. — Osterr.
bot. Z., 1935, Bd 84, S. 1—30.
Newcomb W., Fowke L. C. The fine structure
of the change from the free-nuclear to
cellular condition in the endosperm of chick-
weed Stellaria media. — Bot. Gaz., 1973,
v. 134, N 3, p. 236."
Newcomb W., Fowke L. С Stellaria media
embryology the development and ultra-
structure of the suspensor. — Can. J. Bot.,
1974, v. 5, N 3, p. 60.
Nirawian P. A contribution to the life
histories of Stellaria media Linn, and ,Poly-
carp on loeflingiae (Benth.) Hook. — Proc.
Nat. Inst. Sci. India, B, 1952, v. 18, N 5,
p. 399-406.
Noack K. liber Hypericum-Kreuzungen. 6.
Fortpflanzungsverhaltnisse und. Bastarde
von Hypericum perforatum. — Z.
Inductive Abstam. u« verebro, 1939, Bd 77,
S.'569—601.'
Nohara S. Experimental studies on pollen
of some Salix. — Jap. J, Bot., 1923, v. 11,
p. 1924-1925.
Norton G., Haris J. F. Compositional changes
in developing rape seed (Brassica napus
L.). - Planta, 1975, v. 123, N 2, p. 163—
174.
Oksijuk P. Zur Blutenbiologie der Zucker-
riibe. — Ber. Dtsch. bot. Ges., 1928, Bd 46,
S. 403-408,,
Oliva A. Vergleichende anatomische und ent-
wicklungsgeschichtliche Untersuchungen
die Gruciferen-Samen. — Z. allg. Osterr.
Apothuwereins, 1905, Jahrb. 43, S. 41—52.
Oliver F. W. On Sarcodes sanguinea. — Ann.
Bot., 1891, v. 4, N 15, p. 303—326.
Ono T. Further investigations on the cytology
of Rumex. — Bot. Mag. (Tokyo), 1928,
v., 42, N 6, p. 524—533.
Ono T. Chromosomen und Sexualitat von
Rumex acetose. — Sci. Repts Tohoku Univ.
Ser. 4, 1935, v. 10, p. 41—210.
Oostenink W. J. Ovary wall and pericarp
ontogeny in Lychnus alba (Garyophyl-
laceae). — Proc. Lowa Acad. Sci., 1976,
t. 83, N 2, p. 55—62.
Opute F. I. Seed lipids of the grain
amaranths. — J. Exp. Bot., 1979, v. 30, N 116,
p. 601—606.
Orr M. Y. Observations on the structure of
the seed in the Capparidaceae and Reseda-
ceae. — Notes Roy Bot. Gard. Edinburgh,
1921, v. 60, p. 259.
Osawa I. On the development of the pollen-
grain and embryo sac of Daphne with
special reference to the sterility of Daphne
oxora. — J. Coll. Agr. Univ. Tokyo, 1913,
v. 4, N 5, p. 237—264.
Pacini E., Simoncioli C, Cresti M. Ultra-
structure of nucellus and endosperm of
Diplotaxis ereicoides during embryogene-
sis. — Caryologia, 1975, v. 28, N 4, p. 525—
538.
Padhye M. D. Solanad type of embryo
development in Gomphrena celosioides Mart.,
a member of the Amaranthaceae. — J.
Indian Bot. Soc, 1962, v. 41, N 1, p. 52—63.
Padhye M< D. Two types of embryo
development in Passiflora foetida Linn. — Curr.
Sci., 1963, v. 32, N 8, p. 373—374.
Padhye M. D., Deshpande B. G. The male
and female gametophytes of Passiflora
foetida Linn. — Proc. Indian Acad. Sci. B,
1960, v. 52, N 3, p. 124—130.
Paetow W. Embryologische Untersuchungen
on Taccaceen, Meliaceen und Dillenia-
ceen. — Planta, 1931, Bd 14, S. 441—470.
2% Сравнительная эмбриология
333
Pal A. Structure and development of seed
in Gelosia cristata L. — J. Indian Bot. Soc,
1969, v. 47, N 3—4, p.- 381—387.
Pal Aruna. Structure and development of
seeds in Groton oblongifolius Roxb. —
Proc. 59th Indian Sci. Gongr. Calcutta,
1972, pt 3, Abstr., p. 330.
Pal N. A note on the embryology of Stellaria
media L. — Sci. Cult. (Calcutta), 1951,
v. 16, p. 374.
Pal N. A contribution to the life histories
of Stellaria media and Polycarpon loeflm-
giae. — Proc. Nat. Inst. Sci. India, B,
• 1952, v. 18, p. 363—378.
Pal S. Microsporogenesis in Stellaria aquatica
Scop. — Curr, Sci., (India), 1974, v. 43,
N 6, p. 192.
Pal S. Development of embryo in Stellaria
glauca Withering (Caryophyllaceae). —
Curr. Sci. (India), 1975, v. 44, N 10,
p. 363—364.
Pal S., Murty Y. S. Structure and
development of female gametophyte and embryo
in Stellaria aquatica Scop. —J. Indian
Bot. Soc, 1972, v. 51, N 3—4, p. 232—234.
Paliwal B. L. Life history of Cucumis melo
var. pubescens. — Proc. 37th Indian Sci.
Congr., 1950, v. 3, p. 47.
Palm B. Studieniiber Konstruktionstypen und
Entwicklungswege des Embryosackes der
Angiospermen. Diss. Stockholm, 1915.
Palm B. Das Endosperm von Hypericum. —
Sven. bot. tidskr., 1922, Bd 16, S. 60—68.
Palser В i F. Early endosperm development
and embryogeny in Cassiope hyphoides. —
Trans. 111. State Acad. Sci., 1951a, v. 44,
p. 51-57.
Palser B. F. Studies of floral morphology in
the Ericales. I. Organography and
vascular anatomy in the Andromedeae. — Bot.
Gaz., 1951b, w. 112, N 4, p. 447—485.
Palser B. F. Studies'of floral morphology in
the Ericales. II. Megasp orogenesis and me-
gasporophyte development in the
Andromedeae. — Bot. Gaz., 1952, v. 114, N 1,
p. 33—52.
Palser B. F. Studies of floral morphology in
• the Ericales. III. Organography and
vascular anatomy in several species of the
Arbuteae. — Phytomorphology, 1954, v. 4,
N 3—4, p. 335—354.
Palser B. F. Studies of floral morphology in
the Ericales. IV. Observations on three
members of the Gaultherieae. — Trans.
111. State Acad. Sci., 1958, v. 51, N 1—2,
p. 24—34.
Palser B. F. Some aspects of embryology in
the Ericales. — Recent Advances in
Botany, Toronto, 1959, v. 1, p. 685—689.
Palser B. F. Studies of floral morphology in
the Ericales. V. Organography and
vascular anatomy in several United States
species of the Vacciniaceae. — Bot. Gaz.,
1961, v. 123, N 2, p. 79-111.
Palser B. F. Studies of floral morpholbgy in
the Ericales. VI. Diapensiaceae. — Bot.
Gaz., 1963, v. 124, p. 200—219.
Panda B. S., Datta R. M-. Studies on the cal-
lose plug formation in the pollen tubes of
Corchorus siliquosus, a wild jute of
America. — Sci. and Cult., 1961, v. 27, p. 490—
492.
Pare J. Contribution a l'embryologie des Cru-
ciferes. Nouvelles recherches sur la
transformation de Г ovule en graine chez le Draba
verna L. — Mem. Fac. Sci. Univ. Picardie,
1972, p. 1-80.
Paroli V. Contributo alio studio embriologico
delle Tamaricaceae. — Ann. Bot. (Roma),
1939, v. 22, p. 1—18.
Passmore S. F. Microsp orogenesis in the Cu-
curbitaceae. — Bot. Gaz., 1930, v. 90,.
N 2, p. 213-222.
Pastrana M. D. Sporogenesis and sex
determination in Begonia schmidtiana. — Amer-
J. Bot., 1932, v. 19, p. 365—384.
Paterson B. R. Studies of floral morphology
in the Epacridaceae. — Bot. Gaz., 1961 r
v. 122, N 4, p. 259—279.
Pauze F. Developpement floral et embryologie*
d'Ochna atropurpurea DC. — These de do-
ctorat Universite, Megill, Montral, Quer
1972.
Pax F. Beitrag zur Kenntnis der Ovulums von»-
Primula elatior und P. officinalis. Diss.
Breslau, 1882.
Payer J. B. Traitё d'organogenie de la freur.
Paris, 1857.
Payne N. A. The flower and seed of Mollugo
verticillata. — Bull. Univ. Kansas, 1935,
v. 36, p. 5—25.
Pearson О. Н. Study of the life history of Bras-
sica oleracea. — Bot. Gaz., 1933, v. 94,
N 3—4, p. 534—550.
Peckolt Th. Heilpflanzen Brasiliens aus der Fa-
milie der Guttiferae. — Ber. Dtsch. pharm.
Ges., 1897, Bd 7, H. 6, S. 228—245.
Peltrisot С Developpement et structure de la
graine chezjes Ericacees. — J. Bot., 1904r
t. 18, N 10—11, p. 234—242, 309—367r
386-402.
Periasamy K. The ruminate endosperm: de-^
velopment and types of rumination. — In:
Plant embryology (a symposium CSIR),
New Delhi, 1962, p. 62—74.
Periasamy K. Studies on seed with ruminate
endosperm. 4. Development of rumination
in Coccoloba unifera. — J. Indian Bot.
Soc, 1964, v. 43, N 4, p. 543—547.
Perotti R. Ricerche embriologiche su alcune
«Dianthaceae». — Rend, dell Acad. Lin-
cei, 1913a, v. 22, p. 167—170.
Perotti R. Centribuzione all'embryologia delle
Dianthaceae. — Ann. Bot. (Roma), 1913b,
v. 11, p. 371-399.
Petersen H. E. The structure and biology of
arctic flowering plants. 2. Diapensiaceae^
Diapensia lapponica. — Medd. Granland,,
1912, v. 36, p. 141—154.
Petria E. Contributti la studiul embriologic
al endospermaelor. I. Fam. Caryophylla-
ceae^. Dezvaltarea gametofitului fomenin
su si embriogeneza la Cerastium fomento-
sum L. — An. Univ. Bucuresti. Biol. veg.r
1971, v. 20, p. 109—121.
Petria E. Contributions a Tetude embryologi-
que des Centrospermae. Caryophyllacees.
II. Microsporogenese, macrosporogenese,
developpement du gametophyte femelle
et embryogenese chez Silene italica L. —
Lucr. grM. bot. Bucuresti, 1975—1976,
p. 107^118.
Petria E. Microsporogenese, macrosporoge-
nese, developpement du gametophyte
femelle et embryogenese chez Silene italica
(L) Pers. — Acta bot. horti Bucurestiensisr
1976, p. 95—106.
Philipson W. R., Skipworth I. P. Hectorel-
laceae a new family of dicotyledons. —
Trans. Roy. Soc. N. Z. Rot., 1961, v. 1, "
N, 4, p. 1.
Phouphas С Developpement du proembryon
chez le Gynandropsis pentaphylla DC.
(Capparidacees). — Rull. Soc. bot. France,
1952, t. 99, N 1—3, p. 18—20.
Pilger R. Garyocaraceae. — In: A. Engler,
K. Prantl. Die nattirlichen Pflanzenfami-
lien. Leipzig, 1925, Rd 21, S. 90—92.
Pilgrim H. Untersuchungen zum Kohlenhyd-
rathaushalt der Embryonen aus Agrostemma-
Samen untersehiedlicher Keimungsbereit-
schaft. — Riol. Rundschau, 1965, Rd 2,
N 4, S. 171—172.
Poellnitz K. V. Glaytonia Gronov. und Montia
. Rich. — Feddes repert., 1932, v. 30, p. 279.
Pollock E. G., Jensen W. A. Histochemistry
of chalazal proliferating cells in the embryo
of Capsella bursa-pastoris. — Amer. J. Rot.,
. 1963, v. 50, N 6, p. 617.
Pollock E. G., Jensen W. A. Cell development
during early embryogenesis in Capsella and
Gossypium. — Amer. J. Rot., 1964, v. 51,
N 9, p. 915-921.
Ponzi R., Pizzolongo P., Caputo G. Ultra-
structural particularities in ovular tissues
of some Rhoeadales taxa and their
probable taxonomic value. — J. Submi^rosc.
\ Cytol., 1978, v. 10, N 1, p. 81—88.
Pospisil J. Some results from a study of mic-
rosp orogenesis in the plus-tree of Populus
alba L. — In: Sb. VSS. Rrne, 1966.
Prakasa Rao P. S., Raja RajeswariDeuik. Some
embryological features of Euphorbia vermi-
culata Raf. — Gurr. Sci. (India), 1974,
v. 43, N 8, p. 257-259.
Prakash N. Embryology of Tetragonia tetra-
gonioides (Pall.) o. Kuntze. — Proc. 51st
and 52nd Indian Sci. Congr., 1964, v. 3,
p. 344-345.
Prakash N. Aizoaceae and Gastaceae. A study
of their embryology and relationschips. —
Ph. D. Thesis Univ. Dehli, 1966.
Prakash N. Aizoaceae. A study of its
embryology and systematics. — Rot. notis. (Lund),
1967a, Rd 120, N 3, S. 305—323.
Prakash N. Life history of Tetragonia tetra-
gonioides (Pall) O. Kuntze. — Austral.
J. Rot., 1967b, v. 15, N 3, p. 413—424.
Prakash N. Gametogenesis and seed
development in Hereroa hesperantha (Dtr) Dtr.
et Schwant. (Aizoaceae). — Austral. J. Rot.,
1967c, v. 15, N 3, p. 425-435.
Prakash N., Lau Y. Y. Morphology of Ploia-
rium alternifolium and the taxonomic
position of Ploiarium. — Rot. notis., 1976,
v. 129, N 3, p. 279—285.
Prance С. Т. A monograph of the Neotropical
Dichapetalaceae. — Flora Neotropica Mo-
nogr., New York, 1972, N 10, p. 84.
Prasad K. Seed coat structure and
development in Lepidium sativum L. and Thlaspi
perfoliatum L. — Rot. Jahrb. Syst. Pflan-
zengesch. und Pflanzengeogr., 1977a, Rd 97,
H. 4, S. 508—515.
Prasad K. The development and structure of
basal body in the ovule and seed of certain
species of Cruciferae. — Rot. Jahrb. Syst.*
Pflanzehgesch. und Pflanzengeogr., 1977b,
Rd 98, H. 2, S. 266—272.
Prasad K. Morphology and histochemistry
of the nucellus and endosperm in certain
species of Cruciferae. — Rot. Jahrb. Syst.
Pflanzengesch. und Pflanzengeogr., 1979,
' Rd 100, N 4, S. 536—541.
Preil W., Keyser D. Pollenkeimung und Sa-
menansatz bei einiger «gymnospermen» Re-
gonie. — Naturwiss. Rdsch., 1976, Jahrg.
29, H. 10, S. 360—361.
Pritchard Haeden N. A cytochemical study
of embryo development in Stellaria
media. — Amer. J. Rot., 1964, v. 51, N 5,
p. 472—479.
Prohaska K. Der Embryosack und die Endo-
spermbildung in der Gattung Daphne. —
Rot. Z., 1883, Jahrb. 41, N 52, S. 865*-868.
Prohaska K. Zur Frage der Endospermbildung
bei Daphne. — Rer. Dtsch. bot. Ges.,
1884, Rd 2,3. 219-221.
Prokopova A, Uber die Veranderung des Ge-
schlechtsverhaltnisses der Nachkommen-
schaft im Alter der Rltiten bei M^landrium
album. — Riol. plant. Acad. sci. bohemosl.,
1964, v. 6, N 2, p. 99—103.
Punt W. Pollen morphology of the
Dichapetalaceae with special reference to
evolutionary trends and mutual relationships of
pollen types. — Rev. Palaeobot. and Pa-
lynol., 1975, v. 9, p. 1—97.
Punt W. Evolutionary trends in the pollen
graines of Dichapetalaceae. — In: /. K.
Ferguson, J. Muller. The evolutionary
significance of the exine. London, 1976, p. 139—
146.
Puri V. The life history of Moringa oleifera
Lamk. — J. Indian Rot. Soc, 1941, v. 20,
N 5—6, p. 263—284.
Puri I. A note on the embryo sac and embryo
of Moringa oleifera Lamk. — Proc. Indian
Acad. Sci. R, 1934, v. 1, p. 279—282.
Puri V. Embryo sac and embryo of .Tamarix
chinensis Lour. — Proc. Indian Sci. Congr.,
1938. Abstracts.
Puri V. Studies in the order Parietales. II.
A contribution to the morphology of Gar-
cinia livingstonii T. Anders. — Proc.
Indian Acad. Sci. R, 1939a, v. 9, N 2, p. 74-^86.
Puri V. Studies in the order Parietales. 1.
A contribution to the morphology of Ta-
marix chinensis Lour. — Reih. bot. Ctbl.,
1939b, Rd 59A, S. 325—349.
Puri V. The angiosperm ovule. — Proc. 57th
Indian Sci. Congr, Sect. 6, Rotany. Kha-
ragpur, 1970, p. 1—36.
Puri V., Singh B. Studies in the family Ama-
ranthaceae. 1. The life-history of Digera
arvensis. — Proc. Indian. Acad. Sci., 1935,
v. 1, N 12, p. 893—908.
Purkinje J. E. De cellulis antherarum
fibrosis nee non de granorum pollinarium for-
mis. Vratislaviae, 1830.
Py G. Recherches cytologiques sur I'assise
nourriciere des grains de pollen d'Hellebo-
rus foetidus, Euphorbia sauliana et E. pep-
lus. — С. г. Acad., sci. (Paris), 1929, t. 189,
p. 1298.
Qudrat-i-Khuda M., Khalique A., Das D. С
Examination of the constituents of jute
seeds. Part I. Isolation of jute seed oil,
strophanthidin and raffinose. — Pakistan
J. Sci. and Ind. Res., 1963, v. 6, N 3,
p. 158-160.
Radecke H. R. Reitrage zur Entwicklungs-
physiologie und Riochemie der Samen. 3.
Mitt.: Kohlenhydratstoffwechsel von Ti-
' lia cordata Mill, unter Rerucksichtigung
22*
335
des Carbohsaure- und Fetthaushaltes. —
Pharmazie, 1967, Bd 22, N 2, S. 97—109.
Rader-Roitsch /. E. Untersuchungen iiber die
Stoffwanderungen im Keimungsverlauf von
Quercus pedunculata Ehrt. — Forstwiss.
GbL, 1958, .Bd 77, N 3—4, S. 109-124.
Radlkofer L. Uber einige Sapotaceen. — Sit-
zungsber. Math.-Phys. Gl. Akad. Wiss.,
1884, Bd 14, H. Ill, S. 397-486.
Raghavan T. S. Studies in the Capparidaceae.
I. The lifehistory of Cleome chelidonii
Linn. fil. — J. Linn. Soc. Bot., 1937,
v. 51, p. 43-72.
Raghavan T. S. Morphological and cytological
studies in the Capparidaceae. II. Floral
morphology and cytology of Gynandropsis
pentaphylla DC. — Ann. Bot., 1938, v. 2,
p. 75-95.
Raghavan T. S., Srinivasan V. K. Studies in
the Indian Aizoaceae. — Ann. Bot., 1940a,
v. 4, p. 651—661.
Raghavan T. S., Srinivasan V. K. A
contribution to the life, history of Bergia capen-
sis. — J. Indian Bot. Soc, 1940b, v. 19,
p. 283-291.
Raghavan T. S., Srinivasan V. K. Cyto-mor-
phological features of Portulaca tuberosa. —
Proc. Indian Acad. Sci. B, 1941, v. 14,
p. 472-488.
Raghavan T. S., Venkatasubban K. R.
Studies in the Capparidaceae. 7. The floral
morphology of Crataeva religiosa. — Proc.
Indian Acad. Sci. B, 1941, v. 13, p. 235—
243.
Raghavan V. J., Torrey G. Growth and
morphogenesis of globular and older embryos
of Gapsella in culture. — Amer. J. Bot.,
1963, v. 50, N 6, part. 1, p. 540-551.
Raghavan V. J., Torrey G. Effects of certain
growth substances on the growth and
morphogenesis of inmature embryos of Capsella
in culture. — Plant Physiol., 1964, v. 39,
N 4, p. 691—699.
Raja Rajeswari Devi K., Prakasa Rao P. S.
Embryo development in Euphorbia pep-
lus L. — Curr. Sci. (India), 1975, v. 44,
N 2, p. 57-59.
Raj и M. V. S. Embryology of Passiflora-
ceae. — Curr. Sci., 1952, v. 21, N 10,
p. 288—289.
Raju M. V. S. Embryology of Anagallis pu-
mila. — Proc. Indian Acad. Sci. B, 1953,
v. 36, p. 34-42.
Raj и M. V. S. Embryology of the Passiflora-
ceae. 1. Gametogenesis and seed
development of Passiflora calcarata Mast. — J.
Indian Bot. Soc, 1956, v. 25, N 1, p. 126—
137.
Raju M. V. S. Development of embryo and
seed coat in Turn era ulmifolia L. var. an-
gustifolia Willd. — Bot. notis., 1956, v. 109,
fasc. 3, p. 308—312.
R.aju M. V. S. Seed development and fruit
dehiscence in Ionidium suffruticosum. —
" Phytomorphology, 1958, N 8, p: 218—224.
Raju M. V. S., Rao A. N. The development
of the male and female gametophytes in
Mallotus albus. — J. Mysore Univ., 1953,
v. 13, p. 5—8.
Rakow G., McGregor D. I. Oil, fatty acid and
chlorophyll accumulation in developing
seeds of two «linolenic acid lines» of low
erucic acid rapeseed. — Can. J. Plant Sci.,
1975, v. 55, N 1, p. 197-203.
Ram M. Grubbiaceae. — Bull. Indian Nat-
Sci. Acad., 1970, N 41, p. 13-14.
Ramji M. V. Histology of growth with
regard to embryos and apical meristems in
some angiosperms. I. Embryogeny of Stel-
laria media. — Phytomorphology, 197 5 r
v. 25, N 2, p. 131—145.
Rao A. N. Gametogenesis in Dillenia penta-
gyna. — Curr. Sci., 1955, v. 24, p. 62.
Rao A. N. A contribution to the embryology^
of Agrostistachys meeboldii. — Sci. and
Cult., 1956, v. 21, p. 470-472.
Rao A. N. The embryology of Hypericum
patulum and H. mysorence. —
Phytomorphology, 1957, v. 7, p. 36—45.
Rao A. N. Stamens and carpels within the
ovary of Durio zibethinus. — Singapore-
bot. Gard. Bull., 1964, N 20, p. 287—294.
Rao A. N. Notes on the embryology of Hevea
brasiliensis. — Curr. Sci., 1964, v. 33,
p. 739-740.
Rao A. V.N. Embryological studies in Cleome-
monophylla Linn. — Proc. Indian Acad.
Sci. B, 1967, v. 65, N 6, p. 249—256.
Rao В. А. М. A note on the embryology of
Polygonum glabrum Wild. — Curr. Sci.y
1973, v. 42, N 7, p. 250—252.
Rao'N. A. Embryology of Shorea talura. —
Phytomorphology, 1953, v. 3, N 4, p. 476—
484,
Rao N. A. Development of gametophytes ш
Hopea wightiana. — J. Mysore Univ.r
1955a, v. 15, p. 519—527.
Rao N. A. A contribution to the embryology
of Vateria indica. — Proc. Nat. Inst. Sci-
India, B, 1955b, v. 21, N 5, p. 247—255..
Rao N. A. Life history of Shorea robusta. —
Curr. Sci., 1956, v. 25, N 4, p. 128—129.
Rao N. A. Floral anatomy and gametogenesis^
in Hopea racophloea. — J. Indian Bot.
Soc, 1962, v. 41, N 4, p. 557—562.
Rao P. N. A note on the embryology of Mic-
rococca mercurialis Benth. — Curr. Sci.r
1962a, v. 31, p. 426—427.
Rao P, N. Embryological studies in Acaly-
pha alnifolia Klein ex Willd. — Proc 49th
Indian Sci. €ongr. (Cuttack), pt HI, Abstr.v
1962b, p. 272.
Rao P. N. Euphorbiaceae. — Bull. Indian?
Nat. Sci. Acad., 1970, N 41, p. 136—141.
Rao P. N., Rao S. D. Embryology of Cassav»
(Manihok). — Proc Indian Nat. Sci. Acad.,.
1976, v. 42, N 2-3, pt B, p. 111-121.
Rao P. S., Prakasa D. K., Raja Rajeswari. —
Embryo development in Euphorbia mar-
ginata Pursh. — J. Jap. Bot., 1975, v. 50r
N 2, p. 59—64.
Rao P. S., Prakasa D. K., Raja Rajeswari. —
A note on the occurrence of intracarpellarjr
pollen sacs in Securinega virosa. — J. Jap.
Bot., 1977, v. 52, N 2, p. 60—62.
Rao P. S., RaoB.H. Anther development in
Cleome tenella Linn. — Curr. Sci., 1975r
v. 44, N 12, p. 438—440.
Rao P. S., Rao В. Н. Embryo development
in Cleome aspera L. — J. Jap. Bot., 1976,
v. 51, N 4, p. 110—117.
Rao P. S., Rao В. Н. Anther in Capparis de-
cidua (Forsk.) Pax. — Curr. Sci., 1977r
v. 46, N 15, p. 683—684.
Rao S. Embryo development in five species-
of Mollugo. — Curr. Sci., 1975, v. 44, N 19r
p. 712—713.
336
Rao V. С. Development of the embryo sac
in some Sterculiaceae. — Gurr. Sci., 1948,
v, 17, p. 304—305.
Rao V. C. Contributions to the embryology
• of Sterculiaceae. — J. Indian Bot. Soc,
1949, v. 28, N 3, p. 180-197.
Rao V. C. Contributions to the embryology
Sterculiaceae. II. Waltheria4ndica Linn. —
J. Indian Bot. Soc, 1950, v. 29, N 3,
p. 163—176.
Rao V, C. Contribution to the emrbryology
of Sterculiaceae. III. Melochia corchorifo-
lia. — J. Indian Bot. Soc, 1951, v. 30,
N 1—4, p. 122—131.
Rao V. C. Contributions to the embryology
of Sterculiaceae. IV. Pterospermum sube-
rifolium. — J. Indian Bot. Soc, 1952a,
v. 31, N 4, p. 250—260.
Rao V. C. A case of reversed polarity in embryo
sac of Helicteres isola L. — Sci. and Cult.,
1952b, v. 19, p. 285.
Rao V. C. Contributions to the embryology
of Sterculiaceae. V. — J. Indian Bot. Soc,
1953, v. 32, N 4, p. 208—238.
Rao У. С. The floral anatomy of Ancistrocla-
dus. — Proc Indian Acad. Sci., B, 1969,
v. 70, N 5, p. 215—222.
Rao V. C, Rao K. V. S. A contribution to
the embryology of Triumfetta rhomboidea
J acq. and Corchorus acutangulus L. —
J. Indian Bot. Soc, 1952, v. 31, N 1—2,
p. 56—68.
Rao V. S. A contribution to the morphology
of Antigonon leptopus Hook&& Агд. —
J. Indian Bot. Soc, 1936a, v. 15, p. 105—
115.
Rao V. S. Studies on Capparidaceae. I. The
embryo sac Maerua arenaria. — J. Indian
Bot. Soc, 1936b, v. 15, p. 71—75.
Rao V. S. Studies on Capparidaceae. II. The
embryology of Gynandropsis pentaphylla
DC. — J. Indian Bot. Soc, 1936c, v. 15,
p. 335-344.
Rathore B. K., Singh R. P. Embryological
studies in Brassica campestris L. var jel-
low sarson Prain. — J. Idian Bot. Soc,
. 1969, v. 47, N 3—4, p. 341—349.
Rauh W., Scholch H. F. Weitere Untersu-
chungen an Didiereaceen. 2. Teil. Inflo-
reszenz-, blutenmorphologische und embry-
ologische Untersuchungen mit Ausblick
auf die systematische Stellung der Didiera-
ceen. — Sitzungsber. Heidelberg. Akad.
Wiss. Math.-naturwiss. Kl., 1965, H. 3—4,
S. 217—443. Inhalt.
Raymond W. D., Squires J, A., Ward J. B.
Dryobalanosp oblongifolia kernels and
Elateriospermum tapos kernels from
Malaya. — Colon. Plants a. Animal Products,
1954, v. 4, N 2, p. 159—161.
Reddy К. В., Murthy £., Narayana R. Male
and female gametophytes in Maccinium
leschenaultii W. — Curr. Sci., 1966, v. 55,
N 5, p. 130-131.
Reeves R. G., Valle С. C. Anatomy and micro-
chemistry of the cotton seed. — Bot. Gaz.,
1932, v. 93, N 3, p. 259—277.
Reeves R."G., Beasley J. O. The development
of the cotton embryo. — J. Agr. Res.,
1935, v. 51, N 10, p. 935—944.
Reeves R. G. Comparative anatomy of the
seeds of cottons and other malvaceous plants.
I. Malveae and Ureneae. — Amer. J. Bot.,
1936a, Ml 23, N 4, p. 291—296.
Reeves R. G, Comparative anatomy of the
seeds of cottons and other malvaceous plants.
II. Hibisceae. — Amer. J. Bot., 1930b,
v. 23, N 6, p. 394-405.
Reiche K. Beitrage zur Kenntnisse der Gat-
tung Fouquieria. — Bot. Jahrb. Syst.?
1921, Bd 57, H. 2. S. 287—301.
Reiche V. K. Zur Kenntnis von Sechium edu-
le. — Flora, 1921, Bd 14, S. 232—248.
Renroni Cela. Mattiola trucuspidata R. Br.
(Gruciferae) analisi caryologica ed embrio-1
logica. — Giorn. Bot. Ital., 1969, v. 103,
p. 531—545.
Rest J. A., Vaughan J. С The development
of protein and oil bodies in the seed of Si-
napsis alba L. — Planta, 1972, v. 105s
N 3, p. 245—262.
Reynolds J. D. Morphological studies in Dia-
pensiaceae. I. Pyxidanthera brevifotia
Wells. — Bull. Torrey Bot. Club, 1968,
v. 95, N 6, p. 653—656.
Ricardi S. M. Revision taxonomica de las
Malesherbiaceas. — Gayana. Bot., v 1967,
N 16, 139 S.
Riddle L. С The embryology of Alyssum. —
Bot. Gaz., 1898, v. 26, N 5, p. 314—324.
Rijven A. #. g, C. In vitro studies on the
embryo of Capsella bursa-pastoris. L. — Of fie
publ. Roy. Bot. Soc Netherland, 1952,
v. 1, N 2, p. 158—200.
Richards A. J., Ibrahim H. B. — The
breeding system in Primula veris L. II. Pollen
tube growth and seed-set. — New Phytol.,
1982, v. 90, N 2, p. 305-314.
Rizet G. Contribution a l'etude biologique et
cytologique de TActinidia chinensis. —
C: r. Soc biol. (Paris), 1945, t. 139, N 3,
p. 140—142.
Robbelen G. Uber die Protochlorophyllredu-
ction in einer Mutante von Arabidopsis tha-
liana (L.) Heynh. — Planta, 1956, Bd 47,
H. 5, S. 532—546.
Robins A. Note preliminaire sur la polyembry-
ohie dans Bombax kimuenzae de Wild.
A Th. Dur. — Bull. Jard. bot. nat. Belg.,
1959, t. 29, N 1, p. 23—26.
Rocen T. Nyctaginiaceernas embryologi. —
Vortragsreferat. Svensk bot. Tidskr., 1924a,
v. 18, p. 159—160.
Rocen T. JPortulacaceernas embryologi. —
Vortragsreferat. Svensk bot. Tidskr., 1924b,
v. 18, p. 527—528.
Rocen T. Nagra drag ur caryophyllaceernas
embryologi. — Vortragsreferat. Svensk.
bot. Tidskr., 1926, v. 20, p. 97—98.
Rocen T. Zur Embryologie der Centrospermen.
Diss. Upsala, 1927. 184 p.
Roeper J. Enurneratio Euphorbiarum qui
in Germania et Panonia giguntur. Got-
tingen, 1824.
Rohweder O. Bau und Entwicklung des Gy-
nociums bei Silenoideen. — Ber. Dtsch»
bot. Ges., 1963, Bd 76, Sondernummer,
S. 70—72.
Rohweder O. Centrospermen-Studien. 1. Der
Blutenbau bei Uebelinia kiwuensis Т. С
Fries. — Bot. Jahrb. Syst. Pflanzengasch.
und Pflanzengeogr., 1965, Bd 83, N 4,
S. 406—418.
Rohweder O. Centrospermen-Studien. 3. ВШ-
tenentwicklung und Blutenbau bei Sitenoi-
' deen. — Bot. Jahrb., 1967, Bd 86, S. 130—
185.
Rohweber O. Centrospermen-Studien. 4. Mor-
337
phologie und Anatomie der BlutenrFruchte
* und Samen bei Alsinoideen und Polrony-
cKioideen s. lat. — Bot. Jahrb., 1970,
Bd 90, N 1—2, S. 201—271.
Rohweder 0., Ruber K. Centrospermen-Stu-
dien. 7. Beobachtungen und Anmer—Kun-
gen zur Morphologie und Entwicklungs-
geschichte einiger Nyctaginaceeri. — Bot.
Jahrb. Syst. Pflanzengesch. und Pflanzen-
geogr., 1974, Bd 94, N 3, S. 327—359.
Romell L. G. Notes on the embryology of
Salsola kali. — Sven. bot. tidsk., 1919,
v. 13, p. 213—214;
Rondet P. L'organogenese a cours del'embryo-
genese chez l'Alyssum maritimum Lank. —
C. r. Acad, sci., 1962, t. 255, N18, p. 2278 —
228Э.
Roth F. Die Fortpflanzungsverhaltnisse bei
der Gattung Rumex. — Inaug. Diss. Verh.
natur ver. prenss Rheine westf. Bonn,
1907, Bd 63, S. 327—360.
Roth I. Die Histogenese der Integumente
von Capsella bursa-pastoris und ihre mor-
phologische Deutung. — Flora, 1957,
Bd 145, H. 1—2, S. 212—235.
Rousi A. Gytological observations on some
species and hybrids of Vascinium. —
Ztichter (Genet. Breed. Res.), 1966, Bd 36,
H. 8, S... 352—359.
Rubel E. Uberwinterungsstadien von Loise-
leuria procumbens. — Ber. Dtsch. bot.
Ges., 1908, Bd 26A, S. 803—808.
Russel S. D. Participation of male cytoplasm
during gamete fusion in Angiosperm.
Plumbago zeylanica. — Science, 1980, v. 210,
p. 200—201.
Russell S. D., Cass D. D. Ultrastructure of
fertilization in Plumbago zeylanica. — Acta
Soc. bot. pol., 1981, v. 50, N 1—2, p. 185—
190.
Rutgers F. L. Embryo sac and embryo of
Moringa oleifera Lamk. — Ann. Jard. bot.
Buitenz., 1923, v. 33, N 1, p. 1—66.
Sachar R. C. The embryology of Isomeris-
a reinvestigation. — Phytomorphology,
1956, v. 6, p. 346—363.
Sachar R. C. Polyembryony. — In: Recent
advances in the embryology of angiosperms.
Delhi, 1963, p. 265—296.
Sachar R. C, Murgai P. Embryology of Aerva
tomentosa Forsk. — Gurr. Sci., 1958, v. 27,
N 3, p. 105—107.
Sachar R. C, Murgai P. Diplosporous
parthenogenesis in Aerva tomentosa Forsk. —
Phytomorphology, 1959, v. 9, N 2, p. 119—
129.
Safijowska L. D. On the form and structure of
male gametes in angiosperms. — Prop.
Pherch. Sci. Soc, 1955, v. 3, p. 39—47.
Safijowska L. D. Male gametophyte in En-
kianthus. — Bot. Gaz., 1960, v. 121, N 3,
p. 185-190.
Sakamoto Sadao. Waxy endosperm and peri-
sperm of cereals and amaranth and theis
geographical distributions. Denpun
казаки. — J. Jap. Starch Sci., 1982, v. 29,
N 1, p. 41—55.
Samuelsson G. Studien iiber die Entwicklungs-
geschichte einiger Bicornes-Typen. Ein Bei-
trag zur Kenntnis der systematischen Stel-
lung der Diapensiaceen und Empetraceen. —
Sven. bot. tidskr., 1913, Bd 7- H. 2,
S. 97—188.
Sanchez S. T. Embryo sac development in
Euphorbia heterophylla. — Bull. Univ.
Philipp. Nat. Appl. Sci., 1938, v. 6, p. 59—
75.
Sandt W. Beitrage zur Kenntnis der Begonia-
ceen. — Flora, 1921, Bd 114, S. 329—384.
Sankara Rao K. Studies in Myrsinaceae. I.
A contribution to the embryology of Maesa
dubia Wall. — Proc. Indian Acad. Sci. B,
1972, v. 75, N 4, p. 160—166.
Sargant E. Recent work on the results of
fertilization in angiosperms. — Ann. Bot.,
1900, v. 14, p. 689—712.
Sarrazin P. Contribution a l'embryologie
compared des Gruciferes. — These pres Facult.
Med.- et Pharm. Lille, 1957. 91 p.
Sastri R. L. N. Floral morphology and
embryology of some Dilleniaceae. — Bot. no-
tis., 1958, Bd 111, N 3, S. 495—511.
Sato J. Embryological studies on Stachyums
praccox and its variety. — Sci. Repts
Tohoku Univ., ser. 37, 1976, N 2, p. 131—
138.
Sax K. Meiosis and chiasma formation in Pae-
onia suffruticosa. — In: Chromosome
relationships in the Ponioideae. 1932, p. 383—
384.
Schacht H. Entwicklungsgeschichte des Pflan-
zenembryos. Diss. Amsterdam, 1850.
Schacht Ц. Uber Pflanzenbefruchtung. —
Jahrb. Wiss. Bot., 1858, Bd 1, S. 193—232.
Schaffner J. H. Artificial parthenocarpy. —
J. Hered., 1935, v. 26, N 7, p. 261—262.
Schaffner M. The embryology of the Shephards
Purse. — Ohio Nat., 1906, v. 7, N 1, p. 1—
8.
Schagen R. Embryologische Untersuchungen
am Feigenblattkiirbis (Gucurbita ficifolia
Bouche) nach Bestaubung mit Pollen des
Gartenkurbis (C. pepo L.). — Flora, 1956r
Bd 143, H. 1, S. 91—126.
Schleiden W. J. Bemerkung zur Bildungsge-
schichte des vegetabilischen Embryo. —
Flora, 1844, Bd 27, S. 787—789.
Schloms M. Zur Frage der unterschiedlichen
Embryonalentwicklung nach reziproker Ar-
tenkreuzung. Eine Untersuchung bei Rie-
senktirbis (Gucurbita maxima Duch.) und
Gartenkurbis (C. pepo L.). — Flora, 1958*
Bd 146, H. 4, S. 586—615.
Schlotterbeck J. O. The development of the
seed of Melampyrum pratense and of Gro-
ton tiglium. — Proc. Amer. Assoc. Adv.
Sci., 1898, v. 46, p. 275—278.
Schmid R. Die systematische Stellung der
Dioncophyllaceen. — Bot. Jahrb. Syst.
Pflanzengesch. und Pflanzengeogr., 1964^
Bd 83, H. 1, S. 1—56.
Schmid R. Reproductive anatomy of Actini-
dia chinensis. (Actinidiaceae). — Bot.
Jahrb. Syst. Pflanzengesch. und
Pflanzengeogr., 1978a, Bd 100, H. 2, S. 14&—
195.
Schmid R. Actinidiaceae, Davidiaceae and
Paracryphiaceae: Systematic
considerations. — Bot. Jahrb. Syst. Pflanzengesch.
und Pflanzengeogr., 1978b, Bd 100, H. 2,
S. 196—204.
Schmid W. Morphologische, anatomische und
entwicklungsgeschichtliche Untersuchungen
an Mesembrianthemum pseudotruncatellum
Berger. — Verh. naturf. Ges. Zurich, 1925\
Bd 70, S... 1—96.
Schmidt H. Uber die Entwicklung der BliiteH
und Blutenstande von Euphorbia und Di-
338
plocyathium. — Beih. bot. ZtbL, 1907\
Bd 22, S. 20-69.
Schnarf /L. JBeit^age zur - Reimtnis" der Sa-
menentwicklung einiger europaischer Hype-
ricum-Arten. — S. B. Akad. Wiss: Wien,
Abt. 1, 1914, v. 123.
Schnarf K. Kleine Beitrage zur Keimtnis der
Entwicklungsgeschichte der Angiosper-
men. — Osterr. bot. Z., 1922, Bd 71,
S. 190—199.
Schnarf K. Embryologie der Angiospermen.
Berlin, 1929. 417 S.
Schnarf K. Vergleichende Embryologie der
Angiospermen. Berlin, 1931. 354 S.
Schnarf K. Bemerkungen zur Stellung der
Gattung Saurauia im System. — S. B.
Akad. Wiss. Wien, Abt. 1, 1924, Bd 133,
H. 1, S. 17—28.
Schoch-Bodmer H. Zum Heterostylieproblem:
Griffelbeschaffenkeit und Pollen schlauch-
wachstum bei Fagopyrum esculentum. —
Planta, 1934, Bd 22, H. 1, S. 149-152.
Scholch H. F. Die systematische Stellung
der Didiereaceen im Lichte neuer Unter-
suchungen iiber ihren Blutenbereich. —
Ber. Dtsch. bot. Ges., 1963, Bd 76, H. 11,
S. 49—55.
Schulz P„, Jensen W. A. Capsella embryogene-
sis: the epg, zygote and young embryo. —
Amer. J. Bot., 1968a, v. 55, N 7, p. 807—
819.
Schulz P., Jensen W. A. Capsella embryogene-
sis; the early embryo. — J. Ultrastruct.
Res., 1968b, v. 22, N 5—6, p. 376—392.
Schulz P., Jensen W. A. Capsella embryogene-
sis: the syneigids before and after
fertilization. — Amer. J. Bot., 1968c, v. 55, N 5,
p. 541—552.
Schulz P., Jensen W. A. Capsella embryogene-
sis: the suspensor and the basal cell. —
Protoplasm, 1969, v. 67, N 2—3, p. 139—
163.
Schulz P., Jensen W. A. Capsella embryogene-
sis: the central cell. — J. Cell Sci., 1973,
v. 12, N a, p. 741—763.
Schulz P., Jensen W. A. Capsella embryogene-
sis: the chalazal proliferating tissue. —
J. Cell Sci., 1971, v. 8, p. 139-163.
Schulz P., Jensen W. A. Capsella embryogene-
sis: the development of the free nuclear
endosperm. — Piotoplasma, 1974, v. 80,
N 1—3, p. 183—205. •
Schulz P., Jensen W. A. Cotton embryogene-
sis: the early development of the free
nuclear endosperm. — Amer. J. Bot., 1977,
v. 64, N 4, p. 284—394.
Schulz P., Jenser W. A. Ultrastiuctural
studies of early endospeim development in
fertilized and unfertilized cotton ovules. —
Bull. Soc. bot. France, . Actualites bot.,
1978, t. 125, N 1/2, p. 267—271.
Schiirhoff P. N. t ber die Teilung des genera-
tiven Kerns \or der Keimung des Pollen-
korns. — Arch. Zellf., 1921, Bd 15,
,S. 145—159.
Schiirhoff P. N. Zytologische Untersuchungen
in der Reihe der Geraniales. — Jahrb.
Wiss. Bot., 1924, Bd 63, S. 707—759.
Schiirhoff P. N. Zur Zytologie von Meland-
rium—Zwittern. — Ber. Dtsch. bot. Ges.,
1925, Bd 43, S. 45C-454.
Sclmhofj P. N. Zur Pleiophylie derS^mpeta-
leh' auf Givrd ihrer Baplontenentwick-
lung. — Rep. spec. nov. reg. Veget. Beih.,
ШДмьЗй 41, S. 3-14.
Schiirhoff P. N. Die Zytologie der Bluten-
pflanzen. Stuttgart, 1926b, 792 S.
Schiirhoff P. N. Familie Primulaceae. — In:
Die Zytologie der Bliitenpflanzen.
Stuttgart, 1926c, S. 643—645.
Schwarzenbach A. M. Aletironvakuolen und
Spharosomen im Endosperm von Ricinus
communis wahrend der Samenreifung und
Keimung. — Ber. Schweiz. bot. Ges.,
1972, Bd 81, S. 70—90.
Schwarzenbach F. Untersuchungen iiber die
Sterilitat von Cardamine bulb if era (L.)
Crantz. unter Annahme eines hybriden
Ursprungs dieser Art. — Flora, 1922^
Bd 115, S. 393—514.
Schweiger J. Beitrage zur Kenntnis der Sa-
menentwicklung der Euphorbia ceen. —
Flora, 1905, Bd 94, S. 339—379.
Scott F. M. Survey of anatomy, ergastic
substances and nuclear size in Echinocystis
macrocarpa and Cucurbita pepo L. — Bot.
Gaz., 1943a, v. 104, N 3, p. 394—408.
Scott F. M. Cytology and microchemistry oi
nuclei in developing seed of Echinocystis
macrocarpa. — Bot. Gaz., 1943b, v. 105,
N 3, p. 329—338.
Scott F. M. The physical consistency of the
endosperm nucleus of Echinocystis
macrocarpa. — Phytomorphology, 1953, v. 3,
N 1—2, p. 66—76.
Scott J. Observations on the functions and
structure of the reproductive organs in the
Primulaceae. — Proc. Linn. Soc. London,
1864, v. 8, p. 78—126.
Sedgley M. Flavonoids in pollen and stigma
of Brassica oleracea and their effects on
pollen germination in vitro. — Ann. Bot.
(Gr. Brit.), 1975, v. 39, N 164, p. 1091—
1095.
Sengupta A., Chakrabarty M. M. The seed fat
composition of Citrullus colo суп this. —
Sci. and Cult., 1957, v. 22, N 10, p. 581—
582.
Sethi S. B. Structure and development of seed
in Camellia sinensis (L.) O. Kuiitze. —
Proc. Nat. Inst. Sci. India, 1965, v. 31,
N 1, p. 24—33.
Sharma G. Studies in family Euphorbiaceae.
1. The gametophytes of Crozophora rott-
leri. — J. Indian Bot. Soc, 1956, v. 35,
p. 189—193.
Sharma H. P. Contributions to the
morphology and anatomy of Basella rubra Linn. —
EUll. Bot. Soc. Bengal, 1961, v. 15, N. 1—2,
p. 43-48.
Sharma K. D. Cyto-embryological studies
in some Indian Euphorbiaceae. — Sci. and
Cult., 1955, v. 21, p. 270—271.
Sharma У. M. L. A note on gametogenesis
in a few members of Sterculiaceae. — Curr.
Sci., 1938, v. 8, p. 284—285.
Sharma Y. M. L. Gametogenesis and
embryology of Tamarix ericoides Rottl. — Ann.
Bot. N. S., 1939, v. 3, N 11, p. 861—870.
Sharma Y. M. L. Evidence for the Fritillaria
type of embryo sac in Tamarix ericoides. —
Curr. Sci. (Bangalore), 1940, v. 9, p. 26.
Shibata K. Die Doppelbefruchtung bei Mo-
notropa uniflora L. — Flora, 1902a, Bd 90,
S. 61—66.
S^a/af£.'„Expeximentelie Studien iiber die
Entwicklung des Endospermes bei Mono-
339
tropa. — Biol. CbL, 1902b, Bd. 22,
S. 705-714.
Shoad B. Abortive meiosis plasmodial pollen
mother cells of Helianthemum. — Ann.
Bot.t 1954, v. 18, N 69, p. 1—6.
Showalter #. M. A study of the chromosomes
and degenerating microspore tissue in Mi-
rabilis. — Amer. J. Hot"., 1935, v.. 22, N 6,
p. 594—608.
Silow R. A., Stephens S. G. Twinning in
cotton. — J. Hered., 1944, v. 35, p. 76—78.
Simoncioli С Ultrastriictural characteristics
of Diplotaxis erucoides (L) DC
«suspensory. — Guorn. bot. ItaL, 1974, v. 108,
N 3-4, p. 175—189. /
Simura Т., Oosone K. Studies on the
fertilization of tea plant. — Jap. J. Breed., 1956,
v. 6, p. 111—114.
Singh A. P., Nair R. G. Pollen abnormalities
in Gassawa (Manihot esculenta Grantz.). —
Curr. Sci., 1968, v. 37, N 16, p. 476—477.
Singh B. Studies on the structure and
development of seeds of the Gucurbitaceae. I.
Seeds of Echinocystis wrigtii Gogn. —
Phytomorphology, 1952, v. 2, N 4, p. 201—209.
Singh В: Studies on the structure and
development of seeds of Gucurbitaceae. — Phy-
tomorphology, 1953, v. 3, N 3, p. 224—239.
Singh D. Cytoplasmic nodules in the
endosperm of some Gucurbitaceae. — Nature,
1955a, v. 176, N 4482, p. 607-608.
Singh D. Embryological studies in Gucumis
melo var. , pubescens. — J. Indian Bot.
Soc, 1955b, v. 34, N 4, p. 72—78.
Singh D* A contribution to the embryology
of some members of the Gucurbitaceae. —
Proc. 43rd Indian Sci. Gongr., 1956a, v. 3„
p. 222—223.
Singh. Zh Life history of Viola tricolor. —
Proc. 43rd Indian Sci. Gongr., 1956b, v, 3,
p. 223.
Singh D. Endosperm and its chalasal hausto-
rium in Gucurbitaceae. — Agra Univ. J.
Res.-Sci., 1957, v. 6, p. 75—89.
Singh D* Studies on endosperm and
development, of seeds of Garica papaya L. —
Hort. Adv., 1960, v. 4, p. 89—96.
Singh Z). Studies on endosperm and
development of seed in Gucurbitaceae and some
its related families. — Agra Univ. J. Res.-
Sci., 1961a, v. 10, part 2, p. 117—123.
Singh £>. Development of embryo in the
Gucurbitaceae. — J. Indian Bot. Soc, 1961b,
v. 40, p. 620—623.
Singh D. The structure and development of
ovule and seed of Passiflora foetida Linn. —
Agra Univ. J. Res.-Sci., 1962, v. 11, part 3,
p. 99—110.
Singh D. Studies of the persistent pollen
tubes of the Gucurbitaceae. —- J. Indian
Bot. Soc, 1963a, v. 42, N 2, p. 208—213.
Singh D. Structure and development of ovule
and seed of Viola tricolor L. and Ionidium
suffruticosum Ging. — J. Indian Bot. Soc,
1963b, v. 42, N 3, p. 448—462.
Singh D. A further contribution to the
endosperm of the Gucurbitaceae. — Proc. Indian
Acad. Sci. B, 1964a, v. 60, N 6, p. 399—
413.
Singh D. Cytoplasmic nodules in the
endosperm of angiosperms. — Bull. Torrey Bot.
Club, 1964b, v. 91, TNT 2, p. 86—94.
Singh D. Seed structure in the classification
of the Gucurbitaceae. — X Intern. Bot.
Congr. Edinburgh (Abstracts), 1954c,
p. 516—517.
Singh D. Ovule and seed of Sechiutn edule:
a reinvestigation. — Curr. Sci. (India),
1965a, v. 34, p, 696—697,,
Singh D. Ovule and seed in Dicoelospermum
С. В. Clorke, together with a note on its
systematic position. — J. Indian Bot. Soc,
1965b, v. 44, N 2, p. 181—190.
Singh D. Structure and development of seed
coat in Cucurbitaceae. I. Seed of Biswarea
Gogn., Edgaria Clarke and Herpetosper-
mum Efook. f. — Proc. Indian Acad. Sci.
B, 1967, v; 65, N 6, p. 267—274.
Singh D. Passifloraceae. — Bull. Indian Nat.
Sci. Acad,, 1970a, N41, p. 199—204.
Singh D. Garicaceae. — Bull. Indian Nat.
Sci. Acad., 1970b, N41, p. 208—211.
Singh D. Structure and developm?nt of seed
coat in Gucurbitaceae. II. Seeds of Luff a. —
J. Indian Bot. Soc, 1971, v. 50A, p. 208—
215.
Singh D. Structure and development of seed
coat in Gucurbitaceae. VIII. Seeds of Ma-
ran kell. — Bull. Torrey Bot. Club, 1972,
v. 99, p. 239-242.
Singh D., Dathan A. S, R. Structure and
development of seed in Gucurbitaceae. VI.
Seeds of Gucurbita. — Phytomorphology,
1972a, v. 22, N 1, p. 29—45.
Singh D., Dathan A. S. R. Development of
generative and aposporic embryo sacs in
Cucumis metuliferus E. May ex Schrad. —
Curr. Sci. (India), 1972b, v. 41, p. 33.
Singh D., Dathan A. S. R. Structure and
development of the seed coat in
Gucurbitaceae. IX. Seeds of Zanonioideae. —
Phytomorphology, 1973a, v. 23, N 3—4,
p. 138-143.
Singh D., Dathan A. S. R. Further studies
on the endosperm of the Cucurbitaceae. —
Plant Sci., 1973b, v. 5, p. 42—51.
Singh Z>., Dathan A. S. R. Structure and
development of the seed coat in
Gucurbitaceae. IX. Seeds of Cor alio carpus., Kedro-
stis and Ibervillea. — Bull. Torrey Bot.
Club., 1974a, v. 101, N2, p. 78—82.
Singh D., Dathan A. S. Л. Structure and
development of seed coat in Gucumis L. —
New Botanist, 1974b, N 1—2, p. 8—22.
Singh /)., Dathan A, S. R. Structure and
development of seed coat in Gucurbitaceae.
V. Seeds of Trichosanthes Linn. — J.
Indian Bot. Soc, 1976, \i 55, N 2—3, p. 160—
168.
Singh D., Gupta S. The seeds of the Violaceae
and Resedaceae. A comparison. — J.
Indian Bot. Soc, 1968, v. 46, N 2—3, p. 248—
256.
Singh R. P. Structure and developmBnt of
seeds in Euphorbiaceae: Ricinus
communis L. — Phytomorphology, 1954, v. 4,
N 112, p. 118—123.
Singh R. P. Developm?nt of endosperm and
embryo in Phyllanthus nirarl. — Agra
Univ. J. Res.-Sci., 1956, v. 5, p. 163—167.
Singh R. P. On the struoturi and development
of seeds in Euphorbia geniculata. — J.
Indian Bot. Soc, 1959, v. 38, N 1, p. 103—
108.
Singh R. P, Forms of ovules in
Euphorbiaceae. — In: Plant embryology. A
symposium CSIR. New Delhi, 1962, p. 124-128.
340
Singh R. P. Structure and development ol
seeds in Codiaeum variegatum Blume. —
J. Indian Bot. Soc, 1965a, v. 44, N2,
p. 205—210.
Singh R. P. Stiucture and development of
seeds in Euphorbiaceae: Antidesma menasu
Mi quel. — Balwant. Vidya peeth J. Agr.
and Sci. Res., 1965b, v. 7, p. 96—99.
Singh R. P. Structure and development of
seeds in Euphoibiaceae: Melanthesa rham-
noides Wt. — Beitr. Biol. Pflanz., 1968,
v. 45, N 1, p. 127—133.
Singh R. P. Stiucture and development of
seeds in Euphorbia helioscopia Linn. —
Bot. Mag., lokyo, 1969, v. 82, p. 287—
293.
Singh R. P. Structure and development of
seeds in Euphoibiaceae: Jatropha species. —
Beitr. Biol. Pflanz., 1970a, Bd 47, S. 79—
90.
Singh R. P. Stiuctuie and development of
seeds in Putranji\a roxburghii Wall. —
J. Indian Bot. Soc, 1910b, v. 49, N 1—4,
p. 99—105.
Singh R. P. Structure and development of
seed in Phyllanthus niiuri L. — J. Indian
Bot. Soc, 1972, v. 51, N 1, p. 73-77.
Singh R, P., Chopra S, Stiucture and
development of seeds in Croton konplandia-
num. — Fhytcmorpholcgy, 1970, v. 20,
N 1, p. 83-87.
Singh R. P., Jain J. I. Development of
female gametopbyte in Euphoibia pilosa
L. — Curr. Sci. '(India), 1965, v. 34, N 21,
p. 611—612.
Singh'R. P., Pal A. Stiucture and
development of seeds in Euphoibiaceae: Dalecham-
pia rcezeliara Muell. — Arg. Tech. Ccm.
Nat. Bot. Gaid., Luckrxv^ 1968, p. 65—74.
Singh S. N. A rote of partial partner ocarpy
in the genus Luff a. — Curr. Sci. (India),
1958, v. 27, p. 54-55.
Siva Rao B. S. ЕтЬгло development in five
species of Mollugo.-—Curr. Sci., 1975,
v. 44, N 19, p. 712—713.
Sleumer H. Monographia Clethraceainm. Pf.
1. — Bot. Jahrb. Syst. Pflanzengesch. und
Pflanzengecgr., 1967a, Ed 87, H. 1, S. 36—
116.
Sleumer H. Monographia Clethraceainm. Pf.
2. — Bot. Jahrb. S}st. Pflanzengesch. und
Pflanzengecgr., 1967b, Bd 87, H. 2, S. 117—
175.
Smith В. В. Early сли!е development, me-
gasporogenesis ard mega££metcgeresis of
Capsella bursa-pastoris (L.) Meditus. —
Proc. Pennsylvania Acad. Sci., 1976, v. 50,
p. 13C—132.
Smith-White S. Chrcrrcscme numbers and
pollen types in Epacridaceae. — Austr. J.
Bot., 1955a, v. 3, N1, p. 48—67.
Smith-White S. Ire life history ard genetic
system of Leucopcgcn juniperinus. —
Heredity, 1955b, N 9, p. 79—91.
Smith-WhHe S. Follen development patterns
in the Epacridaceae. A picblcm in
cytoplasm—nucleus inteiaction. — Pice Linn.
. Soc. N. S. W., 19i9, v. 48, p..8-35.
Smith C. R., Shekleton M. C, Wolff I. A.,
Jones Q. Seed protein sources amino acid
composition and total protein content of
various plant seeds. — Econ. Bot., 1959,
v.. 13, N 2, p. 132—150..
Sobaji та У. M., Ishiga M., Jnaba A- Studies
on the fruit development of Japanese
persimmon (Diospyros kaki L.). II. Seed
abortion in Hiratanenashi. — J. Jap. Soc.
Hortic Sci.,, 1975, v. 44, N 1, p. 1—6.
Soepadmo E. The reproductive biology of
Durio zibethinus Murr. — Gard. Bull.
Singapore, 1977, N 9.
Soerodihoesoemo W. Development of the
embryo sac in some Catiliflorous plants. —
Ann. bogor., 1970, v. 5, part 2, p. 93—99,
Soledad J. M., Morales D. Histologic floral
у desarrollo del fruto de Euphorbia atro-
purpurea Brouss. — Vieraea, 1378 {1979),
v. 8, N 1, p. 131—143.
Soltwedel F. Freie Zellbildung im Embryosack
der Angiospermen mit besonderer Beruck-
sichtigung der hierbei stattfindenden Vor-
gange der Kerntheilung. — Jen. Zeit. Nat.,
1882, Bd 15, S. 341—380.
Soueges R: Nouvelles recherches sur le de-
veloppement de l'embryon chez les Cruci-
feres. — Ann. Sci. Nat. Bot., 1314a, ser. 9,
t. 19, p. 311—339.
Soueges R. Nouvelles observations sur Fem-
bryogenie des Cruciferes. — €. r. Acad,
sci. (Paris), 1914b, t. 158, p, 1356—1359.
Soueges R. Nouvelles recherches sur le d£-
veloppement de l'embryon des
Cruciferes. — Ann. Sci. Nat. Bot., 1914c, t. 19,
N 9, p. 311-319.
Soueges R. Les principales divisions de Foeuf
et l'origine de Fhypophyse chez le Capsella
bursa-pastoris. — С. г, Acad. scL (Paris),
1916, t. 163, p. 158—160.
Soueges R. Embryogenie des Polygonacees.
Developpement de l'embryon chez les Ru-
тех et les Rheum. — С. г. Acad. scL
(Paris), 1919a, t. 160, p. 919.
Soueges R. Embryogenie des Polygonacees,
Developpement de l'embryon chez le
Polygonum persicaria. — С. г. Acad. scL
(Paris), 1919b, t. 168, p. 791—793,
Soueges R. Les premieres divisions de Foeuf
et les differenciations du suspenseur chez
le Capsella bursa-pastoris Moench. — An».
Sci. Nat. Bot., 1919c, ser. 10, t. 1, p. 1—28.
Soueges R. Recherches sur Fembryogenie des
Polygonacees, Polygonum persicaria. —
Bull. Soc. bot. France, 1919d, t. 56, p. 168—
199.
Soueges R. Recherches sur Fembryogenie des
Polygonacees. Rumex. — Bull. Soc. bot.
France, 1920a, t. 67, p. 1—11.
Soueges R. Recherches sur Fembryogenie des
Polygonacees. Rheum emodi. — BulL Soc
bot. France, 1920b, t. 57, p. 71—85.
Soueges R. Developpement de l'embryon chez
le Chenopodium bonus-henricus L. — Bull.
Soc. bot. France, 1920c, t. 67, p. 233—257.
Soueges R. Embryogenie des Chenopodiacees.
Developpement de l'embryon chez le
Chenopodium bonus-henricus. — С. г. Acad.
sci. (Paris), 1920d, t. 170, p. 461—469.
Soueges R. Embryogenie des Caryophyllacees.
Les premiers stades du developpement de
l'embryon chez le Sagina procumbens. —
C. r. Acad. sci. (Paris),1922,1.175, p. 709—
711.
Soueges R. Embryogenie des Caryophyllacees.
Les derniers stades du developpement chez
le Sagina procumbens. — С. г. Acad. sci.
/Paris), 1922b, t. 175, p. 894-896.
Scueges R. Embryogenie des Malvacees.
Developpement de l'embryon chez1 le Malva
• 341
rotundifolia L.—С. r. Acad. sci. (Paris),
1922c, t. 175,,, pV 1435—1436.
Soueges R. Embryogenie des Salicacees.
Developpement de l'embryon chez lie Salix
triandra L. — C. r. Acad. sci. .(Paris),
' 1923, t. 177, 1234-1237.
Soueges R. Embryogenie des Euphorbiacees.
Developpement de l'embryon chez Г
Euphorbia exigna. — G. r. Acad. sci. (Paris),
1924a, t. 179, p, 989—991.
Soueges R. Developpement de l'embryon chez
le Sagina procumbens. — Bull. Soc. bot.
France, 1924b, t. 71, p. 590—614.
Soueges R. Embryogenie des Hypericacees.
Developpement de l'embryon chez Г
Hypericum perforatum. — G. r. Acad. sci.
(Paris), 1925a,i t. 180,. p. 949—951.
Soueges R. Developpement de l'embryon chez
l'Euphorbia exigna. — Bull. Soc. bot.
France, 1925b, t. 72, p. 1018—1031.
Soueges R. Les methodes de travail en em-
bryologie vegetate. — Bull. Soc. franc,
micro., 1932, t. 1, N4, ps 88—104.
Soueges R. Embryogenie des Resedacees.
Developpement de l'embryon chez le Reseda
luteola L. — G» r. Acad. sci. (Paris), 1935,
t. 201, p. 910-911.
Soueges R. La differenciation. 2-em fasc.
Paris, 1936a. 139 p.
Soueges R. La segmentation. 2-emfasc. Paris,
1936b. 80 p.
Soueges R. Les relations embryogeniques des
Grassulacees, Saxifragacees et
Hypericacees. — Bull. Soc. bot. France, 1936c,
t. 83, p. 317—329%
Soueges R. Embryogenie des Hypericacees.
Developpement de l'embryon chez l'Andro-
saemum officinale. — G. r. Acad. sci.
(Paris), 1936d, t. 202, p. 679—681.
Soueges R. Les lois du developpement, Paris,
1937a. 94 p.
Soueges R. Embryogenie des Primulacees.
Developpement de l'embryon chez le Samolus
valerandi. — C. r. Acad. sci. (Paris), 1937b,
t. 204, p. 145-157.
Sdjieges R. Developpement de l'embryon chez
l'Helianthemum guttatum. — Buil. Soc.
bot.-France, 1937c, v. 84, p. .400—407.
Soueges R. L'embryon chez les Amaranthus.
Relations embryologiques entre les Sola-
nacees et les Gentrospermales. -«* Bull. Soc.
bot. France, 1937A, t. 84, p. 242—255.
Soueges R. Embryogenie des Amaranthacees.
..Developpement de l'embryon ,chez l'Ama-
^ nanthus retroflexus L. — G. r. Acad. sci.
(Paris), 1937e, t. 204, p. 892—894.
Soueges R. Embryogenie des Plombagacees.
Developpement de l'embryon chez le Viola
tricolor. — G. r. Acad. sci. (Paris), 193/'/,
t. 204, N 21, p. 1583—1585.
Soueges R. Embryogenie des Violacees.
Developpement de l'embryon chez le Viola
tricolor. — G. r. Acad. sci. (Paris), 1937g,
v. 255, p. 169—171.
Soueges R. Embryogenie des Portulacacees.
Developpement de l'embryon chez le Portu-
laca oleracea. — G. r. Acad. sci. (Paris),
1938a, t. 206, p. 768—770.
Soueges R. Embryogenie des Nyctaginacees.
Developpement de l'embryon chez l'Oxy-
baphus viscosus. — G. г.:Acad. sci. (Paris),
1938b, t. 206, p. 1830—1832.
Svueges R. Embryologie des Ericacees.
Developpement de Pyrola rotundifolia L. —
342\
G. r. Acad. sci. (Paris), 1939a, t. 209, N 17,
p. 635—637.
Soueges R. Embryogenie des Gucurbitacees.
Developpement de l'embryon chez le
Bryonia dioica. — C. r. Acad. sci. (Paris) ,
1939b, t. 208, p. 227—229.
Soueges R. Embryogenie des Begoniacees.
Developpement de l'embryon chez le
Begonia semperflorens. — G. r.<~ Acad. sci.
(Paris), 1939c, t. 208, N 7, p. 535—536.
Soueges R. Embryogenie et classification.
Essai d'un systems embryogenique. Partie
generate. Paris, 1939d. 95 p.
Soueges R. Embryogenie des Tiliacees.
Developpement de l'embryon chez le Tilia
platyphyllos. — G. r. Acad. sci. (Paris),
1941, t. 212, N 23, p. 998-1000.
Soueges R. Embryogenie des Thymeleacees.
Developpement de l'embryon chez le Daphne
mezereum L. — G. r. Acad. sci. (Paris)r
1942, t. 214, p. 569—571.
Soueges R. Embryogenie des Actinidiacees.
Developpement de l'embryon chez l'Acti-
nidia chinensis Planch. — G. r. Acad. sci.
(Paris), 1943, t. 217, p. 430-432.
Soueges R. Embryogenie des Portulacacees.
Developpement de l'embryon chez le Clay-
tonia perfoliata. — G. r. Acad. sci. (Paris),
1945a, t. 221, N4, p. 111—113.
Soueges R. Embryogenie des Garyophyllacees.
Developpement de l'embryon chez 1'Arena-
ria serpyllifolia. — G. r. Acad. sci. (Paris),
1945b, t. 221, p. 320—322.
Soueges R. Embryogenie et classification.
Essai d'un systems embryogenique. Partie
speciale. Premiere periode du systeme.
Paris, 1948a. 101 p.
Soueges R. Developpennntde l'embryon chez
le Galandrinia eompressa L. — G. r. Acad.
sci. (Paris), 1948b, t. 226, p. 207.
Soueges R. Embryogenie et classification.
Essai d'un systems embryogenique. Deuxie-
me pMode du system?. Paris, ^5/, 95 p.
Soueges R., СгШ'Р, ЬэЗ acquisitions les plug
recentes de l'embfyologie des Angiosper-
mes. — Ann. biol., 1952\ t, 28, p. 9—45.
Sp.eta F. Die Entwicklung des Endosperms von
Melampyrum cristatum und M. binoerien-
se. — Linz. biol. Beitr., 1975, Bd 7, N 3,
S. 393-402.
Srivastaua P. S. In vitro growth requirements
of mature "endosperm of Ricinus
communis, — Gurr. Sci., 1971a, v. 49, p. 337—339.
Srivastava P. S. Morphogenic studies on
mature endosperm of Jatropha, Putranjiva
and Ricinus. — Ph. D. Thasis Univ. Delhi,
1971b.
Srivastava P. S. In vitro induction of tri-
ploid roots and shoots from mature
endosperm of Jatropha panduraefolia. — Z.
Pfianzenphysiol., 1971c, у. 66, p. 93—96,
Srivastava R. K. Contribution to the
embryology of Indian Euphorbiaceae, 1. Euphorbia
rothiana. — Ann. Bot., 1952, v. 16, p. 505—
511.
Srivastava R. K.,Agarwal G. P< Development
of the female gamatophyte and endosperm
in Ghrozophora rottleri. —• Bat* Gfoz., 1953,
v. 114, p. 348—350.
Stahel G. Beitrage zur Kenntnis dex' Bluten-
biologie von Какао, Theobroma cwcao. —
Verh. К on. ned. akad. wetensch. Ачз*з£ет-
dam, 1928, v, 25, N6, p. 21.
Steed A. D., Roberts I, N., Dickinson H. G.
Pollen-pistil interaction in Brassica ole-
racea. — Planta, 1979, v. 146, N 2, p. 211—
216.
Steenis C. Ancistrocladaceae. — Flora Ma-
lesiana Batavia, 1948, ser. 1, vol. 4, p. 8—
10.
Stenar H. Embryolcgische Studien. 1. Zur
Embryologie einiger Columniferen. 2. Die
Embr\olcgie der .Amaryllidaceen. Diss.
Uppsala, 1925. 197 S.
Stenar H. Das Endosperm bei Hypericum
acutum. — Bot. rotis., 1938, S. 515—527.
Stern F. C. A study of the genus Paconia.
London, 1946. 155 p.
Stevens N. E. Dioecism in trailing aibutus,
with notes on the morphology of the seed. —
Bull. Torrey Eot. Club, 1911, v. 38, N 12,
p. 531—543.
Stevens N. E. The morphology of the seed
of the buckwheat. — Bot. Gaz., 1912a,
v. 53, p. 59—66.
Stevens N. E. Observations on heterostylous
plants. — Bot. Gaz., 1912b, v. 53, p. 277—
308.
Stevens N. E. The development of the
endosperm in Vaccinium corymbosum. — Bull.
Torrey Bot. Club, 1919, v. 46, p. 465—
468.
Stokes G. W. Seed development and failure
in horseradisch. — J. Hered., 1955, v. 46,
N 1, p. 15—21.
Stomps T. J. Kernteilung und Synapsis bei
Spinacea oleracea. — Biol. Zbl., 1911,
Bd31, S. 257—309.
Strasburger E. Lber Befiuchtung" und Zell-
teilurg. — Jen. Zeit. Naturw., 1877, Bd 11,
S. 435—536.
Strasburger E. Lber Polycmbryonie. — Jen.
Zeit. Natuiw., 1878, Bd 12, S. 647—670.
Stia&lurger E. Lher Zellbildung und Zell-
teilurg. — Jen. Zeit. Natuiw., I860, Bd 13.
Straslbiger E. Neueie Untersuchungen uber
den Befiuchtungs\oigarg bei den Phanero-
gamen als Grundlage fur eine Theorie der
Zeugung. Jena, 1884a. 391 S.
Strasbujger E. Die Endospeimbildung bei
Daphne. — Ber. Dtsch. tot. Ges., 1884b,
Bd 2, S. 112—114.
Strasburger E. Zu Santalum und Daphne. —
Ber. Dtsch. bot. Ges,, 1885, Bd 3, S. 105—
113.
Strasburger E. Lber das Wachstum vegetabi-
lischer Zellhaute. — Histolcg. Beitr. Jena,
1889, Bd2, S. 80.
Strasburger E. Die Apogamie von Wikstroe-
mia indica (L.) С A. Mey und das Verhalten
der noimalgeschlech.tlichen Thymelaa-
ceen. — Histolcg. Beitr., 1909a, Bd 7,
S. 47—127.
Strasburger E. Das weitere Schicksal meiner
isolierten weiblichen Mercurialis annua. —
Pflanzen Z. Bot., 1ШЪ, Bd 1, S. 5C6—
525.
Siraslurger E. Lber geschlechtbestimmende
, Ursaehen. — Jahib. Wiss. Bot., 1910,
Bd 48, S. 427—520.
Subramanycm K., Narayana L. L. Floral
anatcmy and embryology of Primula flo-
riburda Wall. — Phytcmorphology, 1968,
v. 18, N 1, p. 105—113.
Sugiura T. On the meiotic division of pollen
mother cells of Polygonum savatieri Na-
kai. -*• Bot JVfag. Tokyo; №$',V. 39,'N ^67,
p. 291—296.
Sugiura T. Some observations on the meiosis
of the pollen mother cells of Carica papaya,
Myrica rubra, Aucuba japonica and Beta
vulgaris. — Bot. Mag. Tokyo, 1927, v. 41,
N 483, p. 218—224.
Sulbha K. Embryology of Brassica juncca
Czern. and Coss. — J. Indian Bot. Soc,
1957, v. 36, N 3, p. 292—301.
Sulbha K., Swaminathan M. S. Effect of
grafting on fruit-set and embryo
development in crosses between Corchorus olito-
rius and С capsularis. — Curr. Sci., 1959,
v. 28, N 11, p. 460-461.
Sutaria R. N. The microsporogenesis in Ra-
phanus sativus L. (the Indian Radisch). —
J. Indian Bot. Soc, 1930, v. 9, p. 253—256.
Swamy B. G. Endosperm in Hypericum myso-
rense. — Ann. Bot., 1946, new ser., v. 10,
N 38, p. 165—169.
Swamy B. G. L. A contribution to the
embryology of the Marcgraviaceae. — Amer.
J. Bot., 1948, v. 35, N9, p. 628—633.
Swamy B. G. L. On the floral structure of
Scyphostegia. — Proc. Nat. Inst. Sci. India,.
1953, v. 19, N 2, p. 127—142.
Swamy B. G. L., Balakrishna B. P. Female
gametophyte of Acalypha tricolor. — J.
Indian Bot. Soc, 1946, v. 25, p. 67—69.
Swamy B. G. L., Parameswaran N. A
contribution to the embryology of Begonia cre-
nata. — J. Indian Bot. Soc, 1960, v. 33,
N 4, p. 140—148.
Swamy B. G. L., Periasamy K. Contributions
to the embryology of Acrotrema arrnottia-
num. — Phytomorphology, 1955, v. 5, N 2—
3, p. 301—314.
Swamy B. G. L., Ganapathy P. M. On
endosperm in dicotyledons. — Bot. Gaz., 1957,
v. 119, p. 41—50.
Sykes M. G. Note on the nuclei of some
unisexual plants. — Ann. Bot., 1909, v. 23,
p. 341.
Szewczyk E. Photosynthesis in the developing
embryo of Crambe tatarica Pall.
(Dicotyledonous Plants). — Bull. Acad. pol. sci.
Ser. sci. biol., 1974, v. 22, N 1, p. 53—57.
Szweczyk E., Ry'czkowski M. Changes in the
chlorophyll content in the developing
embryo (Dicotyledonous plants). — Bull.
Acad. pol. sci. Ser. sci. biol., 1977, v. 25,
N 10, p. 679—683.
Szyszylowicz I. Pellicieraceae. — In: Eng-
ler A., Prantl K. Die natiirlichen Pflan-
zenfamilien. Leipzig, 1895, Bd 3, Abt. 6,
S. 191—192.
Tamari K. Concerning the fruits of Diospyros
kali. — Bull. Soc Agric Japan, 1901,
p. 231—234.
Tan K. Studies in the Thymelaeaceae I:
germination, seedling, fruit and seeds. —
Notes Roy. Bot. Gard. Edinburgh, 1980,
v. 38, N 1, p. 149—164.
Tateishi S. On the development of the embryo
sac ,and fertilization of Acalypha austra-
lis. — Bot. Mag. Tokyo, 1927, v. 41,
p. 477—485. -
Thathachar T. Morphological studies in„ tjie
Euphorbiaceae: 1. Acalypha lanceolata
' Willd.— Phytomorphology, 1952, v,.! .'2,
p. 197—201, ;; t,
Thathachar T. Morphological studies in the
Euphorbiaceae. — J. Mysore Univ., 1953a,
V. 13, p. 43-68.
Jhathachar T, Morphological studies in
Euphorbiaceae. II. Mallotus philippensis,. —
Agr. Proc. nat. Inst. Sci'. India, B, 1953b,
'\ v. 19, p. 469—474.
fhirumalachar M. J., Khan B, A, Megasporo-
genesis and endosperm formation in Erio-
dendron anfractuosum. — Proc. Indian
Acad. Sci. B, 1941, v. 14, N 5, p. 461—
. 465.
Thomas J, L, A monographic study of the
Cyrillaceae. Cambridge, 1960, 114 p.
Thomas J, L. The genera of the Cyrillaceae
and Clethraceae of the south-eastern
United States. — J. Arnold Arboretum, 1961,
v. 42, N 1, p. 96—106.
Thomas M., Monnier M, Studies on the
evolution , of the ultrastructure of immature
embryos of Capsella bursa-pastoris,
cultivated in vitro. — С R. M. S. Securces,
1976, t. 2Щ, N 9, p. 1045—1048.
Thompson R. C, A morphological study of
flower and seed development in Cabbage. —
J. Agr. Res., 1933, v. 47, N 4, p. 215—247.
Tiagi Y. D, Morphology of the ovule and
fruit of Opuntia dillenii. — Proc. 41st
Indian Sci. Congr., 1954a, v. 3, p. 143.
Tiagi Y. D, Studies in the floral morphology
of Opuntia dillenii Haworth. — Bot. notis,
1954b, v. 4, p. 343—356.
Tiagi Y. D, Ро1уетЬгуоцу in Mammillaria
tenuis DC. — Bull. Bot. Soc. Univ. Saugar,
1956, v. 8, p. 25—27.
Tiagi Y. D, Studies in floral morphology.
III. A contribution to the floral morphology
of Mammillaria temiis DC. — J. Univ.
Saugar, 1957, v. 6, part II, ser. B, p. 7—31.
Tiagi Y, D, Studies on the floral morphology
of the order Cactales. — Thesis Submitted
to the Univ. Saugar for the degree of doctor
of philosophy (Botany), 1958,
Tiagi Y, D, Contribution to the embryology
of the genus Pereskia. — Proc. 54th Indian
Sci. Congr. (Hyderabad), 1967, pt III,
Abstr., p. 324—325.
Tiagi Y. D. Cactaceae. — Bull. Indian Nat.
Sci. Acad., 1970a, N 41, p. 29—35.
Tiagi Y, D, Paeoniaceae. — Bull. Indian Nat.
Fci. Acad., 1970b, N 41, p. 53—58.
Tieghem Ph. van. Sur les Phanerogames.
L'ovule sans nucelle, formant le groupe des
Innucellees des Santalinees. — Bull. Soc.
bot. France, 1896, t. 43, p. 543—577.
Tieghem Ph. van. Sur les genres Actinidie
et Saurauie considered comme types d'une
famille nouvelle, les Actinidiacees. — J.
Bot., 1899, ann. 13, ,N 5, p. 170.
Tieghem Ph. van. Sur la structure de Г ovule
et de la graine et sur les affinites des Sa-
lix. —Bull. Mus. Nat. Hist., 1900, t. 6,
p. 131.
Tieghem Ph. van. L'oeuf des plantes considere
comme la base de leur classification. —
Ann. Sci. natur. Not., 1901, ser. 14, v. 8,
p. 213,-390.
Tieghem Ph. van. Structure de Г ovule des
Dichapetalacees et la place de cette famille
dans la classification. — J. Bot., 1903a,
ann. 17, p. 229—233.
Tieghem Ph. van. Sur Thypostase. — Ann.
Sci. natur. Not., 1903b, v. 17, N 8, p. 347—
352.
Tieghem Ph. van. Structure de Tovule des
Caricacees. — Ann. Sci. natur. Bot., 1903c9
v. 8, N 17, p. 373—381.
Tieghem Ph. van. Sur les Ancistrocladacees. —
J. Bot., 1903d, t. 17.
Tietz ,N. tlber mogliche Beziehungen des
Fettstoffwechsels ztim Lichtkeimproblem. —
Biochem. Z., 1953, Bd 324, N 7, p. 517—
529.
Tillman O. /.. The embryo sac and embryo
of Cucumis sativus L. — Ohio Naturalist,
1906, v. 6, p. 423—430.
Tischler G. Zellstudien an sterilen Bastard-
pflanzen. — Arch. Zellf., 1908, Bd 1, H. 1,
S. 33—151.
Tischler G. Uber die Entwicklung der Same-
nanlagen in parthenokarpen Angiospep-
men-Fruchten. — Jahrb. Wiss. Bot., 1912,
Bd52, H. 1, S. 1—84.
Tohda H. tlber die аЬпогтэп Samenanlagen
bei den sterilen hermaphroditischen Pflan-
zen von Moehringia lateriflora. 1. Morpho-
logische Untersuchungen. — Sci. Repts To-
hoku Univ. Ser. 4, 1960, v. 26, p. 37—44.
Tohda H, Morphological investigations on
the staminodia of the female plants in
Moehringia lateriflora. 1. On the
development of tapetal cells and pollen mother
cells. — Sci. Repts Tohoku Univ., Ser. 4,
1965, y. 31, p. 83—92.
Tohda H, Embryological study on Idesia
polycarpa. — Sci. Repts Tohoku Univ.
Ser. 4, 1971, v. 35, N 4, p. 231—237.
Tomo N., Fuchinoue Y., Fuchinoue H.
Embryological study on seeds of a fruit of tea
plant. — Jap. J. Breed., 1958, v. 8,
p. 48.
Traub H, P., O'Rork С J. Papaya pollen
germination and storage. — Proc. Amer.
Soc. Hort. Sci., 1936, v. 34, p. 18.
Traub H. P., O'Rork C, J. Course of pollen
tube in Carica papaya and Cucurbit a
spp. — Nature, 1939, v. 143, N3622,
p. 562.
Treub M. Le sac embryonnaire et l'embryon
dans les Angiospermes. Nouv. serie des
recherches. — Ann. Jard. bot. Buitenz.,
1911a, Ser. 11, t. 9, p. 1—18.
Treub M. Le sac embryonnaire et Tembryon
dans les Angiospermes. Nouv. serie des
recherches. — Ann. Jard. bot. Buitenz.,
1911b, t. 24, p. 1—27.
Tschermak-Woess E., Hasitschka G. Verande-
rungen der Kernstructur wahrend der Endo-
mitose, rhytmisches Kernwachstum und
verschiedenes Heterochromatin bei Angio-
- spermen. — Chromosoma, 1953, Bd 5,
S. 574—614.
Tschermak-Woess E., Hasitschka G. Uber die
endomitotische Polyploidisierung im Zuge
der Differenzierung von Trichomen und
Trychoziten bei Angiospermen. — Osterr.
bot. Z., 1954, BdlOl, S. 79—117.
Tulasne L. R. Etudes d'embryogenie vege-
tale. — Ann. Sci. natur. Bot., 1849, ser. 3,
N 12, p. 21—137.
Tulasne L, R. Nouvelles etudes
d'embryogenie vegetale. — Ann. Sci. natur. Bot.,
1855, ser. 4, v. 3, p. 65—74.
Turala K, Endomitosis in the tapetal cells
of Cucurbita pepo L. — Acta biol. crac.
Ser. bot., 1958, v. .1, p. 25—34.
Turala K. Endomitotical processes during the
differentiation of the anther hairs of Gucu-
344
mis sativus L. — Acta biol. crac. Ser. bot.,
1960, v. 3, p. 1—13.
Turala K. Gytological processes during the
differentiation of the hairs of Echinocystis
lobata. — Acta biol. crac. Ser. bot., 1962,
v. 5, p. 151—169.
Turala K. Studies of endomitotical processes
during the differentiation of the tapetal
layer of the Gucurbitaceae. — Acta biol.
crac. Ser. bot., 1963, v. 6, p. 87—102.
Turala K. Endopolyploidie in Endosperm von
Echinocystis lobata. — Osterr. bot. Z.,
1966a, Bd 113, S. 235—244.
Turala K. Strukturen endopolyploider Kerne
in Bereich der Samenanlage einiger Monoco-
tylen. — Osterr. bot. Z., 1966b, Bd 113,
S. 529—541.
Turala K. Endopolyploidy and structures
of the nuclei in the endosperm of the Cu-
curbitaceae. — Osterr. bot. Z., 1969, Bd 116,
S. 95—111.
Turala K. Mitoses and endomitoses during
differentiation of some tissues in the
Gucurbitaceae. — Genet, pol., 1971a, v. 12,
N 3, p. 281—283.
Turala K. Disturbed mitotic division and
endomitose during the differentiation of the
endosperm in JEcballium elaterium
(Gucurbitaceae). — Acta biol. crac. Ser. bot.,
1971b, v. 14, p. 27—35.
Turala-Szybowska K. . Zostatnich badai nad
endomitosa u Angiospermae. — Wiad. bot.,
1974a, v. 14, N 1, p. 47—53.
Turala-Szybowska K. Karyological anatomy
of the endosperm of Bryonia dioica and
Cucurbita pepo. — Acta biol. crac. Ser.
bot., 1974b, v. 17, p. 75—90.
Turala-Szybowska K. Ultrastructure of the
endosperm of Echinocystis lobata
(Gucurbitaceae) at the cellular stage. — Acta
biol. crac. Ser. bot., 1975, v. 18, p. 27—39.
Tuschnjakowa M. Untersuchungen iiber die
Kernbeschaffenheit einiger diozischer Pflan-
zen. — Planta, 1929, Bd 7, lS. 427—443.
Tyengar N. K. Pollen tube studies in Gos-
sypium. — J. Genet., 1938, v. 37, p. 69—
106.
Tykarska T. Rape embryogenesis. I. The pro-
embryo development. — Acta Soc. bot.
pol., 1976, v. 45, N 1—2, p. 3—16.
Tykarska T. Rape embryogenesis. II.
Development of embryo proper. — Acta Soc.
vbot. pol., 1979, v. 48, N3, p. 391—421.
Ueno S., Matsushima K. Properties of some
Japanese vegetable oils. — J. Japan Chem.
Soc, 1956, v. 5, N1, p. 14-15.
Usteri A. Studien iiber Garica papaya L. —
Ber. Dtsch. bot. Ges., 1907, Bd 25, S. 485—
495,
Yaidya P. B. Occurrence of twin embryo-sacs
in Capparis aphylla Roth. — Gurr. Sci.,
1961, v. 30, N 5„ p. 187—188.-
Vandendries R. Contribution^ а Г etude du
developpement des Cruciferes. — Cellule,
1909, t. 25, fasc. 2, p. 412—459.
Vandendries R. Contribution а Г etude du
developpement de Г ovule dans les
Cruciferes. 2. L'archesporium dans le genre Garda-
mine. — Cellule, 1912, t. 28, p. 215—225.
Varghese В. М. Chromosome constitution and
nuclear behaviour in the endosperm- of
Cucurbita pepo L. — Genetica, 1971, v. 42,
p. 231—238.
Vasil I, K. Studies on pollen germination of
certain Cucurbitaceae. — Amer. J. Bot.,
1960, v. 47, p. 239—247.
Vasil I. K. Formation of male gametes in the
pollen tubes of some crop plants. — In:
Plant embryology. A symposium. С S.
I. Д., New Delhi, 1962, p. 254—260.
Vazart B. La parthenocarpie. — Bull. Soc.
bot. France, 1955, v. 102, N 7—8, p. 406—
Veillet-Bartoszewska M. La polyembryonie
chez le Primula auricula L. — Bull. Soc.
bot. France, 1957a, X, 104, N 7—8, p. 473—
475.
Veillet-Bartoszewska M. Ericacees.
Developpement de l'embryon chez le Rhododendron
ferruqineum L. — C. r. Acad. sci. (Paris),
1957b, t. 244, N 14, p. 1952—1954.
Veillet-Bartoszewska M. Embryogenie veger
tale. Primulacees. Developpement de
l'embryon chez le Primula auricula L. — G. r.
Acad. sci. (Paris), 1957c, t. 245, N 25,
p. 2362—2363.
Veillet-Bartoszewska Ms Embryogenie des
Plumbagacees. Developpement de
l'embryon chez le Plumbago europaea. — С r.
Acad. sci. (Paris), 1958, t. 247, N23,
p. 2178—2181.
Veillet-Bartoszewska M. Developpement de
l'albumen chez le Rhododendron
ferruqineum L. — Bull. Soc. bot. France, 1959a,
t. 106, N 1—2, p. 17—20.
Veillet-Bartoszewska M. Embryogenie des
Ericacees. Developpement de l'embryon chez
le Qaultheria shallon. — G. r. Acad. sci.
(Paris), 1959b, t. 248, N 5, p. 720—722.
Veillet-Bartoszewska M. Embryogenie des Em-
petracees. Developpement du proembryon
chez le Corema album (L.) Don. — G. r.
Acad. sci. (Paris), 1959c, t. 249, N7,
p. 857—859.
Veillet-Bartoszewska M. Embryogenie des Sty-
racacees. Developpement de l'embryon chez
le Styrax officinalis. — G. r. Acad. sci.
(Paris), 1960a, t. 250, ,N5, p. .905—907.
Veillet-Bartoszewska M. Embryogenie des
Ericacees. Developpement de l'embryon chez
Г Erica tetralix L. — G. r. Acad. sci.
(Paris), 1960b, t. 250, N9, p. 1712—1714.
Veillet-Bartoszewska M. Embryogenie des
Ericacees. Developpement de l'embryon chez
le Ledum palustre. — G. r. Acad. sci.
(Paris), 1960c, t. 251,. N 5, p. 777—779.
Veillet-Bartoszewska M. Embryogenie des Cleth-
racees. Developpemenjt de l'embryon chez
le Clethra alnifolia. — G. r. Acad. sci.
(Paris), 1960d, t. 251, N 22, p. 2572—2574.
Veillet-Bartoszewska M. Embryogenie des
Ericacees. Developpement de l'embryon chez
le Calluna vulgaris. — С. г., Acad. sci.
.(Paris), 1961a, t. 252, N 8, p. 1192—4194.
Veillet-Bartoszewska M. Embryogenie des Epa-
cridacees. Developpement de l'embryon
chez le Dracophyllum secundum R. Br. —
С. г. Acad. sci. (Paris), 1961b, t. 253, N 7,
p. 1000-1002.
Veillet-Bartoszewska M. Recherches embryo-
geniques sur les Ericales. Comparaison avec;
les Primulales. Paris, 1963. 72 p.
Venkataramani K. S. An instance of poly-
embryony in tea. — Plrs'Chron., 1950,
v. 45, p. 180^-181.
Venkata Rao C. Life history of Muntingia
calabura L. ^- Gurr. ScL, 1951, v. 20,
N 2, p. 47-48.
345
Venkata Rao С. Occurrence of persistent
pollen tubes in Malvaceae. — Gurr. Sci.,
1952a, v. 21, N 2, p. 49—50.
Venkata Rao C. The embryology of Muntingia
calabura L. — J. Indian Bot. Soc, 1952b,
v. 31, N 1—2, p. 87—101.
Venkata Rao C. Floral anatomy and
embryology of two species of Elaeocarpus. — J.
Indian Bot. Soc, 1953, v. 32, N 1, p. 21—
33.
Venkata Rao C. Embryological studies in
Malvaceae. I. Development of gametophy-
tes. — Proc Nat. Inst. Sci. India, B,
1954a, v. 20, N 2, p. 127—150.
Venkata Rao C. Contribution to the
embryology of Bombacaceae. — Proc Indian Acad.
Sci. B, 1954b, v. 39, N 2, p. 51—75.
Venkata Rao C. Embryological studies in
Malvaceae. 2. Fertilization and seed
development. — Proc. Nat. Inst. Sci. India,
B, 1955, v. 21, N1, p. 53—67.
Venkata Rao C. Pollen types in the Epacri-
daceae. — J. Indian Bot. Soc, 1961, v. 40,
N 3, p. 409—423.
Venkatesh С S. The curious anther of Bixa-
its structure and dehiscence. — Amer.
Midland Natur., 1956, v. 55, N 2, p. 473—476.
Venkateswarlu J. Embryological studies in
the Thymelaeaceae. 1. Thymelaea arven-
sis. — J. Indian Bot. Soc, 1945, v. 24,
p. 45—66.
Venkateswarlu J. A case of polyembryony in
Daphne cannabina. — Curr. Sci., 1946,
v. 15, p. 169.
Venkateswarlu J. Development of the embryo
of Thymelaea arvensis. — Bot. Gaz., 1947a,
v. 108, p. 581—586.
Venkateswarlu J. Embryological studies in the
Thyme]aeaceae. 2. Daphne cannabina and
Wikstroemia canescens. — J. Indian Bot.
Soc, 1947b, v. 26, p. 13—39.
Venkateswarlu J. A contribution to the
embryology 4)f Pisonia aculeata. — J.
Indian Not. Soc, 1947c, v. 26, p. 182—194.
Venkateswarlu J., Maheswari Devi H. An
embryological approach to the taxonomic
status of Nacciniaceae. — Proc Indian
Acad. Sci., 1973, v. 78, N 6, p. 282—291.
Venkateswarlu J., Rao P. N. Endosperm in
Euphorbiaceae and occurrence of endosperm
haustoria in two sps. of Croton Linn. —
Curr. Sci., 1963, v. 32, N 11, p. 514-516.
Venkateswarlu J., Rao P. N. Embryogeny
in the Euphorbiaceae with special reference
to the embryo development in Euphorbia
rothiana Spr. — Proc. 54th Indian Sci.
Congr. (Hyderabad), 1967, pt 3, Abstr.,
p. 322—323.
Venkateswarlu J., Rao P. N. A contribution
to the embryology oi the tribe Hippoma-
neae of the Euphorbiaceae. — J. Indian
Bot. Soc, 1975, v. 54, N 1—2, p. 98—103.
Venkateswatlu J., Rao P. N., Rao S. D.
Occurrence of stylar obturator in two
Euphorbiaceae. — Curr. Sci. (India), 1974,
v. 43, N4, p. 128—129.
Venturd M. Sviluppo del gametofito femminiee
di Euphorbia mauretanica. — Ann. Bot.
(Roma), 1933, v. 20, p. 267—273.
Ventura M. Sulla poliembrionia di Mallotus
japonicus Muell. — Arg. Ann. bot., 1934,
' v. 20, p. 568—578.
Ventura M. Osservazioni embriologiche su
Arechavaletaia uruguayensis Speg. — Ann.
Bot. (Roma), 1938, v. 21, fasc. 3, p. 527—
533.
Ventura M. Nuovo contributo alia embriolo-
gia delle Euphorbiaceae. — Ann. Bot.
(Roma), 1940, v. 22, p. 42—52.
Verdcourt B. Brazzeia longipedicelata. — In:
Tropical African plants. XXI. Scytopeta-
laceae. Kew bull., 1950, N 3, p. 344-347.
Verdcourt В. Scytopetalaceae. — Crown agents
for oversea goverments and administration.
London, 1968, p. 3.
Vesque J. Developpement'du sac embryonnaire
des phanerogames angiospermes. — Ann.
Sci. natur. Bot., 1878, v. 6, p. 237—285. ^
Vesque J. Nouvelles recherches sur le de-
veloppement des phanerogames
angiospermes. — Ann. Sci. Bot., 1879a, t. 6, p. 261—
390.
Vesque /« Neue Untersuchungen uber die
Entwicklung des Embryosackes der Angio-
spermen. — Bot. Z., 1879b, Bd 37, S. 505—
509.
Vesque J. Nouvelles recherches sur le de-
veloppement du sac embryonnaire des
phanerogames angiospermes. — Ann. Sci.
natur. Bot., 1879c, ser. 6, t. 8, p. 261—390.
Viegi L., Pagni A. M., Corsi G., Cela R. G.
II sospensore embrionale nelle Cruciferae.
I. Morfologia e structura. — Ciorn. bot.
Ital., 1976, v. 110, N4—5, p. 347—357.
Vignon F. Contribution a Tembryologie
comparee des Caryophyllacees genre
Lychnis L. D. E. S. Lille—Amiens, 1965. 126 p.
Vignon F. Embryogenie des Caryophyllacees.
Developpement de l'embryon chez le Sper-
gularia marginata Kittel. — С. г. Acad,
sci. (Paris), 1966, ser. D, t. 263, N 5,
p. 505—508.
Vignon F. Recherches sur l'embryogenie des
Centrospermae. Application a la
signification phylogenetique comparee des
classifications embryogeniques. Amien, 1970. 444 p.
Vignon F., Lebegue A. Embryogenie des
Caryophyllacees. Developpement de
l'embryon chez le Lychnis flos-cuculi L. — С. г.
Acad. sci. (Paris), 1965, t. 260, N 21,
p. 5613-5616.
Vignon F., Lebegue A. Embryogenie ^ des
Caryophyllacees. Developpement de l'em-
bryon chez le Melandrium rubrum Gar-
cke. — C. r. Acad. sci. (Paris), 1966, ser.
D, t. 262, N 20, p. 2149—2152.
Vignon F., Lebegue A. Embryogenie des
Caryophyllacees. Developpement de
l'embryon chez le Cerastium obscurum Chaub. —
С. г. Acad. sci. (Paris), 1969, t. 268, N 4,
p. 644—667.
Vijayaraghavan M. R. Morphology and
embryology of Actinidia polygama Franch.
and Sav. and systematic position of the
family Actinidiaceae. — Phytomorphology, '
1965, v. 15, N 3, p. 224—235.
Vijayaraghavan M. R. Studies in the family
Cyrillaceae. I. Development of male and
female gametophytes in Gliftonia momo-
phylla (Lam.) Britton ex Sarg. — Bull.
Torrey Bot. Club, 1969, v. 96, N 4, p. 484—
489.
Vijayaraghavan M. R. Actinidiaceae. — Bull.
Indian Nat. Sci. Acad., 1970, N 41, p. 69—
74.
Vijayaraghavan M. R. Cyrillaceae. — Bull.
Indian Nat. Sci. Acad., 1970, N 41, p. 163—
167.
346
Vijayaraghavan M. R., Dhar U. Scytopeta-
lum tieghemii-embryologically unexplored
taxon and affinities of the family Scytope-
talaceae. — Phytomorphology, 1976, v. 26,
N 1, ^. 16—22.
Vijayaraghavan M. R., Dhar U. Embryology
of Cyrilla and Gliftonia (Gyrillaceae). —
Bot. notis., 1978, v. 131, iss. 1, p. 127—
138.
Vijayaraghavan M. R., Kaur D. Morphology
and embryology of Turnera ulmifolia L.
and affinities of the family Turneraceae. —
Phytomorphology, 1966, v. 16, N 4, p. 539—
553.
Vijendra Das L, D., Ramakrishnan V. Ovule
sterility in Bougainvillea (Nyctagina-
ceae). — Sci. and Cult., 1974, v. 40, N 2,
p. 80—81.
Vijok K. Badania cyto—embriologiczne nad
gatunkiem Brassica rapa L. var. oleifera. —
Zesz. nauk. WSR Olszt., 1964, v. 17, N 1,
p. 125—137.
Vijok K. Studia taksonomiezno-cyto-embrio-
logiczne and europejskimi odmianami
Brassica nigra L. —Zesz. nauk. WSR Olszt.,
1967, v. 23, N 2, p. 325—357.
Villamil P., Palser B. Studies of floral
morphology in the Ericales. IX: Organography,
vascular anatomy and megagametophyte
in three species of Gaultherieae. —
Phytomorphology, 1980, v. 30, N 2—3, p. 250—
265.
Vindt J. Monographie des Euphorbiacees du
Maroc. Tanger, 1953, pt 1. 220 p.
Vishnu-Mitre, Gupta H. P. Studien of Indian
pollen grains. III. Garyophyllaceae. —
Pollen et spores, 1964, v. 6, p. 99—111.
Voughan /. G., Rest J. A. Note on the testa
structure of Panda Pierre, Gallaria Zoll.
et Мог. and Microdesmis Hook. f. (Panda-
ceae). — Kew Bull., 1969, v. 23, p. 215—
218.
Walia K., Kapil R. N. Embryology of Fran-
kenia Linn, with some comments on the
systematic position of the Frankenia-
ceae. — Bot. notis., 1965, Bd 118, N4,
S. 412—429.
Walter H. Phytolaccaceae. — In: Engler A.
Das Pflanzenreich. Leipzig, 1909, S. 1—154.
Walters J. L. Megasporogenesis and gameto-
phyte selection in Paeonia californica. —
Amer. J. Bot., 1002, v. 49, N 7, p. 787—794.
Ward P. F. V., Hull P. J., Peters R. A.
Fluorofatty acids in the seeds of Dichapeta-
lum toxicarium. — Nature, 1964, N 201, *
p. 611-612.
Wadrlaw C. W. Embryogenesis in plants. —
Methuen et Co., Ztd. London John. Wiley
- and sons inc., New York, 1955. 381 p.
Warming E. De Г ovule. — Ann. Sci. natur.
Bot., 1878, ser. 6, t. 5, p. 177—266.
Warming E. Untersuchungen uber pollenbil-
dene Phyllome und Kaulome. — Bot. Ab-
handl., 1873, Bd 2, H. 1, S. 1—90.
Warming E. Observations sur la valeur sy-
stematique de Г ovule. — Mind. Jap. Steen,
1913, v. 23, p. 1—45.
Warsha P. Suspensor in Angiosperms. —
Botanica, 1975, silver jubille volume,
p. 84—90.
Weaver J. B. Embryological studies following
interspecific crosses in Gossypium. I. G.
hirsutum x G. arboreum. — Amer. J. Bot.,
1957, v. 44, N 2, p. 209—214.
Weaver /. B. Embryological studies
following interspecific crosses in Gossypium. II.
G. arboreum x G. hirsutum. — Amer. J.
$0t., 1958, v. 45, N 1, p. 10-16.
Wefelscheid G. Uber die Entwicklung der ge-
nerativen Zelle im Pollen—Korn der diko-
tylen Angiospermen. Diss. Bonn, 1911.
Weibel R. Morphologie de l'embryon et de
la graine des Elaeocarpus. — Candollea,
1968, v. 23, N 1, p. 101—108.
Weiling F., Schagen R. Uber die Preparation
und Gestalt des Endospermhaustoriums bei
den grossamigen Kurbisarten. — Ber. Dtsch.
bot. Ges., 1955, Bd 68, H. 1, S. 2—10.
Wein^ W. N. Uber endopollyploide, Resti-
tutionskernbildung und Kernstrukturen im
suspensor von Angiospermen und einer
Gymnosperme. — Bot. Z., 1962, S. 452—
454.
Weniger W. Development of embryo sac and
embryo in Euphorbia preslii and E. splen-
dens. — Bot. Gaz., 1917, v. 63, p. 266—281.
Werner A., Zenkteler M. The embryo sac
development and fertilization in Dianthus
amurensis Jacq. — Bull. Soc. amis sci. et
lett. Pozn. D, 1973, v. 14, p. 57—69.
West G. Cleistogamy in Viola riviniana with
special reference to the cytological aspects.—
Ann. Bot., 1930, v. 44, p. 87—109.
Westermaier M. Die ersten Zellteilungen im
Embryo von Gapsella bursa-pastoris. —
Flora, 1876, Bd 59, S. 483—491, 499—507,
515-520.
Wettstein R. Uber Parthenokarpie bei Dio-
spyros kaki. — Osterr. bot. Z., 1908,
Bd 58, S. 457—462.
White P. R. Plant tissue culture. A
preliminary report of results obtained in the
culturing of certain plant meristems. —
Arch. exp. Zellf., 1932, Bd 12, H. 4,
S. 601-620.
White Ph. L., Alvistur E., Dias C, Vinas E.,
White H. S., Collazos C. Nutrient content
and protein quality of quinua and canihua,
edible seed products of the Andes
mountains. — J. Agr. and Food Ghem., 1955\
v. 3, N 6, p. 531—534.
Wieler A. Der feinere Bau der Aleuronkorner
und ihre Entstehung. — Protoplasma, 1943,
N1.
Wille N. Ueber die Entwicklungsgeschichte
der Pollenkorner der Angiospermen und
das Wachsthum der Membranen durch
Intussusception. — Forh. Vidensk.-Selsk.
i Christ., 1886, N 5, S. 1—71.
Williams M. E. The origin of the karyokine-
tic spindle in Passiflora coerulea. — Proc.
Calif. Acad. Sci. Bot., 1899, v. 1, p. 189—
206.
Williams M. E. The development of the
embryo of Kochia scoparia. — Bull. Torrey
Bot. Club, 1932a, v. 59, p. 391—400.
Williams M. E. The development of the
embryo of Kochia scoparia. — Bot. Gaz.,
1932b, v. 117, p. 10—15.
Wilms H. J. Ultrastructure of the stigma
and style of Spinach in relation to pollen
germination and pollen tube growth. —
Acta bot, neer., 1980a, v. 29, N 1, p. 33—
47.
Wilms H. J. Development and composition
of the Spinach ovule. — Acta bot. neer.,
1980br v. 29, N4, p. 243—260.
347
Wilms H. J. Ultrastructure of the developing
• embryo sac of spinach. — Acta bot. neer.,
• 1981a, v. 30, N 1—2, p. 75—99.
Wilms H. /. Pollen tube penetration and
fertilization in spinach. — Acta bot. neer.,
• 1981b, v.. 30, N 1—2, p. 101—122.
Wilms H. J. Ultrastructure of the egg
apparatus of Spinacia. — Acta Soc. bot. pol.,
1981c, v. 50, N 1—2, p. 135—168.
Wilms H. J. Pollen tube growth through
nucellus into embryo sac of Spinacia — an
ultrastructural investigation. — Acta Soc.
bot. pol., 1981d, v. 50, N 1—2, p. 191 —
193.
Winkler A. Uber das Vorkommen verwachse-
ner Embryonen. — Verh. Bot. Ver. Prov.
Brandenburg, 1882, Bd 24, S. 94—96.
Winkler H. Uber Parthenogenesis bei Wikst-
roemia indica (L.) G. A. Mey. — Ber. Dtsch.
bot. Ges., 1904, Bd 22, S. 573—580.
Winkler H. Botanische Untersuchungen aus
Buitenzorg. 2. Uber Parthenogenesis bei
Wikstroemia indica. — Ann. Jard. bot.
Buitenz., 1906, ser. 2, v. 5, (20), p. 208—
276,
Winter D. M. The development of the seed
of Abutilon theophrasti, 1. Ovule and
embryo. — Amer. J. Bot., 1960, v. 47, N 1,
p. 8—14.
Witkus E, R. Endomitotic tapetal cell
divisions in Spinacia. — Amer. J. Bot.,
1945, v. 32, p. 326—330.
Wood C. E. J., Channell R. B. The genera
of the Ebenales in the Southeastern United
States; — J. Arnold Arboretum, 1960, v. 41,
N 1, p. 1—35.
Woadburn W. L. Development of the embryo
sac and endosperm in some seedless
persimmons. — Bull. Torrey Bot. Club, 1911,
■ v. 38, p. 379—384.
Woodcock E. F. Observations on the
development and germination of the seed in
certain Polygonaceae. — Amer. J. Bot.,
1914, v. 1, p. 454-476.
Woodcock E. F. Observations on the
morphology of the seed in Phytolacca. — Papers
Mich. Acad. Sci., Arts and Letters, 1925,
v. 4, p. 413—417.
Woodcock E. F. Morphology of the seed in
Claytonia virginica. — Papers Mich. Acad.
Sci., Arts and Letters, 1926a, v. 5, p. 195—
199.
Woodcock E. F. Morphological studies of the
seed of Alsine media. — Papers Mich.
Acad. Sci., Arts and Letters, 1926b, v. 6,
p. 397—402.
Woodcock E. F. Observations on the
morphology of the seed of Cerastium vulgatum. —
Papers Mich. Acad. Sci., Arts and Letters,
1928, v. 8, p. 233—238.
Woodcock E. F. Seed studies in Nyctagina-
ceae. — Papers Mich. Acad. Sci., Arts and
Letters, 1929, v. 9, p. 495—502.
Woodcock E. F. Morphological studies on the
seed of Mesembryanthemum crystallinum.—
Papers Mich. Acad. Sci., Arts and Letters,
1931a, v. 13, p. 221—226.
Woodcock E. F. Seed development in Ama-
ranthus caudatus L. — Papers Mich. Acad.
Sci., Arts and Letters, 1931b, v. 15, p. 173—
178.
Woodell S. R. I. Studies in btitish Primulas.
VII. Development of normal seed and
hybrid seed from reciprocal crosses between
P. vulgaris Huds and P. veris L. — New
Phytol., 1960, v. 59, N 3, p. 302-Г-313.
Woycicki Z. Zur Frage der Entstehung der
Pollenhaut bei Malva silvestris L. — Ber.
Dtsch. bot. Ges., 1911, Bd 29, S. 636—646.
Woycicki Z. Recherches sur les Malvacees.
La formation du pollen chez les Malva
silvestris, Malva rotundifolia et Althaea
officinalis. — .C. r. Soc. sci. Varsovier
1917, t. 26, p. 1—64.
Woycicki Z. Quelques details sur la structure-
du sac embryonnaire et le developpement
de l'embryon chez Malva silvestris et
M. rotundifolia Sep. — Abdr. Kosmos.
Lwow, 1922.
Woycicki Z. Quelques remarques a propos
denies recherches sur la formation du pollen
des Malvacees. — Acta Soc. bot. pol.,
1923, v. 1, p. 149—164.
Wright H. Theobroma cacao or cocoa : its
botany, cultivation, chemistry and
diseases. Colombo, 1907. 249 p.
Wu H. K. Embryogenesis in tea plant. —
Bot. Bull. Acad. Sin. Taipei, 1960, v. lr
p. 165—168.
Ya-E M. Development of the embryo sac in»
Statice japonica. — Sci. Rpts. Tohoku Imp.
Univ. Biol., 1941, v. 16, p. 279—303.
Yamada N. On the development of the embryo*
sac and fertilization in cotton plants. —
J. Coll. Agric, 1939, v. 14, N 5, p. 407—
416.
Yamaha G. Uber die Zytokinese bei der Pol-
lentetradenbildung zugleich weitere Bei-
trage zur Kenntnis uber die Zytokinese im
Pflanzenreich. — Japan. J. Bot., 1926, v. 3,
p. 139—162.
Yamazaki T. The embryology of Schortia
uniflora with a brief review of the
systematic position ofthe Diapensiaceae. — J. Jap.
Bot., 1966, v. 41, N8, p. 245—&51.
Yamazaki T. Embryological studies in
Ebenales. (1). Styracaceae. — J. Jap. Bot.,.
1970a, v. 45, N 9, p. 267—273.
Yamazaki T.Embryological studies in
Ebenales. (2). Symplocaceae. — J. Jap. Bot.,
1970b, v. 45, N 12, p. 353-358.
Yamazaki T. Embryological studies in
Ebenales. (3). Sapotaceae. — J. Jap. Bot., 1971,
v. 46, N 6, p. 161-166.
Yamazaki T. Embryological studies in
Ebenales. (4). Ebenaceae. — J. Jap. Bot., 1972,.
v. 47, N 1, p. 20—28.
Yamazaki T. Floral anatomy and embryology
of Tripetaleia paniculata and T. bracteata?
(Ericaceae). — Bot. Mag. Tokyo, 1975 r
v. 88, p. 267—279.
Yasui K. Studies of Diospyros kaki. I. —
Bot. Gaz., 1915, v. 60, N5, p. 362—373.
Young J. O. Histological comparison of
cucumber fruits developing parthenocarpically
and following pollination. — Bot. Gaz.,.
1943, v. 105, N1, p. 69-79.
Zabban B. Osservazioni sulla embriologia di
Myricaria germanica. — Ann. Bot. (Roma),.
1936, v. 21, p. 1—15.
Zahur M. S. Early ontogeny of the pvule in
Coccinia indica. — Biologia, 1962, v. 8r
p. 179—197.
Zenkteler M. Test-tube fertilization of ovules-
• in Melandrium album Mill, with pollen
v^rsdns of several species of the Paryophyl-
laceae. — Experientia, 1967, v. 23, p. 1—3.
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Abelmoschus esculentus 265
Abroma augusta 248, 251
Abronia 13, 16
— umbelldta 16
Abutilon 260
— avicennae 265
— incanum 265
— indicum 260, 263—265
— populifolium 265
— theophrasti 260, 265
Acalypha 267, 271, 273, 274
— alnifolia 276
— australis 276
— brachystachya 267, 268, 273, 274
. — ciliata 271, 273, 274, 276
— fallax 267, 271, 273, 276
* — indica 267, 271, 273, 274
— lanceolata 267, 271, 273, 276
— malabarica 271, 274, 276
— paniculata 276
— rhomboidea 273, 274, 276
— tricolor 273, 276
Acanthophyllum 39, 41
— albidura 39, 44
— cyrtostegium 39, 43, 44
— elatius 39, 41, 43, 44
— glandulosum 43, 44
— gypsophiloides 41, 43, 44
— krascheninnikovii 39, 41, 43, 44
— leiostegium 44
— microcephalum 39, 44
— paniculatum 39, 41, 44
— pulchrum 44
— pungens 44
— sarawschanicum 39, 44
Achariaceae 124
Achatocarpaceae 13
Achras 235
— sapota 234, 235
Achyranthes aspera 47—49
Acrotrema arnottianum 65, 66, 68
Actinidia 193, 195
— arguta 196, 197
— chinensis 193, 194, 197
— polygama 194, 197
Actinidiaceae 193—195, 197
Actinostemma tenerum 138
Adansonia 259
— digitata 257, 259
Adenia 103, 105
Aegiceras 236, 238
— corniculatum 236, 239
— ma jus 236, 238, 239
Aellenia 49, 50
— glanca 52 .
Aerva lanata 49
— tomentosa 47, 49
Aextoxicaceae 279
Aextoxicon punctatum 279
Agdestis .7
Agrostemma githago 44
Agyneia 273, 276
Aizoaceae 16, 18
Alcea 260, 263
— lenkoranica 265
— litwinovii 265
— nikitinii 265
— rosea 260, 261, 264, 265
— rugosa 265
276 Aleurites cordata 276
— fordii 274, 276
Alchornea 276
Alliaria 157, 161
— officinalis 155, 157, 160, 162
Allotropa 207, 208
— virgata 207, 208
Alluaudia comosa 34, 36
— dumosa 35, 36
— humbertii 35, 36
— montagnacii 35, 36
— procera 35, 36
Alluaudiopsis fiherenensis 36
Alniphyllum 221, 226
— fortunei 221, 222, 226
Alsine laricifolia 44
.„ — media 44
Altemanthera 47
sessilis 47 49
Althaea broussonetiifolia 260, 261, 204, 265
- cannabina 265
— cristata 265
— officinalis 260, 261, 265
— sulphurea (=Alcea sulphurea) 265
Alyssum macrocarpum 161, 1§2
— maritimum 162
Amaranthacoae 47, 48
Amaranthus bHtum 49
— caudatus 47, 49
— hypochondriacus 49
— spinosus 49
— viridis 49
Ammannia baccifera 44
Ammodonia peploides 44
Anabasis 50
— eriopoda 52
— salsa 52
Anacampseros 26
— arachnoides 31
Anagallis 243 '
— arvensis 243
— pumila 241, 243
Ancistrocladaceae 83, 84
23 Сравнительная эмбрисг оги \
349-
Ancistrocladus hamatus 84
— tectorius 84
Andromeda glaucophylla 208
— polifolia 204, 208
Androsace carnea 240, 241, 243
— maxima 243
— pubescens 243
Androsaemum officinale 96
Anguria 127
Anisomeria 7
Xnoda cristata 260
— dilleniana 265
— lavateroides 265
— triangularis 265
— wrightii 265
Anthodiscus 89
— obovatus 90
Antigonon 53, 57
— leptopus 53, 54, 58
Anychia dichotoma 44
Apodanthera undulata 138
Aptenia 18, 19
— cordifolia 16, 19
Arabidopsis 161
— thaliana 155, 162
A-rabis 157, 160—162
— allionii 162
— alpina 162
— caucasica 162
— halleri 162
— hirsuta 162
— holboellii 162
— hornungiana 162
— lyallii 162
— planisiliqua 162
— sagittata 162
Arbutus 204, 208
—- andrachne 208
r— menziesii 208
— unedo 208
Arctostaphylos alpina 202, 208
'— glauca 208
,— pungens 208
— uva-nrsi 202 208
r— viscid a 208
Ardisia 238
— crenata 238
— crispa 236, 239
— elliptica 236, 239
r— japonica 238
,— mamillata 238
— polycephala 238
— tuberculata 238
— wallichii 236, 238, 239
Arechavaletaia uruguayensis 99, 102
Arenaria 41
'— controversa 44
— fendleri 44
.— musciformis 44
— serpylljfolia 44
Aristotelia 245
— maqui 244, 245
— racemosa 244, 245
Armeria 59
'-— bupleuroides 59, 64
— plantaginea 64
— sp. 64
,— vulgaris 59, 60, 64
— vulgaris var. maritima 64
Armoracia rusticana 162
Arthrocnemum indicum 51, 52
Arthrophytum balchaschense 52
Asteropeiaceae 91
'Astrocarpus 164
—- sesamoides 164, 166, 169
Astrophytum 24
— myriostigma 19, 22, 26
Atraphaxis frutescens 53, 58
Atraphaxis sp. 58
Atriplex 50, 51
— hymenelytra 52
Aubrietia croatica 162
Azara microphylla 100, 102
Badula 236
Baliospermum 267
— axillare 276
— montanum 271, 276
Barbarea vulgaris 162
Barbeuia 7
Basella 32, 34
— alba 32, 34
— rubra 34
Basellaceae 32
Bassia latifolia 235
Begonia crenata 145, 148
— cucullata 148
— dregei 148
— floeberi 148
— heracleifolia 148
— hirtella 148
— incana 148
— manicata 144, 145, 147, 148
— richmondiana 148
-*- scharffii 148
— schmidtiana 148
— semperflorens 145, 148
— tuberhybrida 148
— tuberosa 148
Begoniaceae 144—147
Begoniales 139
Bejaria 202
Benincasa hispid a 137, 138
Berberidopsis corallina 99, 102
Bergia 96, 98
— aestivosa 98
— ammannioides 96, 98
— capensis 96
— odorata 96, 98
Berteroa 154, 157, 160—162
— incana 155, 162
Beta 52
— vulgaris 49, 51, 52
Biscutella 160
— eilrphifolia 162
Biswarea 137
— tonglensis 138
Bixa orellana 115, 116
Bixaceae 115—117
Blastania fimbristipula 138
— garcini 138
Boerhaavia 13, 14
— diffusa 13, 16
— repanda 13, 14, 16
— verticillata 16
Bombacaceae 256—258
Bombacopsis glabra 259
Bombax. 259
— kimuenzae 259
— malabaricum 257, 259
Bonnetiaceae 92
Bougainvillaea 13, 14
— glabra 13, 16
Boussingaultia 32
— baselloides 32, 34
Brassica 161, 162
, — alba 162
,350
— campestris var. yellow 162
— campestris var. toria 162
— chenopodiifolia 162
— insularis 162
— juncea 161, 162
— napus 162
— napus var. oleifera f. biennis 162
— nigra 162
— oleracea var. capitata 162
— pekinensis 162
— rapa var. oleifera 162, 163
Brassicaceae 154—159, 160, 162
Brazzeia 253
— longipedicellata 252
Breynia patens 267, 273, 276
Bruckenthalia spiculiflora 208
Brunnichia 53
— cirrhosa 53, 58
Bryanthus empetriformis 208
— taxifolius 208
Bryonia alba 138
— dioica 127, 137, 138
— melanocarpa 138
Bryonopsis laciniosa 138
Buettneria herbacea 248, 251
Bumelia 235
— lanuginosa 234
Bunias 157, 160, 161
— orientalis 155, 163
Cactaceae 19—25
Cadaba 150, 154
— indica 150, 154
Cakile maritima 163
Calandrinia 26
— andrewsii 31
— caulescens 29, 31
— discolor 31
— grandiflora 31
— speciosa 31
Calligonum mongolicum 54, 58
Calluna 202, 208
— vulgaris 208
Caloncoba 99, 100
— echinata 99, 102
— glauca 99, 100, 102
Gamelina sativa 163
Camellia oleosa 89
— sasangua 86, 89
Camptostylus 100
— mannii 99, 102
Gapparaceae 150, 152, 153
Capparales 149
Gapparis 154
— aphylla 154
— decidua 150, 154
— frondosa 154
— galeata 154 %
— horrida 154
— rupestris 154
— seriaria 154
— spinosa 150, 154
Gapsella 162
— bursa-pastoris 163
Gardamine 160, 161
— amara 163
— bulbifera 163
— chenopodifolia 163
— hirsuta 163
— impatiens 163
— pent aphylla 163
— pinnata 163
— polyphyila 163
— pratensis 163
— silvatica 163
Carica 124, 126
— candamarcensis 124, 125, 127
— cauliflora 127
— chrysopetala 127
— quercifolia 127
— papaya 124, 125, 127
— pentagona 127
Caricaceae 124—127
Garyocar 89
— glabrum 89
Caryocaraceae 89
Caryophyllaceae 39, 40, 42, 44—46
Caryophyllales 7
Casearia sp. 99
— tomentosa 102
Gassiope hypnoides 208
— lycopodioides 202, 208
— mertensiana 202,? 208
— tetragona 202, 208
Gelosia argentea 49
— cristata 49
Cephalandra indica 138
Gephalohibiscus 265
Cerastium glomeratum 44
— obscurum 43, 44
— pumilum 44
— tomentosum 44
— triviale 41, 44
— vulgatum 44
Ceratiola ericoides 209, 213
Ceratocarpus 50, 52
— arenarius 52
— utriculosus 52
Ceratoides 50, 52
— ewersmanniana 52
Geratostigma plumbaginioides 59, 64
— willmottianum 59, 64
Cereus 24
— jamacaru 26
Ghamaedaphne calyculata 208
Cheiranthus cheiri 163
Chenopodiaceae 49—51
Chenopodium album 51, 52
— ambrosioides 51, 52
— bonus-henricus 52
— murale 52
Chimaphila 207, 208
— menziesii 208
— umbellata 207, 208
Chiogenes 202
Chosenia 188
Chrozophora 267, 274
— obliqua 274, 276
— prostrata var. parvifolia 276
— rottleri 267, 268, 271, 273, 274, 276
Chrysophyllum 235
Chymococca empetroides 284
Gicca 267
— acida 267, 276
Cienfuegosia 260, 265
— drummondii 265
— heterophylla 260, 261, 264, 265
— hildebrandtii 260, 261, 265
— sulphurea 260, 261, 265
Cistaceae 117—119
Cistus 117, 119
— albidus 120
— ladaniferus 120
— laurifolius 120
— monspeliensis 118
— salvifolius 120
23*
35T
— tauricus 120
— villosus 120
«Citrullus 127, 137
— colocynthis 138
— colocynthoides 138
— fistulosus 137, 138
— lanatus 138
— vulgaris 128, 137, 138
«Clappertonia ficifolia 247, 248
«Clavija 239
— longifolia 239, 240
— ornata 239, 240
dlaytonia 26, 31
— caroliniana 31
— lanceolata 31
— perfoliata 29, 31
— sibirica 26, 29,, 31
— virginica 27, 31
Clematoclethra 193, 195, 197
«Gleome aspera 154
— canescens 154
— chelidonii 154
— graved ens 154
— iberica 150, 154
— lypskyi 150, 154
— monophylla 150, 154
— serrata 154
— spinosa 153, 154
— teneila 154
— violacea 154
— viscosa 150, 154
Clethraceae 198, 199, 201
Clethra 199
— acuminata 200
— alnifolia 198, 200
— arborea 200
— barbinervis 198, 199
Cleyera integrifolia 89
Cliftonia 217, 219
— monophylla 217, 218, 220
Clusiaceae 93—95
Coccinia cordifolia 138
—■> indica 138
Ooccoloba unifera 58
— populifolia 58
Cochlear! a officinalis 163
Codiaeum variegatum var. pictum 268,
Colona scabra 247, 248
Oorallocarpus conocarpus 137, 138
— epigaeus 138
€orchorus acutangulus 248
— capsularis 245, 247, 248
— olitorius 245—248
— siamensis 248
— siliquosus 248
— trilocularis 245, 248
— urticaefolius 248
dorema album 209, 210, 213
€oris 240
-Coronaria 41
— flos-cuculi 41, 43
Gorrigiola littoralis 44
Oortusa mathioli 243
■Grambe 160, 161
— abyssinica 157, 160, 163
— maritima 163
— pontica 163
«Crataeva 150, 154
— nurvala 150, 154
Oossosoma californicum 69
Oossosomataceae 69
€roton 267, 269, 274, 276
— bonplandianus 271, 274, 276
— ciliatoglanduliferus 276
— klotzschianus 271, 274, 276
—- oblongifolius 274, 276
— sparsiflorus 274, 276
Cruciferae 154, 155
Ctenolepis cerasiformis 138
— garcini 137, 138
Cucubalus baccifer 44
Cucumis 127
— anguria 138
— callosus 138
— ficifolius 138
— melo 137
— metuliferus 138
— myriocarpus 138
— prophet arum 138
— sativus 128, 137, 138
Cucurbita 137
— ficifolia 138
— maxima 137, 138
— mixta 138
— moschata 138
— pepo 127, 138
Cucurbitaceae 127—137
Cyathula tomentosa 49
Cyclamen 240
— europaeum 243
Cyclanthera explodens 127, 138
— pedata 138
Cyclolobeae 52
Cyrilla 217, 219
— racemiflora 217, 218, 220
Cyrillaceae 217—219
Daboecia 208
— cantabrica 208
— polifolia 208
Dactylaena micrantha 154
Dactyliandra welwitschii 138
Daphne 280, 283
— blagayana 284,
— cneorum 284
— kiusiana 284
— laureola 280, 283, 284
— mezereum 280, 2ЯЗ, 284
276 — odora 280, 283, 284
— pseudo-mezereum 284
— striata 284
Daphnopsis swartzii 280, 284
Dasylepis brevipedicellata 99, 102
Datisca cannabina 139, 140, 142
Datiscaceae 139—144
Deherainia 239, 240
— smaragdina 239, 240
Delosperma 18, 19
— cooperi 18, 19
Di an thus 41
— amurensis 41, 44
— armeria 39, 44
— caryophyllus 39, 44
— gramineus 44
— plumarius 44
— subulosus 39, 44
— versicolor 44
Diapensia 215
— lapponica 216
— sp. 216
Diapensiaceae 215
Diarthron vesiculosum 284
Dichapetalaceae 278
Dichapetalum bangii 279
— cymulosum 279
— guineense 279
352
— madagascariensis 279
— mombuttense 278, 279
— oblongum 278, 279
— pallidium 279
— toxicarium 278, 279
Dicoelospermum ritchiei 138
Didierea madascariensis 34—36
Didiereaceae 34
Diegodendraceae 83
Dieudonnaea 127
Digera arvensis 47, 49
Dillenia 65
— indica 68
— ovata 65, 6&
— pentagyna 68
— philippinensis 65, 68
— pteropoda 65, 68
— retusa .65, 68
— suffruticosa 65, 66, 68
Mleniaceae 65, 66
Dioncophyllaceae 84
Diospyros 231, 233
— glaucifolia 230, 231
— kaki<230, 231, 233
— lotus 230, 231, 233
— virginiana 230, 231, 233
Dipentodontaceae 121
Diplotaxis 154, 157, 160—162
— erucoides 163
— tenuifolia 16l, 163
Diplycosia ciliolata 208
Dipterocarpaceae 253, 255
Dirca palustris 280, 284
Dombeya mastersii 251
— spectabilis 251
Draba verna 163
Drymaria cordata 44
Drymispermum revolutum 284
Drvobalanops 255
— "sp. 255
Drypis spinosa 44
JDurio zibethinus 259
Ebenaceae 229—232
Ebenales 221
Ecballium elaterium 138
Echinocactus papyracanthus 22, 26
Echinocystis lobata 138
— wrightii 138
Edgaria darjeelingensis 138
Elaeocarpaceae 244
Elaeocarpus 244, 245
— hookerianus 245.
— sikkimensis 245
Elatinaceae 96, 98
Elatine 96, 98
— hexaridra 96
— hydropiper 96
— orthosperma 98
— triandra 96, 98
Elisanthe 41
, Embelia 236, 238
— ribes 238
Emex spinosa 58
Empetraceae 209—213
Empetrum 209
— hermaphroditum 213,
— nigrum 209, 210, 213
Enkiantlms 202
— campanulatus 208
— cernuus 203, 208
— nikoensis 208
— perulatus 202, 208
Entelea palmata 245—248
Ercilla 7
Erica arboraa 208
— ciliaris 208
— cinerea 208
— hirtifolia 202, 208
— mediterranea 208
— sicula 208
— stricta 202, 208
— tetralix 208
— willmoreana 208
Ericaceae ,202—207
Ericales 193, 213
Eriodendron 259
— anfractuosum 257, 259
Erophila verna 163
Eruca 154, 160, 161
— sativa 163
Erysimum 160—162-
— canescens 161, 163
— cheiranthoides 161, 163
— incanum 163
— marschallianum 160, 163
— pannonicum 155, 161, 163
Euphorbia 267, 273, 274
— altissima 276
— amygdaloides 276
— characias 276
— coral!oides 276
— corollata 273, 276
— cyparissias 276
— dracunculoides 267, 276
— dulcis 267, 268, 273, 276
— exigua 276
— falcata var. acuminata 276
— geniculata 271, 274, 276
— gerardiana 276
— globosa 276
— helioscopia 276
— heterophylla 276
— hibernica 276
— hirta 276*
— hypericifolia 274, 276
— ipecacuanha 276
— lagascae 276
— lathyris 276
— maculata 274, 276
— mauritanica 276
— meloformis 276
— microphylla 267, 26&, 276
— milii 267, 268, 276
— oreophila 276
— palustris 276
— paralias 276
— peplus 276
— pithyusa var. ovalifolia 276
— platyphyllos 276
— preslii 276
— procera 268, 274, 276
— prolifera 276
— pubescens 276
— pulcherrima 273, 276
— rosea 276
— rothiana 276
— salicifolia 276
— spinosa 276
— splendens 274, 276
— terracina 276
— thymiflora 276
— tirucalli 271, 176
— variegata 276
— virgata 276 .
— wallichii 276
Euphorbiaceae 267, 274, 276
Euphorbiales 267
Excoecaria 267
— agallocha 271, 276 #
Fagopyrum 57
— esculentum 53, 54, 58
— sagittatum 58
Ferocactus wislizeni 26
Fevillea cordifolia 138
Fibigia clypeata 163
Flacourtia cataphracta 102
— indica 99, 100
— ramontchi 99, 100, 102
Flacourtiaceae 99—f02
Flueckigera 7
— purpurea 7, 13
Fouquieria burragei 185—187
— peninsularis 185—187
— splendens 185—187
Fouquieriaceae 185, 186
Frankenia hirsuta 176, 179
— pulverulenta 176, 179
Frankeniaceae 175—178
Fumana 117
— arabica 120
— procumbens 120
Gamanthus 50—52
— gamocarpus 52
Garcinia livingstonii 93, 94, 96
— mangostana 95, 96
Gaultheria 202
— microphylla 208
— miqueliana 208
— ovatifolia 202, 208
— procumbens 202, 208
— punctata 208
— shallon 202, 208
Gaylussacia dumosa 208
Gelonium multiflorum 276
Girgensohnia 50, 51
— oppositiflora 50—52
Gisekia 7, 10
— pharnacioides 7—10, 13
Glaux maritima 243
Glinus 36
— indicum 39
Gnidia tomentosa 280, 284
Gomphrena celosioides 47, 49
— decumbens 49
Gossypium 260, 265
— abtusifolium 265
— anomalum 265
— arboreum 261, 265
— armourianum 265
— australe 265
— barbadense 260, 265
— bickii 265
— davidsoni 265
— herbaceum 260, 261, 265
— hirsutum 260, 261, 264, 265
— klotzschianum 265
— stocksii 265
— sturtii 265
— tomentosum 265
^- tricuspidatum 265
— trilobum 265
Gregoria vitaliana 243
Grewia acuminata 247, 248
Grubbia tomentosa 220
Grubbiaceae 220
Guazuma tomentosa 248, 251
Gurania 127
Gymnopetalum cochinchinense 138
Gynandropsis pentaphylla 150, 154
— speciosa 150, 154
Gypsophila 41, 43
— elegans 43, 44
— paniculata 39, 41, \k
— perfoliata 41, 44
— trichotoma 41, 44
Halesia 221, 226
— Carolina 221, 222, 226
Halimium 117
— halimifolium 120
Halimocnemis 50—52
— longifolia 52
Haloxylon 49, 50, 52
— ammodendron 52
— aphyllum 50—52
— persicum 52
Harrimanella hypnoides 204T 208
Hectorellaceae 32
Helianthemum alpestre 117, 118, 120
— apenninum 117, 118, 120
— chamaecistus 117, 120
— guttatum 120
— halimifolium 117
— ledifolium 117, 120
— rhodax 120
— vulgare 117—120
Helicteres isora 248, 251
Heliophila 154, 161
— amplexicaulis 155, 161—163
— longifolia 163
Heliosperma alpestre 44
Hereroa 18, 19
— hesperantha 18, 19:
Herniaria glabra 44
Herpetospermum caudigerum 138«
— pedunculosum 138
Hesperis 154, 157, 160r 161
— fragrans 163
— matronalis 163
— steveniana 155
Hevea 274
— brasiliensis 267 r 274, 276
Hibbertia acicularis 65, 68
— dentata ,68
Hibiscus 260
— cannabinus 260 y 264, 265
— costatus 265
— esculentus 265
— grandiflorus 260y 261 r 265
— hirtus 264, 265
— manihot 260, 261 r 264, 265*
— micranthus 264, 265
— militaris 265
— ponticus 265
— rosa—sinensis 265
— solandra 264, 265
— syriacus 260, 261 r 265
— trionum 260, 263—265
Hillebrandia sandwicensis 148*
Hilleria 7
Hodgsonia heteroclita 138
Holosteum umbellatum 44
Homonoia retusa 276
Honckenya peploides 44
Hopea odorata 255
— racophloea 253, 255
— wightiana 255
Hottonia palustris 243>
Huaceae 252
S54
Hura 267
— crepitans 267, 271, 276
Hybanthus 114
— calycinus 115
Hydnocarpus laurifolius 99, 102
Hylocereus undatus 19, 26
Hymenanthera dentata 114, 115
— latifolia 114, 115
Hypericum gentianoides 93, 96
— hookerianum 93, 94—96
— japonicum 96
— kalmianum 96
— maculatum 95, 96
— mysorense 93—96
— patutum 93—96
— perforatum 96
— punctatum 93, 96
-— tetrapterum 96
— virginicum 93, 96
IHypopitys 207
— monotropa 203, 207, 208
ilberis amara 163
— umbellata 163
Idesia 100
~ polycarpa 99, 100, 102
Tljinia regelii 52
Ionidium 112, 114, 115
— suffruticosnm 111, 115
Ionopsidium acaule 163
— savianum 163
Isatis 157, 161
— tinctoria 155, 163
Isomeris 154.
— arborea 150, 154
Jacquinia 239
_— aurantiaca 239, 240
.— ruscifolia 239, 240
,'Jaracatia conica 127
Jatropha 273
— gossvpifolia 273, 276
— panduraefolia 274, 276
_«•— panduraefolia
^Calmia 202
— angustifolia 208
* hirsuta 208
— glanca 208
-r latifolia 208
-r rayrtifolia 208
— polifolia 208
— polifolia var. microphylla 208
?Kiggelaria africana 99, 100, 102
^Citaibelia vitifolia 265
*K.leinhovia hospita 248, 251
iKpchia 49—52
"_— chilcjsii 52
.— .prpstrata 49, 50, 52
.— scoparia 51, 52
fKoenigia 57
— isl^dica 53, 58
sKokia Й65
rKydia caljcina 260, 264, 265
-Labatia 23£
— chryspphyllifolia 235
TLagenari,a vulgaris 127, 137, 138
;Lavatera *2^4
i- афогед &gp
— thuringiaca 260, 263, 265
— trimestris 260, 265
Lebronnecia 265
m Ledum groenlandicum 208
— palustre 208
Leiophyllum buxifolium 202, 208
— lyoni 208
Lepidium 154, 161
— campestre 163
— draba 163
— perfoliatum 163
— sativum 163
Lepyrorticlis holosteoides 44
Leucothoe axillaris 208
— catesbaei 208
— racemosa 202, 208
— recurva 202, 208
Limeum indicum 37
Limonium 59
— eiblimonium 59, 64
— oleaefolium var. confusum 64
— sp. 64
— transwallianum 59, 64
Lindackeria dendata 99, 102
Lissocarpa 229
Lissocarpaceae 229
Loiselearia procumbens 202, 208
Lucuma 235
Luff a acntangula 138
— cylindrica 137, 138
— echinata 138
— graveolens 138
— hermaphrodita 138
Lunaria 157, 160, 161
— annua 154, 161—163
— bipartita 163
Lychnis alba 44
— chalcedonica 44
— flos-cuculi 44
—. flos-jovis 44
— githago (=Agrostemma githago) 44
— viscaria 44
Lyonia mariana 208
— ligustrina 208
Lysimachia 243
— vulgaris 243
— ephemerum 243
Macropodium 161
— nivale 163
Maerua arenaria 154
Maesa 236, 238
— dubia 236, 238, 239
— indica 236, 238, 239
— rubiginosa 236, 239
Malachra capitata 260, 265
Malcolmia africana 163
Malesherbia scarlatiflora 123, 124
— lirana 123, 124
Malesherbiaceae 123, 124
Mallotus 273
— albus 273, 276
— japonicus 273, 276
— philippinensis 273, 276
— roxburghianus 271, 276
Malope trifida 265
Malva 260
— alcea 260, 265
— crispa 265
— heterophylla 265
-- limensis 265
— mauritiana 265
— raohileviensis 265
— moschata 260, 265
— neglecta 260, 265
— oxyloba 265
— palmata 265
— parviflora 265
— pusilla 265
— sylvestris 265
— verticillata 265
— waltherifolia 265
Malvaceae 260—264
Mai vales 244
Malvastrum campanulatum 265
— capense 260, 265
— peruvianum 265
Malvaviscus arboreus 260, 264, 265
Mammillaria 24
— carnea 20, 26
— tenuis 19, 22, 24, 26
Manilkara 235
— hexandra 235
Marah raacrocarpus 138
Marcgravia cuyuniensis 91
— polyantha 91
— purpurea 90, 91
— umbellata 90, 91
Marcgraviaceae 90, 91
Matthiola annua 163
— incana 160, 163
— tricuspidata 163
Medusagynaceae 92
Medusagyne oppositifolia 92
Megacarpaea 160, 161
— orbiculata 163
Melandrium 43
— album 44
— diurnum 44
— rubrum 44
— vespertinum 44
Melanthesa rhamnoides 267, 276 .
Melicytus fasciger 114, 115
Melo 127, 137
— agrestis 138
— ameri 138
— chandalak 138
— sativus 128, 137, 138
— ?ard 138
Melochia corchorifolia 248, 251
Melothria beterophylla . 137, 138
— leiosperma 138
— leucocarpa 138
— maderaspatana 138
— pendula 138
— scabra 138
Meuziesia pentandra 208
Mesembryantbemum pseudotruncatellum 18
19
Micrampelis lobata 138
Micrantheum ericoidcs 276
Micrococca 273
— mercurialis 267, 268, 273, 276
Microtea 7 •
Mimusops 235
— elengi 233, 235
Mirabilis 13, 14
— froebelii 16
— jalapa 13, 14, 16
— longiflora 16
— multiflora 16
— uniflora 16
Modiola caroliniana 265
Modiolastrum malvifolium 265
Moehringia 41
— lateriflora 44
35,6
— muscosa 44
— pentandra 44
— trinervia 44
m Molluginaceae 36—38
Mollugo 36
— cerviana 39
— distich a 39
— lotoides 39
— midicaulis 36, 37, 39
— oppositifolia 39
— stricta 39
— verticillata 39
Momordica balsamina 138
— charantia 137, 138
— cochinchinensis 138
Moneses 207
— uniflora 207, 208
Monoeoccus 7, 13
Monotropa uniflora 208
Montia 26, 29
— font an a 31
— rivularis 27, 29, 31
Moricandia arvensis 163
Moringa concanensis 172, 174
— oleifera 172—174
— pterygosperma 174
Moringaceae 172—174
Muntingia 245
— calabura 244, 245
Myricaria germanica 180, 182, 184, 185
Mvrsinaceae 236
Mvrsine 236, 238
— africana 236, 238, 239
Nannphyton 49, 50, 52
Neopeltandra 267
— suberosa 271, 276
Neoscortechinia arborea 276
Nopalea 24, 26
Nyctaginaceae 13—15
Ochna atropurpurea 78, 83
— multiflora 78, 83
— serrulata 78, 82, 83
— squarrosa 78, 83
Ocbnaceae 78
Ochroma 256, 259
— lagopus 257, 259
Oligorreris glaucescens 164, 166, 16&
Oncoba spinosa 99, 102
Oncothecaceae 89
Opuntia 24
— aurantiaca 19, 20, 25, 26
— dillenii 20, 22, 25, 26
— elata 19, 20, 22, 25, 26
— ficus-indica 19, 20, 22, 24— 2fr
— fulgida 26
— glaucophylla 26
— leucantba 25, 26
— monacantha 26
— rafinesquii 25, 26
— sp. 26
— torti spina 25, 26
— vulgaris 25, 26
Orthilia 207
— secunda 203 207, 208
Orygia 36
— decumbens 36, 39
Oubanguia 253
Oxybaphus 13, 14
— micrantbus 13—16
— nyctagineus 13—16
— viscosus 16
Oxycoccus macrocarpus 208
— quadripetalus 208
Oxydendrum arboreum 20 S
Oxyria 57
— digyna 53, 54, 57, 58
— elatior 58^
Pachira 259
— aquatica 257, 259
— oleagina 259
— ros^a 259
Paeonia 70
— albiflora (=lactiflora) 71, 72, 76
— anomala 71, 72, 74, 76
— brcvwnii 74, 76
— calif ornica 74, 76
— caucasica 76
— delavayi 76
-- la tea 76
— majko 76
— officinalis 71, 72, 76
— suffruticosa (=moutan) 72, 74,
— tenuifolia 72, 73, 76
— veitchii (^ beresowckii) 72, 76
— wittmanniana 73, 74, 76
Paeoniaceae 70, 72—76
Paeoniales 70
Palaquium 235
Tandaceae 277
Paronychia arabica 44
— chilensis 44
Passerina filiformis 280, 284
— pectinata 284
Passiflora 103, 105
— adenophylla 103, 106
— alba 106
— calcarata 103, 106
— coerulea 103, 104, 106
— edulis 106
— foetida 103, 104, 106
— leschenaultii 106
— quadrangularis 106
—^ suberosa 106
— trifasciata 106
Pqssifloraceae 103, 104, 106
Tavonia 260
— sepium 265
— spinifex 265
— zeylanica 260, 265
Pedilanthus tithymaloi'ies 271„ 276
Pelliceriaceae 92
Pelliciera rhizophoreae 92
Pentapetes phoenicea 248, 251
Pentaphylacaceae 89
Pentaphylax euryoides 89
Pereskia 24, 26
— amapola var. argentina 19. 26
Pereskiopsis 24, 26
Peridiscaceae 120
Pernettya macros tigm a 208
— mucronata 208
Peterodendron ovatum 99, 102
Petiveria 7, 9, 12, 13
— alliacea 8, 13
Phaleria capitate 283, 284
Phyllanthus 267, 273
— angustifolius 276
— debilis 267, 276
— maderaspatensis 274, 276
— odotadenius 267, 276
— reticulars 277
Phyllocactus 19, 26
Phyllodoce 202
— aleutica 208
— breweri 208
— caerulea 208
— empetriformis 208
— glanduliflora 208
— nipponica 208
Phytolacca 7, 9
— americana 7—9, 12, 13
— decandra 13
— dioica 13
— octandra 13
Phytolaccaceae 5, 7, S, 9—12
Pieris bracteata 208
— floribunda 208
— japonica 2u8
Pierrina 253
Pisonia 13
— aculeata 16
Pitiopus 207
— californica 207, 208
Plagianthus.pulchellus 260, 265
Pleuricospora 207
— fimbriolata 207, 208
Ploiarium alternifolium 93
Plumbagella 59
-- micrantha 59, 60, 64
— sp. 64
Plumbaginaceae 59, 60, 61
Plumbaginales 59
Plumbago 59
— capensis 59, 64
— coccirtea 59, 60, 64
— euro^aea 59—61, 63, 64
— pulchella 64
— scandens 59, 64
— sp. 04
-- zeylanica 59, 64
Poinsettia pulcherrima 277
Polanisia graveoles 154
— trachysperma 154
Polycarpaea corymbosa 39
— nebulosa 41, 44
Polycarpon tetraphyllum 44
Polygonaceae 53—57
Polygonum 57
— aviculare 58
— bistorta ^3, 58
— divaricatum 58
— orientale 58
— perforatum 53, 54, 57, 58
— persicaria 58
— viviparum 58
Populus alba 188, 191
— balsamifera 188, 191
— bolleana 191
— canadensis 188, 191
— candicans 191
— canescens 191
— deltoides 188, 191
— densa 191
— diversi folia 191
— hybrida 191
— italica 191
— maximowiczii 191
— nigra 188, 191
— pruinosa 188, 191
— pyramidalis 188, 191
— sieboldi 191
— species 188, 191
— suaveolens 191
— tremula 188, 191
— tremuloides 191
— trichocarpa 191
Portulaca 26, 29
— grandiflora 26, 27, 29, 31
— micron at a 31
— oleracea 26, 27, 29, 31
— pilosa 31
— tuberosa 26, 27, 31
Portulacaceae 26—28, 30
Pouteria 234, 235
— obovata var. dubia 234, 235
Primula auricula 243
— denticula 243
— elatior 243
— floribunda 240, 243
— minima 243
— officinalis 240, 241, 243
— sinensis 243
— veris 243
—- vulgaris 243
Primulaceae 240—242
Primulales 236
Psilostachys sericea 47, 49
Psylliostachys suvorovii 64
Pterospermum 248
— acerifolium 248, 251
— heyneanum 248, 251
— suberifolium 251
Pterospora 207
— andromedea 207, 208
l?terostegia 57
— drymarioides 53
Pterostyrax 221, 226
— corymbosus 221, 226
— hispidus 221, 222, 226
Ptilotrichum spinosum 163
Pupalia lappacea 47, 49
Purdiaea 217
Putranjiva roxburgbii 274, 277
Pyrola 207
— chlorantha 207, 208
— media 208
— minor 207, 208
— rotundifolia 203, 207. 208
Quiinaceae 92
Raphanus 162
— sativus var. radicula 163
Reseda alba 164, 166, 169
— crystallina 164, 169
— glauca 164, 169
— inodora 164, 166. 169
— lutea 164, 165, 167, 169
— luteola 164, 169
— media 164, 169
— odorata 164, 169
— phyteuma 164, 169
Resedaceae 164—171
Rhaptopetalum 253
Rheum 57
— compactum 58
— franzenbachii 58
— officinale 58
— rhaponticum 58
— ribes 58
— sanguineum 58
— webbiana 58
Rhipsalis cassytha 19, 20, 22, 26
— capilliformis 19, 26
— gonocarpa 26
— virgata 19, 26
Rhododendron 202
— canadense 208
— catawbiense 203, 208
— ferrugineum 208
— intermedium 208
— japonicum 204, 208
— kamtschaticum 208
— kotschyi 208
— lapponicum 208
— luteum 203, 208
— molle 208
— mucronatiim 203, 204, 208
— mucronulatum 208
— ponticum 208
-- punctatum 208
— sinense 208
Rhodothamnus 202
— leachianus 208
Ricinus 274
— communis 277
Rivina 7, 9
— brasiliensis 8, 13
— humilis 8, 12, 13
Royena lucida 230
Rumex 57, 58
— acetosella 53, 54, 58
— angiocarpus 53, 54, 58°
— confertus 53
— crispus 58
— flexuosus 58
— salicifolius 58
— tenuifolius 53, 54, 58
— turkestanicus 58
— verticillatus 58
Sagina maritima 44
— procumbens 43, 44
— subulata 44
Salicaceae 188, 191
Salicales 188
Salix 188
— acutifolia 191
— alba 191
— aurita 191
— caprea 188, 191
— chaenomeloides 191
— cinerea 191
—* cordata 191
— discolor 191
— fragilis 191
-- glauca 191
— glaucophylla 191
— integra 191
— komarovii 191
— lasiolepis 191
— leiolepis 191
-• multinervis 191
— myrsinifolia 191
— neocinerea 191
— nigricans 191
— pentandra 192
— petiolaris 192
— purpurea 192
— reticulata 192
— tetrasperma 192
— triandra 192
— tristis 192
— viminalis 192
— vulpina 192
Salsola 49, 50
— aperta 50, 52
— arbuscula 50—52
— arbusculiformis 52
358
— gemmascens 51, 52
— orien talis 50—52
— paulsenii 52
— richteri 51, 52
— sclerantha 50, 52
Samolus valerandi 241, 243
Saponaria 43
— cerastoides 44
— officinalis 39, 41, 44
Sapotaceae 233, 234
Sarcodes sanguinea 207, 208
Sarcolaenaceae 255
Sauropug 267
— quadrangularis 267, 271, 277
Sauvagesiaceae 83
Scaphocalyx spathacea 102
Scepasma buxifolia 277
Schiedea spergulina 44
Schindleria 7
Scleranthus annuus 44
— pererinis 44
Scottellia mimfiensis 99, 102
"Scyphostegia borneensis 120, 121
Scyphostegiaceae 120
Scytopctalaceae 252, 253
Scytopetalum 253
— tieghemii 252, 253
Sebastiana 267, 273
— chamaelea 267, 277
Sechium edule 127, 138
;Securinega ramiflora 277
Seguieria 7
Sesuvium 18
— portulacastrum 16, 19
Shorea 255
— robnsta, 253, 255
— sp. 255
— talura 255
Sicyos anguiatus 127, 137, 138
.Sida 260, 264
— carpinifolia 264, 265
— cordifolia 264, 265
— napaea 260, 261, 264, 266
— veronicifolia 264, 266
:Sidalcea Candida 260, 266
— neomexicana 266
Sideroxylon 234, 235
— globosum 234, 235
-Silene 41
— acaulis 44
— arrneria 44
— conoidea 44
— friwaldskyana 44
— maritima 44
— nutans 44
— otites ^4
— tatarica 44
— vallesia 44
— venosa 44
Sinapis alba 163
— arvensis 163
.Sisymbrium 160-162
— officinale" 163
— taraxacifolium 163
— thalianum (=Arabidopsis thaliana) 163
— strictissimum 163
;Smelowskia calycina 163
Soldanella alpina 243
— hungarica 243
:Sparmannia 247
— africana 245—248
Spergula arvensis 43, 44
— canina 44
— pentandra 45
Spergularia marginata 43, 45
Spinacia oleracea 52
Spirolobeae 52
Stachystemon \ermicularis 277
Stachyuraceae 106—109
Stachvurus chinensis 107, 110
— praecox 106, 107, 110
— praecox var. matsuzakii 110
— praecox var. praecox 107, 110
Statice 59
— japonica 64
— oleaefolia var. coflfusa 64
— sinu ata 64
— sp. 64
Stegnosperma halimifolia 284
Stegnospermataceae 36, 284
Slellaria 41
— aquatica 39, 41, 45
— glauca 45
— holostea 45
— media 45
— uliginosa 45
Sterculia 248
— alata 248, 251
— colorata 251
— factida 251
— foetida 248
Sterculiaceae 248—250
Strasburgeria calliantha 83
Strasburgeriaceae 83
Styracaceae 221—225
Styrax: 221, 226
— dasyantha 221, 222
— japonicus 222, 226
— obassia 221, 222, 226
— officinalis 226
Suaeda 50
— fruticosa 51, 52
— maritima 52
Succowia 160
— balearica 163
Symplocaceae 226, 227
Symplocos 226
— chinensis 227, 229
— cochinchinensis 229
— foliosa 229
— japonica 227, 229
— klotzschii 229
— macrophylla 229
— paniculaia (—Svmplocos crataegoides) 227,
229
— racemosa 229
— spicata var. attenuata 229
Syrenia 154, 161, 162
— cana 155, 161, 163
Tacsonia mollissima 103, 106
Talinium patens 31
Tamaricaceae 179-183
Tamaricales 175
Tamarix 182
— aestivalis 185
— africana 184, 185
— androssovii 185
— arceuthoides 185
— chinensis 184, 185
— dioica 180, 184, 185
— gracilis 185
— elongata 185
— ericoides 180, 184, 185
— florida 185
— gallica 179, 184, 185
— hispida 185
359
— hohenackeri 179, 180, 185
— kotsh>i 185
— laxa 185
— leptostachys 185
— odessana 180, 184, 185
— pallasii 185
— parviflora 180, 184, 185
— pentandra 180, 184, 185
— ramosissima 179, 180, 185
— tetrandra 184, 185
— troupii 180, 184, 185
Tapura africana 278, 279
— amazonica 279
— bouquetiana 278, 279
— ivorensis 279
Teesdalia nudicaulis 163
Telephium imperati 45
Tetragonia 18
— tetragonoides 18, 19
Tetrameles midiflora 142
Tetrameristaceae 89
Thea japonica 88, 89
— sinensis 86, 88, 89
Theaceae 85
Theales 78
Thelocactus bicolor 22, 26
Theobroma cacao 251
Theophrasta 239
— macrophylla 239, 240
Theophrastaceae 239
Thespesia 265
— lampas 266
— populnea 260, 264—26B
Thladiantha 137
— calcarata 138
— dubia 138
Thlaspi arvense 163
— perfoliatum 163
Thylacospermum rupifra^um 45
Tbymelaea arvensis 280,"283, 284
— passerina 284
Thymelaeaceae 280
Thymelaeales 280
Tilia 247
— cordata 245—248
— petiolaris 247, 248 -
— platyphyllos 245—248
— rubra 247, 248
— tomentosa 246—248
— ulmifolia 245, 248
— vulgaris 248
Tiliaceae 245—247
Tissa marginata 45
Toumeya papyracantha 22, 26
Tovaria pendula 149
Tovariaceae 149
Tragia 273
— involucrata 2.67, 271, 277
Trewia nudiflora 277
Trianthema 19
— argentina 18, 19
— monogyna 19
— portulacastrum 18, 19
Trichosanthes anguina 138
— bracteata 138
— cucumerina 138
— dioica 138
— lobata 138
Trientalis 240
— europaea 241, 243
Trigonostemon 277
Tripetaleia bracteata 203, 208
— paniculata 208
Triphyophyllum peltatum 84, 85
Triumfetta rhomboidea 245, 247, 248
Tuberaria 117
— guttata 117, 120
Tunica prolifera 45
— saxii'raga 41, 45
Turnera ulmifolia 122, 123
— ulmifolia var. an^ustifolia 123
Turneraceae 121—123
Turritis glabra 163
Tutcheria shinkoensis 89
Uilucus 32, 34
— tuberosus 32, 34
Urena lobata 260, 266
Vaccaria parviflora 45
— segetalis 45
— vaccaria 45
Vaccinium 202, 204
— angnstifolium var. laevifolium 203, 20&
— corymbosum 208
— hirsutum 208
— leschenaultii 208
— myrtillus 208
— nummularia 208
— pennsylvanicum 208
— retusum 208
— serratum 202, 208 .
— uli^inosum 208
— vitis-idaea 208
Vateria indica 252, 255
Villamilla 9
— peruviana 8, 13
Viola 112, 114, 115
— cinerea var. stocksii 115
— collina 111, 112, 114, 115
— epipsila 111, 112, 114, 115
— mirabilis 111, 112, 115
— odorata 112, 115
— riviniana 114, 115
— tricolor 111, 114, 115
Violaceae 111—И 4
Violales 99
Viscaria 41
— viscosa 45
Vogelia 59
— indica 64
— sp. 64
Wahlbergella affinis 45
Waltheria indica 248, 251
Wikstroemia 280
— indica 280, 284
Wormia 65
— suffruticosa 65, 68
Zenobia speciosa 208
СОДЕРЖАНИЕ Стр.
Предисловие 5
Порядок 26. Caryophyllales 7
Семейство Phytolaccaceae (О. П. Камелина) 7
Семейство Achatocarpaceae (Г. И. Савина) 13
Семейство Nyctaginaceae (Г. М. Анисимова) . . . 1-3
Семейство Aizoaceae (Г. М. Ильина, В. А. Поддубная-Арнолъди) 16
Семейство Cactaceae (Т. Н. Наумова) 19
Семейство Portulacaceae (Т. Б. Батыгина) 26
Семейство Hectorellaceae (С. Н. Коробова) 32
Семейство Basellaceae (Т.Н. Наумова) 32
Семейство Didiereaceae (Т.Н. Наумова) 34
Семейство Stegnospermataceae (О. П. Камелина) 36
Семейство Molluginaceae (Г. И. Савина) 36
Семейство Caryophyllaceae (Д. Ю. Турсунов, Т. Е. Матюнина) ... 39
Семейство Amaranthaceae (Г. И. Савина) 47
Семейство Chenopodiaceae (В. И. Конычева, Р. У. Кадырова) .... 49
Порядок 27. Polygonales 53
Семейство Polygonaceae (M. П. Солнцева) 53
Порядок 28. Plumbaginales . 59
Семейство Plumbaginaceae (С. Н. Коробова) 59
Порядок 29. Dilleniales 65
Семейство Dilleniaceae (М- С. Яковлев) 65
Семейство Crossosomataceae (M. С. Яковлев) 69
Порядок 30. Paeoniales v 70
Семейство Paeoniaceae (M. С. Яковлев) 70
Порядок 31. Theales 78
Семейство Ochnaceae (Т. Н. Наумова) 78
Семейство Sauvagesiaceae (Г. К. Алимова) 83
Семейство Strasburgeriaceae (Т. Н. Наумова) 83
Семейство Diegodendraceae (Т. Б. Маметьева) 83
Семейство Ancistrocladaceae (Т. Б. Маметьева) 83
Семейство Dioncophyllaceae (M. П. Солнцева) 84
Семейство Theaceae (В. Ю. Мандрик) . . . , 85
Семейство Oncothecaceae (Т. Б. Соколовская) 89
Семейство Pentaphylacaceae (С. Н. Коробова) . 89
Семейство Tetrameristaceae \T. E. Фрейберг) 89
Семейство Сагуосагасеае (О. П. Камелина) 89
Семейство Asteropeiaceae (О. П. Камелина) , 91
Семейство Marcgraviaceae (Г. И. Савина) 91
Семейство Pelliceriaceae (Г. М. Анисимова) , . 92
Семейство Quiinaceae (Г. М. Анисимова) , 92
Семейство Medusagynaceae (Г. М. Анисимова) 92
Семейство Bonnetiaceae (Г. М. Анисимова) 92
Семейство Clusiaceae (Т. Б. Соколовская) 93
Семейство Elatinaceae (Т. Б. Соколовская) 96
Порядок 32. Violales 99
Семейство Flacourtiaceae (Г. К. Алимова) 99
Семейство Passifloraceae (Г. К. Алимова) 103
Семейство Stachyuraceae (О. П. Камелина) 106
Семейство Violaceae (В. Л. Верещагина) 111
Семейство Bixaceae (Т. Б. Соколовская) 115
Семейство Cistaceae (Т. Б. Соколовская) 117
Семейство Peridiscaceae (Т. Б. Соколовская) 120
•Семейство Scyphostegiaceae (О. П. Камелина) 120
Семейство Dipeiitodontaceae (О. П. Камелина) 121
Семейство Turneraceae (Г. К. Алимова) 121
Семейство Malesherbiaceae (Г. К. Алимова) 123
Семейство Achariaceae (Г. К. Алимова) 124
Семейство Caricaceae (Г. К. Алимова) 124
Семейство Cucurbitaceae (А, К. Дзевалтовский) 127
Порядок 33. Begoniales 139
Семейство Datiscaceae {О. П. Камелина) 139
Семейство Begoniaceae (Г. М. Анисимова) 144
Порядок 34. Capparales 149
Семейство Tovariaceae (Г. Б. Родионова) 149
Семейство Саррагасеае (Г. Б. Родионова) 150
Семейство Brassicaceae (Л. Е. Беляева, Г. Б. Родионова) 154
Семейство Resedaceae (И. А. Чабан) 164
Семейство Moringaceae (Г. Б. Родионова) 172
Порядок 35. Tamaricales ч 175
Семейство Frankeniaceae (О. П. Камелина) 175
Семейство TamaricaCeae (О. П. Камелина) 179
Семейство Fouquieriaceae (О. П. Камелина) 185
Порядок 36. Salicales 188
Семейство Salicaceae (E. С. Николаева) 188
Порядок 37. Ericales . ' 193
Семейство Actinidiaceae (Т. Е. Фрейберг) 193
Семейство Clethraceae (Т. Е. Фрейберг) 199
Семейство Ericaceae (Л. Я. Якобсон, Э. С. Терёхин) 202
Семейство Empetraceae (Т. Е. Фрейберг) 209
Семейство Epacridaceae (С. Н. Коробова) 213
Семейство Diapensiaceae (С. Н. Коробова) 215
Семейство Cyrillaceae (Т. Е. Фрейберг) 217
Семейство Grubbiaceae (Г. Е. Фрейберг) 220
Порядок 38. Ebenales 221
Семейство Styracaceae (3, И. Никишичева) 221
Семейство Symplocaceae (3. И. Никишичева) 226
Семейство Lissocarpaceae (3. И, Никишичева) : . . . 229
Семейство Ebenaceae (3. И. Никишичева) ' 229
Семейство Sapotaceae (3. И. Никишичева) . г 233
Порядок 39. Primulales 236
Семейство Myrsinaceae (Т. Б. Маметъева) 236
Семейство Theophrastaceae (Т. Б. Маметъева) 239
Семейство Primulaceae (Т. Б. Мамешъева) 241
Порядок 40. Malvales 244
Семейство Elaeocarpaceae (Г. Я. Жукова) 244
Семейство Tiliaceae (Г. Я. Жукова) 245
Семейство Sterculiaceae (Г. И. Савина) 248
Семейство Huaceae (M. П. Солнцева) 252
Семейство Scytopetalaceae (M. П. Солнцева) 252
Семейство Dipterocarpaceae (С. Н. Коробова) 253
Семейство Sarcolaenaceae (Г. И. Савина)г 255
Семейство Sphaerosepalaceae (3. И. Никишичева) 255
Семейство Bombacaceae (Т. Б. Соколовская) 256
Семейство Malvaceae (Г. В. Камалова, Г. Я. Жукова, В. А. Руми) 260
Порядок 41. Euphorbiales 267
Семейство Euphorbiaceae (Т. Б. Башыгина, Г. Е. Колесова) 267
Семейство Pandaceae (Т. Б. Башыгина) 277
Семейство Dichapetalaceae (Т. Б. Башыгина) 278
Семейство Aextoxicaceae (Т. Б. Башыгина) \ 279
362
Порядок 42. Thymelaeales 280
Семейство Thymelaeaceae (Т. Н. Наумова) 280
Дополнение — семейство Stegnospermataceae (О. П. Камелина) . . . 284
Приложение 286
Исследованные виды (к приложению «Содержание запасных питательных
веществ в зрелом семени покрытосеменных растений») 294
Литература . 297
Указатель латинских названий растений 349>
СРАВНИТЕЛЬНАЯ ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ РАСТЕНИЙ
PHYTOLACCACEAE — THYMELAEACEAE
Утверждено к печати
Ботаническим институтом им. В. Л. Комарова
Академии паук СССР
Редактор издательства Л. В. Шоренкова
Художник М. И. Р а з у л е в и ч
Технический редактор М. Н. Кондратьева
Корректоры Н. П. К и з и м и С. И. С е м и г л а з о в а
ИБ № 20523
Сдано в набор 17.01.83. Подписано к печати 14.06.83. М-19094.
Формат 70x108 Vie. Бумага типографская № 1. Гарнитура
обыкновенная. Печать высокая. Усл. печ. л. 32.90. Усл.
кр.-отт. 33.08. Уч.-изд. л. 39.59. Тираж 1200. Тип. зак. № 55.
Цена 6 р.
Издательство «Наука». Ленинградское отделение •
199164, Ленинград, В-164, Менделеевская лин., 1
Ордена Трудового Красного Знамени
Первая типография издательства «Наука»
199034, Ленинград, В-34, 9 линия, 12