Автор: Киргинцев А.Н. Трушникова Л.Н. Лаврентьева В.Г.
Теги: химия справочник неорганическая химия
Год: 1972
Текст
РАСТВОРИМОСТЬ
УДК 541.8(083)
Киргинцев А. Н., Трушникова Л. Н., Лавренть-
ева В. Г. Растворимость неорганических веществ
в воде. Справочник. Изд-во «Химия», Л., 1972,
стр. 248, табл. 87, рис. 58§.
Справочник содержит сведения по растворимо-
сти неорганических веществ в воде (двухкомпонент-
ные системы). Данные представлены в основном
в виде диаграмм и таблиц.
Книга рассчитана на широкий круг исследова-
телей, инженерно-технических работников хими-
ческой и других отраслей промышленности, препо-
давателей и студентов вузов.
ОТ АВТОРОВ
Диаграмма состояния, графически изображающая состав сосуществую-
щих фаз, является наиболее выразительной характеристикой системы. По
словам Н. С. Курнакова, «в химической диаграмме химия получает между-
народный геометрический язык, аналогичный языку химических формул).
Цель настоящего справочника—представить растворимость неорганиче-
ских веществ в воде преимущественно в виде диаграмм. Этим он отличается
от других справочных изданий, в которых содержатся данные по раствори-
мости неорганических веществ.
При составлении справочника, как правило, использовались оригинальные
работы, а также монографии и справочные издания.
Авторы выражают благодарность И. И. Яковлеву и В. Л. Варшавскому
за ценные замечания, а также Т. А. Белогрудовой и Н. Я. Якоби за помощь
в работе.
Авторы будут весьма признательны всем, кто пришлет свои замечания
и пожелания по справочнику.
2-5-4
106—71
ВВЕДЕНИЕ
Одной из главных особенностей систем
соль — вода является практическое отсут-
ствие твердых растворов на основе льда
(исключение представляет фтористый ам-
моний) и твердых растворов воды в солях
или гидратах. Поскольку при атмосферном
давлении водные растворы солей не рас-
слаиваются на две жидкие фазы, диаграм-
мы растворимости в этом случае могут быть
представлены тремя простейшими видами
(рис. 1). Диаграмма первого вида отра-
жает образование безводной соли (SA),'
второго — гидрата (S\), растворимого’кон-
груэнтно, третьего — гидрата (SJ, раство-
римого инконгруэнтно. Буквами V, L и S
обозначены области существования пара,
жидкости и твердого вещества; буквой So
обозначен лед. Поле V от поля V + L
отделяет кривая кипения. В случае нелету-
чей соли эта кривая показывает зависи-
мость температуры кипения от состава
раствора; состав пара при этом постоян-
ный — он .содержит только воду.
Реальные диаграммы растворимости ос-
ложняются, по сравнению с изображен-
ными на рис. 1, образованием нескольких
гидратов, а также наличием полиморфных
форм и метастабильных состояний.
Растворимость зависит от давления, но
изменения растворимости заметны лишь
при больших давлениях. Так, например,
растворимость NaCl, по данным Адамса * **,
при 25° С изменяется от 26,4 до 27,3%
с возрастанием давления от атмосферного
до 7896 атм. Влияние давления на вид
диаграммы плавкости •• может быть пред-
ставлено двумя графиками (рис. 2), где
Pi < < Ря. На первом растворимость
всегда изменяется при изменении давления;
на втором есть точка, в которой раствори-
мость соли не зависит от давления.
При нагревании водно-солевой системы
в замкнутом объеме (посторонние газы эва-
куированы) давление в ней будет изме-
няться. В этих условиях растворимость
солей в воде можно изучать в интервале
*L. H.Adams. J. Am. Chem. Soc,, 53,
3802 (1931).
** и. П p и г о ж и я, Р. Д е ф э й, Химиче-
ская термодинамика, Изд. «Наука», 1966.
от критической температуры воды до тем-
пературы плавления чистой соли. По виду
зависимости растворимости соли от тем-
пературы диаграммы могут быть разде-
лены на два типа (рис. 3). Первый харак-
теризуется монотонным возрастанием рас-
творимости с ростом температуры; во вто-
ром растворимость с ростом температуры
вначале растет, а затем падает (ретроград-
ная растворимость). Диаграмму первого
типа дает, например, система НаО — КС1,.
диаграмму второго типа — система Н2О—
K3SO4.
Изменение температуры в замкнутом
объеме вызывает и изменение давления
водяного пара. Одновременно будет из-
меняться и концентрация соли в насыщен-
ном растворе. Повышение температуры вы-
зывает повышение давления водяного пара,
а увеличение концентраций соли, напро-
тив, приводит к понижению давления. По-
этому в диаграммах первого типа давление
водяного пара в зависимости от темпера-
туры проходит через максимум. Этот мак-
симум будет наблюдаться и на диаграмме
зависимости давления водяного пара от со-
става системы (рис. 4). Максимальное да-
вление для КС1 — 220 атм. Интересно,
что если увеличить давление водного рас-
твора КС1 выше 220 атм, то при любых
температурах из этого раствора не выде-
лится твердый КС1 ♦. На диаграммах вто-
рого типа, отражающих уменьшение рас-
творимости с повышением температуры,
давление водяного пара растет, прибли-
жаясь к критическому давлению воды при
температуре, также близкдй к критиче-
ской температуре воды.
В диаграммах первого типа концен-
трация соли изменяется в очень широких
пределах.-Если водно-солевой раствор на-
сыщен по твердой фазе, то критические
явления отсутствуют и соль незначительно
растворяется в паре. Напротив, если рас-
твор не насыщен по твердой фазе, то при
достижении определенной температуры и
давления (критической точйи), пар начи-
нает существенно растворять соль.'
* М. И. Равич, Успехи химии, 21, 1104
(1952).
1*
3
Рис. 1.
Рис. 2.
PHC.Jk ...
Часто при высоких температурах и да-
влениях в замкнутом объеме наблюдается
расслоение раствора на две жидкие фазы.
Примером может служить система Н2О —
KCI, %
Рис. 4.
Рис. 5.
Как уже указывалось, диаграмма раство-
римости дает наиболее выразительную ха-
рактеристику системы. Имеющиеся в лите-
ратуре данные для солей со средней и хоро-
шей растворимостью часто позволяют пред-
ставить диаграммы растворимости в пол-
ном виде. Ситуация осложняется в случае
малорастворимых соединений, т. е. соеди-
нений с растворимостью <0,01%. Для них
растворимость часто существенно зависит
от предыстории твердого соединения (осад-
ка) — от способа получения, размера ча-
стиц и т. д. Время установления равнове-
сия между осадком и водным раствором
может быть весьма длительным. Все это
приводит к тому, что данные о малораство-
римых веществах, полученные разными ав-
торами, часто существенно различаются.
Так, растворимость AgCN при комнатной
температуре по данным 4 работ * соответ-
ственно равна 4,24* 10“в, 2,8-10“в, 2,2 X
X 10~® и 7-10"3%. На рис. 5 представле-
ны значение растворимости ВаСО3 в воде,
взятые из 12 работ. Светлые кружки отно-
сятся к наиболее полной и поздней работе**.
Как видим, разброс данных значителен.
Заметим, что встречаются данные, хорошо,
совпадающие друг с другом. Так, раство-
римость AgCl при 25° С по данным 21 ра-
боты колеблется от 1,22* 10-4 до 2,42 X
X 10-4%. Однако таких веществ мало.
В справочнике щэедставлены данные по
растворимости наиболее распространенных
в химической практике неорганических ве-
ществ в воде (двухкомпонентные системы).
При определении понятия двухкомпонент-
ной системы приходится сталкиваться с за-
труднениями, поскольку комплексные со-
единения, в зависймости от их стойкости,
можно рассматривать как двухкомпонент-
ные или трехкомпонентные системы. По-
этому данные по растворимости комплекс-
ных соединений и двойных солей в спра-
вочник не включены. Исключение соста-
вляют кислые соли, некоторые основные
соли, ферро- и феррицианиды.
На рис. 6 приведены элементы, которые
в виде йатионов входят в состав веществ,
рассмотренных в справочнике. В рамку
взяты те элементы, которые исключены из
этого числа, например, справочник не со-
держит данных по растворимости SiCl4,
GeCl4, SiO2, GeO2.
В справочнике не приведены данные
по некоторым анионам. Так, нет данных
по растворимости солей гетерополикислот;
более сложных поливанадатов, чем гекса-
ванадаты; пертанталатов и фтортантала-
тов; более сложных боратов, чем гексабора-
ты; пблисульфидов; тиопроизводных, кро-
ме тиосульфатов (например, Na3PO3S,
K3PO3S); фторпроизводных серы, бора;
фосфора (например, Na3B«O3Fe, KPFei
Na2PO3F).
Поскольку давление, как указывалось
выше, мало изменяет растворимость соли;
данные о зависимости растворимости от
давления не приводятся.
Методы обработки литературных данных
для соединений с хорошей и средней раствор
римостью отличались от методов обработки
данных для соединений малорастворимых;
В случае соединений с хорошей и сред-
ней растворимостью, для которых в ли-
тературе имеется достаточное количество
сопоставимых значений, последние нано-
* L. М о г g a n, Z. phys. Chem., 17, 535
(1895). — К. М a s а к i, Bull. Chem. Soc. Japan*
5, 347 (1930). — W. Bottger, Z. phys. Chem.,
43, 602 (1903), — M. Sato, J. S a t o, J. Elect-
rochem. Soc. japan, 22, 411 (1954).
** J. Fournier, A. V ё d r i n e, С» 1г.»
258, 2069 (1964).
5
Пе- риоды Ряды I II III IV V VI VII VIII 0
1 I Н He
2 II Li Be В C N 0 F Ne
3 III Na Mg Al Si P s Cl Ar
4 IV К Ca Sc Ti V Cr Mn Fe Co Ni
V Си Zn Ga Ge As Se Br Kr
5 VI Rb Sr Y Zr Nb Mo Tc Ru Rh Pd
VII Ag Cd In Sn Sb Те I Xe
6 VIII Cs Ba La* Hf Ta W Re Os Ir Pt
IX Au Hg T1 Pb Bi Po At Rn
7 X Fr Ra Ac ♦* Ku
* Се Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
*★ Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
Рис. 6.
сились на график и по ним проводилась
усредненная кривая. Отдельные, резко вы-
падающие точки не учитывались. Если
данные какой-либо работы существенно от-
личаются от других и не являются доста-
точно полными, то они также не принима-
лись во внимание, что отмечено выраже-
нием «данные ле использованы». Иногда
опубликованных значений по раствори-
мости какой-либо солп очень много и раз-
личий между ними практически нет.
Поэтому при построении диаграммы раство-
римости, как правило, учитывались наи-
более полные и поздние работы. Точки на
диаграммах нанесены только в случаях,
когда трудно провести кривую однозначно.
Иногда растворимость вычисляется из
уравнения, коэффициенты которого опре-
делены нами по литературным данным ме-
тодом усредненной прямой.
Значения растворимости относятся боль-
шей частью к атмосферному давлению. Со-
став и температура кипения насыщенных
растворов также даны для атмосферного
давления. Выражение «растворимость в зам-
кнутом объеме» означает, что давление
водяного пара в системе может превышать
атмосферное. К сожалению, по литератур-
ным источникам не всегда можно устано-
вить, определялась ли растворимость в зам-
кнутом объеме или нёт. Поскольку раство-
римость мало зависит от давления, значе-
ния, полученные при атмосферном давле-
нии и при температуре выше 100° С,
в отдельных случаях для одного и того же
соединения объединялись в одну диаграм-
му с указанием, что она относится к замк-
нутому объему.
Малорастворимые соединения характери-
зуются нами ориентировочными значения-
ми растворимости. Покажем это на приме-
ре упомянутых на стр. 5 солей AgCN и AgCl.
Для AgCN отбрасываем резко отлича-
ющиеся значения, а из близких (4,24 X
X 10~в; 2,8*10—6) находим ориентировоч-
ное (3 • 10~6). Это значение растворимости
представляет собой оценочную величину.
Для AgCl ориентировочное значение рас-
творимости (2-10"4%) найдено как сред-
нее арифметическое из данных 21 работы,
которые мало отличаются друг от друга.
Подобным образом определялись ориен-
тировочные значения растворимости и в дру-
гих случаях, причем предпочтение отда-
валось наименьшему значению. Конечно,
при этом возможны элементы субъекти-
визма. Однако, на наш взгляд, это оправ-
дано, поскольку для практических нужд
такой точности вполне достаточно.
Ориентировочные значения растворимо-
сти относятся, как правило, к комнатной
температуре.
При изложении материала принят сле-
дующий порядок. Справочник содержит
24 раздела. Название раздела определяется
элементом (или элементами), который вхо-
дит в состав аниона. Порядок в располо-
жении разделов соответствует таблице Мен-
делеева. Каждый подраздел содержит дан-
ные по растворимости веществ только с од-
ним анионом. Подраздел начинается с со-
ответствующей кислоты, затем следуют
вещества, для которых имеются наиболее
полные данные по растворимости (диа-
граммы). Далее идут вещества, для кото-
рых отдельные количественные данные све-
дены в таблицы. Актиний и актиноиды рас-
сматриваются среди элементов третьей
группы таблицы Менделеева. Каждый раз-
дел заканчивается ориентировочными зна-
чениями растворимости. В конце справоч-
ника имеется формульный указатель, со-
ставленный по катионам.
В таблицах в графе «Твердая фаза» и на
некоторых рисунках не всегда приведен -
истинный состав молекул вещества. Дело
в том, что по литературным данным
иногда невозможно установить число моле-
кул кристаллизационной воды или ее от-
сутствие. Как правило, такие случаи спе-
циально оговорены.
Концентрация (с) выражена преимуще-
ственно в массовых процентах (%), в от-
дельных случаях — в граммах на литр
раствора (г/л) или в молях на литр раство-
ра (молъ/л). При концентрации меньше •
0,5 г/л данные пересчитывались в массо-
вые проценты без учета плотности, что не
приводит к заметной погрешности. Значе-
ния концентрации приведены в расчете на
безводную соль с точностью не более трех
значащих цифр.
Температура везде выражена в градусах
Цельсия. Численные значения температур
особых точек приведены с точностью до
0,1° С. Комнатной температурой считается
—20°, а температурой холодной воды 0°.
В скобках указаны цифры, получен-
ные либо графической экстраполяцией,
либо снятые с диаграмм нами или авторами
использованных работ.
В списках литературы применялись со-
кращенные обозначения следующих спра-
вочных изданий:
1. Справочник по растворимости
солевых систем
2. Seidell
3. Т immermans
4. G m е 1 1 п
5. Pascal
£. Mellor
Справочник экспериментальных данных по растворимости
солевых систем, сост. А. Б. Здановский и др., Госхимиздат.
A. S е i d е 11, Solubilities of Inorganic and Metalorganic
Compounds, New York.
J. Timmermans, The Physico-chemical Constants of
Binary Systems in Concentrated Solutions, New York —
• London,
G m e 1 i n s Handbuch der anorganischen Chemie, Berlin.
P. P a s с a 1 (Ed.), Nouveau traite de chimie minSrale, Paris.
J. W. Mellor, A Comprehensive Treatise on Inorganic and
Theoretical Chemistry, London.
7
ГАЛОГЕНИДЫ
ФТОРИДЫ
HF
Рис. 7 построен по данным [1—5]. Осо-
бые точки [2]:
t, °C с, %
Лед+ HF-H2O .-71,5 29,1
hf-h2o -34,5 52,7
HF-H.0 4- 2HFH,0 -74,0 69,8
О те те + о Ci « я м —102,5 78,8
4HF-H2O -99,0 81,8
4HFH2O+ HF -110,5 88,а
8
Рис. 8.
Диаграмма кипения водного раствора
HF (рис. 8) построена по данным [6—10].
Данные [8], по-видимому, занижены для
области, богатой водой, включая азеотроп-
ную точку. Азеотропная точка: 114,5°,
38,2% [9].
ЛИТЕРАТУРА
1. G. И. Cady, J. Н. Hildebrand
J. Am. Chem. Soc., 52, 3844 (1930). — 2. S. Pa-
wl e n k о, Z. anorg. Chem., 328, 133 (1964).—
3. E. Pa t e г no, A. Peratone r, Attl Accad.
Line. (4), 6, 308 (1890). — 4. J. D. Anthony,
L. J. H u d d 1 e s t о n, J. Chem. Soc., 127, 1127
(19251.-5. И.В.Тананаев, Изв. СФХА
АН СССР, 14, 365 (1941). — 6. Н. F. Freden-
h a g е n, Е. Kerck, Z. anorg. Chem., 252, 280
(1944). - 7. P. A. Munter, О. ,T. A e p 11,
P. А. К о a s a t z, Ind. Eng. Ohem., 39, 427 (1947);
.41, 1504 (1949).— 8. E. M. Йояякова,
В. С. Я т л о в, Труды УНИХИМ, W I, 68
(1954). — 9. И. С. Н и к о л а е в, Ю.А. Йус-
л а е в, Изв. СФХА АН СССР, 24 , 22 (1954). —
10. R.Vleweg, Chem. Techn., 15, 734 (1963).
Фториды металлов
первой группы и аммония
LiF
По данным [1—5] растворимость LiF
при 0—80° описывается уравнением! с =
= 0,12 + 0,0004*.
Данные [6, 7] не использованы. В работе
[8] изучена область кристаллизации льда
до -0,09°.
Рис. 9 построен по данным [9], получен-
ным в замкнутом объеме. 1
NaF
Рис. 10 построен по данным [10—12].
Данные [13—16] не использованы. Эвтек-
тика: —3,50°, 3,92% [11].
Рис. 11 построен по данным [17], полу-
ченным в замкнутом объеме.
NaF, %
Рис. 11.
.9’
NaHF2
Рис. 12 построен по данным [11, 18].
Эвтектика: —1,5°, 2,36% [18].
KF
Рис. 13 построен по данным [19, 20}.
Данные [21, 22] не использованы. Особые
точки:
Лед +
4- KF 4Н3О
KF-4H2O
KF-4H,O4-
+ KF-2H2O
KF-2H2O4-
+ KF
Рис. 14.
t, °C с, % Источни- ки
—21,5 22,2 20
18,6 (45,0) 19
(17,7) (47,7) 19
(40,2) (58,2) 19
Рис. 14 построен по данным [23], полу-
ченным в замкнутом объеме.
khf2
Рис. 13.
Рис. 15 построен по данным [19] (черные
кружки). Здесь же приведены не совпада-
ющие с ними данные [24] (светлые кружки).
Эвтектика: —7,6°, 16,5% [19].
10
RbF
Рис. 16.
Рис. 16 построен поданным [25, 26]. Особые точки:
Лед+ RbF-4HaO
RbF-4HaO + RbF3HaO
RbF-3HaO + RbF«2HaO
RbF-2HaO+ RbF-l,5HaO
RbF- 1,Я1аО + RbFHaO
RbFHaO + 3RbFHaO
3RbFH.O + RbF
Лед + RbF.3HaO (мет.)
t, ec c, % Источ ники
-47,5 46,0 25
-30 55,4 25
—5,5 65,9 25
5 68,9 25
(48) (79,5) —
68 (80,5) 26
107,5 (81,9) 26
—60 51 25
11
RbHF2
Имеются данные по понижению температуры замерзания растворов до —0,96* [271*
CsF
Рис.
Рис. 17 построен поданным [28]. Особые
точки:
Лед 4- CsF-ЗН-О
CsF-3H2O
CsF-ЗН«О 4- CsF-1,5Н2О
CsF1,5H2O4- CsF.H2O
t, °C
—64
—17,3
—22
35
с, %
57,6
73
77,4
84,6
nh4f
Фтористый аммоний — единственная
соль, которая образует со льдом твердые
растворы; существование последних впер-
вые установлено БриЛлом и Заромбом [29,
30] и в дальнейшем подтверждено при
исследовании диаграммы состояния [31,
32]. На рис. 18 приведена зависимость
равновесного коэффициента распределения
(ко) NH4F от концентрации его в водном
раствора (cL) по данным [33]. Впервые
растворимость в системе NH4F — Н20 изу-
чена Ятловым и Поляковой [34], которые
установили существование NH4F*H2O, но*
не обнаружили твердых растворов льда
с NH4F.
12
Рис. 19.
Рис. 19 построен по данным [32]. Особые
точки:
-t, °C с, %
Эвтектика Е
Точка €
NILF НаО + 4NH4F -Н2О
4NH4F «НаО + NHjF
—28,7
—27,8
—27,3
—26,8
33
38
39,2
39,5
Указывается на существование ниже 0°
других гидратов неопределенного состава
135]-
13
Рис. 20 построен по данным [32], полу-
ченным в замкнутом объеме.
nh4hf2
Рис. 21 построен по данным [34]. Эвтек-
тика: —14,8°, 23,6%.
AgF
Рис. 22.
Рис. 22 построен по данным [36, 37]".
Особые точки [36]:
/, °C с, %
Лед+ AgF-4H2O
AgF-4Н2О + AgF-2Н2О
AgF-2Н2ОAgF
-14,2 37,5
18,7 62,9
39,5 69,а
Рис. 23 построен по данным [38], получен-
ным в замкнутом объеме.
CuF2
Фториды металлов второй группы
Твердая фаза t, °C С, % Источ- ники
CuF2 • ЗН2О 0 4,53 39
CuF2 • ЗН2О 20 4,49 40
CuF2-2H2O 0 3,50 41
CuF2-2H2O 25 3,28 41
ЛИТЕРАТУРА
1. М. A. Carnot, Bull. Soc. chim. France (3),
1, 281 (1889). — 2. К. Fn J a ns, G.Kara-
g u n i s см. K. Meyer. M. Dunkel, Z. phys.
Chem. Bodcnstein-Festband, 556 (1931). —
3. J, H. Payne, J. Am. Chem. Soc., 59, 947
(1937). — 4. И. В. T а н а н a e в, Химия редких
элементов, вып. 1, 33 (1954). —5. М. А. К л о ч ко,
К. Т. Батова, ЖНХ, 5, 2326 (I960).—
6. F. Mylius, R. Funk, Вег., 30, 1718
(1897). — 7. К. Fredenhagen, Z. phys.
Chem., 128, 5 (1927); 164А, 179 (1933). —
8. G. Karagunis, A. Hawkinson,
G. D a m k 6 h 1 e r, Z. phys. Chem., 151A, 464
(1930). — 9. H. S. Booth, R. M. Bidwell,
J. Am. Chbm. Soc., 72, 2567 (1950). — 10.
А. В. Новоселова, ЖОХ, 4, 1207
(1934); 5, 183 (1935).
11. И,* В. Т а н а н а е в,
(1941). — 12. О. И. В о р о б
ЖОХ, Ц,
ь e в а, А. В. H о -
в,
н и D а.
- ? ", ЖНХ, 1,
J. Schairer,
267
v* да« Cl, A. о. Al U —
воселова, А. Г. Жасмин, Ю. П. Сима-
нов, ЖНХ, 1, 518 (1956). — 13. H. Foote,
J. Schairer, J. Am. Chem. Soc., 52, 4207
(1930). — 14. D. B. J e h n u, L. J. Huddle-
ston, J. Chem. Soc., 125, 1455 (1924).—
15. А. К. Ждано в, ЖОХ, 24, 764 (1954). —
16. J. S. M о г г i s о n, A. W. J а с h е, J. Am.
Chem. Soc., 81, 1822 (1959). — 17. M. И. Pa-
в и ч, В. M. В а л я ш к о, ЖНХ, 10, 204 (1965). —
18. Л. П. Белова, Ю. Д. Некрасов,
ЖНХ, 9, 2669 (1964). — 19. В. С. Ятлов
Е. М. Полякова, ЖОХ, 8, 775 (1938).—
20. И. В. Т а н а н а е в, Изв. СФХА АН СССР
14, 350 (1941); ЖПХ, 11, 216 (1938).
21. R. de F о г с г a n d, С. г,, 152.
/ (1911). — 22. A. L a n n u n g " ---
170А, 1" 2?. ”. ... _
М. И. Р а в и ч, ЖНХ, 11, 652
24. А. -А. Чижи к, Труды ГИПХ, вып.
(1946). — 25. R. Cohen-Adad, J.-C, Vo-
u I 1 1 о n, С. г., 257, 2287 (1963). — 26. J.-C. V о -
u 11 lo n, A. S e b a о u n, Bull. Soc. chim. France
1969, 2604. — 27. H. E g g e 1 i n g, J. Meyer’
Z. anorg. Chem., 46, 176 (1905). — 28. R. Co-
hen-Adad, C. Feri in, C. r. 258, 4057
(1964). — 29. R. В r i 1 1, S. Z a r o m b, Nature,
173, 316 (1954). — 30. S. Z а г о m b, R. В r i 1 1
J. Chem. Phys., 24, 895 (1956).
— 22. A. L a n n un g, Z. phys.’ Chem.°
144 (1934). — 23. M. А. Урусова
............ '* (1966).—
37, 87
31. L. С. Labo wit z, Е. F. Westrum
Jr., J. Phys. Chem., 65, 403, 408 (1961).—
32. A. T r a n q u a r d, G. С о f f у, С. r., 270,
416 (1970). — 33. A. H. Киргинцев,
Б. M. Шавине кий, Изв. АН СССР. Сер.
хим., № 1, 1859 (1971). — 34. В С. Ятлов,
Е. М. Полякова, ЖОХ, 15, 724 (1945).—
35. А. Г. Т р е щ о в, Доклады Моск. с.-х. акад,
им. Тимирязева, .вып. 64, 189 (1961). —
36. A. G u n t z, А.-А. Gunt z, Ann. chim. (9),
2 101 (1914). — 37. W. J a h n - H e 1 d, K. J e1-
1 i n e k, Z. Elektrochem„ 42, 608 (1936).—
M. Л. Гавриш, И. С. Г а л и н к e p, -
ЖНХ, 15, 1979 (1970). — 39. А. А. О п а л о в-
С к и й, Й. И. Тюленева, Изв. АН СССР.
Сер. хим., 1969, 268.
40. Н. Wartenberg, Z. anorg. Chem.,
241, 381 (1939). — 41. Д. Алиев, ЖНХ, 15,
889 (1970).
BeF2
Растворимость BeF2 при 25° составляет
846 г!л (равновесие, однако, не было до-
стигнуто) [1]. Имеются данные по пони-
жению температуры замерзания раство-
ров до —10,3° [2].
CaF2
Рис. 24 построен по данным [3], получен-
ным в замкнутом объеме.
SrF2
Растворимость SrF2 в интервале 0—
30° мало зависит от температуры и равна
0,012% [4].
BaF2
Рис. 25.
Растворимость BaF2 в интервале 10—-
30° мало зависит от температуры и равна
0,161% [4].
Рис. 25 построен по данным [3], полу-
ченным в замкнутом объеме.
15.
ZnF2
Растворимость ZnF2*2H2O при 20° со-
ставляет 1,62% [5]. Согласно данным
[6], в твердой фазе при 20° образуется
ZnF2*4H2O, растворимость которого
равна 16,2 г!л^
CdF2
Рис, 26 построен по данным [5, 7].
ЛИТЕРАТУРА
1. R. Н. Lionel, Н. М. Haendler,
J. Phys. Coll. Chem., 52, 819 (1948). —
2. И. В. Тан ан а ев, Э. Н. Дейчман,
Изв. АН СССР, ОХН, 1951, 29. — 3. Н. S. В о -
oth, R. М. Bidwell, J. Am. Chem. Soc.,
72, 2567 (1950).— 4. F. Kohlrausch,
z.phys. chem., 50, 356 (1905); 04, 168 (1908). —
5. и. В. Тан ан а ев, H. В. Б ay со в а,
Химия редких элементов, вып. 2, 30 (1955). —
6. A. Kurtenac ker, W. Finger. Р. Неу,
Z. anorg. Chem., 211, 89 (1933). — 7. Р. N u k а,
Z. anorg. Chem., 180, 235 (1929).
Фториды металлов'
третьей группы
A1F8
Рис. 27 построен по данным [1]. Точка
AlFB’9H#O4-.p-AlF8>3,5H2O находится
при —8°.
16
T1F
Рис. 28.
- Рис. 28 построен по данным [2], полу-
ченным в замкнутом объеме. Особые точки:
t, °с с, %
Лед + ct-TlF I —26,5. I 64,0
a-TlF-f- jj-TlF | 82 | (78,5)
UO.P,
Рис. 29 построен по данным [3—6].
Эвтектика: (—1о°), (64%).
Рис. 30 построен по данным [3], полу-
ченным в замкнутом объеме. Особые точки:
t, °C с, %
•82
a-U0,F««2H,0 +
+ 0-UO,F,-2H2O
0-UO2Fr2HaO +
+ y-UO2F2 '2HjO
150
—240
Температура расслаивания —320°.
Фториды Ga, In, Pu
Твердая фаза
t, °C
с, %
82,5
Источни-
ки
GaF8«3HeO
InF8.3HaO
InF3 • ЗН2О
I11F3 • ЗН2О
InF8-3H2O
InF8-3H2O
PuO2F8-2H,O
25
О
22
22
25
25
20
4,10
4,60
7,83
83,8 г/л
5,80
86,4 г/л
0,13
7
8
9
12
8, 10
12
11
UOxF8, %
Рис. 29.
Рис. 30.
2 Заказ 976
17
ЛИТЕРАТУРА
1. В. С. Я т л о в, Е. Н. Пинаевскйя,
ЖОХ, 18, 27 (1946). — 2. A. Tranquard,
G. С о f f у, M.-J. В о i no n, Bull. Soc. chim.
France, 1969, 2608. — 3. В. L. Marshall,
J. S. G i 1 1, С. H. S e с о y, J., Am. Chem. Soc.,
76, 4279 (1954). — 4. J. S. Johnson,
K. A. Kraus, J. Am. Chem. Soc., 74, 4436
(1952). — 5. L. M. Ferris, J. Chem. Eng.
Data, 5, 241 (1960). — 6. Дж. Кац, E. Раби-
нович, Химия урана, ИЛ, 1954, стр. 303.—
7. И. В. Т а н а н а е в, Н. В. Б а у сова,
Химия редких элементов, вып. 2, 21 (1955). —
8. Э. Н. Дейчман, Ж. А. Брицына,
ЖНХ, 9, 803 (1964).— 9. F. Ensslin,
Н. D г е у е г, Z. anorg. Chem., 249, 119 (1942). —
10. И. В. Т а н а н а е в, Э. Н. Дейчман,
Химия редких элементов, вып. 1, 95 (1954).
И. И. Ф. А л е н ч и к о в а, А. В. Л и п и с,
Н. С. Николаев, Атомная энергия, 10, 592
(1961). — 12. A. Thiel, Z. anorg. Chem., 40,
331 (1904).
Фториды металлов других групп
ZrF4
Растворимость ZrF4 при 25 и 50° равна
соответственно 15 и 13, 9 г/л [1].
CrF3
Рис. 31.
Рис. 31 построен по данным [2]. Твер-
дой фазой в равновесии с раствором яв-
ляется CrF8»3HaO. В работе [3J изучена
область кристаллизации льда до —0,94°.
Растворимость CrF8-6HaO при 20° и
CrF8'9H4O при 0° равна соответственно
4,49 и 0,90% [2].
MnF2 '
Рис. 32, построен по данным [4]. Данные
[5] не использованы. Переходная точка:
23,5° (1%).
NiF2
Растворимость NiFa-4H2O при 10—90°
по данным [6] описывается уравнением:
с = 2,49 4-0,0003*.
Фториды Sn, Pb, Sb, Fe, Со
Твердая фаза t, °C C, % Источни- ки
SnF2 18 29,6 7
PbF2* 10 0,061 8
PbF2* 20 0,065 8
PbF2* 25 0,067 8
PbF2* 30 0,069 8
SbF3 0 79,4 9
SbF3 20 81,6 9
SbF3 22,5 81,9 9
SbF3 25 83,1 9
SbF3 30 84,9 9
FeF3-3HaO 25 5,59 10
CoF2-4H2O 20 1,36 11
* Значения растворимости интерполированы
нами.
ЛИТЕРАТУРА
1. У. Б. Блюменталь, Химия циркония,
ИЛ, 1963, стр. 125. — 2. В. С. Я т л о в,
Е.М. Полякова, Е. П. Подтымченко,
ЖХП, 14, 935 (1937). — 3. А. Сперанский,
ЖРФХО. Ч. хим., 24, 304 (1892). — 4.
И. Г. Р ы с с, Б. С. Витухновская,
ЖОХ, 25, 643 (1955). — 5. Р. N u k a, Z. anorg.
Chem., 180, 235 (1929). — 6. A. Kurtenac-
к е г, w. Finger, F. Н е у, Z. anorg. Chem.,
211, 87 (1933). — 7. И. Г. Р ы с с, Химия фтора
и его неорганических соединений, Госхимиздат,
1956, стр. 319. — 8. F. Kohlrausch,
Z. phys. Chem., 64, 146 (1908). — 9. A. Ro-
senheim, Н. Griinbaum, Z. anorg. Chem.,
61, 187 (1909), — 10. И. В. Тананаев,
Э. H. Дейчман, ЖПХ, 19, 1018 (1946).—
11. И. В. Тананаев, Н. В. Б а у с о в а.
Химия редких элементов, вып. 2, 21 (1955).
'18
ХЛОРИДЫ
НС1
Рис. 33 построен по данным [1—9].
Особые точки:
t, °C С, % Источ- ники
Лед 4- НС1-6Н2О —74,7 23.-0 1
НС1-6Н2О —70 25,0 1
НСЬ6Н8О + + НС1-ЗН2О —73 26,6 1
НС1-ЗН2О —24,9 40,3 7
НС1-ЗНаО + + НС1-2Н2О —27,5 44,0 7
НС1-2Н2О -17,7 50,3 §
НС1-2НгО + + НСЬН2О —23,5 57,3 9
НС1Н2О -15,3 66,5 9
Лед + + НС1-ЗН2О (мет.) —87,5 24,8 1 /
Руперт [9], изучая систему НС1 — Н2О
в запаянных ампулах, установил существо-
вание НС1'Н2О. Когда концентрация НС1
достигала 66,5%, Руперт наблюдал обра-
зование второй жидкой фазы с концентра-
цией НС1 больше 99,9%. На рис. 33 ли-
нии АВ и CD ограничивают область рас-
слаивания. Приведем значения содержа-
ния Н2О на линии CD [7]:
t, °C С, %
Ниже —50 0,008
0,017
От —17 до 0 0,077
Выше 45 0,021
0,052
0,110
0,130
2*
19
Два жидких слоя исчезают при 54,5°
(линия АС). Это обусловлено тем, что
критическая температура НС1 51,4° (при
давлении 81,5 атм). При температуре мень-
ше —15,4° НСЬНоО полностью затверде-
вает (линия BD). Эвтектика НС1-НаО -f-
+ НС1 находится практически у ординаты
кристаллизации чистого НС1 [10].
Рис. 34.
Диаграмма кипения водного раствора
НС1 (рис. 34) построена по данным [И,
12]. Азеотропная точка: 110°, 20,2% [11].
100% НС1 имеет температуру плавления
—111,3°, температуру кипения —84° [10].
Хлориды металлов \
первой группы и аммония
LiCl
Рис. 35 построен по данным [1] с учетом
согласующихся с ними данных [2—8, 12].
Наибольший разброс данных наблюдается
в области эвтектики. Некоторые авторы
считают, что эта температура равна —80°
или ниже [7, 9, 10]. Большинство же по-
лагает, что температура эвтектики близка
к —75°. В работе [11 ] такое расхождение
объясняется сильным переохлаждением ра-
створов в этой области. Особые точки:
t, °C С, % ники
-74,8 25 1
. —65,4 29,2 1
-20,5 37,8 1
19,4 45,2 1
96 56,2 12
-62,9 32,0 1
построена по данным
кипения насыщенного
Лед + LiCl -5НаО
LiCl-5H2O +
+ LiCl-3HaO
LiCl -ЗН8О +
+ LiCl-2HaO
LiCl-2HaO +
4- LiClHaO
LiClHaO+ LiCl
LiCl-5HaO (мет.)
Кривая кипения
[13]. Температура
раствора 168°, концентрация 60,2% [14].
Рис. 36 построен по данным [15], полу-
ченным в замкнутом объеме.
NaCl
Рис. 37 построен по многочисленным
данным, согласующимся между собой [12].
Особые точки:
t, °C с,%
Лед+NaCl • 2Н2О I —21,2 I 23,3
NaCl • 2H2O-f-NaCl | 0,15 | 26,3
Кривая кипения построена по данным
[13]. Температура кипения насыщенного
раствора 108,8°, концентрация 28,9% [44,
16].
Рис. 38 построен по данным [17—21],
полученным в замкнутом объеме.
КС1
ЛИТЕРАТУРА
1. G. Vuillard, Ann. chim. (13), 2, 287
(1957). — 2. F. Rfldorff, Pogg. Ann., |16,
65 (1862). — 3. F. Guthrie, Phil. Mag. (5),
1, 862 (1876). — 4. S. U. P i c k e r 1 r g, Ber.,
26, 280 (1893). — 5. M. R о 1 о f f, Z. phys. Chem.,
18, 576 (1895). — 6. H. C. Jones, Carnegie
Publication, № 60, 93 (1907). — 7. Se i dell,
V. 1, 1958, p. 1110. — I. Mellor, v. 2, 1956,
p. 182, 189. — 9. F. F. Rupert, J. Am. Chem.
Soc., 81, 860 (1909). — 10. А. Г, Коган,
В. И. H и к о л а е в, Изв. АН СССР. Сер. хим.,
1987, 828.
11. Е. Carriere, Arnaud, С. г., 179,
1266 (1924). — 12. Е. В е г 1, Н. Staudin-
ger, Z. angew. Chem., 43, 1021 (1930).
Рис. 39 построен по данным [22—27].
Особые точки [22]:
t, °C с, %
Лед+ КС1Н,0
КС1НаО+ КС1
Лед + КС1 (мет.)
—10,6
-6,6
—10,8
19,7
20,7
19,9
В работе [22] указывается на существо-
вание гидратаг КСЬ хН2О, где х = 1 ч- 1,5.
В более поздней работу [23] установлено
существование моногидрата. Кривая кипе-
ния построена по данным [13]. Темпера-
тура кипения насыщенного раствора 108,5°,
концентрация 36,5% [14, 16].
20
Рис. 41.
Рис. 40.
Рис. 42.
22
Рис. 40 построен по данным [17—19,
28—30), полученным в замкнутом объеме.
RbCl
Рис. 41 построен по данным [31—34].
Эвтектика: —17,0°, 40,2% [34]. Кривая
кипения построена по данным [35] (при
давлении 747,1 мм рт. ст.). Температура
кипения насыщенного раствора 114°, кон-
центрация 59,5% [31J.
CsCl
Рис. 42 построен по данным [31, 33, 34].
Эвтектика: —23,2°, 57,6% [34]. Кривая
кипения построена по данным [35] (при
давлении 746,6 мм рт. ст.). Температура
кипения насыщенного раствора 119,9°,
концентрация 74,4% [36].
NH4C1
Рис. 43.
Рис. 43 построен по данным [37—40].
Эвтектика: —15,2°, 19,7% [40]. Кривая
кипения построена по данным [13].Темпе-
ратура кипения насыщенного раствора
115,8°, концентрация 46,6% [41].
Рис. 44 построен по данным [18], полу-
ченным в замкнутом объеме. Данные [42]
не использованы.
Рис. 45 построен по данным [12, 43—45].
Данные [28, 46J не использованы. Эвтек-
тика: — 40°, 38,5% [12]. Температура
23
кипения насыщенного раствора 115,8°,
концентрация 57,9% [44].
AgCl
Рис. 46.
Рис. 46 построен по данным [47].
Хлориды Си (I) и Au (III)
Твердая фаза t, °C C, % Источ- ники
CuGl 21,5 1,51 48
CuCl 26,5 1,53 48
CuCl 25 1,63 49
АиС1а — 40,5 50
ЛИТЕРАТУРА
1. J. J. Kessis, Bull. Soc. chim. France,
1960 , 2063; 1961, 1503.— 2. J. A. Friend,
A. T. Colley, J. Chem. Soc., 1931, 3148.—
3. M. Applebey, F. Grawford, K. Gor-
do n, J. Chem. Soc., 1934, 1665. — 4. H. Ben-
rath, Z. anorg. Chem.. 220, 145 (1934).—
5. J. A. F r i e n d R. W. H a 1 e, S. E. Ryder
J. Chem. Soc., 1937, 970. — 6. H. E. Moran,
J. Phys. Chem., 60, 1666 (1956).—7. F. A. Schi m-
mel, J. Chem. Eng. Data, 5,
519 (1960). — 8. H. К. Воскресенская,
О. К. Я н а т ь e в а, Изв. АН СССР. Сер. хим.,
1987, 102. — 9. G. Hiittig, W. Steude-
m a n n, Z. phys. Chem., 126, 117 (1927). —
ill. F. D. Snell, CM. [7].
И. E. К. Акопов, ЖНХ, 7, 385 (1962).—
12. Справочник по растворимости солевых систем,
т. 3, 1961; т. 4, 1963. — 13. Т i m m е г m a ns,
v. 3, 1960, р. 614, 306, 478; V. 4. 1960, р. 582. —
14. G. Т. G е г 1 а С h, Chem. Ind., 9, 241 (1886);
Z. anal. Chem., 26, 437 (1887). — 15. M. И. P a-
в и ч, Л. Ф. Ястребова, ЖНХ, 8, 202
(1963).— 16. G. T. Gerlach, Caliche, 8, 298
(1926). — 17. N. В. К e e v i 1, J. Am. Chem.
Soc., 64, 845 (1942). — 18. А. В e n г a t h,
F. G | e de bo, B. Schiffers, H. Wun-
derlich, Z, anorg. Chem., 281, 285 (1937).—
19. E. И. A x у м о в, Б. Б. В а с и и ь е в, ЖХП,.
8, 20 (1931); ЖОХ, 2, 283 (1932); ТрудцЦГИПХ
вып. 16, 52 (1932); Соликамские карнаЗВППЫ,
1935, стр. 102; Изв. СФХА АН СССР, 9, 308
(1936). — 20. W. Schroeder, A. Gabriel,
Е. Partridge, J. Am. Chem. Soc., 57, 1542
(1935).
21. S. Sourirajan, G. C. Kennedy,
Am. J. Sci., 260, 115 (1962). — 22. M. П. Шуль-
гина, О. С. X a p ч у к, О. К. Я н а т ь е в а,
Изв. СФХА АН СССР, 26, 202 (1955). —
23. Я. А. Ф и а л к о в, В. Б. Черного-
ренко, ДАН СССР, 102, 760 (1955).—
24. А. Г. Бергман, Н. А. Власов, ДАН
СССР, 36, 64 (1942).— 25. В. А. Полосин,
Р. К. О золин, ЖОХ, 17, 406 (1947).—
26. В. А. По л осин, М. И. Ша хпа р он о в,
ЖФХ, 13, 542 (1939); 21, 121 (1947).—
27. А. Г. Бергман, А. И. Кузнецова,
ЖНХ, 4, 196, 201 (1959). — 28. А. Е t а г d,
Ann. chim. phys. (7), 2, 531 (1894). — 29. M. В e -
nedict, J. Geology, 47, 268, 276 (1939).—
30. M. И. P а в и ч, Ф. E. Боровая, Изв.
СФХА АН СССР, 20, 173 (1950).
31. Е. Berkeley, Phil. Trans. Roy. Soc.,
203A, 206 (1904). — 32. E. Rimbach, Ber.,
35, 1304 (1902). — 33. E. Mariani, G. di
Giacomo-Dejak, Gazz. chim. ital.._80,
6 (1950). — 34. A. H. К и p г и н ц е в, Б. М. Ша-
вин с к и й, ЖФХ, 42, 2399 (196 8).—
35. J. Y. Buchanan, Trans. Roy. Soc., 29,
529 (1899). — 36. E. Berkeley, M. Apple-
bey, Proc. Roy. Soc., 85A, 502 (1911).—
37. F.Guthrie, Phil. Mag. (5), 1, 359 (1876). —
38. P. A. Meerburg, Z. anorg. Chem., 37, 199
(1903). — 39. W. Ro debus h, J.'Am. Chem.
Soc., 40, 1209 (1918). — 40. В. А. Полосин,
ЖФХ, 20, 1471 (1946).
41. G. J. M u 1 d e r, Arch. Neer., 1, 82 (1866). —
42. F. E. C. Scheffer, Verslag. Kon. Ned.
Akad. Wet., 24, 271 (1915). — 43. О. А. К о с я -
кина, Уч. зап. Ярославского гос. пед. ин-та,
вып. 24, 17 (1958). — 44. A. Chretien,
R. Weil, Bull. Soc. chim. France (5), 2, 1587
(1935). — 45. F. Rfldorff, Pogg. Aim., 116,
70 (1862). — 46. E. В о у e, Z. anorg. Chem.,
215, 79 (1933). — 47. M. Л. Г а в p и ш, И. С. Г а -
линкер, ДАН СССР, 102, 91 (1955); Труды
Харьковского с.-х. ин-та, 35, 48 (1961). —
48. R. Kremann, F. Noss, Monatsh., 33,
1205 (1912). — 49. О. А. Косякина, Докл.
на научн. конф. Ярославского гос. пед. ин-та,
вып. 1, 21 (1962). — 50. L. L i n d е t, Bull. Soc.
chim. France (2), 49, 450 (1888).
Хлориды металлов
второй группы
BeClg
Из водных растворов при подавлении
гидролиз а кристаллизуется В еС1 а • 4Н аО,
значения растворимости которого интер-
полированы нами по данным [1, 2]:
t, °C . c, % t, °C c, %
0 40,6 25 42,9
10 41,5 30 43,3
20 42,4 40 44,3
В работе [3] изучена область кристал-
лизации льда до —1,442°.
24
MgCl2
Рис. 47.
Рис. 47 построен по многочисленным данным, согласующимся между собой [4].
Особые точки:
Лед + MgCla-12H2O
MgCl212H2Ov
MgCla_12HaO 4-a-MgCl2 -8Н-0
a-MgCl2 -8H2O + Mga2 -6Н2О
MgCl2 -6Н2О 4- MgCl2 -4Н2О
MgCl2 -4Н.0 + MgCl2 -2Н2О
MgCl2 12Н2О 4- P-MgCl2 -8Н2О
(мет.)
MgCl2 • 12Н2О 4-MgCl2 • 6Н2О
(мет.)
P-MgCl2 • 8Н2О 4- MgCl2 • 6Н2О
(мет.)
t, °C с, % Источ- ники
(-33,6) (20,6) 5
—16,3 30,6 6
—16,7 32,2 6
-3,4 34,5 7
116,7 46,2 8
181-182 55,8 6
—17,4 32,3 8
—19,4 33,3 8
-9,6 33,9 8
Кривая кипения построена по данным
растврра 193°, концентрация 5i>,6% [10].
[9]. Температура кипения насыщенного
25,
Рис. 48.
Рис. 48 построен по данным [11, 12],
полученным в замкнутом объеме. Данные
[12] при 125—175° не использованы.
Рис. 49 построен по многочисленным дан-
ным [4]. Существенных разногласий в ста-
бильных областях нет.
Особые точки:
t, °C С, % Источ- ники
Лед + + СаС12-6Н2О -49,8 30,5 13
СаС12-6Н2О+ 4- а-СаС12 -4Н.0 29,8 50,2 13
а-СаС12 -4НаО + + СаС12 -2Н2О 45,3 56,5 15
СаС12-2Н2О + -|- СаС12 Н2О 176 75,0 15
Кривая кипения построена по данным
[9]. Температура кипения насыщенного
раствора 178°, концентрация 75,3% [16].
Рис. 50.
Метастабильная чдсть диаграммы (рис. 50)
построена по данным [4, 14, 17, 18]. Осо-
бые точки:
СаС12 • 6Н2О
СаС12-6Н2О +
+ Р-СаС12-4Н2О
СаС12-6Н2О +
+ у-СаС12 -4Н2О
Р-СаС12 -4Н2О +
4- СаС12-2Н2О
v-CaCl2 -4Н2О +
+ СаС12-2Н2О
t, °C С, % Источ- ники
29,9 50,7 14
29,5 52,4 4
29,2 53,0 4
42,0 56,3 4
39 55,8 18
26
Рис. 51 построен по данным [15, 19, 20],
полученным в замкнутом объеме. Точка
СаС12«Н2О + СаС1п находится при —260°
и 77,0% [15].
SrCl2
Рис. 52 построен по данным [21—25].
Данные [26] не
точки:
Рис. 52.
использованы.
Особые
t, °C
-18,7
. 61,3
С, %
26,2
46,7
Источ-
ники
25
23
Лед + SrCl2 -6Н2О
SrCl2-6H2O +
4- SrCl2-2H2O
Кривая кипения
[9]. Температура
раствора 117°, концентрация 52,9% [16].
по данным
построена
кипения насыщенного
Рис. 53 построен по данным [22, 27, 28],
полученным в замкнутом объеме. Особые
точки:
SrCl2-2H2O4-
+ SrCl2 Н2О
SrCl2H2O +
4- SrCl2 0,5Н2О
SrCl2 0,5Н2О +
+ SrCl2
t, °C с, % Источ- ники
134,4 56,1 22
249 (70,2) 27
338 (79,5) 27
ВаС12
Рис. 54.
27
собой [4].
Рис. 54 построен по многочисленным дан-
ным, согласующимся между
Особые точки:
Лед + ВаС12-2Н2О
ВаС12-2Н2О +
+ ВаС12Н2О
Кривая кипения
[9]. Температура
раствора 104,1°, к(
t, °с
-7,6
102,1
Источ-
ники
29
30
23,5
37,5
по данным
построена
кипения насыщенного
концентрация 37,8% [31].
Рис. 55 построен по данным [26, 30, 32,
33]. Особые точки [33]:
BaCLH.O +
+ ВаС120,5Н2О
ВаС12 0,5Н20 + ВаС12
t, °с
209
272
(43,5)
(50)
RaCl2
Растворимость RaCL при 20'
19,7% [34].
Рис. 55.
составляет
Рис. 57.
Рис. 58.
CdCl2
Рис. 56 и 57 построены по данным [35—
37]. Данные [26] не использованы. Особце
точки:
t, ec c, % Источ- ники
Лед 4-ZnCL-4Н2О ZnCl,-4Н2О + 4- ZnCl2-3H2O -62 51,0 36, 37
-30 61,5 36
ZnCl2-3H2O + + ZdC12-2,5H2O ZdC12-2,5H2O —6,5 71,6 36
12,5 75,2 36
ZnCl2-2,5H2O + 4- ZnCl2-l,5H2O 11,5 77,0 36
ZnCl2l,5H.O + + ZnCl2 «H2O ZnCl2HaO+ ZnCl2 ZnCl23H2O + + ZnCl2 1,5H2O (мет.) 26 80,9 36
28 81,3 36
0 75,5 36
ZnCl,-1,5H2O 4" + ZnCL (мет.) ZnCl2-2,5H.O + 4- ZnCl2 H2O (мет.) 26,3 81,2 36
9 78,3 36
Рис. 59.
Кривая кипения
данным [38].
(рис. 58) построена по
Рис. 59 построен по данным [4, 26, 28, Источ- ники
32, 35, 39]. Особые точки: t, °C С, %
Лед 4- CdCl2 -4Н2О -11,5 43,4 28
CdCl,-4Н2О 4- 4- CdCl2 -2,5Н2О CdCL-2,5Н2О 4- 4- CdCl2 Н2О (-5,6) 45,8 39
(33,8) 57,4 39
сас1,-4н2о 4- 4- CdCl2 Н2О (мет.) 12,5 57,4 4
29
Рис. 60.
Рис. 60 построен по данным [28, 40],
полученным в замкнутом объеме. Пере-
ходная точка: 174°, 69% [28].
HgCl2
Рис. 61.
Данные разных авторов по раствори-
мости HgCl2 плохо согласуются между со-
бой [4]. Рис. 61 построен по данным [26,
30]. Данные [41] не использованы. Эвтек-
тика: —0,2°, 3,26% [42]. Кривая кипения
построена по данным [9].
Рис. 62 [построен по данным [40], полу-
ченным в замкнутом объеме.
30
ЛИТЕРАТУРА
1. Б. Н. Л е й к и н а, А. В. Новоселова,
ЖОХ, 7, 241 (1937). — 2. В. П. Б л и д и н,
Изв. АН СССР. ОХН, 1954, 401; ЖНХ, 1, 2095,
(1956). — 3. R. Fricke, Н. Schutzdel-
1 е г, Z. anorg. Chem., 131, 133 (1923). — 4. Спра-
вочник по растворимости солевых систем, т. 4,
1963. — 5. Н. К. Воскресенская,
О. К. Я н а т ь е в а, Изв. АН СССР. Сер. хим.,
1937, 102.— 6. J. Van't Hoff, W. Mey-
er ho f f er, Sitzungsber. preuss. Akad., 1897,
S. 138. Я. Г. Вант-Гофф, Океанические
соляные отложения, Химтеорет, 1936, стр. 3, 6. —
7. А. П. Палкин, Соликамские карналлиты,
ОНТИ, 1935, стр. 69, 74.- 8. Sei de 1, v. 2,
1965, р. 480. — 9. Timmermans, v. 3,
1960. — 10. В. И. Ильинский, А. Ф. Са-
гайдачный, Л. К. Мордберг, Труды
ВНИИГ, 1932.
И. Н. D i е t z е 1, Dissert., Freiberg (Berg-
akagemie) см. [4]. — 12. E. И. Ахумов,
Б. Б. Васильев, ЖОХ, 2, 283 (1932); Труды
ГИПХ, вып. 18, 26 (1933); Соликамские карнал-
литы, ОНТИ, 1935. стр. 102; Изв. СФХА
АН СССР, 9, 308 (1936). — 13. Н. А. В л а с о в,
С. В. О г и е н к о, Изв. Физ.-хим.' ин-та при
Иркутском гос. ун-те, 4, 68 (1959). —
14. F.A. Lidbury, Z. phys. Chem., 39,459
(1902). — 15. G. О. A s s a r s s о n, J. Am.
Chem. Soc., 72, 1435 (1950). — 16. G. T. Ger-
lach, Chem. Ind., 9, 241 (1886); Z. anal. Chem.,
26, 413, 440 (1887). — 17. H. Bassett,
G. Barton, A. Foster, C. Pateman,
J. Chem. Soc., 1933, 161. — 18. И. Г. Д p у ж и -
нин, А. И. Шепелев, ДАН СССР, 72, 703
(1950). — 19. Н. W. Roozeboom, Z. phys.
Chem., 4, 42 (1889). — 20. А. Г. Бергман,
А. И. Кузнецова, ЖНХ, 4, 200 (1959).
21. G. J. Mu 1 der, Bijdragen tot de Geschie-
denis van het Scheikundig Gebonden Water,
Rotterdam, 1864, S. 118, 45. —22. A. W. M e n -
z i e s, J. Am. Chem. Soc., 58, 936 (1936). —
23. G. O. A s s a r s s о n, J. Phys. Chem., 57,
207, 718 (1953>. — 24. F. Rudorff, Pogg.
Ann., 114, 75 (1861); 145, 614 (1872).—
25. В. П. Б л и д и н, С. М. Асланов, ЖНХ, 4,
688 (1959). — 26. А. Е t а г d, Ann. chim.
phys. (7), 2, 535, 557 (1894). — 27. J-J. Kes-
sis, C. r., 264, 2141 (1967). — 28. A. Ben-
rath, Z. anorg. Chem., 247, 149 (1941).—
29. Л. H. У с п e н с к а я, H. П. Г л у ш к о в а,
А. Г. Бергман, ЖОХ, 25, 1660 (1955).—
30. R. D. Eddy, A. W. Menzies, J. Phys.
Chem., 44, 227 (1940).
31. G. J. Mulder, Arch. Norland. Sci.,
1, 84 (1866). — 32. A. В e n r a t h, K. L e c h -
n e r, Z. anorg.’ Chem., 244, 360 (1940).—
33. J.-J. К ess is, C. r., 264, 973 (1967).—
34.0. Erbacher, Ber., 63, 153 (1930).—
35. R. Dietz, Ber., 32, 91 (1899); Wiss. Abh.
phys. techn. Reich., 3, 429, 435 (1900). —
36. F. M у 1 i u s, R. Dietz, Z. anorg. Chem.,
44, 217 (1905). —37. A. B. G a r r e 11, S. A. Woo-
druff, J. Phys. Coll. Chem., 55, 487 (1951). —
38. Г. И. Чуфаров, M. Г. Журавлева,
E. Л. Татиевская, В. Д. Авербух,
В. К. Аптонов, ЖПХ, 26, 652 (1953).—
39. Н. Н е г 1 n g, Ann. chim. (11), 5, 568 (1936), —
40 . А. В е n г a t h, F. G j е d е b о, В. Schi-
ff c rs, II. Wunderlich, Z. anorg. Chem.,
231, 285, 291 (1937).
41. P о g g i a 1 e, Ann. chim. phys. (3), 8,
408 (1 843). — 42. F. Guthrie, Phil. Mag. (4),
49, 269 (1875).
Хлориды металлов
третьей группы
А1С13
Рис. 63.
Рис. 63 построен по данным [12]. Эвтек-
тика: — 55°, 25,3%.
1пС13
Рис. 64 построен по данным [3]. Особые
точки:
/, °C С, %
1пС13-4НаО + + 1пС13-ЗН2О (26) (70,5)
1пС13-ЗН2О + +'1пС13-2,5Н2О (75) (78,5)
1пС13 -2,5Н2О 4- + 1пС13-2Н О (105) (81,3)
Рис. 64.
Т1С1
Рис. 65.
Рис. 65 построен по данным [1].
Рис. 66 построен по данным [4], получен-
ным в замкнутом объеме. Температура рас-
слаивания 360°, концентрация 30—86%.
31
Рис. 66.
YC13
Рис. 67 построен по данным [5] (черные
кружки) и [6] (светлые кружки). Твердой
фазой в равновесии с раствором являются
YC13-6H3O.
LaCl3
На рис. 68 приведены кривые раствори-
мости LaCl3-7HaO поданным [7] (кривая 1)
и [8] (кривая 2), а также ЬаС13’6Н2О по
данным [7]. Данные [7], по-видимому,
наиболее надежны.
Рис. 67.
CeCls, PrCls, NdCls, SmCls, P11O2CI2
На рис. 69 приведены кривые раствори-
мости гидратов СеС13 [9], РгС13 [8], NdCl3
[5, 8] и SmCl3 [5].
Растворимость РиОаС1а-а:Н2О при —20°
составляет около 350 г!л [10].
Хлориды Tl, Sc, Th, U
Твердая фаза t, °C С, % Источ- ники
Т1С18-4НаО Т1С1аН2О ScCl8-6H9O 17 37,6 11
20 35,9 11
25 48;5 12
ThCL 8Н»О ThCI4-8HaO 0 25 55,7 58,0 13 13
ThCl4 • 8НаО 25 55,4 14
UO2C12-3H2O 18 76,2 15
ч
ЛИТЕРАТУРА
1. S e i d e 11, v. 1, 1958, p. 164; v. 2, 1965,
p, 1566. — 2. H. C. J о n e s, F. H. G e t m a n,
Z. phys. Chem., 4», 385, 421 (1904); H. C. To-
nes С. M. Stine, Am. Chem. J., 3», 313
(1908). — 3. F. E n s s 11 n, B. Ziemeck,
L. deSchaepdryver, Z. anorg. Chem..
254, 293 (1947). — 4. А. В e n r a t h, F. G j e -
debo, B. Schiffers, H. Wunderlich,
Z. anorg. Chem., 231, 285 (1937).— 5. M. D. Wil 1 i-
a m s, H. G. Fogg, C. James, J. Am.
Chem. Soc., 47, 297 (1925). — 6. M. C. Crew,
H. E. Steinert, B. S. H o_p kins, J. Phys.
Chem., 2», 34 (1925). — 7. I. E. Powell,
H. R. Burkholder, J. Inorg. Nucl. Chem,
14, 65(1960). — 8. J. A. Fr ien d, R.W.Ha le.
J. Chem. Soc., 1940, 670. — 9. А. Д. Шеве-
лева, P. Л. Богдановская, E. Ф. Жу-
равлев, ЖНХ, 9, 1435 (1964). — 10. Г. С и-
б о р г, Дж. Кац, Актиниды, ИЛ, 1955, стр. 321.
И. Ф. Я. Кульба, В. Е. Миронов,
Химия таллия, Госхимиздат, 1963, стр. 194. —
12. А. П. Самоделов, ЖНХ, 10, 1735
(1965). — 13. Н. Bassett, Н. F. Gordon,
J. Н. Н е п 8 h а 11, J. Chem. Soc., 1937, 971. —
14. В. П. Б л ид ин, ЖНХ, 1, 2828 (1956).—
15. F. М у И U 8, R. Dietz, Вег., 34, 2774
(1901).
Хлориды металлов
четвертой и пятой групп
РЬС1а
Рис. 70 построен по данным [1].
Рис. 71 построен по данным [2], полу-
ченным в замкнутом объеме (см. также
[3]). Температура расслаивания 345°, кон-
центрация 25—76%.
ZrOCI3
Рис. 72 построен по данным [4] (т > и,
х>8). Переходная точка: 70,5е, 60,7%.
SbCle
Растворимость SbCl а при 0—72° по дан-
ным [5] описывается уравнением: с =
« 85,64-0,2*.
3 Заказ 976
33
Хлориды Sn, Pb (I), Hf
Твердая фаза t, °C c, % Источ- ники
SnCl2 0 45,6 1
SnCl2 15 72,7 1
PbCl 25 0,054 1'
HfOCln -8H2O 25 45,6 1
HfOCl2-8H2O 50 48,0 6
ЛИТЕРАТУРА
t. Seidell, v. 2, 1965, p. 1276, 1465.—
2. A. Benra th, F. G je debo, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
231, 285 (1937). — 3. С. Д. Малинин, Гео-
химия, № 1, 57 (1957). — 4. Л. H. Комис-
сарова, В. Е. П л юще в, И. Н. Кремен-
с к а я, ЖНХ, 5, 586 (1960). - 5. J. М. В е m m е-
1 с n Р. A. Meer burg, U. И. N о о d t,
Z. anorg. Chem., 33, 299 (1903), — 6. И. Г. Ка-
ма e в a, В. В. Серебренников, ЖНХ,
12, 3224 (1967).
Хлориды металлов
шестой и седьмой групп
СгС13
Растворимость СгС13-6Н2О при 20 и 80°
составляет соответственно 40,7 и 54,3%
[1]. В работе [2] изучена область кристал-
лизации льда до —33°. О растворимости
других гидратов СгС13 см. [3].
МпС12
Рис. 73 построен по данным [2, 4—7].
Данные [8] не использованы. Особые точки:
t, °C C, % Источ- ники
Лед + + MnCl2 -6H2O -49,1 37,3 7
MnCl2 -6H2O + + MnCl2-4H2O -6,4 (38,5) . 7
MnCl2 -4H2O + + MnCl2-2H2O 58,1 51,4 4,9
МпС12-4Н2О существует, согласно ра-
боте [10J, в виде а- и в-модификаций. Тем-
пература плавления р-МпС12'4Н2О 87,6°.
Рис. 74 построен по данным [4], полу-
ченным в замкнутом объеме. Особые точки:
МпС12 -2Н2О -|-
МпС12Н2О
МпС12Н2О 4- МпС12
Рис. 73.
Рис. 74.
t, °C с, %
198 63,7
362 85,0
34
ЛИТЕРАТУРА
СоС12
1. М. Т. С е р е б р енникова, М. П. Во-
лыни о. Э. В. Лобацевич, ЖПХ, 32,
291 (1959). — 2. Н. С. Jones, Н. Р. Bas-
sett, Am. Chem. J., 33, 534 (1905); 34, 290,
310 (1905); H. C. Jones, Z. phys. Chem., 55,
403 (1906). — 3. J. О 1 i e, Z. anorg, Chem., 51,
29 (1906); 53, 268 (1907). — 4. А. В e n г a t h,
Z. anorg. Chem., 220, 145 (1934); 247, 147 (1941). —•
5. F. R U do r f f, Pogg. Ann., 116, 55 (1862). —
6. H. W. Dawson, P. W i 1 1 i a m s, Z. phys.
Chem., 31, 59 (1899). — 7. А. А. Озеров,
Труды Воронежского ун-та, 28, 24 (1953). —
8. А. Е t а г d, Ann. chim. phys. (7), 2, 503
(1894). — 9. T. W. Richards, F. Wre de,
Z. phys. Chem., 61, 313 (1908). — 10. П. Куз-
нецов, ЖРФХО. Ч. хим., 30, 741 (1898); 41,
353 (1909).
Хлориды металлов
восьмой группы
FeCl2
Рис. 75 построен по данным
[2] не использованы. Особые
[1]. Данные
точки:
Лед+ FeCl2-6H2O
FeCl2-6H2O +
+ FeCl2-4H2O
FeCl2-4H2O +
+ ТеС12 -2Н2О
1, °C С, %
—36,5 30,4
12,3 37,6
76,5 47,4
FeCl8
Рис. 76 построен по данным [3, 4]. Oco-
бые точки: t, °C C, % Ис- ТОЧ- НИ- КИ
Лед 4- 4- FeCl310H2O —35,0 28,7 4
FeCl3 -ЮН2О + + FeCl3-6H2O ’ 0 42,4 4
FeCl3-6H2O 37,0 60,0 3
FeCl3-6H2O + + FeCl3-3,5H2O 27,4 68,4 3
FeCl3-3,5H2O 32,5 71,0 3
FeCl3‘3,5H2O + + FeCl8-2,5H2O 30,0 73,2 3
FeCl3 -2,5HaO 56,0 78,5 3
FeCla -2,5H2O + + FeCl3-2H2O 55,0 78,6 3
FeCl3-2H2O 73,5 81,8 3
FeCl3-2H2O + + FeCl3 66,0 84,0 3
Лед 4- + FeCl8-6H2O (мет.) 55,0 —33,1 3
FeCl3-6H2O+ + FeCl8-2,5H2O (мет.) — 15,0 —70,5 3
Рис. 77 построен по данным [5], полу-
ченным в замкнутом объеме.
>*
I>
Ряд авторов [2, 6—11] признает суще-
ствование СоС12-6Н2О, СоС12-2Н2О
и СоС12*Н2О, находящихся в равновесии
с насыщенным раствором. Некоторые ав-
торы [12—14] называют СоС12- 4Н2О и дру-
гие гидраты.
Рис. 78 построен по данным [7, И].
Особые точки: 1, °C с, % Источ- ники
Лед + —27,3 26 7, 11
+ СоС12-6Н2О СоС12-6Н2О + 51,3 47,9 • 11
+ СоС12-2Н2О Лед 4- —47,8 (31,5) 11
+ СоС129Н2О (мет.) Перитектика (мет.) —42 (32) 11
Кривая кипения построена по данным
[11]. Температура кипения насыщенною
раствора 120,2°, концентрация 53,7% [11].
Рис. 79 построен по данным [7], полу-
ченным в замкнутом объеме. Особые точки:
t, °C с, %
СоС12-2Н2О + + СоС12Н2О 206,1 (63,5)
СоС12 -Н2О СоС12 NiCl2 335 (72,5)
Рис. 80 построен по данным [15—18].
Существование NiCl2-7H2O, установлен-
ное в работе [18], не подтверждено в ра-
боте [15]. Особые точки:
t, °C c, % Источ- ники
Лед + 4- NiCl2-6H2O -53,4 33,0 15
NiCl2-6H2O4- 4-NiCl2-4H2O 28,8 41,6 18
NiClo-4H20 4- 4- NiCl2-2H2O 64,3 46,1 18
Температура кипения насыщенного рас-
твора 117,9°, концентрация 46,9% [18].
PtCl4 [19]
t, °C C, % 1 Число молей воды на 1 молъ твердой фазы
0 40,0 7,69
25 58,7 —
40 62,4 4,74
50 69,0 —
60 74,0 3,49
70 74,7 —
80 78,6 3,04
90 82,5 —
98 85,1 —
В работе [20] изучена область кристал-
лизации льда до —4,2°.
35
Рис. 78.
Рис. 80.
Рис. 79.
ЛИТЕРАТУРА
1. F. Schimmel, Z. anorg. Chem., 176,
285 (1928); G. A g d e, F. S c h 1 m m e 1, Z. anorg.
Chem., 173, 111 (1928). — 2. A. E t a r d, Ann.
chim. phys. (7), 2, 503, 537 (1894). —
3. H. w. B. Ro о ze boom, Z. phys. Chem.,
10. 477 (1892). — 4. W. F. Linke, J. Phys, Chem.,
60, 91 (1956). — 5. H. Schiffer, Z. anorg.
Chem., 260, 127 (1949). — 6. H. P. Bassett,
J. Sanderson, J. Chem. Soc., 1932, 1885.—
7. R. С о h e n - A d ad, A. Tranquard,
A, Marchand, Bull. Soc. chim. France,
1968, 65. — 8. А. Л. Поты л и цын, ЖРФХО,
Ч. хим., 16, 206 (1884); Вег., 17, 277 (1884). —
9. А. Hantzsch, Z. anorg. Chem., 159, 273
(1927). — 10. И. И. Ангелов, Н. И. С о к о -
л о в, / Трудвд ВНИИ хим. реактивов, вып. 20,
193 (1951).
И. R. Cohen-Ada d, J. Said, M.-T. S a u -
g i e r, A. S e b а о u n, C. r., 267, 962 (1968). —
12. A. Be nr a th, Z. anorg. Chem., 220, 142
(1934). —13. C. D u V a 1, С. r., 200, 934 (1935). —
14. L. J. К a t z i n, J. R. Ferraro, J. Am.
Chem. Soc., 74, 2752 (1952). — 15. A. A. О ae -
p о в, Труды Воронежского ун-та, 57, И (1959). —
16. Н. С. Jones, Н. Р. Basse tt. Am. Chem.
. J., 38, 534 (1905); H. C. Jones, F. H. Get-
man,-.Am. Chem. J., 31, 303 (1904).—
17. F.Rttdorff, Pogg. Ann., 145, 599 (1872). —
18. E. В о у e, Z. anorg. Chem.. 216, 29 (1933). —
19. H. С. К у p н а к о в,Е. А.Никитина,
ЖОХ, 10, 577 (1940). — 20. H.ClKy рнаков,
M. И. Равин, ИзП. Ин-та физ.-хим. анализа,
/ . 7, 230 (1935).
37
БРОМИДЫ
НВг
Рис. 81.
Рис. 81 построен по данным [1—5].
Виллардом [5] установлено образование
НВг-6Н2О. Особые точки [5]:
t, °C С, %
Лед + НВг-6Н2О —89,6 39,4
НВг 6Н2О + 4- НВг-4НаО —88,2 ±1 39,8
ИВг-4Н2О —57,9 52,9
НВг-4Н2О + + НВгЗЩО —58,2 53,1
НВг-ЗНаО —49,6' 60,0
НВг-ЗН2О + + НВг-2НаО —50 60,4
НВг-2НаО —11,3 69,2
НВг-2НаО+НВгНаО —15,5 * 73,3
Лед+ НВг-4НаО (мет.) * При 2,5 атм [1]. —90 39,5
Аналогично системе HCL — Н2О в си-
стеме НВг — Н2О при концентрации НВг
выше 80% и температуре выше —3,3°
Рис. 82.
в замкнутом объеме наблюдается образо-
вание двух жидких слоев. Из-за отсут-
ствия экспериментальных данных линии
АВ и CD даны приблизительно. Эвтектика
НВг-Н2О -]- НВг находится практически
$ ординаты НВг [6].
38
Рис. 82 построен по данным [7]. Данные
[1] не использованы. Азеотропная точка:
126°, 47,5%. 100% НВт имеет температуру
плавления —87°, температуру кипения
—66,8°.
ЛИТЕРАТУРА
1. И. W. Roozeboom, Rec. trav. chim.,
4, 103 (1885); Z. phys. Chem., 2, 454 (1888). —
2. S. U. Pickering, Phil. Mag. (5), 36, 119
(1893). — 3. H. C. Jones, Carnegie Publica-
tion, № 60, 95 (1907). — 4. K. Jablczyn-
s k i, A. Balczewski, Roczn. Chem., 12,
881 (1932). — 5. G. Vuillard, C. r., 24 6,
3252 (1958). — 6. P a s с a 1, t. 16, i960, p. 389. —
7. E. Carr i 4re, Cerveau, C. r., 177, 47 (1923),
Особые точки [1]:
t, °C C, %
Лед+ LiBr-5H2O —67,5 39,1
LiBr-5H2O + + LiBr-3H2O —51,2 47,5
LiBr-3H2O + + LiBr-2H2O 2,9 58,2
LiBr-2H2O + + LiBrH2O 42,8 64,7
LiBr-H2O + LiBr 156 80,5
LiBr • 5H2O (мет.) —49,5 49,1
По данным [1] моногидрат существует
в двух формах: а- и 0-. Точка а-LiBr • Н2О-[-
+0-LiBr-Н2О находитсяпри 33,0°, 82,8%.
Бромиды металлов
первой ^группы и аммония
LiBr
Рис. 83 построен по данным [1—5]. Дан-
ные [6, 7] не использованы.
39
NaBr
Рис. 84 построен по многочисленным дан-
ным, согласующимся между собой [9].
Особые точки [10]:
t, °C с, %
Лед + NaBr-5H2O
NaBr-5H2O +
+ NaBr-2HjjO
NaBr-2H2O + NaBr
Кривая кипения построена по данным
[8]. Температура кипения насыщенного
раствора 121° [11] или 120,1° [12].
Рис. 85 построен по данным [13—15],
полученным в замкнутом объеме.
КВг
—28,2
-23,8
50,2
40,3
41,2
53,4
Рис. 86 Построен по многочисленным дан-
ным, согласующимся между собой [9].
Эвтектика: —13,0°,. 32,0% [16]. Кривая
кипения построена по данным [8]. Темпе-
ратура кипения насыщенного раствора
112° [И].
Рис. 87 построен по данным [14, 17],
полученным в замкнутом объеме.
40
RbBr
Рис. 88.
NH4Br
NH4Br. %
Рис. 88 построен по данным [18].
СаВг
Рис. 89.
РиС. 89 построен по данным [4, 19]. Эв-
тектика: (—8,7°), (40%).
Рис. 90.
Рис. 90 построен по данным [20, 21].
Эвтектика: —17°, 32,1% [20J. Кривая
кипения построена по данным [8].
Рис. 91 построен по данным [17, 20, 22],
полученным в замкнутом объеме. Темпе-
ратура полиморфного превращения NH4Br
137,4°, концентрация (64,5%) [22].
CuBr
Рис^ 92 построен по данным [23], полу-
ченным в замкнутом объеме.
41
Рис. 92,
CuBr2
Рис. 93 построен по данным [24]. Пере-
ходная точка: 18,0°, 55,9%. В работе [25]
изучена область кристаллизации льда до
-3,54°.
Рис. 93.
ЛИТЕРАТУР-А
1. J.-J. Kessis, Bull. Soc. chim. France, ,
1965, 48. — 2. J. R. H e i k s, A. В. G a r r e t t,
J. Am. Chem. Soc., 76, 2587 (1954). — 3. H.C. Jo-
nes, F. H. G.etman, Z. phys. Chem., 49, 390
(1904); Carnegie Publication, № 60, 31. 34, 4 3
(1907).— 4. G. Damkohler. J. Wein-
zierl, Z. phys. Chem., 167A, 80, 86 (1933). —
5. P a s с a 1, t. 2, f. 1, 1966, p. 73. — 6. P.Kre-
m e r s, Pogg. Ann., 103, 65 (1858). — 7. G.H fl t-
t i g, F. Reuscher, Z. anorg. Chem., 137,
177 (1924); G. Huttig, W. S t e u d e m a n n,
Z. phys. Chem., 126, 10 5 (1927). — 8. Timmer-
mans, v. 3, 1960; v. 4, 1960. — 9. Справочник
по растворимости солевых систем, т. 3. 1961. —
10. Н. А. Власов, А. Г. Бергман, ДАН
СССР, 38, 194 (1943); Изв. СФХА АН СССР, 17,
319 (1949); 18, 203 (1949).
И. Р. К г е me г s, Pogg. Ann., 97, 14 (1856). —
12. Е. С о г п е с, Р. Klug, Bull. Soc. chim.
France (4), 41, 1016 (1927). —13. Г. К. Д и с т а -
нов, ЖОХ, 7, 677 (1937). — 14. А. Е t а г d,
Ann. chim. phys. (7), 2, 503, 541 (1894); С. г., 98,
1432 (1884). — 15. N. В. К е е v i 1, J. Am.
Chem. Soc., 64, 845 (1942). — 16. F. Guthrie,
Phil. Mag. (5), 1, 363 (1876). — 17. A; Ben-
rath, F. Gjedebo, B. Schiffers,
H. Wunderlich, Z. anorg. Chem., 231,
289 (1937). — 18. E. Rimbach, Ber., 38,
1557 (1905). —19. Р.Г.Самусева, P.C.Ero-
p о в а, В. E. П л ю щ e в, JRHX, 7 1666 (1962). —
20. A. Smith, H. E. Eastlack, J. Am.
Chem. Soc., 38, 1261 (1916).
21. J. M. Eder, Monatsh., 1, 948 (1880).—
22. F. E. S c h e f f e r, Verslag. Kon. Ned. Akad.
Wet., 25, 762 (1916). — 23. M. Л. Гавриш,
И. С. Г а л и и к е р, ДАН СССР, 102, 89 (1955);
Труды Харьковского с.-х. ин-та, 35, 48 (1961). —
24. S. R. Carter, N. J. М е g s о n, J. Chem.
Soc., 1928, 2954. — 25. W. Hi 11 г, Z. phys.
Chem., 40, 201 (1902).
Бромиды металлов
второй группы
AgBr
0,010 0,015 0,020 0,025
AgBr, %
Рис. 94.
MgBr2
Рис. 95.
Рис. 94 построен по данным [23]; полу-
ченным в замкнутом объеме.
42
Рис. 95 построен по данным [1—4]. Дан-
ные [5] ие использованы. Особые точки [4]:
Лед + MgBr2 ЮН2О
MgBr210H2O4-
+ MgBr26H2O
t, °C с, %
44,0
10,5
36,8
49,7
Температура плавления MgBr2-6H2O
164° [2] или 172,4° [3].
СаВг2
Рис. 96 построен по данным [1, 6]. Дан-
ные [7] не использованы. Эвтектика:
—83,0°, 46,5% [6]. В работах [7, 8] отме-
чено образование СаВг2-4Н2О. Точка
СаВг2-6Ы2О + СаВг2»4Н2О находится
при 34,2° [7] или 55° [8]. Температура
плавления СаВг2-6Н2О 34,2° [9]. Кривая
кипения построена по данным [10]. Тем-
пература кипения насыщенного раствора
149—150° [9].
Рис. 96.
SrBr2
Рис. 97 построен по многочисленным
данным, согласующимся между собой [11].
Особые точки:
Лед 4* t, °C 28 С, % 41,7 Источ- ники 12
4- SrBr2 -6H2O SrBr2-6H2O + 4-SrBr2 • Н2О 88,0 (68) 13,
Кривая кипения построена по данным
[Ю].
Рис. 98 построен по данным [14], полу-
ченным в замкнутом объеме. Переходная
точка: 345°, 92,4%.
43
Рис. 100.
Рис. 99 построен по данным [1, 5, 12,
14]. Данные [7] не использованы. По дан-
ным [15] твердой фазой в равновесии с рас-
твором при 25 и 35° является ВаВг2« 4Н2О.
Эвтектика: —22,6°, 46,6% [12, 14]. Кривая
кипения построена по данным [10]. Тем-
пература кипения насыщенного раствора
113° [7].
Рис. 100 построен по данным [14], по-
лученным В замкнутом объеме. Данные
[5] не испЬльзовдны. Особые точки:
Рис. 101.
ВаВг2 -2НвО + ВаВг2 «Н2О
ВаВг2 Н2О + ВаВг2
t, °с
113
350
С, %
58,5
83,0
RaBr2
, Растворимость RaBr„ при 20° составляет
41,4% [16].
ZnBr2
Рис. 101 построен по данным [17, 18].
Данные [5] не использованы. Особые точки:
ZnBr2-3H2O +
4- ZnBr2-2H2O
ZnBr»-2НаО +
+ ZhBr2
ZnBr2-3H2O (мет.)
44
t, °C с, % ники
-7 (-8) (79,3) 17
35 (85,5) 18
—5 80,6 17
CdBr2
Рис; 102.
Рис. 102 построен по данным [5, 14, 17,
19, 20]. Особые точки:
Лед +
+ CdBr2-4H2O
CdBr2-4H2O +
-I- CdBr2
1, °C с, %
—4,4 33,2
36 60,3
Источ-
ники
14
14, 19
Рис. 105.
Рис. 103 построен по данным [14, 21],
полученным в замкнутом объеме. Данные
[5] не использованы.
HgBr2
Рис. 104.
Рис. 104 построен по данным [22].
Рис. 105 построен по данным [21], полу-
ченным в замкнутом объеме.
ЛИТЕРАТУРА
1. Н. С. Jones, F. Н. Getman, Z. phys.
Chem., 49, 385 (1904); 55, 385 (1906). —
2. Б. Н. Меншуткин, Z. anorg. Chem., 52,
153 (1907). — 3. F. И. Getman, Rec. trav.
chim., 54, 866 (1935); 57, 849 (1938). —
4. J, R. H e i ks, A. B. G а г re 11, J. Am. Chem.
Soc., 76, 2587 (1954). — 5. A. Etard, Ann.
chim, phys. (7), 2, 541 (1894). — 6, F. Rakow-
sky, A. B. Garrett, J. Electrochem. Soc.,
101, 117 (1954). — 7. P. Kremers, Pogg.
Ann., 103, 65 (1858); 99, 43, 47 (1856).—
8. П. И. Кузнецов, ЖРФХО. Ч. хим., 41,
367 (1909). — 9. E. Любарский, ЖРФХО.
Ч. хим., 28, 460 (1896). — 10. S. М. John-
ston, Proc. Roy. Soc., 45, 193, 855 (1906).
И. Справочник по растворимости солевых си-
стем, т. 4, 1963. — 12. J. М i 1 i k a n, Z. phys.
Chem., 92, 59, 78 (1918). — 13. E. M. С о 1 1 i n s,
A. W. Menzies, J. Phys. Chem., 40, 390
(1936). — 14. А. Benratn, K. Lechner,
Z. anorg. Chem., 244, 361 (1940); 247, 152 (1941). —
15. В. П. Б л и д и н, Сборник статей по общей
химии, Изд. АН СССР, т. 1, 1953, стр. 88. —
16. О. Erbacher, Вег., 63, 152, 155 (1930). —
17. R. Dietz, Вег., 32, 93 (1899); Wiss. Abh.
Phys. Techn. Reich., 3, 431, 434 (1900). —
18. F. Ishikawa, G. Kimura, T. Mu-
ro о k a, Sci. Rep. T6hoku Imp. Univ., 21, 474
(1932). — 19. F. Ishikawa, Y. Ueda, Sei.
Rep. TOhoku Imp. Univ., 22, 270 (1933). —
20. H. H e r i n g, Ann. chim. (11), 5, 572 (1936).
21. A. Benra t h, F. G je de bo, B. 8c hif '
fers, H. Wunderlich, Z. anorg. Chem.,
231, 291 (1937). — 22. S e i d e 11, v. 1, 1958.
p. 1180.
Бромиды металлов
третьей и четвертой групп
1пВгз
Рис. 106 построен поданным [1]. Особые
точки:
1, °C С, %
1пВг3-5Н2О + + 1пВг3-2Н2О (22) (85,1)
1пВг3-2Н2О+ 1пВг3 (34,5) (85,2)
45
Рис. 106.
TlBr
Рис. 107 построен по данным [2].
Рис. 108 построен по данным [3], полу-
ченным в замкнутом объеме.
Рис. 107.
YBr3
Рис. 109.
Рис. 109 построен по данным [4]. По-
видимому, представлена растворимость гек-
сагидрата.
Рис. 108.
Рис. 110.
Рис. 110 построен по данным [5].
46
PbBra
Рис. Ill построен по данным [6].
Рис. 112 построен по данным [3], получен-
ным в замкнутом объеме. Температура рас-
слаивания 302°, концентрация 39—80%
РЬВг2.
РЬВг2, %
Рис. 112.
Бромиды Th, Sn, Pb
Твердая фаза 1, °C С, % Источни- ки
ThBr4 • 4Н2О 20 37,4 7
SnBr2 0 46,0 7
» 100 69,0 7
РЬВг 25 0,012 2
ЛИТЕРАТУРА
1. F. Enssliri, В. Ziemeck, L. Scha-
ep dry ver, Z. anorg. Chem., 254, 293 (1947). —
2. S e i d e 1 1, v. 2, 1965, p. 1554, 1250.—
3. A. Benrath, F. Gjedebo, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
231, 285 (1937). — 4. M. С. С r e w, H. E. Stei-
nert, В . S. H о p k i n s, J. Phys. Chem., 29,
34 (1925). — 5. Timmermans^ v. 3, I960,
p. 1005.—’6. D. M. Lichty, J. Am. Chem.
Soc., 25, 474 (1903). — 7. Справочник химика,
изд. 2-е, т. II.
Бромиды металлов
седьмой и восьмой групп
МпВг2
Рис. ИЗ.
Рис. 113 построен по данным [1]. Пере-
ходная точка: (75°), (69%). В литературе
имеются следующие данные: 70—80° [1],
64,3° [2].
FeBr2
Рис. 114 построен'по данным [1, 3].
Особые точки [3]:
t, °C с, %
Лед-|- FeBr2-9H2O —43,6 42,3
FeBr2 -9Н2О +FeBr2 -6Н2О -29,3 47,7
FeBr2-6Н2О + FeBr2-4H2O 49 58,5
FeBr2 -4Н2О + FeBr2 -2Н2О 83 63,3
Температура кипения насыщенного рас-
твора 132°, концентрация 70,2% [3].
47
t,°c
FeBr3
Рис. 115 построен по данным [4]. Эвтек-
тика: —52°, 45,2%. Растворимость
FeBr8’2HaO при 25° составляет 82% [4].
СоВг2
Рис. 116 построен по данным [5, 6].
Особые точки [5]:
t, ес
Лед 4- СоВг» а:Н2О —44,9
СоВга-6Н2О + СоВг2-4Н2О 43,6
СоВг2 4Н2О4- СоВг2-2Н2О 62
С, %
41,2
64,5
69,5
48
Температура кипения насыщенного рас-
твора 143°, концентрация 74,2% [5],
Рис. 117 построен по данным [5], полу-
ченным в замкнутом объеме. Особые точки:
t, °G с, %
СоВг2-2Н.О + СоВг2Н2О 1 160 I 75,3
СоВг2 Н2О + СоВг2 | 238 | 81,0
NiBr2
На рис. 118 приведена растворимость
NiBr2-6ll2O 1Ц.
PtBr4
Растворимость PtBr4 при 20° соста-
вляет 0,41% [7].
ЛИТЕ РАТУРА
1. A. Etard, Ann. chim. phys. (7), 2, 503
(1894). — 2. П. И. Кузнецов, ЖРФХО.
Ч. хим., 29, 331 (1897); 41, 353 (1909).—
3. F. Schimmel, Вег., 82, 963 (1929).—
4. В. П. Ильинский, А. Т. У в е р с к а я,
Сб. трудов ГИПХ, вып. 41, 112 ,(1958). —
5. R. Cohen-Ada d, М.-Т. S a u g i е г,
В. В о i п о n, М. R i v i 6 г е, С. г., 268, 1683
(1969). — 6. A. Benrath, В. Schiffers.
Z. anorg. Chem., 240, 67 (1938). - 7. W. Hal-
berstadt, Ber., 17, 2965 (1884).
ИОДИДЫ
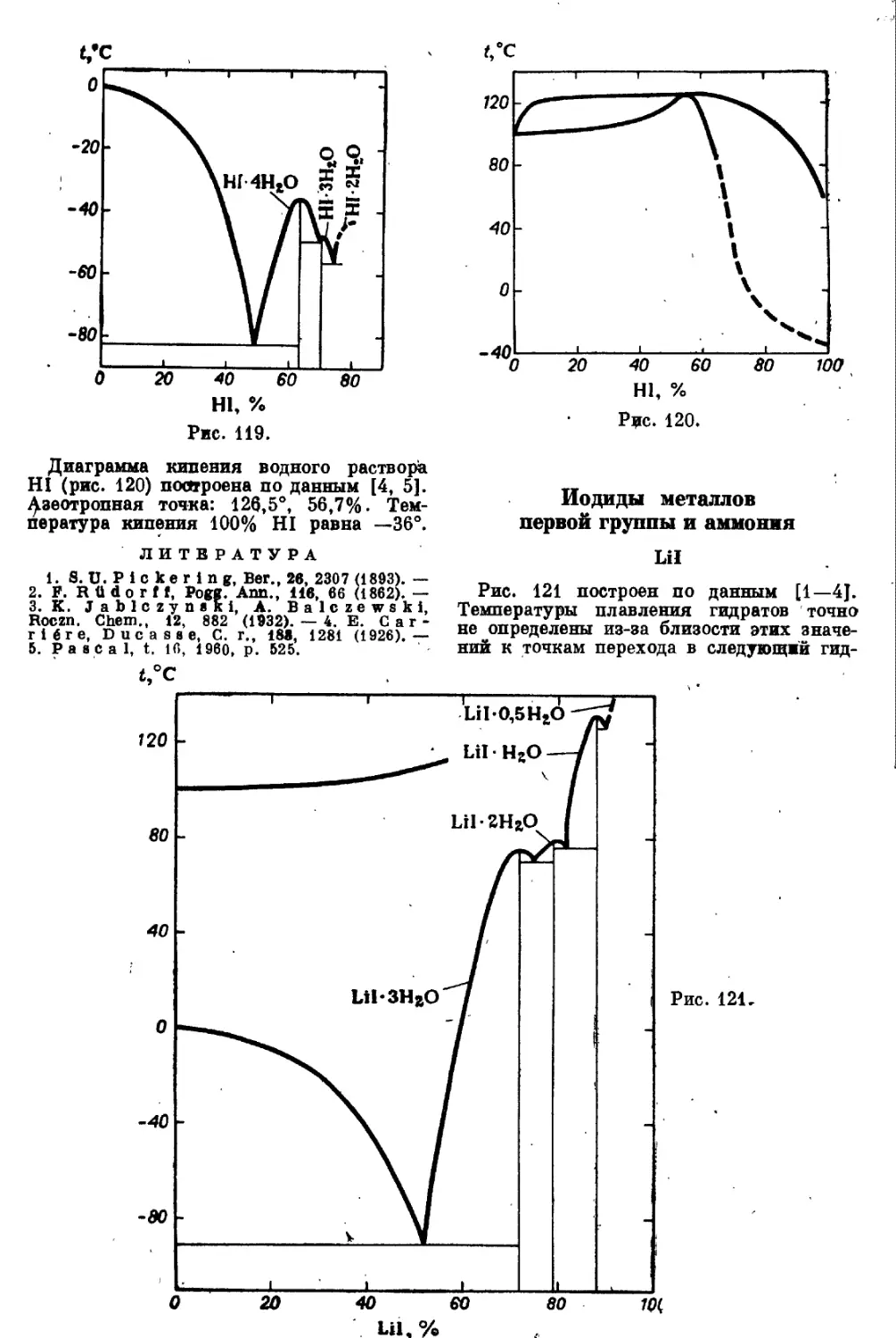
< HI
Рис. 119 построен по данным [1] и от-
дельным значениям работ [2, 3]. Особые
точки [1]:
t, °C С. %
Лед + Н1-4Н2О (—82,4) 48,5
HI-4Н2О (-35,5) 64,0
Н1-4Н2О + НЬЗНоО -49,0 66,3
Н1-ЗН2О -48 70,3
HI -ЗН2О 4- HI 2Н2О —56 74,0
Н1-2НоО (-43) (80)
4 .Заказ 976
49
Рис. 119.
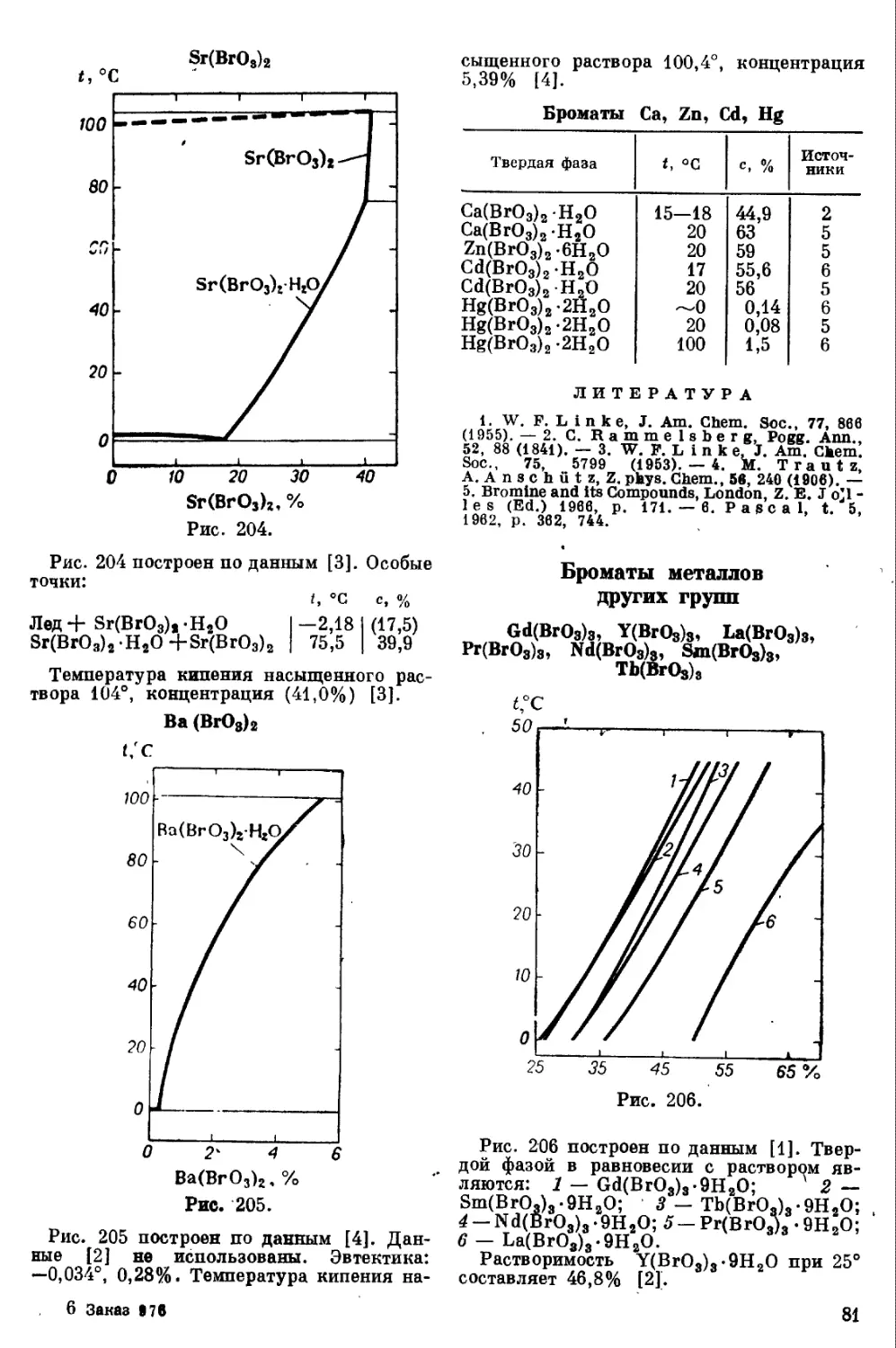
Диаграмма кипения водного раствора
HI (рис. 120) построена по данным [4, 5].
Дзеотропная точка: 126,5°, 56,7%. Тем-
пература кипения 100% HI равна —36°.
ЛИТЕРАТУРА
1. S. U. Р 1 с ke г 1 ng, Вег., 26, 2307 (1893). —
2. F. R й d о г f f, Pogg. Ann., lie, 66 (1862). —
3. К. Jablczynaki, A. Balczewskl,
Roczn. Chem., 12, 882 (1932). — 4. E. Car-
r 1 6 г e, Due a see, C. r., 188, 1281 (1926).—
5. Pascal, t. 10, I960, p. 525.
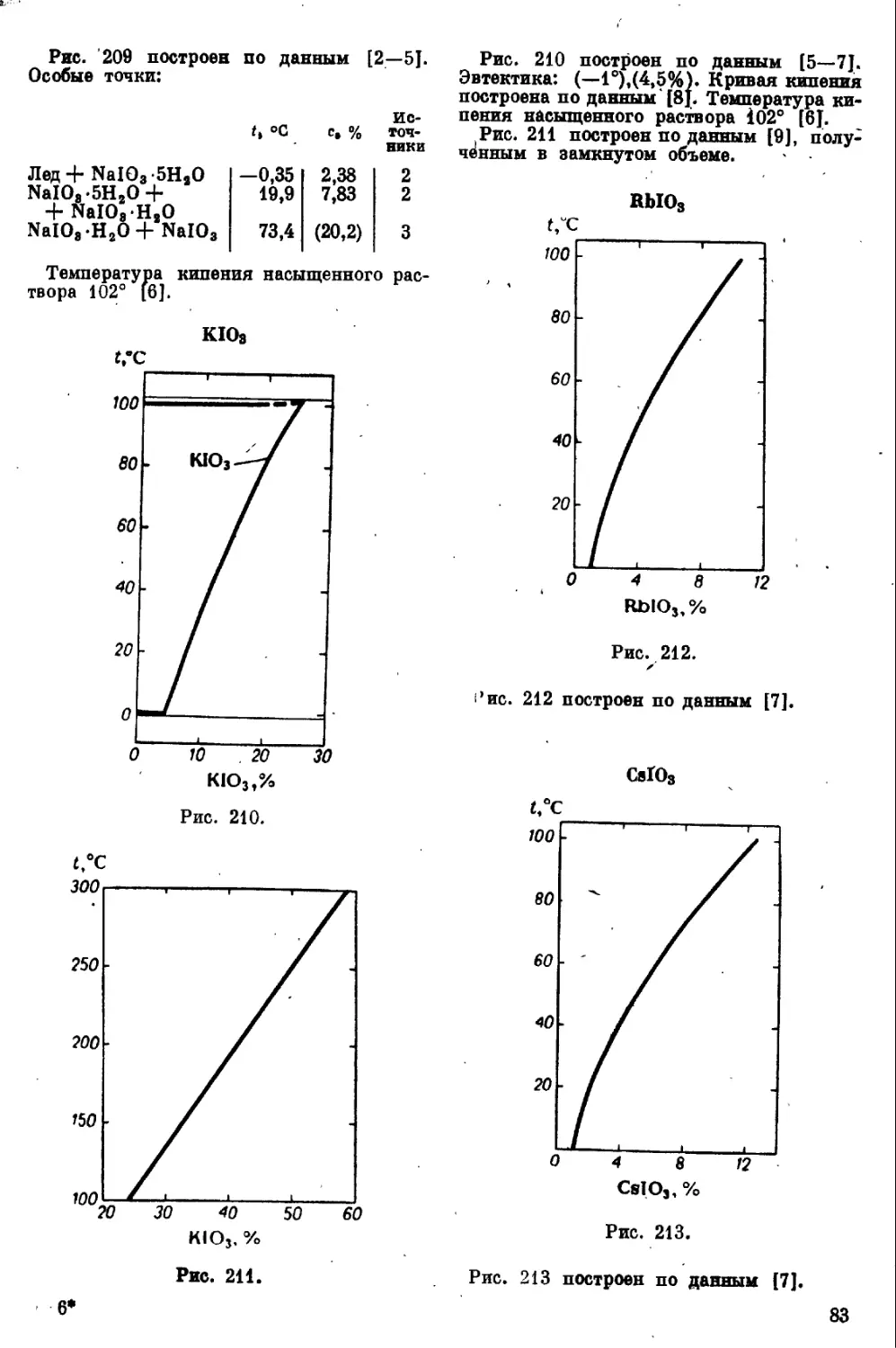
Йодиды металлов
первой группы и аммония
Lil
Рис. 121 построен по данным [1—4J.
Температуры плавления гидратов точно
не определены из-за близости этих значе-
ний к точкам перехода в следующий гид-
рат. Особые точки (эвтектика по 14], остальные — по данным [3]): данным
t, °C C, %
Лед + Lil -ЗН.0 -91 51,7
Ь1ЬЗН2О ^75 (71,3)
UI-3H.0 + + Lil 2Н2О 70,5 74,8
Lil -2Н2О 79 78,8
LiI2H«O + + LiIH2O 77 81,4
LiIH2O ^130-131 88,1
LiIH2O + + Lil 0,5H2O <C130 89,2
Кривая кипения построена по данным [5].
Nal
Рис. 122.
Рис. 123.
Рис. 122 построен по многочисленным
данным, согласующимся между собой [6].
Особые точки: ’
t, °C c, %
ЛеД + -31,5 47,1
+ NaI-5H2O Nal 5H2O + -13,5 60,2
+ NaI-2HaO NaI-2H2O+ Nal 68,0 74,8
Источ-
ники
7
8
7
В работе [9] отмечено образование мета-
стабильного гидрата неизвестного состава
и указано, что точка NaI-xH20 + Nal
находится при 60°, 74,5%. Кривая кипе-
ния построена по данным [5]. Температура
кипения насыщенного раствора 141° [10,
11].
Рис. 123 построен по данным [12], полу-
ченным в замкнутом объеме. Данные [9]
Не использованы.
KI
Рис. 124 построен по многочисленным
данным, согласующимся между собой [6].
Эвтектика: —23,1°, 52,2% [13]. Кривая
кипения построена по данным [5]. Темпе-
ратура кипения насыщенного раствора
118,5°, концентрация 68,8% [11].
51
4*
Рис. 125 построен по данным [12, 14—
16], полученным в замкнутом объеме.
Сз1
Рис. 127 построен по данным [18]. Дан-
ные [19] не использованы. Эвтектика:
—4,0°, 27,5% [18]. Кривая кипения по-
строена по данным [18]. Температура ки-
пения насыщенного раствора 109,1°, кон-
центрация 71,5%.
ВЫ
nh4i
Рис. 128.
Рис. 126.
Рис. 126 построен по данйым [17]. Эв-
тектика: —13,0°, 50,1%. Кривая кипения
построена по данным [17]. Температура
кипения насыщенного раствора 116,4°,
концентрация 77,8%.
Рис. 128 построен по данным [20—22].
Эвтектика: —27,5°, 55,6% [20]. Кривая
кипения построена по данным [5].
52
Cui
Рис. 129.
Рис. 129 построен по данным [23J, полу-
ченным в замкнутом объеме.
Cul2
Растворимость Cul2 при 20° составляет
6,15 г/л [24].
И. G. Gerlach, Z. anal. Chem., 8. 235
(1869); 20, 413 (1887). — 12. N. К e e v i 1,
J. Am. Chem. Soc., 04, 845 847 (1942). —
13. R. К r e m a n n, F. К e r sc h ba um,
Z. anorg. Chem., 50, 219 (1908). — 14. F. С. К r a -
cek.J. Phys. Chem., 35, 949 (1931). —
15. W. A. Tilde n, W. A. S h e n s t d n e,
Phil. Trans. Roy. Soc., 175, 33 (1884). —
16. А. В e n r a t h, F. G j e d e b о, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
231, 290 (1937). —17. T.R.Br iggs,C.C.Con-
r a d, С. C. Gregg, W. H. R e e d, J. Phys.
Chem., 45, 618 (1941); Рубидий. Сборник перево-
дов, под ред. Ф. М. Перельман, ИЛ, 1959,
стр. 208. — 18. Т. R. Briggs, S. S. Hu-
bard, J. Phys. Chem., 45, 808 (1941).—
19. P. Г. Самусева, В. E. Плющев,
P. С. Егорова, ЖНХ, 7, 1415 (1962).—
20. A. Smith, BL E. E a s 11 a c k, j. Am.
Chem. Soc., 38, 1265 (1916).
21. F. Francois, M. L. D e l w a u 11 e,
t
Bull. Soc. chim. France, 3, 687 (1936). —
22. T. R. В г i gg s. К. H. В a 1 1 a r d, F. R. A 1-
r i c h, J. P. wikswo, J. Phys. Chem.. 44,
325 (1940). — 23. M. Л. Гавриш, И. С. Га-
лин к ер, ДАН СССР, 102, 91 (1955); Труды
Харьковского с.-х. ин-та, 85, 48 (1961).—
24. П. П. Ф е д о т ь е в, Z. anorg. Chem., 73,
178 (1912).
Йодиды металлов
второй группы
Agl
Рис. 130.
Рис. 130 построен по данным [23], полу-
ченным в замкнутом объеме.
ЛИТЕРАТУРА
1. Р. К г е m е г s, Pogg. Ann.. 103, 65 (1858).—
2. И. С. J о n е s, F. Н. German, Z. phys.
Chem., 49, 391 (1904); 55, 391 (1906); Carnegie
Publication, Ml 60, 29 (1907). — 3. G. Hfittig,
F. Pohle, Z. anorg. Chem., 138, 12 (1924).—
4. G. H U 11 1 g, W. Steudemann, Z; phys.
Chem., 120, 117 (1927). — 5. Timmermans,
v. 3, I960; v. 4, 1960. — 6. Справочник по рас-
творимости солевых систем, т. 3. 1961; т. 4,
1963. — 7. Т. R. Briggs, W. F. Geigle,
J. Phys. Chem., 44, 376 (1940). — 8. Г. К. Д и-
ст.анов, Научн. зап. Ужгородского ун-та,
7, 154 (1953). - 9. R. D. Eddy, A. W. Men-
zies, J. Phys. Chem., 44, 218 (1940).—
40. Р. Kremers, Pogg. Ann., 97, 14 (1856).
Mgl2
Рис. 131 построен по данным [1], полу-
ченным в замкнутом объеме. Переходная
точка: (43°), (64,7%). Температура пла-
вления MgI2-8H2O 43,5° [2]. По данным
[2], при температуре ниже нуля градусов
из водных растворов кристаллизуется
MgI2*10H2O, переходящий при темпера-
туре —23s в MgI2-8H2O.
53
Cals
Рис. 132 построен по данным [3—7],
полученным в замкнутом объеме. Эвтек-
тика: —77°, 56,1% [7]. Точка Cal а«6НаО-|-
Са1.«4НаО находится при 40—45° [3],
51—64е [4] и при 65° [8]. По данным [9],
температура плавления Са1а«6НаО равна
42°. В работе [8] указывается, что точка
€а1а«7Н.О + СаГа«6На0 находится между
+1 и —2°. Температура кипения насыщен-
ного раствора ~160rf [9].
Srl2
Рис. 133 построен по данным [3—6].
Согласно данным [10], точка SrIa«6Ha0
4- SrIa«2Ha0 находится при 84°, 76,0%.
Bals
Рис. 134 построен по данным [3—6, 11].
О составе гидратов нет единого мнения.
По данным [4], от криогидратной точки
до 87° кристаллизуется Ва1а«7Н»О, по
.данным [11] — Ва1а«7,5НаО (до 26°), по
данным [12] — Ва1а«6Н2О (при 25°). Осо-
бые точки [11]:
i, QC с, %
Лед+ BaIa-7,5HaO (-33,5) (56,0)
Balj -7,5H.O + + BaIa-2H2O 25,7 68,9
BaIa«2HaO + + BaI2HaO 98,9 73,4
Рис. 133.
Рис. 134.
Znls
Рис^ 135 построен по данным [13]. Дан-
ные [4] не использованы. Особые точки:
t, °C С, %
ZnIa-2HaO+ Znla I (0) | (81,1)
ZnIa*2HaO (мет.) | 27 | 89,5
54
Cdla
Рис. 136.
Рис. 136 построен по данным [4, 13—15].
Особые точки [15]:
Лед+ CdI2-4HaO
CdI2-4H2O+ Cdl2
t, °C
-5,3
(-2,9)
e, %
I 42,1
I 43,8
Кривая кипения построена по данным
[16].
Рис. 137 построен по данным [17], полу-
ченным в замкнутом объеме.
Hgla
Рис. 138 построен по данным [17], полу-
ченным в замкнутом объеме. Температур»
расслаивания 241°, концентрация 11—98%
Hgl2. При температуре выше 338° оба ело»
смешиваются в любых отношениях. Hglt
существует в виде двух модификации.
Переход одной формы р другую происх*о-
дит, .по данным одних авторов, при 148—
154°, по данным других — при 126—132*
[18].
55
ЛИТЕРАТУРА
1. Б. Н. Мен шут к ин, Z. anorg. Chem.,
52, 156 (1907). — 2. И. Панфилов, ЖРФХО.
Ч. хим., 26, 234 (1894). — 3. Р. Kremers,
Fogg. Ann., 108, 57, 65 (1858). — 4. А. Е tar d,
Ann. chim. phys. (7), 2, 543 (1894). — 5. J. Me-
yer, Z. anorg. Chem., 80, 118 (1902).—
6. H. C. J о n e s, F. H. G e t m a n, Z. phys.
Chem., 49, 385 (1904); Hydrates in aqueous solu-
tion, 1907, p. 57, 60, 64. — 7. F. R а к о w s к у,
A. Garrett, J. Electrochem. Soc., 101, 117
(1954). — 8. П. И. Кузнецов, ЖРФХО.
Ч. хим., 41, 375. 377 (1909). — 9. Е. Любар-
с кий, ЖРФХО. Ч. хим., 28, 466 (1896).—
10. G m е 1 i n, Bd. 29, 1931, S. 158.
И. J. Packer, A. R 1 v е 11, J. Chem. Soc.’
1926. 1061; 1927, 1344. — 12. J. M i 1 i к a n.
Z. phys. Chem., 92, 79 (1918). — 13. R. Dietz-
Ber., 82, 93, 96 (1899); Z. anorg. Chem., 20, 240
(1899); Wise. Aim. phys. techn. Reich., 8, 432
(1900).— 14 . 0. Guempel, Bull. Soc. chim.
Belg., 88, 455, 475 (1929). — 15. H. Hering,
Ann. chim. (11), 5, 572 (1936). — 16. Timmer-
mans, v. 3, 1960, p. 876. — 17. А. В e n r a t h,
F. Gjedebo, B. Schiffers, H. Wun-
derlich, Z. anorg. Chem., 281, 291 (1937). —
18. M e 1 1 о r, v. 4, 1957, p. 904.
Йодиды металлов
третьей и четвертой групп
T1I
Рис. 140 построен по данным [3].
Inl3
Рис. 139.
Snl2
Рис. 141.
Рис. 139 построен поданным [1]. Твердой
фазой в равновесии с раствором, согласно
данным [1], является безводная соль. Од-
нако излом на кривой при —40° отражает,
по-видимому, переход одной гидратной
формы в другую или в безводную соль.
Отмечено образование гидрата InI3-2H2O
и указано, что точка InI3-2H2O + Inl3
находится при 22°, 93,2% [2].
Рис. 141 построен по данным [4].
РЫ
Растворимость РЫ при 25° составляет
1,2-10-2% [3].
56
Рис. 142-
Йодиды металлов
седьмой и восьмой групп
Рис. 144 построен по данным [2]. Число
молекул воды в кристаллогидрате точно
не установлено.
Рис. 142 построен по данным [5], а
рис. 143 — по данным [6], полученным
в замкнутом объеме. Температура расслаи-
вания 334°, концентрация 12—82% РЫ2.
Nila
Рис. 145 построен по дадным {2]. Пере-
ходная точка: (43°), (64,5%) 13].
ЛИТЕРА ТУР А
1. р. Е п в в 1 i п, В. Ziemeck, L. de
Scha ер dryver, Z. anorg. Chem.,
254, 293 (1947). — 2. P a sc a I, t. . 6, 1961,
p. 845. — 3. Se 1 de 1 1, v. 2, 1965, p. 1580,
1300. — 4. S. W. Y о u n g, J. Am. Chem. Soc.,
19, 851 (1897).— 5. D. M. Lickty, J. Am.
Chem. Soc., 25, 474 (1903). — 6. A. В e n r a t h,
P. Gjedebo, B. Schiffers, H. Wun-
derlich, Z. anorg. Chem., 231, 294 (1937).
литература
1. П. Кузнецов, ЖРФХО. Ч. хим., 82,
29о (1900); Timmermans, v. 3, I960,
р. 924* — 2. А. Е t а г d, Ann. ehim. phys. (7), 2,
546 (1894); С. Г., ИЗ, 699 (1891). — 3. В е 1 -
dell, v. 2, 1965, р. 1?14.
57
ПОЛИГАЛОГЕНИДЫ
Полигалогениды К, Rb, Cs
Твердая фаза i, °C c, % Источ- ники
Rbl. 22 73,5 1
ВЫ. 25 77,5 2
НЫ. 40 84,1 2
CsI. 22 >0,99 1
НЫС11 0 (34) 54,9 3
RbICl, 25 4
RbICl* 0 7,2 7
KIBr.-HjO 18 90,9—92,3 1,5
RbIBr. 20 ~44 1,5
iRbIBr, 25 50,3 6
•CsIBr, 20 4,45 1,5
Рис. 146.
Условная растворимость RbICIBr и
CsICIBr, частично разлагающихся в воде,
приведена на рис. 146 по данным [8].
' ЛИТЕРАТУРА
1. Н. L. Wells, Н. L. W h е 1 1 е г, Am. J.
Sci. (3), 43, 482 (1892). — 2. Б. Д. Степин,
В. Е. Плющев, А. А. Ф а к е е в, Успехи
химии, 34, 1881 (1965). — 3. В. И. С а ф о н о в а,
Б. Д. Степин, Г. П. Кузнецова, ЖНХ,
11, 436 (1966). — 4. В. И. Сафонова,
Г. П. Кузнецова, Б. Д. Степин, ЖНХ,
10, 2351 (1965). — 5. Н. W. Cremer,
D. R. Duncan, J. Chem. Soc., 1931, 2243.—
6. Г. П. К у з н e ц о в а, Б. Д. С т e п и н, ЖНХ,
10, 472 (1965). — 7. М. G. С е 1 i s, Е. М о 1 е 8,
An. Soc. espan. fis. quim., 30, 540 (1932). —
8. Б. Д. Степч н, В. Е. Плющев, ЖНХ,
7, 394 (1962).
Ориентировочные значения
растворимости галогенидов
Соедине- ние c, % Соедине- ние c, %
MgF2 8-10"» HgCl 3-10-*
CaF2 2-10-» CuBr 5- IO'»
YFs 3-10-* I AgBr 2-IO'»
C ej1 з 2-10-* HgBr 2-10-’
NdF3 8-10-» Cui 5-IO-1
EuFs 3«io-’ Agl з-io-7
ErFs 2-10~* 1 Hgl 2-10-’
ThF. 2-10-» Hgl, 6-io-»
UF. 5*10-’ TH 6-10-»
PuF 6-10-’ TH. 7-10-»
AgCl 2-10-* Tl.I. 5-Ю"»
КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
ГИПОХЛОРИТЫ
NaClO
Рис. 147 построен по данным [ точки: 1]. Особые
t, °C c, %
Лед+ NaClO5H2O —16,5 19,2
NaClO-5H2O 24,5 45,3
NaC10-5H20 + + NaC10-2,5H20 23,0 48,5
NaClO-2,5H2O+ + NaClOH2O 57,5 (62,4)
Са(С1О)2
Ниже приведены значения растворимости
Са(С1О)2-ЗН2О:
t, °C c, % Источни- ки
0 21,8 2
0 21,5 3
—10 22,7 3
18 22,5 3
30 23,0 4
.58
Рис. 147.
ЛИТЕРАТУРА
Рис. 148.
1. A. Sanfourche, L. Garden t, Bull.
Soc. chim. France (4), 85, 1090 (1924). —
2. E. A. O’Connor, J. Chem. Soc., 1927,
2705. — 3. M. E. И о з и и, Ц. А. Левина,
ЖХП, 18, 864 (1936). — 4. H. Krombach,
Bull. Soc. chim. France (5), 1, 175 (1934).
ХЛОРИТЫ
NaClO2
Рис. 148 построен по данным [1, 2].
Переходная точка: 37,4°, (53%) [2].
AgC102
Рис. 149 построен по данным [3].
Са(С1О2)2
Растворимость Са(С1О2)а при 0—50° по
данным [4J описывается уравнением: с =
= 11,2 4- 0,035*.
Sr(C102)2
Рис. 150 построен по данным [4]. Состав
твердой фазы точно не установлен.
Рис. 149.
Ва(С1О2)2
Рис. 151.
Рис. 153.
Hg(C102)2 [4]
t, °C с. %
О 0,046
9 0,050
19 0,066
Рис. 151 построен по данным [4]. Данные
[3] не использованы. Переходная точка:
9,5°, (16,3%).
Zn(C102)2
Рис. 152 построен по данным [5]. Твер-
дой фазой в равновесии с раствором являет-
ся Zn(C102)2-2H20.
Cd(C102)2
Рис. 153 построен по данным [5]. Твер-
дой фазой в равновесии с раствором яв-
ляется Cd(C102)2-2H20.
РЬ(С10а)2
Растворимость РЬ(С1О2)2 при 0—100°,
по данным [3], описывается уравнением:
с = 0,035 + 0,00371.
ЛИТЕРАТУРА
1. М.С.Тау lor, J.F.White, G. Р. V i n-
cent, G. L. Gunningham, Ind. Eng.
Chem., 32, 900 (1940). — 2. G. L. Gynning-
h a m, T. S. О e y, J. Am. Chem. Soc., 77, 799,
4498 (1955). — 3. G. R. Levi, Atti Accad.
Line., (5), 32, 626 (1923); Gazz. chim. ital., 53,
525 (1923). — 4. G. R. L e v i, С. В isi Gazz.
chim. ital., 86, 392 (1956). — 5. G. R. L e v i,
M. C u r t i, Gazz. chim. ital., 86, 1022 (1956).
60
ХЛОРАТЫ
Хлораты металлов
первой группы и аммония
LiClOs
Рис. 154 построен по средним данным
[1—3] (в области кристаллизации гидра-
тов LiC103H20 и 4LiC103-H20 — по дан-
ным [3]).
Рис. 154.
61
Особые точки:
t, °C с, % Ис- точ- ники
Лед 4" L1CIO3 ‘SHgO —40,0 37,0 1
ЫС1О3-ЗНаО 8,5 (63) 3
LiGlOg -ЗНаО + —0,1 73,1 3
+ LiClO3-HaO
LiClO3H.O4- 4- 4LiC103 НаО 20,5 81,9 3
4LiC103 НаО + 4- а-ЫСГОз 42 (86,6) 1, 3
а-ЫС1О8 4- 99 (96) 2
4- 0-ЫС1Оз
LiC103 -3H80 4- 4- 4LiClO3 H20 —9 75,7 1
(мет.) LiC103 -3H.0 4* —25,0 82,7 3
4- a-LiC103 (мет.)
LiClOa 127,5 100 3
КСЮэ
Рис. 156.
NaClOs
Рис. 155.
Рис. 157.
Рис. 155 построен по данным [4—8].
Данные [9, 10] не использованы. Эвтек-
тика: —17,8°, 39,7% [8]. Кривая, кипения
построена по данным [11]. Температура
кипения насыщенного раствора 122°, кон-
центрация 74,0% [10].
Рис. 156 построен по данным [7, 8, 10,
12—14]. Данные [15] не использованы.
Эвтектика: —0,8°, 3,01% [8]. Кривая ки-
пения построена по данным [11]. Темпера-
тура кипения насыщенного раствора 104°,
концентрация 37,5% [10].
Рис. 157 построен по данным [16, 17],
полученным в замкнутом объеме.
62
»
RbClOe
Рис. 158 построен по данным [7, 18—20].
Эвтектика: (—1°), (2%).
W4C10s
Рис. 160 построен по данным [21].
Рис. 160.
Си(С10а)а
Рис. 161 построен по данным[22]. Темпе-
ратура плавления Си(С1О 3)2*411,0 73е.
СзС103
Рис. 159.
Рис. 159 построен по данным [7, 19, 20].
Эвтектика: (—0,5°), (2,3%).
Рис. 161.
63
AgClOs
Рис. 162.
Рис. 162 построен по данным [23, 24].
Данные [25] не использованы.
ЛИТЕРАТУРА
1. С. А, Кг a us, W. М. Burgess, J. Am.
Chem. Soc., 49, 1230 (1927). — 2. Л. Берг,
Z. anorg. Chem., 181, 133 (1929).—3. A.N. C a mp-
bell, J. E. Griffiths, Canad. J. Chem.,
84, 1651 (1956). — 4. M. Le В 1 a n c, W. S ch-
rn a n d t, Z. phys. Chem., 77, 626 (1911).
5. H. С. В e 11, J. Chem. Soc., 123, 2714 (1923). —
6. J. E. R 1 с c 1, N. S. Y a n i c k, J. Am. Chem.,
Soc., 59, 493 (1937). — 7. L. Cavallaro,
Ber., 76B, 663 (1943). — 8. A. Na Het, R. Pa-
ris. Bull. Soc. chim. France, 1956, 490. —
9. P. Kremers, Pogg. Ann., 92, 499 (1854). —
10. В. С a r 1 s о n, Klason-Festkrift, 1910, S. 247;
Tables Annuelles, 1, 379 (1910).
11. Timmermans, v. 3, 1960, p. 381,
550. — 12. B. Pawlewski, Ber., 82, 1041
(1899). — 13. M. Wildermann, Z. phys.
Chem., 42, 487 (1903).— 14. J. Fleck, Bull.
Soc. chim. France (5), 4, 559 (1937). —
15. A. Etard, Ann. chim. phys. (7), 2, 528
(1894). — 16. W. A. T i 1 d e n, Proc. Roy. Soc.,
85, 345 (1883); W. A. Tilden, W. A. S hen -
stone, Phil. Trans. Roy. Soc., 175, 34 (1884). —
17. A. Benra t h, F. Gjedebo, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
281, 288 (1937). — 18. T. R e i в s i g, Ann.,
127, 33 (1863). — 19. F. Calzolari, Gazz.
chim. ital., 42, 88 (1912). — 20. О. H. Бре-
усов, H. И. Кашина. T. В. Ревзина,
H. Г. Соболевская, ЖНХ, 12, 2240 (1967).
21. G me 1 in, Bd. 23, 1936, S. 195.—
22. A. Meusser, Ber., 85, 1416 (1902).—
23. E. C. N о о n a n, J. Am. Chem. Soc., 70, 2916
(1948). — 24. J. E. Ricci, J. A. Offen-
bach, J. Am. Chem. Soc., 78,1597 (1951).—
25. G. R. L e v i, Gazz. chim. ital., 58, 522 (1923).
Хлораты металлов
второй группы
Mg(C108)2
Рис. 163 построен по данным [1]. Особые
точки:
t, °с . с, %
Mg(ClO8)a-6НаО + + Mg(ClO3)a-4НаО 35,0 63,7
Mg(C103),-4Ha0 4-Mg(ClO3)a-2Н2О 65,5 69,1
Са(С1О3)2
Рис. 164 построен по данным [2], полученным в
замкнутом объеме. Особые точки:-
Лед -|- Са(С1О3)а-6НаО
Са(С1О3)а -6НаО + Са(С1О3)а -4НаО
Са(С1О3)а -4НаО + Са(С1О3)а -2Н2О
Са(С1О3)а-2НаО+ Са(С1О3)а
t, °C
(-41)
(-26,8)
(-7,8)
(76)
с, %
(45,5)
(55)
(62,7)
(77)
5 Заказ 976
65-
Sr(C108)e
Рис. 167.
Следует подчеркнуть, что данные [4, 5]
противоречат законам термодинамики. В со-
ответствии с последними из двух диаграмм,
представленных на рис. 167, тип «б» не
может быть реализован, а описанная на
рис. 166 диаграмма относится именно к это-
му типу. Особые точки:
t, °C
Рис. 165 построен по данным [3]. Особые
точки:
I, вс с, %
Лед + Sr(C108)2-ЗН2О -37,0 (54,5)
Sr(C103)2 -ЗН2О + Sr(C108)2 10± 1 (63,4)
Температура кипения насыщенного рас-
твора 121°, концентрация (68,7%) [3J.
Лед +
+ Ва(С1О3)2 >Н2О
Ва(С1О3)2 Н2О +
4* Ва (С10з)г
—2,75
(Ю5)
He-
п. точ-
с, /о НИ-
КИ
15,3 4
(54) -
Ва(С10з)2
Рис. 166 построен по данным [4, 5],
полученным в замкнутом объеме. Данные
[6, 7] не. использованы.
Температура кипения насыщенного рас-
твора 105°, концентрация 52,7% [4].
2п(С10з)г
Рис. 168 построен по данным [8]. Особые
точки: .
t, ’С с, %
Лед +
+ Zn(C103)2-12Н2О
Zn(C108)2 12Н2О
Zn(C108)2-12Н2О+,
4- Zn(C108)2-6H20
Zn(C108)2 -6Н2О 4-
4- Zn(C103)2-4H20
Zn(C103)2-4Н2О 4- '
4- Zn(C103)2 -2Н2О
Лед 4"
4- Zn(C103)2-6H20 (мет.)
гп(С10з)2-6Н2О (Мет.)
Zn(C103)2 -6Н2О 4-
4- Zn(C103)2-2Н2О (мет.)
Zn(C103)2-4Н2О (мет.)
—33,4 41,6
-24,9 52,1
-25,3 53,9
14,5 65,5
53,8 75,7
-60,2 48,6
16,4 68,3
11,1 72,4
53,9 76,3
<66
I
Cd(C108)2
Рис. 169 построен по данным [1]. Эвтек-
тика: (22°), (72%). Температура плавле-
ния Cd(ClO3)2-2H2O£79°.
Hg(C108)2
Растворимость Hg(C103)2-2H20 при 20°
составляет 20% [9].
ЛИТЕРАТУРА
1. A. Meusser, Вег., 85, 1416 (1902).—
2. В. С. Егоров, ЖОХ, 1, 1266 (1931); Труды
ГИПХ, № 23* 88, 95 (1935). — 3. W. F. L i n k е,
J. Am. Chem. Soc., 75. 5797 (1953). — 4. M. T r a -
utz, A. Anschutz, Z. phys. Chem., 56, 236
(1906). — 5. W. A. Tilden, W. A. Shen-
stone, Phil. Trans. Roy. Soc., 175, 34 (1884). —
6. B. Carlson, Klason-Festkrift, 1910, S. 247;
Tables Annuelles, ,1, 379 (1910). — 7. P. Kre-
mers, Pogg. Ann., 99, 43, 54 (1856).—
8. H. Remy, H. M a t h i e s, Z. anorg. Chem.,
329, 203 (1964). — 9. P a sc a 1, t. 5, 1962,
p. 739.
Хлораты металлов
других групп
А1(С1О8)з
Имеются данные по понижению темпера-
туры замерзания растворов А1(С1О3)3 до»
-5,5° [1].
Т1С10з
Рис. 169.
Рис. 170.
Рис. 170 построен по данным [2].
РЬ(С1О8)2
Растворимость РЬ(С1О8)2-Н2О при
.составляет 60,2% [3].
Со(С1О3)2
Рис. 171.
[4]. Пере-
Рис. 171 построен по данным
ходная точка: ~18°, 64,2%.
Ni(CiO8)2
Рис. 172 построен по данным
ходная точка: ~48°, (68%).
ЛИТЕРАТУРА
1. W. A. R о t h, Н. Н е n k е 1, Z. phys. Chem.,
’ Muir, J. Chem.,
1 i u s, R. F u n k,
M e u s s e r, Ber.,
[4]. Пере-
43, 539 (1903).— 2. J. J.
Soc., 29, 857 (1876). —3. F. М у
Вег,, 30, 1718 (1897). — 4. А.
.35, 1418 (1902).
Эвтектика Е
НС1О4-5,5Н2О
Точка С
НС1О4-4Н2О
НС1О4 • 4Н2О + НС1О4 • 3,5Н2О
НС1О4-3,5Н2О
НС1О4 • 3,5Н2О + НС1О4 • ЗН2О
НС1О4-ЗН2О
НС1О4 • ЗН2О + НС1О4 • 2,5Н2О
НС1О4-2,5Н2О
НС1О4 • 2,5Н2О + НС1О4 • 2Н2О
НС1О4 • 2Н2О
НС1О4 • 2Н2О + НС1О4 • Н2О
0-НС1О4 • Н2О + а-НС1О4 • Н2О
НС1О4-Н2О
а-НС1О4 • Н2О + Р-4НС1О4 • Н8О
МНС1О4 • Н2О + а-4НС1О4 • Н2О
НС1О4
Рис. 174.
Рис. 172.
ПЕРХЛОРАТЫ
НС1О4
Рис. 173 построен по данным [1—7],
рис. 174 для области концентрирован-
а 1— _ ...
ныхрастворов — по данным[4, 6] (см. также
[8]). Максимум на кривых ликвидуса и со-
лидуса твердых растворов
ву НС1О4-5,5Н2О
отвечает соста-
[3, 4] Особые точки:
t, °C с,. % Источ- ники
—60,2 40,8 4
—45,6 50,5 4
—60,6 56,4 4
-56 (58,2) 4
—57,8 (56,8) 4
—45,6 61,5 4, 5
—45,9 61,8 4, 5
—40,2 65,0 4
—40,4 65,3 4
—32,1 69,1 4, 5
—33,1 69,5 4, 5
—20,7 73,6 '4
—26,4 77,1 4
—24 — 4
49,6 (84,5) 4
—73,1 99,1 4
—101,3 (99,6) 4
—101,6 100 4
.68
Рис. 173
Диаграмма кипения водного раствора
НС1О4 (рис. 175) построена по данным [1].
Азеотропная точка: 203°, 72,4%.
ЛИТЕРАТУРА
1. Н. J. Van Wyk. Z. anorg. Chem., 32, 11»
(1902); 48, 1 (1906). — 2. L. H. В r ic k we d de,
J. Res. Nat. Bur. Stand. (NBS), 42, 309 (1949). —
3. G. M a sc he rp a, Bull. Soc. chiih. France,
1963, 1548. — 4. G. Mascherpa. Rev. chim.
mineral., 2, 379, 405 (1965). — 5. G. Ma-
s c h e r p a, A. Pavia, A. P о t i e r, C. r., 254,
3213 (1962). — 6. G. M a s c h e r p a, C. r., 257,
3414 (1963). — 7. А. А. Зиновьев.
В. Я. Poco лове КИЙ, ЖНХ, 3, 2382 (1958). —
8. В. Я. Росоловский, химия безводной
хлорной кислоты, Изд. «Наука», 1966, стр. 53.
' Перхлораты металлов
первой группы и аммония
LiClO*
Рис. 176 построен по данным [1,2], полу-
ченным в замкнутом объеме. Данные [3]
не использованы.
Рио. 176.
70
Особые точки:
t, ec C, % Ис- точ- ники
Лед + —18,0 (26,0) 2
4- LiClО. -ЗН2О LiC104-3H20 95,1 66,3 1
LiC104 -ЗН2О 4- 4- ЫС1О4Н2О LiC104H20 92,5 70,3 1, 2
149 86,5 1
LiC104H20 4- 4- LiClO. 145,8 (91) 1
1лС1О4 236 100 1
NaClO*
Рис. 177 построен по
Особые точки ‘[6]:
данным
[4-6].
Лёд 4-NaC104-2Н2О
NaClO*-2Н2О +
4- ЬГаСЮл-НлО
NaClO* НоО +NaC104
Лед 4- NаС104Н,0 (мет.)
Рис. 177.
Температура кипения насыщенного рас-
твора 114°. концентрация 79,1% [6].
КС1О4
t, °с
—34,2
—12,7
52,8
-39
С, %
53,0
60
73,6
57,2
Рис. 178 построен по данным [3, 7, 8].
Данные [9, 10] не использованы. Эвтек-
тика: (—0,2°), (0,7%).
Рис. 178.
Рис. 179 построен по данным [11, 12],
полученным в замкнутом объеме.
Рис. 179.
71
RbC104
Рис. 180 построен по данным [8, 13].
Данные [10] не использованы.
Си(С1О4)2
Растворимость Си(СЮ4)2 >6Н2О при О
составляет 54,3% [17] и при 30° 58,6%
[18].
СзС1О4
Рис. 181.
Рис. 181 построен по данным [8, 13].
NH*C1O*
Рис. 182 построен по данным [4, 10,
14—16]. Эвтектика: —2,72°, 9,84% [10].
Температура кипения насыщенного рас-
твора 107 , концентрация 48,4% [10].
А§С1О4, %
Рис. 183.
72
Рис. 183 построен по данным [19, 20].
Особые точки [19]:
t, °C с, %
Лёд +AgC10*Н2О I -58,2 I 74,0
AgClO* Н2О +AgC104 I 43 I 86,5
Рис. 184 построен по данным [1]. Для
Be (С1О4)2«4Н2О не использованы данные
Sr(C104)2
ЛИТЕРАТУРА
1. J. Р. S 1 m mo n s, С. D. R о р р, J. Ат.
Chem. Soc., 50. 16,52 (1928). — 2. К. Е. Миро-
нов. М. 3. Пронина, С. А. Токарева,
ЖНХ, 3, 510 (1958). — 3. G. Scatchard,
S. Prentiss, Р. Jones, J. Am. Chem. Soc.,
50, 806 (1934). — 4. F. A. Freeth, Rec. trav.
chim., 43, 478, 490 (1924). — 5. E. С о r n e c,
J. Dickely, Bull. Soc. chim. France (4), 41,
1017 (1927); Caliche, 8, 99 (1927). — 6. P a s -
cal, t. 2, 1966, p. 345. — 7. E. С о r n e c,
A. Neumeister, Caliche, 10, 492 (1929).—
8. О. H. Бреусов, H. И. Кашина,
T. В. Ревзина, H. Г. Соболевская,
ЖНХ, 12, 2240 (1967).— 9. M. M. Patti-
son-Muir, Chem. News, 33. 15 (1876).—
10. В. G a r 1 s о n, Klason-Festkrift, 1910, S. 262.
11. A.Benrat h, F. Gjedebo, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
231, 289 (1937). — 12. А. В e n r a t h,
A. Braun, Z. anorg. Chem., 244, 356 (1940). —
13. F. С a 1 z о 1 a г Г, Gazz. chim. ital., 42, 89
(1912). — 14. A. Mazzucchelll, A. Rosa,
Attl Accad. Line. (5), 30, 270 (1921).—
15. M. P. M a t h le, Bull. Soc. chim. Beiges, 58,
112 (1949). — 16. R. P. А у e г s t, N. I. P h i 1 -
lips, J. Chem. Eng. Data, 11, 494 (1966). —
17. R. Portillo, L. A Ibero la, An. Soc.
espan, fis, quim., 28, 1117 (1930). — 18. R. C a-
v e n, G. Bryce, J. Chem. Soc., 1934. 516. —
19. A. E. H i 1 1, J. Am. Chem. Soc., 43, 203 (1921);
44, 1164, 1188 (1922); 47, 2709 (1925).—
2o. G. Smith, F. Ring, J. Am. Chem. Soc.,
59, 1889 (1937).
Sr(C104)2, %
Рис. 185.
Рис. 185 построен по данным [1]. Пере-
ходная точка: -~25,7°, (76%).
Перхлораты металлов
второй группы
Ве(С1О4)2, Mg(C104)2, Са(С1О4)2
Ва(С1О4)2
Рис. 186.
Рис. 186 построен по данным [1, 3]. Твер-
дой фазой в равновесии с раствором являет-
ся Ва(С1О4)2-ЗН2О.
73
Zn(C10*)2
Рис. 187.
Рис. 189.
Hg(C104)8
Рис. 187 построен по данным [1]. Дан-
ные [4, 5] не использованы. Переходная
точка: ~20°, (52,4%). См. пояснения
к рис. 167 (стр. 66).
Cd(C10*)2
Рис. 188 построен по данным [1, 6],
полученным в замкнутом 'объеме. Данные
[5] не использованы. Особые точки [6]:
t, °с
с, %
Рис. 190.
Лед+ Cd(C104)2-6H20
Cd(C104)2-6H20
Cd(C104)a-6H20 +
+ a-Cd(C104)a-2H20
a-Cd(C104)a-2H20+
4- p-Cd(C104)2 -2H20
6-Cd(C104)2-2H2O
₽-Cd(CloJ2-2H2O +
+ Cd(C104)2
-66,5
129,4
58,5
66
157,9
144,4
51,2
74,2
82,4
82,9
89,6
92,0
HgClO*
Рис. 189 построен по данным [7]. Пере-
ходная точка: 36°, 82,3%. Эвтектика на-
ходится при температуре около —29°.
Рис. 190 построен по данным [1]. Твер-
дой фазой в равновесии с раствором яв-
ляется Hg(C104)2-6Н2О. Излом на кривой
растворимости отражает, по-видимому, из-
менение кристаллической модификации.
Переходная точка: (20°), (73,5%). См. по-
яснения к рис. 167 (стр. 66).
ЛИТЕРАТУРА \
1. Л. С. Лилия, Б. Ф. Дж урин с к ий,
ЖОХ, 26, 1549 (1956). — 2. N. V. S i d g w i c k,.
N. B. Lewis, J. Chem. Soc., 1926, 1287.—
3. В. С а г 1 в о n, Klason-Festkritt, 1910,8. 262. —
4. В. А. Латышева, CL В. Караван,
Вести. ЛГУ. Сер. физ., хим., № 22, ИЗ (1967). —
5. R. Salvador!, Gazz. chim. ital., 42, 455,
480 (1912).— 6. H. Hering, A. L e г a у.
Bull, Soc. chim. France (5), 6, 1034 (1939). —
7. E. Newbery, Trans. Electrochem. Soc.r
69, 615 (1936),
74
Рис. 188.
Перхлораты металлов
третьей группы
Рис. 191 построен по данным [1J.
Т1С1О4
Рис. 191.
Се(С1О4)3
Рис. 192 построен по данным [2] (сплош-
ная линия — данные получены визуаль-
но-политермическим методом; кружки______
методом отбора проб). Особые точки:
t,°c
Лед +Се(С1О4)312Н2О
Се(С1О4)3 -12Н2О +
+ Се(С1О*)3-9Н2О
Се(С1О4)3-9Н2О +
+ Се(С1О4)3-8Н2О
Се(С1О4)3 8Н3О
Се(С1О4)3 -8Н2О +
+ Се(С1О4)3-4Н2О
Се(СЮ4)3-4н2О
Се(СЮ4)3-4Н2О +
,+ Се(С1О4)3
t, °с
—89,5
-17,5
107
151
84,0
125
81,0
С, %
53,0
63,0
70,2
75,4
79,8
(86,0)
88,0
Сё(С1О4)з, %
76
Перхлораты Al и U
Твердая фаза /, °C с, % Источ- ники
А1(С1О4)з-9Н2О 0 54,9 3
А1(С1О4)з-9Н2О 14,3 56,7 • 3
А1(С1О4)з -9Н2О 91,5 64,6 3
А1(С1О4)з 15Н2О 18,5 3,73 3
А1(С1О4)з ”15Н2О 90 22,8 3
ио2(СЮ4)2-7Н2О 25 73,3 4
ЛИТЕРАТУРА
1. Se 1 de 11, v. 2, 1965, p. 1579. —2. H. А. Щи-
ров a, А. А. Зиновьев, ЖНХ, 6, 1227
(1961). — 3. Д. Добросердо в, Укр. хим.
ж., 2, 109, 119 (1926). — 4. В. М. В д о в е н к о,
Л. Г. М а ш и р о в, В. К. Блохина,
И. Г. Суглооова, Д. Н. Суглобов,
Радиохимия, 5, 80 (1963).
Рис. 194.
Перхлораты металлов
других групп
Мп(С1О*)2
Рис. 193.
Fe(C104)8
Рис. 195 построен по данным [2]. Пере-
ходная точка: ~45°, (83,7%). См. поясне-
ния к рис. 167 (стр. 66)-
Рис. 193 построен по данным [1]. Твер-
дой фазой в равновесии с раствором яв-
ляется Мп(С1О4)2 -6Н2О.
Fe(C104)2
Рис. 194 построен по данным [2]. Твер-
дой фазой в равновесии с раствором яв-
ляется Fe(C104)2 • 6Н2О. Излом на кривой
растворимости при —40° связан, по-види-
мому, с переходом гексагидрата в другую
Модификацию.
Со(С1О4)2
Рис. 196.
77
Рис. 196 построен по данным [3, 4]. Осо-
бые^точки [3]:
Лед +Со(С1О4)г-9Н2О
Со(С1О4)2 -9Н2О + i
4- Со(С1О4)2 -6Н2О
t, °C
—62,2
(-21,3)
с. %
(40)
(48)
Излом на кривой растворимости при
~50° связан, по-видимому, с фазовым пре-
вращением в твердом состоянии [4].
Ni(C104)2
Рис. 197.
Перхлораты РЬ, Bi,
Твердая фаза t, °C С Источ- ники
РЬ(СЮ4)2 -ЗН9О 15 78% 5
РЬ(С1О4)2 знао BiOClO4 -®HaO Bi0C104 НаО 25 81,5% ~5 моль)л 5 6
18 318 а/л 7
ВЮС1О4 -Н2О 20,3 333 г/л ' 7 •
Bi0C104H20 VO(C1O4)25H2O 23,6 342 г/л 7
20 64,3% 7
Сг(С1О4)з-9H2O 0 51,0% 8
Сг(С1О4)з-9Н2О 5 52,9% 8
Сг(С1О4)з-9H2O 10 55,1% 8
Сг(С1О4)з-9Н2О 15 55,3% 8
Сг(С1О4)з-9Н2О 25 57,7% 8
ЛИТЕРАТУРА
1. В. А. Латышева, С. В. Караван,
Вести. ЛГУ. Сер. физ., хим., № 22, 113 (4967). —
2. F. Llndstrand, z. anorg. Chem.. 230,
187 (1936).—т 3. Н. Goldblum, F. !Гег-
1 i k о w s k i, Bull. Soc. chim. France (4), 11,
103, 146 (1912). — 4. А. А. Зиновьев,
В. И. Наумова, ЖНХ, 4, 2009 (1959).—
5. Pascal, t. 8, f. 3, 1963, p. 645.—
6. M. P г у t z, P. Nagel, Z. anorg. Chem.,
227, 65 (1936). — 7. Gmelin, Bd. 19, 1964,
S. 694; Bd. 48, 1967, S. 250. — 8. В. Бибер,
И. Ней май, ЖОХ, 7, 2658 (1937); 10, 723
(1940).
БРОМИТ И БРОМАТЫ
NaBrOa
Растворимость NaBrO2-3H2O при 0 и
20° составляет соответственно 34 и 41%
[1].
ЛИТЕРАТУРА
1. Pascal, t. 2, f. 1, 1966, р. 374.
Броматы металлов
первой группы и аммония
Рис. 197 построен по данным [1, 3, 4].
Данные [3] при температурах выше 0°
не использованы. Особый точки [3]:
LiBrO3
Лед 4- Ni(C104)2 -9Н2О
Ni(C104)2-9Н2О 4-
4- Ni(ClO4)a-6НаО
t, °с с, %-
-49 (48)
(-21,3) (48)
Излом на кривой растворимости при
~50° связан, по-видимому, с фазовым пре-
вращением в твердом состоянии [4].
Рис. 198 построен по данным [1, 2J.
Данные [3] не использованы. Особые точ-
ки [1]:
t, °C с, %
Лед 4- ЫВгО3Н2О I —47 I 54,5
ЫВгО3-Н2О 4- LiBrO3 | 52 I (72,4)
Температура кипения насыщенного рас-
твора 143°, концентраций 84,6% [1].
78
КВгО3
Рис. 200.
Рис. 200 построен по данным [4—8]..
Эвтектика: —0,45°, (2,8%) [8]. Темпера-
тура кипения насыщенного раствора 104°,
концентрация (34,5%) [4].
Рис. 201 построен по данным [9], полу-
ченным в замкнутом объеме.
79?
NaBrOs
Рис. 199.
Рис. 199 построен по данным [4—6].
Температура кипения насыщенного рас-
твора 109 , концентрация (50%) [4].
AgBrO3
Броматы металлов
второй группы
Рис. 202 построен по данным [10].
Броматы Rb, Cs, NH4
Твердая фаза t, °C C, % Источ- ники
RbBrO3 25 2,85 11
RbBrOg 30 3,43 11
RbBrO.3 35 4,08 11
RbBrO3 40 4,83 11
CsBrO3 25 3,53 11
CsBrO3 30 4,33 11
CsBrO3 35 5,05 11
NH4BrO3 20 10,4 12
Mg(BrOs)2
Рис. 203.
Рис. 203 построен по данным [1]. Дан-
ные [2] не использованы. Особые точки:
ЛИТЕРАТУРА
1. И. Н. Аверко-Антонович, ЖОХ,
13, 272 (1943). — 2. J. Р. Simmons,
W, F, Wa 1 dec k, J. Am. Chem. Soc., 53, 1725
(1931). — 3. F. M у 1 i u s, R. Funk, Ber., 30,
1718 (1897). — 4. P. Kremers, Pogg. Ann.,
97, 5 (1856). — 5. J. E. Ricci, J. Am. Chem.,
Soc., 56. 301 (1934). — 6. L. Cavallaro,
Gazz. chim, ital., 72,216 (1942); Ber. 76B, 663,
(1943). — 7. Я. И. Герасимов, ЖОХ, 4,
723 (1934). — 8. Pascal, t. 2, f. 2, 1963,
p. 182. — 9. A. В e n r a t h, F. G j e d e b o,
B. Schiffers, H. Wunderlich, Z. anorg.
Chem., 231, 288 (1937). — 10. J. H. Reedy,
.1. Am. Chem. Soc., 43, 1443 (1921).
11. C. R. McCrosky, H. D. Buell,
J. Am. Chem. Soc., 42, 1788 (1920); 43„
2031 (1 921). — 12. А. А. Шид по вс кий,
JI. Ф. Шмагин, ЖНХ, 14, 2329 (1969).
t, °C c. %
Лед -j- Mg(BrO3)2 -6H2O -13,0 (38,5)
Mg(BrO3)2-6H2O + + Mg(BrO3)2-2H2O 80,0 (70,1)
Mg(BrO3)2-6H2O (мет.) 80,5 70,2
Кривая кипения построена по данным [1 ].
Температура кипения насыщенного раство-
ра 134°, концентрация 73,6%.
80
Рис. 204.
сыщенного раствора 100,4°, концентрация
5,39% [4].
Броматы Са, Zn, Cd, Hg
Твердая фаза t, °C С, % Источ- ники
Са(ВгО3)2 Н2О 15-18 44,9 2
Са(ВгО3)2 Н2О 20 63 5
Zn(BrO3)2-6Н2О 20 59 5
Cd(BrO3)2-H2O 17 55,6 6
Cd(Br03)2H20 20 56 5
Hg(BrO3)2-2Н2О ~о 0,14 6
Hg(BrO3)2-2Н2О 20 0,08 5
Hg(BrO3)2 -2Н2О 100 1,5 6
ЛИТЕРАТУРА
1. W. F. L i n k е, J. Am. Chem. Soc., 77, 866
(1955). — 2. C. Ra mm e Is be г g, Pogg. Ann.,
52, 88 (1841). — 3. W. F. L inke, J. Am. Chem.
Soc., 75, 5799 (1953). — 4. M. T r a u t z,
A. A n s c h ii t z, Z. phys. Chem., 56, 240 (1906). —
5. Bromine and its Compounds, London, Z. E. J o’l -
les (Ed.) 1966, p. 171. — 6. Pascal, t. 5,
1962, p. 362, 744.
Рис. 204 построен по данным [3]. Особые
точки:
/, °C с, %
Лед + Sr(BrO3)j -Н2О I -2,18 I (17,5)
Sr(BrO3)2Н2О +Sr(BrO3)2 I 75,5 | 39,9
Температура кипения насыщенного рас-
твора 104°, концентрация (41,0%) [3].
Ва (ВгО8)г
Рис. 205.
Рис. 205 построен по данным [4]. Дан-
ные [2] не использованы. Эвтектика:
—0,034°, 0,28%. Температура кипения на-
Броматы металлов
других групп
Gd(BrO3)s, У(ВгОз)з, Ьа(ВгО3)з,
Рг(ВгО3)3, Nd(BrO3)s, Sm(BrO3)3,
Tb(BrO3)3
Рис. 206 построен по данным [1]. Твер-
дой фазой в равновесии с раствором яв-
ляются: 1 — Gd(BrO3)3-9H2O; ' 2 —
Sm(BrO3)3-9HaO; 3 — Tb(BrO3)3-9H2O;
4 — Nd(BrO3)3-9H2O; 5-Pr(BrO3% • 9H2O;
6 — La(BrO3)3-9HaO.
Растворимость Y(BrO3)3-9H2O при 25°
составляет 46,8% [2].
6 заказ >76
81
Броматы Tl, Pb, Co
Твердая фаза t, °C с, г/л Источ- ники
Т1ВгО8 19,9 3,46 3
Т1ВгО8 20 3,30 3
Т1ВгО8 25 4,03 3
TlBrOa Pb(BrO8)a HaO 39,8 20 7,36 13,4 3 4
Pb(BrO8)a-H.O Co(BrO8)a-6HaO 25 16,5 4
17 23,3 % 5
ЛИТЕРАТУРА
1. C. James, H. C. Fogg, В. W. М с I п •
t i г е, R. Н. Е v a n a, J. S. D о п о v a n, J. Ат.
Chem. Soc., 4», 132 (1927). — 2. С. J а т е s,
W, F. Langelier, J. Am. Chem. Soc., 81,
913 (1909). — 3. Seidel 1, v. 2, 1965, p. 1557. —
4. F. H. Me Do uga 11. E. J. Hoffmann,
J. Phys. Chem., 40, 317 (1936). — 5. C. F. R a Hi-
rn els berg, Pogg. Ann., 55, 69 (1842).
ИОДАТЫ
HIO8
Рис. 207.
Рис. 207 построен по данным [1], полу-
ченным в замкнутом объеме. Особые точки:
Лед + HIQj
НЮа + Н18О8
Н18Оа + 1аО8
t, °C
—14
110
—190-200
с, %
72,8
(86,5)
Температуры кипения растворов НЮ8
приведены в справочнике [2].
ЛИТЕРАТУРА
1. Е. Groschuff, Z. anorg. Chem., 47,
331 (1905). — 2. Т 1 m m е г m a n s, v. 4, 1960,
p. 491.
82
Иодаты металлов
первой группы/и аммония
LiIO3
Рис. 208.
Рис. 208 построен по данным [1]. При
температуре 50—60° происходит переход
метастабильной формы LiIOs в стабильную.
Значение растворимости при 25°, равное
43,9%, принадлежит, по-видимому, ста-
бильной форме LilOs.
NaIO8
Рис. 209 построен по данным [2—5].
Особые точки:
ис-
t, °C с, % точ-
ники
Лед+ NaIO3-5HaO
NaIOa-5H2O +
+ NaIOaHBO
NaIOa-H2O+ NaIO3
2
-0,35
19,9
73,4
2,38
7,83
(20,2)
2
3
Температура кипения насыщенного рас-
твора 102° [6].
К1Оз
Рис. 210 построен по данным [5—7].
Эвтектика: (—1°),(4,5%). Кривая кипения
построена по данным [8]. Температура ки-
пения насыщенного раствора 102° [6].
Рис. 211 построен по данным [9], полу-
ченным в замкнутом объеме.
КЫО3
Рис. 212.
|’ис. 212 построен по данным [7].
СеЮз
Рис. 213 построен по данным [7].
6*
83
AgIO3
Рис. 214.
Рис. 214 построен по данным [10].
Иодаты К, NH<, Си
Твердая фаза t, °C e, % Источ- ники
КНа(Ю3)8 15 3,8 11
КН(1О8)а 15 1,3 11
КН(Ю8)а 17 5,1 11
NH4IO8 15 2,53 12
nh;io8 25 3,68 1
nh4io8 30 4,2 13
nh4io8 45 5,99 1
nh4io8 100 12,6 12
Cu(IO8)a 25 0,13 14
Cu(IO8)aHaO —20 0,31 12
Cu(IO8)a HaO 25 1,36 г! л 15
Cu(IO3)2 HaO 100 0,62 12
ЛИТЕРАТУРА
1. J. Е. Ricci, I. Am гоп, J. Am. Chem.
Soc., П, 3613 (1951). — 2. H. W. Foote,
J. E. Vance, Am. J. Set. (5), 16, 70 (1928);
17, 425 (1929): 26, 16 (1933). — 3. E. С о Г n e c,
A. S p a c k, Bull. Soc. chim. France (4), 49, 583
(1931). — 4. A. E. Hill, J. E. Donovan,
J. Am. Chem. Soc., 5», 936 (1931). — 5. L. C a-
v a 1 1 a r o, Gazz. chim. ital., 72, 217 (1942);
Вег., 76B, 663 (1943). — 6. P. Kremers,
Pogg. Ann., 97, 5 (1856). — 7. О.Н.Бреусов,
H. Й.Кашина, T. В.Ревзина, H. Г. Со-
болевская, ЖНХ, 12, 2240 (1967).—
8. T 1 m m e г m a n s, v. 3, 1960, p. 552. —
9. A. Benrath, F. GJedebo, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
211, 288 (1937).— 10. Se i de 1 1, v. 1, 1958,
p. 101.
И. Справочник по растворимости солевых
систем, 1961, стр. 2106. — 12. С. Ram me Is-
berg, Pogg. Ann., 44, 555 (1838). — 13. P. A. M e-
erburg, Z. anorg. Chem., 45, 324 (1905). —
14. R. St. Keefer, J. Am. Chem. Soc., 70,
476 (1948). — 15. J. F. Spencer, Z. phys,
Chem., 83, 293 (1913).
84
Иодаты металлов
второй группы
Ве(1Оз)2
Рис. 215.
Рис. 215 построен по данным [1]. Твер-
дой фазой в равновесии с раствором яв-
ляется Ве(Ю3)2-4Н2О.
Mg(IO8)2
Рис. 216.
Рис. 216 построен по данным [2]. Дан-
ные [3] не использованы. Особые точки:
Лед+Мг(1О3)Г10Н2О
Mg(IO8)a10HaO +
+ Mg(IO8)a-4Н2О
Mg(IO8), -4Н2О +
+ Mg(lO8)2
t, ®С
-0,36
13,3
57,5
С, %
3,18
(7,3)
13,1
Са(Юз)г
Рис. 217 построен по данным [4]. Дан-
ные [3] не использованы. Особые точки
[4] (см. также [5]):
t, °C с, %
Са(Ю8),-6Н2О +
+ Са(1О8)а-Н2О
Ca(IO8)t НаО + Са(1О3)2
35 0,48
57,5 0,62
Sr(lO3)2
Рис. 218 построен по данным [6]. Особые
точки [6] (см. также [5]):
t, °C C, %
Sr(IO8)a-6HaO + + Sr(IO8)a 6 ± 1 (0,12)
Sr(IO8)a-6HaO + + Sr(IO8)aHaO (мет.) 20,8 ± 0,5 (0,24)
Ва(10з)а
Рис. 219 построен по данным [7]. Твер-
дой фазой в равновесии с раствором яв-
ляется Ва(1О3)2-Н2О. Данные [8] не ис-
пользованы (см. также [5]).
Ва(Ю3)2
Рис. 220.
Рис. 220 построен по данным [9]. По-
видимому, представлена растворимость гид-
рата.
Иодаты Zn и Cd
Твердая фаза t, °C C, % Источ- ники
Zn(IO3)2 25 0,641 10
Zn(IO3)2-2H2O 15-18 0,801 11
Zn(IO3)2-2H2O 100 1,20 11
Cd(IO3)2 25 0,097 12
85
ЛИТЕРАТУРА
1. В. А. В и б е р, И. А. Н е й м а и, А. А. Б р а -
г ина, ЖОХ, 11, 864 (1941). — 2. А. Е. Hill.
S. М о 8 к о w 11 z* J. Am. Chem. Soc., 58, 943
(1931). — 8. G. Mylius, R. Funk, Wise.
Abh. Phys. Techn. Reich., 8, 446, 449 (1900). —
4. A. E. Hill, S. F. Brown, J. Am. Chem.
Soc., 58, 4319 (1931). — 5. J. Bousquet,
D. Mathurl n, P. V e г ma n de, Bull. Soc.
chim. France, 1969, 1111. — 6. W. F. Linke,
J. Am. Chem. Soc., 75, 5800 (1953). — 7. А.В.По
лесицкий, ДАН СССР, 4, 184 (1935). —
8. М. Т г a u t z, A. Anschiitz, z. phys.
Chem., 56, 241 (1906). — 9. А. Е. По лес иц-
ки й, П. Толмачев, ДАН СССР, 3, 320
(1936). — 10. J. Е. Ricci, G. J. Neese,
J. Am. Chem. Soc., 64, 2305 (1942).
11. C. Ram me Is berg, Pogg. Ann., 44,
564 (1888). — 12. F. S a e g u s a, J. Chem. -Soc.
Japan, 71, 223 (1950).
Иодаты металлов
третьей группы
Иодаты лантаноидов (при 25°)
Твердая фава* с«10*, г/л (4) | с 10», г/л [5]
La(IOa)3 Ge(IO3)a. Рг(Ю3)а Nd(IOa)a Sm(I03)a Еп(1Оа)а Gd(IOa)a ТЬ(Юз)з Ву(Юа)а - Но(Юа)а Ег(1Оа)а ад: 60,5 59,1 52,5 49,1 47,3 33,3: 40,5 43,8 48,4 66,4 ±' 0,1 73,3 ± 0,1 65,6 ± 0,1 54,7 ± 0,3 54,2 ± 0,4 62,1 ± 0,3 61,5 ± 0,1 68,8 ± 0,4 79,3 ± 0,2 96,8 ± 0,3 101 ± 0,4 115 ± 0,5
* Иодаты кристаллизуются из водных раство-
ров в виде гидратов.
1п(Юз)8
Растворимость 1п(1О3)а при 20° составляет
0,67 г!л [1] или 0,53 г!л [2].
ТПО8
Рис. 221.
Иодаты Th и U
Твердая фаза t, °C С, % Источ- ники
ТЦЮз)4 a-UO3(IOa)3-H3O 25 18 0,020 0,105 6 7
P-UO3(IOa)3H3O UO3(IOa)a -2Н3О 18 0,121 7
18 0,204 7
ЛИТЕРАТУРА
1. F. С, Mathers, С. G. Schlueder-
Ь е г g, J. Am. Chem. Soc., 80, 211 (1908).—
2. F. Ensslln, Z. anorg. Chem., 250, 199
(1942/1943). — 3. Seidell, v. 1,1958, p. 770$
v. 2, 1965, p. 1583. •*—4. Г. И. Васильев,
В. В. Серебренников, Труды Томского
гос. ун-та, 154, 103 (1962). — 5. F. Н. F Ir-
sch Ing, Т. R. Paul, J. Inorg. Nucl. Chem.,
28, 2414 (1966). — 6. G. S p a c u, P.Spacu,
Z. anal. Chem., 128, 226'(1948). — 7. P.Art-
m a n n, Z. anorg. Chem., 79, 333 (1913).
Иодаты металлов
других групп
Рис. 221 построен по данным [3].
Мп(1Оа)2
Растворимость Мп(Юа)3 при 3—90° по
данным [1] описывается уравнением: с —
= 0,229 + 0,0013t.
Y(IO3)3
Растворимость Y(IOa)a при 25° соста-
вляет 0,339 г!л [4] или 1,17 г/л [5]. Число
молекул воды в кристаллогидрате точно
не установлено.
Ре(10з)8
Согласно данным [2], Fe(IOa)a суще-
ствует в виде двух модификаций, раствори-
мость которых при 20° составляет соответ-
ственно 0,036 и 0,033%.
86
Co(IO3)2
Рис. 222 построен по данным [3]. Точка
Со(1Оа)3«2Н3О + Со(1Оа)3
—63°.
находится при
Ni(IO8)2
t’C
1001---—1---------,------
Ni (IO3)2, %
Рис. 223.
Рис. 223 построен по данным [3]. Точка
8-Ni (10з)з • 2Н2О 4-Ni (10з)з находится при
—74°.
Литература
1. А. М. Н а у в 8, D. S. М а г t i n Jr., J. Am.
Chem. Soc., 78, 4853 (1951). — 2. A. v. En-
d r 6 d y, Z. anorg. Chem., 217, 59 (1934).—
3. A. Me uss er, Ber., 34, 2435 (1901). J
МЕТАПЕРИОДАТЫ
НЮ4
г,°с
40
30
20
10
О
НЮ4,7о
Рис. 224.
Рис. 224 построен по данным [1]. Число
молекул воды в кристаллогидрате точно
не установлено. Указано, что прй 29,5°
происходит превращение, вид которого
также не определен. Uq данным [2], рас-
творимость НЮ4 при —20° составляет
53%. НЮ4 2НаО можно рассматривать как
кислоту Н6Юв.
NaI04
Рис. 225.
Рис. 225 построен по данным [3]. Пере-
ходная точка: (34,5°), (21,3%).
87
KIO(
Рис. 226 построен по данным [3]. Данные
[4] не использованы.
Ве(Ю4)2
Рис. 227.
Рис. 227 построен по данным [5]. Твер-
дой фазой в равновесии с раствором
является Ве(Ю4)2-8Н2О.
Метапериодаты Rb, Cs, NH4
Твердая фаза t, ec С, % Источ- ники
кыо4 13 0,65 4
СзЮ4 15 2,10 4
NH4IO4 16 2,63 4
ЛИТЕРАТУРА
1. Р. Р. Gyani, В. Р. Gyani, J. Indian
Chem. Soc., 26, 239 (1949).— 2. A. E. Hill,
J. Am. Chem. Soc., 50, 2678 (1928). —
3.A.E. Hill, J. Am. Chem. Soc., 50, 2678(1928).—
4. T. V. В а г к e r, J. Chem. Soc., 93, 16 (1908). —
5. В. А. Б и б e p, И. A. H e й м а н, А. А. Б p a -
г ина, ЖОХ, 11, 867 (1941).
ДРУГИЕ КИСЛОРОДСОДЕРЖАЩИЕ
СОЕДИНЕНИЯ ИОДА
Na2H3IOe
t°C
юо
80
60
40
20
NasH3IO6, %
Рис. 228.
Рис. 228 построен по данным [1].
К41аО9
Рис. 229.
88
Рис. 229 построен по данным [2]. Пере-
ходная точка: 78,0°, 61,7%. В работе [3]
изучена область кристаллизации льда до
—0,6°.
Ортопериодаты NH4 и Ag
и мезопериодаты Ag и Be
Твердая фаза t, °C с Исто- чники
Ортопериодаты
(NH4)2H3IOe 25 5,3 г/л 4
Ag2H3IOe 25 1,65% 5
М езопериодаты
Ag3IO6 18 0,25% 5
Ве3(1О6)2 12Н2О 25 0,01% 4
ЛИТЕРАТУРА
1. A. Rosenheim, Е. Loewentha,
Koll. Z., 25, 53 (1919). — 2. А. Е. Hill, J. Am.
Chem. Soc., 50, 2678 (1928). — 3. E. С о r n e c,
Ann. chim^ phys. (8), 30, 157 (1913). —4. M. D г a-
tovsk y, J. PreizkovA, Goll. Czech. Chem.
Comm., 2 8, 1280 (1963).— 5. B.Curt i,M. Co g-
giola, Gazz. chim. ital., 71, 487 (1941).
Ориентировочные значения
растворимости
кислородсодержащих
соединений иода
Соединение С. %
AgIO3 5-IO’3
HgIO3 5-10-5
Pb(IO3)2 2-Ю-з
ОКИСЛЫ, ГИДРООКИСИ, ПЕРЕКИСИ
окислы
А12О3
Ag2O
Данных по растворимости Ag2O много, од-
нако согласованности между ними нет.
Рис. 230 построен по данным [1—4] (кри-
вая 1) и [5] (кривая 2).
Переходные точки [6]:
А12О3-ЗН2О (гиббсит)+
+ А12О3-Н2О (бемит)
А12О3 Н2О (бемит) 4-
+ А12О3 Н2О (диаспор)
А12О3 Н2О (диаспор) + А12О3 (ко-
РУВД)
t, °C
155
280
450
Рис. 230.
Рис. 231.
Ав2О3
Рис. 231 построен по данным [7—11].
Данные [12—14] не использованы. По дан-
ным [15], растворимость аморфной модифи-
кации As2O3 при ~20о составляет 3,5%.
89
АаД
Рис. 232.
Рис. 232 построен по данным [16]. Осо-
бые точки:
. t, *с с, %
Лед + АзаО6 4НаО —59 31,7
АваО6-4Н.0 + 29,5 41,4
+ ЗАвД-5НаО
Окислы V, Nb, Та
Твердая фаза t. °C c 10», % Источ- ники
V.O, 25 7 17
V?o3 NbaOe • 100 17- 7 17,9 17 18
NbaO6 •• 17 6,0 18
NbaO6 ’• 17 0,96 18
Nba03 • 17 1,19 18
ТааОь • 17 1,62 18
TaaO3 ** 17 1,04 18
Та3О6 »• 17 0,45 18
Ta2<V » 17 0,15 18
* Свежеосажденная.
** Прокалена при 400°.
3* Прокалена при 800 е.
•4* Прокалена при 1000°.
СгОз
Рис. 233 построен по данным [19] в об-
ласти температур от —120 до 100° и данным
[20, 21] при температурах свыше 100°,
полученным в замкнутом объеме. Особые
точки:
t, °C с, %
Лед + СгО3-3,5НаО I -ИЗ I 57
СгОа-3,5НаО+ СгО, J -102 | 60
В работе [22] приведены данные по тем-
пературам кипения растворов СтО3. Уста-
новлено [23], что температура плавления
СгО3 изменяется от 180 До 202°. Это объяс-
няется заметным разложением соединения
еще в твердом состоянии до его плавления.
МоО&
Рис. 234 построен по данным [24].
0s04
Рис. 235 построен по данным [25—28].
RuO4
17, 1111 (1915/1916). — 10. E. Anderson,
L. G. Story, J. Am. Chem. Soc., 45, 1104 (1923).
11. L.Bruner, St. Tolloczko, Z. anorg.
Chem., 37, 456 (1903). — 12. M. R a g g, Farbe
u. Lack, 58, 435 (1950). — 13. J. K. Wood,
J. Chem. Soc., 98, 412 (1908). -li.W.Schnel-
1 b a c h, J. R о s 1 n, J. Am. Pharm. Assoc., 18,
1230 (1929). — 15. C. W 1 n k 1 e r, J. prakt.
Chem. (2), 81, 247 (1885). — 16. A. W. С. M ejn -
z i e s, P. D. Potter, J. Am. Chem. Soc., 34,
1452 (1912). — 17. J. M e у e r, M. Aullch,
Z. anorg. Chem., 194, 278 (1930). — 18. A. B. Ла-
fl и ц к и й, Л. А. П оспелов а, Е. П. Арта-
монов а, ЖНХ, 1, 650 (1956). — 19. G. V u 11 -
lard, С. г., 282, 2212 (1951); Ann. chim., 2, 233
(1957). — 20. R. К г е т a n n, Ber. Wien. Akad.,
120, 339 (1911).
21. Е. Н. В tie h пег, A. Prins, Z. phys.
Chem. 81, ИЗ (1913). — 22. J. Koppel.
R. Blumenthal, Z. anorg. Chem., 53, 228
(1907). — 23. T. В. Роде, Кислородные соеди-
нения хрома и хромовые катализаторы, Изд.
АН СССР, 1962, стр. 13. — 24. A. Rosen-
heim, I. Da vldsohn, Z. anorg. Chem., 87,
315 (1903). — 25. P. W. Squire, С. M. C a i -
ne s, Pharm. J. (London), 74, 720, 784 (1905). —
26. H. von Wartenberg, Ann., 440, 97
(1924). - 27. L. Tse hugae f f, A. J. L uka-
se h u k см. E. F r i t z m a n n, Z. anorg. Chem.,
172, 225 (1928). — 28. L. H. Anderson,
D.M. Y 0 s t, J. Am. Chem. Soc., 60, 1822(1938). —
29. H. R e m y, z. angew. Chem., 39, 1061 (1926).
Рис. 236 построен по данным [29]. Излом
при 25° (21,5 г/л) отвечает температуре
плавления твердой RuO4.
ЛИТЕРАТУРА
1. R. Р, Mathur. N. R. Dhar, Z. anorg.
Chem., 199, 391 (1931). — 2. H. T. Britton,
J. Chem. Soc., 127, 2962 (1925). — 3. E. L a u e,
Z. anorg. Chem., 185, 346, 363 (1927). —
4. Y. О lea, J. Chem. Soc. Japan, 61, 311 (1940). —
5. M. Л. Г а в p и ш, И. С. Г а л и и к е р, ЖНХ,
15,' 1979 (1970). — 6. A. W. Laubengauer,
R. 8. W е i s z, J. Am. Chem. Soc., 85, 247 (1943). —
7. А. В. G а г г е 11, О. Н о 1 т е s, A. L a u b е,
J. Am. Chem. Soc., 62, 2024 (1940). — 8. Е. J о -
zefowlcz, S. Witekowz, w. Lubran-
ska, Roczn. Chem., 24, 64 (1950).—
9. F. A, H. S c h г e 1 n e m a k e г s, W. c. de
Beat, Proc. Konink. nederl. akad. wet. (Amst.),
ГИДРООКИСИ
Гидроокиси металлов
первой группы и аммония
L1OH
Рис. 237.
Рис. 237 построен по данным [1, 2].
Данные [3] не использованы. Эвтектика:
-18,2°, 10,5% [4].
91
Рис. 238.
В работах [4, 8] даются значения бсобых
точек, несколько отличающиеся от приве-
денных. В работе [9] приведены данные по
температурам кипения растворов. Темпера-
тура кипения насыщенного раствора NaOH
314° [9].
КОН
Рис. 241 построен по данным работ [2,
4,10—13], полученными замкнутом объеме.
Особые точки:
t, °C С, % Источ- ники
Лед + КОН -4Н2О —62,8 30,9 10
КОН -4Н2О -33,5 43,8 4
КОН -4Н2О + -34,0 45,2 10
+ КОН-2Н2О КОН-2Н2О + 33 58,1 10
4- КОН-НаО КОН-Н2О 145 75,7 4
КОН Н2о + а-КОН 99 87 10
а-КОН + 0-КОН 248 93,3 13 .
0-КОН 404 100 4,13
Рис. 238 построен по данным [4, 5],
полученным в замкнутом объеме. Точка
LiOH-HaO + LiOH находится при 108,9°,
15,7% [4]. В работе [6] при температуре
413° (72%) констатируется превращение
а-LiOH + р-LiOH. Температура плавле-
ния LiOH 462° [6].
Авторы работы [10] указывают на суще-
ствование при —65,7° области кристалли-
зации КОН-5Н2О и при 85°— нового
соединения, состав которого не определен.
В работе [9] приведены данные по темпера-
турам кипения растворов.
NaOH
Рис. 239 (данные получены в замкнутом
объеме) и рис. 240 построены по данным
работы [7]. Особые точки:
t, °с с, %
Лед + NaOH-7Н.0 NaOH -7Н2О + NaOH -5Н2О —29,0 18,5
—24,0 22,3
NaOH -5Н2О + 4- а-NaOH-4HaO -18 24,7
а-NaOH -4HaO 4- 4- NaOH -3,5HaO 5,10 32,4
NaOH -3,5H2O 15,9 38,8
NaOH -3,5HaO 4~ 4- NaOH -2HaO 6,20 47,0
NaOH -2H2O 4- NaOH -H2O 12,9 50,5
NaOH-HaO 65 69,0
NaOH -H2O4- а-NaOH 62 75
а-NaOH 4- 0-NaOH 297 —
P-NaOH 321 100
Лед 4- NaOH -5HaO (мет.) —34 19,5
В-NaOH -4HaO (мет.) -1,30 35,7
Р-NaOH -4HaO 4- 4-NaOH-3H2O (мет.) -3,0 37
NaOH-3HaO (мет.) NaOH-3,511,0 4- + NaOH -HaO (мет.) 2,6 42
3,0 48,5
RbOH
Рис. 242 построен по данным работы [14],
полученным в замкнутом с точки: )бъеме. t, °c Особые С, %
Лед 4- RbOH -4Н2О —72,5 47,4
RbOH -4НаО 4- 4- RbOH -2Н2О -52,5 55,9
RbOH -2НаО 4- RbOH -Н2О 47 73,8
RbOH-HaO 145 85,0
RbOH-H2O4- 4- 3RbOH-H2O 95 90,6
3RbOH -HaO 4- а-RbOH 104 91,4
a-RbOH 4- Р-RbOH 235 95,5
Р-RbOH 380 100
Лед 4- RbOH -3H2O (мет.) —76,7 48,8
RbOH-3H2O4- 4- RbOH -2H2O (мет.) —57,0 55,5
CsOH
Рис. 243 построен по данным [15] \
и уточнен по данным [16], полученным
в замкнутом объеме. Состав твердой фазы
92
Рис. 239.
Рис. 240.
Рис. 241.
Рис. 242.
<2CsOH-H2O) установлен предположитель-
но. Особые точки [15]:
t, вс с, %
Лед + CsOH -ЗН.0 -73,5 57,6
CsOH -ЗНаО -5,5 73,5
С8ОН-ЗН.О + + СзОН-2НаО —15,5 77
CsOH -2Н-0 + + 2СзОН-ЗН2О 2,5 79,8
2СзОН -ЗН.0 4-CsOH НаО 10 80,4
CsOH НаО 226 89,3
CsOH НаО + 2CsOH НаО 167 95,2
2CsOHНаО 4- а-CsOH 150 96,2
«-CsOH 4- 0-CsOH 215
р-CsOH 346 100
NH3
Соединение NHa«HaO (NH4OH) рассма-
тривается здесь как гидроокись. Рис. 244
построен по данным работы [17] в области
от 0 до 60% NH» и работы [18] в области
от 60 до 100% NHa. Особые точки:
1, °C С, % Йсточ- ники
Лед 4- NH8-2HaO -98 32,9 17
NHa-2HaO4- 4- NHa HaO , -98,8 35,3 17
NH3HaO —79 48,6 17
NHa-H.O4- 4- NH3 0,5HaO -85,1 56,3 18
NHaO,5HaO —77,4 65,4 18
NHa-0,5Ha0 4- NHa —92,2 79,9 18
NH3 —76,5 100 18
Лед 4“ NH3-HaO (мет.) -103,3 33,9 17
Кривая кипения построена по данным
[19].
95
Рис. 244.
ЛИТЕРАТУРА
1. W. D i 11 m а г, J. Soc. Chem. Ind., 7, 731
(1888). — 2. S. U. P ic.kering, J. Chem. Soc.,
63, 909 (1893). — 3. В. Б. Ту л ин о в a,
Л. Г. Моржина, В. Е. Пл ющев, ЖНХ, 4,
1172 (1959). — 4. А.-Р. Rolle t, R. Cohen-
Ada d. Rev. chim. Miner., 1 451 (1964).—
5. E. F. Step ban, P. D. Miller, J. Chem.
Eng. Data, 7, 501 (1962). — 6. В. A. X и т p о в,
H. И. Хитрова, В. Ф. Хмельков, ЖОХ,
23, 1630 (1953). — 7. R. Cohen-Ada d,
A. Tranquard, R. Рёгоппе, Р. Negri,
А.-Р. Ro 1 let, С. г., 251, 2035 (I960).—
8. А. Tranquard, Rev. chim. Miner., 2, 435
(1965). — 9. G. Th. Gerlach, Chem. Ind.,
9. 241 (1886). — 10. R. Cohen-Ada d,
M. Michau d, C. r., 242, 2570 (1956).
11.. W. M. Vogel, K. J. Routsis’
V. J. К e h r e r, D. A. Landsman’
J. G. Tschinkel, J. Chem. Eng. Data, 12,
465 (1967). — 12. A. T. H и ж н и к, А. А. Ла-
сточкина, Укр. хим. ж., 18, 401 (1952).—
13. М. Michaud, С. г., 253, 1947 (1961).—
14. A. Rolle t, R. Cohen-Ada d, М. Mi-
ch a u d, A. T r a n q u a r d, C. r,, 246, 3251
(1958). — 15. A.-P. Rolle t, R. Cohen-
Ada d, C. F e r 1 i n, C. r., 256, 5580 (1963). —
16. R. С о h e n - A d a d, J.-C. F e r 1 i n,
A. Tranquard, Bull. Soc. chim. France,
1968. 71. — 17. G. Vuillard, Ann. chim.,
2, 233 (1957). — 18. К. E. Миронов, ЖОХ,
25, 1081 (1955). — 19. I. P о s t m a, Rec. trav.
chim., 39, 515 (1920).
Гидроокиси металлов
других групп
Са(ОН)2
Данных по растворимости Са(ОН)2 мно-
го, однако согласованности между ними
нет. Рис. 245 построен по данным [1—4],
полученным в замкнутом объеме. Эвтек-
тика: —0,116°, 0,172% [4].
Sr(OH)2
Данных по растворимости Sr(OH)2 много,
практически все они хорошо согласуются
[1]. Построенная по этим данным кривая 1
приведена на рис. 246. Эвтектика: —0,1°,
0,46% [5]. В работе [6] указывается на
существование Sr(OH)2-H2O и точки
Sr(OH)2-8H2O 4* Sr(OH)2-H2O при 85,1°,
14,3%. Кривая 2 на том же рисунке по-
строена по данным [7].
Ва(ОН)2
Данных по растворимости Ва(ОН)2 мно-
го, наиболее полно растворимость этой
гидроокиси изучена в работе [8]. Рис. 247
построен по данным этой работы, получен-
ным в замкнутом объеме. Особые точки:
Лед + Ва(ОН)2 -8НаО
Ва(ОН)2 -8Н2О
Ва(ОН)2 -8НаО +
+ Ва(ОН)2-ЗН2О
Ва(ОН)2-ЗН2О +
+ а-Ва(ОН)2 -Н2О
а-Ва(ОН)2-Н,0+
+ Р-Ва(ОН)2 Н2О
₽-Ва(ОН)2Н2О +
+ а-Ва(ОН)2
а-Ва(ОН)2 + ₽-Ва(ОН)2
t, °C с, %
—0,35 1,52
78,3 (54)
78 57,0
88 62,2
185 (83)
199 88,2
250 (90)
Рис. 248 построен по данным [7], полу-
ченным в замкнутом объеме и резко отли-
чающимся от данных [8].
7 Заказ 976
97
тюн
Рис. 249 построен по данным [9].
Гидроокиси Hg, Mo, Ru, Ir
Твердая фава t, °C с Источ- ники
Hg(OH). —20 —0,09% 10
МоО(ОН), ••и» —2 г/л 11
RuO2 -а:НаО —20 5 -10"10 моль]л 12
1гО2хНаО 20 2-10-4% 13
ЛИТЕ РАТУ PA
1. Справочник по растворимости солевых си-
стем, т. 4, 1963. — 2. R. В. Peppier,
L. S. Wells, J. Res. Nat. Bur. Stand. (NBS),
52, 85 (1954). — 3. I. H e г о 1 d, Z. Electrochem,.
11, 421 (1905). — 4. H. Bassett, J. Chem.
Soc., 1984, 1271; 1958, 2950. — 5. F. G u t hr le,
Phil. Mae. (5), 6, 36 (1878). — 6. W. R e 1 n d e r s,
A. Kllnkenberg, Rec. trav. chim. (4),
48, 1229 (1929k — 7. M. Л. Г а в p и ш, И. С. Г а -
линкер, Труды Харьковского с.-х. ин-та,
85, (72), 61 (1961); ЖФХ, 84, 2610 (I960).—
8. М. Michaud, С. г., 262, 1143 (1966).—
9. F. Bahr, Z. anorg. Chem., 71, 85 (1911).—
10. Y. Oka, J. Chem. Soc. Japan, 61, 311
(1940).
11. Р. К la son, Вег., 84, 150 (1901).
12. J. Brans tetr, M. Krlvdnek,
J. Vrest&l, Coll. Czech. Chem. Comm., 26,
2596 (1961). — 13. L. Moser, H. Hackho-
f e r, Monatsh., 59, 44 (1932).
ПЕРЕКИСИ
HgOj
Рис. 250 построен по данным [1—3].
Указывается на возможность полиморф-
ного превращения перекиси водорода
при —29° и 76,5% [2]. Особые точки:
1, °C С, % Источ- ники
Лед + Н2О»-2Н,О -52,5 46,1 1, 2
Н.Оа-2НаО —50,2 48,6 1, 2
НаОа -2НаО + Ц2Оа, —55,7 60,2 1, 2
наоа —0,461 99,6 3
В работах [4, 5] отмечено образование
твердых растворов. Однако в работах [1, 2
и 3] доказано их отсутствие.
Рис. 250.
99
Na2O2
Рис. 251 построен по данным [6]. Данные
{7] для 0° не совпадают с ними. Эвтектика:
(-4,8°), (6,8%) [6].
ВаО2
Растворимость ВаО2-8Н2О при —20°
составляет 0,09% [8].
ЛИТЕРАТУРА
1. К. Е. Миронов, А. Г. Бергман,
ДАН СССР, 81, 1081 (1951). — 2. К. Е.Миро-
н о в, Изв. СФХА АН СССР, 26, 215 (1955).—
3. W. Т. Foley, Р. A. GiguSre, Can. J.
Chem., 29, 123 (1951). — 4. Р. Giguere,
О. Maass Can. J. Res., 18, 68 (1940).—
5. О. Kubaschewski, W. Weber,
Z. Elektrochem., 54, 201 (1950). — 6. К. E. Ми-
ро н о в, ЖНХ, 10, 531 (1965). — 7. С. 3. М а -
каров, Н. К. Григорьева, Изв.
АН СССР. ОХН, 1955, 19. — 8. G m е 1 i п,
Bd. 30, 1932, 8. 104.
Ориентировочные значения
растворимости окислов,
гидроокисей и перекисей
Соединение c, % Соединение C, %
Си2О 1-10-8 Ce(0H)3 8-10"8
Ag2O 3-10'3 Pr(OH)3 4-10"8
HgO 5-IO"3 Nd(OH)3 5-Ю’8
А12О3 1 IO"* Sm(OH)3 4-10" 8
и308 4-IO"3 Ме(ОН)Г 1 -IO"8
РЬО 2-IO"3 Th(OH)4 1 -10-7
ню2 2-10-® PaO(OH)3 1-10-4
ьЬ2о3 2-IO"3 UO2(OH)2 3-10"8
Sb2O4 4-10-e Sn(OH)2 3 • IO'8
Bi2O3 4-10“ 8 Pb(OH)3* 1 -10-4
NiO 1-IO"* Pb(OH)4 7-IQ-13
Cu(OH)2 5 IO’* Zr(OH)4 iio-»
Au(OH)3 8-IO"8 BiO(OH) 1-10-4
Be(OH)2 4-10"8 Bi(OH)3 1-10-4
Mg(OH)2 2-Ю-3 Po(OH)4 IIO"3
Zn(OH)2 3-10-4 Cr(OH)3 1-10-7
Cd(OH)2 ЗЮ"* Mn(OH)5 3-10’4
HgOH 2-10-7 Fe(OH)2 6-10-4
Ga(OH)3 7-Ю"» Fe(OH)3 З-10-о
In(OH)3 4-10-8 Co(OH)2 2-10-4
T1(OH)3 3-10-8 Co(OH)3 3-10-4
Sc(OH)3 1-10-7 Ni(OH)2 1-10-4
Me(OH)J 2-IO"8 Ag2O2 1 -IO"3
La(OH)3 2-10-4 UO4-2H2O 5-10-4
* Me—Y, Eu, Gd, Ег.
** Me—Tm, Yb, Lu.
•* По данным J. Sehnal [С. г., 148, 1394 (1909)
растворимость Pb(OH)t составляет 1,6«10~*%1
[СЕРУ СО ДЕРЖАЩИЕ СОЕДИНЕНИЯ
СУЛЬФИДЫ
H2s
Диаграмма кипения водного раствора
H8S (рис. 252) построена по данным [1—7].
Данные [8, 9] не использованы.
Na2S
Рис. 253 построен по данным [10, 11],
полученным в замкнутом объеме. Особые
точки [10]:
t, °C c, %
Лед + Na2S-9H2O -9 8
Na2S-9H2O + 49 (26,6)
+ Na2S-5H2O Na2S -5H2O 97 (47)
Na2S-5H2O + 83 60
+ Na2S -0,5H2O Na2S-0,5H2O + Na2S 88 (61,6)
Кривая кипения построена по данным
[10|: Температура кипения насыщенного
раствора 190°, концентрация (76%) [10].
100
Рис. 252.
Рис. 253.
BaS
Рис. 255.
Рис. 255 построен по данным [13]. Дан-
ные [12, 13] выше 90° не использованы.
Твердой фазой в равновесии с раствором
является BaS-6H2O.
Sr(SH)a
Рис. 254 построен по данным [12]. Твер-
дой фазой в равновесии с раствором яв-
ляется Sr(SH)2-4H2O. Выше 60° начинает-
ся разложение соли.
Ba(SH)2
Рис. 256 построен по данным [12]. Твер-
дой фазой в равновесии с раствором яв-
ляется Ba(SH)2«4H2O.
101
ГИПОСУЛЬФИТЫ
Nagsgon
Рис. 257.
Сульфиды Na, К, Са, Т1
Твердая фаза t, °C C, % Источ- ники
NaHS 20 42 14
K8S*5H8O 20 38,8 15
CaS 20 2,1240-a ' 16
TlaS 20 2,15 40-8 17
Количественные данные по растворимости
гипосульфитов имеются только для NaaS2O4
[1, 2] (рис. 257). Особые точки [2]:
t, °с с, %
Лед+Na8SaO4-2H,O I —4,6 1 16,0
NaaSaO4-2H,O + Na2S8O4 | 52 J 21,8
ЛИТЕ РАТУРА
1. J. М е у е г, Z. anorg. Chem., 34, 17 (1903). —
2. К. Jelllnek, Z. anorg. Chem., 70, 119
(1911).
СУЛЬФИТЫ
Na2SO8
ЛИТЕРАТУРА
1. G. Fa user, Math. Naturwis.. Ber. aus
Ungarn, 6, 158 (1888); Ref. Chem. Zbl., 1, 754
(1889). — 2. L. W. Wink ler, 2. phys. Chem.,
55, 350 (1906). — 3. L. W. Winkler, Mathe-
matikai 6s Termdszettudomdnyi Ertesito (Buda-
pest), 25, 86 (1907). — 4. F. P о 1 1 11 z e r,
Z. anorg. Chem., 64, 145 (1909). — 5. I. Ken-
dall, L. Andrews, J. Am. Chem. Soc.,
43, 1549 (1921). — 6. A. К iss, L. L a 11 a 1,
G. Thury, Z. anorg. Chem., 231, 348 (1937). —
7. А. Ф. К а п у ст ин с к и й, Б. И. А н в a e p,
ДАН СССР, 30, 020 (1941). — 8. R. de Fore-
rand, Fonzes-Diacon, Ann. chim.
ЙУ8. (7), 26, 267 (1902). — 9. F. E. S c h e f f e r,
oc. fleet. Sol.. Amsterdam, 14, 198 (1911);
Z. phys. Chem., 84, 741 (1913). — 10. H. И. Ко-
пы л о в, ЖНХ, 13, 529 (1968).
И. A. Saufourche, A. Liebaut;
Bull. Soc. chim., France (4), 31, 968 (1922). —
12 E. T e r r e s, К. В г й c k n e r, Z. Elektro-
chem., 26, 14 (1920). — 13. С. C h о г о w e r,
An. Soc. espan. fis. quim., 37, 533 (1941). —
14. Д. В. Безуглый, Ф. M. К у ц а к о в,
ЖХП, 16, № 8, 37 (1939). — 15. И. И. Анге-
лов. Г. Н. Пятницкая, Труды ИРЕА,
22, 163 (1958). — 16. Е. Rie sente Id,
Н. Feld. Z. anorg. Chem., lie, 214 (1921).—
17. W. В о 11 g e r, Z. phys. Chem., 46, 521 (1903).
102
Рис. 258 построен по данным [1—9].
Особые точки: .
t, °C с, % Источ-
ники
Лед 4- NaaSO3-7HaO —3,51 11,1 8
Na.S03-7HaO + 33,4 28,0 9
+ NaaSO3
Температура кипения насыщенного рас-
твора 105° [5].
Рис. 259 построен по данным [10], полу-
ченным в замкнутом объеме.
Рис. 260 построен по данным [1, 7, 11,
12]. Данные [13] не использованы. Эвтек-
тика: —45,5°, 51,0% [1]. Температура
кипения насыщенного раствора 103°, кон-
центрация (55%) [5].
KHSO3
K2SO8
Рис. 262.
Рис. 261 построен по данным [14].
(NH^sSOg
(NH4)xSO3, %
Вис. 262 построен по данным [15, 16].
Особые точки [16]:
Лед + (NH4)aS03HaO
(NH4).SO8-H.O +
+ (NH4)aSO3
t, °C
—13,0
80,8
С, %
28,9
(60)
103
MgSO3
Рис. 263.
Рис. 263 построен по данным [17]. Пере-
ходная точка: 40°, (43%).
Сульфиты Zn, Tl, U
ПИРОСУЛЬФИТЫ
Рис. 264.
Рис. 264 построен по данным [1, 2].
Особые точки [1]:
Твердая фаза t, °C с Источ- ники
ZnSO3-2H2O 0,13% 18
TI.SO3 15,5 3,23% 19
UO2SO8-4,5Н2О 25 1,81 г/л 20
Лед+ NajSjOj-THjO
Na2S2O5-7H2O-|-Na2S2O5
Лед + Na2S2O6 -6Н2О (мет.)
t, °с
-9,1
5,5
—9,7
С, %
23,5
(38)
24,2
ЛИТЕРАТУРА
1. F. Foerster, А. В rose he, С. Nor-
berg-Schulz, Z. phys. Chem., 110, 435
(1924). — 2. N. B. L e w 1 в, A. C. R i v e 11,
J. Chem, Soc., 125, 1160 (1924). — 3. D.L.Ham-
m lek, I. A. Curr let J. Chem. Soc., 127, 1623
(1925).— 4. K. A. Kobe, К. C. Hellwig,
Ind. Eng. Chem., 47, 1117 (1955). — 5. P. К г e -
mere, Pogg. Ann., 99, 50 (1856). — 6. К. A r i i,
Sci. Rep. TChoky Imp. Univ., 21, 786 (1932). —
7. Г. С. Клебанов, H. А. Остапкевич,
ЖНХ, 5, 2329 (I960). — 8. H. Hartley,
W. Barrett, J. Chem. Soc., 95, 1178 (1909). —
9. Б. Ф. Марков, Укр. хим. ж., 23, 706
(1957). — 10. И. М. Р о д н я н с к и й, И. С. Га -
линкер, Труды Харьковского с.-х. ин-та,
35, 69 (1961).
11. К. В а г t h, Z. phys. Chem., 9, 185 (1892). —
12. P. Ginnings, D. Robbins, J. Am.
Chem. Soc., 52, 2282 (1930).— 13. F. H б 1 z 1,
Z. Elektrochem., 43, 302 (1937). — 14. J. Platt,
D. Hydaon, J. Soc. Dyers Colourists, 42, 348
(1926). — 15. F. Ishikawa, T. Murooka,
Bull. Inst. Phys. Chem. Res., 7, 1167 (1928). —
16. H. А. Василенко, ЖПХ, 23, 472
(1950). — 17. H. Haglsawa, Sci. Rep. T0-
hoku imp. Univ., 23, 184 (1934). — 18. Hous-
ton, Trichborne, Brit. Med. J., 1890,
1063. — 19. K. S e u b e r t, M. E 11 e n, Z. anorg.
Chem., 2, 434 (1892). — 20. Г. А. Йо ленни-
ков a, К. Ф. Кудинова, ЖНХ, в, 1520
(1961).
K2S2O5
Рис. 265.
104
Рис. 265 построен по данным [1]. Особые
точки:
t, °c c, %
t, °с с, %
Лед + K2S2O6-2/3H2O —5,5 19,2
K2s2oB-2/3Hao 4- (5) (23,8)
+ K2s2oB Лед 4-K2S2O6 (мет.) -5,6 19,5
(NH4)2S2O6
Рис. 266.
Лед 4~ H2SO4 -6Н2О
H2SO4-6HaO +
+ HaSO4-4HaO
H2SO4 -4Н2О
H2SO4 -4НаО +
+ H2SO4-3H2O
H2SO4-3H2O-H
+ HaSO4-2H2O
HaSO4-2H2O
HaSO4-2H2O +
4- HaSO4 HaO
H2SO4HaO
H2SO4HaO 4- H2SO4
HaSO4
Лед 4~ HaSO4 -4H2O (мет.)
H2SO4-4HaO4-
4- H2SO4-2HaO (мет.)
H2SO4 -3HaO 4-
4~ H2SO4 H2O (мет.)
—62
—53,7
-28,4
—36,6
—42,7
35,9
42,6
57,2
64,7
69,5
—39,5 73,1
—39,9 73,6
8,56
34,9
10,4
—73,1
—47,5
—52,9
84,5
94,2
100
37,6
67,8
72,5
Диаграмма кипения водного раствора
H2SO4 (рис. 268) построена по данным [5].
Азеотропная точка: 338,8°, 98,3%.
ЛИТЕРАТУРА
1. С. М. G a b 1 е, Н. F. В е t z, S. Н. М а г о п,
J. Am. Chem. Soc., 72, 1445 (1950). — 2. G. V u i 1 -
lard, Bull. Soc. chim. France, 1954, . 802; Ann.
chim., 2, 268 (1957). — 3. R. J. Gillespie,
J. Chem. Soc., 1950, 2493. — 4. J. E. Kunz-
1 e r, W. F. Giauque, J. Am. Chem. Soc.,
74, 5271 (1952). — 5. Г. П. Лучинский,
ЖФХ, 30, 1207 (1956).
Рис. 266 построен по данным [3—6].
Эвтектика: (—31°), (55%) [3]. По данным
[4], твердой фазой в равновесии с раство-
ром является NH4HSO8, а по данным
[6] — (NH4)2S2O6. Василенко [3] опреде-
лил состав твердой фазы при 0, 20 и 30°
и установил, что это (NH4)2S2O6.
ЛИТЕРАТУРА
1. F. Foerster, A. Brosche, С. Nor-
berg-Schulz, Z. phys. Chem., 110, 466
(1924). — 2. К. Arii, Sci. Rep. TOhoku Imp.
Univ., 21. 786 (1932). — 3. H. А. Василен-
ко, ЖПХ, 21, 917 (1948). — 4. E. T e r r e s,
E. Hahn, Gas-Wasserfach, 70, 391 (1927).—
5. E. T e r r e s, A. H e i n s e n, Gas-Wasser-
fach, 70, 1160 (1927). — 6. F. Ishikawa,
H. H a g 1 s a w a, Sci. Rep. TOhoku Imp. Univ.,
1, 22, 241 (1933).
СУЛЬФАТЫ
H2SO4
f Рис. 267 построен по данным [1—4].
Особые точки [1]:
Сульфаты металлов
первой группы и аммония
Li2SO4
Рис. 269 построен по данным [1—8].
Эвтектика: —22,9°, 27,2% [8]. Кривая ки-
пения построена по данным [9]. Темпера-
тура кипения насыщенного раствора
(102,5°), концентрация (23,6%).
Рис. 270 построен по данным [4, 10],
полученным в замкнутом объеме. Переход-
ная точка: ~233°, ~23% [4].
Na2SO4
Данных по растворимости Na2SO4 много,
практически все они хорошо согласуются
[И]. Построенная по этим данным диа-
грамма приведена на рис. 271. Особые
точки:
t, °C c, %
Лед 4- Na2SO4-10H»O Na2SO4-10HaO 4- Na2SO< —1,2 4,0
32,4 33,3
Лед 4- Na2SO4-7H2O (мет.) Na2SO4-7H2O 4- Na2SO4 (мет.) —3,6 12,7
24,0 34,2
105
Рис. 267.
Рис. 268.
Рис. 269.
106
Рис. 270.
Рис. 271.
Кривая кипения (рис. 271) построена по
данным [12,13]. Температура кипения на-
сыщенного раствора 102,9s, концентрация
(30%) [14].
Переходная точка , по данным, получен-
ным в замкнутом объеме (рис. 272): 235°,
Рис. 272.
31,7% [11]. Указывается также на другие
полиморфные превращения при высоких
температурах (выше 100°) [15—18].
NaHSO4
Растворимость NaHS04 при 25 и 100°
составляет соответственно 22,2 и 33% [11].
Рис. 273.
Данных по растворимости KsSO4 много,
практически все они хорошо согласуются,
за исключением области низких темпера-
тур [11]. До 1950 г. считалось, что K#S04
кристаллизуется в виде безводной соли.
107
В работе [19] обнаружен K2SO4«HtO.
Особые точки (рис. 273) по данным [11]:
Лед Ч- K2SO4 НлО
K2SO4H2O + K2SO4
Лед + K2SO4 (мет.)
t, °C с, %
—1,6 6,5
9,7 8,47
—1,9 7,3
Температуры кипения растворов K2SO4
приводятся в работе [12]. Температура ки-
пения насыщенного раствора 101,4°, кон-
центрация (20%) [14].
Рис. 274 построен по данным [11], полу-
ченным в замкнутом объеме.
' Рис. 274.
Рис. 275 построен по данным [20—23].
Область льда изучена в работе [1]. Темпе-
ратура кипения насыщенного раствора
103,5°, концентрация 45,3%. [14].
108
Cs2SO4
Рис. 276.
Рис. 276 построен по данным [1, 20, 24],
а рис. 277 — по данным [25], полученным
в замкнутом объеме. Температура кипения
насыщенного раствора 110°, концентрация
69,4% [14].
(NH4)2SO4
Наиболее полно растворимость (NH4) 2SO4
изучена в работах [26—30], по данным
которых построен рис. 278. Эвтектика:
—19°, 39,5% [31]. Кривая кипения по
Рис. 278.
строена по данным [12]. Температура кипе-
ния насыщенного раствора (107,5°), кон-
центрация (51%).
Рис. 279 построен по данным [32], полу-
ченным в замкнутом объеме.
NH4HSO4
Рис. 280.
Рис. 279.
Рис. 280 построен по данным [33].
CuSO4
Данных по растворимости CuSO4 много,
большинство из них хорошо согласуется
[И ]. Построенная по этим данным диаграм-
ма приведена на рис. 281. Особые точки:
Лед +
-1- a-CuSO4 -5Н2О
a-CuSO4-5H2O +
-|- p-GuSO4 -5H2O
P-CuSO4-5НгО-b
+ CuSO4-3H2O
i, °C c, % Источ-
ники
-1,5 12,3 11
56,0 (27) 34
96,0 43,4 11
Кривая кипения построена по данным
[12, 35]. Температура1 кипения насыщенно-
го раствора CuSO4 (104°), концентрация
(43,8%). Указывается [36, 37] на существо-
вание CuSO.-4H2O с точкой перехода
CuSO4«5H2O + CuSO4.4H2O при 95° [36].
Рис. 282 построен по данным [11], полу-
ченным в замкнутом объеме. Переходная
точка: 150°, 45,2%.
Ag2SO4
Наиболее полно растворимость AggSO*
изучена в работах [38, 39], по данным
которых построен рис. 283. Имеются неко-
торые данные о растворимости Ag2SO4 при
температуре свыше 100° [40].
109
Рис. 281.
Рис. 282. ' ' Рис. 283.
НО
ЛИТЕРАТУРА
1. Ф. Дрейер, Изв. Политехи, ин-та, 14,
229 (1910). — 2. J. A. F г 1 е n d, J. Chem, Soc.,
1929, 2332. — 3. М. Applebey, F. Craw-
ford, К. G о г d о n, J. Chem. Soc., 1984,1666. —
4. A. N. Campbell, J. Am. Chem. Soc.,
85, 2269 (1943).— 5. A. I n d e 111, Ricerca
Sci., 28, 2262 (1953).— 6. В. E. Плющев,
В. В. Ту л ин о в а, Научн. дЬкл. высшей
школы. Химия и хим. технол., 1, 11 (1956).—
7. В. В. Туликова, Л. Г. М о р ж ин а,
В. Е. Плющев, ЖНХ, 4, 1172(1959).—
8. X у К э-Юань, ЖНХ, 4, 1912 (1959).—
9. S. М. Johnston, Proc. Roy. Soc., Edinb.,
45, 193. 855 (1906). — 10. В. M. E л e н e в с к а я.
М. И. Ь а в и ч, ЖНХ, 6, 2380 (1961).
11. Справочник по растворимости солевых
систем, т. 3, 1961; т. 4, 1963. — 12. G. Т. Ger-
lach, Chem. Ind., 9, 241 (1886). — 13. Н. Ger-
lach, Caliche, 8, 298 (1926). — 14. E. Ber-
keley, M. P. A p p 1 e b e y, Pro<?. Roy. Soc.,
85A, 489 (1911). — 15. P. С. К race k, J. Phys.
Chem,. 88, 1291 (1929). — 16. F. С. Кгаиек,
R.E. Gibson, J. Phys. Chem., 84, 197 (1930). —
17. D. R. D a s g u p t a, Proc. Nat. Inst. Sci.
India (A), 21, 170 (1955). — 18. H.S. van Klo-
ster, t. anorg. Chem., 85, 53 (1913).—
19. M. П. Шульгина, О. С. Харчу.к,
О. К. Я н а т ь е в а, ДАН СССР, 78, 507(1950). —
20. Е. Berkeley, Phil. Trans. Roy. Soc.,
208A, 210 (1904).
21. A. E t a r d, Ann. chim. (7), 2, 550 (1894);
C. r., 108. 741 (1888). — 22. F. Zambonini,
V. Caglioti, Attl Accad. Line. (6), 5, 634
(1927). — 23. C. Calvo. E. Simons, J. Am.
Chem. Soc., 74, 1203 (1952). — 24. W. C. von
D о h 1 e n. E. L. Simons, J. Am. Chem. Soc.,
78, 461 (1951). — 25. E. V. Jo n e 8, M. H. L 1 -
e t z k e, W. L. Marshall, J. Am. Chem.
Soc., 79, 269 (1957). — 26. W. H. Ro debush,
J. Am. Chem. Soc., 40, 1204 (1918). —
27. F. Ishikawa, T. Mu rook a, Bull.
Inst. Phys. Chem. Res. Japan, 8, 77 (1929); Sci;
Rep. Tohoku Imp. Univ., 1, 22, 201 (1933). —
28. А. Г. Бергман, M. Л. Шолокович,
ЖПХ, 15, 187 (1942). — 29. H. А. Васи-
ленко, ЖПХ, 21,917 (1948). — 30. А.Г.Тре-
щ о в, Докл. Моск. с.-х. акад. им. Тимиря-
зева, вып. 32, 497 (1958).
31. А Г. Бергман, Р. Таштемиров,
ЖПХ, 40, 2064 (1967). — 32. А. В е n г a t h,
F. Gjedebo, В. Schiffers, H. Wun-
der 1 ic h, Z. anorg. Chem., 281, 285 (1937). —
33. E. Те r r e s, w. Schmidt, Gas-Wasser-
fach, 70, 764 (1927). — 34. E. Cohen, Z. phys.
Chem,, 81, 164 (189v). — 35. L. К a h 1 e n b e r g,
J. Phys. Chem., 5, 339 (1901). — 36. О. А. Ко-
сякина, Уч. зап. Ярославского гос. нед. ин-та,
вып. 24 (34), 11 (19э8). — 37. Л. Г. Берг,
А. В. Николаев, Изв. АН СССР. ОХН,
1940, 866. — 38. М. В а г г е, Ann. chim. phys.
(8), 24, 145 (1911).— 39. Е. L. Simons,
J. E. R icc 1, J. Am. Chem. Soc., 88, 1414, 2195
(1946).— 40. M. H. L 1 e t z k e, R. W. S t о u gh-
t о n, J'. Am. Chem. Soc., 78, 3023 (1956).
Сульфаты металлов
второй группы
Лед + BeSO4 -5НаО
BeSO4-5HaO +
+ BeSO4 -4H2O
BeSO4 -4H.0 + BeSO4 -H?O
Лед+ BeSO4-4H2O (мет.)
BeSO4 -4HaO +
+ BeSO4 -2HaO (мет.)
f, ®с С, %
-18,5 24,0
—16,4 25,0
76 39,0
-21,5 24,8
88,4 42,6
Кроме того, известны переходные точки:
t, °C \ % I Сеточ- ники
BeSO4 -2Н2О + + BeSO4-H2O 158 — 2
BeSO4 -2НаО + + BeSO4H2O 270 — 3
BeSO4 ’НгО -f- BeSO4 BeSO4 -6H2O + 4“ BeSO4-2H2O (мет.) 220 — 4
77,4 45,0 2
По данным [3], существуют а-, Р- и у-
формы BeS04, причем а В при 588°,
Р - у при 639°.
MgSO4
Данных по растворимости MgSO4 много.
Рис. 285 построен по данным [4]. Особые
точки:
t, °C C, %
Лед + MgSO4-12HaO (—4,8) (18,6)
MgSO4 12HaO + + a-MgSO4 -7HaO 1.8 21,1
a-MgSO4 -7HaO + + MgSO4-6H2O 48,1 33,1
MgSO4 • 6H2O+MgSO4 • H2O 70 37,2
Лед+ + a-MgSO4 -7HaO , (мет.) -5,2 19,4
Лед + + p-MgSO4-7H2O (мет.) —8,0 24
B-MgSO4 -7HaO + + MgSO4-6H2O (мет.) : (21) (30,3)
MgSO4-5HaO + + MgSO4-4H2O (мет.) 80 39
BeSO4
Рис. 284 построен по данным работы [1],
Особые точки:
Кривая кипения построена по данным
[5, 6]. Температура кипения насыщенного
раствора 104°, концентрация 40,8% [7].
Рис. 286 построен по данным [4], полу-
ченным в замкнутом объеме.
111
t,c
CaSO4
Сульфат кальция характеризуется нали-
чием нескольких модификаций: ангидрит
(а- иУ р-СаЗОД полуводный гидрат (а-
и JJ-CaS04«0,5H20), гипс (а- и p-CaSO4 ♦
• 2Н2О). Есть сведения о существовании
и других модификаций [8].
Рис. 288.
Рис. 287.
Рис. 287 построен по данным [4]. Пере-
f ходная точка: (40°), (0,210%).
На рис. 288 дана растворимость мета-
' стабильных форм по данным [9—11].
' Рис. 289 построен по данным [4], полу-
ченным в замкнутом объеме.
SrSO4
Данные по растворимости SrSO4 разно-
речивы. Рис. 290 построен по данным [12]
и отдельным данным работы [13].
Рис. 291 построен по данным тех же ра-
бот, полученным в замкнутом объеме.
8 Заказ 976
113
Рис. 290.
Рис. 291.
ZnSO4
Данных по растворимости ZnSO4 много.
Рис. 292 построен по данным [4, 13—15].
Особые точки [4]:
t, ec C, %
Лед+ ZnSO4-7HaO —6,7 27,8
ZnSO4-7H«O+ 4 + ZnSO4-6HaO 38 40,9
ZnSO4-6HaO + + ZnSO4-H.O 51,5 43,8
ZnSO4-6HaO + + ZnSO4*2HaO (мет.) 55 44,2
ZnSO4-6HaO + + ZnSO4-4HaO (мет.) 63 46,4
Кривая кипения построена по данным
[6]. Температура кипения насыщенного
раствора (103°), концентрация (37%).
Рис. 293 построен rio данным [16, 17],
полученным в замкнутом объеме.
CdSO*
Рио. 294 построен по данным [4]. Особые
точки: t, °C c, % _
Лед + CdSO4-8/3HaO —16,8 43,0
CdS04 -8/3H2O + a-CdSO4-HaO 43,5 44,2
a-CdSO4HaO + 74,5 41,0 «
+ 6-CdSO4*H2O Лед-f- CdSO4-7HaO (мет.) -18. 43,8 \
114
1
Рис. 294.
Кривая кипения построена по данным [6].
Температура кипения насыщенного рас-
твора (101,5°), концентрация (36,5%).
Рис. 295 построен по данным [17; 18],
полученным в замкнутом объеме. Переход-
ная точка: 113°, 34,5% [4].
(1966). — 4. Справочник по растворимости соле-
вых систем, т. 4, 1963. — 5. G. Th. Gerlach,
Chem. Ind., 9, 241 (1886).— 6. L. Kahle n-
b e r g, J. Phys. Chem., 5, 339 (1901).—
7. В. П. Ильинский, А. Ф. Сагайдач-
ный, Л. К. M op д б e p г, Труды ВНИИГ,
1932. — 8. И. А. перидерий, Высокопроч-
ный гипс, Куйбышев, I960. — 9. Е. Р о s n j а к,
Am. J. Sci. (5), 85А, 247 (1938). — 10. U. S b о г -
g 1, С. В 1 а п с hi fcGazz. chim. ital., 70, 823
(1940).
И. А. Б. Зд ано вский, Ф. П. Спири-
донов, ЖНХ, 11, 20 (1966). — 12. G. S t г U -
b е 1, Neues Jahrber. Mineral., Monatsh., Nt 4,
99 (1966).— 13. L. C. Copeland,
O. A. Short, J. Am. Chem. Soc., 62, 3286
(1940). — 14. R. Ro hmer, C. r., 210, 670
(1940). — 15. А. Г. Бергман, К. Су лай-
манкулов, ЖНХ, 2, 2813 (1957).—
16. А. В е n г a t h, Z. anorg. Chem., 247, 147
(1941). — 17. E. V. J о n e s, M. H. L 1 e t z k e,
w. L. M a r s h a 11, J. Am. Chem. Soc., 79, 269
(1957). — 18. A. Benrath, F. Gjedebo,
B. Schiffer s, H. Wunderlich, Z. anorg.
Chem., 231, 296 (1937).
Сульфаты металлов
третьей группы
A12(SO4)3
Рис. 296.
ЛИТЕРАТУРА
1. R.Rohmer, Bull. Soc. chim. France (5),
10, 468 (1943). — 2. M. Le vi-Ma Ivano,
Z. anorg. Chem., 48, 449 (1906).— 3. I. J. В e a r,
A. G. Turnbull, Austr. J. Chem., 19, 751
8*
Рис. 296 построен по данным [1—4].
Данные [5—9] не использованы. Эвтектика:
-12,0°, 27,2% [4].
115
TlaSO4
Рис. 297.
Рис. 299.
T12SO4, %
Рис. 298.
Рис. 300.
Данных по растворимости TlaSO4 много,
практически все они хорошо согласуются.
Рис. 297 построен по данным [10—13].
Температура кипения насыщенного рас-
твора 100,3°, концентрация (16%) [14].
Рис. 298 построен по данным [15], полу-
ченным в замкнутом объеме. Температура
расслаивания 359°, концентрация 37—76%.
Ya(SO4)8
Рис. 299 построен по данным [16—18].
Твердой фазой в равновесии с раствором
является Y2(SO4)8-8H2O.
Рис. 300 построен по данным [19], полу-
ченным в замкнутом объеме.
Las(SO4)s
Рис. 301 построен по данным [18—20].
Данные [21, 22] не использованы. Твердой
фазой в равновесии с раствором является
La2(SO4)8«9H2O.
Ce2(SO4)8
Рис. 302 построен по данным [23, 24].
Данные [25, 26] не использованы. Точка
<X(SO4)8-9H2O + Ce2(SO4)8-8H2O нахо-
дится при 30,4°, (6,8%) [24].
Pr2(SO4)8
Рис. 303 построен по данным [17, 18,
20, 26].
116
8*
117
Nd2(SO4)8
Рис. 304*
Рис. 304 построен по данным [17, 27].
Данные [18, 20] не использованы. При 0°
твердой фазой в равновесии с раствором
является Nd2(SO4)3*15H2O, растворимость
которого составляет 11,4% [27].
Gd2(SO4)3
Рис. 305.
Рис. 305 построен по данным [17, 28].
Данные [18, 22, 29] не использованы. Твер-
дой фазой в равновесии с раствором яв-
ляется Gd2(SO4)3«8H2O.
Рис. 306.
Th(SO4)2
Рис. 307 построен по данным [21, 22,
25, 31-35].
Yb2(SO4)3
Рис. 306 построен по данным . [17, 18,
30]. Твердой фазой в равновесии с раство-
ром является Yb2(SO4)3-8H2O.
118
Ш5О«)г. %
Рис. 307.
U(SO4)2
Рис. 308 построен по данным [36].
Рис. 308.
Сульфаты In, Sc, Sm,Eu, Th, Dy, Ho, Er,
Tm, Lu
UO2SO4
Рис. 309.
Рис. 309 построен по данным [37—39],
полученным в замкнутом объеме. ''Особые
точки [39]:
Лед+ UO2SO4-3H2O
UO2SO4-3H2O +
+ UO2SO4-H2O
t, °c
—38,5
181
С. %
58,4
76
Температура расслаивания 374° [38].
Твердая фаза
In2(SO4)3-5H2O
Sc2(SO4)3-5H2O
Sm2(SO4)3-8H2O
Sm2(SO4)3 -8H2Q
Sm2(SO4)3-8H2O
Sm2(SO4)3-8H2O
Eu2(SO4)3-8H2O
Eu2/SO4)3-8H2O
Tb2(SO4 з • 8H2O
Tb2(SO4)3-8H2O
Dy2 SO4)3-8H2O
By2/SO4)3 -8H2O
Dy2 SO4)3-8H2O
Ho2JSO4)3-8H2O
Ho2 SO4)3 -8H2O
Ho2(SO4)3-8H2O
Ho2(SO4)3-8H2O
Er2(SO4)3-8H2O
Er2(SO4)3-8H2O
Er2(SO4)3-8H2O
Er2(SO43-8H2O
Er2(SO4)3-8H2O
Er2(SO4)3-8H2O
Tm2(SO4)3-8H2O
Lu2(SO4)3-8H2O
Lu2(SO4)3-8H2O
t, °C c, % Источ- ники
20 54 40
25 28,5 41
20 2,1 17
25 3,43 22
25 1,46 18
40 1,55 17
20 2,0 17
40 1,5 17
20 2,8 17
40 2,0 17
20 3,9 17
25 3,12 42,43
40 2,7 17
20 6,3 17
25 6,28 18
25 4,92 44
40 3,58 17
20 11,7 17
25 11,9 22
25 13,2 18
25 7,70 42,43
40 5,1 17'
100 4,58 45
20 19,8 46
20 28,1 17
40 12,2 17
r, Jahrber.
(1908). —
.. ™j.,
Ska-
ЛИТЕРАТУРА
1. R. Kremann, К. Hiitinge
K. Geol. Reichsanst. (Wien), 58, 637 _
2. D. T а у 1 о г, H. В a s s e 11, J. Chem. Soc..
1952, 4431. — 3, H. A, Horan, J. A, Ska-
г u 1 i s, J. Am. Chem. Soc., 61, 2689 (1939).—
4. N. O. S m i t h, P. N. W a 1 s h, J. Am. Chem
Soc., 76, 2054 (1954). — 5. K. Funa ki, Bull.
Tokyo Inst. Technol. Ser. B. JMi 1, 165 (1950) —
6. J. T. Dobbins, J. A, Addleston
J. Phys. Chem 39, 637 (1935). — 7. J. L. H e n г у
G. В. К i n g, J. Am. Chem. Soc., 71, 1142(1949). —
8. J. T. D о b b i n s, R. M, By rd; J. Phvs
Chem., 35, 3673 (1931). — 9. N. O. Smith
J. Am. Chem. Soc., 64, 41 (1942). — 10. E. Ber-
keley, Phil. Trans. Roy. Soc., 203A.189 (1904).
11. E. Cohen, W. A. T. de M e e s t e r.
A. L. Th. Moesveld, Z. phys. Chem., 112.
150 Д1924). — 12. J. E. R ic c i, J. Fischer
J. Am. Chem. Soc., 74, 1443 (1952).—
, 13. A. E. H i 11, N. O. S m i t h, J. E. Rlcc i.
J. Am. Chem. Soc., 62, 858 (1940). — 14. E. Вет-
ке 1 e у, M. P. App le bey, Proc. Roy. Soc.,
85A. 489 (1911). — 15. А. В e n r a t h, F. G 1 e -
d e bo, B. Schiffers, H. Wunderlich,
Z. anorg. Chem., 231, 285 (1937). — 16. M. C.
Grew, H. E. Steinert, B. S. Hop-
kins, J. Phys. Chem., 29, 34 (1925). — 17. K. S.
Jackson, G. Rienacker, J. Chem.
Soc., 1930, 1687. — 18. F. H. Sped-
? ding, 8. Jaffe, J. Am. Chem. Soc., 76, 882,
(1954). — 19. E. V. Jones, M. H. L i e t z к e,
W. L. M a r s h a 11, J. Am. Chem. Soc., 79, 267
(1957). — 20. W. M u t h m a n n, H. R б И g,
Ber., 31, 1718 (1898).
21. M. В a r r e, Ann. chim. phys. (8), 24, 149
(1911). — 22. F. Wirth, Z. anorg. Chem., 76,
174 (1912). — 23. J. Koppel, Z. anorg. Chem.,
41, 377 (1904). — 24. N. H. V о о g d, Rec. trav’
chim., 52, 768 (1933). — 25. G. W у г о u b о f f,
119
Bull. Soc. chim. France (3). 25, 105, 122 (1901). —
26. W, Muthmann, H. R 0 1 i g, Z. anorg.
Chem., 1«, 450 (1898). — 27. J. A. N. F r i e n d,
J. Chem. Soc., 1980, 1633. — 28. S e 1 d e 1 1,
v. 1, 1958, p. 1072. — 29. D. W. Bissell,
G. J a m e s, J. Am. Chem. Soc., 38, 873 (1916). —
30. A. C love, Z. anorg. Chem., 32, 142J1902).
31. H. W. Roo zeboom, Z. phys. Chem.,
A5, 198 (189o). — 32. E. D e m a г с а у. C. r.96,
I860 (1883). — 33. R. M. Caven, J. Chem.
Soc., 1932, 2417. — 34. M. В a r r e, Bull. Soc.
chim. France (4), 11, 646 (1912). — 35. J. Kop-
pel. H. Holtkamp, z. anorg. Chem., 67,
266 (1910). — 36. F. Glolltti, G. Bucci,
Gazz. chim. Ital., 35, 11, 162 (1905). —
37. С. H. Secoy, J. /Am. Chem. Soc., 70, 3450
(1948). — 38. С. H, Secoy, J. Am. Chem. Soc.,
72, 3343 (1950). — 39. C. D i 11 r 1 c h, Z. phys.
Chem., 29, 449 (1899). — 40. Химия редких
и рассеянных элементов, Изд. «Высшая школа»,
т. 1, 1965, стр. 91,
41. F. W 1 г t h, Z. anorg. Chem., 87, 1(1914). —
42. А. П. Б e л о у с о в а, И. В. Шахно,
В. Е. Плющев, ЖНХ, 13, 1998 (1968).—
43. И. В. Шахно, А. П. Белоусова,
М. Д. Л авкин а, В. Е. Плющев, ЖНХ,
12, 2600 (1967). — 44. Л. Д. Исхакова,
В. Е. Плющев, Изв, вузов. Химия и хим.
технол., 13, 929 (1970). — 45. Р. Т. Cleve,
О. Hoeglund, Bull. Soc. chim. France (2),
18, 193 (1872). — 46. L. Ho Heck, W. No d-
deck, Angew. Chem., 50, 819 (1937).
Сульфаты металлов
четвертой, шестой
и седьмой групп
MnSO4
Рис. 310.
Рис. 310 построен по данным Особые точки [8]: [1-8].
t, °C с. %
Лед 4~ MnSO4 -7Н2О —11,4 32,2
MnSO* -7Н2О -Ь 8,6 37,2
4* MnSO4-5H2O
MnSO4-5Н2О 4i 23,9 39,0
+ MnSO4H2O
MnSO4 -5H2O 4- 26,1 39,4
4* MnSO4-2H2O (мет.)
MnSO*-5H2O4- 27,5 39,7
4-MdSO4-4H2O (мет.)
MnSO< -4H2O 4* 22,4 39,3
4-MnSO4-H2O (мет.)
Кривая кипения построена по данным
[7, 9]. Температура кипения насыщенного
раствора 102,9°, концентрация (26%) [10].
Данные [12] (кривая I) и [11] (кривая 2)
по растворимости MnS04-H2O в замкнутом
объеме приведены на рис. 311.
Сульфаты Sn, Ti, Zr, Cr '
V)
Твердая фаза t, °c C, % Источ- ники
SnSO4 19 15,8 13
SnSO* 100 15,3 13
TiOSO4-2H2O 20 . 54,2 14
Zr(SO4)2 -4ЩО 25 44 15
Zr(SO4)2 -4H2O 40 45 15
CrSO4-7H2O 0 11 16
Cr2(SO4)316H2O 25 39,1 17
ЛИТЕРАТУРА
1. F. R й d о r f Гг Pogg. Ann., 145, 599 (1872). —
2. F. G. Gott re 11, J. Phys. Chem., 4,. 637
(1900). — 3. T. W. Richards, F. R. F r a p -
r i e, Am. Chem. J., 26, 77 (1901). — 4. R. M. C a -
ven, W. J о h n з t о n, J. Chem. Soc., 131.
2358(1927). —5. J. H. К r e p e 1 k a, B. R e J h a,
Coll. Czech. Chem. Comm., 5, 67 (1933). —
120
в. С. Е. Linebarge г, Am. Chem. J., 15, 995
(1893). — 7. L. Kahlenberg, J. Phys.
Chem,, 5, 339 (1901). — 8. S e i d e 1 1, v. 2, 1965,
p. 562. — 9. G. Th. Gerlach, Chem. Ind.,
•, 241 (1886). — 10. T 1 m m e г m a n n s, v. 3,
1960, p. 928.
И. А. В e n r a t h, Z. anorg. Chem., 247, 447
(1941). — 12. R. D. Eddy, P. E. M ac he-
rn e r. A. W. G. Menzies, J. Phys. Chem.,
45, 908 (1941). — 13. J. Marignac, Ann.
Mines (5), 22, 1 (1857). — 14. Д. Л. Мотов,
ЖНХ, 2, 2661 (1957). — 15. M. F a 1 i n s к i,
Ann. chim., 16, 237 (194^. — 16. H. Mo Is-
sa n, Bull. Soc. chim. France [2], 37, 296 (1882). —
17. D. Taylor, J. Chem. Soc., 1953, 2502.
Сульфаты металлов
восьмой группы
FeSO4, %
Рис. 312.
Рис. 312 построен по данным [1—5].
Особые точки (!]:
°C с, %
Лед+ FeSO4-7H2O -1,82 12,9
FeSO* ’7НаО + + FeSO4-4H2O 56,7 (35,3)
FeSOi -4Н2О + + FeSO4H2O 64,0 (35,6)
FeSO* -7H.0 + + FeSO4-H2O (мет.) 60,5 (36,7)
Кривая кипения построена по данным
[6, 7]. Температура кипения насыщенного
раствора FeSO4 (101°), концентрация
(23,5%).
Рис. 313 построен по данным [8], полу-
ченным в замкнутом объеме.
Рис. 314.
Рис. 314 построен по данным [9—15] Особые точки [10]:
t, °C e, %
Лед + CoSO4-7Н2О —2,7 19,0
CoSO4-7H2O + + CoSO4 -6Н2О 43,3 32,9
CoSO* -6Н2О + + CoSO* НО 64,2 36,7
CoSO*-6H20 + . + CoSO*-2H2O (мет.) 72,9. 38,8
CoSO* -6H2O + + CoSO*-4H2O (мет.) 80,4 40,5
121
Рис. 315.
Рис. 317.
Рис 316.
122
Кривая кипения (рис. 314) построена по
данным [7]. Температура кипения на-
сыщенного раствора 104,5°, концентрация
(26%) [10].
Рис. 315 построен по данным [16], полу-
ченным в замкнутом объеме.
NiSO4
Рис. 316 построен по данным [И, 17,
18]. Особые точки [11]:
t, °C c, %
Лед 4- NiSO4-7H2O -3,4 21,0
NiSO4-7H2O + 4- a-NiSO4-6H2O 30,7 30,7
a-NiSO4-6H2O 4- 4- p-NiSO4-6H2O 53,8 35,3
p-NiSO4 -6H2O 4- 4- NiSO4-H2O 84,8 40,9
p-NiSO4 -6H2O 4- 4- NiSO4-2H2O (мет.) 90,3 42,2
₽-NiSO4 -6H2O 4- 4- NiSO4 -3H2O (мет.) 96,4 43,8
0-NiSO4-6H2O 4- 4- NiSO4-4H2O (мет.) 97,2 44,0
P-NiSO4 -6H2O 4- 4- NiSO4-5H2O (мет.) 98 44,2
Кривая кипения построена по данным
[7]. Температура кипения насыщенного
раствора NiSO4108,4°, концентрация (40%)
[19].
Рис. 317 построен по данным [16], полу-
ченным в замкнутом объеме.
ЛИТЕРАТУРА
1. F. Fraenckel, Z. anorg. Chem., 55, 223
(1907). — 2. G. Agde, Н. Barkho it, Z. an-
gew. Chem., 89, 851 (1926). — 3. А П. Бело-
польский, В. В. Урусов, ЖПХ, 21, 781
(1948). — 4. А. П. Белопольский,
В. Н. К о л ы ч е в а, С. Я. Ш п у н т, ЖПХ, 21,
794 (1948). — 5. К. А. К о b е, R. Е. F г е d ri-
ck 8 о n, Chem. Eng. Data Senes, 1, 13 (1956). —
6. G. Th. Gerlach, Chem. Ind., 9, 241 (1886). —
7. L. Kahlenberg, J. Phys. Chem., 5, 339
(1901). — 8. A. E t a r d, Ann. phys. chim. (7),
2, 503 (1894). — 9. J. К о p p e 1, Z. phys. Chem.,
52A, 385 (1905). -r- 10. R. R о h m e r, G. r., 199,
641 (1934).
11. R. Rohmer, C. f., 209, 315 (1939).—
12. H. D. Crockford, D. J, Brawley,
J. Phys. Chem., 36, 1594 (1932). — 13. R.M. Ca-
v e n W. Johnston, J. Chem. Soc., 131, 2506
(1928). — 14. H. В a s s e t t, J. H. H e n s h a 11,
J. Chem. Soc., 1950, 1970. — 15. А. В e n r a t h,
H.B en rath, Z. anorg. Chem., 179, 369 (1929). —
16. А. В e n r a t h, Z. anorg. Chem., 247, 147
(1941). — 17. F. Rfldorff, Pogg. Ann., 145,
599 (1872). — 18. A. Chretien, R. Roh-
mer, C. r., 198, 92 (1934). — 19. Timmer-
mans, v. 3, 1960, p. 950.
ПЕРСУЛЬФАТЫ
Na2S2O8
Рис. 318 построен по данным [1].
K2S20g
Рис. 319 построен по данным [2—7].
Эвтектика: (—0,3°), (1,7%).
Рис. 318.
Рис. 319.
Rb2S2O8
Растворимость Rb2S,O8 при 22,5° соста-
вляет 3,28% [8].
(NH4)2S2Oe
Рис. 320.
Рио. 320 построен по данным [5, 9—11].
123
BaS2O3 ,
Растворимость BaSgOe*4H3O при 0°
составляет 28,1% [5].
ЛИТЕРАТУРА
1. J. Bale], A. Keener, Coll. Czech.
Chem. Comm., 28, 254 (1963); 82, 4491 (1967). —
2. G.Moeller, Z. phys. Chem., 12, 557 (1893).—
3. N. T arugi, Gazz. chim. ital., 34, 329
(1904). — 4. J. Bale), A. R e g n e r, Goll.
Czech. Chem. Comm,, 25, 1686 (I960); 34, 2161
(1969). — 5. H. Marshall, J. Chem., Soc.,
59, 771 (1891). — 6. R. P< Jetta, Gazz. chim.
ital., 86, 67 (1906). — 7. T. S. P г i c e, J. Chem.
Soc., 91, 532 Й907). —8. Pascal, t. 3, 1957,
p. 79. — 9. J. Ba le J, A. Regner, J. Vo n d-
г a к, Goll. Czech. Chem. Comm., 25, 2216 (1960). —
10. S. К. K. Jatkar.K. S e c h a d г i, J., Sci.
Ind. Res. India, 2B, 554 (1953).
11. J. F. Gall, G. L. Church,
R. L. Brown, J. Phys. Chem., 47, 645 (1943).
ТИОСУЛЬФАТЫ
Na2S2O3
Рис. 321.
Рис. 321, 322 и 323 построены по данным
[1, 2]. По данным [1], гидраты Na2S2Oa
разделяются на первичные (сс-форма) и вто-
ричные (0-форма), причем первичные гид-
раты не могут переходить во вторичные.
Особые точки:
t, °C с, % ис- точ- ни- ки
Лед 4- a-Na2S2O3 • 5Н2О -10,6 (ЗОЛ) 1
a-Na2S2O3 • 5Н2О 4- + a-Na2S2O3 • 2Н2О 48,2 (61,5) 2
a-Na2S2O3 • 2Н2О4" 4" a-Na2S2O3 * 0,5Н20 (65,5) (67,8) —
a-Na2S2O3 • 0,5H2O4~Na2S2O3 (74) (69,0) —
a-Na2S2O3 • 5НаО (мет.) 48,5 (63,7) 2
a-Na2S2O3 • HfoO+a-Na^Os • •0,5Н2О (мет.) (45) (65,4) —
a-Na2S2O3 • Н2О 4~ Na2S2O3 (мет.) (57,5) (68,1) —
0-Na2S2O3 5H2O+0-Na2S2O3 • •4Н2О (мет.) 30,2 (57,1) 2
0-Na2S2O3.4H2O+P-Na2S2O3 • •Н2О (мет.) (39,5) (62,8) —
0-Na2S2O3 • 4Н2О (мет.) 41,7 (68,7) 2
0-Na2S2O3 • Н2О 4~ Na2S2O3 (мет.) (62,5) (68,-3)
Р-НагЗгОэ’бНгО+р-НагЭгОз •Н2О (мет.) 14,3 (59) 2
0-Na2S2O3 6Н2О (мет.) 14,4 (59,3 2
p-Na2S2O3’2H2O+a-Na2S2O3 • •Н2О (мет.) (29,0) (63,2)
Кривая кипения построена по' данным
[3]. Температура кипения насыщенного
раствора Na2S2O3 126°, концентрация
77,7% [3].
Рис. 324 построен по данным [4], полу-
ченным в замкнутом объеме.
K2S2O3
Рис. 325 построен по данным [5]. Особые
точки:
3K2S2O3.5H2O4-K2S2O3 Н2О
K8S2O3H2O+ 3K2S2O3H2O
3K2S2O3 -н2о 4" K2S2O3
1, °C с, %
35,0
56,1
78,3
66,9
70,1
74,5
(NH4)2S2O3
Рис. 326 построен по данным [6]. Эвтек-
тика: —33,1°, 52,4%.
MgS2O3
Рис. 327 построен по данным [7]. Твер-
дой фазой в равновесии с раствором яв-
ляется MgS2O3-6H2O.
124
Рис. 322.
CaS2O3
Рис. 328.
Рис. 328 построен по данным [7—9J
Рис. 327.
SrS2O,
Рис. 329.
Рис. 329 построен по данным [10]. Коор-
динаты перехода SrS2O3«5H2O в SrS2O3 .
• Н2О не установлены.
126
Bas2o3
Растворимость BaS2O3«H2O при 0—60°
по данным [И] описывается уравнением:
с = о,16 + 0,004г.
Тиосульфаты Т1 и РЬ
Твердая фаза t, ‘’С с, % Источ- ники
T12S8O3 25 0,18 12
PbS2O3 25 0,02 13
PbSgQa —0 0,03 14
ЛИТЕРАТУРА
1. М. Picon, Bull. Soc. chim. France (4), 35,
1096, 1106 (1924).— 2. S. W. Young,
W. E. Burke, J. Am. Chem. Soc., 23, 1417,
(1904); 28, 324, 333 (1906). — 3. G. Gerlach,
Chem. Ind., 9, 241 (1886); Z. anal. Chem., 23, 436
(1887). — 4. А. В e n r a t h, Z. anorg. Chem.,
•249, 246 (1942). — 5. J. I n о h 1 к o, Mem. Coll.
Scl. Eng. Kyoto Univ., 3, 41 (1911); Tokyo Chem.
Soc., 85, M 7 (1912), — 6. T a s a к u Nakai,
Hiroshima Dajgaku Ko’gakubu Kenkyu Houoku,
10, 49 (1961). — 7. Я. И. Зильберман,
П. T. Иванов, ЖОХ, 16, 1593 (1946).—
8. R. К r e m a nn. H, R о de mun d, Z. anorg.
Chem., 86, 375 (1914). — 9. F. R. В 1 c h о w s к y,
J. Am. Chem. Soc., 45, 2227, 2233 (1923).—
10. R. Portillo, An. Soc. espan. tis. quim.,
27, 243, 249 (1929).
И. Г. П. Лучинсний, В. G. Сузда-
ле в a, ЖОХ, 10, 2048 (1940). —
12. Ф. Я. Ку л ьба, В. E. Мироно в, Химия
таллия, Госхимиздат, 1963, стр. 198. —
13. К. Б. Я ци мир с.к ий, ЖФХ, 25, 476
<1951).— 14. Pascal, t.-jS, 1963, р. 699.
Рис. 331.
Рис. 330 и 331 построены по данным
[1, 2]. Особые точки [1]:
t, вс
Лед + Na2S2Oe -8Н2О
Na2S2Oe-8НаО +
+ Na2S2Oe-6H2O
Na2S2Oe-6Н2О 4-
+ Na2S2Oe-2Н2О
—1,14
0
9,10
5,72
5,90
9,75
ДИТИОНАТЫ
Na2S2Oe
K2S2Oe
Рис. 332.
Рис. 332 построен по данным [3, 4].
Данные [2] несколько занижены. Эвтек-
тика: (—0,4°), (2,5%) [3].
127
(NH4)2SaOe
Рис. 333.
Рис, 333 построен по данным [2]. Твер-
дой фазой в равновесии с раствором яв-
ляется (NH4)aS2Oe-0,5H2O.
Ag2S2Oe
Растворимость Ag2S2Oe-2H2O при 16°
составляет 500 г!л [4].
MgS2Oe, CaS2O6, SrS2Oe
Рис. 334 построен по данным [2]: 1 —
MgSaOe-6HaO; 2 — CaS^Oe‘4НаО; 3 -
SrS2Oe.4H8O.
BaS2Oe
Рис. 335 построен по данным | 2, б].
Особые точки: i, °C А % Источ-
ники
Лед + BaSaOe -4Н2О -0,46 6,0 5
BaSaOe-4H,O + + BaSaOe-2HaO Лед + BaSaOe-6H2O 13 (13) '5
-0,59 7,7 2
(мет.)
Рис. 335.
Tl2S2Oe
Рис. 336.
Рис. 336 построен по данным
Дитионаты Li и Си
Твердая фаза t,°C с. % J Источники
Li2SaOe -2НаО 20 55 6
CuS2Oe-4H2O 0 43,8 2
CuS2Oe-4HaO 20 44,9 2
CuS2Oe-4HaO 30 45,5 2
128
ЛИТЕРАТУРА
1. F. I eh 14с aw a, M. Oku, Bull. Inst.
Phye. Chem. Ree., Tokyo, в, 80 (1927); Sci. Rep.
Tdnoku Imp. Univ., 21, 729 (1932). —
2. W. C. de В a a t, Rec. trav. chim., 42, 644
(1923); 45, 237 (1926). — 3. E. С о r n e c, Ann.
chim. phye. (8), 30, 90 (1913). — 4. P а в с a 1,
t. 2, t. 2, 1963, p. 298; t. 3, 1957, p. 573; t. 6, 1961,
p. 974. — 5. Seidell, v. 1, 1958, p. 396.—
6. Gmelin, Bd. 20, Г960, S. 485.
ПОЛИТИОНАТЫ
Политионаты Na, К, NH4, Sr, Ba
Твердая, фаза t, °C c, % Источники
.Тритионаты
Na2S3Oe-3H2O 0 37,6 1
Na2S3Oe-3H2O 20 52,2 1
Na2S3Oe:3H2O K2s8oe 30 58,9 1
0 8,14 1,2
К » S3Oe (NH4)2S3Oe 20 18,4 1,2
0 53,2 1
(NH42S3Oe 20 56,4 1
(NH4)2S3Oe 30 58,2 1/
Тетратионаты
Na2S4Oe 2H9O 0 41,3 1
Na2S4Oe-2H2O 20 49,7 1
Na2S4O6-2H2O k2s4o6 30 54,9 1
0 12,6 1, 2
K2S4Ofl (NHahSA 20 0 23,2 51,2 1, 2 1 •
(NH4)2S4Oe 20 54,3 1
(NH4)2S4O3<. SrS4Oe-6H2O 30 56,2 1
-0 19,9 3
SrS4Oft -6H,,0 12,9 26,3 3
SrS4Oe-6H2O 30 39,0 3
BaS4Oe-2H2O* 0 26,6 3, 4
BaS4Oe-2H2O 20 32,4 3, 4
BaS4Oe-2H2O 30 37,4 3
* Значения растворимости для этой соли
интерполированы нами.
Продолжение-
Твердая фаза t°, С с, % Источники
Пентатионаты
Na2S6Oe-2H2O 0 32,9 1
Na2S6Oe-2H,O K2S6Oe -1,5Н2О 20 52,0 1
0 15,5 1, 2
K2S6Oe-l,5H2O 20 24,8 1, 2
ЛИТЕРАТУРА
1. A. Kurtenacker, G. Ldszld,
Z, anorg. Chem., 287, 359 (1938). — 2. A. К u r -
tenacker, w. Flues, Z. anorg. Chem., 219,
129 (1933). — 3. R. Portillo, An. Soc. espan,
fis. quim., 27, 236 (1929). — 4. D. Yost,
H. R u s se 11, Systematic Inorganic Chemistry,
1944, p. 392.
Ориентировочные значения
растворимости серусодержащих
соединений
Соедине- ние c, % Соедине- ние C, %
Cu2S 2-10-13 FeS 5-10’4
CuS 3-10-5 1*е253 6-10-17
Ag2S 610-14 CoS 4-10-4
1-10-8 NiS 4-10-4
CdS 2-10-9 Ag2SO3 5-10-3
Hg2S 2-IO" 21 CaSO3 5-Ю-3
HgS 5-IO"22 SrSO3 ЗЮ"3
SnS 2-10-e BaSOs 2-Ю"3
SnS2 3-10-3 Hg2SO3 7-10-1»
PbS 8-10-Ю BaSO4 2-10-4
As2S3 7-10-5 RaSO4 2-10-4
As2S8 3 10-4 Hg2SO4* 5-IO"8
Sb2S3 2-10-4 EuSO4 2-10-3
Sb2S6 5-10-4 PbSO4 4-10-3
Bi2S3 ’ 2-10-5 Bi2(SO4)3 2-10-5
MnS 7-10-4 Hg2s2o3 110-18
* По данным N. Т. Wilsmore (Z. phys. Chem.4
35, 305 (1900)1 и К. Drucker [Z. anorg. Chem., 28,
361 (1901)], растворимость Hg»SO4 на порядок
выше.
СЕЛЁНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ .
СЕЛЕНИТЫ Na2SeO3
H2SeO3 Рис. 339 построен по данным [3, 4].. C, % 38,8
Особые точки [3]: Лед + t, °C —20,5
Рис. 337 построен по данным [1]. Na2SeO8-8H2O
Li2SeO3 Na2SeO3-8H2O + + Na2SeO3-5H2O —8,7 ± 0,3 (42)
Na»SeO8-5H2O -|- -f" Na2SeO8 • 35,9 ± 0,1 (50)
Рис. 338 построен по данным [2]. Твердой фазой в равновесии с раствором является 4Li2SeO8-3H2O. Лед-j- + Na2SeO3-5H2O мет.) -28,1 ± 0,1 (41,6)
9 Заказ 076
12»
130
NaHSeO3
Рис. 340 построен по данным [3—5].
Особые точки:
Лед +
+ NaHSeO3-3H2O
NaHSeO, -ЗНаО +
+ NaHSeOg
t, °C
-9,3
(27,1)
Выше 93° идет разложение соли с обра-
зованием Na2SeaO5.
' NaH8(SeOa)2
Рис. 341 построен по данным [3, 4]-
Эвтектика: —7,5°, 36,5%.
K2SeO3
с, %
.33,7
(67)
Источ-
ники
3,4
Рис. 342 построен по данным [3, 4].
Особые точки [3J:
Лед+ K.SeO3-4H2O
, KageQH&20+'
'+ K2SeO3
t, °C с, %
—43,5 ± 0,5 (58,0)
24,3 (68,5)
KHSeO3
9*
131
Рис. 343 построен по данным [3, 4].
Эвтектика: —57,0°, 70,0% [4].
№Н4Нз(8еОз)а
КНз(веОд)л
Рис. 344 построен по данным [3, 4].
Эвтектика: —8,0®, 46,0%.
Рис. 346.
Рис. 346 построен по данным [3, 4].
Эвтектика: —14,8 ± 0,1°, 60,1%.
(NH4)2SeO8
Рис. 345.
Селениты La, Nd, Pb
Твердая фаза t, °C С, % Источники
Laa(SeO3)s Nda(SeO3)3 PbSeO8 0,198 0,094 6 6
10 0,01 7
ЛИТЕРАТУРА
1. А. Е t а г d, Ann. chim. phys. (7), 2, 503
(1194).— 2. A. Rosenheim, L. Krause,
Z. anorg. Chem., 118, 183 (1921). — 3. J. Jani-
c k i s, Z. anorg. Chem., 205, 49 (1932); 218, 89
(1934). — 4. J. Ja nick is, ,H. Gutma-
na it e, Z. anorg. Chem., 227, 1 (1936).—
5. E.Opmec, Aim. chim. phys. (8), 80, 127
(1913V^<rJI. А. Алексеенко, В. В. Се-
ребре ннико в, Труды Томского гос. ун-та,
154, 99 (1962).+ 7. R. D о 11 g u е, Bull. Soc.
chim. France (5), 10, 50 (1943).
ПИРОСЕЛЕНИТЫ
Na2Se2O8
Рис. 345 построен по данным [3, 4].
Эвтектика: —21,9 ± 0,1°, (44,8%).
\ и-
Растворимость NaaSeaOe Ври 94—109°
по данным [1] описывается уравнением:
с = 66,5+ 0, it.
132
ЛИТЕРАТУРА
KgSfegOg
Рис. 347.
Рис. 347 построен по данным [1].
1. J. J а и 1 с k 1 s, Z. anorg. Chem., 205, 49
(1932).— 2. J. J a n i с к 1 s, Z. anorg. Chem.,
218, 89 (1934). — 3. J. Janickis, H. Gut-
man a i t e, Z. anorg. Chem., 227, 1 (1930).
СЕЛЕНАТЫ
HaSeO4
Рио. 349 построен по данным [1—6].
Особые точки:
(NH4)2Se2OB
Рис. 348 построен по данным [2, 3].
Особые точки [2]: .
t, °C C, % Источ- ники
Лед 4“ HaSeO4-6HaO HaSeO4-6HaO + —83,4 49,4 1, 2
—68,5 54,8 1, 2
4- HaSeO4 -4H2O
HaSeO4-4HaO -51,7 66,8 1, 2
HaSeO4 -4HaO 4- -54,0 70,3 1, 2
4- HaSeO4 -2HaO
HaSeO4-2HaO 4- —24 77,7 1, 2
4~ HaSeO4 -HaO
HaSeO4 -HaO 26 88 3, 5
HaSeO4 HaO 4“ u 19 . 91 6
+. HaSeO4
HaSeO4 60 100 3
Лед 4“ HaSeO4 -4HaO —88 50 1, 2
HaSeO4 -4HaO 4- -60 75 1, 2
4“ HaSeO4 -Hao (мет.)
NaaSeO4
Рис. 350 построен по данным [5, 7].
Переходная точка: 32°, (36%) [7].
Рис. 351 построен по данным [8], полу-
ченным в замкнутом объеме.
KaSeO4
Растворимость KaSeO4 при изменении
температуры от —20 до 100° по данным
[5, 9] описывается уравнением: с = 52,0 4-
4- 0,035t.
Данные работы [10] несколько завы-
шены.
t, *с с, %
Лед + —16,9 ± 0,1 (49,0)
(NH4).SeaOB-3HaO + + (br4)aSeaO5 32,0 (84,5)
4
(NH4)aSeO4
Рис. 352 построен по данным [11]. Дан-
ные [12, 43] не использованы.
133
CuSeO4
Рис. 353
Эвтектика:
построен по данным [14, 15].
-1,0°, (10,5%) [15].
CaSeO4
Рис. 355.
MgSeO4
Рис. 354.
Рис. 355 построен по данным [16—18].
Данные [5, 9] не использованы. Эвтектика:
—2,6°, концентрация (8,4%) [16]. Темпе-
ратура кипения насыщенного раствора
101,8°, концентрация 3,18% [16].
Рис. 354 построен по данным [15]. Дан-
ные [5] не использованы.
Лед + MgSeO4‘7H2O
MgSeO4-7H2O +
+ MgSeO4-6H2O
MgSeO4-6HaO +
+ MgSeO4-4,5H2O
Особые точки:
t, °C С. %
—7,1 26,6
(3,6) (34,5)
(89,5) (45,0)
SrSeO4
Рис. 356.
Рис. 356 построен по данным [19].
135
Рис. 357.
Рис. 358. ,
136
ZnSeO4
Рис. 357 построен по данным [15]. Осо-
бые точки:
Лед+ ZnSeO4«6H2O
ZnSeO4-6H.O +
+ ZnSeO45H2O
ZnSeO4 -5H.0 + ZnSeO, •
•H2O
2nSeO4-H2O+ ZnSeO4
t, °C с, %
—7,8 32,2
35 (42)
43,4 43,8
62,5 (40)
CdSeO4
Рис. 358 построен по данным [15]. Эвтек-
тика: —11°, 43,5%.
Tl2SeO4
Рис. 359 построен по данным [11, 20].
La2(SeO4)8
Рис. 361.
Рис. 362*
Рис. 360 построен по данным [21, 22].
Переходная точка: (43°), (31%) [21}. В гид-
рате |Ld2(SeO4)9 «а;НаО х — 22 или 24.
Pr2(SeO4)8
Рис. 361 построен по данным [21]. Пере-
ходная точка: (59,5°), (23,5%).
Nd2(SeO4)8
Рис. 362 построен по данным [22, 23].
Переходная точка: (61,5°), (31%) [23].
В гидрате Nda(SeO4)8-a;H2O х =*= 8,12, 13,
22 или 24.
Sm2(SeO4)8
Рис. 363 построен по данным [24]. Твер-
дой фазой в равновесии с раствором яв-
ляется Sm2(SeO4)8*8HaO.
Рис. 363.
137
Рже. 364.
CoSeO4
Рис. 364 построен по данным [15]. Осо-
бые точки:
Лед 4- CoSeO4-7HaO
CoSeO4 ~7HaO +
+ CoSeO4-6HaO
CoSeO4-6HaO +
4- CoSeO4-4HaO
CoSeO4 + CoSeO4 -Ha0
t, ec
—6,4
11,4
33,5
73,5
C, %
30,3
(35)
(37)
39,6
NiSeO4
Рис. 365 построен по данным [15]. Осо-
бые точки:
Лед 4* NiSeO4 -6НаО
NiSeO4-6HaO +
4-NiSeO4-4HaO
t, °с с, %
—3,0 21,0
82,2 (47)
Рис. 365.
138
Селенаты Li, Rb, Cs, Ga, Mn
Твердая фаза t, °C C, % Источники
LiaSe04-Ha0 20 40,6 25
Rb2SeO4 12 61,4 11
Cs2SeO4 12 71,0 11 ,
Ga2(SeO4)8-23H2O 25 12,1* 26
MnSe04-5HaO 30 36,8 15
MnSeO4-2H2O 60 35,4 15
* В расчете на GaaOt.
ЛИТЕРАТУРА
I. G. Vuillard, С. г., 242, 1326 (1956). —
2. G. Vuillard, Ann. chim., 2 233 (1957). —
3. R. К re ma n n, F. Hofmeier, Monatsh.,
19, 1111 (1908). — 4. А. Ф. Капустинский,
A. H. Жданова, ЖПХ, 24, 658 (1951). —
5. J. M e у e r, W. A u 1 ich, Z. anorg. Chem.,
172, 821 (1928). — 6. P a s с a 1, t. 13, f. 2, 1961,
p. 1833. — 7. R. Funk, Ber., 33, 3697, 3702
(1900). — 8. A. Smits, W. M a see, Z. phys.
Chem., 135, 73 (1928). — 9. A. E t a r d, Ann.
chim. phys. (7), 2, 536, 551 (1894)', C. r., 108, 741
(1888). — 10. J. A. Friend, J. Chem. Soc.,
1929, 2783.
11. A. E. T u 11 о n, J. Chem. Soc., 71—72,
850 (1897): 89, 1072 (1906); Proc. Roy. Soc., 79A,
351 (1907); Z. Krlstallogr., 42, 541 (1907).—
12. G. B. King, W. A. Beckman, J. Am.
Chem. Soc., 87, 857 (1945). — 13. G. B. King,
J. Phys. Chem., 41, 797 (1937). 14. C.H. Ka o,
T. L. Chang, Sci. Rep. Nate. Tsing Hua
Univ. (A), 4, 157 (1940). — 15. A. Klein,
Ann. chim. (11), 14, 263 (1940). — 16. H. M. G e -
Ливанова, В. А. Шнейдер, Изв, вузов.
Химия и хим. технод., 2, 651 (1959). —
17. Н. М. Се Ливанова. В. А. Шне йде р,
Научи, доклады высшей школы. Химия и хим.
технол., № 4, 664 (1958). — 18. Н. М. Сели-
ванова, В. А. Шнейдер, Хим. наука
и пром., 3, 834 (1958). — 19. Н. М. С е л и в а -
нова, Г. А. Зубкова, Изв. вузов. Химия
и хим. технол;, 1, № 3, 28 (1958); ЖФХ, 33,
141 (1959). — 20. R. Т. G 1 а и в е г, Z. anorg.
Chem., 88, 437 (1910).
21. J. A. N. Friend, J. Chem. Soc., 1932,
1597, 2410. — 22. Л. А. Алексеенко,
В. В. Серебренников, Труды Томского
гос. ун-та, 154, 99 (1962). — 23. J. A. N. F г i -
end, J. Chem. Soc., 1931, 1802. — 24. J. A. N.
Friend, J. Chem. Soc., 1941, 112. — 25.
S. P a n i, H. T e r r e y, J. Chem. Soc., 1955,
3062. — 26. L. M. Dennis, J. A. Brid-
gman, J. Am. Chem. Soc., 10, 1557 (1918).
Ориентировочные значения
растворимости селенсодержащих
соединении
Соединение
CuSeO3
BaSeO3*
Ag2SeO4
BaSeO4
С, %
2•IO"»
5 • IO"* I. 2 3 * 5 * * * * * 11 12
2 •10-з
5 • IO"3
* По данным R. Doligue [Bull. Soc. chim.
France (5), 10, 50 (1943)1, растворимость BaSeOa
составляет 9,2’10“4%.
ТЕЛЛУРСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
ТЕЛЛУРИТЫ
Рис. 366 построен по данным [1].
Li2TeO3
Na2TeO8
Растворимость Na2TeO8-5H2O при 25°
составляет 45% [2, 3], а при 70° 55,5% [4].
ЛИТЕРАТУРА
1. О. Н. Бреусов, Т. В. Ревзина,
Н. А. Друзь, ЖНХ, 10, 1990 (1965).—
2. О. И. В о р о б ь е в а, Е. А. Л а в у т, ЖНХ,
2, 1155 (1957). -3. Е. А. Лавут, О. И. Во-
робьева, ЖНХ, 5, 1813 (i960).—
4. Е. А. Л а в у т, О. И. Воробьева,
И. М. Шульгина, ЖНХ, 8, 2758 (1961).
ТЕЛЛУРАТЫ
НвТеОв
Теллуровая кислота выделяется в виде
НаТеО4-2НаО. В молекулах воды атомы
водорода способны полностью или частично
замещаться на металл. Рис. 367 построен
по данным [1]. Переходная точка: (8°),
(24%).
139
Рис. 367.
Теллураты Na и К
Твердая фаза t, "С С, % Источ- ники
NaaTeO4-2HaO 18 0,76 1
NaaTeO4«4HaO (мет.) 18 1,4 1
NaaTeO<-4HaO 50 2,5 1
NaaTeO4-2HaO 100 2,0 1
КаТеО4 0 8,11 2
КаТеО4 20 21,6 2
КаТеО4 30 33,5 2
Mg8TeOe, Ca8TeOe, Sr8TeOe, Ва8ТеОв,
CaH4TeO«, SrH4TeOe, ВаНДеО,
Рис. 368 и 369 построены по данным
ЛИТЕРАТУРА
1. F. М U 11 U 8, Вег, 84, 2208 (1901).—
2. A. R о 8 е n h е 1 m, М. w 1 е n h е b е г, Z. anorg.
Chem., 8», 284 (19Н). — 3. Р. Н. Князева,
Г. Н. Чернова, Г. Б. Жуковская,
Изв. вузов. Химия и хим. технол., 9, 869 (1966).—
4. Р. Й. К и я з е в а, В. Н. Б е л ь м а с, ЖНХ,
15, 2564 (1970).
140
НДеО»
Ориентировочное значение растворимости
НаТеО8 составляет 5«10~5%.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
АЗИДЫ
LiN8
Рис. 370.
Лед + Ca(N8)a.4H8O
Ca(N8)8-4H8O +
+ Ga(N3)a-1,5НаО
Ca(N3)a -1,56.0 +
+ Ca(N8)a-0,5HaO
Ca(N8)a-0,5HaO +
+ Ca(N8)a
t, °c
-20,8 ±
± 0,5
0 ± 2
25 ± 1
41
c, %
28,3
(34)
(37,5)
(40,5)
Рис. 370 построен по данным [1]. Данные
[2] не использованы. Особые точки:
е, %
26,0 ± 0,4
33,5 ± 0,3
48,0 ± 0,3
Лед +
+ LiN8>4HaO
LiN,-4HaO +
+ LiN,H»O
LiN,H,O +
+ LiN3
t, °C
—47,5 ± 0,5
-31,0 ± 0,5
68,2 ± 0,1
NaNs
Рис. 371 построен по
Особые точки [3]:
Лед 4- NaN, -3H.O
NaN8-3H8O+ NaN8
Лед + NaN8 (мет.)
данным [2, 3].
t, °с с, %
—15,1 21,6
—2,1 27,8
—20 26,8
KN8
Рис. 372 построен по данным [2, 3]*
Эвтектика: —12,9°, 26,2% [3].
Ca(Ng)a
Рис. 373 построен по данным [4]. Данные
[2] не использованы. Особые точки:
KN3, %
Рис. 372.
141
Азиды Rb, Cs, NH4, Sr, Ba, Hg, Tl, Pb
Твердая фаза t, °C c, % Источ- ники
RbN3 16 51,7 2
RbN3 17 53,3 2
CeN3 0 69,2 2
CsN3 16 75,5 2
nh4n3 0 . 13,2 5
nh4n3 20 19,2 5
nh4n8 40 25,6 5
Sr(N3)2 16 31,4 2
Ba(N3)2 0 11,1 2
Ba(N3)2 10,5 13,9 2
Ba(N3)2 15 14,3 2
a 17 0 14,7 2,5 IO’2 0,171 2 6 2
T1N3 5 0,196 2
T1N3 16 0,30 2
T1N3 25 0,365 5
Pb(N3)2 18 2,32 10"2 6
Pb(N3)2 20 2,47-10"2 7
Pb(lN3)2 70 9,01-IO"2 6
ЛИТЕРАТУРА
1. A. R о 1 let, J. Wohlgemuth, C. r.,
198, 1773 (1934). — 2. T. Curt iue, J. R is-
som, J. prakt. Chem. (2), 58, 277 (1898).—
142
3. J. Wohlgemuth, C.r., 199, 601 (1934). —
4. К. T о r ka r( H. Krischner, G. Ernst,
Monatsh., 100, 203 (1969). — 5. W. S. Frost,
J. С. С о t h r a n, A. W. В г о w n e, J. Am. Chem.
Soc., 55, 3516 (1933).— 6. L. W 6 h 1 e r,
W. К r up ко, Вег., 4611, 2045 (1913).—
7. W. Fe 11 к n e c h t, M. S a h 1 i, Helv. chim.
acta, 37, 1431 (1954).
НИТРИТЫ
Нитриты металлов ,
первой группы и аммония
LINO.,
Рис. 374 построен по данным [1]. Отдель-
ные значения работ [2—5] хорошо согла-
суются с данными [1]. Данные [6] не ис-
пользованы. Особые точки [1]:
t, °C c, %
Лед+ LiNO2-l,5H2O —38,7 26,6
LiNO2-l,5H2O+ LiNOa-H2O —8,0 43,5
LiNO2 H2O + LiNO2 0,5H2O 50,9 63,0
LiNO20,5H2O + LiNO2 94,0 75,9
[NaNOa
Рис. 375 построен по данным [1, 6—8],
согласующимся между собой. Данные [6]
Рис. 374.
в области низких температур и данные [9]
не использованы. Особые точки [1]:
t, °с с, %
Лед + NaNO2-0,5H2O I —19,5 I 28,1
NaN02 0,5H20 + NaNO2 | —5,1 | 41,7
Температура кипения насыщенного рас-
твора 128°, концентрация 68,7% [6].
kno2
Рис. 376 построен по данным [1, 7] и дан-
ным [6] для области кристаллизации KNO2.
При температуре ниже 0° данные [6] не
использованы. Особые точки [1]:
/, °с с, %
Лед+ KNO2 0,5H2O ] —40,2 I 64,9
KNOa-0,5Н2О + KNOa | —8,9 | 71,9
Температура кипения насыщенного рас-
твора 132°, концентрация (82%) [6].
RbNOa
Растворимость RbNO2 при 25° составляет
90,6% [10] или 87,8% [И].
148
CsNOa
Растворимости CsNOa при 25? составляет
84,3% [И]. .
NH4NO2
Рис. 377 построен по данным [1]. Эвтек-
тика: —27,9°, 42,5%.
AgNO2
Рис. 378 построен по данным [12].
ЛИТЕРАТУРА
1. J. Bureau, Ann. chim. (И), 8, 97 (1937);
С. г., 198, 1918 (1934); 200, 395 (1935); 201, 1193
(1935). — 2. J. D. Ray, R. A. Ogg, J. Phys.
Chem., 60, 1600 (1956). — 3. П.И.ПроценКо,
Н, А, Брыкова, Укр.хим.ж., 30, 448 (1964).
4. П. И. Проценко, О. Н. Разумов-
ская, Ю. Г. Литвинов, Укр. хим. ж., 34,
1221 (1968).— 5. О. Н. Разумовская,
И. И. Проценко, Т. И. Ивлева, ЖНХ,
14, 563 (1969). — 6. М. Oswald, Ann. chim.
phys. (9), 1, 32(1914). — 7. А. В. P а к о в с к И й,
Д. С. Славина, Труды ИРЕА, ^вып. И, 20
(1931). — 8. Е. Erdos, Н. Simko vfi,
Chem. listy, 51, 2201 (1957); Coll. Czech. Chem.
Comm., 24, 504 (1959). — 9. H. Heiberg,
Ann. chim. (10), 4, 123 (1925). — 10. П. И. П p о
ценно, H. А. Б p ы к о в а, Изв. вузов. Химия
и хим. технол., 7, I (1964).
И. П. И. П р о ц е н к о, Т. А. А н д р е е в а,
ЖНХ, 9, 1441 (1964). — 12. Н. J. G г е i g h t о n,
W^H. Ward, J. Am. Chem. Soc., 37, 2335 (1915).
Нитриты металлов
второй группы
Mg(NO2)a
Рис. 379 построен по данным [1 ]. Особые
точки:
t, °C с, %
Лед + Mg(NO2)2-9Н2О —21,2 23,2
Mg(NO2)2-9Н2О + + Mg(NO2)2-6Н2О -10,5 38,6
Mg(NO2)2 6Н2О + + Mg(NO2)2-ЗН2О 29,5 51,9
Ca(NO2)2
Рис. 380 построен по данным работы [1].
Данные Д2, 3] не использованы. Особые
точки:
t, °с с, %
Лед + Ca(NO2)2 -4Н2О
Ca(NO2)2-4H2O +
4- Ca(NO2)2H2O
Ca(NO2)2Н2О + Ca(NO2)2
—20,0
34,5
129
34,2
55,1
(69)
Температура кипения насыщенного рас-
твора 133° II].
144
Sr(NO2)2
Рис. 381 построен по данным [1]. Данные
, 3] не использованы. Особые точки:
[2
Лед+ Sr(NOa)a-4НаО
Sr(NOa)a -4На6 +
+ Sr(NOa)a-HaO
t, °с с, %
-8,80 26,4
15,0 39,6
Ba(NO2)2
Рис.'382 построен по данным [1]. Дан-
ные [2—5] не использованы. Особые точки:
t, °C с, %
Лед + Ba(NO2)a-H2O I -5,9 I 29,4
Ba(NO2)2-HaO+ Ba(NO2)2 | 40,4 | 51,6
Cd(NO2>2
Рис. 383 построен по данным [6]. Особые
точки:
*, «с с, %
Лед + Cd(NO2)2-2Н2О
Gd(NOa)2-2Н2О +
+ Cd(NO2)2Н2О
-20,5
50,8
52,1
71,0
10 Заказ 976
145
ЛИТЕРАТУРА
Рис. 384 построен по данным [1, 2].
Co(NO2)2
Рис. 385.
Рис. 385 построен по данным [3].-
1. J. В u г е a u, Ann. chim. (11\ 8, 111 (1937);
С. г. 201, 68 (1935). — 2. М. Oswald, Ann.
chim. (9), 1, 32 (1914). — 3. D. Y о s t, Н. Rus-
sell, Systematic Inorganic Chemistry, 1944,
p. 62.— 4. F. V о g e 1, Z. anorg. Chem., 35, 389
(1903). — 5. L. J. Gay-Lussac, Ann. chim.
phys. (2), 11, 314 (1819). — 6. П. И. Про-
ценко, Ё.М, Иванов а, Г. П. Проценко,
ЖНХ, 14, 40 (1969).
Нитриты металлов
других групп
ЛИТЕРАТУРА
1. A. F е г г а г i, С. С о 1 1 a, Gazz. chim. ital.,
67, 88 (1937). — 2. П. И. Проценко,
Н. А. Б р ы к о в а, Укр. хим. ж., 30, 448 (1964);
Изв. вузов. Химия и хим. технол., 7, I (1964);
ЖНХ, 9, 982 (1964). — 3. L. 1е В о u с h е г,
An. Soc. espan, fis. quim., 24, 95, 277 (1926).
TlNOa
Рис. 384.
НИТРАТЫ
HNO3
Рис. 386 построен по данным [1, 8, 10].
Данные [2—8] согласуются с данными
[1]. Данные [9] не использованы. Особые
точки:
t, °C C, % Источ- ники
Лед+ HNO3-3H2O -43,0 32,8 1
HNO3-3H2O -18,5 53,8 1
HNO3-3H2O + + HNO3H2O -42 70,5 1
hno3h2o -38,0 77,8 1
hno3h2o + + 4HNO3H2O —57,4 88,0 8
4HNO3H2O+ HNO3 —59,0 93,2 8
HNO3 —41,7 100 10
HNO3H2O + HNO3 -66,0 90,0 1
(мет.)
146
Диаграмма кипения водного раствора
HNO3 построена по данным [11]. Азеотроп-
ная точка: 120°, 68,0%.
Нитраты металлов
первой группы и аммония
LiNO3
ЛИТЕРАТУРА
1. F. W. К (iBter, R. Кге ma пп, Z. anorg.
chem., 41, 1 (1904). — 2. S. U. Р i с k е г 1 n g,
J. Chem. Soc., 63, 436 (1893). — 3. F. R й -
do rff, Pogg. Ann., 116, 55 (1862). — 4. F. R ti -
dor ff, Pogg. Ann., 145, 599 (1872). — 5. H. C.
Jones, F. H. Ge t man, Am. Chem. J., 27,
433 (1902). — 6. H. C. J о n e s, H. P. В a s s e t t,
Am. Chem. J., 34, 290 (1905). — 7.
E. Abel, O. Hedllch, von B. Lengyel,
Z. phys. Chem., 132A, 189 (1928). — 8. J. Po -
tier, A. Potier, C. r., 242; 1474 (1956).—
9. S. M. Johnston, Proc. Roy. Soc. Edin-
burg, 45,193, 855 (1906). — 10. R. J. Gille-
spie, E. D. Hughes, С. K. Ingold,
J. Chem. Soc., 1950, 2552. — 11. J. Potier,
C. r., 282, 1106 (1951).
Данных по растворимости LiNO3 много,
практически все они хорошо согласуются
[1]. Построенная по этим данным диаграм-
ма приведена на рис. 387. Особые точки:
t, °C с, %
Лед + LiNO3 -ЗН2О -22,8
LiNO3-3HaO 29,9
LiNO3 -ЗН2О + LiNO3 27,9
24,6
56,0
61,5
Источ-
ники
2
3
4
Кривая кипения построена по данным
[5]. Температура кипения насыщенного
раствора 200°, концентрация (75%) [6].
10’
147
NaNO8
Данных по растворимости NaNO3 много,
практически все они хорошо согласуются
[1]. Построенная по этим данным диаграмма
приведена на рис. 388. Эвтектика: —17,4°,
38,2% [7]. Па данным этой работы, воз-
можно снижение эвтектической точки до
—23,3°, 44%.
Кривая кипения построена по данным
[8, 9]. Температура кипения насыщенного
раствора 121°, концентрация 69,2% [8].
Рис. 389 построен по данным [10, 11],
полученным в замкнутом объеме. Данные
[12] не использованы. При 275° наблюдает-
ся фазовое превращение NaNO3 [10, 13].
KNO3
Данных по растворимости KNO3 много,
практически все ,они хорошо согласуются
[1]. Построенная по этим данным диаграм-
ма приведена на рис. 390. Эвтектика: —3°,
11% [14]. Переходные точки: 45°, 43,5%;
61?, 53,5% [14].
Кривая кипения построена по данным
работ [8, 9]. Температура кипения насы-
щенного раствора 115,9°, концентрация
77,0% [8]. В работе [15] исследована гра-
ница метастабильной области системы
KNO3—Й20, эвтектика в которой: —5,3°,
10,6%.
Рис. 391 построен по данным [11, 16],
полученным в замкнутом объеме. Данные
[12] не использованы.
RbNO3
Данных по растворимости RbNO3 много,
практически все они хорошо согласуются
[1]. ^Построеннад по этим, данным диа-
148
Рис. 391.
грамма приведена на рис. 392. Эвтектика:
-2,7°, (14,6%) [15]:
Температура кипения насыщенного рас-
твора 118,3°, концентрация 86,1% [17].
CsNO3
Данных по растворимости CsNO8 много,,
практически все они хорошо согласуются
[1]. Построенная по этим данным диа-
грамма приведена на рис. 393. Эвтектика:
—1,5°, (8%) [15]. Температура кипения
насыщенного раствора 106,2 , концентра-
ция 68,8% [17].
149
nh4no3
Рис. 394.
Рис. 394 построен по данным [18—22].
Особые точки:
t, °C C, % I 1СТОЧ- НИКИ
Лед + cc-NH4NO3 -16,7 42,8 18
a-NfLNO3 + + 0-NH4NO3 32 (70,5) 19
P-nh4no3 + + y-nh4no3 84 (87)] 19
y-nh4no3 + + 6-NH4NO3 125 (95) 19
Кривая кипения построена по данным
[9].
Cu(NO3)a
Рис. 395 построен по данным [23]. Дан-
ные [12, 24, 25] не использованы. Особые
точки:
Лед + Gu(NOs)a -9НаО
Cu(NO3)a-9НаО +
+ Cu(NO3)a-6НаО
Cu(NO3)»-6HaO +
+ Cu(NO3)a-ЗНаО
Cu(NO3)a-ЗНаО
Gu(NO3)a-6НаО (мет.)
t, °C с, %
—24 (36)
—20,5 (41)
24,5
(60)
114,5 77,6
26,4 63,3
AgNO3
Данных по растворимости AgNO3 много,
практически все они хорошо согласуются
150
Рис. 397.
[1]. Построенная по этим данным диа-
грамма представлена на рис. 396. Эвтек-
тика: —7,6°, 46,9% [26].
Кривая кипения построена по данным
[27—29]. Температура кипения насыщен-
ного раствора (122°), концентрация (90%).
Рис. 397 построен по данным [1, 12, 26],
полученным в замкнутом объеме. Данные
[11] не использованы.
ЛИТЕРАТУРА
1. Справочник по растворимости солевых си-
стем, т. 3, 1961; т. 4, 1963. — 2. М. И. Рави ч,
Изв. ИФХА АН СССР, 7, 237 (1935).—
3. F. G. Donnan, В. С. Burt, J. Chem.
Soc., 83, 337 (1903). — 4. A. N. Campbell,
R, A. Ba i ley, Can. J. Chem., 36, 524 (1958). —
5. S. M. J о h n a t о n, Proc. Roy. Soc. Edinburg,
45, 193, 855 (1906). — 6. P. Kremers, Pogg.
Ann., 97, 1 (1856); 98, 58 (1856); 99, 25, 435
(1856). — 7. А. А. Поспелов, E. К. Сте-
паненко, В. Г. Чухланцев, ЖФХ, 43,
513 (1969). — 8. J. N. Legrand, С. г., 1, 16
(1835); J. prakt. Chem., 6, 56 (1835); Ann. phys.
chim., 59, 11, 423 (1835). — 9. G. T. G e r 1 a c h.,
Chem. Ind., 9, 241 (1886)./— 10. F. С. К r a c e k,
J. Am. Chem. Soc., 53, 2621 (1931).
11. A. Benrath, F. Gjedebo, B. Schif-
fers, H. Wunderlich, Z. anorg. Chem.,
231, 287 (1937). — 12. A. E t a r d, Ann. chim.
phys. (7), 2, 526 (1894). — 13. F. С. К r a c e k,
E. P о s n J a k, S. B. Hendricks, J. Am.
Chem. Soc., 53, 3339 (1931). — 14. В. А. Поте-
хин, А. Г. Бергман, В. А. Гладущенко,
M. А. Захарченко, ЖНХ, 13, 2848 (1968). —
15. В. М. Jones, J. Chem. Soc., 93, 1740
(1908). — 16. A. Benrath, A. Braun,
Z. anorg. Chem., 244, 350 (1940). — 17. E. Ber-
keley, Phil. Trans. Roy. Soc., 203A, 212
(1904). — 18. H. R о d e b u s h, J. Am. Chem.
Soc., 40, 1204 (1918). — 19. I. L. Millican,
A. F. Jo se p h, T. M. L о wr y, J. Chem. Soc.,
121, 959 (1922). — 20. H. С. К у p н а к о в,
М. И. Равич, Изв. ИФХА, 6, 169 (1933).
21. Е. А. Никитина, ЖОХ, 3 (65), 513
(1933). — 22. Н. Koneczny, М. Lango,
Przem. Chem., 46, 585 (1967). — 23. R. Fun k,
Z. anorg. Chem., 20, 413 (1899); Wiss. Abh. Phys.
Techn. Reich., 3,, 400 (1900). — 24. А. А. Ка-
занцев, Труды ИРЕА, вын. 2, 15 (1923). —
25. К. W. W i I с о х, С. R. Bailey, J. Chem.
Soc., 1927, 151. — 26. A. N. Campbell,
M. L. Boyd, Can. J. Res., 21, 167 (1943). —
27. J. Y. Buchanan, Trans. Roy. Soc. Edinb.,
29, 529 (1899). — 28. L. К a h 1 e n b e r g, J.
Phys. Chem., 5, 339 (1901). — 29. A. N. Camp-
bell, E. M. К a r t z m a r k, Can. J. Res.,
28B, 161 (1950).
Нитраты металлов
второй группы
Be(NO3)2
' Рис. 398.
Рис. 398 построен по данным [1—5].
Особые точки:
Лед + Be(NO3)2-7H2O
Be(NO3)2-7H2O +
+ Be(NO3)a -6Н2О
Be(NO3)2-6Н2О +
+ Be(NO3)2-4H2O
Be(NO3)2-4H2O
t, °C c. % I 1СТОЧ- НИКИ
—53,9 38,8 1
-36,3 (44) 1
-14,5 (50) 1
61,0 64,8 2
151
Mg(NOs)2
Данных по растворимости Mg(NO3)2 мно-
го, практически все они хорошо согласу-
ются [6]. Построенная по этим данным,
полученным в замкнутом объеме, диаграмма
приведена на рис. 399. Особые точки:
t, °C c, % . Источ- ники
Лед + Mg(NOs)2 ’9Н8О -31,9 34,0 7
Mg(NOs)a -9НаО + + Mg(NO3)a-6НаО -18,0 38,0 7
Mg(NO3)8 -6Н2О 90 57,8 8
Mg(NOs)2-6H2O + + Mg(NOa)a 2НаО 52,7 (68) 9
Mg(NO3)2-2НаО 130,9 81,1 9
Mg(NOa)o-2Н2О+ + Mg(NO3)8 130,5 81,9 9
Лед + Mg(NO3)2-ЭД18О (мет.) -31,9 32,0 10
Mg(NO8)a-6H2O+ + Mg(NOa)8-4H2O (мет.) 52,2 67,9 10
Mg(NO3)j-4H2O + + Mg(NO3)2-2H2O (мет.) 51,9 — 10
Ca(NO3)2
Данных по растворимости Ca(NOa)a мно-
го, практически все они хорошо согла-
суются [6]. Построенная по этим данным
диаграмма приведена на рис. 400. Особые
точки:
t, °C c, % Источ- ники
Лед + + a-Ca(NOs)2 -4H8O -28,4 42,5 11
a-Ca(NO3)a -4HaO 42,7 69,5 12, 13
<z-Ca(N0a)2-4H2O + + Ca(NO3)2-3HaO 42,6 70,8 6
€a(NO3)a -3H2O 51,1 75,3 12, 13
Ca(NOs)r3HaO + + Ca(N03)a -2HaO 50,6 4 (77) 13
Ca(NOs)«-2H8O + + Ca(NO3)a 152 £ 51,6 (78,5) 13
t, °C c, % Источ- ники
Лед + + ₽-Ca(NO3)2-4H2O -29 43,5 6
p-Ca(NO3)2-4H8O (мет.) 39,6 69,5 6 •
a-Ca(NO3)2 -4H2O + + Ca(NO3)r2 2H3O (мет.) ~ 39,6 — 13
a-Ca(NO3)2-4H8O + + Ca(NO3)2 (мет.) 32,7 — 13
Ca(NO3)2-3H2O + + Ca(NO3)2 (мет.) 49,8 — 13
Кривая кипения построена по данным
[14]. Температура кипения насыщенного
раствора 152°, концентрация 82%.
Рис. 401 построен по данным [12, 15, 16J,
полученным в замкнутом объеме.
Sr(NO3)2
Данных по’растворимости Sr(NO3)2 мно-
го, практически все они хорош» согла-
суются [6]. Построенная по этим данным
диаграмма приведена на рис. 402. Особые
точки [2]:
t, °C С, %
Лед + Sr(NO3)2 -4Н,0 I -5,4 I 24,7
Sr(NO3)2-4H2O+ Sr(NOa)2 | 29,3 | 47,0
Кривая кипения построена по данным
[14]. Температура кипения насыщенного
раствора 106,8°, концентрация (52%) [17].
Рис. 403 построен по данным [18], полу-
ченным в замкнутом объеме.
Ba(NO3)2
Данных по растворимости Ba(NO3)2 мно-
го, практически все они хорошо согла-
суются [6]. Построенная по этим данным
диаграмма приведена на рис. 404. Эвтек-
тика: —0,7°, 4,75% [19].
Кривая кипения построена по данным
[14, 20]. Температура кипения насыщенно-
го раствора 101,8°, концентрация 25,9%
[21].
Рис. 405 построен по данным [22, 23],
полученным в замкнутом объеме. и
Рис. 399.
153
154
Рис. 402.
Рис. 403-
Рис. 405.
155
Ra(NO8)a
Растворимость Ra(NOa)a при 20е соста-
вляет 12,2% [24].
вления 45,5° н точкой Zn(N63).-6H,O 4-
+ Zn(NO8)2-ЗН2О при 34—36,1°. В работе
[2] не подтверждено образование тригид-
рата.
Zn(NO>)a
Рис. 406 построен по данным работ 12 8
25]. Особый точки [2]: ’ ’
1 Лед+ Zn(NO8)a.9H2O Zn(NO8)a.9H26 + + Zn(NO8)26HaO t, °C —32,0 -17,6 C, % 38,9 (45)
ZnNO8)r6H2O 36,4 (63,7)
Zn(NO8)2 -6H2O + + Zn(NO8)24H20 35,6 65,0
(45,0) (73,8)
ZnlNO^e ‘4H2O + + Zd(NOj)2 -2H2O Zn(NO3)a -2H2O 37,0 54,2 77,9 (84)
Zn(NO8)a 2H2O + 4- Zn(NO8)2 H2O 51,8 86,2
В работе [8] указывается на существова-
ла тригидрата с температурой пла-
Cd(NOs)a
Рис. 407 построен по данным [2, 8].
Особые точки:
t, °C c, % Источ- ники
5®?+?а(№з)2-9И2О -16,0 36,9 2
Cd(NOo)2 -9H2O + + Cd(NO8)2 4H2O 3,5 56,1 2
CdNO3k.4H2O 59,5 76,5 8
Cd(NOa)r4H2O + + Cd(NO3)2-2H2O 48,7 82,3 2
Cd(NO3)2.2H2O + + Cd(NO3)2 . 56,8 86,0 2
В работе [26] указывается, что суще-
ствует Cd(NO3)2.8H2O, а не Cd(NO3)2.
* 9Н •
Рис. 406.
156
г., 255,
Р е t -
ЛИТЕРАТУРА
1. G. Vuillard, J.-C. Rosso, C.
521 (1962). — 2. A. Sieverts, W.
z о 1 d, Z. anorg. Chem., 212, 49, 233 (1933).—
3. А. В. Новоселова, H. Д. H а г о n -
с кая, ЖОХ, 5, 1003 (1935), - 4. А. В. H о -
в ос ело ва, Л. П. Решетникова,
К-т,,*?* вемененко, Фам Ван Тыонг, Вести.
МГУ. ттСер,~ химия, № 1, 32 (1967).—
Л„рх е й о ри Ивв- Политехи, ин-та, 14,
235 (1910). — 6. Справочник - по растворимости
солевых систем, т. 4, 1963. — 7. М. В. Г о л о -
58ЛЯ9..?’ .И8В- Воронежского пед. ин-та, 10,
66 (1948); 16,27 (1955). — 8v R. F u n k, Z. anorg.
ЗДет., 20, 395 <4809); Вег., 32, 97 (1899); Wiss,
Abh. Phys. Techn. Reich., 8, 437 (1900). —
Qi«E,£lnB’ тЛ’ S' Brandner,
» B’ 11СЛ 4 ® г» W. K. G r 1 e s i n g e r
J. Am. Chem. Soc., 55, 4823 (1933). — 10. A. S i e -
xE’ .м V,1 e r> z- anorg. Chem., 200,
309 (1931); A. Sieverts, W. Petzold
Z. anorg.’Chem,, 205, 120 (1932). 11 *
11. А. Г. Бергман, M. В. Маркина.
Укр. хим. ж., 34, 582 (1968). — 12. Н. Bas’
®.®44» Н. Taylor. J. Chem. Soc., 101 580
(1912); 105, 1931 ^1914). —>13. W. Ewing,
N. К г e у, H, Law, E. L a,n g, J Am Chem
Soc., 49, 1958 (1927). - 14 A" V Grach’
9’Л41^18£6):тЛ anat
413 (1887). — 15. M. E. П о 8 и н, В. А. К о -
?“ ?,ан J1®-?®®! ЖПХ, 38, 2679 (I960). —
v U’ chem- S°c-. «*. «7
(1942). — 17. E. Berkeley, M. App le-
bey Proc. Roy. Soc., 85A, 503 (1911).—
<м« В<оПГпЧ Z. anorg. Chem., 249, 248
(1942).-r 19. Л. и. Успенская, И. П.
Глушкова, А. Г. Бергман. ЖОХ
25, 105^ (19&5). — 20» J. х. Buchanan’,
Trans. Roy. Soc. Edinb., 29, 529 (1899).
21. M| Ider cm. Timmermans, v. 3
/P? A* Etard, Ann. chim,
Ehys. (7) 2 528 (1894). — 23. A. Benra thl
F. Gjedebo, B. Schiffers, H. Wun-
derlich, Z. anorg. Chem,, 281, 288 (1937). —
24. O. Erbacher, Ber., 68, 115 (1930).—
J?- 9 w ‘ n J- J. McGovern
G. E. M-at he ws. J. Am. Chem. Soc., 55, 4828
(1933). — 26. A. M. Васильев, ЖРФХО.
4. хим., 42, 566 (1910)
157
Нитраты металлов
третьей группы
AI(NO3)3
Рис. 408.
Рис. 409.
Sc(NO8),
Рис. 410 построен по данным [8]. Твер-
дой фазой в равновесии с раствором яв-
ляется Sc(NO3)3-4Н2О.
ScOH(NO3)2
Рис. 408 построен по данным [1—3].
Данные [4, 5] не использованы. Особые
точки [1]:
Рис. 411.
Лед+ A1(NO3)3-9H2O
A1(NO«)3'9H2O 4-
+ AJ(NO3)38H2O
A1(NO3)3 -8H2O +
+ A1(NO3)3-6H2O
t, °C с, %
—27 30,5
73,5 (58)
’ (103) (61,6)
Рис. 411 построен по данным [8]. Твер-
дой фазой в равновесии с раствором яв-
ляется ScOH(NQg)2«3H2O.
T1NO3
Рис. j4O9 построен по данным [6]. Дан-
ные [7] не использованы.
158
Y(NO3)3
Рис. 412.
Рис. 412 построен по данным [9].
La(NO3)3
Рис. 413 построен по данным [10}. Осо-
бые точки:
Лед 4- La(NO3)3-6Н2О
La(NO3)3 -6Н2О 4-
+ La(NO3)3-5Н2О
La(NO3)3-5Н2О 4~
4- La(NO3)3-4Н2О
La(NO3)3-4H2O4-
4- La(NO3)3-ЗН2О
t, °C с, %
—26,5 43 J 51,9 65,0
66,5 72,6
86 78,9
Более ранние исследования раствори-
мости La(NO3)3 были сделаны в работах
[11—13]. Фрэнд [11] отмечал полиморфное
превращение при 43°, что, по данным [10],
соответствует переходу La(NO3)3-6H2O +
4- La(NO3)3-5Н2О.
159
Ce(NO8)8
Рис. 414 построен по данным [10]. Осо-
бые точки:
Лед + Ce(NO3)3 -6Н2О t, °C . —33,7 C. % 53,4
Ce(NO3)8-6H2O + 39 67,2
+ Ce(NO3)8-5H2O Ce(NO8)3.5H2O + + Ce(NO3)8-4H2O 56 71,2
Ce(NO8)8-4H2O + + Ce(NO8)8xH2O 80 79,2
Более ранние исследования раствори-
мости Ce(NO8)8 были сделаны в работах
[13-16].
160
Pr(NO3)3
Рис. 415.
Рже. 415 построен по данным [10]. Особые точки:
Лед 4- Pr(NO«)8’6HBO
Pr(NO8)3-6Н3О + Pr(NO8)3-5H2O
Pr(NO8)3.5H8O + Pr/NO8)8-4H2O
Pr(NO8)8 4Й2О + Pr(NO8)8 -3H2O
1 >°G
—29,7
36
54
77
e, %
53,4
64,9
72,0
82,1
Более ранние исследования растворимости Pr(NO8)8 были сделаны в ряботат [ц, 13].
11 Заказ 076 161
Nd(NO3)s
Рис. 416 построен по данным [17]. Особые точки:
Лед+ Nd(NO3)3-6Н2О
Nd(NO3)3-6H2O+ Nd(NO3)3-5H2O
Nd(NO3)3-5H2O
Nd(NO3)3 -5H2O + Nd(NO3)3 -sH2O (x < 3)
t, °c
—29,0
23,0
69,7
68,9
c, %
51,8
60,3
78,6
79,7
Более ранние исследования растворимости Nd(NO3)3 содержатся в работах [И, 16,
18, 19]. Фрэнд [11] указывал на полиморфное превращение, что, по данным [17], соот-
ветствует переходу Nd(NO3)3-6Н2О + Nd(NO3)3«5H2O.
162
Sm(NO3)a
Рис. 417 построен по данным [17]. Особые точки:
. t, °C c, %
Лед + Sm(NO3)3-6H2O -30,0 52,0
Sm(NO3)3-6H2O 4- Sm(NO3)3-5H2O 48,0 66,0
Sm(NO3)3-5Н2О 88,8 78,9
Sm(NO3)3-5H2O + Sm(NO3)3 a:H2O 86,5 83,7
Лед+ Sm(NO3)3-5H2O (мет.) —36,7 54,3
Sm(NO3)3-6H2O (мет.) 71,7 ± ± 1,5 (75,9)
Более ранние исследования растворимости Sm(NO3)3 содержатся в работах [13, 16, 20].
Th(NO,)*
Рис. 418 построен по данным [21] в об-
ласти низких температур и данным [22]
при температурах выше 37°. Особые точки
[22]:
Лед + Th(NO3)4-QH2O
Th(NO8)v6H8O +
+ Th(NO3)4-4Н2О
Th(NO3)r4H8O +
4- Th(NO3)4-xH2O
t, °G
(-53)
111
151
UO2(NO3)8
Рис. 419 построен по данным [23, 24].
Особые точки:
C. %
(64)
(82)
(87)
t, °G C, % Источ- ники
Лед+ —18,1 43,1 23
+ UO2(NO3)2-6Н2О UO2(NO3)2;6H2O + + UO2(NO3)2.3H2O UO8(NO3)2 -зн2о + 58,6 75,7 23
113 84,7 24
+ UO8(NO3)2-2H2O UO2(NO3)8-2H2O 184 91,6 24
Сведения о растворимости UO«(NO.)2
содержатся также в работах [25—27].
Рис. 418.
164
UO2(NO3)2, %
Нитраты Pm, Eu, Gd, Th, Dy
Твердая фаза t, °C C, % Источ- ники
Pm(NO8)3-6H8O Pm(NO3)8-6H8O 0 20 54,8 58,4 13 13
Pm(NO3)3 -6H8O Eu(NO3)3-6H8O 50 0 65 55,2 13 13
Eu(NO3)36H8O Eu(NO3)3-6H8O 20 50 58,5 64,6 13 13
Gd(NO3)3 6H8O 0 56,5 28
Gd(NO3)3-6H8O 20 59,5 28
Gd(NO8)3-6H8O 50 65,3 28
Tb(NO3)3-6H8O 0 57,6 13
Tb(NO3)3-6H8O 20 60,6 13
Tb(NO3)3-6H8O 50 66,1 13
Dy(NO8)8-6H8O 0 58,9 28
Dy(NO33-6H8O 20 61,5 28
Dy(NO3)3-6H8O 50 68 28
ЛИТЕРАТУРА
1. G. M a 1 g u о г 1, Atti Accad. Line. (6), 5,
882 (1827), —» 2. G. Malguorl, Gazz. chim.
ital., 58, 781 (1928).— a. G. Malguorl,
Attl Accad. Line. (6), 9, 569 (1929); (6); 5, 451
(1927). — 4. А. И. Заславский, Я. А. Рав-
дин, ЖОХ, 9, 1478 (1939). — 5. H. T a n a k a,
J. Soc. Chem. Ind. (Japan), Suppl.,- 88, 489B
(1930). — 6. E. Berkeley, Phil. Trans. Roy.
Soc., 208A, 189 (1904). — 7. A. Etard, Ann.
chim. phys. (7), 2, 503 (1894). — 8. Г. Я. П у ш -
кина, Л. Н. Комиссарова, ЖНХ, 8,
1498 (1963). — 9. М. С. С г e-w, Н. Е. 8 t е i -
пег t, В. S. Hopkins, J. Phys. Chem., 29.
34 (1925). — 10. К.!!. Миронов, А. П. По-
пов, Rev. тот. chim., и, 1373 (1966).
И. J. N. Friend, J. Chem. Soc., 1985, 824,
1430. — 12. С. J а т е s, С. F. W h i 11 е т о г е,
J. Am. Chem. Soc., 84, 1168 (1912). —
13. G. В г u n i s h о 1 z, J. P. Q u i n c h e,
A. M. К a 1 o, Helv. chim. acta, 47, 14 (1964).
14. И..И. Ангелов, Труды ИРЕА.22, 18
(1958). — 15. E. Ф. Журавлев, А. Д. Ше-
велев a, P. Л. Богдановская,
С. Ф. Кудряшов, В. А. Шупов, ЖНХ,
8, 1955 (1963). — 16. L. L. QuilLR. F. Ro-
bey, J. Am. Chem. Soc„ 59, 2591 (1937).—
17. А. П. Попов, К. E. Миронов, Rev.
rom. chim., 18, 765 (1968). — 18. C. James,
J, E. Robinson,). Am. Chem. Soc., 35, 754
(1913). — 19. К. E. Миронов, E. Д. Сини-
цы н a, Иав. CO АН СССР. Сер. хим. наук,
№11, вып. 3, 3 (1963). — 20. К. Е. Миро-
нов, Е. Д. Синицына, А. П. Попов,
ЖНХ, 11, 2361 (1966).
21. Р. Misciatelli, Gazz. chim. ital.,
60, 833 (1930).— 22. L. Marshall,
J. S. G i 11, С. H. S e с о y, J. Am, Chem. Soc.,
73, 4991 (1951). — 23. O. G u e m p e 1, Bull.
Soc. chim. Belg., 88, 443 (1929). — 24. W. L.
Marshall, J. S. G 111, С. H. S e -
coy, J. Am. Chem. Soc., 75, 1867 (1951).—
25. A. M. Васильев, ЖРФХО. Ч. хим.,
42, 570 (1910).— 26. A. Benrath, Z. anorg.
Chem,, 249, 245 (1942). — 27. M. А. Якимов,
H. Ф.. H о с о в а, В. А. Гришин, ЖНХ, 8,
504 (1958). — 28. R. M p r e t CM. Helv. chim.
acta, 47, 14 (1964).
165
Нитраты металлов
четвертой группы
Mn(NO3)2
Рис. 423 построен по данным [3, 4]*
Данные [3] при температуре выше 10°
не использованы. Особые точки:
Pb(NO3)2
Рис. 420 построен по данным [1]. Кривая
кипения построена по данным [2]. Темпе-
ратура кипения насыщенного раствора
103,5°, концентрация 57,8% [2].
Лед +
+ Mn(NO3)2-6НоО
Mn(NO3)2-6H2O
Mn(NO3)2-6H2O +
+ Mn(NO3)2-4H2O
Mn(NO3)2-4H2O
Mn(NO3)2-4H2O +
+ Mn(NO3)2 -2H2O
Mh(NO3)2 -2H2O +
+ Mn(NO3),-H2O
t, °C -36 С, % 40,5 Источ ники 3
25,3 62,4 4
24,7 64,0 4
37,1 71,3 4
(25) (77,2) 4
(36,0) (82) 4
Мнение Функа [3] о существовании
Mn(NO3)2-ЗН2О не подтвердилось.
ЛИТЕРАТУРА
1. М. Т. Серебренникова, ЖПХ, 26,
1081 (1953). — 2. N. О. Smith, J. Am. Chem.
Soc., 67, 1228 (1945). — 3. R. F u n k, Wise.
Abh. Phys. Techn. Reich., 3, 440 (1900); Z. anorg.
Chem., 20, 393 (1899). — 4. W. W. Ewing,
H. E. Rasmussen, J. Am, Chem. Soc., 64,
1443 (1942).
ZrO(NO3)2
Нитраты металлов
восьмой группы
Рис. 421 построен по данным [3]. Пере-
ходная точка: 46°, 43,9%.
HfO(NO3)2
Рис. 422 построен по данным [3]. Пере-
ходная точка: 35°, 50,5%.
Fe(NO3)2
Рис. 424 построен по данным [1, 2]
Особые точки: t, °C с, %
Лед+ Fe(NO3)2-9H2O -28 (35)
Fe(NO3)2-9H2O + —12 (39)
+ Fe(NO3)2-6H2O Fe(NO3)2-6H2O 60,5 62,5
ЛИТЕРАТУРА
1. А. А. К а 3 а н ц е в, ЖНХ, 5, 1598 (i960). —
2. G. Т. Gerlach, Z. anal. Chem., 26, 440
(1887). — 3. Л. И. Ю р а н о в а, Л. Н. Комис-
сарова, В. Е. Плющев, ЖНХ, 7, 1062
(1962).
Нитраты металлов
шестой и седьмой групп
Cr(NO3)3
Растворимость Cr(NO3)3-9H2O при 5,25
и 35° составляют соответственно 39,2 [1],
44,8 [2] и 47,50% [1].
166
Co(NO3)2
Рис. 425 построен по данным ;2]. Осо- c. %
бые точки: t, °C
Лед + Co(NO3)2-9H2O -29 (40)
Co(NO3)2-9Н2О 4- -21 (43,5)
+ Co(NO3)2-6H2O 55
CO(NO3)2-6H2O + (62,5)
+ Co(NO3)2-3H2O Co(NO3)2-6H2O 56 62,9
Co(NO3)2-3H2O 91 77,2
Сведения о растворимости Co(NOs)2 со-
держатся также в работах [3—6].
Рис. 421.
Рис. 422.
Рис. 423.
167
Рис. 424.
Ni(NO3)2
Рис. 426.
Рис. 426 построен по данным работы [7].
Особые точки:
t, *С с, %
Лед + Ni(NO3)a-9HaO —27,8 36,0
Ni(NO3)r9HaO'+ 4- Ni(NO3)a-6HaO Ni(NO3)»-6HaO+ + Ni(NO3)a -4H2O (-3) (44)
54,0 60,0
Ni(NO3).-4HaO + + Ni(NO3)a-2HaO Лед + Ni(NO3)a-6HaO (мет.) 85,4 67,2
—34,1 38,7
Мнение Функа [1, ,2] о существовании
Ni(NO3)a>3HaO не подтвердилось.
Fe(NO3)s
t, °C c. % Источяжкж
0 40,2 8, 9
20 45,2 9
25 46,6 8
40 51,2 8, 9
168
Твердой фазой в равновесии с раствором
является Fe(NO8)8-9H8O.
Имеются данные по понижению темпера-
туры замерзания растворов Fe(NO3)8 [10].
ЛИТЕРАТУРА
1. R. Funk, Wise. Abh. Phys. Techn. Reich.
3, 440 (1900). — 2. R. Funk, Z. anorg. Chem.,
' 20, 393(1800). — 3. K. W. W i loo x, C. R. В a i
ley, J. Chem. Soc., 129, 150 (1927).—
4. А. Вальдман. Л. Клячко-Гурвич,
ЖОХ, 8, 791 (1935). — 5. L. I. Ket zin,
J. R. Ferraro, J. Am. Ghem. Soc., 72, 5451.
(1950). — 6. Г. Ji. Горштейи, H. И. Си-
лантьева, ЖОХ, 24, 201 (1954). — 7. A. Sie-
ve r t s, L. Schreiner, Z. anorg. Chem., 219,
105 (1934).—.8. G. Malguori, Atti Accad.
Line. (6), 5, 801, 1000 (1927); (6), 9, 562 (1920). —
9. А. И. Заславский, Я. A. Pa в дин,
ЖОХ, 9, 1473 (1939). — 10. H. G. Jones,
F. H. Getman, Z, phys. Chem., 49, 427 (1904).
Cu(N3)8
Ориентировочное значение раствори-
мости Cu(N3)2 составляет 8>10~8%.
ФОСФОРСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
ГИПОФОСФИТЫ
Гипофосфиты Са, Ba, Nd, Мп, Ni
Твердая фаза t, °C о. % Источ- ники
! Са(Н2РО2)2 —0 14,3 '4
Ва(Н2РО2)2Н2О —о 22,2 4
Ва(Н2РО8)2Н2О 100 25,0 4
Nd(H2PO2)3 — 0,82 5
Мп(Н2РО2)2-Н2О 25 13,2 6
Мп(Н2РО2)2Н2О 100 14,3 6
Ni(H8PO2)2-6Н2О 30 13,8 7
Ni(H2PO2)2-6Н2О 60 27,8 7
ЛИТЕРАТУРА
1. Л. Н. А л ы и о в а. Д.М, К о р ф, Н. Д. Л е-
б е д е в а, ЖНХ, 8, 1023 (1963); 11, 2401 (1966). —
2. Р. W. Squire, С. М. Caines, Pharm. J.
(London), 74, 720, 784 (1905). — 3. A. F e г г a г i,
G. С о 11 a, Gazz. chim. ital., 67, 88 (1937).—
4. A. Wurtz, Ann., 43, 318 (1842); Ann. chim.
phys. (3), 7, 40 (1843). — 5. В. В. Серебрен-
ников, Химия редкоземельных элементов.
Изд. Томского гос. ун-та, т. 1, 1959, стр. 378. —
6. S е i d е 1 1, v. 2, 1965, р. 561. — 7. G m е -
lin, Bd. 57, Т. В, 1966, S. 961.
ФОСФИТЫ
Рис. 427.
Рис. 427 построен по данным [1].
КН2РО2
Рис. 428 построен по данным [1].
nh4h8po,
Растворимость NH4H2PO8
составляет 830 г/л [2].
при ~201 2 * 4 5 6
Н3РО3
Растворимость Н8РО3 при 0—40° по дан-
ным [1] описывается уравнением: с =
•= 75,4-f-0,30f.
Li2HPO8
Рис. 430 построен по данным [2]. Эвтек-
тика: (—4°), (9,4%).
Т1Н2РО2
NaH2PO8
Рис. 429 построен по данным [3]. Эвтек-
тика: —25°, 70,9%'. Температура плавле-
ния НО*.
Рис. 431 построен по данным [3]. Твер-
дой фазой в равновесии с раствором яв-
ляется NaH2PO3-2,51^0.
169
Рис. 428.
Рис. 430.
Рис. 429.
1
Рис. 431.
170
СоНРОз, NiHPO3
Рис. 432 построен по данным [4].
Фосфиты Na, К, NH4, Mg, Са, Sr,
Ba, Tl, V
Твердая фаза 1, °C С, % Источ- ники
Na2HPO3-5H2O 25 38,4 5
К2НРО3 25 60 6
КН2РО3 10 63,2 3
(NH4)2HPO3-Н2О —о 33,3 7
NH4H2PO3 0 63,1 3
nh4h2po3 14,5 65,5 3
nh4h2po3 31 72,2 3
Mg(HJ>03)2 20 16,3 8
Ca(H2PO3)2H2O 20 26,4 8
Sr(H2PO3)2 20 20,6 8
ВаНРО3 30 0,63 9
Ba(H2PO3)2 Н2О 20 20,0 8
Т12НРо3 20 19,2 10
УН(НРО3)2-ЗН2О 20 —0,021 11
ЛИТЕРАТУРА
1. Timmermans, v. 4, 1960, p. 518;
-Gmelln, Bd. 16, T. C, 1965, S. 124.—
2. A. Rosenheim, W. R e g 1 i n, Z. anorg.
-Chem., 120, 104 (1922). — 3. L. A m a t, C. r.,
105, «09 (18*7); 100, 1352 (1888); Ann. chim. phys.
(6), 24, 300 (1891). — 4. A. M. Луняцкас,
Труды АН ЛитССР. Сер. хим., техн., геогр.,
4, 43 (1905).— 5. Л. Н. Алымова,
Д. М. Корф, Н. Д. Лебедева, ЖНХ, 8,
1023 (1963). — 6. М. Ebert, A. Muck, Coll.
Czech. Chem. Comm., 28, 257 (1963). — 7. G m e -
11 n, Bd. 23, 1936, S. 416. — 8. Z. Dlouhy,
M. Ebert, V. Vesely, Coll. Czech. Chem.
Comm., 24, 2802 (1959). — 9. M e 1 1 о r, v. 8,
1965, p. 915. — 10. M. Ebert, Coll. Czech.
Chem. Comm., 24, 3348 (1959). — 11. J. Pod-
ia h a, Coll. Czech. Chem. Comm., 28, 1541 (1963).
ГИПОФОСФАТЫ
Na4P2O6
Рис. 433.
Рис. 433 построен по данным [1]. Дан-
ные [2] не использованы. Переходная точ-
ка: 66,5°, (5,4%).
Na3HP8Oe
Рис. 434.
Рис. 434 построен по данным [1, 2]. Пе-
реходная точка: 58,5°, (20,9%) [1].
171
ЛИТЕРАТУРА
№18Н8Р2О4
Рис. 435 построен по данным [1, 2].
Переходная точка: 80,5°, (22,7%) [1]..
ГипофосфаТы Li, К, NH4, Mg, Са, Ва
-1. J. Н о 11 у h е a d, J. D. Lee, J. Chem.
Soc., 1937, 923. — 2. I. M ti 11 e r. Z. anorg.
Chem., 96, 56 (1916). — 3. A. Rosenheim,
W. Re gl i n, Z. anorg. Chem., 120, 103 (1922). —
4. G. R a m m e 1 s b e г g, J. prakt. Chem. (2),
45, 154 (1892). — 5. Th. Salzer, Ann., 211,
14 (1882). — 6. Th. Salzer, Ann., 194, 32
(1878). — 7. Th. Salzer, Ann., 232, 116
(1883). — 8. Pa sc a 1, t. 4, 1958, p. 8?5. —
9. E. Cornec, Ann. chim. phys. (8), 30,'112
(1913).
ОРТОФОСФАТЫ
H8PO4
Твердая фаза t, °C C, % Источ- ники
Li^Oe-THaO 0 0,102 3 .
Li<P8Oe‘7H8O —20 0,492 4
Li4P8Oe-7H8O 25 0,058 3
L^PaO^HaO 25 0,013 ♦ 3
ЬцР8Ов-7Н8О Kjape .8H.0 40 0,048 20'** 3 5
K8HP8O,-3H,O KaHaPaOe-2H8O 66,7 ** 5
— —24** 5
KaH8P8Oe-2H8O 100 -50** 5
К8Н9Р8Ов *3H8O —- —24** 5
К^Р^ ЗИ,0 f 100 -50** 40 5 5
(Ын’Ж'НаО (МнХн8Р2Ов (NH4)8H„P80e MgHaPjOe -4H8O CaH8PaOe-6H8O 100 67 5
14 3,22 6
14 6,7 6
100 20л 0,36 6 7
— 1,1 6,7
BaH8P8Oe*2H8O — 1,0 8
* По мнению авторов, эти данные более
достоверны.
** Из работы [5] не ясно, относятся ли числен-
ные значения растворимости к гидрату или
к безводной соли.
Рис. 436.
Рис. 436 построен по данным [1, 2]. Осо-
бые точки fl]:
Лед + 2Н8РО4‘2Н8О
2Н8РО4-Н8СГ
2Н8РО4Н8О+ Н8РО4
Н,РО.
1, *с
-85
29,3
23,5
42,4
ЛИТЕРАТУРА
С, %
62,5
91,6
94,8
100
Имеются данные по понижению темпе-
ратуры замерзания растворов К4Р2Ов,
К8НРяОв, К2Н2Р2Ов [9].
1. W. И. R о в в, R. М. J о п е 8, J. Am. Chem.
Soc., 47, 2165(1925). — 2. G. Grube, M.Stae-
sche, Z. phys. Chem., 130, 572 (1927).
172
Ортофосфаты металлов
первой группы и аммония
ся [4]. Построенная по этим данным диа-
грамма приведена на рис. 439 (стр. 174).
Особые точки [6]:
Рис. 437.
Лед + a-NaaHPO4 12НаО t, °C —0,47 C, % 1,45
a-NaaHPO412HaO + + p-NaaHPO412HaO 29,6 (17)
p-NaaHPO412HaO + + NaaHPO4-7HaO 35,0 (30)
NaaHPO4-7HaO + + NaaHPO4-2HaO 48,1 (44)
Na2HPO4-2Ha0 + + NaaHPO4 95,0 (51)
Кривая кипения построена поданным[7].
Температура кипения насыщенного рас-
твора 106,5°, концентрация (50%).
Рис. 438.
NaHaPO4
Рис. 437 построен по данным [1—4].
Согласно данным [5], точка NajPO4 •
• ЮНа0 + Na3P04«8HaO находится при
73,4°. Сведений об эвтектике: и других
точках перехода кристаллогидратов не
имеется.
Рис. 438 построен по данным И к полу-
ченным в замкнутом объеме. Точкй пере-
хода кристаллогидратов точно не устано-
влены.
NaaHPO4
Данных по растворимости NaaHPO4 мно-
го, практически все они хорЬшо согласуют-
Дэнных по растворимости NaHaPO4 мно-
го, практически все они хорошо согласу-
ются [4]. Построенная по этим данным
диаграмма приведена на рис. 440. Особые
точки: /
Лед +
+ NaHaPO4-2H»O
NaHaPO4-2HnO +
+ NaHaPO4-HaO
NaH,PO4HaO +
+ NaHaPO4
t, °C
-9,9
40,8
58,0
с, %
32,4
58,2
63,3
Источ-
ники
8
9—11
10
См. также рйс. 454.
173
Рис. 439.
. 174
К8РО4
Рис. 441.
КН2РО4
Рис. 441 построен по данным [12—14].
Особые точки [13]:
t, °C с, %
Лед+ К8РО4-9Н2О -24,0 38,3
К8РО49Н2О + + К8РО4-7Н2О (-15,0) (41)
К3РО4-7Н2О 45,6 (63)
К8РО4-7Н2О + + К3РО4-ЗН2О 45,4 (64)
Лед+ К3РО4-7Н2О (мет.) —28,2 40,3]
К2НРО4
Рис. 442 построен по данным [12—17].
Особые точки [13]:
Лед+ К2НРО4-6Н2О
КЯНРО4-6Н2О +
+ К2НРО4-ЗН2О
К2НРО4-ЗН2О+ К2НРО,
t, °с
-13,5
14,3
48,3
С, %
36,8
(61)
(72)
Температура плавления ^КгНРОд’бНгО
15°.
Рис. 443.
Данных по растворимости КН2РО4 много,
практически все они хорошо согласуются
[4]. Построенная по этим данным диаграмма
приведена на рис. 443. Особые точки:
t, °C с, % Источ-
ники
Лед 4- а-КН2РО4 I —2,6 I 11,7 118* 19
а-КН2РО4+ р-КН2РО4 I 65 135 I 20
175
КЬНЯРО4
Рис. 444 построен по данным [21, 22].
Рис. 446 построен по данным [16, 23—
26]. Особые точки [25]:
СзНяРО4
Лед+ (NH4)2HP04-2H20
(NH4)2HPO4-2H2O +
+ (NHJjHPO,
Лед + (NH4)2HPO4 (мет.)
t, °G с, %
-6,5 29,6
16,5 , 39,0
—9,5 35,0
Рис. 445 построен па данным [21].
- (NH4)2HPO4
Рис. 447 построен по данным [27], полу
ченным в замкнутом объеме.
nh4h2po4
176
Данных по растворимости NH4H2P04
много, практически все они хорошо согла-
суются [28]. Построенная по этим данным
диаграмма приведена на рис. 448. Эвтек-
тика: -45°, 18% [29, 30].
Ортофосфаты Li, Си, NH4
Твердая фаза t, °C c, % Источ- ники
Li3PO4 0 0,022 31
Li3PO; 0 0,023 12
Li3PO4 20 0,030 31
Li3PO4 20 0,035 12
Li3PO4-2H2O 25 0,030 32
LiH2PO4 0 55,8 31
(NH4)3PO4 25 15,0 34
(NH4)3PO4-3II2O 25 14,0 35
Cu3(PO4)2 25 0,067 33
Cu3(PO4)2 50 0,21 33 ‘
ЛИТЕРАТУРА
1. W. Schroeder, A. Berk, A. Gab-
riel, J. Am. Chem. Soc., 59, 1785 (1937).—
2. К. Kobe, A. L eipper, Ind. Eng. Chem.,
32, 202 (1940). — 3. А. П. О б у x о в, M. Н. Ми-
ха й л о в а, ЖПХ, 8, 1150 (1935). — 4. Справоч-
ник по растворимости солевых систем, т. 3,
1961. - 5. Т. W. Richards, J. В. Chur-
chill, Z. phys. Chem., 28, 314 (1899). —
6. D.H a mm ic k, H. G о a d b у, H. В о о t h,
J. Chem. Soc,, 117, 1589 (1920). — 7. G. Ger-
lach, Chem. Ind,, 9, 241 (1886); Z. anal. Chem.,
26, 450 (1887). — 8. С. Я. Шпунт, ЖПХ,
13, 10, 25 (1940). — 9. A. I m a d s u, Mem. Coll.
Sci. Eng., Kyoto Univ., 3, 257 (1912). —
10. А. Бу губа ев, Б. Иманакун ов,
М. Ж а к и п о в, Сборник научных работ сту-
дентов Киргизского гос, ун-та, № 1, 1954,
стр. 31.
11. G. W. Morey, J. Am, Chem. Soc., 75,
5794 (1953). — 12. В. W e n d г о w, К. Kobe,
Chem. Rev., 54, 914 (1954). — 13. M. И. Ра-
ви ч, Изв. АН СССР. Сер. хим., 1938, 137; Ка-
лий, № 10, 40 (1936). — 14. Л. Г. Берг, Изв.
АН СССР. Сер. хим., 1938, 147, 161. —
15. L. Selva, Bull. Soc. chim. France, 1947,
261. — 16. А. Г. Бергман, А. Д. Дзуев,
Л. В. О п p e д e л e н к о в а, ЖПХ, 40, 1838
(1967). — 17. А. Д. Д з у e в, А. Г. Б e p г м а н,
Укр. хим. ж., 33, 151 (1967). — 18. П. Ф. Б о ч -
Карев, Труды Вост.-Сиб. гос. ун-та, № 3,
25 (1937). — 19. А. Г. Бергман, П. Ф. Б о ч-
Карев, Изв. АН СССР. Сер. хим., 1938, 239. —
20. К. Сулайманкулов, Л. Шарин-
дина, А. Турдубаев, С. Фельдшер,
Сборник научных работ студентов Киргизского
гос. ун-та, № 1, 1954, стр. 30.
21. И. Н. Быкова, Г. П. Кузнецова,
В. Я. К о л о т и л о в а, Б. Д. Степин,
ЖНХ, 13, 540 (1968). — 22. А. Я. Зворы-
кин, Л. С. В е т к и н а, ЖНХ, 6, 2572 (1961). —
23. А. Г. Бергман, Л. В. Великанова,
ЖНХ, 11, 2370 (1966).— 24. А. Г. Трещов,
Доклады Моск. с.-х. академии им. Тимирязева,
№ 29, 402 (1957). — 25. К. С. -Чернова,
Изв. СФХА АН СССР, 15, 112 (1947). —
26. G. Н. Buchanan, G. R. Winner,
Ind. Eng. Chem., 12, 448 (1920). — 27. E. J a -
песке, Z. phys. Chem., 177A, 7 (1936). —
28. Seidell, v. 2, 1965, p. 729.- 29.
А. Г. Бергман, Л. В. Определен-
но в a, А. Д. Дзуев, Укр. хим. ж., 33, 285
(1967). — 30. А. Г. Бер гман, Л. В. О п р е -
делен кова, ЖПХ, 40, 1835 (1967).
31. A. Rolle t, R. Lauffenburger,
Bull. Soc. chim. France (5), 1, 146 (1934). —
32. A. Rosenheim, W. R e g 1 1 n, Z. anorg.
Chem., 120, 111 (1922). — 33. И. Г. Дружи-
нин, Л. А. Туше в а, ЖНХ, 11, 2374
(1966). — 34. W. H. Ross, A. R. Merz,
K. D. Jacob, Ind. Eng. Chem., 2U 286 (1929). —
35. С. И. В о л ь ф к о в и ч, Л. Е. Берлин,
Б.. М. М а н ц е в, ЖПХ, 5, 1 (1932).
Ортофосфаты металлов
других групп
Ортофосфаты Mg, Са, TI, Со
Твердая фаза t, °C c, % Источ- ники
Mg3(PO4)2-8H2O — 0,021 1
MgHPO4-7H2O — 0,310 1
MgHPO4-3H2O — 0,025 1
Mg(H2PO4)2 25 22,3 2
CaHPO4 * 24,5 0,020 3
CaHPO4 * 25 0,023 4
CaHPO4 * 25 0,015 5
CaHPO4 * 29,5 0,019 6
CaHPO4 2H2O 25 0,103 8
CaHPO4-2H2O (мет.) 25 0,010 9
T13PO4 15 0,49 10 ’
T13PO4 100 0,67 10
Co3(PO4)2 — 52,3 11
* По данным [7] растворимость СаНРО* ири
~20° составляет 0,00486%.
ЛИТЕРАТУРА
1. Pascal, t. 4, 1958, р. 211, 212,—
2. А. П. Б о л о п о л ь с к и й, С. Я. Шпунт,
М. Н. Ш у л ь г и н а, Исследования по приклад-
ной химии. Сборник работ, посвященный памяти
акад. Э. В. Брицке, Изд. АН СССР,. 1955.
стр. 111. — 3. И. Тананаев, С. Чрела
ш в и л и, Н. Шелия, Труды Тбилисского
хим. ин-та, II, 163 (1940).-— 4. G. Magna-
n i n i, Gazz. chim. ital., 31, 544 (1901). —
5. F. Cameron, A. Seidell, J. Am. Chem.
Soc., 26, 1460 (1904). — 6. В. С. В ы з г о,
М. Н. Н а б и е в, ДАН УзССР, № 6, 19 (1955). —
7. К. Н. Behrendt, Biochem. Z., 146, ?20
(1924). — 8. Н. В a s s е 11, J. Chem. Soc., 111.
624 (1917). — 9. J. D’ Ans, R. Knutter,
Angew. Chem., 65, 579 (1953). — 10. W. Cro-
о k e s, J. Chem. Soc., 17, 135 (1864). — 11. G m e -
1 i n, Bd. 58, 1961, S. 741.
ПИРОФОСФАТЫ
H4P2O7
В работе [1] указаны особые точки:
«, °C с, %
Лед + Н4Р2О71,5Н2О —75 59
H4P2O71,5H2O 26 86,8
H4P2O7-1,5H2O+ H4P2O7 23 88,8
H4P207 61 100
12 Заказ 97*6
177
Na4P2O7. %
Рис. 449.
Рис. 449 построен по данным [2—4, 6J.,
Данные [5] не использованы. Особые точки:
t, ®С с, % Источ-
ники
Лед 4- Na<P2O7 • 10НЯ0 —0,43 2,13 2,4
Na^P.O, IOHjO + (79,5) (35,5) 3,6
+ Na<P2O7
Na2H2P20.7
Рис. 451 построен по данным [10]. Осо-
бые точки:
Лед+ NaaH2P2O7-6H2O'
Na2H2P2O7-6H2O +
4~ NaaHaP2O7
t, °C с, %
—0,7 4,08
27 14,4
См. также рис. 454. . Растворимость
Na2H2P2O7*6H2O при 18° составляет
149,5 г/л [9].
Температура кипения насыщенного рас-
твора 101,3°, концентрация 30,1% [7].
Na2HP2O7
Рис. 450.
К4РгО7
Рис. 452.
Рис. 450 построен по данным [8]. Пере-
ходная точка: (29,6°), (23%). Раствори-
мость Na»HP2O7 ’6Н2О при 18° составляет
281,7 э/л [9].
Рис. 452 построен по дайным [11]. От-
мечено, что К4Р2О7 • 3,5Н2О устойчив при
0-79°, К4Р2О7 • 0,5Н2О при 79-100°,К4РаО,
при 105—155°.
178
Данные по растворимости К4Р2О7-ЗН2О
имеются в работе [6], по понижению тем-
пературы замерзания растворов К4Р2О7 —
в работах [4, 12].-
(NH4)8HP2O,
Рис. 453.
Рис. 453 построен по данным [11].
Пирофосфаты Na, Tl, Fe
Твердая фаза i, °C C, % Источ- ники
NaH3P2O7 18 62,7 9
Tl4PjO7 20 28,5 13, 14
Fe4(P 8О?)я -9Н 8О 25 0,373 15
Fe4(P2O7)3 •9Н2О ’ 50 0,612 15
Имеются данные по понижению темпера-
туры замерзания растворов КН,Р2О7,
К2Н2Р2О7, К8НР2О7 [12].
ЛИ ТЕРАТУРА
1. Н. Giran, С. г.. 146, 1270 (1908).—
2. ’Н. Menzel, G. G й b 1 е г, Z. anorg. Chem.,
177, 193 (1929). -3. Н. Menzel, L. Sieg,
Z. Elektrochem., 88, 287 (1932). — 4. S. H u-
sain, Z. anorg. Chem., 177, 220 (1929).—
5. P о g g i a 1 e, J. pharm. chim*. (3), 44, 273
(1863).' — 6. L. R. W a t s о n, J. S. M e t с a 1 f,
J. Chem. Eng. Data, 6, 331 (1961). — 7. G. T. G e r-
1 a c h, Z. anal. Chem., 26, 451 (1887).—
8. P. E. Hubbard, Ind. Eng. Chem., 41, 2911
(1949). — 9. H. Giran, Ann. chim. phys. (7),
80, 249 (1903). — 10. L. Selva, си. Seidell,
v. 2, 1985, p. 1108.
11. Ё. Kobayashi, J. Chem. Soc. Japan,
88, 132 (1962); C. A., 58, 7429h, 8621d.—
12. E. С о r n e c, Ann. chim. phys. ’(8), 80, 112
(1913). — 13. Ф. Я. К у л ь б а, В. Е. Миро-
нов, Химия таллия, Госхимиздат, 1963, стр.
198. — 14. Аналитическая химия таллия, Изд.
АН СССР, I960, стр. 128.— 15. Е. 0 11-
'Verl-Mandala, Gazz. chim. itaL, 51, 135
(1921).
12*
МЕТАФОСФАТЫ
NaPO8
SI Рис. 454 построен по данным [1], полу-
ченным в замкнутом объеме. Особые точки:
NaH2PO4 + Na2HjPjO7
Na2H2P2O7 + a-NaPO8
a-NaPO3 4- p-NaPO3
9. eC c, %
169 (52,3)
343 (64,0)
443 (65,7)
Известны еще две}модификации NaPO8,
которые трудно растворимы в воде.
Na8P gOj
Рис. 455 построен по данным [2]. Особые
точки:
t, “С о, %
Na8P8Oe-6H2O4- Na8P8O9 (33,5) (23)
Na8P3Oe-6H2O + (36,5) (24)
+ Na3P3Oe • Hgg (мет.)
Na4P 4Oia
Рис. 456 построен по данным [2]. Осо-
бые точки: t, °C c» %
Na4P4012-10H20 + 4- cc-Na4P4()12 ^HjO Na<P4O12 10H2O + + P-Na4P4O12-4H2O (мет.) (7,5) (8,5)
(23) (15)
179
Рис. 455.
(NH4)4P4OM
Рис. 457 построен по данным [3].
Ва3(РОз)в
Растворимость Ва3(РО3)в’6Н2О по дан-
ным [4] при 20° составляет 14,3 г/л, а по
данным [5] при —20° — 2,59 г/л.
Метафосфаты К, Ag, Са, Sr, Ва,
Zn, Cd, Tl, Со
Твердая фаза t, °C c, % Источ- ники
К4Р4О12-2Н2О ~o 45 * 6
К4Р4О12-2Н2О 15 50 * 6
Ag3P 369 —0 1,65 7
Ca2P4U12 '4Н2и — —2 * 6
Sr2P4O12 -8Н2О — 1,8 * 6
Ва2Р4О12 -8Н2О — —2 * 6
Zn(PO3)2-4H2O — 1,6 * 6
Zn2P4O1210H2O — 1,8* 6
Zn3(PO3)6-9Н2О 20 0,01 4
Cd(PO3)2 -3H2O — 3,0* 7
a-TlPO3 20 0,15 8
a-TlPO3 100 0,15 8
Co(PO3)2-6H2O — 3,8 * a
* Из работ [6, 7] не ясно, относятся ли числен-
ные значения растворимости к гидрату или к без-
водной соли.
I
ЛИТЕРАТУРА
1. G. W. Morey, J. Am. Chem. Soc., 75,
5794 (1953). — 2. Ван Везер, Фосфор и его
соединения, ИЛ, 1962, стр. 527, 535. — 3. Е. Ko-
to а у a s h i, Nippon Kagaku Zasshi, 85, 481
(1964). — 4. G. T a m m a n n. J. prak't. Chem.
(2), 45, 417, 426 (1892). — 5. A. Wiesler,
Z. anorg. Chem., 28, 198 (1901). — 6. G m e 1 i n,
Bd. 22, 1942, S. 1005; Bd. 28, 1961, S. 1188;
Bd. 29, 1931, S. 216; Bd. 30, 1932, S. 335; Bd. 32,
1924, S. 279; Bd. 58, 1932, S. 391. — 7. M e 1-
lor, v. 3, 1956, p. 489; v. 4. 1957, p. 663.—
8. R. Ciirti, Gazz. chim. ital., 68, 703 (1938).
ПОЛИФОСФАТЫ
Na6P3Oio
Рис. 458 построен по данным [1]. Эвтек-
тика: (—1,41ь), (13,9%). Данные [2] не
использованы.
NaeP40i3
Растворимость NaeP4O13 • 18НаО соста-
вляет 33,3% [3]. Из работы не ясно, от- !
носится ли значение растворимости к гид-
рату или к безводной соли.
K5P3Oio
Растворимость К5Р3О14) при 25° соста-
вляет —65% [4].
180
Рис. 458.
ЛИТЕРАТУРА
1. S. Р. Jones, J. W. Cook, W. С. М с -
Crone см. О. Т. Quimby, J. Phys. Chem.,
58, 608 (1954). — 2. А. В. Памфилов,
Е. А. П р о д а н, Укр. хим. ж., 22, 427 (1956). —
3. Gmc 1 In, Bd. 21, 1928, S. 925. — 4. Ван
Везер, Фосфор и его соединения, ИЛ, 1962,
стр. 501.
Ориентировочные значения
растворимости
фосфорсо держа щих
соединений
Соединение c, % Соединение C, %
GuHPO3 2•10’3 CeP 2O7 7 • IO"6
V2(HPO3)3 <3- IO"4 Pr4(P2O7)3 1-10-e
Mg2P2Oe 3 • 10’3 Nd4(P2O7)3 1 • IO’6
Ag3PO4 2 • 10’3 Sm4(P2O7)3 1 • IO-6
YP04 1 • 10-3 Gd4(P2O7)3 8 • IO-’
ErPO4 1 • 10"3 Dy4(P2O7)3 8 • IO"’
(UO2)3(PO4)2 6 • IO"8 Er4(P2O7)3 8 • IO"’
UO2HPO4 2 • 10"3 Yb4(P2O7)3* 1 • IO"6
PuO2HPO4 2-10-3 Lu4(P2O7)3 1 • IO’6
Pb3(PO4)2 1 • 10-5 ThP2O7 6•10“8
Cd2P2O7 1 • 10-3 Co2P2O7 3 • 10-3
Y4(P2O7)3 8 • IO’’ KPO3 4 • 10’3
La4(P2O7)3 * 1 • IO"6 Си3(РО3)в 4 • 10"3
Се4(Р2О7)з 1 • 10“6 Hg2(PO3)2 2- IO-5
* По данным 3. А. Шека и Э. И. Синявской
[ЖНХ, 11, 1029 (1966)] растворимость Ьа4(РгО7)»
и Yb4(P»O7)» значительно выше.
МЫШЬЯКСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
ОРТОАРСЕНИТЫ
Ортоарсениты Y, La, Се, Pr, Nd, Sm,
Gd, Dy, Er, Yb, Lu (при 25°)
Твердая фаза c, % Источ- ники
YAsO3-3H2O 0,02 1
LaAsO3 -3H2O 0,0410 2
CeAsQ3-3H2O 0,0298 2
PrAs©3.3H2O 0,0288 2
NdAsO3-3H2O 0,0256 2
SmAsO3 -3H2O 0,0213 1
GdAsO3-3H2O 0,02 1
DyAsO3-3H?O 0,0238 1
ErAsO3-3H?O 0,027 1
YbAsO3-3H2O 0,0281 1
LuAsO3-3H2O 0,03 1
-ЛИТЕ РАТУРА
1, Г. И. Васильев, В. В. Серебрен-
ников, Труды Томского гос. ун-та, 157, 66
(1963). — 2. Г. И. Васильев, В. В. С е р ef-
бренников, Труды Томского рос. ун-та,
154, 115 (1962).
ПИРОАРСЕНИТЫ
Пироарсениты Са, Sr, Ва
Твердая фаза i, °C c, % Источ- ники
Ca2As2O6 2H2O 20 0,07 1,2
Ca2As2O6--2H2O 60 0,08 1,2
Sr2As2O6 -H2O 20 0,25 1,2
Sr2As2O6 H2O 60 0,32 1,2
Ba2As2O6 -9H2O 20 1,0 1,2
ЛИТЕРАТУРА
1. J. Masson, Н. Gu6rin, Bull. Soc.
chim. France, 1958, 401. — 2. J. Masson,
Ann. chim. (13), 3, 253 (1958).
181
МЕТААРСЕНИТЫ
Метаарсениты Са, Sr, Ва
Твердая фаза t, °c c, % Источ- ники
Ca(AsO2)2 20 0,09 1,2
Ca(AsO2)2 60 0,09 1,2
Sr(AsO2)2 20 0,38 1,2
Sr(AsO2)2 60 0,39 1,2
Ba(AsO2)2-2H2O 20 1,16 1,2
Ba(AsO2)2 -2H2O 60 1,24 1,2
ЛИТЕРАТУРА
1. J. Masson, Н. Guerin, Bull. Soc.
chim. France, 1958, 401. — 2. J. Masson,
Ann. chim. (13), 8, 253 (1958).
Рис. 459 построен по данным [1]. Дан- ные [2—6] хорошо согласуются с данными [1]. Особые точки:
Лед+ Na2HAsO412H2O NasHAsO4-12H»O + t, °C —1,14 20,5 c, % 5,12 26,1
+ Na2HAsO4-7H2O
Na2HAsO4-7H2O + + Na2HAsO4 5H2O 56,2 57,1
Na2HAsO4-5H2O + + Na2HAsO4H2O 67,4 64,8
Na2HAsO4H2O + + Na2HAsO4 99,5 66,5
Na2HAsO4-5H2O + + Na2HAsO4 (мет.) 68,0 67,3
Температура кипения насыщенного рас-
твора 115,9°, концентрация 66,9% [1].
АРСЕНАТЫ
HgAsOj
См. рис. 232 на стр. 90.
Na2HAsO4
Рис. 459.
NaH2AsO4
Рис. 460.
182
Рис. 460 построен по данным [7]. Данные
(3, 4, 6, 8] не использованы. Особые точки:
t, еС с, %
Лед + NaH2AsO4-2H2O NaH2AsO4 -2Н2О + a-NaH2AsO4 Н2О —21,1 47,7
17,3 56,3
a-NaH2AsO4-Н2О+ 4- P-NaH2AsO4«H2O p-NaH2AsO4H2O + 4- NaH2AsO4 0,5Н20 53,5 65,2
70,0 70,6
NaH.AsO4-0,5H2O4- 4- NaH2AsO4 104,3 75,3
Температура кипения насыщенного рас-
твора 118,4° [7].
К8АвО4
Рис. 461 построен по данным [9—11].
Особые точки [9]:
t, °C с, %
Лед 4- K8AsO4-10(ll)H2O -29 43,2
K3AsO410H2O4- 4- K8AsO4-7H2O -23 46,9
K3AsO4-7H2O 4- K3ASO4 • 3H2O K8AsO4 -3H2O 4- 4- K8AsO4 H2O 50,3 66,8
98 73,1
Температура кипения насыщенного рас-
твора 171°, концентрация 77% [9].
K-jHAsO.
Рис. 462 построен по данным [10, 12].
Особые точки [12]:
Лед 4- K2HAsO4-6H2O
K2HAsO4-6H2O +
+ K2HAsO4-3H2O
K2HAsO4 -3H2O 4-
+ K2HAsO4H2O
K2HAsO4-H2O 4- K2HAsO4
K2HAsO4>6H2O +
+ K2HAsO4H2O (мет.)
t, ec C, %
-17 41,9
17 62,9
66,5 74,9
84 78,7
10,5 71,5
Температура кипения насыщенного рас"
твора 143°, концентрация 82,5% [10].
Рис. 461.
KH2AsO4
RbHeAsO4, CsH2AsO4,
NH4H2AbO4
Рис. 463 построен по данным [12]. Дан-
ные [13, 14] не использова&ы. Эвтектика:
-2,9°, 15,5%.
Температура кипения насыщенного рас-
твора 105°, концентрация 49,5% [12].
Рис. 464 построен по данным [15, 16].
СаНАвО4
Растворимость CaHAsO4 при 25° соста-
вляет 3,10 г/л [17].
183
Арсенаты Li, Na, Mg, Ca, Sr, Ba, La,
Pr, Nd, Sm, Gd, Yb, Ni
Твердая фаза t, °C C, % Источ- ники
Li6(AsO4)2 —, —0,095 18
Na3AsO4 • 12H2O 13—15 10,4 2
Na3AsO4 • 12H2O 30 18,8 3
Na3AsO4 • 8H2O 25 28,9 19
Na3AsO4 • 8H2O , 50 49,1 19
INilg ASO4 25 13,8 20
Mg3(AsO4)2 • 8H2O 60 0,011 21. 22
Ca3(AsO4)2 • 10H2O 17 —0,012 23
Ca3(AsO4)2 • 2H2O 90 —0,028 23
Ca3(AsO4)2 35 —0,012 24
Sr3(AsO4)2 • 17H2O 17 0,027 25
Sr2H2(AsO4)2-3H2O 17 —0,45 v 25
SrHAsO4+ 25 7,35 % SrO, 26
+ Sr(H2AsO4)2 16,9%As2O5
Ba3(AsO4)2 • xH2O 17 0,018 27
Ba3(AsO4)2 —20 0,055 28
BaHAsO4 • H2O 17 —0,055 27
LaAsO4 25 0,013 29
PrAsO4 25 0,017 29
NdAsO4 25 0,023 29
SmAsO4 25 0,010 29
GdAsO4 25 0,010 29
YbAsO4 25 0,012 29
Ni3(AsO4)2 • 8H2O — 0,022 30
ЛИТЕРАТУРА
1. H. Menzel, W. Hagen, Z. anorg.
Chem., 233, 209 (1937). — 2. H. Schiff, Ann.,.
113, 349 (1860). — 3. M. Г. Серебренни-
кова, ЖПХ, 12, 581 (1939). — 4. A. Rosen-
heim, S. T h о n, Z. anorg. Chem., 167, 1 (1927). —
5. W. A. T i 1 d e n, J. Chem. Soc., 45, 260
184
(1884). — 6. H. Guerin, С. г., 243,1 58
(1956), — 7. Р. Genet, С. г., 205, 732 (1937). —
8. G. Levi, A. A g u г г 1, Gazz. chim. ital.,
08, 179 (1938). — 9. С. D и с - М а и g ё, С. г.,
245, 64 (1957). — 10. Н. G и ё г i n, С. Duc-
М а и g ё, С. г., 240, 2410 (1955).
И. С. Вис-Мамё, Bull. Soc. chim.
France, 1958, 227. — 12. G. Duc-Maug6,
C. r., 245, 805 (1957), — 13. R. P a и 1, К. L a 1,
V. G a i n d, S. В a w a, J. Indian Chem. Soc.,
30, 428 (1953). — 14. W. M и t h m a n n,
О. К и n t z e, Z. Krist. u. Miner., 23, 371 (1894). —
15. P. M. Шкловская, С. M. A p x и п о в,
ЖНХ, 12, 2340 (1967). — 16. A. de P a s s i 1 1 e,
Ann. chim. (11), 5, 85 (1936). — 17. Справочник
по растворимости солевых систем, т. 4, 1963. —
18. F. Remy, H. G u ё r i n, С. r., 257, 2837
(1963). — 1 9. И. Г. Дружинин, А. А к -
баев, ЖПХ, 37, 1194 (1964). — 20. Г. Г. У p a -
зов, Б. М. Липшиц, В. С. Л о в ч и к о в,
ЖПХ, 32, 995 (1959).
21. И. G и ё г i n, Р. Ma ttrat, С. г., 247,
1126 (1958). — 22. Р. Ma ttrat, Н. Gud-
r i n, Bull. Soc. chim. France, 1960, 602. —
23. H. G и ё r i n, С. г., 208, 1017 (1939); Ann.
chi/n. (11), 16, 101 (1941). — 24. G. W. Р е а г с е,
A. W. Avens, J. Am. Chem. Soc., 59, 1259
(1937). — 25. H. G и ё r i n, S. Michel, С. r.,
214,' 1004 (1942).— 26. H. V. Tartar,.
M. R. Rice, B. J. Sweo, J. Am. Chem. Soc.,
53. 3949 (1931). — 27. H. G и ё г i n, Bull.
Soc. chim. France (5), 5, 1476 (1938); С. r., 206,
1 302 (1938). — 28. F. F i e 1 d, J. Chem. Soc., 11,
14 (1859). — 29. Г. И. В а с и л ье в, С. П. К a -
з ан цена, В. В. Серебренников,
Труды Томского гос. ун-та, 154, 110 (1962). —
30. В. Charles-Messance, С. Due-
М. а и g 6, М. В a s t i с k, II. G и ё г i n, Bull.
Soc. chim. France, 1964, 35.
П родолжение
Твердая фаза t, °C C, % Источ- ники
K4As2O7-3H2O 40 72,9 3
(мет.) K2(AsO3)2 20 81,8 4
Li2As4O11 -3H9O 20 68,4 5
MgAs4O11 -5H2O 20 5,17 MgO, 6
Ca4As909-5H90 17 61,5 As2O6 —0,012 7
Ca4As2O9-H2O 40 —0,012 7
ЛИТЕРАТУРА
1. J. Masson, Н. G и ё г i n, Bull. Soc.
chim. France, 1958, 401. — 2. J. Masson,
Ann. chim. (13), 3, 253 (1958). — 3. C. Duc-
M a u g ё, Bull. Soc. chim. France, 1958, 227. —
4. C. D u c - M a u g ё, H. Guerin, Bull. Soc.
chim. France, 1957, 995. — 5. F. R e m у, H. G u ё-
r i n, C. r., 257, 2837 (1963). — 6. P. M a t t г a t,
H. Guerin, Bull. Soc. chim. France, 1960,
601. — 7. H. G u ё r i n, C. r., 208, 1017 (1939);
Ann. chim. (11), 16, 101 (1941).
ДРУГИЕ МЫШЬЯКСОДЕРЖАЩИЕ
СОЕДИНЕНИЯ
Мышь яксодержащпе соединения
Li, К, Mg, Са, Ва
Ориентировочные значения
растворимости
мышьяксодержащих
соединений
Твердая фаза t, °C C, % Источ- ники
Ba.AseO41 20 0,88 1, 2
Ba . A s,/),. 60 1,3 1, 2
Ba3As4O9-xII.O * 60 1,02. 1, 2
K4As.O7-7H.b 40 66,4 3
K,jAs.O7-7H2O 60 72,5 3
* х = 1 или 2.
Соединение
r П/
/0
Ag3AsO3
Cu3(AsO4)2
Ag3AsO4
PbHAsO4
CrAsO4
1 -IO"3
1 -IO-3
9-10-4
2-10-4
3-10’3
СУРЬМУ СОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Сурьмусодержащие соединения Na п К
Твердая фаза t, °C c Источ- ники
NaSbO-,-311.0 18 0,44 г/л 3
NaSbO.,-311.0 20 0,094% 1
NaSb()3-311.0 25 0,101% 2
NaSbO3-3HaO 25 Од>8 г/л 3
NaSbO,-311.0 33,5 0,80 г/л 3
NaSbO3-311.0 50 0.30% 2
NaSbO.,-311.0 75 0,59% 2
NaSbO3-3,511.0 12,3 0,031 % 4
Na.11.Sb.O, -611.0 100 0,21 % 4
KSbO3-31I.() 20 2,7% 5
ЛИТЕРАТУРА
1. G. J a n d е г, W. В г й 1 1, Z. anorg. Chem..
158. 321 (1926). — 2. Г. Г. Уразов,
Б. М. Липшиц, В. С. Ловчи ко в, ЖНХ,
4. 440 (1959); ЖПХ, 32, 995 (1959). — 3. Е. S. Т о-
mila, Z. anorg. Chem., 118, 81 (1921). —
4. G m е 1 i n, Bd. 21, 1928, S. 970.—
5. G. v. К n о г г e, P. Olschewsky, вег.,
20, 3049 (1887).
185
УГЛЕРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
КАРБОНАТЫ
Ы8СО8
Рис. 465 построен по данным [1—3],
полученным в замкнутом объеме.
ЫНСОз
грамма приведена на рис. 467. Особые точ-
ки [6]:
Лед + Na2CO3-10H2O
Na2CO810H2O +
+ a-Na2CO3-7H2O
a-Na2CO3-7H2O +
+ Na2CO3.H2O
P-Na2CO3-7H2O +
+ Na2CO8H2O (мет.)
Na2C08-10H20 +
+ NaaCO3-HaO (мет.)
t, °с
—2,1
32
C, %
5,75
31,2
35,4
33,1
(25)
33,0
(34)
33,3
Рис. 466.
Рис. 466 построен по данным [4].
Na2CO8
Данных по растворимости Na^COg мно-
го, практически все они хорошо согласу-
ются [5]. Построенная по этим данным диа-
186
Кривая кипения построена по данным
[7, 8]. Температура кипения насыщенного
раствора 104,8°, концентрация 31,5% [9].
Рис. 468 построен по данным [5, 6],
полученным в замкнутом объеме. Переход-
ная точка: 109°, 30,8% [6].
NaHCOa
Данных по растворимости NaHCO3 мно-
го, практически все они хорошо согласуют-
ся [5]. Построенная по этим данным (в зам-
кнутом объеме) диаграмма приведена на
рис. 469. Эвтектика: —2,33°, 6,26% [10].
Рис. 468.
к2со8
Рис. 470.
Рис. 469.
Рис. 470 построен по данным [11, 12].
Особые точки [И]:
‘ G °C с, %
Лед-]- К2СО8-5Н2О —36,4 40,4
К2СО8-5Н2О+ —6,3 51,2.
4- К2СО8-1,5Н2О
Кривая кипения построена по данным [7,.
8]. Температура кипения насыщенного -
раствора 135,2°, концентрация 67,1% [12].
187;
Рис. 471 построен по данным [11, 13],
полученным в замкнутом объеме. Особые
точки [13]:
K2CO31,5H2O + t, °C 147 c, % 69,5
+ K2C03-0,5H20 K2CO3-0,5H2O + K2CO3 153 70,0
КНСОз
Рис. 472.
Данных по растворимости КНСО3 много,
практически все они хорошо согласуются
[5]. Построенная по этим данным диаграм-
ма приведена на рис. 472. Эвтектика:
(-6°), (17%).
Rb2CO3
Рис. 473 построен по данным [14], полу-
ченным в замкнутом объеме. Особые точки:
t, °C C, %
Лед + Rb2CO3-9H2O -24,8 46,5
Rb2CO3-9H2O —7,0 58,7
Rb2CO3-9Н2О + + Rb2CO3-8H2O -7,2 60,1
Rb2CO3-8H2O -6,8 61,8
Rb2CO3-8H2O + + Rb2CO3l,5H2O —10,2 67,6
Rb2CO3l,5H2O + + Rb2CO3-0,5H,O 162 83,6
Rb^Og 0,5H20 +“Rb2CO3 190 84,2
Лед + Rb2CO3-8H2O (мет.) -28,0 47,0
Rb2CO39H2O + + Rb2CO3l,5H2O (мет.) —12,0 67,4
Добрынина и Дзяткевич [15] не под-
твердили образования гидратов с высоким
содержанием воды (КЬзСО3-8Н2О и
Rb2CO3-9H2O) при 0—75% Rb2CO3, об-
наруженных Карбоннель [14].
Рис. 474 построен по данным [15]. Осо-
бые точки:
t, °C с, %
Лед + Rb2CO3-4H2O —12,5 49,6
Rb2CO3-4H2O + (~0) (71)
+ Rb2CO3-3H2O Лед + Rb2CO3-3H2O (мет.) -22 71
RbHCO3
Растворимость RbHCO3 при 20° соста-
вляет 53,7% [16].
Cs2CO3
Рис. 475 построен по данным [17], полу-
ченным в замкнутом объеме. Особые точки:
t, °C с, %
Лед + Cs2CO3-8H2O. Cs2CO3 -8H2O + -32,0 —15,6 57,9 69,0
+ Cs2CO3-3H2O
Cs2CO3-3H2O 104 85,8
Cs2CO3-3H2O + 89,0 87,8
+ Cs2CO31,5H2O
Cs2CO3-1,5H2O + +Cs 2CO3 0,5H2O 103 90,0
Cs2CO3 0,5H20 + Cs2CO3 151 91,1
Лед+ Cs2CO3-5H2O (мет.) —38,0 59,2
Cs2CO3-5H2O + + Cs2CO3 3H2O (мет.) -18,0 68,6
188
Рис.
Рис. 475.
Добрынина и Дзяткевич [15] не подтвер-
дили образования Cs2CO8-8H2O и мета-
стабильного CsaCO8«‘5HaO, обнаруженных
Карбоннель и Ролле [17].
Рис. 476 построен по данным [15]. Осо-
бые точки:
Лед+ CsaCO8-4HaO
CsaCO3-4HaO +
4- СзаСОя -ЗНаО
Лед + СяаСО3-ЗНаО (мет.)
I, °C
—16,5
~(—6,5)
С, %
60,2
73,5
71,0
СаНСОз
Рис. 477 построен по данным [18]. Осо-
бые тонки:
Лед + a-CsHCOj
a-CsHCO8+ ₽-CsHCO8
₽-CsHCO8+ y-CsHCOs
Лед + P-CsHCO8 (мет.)
t, ec
-24,5
23,0
43,4
—34,0
c, %
62,6
71,7
77,4
68
190
(NH4)2CO3
Рдс. 478.
Данные по растворимости (NH4)2CO^
содержатся в работах [19—21], однако все
они отличаются друг от друга. Рис. 478
построен по данным [19]. Особые тонких
t, ’С с, %
Лед+(NH4)2CO3-H2O —14,6 30
(NH4)2CO3-H2O + 42 54,8
+ (NH4)2CO3
В работе [20] авторы уточняют положе-
ние эвтектической точки: —17,6°, 32,7%.
NH4HCO3
Рис. 479.
Рис. 479 построен по данным [22, 23]
(черные кружки) и [24] (светлые кружки).
Данные [24] выше 20° не использованы.
Эвтектика: —3,90°, 9,5% [24].
ВеСО3
Растворимость ВеСО8*4Н2О при 15°
составляет 212 г/л [25].
Mg(HCO3)2
Растворимость Mg(HCO3)2 при
ставляет 13,0% [26].
18‘
со-
Са(НСО8)а
Растворимость Са(НСО3)2 при 25° со-
ставляет 0,430% [27].
191
TlaCO8
Рис. 480.
Рис. 480 построен по данным [28] (свет-
лые кружки) и [29] (черные кружки).
ЛИТЕРАТУРА
1. В. Е. Плющев, В. Б. Т у л и н о в а,
Химия редких элементов, вып. 3, 4 (1957); Науч-
ные доклады высшей школы. Химия и хим.
технол., 1, 11 (1 958). — 2. И. Б е в а д, ЖРФХО.
Ч. хим., 16, 592 (1884). — 3. В. М. Еленев-
с к а я, М. И. Р а в и ч, ЖНХ, 6, 2380 (1961). —
4. К). И. О с т р о у ш к о, И. В. Му за лев-
с к а я, В. С. К р у ц к о, ЖНХ, 6, 229 (1961). —
5. Справочник по растворимости солевых систем,
т. 3, 1961; т. 4, 1963. — 6. К. A. Kobe,
Т. N. Sheehy, Ind. Eng. Chem., 40, 100
(1948). - 7. J. N. Legrand, С. г., 1, 16 (1835);
Ann. phys. chim.. 53, 423 (1835); J. prakt. Chem.,
6, 56 (1835).— 8. G. Gerlach, Chem. Ind.,
0, 241 (1886); Z. anal. Chem., 26, 413 (1887). —
0. C. 3. Макаров, С. H. Красников,
Изв. СФХА АН СССР, 27, 370 (1956). —
10. А. Е. Н ill, L. R. Bacon, J. Am. Chem.
Soc., 49, 2488 (1927).
11. L. Carbonnel, R. Cohen-Ada d,
A. Ro I let, C. r., 248, 413 (1959).—
12. L. Carbonnel, Publ. Sci. Univ. Alger.
Ser. B, 7, № 1, 293 (1961). — 13. A. R о 1 1 e t,
R. Cohen -Adad, L. Carbonnel, C. r.,
253, 1579 (1961). - 14. L. Carbonnel, Q. r.,
258, 2074 (1964).— 15. T. А. Добрынина,
Б. С. Д л я т к e в и ч, Изв. АН СССР. Сер. хим.,
1967, 723. — 16. R. de Foreran d, С. г., 149,
719 (1 909). — 17. L. Carbonnel, A. R о 1 -
1 е t, С. г., 256, 2178 (1963). — 18. L. С а г b о п -
rue 1, С. г., 265, 864 (1967). — 19. И. Н. Бе-
ляев, Д.С.Лссны х,Е. А. Григорьева,
ЖНХ, 11, 1472 (1966). — 20. Л. В. Велика-
нов а, А. Г. В е р гм а н, ЖНХ, 15, 2252 (1970).
21. С. Н. Г а н з, Р. И. Брагинская,
Тезисы докладов V Всесоюзной конференции
по технологии неорганических веществ и мине-
ральных удобрений, Киев, 1966, .стр. 46. —
22. G me 1 in, Bd. 23, 1936, S. 345,—
23. II. П. Ф е д о т ь е в, Z. phys. Chem., 49,
168 (1904). — 24. Е. J а п е с k е, Z. Elektro-
chem., 35, 332 (1929). — 25. Pascal, t. 4,
1958, p. 106. — 26. О. H a e h n e 1, J. prakt.
Chem., 108, 63 (1924). — 27. A. E. Mitchell,
J. Chem. Soc., 123, 1899 (1923). — 28. A. L a m y,
Ann. chim. phys. (3), 67, 10 8 (1863); J. prakt.
Chem., 88, 375 (1863). — 29. W. Crookes,
J. Chem. Soc., 17, 134 (1864).
192
ЦИАНИДЫ
HCN
Рис. 481.
Рис. 481 построен по данным [1—3].
Эвтектика: —23,4°, 81,4% [1]. По данным
[1], реализуется метастабильная область
с двумя жидкими фазами, пз которых одна
фаза — HCN, другая — соединение HCN
с водой. Критическая температура —24°.
Кривая кипения построена по данным
[4]. Температура кипения 99,8% HCN
26,7°.
NaCN
Рис. 482.
Рис. 482 построен по данным [5, 6].
Особые точки:
И °C с, % Источ-
ники
Лед+ NaCN-2H,0 I —27,8 I 23,8 I 5
NaCN -2Н2О + NaCN | 34,7 | (45,0) | 6
KCN
Рис. 483.
Рис. 483 построен по данным [7, 8].
Эвтектика: —29,6°, (34%) [7].
Температура кипения насыщенного рас-
твора 103,3°, концентрация 55,0% [9].
Hg(CN)2
Цианиды Ba, Cd, Т1
Твердая фаза t, °C c Источ- ники
Ba(CN)2-2H2O 14 44,4% 18
Cd(CN)2 15 17 г/л 18
Cd(CN)2 20 <~18,1 г/л 19
Cd(CN)2 18 0,247 г/л 20
T1CN 25 16,5% 21
T1CN 28,5 14,4% 22
ЛИТЕРАТУРА
1. J. Е. Coates, N. Н. Н а г t s h о г и е,
J. Chem. Soc., 1031, 661. — 2. R. L е s р i е a u,
С. г., 140, 856 (1905). — 3. A. L. Р е 1 к е г,
С. С. Coffin, Can. J. Res., 8, 117 (1933).—
4. М. А. О п ы х т и н а, О. И. Фрост, ЖОХ,
6, 1778 (1936). — 5. О. И. Фрост, ЖОХ, 6,
1911 (1936). — 6. G. D. О 1 i v е г, S. Е. J о h п -
sen, J. Am. Chem. Soc., 76, 4723 (1954).—
7. G. N. L e w i s, T. B. Brighton, J. Am.
Chem. Soc., 40, 487 (1918). — 8. А. А. Ва-
сильев, Записки Казанского - ун-та, т. 85,
1925, стр. 1. — 9. Griffiths см. Сотеу
Dictionary of Chemical Solubilities Inorganic,
1896, p. 146. — 10. Справочник по раствори-
мости солевых систем, т. 4, 1963.
И. S. R. Brinkley, J. Am. Chem. Soc.,
44, 1213 (1922). — 12. E. C. Noonan, J. Am.
Chem. Soc., 70, 2917 (1948). — 13. J. E.Mars h,
J. F. Struthers, J. Chem. Soc., 87, 1878
(1905). — 14. W. Herz, G. A n d e r s, Z. anorg.
Chem., 52, 165 (1907). — 15. В. К. Семен-
ченко, M. И. Шахпаронов, ЖФХ, 22,
250 (1948). — 16. А. В e n r a t h, F. G j e d e b о,
В. Schiffers, H. Wunderlich, Z. anorg.
Chem., 231, 293 (1937). — 17. F. Guthrie,
Phil. Mag. (5), 6, 41 (1878). — 18. A. J о a n n i s,
Ann. chim. phys. (5), 26, 493, 506 (1882). —
19. M. Beck, L. D 6 z s a, Mag. кёт. folyoirat,
70, 163 (1964); Acta chim. Acad. sci. hung., 41,
291 (1964). — 20. К. M a s a к i, Bull. Chem.
Soc. Japan, 6, 163, 233 (1931).
'21. H. Bassett, A. Corbet, J. Chem.
Soc., 125, 1660 (1924). — 22. C. Fronmtil-
1 e r, Ber., 11, 92 (1878).
ЦИАНАТЫ
HOCN
Рис. 485 построен по'данным [1]. Эвтек-
тика: —102,5°, 82,9%. Температура пла-
вления HOCN —86,8°.
KOCN
Рис. 486 построен по данным [2]. Эвтек-
тика: —18,1°, (24,8%).
Данных по растворимости IIg(CN)2 мно-
го, однако согласованности между "ними
нет 110]. Рис. 484 построен по данным
[11 — 16], полученным в замкнутом объеме.
Эвтектика: —"0,45°, 7,45% [17].
T1OCN
Растворимость T1OCN при '0° составляет
7,4% [3].
13 Заказ 976
193
Рис. 485.
Рис. 486.
Цианаты Ba, Cd, Hg
Твердая фаза t, °C с, г/л Источ- ники
Ba(OCN)a 2Cd(OCN)a-5HaO 20 20 106 17,8 4 4
Hg(OCN)a 0 37 4
Hg(OCN)a 12 0,7* 5
Hg(OCN)a 20 75 4
Hg(OCN)a 49 1,75 * 5
* Среднее из двух значений.
ЛИТЕРАТУРА
1. М. Linhard, Z. anorg. Chem., 239. 155
(1938). — 2. G.N. Lewie, Т. В. Brighton,
J. Am. Chem. Soc., 40, 487 (1918). —
3. Ф. Я. К у л ь б а, В. Е. М и р о н о в, Химия
таллия, , Госхимиздат, 1963, стр. 194.—
4. Е. Suderbdck, Acta chem. scand., 11,
1622 (1957). — 5, A. F. Holleman, Rec.
trav. chim., 15, 159 (1896).
194
РОДАНИДЫ
LiSCN
Рис. 487 построен по данным [1] в обла-
сти 0—65% LiSCN и данным [2] в области
80—95% LiSCN (в замкнутом объеме).
Особые точки [1]:
f. °C с, %
Лед 4- LiSCN -5НаО
LiSCN -5Н»О +
+ LiSCN -ЗНаО
LiSCN -ЗНаО +
+ LiSCN -2НаО
—92,0 38,2
—56,0 43,0
1 50,2
NaSCN
Рис. 488.
Рис. 488 построен по данным [3—5].
Переходная точка: (27,7°), (63%).
KSCN
Рис. 489 построен по данным [6], полу-
ченным в замкнутом объеме. Особые точки:
Лед 4- KSCN 0,5НаО
KSCN -0,5НаО 4- a-KSCN
a-KSCN 4- p-KSCN
P-KSCN
Лед 4- KSCN 0,8H3O (мет.)
Лед 4- a-KSCN (мет.)
KSCN 0,8Н2О 4- a-KSCN
(мет.)
t, °c c, %
—29,5 51,2
6,8 (68)
142,3 (94)
177,2 100
—30,1 51,8
—33,2 54,4
—17,8 59,7
Рис. 487.
13*
195
Рис. 489.
nh4scn
Рис. 490 построен по данным [3, 7].
Эвтектика: —25,2°, 42% [7, 8].
Ca(SCN)2
Ca(SCN)x,%
Рис. 491.
Рис. 491 построен по данным [9]. Пере-
ходная точка: 23,7°, (60,1%).
Роданиды Ba, Zn, Hg, Tl, Sc, Pb, Co, Ni
Рис. 490.
Твердая фаза t, °C c Источ- ники
Ba(SCN)2-3H2O 25 62,6% 10
Zn(SCN)2 18 26,1 г/л 11
Hg(SCN)2 20 0,055% 12
T1SCN 20 3,15 г/л 14 .
T1SCN 25 3,9 г/л 15
T1SCN 39,8 7,3 г/л 16
Sc4(SCN)10(OH)2 . • zH2O* 20 96,0% 13
Pb(SCN)2 18 4,43 г/л 11
Pb(SCN)2 25 12,6 г/л 17
Co(SCN)2 . 18 59,7 г/л 11
Co(SCN)2 20 50,7% 18
Ni(SCN)2 20 35,5% 18
*x=l 4-5.
ЛИТЕРАТУРА
1. F. A. Schimmel, J. Chem. Eng. Data,'
5, 519 (I960). — 2. В. И. H и к о л а е в, ЖРФХО.
61, 939 (1929). — 3. Е. Ф. Журавлев,
М. Н. Бычкова, ЖНХ, 4, 2367 (1959).—
4. Е. Ф. Журавлев, О. Г, Никитина,
ЖНХ, 13, 549 (1968). — 5. С. К. Bump, J,
Phys. Chem., 36, 1852 (1932). — 6. A. Chre-
tien, О. Hoffer, С. г., 201, 1131 (1935).—
7. L. Shnidman J, Phys. Chem., 38, 901
(1934). — 8. А. Васильев, ЖРФХО. Ч.
хим., 42, 423 (1910). — 9. А. McKerrow,
V. Occleshaw, F. Drabble, J. Chem.
Soc., 1946, 1. — 10. H. W. Foote, F. C. Hi-
ckey, J. Am. Chem. Soc., 59, 649 (1937).
196
И. К, М a s a k i, Bull. Chem. Soc. Japan,
5, 347 (1930); 6, 143, 163 (1931). — 12. M. C z a -
k 1 в, Roczn. chem., 33, 3 (1959). — 13. JI. H. К о -
м Ис с а р о в а, А. А. Красноярская,
В. Г. Гулиа, ЖНХ, 9, 477 (1964). —
14. W. Bfittger, Z. phys, Chem., 46, 602
(1903). — 15, A. A. Noyes, Z. phys. Chem.,
в, 248 (1890). — 16. A. A. N о у е s, С. G. Ab-
bot, Z. phys. Chem., 16, 123 (1895). —
17. К. Б. Я ц и м и р с к и й, ЖФХ, 25, 475
(1951). — 18. A. de S w е е m е г, Natuurwet.
Tljdechr., 14, 231 (1932).
ФЕРРОЦИАНИДЫ
H4Fe(CN)e
Растворимость H4Fe(CN)6 при 14° со-
ставляет 13,1% [8].
Na4Fe(CN)6
Рис. 492 построен по данным [1—3].
Особые точки [2]:
. t, °C с, %
Лед + Na4Fe(CN)6 ЮН20 —1,4 6,81
Na4Fe(CN)e-10H2O + 81,5 (38,5)
+ Na4Fe(CN)e хН2О
K4Fe(CN)6
Данных по растворимости K4Fe(CN)e
много, практически все они хорошо согла-
суются [4]. Построенная по этим данным
диаграмма приведена на рис. 493. Особые
точки:
Ca2Fe(CN)e
Рис. 494 построен по данным [2, 7].
Особые точки [2]:
Лед + K4Fe(CN)e-3H2O
K4Fe(CN)e-3H2O +
jr K4Fe(CN)e
t, °C c, % Источ-
ники
—1,6 11,6 5
87,3 41,3 6
Лед + Ga2Fe(CN)6-11Н2О
Ca2Fe(CN)e-HHgO+
+ Ca2Fe(CN)e xH2O
t, °C C, %
—10,1 30,5
59,7 44,2
197
Ферроцианиды NH4, Ba, Tl, Ce
Твердая фаза t, °C C. % ИСТОЧ- НИКИ
(NHAFe(CN)e (NH4S4Fe(CN)e BaaFe(CN)e 25,1 51,3 9
40,1 13,5 54,7 —0,164 9 8
Ba,Fe(CN)e 15 0,082 10*
Ba«Fe(CN'Je Tl4Fe(CN)e -2H.0 Ce4[Fe(CN)e]a-20HaO 75 0,81 10 *
18 0,350 11
25 0,016 12
* Обобщение литературных данных.
ЛИТЕРАТУРА
1. J. T, С о n г, о y, J. Soc. Chem. Ind., 17, 104
(1898). — 2. M. Parrow, J. Chem. Soc., 1926,
52; 1927, 1157.— 3. W. » D. Harkins,
W. T. Pearce, J. Am. Chem. Soc., 38,2717
(1916).— 4. Справочник по растворимости соле-
вых систем, т. 3, 1961. — 5. Е. В oval ini,
Е. F а b г 1 в, Gazz. chim. ital., 63, 338 (1933). —
6. Е. F a b г i в, Gazz. chim. ital., 62, 909 (1932).—
7. A. Noyes, J. Johnston, J. Am. Chem.
Soc., 81, 1007 (1909). — 8. A. J о a n n i s, Ann.
chim. phys. (5), 26, 514 (1882). — 9. H. Ir-
ving, G. C h e r r y, J. Chem. Soc., 1941, 25. —
10. P. В. Воронцов, ЖАХ, 8, 228 (1953)
11. C. Dragulescu, P. Tribunescu,
Stud, cercetari chim., 5, № 3—4, 19 (1958). —
12. И. В. Тананаев, Г. Б. Сейфер, ЖНХ,
1, 53 (1956).
ФЕРРИЦИАНИДЫ
KsFe(CN)e
Рис. 495 построен по данным [1—4].
Эвтектика: —3,60°, 20,8% [4].
ЛИТЕРАТУРА
1. Н. С. Jones, Z. phys. Chem., 55, 417
(1906); Carnegie Publication, M 60, 46 (1907). —
2. J. A. V г i e n d, W. N. S m i r 1 e s, J. Chem.
Soc., 1928, 2244. — 3. A. R e gne r, J. Baley,
Coll. Czech. Chem. Comm., 22, 1684 (1957); Chem.
listy, 51, 368 (1957). — 4. H. M filler,
M. L e h n ё, Ann. chim. (11), 8, 150 (1937).
Ориентировочные значения
растворимости углеродсодержащих
соединений
Соединение c, % Соединение C, %
Ag2GO3 MgGO3* CaCO3 SrCO3 BaCO3 ZnCO3 НЯйСОз Ме2(СОз)8 ** ThOCO3 UO2CO3 РЬСОз FeC03 CuCN AgCN Zn(CN)2 HgCN Co(CN)2 Ni(CN)2 AgOCN CuSCN З-10-з 2-10-3 3 • 10-3 2-10-3 6 • 10-3 2-10-3 6-10~7 10"® 4-Ю"3 5 • IO-з 2-10~4 6 • 10“® З-IO"4 3•io-® 5-10-* 3-10-W 4-Ю-3 6-10-3 7•10-3 2-10-® AgSCN Cd(SCN)2*** HgSCN Cu2Fe(CN)e Ag4Fe(CN)e Zn2Fe(CN)e Cd2Fe(CN)e (Hg2)2Fe(CN)e Ga4[Fe(CN)e]3 In4[Fe(GN)eJs (UO2)2Fe(GN)6 Bb2Fe(GN)e Bi4[Fe(CN)e]3 Mn2Fe(CN)e Fe4[Fe(CN)eh Co2Fe(CN)e Ni$Fe(CN)e Ag8Fe(CN)e Zng[Fe(CN)eI2 Cdg[Fe(CN)e] 2 (Hg2)8(Fe(CN)e]2 2 • IO'5 6 • 10-4 1 • 107® 2 • IO'4 8 -10-® 3 • 10-4 3 • io-< 7 • IO'3 1 • IO'3 6 • 10-® 3•10-3 9-10"4 1 •IO-4 7 • IO-4 1 • IO'4 1 • IO'4 9 • 10~4 1 • 10-® 8 • 10-3 5 • IO-» 6 • IO-»
* По данным О. К. Янатьевой [ЖНХ, 1,
1475 (1956)], А. П. Обухова и Е. И. Гордон,
[ЖПХ,' 8, 1144 (1935)] растворимость MgCO*
на порядок выше.
** Me—Y, La, Се, Pr, Nd, Sm, Eu, Gd, Dy,
Ho, Er, Yb, Lu.
.*** По данным E. Siderb&ck [Acta chem.
scan(L, 11, 1622 (1957)], M. Beck и L. D6zsa
[Mag. k6m. folyoirat, 70, 163 (1964)] раствори-
мость Cd(SCN)t значительно выше.
198
КРЕМНИИСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
МЕТАСИЛИКАТЫ
Рис. 496.
Рис. 496 построен по данным [1, 2] C, %
Особые точки (2]: t, °C
Лед 4- Na»SiO3 -9HaO -2,7 5,60
Na2SiOa-9НаО+ + Na2SiO3-6H20 46,8 39,8
NaaSiO3-6HaO + + Na2SiO3-5H2O 59,8 48,0
NaaSiO3-5HaO + NaaSiOa 72,0 56,6
Na2SiO3-6H2O (мет.) 62,9 53,0
Na2Si03-5H20 (мет.) 72,2 57,5
Метастабильная часть диаграммы
Na2SiO3 — НаО (рис. 497) построена по
данным [2]. Особые точки:
t, °C с, %
Na2SiO3-9HaO +
+ NaaSiO3-8HaO
Na2SiO3-9HaO
Na2SiO3-8H2O
KaSiO3
47,6
47,9
48,4
42,2
42,9
45,9
Рис. 498 построен по данным [3], полу-
ченным в замкнутом объеме. Особые точки:
t, °C с, %
K2SiO3HaO+ 370 88,4
+ K2SiOa-0,5H2O
K2Si03 0,5H90+KaSiO3 610 94,2
Рис. 498.
Имеются данные по понижению -темпе-
ратуры замерзания растворов до —0,71°
[1].
199
Метасиликаты Са и Ва
Твердая фаза t, °C С Источ- ники
CaSiOg —20 0,01% 4
CaSiO3 30 0,031% 5
CaSiOg -жНаО —20 0,015%, 6
BaSiO3-6H2O —20 1,2 г/л 7, 8
Имеются данные по понижению темпера-
туры Замерзания растворов Li2SiO3,
NaHSiOg, KHSiO3, Rb2SiO3, Cs2SiO3 [1].
ЛИТЕРАТУРА
1. L. Kahlenberg, A. Lincoln, J
Phys. Chem., 2, 82 (1898). — 2. C. L. В a k e r,
L. R. Jue, J. Phys. Chem., 42, 168 (1938).—
3. G. W. Morey, J. Am. Chem. Soc., 39, 1173,
1207 (1917). — 4. J. Weisberg, Bull. Soc.
chim. France (3), 15, 1098 (1896), — 5. E. P.
Flint, L. 8. we lie, J. Res. Nat. Bur.
Stand. (NBS), 12,755 (1934). — 6. К. Г. Кра-
сильников, Труды Совещания no
химии цемента, Промстройиздат, 1956,-
стр. 378. — 7. Е, Т h i 1 о, G. Kruger, Sili-
kat Technlk, 11, 386 (I960). — 8. G. Kruger
E. Thilo, Z. anorg. Chem., 308, 243 (1961)’
Рис. 499 построен по данным [1], полу-
ченным в замкнутом ' объеме. Переходная
точка: 410°, 87,6%.
BaSi2O5
Растворимость BaSi2O5-3H2O при 20е
составляет —1,7 г/л [2].
Силикаты Li и Са (при ~20°)
Твердая фаза с, % Источ- ники
Li4SiO4-2,5H2O —2 3
CaSi2O5 'хН2О 0,031 4
Ca2Si3O8 -хН2О 0,028 4
Са431й014-а:Н20 0,025 4
Ca9Si10O29 -жН20 0,022 4
Имеются данные по понижению темпе-
ратуры замерзания растворов Li2Si5Oxl
и Na2Si5On [5].
ЛИТЕРАТУРА
ДРУГИЕ СИЛИКАТЫ
1. G. W. Morey, J. Am. Chem. Soc., 39,
1173, 1207 (1917). — 2. H. Рцлк, Z. anorg.
Chem., 296, 51 (1958). — 3. P a s с a 1, t. 2, f. 1,
1966, p.147. — 4. К. Г. Красильников,
Труды Совещания по химии цемента, Промстрой-
издат, 1956, стр. 378. — 5. L. Kahlenberg,
A. Lincoln, J. Phys. Chem., 2, 82 (1898).
K2Si2O5
ФТОРСИЛИКАТЫ
Фторсиликаты металлов
первой группы и аммония
Na2SiF6
Растворимость’ Na2SiF6 при 0—73° по
данным [1—3] описывается уравнением:
с = 0,35 -J- 0,017t.
K2SiF6
Растворимость K2SiFe при 0—88° по
данным [1, 4, 5] описывается уравнением-
c. = ()(об + 0,005#. '
(NH4)2SiFe
Рис. 500 построен по данным [8. 9]. Осо-
бые точки [8]:
t, °C С, %
Лед + a-(NH4)«SiFe | -1,2 I 10,2
a-(NH4)2SiFe-fp-(NH4)2SiFe| 14 | 15,5
Температура кипения насыщенного рас-
твора 102,1°, концентрация 38,2% (при
давлении 748 мм рт. ст.) [8].
200
Рис. 501 построен по данным [10]. Дан-
ные [11] не использованы. Особые точки:
Лед 4- CuSiFe-6H2O
CuSiFe-6H2O +
+ CuSiFe-4H2O
t, °C с, %
—25,3 39,3
(25) (45,7)
Температура кипения насыщенного рас-
твора 112,4°, концентрация 50% (при да-'
влении 721 мм рт. ст.) [10].
Фторсиликаты Li, Rb, Cs
Твердая фаза t, °C c, % Источ- ники
Li2SiFe-2H2O 17 42,2 12
Li2SiFB 0 31,0 13
Li2SiK 25 29,3 13
Rb2SiFe 20 0,160 7, 14
Kb2Sibe 25 0,215 15
Rb2SiFB 100 1,34 14
Rb2SiFe 100 1,37 7
Cs2SiFe 17 0,60 16
CsaSiFe 25 . 0,953 15
ЛИТЕРАТУРА
1. D. D. Morris, В. P. Sutherland,
С. H. Wright, Can. Chem. Metall., 21, 273
(1937). — 2. К. E. Клейнер, ЖПХ, 17, 409
(1944). — 3. R. CaHlat, Ann. chim. (11),
20, 390 (1945). — 4. R. H. С a r t e r, Ind. Eng.
Chem., 22, 887 (1930). — 5. И. Г. P ы с с, ЖФХ,
21, 198, 200 (1947). — 6. G. von Hevesy,
J. Christiansen, V. Berglund, Z.
anorg. Chem., 144, 69 (1925). — 7. F. S t о 1 b a,
J. prakt. Chem., 102,3 (1867). — 8. В. С. Я т л о в,
Е. Н. Пин ае вс кая, ЖОХ 15, 269 (1945). —
9. Е. A. S i m р s-o n, Е. М. G 1 о с k е г, J. Phys.
Chem., 57, 529 (1953). — 10. Е. Н. П и н а е в -
ска я, Л. К. Радостева, Сборник статей
по общей химии, Изд. АН СССР, т. 2, 1953,
стр. 1233.
И. Е. Colton, J. Chem. Educ., 35, 562
(1958). — 12. J. Berzelius, Pogg. Ann., 1,
169 (1824). — 13. J. A. S k a r u 1 is, V. N. Da Г-
n о w s k i, W. P. Kilroy, T. Milazzo,
J. Phys. Chem,, 68, 3074 (1964). — 14. R. В u n-
sen, Ann., 119, 107 (1861). — 15. J. A. Ska -
rulis, P. Kissinger, J. Phys. Chem., 70,
186 (1966). — 16. К. P r e i s, Bull. Soc. chim.
France (2), 10, 361 (1868); J. prakt. Chem., 103,
411 (1868).
Фторсиликаты металлов
второй группы
MgSiFe
Рис. 502 построен по данным [1, 2].
Эвтектика: —6,0°, 19,5% [1].
ZnSiFe
Рис. 503 построен по данным [1, 2]. Дан-
ные [3, 4] Не использованы:. Эвтектика:
—14,6°, 32,0% [1].
201
Рис. 502.
Фторсиликаты Са, Sr, Ва
Твердая фаза t, °C c, % Источ- ники
CaSiFg • 2Н>О 20 15,1 5
CaSiFe.2HaO 50 15,9 5
CaSiFe-2HaO 100 17,6 5
CaSiFe-4H90 60 12,9 6
SrSiFe 15 3,12 7
SrSiR,-2HaO 25 14,9 8
BaSiFg 17,5 0,027 9
BaSiFe —20 0,026 7
BaSiFe 21 0,030 9
BaSiFe 45 0,030 3
BaSiF, 100 0,085 9
ЛИТЕРАТУРА
1. В. С. Я т л о в, Е. Н. П и н а е в с к а я,
ЖОХ, 8, 1665 (1938).— 2. Е. A. Simpson,
Е. М. Gio с кет, J. Phys. Chem., 57, 529
(1953). — 3. Е. С о Ito n, J. Chem. Educ., 35,
562 (1958). — 4. К. К. Worthin g t о и,
М. М. На ring, Ind. Eng. Chem. Anal. Ed., 3,
8 (1931). — 5. M. Г. Г а б p и e л о в а, Исследо-
вания но прикладной химии. Сборник работ,
посвященный памяти акад. Э. В. Брицке, Изд.
АН СССР, 1955, стр. 245. —6. А. В. Р у с а д з е,
С. Я. Шпунт. ЖНХ, 4, 183 (1959). —
7. R. Fresenius, Z. anal. Chem., 29, 144
(1890); Pogg. Ann., 59, 120 (1846). — 8. J. E.
Ricci, J. A. Ska г u 1 i 8, J. Am Chem.
Soc., 73, ^621 (1951). — 9. L. J. Gay-Lus-
sac, Ann. chim. phys., 69, 204 (1809).
Фторсиликаты металлов
других групп
PbSiFe
Рис. 504.
Рис. 504 построен по данным [1]. Пере-
ходная точка: 59,6°, (80%).
MnSiFe
Растворимость MnSiFe-6HaO при 17,5°
составляет 37,8% [2].
202
FeSiFe
Рис. 505 построен по данным [3]. Дан-
ные [2] не использованы. Эвтектика:—14,0°,
30,0%. Температура кипения насыщенного
раствора 105,9°, концентрация 39,3%.
CoSiFe
Растворимость CoSiFe-6H2O при 21,5°
составляет 35,2% [2].
ЛИТЕРАТУРА
1. В. С. Ятлов, Е..Н. П и н а е в с к а я,
ЖОХ, 8, 1665 (1938). — 2. F. S t о 1 b a, Chem.
Zbl,, 14, 292 (1883); Sitzber. Bfihm. Ges.
Wies., 3(1869); 246 (1876). — 3. E. H. П ин a-
e в с к а я, Л. К. Радостей а, Сборник
статей но общей химии, Изд. АП СССР, т. 2,
1953, стр. 1233.
Рис. 505.
ГЕРМАНИЙСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
NaaGeO3
Рис. 506.
Рис. 506 построен по данным [1, 2]. Эв-
тектика: —3,2°, 11,6% [2].
Германаты Li и Ва
Твердая фаза t, °C c. % Источ- ники
LiaGeOsO,33HaO 25 0,84 1
BaGeO3 25 0,0754 3
ЛИТЕРАТУРА
1. W. Pugh, J. Chem. Soc., 1926, 2829.—
2. W. Pugh, Trans. Roy. Soc. S. Africa, 21,
73 (1932). — 3. J. H. M hller, С. E. G u 1 e -
z i a n, J. Am; Chem. Soc., 51, 2Ц41 (1929).
MgaGeO4
Ориентировочное значение растворимо-
сти Mg2GeO4 составляет 2*10~3%,
203
ОЛОВОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
LiaSnO3
Рис. 507.
Рис. 507 построен по данным [1].
Na2SnO3
Рис. 508 построен по данным [1]. Дан-
ные [2] не использованы.
КаЗпОз
Рис. 508.
Твердая фаза t, °C C, % Источ- ники
KaSnO3 10 51,6 3
KaSnO3 20 52,5 3
K2SnO3-4H2O 28 41,5 1
KaSnO8 -5H2O 28 42,9 1
ЛИТЕРАТУРА
1. Н. Zocher, Z. anorg. Chem., 112, Г
(1920). — 2. Г. Г. У р а зо в, Б. М. Лип ши ц(
В. С. Л о в ч и к о в, ЖПХ, 32, 995 (1959).—
3. Ordway, Am. J. Sci. (2), 40, 173 (1865)-
БОРСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
н,во3
Рис. 509 построен по данным [1]. Эвтек-
тика: —0,76°, 2,47%. Кривая кипения по-
строена по средним данным [2—4]. Тем-
пература кипения насыщенного раствора
103,3°, концентрация 29,3% [1].
Рис. 510 построен по данным [5]. Осо-
бые точки (состав выражен в % В2О3):
t, °C с, %
H3BO3+ a-HBO2 169 52,2
a-HBOa 236 79,5
a-HBOa B2O3 235 82,8
BaO3 450 100
H3BO3 (мет.) 170,9 56,2
H3BO3 + p-HBO2 (мет.) 169,6 61,7
₽-HBOa (мет.) 200,9 79,5
p-HBO2 + B2O3 (мет.) 200,5 80,8
H3BO3 + y-HBOa (мет.) 158,5 70,5
у-НВО2 (мет.) 176 79,5
y-HBOa 4- B2O3 (мет.) 176 79,8
204
ЛИТЕРАТУРА
1. N. Р. Nies, R. W. Hulbert, J. Chem.
Eng. Data, 12, 303 (1967). — 2. R. Nasini,
I. Age no, Z. phys. Chem., 69, 483 (1909).—
3. E. Beckmann, Z. phys. Chem., 5, 76
(1890); 6, 437 (1890).— 4. S. Kahlenberg,
Z. anorg. Chem., 88, 355 (1914). — 5. F. С. К r a -
c e k, G. W. Morey, H. E. Merwin, Am.
J. Sci., 85A, 143 (1938).
Рис. 511.
Рис. 512.
МЕТАБОРАТЫ
Метабораты металлов
первой группы
LiBO2
Рис. 511 построен по данным [1—5].
Особые точки: ' t, °C с, % Источ- ники
Лед + ЫВО2 -8Н2О —0,52 0,78 3
LiBO2-8H2O + 40 7,6 5
+ LiBO2-2H2O
LiBO2-8H2O (мет.) 47 (25,7) 2, 4
Температура кипения насыщенного рас-
твора 102°, концентрация (10%) [5].
Рис. 512 построен по данным [5, 6],
полученным в замкнутом объеме. Особые
точки [5]:
t, °C с, %
ЫВО2-2НаО +
+ LiBO2-0,5H2O
LiBO2 0,5Н2О + LiBO2
150 8,75
240 (3,2)
205
NaBOa
Рис. 513.
t,*C
Рис. &13 построен по данным [3, 7—1.0].
При температурах выше 60° данные (3,
8—10] не использованы. Особые точки [7]:
Лед + NaBOa -4Н2О
NaBO2-4H2O +
+ NaBOa-2НаО
NaBOa-2Н2О +
-I- NaBOa 0,5НаО
t, °C с, %
—5,77
53,6
105
13,1
36,9
56,0
Температура кипения насыщенного рас-
твора 120,2°, концентрация 55,3% [7].
Рис. 514 построен по данным [5, 6],
полученным в замкнутом объеме. Данные
[7] не использованы. Особые точки [5, 6]
(см. также [И]):
NaBO2 -2НаО + NaBO2 Н2О
NaBO3 Н8О +
4- NaBOa 0,5Н2О
NaBO2 0,5Н2О + NaBOa
°C
105
155
260
С, %
58,0
58,2
59,5
кво2
NaBOj>, %
Рис. 514.
206
Рис. 515 построен по данным [12, 13],
полученным в замкнутом объеме. Особые
точки [12]: г, °C С. %
Лед+ КВОа4НаО —20 27,1
КВОа-4НаО + + КВО»-1,25НаО КВОа1,25НаО + + КВОа-0,25НаО КВОа -0,25Н2О +, КВО2 24 43,8
195 73,0
250 74,0
RbBO2
Рис. 516.
Рис. 516
быв точки:
построен по данным [13]. Осо-
Лед+ RbBOa-4H2O
RbBO,-4HaO +
4- RbBOa-l,25HaO
t, вс с. %
-19
20
(35,5)
61,5
Переходные точки:
/.’С с, %
RbBOal,25HaO +
+ RbBOa-0,25HaO
RbBOj-0,2оНаО + RbBOa
(79)
CsBOa
Растворимость CsBOa»3,5HaOJnpH 18°
составляет 36,7% [14].
AgBO2
Растворимость AgBO2 при 25° соста-
вляет 0,95 г/л [15].
ЛИТЕРАТУРА
1. Н. Le Chatelier, С. г., 124, 1093
(1897). — 2. A. Rosenheim, W. Regli п,
Z. anorg. Chem., 120, 117 (1922). — 3. Н. Men-
zel, Z. anorg. Chem., 104, 34 (1927); Z. phys.
Chem., 105, 416 (1923). — 4. W. T. R e b u r n,
W. A. Gale, J. Phys. Chem., 59, 20 (1955). —
5. R. В о u a z 1 z, Ann. chim.. 0, 376 (1961). —
6. R. fiouazl z, Bull. Soc. cnim. France, 1902,
1451. — 7. N. P. Nies, R. W. Hulbert,
J. Chem. Eng. Data, 12, 303 (1967). —
8. W. С. В 1 a s d a 1 e, С. M. S 1 a n s Jt y, J. Am.
Chem. Soc., 01, 918 (1939). — 9. D. W. van
G e 1 d e r, Rec. .trav. chim., 75, 117 (1956); 77,
740 (1958). — 10. H. Menzel, H. Schulz,
Z. anorg. Chem., 251, 179 (1043).
11. A. R о 11 e t, R. Bouaziz, C. r., 250’
2578 (I960).— 12. P. ToUdano, C. r., 254.
2348 (1902). — 13. P. To Id da no, Rev.
chim. minerale, 1, 387 (1904). — 14. A. R о 1-
let, L. An dr ds, C. r., 191, 377 (1930).—
15. А. Д. Кешаи. Синтез боратов в водном
растворе и их исследование, Изд. АН ЛатвССР,
1955, стр. 103.
Метабораты металлов
второй группы
СаВ2О4
Рис. 517 построен по данным [1]. Рас-
творимость СаВаО4-6НаО при 10° соста-
вляет 2 г!л [2].
207
Метабораты-Sr, Ba, Cd
Твердая фаза t, °C С ч Источ- ники
SrB2O4-5H2O 10 2,3 г/л 2
ВаВ2О4-4Н2О 25 10,2 г/л 3
CdB2O4 22 0,016% 4
Имеются данные по понижению темпе-
ратуры замерзания растворов SrB2O4 и
ВаВ2О4 [5].
ЛИТЕРАТУРА
1. R. Mandelbaum, Z. anorg. Chem., 62,
379 (1909). — 2. A. D i t t е, Ann. chim. phys.
(5), 30 248, 253 (1883); C. r., 96, 1663 (1883). —
3. А. Д. К e ш а н, Синтез боратов в водном рас-
творе и их исследование, Изд. АН ЛатвССР,
1955, стр. 79. — 4. М. Б. Щ и г о л ь, ЖНХ,
4, 2014 (1959). — 5. А. Д. К е ш а н, С. Г. В и м-
б а, Е. М. Шварц, Изв. АН ЛатвССР, № 8,
127 (1955).
Метабораты редкоземельных
элементов
У(ВО2)з
Растворимость У(ВО2)3 при 25° соста-
вляет 0,45 г/л [1]. Число молекул воды
в кристаллогидрате точно не установлено.
Метабораты лантаноидов (при 25°) [1]
Твердая фаза * с, г/л Твердая фаза * с, г/л
La(BOa)3 0,74 Gd(BO2)3 0,45
Се(ВО2)3 0,68 Dy(BO2)3 0,50
Рг(ВО2)3 0,60 Но(ВО2)3 0,56
Nd(BO2)3 0,58 Ег(ВО2)3 0,62
Sm(BO2)3 0,51 Yb(BO2)3 0,67
* Метабораты кристаллизуются из растворов в виде гидратов. водных
I/I2B4O7,
ЛИТЕРАТУРА
1. Г. И. Васильев, В. В. Серебрен-
ников, ЖНХ, 9, 2490 (1964).
ТЕТРАБОРАТЫ
Тетрабораты металлов
первой группы
и аммония
1ЛгВ4О7
Рис. 518 построен по данным [1—3], со-
став твердой фазы приведен по данным [2].
Эвтектика: (—1°), (2,3%).
NaaB4O7
Рис. 519.
208
Рис. 519 построен по данным [1, 4—9]. Данные [10] не использованы. Особые
точки: t, °C c, % Источ- ники
Лед 4* + Na2B4O710H2O -0,42 1,03 . 4
NaaB4O7 -ЮН20 + 4- NaaB4O7.4HaO NaaB4O7lDH2O + + NaaB4O7-5H2O (мет.) 58,0 14,2 4
60,8 16,7 4, 5
Na2B4O7 -4HaO + 4- NaaB4O7-5H2O (мет.) 39 ± 5 —12 8
Кривая кипения построена по данным
[И]. Температура кипения насыщенного
раствора 102,8°, концентрация 36,7% [4, 5].
Интерполированные нами значения рас-
творимости NaaB4O7'5Н2О (мет.) при тем-
пературах выше 100° приведены ниже [12]:
t, °C % 1 t, °C c, %
105 36,5 125 52,0
110 40,0 130 57,5
115 43,0 135 63,0
120 47,5 140* 69,1
* Температура плавления NatB4Ot« 5Н2О.
КаВ4О7
Рис. 520.
Рис. 520 построей по данным [13]. Дан-
ные [1, 9, 14] не использованы. Эвтектика:
-3,0°, 5,8%.
В работе [13] указаны переходные точки:
t, °C с, %
KaB4O7 -4H2O 4- KaB4O7 -2HaO K.B4O7-2H2O 4- KaB4O7 HaO K2B4O7 H2O4- k2b4o7 145 240 300 (63) (72) (75)
Rb2B4O7 В работе [13] указаны переходные точки:
6 °C с, %
Rb2B4O7 -5Н2О 4- 104 (73)
4~ ВЬаВ4О7 -ЗН2О Rb2B4O7-3H2O4- 172 (79)
4- Rb2B4O7-2H2O ВЬ2В4О7 -2НаО 4- 244 (87)
4“ RbaB4O7 HaO RbaB4O7 -Н2О 4" Rb2B4O7 320 (90)
(NH4)2B4O7
Рис. 521.
Рис. 521 построен по данным [1, 7, 15,
16]. Эвтектика: —1,07°, 3,62% [7, 15].
ЛИТЕРАТУРА
1. Н, Menzel, Z. anorg. Chem., 164, 34, 57
(1927); Z. phys. Chem., 105, 416 (1923). —
2. W. T. R e b u г n, W. A. Gale, J. Phys.
Chem., 59, 20 (1955).— 3. A., R о I 1 e t,
R. Bouaziz, С. r., 240, 1104 (1955).—
4. N. P. Nies, R. W. Hulbert, J. Chem.
Eng. Data, 12, 303 (1967). — 5. W. C. Bias-
dale, С. M. Slansky, J. Am. Chem. Soc.,
61, 918 (1939). — 6. D. Horn, E. van Wag-
ner, Am. Chem. J., 80, 347 (1903). —
7. U. Shor g 1, E. C a 11 1 c h 1, Gazz. chim.
14 Заказ 976
209
ital., 54, 256, 298, 936, 948 (1924). - 8, H.Men-
z e 1, H. Schulz, Z. anorg. Chem., 245, 178
(19^0). — 9. А. Д. К e ш а и, С. Г. В и м б а,
Е. М. Шварц, Изв. АН ЛатвССР, № 7, 129
(1955). — 10. Po'ggiale, Ann. chim. phys.
(3), 8, 467 (1843).
11. G. T. G e г 1 a c h, Chem. Ind., 9, 241 (1886);
Z. anal. Chem., 26, 452 (1887).— 12. A. Ben-
rath, Z. anorg. Chem., 249, 245 (1942).—
13. P. Tolddano, Rev. chim. minerale, 1,
388, 403 (1964). — 14. А. Д. К e ш а н, Синтез
боратов в водном растворе и их исследование,
Изд. АН ЛатвССР, 1955, стр. 62, 66. —
15. U. S Ь о г g 1, L. Ferri, Mem. Accad.
Line. (5), 13, 569 (1920/1922). — 16. P. Tole-
dano, Bull. Soc. chim. France, 1966, 1940.
Тетрабораты металлов
других групп
Т12В4О7
Рис. 522 построен по данным [1]. Особые
точки:
1, вс с, %
Лед + Т12В4О7 -6Н2О -0,2 1,00
Т12В4О7-6Н2О + 4- Т12В4О7 -2Н2О 127 12,6
Т12В4О7 -2Н2О + + Т12В4О7Н2О 190 23,7
Т12В4О7 н2о 4~ Т12в4о7 Т12В4О7 -6Н2О 4- 4* Т12В4О7 Н2О (мет.) 262 50,0
154 18,7
РЬВ4О7
При ~20° происходит образование опа-
лесцирующего раствора РЬВ4О7-4Н2О, со-
держащего —0,7 г/л тетрабората [2].
ЛИТЕРАТУРА
1. М. Touboul, R. В о u a z i z, С. г., 265,
372 (1967).— 2. А. Д. К е ш а н, Синтез бора-
тов в водном растворе и их исследование, Изд.
АН ЛатвССР, 1955, стр. 95.
210
ПЕНТАБОРАТЫ
LiB6Og
Рис. 523.
Имеются данные по понижению темпера-
туры замерзания растворов до —1,877° [4].
Рис. 524 построен по данным [2], полу-
ченным в замкнутом объеме. Переходная
точка: 130°, 51,6%.
Pfic. 524.
NaB5O8
Рис. 525.
Рис. 525 построен по данным [2, 4—9].
Особые точки:
Лед+ NaB5O8-5H2O
NaBBO8-5H2O +
+ NaB6O8-H2O
t, °C с, %
—1,70 5,8
105 55,5
Источ-
ники
7
2, 8
Рис. 523 построен по данным [1, 2], ко-
торые несколько отличаются друг от друга.
По данным [1], соль устойчива при темпе-
ратуре выше 40,5°, по данным [2] — при
температуре выше 37,5°. Твердой фазой
в равновесии с раствором является
LiB6O8*5H2O. Растворимость метастабиль-
ной формы при 30° составляет 13,6% [3].
14*
Температура кипения насыщенного рас-
твора 109,6 , концентрация 55,3% [7].
Рис. 526 построен по данным [2, 8],
полученным в замкнутом объеме. Особые
точки [2J^
t, °C с, %
NaB6O8H2O +
+ NaB6O80,5H2O
NaB6O80,5H2O + NaB6O8
225 71,0
320 64,0
211
Рис. 526.
квБо8
Рис, 527 построен по данным [4, 5, 10,
11]. Эвтектика: —0,53°, 1,54% [10]. Темпе-
ратура кипения насыщенного раствора
102,3°, концентрация 23,4% [10].
Рис. 528 построен по данным [11, 12],
полученным в замкнутом объеме. Особые
точки [11]:
КВБО8-4Н»О+ КВ6О8Н2О
КВБО8-Нг0 +
+ КВБ08 0,5Н20
КВб08 0,5Н20+ КВбО8
t, °C с, %.
165 51,0
265 66,0
310 (37
К2НВбО9
Рис. 529 Построен по данным [11, 12],
полученным в замкнутом объеме. Твердой
фазой в равновесии с раствором является
гидрат К2НВБО9-2Н2О, устойчивый при
температурах выше 40°. При 330° происхо-
дит обезвоживание гидрата и, по-види-
мому, одновременное разложение соли.
212
Рис. 528.
В работе [11] указаны переходные точки:
Рис. 529.
ВЬВ5О8-4Н2О +
+ RbB6Og’H2O
ВЬВ5О8Н2О +
+ RbB5O8-0,5Н2О
RbB5O8 0,5Н20 + RbB5O8
Л °с С, %
166 (55)
262 (70)
327 (72)
CsBbO8
Рис. 531 построен по данным [10]. Эвтек-
тика: —0,36°, 1,59%. Температура кипения
насыщенного раствора 102°, концентрация
(23,7%) [10].
RbBgOg
Рис. 530.
Рис. 530 построен по данным [10]. Эвтек-
тика: —0,43°, 1,57%. Температура кипения
насыщенного раствора 102,2°, концентра-
ция 23,8% [10].
nh4b6o8
Рис. 532.
213
Рис. 532 построен по данным [4, 13, 14].
Эвтектика: —1,37°, 3,92% [13].
ЛИТЕРАТУРА
1. W. Т. Re burn, W. A. Gale, J. Phys.
Chem., 59, 20 (1955). — 2. R. В о u a*z i z, Ann.
chim., 6, 385, 389 (1961); Bull. Soc. chim. France,
1962, 1454. — 3. A. R о 1 1 e t, R. В о u a z i z,
C. r., 240, 1104 (1955).— 4. H. Menzel,
Z. anorg. Chem. 164, 36, 41, 57 (1927). —
5. А. Д. Мешан, С. Г. В и м б а,
Е. М. Шварц, Изв. АН ЛатвССР, № 7, 129
(1955). — 6. W. С. В 1 а в d а 1 е, С. М. S 1 а п -
sky, J. Am. Chem. Soc., 61, 918 (1939).—
7. A. Rolle f, Peng Chung-Ming,
Bull. Soc. chim. France (5), 2, 984 (1935). —
8. R. В о u a Z i z, J. Basset, C, r., 258, 1522
(1964).— 9. N. P. Nies, R. W. Hulbert,
J. Chem. Eng. Data, 12, 303 (1967). — 10. A. R о P
let, L. Andri! s, Bull. Soc. chim. France (4),
49, 1087 (1931); C. r., 191, 375, 567 (1930).
11. P. ToUdano, Rev. chim. minerale, 1,
353 (1964). — 12. P. To 16 da no, Bull. Soc.
chim. France, 1963, 196. — 13. U. S b о г g i,
Li. Ferri, Mem. Accad. Line. (5), 13, 569
(1920/1922). — 14. P. Tolddano, Bull. Soc.
chim. France, 1966, 1940.
Гексабораты Mg, Ca, Ba
Твердая фаза t, °C с Источ- ники
MgBeOi0 • 5Н2О —20 8 г/л * 2
СаВвОю • 5Н2О 20 4,50 г/л 3
СаВвОю • 5Н2О 20 5,14 г/л ** 3
Са2В30ц • 13Н2О 25 0,323% 4
Са2ВвОц • 9Н2О 30 0,29% 5
ВаВдОю • 4Н2О 20 0,21% (ВаО) 0,24% (В2О3) 6
ВаВвОю • 4Н2О 80 0,32% (ВаО) 0,55% (В2О3) 6
BaBgOio * 7Н2О — 0,22% (ВаО) 0,30% (В2О3) 7
* Из работы [2] не ясно, относится ли это
значение к гидрату или к безводной соли.
** Растворению подвергался пентагидрат,
обожженный при 480°.
Имеются данные по понижению темпера-
туры замерзания растворов MgBeO10 до
-0,161° [8].
ГЕКСАБОРАТЫ
Mg2BeOu
Рис. 533.
Рис. 533 построен по данным [1]. Особые
точки:
Лед + MgjBeOjilSHjO
MgaBeOu-15H2O +
-f- MgB2O< • 3H2O
t, °C c, %
—0,10 0,17
43 (0,41)
ЛИТЕРАТУРА
1. J. D’Ans, К. Н. Behrendt, Kali и»
Steinsalz, 2, 121 (1957). — 2. Н. A. L е h m a nn*
Н. J. Papenfuss, Z. anorg. Chem., 301, 228
(1959). — 3. Г. К. Годе, Изв. АН ЛатвССР,
№ 10, 118 (1949). — 4. А. И. С п и р я г и н а,
Труды ВНИИГ, № 27, 82 (1953). — 5. U.
S b о г g i, Atti Accad. Line. (5), 22, 798
(1913). — 6. Ю. С. Плышевский, И. A.
Леонтьева, Г. M. Смирнова,
ЖНХ, 8, 2811 (1963). — 7. G m е 1 i n, Bd. 30,
1932, S. 298. — 8. А. Д. К е ш а н, С. Г. В и м б а,
Е. М. Шварц, Изв. АН ЛатвССР, JXS 8, 128
(1955).
ПЕРБОРАТЫ
NaBO3
Рис. 534.
214
Рис. 534 построен по данным [1, 2] (см.
также [3]). Особые точки:
Лед + NaBOa-4H2O
NaBO3-4Н2О +
+ NaBO3 -ЗН2О
t, °C с, % Источ-
ники
—0,28 0,56
15 ± 2 (11,0)
2
1
КВО3
Растворимость КВО3«0,5Н2О при 0 и
15° составляет соответственно 1,13 и 2,23%
[4]. Имеются данные по понижению тем-
пературы замерзания растворов до —3°
[2].
NH4BOs
Растворимость NH4BO3 -0.5Н2О при 17,5°
составляет 1,53% [5], 0,4—0,45 молъ!л [6].
ЛИТЕРАТУРА
1. D. W. van Gel de г, Rec. trav. chim.,
75, 117 (1956); 77, 740 (1958). — 2. H. M e n z e 1,
Z. anorg. Chem., 164, 39 (1927). — 3. T. И. A p -
нольд, H. H. Стасевич, Изв. АН СССР.
ОХН.1962, 1921. — 4. С. vo n Girsewald,
A. Wolokitin, Ber., 42, 868 (1909).—
5. П. Мелихов, Л. Писаревский,
Ber., 31, 953 (1898). — 6. H. Men zel, Z. anorg.
Chem., 167, 216 (1927).
ФТОРБОРАТЫ
hbf4
Рис. 535 построен по данным [1]. Особые
точки:
t, °C с, %
Лед + HBF45H2O —82,5 39,4
HBF45H2O+ HBF43H2O -80 50,0
HBF43H2O -53 62,6
HBF4.3H2O + HBF4-2H2O —65 67,7
HBF4-2H2O -34 (70,5)
HBF4-2H2O+ hbf4h2o -44 72,3
hbf4h2o 52 83,0
ЛИТЕРАТУРА
1. S. Pawlenko, Z. anorg. Chem., 328
142 (1964).
Фторбораты металлов
первой группы и аммония
NaBF4
Рис. 536.
Рис. 536 построен по данным [1. 2].
Эвтектика: —10,7°, 37,1% [1].
nh4bf4
Рис. 538.
Рис. 538 построен по данным [7]. Эвтек-
тика: —2,7°, 9,79%. Температура кипения
насыщенного раствора 108,5° (при давле-
нии 748 мм рт. ст.), концентрация (53%).
KBF4, RbBF4, CsBF4
При построении кривых (рис. 537) для
KBF4 не использованы данные [5], для
CsBF4 — данные [5, 6].
Cu(BF4)2
Рис. 539.
216
Рис. 539 построен по данным [8]. При
~63° Cu(BF4)2-6Н2О переходит, по-види-
мому, в Cu(BF4)2-4H2O [8, 9].
ЛИТЕРАТУРА
1. И. Г. Рысс, В. А. Плит, ЖОХ, 25, 19
(1955). — 2. R. С а 1 1 1 a t, Ann. chim. (11),
20, 367 (1 >45). — 3. И. Г. Р ы с с, И. С. X ор-
да с, ЖНХ, 3, 1411 (1953). — 4. F. Stolba,
Chem. Techn. Cent., Anz., 7, 459 (1389). —
5. J. H. de Boer, J. A. van L i e m p t,
Rec. trav. chim. (4), 43, 126 (1927). — 6. R. Go-
de f f roy, Ber., 9, 1363 (1876). — 7. В. С. Я т -
лов, E. H. Пинаевская, ЖОХ, 15, 269
(1945). — 8. Е.Н.Пинаевс кая.Э.М.Мор-
гу нова, Н. Л. Антошкин а, С. Г. Су ш-
нова, ЖПХ, 37, 1176 (1964). — 9. А. Г. Э л fa-
it е н б а р д, Сборник статей по общей химии,
Изд. АН СССР, т. 2, 1953, стр. 1239.
Фторбораты металлов
других групп
Zn(BF4)2
Рис-. 540 построен по данным [1].
Ni(BF4)2
Рис. 541 построен по данным [1].
Фторбораты Са, Sr, Ва [2]
Твердая фаза (, °C с, %
Ca(BF4)2-2H3O 20 54,8
Sr(BF4)2-2Н2О 20 65,6
Ba(BF4)2 -2Н2О 20 70,6
ЛИТЕРАТУРА
1. Е. Н. Пинаевская, Э. М. Моргу-
нова, Н. Л. Антошкина, С. Г. Суш-
кова, ЖПХ, 37, 1176 (1964).— 2. S. Pa w-
lenko, Z. anorg. Chem., 315, 141 (1962).
БОРГИДРИДЫ
NaBH4
Рис. 542 построен по данным [1, 2]. Осо-
бые точки:
Лед + NaBH4-2Н2О
NaBH4 -2Н2О +
+ NaBH4
Источ-
ники
2
1
—37,5 21,8
36,4 45,2
217
Рис. 543 построен по данным [3]. Особые
точки:
Лед+ КВН4-ЗН,О
КВН4-ЗН2О+ КВН4-НоО
КВН4Н2О + КВН4
t, °C
-10
7,3
37,5
с» %
11,0
15,2
22,5
ЛИТЕРАТУРА
1. Е. Н. Jensen, A Study on Sodium Вого-
hydride, Copenhagen, 1954. - 2. В. И. Михе-
ев а, В. Б. Б p а й цис, ЖНХ, 5, 2553 (1960). —
3. В. И. М и х е е в а, М. С. Селивохина,
ЖНХ, 8, 439 (1963).
ZnB2O4
Ориентировочное значение растворимо-
сти ZnB2O4 составляет 4-10"3%.
МАРГАНЕЦСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
ЫМпО4
Рис. 544 построен по
данным [1]. Эвтектика:
-12,5°, 22,3%.
218
Рис. 545 построен по данным [2, 3].
Особые точки [2]:
t, °C с, %
Лед+ NaMnO4-3H2O
NaMnO4-3H2O
NaMnO4 -3HjO +
4- NridnO4 H2O
NaMnO4H2O
NaMnO4H»O +
+ NaMnO4-0,5H2O (?)
-15,8
36,0
33,7
68,7
66,2
41,4
72
75,2
88
90,7 (?)
Weekbl., 2, 766 (1905). — 5. G. P. Baxter,
А. С. В о у i s t о n, R. A. Hubbard, J. Am.
Chem. Soc., 28, 1343 (1906). — 6. E. C. Wor-
den, J. Soc. Chem. Ind., 28, 453 (1907).—
7. A. M. P a 11 e г в о n, J. Am. Chem. Soc., 28,
1735 (1906). — 8. W. Muthmann, O. Kun t-
z e, Z. Krist. u. Miner., 23, 377 41894).—
9. А. с. Селиванова, К. С. Билинки c,
Труды МИТХТ им. Ломоносова, jsft 7, 171
(1958). — 10. W. Tr e a d we 11< A. Ammann,
Helv. chim. acta, 21, 1249 (1938).
11. S e i d e 1 1, v. 2, 1965, p. 705. — 12. F.
Hein, W. Daniell, Z. anorg. Chem.,
234, 155 (1937).
KMnO4
Рис. 546 построен по данным [4—6].
Эвтектика: —0,58°, 2,91% [4].
Са(МпО4)2
Рис. 547 построен по данным [3].
Перманганаты Rb, Cs, NH4, Ag, Sr
Твердая фаза t, °C c Источ- ники
RbMnO4 2 4,6 г/л 7
RbMnO4 7 0,6% 8
RbMnO4 19 10,6 г/л 7
RbMnO4 60 46,8 г/л 7
RbMnO4 — 0,45% 9
CsMnO4 1 0,97 г/л 7
CsMnO4 19 2,3 г/л 7
CsMnO4 20 0,23% 10
CsMnO4 59 12,5 г/л 7
CsMnO4 0,1% 9
NH4MnO4 15 7,4% И
AgMnO4 20 9,22 г/л 12
Sr(MnO4)2 0 2,5% 7
ЛИТЕРАТУРА
1. А. А. Зиновьев, K. B. Титова,
ЖНХ, 8, 1579 (1963).— 2. J. C. White,
R. R. Meiller, J. Am. Chem. Soc., 75, 3282
(1953). - 3. F. Be lllnger, H. B. Fried-
m a n n, W. H. Bauer, J. W. E a s t e s,
S. M. Edmonds, Ind. Eng. Chem., 38. 627
(1946). — 4. G. L. V о e r m a n n, Chem.
РЕНИИСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
NaReO4
KReO4
Рис. 548 построен по данным [1] (черные
Кружки) и [2] (светлые кружки).
Рис. 549 построен по данным j [3—6],
полученным в замкнутом объеме. Эвтек-
тика: —0,060°, 0,343% [4].
219
Рис. 548.
Перренаты Li, Rb, Cs, NH4, Ag, Ba, TT
Твердая фаза t, Cc c Источ- ники
LiReO4 -2Н2О 0 72,0% 1
LiReO4-2H2O 30 78,3% 1, 2
LiReO4 -2Н2О 50,3 78,3% 1
RbReO4 0 0,39% 1
RbReO4 19,2 10,5 г/л 3
RbReO4 24,6 14,6 г/л 3
RbReO4 — 1,55% 2
RbReO4 30 1,55% 1
RbReO4 50,3 3,53% 1
CsReO4 0 0,33% . 1
CsReO4 19 7,8 г/л 3
CsReO4 — 1,06% 2
CsReO4 30 1,09% 1
CsReO4 50,3 2,39% 1
NH4ReO4 0 2,70% 1
NH4ReO4 20 120 г/л 7
NH4ReO4 20 65 г/л 2
NH4ReO4 30 8,02% 1
NH4ReO4 30 78 г/л 2
NH4ReO4 50 172 г/л 2
NH4ReO4 50,3 13,8% 1
NH4ReO4 70 268 г/л 2
AgReO4 20 3,2 г/л 7
Ba(ReO4)9 20 ~150 г/л 7
TlReO4 20,3 1,6 г/л 3
TlReO4 21,5 1,7 г/л 3
TlReO4 24,8 2,1 г/л 3
TlReO4 42 5,8 г/л 3
TlReO4 93 15,4 г/л 3
ЛИТЕРАТУРА
1. W. T, S m i t h, S. H. L о ng, J, Am. Chem,
Soc., 70, 355 (1948). — 2. А. С. С e л и в а н о в а,
К. С. Билинки с, Труды МИТХТ им. Ломо-
носова, № 7, 171 (1958). — 3. I. N о d d а с к,
W. N о d d а с к, Z. aagew. Chem., 44, 215
(1931). — 4. N. Puschin, D. Kovac,
Z. anorg. Chem., 199, 370 (1931). — 5. W. T. ‘
Smith, J. Am. Chem. Soc., 68, 394
(1946). — 6. H. H б 1 e m a n n, W. К 1 e e s e,
Z. anorg. Chem., 237, 173 (1938). — 7. I. N о d -
d a c k, W. N о d d a c k, Z. anorg. Chem., 181, 1
(1929).
ХРОМСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
ХРОМАТЫ
Хроматы металлов
первой группы и аммония
Li2CrO4
Рис. 550 построен по данным [1]. Пере-
ходная точка: 74,6°, 56,1%. Температура
эвтектики —60°.
Na2CrO4
Рис. 551 построен по данным [2—6, 8].
В отношении существования Na2GrO4 •
• 6Н2О мнения расходятся. По данным
220
[2, 7] при 25—60° кристаллизуется
Na2CrO4'4НаО. По данным [3, 5, 6] при
20—26° кристаллизуется Na2CrO4 ‘бНвО,
а выше 26° — Na2CrO4'4H2O. Особые
точки [8]:
t, °C с, %
Лед + Na2CrO4 -10Н2О Na2CrO4 -ЮН20 + + Na2GrO4-6H2O Na2CrO4 -6Н2О + 1 —5,3 19,4 19,7 44,1
25,9 46,0
+ Na2CrO4-4H2O
Na2CrO4 -4Н2О + Na2CrO4 Na2CrO4-10H2O + 64 19,6 55,1 45,0
+ Na2CrO4-4H2O (мет.)
К2СгО4
Рис. 551.
Рис. 552 построен по данным [9], полу-
ченным в замкнутом объеме.
Рис. 553.
Рис. 553 построен по данным [6, 10—12].
Данные [13] не использованы. Эвтектика:
—11,3°, 36,1% [6]. Кривая кипения по-
строена по данным [14]. Температура кипе-
ния насыщенного раствора 105,8° [12].
Концентрация, соответствующая этой тем-
пературе, по графику растворимости соста-
вляет 45%; в работе [12] указана концентра-
ция 49,1%.
Рис. 554 построен по данным [15], по-
лученным в замкнутом объеме.
Rb2CrO4
Рис. 555 построен по данным (16]. Эвтек-
тика: (—7°), 36,7%.
Сз2СгО4
Рис. 556 построен по данным [17]. Дан-
ные [18] не использованы.
(NH4)2CrO4
Рис. 555.
Рис. 557 построен по данным [19—21].
CuCrO4
Растворимость СиСгО4 при 25° составляет
0,618 г/л [22].
Рис. 556.
Ag2CrO4
Рис. 558 построен по данным [23], полу-
ченным в замкнутом объеме.
ЛИТЕРАТУРА
Особые точки:
1. W. ’Н. Hartford, R. L. Costa,
Р. Е. Moore, J. Am. Chem. Soc., 74, 4454
(1952).— 2. F. Mylius, R. Funk, Wiss.
Abh. phys. techn. Reich., 3, 451 (1900). —
3. H. Sa Ikowski, Ber., 84, 1948 (1901).—
4. H. C. Jones, Carnegie Publication, № 60,
37 (1907). — 5. T.W. Riohards, G, L. Ke b
ley. J. Am. Chem. Soc., 88, 851, 863 (1911). —
6. W. H. Hartford, Ind. Eng. Chem., 41,
1995 (1949). — 7. H. Ф. Юшкевич,
В. А. К a p » авин, И. H. Ш о к и н, ЖХП, 3,
1120 (1926). — 8. Справочник ио растворимости
солевых систем, т. 3, 1961; т. 4, 1963. —
9. A. Be nr a th. Z. anorg. Chem., 249, 249
(1942). — 10. А 1 1 u а г d, С. г., 59, 500 (1864).
11. A. Nordenskjeid, G. Lindst-
r б m, Ann., 186, 314 (1869).— 12. J. Kop-
pel, R. Blumenthal, Z. anorg. Chem., 53,
228 (1907). — 13. A. E t a r d, Ann. chim. phys.
(7), 2, 550 (1894). — 14. T i m m e r m a n s,
v. 3, 1960, p. 1019. — 15. А. В e n r a t h,
F. G j e de Do, B. Schiffers, H. Wun-
derlich, Z. anorg. Chem., 231, 297 (1937).—
18. F. A. H. S c h r e i n e m a k e r s, A. Fi-
lippo, Chem. Weekbl., 8, 157 (1906).—
17. И. B. HI a x н о, В. Е.П л ю щ e в, E. M. T и-
тунина, P. Г. Самусева, ЖНХ, 8, 1466
,(1963).— 18. T. V. Barker, Mineral. Mag.,
15, 42 (1908). — 19. A. E. H i 11, G. C. S о t h,
J. E. Ricci, J. Am. Chem., Soc., 62, 2131'
(1940).— 20. Я. И. Герасимов, ЖОХ, 4,
721 (1934).
21. F. A. H. Schreinemakers, Z. phys.
Chem., 55, 97 (1906). — 22. S. Peterson,
O. Copper, Trans. Kentucky Acad. Sci., 18,
146 (1950. — 23. M. Л. Гавриш, И. С. Га-
линкер, ЖНХ, 15, 1979 (1970).
Хроматы металлов
второй группы
MgCrO4
Рис. 559 построен по данным [1]. Отме-
чается возможность перехода MgCrO4 •
• 5НаО в другую форму около 75°. Данные
[2] не использованы.
MgCrO4 Лнао+ 4- MgCrO4 -5H2O t, °C c, %
(17,2) (35,2)
MgCrO4-5HaO + 4- MgCrO4 -2HaO 50-60 —
В работе [1] указывается, что точка
MgCrO4-2HaO -j- MgCrO4-HaO находится
при 100—110°, точка MgCrO4-HaO +
+ MgCrO4 при 160—170°.
СаСгОд
На рис. 560 представлена растворимость:
1 — СаСгО4 [3, 4]; 2 — СаСгО4-0,5НаО
[3]; 3 — СаСгО4-НаО [5]; 4 - В-СаСгО4 .
• 2НаО [5]; 5 — а-СаСгО4-2НаО [5].
Для СаСгО4-0,5НаО и СаСгО4 не исполь-
зованы данные [5].
SrCrO4
Рис. 561 построен по данным [6—9].
Данные [8] при 15 и 25° не использованы.
ЛИТЕРАТУРА
1. А. Е. Н i 1 1. G. С. S 6 t h, J. Е. R i с с i,
J. Am. Chem. Soc., 62, 2132 (1940). — 2. F. M у -
lius, R. Funk, Ber.. 80, 1716 (1897).—
3. R. D u r a n d, Ann. chim. (13k 4, 608 (1959). —
4. E. H. Пинаевская, H. JI. Ант о ш-
к ин а, Г. Г. Гу с е в а, ЖПХ, 84, 1925 (1961). —
5. F. М у I lus, J. w г о с h е n, Wiss. Abh.
phys. techn. Reich., 3, 462, 474 (1900). —
6. T. W. D a v i s, Ind. Eng. Chem. Anal. Ed., 14,
709 (1942). — 7. R. Fresenius, Z. anal.
Chem., 29, 419 (1890). — 8. T. W. Davis,
J. E. R i с c i, J. Am. Chem. Soc., 61, 747 (1939)..—
9. И. Мещерский, ЖРФХО. Ч. хим., 14,
220 (1882); Z. anal. Chem., 21, 400 (1882).
223
Рис. 562 построен по данным [1]. Особые
точки:
Лед+ UO2CrO4-5,5Н2О UO2CrO4-5,5H2O + + UO„CrO4 хН2О t, °C —0,15 66,3 m, Dy, C, % 3,07 70,0 Th
Хроматы La, Рг, Nd, S
Твердая фаза t, °C C, % Источ- ники
La2(CrO4)3-8H2O 25 0,020 2
Рг2(СгО4)3-8Н2О 25 0,021 2
Nd2(CrO4)3-8H2O 25 0,027 2
Sm2(CrO4)3 -8Н2О 25 0,043 2
Dy2(CrO4)310H2O 25 1,00 3
Th(CrO4)2-H2O 22 0,35 4
ЛИТЕРАТУРА
1. Р. J. Loprest, W. L. Marshall,
С. Н. S е с о у, J. Am. Chem. Soc., 77, 470 5,
(1955). — 2. Н. Т. S. В г i t t о n, J. Chem. Soc.,
125, 1875 (1924)'. — 3. G. J a n t s c h, A. О h 1,
Ber., 44. 1274 (1911). — 4. G m e 1 i n, Bd. 52,
T. B, 1962, S. 90 8.
БИХРОМАТЫ
Хроматы металлов
других. групп
Бихроматы металлов
первой группы и аммония
Li2Cr2O7
UO2CrO4
Рис. 563.
Рис. 563 построен по данным [1]. Эвтек-
тика: <Z —10°, (48,8%). Температура кипе-
ния насыщенного раствора 149°.
224
Na2Cr2O7
Рис. 564.
Рис. 565.
Рис. 564 построен по данным [2—4].
Данные [5] не использованы. Особые точки
[4]:
t, *С С, %
Лед+ NaaCraO72HaO (—48,2) (60,7)
Na2Cr2O7 -2НаО + 84,6 (79,2)
+ Na2Gr2O7
Температура кипения насыщенного рас-
твора 139° [5].
К2Сг2О7
Рис. 565 построен по данным [4, 6—8].
Данные [9] не использованы. Эвтектика:
—0,63°, 4,30% [4]. Кривая кипения по-
строена по данным [10]. Температура кипе-
ния насыщенного раствора 104,8°, концен-
трация 52% [7].
Рис. 566 построен по данным [9] (черные
кружки) и [11] (светлые кружки), получен-
ным в замкнутом объеме. Отмечено суще-
ствование фазового превращения а-
К2Сг2О7 р-К2Сг2О7 при 241,6° [12] или
255° [13].
15 Заказ 976
Rb2Cr2O7
Рис. 567 построен по данным [14, 15 J-
Cs2Cr2O7
Рис. 568 построен по данным [16]-
225
Рис. 567.
(NH42Cr2O7
Рис. 568.
Рис. 569 построен по данным [4, 17—20].
Эвтектика: —2,51°, 13,6% [4].
ЛИТЕРАТУРА
1. W. Н. Hartford, К. A. L a n е, J. Am.
Chem. Soc., 70, 647 (1948). — 2. F. Mylius,
R. Funk Wise. Abh. phys. techn. Reich., 3, 452
(1900). — 3. А. В. Раковский, E. А. Ни-
китина, Труды Ин-та чистых хим. реактивов,
вып. И, 7 (1931). — 4. W. Н. Hartford,
J. Am. Chem. Soc., 63, 1474 (1941); Ind. Eng.
Chem., 41, 1995 (1949). — 5. A. Stanley,
Chem. News, 54, 195 (1886). — 6. R. К r e m e r s,
Pogg. Ann., 92, 499 (1854). — 7. J. Koppel,
R. Blumenthal, Z. anorg. Chem., 53, 235,
(1907). — 8. А. В. Раковский, А. В. Ба-
баева, Труды Ин-та чистых хим. реактивов,
вып. И, 17 (1931). — 9. А. Е t а г d, Ann. chim.
phys. (7), 2, 550 (1894); (7), 3, 275 (1894). —
10. T 1 m m e r m a n s, v. 3, 1960, p. 1025.
11. W. A. Tilden, W. A. Shenstone,
Phil. Trans. Roy. Soc., 175, 34 (1884). —
12. A. Lehrman n, H. Selditch, P.
Skell, J. Am. Chem. Soc., 58, 1612-(1936). —
13. J. J a f f r a y, A. Labary, C. r., 242,
1421 (1956). — 14. W. Stortenbeker, Rec.
trav. chim. (2), 26, 244 (1907). — 15. G.Wy-
r о u b о f f, Bull. Soc. chim. France (3), 25, 118
(1901). — 16. И. B. HI a x н о, В. E. П л ю щ e в,
E. M. Авжиев а, ЖНХ, 10,1237 (1965).—
17. И. Герасимов, Z. anorg. Chem., 187,
321 (1930). — 18. E. Moles F. Gonzales,
An. Soc. espan. fis. quim., 21, 204 (1923). —
19. F. A. H. S c h r e i n e m a k e r s, Z. phys.
Chem., 55, 97 (1906). — 20. А. Д. Ш e в e л e в a,
ЖНХ, 1, 1883 (1956).
Бихроматы металлов
второй группы
Рис. 569.
MgCraO7
.t,”C
мзсгго7,%
Рис.*570.
Рис. 570 построен по данным [1]. Пе-
реходная точка: —48,5°, —61,2% [1,
2]. В работе [2] отмечено, что точка
MgCraO7 • 5Н2О + MgCraO7. Н2О находится
при 89,4°.
СаСг2О7
Рис.’571.
Рис. 571 построен по данным [3—6].
Отмечено образование в области эвтектики
гидрата неизвестного состава [4]. Особые
точки:
1, °C С, % Источ- ники
Лед + СаСг2О7 -жН2О -40 52,5 4
СаСг2О7 -6Н2О + + СаСгвО7-5Н2О СаСг2О7 -5Н2О Н- + СаСг.О, -4Н2О СаСг2О7-4Н2О + + СаСг2О7-ЗН2О —20 (58) 4
3- 451 <8 (65) 5, 6
81 — 5, 6
ЛИТЕРАТУРА
3. W. Н. Н а г t f о г d, К. A.L a n е, W. А. М е-
уег, J. Am. Chem. Soc., 72, 3354 (1950).—
4. Д. Н. Тарасенков, 3. И. К он о п -
кина, ЖПХ, 27, 200 (1954). — 5. R. Du-
rand, A. Michel, С. г., 246, 1864 (1958). —
6. R. Durand, Ann. chim. (13), 4, 631 (1959).
ДРУГИЕ ХРОМСОДЕРЖАЩИЕ
СОЕДИНЕНИЯ
Na2Cr30u
<
Растворимость Na2Cr8Oi0-H2O при 0—
100° по данным [1] описывается уравнени-
ем: с — 79,7 -J- 0,06i.
Хромсодержащие соединения Na и К
Твердая фаза t, °C С, % Источ- ники
Na2Cr4O18 -4Н2О 0 73,0 1
Na2Cr4O18 -4Н2О 16 74,2 1
Na2Cr4O18 -4Н2О К3СгО8 22 76,0 1
0 —0,15 2
Имеются данные по понижению темпера-
туры замерзания растворов К8СгО8 [2].
ЛИТЕРАТУРА
1. F. Му lius, R. Punk, Wise. Abh. phys.
techn. Reich.. 3, 453 (1900). — 2. G m e 1 1 n,
Bd. 52, T. B, 1962, S. 585.
Ориентировочные значения
растворимости
хромсодержащих
соединений
Соединение с, %
Ag2CrO4
Ag2Cr2O7 *
ВаСгО4
Т12СгО4
РЬСгО4
3-10-»
8-Ю-1 * 3
4-Ю-3
4-Ю-3
6-IO’»
1. R. L. С о s t a, W. Н. Н а г t f о г d.J. Am.
Chem. Soc., 80, 1809 (1958). — 2. W. H. Hart-
ford, J. Am. Chem. Soc., 68/ 2193 (1946).—
15*
* По данным M. S. Sherrill и D. Е. Russ [J. Am.
Chem. Soc., 29, 1673 (1907)] растворимость соста-
вляет 3,2 г /л.
227
МОЛИБДЕНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Li2MoO4
Li2Mo04 , %
Рис. 572 построен по данным [1]. Твер-
дой! фазой в равновесии с раствором яв-
ляется 4Li2MoO4 ‘3H2O. Данные [2] не
использованы.
Рис. 572.
Na2MoO4
Рис. 573 построен по данным [3—5],
полученным в замкнутом объеме. Переход-
ная точка: 10,3°, 39,0% [3]. Точка перехода
Na2MoO4-2H2O + NaMoO4 точно не уста-
новлена.
К2МоО4
Рис. 574 построен по данным [6]. Эвтек-
тика: {—38,0°, 62,7%. Температура кипения
насыщенного раствора 119°, концентрация
67,6%.
MgMoO4
Рис. 575 построен по данным [7]. Особые
точки:
Лед + MgMoO4 -7Н2О
MgMoO4‘7Н2О +
+ MgMo04 ‘5Н2О
:MgMo04 *5Н2О +
+ MgMoO4 -2Н2О
t, °C с, %
—1,67 11,6
12,7 15,2
60,8 19,9
Рис. 573.
Рис. 575.
Молибденсодержащие соединения
Na, К, Rb, Cs, NH4, Си, Mg, Zn
Твердая фаза t, °C c Источ- ники
Молибдаты
Rb2MoO4 18 67,9% 11
Cs2MoO4 18 67,1% 11
(NH4)2MoO4 25 42,8% * 12, 13
CuMoO4 20 0,162 г/л 10
CuMoO4 100 1,61 г/л 10
ZnMoO4 20 1,57 г/л 10
ZnMoO4 100 1,94г/л 10
Бимолибдаты
Na,Mo2O7-6H2O | 24 | 32,8% | 14
Тримолибдаты
Na2Mo3O10 20 3,73%** 15
Na2MO3O10 100 12,1%** 15
Na2Mo3O10 -7Н2О 24 8,60% 14
Na2Mo3O10 -7Н2О 30 13,7% 16
К2Мо3О10-ЗН2О 15 2,2 г/л 17
MgMo3O10-10H2O 25 1,80% 18
CaMoO4
Рис. 576 построен по данным [8] (свет-
лые кружки) и [9] (черные кружки). Данные
[10] не использованы.
Тетрамолибдаты
Na2Mo4O13 7Н2О 15 77 г/л 17
Na2Mo4O13 -7Н2О 24 9,41% 14
Na2Mo4O13 -6Н2О 21 18,9 г/л 2
К2Мо4О13 -ЗН2О 15 10 г/л 17
Октамолибдаты
(NH4)6Mo8O27
| 35 [ 12,5% | 19
Пара молибдаты
Na10Mo12O41 • • 38Н2О 30 54,1% 16
Rb10Mo12O41 • • Н2О (?) 24 19,4 г/л 2
* Среднее значение.
** Из работы [151 не ясно, относится ли чи-
сленное значение растворимости к гидрату или
к-безводной соли.
ЛИТЕРАТУРА
1. A. Rosenheim, W. Regli n, Z. anorg.
Chem., 120, 116 (1922). — 2. G. W e m p e,
Z. anorg. Chem., 78, 309 (1912). — 3. W. E. C a d -
bury, J. Am. Chem. Soc., 87, 263 (1945); J. Phys.
Chem., 59, 257 (1955). — 4. R. F u n k, Ber., 33,
3699 (1900). — 5. И. А. Терешина, Труды
шестого Совещания по экспериментальной и тех-
нической минералогии и петрографии, 1962,
стр. 117. — 6. J. Е. Ricci, F. J. Loprest,
229
J. Am. Chem. Soc., 75, 1224 (1953). —
7. J. E. R 1 с c 1, W. F. L i n к e, J. Am. Chem.
Soc., 73, 3601, 3603 (1951).— 8. В. И. Спи-
ц ы н, И. А. С а в ич, ЖОХ, 22, 1280 (1952). —
9. В. И. Спицын, И. А. Савич, A. H. Не-
смеян о в, сб. «Радиохимия», Изд. МГУ,
1952, стр. 98. — 10. А. Н. 3 е л и к м а н,
Т. Е. Пр осей ко в а, ЖНХ, 6, 212 (1961).
11. В. И. Спицын, И. М. Кулешов,
ЖОХ, 21, 408 (1951). — 12. 3. Г. Каров,
ф. М. Перельман, ЖНХ, 7, 2450 (1962). —
13. 3. Г. Каров, Ф. М. Перельман,
ЖНХ, 5, 713 (i960). — 14. J. By е, Ann. chim.
(11), 20, 527 (1945). — 15. U 11 1 к см. Справоч-
ник по растворимости солевых систем, т. 3,
1961. — 16. A. Rosenheim, Z. anorg. Chem.,
96, 143 (1916).— 17. A. Travers, Mala-
prade, Bull. Soc. chim. France (4), 39, 1548,
1553 (1926). — 18. G. Teller, J. Bye, Bull.
Soc. chim. France, 1959, 1531. — 19. Л. Л. Зо-
лотарев, Изв. вузов. Цвети, металлург.,
М 2, 107 (1958).
Ориентировочные значения
растворимости
молибденсодержащих
соединении
Соединение С, %
Ag2MoO4 4 IO"3
СаМоО4 6-Ю-3
SrMoO4 3-Ю-3
ВаМоО4 2-Ю-3
Ме2(МоО4)3 * 2-Ю-з
РЬМоО4 8-Ю"3
FeMoO4 3-Ю’3
* Me—La, Pr, Nd.
ВОЛЬФРАМСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
NaaWO4
Рис. 577 построен по данным [1—3].
Особые точки [1]:
Рис. 577.
- t, °с
ЛеД + Na2WO4-ЮН2О —7,5
NaaW04-10H20 + “ 6,2
+ Na2WO4-2H2O
Лед+Na2WO4-2H2O (мет.) —13
с, %
30,1
42,5
42,5
NaeHe(W2O7)e
Рис. 578.
Рис. 578 построен по данным [4]. Твер-
дой фазой в равновесии с раствором яв-
ляется NaeHe(W2O7)e-жН2О: 1 — NaeH6 •
• (W2O7)e -23,94Н2О; 2 - NaeH«(W2O7)e .
• 22,56Н2О; 3 — NaeHe(W2O7)e-21,64H2O.
230
Nai0Wi2O4i
Рис. 579 построен по данным [5] (черные
кружки) и [6] (светлые кружки). Твердой
фазой в равновесии с раствором является
Na10W1!SO41.28HaO.
KeH6(W2O7)8
Рис. 580.
Рис. 580 построен по данным [4]. Твер-
дой фазой в равновесии с раствором явля-
ется KeHe(WaO7)e-arHaO: 1- KeHe(W2O7)r
. 23,33H2O; 2 — K-Hft(W2O7)e • 22,40Н2О;
3 - KeHe(WaO-)e-13,72H2O; 4 - KeHe •
• (W2O7)e .12,77Н2О.
(NH<)10W12O41
(NH4)10W,jO4I , %
Рис. 581.
Рис. 581 построен по данным [6].
Вольфрамсодержащие соединения
Li, Rb, Cs, Mg, Ca, Sr, Ba, Zn, Cd, Hg
твердая фаза t, °C c. % Источ ники
Вольфрам а ты
Rb2WO4 7 80,7 7
Rb2WO4 17 80,0 7
CsaWO4-2H2O (?) 17 85,6 7
ZnW04H20 15 —0,189 8, 9
CdWO4H2O 15 —0,048 8, 9
Бивольфраматы
MgW2O7-8H2O 15 0,68 8, 9
CaWa07 -3H2O 15 2,9 8
SrW2O7-3H2O 15 0,31-0,35 8
BaW2O7H2O 15 0,049 8
ZnW2O7 3HaO 15 —8,3 8„ 9
CdW2O7 >3H2O 15 —0,183 8, 9
Тривольфраматы
HgW3O10-7H2O I 15 I —0,726 I 8
Hg4w3ou -8H2O I 15 I —0,905 | 8
Тетравольфраматы
Li2W4O13-10H2O | 20 | 79,3 | 10
Пентавольфраматы
Hg3W5O18-5HaO | 15 | —0,379 | 8
231
ЛИТЕРАТУРА
1. R. L. Pilloton, G. E. Grawley,
J. Electrochem. Soc., 107, 122 (1960). —
2. R. Funk, Ber., 33, 3701 (1900). —
3. 3. Г. Каров, Ф. M. Перельман,
Г. H. Рогожина, ЖНХ, 10, 1233 (1965).—
4. Е.А.Никит и и а, Сборник статей по общей
химии, Изд. АН СССР, № 1, 1953, стр. 48. —
5. R. Н. V а 1 1 а п с е, J. Chem. Soc., 1931,
1427.— 6. A. Rosenheim, A. Wolff,
Z. anorg. Chem., 193, 47 (1930). — 7. В. И. С п и-
цын, ЖОХ, 17, 15 (1947). — 8. J. Lefort,
Ann. chim. phys. (5), 15, 325 (1878). — 9. Спра-
вочник по растворимости солевых систем, т. 4,
1963. — 10. В. И. Спицын, Н. И. Сидо-
ров, И. И. Тихомиров, ЖОХ, 8, 1549
(1938).
Ориентировочные значения
растворимости вольфрамсодержащих
соединений
Соединение C, % Соединение C, %
Ag2WO4 * 3 • IO"3 Ce2(WO4)i * 1•10-3
CaWO4 1•IO"3 Pr2(WO4)j * 2•10-3
SrWO4 ** 3 • IO"3 Nd2(WO4)| * 2 • 10-3
BaWO4 2•IO"3 Sm2(WO4)i* 3 • 10-3
La2(WO4)I* 1 • IO"3 PbWO4 2 • IO"3
* По данным С. D. Hodgman [Handbook
of Chemistry and Physics, 54 ed., 1961, p. 6511
растворимость AgsWO4 составляет 0,05%.
“По данным J. Lefort [Ann. chim. phys. (5),
15, 326 (1878)] растворимость SrWO. составляет
~0,14%.
s* Растворимость прокаленной соли. Раствори-
мость непрокаленной соли по данным R. Vickery
[J. Chem. Soc., 1949, 2501] значительно выше.
ВАНАДИЙСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
МЕТАВАНАДАТЫ
NaVO3
Рис. 582 построен по данным [1]. Пере-
ходная точка: 36°, (20%). Данные [2]
не использованы.
nh4vo3
Рис. 583 построен по данным [3—7]*
Данные [4], согласно справочнику [8],
ошибочно увеличены в 10 раз.
Метаванадаты К, 'Be, Cd
Твердая фаза t, °C c, % Источ- ники
KVOo 25 9,7 9
Be(VO3)2-4H2O 25 0,10 10
Cd(VOs)2-4H2O 20 0,021 11
Имеются данные по понижению темпера-
туры замерзания растворов KVO3 [12].
ЛИТЕРАТУРА
1. D. J. М с A d а т, С. А. Р i е г 1 е, J. Ат.
Chem. Soc., 34, 6о4 (1912). — 2. В. В. Анд-
реев, ЖПХ, 30, 299 (1957). — 3. J. М е у е г,
Z. Elektrochem. 15, 266 (1909). — 4. М. La-
ch а г t г е, Bull. Soc. chim. France (4), 35, 321
(1924). — 5. В. В. Андреев, ЖОХ, 24, 1730
(1954). — 6. Л. А. К а д у ш к и н а, Ю. П. Ше-
велев, Изв. АН КазССР. Сер. хим. наук, № 2,
11(1969). — 7. В. Г. Б а м б у р о в, А. А. Ива-
кин, Труды Ин-та химии АН СССР. Уральский
филиал, Jfi Ю, 25 (1966). — 8. Seidell, v. 2,
1965, р. 782. — 9. R. Trujillo, E. Ma-
chado, An. Soc. espan. fis. quim., 51, 757 (1955);
Zbl., 129, 3827 (1958). — 10. P. В r i n t о n,
J. Am. Chem. Soc., 38, 2365 (1916).
11. Л. Улицка, Л. Журкова, Chem.
zvesti, 22, 939 (1968). — 12. P. D u 1 1 b e r g,
Z. phys. Chem., 45, 156 (1903).
232
ОРТОВАНАДАТЫ
ДРУГИЕ ВАНАДИЙСОДЕРЖАЩИЕ
СОЕДИНЕНИЯ
Li3VO4
Рис. 584.
Ванадийсодержащие соединения
Na, NH4, La, Lu
Твердая фаза t, °C C, % Источ- ники
Na4V2O7 35 38,8 1
(NH4)2V40n • •zH2O* 16 28 2
(NH^VeOie —100 1,5 г/л b
(NH4)8H8VeO„. •H2O 25 0,015 4
La4(VeOi7)3 • 48H2O 25 0,016 5
Lu4(VeOi7)3- •48H2O 25 0,012 5
* x = 0 4.
Рже. 584 построен по данным [1]. Пере-
ходная точка: —35°, (6,3%).
Na3VO4
Рис. 585 построен по данным [2]. При 0°
состав твердой фазы точно не установлен.
Переходная точка: 51,8°, (31,5%). Данные
[3] не использованы.
ЛИТЕРАТУРА
1. A. Rosenheim, W. R е g 1 i n, Z. anorg.
Chem 120, 114 (1922). — 2. H. Menzel,
G. M ii 1 1 e r, Z. anorg. Chem., 272, 93 (1953). —
3. C. 3. Макаров, А. Г. P e п a, I Изв.
АН СССР. OXH, 1940, 349.
ЛИТЕ РАТУPA
1. В. В. А н д р е е в, ЖПХ, 30, 299 (1957). —
2. М. Lachartre, Bull. Soc. chim. France (4),
35, 321 (1924).— 3. A. D i 11 e, C. r., 102, 918
(1886). — 4. G. Bor, D. Sine ger, Veszprfcrm
Vegyipari Egyet. Kozlemfcn., 2, 183 (1958), cm.
Gmelin, Bd. 48, T. B, 1967, S. 459.—
5. E. A. A p б и т, В. В. С e p e б p e н н и к о в.
ЖНХ, 10, 410 (1965).
Ориентировочные значения
растворимости 1 ванадийсодержащих
соединений
Соединение C, % Соединение c, %
T1VO3 * 2•10-3 LuVO4 3 • 10-3
Y(VO3)3 1 •IO"3 T14V2O7 * 7 • IO"3
La(VO3)3 8-10-3 Y4(VeOi7)3 4 • IO"3
Me(VO3)3 ** 2•10-3 Nd4(VeOi7)3 7 • 10-3
LU( V(J3)3 5•10-3 Sm4(VeOi7)3 6 • 10-3
T13VO4 1 • 10-3 Eu4(VeOi7)3 5•10-3
LaVO4 8 -10-3 Gd4(VeO„)8 2 • IO"3
MeVOf * 2 - 10-3 Dy4(VeOi7)3 4 • 10-3
EuVO4 1 • IO-3 Ho4(VeOi7)3 6 • IO"3
GdVO4 5 - IO-4 Me4(VeOi7)3 4* 9 • IO"3
DyVO4 1 • 10-3
* По данным Ф. Я. Нульбы и В. Е. Миронова
(Химия таллия, Госхимиздат, 1963, стр. 200)
растворимость этих солей значительно выше.
“ Me—Pr, Nd, Sm, Eu, Gd, Dy, Ho.
3* Me—Nd, Sm, Ho.
** Me—Ce, Pr, Er.
233
НИОБИЙСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
МЕТАНИОБАТЫ
TlNbO3
LiNbOg, NaNbOg, KNbO3, RbNbO3,
CsNbO3
Растворимость TlNbO3 при 25° соста-
•вляет 0,01% [3].
ДРУГИЕ НИОБИЙСОДЕРЖАЩИЕ
СОЕДИНЕНИЯ
Na3NbO4
Растворимость Na3NbO4 при 20 и 100°
составляет соответственно 3,06 и 11,9 г!л
[4].
Гексан ио б а ты Na и К
Твердая фаза t, °C с, % Источ- ники
Na14Nbi,037-ЗЗЕЦО 20 0,99 5
K8NbeO19-16H2O 25 56,0 2
K14Nb12O37 - 27H2O 25 55,1 2
ЛИТЕРАТУРА
Рис. 586 и 587 построены по данным [1].
Данные [2] не использованы.
1. А. В. Л а п и ц к и й, Л. Н. Шишкина,
М. А. Пче л к ин а, Б. А. Ст е пан о в, ЖОХ.
25, 1862 (1955). — 2. F. Windmaisser,
Osterr. Chem. Ztg., 45, 201 (1942). — 3. И. H. Б e -
л я е в, Д. С. Лесных, Т. Г. Лупейко,
ЖНХ, 14, 648 (1969). — 4. Pascal, t. 12,
1958, р. 465. — 5. Р. S й е, Ann. chim., 7, 493
(1937).
Ориентировочные значения
растворимости ниобийсодержащих
соединений
Соединение c, % Соединение C, %
LiNbOg 4•10-8 Be7Nbi2O37 2 • 10-»
RbNbOg 3 • 10-3 Mg7Nbi2O37 9•IO-4
CsNbOg 3 • IO"3 Ca7Nbi2O37 5 • IO-4
Be(NbOg)a 1 •IO-4 Sr7Nbi20g7 3 • 10-4
Mg(NbO3)2 6•IO-5 Ba7Nbi2O37 1 • IO"4
Ca(NbOg)2 4 • 10“a Pb7Nbi20g7 2 • IO"4
Sr(NbO3)2 4•IO-5 Tl4NbeO17 <i-io-4
Ba(NbO3)2 8 • IO-5 TleNb4(Jig <1- IO-4
Pb(NbO3)2 2 • IO"4
ТАНТАЛСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
LiTaO3, NaTaO3, КТаО3,
RbTaO3, CsTaOs
Рис. 588 построен по данным [1].
ЛИТЕРАТУРА
1. А. В. Лапицкий. Б. А. Степанов,
М. А. Пчелкина, ЖОХ, 25, 1866 (1955).
Ориентировочные значения
растворимости танталсодержащих
соединений
Соединение С, % Соединение С, %
LiTaO3 3 • 10-з СазТа120з8 9 • IO"3
МеТаО3 * 1 •10-з Sr8Tai2O38 5 • IO"3
Са(ТаО3)2 6•10-5 ВадТахдОзз 3 • IO"3
Sr(TaO3)2 з • ю-& РЬ8Та120з8 5 ♦ 10‘4
Ва(ТаО3)2 2•10-5 Т1вТа4О13 < 1 • ю-4
РЬ(ТаО3)2 1 • IO"5 Tl^TagOi? <1»10-4
* Me—Na, К, Rb, Cs.
УРАНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Na4UOe
Рис. 589 построен по данным [1]. Твердой
фазой в равновесии с раствором является
Na4UO8-9H2O. При температуре выше 40°
происходит частичное изменение' состава
твердой фазы.
ЛИТЕРАТУРА.
1. А. П. Р а т н е р, А. М. Гуревич,
Л. И. Положенская, ЖНХ, 2, 2316 (1957);
Труды Радиевого ин-та АН СССР, 8, 79 (1958).
Ориентировочные значения
растворимости урансодержащих
соединений
Соединение
4-10-3
ЗЛО-3
1-Ю-3
8-IO'»
9-Ю-3
235
ФОРМУЛЬНЫЙ УКАЗАТЕЛЬ
Соединения водорода
HF .
НС1 .
НВг .
HI .
нею
ню,
Н104
Н,02
Стр.
8
. 19
38
49
69
, 82
87
99
Стр.
L1F.......................
L1C1......................
LIBr....................
LH................
LIG1O,
LiClO,
LiBrO,
LIIO,
LiOH
LI2SO4
Li ДО,
LkSeO»
Li»SeO4
LLTeO,
Li N,
NaF . . . •
NaHF, . .
NaCl . . .
NaBr . .
Nal . . .
NaClO . .
N^ClOj . .
NaClO, . .
NaClO, .
NaBrO, .
NaBrOj .
NalO, . .
NalO, . .
Na2H2IO, . .
NaOH . .
Na,Ot . .
Na,S ' . .
NaHS . . .
Na2S2O4 .
Na,SO, .
Na ДО, .
Na,SO, .
NaHSO, .
Na,S,O, .
Na,StO, .
Na,S,O, .
Na,S,O, «
Na,S,O, .
ИаДО, .
Na,ScO, .
NaHSeO,
NaH,(SeO,)t
Na,Se,O,
Na,ScO, .
H,S .
H,SO4
H,SeO,
H2SeO4
HsTeOa
H.TeO,
HNO,
H»PO,
Соединения лития
Стр.
9 LINO, . ,
20 LINO. .
39 Li,HPO, ,
50 Li4P2O, .
61 Li,PO4
70 LiH.PO,
78 Li,(AsO4),
82 Li,As4On
91 Li,CO, . .
105 LiHCO, .
128 L1SCN . ,
129 L1,S1O, .
139 Li4SiO, .
139 LitSiBOu .
141 Li,SiF, . .
Стр.
9
10
20
40
51
58
59
62
70
78
79
82
87
88
92
100
100
102
102
102
104
105
107
123
124
127
129
129
129
129
131
131
132
133
100 Н,РО4...................
105 H4P,O7 .................
129 H»AsO4..................
133 HCN ....................
140 HOCN....................
139 H4Fe(CN),...............
146 H,BO,....................
169 HBF4....................
Стр.
Соединения натрия
Na,TeO, .
Na,TeO4 .
NaN, . .
NaNO, .
NaNO, .
NaH,PO, .
Na,HPO, .
NaH,PO, .
Na,P,O, .
Na»HP,O,
Na,H,P,O,
Na,PO, .
Na,HPO,
NaH,PO,
Na,P,O, .
Na»HP,O,
Na2H2PsO,
NaH,P,O7
NaPO,
Na,P,O, .
Na,P,O,, .
Na,P,OI0 .
Na,P,OIS .
NasAsO4 .
Na,HAsO,
NaH,AsO4
NaSbO, .
Na,H,Sb,O7
Na,CO, .
NaHCO, .
NaCN . .
NaSCN .
Na,Fe(CN),
Na,SiO, .
Стр.
142 Li2GeO, ..................
147 LitSnOs...................
169 LiBO......................
172 Li,B4O .................
177 LiB,O, ...................
177 LiMnO,....................
184 LiReO,....................
185 Li,CrO,...................
186 Li,Cr,O7..................
186 Li,MoO,...................
194 Li,W4OIS..................
200 Li«VO4 ...................
200 LiNbO, . ..............
200 LiTaO, . /..............
201 LijUO*....................
Стр.
. 139
. 140
. 141
. 142
. 148
. 169
. 171
. 169
. 171
. 171
. 172
. 173
. 173
. 173
. 178
. 178
. 178
. 179
. 179
. 179
. 179
. 180
. 180
. 184
. 182
. 182
. 185
. 185
. 186
. 186
. 192
, 194
, 197
. 199
172
177
182
192
193
197
204
215
Стр.
203
204
205
208
211
218
220
220
224
228
231
233
234
235
235
NaHSiO,................
Na,SCO, ...............
Na.SiF,................
Na,GeO,................
Na,SnO.................
NaBO, .................
Na,B,O,................
NaB.O,..........- . . .
NaBO, .................
NaBF,..................
NaBH,
Стр.
200
200
200
203
204
206
208
211
214
216
NaMnO4................
NaReO,................
Na,CrO4.............. .
Na,Cr,O7.................
Na,CrsOI0 ...............
Na,Cr4Oi,................
Na,MoO4..............
Na,Mo,O7 ................
Na,Mo,O10................
NaI0Mo!,O4i..............
Na,Mo4O„*...............
Na,WO4..................
Na,H,(W2O7)6 ..........
NaI0W„O41...............
NaVO,................
Na»VO,.................
Na,V,O7
NaNbO, ................
Na,NbO,................
Nal4NbItO„.............
NaTaO, ................
Na,UO,.................
Na4UO,.................
217
218
219
221
225
227
227
228
229
229
229
229
230
230
231
232
233
233
234
234
234
235
235
235
236
Соединения калия
KF ... .
KHF, . . .
KC1 . . . .
KBr . . .
KI ... .
KIBr, . .
KCIO, . .
KC1O* . .
KBrO3 . .
KIO, . . .
KHt(IOa)a .
KH(IO4)a
KIO . . .
K*I,O, . .
KOH . .
K,S . . .
K2SO3 . .
KHSO, .
KjSjOj . .
K,SO* . .
K2S,Og .
KgS2O, .
KtStO, . .
KgSBO . .
Стр.
10
10
K,SeO, . .
KHSeO* .
KH,(SeOa)t
KgSe,O, .
KgScO* . .
40
51
58
62
71
79
83
84
84
88
88
92
102
103
103
104 ,
107 V
123
124
127
129
129
129
131
131
132
133
133
K,TeO*
KN, . .
KNO, .
KNO, .
KHgPO,
KgHPO,
KHgPO,
K*P,O, .
KaHPgO,
KgHgPgOa
KHgPgO,
K.PO* .
KgHPO*
KHgPO*
K*P,O, .
KHaPgO,
KgHgPgO,
K,HP,OT
KPO, .
K*P*OIt
K,P,OI0
K.AsO*
KgHAsO*
KHgAsO
K*As,OT
K,(AsOa)2
KSbO, .
KgCOg .
KHCO,
KCN . .
KOCN .
Стр.
. 140
. 141
. 143
. 148
. 169
. 171
. 171
. 172
. 172
. 172
. 172
. 175
. 175
. 175
. 178
. 179
. 179
. 179
. 181
. 180
. 180
. 183
. 183
. 183
. 185
. 185
. 185
. 187
. 188
. 193
. 193
KSCN . . .
K*Fe(CN), .
KaFe(CN), .
KgSiO, . . .
KHSiO, . .
K2SitOa . .
KgSiF, . . .
KgSnO, . .
КВО2 . . .
K,B*O7 . .
KB.Og . . .
K.HB50, . .
KBO, . . .
KBF* . . .
KBH* . . .
KMnO* . .
KReO* . .
KgCrOg . .
KgCrgO, . .
KaCrOg . .
K,MoO* . .
KgMogOt, . .
KgMogOi., .
K,H,(WgO7)6
KVO, . . .
KNbOa . . .
K,Nb,0 , . .
Ki*Nb„O37 .
KTaOs . . .
K,UO* . . .
Стр4*
. 19т
• 1*8
• 1*8
. 19°
. 200
. 200
. 200
. 204
. 206
. 209
. 212
. 212
. 215
. 216
. 217
. 219
. 219
. 221
. 225
. 227
. 228
. 229
. 229
. 231
. 232
. 234
. 234
. 234
. 235
. 235
Соединения рубидия
RbF . .
RbHF, .
RbCl . .
RbBr .
Rbl . .
Rbl, .
RblCI, .
RblBr, .
RbICI*
RbICIBr
RbClO,
RbClO
RbBrO,
RblO, .
Стр.
. И
. 12
. 23
. 41
52
58
58
58
58
63
72
80
83
RblO* .
RbOH .
RbgSO* .
RbgSgOg
RbgSeOg
RbN, .
RbNOg
RbNO, .
RbHgPO*
RbHgAsO.
RbgCOa
RbHCOa
RbgSiOg
RbaSiF a
Стр.
. 88
. 92
. 108
. 123
. 139
. 142
. 143
. 148
. 176
. 183
. 188
. 188
, 200
201
RbBOg . .
Rb,B*O7 .
RbBKOg .
RbBF* . .
RbMnO* .
RbReO* .
RbgCrO* .
RbgCrgOj .
RbgMoO* .
RbI0Mot ,O*i
RbgWO* .
RbNbO, .
RbTaO, .
RbgUO* .
Стр.
207
209
213
216
219
220
222
225
229
229
231
234
235
235
CsF . .
CsCl . .
CsBr . .
CsI . .
CsI, .
CslBr, •
CsIClBr
CsClO, .
CsClO* .
CsBrO,
Cel О a .
CsIO* .
Стр.
12
23
41
52
58
58
58
63
72
80
83
88
CsOH .
Cs,SO* .
Cs,SeO*
CsN, . .
CsNO, .
CsNOa .
CsHgPO*
CsHgAsO,
CSgCO, •
CsHCO,
Cs2SiO2 .
Cs,SiF, .
Соединения цезия
Стр.
92
108
139
142
144
149
176
183
188
190
200
201
CsBOt .
CsBgOa .
CsBF* .
CsMnO*
CsReO*
Cs2CrO*
CSjCrjO,
Cs,MoO*
Cs,WO*
CsNbO,
CsTaOa .
Cs2UO* .
Стр.
. 207
. 213
. 216
219
, 220
. 222
, 225
, 229
231
234
235
235
Соединения аммония
NH*F . .
nh*hf2 .
NH*Cl . .
NH*Br . .
NH*I . .
NH*C1O, .
NH*C1O* .
NH*BrO, .
NH*IO, .
NH*IO* .
(NH*),H,IO,
Стр.
12
. 14
. 23
. 41
. 52
. 63
. 72
. 80
. 84
. 88
, 89
NH*OH .
(NH*)gSO,
(NHJgSgO,
(NH*)gSO*
NH*HSO*
(NHg)gSgO,
(NHJgSgO,
(NHJgSgO.
(NHJgSaO,
(NH*),S*O
(NHa)gSeOa
Стр.
. 95
. 103
. 105
. 108
. 109
. 123
. 124
. 128
. 129
. 129
. 132
NH*H,(SeOa)2
(NH*),Se2O6
(NH*)2SeO*
NH*N, . .
NH*NO2 . .
NH*NO3 . .
NH*H2PO2 .
(NH*)2HPO3
nh*h2po3 .
(NH*)*P,O,
(NH*)2H,P2O.
Стр.
, 132
. 133
. 133
. 142
. 444
. 150
. 169
. 171
. 171
. 172
. 172
237
Стр.
(NH4),PO4
(NH4)4HPO4
nh4h,po4
(NH4)sHP4O:
(NH4)4P4O1s
nh4h,aso4
(NH4),C0,
NH4HC0, ,
nh4scn .
177
176
176
179
180
183
191
191
196
(NH4)4Fe(CN),
(NH4),S1F.
(NH4)8B4O.
nh4b6o,
NH4B0s .
nh4bf4 . . .
NH4MnO4 . .
NH4ReO4 . . .
(NH4),CrO4 . .
Стр.
198
200
209
213
215
216
219
220
222
(NH.J.Cr.Or .
(NH4)8MoO4 .
(NH4),Mo,O!! .
(NH4)10WltO41
NH4VOs . .
(NH4),V40n .
(NH4)1v.o1. .
Стр-
. 226
. 229
. 229
. 231
. 232
. 233
. 233
. 233
Соединения меди
CuF.
CuCl
CuClj
CuBr
CuBr,
Cu]
Cui, . .
CutClO,).
Cu(C104).
Стр.
15
24
23
41
58
42
53
58
53
63
72
Cu(IO,),
Cu,0 . .
Cu(OH),
Cu,S . .
CuS . .
CuS04 .
CuSjO4 .
CuSeOa .
CuSeO4 .
Cu(Ng), .
Cu(NOs)2
Стр.
84
100
100
129
129
109
128
139
135
169
150
CuHPO, .
Cu,(P04), .
Cu.fPO,), .
Cua(AsO4),
CuCN . .
CuSCN . .
Cu.Fe(CN)e
CuSiF, . .
Cu(BF4), .
CuCrO* . .
CuMgO4 .
Стр.
. 181
, 177
. 181
185
, 198
198
198
201
. 216
, 222
229
Соединения серебра
Стр.
AgF.......................14
AgCl .....................24
58
AgBr......................42
58
Agl.......................53
58
AgClO,....................59
AgClO, ...................63
AgClO*....................72
AgBrO,....................80
AglO,.....................84
89
Ag,H,IO4 .................89
Ag,IO6 ...................89
Ag,0 .
Ag,O, .
Ag,S . .
Ag,SO3
Ag,SO4 .
Ag,S,O4
Ag,SeO*
AgNO,
AgNOs
AgsPO4
AgsPsO,
Ag,AsO3
AgaAsO*
Стр.
. 89
100
. 100
. 129
. 129
. 109
. 128
. 139
. 144
. 150
. 181
. 180
. 185
. 185
Ag,COs . .
AgCN . .
AgOCN .
AgSCN . .
Ag4Fe(CN)<
Ag,Fe(CN)(
AgBOt . .
Стр .
AgMnO*................
AgReO*................
Ag,CrO4...............
Ag,Cr,O,...............
Ag,MoO4................
Ag,W04.................
198
198
198
198
198
198
207
219
220
222
227
227
230
232
Соединения золота
Стр.
АиС1я.......................24
Au(OH),
Стр.
100
Стр.
BeF, ........................15
BeCl,........................24
Be(C104),................... 73
Be(IO.,),....................84
Be(ICM,......................88
Соединения бериллия
Стр.
Ве»(1Ов)» 89
Ве(ОН),..................100
BeSO4....................ill
Be(NO,),.................151
BeCO.i .
Be(VO,),
Be(NbOs).
BeTNb11OJ
Стр.
191
232
234
234
Соединения магния
MgF, . . .
MgCl, . .
MgBr, . .
Mgfiio,),'
Mg(ClO4),
Mg(BrOg),
Mgfio,), .
MgiOH),
MgSO. . .
MgSO4 . .
MgS,O, . .
MgS,O. . .
Стр.
. 58
. 25
. 42
. 53
64
. 73
. 80
. 84
100
. 104
. Ill
. 124
. 128
Стр.
MgSeO*.................135
Mg,TeO» ..............140
Mg(NOt),............. .144
Mg(NOa),...............152
Mg(H,PO,),.............171
Mg,P,0.................181
MgH,P,O.................172
Mg,(P04),..............177
MgHPO4.................177
Mg(H,PO4),.............177
Mg,(AsO4),.............184
MgAB4Ott...............185
MgCOs..................198
Соединения кальция
Стр.
Mg(HCO,)2.............191
MgSiF.................201
Mg,GeO4...............203
Mg,B,Ou...............214
MgB»O10............. 214
MgCrO*................223
MgCr,Oj...............226
MgMoO*................228
MgMo.Oto...............229
MgW,O,...........; ... 231
Mg(NbO.),..............234
Mg,NblsO8T.............234
CaF, .
CaCl, .
CaBr, .
Cal, . .
Ca(ClO),
Ca(ClOi),
Ca(ClOg),
Стр.
. 58
. 26
. 43
. 54
. 58
. 59
. 65
Са(СЮ4),
Са(ВгО4),
СаПО»),
CafOH),
CaS . .
CaSO, .
CaSO4 .
Стр.
73
81
65
97
102
129
CaS,O».............. .
CaS,Oe • . .............
CaSeO4..................
Ca,TeO4 ................
CaH4TeO4................
...................
...................
Ca(Ng)
Ca(NO
Стр.
126
128
135
146
140
141
144
113
238
Ca NO.). .
Ca(H,PO,),
Са(Н.РОя).
CaHgPgOg
CaHPO4 .
Ca4P4OIg .
Ca.As.O. .
Ca(AsO,). .
Ca.(AeO4)B
CaHAeO4 .
Ca.As.O. .
CaCO. . .
Стр.
. 152
. 169
, 171
172
177
, 180
. 181
, 182
184
183
185
198
Ca(HCOg).
Ca(SCN). .
Ca,Fe(CN).
CaSl'O3 .
CaSi.O. .
Ca.Si.Og
Ca4Si.O14 .
Са.8й0Ог,
CaSiF» . .
CaB,O4 . .
CaBgOtg .
CagBgOt i .
Стр.
. 191
. 196
, 197
200
200
, 200
, 200
200
202
207
214
214
Ca(BF4),
СаСМаО.),
СаСгО4 . .
СаСг.О»
СаМоО* .
CaWO4 . .
CaW.O, .
Ca(NbO.)g
Ca?Nbi.0.7
Ca(TaOg).
Ca.Tat.Ogt
Стр.
. 217
. 219
. 223
. 227
. 229
230
. 232
. 231
. 234
. 234
. 235
. 235
SrF. . .
SrCij . .
SrBr. .
Sri. . .
Sr(ClO,)g
Sr(C10g),
Sr(C104),
Sr(BrO ).
Sr(IOg).
Sr(OH),
SrSO4
S1S.O,
Стр.
. 15
. 27
. 43
. 54
. 59
. 6&
. 73
. 81
. 85
. 97
. 101
. 129 :
. ИЗ
, 126
Соединения стронция
Стр.
128
129
135
140
140
142
145
152
171
180'
181
182
184
184
SrS.O. . .
SrS4O, . .
SrSeO4 . .
SrsTeOg .
SrH.TeO. .
:
Sr(NOg). .
Sr(H.POg).
Sr.P.Oi. .
Sr.As.O. .
Sr(AsOg). .
Sr,(AsO4),
SrgH.(AsO4)
SrCO. . .
SrSiF, . .
SrB.O4 . .
Sr(BF4). .
Sr(MnO4).
FrCrO4 .
SrMoO4 . ,
SrWO4 .
SrW,O7. . .
Sr(NbO.). .
Sr.Nbi.O.,
Sr(TaOg). .
Sr.Tai.O..
Стр.
. 198
, 202
208
217
219
223
230
232
231
234
234
. 235
. 235
BaF. .
BaCl. .
ВаВг. .
Bal, .
Ba(ClOt).
Ba(ClOg).
Ba(ClO4).
Ba(BrOg).
Ba(IO»)g
Ba(OH).
BaO,. .
BaS . .
Ba(SH).
,BaSO. .
Ba3O4 .
BaS.O. .
BaS.Og .
BaS.O. .
BaS4O, .
BaSeO. .
Стр.
. 15
. 27
. 43
. 54.
. 60
. 66
. 73
. 81
. 85
. 97
100
101
101
129
129
124
127
128
129
. 139
Соединения бария
Стр.
139
139
140
142
145
152
169
171
171
172
180
180
181
182
185
185
184
184
198
193
BaSeO4 . .
Ba.TeOg .
BaH4TeO.
Ba(Ng). .
Ba(NO.). .
Ba(NO8),
Ba(H.PO.).
BaHPO. .
Ba(H.PO.)g
BaH.P.O.
Ba.P4Olg .
Ba.(PO4).
В a. As. О.
Ba(AsO.).
Ba.As.On
Ba.As.0. .
Ba.(AsO4).
BaHAsO* .
BaCO. • •
Ba(CN), .
Ba(OCN),
Ba(SCN),
Ba,Fe(CN)e
BaSiO. . .
BaSi.O. .
BaSIF, .
ВаСгбОд •
BaB.O4 .
BaB.Oto .
Ba(BF4). .
Ba(ReO4).
BaurO4 . .
BaMoO4 .
BaWO* . .
Ba7Nbi.6g;
Ba(TaOe)t
BagTai,Ogg
Стр.
. 194
. 196
. 198
. 200
. 200
. 202
. 203
. 208
. 214
. 217
. 220
. 227
. 230
. 232
. 231
. 234
. 234
. 235
. 235
RaCl,
RaBr.
Стр.
. 28
. 44
Ra(IO.)g
RaS04 .
Соединения радия
Стр.
85
129
Ra(NOg),
Стр.
, 156
Стр.
ZnF.........................16
ZnCl.............._. . . . 28
ZnBr........................44
Znl, .......................54
Zn(ClO.). ..................60
Zn(ClOg). ..................66
Zn(ClO4)....................74
Zn(BrOg). ........ 81
Zn(IOg).....................85
Zn(OH), ...................100
Соединения цинка
Стр.
ZnS....................129
ZnSO...................104
znso4..................114
ZnSeO. . ..............137
Zn(NO»). ..............156
Zn(PO»), ..............180
Zn.P.O . 180
zn^po.)................180
ZnCO...................198
Zn(CN),................198
Стр.
Zn(SCN). ...............196
Zn.Fe(CN)e .............198
ZnJFe(CN)g], ...........198
ZnSIF»..................201
ZnB.O4..................218
Zn(BF4),................217
ZHMoO4..................229
ZnWO4...................231
ZnW.O ..................231
CdF, . .
CdCl. . .
CdBr, . .
Cdl. . .
Cd(C10B)f .
Cd(C10,), .
Cd GlOJ, .
Cd(BrO.)g .
Cd(IOr). .
Стр.,
. 16
. 28
. 44
. 55
. 60
. 67
. 74
. 81
. 85
Соединения кадмия
Стр.
100
129
114
137
145
156
181
180
193
8ГН)1.
CdSO4 .
CdSeO4 .
Cd(NO.).
Cd(NO»).
Cd.P.O?
Cd(POg).
Cd(CN).
Cd(OCN). .
Cd(SCN). . .
Cd.Fe(CN). .
Cd.LFe(CN)g]:
CdB.O4 . .
CdWO4 . . .
CdW.O, . .
Cd(vO8), . .
Стр.
. 194
. 198
. 198
. 198
. 208
. 231
. 231
. 232
239
Соединения ртути
HgCl .
HgCh .
HgBr . .
HgBr, .
Hgl . .
Hgi, .
Hg(ClO,)2
Hg(ClO,),
Hgdio4
Hg(ClO4)2
Hg(BrOs),
Стр.
58
30
58
45
58
55
58
60
, 67
74
74
81
HglO, .
HgO . .
HgOH .
Hg(OH)2
Hg2S . .
HgS . .
Hg2soa .
Hg2SO4 .
Hg2S2O,
Hg2(N,)2
Hg2(POs)2
Стр.
89
100
100
. 99
129
129
129
129
129
142
181
Hg2CO2 . . .
HgCN ....
Hg(CN), . . .
Hg(OCN), . .
HgSCN ....
Hg(SCN), . . .
(Hg,),Fe(CN), .
(Hg2)s[Fe(CN)e]2
HgWsO10 . . .
Hg4W,Olt . .
HgaW,Ols . .
Стр.
198
198
198
194
198
196
198
198
231
231
231
Соединения алюминия
Стр.
Стр.
A1F. . ; ....................
A) Cl. ......................
A](C1OS)3....................
16 A1(C1O4),...................
31 Al2Oa ........................
67
77
89
100
A1,(SO4),
A1(NOS)S
Стр.
..................115
..................158
Соединения галлия
Стр.
GaF,........................17 Ga2(SeO4),
Ga(OH),...................100
Стр. Стр.
139 Ga4[Fe(CN),]3...............198
Соединения индия
Стр.
Стр.
Стр.
InF.........................
InCis.......................
InBr,.....................
17 Ini, ..........................
31 InflOg),.......................
45 In(OH),........................
56 In,(S04),....................119
86 In4[Fe(CN)»]3...........'. . 198
100
Соединения таллия
Стр. Стр.
Стр.
T1F.....................
Т1С1....................
TIBr ...................
TH......................
TH,
T1,I.
T1C1O....................
T1C1O4...................
TIBrO
T1IO-,
T1OH
Tl(OH)....................
T1,S......................
16
31
33
46
56
58
58
58
67
76
82
86
99
100
102
T1,SO3 .
T1,SO4 .
T1,S2O3 .
T1,S,O, .
Tl,SeO4
TIN, . .
TINO, .
TINO, .
T1H2PO2
T1,HPO,
T1,PO4 .
T14P,O7
T1PO, .
T1,COS .
T1CN .
104 T1OCN......................
116 T1SCN......................
127 Tl4Fe(CN),.................
128 T1,B4O,..................
137 TIReO*.....................
142 Tl,CrO4....................
146 T1VO,......................
158 T1,VO4.....................
169 T14V,O,..................
171 TINbO,.....................
177 Tl4Nb.O„...................
179 Tl,Nb4OJS..................
180 Tl,Ta4O19..................
192 Tl4Ta,OI7..................
193
193
196
198
210
220
227
233
233
233
234
234
234
235
235
8
Соединения скандия
Стр.
ScCl, ......................33
Sc(OH)s....................100
Стр.
Стр.
Sc,(SO4),....................119
Sc(NO,)3.....................158
Sc(OH)(NOs),..............158
Sc4(SCN)10(OH)2 ........196
Соединения иттрия
YF, . .
YC1, .
YBr, . .
Y(BrO,),
Y(IO,), .
Стр.
58
32
46
81
86
Y(OH), .
Y,(S04),
Y(NO,)S
ypo4 .
Y4(P,O7),
Стр.
100
116
159
181
181
YAsOg . . .
Y,(CO,)3 . .
Y(BO,)S . .
Y(VOS)S . .
Y4(V,0 7)s .
Стр.
181
198
218
233
233
Соединения лантана
Стр.
Стр.
Стр .
LaClg .
La(BrOg)s
La(IO,),
La(OH),
La(SO*)s
La,(SeOg),
La,(SeO4),
32 La(NO,)s.....................
81 La4(P,O7), ........
86 LaAsOg.......................
100 LaAsO*......................
116 Las(COa)g...................
132 La(BO,)3....................
137
159 La,(CrO4)s.................224
181 La,(Mo04),................ 230
181 La,(WO4),..................232
184 La(VO,)s...................233
198 I<aVO4.....................233
208 La4(V.O17)3................233
240
Соединения церия
3
3
Стр.
Стр.
Стр.
58 Cet(SO*)3...................116
32 Ce(NO,)a....................160
76 СеР2О,......................181
86 Се4(Р2О7),..................181
100 CeAsO,......................181
Соединения празеодима
Стр.
32 Pr(NOs)3
81 Pr4(P2O7)3
86 PrAsO,
100 PrAsO4
116 Prt(COa)s
137 Pr(BOt)3
Се/СО»)....................198
Ce*[Fe(CN)e]3..............198
Ce(BOi),...................208
Ce2(WO4),.................. 232
Ce4(V4O17)a................233
Стр. Стр.
. 161 Рг2(СгО4)а..................224
. 181 Pr2(MoO4)a..................230
, 181 Pr2(WO4)3...................232
. 184 Pr(VO,)a....................233
. 198 Pr4(V»OI7)a ................233
. 208
Соединения неодима
Стр. Стр.
Стр*
58
32
81
86
100
118
132
Nd2(SeO4),
Nd(NOa)s •
Nd(H2PO2)
Nd4(P2O,)a
NdAsOa .
3
NdAsO4...................
Nd2(COa), ...............
137
162
169
181
181
184
198
Nd(BO2)a .
Nd2(CrO4)a
Nd2(MoO4)a
Nd,(WO4),
Nd(VOs),
NdVO4 . .
Nd4(V«O17),
208
224
230
232
233
233
233
Соединения прометия
Стр.
.............165
Соединения самария
Стр.
Стр.
Стр.
3
32 Sm(NOa),...................
81 Sm (P2O7)S.................
86 SmAsOa.....................
100 SmAsO4....................
119 Sm2(COs),.................
137 Sm(BO.),..................
163 Sm2(CrO4),...............224
181 Sm,(WO4),................232
181 Sm(VOa), ................233
184 SmVO4....................233
198 Sm4(VBO1,),..............233
208
Соединения европия
Стр.
Стр.
Стр.
58 Eu2(SO4),
86 Eu(NOa),
100 Eu2(COa)a
129
119
165
198
Eu(VO,), .
EuVO4 . .
Eu4(V »Oi7)a
233
233
233
Соединения гадолиния
Стр.
Стр.
..................81
..................86
.................100
..................118
.................165
Gd4(P2O7),...............
GdAsOa...................
GdAsO4...................
Gd2(COa),................
181
181
184
198
Gd(BO2), .
Gd(VOs), .
GdV04 . .
Gd4(V«OI7)3
Стр.
208
233
233
233
Соединения тербия
Стр.
..................81.Tb2(SO4),
.................86
Стр.
. 119
Tb(NOa),
Стр.
165
Соединения диспрозия
Стр.
Стр.
Стр.
86
119
165
181
DyAsO3....................
Dyt(CO3)a.................
Dy(BO2)a..................
Dy2(CrO4)a................
181 Dy(VO,)a...................233
198 DyVO*......................233
208 Dy4(VeOI7)a................233
224
Соединения гольмия
Стр.
. 86
. 119
. 198
Но(ВО2)а
Ho(VOa),
Стр.
. 208
. 233
HoVO4 . .
Ho4(V,O„),
Стр.
. 233
. 233
указ 976
241
Соединения эрбия
ErF. . .
Er(IOs)3
Ег(ОН)а
Er(S04),
Стр.
58
86
100
119
ЕгРО4 .
Er4(P.Oj)3
ErAsOj .
Стр.
. 181
. 181
. 181
Erg(COg)g .
Er(BOg)3 .
Er4(VgOu)3
Стр.
. 198
. 208
. 233
Tm(IO,).,
Стр.
86
Tm(OH)a
Соединения тулия
Стр.
100
Tm3(SO4)g
Стр.
. 119
Yb(IO,)g
Yb(OH).
Yb2(SO4l
Стр.
86
100
118
Соединения иттербия
Стр.
181
181
184
Yb4(PjO7);
YbAsOj
YbAsO*
Yb»(COs)s
Yb(BOg)g .
Стр.
, 198
. 208
Lu(OH). .
Lug(SO4)g
Lu4(PgOj)3
Стр.
. 100
. 119
. 181
Соединения лютеция
Стр.
181
198
233
LuAsOs
Lug(CO3)3
Lu(V03)3
LuV04 . .
LiUtViOu),
Стр.
. 233
. 233
ThF4- .
ThCh •
ThBr4 .
Th(IOs)4
Стр.
. 58
. 33
. 47
86
Th(OH)4
Th(SO4)g
Th(NO3)4
Соединения тория
Стр.
100
118
164
ThPgO, .
ThOCOg
Th(CrO4)g
Стр.
. 181
. 198
. 224
РаО(ОН),
Стр.
. 100
Соединения протактиния
UF4 . .
UOgFg .
UOgCl, .
UOg(CIO4),
UOg(IO,)g
ugog . .
Стр.
. 58
. 17
. 33
. 77 '
. 86
. 100
Соединения урана
Стр.
100
100
104
118
119
164
UO4-2H8O
w.
U<so.), .
U0gS04 .
UOg(N&g)g
(UO,). (РО4),
UO2HPO4 .
uogcog . .
(UOg)gFe(CN),
UOgCrO4 . .
Стр.
. 181
. 181
. 198
. 198
. 224
PuF4 .
PuOgFg
Стр.
, 58
17
Соединения плутония
Стр.
33
PuOjCl
PuO2HPO<
Стр.
. 181
SnFg .
SnClg
SnBrg
Стр.
18
34
. 47
SnBr4 .
Snl. . .
Sn(OH)1
Соединения олова
Стр.
46
56
100
SnS
SnSg
SnSO,
Стр.
. 129
. 129
. 120
PbF. . .
PbCl . .
PbClg . .
PbBr . .
PbBrg .
.РЫ . . •
Pbh •
Pb(C10g)g
Pb(C10.)±
Pb(C104)g
Pb(BrO,)g
Pb(IO3)«
Стр.
18
34
33
47
47
56
57
60
68
78
82
89
РЬО . .
РЬ(ОН)2
РЬ(ОН)4
PbS . .
PbSO4 .
PbSiOs .
PbSeOs .
?ж>.
Pbs(PO4)t
PbHAsO*
PbCO. .
Соединения свинца
Стр.
100
100
100
129
129
127
132
142
166
181
185
198
Pb(SCN)g
Pb«Fe(CN),
PbSIF, .
PbB4O, .
PbCrO4 .
PbMoO4 .
PbWO4 .
Pb(NbO3)g
Pb yNbitOg?
Pb(TaOe)8
РЬяТйцОза
Стр.
. 196
. 198
. 202
. 210
. 227
. 230
. 232
. 234
. 234
. 235
. 235
TiOSO,
Стр.
. 120
Соединения титана
ZrP4 .
ZrOGl»
Стр.
. 18
. 33
Соединения циркония
Стр.
100
120
Zr(OH)4
Zr(SO4)g
ZrO(NQs)t
Стр _
. 166
242
Соединения гафния
Стр.
HfOCl, ...................34
Стр.
Ав, О, ......................89
As, О».......................90
Стр.
SbF........................18
. SbClj.....................33
Стр.
HfO,...................100
Соединения мышьяка
Стр.
AstS,..................129
Соединения сурьмы
Стр.
Sb,Os.....................100
Sb,O4.....................100
Стр.
HfO(NOs),...................166
Стр.
AstS5 ......................129
Стр.
SbiS3.......................129
Sb»S,.......................129
Соединения висмута
BiOClO,
В1,О» .
В1(ОН),
Стр.
.• 78
. 100
. 100
ВЮ(ОН)
Bi,Sa . .
Стр.
. 100
. 129
Bi,(SO*)s
Bi4[Fe(CN),]a
Стр.
129
198
VO(C1O<),
v.o, . .
Стр.
. 78
. 90
Соединения ванадия
Стр.
181
А,(НРО»),
VH(HPO,)t
Стр.
171
Nh.O,
Стр.
. 90
Соединения
ниобия
Та,О
Стр.
. 90
Соединения
тант ала
Ро(ОН)4
Стр.
, 100
Соединения
полония
CrF, . .
СгС1, .
Сг(СЮ4),
Стр.
18
34
78
CrO, .
Сг(ОН),
CrSO4
Соединения хрома
Стр.
90
100
120
Cr,(SO*)»
Cr(NO»)t
CrAsO, .
Стр.
120
166
1.85
Стр.
Соединения молибдена
МоО,..................90
Стр.
МоО(ОН)»...............99
Стр.
Соединения марганца
MnF,.....................18
MnCli....................34
Мп В г,..................47
MnI,.....................57
Мп(С1О4)»................77
. Стр.
МП(1О,)Ж................86
МП(ОН),................100
МПВ....................129
MnSO<..................120
MnSeO4.................139
Стр.
Mn(NO»), ...............166
Mn(HtPOt),........' . . .169
Mn.FefCN), .............198
MnSiF...................202
Стр.
FeF,.........................18
FeCl,........................35
FeCla........................35
FeBr»........................47
FeBr»........................48
Fe(ClO<)t....................77
Fe(C104)»....................77
Стр.
CoF,........................18
CoCi,.......................35
CoBr,................... . 48
Col*........................57
Со(С1О,), 68
Co(ClO4)i...................77
Co(BrOj)....................82
Co(IOa)t....................87
Соединения железа
Стр.
Fe(IO»),...................86
Fe(OH)....................100
Fe(OH),...................100
FeS.......................129
Fe,S, ....................129
FeS04.....................121
Fe(NOa),..................166
Fe(NO.)a...................
FeaCPgOj),.................
1?оПГ»
Fe4Fe(CN)e]'s ' .' ' .' .’ .' .'
FeSiF*.....................
FeMoO4 . ..................
Стр.
168
179
198
198
203
230
Соединения кобальта
Co(OH),
CoS )a
CoSO4
CoSeO4
Co(NOt)t
Co(NOt),
CoHPOa
Стр.
100
100
129
121
138
146
166
171
Стр.
Co(POa)...................180
C0a(PO4)> ................177
COfPfO,....................181
Co(CN).....................
Co(SCN)..................196
CotFe(CN), ...............198
CoSiF» ..................203
16*
243
Соединения никеля
N1F» .....................
NiCli.....................
NiBr......................
Nilt .....................
Nl(C10s)t ................
NiO.......................
Ni(OH)»...................
Стр.
18
35
49
57
68
100
100
NiS.....................
Стр.
NiSO*...................
NlSeO* .................
NiHPOs .
Nis(AsO4)
Ni(CN),
Ni(SCN)»
129
123
138
171
184
198
196
NiiFe(CN),
Ni(C104)2 .
Ni(TOs)2 .
Ni(NOs),
Ni(HtPOt)2
Ni(BF*)2 .
Стр.
198
78
87
168
169
217
Соединения рутения
RuO±
Стр. Стр.
99 RuO4.......................91
Соединения осмия
Стр.
OsO*....................91
Соединения иридия
Стр.
TrOj....................99
Соединения платины
Стр. Стр.
PtCi4....................35 PtBr4....................49
СОДЕРЖАНИЕ
Введение ........................ 3
Галогениды ...................... 8
Фториды. Хлориды. Бромиды.
Йодиды. Полигалогениды
Кислородсодержащие соединения га-
логенов .......................58
Гипохлориты. Хлориты. Хлораты.
Перхлораты. Бромит и броматы.
Иодаты. Метапериодаты. Другие
кислородсодержащие соедине-
ния иода
Окислы, гидроокиси, перекиси . . 89
Серусодержащие соединения . . . ЮО
Сульфиды. Гипосульфиты. Суль-
фиты. Пиросульфиты. Сульфа-
ты. Персульфаты. Тиосульфаты.
Дитионаты. Политионаты
Селенсодержащие соединения . . . 129
Селениты. Пироселениты. Селе-
наты
Теллурсодержащие соединения . . 139
Теллуриты.'Теллураты
Азотсодержащие соединения . . . 141
Азиды. Нитриты. Нитраты
Фосфорсодержащие соединения . . 169
Гипофосфиты. Фосфиты. Гипофос-
фиты. Ортофосфаты. Пирофос-
фаты. Метафосфаты. Полифосфа-
ты.
Мышьяксодержащие соединения . 181
Ортоарсениты. Пироарсениты. Ме-
таарсениты. Арсенаты. Другие
мышьяксодержащие соединения
Сурьмусодержащие соединения . 185
Углеродсодержащие соединения . . 186
Карбонаты. Цианиды. Цианаты.
Роданиды. Ферроцианиды. Фер-
рицианиды
Кремнийсодержащие соединения . . 199
Метасиликаты. Другие силикаты.
Фторсиликаты
Германийсодержащие соединения . 203
Оловосодержащие соединения . . . 204
Борсодержащие соединения .... 204
Метабораты. Тетрабораты. Пента-
бораты. Гексабораты. Пербора-
ты. Фторбораты. Боргидриды
Марганецсодержащие соединения . 218
Ренийсодержащие соединения . . . 219
Хромсодержащие соединения . . . 220
Хроматы. Бихроматы. Другие
хромсодержащие соединения
Молибденсодержащие соединения . 228
Вольфрамсодержащие соединения . 230
Ванадийсодержащие соединения . . 232
Метаванадаты. Ортованадаты.
Другие ванадийсодержащие со-
единения
Ниобийсодержащие соединения . . 234
Метаниобаты. Другие ниобийсодер-
жащие соединения
Танталсодержащие соединения . . 235
Урансодержащие соединения . . . 235
Формульный указатель ..........236
Виргинцев Алексей Николаевич
Трушникова Людмила Николаевна
Лаврентьева Валентина Геннадьевна
РАСТВОРИМОСТЬ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
В ВОДЕ
с. 248
Издательство «Химия», Ленинградское отделение
Невский пр., 28
Редакторы издательства: С. Л. Томарченко,
В. А. К оц
Техн, редактор 3. Е. Маркова
Переплет художника Ю. Н. Васильева
Корректору: Л. А. Любо вин, М. 3. Басина
Сдано в набор 23/XI 1971 г. Подписано к печати 26/1 1972 г.
Бумага тиногр. № 2, 70X 100‘/ie. Уч.-изд. л. 19,44.
Усл. печ. л. 20»15. М-12318. Тираж 9000 экз. Цена 1 р. 37 к.
Заказ 976.
Ленинградская типография № 6 Главполиграфпрома
Комитета по печати при Совете Министров СССР
Московский пр., 91
ИЗДАТЕЛЬСТВО «ХИМИЯ»
Готовится к выпуску
Справочник по растворимости солевых систем. Всесоюзный научно-
исследовательский институт галургии (ВНИИГ). Изд. 2-е, пер. и доп.
Второе издание оригинального отечественного справочника
содержит большой экспериментальный материал, накопившийся
в мировой литературе со времени его первого издания (1953 г.).
В справочнике приводятся экспериментальные данные по рас-
творимости многокомпонентных водно-солевых систем. Имеются
краткие характеристики методики исследования и ссылки на лите-
ратурные источники.
Справочник предназначен для работников научно-исследова-
тельских институтов и лабораторий вузов и техникумов, заводских
лабораторий, а также для инженеров-проектировщиков химической
и смежных с ней отраслей промышленности.
Т. I, 1973, 82 л., 4000 экз., 4 р. 55 к. в пер. f
В первом томе представлены данные по растворимости трех-
компонентных систем, описаны методы построения диаграмм и спо-
собы расчета концентраций и плотностей.
Т. П, 1973, 70 л., 4000 экз., 3 р. 91 к. в пер.
Во втором томе представлены данные по растворимости четырех-
компонентных и более сложных систем. Приводится физико-хими-
ческая характеристика минералов.
* * *
Справочник по расплавленным солям. Перевод с англ.
В справочнике даются физико-химические характеристики рас-
плавленных солей. Все данные представлены в виде таблиц и урав-
нений, выражающих температурную зависимость электропровод-
ности, плотности и вязкости индивидуальных солей.
Справочник предназначен для научных и инженерно-техниче-
ских работников, применяющих или исследующих расплавленные
соли.
Имеется в продаже
Т. I, 1971, стр. 168, 79 коп.
Книга представляет собой дополненный перевод I тома
справочника, изданного в 1968 г. Национальным бюро стандартов
США, и содержит сведения по электропроводности, плотности и вяз-
кости расплавленных солей.
Готовится к выпуску
Т. II, 1972, 12 л., 1 р. 06 к.
Книга представляет собой дополненный перевод II тома
справочника, изданного в 1969 г. Национальным бюро стандартов
США, и содержит сведения о термодинамических свойствах и по-
верхностном натяжении расплавленных солей.
ИЗДАТЕЛЬСТВО «ХИМИЯ»
Имеется в продаже
Б. Г. Коршунов, В. В. Сафонов, Д. В. Дробот. Диаграммы плав-
кости хлоридных систем. Справочник. 1972, стр. 384, 1 р. 68 к.
Справочник представляет собой систематизированную сводку
опубликованных в мировой литературе работ по плавкости двой-
ных, тройных и многокомпонентных систем из безводных хлоридов
и оксихлоридов элементов, содержащих и не содержащих свободный
металл или хлор.
Для двойных систем приведены таблицы ликвидуса, солидуса
и превращений в твердом состоянии или таблицы точек нонвариант-
ных равновесий. Для наиболее сложных двойных систем даны диа-
граммы плавкости. Для тройных и многокомпонентных систем
приведены таблицы точек нонвариантных равновесий, данные по
сингулярным сечениям и диаграммы проекций поверхностей (объ-
емов) ликвидуса.
Справочник предназначен для научных и инженерно-техниче-
ских работников химической промышленности, металлургии цвет-
ных и редких металлов, а также для преподавателей и студентов
вузов.
Справочник химика. Изд. 2-е, пер. и доп.
Т. I. Общие сведения. Строение вещества. Свойства важнейших
веществ. Лабораторная техника, 1072 стр., цена 4 р. 74 к.
Т. II. Основные свойства неорганических и органических соедине-
ний, 1168 стр., цена 4 р. 95 к.
Т. III. Химическое равновесие и кинетика. Свойства растворов.
Электродные процессы, 1006 стр., цена 4 р. 80 к.
Т. IV. Аналитическая химия. Спектральный анализ. Показатели
преломления, 920 стр., цена 4 р. 33 к.
Т. V. Сырье и продукты промышленности неорганических веществ.
Процессы и аппараты. Коррозия. Гальванотехника. Хими-
ческие источники тока, 974 стр., цена 4 р. 07 к.
Т. VI. Сырье и продукты промышленности органических веществ,
1012 стр., цена 4 р. 68 к.
Дополнительный том. Номенклатура органических соединений.
Техника безопасности. Сводный предметный указатель,
508 стр., цена 2 р. 42 к.
Книги можно приобрести в местных книжных магазинах, распростра-
няющих научно-техническую литературу.
В случае отсутствия книг в магазинах заказ можно отправить по адре-
сам: Ленинград Д-11, Невский пр., 29, отдел «Книга — почтой» магазина
№ 21 «Книги по химии» или Москва К-50, ул. Медведева, 1, отдел «Книга —
почтой» магазина № 8 «Техническая книга». Заказ будет выслан наложенным
платежом.