Автор: Виестур У.Э. Руклиш М.П. Швинка Ю.Э.
Теги: прикладная микробиология биология микробиология биотехнология биотехнологии
ISBN: 5-7966-0900-9
Год: 1992
Текст
М. П.РУКЛИШ
Ю.Э.ШВИНКАУ. а ВИЕСТУРБИОТЕХНОЛОГИЯБАКТЕРИАЛЬНОГОСИНТЕЗА
СПОНСОРЫ ИЗДАНИЯ:— латвийская академия наук— РМНТК «ЛАТВИЯС БИОТЕХНОЛОГИЯ»,В НАСТОЯЩЕЕ ВРЕМЯ — ООО «ЛАТВИЯС
БИОТЕХНОЛОГИЯ»— НП ФИРМА «ЛАТВИЯС КОКС»— ИНСТИТУТ МИКРОБИОЛОГИИ ЛатвАН— ИНСТИТУТ ХИМИИ ДРЕВЕСИНЫ ЛатвАН— КООПЕРАТИВ «ЛАТПОР», В НАСТОЯЩЕЕ
ВРЕМЯ — ООО «РИТОЛ»
ЛАТВИЙСКАЯ АКАДЕМИЯ НАУКИНСТИТУТ ХИМИИ ДРЕВЕСИНЫ
ИНСТИТУТ МИКРОБИОЛОГИИМ. П. РУКЛИШ
Ю. Э. ШВИНКА
У. Э. ВИЕСТУРБИОТЕХНОЛОГИЯБАКТЕРИАЛЬНОГОСИНТЕЗАРИГА «ЗИНАТНЕ» 1992
Р у к л и ш М. П., Ш в и н к а Ю. Э., В и е с т у р У. Э. Биотехнология
бактериального синтеза. Рига: Зинатне, 1992. — 367 с. — ISBN
5-7966-0900-9.Монография посвящена прокариотным микроорганизмам, их использова¬
нию в биотехнологии. В качестве основной модели рассматриваются проду¬
центы рода Brevibacterium, позволяющие путем регуляции метаболизма из¬
менять выход продукта, снижать непродуктивные затраты энергии, повышать
продуктивность. Описываются основы улучшения свойств продуцентов мето¬
дами генетической инженерии, пути физиологической регуляции метаболизма
бактерий и биоинженерное осуществление биотехнологии. Приводятся при¬
меры биотехнологии получения аминокислот, этанола, биогаза и других
бактериальных продуктов.Табл. 49, ил. 110, библиогр. 416 назв.Ruklisha М., Shvinka J.f VIesturs U. Biotechnology of bacterial
synthesis. — Riga: «Zinatne», Publishers, 1992. — 367 P. — ISBN 5-7966-0900-9The book deals with procariotic microorganisms and their use in biotechnology.
The main model microorganisms described are Brevibacterium strains, producing
amino acids and nucleotides. Due to metabolism flexibility in Corynebacterium
possibilities how to regulate the product yield, decrease non-productive energy
expenses, increase productivity are shown.Separate chapters deal with strain improvement based on genetical engi¬
neering methods, biochemical and physiological regulation of bacterial metabo¬
lism, and bioengineering aspects.Examples of amino acid, ethanol, biogas and producing of other bacterial
products are described.Tab. 49, fig. 110, ref. 416 titles.p 4002000000-022 объявлM8II(11) 92 © М. П. Руклиш, Ю. Э. Швинка,ISBN 5-7966-0900-9 У. Э. Виестур, 1992
ПРЕДИСЛОВИЕБиотехнология — это совместное использование достижений
биохимии, микробиологии и инженерных наук для получения в
производственных технологиях различных продуктов с приме¬
нением культур микроорганизмов, клеток и клеточных компо¬
нентов*. Биотехнология является перспективным путем устране¬
ния дефицита пищевых ресурсов и нехватки энергии, улучшения
здравоохранения и охраны окружающей среды.Анализ объема реализуемой продукции и ассигнований на
развитие микробиологической промышленности в большинстве
стран позволяет констатировать, что на первом месте нахо¬
дятся производства лекарств, диагностикумов и профилактиче¬
ских препаратов для медицины, искусственных подсластителей,
растворителей различных веществ для пищевой и парфюмерной
промышленности. Объем выпуска продукции для сельского хо- '
зяйства, в том числе для животноводства, составляет около
20%.Нам (бывшему СССР) надо пересмотреть структуру микро¬
биологической промышленности. Наряду с развитием крупнотон¬
нажных производств (кормовые дрожжи, лизин, антибиотики)
необходимо увеличить выпуск медицинских препаратов, продук¬
тов для пищевой промышленности, парфюмерии, средств биоло¬
гической защиты растений и корректировки биоценозов почв, в
том числе с использованием рекомбинантных продуцентов.Современная биотехнология сулит оригинальные решения
важных глобальных проблем и конкурирует со многими сущест¬
вующими технологиями. Так, например, в области энер¬
гетики — это получение биогаза, водорода, этанола из возоб¬* Дефиниция акцептирована Федерацией европейских биотехнологических
обществ в 1978 г.
■6Предисловиеновляемого в процессах фотосинтеза сырья. Большое значение
биотехнология имеет в решении проблем защиты окружающей
среды путем очистки сточных вод, переработки отходов про¬
мышленности, биодеградации токсичных соединений, производ¬
ства полимерных материалов, которые разлагаются микроорга¬
низмами. Перечень выпускаемых антибиотиков, гормонов,
витаминов, вакцин и других лекарственных веществ, средств
диагностики огромен и продолжает расти. Все больше биотех¬
нология внедряется в растениеводство для разведения новых
сортов растений на основе клеточных культур, размножения
безвирусных сортов, создания новых средств защиты растений.
В области электроники создаются биологические микроустрой¬
ства (датчики, преобразователи и т. д.). Биотехнология позво¬
ляет улучшить технологию добычи нефти и природного газа,
обогащения руд.Большие достижения в области биотехнологии в последние
годы связаны с возможностями улучшения свойств продуцен¬
тов, синтезирующих важные для человека вещества, методами
генетической инженерии. Это осуществляется способами моди¬
фикации ДНК и переноса генетической информации из одних
организмов в другие.В биотехнологии применяют микроорганизмы, культуры кле¬
ток растений и животных или их компоненты и экзопродукты,
которые используют в процессах в четырех основных вариантах:
получение массы клеток;синтез внутри- и (или) внеклеточных продуктов;
биотрансформация, в том числе использование иммобилизо¬
ванных систем;
биодеградация.Во всех вариантах широко применяют прокариоты, представ¬
ленные разными видами бактерий. Как известно, по сравнению
с эукариотными микроорганизмами (низшими и высшими
грибами, водорослями) прокариоты имеют ряд существенных
отличий, которые необходимо учитывать при разработке соответ¬
ствующих биотехнологий и сопоставлении альтернативных тех¬
нологий. Прежде всего, в клетке отсутствует обособленное кле¬
точное ядро. У бактерий носитель' генетической информации
организован только в одной хромосоме — огромной молекуле
ДНК и в мелких фрагментах ДНК — плазмидах. В бактери¬
альной клетке отсутствуют внутриклеточные энергообеспечива¬
ющие органеллы — митохондрии и хлоропласты. Мембранно¬
связанные генераторы энергии бактерий расположены в цито¬
плазматической мембране. У прокариот плохо выражена про¬
странственная обособленность функций в специализированные
органеллы и части клеток. Бактерии обычно имеют более тол¬
стую клеточную стенку, которая построена из особых гетеро¬
Предисловие7полимеров, состоящих из сахарных остатков, липидов и пепти¬
дов и аминокислот.Важные отличия присущи и процессам жизнедеятельности
бактерий. Для них характерны более простой механизм синтеза
белка, своеобразные механизмы обмена генетической информа¬
цией между клетками, проще регуляция метаболизма. Эти
отличия от эукариотной клетки можно проследить на всех уров¬
нях функционирования: молекулярно-биологическом, генетиче¬
ском, биохимическом и биоэнергетическом.Но, пожалуй, самое главное, что делает бактерии привлека¬
тельными для биотехнологии, связано с биохимией и физиоло¬
гией этих микроорганизмов. Имеется чрезвычайное разнообра¬
зие бактериальных ферментов, осуществляющих превращения
органических и неорганических веществ, что недоступно другим
группам организмов. Только прокариоты фиксируют молеку¬
лярный азот, образуют метан, окисляют молекулярный водород.
Только среди бактерий можно найти представителей, способных
расти в экстремальных условиях: например, при температуре
от 0 до 137 °С, при pH среды от 1 до 11, концентрации NaCl
до 5.2 М.При получении внеклеточных продуктов существенны две
отличительные черты бактерий. Во-первых, экскреция различ¬
ных метаболитов — свойство, которое вообще более выражено
у прокариот. Во-вторых, механизм экскреции (в частности, бел¬
ков) у эукариот принципиально отличается тем, что происходит
выделение гликолизированных белков.В процессах биотрансформации и биодеградации бактерии
незаменимы из-за своих уникальных свойств ассимилировать,
трансформировать, синтезировать соединения, недоступные дру¬
гим организмам.Таким образом, прокариоты, в первую очередь бактериаль¬
ные продуценты, более разнообразны и лабильны. Они легче
поддаются генно-инженерным манипуляциям, а также нужному
управлению физиологией и метаболизмом, изменяя условия
внешней среды. Именно эти свойства бактериальных продуцен¬
тов позволяют, как нам кажется, выделить биотехнологию
бактериального синтеза в качестве самостоятельного предмета
дискуссии.Авторы выражают глубокую благодарность сотрудникам от¬
дела биоинженерии и биоэнергетики Института микробиологии
им. А. Кирхенштейна Латвийской АН за помощь в эксперимен¬
тальных исследованиях.Заключительные этапы настоящей работы финансировались
из бюджета Латвийской Республики через латвийский совет по
науке, гранты № 644, 672.Авторы
ОСНОВНЫЕ УСЛОВНЫЕ ОБОЗНАЧЕНИЯБВК белково-витаминный концентрат (дрожжевой гид¬кэролизат) кукурузный экстрактРВ редуцирующие веществаСВ сухие веществаккл кормовой концентрат лизинаэтц электронно-транспортная цепькж культуральная жидкостьРПА рыбо-пептонный агаржпс жидкая питательная средаДНФ 2,4-динитрофенолДФИ 2,6-дихлорфенолиндофенолттх 2,3,5-трифенилтетразолий хлоридТТХ-Ф формазан 2,3,5-трифенилтетразолий хлоридаPQQ+ пиррол-хинолин-хинонPi ортофосфатATP аденозин-5'-трифосфатADP аденозин-5'-дифосфатAMP аденозин-5'-монофосфатcAMP циклический 3',5'-аденозинмонофосфатCAPбелок, активирующий катаболитчувствительный
генGTP—гуанозин-5'-трифосфатGDP—гуанозин-5'-дифосфатppGpp—гуанозин-5'-дифосфат-3'-дифосфатpppGpp—гуанозин-5'-трифосфат-3'-дифосфатCTP—цитидин-5'-триф^сфатUTP—уридин-5'-трифосфатNAD+—ннкотинамидадениндинуклеотид
10Основные условные обозначенияNADP+—никотинамидадениндинуклеотидфосфатNADH,—то же, восстановленные формыNADPHFAD+—флавинадениндинуклеотидFADH—то же, восстановленная формаРНК—рибонуклеиновая кислотамРНК—матричная (информационная) РНКДНК—дезоксирибонуклеиновая кислотаСоА—коэнзим АФТС—фосфотрансферазная системаЦТК—цикл трикарбоновых кислотГМП—гексозомонофосфатный путькдфгп—кето-3-дезокси-6-фосфоглюконатный путьX—концентрация биомассы, г/лР—концентрация продукта, г/лS—концентрация субстрата, г/лУх/s—выход биомассы из субстрата, г/г
выход продукта из субстрата, г/гУ P/S—Ух/О—выход биомассы по кислороду, г/мольУр/О—выход продукта по кислороду, г/мольУ АТР—выход биомассы по АТР, г/моль АТР<Js—удельная скорость потребления субстрата, г/(г-ч)Цр—удельная скорость синтеза продукта, г/(г*ч)<7о2удельная скорость потребления кислорода,
ммоль/(г-ч)4со2удельная скорость выделения диоксида углерода,
ммоль/ (г-ч)—удельная скорость роста, ч-1Q О:—скорость потребления кислорода, ммоль/(л-ч)Q С02скорость выделения диоксида углерода,
ммоль/(л-ч)Грскорость образования продукта (продуктивность),
г/(л-ч)т—поток вещества, Сэкв/(м3*ч)С—концентрация вещества, мольD—скорость разбавления протока среды, ч-1Д|ШН+—мембранный электрохимический потенциал ионов
водородаА р—протондвижущая силаК*—константа Михаэлиса
ОСНОВНЫЕ КРИТЕРИИ
ОЦЕНКИ БИОТЕХНОЛОГИЧЕСКИХ
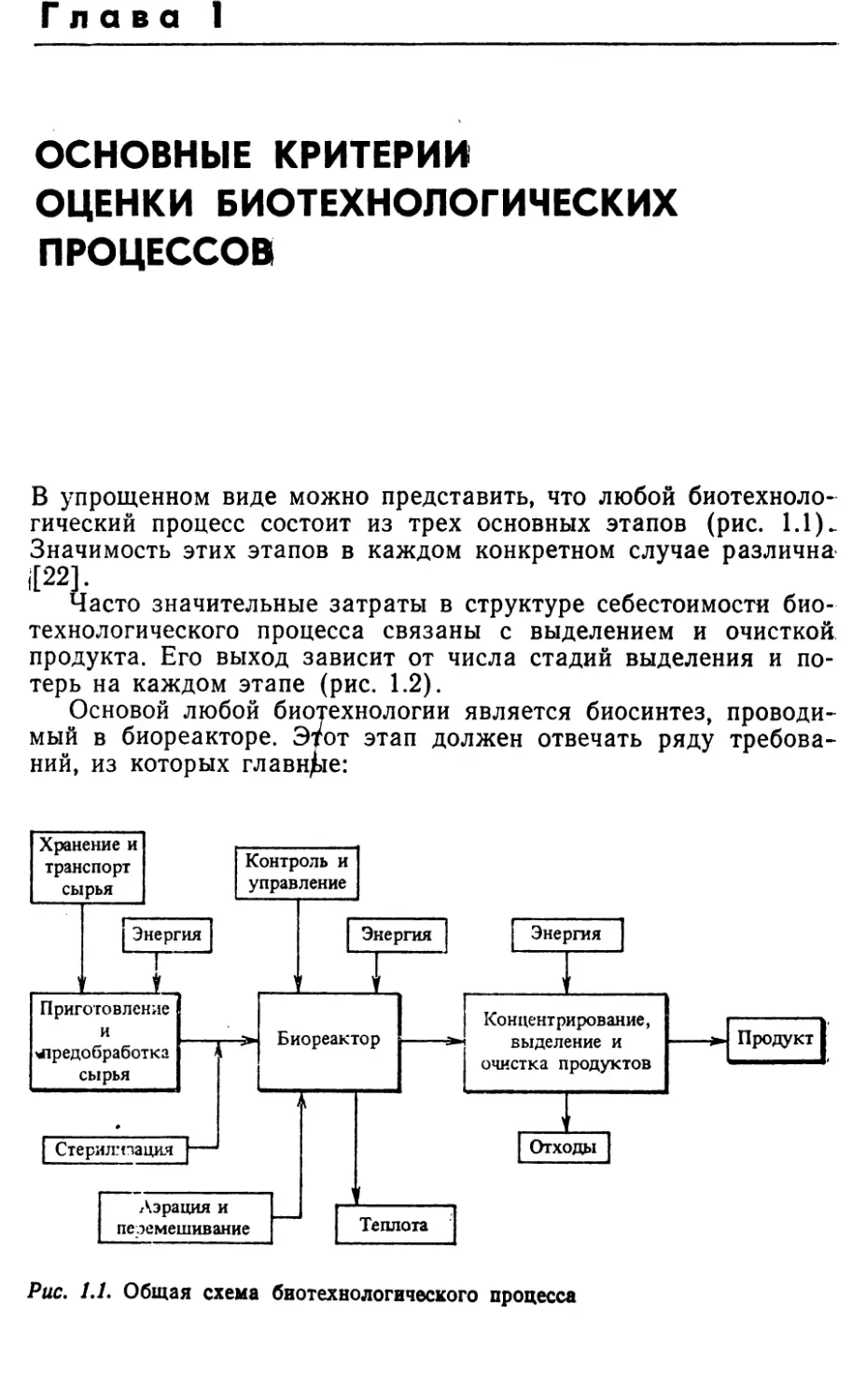
ПРОЦЕССОВВ упрощенном виде можно представить, что любой биотехноло¬
гический процесс состоит из трех основных этапов (рис. 1.1).
Значимость этих этапов в каждом конкретном случае различна
,[22].Часто значительные затраты в структуре себестоимости био¬
технологического процесса связаны с выделением и очисткой
продукта. Его выход зависит от числа стадий выделения и по¬
терь на каждом этапе (рис. 1.2).Основой любой биотехнологии является биосинтез, проводи¬
мый в биореакторе. Этот этап должен отвечать ряду требова¬
ний, из которых главнее:Рис. 1,1. Общая схема биотехнологического процесса
1) обеспечение необходимых физических (температура, дав¬
ление, вязкость) и химических (концентрация источника угле¬
рода и энергии, некоторых ионов и микроэлементов) парамет¬
ров среды;2) контроль и управление процессами биосинтеза в соответ¬
ствии с биохимией превращения субстрата в продукт и физио¬
логией продуцента;3) обеспечение массопередачи (подвода субстратов и отвода
продуктов) в многофазовой системе, включая процессы переме¬
шивания, аэрации, отвода теплоты;4) при необходимости — обеспечение! стерильности процесса
и предотвращение выхода веществ в окружающую среду;5) простота эксплуатации промышленной установки.Рассматривая критерии оценки биотехнологического про¬
цесса, важно учесть все этапы технологической схемы. При раз¬
работке новых биотехнологий основные неопределенности свя¬
заны с реализацией второго этапа. Для подготовки субстрата и
выделения продукта, как правило, можно пользоваться извест¬
ными способами или провести оценку этих этапов по аналогам.
В связи с этим рассматриваемые критерии оценки биотехноло¬
гического процесса иногда применяют только к этапам биосин¬
теза продукта.1.1. СЕБЕСТОИМОСТЬ ПРОДУКЦИИАнализ структуры себестоимости позволяет выявить основные,
экономически наиболее эффективные направления усовершен¬
ствования технологий. В табл. 1.1 показаны примеры этой
структуры для некоторых видов продуктов биотехнологии: кон¬
центратов, метаболитов различной степени очистки.
Основные критерии оценки биотехнологических процессов13Таблица 1.1. Структура себестоимости производств некоторыхбиотехнологических продуктов, % JPy к Л t>i i-U *Статья расходовКормовой кон¬
центрат лизина
из свекловичной
мелассы*Лимонная
кислота,
получен¬
ная из
мелассыПеницил¬линЭтанол [7]сухойжидкийповерх¬ностнымспосо¬бом**Сырье46,349,5433565Электроэнергия и топ¬
ливо11,010,513,31915Заработная плата заня¬
тых в основном произ¬
водстве3,62,89,345Оборудование, его экс¬
плуатацияв том числе аморти¬
зация24,523,210,62215Прочие
в том числе общеза¬
водские расходы14,69,314,08,423,820* По данным Ливанского опытного биохимического завода.** По данным Экспериментального завода Института микробиологии ЛатвАН.Из таблицы видно, что наиболее эффективна работа по за¬
мене дорогостоящих компонентов питательной среды более де¬
шевыми и увеличению выхода продукта YP/s. Следующие по
значимости позиции — энергозатраты и оборудование.Анализ структуры себестоимости — непростая процедура,
т,ак как наблюдается сильное взаимовлияние факторов. Так,
увеличение Yp/s, кроме прямого удешевления продукта, приво¬
дит к уменьшению балласта в культуральной жидкости (см.
раздел 1.7) и, тем самым, к существенному упрощению техно¬
логии концентрирования и очистки целевого продукта. Важ¬
ность этого положения подтверждается анализом зависимости
между ценой реализации и концентрацией продукта в культу¬
ральной жидкости ‘[47]. Между этими величинами наблюдается
обратная зависимость: чем меньше продукта содержится в куль¬
туральной жидкости, тем выше его цена на мировом> рынке
(рис. 1.3).Себестоимость продукта является комплексным критерием,
характеризующим эффективность полного биотехнологического
процесса. Однако при определении и исследовании этого крите¬
рия имеется ряд затруднений. Например, себестоимость про¬
дукта сложно определить на этапе разработки новой техноло¬
гии процесса. По себестоимости продукта трудно сравнивать
10 3^ 102C\>* 101
is „§> 10°%10'1
* 10'2* W'3I nr*' I 10'5* 10's
10'7102 101 100 101 102 103 104 10s 10B 107 10s 10s
Цена 1 кг продукта, дол.Рис. 1.3. Цена продуктов биотехнологии на мировом
рынкеэффективность аналогичной технологии в разных странах.
Даже при действующих производствах достоверная оценка
существенных элементов технологических схем представляет со¬
бой сложную задачу. Так, в России уже 15 лет продолжается
спор об оптимальной конструкции биореактора для производ¬
ства кормового лизина.Ниже будут рассмотрены применяемые на ранних стадиях
разработок новых технологий критерии, которые в конечном
итоге определяют себестоимость продукции.1.2. ПРОДУКТИВНОСТЬВ микробиологической промышленности принято выражать про¬
дуктивность в килограммах продукта, получаемого с 1 м3
геометрического объема биореактора в сутки, включая время
на подготовку аппаратуры между процессами. В лабораторных
исследованиях продуктивность г обычно выражают в г/(л*ч),
относя к объему жидкой фазы и учитывая только продолжи¬
тельность процесса биосинтеза. В непрерывных процессах про¬
дуктивность образования биомассы— -Soda
\ Этанол
N. ^ \s.Лимонная кислота
л /ПенициллинРентами цинТИКИ Протеазы \АмилазыентамицинГиЬдереллинобая кислота
ОСНОВНЫЕ ФЕРМЕНТЫ БИОМАССЫ
ГлюкозооксидазаМОНОКЛОНАЛЬНЫЕ
АНТИТЕЛАДИАГНОСТИЧЕСКИЕ
ФЕРМЕНТЫГлицерофосфатДегидрогеназа'Люцифера заФактор Ж-
Урокиназа-
ТЕРАПЕВТИЧЕСКИЕ-
ФЕРМЕНТЫTx=DX (1*1)при соблюдении условий стационарного состояния, т. е. \i=D.
Основные критерии оценки биотехнологических процессов15Продуктивность биотехнологического процесса зависит от
многих факторов, основными из которых являются активность
продуцента, эффективность биоконверсии, характеризуемая вы¬
ходом продукта (Ур/s), и концентрации X активного биоката¬
лизатора в биореакторе:rp=qsYp/sX. (1-2)Анализ этой обобщенной зависимости применительно к каж¬
дому процессу позволяет решить вопрос, за счет какой состав¬
ляющей целесообразно повышать продуктивность. Например,
самое простое решение — увеличение гР путем повышения кон¬
центрации клеток аэробного продуцента — ограничивается
интенсивностью массопередачи кислорода в данной конструкции
аппарата. В других случаях этот путь оправдан, и значитель¬
ного увеличения продуктивности можно добиться такими при¬
емами, как рециркуляция биомассы, использование флокули-
рующих и иммобилизованных клеток. Увеличение продуктив¬
ности путем повышения qs и YP/s требует более глубоких
знаний биохимии и энергетики процесса. Этот путь связан с
целенаправленным получением новых штаммов, всесторонним
изучением метаболизма и физиологии продуцентов.1.3. УДЕЛЬНЫЕ ЭНЕРГОЗАТРАТЫКак известно, важным показателем любого производства, в том
числе биотехнологического, являются удельные энергозатраты.
Например, при производстве сухого кормового концентрата ли¬
зина энергозатраты составляют 11% от себестоимости*. Из них
на электроэнергию расходуется 23,5%,, на пар — 73, топливо —
3,5%. При этом наряду с интегральной величиной расход энер¬
гии дифференцируют по этапам технологической схемы: терми¬
ческая стерилизация питательных сред, аэробное культивирова¬
ние, сепарация, упаривание различных промежуточных
продуктов очистки и концентрирования, сушка и т. д. Оборудо¬
вание для осуществления каждой из этих операций конкуренто¬
способно только в том случае, если оно имеет наилучшие
технические показатели, в том числе минимальный удельный
расход энергии.Энергетический баланс при аэробной ферментации изобра¬
жен на рис. 1.4. Как видно из рисунка, по сравнению со сво¬
бодной энергией ассимилируемых углеводов потребляемая энер¬
гия невелика, однако следует учитывать ее стоимость и необхо¬
димость последующего удаления из системы. Техническое
соревнование между аналогичными решениями при создании* По ценам на 1989 г.
Рис. 1.4. Схема энергетического баланса про¬
цесса аэробной ферментации. Потоки энергии:Nx — потребляемая от сети (N'x — для сжатия
воздуха; N'\ — для вращения мешалки); ;V2«/V’,—/V3 —
введенная в жидкость; N'3, N"3 — потери (КПД);
#4, N5 — удаляемая с отработанным воздухом;— излучаемая поверхностью; N7 — тепловыде¬
ление, связанное с метаболизмом бактерий; —
теплота, отводимая из аппаратабиореакторов в основном направлено на минимизацию коли¬
чества отводимой энергии.Методические вопросы снятия теплового баланса биореакто¬
ров изложены нами в работах i[l, 13, 27].Таким образом, удельные энергозатраты по полному био¬
технологическому процессу и (или) отдельным его стадиям
являются весьма важным критерием при сравнении альтерна¬
тивных вариантов. Однако определение этих затрат на ранних
стадиях производства весьма затруднительно. Тепловые и энер¬
гетические балансы обычно достоверны при наличии крупных
установок (технологических линий).1.4. ЭКОЛОГИЧЕСКАЯ ЧИСТОТАБорьба с загрязнением среды является одной из задал, решае¬
мых с помощью биотехнологии. Однако необходимо учесть, что
биотехнологические процессы сами могут быть причиной загряз¬
нения. Как известно, мероприятия, направленные на предотвра¬
щение загрязнения окружающей среды, — удаление балласта,
очистка сточных вод и газообразных выбросов — всегда свя¬
заны с удорожанием выпускаемой продукции. В большинстве
стран существуют нормативы, характеризующие экологическую
чистоту соответствующих производств. Появилась даже новая
терминология: безотходная, малоотходная и замкнутая техноло¬
гии. Крайний, но оптимальный в аспекте экологии вариант та¬
ких технологий — культивирование патогенных продуцентов,
когда полностью исключается контакт сред, биологических
агентов, полупродуктов и продуктов с окружающей средой. Од¬
нако такая технология дорога для ряда крупнотоннажных про¬
изводств.Для характеристики экологической чистоты прои"подств
используют следующие основные показатели:
Основные критерии оценки биотехнологических процессов17Таблица 1.2. Основные показатели качества сточных вод Р у Л И ,ВодаКонцентрация растворен¬
ного Ог, мг/лХПК.ВПК,Взвешен¬
ные ве¬Аммоний¬при 20 °Сприо°смг/лмг/лщества,мг/лный азот,
мг/лОчень чис¬8,5... 9,313,0... 14,51 0,5... 11...30,05таяЧистая7,0... 8,511,0... 13,01 ...21 ...23... 100,1Загрязнен¬4,0... 7,03,0... 11,02...52... 3,910...500,2... 1наяГрязная<4,0<3,05... 154... 1050... 1001...3Очень гряз-00>15>10>100>31) количество сточных вод. Одна из мер улучшения этого
показателя — повышение гидромодуля, т. е. увеличение коли¬
чества рециркулируемой воды;2) качественный состав сточных вод (табл. 1.2): общее ко¬
личество сухих веществ, ХПК, БПКб и БПКго- Важно также
характеризовать отдельно токсичные соединения (ионы тяже¬
лых металлов, фенолы и пр.);3) количественный и качественный состав газообразных и
аэрозольных выбросов.Если проанализировать универсальную биотехнологическую
схему (см. рис. 1.1) в этом аспекте, можно выделить следующие
основные пути контаминации:1) приготовление питательных сред — пыление порошкооб¬
разных компонентов, испарение летучих, например NH3. На
этой стадии обычно обеспечивается нужная защита общепри¬
нятыми средствами: засасывание порошкообразных компонентов
в реактор для приготовления питательных сред под вакуумом,
что значительно уменьшает пыление; замена объемного дозиро¬
вания жидкостей при помощи мерников специальными ротаци¬
онными, индукционными и другими дозаторами значительно
сокращает поверхности, подлежащие мойке, и тем самым —
количество технологических сточных вод.Термическая стерилизация питательных сред — операция
малоопасная для окружающей среды, если не считать рассре¬
доточения энергии — появления сравнительно большого коли¬
чества низкопотенциального теплоносителя (воды);2) процесс культивирования аэробных бактериальных про¬
дуцентов. Даже если основной биологический агент всесторонне
апробирован и действительно безвреден, всегда существует
опасность появления посторонней микрофлоры в биореакторе.2 — 361
18Глава 1Таблица 1.3. Химический состав лизиновых стоков, подвергае¬
мых метановому сбраживаниюДо броженияПослеНаименованиеброженияСухие вещества стоков, %*;7,83,55суммарныерастворимые5,00,90нерастворимые2,82,65Химические компоненты раствори¬мой фракции, %:2,5000,10белокорганические кислоты0,4500,01аминокислоты0,2950,02РВ0,8000азот неорганический0,6300,75фссфор неорганический0,1200,06* Приведены данные изменения состава одной партии стоков в перио¬
дическом процессе метанового брожения.При этом биологический агент- может быть безвреден при разо¬
вых контактах, а когда десятками лет контаминируется окру¬
жающая среда большими количествами выбросов, могут поя¬
виться весьма неожиданные последствия, такие, например, как
при производстве БВК из парафинов;3) фракционирование и другие виды обработки культураль¬
ных жидкостей;4) применение множества методов химической технологии
для концентрирования и очистки целевых продуктов;5) сушка биомасс, микробиологических концентратов, про¬
дуктов различной степени очистки (в том числе кристалличе¬
ские формы);6) фасовка готовых продуктов;7) рациональное инженерное решение технологической
схемы, обеспечивающее максимальный сбор и рециркуляцию
низкопотенциальных теплоносителей, воды различной степени
чистоты (промывной, конденсата, охлаждающей и т. д.), био¬
масс (после извлечения целевого продукта) и пр.;8) выпуск микробиологических концентратов.На примере кормового концентрата лизина неоднократно
показывалось бесспорное его преимущество в экологическом от¬
ношении — рациональное использование всего сухого остатка
культуральной жидкости. При получении лизина в кристалли¬
ческом виде весь балласт надо пропустить через очистные соо¬
ружения или как-то использовать для других целей. Можно
использовать сточные воды в процессе метанового брожения с
целью уменьшения их ХПК, а также получения биогаза [12].
Основные критерии оценки биотехнологических процессов19Нерастворимая фракция, 0,1 т (по СВ)Рис. 1.5. Баланс субстратов и продуктов в процессе получения кристалли¬
ческого лизинаПри этом сбраживаются все растворимые органические соеди¬
нения, содержащиеся в лизиновых стоках (табл. 1.3). Количе¬
ство нерастворимой фракции после брожения практически не
менялось (2,65 ... 2,80%).При использовании лизиновых или навозных стоков в каче¬
стве субстрата в процессе метанового брожения суммарное
выделение биогаза составляет 1000 или 1230 л на 1 кг органи¬
ческого вещества. На лизиновых стоках разлагается 77% органи¬
ческого вещества, на навозных —53%* При попытке увеличитьКормовойРис. 1.6. Схема малоотходного технологического процесса получения крис¬
таллического лизина
2•
20Глава 1объем добавляемой свежей среды до 20%, т. е. в 2 раза
больше обычного, средняя скорость выделения газа составила
в сутки 3 л на 1 л стока.На рис. 1.5 приведен баланс субстратов —продуктов процесса
биосинтеза лизина с последующим выделением кристалличе¬
ского лизина и использованием стоков для метанового брожения.
В результате переработки 1 т мелассы получают (ориентиро¬
вочно) 0,143 т кристаллического лизина, 114 м3 биогаза, около
0,1 т (на СВ) удобрения и около 3,0 м3 жидкой фракции.Жидкую фракцию, полученную после метанового брожения,
можно частично (до 35%) использовать в качестве заменителя
воды при подготовке сред для производства лизина, более вы¬
сокие концентрации неэффективны, а твердую фракцию — для
приготовления компостов (рис. 1.6).1.5. ВЫХОД ПРОДУКТА ПО МАССЕ И ЭНЕРГИИВыход продукта обычно обозначают У, соответствующие ин¬
дексы конкретизируют эту величину (табл. 1.4). Наиболее часто
пользуются величиной выхода продукта YP/s, которая отражает
массу продукта, получаемого из определенного количества суб¬
страта. Эту величину иногда называют коэффициентом конвер¬
сии или экономическим коэффициентом, хотя последнее назва¬
ние комиссией IUPAC по биотехнологии не рекомендуется ис¬
пользовать [37]. Выход продукта можно выразить также на
основе энергетического баланса процесса как долю энергосо¬
держания субстрата, перешедшего в продукт биосинтеза. При
этом энергетический потенциал органических веществ — суб¬
стратов и продуктов — выражают в единицах свободной
энергии, теплот сгорания, количества доступных электронов Т8,
10, 17, 18, 25, 34, 36].Как известно, величина Y служит важной характеристикой
процессов микробного синтеза. Это обусловлено рядом причин.
Во-первых, величина выхода продукта непосредственно связана
с продуктивностью процесса выражением (1.2). Небольшое уве¬
личение Yp/s может привести к значительному повышению
продуктивности процесса и к другим выгодам [15, 33, 44]. Во-
вторых, увеличение выхода продукта позволяет снизить себе¬
стоимость целевого продукта, так как при этом экономится суб¬
страт — сырье. Например, при производстве лизина 5000 т в
год расчетный экономический эффект, достигнутый в результате
повышения Yp/s на 0,01, оценивается в 465 тыс. руб.* В-третьих,
величина выхода продукта имеет четкий физико-химический
смысл и способы количественного определения. Знать величину* По ценам на 1989 г.
Основные критерии оценки биотехнологических процессов21Таблица 1.4. Характеристика выхода продуктов, его ограничения
и способы определенияВыходПричины, ограничива-
Обозначение ющие достижимый
пределСпособ определенияТеоретическийМаксимальныйутсор Термодинамические
умакс Генетические и био‘Из баланса энергииИз реального биохимиче-Эксперимен-химические
уэксп Физиологические и
технологическиеского баланса процесса
На основе эксперимен¬тальныйтальных данных:2) У p/s" = — (в стаци-Реальныйонарных условиях)
упроизв Технологические, Анализ результатов про-аппаратурные, изводстваорганизационныеУ необходимо для технологических расчетов, контроля и управ¬
ления процессом биосинтеза .[4].Величины выходов биомассы и продуктов определенным
образом связаны с биохимией и физиологией продуцентов. Эти
вопросы будут рассмотрены в главе 2.Уте°р характеризует предельное значение выхода продукта,
когда вся свободная энергия, содержащаяся в субстрате, пере¬
ходит в продукт. Из термодинамики известно, что в химических
реакциях выход свободной энергии всегда меньше единицы.
К 100%-ной термодинамической эффективности система стре¬
мится в состоянии равновесия, когда скорость процесса стре¬
мится к нулю [20, 45J. Следовательно, по причинам, вытекаю¬
щим из законов термодинамики, величина Утеор на практике
недостижима. Тем не менее, эту величину нужно уметь опреде¬
лять, поскольку она необходима для технологических расчетовСуществует несколько способов определения значения Утеор
в биотехнологических процессах. Все они основываются на
макроскопических принципах биоэнергетики, когда нужная ин¬
формация извлекается из баланса массы и энергии процесса
биосинтеза. Изменение энергетического потенциала многосту¬
пенчатого биохимического превращения субстрата в продукт
можно выразить различными способами: в виде классических
термодинамических функций свободной энергии и энтальпии
[8, 17, 21, 38], разности теплот сгорания субстрата и продукта
[13, 36], баланса доступных электронов [3, 9, 10, 26, 27, 29, 35,
43]. Эти методы расчетов являются приближенными, они по¬
дробно рассмотрены в работах [20, 38]. Для количественного
определения значений Уте°р широкое признание получил метод,[3, 14, 28, 42].
22Глава 1разработанный И. Г. Мннкевнчем и В. К. Ерошиным на основе
созданной ими теории редоксонов [3, 10, 28, 35]. Величина
утеор определяется на основе баланса массы и энергии и вы¬
ражает энергосодержание органических веществ в эквивалентах;
доступных электронов (редоксонов) i[28]. В этом случае для
расчета достаточно знать лишь элементный состав продукта и
субстрата:утеор =0£YS_ (13)iОрургде as и ар — массовая доля углерода в субстрате и биомассе;:
fs и ур — степень восстановленное™ (количество редоксонов)
в субстрате и продукте.Для органического вещества CHpOnN^ степень восстановлен¬
ное™ или количество редоксонов в одном С моле рассчитывают
по формулеY=4+P—2я—3q. (1.4)Этот способ определения У£'|р очень прост и удобен, но
является приближенным. Степень восстановленности прямо
пропорциональна энтальпии сжигания данного органического
вещества. Согласно Роэлсу *[39], при полном окислении i-ro ор¬
ганического вещества между его степенью восстановленности
(у,) и теплотой сжигания — энтальпией (Д#<°) и свободной
энергией (ДG,0) в расчете кДж на один С моль существуют
следующие зависимости:ДЯ,°=115у<; (1.5)AG,°=94,4^+86,6. (1.6)Иной смысл имеет коэффициент выхода, обозначаемый нами
умакс в этом СЛуЧае учитывается ограничение, накладываемое
также вторым законом термодинамики, а именно то, что часть
свободной энергии системы тратится на обеспечение скорости
Протекания химической реакции, поэтому Умакс утеор_ умакс
обозначает предельный выход при биохимически осуществляе¬
мом превращении субстрата в продукт. Значение Умакс коли.
чественно определяют по стехиометрии всех биохимических
реакций на пути превращения субстрата в продукт с учетом
регенерации кофакторов и энергообеспечения процесса.Для сложных процессов, когда вся последовательность ре¬
акций неизвестна или ее трудно учитывать (например, при син¬
тезе биомассы), значение находят с помощью ЭВМ no-
известным картам метаболических путей или другими прибли¬
женными методами [2, 11, 38]. Важно отметить также то обсто¬
ятельство, что может быть несколько значений максимального
выхода продукта из одного и того же субстрата. Это обуслов¬
Основные критерии оценки биотехнологических процессов23лено тем, что превращения субстрат-^продукт и субстрат-*-
-^-доступная клеткам энергия у разных микроорганизмов или
даже у одного микроорганизма могут осуществляться несколь¬
кими альтернативными путями. Материально-энергетический
баланс альтернативных путей биосинтеза, особенно катабо¬
лизма, как правило, различается.В зависимости от функционирования альтернативных путей
лри биосинтезе лизина из глюкозы У маке меняется от 0,47 до 0,69
[15, 41]. Для приближения У^с к значению У£еДр для сложных
'биосинтезов необходимо, во-первых, выяснить наиболее эконом¬
ный путь биохимических превращений субстрата в продукт.
Вторым этапом такой задачи должно быть конструирование
«идеального продуцента» с использованием методов генной ин¬
женерии для генетического закрепления нужных биохимических
свойств.уэ1лсП<-умакс в данном случае определяют на основании
опытных данных по формулам табл. 1.4. Можно еще выделить
значение выхода продукта, получаемое в реальном производ¬
ственном процессе (Упр°изв) Эта величина может быть меньше
уэксл из-за причин, связанных с квалификацией персонала, ка¬
чеством оборудования и т. д.Величинами выхода продукта пользуются для характерис¬
тики полного биотехнологического процесса либо только этапа
биосинтеза (см. рис. 1.1).Рассмотрим смысл и количественное определение Y в каж¬
дом из четырех рассмотренных основных вариантов примени¬
тельно к микробной биотехнологии.В первом варианте продуктом являются сами клетки или их
часть (например, белок) либо какой-нибудь другой внутрикле¬
точный компонент, который впоследствии изолируют из клеток
и очищают. Клеточная масса синтезируется и накапливается в
среде в результате роста микроорганизмов. Обобщенное урав¬
нение баланса роста может быть записано в следующем виде:где Л, Ву D, R9 S, Т — стехиометрические коэффициенты;
СаНьОс — обобщенное обозначение источника углерода и энер¬
гии для гетеротрофных микроорганизмов; CaHpOvN6 — обоб¬
щенное обозначение биомассы.В данном случае выхоЦ' биомассы YXfs является нормиро¬
ванным стехиометрическим коэффициентомА (СаШОс) +В (Од) +D (NH3) +
-W? (CaHpOvNe) +5 (С02) +Т (Н20),(1.7)(1.8)где Мх — молекулярная масса клеток (12a+P+16v+14S),
Мs — молекулярная масса источника углерода (12a-f-&+16c).
24Глава IВ практической работе необходимо учесть то обстоятельство,
что, определяя массу клеток по массе их после высушивания,
необходимо делать поправки на содержание минеральных ком¬
понентов и связанной воды. Содержание золы и связанной воды
составляет 6... 10%, для каждого.Коэффициент Yxls в уравнениях (1.7) и (1.8) выражает эф¬
фективность использования источника углерода и энергии на
прирост клеточной массы. Другая часть углеродсодержащего
субстрата «сжигается» клетками до СОг и НгО с целью полу¬
чения энергии.Во втором варианте целевым продуктом микробного синтеза
является определенный метаболит, синтезируемый живыми клет¬
ками и выделяемый ими в среду. При этом продукт часто
получают в две стадии. Сначала выращивают биомассу, которая
во второй фазе синтезирует нужный продукт. Условия культи¬
вирования в фазах роста и синтеза, как правило, различаются.
По такой схеме получают антибиотики, органические кислоты
и аминокислоты, витамины и пр. В аспекте регуляции эффек¬
тивности биосинтеза очень важно установить корреляцию син¬
теза продукта с ростом биомассы. Крайними идеальными
вариантами являются прямая зависимость роста и синтеза про¬
дукта в одном случае и синтез продукта при отсутствии
роста — в другом. Уравнение баланса для биотехнологического-
процесса, соединяющего в себе рост клеток и синтез внеклеточ¬
ного метаболита — продукта, в общем виде можно записать
так:А (СаШОс) +В (02) +D (NH3)->-
-+R (CaHpOvNe) +Р (Ce.Hr Ne<) +S (С02) +7'(Н20), (1.9)где Ca-Hp'Ov'Ny— обобщенное обозначение продукта; осталь¬
ные обозначения такие же, как в уравнении (1.7).Выход продукта по массе количественно выражается как:у»‘=т- <ио>где МР — молекулярная масса продукта (^а'+р'-Нбу'+Нб')*Коэффициент Yp/s аналогично величине YX/s является нор¬
мированным стехиометрическим коэффициентом в уравнениях
(1.9) и (1.10) и выражает эффективность превращения источ¬
ника углерода в продукт.В третьем варианте клетки или отдельные их части (чаще
всего ферменты) используются в качестве катализатора при
биотрансформации. При этом трансформация или конверсия
субстрата (предшественника) в желаемый продукт включает
одну (чаще всего) либо несколько последовательных биохими¬
ческих реакций. Получаемое вещество, как правило, имеет сход¬
ную с предшественником химическую структуру. В качестве
Основные критерии оценки биотехнологических процессов25примеров биотрансформации можно назвать производство ук¬
сусной кислоты из этанола, аспарагиновой кислоты из фумарата
аммония, получение стероидных гормонов, превращение сорбита
в сорбозу при производстве витамина С. В настоящее время
ассортимент продуктов, получаемых путем биотрансформации,
быстро расширяется, и этому способу, обладающему рядом пре¬
имуществ по сравнению с химическим синтезом, прогнозируется
значительная роль в будущем ![14].Поскольку при биотрансформации происходят незначитель¬
ные изменения структуры субстрата-предшественника, потери
субстрата невелики и величина выхода продукта YP/s имеет
значения, близкие 1.Биодеградацию с помощью микроорганизмов применяют при
переработке отходов и побочных продуктов промышленности,
сельского и коммунального хозяйств. Необходимо учесть, что
субстратами биодеградации являются трудноутилизируемые ве¬
щества, такие, как углеводороды нефти, лигнин, хитин, целлю¬
лоза и ядовитые органические вещества. Минерализация этих
соединений часто является многостадийным процессом. В связи
с этим в очистных сооружениях биодеградация осуществляется
сложными ассоциациями микроорганизмов. Применение сме¬
шанных культур позволяет решить также проблему расширения
спектра утилизируемых органических веществ. Основная цель
переработки отходов в очистных сооружениях заключается в
полном разложении органических веществ. Другие полезные
продукты при этом, как правило, не получают.Весьма заманчивым представляется совмещение биодеграда¬
ции (особенно отходов сельского хозяйства и пищевой промыш¬
ленности) с получением дополнительных полезных продуктов.
Разработка таких технологий является очень важной задачей.
В аэробных процессах дополнительным продуктом может быть
клеточная биомасса, используемая, например, как кормовой бе¬
лок. В процессах анаэробной переработки отходов можно полу¬
чить биогаз, этанол, ацетон и бутанол.Часто возникает необходимость сопоставления эффективно¬
сти разных процессов биосинтеза, различающихся энергоемко¬
стью субстратов и продуктов. В таких случаях удобно пользо¬
ваться энергетическим выходом процессауэксп(1Л1)Величину г) называют также термодинамической эффектив¬
ностью процесса ;[38]. Она выражает выход продукта по энер¬
гии, т. е. обозначает долю свободной энергии субстрата, пере¬
шедшую в целевой продукт. Этот коэффициент аналогичен
КПД. Наиболее высокими значениями ц характеризуются про¬
цессы биотрансформации и экзоэргонические биоконверсии,
26Глава fТаблица 1.5. Эффективность некоторых процессов микробной
биотехнологииПроцесс биоконверсииБиокатализатор и тип процессаГлюкоза-^этанол Иммобилизованные клетки Zymo- 0,99monas tnobilis в проточном био¬
реактореФумарат аммоиия->аспа- Иммобилизованная аспартаза из 0,98рагиновая кислота Escherichia coliЭтанол-^дрожжевая био- Candida utilis, периодическое глу- 0,62масса бинное культивированиеУглеводы мелассы-кли- Brevibacterium jiavum, глубинное, 0,47Зинпериодическое культивирование (на производ-с подпиткойстве)0,61
(в лаборато-
рии)которые состоят из нескольких реакций, не требующих сопряжен¬
ных систем для регенерации кофакторов (табл. 1.5). Для более
сложных процессов, включающих рост микроорганизмов, зна¬
чения энергетического выхода бывают 0,50 ... 0,62 [15, 38].1.6. КОНЕЧНАЯ КОНЦЕНТРАЦИЯ ПРОДУКТАЭтот критерий • важен для тех биотехнологий, в структуре
себестоимости которых значительные расходы связаны с выде¬
лением продукта. Очевидно, чем выше конечная концентрация
продукта, тем легче его выделить и очистить. Считают, что
термофильная анаэробная переработка целлюлозосодержащих
субстратов в этанол станет рентабельной, если концентрация
спирта превысит 4,5% [46].Оправдано применение методов генетической инженерии для
улучшения свойств микроорганизмов — продуцентов ферментов.
Созданы штаммы дрожжей и бактерий Escherichia coli, содер¬
жащие до 120 копий нужного гена на клетку. В итоге такие
рекомбинанты и трансформанты способны продуцировать опре¬
деленный фермент в количестве 40 ... 60%. всего клеточного
белка [16]. Однако необходимо учесть, что высокая конечная
концентрация продукта без учета стехиометпических и кинети¬
ческих характеристик сама по себе не всегда свидетельствует
об эффективном биосинтезе и высокой продуктивности. В боль¬
шинстве случаев эти характеристики ухудшаются после дости¬
Основные критерии оценки биотехнологических процессов27жения определенной концентрации продукта в культуральной
жидкости. Это обусловлено следующим: ингибированием био¬
химических реакций конечным продуктом (при производстве
.лизина '[7]), разобщающим эффектом органических кислот
[30, 40], комплексным, тормозящим хметаболизм действием эта¬
нола, ацетона и бутанола [32], эффектом контактного ингиби¬
рования при высокой концентрации клеток [5] и др.1.7. НАЛИЧИЕ БАЛЛАСТНЫХ ВЕЩЕСТВ
В СРЕДЕ КУЛЬТИВИРОВАНИЯМожно отметить три основные причины появления химического
-балласта в культуральной жидкости. Балласт вносится в среду
культивирования с комплексными питательными субстратами —
мелассой, гидролизатами и пр., часть которых не утилизируется
микроорганизмами. Побочные химические вещества могут также
попасть в среду культивирования в результате определенных
технологических операций, таких, как стерилизация, регулиро¬
вание pH, химическое пеногашение. Балласт появляется в ре¬
зультате жизнедеятельности микроорганизмов в виде образова¬
ния побочных продуктов, которые не реутилизируются.При оценке биотехнологий этим веществам пока уделяют
недостаточно внимания. Однако их важно учитывать, особенно
в процессах бактериального синтеза. Во-первых, прокариоты
из-за различий в строении клетки более чувствительны к хими¬
ческому составу среды, чем эукариоты. Это проявляется, напри¬
мер, в осмотолерантности. Во-вторых, у бактерий в гораздо
большей степени, чем у дрожжей и мицелиальных грибов, вы¬
ражено свойство выделять в среду различные метаболиты. К со¬
жалению, в большинстве биотехнологий балласт не контроли¬
руют и не регламентируют. Это является существенной причи¬
ной ухудшения ряда технологических показателей. Можно
отметить следующие отрицательные последствия повышения со¬
держания балластных веществ:1) снижение выхода целевого продукта;2) осложнение процедуры выделения и очистки продукта;3) ухудшение качества продукта. Например, примесь молоч¬
ной кислоты в культуральной жидкости сильно ухудшает фи¬
зико-химические свойства сухого кормового концентрата
лизина;4) опасность загрязнения окружающей среды недостаточно
очищенными сточными водами.Дополнительные проблемы возникают, когда балласт явля¬
ется биохимически активным веществом. Так, образование и
накопление в среде уксусной кислоты ограничивает рост
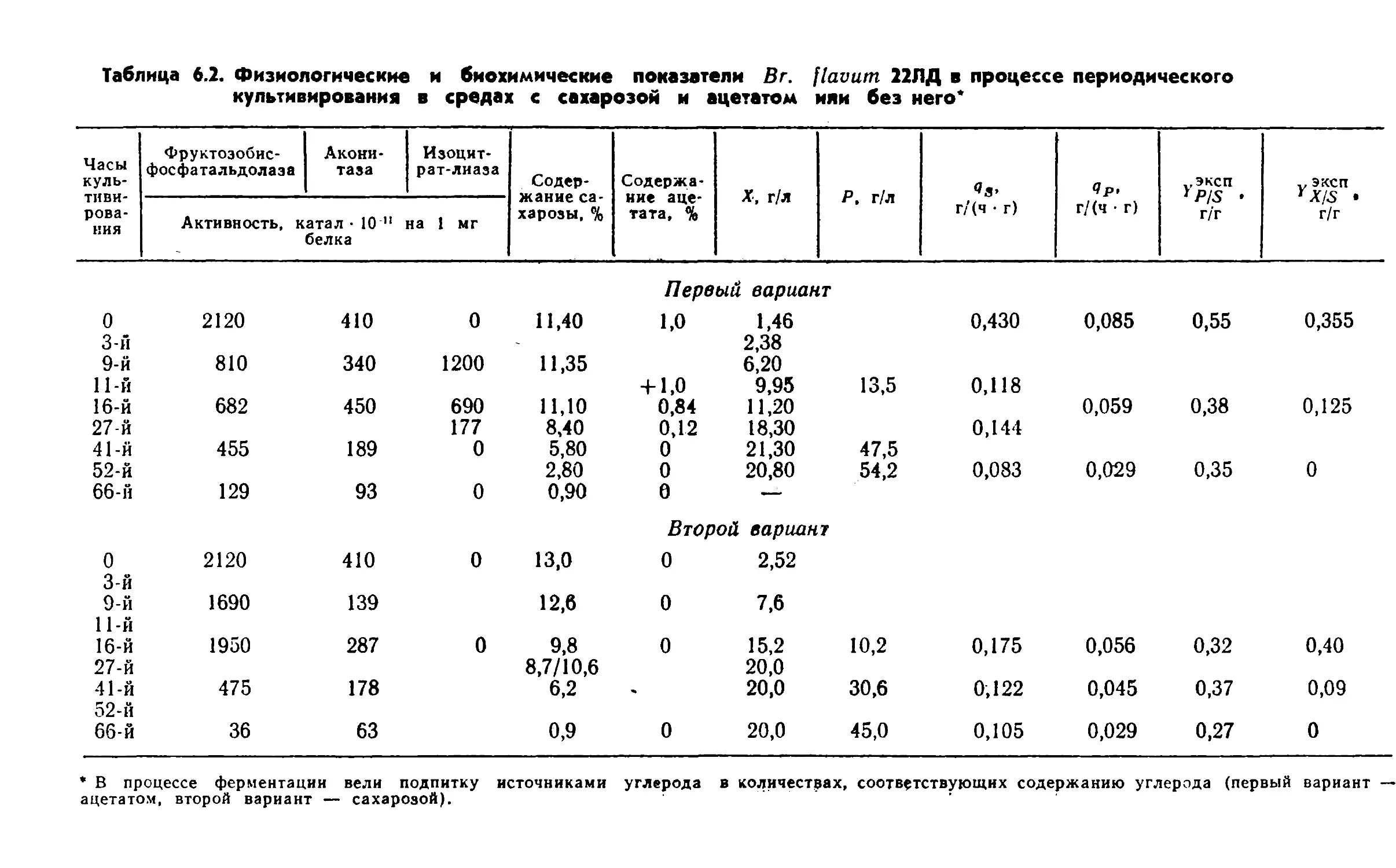
28Глава fТаблица 1.6. Синтез лизина В г. flavunj 22ЛД и Br. flavum RC 115
на мелассной среде с молочной кислотойМелассная среда с содержание РВ, %81012Культурар,
г/л•^ост*%Y p/s,
г/гр,г/л•^ост*%Yp/B;г/гр,г/л^ОСТ»%Y Р/8,
г/гBr. flavum
22ЛДконтроль —
без молочной
кислоты20,51,00,3424,01,30,2713,56,00,22с 1 % молоч¬
ной кислоты
Br. flavum
RC 11519,30,70,2920,10,90,225,04,50,08контроль —
без молочной
кислоты22,41,50,3534,20,70,3732,52,90,32с 1 % молоч¬
ной «кислоты20,22,00,3531,01,00,3525,03,10,26Примечание. Процесс культивирования периодический в течение 41 ч.биомассы в периодической культуре Escherichia coli. Молочная
кислота подавляет активность ферментов, в результате снижа¬
ется выход лизина у лизинпродуцирующих бактерий (табл. 1.6).
Вносимый с факторами роста балласт аминокислот оказывает
ингибирующее действие на метаболизм Brevibacterium flavum,1.8. НЕПРОДУКТИВНЫЕ ЗАТРАТЫ СУБСТРАТА
И ЭНЕРГИИ В ПРОЦЕССАХ
БАКТЕРИАЛЬНОГО СИНТЕЗАВ общем виде непродуктивные затраты выражают так:P=l— n= 1 — уэксп/утеор (112)Р может составлять величину от 0 до 1 и выражает ту часть
свободной энергии субстрата, которая теряется в процессе био¬
синтеза. В уравнении (1.12), когда Уэксп нормируется в зависи¬
мости от теоретического выхода, непродуктивные затраты вклю¬
чают все виды потерь свободной энергии субстрата на пути
превращения его в продукт. Эти потери можно подразделить
на две различные части. Происхождение энергетических потерь
первой части связано с физико-химической природой протека¬
ния биохимических реакций в клетке, в частности с энергообес¬
печением. Вторая часть потерь энергии обусловлена неэффек¬
тивным функционированием метаболизма. Другими словами.
Основные критерии оценки биотехнологических процессов29первая часть энергопотерь обусловливает разницу между зна¬
чениями Умакс и Уте°р, вторая часть — между Уэксп и Ума1<с.
Для определения потерь энергосодержания субстрата, связан¬
ных с неэффективным метаболизмом продуцента, используют
выражение [15]Этот подход близок к определению затрат на поддержание
метаболизма [15, 23].Непродуктивные затраты могут быть рассчитаны с помощью
уравнений баланса роста и синтеза продукта по любому ком¬
поненту или по любому элементу, входящему в состав компо¬
нентов (углероду, кислороду, азоту и др.)» либо по соответству¬
ющему энергетическому эквиваленту. Например, непродуктив¬
ные затраты кислорода в ходе роста биомассы и биосинтеза
продуктов определяют по выражениюЭтот подход был использован для количественного опреде¬
ления непродуктивных затрат кислорода при биосинтезе лизина,
для идентификации биохимических реакций, лежащих в основе
непродуктивного окисления субстрата, и для поиска путей
уменьшения этих затрат '[9, 15, 41].Существует удобный экспресс-метод определения общих не¬
продуктивных потерь энергии в процессах микробного синтеза.
Он основан на расчете газобалансовым способом количества
кислорода, используемого на потребление небольшого количе¬
ства («импульса») энергетического субстрата [31]. Отношение
экспериментально определенного биологического окисления к
полному химическому окислению данного субстрата связано с
коэффициентом р так [11, 23]*: р = БПК/ХПК.С помощью данного метода можнЪ количественно опреде¬
лить непродуктивные потери энергии и энергетическую эффек¬
тивность роста микроорганизмов в интересующих нас реальных
условиях культивирования, провести скрининг энергетической
эффективности окисления различных субстратов и их комбина¬
ций, дать косвенную оценку таких технологических параметров,
как скорость потребления субстрата и интенсивность тепловы¬
деления [9. 15, 24].Практический интерес представляет выяснение возможностей
минимизации непродуктивных затрат в процессах микробного
синтеза. Для этого необходимо знать, какие биохимические про¬
цессы составляют основу непродуктивных потерь субстрата и
энергии в жизнедеятельности микроорганизмов и каковы прин¬
ципы их регуляции. Эти вопросы, касающиеся процессов бакте¬
риального синтеза, будут рассмотрены в следующей главе. уэксп/умакс(1.13)(1.14)
БИОХИМИЧЕСКИЕ ОСНОВЫ
РЕГУЛЯЦИИ ЭФФЕКТИВНОСТИ
БАКТЕРИАЛЬНОГО СИНТЕЗАКак известно, рост бактерий и синтез ими продуктов может
быть реализован только на тех субстратах, которые могут
транспортироваться в клетки и использоваться в катаболиче-
ских и анаболических реакциях. Так, бактерии Pseudomonas
putida способны использовать около 200 различных субстратов
[49]. Однако метаболизм даже одного и того же субстрата,
например глюкозы, может проходить с помощью различных сис¬
тем транспорта в клетку, а также при функционировании аль¬
тернативных метаболических путей. Бактерии родов Brevibacte¬
rium, Micrococcus, Pseudomonas, Bacillus, Acinetobacter и дру¬
гие способны использовать несколько субстратов одновременно.Альтернативные системы транспорта и катаболизма, особен¬
ности их регуляции определяют как скорость, так и эффектив¬
ность синтеза продуктов.2.1. АЛЬТЕРНАТИВНЫЕ СИСТЕМЫ
ТРАНСПОРТА СУБСТРАТОВТранспорт субстратов у бактерий, за небольшим исключением,
проходит с помощью специфических переносчиков — пермеаз и
транслоказ. Эти системы являются мембранными белками, об¬
ладающими свойствами ферментов, так как могут быть консти¬
тутивными и индуцибельными, специфичны в отношении суб¬
страта и образуются лишь в таких условиях, в которых возмо¬
жен синтез белков. Но данные системы нельзя считать
•ферментами, ибо пермеазы не осуществляют химические пре¬
вращения субстратов.Транспорт веществ в основном проходит с помощью меха¬
низмов физической диффузии, облегченной диффузии, активным
Биохимические основы регуляции31транспортом с помощью транслокации групп, а также активным
транспортом без химической модификации транспортируемых
веществ.2.1.1. ДИФФУЗИЯПри физической диффузии транспорт веществ в клетку, как из¬
вестно, основан на разности концентраций субстратов вне и
внутри клеток. Так осуществляется перенос воды и кислорода
в клетку, а также многих органических кислот и аммиака.
Транспорт ионов аммония проходит с помощью переносчиков
[59].При облегченной диффузии молекулы субстратов перено¬
сятся в клетки по концентрационному градиенту с помощью
стереоспецифических переносчиков. В данном процессе, как и
при простой диффузии, энергия на стадии транспорта не рас¬
ходуется. Поскольку облегченная диффузия проходит с помо¬
щью переносчиков (часто при участии отдельных компонентов,
например фермента II фосфотрансферазной системы), она
подчиняется кинетическому закону насыщения. Данным меха¬
низмом транспортируются моносахара у Zymomonas mobilis
[83].2.1.2. АКТИВНЫЙ ТРАНСПОРТПРИ ПОМОЩИ ГРУППОВОЙ ТРАНСЛОКАЦИИНаиболее известной системой групповой транслокации является
фосфоенолпируват : сахарофосфотрансферазная система. Извес¬
тны также полифосфат : гексозотрансферазы; ацилфосфат : гек-
созофосфотрансферазы и гексозофосфат : гексозофосфотрансфе-
разы [20]. Однако их значение для транспорта сахаров у
бактерий относительно невелико. ФТС является мультикомпонент-
ной системой, состоящей из нескольких протеинов, которые
осуществляют перенос фосфатных групп от. фосфоенолпирувата
к сахару и дальнейший перенос сахарофосфатов через цитоплаз¬
матическую мембрану. Последовательность данных реакций
такова:Mg*+Фосфоенолпируват + Фермент I^P-Фермент 1-ьПируват;Р-Фермент 1 + НРгч=*Р-НРг + Фермент I;Р-НРг +Фермент 111^=±Р-Фермент III-fHPr;Комплекс фермента II
Р-фермент Ш + Глюкоза >Тлюкозо-6-Р4-Фермент IIIr
где фермент I — неспецифичный протеин ФТС; НРг — неспе¬
цифичный протеин, осуществляющий перенос фосфатной группы;
фермент II — мембранно-связанный протеин, специфичный к
глюкозе; фермент . III — протеин, переносящий фосфатную
группу, специфичный к глюкозе.Фермент I и НРг являются цитоплазматическими компонен¬
тами, ферменты II и III — мембранными белками. Последние
обусловливают специфичность транспортных систем к субстрату.С помощью ФТС проходит транспорт глюкозы, фруктозы,
маннозы, сорбитола и маннитола у Е. coli, большинства сахаров
у Salmonella typhymurium, Staphyloccocus aureus и бактерий рода
Streptococcus и Clostridium, глюкозы у Bacillus megaterium и
Bacillus subtilis *[83]. В то же время у Azotobacter vinelandii,
Micrococcus luteus, Pseudomonas aeruginosa и других глюкоза
транспортируется механизмом активного транспорта.ФТС имеет важное физиологическое значение у факульта¬
тивных и облигатных анаэробов, что объясняется следующим.
Данная система связывает транспорт и метаболизм субстрата,
так как фосфоенолпируват является промежуточным продуктом
гликолиза; в анаэробных условиях, когда выход АТР невелик,
ФТС позволяет экономить АТР, так как сахарофосфат сразу
включается в метаболизм 1[83]. При транспорте глюкозы в не-
модифицированном виде АТР расходуется на ее фосфорилиро-
вание при функционировании гексокиназыГексокиназа (КФ 2.7.1.1)Г лкжоза+АТР *-Глюкозо-6-фосфат+ADP.Облигатные аэробы (Azotobacter, Mycobacterium и др.), по
данным литературы, не имеют ФТС [27]. Однако ФТС обнару¬
жена также у аэробов Bacillus subtilis, Bacillus megaterium и др.
(табл. 2.1). У этих бактерий ФТС может быть менее сложной,
компонент НРг обычно отсутствует. Такой упрощенной ФТС
транспортируется фруктоза у аэробов Pseudomonas и фотосин¬
тезирующих бактерий [83].Обычная ФТС не функционирует у анаэробных бактерий, у
которых катаболизм глюкозы не проходит через гликолиз. Бак¬
терии Lactobacillus, Leuconostoc и др., в которых функциони¬
рует фосфокетолазная система катаболизма глюкозы, а также
Zymomonas mobilis, использующие путь 2-кето-3-дезокси-6-фос-
фоглюконовой кислоты (КДФГП), или путь Энтнер—Дудо-
рова, не имеют ФТС. Различие в системах транспорта, очевидно,
связано с неодинаковой стехиометрией генерации фосфоенолпи-
рувата из глюкозы (две молекулы — при гликолизе, одна —
при функционировании КДФГП и фосфокетолазногопути). Если
фосфоенолпируват используется на стадии транспорта, созда¬
ется дефицит данного катаболита для биосинтетических реак-
Биохимические основы регуляции33Таблица 2.1. Характеристика систем транспорта глюкозы у некоторых
бактерийОрганизмФТСАктивныйтранспортОблегченнаядиффузияЕ. coli+ _Bacillus megaterium+——В. subtilis+——Clostridium butyricum+——С. pasteurianum+——Staphylococcus aureus+——Micrococcus luteus—+—Mycobacterium smegmatis—+—Pseudomonas aeruginosa—+—Azotobacter vinelandii—.+—Brevibacterium flavum++—Zymomonas mobilis——+ций. Очевидно, по указанным причинам для Lactobacillus и
Leuconostoc характерны системы активного транспорту испрль-
зующие энергию протондвижущей силы, Zymomonas mobilis —
облегченная диффузия.2.1.3. АКТИВНЫЙ ТРАНСПОРТБЕЗ ХИМИЧЕСКОЙ МОДИФИКАЦИИ СУБСТРАТАКак известно, активный транспорт субстрата связан с расходом
химически связанной энергии в клетке. Известны два вида сис¬
тем активного транспорта, основанные на различном энергосо¬
пряжении: хемиосмотическое сопряжение и прямое использова¬
ние химически связанной энергии.Хемиосмотическое сопряжение. Согласно, хемиосмотическому
сопряжению, в процессе транспорта субстратов используетсяэнергия мембранного электрохимического потенциала (Дц,н+),
численное значение которого, деленное на число Фарадея, вы¬
ражают в виде протондвижущей силы и обозначают Др. Об¬
разование Д,ин+ при транспорте протона через мембрану наружу
и электронов — внутрь, когда внешняя сторона мембраны ста¬
новится электроположительной, а внутренняя — электроотрица¬
тельной, называют «первичным» активным транспортом. Энер¬
гия Д|хн+ (электрохимический градиент протонов) для транс¬
порта субстратов в клетку часто используется как транспорт
Н+ и субстратов внутрь клетки, при этом электрохимический
потенциал выравнивается.Передвижение субстрата путем использования электрохими¬
ческого градиента Н+ (иногда и Na+) называют «вторичным»3 — 261
34Глава 2активным транспортом [83]. Митчел ввел термины «симпорт»,
«антипорт» и «унипорт», чтобы охарактеризовать три основных
механизма котранспорта ионов и субстратов. Симпорт — сопря¬
жение, при котором разные молекулы или ионы транспортиру¬
ются с помощью одного и того же переносчика одновременно
в одном направлении; антипорт — перенос молекул в противо¬
положных направлениях; унипорт — перенос только субстрата
[85].Следовательно, в процессе дыхания или при действии АТР-
азы происходит выброс Н+ наружу через мембрану, а при
синтезе АТР и транспорте веществ — обратный процесс —
поступление Н+ в клетку. Таким образом, при активном транс¬
порте веществ тратится энергия, которая может быть использо¬
вана для создания макроэргических связей АТР. Транспорт
многих аминокислот, сахаров, витаминов и пр. осуществляется
хемиосмотическим сопряжением. Ярким примером последнего
является транспорт лактозы, галактозы, глюкозо-6-фосфата
у Е. coli [83].Прямое сопряжение транспорта с энергией. В процессе ак¬
тивного транспорта с прямым использованием энергии макро¬
эргических связей участвуют пермеазы и так называемый свя¬
зывающий белок, локализованный в периплазматическом
пространстве — между наружной и цитоплазматической мем¬
бранами. Данный тип транспорта характерен для грамотрица-
тельных бактерий. Поскольку осмотический шок приводит к по¬
тере связывающего белка, культивирование бактерий с данными
транспортными системами связано с особыми требованиями.
Шокчувствительным является транспорт сахаров (мальтозы,
арабинозы и др.), а также некоторых аминокислот у Е. coli и
Salmonella typhimurium i[83].При транспорте субстратов с участием связывающего белка
возможно йспользо&ание энергии АТР, ацетилфосфата и др.
Котранспорт ионов’ при этом отсутствует, однако дополнитель¬
ным фактором для транспорта веществ этим механизмом явля¬
ется энергизированное состояние мембран [83]. Следует отме¬
нять- что конкретный механизм переноса веществ данной систе-
Ай изучен пока недостаточно.ж, Таким образом, как ФТС, так и активный транспорт веществ
детализируются различными мембранными белками и получают
■ергию тремя независимыми путями. Если при транспорте глю-
ны с помощью ФТС расходуется энергия, включенная в мак-
Дфгические связи фосфоенолпирувата, то при активном транс-
Лрте — энергия мембранного электрохимического потенциалаД|1р+- Последний генерируется дыхательной цепью, а также
npjt транслокации протонов с помощью Са2+-, Мд2+-зависимых
аденозинтрифосфатаз либо обратным переносом электронов с
помощью трансгидрогеназы или неорганической пирофосфатазы.
Биохимические основы регуляции35Бактерии, не имеющие дыхательной цепи, энергизируют мем¬
брану исключительно мембранной АТР-азой путем гидролиза
АТР, накопленного при гликолизе.Специфичность транспорта к донору энергии приводит к
тому, что ингибиторы, блокирующие разные пути энергоснабже¬
ния клеток, эффективны только при функционировании опреде¬
ленной транспортной системы. Так, если ФТС блокируется фто¬
ридом, то активный транспорт — разобщителями (пентахлор-
фенолом и пр.), дыхательными ядами (KCN и др.),
ингибиторами ATP-азы (дициклогексилкарбодиимидом и пр.).
В£е эти ингибиторы могут быть использованы для идентифика¬
ции разных транспортных систем.В клетках бактерий глюкоза может переноситься также в
виде глюконата, образующегося при функционировании глюко¬
зодегидрогеназ и глюкозооксидазы. Известно несколько форм
глюкозодегидрогеназ, которые классифицируются по акцепто¬
рам водорода.Глюкозодегидрогеназы обнаружены у бактерий родов Pseu¬
domonas, Gluconobacter, Acinetobacter, Agrobacterium, Rhizobium
[47, 75] и относительно недавно — у Е. coli [78, 81]. Значения
/См для глюкозы у глюкозодегидрогеназ высокие (около 5 мМ)
по сравнению с такобыми у фосфотрансферазных и других
систем (10... 100 мкМ). Это указывает на то, что глюкозо-
дегидрогеназа имеет низкое сродство к глюкозе. Активность
фермента увеличивается при росте бактерий в средах с повы¬
шенными концентрациями глюкозы, в условиях лимита по ка¬
лию и фосфору или при высокой интенсивности аэрации, а
также при наличии 1 мМ 2,4-динитрофенола ;[ 101 ].Показано, что в некоторых случаях функционирование глю¬
козодегидрогеназы является альтернативным путем поддержа¬
ния энергизованного состояния мембран [101]. Аналогичную
функцию может выполнять также глюконатдегидрогеназа. На
рис. 2.1 приведена схема транспорта глюконата и 2-кетоглю-
коната, образующихся при действии глюкозодегидрогеназы или
глюконатдегидрогеназы. ,Глюкозо- и глюконатдегидрогеназы локализованы снаружи
цитоплазматической мембраны, поэтому глюкоза или глюконат
окисляются экстрацеллюлярно. Образующиеся при этом глю¬
конат и 2-дезоксиглюконат поступают в клетку с помощью
специфических транспортных систем. Поскольку скорость окис¬
ления глюкозы обычно выше скорости транспорта глюконата, в
среде накапливается глюконат ([32].Как видно, физиологической основой наличия различных
транспортных систем у бактерий является, во-первых, возмож¬
ность изменения затрат энергии на стадии транспорта и катабо¬
лизма глюкозы. Например, расходы энергии при транспорте
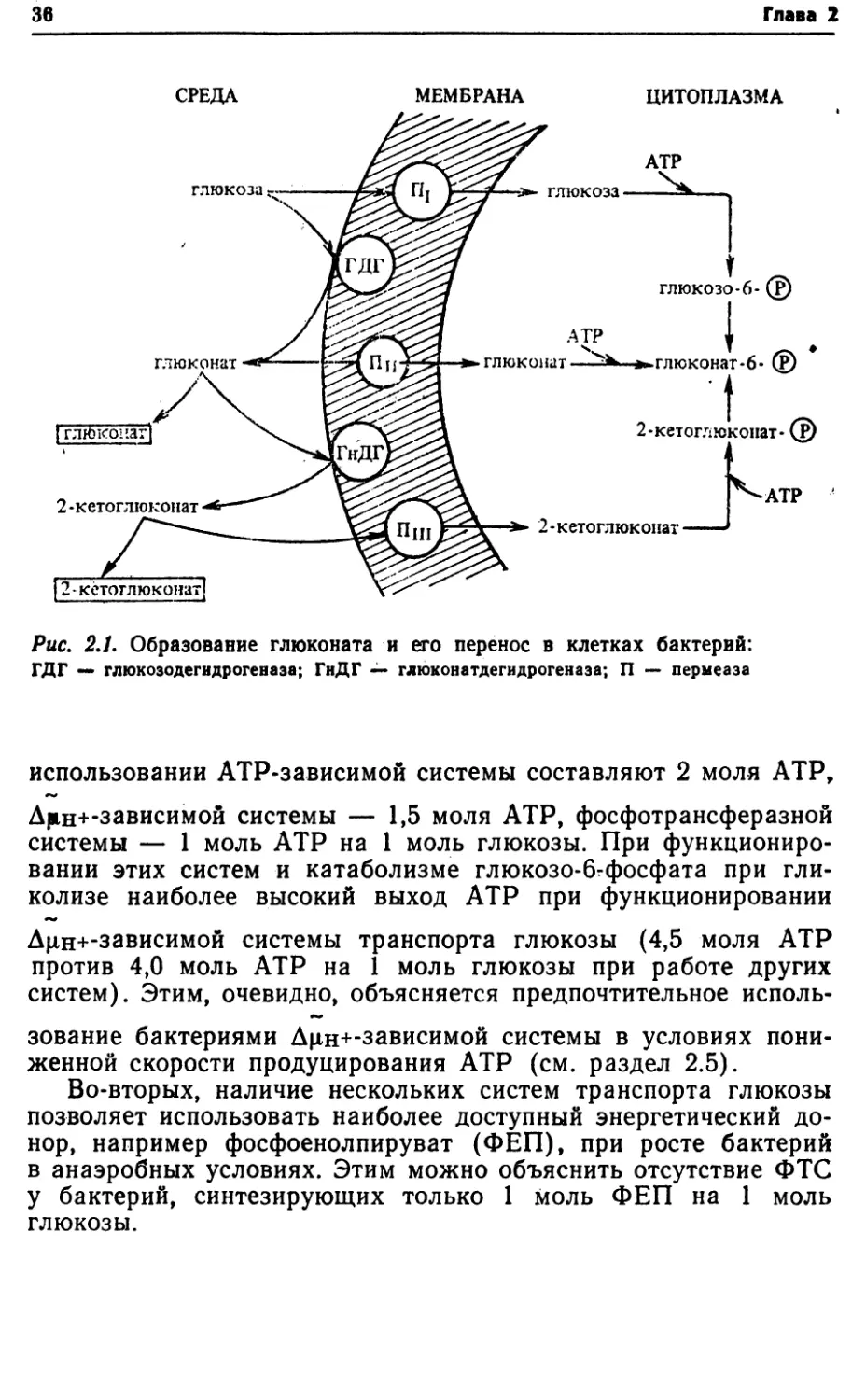
глюкозы и последующем образовании глюкозо-6-фосфата при
36Глава 2СРЕДА МЕМБРАНА ЦИТОПЛАЗМАРис. 2.1. Образование глюконата и его перенос в клетках бактерий:ГДГ — глюкозодегидрогеназа; ГнДГ — глюконатдегидрогеназа; П — пермеазаиспользовании ATP-зависимой системы составляют 2 моля АТР,Дрн+-зависимой системы — 1,5 моля АТР, фосфотрансферазной
системы — 1 моль АТР на 1 моль глюкозы. При функциониро¬
вании этих систем и катаболизме глюкозо-бгфосфата при гли¬
колизе наиболее высокий выход АТР при функционированииДц,н+-зависимой системы транспорта глюкозы (4,5 моля АТР
против 4,0 моль АТР на 1 моль глюкозы при работе других
систем). Этим, очевидно, объясняется предпочтительное исполь¬
зование бактериями Дцн+-зависимой системы в условиях пони¬
женной скорости продуцирования АТР (см. раздел 2.5).Во-вторых, наличие нескольких систем транспорта глюкозы
позволяет использовать наиболее доступный энергетический до¬
нор, например фосфоенолпируват (ФЕП), при росте бактерий
в анаэробных условиях. Этим можно объяснить отсутствие ФТС
у бактерий, синтезирующих только 1 моль ФЕП на 1 моль
глюкозы.
Биохимические основы регуляции372.1.4. СИСТЕМЫ ТРАНСПОРТА ГЛЮКОЗЫ
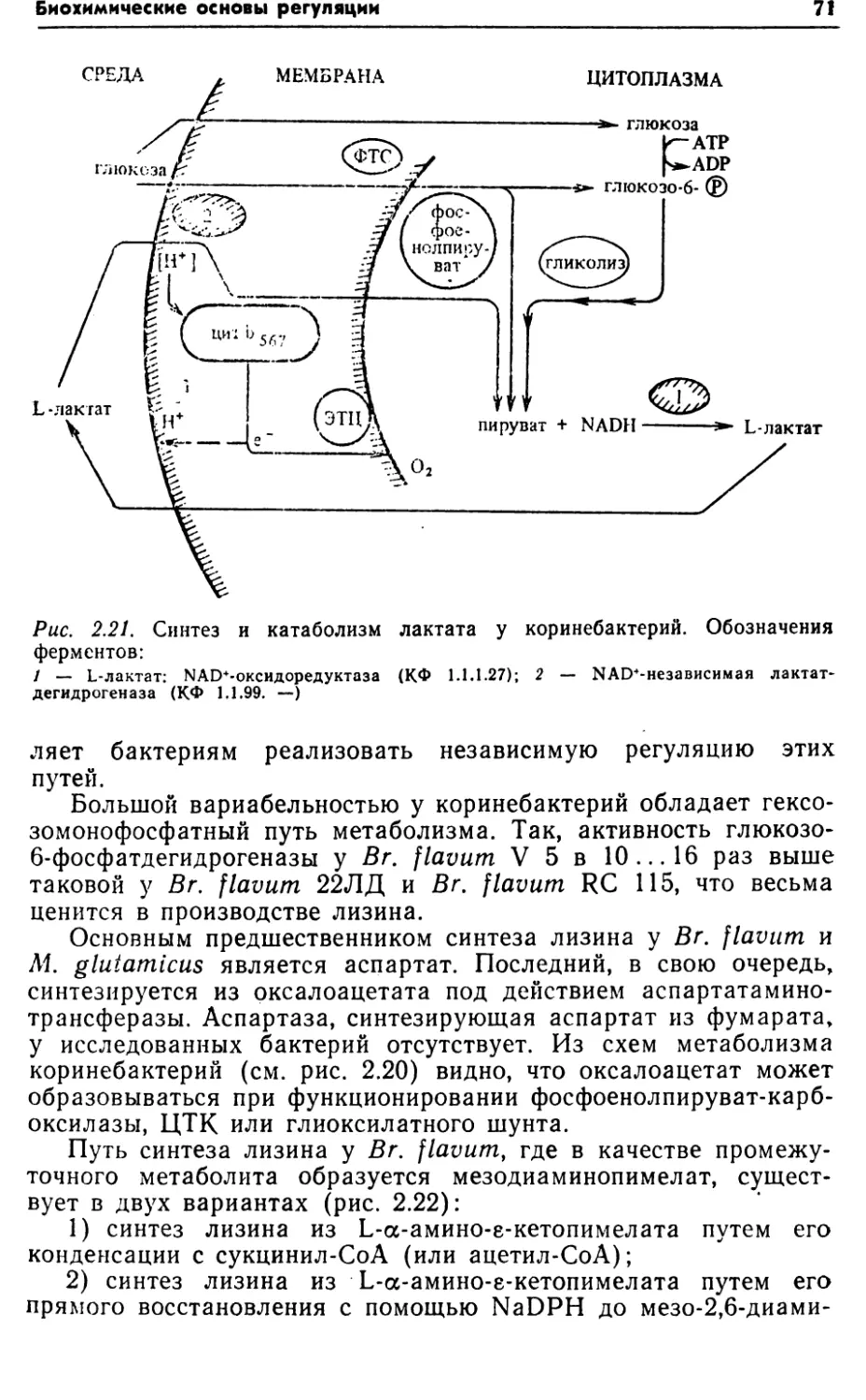
У КОРИНЕБАКТЕРИЙКоринеподобные бактерии Brevibacterium flavum и Micrococcus
glutamicus представляют определенный интерес для исследова¬
ния транспорта и катаболизма глюкозы по следующим причи¬
нам:1) ауксотрофные мутанты этих микроорганизмов используют
при получении L-лизина и других аминокислот в промышленных
масштабах;2) для Br. flavum и М. glutamicus характерно наличие мно¬
гих систем транспорта и большое количество ферментов ката¬
болизма субстратов. Могут иметь место альтернативные пути
переноса электронов в электронно-транспортной цепи;3) синтез лизина у данных бактерий зависит от регуляции
метаболизма.Br. flavum и М. glutamicus являются грамположительнымн
факультативными анаэробами, относящимися к группе корине-
подобных бактерий в качестве «Genera incertae sedis» [26]. Hef
единой точки зрения на определение систематического положе¬
ния Вт. flavum, однако в работах последних лет его характери¬
зуют как Corynebacterium sensu stricto l[57].Как известно, основными источниками углерода для бакте¬
рий служит глюкоза или сахароза, а также ацетат. В качестве
источника энергиии Br. flavum могут использовать Н2, так как
содержат гидрогеназу.Были проведены исследования со штаммами — ауксотро-
фами по гомосерину (или метионину и треонину) и дефицит¬
ными по биотину и пиримидиновой части тиамина — Br. flavum
22ЛД, Br. flavum RC 115 и Br. flavum V 5. В некоторых опытах
использовали прототрофные ревертанты этих штаммов, а такжеРис. 2.2. Транспорт меченой
козы в клетки при действии
ров:1 — контроль (без ингибитора);
Na3As03 (4- 10 » М); 3 — с KCN (5
4 — с дициклогексилкарбодиимидом1750I * 1250614С-глю-ингибито-2 — с
10-2 М);
(10-8 М)§ £
§ *
1*75010т. мин
38Глава 2Таблица 2.2. Скорость транспорта глюкозы в клетках
Br. flavum 22ЛД в зависимости от ее
концентрации в средеКонцентрация
глюкозы, мМТранспорт 6,4С-глю-
козы — число им¬
пульсов в минуту
на 1 мг клетокСоотношение кон¬
центрации глюкозы
в клетке и в среде0,00219710210,00553011010,0106777010,0207503910,0258153410,0409952610,05011272310,10012251211,00012251,31штамм Micrococcus glutamicus ТЗ i[8], ауксотрофный по метио¬
нину, треонину и изолейцину.Общую скорость транспорта глюкозы в клетках определяли
с помощью 614С-глюкозы, активность ФТС переноса глюкозы —
методом, описанным в работе ([67].Транспорт глюкозы в клетках Br. flavum 22ЛД осуществля¬
ется переносчиками против градиента концентрации. При содер¬
жании глюкозы в среде 0,002... 0,010 мМ соотношение глюкозы
в клетке и в среде составляет (70... 100) : 1 (табл. 2.2). При
инкубации клеток с глюкозой в присутствии ингибиторов окис¬
лительного (5-10-2 М KCN) и субстратного фосфорилирования
(4* 10~3 М Na3As03), а также ингибитора ATP-азы (10~3М N,N'-
дициклогексилкарбодиимида) градиент концентрации не дости¬
гается (рис. 2.2). Транспорт глюкозы против градиента концен¬
трации у Br. flavum всегда отсутствует при действии N.N'-ди-
циклогексилкарбодиимида, но не при добавлении относительно
низких концентраций ингибиторов переноса электронов по ды¬
хательной цепи. Движущей силой транспорта глюкозы у Вг.
flavum является мембранный электрохимический потенциал,
создаваемый при функционировании дыхательной цепи, а также
при гидролизе АТР, генерируемого в результате функциониро¬
вания как гликолиза, так и дыхательной цепи.Показано, что итах при транспорте глюкозы у Br. flavum
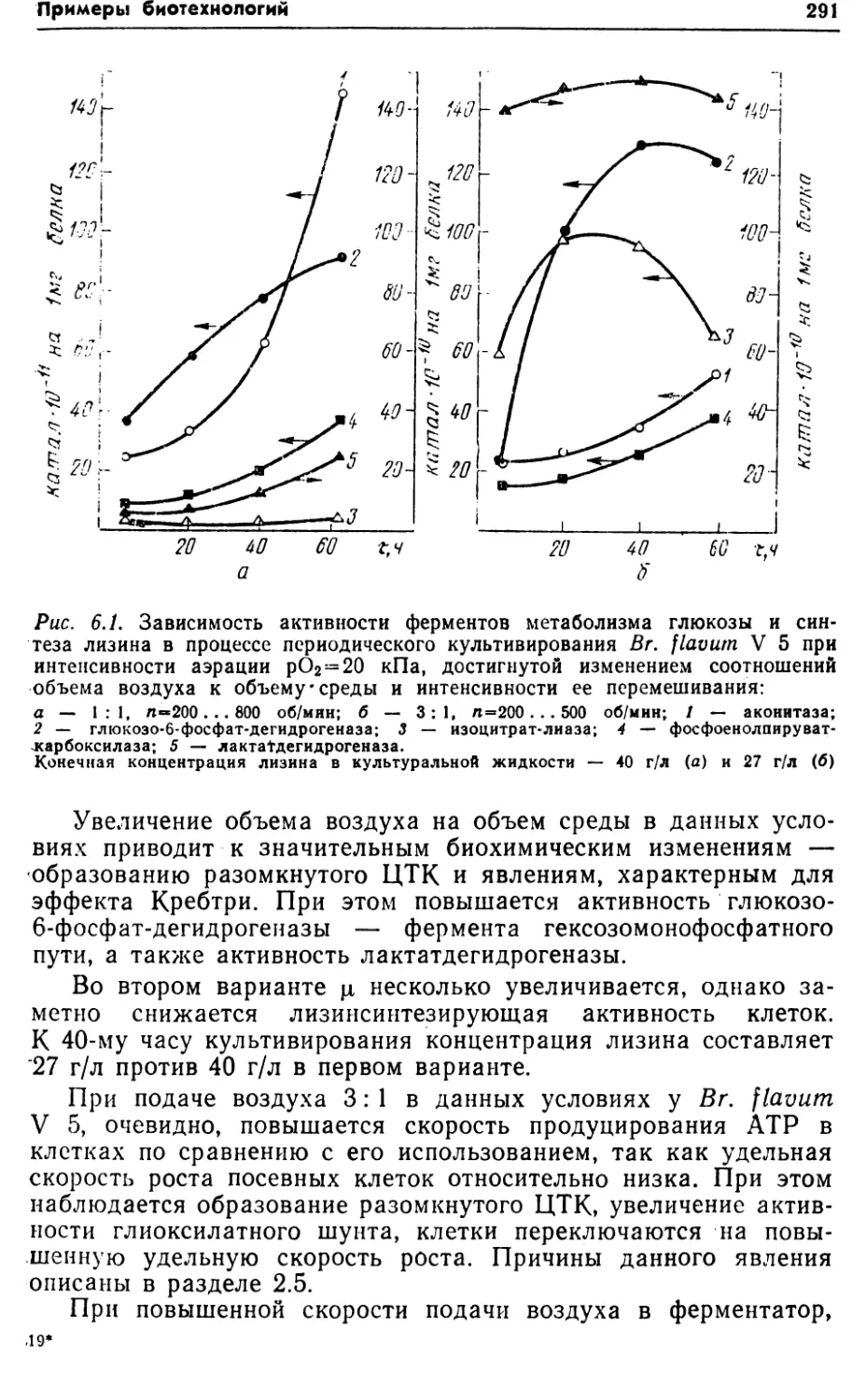
зависит от того, использованы ли в исследованиях клетки с вы¬
сокой активностью ферментов гликолиза (гликолитические
клетки) или клетки с высокой активностью ЦТК. Если скорость
транспорта глюкозы у гликолитических клеток равна41,6 нмоль/(мин-мг), то у клеток с ЦТК — 19 нмоль/(мин-мг),
т. е. гораздо ниже (рис. 2.3).
Биохимические основы регуляции3 9гРис. 2.3. Изменение скорости
транспорта меченой глюкозы (v)
в клетки Br. flavum 22ЛД в за¬
висимости от концентрации глю¬
козы в среде:/ — гликолитические клетки; 2 -
клетки с ЦТК25 50 ~75 100 125
Концентрация глюкозы в сре¬
де, мкмоль /млМетодом двойных обратных координат по Лайнуиверу—
Берку определены величины Км: у гликолитических клеток —26,7 мкМ, у клеток с ЦТК — 18 мкМ (рис. 2.4).При проведении транспорта глюкозы в клетки в течение
6 мин и разделении экстрагированной из клеток смеси глюкозы
и ее фосфатов на колонке Дауэкс 1X8 показано, что у клеток
с ЦТК около 65% глюкозы находится в свободной форме
(фракция, экстрагируемая водой), 35% — в виде фосфатов
(фракция, экстрагируемая формиатом). У гликолитических кле¬
ток соотношение глюкозы и глюкозо-6-фосфата в клетках
иное — большая часть глюкозы обнаружена в виде глюкозо¬
б-фосфата. Данная закономерность подтвердилась также при
определении глюкозо-6-фосфатов при осаждении Zn/Ва-реак-
тивом.Можно предположить, что у Br. flavum существуют две
транспортные системы для глюкозы:транспортирующая глюкозу в свободной форме;
транслоцирующая глюкозу в виде глюкозо-6-фосфата.При инкубации пермеабилизованных толуолом клеток с фос-
фоенолпируватом и АТР было доказано наличие фосфоенолпи-
руватзависимой ФТС переноса глюкозы *[67].0,0025
| 0,0020
Ч ОШ=е 'омй^ /п,zz-0,06 ~0t020,02 0,06 0,10 О,К
1/5, мл/Ак мольРис. 2.4. Зависимость скорости тран¬
спорта меченой глюкозы в клетки
Br. flavum 22ЛД от концентрации в
среде (по Лайнуиверу—Берку):1 — гликолитические клетки; 2 — клетки
с ЦТК
40Глава 2Рис. 2.5. Изменение содержания меченой глю¬
козы в клетках Br. flavum 22ЛД. во времени
при инкубации в 1/15 М фосфатном буфере:1 — без глюкозы и ингибитора; 2 — то же, но
с дициклогексилкарбодиимидом (10~3 М)Следовательно, у коринебактерий имеются две системы пере¬
носа глюкозы в клетках:транспорт свободной глюкозы, зависимый от Дцн+. Вели¬
чина Км данной системы около 18 мкМ, t»max равно 19 нмоль/
(мин-мг);ФТС, транспортирующая глюкозу в виде глюкозо-6-фосфата.
Величина /См этой системы около 27 мкМ, vmax равно
42 нмоль/(мин-мг).Следует отметить, что транспорт глюкозы обеими системами
требует расхода энергии. Энергозависимым процессом у Вг.
flavum является не только транспорт глюкозы в клетку, но и ее
поддержание в клетках против градиента концентрации. Пос¬
леднее подтвердилось данными выхода глюкозы из клеток при
действии дициклогексилкарбодиимида (рис. 2.5).Увеличение конверсии субстрата в продукт в биотехнологи¬
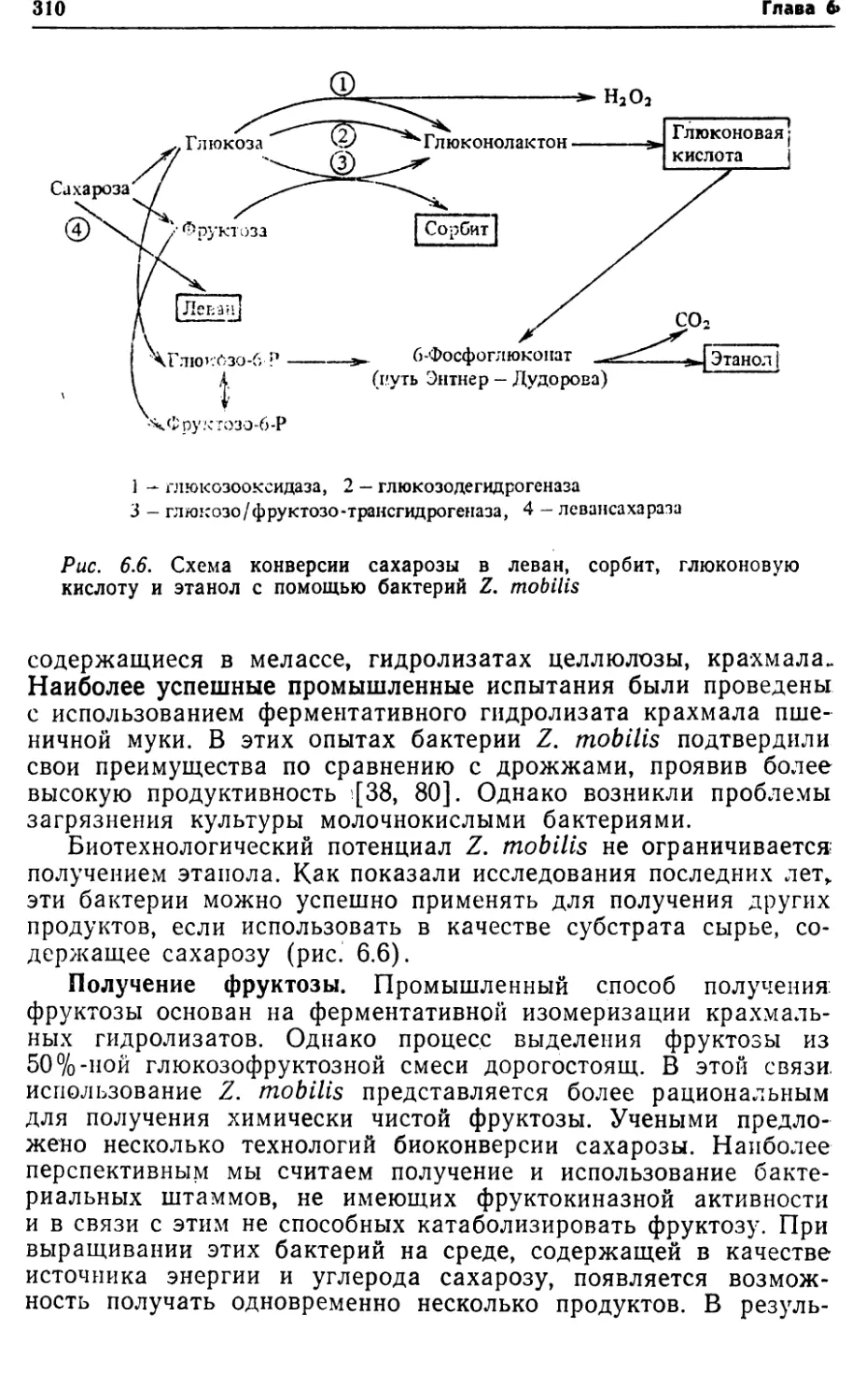
ческом процессе может быть достигнуто, • в частности, повыше¬
нием активности систем транспорта субстратов, имеющих
меньшие расходы энергии.2.2. ПУТИ КАТАБОЛИЗМА СУБСТРАТОВ У БАКТЕРИЙРост бактерий складывается из двух фаз: катаболизма и ана¬
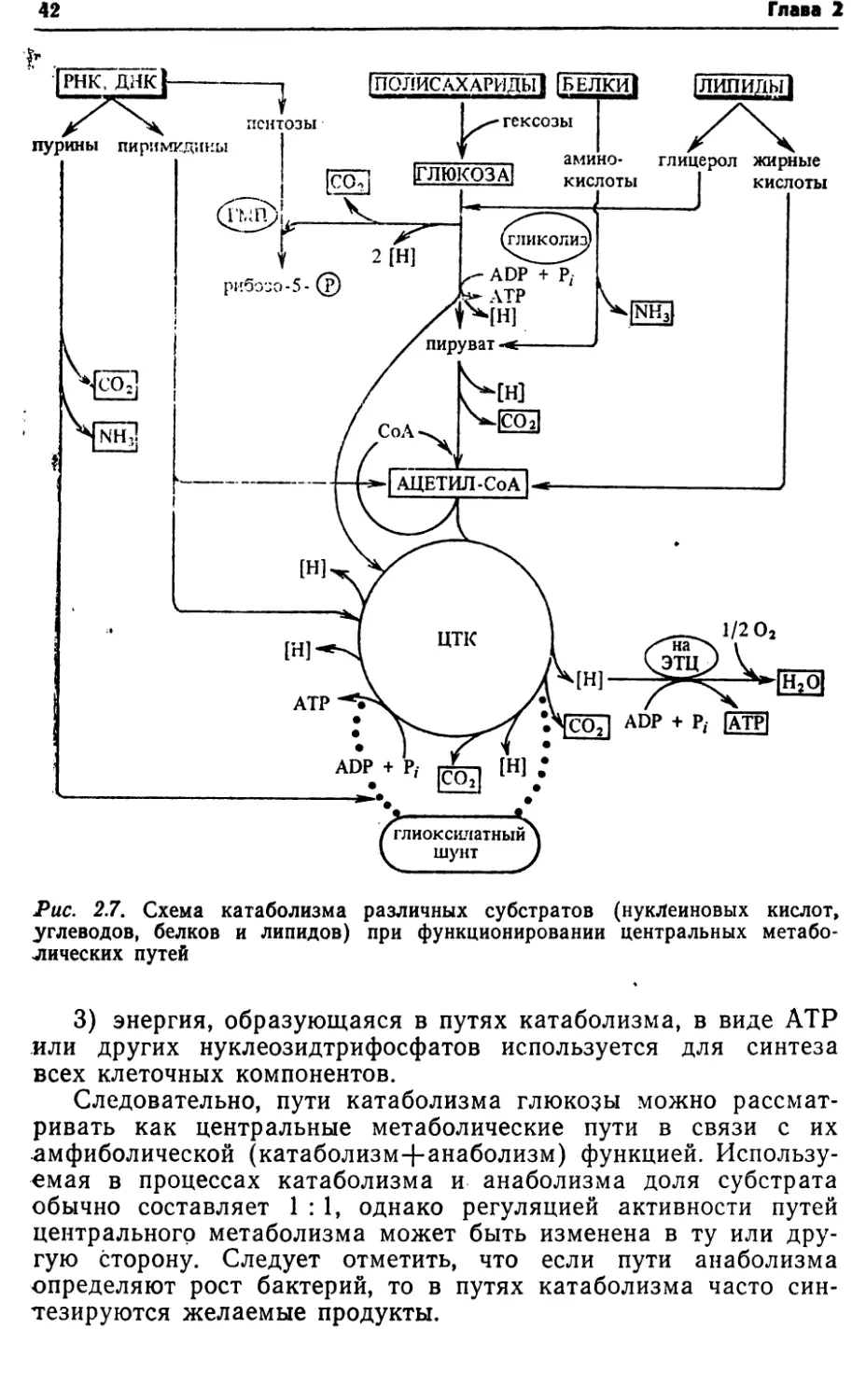
болизма. В процессах катаболизма и анаболизма гетеротрофных
бактерий наиболее важное значение имеют пути катаболизма
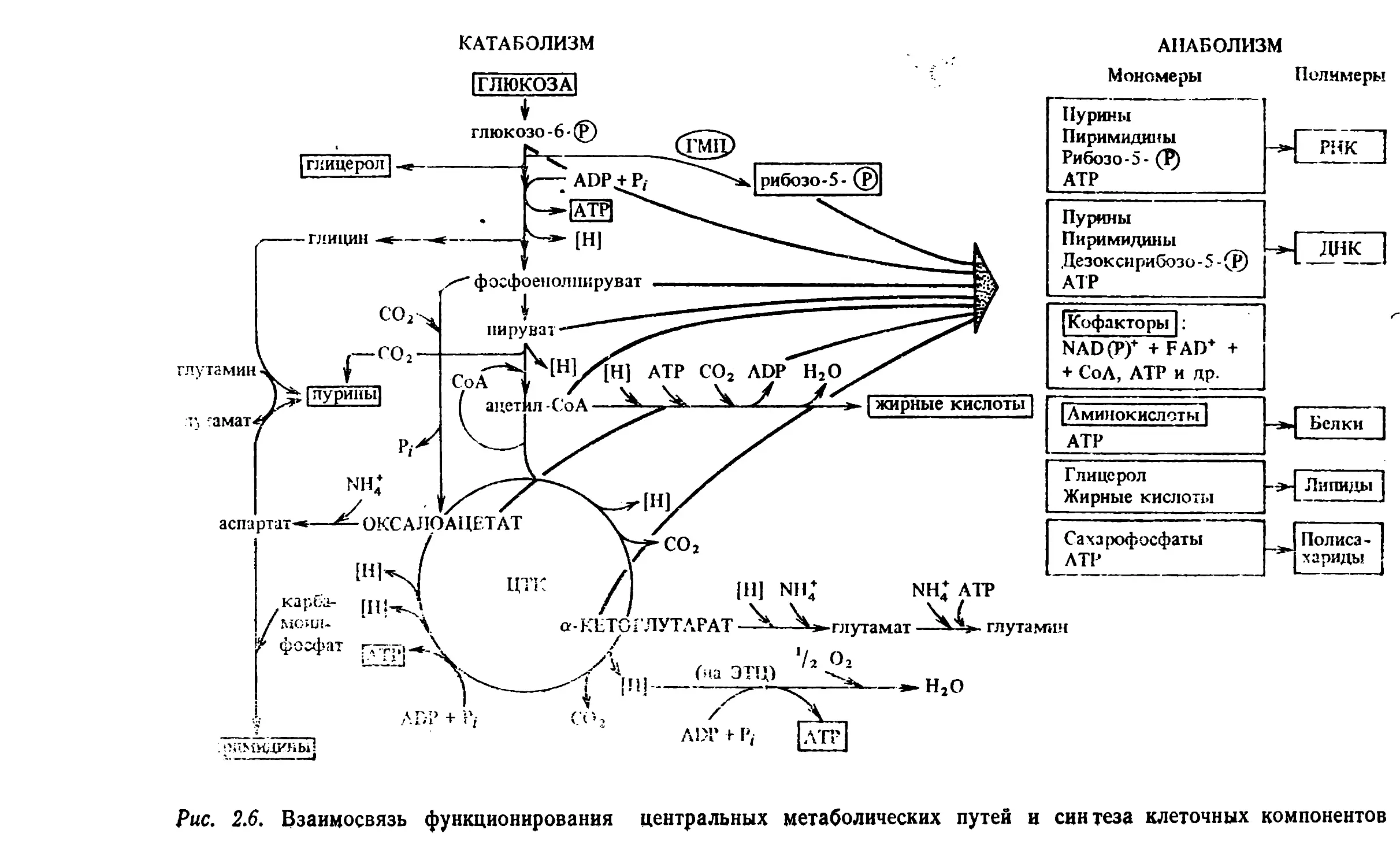
глюкозы. Это обусловлено следующим:1) при их функционировании происходит извлечение и пос¬
ледовательное запасание энергии в виде макроэргических свя¬
зей, а также образование промежуточных блоков для синтеза
всех аминокислот и клеточных компонентов (рис. 2.6);2) в данных путях происходит не только катаболизм угле¬
водов, но и конечный катаболизм аминокислот, белков, липидов,
углеводов, используемых в качестве субстратов и при эндоген¬
ном дыхании клеток в условиях снижения удельной скорости
их роста (рис. 2.7);
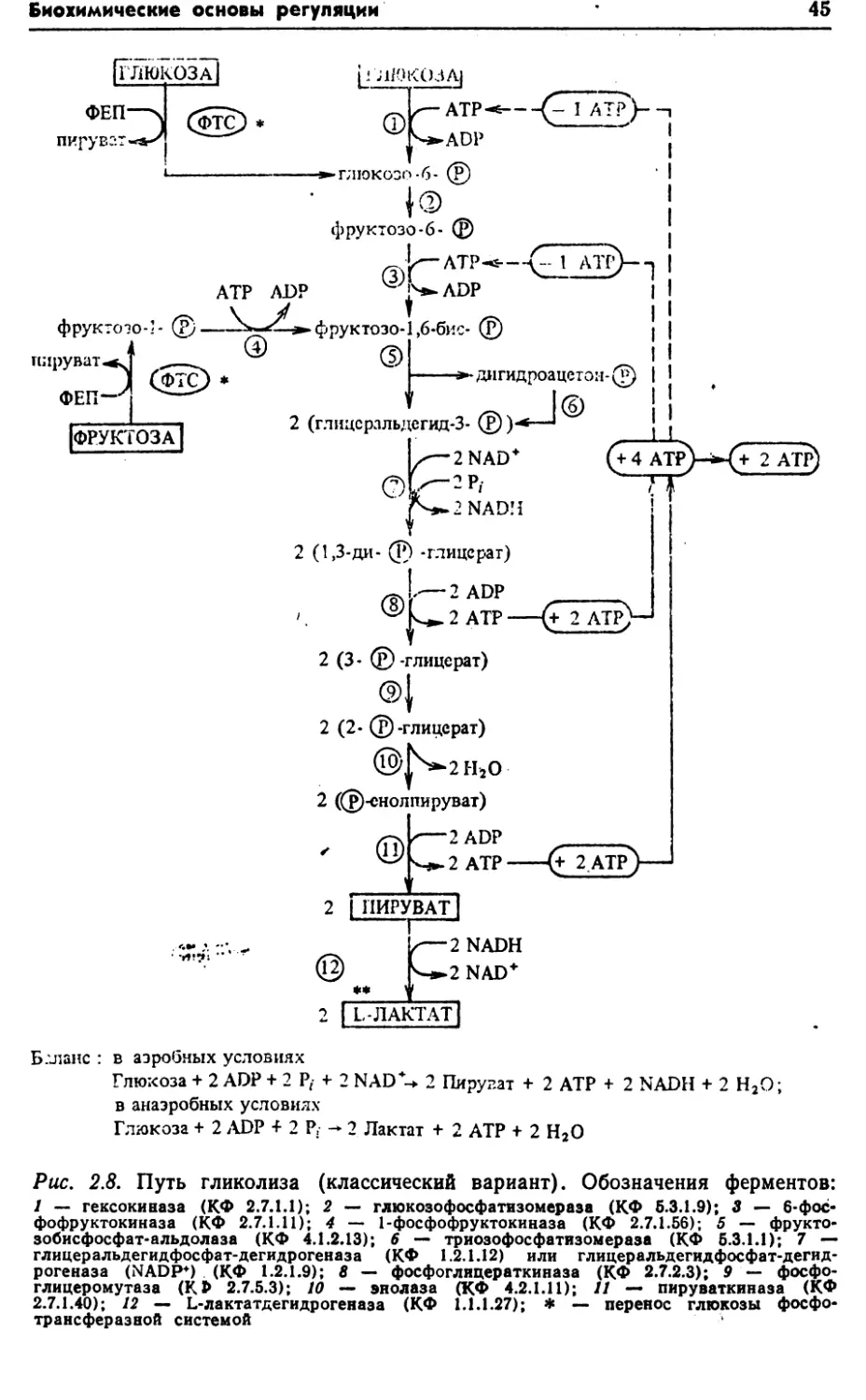
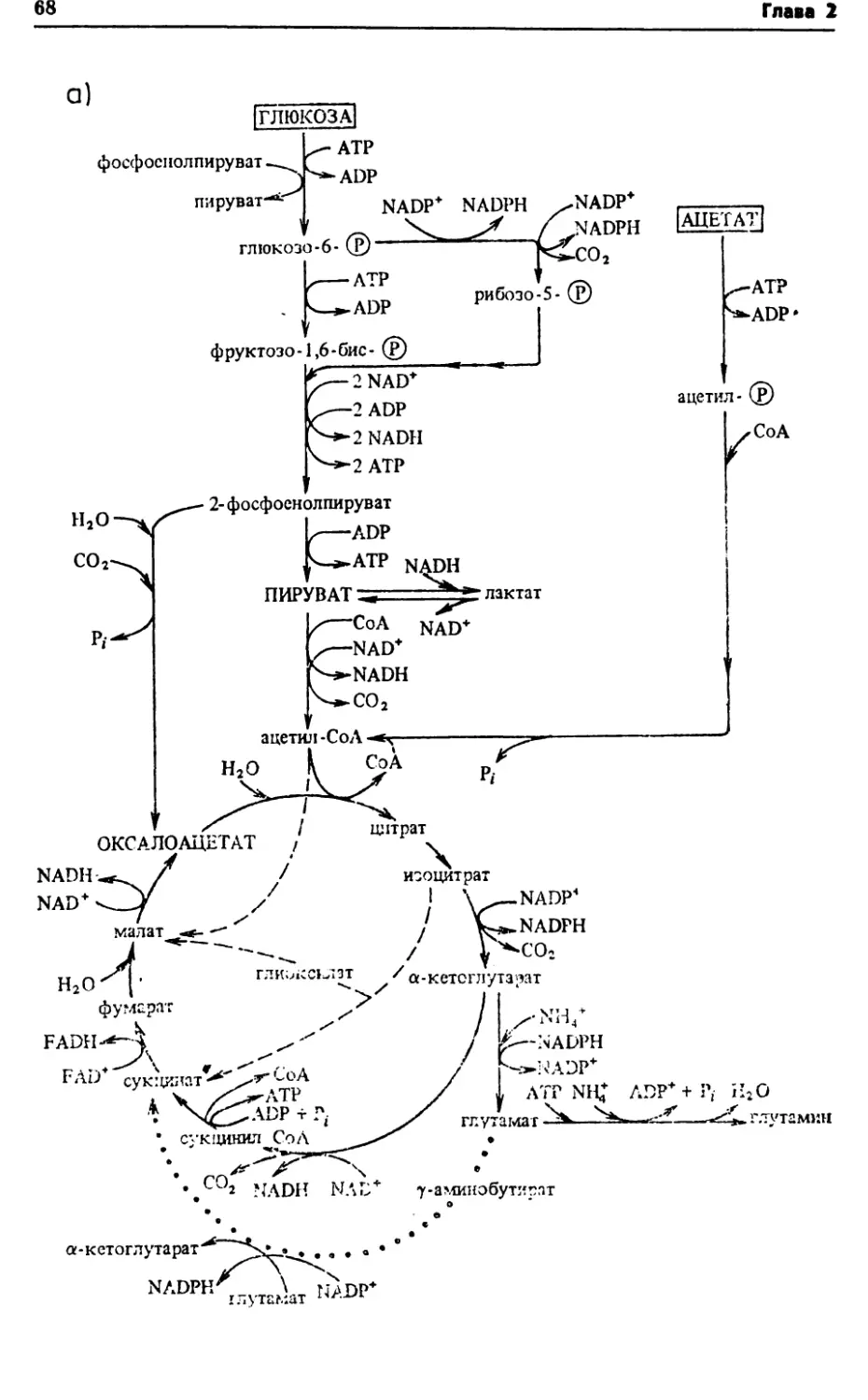
КАТАБОЛИЗМ
IГЛЮКОЗА1Iглюкозо-6-(£)|глицер6л]ч>4.V—: ADP+ Р/■ ^ 1глугг мин V |1^Гпурины|
т, амат^гNH; АТРАНАБОЛИЗМ
Мономеры ПолимерыПурины
Пиримидины
Рибозо-5 - (Р)
АТРПурины
Пи ри МИДИИ LIДезоксирибозо-5 - (£)
АТР|Кофакторы |:
NAD(P)+ + FAD* +
+ СоА, АТР и др.| Аминокислоты!
АТРГлицерол
Жирные кислотыСахзрофосфатыАТРглутамат —глутаминVa о2Н20-*-J~ РНК |
-*1 ДНК IБелкиЛипидыПолиса¬харидыРис. 2.6. Взаимосвязь функционирования центральных метаболических путей и синтеза клеточных компонентов
42Глава 2РНК. днк[-пурины пирнмкдины(полисахариды! 1БНЛКИ1 I ЛИПИДЫ IУ aivinnu- 1 лице[СОл| [ГЛЮКОЗА] кислоты jамино- глицерол жирные
кислотыРис. 2.7. Схема катаболизма различных субстратов (нуклеиновых кислот,
углеводов, белков и липидов) при функционировании центральных метабо¬
лических путей3) энергия, образующаяся в путях катаболизма, в виде АТР
или других нуклеозидтрифосфатов используется для синтеза
всех клеточных компонентов.Следовательно, пути катаболизма глюкозы можно рассмат¬
ривать как центральные метаболические пути в связи с их
амфиболической (катаболизм+анаболизм) функцией. Использу¬
емая в процессах катаболизма и анаболизма доля субстрата
обычно составляет 1:1, однако регуляцией активности путей
центрального метаболизма может быть изменена в ту или дру¬
гую сторону. Следует отметить, что если пути анаболизма
определяют рост бактерий, то в путях катаболизма часто син¬
тезируются желаемые продукты.
Биохимические основы регуляции43Изучение путей катаболизма глюкозы у бактерий — проду¬
центов различных веществ важно по следующим причинам:1) функционирование этих путей часто определяет матери-
ально-энергетический выход компонентов для биосинтеза про¬
дуктов и тем самым величины YP/s, Yx/s',2) регуляция центральных метаболических путей определяет
удельную скорость роста клеток ц и образование физиологи¬
чески активной биомассы X в условиях ферментации;3) в зависимости от функционирования указанных метабо¬
лических путей меняется скорость потребления субстратов клет¬
ками qs. Таким образом, функционирование центральных мета¬
болических путей определяет, в частности, продуктивность,
процесса гР (см. раздел 2.6).Катаболизм глюкозы у бактерий обеспечивается в основном
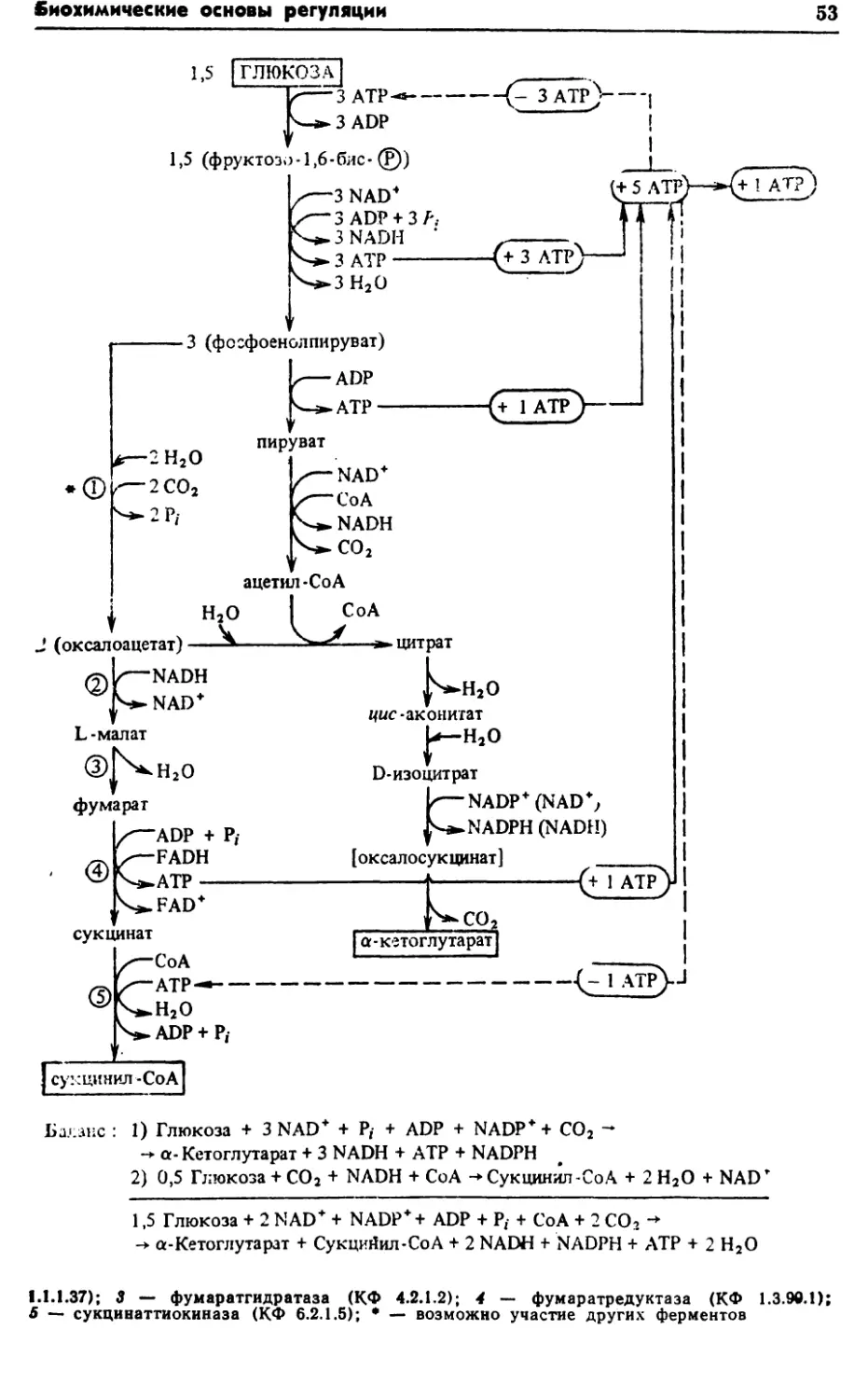
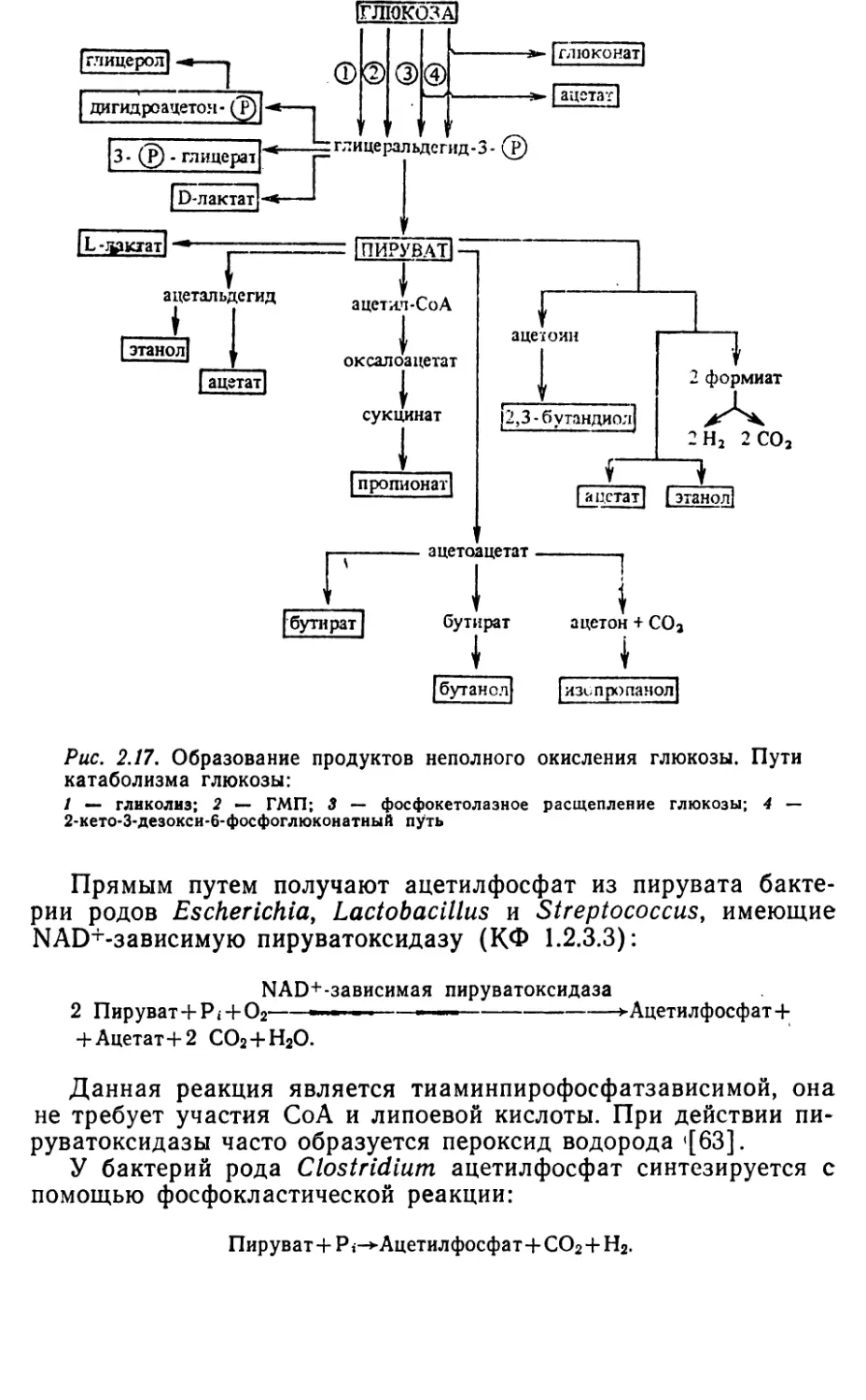
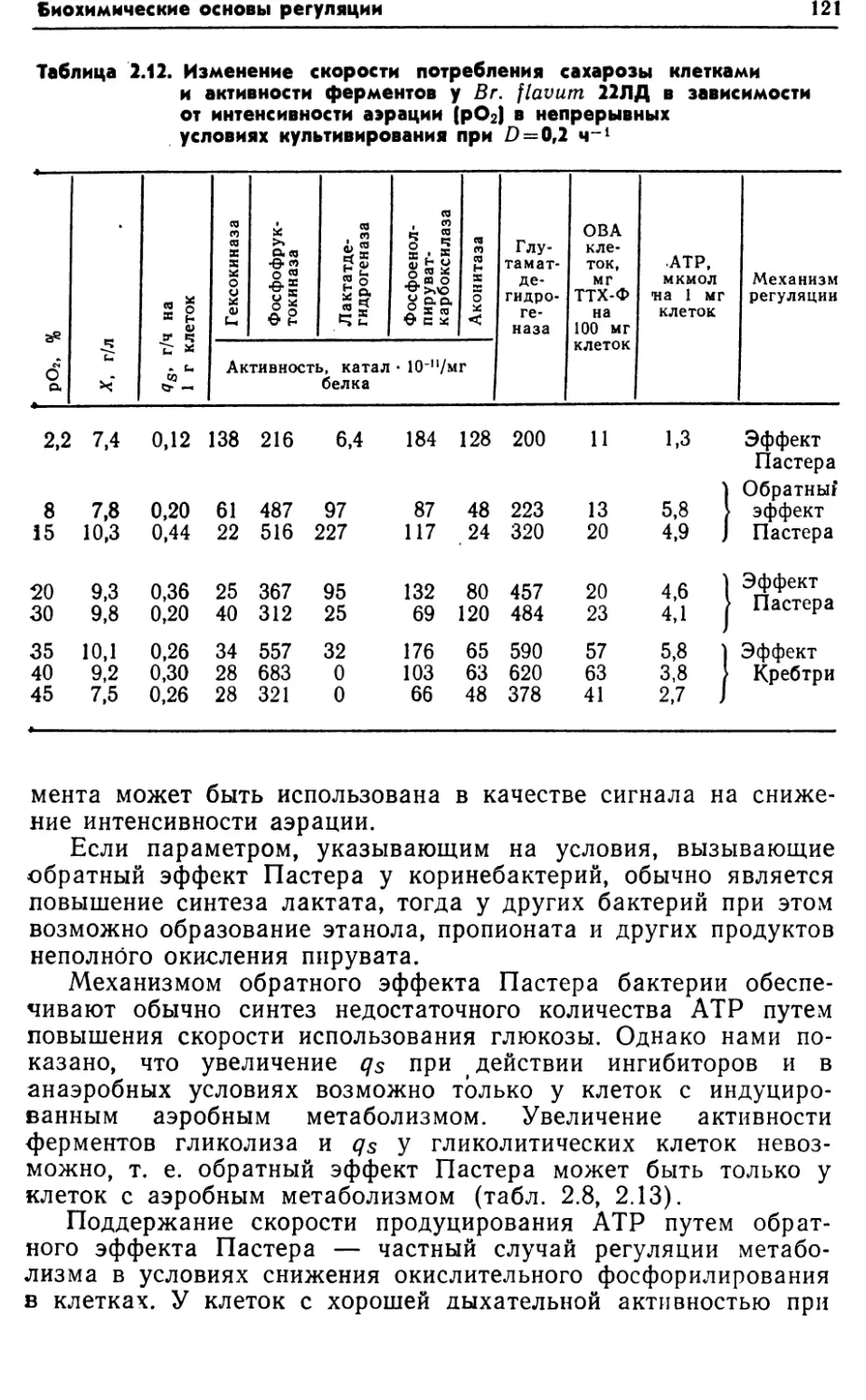
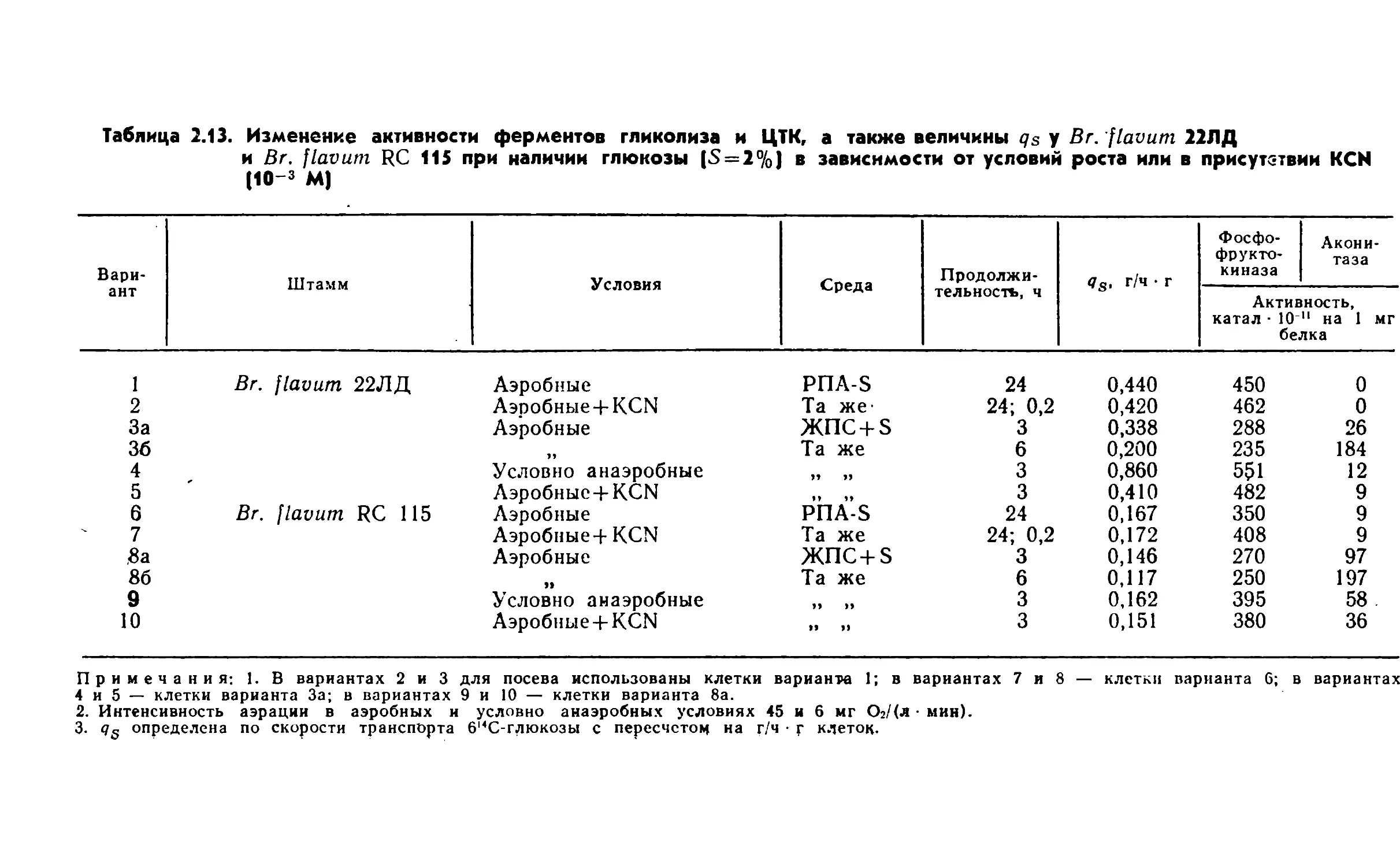
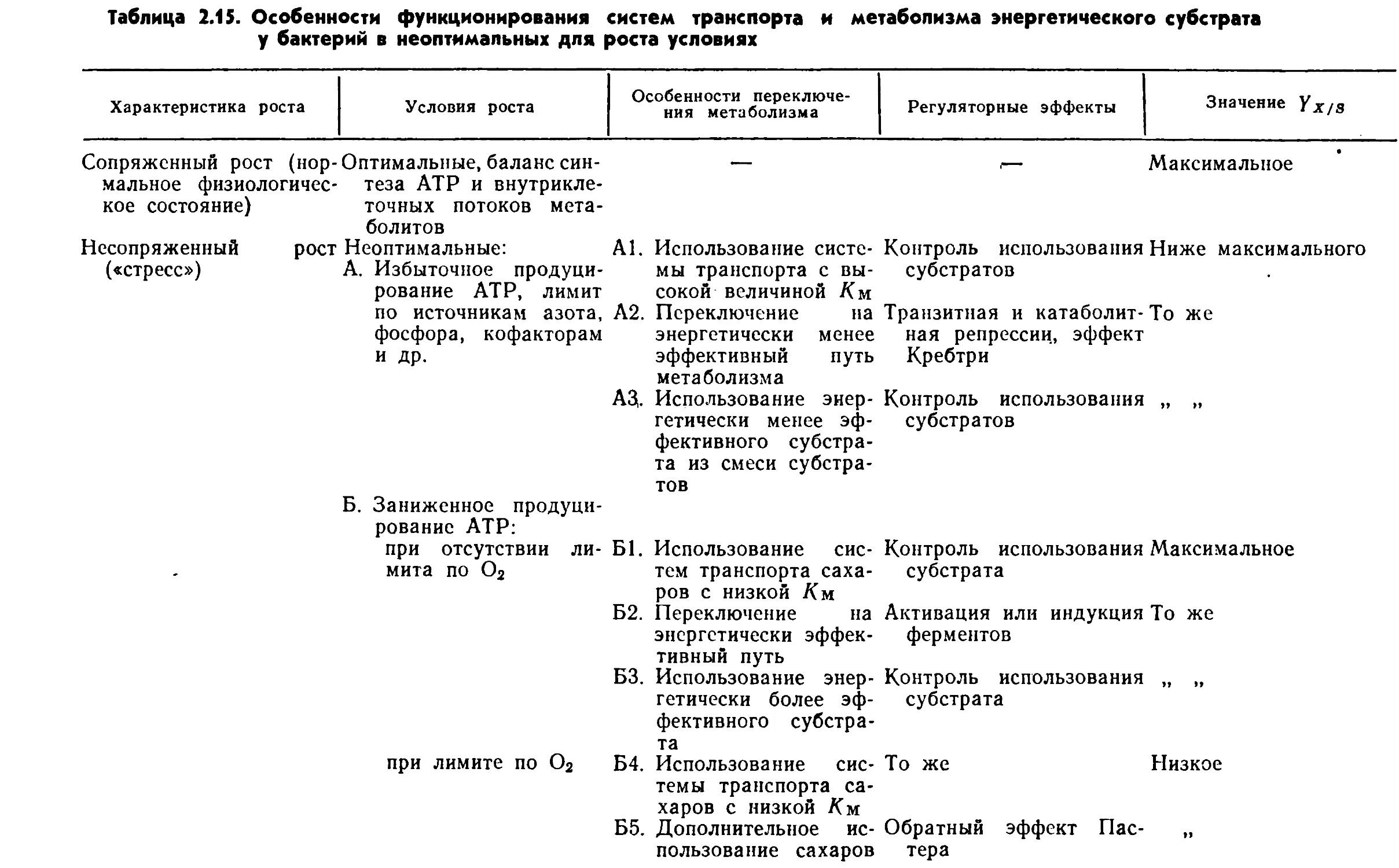
функционированием центральных метаболических путей: фрук¬
тозо-1, 6-бисфосфатного (гликолиз, или путь Эмбдена—Мейер¬
гофа—Парнаса), цикла трикарбоновых кислот (или цикл Креб¬
са) и гексозомонофосфатного (или пути Варбурга—Дикенса—
Хореккера). Однако у бактерий наблюдаются отклонения от
классических вариантов этих метаболических путей.Включение глюкозы в центральные метаболические пути за¬
висит от системы ее транспорта в клетки (см. раздел 2.1). При
физической и облегченной диффузии, а также при активном
транспорте глюкоза включается в клетки в немодифицирован-
ном виде, при транспорте фосфотрансферазной системой —
в виде глюкозо-6-фосфата, при функционировании глюкозоде¬
гидрогеназы — в виде глюконата (см. рис. 2.1). Образование
последнего соединения из глюкозы в основном происходит при
действии глюкозодегидрогеназ:Г люкозодегидрогеназа
Глюкоза *-Глюконат+ [Н].Простетические группы, участвующие в отщеплении [Н], при
этом могут быть разными, на чем и основана классификация
глюкозодегидрогеназ. В настоящее время имеются данные о
существовании следующих форм указанных ферментов: NAD+-
зависимые (КФ 1.1.1.118), ЫАОР+-зависимые (КФ 1.1.1.47 и КФ
1.1.1.119), а также пиррол-хинолин-хинонзависимые или PQQ-
зависимые (КФ 1.1.99.17) >[36].Образование глюконата возможно также при функциониро¬
вании глюкозооксидазы, однако при этом дополнительно обра¬
зуется пероксид водорода:Глюкозооксидаза (КФ 1.1.3.4)Г люкоза+Ог —«-Глюконат+НзОг.Глюкозодегидрогеназы обычно являются мембранно-связан¬
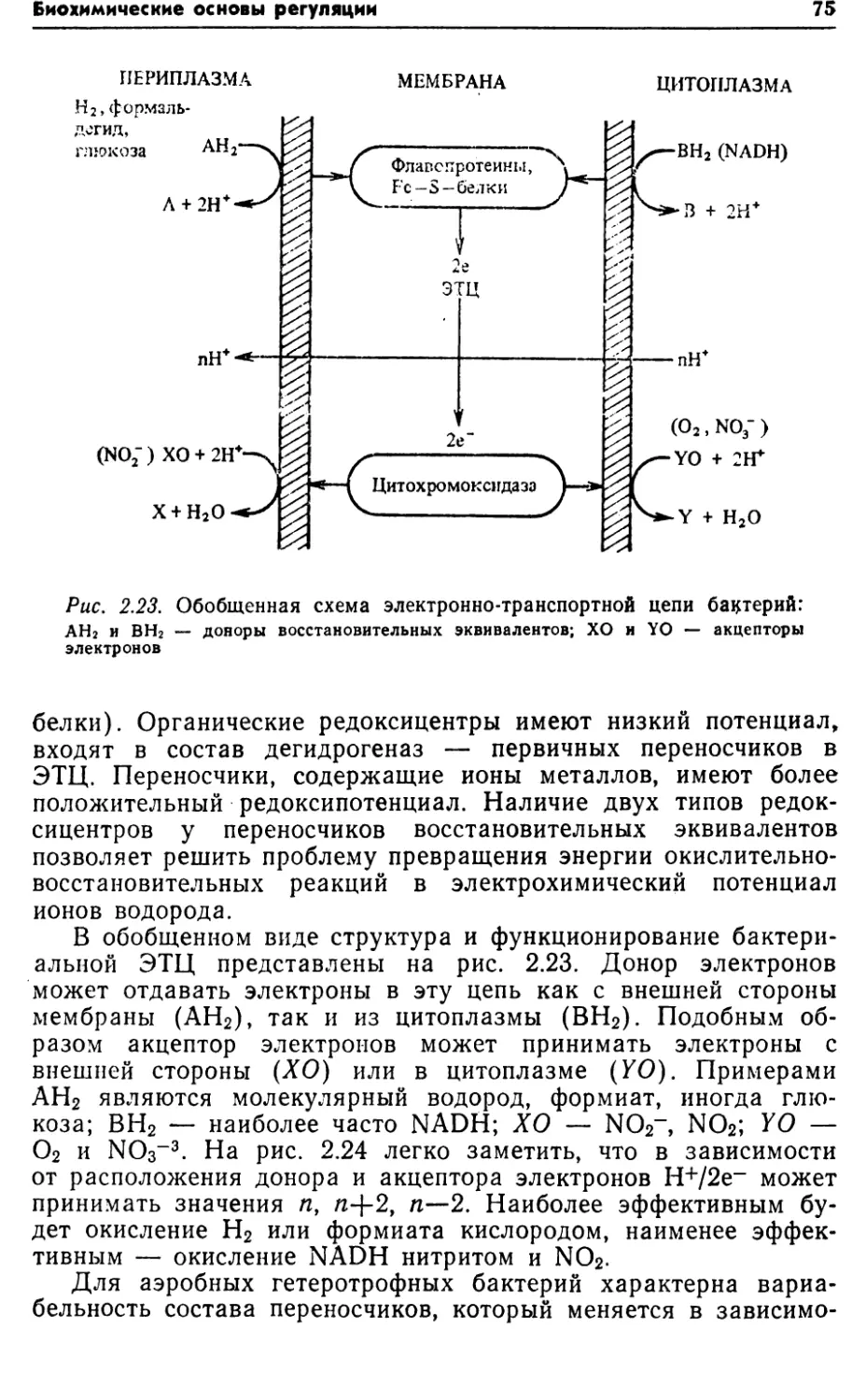
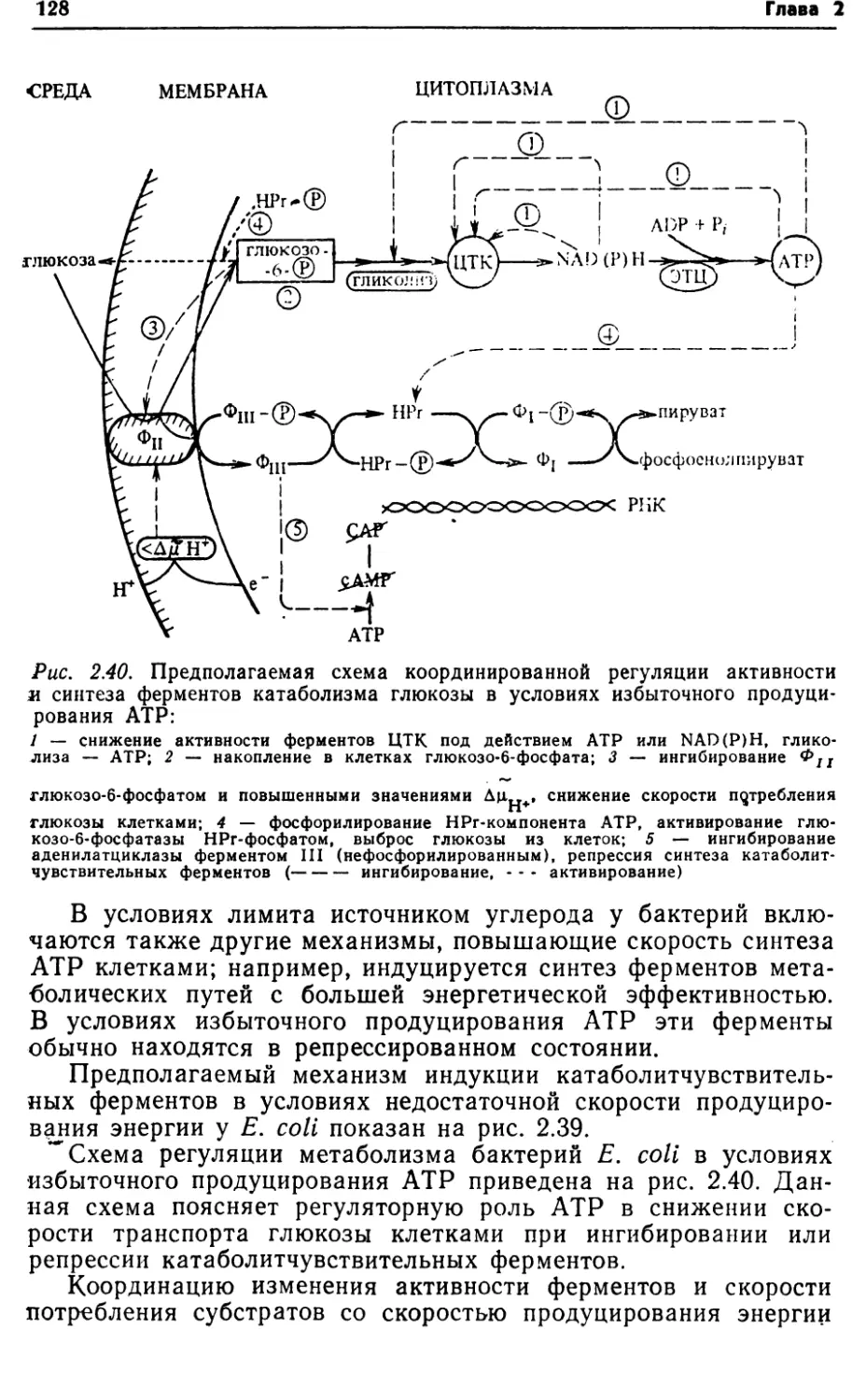
ными ферментами. Водород, отщепленный ими, переносится в
44Глава 2дыхательную цепь на уровне цитохрома b [23]. Дальнейшее
отщепление электрона и его перенос на кислород проходят
обычным путем в электронно-транспортной цепи (см. раздел
2.3).Физиологическая роль большинства глюкозодегидрогеназ,
особенно PQQ+-3aBHCHMbix, заключается в генерации мембран¬
ного электрохимического потенциала, который может быть
источником энергии при транспорте веществ, например лактозы,
аланина, глутамата у Е. coli, транспорте аминокислот у Acine-
tobacter, Calcoaceticum, а также может быть использован для
синтеза АТР у этих бактерий [37]. Таким образом, функциони¬
рование глюкозодегидрогеназ является дополнительным меха¬
низмом генерации энергии у бактерий. Некоторыми авторами
указано на эффективное сопряжение окисления глюкозы и син¬
теза АТР при действии этого фермента ;[47]. Глюкозодегидро¬
геназы обнаружены в основном у грамотрицательных бактерий
родов Enterobacteriaceae, Pseudomonadaceae, Rhizobiaceae, Neis-
seriaceae [37, 75].Следовательно, включение глюкозы в пути катаболизма оп¬
ределяется также системой ее переноса в клетку. При транс¬
порте в немодифицированном виде или в виде глюкозо-6-фос-
фата глюкоза в основном включается в гликолиз, при транс¬
порте в виде глюконата — в гексозомонофосфатный или
2-кето-3-дезокси-6-фосфоглюконатный путь.2.2.1. ГЛИКОЛИЗПуть гликолиза в классическом варианте представлен на
рис. 2.8. Ключевым ферментом этого пути является фосфофрук-
токиназа. При транспорте глюкозы в немодифицированном
виде катаболизм начинается с фосфорилирования при' помощи
гексокиназы. При использовании фруктозы в качестве субстрата
включение ее в гликолиз происходит при образовании фрук¬
тозо-1-фосфата.Конечным продуктом гликолиза является пируват. Однако
в анаэробных условиях при торможении включения NADH в
дыхательную цепь пируват может быть использован для реге¬
нерации NAD+, необходимого для функционирования глицераль-
дегид-3-фосфатдегидрогеназы. При этом конечным продуктом
гликолиза обычно является L-лактат:ПируватЧ- NADH • H+->-L-Лактат+NAD+.Однако продукты, образующиеся при регенерации NAD+ у
бактерий в анаэробных условиях, могут быть очен;, разнообраз- .
ными (см. раздел 2.2.4).
Биохимические основы регуляции45[глюкоза |ФЕП—\
пируват-а-'j.! ЛЮКОЛА)(отс)©АТР-6 Q- I АТ?)- ■S^ADl’► глюкозо-6-\афруктозо-6-[~-атр-»-{- 1 атр) ,АТР ADP j4*- ADP Iфруктото-’- • фруктозо-1,6-бис- (?)@ФТС) *пируват^ФЕП-[фруктоза]©—^днгидроацетои-® |п-з- (Й1-*—1® !2 (глицеральдегид-З- (?) )-• 2 NAD* (+ 4 АТР)—*{+ 2 АТР)-2Р,-2NADH
2 (1,3*ди* ® -глицерат)I— 2 ADPк*2 АТР (+ 2 АТР)2 (3- ©-глицерат)2 (2- ©-глицерат)©|Ч^‘2Н102 ((£)-снолпируват)2 ADP 2 АТР (+ТаТ?) 2 NADH
2 NAD*' (и)2 | ПИРУВАТ ]- @ р
** j
2 | L-ЛАКТАТ|Б.ланс : в аэробных условияхГлюкоза + 2 ADP + 2 Р, + 2 NAD% 2 Пирупат + 2 АТР + 2 NADH + 2 Н20;
в анаэробных условияхГлюкоза + 2 ADP + 2 Р, -*• 2 Лактат + 2 АТР + 2 Н20Рис. 2.8. Путь гликолиза (классический вариант). Обозначения ферментов:1 — гексокиназа (КФ 2.7.1.1); 2 — глюкозофосфатизомераза (КФ 6.3.1.9); 3 — 6-фос-
фофруктокиназа (КФ 2.7.1.11); 4 — 1-фосфофруктокиназа (КФ 2.7.1.56); 5 — фрукто-
зобисфосфат-альдолаза (КФ 4.1.2.13); 6 — триозофосфатизомераза (КФ 5.3.1.1); 7 —
глицеральдегидфосфат-дегидрогеназа (КФ 1.2.1.12) или глицеральдегидфосфат-дегид-
рогеназа (NADP+) (КФ 1.2.1.9); 8 — фосфоглицераткиназа (КФ 2.7.2.3); 9 — фосфо-
глицеромутаза (К& 2.7.5.3); 10 — энолаза (КФ 4.2.1.11); 11 — пируваткиназа (КФ
2.7.1.40); 12 — L-лактатдегидрогеназа (КФ 1.1.1.27); * — перенос глюкозы фосфо-
трансферазной системой
I Глюкоза I-<магр) -•или—(~ 1 АТР ^глюконо - 5 - лактон •о-®2-ксто-3-дезокси-6- (Р) -глюконатзГ1 ПИРУВАТ]глицеральдегид-З- (Р)—NAD4r-^NADH1,3-бис- ® -глицератI ADPIs—► АТР —3 - (?) -глицерат
i2- (?)-глицерат^н,с-енолпируват
L—ADP
J^ATP-IПИРУВАТ 1-(+1 АТР)—-(+ 1 АТР)-Баланс : Глюкоза + NADP+ + NAD+ + ADP + Р,- 2 Пируват + NADPH + NADH + АТР + Н20Рис. 2.9. 2-Кето-З-дезокси-б-фосфоглюконатный путь (путь Энтнер—Дудо-
рова). Обозначения ферментов:1 — гексокиназа (КФ 2.7.1.1); 2 — глюкозодегидрогеназы (КФ 1.1.1.118; КФ
1.1.1.119; КФ 1.1.1.47; КФ 1.1.99.17); 3 — глюконокиназа (КФ 2.7.1.12); 4 — глюкозо-
6-фосфат-дегидрогеназа (КФ 1.1.1.49); 5 — глюконолактоназа (КФ 3.1.1.17); 6 —
фосфоглюконатдегидратаза (КФ 4.2.1.12); 7 — 2-кето-3-дезокси-6-фосфоглюконат-альдо-
лаза (КФ 4.1.2.14)
Биохимические основы регуляции47I ГЛЮКОЗА]_ L-—АТР -« Ш J^ADPГЛЮКОЗО-6 -©|ФФК1 |фруктозо-6- ®I—АТР |s—ADP
фруктозо-1,6-бис - ® (ГГатр) -С- 1 АТР) ,дигидроацетон- ®
-NADH► NAD*
-РIэдетилглиоксаль-глутатион©лактоилглутатион-глутатионI d-jiaktat|I®!глицеральдегид-З- ®L—nad+Lc?iy^NADH1,3-ди- -глицератL ADP[_АТР-3- ® -глицерат
i2-© -глицератI^HjO®-снолпируват— ADP► АТР [пируват!(+ 2 АТР)(+ 1 АТР>-(+ 1 АТРУБаланс : Глюкоза -► Пируват + D-Лактат + Н20Рис. 2.10. Путь гликолиза с метилглиоксалевым шунтом. Обозначения фер¬
ментов:1 — метилглиоксальсинтаза (КФ 4.2.99.11); 2 — лактоилглутатион-лиаза (КФ 4.4.1.5);3 — D-лактатдегидрогеназа (КФ 1.1.2.4); * — обозначения фермента нет в номен¬
клатуреМодификацией гликолиза у бактерий является 2-кето-З-дез-
окси-6-фосфоглюконатный путь (КДФГП), или путь Энтнер—
Дудорова (рис. 2.9), ключевым ферментом которого является2-кето-3-дезокси-6-фосфоглюконат-альдолаза. КДФГП характе¬
рен для бактерий родов Pseudomonas, Xanthomonas и др. Сле¬
дует отметить, что распределение функционирования того или
иного метаболического пути по родам бактерий не всегда харак¬
терно. Например, у бактерий рода Arthrobacter имеет место
гликолиз (у Л. aureofaciens/A. globiformis) и КДФГП (A. simplex
[глюкоза!V"—АТР-
fs^ADP
ГЛЮКОЗО-6-(Р)фруктозо-6- (Р)
-Р/Ч- 1 АТР>тф-Н20(+ 7 АТРХ+ 5 АТР') иг эритрозо-4-(Р)“(ГЛЮКОЗА}ацетил-0“ADP (+1 АТР)!-АТР ^| Ацетат |■АТР-
■ ADPфруктозо-6-(Р)Э jседогептулоэо -7- ® ' глицеральдегид-З- (Р)ксилулозо-5-2P'N2 (глицеральде¬
гид-З- ф )крибозо-5- ®
рибул030-5- (?)I® _ксилулозо-5- (£)
J— 2 NAD+—4 ADP + 2 Р/
2 NADH
-^4 АТР
-*-2НлО(пируват)-2 NADH
-2 NAD*ЛАКТАТ|—(- 1 АТР)-1Баланс : 2 Глюкоза + 5 ADP + 5 Р/ + 2 NAD*-* 2 Лактат + 3 Ацетат + •
+■ 5 АТР + 2 NADH + 3 Н20Рис. 2.11. Фосфокетолазный путь катаболизма глюкозы, сцепленный с глико¬
лизом и гсксозомонофосфатным путем. Обозначения ферментов:/ — фруктозо-6-фосфатфосфокетолаза (КФ 4.1.2.22); 2 — трансальдолаза (КФ 2.2.1.2);3 — транскетолаза (КФ 2.2.1.1); 4 — рибозофосфатизомераза (КФ 5.3.1.6); 5 — ри-
булозофосфат-3-эпимераза (КФ 6.1.3.1); 6 — ксилулозо-5-фосфаттлицеральдегид-3-фос-
фат-лиаза (КФ 4.1.2.9)
Биохимические основы регуляции4&и A. pasens). Последний функционирует в основном у аэробных
грамотрицательных бактерий. Это объясняется тем, что энерге¬
тический выход данного пути в анаэробных условиях состав¬
ляет 1 моль АТР на 1 моль глюкозы. Следовательно, у анаэро¬
бов более предпочтителен гликолиз, дающий при этом 2 моля
АТР на 1 моль глюкозы. КДФГП часто функционирует при
использовании бактериями глюконата.У бактерий Е. coli, P. saccharophila и др. имеет место гли¬
колиз с участием метилглиоксалевого шунта (рис. 2.10) [49].
Ключевым ферментом этого пути является метилглиоксальсин-
таза, катализирующая синтез метилглиоксаля из дигидроацетон-
фосфата с участием NADH. Конечным продуктом данного пути
является D-лактат. Из последнего при наличии D-лактатокси-
дазы может образоваться пируват.Физиологическая роль метилглиоксалевого пути может быть
обоснована следующим:1) данный путь позволяет снизить скорость синтеза АТР при
его избытке и одновременно регенерировать NAD+;2) метилглиоксалевый путь делает возможным образование
ацетил-СоА при низких концентрациях неорганического фос¬
фата, так как последний служит лимитирующим фактором
функционирования глицеральдегид-3-фосфатдегидрогеназы в
гликолизе. Следует отметить, что активность ферментов метил¬
глиоксалевого пути снижается при повышении концентрации
неорганического фосфата в среде.2-Кето-3-дезокси-6-фосфоглюконатный и метилглиоксалевый
пути не образуют предшественников для биосинтеза аромати¬
ческих аминокислот, РНК и ДНК, поэтому микроорганизмы,
осуществляющие катаболизм глюкозы только этими путями, не
растут в минеральных средах, содержащих глюкозу.Бактерии, не имеющие активной фосфофруктокиназы, рас¬
щепляют глюкозу по фосфокетолазному пути (рис. 2.11). При
этом из фруктозо-6-фосфата под действием фосфокетолазы об¬
разуются ацетилфосфат и эритрозо-4-фосфат. Катаболизм послед¬
него проходит по гексозомонофосфатному пути. Образующийся
при этом ксилулозо-5-фосфат под действием другой фосфокето¬
лазы расщепляется до ацетилфосфата и глицеринальдегид-3-фосфата. Конечными продуктами фосфокетолазного расщеп¬
ления глюкозы может быть ацетат и лактат.Фруктозо-6-фосфат—фосфокетолаза и ксилулозо-5-фосфат—
фосфокетолаза являются тиаминпирофосфатзависимыми фер¬
ментами, в катализируемых ими реакциях используется неорга¬
нический фосфат:Фруктозо-6-фосфат—фос¬
фокетолаза (КФ 4.1.2.22)Фруктозо-6-фосфат+Рг- кАцетилфосфат++ Эритрозо-4-фосфат;4 — 361
50Глава 2Ксилулозо-5-фосфат—фос-
фокетолаза (КФ 4.1.2.9)Ксилулозо-5-фосфат + Р» ► Ацетил фосфат +4- Глицеринальдегид-З-фосфат.В связи с этим рост бактерий, расщепляющих глюкозу с помо¬
щью фосфокетолазы, зависит от наличия тиамина и неоргани¬
ческого фосфата.Функционирование фосфокетолазных систем характерно для
строгих анаэробов, например Bifidobacterium bifidum [49], бак¬
терий родов Lactobacillus и Leuconostoc. При этом физиологи¬
ческую роль данной системы расщепления глюкозы можно
объяснить обеспечением синтеза АТР из ацетилфосфата на
уровне субстратного фосфорилирования:Ацетаткиназа (КФ 2.7.2.1)Ацетилфосфат+АЭР ► Ацетат+АТР.Как видно, вариации гликолитического расщепления глю¬
козы у бактерий вызваны обеспечением клеток более или менее
эффективным синтезом АТР либо экономией использования АТР
на стадии катаболизма глюкозы (фосфокетолазное ее расщеп¬
ление). При этом образуются различные конечные продукты.
Если в аэробных условиях конечным продуктом гликолиза
(а также 2-кето-3-дезокси-6-фосфоглюконатного пути) является
пируват, то в анаэробных синтезируются очень вариабельные
вещества (для удобства на рис. 2.8 показан только L-лактат).
Образование D-лактата не всегда связано с торможением вклю¬
чения NADH в дыхательную цепь, но может быть следствием
лимита по фосфору и пр. (см. рис. 2.10).2.2.2. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТПируват, образующийся при гликолизе, функционировании
2-кето-3-дезокси-6-фосфоглюконатного пути, а также из триоз,
синтезирующихся в гексозомонофосфатном пути, может вклю¬
читься в ЦТК — наиболее универсальный путь метаболизма
глюкозы (рис. 2.12). Данный цикл представляет собой серию
реакций, при которых пируват окисляется до диоксида углерода
при одновременном отщеплении водорода. При участии дегид¬
рогеназ водород переносится на NAD(P)+, под действием сук-
цинатдегидрогеназы — на FAD+. Коферменты передают водо¬
род в дыхательную цепь. Функционирование последней обеспе¬
чивает синтез АТР.Приводим баланс NADH при катаболизме пирувата в ЦТК:1) 1 моль NADH образуется на стадии синтеза ацетил-СоА
при воздействии пируватдегидрогеназного комплекса (а) или то
Биохимические основы регуляции51Рис. 2.12. Катаболизм глюкозы при функционировании пируватдегидрогеназ-
ного комплекса и цикла трикарбоновых кислот. Обозначения ферментов:1 — пируватдекарбоксилаза (КФ 4.1.1.1); 2 — липоатацетилтрансфераза (КФ 2.3.1.12);
3 — липоамиддегидрогеназа (КФ 1.6.4.3); 4 — цнтрат-синтаза (КФ 4.1.3.7); 5 — акони-
таза (КФ 4.2.1.3); 6 — изоцитратдегидрогеназа (ЫАОР+-зависимая) (КФ 1.1.1.42); 7 —
оксоглутаратдегидрогеназа или а-кетоглутаратдегидрогеназа (КФ 1.2.4.2) представляет
собой комплекс ферментов; 8 — сукцинаттнокиназа (КФ 6.2.1.4); 9 — сукцинатдегидро-
геназа (КФ 1.3.99.1); 10 — фумаратгидратаза (КФ 4.2.1.2); 11 — малатдегидрогеназа
(КФ 1.1.1.1.37). У некоторых бактерий вместо пируватдегидрогеназного комплекса
функционируют другие ферменты — пируватдекарбоксилаза (КФ 4.1.1.1) и альдегид-
дегидрогеназа (КФ 1.2.1.10)4*
52Глава 2же самое при функционировании альдегиддегидрогеназы (б):а) пируватпируватдекарбоксилаза
-С02
-СоАдигидролипоилацетилтрансферзза
(КФ 2.3.1.12)
t ^ NAD*\j дигидролипоилдегидрогеназа
\ (КФ1.6.4.3)NADHацетил-СоАб) пируватпируватдекарбоксилаза-С02
ацеталвдегид.СоА- NAD*-NADH*альдегид - дегидрогеназа
(КФ 1.1.1.10)ацетил-СоА2) 2 моля NADH, 1 моль NAD(P)H, 1 моль FADH и 1 моль
GTP образуются в цикле трикарбоновых кислот.Таким образом, при функционировании пируватдегидрогеназ-
ного комплекса и ЦТК У бактерий из 1 моля пирувата может
образоваться около 10 молей АТР (при условии Р:0=2).Пируватдекарбоксилаза, участвующая в образовании ацетил-
СоА, является тиаминпирофосфатзависимым ферментом, по¬
этому включение пирувата в ЦТК в большой степени зависитРис. 2.13. Катаболизм глюкозы при функционировании гликолиза, фосфоенол-
пируват-карбоксилазы, пируватдегидрогеназного комплекса разомкнутого
цикла трикарбоновых кислот. Обозначения ферментов:1 — фосфоенолпируват-карбоксилаза (КФ 4.1.1.31)*; 2 — малатдегидрогеназа (КФ
Биохимические основы регуляции531,5 [ГЛЮКОЗААТР-* 3 ADP (- 3 АТР) 1,5 (фруктоэо-1,6-бис-©)Сф- 3 (фосфоенолпируват)
I ADP-2Н20
-2С02
‘ 2 Р/| ►АТР ■пируват/— NAD+
s—СоА
NADH
С023 NAD43 ADP + 3 Р;
3 NADH ‘
3 АТР
ЗН20-(+ 1АТР) Н20J (оксалоацетат) -ацетил-СоАСоА—^.цитрат1.—NADH
|s*-NAD*
L-малатфумаратФ/ ADP + Р,CFADH
АТР |s»-h,o^ыс-аконигатp-Hj°D-изоцитратIr— NADP*(NAD%
|^NADPH (NADH)
[ оксал осу к цинат ]. FAD+сук цинатх—СоА©/-“АТР—-
^Н20ADP + Р,1 су::цкнил -СоА-со2| а кетоглутарат |Баланс : 1) Глюкоза + 3 NAD+ + Р/ + ADP + NADP++ С02 —-*> а- Кетоглутарат + 3 NADH + АТР + NADPH2) 0,5 Глюкоза+ С02 + NADH + СоА -► Сукцинил-СоА + 2 Н20 + NADr1,5 Глюкоза + 2 NAD+ + NADP+ + ADP + Р, + СоА + 2 C02 --* а-Кетоглутарат + Сукцийил-СоА + 2 NADH + NADPH + ATP + 2 H201.1.1.37); 3 — фумаратгидратаза (КФ 4.2.1.2); 4 — фумаратредуктаза (КФ 1.3.90.1);
6 — сукцинаттиокиназа (КФ 6.2.1.5); • — возможно участие других ферментов
1,5 | ГЛЮКОЗА |-3 ATP— (*3 ATP)-3 ADPHjOCO1,5 (фруктозо-1,6-бис- ф)-3 NAD*
-3 Pi
“3 NADH
3 (1,3 -ди - (?) - глицерат)“3 ADP
*3 ATP —
*3H20
3 (фосфоенолпируват)■2 ADP
■2 ATP —
2(пируват)мил пир;"2 NAD*: CoA
NADH
C022 (ацетил-CoA)C~2'
^♦2:HjO2 |оксалоацетат| jr*-2 NADH2 NAD*
2 (L-малат)фумаратFADH->|FAD*—^сукцинат -©CoACoAH20глиоксилат^CD+ 5ATp)—«-(+ 2 ATP)-(+ 3 ATP)--(+ 2 ATP)—►цитрат|^н,одос-аконитат- D-изоцитрат-ATP
-CoA-Pi + ADP
|^H20
сукцинил-СоАБаланс : 1,5 Глюкоза + 7 NAD* + 2 Р* + 2 ADP + H20 + C02 + FAD*
-► 2 оксалоацетат + 7 NADH + 2 ATP + FADHPuc. 2.14. Катаболизм глюкозы при функционировании фосфоенолпируват-
карбоксилазы, пируватдегидрогеназного комплекса и глиоксилатного шунта.
Обозначения ферментов:/ — изоцитрат-лиаза (КФ 4.1.3.1); 2 — малат-синтаза (КФ 4.1.3.2)
Биохимические основы регуляции55от способности бактерий синтезировать тиамин или от обеспе¬
чения необходимой концентрации тиамина в среде.Активность пируватдегидрогеназного комплекса у бактерий
часто низка. Обходным путем синтеза ацетил-СоА при этом мо¬
жет быть фосфокетолазное расщепление глюкозы (см. рис. 2.11).
Образующийся при этом ацетилфосфат может быть использован
для синтеза ацетил-СоА. Однако баланс образования NADH и
АТР в таком случае изменяется.Следует отметить, что ЦТК может быть как полным (см.
рис. 2.12), так и разомкнутым (рис. 2.13). Последний образу¬
ется при снижении активности оксоглутаратдегидрогеназьг —
фермента с самой низкой активностью в ЦТК. Левая сторона
цикла при этом работает в обратном направлении с помощью
фумаратредуктазы и сукцинат-тиокиназы. Первая дает возмож¬
ность проводить синтез АТР на уровне субстратного фосфори-
лирования, в то же время в анаэробных условиях обеспечивает
регенерацию NAD(P)+.ЦТК может быть также сцеплен с глиоксилатным шунтом
(рис. 2.14). Функционирование этого пути у бактерий обычно
связано с катаболизмом двууглеродных субстратов, таких, как
ацетат. Однако у некоторых бактерий, например коринеподоб-
иых, нами доказано действие глиоксилатного шунта при исполь¬
зовании бактериями глюкозы в качестве источника углерода.Сравнение указанных вариантов функционирования ЦТК
доказывает, что при этом бактерии могут менять баланс
NAD(P)H, АТР и других продуктов, образующихся при катабо¬
лизме глюкозы. При функционировании разомкнутого ЦТК,
сцепленного с глиоксилатным шунтом, энергетическая эффек¬
тивность катаболизма глюкозы резко снижается. При этом вы¬
деление С02 уменьшается в 3 раза, вследствие чего возможно
дополнительное образование оксалоацетата. Таким образом,
если при полном ЦТК 2 моля пирувата полностью расщепля¬
ются до С02, то в глиоксилатном пути выделение С02 умень¬
шается и появляется возможное^ сохранения синтеза оксало¬
ацетата для анаболических процессов.При катаболизме глюкозы по разомкнутому ЦТК (см.
рис. 2.13) количество синтезированного и использованного
NAD(P)H в ЦТК находится в равновесии, поэтому единствен¬
ным путем, обеспечивающим образование NADH, является гли¬
колиз. АТР образуется при субстратном фосфорилировании при
действии глицеральдегидфосфатдегидрогеназы и фумаратредук¬
тазы.Функционирование как разомкнутого, так и полного ЦТК в
случае использования оксалоацетата в биосинтетических реак¬
циях возможно только при анаплеротическом синтезе послед¬
него. Это реализуется несколькими путями. На рис. 2.13 показан
только синтёз оксалоацетата при действии фосфоенолпируват-
карбоксилазы:Фосфоенолпируват-карбоксилаза,КФ 4.1.1.3Фосфоенолпируват+С02+Н20 — —— ►Оксалоацетат+Р *.<2.1>Однако возможен синтез оксалоацетата при действии других
ферментов:ATP ADPV JПируват + С02 + НгО ► Оксалоацетат + Р/; (2.2)GDP GTPФосфоенолпируват + С02 _ ^ Оксалоацетат; (2.3)Р, РР/Фосфоенолпируват + С02 V У - — Оксалоацетат; (2.4)Пируват + С О 2 + NAD(P)H ► Малат + NAD(P)+;(2.5)Малат + NAD* ; Оксалоацетат + NADH.Функционирование альтернативных путей синтеза оксало¬
ацетата связано с различным расходом энергии.,Образование разомкнутого ЦТК приводит к следующему:1) к увеличению синтеза метаболитов для анаболических
процессов (оксоглутарат, сукцинат и пр.);2) к снижению выделения СОг;3) к изменению энергетического баланса катаболизма глю¬
козы.Одним из ключевых метаболитов ЦТК является цитрат. .Од¬
нако некоторые бактерии, например молочнокислые, энтеробак¬
терии, бактерии родов Escherichia, Enterobacier, Rhodopseudo-
monas, Veillonella, Clostridium, Salmonella и др., осуществляют
катаболизм цитрата укороченным путем в так называемом
«цитратном» цикле. При этом из цитрата образуются ацетил-
СоА и оксалоацетат. Следует отметить, что данный путь функ¬
ционирует в анаэробных условиях, в аэробных — бактерии
пользуются ЦТК-Своеобразной является регуляция цитратного цикла у раз¬
личных бактерий. Е. coli в анаэробных условиях, например,.
Биохимические основы регуляции57расщепляет цитрат только в присутствии косубстратов (глю¬
козы, пирувата, лактата, фумарата и Н2) '[57]. При их отсут¬
ствии фермент инактивируется. В то же время для катаболизма
цитрата у Salmonella typhimurium в аналогичных условиях ко-
субстрат не нужен.2.2.3. ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬЧасть молекул глюкозы, поступающих в клетки бактерий, под¬
вергается катаболизму в гексозомонофосфатном пути
(рис. 2.15). Соотношение включения глюкозы в гликолиз и гек-
созомонофосфатный путь бактерий в среднем примерно 7:3
'[49]. Конечным продуктом гексозомонофосфатного пути явля¬
ется рибозо-5-фосфат или рибулозо-5-фосфат либо ксилулозо-
5-фосфат. Пентозофосфаты при участии транскетолазы и транс-
альдолазы превращаются в две молекулы фруктозо-6-фосфата
и одну молекулу глицеринальдегид-3-фосфата. Гексозомонофос-
•фатный путь осуществляет синтез исходных веществ (пентозо-
фосфата, эритрозофосфата, глицеринальдегид-3-фосфата) для
биосинтеза нуклеиновых кислот, некоторых аминокислот,
витаминов и др. При этом образуется также NADPH. Однако бак¬
терии Azotobacter, Thiobacillus, Gloconobacter и др., не имею¬
щие активных ферментов гликолиза и 2-кето-3-дезокси-6-фосфо-
глюконатного пути, пользуются окислительным гексозомонофос-
■фатным путем для образования энергии (рис. 2.16). При этом
возможен рост бактерий даже без участия ЦТК.Следует подчеркнуть, что наличие множества альтернатив¬
ных путей именно у бактерий связано с тем, что они занимают
различные экологические ниши, в которых очень быстро может
наступить лимитация по какому-то фактору, другие компоненты
среды при этом могут быть в избытке. Для поддержания жизне¬
способности в таких условиях бактериям приходится менять
скорость образования метаболитов, а также энергетическую эф¬
фективность метаболизма. Один из путей — включение того
или иного метаболического пути.Включение глюкозы в один из путей метаболизма может
быть экспериментально подтверждено с помощью 13С-глюкозы,
меченной по всем атомам С. Выделение 13СОг, меченного в
1-м положении, свидетельствует об эффективности функциони¬
рования гексозомонофосфатного пути; выделение 13С02, мечен¬
ного в 3-м и 4-м положениях, — о протекании гликолиза; вы¬
деление 13СОг, меченного в 1-м и 4-м положениях, — о функцио¬
нировании 2-кето-3-дезокси-6-фосфоглюконатного пути. Можно
пользоваться также данными измерения активности ключевых
ферментов метаболических путей.
trК'1 ГЛЮКОЗА I“АТР
-ADPглюкозо-6- (?) NADP*^K^NADPU6- CP) -П1ЮКОНО-6 -лактоио- p)-глкжонатV NADP*- NADPH
-C03рибозо-5- (?)фруктозена гликолиз или
ГМПЬаланс : а) при образовании рибозо-5-фосфатаГлюкоза + АТР + 2 NADP* + Н20-Рибозо-5- (?) + ADP + 2 NADPH + С02б) при образовании глицеральдегид*3-фосфата и фруктозо-6-фосфата
3Глюкоза + 6 NADP4 + 3 АТР + 3 Н20->2 Фруктозо-6- ® ++ Глицеральдегид-3- ® + 6 NADPH + 3 ADP + 3 С02Рис. 2.15. Гексозомонофосфатный путь. Обозначения ферментов:1 — глюхозо-6*фосфат-дегидрогеназа (КФ 1.1.1.49); 2 — D-глюконо-б-лактон-
лактонгидролаза (КФ 3.1.1.17); 3 — 6-фосфо-0-глюконат; ЫАЭР+-оксидоредуктаза
(декарбоксилирующая) (КФ 1.1.1.44); 4 — транскетолаза (КФ 2.2.1.1); 5 — трансаль-
долаза (КФ 2.2.1.2)
Биохимические основы регуляции592.2.4. НЕПОЛНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫОбразование продуктов неполного окисления глюкозы харак¬
терно для бактерий, не имеющих определенных ферментов или
метаболических путей, вследствие действия на бактерии раз¬
личных факторов внешней среды, а также при регуляции актив¬
ности ферментов катаболизма глюкозы внутриклеточными
эффекторами (катаболитами, конечными продуктами метаболи¬
ческих путей и пр.).Неполным окислением глюкозы можно считать ее катабо¬
лизм с образованием глюконата. Водород, отщепляющийся в
данном процессе, в некоторых случаях может включаться в
дыхательную цепь и использоваться для генерации протондви¬
жущей силы и синтеза АТР. Однако при этом у бактерий из1 моля глюкозы синтезируется примерно 7i3 потенциально воз¬
можной энергии. Ингибирование глицеринальдегид-3-фосфатде-
гидрогеназы может привести к образованию дигидроацетонфос-
фата, D-лактата и др. (см. рис. 2.10). Синтез АТР при этом не
происходит.При отсутствии или ингибировании ферментов ЦТК, а также
переносе электронов по электронно-транспортной цепи могут
образоваться различные продукты неполного окисления пиру-
вата (рис. 2.17). У факультативных анаэробов в большинстве
случаев синтезируется лактат (см. рис. 2.8). Концентрация
последнего в клетках бактерий может достичь 200 мМ [62].
Бактерии, имеющие пируватдекарбоксилазу (КФ 4.1.1.1) и ал-
когольдегидрогеназу (КФ 1.1.1.1), синтезируют этанол:Пируватдекарбоксилаза
Пируват —; ► Ацетальдегид+С02;Алкогольдегидрогеназа
Ацетальдегид + N ADH • Н+ *Эта но л + N AD+.Как известно, одним из факторов, определяющих синтез того
или иного продукта, является изменение pH среды в процессе
роста бактерий. Если синтез молочной и уксусной кислот про¬
исходит при повышенных значениях pH, образование слабых
кислот — бутировой и др. — при снижении pH до 4,0, то образо¬
вание нейтральных продуктов — этанола, бутанола и пр. —
при pH ниже 4,0 [33]. Таким образом, вариабельность ко¬
нечных продуктов неполного окисления пирувата обусловлена
поддержанием физиологически нормальной величины pH в
клетках.Синтез различных веществ сопровождается изменением энер¬
гетического выхода при катаболизме глюкозы: при синтезе
глюкоза)С АТР
ADPтюкозофосфатизомер'*-'' 3 (глюкозо-6- (Р))(КФ 5.3.1.92 (фруктозо-6- (Р))3 (6- -глюконо-5-лактон)3 NADH3 (рибозо-5 - (?))3 (6- (?) -глюконат)3 (рибулозо-5-(р))С 3 NADP*
^3 NADPH
3 С02глицеральдсгид-3- (?)ацетатБаланс : Глюкоза + АТР + 6 NADP* + 3 Н20->Глицеральдегид-3-(?)+■
+ ADP + 6 NADPH + 3 С02Рис. 2.16. Окислительный гексозомонофосфатный путь2 молей лактата образуется 2 моля АТР; при синтезе бути-
рата — 3 моля АТР из 1 моля глюкозы [33].Как отмечалось выше, образование продуктов неполного
окисления пирувата в условиях недостаточной интенсивности
аэрации у факультативных анаэробов связано с его использо¬
ванием для регенерации NAD+. У облигатных анаэробов, а
также у некоторых аэробов пируват может участвовать в обра¬
зовании ацетилфосфата — метаболита, используемого для син¬
теза АТР на уровне субстратного фосфорилирования. В данной
реакции при действии ацетаткиназы (КФ 2.7.2.1) кроме АТР
образуется также продукт неполного окисления пирувата —
ацетат:Следовательно, другой смысл образования продуктов непол¬
ного окисления пирувата — образование таковых при синтезе
АТР на субстратном уровне.АцетаткиназаАцетилфосфат+ADP-Ацетат + АТР.
1ГЛЮК0ЯА]|глицерол|Ф©дигидроацето.ч- (?)глюконатj—I|з- (ij) ■ иш«р.,|—-Ьгап»|»мкпи.З- ®[ Р-лактат)— ‘■ (аце[Ь-^кхат! -гацетальдегидI этанол! |I ацетат I= [ПИРУВАТ]-!Iацетил-CoAIоксалоацетатIсукцинатiI пропионат|ацетоии2,3-бутандиол|12 формиатжЧ2И2 2С02| ацстат| 1 этанол!ацетоацетат.[бутират|J *бутират ацетон + С03\ i|бутанол[ |изопропанол|Рис. 2.17. Образование продуктов неполного окисления глюкозы. Пути
катаболизма глюкозы:1 — гликолиз; 2 — ГМП; 3 — фосфокетолазное расщепление глюкозы; 4 —2-кето-3-дезокси-6-фосфоглюконатный путьПрямым путем получают ацетилфосфат из пирувата бакте¬
рии родов Escherichia, Lactobacillus и Streptococcus, имеющие
NAD^-зависимую пируватоксидазу (КФ 1.2.3.3):ЫАО+-зависимая пируватоксидаза2 Пируват+Р» + 02 —~ ■ — ► Ацетилфосфат+4-Ацетат+2 С02 + Н20.Данная реакция является тиаминпирофосфатзависимой, она
не требует участия СоА и липоевой кислоты. При действии пи-
руватоксидазы часто образуется пероксид водорода *[63].У бактерий рода Clostridium ацетилфосфат синтезируется с
помощью фосфокластической реакции:Пируват+Р Ацетил фосфат+С02+Н2.
62Глава 2Данная реакция происходит при действии комплекса фер¬
ментов — пируват : ферредоксин оксидоредуктазы (КФ 1.2.7.1)
и ферредоксина, тиаминпирофосфатсодержащей оксидоредук¬
тазы, гидрогеназы и фосфотрансацетилазы. При этом в качестве
продукта неполного окисления пирувата образуется газообраз¬
ный водород.В большинстве случаев образование ацетилфосфата проис¬
ходит из ацетил-СоА при функционировании фосфотрансацетил¬
азы (КФ 2.3.1.8):Фосфотрансацетилаза
Ацетил-СоА+Р»• ►Ацетилфосфат + СоА.При этом ацетил-СоА у анаэробных бактерий образуется с
помощью специфических ферментов. У некоторых бактерий
показано функционирование пируват: ферредоксин оксидоредук¬
тазы (КФ 1.2.3.6), катализирующей следующую реакцию:Пируват: ферредоксин
оксидоредуктазаПируват+СоА+2 Ферредоксин (окисл.) ►--►Ацетил-СоА+ С02+2 Ферредоксин (восст.).Окисленный ферредоксин является переносчиком одного
электрона. Восстановленный ферредоксин может быть исполь¬
зован для синтеза восстановленной формы NADP+, необходимой
для осуществления анаболических реакций в клетках.Второй известный путь синтеза ацетил-СоА у анаэробов осу¬
ществляется при действии пируват-формиат-лиазы (КФ 2.3.1.54):Пируват-формиат-лиаза
Пируват + СоА ► Ацетил-СоА + Формиат.Формиат образуется в качестве не полностью окисленного
продукта.Следует отметить, что приведенные примеры неполного окис¬
ления пирувата у анаэробных бактерий не отражают всю вари¬
абельность этих процессов. Более подробно эти вопросы рас¬
смотрены Готшалком и др. [49]. Нам важно подчеркнуть фи¬
зиологическую сущность образования не полностью окисленных
продуктов. Они образуются при регенерации кофакторов и син¬
тезе АТР без участия электронно-транспортной цепи. В некото¬
рых случаях эти продукты получаются при использовании таких
макроэргических соединений, как ацетилфосфат, непосредст¬
венно в процессах энергизации транспорта субстратов в клетки.Как своеобразную форму генерации энергии у некоторых
бактерий можно рассматривать образование трансмембранного
градиента Н+ (ДрН) при переносе продуктов неполного окисле¬
ния из клеток в среду [61]. Транспорт лактата при этом про¬
Биохимические основы регуляции63исходит с помощью переносчика при симпорте с протонами.
В оптимальных условиях (pH среды выше 6,7; концентрация
лактата ниже 10 мМ) 1 моль лактата транспортируется из кле¬
ток с симпортом двух протонов. Таким образом, при катабо¬
лизме 1 моля глюкозы анаэробным путем четыре протона
транспортируются из клеток в симпорте с 2 молями лактата
,[61].Если предположить, что на образование 1 моля АТР в АТР-
азном комплексе расходуется два протона, можно подсчитать
количество дополнительной энергии, получаемой клеткой при
выделении молочной кислоты. Этим путем клетки получают
энергию, равную 2 молям АТР на 1 моль потребленной глю¬
козы.Физиологический смысл образования не полностью окислен¬
ных продуктов, выделяющихся из клеток бактерий в среду,
заключается в следующем: 1) в регенерации NAD(P)+; 2) всин-
тезе АТР на уровне субстратного фосфорилирования; 3) в
генерации АТР с помощью ATP-азы при использовании транс¬
мембранного градиента Н+, образующегося при транспорте не
полностью окисленных продуктов глюкозы из клеток.В качестве продуктов неполного окисления глюкозы можно
рассматривать также накапливающиеся в клетках полиглюканы
и полимеры липидного происхождения. Наличие этих двух группБаланс: Глюкозо-6-© + АТР + (1,4-а-0-Глюкозил)„ -*-(1,4-а-0-Глюкозил)„ + 1 -+
->(1,4-а-1)-Глюкозил) ГликогенРис. 2.18. Биосинтез и катаболизм гликогена. Обозначения ферментов:/ — фосфоглюкомутаза (КФ 2.7.5.5); 2 — глюкозо-1-фосфат-аденилтрансфераза (КФ
2.7.7.27); 3 — гликогенсинтаза (КФ 2.4.1.21); 4 — полифосфорилаза (КФ 2.4.1.1)
€4Глава 2полимеров показано у Bacillus megaterium, только гликогена —
у Е. coli\ Pseudomonas aeruginosa не накапливают эти про¬
дукты [49]. Физиологический смысл образования этих полиме¬
ров заключается в связывании продуктов катаболизма глюкозы,
образующихся при снижении скорости их использования в клет¬
ках. Следовательно, образование внутриклеточных полимеров
является механизмом, предотвращающим избыточное накопле¬
ние промежуточных метаболитов в клетках.Биосинтез полиглюканов происходит при образовании избы¬
точных количеств глюкозо-6-фосфата, т. е. при снижении
скорости его использования клетками. Схема биосинтеза глико¬
гена из глюкозо-6-фосфата показана на рис. 2.18.Продуктом неполного окисления глюкозы можно считать
также резервные липиды, в том числе поли-р-гидроксибутират
(рис. 2.19) [32]. Он образуется у Е. coli, а также у бактерий
родов Azotobacter, Pseudomonas, Bacillus и др. Например, Ba¬
cillus megaterium и Pseudomonas aeruginosa синтезируют поли-
p-гидроксибутирата 12... 18%, а в некоторых случаях до 80%.
к массе сухих клеток [32]. Образование этого вещества в клет¬
ках можно назвать механизмом связывания ацетил-CoA при его
избытке в клетках. Данный путь можно считать также одним
из механизмов, позволяющих бактериям регенерировать NAD4*.ПИРУВАТ1соа|~со2-^ацетил-Со А-►ацетоаце i ил -Со АL NAD(P)H'o' *—NAD(P)*D-3-гид рокси бутири;:-СоАПОЛИ - g - ГИДРОКСИБ УТИРАТ |Баланс :2 Пируват + NAD;T)H + CoA -►D-3-Гидроксибутирил-СоА + NAD(P)++ 2 С02ОЗ-Пщроксибуглрат) „ + D-3-Гидроксибутирил-СоА (/3-Гидрокснбутират),м х+
+ СоАРис. 2.19. Биосинтез поли-р-гидроксибутирата у бактерий. Обозначения
ферментов:1 — тиолаза (КФ 2.3.1.9); 2 — D-3-гидроксибутират: КАО+-оксидоредуктаза
(КФ 1.1.1.30)
Биохимические основы регуляции 65Коринебактерии также имеют механизмы удаления продук¬
тов катаболизма глюкозы, накопившихся в клетках при сниже¬
нии активности определенных метаболических путей. Например,
при накоплении пирувата бактерии пользуются некоторыми ме¬
ханизмами, позволяющими уменьшить его концентрацию.
Аналогично накопление NADH приводит к включению механиз¬
мов регенерации NAD+. Методом газожидкостной хроматогра¬
фии показано, что на долю L-лактата приходится основная
часть органических кислот (80% и выше), синтезированных
коринебактериями. Уксусная, валериановая, пропионовая и
другие органические кислоты синтезируются в ничтожных коли¬
чествах. В некоторых случаях при образовании разомкнутого
ЦТК и увеличении активности ферментов левого звена цикла
обратным путем показано увеличение накопления сукцината до
0,5%.Кроме описанных механизмов, регенерация NAD+ и связы¬
вание пирувата в клетках исследуемых бактерий реализуются
синтезом аминокислот (например, валина и изолейцина):тиаминпиро-фосфатПируват -NAD (Р) Н NAD(P )♦' w -треонин-(производные
валериата)-Валин [7].Пируват -NAD (Р)Н NAD(P)+• Изолейцин [7].треонинСинтез аланина осуществляется только путем удаления пи¬
рувата:L -аланин -а-кетоглутарат
аминотрансфераза (КФ 2.6.1.2)Пируват АланинГлутамат а-кетоглутаратРегенерация NAD(P)+ происходит при синтезе цистина и
пролина:NAD (Р) Н ч™3* NAD (Р)+(КФ 1.6.4.1)Цистеин -Цистин;NAD(F)tiNAD (Р)+ГлутаматПролин [7].5 — 361
66Глава 2Окисление NAD(P)H протекает также в процессе синтеза
лизина, глутамата и др.Регенерация NADP+ у коринебактерий происходит под дей¬
ствием глутаматдегидрогеназы (КФ 1.4.1.3):Г лутаматдегидрогеназаOKco™yTapaT-f-NADPH + NH4+ >-Глутамат ++ NADP+,+H20.Одновременно с фиксацией NH4+ данный фермент у корине¬
бактерий выполняет NADPH-оксидазную функцию, так как при
отсутствии субстрата у этих бактерий окисления NADPH не
происходит.На основе рассмотренных выше реакций можно констатиро¬
вать, что для связывания пирувата и регенерации кофакторов
очень важно обеспечить необходимую концентрацию ионов NH4+,
так как при этом возможен синтез более нейтральных по срав¬
нению с органическими кислотами продуктов (аминокислот).При культивировании коринебактерий нами было доказано,
что концентрация лактата в среде культивирования может до¬
стичь 200 мМ, аланина — 20, валина — 15, цистеина — 1,
изолейцина — 0,5 мМ. %Продукты неполного окисления глюкозы у этих бактерий
накапливаются при торможении переноса электронов по ЭТЦ,
при образовании разомкнутого ЦТК, снижении активности фос-
фоенолпируваткарбоксилазы и при сокращении количества
пирувата, включенного в ЦТК.Следовательно, бактерии, в том числе коринеподобные, осу¬
ществляют катаболизм глюкозы различными путями. Это позво¬
ляет менять продуцирование АТР из использованного количе¬
ства глюкозы, а также поменять скорость синтеза определенных
метаболитов, используемых в анаболических реакциях.2.2.5. КАТАБОЛИЗМ ГЛЮКОЗЫ У КОРИНЕБАКТЕРИЙКоринебактерии — весьма интересный объект исследований
катаболизма источников углерода, например глюкозы. Предста¬
вители этих бактерий проявляют неклассический тип регуляции
метаболизма (рис. 2.20).Фосфорилирование глюкозы у Br. flavum и М. gluiamicus
при ее переносе в клетку путем механизма активного транс¬
порта может проходить с помощью глюкокиназы при использо¬
вании разных энергетических доноров —‘ АТР, ITP и полифос¬
фатов с молекулярной массой 188 и более. Фосфорилирование
глюкозы с помощью GTP и СТР невелико, как и фосфорилиро¬
вание при использовании полифосфадюв с ниткой молекулярной
Биохимические основы регуляции67массой. Показано также наличие глюконокиназ, осуществляю¬
щих фосфорилирование глюконата. Следовательно, начальный
катаболизм глюкозы может проходить четырьмя путями:Глюкокиназы
(КФ 2.7.1.1,КФ 2.7.1.2)1) Глюкоза + АТР >Тлюкозо-6-фосфат+ADP;Глюкокиназа(КФ 2.7.1.63)2) ГлюкозаН- (PPi)n ►Глюкозо-б-фосфат-Ь (PPi)n-i;Глюконокиназа(КФ 2.7.1.12)3) Глюконат-f АТР >-Глюконат-6-фосфат+ADP;Глюконокиназа4) Глюконат+ (РРг) п ►Глюконат-6-фосфат+ (PPt) n-i.При транспорте глюкозы фосфотрансферазной системой
активность указанных выше ферментов у Br. flavum и М. glu-
tamicus отсутствует.Физиологический смысл действия глюкокиназы и глюконо-
киназы у коринебактерий окончательно не изучен, но поскольку
активность глюкокиназ и глюконокиназ (как АТР-, так и поли-
фосфатзависимых) меняется некоординированно, можно пред¬
полагать, что либо это разные ферменты, либо их активность
меняется в зависимости от доступности доноров энергии. Неко¬
торыми исследователями показано, что у других представителей
коринебактерий АТР- и полифосфатзависимые глюкокиназы и
глюконокиназы — один и тот же фермент. Однако роль исполь¬
зования разных энергетических доноров для фосфорилирования
глюкозы или глюконата окончательно не изучена.У коринебактерий обнаружена фруктозо-6-фосфат-фосфоке-
толаза [5], однако активность этого фермента у Br. flavum и
М. glutamicus относительно низка. Следовательно, трудно су¬
дить, является ли фосфокетолазный путь существенным для
катаболизма глюкозы этих бактерий.ЦТК у исследованных бактерий может быть полным (при
функционировании оксоглутаратдегидрогеназы) и разомкнутым
при снижении активности фермента. В последнем случае левая
сторона цикла'работает в обратном направлении, на что ука¬
зывает значительное увеличение активности малатдегидроге-
назы. /Блок на уровне оксоглутаратдегидрогеназы может быть
частично компенсирован глиоксилатным либо у-аминобутират-
ным шунтом (тест-ферменты изоцитрат-лиаза и v-аминобутират-
аминотрансфераза) [87]. Однако активность последней у иссле¬
дованных бактерий относительно низка. Более значительную
роль играет глиоксилатный шунт. Характерной чертой исследо¬
ванных бактерий является катаболизм глюкозы при одновре¬
менном функционировании ЦТК и глиокснлптного шунта.5*
а)[глюкоза|фосфоенолпируват -пируватглюкозо*6 -©•АТР-ADPNADP* NADPH ^NADP* —.^ /nADPH [АЦЕТА^f<ico2-АТР.ADP►COi
рибозо-5- (?)фруктозо-1,6-бис- (?)С;NAD*
■2 ADP
NADH
2 ATPH20C02?r- 2-фосфоенолпируватI ADP|^-*-ATP N^DHPVR AT — ^ПИРУВАТ:“CoA-NAD** лактатNAD*H20K4^NADH
^C02ацетил -CoA —L>oXОКСАЛОАЦЕТАТ /
NADH*^/ /NAD*малат .
фумарат/p,цитрат\и^оцитратI — NADP'1j V*. NADPH
/ j^CO,Г.-!И.;,ССЫ5Т / ск-кеТОП!уТЗ;1аТFADH-*-'^t<AiJ сукц/гнат-* ,А Ч /<^ЛТР
\ N^ADP + Г,.С■AT?•ADP*ацетилCoAI /'N"V—NADPH
-:~NADP+ATP nh; adp++p, h2oгг.утамаг ^глутгмкнСуК!ЩКИЛ CoA’• гГ'У- 'ч*• 2 NADH NAL -у-аминэбут^пт• о« • e *л/ \а-кетоглутарат"NADPH \,_ NADP*глутсмат
Биохимические основы регуляции69б)а-кетоглу
таратАСПАРТАТ-глутаматоксалоацетатIе.АТРADPаспартил-(р)СГОМОСЕРИНгомосериндегидрогеназа
(КФ 1.1.1.3)треонинизолеицинNADPHNADP*пируватNADPHNADP*L -а-аминокетопимслатNADP*
а - кетоглутарат-*—сукцинил (ацетил)-СоА
^-►СоА—L-глутамат
а-кетоглутаратсук цинат (ацетат)мезо-а, е-диаминопимелатX1лизин!Рис. 2.20. Пути катаболизма глюкозы и ацетата (а) и синтеза лизина
(б) у коринебактерийАнаплеротическим путем синтеза оксалоацетата для вклю¬
чения ЦТК в условиях его использования в анаболических
процессах является фосфоенолпируват-карбоксилаза. У боль¬
шинства штаммов коринебактерий этот фермент строго зависит
от наличия ацетил-СоА, однако некоторые штаммы содер¬
жат ацетил-СоА-независимую фосфоенолпируват-карбоксилазу.
Именно поэтому их предпочтительно использовать для биосин¬
теза лизина, поскольку клетки могут синтезировать оксалоацетат
независимо от функционирования ЦТК.Активность других ферментов, синтезирующих оксалоацетат
анаплеротическими путями, «малик»-фермента и пируват-карб-
оксилазы, у исследованных нами штаммов отсутствует, хотя
активность этих ферментов у некоторых других коринебактерий
имеет место.
70Глава 2Таблица 2.3. i- и n-лактатдегидрогеназная активность(катал* 10~17мг белка) в различных фракцияхВ г. flavum RC 115 и В г. flavum V 5ШтаммСубстратИнтенсивность
массоиередачи
кислорода (по
сульфитному
числу),
мг/(л • мин)/-Лактатдегидро-геназал-Лактат-дегидро-геназаМем¬браннаяфракцияЦитоплазматическаяфракцияBr. flavum RCСахароза458764120115И647626492,5D.L-молочная4511562570кислотаBr. flavum VСахароза45900228056954197700,Ь-молочная45102825770кислотаУ Br. flavum и Л1 glutamicus показана относительно высо¬
кая активность ацетаткиназы при культивировании бактерий на
глюкозе или сахарозе. В некоторых случаях активность фер¬
мента соизмерима с таковой у бактерий, выращенных на аце¬
тате.У исследованных бактерий установлена также активность
лактатдегидрогеназ двух типов: ЫАО+-зависимой (я-лактатде-
гидрогеназы) (КФ 1.1.1.27) и ЫАЭ+-независимой (f-лактатдегид-
рогеназы) (КФ 1.1.99.—). Активность последней обнаружена
при использовании в качестве акцептора водорода дихлорфенол-
индофенола и при прямом восстановлении лактатом цитохромов
мембран. Активность t-лактатдегидрогеназы у Br. flavum и
М. glutamicus локализована в мембранах, я-лактатдегидроге-
назы — в цитоплазматической фракции (табл. 2.3). Поскольку
активность t-лактатдегидрогеназы увеличивается при культиви¬
ровании бактерий в присутствии 0,Ь-лактата, а активность
/г-лактатдегидрогеназы в условиях заниженной интенсивности
аэрации, можно заключить, что действие первого фермента свя¬
зано с использованием молочной кислоты. Следует отметить,
что скорость использования L-лактата с помощью мембранно¬
связанного фермента в 5... 10 раз выше таковой для D-лак-
тата.Функционирование я-лактатдегидрогеназы связано с синте¬
зом молочной кислоты цитоплазматическим ферментом
(рис. 2.21). Следовательно, коринебактерии способны синтези¬
ровать и использовать L-лактат. Данные о синтезе D-лактата
пока отсутствуют.Наличие двух ферментов, осуществляющих одну и ту же
реакцию, но только в противоположных направлениях, позво-
Биохимические основы регуляции71Рис. 2.21. Синтез и катаболизм лактата у коринебактерий. Обозначения
ферментов:/ — L-лактат: ЫАО+-оксидоредуктаза (КФ 1.1.1.27); 2 — ЫАО+-независимая лактат*
дегидрогеназа (КФ 1.1.99. —)ляет бактериям реализовать независимую регуляцию этих
путей.Большой вариабельностью у коринебактерий обладает гексо-
зомонофосфатный путь метаболизма. Так, активность глюкозо-
6-фосфатдегидрогеназы у Br. flavum V 5 в 10... 16 раз выше
таковой у Br. flavum 22ЛД и Br. flavum RC 115, что весьма
ценится в производстве лизина.Основным предшественником синтеза лизина у Br. flavum и
М. glutamicus является аспартат. Последний, в свою очередь,
синтезируется из оксалоацетата под действием аспартатамино-
трансферазы. Аспартаза, синтезирующая аспартат из фумарата,
у исследованных бактерий отсутствует. Из схем метаболизма
коринебактерий (см. рис. 2.20) видно, что оксалоацетат может
образовываться при функционировании фосфоенолпируват-карб-
оксилазы, ЦТК или глиоксилатного шунта.Путь синтеза лизина у Br. flavum, где в качестве промежу¬
точного метаболита образуется мезодиаминопимелат, сущест¬
вует в двух вариантах (рис. 2.22):1) синтез лизина из L-a-амино-е-кетопимелата путем его
конденсации с сукцинил-СоА (или ацетил-СоА);2) синтез лизина из L-a-амино-е-кетопимелата путем его
прямого восстановления с помощью NaDPH до мезо-2,6-диами-
L-АСПАРТАТCD©-ATP
,S-^ADP
L-аспартил--NADPH
. _»NADP*L -аспартил -полуальдегидQ>\пируват
I2,3 -дигидропиколинатNADPH
Г—»-NADP+пиперидин-а, е-дш<арбоксилат
-H20L -а-амино-е-кетопимелинат
(Б-l) | или (Б-2)©-сукцинил (ацетил)-CoA
►CoA©ldL‘rN-^a-кN-сукцинил (ацетил) -L-а-амино-
е-кетопимелинат-глутамат
жетоглутаратN-сукцинил (ацетил)-L-a, е-
диаминопимелинатrfi—Н2°►сукцинат (ацетат)УL, L-a, 6-диаминопимелинат®©имезо-a, е-диаминопимелинат-Ш\L-глутамат
NADPHа-кетоглутаратNADP*Н20Баланс:L-ЛИЗИНБ - 1) Аспартат + Пируват + АТР + 2 NADPH + Сукцинил (ацетил) — СоА +
Глутамат-* Лизин + ADP + 2 NADP+ + Pj + CoA + o-Кетоглутарат + Сукцинат (ацетат)4- С02;Б - 2) Аспартат + Пируват + АТР + 3 NADPH + Глутамат - Лизин + ADP + Р,3 NADP4 + 2 Н;0 + С02 + а-КетоглутаратРис. 2.22. Схема синтеза лизина у коринебактерий. Обозначения ферментов:
1 — аспартаткиназа (КФ 2.7.2.4); 2 — дегидрогеназа полуальдеглда аспарагиновой
кислоты (КФ 1.2.1.11); 3 — дигидропиколинат-циклогидролаза (КФ 3.5.4.—); 4 —
пипериденн-а-е-дикарбоксилат: ^ОР+-оксидоредуктаза (КФ 1.3.1.—); 5 — сукцинил-
Биохимические основы регуляции7£нопимелата. Диаминопимелинат-дегидрогеназа (КФ 4.1.1.16) ^
осуществляющая эту реакцию у коринеподобных бактерий, об¬
наружена сравнительно недавно [53]. Активность этого фер¬
мента у Br. flavum довольно высокая. Данный путь позволяет
синтезировать лизин при отсутствии сукцинил-СоА (или ацетил-
СоА) и одновременно регенерировать NADP+.2.3. ЭЛЕКТРОННО-ТРАНСПОРТНЫЕ СИСТЕМЫКак известно, хемотрофные бактерии в зависимости от исполь¬
зуемого источника углерода и энергии подразделяют на хемо-
органотрофы и хемолитотрофы. Первая группа получает угле¬
род для биосинтетических целей и энергию для обеспечения
процессов жизнедеятельности из органических веществ. В связи
с этиц иногда их называют гетеротрофными бактериями. Хемо¬
литотрофы в качестве источника углерода используют С02 или
ионы НСОз~, а необходимую энергию получают в процессе окис¬
ления неорганических веществ. У обеих групп хемотрофных
бактерий генерация энергии связана с электронно-транспорт¬
ными реакциями, сопряженными с образованием протондвижу-
щей силы и синтезом АТР. У хемоорганотрофных бактерий, как
было рассмотрено ранее, АТР образуется также при субстрат¬
ном фосфорилировании. Для целей биотехнологии пока исполь¬
зуются в основном хемоорганотрофные бактерии. Биоэнергетику
этой группы прокариот рассмотрим подробнее.2.3.1. ВОЗНИКНОВЕНИЕ ПРОТОНДВИЖУЩЕЙ СИЛЫПеренос электронов по электронно-транспортной цепи (ЭТЦ)
сопряжен с трансмембранным переносом п ионов Н+ из внутри¬
клеточного пространства в периплазму и внешнюю среду. В ре¬
зультате генерируется трансмембранная разность потенциалаионов водорода — электрохимический градиент протонов Д|1н+
(выражается в Дж/моль):Д|ин+ = /гДг|)—2,3/?ГДрН,где F — число Фарадея; Дф — электрическая составляющая —
мембранный потенциал; R — газовая константа; Т — абсолют¬
ная температура; ДрН — разность концентраций протонов по
обе стороны мембраны.СоА: пиперидин-а-8-дикарбоксилатсукцинил-трансфераза (КФ 2.3.1.—); 6 — сукци-
нилдиаминопимелат-аминотрансфераза (КФ 2.6.1.17); 7 — _ ..и .ил-диамин пимслинат-
десукцинилаза (КФ 3.5.1.18); 8 — диаминопимелинат-эпи'’ор'1ЗП (КФ 5.1.1.7>: 9 - ди¬
аминопимелинат-дегидрогеназа (КФ 1.4.1.16); 10 — диаминоиил*елинат-декар0оксилаза
(КФ 4.1.1.20)
A[m+/F называют протондвижущей силой и обозначают:л , 2,3RT А u
Др = Дг|) -—ДрН.При 25 °С она равна 29 мВ (2y3RT/F).Энергетическая эффективность работы ЭТЦ зависит от ко¬
личества протонов, транслоцированных при прохождении двух
электронов по всей цепи. Она выражается Н+/2е~.Как известно, трансмембранный электрохимический градиент
ионов водорода образует направленную внутрь клетки силу
(точнее — потенциал), которая используется как источник
энергии для синтеза АТР, транспорта веществ и движения жгу¬
тиков. Наиболее важным процессом в жизнедеятельности бак¬
терий является окислительное фосфорилирование. Оно проте¬
кает в энерготрансдуцирующих мембранах, обладающих рядом
особых свойств: низкой проводимостью ионов водорода, везику¬
лярной структурой, наличием генератора Др и Независимой
АТР-синтазы [12, 32]. У эукариот окислительное фосфорилиро¬
вание протекает в специализированных органеллах — митохон¬
дриях. У бактерий энерготрансдуцирующей мембраной является
цитоплазматическая мембрана, в ней и расположены перенос¬
чики электронов и АТР-синтазный комплекс.Бактериальные ЭТЦ имеют ряд особенностей:1) содержат некоторые переносчики электронов, которые не
свойственны митохондриям;2) отличаются вариабельностью состава переносчиков,
который детерминирован генетически, а также в значительной
мере зависит от условий культивирования;• 3) характеризуются разветвленными ЭТЦ с альтернативными
участками переноса электронов, что обеспечивает использова¬
ние нескольких доноров и акцепторов электронов и приводит к
различной энергетической эффективности функционирования
ЭТЦ;4) кроме кислорода — акцептора электронов, многие бак¬
терии способны использовать ряд других соединений, таких,
как нитраты, нитриты, оксиды азота, сульфат и др.;5) энергетическая эффективность функционирования ЭТЦ
зависит от пространственного расположения донора и акцеп¬
тора электронов.Электронно-транспортные цепи гетеротрофных бактерий
обычно содержат несколько альтернативных начальных пере¬
носчиков — дегидрогеназ и несколько альтернативных терми¬
нальных переносчиков — цитохромоксидаз. Переносчики восста¬
новительных эквивалентов содержат редоксицентры органиче¬
ской природы — FMN, FAD (флавопротеины), менахиноны, уби-
хиноны (хинопротеины) и неорганической природы — Fe, S
(железо-, серосодержащие белки), Мо (молибденсодержащие
Биохимические основы регуляции75ПЕРИПЛАЗМА МЕМБРАНА ЦИТОПЛАЗМАН2, формаль-Рис. 2.23. Обобщенная схема электронно-транспортной цепи бактерий:АН2 и ВН2 — доноры восстановительных эквивалентов; ХО и YO — акцепторы
электроновбелки). Органические редоксицентры имеют низкий потенциал,
входят в состав дегидрогеназ — первичных переносчиков в
ЭТЦ. Переносчики, содержащие ионы металлов, имеют более
положительный редоксипотенциал. Наличие двух типов редок-
сицентров у переносчиков восстановительных эквивалентов
позволяет решить проблему превращения энергии окислительно¬
восстановительных реакций в электрохимический потенциал
ионов водорода.В обобщенном виде структура и функционирование бактери¬
альной ЭТЦ представлены на рис. 2.23. Донор электронов
может отдавать электроны в эту цепь как с внешней стороны
мембраны (АН2), так и из цитоплазмы (ВН2). Подобным об¬
разом акцептор электронов может принимать электроны с
внешней стороны (ХО) или в цитоплазме (КО). Примерами
АН2 являются молекулярный водород, формиат, иногда глю¬
коза; ВН2 — наиболее часто NADH; ХО — N02“, N02; YO —02 и N03-3. На рис. 2.24 легко заметить, что в зависимости
от расположения донора и акцептора электронов Н+/2е_ может
принимать значения п, я+2, /г—2. Наиболее эффективным бу¬
дет окисление Н2 или формиата кислородом, наименее эффек¬
тивным — окисление NADH нитритом и N02.Для аэробных гетеротрофных бактерий характерна вариа¬
бельность состава переносчиков, который меняется в зависимо-
76Глава 2NADPH-FADH-►NADH-2BХиноны, цит b-2A• цит сЗАЗВцит о
цит d
цит аа3цит со
цит аа3нч/о6• цит саа3 10Рис. 2.24. Схема бактериальных электронно-транспортных цепей с
альтернативными путями переноса электронов и соответствующими
максимальными значениями коэффициента Н+/0:0, I, 2А, 2ВГ ЗА и ЗВ — места энергосопряжениясти от физиологических условий. Наиболее часто встречаются
изменения хинонов (убихинон или менахинон) и цитохромокси-
даз. Встречаются пять основных типов бактериальных цито-
хромоксидаз: аа3, саа3, о, со, d [21, 55]. Синтез цитохромокси-
даз, в частности, регулируется в зависимости от типа углерод¬
ного субстрата и концентрации кислорода в среде. Обычно при
низкой его концентрации синтезируется и функционирует цито-
хромоксидаза, у которой сродство к кислороду больше: d>o и
со>ааъ. Подобным образом концентрация источника углерода
(или промежуточного продукта катаболизма) влияет на синтез
некоторых дегидрогеназ. Увеличивается вклад той дегидроге¬
назы (часто и пермеазы), которая реагирует с лимитирующим
субстратом, и тем самым клетки стремятся уменьшить лимити¬
рующий эффект.Вследствие вариабельности состава переносчиков бактерии
имеют разветвленные ЭТЦ с альтернативными (точнее, парал¬
лельно функционирующими) путями переноса восстановитель¬
ных эквивалентов [11, 32]. Смысл этого явления заключается
в том, что бактерии, имеющие альтернативные дегидрогеназы
и цитохромоксидазы, легче приспосабливаются к меняющимся
условиям среды, т. е. являются более конкурентоспособными.
Следующее важное следствие такой организации ЭТЦ состоит
в том, что альтернативные пути позволяют регулировать энерге¬
тическую эффективность окисления атомов водорода. Это поло¬
жение изучено экспериментально по величине стехиометриче-
ского коэффициента Н+/0 [22, 54, 55, 77, 95].Теоретически, включая трансгидрогеназу, в бактериальных
и митохондриальных ЭТЦ могут функционировать четыре точки
энергосопряжения. Однако у бактерий в зависимости от раз¬
ветвления и функционирования альтернативных цитохромокси-
даз величина Н+/0 меняется от 6 до 10 (см. рис. 2.24). Мак¬
симальное значение возможно при функционировании нулевой
точки сопряжения (NADPH-^NAD+, катализируемое трансгид-
рогеназой), первой точки (NADH-кхинон), второй А точки
Биохимические основы регуляции77-С\Н2\
Оукцинат-Х-
• X-NADH-\\УФIMXцит Ь567цит bs\ \\ \ СГК, ЬГКчоАмтимицин А
I1 ■ ЦИТ С 5 5 5 ■
\\KCNII► циг а604—^02
KCN\чцит о-Л!V'X-Рис. 2.25. Схема электронно-транспортной цепи Br. flavum:MX — менахинон; X — неидентифицированные переносчики: СГК — сали-
цилгидроксамовая кислота; БГК — бензигидроксамовая кислота; УФ —
ультрафиолетовое облучение. Вертикальными пунктирными линиями обозна¬
чены места действия соответствующих ингибиторов(хинон—цитохром с) и третьей В точки (цитохром с-*02 через
Н+-транслоцирующую цитохромоксидазу аа3). В опытах значе-
« ние Н+/0 у бактерий много меньше. Как правило, редко функ¬
ционирует трансгидрогеназная (о) точка сопряжения. При вы¬
соких концентрациях кислорода и недостатке в среде серы и
ионов железа инактивируется (выпадает) первая точка сопря¬
жения. Иногда точка 2А заменяется сегментом 2В, не содержа¬
щим цитохром с. Довольно часто у бактерий отсутствует
Н+-транслоцирующая цитохромоксидаза, в результате также
снижается эффективность работы ЭТЦ.Примером бактерий, имеющих разветвленную ЭТЦ с аль¬
тернативными путями переноса электронов, являются лизин-
продуцирующие штаммы Brevibacterium flavum. Схема ЭТЦ
этих бактерий представлена на рис. 2.25. Было выявлено, что в
дыхательной цепи имеется цианидрезистентный путь окисления,
обладающий меньшей фосфорилирующей активностью [14, 76].
Мембранные частицы Br. flavum катализируют реакцию одно¬
электронного восстановления кислорода с образованием супер-
оксиданионрадикала — 02“ [15, 76]. Эта минорная реакция,
наряду с основным электронным транспортом, связана с функ¬
ционированием дыхательной цепи бактерий.Усиленная генерация 02~ в клетках приводит к разобщению
окисления и фосфорилирования и уменьшению генерации мем¬
бранного потенциала [15]. В мембранных частицах Br. flavum
совместно с компонентами ЭТЦ локализована и действует гид-
рогеназа. Мембранно-связанная гидрогеназа Br. flavum ката¬
лизирует окисление молекулярного водорода, сопряженное с
образованием АТР и восстановлением NADH. С компонентами
ЭТЦ Br. flavum тесно связаны каротиноиды [16], часть
78Глаба 2которых участвует в окислительном метаболизме клеток и, по-
видимому, функционально защищают мембранные структуры от
токсичного воздействия «активных» форм кислорода (О2” и О2).2.3.2. ЭНЕРГЕТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
ЭНЕРГОТРАНСДУЦИРУЮЩИХ СИСТЕМЗначительные трудности представляет экспериментальное опре¬
деление эффективности функционирования ЭТЦ в бактериаль¬
ных клетках, находящихся в физиологических условиях. Неко¬
торую информацию дает изи^ерение Н+/0 в эндогенно дышащих
клетках, окисляющих NADH. В большинстве экспериментов эта
величина имеет значение, близкое к 4 [9, 95]. Например, у
Br. flavum Н+/О при окислении эндогенных субстратов прини¬
мает значения от 3,9 до 4,3. Нами сделана попытка оценить
эффективность работы ЭТЦ Br. flavum другими методами, ко¬
торые, однако, дают еще меньшие значения Н+/0. Метод, осно¬
ванный на измерении дыхания путем изменения величины ста¬
ционарного потока Н+ через мембрану протонофорами, дает
Н+/0=1,7. Перспективным представляется анализ кинетики
ответной реакции изменения дыхания после импульса кислоты.
Метод применим в физиологических условиях и дает значения
Н+/0 = 3 ... 4 [9, 17, 77].Вопрос о том, действительно ли бактериальные ЭТЦ функ¬
ционируют с заниженной энергетической эффективностью, пока
не решен. Кажущееся уменьшение Н+/0 может быть связано
с методикой и тем обстоятельством, что в бактериальной энерге¬
тике относительно большую роль играют так называемые ло¬
кальные градиенты ионов водорода [2, 6, 39, 58]. Измерение
протондвижущей силы свидетельствует, что у бактерий эта ве¬
личина несколько меньше, чем у митохондрий. В бактериальных
клетках Ар= 160 ... 180 мВ, в митохондриях — 180 ... 220 мВ
[6, 12]. В табл. 2.4 приведены значения протондвижущей силы
и ее составляющих у четырех штаммов Br. flavum в различных
физиологических условиях. Ар понижается в периодической
культуре по мере исчерпания источника углерода из среды и с
понижением pH среды.Согласно хемиосмотической теории сопряжения, Ар явля¬
ется движущей силой фосфорилирования. Функцию образования
АТР выполняет локализованная в мембране Н+-АТР-аза. Дф и
ДрН одинаково эффективны как движущие силы фосфорилиро¬
вания. Следует лишь учесть то обстоятельство, что они сильно
различаются по энергоемкости. Энергия, запасенная клеткой в
виде осмотического потенциала (ДрН), на несколько порядков
превышает количество* энергии, запасенной в электрическом
потенциале Дф такой же величины [62]. Порог Ар, необходи-
Биохимические основы регуляции79Таблица 2.4. Значения Др, и ДрН у четырех штаммовBrevibacterium flavumг измеренные по распределению
меченого тетрафенилфосфонияШтамм
Br. flavumУсловия, в которых
находились клетки перед
измерениемЛ*ф, мВЛрН, мВДр. мВRC 115Экспоненциальная фаза,
pH 6,7117 ± 1338± 1015522ЛДТо же, pH 6,95141 ±914± 11155Начало стационарной
фазы роста, pH 6,397±831 ± 1012822ЛД-ПТо же, pH 5,455± 1242 ±997То же, pH 6,080 ±1339± 10119V 5Экспоненциальная фаза,
pH 6,9139± 1021 ± 11160мый для образования АТР из ADP+P, составляет примерно
150 мВ.Характерной чертой работы мембранной Н+-АТР-азы явля¬
ется обратимость реакции ATP^Ajih+ (рис. 2.26). При актив¬
ном дыхании этот ферментный комплекс работает как АТР-
синтаза. Однако в анаэробных условиях реакция приобретает
противоположное направление, и значительная часть АТР рас¬
ходуется на генерирование Ар.Особенностью прокариот является использование двух ис¬
точников энергии — АТР и протондвижущей силы. АТР обес¬
печивает энергией биосинтетические реакции и некоторые виды
транспорта веществ, служит непосредственным источником
энергии для движения жгутиков и большинства видов транс¬
порта веществ. Оба энергетических источника взаимосвязаны
посредством ATP-азы и действуют по принципу сообщающихся
сосудов '[62].ДЫХАНИЕДвижение
жгутиков "ЭнергизованнаяATP-аза Iмембрана Д /Гн +ЧТранспортГЛИКОЛИЗ
1РеакциибиосинтезаРис. 2.26. Функциональная роль Н+-АТР-азы в энергетическом
метаболизме бактерий
80 LГлава/2СРЕДА МЕМБРАНА ЦИТОПЛАЗМАРис. 2.27. Схема энергетического метаболизма гетеротрофных
бактерий и возможные механизмы непродуктивных потерь
энергииПри наличии избытка восстановительных эквивалентов в
клетке в аэробных условиях активируется перенос электроновпо ЭТЦ, генерируется Ajih+, и процесс идет в сторону синтеза
АТР. В условиях низкого значения протондвижущей силы АТР
используется для энергизации мембраны и меньше его остается
для биосинтетических реакций. По оценке Стутхамера, на энер-
гизацию цитоплазматической мембраны Е. coli расходуется до
60% энергии АТР ([93]. Для этих же целей Br. flavum непро¬
дуктивно тратит до 20% энергии, содержащейся в ассимили¬
руемом источнике углерода и энергии {9].Особенно возрастают непродуктивные затраты энергии, если •
увеличивается пассивная проницаемость цитоплазматической
мембраны для протонов (рис. 2.27). По этой схеме можно
наглядно представить и другие виды непродуктивных потерь
энергии окисляемого субстрата, связанные с уменьшением эф¬
фективности работы энергосопрягающих механизмов [55]:1) инактивация или выпадение точек сопряжения (напри¬
мер, 0 и 1) [1];2) перенос электронов менее эффективными путями, минуя
точки 2 и 3 энергосопряжения [13];3) уменьшение эффективности протонного насоса вследствие
уменьшения Н+/2е~ стехиометрии;4) дисбаланс потоков Н+, связанный напримеп. г поддер¬
жанием внутриклеточного pH, осмотического давления и пр.;
Биохимические основы регуляции815) увеличение пассивной проницаемости мембраны для про¬
тонов [9, 77].К непродуктивным потерям энергии следует также отнести
диссипацию энергии АТР в следующих случаях:1) активирование АТР гидролизирующей Н+-АТР-азы, с дис¬
сипацией энергии в виде тепла [24];2) функционирование ATP-зависимых систем рециркуляции
некоторых ионов, например К+, NH4+ [52, 59, 94];3) увеличение затрат АТР в случае нарушения регуляции
процессов транспорта катаболизма и анаболизма.в В заключение этого раздела слёдует сказать, что пока не
ясно, каков вклад перечисленных выше механизмов непродук¬
тивных потерь энергии в реальных условиях культивирования
бактерий. Данные биохимических исследований in vitro свиде¬
тельствуют о якобы уменьшенной энергетической эффективности
энерготрансдуцирующих систем бактерий. С другой стороны,
суммарный энергетический баланс метаболизма бактерий, оце;
ниваемый по YX/s и цх> мало чем отличается от такового у
эукариот.2.4. РЕГУЛЯЦИЯ ТРАНСПОРТА СУБСТРАТОВ
И ФЕРМЕНТОВДля повышения скорости роста бактерий и синтеза ими опре¬
деленных продуктов важно знать механизмы регуляции фермен¬
тов путей образования этих продуктов. Повышение или сниже¬
ние скорости транспорта субстратов, а также активности от¬
дельных ферментов и целых метаболических путей у бактерий
может существенно снижать непродуктивные затраты субстра¬
тов и продуктивность биотехнологического процесса.2.4.1. КОНСТИТУТИВНЫЕ
И ИНДУЦИБЕЛЬНЫБ ФЕРМЕНТЫХарактер регуляции систем транспорта субстратов и ферментов
метаболизма (конститутивный или индуцибельный) у бактерий
может быть проверен с использованием ингибиторов процессов
транскрипции и трансляции при синтезе белков.С целью изучения природы регуляции активности ферментов
метаболизма у коринебактерий были использованы рифамицин
(0,2 мкг/мл) и хлорамфеникол (100 мкг/мл). Сначала была
проверена пригодность указанных ингибиторов для предотвраще¬
ния транскрипции и трансляции. Показано, что рифамицин пре¬
пятствует синтезу РНК уже в течение первого часа инкубации,6 — 361
Таблица 2.5. Активность ферментов Br. flavum 22/1Д при наличии
или отсутствии индукторов — глюкозы и ацетатаВари¬антСредаСкоростпортаймп /
/(мин • мг)ь транс-
лкжозыг/(г • ч)Фосфо-фрукто-киназаФруктозо-1,6-бис-фосфат-альдолазаФос-фо-енол-пиру-ват-кар-бок-си-лазаЦнт-рат-син-тазаАко-ни-тазаИзоцит-/ратде-|гидро-геназаМалат-дегидро-геназаИзоцит-рат-лиазаАктивность,катал •10_и наi 1 мг белка1РПА рез глюкозы52380,49657645038543012231480£РПА с 1% глюкозы25000,233128269006933223097527203ЖПС без глюкозы——6505500443063102811204ЖПС с 2,5% . глюкозы——1420118002104212101115526525РПА без СНзСОО-——629730038 ‘—0—17906РПА с 1 % СНзСОО"——4276200112—180—192112
О)Таблица 2.6. Активность ферментов гликолиза, ЦТК и глиоксилаткого шунта у Br. flavum 22ЛД в средах с глюкозой
при наличии или без ингибиторов транскрипции н трансляцииУсловия культивированияФруктозо-
1,6-бисфос-
фат-альдо-
лазаФосфо-СредаПродол¬
житель¬
ность, чИнгибиторСкорость
транспорта
глюкозы,
имп/(мин • мг)енолпи-руват-карбок-силазаЦитрат-синтазаАкони-тазаМалат-дегид-рогеназаИзоцит-рат-лиазаАктивность,, катал • 10I м на 1 мгбелкаРПАЖПС+2,5%24Без ингибитора548012404212301480глюкозы3То же34201440153—8115206—1700246306195169593Рифамицин3980192089—021206То же—1180121227015403Хлорамфсникол4120152097—016206То же—192018127302190
84Глава 2хлорамфеникол — синтезу белка в течение 3 ч инкубации.
Таким образом, ингибиторы могут быть использованы при уста¬
новлении механизмов регуляции ферментов.Бактерии, выращенные в отсутствие глюкозы, способны
транспортировать ее с высокой скоростью (результаты полу¬
чены при использовании 614С-глюкозы). Бактерии характери¬
зовались высокой активностью ферментов гликолиза (фосфо-
фруктокиназа, фруктозо-бисфосфат-альдолаза), более низкой
активностью фосфоенолпируват-карбоксилазы. В то же время
активность фермента ЦТК-аконитазы практически отсутствует,
активность цитрат-синтазы, изоцитратдегидрогеназы и малатде-
гидрогеназы высока (табл. 2.5). Повышение активности акони-
тазы происходит только при синтезе РНК и белка de novo, при
этом увеличивается также активность изоцитрат-лиазы
(табл. 2.6).Из полученных данных следует, что у Br. flavum фосфофрук-
токиназа, фруктозо-бисфосфат-альдолаза, фосфоенолпируват-
карбоксилаза, цитрат-синтаза, изоцитратдегидрогеназа и малат-
дегидрогеназа являются конститутивными ферментами; акони-
таза и изоцитрат-лиаза — индуцибельными. Конститутивной
является также система транспорта глюкозы у этих бактерий,
поэтому транспорт обычно не является лимитирующей стадией
роста.Чтобы получить достоверные данные о том, что при наличии
ингибиторов синтеза РНК и белка не изменяется активность
уже имеющихся в клетках ферментов, было проверено влияние
ингибиторов на активность ферментов индуцированной куль¬
туры. Ингибитор вносили после 3-часового индуцирования куль¬
туры в среде с 2,5%. глюкозы.Было показано, что в течение 3-часового инкубирования
ингибиторы синтеза РНК и белка не влияют на активность уже
индуцированных ферментов, но предотвращают их дальнейшую
индукцию.Следует обратить внимание на то, что при предотвращении
индукции аконитазы при культивировании Br. flavum 22ЛД в
среде с глюкозой или сахарозой активность фосфофруктоки-
назы, фруктозо-бисфосфат-альдолазы, фосфоенолпируват-карб¬
оксилазы и малатдегидрогеназы увеличивается в большей сте¬
пени, чем без ингибиторов. Это еще раз подтверждает консти¬
тутивную природу указанных ферментов, что имеет определен¬
ный физиологический смысл.Конститутивно обычно синтезируются фосфотранс^Ьеразиые
системы для транспорта более доступных сахаров (глюкозы,
фруктозы, маннозы), а также глюкозодегидрогеназы у некото¬
рых бактерий [47]. Системы транспорта других сахаров (лак¬
тозы, мальтозы и др.) в большинстве случаев индуцибельны.
Для некоторых сахаров имеется несколько систем транспорта
Биохимические основы регуляции85{например, для глюкозы у Е. coli — три), часть которых имеет
конститутивный характер, часть — индуцибельный [45, 92].Выявлено также, что конститутивными могут быть только
определенные компоненты одной и той же транспортной сис¬
темы, например фермент I и НРг у ФТС бактерий [84].Наличие нескольких систем транспорта одного и того же
субстрата, различающихся по величине кинетических характе¬
ристик (Км и Кмакс), существенно влияет на скорость транс¬
порта субстратов при изменении условий окружающей среды.
Конститутивный характер определенных компонентов позволяет
более оперативно включать соответствующие транспортные
системы.Представляет интерес регуляция систем транспорта органи¬
ческих кислот у различных групп бактерий: если транспорт
таковых у Е. coli индуцибельный, то у Azotobacter vinelandii,
Pseudomonas aeruginosa, Arthrobacter sp. и других — конститу¬
тивный. Отличие регуляции транспорта одного и того же суб¬
страта у различных групп бактерий, очевидно, следует рассмат¬
ривать с точки зрения их экологических стратегий. Например,
приведенные варианты регуляции систем транспорта у Е. coli
(типичного представителя г-стратегии) и бактерий родов Pseu¬
domonas, Azotobacter, Arthrobacter (представителей /(-страте¬
гии) связаны с особенностями регуляции скорости их роста.
r-Стратеги чаще располагают конститутивными системами для
транспорта глюкозы, /C-стратеги — органических кислот.Часто по изменению активности ферментов или скорости
транспорта субстратов трудно определить, являются ли данные
белки индуцибельными, так как ферментов и белков, осущест¬
вляющих одну и ту же функцию, может быть несколько. При
этом, возможно, индуцибельны только отдельные компоненты.
Например, на основе наших данных об изменении общей ско¬
рости транспорта глюкозы у коринебактерий трудно судить,
являются ли конститутивными обе системы транспорта глюкозы(ФТС и Д]ын+-зависимая). Более вероятен конститутивный ха¬
рактер ФТС, что следует из особенностей функционирования
этих систем у бактерий. Однако не исключено, что активность
систем транспорта субстратов зависит от индукции синтеза и
доступности энергетических доноров.Изучение характера регуляции ферментов и других биоло¬
гически активных белков представляет интерес, так как они
могут быть целевыми продуктами. От активности определенных
ферментов или целых метаболических путей зависят скорость
роста клеток и синтез продуктов.
86Глава z2.4.2. МЕХАНИЗМЫ ИЗМЕНЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВКак известно, изменение скорости потоков субстратов и их
катаболитов через определенные метаболические пути происхо¬
дит благодаря изменению активности уже синтезированных бел¬
ков путем их активирования или ингибирования или синтезу
белков de novo. Эффекторами регуляции могут быть не только
субстраты и продукты, но и катаболиты определенных мета¬
болических путей. Данная регуляция позволяет поэтапно и бо¬
лее оперативно выключать определенные метаболические пути
и включать компенсирующие пути (как их часто обозначают —
шунты).Выключение одних и включение других путей катаболизма
субстратов происходит благодаря регуляторному действию про¬
дуктов катаболизма глюкозы и различию величин /См для суб¬
стратов у ферментов альтернативных метаболических путей.Изменение активности ферментов определяет более опера¬
тивную регуляцию метаболизма, чем изменение скорости син¬
теза. Если скорость синтеза ферментов соизмерима со скоро¬
стью синтеза рибосомального РНК и белка, то изменение
активности — со скоростью изменения конформации белков,
т. е. практически происходит моментально.Изменением активности ферментов обычно регулируется
первый фермент цепи реакций. У Br. flavum показано, что
активность первых ферментов отдельных этапов метаболизма
значительно ниже, Дм их выше по сравнению с таковой у фер¬
ментов последующей цепи реакций.Очень чувствительны к небольшим изменениям концентра¬
ции субстратов регуляторные ферменты, поэтому их активность
существенно зависит от условий культивирования. Активность
последующих ферментов часто бывает высокой независимо от
условий роста бактерий. Если активность фосфофруктокиназы,
аконитазы и глюкозо-6-фосфат-дегидрогеназы меняется при пе¬
реходе бактерий от лаг- на логарифмическую фазу роста в 2,10 и 4 раза соответственно, то изменения фруктозо-бисфосфат-
альдолазы и изоцитратдегидрогеназы несущественны. В каче¬
стве показателя потоков, метаболитов через различные метабо¬
лические пути должна быть выбрана активность регуляторных
ферментов.Следует отметить, что общеизвестна регуляторная роль
цитрат-синтазы — фермента ЦТК*. Такова она у Br. flavum [88].
Однако большую чувствительность к условиям культивирования*Wcitzman P. D. F. Unity and diversity in some bacterial citric acid-
cycle enzymes // Advances in Microbial physiology / Ed by Rose A. H.,
Morris F. — London, N. Y., Toronto, Sydney, San Francisko: Acad. Press,
1988. — Vol. 22. — P. 185—244.
Биохимические основы регуляции87*у коринебактерий проявляет аконитаза. Это показано также у
Pseudomonas aeruginosa [66] и Bacillus subtilis [43].Регуляция активности ферментов субстратом. Как известно,
самый простой механизм изменения активности ферментов и
систем транспорта — изменение активности в присутствии суб¬
стратов. Последнее приводит к образованию упорядоченного
состояния активных центров ферментов. Поскольку каждая мо¬
лекула ферментов может иметь несколько участков для связы¬
вания субстрата, небольшого числа молекул субстрата доста¬
точно для того, чтобы привести большое число активных
центров в состояние высокой каталитической активности. Это
облегчает связывание и других молекул субстрата.Присутствие субстрата защищает активный центр фермента
от действия различных химических веществ, в том числе кисло¬
рода. Данный способ следует использовать для сохранения
активности ферментов в процессе культивирования и при вы¬
делении ферментов. Примером поддержания активности фер¬
ментов в процессе роста бактерий служат индукция и
поддержание активности ферментов субстратом при низкой
интенсивности аэрации в лаг-фазе и только затем повышение
скорости подачи кислорода.Аллостерическая регуляция ферментов. Как известно, алло-
стерический регулятор (или модулятор), связываясь с аллосте-
рическим центром, изменяет конформацию активного центра
фермента, т. е. повышает или снижает его сродство к субстрату.
Это свойстзо широко используется в биотехнологии для увели¬
чения активности необходимых метаболических путей с целью
увеличения роста бактерий или синтеза ими продукта.Аллостерическими регуляторами часто являются низкомоле¬
кулярные вещества. Например, для ферментов центрального
метаболизма могут быть промежуточные или конечные про¬
дукты отдельных метаболических путей.Ингибитором фосфофруктокиназы может быть фосфоенол¬
пируват, активатором — ADP, пируваткиназа активируется
фруктозо-1,6-бисфосфатом и рибозо-5-фосфатом [105], ингиби¬
тором пируватдегидрогеназы может быть NADH, активатором —
фосфоенолпируват и АМР, фосфоенолпируват-карбоксилаза ак¬
тивируется фруктозо-1,6-бисфосфатом [68] и ингибируется ас-
партатом, ацетил-CoA, цитрат-синтаза у грамотрицательных
бактерий ингибируется NADH и оксоглутаратом [31], у грам-
положительных бактерий — АТР и т. д. Таким образом, инги¬
биторами ферментов обычно служат конечные продукты, акти¬
ваторами — предшественники цепи реакций.Самым распространенным примером служит аллостерическое
ингибирование ферментов конечным продуктом. Однако данная
регуляция может осуществляться одновременно несколькими
регуляторами. При этом эффект может быть кумулятивным или
мультивалентным. Примером мультивалентного ингибирования
является регуляция аспартаткиназы — ключевого фермента
цепи синтеза лизина у коринебактерий. Если лизин и треонин
в концентрациях 10 мМ в отдельности снижают активность
аспартаткиназы на 10... 20%, при одновременном действии
этих аминокислот активность фермента снижается на 50% [96].Часто существует несколько ферментов, осуществляющих
одну и ту же функцию, каждый из которых регулируется раз¬
личным эффектором. Например, у Е. coli три изомера аспар¬
таткиназы:I — регулируется треонином;II — не подвергается аллостерической регуляции, репресси¬
руется метионином;III — ингибируется и репрессируется лизином.Следовательно, у Е. coli в отличие от коринебактерий ас-партаткиназа не регулируется мультивалентно.Наличие нескольких ферментов, осуществляющих одну и ту
же реакцию, но реализующих различный аллостерический кон¬
троль, позволяет получать мутанты с дефектами по одному или
другому изоферменту, т. е. мутанты, нечувствительные к ка¬
кому-то конечному продукту (например, лизину).Феномен мультивалентного ингибирования должен учиты¬
ваться при регуляции синтеза. Например, недопустимо введение
треонинсодержащих субстратов в процессе культивирования
Br. flavum при значительном накоплении лизина, особенно при
низкой удельной скорости роста клеток.Аллостерическими регуляторами могут быть не только ко¬
нечные продукты, но и предшественники (precursor activation)
[32]. При этом метаболит — предшественник цепи реакций
может активировать последний фермент метаболического пути.Ковалентная модификация ферментов. Важным механизмом
регуляции активности ферментов является их ковалентная мо¬
дификация. Преимущество этого механизма — в изменении ак¬
тивности ферментов при сравнительно низких колебаниях кон¬
центрации регулирующих метаболитов в клетках, а также в
высокой скорости этого процесса: за несколько минут актив¬
ность ферментов может изменяться на 80... 90%.Регуляция активности ферментов, а также биологически
активных белков данным механизмом впервые установлена
только в конце 60-х годов, поэтому их список постепенно по¬
полняется '[30, 70].Число белков, регулируемых ковалентной модификацией в
бактериальной клетке, весьма значительно. У бактерий из¬
вести!! фосфорилирование, аденилирование и ацетилирование
белков. При этом присоединение групп к сериновым или тиро¬
зином мм остаткам в белковых молекулах, катализируемое ки¬
назами, приводит белки в неактивное состояние. Отщепление-
Биохимические основы регуляции89ортофосфатных, ацетильных групп от молекул белков при функ¬
ционировании фосфатаз, деацетилаз и пр. обратимо переводит
белки в активное состояние. Имеются примеры того, как кова¬
лентная модификация делает ферменты неактивными.Наиболее изученным примером регуляции активности фер¬
ментов ковалентной модификацией является фосфорилирование
NADP+-3aBHCHMOft изоцитратдегидрогеназы у Е. coli [70]. При
этом киназы, переносящие четыре фосфатные группы от АТР
на молекулу изоцитратдегидрогеназы, переводят ее в неактив¬
ную форму. Снижение активности ферментов при этом объяс¬
няется их неспособностью связывать кофермент, так как
фосфорилирование фермента происходит вблизи коферментсвя-
зывающего центра. При отщеплении фосфатных групп с по¬
мощью фосфатаз фермент обратимо переходит в активное
состояние.4ATP 4ADP\ киназа у'Изоцитратдегидро-геназаактивнаяформа4Р, тбяИ'ф0Сфа 4Н20
1 тазаИзоцитратдегидро-
геназа -Ф,неактивнаяформаПоказано, что киназа и фосфатаза у изоцитратдегидроге-
назы являются одним и тем же белком, имеющим две противо¬
положные функции. Пока неизвестно, каково преимущество
существования такого бифункционального белка.Снижение активности изоцитратдегидрогеназы путем фос-
форилирования происходит при росте Е. coli на ацетате [70].
При этом инактивация изоцитратдегидрогеназы приводит к
снижению катаболизма изоцитрата в ЦТК. Накопление послед¬
него в клетках вызывает рост активности изоцитрат-лиазы —
ключевого фермента глиоксилатного шунта. Следовательно,
фосфорилирование изоцитратдегидрогеназы приводит к вклю¬
чению изоцитрата в глиоксилатный шунт. Этому способствуют
также значительные различия /См для изоцитрата у изоцитрат¬
дегидрогеназы (1...2 мкМ) и у изоцитрат-лиазы (примерно3 мМ).Физиологический смысл снижения активности ЦТК на аце¬
тате заключается в следующем. Если источником углерода для
бактерий является ацетат, функционирование ЦТК приводит к
выделению обоих атомов углерода ацетата в виде двух моле¬
кул С02, т. е. наступает лимитирование роста бактерий по
источнику углерода. Бактерии выходят из этой ситуации
включением новых ферментов изоцитрат-лиазы и малат-синтазы*
обеспечивая таким путем синтез сукцината, оксалоацетата и
других предшественников для анаболических процессов.Данное снижение активности изоцитратдегидрогеназы при
культивировании бактерий на ацетате, показанное у Е. coli
[25], нельзя абсолютизировать. При культивировании Br. flavum
в средах с добавлением ацетата активность изоцитратдегидро¬
геназы часто увеличивается. При этом ЦТК и глиоксилатный
шунт функционируют одновременно. Более подробно регуляция
соотношения активности этих метаболических путей у Br. flavum
показана в разделе 2.5.Полученные нами данные позволяют предполагать, что фак¬
тором, определяющим фосфорилирование изоцитратдегидроге¬
назы при культивировании бактерий в средах с ацетатом,
является концентрация АТР в клетках. Его недостаток, даже
при росте бактерий на ацетате, приводит к повышению актив¬
ности изоцитратдегидрогеназы, но не глиоксилатного шунта.
Очевидно, только при повышении концентрации АТР в клетках
происходят фосфорилирование изоцитратдегидрогеназы и повы¬
шение активности глиоксилатного шунта.Ковалентной модификацией регулируется также скорость,
транспорта сахаров с помощью ФТС. Снижение этой скорости
происходит при фосфорилировании с помощью АТР НРг-белка —
одного из компонентов ФТС [97]. Следует отметить, что АТР-
протеинкиназа дополнительно (аллостерически) активируется
фруктозо-1,6-бисфосфатом и глюконат-6-фосфатом, т. е. продук¬
тами катаболизма глюкозы. Таким образом, при образовании
избыточных количеств АТР, а также указанных катаболиток
глюкозы скорость потребления сахаров клетками снижается,
т. е. реализуется координация синтеза АТР и переноса сахаров
в клетку.Примером регуляции активности ферментов ковалентной мо¬
дификацией является также аденилирование глутамин-синтазы
осуществляющей синтез глутамина из глутамата:Однако при этом с помощью 12 молекул АТР происходит
аденилирование, а не фосфорилирование определенных участ¬
ков молекул глутамин-синтазы:Г лутамин-сиитетаза
(КФ 6.3.1.2)Глутамат -f NH3-f АТРГлутамин + ADP + Pi + H20.12 АТР 12 РРг*Глутамин-синтаза(активная)^ Глутамин-синтаза - (АМР) 12
(неактивная)
Биохимические основы регуляции91Регуляторы активности ферментов. Как известно, физиоло¬
гической основой изменения активности ферментов с помощью
указанных выше механизмов является необходимость повыше¬
ния активности ферментов для увеличения скорости образова¬
ния в клетках лимитирующих рост метаболитов, а также сни¬
жения биосинтеза при образовании их избыточных количеств.Как при аллостерической регуляции, так и при ковалентной
модификации регуляторами часто служат продукты энергети¬
ческого метаболизма АТР, NADPH и др., а также катаболиты
и конечные продукты путей метаболизма. АТР часто является
аллостернческим ингибитором ферментов центральных метабо¬
лических путей. В то же время следует упомянуть активирова¬
ние указанных ферментов с помощью ADP или АМР. Более
четко регулирующую роль продуктов энергетического метабо¬
лизма выражает величина аденилатного энергетического заряда,
введенная Аткинсоном*:ATP+VaADPATP+ADP+AMP*Если аденилаты в клетках находятся в виде АТР, ЭЗ равно
•единице, если в виде АМР — нулю. Следовательно, величина
33 выражает энергию, аккумулированную в аденилатной сис¬
теме.Имеется большая вариабельность в эффекторах, регулирую¬
щих активность одного и того же фермента у различных бакте¬
рий. Регуляция у грамположительных и грамотрицательных
бактерий, а также аэробов или анаэробов резко различается.
У грамотрицательных бактерий регулятором ферментов часто
служит NAD(P)H. Неодинаковая регуляция одного и того же
фермента может возникнуть при изменении его структуры.Регуляция путей метаболизма, имеющих только одну функ¬
цию — катаболическую или анаболическую, — относительно
проста, т. е. конечный продукт ингибирует первый фермент цепи
синтеза. Например, лизин, треонин и метионин у Е. coli в
'Определенных концентрациях снижают активность аспартатки-
назы — первого фермента цепей их биосинтеза. Однако регуля¬
ция не всегда так проста. Как показано, все системы переноса
глюкозы в клетку бактерии (активный транспорт с симпортом
Н+, ФТС и даже облегченная диффузия) ингибируются глю-
козо-6-фосфатом. Предполагается, что последний воздействует
на аллостерическнй центр фермента II, находящегося на внут¬
ренней стороне мембраны, снижая таким образом сродство пер-
меазы к субстрату. Однако возможна также регуляция глю-
козо-6-фосфатом пермеаз других сахаров, например лактозы
[83].* Atkinson D. Е. Cellular energy metabolism and its regulation. — N. Y.:
Acad. Press, 1977. — P. 387.
Активность пермеаз регулируется также энергизированнымсостоянием мембран. Повышение величины Д|хн+ может сни¬
жать скорость транспорта. Показано, что в зависимости от
величины последней меняется сродство фермента II фосфо^
трансферазной системы к субстрату.Относительно сложна регуляция активности ферментов ме¬
таболических путей, играющих двойную роль — катаболиче-
скую и анаболическую.В качестве примеров можно назвать гликолиз, ЦТК и ГМП.
При регуляции активности амфиболических ферментов путей
происходит ингибирование первого фермента конечным продук¬
том и активирование последнего фермента предшественником.При функционировании гликолиза такими ферментами, регу¬
лируемыми аллостерически, являются фосфофруктокиназа и
пируваткиназа. Фосфофруктокиназа ингибируется АТР и фос-
фоенолпируватом, т. е. конечными продуктами цепи реакций;
пируваткиназа активируется фруктозо-1,6-бисфосфатом [32].Ферменты гексозомонофосфатного пути, например глюкозо-
6-фосфат-дегидрогеназа и 6-фосфоглюконат-дегидрогеназа, регу¬
лируются АТР, а у бактерий с конечным катаболизмом про¬
дуктов гексозомонофосфатного пути в 2-кето-3-дезокси-6-фос-
фоглюконатном пути — фосфоенолпируватом [32]. У коринебак¬
терий показано ингибирование глюкозо-6-фосфат-дегидрогеназы
и 6-фосфогл юконатдегидрогеназы фруктозо-1,6-бисфосфатом,
оксалоацетатом, эритрозо-4-фосфатом, ацетил-СоА, рибулозо-5-фосфатом и NAD(P)H [99, 100]. В то же время эти ферменты
не регулируются АТР. Как видно, при этом регуляторами фер¬
ментов ГМП служат как конечные продукты этого пути, так и
катаболиты гликолиза и ЦТК. На данном примере показано,
что пути центрального метаболизма регулируются координиро¬
ванно.Физиологический смысл данной регуляции можно объяснить
следующим: указанные метаболиты — это катаболиты глюкозы,
необходимые для биосинтеза всех клеточных компонентов. Если
в клетках происходит их накопление, это свидетельствует о том,
что синтез клеточных компонентов из данных предшественников
и рост клеток невозможны и нет необходимости в функциониро¬
вании ГМП — поставщика пентозофосфатов для синтеза нуклеи¬
новых кислот.Результаты исследования регуляции метаболизма Br. flavum
дают основание предполагать, что цитрат-синтаза и особенно
аконитаза ингибируются АТР. Снижение продуцирования АТР
ингибитором окислительного фосфорилирования KCN в концен¬
трации 10~3 М приводит к резкому увеличению активности ако-
нитазы, а также фосфоенолпируват-карбоксилазы — фермента
Биохимические основы регуляции93анаплеротического синтеза оксалоацетата. Активность этих фер¬
ментов за 15 мин повышается примерно в 10 раз.При использовании бесклеточных экстрактов активность
аконитазы заметно снижается при концентрации АТР в реак¬
ционной смеси 2,5 мМ и выше, в то же время активность фос-
фофруктокиназы при таковой около 5 мМ. Следовательно, клю¬
чевые ферменты (особенно аконитаза) у Br. flavum подверга¬
ются энергетическому контролю.Биосинтетический контроль ЦТК у бактерий проявляется
регуляцией цитрат-синтазы оксоглутаратом как у грамположи-
тельных (Bacillus polymyxa и др.), так и грамотрицательных
факультативных анаэробов (Е. coli, Proteus vulgaris, Salmo¬
nella amotum). Указанный контроль у некоторых бактерий про¬
является также ингибированием цитрат-синтазы оксоглутаратом
и сукцинил-CoA, т. е. продуктами, образующимися в разомкну¬
том ЦТК. В то же время у грамотрицательных (Pseudomonas
aeruginosa, Pseudomonas fluorescens и др.)» а также у грам-
положительных аэробов (бактерии родов Bacillus, Streptomyces
и др.) ингибирования цитрат-синтазы оксоглутаратом не про¬
исходит.Своеобразный биосинтетический контроль ЦТК наблюдается
у коринебактерий. Нами выявлено, что при образовании разом¬
кнутого цикла у этих бактерий снижается активность акони¬
тазы, резко увеличивается активность NADP+-3aBHCHMofi глута-
матдегидрогеназы и синтез глутамата. Последнее можно считать
механизмом удаления избытка оксоглутарата. В периодическом
процессе культивирования повышение активности аконитазы
происходит только при снижении активности глутаматдегидро-
геназы и содержания глутамата в клетках (рис. 2.28). На
кривой 1 показана сумма аминокислот обменного фонда, но
поскольку глутамата более 90%, от общей суммы аминокислот
обменного фонда, эта кривая отражает также динамику содер¬
жания глутамата.Аналогичные данные снижения активности аконитазы при
образовании разомкнутого ЦТК и повышении активности глу-
таматдегидрогеназы были получены в разных условиях культи¬
вирования. Это позволило предположить, что глутамат может
быть одним из эффекторов функционирования ЦТК у Br. flavum.Опыты показали, что при росте клеток в средах с глутама-
том активность аконитазы снижается более чем в 4 раза, при
этом почти во столько же раз возрастает активность глкжозо-
6-фосфат-дегидрогеназы — фермента гексозомонофосфатного
пути. Регуляторное действие глутамата на активность акони¬
тазы обнаружено также у Bacillus subtilis [43].Регуляция активности ферментов отдельных метаболических
путей взаимосвязана, так как ингибирование определенных фер-
ментов приводит к накоплению катаболитов, которые являются
If*I**10 20 30 40 501,4Puc. 2.28. Изменение содержания
a-NH2-rpynn аминокислот обменного
фонда (/), активность аконитазы (2)
и глутаматдегидрогеназы (5) у Вг.
flavum 22ЛД в процессе периодиче¬
ского культивирования:I — лаг-фаза (ji-=0,030 ч'); II — лога¬
рифмическая фаза (|1=0,179 ч '); III —
фаза замедленного роста (jlx=0, 103 ч1);
IV — стационарная фаза (м,=0,043. . .
... 0 ч1)субстратами для ферментов других метаболических путей. На¬
пример, увеличение активности глутаматдегидрогеназы приводит
к снижению активности аконитазы, в то же время активность
глюкозо-6-фосфат-дегидрогеназы и фосфоенолпируват-карбокси-
лазы увеличивается.Существенную роль в регуляции ЦТК у бактерий представ¬
ляет пируватдегидрогеназный комплекс, так как от него
зависит включение цикла. Этот комплекс, а именно дигидроли-
поамиддегидрогеназа, у некоторых бактерий ингибируется
NAD(P)H. Данная регуляция имеет место у Е. cdli, Acetobacter
calcoaceticus, Acetobacter vinelandii. Активность фермента сти¬
мулируется АМР, т. е. энергетический контроль ЦТК осущест¬
вляется также на уровне пируватдегидрогеназного комплекса.
При его ингибировании у Е. coli активируется пируватформиат-
лиаза [86].Существенную роль при функционировании ЦТК играет ре¬
гуляция активности фосфоенолпируват-карбоксилазы и других
ферментов, синтезирующих его ключевой метаболит — оксало¬
ацетат. У Br. flavum этот фермент регулируется аспартатом.
Активность фосфоенолпируват-карбоксилазы в присутствии
1 мМ аспартата снижается на 90%, ингибирование почти пол¬
ностью снижается в присутствии ацетил-СоА [91]. Данную
особенность следует учесть при целенаправленной регуляции
метаболизма бактерий, т. е. активность фосфоенолпируват-карб¬
оксилазы даже в присутствии аспартата можно увеличить при
повышении скорости потребления сахаров и активности цен¬
тральных метаболических путей.2.43. РЕГУЛЯЦИЯ СИНТЕЗА ФЕРМЕНТОВКонкретные механизмы регуляции синтеза белка у бактерий
важно знать для того, чтобы изменять их физиологическую ак¬
тивность в зависимости от условий культивирования, особенно
Биохимические основы регуляции95ОПЕРОНРис. 2.29. Механизм репрессии. Апо-
репрессор, вырабатываемый под кон¬
тролем гена регулятора (R), при на¬
личии корепрессора переходит в
форму репрессора. Последний связы¬
вается с геном-оператором (О), сиг¬
нал от О отсутствует; транскрипция,
трансляция и синтез белка не про¬
исходятпри получении мутантов, позволяющих достичь сверхсинтеза
продукта, например, при отсутствии обратной отрицательной
регуляции его синтеза.Индукция и репрессия. Механизмы индукции и репрессии
ферментов толкуются известной схемой, предложенной Жако¬
бом и Моно. При отсутствии индуктора оперон, кодирующий
синтез белков, находится под отрицательным контролем репрес¬
сора (рис. 2.29). Последний, связываясь с оператором, предот¬
вращает транскрипцию структурных генов. Синтез белка при
этом не происходит.При наличии индуктора репрессор аллостерически перехо¬
дит в состояние, при котором он не способен связываться с
оператором. Происходят транскрипция оперона и синтез инфор¬
мационной РНК (мРНК), а также трансляция и синтез белка
(рис. 2.30, А).Индукторами синтеза ферментов могут быть не только суб¬
страты или их аналоги, но и катаболиты субстратов. В послед¬
нем случае индукция имеет последовательный характер.В случае репрессии низкомолекулярные регуляторы (конеч¬
ные продукты и катаболиты субстратов) — корепрессоры —
взаимодействуют с апорепрессором, вырабатываемым регуля¬
торным геном. Апорепрессор при этом переходит в форму ис¬
тинного репрессора. Последний, связываясь с геном-оператором,
прекращает транскрипцию и синтез мРНК. Следовательно, бе-
лок-репрессор, благодаря способности обратимо связываться с
индуктором или с оператором, может определять репрессию
или индукцию синтеза белков. Репрессия при этом может про¬
исходить при наличии в среде индуктора, так как действие
индуктора и корепрессора может быть конкурентным.Регуляция по данной схеме представляет собой контроль на
уровне транскрипции, ибо происходит на стадии синтеза мРНК
при включении или выключении транскрипции генов. СледуетСтруктурные ш/ь •
R Р 0 ' X Y I:—(р>\ о нишrr.ec:w Корпргссср Репрессоо
CAMPСЩсатЬ(puIocom^--^■>"Nv:, v;ИнгиЪиробаниеА Б-An open рессор1-Реп рессор■ - Индуктор
и I Д| 11 \-Нрпктивнмй penpeccopРис. 2.30. Механизмы индукции (Л) и регуляция синтеза ката-
болитчувствительных белков, контролируемых САР-сАМР-ком-
плексом (5)отметить, что если при изменении активности регуляторы —
низкомолекулярные соединения — действуют на ферменты не¬
посредственно, то при изменении скорости синтеза через
внутриклеточный регулятор (репрессор), представляющий собой
белок.Катаболитная репрессия. При катаболитной репрессии эф¬
фекторы (глюкоза или ее катаболиты) часто предотвращают
транскрипцию как транспортных белков, так и ферментов ка¬
таболизма других субстратов. Обычно это проявляется как
диауксия.Глюкоза и ее катаболиты у Е. coli репрессируют синтез
ферментов катаболизма лактозы, арабинозы, сорбитола, кси¬
лита, глицерина и др. Данные ферменты синтезируются лишь
после того, когда израсходована глюкоза. В некоторых случаях
глюкоза не вызывает репрессии ферментов другого источника
углерода, но предотвращает ее транспорт в клетку (например,
перенос галактозы в клетках Е. coli). Данное явление называют
«исключением индуктора». В большинстве случаев глюкоза вы¬
зывает одновременно репрессию синтеза пермеаз и ферментов
катаболизма других субстратов.Механизм регуляции синтеза ряда ферментов катаболитндй
репрессией более подробно исследован у Е. coli. Считают, что
Биохимические основы регуляции97определенную роль играют циклический 3',5'-аденозинмонофос-
фат (сАМР) и белок, активирующий катаболитчувствительные
гены [56]. Синтез последнего кодируется CRP-геном (catabolite
repressor protein gene). CAP (catabolite-activator protein) имеет
участки для связывания с циклическим АМР и с промоторным
геном (рис. 2.30, Б). При связывании комплекса циклического
3',5'-аденозинмонофосфата и катаболитактивирующего белка с
указанным геном возможно присоединение РНК-полимеразы с
промоторным геном. Следовательно, синтез катаболитчувстви-
тельных ферментов находится под двойным контролем: обыч¬
ным механизмом индукции и репрессии, а также регуляцией
катаболитной репрессией.Рассмотрим вопрос о взаимосвязи концентрации глюкозы и
репрессии синтеза ферментов. При культивировании бактерий
в средах с повышенным содержанием глюкозы в клетках могут
образоваться неиспользованные катаболиты глюкозы, являю¬
щиеся эффекторами репрессии Гл ю ten я я и
ее катаболиты действуют на синтез белка посредством регуля¬
ции синтеза сАМР путем_)Ш11£щЩ}ВШ1^довательно, концентрация сАМР в клетках "при этом снижа¬
ется. Например, у Е. coli при катаболитной репрессии отмечено
уменьшение концентрации сАМР в клетках от 14 до 2 мкМ.
В данных условиях не происходит транскрипция катаболитчув-
ствительных генов, так как связывание РНК-полимеразы с про¬
мотором возможно только при одновременном присоединении
комплекса циклического 3',5'-аденозинмонофосфата и катабо¬
литактивирующего белка.Ингибиторами аденилатциклазы у Е. coliy по некоторым
данным, являются оксалоацетат, малат и другие катаболиты
глюкозы. Недавно выявлен более сложный механизм регуляции
этого фермента. Так, при переносе глюкозы в клетку фосфо-
трансферазной системой у Е. coli ингибитором аденилатциклазы
является фермент III. Последовательность данной регуляции
такова. При наличии ФТС для переноса глюкозы фермент III
в клетке фосфорилируется фосфоенолпируватом, образуется
фосфофермент III. Фосфатная группа передается на глюкозу,
образуются глюкозо-6-фосфат и свободный фермент III. Послед¬
ний и является регулятором аденилатциклазы [41].При снижении скорости транспорта глюкозы в клетку, на¬
оборот, повышается содержание фосфофермента III и восстанав¬
ливается активность аденилатциклазы. Согласно данной регу¬
ляции, глюкоза является ингибитором аденилатциклазы и
эффектором, регулирующим транскрипцию катаболитчувствитель-
ных генов, только в том случае, если она транспортируется в
клетки. Механизм катаболитной репрессии изучен недостаточно,
так как в данном вопросе много неясностей. Нет сведений, как
реализуется эта регуляция у бактерий (в основном грамполо-7 — 361
жительных), не имеющих аденилатциклазы и сАМР. Трудно
также связать катаболитную репрессию у бактерий, имеющих
сАМР, со снижением его концентрации в клетках. Даже у
Е. coli эта закономерность выражена нечетко [106]. Показано,
что бактерии поддерживают относительно константную концен¬
трацию сАМР при изменении удельной скорости роста клеток
(ji) от 0,05 до 0,4 ч”1. Содержание сАМР в клетках Е. coli при
этом соответствовало 0,22...0,37 мкМ в условиях лимита азо¬
том и около 5,5 мкМ в условиях лимита глюкозой. В то же
время активность ферментов гликолиза, ЦТК и дыхательной
цепи менялась значительно.На данном примере видно, что при изменении скорости
роста клеток связь между содержанием сАМР в клетках и
синтезом катаболитчувствительных ферментов выражена слабо.
Более значительное изменение содержания сАМР наблюдалось
при культивировании бактерий в условиях избыточной (лимит
азотом) или лимитирующей концентрации глюкозы в среде (ли¬
мит глюкозой). Однако даже при этом повышение концентра¬
ции сАМР только в клетках в 1,5 раза вызывало повышение
синтеза катаболитчувствительного фермента в 80 раз [107].
Следовательно, концентрация сАМР в клетках бактерий не мо¬
жет быть показателем катаболитной репрессии. Более достовер¬
ной является обратная пропорциональность между активностью
аденилатциклазы и степенью данной репрессии.сАМР снижает активность терминирующих генов транскрип¬
ции [103]. Синтез мРНК катаболитчувствительных генов при
этом продолжается даже в условиях, обычно вызывающих ка¬
таболитную репрессию. На основе этой концепции роль сАМР
можно связать с его антитерминирующим действием.Несмотря на то что в регуляторном действии с АМР много*
неясного, тем не менее имеются данные, что катаболитная реп¬
рессия снимается и синтез ферментов восстанавливается при
добавлении сАМР [103]. Например, если синтез р-галактози-
дазы у Е. coli при катаболитной репрессии снижается в 80 раз,
при добавлении сАМР в среду культивирования до концентра¬
ции 2 мМ активность фермента повышается в 20 раз, т. е.
катаболитная репрессия частично снимается [107]. Однако не¬
которые данные свидетельствуют о том, что катаболитная реп¬
рессия у Е. coli не снимается сАМР i[45].Трудно судить, насколько признанной окажется роль сАМР
в регуляции синтеза катаболитчувствительных ферментов. Тем
не менее изучение механизма катаболитной репрессии, в част¬
ности роли сАМР при этом, имеет определенное значение при
создании условий роста для бактерий, не вызывающих катабо¬
литную репрессию необходимых ферментов, а также при полу¬
чении мутантов, нечувствительных к данной репрессии (напри¬
мер, с измененной регуляцией аденилатциклазы и др.).
Биохимические основы регуляции99Рис. 2.31. Изменение скорости транс-
порта глюкозы у Br. flavum 22ЛД в к ^
средах, содержащих 0,015% глюкозы,
при добавлении 0,01... 1,5% ацетата0,5 %0СН3Сд0Н;/оВажно также выяснить конкретное проявление катаболитной
репрессии у различных бактерий. Если у Е. coli и пр. эффекто¬
рами репрессии синтеза ряда ферментов являются глюкоза и ее
катаболиты, то имеется множество бактерий, которые не под¬
чиняются данной закономерности (бактерии родов Brevibacte-
rium, Micrococcus, Arthrobacter, Pseudomonas и др.)- У этих
бактерий глюкоза и ее катаболиты не всегда репрессируют
транспорт и синтез ферментов катаболизма других субстратов.• Многие бактерии, в том числе коринеподобные, проявляют
неклассический тип последовательности использования субстра¬
тов из их смеси. Зачастую они сначала используют другие са¬
хара и органические кислоты, а затем глюкозу. Например, если
у Е. coli уже при концентрации глюкозы 1,8 г/л и менее наблю¬
дается репрессия ферментов катаболизма глицерола и лактозы
[45], то при культивировании Br. flavum в средах, содержащих
глюкозу и ацетат, использование ацетата и синтез ферментов
его катаболизма (тест фермент изоцитрат-лиаза) не репресси¬
руются даже при концентрации глюкозы в среде 120 г/л. На¬
оборот, бактерии при этом сначала используют ацетат, а затем
глюкозу. Ацетат в концентрациях менее 0,1% снижает транс¬
порт глюкозы в клетки этих бактерий (рис. 2.31). Следова¬
тельно, данные бактерии проявляют неклассический тип ди-
ауксии.Предпочтительное использование органических кислот по
сравнению с глюкозой отмечено также у Arthrobacter pyridi-
nolisy A. cristallopoietes и у бактерий рода Pseudomonas. Как
отмечено Е. Л. Головлевым, эти бактерии демонстрируют не¬
обычный тип ингибирования в полисубстратных средах, проти¬
воположный катаболитной репрессии и катаболитному ингиби¬
рованию бактерий кишечной группы [4].Как показано на примере Br. flavum, регуляция транспорта
и ферментов катаболизма субстратов на многокомпонентных
средах, наиболее сложна. Эти бактерии могут не только пред¬
варительно использовать ацетат, но и в некоторых условиях
100Глава 2« т14 8 12 16 Sf%Рис. 2.32. Изменение активности аконитазы
у Br. flavum 22ЛД со скоростью роста
0,2 ч-1 (/) или 0,1 ч-1 (2) при повыше¬
нии концентрации сахарозы в средеиспользовать ацетат и глюкозу одновременно, а в определен¬
ных случаях — предпочтительно глюкозу.В то же время репрессия ферментов ЦТК (цитрат-синтазы,
аконитазы) и др. при повышении концентрации глюкозы или
сахарозы в среде хорошо выражена. Следует отметить, что кон¬
центрации глюкозы, вызывающие катаболитную репрессию
ферментов у Br. flavum (очевидно, и у других бактерий), нельзя
абсолютизировать. Если концентрации глюкозы (или сахарозы),
вызывающие снижение активности аконитазы у. Br. flavum
22ЛД при удельной скорости роста клеток 0,1 ч-1, выше 8%,
то при 0,2 ч-1 активность фермента снижается в значительно
меньшей степени (рис. 2.32). У нерастущих клеток репрессия
фермента наблюдается даже при концентрации сахаров 2% и
более.Следовательно, механизмы катаболитной репрессии у раз¬
личных бактерий варьируют. Регуляцию синтеза белков ката¬
болитной респрессией следует учитывать при регуляции синтеза
продуктов микроорганизмами. При этом предпочтительно ис¬
пользовать как генетические, так и физиологические методы
снижения этого эффекта в процессе культивирования бактерий.Нетрадиционные типы репрессии синтеза белков конечными
продуктами. Кроме классического механизма репрессии транс¬
крипции генов и синтеза мРНК конечными продуктами, сущест¬
вуют дополнительные. В качестве примера можно привести ре¬
гуляцию активности РНК-полимеразы. При снижении актив¬
ности фермента конечными продуктами происходит ослабление
транскрипции. При этом синтез мРНК прекращается. Вследст¬
вие короткого времени полураспада уже синтезированного
мРНК (около 3 мин) быстро прекращается также синтез белка
[49]. Следовательно, при накоплении избыточного количества
конечного продукта синтез белка более оперативно, чем при
репрессии, выключается механизмом ослабления транскрипции.
Путем ослабления транскрипции генов регулируется синтез ас-
Биохимические основы регуляции101партаткиназы I у Е. coli ,[49]. Данный фермент ингибируется
треонином. Следовательно, ослабление транскрипции — допол¬
нительный механизм регуляции.Известны такие механизмы регуляции скорости транскрип¬
ции, как изменение структуры и конформации (например, сверх-
спирализация) ДНК. Исследований и примеров по данному ме¬
ханизму регуляции пока мало. Однако ясно, что указанные
механизмы регуляции синтеза белков являются наиболее опера¬
тивными по сравнению с механизмом репрессии.. Знание механизмов репрессии синтеза белков у бактерий
важно по двум причинам:1) позволяет разрабатывать способы устранения этих эф¬
фектов при сверхсинтезе продуктов бактериями;2) конечные продукты метаболических путей могут быть
составной частью комплексных сред, используемых при культи¬
вировании бактерий. Успешный их рост и синтез продуктов
часто могут быть достигнуты только при устранении репресси¬
рующего эффекта продуктов, присутствующих в среде.2.5. РЕГУЛЯЦИЯ ЭНЕРГЕТИЧЕСКОГО
И КОНСТРУКТИВНОГО МЕТАБОЛИЗМАИзменение условий окружающей среды приводит к координиро¬
ванным изменениям активности ферментов метаболизма и ско¬
рости транспорта субстратов в клетках. При избыточной или
недостаточной скорости продуцирования АТР согласованно
меняются активность ферментов метаболизма и скорость пере¬
носа субстратов в клетках. Данная координация направлена на
поддержание необходимой скорости продуцирования энергии в
клетках и поддержание роста бактерий при изменении условий
окружающей среды.2.5.1. КООРДИНАЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
И СКОРОСТИ ПОТРЕБЛЕНИЯ СУБСТРАТОВПри культивировании коринебактерий в различных условиях
окружающей среды нами выявлена следующая закономерность:
при моментальном воздействии на бактерии различными фак¬
торами (при повышении концентрации источников углерода,
снижении или повышении интенсивности аэрации, воздействии
на клетки ингибиторов переноса электронов по электронно¬
транспортной цепи и др.) одновременно с изменением актив¬
ности ферментов катаболизма глюкозы меняется также скорость
ее потребления. Поскольку при ингибировании активности
Таблица 2.7. Взаимосвязь изменения скорости потребления сахарозы,активности фосфофруктокиназы и аконитазы у Br. flavum 22ЛД
в условиях периодического культивированияЧас куль¬
тивирова¬
нияСодержа¬
ние саха¬
розы, %М., ч-‘<7S, г/ч
на 1 г клетокФосфофрук¬токиназаАконитазаАктивность, катал • 10 11
на 1 мг белка0162101128-й14,20,280,324313217-й12,90,120,253755022-й8,80,040,203228641-й4,60,020,15129310244-йПодпитка сахарозой— 22 г/л48-й4,60,060,3344105855-й0,80,040,314327115определенных ферментов скорость потребления субстратов часто
повышается, можно заключить, что определяющим фактором
при изменении скорости транспорта субстратов является именно
регуляция активности ферментов, их катаболизма.Нами было показано, что при повышении активности фер¬
ментов ЦТК происходит снижение активности ферментов гли¬
колиза и скорости потребления глюкозы или сахарозы клет¬
ками, и наоборот.Координацию изменения активности указанных ферментов
можно проследить в условиях периодического культивирова¬
ния. При этом пересев клеток Br. flavum 22ЛД с предвари¬
тельно индуцированными ферментами ЦТК на среды, содержа¬
щие 16% сахарозы, приводит к снижению активности акони¬
тазы, повышению активности фосфофруктокиназы — фермента
гликолиза и скорости потребления сахарозы клетками qs
(табл. 2.7). При снижении концентрации сахарозы в среде ак¬
тивность аконитазы повышается, снижается активность фосфо¬
фруктокиназы и величина qs. При добавлении в среду сахарозы
к 41-му часу культивирования до повышения ее концентрации
на 2,2%, снова снижается активность аконитазы, повышается
активность фосфофруктокиназы и величина qs.Следовательно, наблюдается обратная зависимость между
изменением активности аконитазы, с одной стороны, и актив¬
ности фосфофруктокиназы и величины qs — с другой. Однако
в условиях периодического культивирования бактерий измене¬
ние указанных величин может быть также следствием изменения
удельной скорости роста клеток. В связи с этим данная зако¬
номерность была проверена при пересеве клеток с одной и той
Биохимические основы регуляции103Таблица 2.8. Изменение скорости транспорта глюкозы при действии ПХФ
и KCN на клетки Вт. flavum 22ЛДВариантИнгибитор, концен¬Ф-осфо-фрукто-киназаАкони-*газаСкорость транс¬
порта глюкозытрация, МАктивность,
катал • 10_п на
1 мг белкаимп/мин
на 1 мг
клеток% к кон-1ТРОЛЮКлетки с инду¬
цированнымКонтроль (без инги¬
битора)230184,01258100ЦТКПХФ, 10-341718,936526,4ПХФ, ю-443968,02342169,0ПХФ, 10-52421281478106,8KCN, 5-10-342816,52210160Глнколитичес-
кие клеткиКонтроль (без инги¬
битора)46402060100ПХФ, 10-3230084340,9ПХФ, 10~437002092101,5ПХФ, 10-53480202298,1KCN, 5-10-345201812110же скоростью роста на среды с различными концентрациями
глюкозы. При этом закономерность изменения активности ука¬
занных ферментов и скорости потребления глюкозы клетками
при повышении концентрации глюкозы до 10% такая же, как
и в условиях периодического культивирования. При, повышении
концентрации глюкозы до 15% активность указанных ферментов
и величина qs снижаются.Для установления факторов, координирующих активность
ферментов метаболизма и транспорта глюкозы у Br. flavum,
была изучена взаимосвязь этих процессов при изменении ско¬
рости продуцирования АТР в клетках. Использованы ингибитор
переноса электронов KCN и пентахлорфенол (ПХФ) — разоб¬
щитель процессов окисления и фосфорилирования в электронно¬
транспортной цепи (табл. 2.8).Было показано, что в определенных пределах изменений
скорости продуцирования АТР у коринебактерий наблюдается
обратная зависимость между изменением активности аконитазы
и активности фосфофруктокиназы и величины qs (рис. 2.33).
При максимальной активности аконитазы у Br. flavum 22ЛД
скорость потребления сахаров клетками характеризуется вели¬
чиной 0,2 г/ч на 1 г клеток, при максимальной активности фос¬
фофруктокиназы — примерно 0,4 г/ч на 1 г клеток. Данная
закономерность показана у Br. flavum при регуляции метабо¬
лизма бактерий изменением концентраций сахаров, скорости
протока среды в непрерывных условиях культивирования, вели¬
чины парциального давления кислорода в среде и т. д.
104Глава 2Рис. 2.33. Изменение активности аконитазы и фосфофруктокиназы в зависи¬
мости от скорости потребления сахаров клетками у Br. flavum 22ЛД в
аэробных условияхУвеличение скорости потребления сахаров клетками может
быть вызвано как снижением активности регуляторных фер¬
ментов ЦТК, так и при снижении окислительного фосфорилиро-
вания в ЭТЦ. Результаты наших исследований свидетельствуют
о том, что фактором, регулирующим величину qs у коринебак¬
терий, является скорость продуцирования АТР в клетках. Ее
снижение в определенных пределах вызывает повышение ско¬
рости потребления сахаров клетками. При сравнении скоростей
снижения активности аконитазы и повышения величины qs в
аэробных условиях видно, что последняя возрастает на вели¬
чину, обеспечивающую синтез АТР гликолитическим путем
(рис. 2.34). Теоретически данная закономерность проверена на
основе данных энергетической эффективности продуцирования
АТР в гликолизе и ЦТК (28 моль АТР на 1 моль глюкозы)Актибность аконитазы,
катал-10~н на 1мг
белкаРис. 2.34. Зависимость активности акони¬
тазы от скорости потребления глюкозы
клетками при переходе от аэробных к ана¬
эробным условиям (указано стрелкой):1 —> экспериментальные данные; 2 — теорети¬
ческие данны$
Биохимические основы регуляции105или только в гликолизе (6 моль АТР на 1 моль глюкозы, см.
табл. 2.9). При лимитировании кислородом скорости продуциро¬
вания АТР в клетках скорость потребления ими сахаров увели¬
чивается значительнее, чем снижается активность аконитазы.
Последнее объясняется значительным уменьшением образования
АТР (2 моль на 1 моль глюкозы).Следовательно, координацией активности ферментов и ско¬
рости потребления сахаров клетками регулируется скорость
продуцирования АТР. При этом клетки Br. flavum. способны
поддерживать на постоянном уровне мембранный электрохими¬
ческий потенциал, определенный по флуоресценции клеток с1-анилин-8-нафтосульфонатом. При снижении величины Дцн+,
создаваемой функционированием дыхательной цепи (доля, сни¬
жающаяся при действии пентахлорфенола), увеличиваетсяДцн+, создаваемая АТР, образующимся при гликолизе:Дцн, =Дц н, (снимаетсягликол сумдициклогексилкарбодиимидом) — Дц н+окисл. фосф
(снимается пентахлорфенолом).Однако поддержание постоянной скорости продуцирования
АТР повышением скорости потребления глюкозы невозможно
при резком снижении скорости синтеза АТР. Последнее можно,
очевидно, объяснить снижением скорости переноса глюкозы в
клетках в указанных условиях, так как следствием резкого сни¬
жения синтеза АТР является уменьшение Др,н+.На примере коринебактерий показано, что путем координи¬
рованной регуляции изменения активности ферментов и скоро¬
сти транспорта субстратов в клетках бактерии способны
поддерживать определенную скорость продуцирования АТР и
тем самым поддерживать рост в неблагоприятных условиях ок¬
ружающей среды.Если снижается скорость продуцирования АТР в ЦТК, то
поддержание той же скорости синтеза АТР гликолитическим
путем должно быть связано с увеличением потребления глю¬
козы в 4,66 раза и дополнительным синтезом 9,32 моль пиру-
вата, в анаэробных условиях — увеличением скорости потреб¬
ления глюкозы в 14 раз и синтезом 28 моль лактата.Синтез АТР при функционировании гликолиза и ЦТК:Глюкоза+12NAD (Р)+-+6С02+ 12NAD (Р) Н+4АТР;
12NAD(P)H+30a-»6H20+12NAD(P)Глюкоза-»-6С02+6Н20+28АТР(2.1)
106Глава 2Синтез АТР при функционировании гликолиза (аэробные
условия):Глюкоза+2МАВ+-»-2ЫАВН-|-2АТР+2Пируват
или (2.2)4,66Глюкоза+4,66НАО+->-4,66Н20-(-28АТР+9,32Пируват.Синтез АТР при функционировании гликолиза (анаэробные
условия):14Глюкоза-»-28АТР+28Лактат. (2.3)Следовательно, поддержание синтеза АТР при снижении
активности ферментов ЦТК связано с дополнительным исполь¬
зованием сахаров и приводит к сверхсинтезу различных мета¬
болитов (избыточный метаболизм).Из уравнений (2.1) ... (2.3) следует, что в случае снижения
активности ферментов ЦТК возможно поддержание синтеза того
же количества АТР путем увеличения потребления глюкозы
клетками. Значит, должен существовать какой-то регулирующий
фактор, согласующий активность ферментов и скорость потреб¬
ления сахаров клетками при изменении скорости продуцирова¬
ния АТР. Это должно иметь место и при изменении удельной
скорости роста клеток. Например, добавление лимитирующего
фактора (метионина и треонина) в среду при культивировании
Br, flavum приводит к повышению удельной скорости роста
клеток, активности ферментов и скорости потребления сахаров
клетками.Аткинсоном с соавт. показано, что повышение удельной ско¬
рости роста клеток (что аналогично снижению продолжитель¬
ности генерации) у Е. coli и Salmonella typhimurium приводит
к увеличению скорости обновления пула аденилатов [28]. Если
при низкой скорости роста клеток последний обновляется за4 ... 6 мин, то при высокой — за 40 с. При снижении продол¬
жительности генерации у 5. typhimurium в 12 раз указанный
пул обновляется в 10 раз быстрее; при снижении таковой у
Е. coli в 5 раз пул аденилатов обновляется в 5 раз быстрее.
Концентрация АТР в клетках при сокращении длительности ге¬
нерации в 5 ... 12 раз повышается только в 1,5 .. .2,0 раза.Клетки бактерий не способны накапливать АТР, так как
продолжительность его распада и ресинтеза мала — примерно
0,2 с [28]. Эта величина не зависит от удельной скорости
роста клеток. Если длительность генерации у бактерий равна3 ч, то АТР должен при этом ресинтезироваться около 54 000 раз.
Следовательно, синтез АТР в клетках должен поддерживаться
непрерывно и должен быть механизм, меняющий скорость его
продуцирования как при моментальном изменении скорости
синтеза, так и при изменении скорости использования АТР
клетками.
Биохимические основы регуляции107Поскольку бактерии способны поддерживать относительна
постоянную величину энергетического заряда [28], можно пред¬
положить, что именно она является фактором, координирующим
активность ферментов и скорость потребления субстратов клет¬
ками.Относительно постоянный уровень ЭЗ может поддерживаться
несколькими путями:1) увеличением скорости синтеза АТР путем повышения
активности ATP-продуцирующих ферментов или увеличением
скорости потребления энергетического субстрата клетками;2) снижением скорости синтеза АТР путем уменьшения ак¬
тивности ATP-регенерирующей системы клеток, экскрецией АТР
и др.;3) снижением содержания АМР в клетках, не способных к:
повышению активности ATP-регенерирующей системы. Содер¬
жание АМР снижается путем экскреции или увеличения скоро¬
сти его катаболизма с образованием аденина.Аткинсон с соавт. не считают, что ЭЗ является единственным
регулятором метаболических цепей - у бактерий, но метаболи¬
ческие пути всегда прямым или опосредованным путем регу¬
лируются ЭЗ. Регуляторная роль величины этого показателя
проявляется при его изменении уже на Q,01 единицы. Установ¬
ление зависимости метаболических процессов от изменения
величины ЭЗ практически невозможно вследствие высокой ско¬
рости оборота АТР, а также быстрой стабилизации ЭЗ. Чем
чувствительнее регуляторная система, тем труднее исследовать
указанную зависимость. Регуляторная роль абсолютных кон¬
центраций АТР в клетках, очевидно, менее выражена из-за не¬
стабильности. Так, если ЭЗ у некоторых бактерий меняется от
0,90 до 0,94, то содержание АТР в клетках — от 2,9 до
5,8 мкмоль на 1 г сухих клеток [28].В условиях избыточного или заниженного продуцирования
АТР бактерии пользуются различными путями для поддержа¬
ния скорости его продуцирования в соответствии со своими
потребностями:1) использованием и изменением активности ферментов ме¬
таболических путей и ЭТЦ с различной энергетической эффек¬
тивностью (табл. 2.9);2) изменением скорости потребления субстратов клетками;3) использованием различных субстратов механизмом кон¬
троля их транспорта в клетку при культивировании бактерий
на многокомпонентных средах;4) изменением внутриклеточного состава и удельной ско¬
рости роста клеток;5) изменением формы бактерий, в частности соотношения
площади их поверхности и объема.
Таблица 2.9. Энергетическая эффективность различных метаболических путей бактерий*№Путь метаболизмаУсловияСинтез из 1 мольглюкозыXСуммарный АТР на 1 моль
глюкозыИсполь¬
зование
Глюкозы
для син¬п/ппродуктАТРNADHсхР<Zсинтез(расход^суммар¬ныйтеза28 моль
АТР
(в молях)1ГликолизАэробные2пируват420+8-2+ 64,662»»Анаэробные2L-лактат400+ 4-2+ 214,003Гликолиз + метилглиок-
салевыйАэробные1пируват+1 D-лак-
тат210+4-2+ 214,004То жеАнаэробные1Ь-лактат+1 D-лак-
тат100+ 1-10—5Г ликолиз + ацетаткиназаАэробные2ацетат6 *20+ 10-2+ 83,506То жеАнаэробные2ацетат+Н2600+6-2+47,007.ФосфокетолазныйАэробные1ацетат+1 пируват2,510 .+4,5-1+3,58,008КДФГП[Го же2пируват211+6-1+ 55,609Г ликолиз+пируватде-
гидрогеназный ком¬
плекс +ЦТК (полный)»> »»6со26124+30-2281,00-10Глюколиз + пируватде-
гидрогеназный ком¬
плекс-1-ЦТК (разом¬
кнутый)ч »>1оксоглутарат++ 1 сукцинат + С02330,66 0,66 +6— 2,63,48,061,1Г ликолиз + пируватде-
гидрогеназный ком¬
плекс + глиоксилатный
шунт»* *»Оксалоацетат3,33,40+ 10-2+ 83,512Г ексозомонофосфатный
путь»> »»1 рибозо-5-фосфат +
Н-1 СО2002+ 4-2+ 214,0013Г ексозомонофосфатный
путь — окислительный»» »»1глицеринальдегид-
З-фосфат + З С02006+ 12-2+ 102,50* При условии, что NADH и NADPH окисляются в ЭТЦ с эффективностью Р/0=2.
Биохимические основы регуляции109ЭЗ у растущих клеток поддерживается необходимой скоростью
продуцирования АТР клетками. При снижении удельной скоро¬
сти роста, когда нет необходимости в поддержании высокой ско¬
рости синтеза АТР, ЭЗ поддерживается катаболизмом АМР.Высокая чувствительность ферментов метаболических путей
к небольшим изменениям ЭЗ может быть объяснена значитель¬
ным изменением содержания отдельных нуклеотидов. Напри¬
мер, согласно расчетам, приведенным в работе [60], снижение
ЭЗ от 0,92 до 0,80 в меньшей мере обусловлено снижением
концентраций АТР в клетках (на 20%), чем повышением со¬
держания АМР (примерно в 5 раз). При этом соотношение
АТР : АМР менялось от 45 : 1 до 8:1.2.5.2. КООРДИНАЦИЯ СКОРОСТЕЙ КАТАБОЛИЗМА
СУБСТРАТОВ И ИХ ПОТРЕБЛЕНИЯ КЛЕТКАМИ
В УСЛОВИЯХ ИЗБЫТОЧНОГО ПРОДУЦИРОВАНИЯ АТРДля повышения эффективности микробиологического синтеза
требуется постоянно вносить в среду по возможности большие
количества источников углерода. Однако при этом в клетках
продуцентов может возникнуть несоответствие скоростей проду¬
цирования АТР и его использования. Это объясняется тем, что
некоторые транспортные системы и ферменты, функционирова¬
ние которых приводит к синтезу АТР, являются конститутив¬
ными. В то же время процессы, связанные с использованием
АТР (например, изменение удельной скорости роста бактерий),
зависят от синтеза клеточных структур и ферментов.Повышенная скорость катаболических процессов по сравне¬
нию с анаболическими может возникнуть при снижении удель¬
ной скорости роста клеток в результате воздействия физико¬
химических факторов, лимитирования роста и т. д. В клетках
при этом включаются следующие компенсирующие процессы,
связанные с уменьшением скорости продуцирования АТР:1) повышение активности метаболических путей и исполь¬
зование ЭТЦ с меньшей энергетической эффективностью;2) уменьшение скорости потребления субстратов;3) увеличение активности ферментов метаболических путей
с повышенной скоростью использования АТР и NAD(P)H;4) переключение клеток на использование энергетически
менее эффективных субстратов.При изменении скорости продуцирования АТР бактерии раз¬
личаются «экологической стратегией». Бактерии г-тактики,
например Е. coli, характеризуются повышенным значением мак¬
симальной удельной скорости роста — 2,6 ч-1. Бактерии /C-так¬
тики (Br. flavum и М. glutamicus) имеют более низкие ее зна¬
чения — 0,2...0,4 ч-1. Это определяет различия в регуляции
ноГлава X100 г1800 -
600-
т-
200 -800600400200Фосфосррукто-KUHC3JДлА._оЛL зП. Г1Цитрат- А кони таза Изоцитратде- ас-Кетощта-
синтаза 2 идроге на за рат дегидроге¬наза1 2пГлитаматде-гиорогеназаОАаМп_П1_q_6_d.Малатдегид" Фосфоенолпи- Изо цитрат- Глюнозп-6-фосц.тп;рогеназа0,30,40,14/75
к 205еда§pydam-xapfio-
ксилазалиазадегидрогеназаJZL600IГъВш11Рис. 2.35. Изменение активности ферментов метаболизма, а также скорости
потребления глюкозы клетками, величины общей восстанавливающей актив¬
ности (ОВА) клеток и концентрации глюкозо-6-фосфата (эндогенного) при
пересеве клеток Br. flavum V 5 с рыбо-пептонного агара (/) на жидкие
питательные среды, содержащие глюкозу 2,5% (2), 10% (5) или 15% (4)метаболизма г- и /(-тактиков. Последняя у r-тактиков направ¬
лена на быстрое обеспечение синтеза АТР, /С-тактиков — на
обеспечение роста и заниженной скорости продуцирования АТР
в вариабельных условиях культивирования.
биохимические основы регуляции111г-Тактики в большей степени имеют конститутивные системы
транспорта энергетически более эффективных субстратов, на¬
пример глюкозы. Из смеси субстратов они обычно сначала ис¬
пользуют глюкозу [44]. В то же время К-тактики из смеси
субстратов сперва используют энергетически менее эффективный
субстрат либо пользуются энергетически менее эффектив¬
ными путями катаболизма субстрата. Энергетически наиболее
эффективный путь катаболизма глюкозы, например ЦТК, у
этих бактерий обычно индуцибелен. Однако вследствие этих
особенностей регуляции метаболизма г- и /(-тактиков избыточ¬
ное продуцирование АТР у первых наступает при значительно
мейьших концентрациях сахаров. Эти микроорганизмы обычно
не способны расти в средах с концентрациями глюкозы выше
1%, в то же время /(-тактики растут в средах с концентрациями
глюкозы или сахарозы 1 ... 10% и выше. Однако рост бактерий
в таком широком диапазоне концентраций источников углерода
обеспечивается изменением скорости продуцирования АТР в
клетках. Одной из характеристик этих бактерий является осо¬
бенность «контроля использования субстратов».Эффект Кребтри. Является наиболее изученным механизмом
координации продуцирования АТР в клетках со скоростью его
использования. Известен также под названием «глюкозный эф¬
фект». Метаболизм бактерий при этом часто переключается с
функционирования ЦТК на катаболизм глюкозы в энергети¬
чески менее эффективном пути, например в гликолизе.Признаки эффекта Кребтри у коринебактерий видны из дан¬
ных, представленных на рис. 2.35. При этом в условиях избы¬
точного продуцирования АТР происходят снижение активности
аконитазы и повышение активности фосфофруктокиназы. Про¬
дуцирование АТР поддерживается гликолизом при дополнитель¬
ном перерасходе сахаров клетками.При относительно низких концентрациях сахаров (отсутст¬
вие эффекта Кребтри) бактерии пользуются Д|1н+-зависимой
системой транспорта глюкозы в клетки. При этом катаболизм
ее начинается функционированием гексокиназ (АТР- или поли-
фосфатзависимых). Бактерии характеризуются сравнительно
низкой удельной активностью фосфофруктокиназы, высокой ак¬
тивностью аконитазы. Функционирование глиоксилатного шунта
незначительное. ЦТК полный, так как активность оксоглутарат¬
дегидрогеназы довольно высока.При повышении концентрации глюкозы в среде до 10% у
коринебактерий появляются характерные признаки эффектаКребтри. Кроме того, снижается активность Д^н+-зависимой
системы транспорта глюкозы, а также активность гексокиназы,
увеличивается скорость переноса глюкозы фосфотрансферазной
системой, в клетках накапливаются повышенные количества
Рис. 2.36. Схема функционирования метаболических путей у коринебактерий
в отсутствие (а) или при наличии (б) эффекта Кребтри:— ингибирование активирование
Биохимические основы регуляциигл^окозо-6-фосфата и фруктозо-6-фосфата. При этом увеличива¬
ется активность изоцитрат-лиазы — фермента глиоксилатного
шунта. Наблюдается также значительное повышение активно¬
сти NADP^-зависимой глутаматдегидрогеназы. Вследствие сни¬
жения активности оксоглутаратдегидрогеназы цикл трикарбо¬
новых кислот становится разомкнутым. При этом повышается
также активность фосфоенолпируват-карбоксилазы и глюкозо-
6-фосфат-дегидрогеназы — фермента гексозомонофосфатного
пути (рис. 2.36).Повышение активности глиоксилатного шунта можно объяс¬
нить так: либо это является путем, компенсирующим синтез
оксалоацетата при снижении активности, оксоглутаратдегидро¬
геназы, либо данный путь обеспечивает снижение продуцирова¬
ния АТР клетками в условиях эффекта Кребтри. Если из 1 моль
глюкозы при катаболизме глюкозы через гликолиз и ЦТК син¬
тезируются 28 моль АТР, то при функционировании гликолиза
и глиоксилатного шунта — 12 моль АТР на 1 моль глюкозы.Следует обратить внимание на то, что при эффекте Кребтри
в клетках активируются процессы, связанные с использованием
NAD(P)H либо АТР. Например, увеличивается скорость ис¬
пользования NADPH при синтезе глутамата, резко повышаются
общая восстанавливающая активность (ОВА) клеток, содержа¬
ние в них РНК и белка. Одновременно увеличиваются актив¬
ность ферментов ГМП и скорость роста клеток. Это можно
рассматривать как саморегулирующуюся систему снижения
продуцирования АТР (при образовании разомкнутого ЦТК)
либо увеличения его использования (при росте \х).Наши многочисленные эксперименты подтвердили резкое^
увеличение ОВА клеток при повышении jli. Так, если последняя
увеличивается в 5 раз, ОВА клеток — примерно в 6 раз. Резкое
увеличение ОВА клеток является характерным признаком эф¬
фекта Кребтри у коринебактерий.Эффект Кребтри является механизмом, координирующим
продуцирование и использование АТР в клетках. Это позволяет
обеспечить рост бактерий в определенных пределах концентра¬
ций сахаров в среде.Концентрации глюкозы, вызывающие эффект Кребтри, даже
у одних и тех же бактерий не являются какой-то постоянной
величиной. На рис. 2.37 видны признаки эффекта Кребтри в
условиях периодического культивирования Br. flavum V 5 с
дробной подачей сахарозы, начиная с 26-го часа, когда \х=
=0,05... 0,08 ч""1. При увеличении дозы сахарозы, введенной
с подпиткой, наблюдается резкое снижение активности гексо-
киназы, аконитазы, поддержание роста клеток дополнительным
использованием сахаров при повышенной активности фермен¬
тов гликолиза и гексозомонофосфатного пути. В клетках зна¬
чительно увеличивается содержание неиспользованного глюкозо-8 — 361
114/Глава 2/Рис. 2.37. Изменение активности
гексокиназы (У), глюкозо:6-фос-
фат-дегидрогеназы (2), фосфо¬
фруктокиназы (5) и аконитазы
(4), а также содержания внутри¬
клеточного глюкозо*6-фосфата
(столбики) при культивировании
Br. flavum V 5 в периодических
условиях с подпиткой сахарозой
(момент начала подпитки пока¬
зан стрелкой), содержание саха¬
ров в среде с 25-го часа до конца
ферментации 0,7... 0,8%. Дозы
сахарозы:А — 80 мл (<7ge0,23 г на 1 г клеток);
Б — 230 мл [<75“0,71 г/(ч • г)];, В —
750 мл [<7S“0,60 г/(ч • г)]; Г — 800 мл
[<75=0,46 г/(ч • г)]6-фосфата. В то же время концентрация сахаров в среде со¬
ставляет 0,7...0,8%. При добавлении лимитирующих рост фак¬
торов и увеличении р, скорость использования АТР клетками
повышается и эффект Кребтри снижается.В понятии эффекта Кребтри, как и механизма катаболитной
репрессии, много неясного. Его первичная дефиниция — инги¬
бирование дыхания бактерий глюкозой — не объясняет все
явления, связанные с этим эффектом. Определяющим механиз¬
мом при образовании эффекта Кребтри считают выпадение пер¬
вой точки сопряжения окисления '[Н+] и образования АТР в
ЭТЦ [34], следствием чего является накопление NADH. При
этом у коринебактерий снижается перенос электрона по основ¬
ной ЭТЦ и увеличивается скорость его переноса по так назы¬
ваемому цианидрезистентному пути. Это выражается в значи¬
тельном повышении активности цианидрезистентного потребле¬
ния кислорода клетками. Следовательно, если повышение
концентрации глюкозы часто вызывает снижение активности
аконитазы, увеличение активности фосфофруктокиназы, то сни¬
жения интенсивности дыхания, определяемого по потреблению
кислорода клетками (до,), не происходит (табл. 2.10). Наобо¬
рот, величина qo2 может значительно повышаться, что связано
с увеличением цианидрезистентного потребления кислорода
[141-Результаты исследований регуляции метаболизма корине¬
бактерий и литературные данные позволяют заключить, что у
бактерий существуют саморегулирующие механизмы, устраня¬
ющие избыточное продуцирование АТР при повышении концен¬
траций глюкозы или сахарозы в среде, т. е. механизмы, предот¬
вращающие появление эффекта Кребтри. Это достигается, во-^ Си $5 '%т
<22
Биохимические основы регуляции 115Таблица 2.10. Взаимосвязь изменения активности фосфофруктокйназы,аконитазы и величины q 0j у Вт. flavum 22ЛД при изменении
концентрации сахарозы 5 в среде*5, %Фосфофрукто-киназаАктивность,
на 1 мАконитазакатал • 10"м
г белкаQсуммарное,
ммоль/ч на
1 г клетокОаCN-резистент-
ное, % от
суммарного2,52111635,0625,011521255,8212101420895,618215923412,8088* Острые опыты, 5 ч, p02-30% от насыщения, л» 1000 об/мин, исходных клеток
равна 0,1 ч-1; — CN-резистентное определено при концентрации KCN • 10 3 М.Озпервых, повышением использования АТР или его
предшественников NADH и NADPH клетками:а) при увеличении скорости анаболических процессов путем
переключения метаболизма от полного на разомкнутый ЦТК и
глиоксилатный шунт;б) при использовании АТР или потенциальных энергетичес¬
ких предшественников для синтеза мономеров (глутаминовой
кислоты с использованием NADPH и др.), внутриклеточных
полимеров (гликогена из глюкозо-6-фосфата, липидов и поли-
p-гидроксибутирата с использованием ацетил-CoA и NADPH и
др.), а также внеклеточных полимеров. При этом в клетках
снижается накопление тех полимеров, для которых необходим
лимитирующий фактор; увеличивается синтез тех, которые в
избытке.Во-вторых, появление эффекта Кребтри предотвращается
снижением продуцирования АТР клетками:а) при уменьшении сопряженности между окислением суб¬
страта и фосфорилированием в ЭТЦ (внутриклеточным эффек¬
том может быть Ог--радикал);б) при использовании альтернативных путей переноса элек¬
тронов в ЭТЦ, не связанных с синтезом АТР;в) инактивацией мест энергосопряжения [34];г) активированием ATP-азы и тепловыделения;д) переключением метаболизма на энергетически менее эф¬
фективные пути.Факторы, вызывающие избыточное продуцирование АТР.
Биохимической основой создания условий с избыточным про¬
дуцированием АТР в клетках в основном является снижение
скорости анаболических процессов и использования АТР. Это
8*
116Глава 1может быть вызвано снижением белоксинтезирующей активно¬
сти клеток. Определяющим при этом является лимитирование
роста ауксотрофными факторами, например метионином и тре¬
онином, у продуцентов лизина. Такое же значение в условиях
избыточного содержания источника энергии имеет лимит по
источнику азота.При изучении регуляции метаболизма Br. flavum показано,
что снижение концентрации (NH4)2S04 от 2,0 до 0,3% не вызы¬
вает эффекта Кребтри. В указанных пределах содержание NH4+
в клетках не меняется. При этом активность фермента, асси¬
милирующего NH4+, — глутаматдегидрогеназы — высокая. При
культивировании Вг. flavum в средах с 0,5% (NH4)2S04 через
24 ч возникает эффект Кребтри: увеличивается потребление са¬
харозы клетками, снижается активность аконитазы.Следует отметить, что бактерии пользуются механизмами,
снижающими эффект Кребтри в условиях лимита по источнику
азота. Ассимиляция ионов NH4+ при низком их содержании в
среде обычным механизмом невозможна, так как величина Кш
для МН4+ у глутаматдегидрогеназы высока — 1 ... 5 мМ. В ус¬
ловиях пониженных концентраций NH4+ в среде активность
глутаматдегидрогеназы снижается и повышается активность
ферментов с большим сродством и более низкими значениями
Дм по отношению к NH4+. Таким путем является связывание
ионов NH4+ при функционировании глутаминсинтетазы (КФ
6.3.1.2) {102]. Одновременное использование АТР при этом яв¬
ляется еще одной возможностью снижения эффекта Кребтри:Г лутаминсинтетазаГ лутамат-f NH4++АТР лутамин + ADP + Р< + Н20.*ттВ условиях лимита NH4+ повышается активность Д(1н+-за-
висимой системы транспорта этих ионов в клетки [59], а иногда
и активность гистидазы (КФ 4.3.1.3). При этом гистидин ис¬
пользуется в качестве источника азота.У коринебактерий признаки эффекта Кребтри наблюдаются
также при повышенных концентрациях 02 в среде (более4 кПа). При этом несколько снижается активность аконитазы,
значительно — сукцинатдегидрогеназы. ЦТК становится разом¬
кнутым, значительно повышается активность глутаматдегидро¬
геназы. Несмотря на то что скорость потребления сахарозы при
этом повышается, jn не увеличивается. Содержание РНК в клет¬
ках существенно не меняется.Снижение активности включения глюкозы в ЦТК при повы¬
шенной интенсивности аэрации можно толковать с позиций
регуляторного действия кислорода на рост клеток. Имеются
данные, что при высоких значениях р02 происходит инактива¬
ция рибосомальных Т- и G-факторов,, определяющих процессы
Биохимические основы регуляции117Таблица 2.11. Изменение удельной скорости роста клеток \х, скоростипотребления сахарозы qs, активности ферментов и содержания
некоторых клеточных компонентов у Br. flavum 22ЛД
в условиях хемостата с подачей свежей среды
во второй стадии культивированияСтадиякульти¬вирова¬нияМ-»Яs. г/ч
на 1 г
клетокФос-фо-фрук-токи-назаАко¬ни¬тазаАктивность,
катал • 10“
на 1 мг
белкаКислото¬раство¬римыеРНКднкнуклео¬тиды% на сухие клеткиI0,100,10,31220900,979,061,53Па0,450,320,683842241,4020,53,101160,600,420,754901880,3415,01,45трансляции в клетках [73]. Снижение скорости последних, воз¬
можно, вызывает избыточное продуцирование АТР в клетках
и явления, аналогичные эффекту Кребтри.Скорость потребления сахаров клетками повышается и ак¬
тивность ферментов ЦТК снижается при культивировании Вг.
flavum в непрерывных условиях при высоких значениях про¬
тока среды. Например, при повышении скорости протока среды
от 0,19 до 0,28 ч-1 скорость потребления сахаров клетками
повышается от 0,127 до 0,3 г/на 1 г клеток в час, активность
аконитазы снижается почти в 5 раз.Своеобразно меняются активность ферментов метаболизма и
содержание в клетках РНК и ДНК при культивировании бак¬
терий в условиях хемостата (лимитирующие факторы метионин
и треонин) в двухступенчатом процессе с подачей свежей среды
на второй стадии культивирования (табл. 2.11). При высоких
значениях скорости протока среды наблюдается несоответствие
между скоростью потребления сахаров, синтезом РНК и ДНК
в клетках. Это приводит к возникновению признаков эффекта
Кребтри.Весьма своеобразно поддерживается скорость продуцирова¬
ния АТР при культивировании коринебактерий в средах с двумя
источниками углерода (например, сахарозы и ацетата). При
повышении . концентрации сахарозы в условиях использо¬
вания ее в качестве единственного источника углерода
и энергии бактерии пользуются энергетически менее эффектив¬
ным путем — гликолизом, активность аконитазы — фермента
ЦТК — низка. В средах с сахарозой и ацетатом клетки пере¬
ключаются на использование ацетата через энергетически менее
118Глава 2J iО 510 15 г,ч5 1015 ?Ог,чабРис. 2.38. Изменение активности аконитазы (/) и изоцитрат-лиазы (2), а
также скорости потребления сахарозы qs (3) при культивировании Br. fla¬
vum 22ЛД в средах, содержащих 2,5% сахарозы и 1,0% ацетата (а) или
15% сахарозы и 1,0% ацетата (б)эффективный глиоксилатный путь. Активность изоцитрат-лиазы
в средах с 15% сахарозы и 1% ацетата значительно выше, чем
в средах с более низкими концентрациями сахарозы и ацетата.Можно выявить следующую закономерность: чем выше кон¬
центрация сахарозы, тем больше скорость использования аце¬
тата и выше активность изоцитрат-лиазы, ниже скорость ис¬
пользования сахарозы (рис. 2.38). При этом в средах с двумя
субстратами не только снижается qs, но и увеличивается ак¬
тивность аконитазы. Если ацетат у многих бактерий вызывает
снижение активности изоцитратдегидрогеназы, то у коринебак¬
терий активность этого фермента даже повышается.Следовательно, на двухсубстратных средах коринебактерии
проявляют своеобразный контроль использования субстратов:
предпочтительно или одновременно с сахарозой используют
ацетат, только в средах с низкими концентрациями сахарозы
(около 1%) ее используют предпочтительно. Такой контроль,
очевидно, направлен на поддержание необходимой скорости
продуцирования АТР в клетках.Бактерии рода Pseudomonas в условиях избытка источника
энергии также сначала используют органические кислоты, затем
углеводы. Установленное у этих бактерий переключение с пря¬
мого переноса глюкозы в клетку на функционирование глюкозо-
Биохимические основы регуляции119дегидрогеназ и перенос в клетку глюконата '[64] частично
можно объяснить следующим. Снижение использования глю¬
козы уменьшает продуцирование АТР клетками, в то же время
позволяет поддерживать энергизованное состояние мембран.Следовательно, эффект Кребтри можно считать механизмом,
обеспечивающим координацию продуцирования АТР и его ис¬
пользование в клетках. При этом в бактериях активируются
пути с меньшим продуцированием АТР либо пути с повышенной
скоростью его использования. В то же время при более силь¬
ном действии «глюкозного эффекта» поддержание клеток в фи¬
зиологически активном состоянии невозможно.2.5.3. ОСОБЕННОСТИ КАТАБОЛИЗМА
ЭНЕРГЕТИЧЕСКОГО СУБСТРАТА В УСЛОВИЯХ
НЕДОСТАТОЧНОГО ПРОДУЦИРОВАНИЯ АТРЗаниженную скорость продуцирования энергии у бактерий соз¬
дают в основном такие условия:1) образование лимитирующих концентраций энергетичес¬
кого субстрата;2) низкая скорость продуцирования АТР в условиях недо¬
статочной интенсивности массопередачи кислорода по системе
газ—жидкость—клетка у аэробов;3) низкая активность ATP-регенерирующей системы вслед¬
ствие недостаточных концентраций предшественников кофакто¬
ров в среде или малой скорости их синтеза в клетках;4) ингибирование или репрессия пермеаз и ферментов, свя¬
занных с продуцированием энергии.Несмотря на то что в указанных условиях скорость про¬
дуцирования АТР в клетках занижена и рост лимитирует именно
скорость синтеза АТР, у бактерий существуют механизмы, по¬
вышающие скорость образования энергии. Таким образом со¬
храняется рост клеток.Поддержание скорости продуцирования энергии в условиях
лимита источником энергии. При низкой концентрации энерге¬
тического субстрата в среде метаболизм бактерий обычно
характеризуется повышением активности энергетически более
эффективных метаболических путей. Так, при концентрации
глюкозы в среде 2% Br. flavum характеризуются высокой ак¬
тивностью ЦТК — энергетически более эффективного метабо¬
лического пу?и. Активность аконитазы в 2 раза выше по срав¬
нению с таковой у бактерий, выращенных при концентрации
глюкозы в среде 6%. При более низкой концентрации глюкозы
снижается активность ФТС, повышается скорость переноса глю¬
козы Д|1н+-зависимой системой и активность гексокиназы, зна¬
чительно возрастает активность NADH-оксидазного комплекса.
120Глава хПри этом значительно снижаются также концентрация неис¬
пользованных количеств глюкозо-6-фосфата и фруктозо-1,6-бис-
фосфата в клетках, резко уменьшается ОВА клеток. Следова¬
тельно, при этом метаболизм переключается с анаболических,
процессов на катаболические. Это подтверждается также сни¬
жением активности глутаматдегидрогеназы и повышением кон¬
центрации NH4+ в клетках. Очевидно, именно данная регуляция
позволяет бактериям поддерживать более или менее постоян¬
ные скорость продуцирования АТР и ее концентрацию в клет¬
ках (примерно 3 мкмоль на 1 мг клеток).Бактерии способны использовать низкие концентрации суб¬
страта в условиях лимита источником энергии благодаря
наличию систем транспорта субстратов с различным энерго¬
обеспечением. Это достигается как увеличением сродства пере¬
носчика к глюкозе, так и изменением содержания пермеаз при
индукции.Поддержание скорости продуцирования энергии в условиях:
лимита кислородом. Низкая скорость продуцирования АТР у
бактерий создается также в условиях лимитирования окисли¬
тельного фосфорилирования недостаточной массопередачей
кислорода в клетках. При этом увеличение активности глико¬
лиза и дополнительное использование сахаров, т. е. обратный
эффект Пастера, является механизмом, поддерживающим син¬
тез АТР в клетках.Изменение активности ключевых ферментов гликолиза, а
также некоторых других в зависимости от концентрации раство¬
ренного в среде кислорода у Вг. flavum показано в табл. 2.12.Из таблицы следует, что признаки обратного эффекта Пас¬
тера в данных условиях наблюдаются при р02=8... 15%. Од¬
нако, вследствие того, что при р02=3...5% активность
аконитазы возрастает, снижаются активность фосфофруктоки¬
назы и величины qSi можно констатировать, что обратный эф¬
фект Пастера при очень низкой интенсивности аэрации снима¬
ется. Данную регуляцию можно объяснить снижением-удельной
скорости роста клеток при низких значениях р02. Это сопро¬
вождается низкими скоростями потребления АТР. Его концен¬
трация в клетках при этом низкая (около 1,3 мкмоль на 1 мг
клеток). В данном случае интенсивность аэрации 3 ... 5% 02
от насыщения, очевидно, является достаточной для обеспечения
синтеза АТР дыхательным путем.По абсолютным .значениям р02 трудно предсказать образо¬
вание обратного эффекта Пастера. Данную величину надо рас¬
сматривать в комплексе с удельной скоростью роста клеток.Уменьшение удельной скорости роста бактерий приводит к
снижению скорости потребления сахаров клетками и активности
лг ;тдегидрогеназы, несмотря на то что значение р02 низкое.
Однако при определенных значениях [г активность этого фер-
Биохимические основы регуляции121Таблица 2.12. Изменение скорости потребления сахарозы клеткамии активности ферментов у Br. flavum 22ЛД в зависимости
от интенсивности аэрации (р02) в непрерывных
условиях культивирования при £> = 0,2 ч-1SiоV чГексокиназаФосфофрук-токиназаЛактатде-гидрогеназаФосфоенол-пируват-карбоксилазаАконитазаГлу-тамат-де-гидро-ге-назаОВА
кле¬
ток,
мг
ТТХ-Ф
на
100 мг•АТР,
мкмол
на 1 мг
клетокМеханизмрегуляцииба..4*"и *. и
со
й- —Активность, катал
белка• 10_м/мгклеток2,27,40,12 1382166,4184128200111,3ЭффектПастераОбратны?87,80,2061487978748223135,8 \эффект1510,30,4422516 22711724320204,9 JПастера209,30,36253679513280457204,6 \ЭффектПастера309,80,20403122569 :120484234,1 }3510,10,26345573217665590575,8 )Эффект409,20,3028683010363620633,8Кребтри457,50,262832106648378412,7 Jмента может быть использована в качестве сигнала на сниже¬
ние интенсивности аэрации.Если параметром, указывающим на условия, вызывающие
обратный эффект Пастера у коринебактерий, обычно является
повышение синтеза лактата, тогда у других бактерий при этом
возможно образование этанола, пропионата и других продуктов
неполного окисления пирувата.Механизмом обратного эффекта Пастера бактерии обеспе¬
чивают обычно синтез недостаточного количества АТР путем
повышения скорости использования глюкозы. Однако нами по¬
казано, что увеличение qs при действии ингибиторов и в
анаэробных условиях возможно только у клеток с индуциро¬
ванным аэробным метаболизмом. Увеличение активности
ферментов гликолиза и qs у гликолитических клеток невоз¬
можно, т. е. обратный эффект Пастера может быть только у
клеток с аэробным метаболизмом (табл. 2.8, 2.13).Поддержание скорости продуцирования АТР путем обрат¬
ного эффекта Пастера — частный случай регуляции метабо¬
лизма в условиях снижения окислительного фосфорилирования
в клетках. У клеток с хорошей дыхательной активностью при
Таблица 2.13. Изменение активности ферментов гликолиза и ЦТК, а также величины qs у В г. flavum 22ЛДи Br. flavum RC 115 при наличии глюкозы (5 = 2%) в зависимости от условий роста или в присутствии KCN
|10—3 М)Вари¬антШтаммУсловияСредаПродолжи¬
тельность, чqs, г/ч • гФосфо¬фрукто¬киназаАкони¬тазаАктивность,
катал • 10 м на 1 мг
белка1Br. flavum 22ЛДАэробныеРПА-S240,44045002Аэробные-f KCNТа же24; 0,20,4204620ЗаАэробныеЖПС + S30,3382882636Та же60,2002351844Условно анаэробные>♦ >>30,860551125Аэробные+ KCNРПА-S30,41048296Br. flavum RC 115Аэробные240,16735097Аэробные-f KCNТа же24; 0,20,1724089,8аАэробныеЖПС + S30,146270978699Та же60,1172501979Условно анаэробные99 п30,16239558 .10Аэробные+ KCN>9 9)30,15138036Примечания: 1. В вариантах 2 и 3 для посева использованы клетки варианта 1; в вариантах 7 и 8 — клетки варианта 6; в вариантах
4 и 5 — клетки варианта За; в вариантах 9 и 10 — клетки варианта 8а.2. Интенсивность аэрации в аэробных н условно анаэробных условиях 45 и 6 мг Оз/(л - мин).3. qs определена по скорости транспорта 6|4С-глкжозы с пересчетом на г/ч • г клеток.
Биохимические основы регуляции123Таблица 2.14. Изменение скорости транспорта глюкозы, скоростипотребления кислорода q0i, а также ферментов катаболизма
у Br. flavum 22ЛД при действии KCNУсловия инкубации
клетокСкорость
транспорта
глюкозы,
имп/мин
на 1 мг клеток*<vммоль/(г • ч)Фосфо-фрукто-киназаАконитазаАктивность, катал -lCH1
на 1 мг белкаБез ингибитора (кон¬14302,9222686,0троль).С цианидом5-10-2 М4700,334563,35-10"3 М5692,9444610,210-3 М18403,704298410“4 м14403,12309168частичном снижении окислительного фосфорилирования в ре¬
зультате действия KCN (10_3 М), наоборот, дыхательная ак¬
тивность увеличивается (табл. 2.14). Только при более значи¬
тельном снижении скорости окислительного фосфорилирования
наблюдаются признаки обратного эффекта Пастера.Следовательно, как при снижении интенсивности аэрации,
так и при действии ингибиторов окислительного фосфорилиро¬
вания регуляция активности ферментов происходит в два этапа:
повышение активности ферментов ЦТК при незначительных
изменениях активности ферментов гликолиза и величины qs\
снижение активности ферментов ЦТК, повышение активности
ферментов гликолиза и скорости потребления сахаров клет¬
ками, т. е. обратный эффект Пастера.Из табл. 2.13 следует, что существует довольно определен¬
ная граница повышения активности фосфофруктокиназы и ве¬
личины qs как при снижении окислительного фосфорилирования
ингибиторами, так и при лимите кислородом. Возможно, эти
границы отражают ту скорость продуцирования АТР, которую
должен поддерживать определенный штамм при определенной
удельной скорости роста клеток. Однако поддержание продуци¬
рования АТР гликолитическим путем при дополнительном ис¬
пользовании сахаров приводит к увеличению синтеза частично
окисленных побочных продуктов, например лактата. Его кон¬
центрация в среде может служить сигналом появления обрат¬
ного эффекта Пастера.Как отмечалось выше, снижение продуцирования энергии в
клетках может быть вызвано недостаточным образованием в
клетках кофакторов для функционирования АТР-продуцирую-
щей системы. В качестве примера можно привести изменение
метаболизма у коринебактерий в условиях лимита по тиамину.
124Глава 2Недостаточная скорость продуцирования АТР в клетках
может быть вызвана также прямым ингибированием или реп¬
рессией дыхательных ферментов. Поддержание продуцирования
АТР и скорости роста клеток при этом реализуется механизмом
обратного эффекта Пастера.Активность аэробного метаболизма бактерий может быть
увеличена путем повышения интенсивности аэрации. Снижение
интенсивности анаэробного метаболизма в присутствии кисло¬
рода (эффект Пастера) можно связать с регуляторным дейст¬
вием АТР, скорость синтеза которого в аэробных условиях
увеличивается. Если при функционировании ЦТК скорость син¬
теза АТР в клетках возрастает в 14 раз, то скорость потребле¬
ния глюкозы снижается.При реализации биотехнологических процессов обычно
важны условия, вызывающие эффект Пастера. В связи с этим
важно знать конкретные значения концентраций кислорода, вы¬
зывающие переход бактерий к аэробному метаболизму, а также
факторы, вызывающие при этом индукцию необходимых фер¬
ментов.2.5.4. МЕХАНИЗМЫ, КООРДИНИРУЮЩИЕ ЭНЕРГЕТИЧЕСКИЙ
И КОНСТРУКТИВНЫЙ МЕТАБОЛИЗМНа основе изложенного выше можно заключить, что бактерии
пользуются различными механизмами, координирующими об¬
разование АТР в клетках (табл. 2.15).Повышение активности ферментов гликолиза и скорости по¬
требления глюкозы клетками при снижении окислительного
фосфорилирования, в том числе при обратном эффекте Пастера,
можно объяснить тем, что между системами окислительного
фосфорилирования в ЭТЦ и субстратным фосфорилированием
в гликолизе имеется конкуренция за ADP и Р/. При сниже¬
нии их использования в процессах окислительного фосфорили¬
рования в отсутствие кислорода (а также при ингибировании
или репрессии ферментов окислительного метаболизма) кон¬
центрации ADP и Р, повышаются. Одновременно возможна
увеличение активности ATP-регенерирующей системы на уровне
субстратного фосфорилирования. Активность фосфофруктоки¬
назы и скорость включения глюкозо-6-фосфата в гликолиз воз¬
растают. Снижение его концентрации приводит к повышению
активности гексокиназы. При этом возможно увеличение ско¬
рости потребления глюкозы клетками. Такой механизм обрат¬
ного эффекта Пастера для эукариот был предложен Рекером
[79, 80]. Однако этот механизм может быть основой данного'
эффекта только при условии ингибирования фосфофруктоки¬
назы АТР и активирования ADP или АМР, а также иигибиро-
Таблица 2.15. Особенности функционирования систем транспорта и метаболизма энергетического субстрата
у бактерий в неоптимальных для роста условияхХарактеристика ростаУсловия ростаОсобенности переключе¬
ния метаболизмаРегуляторные эффектыНесопряженный(«стресс»)Сопряженный рост (нор-Оптимальные, баланс син-
мальное физиологичес- теза АТР и внутрикле-
кое состояние) точных потоков мета¬болитоврост Неоптимальные: А1.А. Избыточное продуци¬
рование АТР, лимит
по источникам азота, А2.
фосфора, кофакторам
и др.АЗ.Б. Заниженное продуци¬
рование АТР:
при отсутствии ли- Б1.
мита по 02Б2.БЗ.при лимите по 02 Б4.Б5.Значение Yx/sМаксимальноеИспользование систе- Контроль использования Ниже максимального
мы транспорта с вы- субстратов
сокой величиной КмПереключение
энергетически
эффективный
метаболизма
Использование
гетически менее эф¬
фективного субстра¬
та из смеси субстра¬
товна Транзитная и катаболит-То же
менее ная репрессии, эффект
путь Кребтриэнер- Контроль использования
субстратовИспользование сис- Контроль использования Максимальное
тем транспорта саха- субстрата
ров с низкой /СмПереключение на Активация или индукция То же
энергетически эффек- ферментов
тивный путьИспользование энер- Контроль использования „ „
гетически более эф- субстрата
фективного субстра¬
таИспользование сис- То же Низкоетемы транспорта са¬
харов с низкой /СмДополнительное ис- Обратный эффект Пас- „
пользование сахаров тера
126Глава 2вания гексокиназы глюкозо-6-фосфатом. Однако, вследствие
множества систем транспорта глюкозы, их переключения при
изменении условий роста, механизм обратного эффекта Пас¬
тера, предложенный Рекером, не может полностью объяснить
повышение активности гликолиза и величины qs у бактерий,
например, в анаэробных условиях.У коринебактерий показана четкая корреляция повышения
активности фосфофруктокиназы и гексокиназы, а также сниже¬
ния содержания глюкозо-6-фосфата в клетках при увеличении
скорости использования АТР. Очевидно, снижение содержания
АТР в клетках при этом может увеличить активность фосфо¬
фруктокиназы и гексокиназы. Однако такая корреляция отме-ттчена в условиях функционирования Д|!н+-системы транспорта
глюкозы. При функционировании ФТС взаимосвязь содержания
глюкозф-б-фосфата в клетках и активности фосфофруктокиназы
выражена нечетко.Пока ясным кажется факт, что обратный эффект Пастера
не является следствием регуляторного действия кислорода, а
связан со снижением окислительного фосфорилирования и регу¬
ляцией фосфофруктокиназы. На примере коринебактерий нами
показано, что и в анаэробных условиях, и в присутствии инги¬
биторов окислительного фосфорилирования активность фосфо¬
фруктокиназы и скорость потребления глюкозы клетками уве¬
личивается.Увеличение скорости потребления глюкозы при обратном
эффекте Пастера можно объяснить не только регуляторным
действием глюкозо-6-фосфата на транспорт глюкозы, но и регу¬
ляторным действием Д|ян+*. Полагают, что снижение этой ве¬
личины может привести к увеличению скорости потребления
глюкозы клетками. При снижении окислительного фосфорили¬
рования мембранный электрохимический потенциал образуется
с помощью градиента протонов и электронов, создаваемого при
использовании энергии АТР. Вследствие заниженной скоростиего синтеза в указанных условиях величина Дцн+ может сни¬
жаться. Показано, что у Е. coli и цианобактерий у фермента
II ФТС имеются регуляторные места, чувствительные к изме¬
нению Д|ын+.До сих пор не выяснено, как передается сигнал величиныД|хн-|- на рецепторный участок фермента II. По существующимпредставлениям, при низких значениях Д|д,н+ компоненты ЭТЦ,
а также SH”-rpynnbi в рецепторном участке ФТС (а именно в♦Glagolev А. N. Bacterial Дц,н+ sensing // TIBS. — 1984. — Vol. 9,
N. 9. — P. 397—400.
Биохимические основы регуляции127СРЕЛлMEMBFЦИТОПЛАЗМА- у-НРг Ф,фосфоенол¬пируватпируват• • •Белок (-у снижение^ ингибирования активирование. снижение скорости
S2~>i снте?аРис. 2.39. Предполагаемая схема координированной регуляции активности и
синтеза ферментов катаболизма глюкозы в условиях снижения скорости про¬
дуцирования АТР у бактерий (например, в условиях лимита глюкозой),
имеющих ФТС для переноса глюкозы, ферменты гликолиза и ЦТК:1 — снижение ингибирования ферментов цикла трикарбоновых кислот АТР и NAD(P)H,
гликолиза — АТР, активирование ADP и АМР, повышение скорости потребления глю¬
козы через гликолиз и ЦТК; 2 — снижение концентрации глюкозо-6-фосфата в клетках;
3 — снижение ингибирования фермента Ф11 глюкозо-6-фосфатом; 4 — повышениеактивности <PfI при низких значениях 5 — активация аденилатциклазы Фщ-фосфатом и ^j-фосфатом, увеличение синтеза катаболитчувствительных ферментовферменте II) переходят в окисленное состояние. При этом из¬
меняется конфигурация фермента II, увеличивается его срод¬
ство к глюкозе и уменьшается величина /См. Следовательно,возможно повышение qs при снижении Дрл+. Таким образом,
увеличение скорости потребления глюкозы клетками при сни¬
жении окислительного фосфорилирования можно объяснить по¬
вышением активности фосфофруктокиназы и компонентов сис¬
тем транспорта глюкозы. При этом недостаточный синтез АТР
компенсируется катаболизмом дополнительных количеств са¬
харов.*
СРЕДАМЕМБРАНАЦИТОПЛАЗМАГ~©.НРг*-®/©глюкозаГ~©©(глико©I 1ADP + Р, I |tНРгНРг —ФП1 yV.Hpr_@^-/V_e^ ф, -А^фспируват
фосфоснолпируватРНКРис. 2.40. Предполагаемая схема координированной регуляции активности
и синтеза ферментов катаболизма глюкозы в условиях избыточного продуци¬
рования АТР:1 — снижение активности ферментов ЦТК под действием АТР или NAD(P)H, глико¬
лиза — АТР; 2 — накопление в клетках глюкозо-6-фосфата; 3 — ингибированиеглюкозо-6-фосфатом и повышенными значениями снижение скорости потребленияглюкозы клетками; 4 — фосфорилирование НРг-компонента АТР, активирование глю-
козо-6-фосфатазы НРг-фосфатом, выброс глюкозы из клеток; 5 — ингибирование
аденилатциклазы ферментом III (нефосфорилированным), репрессия синтеза катаболит-
чувствительных ферментов ( ингибирование, - - - активирование)В условиях лимита источником углерода у бактерий вклю¬
чаются также другие механизмы, повышающие скорость синтеза
АТР клетками; например, индуцируется синтез ферментов мета¬
болических путей с большей энергетической эффективностью.
В условиях избыточного продуцирования АТР эти ферменты
обычно находятся в репрессированном состоянии.Предполагаемый механизм индукции катаболитчувствитель-
ных ферментов в условиях недостаточной скорости продуциро¬
вания энергии у Е. coli показан на рис. 2.39.~Схема регуляции метаболизма бактерий Е. coli в условиях
избыточного продуцирования АТР приведена на рис. 2.40. Дан¬
ная схема поясняет регуляторную роль АТР в снижении ско¬
рости транспорта глюкозы клетками при ингибировании или
репрессии катаболитчувствительных ферментов.Координацию изменения активности ферментов и скорости
потребления субстратов со скоростью продуцирования энергии
Биохимические основы регуляции129SРис. 2.41. Изменение физиолого-биохимической активности Br. fla¬
vum 22ЛД в непрерывных условиях культивирования в зависимости
от интенсивности аэрации (рОг):1 — скорость протока 0,1 ч ‘; 2 — 0,2 ч-*9 — 361
130Глава 2в клетках нельзя считать изученной. Выше нами было пока¬
зано, насколько вариабельны системы транспорта субстратов
и их катаболизм. Следовательно, возможны также большие
вариации в регуляторных механизмах у различных бактерий.
Большое разнообразие регуляции у Е. coli и у коринебактерий,
очевидно, связано с тем, что они являются факультативными
анаэробами и имеют множество механизмов, изменяющих ско¬
рость продуцирования энергии при изменении условий роста.
Определенную роль при этом играют конститутивные и инду-
цибельные факторы.Определяющим фактором, вызывающим изменение активно¬
сти ферментов катаболизма сахаров и скорости продуцирова¬
ния АТР, является изменение скорости роста. Это имеет место
в процессе культивирования коринебактерий при отсутствии
или наличии лимитирующих рост факторов — метионина и
треонина, а также при увеличении скорости протока среды в
непрерывных условиях культивирования. Следовательно, ак¬
тивность энергетического метаболизма зависит от конструктив¬
ного метаболизма. Существует также противоположная зави^
симость: при недостаточной эффективности энергетических
процессов активность анаболических процессов снижается. Обе
эти зависимости можно проследить в условиях непрерывного
культивирования коринебактерий с различными скоростями
протока среды и интенсивностью аэрации (рис. 2.41).Можно предположить, что уменьшение скорости продуциро¬
вания АТР в клетках сокращает синтез нуклеиновых кислот,
белков и других клеточных компонентов, так как все эти мета¬
болические процессы связаны с использованием значительныхТаблица 2.16. Изменение скорости потребления сахаров клетками, роста
клеток и соотношения РНК/ДНК у Br. flavum 22ЛД
при изменении концентрации сахарозы в среде
и скорости ее перемешиванияп, об/мин5, %qs, г/ч • гJ1, ч 1РНК/ДНК5002,50,170,099,95,00,160,109,37,50,130,1110,010,00,200,1310,712,50,210,1411,815,00,220,1511,410002,50,320,1714,45,00,340,1714,27,50,340,1814,510,00,400,2216,412,50,120,0812,115,00,040,0310,8
Биохимические основы регуляции131Рис. 2.42. Синтез и катаболизм ppGpp в зависимости
от доступности источников углерода и энергии (С),
источников азота (N) и скорости продуцирования энер¬
гии в клеткахколичеств АТР. Однако между изменением активности АТР-
продуцирующих ферментов и скорости анаболических процес¬
сов прямая связь отсутствует.В качестве показателя конструктивных процессов может
быть использована величина удельной скорости роста клеток.
Одновременно с повышением скорости роста клеток наблюда¬
ется резкое увеличение ОВА клеток, а также соотношения
РНК/ДНК в клетках (табл. 2.16). Если эта величина у расту¬
щих клеток обычно равна 10, то при высокой скорости переме¬
шивания она достигает 16. Значения скоростей потребления са¬
харов, при которых происходит сравнительно резкое повышение
содержания РНК, соотношения РНК/ДНК и удельной скорости
роста клеток у коринебактерий, относительно постоянны.Данную регуляцию частично можно объяснить переключе¬
нием бактерий на катаболизм глюкозы по разомкнутому ЦТК
и повышением активности потоков метаболизма через ГМП.
При этом увеличивается синтез аминокислот, а также рибозо-
5-фосфата, используемых для роста клеток. Резкое повышение
удельной скорости роста бактерий можно объяснить так назы¬
ваемым механизмом строгого контроля (от англ. «stringent»),
с помощью которого реализуется регуляция синтеза РНК9*
132Глава 2(в основном гРНК) у многих бактерий. Данный механизм обычно
реализуется с помощью внутриклеточного регулятора гуанозин-
б'-дифоефат-З-фосфата (ppGpp). Его синтез контролируется ге¬
ном «ге1». Наличие ppGpp показано у бактерий родов Esche¬
richia, Bacillus, Paracoccus, Rhizobium, а также у коринебакте¬
рий. Только в некоторых случаях этот нуклеотид обнаружен у
дрожжей, а у высших эукариот он отсутствует.Синтез ppGpp может проходить из гуанозин-5'-дифосфата
(GDP) двумя путями (рис. 2.42): при прямом его образовании
или при синтезе с образованием в качестве промежуточного
продукта гуанозин-5'-трифосфат-3-дифосфата (pppGpp). Регу¬
ляторное действие ppGpp заключается в ингибировании синтеза
рибосомального РНК, а также синтеза пуриновых нуклеоти¬
дов. Следствием этого является снижение содержания также
других форм РНК в клетках. Показано также, что ppGpp
уменьшает частоту трансляции, дополнительно снижая скорость
синтеза белков. Следовательно, образование ppGpp в клетках
приводит к уменьшению ц.Синтез ppGpp индуцируется лимитом аминокислот и уско¬
ряется при низких скоростях ассимиляции источника углерода и
азота, а также низкой скорости продуцирования энергии в
клетках*. При этом уменьшается использование лимитирующих
факторов на рост и увеличивается их использование на поддер¬
жание жизнеспособности клеток. Представленной на рис. 2.42
схемой можно пояснить резкое снижение или повышение ско¬
рости роста бактерий при изменении скорости продуцирования
АТР клетками: при повышении этой скорости снижается синтез
ppGpp, повышается синтез РНК и скорость роста клеток.Классическим примером строгой регуляции является индук¬
ция синтеза ppGpp и снижение синтеза РНК при наступлении
лимита по какой-то аминокислоте. При этом синтез ppGpp мо¬
жет наступить не только при недостаточном содержании амино¬
кислот в среде (внеклеточная лимитация), но и при ингибиро-
ванйи или репрессии синтеза ферментов или целых метаболи¬
ческих путей, приводящих к синтезу определенной аминокис¬
лоты. В последнем случае можно говорить о внутриклеточной
лимитации i[3].У некоторых бактерий показано также сопряжение синтеза
ppGpp с синтезом циклического 3',5'-аденозинмонофосфата
(сАМР) с клетках. При повышении синтеза ppGpp образова¬
ние сАМР и транскрипция контролируемых САР—сАМР генов
снижается. Синтез катаболитчувствительных ферментов при
этом у некоторых бактерий снижается в 20... 70 раз. Это зна¬*Verseveld Н. W., Artige М., Chesbro W. R. Continuous culture
of bacteria with biomass retention // Trends biotechnol. — 1984. — Vol. 2,
N. 1. — P. 8-12.
Биохимические основы регуляции133чит, что при лимите роста какой-то аминокислотой может сни¬
жаться также синтез катаболитчувствительных ферментов. Фи¬
зиологической основой такой регуляции является необходимость
снижения образования энергии в клетках, так как их рост и
использование АТР при этом уменьшаются.В условиях строгой регуляции быстро прекращается не
только синтез гРНК, но и синтез мРНК, так как скорость его
оборота измеряется несколькими минутами. Время полного сни¬
жения активности ферментов от момента прекращения синтеза
мРНК, очевидно, соизмеримо со скоростью оборота белков.Однако не всегда строгий контроль реализуется с помощью
регуляторного действия ppGpp. Например, удаление лейцина
из среды при культивировании ауксотрофного по этой амино¬
кислоте штамма Rhodobacter sphaeroides приводит к прекраще¬
нию синтеза РНК, фосфолипидов и белка в клетках, однако
аккумуляция ppGpp в клетках при этом не обнаружена. Зна¬
чит, в данном случае координация метаболических процессов
у этих бактерий опосредствуется, видимо, не накоплением и
деградацией ppGpp, а другими механизмами [18].Следовательно, строгий контроль обеспечивает координацию
роста и метаболизма источников углерода в соответствии с
условиями окружающей среды. При этом переключение процес¬
сов с анаболических на катаболические позволяет бактериям
сохранить жизнеспособность в неоптимальных для роста усло¬
виях.Особенности регуляции метаболизма коринебактерий при
изменении удельной скорости их роста видны не только на при¬
мере изменения активности ферментов и содержания клеточных
компонентов,’ но и на изменении структуры клеток. При низкой
удельной скорости роста клетки Br. flavum представляют собой
кокки. Цитоплазматическая мембрана гладкая и ровно приле¬
гает к клеточной стенке, инвагинации мембран (мезосомы)
отсутствуют. Цитоплазма наполнена полирибосомами, имею¬
щими высокую электронную плотность. В центральной зоне
клеток находится более рыхлый нуклеоид.При увеличении jut клетки удлиняются и приобретают форму
палочек. Цитоплазматическая мембрана образует внутриклеточ¬
ные мембранные структуры, в том числе сложные мембранные
структуры — мезосомы. Нуклеоид становится более рыхлым;
на срезах он представлен в виде светлых мелкогранулярных
участков. Деление клеток связано с образованием внутрикле¬
точных инвагинаций цитоплазматической мембраны и перего¬
родки.Удлинение клеток при повышении ц, очевидно, можно объяс¬
нить необходимостью увеличения соотношения площади поверх¬
ности и объема клеток, так как скорость транспорта
субстратов ускоряется. Образование более сложной структуры
Рис. 2.43. Клетка в экспоненциальной фазе роста (ц = 0,2 ч-1). Фрагмент
ультратонкого среза клетки, нуклеоид более рыхлый, видны участки низкой
электронной плотности. На поверхности клеточной стенки микрокапсула
(М/С), клеточная стенка (С) гомогенная, цитоплазматическая мембрана (ЦМ)
ровно прилегает к клеточной стенке, нуклеоид (Я) рыхлый, расположен в
центральной части клеток, рибосомы (Р) характеризуются высокой электрон¬
ной плотностью. X115 ОООцитоплазматической мембраны, в том числе мезосом, можно
объяснить увеличением активности ферментов энергетического
метаболизма, часть которых локализована в мембранах.\Ь'Г‘ kXlJt Ъ\i • ч Л • П F U-: VРис. 2.44. Микрофотография — фраг¬
мент среза клетки в фазе замедленного
роста (ц = 0,1 ч-1). Содержание рибо¬
сом сравнительно низкое, прослежива¬
ется образование перегородки (ЯР),
наблюдается значительное количество
инвагинаций цитоплазматической мем¬
браны,—мезосомы (М). X125 ООО■* г •-••г!■^ттт
Биохимические основы регуляции13SРис. 2.45. Срез клетки в стационарной фазе роста.
Содержание рибосом сравнительно низкое, наблюдается
образование значительных количеств полифосфатных
гранул (ПФ)При повышенных значениях ц, наблюдаются менее развитый
мембранный аппарат и значительно меньше мезосом (рис. 2.43),
чем у бактерий с более низкими удельными скоростями роста
(рис. 2.44). В последнем случае у бактерий уменьшается со¬
держание рибосом и они приобретают меньшую электронную
плотность.Если изменение структуры клеток сравнить с содержанием
клеточных компонентов и изменениями активности ферментов,
можно наблюдать явную корреляцию. Содержание РНК выше
у бактерий с более высокими значениями ц, а активность инду-
цибельных ферментов катаболизма глюкозы (ферментов ЦТК
у коринебактерий) увеличена при относительно низкой удель¬
ной скорости роста клеток.Поскольку при ц=0,1.. .0,15 ч-1 наблюдается повышение
скорости синтеза лизина и выхода продукта из данного
количества субстрата, также имеет место явная корреляция
между лизинсинтезирующей активностью и структурой клеток.
Более высокие величины qP и у тех бактерий, у которых^<1 Циане, т. е. у бактерий с хорошо развитым мембранным ап¬
паратом.
При снижении скорости роста клеток в условиях лимита
метионином и треонином в клетках наблюдается значительное
накопление полифосфатных гранул (рис. 2.45). Это можно объ¬
яснить снижением использования Р,• для синтеза РНК, а также
в процессах окислительного фосфорилирования, так как в усло¬
виях лимита метионином и треонином активность обоих этих
процессов снижается путем строгой регуляции.Следовательно, согласованно с изменением активности фер¬
ментов метаболизма и транспорта сахаров в клетки меняется
также их структура. Последняя может быть показателем фи¬
зиологической активности клеток. Как видно на примере с ко-
ринебактериями, более высокую лизинсинтезирующую актив¬
ность имеют бактерии с хорошо развитыми внутриклеточными
мембранными структурами.2.6. РЕГУЛЯЦИЯ СКОРОСТИ РОСТА КЛЕТОККак известно, основной способ увеличения синтеза продуктов —
повышение содержания биомассы в ферментаторе за единицу
времени, т. е. повышение скорости роста клеток. Последняя
количественно характеризуется удельной скоростью роста.Удельная скорость роста в периодическом процессе культи¬
вирования может быть определена по уравнению|x=2,3(lg*2-lg*,)(f2-fi),где Хг ц Х2 — содержание биомассы в начале и в конце интер¬
вала времени, г/л; t2—ti — интервал времени, ч.Величина fi может быть преобразована в величину времени
генерации: g=0,693/ц. При этом видно, что чем больше удель¬
ная скорость роста клеток, тем короче генерация.Рассмотрим изменение ^ при культивировании бактерий в
непрерывном процессе по принципу хемостата. При этом для
поддержания концентрации биомассы на постоянном уровне
лимитирующим фактором (принцип хемостата) в условиях по¬
вышения скорости протока среды удельная скорость роста кле¬
ток должна увеличиться во столько же раз.Для повышения скорости роста клеток должны увеличиться
скорость синтеза клеточных компонентов и скорость продуци¬
рования АТР клетками.По данным Стутхамера* и др., расход АТР для синтеза 1 г
биомассы у Е. coli при росте в средах, содержащих глюкозу,
аминокислоты и пуриновые и пиримидиновые основания, состав¬
ляет 314,6-Ю-4 моль.♦♦Stouthamer А. Н. Energetic aspects о! the growth of microorganisms //
Microbial energetics. 27-th Symp. Soc. Gen. Microbiol. — Cambridge: Univ.
Press, 1977. — P. 285—315.
Биохимические основы регуляции137Расход АТР (%) на синтез клеточных компонентов распре¬
деляется так: белок — 60; РНК — 12; ДНК — 1,8; полисаха¬
риды — 6; липиды — 0,5; процессы транспорта — 18. Для
синтеза 1 г биомассы на других субстратах (органические кис¬
лоты, ацетат) АТР может потребоваться в 3 раза больше
[100]. Следовательно, удельная скорость роста клеток зависит
от скорости синтеза АТР и, таким образом, от активности фер¬
ментов центрального метаболизма бактерий. Чем больше ско¬
рость роста клеток, тем больше должна быть скорость проду¬
цирования АТР. В то же время ц, зависит также от скорости
включения предшественников в анаболические процессы и фор¬
мирования клеточной структуры. Поскольку деление клеток
начинается только после удвоения генома и синтеза РНК, при
увеличении ц, должна повышаться скорость редупликации
ДНК, формирования рибосомального аппарата, синтеза белка
и др. По окончании репликации синтезируется так называемый
терминирующий протеин. При этом начинается образование пе¬
регородки клеточной стенки. Процесс деления клеток корине¬
бактерий изображен на рис. 2.44.Для ответа на вопрос, какой фактор является лимитирую¬
щим при увеличении удельной скорости роста клеток, можно
привести несколько возможностей: 1) продолжительность ДНК
репликации; 2) время синтеза РНК и образования рибосом;3) дуплицирование и мультиплицирование клеточной массы;4) скорость транспорта в клетку фактора, лимитирующего рост;Таблица 2.17. Изменение содержания клеточных компонентови белоксинтезирующей активности РНК у Br. flavum 22ЛД
в зависимости от и*Показателии, ч-1следы0,10,2Клеточные компоненты, % насухую массу:ДНК1,8 ± 0,12,2±0,12,3±0,15РНК10 ± 0,520,0 ±0,1124 ±0,9кислоторастворимые нукле- 0,4 ±0,020,6 ±0,011,3 ±0,06отидыбелок30 ± 1,334± 1,642 ±1,8a-NH2 аминокислот обмен- 0,15±0,010,2 ±0,010,6 ±0,02ного фондаРНК/ДНК5,5910Белоксинтезирующая актив- 00,190,35ность РНК* Остальные клеточные компоненты не опрелеляли.
138Глава 2Рис. 2.46. Изменение содержания
клеточных компонентов во вре¬
мени при периодическом культи¬
вировании Br. flavum 22ЛД:/ — белок; 2 - РНК; 3 - a-NH2-аминокислот обменного фонда; 4 —ДНК; 5 — кислоторастворимые нук¬
леотиды5) продолжительность образования мембранных структур;6) скорость синтеза АТР. На основе данных, полученных при
изучении регуляции метаболизма ауксотрофных мутантов ко¬
ринебактерий, более вероятным кажется продолжительность
синтеза РНК и образования рибосом.При увеличении ц коринебактерий заметно повышается со¬
держание РНК в клетках, увеличивается соотношение РНК/ДНК
и PHK-белоксинтезирующая активность. Содержание осталь¬
ных клеточных компонентов изменяется менее заметно
(табл. 2.17). Если количество РНК у нерастущих клеток со¬
ставляет 10%, то у клеток с удельной скоростью роста 0,1 ...
... 0,2 ч-1 повышается до 20... 24% в пересчете на сухую массу.Рассмотрим изменение скорости синтеза РНК и роста кле¬
ток Br. flavum. 22ЛД при пересеве с твердой питательной
среды (РПА) на жидкую. Состав сред при культивировании
гомосериновых или метионин+треониновых ауксотрофов Вг.
flavum-. сахароза или меласса — 2... 15% в зависимости отТаблица 2.18. Изменение активности ферментов в периодическом процессе
концентрацией сахарозы 7,5%СредаФаза ростаЧас культи¬
вированияц, ч-1Фосфо-мфрукто-киназаФосфо-енолпи-руват-карбок-силазаЛактатде-гидро-геназаАктивность, каталРПА —24-й—4523210ЖПС Лаг-фаза3-й0,03378102132Логарифмическая12-й0,239116285Замедленного24-й0,152669359роста35-й0,01243720Стационарная40-й0147550
Биохимические основы регуляции13»цели исследования; факторы роста в количествах, обеспечива¬
ющих содержание L-метионина и L-треонина в количествах
0,01 и 0,04%, биотин и тиамин — 50 и 150 мкг на 1 л среды;
(NH4)2S04 — 2%, К2НРО4 и КН2Р04 — по 0,05%.Рост коринебактерий характеризуется всеми фазами со¬
гласно классическому представлению. Увеличению удельной
скорости роста до 0,2 ч-1 в логарифмической фазе предшествует
некоторое повышение содержания ДНК и кислоторастворимых
нуклеотидов, а также значительное увеличение количества РНК
(рис. 2.46). В логарифмической фазе роста повышается соотно¬
шение РНК/ДНК. Его снижение в фазе замедленного роста
связано с уменьшением содержания РНК в клетках.На основании изложенного можно заключить, что у корине¬
бактерий увеличение удельной скорости роста клеток связано
с повышением содержания РНК. У Е. coli, например, количе¬
ство рибосом может увеличиваться пропорционально значению
удельной скорости роста клеток, наблюдается также повышение
содержания РНК и нуклеотидов {46].Фактором, вызывающим переход коринебактерий в фазу за¬
медленного роста, обычно является лимитирование роста метио¬
нином и треонином. Снижение содержания РНК в клетках при
этом, очевидно, обеспечивается механизмом строгого контроля.Указанные изменения синтеза клеточных компонентов и
удельной скорости роста клеток должны быть связаны с изме¬
нением активности ферментов и продуцированием АТР. Однако
изменение активности ферментов при увеличении \х у корине¬
бактерий имеет очень сложный характер (табл. 2.18). При ис¬
пользовании неиндуцированной к сахарозе или глюкозе куль¬
туры активность ферментов ЦТК в лаг-фазе и в логарифми¬
ческой фазе низка. Удельная скорость роста клеток повышаетсякультивирования Br. flavum 22ЛД в среде с начальнойАкони¬тазаа-Кето-глутарат-дегидро-геназаГлута-матде-гидроге-назаМалатде-гидроге-назаИзоцитрат-лиазаNADH-окси-
дазный ком¬
плексОВА клеток,
мг ТТХ-Ф
на 100 мг
клеток• 10"ц на 1 мгбелка00695000232985173828700386740118116802232915352130489361021213243001582353010722106214
140Глава 2'rtf it СО г,чРис. 2.47. Изменение содержания биомассы (X), скорости роста клеток (ц)
и концентрации сахарозы (S) во времени при периодическом культивирова¬
нии Br. flavum 22ЛД при начальной концентрации сахарозы в среде, %:
/ — 7,5; 2 — 15; 3 — при дробном введении сахарозы 7,5+7,5 (отмечено стрелкой)в основном «при увеличении активности функционирования гли¬
колиза. Активность аконитазы значительно увеличивается
только в конце логарифмической фазы роста.Большое значение при повышении удельной скорости роста
имеет так называемый контроль роста, при котором реализация
генетически детерминированных свойств бактерий зависит от
условий окружающей среды. Увеличение д в логарифмической
фазе роста коринебактерий зависит от концентрации сахаров,
величины рОг, скорости перемешивания среды и пр. Чем выше
концентрация сахарозы в среде при культивировании клеток с
неиндуцированными ферментами ЦТК, тем длительнее лаг-фаза
и меньше \х (рис. 2.47). В то же время скорость потребления
сахаров клетками при повышенных концентрациях сахарозы не
снижается. Следовательно, в данных условиях скорость транс¬
порта сахаров в клетку не лимитирует увеличение удельной
скорости роста клеток.При культивировании бактерий в условиях повышенных
концентраций сахарозы в среде наблюдается низкая скорость
индукции аконитазы, увеличенная активность лактатдегидроге-
назы и глутаматдегидрогеназы. Одной из причин удлинения
лаг-фазы при повышенных концентрациях сахарозы может быть
репрессия синтеза катаболитчувствительных ферментов при
низкой скорости использования АТР в клетках. При синтезе
АТР гликолитическим путем (например, в условиях катаболит¬
ной репрессии) синтез РНК и рост клеток невозможны в
отсутствие синтеза предшественников для образования гРНК
и др. (нуклеотидов, аминокислот, кофакторов и др.)- Следст¬
вием данной регуляции является также прекращение использо¬
вания сахаров клетками.
Биохимические основы регуляции141Индукцию ферментов ЦТК можно провести при выращива¬
нии бактерий на твердой питательной среде с добавлением
глюкозы или сахарозы (0,5 ... 1,0%), а также при выращива¬
нии бактерий в средах со сравнительно низкими концентраци¬
ями сахаров. Использование «индуцированной» культуры не
означает использование клеток только с повышенной активно¬
стью ферментов. Одновременно с индукцией происходит обра¬
зование рибосомального аппарата, и клетки потенциально го¬
товы к повышению \х. Следует отметить, что индукция фермен¬
тов происходит только при одновременном наличии сахаров,
факторов роста, источников азота и пр. При пересеве индуци¬
рованных клеток на среды с содержанием сахаров даже в пре¬
делах 10... 15% эффект Кребтри менее выражен.Длительность лаг-фазы и удельную скорость роста клеток
можно регулировать интенсивностью аэрации, скоростью пере¬
мешивания среды и др. При этом повышение значения рОг или
переноса кислорода в клетках может привести к увеличению
скорости синтеза АТР, но при низкой скорости анаболических
процессов может наблюдаться эффект Кребтри, а затем ката-
болитная репрессия ферментов. Длительность лаг-фазы часто
увеличивается.С позиции теории строгой регуляции причины снижения
удельной скорости роста клеток и образование фазы замедлен¬
ного роста могут быть следующими:1) снижение скорости продуцирования энергии в условиях
лимита источником энергии;2) низкая скорость потребления источников азота и факто¬
ров роста, особенно при введении дополнительных количеств
источников углерода, энергии и других факторов, способствую¬
щих увеличению синтеза АТР в условиях его низкого использо¬
вания. В обоих случаях (п. 1 и 2) возможно увеличение син¬
теза ppGpp и прекращение образования гРНК.Регуляторное действие могут оказать также повышенное со¬
держание клеток в среде [48], увеличенное осмотическое дав¬
ление среды и т. д.Из сказанного следует, что с целью поддержания высокой
удельной скорости роста в процессе периодического культиви¬
рования нельзя допустить ее резкого снижения при введении
в среды повышенных концентраций источников энергии и др.
В периодическом процессе любая лимитация, ингибирование
или репрессия ферментов центрального метаболизма и др. мо¬
жет прекратить синтез РНК и снизить удельную скорость роста.
Добавление источников энергии в несбалансированных соотно¬
шениях может вызвать еще более значительное уменьшение \х>
выключить транспорт сахаров в клетку и даже активизировать
выход сахаров из них. Согласование концентраций энергетиче¬
ских субстратов со скоростью использования энергии в клетках
142Глава 2возможно только в непрерывных условиях культивирования.Следует подчеркнуть, что бактерии, полученные в различ¬
ных условиях культивирования, у которых |ы одинаково и кото¬
рые характеризуются определенным содержанием РНК в клет¬
ках, могут различаться количеством остальных компонентов и
активностью ферментов. Может быть разным функционирова¬
ние ферментов метаболических путей при определенных удель¬
ных скоростях роста в условиях периодического и непрерыв¬
ного культивирования.2.7. ИЗМЕНЕНИЕ ВЕЛИЧИНЫ КОНВЕРСИИ
СУБСТРАТОВ В ПРОДУКТ ПРИ БАКТЕРИАЛЬНОМ
СИНТЕЗЕЗная особенности регуляции метаболизма бактерий при изме¬
нении условий культивирования, можно целенаправленно регу¬
лировать конверсию субстратов в биомассу или продукт (У*/”
или Яр/s1). Рассмотрим некоторые аспекты регуляции этих ха¬
рактеристик при биосинтезе лизина у коринебактерий.Как было показано выше, существует множество систем
транспорта субстратов и путей катаболизма источников угле¬
рода, а также альтернативные пути синтеза лизина у этих
бактерий. Изменение активности транспортных белков и фер¬
ментов катаболических и анаболических процессов позволяет
поддерживать рост и жизнеспособность бактерий в вариабель¬
ных условиях окружающей среды, однако величина конверсии
субстратов в биомассу или продукт при этом сильно изменя¬
ется. Условиями культивирования и технологическими манипу¬
ляциями поток субстратов можно направить по альтернативным
метаболическим путям.При культивировании коринебактерий показано, что усло¬
вия, оптимальные для повышения Y™/s , не являются таковыми
для увеличения Ур%п. При этом не совпадают также макси¬
мальные значения ц и лизинсинтезирующей активности клеток
(qP). Если jlim акс в процессе периодического культивирования
бактерий наблюдается в логарифмической фазе, то qpMакс —
в фазе замедленного роста. Аналогично меняется величина кон¬
версии сахарозы в биомассу или продукт (рис. 2.48). Yx/a мак¬
симально при высокой скорости потоков продуктов катаболизма
сахарозы через гликолиз и ГМП при сравнительно низкой ак¬
тивности регуляторных ферментов ЦТК. Последний при этом
является разомкнутым. На данном этапе роста наблюдается
высокая ОВА клеток. Yp)csn максимально при резком снижении
ОВА клеток, активности ферментов гликолиза и повышении
Биохимические основы регуляции143Рис. 2.48. Изменение физиологической активности при периоди¬
ческом культивировании Br. flavum 22ЛД:1 — М>» 2 — g] 3 — qр\ 4 qs\ 5 ^x/S' ^ ^P/Sактивности ферментов ЦТК, особенно аконитазы и оксоглутарат¬
дегидрогеназы. Так как активность последнего фермента у Вг.
flavum низка, то даже при увеличении включения в ЦТК пиру¬
вата его катаболизм только частично проходит по полному
циклу. Взаимосвязь некоторых из этих характеристик в про¬
цессе периодического культивирования показана на рис. 2.49.При непрерывном культивировании бактерий максимальное
значение Ydxfs имеет место при более высоких значениях ско¬
рости протока среды, чем максимальное значение YpK/sn
(табл. 2.19). При повышенных значениях скорости протока сни¬
жаются обе эти величины.В различных условиях культивирования нами показана сле¬
дующая закономерность. При цмакс скорость потребления
сахаров клетками выше, чем при ^ямакс (рис. 2.48). В аэроб¬
ных условиях qs для достижения максимальной удельной ско¬
рости роста клеток и синтеза лизина у определенных штаммов10 20 30 ЬО 50 60т;чРис. 2.49. Изменение во времени ак¬
тивности аконитазы (/) и фосфо¬
фруктокиназы (2), ОВА клеток (3)
и qs (4) (г/ч*г клеток) при перио¬
дическом культивировании (началь¬
ная концентрация субстрата —
7,5%). Размерности см. на рис. 2.37
и др.
Таблица 2.19. Изменение содержания биомассы X, скоростей потребления сахаров и синтеза лизина (<?s и qr),величин конверсии сахаров в биомассу и лизин (У и Y ), а также активности ферментови их соотношений в процессе непрерывного культивирования Br. flavum 22ЛД при изменении скорости
протока D средыD, ч 1X» г/л*8ЯруэкспXJSуэкспPJSФосфофрук-токиназаФосфоенол-пируват-карбоксилазаАконн-тазаФосфофруктоки-наза/аконитазаФосфссмол-пнрупат-карб-окснлаза/ако-нитазаг/ч на 1г клетокг/гАктивность, катал • 10 11
белкана 1 мг0,0527,60,090,030,300,34235132405,8: 13,3: 10,1024,10,140,060,170,381852141980,9 : 11,1 : 10,1524,30,160,050,150,482102292780,75 : 10,82 : 10,2019,50,330,070,600,322583481761,46: 119 : 10,2518,00,330,020,540,28283173873,2 : 11,9 : 10,3014,50,280,010,520,16270200495,5 : 14 : 1Таблица 2.20. Изменение величин qs, qp и у Br. flavum 22ЛД в зависимости от активности ферментовУсловия ростаФосфофрукто-киназаАкони¬тазаЛактатде-гндрогеназаявЯр„ЭКСПУ P!S »
г/гХарактеристика культурыАктивность, катал - 10 11 на 1 мг белкаг/ч на 1г клетокАэробные2328700,1580,070,46Аконитаза индуцирована, высокая
активность ЦТК3635600,2500,050,32Ингибирование или репрессия ако¬6313100,4340,040,25нитазы, увеличение анаболической
роли ЦТК (эффект Кребтри и др.)Условно анаэробные1460292850,7920,030,16Снижена активность аконитазы, зна¬
чительно увеличена активность
фосфофруктокиназы (обратный эф¬
фект Пастера и др.)
Биохимические основы регуляции145Рис. 2.50. Изменение удельной скорости синтеза лизина qp
(а) и роста клеток ц (б) у Br. flavum 22ЛД в зависимости
от скорости потребления сахарозы клеткамиимеет конкретное значение. Так, |ыМакс у Br. flavum 22ЛД наб¬
людается при qs = 0,42 г/ч на 1 г клеток, <7ямакс — при qs =
=0,2 г/ч на 1 г клеток. Если кривые на рис. 2.50 сравнить
с изменением активности ферментов в зависимости от скорости
потребления сахаров клетками (см. рис. 2.33), то подтвержда¬
ется приведенная выше закономерность: \i и Y^s максимальны
при высокой активности ферментов гликолиза. Скорость синтеза
лизина и У|>%п максимальны при более низкой скорости потреб¬
ления сахаров клетками и при высокой активности регулятор¬
ных ферментов ЦТК и функционировании полного цикла (см.
рис. 2.36).В табл. 2.20 показано изменение Yp/s11 и qs в аэробных и
условно анаэробных условиях в зависимости от активности
ферментов. Следует отметить, что максимумы qP и Ур%п при
варьировании регулирующих факторов не всегда совпадают.Повышение лизинсинтезирующей активности клеток и кон¬
версии сахаров при относительно высокой интенсивности мета¬
болизма через ЦТК у коринебактерий можно объяснить сле¬
дующим:1) образование метаболитов для синтеза лизина (пирувата,
сукцинил-СоА, оксалоацетата, АТР, NAD(P)H) на использован¬
ное количество сахаров при функционировании этого цикла
наивысшее;2) активность ферментов ЦТК увеличивается только в ус¬
ловиях, при которых рост и поддержание жизнеспособности
клеток лимитируются скоростью продуцирования АТР. Это сни¬
жает анаболическую функцию клеток механизмом строгого
контроля и использование метаболитов для образования био¬
массы.Функционирование ЦТК у бактерий возможно только при
наличии альтернативных путей, компенсирующих синтез окса¬
лоацетата при использовании его для синтеза лизина. Таким10 — 361
путем у коринебактерий является функционирование фосфо-
енолпируват-карбоксилазы, активность которой увеличивается
при повышении скорости потоков метаболитов через ЦТК.Образование разомкнутого ЦТК у коринебактерий проис¬
ходит только при высокой скорости продуцирования АТР клет¬
ками. Повышение анаболической функции ЦТК при этом при¬
водит к снижению содержания катаболитов этого цикла,
ингибирующих глюкозо-6-фосфат-дегидрогеназу в клетках. Это
приводит к повышению скорости включения глюкозы в ГМП.
Величина конверсии сахаров в продукт при этом снижается,
повышается их использование на образование биомассы.Следовательно, важным условием увеличения лизинсинтези-
рующей активности коринебактерий является ограничение ско¬
рости продуцирования АТР в клетках ниже максимального
уровня. Активность регуляторных ферментов ЦТК (например,
аконитазы) при этом увеличивается, чем, очевидно, объясня¬
ется прямая зависимость между активностью аконитазы и ли-
зинсинтезирующей активностью бактерий. Увеличение активно¬
сти этого фермента вызывает у коринебактерий повышение
лизинсинтезирующей активности и конверсии субстратов в ли¬
зин, что может быть достигнуто предотвращением избыточного
продуцирования АТР и поддержанием ji ниже jlim акс С ПОМОЩЬЮ
следующих мероприятий:1) дробная подача источников углерода;2) регуляция скорости перехода кислорода по системе газ—
жидкость—клетка;3) поддержание скорости протока среды в условиях непре¬
рывного культивирования на таком уровне, при котором актив¬
ность аконитазы максимальна;4) прямая регуляция скорости окислительного фосфорили¬
рования в клетках;5) использование нескольких источников углерода и энергии;6) использование регулирующих веществ.Причины снижения Yp/s11 в условиях избыточного продуциро¬
вания АТР могут быть следующими:1) переключение бактерий на повышенную скорость роста;2) катаболитная репрессия ферментов и снижение скорости
роста клеток.Данные этапы регуляции можно проследить при пересеве
бактерий в среды с концентрациями сахаров в пределах 2...
... 16% в условиях высокой интенсивности аэрации. В пределах
концентраций 2... 10% наблюдается первый принцип указан¬
ной регуляции, при концентрации сахаров выше 10% — второй
(рис. 2.51). При максимальных значениях qP наблюдается мак¬
симальная активность аконитазы, при \хМакс — высокая актив¬
ность фосфофруктокиназы, однако если на первом этапе данной
Биохимические основы регуляции147Рис. 2.51. Изменение величин \х (/), qp (2), а также активности
аконитазы (<?), фосфофруктокиназы (4), лактатдегидрогеназы (5) и
ОВА клеток (6) у Br. flavum 22ЛД в зависимости от концентрации
сахарозы в среде. (Острые опыты в течение 5 ч, р02=30% от
насыщения, я=1000 об/мин)регуляции снижается Ур%п и повышается У*/? , то на вто¬
ром — снижаются обе эти величины.Уменьшение активности аконитазы и лизинсинтезирующей
активности бактерий, особенно Ур%п у коринебактерий, проис¬
ходит также в условиях заниженной скорости продуцирования
энергии в клетках. Регуляция синтеза лизина при этом подчи¬
няется следующим закономерностям:1) уменьшение скорости продуцирования АТР у гликолити-
ческих клеток приводит в основном к снижению удельной ско¬
рости роста, а также к некоторому сокращению синтеза лизина;2) при уменьшении скорости продуцирования АТР у клеток
с ЦТК возможно поддержание синтеза АТР и удельной ско¬
рости роста дополнительным использованием субстрата, однако
У™и Ур/s1 при этом снижаются.Заниженная скорость продуцирования АТР и снижение Ур%п
при синтезе лизина, особенно в промышленных условиях, на¬
блюдаются при недостаточной интенсивности аэрации. При
этом накапливаются значительные количества лактата. Введе¬
ние ионов NH4+ для нейтрализации среды и повышение
содержания NH4+ до 1% и более вызывает дополнительное ин¬
гибирование синтеза АТР окислительным путем. Синтез АТР
при этом компенсируется дополнительным использованием суб¬
стратов, однако их конверсия в биомассу или в продукт сни¬
жается.Закономерности изменения конверсии сахаров в лизин и
функционирования ферментов центрального метаболизма,
ю*
Аминокислоты
» ф - Met/ 2 S M 5 6 7 в Э 13 II 12Рис. 2.52. Изменение аминокислотного состава сред при куль¬
тивировании различных штаммов коринебактерий в течение
24 ч в средах, содержащих КЭ (/, 3, 5, 7, 10), гидролизат
БВК (2, 4, 6, 5, /7) или гидролизат БВК с биотином и
тиамином (9, 12):1,2— среды; 3, 4 — штамм Af. glutamicus ТЗ; 5, 6 — Br. flavum
22ЛД; 7—9 — Яг. flavum RC 115; 10—12 — штамм Br. flavum V 5.
Аминокислоты идентифицированы методом тонкослойной хромато¬
графииописанные нами выше, получены при культивировании корине¬
бактерий в средах, содержащих сахарозу или мелассу, и при
использовании в качестве факторов роста синтетического ме¬
тионина и треонина или их природного источника — кукуруз¬
ного экстракта (КЭ). Однако регуляция синтеза лизина при
использовании других источников метионина и треонина за¬
метно меняется.В качестве источника факторов роста при микробиологиче¬
ском синтезе лизина бактерии часто используют различные
гидролизаты, например гидролизат белкового витаминного кон¬
центрата (гБВК). При культивировании различных штаммов
Br. flavum, а также М. glutamicus в средах, содержащих
гБВК, заметно снижаются конверсия сахаров в лизин и про¬
дуктивность процессов по сравнению с таковыми в синтетиче¬
ских средах или в средах с другим источником факторов роста —
кукурузным экстрактом.При росте бактерий в средах с гБВК наблюдается значи¬
тельное накопление побочных метаболитов — лактата, аланина,
валина и др. (рис. 2.52). Образования значительных количеств
этих веществ при культивировании бактерий в аналогичных
условиях в средах с КЭ не происходит. При культивировании
четырех штаммов в средах с гБВК показано накопление
Биохимические основы регуляции14910 20 30
аРис. 2.53. Изменение активности ферментов при культивировании
Br. flavum V 5 в средах с различными ростовыми факторами:1 — фосфофруктокиназа; 2 — глюкозо-6-фосфат-дегидрогеназа; 3 — акони¬
таза; 4 — NADH-оксидазный комплекс; а — с гидролизатом БВК и добав¬
лением биотина и тиамина; б — с кукурузным экстрактомзначительных количеств аланина. Концентрация последнего при
этом может достигать 35 мМ, лактата — 200 мМ.Образование продуктов неполного окисления пирувата при
культивировании бактерий в средах с гБВК может быть обус¬
ловлено низким содержанием биотина и тиамина в гидроли¬
зате. Однако при добавлении этих витаминов синтез аланина
не уменьшается, следовательно, в средах с гБВК имеются фак¬
торы, ингибирующие полное окисление сахаров и приводящие
к снижению величин конверсии сахаров в продукт. Если вели¬
чина Ур/s11 в вариантах с использованием гБВК в среднем
равняется 0,29, то в вариантах с КЭ — 0,35.При культивировании бактерий в средах с различными ис¬
точниками факторов роста изменяются закономерности функци¬
онирования ферментов центрального метаболизма (рис. 2.53).
Активность аконитазы у посевной культуры к 12-му часу
культивирования снижается почти до нуля и повышается
только к 30-му часу культивирования. При культивировании
бактерий в средах с гБВК заметно уменьшается также актив¬
ность NADH-оксидазного комплекса.Величина qs (г на 1 г клеток) у бактерий, выращенных в
средах с гБВК, в представленном опыте в среднем составляет
0,20, в средах с КЭ — 0,19, в промежутке времени 0 ... 15 ч —
0,45 и 0,20 соответственно.
150Глава 250%40cb
^ <* 523 £J020*о ас•о ^10]лПгиПгчпШЛ5Шг,чРис. 2.54. Изменение содержания глюкозы (/), глюкозо-6-фосфата (II)
и АТР (///) в клетках Br. flavum V 5 при их культивировании в средах,
содержащих гидролизат БВК (о) или кукурузный экстракт (б). Все
анализы были выполнены через 7, 15, 22 и 27 ч от начала культивиро¬
ванияВ клетках, выращенных в средах с гБВК, накапливаются
значительные количества неиспользованных глюкозы и глюко-
зо-6-фосфата (рис. 2.54). Следовательно, транспорт сахаров в
клетку при этом не является стадией, лимитирующей скорость
катаболизма глюкозы в клетках.Данные особенности регуляции метаболизма бактерий при
их культивировании в средах с гБВК можно объяснить регули¬
рующим действием повышенных концентраций аспартата и
глутамата. Содержание этих аминокислот в средах с гБВК в
2 ... 3 раза выше, чем в средах с КЭ. При культивировании
Br. flavum в средах с гБВК наблюдается повышение активно¬
сти аконитазы при снижении содержания аспартата и глута¬
мата в среде (см. рис. 2.53).Поскольку при культивировании бактерий в средах с гБВК
наблюдается заметное снижение содержания АТР в клетках
(см. рис. 2.54) и часто синтезируется валин, возможно также
наличие ингибиторов окислительного фосфорилирования.Следовательно, для увеличения конверсии субстратов в ли¬
зин при культивировании бактерий в средах с гБВК должны
быть использованы специальные технологические приемы.Рост бактерий на комплексных средах (например, содержа¬
щих КЭ) имеет также определенные преимущества. Величина
конверсии сахаров в продукт при использовании КЭ обычно
увеличивается по сравнению с таковой в синтетических средах.
Это можно объяснить контролем использования азота (сначала
Биохимические основы регуляции151используется органический азот, затем — неорганический).
Скорость синтеза РНК и рост клеток при этом повышаются и
уменьшается вероятность образования условий, обеспечиваю¬
щих избыточное- продуцирование энергии в клетках и катабо-
литную репрессию.Основными принципами снижения конверсии субстратов в
лизин у коринебактерий является либо переключение бактерий
на повышенную удельную скорость роста, либо использование
для синтеза продукта дополнительных количеств субстрата.Путем регуляции условий культивирования коринебактерий
экспериментально достигнута величина конверсии сахаров в ли¬
зин около 0,49 г/г в пересчете на лизинмонохлоргидрат. Теоре¬
тически максимальное значение этой величины при синтезе
оксалоацетата в ЦТК — 0,57 г/г, при его синтезе путем функ¬
ционирования фосфоенолпируват-карбоксилазы — 0,67. Однако
на практике эту цифру практически нельзя получить, что объ¬
ясняется тем, что фосфоенолпируват-карбоксилаза функциони¬
рует только при наличии ацетил-СоА. Образование данного
метаболита в клетках уменьшается при снижении его включе¬
ния в ЦТК. Следовательно, невозможно функционирование
фосфоенолпируват-карбоксилазы при репрессии ферментов
ЦТК. Исключением является действие этого фермента у Вг.
flavum V 5.Увеличения Ур/|п при синтезе лизина коринебактериями
можно достичь при использовании сред, содержащих несколько
источников углерода, например сахарозу и ацетат. Однако уве¬
личение Yp/s11 при добавлении ацетата возможно только при
обеспечении условий одновременного использования этих суб¬
стратов. При этом достигаются все условия, необходимые для
увеличения синтеза лизина бактериями:1) снижение скорости продуцирования АТР вследствие бо¬
лее низкого энергетического выхода при использовании ацетата
по сравнению с сахарозой;2) повышение активности аконитазы, обеспечение синтеза
оксалоацетата и АТР при функционировании глиоксилатного
шунта и ЦТК;3) обеспечение синтеза пирувата при катаболизме саха¬
розы.Показано, что одновременное использование сахаров и аце¬
тата у коринебактерий наблюдается в условиях переноса глю¬
козы в клетках с помощью ФТС. При функционировании этой
системы транспорта глюкозы одновременно высвобождается
пируват. Его синтез на ацетате сложный, сопровождается рас¬
ходом АТР, поэтому использование ацетата в качестве един¬
ственного источника углерода неэкономно, хотя активность
152Глава 2'.Таблица 2.21. Изменение активности ферментов и величины конверсии
субстратов (сахарозы+ацетата) при культивировании
Br. flavum 22ЛД в средах с сахарозой или смеси
сахарозы и ацетатаИсточник углерода^ацФосфо-фрукто-кинаэаАкони¬тазаИзоцит-рат-лиазаNADH-
оксидаз-
ный ком¬
плексV9KCIIYP/S .
г/гг/ч на 1 г
клетокАктивность, катал • 10 " на1 мг белкаСахароза0,1843752871570,42Сахароза+ацетат0,100,055963901893090,50То же0,0040,179198539463190,29аконитазы высока (табл. 2.21). Изменение скорости потреб¬
ления клетками сахарозы (qs) или ацетата (?ац) достигнута
при регуляции скорости подпитки по скорости потребления кис¬
лорода, регистрируемой газоанализатором в условиях фермен¬
тации и изменением соотношения сахарозы и ацетата в под¬
питываемой смеси.На основании расчетов и экспериментальных данных можно-
сформулировать основные причины изменения величины кон¬
версии субстратов в продукт:1) перераспределение использования субстратов на рост или.
синтез продуктов;2) синтез продуктов различными метаболическими путями,
с различным материально-энергетическим балансом;3) неодинаковые затраты энергии на транспорт субстратов;.4) рост бактерий на комплексных средах при наличии инги¬
биторов и стимуляторов;5) образование продуктов неполного окисления субстратов*
(вне- и внутриклеточных);6) изменение мембранной проницаемости бактерий.Повышение УхДп или Ур/s11 согласно изложенному выше мо¬
жет быть достигнуто изменением состава сред и условий куль¬
тивирования бактерий, а также изменением их генетических
свойств.Перераспределение использования субстратов на рост и син¬
тез продуктов может быть достигнуто регуляцией синтеза РНК.
и скорости продуцирования АТР в клетках.Например, ограничение скоростей потребления сахаров, ис¬
точников азота (или ауксотрофных факторов), а также под¬
держание скорости продуцирования АТР в клетках ниже мак¬
симальной позволяет включить механизм строгого контроля:
Биохимические основы регуляции153повысить синтез ppGpp в клетках, снизить образование РНК
и использование субстратов на рост клеток.Повышение активности метаболических путей, имеющих
наименьшие затраты субстратов на рост и синтез продуктов,
может быть достигнуто изменением концентрации субстратов,
использованием субстратов с различной скоростью катабо¬
лизма, сред с несколькими источниками углерода, изменением
интенсивности аэрации и перемешивания среды в процессе куль¬
тивирования и др. Следует отметить, что концентрации суб¬
стратов должны быть не намного выше оптимальных, так как
избыток любого компонента может оказывать ингибирующее
или репрессирующее действие на ферменты метаболизма и при¬
водить к прекращению роста.У бактерий наблюдается катаболитная репрессия источни¬
ками азота, фосфора, серы. Снижение дыхательной активности
у коринебактерий наблюдается при концентрации NH4+ в среде
около 550 мМ. Ингибирующее действие Р, проявляется при
концентрациях 20 мМ и выше.Регуляторное действие может оказывать также повышение
концентрации витаминов, например тиамина. Его присутствие
в среде в концентрациях, в 4 раза превышающих таковые в
стандартных средах, приводит к явлениям, аналогичным эф¬
фекту Кребтри: у Br. flavum происходит повышение активности
энергетически менее эффективных метаболических путей. Это
можно объяснить ингибирующим действием АТР, образующе¬
гося при увеличении активности ферментов ЦТК при повышен¬
ных концентрациях тиамина.Регуляция величины конверсии субстратов в биомассу мо¬
жет быть вызвана также неспецифическими факторами. На¬
пример, повышение осмотической концентрации среды
сопровождается синтезом внутриклеточных осморегуляторов —
глутамата, трегалозы и др. [19]. В экстремальных условиях
повышается синтез шокспецифических белков. В качестве при¬
мера можно привести синтез таковых при повышенных темпе¬
ратурах [51], увеличенных концентрациях пероксида водорода
[72] и др. Большие концентрации субстратов и продуктов мо¬
гут вызвать разобщающее действие на окислительное фосфо¬
рилирование [55]. Во всех этих случаях расход субстратов при
бактериальном синтезе увеличивается.Как было показано выше, концентрации субстратов, вызы¬
вающие репрессию одних и тех же ферментов, не абсолютны;Увеличение конверсии субстратов в биомассу или продукт
в комплексных средах, содержащих факторы, ингибирующие
или репрессирущие необходимые метаболические реакции, мо¬
жет быть достигнуто путем использования смешанных культур,
штаммов с низкой скоростью потребления ингибирующих ве¬
ществ, штаммов, нечувствительных к ингибиторам, и др.
154Глава 2Регуляции конверсии субстратов в биомассу или продукт у^ „ ж/ЭКСП л/DKCIIбактерии часто различаются, поэтому повышение Уx/s и Yp/s
может быть достигнуто различными путями. Увеличение син¬
теза продуктов часто происходит при лимитировании роста
источниками азота, фосфора, серы и др.При повышении продуктивности процесса по биомассе не¬
обходимым условием является достижение максимальных
значений удельной скорости роста. При увеличении конверсии
субстратов в продукт очень важно поддерживать определенную
удельную скорость роста клеток, часто — ниже максимальной.
Это было показано на примере синтеза лизина коринебакте-
риями. При поддержании цС^макс уменьшается также расход
субстратов на синтез клеточных компонентов (РНК, нуклеоти¬
дов) и, возможно, других эндогенных метаболитов. Расход
энергии на синтез РНК при снижении ji, по некоторым данным,,
уменьшается на 25% [28].В то же время при повышении конверсии субстратов в
продукт часто нецелесообразно поддерживать пониженную
удельную скорость роста клеток. При этом увеличиваются за¬
траты субстрата на оборот метаболитов и клеточных компонен¬
тов. Одновременно при низких скоростях роста бактерий ос¬
ложняется сбалансирование скоростей катаболических и анабо¬
лических процессов. При дополнительном введении повышенных
количеств источников углерода и азота в процессе фермента¬
ции возможно резкое снижение \i и прекращение процесса
ферментации. Это объясняется низкой скоростью использова¬
ния АТР клетками, что может привести к катаболитной репрес¬
сии ферментов и др. При малой удельной скорости роста уве¬
личивается вероятность потери жизнеспособности бактерий в
неблагоприятных условиях. Показателем, характеризующим
физиологическую активность бактерий, может быть использо¬
вана их ОВА. Например, при увеличении д у Br. flavum 22ЛД.
в 2 раза величина ОВА бактерий возрастает в 3 раза. Под¬
держивание ОВА на уровне, превышающем минимальный,
можно считать условием, позволяющим сократить лаг-фазу при
изменении условий роста, а также обеспечивающим сохранение
жизнеспособности клеток в вариабельных условиях.Для увеличения конверсии субстратов в продукт нецелесо¬
образно культивировать бактерии не только при очень высоких,
но и при низких концентрациях источников углерода и азота,
а также при пониженных скоростях продуцирования АТР.Часто одновременная реализация роста бактерий и синтеза
продуктов невозможна. При этом рост* бактерий и синтез не¬
обходимо реализовать в двухстадийном процессе. Это особенна
важно при получении продуктов, образующихся только на ста¬
дии лимитирования роста различными факторами.
Биохимические основы регуляции155Сверхсинтез продуктов бактериями обычно связан с ингиби¬
рованием или репрессией определенных ферментов и метабо¬
лических путей полного катаболизма субстратов и выбросом
не полностью окисленных продуктов. На рис. 2.17 показано,
что при изменении активности путей катаболизма глюкозы воз¬
можен синтез очень вариабельных продуктов. Выключение или
включение определенных ферментов и метаболических путей у
бактерий является следствием поддержания роста в вариабель¬
ных условиях механизмами, рассмотренными выше: поддержа¬
нием энергетического заряда клеток, координацией энергети¬
ческого и конструктивного метаболизма и др. Аналогичными
механизмами включается или выключается синтез продуктов,
связанных с функционированием соответствующих метаболиче¬
ских путей.Увеличение синтеза продуктов, образующихся при аэробном
метаболизме бактерий, может быть достигнуто при предотвра¬
щении обратного эффекта Пастера, эффекта Кребтри и катабо¬
литной репрессии. Увеличение синтеза этих продуктов может
быть достигнуто такими же путями, что и регуляция синтеза
лизина коринебактериями. Увеличение синтеза продуктов у бак¬
терий, особо чувствительных к катаболитной репрессии, обычно
достигается заменой глюкозы на ксилозу, арабинозу, лактозу
и др., т. е. на сахара с меньшей скоростью катаболизма.Увеличение синтеза продуктов, связанных с функциониро¬
ванием анаэробного метаболизма, может быть достигнуто в
условиях обратного эффекта Пастера. При этом целесообразно
использование бактерий с повышенными значениями скорости
использования субстратов в анаэробных условиях. Имеется
множество примеров, показывающих синтез различных продук¬
тов при постепенном снижении аэрации. Так, если этанол
обычно синтезируется в условно анаэробных условиях, то лак¬
тат — при более выраженном лимите по кислороду [104]. При
этом возможны гибкая регуляция метаболизма и получение раз¬
личных продуктов [40, 71]. Увеличение синтеза продуктов, свя¬
занных с функционированием анаэробного метаболизма, может
быть достигнуто не только снижением интенсивности аэрации,
но и созданием эффекта Кребтри, например в условиях высоких
скоростей роста бактерий. Данный метод часто используют при
'биосинтезе этанола. При этом возможно получение как моно¬
меров, так и полимеров, например поли-р-гидроксибутирата
[82]. Разнообразные продукты (мономеры и полимеры) могут
синтезировать Zymomonas mobilis.Важным фактором в регуляции синтеза является транспорт
продукта из клеток. Его избыточное накопление в клетках по
типу отрицательной обратной связи ингибирует дальнейший
синтез. Перенос веществ из клеток обычно происходит с
Гглюкоза! АТР—ADPг;;юкозо-6-(р)\ _
фруктозо-1,6-бис-©I0.400.25VTTTT'
'//■"-шут JH
* VXIS‘PISРис. 2.55. Схемы функционирования центральных мета
(б) концентрациях источников углерода, азота и кис
диаграммахпомощью специфических пермеаз. При этом необходимо поддер¬
живать мембраны в энергизованном состоянии [29].С другой стороны, синтез продукта может регулироваться
при изменении химического состава мембран. Снижение прони¬
цаемости бактерий по отношению к определенному продукту
Биохимические основы регуляции157[глюкозафоофоанолпируват ч |' <3й> 11г АТР■**ADPпируват-* ' |ГЛЮКОЗО-6-(?)id)DyKT030-l ,6-бИС-(?)г■ 6-(Р)-пноконат
1рибозо-5-(Р)ГфосфоенолпируватIIIпируват1\Iацетил-СоАКонцентрация источников:1) С + + + 2) C + +N + + N + + +02 + +02 + +3) С + +N + +02 + + +аспартат-IVизо цитратсук цината-кетоглутарат
/глутаматболических путей коринебактерий при нормальной (а) и повышенной
лорода. Выход биомассы и лизина отражен на соответствующихявляется фактором, вызывающим прекращение дальнейшего
его синтеза.Классическим примером данной регуляции является синтез
лизина и глутамата у коринебактерий. Повышение содержания
в мембранах бактерий ненасыщенных жирных кислот вызывает
158Глава 2I ГЛЮКОЗА I-фосфоенолпируват(фтс)- пируват Ч ЛАКТАТ1ГЛЮКОЗО-6- (Р)Iфруктозо-1,6-бис- @
1t - фосфоенолпируват0,05.. У7777\Y3Kcr уэкспX' -PISаРис. 2.56. Схемы функционирования центральных метаболических
трациях источников углерода, азота и кислорода. Выход биоснижение их проницаемости к глутамату и прекращает его
дальнейший синтез. При этом возможно увеличение синтеза
лизина. Увеличение соотношения ненасыщенных и насыщенных
жирных кислот в мембранах и одновременно синтеза лизина
может быть достигнуто повышением синтеза ненасыщенных
жирных кислот бактериями при концентрациях биотина в среде
50 мкг/л. В то же время синтез глутамата происходит при более
низких концентрациях биотина в среде — около 5 мкг/л [89].
Биохимические основы регуляции1590,35путей коринебактерий при пониженной (а) и очень высокой (б) концен-
массы и лизина отражен на соответствующих диаграммахПри синтезе этой аминокислоты применяют также другие спо¬
собы увеличения проницаемости мембран:1) используют мутанты с недостаточным синтезом ненасы¬
щенных жирных кислот;2) добавляют в среду насыщенные жирные кислоты;3) вносят пенициллин и поверхностно-активные вещества
типа твин-60 и др.
160Глава 2Следовательно, различными путями регуляции метаболизма
можно достичь увеличения конверсии субстратов в продукт.На рис. 2.55 и 2.56 показаны схемы функционирования 7пу-.
тей катаболизма глюкозы и соответствующие средние величины
У jr/s и Ур/|п у Br. flavum при поддержании концентрации
метионина, треонина, биотина и тиамина на определенном уровне
и регуляции метаболизма изменением концентрации источников
углерода, азота или кислорода. Оптимальным для увеличения
конверсии сахаров в лизин является метаболизм, соответствую¬
щий схеме б, для конверсии сахаров в биомассу — схеме а
(рис. 2.55). Как очень высокие, так и низкие концентрации ука¬
занных факторов вызывают снижение конверсии сахаров в био¬
массу или лизин (рис. 2.56).Продуктивность процесса по лизину не только зависит от
величины YpK/csn, но и определяется также скоростью потребле¬
ния сахаров клетками и содержанием .биомассы в фермента¬
торе. Однако повышение qs и X не всегда приводит к увеличе¬
нию гР. Рост продуктивности процесса при повышении содержа¬
ния биомассы в ферментаторе и увеличении скорости потреб*
ления сахаров клетками приводит к повышению продуктивности
процесса только при одновременном поддержании конверсии
субстрата в продукт.Следовательно, увеличение гР при повышении X в уравне¬
нии rP=X-YP/s-qs у аэробных бактерий может быть достигнуто
только при таких условиях, при которых возможно обеспечение
необходимой интенсивности аэрации, т. е. в условиях, не вызы¬
вающих возникновение обратного эффекта Пастера. Аналогично
увеличение гР путем повышения qs также возможно только в
условиях, не приводящих к снижению Экспериментально полу¬
ченной величины Yp/s, т. е. для продуктов, синтезируемых при
аэробном метаболизме, — при отсутствии эффекта Кребтри или
катаболитной репрессии ферментов окислительного метабо¬
лизма.
ГЕНЕТИЧЕСКИЕ
И ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ
РЕГУЛЯЦИИ БАКТЕРИАЛЬНОГО СИНТЕЗАПотенциальная возможность роста бактерий в различных усло¬
виях определяется той генетической информацией, которая
записана в геноме. При этом обычно синтезируются только те
продукты, которые образуются при обеспечении синтеза мета¬
болитов и энергии для роста бактерий. Более интенсивный син¬
тез продуктов может быть достигнут при изменении заложенной
в геноме информации.Улучшение свойств бактерий изменением их генетических
свойств возможно путем использования следующих принципов:1) получение мутантов с измененными регуляторными или
структурными генами [46, 61];2) получение рекомбинантов методом гибридизации и гене¬
тической инженерии [80].3.1. ГЕНЕТИЧЕСКИЕ ОСНОВЫ
РЕГУЛЯЦИИ БАКТЕРИАЛЬНОГО СИНТЕЗА3.1.1. СВЕРХСИНТЕЗ ПРОДУКТОВУ БАКТЕРИЙ С ИЗМЕНЕННЫМ ГЕНОТИПОМСамым простым методом получения штаммов с измененными
генетическими свойствами является индуцированный мутагенез
и ступенчатый отбор полученных клонов методом селекции. Его
преимущество состоит в возможности получения продуцентов
только по признаку накопления продукта. Недостаток этого ме¬
тода заключается в непредсказуемости результатов.11 - 361
162Глава 33.1.1.1. МЕТОДЫ МУТАГЕНЕЗА И СЕЛЕКЦИИОбычный метод получения мутантов — использование хими¬
ческих веществ, ультрафиолетового и рентгеновского облучений.
Если в естественных экосистемах вероятность образования му¬
тантов в среднем 10“8...10“и на одну клетку, то при исполь¬
зовании мутагенов — 2,5-10~4 мутантов на одну клетку [84].Однако мутагенез является неспецифичным методом. Воз¬
можно одновременное проявление как нужных, так и ненужных
свойств. Чтобы получить штаммы с определенными свойствами,
мутагенез обычно проводят несколько раз.Бактерии с нужными свойствами определяют методом селек¬
ции. При этом клоны единичных клеток получают методом рас¬
сева бактерий на твердые питательные среды, чтобы колонии,
выросшие из одной клетки, были отделены друг от друга.
С помощью селективных сред можно получать штаммы, не
синтезирующие какой-либо метаболит, но синтезирующие его
предшественник. Например, отсутствие синтеза гомосерина у
бактерий обычно приводит к сверхсинтезу аспартата и далее —
лизина. Эти ауксотрофные мутанты нуждаются в несинтезируе-
мых метаболитах. Например, в приведенном примере рост
возможен только при обеспечении в среде необходимых коли¬
честв метионина и треонина, однако возможно накопление ли¬
зина, который не используется бактериями.Ауксотрофы от прототрофов отделяют при культивировании
бактерий в средах, не содержащих ауксотрофных факторов.
При этом растут только прототрофные клетки. Последние
уничтожаются антибиотиками. Пересев нерастущих ауксотроф¬
ных клеток на полноценные среды позволяет отделить ауксо¬
трофные штаммы.Образование мутантов возможно также в естественных
условиях путем возникновения случайных ошибок при считы¬
вании генетического кода (спонтанные мутации). Ошибки про¬
исходят часто при таутомерном перемещении электронов в ос¬
нованиях. При этом возможно изменение спаривания оснований
в молекулах ДНК.Доля мутантов зависит от среды культивирования, удельной
скорости роста клеток, наличия ингибиторов и др. При этом
возможно также образование «молчащих» мутаций, не всегда
проявляющихся фенотипически. При селекции спонтанных му¬
тантов описанными выше методами также возможно получение
продуцентов различных метаболитов. Иногда естественные му¬
тации усиливают искусственными.Образование мутантов при действии искусственных мута¬
генов может быть связано со следующими механизмами:1) изменением оснований в молекулах ДНК и образова¬
нием «точечных» мутаций;
Генетические и физиологические основы регуляции1632) включением дополнительных пар оснований;3) утратой отдельных генов;4) образованием мутантов, связанных с репарацией, т. е.
восстановлением ДНК при их повреждении УФ-облучением
бактерий и др.Частота мутаций указанных типов различна. С брлее вы¬
сокой частотой происходив мутация первого типа, второй тип
наблюдается редко, третий обычно отсутствует. Частота четвер¬
того типа мутаций высока. Некоторые авторы считают их наи¬
более эффективными при мутагенезе.Мутации первого типа обычно получают при использовании
структурных аналогов (антиметаболитов) пуриновых и пирими¬
диновых оснований, например бромурацила, который включа¬
ется в молекулы ДНК. При этом у спирали ДНК появляется
тенденция связывать неподходящих партнеров оснований при
репликации. Аналогичные мутации возможны при действии хи¬
мических веществ, например нитритов. Они обычно дезамини¬
руют аденин, при этом изменяется спаривание оснований в
молекулах Д+iK. Аналогично действует также гидроксиламин.
При ультрафиолетовом и рентгеновском облучении изменяются
пиримидиновые основания.Следовательно, методом мутагенеза могут быть получены
продуценты различных метаболитов. Однако сверхсинтез лю¬
бого продукта, который не используется в анаболических про¬
цессах, должен привести к прекращению функционирования
цепи его синтеза. При осуществлении мутагенеза одновременно
с селекцией штаммов, синтезирующих продукт, проводят селек¬
цию резистентных к продукту штаммов, т. е. синтезирующих
его в отсутствие указанных регуляторных механизмов. Эти му¬
танты получают при использовании структурных аналогов про¬
дуктов. В метаболические процессы аналоги не включаются,
хотя и являются регуляторами метаболизма, поэтому при их
наличии растут только бактерии с поврежденными регулятор¬
ными механизмами. Указанные штаммы одновременно резис¬
тентны как к аналогу, так и к продукту. Данный принцип ис¬
пользуется для получения продуцентов, синтезирующих про¬
дукт в избыточных количествах независимо от его концентрации
в среде.3.1.1.2. ПОЛУЧЕНИЕ БАКТЕРИЙ-СВЕРХПРОДУЦЕНТОВ
ЛАЕТ О ДОМ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИЗначительное повышение синтеза продуктов может быть дос¬
тигнуто при более глубоком и целенаправленном изменении
генома клеток. Данный метод основывается на конструировании
in vitro функционально активных генетических структур,11*
164Глава звведении и стабильном поддержании этой генетической инфор¬
мации в клетках.Ведущим советским ученым-генетиком А. А. Баевым сфор¬
мулированы различные понятия терминов «генетическая инже-
нерия» и «генная инженерия», часто употребляемых как
синонимы. Он считает, что термин «генетическая _ш|жен£рия»
более точно передает суть дела, так как включает все манипу¬
ляции, проведенные с живыми организмами при изменении их
генетических программ, термин «генная инженерия» — только
манипуляции, проведенные с генами [3].Инструментами молекулярного манипулирования при гене¬
тической инженерии являются рестрикционные эндонуклеазы
и лигазы. При действии данных ферментов получают фраг¬
менты ДНК, которые «сшивают» ковалентными связями. Эти
ферменты обычно лишены видовой специфичности, поэтому
можно сочетать гены любого происхождения в избранной по¬
следовательности. Возможно неограниченное межвидовое скре¬
щивание.Как известно, гены получают: 1) выделением т природного
источника; 2) получением ДНК-реплик путем копирования!
мРНК с помощью обратной транскрилтазы; 3) химическим
синтезом. Однако гены определяют только последовательность
полипептидной цепи. Регуляцию репликации и транскрипции
генов в клетках осуществляет так называемый вектор. В каче¬
стве векторов используют циклические молекулы ДНК, способ¬
ные акцептировать чужеродную ДНК и автономно реплициро¬
ваться. Комплекс ДНК и вектора составляет рекомбинантную
ДНК. При этом изолированный и синтезированный ген при¬
обретает способность функционировать в реципиентной клетке.
ДНК без вектора в данных клетках подвергается гидролити¬
ческому расщеплению.Однако репликация и транскрипции рекомбинантных ДНК
in vivo зависят от видовой специфичности реципиентных бак¬
терий. Данный этап в генетической инженерии наиболее слож¬
ный. Например, достигнуто функционирование генов Bacillus
subtilis в Е. coliy — но не наоборот.Рекомбинантные ДНК вводят в клетку хозяина и поддер¬
живают там обычно с помощью плазмид, вирусов и пр. Наи¬
более распространенные векторы — многокопийные плазмиды
с молекулярной массой 3... 10 кб. Векторные плазмиды и ви¬
русы со встроенными чужеродными генами часто называют
гибридными или гимерными [80]. Векторные ДНК после вве¬
дения в клетку способны к автономному существованию и при
последующих делениях реплицируются. При этом возможно
придание бактериям желаемых свойств.Как известно, метод введения генов в клетку с помощью
векторов называют трансформацией, при использовании фа¬
Генетические и физиологические основы регуляции165гов — трансдукцией. Использование вектора обусловливает
возможность его проникновения в реципиентную клетку. После
окончания трансформации и трансдукции клоны с нужными
свойствами отбирают методом селекции.Для придания определенного признака бактериям часто ис¬
пользуют конъюгацию. При этом мутанты получают свойства
родительских клеток. Данный метод основывается на удалении
оболочек бактерий ферментативным методом, слиянии прото¬
пластов и последующей регенерации оболочек. При конъюгации
в клетку переносятся целые органеллы, в том числе большие
плазмиды с молекулярной массой 65-10-6 кб [40]. Данный ме¬
тод пока применяется только при использовании грамположи-
тельных бактерий.Генетические свойства бактерий можно изменять с помощью
коротких фрагментов двойных цепей ДНК (около 200 пар ос¬
нований) — транспозонов. Последние способны «перепрыги¬
вать» из одной части генома в другую, из хромосомы — в плаз¬
миду и т. д. При их включении нуклеотидная последователь¬
ность исходного генома нарушается и информация не
транслируется. Транспозоны обычно переносятся в клетку с
помощью плазмид.Длительное поддержание новых генетических программ у
бактерий зависит часто от условий культивирования. К наи¬
более оптимальным условиям часто относят: культивирование
при низких скоростях протока среды, при пониженных темпе¬
ратурах и т. д. [70].Перспективность использования в генетической инженерии
тех или иных бактерий определяет не только технические воз¬
можности манипуляций, но и физиологические свойства бакте¬
рий. В последнее время проведено множество работ по введе¬
нию генов именно в коринебактерии. На этой основе созданы
продуценты почти всех аминокислот [32]. Преимущество дан¬
ных бактерий заключается в их подвижном метаболизме и
способности роста в вариабельных условиях.3.1.1.3. СИНТЕЗ ПРОДУКТОВ У АУКСОТРОФОВ И МУТАНТОВ
С ИЗМЕНЕННОЙ ГЕНЕТИЧЕСКОЙ РЕГУЛЯЦИЕЙОсновной принцип сверхсинтеза аминокислот, как уже указы¬
валось, — создание ауксотрофности обычно по нескольким
аминокислотам, а также резистентности к синтезируемому про¬
дукту. Этим методом получено множество продуцентов амино¬
кислот как советскими, так и зарубежными исследователями.
Ведущая роль в данном направлении принадлежит японским
ученым [32].
Мутанты с ограниченным функционированием ферментов
синтеза определенных аминокислот семейства аспарагиновой
кислоты синтезируют лизин, треонин, изолейцин. Продуцентами
лизина обычно являются бактерии с дефектным синтезом фер¬
ментов, участвующих в синтезе метионина, треонина и изолей¬
цина, — гомосериндегидрогеназы и гомосеринкиназы.При получении штаммов — продуцентов различных веществ
большое внимание уделяют улучшению регуляторных свойств
бактерий (уменьшение чувствительности бактерий к конечному
продукту, снижение ингибирования или репрессии синтеза
предшественников и др.).На примере продуцентов лизина было показано, что штаммы,
нечувствительные к конечному продукту, получают селекцией
при наличии аналогов лизина. Однако синтез лизина регули¬
руется на уровне аспартаткиназы лизином+треонином. Совер¬
шенствование свойств продуцентов требует создания нечувстви¬
тельности бактерий к мультивалентному ингибированию этими
аминокислотами. Японским ученым удалось снизить чувстви¬
тельность аспартаткиназы к лизину и треонину у Brevibacterium
lactofermentum в 150 раз [90].Увеличение синтеза аминокислот также достигается мето¬
дами генетической инженерии. При этом часто вводят гены,
лимитирующие синтез продукта. В течение ряда лет интенсивно
разрабатываются методы получения векторов для увеличения
синтеза аминокислот коринебактериями [36]. В качестве векто¬
ров применяют фаги, плазмиды, резистентные к антибиотикам,
и криптические плазмиды с большим потенциально возможным
числом копий. Для рестрикции используют ДНК-азы из уме¬
ренных фагов. Разрабатываются методы конъюгации этих
бактерий [32].Репрессию синтеза конечным продуктом часто уменьшают
путем введения генов из других бактерий, нечувствительных к
этому продукту. Например, при клонировании гена дегидро-
пиколинат-синтазы из Е. coli достигнуто снижение репрессии
этого фермента лизином в клетках Br. lactofermentum [39].Скорость синтеза лизина увеличена трансформацией генов
аспартатполуальдегиддегидрогеназы и аспартатаминотрансфе-
разы из Е. coli с помощью плазмид в коринебактерий, а
также улучшением свойств бактерий методом конъюгации
[31, 47, 71].Методы генетической инженерии используют также для
увеличения продуктивности синтеза треонина коринебактериями
[7]. Методом трансдукции достигнута нечувствительность ас¬
партаткиназы и гомосериндегидрогеназы у продуцентов трео¬
нина [67]. При трансформации треонинового гена из •£. coli в
коринебактерии продуктивность синтеза треонина увеличива¬
ется в 4 раза [51]. Методом трансдукции получены также
Генетические и физиологические Основы регуляции167продуценты треонина из бактерий Serratia marcescens с нечув¬
ствительной к отрицательной регуляции аспартаткиназой и
гомосериндегидрогеназой ,[67].Методом генетической инженерии получены штаммы кори¬
небактерий, синтезирующие треонин в количестве до 55 г/лг
гистидин — 20, пролин — 40 г/л и др. .[32].Если синтез аминокислот часто улучшается клонированием
генов в коринебактерии, то введение триптофанового гена из
Br. lactofermentum в Е. coli позволяет значительно улучшить
свойства продуцентов триптофана >[69].В последнее время разрабатываются методы получения про¬
дуцентов различных аминокислот из бактерий Zymomonas то-
bilis. На их основе получены ауксотрофы, синтезирующие
триптофан [44], аланин [91] и др. Большое внимание к этим
бактериям можно объяснить чрезвычайно высокими скоростями
потребления субстратов и простотой культивирования.Следовательно, сверхсинтез продуктов бактериями может
быть достигнут нарушением обычных биосинтетических цепей
в бактериях и получением ауксотрофных мутантов, снижением
генетического контроля конечными продуктами. В то же время
продуктивность процесса может быть увеличена повышением
синтеза предшественников. При этом большое значение имеет
сбалансирование потоков субстратов по необходимым метабо¬
лическим путям. Ранее были рассмотрены пути регуляции про¬
дуктивности процессов синтеза лизина у коринебактерий изме¬
нением их метаболизма условиями культивирования. Однако
повышение значений Гр, Ур/s1 и других показателей при био¬
синтезе лизина может быть достигнуто также изменением гене¬
тической регуляции путей катаболизма источников углерода.
Синтез продукта бактерий часто снижается при катаболитной
репрессии, переключении бактерий на повышенную удельную
скорость роста клеток или значительном снижении роста.
В последнем случае механизмом строгой регуляции выключа¬
ется как синтез РНК, так и регуляторные ферменты метаболи¬
ческих путей, необходимые для синтеза лизина.Для улучшения регуляторных свойств различных продуцен¬
тов представляет интерес получение мутантов с измененной
генетической регуляцией: /1) с дефектами в промоторном гене, т. е. не вырабатыва¬
ющих репрессор или вырабатывающих репрессор, неспособный
связываться с оператором;2) нечувствительных к катаболитной репрессии;3) с конститутивным синтезом катаболических и анаболи¬
ческих ферментов;4) не подчиняющихся механизму строгой регуляции и др.Было сделано много попыток уменьшить катаболитнуюрепрессию синтеза различных ферментов глюкозой. Получены
168Глава 3мутанты со сниженной чувствительностью циграт-синтазы к
NADH (например, цитрат-синтаза у Е. coli, нечувствительная к
NADH в концентрации примерно 2 мМ) [93]. При этом у му¬
тантов изменялись молекулярная масса фермента, величина Кт
к субстрату. Полученные мутанты были способны к сверхсин¬
тезу глутамата.Приведем несколько примеров изменения генетической
регуляции у продуцентов лизина группы коринебактерий. Увели¬
чение синтеза продукта этими бактериями достигнуто у мутан¬
тов, дефектных по цитрат-синтазе {84], пируваткиназе и пиру-
ватдегидрогеназе. Очевидно, были получены мутанты с изме¬
ненной скоростью продуцирования АТР. Однако нельзя оценить
однозначно положительную или отрицательную роль изменения
активности определенных ферментов. Если при снижении ско¬
рости синтеза АТР у штаммов с низкой удельной скоростью
роста- увеличивается активность окислительного метаболизма
глюкозы и синтеза лизина, то у штаммов с высокой удельной
скоростью роста эффект может быть обратным. В связи с этим
при изменении синтеза ферментов у бактерий на уровне генома
необходимо иметь данные о физиолого-биохимических свойствах
конкретного продуцента.Методом мутагенеза и последующей селекцией штаммов Вг.
flavum получены мутанты с измененной биохимической регу¬
ляцией. Определенные преимущества при биосинтезе лизина
представляет штамм Br. flavum RC 115. Его основные отличия
от штамма Br. flavum 22ЛД:1) пониженные значения qs макс и одновременно небольшое
повышение скорости потребления сахаров в условиях обратного
эффекта Пастера;2) высокая скорость индукции ферментов ЦТК;3) увеличенное соотношение активности фосфоенолпируват-
карбоксилазы и аконитазы (у Br. flavum 22ЛД в фазе замед¬
ленного роста — 0,7 : 1; у Вг. flavum RC 115 — 1,2 : 1);4) повышенное значение при биосинтезе лизина
(у Br. flavum 22ЛД — 0,39 г/г; у Br. flavum RC 115 —0,49 г/г; qs при этом 0,24 и 0,15 г/ч на 1 г клеток).Использование бактерий Br. flavum RC 115 наиболее эф¬
фективно в средах с повышенными концентрациями сахаров,
в условиях колебания интенсивности аэрации и др. Образова¬
ние побочных продуктов катаболизма глюкозы этим штаммом
более низкое, чем у штамма Br. flavum 22ЛД.Методом многократного мутагенеза и селекции получен
также штамм Br. flavum V 5. Если увеличение конверсии саха¬
ров в лизин у растущих клеток Br. flavum 22ЛД и Br. flavum
RC 115 достигается индукцией ферментов ЦТК (например, ако¬
нитазы) при снижении скорости потребления сахаров клетками,
Генетические и физиологические основы регуляции16»Рис. 3.1. Изменение показателей физиологической активности (грт
X qp, Ур/s) при культивировании Br. flavum 22ЛД (/) к
Br. flavum V 5 (2) в условиях непрерывного культивирования
в пределах скорости протока среды D от 0,05 до 0,2 ч”1то у штамма Br. flavum V 5 Ур%п возрастает при высоких
значениях скоростей потребления сахаров клетками. Продук¬
тивность синтеза лизина, достигнутая при использовании
штамма Br. flavum V 5, значительно выше по сравнению с та¬
ковой при использовании Br. flavum 22ЛД и Br. flavum RC 115,
Преимущества штамма Br. flavum V 5 проявляются в усло¬
виях непрерывного культивирования. При повышении скорости
протока среды у штамма Br. flavum 22ЛД снижаются содер¬
жание биомассы (10... 15 г/л) и конверсия сахаров в лизин
(рис. 3.1). Следовательно, продуктивность процесса по лизину,
достигнутая при культивировании Br. flavum 22ЛД, 0,8...
...0,9 г/(л-ч). В то же время содержание биомассы при культи¬
вировании Br. flavum V 5 достигает 20... 30 г/л. Значение
Y УД” меняется в зависимости от скорости протока среды, про¬
дуктивность процесса составляет 2,3... 3,0 г/(л*ч) (табл. 3.1).
У штамма Br. flavum V 5 активность глюкозо-6-фосфат-дегид-
рогеназы увеличена почти в 16 раз (рис. 3.2), что, очевидно,
связано с повышенной удельной скоростью роста этих
170Глава 31 мг белка) у Br. flavum 22ЛД (1) и Br. flavum V 5 (2) в
условиях непрерывного культивирования./* и 2* — ацетил-СоА-зависимая фосфоенолпируват-карбоксилаза; 2** —
ацетил-СоА-независимая фосфоенолпируват-карбоксилазабактерий. Активность аконитазы и фосфоенолпируват-карбокси-
лазы у Br. flavum V 5 поддерживается на высоком уровне даже
при повышенных значениях D.В разделе 2.5 обсуждались причины снижения активностиУэкспp/s при повышении скорости протока среды у
Br. flavum 22ЛД. Было показано, что возможной причиной
этого является сравнительно низкая скорость синтеза РНК.
Сопоставляя данные закономерностей роста и функционирова¬
ния ферментов у представленных штаммов, можно предпола¬
гать, что бактерии Br. flavum V 5 имеют более высокую удель¬
ную скорость роста и, очевидно, синтеза РНК. Это свойство
позволяет культивировать бактерии при повышенных скоростях
протока среды без выраженных признаков эффекта Кребтри и
снижения конверсии сахаров в лизин.Особым преимуществом бактерий Br. flavum V 5 является
наличие ацетил-СоА-независимой фосфоенолпируват-карбокси-
Генетические и физиологические основы регуляции17ГТаблица 3.1. Физиологическая активность Br. flavum V 5 в процессе
двухступенчатого непрерывного культивирования
(D = 0,1 ч-1 на каждой ступени)*СтупеньЛизин,г/лЯ SЯрv эксп
YP/S„экспYx/sГр, г/(л • ч)г/(ч[ • г)г/г1 24 0,3 0,11 0,38 0,50 2,42 . 46 0,27 0,08 0,30 0,15 2,2* Работа проведена совместно с М. Э. Дунц.Таблица 3.2. Активность ферментов (катал *10-11 на 1 мг белка|некоторых штаммов Br. flavum (фаза замедленного роста
в процессе периодического культивирования)Штаммфосфо-Фосфоенолпируват-карбоксилазаАкони¬а-Кето-глутарат-дегидро-геназаГлюкозо-6-фосфат-дегидро-геназафрукто-кнназаацетил-СоА-за-висимаяацетиль-СоА-неза-виснмаятазаBr. flavum
22ЛД41223001442053Br. flavum
V 528963225922022788лазы. У других изученных нами штаммов активность этого фер¬
мента зависит от наличия ацетил-CoA (табл. 3.2). Это позво¬
ляет бактериям сохранить повышенную активность фосфоенол-
пируват-карбоксилазы и высокую скорость синтеза лизина при
ингибировании или репрессии регуляторных ферментов ЦТК.
Этим свойством, очевидно, объясняется достижение относи¬
тельно высокой конверсии субстрата в лизин при удельных
скоростях роста клеток, близких к максимальным. У Br. flavum
22ЛД и Br. flavum RC 115 эти максимумы четко сдвинуты.3.1.2. ПОЛУЧЕНИЕ ШТАММОВ, УСТОЙЧИВЫХ
К ФАГАМ И БАКТЕРИЦИДНЫМ ВЕЩЕСТВАМКак известно, одним из существенных факторов, снижающих
продуктивность бактериального синтеза, является лизис клеток
при действии бактериофагов. Последние в зависимости от их
172Глава 3взаимоотношения с клеткой-хозяином могут быть разделены на
вирулентные и умеренные фаги. Мультипликация первых в клет¬
ках и их лизис особенно выражены у клеток с более высокой
удельной скоростью роста. Следовательно, наиболее критиче¬
ским периодом фаговой инфекции является логарифмическая
фаза роста.Умеренные фаги заражают бактерии, но не размножаются
в клетках автономно и не вызывают лизис. Фаговая ДНК при
этом интегрируется в ДНК клетки-хозяина в виде профага и
репродуцируется одновременно с хромосомальной ДНК- Бак¬
терии, содержащие и реплицирующие профаг, обозначают как
лизогенные [64]. Они приобретают иммунитет к заражению
теми фагами, которые присутствуют в них в виде профага.
Этот иммунитет обусловлен наличием особого цитоплазмати¬
ческого белка-репрессора, предотвращающего размножение ве¬
гетативного фага. Этот же репрессор препятствует обратному
переходу профага в вегетативное состояние и подавляет синтез
фаговых белков.Обычно профаг может образовать истинный фаг с помощью
механизма индукции, при котором, очевидно, устраняется или
инактивируется репрессор. На образование и высвобождение
инфекционного фага, который вызывает лизис клеток, влияют
ультрафиолетовое облучение, хелатообразующие агенты, по-
верхностно-активные вещества и антибиотики >[64]. Литератур¬
ные данные по этому вопросу представлены также в работе
[1]. Следовательно, одним из путей предотвращения фаголи-
зиса бактерий можно считать оптимизацию условий роста.
Другой путь — получение лизогенных бактерий при многократ¬
ных пассажах совместно с фагом. Данным методом получены
фагорезистентные варианты продуцентов аспарагиназы Erwinia
carotovora [i].Снижение репродукции фагов может быть достигнуто хими¬
ческими веществами (я-аминобензойной кислотой, акридиновым
оранжевым и др.), изменяющими структуру ДНК. При этом
лизогенные культуры могут освободиться от профагов [64].Более радикальный метод увеличения фагоустойчивости —
получение резистентных штаммов. Устойчивость бактерий к оп¬
ределенному фагу обычно достигается в результате мутаций,
ведущих к утрате способности синтезировать фагорецепторное
вещество. Например, резистентность бактерий к фагу в неко¬
торых случаях объясняется утратой галактозы, входящей в
состав капсулярного полисахарида исходного штамма [50].
Однако в некоторых случаях свойство фагорезистентности у
мутантов может проявляться только через несколько генера¬
ций [64].Большое внимание уделяется получению фагорезистентных
бактерий, продуцирующих лизин [10, 19]. При этом невоз¬
Генетические и физиологические основы регуляции173можно получить клоны, нечувствительные одновременно ко всем
фагам [10]. Это позволяет утверждать, что каждый фаг имеет
определенное рецепторное место в стенке бактерий.Следует отметить, что при получении свойства фагорезис-
тентности могут изменяться физиолого-биохимические свойства
бактерий. При многократных пассажах бактерий с фагами это
можно объяснить изменением информации, заложенной в ге¬
номе бактерий, по аналогии с трансдукцией. Приобретение свой¬
ства фагорезистентности часто приводит к изменению скорости
транспорта сахаров, витаминов и др. в клетку. Это свидетель¬
ствует о том, что фагорецепторные участки выполняют важную
функцию при транспорте веществ в клетку. При исследовании
свойств фагоустойчивых клонов Erwinia carotovora показано,
что некоторые из них приобретали свойство использовать дру¬
гие сахара в качестве единственного источника углерода, у не¬
которых штаммов наблюдались изменения активности фермен¬
тов энергетического метаболизма бактерий [1]. После получе¬
ния фагоустойчивых клонов необходимо проверить их биосин¬
тетическую активность, а также изучить изменение свойств ре¬
гуляции метаболизма.В популяции бактерий часто наблюдается также антагонизм
между разными представителями даже одного вида бактерий.
При этом возможно снижение удельной скорости роста, а также
потеря жизнеспособности одних бактерий в присутствии других.
Показано, что ингибирующее действие оказывают специфиче¬
ские белки — бактериоцины. Их продуцирование установлено
как у грамположительных, так и у грамотрицательных бакте¬
рий. Синтез бактериоцинов обычно кодирует ДНК особых
плазмид — бактериоциногенный фактор. Обозначение бакте¬
риоцины получают от родового или видового названия микро¬
организма, синтезирующего соответствующий бактериоцин.
Наиболее известными и широко описанными являются
бактериоцины, продуцируемые Е. coli и известные под назва¬
нием «колицины». Синтез бактериоцинов (или каротовороцинов)
показан также у продуцентов аспарагиназы Е. carotovora ![1].
Свойство бактериоциногенности у этих бактерий не приводит
к снижению аспарагиназной активности. В то же время регу¬
ляторное действие каротовороцинов на синтез фермента у чув¬
ствительных клеток Е. carotovora может быть различным; в
некоторых случаях показано сохранение биосинтетической ак¬
тивности клеток, в некоторых — она снижается. Авторы ра¬
боты [1] считают, что пока трудно делать вывод о корреля¬
тивной связи аспарагиназной активности и бактериоциногенно¬
сти у Е. carotovora. Синтез бактериоцинов у этих бактерий
зависит как от среды культивирования, так и от физиологиче¬
ского состава. Ингибирующее рост действие бактериоциногенных
клеток на чувствительные в 2—3 раза увеличивается в стацно-
174Глава 3нарной фазе роста. Это может быть следствием усиления син¬
теза каротовороцинов и увеличения проницаемости клеток.Регуляторное действие бактериодинов на чувствительные
клетки может быть объяснено: 1) ингибированием синтеза
нуклеиновых кислот, протеинов, полисахаридов и пр.; 2) сни¬
жением скорости транспорта сахаров, аминокислот, ионов
(особенно К+) и др.; 3) изменением скорости окислительного
фосфорилирования в клетках.Синтез бактериодинов (или бревицинов) установлен также
у продуцентов лизина Вт. flavum. Их выделение из клеток
достигается при действии митомицина С в концентрации
1 мкг/мл. Наивысшая бревициногенная активность клеток дос¬
тигается в стационарной фазе роста. Нами исследовано дейст¬
вие синтезированных клетками бревицинов на чувствительные
клетки Вт. flavum. Концентрационная зависимость регулятор¬
ного действия бревицинов на транспорт глюкозы напоминает
таковую при регуляторном действии ингибиторов окислитель¬
ного фосфорилирования (см. табл. 2.14): при низких концен¬
трациях бактериоцина скорость транспорта глюкозы повыша¬
ется, при высоких — снижается. Это дает основание предпола¬
гать, что бактериоцины действуют на окислительное фосфори¬
лирование клеток. В некоторых случаях этим, очевидно, можно
объяснить их различное регуляторное воздействие на синтез
продуктов в зависимости от дозы бактериоцинов. Ранее было
отмечено, что ингибиторы окислительного фосфорилирования у
коринебактерий, характеризующихся функционированием ЦТК
при низких концентрациях, могут стимулировать синтез лизина
и увеличивать конверсию источников углерода в лизин.Можно представить, что если фаг и бактериоцин имеют
общий рецептор связывания в клеточной стенке, то свойство
фагоустойчивости одновременно приводит к бактериоциноген-
ной устойчивости '[1]. Следовательно, успешное проведение
технологических процессов часто может быть достигнуто только
при получении фаг- и бактериоцинрезистентных штаммов.3.1.3. СТАБИЛЬНОСТЬ ГЕНЕТИЧЕСКИХ СВОЙСТВ
МУТАНТОВ И РЕКОМБИНАНТОВОдно из важных условий достижения высокой продуктивности
технологического процесса — стабильность генетических
свойств используемых мутантов и рекомбинантов в процессе
ферментации. Часто возможен обратный процесс — полученные
сверхпродуценты путем обратных мутаций утрачивают зало¬
женную в геноме информацию. При этом возможно восстанов¬
ление свойств дикого штамма. Если при обратных мутациях
четко восстанавливаются свойства исходного штамма, обратные
Генетические и физиологические основы регуляции175мутанты называют «ревертантами». Вероятность их образова¬
ния обычно равна одному ревертанту на 106 клеток. Коэффи¬
циент реверсии означает число ревертантов на одну клетку за
одну генерацию. Его величина у продуцентов лизина Br. flavum
относительно постоянная и колеблется в пределах 2* 10“5... 10~6
ревертантов на клетку в течение одной генерации. Некоторое
увеличение прототрофных клеток наблюдается в стационарной
фазе в процессе периодического культивирования бактерий.Однако не всегда по изменению количества прототрофных
клеток можно судить о величине реверсии ауксотрофов. Иногда
наблюдается резкое повышение числа прототрофных клеток,
превышающих теоретически ожидаемую величину (рассчитан¬
ную на основании указанного коэффициента реверсии и сред¬
ней скорости роста прототрофа). Увеличение доли прототроф¬
ных клеток может быть связано с селективными преимущест¬
вами их роста перед ауксотрофными. Таким условием при
культивировании коринебактерий является снижение концен¬
трации треонина в среде. В то же время при наличии повышен¬
ных концентраций треонина скорость роста прототрофов отно¬
сительно невелика, что объясняется мультивалентным ингиби¬
рованием аспартаткиназы лизином+треонином. Способность
прототрофных клеток синтезировать обе эти аминокислоты яв¬
ляется фактором, вызывающим более заметное снижение
удельной скорости роста этих бактерий по сравнению с ауксо-
трофами.Показано, что концентрации ингибиторов (лизина и трео¬
нина), снижающие удельную скорость роста прототрофов
вдвое, равны 3 г/л лизина и 300 мг/л треонина. Следовательно,
повышение концентрации треонина в среде создает селективные
цреимущества для роста ауксотрофных форм. Из сказанного
следует, что один из способов сохранения гомогенности ауксо¬
трофных бактерий — создание селективных преимуществ их
роста перед прототрофными.Нестабильность генетической информации особенно выра¬
жена при использовании рекомбинантных бактерий. При куль¬
тивировании рекомбинантных клеток Е. coli, по некоторым
данным, через 36 ч только 10% клеток содержат плазмиды.
Остальные элиминируются делециями в зоне генов, определяю¬
щих сверхсинтез продуктов [43].3.1.4. ПЕРСПЕКТИВЫ ПОВЫШЕНИЯ СИНТЕЗА
ПРОДУКТОВ МЕТОДОМ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИМетодами генетической инженерии можно радикально повы¬
сить продуктивность процесса, снизить себестоимость получения
продуктов на определенном субстрате или при использований
176Глава Sболее доступных и дешевых субстратов. При этом перспективны
процессы, в которых одновременно возможна реализация как
получения продукта, так и очистки окружающей среды.Основные проблемы при получении генетически сконструиро¬
ванных бактерий:1) генетическая нестабильность трансформированных генов;2) недостаточная разработка генетической техники для изо¬
лирования генов и т. д.Если методы генетической инженерии на Е. coli разработаны
относительно хорошо, то для других бактерий эти методы пока
используются в значительно меньшей степени. Тем не менее
у бактерий Е. coli выявляются значительные ограничения при¬
менения этих методов в вариабельных условиях. Выше было
показано, что более перспективны для синтеза аминокислот и
других продуктов коринебактерии, что связано с их подвижным
метаболизмом и способностью роста в вариабельных условиях.
Поэтому понятно то большое внимание, которое уделяется этим
бактериям как при разработке методов генетической инжене¬
рии, так и при получении новых сверхпродуцентов из бактерий
данной группы [32]. Использование коринебактерий для полу¬
чения новых продуцентов облегчает возможность функциониро¬
вания генов Е. coli в данных бактериях, что объясняется сход¬
ством промоторных генов у обеих бактерий [42].Перспективными являются также работы, связанные с кон¬
струированием бактерий, способных использовать различные
субстраты, особенно различные токсические отходы химической
промышленности. При этом перспективно использование бакте¬
рий рода Pseudomonas.Спектр используемых субстратов у коринебактерий относи¬
тельно ограничен. Поэтому интерес представляют работы па
конструированию бактерий этой группы, содержащих а-амилаз-
ный ген [79], получению термостабильных штаммов и др. По¬
казана также возможность использования коринебактерий для
продуцирования животных белков [42].3.2. ФИЗИОЛОГИЧЕСКАЯ
РЕГУЛЯЦИЯ БАКТЕРИАЛЬНОГО СИНТЕЗАПоведение популяции микроорганизмов является результатом
взаимодействия внутриклеточно расположенных биохимических
систем с окружающей средой. Экспрессия генетической инфор¬
мации, закодированной в нуклеиновых кислотах, реализуется
посредством изменения количественного содержания и качест¬
венного состава ферментов и их биохимической активности.
Активность ферментов регулируется множеством внутриклеточ¬
Генетические и физиологические основы регуляции177ных контрольных механизмов, но в значительной мере зависит
также от состояния физико-химических параметров вне
клетки — того, что мы обычно объединяем термином «внешние
условия среды».Как правило, не существует однозначной зависимости между
изменением какого-то параметра среды и желаемой биосинтети¬
ческой активностью микроорганизмов, что позволило бы четко
управлять метаболизмом путем создания определенных внеш¬
них условий. Ситуация осложняется несколькими причинами.
Во-первых, изменение одного внешнего параметра сказывается
и на других. Например, в зависимости от увеличения или
уменьшения pH меняется осмотическое давление, активность'
воды, растворимость веществ, особенно концентрация С02. Из¬
менение температуры оказывает влияние на вязкость, раство¬
римость и диффузию веществ. Практически невозможно экспе¬
риментально реализовать изменение только одного параметра
среды. Все рассуждения о влиянии температуры, pH, р02, рС02,
еН и пр. на жизнедеятельность микроорганизмов с этой точки
зрения являются упрощением действительной ситуации.Приведем только один пример, иллюстрирующий сказанное
выше. Одним из важнейших параметров среды, определяющих
жизнедеятельность микроорганизмов, является концентрация
растворенного в среде кислорода. В процессе культивирования
микроорганизмов этот параметр контролируют по парциаль¬
ному давлению растворенного кислорода — р02. Физиологам
известно, что реакция микроорганизмов различается в зависи¬
мости от того, каким образом достигнуто данное значение р02:
увеличением объема аэрируемого воздуха, повышением концен¬
трации 02 в аэрируемой газовой смеси или увеличением час¬
тоты вращения мешалки. Пренебрежение сопутствующим эф¬
фектом в подобном случае дает неполную или даже неверную’
информацию об изучаемом явлении.Во-вторых, ответная реакция микроорганизмов на опреде¬
ленное внешнее воздействие зависит от вида микроорганизма,
состояния культуры, среды — того, что подразумевается под
физиологическим состоянием культуры i[14, 95].В физиологических исследованиях доминируют два подхода.
Первый: изучают влияние какого-то отдельного фактора, описы¬
вают и анализируют наблюдаемые эффекты. В этом подходе
важно правильно идентифицировать действующий фактор
[49, 95]. В большинстве публикаций, посвященных физиологии
микроорганизмов, придерживаются этого принципа и анализи¬
руют влияние традиционных параметров — температуры, pH,
еН, р02 и т. д. — на жизнедеятельность микроорганизмов. Дру¬
гой подход физиологических исследований базируется на
стремлении учитывать состояние популяции и на этой основе12 — 361
178Глава 3обобщать реакцию микроорганизмов на определенные внешние
воздействия. В этом плане достижения физиологии более скром¬
ные и, по нашему мнению, являются во многом «узким» местом.3.2.1. МЕХАНИЗМЫ ОТВЕТНОЙ РЕАКЦИИ ПОПУЛЯЦИИ
НА ИЗМЕНЕНИЯ СРЕДЫВ природных экосистемах бактерии подвержены различным
влияниям, поэтому в ходе эволюции выработались механизмы,
позволяющие реагировать на изменения окружающей среды и
приспособиться к ним. Ответная реакция популяции складыва¬
ется из действия следующих основных механизмов.1. Изменение физических и химических параметров среды
(например, температуры, концентрации веществ) непосредст¬
венно сказывается на скорости биохимических реакций.2. Быстрая ответная реакция популяции обеспечивается бла¬
годаря изменению активности ферментов под влиянием внеш¬
них условий. Эффекторами механизмов, регулирующих актив¬
ность ферментативных реакций, могут быть компоненты внеш¬
ней среды — субстраты, кислород, ионы водорода, ингибиторы
и пр.3. Наибольшее приспособление бактерий к внешним усло¬
виям достигается благодаря индукции и репрессии синтеза
ферментов: включается синтез нужных в данных условиях
ферментов и выключается синтез ненужных.4. Медленные адаптационные перестройки популяции свя¬
заны с изменением генотипа и селекцией новой, более приспо¬
собленной формы. Скорость адаптационной ответной реакции
зависит от частоты мутаций и селекционного давления. Такие
перестройки популяции проходят в течение нескольких генера¬
ций. Способность к адаптационным перестройкам увеличива¬
ется при использовании генетической информации, закодиро¬
ванной в плазмидах. Бактерии рода Pseudomonas, содержащие
много плазмид, характеризуются более широким спектром ас¬
симилируемых субстратов. Это свойство широко используют в
практических целях для создания плазмидных штаммов
Pseudomonas, способных ассимилировать или трансформировать
трудноутилизируемые органические соединения.5. У многих микроорганизмов, включая бактерии, в зависи¬
мости от условий среды наблюдаются изменения морфологии
клеток: образование капсул и спор в неблагоприятных для
роста условиях. Достаточно распространенным явлением можно
считать изменение отношения поверхности клетки к ее объему
[63]. Увеличение этого отношения способствует более быстрому
достижению потока любого вещества вне клетки к любой точке
внутри нее.
Генетические и физиологические основы регуляции179Наиболее распространенным способом увеличения поверх¬
ности бактериальной клетки является образование нитчатых
форм. Десятикратное увеличение длины клетки приводит к уве¬
личению отношения поверхности к объему в 1,68 раза по
сравнению со сферической формой [63]. По-видимому, увеличе¬
ние этого отношения облегчает обменные процессы в условиях
с очень низкой концентрацией субстрата. В связи с этим нит¬
чатые и пластинчатые формы особенно характерны для олиго-
трофных бактерий [78]. Известны примеры, когда и другие
неблагоприятные условия приводят к образованию нитчатых
форм бактерий. Например, культура Zymotnonas mobilis пре¬
терпевает морфологические изменения, превращаясь в нитчатую
форму при повышении температуры до 36 °С (близкой к кри¬
тической) [45].6. Малоисследованной и поэтому дискуссионной является
проблема, в какой мере бактерии обладают сенсорной функ¬
цией. Имеются наблюдения и высказаны предположения, что
бактерии «чувствуют» концентрацию некоторых ионов, органи¬
ческих веществ, биомассы и определенным образом реагируют
на эти изменения. Наиболее изучена сенсорная функция бак¬
терий в связи с фото-, хемо- и другими видами тактильных
активностей. Механизмы, с помощью которых бактерии реаги¬
руют на внешние сигналы, принципиально отличаются от тако¬
вых у эукариот. У бактерий не найдены гуанин-нуклеотидчувст-
вительные белки (G-белки), не обнаружен фосфатидилинози-
тольный цикл, нет четких доказательств того, что
аденилатциклаза взаимодействует с клеточными рецепторами
[58]. Механизм бактериального восприятия внешнего сигнала
и последующей реакции связан с метилированием остатков глут¬
аминовой кислоты в мембранных рецепторных белках [86].
Однако мутанты, лишенные метилирующих и деметилирующих
ферментов, в меньшей степени сохраняют способность передви¬
гаться в ответ на изменение концентрации аттрактантов и ре¬
пеллентов. Можно заключить, что механизмы рецепции внешних
сигналов и быстрой адаптации у бактерий изучены пока не¬
достаточно.Предполагают, что в осуществлении сенсорной функции у
бактерий принимают участие термочувствительные эффекторы,
специфические фосфорилированные нуклеотиды [65], системы
экспрессии генов и транспорта, чувствительные к осмотиче¬
скому давлению [76].12*
180Глава 33.2.2. ХАРАКТЕРИСТИКИ ФИЗИОЛОГИЧЕСКОГО
СОСТОЯНИЯ КУЛЬТУРЫМетаболическая активность микробной клетки определяется
функционированием внутриклеточных биохимических систем,
которые изменяют свою активность в зависимости от физичес-
ского и физико-химического состояния среды. В идеале для
характеристики состояния системы клетка—среда необходимо
учитывать всю временную и пространственную шкалу процес¬
сов, влияющих на жизнедеятельность клетки. Это чрезвычайно
сложная задача. Например, продолжительность диффузии, из¬
менения активности ферментативных реакций, с одной стороны,
и изменения структуры популяции, с другой, различаются при¬
близительно в 1010 раз. При изучении факторов внешней среды
обычно ограничиваются характеристикой микроокружения бак¬
териальной клетки. Влияние суточных, сезонных ритмов, вели¬
чины земного притяжения, космического излучения и других
факторов макроокружения в физиологии микроорганизмов учи¬
тывается пока недостаточно. Для характеристики физиологи¬
ческого состояния культуры микроорганизмов пользуются
обобщениями и упрощениями.З.2.2.1. РАСТУЩИЕ И НЕРАСТУЩИЕ КУЛЬТУРЫ.РАЗОБЩЕННЫЙ РОСТОтношение к росту является наиболее важной характеристикой
физиологического состояния культуры. В дискуссии, проведен¬
ной в журнале «Микробиология» по этому поводу, И. Л. Ра-
ботнова [14] предложила нормальным физиологическим состо¬
янием считать неограниченный рост культуры. Все другие
состояния, когда рост культуры замедлен по сравнению с мак¬
симально возможным, следует считать стрессовыми [16, 17].
Экспоненциальный рост культуры происходит в постоянных ус¬
ловиях окружающей среды и с неизменным составом биомассы.
Нарушение одного из этих условий приводит к замедлению ско¬
рости роста культуры. Быстрое увеличение клеточной массы,
происходящее в результате размножения клеток, является ос¬
новным свойством, на котором базируются многие биотехно¬
логии.Как известно, наиболее быстро размножаются бактерии.
Так, максимальная удельная скорость роста культуры Е. coli
достигает 2,6 ч-1, что соответствует удвоению числа клеток за
16 мин. Рост культуры с максимальной скоростью, по-види¬
мому, действительно характеризуется особым состоянием. Од¬
нако у исследователей в определении этого состояния нет еди¬
ной точки зрения. Часто говорят о сбалансированном метабо-
Генетические и физиологические основы регуляции181лизме. Под ним, очевидно, следует понимать стационарное
состояние, при котором внутриклеточная концентрация всех
компонентов постоянна во времени [60]. Мы считаем, что этому
понятию можно придать более наглядную трактовку. Под сба¬
лансированностью метаболизма следует понимать равенство
основных потоков (углерода, восстановительных эквивалентов
и энергии в виде АТР) на этапах катаболизма, промежуточного
обмена и анаболизма.Сбалансированность метаболизма означает не просто равен¬
ство скоростей катаболизма и анаболизма. При неизменной
скорости потребления субстрата из-за изменения соотношения
между альтернативными путями катаболизма у многих микро¬
организмов меняется выход АТР и NAD(P)H. Альтернативные
пути катаболизма с различными выходами АТР и NAD(P)H
обнаружены как у аэробных, так и у анаэробных микроорга¬
низмов. Все больше накапливается данных о том, что одним
из главных принципов регуляции метаболизма микроорганиз¬
мов является стремление поддерживать баланс между потоками
углерода, АТР, восстановительных эквивалентов. Сбалансиро¬
ванность метаболизма позволяет длительное время сохранять
активность процессов жизнедеятельности микроорганизмов.Несбалансированность метаболизма может быть только
кратковременной, во время так называемых переходных про¬
цессов. Изучению последних придается большое значение как
в теоретическом, так и в прикладном аспектах [13].Как уже указывалось выше, у микроорганизмов характерно
наличие альтернативных и параллельно функционирующих пу¬
тей катаболизма и биосинтеза промежуточных метаболитов,
различающихся выходом или потребностями АТР и NAD(P)H,
поэтому состояний сбалансированного метаболизма много. Из
них важно выделить состояние «идеальной» сбалансированно¬
сти метаболизма, когда АТР, NAD(P)H и другие метаболиты
образуются в строгом соответствии с нуждами клетки и с
максимальным выходом. Такое состояние следует рассматри¬
вать как полностью сопряженный метаболизм [9, 17].В силу разных причин соотношение между потоками в
клетке может изменяться. Равновесие между потоками тогда
поддерживается либо за счет уменьшения выхода АТР и
NAD(P)H в путях катаболизма, либо утилизацией их избытка
в так называемых футильных реакциях. В результате сопря¬
женность между образованием и использованием энергии осла¬
бевает. Равновесие метаболических потоков поддерживается, но
с уменьшенной энергетической эффективностью и, следова¬
тельно, меньшим выходом биомассы. Степень сопряженности
метаболизма, по данным В. Н. Иванова, приблизительно выра¬
жает отношение x/s° '[9]. Крайним случаем является
полностью разобщенный метаболизм, когпа гетеротрофные
182Глава 3клетки интенсивно потребляют источники углерода и энергии,
но прироста биомассы не происходит.Термин «разобщенный рост» был введен для обозначения
явления, когда скорость генерации энергии в реакциях катабо¬
лизма превышает потребность организма в энергии. В дальней¬
шем было выяснено, что это явление широко распространено*
среди разных групп прокариот. Реакции, направленные на под¬
держание равновесия метаболических потоков на этапах ката-
болизма и анаболизма, носят различный характер [73—75]. На
практике это свойство бактерий имеет отрицательное значение
(уменьшает Kjr/s), но может быть также использовано как по¬
ложительное, способствующее сверхсинтезу внеклеточных про¬
дуктов '[22].Огромный практический интерес представляют биотехноло¬
гические процессы, совмещающие рост продуцента и синтез
целевого продукта. По такой схеме получают органические кис¬
лоты, аминокислоты, антибиотики и др. Наш опыт и анализ
литературных данных показывают, что именно для процессов,
в которых совмещаются рост продуцента и синтез продукта,
имеется значительный резерв в повышении Ур%п физиологиче¬
ским путем [22]. Вопросы биосинтеза экстрацеллюлярных про¬
дуктов целесообразно рассмотреть подробнее.Существует общепринятая терминология для характеристики
продуктов микробного синтеза. Первичными продуктами (ме¬
таболитами) называют небольшие молекулы, которые являются
промежуточными или конечными продуктами катаболизма или
используются как строительные блоки для образования основ¬
ных макромолекул клетки [20, 60].Вторичные метаболиты представляют собой вещества, син¬
тез которых не связан с ростом, но они могут играть определен¬
ную роль в метаболизме производящего их организма. Эти
вещества синтезируются на последних фазах ростового цикла
(антибиотики, пигменты, токсины). Однако оказалось, что ан¬
тибиотики в некоторых случаях можно получать в условиях
непрерывного культивирования [20]. Предполагалось опреде¬
лять вторичные продукты как метаболиты, не являющиеся не¬
обходимыми для роста [20].Иногда имеют место процессы, когда синтез продукта час¬
тично связан с ростом. Однако в эту классификацию трудно
включить сверхсинтез продуктов ауксотрофными мутантами,
которые широко применяют в биотехнологии.Таким образом, на практике встречаются случаи, когда,
с одной стороны, вторичные метаболиты (антибиотики) синте¬
зируются растущими в хемостате микроорганизмами. С другой
стороны, сверхсинтез многих первичных продуктов ауксотроф¬
ными мутантами протекает в отсутствие роста клеток. В связи
с этим, на наш взгляд, правильнее подразделять продукты
Генетические и физиологические основы регуляции183Рис.'3.3. Динамика роста (/) и об¬
разования этанола (2) в периоди¬
ческой культуре Zymomonas mobilis
113. Удельные скорости роста |х и
синтеза продукта обозначены кри¬
выми 3 и 4микробного синтеза по признаку: связан или не связан синтез
продукта с ростом.Для установления связи между ростом и биосинтезом про¬
дукта необходимо изучить поведение культуры в условиях
периодического и непрерывного культивирования. В качестве
примера синтеза продукта, совпадающего с ростом, можно при¬
вести биосинтез этанола из углеводов бактериями Zymomonas
mobilis. Динамика накопления биомассы и этанола в периоди¬
ческой культуре показана на рис. 3.3. Этанол является конеч¬
ным продуктом катаболизма углеводов. В данном случае мо¬
менты достижения jxMaKC и qp*KC совпадают. Такие процессы
можно обозначить как конкордантные ‘[4]. В условиях непре¬
рывного культивирования удельная скорость синтеза этанола и
потребления субстрата являются линейными функциями скоро¬
сти протока (рис. 3.4). В общем виде для конкордантных про¬
цессовdP/dt=jliXYp/Xy (3.1)где Yp/x — количество продукта, г на 1 г биомассы.В качестве примера дискордантного процесса можно при¬
вести сверхсинтез лизина ауксотрофными мутантами Brevibac¬
terium flavum. В динамике периодической культуры момент
достижения |ымакс не совпадает с ^ракс. В условиях непрерыв¬нее. 3.4. Удельные скорости синтеза эта¬
нола (/) и потребления глюкозы (2) при
непрерывном культивировании Zymomonas
mobilis 113
184Глава 3&Рис. 3.5. Удельные скорости син¬
теза лизина (/) и потребления
углеводов (2) при непрерывном
культивировании Br. flavum RC
115ного культивирования qp не является линейной функцией от
скорости протока (рис. 3.5). В общем виде для таких процес-
сов справедливо уравнениеqs = \ilYx/s-)r4p/Yp/s-\“mt (3.2)где т — затраты субстрата, не проявляющиеся в приросте био¬
массы и синтезе продукта.Пути физиологического регулирования У p/s" для конкордант*
ных и дискордантных процессов различаются. В первом случае
Ур/С8п мало зависит от |х и оптимизация синтеза продукта
совпадает с оптимизацией условии, необходимых для достиже¬
ния максимальной удельной скорости роста. Кроме того, синтез
продукта в конкордантных процессах может быть связан с об¬
разованием энергии. Основной путь увеличения продуктивности:
таких процессов связан с увеличением удельной скорости роста
культуры.Менее исследованы пути регуляции Ур%п в дискордантных
процессах. Как показывает анализ литературных данных, Ур1/?
в таких процессах значительно ниже максимальных значений
выхода продукта. В этих случаях возможно значительное уве¬
личение выхода продукта, но достижение этой цели требует
более глубоких знаний энергетики, биохимии и физиологии
продуцента.3.2.2.2. ЛИМИТИРОВАНИЕ РОСТА ПИТАТЕЛЬНЫМИ ВЕЩЕСТВАМИ.
ИЗБЫТОЧНЫЙ МЕТАБОЛИЗМЧтобы охарактеризовать физиологическое состояние культуры,,
следует установить компонент среды, лимитирующий рост. Ли¬
митирующим считают тот, добавление которого приводит к уве¬
личению удельной скорости роста или интенсификации мета¬
болизма. С другой стороны, идентификация лимитирующего
компонента позволяет в некоторой степени прогнозировать ак¬
тивность и направленность метаболизма клеток.
Генетические и физиологические основы регуляции185Как известно, основными питательными элементами микро¬
организмов являются углерод, азот, фосфор, калий, сера, маг¬
ний. Кроме того, часто для роста микроорганизмов необходимы
так называемые факторы роста — некоторые аминокислоты,
«витамины, коферменты, которые в готовом виде вносят в пита¬
тельные среды. Аэробы нуждаются в кислороде. Недостаток
каждого из этих компонентов приводит к изменению метабо¬
лизма.Для изучения лимитированного роста микроорганизмов
используют различные способы непрерывного культивирования,
чаще всего хемостатные культуры [10, 55, 89].Лимитирование источником углерода характеризуется вы¬
сокой эффективностью использования клетками углеродсодер-
.жащего субстрата. Как правило, внеклеточные метаболиты при
недостатке углерода не образуются, поэтому лимитирование
источником углерода нашло применение в процессах, цель кото¬
рых — получение клеточной массы, например микробного
-белка [6, 12].При азотном лимитировании создаются условия, способству¬
ющие сверхсинтезу безазотистых соединений — полисахаридов,
органических кислот и др. Изменением концентрации источника
азота, точнее, отношением азот: углерод при непрерывном
культивировании можно достичь стабильных стационарных со¬
стояний, способствующих образованию желаемых клеточных
компонентов ![89].Лимитирование роста бактерий недостатком факторов роста
также ограничивает образование биомассы. Данный способ при
использовании ауксотрофных мутантов позволяет регулировать
концентрацию биомассы. Однако при этом часто возникают до¬
полнительные технологические трудности, связанные с тем, что
в качестве ростовых факторов используют комплексное сырье —
гидролизаты, экстракты, бульоны. Кроме того, возникают проб¬
лемы стандартизации состава питательных сред, балласта
и др.Недостаток фосфора в среде в первую очередь сказывается
на составе фосфорсодержащих клеточных макромолекул —
нуклеиновых и тейхоевых кислот клеточных оболочек грампо-
ложительных бактерий. Кроме того, некоторые бактерии обра¬
зуют значительные количества полифосфатов. Фосфатное
лимитирование влияет также на энергетический метаболизм
бактерий, как правило, активируя альтернативные системы
транспорта и генерации энергии. Для биотехнологов представ¬
ляют интерес случаи стимулирования образования и экскреции
некоторых ферментов и антибиотиков недостатком фосфора в
среде [27].Концентрация ионов калия в клетках бактерий меняется ог0,01 до 0,2 М. Лимит калия приводит к увеличению дыхания
186Глава 3»у Klebsiella aerogenes и наименьшей эффективности их роста.
Такое явление может оказаться полезным при биологической
очистке сточных вод.Лимитирование источниками серы приводит к дефектам
Fe—S-содержащих белков ЭТЦ и потере энерготрансдуцирую-
щей активности первой точки сопряжения. Лимитирование дру¬
гими минеральными веществами на практике используется
редко, так как потребность микроорганизмов в них невелика.
К тому же при использовании комплексных сред, содержащих,
мелассу и гидролизаты, приходится часто считаться не с ли¬
митирующими, а скорее' с ингибирующими концентрациями
минеральных компонентов.Явление лимитирования роста компонентами питательной
среды широко используется в физиологических исследованиях.
Н*а практике оно используется при составлении питательных
сред.Особый практический интерес представляет культивирование
бактерий на богатой питательными веществами среде. Избы¬
ток источников углерода и энергии у гетеротрофных бактерий)
вызывает явление избыточного метаболизма (owerflow). Это
явление подробно описано в работе [88], и его суть заключа¬
ется в стремлении клеток поддерживать необходимый редокс-
баланс путем выделения в среду метаболитов промежуточного
обмена с различной степенью восстановления углерода. В ус¬
ловиях избыточного метаболизма уменьшается выход биомассы,
но скорость катаболизма остается высокой. Созданием опреде¬
ленных условий культивирования (например, лимитированием
фосфором, калием, серой, ростовыми факторами) можно до¬
биться такого перераспределения метаболических потоков,
когда клетки синтезируют и выделяют в среду преимущественна
определенный метаболит. Умелое использование этого явления
биотехнологами позволит физиологическим путем улучшить
многие процессы сверхсинтеза бактериальных продуктов.3.2.2.3. АДАПТАЦИЯ К ОПРЕДЕЛЕННЫМ УСЛОВИЯМ СРЕДЫ.
ЭКСТРЕМОФИЛЫМеханизмы адаптации бактерий к определенным, особенно к
экстремальным, условиям среды могут характеризовать физио¬
логическое состояние культуры. Предполагается, что эти меха¬
низмы у разных групп бактерий имеют общие свойства [65,66].Особые свойства ферментов только частично обеспечивают
приспособленность бактерий к экстремальным условиям. Лучше
всего это положение характеризует адаптация бактерий к зна¬
чениям pH среды. Хотя разные виды бактерий способны раз¬
множаться в средах со значениями pH от 1 до 11, pH оптимумы
Генетические и физиологические основы регуляции187действия ферментов, выделенных из ацидофилов и алкалофи-
лов, наблюдаются в более узком диапазоне значений pH —
от 6 до 8 [66]. То же в отношении галофильных бактерий,
живущих в насыщенном растворе NaCl (5,2 М). Их ферменты
обладают несколько повышенной осмотолерантностью. Более
стабильными являются ферменты термофильных бактерий. На
практике используют гидролитические, выделенные из термо¬
фильных бактерий ферменты, сохраняющие активность при тем¬
пературах 80 ... 105 °С.Индукция и репрессия специфических ферментов, обеспечи¬
вающих адаптацию к неблагоприятным условиям, довольно ши¬
роко распространены. Например, у Е. coli индуцируется синтез
декарбоксилаз аминокислот при низких значениях pH среды.
Изменение температуры также является сигналом индукции
специфических лиаз и ферментов липидного обмена.Особые механизмы адаптации у бактерий реализуются в
основном двояко. Известны случаи, когда в неблагоприятных
условиях активизируются защитные реакции клеток, направлен¬
ные на ликвидацию повреждений, например фотозащита и фо¬
тореактивация. Чаще бактерии приспосабливаются к экстре¬
мальным условиям путем пассивной защиты. Это изменение
свойств клеточной оболочки и цитоплазматической мембраны —
усиление барьерной функции клеточной оболочки. При этом
перестраиваются в основном липидные компоненты оболочки
и мембраны. Другим примером пассивной защиты является об¬
разование особых веществ — осмопротекторов — в ответ на
повышение концентрации солей в среде.Более сложные механизмы адаптации реализуются посред¬
ством образования особых морфологических форм, таких, как
споры, капсулы, которые способствуют выживанию бактерий в
экстремальных условиях.Использование экстремофилов в биотехнологии пока огра¬
ничено бесспорным признанием преимуществ термофильных
процессов. Другие примеры пока единичны.3.2.2.4. СТРАТЕГИИ РАЗВИТИЯ
И ТИПЫ ПИТАНИЯ ПОПУЛЯЦИЙОбобщению понятия «физиологическое состояние культуры»
помог бы ответ на вопрос, на осуществление какой функции
направлена регуляция метаболизма бактерий. Преобладает
точка зрения, что основной функцией жизнедеятельности микро¬
организмов является размножение и регуляторные механизмы,
направленные на ее осуществление [48, 57]. По мнению Д. Тем-
песта, экономичность метаболизма не является селективным
фактором отбора и не обеспечивает экологическое преимуще¬
ство. Эти заключения автора базируются в основном на ис¬
следованиях быстрорастущих бактерий Klebsiella aerogenes. По-
видимому, преждевременно обобщать этот вывод и относить
его к группам микроорганизмов с другими принципами жизне¬
деятельности.Недавно получила признание концепция г-, К- и L-типов
отбора, заимствованная из экологии высших растений и жи¬
вотных ([5, 11]. Следует отметить, что в отношении микроорга¬
низмов эти вопросы трактуются значительно шире, чем в бук¬
вальном смысле. Предлагается подразделять микроорганизмы
на три группы по типу осуществляемой ими экологической так¬
тики: г-тактика — быстрое размножение; К-тактика — поддер¬
жание стабильной численности в заполненной экологической
среде за счет высокой конкурентоспособности и эффективного
использования пищевых ресурсов; L-тактика — медленное раз¬
витие в олиготрофных условиях и поддержание стабильной
численности на низком уровне в результате высокой выживае¬
мости организмов.Быстрое размножение является наиболее заметным проявле¬
нием жизнедеятельности микроорганизмов. Намного меньше
исследован метаболизм микроорганизмов, осуществляющих К-
и L-тактику. По-видимому, реализация стратегий выживания и
поддержания конкурентоспособности достигается на основе дру¬
гих принципов регуляции метаболизма, в частности на рацио¬
нальном использовании субстрата с высоким значением
Y3x/s- Последние вопросы мало изучены. Однако в некоторых
работах отмечено, что выход биомассы может иметь решающее
значение, обеспечивающее конкурентоспособность бактерий в
условиях, когда в среде имеются два и более субстратов
[54, 56].Следующим шагом в расширении понятий г-, К- и L-типов
отбора явилась бы типизация регуляции метаболизма микро¬
организмов на основе осуществляемой ими экологической так¬
тики. Правомерность такого предположения подтверждается
данными, приведенными в работах |[48, 92].При изучении роста прокариот в ферментаторе с рецирку-
ляцией биомассы и в периодическом режиме с подпиткой в
условиях энергетического и субстратного лимита были обнару¬
жены три типа роста бактерий, обусловленные потоком пита¬
тельных веществ. Каждый тип роста наблюдался в определен¬
ном диапазоне |ы и характеризовался набором особых свойств.
При непрерывном уменьшении ц было .выявлено скачкообразное
изменение таких показателей, как выход биомассы и непродук¬
тивные затраты энергии [48, 92].Первый тип роста — экспоненциальный или, по терминоло¬
гии авторов работы *[48], эксплуатационный — характеризуется
наименьшими затратами на поддержание и самым высоким
Генетические и физиологические основы регуляциизначением YX/s, который авторы обозначают как Y'x/'s- Второй
тип — адаптационный — наблюдается при ц, = 0,008... 0,04 ч-1.
У^/s составляет 50... 75% от Yx)sc• Увеличиваются затраты
на поддержание метаболизма, что авторы объясняют увеличе¬
нием энергопотребности функционирования белоксинтезирую-
щего аппарата [48, 87].При очень малой удельной скорости роста ji<0,008 ч-1
наступает третий тип — «поддержание роста», при котором
Ydx/s равно 30... 40% от K*/sc [26, 48]. Установлено, что
наступление третьего типа роста связано с проявлением «стро¬
гого регуляторного контроля» (stringent control). Для этой
фазы характерно увеличение содержания в клетках гуанозин-
5'-бисфосфат-3' ди (три) фосфатов ppGpp и pppGpp [21, 52, 82]
и циклического АМР. Индуцируется синтез ферментов, контро¬
лируемый этими регуляторными нуклеотидами. Бактерии при¬
обретают способность расширить спектр утилизируемых суб¬
стратов, возрастает потенциальная активность катаболизма.
Подсчитано, что для обеспечения строгого контроля метаболита
требуется примерно 9% всей поступающей в клетку энергии
[26].Описанные три типа роста и регуляции метаболизма харак¬
терны только для прокариот и имеют общие черты у всех до
сих пор изученных бактерий: анаэробных культур Bacillus
polymyxa и Е. coli, аэробных культур Е. coliy Paracoccus denitri-
ficans и Rhizobium leguminosarum i[26, 48, 85, 87].Нам представляется, что обобщение физиологического со¬
стояния культуры по стратегиям развития популяции и типам
питания является основным ключом к пониманию регуляторных
механизмов метаболизма бактерий и разработке управляемых
систем культивирования.3.3. ФИЗИОЛОГИЧЕСКИЕ ПУТИ УВЕЛИЧЕНИЯ
ЭФФЕКТИВНОСТИ БАКТЕРИАЛЬНОГО СИНТЕЗАПри создании эффективных биотехнологий одну из главных
задач можно сформулировать так: достичь на практике величин
выхода продукта, близких к Kp/sc. Рассматривая возможные
решения этой задачи физиологическим путем, исходим из сле¬
дующих общих положений.1. В зависимости от экологических и физиологических усло¬
вий бактерии реализуют определенный тип регуляции метабо¬
лизма. По-видимому, бактерии способны «чувствовать» достоя¬
ние окружающей среды и каким-то образом использовать эту
информацию.
190Глава 3Рис. 3.6. Схема основных физиологических метаболических потоков у гете¬
ротрофных микроорганизмов2. Общим принципом регуляции метаболизма как при быс¬
тром размножении, так и в случае разобщенного роста и сверх¬
синтеза экстрацеллюлярных продуктов является стремление к
поддержанию баланса внутриклеточных метаболических пото¬
ков на этапах образования и использования энергии. Как пра¬
вило, баланс внутриклеточных потоков регулируется их пере¬
распределением, но не замедлением скорости начальных
реакций катаболизма. Последнее наблюдается только при осу¬
ществлении тактики выживания.3. Соотношение между внутриклеточными потоками угле¬
рода, восстановительных эквивалентов, энергии АТР можно
направленно менять извне. Однако при этом следует учесть, что
ответная реакция на какое-то определенное внешнее воздействие
будет зависеть от состояния внутриклеточного метаболизма
(включенного алгоритма).При росте гетеротрофных микроорганизмов между клеткой
и средой существуют семь основных обменных потоков
(рис. 3.6). Цель управляемого культивирования заключается
в обеспечении нужного соотношения между внешними и внутри¬
клеточными потоками. Можно привести множество примеров,
свидетельствующих о предсказуемой реакции микроорганизмов
в ответ на изменение обменных потоков в рамках этой простой
модели. Более обобщенно регуляцию соотношения обменных
потоков с целью увеличения выхода желаемого продукта био¬
синтеза можно осуществить двояко (табл. 3.3).Приведенный перечень способов регуляции баланса метабо¬
лических потоков «внешними потоками», т. е. направленными
физиологическими воздействиями, позволяет находить рацио¬
нальные решения для усовершенствования ряда биотехнологий.
Генетические и физиологические основы регуляции191Таблица 3.3. Принципы регуляции баланса метаболических потоков
физиологическим путемПринципрегуляцииФизиологические манипуляцииПримеры, приведен¬
ные в литературеУменьшениеНаправленное лимитирование метабо¬[17, 89]излишкализма входящим потокомНаправленное ингибирование «лишнего»[15]внутриклеточного потока[8, 94]Использование веществ-«регуляторов»Использование смешанных культурВосполнениеИспользование дополнительного источ¬[30, 72]нехваткиника углеродаИспользование дополнительного источ¬[18, 22, 28, 56, 62]ника энергииРегенерация кофакторов в сопряженных[40]системахИспользование смешанных культур[8, 33]3.3.1. УМЕНЬШЕНИЕ «ЛИШНЕГО»
МЕТАБОЛИЧЕСКОГО ПОТОКАВ биотехнологии первый принцип регуляции наиболее часто
реализуют, ограничивая рост бактериальной культуры концен¬
трацией или массопередачей какого-либо компонента среды.
Характерным примером является увеличение выхода продуктов
в дискордантных процессах при лимитировании энергогенериру¬
ющих процессов. Этот прием широко используется, например,
для увеличения выхода антибиотиков путем лимитирования
роста продуцентов фосфором [17, 20, 27].Лимитирование роста гетеротрофных микрорганизмов угле¬
родным субстратом применяется в процессах, в которых целе¬
вым продуктом является биомасса. В таких условиях органи¬
ческий субстрат наиболее эффективно используется для образо¬
вания клеточной массы ,[6, 9, 68, 83]. Еще эффективнее этот
процесс происходит в условиях двойного и тройного лимита.
Правильным сбалансированием питательной среды по основным
элементам — углероду, азоту и фосфору — можно достичь
максимальных значений У^/s [24].Довольно часты случаи, когда сверхсинтез нужного метабо¬
лита требует избытка источника углерода в среде. Наилучшие
результаты получают, лимитируя рост источником азота. Этот
принцип положен в основу синтеза полисахаридов и поли-р-окси:
масляной кислоты [35]. Часто в качестве продуцентов исполь¬
зуют ауксотрофные мутанты. Лимитирование роста факторами
роста (отдельными аминокислотами, витаминами) позволяет
10 20 30 40 JO 60 тчРис. 3.7. Влияние лимитированной
массопередачи кислорода на ин¬
тенсивность дыхания (/, 2) и био¬
синтез лизина (3, 4) культурой
Br. flavum 22ЛД при концентра¬
ции факторов роста в среде 40 г/л
(1,3) и 50 г/л (2, 4). Начальная
концентрация редуцирующих ве¬
ществ — 142 г/лограничивать накопление биомассы и поддерживать одновре¬
менно избыточную концентрацию источника углерода, т. е.
создавать условия, способствующие сверхсинтезу многих про¬
дуктов.Использование ауксотрофных мутантов в биотехнологии
позволяет решать часто возникающую проблему ограниченной
интенсивности массопередачи кислорода системами аэрации
промышленных биореакторов. На рис. 3.7 показана интенсив¬
ность потребления кислорода культурой Вг. flavum 22ЛД на
средах с концентрацией ростовых факторов (кукурузного экс¬
тракта) — 40 г/л (кривая 1) и 50 г/л (кривая 2). Во втором
случае интенсивный рост культуры не обеспечивается достаточ¬
ным количеством кислорода, и культура с 11-го по 22-й час
испытывает лимит по кислороду. В результате уменьшается ли-
зинсинтезирующая активность и суммарный выход лизина со¬
ставляет 0,28 г/г, что значительно меньше, чем в первом ва¬
рианте (0,34 г/г).Лимитирование роста микроорганизмов элементами питания
достаточно хорошо изучено 1[16, 89].Увеличения выхода продуктов бактериального синтеза
можно добиться, если воздействовать на культуры специфичес¬
кими ингибиторами и регуляторами. В качестве примера можно
привести увеличение Ур/s1 путем ингибирования «лишнего»
метаболического потока — непродуктивного окисления части
субстрата в цианидрезистентном пути дыхания Br. flavum. В ка¬
честве ингибитора был использован салицилгидроксамат.У лизинсинтезирующих бактерий непродуктивные затраты
энергии используются в основном для окисления субстрата в
цианидрезистентном пути. Предполагается, что между этим
окислением и биосинтезом лизина существуют конкурентные
взаимоотношения за восстановительные эквиваленты в клетке.
По-видимому, соотношение между потоками восстановительных
эквивалентов в сторону биосинтеза лизина можно изменить,
ингибируя цианидрезистентный перенос электронов в ЭТЦ. Дан¬
ное предположение было экспериментально проверено. При
Генетические и физиологические основы регуляции193Таблица 3.4. Влияние салицилгидроксамата на ростг выход лизина
и скорость потребления кислорода Br. flavum 22ЛДУсловия культивированияX. г/лЛизин, г/л’ qo} -ммоль/(г • ч)Y, г/гКонтрольС салицилгидроксаматом8,79,39,410,83,672,840,320,38периодическом культивировании Br. flavum на синтетической
среде после экспоненциальной фазы роста (6 ч) добавляли
2 -10~3 М салицилгидроксамата. После 12 ч культивирования
были выполнены анализы (табл. 3.4).Добавление салицилгидроксамата привело к такому пере¬
распределению метаболических потоков, в результате которого
увеличился выход лизина и уменьшилась скорость потребления
кислорода.Следует отметить, что практическое применение химических
веществ-ингибиторов в биотехнологии ограничено. Все же по¬
добные эксперименты показывают, как можно добиться увели¬
чения эффективности биосинтеза. На практике можно пользо¬
ваться другими приемами. Увеличения выхода лизина за счет
уменьшения потерь энергии в цианидрезистентном пути окис¬
ления субстрата мы добились оптимизацией массопередачи
кислорода и скорости подпитки [22]. В других случаях хоро¬
ших результатов можно достичь, если применять неспецифи¬
ческие ингибиторы — экстремальные концентрации ионов водо¬
рода (pH среды), сверхоптимальные температуры и др.
■[13, 81].Эффективный способ увеличения выхода продукта — ис¬
пользование «регуляторов», которые в малых концентрациях
способны вызывать биохимические изменения в клетках, приво¬
дящие к более высоким выходам продуктов. Например, увели¬
чение эффективности биосинтеза у некоторых гетеротрофных
бактерий под влиянием повышенной концентрации С02 в среде.Нами исследовано влияние концентрации растворенного С02
на скорость потребления и использования кислорода у проду¬
центов лизина. Процесс культивирования был непрерывным
при £) = 0,15 и 0,16 ч-1. Основные параметры (pH среды, р02,
температура) поддерживались на постоянном уровне для каж¬
дой культуры. Концентрацию С02 в ферментационной жидкости
меняли, добавляя вместе с аэрирующим воздухом технический
С02. У штаммов 22ЛД и RC 115 увеличивалась скорость
потребления кислорода при возрастании С Со2 ДО 2,0 ммоль/л.
Это соответствовало содержанию С02 примерно 6 об.%J3 - 361
Таблица 3.5. Влияние концентрации растворенного диоксида углеродана Ух/о и Ур/о у Br. flavum 22ЛД и RC 115
в условиях непрерывного культивированияОпытССоа* м м°ль/лYХ/О» г/мольУр/О* Г/мольBr. flavum 22ЛД(D = 0,16 ч 1, pH 7,4± 1, р02=20±5%, / = 30°С)10,1928,221,120,7628,321,431,2630,019,443,0740,024,954,7441,427,1Br. flavum RC 115(/> = 0,15 ч-1, pH 72±0,1, р02= 10±5%, / = 31 °С>10,1933,734,520,7633,329,931,7128,339,142,7531,849,6в выходящем из ферментатора газе. При дальнейшем увеличе¬
нии концентрации растворенного диоксида углерода стимули¬
рующий дыхание эффект уменьшался.В табл. 3.5 приведены данные о влиянии Ссо2 на эффектив¬
ность роста и синтеза лизина.Повышение Ссо2 ДО 4,74 ммоль/л при культивировании
штамма 22ЛД приводит к увеличению выхода биомассы и ли¬
зина по кислороду. Для штамма RC 115 приССо2 =2,75 ммоль/л
выход лизина по кислороду возрастает. Характерно, что по аб¬
солютной величине YX/o достигает больших значений у штамма
22ЛД, а Ур/о — у RC 115.Таким образом, увеличение концентрации растворенного
С02 воздействует на физиологическую активность лизинпроду-
цирующих бактерий. В диапазоне концентраций 0,6...
... 0,8 ммоль/л для штамма 22ЛД и 1,5 ... 2,0 ммоль/л для штамма
RC 115 наблюдается стимуляция дыхания. При этом УХ/о и
Ур/о заметно не уменьшаются, что свидетельствует об увели¬
чении удельной скорости роста клеток и биосинтеза лизина.
В диапазоне больших концентраций растворенного С02
(3,07... 4,74 ммоль/л для штамма 22ЛД и 1,71... 2,75 ммоль/л
для штамма RC 115) увеличивается энергетическая эффектив¬
ность роста клеток и биосинтеза лизина.В биотехнологии широко используют смешанные культуры,
состоящие из двух и более видов. Взаимодействие между ви¬
дами на основе биологических механизмов Дж. Слейтер под¬
разделяет на семь классов, приводя соответствующие при¬
меры [34J.
Генетические и физиологические основы регуляции195Классификация микробных ассоциаций на основе
«биологических механзмов взаимодействияКласс Биологический механизм взаимодействия1 Обеспечение специфическими питательными веществами2 Удаление ингибиторов роста3 Изменение параметров роста, приводящих к более кон¬курентоспособной или эффективной ассоциации4 Комбинированная зависимость метаболизма, затрагива¬ющая более чем два вида5 Кометаболизм6 Межвидовой перенос водорода7 Взаимодействие между несколькими первичными ви¬дамиВзаимодействия между двумя видами подразделяют на
шесть типов [33, 34]. Ниже приведена классификация взаимо¬
действий между видами i и /. Знаками «+», «О» и «—» обо¬
значено положительное влияние на рост другой популяции,
нейтральное влияние (его отсутствие) и отрицательное воз¬
действие..Матрица взаимодействия между двумя видами микроорганизмовВлияние i на / (а|;) Влияние / на i (ai;-)+ 0
+ -f + +0 + —О О + 0 0 0 —- + - о Различают шесть основных типов взаимодействий: «+ +» —мутуализм (взаимовыгодный); « » — конкуренция; «0 0» —нейтральность; «0 +», «+ 0» — комменсализм; «~\ », « \-» —паразитизм; «0—», «—0» — аменсализм. Для биотехнологов
наибольший интерес представляют взаимодействия типов муту¬
ализма и комменсализма. Смешанные культуры широко исполь¬
зуют в пищевой биотехнологии, при очистке сточных вод и в
биогеотехнологии.3.3.2. ВОСПОЛНЕНИЕ НЕДОСТАЮЩИХ
МЕТАБОЛИЧЕСКИХ ПОТОКОВВторой принцип физиологической регуляции метаболических
потоков — восполнение нехватки — более выгоден, так как при
этом удается достичь более значительного повышения выхода
продуктов.При рассмотрении возможностей повышения выхода путем
использования нескольких источников углерода целесообразно13*
196Глава 3подразделять субстраты на две группы — богатые энергией и
богатые углеродом '[28, 29, 83]. Принадлежность субстрата к
той или иной группе определяется его удельным энергосодер¬
жанием. Богатым энергией называют такой источник углерода,
у которого удельное содержание свободной энергии в пересчете
на грамм-эквивалент углерода выше, чем в биомассе [28]. Это
определение можно расширить, сравнивая удельное энергосо¬
держание субстрата с таковым любого продукта биосинтеза.На основании литературных данных можно заключить, что
наиболее высокая эффективность роста на моносубстрате в том
случае, когда продукт биоситеза (биомасса) и субстрат имеют
одинаковое или близкое удельное энергосодержание [6, 68].
Более значительного увеличения У я/s11 и х\х в средах с несколь¬
кими субстратами следует ожидать в случае использования
источников углерода с различным энергосодержанием. Допол¬
нительный источник углерода используется как бы для ком¬
пенсации разницы энергосодержания между основным субстра¬
том и продуктом. Правильно подбирая дополнительный
источник углерода, можно повысить степень конверсии угле¬
рода и достичь величин, превышающих максимальную степень
конверсии углерода субстрата в биомассу, которая, по оценке
Роэлса, составляет 65% {83], а по данным Линтона и Сте¬
фенсона — 68% [68]. В литературе описаны некоторые при¬
меры повышения YX/s при использовании смешанных субстра¬
тов: метанол — формиат, метанол — глюкоза, этанол — глю¬
коза, ацетат — формиат [33, 56, 57].3.3.3. УВЕЛИЧЕНИЕ ВЫХОДА ЛИЗИНА
У Br. flavum ПРИ ОДНОВРЕМЕННОМ ИСПОЛЬЗОВАНИИ
ДВУХ ИСТОЧНИКОВ УГЛЕРОДАИзучение затрат энергии при биосинтезе лизина в альтернатив¬
ных путях показало, что ни в одном из рассмотренных вариан¬
тов нет полного равновесия между образованием и использова¬
нием АТР и восстановительных эквивалентов [22]. Возникло
предположение, что в фазе синтеза лизина у Br. flavum баланс
между потоками АТР и NAD(P)H можно улучшить по прин¬
ципу «восполнения нехватки» комбинацией нескольких источ¬
ников углерода с различным балансом АТР и NAD(P)H. Для
этого необходимо было выяснить способность бактерий исполь¬
зовать смешанные субстраты.Был использован «импульсный метод», т. е. анализ ответной
реакции культуры после небольших доз разных комбинаций
источников углерода в условиях его лимита. Доказательством
одновременного использования двух субстратов мы считали
Генетические и физиологические основы регуляции197Сахароза * малат
6Сахароза,Ацетат, Сахарозав¬
од г/л и,5?/л ацетат,
к 0,510,5г /лVjvKРйи--0,30 у?пиР-С,28 fiau<*пиР= 0.24Рис. 3.8. Схематическое изображение изменения дыхания при совместной
утилизации нескольких источников углерода в культуре Br. flavum RC 115,
лимитированной источником углерода:а — совместная утилизация сахарозы и ацетата, б — одновременная ассимиляция
двух источников углерода, в — последовательная ассимиляция двух источников угле*
рода, г — неаддитивность ассимиляции ацетата и пирувата — двух источников угле¬
рода — +Ъ)увеличение скорости потребления кислорода после небольших
доз этих субстратов в разной последовательности (рис. 3.8).
В приведенном примере (а) видно, что бактерии способны одно¬
временно использовать сахарозу и ацетат. Выяснилось, что
лизинпродуцирующие штаммы могут одновременно с углево¬
дами (сахарозой и глюкозой) ассимилировать ацетат, пируват,
сукцинат, малат и лактат (некоторые штаммы). Кинетика ды¬
хания свидетельствует о том, что не все субстраты ассимили¬
руются одновременно. Малат, например, утилизируется после
сахарозы.Эффективность использования смешанного субстрата оцени¬
вали по величине коэффициента р (см. главу 1). Он характе¬
ризует непродуктивные затраты энергии при утилизации
бактериями разных источников углерода в определенных физиоло¬
гических условиях. В рассмотренном выше примере эффектив¬
ность использования нескольких субстратов проверяли на
стационарной фазе роста периодической культуры Br. flavum
RC 115 в условиях С-лимита. Было выявлено, что для неко¬
торых комбинаций субстратов на окисление смешанного суб¬
страта потребляется меньше кислорода, чем для окисления того
же их «количества, но поданных раздельно. В табл. 3.6 при¬
ведены значения коэффициента р при ассимиляции сахарозы,
ацетата и смеси.Меняя количественное соотношение между сахарозой и аце¬
татом, оценили лучшую комбинацию концентраций этих
198Глава 3Таблица 3.6. Экспресс-оценка эффективности использования смеси
двух источников углерода — сахарозы и ацетата —у Br. flavum RC 115СахарозаАцетат, г/5,5 л/71 ,о2ммольР0,505,410,321,0010,940,331,5015,970,3200,53,690,3001,07,870,320,5*0,58,400,290,50,5*8,180,281,0*1,015,720,271,01,0*15,580,271,0*0,511,270,271,00,5*11,900,261,5*0,515,510,251,50,5*15,080,24* Данный субстрат добавляли первым.субстратов. В данном случае таковой оказалась смесь сахарозы
и ацетата в соотношении 3:1 по массе.Эти результаты свидетельствуют о том, что энергетическая
эффективность увеличивается неаддитивно при использовании
импульса смешанного субстрата (сахароза+ацетат). Удельная
энергоемкость субстратов приблизительно одинакова. Сте¬
пень восстановленности для этих субстратов ys = 4,0. По стан¬
дартной свободной энергии и теплоте сгорания глюкоза явля¬
ется несколько более энергоемким субстратом [77, 83]. В стан¬
дартных условиях (298 К, 0,1 МПа, pH 7,0) теплота сгорания
уксусной кислоты составляет 876 кДж/моль, глюкозы —
2807 кДж/моль (соответственно 14,6 и 15,6 кДж/г) [83]. Не¬
смотря на меньшую удельную энергоемкость уксусной кислоты,
изученный штамм Br. flavum использует ацетат на конструк¬
тивный метаболизм более эффективно, чем сахарозу (коэффи¬
циент р меньше).Из других проверенных источников углерода лизинпродуци-
рующие бактерии относительно эффективно утилизируют пиру¬
ват и сукцинат: значения р при этом составляют 0,20 и 0,21.Проведенная оценка эффективности использования углерод¬
ных субстратов и их комбинаций характеризует непродуктивные
затраты при биологическом окислении небольшой дозы суб¬
страта. Необходимо было выяснить, как значение получаемого
коэффициента р связано с эффективностью синтеза. При этом
следовало ответить на два вопроса. Первый — одинаковы ли
Генетические и физиологические основы регуляции199Таблица 3.7. Эффективность биосинтеза лизина при периодическом
культивировании Br. flavum RC 115
с подпиткой сахарозой, ацетатом
и их смесью (p02 = 10±5%r pH 7Г4±0,05Г / = 31 °С)Время
от на¬
чала
подпит¬
ки, чСостав подпитки, г/лКонцен¬трациялизина,г/лАР, лРас¬
ход
под¬
питки,
мл/лД5, гуЭКСПYP/Sг/г11 Контроль11,6 0,3316 Сахароза — 120| 16,727,612876,80,36Кукурузный экстракт — 2021 Ацетат натрия — 202,4
Ацетат аммония — 69,61 18,928,416783,30,34Кукурузный экстракт — 20
26 Сахароза — 120Ацетат натрия — 67,5
Ацетат' аммония — 23,2
Кукурузный экстракт — 20эффективность окисления небольшой дозы субстрата и эффек¬
тивность потребления этого субстрата в течение всего процесса?
Исследование роста прототрофного штамма в непрерывной
культуре показало, что зависимость величины р от дозы суб¬
страта имеет линейный характер. Линейность этой зависимости
отмечали также другие авторы у продуцента глутаминовой кис¬
лоты Corynebacterium sp. [37]. Эти результаты свидетельствуют
в пользу предположения о том, что эффективность ассимиля¬
ции небольшой дозы субстрата такая же, как и интегральная
величина эффективности использования этого субстрата в тече¬
ние длительного периода роста культуры.Второй вопрос касается того, в какой мере коэффициент
Р дает информацию об эффективности синтеза продукта. Вы¬
ражение р=1 — г] связывает непродуктивные затраты энергии
с суммарной эффективностью использования субстрата на весь
конструктивный обмен, т. е. на образование биомассы и вне¬
клеточных метаболитов. Полученные значения коэффициента р
у прототрофного штамма в хемостатной культуре (т. е. в усло¬
виях роста) были несколько больше, чем у лизиипродуцирую-
щего штамма в стационарной фазе роста, т. е. в условиях,
благоприятных для синтеза лизина. В первом случае при
окислении сахарозы р составила 0,30, во втором — 0,28. Со¬
гласно расчетам, удельные затраты энергии (в виде АТР) для
образования биомассы примерно в 10 раз больше, чем для
синтеза лизина. Соответственно можно было бы ожидать, что
в случае интенсивного образования лизина субстрат будет ути¬
лизироваться с меньшими затратами кислорода. Эксперимен¬
тально это подтвердилось лишь частично.23,141,9 127 97,4 0,43
200Глава 3Эффективность использования смешанного субстрата на
биосинтез лизина проверяли на периодической культуре с под¬
питкой. Опыты проводили по следующей схеме. В периодичес¬
кой культуре Br. flavum RC 115 в начале стационарной фазы
роста включали непрерывную подпитку. Момент ее начала оп¬
ределяли по уменьшению концентрации кислорода в выходящем
из ферментатора воздухе. Для подпитки использовали рас¬
творы, которые содержали смесь источников углерода в опре¬
деленном соотношении, составленном согласно данным импульс¬
ной оценки эффективности использования субстратов. За период
времени порядка 5 ч определяли прирост концентрации лизина
в ферментационной жидкости. Потребление источника углерода
за это же время вычисляли по объему использованного рас¬
твора. Значения выхода лизина (YP/s=AP/AS) в использован¬
ных режимах подпитки приведены в табл. 3.7. Выход лизина
за период утилизации сахарозы Ур%п составил 0,36, при потреб¬
лении ацетата (в пересчете на массу С2Н4О2) — 0,34. Несмотря
на то что смесь субстратов подавалась последней и активность
продуцента могла быть уменьшена, этот период подпитки ха¬
рактеризовался наиболее высоким значением Ур%п — 0,43.Приведенный пример показывает, что смесь двух углерод¬
содержащих субстратов — сахарозы и ацетата — в соотноше¬
нии 3,6: 1 для биосинтеза лизина более эффективна, чем эти
же субстраты в отдельности.3.3.4, УВЕЛИЧЕНИЕ ВЫХОДА БИОМАССЫ
И ЛИЗИНА НА ОСНОВЕ МИКСОТРОФИИУ Br. flavumПри изучении энергетического метаболизма у лизинпродуциру-
ющих бактерий нами была обнаружена ранее неизвестная
способность представителей группы коринебактерий ассимили¬
ровать молекулярный водород ([ 18]. Была обнаружена гидро-
геназа и выяснена ее роль в энергетическом метаболизме Вг.
flavum. Исследование активности гидрогеназы у лйзинпродуци-
рующих бактерий позволило выявить штаммы с наибольшей
удельной активностью этого фермента. Такими оказались
штаммы RC 115 и их прототрофный ревертант. Была проверена
способность этих бактерий использовать молекулярный водород
(хемолитоавтотрофный и хемолитогетеротрофный типы пита¬
ния). Оказалось, что прототрофный штамм в автотрофных ус¬
ловиях — на минеральной среде Шлегеля '[25] в атмосфере
смеси газов Ог: Нг: СОг=2: 6 : 1 — растет очень медленно.
Время удвоения биомассы составляет примерно 30 ч. В гетеро¬
трофных условиях эти бактерии растут с удельной скоростью
Генетические и физиологические основы регуляции20!Рис. 3.9. Влияние газообразного
водорода на рост периодической
культуры Br. flavum RC 115 М:1 — кривая роста; 2 — потребление
сахарозы; 3 — скорость дыхания0,45 ч-1, т. е. время удвоения биомассы составляет 1,5 ч. С прак¬
тической точки зрения интересно выяснить способность Br. fla¬
vum к миксотрофному типу питания.Были проведены опыты в условиях периодического культи¬
вирования на среде, содержащей сахарозу. В момент замедле¬
ния роста в смесь аэрируемых газов добавляли водород (поло¬
вину объема воздуха) и продолжали культивирование до
прекращения роста бактерий (рис. 3.9). До начала подачи во¬
дорода рост контролировали по скорости дыхания, потреблению
сахарозы и образованию биомассы. После подачи водорода
продолжали поддерживать аэробные условия (рОг=25%)- Было
выявлено, что культура возобновляет рост с некоторой задерж¬
кой и к 24 ч культивирования концентрация биомассы дости¬
гает 22,4 г/л. Несколько фактов свидетельствовало о том, что
при этом бактерии использовали энергию окисления молеку¬
лярного водорода. По динамике основных параметров роста
можно заключить, что бактерии размножались даже тогда,
когда потребление органического источника углерода почти
прекратилось. Суммарный выход биомассы в пересчете на по¬
требленный органический субстрат составил 0,83 г/г.Нами было рассчитано, что значение У5с/ес в гетеротрофных
условиях роста составило 0,51 г/г ([22]. Следовательно, обра¬
зование биомассы без потребления сахарозы в последние часы
культивирования может быть объяснено тем, что Н2 использо¬
вался в энергетическом метаболизме, а СОг, возможно, — в
конструктивном метаболизме бактерий. Или, как это отмечено
у других микроорганизмов, в условиях миксотрофного роста
увеличивается доля углерода органического субстрата, пере¬
шедшая в биомассу [62].Во всех проведенных опытах была отмечена общая законо¬
мерность: при ассимиляции молекулярного водорода снижалось
или полностью прекращалось потребление углеводов культурой
бактерий.
”202Глава 3Таблица 3.8. Влияние водорода на синтез лизина при непрерывном
культивировании В г. flavum RC 115Вари¬антСостав аэрируемой
газовой смесиXASАР..ЭКСПу Pis ’г/г*о2‘'сОаД. к.г/лммоль/(г • ч)6,712,94,10,323,23,41,066,911,26,00,548,16,10,756,811,56,30,556.75,80,871 Воздух2 Воздух
Н23 Воздух
Н2
С02- 50%- 50%- 48,5%- 48,5%- 3%В миксотрофных условиях роста Br. flavum обнаружены
закономерные изменения состава нуклеотидов. Особенно замет¬
ным было увеличение концентрации восстановленного
NADPH. Согласно расчетам, все это должно было привести к
улучшению сбалансированности метаболических потоков по
принципу «восполнения нехватки» при биосинтезе лизина из
углеводов. Данное предположение было проверено при непре¬
рывном культивировании лизинпродуцирующих бактерий. В на¬
чале опыта условия были гетеротрофными при скорости про¬
тока среды £>=0,11 ч-1, pH 7,4, р02= 20 ... 30%.После установления стационарного состояния провели ана¬
лизы (табл. 3.8). В дальнейшем режимы культивирования из¬
меняли, добавляя к аэрируемому воздуху в варианте 2 водо¬
род, в варианте 3 — еще и диоксид углерода. Добавление
водЬрода к смеси аэрируемых газов привело к значительному
увеличению скорости потребления кислорода и сокращению
потребления органического источника углерода. Характерно,
что в этом режиме величине дыхательного коэффициента со-• ставила 0,75.Полученные результаты свидетельствуют о том, что при
наличии в среде водорода бактерии переключаются на миксо-
трофный тип питания. При одновременном потреблении неорга¬
нического источника энер!ии и органического источника угле¬
рода и энергии выход лизина У2%п увеличивается и достигает0,54 г/г. Повышение концентрации СОг в среде приводит к еще
большему увеличению концентрации лизина и значенияУэксп
P/S •Таким образом, можно констатировать, что правильный вы¬
бор внешних потоков (дополнительных источников углерода
или водорода) позволяет направить внутриклеточные потоки
ка увеличение синтеза желаемого продукта
Генетические и физиологические основы регуляции20$3.4. УПРАВЛЕНИЕ
ПРОЦЕССОМ ПУТЕМ ИЗМЕНЕНИЯ
ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТИ ПРОДУЦЕНТА3.4.1. ВЫБОР ОСНОВНОГО ПАРАМЕТРА УПРАВЛЕНИЯРегулирование активности продуцента физиологическим путем
во многом определяется выбором параметра (или параметров)
контроля и управления. В первую очередь выбор параметров
зависит от инженерно-технического оформления аппаратуры.
Имеются экспериментальные установки ферментатор — ЭВМ,,
в которых можно контролировать до десяти параметров и уп¬
равлять температурой, pH, еН, р02, скоростью подпитки и дру¬
гими параметрами. Существует мнение, что разработка
способов автоматического управления процессами микробного
синтеза на данном этапе не ограничивается техническими причи¬
нами [49]. С этим можно согласиться лишь частично. До сих
пор отсутствуют удобные и надежные методы непрерывного
контроля таких важных физиологических характеристик куль¬
тур, как (я, qs, qp.Следующее условие выбора управляющего параметра —
информативность. Большинство перечисленных выше парамет¬
ров дают косвенные сведения о физиологической активности
микроорганизмов. Наиболее информативны те параметры, кото¬
рые непосредственно связаны с материально-энергетическим
балансом процесса, — тепловыделение, Q0l, Qсо,. скорость
подачи субстрата (в непрерывном процессе или при подпитке)
[53].В качестве основного параметра контроля и управления бак¬
териальных продуцентов в своих работах мы использовали
состав выходящих из биореактора газов — кислорода и диок¬
сида углерода.3.4.2. ИНТЕРПРЕТАЦИЯ ПАРАМЕТРА
«СКОРОСТЬ ПОТРЕБЛЕНИЯ КИСЛОРОДА»Наш опыт свидетельствует о том, что наиболее информативным
и технически легко определяемым параметром контроля аэроб¬
ных процессов культивирования служит величина Qo*> которую
рассчитывают с помощью метода газового баланса. Общеиз¬
вестно, что в процессах, в которых ух^уs потребление кисло¬
рода связано с биологическим окислением субстрата, т. е. с
дыханием; последнее, в свою очередь, — с образованием АТР
в ЭТЦ. В связи с этим в условиях сопряженного роста наблю¬
дается хорошая корреляция между д0з1 ^ и тепловыделением
204Глава 3[20, 38]. По виду кривой <7оа=/(0 можно определить фазы
роста культуры в периодическом процессе, определить момент
достижения [хмакс.Информативность контроля концентрации кислорода в вы¬
ходящем из ферментатора газе значительно повышается благо¬
даря возможностям анализа ответной реакции культуры на
малые возмущения '[2]. Таким образом можно идентифициро¬
вать фактор, лимитирующий рост, оценить энергетическую эф¬
фективность окисления субстратов, возможность одновременного
использования нескольких источников углерода и др.3.4.3. ОПРЕДЕЛЕНИЕ ДОЗЫ, МОМЕНТА
И ПРОДОЛЖИТЕЛЬНОСТИ ПОДПИТКИБактериальный синтез лизина является дискордантным процес¬
сом, т. е. qP прямо не коррелирует с qs и ji. На практике
лизин получают в процессах периодического культивирования
с подпиткой. Продуктивность существенно зависит от управле¬
ния подачей подпитки. Разработаны способы определения мо¬
мента подпитки по достижении определенного времени, накоп¬
лению биомассы или остаточной концентрации редуцирующих
веществ. Однако все эти методы не учитывают физиологическую
активность продуцента in situ.Момент подпитки можно физиологически обосновать на ос¬
нове данных скорости потребления кислорода (рис. 3.10). Как
было показано выше, удельная энергопотребность при биосин¬
тезе лизина меньше, чем при образовании биомассы. В связи
с этим при периодическом культивировании в момент дости¬
жения <7ракс потребность микроорганизмов в кислороде снижа¬
ется по сравнению с Qoa при максимальной удельной скорости
роста. В этот момент времени т потребление кислорода свя¬
зано с энергообеспечением биосинтеза лизина (включая
транспорт субстрата), замедленным ростом культуры и непро¬
дуктивными затратами энергии, включающими физиологически
обязательные затраты на поддержание жизнеспособности
клеток.У разных штаммов продуцентов, а также в зависимости от
состава среды и регламента культивирования в момент дости¬
жения qp*KC скорость потребления кислорода неодинакова.
В контрольном опыте с измерением qp определяли для данного
штамма и условий культивирования скорость потребления кис¬
лорода Qо2 в момент т. Величину Q0i (т) можно выразить в
абсолютных единицах [ммоль/ (л -ч)] или в процентах отп макс
^02
Генетические и физиологические основы регуляции205Рис. 3.10. Определение макси¬
мальной удельной лизинсинтезиру-
ющей активности и момента на¬
чала подпитки (Т) в периодичес¬
кой культуре Br. flavum RC 115:1 — кривая роста; 2 — скорость по¬
требления кислорода; 3 — удельная
скорость биосинтеза лизина10 9Ц 30t,4Согласно рис. 3.10, скорость потребления кислорода, соот¬
ветствующая максимальной удельной активности синтеза ли¬
зина, равна 37,5 ммоль/(л-ч), или 38% Qo*KC. Для проверки
правильности данных предположений в последующих экспери¬
ментах изучали зависимость эффективности синтеза лизина от
физиологической активности продуцента, введя подпитку на
разных уровнях дыхания. Культуру Br. flavum RC 115 выра¬
щивали в периодическом режиме до наступления признаков
лимита углеродным субстратом. В этот момент включали не¬
прерывную подачу подпитки и поддерживали низкий уровень
дыхания — 21,7% от Qo,K°- В течение 4 ч определяли расход
субстрата и прирост лизина.Следующий режим подпитки задавали на более высоком
уровне дыхания — в среднем 37,5% от Qo*KC. В этих условиях
потребление кислорода культурой лимитировала концентрация
ростовых факторов в среде. Результаты анализов (табл. 3.9)
показали, что этот режим подпитки, близкий к расчетному
оптимальному, характеризуется наиболее высокими выходом ли¬
зина и продуктивностью. Увеличение скорости подпитки и
культивирование продуцента в режиме респиростата при более
высоких стационарных значениях QoT* приводило к уменьше¬
нию выхода лизина.Управление подачей подпитки в соответствии с заданным
уровнем физиологической активности продуцента по Qo, легко* осуществить с помощью локальной автоматики или микропро¬
цессоров.Продолжительность подпитки определяется в основном
двумя факторами: активностью продуцента и заполнением фер¬
ментатора. Биосинтетическую активность лизинпродуцирующих
бактерий в некоторой мере можно регулировать составом под¬
питки и условиями культивирования. Одной из причин сниже¬
ния активности является накопление конечного продукта в
большой концентрации. Для продления процесса, сохраняя
Таблица 3.9. Эффективность^ биосинтеза лизина при управленииподпиткой на разных уровнях дыхательной активности
культуры Br. flavum RC 115Объем среды
в аппарате, лСкорость потребления
кислородаСкорость подачи
подпиткиv эксп
yP/S -
г/ггр»г/(л • ч)ммоль/
!(л • ч)% от
^максСо2мл/чв пересчете
на РВ,
г/(л • ч)5,5022,421,71503,240,290,946,1038,737,51442,810,421,186,8549,147,51733,010,361,087,6062,560,52103,290,240,79наиболее благоприятные физиологические условия, наиболее
рационально перейти на непрерывное культивирование или про¬
должить процесс в отъемно-доливном режиме. При этом основ¬
ным фактором, ограничивающим продолжительность процесса,
является обеспечение стерильности.Управление подпиткой по Q о2 позволяет рационально ис¬
пользовать рабочий объем ферментатора. Подпитку продолжают
до полного заполнения аппарата. Конец процесса определяют
по уменьшению Qo,, что соответствует утилизации остаточного
субстрата.Нами совместно с JI. А. Бабуриным, В. В. Крикисом и др.
был проверен способ управления биосинтезом лизина по физио¬
логической активности продуцента, определяемой газобалансо¬
вым методом в промышленных условиях на Ливанском и Три¬
польском биохимических заводах, и получены очень хорошие
результаты.
ИНЖЕНЕРНОЕ
ОСУЩЕСТВЛЕНИЕ БИОТЕХНОЛОГИЙКак известно, технология и оборудование для приготовления,
транспорта и стерилизации питательных сред зависят главным
образом от их состава (наличия нерастворимых ингредиентов,
термолабильных компонентов и т. д.), определяемого физиоло¬
гией продуцента, а не от вида продуцента. Бактериальные
культуры, в частности наша основная модель Brevibacterium
flavum, обычно не агрегатируют, клетки сравнительно мелкие
и устойчивые к срезовым усилиям, средняя потребность в кис¬
лороде 3...5 кг/(м3-ч), поэтому для их культивирования в
большинстве случаев пригодны биореакторы любой конструк¬
ции. Правда, встречаются исключения. Например, при биосин¬
тезе полисахаридов требуется подбирать штаммы и оптималь¬
ные конструкции аппаратов в каждом отдельном случае.Представляет* определенную проблему фракционирование
культуральных жидкостей. Региональная промышленность вы¬
пускает в основном дрожжевые сепараторы; бактофуги необхо¬
димо закупать за валюту. Дезинтеграция бактериальных био¬
масс в большинстве случаев не сложнее, чем дрожжевых, и
можно применять обычное оборудование. Методы очистки и
концентрирования продуктов биотехнологии бактериального
происхождения практически не отличаются от таковых для дру¬
гих групп микроорганизмов.Характеристика аппаратуры по стадиям технологического процессаПриготовлениесредыАппаратурапитательной Реакторы с мешалками, дозаторы, смеси¬
тели жидких и сыпучих сред, насосыСтерилизациясредыпитательной Специальная линия для непрерывной сте¬
рилизации, паровая колонка, выдержи-
ватель, холодильник; специальная аппа-
ФерментацияПодпитка, контроль pH и це¬
нообразования при глубин¬
ной ферментацииОбработка продуктов фермен¬
тации:для получения микробных
концентратов
для получения биомассдля получения экзопродук¬
товдля получения эндопродук¬
товэтаноладля получения
растворителейратура для стерилизации сыпучих (не¬
растворимых) субстратовШирокий выбор аппаратов различных кон¬
струкций [6JОбъемные мерники, дозаторы различного
типаВыпарные установки, сушилки, линии фа¬
совкиСепараторы, выпарные установки, сушилки,
линии фасовки
Сепараторы, оборудование для концентри¬
рования и очистки (ионообмснники, мем¬
бранные аппараты, кристаллизаторы в
т. п.), сушилки, линии фасовки (амнули-
рования, таблетирования)То же, плюс дезинтеграторы клетокСепараторы, оборудование для перегонки
и ректификацииВ свое время было отмечено, что дальнейший прогресс в
биотехнологии может быть достигнут при условии, если хими¬
ческое и нефтяное машиностроение обеспечит повышение
технического уровня действующего оборудования, создание но¬
вых аппаратов конкурентоспособных конструкций, использова¬
ние систем управления на основе микропроцессорной техники,
поставки комплексов оборудования максимальной заводской
готовности для имеющихся и новых интенсивных технологий
микробиологических производств. 0В последние годы на предприятиях России широко
применяют новое оборудование, изготовленное заводами Мин-
химмаша.Разработаны и серийно выпускаются ферментаторы для
производства кормовых дрожжей, лизина и антибиотиков
(дрожжерастил ьный аппарат АДР-900-1К-01, ферментаторы
объемом 630 и 1250 м3, ферментаторы объемом 2,5; 6,3; 10; 16
и 63 м3 для асептических процессов). Изготовляются распы¬
лительные сушилки, сепараторы, выпарные установки, гидро-
лизаппараты периодического действия вместимостью 25, 50 и
80 м3, пластинчатые теплообменники, фильтры и другое обо¬
рудование.Выпущен опытный образец колонного газлифтного фермен¬
татора объемом 320. м3 для производства белка из спиртов.
Инженерное осуществление биотехнологий20»Рекомендованы к серийному производству ферментаторы
объемом 0,005; 0,025; 0,10 и 0,25 м3 для культивирования микро¬
организмов на микроносителях.В рамках комплексной программы научно-технического-
прогресса создаются новые аппараты и установки, в том числе:ферментатор вместимостью 200 м3 для выращивания кормо¬
вых дрожжей на гидролизатах с содержанием сахаров до 3,5%;сепарационная установка с применением микропроцессорной
техники производительностью 250 и 450 м3/ч по исходной сус¬
пензии для производства кормовых дрожжей;грануляционные установки с сушкой в псевдоожижженном
слое;мембранные установки для стерилизующей микрофильтра¬
ции и др.Проводятся научно-исследовательские и опытно-конструк¬
торские работы по созданию и отработке новых интенсивных тех¬
нологий высокотемпературного и ферментативного гидролиза,
технологии культивирования кормовых дрожжей на основе аэра¬
ции кислородно-воздушной смесью с замкнутым циклом подачи
газа, что улучшает экологию, повышает производительность
оборудования.Ниже будут коротко рассмотрены важнейшие, на наш
взгляд, проблемы бактериального синтеза. Подробнее остано¬
вимся на трактовке понятия «лимитирующая концентрация кис¬
лорода», а также на ее физиолого-биохимической роли при реа¬
лизации процессов биосинтеза с использованием бактериальных
продуцентов. Проблема заключается в том, что влияние аэра¬
ции и перемешивания среды при культивировании микроорга¬
низмов обычно не разделяют и применяют термин «интенсив¬
ность аэрации», что означает одновременно изменение количества
и качества газа, поступающего в аппарат, или интенсивность
перемешивания среды.В опытах с одинаковой интенсивностью аэрации (по парци¬
альному давлению кислорода р02), но различающихся интен¬
сивностью перемешивания среды, нами установлено, что лизин-
синтезирующая активность и удельная скорость роста проду¬
цента лизина Br. flavum 22ЛД меняются в зависимости от
интенсивности перемешивания. Мы стремились выяснить влия¬
ние интенсивности перемешивания среды (при неизменном р02)
на физиологическую активность продуцента лизина, а также
важнейшие факторы (концентрация, срезовые усилия и др.) и
последствия (физиологические, биохимические, морфологичес¬
кие и др.) в бактериальных системах культивирования (раздел
4.1). Следует отметить, что в определенных околооптимальных
пределах эффективные концентрации субстратов, в том числе14 - 361
кислорода, и интенсивность перемешивания являются альтер¬
нативными факторами, т. е. имеют одинаковое (равноценное)
влияние на процессы бактериального (микробного) синтеза.4.1. ВЛИЯНИЕ ЛИМИТИРУЮЩИХ
КОНЦЕНТРАЦИЙ СУБСТРАТОВ
НА ПРОЦЕССЫ КУЛЬТИВИРОВАНИЯСогласно классическим представлениям, при росте и биосинтезе
один из субстратов является лимитирующим — определяющим
кинетику популяции. Развивается теория двух- и многосуб¬
стратного лимитирования, точнее многофакторные кинетические
зависимости удельной скорости роста от условий культивирова¬
ния [2]. Общеизвестно замедление процессов при накоплении
продукта (-ов), в том числе биомассы. В конечном итоге проб¬
лема сводится к оптимизации условий культивирования, теорию
которой в течение ряда лет развивает, в частности, В. В. Би¬
рюков. Однако проблема в значительной степени осложняется
следующим.1. Единственным в настоящее время экономически прием¬
лемым источником кислорода является воздух, следовательно,
максимальная концентрация этого субстрата в культуральной
жидкости при 30 °С не превышает 7 мг/л. На практике эта
концентрация приближается к нулю в течение нескольких ми¬
нут или даже секунд, что обусловливает необходимость непре¬
рывного продувания системы культивирования воздухом. А это,
в свою очередь, означает, что одновременно необходимо обеспе¬
чить массопередачу на фазовых переходах жидкость — клетка
и газ — жидкость. Кроме того, наличие воздушной фазы ос¬
ложняет гомогенизацию содержимого биореаКтора (образование
пены, флотация и т. д.). Поддержание концентрации кислорода
в среде выше 7 мг/л пока приемлемо только в экспериментах.2. Перемешивание культуральной жидкости влияет не только
на массопередачу через фазовые переходы, но и на все про¬
цессы сложной системы культивирования, в том числе на мор¬
фологические и физиологические свойства микробных популя¬
ций. Некоторые продуценты весьма чувствительны к срезовым
усилиям, которым подвергаются клетки в микропотоках, а
также при взаимодействии с мешалками и другими конструкци¬
онными элементами внутри биореакторов.Таким образом, проблема оптимизации системы аэробного
культивирования сводится к пониманию и оптимизации условий
аэрации и перемешивания. Иными словами, среди факторов
оптимизации в числе обязательных должны быть характерис¬
тики этих величин. А достоверная индикация и обеспечение
Инженерное осуществление биотехнологий211интенсивности аэрации и перемешивания опять представляют
собой центральную задачу современной биоинженерии.Специалисты по математическому описанию кинетики
микробных популяций чаще всего начинают свои рассуждения
с допущения, что кислород не лимитирует процесс. В работах
[8, 14, 27, 50] авторы оперируют понятием «критическая кон¬
центрация кислорода». В литературе 70-х годов можно
найти утверждения, что критическая концентрация характерна
для культуры, а не для условий культивирования. Фактически,
как это было нами впервые показано в 1973 г. [16] на примере
с кислородом, ситуация значительно сложнее: в определенных
пределах концентрация субстрата (кислорода) и интенсивность
перемешивания являются альтернативными факторами. В экс¬
перименте с газовой смесью (02, N2, воздух) для стабилизации
р02 при изменении частоты вращения вала мешалки было по¬
казано, что изменение концентрации кислорода или интенсив¬
ности перемешивания приводит к одинаковому эффекту: уве¬
личению или снижению удельной скорости роста. При этом
наблюдаются глубокие морфологические, биохимические, фи¬
зиологические изменения в структуре и функциях популяции,
которые трудно идентифицируются и интерпретируются.4.1.1. КОНЦЕНТРАЦИЯ СУБСТРАТА
В РАЗЛИЧНЫХ УСЛОВИЯХ ПЕРЕМЕШИВАНИЯ
И СКОРОСТЬ ЕГО ПОТРЕБЛЕНИЯНеобходимость искусственного выращивания микроорганизмов
привела к созданию управляемых условий культивирования,
идеализированная схема которых на уровне внешней среды
представлена в работе ,[7, с. 195]. В общем случае смысл уп¬
равляемости заключается в обеспечении оптимальной концен¬
трации конкретного субстрата на поверхности соответствующей
внутриклеточной мембраны (на которой происходит конкретная
энзиматическая реакция), а также в отводе продукта реакции.
Отсюда следует, что обеспечение оптимальной концентрации
субстрата возможно только при непрерывной его доставке к
месту реакции. Поскольку метаболизм у бактерий обеспечива¬
ется, как известно, сотнями энзиматических реакций, в том
числе на специфических поверхностях мембран, при этом часть
транспортных процессов также катализируется ферментами,
оптимизация всей системы (т. е. создание управляемых усло¬
вий) исключительно сложна. Однако измерение и регулирова¬
ние внутриклеточных потоков длинных цепей превращения суб¬
страт — продукт в практике культивирования при имеющемся
уровне инструментализации практически невозможны. В связи
212Глава 4Рис. 4.1. Изменение активности аконитазы (а), фруктозо-1,6-бисфосфат-
альдолазы (б) и величины qs (в) в зависимости от концентрации саха¬
розы Sun:1 — 300 об/мин; 2 — 800 об/минс этим оптимизацию проводят по величинам, поддающимся из¬
мерению и управлению.В эксперименте основную ферментацию проводили в аппа¬
рате ФУ-8 непрерывным способом по принципу хемостата и
периодическим способом. Среды культивирования были приго¬
товлены на синтетической или кукурузно-мелассной основе (осо¬
бенности культивирования описаны ранее). Переменным факто¬
ром среды была концентрация сахарозы или мелассы, которую,
в зависимости от цели исследований, меняли в пределах 1... 16%
(по сахарозе). В процессе периодического культивирования в
некоторых опытах проводили дробную подпитку сахарозой или
мелассой до увеличения концентрации сахарозы на 2,2%.Частота вращения мешалки в различных опытах соответст¬
вовала 300 и 800 об/мин, температура — 30±0,5°С, интенсив¬
ность аэрации — 15 ... 20% от насыщения, pH 7,2 ... 7,6.Результаты эксперимента приведены на рис. 4.1. Из полу¬
ченных данных вытекает общая тенденция изменения метабо¬
лизма продуцента: снижение активности ферментов ЦТК
приводит к увеличению активности ферментов гликолиза и ско¬
рости потребления сахарозы или глюкозы клетками. Одним из
факторов, регулирующих соотношение активности систем транс¬
порта, ферментов гликолиза и ЦТК, является изменение кон¬
центрации сахарозы в среде. Однако снижение активности
ферментов ЦТК при увеличении концентрации сахарозы выше
3% установлено как в комплексных средах на кукурузно-мелас¬
сной основе, так и в синтетических средах только при высоких
скоростях перемешивания среды.
Инженерное осуществление биотехнологий213Рис. 4.2. Изменение активности аконитазы" (а) и фос¬
фофруктокиназы (б) у Br. flavum 22ЛД в условиях
непрерывного культивирования £> = 0,1 ч-1 при л =
= 1000 об/мин (/) и л=500 об/мин (2) в зависимости
от интенсивности аэрации р02Следовательно, критические концентрации сахарозы, вызы¬
вающие снижение активности ферментов ЦТК, повышение ак¬
тивности ферментов гликолиза и скорости транспорта сахаров
в клетку, даже при постоянном значении р02 меняются в зави¬
симости от скорости перемешивания среды. При культивирова¬
нии Br. flavum 22ЛД в ферментаторах ФУ-8 в среде на куку-
рузно-мелассной основе критические концентрации сахарозы
снижаются при увеличении скорости перемешивания среды от
300 до 800 об/мин.Можно отметить, что данные особенности переключения ме¬
таболизма от ЦТК на гликолиз при изменении скорости пере¬
мешивания среды не связаны с возникновением обратной реак¬
ции эффекта Пастера, так как активность ЛДГ при этом равна
нулю. Возможно, снижение активности ферментов ЦТК при вы¬
сокой скорости перемешивания среды связано с инактивирую¬
щим действием кислорода при увеличении интенсивности его
массопередачи на переходе жидкость — клетка.Аналогичные особенности функционирования системы
транспорта, ферментов гликолиза и ЦТК установлены также в
непрерывных условиях культивирования при использовании в
качестве переменных факторов интенсивности аэрации при ско¬
рости протока среды 0,1 ч-1 (рис. 4.2).Скорость потребления сахаров клетками при этом показана
на рис. 4.3.Таким образом, нами установлено, что при отсутствии лими¬
тирования процесса кислородом имеется определенная связь
между активностью ферментов ЦТК (например, аконитазы) и
гликолиза (фруктозо-бисфосфат-альдолаза) и скоростью транс¬
порта глюкозы или сахарозы в клетки. Например, у Br. flavum
22ЛД при максимальной активности аконитазы скорость транс¬
порта глюкозы соответствует 0,2 г/ч на 1 г клеток, при макси-
Рис. 4.3. Изменение скорости потребления
о * <п п п сахаров qs у Br. flavum 22ЛД в условиях,.
* о 1ир02)КПа аналогичных рис. 4.2 *мальной активности фруктозо-бисфосфат-альдолазы у растущей
культуры — 0,42 г/ч на 1 г клеток. Данная закономерность
сохраняется при различных скоростях перемешивания среды в
условиях культивирования бактерий в средах с определенным
составом ингредиентов. Можно заключить, что именно скорость
перемешивания является фактором, меняющим активность фер¬
ментов катаболизма глюкозы у Вг. flavum 22ЛД.В контексте нашей основной проблемы можно сделать вы¬
вод, что концентрация, интенсивность перемешивания и ско¬
рость потребления субстрата (-ов), такие физиологические ха¬
рактеристики, как ц,, qp, Yp/s и др., характеризуют состояние
популяции. Фактически для управления процессом следует вы¬
брать тот параметр (группу параметров), который (-ые) легче
поддаются инструментализации. С учетом технических возмож¬
ностей реализации наиболее приемлемой является скорость
потребления кислорода qогили Qo2. Более того, для продуцен¬
тов со сложным метаболизмом, например рода Brevibacterium
(мутант, альтернативы путей метаболизма и дыхательной цепи),
теория односубстратного лимитирования устарела. Фактически,
как это будет показано далее, управление следует вести по
важнейшим физико-химическим параметрам внешней среды и
нескольким, наиболее просто поддающимся непосредственному
измерению или рассчитываемым физиологическим величинам.4.1.2. РОСТ И СИНТЕЗИРУЮЩАЯ АКТИВНОСТЬ
ПРОДУЦЕНТОВ ЛИЗИНАОтветные реакции популяций бактериальных культур на изме¬
нения интенсивности перемешивания очень разнообразны.
Однако их интегральное влияние лучше всего выражается че¬
рез рост и синтезирующую активность. Эти показатели были
выбраны в качестве определяющих.Среда для периодического культивирования содержала (%):
мелассы — 7,5 (по сахару); кукурузного экстракта — 2,0 (по
сухому веществу); (NH4)2S04 — 2,0; КН2Р04 —0,05; К2НР04 —
0,05. Интенсивность регулирования аэрации изменением коли¬
чества поступающего кислорода или азота в аэрирующем газе
Инженерное осуществление биотехнологий215Таблица 4.1. Условия аэрации и перемешивания среды
при периодическом культивированииро2Длительность про¬Частота вращенияВариантцесса,чкПак гс/см2мешалки п, об/минА0... 15100,10300015...6010,013000Бо... 15100,10Без мешалки15...6010,01и tiВ0... 15100,1050015...6010,01500характеризовали величиной парциального давления кислорода.
В работе применяли дифференциальный режим аэрации: р02=
= 10 кПа в первые 15 ч культивирования, р02=1 кПа в тече¬
ние последующих часов культивирования (табл. 4.1).При наивысшей в условиях нашего опыта интенсивности
перемешивания среды — 3000 об/мин (рис. 4.4, кривая 1) —
сокращалась длительность лаг-фазы. Максимальная удельная
скорость роста культуры при л=3000 об/мин была к 10-му часу
культивирования, а при л = 500 об/мин (вариант В) — к 15-му
часу; при использовании аппаратуры без мешалки (рис. 4.4,
кривая 2) — к 15... 20-му часу. В зависимости от интенсив¬
ности перемешивания менялась и максимальная удельная ско¬
рость роста клеток. При /г=3000 об/мин она достигала 0,184 ч-1,W1 №'(ч-г)Рис. 4.4. Изменение удельной скорости роста клеток (а) и интенсивность
потребления сахаров (б) культурой Br. flavum 22ЛД в процессе периоди¬
ческого культивирования:1 — 3000 об/мин; 2 — перемешивание поступающим воздухом; 3 — 500 об/мин
216Глава 4К г/лРис. 4.5. Изменение концентрации лизина Р (а) и лизинсинтезирующей ак¬
тивности (б) у Br. flavum 22ЛД в процессе периодического культивирования
в зависимости от интенсивности перемешивания среды:/ — зооо об/мин; 2 — перемешивание поступающим воздухом; 3 — 500 об/минпри п—500 об/мин — 0,202 ч-1, в аппарате без мешалки —
0,157 ч-‘.Таким образом, для достижения максимальной удельной
скорости роста клеток оптимальным в данных условиях куль¬
тивирования являлось перемешивание при п=500 об/мин. При
такой интенсивности перемешивания содержание биомассы к
60-му часу культивирования достигало 16,6 г/л, в то же время
в варианте без мешалки — 13,5, при /г=3000 об/мин —11,6 г/л.Росту культуры при высокой интенсивности перемешивания
среды, по-видимому, способствовало интенсивное потребление
клетками компонентов, в том числе сахаров мелассы. Количе¬
ство сахара, потребленного единицей биомассы (рис. 4.4, б) в
первые часы культивирования, оставалось самым низким в ва¬
рианте, где аппаратура работала без мешалки. В более поздние
сроки культивирования (от 40 до 60 ч) не наблюдалось строгой
корреляции между интенсивностью перемешивания среды и
потреблением сахаров клетками, так как содержание остаточ¬
ного сахара в системе в разных вариантах в этот промежуток
времени было неодинаковым.Высокая интенсивность перемешивания среды отрицательно
влияла на биосинтез лизина. Если без перевешивания содер¬
жание лизина к 60-му часу культивирования достигало 20,4 г/л,
то при л=500 об/мин оно составляло 16,4 г/л, при п—
= 3000 об/мин — 11,6 г/л (рис. 4.5, а). Интенсивность образо¬
вания лизина единицей биомассы (рис. 4.5, б) после достиже¬
ния фазы с максимальной удельной скоростью роста клеток
была наиболее высокой при наименьшей интенсивности переме¬
шивания среды.
Инженерное осуществление биотехнологий21720 40 6020 40 60
д20 40 60 г,чгеРис. 4.6. Динамика активности аконитазы (а), малатдегидрогеназы
(б), сукцинатдегидрогеназы (в), лактатдегидрогеназы (г), глюкозо-
6-фосфат-дегидрогеназы (д) и ОВА клеток (е) у Br. flavum 22ЛД
в процессе периодического культивирования в зависимости от ин¬
тенсивности перемешивания среды:I — 3000 об/мин; 2 — перемешивание поступающим воздухом; 3 — 500 об/минПри изменении интенсивности перемешивания среды меня¬
ется также активность ферментов метаболизма углеводов и
содержание основных клеточных компонентов. При п=
= 3000 об/мин быстро наступала логарифмическая фаза роста
и повышалась активность дегидрогеназ ЦТК (рис. 4.6, кри¬
вая /), но к 40-му часу культивирования снижалась до нуля.
Активность сохранялась дольше у малатдегидрогеназы. При
этом снижалась активность лактатдегидрогеназы и глюкозо-
6-фосфат-дегидрогеназы, а также ОВА клеток.Умеренное перемешивание среды (га=500 об/мин) также
тормозило повышение активности дегидрогеназ ЦТК после пе¬
рехода клеток в фазу замедленного роста (рис. 4.6, кривая 3),
тогда как в варианте без применения турбинной мешалки
(рис. 4.6, кривая 2) удельная активность дегидрогеназ ЦТК
после достижения фазы замедленного роста возрастала. Таким
образом, интенсивность синтеза лизина этой культурой зависит
от активности дегидрогеназ ЦТК и, возможно, от интенсивности
метаболизма через ЦТК. Особенно очевидна корреляция ли-
зинсинтезирующей активности культуры qp с активностью
сукцинатдегидрогеназы (см. рис. 4.5, б и рис. 4.6).При повышении интенсивности перемешивания среды уве¬
личивается удельная скорость роста клеток, что, очевидно,
218Глава 4сивности перемешивания среды:/ — 3000 об/мин; 2 — перемешивание поступающим воздухом; 3 — 500 об/минсвязано с повышением интенсивности синтеза клеточных компо¬
нентов— РНК, белка, кислоторастворимых нуклеотидов, амино¬
кислот обменного фонда (рис. 4.7, кривая 2). Содержание ДНК
в клетках почти не зависит от интенсивности перемешивания
среды. При /г=3000 об/мин содержание клеточных компонен¬
тов у Br. flavum 22ЛД к 20-му часу культивирования резко
снижается (рис. 4.7, кривая /).Следует отметить, что при л=500 об/мин с максимальной
удельной скоростью роста клеток (jli=0,202 ч-1) содержание
РНК в клетках достигает 24,4%, при 3000 об/мин с |ыМакс =
= 0,184 ч-1 и в варианте без мешалки с |лМакс=0,157 ч-1 — 21
и 19%. Содержание белка в клетках при этом составляет 40,
36 и 34% на массу сухих клеток. Следовательно, имеется пря¬
мая корреляция между содержанием РНК и белка в клетках и
удельной скоростью их роста.На рис. 4.8 и 4.9 показана динамика продуктивности обра¬
зования биомассы гх и лизина гр.На основании полученных данных можно сделать вывод,
что парциальное давление кислорода в системах глубинного
культивирования не является параметром, полностью характе¬
ризующим условия интенсивности аэрации: при неизменном рО*
активность метаболических реакций и одновременно удельная
.Инженерное осуществление биотехнологий219Рис. 4.8. Изменение продуктив¬
ности процесса по лизину
при культивировании Br. fla¬
vum 22ЛД в условиях непре¬
рывного культивирования и =
= 0,1 ч-1 в зависимости от
интенсивности перемешивания
среды и р02:1 — 500 об/мин; 2 — 1000 об/мин10р02,кПаРис. 4.9. Изменение продуктив¬
ности процесса по биомассе в
условиях, соответствующих
рис. 4.8скорость роста и лизинсинтезирующая активность у продуцента
лизина Br. flavum 22ЛД меняются с изменением интенсивности
перемешивания среды. Лизинсинтезирующая активность про¬
дуцента непосредственно связана с активностью дегидрогеназ
ЦТК. То же происходит при стабилизации р02 и изменении
интенсивности перемешивания.Изменение интенсивности перемешивания, очевидно, меняет
характер транспорта кислорода не только на границах раздела
фаз газ — жидкость, но и жидкость — клетка. Возможно, это
приводит к изменению транспорта других компонентов среды.
Регуляцию роста культуры и синтеза метаболита технически
трудно доказать изменением содержания компонентов среды в
клетках (например, кислорода и др.). Однако мы предполагаем,
что одновременное ингибирование или репрессия дегидрогеназ
ЦТК и снижение лизинсинтезирующей активности культуры
связано с увеличением интенсивности перехода кислорода, са¬
харов или других компонентов по системе жидкость — клетка
в зависимости от скорости перемешивания среды. На основании
полученных данных можно констатировать, что основным регу¬
лирующим фактором продуктивности процесса является ско¬
рость перемешивания среды: высокая скорость увеличивает
продуктивность процесса по биомассе, снижает продуктивность
по лизину.Таким образом, изменение интенсивности аэрации и пере¬
мешивания приводит к изменению физиологии и морфологии
продуцента. В целом в определенных пределах подтверждается
альтернативная роль этих двух факторов: концентрация любого
220Глава 4субстрата (-ов) или интенсивность перемешивания. Однако экс¬
периментальное выявление чистого эффекта перемешивания
или аэрации настолько сложно, а физиологические последствия
изменений этих величин настолько существенны, что мы ре¬
шили отдельно исследовать регуляцию метаболизма Br. flavum
этими двумя важнейшими факторами внешней среды.4.1.3. БИОХИМИЧЕСКИЕ РЕАКЦИИ Brevibacterium flavumРегуляторное действие скорости перемешивания среды выража¬
ется в изменении активности ферментов центральных метаболи¬
ческих путей в клетках и зависит также от концентрации глю¬
козы или сахарозы в среде, что, в свою очередь, приводит к
изменениям скорости их транспорта в клетку. Можно предпо¬
лагать, что, кроме концентраций субстратов, растворенных 02
и С02 в среде, регулирующим фактором метаболизма при этом
являются также гидродинамические факторы ферментационной
жидкости, приводящие к структурным и функциональным из¬
менениям клеток.Нами были получены данные, свидетельствующие об изме¬
нении регуляторного воздействия скорости перемешивания
среды у Br. flavum и концентрации сахаров ,при постоянных
значениях р02 (применяли смесь газов: воздух, 02, N2); сопо¬
ставлены гидродинамические характеристики среды и скорости
биохимических реакций и метаболических потоков в. клетках.В качестве объектов исследования использовали Br. flavum
22ЛД и Br. flavum RC 115. Культивирование проводили в фер¬
ментаторах ФУ-8 с двухъярусными турбинными мешалками.
Рабочий объем равнялся 3 л. Были использованы среды, содер¬
жащие 1 ... 15% (по РВ) сахарозы или мелассы, 2% (по СВ) —
кукурузного экстракта, 2% — (NH4)2S04, по 0,05% КН2Р04
и К2НР04. Температура культивирования составляла 30 °С, ин¬
тенсивность аэрации, регистрируемая по парциальному давле¬
нию кислорода, — 30% от насыщения, что в различных усло¬
виях перемешивания достигалось изменением соотношений
объемов воздуха и азота в аэрируемом газе; частота вращения
мешалки — 300... 1000 об/мин. При р02 = 30% не наблюдается
ни лимитирования, ни ингибирования кислородом.Кинетическую энергию флуктуаций потока среды еу которая
количественно характеризует гидродинамическую обстановку в
биореакторе, определяли методом, приведенным в работах [15,
54], который основывается на преобразовании воздействия по¬
токов среды в пропорциональный электрический сигнал пьезо¬
электрическим датчиком. При этом можно определить введен¬
ную в биореактор энергию в разных точках аппарата.
Инженерное осуществление биотехнологий221Характеристики среды при перемешивании определяли в
горизонтальной плоскости, высота которой соответствовала се¬
редине высоты верхней мешалки. Такой выбор был обоснован
тем, что в этой зоне значения диссипируемых энергий и их
градиентов наибольшие. Вязкость среды г] измеряли вискози¬
метром «Реотест-2».Предварительные опыты показали, что в ферментаторе су¬
ществуют зоны с повышенными значениями еу при прохождении
которых происходят существенные физиолого-биохимические из¬
менения в клетках. Указанные величины е были обозначены
как екр. Для определения вероятности W пребывания клеток в
зоне, где е>екР, было использовано уравнениеW=TKP/Tt (4.1)где Ткр — время пребывания клеток в критической зоне; Т —
средняя продолжительность пребывания клетки в биореакторе
(или длительность прохождения всех зон).Расчеты Ткр и Г и результаты соответствующих эксперимен¬
тов, проведенных инж. Ю. Я. Ванагсом, позволили рекомендо¬
вать критерий Ф стресса для учета степени воздействия потока
среды на клетку в зависимости от величины е:ГКР гкрФ= / Щ~е(г)=Ткр /e{r)dr' (42)о огде гкр — радиус критической зоны; п — частота вращения
мешалки; V — объем перемешиваемой среды.При этом принимается:1) степень воздействия потока среды на клетку пропор¬
циональна произведению dt(r)[e(r)—eкр], где dt(r) — время
пребывания клетки в полосе dr на расстоянии г от мешалки;2) при всех значениях е>екР оказывается одинаковое воз¬
действие на клетку.Из рис. 4.10 следует, что при низкой скорости перемеши¬
вания среды повышение концентрации сахарозы у Br. fla¬
vum приводит к некоторому увеличению активности ферментов
ЦТК, снижению активности ферментов гликолиза, повышению
скорости роста и синтеза лизина клетками. Активность лактат-
дегидрогеназы при этом равняется нулю.При повышении концентрации сахарозы от 2,5 до 10% в
условиях высокой частоты вращения мешалки (1000 об/мин)
наблюдаются признаки, характерные для эффекта Кребтри
(см. рис. 4.10, г): повышается активность ферментов фосфо¬
фруктокиназы, малатдегидрогеназы, глутаматдегидрогеназы, а
также лактатдегидрогеназы, снижается активность аконитазы
’222Глава 4Рис. 4.10. Изменение параметров физиологической активности и активности
ферментов метаболизма у Br. flavum 22ЛД в зависимости от интенсивности
перемешивания среды (р02 = 30% от насыщения):1 — qp\ 2 — \i\ 3 — qs; 4 — фосфофруктокиназа; 5 — лактатдегидрогеназа; 6 —
аконитаза; 7 — глутаматдегидрогеназа; 8 — сукцинатдегидрогеназа; 9 — малатде-
гидрогеназа; а и в — 300 об/мин; 6 иг — 1000 об/мини сукцинатдегидрогеназы. В данных условиях повышается ин¬
тенсивность эндогенного дыхания клеток, регистрируемая по
ОВА клеток (рис. 4.11, а), снижается активность диаминопи-
мелинат-декарбоксилазы (рис. 4.11, б).Увеличивается содержание РНК, белка (рис. 4.12) и удель¬
ная скорость роста клеток.При более высоких концентрациях сахарозы (10... 15%) и
скорости перемешивания среды резко снижается активность
всех ферментов центральных метаболических путей, содержание
Инженерное осуществление биотехнологий223Со*k0» 30§1е- ыго&0ш\12 16Рис. 4.11. Зависимость ОВА клеток (а) и активности диаминопимелинат-
декарбоксилазы (б) у Br. flavum 22ЛД от интенсивности перемешивания
среды:/ — 300 об/мин; 2 — 1000 об/минРНК, ДНК, белка и ОВА клеток. Это подтверждается
рис. 4.10 ... 4.12.Аналогичные данные были получены при культивировании
бактерий на синтетических средах (табл. 4.2). При этом пока¬
зано, что в условиях возникновения эффекта Кребтри (S>5%,
/г= 1000 об/мин) возрастает скорость потребления кислорода
клетками.Активность ферментов метаболизма Br. flavum изменяется
при интенсивной аэрации в ферментаторе (рис. 4.13), а также
при прямом ингибировании переноса электронов по дыхатель¬
ной цепи [29, 48, 49]. Снижается активность ферментов ЦТК,
повышается активность ферментов гликолиза и в условиях от¬
сутствия лимита по ингредиентам среды увеличивается скорость
потребления сахарозы до уровня, обеспечивающего постоянную
скорость синтеза АТР в клетках.Появление эффекта Кребтри в условиях высокой интенсив¬
ности перемешивания среды не может быть истолковано регу-°ШРис. 4.12. Изменение содержания РНК (я), ДНК (б) и белка (в) у Вг.
flavum 22ЛД в зависимости от интенсивности перемешивания среды (усло¬
вия эксперимента см. на рис. 4.10):1 — 300 об/мин; 2 — 1000 об/мин
224Глава 4Рис. 4.13. Изменение активности ако¬
нитазы в зависимости от частоты
вращения мешалки (об/мин):1 — 500; 2 — 600; 3 — 700; 4 — 800;
5 — 1000 (Условия эксперимента: рОг-
=30%, S=2,5. . . 15%)ляторным воздействием повышенных концентрации сахарозы,
так как при низкой интенсивности перемешивания среды анало¬
гичный эффект не наблюдается. Можно привести несколько при¬
чин образования данного эффекта Br. flavum в условиях ин¬
тенсивного перемешивания среды:Таблица 4.2. Зависимость активности ферментов метаболизмаи величины qQi у Br. flavum 22ЛД от концентрации
глюкозы и скорости перемешивания средыФосфофрук-токиназаАконитазаЛактатдегидро-геназаАктивность, катал • 10"“ на 1 мг белкаЧОг *
ммоль/(г • ч)2,52769п = 300 об/мин
560207,524707401615,01963570162,52347л = 500 об/мин
670227,526227802615,0254161о •232,53104л = 800 об/мин
5912197,5417948995215,0181239134292,52171/1=1000 об/мнн
530287,56084332308315,01105153093
Инженерное осуществление биотехнологий225Рис. 4.14. Зависимость вязкости куль¬
туральной среды г] от концентрации са¬
харозыS,%1) увеличение скорости передачи кислорода по системе
жидкость — клетка (регуляторное воздействие перемешивания
среды при этом аналогично таковому при увеличении рОг);2) изменение свойств мембран, в том числе вследствие по¬
вреждения ферментов окислительного фосфорилирования. Кос¬
венным утверждением этого является резкое снижение скорости
потребления сахарозы клетками в условиях высокой скорости
перемешивания (см. рис. 4.10);.3) образование зон с недостаточной массопередачей кисло¬
рода.При высокой скорости вращения мешалки в аппаратах с
турбинными мешалками наблюдается неравномерное распреде¬
ление вводимой энергии е по рабочему объему ферментатора.
Это особенно заметно при высоких концентрациях сахарозы,
когда повышается вязкость среды (рис. 4.14). При этом в пери¬
ферийной зоне ферментатора резко снижается величина микро¬
перемешивания среды Kr. Можно предположить, что в пери¬
ферийной зоне возникает недостаточная массопередача кислорода
в системе жидкость — клетка, так как при этом снижа¬
ется активность аконитазы — ключевого фермента аэробного
метаболизма. На оснозании данных растворимости кислорода в
средах с концентрациями сахарозы от 1 до 16% (от 2,32-104
до 1,85-10-’4 М) нами показано, что при содержании биомассы
30 г/л и величине р02 = 30% концентрация 02 может снизиться
до нуля за 2...3 с [21]. Однако время прохождения клеток
через все зоны ферментатора по подсчетам, проведенным со¬
гласно методике Ю. Я. Ванагса, существенно меньше — 0,1 ...
...0,5 с. Следовательно, можно предположить, что возникновение
эффекта Кребтри в рассмотренных выше условиях не связано15 — 361
Смаке, УЫ ейРис. 4.15. Зависимость максимальной
вводимой энергии еМакс в ферментаторе
ФУ-8 от частоты вращения мешалки
при концентрации сахарозы 5 (/), 7,5-
(2) и 10% (3)200 400 600 800 1000 1200
/7, од/минс недостаточной массопередачей Ог в клетках, находящихся в
периферийной зоне ферментатора.Таким образом, более вероятной причиной возникновения
эффекта Кребтри при высокой скорости перемешивания среды
могут быть изменения в мембранах при возникновении значи¬
тельных градиентов локальных потоков среды.Для подтверждения данной гипотезы мы выявили распре¬
деление введенной энергии по объему ферментатора в указан¬
ных условиях культивирования. При концентрации сахарозы
5... 10% и л>700 об/мин в зоне мешалки резко возрастало
количество введенной энергии (рис. 4.15). Вероятность пребы¬
вания клеток в этой зоне также увеличивалась (рис. 4.16). Для
характеристики срезового действия потоков среды на' клетки
был использован фактор стресса, учитывающий величину вве¬
денной энергии е и время пребывания клеток в критической
зоне. Из данных рис. 4.17 следует, что срезовое действие пото¬
ков культуральной жидкости увеличивается при 5>5% и
п>700 об/мин. Именно в этих условиях возникает эффект
Кребтри. Можно предположить, что при некотором значении е
происходит срезовое воздействие на мембраны клеток. Данную»?,%1210в642клеток в зоне ферментатора с е>еКри it | | I 1 Рис. 4.16. Вероятность Р пребывания 7QQ S00 900 1000 J'nn 'r'"9
Инженерное осуществление биотехнологий227(J J / 1Г* п л/?Рис. 4.17. Показатель срезового действия
потока среды на клетки, учитывающий
продолжительность их пребывания в кри¬
тической зоне.4321О700 800 900 1000 1Ю0 1200
п, од/М и,чвеличину е можно считать екр. При е>екр снижается актив¬
ность аконитазы — фермента ЦТК (см. рис. 4.13).Следовательно, можно предположить, что одним из факто¬
ров, приводящих к возникновению эффекта Кребтри, является
срезовое действие потоков среды, вызванное градиентом вводи¬
мой энергии в центральной и периферийных зонах фермента¬
тора. Увеличение значения е вблизи мешалки при S>5% можно
объяснить повышением вязкости среды (см. рис. 4.14).На основании результатов экспериментов с Br. flavum
можно заключить, что постепенным повышением количества вво¬
димой энергии в зону мешалки можно добиться изменения фи¬
зиологического состояния клеток:1) клетки с функционирующим полным ЦТК, характеризу¬
ющиеся высокими значениями qP и Ур/s;2) клетки с выраженным эффектом Кребтри, образующие
разомкнутый ЦТК, с увеличенной активностью глутаматдегид¬
рогеназы, лактатдегидрогеназы, ферментов гликолиза и ГМП,
повышенным содержанием РНК, белка и высокой ОВА кле¬
ток; JH близко К ^макс;3) клетки с низкой активностью ферментов метаболизма, а
также с заниженными величинами qst qp> |ы и др., т. е. клетки
в состоянии, которое нами названо состоянием турбогипобиоза;4) морфологически поврежденные клетки;5) очевидная дезинтеграция популяции.Можно предположить, что причиной регуляторного воздей¬
ствия скорости перемешивания среды на скорости биохимиче¬
ских реакций в клетках Br. flavum является изменение мембран¬
ного электрохимического потенциала (Д^хн+) при е>ек? в зонемешалки. При некотором снижении Ajlih+ скорость роста под¬
держивается дополнительным потреблением субстрата и изме¬
нением активности ферментов согласно эффекту Кребтри.Дальнейшее повышение е и, очевидно, снижение Д|1н+ приводят15*
228Глава 4к более существенным изменениям структуры клеток, при кото¬
рых они не способны воссоздать нормальное физиологическое
состояние.Следовательно, для обеспечения определенной удельной ско¬
рости роста клеток или синтеза ими продукта в процессе фер¬
ментации необходимо поддерживать соответствующую величину
е в зоне мешалки. Сказанное особенно важно при использова¬
нии мицелиальных культур (например, микромицетов рода Tri-
choderma и др.) и сред с повышенной вязкостью или содержа¬
щих нерастворимые субстраты.4.1.4. ТУРБОГИПОБИОЗ МИКРОБНЫХ ПОПУЛЯЦИЙРанее нами было показано, что концентрация растворенного
кислорода и интенсивность перемешивания существенно влияют
на биохимический состав, ультраструктуру, активность фермен¬
тов метаболизма, а также на удельную скорость роста, лизин-
синтезирующую активность и коэффициент конверсии углерода
у Brevibacterium. Кроме того, установлено, #что критические
концентрации углеродного субстрата, вызывающие снижение
активности ферментов ЦТК, повышение активности ферментов
гликолиза и скорости транспорта сахаров в клетки, даже при
постоянном значении парциального давления кислорода меня¬
ются в зависимости от интенсивности турбулизации среды.На основании результатов экспериментов можно сделать
вывод, что парциальное давление кислорода в системах глу¬
бинного культивирования не является параметром, вполне ха¬
рактеризующим условия интенсивности аэрации, — при неиз¬
менном парциальном давлении кислорода активность метаболи¬
ческих реакций, удельная скорость роста, лизинсинтезирующая
активность, скорость потребления углеродного субстрата меня¬
ются с изменением интенсивности турбулизации среды.В табл. 4.3 приведены данные опытов, при проведении ко¬
торых для стабилизации концентраций кислорода применяли
газовые смеси. При постепенном повышении турбулизации
среды (на всех исследуемых уровнях р02) снижались удельная
лизинсинтезирующая активность, активность аконитазы — клю¬
чевого фермента ЦТК, коэффициент конверсии сахаров в лизин
Yp/S у Br. flavum 22ЛД. Максимум лизинсинтезирующей ак¬
тивности, высокие активность аконитазы и значения YP/S при
неизменном р02 — 10% — имели место при интенсивности
перемешивания среды 800 об/мин; при р02, равном 20 и 50%
от насыщения, — при минимальной интенсивности перемешива¬
ния. Высокая степень турбулизации среды во всех вариантах
способствовала снижению экономических показателей процесса
и увеличению скорости потребления субстрата.
Инженерное осуществление биотехнологий229Рис. 4.18. Влияние степени турбули-
зации среды в ферментаторе ФУ-8
на скорости потребления кислорода
q о2 я выделения диоксида углерода
qco2 у микроорганизмов:1 — Trichoderma viridae; 2 — Saccharo-
niyces cerevisiae; 3 — Polyangium sp.Из рис. 4.18 следует, что каждая культура имеет свой опти¬
мум интенсивности перемешивания. Причем чем чувствитель¬
нее культура, тем оптимум уже. Так, наиболее узок оптимум
перемешивания у мицелиальных грибов рода Trichoderma —
150 об/мин; дрожжи Saccharomyces cerevisiae и бактерии
Polyangium sp. более толерантны, торможение их жизнедея¬
тельности проявляется при интенсивности перемешивания
свыше 1000 об/мин. Из литературных данных следует, что оп-
тимумы перемешивания у разных штаммов мицелиальных гри¬
бов Aspergillus nigery продуцирующих лимонную кислоту,Таблица 4.3. Основные показатели роста и биосинтеза лизина
у Br. flavum 22ЛД в хемостате при D = 0,12 ч-1,
постоянном р02 и различной турбулизации средырОз, °1.отнасы¬ще¬нияп, об/минX, г/лм02’
ммоль на
1 г кле¬
ток в часУ s*
г/(ч • г)QP,г/(ч • г)'P/S’г/гАктив¬
ность
акони¬
тазы,
каталХ
Х1011 на
1 мг
белка103008,61,40,150,0420,361202030010,20,960,140,0580,38106503009,61,30,160,060,3988108006,40,60,130,0580,38140208009,40,90,160,460,348650800, 8,80,30,180,040,30761012005,00,550,180,0360,321102012007,60,40,200,0370,30715012007,00,60,220,0340,28641018004,43,20,240,0280,22902018006,72,20,280,0280,20605018005,01,30,260,030,2058
230Глава 4различны [53]. Одновременно с повышением турбулизации
среды меняется морфология — мицелий становится более тол¬
стым и извилистым.Ввиду того что причиной гипобиоза, мы полагаем, является
высокая турбулентность среды культивирования, предлагаем
термин «турбогипобиоз», включающий как причину, так и след¬
ствие этого состояния. Таким образом, есть основание предпо¬
лагать, что для любой системы культивирования в определен¬
ных условиях существует состояние турбогипобиоза, которое
выражается замедлением роста и биосинтеза и сопровождается
повреждениями клеток и другими гипоэффектами, вызванными
турбулентностью среды, точнее — срезовыми усилиями, возни¬
кающими при взаимодействии ферментационной жидкости с
конструктивными элементами биореактора.Согласно концепции, выдвинутой И. JI. Работновой, любое
замедление роста — это стресс, реакция клетки на неблагопри¬
ятные условия. Таким образом, можно считать, что в данных
условиях стресс вызван гидродинамическим воздействием, в
частности высокой турбулизацией среды.Состояние стресса наиболее изучено у высших организмов,
но торможение метаболических процессов при стрессовых воз¬
действиях, по всей вероятности, является неспецифической ре¬
акцией, характерной для различных представителей живых
существ, в том числе и для микроорганизмов.К сожалению, вопросы торможения жизнедеятельности
микроорганизмов при таких стрессовых воздействиях, как ско¬
рость перемешивания среды, недостаточно изучены. Имеются
лишь отдельные сведения об устойчивости микробных популя¬
ций и некоторых ферментов к механическому воздействию
,[22, 40, 42].Таким образом, нами исследован еще один аспект изменчи¬
вости реакций у микроорганизмов при постоянном р02 и раз¬
личной интенсивности перемешивания содержимого биореак¬
тора.* * *В заключение можно констатировать, что лимитирующая
концентрация субстратов как определяющая приемлема только
для упрощенных вариантов выращивания. Перемешивание
среды имеет гораздо большее значение, чем это обычно трак¬
туется. Оно существенным образом влияет на физиологические,
морфологические и другие характеристики культуры. Показано,
что можно достичь одинаковых реакций популяции (физиологи¬
ческих и др.) путем изменения концентрации субстратов или
интенсивности перемешивания как параметров управляемого
Инженерное осуществление биотехнологий231культивирования. В определенных, характерных для каждой
конкретной системы пределах эти показатели являются аль¬
тернативными, т. е. увеличение или снижение одного или дру¬
гого приводит к адекватной реакции (-ям) системы культиви¬
рования.4.2. ИДЕНТИФИКАЦИЯ УСЛОВИЙ АЭРАЦИИ
И ПЕРЕМЕШИВАНИЯВ разделе 4.1 была показана сложность и разновидность влия¬
ния интенсивности аэрации и перемешивания на физиологи¬
ческие и другие показатели бактериальных популяций. При
этом появление в системах культивирования нерастворимых
субстратов (четвертой фазы) эту картийу усложняет. Для
идентификации условий аэрации и перемешивания применяют
ряд критериев подобия и параметров i[6, с. 132; 7, с. 195].Большая работа по сравнению критериев и параметров , пе¬
ремешивания выполнена В. Линэком с сотр. в Институте хими¬
ческой технологии в Праге. Был рекомендован динамический
метод определения коэффициента массопередачи по кислороду
/Сьа для идентификации условий аэрации и перемешивания.
Однако этот метод вошел лишь в арсенал экспериментаторов,
что, на наш взгляд, объясняется изменчивостью характеристик
датчиков р02, необходимостью весьма сложного алгоритма обра¬
ботки измерений и главное — измерения проводятся при пере¬
ходном процессе, что не отражает истинную картину в дейст¬
вующем биореакторе.С целью отделения эффектов перемешивания от эффектов
аэрации нами разработан специальный измеритель интенсивно¬
сти перемешивания '[15, 54]. Область его применения — био¬
технология и химическая технология. Устройство позволяет
провести оптимизацию конструкции реактора в технологи¬
ческом режиме с учетом особенностей реального процесса.
В локальных точках определяют кинетическую энергию Е
флуктуаций потока перемешиваемой среды, ее дисперсию SE и
вариацию дисперсии Vs- В зависимости от поставленной цели
измерения проводят:1) в одной или в нескольких характерных точках;2) в достаточно большом количестве точек для получения
математического выражения распределения энергии Е=
= E(r, Л, ф), где г, Л, <р — пространственные координаты по
объему биореактора.В первом варианте с помощью величины Е можно опреде¬
лить уровень перемешивания, наличие локально интенсивных
и «мертвых» зон. В совокупности с дисперсией SE и вариацией
Vs рассчитывают степень микро-, макроперемешивания и
232Глава 4турбулизации среды. Это позволяет выбрать нужный режим ра¬
боты.Если первый вариант не обеспечивает необходимой точности,
следует реализовать второй. В этом случае учитывают интен¬
сивность перемешивания во всем объеме биореактора. Исходя
из распределения энергии Е=Е(гу Л, ф), определяют неравно¬
мерность перемешиваниягде V — объем доступной для измерений области.Критерии Ко и eD однозначно характеризуют гидродинами¬
ческую обстановку в реакторе.По известным значениям Ко и eD рассчитываютКритерий Kg позволяет идентифицировать интенсивность
массообменного процесса. Константы а, Ь и показатели степени
ту п можно определять для исследуемого процесса в лабора¬
торных условиях, сопоставляя Kg и скорость массообмена. Для
установления величин Kd и eD можно использовать модельную
среду, которая по реологическим свойствам аналогична реаль¬
ной среде. Для других аппаратов по значению Kg можно прог¬
нозировать интенсивность реального массообменного процесса.Для проведения измерений в биореакторах специально раз¬
работанные М. А. Рикманисом и др. пьезоэлектрические пер¬
вичные преобразователи (ППП) помещают в локальных точках
перемешиваемой среды. Посредством согласующих зарядных
усилителей ППП подключают ко входам коммутатора. Послед¬
ний обеспечивает ручное или автоматическое подключение ППП
к основному блоку. Он выполняет следующие функции:— измерение и цифровую индикацию кинетической энергии
Е флуктуаций потока среды, ее дисперсию и вариацию дис¬
персии;— цифровую индикацию подключаемого канала;— возможность поддерживания величины Е в измеряемой
точке на установленном уровне в случае подключения устрой¬
ства к блоку управления электропривода;(V)и среднюю кинетическую энергию потока среды(4.4)(4.5)
Инженерное осуществление биотехнологий— аналоговый и цифровой вывод измеряемых величин и но¬
мера канала;— сопряжение с ЭВМ.Аналого-цифровое интегрирование и автоматическая вы¬
борка динамического диапазона обеспечиваются управлением
от микропроцессора. Можно использовать максимум 12 ППП.Пределы 4-разрядного индицирования измеряемых величин
(динамический диапазон выбирается автоматически):— кинетической энергии Е — от 0,1 до 5000 уел. ед.;— дисперсии — от 0,1 до 5000 уел. ед.;— вариации — от 0,1 до 100%.Пределы установки регулируемого Е — от 0,1 до 5000 уел»
ед. Значение поддерживаемой величины Е вводится с клавиа¬
туры. Диапазон аналогового вывода — от 0 до 10 В. Время
измерения Е — 60 с, Se — 120, Vs — 120 с.На практике были получены хорошие результаты использо¬
вания данной системы для исследования и создания интенсив¬
ных, но работающих в щадящих режимах биореакторов. На¬
хождение корреляций между Е, SE, Vs и кинетикой роста и
биосинтеза нужных продуктов бактериальных (и других) про¬
дуцентов является задачей ближайших лет.В разделе 4.1 было показано, что концентрации субстратов,
в том числе кислорода, со своей альтернативой — интенсив¬
ностью перемешивания — являются важным, но все же проме¬
жуточным параметром управления бактериальным синтезом.
В конечном итоге рост и биосинтетическая деятельность попу¬
ляции определяются массой субстрата (-ов), поступившего в
клетки (ассимилированные). Условия внешней среды являются
всего лишь факторами, регулирующими процессы транспорта
субстратов (и продуктов) через фазовые переходы [7, с. 195],
а также (в меньшей степени) через мембраны клеток.С целью определения количества ассимилированного 02, на¬
чиная с первого эксперимента по снятию баланса кислорода и
тепла [17], нами развивались как техника балансового метода,
так и интерпретация полученных результатов. Ю. Э. Швинка
и Л. А. Бабурин разработали методы управления бактериаль¬
ным синтезом на примере получения лизина по интенсивности
дыхания. Ее определяют при помощи газоанализаторов ГТМК-16
на выходе (в общем случае и на входе) биореакторов по ба¬
лансу кислорода в аэрирующем воздухе (газе). Для более
точных экспериментов разработан пульт газоанализаторов
ПГА-2. Он позволяет автоматизировать определение скоростей
потребления кислорода и выделения диоксида углерода. Пульт
включает газоанализаторы ГТМК-11М или ГТМК-16 для кисло¬
рода и ГИАМ-5 для диоксида углерода, измеритель расхода
воздуха ИРВ-2 на базе газового счетчика ГСБ-400 и блок
234Глава 4масштабирования для преобразования сигналов газоанализато¬
ров, входящий в ИРВ-2.Для измерения концентрации кислорода в выходящем газе
используют газоанализатор ГТМК-16М. В качестве регистри¬
рующего устройства в нем применены самопишущие приборы
типа КСП со шкалой 0...10 мВ, соответствующей концентра¬
ции кислорода в анализируемой газовой смеси в стандартном
варианте (15... 21%).При глубинном культивировании микроорганизмов концентра¬
ция кислорода в выходящем газе обычно составляет 15... 21%,
при твердофазной ферментации — 0... 21 % к объему. В от¬
дельных случаях концентрация 02 в газовых смесях может
изменяться в более широких пределах.Практически во всех экспериментах использование полной
шкалы неудобно. В связи с этим разработан масштабирующий
блок, позволяющий выбирать необходимый поддиапазон изме¬
рения, плавно изменяющийся от 0 до 2%, и сам поддиапазон
может плавно (в режиме «окна») перемещаться вдоль всей
шкалы от 0 до 21%, т. е. можно установить диапазон измере¬
ния от 19 до 21% и от 17 до 19% с помощью элементов пред¬
варительной установки.Для измерения концентрации С02 используют газоанализа¬
тор ГИАМ-5 со шкалой 0...5%. Так как во всех процес¬
сах этот диапазон примерно соответствует изменению С02 за
время эксперимента, необходимость в создании масштабирую¬
щего устройства не возникала. Сигнал ГИАМ-5, как и сигнал
ГТМК-НМ, в масштабирующем устройстве усиливается до 5 В,
выбранных нами как стандартная величина для ввода в ЭВМ.Таким образом, пульт выполняет следующие функции: изме¬
рение расхода воздуха в единицу времени; представление ре¬
зультата измерения в цифровой и аналоговой формах и ото¬
бражение его на передней панели прибора; масштабирование
сигналов газоанализаторов, входящих в ПГА-2; выбор опти¬
мального масштаба для измерения концентрации кислорода в
газовой смеси.Пульт ПГА-2 позволяет автоматизировать все процессы из¬
мерения концентраций кислорода и диоксида углерода и скоро¬
стей их изменений.Способы управления бактериальным синтезом но интенсив¬
ности дыхания продуцентами рода Brevibacterium, разработан¬
ные В. В. Крикисом, Ю. Э. Швинка, А. К. Саксе и др., нашли
промышленное применение в качестве основного управляющего
фактора при отъемно-доливном (полунепрерывном) культивиро¬
вании. Одновременно по интенсивности дыхания проводится
индикация условий аэрации и перемешивания; р02 служит
лишь дополнительным контрольным параметром. В табл. 4.4
приведены результаты заводских испытаний этих процессов.
Таблица 4.4. Сравнительные результаты периодического и отъемно-доливного (полунепрерывного) процессов
биосинтеза лизинаКонцентрация лизина в КЖ,Произво¬Цикл ра¬Объем куль¬г/лдитель¬Процессботытуральной жид¬ностьСтерильность КЖПримечаниефермен¬
татора, чкости за цикл,I*3максимальнаясредняя по
операциилизина,
кг/м3
в суткиОтъемно-доливной
(ферментаторы
№ 55, 56)Средние данныеПериодический
(ферментаторы
N2 53, 54)Средние данные769542,541,612,7Стерильна105106,548,743,211,6Нестерильна с 51-го
часа9410249,447,712,5Нестерильна с 30-го
часа13115649,143,512,9Стерильна8910046,84412,2Нестерильна с 37-го
часа122103187124,448,445.344.417,013,2Условно стерильна916340,86,8Стерильна1007042,457,1Нестерильна с 64-го
часа867240,98,2Нестерильна с 21-го
часа847542,69,1Стерильна908240,38,8Нестерильна с 53-го
часа957442,67,9Стерильна986849,68,2Условно стерильна93927672,549.443.49,78,2»» »»ПерегревБез работаю¬
щей мешалки
236Глава 4Помимо управления бактериальным синтезом по дыхательной
активности qо2 (Qo2) и (или) объемному коэффициенту массо¬
передачи Kvp> результаты балансового анализа аэрирующего
воздуха (газа) были успешно применены для: %1) определения растворимости кислорода в различных жид¬
костях [21];2) получения исходных данных для инженерных расчетов
биореакторов — динамики потребности в кислороде и тепло¬
выделения [6];3) анализа метаболизма (энергетического, углеводного) бак¬
териальных продуцентов;4) анализа эффективности использования различных источ¬
ников углерода;5) изучения ответных реакций на импульсные возмущения
(физико-химические, добавки субстратов) стационарного состо¬
яния популяций продуцентов и идентификации лимитирующих
рост культуры факторов [1].Поскольку потребность культур в кислороде коррелирует с
количеством выделяемой теплоты i[7], нередко дискутируется
вопрос: что более информативно — интенсивность дыхания или
интенсивность тепловыделения? В принципе, как это нами было
показано еще в 1972 г., путем анализа составляющих теплового
баланса биореакторов для бактериального синтеза можно по¬
лучить аналогичную описанной выше информацию (из газового
баланса). Существуют также системы прямого измерения теп¬
ловыделений в биореакторах. Однако наш опыт работы с двумя
такими нестандартными системами (в частности, разработан¬
ными Б. И. Ивановым и С. А. Василяускасом) показал, что
метод газового баланса достаточно информативен и технически
легче осуществим (газоанализаторы выпускаются промышлен¬
ностью) .Возвращаясь к основной теме данного раздела — иденти¬
фикации условий аэрации и перемешивания, следует еще раз
отметить, что q0i> Q о2 или Kvp наиболее полно отражают со¬
стояние сложной системы бактериального синтеза в биореакто¬
рах. Преимущества этого параметра как для управления (ха¬
рактеристики состояния функционирующей популяции), так и
для массообменной характеристики самого биореактора заклю¬
чаются в следующем:1) газоанализатор находится вне биореактора и не ослож¬
няет обеспечение условий стерильности;2) измерение KvpIQ о2 и управление по этому показателю
сравнительно легко осуществить в АСУТП, в том числе с ис¬
пользованием ЭВМ;3) наиболее полное отражение физиологического состояния
популяции и соответственно наиболее эффективное управление
процессами роста и биосинтеза;
Инженерное осуществление биотехнологий2374) возможность одновременного использования полученных
результатов для характеристики биореакторов.Практически Kvp или Qо2 является одним из наиболее эф¬
фективных параметров, позволяющих сочетать массообменные
характеристики для технологии с таковыми, предъявляемыми к
соответствующим биореакторам. Как было показано ранее
[6, с. 160], Kvp/X может служить весьма достоверной характе¬
ристикой геометрически неподобных биореакторов с точки зре¬
ния индикации условий аэрации и перемешивания.4.3. ВЫБОР КОНСТРУКЦИИ БИОРЕАКТОРОВОсновная проблема выбора или целенаправленного создания
новых конструкций биореакторов заключается в том, что не¬
достаточно обоснованы требования к биореакторам со стороны
микробиологов, биохимиков, биотехнологов, а также со стороны
машиностроителей. Технические характеристики этих аппаратов
неполные.Особенно скромны данные каталогов, содержащие в основ¬
ном информацию о конструкционных признаках: объем, допус¬
тимое давление в аппарате и в рубашке, диаметры штуцеров
и люков, установленная мощность, частота вращения вала ме¬
шалки, геометрия турбин и других внутренних конструкций,
металлоемкость, марки материалов, масса конструкции и т. д.
Биореакторы не характеризуются даже номограммами, харак¬
теризующими введенную мощность при помощи данного при¬
вода и системы перемешивания в зависимости от газонасыще-
ния фиксированной среды (например, воды).Рассмотрим сначала проблему общих характеристик био¬
технологий, которые необходимо реализовать. Ниже перечис¬
лены основные из этих характеристик, которые должны содер¬
жаться в технологических регламентах соответствующих про¬
изводств:1) вид субстратов (растворимые в воде, нерастворимые,
газообразные), их концентрация (состав сред), физико-механи¬
ческие и реологические характеристики (термостабильность,
если процесс стерильный);2) технологический способ культивирования (периодический,
отъемно-доливной, с подпиткой, непрерывный и т. д.) и вид
процесса ферментации (глубинный, поверхностный, биокатализ
и т. д.);3) характеристика, перечень и пределы измерений контро¬
лируемых параметров; то же в отношении управляемых пара¬
метров и вторичных расчетных величин; способы поддержания
всех этих величин;
238Глава 4Таблица 4.5. Основные требования к ферментационной аппаратуруПродуктыБиологическиеагентыТребования к аппарату
для культивированияБиологически активные
вещества, биохимичес¬
кие реактивы, в том
числе для генной ин¬
женерии, медикаменты,
вакцины, диагности-
кумыБиологически активные
вещества, медикамен¬
ты, иммунорегуляторы
(лимфокины, интерфе¬
рон и др.), гормоны,
факторы роста клеток,
продукты крови, моно¬
клональные антитела,
продукты для гибриди¬
зацииТо же, а также тради¬
ционные продукты
биотехнологии (амино¬
кислоты, антибиотики
и т. д.)Микроорганизмы, в
том числе рекомби¬
нантные, вирусы
(бактериофаги)Клетки растений и
животных, в том
числе полученные
методами генной
инженерииКлетки микроорганиз¬
мов, растений, жи¬
вотных и их ком¬
поненты в иммоби¬
лизованном состоя¬
нииСовмещение процессов фер¬
ментации и получения
продуктов (встроенные
мембраны, сепараторы ит. д.);повышенная стерильность
процесса;
точная регуляция режима;
импульсовидные изменения
параметров;
мгновенное прекращение
роста культуры путем
охлажденияОбеспечение стерильности
процесса на длительный
период;
обеспечение условий для
фотосинтеза (свет);
отсутствие токсичных ве¬
ществ в материалах для
изготовления аппарата;
щадящий режим перемеши¬
вания среды;
обеспечение субстрата (но¬
сителя) для крепления
клетокСпециальные конструкции
биохимических реакторов;
щадящий режим перемеши¬
вания;обеспечение стерильности
процесса на длительный
период4) потребность культуры в кислороде Kvp или Q0i ;
кг/(м3-ч); кг/кг биомассы; кг/кг ассимилированных РВ; кг/кг
синтезированного продукта и т. д.;5) чувствительность культуры к накоплению СОг в отрабо¬
танном воздухе;6) удельные тепловыделения кДж/(м3-ч) в динамике ре¬
ального времени. Удельная теплоемкость, коэффициенты тепло¬
проводности и температуропроводности. Эти показатели крайне
необходимы для расчета поверхности теплопередачи биореак¬
тора;
Инженерное осуществление биотехнологий 2397) характеристики образования и свойства (стойкость и др.)
образовавшейся в процессе ферментации пены. Рекомендуемый
вид жидкого пеногасителя;8) допустимый уровень срезовых усилий в биореакторе (по¬
рог турбогипобиоза);9) свойства биомассы в отношении флотации;10) способность биомассы к осаждению и нарастанию на
поверхностях внутренних конструкций аппарата. Рекомендации
по мойке внутренних поверхностей биореакторов;11) необходимость разрушения (дезинтеграции) образова¬
ний мицелия во время культивирования;12) коррозионные характеристики сред по отношению к раз¬
личным конструкционным материалам аппаратов.Развитие современной биотехнологии связано с широким
применением биологических агентов, полученных методами ген¬
ной инженерии; биокаталйтических реакций (иммобилизован¬
ные системы); выращиванием животных и растительных клеток
на микроносителях.Все возрастающий интерес к биоконверсии фотосинтезируе¬
мого сырья преимущественно мицелиальными культурами вы¬
двигает новые требования к ферментационной аппаратуре.
Среди них наиболее важные (табл. 4.5):1) обеспечение интенсивного, но щадящего режима переме¬
шивания (для мицелия, продуцентов, полученных методами
генной инженерии клеток животных и растений);2) обеспечение кратковременного дезинтегрирующего ре¬
жима перемешивания (для разрушения шариков мицелия);3) быстрое охлаждение культуральной жидкости (для со¬
хранения активности ферментов);4) высокий уровень стерильности;5) специальные требования к конструкционным материалам
биореакторов (тканевые культуры);6) техническое осуществление твердофазной ферментации и
щадящее перемешивание высоковязких сред (биоконверсии
целлолигниновых материалов);7) специальный режим перемешивания (только гомогениза¬
ция) популяций тканевых культур;8) контроль обеспечения кислородом, не допускающий рез¬
ких скачков (стабилизация плотности газожидкостных эмуль¬
сий) ;9) измерение и поддержание новых (для автоматического
контроля в биореакторах) параметров среды культивирования
(еН, диэлькометрия, плотность пены, срезовые усилия, харак¬
тер диссипации энергии /Ся, еу ^стр, физиологическое состояние
популяции, биохимические показатели и др.);
240Глава 4Рис. 4.19. Схемы основных конструкций ферментаторов для производства
кормового лизина:1 — газлифтный с диффузором; II — с мешалкой с верхним приводом; III — газ-
лифтный по / с механическим пеногасителем и контактными устройствами в диффу¬
зоре; IV — с мешалкой с нижним приводом; V — с неподвижными контактными
устройствами; VI — модернизированный по V; VII — трехкорпусный; VIII — с кон¬
тактными устройствами и наружным циркуляционным контуром; / — диффузор;2 — аэратор; 3 — электродвигатель с редуктором; 4 — вал мешалки с турбинами;
5 — контактные устройства; 6 — внутренние циркуляционные трубы; 7 — соедини¬
тельная труба для газожидкостной эмульсии; 8 — устройство пеногашения; 9 —
циркуляционная труба; 10 — эмульсионный насос10) применение ЭВМ для поддержания процесса. Появля¬
ются параметры Kr, в, FCTP и др., регистрация которых в прин¬
ципе невозможна без ЭВМ;11) создание безотходных производств.Предмет наших исследований — бактериальные проду¬
центы — является наиболее благоприятным объектом для
культивирования. Они преимущественно выращиваются на рас¬
творимых субстратах, сравнительно устойчивы к срезовым уси¬
лиям, не агрегируют, растут сравнительно быстро. Культивиро¬
вать их можно практически в любых биореакторах. При этом
в качестве главных критериев их выбора должны были быть
приняты Kvp/Qoz> удельное тепловыделение и удельная потреб¬
ность в электроэнергии.Следовательно, себестоимость продукта должна играть ре¬
шающую роль при выборе биореакторов. Несомненно, этот
показатель важен всегда, но, например, наличие нерастворимых
Инженерное осуществление биотехнологий 241компонентов в питательной среде, характерные для продуцента
высокие рачения требуемого Kvp — более 7 кг/(м3-ч) — мо¬
гут принципиально исключить возможность эксплуатации срав¬
нительно дешевых (простая эксплуатация, несложная конструк¬
ция и т. д|) биореакторов, например аппаратов с вводом энер¬
гии только1 аэрирующим газом.Однако5 практическая реализация культивирования связана
с определенными традициями и условностями. Так, для глав¬
ного нашего объекта — продуцентов рода Brevibacterium, —
исходя из вышеизложенных соображений, можно подбирать
подходящий аппарат среди биореакторов практически всех кон¬
струкций. Однако на практике поиск ограничивается конструк¬
циями, которые схематически изображены на рис. 4.19.Традиционность и условности вообще характерны для био¬
реакторов. Типичным примером служат производства хлебопе¬
карных и кормовых дрожжей в нашей стране. Хотя продуценты
по морфологическим и физиологическим свойствам, порогу
турбогипобиоза, потребности в кислороде (на одинаковых ви¬
дах сырья) и другим характеристикам весьма близки, техника
их культивирования принципиально различается. Для производ¬
ства первого продукта используют в основном барботажные ап¬
параты, для второго — газлифтные (на гидролизатах, сульфитных
щелоках, барде). В то же время для производства кормовых
дрожжей из нетрадиционных видов сырья (парафины, нефти,
спирты, газ и др.) ведется интенсивный поиск (разработка и
испытание) промышленных биореакторов разнообразных кон¬
струкций. Их перечень, по данным А. М. Кузнецова, приведен
в табл. 4.6.Следует отметить, что сравнение и выбор наиболее опти¬
мальной для конкретного биотехнологического процесса про¬
мышленной конструкции биореактора — весьма сложная за¬
дача [6, 45].Чтобы выбрать биореактор для конкретного процесса, в том
числе для бактериального синтеза, можно воспользоваться
табл. 4.7. Таблица содержит весьма ориентировочные цифры и
скорее вызовет у читателей больше вопросов, чем представлено
ответов. Наиболее дискуссионным и недефинированным явля¬
ется термин «порог турбогипобиоза». Ориентировочны также
значения /Сур.На стадии лабораторных и пилотных экспериментов доми¬
нируют наиболее универсальные аппараты с механической ме¬
шалкой из группы ФЖГ, так как здесь экономические вопросы
(расход электроэнергии и др.) играют незначительную роль.
Для производства однозначный окончательный выбор конструк¬
ции крайне затруднен. Кроме того, н>а практике всегда моются
возможности подогнать технологию ;под конкретную конструк¬
цию биореактора.16 — 361
Таблица 4.6. Сравнительные характеристики действующих, модернизирован
кормовых дрожжейПоказательЭрлифтные (гидроликаты) f-ЭВЦ 1250ЭВЦ 630ЭВЦ 1250ЭВК 200-
1К-01.-(модер¬низиро¬ванный)Производительность, т/сут
Объем, м3:геометрический
рабочий
Потребляемая мощность, кВт
Рабочее давление, МПа (кгс/см2)
Рабочая температура, °С
Площадь поверхности теплообмена,
м2Удельная производительность,
кг/(м3*ч)Удельная металлоемкость:
кг/м3кг на 1 кг АСБ в час
Удельные энергозатраты:
кВт/кг АСБ
кВт/м3
Наработка на отказ, ч
Ресурс до капитального ремонта, ч
Габаритные размеры, мм
длина
ширина
высота
Масса, кг8,1»17,57,020,06301250200125025050070 ...100550320600283550ATMATMATMATM,36, 3639364005603306001,351„464,161,5278,069,616064,0145119,3109960,950,820,6540,661,281,202,761,080008000800080004000040000400004000082701236037121236080701236035401236015600,18770264201877049183870003200080000Следовательно, после выбора аппарата по табл. 4.7 (или по
опыту разработчиков)* и пуска производства, если себестоимость
продукта вполне приемлема, импровизация с конструкциями
действующих биореакторов очень сложна. Чаще всего усовер¬
шенствования идут по пути модификации технологии под кон¬
кретную, имеющуюся на данном заводе (цехе) конструкцию.
Отсюда упомянутый традиционализм применения для одного
производства однотипных биореакторов, хотя, посмотрев на
проблему шире, вполне можно было бы более эффективно ис¬
пользовать другую конструкцию. Но, чтобы это доказать, нужны
значительные капитальные вложения, а мероприятие все же
связано с определенным риском.Теория и практика выбора имеющихся и разработки новых
биореакторов под многие конкретные технологии описаны ра¬
нее [3—6, 10, 11, 18]. Наиболее популярные разработчики и
ных и перспективных конструкции ферментаторов для выращивания( механическим
перемешиванием
(парафины,' Колонные эжекцнонные
(природный газ)Колонные насадочные (парафины,
спирты)АДР-уоо-IK-01и р 1 ы;
ОПЫТНЫЙобразецФКЭР 63ФКЭР 750опытныйобразецФКЗН320ФКПН63ФКПН 800ФКЗН800(опытныйобразец)До 40До 459,01001002605,335,560,090090006395095032014080080055055055800800200634164504095(260064075007500126058023942000ATMATM0,9(9)0,9(9)0,3(3)ATMATMЛТМATM340438383836У36363630003000960;15120151202568580320032003,033,46,825,835,235,423,53,55,55533,3388,0761,9949,7842604,1057,1255,0185,0288186127,9216,5192178,4,226,4123,460,02,451,381.71.81,81.172,631,640,87,444,7211,69.49,46,39,25,764,456300800040008000100008000J34221400016000258204000040000480005500040000159400594006000019800198001160026000260008200401636903690198001980026001300013000820040164980498080008000/21820310003100047000250005150051500480009500004800090221880000019332050000180000150000производители действующих промышленных биореакторов сле¬
дующие: в России (ИркутскНИИХИММАШ—ДзержинскХИМ-
МАШ и другие заводы химического машиностроения), в
других странах (например, фирмы «Робин» — Франция; «Хе-
пос» — ЧСФР; «Хемап» — Швейцария; «Тиссен» — Германия;
«Техникон» — Италия; «Хеми анлагенбау» — Германия; «Гра-
вита роса» — Румыния; «Электролюкс» — Швейцария;
«Экато»—Австрия). В России выпускаются промышленные био¬
реакторы вместимостью до 160 м3 с механической мешалкой
(разработчики ВНИИА и ИркутскНИИХИММАШ), газлифтные
аппараты объемом до 1200 м3, аппараты, изображенные на
рис. 4.19 и рассмотренные в табл. 4.6, а также ряд других
конструкций ИркутскНИИХИММАШ, ВНИИсинтезбелок, НПО
«Гидролизпром», ВНИИгидролиз, ВИИППД (УкрНИИСП),
Киевского технологического института пищевой промышленно-
16»
Таблица 4.7. Критерии предварительного выбора биореакторов
для культивирования различных продуцентовНомер
п.. п.ПродуцентKvp (или Qq^),
кг/м* • чПорог турбо-
гипобиоза1 Бактерии:быстрорастущие (ц>0,2 ч-1) 4... 5 и болееВысокиймедленнорастущие (|j.<0,3 ч”1)<4чувствительные к срезовым Индивидуально Низкий
усилиям нитчатые формы, об- для каждого
разующие микрофибрилляр- штамма
ные внеклеточные полимеры
и др.с высокой концентрацией био- 5... 12 Средниймассы (>50 г/л)выделяющие вязкие метабо- Индивидуально „литы для каждогоштаммаанаэробные — НизкийпрочиеИндивидуально
для каждого
штаммаВысокийГрибы:мицелиальные3... 8Низкийагрегатирующие (образующие 3 ... 8шарики или другие формиро¬
вания)СреднийГруппа реко¬
мендуемых био¬
реакторов по [6]Особые требованияФЖ, ФЖГ Нет особых требований, кроме
экономическихФГ, ФЖ, ФЖГ То жеФЖГ Рекомендуются специальные кон¬струкцииФЖГ То же, с возвратом биомассыФЖГ Рекомендуются специальные кон¬струкции для вязких средСпециальные Рекомендуются специальные кон-
бродильные струкции
аппаратыФГ, ФЖ, ФЖГ Нет особых требований, кроме
экономическихФЖГ Рекомендуются спеШтзяыщ£_кон¬струкции, интенсивные, но Ица7^
дящиеФЖГ Рекомендуются специальные кон¬струкции с периодической дез¬
интеграцией
дрожжи:
на углеводахна углеводородах
на спиртах, органических
кислотах
на газе
прочие2...44 и более
• 3...54 и более
Индивидуально
для каждого
штамма3 ПростейшиеТо же4 Животные и растительные клеткиВирусы (облигатные интрацеллю-
лярные паразиты)0...2ВысокийСредний, вы¬
сокийИндивиду¬
ально для
каждого
штаммаНизкийФГ, ФЖ, ФЖГНет особых требований, кроме
экономических
ФЖ, ФЖГ ' Эмульгирование парафинов
ФЖ, ФЖГ Ограничение испарения субстрата—ФЖ, ФЖГ Взрывобсзопасность
ФГ, ФЖ, ФЖГ Для каждого штамма индивиду¬
альноФГ Рекомендуются специальные кон¬струкции щадящего режимаФГ, ФЖГ Щадящий режим, для каждого
штамма индивидуальный под¬
бор конструкционных материа¬
ловВ качестве пермиссивных клеток продуценты поз. 4, для бактериофагов —
поз. 1Примечания. ФГ — ферментаторы с подводом энергии только аэрирующим газом (барботажные, газлифтные с контактными устрой¬
ствами, с плавающей насадкой и др.); ФЖ — с подводом энергии только с жидкой фазой (эжекционные, струйные, с самовсасывающей
мешалкой и др.); ФЖГ — комбинированные с подводом энергии газовой и жидкой фазами.
246iГлава 4сти, Смелянского машиностроительного завода, ЛенНИИХИМ-
МАШ, Института микробиологии ЛатвАН и др.Кроме того, известны фирмы, специализирующиеся в основ¬
ном на выпуске биореакторов. Например, австрийская фирма
«Фогельбуш» специализируется на выпуске самовсасывающих
дрожжерастильных аппаратов, а также ферментаторов для
бактериального брожения при получении пищевого уксуса из
этанола.Одна из последних, перспективных, по нашему мнению, для
бактериального синтеза разработок австрийской фирмы «Фо¬
гельбуш» по лицензии «Инженер-технишес централбюро»
(Германия) является система аэрации струей глубокого
погружения ФБ-ИЦ. Объем аппаратов 40, 400, 1000 м3.
Аэрация происходит в основном за счет внешней рециркуляции
всего содержимого реактора. Среда подсасывается через вса¬
сывающие трубопроводы соответствующих размеров специаль¬
ными насосами, пригодными для транспорта жидкости с боль¬
шим содержанием газа (двухфазные среды) и имеющими высо¬
кий КПД, и перекачивается через напорные трубопроводы и
аэрационные устройства в реактор.Устройства аэрации, называемые также шахтными перепа¬
дами, представляют собой трубы, расположенные вертикально.
Циркулируемая в трубах жидкость, благодаря соответствую¬
щей конструкции входа шахты, падает свободно в виде коль¬
цевого потока вниз, на поверхность аэрируемой среды,
всасывая при этом необходимое количество воздуха. В нижней
части шахты кольца потока распадаются, происходит тонкое
диспергирование газа, и из шахты выходит гомогенная струя
жидкостно-газовой смеси. Импульс среды рассчитан так, что
она доходит до дна емкости.В результате, по данным фирмы «Фогельбуш», создаются
основные предпосылки для интенсивного массообмена в реак¬
ционной системе: высокая турбулентность, тонкое диспергирова¬
ние газа, длительное пребывание его в среде и высокая степень
гомогенности. Для отвода теплоты можно применять различные
системы охлаждения. К форме реакционной емкости при этой
системе аэрации не предъявляется особых требований. Единст¬
венными агрегатами с механическим движением являются спе¬
циальные эмульсионные насосы. Потребность в химических
пеногасителях ниже, чем при других системах аэрации. Мак¬
симальная массопередача по кислороду до 12 кг/(м3-ч).Данный принцип — использование механической энергии
лишь для обеспечения организованного движения газожидкост¬
ной эмульсии, на наш взгляд, является весьма перспектив¬
ным для культивирования бактериальных продуцентов с низким
порогом турбогипобиоза В наших работах (В. Д. Прокопенко,
Инженерное осуществление биотехнологий247В. В. Крикис и др.) он нашел инженерную реализацию в трех¬
корпусном ферментаторе на 300 м3 (см. рис. 4.19, вариант VII).
Этот аппарат имеет следующие преимущества:1) максимальное заполнение аппарата гомогенной газожид¬
костной эмульсией в результате создания циркуляционных
контуров и оптимизации ее плотности, а также повышения ко¬
эффициента заполнения ферментатора, использования пенооб¬
разующих свойств ферментационных жидкостей;2) обеспечение интенсивной «начальной» аэрации непосред¬
ственно над дном;3) использование эффекта гидростатического столба жид¬
кости (конструктивно наиболее возможное соотношение высоты
и диаметра ферментатора);4) максимальное распространение интенсивно аэрируемой
зоны по всему сечению аппарата, так как в присутствии труд¬
норастворимых газов (например, кислорода) снижается эффект
локальных интенсивных участков;5) максимально возможная частота возобновления поверх¬
ности фазового контакта на пути аэрирующего воздуха и ста¬
билизация ее усредненной величины;6) обеспечение достаточной интенсивности макро- и микро¬
смешивания жидкости по всему объему ферментатора, что
предотвращает образование застойных зон или других видов
негомогенности по определяющим компонентам культуральной
жидкости (выравнивание карты турбулентности);7) введение энергии аэрирующим газом, где это возможно
по абсолютным величинам коэффициентов массопередачи для
культур, которые не образуют мицелия, клеточных агрегатов
или слизистых слоев вокруг клеточной стенки, незначительно
меняют вязкость культуральной жидкости при периодическом
режиме, не требуют нерастворимых питательных компонентов,
в том числе нерастворимых жидкостей;8) применение контактных устройств с контурами циркуля¬
ции и комбинированной системой пенорегуляции (механическое
и химическое пеногашение при управлении процессом по при¬
косновению пены к контактному электроду или по нагрузке
электродвигателя рабочего органа);9) длина контура естественной циркуляции (за счет раз¬
ницы плотностей газожидкостных эмульсий) при Kvp=
= 3...5 кг/(м3-ч) не должна превышать 10... 12 м, в против¬
ном случае наступает лимит по кислороду [45].Специализированных фирм по выпуску лабораторных и пи¬
лотных (уже комплектных) ферментационных установок
значительно больше. Наиболее популярные среди них: СКВ
биологического приборостроения (г. Пущино), Инсти¬
тут микробиологии ЛатвАН с Экспериментальным электрон¬
248Глава 4но-механическим заводом (в настоящее время СКВ энерготех¬
ники ФЭИ), Центр биотехнологии (г. Горький), НПО «Пром-
автоматика» (г. Грозный) — контрольно-регулирующие системы,
с ЭВМ, Иркутский НИИХИММАШ, ВНИИбиохиммашпроект,
ОКТБ приборостроения (г. Москва, г. Кириши); фирмы «Мит-
рон» (Германия), «Хемап», MBR «Bioengineering» (Швейца¬
рия), «Браун» (Германия), «Нью Брансвик» (США), «Биотек»
(Швеция), «Марубиси» (Япония), «Ринтекно» (Финляндия);.
ХО «Биоинвест» (Болгария), «Электролюкс» (Швеция), «Аппли-
кон» (торговая фирма «Донау трейдинг», Швейцария), «ЛХ
Ферментейшн» (Великобритания) и др. Информация об этих
установках имеется в соответствующих каталогах [24] и в ли¬
тературе [6].4.3.1. ЛАБОРАТОРНАЯ ФУ-8А
И ПИЛОТНАЯ ФУ-ЗОВ УСТАНОВКИРазработка исследовательской биотехнологической аппаратуры:
серии ФУ для культивирования микроорганизмов была начата
нами в 60-х годах. Кроме лабораторий институтов микробиоло¬
гии, химии древесины ЛатвАН этими установками пользуются
около 20 институтов и заводских лабораторий бывшего СССР,
а также коллеги в Чехо-Словакии, Югославии, Болгарии, Герма¬
нии. Комплекс ФУ постоянно совершенствуется: в частности,
разработаны твердофазный вариант культивирования, взаимо¬
заменяемые мешалки для обеспечения различных режимов пе¬
ремешивания, оригинальные приборы для измерения еН, уровня
и состояния пены и др. [6, 37, 45, 54]. Предусмотрена возмож¬
ность использования ЭВМ в режиме обработки измерений к
управления процессом.В дальнейшем предусматривается:1) обеспечение интенсивного, но щадящего мицелий режима,
перемешивания;2) усовершенствование систем контроля и управления;3) модификация аппаратуры для культивирования рекомби¬
нантных продуцентов, животных и растительных клеток.Бессменным изготовителем аппаратуры является СКБ
энерготехники ФЭИ ЛатвАН.Установка ФУ-8А. Предназначена для непрерывного и пе¬
риодического культивирования микроорганизмов . в глубинных
условиях и периодического твердофазного культивирования в
стационарном и перемешиваемом состояниях нерастворимого'
субстрата. Комплектуется пультом автоматического управления
с выходом на ЭВМ и тремя взаимозаменяемыми ферментато¬
рами для глубинного и твердофазного культивирования.
Инженерное осуществление биотехнологий249Ферментатор глубинного культивирования вместимостью
5 л имеет три типа взаимозаменяемых мешалок. На его крышке
расположен механический пеногаситель.Контролируются температура среды, аэрирующего воздуха,
воды в увлажнителе, pH (автоматически поддерживается при¬
боров АРКО-5), р02 (автоматически регулируется прибором
РОМ-9), еН и другие параметры в зависимости от требований
эксперимента.Аппарат для стационарного твердофазного культивирования
выполнен в виде цилиндрического сосуда с коническим дном,
снабжен теплообменной рубашкой. Внутри имеется перфориро¬
ванная перегородка, субстрат загружается через верхний люк.
При необходимости ферментатор может быть использован для
глубинного культивирования либо в качестве колонны для фер¬
ментативного гидролиза.Аппарат твердофазного культивирования с перемешиванием
представляет собой горизонтальный сосуд с лопастной мешал¬
кой, снабжен теплообменной рубашкой. При помощи блока уп¬
равления РОМ-9 частота вращения мешалки может быть уста¬
новлена до 50 об/мин в непрерывном или периодическом ре¬
жиме.Установка ФУ-ЗОВ. Предназначена для культивирования
микроорганизмов в глубинных условиях периодическим или
непрерывным способом.В состав установки входят:1) блок ферментации, представляющий собой вертикальный
цилиндрический сосуд со съемными крышкой и дном; снабжен
нижним приводом для мешалки и верхним — для механиче¬
ского пеногасителя, системой подготовки стерильного увлажнен¬
ного воздуха и блока дозаторов, который состоит из сосудов
для химического пеногасителя, щелочи и кислоты и дозирую¬
щих перистальтических насосов;2) пульт управления, с помощью которого регулируют тем¬
пературу, pH, р02, еН, уровень пены и другие параметры. Для
стерилизации подключают линию пара давлением 0,2 МПа.Установка ФАС-01 — комплектный ферментатор емкостью
5 л, изготовитель — БТЦ (Рига).4.3.2. ЛАБОРАТОРНАЯ ФЕРМЕНТАЦИОННАЯ
УСТАНОВКА ШВЕЙЦАРСКОЙ ФИРМЫ «MBR»Эти установки выпускают в двух основных модификациях:
стеклянный ферментатор (мини) вместимостью 2,5 л с блоком
управления МС-1 и лабораторные биореакторы на 5 либо 7,
250Глава 410, 12, 15, 18, 20 л с блоком управления 1МС-2000 и компью¬
терной системой контроля РС-68000.Стеклянный ферментатор снабжен турбинной мешалкой
Раштона с магнитным приводом, двумя нагревательными эле¬
ментами мощностью 400 Вт, системой аэрации, предохранитель¬
ным клапаном и датчиками р02, pH фирмы «Ингольд», датчи¬
ками температуры, пеногашения, массы. С помощью локальной
автоматики МС-10 либо компьютера можно управлять 12 пара¬
метрами.Лабораторный биореактор вместимостью 7 л аналогичен
рассмотренному выше, имеет теплообменную рубашку, датчик
биомассы. Все выходные отверстия, соединительные шланги,
кабели и пр. стандартизованы, что позволяет удобно реализо¬
вать модульную комплектацию. Лабораторные биореакторы
фирмы MBR укомплектованы дополнительными блоками и сис¬
темами.Компьютер записывает в памяти все параметры с интерва¬
лом 1 ... 60 мин, дает возможность управлять ферментацией,
делать распечатки и графики параметров, а также использо¬
вать экспериментальные данные для расчетов в любое время.
На одной координатной системе плоттер может построить во¬
семь разноцветных кривых. Стерилизуются ферментаторы с
датчиками на месте в собранном виде, заполненные водой или
средой. Заданный режим стерилизации реализуется автомати¬
чески.Для непрерывного анализа выходящих газов биореакторы
дополнительно укомплектованы анализатором кислорода
ГТМК-16 (Россия) и анализатором СО и С02 Инфралит 2200
(Германия). Масс-спектрометр ОМ-311 фирмы «Балцерс»
(Лихтенштейн) применяется для анализа выходящих газов; то
же с мембранным датчиком — для анализа летучих веществ и
растворенных в культуральной жидкости газов.Для измерения еН в стеклянном ферментаторе используют
иономер ЭВ-74 (Россия) с оригинальной системой деполяриза¬
ции электродов, что дает возможность регулировать еН и р02.
В линии аэрации предусмотрен нагреваемый до 350 °С допол¬
нительный воздушный фильтр.4.4. СТАБИЛИЗАЦИЯ И РАСПРЕДЕЛЕНИЕ ВВЕДЕННОЙ
В БИОРЕАКТОР ЭНЕРГИИДля оптимизации бактериального синтеза в систему фермен¬
тации необходимо ввести определенное количество механиче¬
ской энергии, которая должна обеспечить целевые функции
биологического агента:
Инженерное осуществление биотехнологий2511) путем диспергирования гетерогенных систем (воздух,
растворы, клетки, в некоторых случаях нерастворимые суб¬
страты) ;2) равномерным распределением компонентов среды по
объему аппарата (макроперемешивание);3) путем транспорта субстратов и продуктов метаболизма и
обеспечения межфазных переходов, в том числе у поверхности
клеток (микроперемешивание);4) повышением коэффициента теплообмена (увеличением
скорости обтекания теплообменных поверхностей).Обычно все эти задачи решают путем использования аппа¬
рата оптимальной конструкции. В случае аэробных процессов
(или при работе с газообразными субстратами) энергию вводят
с помощью механических рабочих органов (подвод энергии к
жидкой фазе — ЖФ), аэрирующего газа (подвод энергии к
газовой фазе — ГФ) или путем одновременного применения
механических перемешивающих устройств и компрессирован¬
ного газа (комбинированный подвод энергии — к газовой и
жидкой фазам — ГЖФ).Для аппаратов ЖФ и ГЖФ мощность и прочие характерис¬
тики рабочего органа, в первую очередь мешалки, зависят от
реологических и других свойств культуральных жидкостей. Ос¬
новное из этих свойств — плотность (газонасыщение), от кото¬
рой зависит величина потребленной мощности. Для аппаратов
ГФ сказанное относится к системам механического пеногаше-
ния, если таковые имеются. Энергия, вводимая аэрирующим
газом, зависит от количества жидкости в биореакторе; в мень¬
шей степени — от ее газонасыщения.Таким образом, проблема стабилизации введенной в биоре¬
актор ГЖФ и ЖФ энергии практически сводится к стабилиза¬
ции газонасыщения культуральных жидкостей, в том числе к
регуляции плотности пены (к пеногашению). При этом газо¬
насыщение через поверхность фазового контакта газ — жид¬
кость [7, с. 195] существенно влияет на процессы массопере-
дачи. Суммарное количество абсорбированного кислорода про¬
порционально этой поверхности Fr-ж- Проиллюстрируем
сказанное двумя примерами.На рис. 4.20 показано изменение О2 в выходящем газе
Br. flavum после введения в биореактор жидкого пеногасителя.
Кратковременные увеличения 02 после импульса пеногасителя
объясняются переводом в жидкость богатых кислородом погра¬
ничных (околопеиных пузырей) пленок пенных структур, а
последующее снижение — уменьшением Fr-ж в результате
действия введенных поверхностно-активных веществ.На рис. 4.21 приведены значения р02 по высоте различных
биореакторов, в том числе аппарата с контактными устрой¬
ствами (50 м3, схема V по рис. 4.19), в процессе культивиро-
йСт. Puc- 4.20. Изменение концентрации . С02 и 02 в выходящем из фермен-I / татора воздухе после добавления10 мин t ^ пеногасителя (пропинола):1 — 0,2 мл/л; 2 — 0,5 мл/л; 3 — 2 мл/лвания продуцента лизина Br. flavum. Величина р02 зависит
главным образом от размещения контактных устройств и сте¬
пени вспенивания среды, однако для данного случая важен
вывод, что аппараты группы ГФ весьма негомогенны. В аппа¬
ратах группы ГЖФ очень важной проблемой является пено-
гашение.Исследования показали, что с образованием устойчивой
неподвижной пены в верхних зонах аппаратов, в том числе
группы ФГЖ, условия массопередачи через нее ухудшаются.
При этом парциальное давление растворенного С02 увеличива¬
ется, а растворенного кислорода уменьшается. Снижается также
интенсивность дыхания культуры, и ингибируется процесс био¬
синтеза. С добавлением химических пеногасителей условияТарелки С
7 JJO 40• р02, кПаРис. 4.21. Распределение р02 по высоте Н экспериментального ферментатора
(50 м3) с контактными устройствами и диффузором:I, II, III, IV, V — высота установки контактных тарелок; 1, 2 — равновесные рОг;
3, 4 — р02 в аппарате при избыточном давлении ра = 40 кПа и расходе аэрирующего
воздуха 1200 нм3/ч, KVP = \J7 и 1,48 кг/(м3 • ч) по кислороду; 5, 6 — то же, при
Ра“18 и 40 кПа, расходе аэрирующего воздуха 1200 нм3/ч, KVP = 1,92 кг/(м3 • ч)
по кислороду; 7 — то же, в аппарате с диффузором при ра— 40 кПа, расходе аэри¬
рующего воздуха 1500 нм3/ч, Ayj>=2,32 кг/(м8 • ч) по кислороду
Инженерное осуществление биотехнологий253периодического процесса культивирования т:лм, Пп ~~ частота вращения вала мешалки и пеногасителя; а—б —
падение потребленной энергии после включения аэрации; П — момент
- ввода жидкого пеногасителя (ЖП); в—г — повышение Л^м в результате
уплотнения культуральной жидкости (уменьшения газонасыщения) после
ввода ЖП; д — установленный предел нагрузки электродвигателя меха¬
нического пеногасителя; е—ж — падение Л^п после ввода ЖП; е—ж',
ж", ж'м — то же, при различных дозах ЖП; э — точка пересечения
кривых N2w и iV2n при отсутствии ввода ЖП в систему; тп — время
достижения пеной рабочего органа механического пеногасителя; е—и —
идеальная кривая поддержания близкой к постоянной величины jV2п пу¬
тем подачи многократных импульсов ЖП при помощи специального при¬
бора АИПП; г—к — кривая изменения W2M в данном случаежизнедеятельности микроорганизмов восстанавливаются прак¬
тически до нормы. Этим и объясняется отсутствие отрицатель¬
ного влияния пеногасителей на массопередачу кислорода в
культуральных жидкостях, несмотря на наблюдаемое иногда
снижение сульфитного числа. Очевидно, угнетение дыхания
культуры при'использовании тех же самых пеногасителей свя¬
зано с уменьшением содержания газа в жидкости, а следова¬
тельно, и сокращением межфазной поверхности массообмена.В аппаратах группы ЖФ необходимо рассмотреть каждую
конструкцию отдельно, так как они очень различаются.Количество потребленной энергии (газонасыщение культу¬
ральных жидкостей) неодинаково при периодическом культиви¬
ровании, ибо меняются физико-химические свойства среды. Кри¬
вые изменения введенной мешалкой N2U и механическим пено-
гасителем N2n энергии для идеальных условий культивирования
приведены на рис. 4.22. С момента тп соприкосновения пены с
рабочим органом механического пеногасителя до момента е
ввода жидкого пеногасителя происходит постепенное эмульги¬
рование культуральной жидкости. Пена (эмульсия) становится
мельче, а потребленная пеногасителем энергия возрастает. Если
не вводится жидкий пеногаситель, из биореактора выбрасыва¬
ется пена или перегружается электродвигатель. После внесения
пеногасителя происходит падение N2n по линии е—ж. В зави¬
симости от дозы пеногасителя N2n принимает значения ж', ж'\
жДалее процесс повторяется по аналогии с тп — ей
е—ж.Следует добавить, что практически все кривые получаются
пилообразные, так как пена не дает равномерной нагрузки на
рабочий орган механического пеногасителя. Если жидкий пено¬
гаситель не добавляют и конструкция пеногасителя обеспечи¬
вает дальнейшее уплотнение эмульсии (не происходит выброса
пены или поломки электродвигателя), N2n растет и становится
равным N2m. Экспериментально можно создать даже такие си¬
туации, когда N2n>N2м. В идеальном случае целесообразно ста¬
билизировать N2n путем импульсного введения небольших доз
жидкого пеногасителя на уровне допустимой нагрузки электро¬
двигателя, например по кривой е—и на рис. 4.22. Обычно в
таких случаях N2M практически стабилизируется, например по
г—к. Рис. 4.22 учитывает только изменения газонасыщения в
варианте с идеальными условиями культивирования. Конечно,
в реальном периодическом процессе изменяется во времени со¬
став (и свойства) культуральной жидкости, что усложняет
кинетику N2m и N2u. Но это частные случаи, которые возможны
с сотнями конкретных бактериальных продуцентов и соответст¬
вующими питательными средами. Собственно в обеспечении
практически постоянного газонасыщения пены (плотности газо¬
жидкостной эмульсии) по линии е—и на рис. 4.22 мы видим
перспективу стабилизации введенной в биореактор энергии.Существует также возможность применения коллекторных
электродвигателей, позволяющих работать при изменяемых пы
и пи. Это позволяет избежать очень невыгодного падения аб
Инженерное осуществление биотехнологий255после включения аэрации. Однако такие системы по ряду тех¬
нических причин применяют только в лабораторных и пилотных
установках.Возможны следующие варианты технического осуществления
описанного выше принципа стабилизации вводимой в биореак¬
тор механической энергии.Оптимальные условия регулирования пены в реакторах
можно реализовать только при условии комплектации устройств
механическим пеногасителем, системой подачи жидкого пено¬
гасителя и автоматическим регулятором, позволяющим управ¬
лять химико-механическим пеногашением *[55]. Существует
множество механических пеногасителей и достаточно жидкие
ПАВ, но очень мало автоматических регуляторов. Ниже рас¬
сматриваются некоторые регуляторы пены, в том числе и раз¬
работанные авторами, а также биореактор в комплекте с
полной системой пенорегулирования.Регуляторы уровня пены с контактными электродами. Важ¬
ное значение для процессов биосинтеза имеет автоматическое
поддержание заданного уровня пены, так как при ее переливах
теряется часть целевого продукта, возникает возможность ин¬
фицирования среды, а также происходит дестабилизация вве¬
денных N2m и А^2п. Вообще эта задача решается сравнительно
просто: на ферментаторе устанавливают устройство, подающее
химический пеногаситель в зависимости от уровня пены. Можно
также на заданном уровне пены установить контактный элек¬
трод. Например, используют устройство с электрическим регу¬
лятором-сигнализатором уровня ЭРСУ-2, который при необхо¬
димости включает подачу пеногасителя либо подает звуковой
или световой сигнал, уменьшает подачу воздуха на аэрацию.
Для биореакторов разработана комбинированная система с
возрастающей эффективностью действия. Сигнал от датчика
поступает на усилитель, который включает механический пено¬
гаситель. Одновременно по сигналу через заданные промежутки
времени включается импульсный регулятор подачи химического
пеногасителя.Нами разработаны кондуктометрические регуляторы уровня
типа ПАП со встроенным счетчиком доз химического пенога¬
сителя.Для пеногашения в биореактор предложено подавать све¬
жую питательную среду. Заданный уровень пены поддержива¬
ется контактными электродами. В открытых биореакторах
используют устройство с пьезометрическим уровнемером для
автоматического предотвращения избытка пены.Простой следящий регулятор, определяющий степень очистки
жидкости от газа, представляет собой поплавок, погруженный
в дегазированную жидкость.
256Глава 4Поскольку не все пены электропроводны, напряжение пи¬
тания электродов колеблется обычно от 10 до 30 В, а через
пену пропускается постоянный ток 5... 20 мА и более, воз¬
можна поляризация электродов, приводящая к изменению их
чувствительности. При использовании переменного тока наблю¬
дается эрозия электродов и попадание ионов металла в куль¬
туральную жидкость. При загрязнении емкостных электродов
пеной чистить их очень сложно.Бесконтактные регуляторы уровня пены. При их использо¬
вании не возникает осложнений, которые имеют место в случае
эксплуатации контактных электродов.Представляет интерес применеиие в автоматических систе¬
мах пенорегулирования радиоизотопных плотномеров как для
позиционных измерений, так и для непрерывного измерения
уровня пены.При обильном пенообразовании в аппарате повышается
давление. Это явление учитывается в автоматической системе,
изменяющей уровень культуральной жидкости в биореакторе в
зависимости от давления в нем. Можно следить за уровнем
пены с помощью сканирования ультразвуком.Нами разработаны прибор АИПП-1 и способ регулирования
пены, который предусматривает при увеличении нагрузки на
вал выше заданной уменьшение частоты импульсов подачи воз¬
духа на аэрацию. Эта частота должна быть в 4... 20 раз
меньше частоты изменения нагрузки на вал пеногасителя. При
фиксировании датчиком уровня пены «мин» запускается элек¬
тродвигатель механического пеногасителя, при этом напряжение
со вторичной обмотки измерительного трансформатора посту¬
пает на выпрямитель и дальше на схему сравнения. Уровень
-срабатывания схемы сравнения задается источником тока че¬
рез переменный резистор. Если среднее значение выпрямленного
напряжения вторичной обмотки трансформатора, пропорцио¬
нальное нагрузке электродвигателя механического пеногасителя,
превысит установленное напряжение источника тока, схема
сравнения сменит полярность выходного напряжения и через
усилитель запустит реле, включающее реле времени «задер¬
жка».Если нагрузка на механический пеногаситсль за время,
установленное на реле времени «задержка», не уменьшится
ниже уровня, заданного источником тока, запустится следующее
реле времени «интервал», периодически включающее реле вре¬
мени «доза». В свою очередь оно подает сигнал на исполни¬
тельный механизм, который включает подачу химического' пено¬
гасителя внутрь биореактора. При аварийном уровне пены сра¬
батывает датчик «макс» и подается химический пеногаситель
независимо от величины нагрузки механического пеногасителя.
Регуляторы такого типа применяют в основном для систем сте-
Инженерное осуществление биотехнологий257рильного культивирования продуцентов биологически активных
веществ.Несмотря на ряд преимуществ автоматических регуляторов
пенообразования, в промышленности их применяют редко. На
предприятиях превалирует простейшая контактная автоматика,
на некоторых заводах уровень пены регулируют вручную.Рассмотрим в качестве примера биореактор в комплекте с
системой регулирования процесса по состоянию газожидкостной
эмульсии (пены).В биореакторе вместимостью 100 м3 с контактными устрой¬
ствами установлен экспериментальный механический пеногаси-
тель в виде гладкого диска с приводом мощностью 13 кВу и
частотой вращения 150 об/мин. Аппарат снабжен мерниками
для подачи химического пеногасителя и подпитки питательной
средой. Вал механического пеногасителя введен в биореактор
через стерилизуемое уплотнение. Нагрузка на электродвигатель
привода пеногасителя измеряется прибором АИПП-1, который
управляет включением механического и подачей химического
пеногасителей.Система обеспечивает близкие к идеальным условия куль¬
тивирования микроорганизмов, так как достигается практиче¬
ски постоянная плотность (газонасыщение) пенной эмульсии.
При этом максимально используется механическое пеногаше-
ние, жидкие ПАВ вводятся только для предотвращения перели¬
вов пены. Дозы- ПАВ отрегулированы так, что механический
пеногаситель имеет номинальную нагрузку и после подачи им¬
пульса жидкого пеногасителя. Таким образом, не происходит
лавинообразного разрушения газожидкостной эмульсии. В ис¬
пытаниях достигнута значительная экономия пеногасителя и
воздуха, подаваемого на аэрацию, при нормальном росте про¬
дуцента и биосинтезе лизина.Третий компонент баланса механической энергии — введен¬
ная в биореактор с газом энергия N2r> более постоянная по
сравнению с N2M и N2n, так как ее диссипация в основном опре¬
деляется перепадом давления, что, в свою очередь, пропорцио¬
нально гидростатическому столбу жидкости. После стабилиза¬
ции суммарной введенной в биореактор энергии N2M-{-N2n не¬
обходимо обратить внимание на распределение N2M+N2n-\-N2r
внутри биореактора. Понимание этих процессов позволяет соз¬
давать и применять соответствующие системы аэрации и переме¬
шивания (максимальный КПД использования введенной меха¬
нической энергии для осуществления массопередачи на фазовых
переходах и гомогенизации содержимого биореактора). При
этом необходимо исключить механические повреждения клеток
и учесть потребность аэробных культур в кислороде, оптималь¬
ный состав питательной среды и т. д. Значение рационального
использования введенной энергии Ni повышается, поскольку вся17 — 361
258Глава 4введенная энергия диссипирует в тепло. Следовательно, увели¬
чение iV2 автоматически влечет за собой повышение затрат на
отвод избыточной теплоты.Распределение введенной энергии важно в следующих ас¬
пектах:1) гомогенизация биореакторов по основным составным
компонентам культуральных жидкостей, а также по газонасы-
щению;2) обеспечение микроперемешивания, т. е. массопередачи на
фазовых переходах.Данная проблема весьма сложна, и ее решению посвящена
теория масштабных переходов, которая лежит в основе констру¬
ирования систем аэрации и перемешивания и биореакторов в
целом. Для понимания проблемы на уровне биотехнологов мы
рекомендуем уже упомянутую схему транспорта [7, с. 195], где
рассмотрены основные факторы, влияющие на распределение
введенной энергии и наиболее важные параметры индикации
перемешивания (распределения энергии). Методы масштабиро¬
вания и оценки созданной аппаратуры по распределению вве¬
денной в биореактор энергии, в том числе по фазовым перехо¬
дам, подробно изложены в работе |[6].4.5. ИЗМЕРЕНИЕ И КОНТРОЛЬ
ФИЗИКО-ХИМИЧЕСКИХ ПАРАМЕТРОВ СРЕДЫУспех практической реализации процессов бактериального
синтеза зависит от умения использовать два типа регулирую¬
щих факторов: активности внутриклеточных биохимических
реакций и условий внешней среды. Особенность использования
микробных клеток в качестве биокатализатора состоит в том,
что их биосинтетическая активность, как известно, зависит от
условий среды. Цель управляемого культивирования — создать
во времени наиболее благоприятные (оптимальные) физиоло¬
гические условия в биореакторе.Основные параметры, по которым контролируют и регули¬
руют процессы бактериального синтеза, подразделяют на две
группы: физические и химические (включая физико-химические
и биохимические) 1[32].Измерение перечисленных параметров в процессах бактери¬
ального синтеза мало чем отличается от общепринятых [12, 20,
23, 25, 36, 39, 41, 43, 51]. Информация, получаемая с помощью
различных датчиков и устройств, очень разнокачественна. Ниже
приведены параметры и характеристики процесса культивиро¬
вания микроорганизмов, сгруппированные по способу получе¬
ния информации.
Инженерное осуществление биотехнологий259Основные параметры контроля процессов бактериального
синтеза и их функцииВозможные контрольные функцииФизические параметрыТемператураОхлаждение, нагревание, стерилиза¬цияДавлениеРегуляция аэрацииМассаСкорость подпитки, разбавлениясредыСкорость потока газа иРежим аэрации, дозирование под¬жидкостипитки, режим непрерывной куль¬турыВязкость средыНакопление внеклеточных полимеровМощность электродвига¬ПеремешиваниетеляВспениваниеВключение пеногашенияХимические параметрыpHДобавление кислоты или щелочи, ре¬гуляция подпиткиеНРежим аэрации (при низких р02)ро2Скорость массообмена 02, концен¬трация растворенного 02рС02Концентрация растворенного С02Анализ выходящихгазовСкорость массообмена газов, управ¬ление подпиткойАнализ компонентовКоррекция состава среды, управле¬средыние подпиткойАнализ внутриклеточныхРегуляция метаболизмакомпонентовОсновные характеристики, измеряемые в масштабе реаль¬
ного времени:I) продолжительность процесса;2) температура (в биореакторе, охлаждающей воды, при
стерилизации, в воздушном фильтре и др.);3) давление (в аппарате, в воздушной линии, уровня жид¬
кости в аппарате и др.);4) мощность на валу электродвигателя;5) частота вращения мешалки;6) pH, р02, еН, рС02;7) скорость потока аэрируемого газа на входе и выходе;8) химический состав аэрируемого газа на входе и выходе;9) количество титрантов для регулирования pH;10) количество или скорость потока питательной среды и
других добавок;II) уровень пены (или наличие пены) и расход пеногаси¬
теля;12) оптическая плотность или мутность среды;13) концентрация неорганических ионов, измеряемая с по¬
мощью ионселективных электродов;17*
260Глава 414) флуоресценция;15) концентрация некоторых субстратов и метаболитов, из¬
меряемая с помощью биосенсоров (глюкоза, молочная кислота
И др.).Основные характеристики процесса бактериального синтеза,
полученные путем отбора образцов:1) число клеток, их подробный морфологический и цитохи¬
мический анализ;2) количество живых клеток (после высева в чашки Петри);3) наличие посторонней микрофлоры;4) масса высушенной биомассы;5) концентрация биомассы по оптической плотности или
мутности культуральной жидкости;6) концентрация источника углерода;7) концентрация источника азота;8) концентрация целевого продукта;9) концентрация белка в культуральной жидкости;10) анализ побочных продуктов биосинтеза;И) активность ключевых ферментов;12) концентрация АТР, NADH и других ключевых регуля¬
торных метаболитов.Основные расчетные величины, получаемые с помощью ЭВМ
после обработки первичной информации:1) скорость потребления кислорода;2) скорость выделения СОг;3) дыхательный коэффициент;4) концентрация биомассы и удельная скорость роста куль¬
туры;5) удельные скорости роста, дыхания, потребления субст¬
рата и синтеза продукта;6) коэффициенты выхода продукта;7) баланс процесса (в пределах первого закона термодина¬
мики), интенсивность тепловыделения, непродуктивные затраты
энергии;8) коэффициент массопередачи кислорода;9) величина введенной мощности;10) кинетические характеристики процесса;И) константы математических моделей.Существуют две противоположные тенденции в инструмен¬
тальном оснащении биореакторов. Первая — оснастить биоре¬
актор как можно большим числом датчиков и ЭВМ с целью
получения максимально возможной информации о прохождении
процесса. Такой подход желательно использовать на этапе ла¬
бораторных исследований. Однако надежда на то, что чем
больше параметров мы будем регистрировать, тем лучше будет
практический результат в производстве, далеко не всегда осу¬
ществляется.
Инженерное осуществление биотехнологий261Рис. 4.23. Базисный вариант ос¬
нащения биореактора локальными
контрольно-измерительными при¬
борами для процессов культиви¬
рования аэробных микроорганиз¬
мовЗдесь в основном три причины. Во-первых, инструменталь¬
ное усовершенствование контроля неизбежно связано с мате¬
риальными затратами, что сказывается на себестоимости про¬
дукта. Во-вторых, как уже указывалось, качество информации,
получаемой с помощью различных датчиков, сильно различа¬
ется. Информативность складываетсй из технических характе¬
ристик датчика (чувствительность, время ответной реакции,
точность, разрешающая способность, воспроизводимость, ли¬
нейность зависимости) и того, в какой мере измеренный сигнал
отражает интересующую нас биосинтетическую активность.
В-третьих, не всегда первичная информация, получаемая с по¬
мощью датчиков, пригодна для регулирования процесса.Как правило, зависимость между измеренным сигналом, ожи¬
даемой биохимической активностью клетки и регулирующим
воздействием достаточно сложна. Часто успех в оптимизации
процесса в меньшей мере зависит от технических средств, но
главным образом определяется качеством алгоритма управле¬
ния.На практике встречается противоположная тенденция —
проводить биотехнологический процесс как можно проще, с ми¬
нимумом контрольно-измерительных систем. В этом случае
результат очень сильно зависит от квалификации обслуживаю¬
щего персонала, к тому же затруднена возможность автомати¬
зации производства. По-видимому, должно быть компромиссное
решение при оснащении процессов бактериального синтеза
контрольно-измерительными приборами. Базисный вариант
(рис. 4.23) предполагает измерение температуры, р02, pH куль¬
туральной жидкости, давления в аппарате, детекции пены, мощ¬
ности электродвигателя и частоты вращения мешалки. В охлаж-Частота Вращения ^
бала мешалки^ (юМощностьv
Кислота,
щелочь _ чу
fie нога си тел/Г “
питательная
среда*Газоанализа-
^торыРасход охлаж¬
дающей доды0-4Темп
262Глава 4Рис. 4.24. Базисное оснащение биореактора, контролируемого и управляемого
с помощью ЭВМ: измерение, управление, ЭД — электродвигательдающей рубашке измеряют температуру и расход подаваемой
воды, в линиях подачи аэрируемого воздуха — давление и
расход воздуха. На выходящей линии анализируются количест¬
венные и качественные изменения состава газов с помощью
газоанализатора. Предусмотрено также измерение расхода жид¬
кости для регулирования pH и в линии подачи питательных
веществ. Эти же функции могут реализовываться автоматически
с помощью ЭВМ. Базисное оснащение биореактора, контроли¬
руемого и управляемого с помощью ЭВМ, показано на рис. 4.24.
В зависимости от специфики процесса к этим основным пара¬
метрам добавляют другие (см. с. 259—260).Остановимся подробнее на отдельных основных параметрах.
При изложении материала будем придерживаться следующей
логической последовательности:1) измерение и регулирование данного параметра;2) его физико-химическая сущность и физиологическая
роль;3) возможности его использования для управления процес¬
сом.
Инженерное осуществление биотехнологий263Температура. Кроме самого биосинтетического процесса,
температурный режим важен также при стерилизации аппарата,
подготовке питательных сред и на этапе выделения продукта.
Измерение и регулирование температурного режима в биореак¬
торе без нарушения стерильности не составляет трудности. Для
измерения пользуются термосопротивлениями, термопарами,
термисторами и жидкостными термометрами. В малогабарит¬
ных аппаратах тепловой режим регулируют с помощью нагре¬
вательных элементов, расположенных либо в водяной рубашке,
либо на границе контакта с культуральной жидкостью. В ап¬
паратах большого объема заданный тепловой режим создается
путем пропускания пара или холодной воды через специальные
системы теплообмена.Температура оказывает комплексное воздействие на микро¬
организмы. Прямое влияние связано с изменением скорости
биохимических реакций и структуры клеточных компонентов,
косвенное — с изменением вязкости среды, растворимости га¬
зов и других компонентов, скорости диффузии веществ.Рост микроорганизмов является суммой многих фермента¬
тивных реакций. Как известно, скорость реакции зависит от
температуры:v=Ae-E'*T, (4.6)где А — константа; Е — энергия активации; R — газовая
постоянная; Т — абсолютная температура.Для всех микроорганизмов характерно наличие узкого диа¬
пазона температур, при котором проявляется наибольшая био¬
логическая активность. Однако прокариоты отличаются чрезвы¬
чайным разнообразием в отношении температуры окружающей
среды. По этому признаку микроорганизмы подразделяют на
три группы (рис. 4.25). Психрофилы имеют свой температур¬
ный оптимум при /<20 °С и способны расти при /<0°С. Наи¬
большую группу составляют мезофилы, оптимум развития кото¬
рых при 30... 40 °С. Биотехнологов интересуют термофилы,
представляющие преимущественно анаэробные бактерии. Экс¬
тремально термофильные бактерии способны развиваться при
/>100 °С.Температура в отношении регуляции метаболизма бактерий
оказывает неспецифическое влияние. Выяснено, что в диапазоне
физиологических температур все ферменты клетки имеют при¬
близительно одинаковую энергию активации. Это означает, что
резкого изменения соотношения метаболических потоков не про¬
исходит и, следовательно, стехиометрические показатели роста
популяции мало зависят от температуры среды. У мезофильных
бактерий Е. coli в диапазоне температур 17...32°С, у Kleb¬
siella pneumoniae'при 25...39°С выход биомассы прак¬
тически не меняется. Общая закономерность — уменьшение
Рис. 4.25. Зависимость максимальной ско¬
рости роста от температуры у психрофилов
Vibrio psychroerythrus (/), мезофилов Вгш
flavum 22ЛД-П (2), термофилов Bacillus
acidocaldarius Д4 (5)с увеличением температуры. Причиной этого является воз¬
растание непродуктивных затрат энергии.Температурный коэффициент Qio (увеличение скорости реак¬
ции при повышении температуры на 10 °С) в ферментативных
реакциях близок к 2, но для затрат на поддержание метабо¬
лизма у К. pneumoniae — около 4. У одной бактериальной
культуры температурные оптимумы для цмакс и У “/“могут не
совпадать. Известны также некоторые примеры, когда различа¬
ются температурные оптимумы роста и сверхсинтеза продуктов.
Например, понижение температуры в фазе синтеза способствует
образованию рибофлавина, антибиотиков, бактериальных поли¬
сахаридов.Интересные возможности в биотехнологии, позволяющие с
помощью температурного режима регулировать метаболизм,
появились с использованием мутантов, содержащих термочув¬
ствительные белки (beat-shock proteins) [38], и особенно плаз¬
мид с температурно-чувствительной репликацией [52]. Созданы
рекомбинантные штаммы бактерий, у которых при повышении
температуры до 35 °С теряется контроль репликации плазмиды,
содержащей нужную генетическую информацию. При этом ДНК
плазмиды достигает 75% клеточной ДНК и обеспечивает сверх¬
синтез рекомбинантных белков. Примером температурно-чувст¬
вительной репликации является использование PL промотора
фага X. Температурно-чувствительным является белок-репрес-
сор, который не работает при температуре 30°С, но активизи¬
руется при 42 °С i[3].Величина pH. Является, как известно, отрицательным лога¬
рифмом активности свободных ионов водорода (ан+), что в
разбавленных растворах близко совпадает с их концентрацией
(Н+):рН =—In ан+ ——In (Н+). (4.7)pH измеряют с помощью Н+-проницаемых стеклянных элек¬
тродов (комбинированных либо с отдельным Ag/AgCl-электро-
дом сравнения). Для биотехнологии наиболее удобны стерили¬
зуемые паром (до 121 °С) комбинированные электроды. pH ре¬
гулируется автоматической подачей титранта по сигналу от
Инженерное осуществление биотехнологий26SРиС. 4.26. Зависимость (1макс от pH
среды у ацидофнлов Bacillus acido-
caldarius Д4 (1), нейтрофилов Вг.
flavum 22ЛД-П (2) и алкалофилов
Вас. alcalophilus (3)Ртах'4'1рН-метра путем открывания клапана или включения насоса.
Технически автоматическая регуляция pH не вызывает затруд-
H2SO4, NH4OH, NaHC03. Однако необходимо учесть физико-
нений. В качестве титрантов обычно применяют растворы NaOH,
химические и физиологические эффекты, связанные с регуля¬
цией pH культуральной жидкости во время процесса.Существуют две доминирующие причины изменения pH ва
время культивирования микроорганизмов. Первая из них свя¬
зана с ассимиляцией источников углерода, азота, фосфора,
являющихся электролитами. Например, ассимиляция азота в
виде иона NH4+ из сульфата аммония вызывает подкисление
среды. Использование нитратов как источников азота приводит
к подщелачиванию среды — ЫОз~ ассимилируется клетками;
оставшийся катион К+ или Na+ увеличивает pH культуральной
жидкости.Вторая основная причина связана с образованием и выде¬
лением микроорганизмами кислых продуктов. Например, ха¬
рактерно подкисление среды вследствие выделения молочной
кислоты при недостаточной аэрации. Необходимо учесть, что
применение титрантов для поддержания pH на заданном
уровне приводит к нежелательным изменениям физико-хими-
ческих свойств культуральной жидкости. Главные из них —
уменьшение активности воды и увеличение осмотического дав¬
ления вследствие накопления, например, иона Na+ в среде. Зная
и правильно учитывая природу процессов, приводящих к изме¬
нениям pH во время культивирования, можно подобрать нуж¬
ный состав питательной среды и вести процесс без применения
титрантов.Как известно, по способности расти в зависимости от pH
среды микроорганизмы подразделяют на ацидофилы (оптимум
pH около 4), нейтрофилы (pH 7) и алкалофилы (рН>9). Са¬
мое большое разнообразие в природе в отношении обитания
в средах с различными значениями pH наблюдается у прока¬
риот. Типичные зависимости скорости роста у представителей
трех групп бактерий представлены на рис. 4.26. Максимальная
удельная скорость роста наблюдается в достаточно узком диа¬
пазоне значений pH среды.
266Глава 4Рис. 4.27. Зависимость значений внутри**
клеточного pH у Zymomonas mobilis 113;
от величины pH среды в метаболически;
активных (/) и голодающих клетках'*
(2) \а5pH средыИоны водорода (протоны) по сравнению с другими ионами
более активны в биохимических и физико-химических реакциях,
связанных с /жизнедеятельностью бактерий. Все ферменты, в
том числе изолированные из ацидофилов и алкалофилов, имеют
узкий диапазон активности с максимумом, близким к pH 7.
Независимо от концентрации ионов водорода бактерии стре-,
мятся поддерживать pH внутри клетки постоянным: ацидо-'
филы — 6,5; нейтрофилы — 7,5; алкалофилы — 9,5 [44]. Име-;
ются специальные механизмы регуляции клеточного pH гомео- i
стаза, такие, как ЭТЦ аэробных бактерий, Na+/H+ антипорт у;
алкалофилов. Менее выражен внутриклеточный pH гомеостаз ]
у анаэробных бактерий, у которых функцию регуляции pH в ;
цитоплазме выполняет Независимая ATP-аза. На рис. 4.27,
показана зависимость внутриклеточного pH от pH среды у i
бактерий Zymomonas mobilis.В энергетическом метаболизме бактерий ионы водорода иг¬
рают исключительно важную роль. Они являются основными ;
потенциалобразующими ионами на энергосопрягающих мембра-;
нах. Механизмы энергетического сопряжения локализованы у
бактерий в цитоплазматической мембране. Для выполнения
основных энергетических функций бактериальная мембрана
должна быть «заряжена». Это достигается образованием транс¬
мембранной разности электрохимического потенциала ионов
водорода — протондвижущей силы: Iгде A\J? — мембранный потенциал; R — газовая постоянная;Т — абсолютная температура; при 25 °С множитель 2,3R7’/F=
= 59 мВ; F — число Фарадея; АрН — градиент pH по обе
стороны мембраны.Протондвижущая сила создается энергозависимым путем —
работой ЭТЦ, Независимой АТР-азой или экскрецией некото¬
рых метаболитов. Очевидно, Др зависит от pH окружающей
среды. Классическая зависимость Ар и ее составляющих Дф !Др^+Ц^-ДрН,(4.8)
Инженерное осуществление биотехнологий267•WхдрНpH средыpH средыРис. 4.28. Зависимость протондвижущей силы (Др) и ее
составляющих Дг|э и ДрН от величины pH среды у Br. flavum
в энергетически лимитированных (а) и нелимитированных
(б) условияхи АрН от pH среды имеет вид, представленный на рис. 4.28,а.
В физиологическом диапазоне pH среды у энергетически нели-
митированной культуры Ар поддерживается постоянным. В ус¬
ловиях энергетического лимита Ар снижается с уменьшением
pH среды. Причина этого явления заключается в необходимо¬
сти дополнительных затрат энергии для компенсации увеличен¬
ной пассивной Непроницаемости мембраны при низких значе¬
ниях pH среды.pH среды сильно влияет на транспорт веществ, которые
подвержены диссоциации. Мембрана считается непроницаемой
для ионизированных заряженных частиц. В связи с этим орга¬
нические кислоты легче диффундируют при значениях pH среды,
меньших рКа соответствующей кислоты. В зависимости от pH
меняется также эффективность систем активного транспорта
(например, переносящих нейтральные молекулы в симпорте с
протонами).Концентрация ионов водорода в среде оказывает воздей¬
ствие на метаболизм бактерий. Этот феномен широко известен
и часто на основе эмпирических закономерностей применяется
для регулирования процессов бактериального синтеза. Харак¬
терным примером является переключение метаболизма с обра¬
зования кислот на экскрецию нейтральных веществ при ацето¬
нобутиловом брожении при понижении pH среды. Это явление
можно объяснить скачкообразным уменьшением внутриклеточ¬
ного pH [35]. Зная зависимость pH внутриклеточного от pH
среды, можно, очевидно, управлять метаболизмом бактерий.Следует отметить, что изменением pH среды можно косвен¬
ным путем влиять на технологический процесс. Например,
можно в некоторых пределах изменить состав среды, используя
явление pH-зависимой преципитации солей органических
кислот, фосфатов, микроэлементов. Другая обратившая на себя
внимание в последнее время pH-зависимая особенность многих
бактериальных культур заключается в способности образовы¬
вать клеточные агрегаты. Изменением pH среды можно нейтра¬
лизовать поверхностный заряд клетки и способствовать обра¬
зованию флокул.Редокс-потенциал. Для простой системыеН=£о+Щ-1п , (49)п¥ [восстановитель]где еН — измеряемый потенциал, выраженный относительно
нормального водородного электрода; Е0 — стандартный потен¬
циал системы; п — число переносимых электронов.еН измеряют с помощью платиновых электродов. Одна из
проблем применения этого параметра связана с искажением
результатов в результате поляризации электродов. Данный
недостаток ликвидируется в измерительных системах с депо¬
ляризацией электродов [12]. еН-Электроды стерилизуемы, в
системах с деполяризацией дают воспроизводимую информа¬
цию об изменении редокс-потенциала среды. Однако этот па¬
раметр в контроле и управлении процессами бактериального
синтеза широкого применения, к сожалению, не получил. При¬
чиной тому являются значительные сложности в интерпретации
результатов. Редокс-электрод реагирует на изменение pH и
р02 среды и отражает некий суммарный окислительно-восста-
новительный потенциал культуральной жидкости. Корреляция
изменений этого параметра с активностью продуцента носит
эмпирический характер. Все же отдельные опыты свидетель¬
ствуют о том, что данный параметр может быть успешно ис¬
пользован, например, для регуляции массопередачи кислорода,
для контроля и регуляции анаэробных процессов [28].Осмотическое давление и активность воды. Являются взаи¬
мосвязанными величинами в культуральной жидкости [34]:n=RT\naw/VWi (4.10)где Я — осмотическое давление (потенциал воды); aw — ак¬
тивность воды; W — парциальный молярный объем воды.Созданы приборы, с помощью которых непрерывно измеряют
относительную влажность ср потока воздуха, уравновешенного
со средой. Если принять, что водяные пары подчиняются за¬
кону идеального газа, то(4.11)где mw — масса водяных паров в фиксированном объеме
Инженерное осуществление биотехнологий269влажного воздуха; mWo — максимальная масса водяных па¬
ров, адсорбированных в том же объеме воздуха. Определяемая
этим путем величина ф пропорциональна активности воды, ко¬
торая по определению является характеристикой количества
свободной воды в системе:dw=pslpwy (4.12)где ps — парциальное давление водяных паров в растворе;
pw — то же, для чистой воды.Активность воды проще определить по формуле, которая
связывает aw с концентрацией солей:а\¥== - ° , (4.13)nB+nsгде пв — молярная концентрация воды (растворителя); ns —
молярная концентрация растворенного вещества.Активность воды в культуральной жидкости определяется
двумя факторами. Во-первых, активность воды уменьшается
при наличии в среде нерастворимых частиц, способных адсор¬
бировать молекулы воды. Этим свойством обладают все био¬
полимеры, особенно полисахариды. Во-вторых, активность воды
зависит от осмотических эффектов, определяемых взаимодейст¬
вием воды с растворенными веществами. На самом деле эф¬
фектором среды, влияющим на метаболизм бактерий, по-види-
мому, является осмотическое давление. Однако датчиков и
измерительных систем для этого параметра в биотехнологичес¬
ких процессах пока не существует.Как известно, для нормальной жизнедеятельности клетка
должна иметь некое внутриклеточное давление — тургор.
У грамположительных бактерий Staphylococcus aureus внутри¬
клеточное осмотическое давление составляет 20...25-105 Па;
у грамотрицательных Е. coli — 4...8-105 Па [47]. Грамотри-
цательные бактерии более чувствительны к порышению осмо¬
тического давления среды (понижению активности воды).Минимальное значение активности воды, при котором разви¬
ваются Salmonella typhimurium, составляет 0,97. Грамположи-
тельные бактерии из-за особенностей строения клеточной стенки
более осмотолерантны. Например, S. aureus растут еще при
aw=0,86 [47]. При более низких значениях активности воды
происходит плазмолиз.Хотя влияние активности воды и осмотического давления
на метаболизм микроорганизмов, в частности бактерий, мало
изучено, уже сейчас можно указать на некоторые прикладные
аспекты этой проблемы. Внутриклеточное осмотическое давле¬
ние во многом определяет метаболизм микроорганизмов.
270Глава 4Таблица 4.8. Примеры наиболее распространенных субстратов,продуктов, метаболитов, анализируемых с помощью
ферментных электродовВеществоФерментДетектируемый
продукт реакцииГлюкозаСахарозаЛактозаГ люкозооксидаза + каталаза
Инвертаза+глюкозооксидаза
Р-галактозидаза+глюкозо-Нг02, О2
Н202
Н202, Н+СпиртыЛизинМочевинаПенициллинПируватL-аминокислотыАцетальдегидоксидазаАлкогольоксидазаЛизиноксидазаУреазаПенициллиназа (Р-лактамаза)
Г лутаматдегидрогеназа
Оксидаза L-аминокислот
КсантиноксидазаН+NH4+NH4+, Н202
Н+В отношении бактерий этот вопрос изучен недостаточно, но в
отношении грибов показано, что осмотическое давление (соот¬
ветственно и активность воды) регулирует морфогенез Грибов.На практике используется явление осмотического шока для
высвобождения и последующего отделения ферментов, связан¬
ных с клеточной стенкой и периплазмой. Использование
осмофильных бактерий способствует улучшению некоторых био¬
технологий '[46]. В основном это относится к микробиологи¬
ческой очистке сточных вод, для которых показано, что биоло¬
гическая потребность кислорода может быть увеличена путем
контролируемого повышения концентрации NaCl в культураль¬
ной жидкости [31].Анализ компонентов среды. Контроль состава среды
(культуральной жидкости) наиболее адекватно отражает про¬
хождение процессов бактериального синтеза. В эту группу мы
включили все компоненты, изменение концентрации которых
связано с ростом популяции и метаболической активностью
клеток: питательные вещества, потребляемые из среды, а также
метаболиты и продукты жизнедеятельности, которые образу¬
ются в процессе роста микроорганизмов, включая новую био¬
массу. Технические возможности измерения и контроля этой
важной группы параметров оставляют желать лучшего. Только
некоторые из них могут быть измерены в масштабе реального
времени и соответственно использованы для непрерывного уп¬
равления процессом биосинтеза. В этом отношении из указан¬
ных ниже компонентов среды технически наиболее легко осу¬
ществить контроль газов и летучих веществ.Одно из затруднений в использовании ЭВМ для управления
бактериальным синтезом заключается в том, что для большин-
Инженерное осуществление биотехнологий271Перечень компонентов среды и методов анализа их концентрацииБиомассаВнеклеточные метаболи¬
ты (продукты)Растворенные газы и ле¬
тучие веществаОрганическийуглеродаисточникМакроэлементы (С, О,Н, N, S, Р, К, Са, Mg)МикроэлементыФакторы ростаМетод контроляСпектрофотометрический (по оптической плотно¬
сти или мутности среды);
гравиметрический — взвешивание высушенной
биомассы;микроскопический или автоматизированный под¬
счет числа клеток;
электропроводность (импеданс);
биохимический анализ концентрации белка, ДНК,
АТР и других клеточных компонентов;
косвенный расчет по балансу 02, С02, теплоты*
Биохимические анализы;ферментные электроды (в отдельных случаях);высокоэффективная жидкостная хроматографияГазоанализаторы С02 и 02*;мембранные электроды;масс-спектрометрия;газовая хроматографияФерментные электроды (для некоторых субстра¬
тов);биохимические и физико-химические анализы
Анализатор С, N, Н, О;ионселективные электроды Са2+, N03+, NH*+
и др.Атомно-адсорбционная спектроскопия;
ионселективные электроды Cd2+, Zn2+ и др.
Биохимические анализы* Параметры, измеряемые в масштабе реального времени.ства органических веществ, являющихся субстратами, продук¬
тами и метаболитами, нет прямых методов измерения. В пос¬
леднее время для этих целей применяют биосенсоры, в том
числе ферментные электроды (табл. 4.8) [39]. Ферментные
электроды обладают высокой селективностью по отношению к
измеряемому веществу, являются чувствительными и достаточно
стабильными датчиками. Трудности со стерилизацией, необхо¬
димость в большинстве случаев предварительно готовить мате¬
риал к анализу затрудняют их использование. Интересно
отметить, что исследования в этом направлении продолжаются
и перечень компонентов, концентрацию которых можно опре¬
делить с помощью ферментных электродов, быстро расширя¬
ется.Анализ внутриклеточных компонентов. Непрерывное наблю¬
дение за концентрацией определенных внутриклеточных ком¬
понентов или активностью ферментов дает наиболее точную
информацию для контроля и управления процессами бактери¬
ального синтеза. В патентной литературе можно найти доста¬
точно много примеров, когда процессы биосинтеза управляются
по активности отдельных ферментативных реакций. Разрабо¬
таны полуавтоматические сложные анализаторы, которые
позволяют проводить такие анализы. Отбор проб, отделение
биомассы, дезинтеграция клеток, добавление необходимых ин¬
гредиентов для тест-реакции, спектрофотометрирование и ана¬
лиз результатов осуществляются автоматически или полуавто¬
матически [25, 41]. Однако широкого применения подобные
аналитические системы не получили. Сообщается также об
автоматическом анализаторе концентрации АТР в клетках [30].
Эта работа также пока не получила развития. Для контроля
внутриклеточных пигментов и флуоресцирующих соединений
более широко используют спектрофотометрические и флуорес¬
центные зонды. С помощью флуорометрического датчика, на¬
пример, можно следить за концентрацией восстановленных
пиридиннуклеотидов в клетках.Методы контроля концентрации и активности внутриклеточ¬
ных компонентов сложны и дороги. Пока они не нашли широ¬
кого применения.
Глава 5ПОЛУЧЕНИЕ ПРОДУКТОВ
МИКРОБНОГО СИНТЕЗАКак известно, целевые продукты микробного синтеза могут
находиться:1) в массе биологического агента (в клетках популяции);2) после синтеза (сверхсинтеза) выводятся из клеток в
культуральную жидкость (экзопродукты);3) в твердофазной массе при поверхностном (твердофаз¬
ном) культивировании;4) в протекающей через биокаталитический реактор жид¬
кости при осуществлении конверсии с помощью иммобилизо¬
ванных биологических агентов.Нередко целевым продуктом является биомасса. Целевым
продуктом может быть также весь сухой остаток культуральной
жидкости, т. е. смесь остатков питательной среды биомассы и
экзопродуктов биосинтеза — микробиологический концентрат
,[6, 17].В зависимости от места нахождения целевого продукта (-ов)
биотехнологические схемы после ферментации существенно раз¬
личаются. Так, выделение внутриклеточных продуктов биосин¬
теза связано с дезинтеграцией биомассы. Получение микробио¬
логических концентратов, на первый взгляд, наиболее простой
процесс, осложняется аморфной структурой продукта, что вне¬
шне выражается в виде гигроскопичности, термопластичности
и других технологически «неудобных» свойств. Технологические
варианты обработки продуктов ферментации представлены на
рис. 5.1 и 5.2 ![3, с. 178; 6, с. 121].5.1. МИКРОБИОЛОГИЧЕСКИЕ КОНЦЕНТРАТЫКонцентратные формы ряда продуктов микробиологического
синтеза кормового назначения — аминокислоты (ККЛ), вит¬
амины, ферментные и бактериальные препараты, в которых18 — 361
Рис. 5.1. Схема переработки культуральных жидкостей после ферментацииосновная масса компонентов составляет водорастворимую эк-
страцеллюлярную фракцию, имеют, в частности, повышенную
гигроскопичность, что затрудняет обезвоживание культуральных
жидкостей.Известные приемы повышения устойчивости работы сушиль¬
ных аппаратов при сушке культуральных жидкостей и стабили¬
зации механических характеристик получаемых препаратов
основываются на введении в состав продукта технологических
добавок — гелеобразующих веществ, инертных и сорбирующих
дисперсных носителей.При получении концентратных форм некоторых аминокислот
и ферментных препаратов дает эффект использование СаО и
NaCl, вводимых в суспензию перед распылительной сушкой, а
также тонкодисперсных инертных наполнителей — аэросила,
сиперната, вводимых непосредственно в процессе сушки. Од¬
нако для высокогигроскопичных препаратов, например для
ККЛ, объем добавок составляет 20... 60%, что недопустимо
снижает относительное содержание целевого продукта и ухуд¬
шает экономические показатели процесса сушки. Наиболее це-
1олучение продуктов микробного синтеза275Экстрацеллюлярные продукты . . . .КУЛЬТУ' j Дезин-
Разделение тегра-
клеток ция кле-
I ток
Биомасса ральпая
жидкость
после фер¬
ментацииЭкстракты _
сырья рас¬
тительногоОчисткаэкстрактаОбогаще-
” ниеМетоды
разде- -Концентриро¬
вание, прида¬
ние товарной
формы
tи животно¬ОсаждениеЦентри¬Осаж¬Хроматогра¬го проис¬Центрифу¬фугиро¬дениефия,хождениягированиеФильтрацияваниеЭкстра¬гирова¬Адсорб¬цияв том числе
аффинная;ФильтрацияниеУльтра-адсорбцион¬самоочищаю¬Фильт¬фильт.ная;щейся струейрации раз¬рациягидрофоб¬ФлотацияличныхРазделе¬ная гель-Обработкавидовниефильтрацияфлокулян-Электро¬тамифорезИо.:ныйобменСтерильнаяфильтрацияДиафильтрацияУльтрафильт¬рацияВымораживаниеВысушиваниеЛиофилизацияВысушиваниераспылениемОсаждениеКристаллиза¬цияРис. 5.2. Схема получения биопродуктов из культуральных жидкостей и
сырья растительного и животного происхождениялесообразен в таком случае способ структурирования дисперс¬
ными носителями — сорбентами, сущность которого заключается
в размещении высушиваемого материала в поровом простран¬
стве частиц носителя. Уровень стабильности получаемого таким
образом сухого препарата, по данным Г. Г. Смирнова, опре¬
деляется соотношением толщины поверхностного незащищен¬
ного слоя и размера частиц носителя и может, быть количест¬
венно оценен по степени связанности частиц препарата:т=р- (d-—4Д).(‘(’+26>*] . 100. (5.1)где у — степень связанности частиц препарата, %; 6 — тол¬
щина незащищенного слоя препарата на поверхности частиц
носителя, м; d4 — усредненный объемно-поверхностный диаметр
частиц носителя, м.Связанность частиц практически стабильного препарата
ККЛ составляет 18,3%. Толщина поверхностного слоя зависит
18*
от задаваемого соотношения компонентов, сорбционной емкости
носителя и степени ее заполнения препаратом:(5.2)где ра — пикнометрическая плотность частиц материала, м3/кг;
Д — дисперсность носителя; Д= (6/d4)m-1; Хс — содержание
носителя в препарате по сухому веществу, кг/кг; р0 — истинная
плотность сухого вещества препарата, кг/м3; Vs — удельная
открытая пористость частиц носителя, м3/кг; Ks — показатель
уплотнения структуры; т — масса.Показатель уплотнения структуры Ка зависит от условий
проведения капиллярной пропитки носителя культуральной
жидкостью и сушки, характеризует степень использования сорб¬
ционной емкости носителя и определяется выражениемструктурированном комплексе.При степени связанности препарата, обеспечивающей прак¬
тическую стабильность (у=18,3%), минимально необходимое
количество носителя для структурирования ККЛ рассчитывают
по формулеИз выражения (5.4) следует, что увеличение содержания
целевого компонента в структурированном препарате может
быть достигнуто повышением сорбционной емкости носителя и
уплотнением структуры.В промышленных технологических вариантах с предвари¬
тельным структурированием сорбционная емкость носителя
0,34• 10—3 м3/кг, Ks находится в пределах 0,3...0,4, и мини¬
мально необходимое количество структурирующего носителя
составляет в среднем 1,2 кг/кг. При таком соотношении ком¬
понентов исходный материал представляет собой комкующуюся
вязкую пасту и является сложным объектом для сушки. Ис¬
пользование для сушки такого материала традиционных техно¬
логических схем, включающих операции предварительного
гранулирования и высушивания гранул в стационарном или
псевдоожиженном слое, требует применения специальных мер,
препятствующих комкованию и слипанию материала в про¬
цессе сушки. На практике эта проблема решается укрупнениемKsy's~|~l/p ' d— (Cc/pd-\-Cp/po)
Vs(5.3)где Cc и Cp — соотношение масс носителя и препарата в(5.4)
Получение продуктов микробного синтеза277частиц высушиваемого материала и созданием локальных зон
фонтанирования в сушильном аппарате, однако при этом про¬
цесс сушки протекает недостаточно интенсивно и требует высо¬
ких энергозатрат.Проведенные нами исследования процессов структурирова¬
ния — сушки ККЛ позволили разработать ряд новых техничес¬
ких решений, способствующих увеличению относительного
содержания L-лизина в готовом продукте при сохранении его
практической стабильности, а также интенсифицировать про¬
цесс сушки с одновременным снижением энергозатрат. Новая
технология включает операции предварительной подготовки
структурирующего носителя, его капиллярную пропитку куль¬
туральной жидкостью в вакууме и двухстадийный процесс
сушки, который проводится в комбинированном сушильном ап¬
парате оригинальной конструкции [8, 17]. В принципе это
двухступенчатый аппарат. На первой ступени происходит дис¬
пергирование исходной смеси и высушивание частиц материала
в аэромеханическом фонтанирующем слое до промежуточной
влажности 13... 20%. На второй ступени материал оконча¬
тельно высушивается в орошаемом виброкипящем слое с
локальным фонтанированием в зоне решетки до остаточной влаж¬
ности 4... 6%. В результате дополнительного введения культу¬
ральной жидкости на второй ступени происходит агрегатирова¬
ние мелких частиц материала, а разнонаправленное воздействие
вибрации и потока теплоносителя обеспечивает классификацию
и выравнивание гранулометрического состава продукта непо¬
средственно в ходе сушки. В этих условиях относительное со¬
держание L-лизина в ККЛ повышается на 13... 15% при со¬
хранении стабильности и увеличении удельного влагосъема в
процессе сушки в 1,9 раза при значительном (в 1,5 раза) сни¬
жении энергозатрат.Теория образования и свойства гигроскопических концентра¬
тов, а также способы их получения описаны в работах [1, 6,
8, И, 17].Наиболее крупным примером промышленного производства
продукта данного класса является получение кормового лизина
из культуральной жидкости бактериальных продуцентов рода
Brevibacterium. Выпускаются кормовые антибиотики, кормовой
витамин В12 и пр. По своим свойствам близки к концентратам
технические ферментные препараты различной степени чистоты.5.2. БИОМАССАК этой группе продуктов относятся бактериальные удобрения
и средства борьбы с вредителями сельского хозяйства, вак¬
цины и пр. Для их получения культуральную жидкость подвер¬
гают фракционированию. При использовании биомассы как
целевого продукта ее отделяют центрифугированием и сепари¬
рованием [5, 13, 14, 16].Основной проблемой при получении биопродуктов данного
класса являются максимальное сохранение жизнеспособности
бактерий, а также обеспечение оптимального режима реактива¬
ции сухих биопрепаратов. Максимальная выживаемость обычно
достигается при лиофилизации с применением защитных сред.
Немаловажно также правильное хранение сухих биомасс.Теории и практике сохранения бактериальных биомасс и
восстановления их жизнеспособности посвящен ряд работ [2У
5, 9—11].Существенной проблемой является применение бактериаль¬
ных препаратов и познание всего сложного комплекса взаимо¬
действия почвенных микроорганизмов и растений [4, 7, 12, 15].Для обезвоживания биомассы продуцентов бактериальных
удобрений и средств защиты растений применяют сублимаци¬
онную или распылительную сушку, а также контактный, кон¬
тактно-сорбционный и контактно-конвективный методы.Успешное применение бактериальных средств защиты рас¬
тений зависит от формы препарата. Выпускают:— порошки (дусты) — смесь инсектицида и наполнителя
(тальк, каолин, бентонит);— смачивающиеся порошки; при разбавлении водой дают
устойчивые суспензии и, помимо действующего начала, содер¬
жат ПАВ и прилипатели;— пропитанные инсектицидом' гранулы;— водные растворы;— концентраты эмульсий — растворы пестицидов в масле;— микрокапсулированные препараты, действующее веще¬
ство которых заключено в оболочку из полиамида, желатина,,
агара и др.;— пасты.Классификация методов фракционирования гетерогенных
жидкостей, в том числе культуральных сред,
после ферментацииХарактерный признакВеличина частиц
Величина молекулЭлектрический зарядРазницаботкаплотности, обра-
в центробежномМетод фракционированияФильтрация, микрофильтрация
Ультрафильтрация, диализ, гель-
хромотография
Электрофорез, электродиализ,
ионный обмен, флокуляция, ко¬
агуляцияСедиментация, центрифугирование
(сепарирование)
Получение продуктов микробного синтеза279За последние годы разработан ряд новых форм: для уль-
трамалообъемного опрыскивания, концентрированные суспензии.
Созданы вспомогательные вещества, снижающие испарение ка¬
пель или способствующие лучшему прилипанию к растениям.5.3. ПОЛУЧЕНИЕ ВНУТРИКЛЕТОЧНЫХ ПРОДУКТОВ[Этот процесс связан с высвобождением целевого продукта из
клеточных структур, т. е. начинается дезинтеграцией отделенной
от жидкости биомассы. Ниже перечислены основные методы
дезинтеграции.Как видно из рис. 5.2, дальнейшая обработка жидкой фрак¬
ции дезинтегратов в принципе аналогична таковой при получе¬
нии экстрацеллюлярных целевых продуктов. Эти процессы очень
разнообразны и их технология зависит от свойств целевого
(-ых) продукта (-ов).Способы дезинтеграции клетокНемеханическиеМеханическиеБиохимическиеВид обработкиХимическая обработка (кислоты, ос¬
нования, растворители или детер¬
генты);физическая обработка (заморажива¬
ние, оттаивание, осмотический
шок)Размол, гомогенизация под высоким
давлением, экструзия, ультразву¬
ковая обработкаОбработка различными ферментами,
автолиз5.4. ПОЛУЧЕНИЕ ВНЕКЛЕТОЧНЫХ ПРОДУКТОВ
БАКТЕРИАЛЬНОГО СИНТЕЗАОперации по отделению нерастворимой фракции культуральных
жидкостей весьма схожи с таковыми при получении биомасс.
Но, поскольку основной целевой продукт содержится в жидкой
фракции, а нерастворимая часть является отходом либо пере¬
рабатывается в малоценный продукт для корма или в удобре¬
ние, технология фракционирования упрощается. Широко при¬
меняют коагулянты, различные добавки, способствующие
фильтрации или осаждению, которые дешевле и проще энерго¬
емкой сепарации.
Итак, следует отметить, что основная цель включения
главы 5 в монографию заключалась в том, что обычно
недостаточно четко различают технологии в зависимости от
расположения целевого (-ых) продукта (-ов). Мы не ставили
цель рассмотреть многочисленные варианты осуществления опе¬
раций по выделению, очистке и концентрированию продуктов
бактериального синтеза, а хотели лишь отметить особенности
получения концентратов, живых и инактивированных (полно¬
стью или частично) биомасс, вне- и внутриклеточных продуктов..
ПРИМЕРЫ БИОТЕХНОЛОГИЙ
В ЭКСПЕРИМЕНТАЛЬНЫХ
И ПРОИЗВОДСТВЕННЫХ УСЛОВИЯХВ этой главе в качестве примера будут рассмотрены три про¬
цесса -бактериального синтеза, разработанные с участием
авторов:1) производство кормового лизина, реализованное на ряде
заводов;2) метановое сбраживание отходов свиноферм, реализован¬
ное на пилотной установке с биореакторами вместимостью 75
и 100 м3;3) спиртовое брожение с помощью Zymomonas mobilis, ко¬
торое пока реализовано в лабораторных условиях.Нам представляется целесообразным ограничиться этими
примерами '[6, 25], поскольку особенности бактериальных про¬
дуцентов и реализация биотехнологических процессов доста¬
точно наглядно иллюстрируются ими. Здесь отражена основная
идея нашей книги — знания генетики, биохимии и биоэнерге¬
тики продуцента нужны специалисту для обоснования макси¬
мизации выхода желаемого продукта при реализации конкрет¬
ной биотехнологии. Кроме того, мы обосновываем положение,
как с помощью одних и тех же бактерий можно создать био¬
технологии для разных продуктов.6.1. ПРОИЗВОДСТВО ЛИЗИНА
И ДРУГИХ АМИНОКИСЛОТОдна из наиболее важных сфер применения бактерий в био¬
технологии — производство аминокислот, в частности глутами-
иовой и лизина [18, 25, 89]. Из других аминокислот, исполь¬
зуемых в качестве кормовых добавок, микробиологическим пу¬
тем получают триптофан [48].
282Глава 6Для всех аминокислот известны способы химического син¬
теза. Конкуренция между химическими и микробиологическими
альтернативными технологиями определяется в основном эконо¬
мическими и экологическими факторами. Предпочтение отда¬
ется биотехнологии. В Японии, Германии, США, Австралии и
других странах разработаны микробиологические способы по¬
лучения ряда аминокислот — аспарагиновой, пролина, глицина,
аланина, цистеина и пр., используемых в медицине, пищевой
и других отраслях промышленности.В 60-х годах аналогичные исследования были начаты в
Институте биохимии им. А. Н. Баха АН СССР под руковод¬
ством В. Н. Букина. Вместе с Институтом микробиологии:
ЛатвАН впоследствии была разработана технология биосин¬
теза лизина*. Наиболее значительное достижение латвийских
специалистов при создании технологии лизина — обоснование
концепции теплового обезвоживания продуктов ферментации,,
позволившей создать процесс получения кормового лизина в.
концентратной форме, сохранив тем самым, помимо лизина,
клеточную биомассу с белком и витаминами, а также 'бетаин
среды и экстрацеллюлярные продукты биосинтеза, в том числе
рибофлавин [4]. По сравнению с технологией получения крис¬
таллического лизина это позволило на 20... 30% снизить себе-
стоимость продукта, на 40% уменьшить объемы капиталовло¬
жений и защитить от загрязнения окружающую среду.Опыты с различными животными показали, что обогащение
рационов концентратом лизина дает увеличение среднесуточных
привесов на 15... 25% при экономии 10... 20% кормов.Завод по производству лизина в г. Ливаны был пущен в<
1971 г. и в первый же год освоил проектную мощность —
1 тыс. т продукции в год. После усовершенствования техноло¬
гии на тех же производственных мощностях выпуск лизина
достиг в 1987 г. более 3 тыс. т при низкой себестоимости.
По данной технологии работают еще четыре завода.6.1.1. ПРОДУЦЕНТЫ ЛИЗИНА
И ДРУГИХ АМИНОКИСЛОТВсе используемые в промышленности продуценты L-лизина
являются представителями группы коринебактерий. Их относят
к трем близкородственным родам: Coryhebacterium, Brevibacte-
rium и Micrococcus. В лабораторных опытах в качестве проду¬
центов лизина проверены также представители родов Bacillus,
Pseudomonas, Staphylococcus и др. '[90].* А. с. 171727 (СССР). — Б. И. — 1965. — № Ц.
Примеры биотехнологий283По сравнению с другими потенциальными сверхпродуцен¬
тами лизина коринебактерии имеют ряд существенных преиму¬
ществ. Во-первых, у них относительно простой механизм
регуляции биосинтеза лизина. Благодаря этому сверхсинтез
достигается всего двумя мутациями — блокированием метабо¬
лизма на уровне гомосериндегидрогеназы и десенсибилизацией
аспартаткиназы от ингибирующего воздействия треонина и ли¬
зина. Например, у Е. coli и Serratia marcescens, обладающих
иным типом регуляции активности аспартаткиназы, для гене¬
тического закрепления свойств сверхсинтеза лизина необходимо
семь мутаций. Во-вторых, у коринебактерий отсутствуют фер¬
менты, деградирующие лизин. В-третьих, продуценты лизина
из группы Corynebacterium, по крайней мере Br. flavum, явля¬
ются типичными представителями так называемых /(-стратегов.
В природе осуществление этой стратегии направлено на под¬
держание стабильной численности популяции в заполненной
экологической нише ^[9].Высокая конкурентоспособность коринебактерий обеспечи¬
вается способностью использовать широкий спектр органичес¬
ких субстратов, одновременно ассимилировать несколько источ¬
ников углерода и энергии как органической, так и неоргани¬
ческой природы, альтернативными реакциями метаболизма на
уровне транспорта субстратов, катаболизма углеводов, мета¬
болических шунтов, регенерации кофакторов, генерации энер¬
гии. В итоге, благодаря этим свойствам, Br. flavum могут
развиваться в условиях, когда основные физико-химические па¬
раметры среды изменяются в значительных пределах, — pH
среды, например, от 4 до 9, концентрация углеводов до 150 г/л
как в анаэробных, так и в аэробных условиях. Таким образом,
микроорганизмы, осуществляющие /(-стратегию жизнедеятель¬
ности, легко приспосабливаются к условиям среды. Следова¬
тельно, параметрами культивирования можно в значительной
мере управлять метаболизмом этих бактерий.Первые мутанты коринебактерий — продуценты лизина —
были созданы в Японии К. Накаямой, С. Китадой и С. Кинош-
той в конце 50-х годов ,[68] и в СССР в 1963 г. в Институте
биохимии им. А. Н. Баха АН СССР под руководством В. Н. Бу¬
кина. В дальнейшем усилиями многих специалистов были соз¬
даны улучшенные штаммы (табл. 6.1).Свойства лизинпродуцирующих бактерий, их подробная
морфология обобщены А. Апсите, Г. Межиней и В. Осе [1].Путем слияния протопластов создан высокоактивный штамм
Br. lactofermentum, синтезирующий 70 г/л лизина за 30... 35 ч
[49]. Ставится цель достичь конечной концентрации лизина
240 г/л — величины, близкой к пределу растворимости [48].
Экономическая оценка процесса бактериального синтеза ли¬
зина, проведенная П. Роджерсом и соавт. [89], позволяет
284Глава 6Таблица 6.1. Характеристика некоторых лизинсинтезирующих штаммов
бактерий рода BrevibacteriumПоказатель биосинтеза лизинаШтамм продуцентаГод созда¬
нияконечная кон¬
центрация,
г/лвыход, г/гпродуктив¬
ность,
г/(л • ч)Brevibacterium sp 22*196423,40,330,47Brevibacterium sp 22ЛД**197336,0—0,58—0,72Br. flavum RC 115 [32]197660,00,351,09Br. flavum V5 [45]198370,00,322,8Br. lactofermentum198470,0—2,0—2,3* A. c. 171727 (СССР). — Б.
** A. c. 502019 (СССР). - Б.И, — 1965. —
И. - 1976. —№ п.№ 5.заключить, что наиболее значительного снижения себестоимости
продукта можно достичь увеличением Ур/™0,11 и достижением
высокой концентрации лизина в конце процесса ферментации.Бактерии родов Corynebacterium, Micrococcus и Brevibacte¬
rium могут быть использованы также как продуценты глутами¬
новой кислоты. Изменением лишь условий их культивирования
синтез можно сдвинуть в сторону образования лизина или глут¬
аминовой кислоты. Увеличение синтеза глутаминовой кислоты
осуществляется повышением проницаемости клеточной стенки к
данной аминокислоте. При этом используются среды с низким
содержанием биотина. Если для синтеза лизина требуется 30—
50 мкг/л биотина, то для синтеза глутаминовой кислоты —1—5 мкг/л.Биотин регулирует проницаемость бактерий, участвуя в био¬
синтезе ненасыщенных жирных кислот. Чем меньше со¬
держание биотина в среде, тем меньше содержание ненасыщен¬
ных жирных кислот в бактериальных мембранах и больше
проницаемость стенки бактерий к глутаминовой кислоте. Синтез
глутаминовой кислоты можно увеличить также использованием
пенициллина, эфиров ненасыщенных жирных кислот, например
полиоксиэтилсорбитана, т. е. Твина 60 и других поверхностно¬
активных веществ.При низкой проницаемости клеточной стенки к глутамино¬
вой кислоте последняя, накапливаясь в клетке, ингибирует свой
дальнейший синтез. При этом увеличивается синтез лизнна
бактериями.Биохимической основой переключения бактерий на синтез
лизина или глутаминовой кислоты является конкуренция фер¬
ментов за NADPH, используемого для синтеза обеих этих
аминокислот.
Примеры биотехнологий285При регуляции условий культивирования коринебактерии
способны синтезировать около 100 г/л глутаминовой кислоты.
Хорошими ее продуцентами являются ауксотрофы по глицеролу
и олеиновой кислоте.Ограничением дальнейшего улучшения свойств продуцентов
на основе коринебактерий является отсутствие хорошо разра¬
ботанной техники получения рекомбинантов из этих бактерий.
Создание векторных систем для технологии рекомбинантных
ДНК у Corynebacterium, использование метода слияния прото¬
пластов обещают дальнейшие успехи в работе с этой важной
для промышленности группой микроорганизмов.Методом мутагенеза и генетической инженерии получены
продуценты не только лизина и глутаминовой кислоты, но и
других аминокислот. Коринебактерии, ауксотрофные по изолей¬
цину, синтезируют до 40 г/л пролина, ауксотрофные по цитру-
лину и аргинину используются в качестве продуцентов орни-
тина, ауксотрофные по глутаминовой кислоте — как продуценты
аспарагиновой кислоты, ауксотрофные по фенилаланину и ти¬
розину — как продуценты триптофана.Эти бактерии можно считать также эффективными проду¬
центами никотинамидадениндинуклеотида. Последний исполь¬
зуется в медицине для лечения психических и онкологических
заболеваний, миокардитов, атеросклероза и заболеваний, свя¬
занных с гипоксией мозга.Для синтеза NAD+ в настоящее время применяется метод
вторичного культивирования, сущность которого заключается в
том, что клетки бактерий инкубируются с предшественниками
NAD+. Если содержание этого нуклеотида в коринебактериях
составляет 4,5 мкмоль на 1 г с. в., то с применением пред¬
шественников можно получить в 20 раз большее количество
NAD4*.Методом микробиологического синтеза с помощью'Brevibac¬
terium ammoniagenes получают около 5 г/л этого нуклеотида.
Производство NAD+ в Японии составляет около 100 кг в год,
что составляет 70—80% его производства в мире*.6.1.2. ЭНЕРГЕТИКА БИОСИНТЕЗА ЛИЗИНАИсследование энергетики лизинсинтезирующих бактерий явля¬
ется основой совершенствования технологии биосинтеза лизина.
Фундаментальная работа С. Э. Селги и М. Е. Бекера ,[26]
положила начало более глубокому изучению баланса массы
и энергии в процессе микробиологического синтеза лизина.* Цит. по: Б а з д ы р е в а Н. М. Биосинтез никотинамидадениндинуклеотида
(НАД+) у микроорганизмов // Прикладная биохимия и микробиология. —
1988. — Т. 24, вып. 2. — С. 147—163.
Цель этих исследований — установление значений стехиометри-
ческих коэффициентов уравненияA (CHmO/) -\-D (NH3) +В (О2) *~Y x/S (CHi,8oOo,5oNo,17) +Н” Yp/s (C6H14O2N2) -j- [ 1 — Yx/s— Yp/s (CO2) (H2O) -(-теплота,где CHmO/ — обобщенная формула источника углерода и энер¬
гии; CHi,8oOo,5oNo,i7 — формула биомассы Br. flavum RC 115;
Yx/s, Yp/s, A, D, В, T — соответствующие стехиометрические
коэффициенты.Биотехнология синтеза лизина объединяет рост клеточной
массы бактерий, сверхсинтез и экскрецию лизина. Хотя лизин
по общепринятой классификации относится к первичным про¬
дуктам, т. е. его синтез связан с ростом, кинетика роста и
сверхсинтеза лизина у ауксотрофных мутантов неодинакова.
Лизин синтезируется только растущими клетками, поэтому
всегда необходимо считаться с тем, что часть источника угле¬
рода и энергии расходуется на обеспечение роста популяции и
коэффициенты Y™/£ и Ур%п будут меньше их теоретических
значений.Коэффициенты В, Yx/s, Yp/s применяются в инженерно-тех-
нологических расчетах при оценке и прогнозировании процесса
биосинтеза. Выяснение их точных значений в технологическом
процессе затруднено. Во-первых, YX/s и YP/S не являются кон¬
стантами, а зависят от свойств продуцента и условий культи¬
вирования; во-вторых, использование комплексных источников
углерода и ростовых факторов осложняет количественный учет
субстрата в балансе углерода и азота. Наиболее точные данные
материально-энергетического описания биосинтеза лизина по¬
лучены на основе газового баланса [3, 50, 54, 84]. В результате
этих исследований выявлена интенсивность тепловыделения,
установлены теоретические, максимальные и эксперименталь¬
ные значения коэффициентов выхода биомассы и лизина. Со¬
поставление Кр%П со значениями Yp%p и Y***c чрезвычайно
важно для выяснения потенциальных возможностей повышения
выхода лизина генно-инженерным и физиологическим путями
[30]. На основе знаний энергетики, биохимии и физиологии
уже на сегодняшний день значение энергетического выхода ли¬
зина т)р=Ур%п /Ур%р можно поднять с 0,38 (на производстве)
до 0,53 (в экспериментальных условиях).Как отмечалось ранее, энергетический метаболизм Br. fla¬
vum имеет ряд особенностей. Так, в электронно-транспортной
цепи функционируют альтернативные пути переноса электро¬
нов, отличающиеся от основного пути как механизмом восста¬
новления кислорода, так и эффективностью окислительного
фосфорилирования [76]. Впервые среди бактерий (именно у
Примеры биотехнологий287продуцентов лизина) было показано наличие в ЭТЦ одноэлек¬
тронного механизма восстановления кислорода, протекающего
с образованием супероксидных радикалов [8,76]. У Br. flavum
выявлен цианидрезистентный нефосфорилирующий путь пере¬
носа электронов. Иногда более половины кислорода потребля¬
ется в этой реакции. Увеличение цианидрезистентного дыхания
сопровождается снижением выхода лизина [28].Оценка эффективности окислительного фосфорилирования
на основе данных непрерывного культивирования прототрофного-
ревертанта Br. flavum RC 115-П свидетельствует о заниженной
величине Р/О [17]:макср/0= — х/0 =1 7
' ovMaKC — *Li АТРБыл проведен направленный поиск механизмов, ответствен¬
ных за непродуктивные потери на этапе образования энергии.
Подсчитано, что до 20% энергии тратится на поддержание
трансмембранного электрохимического градиента протоновД|1н+. Непосредственные измерения Н+/0 = 2...4 подтверж¬
дают низкую эффективность эжекции протонов при работе ЭТЦ
[15, 17]. Одной из возможных причин этого может быть повы¬
шенная проницаемость энергосопрягающей мембраны Br. fla¬
vum для протонов, которая имеет тенденцию увеличиваться при
низких значениях pH среды i[ 15, 77].Таким образом, выяснены основные причины непродуктив¬
ных затрат энергии, что является необходимым условием для
их минимизации в процессах культивирования лизинпродуци-
рующих бактерий.6.1.3. БИОХИМИЯ ПРОДУЦЕНТОВ ЛИЗИНАОсновная последовательность реакций биосинтеза лизина из
углеводов включает около 20 этапов. Регуляция активности
ферментов ключевых реакций в общих чертах была рассмот¬
рена в главе 2.Остановимся подробнее на основных принципах регуляции
метаболизма коринебактериями при сверхсинтезе лизина. Пер¬
вое условие максимальной продуктивности синтеза лизина —
достижение максимально допустимого содержания биомассы в
ферментаторе в наиболее коротком промежутке времени. ^макс,
допустимое при этом, обозначает количество биомассы, которое
можно обеспечить необходимой массопередачей кислорода для
осуществления роста аэробным путем.Основным принципом увеличения скорости роста клеток в
процессе периодического культивирования, как было показано
288Глава 6ранее, является индукция синтеза РНК и ферментов энергети¬
чески наиболее эффективного метаболического пути ЦТК (тест-
фермент аконитаза). Это достигается при выращивании посев¬
ного материала в несколько этапов:1) на твердой питательной среде (обычно РПА) с добавле¬
нием 0,5% сахарозы;2) при пересеве бактерий в колбах на качалке в средах,
содержащих не более 5% сахарозы и все остальные необходи¬
мые компоненты. При этом культивирование следует закончить
в промежутке времени, когда бактерии находятся в конце лога¬
рифмической или в начале фазы замедленного роста (прибли¬
зительно на 12...15-м часу культивирования). Конкретное
время зависит от среды культивирования, штамма, количества
посевного материала в колбе и др. Посевной материал, выра¬
щенный в колбах на качалке, характеризуется при этом удель¬
ной скоростью роста клеток 0,15...0,20 ч-1, содержанием РНК20... 22%, активностью аконитазы 80... 120 катал-10-11 на
1 мг белка. При использовании штаммов с другими значениями
|хмакс конкретные величины указанных параметров могут из¬
меняться.Использование неиндуцированных клеток с низкими кон¬
центрациями РНК для посева в ферментационные среды, со¬
держащие 10... 12% сахаров, приводит к предотвращению
индукции ферментов и синтеза РНК, удлинению лаг-фазы и
даже снижению жизнеспособности клеток. Биохимической ос¬
новой этих явлений является уменьшение активности и синтеза
ферментов, а также прекращение транспорта сахаров в клетку,
возможен также их выброс из клеток. Чем меньше удельная
скорость роста посевной культуры и выше концентрация саха¬
ров в среде, тем больше вероятность возникновения катаболит¬
ной репрессии ферментов и прекращения синтеза РНК. Послед¬
ний при этом может прекращаться вследствие уменьшения
скорости продуцирования АТР клетками.Тем не менее снижение ATP-синтезирующей активности мо¬
жет происходить также у индуцированных клеток коринебак¬
терий при содержании веществ, уменьшающих дыхательную
активность клеток. Такими могут быть соединения, снижающие
функционирование ЭТЦ и ферментов ЦТК. Одним из примеров
является снижение дыхательной активности клеток при исполь¬
зовании индуцированных клеток в средах, содержащих гидро¬
лизаты дрожжей, выращенных на парафинах.Ингибирование активности ферментов ЦТК при этом
частично объясняется регуляторным действием повышенного
содержания глутаминовой и аспарагиновой кислот, являющихся
ингибиторами аконитазы [21] и фосфоенолпируват-карбокси-
лазы [82]. Возможно также наличие других регуляторов, на¬
пример фурфурола и оксифурфурола, образующихся из пентоз
Примеры биотехнологий289и гексоз. Однако химический анализ этих соединений не пока¬
зал их повышенного содержания в дрожжевых гидролизатах.
Следовательно, репрессирующее действие этих гидролизатов на
ферменты у коринебактерий можно объяснить регулирующим
действием указанных аминокислот, однако не исключено также
наличие других ингибиторов. Снижение дыхательной активности
клеток в средах с указанными гидролизатами по сравнению с
таковыми в средах с кукурузными экстрактами значительно.Ингибирование дыхательной активности коринебактерий
может происходить также при повышении до 1% концентрации
ионов NH4+ в среде.Вследствие регуляторного действия указанных и других фак¬
торов рост клеток и содержание РНК могут снижаться. Под¬
держание жизнеспособности посевных клеток в какой-то мере
может компенсироваться дополнительным использованием саха¬
ров клетками по механизму обратного эффекта Пастера. Од¬
нако рост при этом может прекратиться из-за недостаточной
скорости регенерации кофакторов при низкой дыхательной ак¬
тивности клеток, а также вследствие ингибирующего эффекта
лактата, образующегося в данных условиях.Предотвращение ингибирования или репрессии синтеза фер¬
ментов ЦТК, а также прекращение синтеза РНК в лаг-фазе
достигается добавлением в среду компонентов, поддерживаю¬
щих высокую дыхательную активность клеток (например, аце¬
тата и др.), относительно невысокой интенсивностью аэрации
и др.Определенную интенсивность аэрации можно поддерживать
путем увеличения объема аэрируемого воздуха на объем среды,
повышением скорости ее перемешивания и др. Обычно эти тех¬
нологические приемы реализуются одновременно, однако их со¬
отношение может меняться. Как было показано в главе 4, кон¬
кретные значения р02 не являются показателями, вполне
характеризующими регуляцию метаболизма бактерий.Рассмотрим несколько подробнее регуляторную роль интен¬
сивности аэрации на рост клеток и синтеза ими лизина после
посева бактерий. Очень важно выбрать способ поддержания
величины р02 на заданном уровне.На рис. 6.1 приведен пример регуляции активности фермен¬
тов метаболизма и синтеза лизина при культивировании Вг.
flavum V 5 в ферментационной установке ФС-8 при различном
обеспечении значения р02 = 20% от насыщения в первые 10 ч
культивирования. В первом варианте величина р02 поддержи¬
вается объемом воздуха на объем среды (1:1 в минуту) и
скоростью перемешивания среды 200 ... 800 оборотов в минуту
(рис. 6.1,а), во втором варианте — увеличенным объемом воз¬
духа на объем.среды (3 : 1 в минуту) и скоростью перемешива¬
ния среды 200 ... 500 оборотов в минуту (рис. 6.1,6).19 — 361
Таблица 6.2. Физиологические и биохимические показатели Вг. flavum 22ЛД в процессе периодического
культивирования в средах с сахарозой и ацетатом или без него*Часыкуль-тнви-рова-кияФруктозобис-фосфатальдолаэаАкони¬тазаИзоцит-рат-лиазаСодер¬
жание са¬
харозы, %Содержа¬
ние аце¬
тата, %X, г/лР. г/лг/(ч • г)Яр,
г/(ч • г)-,ЭКСПyP/S •
г/гv ЭКСПyX/S *
г/гАктивность, катал • 10 11
белкана 1 мгПервый вариант02120410011,401,01,460,4300,0850,550,3553-Й-2,389-й810340120011,356,2011-й+ 1,09,9513,50,11816-й68245069011,100,8411,200,0590,380,12527-й1778,40ОД 218,300,14441-й45518905,80021,3047,552-й2,80020,8054,20,0830,0290,35066-й1299300,900—Второй вариант02120410013,002,523-й9-й169013912,607,611-й16-й195028709,8015,210,20,1750,0560,320,4027-й8,7/10,620,041-й4751786,220,030,60,1220,0450,370,0952-й66-й36630,9020,045,00,1050,0290,270* В процессе ферментации вели подпитку источниками углерода в количествах, соответствующих содержанию углерода (первый вариант —
ацетатом, второй вариант — сахарозой).
Примеры биотехнологий291§Ь5Рис. 6.1. Зависимость активности ферментов метаболизма глюкозы и син¬
теза лизина в процессе периодического культивирования Br. flavum V 5 при
интенсивности аэрации р02 —20 кПа, достигнутой изменением соотношений
объема воздуха к объему'среды и интенсивности ее перемешивания:а — 1:1, л=200... 800 об/мин; б — 3:1, я=200 . .. 500 об/мин; / — аконитаза;
2 — глюкозо-6-фосфат-дегидрогеназа; 3 — изоцитрат-лиаза; 4 — фосфоенолпируват-
лсарбоксилаза; 5 — лакта1*дегидрогеназа.Конечная концентрация лизина в культуральной жидкости — 40 г/л (а) и 27 г/л (б)Увеличение объема воздуха на объем среды в данных усло¬
виях приводит к значительным биохимическим изменениям —
образованию разомкнутого ЦТК и явлениям, характерным для
эффекта Кребтри. При этом повышается активность глюкозо-
6-фосфат-дегидрогеназы — фермента гексозомонофосфатного
пути, а также активность лактатдегидрогеназы.Во втором варианте ц несколько увеличивается, однако за¬
метно снижается лизинсинтезирующая активность клеток.
К 40-му часу культивирования концентрация лизина составляет
'27 г/л против 40 г/л в первом варианте.При подаче воздуха 3:1 в данных условиях у Br. flavum
V 5, очевидно, повышается скорость продуцирования АТР в
клетках по сравнению с его использованием, так как удельная
скорость роста посевных клеток относительно низка. При этом
наблюдается образование разомкнутого ЦТК, увеличение актив¬
ности глиоксилатного шунта, клетки переключаются на повы¬
шенную удельную скорость роста. Причины данного явления
описаны в разделе 2.5.При повышенной скорости подачи воздуха в ферментатор,■19*
292Глава 6особенно в начальные сроки культивирования, может происхо¬
дить инактивация ферментов кислородом. Для защиты от окис¬
ления SH-групп у ферментов важно предварительное образо¬
вание фермент-субстратных комплексов.На примере культивирования Br. flavum V 5 видно, что ве¬
личина jj, (особенно в периодическом процессе культивирова¬
ния) еще не является достаточным показателем, по которому
можно судить о последующей лизинсинтезирующей активности
бактерий. Последнее объясняется тем, что одинаковые значения
ц могут быть достигнуты альтернативными метаболическими
путями. Для переключения бактерий на повышенную скорость
синтеза лизина требуется поддерживать клетки в состоянии бо¬
лее низкой скорости потребления сахаров и продуцирования
АТР при функционировании полного ЦТК. Данная регуляция
объясняется не только тем, что ЦТК является поставщиком
метаболитов для синтеза лизина, но в большей степени тем,
что при более низкой скорости продуцирования АТР в клетках
повышается концентрация катаболитов глюкозы (оксалоацетата
и др.), являющихся ингибиторами глюкозо-6-фосфат-дегид-
рогеназы. В связи с этим, а также благодаря регуляции син¬
теза РНК механизмом строгого контроля, переключения бак¬
терий на повышенную удельную скорость роста при этом не
происходит.Нами показано, что биосинтез лизина культурой Br. flavum
22ЛД может быть улучшен при добавлении в среды, содержа¬
щие более 10% сахарозы, ацетата в концентрациях, не превы¬
шающих 1,5%. Это снижает скорость использования сахаров
клетками и поддерживает высокую активность потоков мета¬
болитов через ЦТК, а также глиоксилатный шунт (табл. 6.2).
При использовании сред, содержащих сахарозу и ацетат, по¬
вышается величина конверсии источников углерода в лизин и
скорость его синтеза. Если У 5%" к 16-му часу культивирования
в среде с добавками ацетата равна 0,43, то в средах с сахаро¬
зой — 0,32, в среднем в процессе ферментации — 0,40 и 0,33.
У p/s" в варианте сахароза+ацетат в начальные сроки культи¬
вирования достигает 0,55, т. е. почти теоретически максималь¬
ной величины, получаемой при культивировании на ацетате
[81]. При добавлении ацетата ц несколько снижается, однако
рост клеток длится дольше.На основании полученных данных можно констатировать,
что повышение конверсии субстрата в лизин при добавлении
ацетата связано со снижением использования субстратов на
рост, активности ферментов гликолиза, увеличением активности
ЦТК и глиоксилатного шунта [21, 46].Однако при работе со средами с добавлением ацетата необ¬
ходимо соблюдать следующие условия:1) использовать посевной материал с индуцированным син¬
Примеры биотехнологий293тезом РНК, а также ферментов ЦТК, т. е. культуры с удельной
скоростью роста клеток 0,15... 0,2 ч-1;2) концентрации сахарозы и ацетата, а также удельная
скорость роста клеток должны быть такими, чтобы субстраты
использовались одновременно, так как скорость роста клеток
на ацетате низкая и связана с большим расходом АТР.Обязательным условием увеличения лизинсинтезирующей
активности коринебактерий является уменьшение скорости про¬
дуцирования АТР клетками и снижение образования РНК в
них.В заводских условиях снижение биосинтетической активно¬
сти бактерий часто происходит вследствие недостаточного мас¬
сообмена кислорода по фазовым переходам газ — жидкость —
клетка. При этом возможны удлинение лаг-фазы и другие эф¬
фекты, связанные с недостаточной скоростью продуцирования
АТР бактериями. Рост клеток поддерживается повышенной ско¬
ростью использования сахаров при низкой энергетической эф¬
фективности катаболизма (обратный эффект Пастера). Синтез
лизина бактериями резко снижается. Это свидетельствует о
том, что увеличение скорости потребления сахаров бактериями
не всегда позволяет повысить продуктивность процесса.Недостаточная интенсивность аэрации может привести к
подкислению среды и синтезу лактата или повышению актив¬
ности лактатдегидрогеназы. Однако низкие значения этих пока¬
зателей не всегда указывают на недостаточную интенсивность
аэрации, так как их следует рассматривать в совокупности с
величиной удельной скорости роста клеток и скорости потреб¬
ления ими сахарозы.В условиях лимитирования роста кислородом следует сни¬
зить концентрацию биомассы в ферментаторе путем уменьше¬
ния ростовых факторов либо использовать штаммы с неболь¬
шими jnMaKC и величинами потребления сахаров клетками. В дан¬
ном случае весьма перспективен штамм Br. flavum RC 115.Важным условием достижения высокой продуктивности
синтеза лизина является длительное поддержание лизинсинте¬
зирующей активности клеток в течение всего процесса фермен¬
тации. ЭТО ВОЗМОЖНО ТОЛЬКО При |1<Цмакс.Поддержание клеток в состоянии повышенной лизинсинте¬
зирующей активности в фазе замедленного роста достигается
при соблюдении jx<jxMaKC и функционировании полного ЦТК,
что обеспечивается:1) факторами роста;2) дополнительными источниками углерода, в том числе
использованием многокомпонентных сред;3) источниками азота;4) регуляцией интенсивности аэрации, скорости перемеши¬
вания среды и др.
294Глава 6Следует отметить, что подпитку источником углерода и
энергии необходимо начинать, не ожидая резкого снижения
концентрации РНК в клетках из-за лимита источника энергии,
и поддерживать в соответствии с удельной скоростью роста
клеток.Подпитку треонин- и метионинсодержащими субстратами
необходимо закончить при значительном снижении ji, так как
неиспользованный треонин и синтезированиый лизин мульти-
валентно ингибируют аспартаткиназу. При этом по типу отри¬
цательной обратной связи снижается потребление сахаров
клетками, и их рост прекращается быстрее, чем при отсутствии
подпитки указанными факторами роста. Последовательность
регуляторных эффектов при этом такова:1) ингибирование аспартаткиназы лизином и треонином;2). ингибирование фосфоенолпируват-карбоксилазы аспарта-
том;3) снижение активности катаболизма глюкозы через ЦТК
вследствие недостаточного синтеза оксалоацетата;4) снижение ц при недостаточном синтезе предшественни¬
ков;5) поддержание продуцирования АТР гликолизом;6) накопление продуктов неполного окисления глюкозы;7) снижение скорости транспорта глюкозы в клетки.Следовательно, для поддержания высокой лизинсинтезиру-ющей активности коринебактерий требуется сбалансирование
условиями окружающей среды скоростей продуцирования АТР
в клетках со скоростью их роста и, наоборот, поддержание ро¬
ста для обеспечения функционирования метаболических путей,
необходимых для образования предшественников для синтеза
продукта. Особые трудности представляет регуляция метабо¬
лизма бактерий в фазе замедленного роста, а также в лаг-фазе
(см. рис. 4.4).Путем регуляции скорости перемешивания среды можно
прекратить рост клеток в фазе замедленного роста либо пере¬
ключить бактерии на увеличенную скорость синтеза РНК и
повышенное использование сахаров на образование биомассы,
или увеличить лизинсинтезирующую активность клеток (см.
рис. 4.6). Несмотря на использование сред определенного со¬
става, а также константные значения р02, продуктивность про¬
цесса по лизину в данных вариантах можно характеризовать
соотношением 1:1,5: 2. Конкретные значения р02 и скорости
перемешивания среды, как показано выше, нельзя абсолюти¬
зировать, так как последнее зависит от характеристик фермен¬
татора, используемого продуцента, состава среды, содержания
биомассы и пр.Во избежание избыточного продуцирования АТР и переклю¬
чения бактерий на повышенную удельную скорость роста в
Примеры биотехнологий295Таблица 6.3. Изменение активности ферментов метаболизма
Br. flavum 22ЛД при действии милдроната
в непрерывных условиях культивирования (Z) = 0,2 ч-1)Вари¬антКонцентрация
милдроната, МФосфофрукто¬киназаФосфоеиолпируват-карбоксилазаАконитазаАктивность, катал • 10п на 1 мг белка1-Й124330,2428,492-й10-41705339,30335,473-й10-81482180,75223,08фазе замедленного роста нами использовано соединение, пред¬
ставляющее собой производное |[3-(2,2,2-триметилгидразоний)-
пропионат М246], известное под названием «милдронат». Дан¬
ное вещество синтезировано сотрудниками Института органи¬
ческого синтеза ЛатвАН. В предварительных опытах было
показано, что соединение в концентрациях 10-5...10~4 М в
течение нескольких секунд повышает скорость дыхания клеток.
Изменение активности ферментов при инкубации клеток с мил-
дронатом в продолжение 15 мин показано в табл. 6.3. Из
полученных данных следует, что у клеток, характеризующихся
jm=0,2 ч-1, активность аконитазы и фосфоенолпируват-карбок¬
силазы в течение 15 мин повышается примерно в 10 раз. При
исследовании регуляторного действия этого вещества на транс¬
порт глюкозы у Br. flavum было показано, что скорость по¬
требления сахаров клетками при наличии милдроната в_кон¬
центрациях 10~4 М снижается на 23%, одновременно увеличи¬
вается активность указанных ферментов.Регуляция скорости транспорта глюкозы у коринебактерий
в зависимости от концентрации этого соединения аналогична
таковой при использовании ингибиторов окислительного фосфо¬
рилирования. Вследствие отсутствия токсичного эффекта мил¬
дронат был апробирован при регуляции синтеза лизина в про¬
цессе ферментации на пилотных установках. Показано, что
добавление милдроната в концентрациях 10~4 М к 20-му часу
культивирования повышает на 20% Ур/s1 и гР в промежутке
от 20-го до 42-го часа культивирования и увеличивает синтез
лизина на 6 г/л [14].Как показывает практика, сложно вести контроль процесса
биосинтеза по активностям ключевых метаболических путей
или ферментов. Рациональнее использовать в качестве основ¬
ного контрольного и управляющего параметра показатели фи¬
зиологической активности — изменения pH, рОг, еН, скорости
дыхания. Именно с помощью последнего показателя — скоро¬
296Глава 6сти дыхания, контролируемой автоматически в режиме реаль¬
ного времени на данном этапе, можно реально управлять био¬
синтезом лизина [30].6.1.4. ПОЛУЧЕНИЕ ЛИЗИНАКак известно, основным этапом получения лизина микробио¬
логическим путем является культивирование продуцента — фер¬
ментация. Его удачное решение во многом определяет выход,
себестоимость продукта, количество и качество стоков.Успех производства в значительной мере зависит от каче¬
ства посевного материала. На рис. 6.2 приведена схема полного
технологического процесса получения кормового концентрата
лизина.Стерильный, предварительно очищенный от пыли воздух
подается на аэрацию нагнетателями.Пеногаситель готовится в виде эмульсии и стерилизуется
при 132 °С в течение 1,5 ч.Аммиачную воду, используемую для регуляции pH среды,
перед подачей в ферментатор фильтруют.Растворы питательной среды готовят в смесителях [1,2,5,7].В связи с тем что при совместной стерилизации всех компо¬
нентов могут образовываться ингибирующие рост бактерий ве¬
щества, питательную среду готовят и стерилизуют в виде двух
отдельных частей: первая — раствор мелассы, вторая — рас¬
твор ростового фактора и солей. Аналогично готовят и стери¬
лизуют подпиточную питательную среду. Растворы компонентов
питательной среды стерилизуют в установке непрерывного дей¬
ствия.В качестве ростовых факторов при биосинтезе лизина ис¬
пользуют кукурузный экстракт, гидролизаты дрожжей (БВК)
или других содержащих белок субстратов. На рис. 6.3 предус¬
мотрен участок кислотного гидролиза БВК.Наиболее ответственным участком технологического про¬
цесса является производственная ферментация, которую
проводят в ферментаторах объемом 100 м3. В простерилизован-
ный и подготовленный ферментатор заливают под давлением в
50 м3 питательной среды следующего состава (%): редуциру¬
ющие вещества — 10,0... 12,0; аммонийный азот — 0,45... 0,50;
аминный азот — не менее 0,07.Стерильной аммиачной водой доводят pH среды до 7,0 ...... 7,2. Из посевного аппарата 5 м3 культуральной жидкости
под давлением передают в производственный аппарат и начи¬
нают процесс биосинтеза лизина.
Примеры биотехнологий297Получение стерильных
питательных средПолучение
гидролнзата БВКIИсходныйштамм /у , продуцента /У Л Получение посевного
(0 I материалаIПроизводственнаяНа подкислениеферментацияи стабилизациюСтерильныйКонтроль ивоздухуправлениеВодаNaOHHNO3КонденсатМ_]Мойка и дезинфекцияСтоки(СВ > 1 %) на упариваниеаппаратаРазбавленные стокина очистные сооружения
Рис. 6.2. Схема микробиологического синтеза лизинаВ целях увеличения съема лизина с одной операции про¬
изводят дополнительную подпитку более концентрированным
питательным раствором. Правильное ее дозирование позволяет
продлить состояние наибольшей физиологической активности
продуцента. Подачу подпитки контролируют по концентрации
редуцирующих веществ в среде либо по интенсивности дыха¬
ния культуры, определяемой с помощью анализаторов О2 и
С02 в выходящих из ферментатора газах; можно пользоваться
также сигналом датчика еН или датчика рОг, которые уста¬
новлены в ферментаторе.Как было сказано в разделе 3.4, управление процессом
культивирования лизинпродуцирующих бактерий по интенсив¬
ности дыхания информативно, технически не сложно и легко
автоматизируемо. Опытно-промышленная проверка этого при¬
ема управления в сочетании с отъемно-доливным способом
культивирования позволила значительно улучшить показатели
процесса биосинтеза лизина. В 1985 г. на Трипольском биохи-
298Глава 6Рис. 6.3. Динамика биосинтеза ли¬
зина (/) и роста (2) Br. flavum V 5
в условиях периодического культи¬
вирования с подпиткой мелассой, ис¬
точниками азота и факторами роста
(начало подпитки отмечено стрел¬
кой); 3 — концентрация редуциру¬
ющих веществ:Состав основной среды: меласса — 15%
(по сахарозе), гидролизат БВК — 4,5,
гидролизат хлопкового шрота — 4,5,
(NH4hHP04 — 0,1%, биотин — 50 мкг/л,
тиамин — 150 мкг/л.Концентрацию 5 поддерживают мелассой,
начиная с 30-го часа в пределах 2,8.. .
. . . 5,4%, концентрацию NH«+ поддерживают
в пределах 0,38... 0,50%, подпитка био¬
факторами — с 26-го по 48-й чмическом заводе с участием В. В. Крикиса, Л. А. Бабурина,
А. К- Саксе, Э. П. Кузьминой и А. М. Лужкова впервые в
СССР была осуществлена технология отъемно-доливного про¬
мышленного процесса биосинтеза лизина. За один цикл 96±8 ч
3—4 раза частично отливают культуральную жидкость. На ме-
лассных средах в конце ферментации концентрация лизинмоно-
хлоргидрата достигает 55 кг/м3. С 1 м3 геометрического' объ¬
ема аппарата получают 85...100 кг лизинмонохлоргидрата за
один цикл. Производительность аппарата с учетом времени
подготовки ферментатора (24 ч) составляет 17... 20 кг/м3 в
сутки. В лабораторных экспериментах производительность до¬
стигала 30 кг лизина/м3 в сутки (М. Э. Дунце, А. К. Саксе
и др.).В Институте микробиологии ЛатвАН реализованы и другие
технологические усовершенствования процесса биосинтеза ли¬
зина [19, 23, 24, 27, 45]. В частности, разработан способ не¬
прерывного биосинтеза с продуктивностью 2,8 г/(л-ч) при ста¬
ционарной концентрации лизина 60... 70 г/л (М. Э. Дунце и
ДР-)-Резюмируя, можно отметить, что успешное проведение био¬
синтеза лизина обусловлено следующим:1) использованием штаммов с измененными регуляторными
свойствами;2) составом питательной среды;3) конструкцией биореактора;4) условиями культивирования;5) алгоритмом управления и автоматизацией;6) регламентированием введения дополнительного суб¬
страта (подпитки) по времени, концентрации субстрата, био¬
Примеры биотехнологий289массы или продукта, по активности ключевых ферментов мета¬
болизма и физиологической активности продуцента (интенсив¬
ности дыхания);7) математической моделью;8) использованием комбинаций субстратов;9) применением веществ-регуляторов;10) пролонгацией активного состояния продуцента, напри¬
мер непрерывным культивированием.6.1.5. ПОЛУЧЕНИЕ КОРМОВОГО КОНЦЕНТРАТА ЛИЗИНАПосле производственной ферментации культуральную жидкость,
содержащую растворенный лизин, перекачивают в емкость для
стабилизации и подкисления соляной кислотой до pH 5,0. Под¬
кисленная культуральная жидкость, а также часть технологи¬
ческих стоков поступают в вакуум-выпарную установку. В ре¬
зультате многоступенчатого упаривания получают частично обез¬
воженный продукт, содержащий 45... 55% сухих веществ, в
том числе около 15% лизина (рис. 6.4).Кормовой концентрат лизина выпускают в трех основных
товарных формах:1) ЖКЛ — жидкий кормовой концентрат (упаренная куль¬
туральная жидкость);2) ККЛ гигроскопический;3) ККЛ с наполнителем, гранулированный.ККЛ гигроскопический представляет собой обезвоженную
культуральную жидкость. Его получают в распылительных су-я1516XГигроскопи¬ческийV / 71/ £ А U ►Т ККЛ Гранили-жШйконцентрат
лизинаКИЛРис. 6.4. Схема технологического процесса получения кормовых концентратов
лизина:/ — смеситель мелассы и солей; 2 — смеситель ростовых факторов; 3 — емкость для
воды; 4 — установка непрерывной стерилизации; 5 — смеситель питательной среды
для посевных аппаратов; Ь — посевной аппарат; 7 — смеситель растворов для под¬
питки; 8 — накопитель; 9 — рабочий ферментатор; 10 — промежуточная емкость для
подкисления культуральной жидкости; Л — емкость для соляной кислоты; 12 —
сборник культуральной жидкости; 13 — вакуум-выпарная установка; 14 — емкость
жидкого кормового концентрата; 15 — распылительная сушилка; 16 — линия полу¬
чения гранулированного ККЛ; 17 — насос; 18 — стерилизационная колонка
800Глава 6шилках. Этот продукт содержит, кроме лизина (18... 20%),
и другие ценные компоненты (%): глутаминовую кислоту —
0,1 .. . 0,3; валин — 0,13 .. .0,17; аланин — 0,05 . . .0,07; жиры —1,0... 1,3; бетаин — 6... 13. В нем присутствуют также вит¬
амины (мкг/г): тиамин — 0,75 ... 5,4; рибофлавин — 84 ... 160;
пантотенат — 30... 60; фолиевая кислота — 10... 20; пиридок-
син — 200 . .. 340; никотиновая кислота — 8... 10.Недостаток этой препаративной формы ККЛ — гигроско¬
пичность, поэтому предложено выпускать его в гранулирован¬
ном виде с наполнителем [2, 20]. В качестве наполнителя ис¬
пользуют чаще всего пшеничные отруби. Готовый продукт
негигроскопичен, содержит 8... 10% лизина и 6... 7% влаги.Технология получения ККЛ по сравнению с технологией
получения кристаллического чистого лизина имеет ряд преи¬
муществ:1) более низкая себестоимость продукта и меньший объем
капитальных вложений;2) высокая кормовая ценность;3) производство ККЛ экологически более чистое.Создание препаративных форм лизина повлекло за собойфундаментальные исследования ученых, работающих как в
области физико-химии, так и физиологии и биохимии живот¬
ных [2, 20]. Именно состав самих концентратов обусловил ре¬
шение создать на их основе комплексный обогатитель
растительных рационов для животных. Получение кормовых
концентратов лизина предусматривает обезвоживание всей
культуральной жидкости, в результате создаются предпосылки
создания экологически безвредного производства.С другой стороны, трудности стандартизации продуктов
концентратного типа и относительно низкое содержание в них
лизина привели к необходимости его выделения из культураль¬
ной жидкости в кристаллическом виде, что, однако, сопровож¬
дается значительным увеличением объема сточных вод.
М. Е. Бекером и Р. Ю. Аре предложено компромиссное техно¬
логическое решение, позволяющее одновременно получать кор¬
мовые концентраты с различным содержанием лизина и сни¬
жать до минимума объем производственных стоков. При
необходимости по этой технологии можно получить и кристал¬
лический лизин [2].В последнее время возрос интерес к использованию лизин¬
содержащих аминокислотных препаратов, в том числе получен¬
ных из отходов при производстве кристаллического лизина, в
растениеводстве. Применение таких препаратов, содержащих,
кроме аминокислот, и другие биостимуляторы, дает значитель¬
ное увеличение урожая тепличных и полевых сельскохозяйст¬
венных культур.
Примеры биотехнологий3016.2. БИОТЕХНОЛОГИЯ АНАЭРОБНЫХ ПРОЦЕССОВМожно указать на два аспекта, обусловливающих актуальность
использования анаэробных процессов в биотехнологии в насто¬
ящее время. Первое — путем анаэробного брожения можно
получить такие восстановленные продукты, как биогаз (метан)
и этанол, используемые в качестве источников энергии. С точки
зрения материально-энергетического баланса, энергетический
выход анаэробных процессов метанового и спиртового броже¬
ния значительно выше, чем при конверсии органических суб¬
стратов в другие продукты путем аэробных биотехнологических
процессов [87]. Ниже приведены усредненные расчеты балан¬
сов массы и энергии этих процессов.Анаэробный процесс метанового брожения, осуществляемый
ассоциацией бактерий [31, 75]СпН2„Оя + NH3—►Биомасса + СН4Материальный 1,00 +0,01 —*0,06 +0,25
баланс (ед.
массы)Энергетический
баланс (относи- 1,00 —* 0,08 +0,89
тельный запас
свободной энер¬
гии)Усредненный баланс процесса спиртового броженияCnH2nOn+NH3 Биомасса+С2Н5ОН +С02+ТеплотаМатериальный ба- 1,00 +0,005 0,04 +0,47 + 0,47ланс (ед. массы)Энергетический 1,00 0,05 +0,05 +0,05баланс (относи¬
тельный запас
свободной энер¬
гии)Усредненный баланс аэробного процесса роста бактериальной биомассы
из углеводовСпН2пОп+NH3 + 02 Биомасса+С02+Н20+ТеплотаМатериальный ба- 1,00 +0,05 +0,31 —0,52 +0,49 +0,35
ланс (ед. массы)Энергетический 1,00 0,60 + 0,40баланс (относи¬
тельный запас
свободной энер¬
гии)+ С02 +Теплота
+ 0,70+ 0,03Данные баланса массы и энергии анаэробных и аэробного
процессов показывают, что в анаэробных условиях метанового
и спиртового брожения в продуктах запасается около 90%
свободной энергии субстрата (углеводов) и лишь 3...5% этой
энергии теряется в виде теплоты. В аэробном процессе неиз¬
бежные непродуктивные потери свободной энергии субстрата
составляют около 40%. В этом заключается существенная вы¬
года использования биотехнологий анаэробных процессов для
получения универсальных источников энергии — биогаза и
этанола.Второй аспект актуальности анаэробных биотехнологий
связан с тем обстоятельством, что имеются огромные запасы
органических веществ, представляющих в настоящее время ма-
лоиспользованное сырье и отходы пищевой промышленности,
сельского и коммунального хозяйства. Основной сырьевой запас
составляет растительная биомасса. Ее запасы на Земле оцени¬
ваются в количестве 1,8* 1012 т, и 1,7-1011 т ежегодно возобнов¬
ляется в процессе фотосинтеза >[25, 29]. В условиях исчерпания
полезных ископаемых источников энергии — нефти, угля, при¬
родного газа — все большая доля энергетического потенциала
будет получена из биомассы возобновляемого сырья. К тому
же получение биогаза из отходов, содержащих органические
вещества, решает проблему загрязнения окружающей среды.6.2.1. ПОЛУЧЕНИЕ ЭТАНОЛА
И ДРУГИХ ПРОДУКТОВ С ПОМОЩЬЮ
БАКТЕРИЙ Z. mobilisТрадиционно для конверсии углеводов в этанол применяют
дрожжи. Однако за последние годы найдены и широко иссле¬
дуются новые продуценты этанола, которые по ряду свойств
превосходят дрожжи. Сказанное относится к двум группам
этанолобразующих бактерий. Первую группу составляют мезо-
фильные бактерии Z. mobilis. Они развиваются при темпера¬
туре 30...35°С и обладают в несколько раз более интенсив¬
ным метаболизмом, чем дрожжи. Вторую группу образуют тер¬
мофильные этанолобразующие бактерии (оптимум температуры,60...70°С), привлекшие внимание тем, что в этой группе име¬
ются бактерии, способные трансформировать растительные
углеводные полимеры — гемицеллюлозу и целлюлозу — непо¬
средственно в этанол [94]. При этом отпадает необходимость
предварительной деполимеризации данных субстратов. В табл. 6.4
обобщены основные преимущества и недостатки использования
этих трех групп микроорганизмов.Среди известных к настоящему времени продуцентов спирта
все большее внимание биотехнологов привлекают бактерии
рода Zymomonas. Основная особенность этих бактерий — ис¬
ключительно высокая удельная активность ассимиляции угле¬
водов, достигающая 12 г на 1 г биомассы в час [22]. Умелое
Примеры биотехнологий303Таблица 6.4. Характеристика биотехнологических процессов
получения этанола с помощью различных групп
микроорганизмовГруппа микроорга¬
низмовНедостатки процессаДрожжиМезофильные бак¬
терии рода
ZymomonasТермофильныебактерииМожно достичь почти
100%-ной конверсии суб¬
страта в этанол*. По¬
бочных продуктов обра¬
зуется мало. Дрожжи
растут при низких зна¬
чениях pH среды, что
уменьшает опасность ее
контаминации и снижает
требования к стерильно¬
стиВысокие удельная ско¬
рость синтеза и выход
этанола. Можно исполь¬
зовать концентрирован¬
ные среды, содержащие
до 40 % углеводов. От¬
носительно высокая то¬
лерантность бактерий к
этанолуСреди термофильных
бактерий есть такие, ко¬
торые трансформируют
целлюлозу непосредст¬
венно в этанол. Нет
опасности контаминации,
поэтому не нужно сте¬
рилизовать среду. Отде¬
ление этанола от суспен¬
зии менее энергоемко.
Улучшаются некоторые
физико-химические пара¬
метры процесса (раство¬
римость субстрата, вяз¬
кость и др.)Ограничен спектр используе¬
мых субстратов.Для выращивания биомассы
необходим кислород. Темпера¬
тура в интенсивных процессах
повышается до 39 °С, что инги¬
бирует их. Процесс ингибиру¬
ется также высокими концен¬
трациями субстратаОграничен спектр используе¬
мых субстратов. Оптимум pH,
равный 5,5, не обеспечивает
селективности, есть опасность
контаминацииОбразуются побочные продук¬
ты (ацетат, лактат и др.),
вследствие чего уменьшается
выход этанола. Недостаточна
толерантность бактерий к эта¬
нолу* За 100%-ную конверсию принимают, теоретически максимальный выход этанола, когда
образуется 2 моля этанола из 1 моля глюкозы, а выход по массе составляет 0,51 г
этанола на 1 г глюкозы.использование этого свойства делает бактерии Zymomonas то-
bilis очень перспективными продуцентами этанола и других
продуктов.В настоящее время к роду Zymomonas относят один вид
Zymomonas mobilis с двумя подвидами — mobilis и ротасеа
[42, 61]. Необходимо отметить, однако, что мнения разных
авторов о таксономическом статусе этого рода бактерий
304Глава 6расходятся. Z. mobilis представляют собой грамотрицательные па¬
лочки длиной до 1,7 мкм и шириной 0,7... 1,0 мкм, образую¬
щие, как правило, пары или длинные цепочки. В популяции
встречаются неподвижные и подвижные с 1 ... 4 полярно раз¬
мещенными жгутиками.Бактерии рода Zymomonas аэротолерантные анаэробы. Рас¬
тут на средах, содержащих глюкозу, фруктозу или сахарозу,
и нуждаются в ростовых факторах и некоторых витаминах
'[88]. Способны расти в широком диапазоне pH — от 3,5 до
7,5 при температуре не выше 36 °С. Для этих бактерий харак¬
терна относительно высокая толерантность к этанолу — до70...80 г/л в непрерывной и до 130 г/л в периодической куль¬
туре [51], а также к высоким концентрациям углеводов в
среде. Они растут в сиропах, содержащих в 1 л 400 г сахарозы
,[47]. У Z. mobilis отсутствует эффект катаболитной репрессии.Прослеживая историю изучения этих бактерий, можно от¬
метить несколько периодов, каждый из которых связан с обна¬
ружением у Zymomonas необычных свойств. Так, в 50-е годы
был открыт необычный для анаэробов путь катаболизма угле¬
водов, соответствующий схеме Энтнер—Дудорова. В 60-х годах
эти бактерии были излюбленным объектом биоэнергетиков и
физиологов благодаря открытию явления разобщенного роста
[36]. Нынешний интерес связан с работами проф. П. Роджерса
51], раскрывшими перспективность использования бактерий
Z. mobilis для получения этанола. Исследования возможностей
применения бактерий Z. mobilis в биотехнологии начаты в Ин¬
ституте микробиологии ЛатвАН в начале 80-х годов под руко¬
водством акад. М. Е. Бекера*.Метаболизм углеводов. Анаэробный катаболизм глюкозы у
бактерий рода Zymomonas осуществляется по пути Энтнер—
Дудорова (рис. 6.5).Отличительным ключевым метаболитом этого пути является2-кето-3-дезокси-6-фосфоглюконат, который образуется из 6-фос-
фоглюконата. Суммарная реакция образования пировиноград-
ной кислоты имеет такой вид:C6HI206+ADP+Pi+2NAD(P)+->2CH3C0C00H+ATP+,+2NAD(P)H+H20.Необходимо отметить два основных различия пути спирто¬
вого брожения у бактерий и у дрожжей. Последние сбраживают
углеводы по пути Эмбдена—Мейерг<рфа. Во-первых, у бактерий
меньше выход АТР. При расщеплении одной молекулы глю¬
козы Zymomonas образуют одну молекулу АТР, в то время как
дрожжи — две. Это биохимическое отличие определяет неко-* Л. с. 1110800 (СССР). — Б. И. — 1984. — № 32.
Примеры биотехнологий305©,фруктоза
ф-
фруктозо-6- -
фосфатNADP* NADPH
а-©АТРADPZ)ф©глюконовая к-таглюкозо-6-фосфатgv I NAD0TK-*>NAD(P)H
6-фосфоглюконат-< (ГНг02-кето-3-дезокси-6- фосфоглюконат©I3-фосфоглицериновый „
альдегидNAD* \^'Нз?°АNADH-*—'jj ф1,3-дифосфоглицерат©А0?-S,АТР-*-Л3-фосфоглицератI®2-фосфоглицсратНгО^ ®фосфоенолпируват“Н©\АТР-пируват-И©дегид
©.С02
ацетальдегидNAD+ -NADH-©-АТР*\DPэтанолРис. 6.5. Схема катаболизма углеводов у Z. mobilis. Цифрами обозначены
ферменты, катализирующие соответствующие реакции:1 — глюлокиназа; 2 — глюкозо-6-фосфат-дегидрогеназа; 3 — 6-фосфоглюконат-дегид-
ратаза; 4 — 2-кето-3-дезокси-6-фосфоглюконатальдолаза; 5 — 3-фосфоглицеральдегид-
дегидрогеназа; 6 — 3-фосфоглицераткиназа; 7 — фосфоглицератмутаза; 8 — энолаза;
9 — пируваткиназа; 10 — фруктокиназа; 11 — фосфогексоизомераза; 12 — левансаха-
раза; 13 — глкжонаткиназа; 14 — глюкозодегидрогенаэа; 15 — пируватдекарбоксилаза;
16 — алкогольдегидрогеназа20 — 3G1
306Глава 6торые преимущества бактерий как продуцента этанола. Бакте¬
рии благодаря низкому выходу АТР дают более низкий выход
биомассы, т. е. Z. mobilis используют меньше углеродного суб¬
страта для построения биомассы, поэтому у бактерий по срав¬
нению с дрожжами выше значения УрД". Кроме того, образо¬
вание только одной молекулы АТР из глюкозы обеспечивает
лучшее сбалансирование метаболических потоков в отсутствие
роста клеток. Это создает преимущества при использовании
бактерий в качестве продуцента этанола в иммобилизованных
системах.,Второе существенное биохимическое отличие катаболизма
углеводов бактерий в отличие от такового у дрожжей состоит
в том, что дегидрогеназа глюкозо-6-фосфата является как
NAD+-, так и ЫАОР+-зависимой. Соотношение активностей
образования NADPH и NADH связано с условиями культиви¬
рования. Эта особенность важна потому, что алкогольдегидро-
геназа (потребитель восстановительных эквивалентов) у бакте¬
рий, как и у дрожжей, является только NADH-зависимой.У бактерий Z. mobilis выявлен эффект разобщенного роста.
Он заключается в том, что бактерии способны потреблять ис¬
точник углерода и энергии в отсутствие роста. Это свойство
также расширяет технологические возможности применения
Z. mobilis для биосинтеза этанола. Разобщение роста и ката¬
болизма углеводов происходит при лимитации процессов факто¬
рами роста, например пантотенатом, или при высоких концен¬
трациях этанола в’ среде, причем* скорость потребления и
путь катаболизма глюкозы не меняются. Используя это свой¬
ство, можно продлить фазу синтеза этанола, например в систе¬
мах с иммобилизованными клетками или с рециркуляцией
биомассы.Бактерии рода Zymomonas используют ограниченное коли¬
чество углеводов — глюкозу и фруктозу. Некоторые штаммы,
в том числе и Z. mobilis Т ИЗ, утилизируют также сахарозу
[22, 91, 92]. Для расширения спектра используемых субстратов
необходимо дальнейшее направленное генетическое улучшение
свойств штаммов-продуцентов [40, 41].Получение этанола. Биосинтез этанола из пирувата у
Z. mobilis отличается от такового у многих других бактерий,
но сходен с дрожжевым [88]. Это превращение происходит с
участием двух ферментов: пируват-декарбоксилазы (1) и алко-
гольдегидрогеназы (2) согласно приведенному ниже уравне¬
нию:СНзСОСООН.(1)(2)СНэСНОСН3СНгОН.СО*NADH NAD+
Примеры биотехнологий307Алкогольдегидрогеназа у Z. mobilis NADH-зависима. Эти
бактерии содержат ферменты, способные превратить пируват
в молочную и уксусную кислоты. Образование указанных по¬
бочных продуктов зависит от условий культивирования. Напри¬
мер, синтез ацетата усиливается с ростом концентрации раство¬
ренного кислорода в среде [7, 37, 73]. Образование молочной
‘ кислоты значительно увеличивается при наличии в среде олеи¬
новой кислоты [88].Влияние кислорода. Z. mobilis содержат ферменты ЦТК и
дыхательной цепи, но в отличие от дрожжей они не способны
продуктивно использовать энергию, образующуюся в ходе
аэробного катаболизма углеводов [16, 36, 73, 88]. Бактерии
чувствительны даже к небольшой концентрации растворенного
в среде кислорода. Этот эффект заметен по длительности лаг-
фазы. Культура начинает расти только после полного потребле¬
ния растворенного кислорода из среды. При пересеве Z. mobilis
на предварительно деоксигенизированную среду рост культуры
начинается практически без лаг-фазы {7].В аэробных условиях по сравнению с анаэробными скорость
потребления глюкозы и выход биомассы у Z. mobilis меняются
незначительно [37]. Однако YP/S снижается значительно, по¬
скольку бактерии могут переключиться на использование эта¬
нола [73]. При интенсивной аэрации среды, соответствующей
массопередаче кислорода 0,2 кг/(м3-ч), метаболизм Z. mobilis
тормозится.Бактерии рода Zymomonas можно характеризовать как
аэротолерантные бактерии. Они сохраняют жизнеспособность в
аэробных условиях благодаря наличию ферментов, выполняю¬
щих защищающую от кислорода роль, — каталазы, перокси-
дазы и супероксиддисмутазы [7, 73].Технология культивирования Z. mobilis 113. Основным эта¬
пом технологии получения этанола при глубинном культиви¬
ровании является процесс культивирования продуцента, осу¬
ществляемый * в биореакторе в управляемых условиях. Это
означает, что требуемая биохимическая активность продуцента
регулируется и поддерживается путем создания оптимальных
условий внешней среды (концентрации клеток, массопередачи
питательных веществ, температуры, pH, еН и пр.).Для получения этанола из углеводов по разработанному
нами совместно с Л. М. Панковой регламенту можно исполь¬
зовать любой тип лабораторных ферментаторов, обеспечиваю¬
щий стерильность процесса, механическое перемешивание
среды, проточный режим культивирования, регулирование тем¬
пературы, pH, рОг или еН среды. Желательно предусмотреть
вентиляцию аппарата инертным газом (например, азотом). Если
ее проводить перед посевом культуры, то сокращается лаг-
фаза. Вентиляция суспензии во время интенсивного процесса
20*
308Глава 6облегчает удаление С02. При использовании сред, содержащих
глюкозу, фруктозу или сахарозу, вспенивание суспензии незна¬
чительно. Однако при использовании сред с нестандартным
источником углеводов (например, мелассы) следует предусмот¬
реть возможность пеногашения. Отвод теплоты во время глу¬
бинного процесса не представляет проблемы, так как удельное
тепловыделение на единицу потребляемого субстрата прибли¬
зительно в 10 раз меньше, чем при аэробных процессах.Штамм Z. mobilis 113 поддерживают периодическими посе¬
вами на жидкой среде — один раз в 2 недели. На твердых
агаризованных средах культура хранится плохо.Популяция, выращенная из одной колонии, довольно быстро
становится гетерогенной по продуктивности образования эта¬
нола и другим свойствам. Для поддержания высокой активно¬
сти культуры необходимо регулярно путем селекции отбирать
наиболее продуктивный клон.Инокулят добавляют в количестве 10% по объему и приго¬
товленную среду разливают в колбы на 250 мл, заливая в
каждую по 200 мл. Колбы закрывают ватными пробками и по¬
мещают в термостат при 32 °С. Для основной ферментации
используют стерильный посевной материал после 24 ч выращи¬
вания.Для процесса периодического культивирования используют
биореактор с рабочим объемом 2 л. Среда имеет следующий
состав (г/л): глюкоза — 220; дрожжевой экстракт — 7,0;
КН2Р04 — 2,5; (NH4)2S04 — 1,6; MgS04-7H20 — 4,0. Среду
(1,8 л) стерильно заливают в аппарат. После установления в
аппарате температуры 32 °С стерильным раствором 5%-ного
NaOH доводят pH до 6,0. Продуванием стерильного азота до¬
биваются анаэробных условий. При этом парциальное давление
растворенного в среде кислорода (р02) снижается до нуля.
Аналогично можно судить о наступлении анаэробных условий
в среде по величине еН. Она должна уменьшиться приблизи¬
тельно на 200 мВ от исходного значения. Если процедуру дез-
оксигенации среды не проводить, культура будет развиваться
с более продолжительной лаг-фазой {22].После установления нужных исходных значений темпера¬
туры, pH, еН, р02 в аппарат стерильно добавляют активный
посевной материал в количестве 10% по объему. Ферментацию
проводят при 32 °С.После 1 ... 2 ч культура начинает обильно выделять С02
(его количество можно контролировать непрерывно с помощью
газоанализатора). pH на уровне 5,5 поддерживают автомати¬
чески, путем добавления стерильного 5%-ного раствора NaOH.
Окончание процесса ферментации определяют по прекращению
выделения С02. Продолжительность ферментации — 43 ч. За
это время в среде накапливается этанола 98...101 г/л.
Примеры биотехнологий309Остаточная концентрация неиспользованных регулирующих ве¬
ществ — примерно 1,0 г/л. Средняя продуктивность процесса —
2,29 г/(л - ч).Z. mobilis 113 синтезирует этанол также из углеводов ме¬
лассы. При периодическом культивировании на мелассе с на¬
чальной концентрацией редуцирующих веществ 149 г/л через
76 ч образуется 45,5 г/л этанола из 101 г/л использованных
редуцирующих веществ. Средняя продуктивность процесса
0,60 г/(л-ч).Для получения этанола в условиях непрерывного культиви¬
рования применяют среду, содержащую в 1 л 100 г глюкозы.
Непрерывный процесс начинают так же, как и периодический.Через 20 ч культивирования в периодическом режиме перехо¬
дят на непрерывный режим. Это делают постепенно. Начальная
скорость протока среды — 0,06 ч-1, через 5 ч — уже 0,15 ч-1.
Во время процесса температуру и pH среды поддерживают на
уровне 32 °С и 5,5.После установления стационарного режима непрерывный
процесс биосинтеза этанола характеризуется следующими по¬
казателями;— скорость протока среды — 0,15 ч-1;— концентрация этанола на выходе — 46,3 г/л;— концентрация редуцирующих веществ на выходе —
1,6 г/л;— концентрация биомассы — 1,0 г/л;— продуктивность процесса — 6,95 г/(л-ч);— выход этанола — 0,46 г/г.При соблюдении указанного режима и стерильности пере¬
численные выше показатели процесса сохраняются в течение
10 сут.Для более полного использования потенциальных возмож¬
ностей Z. mobilis необходимо применять технологические спо¬
собы, основанные на эксплуатации биотехнологических систем
с повышенным количеством биомассы. Их продуктивность по
этанолу значительно возрастает в системах с рециркуляцией
биомассы, иммобилизованными и флоккулирующими клетками
[35]. По оценке П. Роджерса и сотр. *[51], экономически наи¬
более приемлемо использование флоккулирующего штамма при
периодическом культивировании с подпиткой и повторными от¬
ливами культуральной жидкости. В перспективе, по-видимому,
будет использоваться непрерывное культивирование с рецирку¬
ляцией биомассы.Большинство лабораторных исследований спиртового бро¬
жения с применением бактерий Z. mobilis проведены на чистых
субстратах, в основном на глюкозе. Эти бактерии эффективно
конвертируют в этанол также сахарозу, глюкозу и фруктозу,
] - глюкозооксидаза, 2 - глюкозодегидрогеназа
3 - глюкозо /фруктозо-трансгидрогеназа, 4 - левансахаразаРис. 6.6. Схема конверсии сахарозы в леван, сорбит, глюконовую
кислоту и этанол с помощью бактерий Z. mobilisсодержащиеся в мелассе, гидролизатах целлюлозы, крахмала.
Наиболее успешные промышленные испытания были проведены
с использованием ферментативного гидролизата крахмала пше¬
ничной муки. В этих опытах бактерии Z. mobilis подтвердили
свои преимущества по сравнению с дрожжами, проявив более
высокую продуктивность [38, 80]. Однако возникли проблемы
загрязнения культуры молочнокислыми бактериями.Биотехнологический потенциал Z. mobilis не ограничивается:
получением этанола. Как показали исследования последних лет,
эти бактерии можно успешно применять для получения других
продуктов, если использовать в качестве субстрата сырье, со¬
держащее сахарозу (рис. 6.6).Получение фруктозы. Промышленный способ получения:
фруктозы основан на ферментативной изомеризации крахмаль¬
ных гидролизатов. Однако процесс выделения фруктозы из
50%-ной глюкозофруктозной смеси дорогостоящ. В этой связи,
использование Z. mobilis представляется более рациональным
для получения химически чистой фруктозы. Учеными предло¬
жено несколько технологий биоконверсии сахарозы. Наиболее
перспективным мы считаем получение и использование бакте¬
риальных штаммов, не имеющих фруктокиназной активности
и в связи с этим не способных катаболизировать фруктозу. При
выращивании этих бактерий на среде, содержащей в качестве
источника энергии и углерода сахарозу, появляется возмож¬
ность получать одновременно несколько продуктов. В резуль-
Примеры биотехнологий311Рис. 6.7. Образование левана в периодической куль¬
туре Z. mobilis 113. Стрелками отмечен момент начала
рН-статирования и подпитки сахарозой:1 — сахароза; 2 — этанол; 3 — леван; 4 — биомассатате действия фермента левансахаразы сахароза в основном
расщепляется на глюкозу и фруктозу. Глюкоза метаболизиру-
егся обычным путем до этанола и диоксида углерода, обеспе¬
чивая при этом рост и поддержание жизнедеятельности куль¬
туры. Фруктоза благодаря заблокированной фруктокиназе да¬
лее не метаболизируется и накапливается в среде [39, 47].Получение сорбита и глюконовой кислоты. Сорбит представ¬
ляет интерес не только как сладкое вещество, но и как сырье
для получения витамина С в промышленных условиях. Z. mo¬
bilis способны синтезировать из сахарозы сорбит и глюконовую
кислоту в эквимолярных соотношениях благодаря функциони¬
рованию особого фермента — фруктозо-глюкозо-трансгидроге-
назы [93]. Учеными Австралии предложена технология полу¬
чения этих продуктов с использованием в качестве биотехно¬
логического агента пермеабилизованных клеток бактерий [79].Получение левана. Этот полисахарид представляет собой
фруктозный полимер. Леван может быть рекомендован в каче¬
стве заменителя плазмы крови, пролонгатора действия лекарст¬
венных препаратов, а кислотный гидролиз левана — еще одна
возможность получения химически чистой фруктозы посредст¬
вом конверсии сахарозосодержащих субстратов [60, 63].В Институте микробиологии ЛатвАН Е. П. Райпулисом с
соавт. недавно получен высокопродуктивный продуцент ле¬
вана — штамм Zymomonas, превосходящий по левансинтезиру-
ющей активности известные бактериальные культуры (рис. 6.7).
Использование Z. mobilis для биоконверсии сахарозы в леван
и этанол открывает перспективы создания технологического
процесса с выходом левана по субстрату 0,22 г/г и продуктив¬
ностью в периодическом процессе до 1,4 г/л в час. Высокая ско¬
рость процесса биосинтеза и конечная концентрация левана в.
среде ферментации, достигающая 80 г/л, могут оказаться мно¬
гообещающими при реализации процесса в проточном режиме.Бактерии Z. mobilis можно успешно применять для одно¬
временного получения нескольких продуктов: например, эта¬
нола, сорбита и фруктозы [47]. Возможны и другие варианты.
Биомасса Z. mobilis характеризуется высоким удельным содер¬
жанием белков и может использоваться как белковый препарат
в кормах или в качестве источника получения ряда фермент¬
ных препаратов [62].6.2.2. МЕТАНОВОЕ СБРАЖИВАНИЕ ОТХОДОВМетановое брожение сейчас широко используется при очистке
коммунальных стоков, отходов ферм и промышленных пред¬
приятий, в некоторых случаях для производства витамина Bi2.
В Юго-Восточной Азии действуют миллионы мелких установок:
для утилизации хозяйственных и других отходов, в Западной
Европе — более 500 установок различного назначения. Интен¬
сивные исследования ведутся также в России, для утилизации:
отходов ферм начинают функционировать первые опытные ус¬
тановки .[ 12].Метаногенные бактерии являются строгими анаэробами, по¬
этому присутствие в биореакторе кислорода и значительного*
количества ионов нитратов может препятствовать выделению
метана. Метановое брожение протекает при отрицательном зна¬
чении окислительно-восстановительного потенциала порядка
330 мВ. Анаэробные условия в биореакторе создаются при по¬
треблении кислорода факультативными анаэробами (Е. coli
и др.). Снижение окислительно-восстановительного потенциала
способствует образованию сульфидов и водорода. Однако не¬
которые метаногены сохраняют жизнеспособность при кратко¬
временном воздействии кислорода.Метанобразующие бактерии развиваются в составе сложной
популяции, включающей разные виды анаэробов. Такая ассо¬
циация может использовать для образования метана практи¬
чески все естественные органические соединения (кроме лиг¬
нина) .Подавляющее большинство метаногенов достигает макси¬
мальной удельной скорости роста при 30... 40 °С. Имеются
также термофильные виды с оптимумом температуры от 50 до*
85 °С. Многие метанобразующие бактерии растут в средах с
pH, близким к нейтральному (от 6,5 до 7,5).Метанобразующие бактерии представляют собой физиоло¬
гически однородную группу, по морфологическим признакам
Примеры биотехнологий313весьма разнообразную. Можно выделить четыре типа: палочки,
кокки, вибрионы и спириллы.Палочковидные клетки могут быть различной формы и
длины (от 0,5 до 3,0 мкм); нередко они изогнуты, образуют
цепочки и длинные нити, достигающие 10... 15 мкм. Все па¬
лочки, за исключением Methanobacterium mobilis, неподвижны.Кокковидная форма клеток весьма разнообразна — от пра¬
вильных до неправильных угловатых сфер диаметром 1...5 мкм.
Клетки кокковидной формы — сарцины — развиваются в виде
симметричных или неправильных кокков, образующих пакеты
и агрегаты, похожие на склеенные песчинки. Агрегаты при лег¬
ком сдавливании распадаются на отдельные пакеты, которые
состоят из крупных несимметричных клеток размером
2... 3 мкм. Клетки метаносарцин неподвижны.Вибрионы и спириллы \Methanospirilium hungatii) представ¬
ляют собой правильно изогнутые палочки длиной 1,0... 7,0 мкм,
^которые образуют спиральные нити, достигающие 100 мкм. На
ранней стадии развития неподвижны.Процесс анаэробного разложения органических веществ в
•биореакторах осуществляется с помощью сложной ассоциации
упомянутых выше бактерий. Их соотношения и взаимодействия
‘обусловливают его стабильность. Для нормального протекания
процесса прежде всего необходимы оптимальные условия жиз¬
недеятельности бактерий [12].В качестве примера рассмотрим опыт эксплуатации экспери¬
ментальной биогазовой установки бывшего совхоза «Огре»
(Латвия), которая состоит из двух биореакторов объемом по
75 м3.Навозные стоки собирают с пяти свинарников фермы и
трактором Т-150К загружают в емкость для свежего навоза,
затем насосом подают в емкость предварительного подогрева.
После подогрева или без него навозные стоки насосом пере¬
качивают в биореактор. Здесь в анаэробных условиях при по¬
стоянной температуре (54°С) происходит метановое брожение.
Биогаз собирается в верхней части аппарата в газгольдере и
по трубам поступает в специально переоборудованный котел
КВ-300М, где сгорает с помощью инжекционных горелок низ¬
кого давления. Полученная горячая вода от бойлера (4 м3)
насосом подается по трубам, расположенным внутри биореак¬
тора в виде змеевика. Воду можно подавать также по тепло¬
трассе для обогрева свинарников. Переброженный субстрат
вытесняется из биореактора в емкости для переброженного
шлама и трактором Т-150К вывозится на поля для удобрения.Для уменьшения теплопотерь биореакторы и система подачи
навоза, а также емкость предварительного нагрева изолиро¬
ваны. Теплопотери компенсируются автоматически — включе¬
нием насоса и подачей горячей воды п змеевик биореактора.
314Глава 6>Таблица 6.5. Средние показатели эксплуатации экспериментальной
биоэнергетической установки совхоза «Огре»Показатель25.05.83-25.05.85
(730 сут)Период стабиль¬
ной эксплуатации
двух биореактсров
(5 мес)Выделение биогаза, м3/сут136,640264,870Выделение энергии, МДж/сут3060,7406091,920Выделение СН4 на 1 кг СОВ загруз¬0,2560,243ки, м3/кг СОВ в сутки
Выделение СН4 на 1 м3 объема1,4301,700шлама биореактора, м3/м3 шлама в
суткиВыделение бногаза на 1 кг СОВ за¬0,4180,379'грузки, м3/кг СОВ в сутки
Содержание СН4, %Загрузка СОВ, кг/сут62,51064,000>327,270698,310Выделение биогаза на 1 м3 объема2,1502,650>шлама биореактора, м3/м3 шлама
в суткиМаксимальное выделение биогаза на5,8105,8 Ш1 м3 объема шлама биореактора,
м3/кг СОВ в сутки
Загрузка СОВ на 1 кг объема шлама5,2306,980биореактора, кг СОВ/м3 шлама в
сутки
Доза загрузки, %16,10018,250Примечание. СОВ — сухие органические вещества.Установка успешно эксплуатируется и сейчас. В табл. 6.5
в первой графе приведены данные о результатах эксплуатации
установки в течение двух лет без вычета пусковых периодов
первого и второго биогазовых реакторов. Средние показатели
ухудшились в период, когда работа установки проходила в
мезофильном режиме и при пониженной дозе загрузки.В табл. 6.5 показаны также результаты стабильной эксплу¬
атации двух биореакторов в термофильном режиме. Выделение
энергии за этот период в сутки приблизительно в 2 раза выше,
чем в среднем в сутки за период двухлетней эксплуатации.В настоящее время разработан проект экспериментальной
биоэнергетической установки для всего свиноводческого ком¬
плекса совхоза «Огре». Из двух существующих на свиновод¬
ческом комплексе навозосборников навозные стоки насосами
предусмотрено перекачивать в промежуточный резервуар, в ко¬
тором будет происходить гомогенизация. Из этого резервуара
навозные стоки через теплообменники должны поступать в под¬
готовительный биореактор.
Примеры биотехнологий315В качестве таких биореакторов будет использован резервуар
объемом 100 м3, оборудованный механической мешалкой. Для
уменьшения потерь теплоты биореакторы, теплообменники и
трубопроводы предусмотрено теплоизолировать. Некоторые
«биореакторы будут соединены при помощи трубопроводов и
созданы три отдельные батареи. Предусмотрены заполнение
каждого биореактора до объема 90 м3 и подача биогаза через
систему очистки и хранения в газоэлектрогенератор для полу¬
чения электроэнергии и тепла.После брожения навозные стоки через теплообменник дол¬
жны поступать в отстойники и в цех для разделения на фрак¬
ции, Густая фракция будет вывозиться на площадку для
^компостирования, а жидкая — перекачиваться насосами в на¬
возохранилище и далее на полив полей. Предусмотрена также
утилизация теплоты газов, образующихся при сжигании био¬
газа.В процессе метанового брожения сельскохозяйственных
отходов получают два основных продукта — биогаз и пере¬
ложенный шлам, которые можно использовать как в сельско¬
хозяйственном производстве, так и в промышленности (биогаз).
Шлам может быть использован в качестве удобрения или кор¬
мовых добавок.Основное преимущество метанового брожения заключается
в том, что сохраняется практически весь азот, содержащийся
в исходном сырье. В условиях, благоприятных для метанового
брожения, обычно разлагается около 70% органических ве¬
ществ и 30% содержится в остатке.В процессе термофильного метанового брожения происходит
инактивация гельминтов, патогенных микроорганизмов, а также
семян сорняков.63. ОСОБЕННОСТИ БИОТЕХНОЛОГИИ
НА ОСНОВЕ РЕКОМБИНАНТНЫХ КУЛЬТУРВ начале 70-х годов на основе достижений молекулярной био¬
логии и генетики широкое развитие получили методы генной
и клеточной инженерии. Была создана технология рекомбинант¬
ных ДНК. Одним из первых результатов ее применения была
успешная экспрессия trp-оперона в 1;гр~-мутанте Е. coli [83].С помощью рекомбинантных ДНК получают сейчас различ¬
ные ферменты и незаменимые аминокислоты, а также гормоны
(инсулин, соматотропин) и препараты иммунного назначения
(интерферон, антиген вируса гепатита В, интерлейкины) и др.В России также созданы рекомбинантные штаммы проду¬
центов интерферонов, интерлейкина-2, проинсулина человека,
316Глава 6гормонов роста человека и сельскохозяйственных живот¬
ных. Освоено промышленное производство интерферона IFN-a^
и гормона роста человека.Как известно, в основе технологии рекомбинантных ДНК
лежит введение в живую микробную клетку новой, полученной
in vitro, генетической структуры, обеспечивающей проявление
нового признака. Генетический код является универсальным
для всех живых организмов, однако регуляторные механизмы
транскрипции и трансляции в животных и бактериальных клет¬
ках существенно различаются. Для экспрессии в бактериальной
клетке интересующего нас гена недостаточно только введения
молекулы ДНК с последовательностью нуклеотидов, кодирую¬
щей синтез нужного белка. Необходимо согласовать регулятор¬
ные сигналы как путем модификации регуляторных участков
рекомбинантной ДНК, так и дополнительными изменениями
самой бактериальной клетки. Эти вопросы рассматриваются в
специальной литературе. Мы остановимся на создании реком¬
бинантных бактериальных продуцентов со стабильными гене-
тическими структурами, обеспечивающими высокий уровень
экспрессии клонированного гена.6.3.1. ВЫБОР МИКРООРГАНИЗМА-РЕЦИПИЕНТА
РЕКОМБИНАНТНОЙ ДНКРентабельность биотехнологии во многом зависит от применяе¬
мых штаммов-продуцентов. Эти микроорганизмы должны обла¬
дать высокой удельной скоростью роста, стабильностью насле¬
дования, способностью использовать дешевые и доступные суб¬
страты, фагоустойчивостью и безвредностью для человека и.
окружающей среды.Первые работы по созданию современных промышленных
штаммов методом рекомбинантных ДНК связаны с использо¬
ванием Е. coli — микроорганизма с хорошо изученными орга¬
низацией генома и регуляцией метаболизма микробной клетки.
На его базе были созданы первые продуценты инсулина, интер-
феронов, интерлейкина и проведены широкие исследования па
генетике, биохимии и физиологии рекомбинантных культур.Однако использование Е. coli в качестве продуцента в
микробиологической промышленности связано с некоторыми
опасениями. Е. coli является естественным обитателем кишеч¬
ного тракта человека, и существует риск заражения человека
искусственно созданными штаммами. Клеточная стенка Е. coli
содержит токсин липополисахаридной природы, который трудна
отделяется от белков, получаемых с помощью рекомбинантных
штаммов. Природные штаммы Е. coli в качестве источника уг¬
лерода ассимилируют глюкозу, фруктозу, но не сахарозу —
Примеры биотехнологий317более дешевый и технологически удобный субстрат. Клетки
Е. coli подвержены фаголизису.В связи с изложенным в качестве реципиентов рекомбинант¬
ных ДНК в биотехнологии подыскивают другие микроорга¬
низмы. Для создания высокоактивных штаммов, методами
генной инженерии сегодня используют также псевдомонады, ба¬
циллы, актиномицеты и дрожжи. Так, созданы иные микроорга-
низмы-реципиенты для экспрессии генов интерферонов человека.
По сравнению с исходным штаммом Е. coli выход интер¬
ферона IFN-ai в клетках Methylophilus methylotrophus увели¬
чивается в 2 раза, а выход интерферона IFN-a2 в Pseudomo¬
nas sp. — в 100 раз |[ 10, 11].Предполагают, что в новом хозяине повышается стабиль¬
ность белка или мРНК либо более эффективно используются
сигналы инициации транскрипции и трансляции.Перспективным направлением является адаптация бацилл
для получения интерферонов. Преимуществом использования
этих бактерий является синтез экзоферментов в клетке бацилл.
Белки имеют сигнальную последовательность, которая обеспе¬
чивает их прохождение через цитоплазматическую мембрану.
Система экспрессии и секреции интерферонов в бациллах обес¬
печивает их выделение в среду, облегчает очистку белка и сни¬
жает влияние сверхпродукции на метаболизм клетки.Другое направление исследований — синтез интерферонов
на основе дрожжевых клеток. Дрожжи рода Saccharomyces
непатогенны, их биомасса не содержит токсичных и пирогенных
факторов, и дрожжи не подвергаются фаголизису и автолизу.
В режиме ферментации более 99% клеток специально сконстру¬
ированных штаммов сохраняют гибридную плазмиду [11].Еще одно преимущество дрожжей — они синтезируют гли-
козилированные белки подобно клеткам высших организмов.
Это свойство особенно важно для создания продуцентов глико¬
протеидов, например ^-интерферонов.Таким образом, в основе традиционной стратегии генети¬
ческой инженерии лежит получение подходящей клетки-хозяина
и введение в нее рекомбинантной плазмиды, содержащей ген
нужного продукта и соответствующие нуклеотидные последо¬
вательности для эффективной экспрессии.6.3.2. ПОЛУЧЕНИЕ ГЕНОВ — ФРАГМЕНТОВ ДНКНаиболее часто используемым источником ДНК для клонирова¬
ния являются фрагменты генетического материала различных
организмов.Строение и размер генома отражают положение организма
в эволюционном ряду. Для получения фрагментов ДНК в гене¬
318Глава 6тической инженерии используют класс ферментов прокариот —
специфических эндонуклеаз или рестриктаз. Рестриктазы на
двуспиральной ДНК узнают определенные нуклеотидные после¬
довательности и расщепляют ДНК в строго определенных точ¬
ках — сайтах. В генной инженерии используют рестриктазы
класса II, состоящие из белков рестрицирующей эндонуклеазы
и модифицирующей метилазы. Данные ферменты являются со¬
ставной частью защитной системы рестрикции — модификации
клетки от чужеродной ДНК.В настоящее время выделено более 500 рестриктаз данного
класса. В соответствии с номенклатурой X. Смита и Д. На-
танса — первая буква рода и две первые буквы вида образуют
сокращенное название источника фермента; нумеруют рестрик¬
тазы римскими цифрами. Эндонуклеазы обозначают символом
R, метилазы — М. В генной инженерии широко используют
рестриктазы EcoRI, EcoRII, EcoRV (Е. coli), BsuRI (Вас. sub¬
tilis) и др.Вторым источником ДНК для клонирования является ДНК,
получаемая на основе однонитевой ДНК, комплементарной
мРНК эукариот. Для получения в бактериальных клетках бел¬
ков человека и животных целые участки генома нельзя исполь¬
зовать, так как у эукариот информативные части структурных
генов разобщены. Прокариоты не способны осуществлять
сплайсинг — выщеплять некодирующие последовательности
(интроны) из ДНК. В связи с этим для экспрессии в бактери¬
альной клетке гена из животных клеток предварительно в мо¬
лекуле ДНК соответствующего гена необходимо удалить ин¬
троны. Это достигается путем синтеза нужного гена на соот¬
ветствующий мРНК обратной транскриптазой.Третьим источником ДНК служит искусственный химико¬
ферментативный синтез генов. Для синтеза гена необходима
информация о его нуклеотидных последовательностях или об
аминокислотных последовательностях соответствующего белка.Воссоединение фрагментов ДНК после обработки рестрик-
тазой и «сшивание» фрагментов ДНК осуществляют с помощью
ДНК-лигазы, которая катализирует образование фосфодиэфир-
ной связи между нуклеотидами и восстанавливает непрерыв¬
ность цепей ДНК.4.3.3. ВВЕДЕНИЕ ДНК/
В БАКТЕРИАЛЬНЫЕ КЛЕТКИДля введения нужного гена (фрагмента ДНК) в бактериаль¬
ную клетку наиболее часто используют метод, основанный на
применении плазмид в качестве вектора. Как известно, вектор —
это молекула ДНК, которая обеспечивает проникновение и реп¬
Примеры биотехнологий319ликацию в нем включенной ДНК в клетку-хозяин, причем
последнюю часто необходимо специально подготовить — обес¬
печить компетентность.Для фенотипического определения присутствия векторной
молекулы в клетке-хозяине она должна иметь один или не¬
сколько генетических маркеров. Обычно это резистентность к
определенному антибиотику. Векторная молекула содержит
сайты расщепления рестриктазами для обеспечения включения
нужного гена — фрагмента чужеродной ДИК [33].Удобно работать с небольшими по размеру векторами.
В качестве векторов обычно используют плазмиды, содержа¬
щие 15...20 тыс. пар оснований (чаще 2... 10 тыс. пар осно¬
ваний).При увеличении молекулярной массы вектора снижается
число его копий на клетку.Система вектор—хозяин лучше всего разработана для бак¬
терий Е. coli. В данном случае используют четыре типа век¬
торов: 1 — плазмиды; 2 — бактериофаг К; 3 — производные
бактериофага (космиды и фазмиды) и 4 — бактериофаг
М-13.Плазмиды являются внехромосомными генетическими эле¬
ментами; представляют собой замкнутые кольцевые суперспи-
рализованные молекулы ДНК; встречаются во многих видах
бактерий, составляя 1 ...3% генома.Молекулы ДНК плазмиды содержат гены, кодирующие по¬
рой свойства, отличающиеся от таковых в генетической инфор¬
мации бактериальной хромосомы: определение конъюгации,
способность использовать сложные органические вещества в
качестве источников питания, резистентность к антибиотикам
и др. Репликацию плазмидной ДНК осуществляют те же фер¬
менты, которые участвуют в дупликации бактериальной хромо¬
сомы. Специальный участок — ori — является участком ини¬
циации репликации.Различают строгий и нестрогий контроль репликации
плазмид. При строгом контроле репликация сопряжена с тако¬
вой хромосомы хозяина и каждая клетка имеет одну или
несколько копий плазмиды. В случае нестрогого контроля реп¬
ликация плазмид осуществляется независимо от репликации
хромосомы, число копий плазмиды при делении клеток распре¬
деляется неравномерно и достигает 100... 200 на одну клетку.
Характерными показателями плазмиды являются размер, се¬
лективные маркеры и сайты для рестрикции. Общая схема
рекомбинантных плазмид дана на рис. 6.8.Плазмиды вводят в клетки хозяина посредством трансфор¬
мации. Для узнавания трансформантов в генетической инжене¬
рии часто используют инактивацию маркера, обусловленную
вставкой. В настоящее время существуют векторы для прямого'
более 100 промоторов из Е. coli и его фагов, а также промото¬
ров других бактерий. В конструкциях векторов часто исполь¬
зуют сильные промоторы Е. coli триптофанового оперона (trp),.
лактозного оперона (lac UV5), а также промоторы фага X (Pr
и Pl), сильные промоторы фагов Т5, Т7 и др.Высокий уровень транскрипции может привести к нестабиль¬
ности плазмидной системы. Имеются данные, что сверхпроду¬
цирование мРНК может оказаться гибельным для клетки [71].
Рекомендуется использовать регулируемую экспрессию, позво¬
ляющую включать и выключать промотор, так как конститу¬
тивные продуценты сравнительно нестабильны.Применение репрессируемых/индуцируемых промоторов дает
возможность разделить фазы роста популяции и образования
продукта в клетках продуцента. В первой фазе ферментации
осуществляется ро^т клеток и накопление больших количеств
биомассы. Во второй фазе с помощью внешнего индуктора (хи¬
мического вещества) обеспечивается экспрессия чужеродного
гена.Наиболее рационально использовать плазмиды, в которых
экспрессия клонированного гена регулируется термоиндуцибель-
ными промоторами, например Pr ,и фага-Я, Преимуществом
данной системы является почти полная репрессия инициации
транскрипции с помощью cl репрессора. Температура выше
38 °С вызывает денатурацию белка-репрессора и одновременно
инициирует транскрипцию с промотора. Метод термоиндукции
сравнительно прост, так как экспрессию контролируют с помо¬
щью температурного режима без. дополнительных изменений
среды культивирования ([83] 1Широко применяется также триптофановый промотор, ин¬
дукцию которого проводят путем добавления химического
индуктора. Триптофановый промотор используют д,пя экспрес¬
сии генов интерферонов, гормона роста и других чужеродных
белков в бактериальной клетке. Контроль транскрипции в слу¬
чае триптофанового промотора более сложен, и возможны как
репрессия, так и ослабление транскрипции. Активность промо¬
тора регулируют с помощью контроля содержания триптофана
в среде или повторным добавлением индуктора — 3-р-индолил-
акриловой кислоты (IAA) [71].При повышенной концентрации триптофана присоединение
репрессора к оператору в области промотора блокирует транс¬
крипцию. Включение промотора происходит после индукции
клеточной триптофаназы. Этому способствует уменьшение ката¬
болитной репрессии фермента, достигаемое заменой глюкозы
глицерином/IAA является аналогом триптофана и конкурентным инги¬
битором белка-репрессора. При добавлении индуктора репрес-
Примеры биотехнологий32»сор инактивируется, и активность экспрессии становится мак¬
симальной.Таким образом, при использовании регуляторных элементов
бактериального происхождения возможен сверхсинтез эукарио¬
тических белков в клетке прокариот.6.3.5. ВЛИЯНИЕ ПЛАЗМИД НА РОСТ КЛЕТОК-ХОЗЯЕВВключение плазмид в геном микроорганизмов почти всегда
снижает удельную скорость роста рекомбинантных клеток по
сравнению с клетками, не содержащими плазмид [43, 83].Данный эффект не является неожиданным, так как плаз¬
миды в известной степени балласт для клетки и не всегда обес¬
печивают экологические преимущества для клетки-хозяина.
В культурах с сильно умноженным количеством плазмид
клетки становятся нежизнеспособными |[57] .Эффекты увеличенного содержания плазмид, очевидно, оп¬
ределяет конкуренция плазмидных и клеточных ДНК и РНК
за общие фонды внутриклеточных метаболитов — предшест¬
венников. клеточных макромолекул метаболической энергии.
В этом случае клетка должна тратить дополнительную энергию
на репликацию плазмидной ДНК, транскрипцию сегментов
ДНК и соответствующую трансляцию плазмидной РНК. Такйм
образом, даже если плазмиды не имеют специфического небла¬
гоприятного воздействия на клетку-хозяина, для содержания
плазмид необходимо |тратить дополнительную энергию, в ре¬
зультате удельная скорость роста клеток снижается.(д. бактериальных ^леток, которые содержат плазмиды, на
0,06 ч-1 ниже по сравнению с таковой клеток, не содержащих
плазмид [83], в широком диапазоне скоростей роста. Эффект
снижения удельной скорости роста специфичен для плазмид.Разность удельных скоростей роста плазмидсодержащих и
не содержащих плазмид клеток является основной причиной по¬
степенного уменьшения доли плазмидсодержащих j клеток в
популяции (постепенной потери количества плазмид в дочерних
клетках). Состояние популяции бактерий, содержащих реком¬
бинантную ДНК, определяется удельной скоростью/роста, жиз¬
неспособностью клеток и долей плазмидсодержащих клеток в
популяции. С науалом экспрессии рекомбинантной ДНК эти
показатели снижаются. Дерепрессии промотора вызывают по¬
степенное снижение удельной скорости роста ш)пуляции до
полной ее остановки. Множество клеток становятся неспособ¬
ными к образованию колоний. /Дерепрессия промотора изменяет метаболизм/клетки в сто¬
рону сверхсинтеза чужеродного белка и одновременно снижает
удельную скорость роста клетки-хозяина. Низкая величина ц
21* / j
324Глава 6отражает неспособность клеток с высоким содержанием плаз¬
мид восстанавливаться после шока, вызванного дерепрессией.Неблагоприятное влияние плазмид на рост клетки-хозяина
лимитирует синтез рекомбинантного белка. Продолжительность
ферментации определяет появление клеток, не содержащих
плазмид в популяции, удельная скорость роста которых зна¬
чительно выше.Воздействие плазмид на рост клеток-хозяев возрастает в
условиях увеличенной экспрессии плазмидных генов. Количе¬
ство плазмид в клетке является важным фактором при кон¬
струировании продуцентов и выборе стратегии культивирования.
Результаты экспериментов показывают, что экспрессия клони¬
рованного гена в клетках, оцениваемая по количеству синтези¬
рованного белка, прямо пропорциональна числу копий плазмид
[57].Число копий плазмид, во-первых, находится под генетичес¬
ким контролем. Во-вторых, на количество плазмидных молекул
ДНК в клетке влияют среда и режим культивирования, кото¬
рые определяют скорость роста микроорганизмов.Определено, что число копий плазмид возрастает при сни¬
женной удельной скорости роста клеток [57, 69, 85]. Концен¬
трация плазмидной ДНК и число копий плазмид уменьшаются
при повышении скорости разбавления среды в условиях непре¬
рывного культивирования [83].Число копий плазмиды pBR322
меняется от 33 на одну клетку во время логарифмической фазы
роста до 141 во время стационарной фазы [85].Несмотря на сильное влияние удельнбй скорости роста на
содержание плазмид в клетках данные экспериментов неодно¬
значны в оценке этого влияния на стабильность плазмид. Су¬
ществует два противоположных мнения на, этот счет: первое —
увеличение числа копий повышает стабильность плазмид [65,
86]; второе — увеличенное число копий i плазмиды pBR 322
вызывает рост скорости потери плазмид клетками [74].Известйо, что повышенная экспрессия', снижает удельную
скорость роста клеток-хозяев и конкурентоспособность реком¬
бинантных клеток в смешанной популяции.' Так как снижение
jLi вызывает увеличение числа копий плазмид, очевидно, это
приводит к уменьшению стабильности системы.Биосинте^ триптофана максимален при относительно низком
числе копий\ плазмид — 5 на одну хромоорму. Увеличенное
содержание Алазмид значительно повышает их структурную не¬
стабильность! и снижает сверхсинтез триптофана [34, 70].Изменение! числа плазмид в клетке физиологическим путем
с помощью изменения состава среды культивирования или гене¬
тической манмуляции дает различные результаты. Удельная
активность клонированного гена при изменении содержания
плазмид с помощью ji в 2 раза превышает активность, достиг¬
Примеры биотехнологий325нутую путем изменения генетического контроля плазмидной
репликации [57].Стабилизация плазмид в клетках реципиента является од¬
ним из направлений повышения выхода продуктов у рекомби¬
нантных клеток. Утрата клонированной ДНК ведет к образова¬
нию нежелаемых «контаминантных» организмов и снижает
продуктивность системы. Это определяет особую роль устой¬
чивости плазмид в генетической инженерии.Результаты многих экспериментов свидетельствуют о том,
что скорость образования плазмидсвободных клеток повыша¬
ется с усилением экспрессии клонированного гена.Критерием стабильности плазмид служит скорость измене¬
ния логарифма соотношения плазмидсвободных и плазмидсо¬
держащих клеток (1пР). Установлено, что In Р не меняется в
зависимости от состава среды — бедная или богатая, несмотря
на разницу в удельных скоростях роста [83].Судить о том, поддерживаются ли плазмиды в репрессиро¬
ванном состоянии, обычно можно с помощью двух парамет¬
ров: 1) возникновения плазмидсвободных клеток в результате
деления клеток (коэффициент сегрегации а отражает скорость
генерации плазмидсвободных клеток из рекомбинантных);
2) сравнительное преимущество роста плазмидсвободных кле¬
ток (коэффициент G показывает прирост плазмиднесодержащих
клеток в течение одной генерации плазмидсодержащих клеток).Мутация является естественным и поэтому неизбежным про¬
цессом при культивировании микроорганизмов. В результате
мутации происходит изменение генома клетки и потеря способ¬
ности к сверхсинтезу желаемого продукта. Для клеток Е. coli
(pPLc23trpAI) в репрессированном состоянии величина коэф¬
фициента сегрегации находится в пределах 0,001 ... 0,002 [83].Установлено, что транскрипция в случае сильных промото¬
ров препятствует репликации плазмид. Этот нежелательный
эффект накладывается на нестабильность популяции в резуль¬
тате снижения jj рекомбинантных клеток во время экспрессии.Дерепрессия вызывает изменение формы плазмидной ДНК
pPLa 2311. Наблюдается стремительный рост плазмид ОС от¬
крытой формы (open circular) взамен плазмид ССС, имеющих
форму закрытого кольца (covalently closed circular). Сущест¬
вует гипотеза, что инициация транскрипции с Рь-промотора
настолько частая, что комплекс РНК—полимеразы поддерживает
молекулу в открытой форме. Через некоторое время быстро
возрастает ДНК-фракция, электрофоретическая подвижность
которой соответствует димерам плазмиды pPLa 2311 [83].
326Глава 66.3.6. ВЛИЯНИЕ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ
НА СТАБИЛЬНОСТЬ ПЛАЗМИД
И БИОСИНТЕТИЧЕСКУЮ АКТИВНОСТЬ
РЕКОМБИНАНТНЫХ ШТАММОВ БАКТЕРИЙВ результате изучения влияния отдельных параметров культи¬
вирования на стабильность плазмид было установлено, что она
снижается при повышении температуры среды. Кинетика сегре¬
гации была одинаковой в процессах периодического и непре¬
рывного культивирования. Соотношение плазмидсодержащих
клеток возрастает значительно медленнее в богатой (LB) среде,
нежели в бедной.В условиях культивирования при лимитации роста глюкозой
доля плазмидсвободных клеток существенно не повышается.
Предполагают, что стабилизация популяции происходит в ре¬
зультате снижения удельной скорскгги роста в условиях низкой
концентрации глюкозы в среде.Доказано, что стабилизация плазмид связана с функциони¬
рованием отдельных генетических локусов и происходит, оче¬
видно, во время деления клеток. Стабилизация с помощью
cis-фактора осуществляется путем точного распределения плаз¬
мид между дочерними клетками [67].Функционирование генетического раг-локуса способствует
неслучайному распределению плазмид во время деления кле¬
ток [69]. par-Локус связан со снижением мультимерных и воз¬
растанием мономерных форм плазмид и, таким образом, повы¬
шает фактическое число молекул плазмид, подвергнутых слу¬
чайному распределению [86].Имеются отдельные сообщения о деградации плазмид в не¬
растущих клетках [70]. Однако, по мнению других авторов,
плазмиды в индивидуальной клетке сохраняются |[83]. Плаз-г
мидсвободные клетки возникают во время деления, когда до¬
черняя клетка не получает плазмиду, но не образуются путем
деструкции существующих плазмид.Для обеспечения максимальной продуктивности рекомби¬
нантных клеток необходимо сводить к минимуму потери плаз¬
мид клетками во время производственного цикла. Проблема
генетической нестабильности существует с самого начала при¬
менения технологии рекомбинантов. В промышленном мас¬
штабе производство необходимого белка в больших количествах
связано со сравнительно большим числом генераций клеток.
Это увеличивает вероятность возникновения плазмидсвободных
клеток. Промышленное применение технологии рекомбинантных
ДНК в значительной степени зависит от способности конструи¬
рованных организмов стабильно сохранять генетическую инфор¬
мацию в течение множества генераций.
Примеры биотехнологий327Кинетика потери плазмид показывает, что разница в удель¬
ных скоростях роста плазмидсодержащих и плазмидсвободных
клеток в условиях экспрессии является главным фактором по¬
тери плазмид, когда коэффициент сегрегации сравнительно мал
(а= 10-3) [83].Продуцирующие клетки растут медленнее, поэтому возрас¬
тает селективное преимущество нормальных клеток. Например,
ptrp ED 5-1 стабильно сохраняется в клетках Е. coli во время
обыкновенного роста, но быстро теряется во время синтеза про¬
теина, и 96 из 100 колоний индуцированной культуры на се¬
лективных средах теряют плазмиды {55].Установлено значительное воздействие условий культивиро¬
вания на кинетику потери плазмиды pBR 322 клетками Е. coli
[74]. Скорость потери плазмид была выше при низких скорос¬
тях разбавления и постоянной температуре. Результаты отра¬
жают отрицательное влияние плазмид на удельную скорость
роста клеток-хозяев. Этот эффект возрастает при снижении
скоростей разбавления, что способствует повышению содержа¬
ния плазмид в клетке и одновременно нестабильности системы.
Потеря плазмид при постоянной скорости разбавления возрас¬
тает с повышением температуры.Результаты других исследований [83] свидетельствуют о
том, что скорость разбавления не влияет на скорость потери
плазмид. Скорость увеличения доли плазмидсвободных клеток
была, по существу, постоянной величиной в исследованном диа¬
пазоне скоростей роста — от 1,08 до 0,06 ч-1; оптимальной
скорости роста для задержки увеличения числа сегрегантов не
существовало. Такая независимость потери плазмид от встре¬
чается чаще и объясняется разницей в удельных скоростях
роста плазмидсодержащих и плазмидсвободных клеток, состав¬
ляющей 0,05 ч-1.Установлено, что свободных сегрегантов pBR 322 не сущест¬
вует в хемостатных культурах, лимитируемых глюкозой или
фосфатом после 40 и даже после 100 генераций [64, 66].Для описания потери плазмид клетками существует ряд ки¬
нетических моделей i[56, 59]. Авторы показывают, что модель
для описания аккумуляции в культуре мутантных клеток (Мо¬
зер, 1958) пригодна и для описания потери плазмид. Таким
образом, потерю плазмид культурой можно рассматривать как
особый случай мутации.Выяснение условий, которые способствуют потери плазмид,—
важный момент в усовершенствовании технологии культивиро¬
вания рекомбинантных микроорганизмов. Нестабильность плаз¬
мид контролируют с помощью генетических манипуляций и се¬
лективных маркеров.Для предотвращения возрастания плазмидсвободных бак¬
терий в популяции при культивировании рекомбинантных
328Глава 6микроорганизмов используют селективное давление, т. е. каким-
то фактором среды (обычно наличием антибиотиков) создают
условия, обеспечивающие селективные преимущества плазмид-
содержащих рекомбинантных штаммов.Селективное давление считают эффективным, если оно дей¬
ствует при средних и больших плотностях популяции. В каче¬
стве селективных маркеров широко используют гены резистент¬
ности к разным антибиотикам. Установлено, что тетрациклин
является эффективным селективным фактором в процессе не¬
прерывного культивирования, чего нельзя сказать об ампицил¬
лине [83].Результаты экспериментов показывают, что плазмидсвобод-
ные клетки не способны расти при концентрациях ампициллина
выше 25 мг/л. Только при концентрации 8000 мг/л наблюдается
замедление роста клеток, содержащих плазмиды pPLc23trpAI„
но рост не ингибируется полностью [83]. В работе [66] уста¬
новлена минимальная ингибирующая концентрация ампицил¬
лина — 3000 мг/л — для клеток Е. coli, несущих плазмиды
pBR 322; ингибирующая концентрация для чувствительных кле¬
ток Е. coli составляла 10 мг/л.Механизм резистентности к тетрациклину заключается в
следующем. Полипептид гена TetR плазмиды pBR 322 меняет
проницаемость бактериальной мембраны '[44]. В этом случае
происходит модификация бактериальной стенки, а не молекулы
антибиотика, чтобы придать устойчивость клетке. Установлено,
что миллимолярные концентрации Mg+2 (MgS04-7H20 —
0,1 г/л) снижают чувствительность к тетрациклину.Плазмидсвободные клетки чувствительны к концентрациям
тетрациклина 5 мг/л. Данная концентрация в течение 150 ч
обеспечила высокую селективность среды; плазмидсвободных
клеток не обнаружено. Клетки с плазмидой pBSH снижали
удельную скорость роста при содержании тетрациклина в среде
более 15 мг/л i[83].Таким образом, в процессе непрерывного культивирования
в качестве селективного фактора можно использовать антибио¬
тики.Экспрессия белка в рекомбинантной клетке связана со мно¬
гими клеточными процессами. Транскрипция и трансляция про¬
кариот в клетке взаимосвязаны, и первичную скорость синтеза
белка определяют по скорости транскрипции, оборота мРНК
и трансляции. Конечный стационарный уровень белкового про¬
дукта зависит также от скорости его деградации, что обуслов¬
лено структурой.Эукариотический белок и его мРНК, по существу, чуже¬
родны для бактерий. В таких системах существенны два фак¬
тора: стабильность конечного белка (отсутствие протеолиза) и
стабильность мРНК.
Примеры биотехнологий329Количество и качество белка в функционирующей клетке
постоянно контролируются системой протеолиза. В норме у
бактерий в логарифмической фазе роста протеолизу подвер¬
гается 1...2% клеточного белка. Скорость деградации и ста¬
бильность индивидуальных белков существенно различаются и
определяются структурными особенностями белка, генотипом
и физиологическим состоянием бактериального штамма.Аномальные бел^ — продукты ошибок биосинтеза — ха¬
рактеризуются гораздо меньшей стабильностью и большей ско¬
ростью протеолиза, чем нормальные. Белки — продукты чуже¬
родных генов — распознаются системой протеолиза как ано¬
мальные, сравнительно быстро деградируют в бактериальной
клетке. Таким образом, аккумуляция продукта зависит не
только от уровня экспрессии гена, но и от активности протео-
литических реакций. Протеолизу менее подвергаются большие
молекулы. Для сохранения чужеродного белка его ген «сши¬
вают» с геном хозяина (например, ген соматостатина — с ге¬
ном р-галактозидазы). Такой химерный белок устойчив к
протеолизу.Один из методов стабилизации продукта связан с использо¬
ванием мутантов, дефективных по протеолизу чужеродных бел¬
ков, в том числе мутантов Ion [13].Протеаза La — продукт гена Ion — входит в систему
протеолиза клеток Е. coli и является одним из белков тепло¬
вого шока, синтез которого находится под контролем гена
htpR. В мутанте htpR не происходит тепловой индукции синтеза
примерно 13 белков, один из них — протеаза — продукт lon-
гена. Установлено, что эффекты действия генов Ion и htpR
суммируются [72]. Таким образом, по крайней мере, один ген
теплового шока кодирует протеазу, отвечающую за деградацию
чужеродного белка.Мутации в Ion- и htpR-генах или подавление активности
Ьа-протеазы могут увеличить стабильность продукта. Содержа¬
ние (3-интерферона в клетках 1оп_-мутанта увеличивается в
2 раза по сравнению с таковым в штаммах дикого типа (1оп+)
'[78].Введение в клетки Е. coli рекомбинантной плазмиды, несу¬
щей ген pin фага Т4 (proteolysis inhibition), стабилизирует чу¬
жеродные белки, так как продукт этого гена является ингиби¬
тором протеиназы La. Выход 0-интерферона (lac-промотор) в
клетках с гибридной плазмидой, несущей pin-ген, повышается
в 4 раза .[11].Установлено, что выход лейкоцитарного интерферона в клет¬
ках Е. coli повышает мутации по полинуклеотидфосфорилазе
(рпр). Рост эффективности связан со стабилизацией РНК —
время полужизни РНК возрастает и выход белка увеличива¬
ется примерно в 4,5 раза тп].
330Глава 6Сверхсинтез белка клонированными генами может завер¬
шиться формированием протеиновых гранул — особых внутри¬
клеточных включений I[58]. На образование этих включений
(inclusion bodies) влияет множество факторов: характерные
свойства клетки-хозяина, условия культивирования и качество
самого белка.Преимущество такой аккумуляции — повышение стабильно¬
сти и уровня накапливания продукта в 1евязи с уменьшением
протеолитического расщепления. Существуют доказательства,
что внутриклеточные протеазы не разрушают агрегатные формы
белка.Нет корреляции между определенным видом клеток-хозяев
и образованием включений. Не установлена также взаимосвязь
между формированием гранул и I) промотором, 2) образова¬
нием дисульфидных связей, 3) молекулярной массой продукта,
4) степенью экспрессии. Еще неизвестно, каким образом разные
факторы клетки и среды влияют на стабильность, раствори¬
мость и конформацию клонированных протеинов.Установлено, что свойства белков меняются в зависимости
от вида клеток-реципиентов и при разных условиях культи¬
вирования.Главными факторами, обусловливающими экспрессию ре¬
комбинантных ДНК и высокую продуктивность штамма, явля¬
ются: число копий вектора; стабильность мРНК; использование
кодонов гена, характерных для бактерии-хозяина; оборот про¬
дуктов; последовательности перед структурным геном и после
него — место связывания с рибосомой и терминаторы; возмож¬
ные барьеры экспрессии (транслокация белков через мембраны
Е. coli); промоторы i[55, 82]; секреция продукта из клеток.При использовании рекомбинантных штаммов следует счи¬
таться с тем, что высокий уровень экспрессии снижает стабиль¬
ность генотипа, что неизбежно приводит к постепенному умень¬
шению продуктивности. Параллельно с улучшением качества
генетических свойств системы хозяин — вектор необходимо усо¬
вершенствовать технологию ферментации, чтобы свести к мини¬
муму нарушения клеточной физиологии, связанные с экспрес¬
сией и аккумуляцией продукта.Стоимость продуктов, в том числе получаемых с помощью
рекомбинантных штаммов бактерий, существенно зависит от
концентрации продукта в культуральной жидкости. В этой
связи необходимо добиваться высокой концентрации клеток в
объеме ферментатора и высокого удельного содержания реком¬
бинантного белка. Уже созданы штаммы Е. coli, накапливающие
нужного белка до 60% от общих белков клетки [Н, 58]. Пред¬
ложены технологии культивирования рекомбинантных бактерий,
обеспечивающие концентрацию биомассы до 100 г/л [П> 52].
Удобной и практически легко осуществимой технологией, обес¬
Примеры биотехнологий331печивающей максимизацию продуктивности популяции реком¬
бинантных клеток, является индукция сверхсинтеза при высо¬
ких концентрациях биомассы в процессах периодического куль¬
тивирования с подпиткой.Нами совместно с А. Гертнере, Л. Лицисом, Э. Гейгером
и И. Рикмане разработан алгоритм управления культивирова¬
нием Е. coli, обеспечивающий при периодическом культивиро¬
вании с подпиткой концентрацию биомассы более 100 г/л. Авто¬
матическое управление подпиткой не допускает образования
уксусной кислоты, которая, как известно, ингибирует рост бак¬
терий. Данный способ проверен в Институте органического
синтеза ЛатвАН для синтеза рекомбинантных белков на ряде
штаммов Е. coli, используемых в качестве клеток-хозяев.Применение очень плотных клеточных культур — одна из
особенностей биотехнологии рекомбинантных бактерий. При
этом экономически оправдано использование чистого кислорода
вместо воздуха для аэрации, чистых ингредиентов для пи¬
тательных сред.6Л. УСПЕХИ И ПЕРСПЕКТИВЫ
ИСПОЛЬЗОВАНИЯ БАКТЕРИЙ В БИОТЕХНОЛОГИИШирокое использование методов генетической и клеточной
инженерии в середине 70-х годов вызвало существенные пере¬
мены в биотехнологии. Эти методы обычно сочетаются с клас¬
сическими методами селекции, например с закреплением резис¬
тентности к антиметаболитам. Примером является созданный
во ВНИИ генетики штамм Е. coli — продуцент L-треонина,
синтезирующий за 40 ч до 60 г/л этой аминокислоты с выходом
Ур/5 = 0,40 [11]. Предполагается, что в скором будущем многие
биологически активные высокомолекулярные вещества — фер¬
менты, полипептиды — можно будет заменить специфически
активными веществами с меньшей молекулярной массой, соз¬
данными методами белковой и генетической инженерии.Вместе с несомненными успехами прикладного использова¬
ния результатов генетической и клеточной инженерии остается
нерешенным ряд проблем. Одна из проблем связана с тем, что
обычно белки, синтезируемые рекомбинантными бактериями,
отличаются от природных (животного происхождения) нали¬
чием дополнительного метионина в N-конце молекулы. Нет чет¬
ких данных о том, насколько важна биологическая роль этой
дополнительной аминокислоты в получаемом с помощью ре¬
комбинантной техники белке.Другая принципиальная проблема вызвана тем, что чуже¬
родные белки, синтезируемые бактериями (интерфероны, интер¬
332Глава 6лейкин-2, ренин и др.), имеют иную пространственную струк¬
туру, чем белки, синтезирующиеся в организме животных. Эта
обстоятельство является однЬй из причин более критического
подхода к медицинским препаратам, получаемым с помощью
рекомбинантных бактерий.Следует также упомянуть о том, что бактерии синтезируют
негликолизированные белки, в то время как дрожжи, грибы,
клетки животных образуют гликопротеины. Роль дополнитель¬
ных сахарных остатков в молекулах разных интерферонов с
медицинской точки зрения также еще не совсем ясна.В силу этих причин в настоящее время возросли требования
к токсикологической проверке и необходимость тщательных и
всесторонних испытаний, прежде чем разрешить использование
данного препарата в клинике [25]. Упомянутые выше различия
рекомбинантных белков и пептидов бактериального синтезаг
по-видимому, приведут к необходимости производить медицин¬
ские препараты преимущественно путем культивирования кле¬
ток человека и животных.Наряду с расширением перечня используемых биологических
агентов развитие новой биотехнологии требует решения ряда
новых задач в биоинженерии, технологии выделения и очистки
продуктов и проверки качества новых биопродуктов [6].В последние годы методы биотехнологии широко внедря¬
ются в разные области сельского хозяйства. Авторы многих
работ предлагают повысить продуктивность сельского хозяй¬
ства двумя путями ![53]: созданием и использованием микро¬
организмов, повышающих урожайность и защищающих от за¬
болеваний, вредителей и неблагоприятных погодных условий;
улучшением свойств самих сельскохозяйственных культур.В связи с угрожающим ухудшением экологической обста¬
новки во всем мире наблюдается стремление заменить хими¬
ческие средства защиты растений и удобрения биологическими.Использование эпифитных бактерий. Естественным местом
обитания эпифитных микроорганизмов служит поверхность рас¬
тений. Эта группа микроорганизмов представлена мицелиаль-
ными грибами, дрожжами, бактериями и реже — актиноми-
цетами. В зоне умеренного климата эпифитные микроорганизмы
занимают 1... 10% поверхности растений. Своей жизнедеятель¬
ностью эпифитные микроорганизмы в значительной мере вли¬
яют на урожай. Большинство из них являются фитопатогенами,
вызывающими заболевания у растений. Некоторые эпифитные
микроорганизмы оказывают положительное влияние на разви¬
тие растений. К последним можно отнести азотфиксирующие
бактерии и бактерии, продуцирующие вещества, которые сти¬
мулируют рост растений. А. А. Клинцаре, используя штамм
Pseudobacterium lacticum 392, разработала в Институте микро¬
Примеры биотехнологий333биологии ЛатвАН способ получения бактериального препарата,
стимулирующего рост растений.В последнее время выявлено, что эпифитная микрофлора
влияет на морозоустойчивость растений. Во многих случаях
повреждения растений под воздействием низкой температуры
вызваны особыми микроорганизмами. Они катализируют обра¬
зование кристаллов льда в листьях и таким образом повреж¬
дают ткани. Особо активными в инициации кристаллизации
льда являются бактерии Pseudomonas syringae. Возникло пред¬
положение, что можно было бы повысить морозоустойчивость
растений, если каким-то образом подавить рост этих бактерий.Оригинальное решение данной проблемы предлагают уче¬
ные США [53]. С помощью методов генетической инженерии
был создан штамм Ps. syringae, который не способен синтези¬
ровать белок, ответственный за инициацию кристаллизации
льда. Этот штамм назвали «не образующим лед» (ice-minus).
Дальнейшая технология основывается на колонизации соответ¬
ствующих культурных растений этими бактериями либо путем
обработки семян, либо опрыскиванием полей. Не образующие
лед бактерии быстро колонизируют поверхность растений и не
позволяют развиваться диким штаммам, которые инициируют
образование кристаллов льда. Это очень простое решение дало
существенные результаты — позволило повысить морозоустой¬
чивость картофеля и клубники.На пути внедрения этой технологии в США ученые впервые
столкнулись с проблемой распространения рекомбинантных
бактерий в природе. Существуют очень строгие правила Агент¬
ства защиты природы (ЕРА), регламентирующие применение
рекомбинантных бактерий. С другой стороны, подсчитано, что
сельское хозяйство США несет убытки от мороза порядка
1 млрд. дол. ежегодно.Повышение эффективности биологической фиксации азота.
Свойство фиксации атмосферного азота путем его восстановле¬
ния нитрогеназой до аммония ‘ присуще только прокариотам.
Наиболее эффективными азотфиксаторами являются клубень¬
ковые бактерии из рода Rhizobium, свободноживущие предста¬
вители Azotobacter и Cyanobacterium. В зонах умеренного
климата особое значение имеют клубеньковые бактерии, разви¬
вающиеся в симбиозе с бобовыми растениями. Различные спо¬
собы внесения клубеньковых бактерий для улучшения урожай¬
ности клевера, люцерны, гороха, фасоли и других сельскохо¬
зяйственных культур известны давно. После освоения способа
размножения Rhizobium путем глубинного культивирования ос¬
новной проблемой стало сохранение жизнеспособности получае¬
мых препаратов. Высушивание бактерий приводит к быстрой
потере их жизнеспособности. Наиболее приемлемой товарной
формой бактериальных удобрений оказалась смесь соответст¬
334Глава 6вующих азотфиксирующих бактерий е твердым носителем —
торфом. Образование клубеньков зависит от качества иноку-
лята и способа его внесения в почву. Самый простой способ —
смешивание семян с инокулятом и совместное внесение в
почву — малоэффективен.Более рационально применение гранулированных препаратов
или дражирование семян. В последнем варианте совместно с
бактериями и семенами в гранулу добавляют другие нужные
ингредиенты, например карбонат кальция и фосфат кальция,
для внедрения культуры в кислые почвы.Микробные препараты для защиты растений. В мире уже
имеется опыт создания и использования биологических средств
защиты растений на основе бактериальных, грибных и вирус¬
ных культур [6]. Это позволит получать чистую сельскохо¬
зяйственную продукцию. Основным бактериальным препара¬
том, получаемым с помощью Bacillus thuringiensis, являются
биотоксины, которые обладают специфической активностью
против гусениц вредителей ряда растений.Недавно в США в компаниях «Микоген» и «Монсанто» с
помощью методов генетической инженерии созданы новые, бо¬
лее эффективные препараты биопестицидов. Идея заключается
в том, что гены биотоксина из Вас. thuringiensis переносят в
эпифитные бактерии, которые легко колонизируют соответству¬
ющее растение. Наилучшим реципиентом для экспрессии син¬
теза биотоксинов оказались бактерии Pseudomonas fluorescens.
Рекомбинантный штамм синтезировал биотоксин в количестве
до 30% от общих клеточных белков <[53]. Эти токсины без¬
вредны для растений, животных и людей. Для уменьшения
риска компания «Микоген» предлагает использовать биомассу,
содержащую биотоксины, после специальной обработки, уби¬
вающей бактерии. Применение такого препарата удлиняет срок
его действия — достаточно одной обработки растений за сезон.Альтернативой уменьшения заболеваемости растений явля¬
ется изменение генома самого растения таким образом, что он
приобретает резистентность к определенным болезням. Первые
успехи в этом направлении достигнуты с помощью Ti-плазмиды
бактерий Agrobacterium tumefaciens, которая интегрируется в
геном растений. В природе эти плазмиды индуцируют образо¬
вание опухолей у растений — корончатый галл. Используя
Ti-плазмиду как вектор, можно направленно изменять геном в
двудольных растениях и таким образом придавать растению
новые свойства [5].
СПИСОК ЛИТЕРАТУРЫК ГЛАВЕ 11. В и е с т у р У. Э. и др. Биоэнергетические и аппаратурные аспекты
создания энергосберегающих систем ферментации / У. Э. Виестур,
Ю. Э. Швинка, М. А. Рикманис // Биотехнология. — 1988. — Т. 4, № 2. —
С. 235—245.2. Гуревич Ю. Л. Устойчивость и регуляция размножения в микроб¬
ных популяциях. — Новосибирск: Наука, 1984. —| 161 с.3. Е р о ш и н В. К. Основы материально-энергетического баланса роста
микроорганизмов // Лимитирование и ингибирование микробиологических
процессов. — Пущино, 1980. — С. 34—65.4. Исследование роста микроорганизмов1 на основе материально-энерге¬
тического баланса с использованием ЭВМ в режиме' реального времени /
И. Г. Минкевич, Л. Г. Лысенко, В. Д. Кувшинников, В. К. Ерошин // Acta
Biotechnologica. — 1984. — Vol. 4, N 1. — P. 25—35.5. Конев С. В. Структурная лабильность биологических мембран и
регуляторные процессы. — Минск: Наука и техника, 1987. — 240 с.6. Л а укевиц Я. Я., Смирнов Г. Г., Виестур У. Э. Микро¬
биологические концентраты. — Рига: Зинатне, 1982. — 280 с.7. Л иепиньш Г. К., Д у и ц е М. Э. Сырье и питательные субстраты
для промышленной биотехнологии. — Рига: Зинатне, 1986. — 158 с.8. Манаков М. Н. Стехиометрия и энергетика биосинтеза // При¬
кладная биохимия и микробиология. — 1981. — Т. 17, вып. 3. — С. 375—379.9. Метод оценки эффективности использования источника углерода при
росте гетеротрофных бактерий / Л. А. Бабурин, Ю. Э. Швинка, У. 3. Кал-
нениекс, В. Н. Иванов // Микробиологический журнал. — 1987. — Т. 49,
№ 5. — С. 90—93.10. Минкевич И. Г. Физико-химические основы материально-энерге¬
тического баланса клеточного .метаболизма // Лимитирование и ингибирова¬
ние микробиологических процессов. — Пущино, 1980. — С. 55—101.И. Перт С. Д ж. Основы культивирования микроорганизмов и кле¬
ток. — М.: Мир, 1978. — 331 с.12. Получение биогаза из отходов производства кристаллического L-ли-
зина / У. Э. Виестур, В. С. Дубровскис, А. К. Саксе, М. П. Руклиш //
Изв. АН ЛатвССР. — 1987. — № 8 (481). — С. 102—105.13. С ел га С. Э., Бекер М. Е. Оценка процесса биосинтеза лизина
продуцентом Brevibacterium sp. 22 // Микробные биомассы и их метабо¬
литы. — Рига: Зинатне, 1972. — С. 31—88.
336Список литературы14. Ферментация и технология ферментов / Д. Уонг, Ч. Кооней, А. Де-
майн и др. — М.: Легкая и пищевая промышленность, 1983. — 336 с.15. Швин ка Ю. Э. Физиологические аспекты регуляции выхода про¬
дуктов бактериального синтеза: Автореф. дис. ... д-ра биол. наук. — Пу-
щино, 1986. — 34 с,16. Aar Р. С., van den. Verse veld H. W., van, Stoutha-
шег A. H. The consequences of protein-overproduction on the growth and
physiology of yeasts // Abstract Book of 2nd Int. Symp. on Overproduction
of Microbial Products. — Ceske Budejovice, 1988. — P. 40.17. Babel W. Bewertung von Substraten iur das mikrobielle Wachstum
auf der Grundlage ihres Kohlenstoff / Energie Verhaltnisses // Z. Allg.
Microbiol. — 1979; — Bd 19, H. 9. — S. 671—677.18. Babel W., Muller R. H. Correlation between cell composition and
carbon conversion efficiency in microbial growth: a theoretical study // Appl.
Microbiol. Biotechnol. — 1985. — Vol. 22, N 3. — P. 201—207.19. Battley E. H. Energetics of microbial growth. — New York etc.:
Wiley-Intersci. Publ., 1987. — 456 p.20. В e 1 a i с h J. P. Growth and metabolism in bacteria // Biological micro-
calorimetry / Ed. by A. E. Beezer. — London etc.: Acad. Press, 1980. —
P. 1—42.21. Cooney Ch. L. Bioreactors design and operation // Science. —1983. - Vol. 219, N 4585. — P. 728—733.22. Dawes E. A. Starvation, survival and energy reserves // Bacteria
in their natural environments / Ed. by M. Fletcher, G. D. Floodgate. — London
etc.: Acad. Press, 1985. — P. 43—79.23. D e m a i n A. L. New applications of microbial products // Science. —1983. - Vol. 219, N 4585. — P. 709—714.24. Energetic efficiency of complex substrate utilization by Trichoderma
viride / M. P. Leite, A. J. Apine, M. O. Zeltina, J. E. Shvinka // Acta Bio¬
technol. — 1989. — Vol. 5.25. Erickson L. E. Biomass elemental composition and energy con¬
tent // Biotechnol. Bioeng. — 1980. — Vol. 22. — P. 451—456.26. Erickson L. E.f Mi nke vich I. G., Eroshin V. K. Application
of mass and energy balance regularities in fermentation // Biotechnol. Bio¬
eng. — 1978. — Vol. 20, N 10. — P. 1595—1621.27. Erickson L. E., S e 1 g a S. E., V i e s t u r s U. E. Application of
mass and energy balance regularities to product formation // Biotechnol.
Bioeng. — 1978. — Vol. 20, N 10. — P. 1623—1638.28. Eroshin V. K., Minkevich I. G. On the upper limit of mass
yield of an organic product from an organic substrate // Biotechnol. Bioeng. —
1982. — Vol. 24. — P. 2263—2265.29. Esener A. A. An engineering study of bacterial kinetics and ener¬
getics. Ph. D. thesis, Delft Univ. of Technol. — The Netherlands, Delft Univ.
Press. 1981. — 126 p.30. F i e s с h k о J., R i t с h T. Production of human alpha consensus
interferon in recombinant Escherichia coli // Chem. Eng. Commun. — 1986. —
Vol. 45. — P. 229—240.31. Gas balance method for testing of microbial growth efficiency after
carbon substrate pulse / L. A. Baburin, J. E. Shvinka, M. P. Ruklisha,
U. E. Viesturs // Acta Biotechnol. — 1986. — Vol. 6, N 2. — P. 123—128.32. Ingram L. O., Buttke Т. M. Effects of alcohols on microorga¬
nisms // Adv. Microb. Physiol. — 1984. — Vol. 25. — P. 256—300.33. Koch A. L. The macroecomonics of bacteria growth // Bacteria in
their natural environments / Ed. by M. Fletcher, G. L. Floodgate. — London
etc.: Acad. Press, 1985. — P. 1—42.34. Minkevich I. G. Physico-chemical properties of organic compounds
and the energetics of metabolism // J. Theor. Biol. — 1982. — Vol. 95, N 3. —
P. 569—590.
К главе 233735. Minkevich I. G. Mass-energy balance for microbial product syn¬
thesis-biochemical and cultural aspects // Biotechnol. Bioeng. — 1983. —
Vol. 25. — P. 1267—1293.36. Patel S. A., E r i с k s о n L. E. Estimation of heats of combustion
of biomass from elemental analysis using available electron concepts // Bio¬
technol. Bioeng. — 1981. — Vol. 23. — P. 2051—2067.37. Provisional list of symbols and units recommended for use in bio¬
technology by the 1UPAC Commission on Biotechnology // Pure Appl. Chem. —
1982. — Vol. 54. — P. 1743—1749.38. R о e 1 s J. A. Energetics and kinetics in biotechnology. — Amster¬
dam: Elsevier Biomed., 1983. — 340 p.39. Roels J. A. Thermodynamics of growth: Basic biotechnology / Ed.
by J. Bu Lock, B. Kristiansen, — London ptc.: Acad. Press, 1987. — P. 57—74.40. Salmond Ch. V., К г о 11 R. G., В о о t h I. R. The effect of food
preservatives on pH homeostasis in Escherichia coli // J. Gen. Microbiol. —
1984. — Vol. 130. — P. 2845—2850.41. Shvinka J., Viesturs U., Ruklisha M. Yield regulation of
lysine biosynthesis in Brevibacterium flavum j I Biotechnol. Bioeng. — 1980. —
Vol. 22, N 4. — P. 897—912.42. Solomon B. .0., Erickson L. E. Biomass yields and maintenance
requirements for growth on carbohydrates // Proc. Biochem. — 1981. —
Vol. 16. — P. 44-49.43. Stout hamer A. H. Towards an integration of various aspects of
microbial metabolism: energy generation, protein synthesis and regulation //
Proc. 3rd Eur. Congr. on Biotechnol. — Miinchen: Verl. Chemie; Weinheim,1984. — Vol. 4. — P. 223—239.44. Tempest D. W. The biochemical significance of microbial growth
yields: a reassessment // Trans. Biochem. Sci. — 1978. — Vol. 3. —
P. 180—184.45. W e s t e г h о f f H. V., H e 11 i n g w e г f K. J., V a n Dam K. Ther¬
modynamic efficiency of microbial growth is low but optimal for maximal
growth rate // Proc. Nat. Acad. Sci. USA. — 1983. — Vol. 80, N 1. —
P. 305—309.46. Z e i k u s J. G., N g Т. K. Thermophilic saccharide fermentations //
Ann. Rep. Fermentation Processes. — 1982. — Vol. 5. — P. 263—289.47. Z 1 о k a r n i k M. Bioverfahrenstechnik in den 80er Jahren. Wege und
Ziele // Biotechn.- Forum- Intern. Ztschr. Biotechnol. — 1985. — Bd 2, N 4. —
S. 1 — 12.К ГЛАВЕ 21. Арпатбанов В. Ю. и др. Генерация мембранного потенциала
аэробными бактериями Micrococcus lycodeicticus. Соотношение сопряженного
и несопряженного дыхания / В. Ю. Арцатбанов, Г. В. Тихонова, Д. Н. Ос¬
тровский // Биохимия. — 1983. — Т. 48, вып. 9. — С. 1568—1579.2. Генерация мембранного потенциала и синтез АТФ мембранными пре¬
паратами с нарушенным барьером проницаемости из бактерий Stapnylococcus
aureus / Ш. Т. Талыбов, Е. Ф. Харатьян, А. С. Каирельянц, Д. Н. Остров¬
ский / Биологические мембраны. — 1986. — Т. 3, № 6. — С. 575—591.3. Головлев Е. Л. Влияние лимитирования роста на метаболизм
микроорганизмов // Лимитирование и ингибирование микробиологических
процессов. — Пущино, 1980. — С. 22—33.4. Головлев Е. Л. Коринеподобные бактерии и близкие к ним орга¬
низмы /'/ Успехи микробиологии. — 1978. — № 13. — С. 73—83.5. Г о л о в л е в Е. Л. и др. Фосфокетолазная система расщепления
углеводов у сапрофитных микобактерий / Е. Л. Головлев, Н. В. Ерошина,
Л. М. Барышникова // ДАН СССР. — 1983 — Т. 272. № 2. — С. 490—493.*>9. -- 3*4
338Список литературы6. Гринюс Л. Л. Транспорт макромолекул у бактерий. — М.: Наука,.1986. — 240 с.7. Дэгли С., Никольсон Д. Метаболические пути. — М.: Мир,
1973. — 310 с.8. Зайцева 3. М., Миндлин С. Э. О некоторых особенностях
метаболизма карликового мутанта Micrococcus glutamicus — продуцента
лизина // Микробиология. — 1968. — Т. 37, № 1. — С. 103—108.9. Калнениекс У. 3. Изучение энергетических затрат поддержания,
ионных градиентов у бактерий: Автореф. дис. ... канд. биол. наук. — Пу-
щино, 1989. — 20 с.10. Карзанов В. В. и др. Поглощение ацетата Thiocapsa roseopcr-
sicina / В. В. Карзанов, Р. Н. Ивановская, Е. Н. Кондратьева // Микробио¬
логия. — 1982. — Т. 51. — С. 751—755.11. Лукоянова М. А., Тихонова Г. В. Организация дыхательной,
цепи и аккумуляция энергии у бактерий // Биологическая химия. Итоги
науки и техники. — М.: ВИНИТИ, 1982. — Т. 17. — С. 3—74.12. Николс Д. Д ж. Биоэнергетика. Введение в хемиосмотнческую
теорию. — М.: Мир, 1985. — 190 с.13. Цианидрезистентное дыхание бактерий и его взаимосвязь с избыточ¬
ным синтезом метаболитов / С. М. Трутко, А. Г. Меденцев, В. П. Коробов,В. К. Акименко // Микробиология. — 1984. — Т. 53, вып. 1. — С. 21—27.14. Цианидрезистентное потребление кислорода у лизинсинтезирующих.
бактерий Brevibacterium flavum 22ЛД / М. К. Тома, Ю. Э. Швинка,
М. П. Руклиш и др. // Прикладная биохимия и микробиология. — 1984. —
Т. 20, вып. 1. — С. 95—100.15. Швинка Ю. Э. Образование супероксидных радикалов в бактери¬
альных мембранах // Биомембраны, структура, функции, медицинские ас¬
пекты. — Рига: Зинатне, 1981. — С. 232—256.16. Швинка Ю. Э. Об участии коротиноидов в окислительном мета¬
болизме гетеротрофных бактерий // Селекция и культивирование продуцентов
аминокислот и ферментов. — Рига: Зинатне, 1979. — С. 13—20.17. Швинка Ю. Э. и др. Чувствительность процесса поглощения кис¬
лорода у Brevibacterium flavum к изменениям pH среды и действию разоб¬
щителя окисления и фосфорилирования / Ю. Э. Швинка, Л. А. Бабурин,
У. Э. Виестур // Микробиология. — 1982. — Т. 51, вып. 6. — С. 926—931.18. Acosta R., Lueking D. R. Stringency in the absence of ppGoo
accumulation in Rhodobacter sphaeroides // J. Bacteriol. — 1987. — Vol. 169,
N. 2. — P. 908—912.19. Accumulation of trehalose by E. coli K12 at high osmotic pressure
depends on the pressure of amber suppressors / M. L. Rod., K. Y. Alan,
P. R. Cunningam, D. P. Clark // J. Bacteriol. — 1988. — Vol. 170, N 8. —
P. 3601—3610.20. Anderson R. L., Wood W. A. Carbohydrate metabolism in micro¬
organisms // Ann. Rev. Microbiol. — 1969. — Vol. 23. — P. 539—578.21. Anraku Y., Gennis R. B. The aerobic respiratory chain of
Escherichia coli // Trends Biochem. Sci. — 1987. — Vol. 12, N 7. —
P. 262—266.22. Bacterial respiratory-linked proton translocation and its relation to
respiratory chain composition / C. W. Jones, J. M. Brice, A. J. Downs,
J. W. Drozd // Eur. J. Biochem. — 1975. — Vol. 52, N 2. — P. 265—271.23. Beardemore-Gray М., Anthony C. The oxidation of glucose
by Acetinobacter calcoaceticus: interaction of the quinoprotein glucose dehydro¬
genase with the electron transport chain // J. Gen. Microbiol. — 1986. —
Vol. 132. — P. 1257—1268.24. В e 1 a i с h J. P. Growth and metabolism in bacteria // Biological
microcalorimetry / Ed. by A. E. Beezer. — London etc.: Acad. Press. 1980. —
P. 1—42.
К главе 233925. Bennett Р. М., Holms W. H. Reversible inactivation of the
isocitrate dehydrogenase of E. coli ML 308 during growth on acetate // J.
'Gen. Microbiol. — 1975. — Vol. 87. — P. 37—51.26. Bergey's manual of determinative bacteriology. 8th ed. / Ed. by
R. E. Buchanan, N. E. Gibbons. — Baltimore, 1984. — 1269 p.27. Carobyhvdrate transport in bacteria / S. S. Dills, A. Apperson,
M. R. Schmidt, М. H. Saier // Bacteriol. Rev. — 1980. — Vol. 44, N 3. —
P. 385—418.28. Chapman A. G., A t k i n s о n D. E. Adenine nucleotide concentra¬
tions and turnover rates // Adv. Microbiol. Phys. — 1977. — Vol. 15. —
P. 254—306.29. Clement Y., L a n e 11 e G. Glutamate excretion mechanism in
Corynebacterium glutamicum: Triggering of biotin starvation by surfactant
addition // J. Gen. Microbiol. — 1986. — Vol. 132. — P. 925—929.30. Cozzone J. J. Protein phosphorylation in bacteria // TJBS. —1984. — N 9. — P. 400—403.31. Danchin A. et al. Metabolic alteration mediated by 2-ketogluta-
rate in Escherichia coli K12 / A. Danchin, L. Dondon, L. Daniel // Mol. Gen.
Genet. — 1984. — Vol. 193. — P. 473—478.32. D a w e s E. A. Microbial energetics. — Glasgow; London: Blackie,1986, — 187 p.33. D о e 11 e H. W. Basic metabolic processes, 9 // Biotechnology / Ed.
bv H.-J. Rehm, G. Reed. — Weinheim; Deerfield Beach; Basel: Verl.-Chemie,1981. — Vol. 1. — P. 113—210.34. Doelle H. W. et a 1. Regulation of glucose metabolism in bacterial
systems / H. W. Doelle, K. N. Ewings, N. W. Holywood // Adv. Biochem.
Eng. — 1983. — Vol. 23. — P. 1—35.35. Doelle H. W., M с I v о г S. The Pasteur effect in Escherichia coli
K12 mutants lacking the allosteric form of phosphofructokinase // FEMS
Microbiol. Letters. — 1980. — Vol. 7, N 4. — P. 337—340.36. D u i n e J. A. e t a 1. PQQ and quinoprotein enzymes in microbial
oxidations / J. A. Duine, J. J. Frank, J. A. Jongejan // FEMS Microbiol.
Rev. — 1986. — Vol. 32. — P. 165—178.37. Energy transduction by electron transfer via a pyrroloquinoline
quinone-dependent glucose dehydrogenase in E. coli, Ps. aeruginosa, Acineto-
bacter calcoocencus (var Lwoffi) / B. J. Van Schie, K. J. Wellingwerf,
J. P. Van Dijken et al. // J. Bacteriol. — 1985. — Vol. 163, N 2. —
P. 393—499.38. Evidence for the coordinate control of glycogen synthesis, glucose
utilization and glucolysis in Escherichia coli. Pt II / D. N. Dietzler, M. P. Lec-
kie, J. L. Maghani et al. // J. Biol. Chem. — 1975. — Vol. 250, N 18. —
P. 7194—7203.39. Ferguson S. J. Fully localised chemiosmotic of localised proton
flow pathways in energy coupling? A scrutiny of experimental evidence //
Biochim. Biophys. Acta. — 1985. — Vol. 811, N 1. — P. 47—95.40. Fermentation shifts and metabolic reactivity during anaerobic carbon-
limited growth of Klebsiella aerogenes NGTC 418 on fructose, gluconate,
mannitol and pyruvate / H. Streekstra, E. T. Buurman, C. W. G. Hoitink et
al. // Arch. Microbiol. — 1987. — Vol. 148. — P. 137—143.41. Feucht В. М., Saier М. H. Fine control of adenylate cyclase by
the phosphoenolpyruvate: sugar phosphotransferase systems in Escherichia coli
and Salmonella typhimurium // J. Bacteriol. — 1980. — Vol. 141, N 2. —
P. 603—610.42. Fiechter A., Fuhrmann G. F., Kappeli O. Regulation of
glucose metabolism in growing yeast cells // Advances in microbial physio¬
logy / Ed. by A. H. Rose, J. G. Morris. — London etc.: Acad. Press, 1981. —
Vol. 22. — P. 123—183.22*
340Список литературы43. Fisher S. Н., М a g a s a n i к В. Ketoglutarate and the regulation
of aconitase and histidase formation of Bacillus subtilis I j J. Bacteriol. —1984. — Vol. 158, N 1. — P. 379—382.44. Fraser A. D. E., Y a m a z a k i H. Difference between glucose inhi¬
bition of glycerol and lactose utilization in Escherichia coli j I FEMS Micro¬
biol. Letters. — 1983. — Vol. 16. — P. 195—198.45. Fraser A. D. E., Y a m a z a k i H. Evidence for the third system
for glucose uptake in Escherichia coli // FEMS Microbiol. Letters. — 1983. —
Vol. 17. — P. 27—29.46. G a u s i n g K. Regulation of ribosome synthesis in Escherichia
coli // THBS. — 1982. — Vol. 7, N 2. — P. 65-67.47. Glucose-dehydrogenase-mediated solute transport and ATP synthesis
in Acinetobacter calcoaceticus / B. J. Van Schie, J. T. Pronk, K. J. Helling-
werf et al. j I J. Gen. Microbiol. — 1987. — Vol. 133. — P. 3427—3435.48. Goma G., Durand G. Behaviour of high cell density culture //
8th Intern. Biotechnol. Symp. — Paris, 1988. — P. 37.49. Gottschalk G. Bacterial metabolism 3rd ed. — New York etc.:
Springer-Veri. — 1985. — 359 p.50. Griffiths M. W. The control of the synthesis of isocitrate lyase
in a thermophyllic bacillus // J. Gen. Microbiol. — 1979. — Vol. 112, N 2. —
P. 357—364.51. Heat shock responses of Pseudomonas aeruginosa / B. Allan, M. Lin-
seman, L. M. MacDonald et al. // J. Bacteriol. — 1988. — Vol. 170, N 8. —
P. 3668—3674.52. H u e t i n g S. e t a 1. Energy requirement for maintenance of the
transmembrane potassium gradient in Klebsiella aerogenes NCTC 418: A con¬
tinuous culture study / S. Hueting, T. de Lange, P. M. Tempest // Arch.
Microbiol. — 1979. — Vol. 123. — P. 183—188.53. Involvement of meso-, diaminopimelate D-dehydrogenase in lysine
biosynthesis in Corynebacterium glutamicum / S. Ishino, K. Yamaguchi, K. Shi-
gahata, K. Araki // Agr. Biol. Cem. — 1984. — Vol. 48, N 10. — P. 2557—
2560.54. J о n e s C. W. e t a 1. The effect of respiratory chain composition
on the growth efficiencies of aerobic bacteria / C. W. Jones, J. M. Brice,
C. Edwards // Arch. Microbiol. — 1977. — Vol. 115, N 1. — P. 85—93.55. Jones C. W. Bioenergetics of aerobic bacteria // Abstr. 8th Intern.
Biotechnol. Symp. — Paris, 1988. — P. 24.56. К a 1 у a n a r a m a n V. S. Catabolite repression // J. Sci. Ind. Res. —
1971. — Vol. 30. — P. 560-570.57. К e d d i e R. М., Jones D. Saprophytic, aerobic coryneform bac¬
teria // Procaryotes / Ed. by M. P. Starr et al. — Berlin; Heidelberg:
Springer-Veri, 1981. — Vol. 133. — P. 1651—1665.58. К e 11 D. Forces, fluxed and the control of microbial growth and
metabolism // J. Gen. Microbiol. — 1987. — Vol. 133. — P. 1651 — 1665.59. Kleiner D. Bacterial ammonium transport // FEMS MicrobioL
Rev. — 1985. — Vol. 32. — P. 87—100.60. К n о w 1 e s C. J. Microbial metabolic regulation by adenine nucleotide
pools // Microbial energetics / Ed. ,by B. A. Haddock, W. A. Hamilton. —
Cambridge: Univ. Press, 1977. — P. 241—283.61. Konings W. N. Generation of metabolic energy by end-product
efflux // TJBS. — 1985. — N 8. — P. 317—319.62. Konings W. N., V e 1 d k a m p H. Energy transduction and solute
transport mechanisms in relation to environments occupied by microorga¬
nisms // Microbes in natural environment. 34th Symp. Soc. Gen. Microbiol. —
Cambridge, 1983. — P. 153—186.63. К u j a 1 a C. J. Pyruvate oxidase activity dependent on thiamine
pyrophosphate, flavin adenine dinucleotide and orthophosphate in Streptococcus
sanguis // FEMS Microbiol. Letters. — 1984. — Vol. 25, N 1. — P. 53—56.
64. Lunch W. H., F r a n к 1 i n M. Effect of temperature on the uptake
of glucose, gluconate and 2-ketogluconate by Pseudomonas fluorescens //
Canad. J. Microbiol. — 1978. — Vol. 24. — P. 56—62.65. L u t g e n s М., Gottschalk G. Why a co-substrate is required
for anaerobic growth of Escherichia coli on citrate // J. Gen. Microbiol. —1980. — Vol. 119. — P. 63-70.66. Mitchell C. G., Dawes E. A. The role of oxygen in the regu¬
lation of glucose metabolism, transport and the tricarboxylic acid cycle in
Pseudomonas aeruginosa // J. Gen. Microbiol. — 1982. — Vol. 128, N 1. —
P. 49—59.67. Mori М., S h i i о J. Pyruvate formation and sugar metabolism in
an amino acid producing bacterium Brevibacterium flavum j I Agr. Biol.
Chem. — 1987. — Vol. 51, N 1. — P. 129-138.68. Mori М., Shiio J. Multiple interaction of fructose 1.6-biphosphate
and other effectors on phosphoenolpyruvate carboxylase from Brevibacterium
flavum and its aspartate-producing mutant // Agr. Biol. Chem. — 1986. —
Vol. 50, N 10. — P. 2605—2614.69. Morphologische und physiologische Untersuchungen des L-Lysin Pro-
duzenten Brevibacterium sp. 22L unter dei) Bedingungen der kontinuierlichen
Kultivierung / M. Beker, G. Mezhina, M. Ruklisha et al. // Z. Allg. Micro¬
biol. — 1976. — Bd 16, N 7. — S. 497—508.70. N i m m о H. G. Control of Escherichia coli isocitrate dehydrogenase:
an example of protein phosphorylation in a procaryote // TJBS. — 1984. —
N 11. — P. 475—478.71. Overflow metabolism during anaerobic growth of Klebsiella aerogenes
NCTC 418 on glycerol and dihydroxyacetone in chemostat culture / H. Streek¬
stra, M. J. Teixeira de Mattos, О. M. Neijssel, D. W. Tempest // Arch. Micro¬
biol. — 1987. — Vol. 147, N 3. — P. 268—275.72. Oxidative stress and growth temperature in Bacillus subtilis /
P. Murphy, В. C. A. Dowds, D. McConnell, К. M. Devine // J. Bacteriol. —1987. — Vol. 169, N 12. — P. 5761—5770.73. Oxygen inhibition of growth of Mycobacterium tuberculosis /S. P. Gottlieb, N. R. Rose, J. Maurizi, E. H. Langhier // J. Bacteriol. —
1967. — Vol. 87, N 4. — P. 838—843.74. О z a к i H., Shiio J. Production of lysine by pyruvate kinase mu¬
tants of Brevibacterium flavum // Agr. Biol. Chem. — 1983. — Vol. 47,
N 7. — P. 1569—1576.75. PQQ-dependent production of gluconic acid by Acinetobacter, Agro¬
bacterium and Rhizobium species / B. J. Van Schie, О. H. De Mooy,
J. D. Linton et al. // J. Gen. Microbiol. — 1987. — Vol. 133, N 4. —
P. 867—875.76. Production of superoxide radicals during bacterial respiration /
J. E. Shvinka, М. K. Toma, N. I. Galinina // J. Gen. Microbiol. — 1979. —
Vol. 113, N 2. — P. 377—382.77. Protonmotive force in Brevibacterium flavum: The lack on intracellular
pH homeostasis / U. Z. Kalnenieks, J. B. Saulitis, N. I. Galinina et al. //
Arch. Microbiol. — 1989. — Vol. 151, — P. 213—219.78. Purification and characterization of the quinoprotein D-glucose de-
hydrogenase apoenzyme from Escherichia coli / M. Ameyama, M. Nonobe,
E. Shinagawa et al. // Agr. Biol. Chem. — 1986. — Vol. 50, N 1.P. 49—57.79. R acker E. A. new look at mechanisms in bioenergetics. — New
York etc.: Acad. Press, 1976. — 197 p.80. R acker E. Energy transducing mechanisms // Biochemistry, Ser. I/
Ed. by E. Racker. — Butterworth: Univ. Park Press, 1975. — Vol. 3. —
P. 163—181.
342Список литературы81. Regulation of PQQ-linked glucose dehydrogenase activity in chemo-
stat culture of Klebsiella erogenes and Escherichia coli / О. M. Neijssel,
R. W. J. Hommes, P. W. Postma, D. W. Tempest // Continuous culture /
Ed. by P. Kyslik et al. — London etc.: Acad. Press, 1988. — P. 127—141.82. Regulation of respiratory activity by oxygen in Arthrobacter fluores-
cens ammonium-limited chemostat culture / J. Cacciari, D. Lippe, S. Ippoliti
et al. // Canad. J. Microbiol. — 1985. — Vol. 31, N 10. — P. 896—899.83. Romano A. H. Microbial sugar transport systems and their impor¬
tance in biotechnology // TJBS. — 1986. — N 8. — P. 207—213.84. Rosen B. P. Bacterial transport. — New York; Basel: Marcel Dekkcr
Inc., 1978. — 684 p.85. Rosen B. P., Kashket E. R. Energetics of active transport // Bac¬
terial transport / Ed. by B. P. Rosen. — New York; Basel: Marcel. Dekker Inc.,1978. — P. 560—620.86. Routes of flavodoxin and ferrodoxin reduction in Escherichia coli /H. P. Blachkowski, G. Neuer, M. Ludwig-Festl, J. Knappe // Eur. J. Biochem. —
1982. — Vol. 123. — P. 536—569.87. Scott E. М., Jacoby W. B. Pyrrolidine metabolism-soluble —
aminobytiric transaminase and sqnialdehyde dehydrogenase // Science. —
1958. - Vol. 128. - P. 361—362.88. S h i i о J. e t a 1. Regulation of citrate synthese in Brevibactcrium
flavum, a glutamate-producing bacteria / J. Shiio, H. Ozaki, K. Ujigawa //
J. Biochem. (Tokyo). — 1977. — Vol. 82. — P. 395—405.89. Shiio J. Glutamate metabolism in a glutamate-producing bacterium
Brevibacterium flavum / J. Shiio, H. Ozaki, M. Mori // Agr. Biol. Chem. —
1982. - Vol. 46, N 2. — P. 493-500.90. Shiio J., U j i g a w a - T a k e d a K. Presence and regulation of
a-ketoglutarate dehydrogenase in a glutamate-producting bacterium Brevi¬
bacterium flavum I j Agr. Biol. Chem. — 1980. — Vol. 44, N 8. — P. 1897—
1904.91. Shiio J., U j i g a w a - T a k e d a K. Regulation of phosphoenol-
pyruvate carboxylase by sinergetic action of aspartate and 2-oxoglutarate //
Agr. Biol. Chem. — 1979. — Vol. 43, N 12. — P. 2479—2485.92. Silhavy T. J., F e r e n с i T., Boss W. Sugar transport systems
in Escherichia coli // Bacterial transport / Ed. by B. P. Rosen. — New York;
Basel: Marcel Dekker Inc., 1978. — P. 128—169.93. Stouthamer A. H., Bettenhaussen C. W. A continuous cul¬
ture study of an ATPase negative mutant of Escherichia coli // Arch. Micro¬
biol. - 1977. — Vol. 113. — P. 185-189.94. Stouthamer A. H., Bettenhaussen C. W. Growth and phy¬
siology of potassium-limited chemostat cultures of Paracoccus denitrificans //
Arch. Microbiol. — 1980. — Vol. 125, N 3. — P. 239—244.95. Stouthamer A. H. Energy yielding pathwavs // The bacteria.
A treatise on structure and function. — Acad." Press, 1978. — Vol. 6. —
P. 389—462.96. Studies on lysine fermentation. V. Concerted, feedback inhibition of
aspartokinase and the scheme of lysine inhibition on ^aspartic semyaldehide-
pyruvate condensation in Micrococcus glutamicus / K. Nakayama, K. Tanaka,H. Ogino, S. Knoshita // Agr. Biol. Chem. — 1966. — Vol. 30, N 6. —
P. 611—616.97. Sugar accumulation in gram-positive bacteria: Exclusion and expulsion
mechanisms / J. Reizer, J. Deutscher, S. Sutrina et al. // TJBS. — 1985. —
Vol. 10, N 1. — P. 32—35.98. S u g i m о t о S., Shiio J. Regulation of 6-phosphogluconate de¬
hydrogenase in Brevibacterium flavum // Agr. Biol. Chem. — 1987. —
Vol. 51. — P. 1257—1263.
К главе 334399. S u g i m о t о S., Shiio J. Regulation of glucose-6-phosphate de¬
hydrogenase in Brevibacterium flavum // Agr. Biol. Chem. — 1987. —
Vol. 51, N 1. — P. 101—108.100. Texeira de Mattos M. J., Tempest D. W. Metabolic and
energetic aspects of the growth of Klebsiella aerogenes NCTC 418 on glucose
in anaerobic chemostat culture // Arch. Microbiol. — 1983. — Vol. 134. —
P. 80-85.101. The functional signifacance of glucose dehydrogenase in Klebsiella
oerogenes / R. W. J. Hommes, B. Van Hell, P. W. Postma // Arch. Micro¬
biol. — 1985. - Vol. 143. — P. 163-168.102. Tyler B. Regulation of the assimilation of nitrogen compounds //
Ann. Rev. Biochem. — 1978. — Vol. 48. — P. 1127—1162.103. U 11 a m a n n A., Danchin A. Role of cyclic AMP in regulatory
mechanisms in bacteria // TJBS. — 1980. — Vol. 5. — P. 95—101.104. Vollbrecht D. Restricted oxygen supply and extraction of meta¬
bolites. II. Escherichia coli K12, Enterobacter aerogenes and Brevibacterium
lactofermentum // Eur. J. Appl. Microbiol. Biotechnol. — 1982. — Vol. 15,
N 12. — P. 111—116.105. Way good E. B. et a 1. The control of pyruvate kinases of
E. coli. II. Effectors and regulatory properties of the enzyme activated by
ribose-5-phosphate / E. B. Waygood, М. K. Rayman, B. D. Sanwal // Canad.
J. Biochem. — 1975. — Vol. 53, N 4. — P. 444-454.106. Wayne P. K., R о s e n О. M. Adenosine cyclic 3,5-monophosphate
in Escherichia coli during transient and catabolite repression // Proc. Nat.
Acad. Sci. USA. — 1974. — Vol. 71, N 4. — P. 1436—1440.107. Wright L. F. et a 1. The regulatory effects of growth rate and
cyclic AMP levels on carbon metabolism and respiratory activity in Escher¬
ichia coli K12 / L. F. Wright, D. P. Milne, C. J. Knowles // Biochem. Biophys.
Acta. — 1979. — Vol. 583. — P. 73—80.К ГЛАВЕ 31. Аспарагиназа и сериндегидратаза микроорганизмов / Р. К. Озолинь,
П. П. Гривиня, Л. Ф. Савенкова и др. — Рига: Зинатне, 1985. — 149 с.2. Бабурин Л. А., Швинка Ю. Э. Ответная реакция хемостатной
культуры микроорганизмов при малых возмущениях // Микробный синтез
ферментов и получение их препаративных форм. — Рига: Зинатне, 1983. —
С. 78—89.3. Баев А. А. Генетическая инженерия — основные понятия // Био¬
технология. — М.: Наука, 1984. — С. 155—160.4. Б и р ю к о в В. В., К а н т е р е В. М. Оптимизация периодических
процессов микробиологического синтеза. — М.: Наука, 1985. — 296 с.5. Головлев Е. Л. Биология сапрофитных микобактерий : Автореф.
дис. ... д-ра биол. наук. — Пущино, 1983. — 37 с.6. Гуревич Ю. Л. Устойчивость и регуляция размножения в микроб¬
ных популяциях. — Новосибирск: Наука, 1984. — 161 с.7. Дебабов В. Г. Возможные пути использования техники генной
инженерии в микробиологической промышленности // Успехи микробиоло¬
гии. — 1983. — Ко 18. — С. 76—92.8. Егоров Н. С., Ландау Н. С. Биосинтез биологически активных
соединений смешанными культурами микроорганизмов // Прикладная биохи¬
мия и микробиология. — 1982. — Т. 18, вып. 6. — С. 835—849.9. Иванов В. Н. Энергетика роста микроорганизмов. — Киев: Наук,
думка, 1981. — 140 с.10. Изучение фагоустойчивых мутантов Brevibacterium flavum / С. Ж. Ару-
тюнян, А. В. Кожоян, М. Б. Читьян и др. // Биотехнология. — 1987. —
No 1. — С. 9—13.
344Список литературы11. Паников Н. С. Кинетика роста микроорганизмов (общие законо¬
мерности и экологические приложения) : Автореф. дис. ... д-ра биол.
наук. — М., 1988. — 49 с.12. Перт С. Д ж. Основы культивирования микроорганизмов и кле¬
ток. — М.: Мир, 1987. — 331 с.13. П оз м ого в а И. Н. Культивирование микроорганизмов в перемен¬
ных условиях. — М.: Наука, 1984. — 104 с.14. Р а б о т и о в а И. Л. Заключительные замечания о дискуссии, по¬
священной физиологическому состоянию исследуемых микроорганизмов //
Микробиология. — 1983. — Т. 52, вып. 1. — С. 166—168.15. Работнова И. Л. Ингибиторы роста и метаболизм микроорга¬
низмов // Лимитирование и ингибирование микробиологических процессов. —
Пущино, 1980. — С. 3—21.16. Работнова И. Л., Позмогова И. Н. Хемостатное культиви¬
рование и ингибирование роста микроорганизмов. — М.: Наука, 1979. —
208 с.17. Работнова И. Л., Позмогова И. Н., Беснакьян И. А.
Хемостатное и периодическое культивирование при изучении физиологии мик¬
роорганизмов // Итоги науки и техники. Микробиология. — М.: ВИНИТИ,1981. — Т. И. — С. 3—54.18. Роль газообразного водорода в микробиологическом биосинтезе L-ли¬
зина / Л. Я. Лицис, М. Ж. Кристапсонс, Ю. Э. Швинка, М. К. Смолкина //
Изв. АН ЛатвССР. — 1982. — Кя 8. — С. 99—103.19. Селекция фагоустойчивого штамма / Г. А. Удровский, Л. Б. Шкагале,
Р. Б. Далка // Микробиологическая промышленность. — 1979. — № 3. —
С. 18—20.20. Селекция штаммов — продуцентов лизина / Л. Б. Шкагале,
Р. Б. Далка, Г. А. Удровский // Микробиологическая промышленность. —
1979. — № 3. — С. 10—12.21. Ферментация и технология ферментов / Д. Уонг, Ч. Кооней, А. Де-
майн и др.; Пер. с англ. — М.: Легкая и пищевая промышленность, 1983. —
336 с.22. Шакулов Р. С., Белицкий Б. Р. Метаболизм гуанозинтетрафос-
фата и его распространение среди прокариот // Успехи биохимии. — 1984. —
Т. 25. — С. 70—88.23. Ш в и н к а Ю. Э. Физиологические аспекты регуляции выхода про¬
дуктов бактериального синтеза : Автореф. дис. ... д-ра биол. наук. —
Пущино, 1986. — 34 с.24. Эффективность роста дрожжей Candida utilis при одно- и трехфак¬
торном лимитировании / Е. М. Шульговская, И. Н. Позмогова, 3. В. Саха¬
рова и др. // Микробиология. — 1988. — Т. 57, вып. 4. — С. 686—687.25. Aragno М., S chi е gel Н. G. The hydrogen-oxidizing bacteria //
The procaryotes / Ed. by M. P. Starr et al. — Berlin; Heidelberg: Springer-
Verlag, 1981. — Vol. 2. — P. 865—893.26. А г b г i d g e M, С h e s b г о W. R. Very slow growth of Bacillus
polymyxa: stringent response and maintenance energy // Arch. Microbiol. —1982. — Vol. 132. — P. 338—344.27. ATP levels in phosphate-deregulated and arsenate-resistant mutants
of Streptomyces noursei / F. Hanel, U. Grafe, W. Friedrich, E. J. Bormann //
Z. Allg. Mikrobiol. — 1984. — Bd 24, H. 4. — S. 239—245.28. Babel W. Bewertung von Substraten fur das mikrobielle Wachstum
auf der Grundlage ihres Kohlenstoff / Energie Verhaltnisses // Z. Allg.
Mikrobiol — 1979. — Bd 19, H. 9. — S. 671—677.29. Babel W., Muller R. H. Correlation between cell composition
and carbon conversion efficiency in microbial growth: a theoretical study //
Appl. Microbiol. Biotechnol. — 1985. — Vol. 22, N 3. — P. 201—207.
К главе 334530. Babel W., Muller R. H. Mixed substrate utilization in microor¬
ganisms: biochemical aspects and energetics // J. Gen. Microbiol. — 1985. —
Vol. 131, — P. 39—45.31. Best G. R., Britz M. L. Facilitated protoplasting in certain auxo¬
trophic mutants of Corynebacterium glutamicum // Appl. Microbiol. Bio¬
technol. — 1986. — Vol. 28. — P. 288—293.32. Biotechnology of amino acid production // Progress in industrial
microbiology / K. Aida, J. Chibata, K. Nakayama et al. — Amsterdam etc.:
Elsevier Kodansha Ltd., 1986. — Vol. 24. — 340 p.33. Bull A. T. Mixed culture and mixes substrate systems // Compre¬
hensive biotechnology / Ed. by M. Moo-Young. — Oxford etc.: Pergamon
Press, 1985. — Vol. 1. — P. 281—299.34. Bull A. Т., Slater J. H. Microbial interactions and community
structure // Microbial interactions and communities / Ed. by A. T. Bull,
J. H. Slater. — London: Acad. Press, 1982. — Vol. 1. — P. 13—44.35. Byrom D. Polymer synthesis by microorganisms: technology and
economics // Trends Biotechnol. — 1987. — Vol. 5, N 9. — P. 246—250.36. Cloning vector systems for Corynebacterium glutamicum / M. Yoshi-
homa, K. Higashiro, E. Rao et al. // J. Bacteriol. — 1985. — Vol. 162. —
P. 591—597.37. Control of sugar feeding for glutamic acid fermentation / К. T. Hong,S. H. Park, J. H. Lee // J. Fermentation Technol. — 1984. — Vol. 62, N 1. —
P. 49—54.38. Cooney C. L. Growth of microorganisms // Biotechnology / Ed.
by H. J. Rehm, G. Reed. — Weinheim etc., 1981. — Vol. 1. — P. 73-112.39. Cremer J., E g g 1 in g L., S ahm H. Regulation of enzymes of
the aspetate family in Corynebacterium glutamicum // Abstr. 8th Intern. Bio¬
technol. Symp. — Paris, 1988. — P. 94.40. Crueger W., Crueger A. Biotechnology: A textbook of Industrial
microbiology / Ed. by T. D. Brook. — Madison: Sci. Techn. Inc., 1984. —
308 p.41. Daves E. A. Starvation, survival and energy reserves // Bacteria
in their natural environment / Ed. by M. Fletcher, G. D. Floodgate. — Lon¬
don etc.: Acad. Press, 1985. — P. 43—79.42. Determination of the complete nucleotide sequence of Brevibacterium
lactofermentum plasmid pAM 330 and analysis of its genetic information /
R. Yamaguchi, M. Terabe, K. Miwa et al. // Agr. Biol. Chem. — 1986. —
Vol. 50, N 11. — P. 2771—2778.43. D w i v e d i C. P. et al. Instability of plasmid-harbouring strain of
E. coli in continuous culture / T. Imanaka, S. Aiba, C. P. Dwivedi // Bio¬
technol. Bioeng. — 1982. — Vol. 24, N 6. — P. 1465—1468.44. Eddy С. K. et al. Isolation of auxotrophs and analysis of regulation
of triptophane biosynthesis in Zymomonas mobilis / С. K. Eddy, K. D. Noel,О. H. Smith // Arch. Microbiol. — 1988. — Vol. 149, N 6. — P. 561—564.45. Effect of growth temperature on the morphology and performance of
Zymomonas mobilis ATCC 29191 in batch and continuous culture / N. Stevns-
borg, H. G. Lawford, N. Martin, T. Beveridge // Appl. Microbiol. Bio¬
technol. — 1986. — Vol. 25, N 2. — P. 116—123.46. E 1 a n d e r R. P., D e m a i n A. L. Genetics of microorganisms in
relation to industrial requirements // Biotechnology / Ed. by H.-J. Rehm,
G. Reed. — Weinheim etc., 1981. — Vol. 1. — P. 235—277.47. E n e i H., H i г о s e Y. Recent research on the development of micro¬
bial strains for amino acid production // Biotechn. Gen. Eng. Rev. / Ed. by
G. E. Russell. — New York: Intercept Press, 1984, — Vol. 2. — P. 101—120.48. Eubacteria have 3 growth modes keyed to nutrient flow. Consequences
for the concept of maintenance and maximal growth yield / H. W. Van
Verseveld, W. R. Chesbro, M. Braster, A. H. Stouthamer // Arch. Microbiol. —1984. — Vol. 137, N 2. — P. 176—184.
346Список литературы49. Fiechter A. Physical and chemical parameters of microbial
growth // Adv. Biochem. Eng. Biotechnol. — 1984. — Vol. 30. — P. 7—60.50. Flamman H. T.f Weckesser J. Composition of the cell wall
of the phage resistant mutant Rhodopseudomonas capsulata St. Louis RCI //
Arch. Microbiol. — 1984. — Vol. 139, N 1. — P. 33—37.51. Furuya A., Katsumata R. Strain improvement of amino-acid
producing Corynebacteria by genetic engineering // Abstr. 8th Intern. Bio¬
technol. Symp. — Paris, 1988. — P. 29.52. Gallant J. A. Stringent control in Escherichia coli // Ann. Rev.
Genet. — 1979. — Vol. 13. — P. 300—302.53. Gas balance method for testing of microbial growth efficiency after
carbon substrate pulse / L. A. Baburin, J. E. Shvinka, M. P. Ruklisha,
U. E. Viesturs // Acta Biotechnol. — 1986. — Vol. 6, N 2. — P. 123—128.54. Gottschal J. C, Kuenen J. G. Physiological and ecological
significance of facultative chemolithotrophy and mixotrophy in chemolitho-
trophic bacteria // Intern. Symp. Microbial Growth on Q Compounds / Ed.
by H. Dalton. — London etc., 1981. — P. 92—104.55. Harder W., Dijkhuizen L. Physiological responses to nutrient
limitation // Ann. Rev. Microbiol. / Ed. by L. N. Omston et al. — California:
Ann. Rev. Inc., 1983. — Vol. 37. — P. 1—23.56. Harder W., Dijkhuizen L. Strategies of mixed substrate utili¬
zation in microorganisms // Phil. Trans. Roy. Soc. London. — 1982. —
Vol. B. 297. — P. 459—480.57. Harder W., Dijkhuizen L., Veldkamp H. Environmental
regulation of microbial metabolism // The Microbe. Prokaryotes and Eukaryo¬
tes. Symp. 36th. — Cambridge: Cambridge Univ. Press, 1984. — P. 51—95.58. Hazelbauer G. L. The bacterial chemosensory system // Canad.
J. Microbiol. — 1988. — Vol. 34. — P. 466—474.59. Ingledew W. J., Poole R. K. The respiratory chains of
Escherichia coli // Microbiol. Rev. — 1984. — Vol. 48, N 1. — P. 222—271.60. Ingraham J. L., M a a 1 о e O., N e i h a r d t F. C. Growth of the
bacterial cell. — Sunderland, Massachusetts: Sinnaner Assoc. Inc., 1983. —
435 p.61. Jacobson G. K. Mutations // Biotechnology / Ed. by H.-J. Rehm,G. Reed. — Weinheim etc.: Verlag-Chemie, 1981. — Vol. 2. — P. 280—304.62. Karst U., Friedrich C. G. Mixotrophic capabilities of Alcali-
genes eutrophus // J. Gen. Microbiol. — 1984. — Vol. 130, N 8. — P. 1987—
1994.63. Koch A. L. The macroeconomics of bacterial growth // Bacteria щ
their natural environments / Ed. by M. Fletcher, G. D. Floddgate. — Lon¬
don etc.: Acad. Press, 1985. — P. 1—42.64. Kockova-Kratochivilova A. Characteristics of industrial
microorganisms // Biotechnology / Ed. by H.-J. Rehm, G. Reed. — Weinheim
etc.: Verlag-Chemie, 1981. — P. 5—71.65. К о g u t M. Microbial strategies of adaptability // Trends Biochem.
Sci. — 1980. — Vol. 5, N 2. — P. 47—50.66. К о g u t М., Russell N. J. Life at the limits. Considerations on
how bacteria can grow at extremes of temperature and pressure, or with high
concentrations of ions and solutes // Sci. Progr. Oxf. — 1987. — Vol. 71. —
P. 381—399.67. Komatsubara S. et al. Transductional construction of a threonine
hyperproducing strain of Serratia marcescens: Lack of feedback controls of
three aspartokinases and two homoserine dehydrogenases / S. Komatsubara,
M. Kisumi, J. Chibata // Appl. Environm. Microbiol. — 1983. Vol. 45,
N 5. — P. 1445—1452.68. Linton J. D., Stephenson R. J. A preliminary study of growth
yields in relation to the carbon and energy content of various organic growth
substrates // FEMS Microbiol. Letters. — 1078. — Vol. 3, N 1. — P. 95—98.
К главе 334769. М a t s u i К. et al. Cloning of tryptophan genes of Brevibacterium
lactofermentum, a glutamic acid-producting bacterium / K. Matsui, K. Miwa,
K. Sano // Biol. Chem. — 1987. — Vol. 51, N 3. — P. 823—828.70. M e у e г H. P., К a p e 1 i O., Fiechter A. Growth control in micro¬
bial cultures // Ann. Rev. Microbiol. — 1985. — Vol. 39. — P. 299—319.71. Molecular cloning in Corynebacterium, identification of amino acid
biosynthesic genes of Corynebacterium glutamicum / C. Blanco, J. F. Burient,
J. C. Patte et al. // Abstr. 8th Intern. Biotechnol. Symp. — Paris, 1988. —
P. 102.72. Muller R. H., Babel W. Glucose as an auxiliary substrate. The
influence of its carbon catabolism on the maximum carbon conversion effi¬
ciency // Appl. Microbiol. Biotechnol. — 1984. — Vol. 20. — P. 195—200.73. N e i j s s e 1 О. М., Tempest D. W. Bioenergetic aspects of aerobic
growth of Klebsiella aerogenes NCTC 418 in carbon-limited and carbon-
suffiecient chemostat culture // Arch. Microbiol. — 1976. — Vol. 107, N 2. —
P. 215—221.74. N e i j s s e 1 О. М., T e m p e s t D. W. The regulation of carbohydrate
metabolism in Klebsiella aerogenes NCTC 418 organisms growing in chemo¬
stat culture // Arch. Microbiol. — 1975. — Vol, 106, N 3. — P. 251—258.75. N e i j s s e 1 О. М., Tempest D. W. The role on energy-spilling'
reactions in the growth of Klebsiella aerogenes NCTC 418 in aerobic chemo¬
stat culture // Arch. Microbiol. — 1976. — Vol. 110, N 2—3. — P. 305—311.76. Osmotic regulation of gene expression: ionic strength as an intra¬
cellular signal? / C. F. Higgins, J. Caimey, D. A. Stirling et al. // Trends
Biochem. Sci. — 1987. — Vol. 13, N 9. — P. 339—344.77. Patel S. A., E r i с k s о n L. E. Estimation of heats of combustion
of biomass from elemental analysis using available electron concepts // Bio¬
technol. Bioeng. — 1981. — Vol. 23. — P. 2051—2067.78. Poindexter J. Oligotrophy: Fast and famine existence // Adv.
Microb. Ecol. — 1981. — Vol. 5. — P. 63—89.79. Protoplast transformation in Coryneform bacteria and introduction
of an a-amilase gene from Bacillus amiloliquefaciens into Brevibacterium
lactofermentum / M. D. Smith, J. M. Flichinger, D. W. Lineberger, B. Schmidt jf
Appl. Environm. Microbiol. — 1986. — Vol. 51. — P. 634—639.80. P u h 1 e r A. Genetic engineering // Biotechnology / Ed. byH.-J. Rehm, G. Reed. — Weinheim etc.: Verlag-Chemie, 1981. — Vol. 1. —
P. 331—356.81. Rhee S. K., Pack M. Y. Effect of environmental pH on fermen¬
tation balance of Lactobacillus bulgaricus // J. Bacteriol. — 1980. — Vol. 144,
N 1. — P. 217—221.82. R i e d e 1 K. Nucleosidpolyphosphate: Vorkommen, Metabolismus und
Funktion // Z. Allg. Mikrobiol. — 1983. — Bd 23, H. 2. — S. 103—141.83. Roel J. A. Energetics and kinetics in biotechnology. — Amsterdam:
Elsevier Biomed., 1983. — 340 p.84. Shiio J. et al. Production of aspartic acid and lysine by citrate
synthese mutants of Brevibacterium flavum / J. Shiio, H. Ozaki, K. Ujigawa-
Takeda // Agr. Biol. Chem. — 1982. — Vol. 46, N 1. — P. 101—107.85. S t a m H. et al. Depression of nitrogenase in chemostat cultures of
the fast growing Rhizobium leguminosarum / H. Stam, H. W. van Verseveld,
A. H. Stouthamer // Arch. Microbiol. — 1983. — Vol. 135. — P. 199—204.86. Stock J. Mechanisms of reception function and the molecular bio¬
logy of information processing in bacteria // Bio Essays. — 1987. — Vol. 6. —
P. 199—203.87. Stouthamer A. H. Towards an integration of various aspects of
microbial metabolism: energy generation, protein synthesis and regulation //
Proc. 3rd Eur. Congr. on Biotechnology. — Munchen: Verlag-Chemie; Wein¬
heim, 1984. — Vol. 4. — P. 223—239.
348Список литературы88. Tempest D. W., Neijssel О. M. Overflow metabolism in aerobic
microorganisms // Biochem. Soc. Trans. — 1979. — Vol. 7. — P. 82—85.89. Tempest D. W, Wouters J. Т. M. Properties and performance
of microorganisms in chemostat culture // Enzyme Microb. Technol. —1981. — Vol. 3. — P. 283—290.90. T о s a k а О., T a k i n a m i K. Lysine // Biotechnology of amino
acid production / Ed. by K. Aida et al. — Progress in industrial, microbio¬
logy. — Amsterdam etc., 1986. — Vol. 24. — P. 152—172.91. Uhlenbusch ,1., Sprenger G., Sahm H. Transfer of the alanine
dehydrogenase gene in Zymomonas mobilis for alanine production // Abstr.
8th Intern. Biotechnol. Symp. — Paris, 1988. — P. 103.92. Van V e r s e v e 1 d H. W. et al. Continuous culture of bacteria with
biomass retention / H. W. Van Verseveld, M. Arbridge, W. R. Chesbro //
Trends Biotechnol. — 1984. — Vol. 2, N 1. — P. 8—12.93. W e i t z m a n P. D. J. Unity and diversity in some bacterial citric
acid-cycle enzymes // Advances in microbial physiology / Ed. by A. H. Rose,
J. G. Morris. — London etc.: Acad. Press, 1981. — Vol. 22. — P. 185—244.94. Wiegel J. Formation of ethanol by bacteria. A pledge for the use
of extreme thermophylic anaerobic bacteria in industrial ethanol fermentation
process // Experientia. — 1980. — Vol. 36, N 12. — P. 1434—1446.95. Yerushalmi L. et al. Fermentation process diagnosis usieg a
mathematical model / L. Yerushalmi, B. Volesky, J. Votruba // Appl. Micro¬
biol. Biotechnol. — 1988. — Vol. 29, N 2/3. — P. 186—197.К ГЛАВЕ 41. Б а б у p и н Л. А., Швинка Ю. Э. Ответная реакция хсмостатной
культуры микроорганизмов при малых возмущениях // Микробный синтез
ферментов и получение их препаративных форм. — Рига: Зинатне, 1983. —
С. 78—89.2. Б и р ю к о в В. В., К а н т е р е В. М. Оптимизация периодических
процессов микробного синтеза. — М.: Наука, 1985. — 292 с.3. Бортников И. И, Босенко А. М. Машины и аппараты микро¬
биологических производств. — Минск, 1982. — 287 с.4. Быков В. А, Винаров А. Ю., Шерстобитов В. В. Расчет
процессов микробиологических производств. — Киев: Техника, 1985. — 246 с.5. Виестур У. Э., Крист а пеон с М. Ж., Былин кин а Е. С.
Культивирование микроорганизмов. — М., 1980. — 232 с.6. Виестур У. Э., Кузнецов А. М., Савенков В. В. Системы
ферментации. — Рига: Зинатне, 1986. — 368 с.7. Виестур У. Э., Шмите И. А., Жилевич А. В. Биотехнология:
биологические агенты, технология, аппаратура. — Рига: Зинатне, 1987. —
263 с.8. Г а п о н о в К. П., Ч у г а с о в а В. А., Познякова В. М. Кисло¬
род в ферментационных процессах. — М.: ОНТИТЭИмикробиопром, 1984. —
37 с.9. Голдовский А. М. Промежуточные состояния между анабиозом
и жизнедеятельностью — мезабиоз // Анабиоз и преданабиоз микроорганиз¬
мов. — Рига: Зинатне, 1973. — С. 23—30.10. Д у б р о в с к и й В. С, Виестур У. Э. Метановое сбраживание
сельскохозяйственных отходов. — Рига: Зинатне, 1988. — 204 с.11. Калунянц К- А., Голгер Л. И., Балашов В. Е. Оборудова¬
ние микробиологических производств. — М.: Агропромиздат, 1987. — 399 с.12. Кристапсон М. Ж., Хабибулин Р. Э. Принципы измерения
окислительно-восстановительного потенциала в биотехнологии микробного
синтеза: Обзорная информация. — М.: ВНИИСЭНТИ, 1985. — С. 36.
И главе 434913. Левитан Е. С., Виестур У. Э., Дундуре Д. П. Тепловой
автомат пеногашения // Автоматизация микробиологических процессов. —
Рига: Зинатне, 1982. — С. 70—79.14. Л оз и нов А. Б. Влияние концентрации кислорода в среде на рост
и окислительный обмен веществ микроорганизмов // Проблемы биохимии и
физиологии микроорганизмов. — Пущино, 1985. — С. 13—25.15. Рикманис М. А., В а н а г «с Ю. Я., Виестур У. Э. Определе¬
ние показателей перемешивания среды в биореакторах // Биотехнология. —1987. — № 1. — С. 70—78.16. Сел га С. Э. и др. Анализ процесса биосинтеза L-лизина и испы¬
тание ферментаторов балансовым методом / С. Э. Селга, Г. Р. Межиня,А. А. Лацар, У. Э. Виестур // Микробные биомассы и их метаболиты. —
Рига: Зинатне, 1972. — С. 21—30.17. Селга С. Э. и др. Изучение процесса массопередачи по кислороду
в различных условиях турбулизации среды / С. Э. Селга, И. Я. Краузе,
У. Э. Виестур и др. // Управляемый микробный синтез. — Рига: Зинатне,
1973. — С. 25—37.18. Соколов В. Н., Я блоков а М. А. Аппаратура микробиологи¬
ческой промышленности. — Л.: Машиностроение, 1988. — 278 с.19. Afschar A., Schaller К., Schiigerl К. Continuous production
of acetone and butanol with shear-activated Clostridium acetobutylicum I j
Appl. Microbiol. Biotechnol. — 1986. — Vol. 23, N 5. — P. 315—321.20. Armiger W. B. Instrumentation for monitoring and controlling
bioreactors // Comprehensive Biotechnology / Ed. by M. Moo-Young. — Oxford:
Pergamon Press, 1985. — Vol. 2. — P. 133—148.21. Baburin L. A., Shvinka J. E., Viesturs U. E. Equilibrium
oxygen concentration in fermentation fluids // Eur. J. Appl. Microbiol. Bio¬
technol. — 1981. — Vol. 13, N 1. — P. 15—18.22. В г о n n e n m e i e г., M a r k 1 H. Hydrodynamic stress capacity of
microorganisms // Biotechnol. Bioeng. — 1982. — Vol. 24, N 3. — P. 553—578.23. В u 11 D. N. Instrumentation for fermentation process control //
Comprehensive Biotechnology / Ed. by M. Moo-Young. — Oxford: Pergamon
Press, 1985. — Vol. 2. — P. 149—163.24. Catalogue Biotechnology. ACHEMA 88. — Frankfurt-am-Main: Deche-
ma, 1988. — 111 S.25. Clarke D. J. et al. Sensors for bioreactor monitoring and control
a perspective // J. Biotechnol. — 1984. — Vol. 1. — P. 135—158.26. Cooney C. L., W a n g D. I. С., M a t e 1 e s R. I. Measurement of
heat evolution and correlation with oxygen consumption during microbial
growth // Biotechnol. Bioeng. — 1968. — Vol. 11. — P. 269—281,27. Crueger W., Crueger A. Biotechnology: a textbook of industrial
jnicrobiology. — Sci. Techn., 1984. — 308 p.28. D a h о d S. K. Redox potential as a better substitute for dissolved
oxygen in fermentation process control // Biotechnol. Bioeng. — 1982. —
Vol. 24. — P. 2123—2125.29. D о e 11 e H. W., Ewings K. N., Hollywood N. W. Regulation
of glucose metabolism in bacterial systems // Adv. Biochem. Eng. — 1983. —
Vol. 23. - P. 1-25.30. Esbroeck van H., Schram E., Vereecken J. An automatic
ATP monitor for activated sludge characterization // J. Chem. Techn. Bio¬
technol. — 1984. — Vol. 34 B, N 2. — P. 76—86.31. Esener A. A. An engineering study of bacterial kinetics and
energetics. Ph. D. thesis. — Delft: Univ. Press, 1987. — 126 p.32. F i e с h t e г A. Physical and chemical parameters of microbial
growth // Adv. Biochem. Eng. Biotechnol. — 1984. — Vol. 30. — P. 7—60.33. Genetic engineering / Ed. by R. Williamson. — London etc.: Acad.
Press, 1983. — Vol. 4. — 185 p.
350Список литературы:34. G е г v a i s P. Development of a sensor allowing the continuous
measurement of the water activity value of a liquid medium // Biotechnol.
Techn. — 1987. — Vol. 1, N 1. — P. 15—18.35. Gottwald М., Gottschalk G. The internal pH of Clostridium
actobutylicum and its effect on the shift from acid to solvent formation //
Arch. Microbiol. — 1985. — Vol. 143. — P. 42—46.36. Kristiansen B. Instrumentation // Basic biotechnology / Ed. by
J. Bu’Lock. B. Kristiansen. — London: Acad. Press, 1987. — P. 253—281.37. Levitan J. S., V i e s t u г s U. E., К r i s t a p s о n s M. Z. et al.
Automatisiertes Laborfermentorsystem mit Mikrorechner «Elektronica-бО» ge-
koppelt // Acta Biotechnol. — 1987. — Vol. 7, N 6. — P. 515—519.38. Lindquist S. The heat-shock response // Ann. Rev. Biochem. —1986. — Vol. 55. - P. 1151-1191.39. Lowe C. R. An introduction to the concepts and technology of bio¬
sensors // Biosensors. — 1985. — Vol. 1, N 1. — P. 3—16.40. Markl H., Bronnenmeier R. Mechanical stress and microbial
production // Biotechnology. — Weinheim, 1985. — Vol. 2. — P. 359—392.41. Meyer H.-R., Kappeli O., Fiechter A. Growth control in
microbial cultures // Ann. Rev. Microbiol. — 1985. — Vol. 39. — P. 299—319.42. Mixing in bioreactors. Proc. Microsymp., Pavia, Italy, May 24—26,1988. The Fluid Engineering Centre. — Cranfield; Bedford, 1988. —
P. 435-479.43. О n k e n U., В u с h h о 1 z R., S i 11 i g W. Measurement and instru¬
mentation // Biotechnology / Ed. by H. J. Rehm, G. Reed. — Weinheim,.1985. - Vol. 2. — P. 763-786.44. P a d a n E. Adaptation of bacteria to external pH // Current per¬
spectives in microbial ecology / Ed. by H. J. Klug, C. A. Reddy. — Washington::
Amer. Soc. Microbiol., 1984. — P. 49—55.45. Prokopenko V. D„ Viesturs U. E. Development of the design
of fermenters with energy introduced by aerating gas, having contact devices//
Acta Biotechnol. — 1986. — Vol. 6, N 4. — P. 325—338.46. Ren gp ip at S., Lowe S. E., Zeikus J. G. Effect of extreme
salt concentrations on the physiology and biochemistry of Halobacteroides
acetoethylicus // J. Bacteriol. — 1988. — Vol. 170, N 7. — P. 3065—3071.47. Rose A. H. Osmotic stress and microbial survival // The survival
of vegetative microbes / Ed. by T. R. G. Grow, J. R. Postgate. — Cambridge:
Univ. Press, 1976. — P. 155—182.48. R u k 1 i s h a M. et al. Coordination of energy and carbon metabolism
in lysine producing Brevibacterium flavum // Biotechnol. Letters. — 1981. —
Vol. 3, N 9. — P. 465-470.49. Shvinka J., Viesturs U., Ruklisha M. Yield regulation of
lysine biosynthesis in Brevibacterium flavum j I Biotechnol. Bioeng. — 1980. —
Vol. 22. — P. 897—912.50. Sikyta B. Methods in industrial microbiology. — Ellis Horwood,1985. — 304 p.51. Stanbury P. F., Whitaker A. Principles of fermentation techno¬
logy. — Oxford: Pergamon Press, 1984. — 255 p.52. U h 1 i n В. E., M о 1 i n S., G u s t a f s s о n P., Nordstrom K.
Plasmids with temperature dependent copy number for amplification of cloned
genes and their products // Gene. — 1979. — Vol. 6. — P. 91—106.53. Ujcova E., Fenzl Z., Musilkova М., Seichert L. Depen¬
dence of release of nucleotides from fungi on fermentor turbine spee d //
Biotechnol. Bioeng. — 1980. — Vol. 22, N 2. — P. 237—241.54. V a n a g s J., R i k m a n i s М., Uschkans E., Viesturs U. Bio-
rcakloren mil glcichmjissigor Vorteilung von eingefuhrter Energie // 4. Hei-
ligenstadter Kolloqium Wissenschaftliche Gerate fur die Biotechnologie. Hei-
ligerisladt, 24—27. October, 1988. I Iriligenstadt, 1989.
И главе 535155. Viesturs U. Е., К г i s t а р s о n s М. Z., L e v i t a n s М. E. Foam
in microbiological processes // Advances in biochemical engineering. — Heidel¬
berg, 1982. — Vol. 21. — P. 169—224.К ГЛАВЕ 51. Ape P. Ю., Виестур У. Э. Получение микробных метаболитов. —
М.: ОНТИТЭИмикробиопром, 1979. — 68 с.2. Б е к е р М. Е., Д а м б е р г Б. Э., Р а п о п о р т А. И. Анабиоз микро¬
организмов. — Рига: Зинатне, 1981. — 279 с.3. Виестур У. Э., Шмите И. А., Жилевич А. В. Биотехнология*:
биологические агенты, технология, аппаратура. — Рига: Зинатне, 1987. —
263 с.4. Г а в р и л о в а Н. Н. Основы биотехнологии получения микробных
препаратов // Технология получения продуктов микробиологического син¬
теза. — Алма-Ата: Наука, 1983. — С. 24—35.5. Калунянц К. А., Голгер Л. И., Балашов В. Е. Оборудова¬
ние микробиологических производств. — М.: Агропромиздат, 1987. — 398 с.6. Лаукевиц Я. Я., Смирнов Г. Г, Виестур У. Э. Микробио¬
логические концентраты. — Рига: Зинатне, 1982. — 280 с.7. Муромцев Г. С., Черняева И. И. Использование микробиоло¬
гических факторов для защиты растений от корневых инфекций // Вестник
сельскохозяйственной науки. — 1988. — № 7. — С. 29—35.8. С м и р и о в Г. Г., Виестур У. Э. Двухстадийный процесс грану¬
лирования и сушки микробиологических концентратов на примере кормового
концентрата лизина с использованием пористых дисперсных носителей //
Биотехнология и биотехника. — София, 1986. — № 5. — С. 14—18.9. Торможение жизнедеятельности клеток / Под ред. М. Е. Бекера. —
Рига: Зинатне, 1987. — 240 с.10. Тутов а Э. Г., Идельчик М. С. Консервация микробиологических
препаратов и штаммов-продуцентов. — М.: ВНИИСЭНТИ, 1986. — 85 с.11. Т у т о в а Э. Г., Куц П. С. Сушка продуктов микробиологического
производства. — М.: Агропромиздат, 1987. — 304 с.12. Черменский Д. Н. Биологические средства защиты растений:
современные тенденции и перспективы // Бюл. ВНИИ сельскохозяйственной
микробиологии. — 1987. — № 47. — С. 35—37.13. Basic biotechnology / Ed. by J. Bu’Lock. — Acad Press, 1987. —
561 p.14. Bowden C. P. Primary solid-liquid separation // World Biotechnol.
Rep. — 1984. — Vol. 2. — P. 139—172.15. Deacon J. W. Biocontrol of soil-borne plant pathogens with intro¬
duced inocula // Phil. Trans. Roy. Soc. — London, 1988. — Vol. В 318,
N 1198. — P. 249—263.16. Kula M. Recovery operations // Biotechnology / Ed. by H. Rehm,
G. Reed. — Weinheim, 1985. — Vol. 2. — P. 725—760.17. Smirnov G. G., Viesturs U. E. Physico-mechanical properties
of some agricultural by-products (Carriers for hygroscopic feed mixtures) //
Physical properties of agricultural materials and their influence on design and
performance of agricultural machines and technologies. 3rd Intern. Conf.
Prague, Czechoslovakia, August 19—23, 1985. — Washington etc.: Hemisphere
Publ. Co., 1987. — P. 305—310.К ГЛА5Г: 6! А пейте А. Ф., Межиня Г. P., Осе В. П. Продуценты L-лизина
из родя Brevibacterium. — Рига: Зинатне, 1978. — 171 с.
352Список литературы2. Аре Р. Ю., Лаукевиц Я. Я., Виестур У. Э. Микробные кон¬
центраты, их свойства и применение // Изв. АН ЛатвССР. — 1980.—№9.—
С. 113—126.3. Б а б у р и н Л. А., Швинка Ю. Э. Пути распределения потреблен¬
ного кислорода у микроорганизмов // Автоматизация микробиологических
процессов. — Рига: Зинатне, 1982. — С. 61—69.4. Бекер М. Е. Обезвоживание микробной биомассы и экстрацеллю-
лярных метаболитов. — Рига: Зинатне, 1967. —< 361 с.5. Б у р ь я н о в А. Ю. Проблемы и перспективы использования векто¬
ров на основе Ti-плазмид Agrobacterium tumefaciens для генетической инже¬
нерии растений // Биотехнология. — 1985. — № 2. — С. 67—74.6. Виестур У. Э., Шмите И. А., Жилевич А. В. Биотехцшюгия:
биологические агенты, технология, аппаратура. — Рига: Зинатне, 1987. —
263 с.7. Влияние аэрации на метаболизм Zymomonas mobilis / Л. М. Панкова,
Ю. Э. Швинка, М. Е. Бекер, Э. Э. Слава // Микробиология. — 1985. —
Т. 54, вып. 1. — С. 141—145.8. Г а л ы н и н а Н. И., Швинка Ю. Э., Тома М. К. Увеличение
скорости образования супероксидных радикалов при разобщении фосфори¬
лирования в мембранах бактерий // Влияние услознй культивирования на
активность продуцентов. — Рига: Зинатне, 1980. — С. 47—52.9. Головлев Е. Л. Биология сапрофитных микобактерий : Авто-
реф. дис. ... д-ра биол. наук. — Пущино, 1983. — 37 с.10. Дебабо в В. Г., Гордон И. О., Серегин В. И. Генная инже¬
нерия и производство биологически активных веществ. — М.: ОНТИТЭИмик-
робиопром, 1982. — 40 с.11. Дебабов В. Г., Лившиц В. А. Современные методы создания
промышленных штаммов микроорганизмов. — М.: Высшая школа, 1988. —
208 с.12. Д у б р о в с к и й В. С., Виестур У. Э. Метановое сбраживание
сельскохозяйственных отходов. — Рига: Зинатне, 1988. — 204 с.13. Изучение стабильности нормальных, аномальных и генно-инженер¬
ных белков в штаммах Escherichia coli, дефицитных по внутриклеточной
протеиназе La — продукте гена Ion / А. С. Рыжавская, Н. В. Кайдалова,
Ю. М. Анухин и др. // Молекулярная биология. — 1988. — Т. 22, вып. 1. —
С. 201—208.14. Использование принципов координированной регуляции активности
ферментов транспорта и метаболизма глюкозы при направленном биосинтезе
лизина / М. П. Руклиш, У. Э. Виестур, А. К. Ялынска, Д. В. Рсйнхолде //
Изв. АН ЛатвССР. — 1988. — № 9 (494). — С. 126—129.15. Калнениекс У. 3. Изучение энергетических затрат поддержания
ионных градиентов у бактерий : Авторсф. дис. ... канд. биол. наук. —
Рига, 1988. — 20 с.16. Калнениекс У. 3., Панкова Л. М., Швинка Ю. Э. Протон-
движущая сила у бактерий Zymomonas mobilis // Биохимия. — 1987. —
Т. 52, вып. 5. — С. 720—723.17. Калнениекс У. 3., Тома М. К., Швинка Ю. Э. Влияние пен-
тахлорфенола на протондвижущую силу, потребление кислорода и Непроницае¬
мость мембран у Brevibacterium flavum // Изв. АН ЛатвССР. — 1985. —
№ 11. — С. 72—76.18. Котова Г. А., Волкова М. В. Успехи в области производства
и применения аминокислот. — М.: ОНТИТЭИмикробиопром, 1983. — 48 с.19. Крики с В. В. Ферментатор с неподвижными контактными устрой¬
ствами для биосинтеза лизина : Автореф. дис. ... канд. техн. наук. —
Рига, 1984. — 21 с.20. Л а у к е в и ц Я. Я., Смирнов Г. Г., Виестур У. Э. Микробио¬
логические концентраты. — Рига: Зинатне, 1982. — 280 с.
К главе 6 35321. Особенности функционирования цикла трикарбоновых кислот у
Brevibacterium flavum и Micrococcus glutamicus / М. П. Руклиш, М. Э. Дунце,B. А. Леване, Р. В. Калниня // Микробиология. — 1987. — Т. 56, вып. 5. —C. 759-763.22. Панкова Л. М. Исследование метаболизма углеводов и энергети¬
ческого метаболизма у Zymomonas mobilis 113 : Автореф. дис. ... канд.
биол. наук. — М., 1986. — 21 с.23. Пути интенсификации микробиологического синтеза лизина /
М. Е. Бекер, Ю. Э. Швинка, Г. К. Лиепиньш и др. // Изв. АН ЛатвССР. —1988. — Jsi'b 8. — С. 43—51.24. Руклиш М. П., Швинка Ю. Э., Виестур У. Э. Биотехнология
регуляции метаболизма бактериальных продуцентов, ее биоинженерное осу¬
ществление II Биотехнология и биотехника. — 1987. — № 4. — С. 3—15.* 25. С а с с он А. Биотехнология: свершения и надежды. — М.: Мир,1987. — 410 с.26. С е л г а С. Э., Бекер М. Е. Оценка процесса биосинтеза лизина
продуцентом Brevibacterium sp. 22 // Микробные биомассы и их метабо¬
литы. — Рига: Зинатне, 1972. — С. 31—38.27. Усовершенствование промышленной технологии получения лизина /
А. А. Лацарс, А. К. Седвалд, В. В. Савенков и др. // Изв. АН ЛатвССР. —1982. — № 8. — С. 83—92.28. Цианидрезистентное потребление кислорода у лизинсинтезирующих
бактерий Brevibacterium flavum 22ЛД / М. К. Тома, Ю. Э. Швинка,
М. П. Руклиш и др. // Прикладная биохимия и микробиология. — 1984. —
Т. 20, вып. 1. — С. 95—100.29. Ш в и н к а Ю. Э., Панкова Л. М. Нетрадиционные пути биокон¬
версии растительных углеводов в этанол // Трансформация продуктов фото¬
синтеза. — Рига: Зинатне, 1984. — С. 26—48.30. Ш в и н к а Ю. Э. Физиологические и биотехнологические аспекты
регуляции выхода продуктов, синтезируемых микроорганизмами // Изв. АН
ЛатвССР. — 1984. — № 10. — С. 56—71.31. Швинка Ю. Э. Экономичность энергетического метаболизма гете¬
ротрофных микроорганизмов // Биотехнология микробного синтеза. — Рига:
Зинатне, 1980. — С. 70—91.32. Шкагале Л. Б., Далка Р. Б., Уровский Г. А. Селекция
штаммов — продуцентов лизина // Микробиологическая промышленность. —
1979. — № 3. — С. 10—12.33. Щелкунов С. Н. Конструирование гибридных молекул ДНК. —
Новосибирск: Наука, 1987. — 168 с.34. A i b a S., Tsunekawa Н., Imanaka I. New approach to
tryptophan production by Escherichia coli: Genetic manipulation of composite
plasmids in vitro // Appl. Environm. Microbiol. — 1982. — Vol. 43. —
P. 389—397.35. Baratti J., Varma R., Bu’Lock J. D. High productivity etha¬
nol fermentation on a mineral medium using a flocculent strain of Zymomonas
mobilis // Biotechnol. Letters. — 1986. — Vol. 8. — P. 175—180.36. Belaich J. P., Belaich A., Simonpietri P. Uncoupling of
bacterial growth: effect of pantothenate starvation on growth of Zymomonas
mobilis II J. Gen. Microbiol. — 1972. — Vol. 70, N 2. — P. 179—185.37. В r i n g e г S., Finn R. K., S a h m H. Effect of oxygen on the
metabolism of Zymomonas mobilis // Arch. Microbiol. — 1984. — Vol. 139,
N 4. — P. 376—381.38. Bringer S, Sahm H., Swyzen W. Ethanol production by
Zymomonas mobilis and its application on an industrial scale // Biotechnol.
Bioeng. Symp. — 1984. — N 14. — P. 311—319.39. В r i n g e r - M e у e г S., S с о 11 a г М., Sahm H. Zymomonas mo¬
bilis mutants blocked in fructose utilization // Appl. Microbiol. Biotechnol. —1985. — Vol. 23. — P. 134—139.23 — 361
354Список литературы40. Buchholz S. Е., Dooley М. М., Eveleigh D. Е. Zymomo¬
nas — an alcoholic enigma // Trends Biotechnol. — 1987. — Vol. 5, N 7. —
P. 199—204.41. Buchholz S. E., Dooley М. М., Eveleigh D. E. Growth of
Zymomonas on lactose: gene cloning in combination with mutagenesis // J.
Ind. Microbiol. — 1989. — Vol. 4, N 1. — P. 19—27.42. Carr J. G. The genus Zymomonas // The Prokaryotes. — Berlin etc.:
Springer Verl., 1981. — Vol. 2. — P. 1349—1354.43. Chew L. С. К., T а с о n W. C. A., Cole J. A. Effect of growth
conditions on the rate and loss of the plasmid pAT 153 from continuous
cultures of. Escherichia coli HB101 // FEMS Microbiol. Letters. — 1988. —
Vol. 56, N 1. — P. 101—104.44. Chopra J., Howe T. G. B. Bacterial resistance to the tetra¬
cyclines // Microbiol. Rev. — 1978. — Vol4. 42. — P. 707—724.45. Continuous cultivation of L-lysine-producing bacteria: biochemical and
physiological aspects // Continuous culture / Ed. by P. Kyslik, E. Dawes. —
London: Acad. Press Inc., 1987. — P. 119—126.46. Coordination of energy and carbon metabolism in lysine producing
Brevibacterium strains / M. Ruklisha, O. Marauska, J. Shvinka et al. // Bio¬
technol. Letters. — 1981. — Vol. 3. — P. 465—470.47. Doelle H. W., Greenfield P. F. Fermentation pattern of Zymo¬
monas mobilis at high sucrose concentrations 11 Appl. Microbiol. Biotechnol. —1985. — Vol. 22. — P. 411—415.48. E 1 d i b I. A., V a 1 e n t i G. Balancing market, technology, plant
design: lvsine and tryptophan production // Biotechnology. — 1985. —
Vol. 3. — P. 425—426.49. Enei H., Hirose Y. Recent research on the development of micro¬
bial strains for amino acid production / Ed. by G. E. Russell // Biotechno¬
logy and genetic engineering reviews. —• New York: Intercept Press, 1984. —
Vol. 2. — P. 101—120.50. Erickson L. E., Selga S. E., V i e s t u r s U. E. Application of
mass and energy balance regularities to product formation // Biotechnol.
Bioeng. — 1978. — Vol. 20, N 10. — P. 1623—1638.51. Ethanol production by Zymomonas mobilis / P. L. Rogers K. J. Lee.,
M. L. Skotnicki, D. E. Tribe // Adv. Biochem. Eng. — 1982. — Vol. 23. —
P. 37—84.52. F i e s с h k о J., R i t с h T. Production of human alpha consensus
interferon in recombinant Escherichia coli // Chem. Eng. Commun. — 1986. —
Vol. 45. — P. 229—240.53. Gaertner FM I<im L. Current applied recombinant DNA pro¬
jects // Trends Biotechnol. — 1988. — Vol. 6, N 4. — P. 54—57.54. Gas balance method for testing of microbial growth efficiency after
carbon substrate pulse / L. A. Baburin, J. E. Shvinka, M. P. Ruklisha,
U. E. Viesturs // Acta Biotechnol. — 1986. — Vol. 6, N 2. — P. 123—128.55. H a 11 e w e 11 R. A., E m t a g e S. Plasmid vectors containing the
tryptophan operon promoter suitable for efficient cegulated expression of
foreign genes // Gene. — 1980. — Vol. 9. — P. 27—47.56. I m a n a k a Т., A i b a S. A perspective on the application of genetic
engineering: Stability of recombinant plasmid // Ann. N. Y. Acad. Sci. —1981. — P. 1—14.57. J i n - H о S e o, Bailey J. E. Effects of recombinant plasmid
content on growth properties and cloned gene product formation in Escherichia
coli // Biotechnol. Bioeng. — 1985. — Vol. 27. — P. 1668—1674.58. Kane J. F., Hartley D. L. Formation of recombinant protein
inclusion bodies in Escherichia coli // Trends Biotechnol. — 1988. — Vol. 6,
N 5. — P. 95—101.
К главе 635559. Kim S. Н., R и у D. D. Y. Instability kinetics of trp operon plasmid
Col El-trp in recombinant Escherichia coli MVl2 (pVH5) and MV 12 trp R
(pVH5) // Biotechnol. Bioeng. — 1984. — Vol. 26. — P. 497—502.60. К о u f m a n n W, Bauer K. Levan compositions as blood substi¬
tutes. Pat. 1011578 (FRG) 1957.61. Krieg N. R., Holt J. G. Bergey’s manual of systematic bacterio¬
logy- — Baltimore: Williams a. Wilkins, 1984. — Vol. 1. — P. 576—580.62. Low K. S., Rogers P. L. The macromolecular composition and
essential amino acid protiles of strains of Zymomonas mobilis Ц Appl..
Microbiol. Biotechnol. — 1984. — Vol. 19. — P. 75—78.63. L у n e s s E., D о e 11 e H. W. Levansucrase from Zymomonas mo¬
bilis // Piotechnol. Letters. — 1983. — Vol. 5. — P. 345-350.64. Maintenance and genetic stability of vector plasmids pBR 322 and
pBR 325 in Escherichia coli K12 strains grown in a chemostat / D. Noack*
M. Roth, R. Guethur et al. // Mol. Genet. — 1981. — Vol. 184. — P. 121—124.65. Maintenance of multicopy plasmid CIoDF 13 in E. coli cells: Evidence
for site-specific recombination at par В / M. J. J. Hakkaart, P. J. M. van den
Elzen, E. Veltkamp, H. J. J. Nijkamp // Cell. — 1984. — Vol. 36. —
P. 203—209.66. Maintenance of some Col E I-type plasmids in chemostat culture /
L. M. Jones, S. B. Primrose, A. Robinson, D. C. Elwood // Mol. Gen..
Genet. — 1980. — Vol. 180. — P. 579—584.67. Me acock P. A., Cohen S. N. Partitioning of bacterial plasmids
during cell division: A cis acting locus that accomplishes stable plasmid
inheritance // Cell. — 1980. — Vol. 20. — P. 529—542.68. Nakayama К., К i t a d a S., К i n о s h i t a S. Studies on lysine
fermentation. I. The control mechanism on lysine accumulation by homoserine
and threonine // J. Gen. Appl. Microbiol. — 1961. — Vol. 7. — P. 145.69. Nordstrom K. Replication of plasmid RI: Maselson-Stahl density
shift experiments revisited // Plasmid. — 1983. — Vol. 9. — P. 218—221.70. Nugent М. С., P r i m г о s e S. В., T а с о n W. С. A. The stability
of recombinant DNA // Develop. Ind. Microbiol. — 1983. — Vol. 24. —
P. 271—285.71. On-off regulation of the tryptophan promoter in feed-batch culture /S. Kawai, S. Mizutani, S. Jijima, T. Kobayashi // J. Ferment. Technol. —1986. — Vol. 64, N 6. — P. 503—510.72. Optimizing the expression in E. coli of a synthetic gene encoding
somatomeain-C (ICF-I) / G. Buell, M. F. Schulz, G. Selzer // Nucleic Acids
Research. - 1985. - Vol. 13, N 6. — P. 1923-1938.73. Pankova L. М., Shvinka J. E., Beker M. J. Regulation of
H+ balance in Zymomonas mobilis 113 during shift from anaerobic to aerobic
conditions // Appl. Microbiol. Biotechnol. — 1988. — Vol. 28. — P. 583—588.74. W о u t e r s J. Т. М., D г i e h i s F. G., P о 1 a с z e k P. J, Oppen-
гаау M. L. H. A. v a n, A n d e 1 J. G. Persistence of the pBR 322 plasmid
in Escherichia coli K12 grown in chemostat cultures // Antonie van Leeuwen-
hoeck. — 1980. — Vol. 46. — P. 353—362.75. P i r t S. J. Aerobic and anaerobic microbial digestion in waste
reclamation // J. Appl. Chem. Biotechnol. — 1978. — Vol. 28, N 4. —
P. 232—236.*76. Production of superoxide radicals during bacterial respiration /
J. E. Shvinka, М. K. Toma, N. I. Galinina et al. // J. Gen. Microbiol. —1979. - Vol. 13, N 2. — P. 377—382.77. Protonmotive force in Brevibacterium flavum: the lack of intracellular
pH homeostasis / U. Z. Kalnenieks, J. B. Saulitis, N. I. Galinina et al. //
Arch. Microbiol. — 1989. — Vol. 151. — P. 213—219.23*
356Список литературы78. R е m a n t Е., S t a n s s е n s P., F i е г s W. Plasmid vectors with
thermoinducible expression and temperature-regulated runaway replication //
Gene. — 1983. — Vol. 22. — P. 103—113.79. Rogers P. L., Chun U. H. Novel enzymatic process for sorbitol
and gluconate production // Austral. J. Biotechnol. — 1987. — Vol. 1. —
P. 51—54.80. Sahm H., В r in ger -Meу er S. Continuous ethanol production
by Zymomonas mobilis on an industrial scale // Acta Biotechnol. — 1978. —
Vol. 7, N 4. — P. 307—313.81. Shvinka J. E.f V i e s t u r s U. E., R u k 1 i s h a M. Yield regulation
of lysine biosynthesis in Brevibacterium flavum // Biotechnol. Bioeng. —1980. — Vol. 22, N 4. — P. 897—912.82. Shiio J., U j i g a w a - T a k e d a K. Regulation of phospoerolpyru-
vate carboxylase by synergistic action of aspartate and 2-oxygiutarate // Agr.
Biol. Chem. — 1979. — Vol. 43, N 12. — P. 2379—2485.83. Siegel R. S. Plasmid stability and Trp A productivity of recom¬
binant plasmids in single and two stage fermentations of Escherichia coli. —
Ann. Arbor, 1986. — 180 p.84. Simon J. L., Engasser J. М., Germain P. Substrate flux
mapping in Corynebacteria for amino acid production // Proc. 3rd Europ.
Congr. on Biotechnology. — Mtinchen; Weinheim: Verl. Chemie, 1984. —
Vol. 2. — P. 49—54.85. Steuber D., В u j a r d H. Transcription from efficient promotors
can interfere with plasmid replication and diminish expression of plasmid
specified genes // EMBO J. — 1982. — Vol. 1. — P. 1399—1404.86. Summers К. K., S h a r r a 11 D. J. Multimerization of high copy
number plasmid causes instability: Col El encodes a determinant essential for
plasmid monomerization and stability // Cell. — 1984. — Vol. 36. —
P. 1097—1103.87. Stouthamer A. H. Energetic aspects of the growth of micro¬
organisms // Microbial energetics. — Cambridge: Univ. Press, 1977. —
P. 285—315.88. Swings J., D e L e у J. The biology of Zymomonas // Bacteriol.
Rev. — 1977. — Vol. 41. — P. 1—46.89. The prospects for L-lvsine production in Australia // Food technology
in Australia. — 1986. — Vol. 38, N 12. — P. 514—518.90. T о s a k а О., T a k i n a m i K. Lysine, biotechnology of amino acid
production / Ed. by K. Aida et al. — Amsterdam: Elsevier etc., 1986. —
P. 152—172.91. Viikari L. Carbohydrate metabolism in Zymomonas // CRC Criti¬
cal Rev. Biotechnol. — 1988. — Vol. 7, issue 3. — P. 237—261.92. Viikari L., L i n k о M. Rate and yield limiting factors in con¬
tinuous fermentation of sucrose by Zymomonas mobilis j I Biotechnol. Letters. —1986. - Vol. 8. — P. 139-144.93. Zachariou М., Scopes R. K. Glucose-fructose oxidoreductase,
a new enzyme isolated from Zymomonas mobilis that is responsible for
sorbitol production // J. Bacteriol. — 1986. — Vol. 167. — P. 863—869.94. Z e i k u s J. G. Thermophilic saccharide fermentations // Ann. Rep.
Fermentation Processes. — 1982. — Vol. 5. — P. 263—289.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬАдаптация 178, 186—187
Аденозинтрифосфат
—• использование 113—*115, 136—137• оборот 106— регуляторная роль 91—93— синтез 105—107, 109, 111, 113,
115, 119—120, 147Азотфиксация 333—334
Активность воды 299
Алкалофилы 187, 266
Альтернативные
—• пути катаболизма 23, 43— пути транспорта электронов 76—
77Аминокислоты 165—167, 281—282,
285Амфиболизм 42, 92
Анаболизм 4(^-42
Анаплеротический синтез 55
Анаэробы 32, 263, 301—302, 304, 312
Ацетаткиназа 50, 60, 70
Ацетилфосфат 60—62
Ацидофилы 265Аэробы 33, 104—106, 144—145
Бактерии— анаэробные см. Анаэробы— аэробные см. Аэробы— I емолитотрофные 73— гемотрофные 73— особенности 7, 27, 78, 17Э, 188—
189Бактериоцины 173—174
Балласт 27—28
Биомассы 277—279
-■ живые 24, 278— инактивированные 278— химический состав 23
Биореакторы 208—209, 262выбор 237, 244—245— объемом 100 м3 с контактными
устройствами 247, 257— основные разработчики 208—209,
243—250— принципы создания 15, 235,237—
248— трехкорпусный с циркуляцион¬
ным насосом 240— ФГ 246— ФГЖ 242, 245— ФЖ 241, 251—254— фирмы MBR (Швейцария) 246—
250— ФУ-8 248—249— ФУ-30 249Биотехнологический процесс— стадии 17—18— эффективность 26
Биотехнология— дефиниция 5— перспективы 331—331
Биотин 284Внеклеточные продукты 279—280
Внутриклеточные продукты 279
Выход— биомассы 156—160, 186, 191, 286— продукта (коэффициент конвер¬
сии) 13, 156—160, 189, 191 —
193, 200, 286, 292, 306— энергетический 26Газоанализаторы— для 02 234— для С02 234
Гексокиназы 32, 66—67
Генетическая инженерия 166, 175—170, 331— векторы 318—319, 321
s«- конъюгация 165— методы 166, 317—321— рекомбинанты 26, 16), 164, 1/5,
264, 285, 315—316, 321, 326—
331
358Предметный указатель— реципиент 316— трансдукция 164*—165— транспозоны 165— трансформация 164, 320
Гидрогеназы 200
Гликоген 62—64Глутаминовая кислота 281—285
Глюкозодегидрогеназа 35—36, 43—44
Глюкозооксидаза 43
Глюконовая кислота 43
Гуанозин-5'-дифосфат-3'-дифосфат
(ppGpp) 132*—133, 189
Гуанозин-5'-трифосфат-3'-дифосфат
(pppGpp) 132—133, 189Диаминопимелинат-дегидрогеназа72—73Защита растений 334Измеритель интенсивности перемеши¬
вания 231*—233Ингибирование 27, 87—89, 91—94,
114—115
Индукция ферментов 95, 14,1
Интенсивность— аэрации 209—210, 213—214, 231— дыхания (Qq2 ) 203—206, 233— массопередачи (/Ср) 226— перемешивания 215—224, 231,
294Катаболизм 40
Катаболизм глюкозы 40—41— Y-аминобутиратный путь 67— гексозомонофосфатный (ГМП),
или путь Варбурга—Дикенса—
Хорекера 43, 57—58, 71— глиоксилатный шунт 54, 111, 113,
118— ГМП-окислительный 60— кетодезоксифосфоглюконатный
(КДФГП), или путь Энтнер—
Дудорова 32, 46—47, 49, 304—
305— метилглиоксалевый путь 47, 49—■ фосфокетолазный путь 32, 48—50, 55, 67— фруктозо-1,6-бисфосфатный путь,
или гликолиз, или путь Эмбде-
на—Мейэргофа—Парнаса 43, 44— цикл трикарбоновых кислот, или
цикл Кребса 43, 50—53, 55—56,
50-62, 65—67, 93—94Катаболитная репрессия 96, 99, 153
Контроль— биосинтетический 93— использования субстрата 99, 107,
10У, 125— репликации плазмид 319— роста 10/, 131—l.Vj, 140— энергетический 81
Концентрация— лимитирующая 210— оптимальная 213— рабочая 214— равновесная 236
Коринебактерии 37, 285— катаболизм глюкозы 43, 66—70,.
111— морфология 133—136— продуценты аминокислот 37,
167—171, 281—285— продуценты лизина см. Лизин— транспорт глюкозы 37—40, 111Лактат— биосинтез 44—45, 47—48, 59, 65,.
70—71, 148—149— катаболизм 70—71— транспорт 63
Леван 311—312
Лизин— биосинтез 69, 72, 145—14$, 199,
214—220, 287, 294— кормовой концентрат 299—301— продуценты 37, 167—171, 282—
284— производство 281—282— технология 193—194, 196, 205—
206, 287, 294—299Мембранный потенциал 105, 227т.
287
Метаболизм— избыточный 186— потоки 190—191, 195— регуляция 101—136— сбалансированный 180—181
Метановое брожение 18—19, 312—315Методы определения Кьа и Kvp 236— балансовый 236—237— динамический 236
Микробиологические концентраты— варианты производства 273—280»— наполнение при сушке 274— определение 275— пример производства 299—301
Микробные ассоциации 194—195
Миксотрофия 200—202
Мутанты 174—175— ауксотрофные 162, 165— селекция 162—163— с нарушенной регуляцией 161—
163, 167—168, 200
Предметный указатель359Мутации
—' индуцированные 162— механизмы образования 162—163— спонтанные 162— типы 163Нейтрофилы 266Неполное окисление субстратов 5£—
66Непродуктивные затраты энергии— дефиниция 28— классификация .28— способ определения 28—29,
197—198Нуклеиновые кислоты— взаимосвязь с ростом бактерий
131—132, 137—139— регуляция синтеза 95—96, 101,
117, 131—132Обратный эффект Пастера 119—*121,
123, 125—126, 155, 289
Общая восстанавливающая актив¬
ность клеток 129, 131, 141—143, 223
Оксалоацетат, биосинтез 56, 69, 71,
94,, 151Осмотическое давление 268—270
Ответная реакция 178—179, 204,Перемешивание— влияние на бактериальные попу¬
ляции 130— измерение 232, 240— макро- 247— микро- 232, 247— техническая реализация 262
Пермеазы 30
Пируватоксидаза 61
Плазмиды 318—320, 323—334
Подпитка 204—206
Полимеры— внеклеточные, внутриклеточные
63—64— поли-Р-гидроксибутират 64— полиглюканы 63*—64
Продуктивность— определение 14—15— способы повышения 189, 293
Продукты 273—277— вторичные 24, 182—183— первичные 182—183— связь с ростом 182—183— себестоимость 12—13— физиологическая регуляция 176—
177Прокариоты 6—7, 27, 73
Протон движуща я сил л 33, 74, 79— генерация 73— использование 7\ 78— составляющие 73
Психрофилы 263Пульт газоанализатора для опреде¬
ления интенсивности дыхания 234
pH— внутриклеточный 266-^-267— измерение 264—265— регуляторная роль 59, 177Ревертанты 175Регуляция активности ферментов— активирование субстратом или
предшественником 87— аллостерическая 87, 91— ингибирование продуктом или
его предшественником 59, 87—88— ковалентная модификация 88—89Регуляция синтеза ферментов— индукция 95—96— ослабление транскрипции 100— репрессия 95—101
Редоксоны 22
Редокс-потенциал 268
Рекомбинанты 26, 161, 164, 175, 264,285, 315—316, 334Реципиент см. Генетическая инжене¬
рия
РНК— белокоинтезирующая активность
137—* взаимосвязь с ростом 137-—139,
218, 223
Рост 180, 188— время генерации 136— лимитированный 184—186— разобщенный 180-—182, 306— регуляция 130, 136— сопряженный 180—181— удельная скорость 43, 106, 109,
131, 180, 323—324— фазы роста 133—136, 138, 141,
289Себестоимость— структура 13
Смешанные культуры 194—105
Сорбит 311Среды 180, .?7Г—?71— изм ренио физико-химических па¬
рам тров 258—261— комплекс::».’ 27— многокомпонентные 99, 117“-118,
106— 198 ?.9Г 2?3Стимуляторы пост л растений 332—ГтМ') у. '•;< : ’ 9~— Г' -о-'п ллюж-ния 85, 109—
360Предметный указатель— выживания 85, 188— конкурентоспособности 109—111,
188Субстраты 185—186— конверсия в биомассу 44, 143,
152—154— конверсия в продукт 22—23, 44,
142—144, 146—147, 151—160— контроль использования 99, 107,
109, 125Супероксид 78, 287Тенденции— организации управления биосин¬
тезом 261— развития биореакторов 261— развития биотехнологии 331—334
Теплопродукция— измерение 203, 251, 263— интерпретация 236— удельная 238
Термофилы 263
Транспорт глюкозы— методы исследования 35, 38— механизмы 30—31, 34—35— пермеазы 30— регуляция 43, 81, 84—85, 91—92, 101—104, 109, 119, 123, 125—
128— транслокация 31— у различных бактерий 32—33,35, 37—39— фосфотрансферазные системы
31—32, 35, 39— энергообеспечение 33—34, 35—36
Транспорт ионов аммония 31
Турбогипобиоз 228, 241Фаги 172Фагорезистентность 171—173
Ферменты— активный центр 87— аллостерическая регуляция 87,
91— индуцибельные 81, 84, 111— ковалентная модификация 89—90— конститутивные 81, 84— регуляторы ферментов 86, 91— регуляция активности 87, 92— регуляция синтеза 94
Фосфокластическая реакция 61—62
Фруктоза 310—311Цикл трикарбоновых кислот см. Ка¬
таболизм глюкозыЦиклический АМР (сАМР) 96—98,.
132сАМР-рецепторный белок, или САР-
белок, активирующий катаболитчув-
ствительный ген 97, 132Экологическая чистота— повышение 27— характеристики 16—17
Экспрессия 321—323
Экстремофилы 186—187
Электронно-транспортная цепь 73—77,.287Энергетический заряд 91— пути поддержания 107, 109— регуляторная роль 91, 107, 109
Энергетический метаболизм 80— непродуктивные затраты 80—81,
192— эффективность 25, 78, 287, 302
Энергия— М2? введенная газом 253—254
/v2m введенная мешалкой 253,
258— N2П — введенная механическим
пеногасителем 253-^254, 258— распределение 250— стабилизация в реакторе 13, 250,
255— удельные затраты 15—16, 242
Эпифиты 332—333Этанол 302—304, 306—310
Эффект Кребтри 111—114, 125, 155
Эффект Пастера 121
ОГЛАВЛЕНИЕПредисловие ... 5Основные условные обозначения 9Глава 1. Основные критерии оценки биотехнологических процессов 111.1. Себестоимость продукции 121.2. Продуктивность 141.3. Удельные энергозатраты 151.4. Экологическая чистота 161.5. Выход продукта по массе и энергии 201.6. Конечная концентрация продукта 261.7. Наличие балластных веществ в среде культивирования ... 271.8. Непродуктивные затраты субстрата и энергии в процессах бак¬
териального синтеза 28Глава 2. Биохимические основы регуляции эффективности бактери¬
ального синтеза 302.1. Альтернативные системы транспорта субстратов 302.1.1. Диффузия 312.1.2. Активный транспорт при помощи групповой транслокации 312.1.3. Активный транспорт без химической модификации субстрата 332.1.4. Системы транспорта глюкозы у коринебактерий .... 372.2. Пути катаболизма субстратов у бактерий 402.2.1. Гликолиз 442.2.2. Цикл трикарбоновых кислот 502.2.3. Гексозомонофосфатный путь 572.2.4. Неполное окисление глюкозы 592.2.5. Катаболизм глюкозы у коринебактерий 662.3. Электронно-транспортные системы 732.3.1. Возникновение протондвижущей силы 732.3.2. Энергетическая эффективность энерготрансдуцирующих систем 782.4. Регуляция транспорта субстратов и ферментов 812.4.1. Конститутивные и индуцибельные ферменты 812.4.2. Механизмы изменения активности ферментов 862.4.3. Регуляция синтеза ферментов 942.5. Регуляция энергетического и конструктивного метаболизма . . 1012.5.1. Координация активности ферментов и скорости потребления
субстратов 1012.5.2. Координация скоростей катаболизма субстратов и их потреб¬
ления клетками в условиях избыточного продуцирования АТР 1092.5.3. Особенности катаболизма энергетического субстрата в усло¬
виях недостаточного продуцирования АТР . . t . 119
to to362Оглавление2.5.4. Механизмы, координирующие энергетический и конструктив¬
ный метаболизм 124.6. Регуляция скорости роста клеток 136-.7. Изменение величины конверсии субстратов в продукт при бак¬
териальном синтезе 142Глава 3. Генетические и физиологические основы регуляции бакте¬
риального синтеза 1613.1. Генетические основы регуляции бактериального синтеза . . 1613.1.1. Сверхсинтез продуктов у бактерий с измененным генотипом 161>3.1.1.1. Методы мутагенеза и селекции 1613.1.1.2. Получение бактерий-сверхпродуцентов методом генетиче¬
ской инженерии 163'3.1.1.3. Синтез продуктов у ауксотрофов и мутантов с изменен¬
ной генетической регуляцией 165*3.1.2. Получение штаммов, устойчивых к фагам и бактерицидным
веществам 171:3.1.3. Стабильность генетических свойств мутантов и рекомбинантов 1743.1.4. Перспективы повышения синтеза продуктов методом гене¬
тической инженерии 1753.2. Физиологическая регуляция бактериального синтеза . . . 1763.2.1. Механизмы ответной реакции популяции на изменения среды 1783.2.2. Характеристики физиологического состояния культуры . . 1803.2.2.1. Растущие и нерастущие культуры. Разобщенный рост 1803.2.2.2. Лимитирование роста питательными веществами. Избы¬
точный метаболизм 1843.2.2.3. Адаптация к определенным условиям среды. Экстремофилы 1863.2.2.4. Стратегия развития и типы питания популяций . . . 1873.3. Физиологические пути увеличения эффективности бактериального
синтеза 189<3.3.1. Уменьшение «лишнего» метаболического потока . . . . 1913.3.2. Восполнение недостающих метаболических цотоков . . . 1953.3.3. Увеличение выхода лизина у Вг. flavum при одновременном
использовании двух источников углерода 1963.3.4. Увеличение выхода биомассы и лизина на основе миксотро-фии у Br. flavum . . . 2003.4. Управление процессом путем изменения физиологической актив¬
ности продуцента 2033.4.1. Выбор основного параметра управления 2033.4.2. Интерпретация параметра «скорость потребления кислорода» 2033.4.3. Определение дозы, момента и продолжительности подпитки 204Глава 4. Инженерное осуществление биотехнологий ..... 2074.1. Влияние лимитирующих концентраций субстратов на процессы
культивирования 2104.1.1. Концентрация субстрата в различных условиях перемешива¬
ния и скорость его потребления 2114.1.2. Рост и синтезирующая активность продуцентов лизина . . . 2144.1.3. Биохимические реакции Brevibacterium flavum .... 2204.1.4. Турбогипобиоз микробных популяций 2284.2. Идентификация условий аэрации и перемешивания .... 2314.3. Выбор конструкции биореакторов 2374.3.1. Лабораторная ФУ-8А и пилотная ФУ-ЗОВ установки . . . 2484.3.2. Лабораторная ферментационная установка швейцарской
фирмы «MBR» 2494.4. Стабилизация и распределение введенной в биореактор энергии 2504.5. Измерение и контроль физико-химически* параметров среды 258
Оглавление363Глава 5. Получение продуктов микробного синтеза . . 2735.1. Микробиологические концентраты 2735.2. Биомасса 2775.3. Получение внутриклеточных продуктов 2795.4. Получение внеклеточных продуктов бактериального синтеза . . 279Глава 6. Примеры биотехнологий в экспериментальных и производ¬
ственных условиях 2816.1. Производство лизина и других аминокислот . . . . . . 2816.1.1. Продуценты лизина и других аминокислот 2826.1.2. Энергетика биосинтеза лизина 2856.1.3. Биохимия продуцентов лизина 2876.1.4. Получение лизина 2966.1.5. Получение кормового концентрата лизина 2996.2. Биотехнология анаэробных процессов 3016.2.1. Получение этанола и других продуктов с помощью бакте¬
рий Z. mobilis 3026.2.2. Метановое сбраживание отходов 3126.3. Особенности биотехнологии на основе рекомбинантных культур 3156.3.1. Выбор микроорганизма-реципиента рекомбинантной ДНК 3166.3.2. Получение генов фрагментов ДНК 3176.3.3. Введение ДНК в бактериальные клетки 3186.3.4. Экспрессия рекомбинантных ДНК в бактериях .... 3216.3.5. Влияние плазмид на рост клеток-хозяев 3236.3.6. Влияние условий культивирования на стабильность плазмид
и биосинтетическую активность рекомбинантных штаммов
бактерий 3266.4. Успехи и перспективы использования бактерий в биотехнологии 331Список литературы . . ...... . 335Предметный указатель 357
CONTENTSFeroword 5-Chapter 1. Basic criteria for evaluating biotechnological processes . 111.1. Production cost of the products . . 121.2. Productivity 141.3. Specific power inputs 151.4. Ecological cleanness 161.5. Product mass and energy yields 201.6. Final concentration of the product 261.7. Presence of ballast substances in cultivation medium .... 271.8. Unproductive losses of the substrate and energy in the process of
bacterial synthesis 28Chapter 2. Biochemical principles of the efficiency control of bacterial
synthesis 302.1. Alternative systems of substrate transport 302.1.1. Diffusion 312.1.2. Active transport by group translocation 312.1.3. Active transport without chemical modification of substrate . 332.1.4. Systems of glucose transport in Corynebacteria 372.2. Substrate catabolism pathways 402.2.1. Glycolysis 442.2.2. Tricarboxylic acid cycle 502.2.3. Hexose monophosphate pathway 572.2.4. Incomplete oxydation of glucose 592.2.5. Glucose catabolism in Corynebacteria 662.3. Energy generation 732.3.1. Formation of proton motive force 732.3.2. Energetic efficiency of energy-transducing systems .... 782.4. Control of substrate transport and enzyme activity 812.4.1. Constitutive and inducible enzymes 812.4.2. Regulation of enzyme activity/ 862.4.3. Control of enzyme synthesis 942.5. Control of energetic and constructive metabolism 1012.5.1. Coordination of enzyme activity and substance consumption rate 1012.5.2. Correlation between substrate catabolism rates and their con¬
sumption by cells under conditions of extra production of ATP 1092.5.3. Catabolism in the conditions of limited production of ATP . . 1192.5.4. Mechanisms coordinating energetic and constructive metabo¬
lism 1242.6. Control of cell growth rate 1362.7. Yield regulation in the processes of bacterial synthesis .... 142
Contents365Chapter 3. Genetic and physiological principles of bacterial synthesis 1613.1. Genetic principles of the control of bacterial synthesis .... 1613.1.1. Overproduction in the bacteria with artifical genotype ... 1613.1.1.1. Methods of mutagenesis and selection 1613.1.1.2. Obtaining the bacteria-superproducers by the gene engi¬
neering technique 1633.1.1.3. Product synthesis in auxotrophs and regulatory mutants 1653.1.2. Obtaining of the phage- and bacteriocines resistant strains . . 1713.1.3. Mutant and recombinant stability 1743.1.4. Prospects for product synthesis increase by application of the
gene engineering technique 1753.2. Physiological regulation of bacterial synthesis 1763.2.1. Mechanisms of the population responses to the environment 1783.2.2. The physiological state of the culture 1803.2.2.1. Growing and non-growing cultures. Uncoupled growth . . 1803.2.2.2. Growth limitation by nutrients. Overflow 1843.2.2.3. Adaptation to the environment. Extremophylls . . . 1863.2.2.4. Growth strategies and nutrition types 1873.3. Physiological possibilities to increase bacterial synthesis . . . 1893.3.1. Examples of yield improving by excess metabolic flow cutting 1913.3.2. Increase of biosynthesis efficiency by metabolic flow shortage
substitution 1953.3.3. Increase of lysine yield in Brevibacterium flavum during simul¬
taneous use of two carbon cources 1963.3.4. Increase of biomass and lysine yields on the basis of mixotrophyin Brevibacterium flavum 2003.4. Control of the process according to the physiological activity of
producer 2033.4.1. Selection of the principal control parameters '2033.4.2. Interpretation of the parametre «oxygen consumption rate» . . 2033.4.3. Determination of the dose, moment and duration of feeding 204Chapter 4. Engineering realization of biotechnologies 2074.1. Effect of limiting concentrations of substrates upon cultivation
processes 2104.1.1. Substrate concentration under different stirring conditions andits consumption rate 2114.1.2. Growth and synthesizing activity of lysine producers . . . 2144.1.3. Biochemical responses of Brevibacterium flavum to stirring
intensity 2204.1.4. Turbohypobiosis of microbial populations 228,4.2. Identification of aeration and mixing conditions 2314.3. Bioreactor design 2374.3.1. Laboratory FU-8A and pilot FU-30B sets 2484.3.2. Laboratory fermentation set of the Swiss company MBR . . 2494.4. Stabilization and distribution of the energy introduced in bioreactor 2504.5. Measurement and monitoring of physicochemical parameters of the
medium 258Chapter 5. Obtaining the products of microbial synthesis . 2735.1. Microbiological concentrates 2735.2. Biomass ’ 2775.3. Obtaining the endocellular products 2795.4. Obtaining the exocellular products of bacterial synthesis . . 279Chapter 6. Examples of biotechnologies under experimental and work¬
ing conditions 2816.1. Production of lysine and other amino acids ... 281
366Contents6.1.1. Producers of lysine 2826.1.2. Energetics of lysine biosynthesis 2856.1.3. Biochemistry of lysine producers 2876.1.4. Technology of lysine biosynthesis 2966.1.5. Production of lysine feed concentrate 2996.2. Biotechnology of anaerobic processes 3016.2.1. Obtaining ethanol and other products by the bacteria Z. mobilis 3026.2.2. Methane fermentation of waste ’ . 3126.3. Biotechnology on the basis of recombinate cultures .... 3156.3.1. Choice of microorganism-recipient of recombinat DNA . . . 3166.3.2. Obtaining the genes — DNA fragments 3176.3.3. Introduction of DNA to bacterial cells 3186.3.4. Expression of recombinat DNA in bacteria 3216.3.5. Effect of plasmids upon host cells growth 3236.3.6. Effect of cultivation conditions upon plasmids stability and
biosynthetic activity of the recombinat strains of bacteria . . 3266.4. Novel biotechnology: progress and bottle-necks 331References 335Subject index 357
СВЕДЕНИЯ ОБ АВТОРАХРУКЛИШ МАЙЯ ПАВЛОВНА — кандидат биологи¬
ческих наук, старший научный сотрудник лаборатории
биоинженерии и биоэнергетики Института микробиоло¬
гии Латвийской академии наук. Автор 105 научных
публикаций, 12 изобретений и 5 патентов.Круг научных интересов — особенности функциони¬
рования и механизмы, согласующие с?:орость транс¬
порта субстратов и активность путей их катаболизма
с энергетическим и конструктивным метаболизмом бак¬
терий, взаимосвязь этих процессов с синтезом продук¬
тов, биохимические основы повышения продуктивности
бактериального синтеза.ШВИНКА ЮРИС ЭВАЛДОВИЧ — доктор биоло¬
гических наук, заведующий лабораторией биоинжене¬
рии и биоэнергетики Института микробиологии Лат¬
вийской акадехмии наук. В настоящее время — заведу¬
ющий отделом науки и развития предприятия «Алоя—
Старкелсен». Автор 130 научных публикаций, 15 изобре¬
тений и 2 патентов.Круг научных интересов — биоэнергетика и физио¬
логия микроорганизмов, непродуктивные затраты энер¬
гии в метаболизме бактерий, пути повышения эффек¬
тивности бактериального синтеза.ВИЕСТУР УЛДИС ЭРНЕСТОВИЧ — доктор тех¬
нических наук, профессор, академик Латвийской
академии наук, директор Института химии древесины
Латвийской академии наук, вице-президент Латвийской
академии наук.Круг научных интересов — биотехнология, био- и
химическая инженерия, проблемы биоконверсии расти¬
тельного сырья.
Майя Павловна Руклиш
Юрис Эвалдович Швинка
Улдис Эрнестович ВиестурБИОТЕХНОЛОГИЯБАКТЕРИАЛЬНОГОСИНТЕЗАРедакторы Л. Иванушко, М. Проворова
Художник В. Трифонов
Художественный редактор В. Ковалев
Технический редактор Л. Мисевича
Корректоры Л. Гладышева, Н. ЛебедеваСдано в набор 10.04.91. Подписано в печать 09.04.92. Формат 60X90/16. Бумага тнпогр.
№ 2. Литературная гарнитура. Высокая печать. 23 уел. печ. л.; 23,27 уч.-изд. л.
Заказ № 361. Издательство «Зинатне», 226530 ГСП Рига, ул. Тургенева, 19. Регистра¬
ционное удостоверение № 20250. Отпечатано в типографии «Рота», 226011 Рига, ул.
Блауманя, 38/40.