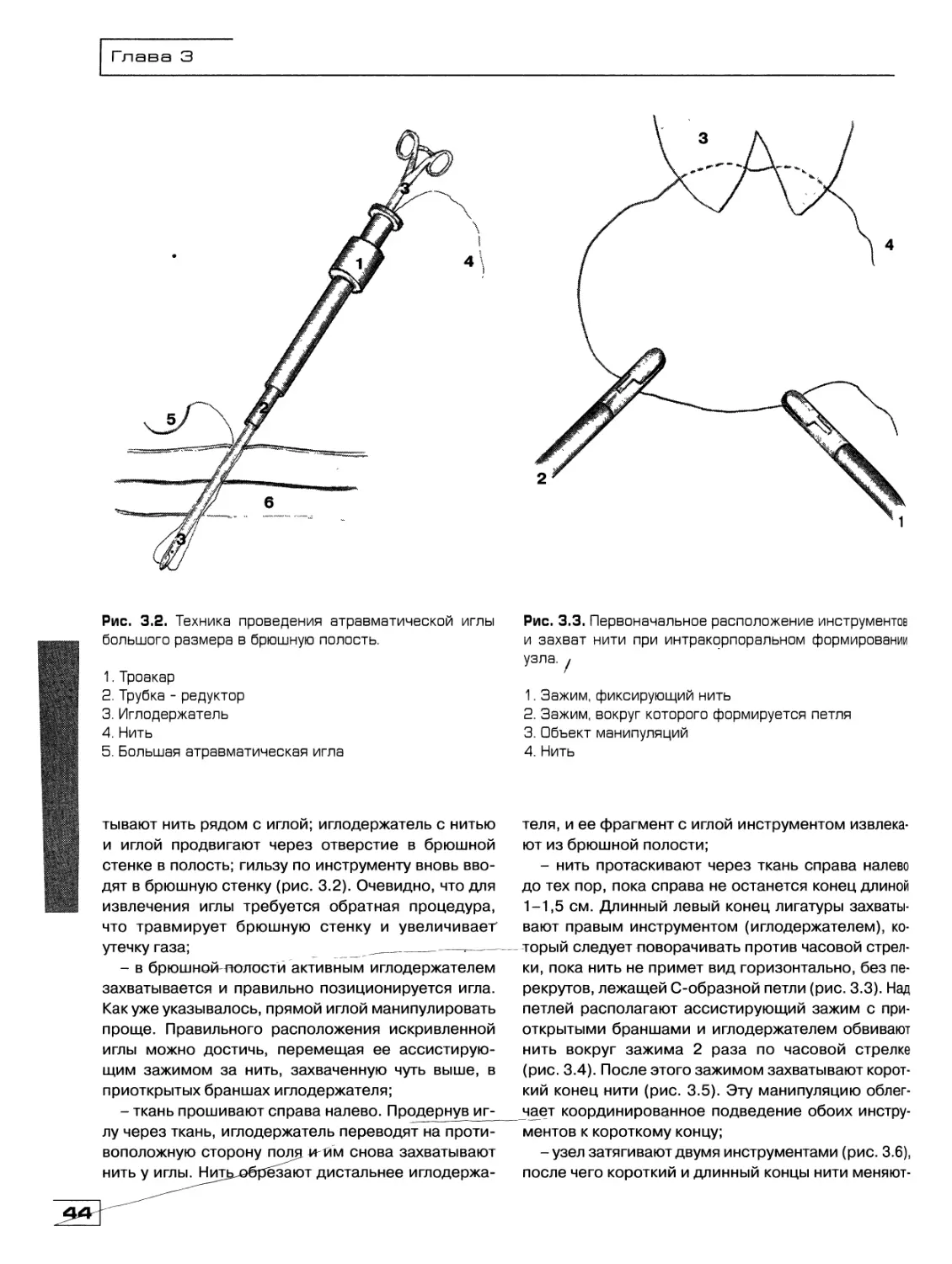
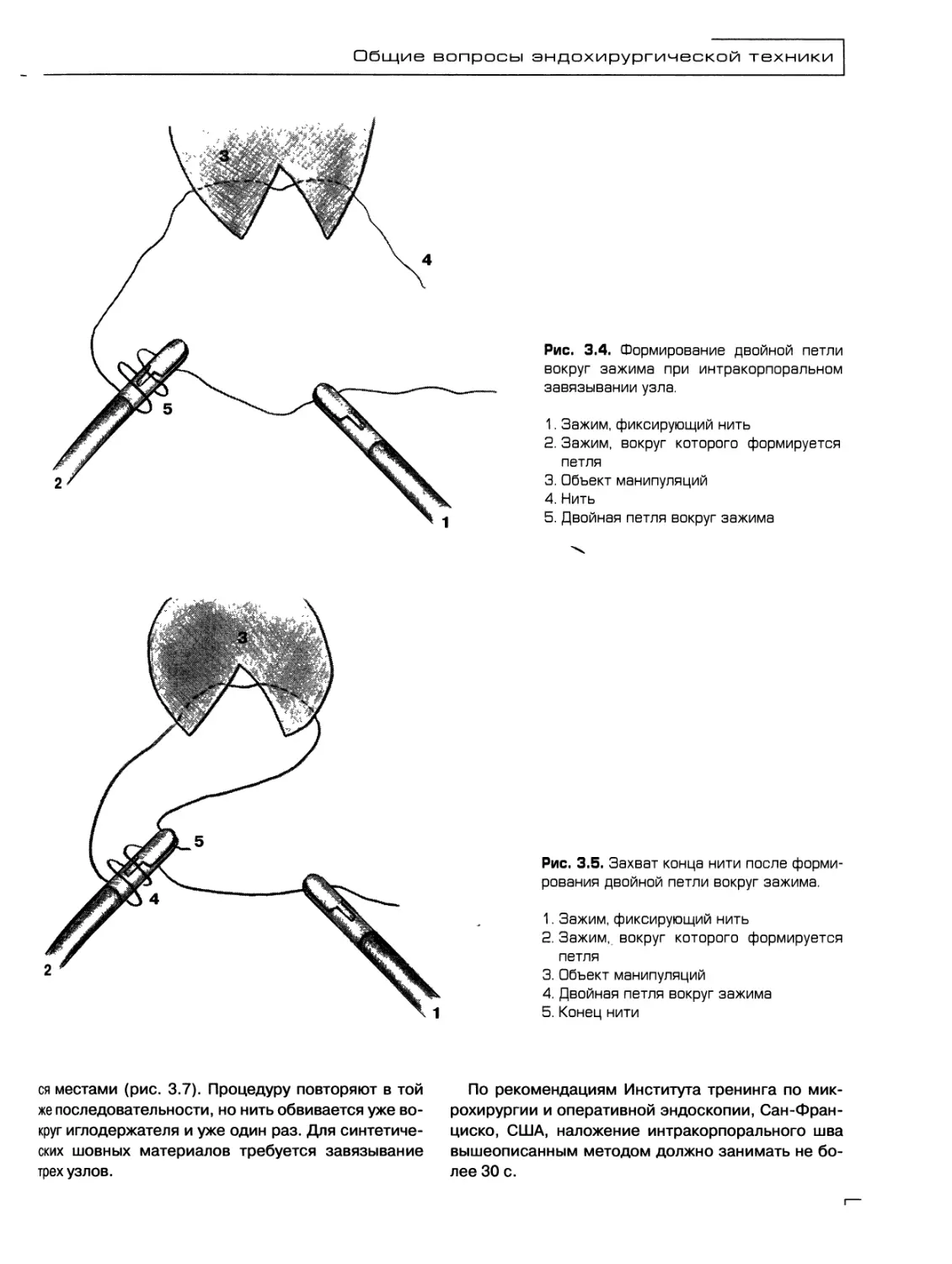
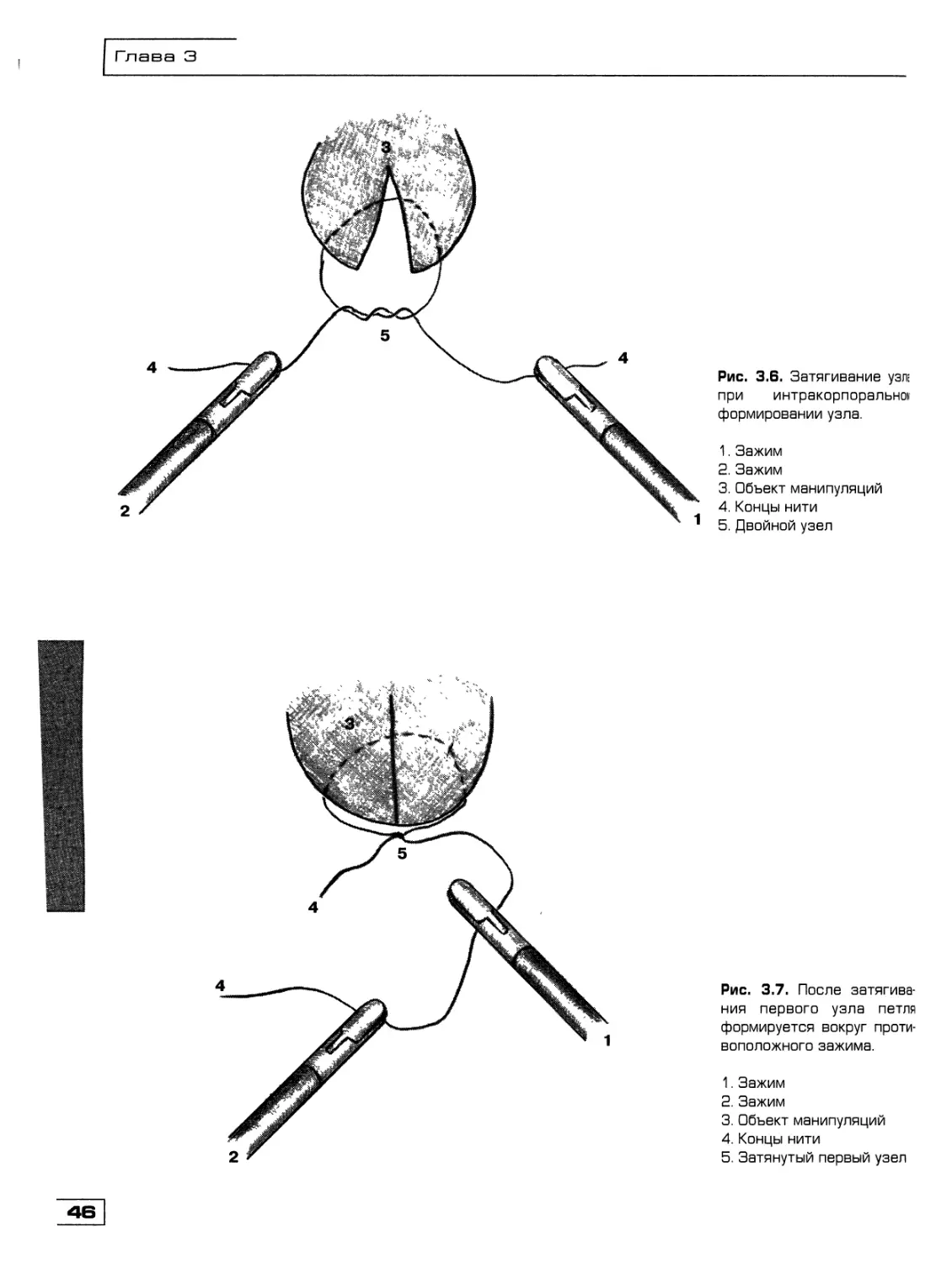
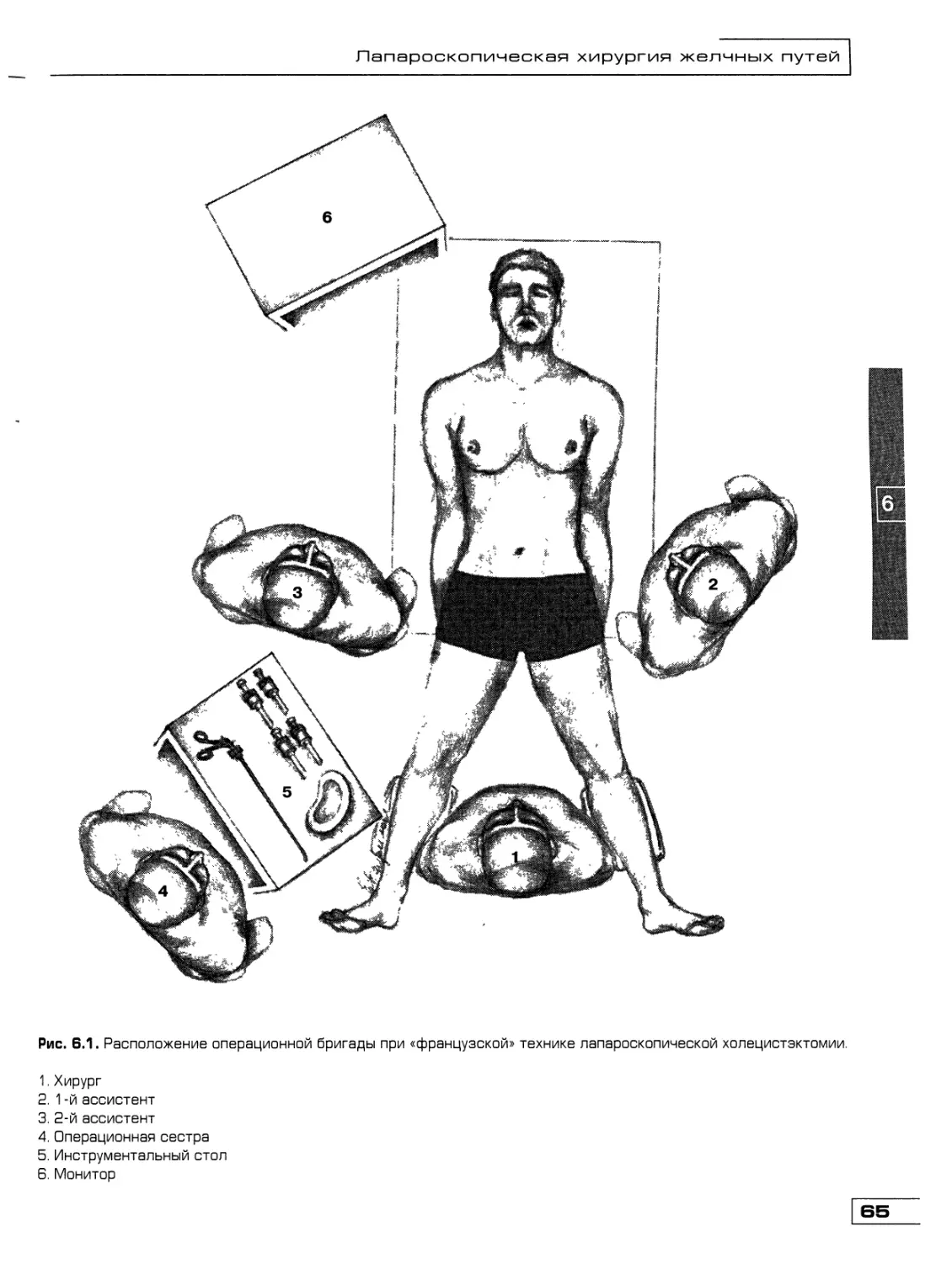
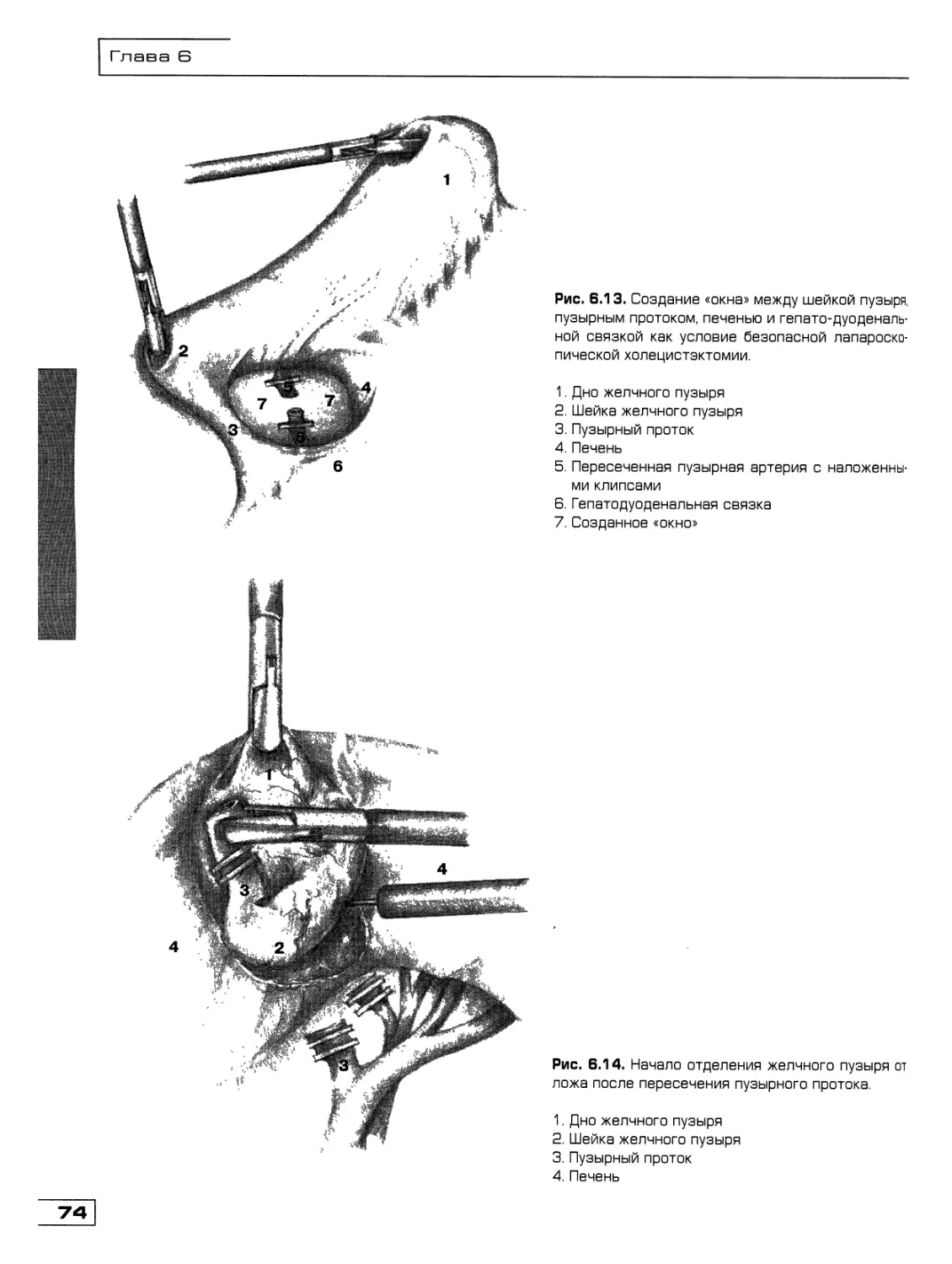
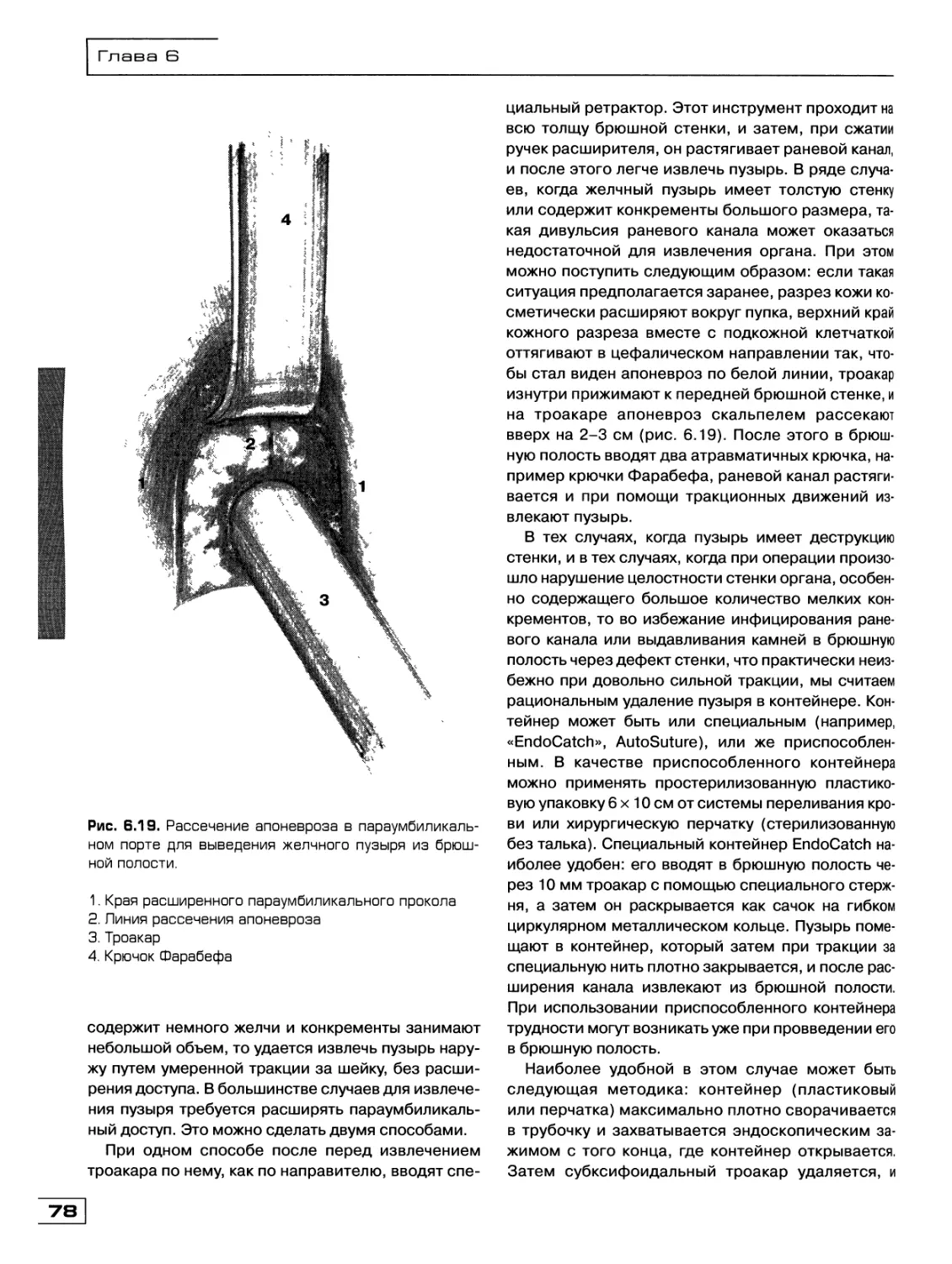
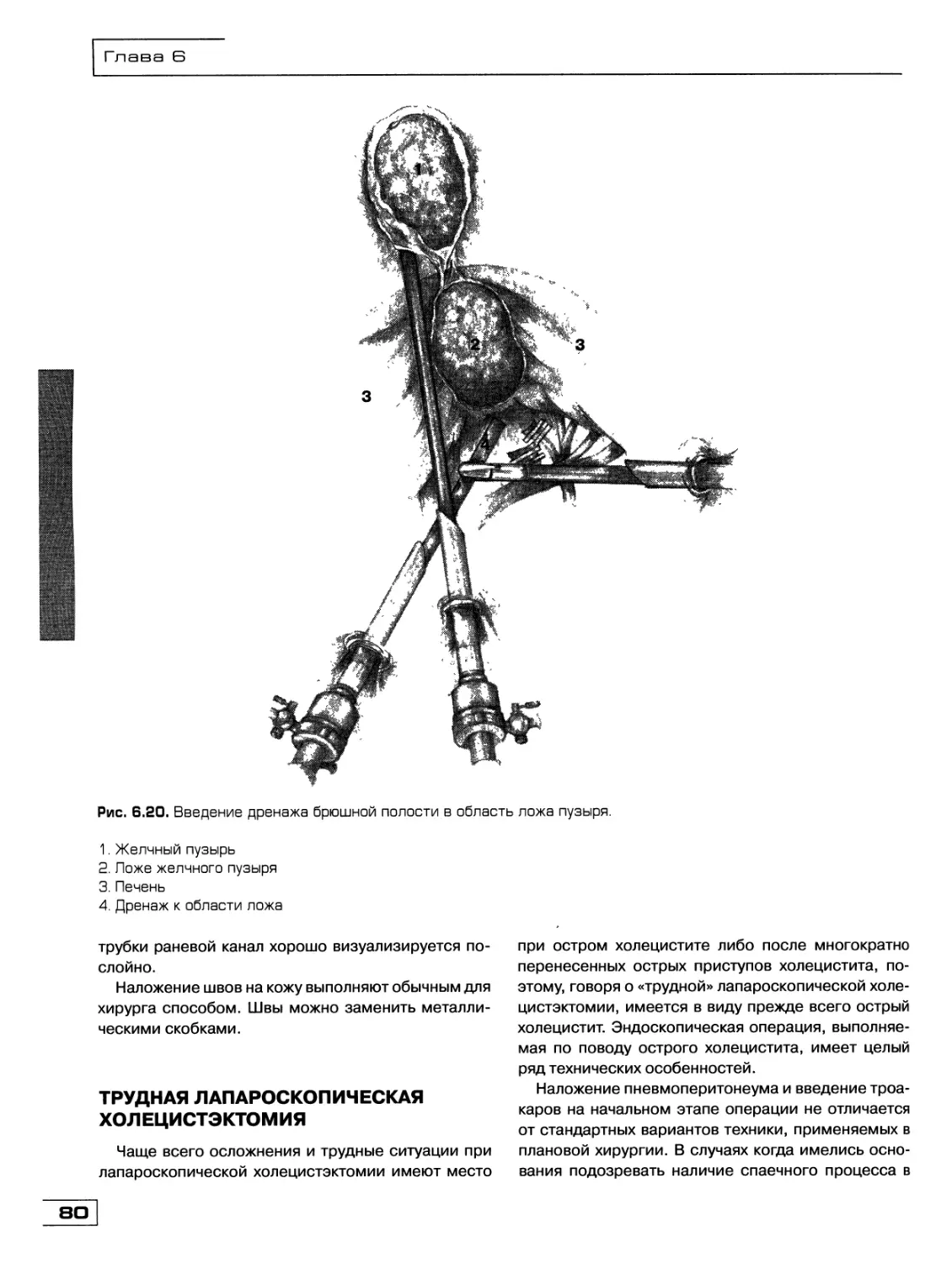
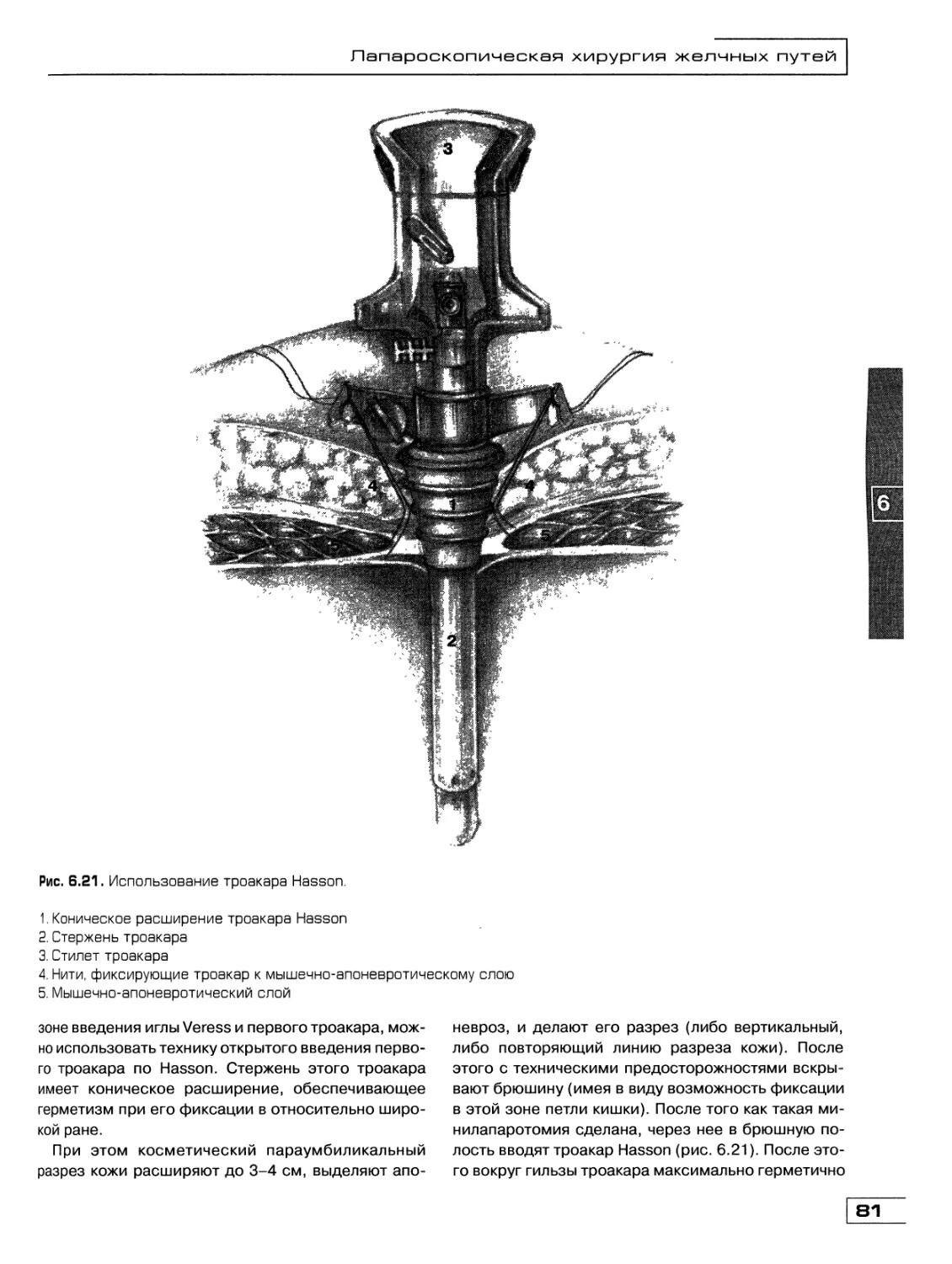
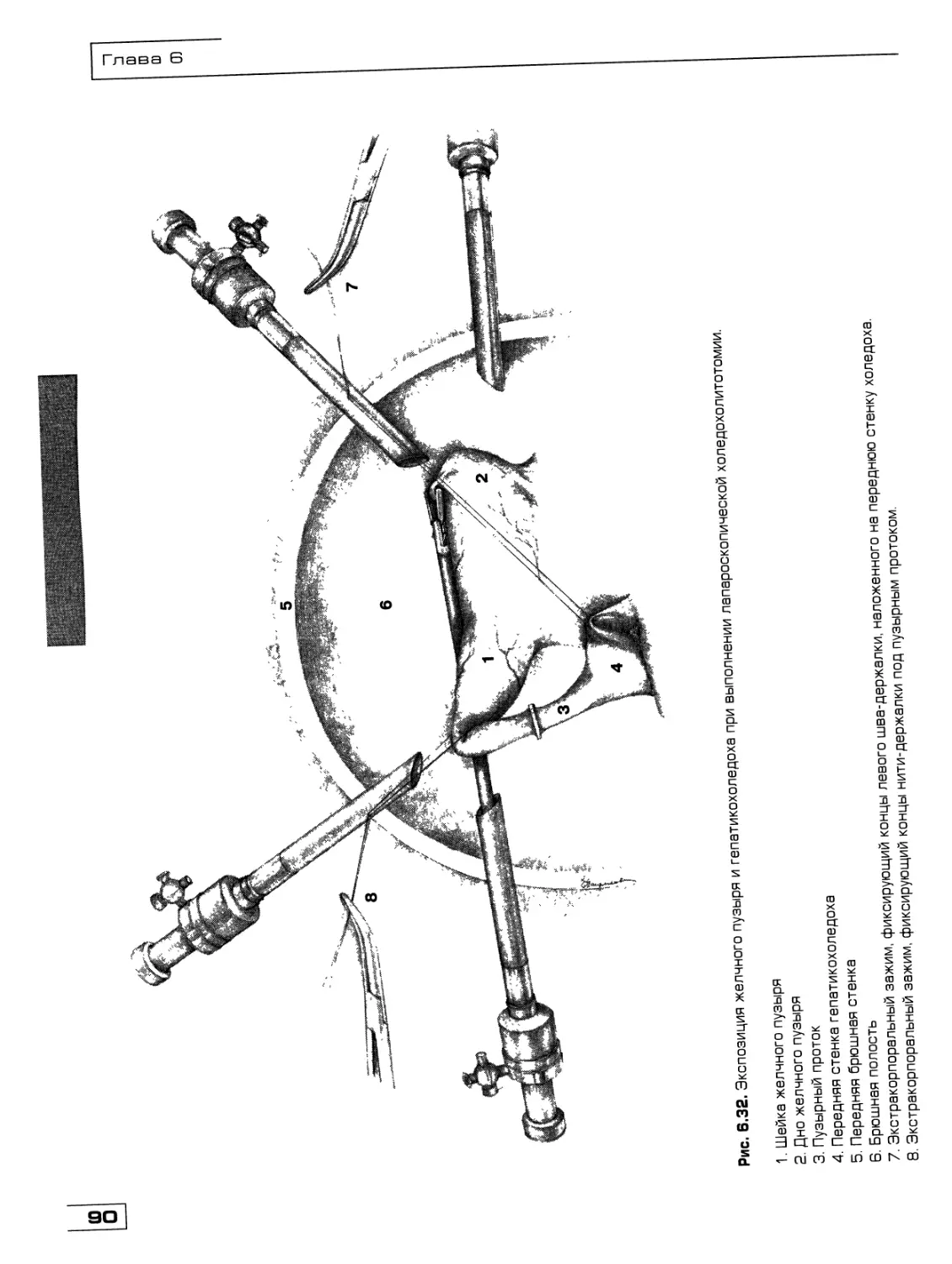
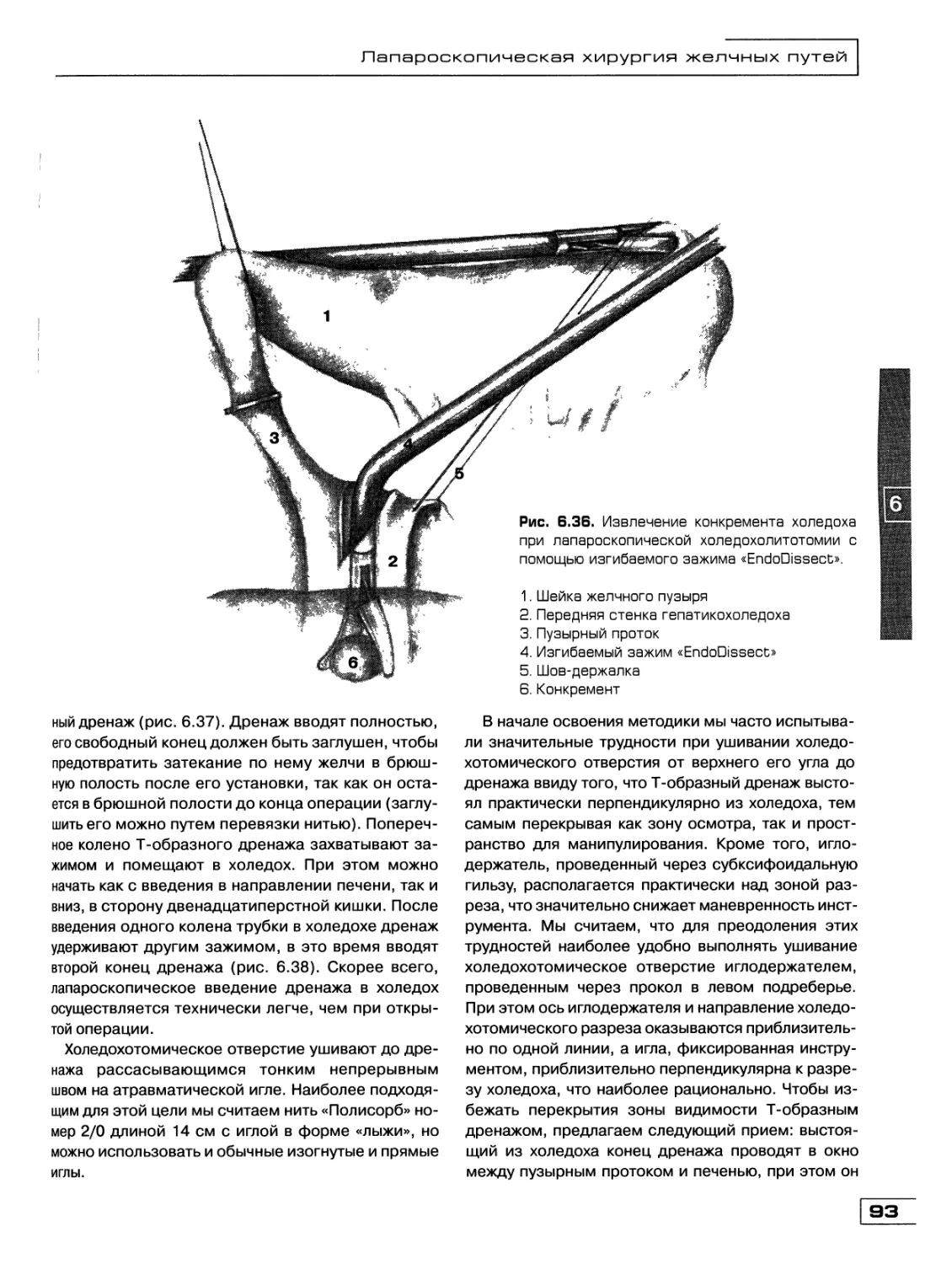
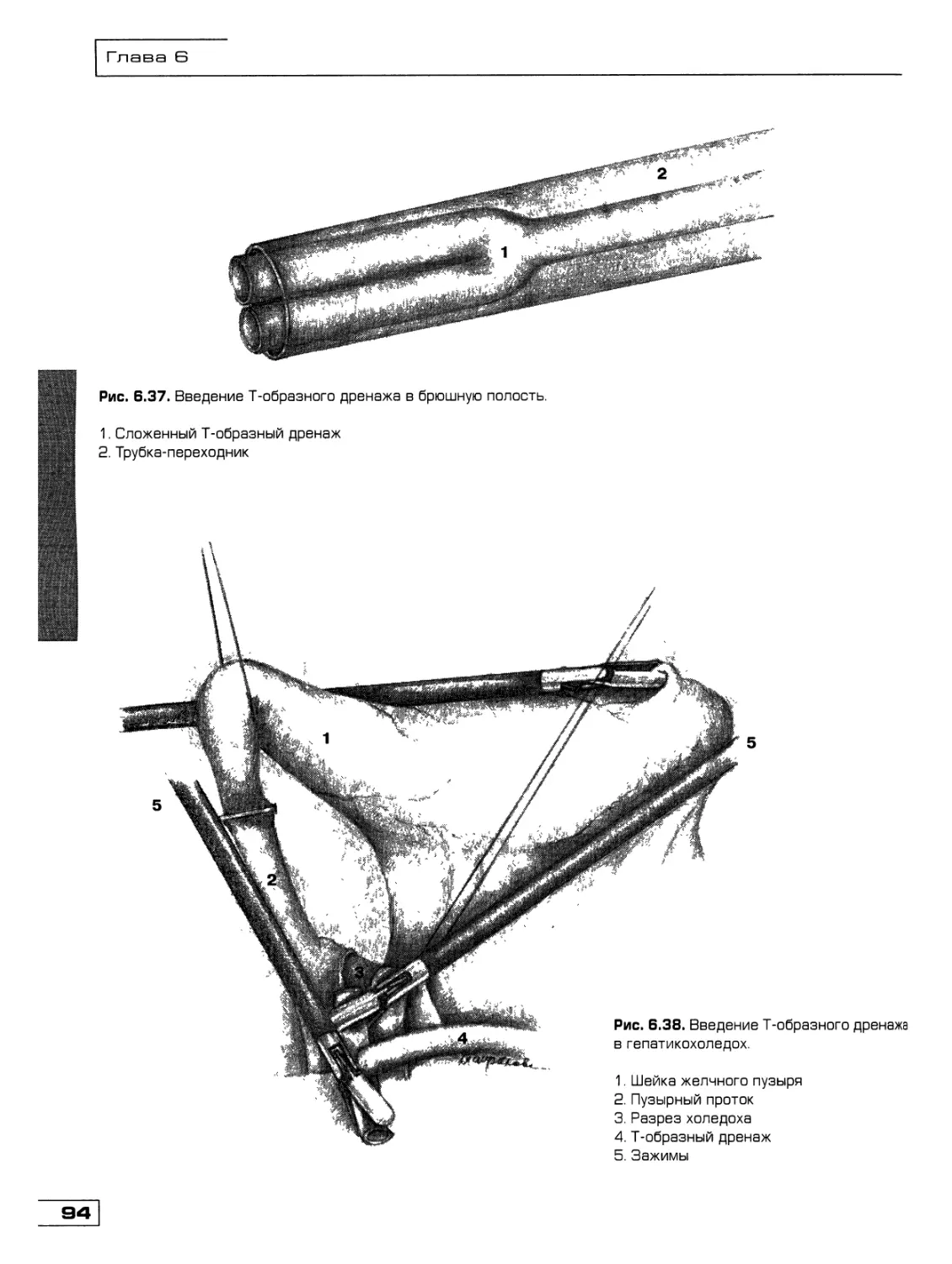
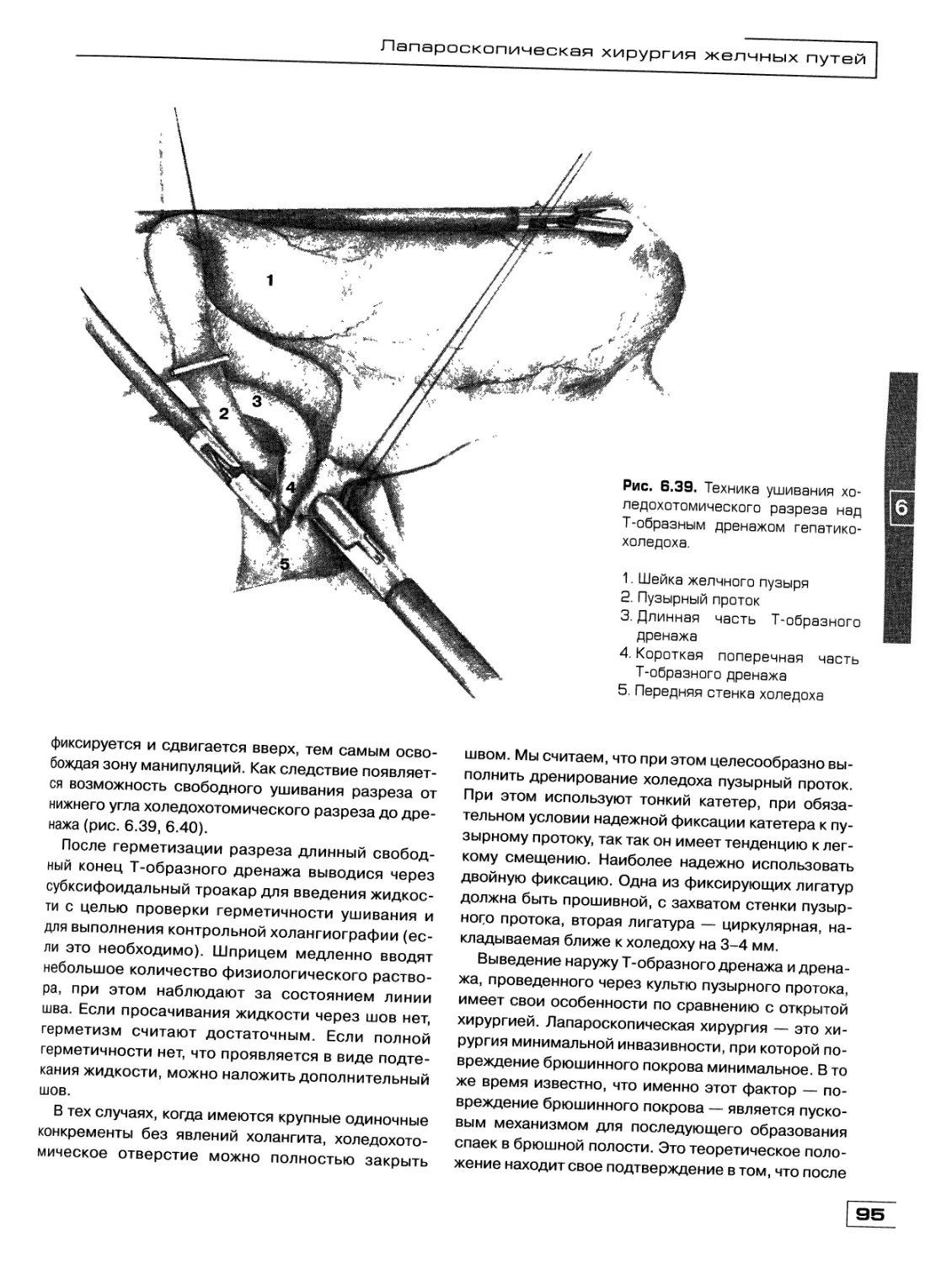
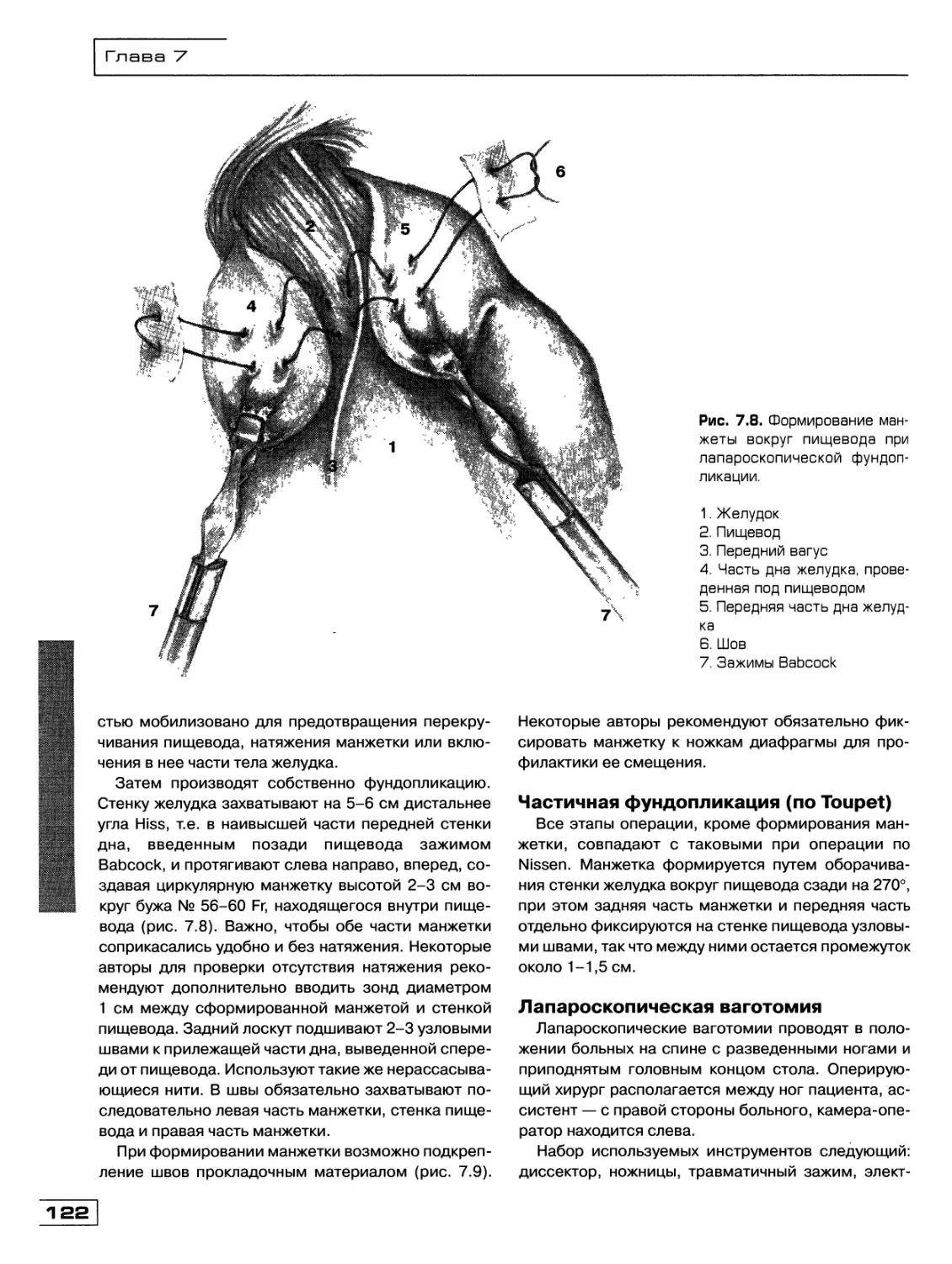
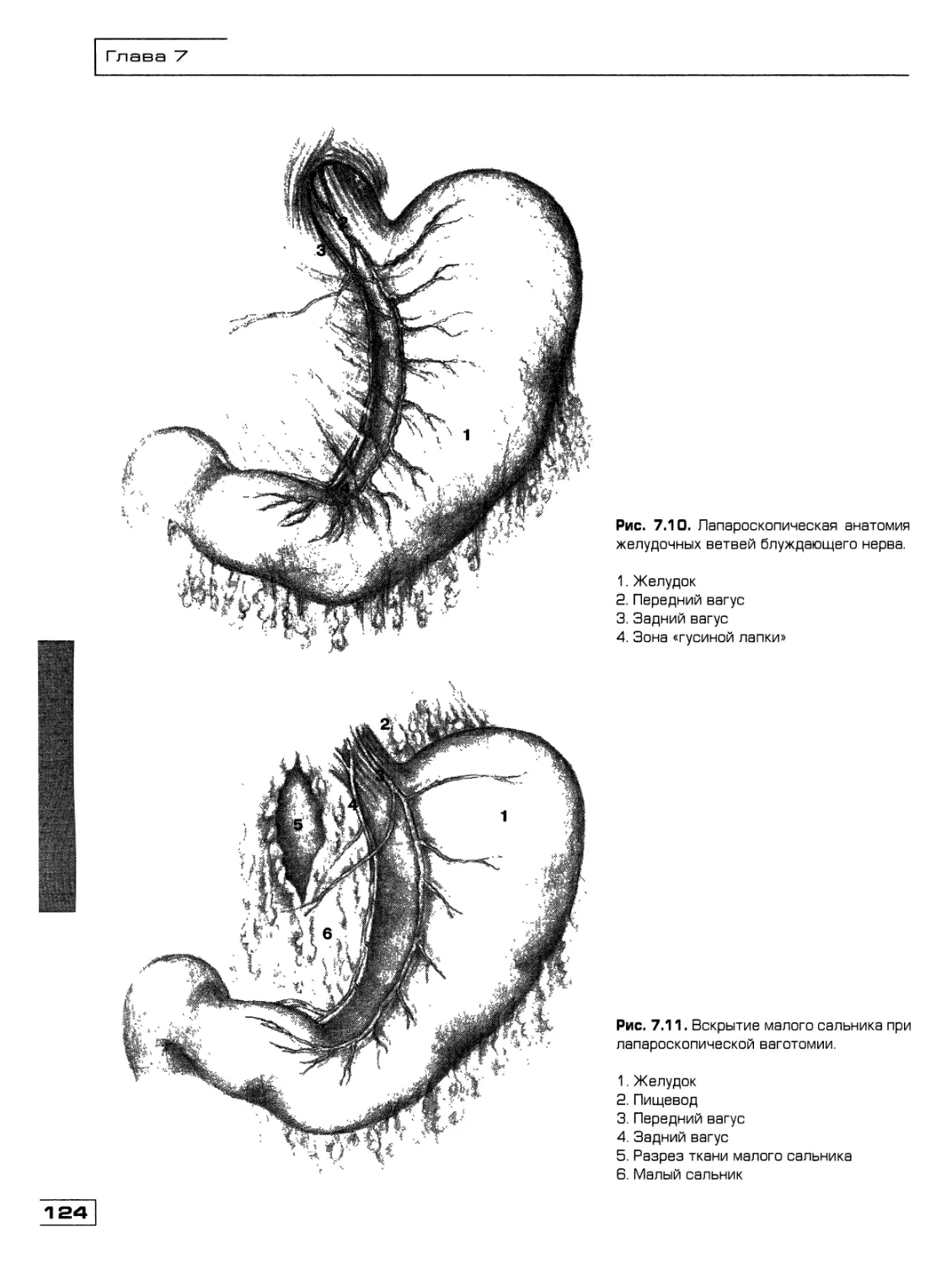
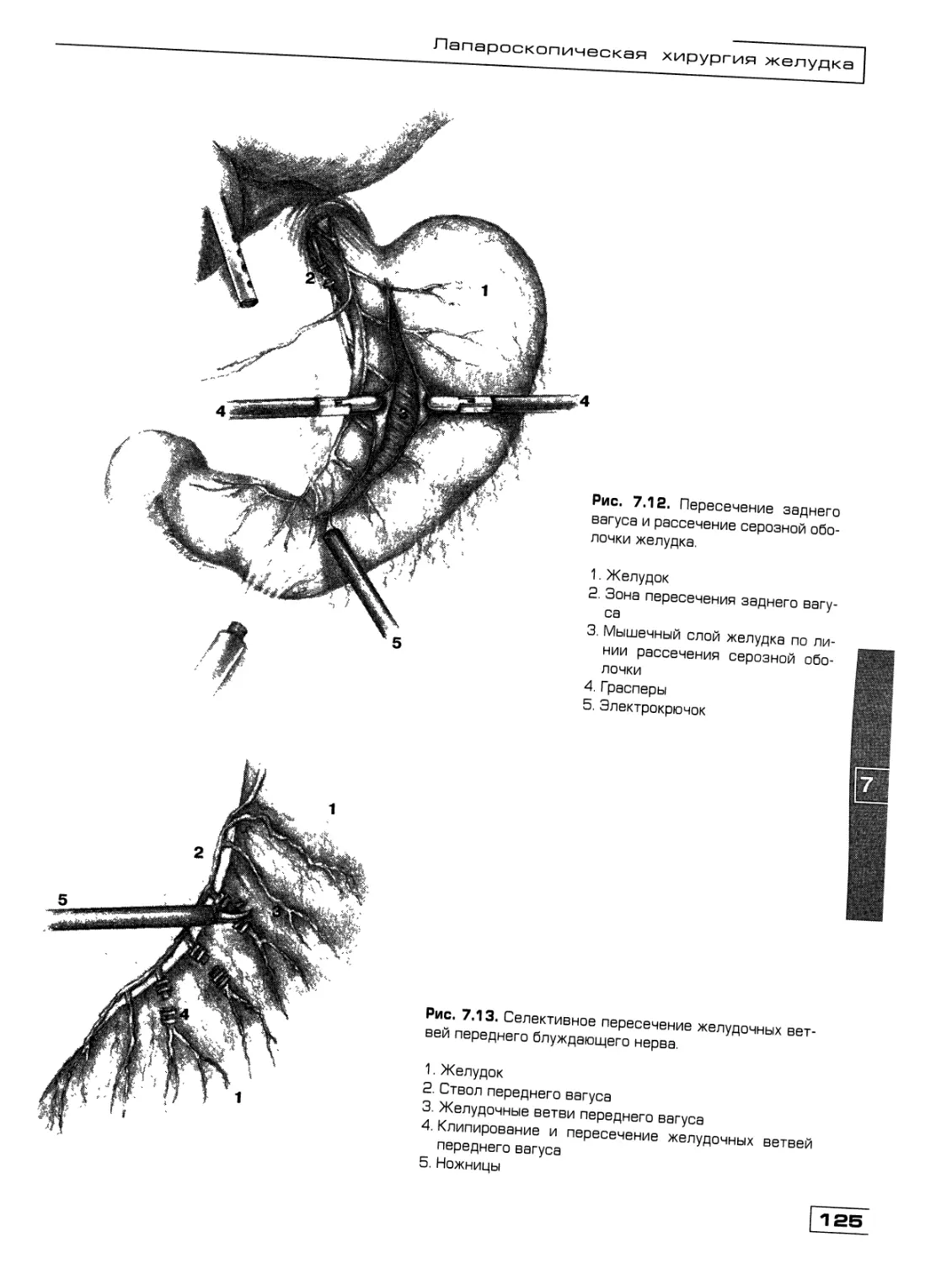
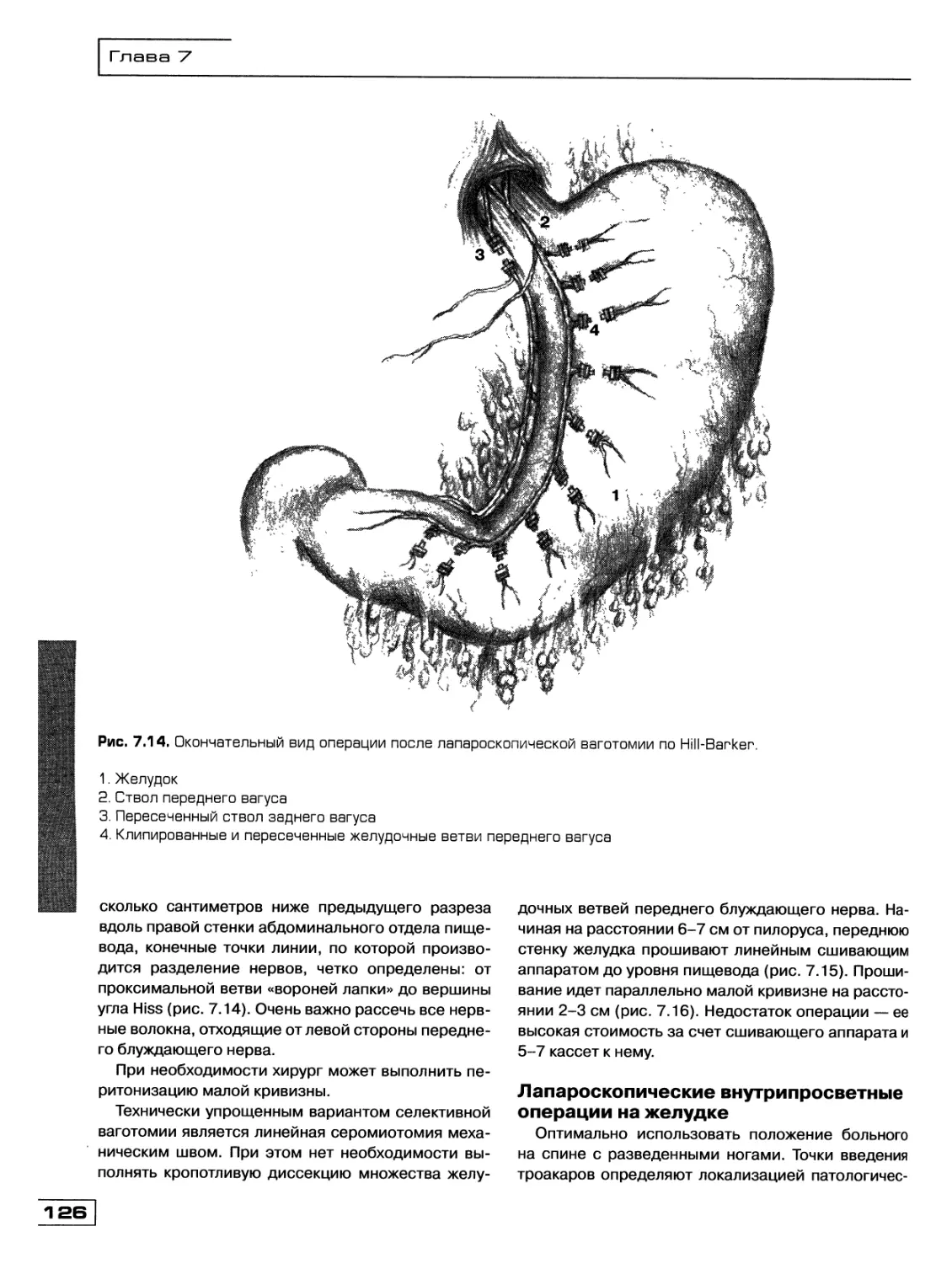
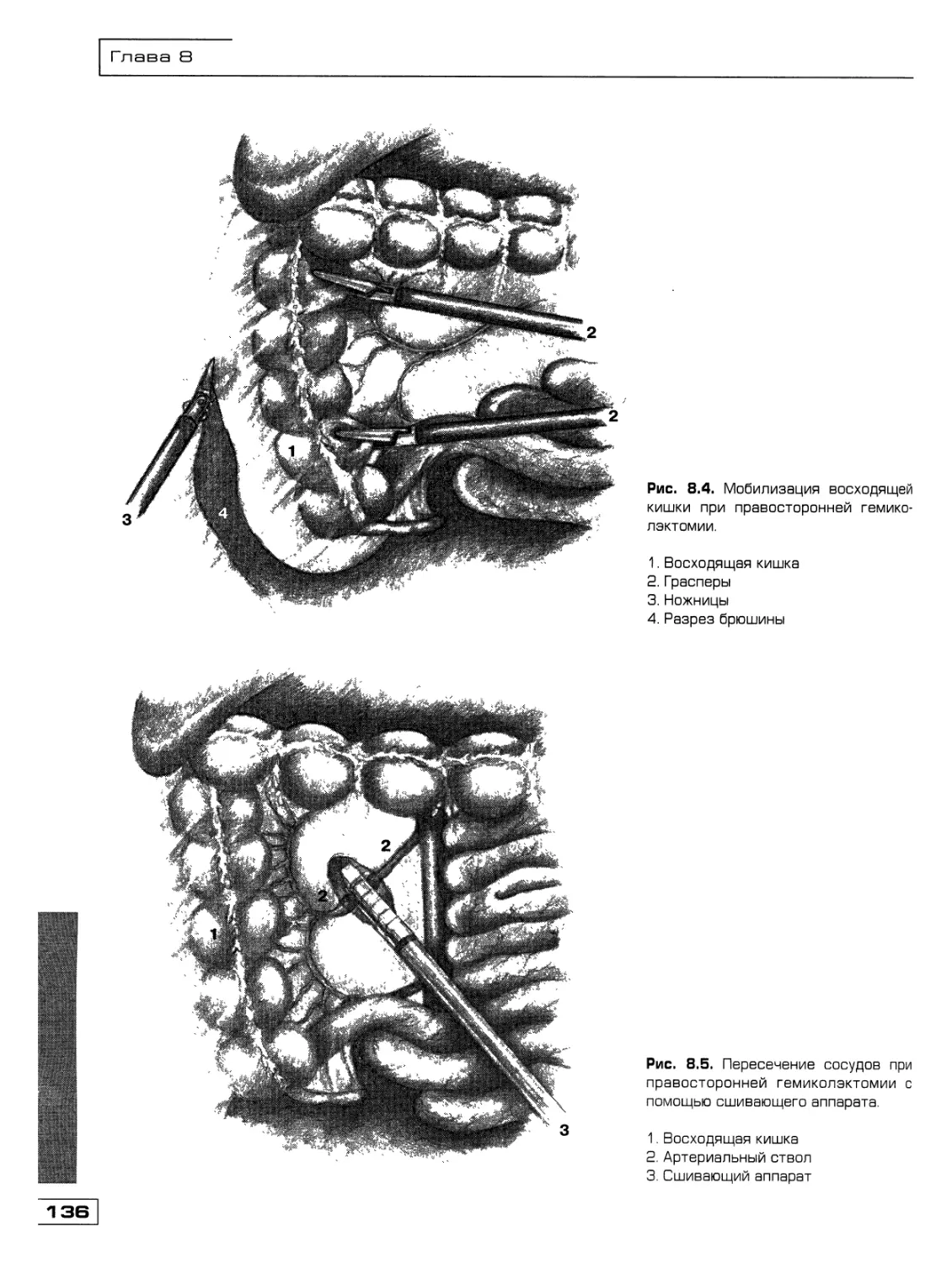
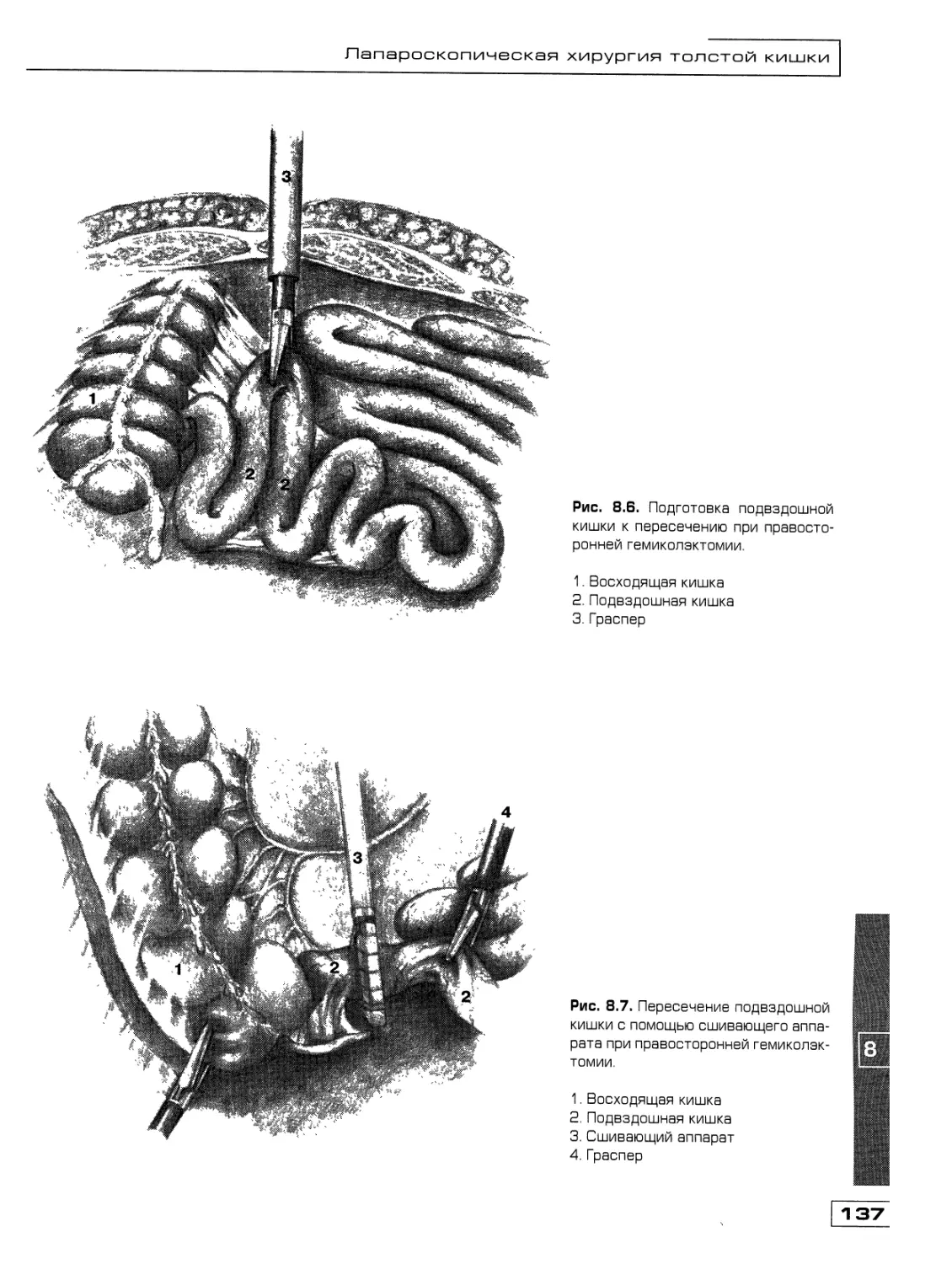
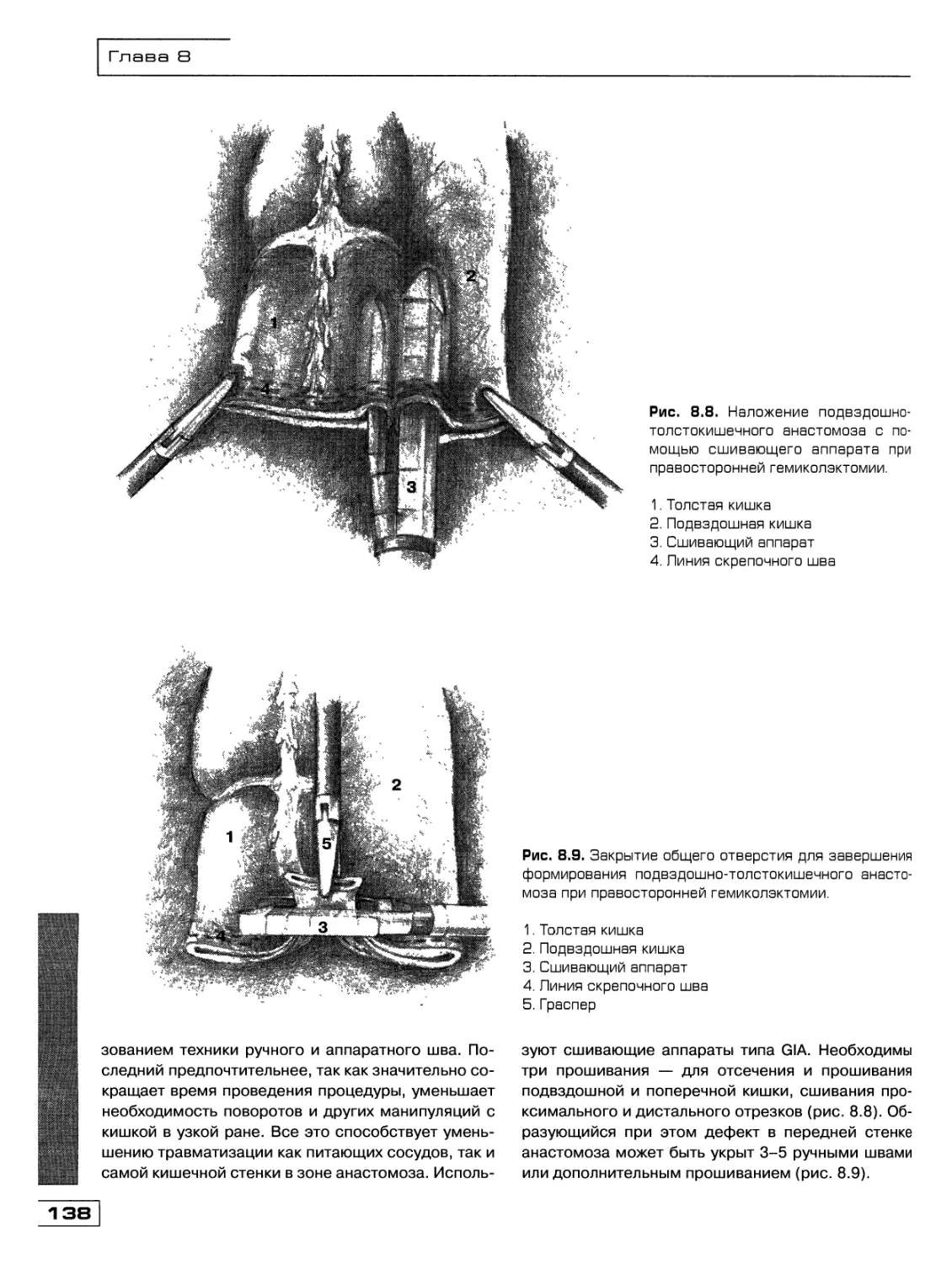
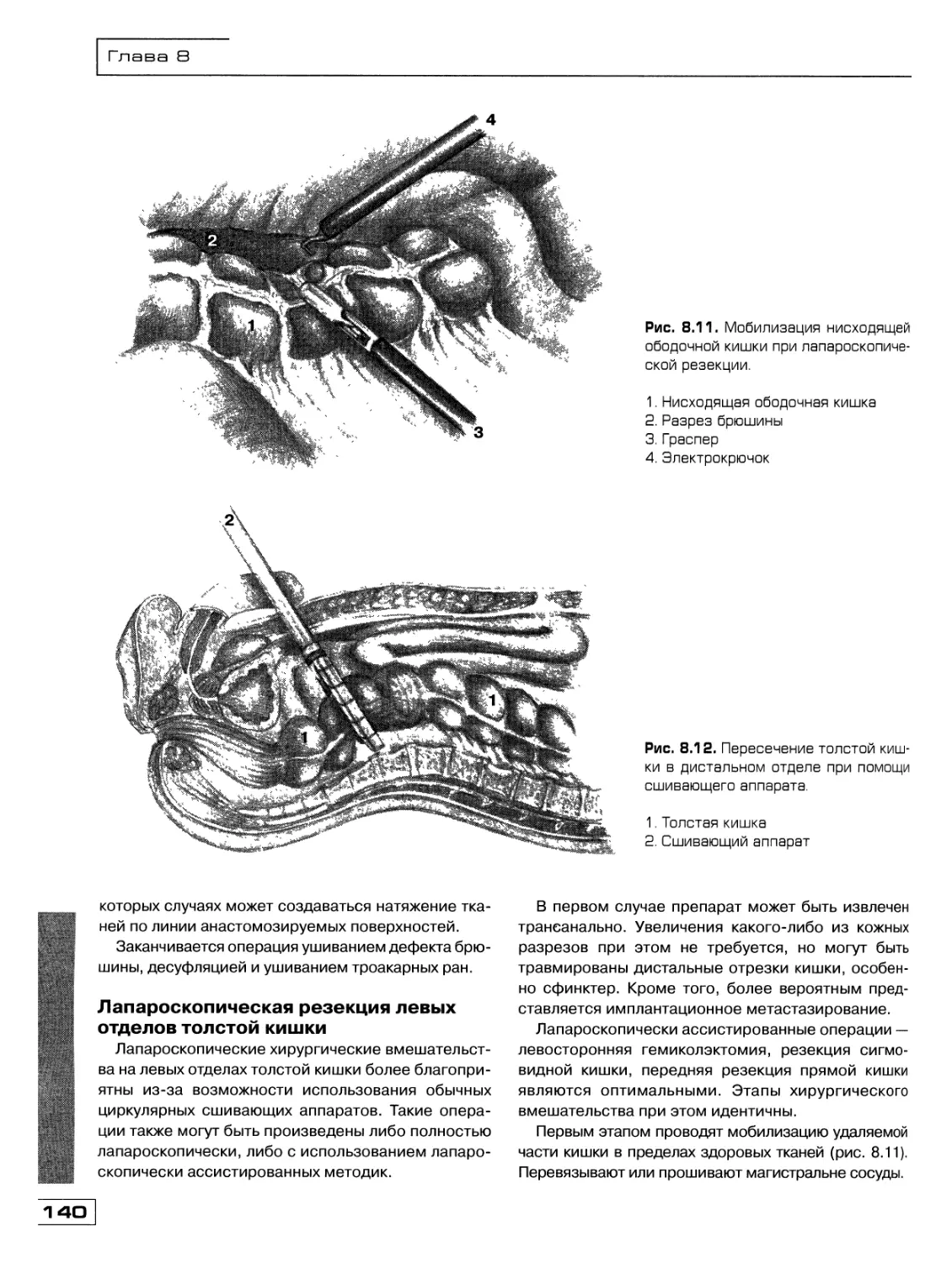
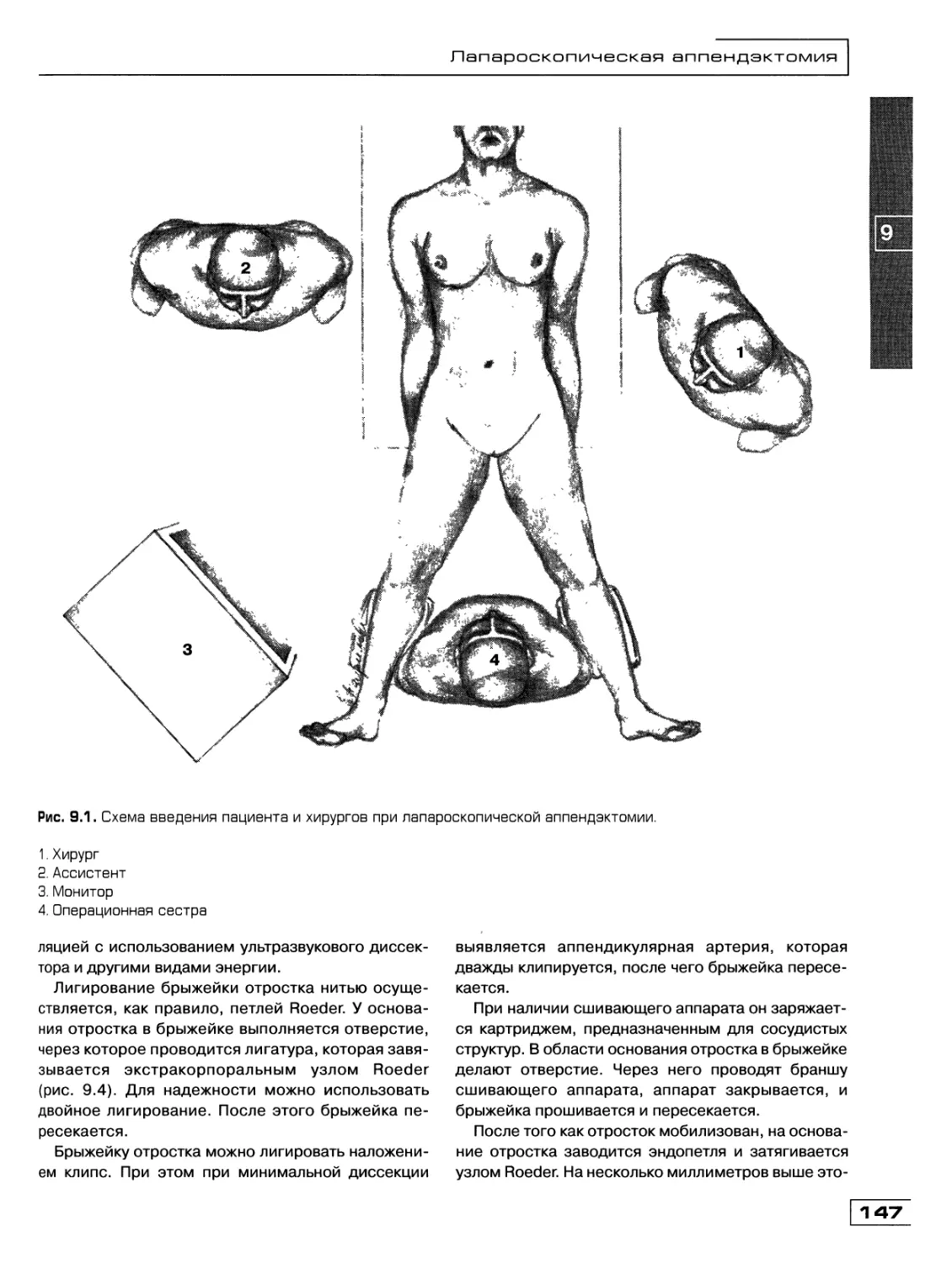
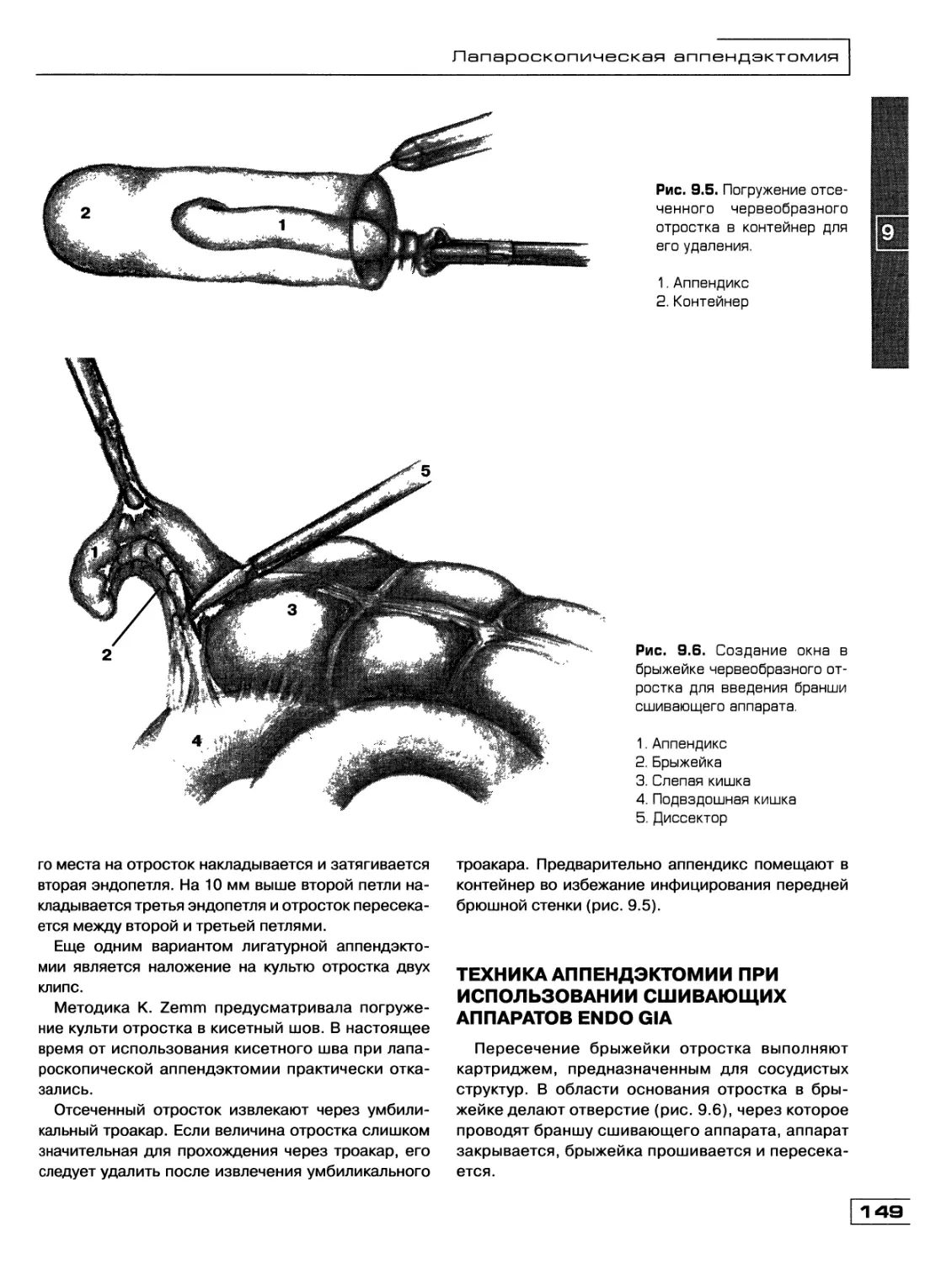
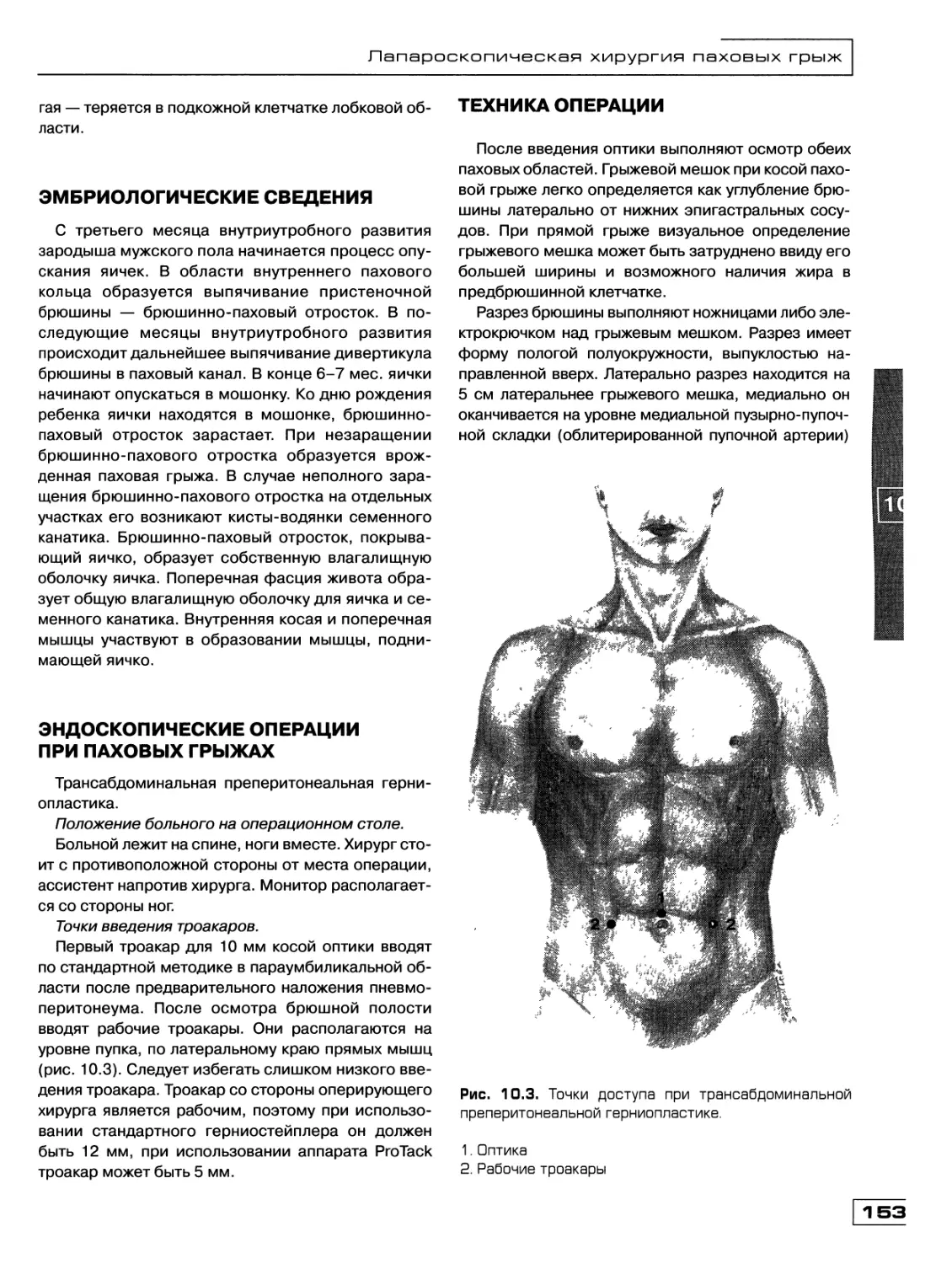
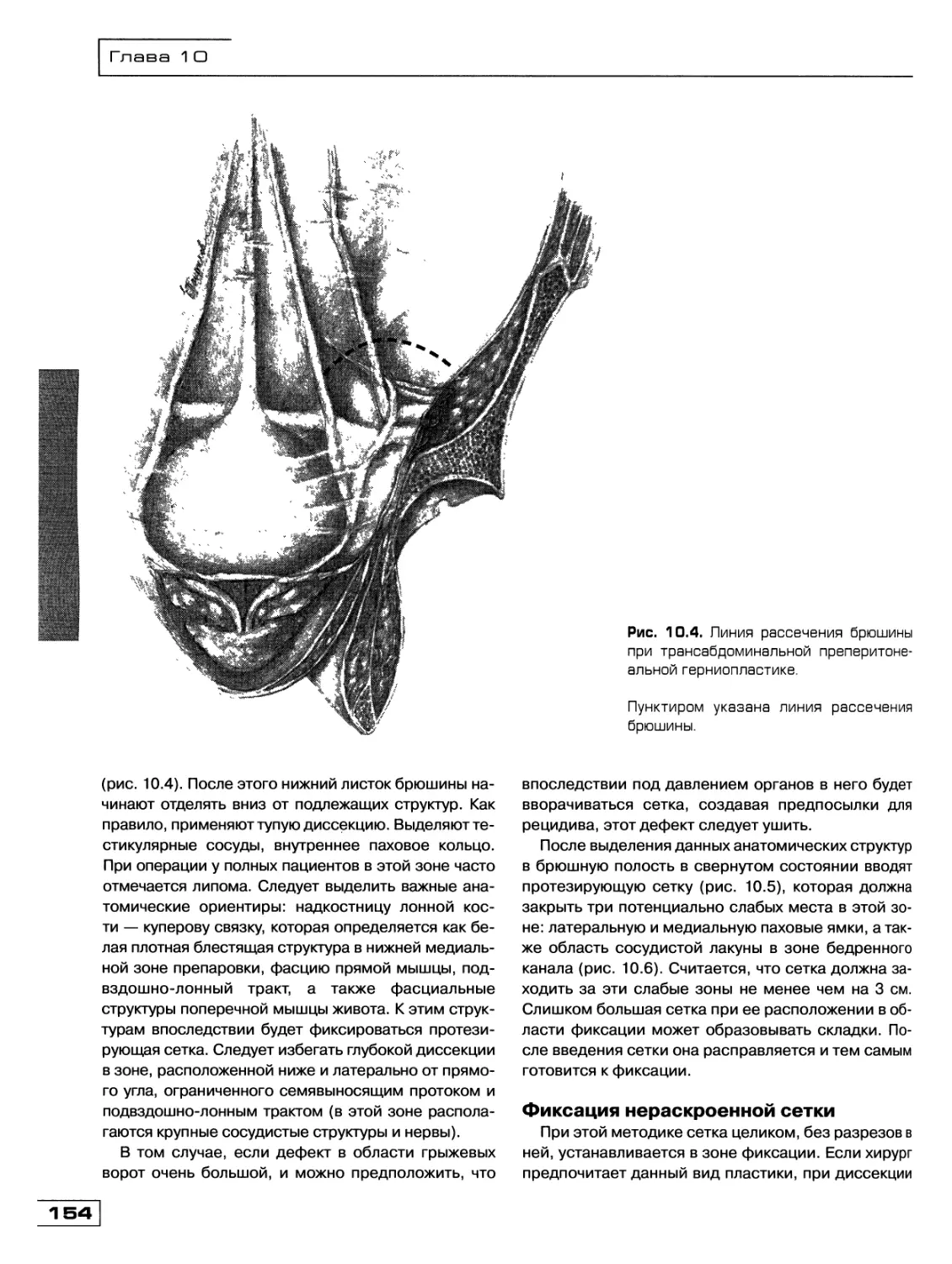
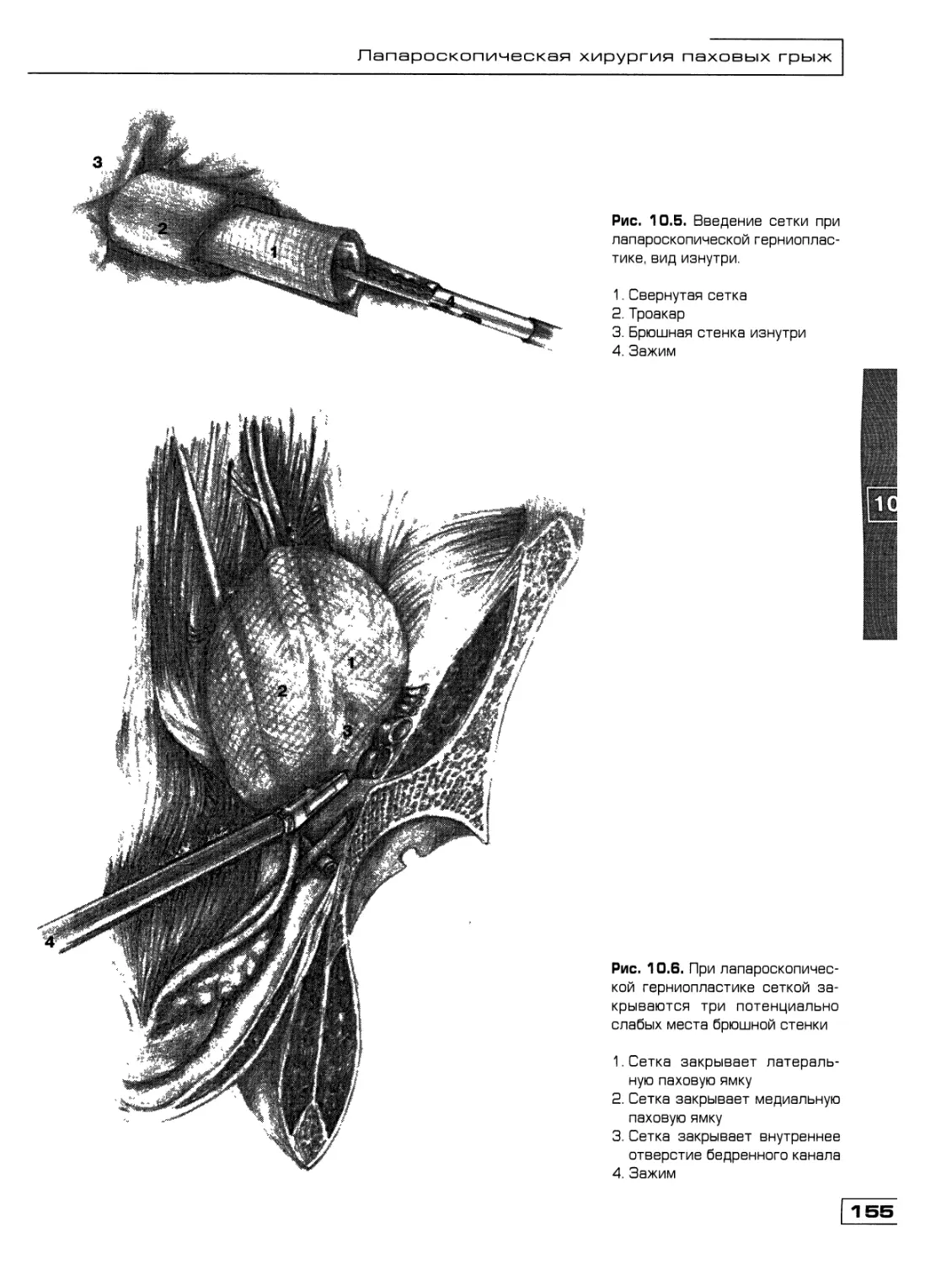
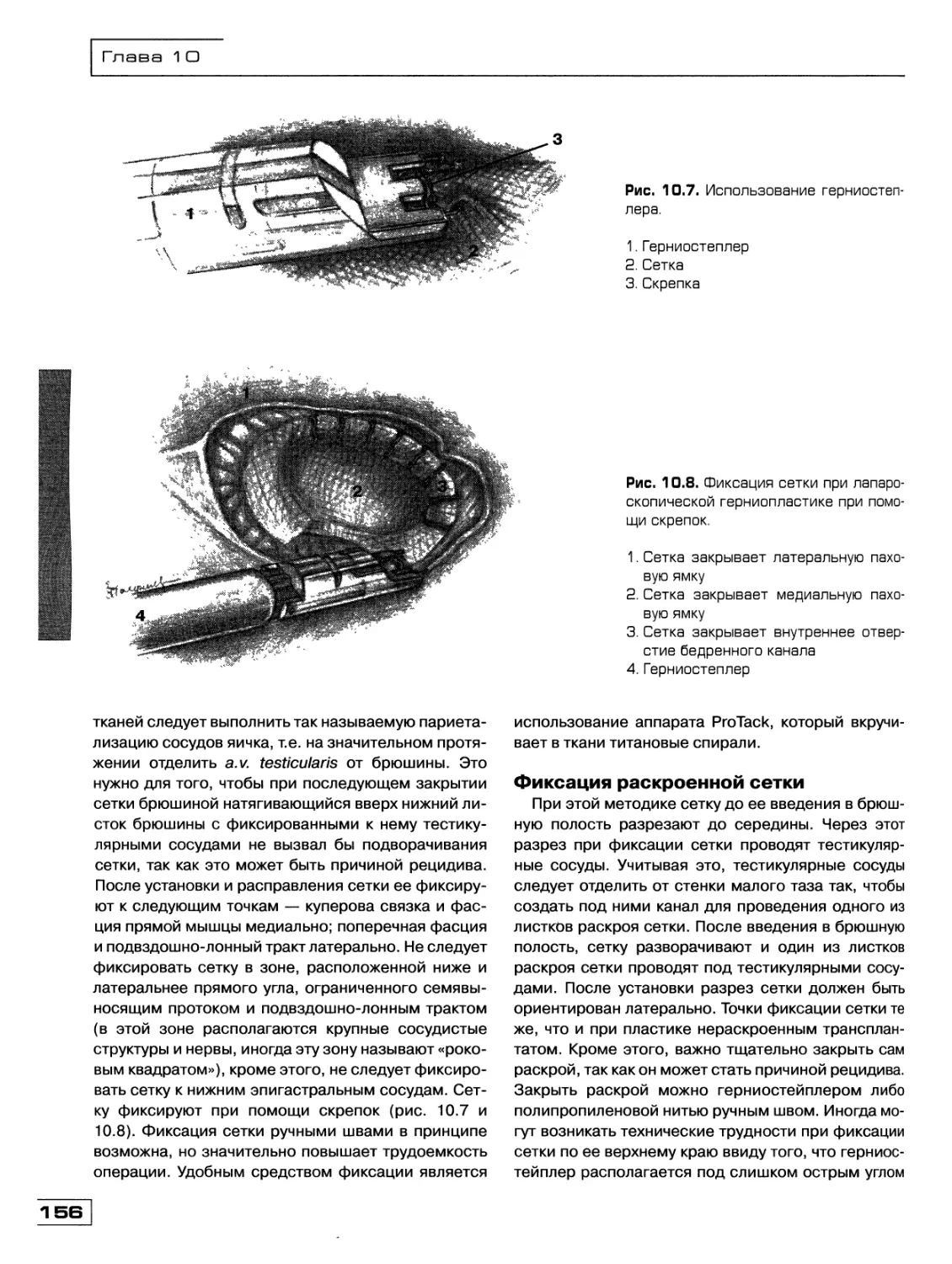
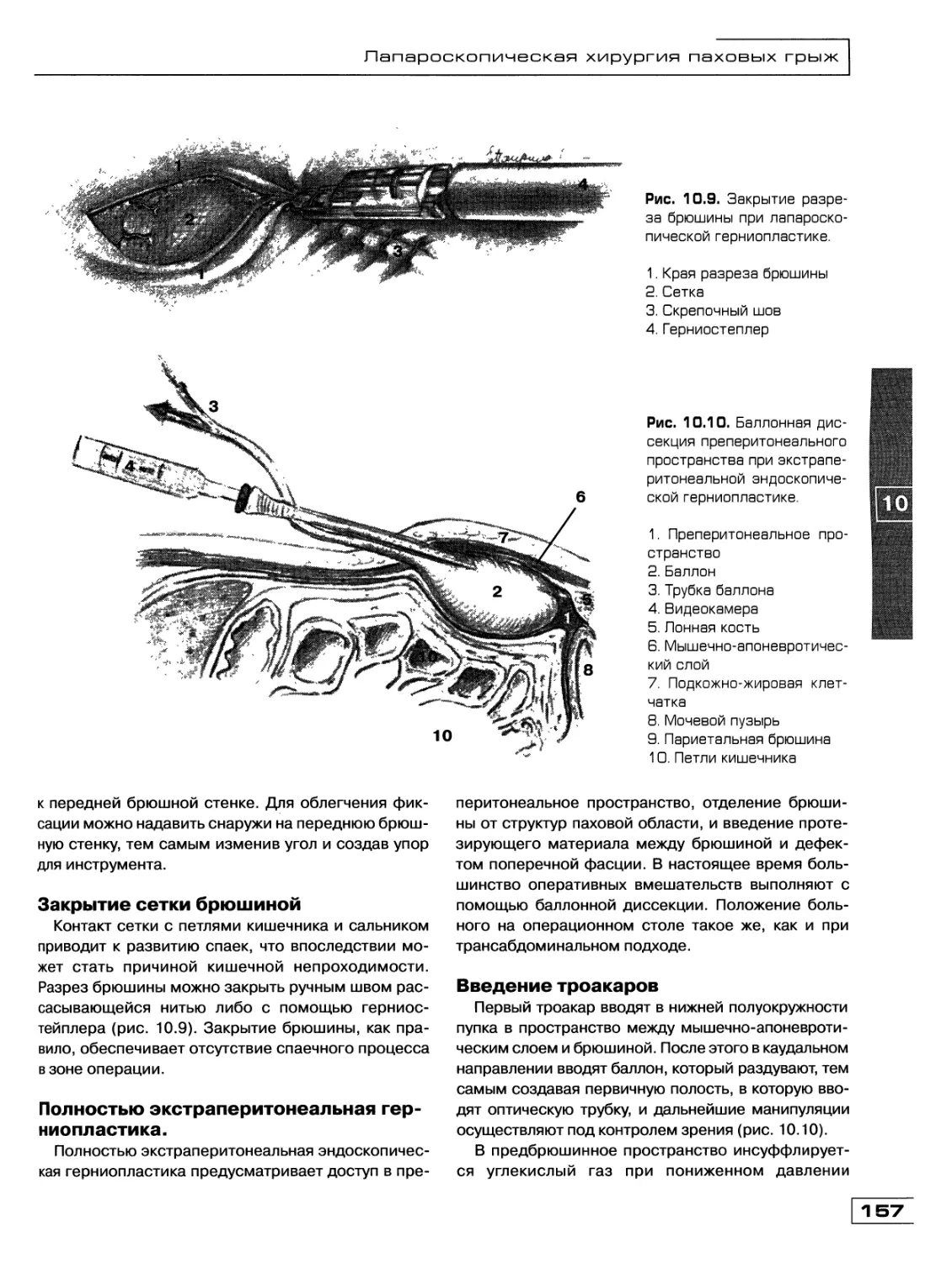
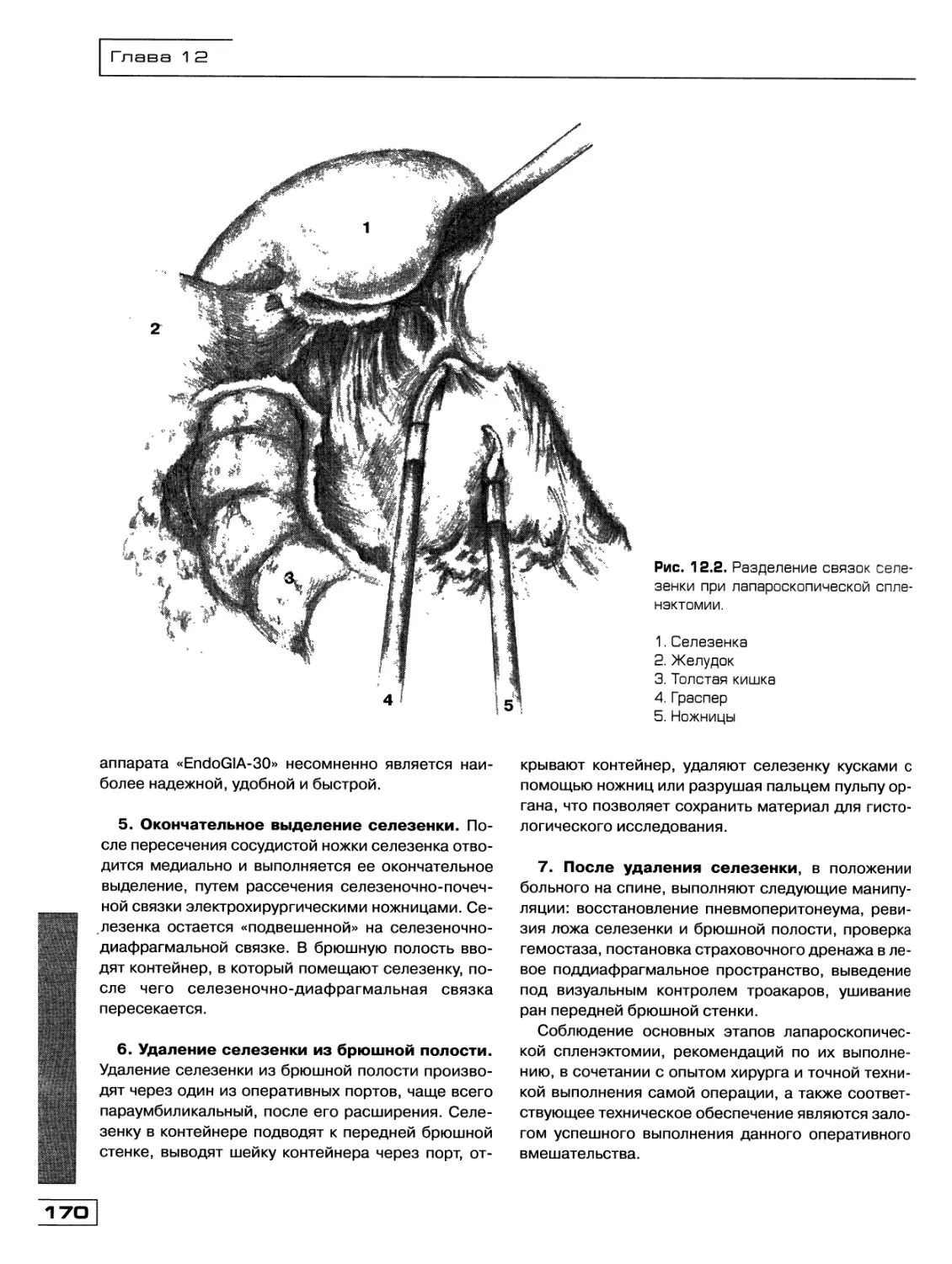
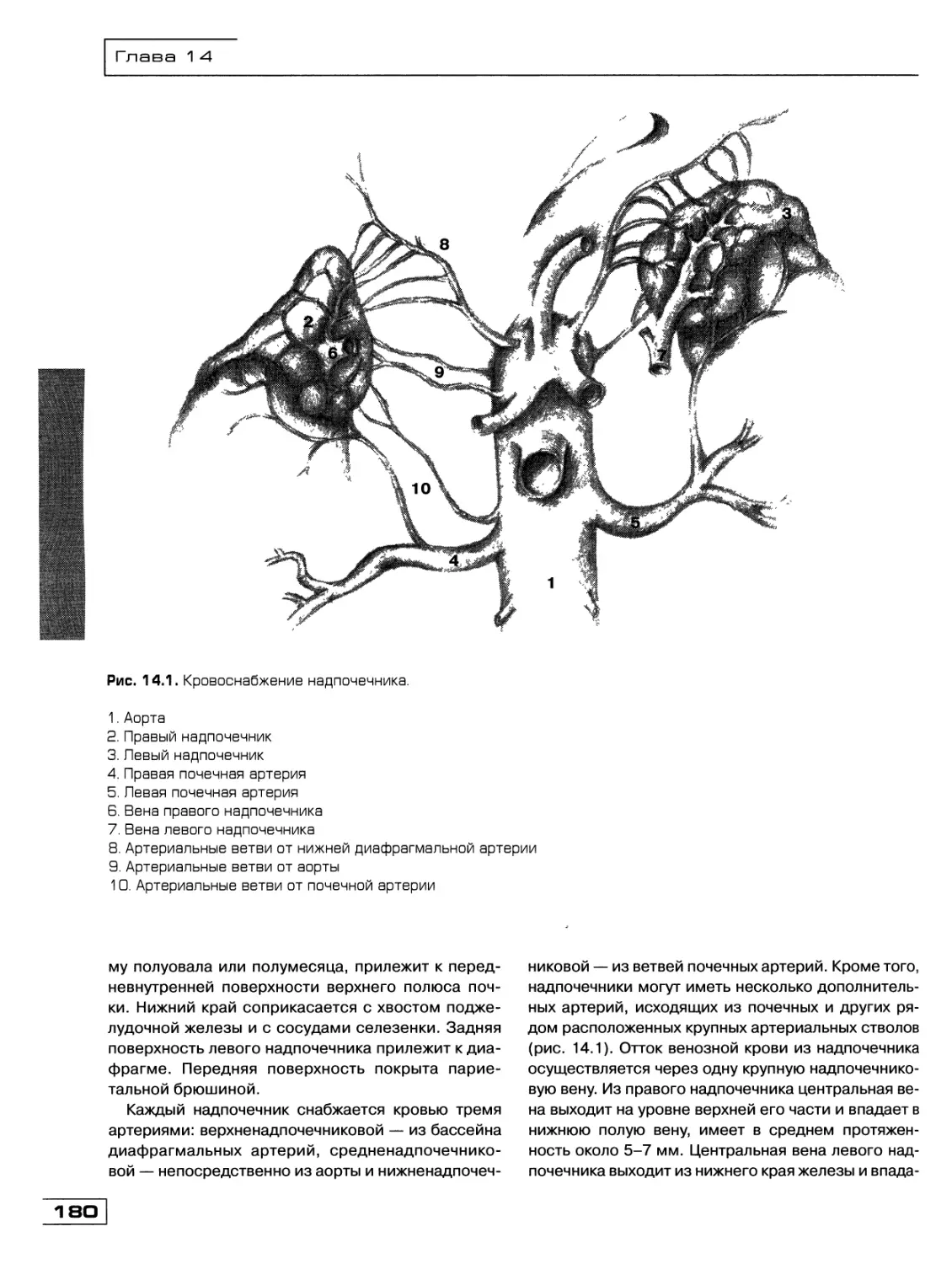
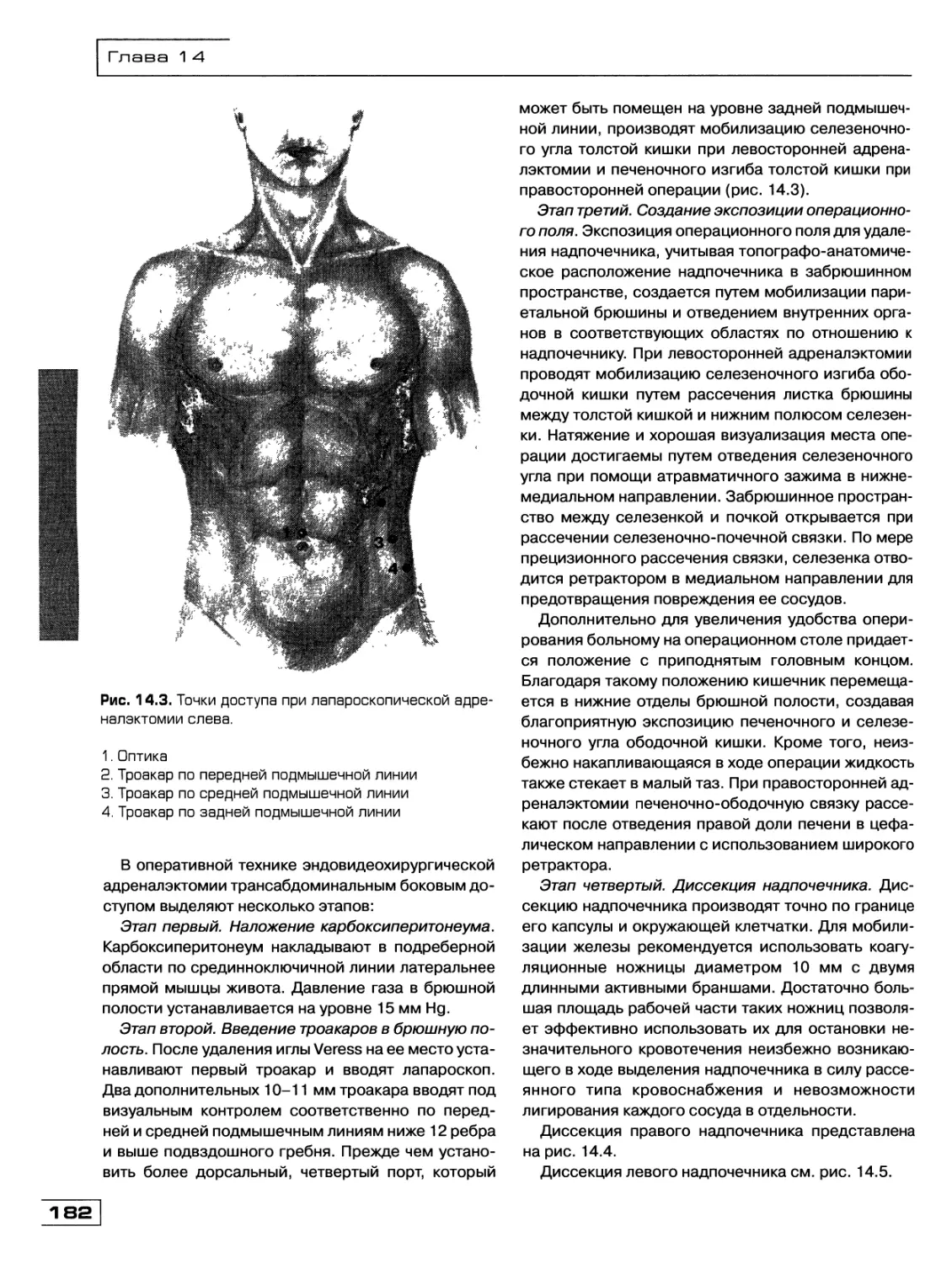
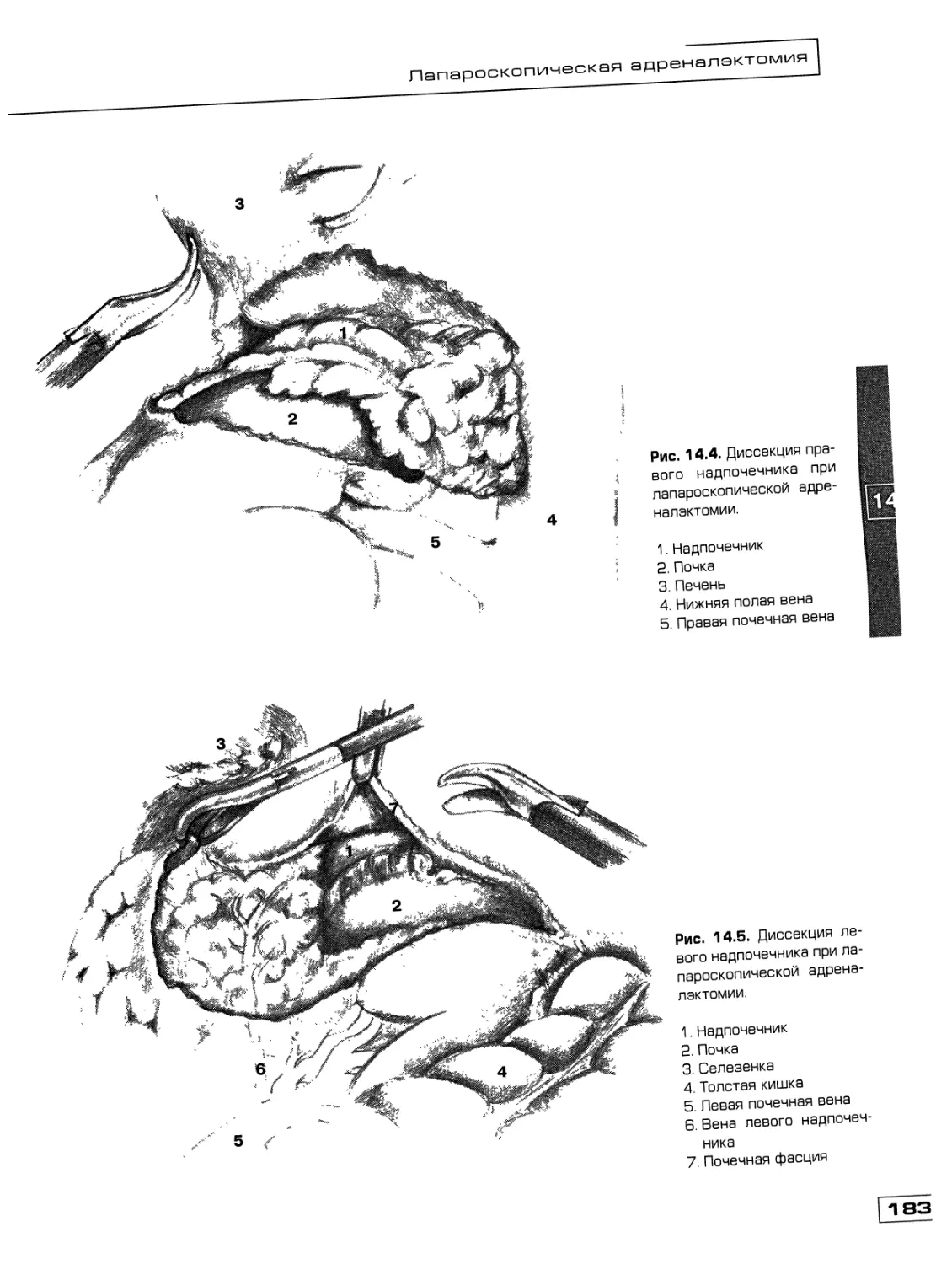
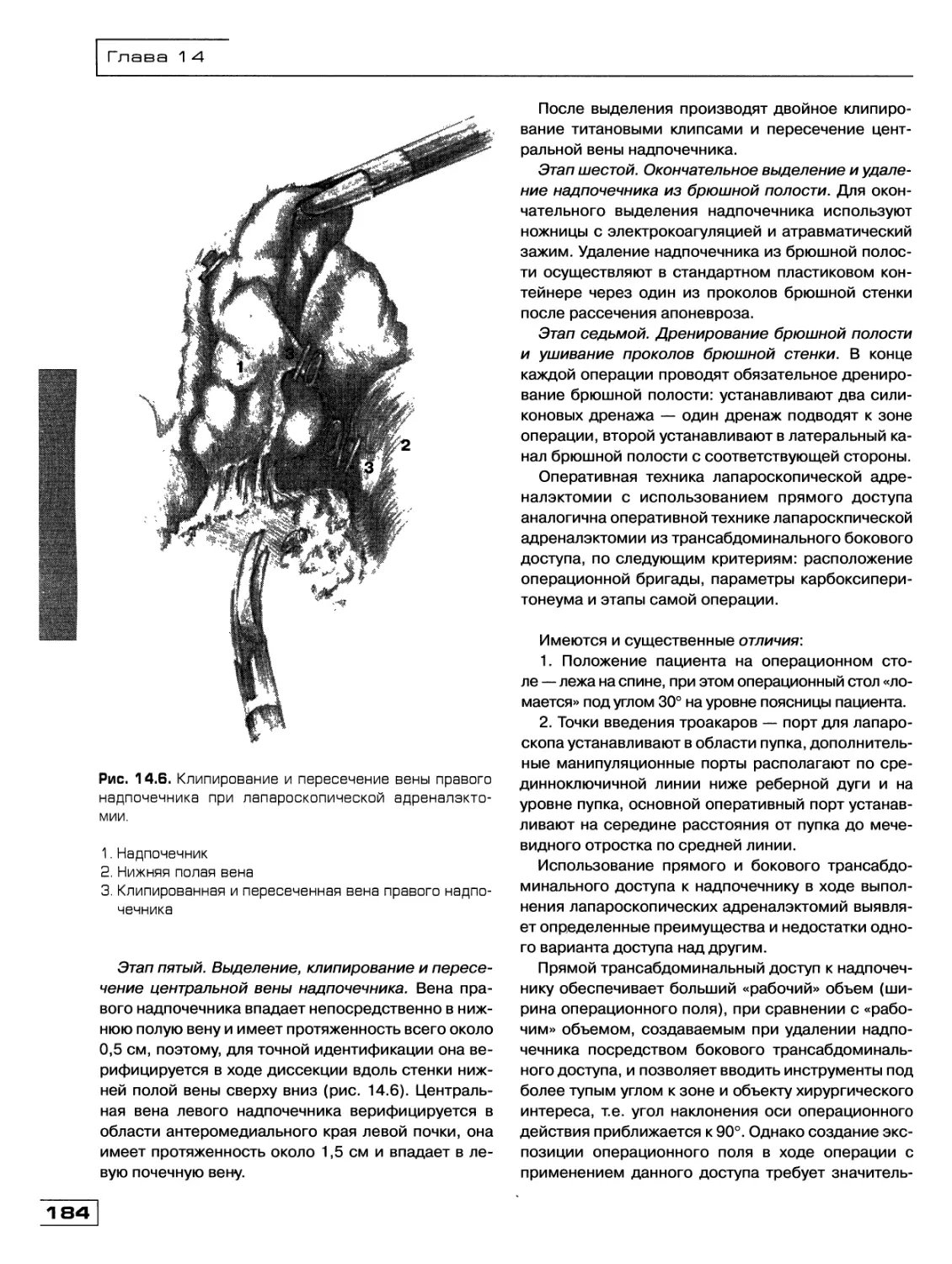
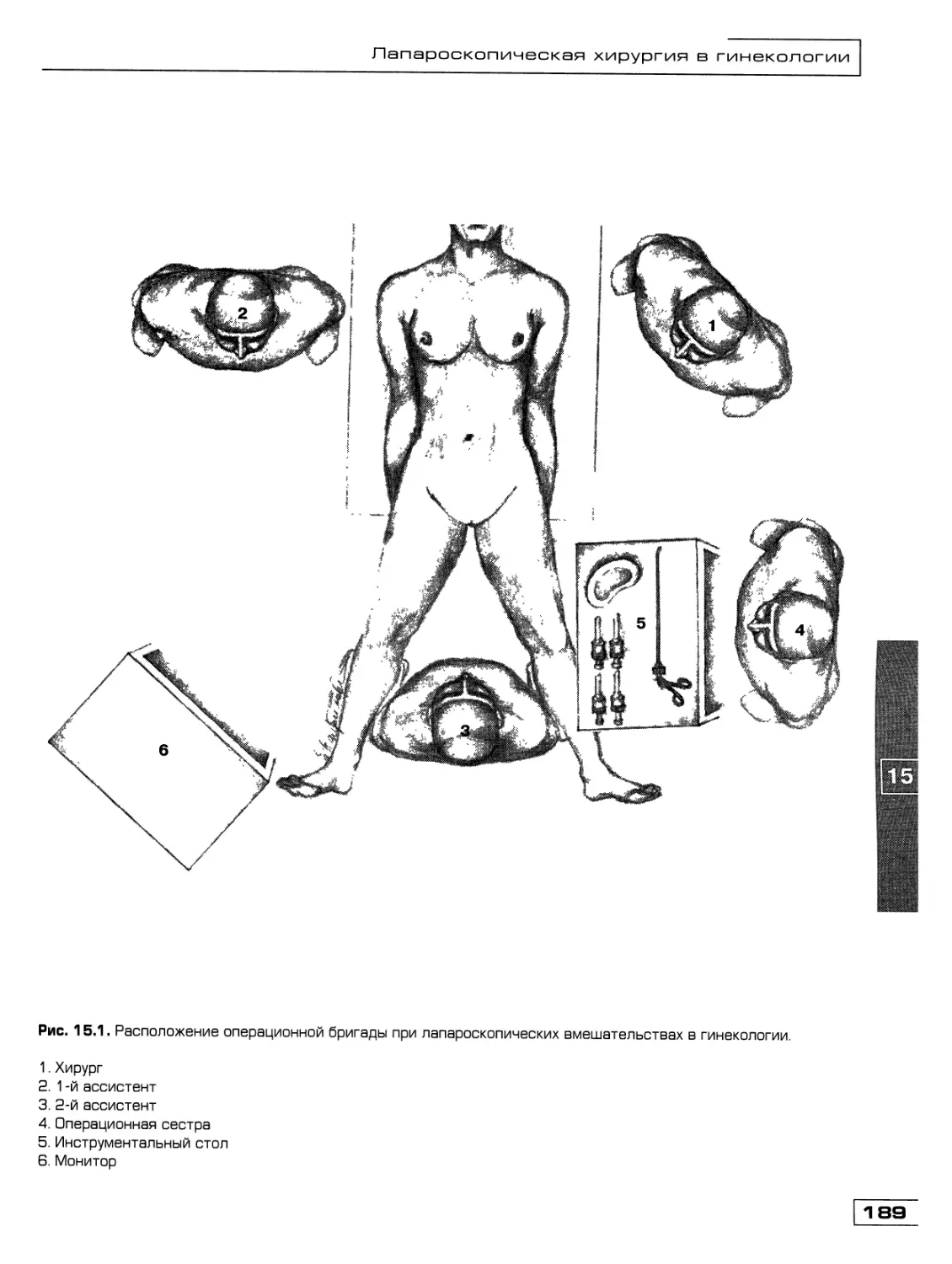
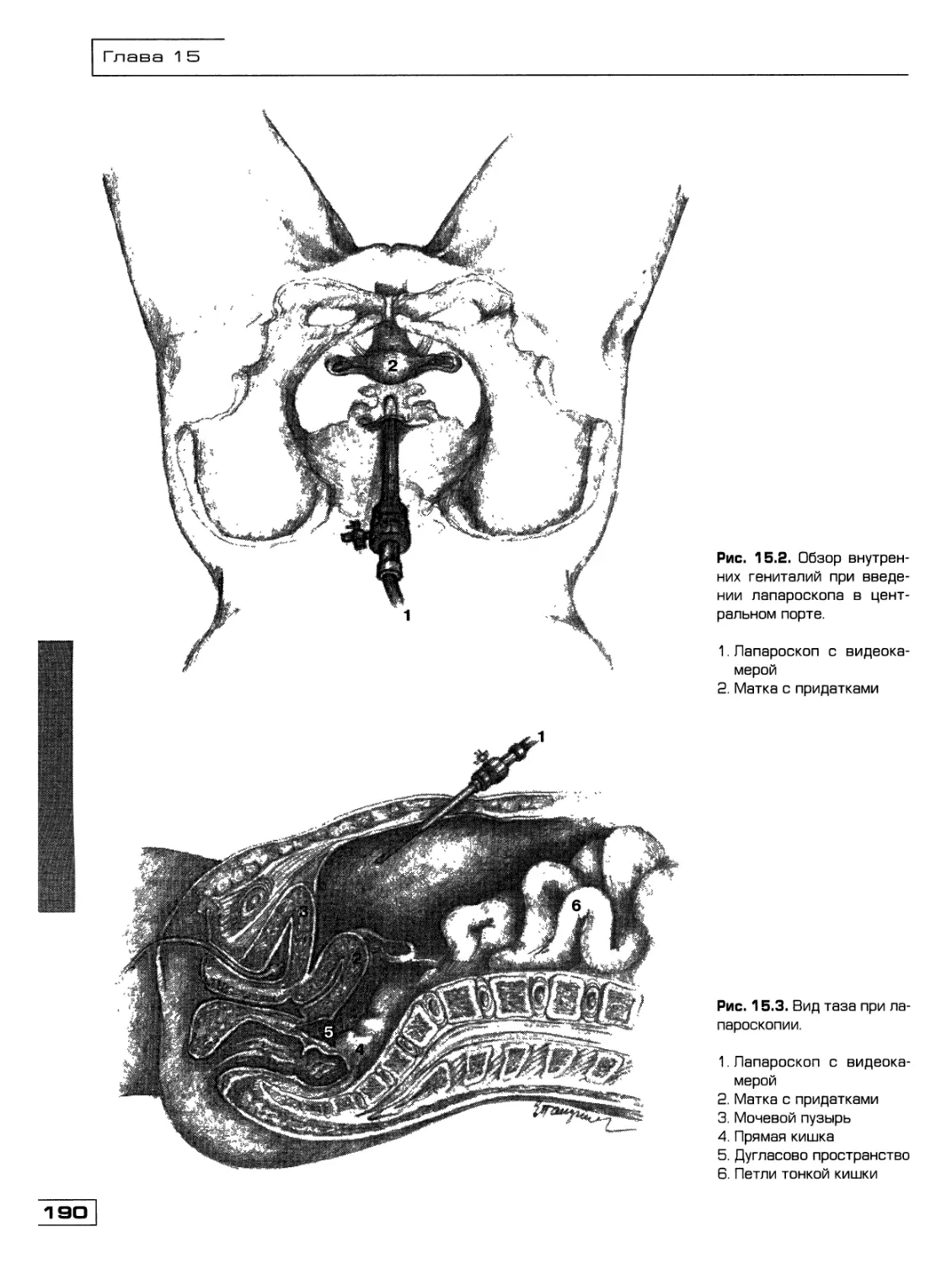
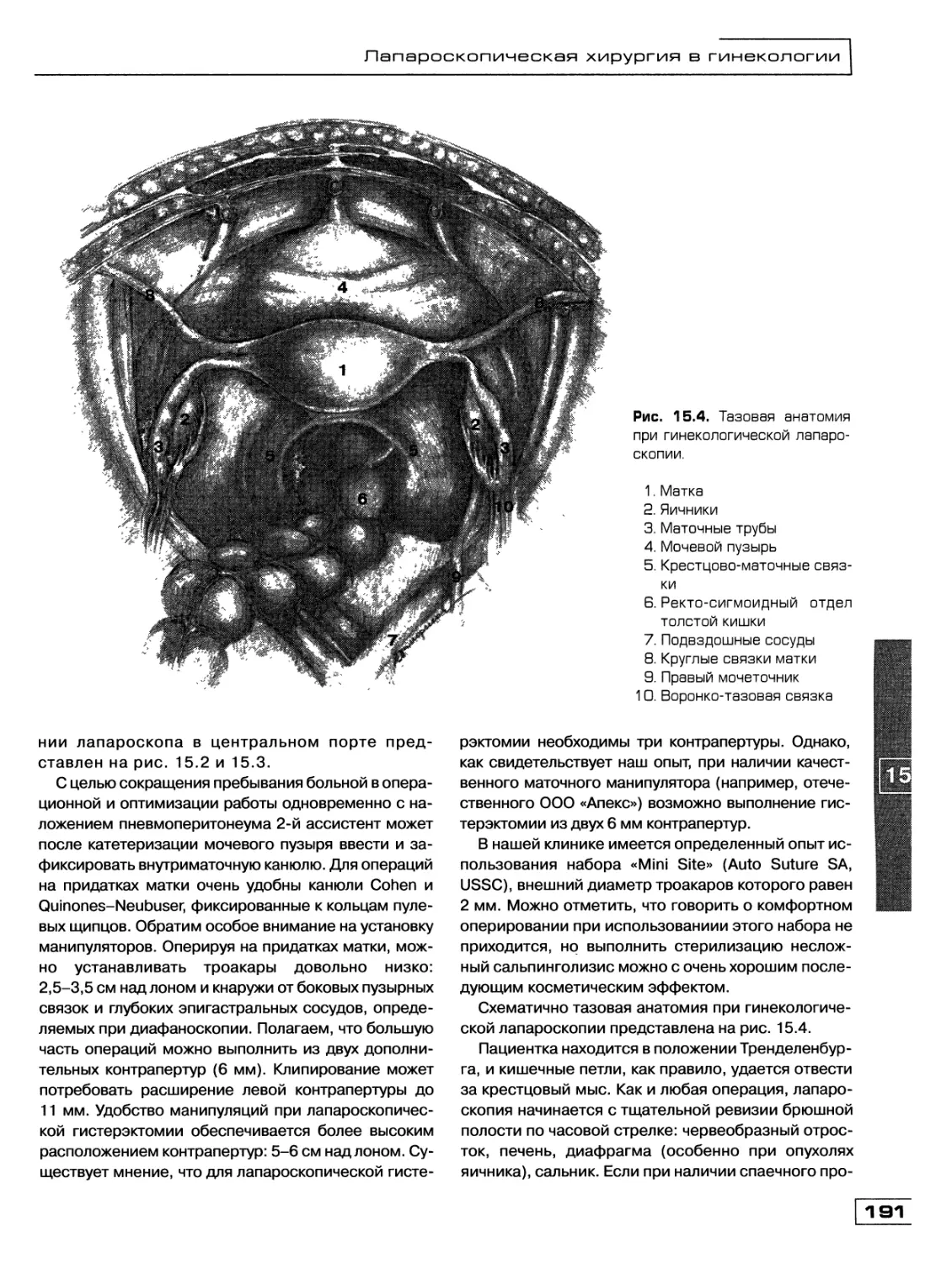
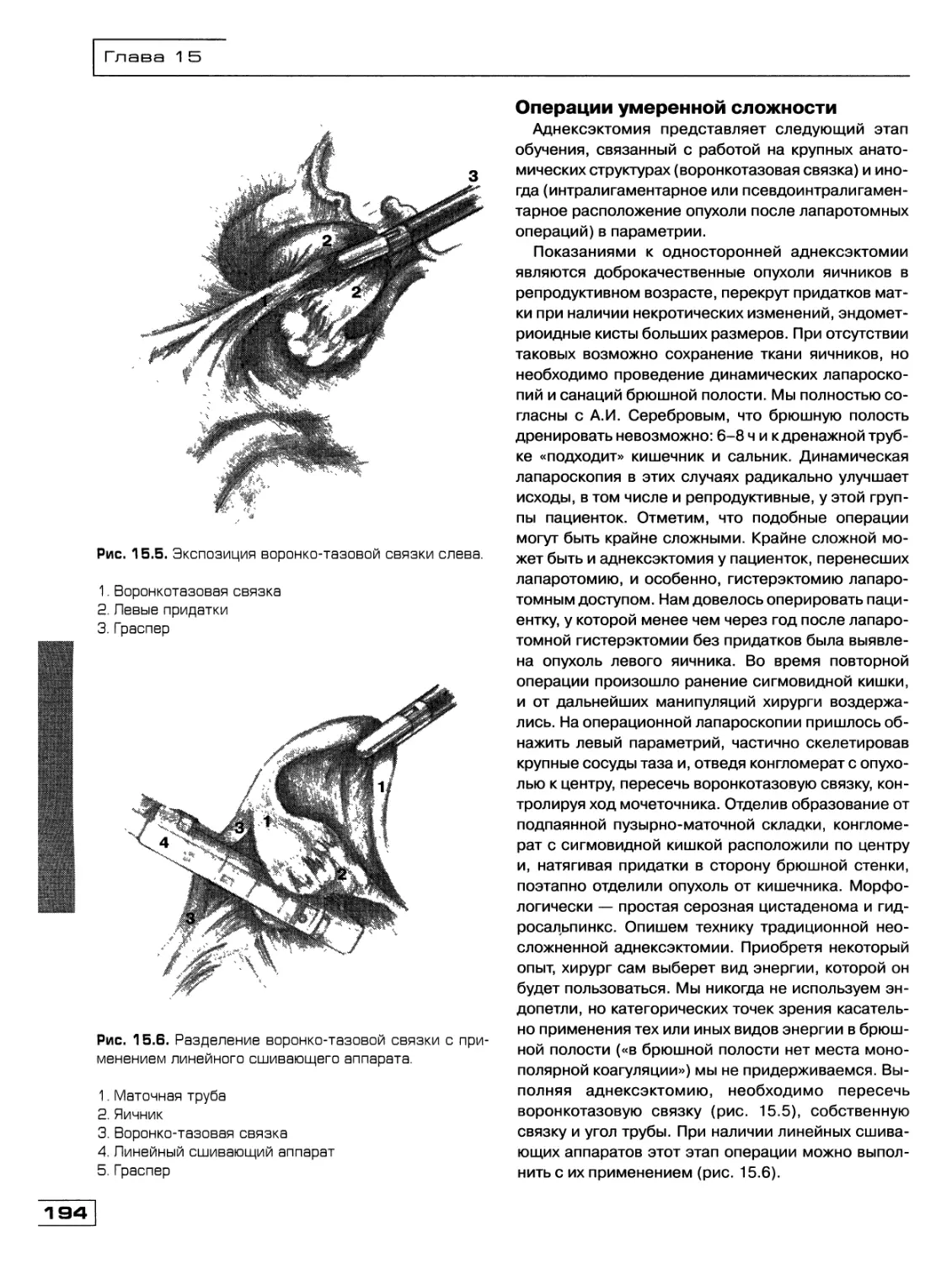
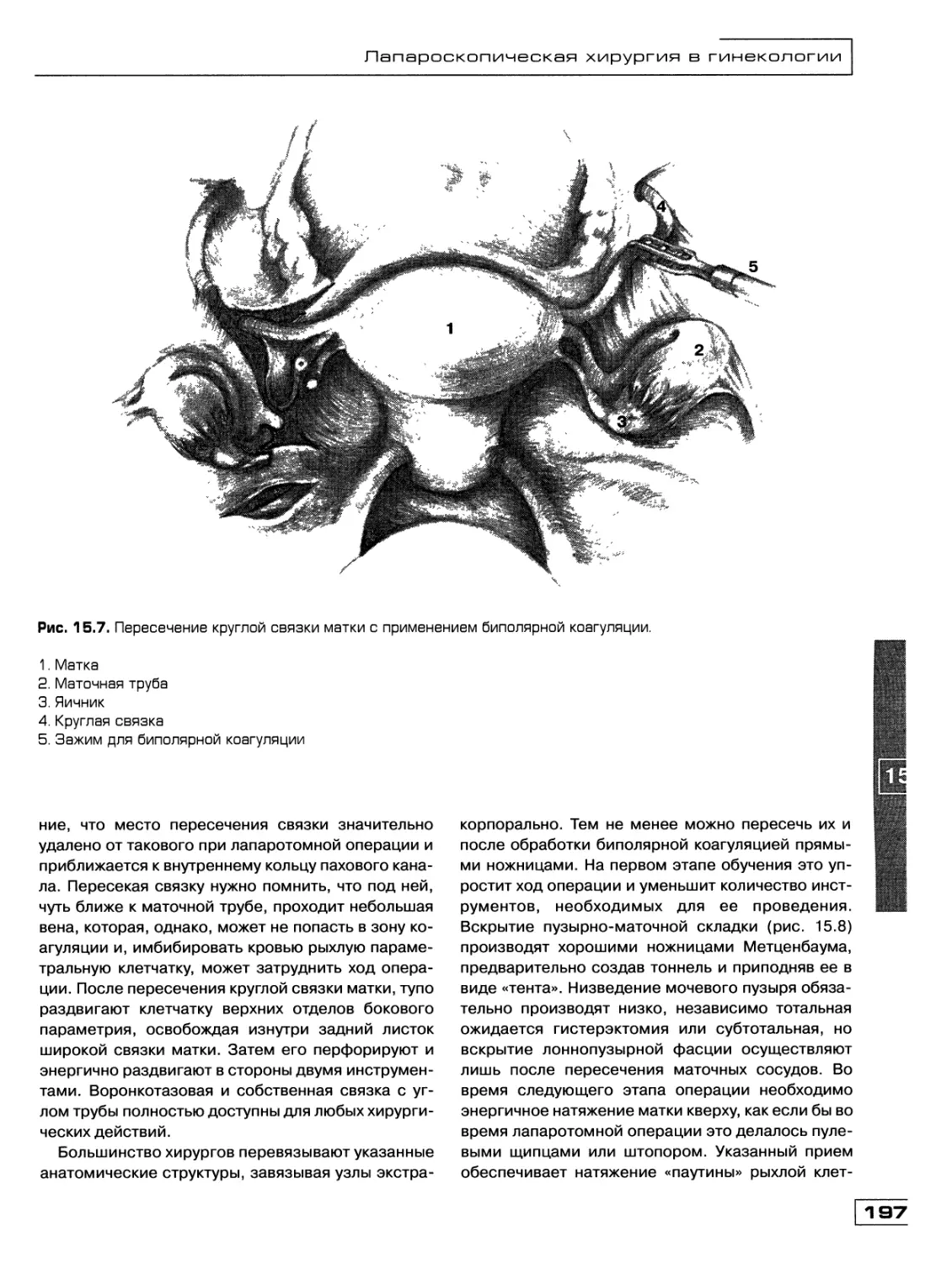
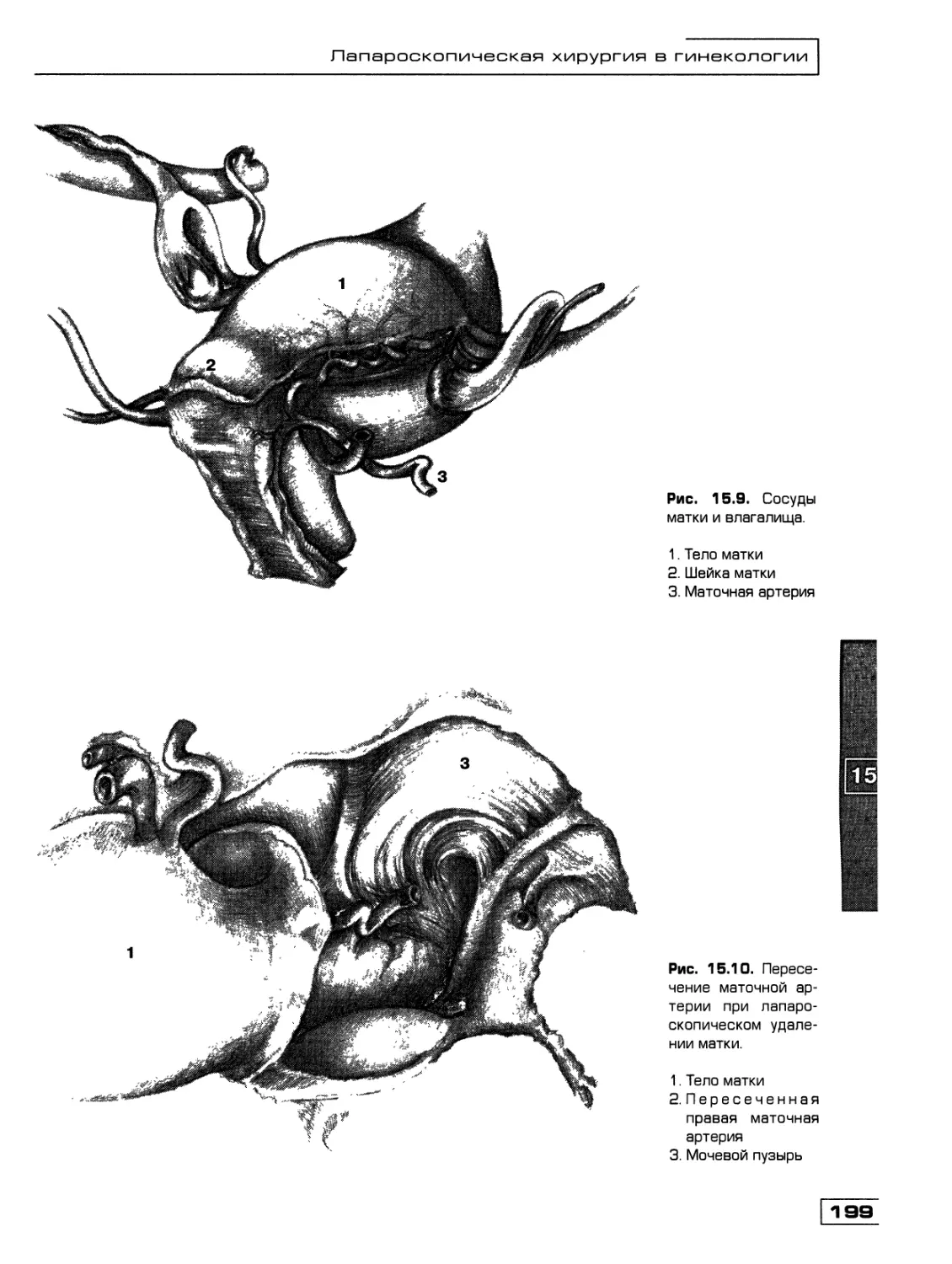
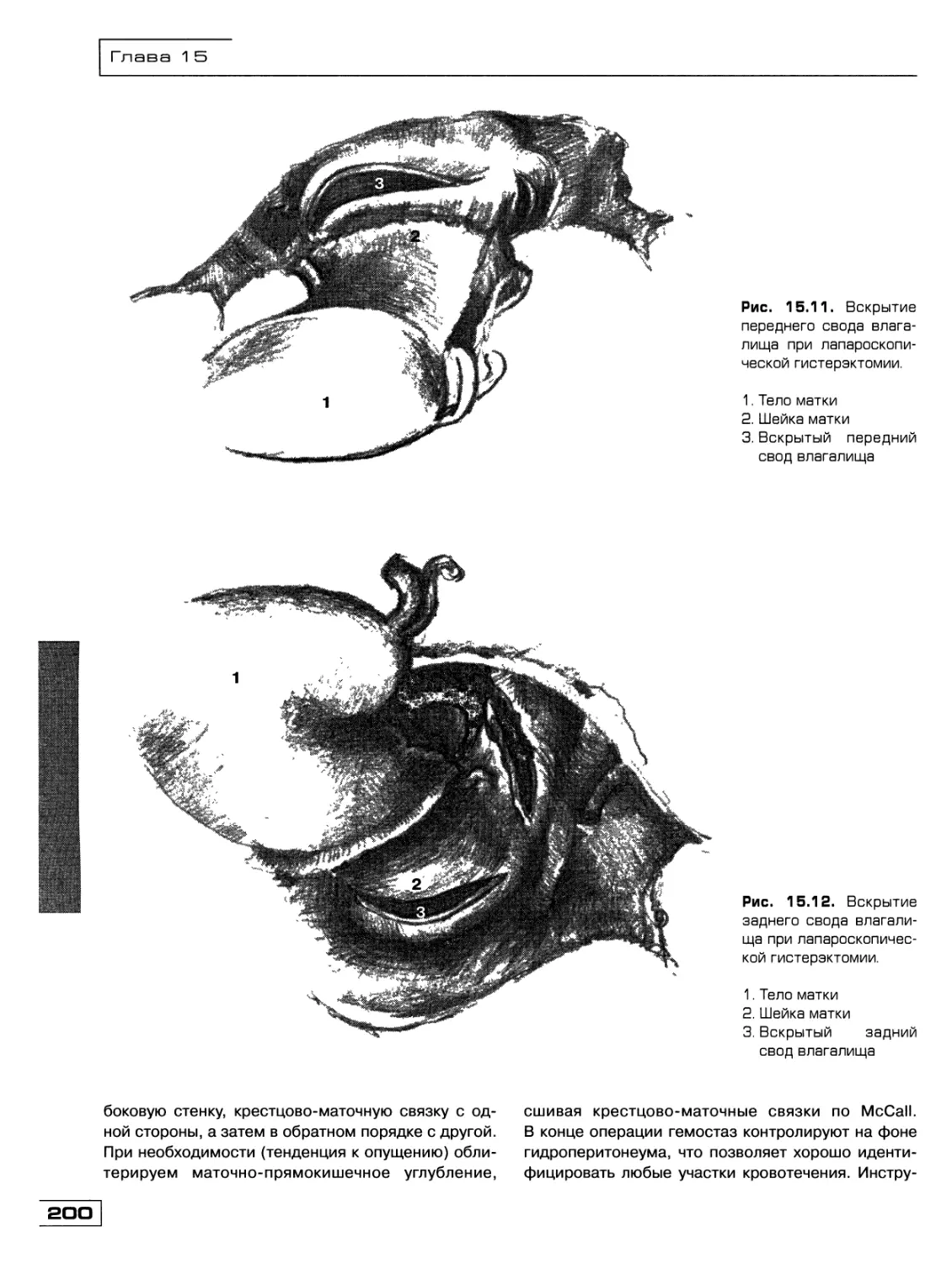
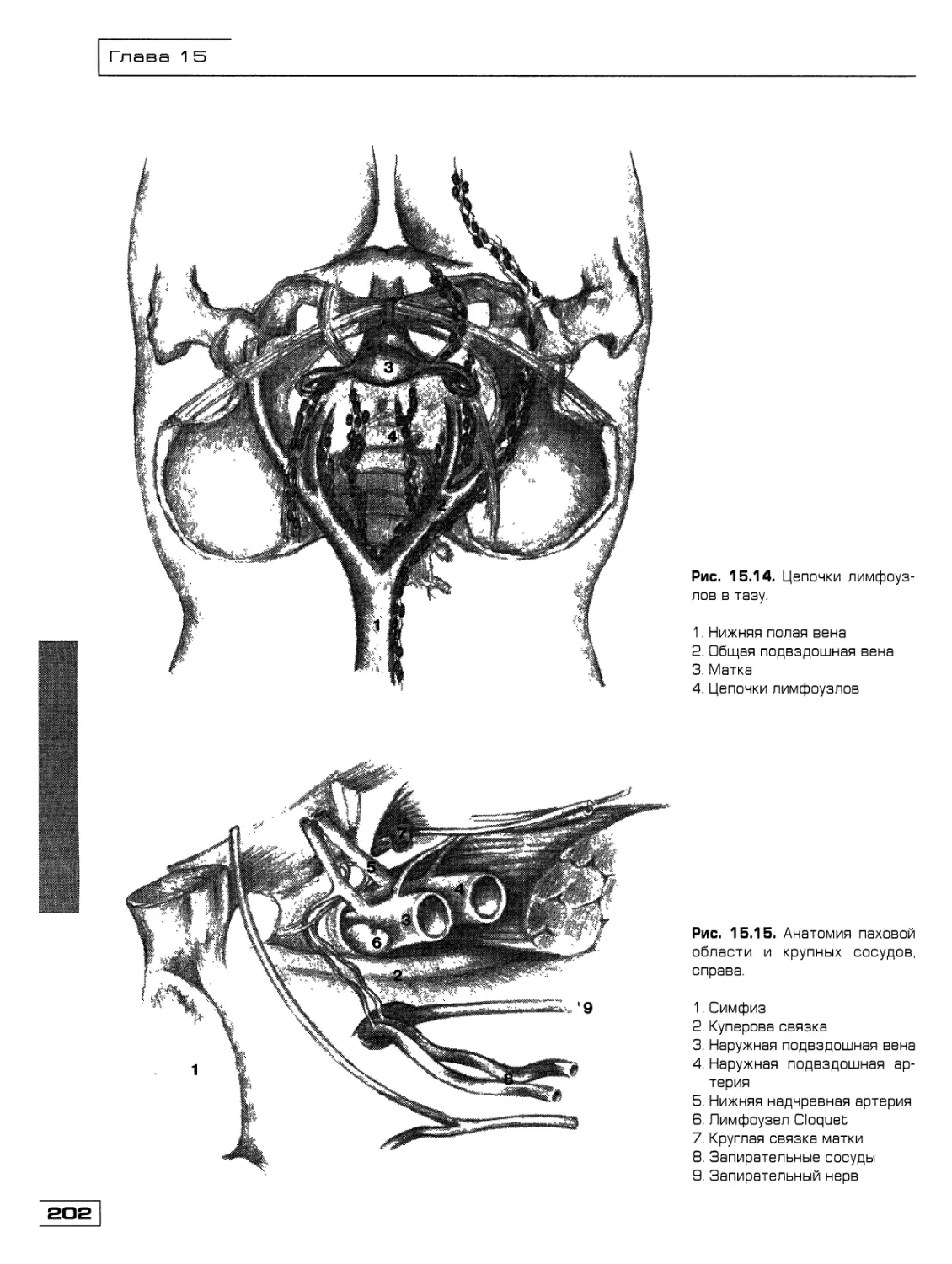
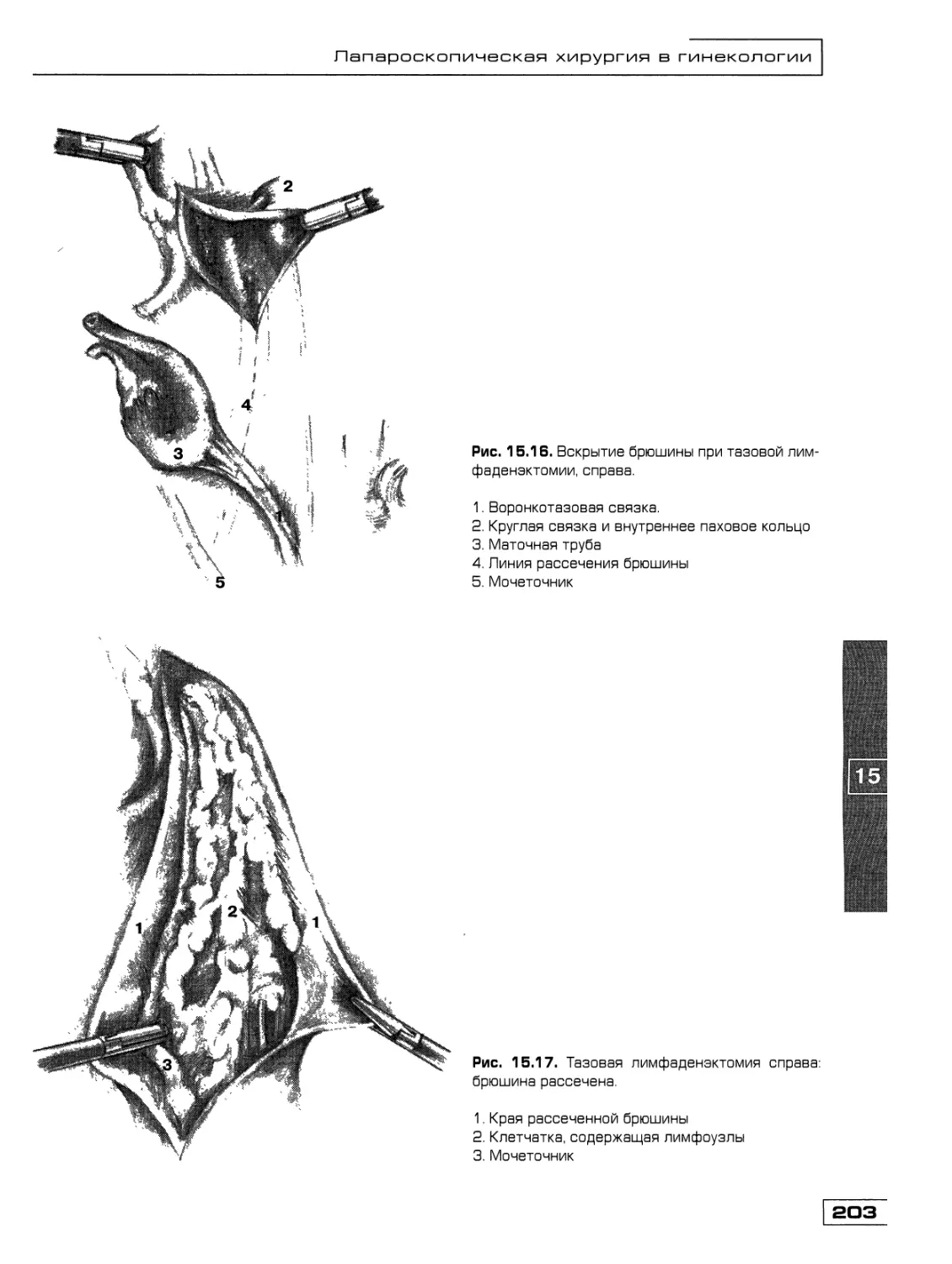
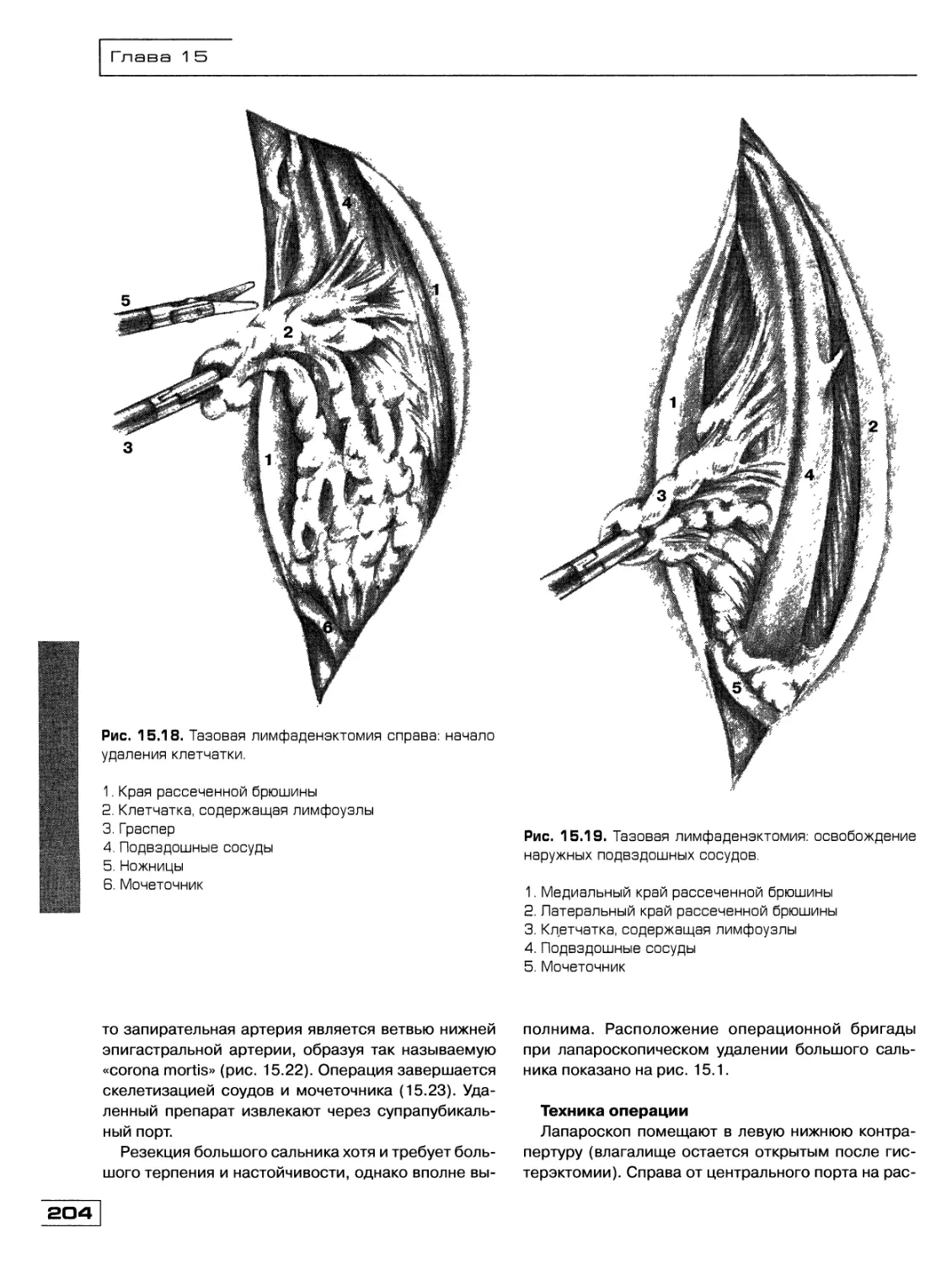
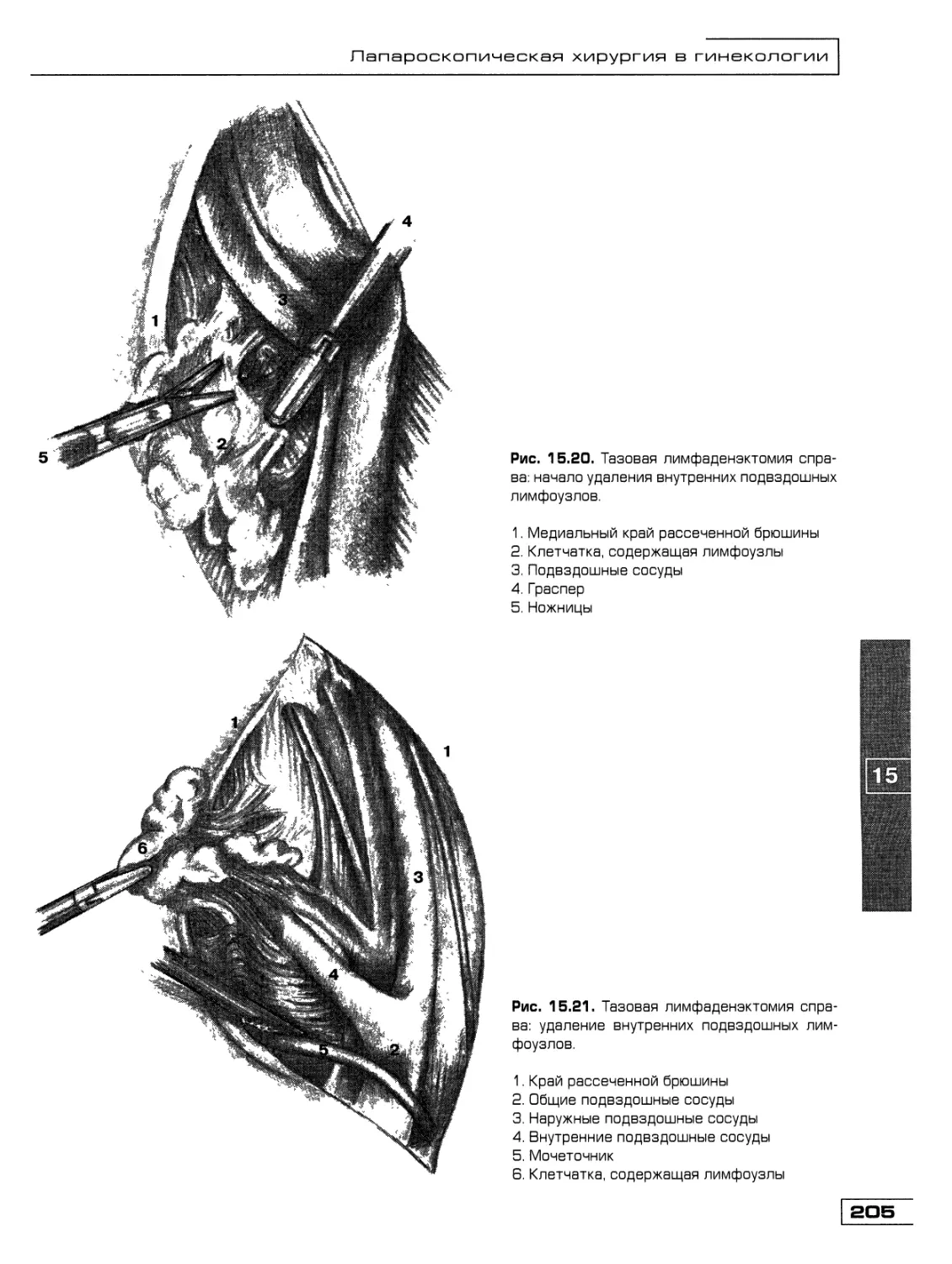
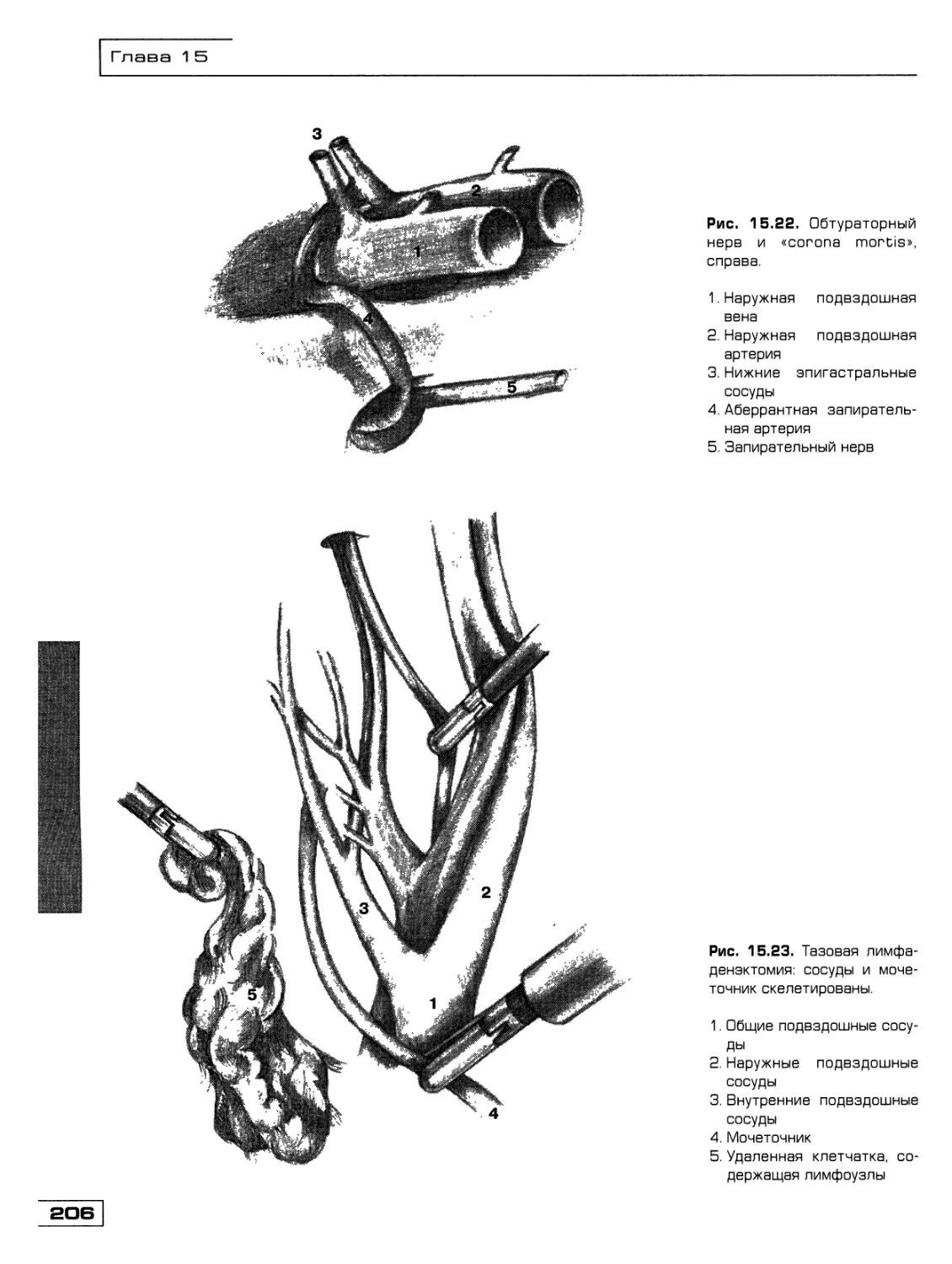
Текст
Иллюстрированное
по эндоскопической
Под редакцией
СИ. Емепьяг
.Медицинское
информационно*
агентство
Иллюстрированное
руководство
по эндоскопической
хирургии
Учебное пособие
для врачей-хирургов
Под редакцией профессора
СИ. Емельянова
Рекомендовано Учебно-методическим объединением
по медицинскому и фармацевтическому образованию вузов России
в качестве учебного пособия для системы послевузового
профессионального образования врачей
МЕДИЦИНСКОЕ
ИНФОРМАЦИОННОЕ
АГЕНТСТВО
Москва — 2004
Оглавление
Введение
(СИ. Емельянов) 5
Глава 1. История эндоскопической хирургии
(Н.Л. Матвеев, В.В. Феденко, ОМ. Фомичев) 7
Глава 2. Техническое обеспечение эндохирургических операций
(А.В. Федоров, В.В. Евдошенко, В.А. Вишневский) 14
Глава 3. Общие вопросы эндохирургической техники
(Н.Л. Матвеев, И.Е. Хатьков, В.В. Феденко) 36
Глава 4. Анестезиологическое обеспечение в лапароскопической
хирургии
(В.В. Феденко, И.К. Бобринская, Е.М. Левитэ) 52
Глава 5. Общие осложнения лапароскопических операций
(И.Е. Хатьков, СИ. Емельянов) 58
Глава 6. Лапароскопическая хирургия желчных путей
(В.В. Феденко, СИ. Емельянов) 64
Глава 7. Лапароскопическая хирургия желудка
(Н.Л. Матвеев, СИ. Емельянов) 115
Глава 8. Лапароскопическая хирургия толстой кишки
(И.Е. Хатьков, СИ. Емельянов) 131
Глава 9. Лапароскопическая аппендэктомия
(ОМ. Фомичев) 146
Глава 10. Лапароскопическая хирургия паховых грыж
(А.В. Протасов, СИ. Емельянов) 151
Глава 11. Лапароскопическая хирургия поджелудочной железы
(В. Пономарев) 159
Глава 12. Лапароскопическая спленэктомия
(Д.Ю. Богданов) , 1 67
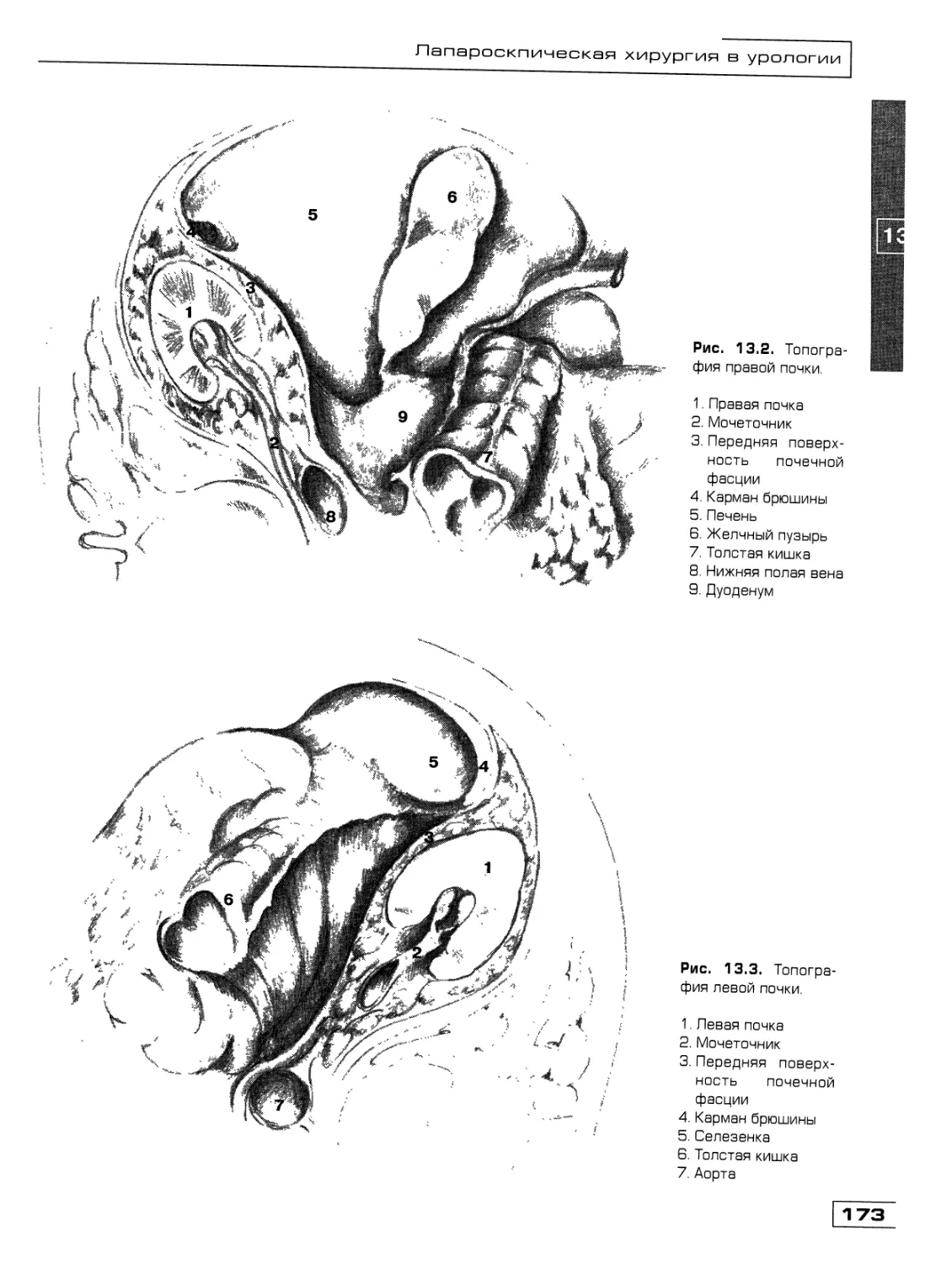
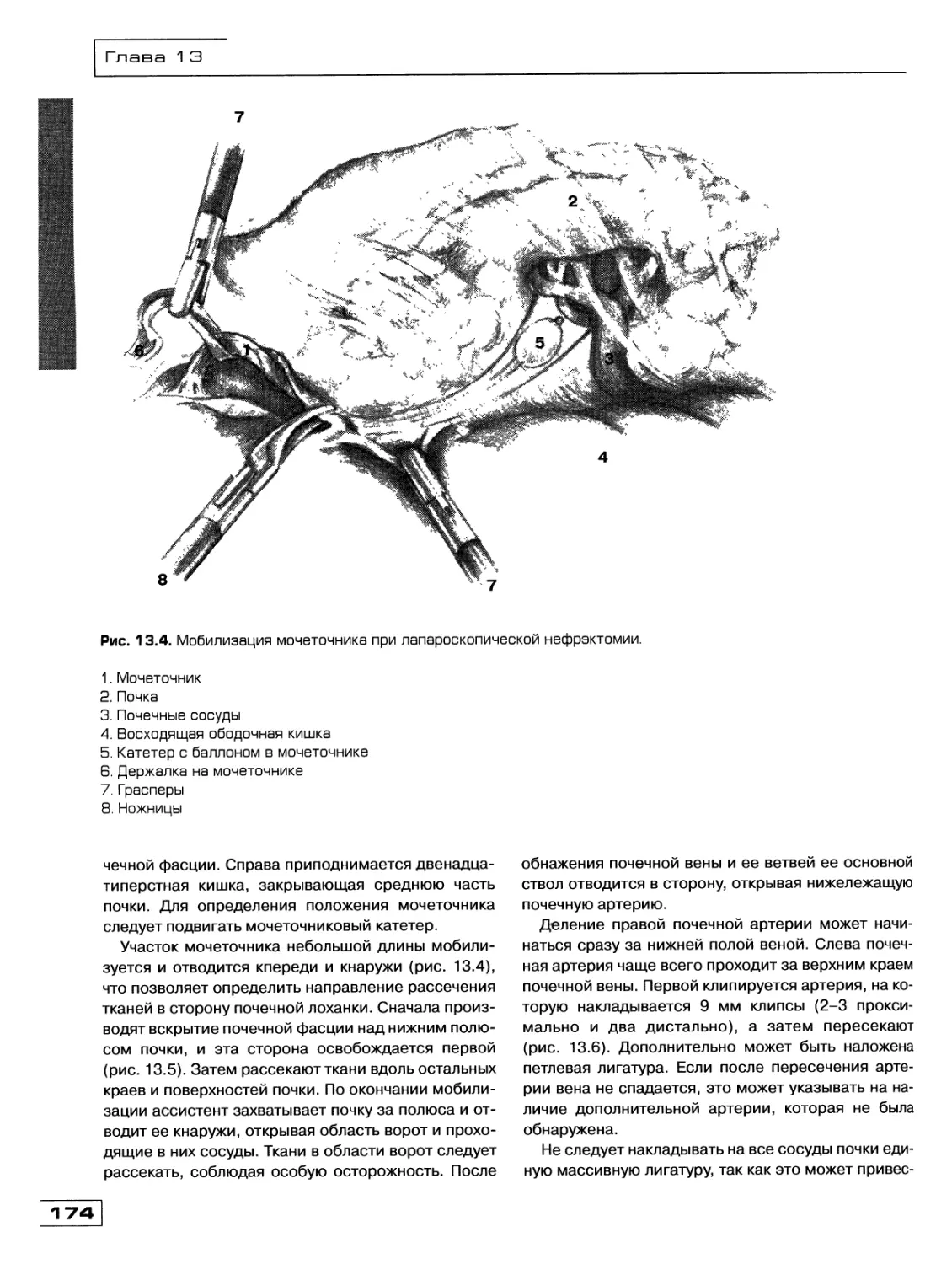
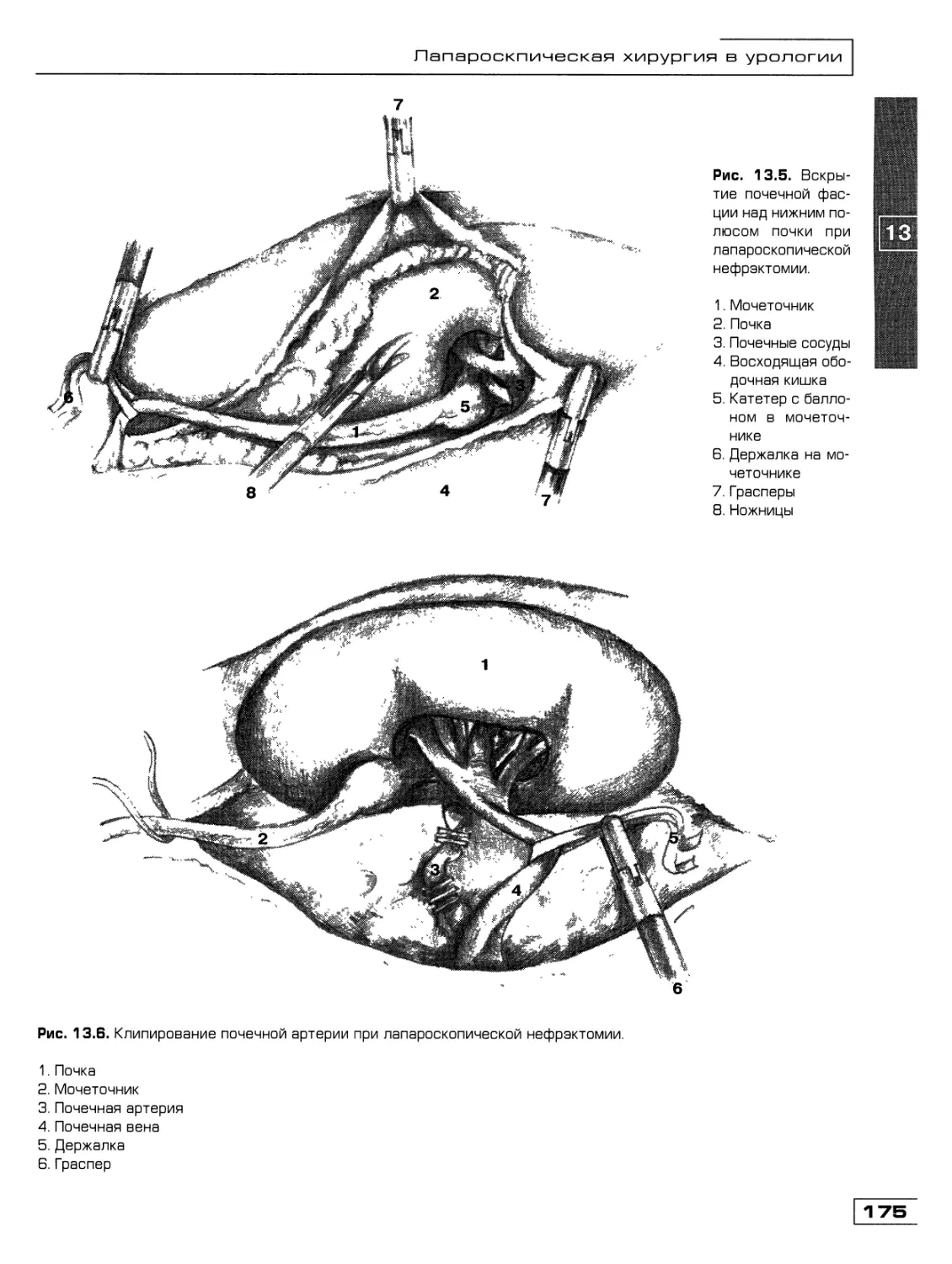
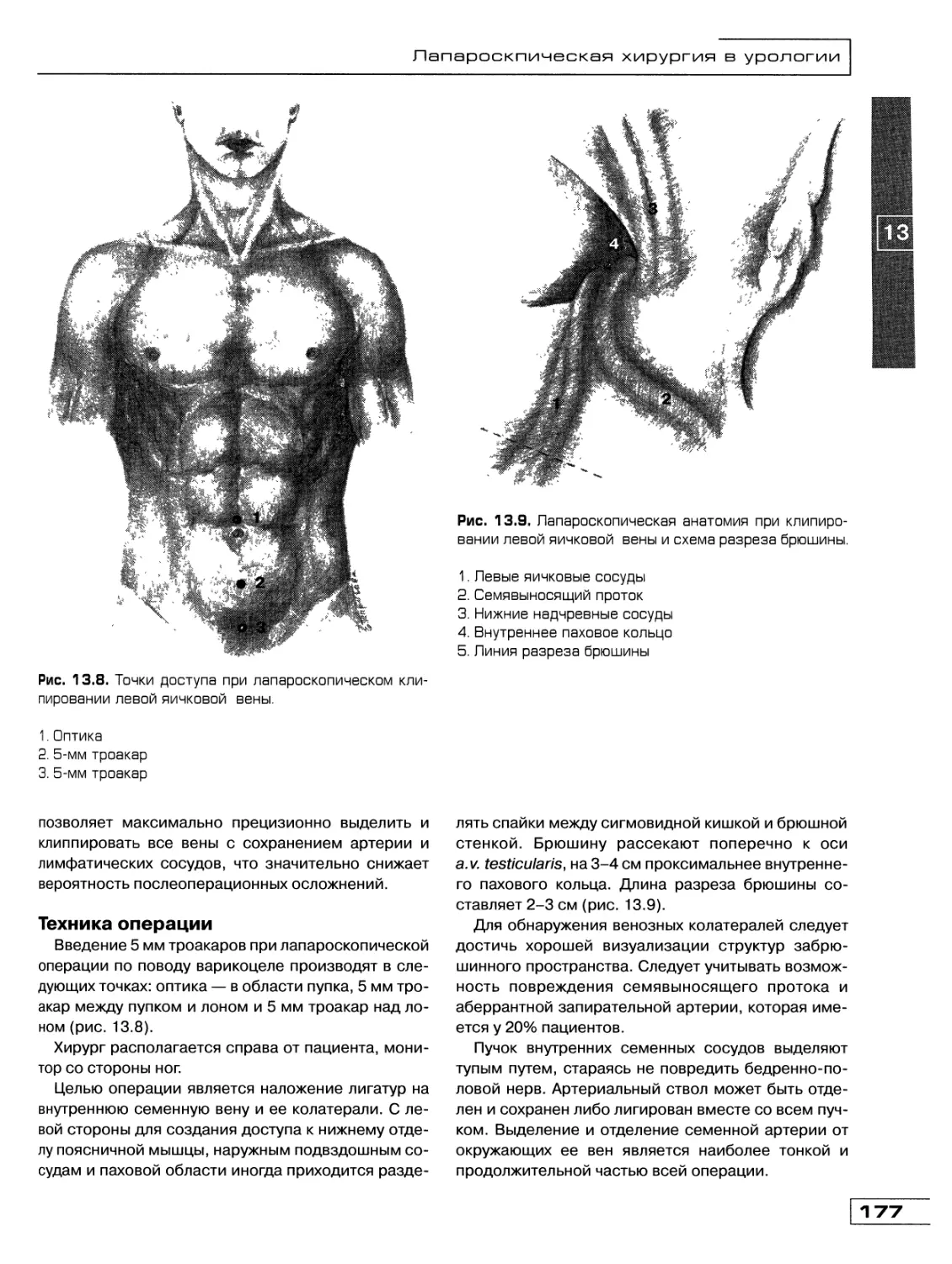
Глава 13. Лапароскопическая хирургия в урологии
(Д.Ю. Богданов, О.М. Фомичев) 171
Глава 14. Лапароскопическая адреналэктомия
(Д.Ю. Богданов, СИ. Емельянов) 179
Глава 15. Лапароскопическая хирургия в гинекологии
(И.Б. Манухин, М.М. Высоцкий) 1 88
Глава 16. Компьютерные технологии в эндохирургии
(С.А.Панфилов, О.М.Фомичев) 208
История
эндоскопической
хирургии
Во все времена хирургов не удовлетворял тот
факт, что доступ к объекту хирургического
вмешательства в какой-либо полости человеческого тела
может занимать почти такое же время, что и
операция в этой полости. Хирургическая травма при таком
доступе часто более значительна, чем травма,
нанесенная во время основного этапа операции. Для
преодоления этого обстоятельства были
разработаны разрезы, максимально предохраняющие ткани, а
также специальные ретракторы — инструменты,
помогающие выполнять хирургические манипуляции
через наименьшие разрезы. Однако маленький
разрез почти всегда делает операцию трудоемкой и
вряд ли сокращает ее время, поэтому ироничные хи-
,,рурги прозвали эти попытки «хирургией через
замочную скважину» («key-hole surgery»). По той же
причине часто употребляется старое немецкое
выражение «Grosse Chirurge machen grosse Schnitte»
(«Большой хирург делает большой разрез»). С
другой стороны, хорошо известно, что больные во
многом оценивают качество операции по тому, что они
могут видеть на своей коже, — рубцу.
В этой связи вспомним основные этапы развития
лапароскопии и лапароскопической хирургии,
имена выдающихся хирургов и изобретателей,
поставивших своей целью помочь больному, причиняя
ему меньшие страдания.
Считается, что первая эндоскопия была
выполнена арабским врачевателем X столетия Abdul Quasim
(936-1013). Объектом его исследования была
шейка матки. Для освещения использовался
стеклянный зеркальный рефлектор. Однако уже у
Гиппократа D60-375 до н.э.) встречается описание
ректоскопии: «Уложить пациента ... и осмотреть
пораженные участки прямой кишки при помощи
рефлектора». Кажется невероятным, но на развалинах
Помпеи, в городе, который был разрушен в 70 г. нашей
эры, было найдено трехлепестковое вагинальное
зеркало.
Первый экстракорпоральный источник света для
медицинских целей был создан R.P. Arnaud
A651-1723) — французским хирургом и
гинекологом: он представлял собой покрытый серебром
цилиндр, в котором свет свечи собирался в один луч
при помощи конвексных линз.
Один из первых эндоскопов был создан Джоном
Фишером (John D. Fisher) в 1827 г. и представлял
собой инструмент, имеющий вид изогнутой трубки,
снабженной рефлекторами для отражения пламени
свечи, служившей в качестве источника света.
В 1806 г. Philip Bozzini A773-1809) создал
эндоскоп, конструкция которого была названа
«LICHTLEITER». Источником света для него служила
свеча. Эта конструкция стала очень популярной, и
на ее основе были созданы многочисленные
модификации эндоскопов.
«Отцом эндоскопии» многие считают
французского хирурга Antonin Jean Desormeaux, который в
1853 г. в качестве источника света в своем
эндоскопе использовал газовую лампу, а свет при этом
отражался серебряным зеркалом. Его инструмент
являлся модификацией аппарата Bozzini.
Ernst Fursterheim в 1863 г. модифицировал и
упростил устройство, сконструированное Antoine Jean
Desormeaux, создав инструмент, снабженный
масляной лампой, помещенной в металлический кожух.
Gustave Trouve в 1873 г. в Вене представил на суд
медицинской общественности «полископ», пред-
Глава 1
назначенный для гастроскопии и цистоскопии,
яркость свечения платиновой проволоки в котором
регулировалась при помощи реостата. В созданном
Trouve полископе встроенная в концевую часть
аппарата платиновая нить при прохождении через нее
электрического тока давала достаточно яркое
свечение, но приводила к столь значительному
разогреву окружающих тканей, что время исследования
приходилось ограничивать 20 с.
Во второй половине XIX столетия Josef Leiter
создал гастроскоп. В 1880 г. он был усовершенствован
Maximilian Nitze: конструкция типа «хвост лобстера»
была дополнена резиновой трубкой для
предотвращения повреждения слизистой оболочки
исследуемого органа.
В 1881 г. Johann Mikulicz внес в конструкцию,
созданную Josef Leiter, свои изменения.
Max Nitze и Josef Leiter к 1883 г. создали целый
ряд «электроэндоскопических инструментов».
В конце XIX в. процедура гастроскопии, которая и
сегодня остается далеко не приятной, была
чрезвычайно болезненной и часто сравнивалась с
глотанием шпаги не только потому, что гастроскоп своим
внешним видом напоминал шпагу, но и потому, что в
нем таилась не меньшая угроза для жизни больного.
Одновременно с первым опытом проведения
эндоскопических процедур возникли проблемы их
документирования. Первые эндоскопические
фотографии собственной глотки были получены Johann
Nepomuk Czremark в 1858 г.
В 1874 г. Theodor S. Stein удалось выполнить
фотографии патологических образований,
визуализированных при проведении цистоскопии. Для
фотографического документирования эндоскоп был
специально модифицирован и получил название «pho-
toendoscope» (фотоэндоскоп).
Первая эндокамера, сконструированная Theodor
S. Stein, называлась «Heliopiktor». Для улучшения
качества фотографий в ней была использована
магниевая вспышка.
В 1912 г Jacobaeus включил в свою монографию,
посвященную лапароскопии, 8 черно-белых и
5 цветных рисунков. В 1927 г. иллюстрированный
атлас («Lehrbuch und Atlas der Laparo-und Thorako-
skopie»), изданный Korbsch, содержал 17
акварельных рисунков.
В 1913 г. Nordenoeft получил первые фотографии
эндоскопической картины таза трупа женщины.
Cohen и Guterman A953) выполнили первые
прижизненные эндофотографии, применив технологию
Kodachrome. Фотографии были отличного качества,
но из-за несовершенства оптической системы их
размер не превышал 6 см в диаметре.
Камера, которая могла крепиться на гастроскоп,
была разработана Hennings в 1931 г. Эта камера
также могла использоваться при лапароскопии.
Первые лапароскопические фотографии были
опубликованы Kalk в 1942 г. Caroli и Foures для улучшения
качества фотографий первыми использовали
встроенную электронную вспышку.
D.D. Smith описал передачу света от внешнего
источника света к точке осмотра через стеклянный
цилиндр еще в 1899 г. Примерно в это же время
Thompson рекомендовал использовать для этой же
цели расплавленный кварц. Однако использование
в клинике этого принципа передачи света
произошло только через 50 лет, а именно в 1952 г., когда
N. Fourestier, A. Gladu и J. Valmiere из Парижского
Института оптики опубликовали опыт
использования жесткого бронхоскопа, свет в котором
передавался от внешнего источника по кварцевому
цилиндру. До этого источник света крепился к дис-
тальному концу эндоскопа и при выполнении
исследования находился внутри тела, что повышало
риск теплового и электрического травмирования
тканей.
Существенную роль в развитии
лапароскопической изобразительной техники сыграл английский
физик-оптик Harold H. Hopkins.
В конце 40-х гг. в Лондоне гастроэнтеролог Hugh
Gainsborough в беседе с Hopkins заинтересовал его
проблемой ригидной гастроскопии — процедуры,
которую большинство больных переносили с
большим трудом. Получив в 1952 г. грант на разработку
систем передачи изображений по гибким трубкам, в
1954 г. Hopkins совместно со
студентом-старшекурсником N.S. Карапу в статье журнала «Nature»
описали «fiberscope» — устройство, способное
передавать изображения по гибкому стекловолокну.
В 1960 г. профессор Harold H. Hopkins был
приглашен в Дюссельдорф на международную
конференцию, посвященную медицинским
изображениям, где продемонстрировал цветные снимки
внутренней поверхности мочевого пузыря, сделанные
James Gow, который использовал цистоскоп с
цилиндрическими линзами. Вскоре после этого
состоялся телефонный разговор Н. Hopkins с
известным производителем хирургического
инструментария Karl Storz, в ходе которого было
достигнуто соглашение о промышленном производстве
эндоскопов с системой линз, изобретенной
Н. Hopkins.
В 1964 г. фирмой Karl Storz был сконструирован
первый экстракорпоральный источник холодного
света, световой поток от которого передавался по
стеклянным оптическим волокнам.
История эндоскопической хирургии
В 60-70-е гг. видеооборудование еще было
слишком громоздким и не использовалось в эндохирур-
гии. Только в 1977 г. Yuzpe впервые применил
телекамеру в лапароскопических операциях на органах
малого таза. Развитие микропроцессорной техники
позволило в середине 80-х гг. создать цветные
малогабаритные видеокамеры весом 100-150 г и
мощные источники холодного света (до 400-450 W),
сделавшие возможными осмотр брюшной полости
и проведение хирургических операций без
утомительного следования за окуляром лапароскопа.
Наконец, Nezhata в 1986 г. и Mouret в июне 1987 г.
выполнили первые операции под
видеоэндоскопическим контролем (холецистэктомия).
ИСТОРИЯ ЛАПАРОСКОПИИ
И ЛАПАРОСКОПИЧЕСКОЙ ХИРУРГИИ
Первый официальный отчет о проведении
лапароскопии, который назывался «Осмотр пищевода и
желудка с помощью гибких инструментов»
датируется 23 сентября 1901 г. Он был представлен George
Kelling, дрезденским хирургом, в Гамбурге.
Ученый провел лапароскопию (названную
автором «целиоскопия») с помощью цистоскопа,
созданного Maximilian Nitze в 1887 г.
В 1877 г. Maximilian Nitze создал цистоскоп с
ирригационной системой для охлаждения. В качестве
источника света использовалась платиновая
электрическая лампочка с нитью, закрепленная на конце
инструмента. А в 1887 г. он же снабдил свой
цистоскоп инструментальным каналом для уретральных
проб. Именно с его помощью после создания пнев-
моперитонеума посредством инсуффляции
атмосферного воздуха через особый стерильный фильтр
George Kelling производил осмотр брюшной
полости у живых собак.
В 1901 г. в журнале «Munchner Medizinische
Wochenschrift» George Kelling опубликовал статью,
получившую название «Эзофагоскопия,
гастроскопия и целиоскопия».
Русский гинеколог Дмитрий Оскарович Отт в
1901 г. впервые произвел дистантный осмотр
органов малого таза через кольпотомию, используя для
освещения лобный рефлектор. Исследование
проводилось в положении Тренделенбурга D5°),
брюшная стенка приподнималась пулевыми щипцами. С
1901 г. по 1908 г. Д.О. Оттом было выполнено около
800 таких осмотров, названных автором «вентро-
скопией». Русский ученый считается
основоположником таких эндоскопических наблюдений и
манипуляций как диагностика и лечение овариальных
кист и опухолей, лечение «инфекции в трубах и экто-
пированной беременности», удаление фибромио-
матозных узлов в матке.
В октябре 1910 г. H.Ch. Jacobaeus, профессор
медицины Стокгольмского университета, в журнале
«Munchner Medizinische Wochenschrift» опубликовал
отчет о выполненных им 17 лапароскопиях у
больных с асцитом и двух торакоскопиях у больных с экс-
судативным плевритом. Статья «О возможностях
использования цистоскопа для осмотра серозных
полостей» включала в себя экспериментальную
часть, основанную на введении троакара в грудную
и брюшную полости 20 человеческим трупам.
В отличие от G. Kelling, H.C. Jacobaeus не
использовал иглу для наложения пневмоперитонеума, а
инсуффлировал воздух через троакар с уже
вставленным в него цистоскопом Nitze.
Спустя два месяца после появления этой
публикации G. Kelling в этом же журнале пытался
оспорить приоритет шведского хирурга, указывая на то,
что им в период с 1901 по 1910 г. у двух больных
была успешно проведена целиоскопия, однако отчет
об этом до 1910 г. не был опубликован.
В следующем 1911 г. H.C. Jacobaeus представил
отчет о 115 (!) лапароскопиях и торакоскопиях,
выполненных им у 72 больных, у 45 из которых
имелись заболевания органов брюшной полости и у 27
— заболевания плевры. Только у одного больного
было отмечено серьезное осложнение
(кровотечение) в результате проведения эндоскопической
процедуры.
В 1923 г. G. Kelling после 13 лет «молчания»
опубликовал статью, в которой указывал, что в связи с
тяжелым экономическим положением Германии,
связанным с первой мировой войной, он широко
использовал целиоскопию как диагностический
метод, поскольку у большинства больных не было
финансовой возможности длительно находиться под
наблюдением в стационаре или оплатить эксплора-
тивную лапаротомию. В этой статье Kelling
приводит описание целиоскопической картины цирроза
печени, а также рака желудка. Кроме этого, автор
впервые описывает новый троакар со встроенным в
него каналом небольшого диаметра, который
служил для прохождения воздуха.
Значительный этап в развитии лапароскопии
связан с именем немецкого гастроэнтеролога Heinz
Kalk, основателя немецкой лапароскопической
школы. В 1928 г. Kalk разработал методику
лапароскопической пункционной биопсии печени, а в
1939 г. опубликовал труд, основанный на
исследовании 200 больных, в котором суммировал
результаты биопсий печени, сделанных им под местной
Глава 1
анестезией. В период с 1923 по 1962 г. он и его
ученики разработали или модифицировали
оборудование и методику исследования, основы которых
используются и в настоящее время.
Американский врач John С. Ruddock считал
лапароскопию одним из лучших диагностических
методов. С 1934 по 1957 г. он произвел около 250
лапароскопических исследований, внес свои
модификации в оборудование.
Значительный вклад в развитие
лапароскопической диагностики был внесен Raoul Palmer,
парижским гинекологом, широко использовавшим
лапароскопию в качестве диагностической процедуры.
Им впервые были предложены широко
использующиеся в настоящее время способы определения
положения иглы для инсуффляции (тест Пальмера).
Otto Goetze из Германии в 1918 г. сообщил о
создании иглы для инсуффляции, которая
использовалась в диагностической радиологии. В своей
статье он предположил, что такая игла может быть
использована в лапароскопии.
В 1938 г. Janos Veress из Венгрии изобрел иглу с
подпружиненным мандреном для эвакуации асци-
тической жидкости, а также для эвакуации жидкости
и газа из грудной клетки. Эффективность
использования иглы была продемонстрирована в более чем
2000 случаев. Изобретатель не предполагал
использование иглы в лапароскопии, но на
сегодняшний день — это наиболее широко используемый
инструмент для наложения пневмоперитонеума.
В опубликованной в 1924 г. статье Richard
Zollikofer из Швейцарии рекомендовал
использовать углекислый газ для создания
пневмоперитонеума, так как он, в отличие от фильтрованного
воздуха и азота, исключал возможность внутрибрюшных
взрывов и наиболее быстро абсорбировался
брюшиной.
30-50-е годы отмечены внедрением и быстрым
развитием комбинированной, манипуляционной
лапароскопии.
В 1937 г. Andersen впервые осуществил
лапароскопическую трубную стерилизацию женщин. Далее
были разработаны лапароскопическая холецисто-
графия, холангиография, спленопортография [Kalk
A934-54), Lee A943), Royer A947-50), Roaenbamn
A954) и др.].
Так как около 1% осложнений лапароскопии
связано со слепым введением троакара, Hasson A971)
предложил метод открытой лапароскопии.
Значительную роль в развитии лапароскопии
сыграла разработка и внедрение электро- и
термохирургической техники: в 1941 г. Powers и Barnes
применили высоковольтный высокочастотный
электрический ток в лапароскопии, Rioux и Cloutier в 1974 г.
разработали биполярную электрохирургическую
систему.
Немецкий исследователь Н. Frangenheim,
ратовавший за расширение показаний к лапароскопии,
с начала 50-х гг. прошлого века модифицировал и
спроектировал множество лапароскопических
инструментов, включая прототип современного угле-
кислотного инсуффлятора.
Позднее, в 1950-х гг., Palmer и Frangenheim
независимо друг от друга предложили методы
электрокоагуляции для трубной стерилизации.
Британский гинеколог Patrick Steptoe в 1967 г.
написал первый учебник по лапароскопии на
английском языке, который назывался «Laparoscopy in
Gynaecology».
После внедрения в практику вышеуказанных
разработок, в середине 70-х гг., в лапароскопии
произошел революционный прорыв — родилась
лапароскопическая хирургия. Вероятно, термин
«лапароскопическая хирургия» впервые был использован
Cohen в 1970 г.. Meyer-Burg A973) внедрил прямую
лапароскопическую панкреатоскопию. В 1973 г.
Shapiro и Adler произвели первое органосохраняю-
щее удаление трубной беременности.
Хирургические лапароскопические операции, в
основном на органах малого таза (адгезиолиз, нео-
сальпингостомия, овариокистэктомия, овариоэкто-
мия и др.), получили значительное
распространение после выхода в свет руководства Kurt Semm
«Атлас гинекологической лапароскопии и
гистероскопии» A975).
Выдающийся немецкий гинеколог-хирург и
изобретатель из Киля Kurt Semm со своими коллегами и
учениками разработали технику большинства
лапароскопических вмешательств на органах малого
таза, изобрели огромное количество
лапароскопических инструментов и приборов, которыми в
настоящее время пользуются все лапароскопические
хирурги.
К 1988 г. в клинике, возглавляемой Kurt Semm,
было выполнено более 1400 лапароскопических
операций с частотой осложнений 0,28%.
Количество лапаротомий по поводу плановой
гинекологической патологии было уменьшено на 90%.
Таким образом, К. Semm четко
продемонстрировал, что лапароскопическая хирургия безопасна,
экономически эффективна и менее травматична,
чем традиционная открытая хирургия.
После ознакомления с предложенной Semm
техникой малоинвазивных оперативных вмешательств
в середине 80-х гг. в гинекологии, а затем и в
хирургии образовалась целая новая эндохирургическая
1О
История эндоскопической хирургии
отрасль. Ведущие специалисты и фирмы,
занимающиеся выпуском хирургического оборудования и
инструментария, включились в интенсивную
разработку этого направления.
В 1979 г. Bruhat и коллеги впервые использовали
в эндохирургии углекислотный лазер, в 1981 г. —
Goldrath, Fuller и Segal применили Nd: YAG лазер.
В январе 1988 г. Reich впервые произвел
лапароскопическую гистерэктомию.
В три последующих года лапароскопическая
техника отвоевала у «большой» хирургии значительное
количество классических, объемных вмешательств,
в некоторых из них приобретя к настоящему
времени статус «золотого стандарта». Навсегда вошли в
историю хирургии имена специалистов, взявших на
себя ответственность проведения этих операций
под прессом традиционно консервативной
хирургической общественности.
Закономерно, что лапароскопические
манипуляции были апробированы на т.н. «концевых» органах
с высокой частотой вовлечения в патологические
процессы — желчный пузырь, червеобразный
отросток.
Как известно, первую холецистэктомию
выполнил германский хирург Karl Langenbuch в 1882 г.
Более чем через 100 лет, а именно в 1985 г., в хирургии
желчных путей произошло революционное событие,
которое принесло огромную пользу всем
пациентам, страдающим желчнокаменной болезнью, а
именно открытие лапароскопической холецистэк-
томии, т.е. удаление желчного пузыря через
косметические проколы. Пионером в этой области стал
опять-таки немецкий хирург, доктор Erich Muhe из
города Boblingen.
В это время медицинская общественность
Германии обсуждала новость о том, что гинеколог Kurt
Semm из города Kiel делает лапароскопическую ап-
пендэктомию (т.е. удаление червеобразного
отростка). Хотя первая работа Semm, относящаяся к
лапароскопическому удалению червеобразного
отростка, появилась только в 1982 г., германские
хирурги были в курсе этих пионерских операций. Muhe
захватила идея сделать лапароскопическую
холецистэктомию. Как и многие хирурги, Muhe высоко
ценил успехи гинекологов в эндоскопической
хирургии и учился у них. В 1983 г. он часто посещал
гинекологическое отделение, где присутствовал на
эндоскопических операциях. Muhe пишет: «Один из
наших ведущих гинекологов, Willi-Reinhard Brau-
mann, оказал мне дружескую поддержку на
начальной стадии. Я несколько раз помогал ему при
лапароскопических операциях. Он был в курсе моих
планов, и один раз направил лапароскоп на желчный
пузырь и сказал «Я полностью уверен, что это
получится». Однако в то время у меня была только
концепция. Мне было нужно время, что бы разработать
необходимую технологию».
В конце сентября 1984 г. в больницу Boblingen
поступило четыре набора инструментов для
гинекологических лапароскопических операций. Muhe знал,
что с помощью этих инструментов он сможет
удалить нормальный желчный пузырь, однако он не был
уверен в отношении пузыря, наполненного камнями
или имеющего толстую стенку. Постепенно он
разработал концепцию нового операционного
лапароскопа, который автор назвал галлоскоп («Gallo-
scope», т.е. «желческоп»). К сентябрю 1985 г.
инструмент был изготовлен. Наружный диаметр его
составлял 3 см, он содержал оптическую систему с
боковым полем обзора, световод,
инструментальный канал, систему клапанов и патрубок для
создания и поддержания пневмоперитонеума.
К отбору своего первого пациента Muhe подошел
очень тщательно. Это была худенькая 35-летняя
женщина без сопутствующих заболеваний. Почти
через пять лет после того, как Semm выполнил
лапароскопическую аппендэктомию, Muhe смог
применить свой Galloscope. Это событие произошло
12 сентября 1985 г. Пневмоперитонеум был наложен
с помощью иглы Veress. Галлоскоп был введен через
пупок. Интересно, что два дополнительных
троакара для удержания пузыря Muhe ввел через проколы
над лоном, вероятно, для улучшения
косметического эффекта. Благо, телосложение больной
позволило это сделать. После того как пузырь отделялся от
ложа, верхняя часть галлоскопа снималась, и
пузырь удалялся через гильзу галлоскопа. Операция
шла два часа и успешно завершилась.
Как и другие лапароскопические хирурги, Muhe
был поражен, насколько благоприятно протекал
послеоперационный период. «У больной отмечался
стул почти сразу после операции, вечером того же
дня она уже ужинала».
По данной методике Muhe прооперировал шесть
пациентов. Результаты первых операций Muhe
опубликовал в 1986 г., в журнале «Langenbecks Archiv fur
Chirurgie», статью «Die erste Cholecystektomie durch
das Laparoskop» («Первая холецистэктомия через
лапароскоп»).
В 1986 г. на очередном съезде германских
хирургов Muhe решил представить результаты своих
операций. Для доклада Muhe подготовил 42 слайда.
Два первых были слайдами операции доктора
Semm на яичниках. Четыре следующих слайда
демонстрировали галлоскоп. В заключение он
представил преимущества такой минимально инвазив-
Ш
Глава 1
ной процедуры, которые, по его мнению, состояли
из пяти пунктов:
1. Мышцы живота не пересекаются.
2. Небольшие боли после операции,
прекращающиеся через 2-3 дня.
3. Короткий период обездвиживания больного
(даже пожилые больные лежат в кровати всего
1 день).
4. Короткий период госпитализации D-5 дней).
5. Быстрое возвращение на работу (на 50-75%
быстрее, чем после открытой операции).
Доклад Muhe аудитория восприняла
скептически. Ему пришлось иметь дело с уничижительными
замечаниями типа «хирургия Микки Мауса» и
«маленький мозг — маленький разрез». Дело с
внедрением операции в Германии не пошло — ни в одной
другой клинике эту операция не делали. Сам Muhe
продолжал работу, и к 1987 г. он выполнил 98 холе-
цистэктомий.
Однако эта идея уже витала в воздухе. В июне
1987 г. в аргентинском хирургическом журнале
«Revista Argentina de Cirugia» появилась статья
A. Kleiman и О. Poitevin, в которой сообщалось об их
эксперименте — лапароскопическом удалении
желчного пузыря у овец. В 1987-88 гг.
лапароскопическая холецистэктомия распространяется во
Франции усилиями Dubois, Mouret, Perrissat.
В 1988-89 гг. Becker, Bness, Trede, внедряют эту
операцию в хирургические клиники Европы. После
первой операции, проведенной McKernan и Saye, в
октябре 1988 г. Reddick и Olsen вводят
лапароскопическую холецистэктомию в США и разрабатывают
методику интраоперационной холангиографии.
После анализа результатов операций, проведенных в
мире в 1987-90 гг., лапароскопическая
холецистэктомия заняла ведущее место в лечении
желчнокаменной болезни.
В России лапароскопическая холецистэктомия
впервые была выполнена в Научном центре
хирургии РАМН в 1991 г. профессором Ю.И. Галлингером.
При закономерном расширении показаний к
лапароскопической холецистэктомии хирурги
столкнулись с проблемой холедохолитиаза. В 1990-91 гг.
в Европе и США появляются первые работы,
посвященные этой проблеме. Разрабатываются подходы
через предварительно расширенный пузырный
проток, в 1993 г. появились первые сообщения о
лапароскопической холедохотомии.
De Kok в 1977 г. впервые выполнил аппендэкто-
мию под контролем лапароскопа, потребовавшую
мини-лапаротомии для извлечения отростка.
К. Semm A988) произвел первую полностью
лапароскопическую аппендэктомию у пациентки с
патологией правых придатков. Изменения в отростке не
носили характера острых.
В 1987 г. Schrieber впервые выполнил
аппендэктомию по поводу острого аппендицита, в своей
статье он сообщил о 70 операциях, из них 7 — по
поводу острого воспаления. Лапароскопические аппен-
дэктомии по поводу острого аппендицита — первые
малоинвазивные вмешательства при ургентной
хирургической абдоминальной патологии —
оказались вполне выполнимыми.
Параллельно с очевидными успехами в желчной
хирургии лапароскопическая техника продолжала
«наступление» на другие виды патологии,
традиционно требовавшие широкой лапаротомии.
С начала 1989 г. Mouret и Katkhouda приступили к
лапароскопическим операциям при язвенной
болезни двенадцатиперстной кишки: сначала к
двухсторонней стволовой ваготомии с
гастроскопической баллонной дилятацией привратника, затем —
задней стволовой в сочетании с передней
продольной серомиотомией желудка и, наконец, задней
стволовой и передней селективной ваготомии.
Лапароскопическое лечение осложненных
дуоденальных язв также включает в себя ушивание их
перфораций. В 1991 г. те же авторы опубликовали отчет о
первых 8 таких случаях.
Веским словом в хирургии дуоденальных язв
стала выполненная в феврале 1992 г. Goh и Кит
успешная лапароскопическая резекция 2/3 желудка по
БильротИ.
Хирургическая лапароскопия внедрена в лечение
такой крайне частой патологии, как грыжа
пищеводного отверстия диафрагмы с рефлюкс-эзофагитом.
В 1991 г. Nathanson, Cuschieri и Shimi сообщили о
первой лапароскопической антирефлюксной
операции — гастропексии круглой связкой печени.
В том же году Dallemagne впервые произвел
лапароскопическую операцию Ниссена.
Разработка лапароскопического подхода к
лечению грыж нижнего отдела передней брюшной
стенки производилась на основе работ Ger по
трансабдоминальному закрытию внутреннего пахового
кольца A982). В 1989 г. группа исследователей,
возглавляемая тем же Ger, выполнила
экспериментальное исследование по лапароскопическому интрапе-
ритонеальному закрытию шейки грыжевого мешка у
собак с хорошим ближайшим результатом. Эта
методика вскоре была применена в клинике.
Возможность добиться благоприятных
отдаленных результатов с помощью эндохирургического
вмешательства путем предбрюшинного укрепления
нижнего отдела передней брюшной стенки
исследовалась с начала 1990 г., когда были предприняты экс-
12
История эндоскопической хирургии
периментальные исследования по изучению
реакции тканей на предбрюшинную имплантацию
синтетической сетки (марлекс, пролей, дакрон). Сразу же
после экспериментов была разработана методика
трансабдоминального преперитонеального
введения свертка синтетической сетки в паховый канал
без препаровки грыжевого мешка. Этот способ был
популярен в 1990-91 гг. и затем оставлен в связи с
большим числом воспалительных реакций тканей
пахового канала с вовлечением семенного канатика.
В конце 1990 г. Corbitt использовал метод
трансабдоминального преперитонеального введения
свертка синтетической сетки в паховый канал, но в
сочетании с препаровкой грыжевого мешка и пери-
тонизацией сетки на 30 больных. Далее были
разработаны еще несколько модификаций
лапароскопической герниорафии: трансабдоминальная интра-
перитонеальная и преперитонеальная, а также экс-
траперитонеальная имплантация сетки на область
латеральной, средней и срединной пупочных ямок.
Первые итоги лапароскопических грыжесечений
подвел Filzgibbons, проанализировав 736 операций
у 597 пациентов. Автор показал, что метод интрапе-
ритонеальной имплантации дает 4,6% рецидивов,
трансабдоминальный преперитонеальный — 3,5%,
экстраперитонеальный — 0%.
Лапароскопическая хирургия кишечника
началась с 1990 г., когда Jacobs выполнил
правостороннюю гемиколэктомию под лапароскопическим
контролем с внебрюшинным анастомозом через 5 см
разрез. В том же году Lahey произвел резекцию
ситовидной кишки, Flower — левостороннюю
гемиколэктомию под лапароскопическим контролем, в
конце 1990 г. Franklin выполнил у животных, а затем
и у больных, первый ручной и аппаратный швы
толстой кишки. К 1993 г. этой группой выполнено
119 вмешательств на толстой кишке, в том числе
право- и левосторонние гемиколэктомии, резекции
поперечноободочной и сигмовидной кишок,
передняя и брюшно-промежностная резекции прямой
кишки.
В середине 1993 г. была произведена первая вну-
трибрюшинная лапароскопическая резекция тонкой
кишки в эксперименте.
Следует отметить большой прогресс
лапароскопической урологии. В июне 1990 г. была впервые
выполнена лапароскопическая нефрэктомия по
поводу 3 см опухоли. В 1991 г. — лигирование семенных
вен при варикоцеле и орхопексии, в 1993 г. — урете-
ролиз при ретроперитонеальном фиброзе. 1993 год
вошел в историю урологии первой
лапароскопической тонкокишечной пластикой мочевого пузыря и
радикальной позадилонной простатэктомией.
Помимо расширения круга операций и
совершенствования мастерства хирургов, в
лапароскопической хирургии растет и число технических
нововведений, которые когда-то были более уместны в
фантастических романах, нежели в операционной.
В 1994 г. был сконструирован робот,
управляющий лапароскопической камерой.
В 1996 г. была проведена лапароскопическая хо-
лецистэктомия, во время которой производились
консультации хирургов, находящихся на территории
Аргентины и Америки. Неординарность этого
события заключается в том, что изображения и речь
передавались по всемирной компьютерной сети
Интернет с использованием спутниковой связи.
В январе 1987 г. вышел в свет первый номер
журнала «Surgical Endoscopy», в 1990 г. — «Jornal of
Laparoendoscopic Surgery», в 1991 г. — «Surgical
Laparoscopy & Endoscopy». С 1995 г. в России
издается научно-практический журнал
«Эндоскопическая хирургия».
13
Техническое
обеспечение
эндохирургических
операций
Любое хирургическое вмешательство всегда
было связано с использованием специальных
инструментов. Чем сложнее становились операции, тем
более совершенный и специфический
инструментарий требовался врачу для решения поставленной
задачи. В течение столетий создавались и
совершенствовались инструменты, пополняя арсенал
хирурга и расширяя его возможности. Инструмент
стал неотъемлемой частью любого хирургического
лечения, все больше укрепляя зависимость
качества выполнения операции от правильного
использования соответствующего оборудования.
Эндоскопическая хирургия стоит особняком
среди других хирургических методик по степени своей
зависимости от технической оснащенности.
Недостаток количества и качества инструментальной
базы, а также неудовлетворительная
подготовленность хирургического персонала зачастую является
основным препятствием на пути внедрения и
распространения этого прогрессивного метода
выполнения операций. Нет сомнений в том, что, начиная
оперировать эндоскопически, следует иметь
достаточно полное представление о структуре и
назначении специального оборудования, уметь легко
диагностировать возможные неисправности, дефекты
соединения и взаимодействия сложных приборов,
входящих в эндохирургический комплекс. Эти
знания должны не только обеспечить бесперебойное
функционирование комплекса, но и предотвратить
развитие ятрогенных осложнений, которыми, к
сожалению, изобилует период становления методики
в мире и особенно в нашей стране. Спектр
небольших неисправностей и «нестыковок» очень велик.
Накапливаясь, мелкие неурядицы способны так
«затянуть» операцию, сделать ее такой технически
«некрасивой», что формирование негативного
отношения к новому способу может стать практически
неизбежным. Несомненно, что эффективность и
безопасность эндохирургической операции может быть
в полной мере обеспечена лишь при наличии
качественной и исправной инструментальной базы.
Большинство эндоскопических приспособлений
было известно задолго до начала эры эндохирур-
гии. Вероятно, нет необходимости в этой главе
подробно описывать историю каждого инструмента,
следует лишь отметить некоторые наиболее
значимые события, произошедшие в двадцатом веке и
определившие современное состояние
эндохирургической инструментальной базы:
Orndoff в 1920 г. разработал троакар и канюлю с
механическим клапаном.
Korbsch A921) впервые применил раздельную
инсуффляцию иглой.
Значительный вклад в создание специальных
эндоскопических инструментов внес Kalk со своей
школой. В период 1923-1962 гг. он и его ученики создали
оборудование и методику исследований, основы
которых используются до настоящего времени.
Ruddock с 1934 по 1957 г. произвел около 2500
лапароскопии, внес свои модификации в
оборудование.
Veress в 1940 г. предложил оригинальную
конструкцию иглы, которая и теперь является лучшим
инструментом для наложения пневмоперитонеума.
Техническое обеспечение эндохирургических операций
Широкое распространение специализированные
эндохирургические инструменты получили после
выхода в свет руководства Semm «Атлас
гинекологической лапрароскопии и гистероскопии» A975).
Выдающийся гинеколог, хирург и изобретатель со
своими учениками разработал технику большинства
лапароскопических вмешательств на органах
малого таза, сконструировал огромное количество
инструментов и приборов, которыми в настоящее время
пользуются эндоскопические хирурги. После
ознакомления с предложенной Semm техникой
эндоскопических хирургических вмешательств
образовалась целая новая отрасль. Ведущие специалисты и
фирмы включились в интенсивную разработку этого
направления.
ТЕРМИНОЛОГИЯ
Вопрос терминологии, принятой для обозначения
эндохирургических процедур и оборудования,
достаточно сложен. Проблема заключается в
отсутствии на сегодняшний день единого соглашения
среди хирургов относительно терминообразования,
обычные способы формирования названий с
использованием латинских корней приставок и
суффиксов далеко не всегда оказываются приемлемы в
связи с абсолютной новизной многих устройств и
понятий. Ситуация осложняется тем
обстоятельством, что большинство компаний-производителей
предпочитают придавать названию прибора статус
торговой марки, ограничивая тем самым его
распространение на аналогичные устройства других
фирм. Кроме того, представители различных
хирургических школ стремятся создать свой
терминологический ряд, претендующий на признание в
будущем, когда, наконец, буде утверждена единая
номенклатура. В этой главе будет приведено как
можно больше всевозможных названий одного и того же
инструмента, однако этот список, скорее всего,
будет неполным.
ЭНДОХИРУРГИЧЕСКИЙ КОМПЛЕКС
Наиболее прижившееся название комплекса
электроприборов, предназначенных для выполнения
эндоскопических операций, — «стойка». В стойку
входит необходимый минимум устройств и тележка
для установки и перемещения всего комплекса по
операционной. Поскольку все приборы, как
правило, используются одновременно, к самой тележке
предъявляются определенные требования.
Тележка
Обеспечивает консолидированную работу и
электрическую защиту всех установленных устройств.
Верхняя полка тележки предназначена для
установки монитора (за исключением случаев
крепления последнего к потолку) и должна находиться
приблизительно на уровне глаз оперирующего
хирурга. Эта полка должна свободно вращаться
вместе с монитором в горизонтальной плоскости,
ввиду необходимости изменения угла зрения в ходе
вмешательства. Еще лучше, чтобы тележка имела
еще шесть полок, причем желательно иметь
возможность регулировки высоты каждой в
отдельности. Иногда тележка комплектуется выносными и
даже установленными на шарнирах дополнительными
полочками. Они предназначены для приборов, к
которым необходим частый доступ во время
операции (например, для смены емкости хирургического
отсоса).
Перемещение тележки должно быть легким ввиду
часто возникающей необходимости изменения
положения стойки, даже в ходе одной операции,
например: при положении комплекса со стороны
головы пациента он может мешать
анестезиологической службе интубировать больного, тогда, уже
подключенную стойку необходимо временно
отодвинуть и затем вернуть на прежнее место.
После окончательной установки тележка фиксируется
жестким тормозным механизмом во избежание
нежелательных смещений комплекса.
Поскольку стойка содержит пять-семь, а иногда и
более электрических приборов, потребляющих
большую мощность, тележка снабжается блоком розеток,
защищенных предохранителем, фильтром или
стабилизатором напряжения. Последний устанавливают
дополнительно в случае нестабильности
электрических сетей. Весь блок должен иметь единый
выключатель для обеспечения возможности быстро
обесточить электрохирургический комплекс в случае
необходимости. На любой тележке обязательно
предусматривается заземление каждого прибора на корпус,
и затем единым кабелем к штатному заземлению
операционной. Все сетевые провода электрических
устройств прокладываются в специальных
магистралях тележки, дополнительно изолированных от
наведенных токов и предотвращающих запутывание
большого количества кабелей.
В последние годы большой популярностью
пользуется идея консолидированного компьютерного
управления приборами стойки. Эндохирургический
комплекс в этом случае снабжается компьютером, а
тележка, соответственно, получает дополнительные
панели с цифровыми портами.
15
Глава 2
Видеосистема
Монитор
Часть видеосистемы, непосредственно
воспроизводящая операционную картину —
видеомонитор. Это один из наиболее важных компонентов
задействованных в эндохирургическом комплексе,
однако иногда выбору монитора не придается
должного значения, вплоть до замены его бытовым
телевизором. На наш взгляд, это серьезная
ошибка. От правильной цветопередачи, разрешающей
способности и четкости изображения монитора
зачастую зависит точность диагностики и тканевой
дифференцировки. Все мониторы, используемые
сегодня в эндохирургии (за исключением
несерийных разработок) аналоговые. Это означает, что они
воспроизводят электрический сигнал, получаемый
от видеокамеры напрямую (в отличие от цифрового
кодированного сигнала). При этом качество
воспроизведения в значительной степени зависит от
посторонних электромагнитных влияний —
эфирных помех, которых в любой операционной
достаточно. Поэтому только профессиональный
медицинский монитор с его электромагнитной защитой
способен противодействовать мощным токам
утечки, исходящим из других электроприборов.
Экранное разрешение монитора может находиться в
пределах от 450 до 1400 строк, чем выше
разрешающая способность, тем более четкое изображение
можно получить, тем более мелкие детали
доступны осмотру (для сравнения: экранное разрешение
большинства бытовых телевизоров не превышает
450 строк). Как правило, используется экран с
диагональю 14" и 21". Чем меньше экран, тем выше
четкость изображения.
Профессиональный монитор должен иметь все
наиболее распространенные разъемы для приема и
передачи видеосигнала. Наряду с обычным VHS
монитор должен воспринимать и воспроизводить
современный S-VHS сигнал способный передавать
изображение высокого разрешения. Для этого
требуется специальный разъем, которого, как правило,
нет на бытовом телевизоре. Эндохирургический
монитор имеет несколько (обычно три)
независимых линий для подключения различных источников
изображения (например, интраоперационного
ультразвукового аппарата). Независимые линии могут
просматриваться путем переключения каналов
либо с использованием функции «картинка в
картинке». И наконец, монитор должен без искажений
передавать видеосигнал на другой монитор или
видеомагнитофон. Современные мониторы ведущих
фирм в последнее время снабжаются
специальными устройствами, трансформирующими
аналоговый сигнал в цифровой для передачи последнего на
компьютер.
Общим недостатком любого монитора является
его стационарность. Все хирурги вынуждены в
течение операции смотреть в одном направлении
зачастую из неудобного положения. В качестве выхода
часто используют два и более мониторов,
устанавливая их под физиологическим углом зрения для
основных членов операционной бригады. Однако при
таком варианте громоздкие мониторы занимают
слишком много места, увеличивают нагрузку на
электросеть, требуют дополнительных мобильных
тележек, добавляют соединительных проводов
пожирая свободное пространство операционной.
Оригинальное решение всех этих проблем
заключается в использовании монитора, который в виде
специального шлема одевают на голову
оперирующего хирурга. Независимо от поворота головы
оператора изображение не смещается, и хирург может
легко поворачиваться, не опасаясь потерять из виду
операционную картину. Кроме того, поле зрения в
таком мониторе поделено пополам в
горизонтальной плоскости, т.е., опустив взгляд, хирург видит
больного и инструменты, подняв глаза — объект
операции. Все остальные визуальные отвлекающие
факторы, такие, как светящиеся
анестезиологические мониторы, лампы освещения, и др., хирургу в
этот момент недоступны.
Видеокамера
Самый сложный и дорогой компонент
видеосистемы, определяющий качество изображения. Если
монитор лишь воспроизводит полученный
электрический сигнал, то камера его формирует.
Обычно хирургическая видеокамера
представляет собой прибор, состоящий из двух компонентов:
воспринимающей головки и блока обработки
изображения. Такая конструкция позволяет
максимально облегчить и уменьшить в объеме ту часть
аппарата, которую хирург держит в руке. Фактически,
головка содержит лишь преломляющую линзу и
воспринимающую микросхему — чип (chip).
Большинство известных видеокамер
соединяется с любым стандартным жестким эндоскопом.
Соединение отличается лишь способом крепления
головки. Наиболее удобным является так называемое
цанговое крепление, при котором хирург может
одним движением без дополнительных усилий
соединить или снять головку камеры при необходимости.
Поскольку электрический кабель может
перегибаться во время операции, лучше, если он отходит
от головки камеры под прямым углом, т.е.
направлен вниз.
Техническое обеспечение эндохирургических операций
Качество видеокамеры в первую очередь
определяет ее чувствительность. Этот показатель
должен составлять не менее Зх люкс, хотя существуют
камеры, которые «видят» объект, освещенный
всего лишь на 1,5 люкс. Более высокой
чувствительностью отличаются так называемые трехчиповые
камеры, имеющие три воспринимающие
микросхемы, специализированные по трем основным
цветам. У трехчиповых камер более достоверная
цветопередача, что достаточно важно^при
необходимости тонкой цветовой дифференцировки.
Например, при операциях на кишке, когда состояние
органов определяется почти исключительно по
оттенкам цвета. Современные эндохирургические
видеокамеры предусматривают автоматическую
регулировку чувствительности. Это означает, что
камера должна изменять порог восприимчивости в
зависимости от освещенности объекта операции.
Автоматическая регулировка чувствительности
вместе с автоконтролем освещенности составляют
так называемую противобликовую систему. Эта
система крайне необходима, поскольку обеспечивает
равномерное видеоизображение всех участков
операционной полости, как в центре, так и по
периферии поля зрения.
Разрешающая способность видеокамер
варьирует от 450 до 1100 строк, оптимум, по нашему
мнению, находится где-то между 600 и 850 строками.
Необходимо отметить, что разрешение свыше
600 строк передается на монитор и
воспроизводится последним только по S-VHS каналу. Таким
образом, видеокамеры, в которых отсутствует эта линия
бессмысленно комплектовать дорогим монитором
и наоборот: монитор высокого разрешения для
реализации своих возможностей требует трехчиповой
камеры.
Все видеокамеры, используемые в настоящее
время в эндохирургии — аналоговые, однако для
уменьшения потерь качества при передаче
электрического сигнала современные модели снабжаются
блоком цифровой обработки изображения, что
позволяет эффективно отфильтровывать
электромагнитные помехи неизбежно присутствующие в
эфире. Уже существуют полностью цифровые камеры,
но их проникновение в эндохирургию замедляется
из-за высокой стоимости самого устройства, и
необходимости комплектации системы специальным
дорогим компьютерным монитором.
Важной функцией видеокамеры является
способность автоматической цветовой настройки. В
качестве эталона используют любой белый предмет
(например, салфетка). Направив камеру на эталон,
активируется настройка цветового баланса кнопкой
на передней панели блока обработки изображения.
Далее электроника выстраивает цветовой ряд
относительно белого цвета. Без такой системы
цветопередача неизбежно будет недостоверной.
Пространственную ориентацию хирурга в
операционной полости затрудняет необъемное
(двухмерное) изображение. Попытки создания
стереоскопической видеокартинки предпринимались
неоднократно, однако широкого применения эти системы
на сегодняшний день не получили. Причина
заключается в отсутствии радикального технического
решения. Дело в том, что для восприятия объема
необходимо «снимать» объект с двух точек,
находящихся на определенном E-10 см) расстоянии друг
от друга, что неприемлемо для эндохирургии,
поскольку требует увеличения инвазивности
операции. Все попытки разнести точки восприятия
изображения при помощи преломляющих призм не дают
желаемого эффекта: изображение выглядит
искусственным и утомляет зрение. Кроме того,
стереоскопический лапароскоп должен содержать два
независимых канала передачи изображения, что
вдвое уменьшает их диаметр.
После сканирования стереоизображение должно
проходить специальную обработку и выдаваться на
монитор в виде наложенных друг на друга картинок,
которые воспринимаются с помощью специальных
очков, фильтрующих поляризованный свет. Однако
монитор при этом делит свои ресурсы пополам и,
соответственно, разрешающая способность падает
вдвое.
Видеозапись
Начинающие эндохирурги часто расценивают ее
как излишнюю роскошь, однако именно для
начинающих особенно важно документировать свои
операции.
Видеозапись позволяет:
а)после операции спокойно проанализировать
свои ошибки и неточности,
б) получить уникальный учебный материал для
других хирургов,
в) не позволить списать осложнения
послеоперационного периода на технические погрешности
в ходе операции.
Учитывая внедрение страховой медицины,
документальное видео может стать объективным
критерием оценки качества выполненной операции.
Кроме того, благодаря видеозаписи пациент может
получить более полное представление об оказанной
ему помощи.
Для записи можно использовать любой
видеомагнитофон, в зависимости от задач которые ста-
"86983
Глава 2
вит перед собой хирург и клиника. Для достижения
наилучшего качества и возможности многократного
просмотра пленки лучше всего подходит
профессиональный видеомагнитофон системы S-VHS. Для
временных рутинных записей вполне достаточно
бытового видеоплеера.
Иногда стойка комплектуется видеопринтером,
который позволяет делать снимки отдельных этапов
операции выборочно. На наш взгляд,
использование этого прибора в операционной неоправданно,
поскольку хирург вынужден помнить о
необходимости копирования как раз в те моменты, когда его
внимание более всего приковано к операции.
Гораздо рациональнее делать эти снимки (если они
необходимы) с видеозаписи после завершения
вмешательства.
Компьютерная запись всей операции пока
технически и экономически пока недостаточно
обоснована. Перевод фрагментов вмешательства в
электронную форму возможен при наличии той же
видеозаписи с использованием специальных
транспонирующих устройств.
Оптика
Как правило, эндохирурги используют жесткие
оптические приборы с системой цилиндрических
линз Хопкинса. Существуют также лапароскопы с
подвижным управляемым дистальным концом, но
их применение весьма ограничено ввиду отсутствия
заметных преимуществ перед стандартной
оптикой. Любой эндоскоп включает в себя два
совершенно независимых канала: канал передачи
изображения и канал светоперердачи. Первый
транслирует изображение объекта операции на
воспринимающий чип видеокамеры, второй соединяется со
световодом и, являясь как бы его продолжением,
проводит свет в операционную полость. Наиболее
распространен эндоскоп диаметром 10 мм, хотя
успешно применяют и вполне отвечают современным
стандартам качества эндоскопы диаметром 5, и
даже 2 мм. Стремление уменьшить диаметр
операционного эндоскопа вполне укладывается в общую
доктрину уменьшения хирургической инвазии, и если
разница между 10 мм и 5 мм проколами
практически отсутствует, то 2 мм — это принципиально новое
решение позволяющее сделать операционные
проколы совершенно незаметными и
нетравматичными. Конструкция 2 мм эндоскопа абсолютно
отличается от «десятки» ввиду того, что такой оптический
прибор невозможно сделать совершенно жестким.
Он должен быть эластичным и допускать небольшую
деформацию, которая приемлема лишь для
волоконной оптики. Однако поместить достаточное
количество светопередающих волокон в таком тонком
инструменте технологически довольно сложно,
поэтому 2 мм эндоскоп пока не очень распространен и
достаточно дорог.
Стандартный лапароскоп (эндоскоп) имеет угол
обзора от 90 до 120°, что не всегда достаточно,
особенно в случаях, когда требуется осмотр объекта
сбоку. Решение проблемы — использование
приборов с угловой оптикой C0 и редко 45°). За счет
поворота такого эндоскопа вокруг оси хирург может
осмотреть объект практически со всех сторон,
получив даже вид сзади, если, конечно, объект
полностью находится в операционной полости. Однако
следует учитывать, что эндоскопы с угловой
(скошенной) оптикой требуют дополнительных навыков
ориентации, в связи с чем, мы не рекомендуем их
начинающим эндоскопическим хирургам.
Необходимо также учитывать, что преломляющая призма
углового эндоскопа может поглощать до 30% света!
Освещение
До появления волоконной оптики проблема
освещения полости при эндоскопических
исследованиях казалась неразрешимой. Использовался и
лобный рефлектор и лампы накаливания, которые
помещались непосредственно на конце эндоскопа, но
все эти способы не могли удовлетворить
диагностов и, разумеется, совсем не годились для
эндохирурги и.
Для получения адекватной освещенности
объекта операции необходим мощный источник света,
причем во избежание ожогов и других негативных
тепловых явлений, свет должен быть холодным.
Эндохирургическая система освещения
представляет собой стационарный осветитель и
световод, передающий свет к объекту операции.
Осветитель включает в себя лампу, систему
охлаждения (автоматический вентилятор), и
электронику, регулирующую интенсивность света.
Существует три вида ламп в хирургических осветителях: га-
лбгеновые, металлогаллоидные, и ксеноновые.
Галогеновые лампы могут иметь мощность до
150 Вт, их используют почти исключительно для
диагностических целей. Мощность такого осветителя
недостаточна для большинства хирургических
процедур. При внутреннем кровотечении свет галоге-
новой лампы может почти полностью поглощаться.
Кроме того, галогеновая лампа весьма
недолговечна и перегорает внезапно, поэтому обычно в
осветитель устанавливают две лампы с возможностью
переключения во время операции. Свет галогеново-
го источника имеет зеленоватый оттенок, поэтому,
когда производится настройка цветового баланса
Техническое обеспечение эндохирургических операций
видеокамеры, возможно некоторое искажение
реальной картины.
Металлогаллоидная лампа, комплектующая в
большинстве операционных осветителей, имеет
мощность до 250 Вт, что вполне достаточно для
эндоскопической хирургии. Наибольшую
привлекательность именно этой лампы определяет ее
совершенно белый свет и долговечность. Производители
ламп обычно точно не указывают их ресурс, однако
опыт показывает, что металлогаллоидная лампа
служит примерно 300-500 ч. Кроме того, такой
источник света не перегорает внезапно, а постепенно
«садится», уменьшая интенсивность свечения, что
позволяет прогнозировать его окончательный
выход из строя.
Ксеноновая лампа может иметь мощность до
300 Вт, что позволяет использовать такой
осветитель в наиболее трудных ситуациях, при массивных
внутренних кровотечениях, при использовании
видеокамеры с низкой светочувствительностью.
Однако свет ксенонового источника слегка
голубоватый, что, впрочем, не так критично как в ситуации с
галогеновой лампой.
Система охлаждения предназначена для
поддержания благоприятного температурного режима
источника света. Лампа охлаждается в течение всего
периода работы. Металлогаллоидный и ксеноновый
источник света нельзя повторно включать до
полного остывания лампы, поскольку это приводит к ее
преждевременному износу. Для сокращения
периода остывания после выключения большинство
осветителей оборудовано специальным температурным
реле, выключающим вентилятор лишь после
полного охлаждения источника света. Таким образом, не
стоит отключать прибор от сети, не дождавшись
остановки электромотора.
Электрохирургический осветитель обязан иметь
электронное устройство, регулирующее
освещенность операционного поля, которое в комплексе с
автоматикой видеокамеры предотвращает
образование бликов. Осветитель соединяется с
видеокамерой по специальному каналу, получая тот же
видеосигнал, что и монитор. Анализируя полученную
информацию, электронное устройство осветителя
уменьшает или увеличивает диафрагму на выходе
источника. Интенсивность свечения лампы при
этом остается неизменной.
На переднюю панель осветителя обычно
выводится индикатор интенсивности светового потока в
процентах от максимального. Некоторые приборы
снабжаются также электронным счетчиком ресурса
лампы в часах непрерывной работы, который
позволяет прогнозировать выход ее из строя и заранее
заменить. Наиболее сложные и качественные
источники света снабжаются дополнительной
функцией Standby, которая предназначена для экономии
ресурса лампы в те периоды эндохирургической
операции, когда источник света временно не
используется (например, при выполнении «открытого»
этапа лапароскопически ассистированной
операции).
Для проведения света к операционному
эндоскопу служит специальный оптиковолоконный
световод. Существовали жидкостные световоды, однако
ввиду явных преимуществ волоконной оптики в
настоящее время они практически не выпускаются.
Следует помнить, что волокна, из которых состоит
световод, достаточно хрупкие и могут ломаться при
значительном перегибе последнего. Считается, что
световод можно сворачивать в бухту не менее 30 см
в диаметре, и изгибать не более чем под 90°.
Несмотря на все меры предосторожности через
некоторое время световод все же выходит из строя и
тогда его следует заменить новым, поскольку
ремонту он не подлежит. Большой проблемой может
стать несовпадение разъемов световода, как с
осветителем, так и с лапароскопом. В связи с этим
обстоятельством мы рекомендуем использовать
осветитель, световод и лапароскоп от одного
производителя. Покупая эти вещи по отдельности,
убедитесь в наличии переходников на все четыре
общепринятых стандарта. Не стоит приобретать
нестандартное оборудование. Переходники
кустарного изготовления часто приводят к поломкам,
недопустимому нагреванию деталей и потерям света.
Инсуффляторы и лапаролифтинг
Инсуффляторы
Все эндохирургические операции выполняют в
естественной или искусственно создаваемой
полости, что, впрочем, следует из названия методики.
Полость, в которой проводят вмешательство,
принято называть операционной. Понятно, что чем
больше операционная полость, тем лучше
визуализация объекта, тем. выше эффективность и
диапазон оперативных действий. Достаточно просто дело
обстоит с полостями, имеющими естественную
жесткость (грудная, полость черепа), сложнее с
брюшной и искусственно создаваемой. Для того чтобы
приподнять брюшную стенку, или удержать от
спадания стенки забрюшинной полости давно и
эффективно используют газ. Первый автоматический
прибор для нагнетания газа в брюшную полость был
изобретен Куртом Земмом и назывался Pelvipneu,
поскольку изобретатель был гинеколог и
оперировал преимущественно в малом тазу. Под таким на-
19
Глава 2
званием он продолжает выпускаться одной из
фирм. Можно встретить также термин «лапарофла-
тор», но наиболее прижившееся имя таких
приборов — инсуффлятор.
Инсуффлятор — сложный электронный прибор,
принципиально отличающийся от шприца Жане и
примитивного компрессора, которыми еще не так
давно нагнетали воздух операционной в живот
пациента. Начнем с того, что для инсуффляции может
использоваться только углекислый газ. Этот газ
невзрывоопасен, не поддерживает горение и дымо-
образование, быстро рассасывается при
возникновении подкожной или другой эмфиземы.
Инсуффлятор может быть рассчитан на использование
баллона с углекислым газом или централизованной
подачи из системы низкого давления. В первом
случае инсуффлятор содержит внутренний
редуктор, во втором газ подается напрямую в систему
дозировки и очистки. Это важно учитывать,
поскольку ошибочное подключение баллона к инсуф-
флятору без внутреннего редуктора, приведет к
немедленной порче последнего. Подключение
разводки низкого давления к прибору с редуктором не
будет иметь таких фатальных последствий, однако
индикатор количества газа в баллоне, которым
снабжен такой инсуффлятор, будет подавать
сигнал «пустой баллон». Любой качественный
инсуффлятор должен содержать внутренний фильтр грубой
очистки, предотвращающий проникновение
дисперсных частиц в операционную полость. Как
правило, этот фильтр может быть заменен только
сервисной службой компании производителя,
поэтому, во избежание порчи прибора, использоваться
может только специальный медицинский газ,
применение пищевого и тем более технического газа
недопустимо. Для фильтрации мелких частиц,
которые могут содержаться даже в специальном
очищенном углекислом газе, используют
дополнительный фильтр, который устанавливается на выходе
инсуффлятора в начале магистральной трубки
идущей к пациенту. Этот фильтр обычно предназначен
для одного пациента и заменяется после каждой
операции.
В этой главе мы рассматриваем только
электронные приборы, поскольку электромеханические ин-
суффляторы безнадежно устарели и перестали
отвечать возрастающим требованиям эндохирургии.
Итак, главная задача инсуффлятора заключается в
создании и поддержании на заданном уровне
давления газа в операционной полости. Большинство
приборов подают газ порционно, фазы подачи
чередуются с фазами измерения давления в
магистральной трубке. Когда давление достигает
заданного, специальный датчик отключает подачу газа. Если
давление снижается, по причине утечки газа,
возобновляется подача.
Важным параметром инсуффлятора является его
производительность, т.е. максимально возможная
скорость подачи газа в единицу времени.
Существуют приборы способные инсуфлировать 9, 16, 20 и
даже 40 л/мин. Высокая скорость подачи газа
становится необходимой при длительных и сложных
операциях, связанных с частой сменой
инструмента, активным использованием электрокоагуляции,
высокой вероятностью интраоперационных
кровотечений. В этих случаях возникает необходимость
быстрой эвакуации жидкости или дыма из
операционной полости, которая, разумеется,
осуществляется вместе с газом. Быстрое восполнение потерь
карбоксиперитонеума в такой ситуации определяет
оперативность устранения возникших
интраоперационных осложнений. На наш взгляд, для
большинства эндоскопических операций достаточно
использовать 16-литровый инсуффлятор, который
наиболее удобен и надежен. Необходимо учитывать,
что высокая скорость прохождения газа возможна
лишь через троакар, при инсуффляции через иглу
скорость подачи обычно не превышает 3 л/мин.
Кроме того, быстрая смена газа в операционной
полости приводит к охлаждению организма пациента,
поэтому 20 и 40-литровые приборы обязательно
должны быть снабжены системой подогрева.
Обычно нагревательный элемент устанавливается
непосредственно в магистральную трубку,
соединяющую инсуффлятор и пациента, а специальный
датчик автоматически отслеживает нагрев до заданной
температуры.
Мониторинг состояния карбоксиперитонеума
(ретрокарбоксиперитонеума) — очень важная
функция электронного инсуффлятора. Хирургу
необходимо постоянно иметь информацию о динамике
трех основных параметров: давление в
операционной полости, скорость подачи газа и расход газа на
всю операцию. Как известно превышение
допустимого давления газа приводит к целому ряду
неблагоприятных последствий в виде уменьшения
дыхательного объема, избыточного давления на
средостение, нарушения венозного оттока и т.д., поэтому
помимо постоянной цифровой индикации на
передней панели прибора, резкое повышение давления в
полости должно сопровождаться звуковым
сигналом тревоги. Скорость подачи газа во время
операции в идеале должна быть равна нулю, однако
постоянные потери карбоксиперитонеума при смене
инструмента, эвакуации жидкости и дыма, при
изношенных клапанах троакаров требуют восполне-
2О
Техническое обеспечение эндохирургических операций
ния. В норме постоянная подкачка газа не
превышает 1-2 л/мин. При более высокой скорости подачи в
течение рутинных процедур, следует проверить
герметичность системы. Скорость инсуффляции
газа может также являться одним из тестов
проникновения иглы Вереша в операционную полость при
первичном наложении карбоксиперитонеума (рет-
рокарбоксиперитонеума): если игла находится в
полости, газ будет проходить свободно, т.е. 2-3 л/мин
при меньшей скорости подачи высока вероятность
попадания иглы в одно из клетчаточных
пространств. Расход газа на всю операцию необходимо
знать в тех случаях, когда запас его ограничен,
например при использовании маленького баллона.
Индикация этого параметра на передней панели
(в л/мин) позволяет прогнозировать необходимое
количество сменных баллонов. Кроме расхода газа
на передней панели должен быть индикатор остатка
в баллоне в процентах или других относительных
величинах. Предельное давление задается прибору
перед каждой операцией. Максимальную скорость
подачи газа на некоторых инсуффляторах также
устанавливает хирург. Если эта функция отсутствует,
значит, постоянно задействован максимальный
ресурс прибора.
Лапаролифтинг
Под этим термином подразумеваются
различные безгазовые способы приподнимания
передней брюшной стенки для создания адекватной
операционной полости. Необходимость такого
рода процедур продиктована стремлением избежать
осложнений связанных с вредным воздействием
давления газа на внутренние органы. Существует
множество различных конструкций, например
устройство, приподнимающее переднюю брюшную
стенку специальным крючком соединенным с
винтовым подъемником, для этого в зоне интереса
выполняют микролапаротомию B-3 см).
Интересен способ, при котором брюшную стенку
прошивают на всю толщину при помощи специальной
иглы (Endo Close) в нескольких ключевых точках, и
затем нити-держалки фиксируют к закрепленным
стальным дугам, установленным над
операционным столом.
Наибольшее применение лифтинг получил при
хирургических вмешательствах через мини-доступ.
При таких операциях недостаток видимости через
маленький разрез компенсируется
приподниманием стенки операционной полости и формированием
купола увеличивающего обзор. Особенно
популярными стали специальные лифтинговые ранорасши-
рители в мини-инвазивной торакальной хирургии, и
в частности при операциях на сердце.
Приспособление для грудной стенки, позволяющее не только
приподнимать ее, но и фиксировать всевозможные
инструменты, называется торалифт.
Давно и плодотворно развивается направление, в
какой то степени альтернативное ретропневмопе-
ритонеуму. Известно, что газ довольно сложно
удержать в области ограниченной хирургическим
интересом. Происходит быстрое его «расползание»
на соседние клетчаточные пространства. Во
избежание такого эффекта для создания забрюшинной
(или другой) полости в клетчатке широко
используют так называемые баллонные диссекторы,
представляющие собой пластиковые резервуары для
газа самой различной формы и назначения. После
раздувания баллона он опорожняется и удаляется
из сформированной полости, в которую затем
вводятся специальные троакары, снабженные
опорными раздувными баллонами. Опорные баллоны
поддерживают объем операционной полости, не
занимая много места и оставляя пространство для
манипуляций.
Эвакуация и подача жидкости
Эндохирургический отсос практически не
отличается от общехирургического, его особенность
заключается в том, что обычно он комбинируется в
одном корпусе с прибором для подачи жидкости в
операционную полость. Такой комплексный прибор
с легкой руки того же Земма принято называть ак~
вапуратором, но часто можно услышать и другие
названия, например: аспиратор-ирригатор или
просто эндоотсос. Отсасывание и подачу жидкости
осуществляют через общую универсальную
канюлю путем переключения режимов специальными
кнопками. Такая унификация инструмента очень
важна для эндохирургии, поскольку, как уже
отмечалось, частая смена инструментов приводит к
серьезным потерям времени и газа. Каких-либо
особых требований к аквапуратору не предъявляется.
Как правило, это вакуумный мембранный
электронасос, соединенный герметичной системой трубок
с емкостями для аспирата и ирригационной
жидкости. Существуют также роликовые приборы,
преимущество которых — отсутствие внутренних
полостей и простота в использовании. Мощность
прибора должна быть достаточной для эффективной
эвакуации кровяных сгустков через канюлю
диаметром 10 мм. Активация аквапуратора может
осуществляться нажатием на педаль, или быть
автоматической — включаться при открытии
соответствующей магистрали. Простая конструкция более
надежна.
21
Глава 2
Коагуляция и резание тканей
Для коагуляции и резания тканей в эндохирургии,
как и в «открытой» могут использоваться различные
источники энергии, например лазер или
высокочастотные звуковые колебания. Однако на
сегодняшний день доминирующим способом борьбы с
кровотечением при эндоскопических операциях является
электрохирургия.
Электрохирургические устройства в разное
время имели различные названия, которые мы
зачастую произносим, не вникая в смысл: диатермия,
электронож, электрохирургический блок, электро-
каутер, радионож и т.д. По сути, все это синонимы.
Принцип работы этих приборов одинаковый —
локальный разогрев тканей пациента за счет иысокой
концентрации тока на активном электроде.
Это устройство давно стало атрибутом каждой
операционной, и подавляющее большинство
хирургов используют его практически постоянно. Однако
<любовь» к коагулятору сочетается с известной
долей недоверия, что является следствием
возникающих время от времени «труднообъяснимых»
осложнений, а также, периодически, недостаточной
эффективностью гемостаза. Причин неважной работы
сложных приборов бывает две: неправильное
использование и низкое качество. К сожалению, в
подавляющем большинстве отечественных больниц
установлены электрокоагуляторы, которые не
только давно выработали свой ресурс, но и перестали
отвечать современным требованиям безопасности
таких аппаратов для пациента.
Что же такое качественный коагулятор и какова
область его применения? Для ответа на эти
вопросы необходимо «заглянуть внутрь» прибора и, не
вдаваясь в тонкости электронных схем, понять, для
чего, собственно, предназначено его содержимое.
Всем известно, что коагуляционный эффект
возникает за счет разогрева тканей электрическим током,
проходящим непосредственно через пациента.
Разогрев происходит на протяжении всей цепи,
однако клинически значимым он становится в области
наименьшей площади проводника, а именно в
месте контакта: «активный» электрод — пациент. При
этом никакого вреда от прохождения тока
значительной силы через пациента не наблюдается. Если
так, то может быть, напрямую использовать ток,
который можно получить из бытовой электрической
сети? Вот здесь мы подошли к наиболее важной
характеристике переменного тока — его частоте.
Частота тока бытовой электросети, как известно,
составляет 50ГЦ, т.е. 50 колебаний в секунду. При
воздействии такого тока мышечная ткань успевает
реагировать на электрические импульсы
соответствующим количеством сокращений, что приводит к
судорогам и фибрилляции. Чем ниже частота тока,
тем выше вероятность развития такого рода
осложнений. Использовать постоянный ток также не
представляется возможным, в силу его
однонаправленности. Такой ток вызовет электролиз тканей, и
спазм всей мускулатуры организма. Таким образом,
для электрохирургической коагуляции и резания
можно использовать лишь высокочастотный ток.
Многолетними клиническими и
экспериментальными исследованиями установлено, что приемлемой
для медицинского использования считается
частота, начинающаяся от 20 тыс. ГЦ B0КГЦ).
Следовательно, чем выше частота тока, тем лучше для
пациента? Это не совсем так. Дело в том, что у
электрохирургического блока есть еще одна важнейшая
характеристика — интенсивность утечки тока
Токи утечки, к сожалению неизбежны. Они
становятся значимыми при увеличении частоты тока в
колебательном контуре. Фактически высокочастотный
электрокоагулятор во время работы превращается
в мощный радиопередатчик, распространяя вокруг
себя электромагнитные колебания — радиоволны.
Чем выше частота, тем более значительна
электромагнитная утечка. Эфирные колебания вызывают
индукционные токи во всех металлических
предметах операционной, которые могут оказывать
вредное воздействие на пациента при соприкосновении
с ним. Например, все зажимы, удерживающие ткани
в операционной ране, становятся принимающими
антенами, между ними и пассивным электродом
пациента возникает электрический ток, сравнимый с
током от активного электрода. Величина тока утечки
зависит не только от частоты колебаний в контуре,
но и от силы тока возникающего между активным и
пассивным электродами. От силы тока проходящего
через ткани зависит и собственно хирургический
эффект, которого мы ждем от коагулятора. Чем
выше разность потенциалов, которую способен
воспроизвести коагулятор между электродами, тем
выше юила тока протекающего через пациента.
Способность прибора увеличивать разность
потенциалов характеризует его мощность.
Мощность электрохирургического блока должна
соответствовать его назначению. Для резания
тканей электродом небольшой площади при
небольших вмешательствах на коже, достаточно прибора
мощностью 80-100 Вт. Для эндоскопических
операций, где необходим больший коагуляционный
эффект, используют коагуляторы от 200 до 400 Вт.
Дальнейшее наращивание мощности
нецелесообразно и небезопасно, поскольку приводит к
обугливанию и глубокому некрозу ткани в зоне коагуляции
Техническое обеспечение эндохирургических операций
и прогрессивному возрастанию утечки тока. В
настоящее время большинство приборов имеет
мощность 300 Вт, этого вполне достаточно для
хирургических процедур, вплоть до вопаризации простаты в
жидкой среде. Коагуляционный и режущий
эффекты зависят не только от мощности, но и от
сопротивления тканей пациента. Если электронож проходит
через ткани с различным электрическим
сопротивлением, эффект будет различным, что приведет к
неравномерности процесса и различной глубине
коагуляционного повреждения. Для решения этой
сложной проблемы некоторые современные
электрохирургические блоки оснащаются системой
компьютерного контроля и регулирования.
Система компьютерного контроля и
регулирования основных функций — весьма важная
составляющая электрокоагулятора, обеспечивающая его
эффективную и безопасную работу. Компьютер,
встроенный в блок, контролирует изменение
сопротивления ткани подвергаемой воздействию электроножа,
и изменяет мощность прибора для сохранения
достаточного эффекта. Кроме того, компьютерный
процессор необходим для контроля качества
соединения: пациент — электрокоагулятор.
Достаточный для безопасной работы контакт пациента с
пластиной, целостность изоляции проводов,
отсутствие поломок прибора — вот перечень основных
«обязанностей» системы компьютерного контроля.
Электрокоагулятор такого класса способен
самостоятельно определять неисправность, обозначая
ее соответствующим кодом. Некоторые модели
можно соединять по телефону через модем с
сервисным центром для тестирования «не выходя из
операционной». Таким образом: современный
электрокоагулятор — это сложная сбалансированная
эффективная хирургическая система, являющаяся
результатом многолетнего научного поиска, и
отвечающая самым жестким критериям безопасности.
При выборе прибора для своей работы необходимо
руководствоваться наличием всех перечисленных
составляющих, которые помогут отличить
достойную технику от суррогата.
Некоторые производители, давая звучные
имена своей продукции, решают проблему сбыта
путем создания искусственной «ниши». Например,
называя приборы «радионожами», имеют в виду,
что коагулятор работает на сверхвысоких частотах
C,8 МГЦ) Такой инструмент действительно
больше радиопередатчика, излучающего мощные
электромагнитные потоки во всех направлениях,
увеличивая риск развития осложнений и оказывая
вредное воздействие. Таким образом,
рекламируемая особенность высокочастотных приборов, на
самом деле является серьезным недостатком.
Важно учитывать, что все разрешенные к
использованию в медицинской практике
электрохирургические блоки работают на радиочастоте D40-
510 КГЦ), которая сбалансирована с другими
параметрами устройства. При увеличении частоты,
во избежание запредельного возрастания утечки
тока, неизбежно приходится уменьшать
мощность, что существенно снижает область
применения такого прибора.
Моно- и биполярная электрохирургия
Две эти разновидности электрохирургического
воздействия существенно отличаются. При моно
полярной коагуляции и резании электрический тек
проходит через все тело пациента от собственно
рабочего инструмента до второго электрода — пла
стины, обеспечивающей широкий контакт. Рабочий у
электрод обычно называют «активным», а пластину
«пассивным» электродом (хотя с точки зрения фи г
зики это и неправильно). Как уже отмечалось коаг\-
ляционный эффект развивается на том участке це
пи, где происходит наибольшая концентрация тока
В норме это место между рабочим инструментом и
тканью, но в случае изменения условий похождения
тока возможно появление нежелательного
коагуляционного эффекта на других участках электричес
кой цепи, что может приводить к серьезным
осложнениям. Например: уменьшение площади контакта
на «пассивном» электроде превращает его в
«активный» вызывая термическое повреждение кожи и
подлежащих тканей. Известны случаи получения
пациентом ожога III-IV степени вследствие
неплотного прилегания пластины. Иногда на пластину
кладут смоченную физиологическим раствором
салфетку для улучшения контакта с неровной
поверхностью, но такое решение проблемы также
небезопасно поскольку, высыхая, салфетка постепенно
увеличивает концентрацию тока на влажных
участках и вызывает тем самым термическое
повреждение. Радикальным решением проблемы скорее
всего является использование
электрокоагуляторов оборудованных так называемой REM системой.
Суть ее заключается в том, что прибор постоянно
измеряет сопротивление на пластине пациента,
которая представляет собой гибкий электрод,
покрытый клейким токопроводящим слоем. Как только
сопротивление возрастает до опасных величин,
коагулятор подает звуковой сигнал и отключается.
Электрический ток течет через организм по пути
наименьшего сопротивления, поэтому, встречая на
своем пути металлические предметы, ток
концентрируется в них. Очень опасно в связи с этим, коагу-
23
Глава 2
лировать, например, в непосредственной близости
от механического скрепочного шва. Токи,
возникающие в скрепках, вызывают коагуляционный эффект
и могут привести к несостоятельности швов в
послеоперационном периоде. Небезразлична
монополярная электрохирургия и для пациентов с
имплантированными металлическими суставами.
Разогрев протеза во время операции, может вызвать
денатурацию белка фиксирующей кости, что в
дальнейшем способствует «разбалтыванию» сустава.
Наконец существует еще одно грозное осложнение,
возникновение которого не исключено при
использовании электрокоагулятора низкого качества. Это
емкостной пробой. Дело в том, что два электрода,
имеющие разность потенциалов и разделенные
слоем диэлектрика, являются электрическим
конденсатором. В нашем случае между электродами
f находится пациент, который хотя и является токо-
] проводящей средой, при определенных условиях
может весьма затруднять прохождение
электрических зарядов. Например, при длительной коагуляции
| одного и того же участка ткань высыхает и
приобретает свойства диэлектрика. При очень высоком
сопротивлении тканей происходит накопление заряда
на электродах, точно также как и на пластинах
конденсатора. Если отсутствие достаточного
коагуляционного эффекта на высохшей ткани побуждает
хирурга к неадекватному увеличению мощности
электрохирургического блока, величина
накопленного заряда возрастает до тех пор, пока не
происходит пробой через тело пациента. Сила тока в
момент пробоя достигает огромной величины, и
вызывает термическое повреждение тканей на всем пути
электрического разряда.
Биполярная электрохирургия более безопасна в
связи с тем, что ток в этом случае течет только
между браншами рабочего инструмента, и такие
осложнения как ожоги на пластине пациента и
емкостной пробой исключены в принципе. Однако
область применения биполяра довольно узкая, так как
при биполярном режиме отсутствует возможность
резания тканей, за исключением прибора Trimax,
который разрезает ткань после коагуляции
обычным лезвием. Правда, периодически появляются
разработки вроде биполярных ножниц, но они до
сих пор не получили большого распространения
ввиду технического несовершенства. Кроме того,
для получения коагуляционного эффекта
необходимо захватить ткань между браншами
инструмента, что не всегда возможно. Тем не менее
биполярный коагулятор практически незаменим, когда
необходима продолжительная и локальная
коагуляция, например обработка широкой связки матки
при гистерэктомии. При этой процедуре
анатомическая структура целиком располагается между
браншами инструмента и коагулируется на всю
глубину, без распространения эффекта на
окружающие ткани.
Бесконтактная электрокоагуляция
Как известно, при непосредственном контакте
коагулирующего электрода с тканью возникает
эффект «приваривания». Образующийся струп
прилипает к электроду и отрывается при удалении
последнего. Для предотвращения подобного
эффекта, а также для увеличения площади
обрабатываемой поверхности существуют специальные режимы
бесконтактной коагуляции, которые обычно
называют спрей-коагуляцией, или фульгурацией. Суть
метода заключается в прохождении электрического
тока через небольшую B-3 мм) воздушную
постройку между рабочим электродом и тканью. Однако
использование спрей-коагуляции при
эндоскопических операциях не всегда безопасно. Дело в том,
что для получения электрической искры требуется
увеличение мощности коагулятора до 100-120 Вт,
что приводит к возрастанию токов утечки, кроме
того, особенностью эндохирургического рабочего
электрода является его непосредственное
соприкосновение со стенкой операционной полости. При
наличии даже незначительных дефектов изоляции
инструмента в процессе использования
спрей-коагуляции может произойти ее пробой, поскольку
величина электрического сопротивления
воздушной прослойки и изоляции инструмента
сопоставимы. Для предотвращения осложнений при
бесконтактной коагуляции мы рекомендуем
использовать специальную приставку к электрохирурги-
чекому блоку подающую инертный газ аргон
непосредственно к рабочему электроду. Под
воздействием электрического тока аргон легко
ионизируется и даже на небольшой мощности проводит
коагулирующий ток. Поток аргоновой плазмы
позволяет удалять рабочий электрод от
коагулируемой поверхности на расстояние 1,5-2 см, что
увеличивает площадь воздействия на ткани. Кроме
того, аргон-усиленная коагуляция весьма
поверхностна. Проникновение коагуляционного некроза в
ткани не превышает десятых долей миллиметра.
Учитывая это обстоятельство, этот вид
бесконтактной электрокоагуляции лучше всего использовать
для обработки больших поверхностей при
диффузном кровотечении (например, паренхиматозные
органы). По той же причине не следует добиваться
остановки кровотечения из крупного сосуда
потоком аргоновой плазмы.
Техническое обеспечение эндохирургических операций
Блок подачи аргона, предназначенный для
эндохирургических операций, имеет специальный датчик
контроля давления в операционной полости. Блок
соединяется с троакаром дополнительной
магистральной трубкой, и при превышении допустимого
давления автоматика отключает подачу газа.
Ультразвуковая коагуляция и резание
тканей
Наличие определенных проблем и условий
использования электрического тока для остановки
кровотечений в ходе операции, заставляет искать
альтернативные способы коагуляции и резания.
Один из таких способов — воздействие на ткани
ультразвуковыми колебаниями с частотой
55,5 kHz, которая специально подобрана для
оказания деструктивного денатурирующего эффекта на
ткани без вредного воздействия на организм в
целом. Специальный ультразвуковой генератор
соединяется с инструментом, выполненным в виде
ножниц или шарика. Эффект ультразвукового
воздействия по качеству приближается к таковому при
электрохирургическом способе, что делает такой
прибор незаменимым при наличии прямых
противопоказаний к использованию монополярной
коагуляции (например, искусственный водитель
ритма). Ультразвуковое воздействие обладает рядом
неоспоримых преимуществ перед
электрохирургией: во время коагуляции и резания нет дыма, и в
атмосферу операционной полости не выделяются
вредные продукты горения. Пар, который
образуется при коагуляции, не требует эвакуации,
поскольку оседает самопроизвольно за короткое
время. Диаметр сосудов, которые можно закрыть при
помощи ультразвукового воздействия достигает
3 мм, что ощутимо больше, чем при работе с
коагулятором. Благодаря такой эффективности
ультразвуковой прибор может быть использован для
массивных мобилизаций (например, при гемиколэкто-
мии), без привлечения дополнительных
кровоостанавливающих средств. Кроме того, ультразвуковые
ножницы позволяют сначала захватывать порцию
ткани и лишь затем ее пересекать, что является
дополнительной гарантией безопасности.
LigaSure™ Vessel Sealing System —
генератор для электролигирования
сосудов
В конце 1999 г. компания «Валлилаб» представила
миру принципиально новый способ
электрохирургического воздействия на ткани. Генератор и новые
инструменты к нему получили название LigaSure™
Vessel Sealing System.
Напомним, что электрохирургический гемостаз
— это монополярная или биполярная коагуляция
сосудов, диаметром до 1,5 мм. При этом сосуд с
небольшим участком ткани интенсивно высушивают
вместе с находящейся в нем кровью. Эта
достаточно хрупкая субстанция (коагулят) не слишком
прочно связана с подлежащими тканями, и часто
присыхает к коагулирующему инструменту. Отрывание
инструмента от ткани может приводить к
продолжению кровотечения. Электрохирургическое
воздействие осуществляют малыми переменными
токами (десятые доли ампера), и разным
электрическим напряжением (большое, несколько тысяч
вольт — монополярная коагуляция; небольшое —
300-800 W при биполярной коагуляции).
Первое отличие LigaSure™ от традиционной
электрохирургии состоит в иных электрических
характеристиках. Способ воздействия — биполярный. Сила
тока очень большая — 4 ампера. Напряжение
напротив очень низкое — 180 вольт. Второе — у
подаваемого переменного тока нет стандартных модуляций.
Они зависят от тканевого ответа. Третье и главное —
изучение тканевого ответа построено на
электронной системе слежения за импедансом тканей
(Instant Responce™) больного под рабочим
электродом (электродами), с соответствующей
корректировкой выхода. Instant Responce™ позволяет 200 раз
в секунду проверить сопротивление,
подкорректировать подаваемую энергию, завершить подачу.
Затем этот цикл повторяется. После того как
постепенно изменяющиеся электрические характеристики
тканей будут соответствовать «портрету» надежно
запечатанного сосуда, воздействие автоматически
прекращается. Каждая обработка сосуда занимает
по времени от 2 до 6 с (в среднем около 5 с). Не
менее важной должна считаться четвертая характерная
особенность LigaSure: электрическое воздействие
сочетается с постоянным давлением на ткани. Оно
реализуется эластичностью инструмента-зажима и
обязательным защелкиванием кремальеры.
Несоблюдение этого правила не только удлиняет
воздействие, делает его менее качественным, но и
существенно увеличивает боковое распространение тепла,
повреждающего окружающие ткани.
Система LigaSure™ не коагулирует, а заваривает
сосуд. Ткани не пересушиваются. Коллаген и
эластин сосудистой стенки превращаются в гомогенную
субстанцию. Фактически они расплавляются и
затвердевают в процессе воздействия. Заваренное
(запечатанное, запломбированное, электролигиро-
ванное) место — это тонкая полупрозрачная
пластина, повторяющая по форме рабочую поверхность
браншей инструмента. Прочность «заклеенной зо-
Глава 2
ны», состоящей из частично денатурированного
протеина, сопоставима с прочностью прошитой
ткани. Эту «пластиковую» пломбу пересекают
ножницами. Генератор LigaSure™ получил разрешение
Американского комитета по контролю качества
лекарственных средств и пищевых продуктов (FDA)
для использования на изолированных артериях и
венах диаметром до 7 мм, а также на прядях тканей.
Система позволяет свести до минимума
прилипание ткани к браншам, обугливание и термическое
повреждение близлежащих тканей. Возможность
работать, не выделяя сосуды из окружающих
тканей, позволяет существенно сократить время,
необходимое для мобилизации.
Компьютер
Использование компьютерного контроля
правильности и стабильности работы приборов,
входящих в эндохирургический комплекс, — новая
тенденция. Технология такого контроля пока
недостаточно продуманна. Однако сама идея весьма
прогрессивна. Вероятно, в ближайшем будущем
хирурги получат единый программируемый блок,
которому нужно будет сообщать не технические
параметры, а лишь вид оперативного вмешательства
и информацию о динамике показателей гомеостаза
пациента, которая может передаваться
непосредственно с анестезиологических мониторов
слежения. Компьютер, переводящий аналоговый
видеосигнал в цифровой, дает возможность передачи
динамической операционной картинки через
глобальную сеть в режиме «on line». Это позволяет
пользоваться консультациями специалистов,
находящихся за тысячи километров, непосредственно в
ходе операции. Кроме того, уже созданы и
испытаны роботы, точно повторяющие движения врача
манипулирующего специальным джойстиком, вроде
того, который применяют в компьютерных играх.
При использовании роботизированной техники, не
только консультант, но и оперирующий хирург
может находиться вне операционной. Это на первый
взгляд излишество может произвести революцию в
системе оказания неотложной хирургической
помощи в экстремальных ситуациях. Достаточно
доставить мобильный компьютерный хирургический
комплекс непосредственно в прифронтовой госпиталь,
или к месту экологической катастрофы, и ведущие
хирурги со всего мира могут быть задействованы в
оказании помощи раненым и пострадавшим.
Размещение и соединения
Расположение эндохирургического комплекса в
операционной зависит от вида оперативного
вмешательства и личных предпочтений хирурга.
Идеален вариант, при котором видеомонитор
устанавливают отдельно и крепят на специальных шарнирах к
потолку. Учитывая влияние электрокоагулятора на
другие приборы, его также лучше выносить за
пределы «стойки». Однако такой разброс приборов
возможен, если клиника располагает специальной эн-
дохирургической операционной. Если
оборудование необходимо часто перемещать к различным
операционным столам, лучше полностью
установить его на тележку.
На верхнюю полку тележки устанавливают
монитор. Остальные приборы размещают произвольно,
с учетом следующих основных требований: а —
световод и кабель видеокамеры на должны
перегибаться, б — в пределах видимости должны находиться
все важнейшие показатели состояния системы
(давление в полости, расход газа, скорость подачи
газа, освещенность, мощность коагуляции и
резания и т.д.) Существуют устройства, например ин-
суффляторы, которые позволяют выводить
основные параметры непосредственно на видеомонитор,
что дает определенную свободу расположения.
Схема соединения видеосистемы обычно
выглядит следующим образом: S-VHS выход
видеокамеры соединяется с аналогичным входом монитора,
стандартный VHS выход подключается к осветителю
для активации противобликовой системы. При
отсутствии у камеры дополнительного выхода, сигнал
на осветитель берется с выхода монитора. С
монитора обычно производят и видеозапись.
Необходимо следить, чтобы видеокабели нигде не
соприкасались с проводами электрокоагулятора, во
избежание помех. Несмотря на наличие единого тумблера
блока розеток, каждый прибор включается и
выключается отдельно. Это связано с тем, что любой,
даже самый совершенный выключатель при
срабатывании вызывает некоторый перепад напряжения,
который тем значительнее, чем больше
потребляемая мощность электроприборов. Суммарная
мощность устройств «стойки» может составлять
1-1,2 КВт, что уже критично для предохранителей.
Ввиду обилия проводов и магистралей для
жидкости, процесс сборки и подключения стерильной
части оборудования занимает довольно много
времени A0-15 мин), поэтому вводить больного в
хирургическую стадию наркоза до полной сборки
всего инструментария нерационально.
Сначала подключается головка видеокамеры,
которая помещается в стерильный чехол (несмотря на
возможность газовой стерилизации, большинство
клиник предпочитают не подвергать этот прибор
дополнительным испытаниям), затем производится
Техническое обеспечение эндохирургических операций
присоединение лапароскопа и световода, причем
последний укладывается и фиксируется к белью
таким образом, чтобы избежать перегибов. Обе
магистрали аквапуратора, как правило, соединяются
вместе и прокладываются в складке операционного
белья во избежание запутывания в ходе операции.
Отдельно проводится трубка от инсуффлятора и
электрохирургический кабель. Последний
фиксируется к белью исключительно пластиковыми
зажимами для предотвращения нежелательных эффектов
описанных выше. Необходимо избегать
соприкосновения кабеля электрокоагулятора и провода
видеокамеры, во избежание появления искажений на
мониторе. Лучше если все трубки, а также
электрические провода, будут иметь фиксирующиеся
соединения типа «Байонет» для предотвращения
разрыва связей во время операции.
После полного подключения и расположения
инструментов в стерильной зоне и обработки
операционного поля, следует сдвинуть весь комплекс
(если он расположен у головного конца операционного
стола) для того, чтобы дать возможность
анестезиологической бригаде интубировать пациента для
подключения к ИВЛ и введения в наркоз.
Стерилизация
Стерилизация и подготовка эндохирургических
инструментов достаточно сложный процесс. С
одной стороны, для обеспечения стерильности
инструментария должны применяться совершенно
обычные для хирургии правила и нормы, а с другой
— эндоскопические инструменты значительно
более сложные и требуют повышенного внимания к
возможным негативным последствиям рутинной
обработки.
Практически ни один эндоскопический
инструмент не допускает обработки при температуре
свыше 120° С, а следовательно, для стерилизации
допустимо только автоклавирование. Любые
современные жесткие эндоскопы могут обрабатываться в
автоклаве, но требуют обязательного соблюдения
параметров давления и температурного режима,
что возможно лишь при использовании
качественного стерилизатора. По этой причине большинство
хирургов не рискуют применять автоклавирование
для наиболее дорогих компонентов
эндоскопического комплекта. Кроме того, даже обычные
металлические инструменты в результате многократной
обработки теряют прочность, и срок их службы
сокращается. Наиболее безопасный и
распространенный сегодня способ — это жидкостная
стерилизация специальными растворами; эта методика
позволяет обрабатывать в том числе и пластиковый
инструмент, удельный вес которого в операционных
имеет тенденцию к увеличению. Другой удобный
способ обработки — газовая стерилизация.
Стерилизация таких компонентов как электропровода,
оптика, видеокамера, световоды осуществляют почти
исключительно с использованием паров
антисептика. Необходимо учитывать, что при обработке
инструмента в газовой камере требуется полная его
разборка, для обеспечения беспрепятственного
доступа паров во внутренние полости.
РУЧНЫЕ ИНСТРУМЕНТЫ
Инструменты для формирования
операционной полости
Любая эндоскопическая операция требует
создания достаточного операционного пространства для
манипуляций. Поэтому соответствующий
инструмент абсолютно необходим при проведении
любого, даже диагностического, вмешательства.
Специальный инструмент для инсуффляции газа в
полости — игла Veress. Она представляет собой обычную
полую иглу с подпружиненным мандреном, который
выдвигается сразу после проникновения в полость,
закрывая острие. Этот механизм положен в основу
защиты внутренних органов от повреждения как
иглой, так и троакаром. Конструкция иглы для
инсуффляции позволяет оценивать момент прохождения
иглой плотных тканей, благодаря контролю за
подвижным внутренним стержнем. Диаметр иглы
обычно составляет 1,5-2 мм.
Несмотря на свою универсальность, иглу Veress
используют в основном для наполнения
естественных полостей (брюшная, плевральная) или для
инсуффляции газа в заранее созданную операционную
полость (ретропневмоперитонеум). Формирование
операционных полостей в клетчаточных
пространствах—проблема, решение которой значительно
расширяет возможности эндохирургии, распространяя
методику на внебрюшинно расположенные органы
и ткани. Наилучшим инструментом,
предназначенным для этой цели, является специальный баллон,
изготовленный из силикона или полиуретана и
соединенный с троакаром. После подведения
троакара к месту хирургического интереса баллон
медленно наполняется газом или физиологическим
раствором. Такую пневматическую или гидравлическую
диссекцию можно осуществлять непосредственно
через прозрачную стенку баллона, под контролем
эндоскопа, предварительно введенного в троакар.
Наиболее известные названия таких баллонов:
ExtraVlew, Spacemaker.
Глава 2
Троакары
Доступ к объекту операции в эндохирургии
возможен лишь через определенные заранее
выбранные точки доступа, именуемые в иностранной
литературе операционными портами. Для проведения
инструмента порт должен быть снабжен
специальным устройством в виде полой трубки
соответствующей по диаметру рабочей части манипулятора.
В качестве такого устройства используют
хирургический троакар. Троакаром обычно называют
инструмент, состоящий из трубки (канюли) с клапаном, в
которую вставлен специальный стилет. Хотя в
старой литературе иногда под троакаром
подразумевают только стилет без канюли. Большинство эндо-
хирургических троакаров имеют еще и специальный
кран для инсуффляции и десуфляции. Через этот
кран возможно заполнение операционной полости
газом во время операции.
Первые троакары не имели клапанной системы и
предназначались преимущественно для эвакуации
жидкости и дренирования полостей. В
эндохирургии к троакару предъявляется целый ряд новых
требований, одно из них обеспечение герметичности
операционной полости во избежание утечки газа.
На сегодняшний день существует несколько
разновидностей клапанов, которые неодинаковы по
качеству и удобству.
а) Плунжерный троакар имеет клапан, который
представляет собой цилиндр, перпендикулярный
основной трубке. В цилиндре находится
подвижный подпружиненный плунжер, при нажатии на
который появляется отверстие, открывающее
рабочий канал. Такой троакар был вполне удобен для
диагностических процедур, когда хирург одной
рукой может держать эндоскоп, а другой нажимать на
кнопку. При операциях, в ходе которых используют
несколько троакаров, такой прием становится
затруднителен, а то и вовсе не возможен. Когда
хирург выводит инструмент из операционной
полости, чаще всего вынимается и троакар, который
давит на манипулятор пружиной плунжера. Кроме
того, эндохирурги, имеющие определенный опыт,
вполне могут оценивать опосредованные через
инструмент тактильные ощущения, и динамические
нагрузки необходимые в тех или иных условиях.
В плунжерномлроакарв-инетрумент получает до-
полнмтв/шную боковую нагрузку, которая
нивелирует все остальные воздействия. Как правило, все
современные манипуляционные инструменты,
даже не предусматривающие подключение
электрокоагулятора, имеют электроизоляцию.
Изнашиваясь, край плунжера постепенно заостряется и, в
случае поверхностного повреждения изоляции
инструмента, срезает ее, увеличивая опасность
электротравмы.
б) Магнитно-клапанный троакар снабжается
постоянным магнитом, отверстие в котором
закрывается стальным шариком. Эта система вполне надежна в
плане герметичности, поскольку здесь нет пружин и
прокладок, но такой троакар имеет целый ряд
недостатков, делающих его крайне нежелательным для
применения в эндохирургии. Во-первых, если
вставлять в такой троакар оптический прибор с торцевой
оптикой, возможно повреждение линзы о
металлический шарик. Если хирургу все же удается аккуратно
вставить эндоскоп, то при удалении его из полости
шарик магнитного клапана успевает ударить точно в
центр торцевой линзы. Во-вторых, при
использовании трубчатого инструмента (например, канюли
отсоса), возникает эффект вклинения последнего
между стенкой троакара и шариком клапана. В-третьих,
происходит намагничивание всех инструментов, что
особенно сказывается на иглодержателях при
наложении ручного шва: игла, которую и без того трудно
правильно ориентировать в операционной полости,
становится совершенно неуправляемой.
в) Троакар с форточным клапаном наиболее
распространенная на сегодняшний день модель.
Клапан представляет собой «форточку»
отодвигающуюся в сторону на мягкой пружине. Наиболее
качественные представители этого семейства
позволяют открывать клапан наружным рычагом, хотя это
актуально только для оптики. Форточный клапан не
оказывает сколько-нибудь существенного давления
на инструмент и не приводит к намагничиванию
последнего. Однако недостатки такого троакара —
сравнительно быстрый износ по сравнению с
плунжерным: в боковой поверхности «форточки» со
временем протачивается бороздка, что приводит к
нарушению герметичности операционной полости.
г) Троакар со створчатым клапаном —
наиболее совершенное устройство, поскольку клапан не
оказывает никакого влияния на введенный
инструмент, обеспечивает полную герметичность полости.
Он представляет собой две эластичные створки,
соприкасающиеся между собой наподобие
митрального клапана сердца. Троакары с таким клапаном,
как правило, изготовлены из пластика либо
представлены в виде титановой канюли и пластиковой
клапанной системы. Такое решение наиболее
интересно с практической точки зрения, поскольку
изношенный пластиковый клапан легко заменить, а
канюля, изготовленная из инертного сплава,
практически долговечна.
Кроме клапанной системы троакары могут иметь
самые разные конструкции стилетов.
28
Техническое обеспечение эндохирургических операций
Мы можем предложить следующую
классификацию по типу проникновения троакара в полость:
а) Конический стилет в настоящее время
практически не используют, поскольку проведение его
затруднено из-за отсутствия режущих граней. Такой
стмлет либо рвет ткани, либо раздвигает их,
создавая сдавление и ишемию в месте проникновения.
Затрудненное прохождение брюшной стенки может
приводить к неконтролируемому проникновению
троакара в полость и повреждению внутренних
органов.
б) Пирамидальный стилет имеет три или
четыре грани с режущими краями, что позволяет легко
вводить троакар, который разрезает плотную ткань
соответственно форме граней. Однако для
дозирования усилий по введению троакара хирург
вынужден вращать стилет по оси, что приводит к разрыву
тканей в месте введения. Исходя из этого,
пирамидальный троакар должен допускать независимое от
режущей головки вращение рукоятки.
1. Троакар с режущей кромкой. Стилет такого
троакара представляет собой полую трубку с
режущим краем, что достаточно атравматично и удобно
для хирурга.
2. Троакары со специальными лезвиями — как
правило, наиболее совершенные инструменты
снабженные «активной» защитой стилета, о которой
будет упомянуто ниже, введение такого стилета
наименее травматично и напоминает разрез
скальпелем.
3. Троакар с тупым стилетом — инструмент
предназначен для так называемого
открыто-лапароскопического доступа, т.е. для его введения
предварительно выполняют микролапаротомию A,5-2 см).
Троакар вводят в подготовленное отверстие и
закрывают его специальным обтуратором, который
подшивается к стенке операционной полости
(методика Hasson). Такая техника введения
необходима при наличии труднопроходимых спаек органов и
стенок полости. Существуют троакары, снабженные
раздувной манжеткой плотно обтурирующей мини-
лапаротомное отверстие. Такая система не требует
дополнительной фиксации.
Следующее требование к эндохирургическому
троакару — наличие защиты стилета, точнее,
защиты внутренних органов от повреждения. Особенно
это актуально для троакара первого введения.
Механизмы защиты могут быть «пассивными» и
«активными». Первые обычно представляют собой нечто
вроде подпружиненного цилиндра внутри полого
стилета с режущим краем. После проникновения в
полость, защитный цилиндр выдавливается над
лезвием, отодвигая органы. Но если имеется
нарушение мобильности последних вследствие
спаечного процесса, такая защита не всегда срабатывает,
кроме того, при случайном неконтролируемом
проникновении в полость и неосторожном толчке
защита отодвигается так же легко, как и при
прохождении стенки операционной полости. Во избежание
таких осложнений выталкивающую пружину
приходится делать достаточно жесткой, что, в свою
очередь ограничивает применение такого троакара.
Например, если предбрюшинная клетчатка
выражена, брюшина легко отслаивается защитным
цилиндром, не обнажая лезвие. В такой ситуации
проникновение троакара в полость может оказаться за-
труд н ител ьн ы м.
То, что называют «активной» защитой,
принципиально отличается от описанного выше. После
проникновения в полость такая защита
срабатывает и жестко фиксируется, предотвращая
повторное отодвигание защитного колпачка. Для
возобновления прохождения тканей механизм
необходимо вновь активизировать простым ослаблением
давления на стилет. Наиболее сложные модели
«активного» троакара предусматривают
срабатывание защиты еще до полного проникновения
троакара в операционную полость: защитный
колпачок имеет боковые прорези, и закрывает острие,
оставляя открытыми режущие края стилета.
Другая современная система активной защиты
предусматривает использование плоского лезвия,
которое убирается вовнутрь стилета сразу после
проникновения в полость.
Существуют ситуации (например, интимно
подпаянная к передней брюшной стенке кишка), при
которых отсутствует даже небольшой зазор между
органом и стенкой полости. В этом случае даже
активная защита не «увидит» фиксированный орган и не
сработает.
Для того чтобы вовремя увидеть препятствие и
избежать его повреждения существует оптический
троакар, позволяющий проводить стилет под контролем
зрения (Visiport). Стилет такого троакара выполнен из
прозрачного пластика, вовнутрь которого
вставляется лапароскоп, соединенный с видеокамерой. В поле
зрения постоянно находится лезвие, которое
«выстреливает» на 1 мм при каждом нажатии на
специальный курок. Таким образом, хирург шаг за шагом
прослеживает весь путь стилета и имеет возможность,
изменяя направление, обойти подпаянный орган или
даже сосуд передней брюшной стенки.
Троакары могут быть разного диаметра, в
зависимости от назначения. Существует несколько
стандартных размеров 2; 5; 10; 12 мм (реже 15; 22 мм).
Инструмент другого диаметра в современной эндо-
29
Глава 2
хирургии почти не используется. В связи с тем, что
через один и тот же порт проводится инструмент
разного диаметра, возникает проблема
обеспечения герметичности операционной полости.
Существуют различные редукторы, позволяющие менять
диаметр герметизирующей прокладки, в виде
внутренней вставки или револьверной насадки.
Наиболее интересен троакар, снабженный универсальной
насадкой, плотно облегающей инструмент
диаметром от 5 до 12 мм, и не требующий переключения
или смены переходников (Versaport).
Учитывая сложность конструкции, часть наиболее
совершенных троакаров изготавливают из
пластика. Кроме того, резиновые части клапанов и
переходников стилеты с защитой изнашиваются
быстрее, чем канюли, что также делает нерациональным
изготовление этих частей из металла. Пластик
имеет еще одно важное преимущество — рентгеннега-
тивность. При выполнении интраоперационных
рентгеновских исследований металлические
троакары приходится удалять из зоны интереса.
Во время больших эндоскопических
вмешательств, как правило, нет возможности
придерживать троакары, предотвращая их выпадение или
напротив избыточное проникновение в операционную
полость. Для жесткой установки троакара в стенке
операционной полости существуют специальные
резьбовые фиксаторы. При использовании
фиксаторов необходимо соблюдать правила
электробезопасности. Дело в том, что если троакар имеет
металлическую канюлю, а фиксатор пластиковый, то
всегда существует опасность повреждения
внутренних органов при случайной активации коагуля-
ционного электрода в соприкосновении с канюлей.
В этом случае троакар изолирован от брюшной
стенки диэлектриком, и ток концентрируется в
месте случайного контакта. Повреждение может
находиться вне зоны видеообзора, что приводит к неди-
агностированным интраоперационным
осложнениям. Лучше всего использовать металлическую
канюлю с металлическим фиксатором и,
соответственно, пластиковый троакар с
пластиковым фиксатором.
Зажимы и пинцеты
Отличаются от общехирургических удлиненной
рабочей частью, которая соответствует по диаметру
одному из стандартных троакаров. Рабочая часть
зажимов различна, в зависимости от требований
предъявляемых к инструменту. Например, мягкий
зажим для атравматичного удержания и тракции
органов, или жесткий «когтистый» повреждающий
зажим для захвата и эвакуации удаленных тканей. Как
правило, зажимы от различных производителей
отличаются качеством материала, из которого они
изготовлены, долговечностью и удобством в
использовании. При эндоскопических операциях
невозможна столь быстрая смена инструмента как в
открытой хирургии, поэтому зажим должен быть как
можно более универсальным. Существуют
инструменты, снабженные отключающейся кремальерой,
что позволяет использовать такой зажим, как для
длительного удержания ткани, так и в качестве
пинцета. Диаметр используемых зажимов
соответствует стандартным размерам троакаров и, как
правило, бывает 5 и 10 мм. Для большинства рутинных
процедур подходят 5 мм инструменты, но при
необходимости увеличения объема захвата ткани,
например при операциях на кишке и желудке,
требуется мягкий 10 мм зажим, для удержания удаляемого
органа в гинекологии часто необходим мощный
«когтистый» инструмент.
Создание 2 мм инструментов вполне
укладывается в рамки общей тенденции к снижению
операционной травмы, однако использование таких
инструментов чаще всего мотивировано лучшим
косметическим эффектом. После появления полноценного
набора для «игольных операций», специалисты
говорят уже о микроинвазивной хирургии.
Среди всего многообразия эндохирургических
зажимов довольно трудно выбрать наиболее
удобный. Мы предлагаем обращать внимание на
следующие детали: ручка, поворотный механизм и
изоляция. При работе удлиненным инструментом кисть
хирурга находится в положении сгибания в лучеза-
пястном суставе, следовательно, дальнейшее
сгибание пальцев для нажатия на ручку инструмента
неудобно. Удобно в таком положении работать
большим пальцем, поскольку пястно-фаланговый
сустав большого пальца свободен. Таким образом,
подвижной должна быть задняя ветвь рукоятки.
Передняя ее часть должна иметь широкое кольцо для
четырех пальцев и быть жестко фиксированной к
инструменту — неподвижной.
Удобный в обращении поворотный механизм —
важнейшая часть любого эндоскопического
манипулятора. Это устройство позволяет адаптировать
бранши зажима, соответственно плоскости захвата
ткани, без поворота ручки инструмента. Кольцо
поворотного механизма обычно располагают таким
образом, чтобы его можно было вращать
указательным пальцем руки удерживающей ручку зажима.
Электроизоляция любого инструмента должна
быть достаточно стойкой к повреждению,
поскольку даже микроскопическая трещина в изоляции
будет приводить к уменьшению электрического со-
ЗО
Техническое обеспечение эндохирургических операций
противления в этом месте, и, соответственно, к
концентрации тока. Локальная концентрация тока,
в свою очередь, вызывает расплавление
изолирующего пластика, и пробой на троакар. Даже если
инструмент не предусматривает подключения к
электрокоагулятору, он должен быть изолирован,
поскольку возможно случайное прикосновение
активного электрода и развитие коагуляционного
эффекта вне зоны видимости.
Режущий и коагулирующий инструмент
Наибольшую популярность среди начинающих
эндохирургов приобрел L-образный электрод —
«крючок». Эффект разрезания тканей достигается
путем активации соответствующего режима
электрокоагулятора. Этот режим представляет собой
переменный ток постоянной амплитуды, который,
разогревая ткань, приводит к закипанию
внутриклеточной жидкости и разрыву мембран. Простые
режущие электроды имеют самые разнообразные
формы и размеры, их общий недостаток —
отсутствие возможности получения эффекта разрезания
без активации коагулятора, что существенно
ограничивает область применения таких инструментов.
Однако такое вмешательство, как холецистэкто-
мия, может выполняться одним (!) крючком» от
начала до конца.
Важной составляющей монополярных режущих
электродов является промывной канал, который
обычно соединяется с системой аспирации и
ирригации. Дело в том, что для обеспечения четкой
визуализации, операционное поле необходимо часто
орошать промывной жидкостью, поскольку
использование осушающих салфеток весьма
затруднительно. Такие унифицированные электроды, как
правило, предусматривают возможность убрать
вовнутрь режущий элемент для обеспечения
безопасной аспирации жидкости.
Монополярные электроды могут иметь большую
площадь и предназначаться исключительно для
остановки кровотечения. Рабочая часть таких
инструментов обычно выполняется в виде «лопатки»
или «шарика». Режим коагуляции
электрохирургического блока представляет собой переменный ток
последовательно нарастающей и убывающей
амплитуды, что приводит к выпариванию
внутриклеточной жидкости и образованию коагуляционного
струпа.
Одни из самых необходимых для выполнения
эндоскопических операций инструментов — ножницы.
Эндоножницы, как правило, предусматривают
подключение электрокоагулятора, однако их
важное преимущество именно возможность
механического резания в местах, где использование
электрохирургии опасно или недопустимо. Наиболее
удобны изогнутые ножницы с двумя рабочими бранша-
ми, поскольку именно такими ножницами только и
возможна мобилизация больших объемов тканей
без коагуляции. Недостатком такого инструмента
является его сравнительно быстрый износ
(затупление), поэтому мы рекомендуем пользоваться
ножницами, изготовленными из пластика, поскольку
разумнее периодически менять инструмент, чем его
ремонтировать. Чтобы избежать затупления, ряд
фирм выпускает ножницы, одна бранша которых
заточена в виде пилы. Такое решение сразу же
приводит к потере качества препаровки.
Как и зажимы, ножницы должны иметь
поворотный механизм и электроизоляцию. Причем
необходимо обращать внимание на то, чтобы изолирована
была вся рабочая часть до режущих поверхностей. ^
Удобство эндоножниц заключается в их универсаль- |
ности: возможность совмещения механического <;
резания с одновременной коагуляцией тканей дела- w*
ет этот инструмент незаменимым при подавляю- |Л*
щем большинстве эндоскопических операций. *
Используют в эндохирургии также и «клювовид- ьч
ные» ножницы, особенностью которых являются
загнутые навстречу друг другу бранши. Такая конст- I
рукция позволяет избежать выскальзывания пере- *•-
секаемой ткани. Этот инструмент применяют в
основном для пересечения лигатур и тубулярных
структур.
Эндодиссектор — инструмент, без которого
трудно представить себе остановку кровотечения и
прецизионную препаровку тканей при
эндоскопических операциях. Область применения эндодис-
сектора очень широка. Практически все операции
предполагают использование этого инструмента,
основные функции которого — захват
кровоточащего сосуда с электрокоагуляцией, диссекция и
удержание тканей. В связи с частым
использованием эндодиссектора в качестве монополярного
активного электрода требования к электроизоляции
предъявляются повышенные. Разумеется,
эндодиссектор должен быть снабжен поворотным
механизмом и удобной рукояткой. Чаще применяется
инструмент с изогнутыми браншами для
обеспечения возможности доступа к объекту операции под
различным углом.
Для тупой эндоскопической препаровки иногда
используют специальный тупфер, но его
применение весьма ограничено из-за необходимости частой
смены материала.
При некоторых операциях возникает потребность
обойти ту или иную структуру (например, пищевод
31
Глава 2
при фундопликации). Для этой цели используют
модифицированный инструмент с произвольно
изгибающейся частью — так называемый ротикулятор.
Обычно это диссектор или ножницы.
Биполярные режущие и коагулирующие
инструменты уже упоминались в соответствующем
разделе.
Ретракторы
Удержание и перемещение мобильных
внутренних органов по операционной полости
осуществляют всевозможными ретракторами. При
эндоскопических операциях ретракторы призваны заменить
ранорасширители, крючки, салфетки и собственно
руки помощника оперирующего хирурга. При
подавляющем большинстве больших
эндоскопических операций создание достаточной экспозиции
без ретрактора практически невозможно.
Требований к этому инструменту два. Первое: ретрактор
должен складываться до размеров троакара и легко
раздвигаться в операционной полости. Второе:
ретрактор должен быть атравматичен.
Существует целый ряд конструкций в виде веера
из эластичных стальных пластин, которые
управляются поворотом рукоятки, или выдвижных
загнутых пластинок вроде иглы Дешана. Надежность
механизма ретрактора очень важна, поскольку при
поломке извлечь последний из полости без
дополнительного разреза часто не представляется
возможным.
Контейнеры для эвакуации удаленных
органов и тканей
В процессе распространения эндоскопической
техники на неотложную хирургию и онкологию
возникла необходимость «чистой» эвакуации
удаленного органа из операционной полости. Для этой
цели использовались самые различные специальные
и приспособленные контейнеры. Однако к
контейнеру со временем стали предъявляться
определенные требования: он должен быть прочным, иметь
жесткое кольцо с отверстием для помещения
органа, и легко извлекаться наружу. Всем эти
требованиям отвечает специальный сачок, который
вводится в полость через 10-15 мм троакар и уже там
раскрывается. Металлическое кольцо позволяет легко
«поймать» удаленный орган и эвакуировать его в
закрытом контейнере с соблюдением правил абла-
стики.
Ручной эндоскопический шов
Уже в ходе первых эндоскопических операций,
связанных с рассечением полых органов,
мобилизацией больших массивов тканей хирурги
столкнулись со значительными трудностями при ушивании
и лигировании под эндоскопическим контролем.
Эти трудности связаны со следующими
техническими различиями между лапароскопической и
открытой хирургией: отсутствие прямого мануального
контакта с тканями, отсутствие бинокулярного
обзора операционного поля, ограниченное поле зре-,
ния, вариабельность размеров изображения
объекта в зависимости от расстояния до него,
ограниченность подвижности инструментов фиксированных в
местах установки троакаров.
Сведение к минимуму трудностей
эндоскопического ручного шва возможно только при
использовании инструментария специально приспособленного
для преодоления «узких мест» метода.
Иглодержатели
Требования к инструменту для удержания иглы в
операционной полости, не отличаются от открытой
хирургии. Необходима жесткая фиксация иглы
между браншами иглодержателя, предотвращающая ее
смещение или вращение. В связи с этим для
развития достаточного усилия иглодержатели для эндо-
хирургии, как правило, имеют только одну
подвижную браншу. Для увеличения толщины внутренней
тяги инструмента производители иглодержателей,
как правило, отказываются от поворотного
механизма. Бранши иглодержателя должны иметь
алмазное напыление для предотвращения
скольжения иглы. На дистальном конце иглодержателя не
должно быть выступающих шарниров, которые
могли бы помешать скольжению нити при завязывании
узла. Рукоятка иглодержателя обычно содержит
кремальеру, управление которой осуществляют
одной рукой. Иглодержатель довольно сложный в
производстве инструмент, видимо поэтому, выбрать
качественный довольно сложно. Иглодержатель в эн-
дохирургии используется не только для
прошивания, но и при завязывании интракорпоральных
узлов. Это процедура достаточно сложна но,
безусловно, необходима для большинства операций.
Формирование узлов осуществляют несколькими
способами, которые подробно описаны в
литературе.
Аппараты для ручного
эндоскопического шва
Уже на заре эндоскопической методики
оперирования хирурги мечтали получить прибор
способный выполнять обычный хирургический шов иглой и
нитью. Достойный аппарат, достаточно близко
имитирующий ручной шов, создан сравнительно не-
Техническое обеспечение эндохирургических операций
давно (EndoStitch) В основу устройства положен
механизм, передающий обоюдоострую иглу из
одной бранши в другую. Нить закреплена посередине
иглы. Аппарат для ручного шва позволяет
уменьшить время наложения эндошва и сделать его
сопоставимым со временем наложения швов в
«открытой» хирургии. Эндостич вполне пригоден для
внутреннего ушивания брюшины, наложения
непрерывного и узлового шва при операциях на
полых органах и органах малого таза. Благодаря
оригинальной конструкции завязывание интракорпо-
ральных узлов из сложной задачи превращается в
рутинную процедуру. Шовный материал для
аппарата ручного шва заряжается в кассету и
вставляется одним движением.
Известны попытки создания аппаратов ручного
шва с использованием челночного механизма
наподобие бытовых швейных машин. Широкого
распространения такие аппараты не получили из-за
высокой сложности формирования шва и технического
несовершенства.
Экстракорпоральный шов
Изобретение устройств для экстракорпорального
шва и лигирования также принадлежит
австрийскому гинекологу Semm. Для того чтобы избежать
трудностей внутреннего завязывания узла, было
предложено формировать узел вне операционной
полости. При этом лигатура или игла проводится в
операционное поле, а затем оба конца нити
извлекаются наружу через троакар. После
формирования узла последний опускается в
операционную полость специальным толкателем. Толкатель
может быть выполнен в виде вилочки. Как правило,
для такого лигирования используется узел Roeder,
который не распускается самопроизвольно и не
требует подкрепления вторым узлом. Техника
наложения экстракорпоральных узлов получила
широчайшее распространение и достаточно подробно
описана в литературе. Заметим, что наиболее
удобными являются петли и лигатуры с заранее
приготовленным узлом и одноразовым толкателем,
поскольку такой комплект значительно сокращает
время процедуры.
Шовные материалы
Структура шовных материалов применяемых в
эндоскопической хирургии мало отличается от
традиционной, но существуют нюансы, которые
необходимо учитывать. Разумеется, для эндошва
абсолютно непригодны крученые нити, которые по-
прежнему применяются в некоторых операционных.
Крученая нить неизбежно запутается и расслоится
при завязывании узла инструментом. Кроме того,
применение высокотехнологичного оборудования
обязывает хирургов к использованию современных
синтетических плетеных и монофиламентных
материалов. Это должны быть нити достаточно легко
скользящие через ткани и в то же время не
распускающиеся в узле. По показаниям применяется
рассасывающаяся синтетика (например, Polysorb,-
Dexon — плетеные; Maxon, Biosin — монофиламен-
ты). Для фиксации искусственного трансплантата и
ряда других процедур используются
полипропиленовые (Surgipro, Surgilen), нейлоновые (Surgilon,
Monosof), полиэстеровые (Surgidac, Ti-cron) нити.
Крупные производители выпускают
специализированные эндохирургические модификации шовных
материалов. Их особенность — небольшая длина
нити A8 см). Это важно, поскольку более длинная
нить не позволяет манипулировать в ограниченной
полости. Кроме того, для эндоскопических
операций, как правило, используют прямые либо
«лыжные» иглы. Это обусловлено тем, что прямую иглу
легче ориентировать в пространстве.
Механический шов
Ручной эндоскопический шов долгое время
оставался непреодолимо трудным для эндоскопических
хирургов. Даже сейчас, несмотря на то, что уже
разработаны всевозможные рекомендации, ручной
шов остается технически сложным для начинающих
и имеет репутацию «высшего пилотажа». Поэтому
стремительное развитие эндохирургии в конце
80-х — начале 90-х гг. связано с развитием
механического шва.
Первым устройством, которое можно отнести к
механическим сшивающим (лигирующим)
аппаратам, является клипаппликатор.
Клипаппликатор был известен и широко
применялся в хирургии задолго до появления
эндоскопических методик, но именно в эндохирургии он обрел
свою настоящую популярность. При небольших
гинекологических операциях и холецистэктомии кли-
пирование сосудов м протоков является
полноценной альтернативой лигированию шовными
материалами.
Большинство выпускаемых на сегодняшний день
клипаппликаторов однозарядные, т.е. после
наложения клипсы необходимо вынуть аппарат из
троакара и перезарядить. Это вполне приемлемо, если
не требуется быстрое последовательное наложен—
ние нескольких клипов (например, при^ютановке
кровотечения). Для обеспечение-эффективной и
быстрой работы созданы^автоматические клипапп-
ликаторь1^ааряженнные некоторым количеством
33
Глава 2
клипс сразу (от 10 до 20). Клипса подается между
браншами автоматически уже в брюшной полости.
Это обстоятельство позволило вводить инструмент
в брюшную полость в сомкнутом виде, т.е.
уменьшить внешний диаметр инструмента. Сегодня мы
имеем уже клипаппликатор диаметром 5 мм, хотя
большинство инструментов этого семейства
десятимиллиметровые.
Многозарядные клипаппликаторы могут быть
пластиковыми или стальными. Последние
заряжаются съемными кассетами.
Клипы изготавливают преимущественно из
биологически инертного титанового сплава и
стандартизируются по четырем основным размерам — в
порядке возрастания: М, ML, L.
Сшивающие аппараты
Революционный прорыв, произошедший в 1987 г.
после выполнения первой холецистэктоми, стал
началом стремительного развития эндоскопической
хирургии, таким же прорывом эндоскопической
технологии в «большую» хирургию считается создание
американской компанией «AutoSuture» специальных
сшивающих аппаратов. Первым из большого
семейства эндоскопических сшивающих аппаратов
стал Endo GIA 30, гордость отечественных хирургов,
поскольку прародителем его несомненно был всем
известный НЖК. Как и аппараты для открытой
хирургии, эндоскопические приборы построены по
стандартному принципу и накладывают заданное
число титановых скобок различной высоты в
зависимости от толщины тканей.
При создании этого аппарата были
принципиально решены две проблемы, что послужило в
дальнейшем быстрому развитию и совершенствованию
этих приборов. Во-первых, была разработана
технология, при которой нож аппарата способен
пересекать скрепочный шов, что сделало возможным
его последовательное наложение. Во-вторых, был
предложен принцип трехрядного прошивания
каждой стенки анастомоза скрепками,
расположенными в шахматном порядке. Три ряда титановых
скрепок (в отличие от двух рядов используемых в
открытой хирургии) позволяют увеличить надежность шва
и полностью отказаться от дополнительной перито-
низации. Это позволило практически во всех
случаях отказаться от дополнительной перитонизации
механического шва, что весьма экономит время в
процессе эндоскопической операции. Все эндо-
степлеры перезаряжаются одноразовыми
кассетами, содержащими скобки, рассчитанными на
тонкую ткань 2,5 мм (белая кассета) и на более толстую
3,5 мм (синяя кассета). Дифференциация кассет
связана с особенностями закрытия скобки. Дело в
том, что, закрываясь, скобка не раздавливает ткань,
а лишь прокалывает ее, сохраняя трофику
прошиваемого участка. Таким образом, не толщина
подгоняется под скобку, а скобка подбирается под ткань.
Предложенная технология позволяет достичь
высочайшего качества шва и свести к минимуму интра и
послеоперационные осложнения.
Уже первый эндоскопический степлер имел
возможность поворота шьющей части на 360°,
дальнейшее совершенствование аппаратов этой серии
пошло по пути удлинения шьющей части, и
повышения интраоперационной мобильности аппарата. На
сегодняшний день в нашем арсенале имеются
аппараты, прошивающие на 30, 45 и 60 мм. Все они
предназначены для наложения анастомозов, т.е.
имеют нож, который рассекает ткань в месте
наложения, оставляя по три ряда скобок с каждой
стороны разреза. Более современные аппараты
обладают большей степенью раскрытия бранш, что
облегчает их наложение, а последние модели
предусматривают поворот шьющей части под 45°.
Полезной находкой является техническое
решение, при котором нож аппарата находится в
одноразовой кассете. Это обстоятельство позволяет
использовать аппарат много раз, не опасаясь
затупления ножа.
Настоящей сенсацией стало создание
эндоскопической модификации циркулярного
сшивающего аппарата. Проблема заключалась в том, что
аппарат трудно ввести (например, в прямую кишку)
без помощи со стороны операционной полости, и
еще труднее вывести после прошивания.
Эндоскопический вариант аппарата для наложения
циркулярного анастомоза имеет следующие
особенности: он удлинен и изогнут для облегчения
введения, имеет головку, которая после
прошивания и открытия аппарата поворачивается под 90°
относительно анастомоза, допускает
возможность эндоскопической стыковки головки
аппарата с основной его частью. Поворот головки
аппарата делает ее прохождение через анастомоз
совершенно свободным и атравматичным «как
пуговица из петли», что значительно уменьшает риск
развития осложнений.
Аппараты для герниорафии
и герниопластики
Несмотря на бурные дискуссии, которые
продолжает вызывать эндоскопическая герниопластика
среди хирургической общественности,
медицинская промышленность уже создала два поколения
аппаратов для этой операции. Первое поколение —
Техническое обеспечение эндохирургических операций
герниостеплеры. Эти приборы накладывают за один
прием только одну титановую скрепку, причем без
упорной бранши. Такая технология позволяет
фиксировать ткани, а также эндопротезы в любом
доступном месте операционной полости. В основном
эндоскопическая герниопластика — это
протезирующая операция с использованием
полипропиленовой сетки для закрытия дефекта.
Недостаток степлеров применительно к гернио-
пластике — тот факт, что скобка не всегда удачно
закрывается, захватив достаточно ткани для
надежной фиксации. В этом случае прошивание
приходится повторять. Кроме того, диаметр аппарата
12 мм позволяет вводить его только с одной
стороны, чтобы не увеличивать число больших проколов.
Во избежание неудобств аппликации аппарата гер-
ниостеплер допускает поворот шьющей головки
под углом до 65° и вращение ее на 360°. Однако это
не всегда спасает, поскольку угловое усилие на
аппарат может оказаться недостаточным.
Второе поколение фиксирующих аппаратов
основано на совершенно ином принципе. Например,
аппарат РгоТаск или Таскег представляет собой
прибор 5 мм в диаметре, который завинчивает
специальные спиралевидные фиксаторы. Такой фиксатор
легко имплантируется в ткани любой плотности, (в
том числе и в надкостницу) и практически
исключает неудачную установку. Если все же хирурга не
удовлетворяет положение трансплантата, фиксатор
может быть выкручен. Диаметр аппарата позволяет
проводить его через любой 5 мм троакар, и,
следовательно, нет необходимости снабжать прибор
дополнительными поворотными механизмами. В один
аппарат помещается до 30 фиксаторов.
35
Общие вопросы
эндохирургической
техники
Пионеры лапароскопической хирургии и их
последователи выдвинули тезис: «Хирургическое
вмешательство, которое можно выполнить открытым путем,
может быть произведено и лапароскопически». Уже в
ходе первых операций, включавших рассечение,
пересечение полых органов, мобилизацию больших
массивов тканей, хирурги столкнулись со
значительными трудностями при ушивании и лигировании под
лапароскопическим контролем. Эти трудности
связаны с существенными техническими различиями
между лапароскопической и открытой хирургией:
- отсутствием прямого мануального контакта с
тканями. Тактильные ощущения ограничены
тем, что может быть передано через
инструмент 30-сантиметровой длины;
- отсутствием прямого бинокулярного обзора
операционного поля. Утрата чувства истинной
глубины операционной зоны затрудняет
координацию и точность движений;
- ограниченностью поля зрения;
- вариабельностью размеров изображения
объекта в зависимости от расстояния до него
(увеличение до 16 раз);
- ограниченной подвижностью инструментов.
Точки введения лапароскопических троакаров
подвижны только в пределах эластичности
брюшной стенки.
ПНЕВМОПЕРИТОНЕУМ
Введение
Пневмоперитонеум — один из способов создания
рабочего пространства для лапароскопической
операции и накладывается путем введения газа в брюшную
полость. В дальнейшем давление газа
поддерживается на заданном уровне в течение всего интраабдоми-
нального этапа оперативного вмешательства.
Прямая пункция иглой Veress — наиболее
распространенный способ наложения пневмоперитонеума.
Хорошо известно, что массивный спаечный
процесс в области кишечника и сальника может
развиваться и без ранее перенесенной абдоминальной
операции, вследствие, например, тупой травмы
органов брюшной полости. Когда наличие внутри-
брюшных сращений остается нераспознанным,
слепая пункция брюшной полости всегда несет в
себе риск вне зависимости от того, выполняется ли
она с использованием иглы Veress или первичной
пункцией 5 мм троакаром. В этой связи никогда не
следует вводить первично троакары диаметром
10 мм и более.
Во времена Kalk, когда он разрабатывал
принципы лапароскопии в диагностике заболеваний
печени, перенесенные операции на органах брюшной
полости считались противопоказанием к рутинной
лапароскопии.
* К настоящему времени, когда наложение
пневмоперитонеума проводилось уже миллионы раз,
серьезные повреждения органов происходят снова и
снова. Тем не менее считается, что их почти всегда
можно предотвратить. Существует ряд мер и
тестов, выполнение которых позволяет
лапароскопическому хирургу безопасно выполнять наложение
пневмоперитонеума в 99% случаев.
Тест инсуффлятора
Электронный инсуффлятор, входящий в состав эн-
дохирургического комплекса, должен
контролировать следующие параметры инсуффляции:
ЗБ
Общие вопросы эндохирургической техники
-давление введения газа;
- количество газа, вводимое в 1 мин;
-давление в брюшной полости;
- объем введенного газа.
При этом динамика давления инсуффляции
косвенно указывает на положение конца пункционной
иглы.
Инсуффлятор должен быть снабжен звуковой и
световой сигнализацией для оповещения об
аварийных ситуациях, к которым относятся отсутствие
газа в баллоне, обрыв или пережатие шланга.
Выбор точки пункции брюшной полости
Оптимальной точкой для пункции следует признать
верхнюю или нижнюю полуокружности пупка, она
применима для 95% больных. Поскольку в этой зоне
жировых отложений под пупочной ямкой мало, эта
часть брюшной стенки самая тонкая. При наличии
пупочной грыжи точка пункции брюшной полости
может быть выбрана в пупочном кольце. У тучных
больных пункция брюшной полости может быть
произведена ближе к месту расположения объекта
оперативного вмешательства.
Если попытки пунктировать брюшную полость
в типичных точках не увенчались успехом, должна
быть найдена альтернативная точка. Например,
брюшная полость может быть пунктирована
через реберную дугу либо через задний свод
влагалища.
Пальпация аорты
Следует обращать внимание на то, чтобы во время
наложения пневмоперитонеума крупные сосуды не
были повреждены иглой или троакаром. Поэтому
большое значение имеет пальпаторное
определение области бифуркации аорты. Если хирург
правильно установил локализацию бифуркации,
повреждение этой зоны не происходит. Пальпацию
проводят указательным пальцем через пупочное
кольцо в направлении позвоночного столба, при
этом могут быть три варианта локализации
бифуркации:
А — выше пупка;
В — на уровне пупка;
С — ниже пупка.
Проверка пункционной иглы
Перед началом инсуффляции игла Veress и
соединительный шланг должны быть проверены для
определения их сопротивления проходящему потоку
газа.
Проверка выполняется следующим образом:
- поток газа устанавливается на уровне 1 л/мин;
- при этом давление инсуффляции не должно
превышать 7 мм рт. ст.
Если давление превышено, это говорит либо о
загрязнении иглы, либо о наличии жидкости в ее
просвете. При этом на несколько секунд
устанавливают максимальный поток газа, после чего
вновь проверяют сопротивление при потоке
1 л/мин. Если показатель вновь превышает
7 мм рт. ст., требуется замена иглы либо трубки
подачи газа.
Правильные показатели этого теста имеют
важное значение, так как давление в брюшной полости
— один из основных параметров правильности
нахождения иглы в брюшной полости.
Техника введения иглы Veress через
переднюю брюшную стенку
8 предполагаемой точке введения иглы и первого
троакара производят разрез кожи длиной 2-3 см.
Горизонтальное положение скальпеля при
проведении кожного разреза позволяет избежать
неконтролируемого случайного «проваливания»
скальпеля в брюшную полость. Направление разреза
выбирается из косметических соображений. После
окончания рассечения кожи и выполнения
гемостаза передняя брюшная стенка приподнимается
рукой или цапкой для создания свободного
пространства между париетальной брюшиной и внут-
ренними органами. Оно не должно быть
чрезмерным, поскольку в этом случае за счет различной
эластичности слоев брюшной стенки необходимое
свободное пространство приобретает вид конуса, (
в который трудно попасть иглой Вереша или
троакаром. Использование цапки может привести к
травмированию кожи, ухудшению качества
послеоперационного периода.
Пункционная игла проводится через брюшную
стенку движением кисти. Тактильно во время
пункции ощущается прохождение иглой апоневроза и i
брюшины.
Лри этом пружина иглы совершает два видимых
движения:
- при прохождении через апоневроз;
- при прохождении через брюшину.
В ряде случаев париетальная брюшина перед ее
перфорацией иглой может смещаться достаточно
глубоко. Иногда движение пружины и/или з^ук при
прохождении через брюшину отметить не удается.
После введения иглы в брюшную полость следует
избегать изменения ее местоположения из-за
возможного повреждения внутренних органов и
сосудов. Брюшную стенку не следует отпускать до
создания давления внутри брюшной полости в 7-8 мм
Глава 3
рт. ст. — с целью предупреждения попадания
кончика иглы Вереша в сальник или повреждения
внутренних органов и забрюшинных сосудов.
Определения возможного места
положения иглы Veress
Для определения возможного места положения
иглы Veress после выполнения пункции могут быть
использованы следующие пробы.
Возможные положения конца иглы после ее
прохождения через брюшную стенку:
1 — преперитониальное (преперитониальная
эмфизема);
2 — субперитониальное (пневмоперитонеум);
3 — в большом сальнике (эмфизема большого
сальника);
4 — интестинальное (в полости кишки или желудка);
5 — ретроперитониальное (медиастинальная
эмфизема или же (при нахождении в просвете
сосуда) газовая эмболия).
Тесты
Тест «шипения»
В том случае, если хирург считает, что конец иглы
Veress находится в брюшной полости, он
приподнимает брюшную стенку, при этом, если кран иглы
открыт, то воздух, входящий в брюшную полость
между париетальной и висцеральной брюшиной через
иглу, издает характерный шипящий звук.
У больных с массивной брюшной стенкой вместо
теста «шипения» может быть проведена проба на
пассивное поступление в брюшную полость
жидкости (изотонический раствор NaCI) из шприца,
соединенного с иглой Veress. Эта проба также
проводят при поднятой передней брюшной стенке.
Тест Palmer
Если на канюлю иглы поместить каплю жидкости, то
в случае нахождения конца иглы в свободной
брюшной полости, жидкость будет втянута в канюлю иглы.
Аспирационный тест
В том случае, если конец иглы находится в
просвете желудка, тонкой или толстой кишки,
вышеуказанные тесты могут указывать на правильное
положение иглы. Рекомендуется ввести через иглу 5 мл
физиологического раствора и попытаться аспири-
ровать введенную жидкость.
Возможные результаты теста:
А — введение изотонического раствора;
В — инъецированная жидкость находится между
париетальной и висцеральной брюшиной,
аспирировать жидкость не удается;
С — жидкость инъецирована в просвет полого ор
гана, аспирационная проба положительна*
(получено мутное содержимое). В этом слу
чае положение иглы следует изменить.
После того как хирург убедился, что конец иглы на
ходится в свободной брюшной полости, к игле Veress
подключается трубка от инсуффлятора и включается
поток углекислого газа. Одновременно проводят
тесты контроля правильности инсуффляции.
Для того чтобы убедиться, что газ поступает
именно в брюшную полость, можно провести
следующие инсуффляционные тесты.
Тест отрицательного давления
При соединении иглы Veress, конец которой
находится в свободной брюшной полости, с
манометром при поднятой передней брюшной стенке,
стрелка (или цифровая индикация) манометра
должна указать на отрицательное давление равное
от 5 до 9 мм рт. ст.
Тест давления инсуффляции
Если игла расположена в свободной брюшной
полости, то при поднятой брюшной стенке, давление
инсуффляции (при скорости подачи газа 1 л/мин) не
должно превышать давления, имевшего место при
контрольной подаче газа через иглу до начала
работы. Если давление превышает исходную цифру,
конец иглы не находится в свободной брюшной
полости, а расположен в предбрюшинной клетчатке, в
спайке, в сальнике, петле кишки либо в другом
органе. Если такая картина повторяется еще раз при
повторной пункции, иглу следует извлечь из брюшной
стенки и выполнить тест проверки иглы на предмет
ее обтурации элементами тканей.
Тест потока газа
Поток газа должен оставаться постоянным при
его скорости подачи 1 л/мин. Снижение скорости
потока может говорить о наличии сопротивления.
После введения 1 л газа скорость подачи газа
можно увеличить.
Тест внутрибрюшного давления
Давление в брюшной полости при введении газа
в объеме до 4 л возрастает прямо пропорционально
объему введенного газа и достигает 12 мм рт. ст.
Как только первый троакар будет введен в
брюшную полость, необходимо убедиться, что ее
содержимое не было повреждено при введении иглы
Veress или самого троакара. С этой целью
выполняется 360-градусный обзор видимой части брюшной
полости.
Общие вопросы эндохирургической техники
Пункция брюшной полости троакаром
под контролем зрения
Оптический троакар Visiport наиболее удобный
инструмент для проведения пункции под контролем
зрения.
Перфорация брюшины под прямым зрительным
контролем с использованием 5 мм троакара
состоит из следующих этапов:
1. 5 мм троакар с конически заточенным острием
проводится через мышцу с использованием
методики Z-образной пункции.
2. Конически заточенный стилет троакара
замещается 5 мм оптической трубкой. Дальнейшее
продвижение гильзы троакара через мышцы брюшной
стенки к брюшине осуществляется под прямым
зрительным контролем с выполнением вращательно-
поступательного движения.
3. Если сращения (кишечные или сальниковые)
оказались непосредственно под троакаром, то
вследствие общего отражения света поле зрения
становится белым.
4. Путем латерального смещения гильзы
троакара к апоневрозу прямой мышцы и брюшине
достигается прозрачная видимость брюшины, в которой
индентифицируются отдельные сосуды.
5. Париетальная брюшина перфорируется путем
тупого проникновения под контролем зрения. После
этого становится видна брюшная полость с
наличием массивных сращений.
6. Если шаг 5 не привел к успеху (например, при
наличии слишком толстого апоневроза),
проникновение через брюшину под контролем зрения
проводят по классической методике путем введения в
троакар конически заточенного стилета.
Технические ошибки при наложении
пневмоперитонеума
Максимальное давление в нижней полой вене
составляет 15 мм рт. ст. Внутрибрюшное давление,
превышающее 12 мм, может вызывать обструкцию
кровотока по нижней полой вене. Превышение
давления также может ограничивать экскурсию
диафрагмы и тем самым снижать дыхательный объем.
Введение газа при расположении конца иглы в
клетчатке вызывает эмфизему соответствующей
локализации.
При выполнении скальпелем кожного разреза в
области пупка описаны случаи повреждения
подвздошных сосудов и аорты. Во избежание такого
явления рекомендуется держать скальпель
параллельно брюшной стенке, а не перпендикулярно ей.
Во избежание повреждения подвздошных
сосудов и аорты иглой Veress, а также для того, чтобы
игла не действовала как скальпель, ее следует
вводить под углом 45° в направлении малого таза.
Пункционные повреждения полых органов иглой
Veress не требуют хирургической коррекции. В то же
время повреждения скальпелем или троакаром
требуют эндоскопического наложения швов либо
ушивания после лапаротомии.
МЕХАНИЧЕСКОЕ ПОДНЯТИЕ ПЕРЕДНЕЙ
БРЮШНОЙ СТЕНКИ
Альтернативным по отношению к пневмоперитоне-
уму способом создания рабочего пространства в
брюшной полости является способ механического
поднятия передней брюшной стенки (лифтинг) над
зоной оперативного вмешательства. Этот способ
используют в тех случаях, когда терапевтический
статус больного не позволяет накладывать
напряженный пневмоперитонеум (тяжелая
сердечно-сосудистая и легочная патология). Для этого
разработаны различные типы механических устройств
(лапаролифтеры). Устройство состоит из рабочей
части, приподнимающей брюшную стенку и
тяговых приспособлений, обеспечивающих тракцию.
К недостаткам механического поднятия брюшной
стенки как способа создания необходимого
рабочего пространства при лапароскопических операциях
относятся:
- невозможность создания рабочего
пространства более чем над двумя квадрантами брюшной
полости;
- неудобная форма рабочего пространства в
виде усеченной пирамиды;
-значительные технические трудности при
выполнении у тучных больных.
МЕТОДИКА ВВЕДЕНИЯ ТРОАКАРА
ПО HASSON
При наличии спаечного процесса в зоне введения
иглы Veress и первого троакара используется
методика введения троакара по Hasson (см. рис. 6.21).
Данная методика предусматривает:
А — выполнение мини-лапаротомии длиной
3-4 см;
В — в брюшную полость открытым путем
устанавливается специализированный троакар Hasson;
С — вокруг троакара Hasson лапаротомическая
рана герметично ушивается.
Троакар, имеющий коническую форму, плотно
фиксируется теми же нитями, которые были ис-
$5*
Глава 3
пользованы для ушивания лапаротомической раны.
После этого через троакар в брюшную полость ин-
суффлируется углекислый газ. Такой способ
наложения пневмоперитонеума позволяет существенно
снизить вероятность повреждения органов и
сосудов брюшной полости.
ОПЕРАТИВНАЯ ТЕХНИКА
Положение тела больного
Положение тела больного во время проведения эн-
дохирургического вмешательства определяется
необходимостью наилучшей экспозиции
оперируемого органа, при которой рядом расположенные
органы были бы максимально отдалены от него, а сам
орган расположен в наиболее высокой точке.
Операции на органах верхнего этажа брюшной
полости требуют положения больного на спине с
поднятым головном концом (положение Фаулера). При
операциях на органах нижнего этажа брюшной
полости используется положение больного на спине с
опущенным головным концом (положение Тренде-
ленбурга). Боковой наклон операционного стола на
20-30° используется при работе на органах,
расположенных в боковых отделах брюшной полости.
Комбинированные положения больного на
операционном столе (сочетание горизонтального и
бокового наклонов) в лапароскопической хирургии
используют при операции на желчном пузыре, печени
(поднятый головной конец и боковой наклон влево),
червеобразном отростке, слепой кишке
(опущенный головной конец и боковой наклон влево), на
сигмовидной кишке (опущенный головной конец и
боковой наклон вправо), на селезенке,
селезеночном углу ободочной кишки (поднятый головной
конец и боковой наклон вправо).
В ряде случаев в лапароскопической хирургии
используются боковые комбинированные положения
тела больного, например, при лапароскопической
андреналэктомии.
Видеопанорама
Вне зависимости от того, какую операцию
предполагается выполнить, хирург обязан выполнить
полный системный осмотр брюшной полости, так как
случайные находки (например, метастазы
злокачественных опухолей в печени) могут полностью
изменить план оперативного вмешательства.
Функция ассистента-телеоператора заключается
в поддержании линзы телескопа в чистом
состоянии путем острожного протирания оптики о печень,
большой сальник или петли кишечника, при
неэффективности этого оптическая трубка извлекается и
протирается стерильной салфеткой. Кроме этого, в
процессе работы ассистент-телеоператор
удерживает зону оперативных действий в центре
монитора. Не следует забывать о необходимости
правильной ориентировки изображения по так называемой
«линии горизонта». Приближение и удаление
телескопа от объекта должны осуществляться только по
команде хирурга.
Введение инструментов и шовного
материала
Введение первого троакара в брюшную полость (как
правило, в параумбиликальной области)
осуществляется вслепую. Все последующие троакары вводят
под контролем зрения.
Должны использоваться троакарные гильзы с
автоматическим шторковым или шариковым
клапаном. Применение канюль с поршневым
(плунжерным) клапаном недопустимо, так как они зажимают
инструменты и могут перерезать лигатуры. Гильзы
желательно оснащать устройствами для фиксации в
брюшной стенке.
Требуются минимум две троакарные гильзы (не
считая гильзы для оптической трубки). Расстояние
между местом введения гильз и операционным
полем должно составлять примерно половину длины
используемого инструмента (около 15 см). Это
позволяет избежать большого размаха движений либо
ручкой (случайное нарушение стерильности), либо
рабочим концом (опасность неконтролируемых
перемещений в брюшной полости), а также
уравновешивает инструмент. Рекомендуемая дистанция
между гильзами — около 15-17 см (соответствует
расстоянию между противопоставленными
большим и указательным пальцами).
Таким образом, инструменты, введенные через
гильзы, должны встречаться в операционном поле
под углом меньше прямого. Видеомонитор должен
располагаться поперек оси оптической трубки,
направленной на зону операции, центр экрана — на
уровне глаз хирурга. Инструменты должны входить
в операционное поле по направлению к
видеомонитору, а не от него (работа в зеркальном
отображении очень утомительна и неэффективна), и не по
оси лапароскопа, иначе они будут перекрывать зону
операции (лапароскоп находится «позади» концов
инструментов). Линия шва должна быть
приблизительно параллельна оси активного иглодержателя.
Введение инструментов через установленные
троакары, по возможности, следует осуществлять
также под контролем зрения. Особенно это важно в
отношении острых инструментов (микроножницы,
4О
Общие вопросы эндохирургической техники
пункционные иглы), их введение следует
прослеживать от момента появления из троакара до зоны
предполагаемого действия.
Извлечение инструментов из брюшной
полости
Извлечение инструментов из брюшной полости
желательно проводить под контролем зрения, так как
может происходить неконтролируемый захват части
какого-либо органа (например, кишки, пряди
сальника).
Перед извлечением троакаров, через них в
брюшную полость следует ввести какой-либо
инструмент с электроизоляцией. После этого гильза
троакара извлекается, и затем, при отсутствии
кровотечения, извлекается и сам инструмент. При
наличии кровотечения электрохирургический
инструмент используют для гемостатической коагуляции
стенки троакарного канала.
Экспозиция — создание доступа к тканям,
обеспечивающего проведение хирургических
манипуляций. Способы достижения: наложение пневмопери-
тонеума, изменение положения тела больного,
тракция и противотракция тканей, дистанциониро-
вание близлежащих органов.
Тракция и противотракция
Тракция и противотракция (тяга и противотяга)
тканей для создания необходимой для проведения
хирургических манипуляций экспозиции. Возможны
следующие варианты:
-ткани фиксированы и натянуты естественным
способом в двух противолежащих точках;
-ткани фиксированы естественным способом в
одной точке;
-ткани обладают свободной подвижностью в
брюшной полости.
Разделение тканей
Эндохирургическое разделение тканей можно
осуществлять несколькими способами:
- остро, механическим путем — ножницами.
Осуществляется для тканей, содержащих
относительно небольшое число мелких сосудов,
например рассечения брюшины, бессосудистых
спаек либо после перевязки, клипирования,
коагуляции тканей;
- тупо — диссектором;
- высокочастотным электротоком при помощи
электроинструментов — монополярное
рассечение и коагуляция. Данный вид разделения
тканей можно осуществлять при помощи
инструментов, имеющих изоляцию, и небольшую
площадь рабочей поверхности, например
электрокрючок. Использование электрокрючка для
рассечения мягких тканей или ножниц. В
последнем случае возможно комбинированное
применение электрорассечения и
механического рассечения. Такой вид разделения
применяется наиболее часто и возможен для
большинства тканей.
В ряде случаев для рассечения тканей
целесообразно использование инструментов с изменяемой
кривизной стержня.
Наиболее эффективный способ препаровки
тканей — использование бимануальной техники.
Часто сшивающий аппарат содержит нож,
который одновременно с прошиванием ткани выполняет
ее рассечение. Примером такого устройства
является аппарат EndoGIA-ЗО. Данный аппарат для
эндоскопической хирургии накладывает 6 рядов
титановых скрепок и между каждыми тремя рядами
рассекает прошитую ткань.
Применение такого вида разделения тканей
наиболее целесообразно в эндоскопической хирургии
полых органов, легких, а также при^Пересечении
крупных тубулярных структур и стенок полых
органов, ручная обработка которых крайне трудоемка и
может быть рискованна.
Соединение тканей
Соединение тканей в эндоскопической хирургии в
целом аналогично методикам, применяемым в
открытой хирургии, и может осуществляться как
путем их механического сшивания, так и склеиванием
тканей, например применение фибринового клея
для соединения краев маточной трубы после саль-
пинготомии по поводу трубной беременности.
Сведение к минимуму трудностей
лапароскопического ушивания и лигирования тканей, которые
являются «узким местом» всего метода, возможно
двумя путями:
1) разработка принципиально новых специальных
* устройств;
2) адаптация ортодоксальных хирургических
приемов.
Первое направление реализуется в настоящее
время как разработка и промышленное
производство разнообразных аппаратов для наложения
механического шва и клипирования. Доступны
инструменты, накладывающие титановыми скобками
2-4-рядный шов протяженностью 30-60 мм —
стейплеры (от англ. Staple — скрепка, скобка), как
комбинированные с режущим устройством (серия
EndoGIA, Auto Suture Surgical Instruments; серия ELC,
Ethicon Endosurgery), так и без него (соответственно
Глава 3
Endo ТА и EL4). Выпускаются разные модели
аппаратов для наложения клипс, смыкающихся по оси
инструмента и перпендикулярно ей. Достоинства
этих хирургических инструментов неоспоримы —
они позволяют быстро и надежно рассекать,
ушивать ткани, накладывать разнообразные
анастомозы между полыми органами. Ограничивает
применение аппаратов значительная стоимость сменных
одноразовых кассет, особенно при наложении швов
сложной конфигурации, когда расход этих линейных
устройств неоправданно высок. Нерационально
также использовать 30 миллиметровую кассету для
ушивания отверстия, которое может быть закрыто
1-2 узловыми швами. Кроме этого, современные
сшивающие аппараты вовсе не пригодны для анас-
томозирования таких тонких структур, как желчные
и панкреатические протоки, маточные трубы,
мочеточники, кровеносные сосуды.
Таким образом, при очевидности удобств эндо-
стейплеров, ручной шов и лигирование имеют
монопольные области применения. Поэтому эволюция
лапароскопической хирургии требует от
специалистов переобучения базовым хирургическим навыкам.
Для сшивания ткани иглами в эндоскопической
хирургии оптимально применение атравматичес-
ких игл.
Игла проводится в полость через троакар в
редукторе, фиксируется иглодержателем, и выполняется
прошивание. Формирование узла на данной нити
возможно интракорпоральным и
экстракорпоральным путем.
К сожалению, выполнение лапароскопической
холецистэктомии не способствует приобретению
навыков наложения ручных швов и формирования
узлов — при разделении тканей используются
клипсы и электрокоагуляция. К тому же расположение
бригады в соответствии с «американским» методом
и наличие двух ассистентов, не дают возможности
освоить координированное манипулирование
двумя инструментами. В самом деле, одной рукой
хирург работает инструментом, помещаемым через
субксифоидный операционный порт, а другой —
стабилизирует гильзу. Так очень легко стать
«одноруким хирургом».
Отработка лапароскопического шва и
формирования узлов должны производиться на тренажерах,
с использованием муляжей и нефиксированных
тканей. В таком обучении нет ничего зазорного и для
хирургов, имеющих большой опыт
лапароскопической холецистэктомии. Совершенно справедливо
высказывание известного американского хирурга
N. Soper: «Это разочаровывающий и унизительный
опыт для хирурга, когда вся операционная бригада
наблюдает на видеомониторе 15-минутное сраже
ние за один простой узел!».
Шовный материал
Помимо общих принципов подбора шовного
материала для различных тканей имеются некоторые
особенности. В частности, для
экстракорпорального узла Roeder требуется нить длиной 70-90 см,
№ 0, монофиламентная или псевдомонофиламент-
ная, т.е. имеющая меньший коэффициент трения и
пилящий эффект. Для экстракорпорального
хирургического узла нужна нить такой же длины и
толщины, но с высоким коэффициентом трения, плетеная,
способная временно «держать» одинарный простой
узел.
Для интракорпорального узла требуется короткая
(8-15 см) лигатура, для минимизации количества
нити, протягиваемой через ткань и
прослеживаемой ассистентом. При помещении в брюшную
полость нити длиной 30-40 см практически
невозможно отследить ее концы, быстро и координировано
производить лигирование.
Иглы
Для лапароскопического шва, безусловно,
необходим атравматичный тип крепления нити к игле.
Удобно использовать прямые иглы длиной около
20 мм. Иглой большей длины сложнее и опаснее
манипулировать в брюшной полости. Для
прошивания ткани прямую иглу необходимо правильно
ориентировать только в одной плоскости, а
искривленную — в двух, что в условиях двухмерного
изображения сложнее. Иногда, при наложении
швов сложной конфигурации и сшивании
ригидных тканей, которые трудно приподнять для
прокалывания прямой иглой, используются и
искривленные иглы. Необходимо отметить, что
воспользоваться можно только такими иглами, радиус
кривизны которых меньше внутреннего диаметра
троакарной гильзы. Для проведения больших
искривленных игл в брюшную полость требуется
специальная методика, описанная ниже.
Компромиссно применение недавно разработанных лы-
жеобразных игл, имеющих круглое сечение вблизи
слегка искривленного конца и треугольное — на
остальном протяжении.
Инструменты
Большинство швов выполняют с помощью
иглодержателя и ассистирующего зажима диаметром 5 мм.
В настоящее время выпускается большое
количество иглодержателей, различающихся конфигурацией
рукоятки, конструкцией замка, формой рабочей ча-
Общие вопросы эндохирургической техники
сти. Классический набор К. Semm, широко
применявшийся в 80-е гг. XX в., сейчас находит все
меньше приверженцев. Слабая пружинная фиксация
браншей и их грубая поперечная насечка плохо
стабилизируют иглы, особенно искривленные,
трехмиллиметровый ассистирующий иглодержатель
(для параллельного проведения нитей в
пятимиллиметровой гильзе) слишком мал и непрочен для
манипулирования тканями и захвата иглы. К тому же в
лапароскопической хирургии желудка, кишечника
используют 10-12-миллиметровые троакарные
гильзы, позволяющие проводить лигатуры без
уменьшения диаметра инструмента. Как
иглодержатель, так и ассистирующий зажим должен иметь
одну активную браншу — такая конструкция имеет
более простой и прочный привод. При интракорпо-
ральном формировании узла на инструменте с
двумя активными браншами нить довольно часто
застревает в элементах привода у основания браншей
эис. 3.1. Для проведения в полость атравматическая
шла втягивается в трубку-редуктор.
1. Трубка - редуктор
\. Иглодержатель
3. Нить с атравматической иглой
(в так называемых «ушах»), запутывается и может
порваться.
По нашему мнению, удобны инструменты с
коаксиальной ручкой, привычным для хирурга
храповиком, длинными узкими браншами с
твердосплавными накладками. Такие инструменты хорошо держат
иглу, удобны при формировании узла.
Безусловно, перспективен набор Szabo-Berci,
выпускаемый фирмой «Karl Storz». Коаксиальная
конструкция ручек и отсутствие колец позволяют
держать их пальцами как отвертку, что
увеличивает точность движений (работа пальцами вместо
работы запястьем). Замки можно закрывать и
открывать без изменения положения пальцев, это
экономит время и делает управление иглой более
плавным. Активный иглодержатель с браншами в
виде клюва попугая достаточно прочно держит
иглу, а ассистирующий зажим с браншами в виде
клюва фламинго удобен при работе с тканями и
лигатурой.
Особо следует отметить поршневой
иглодержатель фирмы «Wilson-Cook Medical», идею которого
предложил известный хирург-гинеколог Н. Reich.
Этот инструмент очень удобен для работы с
искривленными иглами, так как он автоматически
ориентирует их правильно.
При наложении сложного ручного шва могут
потребоваться дополнительные ассистирующие
зажимы (до двух), а также специальные толкатели —
аппликатор узлов Roeder, вилочка Clarke.
Интракорпоральное формирование
узлов
Интракорпоральное лигирование требует
существенной тренировки. Формирование узла идет
согласно стандартной микрохирургической технике и
включает несколько этапов (для хирурга с ведущей
правой рукой):
- нить захватывается иглодержателем в 2-3 см от
иглы (прямой) и проводится в брюшную полость.
Искривленную иглу приходится вводить через
11-миллиметровый троакар несколько другим
образом: иглодержатель проводится через редуктор
10 х 5 мм, затем захватывает нить, полностью
втягивает ее и иглу в редуктор и в нем транспортируется
в брюшную полость (рис. 3.1). Попытка провести
искривленную иглу без редуктора может привести к
заклиниванию иглы в клапанном механизме.
Н. Reich предложил следующий метод
манипулирования искривленной иглой большого радиуса:
гильзу 5,5 мм^извл^кают из брюшной стенки,
отверстие в последней временно закрывают пальцем;
иглодержатель проводят через гильзу и вне ее захва-
Глава 3
Рис. 3.2. Техника проведения атравматической иглы
большого размера в брюшную полость.
1. Троакар
2. Трубка - редуктор
3. Иглодержатель
4. Нить
5. Большая атравматическая игла
Рис. 3.3. Первоначальное расположение инструментов
и захват нити при интракорпоральном формировании
узла. /
1. Зажим, фиксирующий нить
2. Зажим, вокруг которого формируется петля
3. Объект манипуляций
4. Нить
тывают нить рядом с иглой; иглодержатель с нитью
и иглой продвигают через отверстие в брюшной
стенке в полость; гильзу по инструменту вновь
вводят в брюшную стенку (рис. 3.2). Очевидно, что для
извлечения иглы требуется обратная процедура,
что травмирует брюшную стенку и увеличивает
утечку газа; ,
- в брюшнойчтолости активным иглодержателем
захватывается и правильно позиционируется игла.
Как уже указывалось, прямой иглой манипулировать
проще. Правильного расположения искривленной
иглы можно достичь, перемещая ее
ассистирующим зажимом за нить, захваченную чуть выше, в
приоткрытых браншах иглодержателя;
- ткань прошивают справа налево. Продернув
иглу через ткань, иглодержатель переводят на
противоположную сторону полдм-тлм снова захватывают
нить у иглы. Нить^обрезают дистальнее
иглодержателя, и ее фрагмент с иглой инструментом
извлекают из брюшной полости;
- нить протаскивают через ткань справа налево
до тех пор, пока справа не останется конец длиной
1-1,5 см. Длинный левый конец лигатуры
захватывают правым инструментом (иглодержателем),
который следует поворачивать против часовой
стрелки, пока нить не примет вид горизонтально, без пе-
рекрутов, лежащей С-образной петли (рис. 3.3). Над
петлей располагают ассистирующий зажим с
приоткрытыми браншами и иглодержателем обвивают
нить вокруг зажима 2 раза по часовой стрелке
(рис. 3.4). После этого зажимом захватывают
короткий конец нити (рис. 3.5). Эту манипуляцию облег-
jnaeT координированное подведение обоих
инструментов к короткому концу;
-узел затягивают двумя инструментами (рис. 3.6),
после чего короткий и длинный концы нити меняют-
Общие вопросы эндохирургической техники
Рис. 3.4. Формирование двойной петли
вокруг зажима при интракорпоральном
завязывании узла.
1. Зажим, фиксирующий нить
2. Зажим, вокруг которого формируется
петля
3. Объект манипуляций
4. Нить
5. Двойная петля вокруг зажима
Рис. 3.5. Захват конца нити после
формирования двойной петли вокруг зажима.
1. Зажим, фиксирующий нить
2. Зажим, вокруг которого формируется
петля
3. Объект манипуляций
4. Двойная петля вокруг зажима
5. Конец нити
ся местами (рис. 3.7). Процедуру повторяют в той
же последовательности, но нить обвивается уже
вокруг иглодержателя и уже один раз. Для
синтетических шовных материалов требуется завязывание
трех узлов.
По рекомендациям Института тренинга по
микрохирургии и оперативной эндоскопии,
Сан-Франциско, США, наложение интракорпорального шва
вышеописанным методом должно занимать не
более 30 с.
Глава 3
Рис. З.Б. Затягивание узя
при интракорпоральнои
формировании узла.
1.Зажим
2. Зажим
3. Объект манипуляций
4. Концы нити
5. Двойной узел
Рис. 3.7. После
затягивания первого узла петля
формируется вокруг
противоположного зажима.
1.Зажим
2. Зажим
3. Объект манипуляций
4. Концы нити
5. Затянутый первый узел
46
Общие вопросы эндохирургической техники
Рис. 3.8. Палец ассистента
герметизирует троакар при
экстракорпоральном формировании узла
Roeder.
1. Троакар
2. Палец ассистента
3. Концы нити
Экстракорпоральное формирование
узлов
Исторически первым видом хирургического узла,
адаптированного к лапароскопии, был скользящий
узел Roeder. Выдающийся немецкий хирург К. Semm
предложил использовать разработанный для тон-
зиллэктомии узел в эндохирургии. В оригинале узел
формировался на кетгутовой нити, но
принципиально для него подходит любой материал, кроме
крученого, который плохо скользит и перекручивается.
При затягивании лигатура выдерживает
значительную нагрузку, поэтому должна использоваться нить
не тоньше № 2/0. Показано, что узел Roeder с сухим
хромированным кетгута^гимеетсуществекньТи фак^
тор безопасности 55:1 при лигировании сосудов
диаметром более 3 мм.
Нить длиной около 80-90 см захватывают
зажимом в 2-3 см от конца и проводят в троакарную
гильзу. В брюшной полости лигатуру с пом^лдью
дополнительного зажима обводят вокруг лигируе-
мой структуры и выводят наружу через ту же
гильзу. Во время протягивания нити дополнительный
зажим помещают между ней и тканью для
улучшения скольжения и предотвращения перепиливания
последней. Когда оба конца лигатуры окажутся
снаружи, между ними, для предотвращения утечки
газа (нити блокируют автоматический клапан), на
резинку гильзы ассистент кладет палец (рис. 3.8).
Методика формирования узла показана на рис.
3.9. Узел формируется поверх пальца, избыток
нижнего конца отрезают и по верхнему, как по
рельсе, низводят узел в брюшную полость, для
чего используют либо одноразовый пластиковый,
либо металлический толкатель (рис. 3.10). Чтобы
точно расположить лигатуру, конец толкателя под-
^Т^~у, а затем полностью
затягивают петлю и обрезают конец нити. Удобны
многоразовые толкатели, комбинированные с ножом
(PCI Instruments).
Узел Melzer практически не отличается от
описанного по характеристикам и методу наложения и
здесь не описывается.
В 1972 г. Н. Clarke опубликовал описание метода,
сходного с обычным хирургическим, но вместо ука-
Глава 3
Рис. 3.9. Методика формирования узла Roeder.
1. Троакар
2. Палец ассистента
3. Свободный конец нити
4. Нить-«рельса»
Рис. 3.10. Затягивание узла Roeder при помощи
толкателя.
1. Троакар
2. Нить вокруг лигируемой структуры
3. Лигируемая структура
4. Узел-RQed^r
5. Толкатель ^ ~~ ^-^
6. Нить-«рельса»
7. Брюшная стенка
48
Общие вопросы эндохирургической техники
Рис. 3.11. Затягивание узла при помощи лигатурной
вилки Clarke.
1. Троакар
2. Лигатурная вилка Clarke
3. Концы нити
4. Узел
Рис. 3.12. Методика формирования смешанной
скользящей петли Dundee.
1. Конец нити
2. Атравматическая игла
3. Петля Dundee
зательного пальца, перемещающего узел, он
предложил использовать инструмент в виде вилки
(рис. 3.11).
Лигатура должна быть больше двойной длины
инструмента Clarke и по физическим характеристикам
способна удерживать одинарный узел (Polysorb или
Vicril). Способ введения нити и захвата лигируемой
структуры не отличается от предыдущего, и так же
ассистент использует палец. Удерживая в
натяжении оба конца лигатуры, обычный простой узел
проталкивают в брюшную полость и затягивают
толкателем.
Второй и третий узлы формируются
экстракорпорально и низводятся на место таким же образом.
Легко заметить, что различие между методами
Semm-Roeder и Clarke состоит в том, что в первом
случае нить всей своей длиной, скользит вокруг
лигируемой структуры, а во втором остается
неподвижной. Поэтому первый метод применим только
при лигировании без прошивания или после
наложения одиночного шва. Второй же позволяет
затягивать Z-образный и кисетный швы.
Непрерывный шов
Прошивание тканей при наложении
эндоскопического непрерывного шва не отличается от такового в
открытой хирургии. Особенности имеются на этапах
начала и завершения шва. Для экономии времени
большую часть работы по формированию
начального узла можно проделать экстракорпорально.
Существуют три метода.
Первый — обычный простой узел, описанный
выше, но, естественно, без срезания иглы. При
завязывании длинный конец нити беретут рядом с
иглой или за ее острие, чтобы при круговых
движениях не повредить окружающие ткани. Следует
отметить, что обводить зажим, держа нить за иглу,
удобнее.
Второй был предложен A. Cuschieri в 1991 г. Он
назвал свой узел смешанной скользящей петлей
Dundee (рис. 3.12 и 3.13). На противоположном игле
конце нити формируется узел с петлей около 1 см в
диаметре, короткий конец нити обрезают до 1,5 см.
Иглу с нитью полностью опускают в брюшную
полость через редуктор, ткань прошивают, и лигатуру
протягивают до петли, обратным движением иглу
проводят через петлю, нить захватывают зажимом
около петли и ее короткий конец затягивают в
противоположную сторону.
Третий, зажимной анкерный, узел впервые
описан L. Nathanson. Конец лигатуры,
противоположный игле, 2.5 раза оборачивается вокруг обычного
хирургического зажима. Затем участок нити перед
49
Глава 3
Рис. 3.13. Применение
скользящей петли Dundee.
1. Петля Dundee
2. Атравматическая игла
3. Объект манипуляций
спиралью захватывается в бранши зажима и
протаскивается через нее с образованием петли,
спираль затягивается (рис. 3.14). Применяется
сформированный узел так же, как и петля Dundee.
Завершить непрерывный шов удобно также
обычным простым узлом, как в открытой хирургии.
Разработан и так называемый крокетный узел (Aberdeen).
Это очень надежный узел, ликвидирующий частую
проблему неравной длины при связывании конца
нити с петлей предыдущего стежка в простой узел.
Последний стежок вытягивают вверх для получения
петли. Через эту петлю частично пропускается конец
нити с формированием следующей петли. Третья
петля формируется также, как и вторая.
Многие хирурги пытаются фиксировать швы с
помощью металлических клипс. Однако клипсы
скользят и могут смещаться при минимальной тракции.
В заключение подчеркнем, что овладение
методиками ручного лапароскопического шва
необходимо всем хирургам, так как при любой операции
могут возникнуть нестандартные ситуации, выйти из
которых, не меняя доступа, а следовательно, не *
травмируя дополнительно пациента, можно
наложив швы.
Гемостаз
Эндоскопический гемостаз может быть
осуществлен различными способами.
Наиболее часто применяют монополярную и
биполярную коагуляцию. Данный вид гемостаза
наиболее распространен при работе с тканями вдали от
жизненно важных структур. При работе на жизненно
важных структурах (общий желчный проток,
мочеточник, крупные сосуды и прочее) и вблизи от них
Рис. 3.14. Формирование анкерного узла.
1. Зажим
2. Ножницы
3. Нить с иглой
4. Сформированный анкерный узел
5О
Общие вопросы эндохирургической техники
использование данного вида гемостаза безусловно
возможно, но должно осуществляться с большой
осторожностью и вниманием, так как возможно
неконтролируемое распространение тока на эти
структуры с последующим развитием некроза.
Коагуляция должна осуществляться на возможно
минимальных значениях мощности электротока и в
возможно минимальное время.
Механический гемостаз возможен в разных
вариантах. Наиболее часто этот вид гемостаза
используют для остановки кровотечения из относительно
крупных сосудов. Различают временный гемостаз и
окончательный гемостаз. Временный гемостаз
достигается временным сдавлением кровоточащей
зоны либо видимого сосуда при помощи зажима.
После этого осуществляют удаление крови и
сгустков изданной зоны и проводят селективное лигиро-
вание кровоточащего сосуда, т.е. осуществляют
окончательный гемостаз.
Технически наиболее простой вариант такого
вида гемостаза — эндохирургические клипсы. При
наложении клипс следует видеть оба конца клипсы.
Наложение их «вслепую» нежелательно.
Еще одним видом механического гемостаза —
использование лигатурного материала. Лигатурный
материал проводят вокруг лигируемого сосуда либо
при помощи зажима, если данный сосуд уже
мобилизован, либо при помощи иглы. Завязывание
производят путем наложения экстракорпорального
либо интракорпорального узла.
Эндоскопический гемостаз из диффузно-крово-
точащей зоны возможен путем фиксации к ней ге-
мостатической губки либо специализированного
материала — тахокомба.
Извлечение препарата из брюшной
полости
Наиболее просто извлекается препарат, имеющий
незначительный объем (например, стенка серозной
кисты яичника), в этом случае препарат просто
протаскивается через пункционный канал. Большие
трудности возникают при извлечении препаратов,
имеющих объем, больший по сравнению с пункци-
онным троакарным каналом. В этом случае
возможно применение различных методик.
Наиболее просто использование расширение
пункционного канала тупым или острым путем. Для
расширения тупым путем применяют
специализированные ретракторы, которые вводятся поверх
троакара и затем растягивают канал изнутри.
Острым путем расширение канала производят
через рассечение апоневроза скальпелем или
ножницами. Наиболее удобно рассечение скальпелем
поверх троакара. После расширения отверстия до
необходимой длины орган извлекают путем тракции
за него. После расширения отверстия требуется его
обязательное ушивание (ушивания не требуют
проколы не более чем 10 мм троакаром).
В тех случаях, когда расширение пункционного
отверстия недостаточно для извлечения органа,
приходиться прибегать к его фрагментированию.
Это делают при помощи эндоскопического
инструмента — морцеллятора, который либо скусывает
орган, либо вырезает в нем цилиндрические блоки.
Часто извлечение органа требует помещения его
в контейнер. Это необходимо в следующих случаях:
1. Орган с наличием повреждений стенки либо
возможностью его перфорации при
извлечении.
2. Инфицированный орган.
3. Орган с наличием злокачественных опухолей.
Существуют контейнеры фабрично
изготовленные и приспособленные. Оптимально применение
пластиковых приспособленных контейнеров.
Использование резиновой перчатки, которое зачастую
имеет место в хирургической практике,
нежелательно, так как тальк, попадающий из перчатки,
вызывает массивный спаечный процесс в брюшной
полости.
Примером извлечения органа с поврежденной
стенкой является удаление желчного пузыря. Если
при наличии мелких множественных камней в
пузыре во время его отделения от ложа происходит
перфорация стенки A/3-1/4 всеххолецистэктомий), то
извлечение пузыря чревато выдавливанием
конкрементов и рассеиванием их по брюшной полости. Их
поиск и поштучный сбор резко удлиняет операцию и
создает опасность оставления камней.
Предварительное помещение пузыря в контейнер требует
лишних 4-5 мин, но может дать экономию
30-60 мин, которые требуются на сбор рассеянных
в брюшной полости конкрементов.
Примером удаления инфицированного органа —
извлечение деструктивно измененного
червеобразного отростка при лапароскопической аппен-
дэктомии.
Необходимость извлечения в контейнере органа,
содержащего злокачественные опухоли,
объясняется профилактикой имплантационных метастазов
в пункционном канале.
51
>
Анестезиологическое
обеспечение
в лапароскопической
хирургии
В связи с быстрым развитием
лапароскопической хирургии все большее значение приобретает
решение вопросов анестезиологического
обеспечения. Речь идет, прежде всего, о наложении пнев-
моперитонеума и связанных с ним
патофизиологических сдвигах. Этой проблеме в прошлом не
уделялось особенного внимания, поскольку
лапароскопия применялась у ограниченного контингента
больных и служила в основном средством
диагностики; длительность процедуры ограничивалась
15-30 мин. В настоящее время, когда лапароскопия
становится показанной все бульшему числу
пациентов, а длительность ее стала измеряться часами,
эффекты карбоксиперитонеума под повышенным
давлением стало невозможно игнорировать.
В связи с этим в нашем обзоре значительное
место будет уделено данной проблеме, кроме того,
мы рассмотрим другие вопросы практической
анестезиологии в приложении к лапароскопической
хирургии.
ПАТОФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ
КАРБОКСИПЕРИТОНЕУМА
ПОД ПОВЫШЕННЫМ ДАВЛЕНИЕМ
Эти эффекты возникают в связи с воздействием
повышенного давления в брюшной полости и
биохимическими изменениями, происходя вследствие
всасывания СО2 в системный кровоток. Кроме того,
в зависимости от уровня давления и положения
больного на операционном столе (горизонтальное,
Тренделенбурга, Фовлера) изменения могут быть
противоположно направленными, и в результате
физиологические изменения становятся суммой
сложных эффектов.
Углекислый газ, введенный под давлением в
брюшную полость, оказывает равномерное
давление во всех направлениях, из которых наиболее
важным признается давление на заднюю стенку
брюшной полости, где расположены нижняя полая
вена и аорта, а также давление в цефалическом
направлении на диафрагму, что вызывает компрессию
в грудной полости. Кроме того, имеется
непосредственное воздействие на париетальную и
висцеральную брюшину.
Изменения в системе нижней полой
вены
Наружная компрессия нижней полой вены и
подвздошных вен приводит к тому, что давление ниже
препятствия (т.е. в венах нижних конечностей)
может повышаться на 80% при давлении в брюшной
полости 14 мм рт. ст. Прямые экспериментальные
исследования кровотока в нижней полой вене
ниже почечных вен методом электронной флуомет-
рии выявили снижение кровотока до 30%. Эти
изменения находятся в прямой корреляции с
уровнем давления в брюшной полости, вызывают
снижение венозного возврата крови к сердцу и
нарушают отток по почечным венам. При уровне
давления 20-25 мм рт. ст. (используемого главным
образом в гинекологической практике) снижение
ренального кровотока, клубочковой фильтрации и
тубулярной абсорбции может приводить к
повреждению почечной паренхимы, если операция
продолжается несколько часов. Снижение венозного
возврата к сердцу может достигать 20%. Придание
Анестезиологическое обеспечение в лапароскопической хирургии
больной положения Тренделенбурга до 30° хотя и
компенсирует нарушение венозного возврата,
однако ограничивает экскурсию диафрагмы и
увеличивает внутригрудное давление за счет смещения
внутрибрюшных органов, что нейтрализует этот
положительный эффект. С другой стороны,
положение Фовлера может усиливать нарушения
венозного кровотока, что может сопровождаться
снижением сердечного выброса и артериального
давления, хотя это встречается нечасто, поскольку
в общей хирургии используется более низкое
давление A4 мм. рт. ст.).
Изменения в артериальной системе
Большинство авторов считают, что изменения в
артериальной системе заключаются главным
образом в увеличении системного сосудистого
сопротивления. Системное сосудистое сопротивление может
увеличиваться на 50%, вызывая повышение
артериального давления как систолического, так и диасто-
лического. Этот феномен может продолжаться 1-2 ч
после снятия пневмоперитонеума. Механизм
развития феномена неясен, существуют различные
гипотезы о его происхождении. Одни авторы считают, что
это следствие механического сдавления
артериальных стволов брюшной полости, другие
предполагают, что снижение почечного кровотока вызывает
активацию вазоактивных субстанций (катехоламинов и
системы ренин-ангиотензин). Еще одна гипотеза
объясняет появление феномена работой вазоконст-
рикторного рефлекса, запускаемого снижением
венозного возврата и сердечного выброса. Некоторые
исследователи видят причину в прямом
раздражающем воздействии углекислого газа на брюшину, а
также в повышении парциального давления СО2 в
крови с запуском известного механизма гиперкапния
— катехоламины — гипертензия. С другой стороны,
повышение системного сосудистого сопротивления
развивается даже при использовании для
пневмоперитонеума других газов.
Воздействие на деятельность сердца
Большинство клинических наблюдений,
выполненных различными методами, говорит о том, что кар-
боксиперитонеум приводит к снижению сердечного
выброса и сердечного индекса. Считается, что это
обусловлено снижением венозного возврата крови.
Сердечный индекс остается какое-то время
сниженным и после снятия пневмоперитонеума, возможно,
вследствие сохранения увеличенного системного ва-
скулярного сопротивления.
Что касается частоты сердечных сокращений, то
существенных ее изменений у здоровых пациентов
не отмечено. Имеется тенденция к нарастанию
тахикардии у больных с патологией
сердечно-сосудистой системы.
У некоторых больных под воздействием гипер-
капнии может появиться сердечная аритмия, для
купирования которой рекомендуют Ь-блокаторы.
Аритмия может появиться при резком и
значительном изменении положения операционного стола,
особенно у пожилых людей, вследствие
блокирования компенсаторных механизмов препаратами для
наркоза.
Воздействие на органы дыхания
Давление, оказываемое на диафрагму и
поджимающее ее вверх, приводит к сдавлению легких с
развитием настоящего рестриктивного легочного
синдрома. При этом уменьшаются функциональная
остаточная емкость, податливость, общая емкость
легких и изменяются вентиляционно-перфузионные
отношения в передней легочной зоне с
относительным увеличением мертвого пространства, что ведет
к гиперкапнии.
В то же время преимущества лапароскопической
операции по сравнению с лапаротомией особенно
отчетливо проявляются в послеоперационном периоде.
После открытой операции дыхательная функция
может быть значительно снижена. По данным
G. Putensen-HJmmer и соавт., после
лапароскопической операции такие показатели, как форсированная
жизненная емкость, функциональная остаточная
емкость значительно лучше, чем после открытой
операции, и сопровождаются лучшей оксигенацией крови.
Эти преимущества сохраняются на протяжении 72 ч
после операции. Авторы рекомендуют
лапароскопическую операцию больным со сниженной
дыхательной функцией, а также больным с ожирением.
Биохимические изменения
Гиперкапния, развивающаяся после наложения
карбоксиперитонеума, имеет две причины
происхождения. Одна из них — прямая абсорбция СО2 из
брюшной полости и вторая — ограничение
дыхательной функции.
Значение прямой абсорбции углекислого газа в
генезе гиперкапнии было продемонстрировано в
работах, где при использовании для
пневмоперитонеума инертного газа гелия вместо СО2 отмечалось
существенное снижение уровня гиперкапнии.
Определенную роль в происхождении
гиперкапнии играет и нарушение элиминации углекислого
газа из тканей брюшной полости и нижних
конечностей. После снятия карбоксиперитонеума
происходит быстрое восстановление перфузии тканей и по-
53
Глава А
вышенный клиренс из них углекислого газа. Такой
механизм может объяснить иногда отмечающееся,
казалось бы, парадоксальное нарастание уровня
СО2 в выдыхаемом воздухе после окончания
операции. Вместе с тем это не противоречит другим
фактам, говорящим о параллельном увеличении уровня
СО2 в выдыхаемом воздухе одновременно с
наложением карбоксиперитонеума. Это можно
объяснить тем, что величина абсорбции углекислого газа
через брюшину и выделение его через легкие
намного больше, чем вымывание его из плохо перфу-
зируемых тканей.
Максимальный уровень парциального давления
углекислого газа в крови наблюдается к концу
операции, что, вероятно, связано с истощением
способности тканей поглощать СО2.
Как известно, гиперкапния приводит к
дыхательному ацидозу. Снижение рН прогрессирует в
зависимости от длительности операции и
адекватности искусственной вентиляции легких,
поэтому одна из важных задач анестезиолога —
выбор нужного режима вентиляции под контролем
капнометрии.
ТЯЖЕЛЫЕ ОСЛОЖНЕНИЯ
Газовая эмболия
Газовая эмболия — наиболее серьезное
осложнение хирургической лапароскопии. Считается, что
она возникает крайне редко. Однако, по данным
О. Nagata и К. Hanaoka, проводивших изучение
газовой эмболии методом перфузионной легочной
сцинтиграфии альбумином, меченным макроагре-
гированным 99тТс, у 50% больных имелась газовая
эмболия, не проявлявшаяся клинически. Сцинти-
графические признаки эмболии сохранялись в
течение 7 дней. Длительность операции у всех этих
больных превышала 250 мин.
Механизм эмболии связывают с прямым
попаданием газа в кровеносное русло. Наиболее
серьезным осложнением является массивное нагнетание
газа в кровь вследствие попадания конца иглы Ве-
реша в кровеносный сосуд. Если количество газа
достигает 25-30 мл/кг/мин, то наступает смерть от
cor pulmonale. Подобное явление может возникать
при наличии в брюшной полости открытых
кровеносных сосудов (например, в ложе желчного пузыря
при холецистэктомии).
Другой причиной может быть образование
газовых пузырьков в крови при недостаточном
элиминировании СО2 во время искусственной вентиляции
легких.
В последнее время появились сообщения о
газовой эмболии при использовании в лапароскопии
YAG-лазера, рабочий конец которого требует
охлаждения газовой струей. При пересечении
кровеносного сосуда таким лазером охлаждающий газ
успевает проникнуть в просвет сосуда до его
коагуляции.
Чтобы вовремя диагностировать газовую
эмболию, необходимо очень тщательно наблюдать за
больным, обращая внимание не только на
классические признаки эмболии (потливость, цианоз,
аритмия, резкое снижение артериального давления,
снижение насыщения крови кислородом), но и на такие
признаки, как появление при аускультации сердца
новых шумов: «мельничные жернова», «колеса
телеги». Также важно раннее распознавание резкого
повышения PetCO2 даже при небольшой эмболии.
Лечебные мероприятия при массивной газовой
эмболии предусматривают немедленное удаление газа
из брюшной полости, наружный массаж сердца,
помещение больного в положение Durant (положение
Тренделенбурга на левом боку), введение
центрального венозного катетера для аспирации пузырьков
газа из правых отделов сердца.
Смещение интубационной трубки
Пневмоперитонеум приподнимает диафрагму и
отдавливает карину краниально. Это наряду с
положением больного на операционном столе (положение
Тренделенбурга) может приводить к тому, что интуба-
ционная трубка смещается вниз, в бронхи. В таких
случаях очень важен мониторинг, включающий пуль-
соксиметрию и периодическую аускультацию.
Пневмоторакс
Возникающий напряженный пневмоторакс при
лапароскопических операциях требует
немедленного дренирования плевральной полости. Причина
пневмоторакса — баротравма легочной ткани,
зачастую патологически измененная.
При проникновении газа из брюшной полости по
анатомическим дефектам пневмоторакс обычно не
достигает выраженных степеней и рассасывается
самостоятел ьно.
Пневмомедиастинум
Пневмомедиастинум возникает всегда при
работе в области пищеводно-желудочного перехода
(операция Nissen, ваготомия). Для снижения его
степени рекомендуется уменьшать давление в
брюшной полости вдвое против обычного. Иногда
пневмомедиастинум может вызвать даже
тампонаду сердца.
54
Анестезиологическое обеспечение в лапароскопической хирургии
ПРАКТИЧЕСКАЯ АНЕСТЕЗИОЛОГИЯ
В ЛАПАРОСКОПИЧЕСКОЙ ХИРУРГИИ
Сейчас уже ни у кого не вызывает сомнения, что
лапароскопическая хирургия в ее классическом
виде помимо своих неоспоримых преимуществ несет в
себе потенциальный риск осложнений, связанных с
наложением карбоксиперитонеума под давлением.
Вероятно, компромисс здесь может быть достигнут
на пути использования так называемых лифтинговых
методик лапароскопии, при которых пространство
для манипуляций создается тракцией передней
брюшной стенки вверх, без применения
напряженного пневмоперитонеума. Но пока что мировой опыт
по использованию этой методики очень ограничен,
и, кроме того, она также не лишена недостатков
(например, ограниченность рабочего пространства).
Поэтому выводы о ценности того или иного подхода
будут выработаны позднее, после накопления
опыта, а пока в своей практической работе большинство
хирургических клиник исходит из классической
методики лапароскопической хирургии.
Как и любая другая абдоминальная операция,
лапароскопическая операция может выполняться под
общей, проводниковой, и местной анестезией,
возможно также сочетание этих способов. Для
рационального выбора метода анестезии важна
предоперационная оценка состояния больного.
В случаях выраженной аритмии, ишемической
болезни сердца, некомпенсированного шока, плохо
поддающейся терапии артериальной гипертензии,
миокардиопатии, значительно сниженной
сократительной функции сердца, а также сильного
обезвоживания организма необходимо тщательное
обследование больных и достижение максимальной
компенсации перед выполнением лапароскопической
операции.
Совершенно особый контингент представляют
больные со сниженной дыхательной функцией. Как
видно из приведенных выше данных, главная
проблема в анестезиологии лапароскопической хирургии
состоит в устранении эффектов напряженного
карбоксиперитонеума и связанной с ним гиперкапнии.
Единственный путь элиминации СО2 из организма —
дыхательный. Больные, страдающие хроническим об-
структивным легочным синдромом, находятся на
грани компенсации по резервной емкости тканей в
отношении СО2. Казалось бы, всякие лапароскопические
процедуры им однозначно противопоказаны. Но опыт
показывает, что лапаротомия, которая в подобном
случае облегчает «жизнь» анестезиологу в
операционной, в послеоперационном периоде создает таким
больным значительную угрозу для жизни: так,
смертность этих больных после лапаротомии в верхних
отделах живота в 2 раза выше, чем при других
периферических операциях (не связанных с грудной
клеткой). Этот факт объясняют развитием
послеоперационного рестриктивного дыхательного синдрома из-за
ограничений эффективной работы диафрагмы.
Данные ряда работ свидетельствуют о том, что у больных
с хроническим обструктивным легочным синдромом
восстановление эффективной дыхательной функции
происходит гораздо быстрее после
лапароскопической холецистэктомии, чем после открытой операции.
С. Cozza и соавт. предлагают разделить
кандидатов на проведение лапароскопической операции,
имеющих обструктивную легочную патологию, на две
группы: 1) больные, которым операция может быть
выполнена посредством лапаротомии; 2) больные,
не нуждающиеся в лапаротомии (например, в
случаях грыжесечения, влагалищной гистерэктомии).
Больным 2-й группы проведение лапароскопии
считают нецелесообразным, отдавая предпочтение
неабдоминальным доступам. Больных 1-й группы
оперируют лапароскопически, однако используют
приемы, позволяющие минимизировать возможные
эффекты напряженного карбоксиперитонеума:
смешанную анестезию, эпидуральную анестезию,
или применяют лифтинговые методики
лапароскопии. Если во время лапароскопии показатели
мониторинга начинают приближаться к критическим,
лапароскопическую процедуру сразу конвертируют в
открытую.
С целью предоперационной оценки дыхательной
функции больных для отнесения их к группе риска в
качестве справочной можно использовать таблицу,
предложенную В. Dureuil.
Параметр
FVC
FEV1
FEV1/VC
, FEF 25-75
MWIND
раСО2
Ограничивающие значения,
% нормы
<70-75
<70
<65
<50
<50
>45 мм рт. ст.
Общая анестезия
При выборе метода анестезии большинство
авторов склоняются к общей анестезии с интубацией и
механической вентиляции.
Техника проведения наркоза при
лапароскопической хирургии имеет ряд особенностей:
1. При этом типе хирургии больше, чем при
каком-либо другом, рекомендуется только
внутривенный путь введения анестетиков. В особенности ре-
б
Глава А
комендуется исключить N20 из вдыхаемой смеси
или уменьшить ее содержание до уровня менее
50%. Хорошо известно, что N2O замещает О2 на
альвеолярном уровне, вызывая десатурацию
гемоглобина кислородом. В ходе лапароскопической
процедуры это явление нарастает.
Кроме того, N2O имеет свойство накапливаться в
просвете кишечных петель, вызывая значительное
увеличение их объема, препятствуя
восстановлению кишечной моторики в послеоперационном
периоде. Помимо кишечных петель N2O
диффундирует в просвет брюшной полости, где он смешивается
с введенным СО2. Некоторые авторы считают эту
смесь CO2-N2O ответственной за возникновение в
послеоперационном периоде плечелопаточного
синдрома, типичного последствия
лапароскопической хирургии.
Еще одним аргументом против использования
N2O является то, что при возникновении газовой
эмболии углекислым газом закись азота имеет
свойство быстро проникать в просвет образовавшихся
пузырьков, тем самым усугубляя проблему.
2. Рекомендуется максимально ограничивать
использование морфина и его производных.
Замечено, что после лапароскопии на протяжении первых
3 ч послеоперационного периода больные
нуждаются в проведении большего объема легочной
вентиляции A8-20 л в 1 мин), чем после открытой
хирургии A2-15 л в 1 мин), и кроме того, у них в крови
сохраняется большее парциальное напряжение
углекислого газа D6 мм рт. ст. против 36 мм рт. ст.).
Именно поэтому использование препаратов,
подавляющих дыхательный центр, нежелательно.
3. Одна из целей лапароскопической хирургии —
быстрое восстановление больного в
послеоперационном периоде, по этой причине желательно
использовать анестезиологические препараты с
минимально выраженным эффектом последействия.
4. Необходимо поддерживать хорошую
мышечную релаксацию во время лапароскопической
хирургии. Это нужно для того, чтобы, во-первых,
можно было легко приподнять переднюю брюшную
стенку при введении иглы Вереша и троакаров и тем
самым уменьшить риск повреждения подлежащих
структур, во-вторых, напряженное состояние мышц
передней брюшной стенки значительно
увеличивает давление карбоксиперитонеума в брюшной
полости, что приводит к усилению всех нежелательных
явлений, описанных выше.
5. В процессе наркоза больной должен
находиться на вентиляции легких с перемежающимся
положительным давлением, подобранным в
соответствии с уровнем СО2. Наличие карбоксиперитонеума
диктует необходимость гипервентиляции, которая
должна в среднем осуществляться на уровне
120-150 мл/кг/мин. В отношении пути достижения
гипервентиляции нет единого мнения. Так, если
С. Cozza и соавт. рекомендуют добиваться
гипервентиляции прежде всего увеличением
дыхательного объема, а не частоты дыхания, чтобы избежать
вредного влияния мертвого пространства, то
L. Llndgren рекомендует увеличивать минутный
объем за счет снижения дыхательного объема, чтобы
избежать повышения внутригрудного давления.
Впрочем, и С. Cozza и соавт. также рекомендуют не
достигать очень высоких пиков давления во
избежание баротравмы легких. Гипервентиляция понижает
накопление углекислого газа в тканях,
предотвращая организм от значительного понижения рН.
6. Проведение наркоза больному с хронической
обструктивной патологией легких при
лапароскопической операции представляет собой
трудноразрешимую задачу со множеством неизвестных.
Анестезиолог должен пытаться ликвидировать ги-
перкапнию через дыхательную систему с
выраженной неравномерностью вентиляции легких. Разные
области легких будут иметь разное время
заполнения и опорожнения альвеол или временные
константы ТС («Time Constant» — время в секундах,
необходимое для смены газового объема в 1 л). Во
время вдоха области с большими ТС (снабжаемыми
тонкими бронхами) получат меньше воздуха, чем
области с меньшими ТС (снабжаемыми бронхами
большего диаметра). Когда больший объем
вдыхаемого газа достигает альвеол, они еще больше
растягиваются. В конце фазы вдоха определенное
количество воздуха остается неиспользованным и
будет перемещаться от растянутых альвеол в сторону
менее растянутых: это так называемый феномен
Pendelluft. Во время фазы выдоха области,
дренируемые тонкими бронхами, опорожняются
медленнее, чем сегменты, дренируемые более толстыми
бронхами. В этом состоит механизм «воздушных
ловушек». Для уменьшения этого явления
искусственную вентиляцию рекомендуется проводить в
соответствии со следующими принципами:
- уменьшать частоту дыхания, добиваясь
удлинения, таким образом, фазы вдоха и выдоха;
- использовать прогрессивно растущую кривую
давление — поток (для снижения эффектов
различных временных констант), предусматривая
наличие плато после достижения пика
давления. При этом при нулевом потоке газа будет
происходить более равномерное
распределение введенного газа, уменьшая феномен
Pendelluft. Суть состоит в приближении време-
Анестезиологическое обеспечение в лапароскопической хирургии
ни вдоха ко времени заполнения сегментов
легких с высоким сопротивлением;
- подбирать соотношение вдох/выдох как 1:3-1:5,
чтобы снизить до минимума «воздушные
ловушки» в областях с высоким ТС (удлиняя период
выдоха для того, чтобы даже области с высоким
сопротивлением могли опорожниться).
Адекватность вентиляции должна
контролироваться главным образом измерением пиков вдоха и
уровнем PetCO2.
Эпидуральная анестезия
Считается, что данный вид анестезии больше
подходит для кратковременных процедур и для
амбулаторной хирургии. Это объясняется тем, что
наряду с основным его преимуществом — четко
ограниченная зона воздействия и отсутствие влияния на
центральную нервную систему, у этого метода есть
ряд недостатков:
1) эпидуральная анестезия ведет к более
выраженной гиперкапнии, чем общая анестезия с
гипервентиляцией. Самостоятельная вентиляция при
этом методе может обеспечить нормальные
показатели по СО2 только короткое время;
2) частое появление френикус-симптома во
время операции;
3) эпидуральная анестезия при
лапароскопической хирургии имеет потенциальный риск аспирации
через гастроэзофагеальный рефлюкс: этому
способствует повышенное давление в брюшной
полости, особенно в положении Тренделенбурга;
4) часто требуемое назначение внутривенных се-
дативных препаратов при эпидуральнои анестезии
может подавлять спонтанное дыхание, тем самым
повышая уровень гиперкапнии.
5) потенциальный эффект нарушения
гемодинамики при эпидуральнои анестезии может
потенцировать влияние пневмоперитонеума на систему
кровообращения.
Проводниковая и местная анестезия
Двустороняя блокада межреберных нервов и
местная инфильтрационная анестезия больше
подходят для кратковременных диагностических проце-
ДУР-
Мониторинг во время операции
Во время лапароскопической хирургической
операции желательно проводить мониторинг
следующих показателей:
- давление в брюшной полости;
- мониторинг сердечных шумов через стетоскоп;
- ЭКГ, частота пульса, АД;
- показатели дыхания: частота, минутный объем,
давление в дыхательных путях (включая
пиковое и давление плато), давление О2 на вдохе;
- сатурация О2, PetCO2 и в необходимых случаях
чрескожное измерение тканевого давления О2 и
СО2.
Некоторые особенности
послеоперационного периода
Как правило, болевой синдром после
лапароскопической хирургии незначительный и легко
купируется ненаркотическими анальгетиками.
Как известно, частой проблемой после
длительного пневмоперитонеума является возникновение
плечелопаточного (френикус) симптома.
Ненаркотические анальгетики также дают лечебный эффект
при этом явлении. J. Infante и соавт. получили
хороший профилактический эффект в отношении фре-
никус-синдрома, вводя в конце операции местный
анестетик длительного действия бупивакаин в под-
диафрагмальное пространство.
Постоянным явлением после наркоза в
лапароскопической хирургии бывает тошнота и рвота. Для
борьбы с ними применяется подкожное введение
скополамина. Проведенное J. Payne
рандомизированное исследование в отношении скополамина
подтвердило его действительно высокую
эффективность.
Еще одним препаратом, применяемым для этой
цели, является дроперидол. Хороший эффект дал
новый препарат — Ondansetron — антагонист
ЭНЗ-рецепторов, используемый как мощный су-
прессор рвоты в химиотерапии.
57
Общие осложнения
лапароскопических
операций
Развитие высокотехнологичных эндовидеохирур-
гических методик значительным образом изменило
представления о благоприятном течении операции
и послеоперационного периода. Использование
современных технологий позволяет точно
контролировать все манипуляции, выполняемые хирургом.
Таким образом, идеальная эндовидеохирургичес-
кая операция представляется на сегодня
вмешательством с прецизионным выделением,
пересечением и анастомозированием всех анатомических
структур, отсутствием кровопотери,
инфицирования брюшной полости и брюшной стенки; а также
минимальными сроками стационарного лечения и
нетрудоспособности.
Любые отступления от подобной схемы многими
хирургами рассматриваются как осложнения.
Общее их количество составляет, по данным
различных авторов, от 0,1-0,2% до 4-5% и выше.
С точки зрения терминологии мы считаем, что
большую часть подобных ситуаций правильнее
определять как «неудачи» или «трудности» операции.
Но в любом случае многие из них приводят к
увеличению сроков пребывания в стационаре,
относительно более тяжелому послеоперационному
периоду, а в некоторых случаях могут стать причиной
действительно серьезных осложнений. При этом
даже при отсутствии последних теряются
преимущества лапароскопической операции, в
определенной степени дискредитируется метод. Все это
предъявляет повышенные требования к понять
«безопасность лапароскопической операции».
Практически целесообразно построить анализ
общих осложнений лапароскопических
вмешательств имеенно с точки зрения действий лечащего
врача — хирурга по обеспечению безопасности
вмешательства.
ТРОМБОТИЧЕСКИЕ ОСЛОЖНЕНИЯ
Под тромботическими осложнениями
понимается прежде всего развитие флеботромбозов и
тромбофлебитов в нижних конечностях и малом тазу с
угрозой последующей тромбоэмболии легочной
артерии. Помимо самой операционной агрессии,
всегда сдвигающей систему гемостаза в сторону
гиперкоагуляции, при лапароскопических операциях в
патогенез этого процесса включаются
дополнительные факторы.
К ним относятся:
- повышенное внутрибрюшное давление из-за
пневмоперитонеума,
- положение больного на столе с приподнятым
головным концом,
- большая длительность операции.
Несмотря на то, что наш опыт и данные
литературы не позволяют говорить о достоверно чаще
встречающейся тромбоэмболии после
лапароскопических операций, имеющиеся предпосылки к
венозному стазу в нижних конечностях заставляют с
повышенным вниманием относиться к
профилактике тромботических осложнений.
5S
Общие осложнения лапароскопических операций
С этой целью мы считаем необходимым:
1. Эластическое бинтование нижних конечностей
перед операцией и в течение всего
послеоперационного периода независимо от наличия
варикозной болезни у пациента.
2. Применение, по возможности, пневматической
компрессии нижних конечностей во время
операции.
3. Применение антикоагулянтов (при наличии
изменений в свертывающей системе крови) в
малых дозах перед и после операции. В
настоящее время известно, что назначение гепарина
по 5000 ЕД перед и каждые 12ч после
операции (или фраксипарина — каждые 24 ч) не
увеличивает риск кровотечений, но снижает риск
тромбообразования.
Такую профилактику можно и следует проводить
при всех лапароскопических вмешательствах.
Соответствующие назначения делает врач-хирург перед
операцией.
ЛЕГОЧНЫЕ И СЕРДЕЧНО-СОСУДИСТЫЕ
ОСЛОЖНЕНИЯ
Основные причины этой группы осложнений при
эндовидеохирургических операциях следующие:
• ограничение экскурсий легких из-за сдавления
их диафрагмой при пневмоперитонеуме.
• рефлекторное угнетение двигательной функции
диафрагмы в послеоперационном периоде из-
за перерастяжения ее во время
лапароскопического вмешательства.
• отрицательное влияние абсорбируемой
углекислоты на сократительную функцию миокарда,
депрессия центральной нервной системы, в
частности, дыхательного центра, особенно при
длительно существующем карбоксипневмопе-
ритонеуме.
• снижение сердечного выброса из-за
уменьшения венозного возврата к сердцу
• вследствие депонирования крови в венах таза и
нижних конечностей.
• дополнительное отрицательное влияние
положения тела больного — Тренделенбурга или Фа-
улера.
• ишемические нарушения в микроциркулятор-
ном русле органов брюшной полости из-за
компрессии при пневмоперитонеуме, а также из-за
рефлекторного спазма в ответ на
развивающуюся гипотонию гиперкапнию.
• смещения средостения и снижения легочных
объемов при торакоскопических
вмешательствах вследствие пневмоторакса и бокового
положения больного.
Указанные причины — ведущие в развитии интра-
или послеоперационных сердечно-легочных
нарушений, развитие которых может стать основанием
для перехода на «открытое» вмешательство, вызвать
остановку дыхания или развитие пневмонии,
инфаркта миокарда или других серьезных осложнений
после операции. Их предупреждение в большей
степени задача анестезиологического и
реаниматологического обеспечения. Хирург должен
настороженно относиться к данной группе осложнений и при
необходимости расширять комплекс
предоперационных функциональных обследований больного.
В организационном плане, во время эндовидео-
хирургической операции и в раннем послеоперци-
онном периоде, следует обеспечить мониторирова-
ние показателей газов крови, пульса, артериального
давления и, по показаниям, электрокардиограммы.
Кроме того, необходимо помнить о возможности
развития пневмо- или гидроторакса после
лапароскопических операций. Причиной может являться
проникновение газа или жидкости (при массивных
промываниях брюшной полости во время операции)
через физиологические или патологические дефекты
диафрагмы. Эти осложнения могут быть двух- и
односторонними, сочетаться с пневмомедиастинумом и
подкожной эмфиземой. Лечение их не представляет
больших сложностей — следует произвести пункцию
или, в некоторых случаях, дренирование грудной
полости. Более сложной может быть своевременная
диагностика. В связи с этим некоторые хирурги
предлагают рутинное рентгенологическое исследование
легких на операционном столе при длительных (более
2 ч) лапароскопических операциях.
НЕУДАЧИ И ОСЛОЖНЕНИЯ ПРИ
СОЗДАНИИ ПНЕВМОПЕРИТОНЕУМА
Создание пневмоперитонеума потенциально
один из наиболее опасных этапов любой
лапароскопической операции. Большое количество
осложнений может быть связано непосредственно с
техникой выполнения манипуляции. Они обусловлены
прежде всего отсутствием визуального контроля
при пункции брюшной полости иглой Вереша и
введении первого троакара.
Осложнения, возникающие при наложении
пневмоперитонеума, можно разделить на следующие
группы:
1. Связанные с экстраперитонеальным
нагнетанием газа.
59
Глава 5
2. Связанные с непосредственным механическим
повреждением различных анатомических
структур.
Наиболее часто встречаются ситуации, когда в
силу различных причин (ошибок при проведении
тестов или пренебрежения ими) производится инсуф-
фляция газа в подкожную клетчатку, предбрюшин-
но, в ткань большого сальника или круглой связки
печени.
Мы считаем, что пневматизацию клетчаточных
пространств следует относить к неудачам, а не к
осложнениям операции, так как они достаточно легко
могут быть распознаны при возникновении
визуально, а также по показаниям инсуффлятора, и даже
при достаточной выраженности практически не
влияют на течение послеоперационного периода.
Большую опасность представляют случаи
попадания газа в венозную систему при случайной
пункции венозного сосуда или его ранении при наличии
пневмоперитонеума. И если при инсуффляции в
клетчатку, лечение, как правило, не обязательно, то
газовая эмболия требует немедленных активных
действий.
Необходимо:
1. Снять пневмоперитонеум.
2. Перевести пациента в положение Дюранта -—
на левом боку с приподнятым ножным концом
стола.
3. Произвести аспирацию газа из правого
предсердия через центральную вену.
4. Наладить вентиляцию чистым кислородом.
5. Проводить реанимационную терапию.
Механические повреждения сосудов и кишечника
встречаются в 0,14-2% наблюдений.
Повреждения сосудов передней брюшной
стенки, как правило, не представляют
непосредственной угрозы жизни больного, но приводят к
образованию гематом с риском последующего нагноения.
Травмы крупных сосудов забрю шинного
пространства — аорты, полой вены, подвздошных
артерий и вен более опасны и требуют немедленных
активных действий по устранению повреждений.
Летальность в этих случаях достигает 40%.
Наиболее часто такие осложнения возникают при
введении первого троакара — в 66-100%
наблюдений, реже — при введении иглы Вереша. К. Semm
A996) и некоторые другие авторы указывают на
вероятность повреждения крупных сосудов при
проведении околопупочного разреза скальпелем.
Кроме того, в литературе можно найти примеры
неудач выполнения пневмоперитонеума,
проявляющихся через значительное время после операции.
Так, например, существует описание случая
ущемления трансмезосигмовидной грыжи через 5 мес
после повреждения брыжейки сигмовидной кишки
во время лапароскопического вмешательства.
Большое количество различных осложнений гр
наложении пневмоперитонеума, представляющие
непосредственную угрозу жизни больного, диктуют
необходимость обязательного соблюдения ряда
правил проведения этой процедуры. Строгое вы
полнение каждого из них позволяет максимально
обезопасить пациента и хирурга.
С целью снижения риска от вероятных
нераспознанных повреждений внутренних органов и
сосудов при создании пневмоперитонеума, необходимо
в начале каждой лапароскопической операции в
обязательном порядке проводить осмотр брюшной
полости. В этой связи актуально высказывание
К. Semm: «Серьезная опасность возникает, как
правило, не от первичного осложнения, а от
осложнений этого осложнения».
Соблюдение всех правил, по мнению
большинства авторов, позволяет более чем в 99% случаев
избежать серьезных осложнений при слепом доступе
в брюшную полость, но полностью гарантировать их
отсутствие может только рутинное использование
«открытой» лапароскопии.
Таким образом, основным условием
профилактики неудач и осложнений начального этапа
лапароскопического вмешательства является тщательное
и последовательное выполнение всех правил
создания пневмоперитонеума. Во всех трудных и
сомнительных случаях предпочтение следует отдавать
методике открытой лапароскопии. При
возникновении какого-либо осложнения, в случае
недостаточного контроля над ситуацией, следует перейти к
открытой операции с привлечением, при
необходимости и возможности, специалистов
соответствующего профиля (например, сосудистых хирургов).
ТЕРМИЧЕСКИЕ И КОАГУЛЯЦИОННЫЕ
ПОВРЕЖДЕНИЯ
Эндовидеохирургия неразрывно связана с
использованием тепловой энергии, носителями
которой являются электрохирургические, а также
лазерные и аргоновые устройства. Эго позволяет
проводить диссекцию тканей в условиях немедленного
полного гемостаза. При этом использование
указанной аппаратуры, особенно монополярной
коагуляции, имеет свою специфику в условиях эндовиде-
охирургических операций.
Последняя определяется следующим:
• ограничением визуального контроля;
ВО
Общие осложнения лапароскопических операций
• наличием в зоне операции нескольких
инструментов, рабочая часть почти каждого из
которых может являться проводником
электрического тока.
• большей длинной инструмента, наличием
постоянного дополнительного контакта через
троакар с брюшной стенкой;
• использованием ирригации во время операции,
что может привести к появлению электрической
проводимости вдоль диэлектрических
поверхностей инструментов или появлению
аномальных путей тока через жидкость.
Основные механизмы электрокоагуляционных
повреждений:
• прямое повреждающее воздействие рабочей
частью инструмента при несвоевременном
нажатии на педаль или при неправильной
ориентировке в тканях, или при коагуляции
«вслепую»;
• прямое повреждающее воздействие
инструмента с удлиненной металлической рабочей частью
(некоторые виды диссекторов), находящейся
вне зоны видимости в момент коагуляции;
• прямое повреждающее воздействие из-за
нарушения изоляции или ее емкостного пробоя;
• опосредованное (через касание другого
инструмента, в том числе лапароскопа)
повреждение;
• прямое повреждение из-за касания
инструментом какого-либо органа сразу после
проведения коагуляции, когда рабочая часть еще
сохраняет повышенную температуру;
• коагуляция вблизи клипс или механического
шва; при этом скрепки становятся электрчес-
кими проводниками, что вызывает некроз
тканей;
• длительная коагуляция тонких структур,
вызывающая аномальное движение тока, например,
при электрокоауляции маточной трубы — через
ее фимбриальный конец, что может повредить
предлежащие к нему органы;
• длительное использование коагуляции в
условиях недостаточной видимости вблизи
трубчатых структур (холедоха) — приводит к развитию
Таким образом, видно, что основные причины ко-
агуляционных повреждений — это дефекты
инструментария и технические ошибки хирурга.
Соответственно предупреждение осложнений данной группы
возможно при соблюдении правил использования
электрохирургических аппаратуры и инструментов:
1. Проверка работы аппаратуры и правильности
ее установки и настройки перед операцией
непосредственно оперирующим хирургом.
2. Проверка качественного состава инсуфлируе-
мого газа — в отечественной и зарубежной
литературы описаны случаи возгораний внутри
брюшной полости из-за непреднамеренной ин-
суффляции кислорода в брюшную полость.
3. Проверка целостности изоляционных
покрытий инструментов. Следует обратить
внимание, что при работе через троакары с
«плунжерным» клапанным механизмом, возможно
повреждение изоляции инструментов при
введении и выведении инструментов. Для
предупреждения этого клапан необходимо
открывать.
4. Коагуляция внутри брюшной полости должна
производиться под четким визуальным
контролем всей рабочей части инструмента,
желательно «на весу», не касаясь окружающих
тканей или наложенных ранее клипс.
5. Коагуляция не должна быть длительной.
6. По окончании коагуляции необходимо выждать
несколько секунд, избегая контакта
инструмента с каким-либо органом, что приведет к
снижению температуры его рабочей части.
7. При необходимости одновременной тракции,
последняя должна быть направлена в сторону
лапароскопа с целью полного визуального
контроля инструмента в случае его «срыва» с
тканей.
Во всех возможных случаях предпочтение
следует отдавать биполярной коагуляции.
ИНФЕКЦИОННЫЕ ОСЛОЖНЕНИЯ
Инфекции троакарных ран достаточно редкое в
их отсроченных стиктур;
____эндовидеохирургии; по многочисленным литера-
• ожоговое поражение внутренних органов
лапароскопом, оставленным в брюшной полости без
пневмоперитонеума во время каких-либо
манипуляций (например, удалении органа из
полости живота);
• ожоги в области пластиньи[гтассивноп1электро-
да) из^за уменьшения площади контакта^ее с
поверхностью тела.
турным данным, частота этотосложненя не
превышает 1%. Правила предотвращения инфекции
общеизвестны: бережное обращение с тканями,
удаление органа в контейнере через разрез в области
наименьшей толщины брюшной стенки, антибиоти-
копрофилактика.
При этом мы бы хотели обратить внимание hsu
возможные сложности своевременного распозна-
61
Глава 5
вания инфекционных осложнений после
лапароскопических операций. В своей практике мы наблюда-
пи подапоневротический гнойник области эпигаст-
рального прокола после холецистэктомии.
Возникший на 3 сут. после операции болевой синдром в
эпигастрии был вначале ошибочно расценен как
проявление послеоперационного панкреатита.
Правильный диагноз был поставлен только в момент
перфорации гнойника в брюшную полость.
Причинами позднего диагноза были: отсутствие внешних
проявлений из-за малых размеров кожного
разреза, отсутствие настороженности. Последняя
является основным условием своевременной
профилактики и лечения любых осложнений.
ПОСЛЕОПЕРАЦИОННЫЕ ГРЫЖИ
Встречаются достаточно редко. Мера
профилактики — ушивание всех троакарных дефектов в
апоневрозе диаметром более 1 см, что может быть легко
проконтролировано пальпаторно в конце операции.
СПОСОБЫ КОРРЕКИИИ ОСЛОЖНЕНИЙ
В ЭНДОВИДЕОХИРУРГИИ
Необходимо еще раз подчеркнуть, что
эффективные действия по ликвидации осложнения
начинаются со своевременности его распознавания.
Поэтому любая эндовидеохирургическая операция
должна начинаться с обзорной лапароскопии, одна из
задач которой — своевременная диагностика
осложнений начального этапа операции.
При обнаружении ранения какого-либо органа
(например, кишки), необходимо выполнить его
ушивание. При этом мы считаем, что при повреждении
кишки иглой Вереша безопаснее сразу наложить
погружной серо-серозный шов, чем отдавать
предпочтение выжидательной тактике, как рекомендуют
некоторые хирурги. Если использование при этом
лапароскопической техники невозможно, следует
перейти на микролапаротомию или полноценную
лапаротомию, что обеспечит максимальную
надежность манипуляций.
Ранения сосудов во врём^операции
представляют непосредственную опасность как для
нормального хода операции, так и, иногда, для жизни
больного. Хирургическая тактика зависит при этом от
характера повреждения сосуда и интенсивности
кровотечения.
При незначительном кровотечении можно
избрать выжидательную тактику — при
самопроизвольном уменьшении интенсивности кровотечения
каких-либо дополнительных действий не требуется.
При увеличении интенсивности или изначально
умеренно выраженном кровотечении необходимо
достичь временного гемостаза, например тампонадой
предлежащим органом (желчным пузырем, кишкой).
Мы часто пользуемся для этого марлевым
развернутым тампоном, вводимым через 10 мм троакар.
Иногда временный гемостаз удается достигнуть
захватом сосуда диссектором или атравматичным
зажимом. После оценки ситуации, сосуды до одного,
иногда — 2 мм в диаметре могут быть скоагулирова-
ны, если при этом есть уверенность в отсутствии
угрозы повреждения окружающих органов, или клип-
пированы. Клиппирование так же должно
производиться под четким визуальным контролем.
Для безопасного выполнения указанных
манипуляций считаем необходимым уверенное владение
бимануальной техникой оперирования.
Оптимальным при этом считаем работу диссектором или ат-
равматическим зажимом — в левой руке и электро-
отсасывателем — в правой. Техника остановки
кровотечения следующая: при постоянной ирригации и
аспирации жидкости и крови, отводя при
необходимости окружающие ткани диссектором, четко
визуализируется сосуд. Достигается ситуация, когда
изливающаяся кровь аспирируется непосредственно
из сосуда. Последний захватывается
атравматичным инструментом, выводится наконечник электро-
отсасывателя, через этот троакар вводят клипапп-
ликатор, и сосуд пережимают клипсами под четким
визуальным контролем.
При сильном кровотечении, или неудачных
попытках остановки умеренного, или при
невозможности достижения 100% визуализации и опасности,
вследствие этого, дополнительных повреждений,
необходимо произвести адекватную лапаротомию.
Тактика хирурга при ранении сосудов забрюшин-
ного пространства имеет свою специфику. При
обоснованном подозрении на ранение аорты,
нижней -полой вены или их ветвей, необходимо
произвести немедленную лапаротомию и ушивание
дефекта сосуда.
При ранении мелких сосудов этой области
возможна выжидательная тактика. Мы_считаем, что
обнаружение, после наложения пневмоперитонеума,
забрюшинной гематомы без явных признаков
увеличения, позволяет придерживаться следующего
алгоритма действий: снять пневмоперитонеум на
3-5 мин, затем, после повторного его создания,
оценить размеры-гематомы. Если они не увеличились —
выполнить операцию. По окончании ее оценить
размеры гематомы после снятия и повторного наложе-
62
Общие осложнения лапароскопических операций
ния пневмоперитонеума. При отсутствии признаков
увеличения дополнительных хирургических действий
не требуется. Целесообразно провести антибиотико-
терапию в послеоперационном периоде.
Хотелось бы подчеркнуть, что любые сомнения в
устойчивости хирургического гемостаза, особенно
при повреждениях крупных сосудов, должны
заканчиваться конверсией.
Остановка кровотечения из поврежденных
сосудов передней брюшной стенки не простая задача.
Опыт показывает, что чрезкожное прошивание эпи-
гастральных артерий или их крупных ветвей, как
правило, малоэффективно и приводит к ухудшению
косметических результатов. При возникновении
таких осложнений мы считаем оптимальным
использование скорняжной иглы, позволяющей
практически из одного наружного вкола захватить нитью
достаточный массив глубокорасположенных тканей
брюшной стенки. Это позволяет гарантированно
прошить сосуд, не нарушая косметики.
Небольшие кровотечения из троакарных вколов
нередко останавливаются самопроизвольно к концу
операции. Если этого не происходит, или
изливающаяся кровь создает трудности для проведения
основного этапа операции, такое кровотечение может
быть остановлено электрокоагуляцией. Один из
таких успешно применяемых способов: в конце
операции через троакар вводят коагуляционный
инструмент (например, диссектор), троакар выдвигают
из брюшной полости, а инструмент устанавливают
таким образом, что его рабочая часть оказывается в
толще брюшной стенки. Производится коагуляция
стенок раневого троакарного канала.
В заключение хотелось бы отметить, что для
достижения надежного гемостаза, всегда в конце
операции необходимо произвести осмотр
возможных мест кровоточивости на пониженным до
7-8 мм рт. ст. внутрибрюшном давлении. Это
позволяет исключить тампонирующий эффект
пневмоперитонеума.
В заключение хотелось бы отметить, что эндови-
деохирургия не может быть абсолютно безопасной
и не иметь неудач и осложнений. Мы считаем, что
каждый хирург, выполняющий эндоскопические
вмешательства, не должен пренебрегать любыми
мелочами в дооперационном обследовании и
подготовке пациента к операции, а также подготовке и
настройке аппаратуры. Кроме того, оперирующий
хирург должен иметь четкий алгоритм действий в
случаях тех или иных осложнений. Все это
основополагающий момент, позволяющий предупредить
или, при необходимости, быстро и безопасно
ликвидировать возникшее осложнение.
Переход на «открытое» вмешательство следует
рассматривать не как осложнение эндовидеохирур-
гической операции, а как выбор оптимальной в
создавшейся в конкретной ситуации хирургической
тактики, позволяющей наиболее безопасно
излечить больного от имеющегося заболевания.
Следует помнить, что по многочисленным
данным, полученным в различных учреждениях,
количество осложнений невелико при выполнении
хирургом первых 20 эндоскопических вмешательств,
затем эти показатели резко нарастают, достигая
максимума к 40-50 операциям. В последующем, кривая
показателей осложнений снижается, достигая
приемлемого низкого уровня после выполнения
100-200 эндоскопических вмешательств. Хирургам,
начинающим осваивать эндовидеохирургию,
следует обращать внимание на эти данные.
63
Лапароскопическая
хирургия желчных
путей
ЛАПАРОСКОПИЧЕСКАЯ
ХОЛЕЦИСТЭКТОМИЯ
Расположение больного
на операционном столе
Больного можно расположить на операционном
столе двумя различными способами в зависимости
от того, какую технику оперативного доступа
применяет хирург. Условно эти два варианта техники
называют «французская» и «американская».
При первом варианте («французская» техника)
оперативного доступа больного располагают на
столе с разведенными ногами (рис. 6.1), хирург
находится между ног больного. Ассистенты при этом
располагаются справа и слева от больного, а
операционная сестра у левой ноги пациента.
При использовании «американской» техники
больной лежит на столе без разведения ног
(рис. 6.2); хирург располагается слева от больного,
ассистент справа; ассистент — на камере у левой
ноги больного, операционная сестра у правой.
Различия этих двух вариантов техники касаются и
точек введения троакаров и фиксации желчного
пузыря. Считается, что различия эти
непринципиальны и это вопрос личной привычки хирурга. В то же
время при использовании «американского»
способа, при котором применяется цефалическая трак-
ция дна желчного пузыря с помощью зажима,
создается гораздо более качественная экспозиция
подпеченочного пространства. Поэтому в
дальнейшем опишем именно этот вариант.
Размещение оборудования
и инструментария
Традиционно в статьях и руководствах этому
вопросу не уделяют особого внимания, хотя он имеет
практическое значение. Так, нерациональное
расположение стойки с оборудованием и мониторов может
привести к тому, что в ходе оперативного вмешательства
экран монитора закроется посторонними предметами
или головой анестезиолога, и тогда хирург и
ассистенты занимают вынужденное напряженное положение и
быстро устают; нерациональное размещение на
больном кабелей, трубок может приводить к тому, что в
конце операции они запутываюся в узел. Безусловно,
здесь трудно дать однозначные рекомендации на все
случаи жизни, и вероятно, каждый хирург в ходе
практики должен выработать для себя наиболее
удовлетворяющие его варианты. Наиболее часто перепугы-
вание коммуникаций происходит, если их фиксируют к
операционному белью в одной точке. Поэтому мы
разделяем их на два пучка: A) шланг подачи газа + кабель
электрокоагуляции и B) шланги
ирригации/аспирации + кабель телекамеры + световод. Конец кабеля
электрокоагуляции пропускают в кольцо цапки,
фиксирующей операционное белье к дуге. Слева от
больного из операционного белья при помощи цапок
формируют широкий карман от дуги до левой ноги
пациента. Наличие такого кармана предотвращает
случайное падение этих предметов вниз за пределы
стерильной зоны и, следовательно, нарушения
асептики. Дуга, по которой располагаются кабель
телекамеры и световод, должна быть свободной, чтобы к
концу операции при удалении пузыря через параумби-
ликальный прокол можно было бы легко переместить
телескоп в субксифоидальный порт.
Техника оперативного вмешательства
Оперативное вмешательство начинают с
наложения пневмоперитонеума при помощи иглы Вереша.
Наиболее часто иглу Вереша вводят через параум-
64
Лапароскопическая хирургия желчных путей
Рис. 6.1. Расположение операционной бригады при «французской» технике лапароскопической холецистэктомии.
1. Хирург
2. 1 -й ассистент
3. 2-й ассистент
4. Операционная сестра
5. Инструментальный стол
6. Монитор
65
Глава В
6
Рис. В.2. Расположение операционной бригады при «американской» технике лапароскопической холецистэктомии.
1. Хирург
2. 1 -й ассистент
3. 2-й ассистент
4. Операционная сестра
5. Инструментальный стол
6. Монитор
66
Лапароскопическая хирургия желчных путей
Рис. Б.З. Разрез кожи для
первого троакара при
выполнении
лапароскопической холецистэктомии.
биликальный доступ. Технически выполнение
косметического параумбикального разреза
облегчается, если первоначально сделать небольшой прокол
кожи C-4 мм) по линии предполагаемого
косметического разреза, наложить пневмоперитонеум, а
затем выполнить разрез (рис. 6.3). Длина параум-
биликального разреза первоначально составляет
по меньшей мере 2 см, при необходимости он
может быть расширен. Пневмоперитонеум
поддерживают на уровне 12 мм рт. ст., скорость подачи газа
2-6 л/мин. После выполнения разреза кожи через
него в брюшную полость вводят 10 мм троакар, к
патрубку которого подключают шланг подачи газа.
Через троакар в брюшную полость вводят
оптическую трубку и выполняют общий осмотр всей брюшной
полости. При этом обращают внимание на наличие в
брюшной полости жидкости, состояние печени,
желудка, сальника, петель кишечника. Этот момент
операции очень важен, так как если сразу
сконцентрироваться на правом подреберье, можно не заметить,
например, кровь в месте ранения большого сальника
непосредственно под пупком или продолжающееся
кровотечение из точки введения первого троакара,
либо пропустить метастазы в левой доле печени, если
онкопроцесс не подозревался до операции, либо
патологию женских гениталий (кисты, онкопроцессы).
Если хирург выявит такие изменения, то это может
изменить весь дальнейший план действий, может
заставить отказаться от выполнения холецистэктомии,
либо может побудить хирурга к введению троакаров в
других местах, отличных от стандарта.
Если ничего неожиданного в брюшной полости
выявлено не было, то вводят следующие троакары.
Стандартом в настоящее время считается введение
в общей сложности четырех троакаров: двух 10 мм
троакаров (один из которых параумбиликальный) и
двух 5 мм троакаров. Все троакары, за исключением
первого, вводят под обязательным визуальным
контролем: при этом острый конец троакара всегда
должен находиться в центре поля зрения. Точки
введения троакаров показаны на рис. 6.4. Субксифои-
Рис. 6.4. Точки доступа при выполнении
лапароскопической холецистэктомии.
1. Первый, 10-мм троакар
2. Основной манипуляционный 10-мм троакар
3. 5-мм троакар
4. 5-мм троакар
Глава В
Рис. Б.5. Введение субксифоидального
троакара при выполнении лапароскопической
холецистэктомии.
1. Средняя линия
2. Серповидная связка печени
3. Троакар
Рис. 6.6. Захват и тракция желчного пузыря
при лапароскопической холецистэктомии.
1. Дно желчного пузыря
2. Гартмановский карман
3. Направление тракции за дно желчного
пузыря
4. Направление тракции за гартмановский
карман желчного пузыря
Лапароскопическая хирургия желчных путей
дальный троакар вводят на границе верхней и
средней трети расстояния между мечевидным
отростком и пупком чуть вправо от средней линии, один из
5 мм троакаров вводят по среднеключичной линии
на 2-3 см ниже реберной дуги, и второй 5 мм
троакар по передней подмышечной линии на уровне
пупка. Субксифоидальный троакар вводят в косом
направлении (приблизительно 45°) так, чтобы его
конец вышел в брюшную полость справа от
серповидной связки печени, если он окажется слева от
связки, то это может затруднить дальнейшие
манипуляции (рис. 6.5). Один 5 мм троакар (по средне-
ключичной линии) вводят перпендикулярно к
брюшной стенке. Другой (по передней подмышечной
линии) вводят в косом направлении, ориентируя его
конец на дно желчного пузыря; такое расположение
пункционного канала оптимально, так как работа
инструмента, вводимого через этот троакар,
протекает по большей части именно по такой оси, при
этом надрывы брюшины, особенно значительно
выявляющиеся к концу операции, будут минимальны,
и кроме того, если через этот порт потребуется
вводить дренаж, то он будет направлен четко к ложу
желчного пузыря.
Через боковой 5 мм троакар ассистент вводит
граспер, которым захватывает дно желчного
пузыря. При этом следует использовать зажим с замком,
так как удерживание дна пузыря зажимом без замка
очень утомительно для ассистента. Перед
фиксацией дна пузыря хирург может помочь, приподняв
край печени, или захватив за пузырь. В тех случаях,
когда захват стенки пузыря в складку не удается из-
за его выраженного напряжения за счет жидкости,
то пузырь следует пунктировать.
Затем ассистент отводит дно пузыря вверх, т.е.
создает так называемую цефалическую тракцию
(рис. 6.6). При этом хорошо видны спайки, если они
имеются. Нежные и прозрачные спайки можно
легко рассечь электрокрючком. Эта манипуляция
облегчается, если спайку оттянуть от пузыря мягким
зажимом, введенным через свободный порт. В
случаях, когда спаечный процесс выраженный, спайки
плотные и непрозрачные, эту работу следует делать
очень медленно, осторожно и постепенно, так как
описаны случаи повреждения толстой кишки,
которая была вовлечена в спаечный процесс в области
дна и тела пузыря, и известно множество случаев
повреждения двенадцатиперстной кишки при
разделении спаек в области гартмановского кармана.
Кроме того, в таких случаях следует с крайней
осторожностью пользоваться электрокоагуляцией, так
как повреждение этих органов может носить
характер термического ожога и некроза.
В процессе рассечения большого количества
спаек в подпеченочном пространстве может
скапливаться значительное количество крови и
сгустков, которые значительно снижают качество
визуализации и уровень освещенности (так как кровь
поглощает свет). Для профилактики сгусткообразова-
ния и улучшения видимости целесообразно
периодически промывать эту зону жидкостью с
добавлением гепарина E тыс. ЕД гепарина на 1 л
жидкости). Добавление гепарина снимает сгусткообра-
зование в свободной брюшной полости, поэтому
излившуюся кровь можно свободно аспирировать.
Проведенные исследования показали, что на общую
свертываемость крови такое добавление гепарина
влияния не оказывает.
После освобождения желчного пузыря из спаеч- ^
ного процесса его фиксируют зажимом и за область
гартмановского кармана. При этом следует
обратить внимание на создание правильной экспозиции:
дно пузыря продолжают отводить в цефалическом f
направлении, а гартмановский карман отводят ла-
терально и от печени (рис. 6.7). Ошибочно, если ас- i
систент прижимает гартмановский карман к
печени — это не только затрудняет препаровку, но и
просто опасно, поскольку не дает возможности хорошо 4
верифицировать анатомию этой зоны.
Диссекцию тканей в этой зоне можно проводить
как с помощью электрокрючка, так и при помощи
ножниц с электрокоагуляцией. Это вопрос
индивидуальной привычки хирурга, хотя крючок все же
имеет некоторые преимущества: так, им захватить
более мелкую порцию тканей, и кроме этого,
рассекаемую ткань можно приподнять, т.е. диссекция
становится гораздо более деликатной. Первоначально
следует рассечь брюшину вокруг шейки пузыря,
разрез должен быть сделан как с правой, так и с
левой стороны от пузыря, и он должен иметь форму
параболы, направленной ветвями вверх (рис. 6.8).
Электрокрючком можно сделать насечку брюшины в
левой верхней части параболы, а затем, постепенно
приподнимая брюшину и рассекая ее, продвигаться
дальше. Ассистент при этом постепенно
поворачивает гартмановский карман в направлении,
противоположном ходу разреза, и тем самым улучшает
экспозицию.
Затем приступают к выделению анатомических
элементов в области треугольника Calot. Эту
препаровку можно проводить опять-таки при помощи
электрокрючка (рис. 6.9), а также сочетать работу
крючком с помощью диссектора. Постепенно
захватывая и пересекая небольшие пучки
соединительной ткани (критерием пересечения может быть
тонкость и прозрачность рассекаемых элементов). Эти
Глава Б
Рис. Б.7. Создание
экспозиции желчного пузыря при
лапароскопической холецис-
тэктомии.
1. Желчный пузырь
2. Печень
3. Направление тракции
зажима на дне желчного
пузыря
4. Направление тракции
зажима на гартмановском
кармане желчного пузыря
5. Оптика
Рис. 6.8. Линия первоначального рассечения
брюшины у шейки желчного пузыря при
лапароскопической холецистэктомии.
1. Дно желчного пузыря
2. Гартмановский карман желчного пузыря
3. Гепато-дуоденальная связка
4. Линия рассечения брюшины вокруг шейки
желчного пузыря
Лапароскопическая хирургия желчных путей
Рис. Б.9. Диссекция тубулярных
структур в области
треугольника Calot при лапароскопической
холецистэктомии.
1. Дно желчного пузыря
2. Гартмановский карман
желчного пузыря
3. Пузырный проток
4. Пузырная артерия
5. Электрокрючок
соединительно-тканные элементы рассекают с
обеих сторон шейки, ассистент для этого поворачивает
гартмановский карман. Постепенно выявляются ту-
булярные структуры: пузырный проток и артерия
(рис. 6.10). Чаще всего пузырный проток л ежит
ближе к свободному краю «брыжейки» пузыря, а
артерия дальше, однако это бывает далеко не всегда.
Маркером артерии может служить лимфатический
узел, который тут расположен, и который на фоне
хронического воспаления часто бывает гиперплази-
рован. После выделения этих тубулярных структур
следует попытаться увидеть конфлюэнс пузырного
протока и гепатикохоледоха. В литературе
существуют противоречивые мнения о необходимости
четко видеть место соединения пузырного протока с
гепатикохоледохом: так, одни авторы считают
необходимым делать это всегда, другие обязательным
это не считают. Вероятно, если сомнений в
анатомической ситуации нет и при соблюдении ряда
правил (которые описаны ниже), стремление во чтобы
то ни стало распрепарировать эту зону неоправдано
и может увеличивать вероятность травмы важных
анатомических структур.
Следующий этап операции — пересечение
пузырной артерии. Следует обратить внимание на то, что
пузырная артерия пересекается раньше пузырного
протока. На ствол артерии максимально близко к
стенке пузыря накладывают по две клипсы с каждой
стороны от предполагаемой линии пересечения
(рис. 6.11), после чего ее пересекают ножницами
(рис. 6.12). Некоторые авторы рекомендуют
пересекать артерию после ее электрокоагуляции, считая
эту методику более надежной, чем только клиппиро-
вание; во всяком случае, если хирург и на
коагулированный ствол артерии наложит клипсу перед ее
пересечением, то это, вероятно, не повредит.
Глава Б
Рис. 6.10. Выделенные тубуляр-
ные структуры в области
треугольника Calot при
лапароскопической холецистэктомии.
1. Дно желчного пузыря
2. Шейка желчного пузыря
3. Пузырный проток
4. Пузырная артерия
5. Печень
Рис. 6.11. На выделенные тубу-
лярные структуры в области
треугольника Calot наложены
титановые клипсы.
1. Шейка желчного пузыря
2. Пузырный проток с
наложенными клипсами
3. Пузырная артерия с
наложенными клипсами
4. Печень
Лапароскопическая хирургия желчных путей
Рис. Б.12. Выделенные и клипированые
тубулярные структуры в области
треугольника Calot пересекаются ножницами.
1. Шейка желчного пузыря
2. Пузырный проток с наложенными
клипсами
3. Пузырная артерия с наложенными
клипсами
4. Печень
5. Ножницы
Пересечение артерии при сохранении
пузырного протока дает возможность выполнить одно из
главных условий безопасной диссекции: создать
«окно» между шейкой пузыря, пузырным
протоком, печенью и гепато-дуоденальной связкой
(рис. 6.13). Если такое окно создано, то это в
значительной степени гарантирует хирурга от
повреждения холедоха. Если не предполагается
выполнения интраоперационной холангиографии
или холедохоскопии через пузырный проток, то
его дважды клиппируют с каждой строны от линии
пересечения и пересекают ножницами.
Пересечение пузырного протока с применением
электротока недопустимо: электроток может пойти по
металлическим клипсам как по проводнику, это
приведет к термическому некрозу стенки пузырного
протока вокруг клипс. Желательно, чтобы над
клипсами оставался участок пузырного протока
около 0,5 см, это уменьшит вероятность
смещения клипс в послеоперационном периоде.
В ряде случаев требуется выполнение
интраоперационной холангиографии.
На основании большого опыта
лапароскопических операций и анализа большого количества ос-
ложений в мировой литературе был выработан ряд
правил, которые можно рассматривать как
«золотой стандарт» в технике безопасного выполнения
лапароскопической холецистэктомии, и
соблюдение которых должно сводить риск осложений к
минимуму:
1. Производить максимальную цефалическую
тракцию дна желчного пузыря.
2. Зажимом, наложенным у места перехода
воронки пузыря в его проток, следует смещать
карман Hartmann латерально и отодвигать его
от печени.
3. Начинать диссекцию следует высоко у шейки
пузыря и продолжать ее медиально и
латерально вблизи стенки органа.
4. После четкой идентификации анатомических
структур первой следует пересекать артерию.
* После рассечения тканей в треугольнике Calot,
шейку желчного пузыря нужно освободить,
четко определить место соединения стенки тела
пузыря с его ложем на печени для создания
«окна» (см. рис. 6.13) и лишь потом пересекать
пузырный проток.
5. При наложении клипс нужно четко видеть
местоположение их дистальных концов.
6. В неясных случаях производить интраопераци-
онную холангиографию.
После пересечения пузырного протока шейка
пузыря становится намного более мобильной
(рис. 6.14). Следующая задача — отделение тела
73
Глава В
6
Рис. 6.13. Создание «окна» между шейкой пузыря,
пузырным протоком, печенью и гепато-дуоденаль-
ной связкой как условие безопасной
лапароскопической холецистэктомии.
1. Дно желчного пузыря
2. Шейка желчного пузыря
3. Пузырный проток
4. Печень
5. Пересеченная пузырная артерия с
наложенными клипсами
В. Гепатодуоденальная связка
7. Созданное «окно»
Рис. 6.14. Начало отделения желчного пузыря от
ложа после пересечения пузырного протока.
1. Дно желчного пузыря
2. Шейка желчного пузыря
3. Пузырный проток
4. Печень
Лапароскопическая хирургия желчных путей
Рис. Б.15. «Правый поворот» при
отделении желчного пузыря от ложа.
1. Шейка желчного пузыря.
2. Тело желчного пузыря
3. Ложе желчного пузыря
4. Печень
5. Электрокрючок
пузыря от его ложа. Ключевым моментом в
выполнении этого этапа является рассечение брюшины
по сторонам от тела пузыря. Такое рассечение
следует производить на расстоянии около 0,5 см
от ткани печени. Для облегчения такого
рассечения применяют приемы, которые известны в
мировой литературе под названием «правый
поворот» и «левый поворот». При выполнении «правого
поворота» шейка пузыря отводится вправо, в то
время как дно, напротив, смещается влево
(рис. 6.15). При этом экспонируется переходная
складка брюшины с медиальной стороны
желчного пузыря. Брюшину по складке рассекают при
помощи крючка или при помощи ножниц на
протяжении около 2 см, затем производят левый поворот,
при котором шейку пузыря отводят влево, а
дно — вправо (рис. 6.16). Левый поворот
экспонирует латеральную переходную складку, которую
также рассекают на протяжении около 2 см. После
этого шейку отводят вверх и пересекают
соединительно-тканные элементы в области ложа. Затем
вновь повторяют правый и левый повороты и
отделение от ложа. Эти технические приемы
повторяют до тех пор, пока желчный пузырь не окажется
соединенным с ложем только в области дна.
Важно, чтобы хирург сразу останавливал
возникающее кровотечение из ложа, не оставляя это «на
потом», поскольку впоследствии ложе может
«складываться», и источник кровотечения может
оказаться в труднодоступном месте.
После того как пузырь окажется связан сложем
только в области дна (рис. 6.17), процедура
отделения останавливается, и хирург выполняет
заключительную инспекцию ложа пузыря и состояния культи
пузырного протока и артерии на предмет
кровотечения, поступления желчи или смещения клипс. Для
этого подпеченочное пространство и ложе пузыря
тщательно промывают жидкостью с добавлением
гепарина, с последующей аспирацией жидкости.
Доотаточность промывания определяется степенью
прозрачности жидкости в подпеченочном
пространстве — жидкость должна быть максимально
прозрачной. Практически всегда требуется остановить
капиллярное кровотечение из области ложа. Это
удобно делать при помощи промывного ложковид-
ного электрода — струя жидкости, подаваемая
через канал при помощи шприца, позволяет точно
увидеть локализацию источника, что облегчает его
прицельную коагуляцию.
После полной остановки кровотечения проводят
отделение дна пузыря от ложа. Для облегчения
этого этапа применяется особый прием, когда тракция
Глава В
Рис. Б.16. «Левый поворот» при
отделении желчного пузыря от ложа.
1. Шейка желчного пузыря
2. Тело желчного пузыря
3. Ложе желчного пузыря
4. Печень
5. Электрокрючок
Рис. Б.17. Желчный пузырь почти
полностью отделен от ложа.
1. Шейка желчного пузыря
2. Тело желчного пузыря
3. Ложе желчного пузыря
4. Печень
5. Соединительная ткань в области дна
пузыря
Лапароскопическая хирургия желчных путей
Рис. 6.18. Выведение шейки желчного пузыря из брюшной полости.
1. Тело желчного пузыря
2. Шейка желчного пузыря
3 Края расширенного параумбиликального прокола
4. Зубчатый граспер на шейке желчного пузыря
5. Зажим на шейке желчного пузыря
дна пузыря меняется с цефалического направления
на каудальное. В том же направлении выполняют и
тракцию шейки пузыря. При этом брюшина,
соединяющая дно пузыря с печенью, и
соединительнотканные элементы ложа, становятся хорошо видны,
натягиваются, и их можно легко пересечь при
помощи электроинструмента. После отделения пузыря
целесообразно еще раз промыть подпеченочное
пространство.
Следующий этап операции — извлечение пузыря
из брюшной полости. Наиболее обоснованным с
косметической точки зрения является извлечение
пузыря через параумбиликальный порт — при наличии
технических трудностей этот доступ легко
расширяется вокруг пупка до длины 3-4 см, без нарушения
косметичности. Технически в типичных случаях это
выполняют следующим образом: камеру
перемещают в субксифоидальный порт, а через
параумбиликальный порт вводят зажим, имеющий зубчики на
рабочих поверхностях. Пузырь захватывают
зажимом за область шейки и пузырного протока, и этот
отдел пузыря извлекают наружу вместе с троакаром
(рис. 6.18). Ассистент сразу фиксирует шейку
пузыря зажимом уже экстракорпорально. Если пузырь
77
Глава В
Рис. 6.19. Рассечение апоневроза в параумбиликаль-
ном порте для выведения желчного пузыря из
брюшной полости.
1. Края расширенного параумбиликального прокола
2. Линия рассечения апоневроза
3. Троакар
4. Крючок Фарабефа
содержит немного желчи и конкременты занимают
небольшой объем, то удается извлечь пузырь
наружу путем умеренной тракции за шейку, без
расширения доступа. В большинстве случаев для
извлечения пузыря требуется расширять параумбиликаль-
ный доступ. Это можно сделать двумя способами.
При одном способе после перед извлечением
троакара по нему, как по направителю, вводят
специальный ретрактор. Этот инструмент проходит на
всю толщу брюшной стенки, и затем, при сжатии
ручек расширителя, он растягивает раневой канал,
и после этого легче извлечь пузырь. В ряде
случаев, когда желчный пузырь имеет толстую стенку
или содержит конкременты большого размера,
такая дивульсия раневого канала может оказаться
недостаточной для извлечения органа. При этом
можно поступить следующим образом: если такая
ситуация предполагается заранее, разрез кожи
косметически расширяют вокруг пупка, верхний край
кожного разреза вместе с подкожной клетчаткой
оттягивают в цефалическом направлении так,
чтобы стал виден апоневроз по белой линии, троакар
изнутри прижимают к передней брюшной стенке, и
на троакаре апоневроз скальпелем рассекают
вверх на 2-3 см (рис. 6.19). После этого в
брюшную полость вводят два атравматичных крючка,
например крючки Фарабефа, раневой канал
растягивается и при помощи тракционных движений
извлекают пузырь.
В тех случаях, когда пузырь имеет деструкцию
стенки, и в тех случаях, когда при операции
произошло нарушение целостности стенки органа,
особенно содержащего большое количество мелких
конкрементов, то во избежание инфицирования
раневого канала или выдавливания камней в брюшную
полость через дефект стенки, что практически
неизбежно при довольно сильной тракции, мы считаем
рациональным удаление пузыря в контейнере.
Контейнер может быть или специальным (например,
«EndoCatch», AutoSuture), или же
приспособленным. В качестве приспособленного контейнера
можно применять простерилизованную
пластиковую упаковку 6 х 10 см от системы переливания
крови или хирургическую перчатку (стерилизованную
без талька). Специальный контейнер EndoCatch
наиболее удобен: его вводят в брюшную полость
через 10 мм троакар с помощью специального
стержня, а затем он раскрывается как сачок на гибком
циркулярном металлическом кольце. Пузырь
помещают в контейнер, который затем при тракции за
специальную нить плотно закрывается, и после
расширения канала извлекают из брюшной полости.
При использовании приспособленного контейнера
трудности могут возникать уже при провведении его
в брюшную полость.
Наиболее удобной в этом случае может быть
следующая методика: контейнер (пластиковый
или перчатка) максимально плотно сворачивается
в трубочку и захватывается эндоскопическим
зажимом с того конца, где контейнер открывается.
Затем субксифоидальный троакар удаляется, и
8
Лапароскопическая хирургия желчных путей
контейнер проводится непосредственно через
раневой канал при помощи зажима. Попытки
провести свернутый приспособленный контейнер через
троакар в большинстве случаев очень трудоемки и
малопродуктивны. После введения контейнера
троакар вновь устанавливается на место. Утечек
газа из брюшной полости через этот раневой
канал после этого, как правило, не бывает. При
помощи зажимов контейнер разворачивается и
раскрывается, и устанавливается таким образом,
чтобы его дно было направлено к диафрагме. Это
значительно облегчает введение в него желчного
пузыря. Значительно облегчает погружение
пузыря в контейнер следующий прием: широко
открытое отверстие контейнера по возможности плоско
укладывается на органы, и желчный пузырь
зажимом кладут в область центра отверстия. Затем
контейнер приподнимают зажимами за его
противоположные края и трясут, чтобы пузырь
сместился в область дна контейнера. Этот прием
значительно эффективней попыток проведения пузыря
в контейнер, удерживаемый на весу. После
контейнер с пузырем извлекают через параумбили-
кальный доступ после его расширения.
Извлечение пузыря в контейнере также имеет
определенные особенности. Так, после извлечения краев
контейнера наружу его края растягивают руками
так, чтобы орган стал виден в глубине раны. После
этого зажимом извлекают собственно пузырь, а не
стенку контейнера, так как если просто тянуть за
контейнер, его стенка может легко разорваться и
содержимое пузыря, либо он сам ускользнет в
брюшную полость.
После извлечения пузыря выполняют ушивание
параумбиликального доступа. Отдельные авторы
говорят о возможности не ушивать раневой канал,
если его диаметр составляет 1 см и менее. Однако
в параумбиликальной точке, через которую
извлекают пузырь, такое условие наблюдается крайне
редко, и в подавляющем большинстве случаев на
апоневроз приходиться накладывать швы.
Зачастую хирург находится в трудном положении:
стремление получить максимальную косметичность
путем выполнения минимального кожного разреза
вступает в противоречение с техническими
трудностями ушивания апоневроза в глубине узкого
раневого канала. Наложение швов можно осуществить
двумя путями. Один из них «традиционный», при
котором хирург использует иглодержатель и
маленькую иглу с высокой кривизной, при этом
манипуляции можно облегчить, захватив края разреза
апоневроза зажимами. Как правило, всего требуется
2-3 узловых шва.
Второй способ ушивания раневого канала —
использование длинных игл, имеющих ручку и «ушко»
для нити на рабочем конце. Применение этого
способа затруднено тем, что герметичность брюшной
полости после извлечения пузыря утрачивается, и
для осуществления визуального контроля
приходится приподнимать переднюю брюшную стенку
крючками. Значительно облегчает ушивание узкой
раны использование конического обтуратора
Carter-Thomason, имеющего боковые отверстия для
прямой иглы. Для визуального контроля при этом
оптимально использование угловой оптической
трубки, проводимой через субксифоидальный
прокол. После завершения ушивания параумбикально-
го доступа выполняют эндоскопический осмотр
этой зоны на предмет возможного подтекания
крови, что может потребовать наложения
дополнительных швов.
После восстановления герметизма брюшной
полости производят повторный осмотр,
максимально аспирируют промывную жидкость и, если
нужно, устанавливают дренаж в подпеченочное
пространство. Вопрос о дренировании брюшной
полости после лапароскопической холецистэкто-
мии до сих пор находится в стадии изучения. Все
больше авторов склоняются к тому, что после
гладко выполненной операции рутинного
дренирования брюшной полости не требуется. Дренаж
устанавливают только по показаниям (сомнения в
стабильности гемостаза, острый холецистит,
«грязно» протекавшая операция). Тонкий дренаж
проводят через один из боковых 5 мм троакаров,
его конец захватывают зажимом, проведенным
через другой 5 мм троакар, и устанавливают в
подпеченочном пространстве. Многие хирурги
считают, что дренаж ставить удобнее, пока пузырь
еще не отделен полностью от печени (рис. 6.20).
После этого газ из брюшной полости начинают
медленно выпускать, и по мере опускания
передней брюшной стенки дренаж слегка подтягивают,
следя за тем, чтобы он не перегибался в брюшной
полости.
Извлечение трокаров из брюшной полости
выполняют под визуальным контролем. При этом в
брюшную полость вводят какой-либо
электроинструмент, например ложковидный электрод или
зажим, и по инструменту троакар извлекают. Это
необходимо для того, чтобы при наличии подтекания
крови через прокол было можно выполнить
электрокоагуляцию раневого канала при извлечении
электроинструмента. Эндоскопический контроль
выполняют также при извлечении субксифоидального
троакара: при медленном извлечении оптической
iSi
Глава В
Рис. В.20. Введение дренажа брюшной полости в область ложа пузыря.
1. Желчный пузырь
2. Ложе желчного пузыря
3. Печень
4. Дренаж к области ложа
трубки раневой канал хорошо визуализируется
послойно.
Наложение швов на кожу выполняют обычным для
хирурга способом. Швы можно заменить
металлическими скобками.
ТРУДНАЯ ЛАПАРОСКОПИЧЕСКАЯ
ХОЛЕЦИСТЭКТОМИЯ
Чаще всего осложнения и трудные ситуации при
лапароскопической холецистэктомии имеют место
при остром холецистите либо после многократно
перенесенных острых приступов холецистита,
поэтому, говоря о «трудной» лапароскопической
холецистэктомии, имеется в виду прежде всего острый
холецистит. Эндоскопическая операция,
выполняемая по поводу острого холецистита, имеет целый
ряд технических особенностей.
Наложение пневмоперитонеума и введение
троакаров на начальном этапе операции не отличается
от стандартных вариантов техники, применяемых в
плановой хирургии. В случаях когда имелись
основания подозревать наличие спаечного процесса в
8О
Лапароскопическая хирургия желчных путей
Рис. Б.21. Использование троакара Hasson.
1. Коническое расширение троакара Hasson
2. Стержень троакара
3. Стилет троакара
4. Нити, фиксирующие троакар к мышечно-апоневротическому слою
5. Мышечно-апоневротический слой
зоне введения иглы Veress и первого троакара,
можно использовать технику открытого введения
первого троакара по Hasson. Стержень этого троакара
имеет коническое расширение, обеспечивающее
герметизм при его фиксации в относительно
широкой ране.
При этом косметический параумбиликальный
разрез кожи расширяют до 3-4 см, выделяют
апоневроз, и делают его разрез (либо вертикальный,
либо повторяющий линию разреза кожи). После
этого с техническими предосторожностями
вскрывают брюшину (имея в виду возможность фиксации
в этой зоне петли кишки). После того как такая ми-
нилапаротомия сделана, через нее в брюшную
полость вводят троакар Hasson (рис. 6.21). После
этого вокруг гильзы троакара максимально герметично
81
Глава Б
Рис. В.22. Пункция дна желчного пузыря.
1 Желчный пузырь
2. Пункционная игла
3 Граспер
ушивают разрез апоневроза, таким образом, чтобы
троакар был фиксирован в середине разреза. Затем
длинные концы нитей шва апоневроза завязывают с
двух сторон через специальные фиксаторы
троакара. Поскольку этот троакар имеет коническое
расширение, при затягивании нитей конус троакара
плотно фиксируют в ушитой ране апоневроза, тем
самым обеспечивая герметизм. После этого к
патрубку троакара подключают подачу газа, и далее
операцию выполняют обычным способом.
На следующем этапе операции определяют
возможность дальнейшего лапароскопического
вмешательства, т.е. определяется принципиальная
выполнимость операции лапароскопическим путем.
При наличии инфильтрата проводят оценку его
плотности, напряженности желчного пузыря,
ригидности его стенки, анатомических взаимоотношений
органов, вовлеченных в инфильтрат. Иногда дно и
тело инфильтрированного и напряженного
желчного пузыря располагаются в брюшной полости
свободно, симулируя пальпаторные признаки
инфильтрата. Однако чаще орган бывает вовлечен в
инфильтрат с большим сальником, двенадцатиперстной и
поперечноободочной кишкой. При разделении
инфильтрата обнаруживается резко гиперемирован-
ная стенка желчного пузыря, и возникает
капиллярное кровотечение, иногда требующее
поверхностной электрокоагуляции.
В том случае, если желчный пузырь напряжен
настолько, что захватить его стенку в складку
невозможно, делают пункцию пузыря. Пузырь пунктируют
эндоскопической иглой, введенной через троакар,
расположенный по среднеключичной линии
(рис. 6.22). Полученное содержимое посылают на
микробилогическое исследование и определение
чувствительности к антибиотикам. Жидкость
эвакуируется не полностью, а лишь до появления
возможности захвата стенки органа удерживающим
зажимом. На место пункции накладывают зубчатый 5 мм
граспер. Такая техника позволяет избежать
подтекания содержимого желчного пузыря через пункцион-
ное отверстие в брюшную полость. В тех случаях,
когда операционная не располагает специальной
эндоскопической иглой, для пункции пузыря можно
использовать альтернативную технику, при этом
используют обычную длинную толстую иглу, и дно
пузыря напрямую пунктируют через дополнительный
прокол. Но этот способ оставляют на крайний
случай, так как при извлечении такой иглы происходит
неминуемое инфицирование брюшной стенки
микрофлорой пузыря, что хотя и проходит в
большинстве случаев без последствий, все же несет в себе
потенциальную угрозу инфекционных осложнений.
В случае невозможности захвата ригидной стенки
органа тонким зажимом, используют мощный
зубчатый граспер диаметром 10 мм с длинными бран-
шами. Для этого прибегают к замене 5 мм троакара
на 11 мм.
В ряде случаев инфильтрация стенки желчного
пузыря достигает такой степени, что становится
невозможным ее удержание даже мощным зажимом,
попытки фиксировать орган приводят к
«расползанию» его деструктивно измененной стенки. В таких
ситуациях мы рекомендуем широко прошивать
стенку области дна Z-образным швом (рис. 6.23).
После этого лигатуру захватывают зажимом и трак-
цию органа осуществляют за эту лигатуру. В
области шейки пузыря чаще всего удается захватить и
удерживать стенку зубчатым 5 мм зажимом, однако
в трудных случаях прием прошивания может быть
использован и здесь.
Дно желчного пузыря отводят в цефалическом
направлении, добиваясь тем самым адекватной
экспозиции. В случаях когда желчный пузырь
фиксирован плотными сращениями к прилежащим
органам, выполняют разделение спаек
электрокрючком, или коагуляционными ножницами. В процессе
разделения инфильтрата или спаек осуществляют
82
Лапароскопическая хирургия желчных путей
непрерывная тракция пузыря за дно. Таким
образом, постепенно освобождая стенки органа от
сращений, добиваются выведения его шейки в
доступную для осмотра зону.
Если, несмотря на все мероприятия, не удается
добиться удовлетворительной экспозиции,
устанавливают еще один дополнительный 5 мм троакар
по левой среднеключичной линии на 3-4 см ниже
реберной дуги. Введение данного троакара
позволяет использовать трубку аспиратора/ирригатора
для отведения наползающих на область операции
органов и одновременно отмывать операционное
поле. Такое введение дополнительного троакара во
многих случаях дает возможность избежать лапаро-
томии и, безусловно, намного предпочтительнее
перехода на открытый доступ.
Если при отделении пузыря от печени инфильтра-
тивные изменения в области шейки желчного
пузыря не позволяют с уверенностью идентифицировать
анатомию, и хирург повреждает паренхиму печени,
можно использовать следующий прием: желчный
пузырь отсекается по периметру этой зоны
электрорежущим инструментом. Конкременты
помещают в пластиковый контейнер. Далее проводят
тотальную электрокоагуляцию слизистой оставшейся
части желчного пузыря. Таким образом выполняют
эндоскопический вариант операции Pribram.
Трудная лапароскопическая холецистэктомия,
как правило, сопровождается повышенной
кровоточивостью на всех этапах операции. В связи с этим
значительной проблемой является образование в
брюшной полости сгустков крови. Во избежание
подобного явления мы прибегали к приему с
добавлением гепарина в физиологический раствор,
используемый для промывания брюшной полости в ходе
операции из расчета 5000 ЕД на 1 л раствора. Если
сгустки все же образуются, для их удаления
целесообразно использовать трубку аспирации диаметром
10 мм.
Иногда диаметр пузырного протока может быть
очень большим, и длины клипсы может не хватить
для полного перекрытия его просвета. В таком
случае можно попытаться положить две клипсы с двух
сторон протока. Однако наиболее надежна в такой
ситуации перевязка протока лигатурой (рис. 6.24).
При выполнении лаапароскопической холецис-
тэктомии при остром деструктивном холецистите
после клипирования и пересечения пузырного
протока и артерии проводят пересечение
соединительно-тканных пучков, распололоженных в ложе пузыря
и соединяющих стенку желчного пузыря с печенью.
Для этой цели можно пользоваться различными
способами, чаще всего это электрокрючок или эле-
Рис. 6.23. Z-образный наложен на дно желчного
пузыря для его тракции.
1. Дно желчного пузыря
2. Z-образный шов
3.Граспер
ктроножницы. Работа электрокрючком гораздо
более деликатна, та как крючок захватывает
небольшие порции тканей, кроме того, перед включением
рассекающего электротока имеется возможность
приподнять ткань, что важно в аспекте
профилактики электроповреждения прилежащих
анатомических структур.
В процессе удаления пузырь поворачивают
вправо и влево, и рассекают переходную складку
брюшины, соединяющую пузырь с печенью по бокам.
Это ключевые моменты отделения пузыря.
Считается, что наиболее трудным моментом является
отделение последних сантиметров, соединяющих дно
пузыря с его ложем. При этом может сказываться
недостаточность тракции. Кроме того, важно сразу
останавливать возникающее кровотечение из ложа
пузыря, не оставляя это на «потом».
Довольно часто в процессе отделения
деструктивно измененного желчного пузыря от печени,
возникает диффузная капиллярная кровоточивость из
его ложа, трудно контролируемая электрокоагуля-
83
Глава В
Рис. Б.24. Перевязка пузырного протока эндолигату-
рой.
1. Шейка желчного пузыря
2. Пузырный проток
3.Граспер
4. Эндолигатура
Рис. Б.25. Расширение параумбиликального троакар-
ного прокола для извлечения желчного пузыря.
1. Пупок
2. Края кожного разреза
3. Пунктирная линия, обозначающая направление
рассечения апоневроза
4. Шейка желчного пузыря
5. Проекция крупного камня в теле желчного пузыря
6. Крючки Фарабефа
7. Граспер
84
Лапароскопическая хирургия желчных путей
цией. Подчас интенсивность кровотечения после
применения электрохирургического инструмента
даже нарастает. Скапливающиеся в ложе и подпече-
ночном пространстве сгустки поглощают свет,
затемняя операционное поле и затрудняя
ориентацию. В таких случаях может быть признано
целесообразным прекращение бесплодных попыток
электрокоагуляции, введение в брюшную полость
фрагмента гемостатической губки размером
приблизительно 5 х 1 х 1 см и фиксация его с помощью
зажима к кровоточащему месту в течение 5 мин до
приклеивания. Такой прием помогает достичь
гемостаза во многих трудных случаях
Одним из трудоемких технических этапов
операции при остром холецистите является извлечение
пузыря из брюшной полости. Учитывая ригидность
стенки органа и риск инфицирования брюшной
стенки при его экстракции, дефект апоневроза в па-
раумбиликальной области превентивно
расширяется. Выполняют широкий параумбиликальный
кожный разрез в виде полуокружности, дефект
апоневроза расширяется острым путем вертикально
вверх. Такой доступ дает возможность получить
отверстие в брюшной стенке диаметром до 4 см, не
снижая косметичности операции. Другим путем
вариантом расширения троакарного прокола
апоневроза является его расширение в стороны и вниз, так
что его разрез повторяет форму кожного разреза
(рис. 6.25). Расширять троакарный прокол тем или
иным способом необходимо, поскольку тракция
деструктивно измененного желчного пузыря через
узкий пупочный прокол может сопровождаться
разрывом органа и диссеминацией его содержимого по
брюшной полости. Кроме этого, деструктивно
измененный желчный пузырь, даже не имеющий
дефектов, во избежание инфицирования брюшной
стенки всегда следует удалять из брюшной полости,
поместив его в контейнер. Предпочтительнее
использовать разовые изделия фирм «AutoSuture»,
«Ethicon», но можно с успехом применять и
приспособленные резервуары. В таких ситуациях следует
ввести в брюшную полость стерильный
полиэтиленовый пакет или мешок из плотного латекса
размером 5x10 см. Если нет даже такого контейнера,
можно использовать хирургическую перчатку
(предварительно ее следует тщательно отмыть от всех
элементов талька, попадание которого в брюшную
полость вызывает развитие массивного спаечного
процесса вследствие образование гранулем вокруг
кристаллов талька).
Для введения приспособленных контейнеров
можно использовать 11 мм эпигастральную гильзу,
но удобнее проводить контейнер обычным
хирургическим инструментом с длинными браншами через
эпигастральный прокол, после предварительного
извлечения троакара. При таком способе отпадает
необходимость очень плотного сворачивания
контейнера, и не возникает сложностей при его
расправлении в брюшной полости.
В том случае, если после вытягивания наружу
шейки пузыря его тело извлечь не удается из-за
наличия множества мелких камней или нескольких
крупных камней, поступают следующим образом.
Шейку пузыря, вытянутую наружу, вскрывают,
предварительно изолировав рану брюшной стенки, и
максимально аспирируют жидкое содержимое
(рис. 6.26-6.28). После этого окончатыми щипцами
постепенно извлекают конкременты, если камень
крупный, его фрагментируют мощным зажимом и
извлекают по частям.
После извлечения желчного пузыря и ушивания
дефекта апоневроза следует выполнить обильное
промывание подпеченочного и поддиафрагмально-
го пространства изотоническим солевым
раствором B-3 л). Наш опыт свидетельствует о
необходимости тщательной санации брюшной полости даже
при отсутствии признаков перитонита. Промывание
-У-
Рис. Б.2Б. Шейка желчного пузыря вытянута наружу.
1. Шейка желчного пузыря
2. Края кожного разреза
3. Крючки Фарабефа
4. Граспер
85
Глава В
Рис. Б.27. Шейка желчного пузыря вытянута наружу.
1. Шейка желчного пузыря
2. Проекция тела желчного пузыря
3. Зажимы
4. Ножницы
Рис. 6.28. Аспирация содержимого желчного
пузыря.
1. Вскрытая шейка желчного пузыря
2. Проекция тела желчного пузыря
3. Мелкие конкременты
4. Трубка аспиратора
позволяет снизить количество микробных тел путем
разведения, и избежать оставления небольших
количеств крови, желчи или гноя.
Дренирование брюшной полости при остром хо-
лицистите мы применяем у всех больных, используя
дренаж из силиконовой резины диаметром
7-10 мм, вводимый через широкую переднеакси-
лярную гильзу. Дренаж диаметром 4-5 мм, который
можно провести через 5 мм троакар, не всегда
обеспечивает адекватное дренирование брюшной
полости после операции по поводу острого холици-
стита. Техническим приемом, облегчавшим
введение дренажа большего диаметра, является
следующая методика: пузырь извлекают через
расширенный параумбиликальный прокол, сразу после этого
со стороны одного из латеральных 5 мм троакаров,
по выбору хирурга, в параумбиликальный прокол
проводят зажим с зубчиками на браншах, которым
захватывают конец дренажа, предназначенный для
выведения из брюшной полости. Затем весь дренаж
полностью погружают в брюшную полость. После
ушивания параумбиликального прокола и
восстановления пневмоперитонеума захваченный этим
зажимом конец дренажа под контролем зрения
извлекают наружу вместе с троакаром. Положение
дренирующей части трубки при этом корректирует-
86
Лапароскопическая хирургия желчных путей
ся другим граспером. Преимуществом данной
методики является возможность использовать для
дренирования трубку большего диаметра, чем
троакар, стоящий в соответствующей точке, без смены
троакара.
ЛАПАРОСКОПИЧЕСКАЯ
ХОЛЕДОХОЛИТОТОМИЯ
Холедохолитиаз — одно из самых
распространенных осложнений желчнокаменной болезни, и
крайне актуальна разработка вопросов его
диагностики, лечения и оперативной техники в аспекте
эндоскопической хирургии.
По мере накопления опыта лапароскопической
холецистэктомии, каждый хирург рано или поздно
сталкивается с необходимостью решить вопрос о
возможности лапароскопического лечения холедо-
холитиза. К этому его подталкивают все
преимущества лапароскопических операций и большое
количество больных этим осложнением желчнокаменной
болезни. О том, что эта процедура является
следующим логическим этапом в билиарной хирургии
после холецистэктомии, можно судить хотя бы по
тому, что сообщения о ней появились практически
одновременно от нескольких авторов.
На основании большого мирового опыта
эндоскопической хирургии можно сказать, что в настоящее
время лапароскопическая ревизия общего
желчного протока при холедохолитиазе может быть
выполнена по тем же показаниям, что и в классической
открытой билиарной хирургии. Разумеется, что речь
идет об опытном эндоскопическом хирурге, хорошо
владеющем техникой эндоскопического шва, и при
наличии технических возможностей для
полноценной ревизии, а именно возможностей для интраопе-
рационной холангиографии и фиброхоледохоско-
пии.
Техника лапароскопической
холедохолитотомии
Как правило, операция осуществляется из 5
проколов: 10 мм проколы в параумбиликальной и суб-
ксифоидальной зонах, 5 мм проколы по среднеклю-
чичной и передней подмышечной линии справа и
один дополнительный 5 мм прокол по среднеклю-
чичной линии слева (рис. 6.29).
В отличие от открытой операции, при
лапароскопической холедохотомии вначале выполняют холе-
дохотомический этап операции, и лишь затем
удаляется желчный пузырь. Это объясняется тем, что
создать адекватную экспозицию подпеченочного
Рис. 6.29. Точки доступа при выполнении
лапароскопической холедохолитотомии.
1. Первый, 10-мм троакар
2. Основной манипуляционный 10-мм троакар
3. 5-мм троакар
4. 5-мм троакар
5. 5-мм троакар
пространства возможно, лишь осуществляя трак-
цию за желчный пузырь.
Оперативное вмешательство начинается, как при
холецистэктомии, с выделения шейки пузыря,
пузырного протока и пузырной артерии. После этого,
по принципам классической хирургии желчных
путей, выполняется наложение одной клипсы на
пузырный проток сразу ниже желчного пузыря с целью
предотвращения миграции камней из пузыря в хо-
ледох.
После этого используют прием, разработанный
для освобождения от тракции за пузырь одного из
боковых зажимов. Для этого под пузырный проток
подводят длинную лигатуру, оба конца которой
захватывают зажимом и выводят из брюшной полости
Глава В
Рис. 6.30.
Освобождение передней стенки ге-
патикохоледоха при
выполнении
лапароскопической холедохолитото-
мии.
желчного пу-
1. Шейка
зыря
2. Пузырный проток
3. Передняя стенка ге-
патикохоледоха
4. Электрокрючок
5. Диссектор
вместе с троакаром. Затем троакар повторно
вводят через ту же точку, через него проводят зажим,
фиксируют дно пузыря и отводят его в цефаличес-
ком направлении. Концы нити, выведенные
экстракорпорально, фиксируют обычным зажимом: трак-
ция за эту нить в сочетании с цефалической тракци-
ей дна пузыря позволяет создать адекватную
экспозицию подпеченочного пространства, в то же время
один боковой троакар освобождается для
выполнения тонких манипуляций.
После этого продолжается препаровка в сторону
холедоха. Ориентир для такой препаровки —
пузырный проток. Идя по нему, хирург, как правило,
находит переднюю стенку холедоха, хотя, конечно же,
следует иметь в виду и самые разнообразные
возможные анатомические варианты (в том числе
впадение пузырного протока в холедох с правой
стороны и очень низкое впадение пузырного протока, за
двенадцатиперстной кишкой). Мы не приводим
схем этих анатомических вариантов, так как они
есть в любом руководстве по классической
хирургии желчных путей. Натяжение пузырного протока
за нить существенно облегчает работу. Кроме этого,
при выделении передней стенки холедоха хирург
обязательно должен работать двумя руками,
используя в качестве пинцета атравматичный зажим,
проведенный через пятый боковой порт в левом
подреберье. Этим зажимом приподнимают
брюшину и пучки соединительной ткани, покрывающие
переднюю стенку холедоха, и мелкими порциями
пересекают их при помощи электрокрючка в режиме
очень тонкой и нежной коагуляции, включая
электрокоагулятор буквально на доли секунды
(рис. 6.30). Кроме этого, следует использовать
технику тупой препаровки, используя маленький туп-
фер, зажатый в зажиме, и проводимый через суб-
ксифоидальный порт. Кроме этого, большое
удобство в процессе такого выделения может давать дает
промывание зоны манипулирования
физиологическим раствором через трубку аспирации-ирригации,
Лапароскопическая хирургия желчных путей
Рис. 6.31. Наложение левого
шва-держалки на переднюю стенку гепатикохоле-
доха при выполнении лапароскопической
холедохолитотомии.
1. Передняя стенка гепатикохоледоха.
2. Пузырный проток
3. Нить
4. Иглодержатель
также проводимую через троакар в левом
подреберье. Данной трубкой можно работать и как
манипулятором, одновременно используя по прямому
назначению.
Передняя стенка холедоха выделяется на
участке, достаточном для холедохотомии, аналогично
открытой операции. После этого ближе к левому краю
холедоха накладывают шов-держалка (рис. 6.31).
Для наложения швов-держалок можно
использовать как круглую, так и лыжеобразную атравматиче-
скую иглу с тонкой нитью. Длина нити должна
составлять не менее 40 см. Кроме этого, желательно
применять монофиламентную нить, так как следует
избегать пилящего эффекта нити при ее
протаскивании через раневой канал на тонкой стенке
холедоха. После прошивания концы нити-держалки
извлекают из брюшной полости через
субксифоидальный прокол вместе с троакаром. После этого
троакар вновь вводят через ту же точку, а нить
захватывают зажимом экстракорпорально. Иногда
хирург испытывает трудности при наложении этой
держалки через субксифоидальный порт, поскольку
иглодержатель может оказываться
непосредственно над холедохом. В таком случае облегчить
наложение шва можно, использую более прямую иглу,
или проводя иглодержатель через левый боковой
троакар. Правую держалку вообще не накладывают,
а ее функцию выполняет тракция, приложенная за
пузырный проток (рис. 6.32).
При лапароскопической холедохолитотомии
перед началом вскрытия холедоха может быть
целесообразно в подпеченочном пространстве рядом с ге-
патодуоденальной связкой расположить контейнер
для сбора камней. Особенно это можно
рекомендовать в случаях, когда при дооперационной РХПГ
были выявлены множественные конкременты
холедоха. Тогда после извлечения из холедоха их сразу же
помещают в контейнер и не теряют в брюшной
полости.
Вскрытие холедоха очень удобно делать при
помощи микроножниц (рис. 6.33). При
лапароскопической холедохотомии, учитывая увеличение,
высокую освещенность и использование микроножниц,
удается четко увидеть и отдельно вскрыть адвенти-
циально-мышечный слой холедоха и слизистую
оболочку. В процессе вскрытия холедоха обычно
отмечается незначительное кровотечение из его ад-
вентиции и мышечно-эластического слоя. Такое
неизбежно возникающее кровотечение
останавливают прицельной точечной коагуляцией на фоне
постоянного промывания зоны оперирования
физиологическим раствором. Для этого
электрокрючок, имеющий канал для промывания,
располагают свободным концом вниз, на зону кровотечения
(О
о
го
Рис. 6.32. Экспозиция желчного пузыря и гепатикохоледоха при
выполнении лапароскопической холедохолитотомии.
1. Шейка желчного пузыря
2. Дно желчного пузыря
3. Пузырный проток
4. Передняя стенка гепатикохоледоха
5. Передняя брюшная стенка
5. Передн р
В. Брюшная полость
7. Экстракорпоральный зажим, фиксирующий концы левого шва-держалки, наложенного на переднюю стенку холедоха.
8. Экстракорпоральный зажим, фиксирующий концы нити-держалки под пузырным протоком.
Лапароскопическая хирургия желчных путей
Рис. Б.33. Вскрытие гепатикохоледо-
ха при помощи микроножниц.
1. Передняя стенка гепатикохоледо-
ха
2. Пузырный проток
3. Линия разреза холедоха
4. Микроножницы
5. Левая нить-держалка
6. Трубка аспиратора
через шприц подают немного физиологического
раствора, и в текущей струе жидкости четко видна
кровоточащая точка. К ней подводят конец крючка и
на доли секунды включают электроток. Так как
кровотечение незначительно, оно, как правило,
останавливается. Пренебрегать такой остановкой
кровотечения не следует, так как оно будет сильно
затруднять последующие манипуляции. Просвет
холедоха вскрывают микроножницами на протяжении
приблизительно 1 см, затем при необходимости
расширяют.
Просвет холедоха желательно обследовать с
применением фиброхоледохоскопа. Оптимально, если
есть возможность соединить фиброхоледохоскоп с
телекамерой и поключить к видеомонитору. При
выполнении холедохоскопии через холедохотомичес-
кое отверстие холедохоскоп направляют в сторону
печени, затем в сторону двенадцатиперстной
кишки. Выполняют ревизию внепеченочных желчных
протоков. По выявлении конкремента его
захватывают корзиной Dormia и выводят через холедохото-
мическое отверстие в брюшную полость, где
помещают в контейнер. При необходимости процедуру
повторяют. После удаления конкрементов
выполняют контрольную холедохоскопию.
Для ревизии холедоха через пузырный проток
можно использовать тонкий фиброхоледохоскоп,
например EndoMedix S 760 L B,8 мм). При
использовании данного аппарата нет необходимости
прибегать к баллонной дилятации пузырного протока.
Данный холедохоскоп мы вводим через 5 мм
троакар по среднеключичной линии. Однако проведение
данного инструмента просто через троакар
нерационально: во-первых, при этом невозможно
обеспечить герметизм, и во-вторых, практически
неизбежно возникновение скальпированного повреждения
нежной резиновой оболочки фиброскопа об острые
края троакара. Для выполнения холедохоскопии
через пузырный проток целесообразно использовать
4,5 мм адаптер, что обеспечивает герметизм, и
предотвращает травмирование оболочки холедохоско-
па. Учитывая тонкость инструмента, для
обеспечения расправления стенок холедоха можно вводить
физиологический раствор не самотеком через
систему, как это обычно делается, а подключать к
патрубку холедохоскопа магистраль от аквапуратора,
что дает адекватный поток жидкости.
При наличии широкого пузырного протока
воспользоваться обычным холедохоскопом.
После того, как манипуляции на холедохе в одном
направлении выполнены, инструмент вводят в
другом направлении. Кроме этого, холедохоскопию
можно использовать и просто как контрольный
способ обследования после удаления камней другими
Глава Б
Рис. 6.34. Вымывание конкремента холедоха струей
жидкости через катетер при лапароскопической холе-
дохолитотомии.
1. Передняя стенка гепатикохоледоха
2. Разрез холедоха
3. Пузырный проток
4. Катетер
5. Конкремент
В. Шов-держалка
Рис. Б.35. Извлечение конкремента холедоха при
лапароскопической холедохолитотомии с помощью
прямого зажима.
1. Передняя стенка гепатикохоледоха
2. Разрез холедоха
3. Пузырный проток
4. Конкремент
5. Зажим
6. Шов-держалка
способами. При крупных одиночных конкрементах,
четко верифицированных предоперационно на
основании РХПГ, холедохоскопию можно не
применять. В этих случаях можно удалить конкременты
другими способами (см. ниже). Полнота удаления
камней в таком случае контролируется
рентгенологически.
Помимо холедохоскопического способа удаления
конкрементов из холедоха рутинно используют:
захват корзиной Дормиа без холедохоскопа;
извлечение при помощи катетера Фогарти; вымывание
конкрементов струей жидкости через катетер
(рис. 6.34); захват зажимами различного вида.
Изучив весь ряд этих технических способов,
можно сделать вывод, что наиболее практичен способ
вымывания камней сильной струей через катетер и
удаление их зажимами (рис. 6.35). Очень удобен
для этой цели зажим-ротикулятор «EndoDissect»,
который позволяет изгибать рабочую часть
инструмента почти на 90°, что дает возможность удобно
вводить его по оси холедоха как вверх, так и вниз
(рис. 6.36).
В редких случаях перечисленные способы
удаления камней эффекта не дают. Чаще всего в такой
ситуации речь идет о вколоченных камнях холедоха.
В такой ситуации наиболее рациональным
решением будет переход на открытый доступ.
Как и в открытой бил парной хирургиии,
манипуляции на холедохе можно закончить различными
способами.
Дренирование холедоха по Kehr
Технически процедуру выполняют следующим
образом.
Через субксифоидальный троакар в брюшную
полость в сложенном состоянии вводят Т-образ-
Лапароскопическая хирургия желчных путей
ный дренаж (рис. 6.37). Дренаж вводят полностью,
его свободный конец должен быть заглушён, чтобы
предотвратить затекание по нему желчи в
брюшную полость после его установки, так как он
остается в брюшной полости до конца операции
(заглушить его можно путем перевязки нитью).
Поперечное колено Т-образного дренажа захватывают
зажимом и помещают в холедох. При этом можно
начать как с введения в направлении печени, так и
вниз, в сторону двенадцатиперстной кишки. После
введения одного колена трубки в холедохе дренаж
удерживают другим зажимом, в это время вводят
второй конец дренажа (рис. 6.38). Скорее всего,
лапароскопическое введение дренажа в холедох
осуществляется технически легче, чем при
открытой операции.
Холедохотомическое отверстие ушивают до
дренажа рассасывающимся тонким непрерывным
швом на атравматической игле. Наиболее
подходящим для этой цели мы считаем нить «Полисорб»
номер 2/0 длиной 14 см с иглой в форме «лыжи», но
можно использовать и обычные изогнутые и прямые
иглы.
Рис. Б.ЗБ. Извлечение конкремента холедоха
при лапароскопической холедохолитотомии с
помощью изгибаемого зажима «EndoDissect».
1. Шейка желчного пузыря
2. Передняя стенка гепатикохоледоха
3. Пузырный проток
4. Изгибаемый зажим «EndoDissect»
5. Шов-держалка
6. Конкремент
В начале освоения методики мы часто
испытывали значительные трудности при ушивании холедо-
хотомического отверстия от верхнего его угла до
дренажа ввиду того, что Т-образный дренаж
выстоял практически перпендикулярно из холедоха, тем
самым перекрывая как зону осмотра, так и
пространство для манипулирования. Кроме того,
иглодержатель, проведенный через субксифоидальную
гильзу, располагается практически над зоной
разреза, что значительно снижает маневренность
инструмента. Мы считаем, что для преодоления этих
трудностей наиболее удобно выполнять ушивание
холедохотомическое отверстие иглодержателем,
проведенным через прокол в левом подреберье.
При этом ось иглодержателя и направление холедо-
хотомического разреза оказываются
приблизительно по одной линии, а игла, фиксированная
инструментом, приблизительно перпендикулярна к
разрезу холедоха, что наиболее рационально. Чтобы
избежать перекрытия зоны видимости Т-образным
дренажом, предлагаем следующий прием: выстоя-
щий из холедоха конец дренажа проводят в окно
между пузырным протоком и печенью, при этом он
93
Глава 6
Рис. Б.37. Введение Т-образного дренажа в брюшную полость.
1. Сложенный Т-образный дренаж
2. Трубка-переходник
Рис. Б.38. Введение Т-образного дренажа
в гепатикохоледох.
1. Шейка желчного пузыря
2. Пузырный проток
3. Разрез холедоха
4. Т-образный дренаж
5. Зажимы
эа
Лапароскопическая хирургия желчных путей
Рис. 6.39. Техника ушивания хо-
ледохотомического разреза над
Т-образным дренажом гепатико-
холедоха.
1. Шейка желчного пузыря
2. Пузырный проток
3. Длинная часть Т-образного
дренажа
4. Короткая поперечная часть
Т-образного дренажа
5. Передняя стенка холедоха
фиксируется и сдвигается вверх, тем самым
освобождая зону манипуляций. Как следствие
появляется возможность свободного ушивания разреза от
нижнего угла холедохотомического разреза до
дренажа (рис. 6.39, 6.40).
После герметизации разреза длинный
свободный конец Т-образного дренажа выводися через
субксифоидальный троакар для введения
жидкости с целью проверки герметичности ушивания и
для выполнения контрольной холангиографии
(если это необходимо). Шприцем медленно вводят
небольшое количество физиологического
раствора, при этом наблюдают за состоянием линии
шва. Если просачивания жидкости через шов нет,
герметизм считают достаточным. Если полной
герметичности нет, что проявляется в виде
подтекания жидкости, можно наложить дополнительный
шов.
В тех случаях, когда имеются крупные одиночные
конкременты без явлений холангита, холедохото-
мическое отверстие можно полностью закрыть
швом. Мы считаем, что при этом целесообразно
выполнить дренирование холедоха пузырный проток.
При этом используют тонкий катетер, при
обязательном условии надежной фиксации катетера к
пузырному протоку, так так он имеет тенденцию к
легкому смещению. Наиболее надежно использовать
двойную фиксацию. Одна из фиксирующих лигатур
должна быть прошивной, с захватом стенки
пузырного протока, вторая лигатура — циркулярная,
накладываемая ближе к холедоху на 3-4 мм.
Выведение наружу Т-образного дренажа и
дренажа, проведенного через культю пузырного протока,
имеет свои особенности по сравнению с открытой
хирургией. Лапароскопическая хирургия — это
хирургия минимальной инвазивности, при которой
повреждение брюшинного покрова минимальное. В то
же время известно, что именно этот фактор —
повреждение брюшинного покрова — является
пусковым механизмом для последующего образования
спаек в брюшной полости. Это теоретическое
положение находит свое подтверждение в том, что после
95
Глава Б
Рис. Б.40. Вид ушитого холедохотомичес-
кого разреза над Т-образным дренажом
гепатикохоледоха.
1. Передняя стенка холедоха
2. Пузырный проток
3. Длинная часть Т-образного дренажа
4. Шов гепатикохоледоха
Рис. 6.41. Выведение дренажа
гепатикохоледоха наружу.
1. Передняя стенка холедоха
2. Длинная часть Т-образного дренажа
3. Печень
4. Ложе желчного пузыря
5. Передняя брюшная стенка
В. Дренаж брюшной полости
96
Лапароскопическая хирургия желчных путей
лапароскопической холецистэктомии спаечный
процесс в брюшной полости минимальный и
ограничивается только зоной ложа пузыря, куда
подпаивается большой сальник. Большой опыт нескольких
повторных лапароскопии в разные сроки после
лапароскопических холецистэктомии позволяет в
этом убедиться. Из литературы известно, что
дренажи, помещенные в брюшную полость лапароско-
пически для проведения перитонеального диализа
при хронической почечной недостаточности,
остаются свободными в течение очень длительного
времени. Также описано несколько случаев
лапароскопических холецистэктомии у больных, которым
ранее устанавливался вентрикулоперитонеальный
шунт по поводу внутричерепной гипертензии,
причем перитонеальная часть шунта была установлена
лапароскопически. При ЛХЭ ни в одном случае в
брюшной полости не было спаечного процесса и
конец шунта лежал свободно в брюшной полости и
функционировал.
Это дает нам основание полагать, что выведение
дренажей холедоха через свободную брюшную
полость может быть рискованным, и грозит тем, что
Рис. 6.42. Вскрытие пузырного протока
микроножницами.
1. Шейка желчного пузыря
2. Пузырный проток
3. Холедохотомический разрез
4. Передняя стенка холедоха
5. Разрез пузырного протока на 1 /2 диаметра
6. Микроножницы
такой дренаж не будет отграничен брюшиной. Для
профилактики необразования спаечного процесса
вокруг дренажа в подобных случаях предлагаем
способ выведения дренажей исключительно по
ложу желчного пузыря. Для этого его фиксируют
швами в двух местах — в области бывшей шейки пузыря
и в области дна. Мы предполагаем, что дренаж,
выведенный таким образом, будет неминуемо
отграничен спаечным процессом, развивающимся между
ложем, не имеющим брюшинного покрова, и
большим сальником (рис. 6.41).
После завершения холедохотомического этапа
операции пузырный проток пересекается, и
желчный пузырь удаляют по обычной методике.
Т-образный дренаж при этом полностью находится в
брюшной полости. Удаленный желчный пузырь
помещают в тот же контейнер, где уже находятся
конкременты, удаленные из холедоха. После этого
производят заключительную санацию подпеченоч-
ного пространства, Т-образный дренаж выводят
через среднеключичный прокол вместе с
троакаром, через передне-аксиллярный прокол
дренируют подпеченочное пространство. После этого теле-
Глава Б
Рис. Б.43. Введение дренажной трубки с
фиксированной лигатурой.
1. Шейка желчного пузыря
2. Пузырный проток
3. Холедохотомический разрез
4. Передняя стенка холедоха
5. Дренажная трубка с фиксированной
лигатурой
скоп перемещают в субксифоидальный прокол,
через умбиликальный прокол вводят зажим, которым
захватывают контейнер, содержащий конкременты
и пузырь. Умбиликальный прокол косметически
расширяется, контейнер извлекают из брюшной
полости, дефект герметически закрывается, и
вновь накладывают пневмоперитонеум. Выполняют
визуальный контроль правильности стояния обоих
дренажей, при необходимости их корректируют
при помощи зажима, проведенного из левого
подреберья. Затем, постепенно выпуская газ из
брюшной полости, дренажи подтягивают под
зрительным контролем так, чтобы опускающаяся брюшная
стенка не вызвала деформации прямого хода
дренажа. После этого дренажи фиксируют кожным
швом по обычной методике.
В том случае, когда в холедохе имеются
единичные конкременты и нет явлений холангита, хирург
может выбрать такую тактику, как полное ушивание
разреза гепатикохоледоха с одновременным
дренированием желчных путей через культю пузырного
протока. С этой целью пузырный проток вскрывают
микроножницами на 1/2 его просвета (рис. 6.42), и в
него вводят тонкую дренажную трубку диаметром
2-4 мм, с закругленным концом и несколькими
боковыми отверстиями. На расстоянии около 4 см от
вводимого конца вокруг трубки должна быть плотно
фиксирована тонкая рассасывающаяся нить с ат-
равматической иглой (рис. 6.43). Эту нить
используют для прошивания края пузырного протока
(рис. 6.44). После этого концы нити завязывают.
Кроме этого, накладывают дополнительную
циркулярную лигатуру на 5-7 мм ниже первой прошивной
лигатуры (рис. 6.45). Таким образом, дренаж,
введенный через пузырный проток, оказывается
надежно фиксированным прошивной лигатурой. Это
очень важная техническая деталь: опыт показывает,
что тонкие дренажи пузырного протока,
фиксированные простой перевязкой, легко выскальзывают с
последующим подтеканием желчи в брюшную
полость. После фиксации дренажа
холедохотомический разрез полностью ушивают узловыми швами
Лапароскопическая хирургия желчных путей
Рис. Б.44. Прошивание стенки
пузырного протока для фиксации дренажной
трубки.
1. Передняя стенка холедоха
2. Холедохотомический разрез
3. Пузырный проток
4. Дренажная трубка с фиксированной
лигатурой
5. Игла, прошивающая стенку пузырного
протока
Рис. 6.45. Дренажная трубка
фиксирована к пузырному протоку.
1. Передняя стенка холедоха
2. Холедохотомический разрез
3. Пузырный проток
4. Прошивная лигатура пузырного
протока
5. Вторая, циркулярная лигатура вокруг
пузырного протока
99
Глава Б
Рис. В.46. Окончательный вид
после полного ушивания холе-
дохотомического разреза с
дренированием холедоха
через пузырный проток.
1. Передняя стенка холедоха
2. Пузырный проток
3. Полностью ушитый холедо-
хотомический разрез
4. Фиксированная дренажная
трубка
или непрерывным швом рассасывающейся
синтетической нитью (рис. 6.46). Дальнейший ход
операции заключается в удалении желчного пузыря и
выведению дренажа наружу. Техника этих этапов не
отличается от описанной ранее.
Таким образом, мировая эндохирургическая
практика показывает, что с накоплением опыта
становится возможно выполнять лапароскопическую
холедохолитотомию даже в технически трудных
ситуациях.
ХОЛЕЦИСТОЭНТЕРОАНАСТОМОЗ
ПРИ РАКЕ ГОЛОВКИ ПОДЖЕЛУДОЧНОЙ
ЖЕЛЕЗЫ
Лапароскопический холецистоэнтероанастомоз,
как правило, выполняют при раке головки
поджелудочной железы, что является паллиативным
вмешательством. Вопросы онкологической тактики при
этой патологии и возможности радикального
оперативного лечения выходят за пределы этой книги и
здесь не рассматриваются.
Принципиально лапароскопический
холецистоэнтероанастомоз можно выполнить в двух
вариантах — в полностью лапароскопическом варианте и в
лапароскопически ассистированном варианте. При
полностью лапароскопическм варианте все
манипуляции выполняют эндоскопическим путем. При ла-
пароскопически-ассистированном варианте
эндоскопически осуществляют осмотр брюшной
полости, уточнение ситуации, поиск петли кишки для
анастомоза и выбор рациональной точки для
выполнения минилапаротомии длиной 3-4 см, а само
наложение анастомоза делают через эту
минилапаротомию. Лапароскопически ассистиро-
ванный вариант при данной патологии может иметь
некоторые преимущества, которые заключаются в
том, что этот способ значительно сокращает время
вмешательства и экономит деньги при сохранении
всех преимуществ минимальной инвазивности.
Полностью лапароскопический
холецистоэнтероанастомоз
Точки введения инструментов при выполнении
лапароскопической холецистоэнтеростомии
представлены на схеме (рис. 6.47). Для оптики
используют параумбиликальный 10 мм прокол. На 4 см ниже
мечевидного отростка 10 мм порт. Два 5 мм порта в
правом подреберье и один 5 мм порт в левом
подреберье.
После введения лапароскопа выполняют осмотр
брюшной полости. При желтухе на фоне рака
головки поджелудочной железы первое, на что следует
обратить внимание, это цвет печени. Он, как
правило, бывает буро-зеленым. При приближении оптики
в поверхности печени удается различить, что такой
цвет обусловлен наличием мельчайших зеленых
1ОО
Лапароскопическая хирургия желчных путей
точек. Поверхность печень остается гладкой.
Иногда в брюшной полости имеется прозрачная или
желтоватая жидкость. Желчный пузырь бывает
увеличен в размере, растянут желчью. Признаков
воспаления в нем нет. Следует обратить внимание на
наличие метастазирования в печень или по
брюшине. Участки, подозрительные на метастазирование,
подлежат биопсии для уточнения диагноза.
Если возникли сомнения в правильности
диагноза, можно выполнить лапароскопическую холецис-
тохолангиографию. Для этого желчный пузырь
пунктируют тонкой длинной иглой через край печени,
эвакуируется желчь (по возможности полностью),
вводят 30-40 мл неразведенного контраста и
делают снимок либо выполняют рентгеноскопию с
использованием электронно-оптического
преобразователя.
В тех случаях, когда у пациента имеется очень
выраженная желтуха, признаки печеночной
недостаточности и сопутствующая соматическая патология,
в качестве первого этапа лечения можно наложить
лапароскопическую холецистостому для разгрузки
желчных путей. Лапароскопическую холецистосто-
мию делают при помощи специального троакар-
катетера с баллончиком на вводимом конце,
раздувание этого баллончика позволяет фиксировать
катетер в просвете пузыря. Пункцию пузыря делают
через край печени. Через 2-3 нед., после того как
желтуха разрешится и состояние пациента
стабилизируется, можно приступить ко второму этапу
лечения, а именно наложить анастомоз.
Наличие холецистостомы, наложенной в
предоперационном периоде для разгрузки желчных путей
позволяет во время операции раздуть желчный
пузырь для облегчения его вскрытия, облегчает
проверку герметичности вновь созданного анастомоза
путем введения красителя, в послеоперационном
периоде способствует разгрузке анастомозируе-
мых органов, а также позволяет проводить
рентгеновский контроль функционирования анастомоза.
Как правило, во время второй лапароскопии, при
которой уже накладывается холецистоэнтероанас-
томоз, в области стояния холецистостомы имеется
фиксация пряди большого сальника. Технических
трудностей при этом не возникает, эту прядь
сальника легко отделяют зажимом.
После уточнения диагноза приступают к
выполнению анастомоза. Выбирают подходящую петлю
тощей кишки. Для этого большой сальник и
поперечную ободочную кишку при помощи мягких зажимов
отводят вверх, в сторону диафрагмы. При этом
обнажается нижняя поверхность корня брыжейки
поперечной кишки, и влево от средней линии находят
Рис. 6.47. Точки доступа при выполнении
лапароскопического холецистоэнтероанастомоза.
1. Первый, 10-мм троакар
2. Основной манипуляционный 10-мм троакар
3. 5-мм троакар
4. 5-мм троакар
5. 5-мм троакар
первую петлю тощей кишки и связку Treitz
(рис. 6.48). От этой связки отступают на 40-50 см,
так чтобы петля кишки была мобильной. Выбранную
петлю кишки подводят к желчному пузырю.
После подведения петли тощей кишки к желчному
пузырю между ними накладывают один
шов-держалка, и эту нить выводят экстракорпорально
вместе с троакаром через прокол в правом подреберье
по средней ключичной линии. После этого через тот
же прокол вновь вводят троакар (рис. 6.49).
После того как органы оказываются
фиксированными друг к другу, приступают к вскрытию их
просвета электрокрючком (рис. 6.50). Вскрытие
просвета желчного пузыря облегчается при раздувании
его жидкостью через имеющуюся холецистостому.
1O1
Глава Б
Рис. 6.48. Поиск петли тощей кишки для наложения лапароскопического холецистоэнтероанастомоза.
1. Связка Treitz
2. Петля тощей кищки
3. Поперечная ободочная кишка
4. Мезоколон
5. Грасперы
1O2
Лапароскопическая хирургия желчных путей
Рис. Б.49. Петля тощей кишки и I
желчный пузырь фиксированы ?
друг к другу швом-держалкой.
1. Дно желчного пузыря
2. Петля тощей кищки
3. Шов-держалка между желчным
пузырем и петлей тощей кишки
4. Печень
5. Троакар
Рис. Б.50. Вскрытие желчного
пузыря и тощей кишки при
наложении лапароскопического холецис-
тоэнтероанастомоза.
1. Дно желчного пузыря
2. Петля тощей кищки
3. Шов-держалка между желчным
пузырем и петлей тощей кишки
4. Печень
5. Разрез тощей кишки
6. Разрез желчного пузыря
7. Электрокрючок
ЮЗ
Глава Б
Использование электротока позволяет выполнить
вскрытие просвета органа бескровно.
Длина предполагаемого разреза пузыря и кишки
зависит от того, каким способом хирург планирует
наложить анастомоз — ручным или аппаратным.
При использовании стейплера разрез делают
длиной около 5 мм. При ручном формировании
анастомоза длина разреза не менее 2 см. Разрез делают в
области дна пузыря и по противобрыжеечному краю
кишки.
Ручное формирование анастомоза
После завершения вскрытия просветов желчного
пузыря и тощей кишки целесообразно наложить
узловые швы-держалки на края и середину задней
стенки будущего анастомоза, и затянуть его при
помощи пушера — лигатурной вилки (рис. 6.51). После
того как края разреза желчного пузыря и тощей
кишки по задней стенке адаптированы друг к другу
тремя швами-держалками, задняя стенка
формируется наложением непрерывного обвивного шва че-
Рис. 6.51. Наложение
узловых швов-держалок
на края и середину
задней стенки
формируемого лапароскопического
холецистоэнтероанасто-
моза.
1. Желчный пузырь
2. Петля тощей кищки
3. Шов-держалка между
желчным пузырем и
петлей тощей кишки
4. Печень
5. Наложен
шов-держалка на край
формируемого анастомоза
6. Завязывание шва-
держалки на середину
задней стенки
формируемого анастомоза
7. Пушер
8. Троакар
рез все слои (рис. 6.52). Используют
рассасывающийся шовный материал на игле-«лыже» или
обычной изогнутой игле. Длина нити должна быть около
25-30 см. Следует учесть, что более длинная нить
сильно затрудняет манипуляции, так как неизбежно
путается в брюшной полости, порой даже с
самопроизвольным образованием узлов. Как правило, в
лапароскопической хирургии оптимальным
признается наложение шва по направлению «к себе», т.е. от
более удаленной точки к ближайшей по отношению
к оператору или к тому порту, через который
проводится иглодержатель.
После того как задняя стенка анастомоза
сформирована путем наложения сквозного обвивного
шва через все слои, шов переходит на переднюю
стенку (рис. 6.53). Если шов продолжается той же
нитью, то в этом случае хирургу приходится шить
«от себя», что сложнее. Поэтому, в принципе
формирование передней стенки, можно производить
другой нитью, начав этот шов с латеральной
стороны анастомоза.
1O4
Лапароскопическая хирургия желчных путей
Рис. 6.52.
Формирование задней стенки
лапароскопического холе-
цистоэнтероанастомо-
за при помощи
непрерывного шва.
1. Желчный пузырь
2. Петля тощей кищки
3. Шов-держалка между
желчным пузырем и
петлей тощей кишки
4. Печень
5. Непрерывный шов на
заднюю стенку
формируемого
анастомоза
6. Иглодержатель
7. Троакар
Рис. Б.53.
Формирование передней стенки
лапароскопического хо-
лецистоэнтероанасто-
моза при помощи
непрерывного шва.
1. Желчный пузырь
2. Петля тощей кищки
3. Шов-держалка между
желчным пузырем и
петлей тощей кишки
4. Печень
5. Непрерывный шов на
переднюю стенку
формируемого
анастомоза
В. Иглодержатель
7. Троакар
1O5
Глава 6
Рис. 6.54. Вид
сформированного лапароскопического
холецистоэнтероанастомоза.
1. Желчный пузырь
2. Петля тощей кищки
3. Сформированный холецис-
тоэнтероанастомоз
4. Печень
5. Троакар
Рис. Б.55. Введение эндостейплера
EndoGIA-ЗО при выполнении
лапароскопического холецистоэнтероанастомоза с
использованием эндоскопического
сшивающего аппарата.
1. Желчный пузырь
2. Петля тощей кищки
3. Разрез желчного пузыря
4. Разрез тощей кишки
5. Аппарат EndoGIA-ЗО
6. Печень
7. Троакар
1O6
Лапароскопическая хирургия желчных путей
Рис. В.5Б. Бранши эн-
достейплера EndoGIA-
30 введены в разрезы
желчного пузыря и
тощей кишки.
1. Желчный пузырь
2. Петля тощей кищки
3. Разрез желчного
пузыря
4. Разрез тощей кишки
5. Аппарат EndoGIA-30
6. Печень
7. Троакар
Завершение формирования анастомоза
производят путем связывания концов нити (рис. 6.54).
При этом, как правило, приходится использовать
интракорпоральный способ завязывания узла.
Одним из преимуществ наличия ранее
наложенной транспеченочной холецистостомы является
возможность проверки герметичности анастомоза
путем введения раствора красителя (метиленовой
сини) через холецистостомическую трубку. При
этом область анастомоза осматривают на предмет
появления красителя в брюшной полости. При
выявлении подтекания синего красителя выполняют
дополнительную герметизацию путем наложения
отдельных узловых швов в слабом месте.
Использование сшивающих аппаратов
Безусловно, что для формирования холецистоэн-
тероанастомоза предпочтительно использовать
механические сшивающие устройства — эндостейп-
леры, которые позволяют одним движением
сформировать заднюю стенку анастомоза стандартным
механическим швом на 3/4 просвета.
При выборе такого способа анастомоза желчный
пузырь и тощая кишки вскрывают на протяжении
5 мм. После этого в брюшную полость вводят
сшивающий аппарат (рис. 6.55). Для его введения в
правом подреберье по среднеключичной линии
требуется установка соответствующего троакара (в
настоящее время для проведения такого аппарата
необходим троакар диаметром 12 мм). После
введения аппарат раскрывается, и его бранши
проводятся в анастомозируемые органы (рис. 6.56). При
этом, учитывая малую мобильность аппарата,
желчный пузырь и петля кишки со сделанными
отверстиями подводятся к браншам при помощи зажимов.
После того как бранши аппарата оказались в
отверстиях, при помощи тракции за нить-держалку,
соединяющую пузырь и кишку, эти органы как бы
натягивают на бранши на всю их длину.
После этого аппарат Endo GIA-30 закрывается.
Хирург тщательно контролирует правильность
расположения аппарата, убеждается в отсутствии
попадания между браншами аппарата
дополнительных анатомических структур и после этого
выполняГлава В
Рис. Б.57. Ушивание
общего отверстия хо-
лецистоэнтероанасто-
моза ручным швом
после использования
эндоскопического
сшивающего аппарата.
1. Желчный пузырь
2. Петля тощей кищки
3. Общее отверстие
холецистоэнтероа-
настомоза
4. Печень
5. Нить-держалка
между желчным
пузырем и тощей кишкой
6. Иглодержатель
7. Троакар
ет прошивание. После выполнения прошивания
стенок анастомозируемых органов аппаратом Endo
GIA-30, последний раскрывается и извлекается из
просвета вновь созданного анастомоза.
Общее отверстие, остающееся после
использования эндостейплера можно закрыть различными
способами, в том числе ручным швом (рис. 6.57),
или дополнительным прошиванием аппаратом
EndoGIA-ЗО или аппаратом EndoStitch. При
формировании холецистоэнтероанастомоза, наиболее
целесообразно использовать ручной шов, так как при
повторном использовании для этой цели аппарата
EndoGIA-ЗО существует потенциальная опасность
сужения анастомоза. После завершения
формирования холецистоэнтероанастомоза при наличии
транспеченочной холецистостомы также проверяют
герметичность путем введения раствора метилено-
вой сини.
Формирование межкишечного
анастомоза
В том случае, если хирург считает
целесообразным формирование межкишечного брауновского
анастомоза, он может сделать это двумя путями.
При наличии сшивающего аппарата можно
сформировать межкишечный анастомоз аппаратом в
брюшной полости. Техника формирования такого
анастомоза сходна с вышеописанной техникой
холецистоэнтероанастомоза.
С целью экономии времени, трудозатрат и
материальных ресурсов (кассеты к сшивающему
аппарату) можно использовать экстракорпоральную
технику. При этом в зоне предполагаемого межкишечного
анастомоза между петлями кишки накладывают
шов-держалку длинной нитью (рис. 6.58, 6.59).
После этого оптику извлекают из параумбиликального
порта и вводят в субксифоидальный. Под контролем
зрения оба конца этой нити-держалки захватывают
зажимом, проведенным через парамбиликальный
порт. После этого прокол в области пупка
косметически расширяется до 4 см (рис. 6.60) и путем тракции
за нить, обе петли тощей кишки выводят наружу.
После этого между петлями кишки формируют
анастомоз обычным путем (либо ручной, либо аппаратный).
Операция завершается подведением
контрольного дренажа к холецистоэнтероанастомозу.
При наличии транспеченочной холецистостомы в
послеоперационном периоде можно выполнить фи-
1O8
Лапароскопическая хирургия желчных путей
Рис. 6.58. Наложение шва-держалки
между петлями тощей кишки для
формирования межкишечного
анастомоза.
1. Желчный пузырь
2. Петля тощей кищки
3. Печень
4. Ранее сформированный холецис-
тоэнтероанастомоз
5. Шов-держалка между петлями
тощей кишки
Рис. 6.59. Шов-держалка между
петлями тощей кишки для
формирования межкишечного анастомоза
наложен.
1. Желчный пузырь
2. Петля тощей кищки
3. Печень
4.Ранее сформированный холецис-
тоэнтероанастомоз
5. Шов-держалка между петлями
тощей кишки
1ОЭ
Глава 6
Рис. Б.БО. Расширение параумбиликального доступа
для извлечения наружу петель тощей кишки для
формирования межкишечного анастомоза вне брюшной
полости.
1. Края параумбиликального разреза
2. Троакарный дефект апоневроза
3. Линия рассечения апоневроза вверх
4. Зажим, фиксирующий концы нити-держалки между
петлями тощей кишки
5. Крючки, растягивающие параумбиликальный разрез
стулографию с целью контроля за
функционированием анастомоза.
Лапароскопически ассистированный
холецистоэнтероанастомоз
Если хирург сразу решит формировать
лапароскопически ассистированный анастомоз, то
введения всех пяти троакаров не требуется. Достаточно
ввести один параумбиликальный троакар для
оптики, и один троакар в правой подвздошной области.
Первые эпаты операции не отличаются от
вышеописанных. Выполняют ревизию брюшной полости, при
необходимости биопсию и холангиографию.
После этого через точку, расположенную
непосредственно над желчным пузырем, вводят еще
один троакар. При помощи двух атравматичных
зажимов находят петлю кишки для анастомоза, и ее
мягко фиксируют одним из зажимов. Затем прокол,
расположенный над желчным пузырем, послойно
расширяют до 3 см, получая таким образом минила-.
паротомию. Если зажим, фиксирующий кишку,
находился в этой точке, то его вытягивают вместе с
кишкой, если кишка была фиксирована другим
зажимом, то кишку подают в рану. На кишку
накладывают шов-держалку, и ее погружают в брюшную
полость (оставляя держалку на экстракорпоральном
обычном хирургическом зажиме). После этого
находят дно желчного пузыря, пунктируют толстой
иглой, эвакуируют желчь, и затем тем же
швом-держалкой прошивают пузырь и завязывают шов. Таким
образом, желчный пузырь и кишка оказываются
фиксированными друг к другу. На расстоянии 3 см
от первого шва накладывают второй серозно-мы-
шечный шов. После этого кишка и пузырь
вскрываются, и между ними формируется анастомоз по
обычной хирургической технике. Мы предпочитаем
однорядный шов рассасывающейся синтетикой.
Затем, если хирург сочтет это целесообразным,
через тот же доступ формируют межкишечный
анастомоз.
Таким образом, травматичность операции
практически не изменяется, она остается минимально
инвазивной, в то же время существенно
сокращается время операции, а также экономятся
материальные ресурсы.
ОСЛОЖНЕНИЯ ЛАПАРОСКОПИЧЕСКОЙ
ХИРУРГИИ ЖЕЛЧНЫХ ПУТЕЙ
Как при абсолютно любой операции, при
лапароскопических операциях на желчных путях возможны
самые разнообразные осложнения. Общие
осложнения лапароскопических операций описаны в
соответствующем разделе.
Наиболее частым осложнением во время
лапароскопической холецистэктомии является
перфорация желчного пузыря, которая происходит в 1/3-1/4
случаев, и многими авторами в качестве
осложнения даже не рассматривается. Не опасная сама по
себе, она может вызвать ряд неприятных
последствий. К ним относят попадание в брюшную полость
инфицированного содержимого при остром
холецистите, рассеивание конкрементов по брюшной
полости. Известно, что в такой ситуации 30-40%
рассеянных конкрементов не удается эвакуировать.
ПО
Лапароскопическая хирургия желчных путей
В последнее время в литературе появилось много
статей, посвященных судьбе оставленных камней.
Выяснилось, что это далеко не безобидная вещь,
довольно часто они являются причиной
осложнений. Поэтому любая перфорация желчного пузыря
должна быть по возможности закрыта.
В ситуации, когда удаляется желчный пузырь без
серьезных изменений в его стенке, закрытие
пузыря возможно различными способами. Самым
простым способом является наложение клипсы на
место перфорации. Для этого оба края перфорации
захватывают и приподнимают зажимом, после чего
под этим зажимом накладывают клипсу.
С другой стороны, такое закрытие не всегда
бывает эффективным, и вытекание желчи
продолжается. В таком случае перфорацию можно закрыть
эндоскопической петлей. Петлю проводят в брюшную
полость, через нее проводят зажим, который затем
захватывает оба края перфорации. Под зажимом
петля затягивается.
При неэффективности этих способов на
перфорацию можно наложить восьмиобразный шов.
Другая ситуация, как правило, бывает при остром
холецистите. Опыт показывает, что попытки клиппи-
ровать, закрыть с помощью EndoLoop или зашить
образовавшееся отверстие при остром процессе
чаще всего оказываются неэффективными. Клипсы
не удерживаются, легко прорезая деструктивно
измененную стенку желчного пузыря, что приводит к
значительному увеличению дефекта; Endoloop
соскальзывает с инфильтрированных тканей;
наложение и завязывание швов трудоемко, а также не
всегда эффективно; переставление зажима с другого
места часто лишает хирурга удобства работы. В
таких случаях можно использовать два способа
выхода из данной ситуации:
К отверстию сразу же подвести трубку отсоса и
вытекающее жидкое содержимое максимально ас-
пирировать. После этого трубку отсоса провести в
полость пузыря для полной аспирации жидкого
содержимого, и промывания изотоническим солевым
раствором. При наличии крупных конкрементов,
значительно превосходящих размер дефекта,
можно продолжить выделение пузыря, не
предпринимая каких-либо дополнительных действий. Если
обнаруживается большое количество мелких и
средних, по отношению к размерам перфорации,
конкрементов, оставить дефект открытым нельзя, так
как будет происходить их неизбежное рассеивание
по брюшной полости.
Если перфорационное отверстие небольшое, то
после максимальной аспирации вытекающего
жидкого содержимого можно обтурировать отверстие
поролоновой пробкой, вводимой с помощью
предлагаемого нами устройства для простого и
быстрого закрытия перфорационного отверстия.
Устройство представляет собой трубку, в просвете
которой в области вводимого конца в сжатом состоянии
находится поролоновая губка, имеющая форму
цилиндра. Внутри трубки имеется поршень,
выталкивающий губку наружу. При нажатии на поршень он
выталкивает губку, имеющую форму цилиндра.
Диаметр губки в расправленном состоянии в три раза
больше диаметра губки в сжатом состоянии. На
расстоянии 20 мм от вводимого конца трубки
имеется циркулярная метка. При возникновении
перфорации данное устройство вводят в
перфорационное отверстие до метки, после чего извлекают
трубку из перфорационного отверстия, одно
временно оставляют поршень неподвижным. При этом
часть губки оказывается в полости желчного
пузыря, другая часть — снаружи. Поролоновая губка,
стремясь к расправлению, самофиксируется в
перфорационном отверстии, тампонируя его.
Применение этой методики возможно и в упрощенном
варианте, когда поролоновая губка сжимается при
помощи зажима, затем так же наполовину вводится
в перфорационное отверстие, и затем отпускается,
после чего происходит ее расправление и
самофиксация.
В тех случаях, когда размер перфорации стенки
пузыря значителен, и имеется выраженная
воспалительная деструкция, то попытки обтурации
пробкой, а также закрытие швами обречены на неудачу.
В таких ситуациях следует ввести в брюшную
полость стерильный полиэтиленовый пакет, или
мешок из плотного латекса, размерами 5 х 10 см.
Предпочтительнее использовать разовые изделия
фирм «AutoSuture», «Ethicon», но можно с успехом
применять и приспособленные резервуары. Пакет
разворачивается и подводится к дефекту, где
плотно удерживается зажимом, временно снимаемым
для этой цели с кармана Hartmann. Инструментом,
введенным через субксифоидальную гильзу,
выдавливают все конкременты из пузыря в мешок.
Последний закрывают и временно оставляют в правом
боковом канале. Препаровка пустого пузыря
продолжается. При кажущейся сложности этой
методики мы убедились в значительном выигрыше во
времени, по сравнению с поиском и поштучным
извлечением множества конкрементов.
Повреждения внепеченочных магистральных
желчных путей относятся к самым тяжелым
осложнениям билиарной хирургии. Лапароскопическая
хирургия полностью унаследовала эти осложнения,
добавив к ним ряд специфических особенностей.
Глава В
Повреждение внепеченочных желчных протоков
происходит в среднем в 0,6-0,8% всех
лапароскопических холецистэктомий, и чаще случается при
остром холецистите. При лапароскопической
холецистэктомий этот показатель достигал поначалу
3%. Интересно, что 70-80% таких осложнений
приходится на долю хирургов, имеющих опыт менее
10-15 операций.
Чаще всего повреждается холедох (88%), реже
правый печеночный проток A2%). Наиболее
типичным механизмом повреждения холедоха в
лапароскопической хирургии является следующий: при
наличии короткого пузырного протока тракция за кар-
¦j ман Hartmann может вытягивать общий желчный
\ проток, хирург принимает его за пузырный проток и
| пересекает. Реже происходит латеральное повреж-
4 дение клипсой или электроожог из-за агрессивных
попыток гемостаза в этой зоне «вслепую».
Небольшое повреждение в виде частичного клип-
пирования холедоха может быть устранено снятием
клипсы.
Если произошло полное или почти полное
пересечение холедоха, то принципиально из этой ситуации
можно выйти двумя путями: A) восстановить
непрерывность холедоха путем наложения холедохо-холе-
дохоанастомоза либо B) наложить холедохо-еюноа-
настомоз. В отношении выбора между этими двумя
возможностями очень интересна работа F.P. Schol
et al, которые проследили результаты лечения 49
повреждений желчных протоков в Нидерландах.
Результаты прослеживались на протяжении 14-570
дней. Трое больных умерли от нераспознанного
повреждения. Большинство хирургов выполняли
анастомоз конец-в-конец в случаях незначительных
повреждений и билиодигестивный анастомоз после
значительных повреждений. У 12 B5%) развилась
стриктура по прошествии 134 A3-270) суток после
восстановления проходимости протоков. Авторы
делают вывод, что тип восстановления проходимости
протока не влиял на результаты.
Однако здесь мы хотели подчеркнуть, что обе эти
возможности — для опытных хирургов, владеющих
широким диапазоном реконструктивно-восстано-
вительных операций на желчных путях. Если хирург
не имеет такого опыта, ему следует выполнить
наружное дренирование поврежденного холедоха, с
последующим выполнением вышеуказанных
операций опытным хирургом.
После детального анализа подобных
повреждений в мировой эндохирургической практике были
выработаны следующие рекомендации,
следование которым снизило частоту этого опасного
осложнения с 3% до 0,3-1,0%:
1. Производить максимальную цефаллическую
тракцию дна желчного пузыря.
2. Зажимом, наложенным на карман Hartmann,
следует осуществлять тракцию кармана,
вытягивая его от печени, а ни в коем случае не
прижимая.
3. Начинать диссекцию следует высоко у шейки
пузыря и продолжать ее медиально и латерапь-
но вблизи стенки органа.
4. Очень важно тщательно выделить и
идентифицировать пузырный проток, пузырную артерию,
холедох. Пересекать любую анатомическую
структуру можно только после ее
идентификации. Первой пересекают пузырную артерию.
При этом образуется «окно» между шейкой
пузыря, пузырным протоком, холедохом и
печенью. Только после этого пузырный проток
можно пересечь. Это правило является «золотым»,
его следует соблюдать всегда.
5. При наложении клипс нужно четко видеть
местоположение их дистальных концов.
6. В неясных случаях производить интраопераци-
онную холангиографию.
Принцип диссекции тканей в треугольнике Calot у
стенки желчного пузыря позволил значительно
уменьшить вероятность развития
неконтролируемого артериального кровотечения, так как даже при
полном пересечении пузырной артерии ее культя не
уходит в печеночно-двенадцатиперстную связку,
давая возможность для клипирования или
коагуляции. В настоящее время интраоперационные
кровотечения встречаются в 0,3-0,9% случаев. Если
хирург проявит невнимательность или торопливость,
возможно повреждение правой печеночной
артерии при нетипичной анатомической ситуации.
При этом наложение клипсы «вслепую» —
опасное мероприятие, так как клипса может
прорезаться или захватывать соседние структуры, травмируя
их. Более рациональным будет мягкое сдавление
данной зоны атравматичным зажимом или
использование кармана Hartmann в качестве
тампона — зажим, удерживающий карман, прижимает его
к печени. В это время отмывают оптика,
операционное поле, меняют инструмент. Возможно введение
пятой гильзы для постоянного использования
отсоса. После этого сосуд изолировано захватывают
зажимом и коагулируют либо прецизионно клипируют.
Иногда встречается такое осложнение
лапароскопической холецистэктомий, как повреждение
крупных венозных сосудов в ложе пузыря. Известно,
что в проекции ложа между 4 и 5 сегментами печени
расположен крупный венозный сосуд. В том случае,
если он располагается поверхностно, при отделе-
112
Лапароскопическая хирургия желчных путей
нии пузыря его можно повредить. Ранения венозных
сосудов в ложе желчного пузыря могут быть не
распознаны интраоперационно, так как при наличии
пневмоперитонеума внутрибрюшное давление
A2 мм рт. ст.) может значительно превышать
венозное, вена сдавливается и не кровоточит. Клиника
кровотечения может развиться в раннем
послеоперационном периоде, после ликвидации
пневмоперитонеума. Поэтому контрольная лапароскопия
после извлечения желчного пузыря из брюшной
полости обязательна. Кровотечение из вен печени
достаточно трудно остановить: прицельное
клипирование затрудняется неясностью траектории
сосуда в паренхиме печени — клипсы прорезают ее
и кровотечение иногда даже усиливается;
коагуляция малоэффективна, иногда она может лишь
увеличить рану в печени. В таких случаях практически
всегда эффективна техника использования гемо-
статической губки. Губку, плотно свернутую,
проводят через редуктор с помощью зажима и, не
разворачивая, прижимают к источнику кровотечения.
Такое прижатие в течение 5 мин позволяет остановить
практически любое венозное кровотечение, с
которым ранее хирург безуспешно боролся втрое
дольше с помощью электрокоагуляции.
Повреждение печени при лапароскопической хо-
лецистэктомии чаще носит характер надрыва ее
капсулы при разделении перивезикальных
сращений, и при этом легко останавливается
электрокоагуляцией.
Повреждение двенадцатиперстной кишки —
достаточно частое осложнение, которое специфично
для лапароскопической хирургии. Такое
повреждение происходит при разделении массивных
сращений желчного пузыря с двенадцатиперстной кишкой
при помощи электрокрючка. Как правило, эти
повреждения остаются нераспознанными на
операции — его выявляют через 1-3 сут., после развития
перитонеальных явлений. Для улучшения
диагностики повреждений двенадцатиперстной кишки в
подобных случаях, когда приходится разделять грубые
сращения в этой зоне, мы предлагаем рутинно
использовать следующий прием: зона оперирования
заполняется жидкостью, и через зонд желудок
раздувается воздухом. При наличии перфорации на
фоне жидкости будет отмечаться поступление
пузырьков газа из перфорационного отверстия.
Отрыв пузырного протока отхоледоха произошел
на нашем материале в одном случае. В этом случае
была технически трудная операция при остром
холецистите, на фоне инфильтрации в этой зоне.
Остатки слизистой протока приподняты зажимом, и
под ним наложена клипса. Гладкое выздоровление.
Описано такое специфическое осложнение
лапароскопической холецистэктомии, как перфорация
диафрагмы. Механизм развития осложнения
следующий: в процессе отделения пузыря от ложа при
осуществлении тракции в цефалическом
направлении произошла лацерация брюшины, покрывающей
диафрагму в ее мышечной части, и началось
кровотечение. С целью остановки кровотечения хирург
стал выполнять электрокоагуляцию брюшины в этой
зоне. При включении электротока диафрагма
сократилась, резко опустилась вниз, и электрод
прорезал в ней сквозное отверстие около 1 см. При
осмотре лапароскопом через дефект диафрагмы
повреждения органов плевральной полости не
выявлено. Дефект диафрагмы ушит двумя узловыми
швами.
При выполнении лапароскопической холецистос-
томии нередко встречается такое осложнение, как
сквозная перфорация противоположной стенки
желчного пузыря при использовании
троакар-катетера с очень острым концом. Не всегда удается
четко контролировать момент проникновения катетера
в пузырь, он продолжает движение и острым
концом перфорирует противоположную стенку. В таком
случае в области пузыря появляется небольшое
количество желчи, это дает основания заподозрить
такое осложнение. При возникновении перфорации
ее можно ушить лапароскопическим швом, хотя
некоторые авторы считают, что колотые повреждения
любых органов и сосудов ушивания не требуют.
Одним из технических осложнений
лапароскопической холедохолитотомии может являться
сквозной дефект стенки холедоха в месте наложения
швов-держалок. Для закрытия дефекта может
потребоваться наложение дополнительных швов
тонким рассасывающимся шовным материалом.
Раневая инфекция — редкое осложнение
лапароскопических операций, почти она всегда
развивается в области параумбиликального прокола,
который может инфицироваться при экстракции
желчного пузыря. Для профилактики этого
желательно перфорированные или
воспалительно-измененные органы удалять в пластиковых или ла-
тексных мешках.
Одним из тяжелых послеоперационных
осложнений после лапароскопической операции на желчных
путях является развитие подчеченочного абсцесса в
области ложа желчного пузыря @,24%). В тех
случаях, когда это осложнение распознается в первую
неделю после операции, возможно выполнение
лапароскопической санации полости абсцесса:
разделяется воспалительный инфильтрат, гной
максимально аспирируется, полость гнойника и
113
Глава В
подпеченочное пространство тщательно
отмываются 5-10 л жидкости, и операция завершается
установлением дренажей в область стенок абсцесса.
Кровотечение из проколов передней брюшной
стенки после удаления троакаров — довольно частое
явление. Остановка такого кровотечения — трудное
дело, так как повторное введение электрода по ходу
раневого канала затруднительно. Поэтому
рациональным приемом перед удалением троакаров
является введение в брюшную полость ложковидного
электрода, по нему, как по проводнику, троакар
удаляют, и возможное кровотечение из толщи брюшной
стенки можно остановить коагуляцией при
постепенном выведении электрода. В случае повреждения
крупного сосуда более надежно — прошить
переднюю брюшную стенку прямой иглой.
Послеоперационная грыжа после
лапароскопической холецистэктомии встречается намного
реже, чем при открытой операции. Одной из причин
развития грыжи, по нашему мнению, может
являться некачественное ушивание дефекта апоневроза у
больных избыточного веса. Это происходит из-за
стремления хирурга выполнить минимальный
разрез кожи из косметических соображений. Кроме
того, многие авторы пишут, что дефект апоневроза
при использовании троакара диаметром 10 мм и
менее рутинно можно не ушивать. Мы считаем, что
это не всегда так: ввиду того, что в процессе
манипуляций троакар совершает боковые движения,
диаметр пункционного канала может существенно
увеличиваться, и по возможности, дефект
апоневроза следует закрывать швами.
Таким образом, большую часть осложнений
лапароскопической хирургии желчных путей можно
успешно корректировать лапароскопическим путем.
Однако никогда не следует забывать, что
лапароскопическая хирургия — не самоцель, и при
наличии серьезных затруднений в эндоскопической
коррекции осложнений целесообразно переходить на
открытый доступ. Такой переход нисколько не
должен ущемлять самолюбие хирурга, так как он
говорит не о недостатках его технического мастерства, а
скорее о преобладании здравого смысла над
профессиональным азартом.
114
Лапароскопическая
хирургия желудка
ЛАПАРОСКОПИЧЕСКАЯ РЕЗЕКЦИЯ
ЖЕЛУДКА
Операция выполняют в положении больного лежа
на спине с разведенными ногами (рис. 7.1).
Расположение операционной бригады:
Оперирующий хирург располагается между ног, а
ассистенты — по сторонам от больного.
Используемый инструментарий:
• стейплеры Endo GIA 30 и/или Endo GIA 60 с
кассетами для прошивания тканей разной толщины;
• коагуляционный монополярный электрод в
форме крючка;
• коагуляционные 5 мм ножницы типа Metzen-
baum с поворотным механизмом;
• коагуляционные 10 мм ножницы типа Мауо с
поворотным механизмом;
• многозарядный клип-аппликатор;
• зажимы Babcock;
• 5 мм диссектор типа Merryland с поворотным
механизмом;
• 5 мм малотравматичные зажимы;
• пятилопастной ретрактор;
• иглодержатель;
• пинцет;
• устройство Endo Stitch;
• синтетический рассасывающийся шовный
материал.
Введение троакаров (по P. Goh) при
лапароскопической резекции желудка производят в следующих
точках (см. рис. 7.2):
1. Параумбиликально — для введения торцевой
оптики.
2. По среднеключичной линии в правом
подреберье.
3. По среднеключичной линии в левом
подреберье.
4. По среднеключичной линии в правой
подвздошной области.
5. По среднеключичной линии в левой
подвздошной области.
Кроме этого, возможно введение
дополнительного 6 троакара в субксифоидальной точке для
введения ретрактора и трубки ирригатора/аспиратора.
Мобилизация желудка
Операцию всегда начинают с осмотра брюшной
полости, уточнения локализации и
распространенности процесса. Затем выполняют мобилизацию
желудка. При операциях по поводу
доброкачественных заболеваний мобилизацию начинают с
создания электрокоагуляционным инструментом
сквозного отверстия в желудочно-ободочной связке
несколько дистальнее проекции середины большой
кривизны желудка, под желудочно-сальниковой
сосудистой аркадой — ближе к поперечноободочной
кишке. При резекции по онкологическим
показаниям этот этап начинается с отделения большого
сальника от поперечноободочной кишки.
Сальник можно рассекать одним из способов:
1. Наложением рассекающих степплеров.
Используют последовательное наложение рассекающих
стейплеров с 30 мм сосудистыми кассетами
проксимально до уровня коротких желудочных сосудов и
дистально — с захватом правой
желудочно-сальниковой артерии. Для мобилизации большой кривизны
115
Глава ~7
Рис. 7.1. Расположение операционной бригады при операциях на желудке.
1. Хирург
2. 1 -й ассистент
3. 2-й ассистент
4. Мониторы
5. Операционная сестра
6. Инструментальный стол
в этих пределах обычно требуется 6-7 кассет. Этот
способ отличается быстротой и надежностью —
аппаратный срез сальника кровоточит незначительно и
не требует дополнительного гемостаза.
2. Мануально. Лучшим инструментом для
обработки сальника при ручной мобилизации являются
электрокоагуляционные ножницы. Они сочетают в
себе три функции — диссекцию, гемостаз,
рассечение. Но при значительной выраженности клетчатки
коагуляционного потенциала 5 мм ножниц часто не
хватает. Высокую эффективность при мобилизации
желудка показали 10 мм ножницы. Они позволяют
производить манипуляции в следующей
последовательности:
1 - выделение пряди сальника;
2 — ее коагуляция при «подвешивании» на
плоскости браншей;
3 — пересечение без прицельного выделения
сосудов.
Проводить такими ножницами надежный коагуля-
ционный гемостаз в массе сальника можно при
диаметре сосуда до 2 мм. У тучных больных с выра-
11Б
Лапароскопическая хирургия желудка
женной жировой клетчаткой для быстрой
мобилизации лучше воспользоваться лигированием прядей
сальника с экстракорпоральным формированием
узлов Roeder.
После завершения мобилизации по большой
кривизне область привратника поднимают атравматич-
ным зажимом, и на кишку под привратником в
поперечном направлении накладывают сшивающий
аппарат. Выполняют прошивание. При использовании
30 мм кассеты требуется два прошивания. После
прошивания возможно кровотечение из линии швов
или из рядом расположенных мелких питающих
сосудов, оставшихся не прошитыми. Остановку
кровотечения при этом следует проводить клипирова-
нием, избегая электрокоагуляции, так как ток может
распространяться по скрепочному шву, вызывая
некроз тканей кишки в месте прошивания.
После пересечения кишки следует клипировать
ткань малого сальника в области правой
желудочной артерии либо выделять и клипировать артерию
из заднего доступа до пересечения кишки.
После этого малый сальник отсекают по
бессосудистой зоне вдоль печени вверх до границы
резекции по малой кривизне. Очень часто по задней
стенке желудка имеются спайки, их следует рассечь
электроинструментами. В случаях когда язва
желудка пенетрирует в поджелудочную железу, дно язвы
можно отсечь и оставить на железе. При
онкологических операциях, когда требуется удаление
регионарных лимфатических узлов в объеме D1, сальник
отделяют до правой ножки диафрагмы. Левые
желудочные сосуды пересекают в этих случаях
аппаратом на уровне отхождения артерии от чревного
ствола.
При резекции 2/3 желудка со стороны
сальниковой сумки у стенки желудка делают отверстие в
малом сальнике, после чего левая желудочная артерия
пересекают стеиплером и/или лигируют на уровне
границы резекции по малой кривизне с
последующим рассечением сальника дистальнее лигатуры.
В том случае, если резекцию делают по поводу
высоко расположенной язвы малой кривизны
желудка, левую желудочную артерию можно пересечь
не на уровне стенки желудка, а ниже, почти на
уровне отхождения от чревного ствола.
Иногда после пересечения левой желудочной
артерии мобилизация стенки желудка оказывается
недостаточной, и требуется дополнительное
рассечение элементов ткани малого сальника.
Пересечение желудка и наложение гас-
троеюноанастомоза
Данный этап можно выполнить в двух вариантах:
Рис. 7.2, Точки доступа при резекции желудка.
1. Оптика
2. Рабочие троакары
1. полностью эндоскопическим способом;
2.лапароскопически ассистированным
способом.
Эндоскопический способ
Перед пересечением линию резекции отмечают
на передней поверхности желудка монополярным
электродом либо путем маркировки с помощью
наложения швов-держалок со стороны малой и
большой кривизны. Строго по этой линии
последовательно накладывают аппарат. Последующее
прошивание производят точно через угол предыдущей
линии скобок. Требуются две 60 мм кассеты или 3-4
30 мм кассеты.
Отсеченную часть желудка временно помещают
на правую долю печени. Дальше накладывают гас-
троеюноанастомоз. Для этого выбирают участок
тощей кишки в 40-45 см от связки Treitz, который
выводится впередиободочно. Культю желудка рас-
Глава
правляют зажимами Babcock. Используемые
технические модификации этого этапа в основном
касаются способа фиксации петли тощей кишки к
передней стенке желудка. Один способ
предусматривает удерживание кишки у желудка с помощью
зажимов, второй — с помощью двух интракорпо-
рально завязываемых швов-держалок.
Удерживание кишки зажимами — наиболее быстрый, каза-
дось бы, способ. Однако после просечения первой
30 мм части анастомоза, становится ясно, что
ориентирование кишки и желудка для точного
наложения второй кассеты достаточно трудно и требует
дополнительного времени. Наложение
швов-держалок в проекции краев анастомоза выгодно тем,
что концы нитей можно использовать для
перемещения органов, не травмируя дополнительно их
стенок.
Рис. 7.3. Точки доступа при лапароскопической фун-
допликации.
1. Оптика
2. Рабочие троакары
Независимо от избранного способа фиксации,
после нее в стенках желудка и тощей кишки делают
отверстия диаметром около 5 мм. Это лучше
выполнять электрохирургическим монополярным
крючком или браншей ножниц, так как при этом
существенно уменьшается кровотечение из краев разреза.
После этого в отверстия в стенке желудка и кишки
вводят бранши сшивающего аппарата и формируют
соустье. Если хирург планирует закрыть
остающееся отверстие сшивающим аппаратом, то длина
анастомоза должна быть не менее 6 см, так как при
этом иссекается часть стенок анастомозируемых
органов и имеется опасность сужения. При
закрытии остаточного отверстия ручным швом или
аппаратом Endo Stitch можно ограничиться
протяженностью анастомоза в 3 см.
Проходимость и состоятельность анастомоза
проверяют с помощью интраоперационной
гастроскопии в положении Тренделенбурга и при
заполненном жидкостью подпеченочном пространстве.
При наличии капиллярного кровотечения из линии
механического шва возможна фиксация фрагмента
гемостатической губки.
Энтероэнтероанастомоз при такой модификации
резекции желудка не накладывают. Перед
удалением препарат обязательно помещают в пластиковый
мешок, удаляют через косметически расширенный
параумбиликальный прокол.
Лапароскопически ассистированная
резекция желудка
После лапароскопической мобилизации желудка
границы резекции по малой и большой кривизне
помечают лигатурами, которые интракорпорально
захватывают зажимом. Затем определяют и
захватывают зажимом Babcock участок тощей кишки,
требуемый для анастомозирования. В эпигастральной
области слева выполняют поперечную минилапаро-
томию протяженностью 4-5 см. Через этот разрез
желудок пересекается аппаратом с 90 мм кассетой
интракорпорально, после чего препарат извлекают.
Если речь идет о резекции 2/3 желудка при
мобильном желудке, то после вытягивания желудка через
минилапаротомию его можно отсечь
экстракорпорально. Культю захватывают мягким зажимом. Под
контролем лапароскопа производят поиск петли
тонкой кишки для формирования гастроеюноанас-
томоза.
Маркировка тощей кишки (для верификации
отводящего и приводящего отделов) возможна путем
наложения шва-держалки или коагуляционной
метки. После этого участки передней стенки желудка и
противобрыжеечного края тощей кишки (последний
118
Лапароскопическая хирургия желудка
Рис. 7.4. Разделение печеночно-желу-
дочной порции малого сальника.
1. Желудок
2. Печеночно-желудочная порция малого
сальника
3. Печень
4. Грасперы
5. Ретрактор
подается изнутри эндоскопическим зажимом)
выводят в рану и подшивают друг к другу двумя
узловыми серо-серозными швами. Стенки органов
перфорируются электрохирургическим крючком и ана-
стомозируются одним прошиванием аппарата с
30 мм кассетой. Эндоскопический аппарат
применяется на этом этапе потому, что его не нужно
собирать из двух частей, т.е. им удобнее манипулировать
в узкой ране. Остающееся отверстие закрывают
ручным непрерывным однорядным серозно-мы-
шечным швом. Рана брюшной стенки послойно
ушивают, восстанавливается пневмоперитонеум,
производят ревизию, санацию и дренирование
брюшной полости.
Лапароскопическая фундопликация
Фундопликации по Nissen выполняются в
положении пациентов лежа на спине с приподнятым
головным концом и разведенными ногами. Хирург
располагается с правой стороны пациента,
ассистент — с левой, камера-оператор — между ног
больного.
При выполнении операции оптимально
использование 10 мм троакаров, что дает возможность
свободно менять расположение инструментов по мере
потребности: 30° или 45° оптику вводят через пара-
умбиликальный прокол, манипуляционные
троакары для хирурга располагают в правом и левом
подреберьях по среднеключичной линии, троакар для
введения ретрактора устанавливают в субксифои-
дальной зоне и дополнительный троакар для
ассистента устанавливают в левом подреберье на уровне
пупка (рис. 7.3).
После осмотра брюшной полости создается
экспозиция абдоминального отдела пищевода и
пищеводного отверстия диафрагмы. Для этого из суб-
ксифоидного троакара вводят ретрактор и
отодвигают левую долю печени. Переднюю стенку желудка
под пищеводно-желудочным переходом
захватывают зажимом Babcock и отводят влево и вниз. При
этом обычно низводится скользящая грыжа
пищеводного отверстия диафрагмы.
Следующий шаг — разделение печеночно-желу-
дочной порции сальника в бессосудистой зоне
выше печеночных ветвей блуждающего нерва
(рис. 7.4). Их можно видеть в тканях худых
пациентов. Обычно эта порция у пациентов умеренного
питания представляет собой прозрачную пленку и
почти не содержит сосудов. Она легко рассекается
коагуляционными ножницами. Рассечение
брюшины продолжается влево над передней стенкой
пищевода и выше свода желудка (рис. 7.5).
11Э
Глава ~7
6
Рис. 7.5. Выделение передней стенки
пищевода при лапароскопической фундоп-
ликации.
1. Желудок
2. Пищевод
3. Правая ножка диафрагмы
4. Левая ножка диафрагмы
5. Передний вагус
6. Зажим Babcock
7. Электрокрючок
Рис. 7.6. Создание окна позади пищевода
при лапароскопической фундопликации.
1. Желудок
2. Пищевод
3. Правая ножка диафрагмы
4. Левая ножка диафрагмы
5. Жировая клетчатка в зоне диссекции
При отведении пищевода вперед и влево
становится виден задний блуждающий нерв. Затем
иссекают жировую подушку, обычно находящуюся на
передней поверхности нижней части пищевода.
Следующий этап — создание окна позади
пищевода (рис. 7.6). При этом тупую препаровку делают
так, чтобы сверху оставался пищевод, слева левая
ножка диафрагмы, а справа желудок. Для создания
достаточно широкого окна позади пищевода, его
необходимо поднять и разделить натянувшиеся
сзади ткани. В брюшную полость через троакар в
левом подреберье вводят резиновую держалку.
Зажим проводят за пищевод параллельно левой ножке
диафрагмы, конец держалки перехватывают позади
пищевода другим зажимом из правого подреберья.
Таким образом, пищевод берется на эластичную
ISO
Лапароскопическая хирургия желудка
Рис. 7.7. Пересечение коротких желудочных сосудов при мобилизации дна желудка при лапароскопической фун-
допликации.
1. Дно желудка
2. Пищевод
3. Передний вагус
4. Правая ножка диафрагмы
5. Левая ножка диафрагмы
6. Печень
7. Селезенка
8. Короткий желудочный сосуд
9. Ножницы
10. Зажим Babcock
держалку, облегчающую диссекцию его задней
стенки.
Ретроэзофагеальная клетчатка тупо разделяется
при отведении пищевода за держалку кпереди и
влево. После создания окна ножки диафрагмы
сводятся швами из нерассасывающегося шовного
материала, накладываемыми позади пищевода с
предварительно введенным в него зондом № 56-60 Fr.
Количество швов зависит от размеров дефекта и
составляет обычно 2-3. Они накладываются
иглодержателем или устройством Endo Stitch.
Операция продолжается мобилизацией дна
желудка и примерно 10 верхних сантиметров его
большой кривизны для фундопликации. Для этого
разделяют диафрагмально-желудочную связку.
Короткие желудочные сосуды в этой области дважды кли-
пируют и пересекают (рис. 7.7). Этот этап операции
весьма важный и наиболее технически сложный.
Работами многих авторов показано, что адекватную
функциональную манжетку по Nissen без натяжения
можно создать только при разделении коротких
желудочных сосудов. Дно желудка должно быть полно-
121
Глава
6
7\
Рис. 7.8. Формирование
манжеты вокруг пищевода при
лапароскопической фундоп-
ликации.
1. Желудок
2. Пищевод
3. Передний вагус
4. Часть дна желудка,
проведенная под пищеводом
5. Передняя часть дна
желудка
В. Шов
7. Зажимы Babcock
стью мобилизовано для предотвращения
перекручивания пищевода, натяжения манжетки или
включения в нее части тела желудка.
Затем производят собственно фундопликацию.
Стенку желудка захватывают на 5-6 см дистальнее
угла Hiss, т.е. в наивысшей части передней стенки
дна, введенным позади пищевода зажимом
Babcock, и протягивают слева направо, вперед,
создавая циркулярную манжетку высотой 2-3 см
вокруг бужа № 56-60 Fr, находящегося внутри
пищевода (рис. 7.8). Важно, чтобы обе части манжетки
соприкасались удобно и без натяжения. Некоторые
авторы для проверки отсутствия натяжения
рекомендуют дополнительно вводить зонд диаметром
1 см между сформированной манжетой и стенкой
пищевода. Задний лоскут подшивают 2-3 узловыми
швами к прилежащей части дна, выведенной
спереди от пищевода. Используют такие же нерассасыва-
ющиеся нити. В швы обязательно захватывают
последовательно левая часть манжетки, стенка
пищевода и правая часть манжетки.
При формировании манжетки возможно
подкрепление швов прокладочным материалом (рис. 7.9).
Некоторые авторы рекомендуют обязательно
фиксировать манжетку к ножкам диафрагмы для
профилактики ее смещения.
Частичная фундопликация (по Toupet)
Все этапы операции, кроме формирования
манжетки, совпадают с таковыми при операции по
Nlssen. Манжетка формируется путем
оборачивания стенки желудка вокруг пищевода сзади на 270°,
при этом задняя часть манжетки и передняя часть
отдельно фиксируются на стенке пищевода
узловыми швами, так что между ними остается промежуток
около 1-1,5 см.
Лапароскопическая ваготомия
Лапароскопические ваготомии проводят в
положении больных на спине с разведенными ногами и
приподнятым головным концом стола.
Оперирующий хирург располагается между ног пациента,
ассистент — с правой стороны больного,
камера-оператор находится слева.
Набор используемых инструментов следующий:
диссектор, ножницы, травматичный зажим, элект-
122
Лапароскопическая хирургия желудка
рохирургический крючок, клип-аппликатор,
трехлопастной печеночный ретрактор, ретрактор ножек
диафрагмы, зажим Babcock.
Расположение троакаров при этом типе операций
привязано к конкретным анатомическим точкам, и
должно обосновываться достаточно строго. Так,
10 мм троакар для 30° оптики вводят на 5 см выше и
левее пупка (в проекции второй сухожильной
перемычки левой прямой мышцы живота). Как и при
других типах «больших» вмешательств,
лапароскопический доступ осуществляется через 10 мм троакары
для того, чтобы иметь возможность вводить
необходимые инструменты через любой из них. Манипуля-
ционные троакары вводят под мечевидным
отростком, под левой реберной дугой по среднеключичной
линии, на 5-6 см выше и правее пупка, в мезогаст-
рии по наружному краю левой прямой мышцы
живота.
Ваготомия по Hill-Barker
После верификации анатомических ориентиров
(рис. 7.10) выполняют этап задней стволовой ваго-
томии. Левую долю печени отводят из субксифоид-
ного троакара ретрактором вправо и вверх.
Абдоминальный отдел пищевода отклоняют влево и вниз
зажимом Babcock, вводимым из левого
подреберья. Тракция кардиального отдела желудка
проводят по оси пищевода для предотвращения разрыва
хрупких сосудов в области малой кривизны
желудка. При этом расправляются брюшина и клетчатка
верхней части малого сальника. Затем вскрывают
малый сальник, растягиваемый в стороны
перпендикулярно правой ножке диафрагмы (рис. 7.4 и
7.11).
Это дает доступ к правому отделу сальниковой
сумки у печеночно-желудочных нервов, которые
исходят из переднего нерва Latarjet. Разрез
последовательно продолжают вверх до уровня мышечной
дуги правой ножки, которая выделяется на всю
длину. Два ориентира для задней стволовой ваготомии
представлены спигелиевои долей печени и правой
ножкой диафрагмы.
Правую ножку диафрагмы оттягивают вправо
таким образом, чтобы натянуть околопищеводную
брюшину. Разрез брюшины в этой области вдоль
края правой ножки позволяет, путем отведения
абдоминального отдела пищевода влево, получить
доступ к его задней части и окружающим ее тканям.
Там, в вершине угла, становится видна белая
полоска заднего блуждающего нерва, легко
распознаваемая благодаря блестящей поверхности. Нерв
захватывают зажимом и отделяют от сосудов коагуляци-
онным крючком и диссектором. Часть нерва (около
Рис. 7.9. Вид сформированной манжеты вокруг
пищевода при лапароскопической фундопликации.
1. Желудок
2. Пищевод
3. Передний вагус
4. Часть дна желудка, проведенная под пищеводом
5. Передняя часть дна желудка .
6. Швы, сформированные с использованием
прокладочного материала
1 см) вырезают между клипов и забирают для
гистологического исследования (рис. 7.12).
После задней стволовой ваготомии выполняют
селективное рассечение желудочных ветвей перед- {
него блуждающего нерва (рис. 7.13). С помощью ат- J
равматичного зажима и диссектора производят
осмотр малого сальника вниз до уровня угла желудка,
где находится так называемая «воронья лапка» —
концевое разветвление переднего нерва Latarjet.
Пересечение желудочных составляющих этого
нерва начинается с наиболее краниальных ветвей «во-
роней лапки» вверх, вблизи желудка. При этом
оставляют нетронутыми дистальные нервные ветви,
идущие к антральному отделу и привратнику. Для
гемостаза при разделении идущих совместно с
нервами достаточно хрупких сосудов используют
электрокоагуляция и клипы. При продвижении вверх
рассекают верхний листок брюшины, обнажая
мышечный слой малой кривизны. После достижения
зоны кардии диссекцию продолжают влево, на не-
Глава ~7
Рис. 7.10. Лапароскопическая анатомия
желудочных ветвей блуждающего нерва.
1. Желудок
2. Передний вагус
3. Задний вагус
4. Зона «гусиной лапки»
Рис. 7.11. Вскрытие малого сальника при
лапароскопической ваготомии.
1. Желудок
2. Пищевод
3. Передний вагус
4. Задний вагус
5. Разрез ткани малого сальника
6. Малый сальник
1S4
Лапароскопическ
ая
хирургия желудка
Рис. 7.12. Пересечение заднего
вагуса и рассечение серозной
оболочки желудка.
1. Желудок
2. Зона пересечения заднего
вагуса
3. Мышечный слой желудка по
линии рассечения серозной
оболочки
4. Грасперы
5. Электрокрючок
Рис. 7.13. Селективное пересечение желудочных
ветвей переднего блуждающего нерва.
1. Желудок
2. Ствол переднего вагуса
3. Желудочные ветви переднего вагуса
4. Клипирование и пересечение желудочных ветвей
переднего вагуса
5. Ножницы
125
Глава V
Рис. 7.14. Окончательный вид операции после лапароскопической ваготомии по Hill-Barker.
1. Желудок
2. Ствол переднего вагуса
3. Пересеченный ствол заднего вагуса
4. Клипированные и пересеченные желудочные ветви переднего вагуса
сколько сантиметров ниже предыдущего разреза
вдоль правой стенки абдоминального отдела
пищевода, конечные точки линии, по которой
производится разделение нервов, четко определены: от
проксимальной ветви «вороней лапки» до вершины
угла Hiss (рис. 7.14). Очень важно рассечь все
нервные волокна, отходящие от левой стороны
переднего блуждающего нерва.
При необходимости хирург может выполнить пе-
ритонизацию малой кривизны.
Технически упрощенным вариантом селективной
ваготомии является линейная серомиотомия
механическим швом. При этом нет необходимости
выполнять кропотливую диссекцию множества
желудочных ветвей переднего блуждающего нерва.
Начиная на расстоянии 6-7 см от пилоруса, переднюю
стенку желудка прошивают линейным сшивающим
аппаратом до уровня пищевода (рис. 7.15).
Прошивание идет параллельно малой кривизне на
расстоянии 2-3 см (рис. 7.16). Недостаток операции — ее
высокая стоимость за счет сшивающего аппарата и
5-7 кассет к нему.
Лапароскопические внутрипросветные
операции на желудке
Оптимально использовать положение больного
на спине с разведенными ногами. Точки введения
троакаров определяют локализацией патологичес-
126
Лапароскопическая хирургия желудка
Рис. 7.15. Начало
прошивания желудка при линейной се-
ромиотомии механическим
швом.
1. Желудок
2. Пищевод
3. Линейный сшивающий
аппарат
4. Грасперы
5. Складка желудка
Рис. 7.16. Этап прошивания желудка при
линейной серомиотомии механическим
швом.
1. Желудок
2. Складка желудка
3. Линейный скрепочный шов
4. Линейный сшивающий аппарат
5. Грасперы
127
Глава ~7
кого процесса. Так, при локализации очага в
области верхней трети желудка оптика вводится через па-
раумбиликальный троакар, затем, после введения
троакаров в желудок, лапароскоп перемещается в
данный порт. Дополнительные троакары вводят со
стороны большой и малой кривизны в верхней
трети желудка.
Для удаления доброкачественных
новообразований апробированы три принципиально различных
подхода. При локализации опухолей в антральном
отделе или теле желудка по большой кривизне их
иссечение производят со стороны серозной
оболочки рассекающим эндостейплером. Для этого
лапароскоп вводят в параумбиликальной зоне. После
окончательной локализации новообразования с
помощью интраоперационной гастроскопии в левом
подреберье по среднеключичной линии и на
середине расстояния между пупком и мечевидным
отростком помещают два 12 мм манипуляционных
троакара.
При локализации опухоли в большой кривизне в
ее проекции желудочно-ободочную связку отделяют
от стенки желудка с помощью коагуляционных
ножниц, диссектора и лигирования. Новообразование
иссекают путем встречного прошивания и
пересечения стенок желудка по направлению к его
просвету, при этом оно помещается как бы в «футляр» из
стенки желудка. Препарат извлекают из живота
через параумбиликальный разрез. В желудке
оставляют назогастральный зонд. Брюшную полость не
дренируют.
Если опухоль находится высоко в дне желудка, то
мобилизация части желудка для его краевой
резекции при такой локализации патологического
процесса должна была бы включать пересечение желу-
дочно-селезеночной и диафрагмально-желудочной
связок, что в условиях лапароскопического доступа
достаточно трудоемко. Кроме того, краевая
резекция дна с избытком стенки могла бы привести к
сужению пищеводно-желудочного перехода. Поэтому
в таких ситуациях в полость желудка через
брюшную стенку под контролем параумбиликально
расположенного лапароскопа и гастроскопа вводят три
5 мм троакара. Шланг от инсуффлятора подключают
к одному из троакаров, и желудок наполняется
углекислым газом. Выполняют ревизию желудка и
оценку опухоли. Затем опухоль захватывают
травматичным зажимом и приподнимают. После разделения
слизистой оболочки электрохирургическими
инструментами на стенку желудка под ножкой опухоли
накладывают две петли из синтетической
рассасывающейся нити с предварительно
сформированным узлом Roeder. Над затянутыми петлями опухоль
отсекают ножницами, затем рассекают на части и
извлекают с помощью гастроскопа в
предварительно введенном в желудок латексном мешочке.
Отверстия в желудке ушивают узловыми интракорпо-
ральными швами. Желудок интубируют. Брюшную
полость не дренируют.
Возможно отсечение образования при помощи
сшивающего аппарата. Для этого желудок
перфорируют троакарами 12 мм либо выполняют гастро-
томию по передней стенке желудка. После этого
образование задней стенки приподнимается
инструментом, если оно подвижно, под него подводят
аппарат и выполняют прошивание. Передняя
гастротомия закрывается либо ручным швом, либо
тем же аппаратом после смены кассеты.
Крупные инородные тела
Крупные инородные тела, которые не удается
извлечь с помощью фиброгастроскопа, можно
извлекать посредством лапароскопической гастро-
томии. В параумбиликальной области вводят
лапароскоп, 10 мм гильзу помещают в правой
боковой области живота по краю прямой мышцы, две
5 мм гильзы — в левой боковой области, по краю
прямой мышцы, и в эпигастрии по средней линии.
Через небольшое гастротомическое отверстие в
полость желудка вводят инструмент типа Endo
Catch (Auto Suture), которым, под контролем
гастроскопа, захватывают инородное тело. На
инструменте разрез стенки желудка продлевают до
размеров, необходимых для удаления объекта;
последний извлекают в пластиковом мешке и
временно оставляют в правом латеральном канале.
Гастротомическое отверстие ушивают
однорядным непрерывным швом синтетической
рассасывающейся нитью иглодержателем или с помощью
инструмента Endo Stitch. Инородное тело, по
возможности, интракорпорально механически
измельчают в мешке и извлекают из брюшной
полости через параумбиликальный доступ.
Гастростомия
При лапароскопической гастростомии по Веек-
Jianu оптимальное расположение пациента в
положении горизонтально на спине с разведенными
ногами. Хирург располагается между ног больного,
ассистенты — слева и справа.
Используют следующую схему введения
троакаров: торцевую оптику вводят в супраумбиликальной
области; манипуляционные 5 мм и 12 мм троакары
помещают на 5 см ниже реберной дуги слева и
справа по среднеключичной линии; манипуляцион-
ный 10 мм троакар вводят немного левее средней
128
Лапароскопическая хирургия желудка
линии на границе верхней и средней трети
расстояния между пупком и мечевидным отростком.
После ревизии брюшной полости диссектором
и ножницами создается окно в бессосудистой
зоне желудочно-ободочной связки примерно в
средней трети желудка. На этом уровне выделяется и
пересекается правая желудочно-сальниковая
артерия. Окно расширяется дистальнее и
параллельно сосудистому пучку большой кривизны.
Затем из большой кривизны желудка двумя
прошиваниями аппарата Endo GIA 30 выкраивают
антиперистальтический стебель диаметром 1,5 см и
длиной около 6 см. Верхушку стебля захватывают
зажимом из эпигастрального троакара и вместе с
ним выводят из брюшной полости через
расширенный прокол. С помощью четырех продольных
узловых швов в стебле создается клапан типа
песочных часов. Стебель фиксируют к апоневрозу и
коже и интубируют трубкой из силиконовой
резины.
Подвесная лапароскопическая
гастростомия
Подвесную лапароскопическую гастростомию
выполняют при таком же расположении пациента и
операционной бригады, что и описанная выше
операция. Троакары вводят в тех же точках, но в эпига-
стральной области устанавливают 5 мм порт. С
помощью иглодержателя ручным швом или аппаратом
Endo Stitch на переднюю стенку тела желудка
накладывают кисетный шов диаметром примерно 2 см.
Используют синтетическую рассасывающуюся нить
№ 0 длиной 60 см. Затем стенку желудка внутри
кисетного шва прокалывают иглой Veress, и желудок
наполняется газом. В эпигастральной области по
левой парастернальной линии, в проекции
кисетного шва на желудке делают кожный разрез 1 см
длиной и через него брюшную стенку, а затем и
переднюю стенку раздутого желудка внутри кисетного
шва, прокалывают троакар-катетером 24 Fr. Стилет
извлекают, баллон катетера наполняется воздухом,
кисетный шов затягивается. После десуффляции
брюшной полости стенка желудка подтягивается к
передней брюшной стенке за катетер и последний
фиксируют к коже.
Лапароскопически ассистированная
гастростомия
Еще одним, упрощенным вариантом операции
может быть лапароскопически ассистированная
гастростомия, когда под контролем лапароскопа
выбирают точку наложения стомы на желудке, это
место фиксируют лапароскопическим зажимом,
введенным через троакар в левом подреберье. После
этого данный прокол расширяется до 2-3 см,
стенка желудка вытягивается наружу, и формируется га-
стростома.
ОПЕРАЦИИ НА ДВЕНАДЦАТИПЕРСТНОЙ
КИШКЕ
Ушивание перфоративной язвы
двенадцатиперстной кишки
Оптимально расположить больного на
операционном столе горизонтально в положении на спине с
разведенными ногами, при этом хирург
располагается между ног больного, что дает возможность
комфортного манипулирования двумя руками при
ушивании язвы. Ассистент находится с левой
стороны стола, телеоператор — с правой. Допускается
положение пациента и без разведения ног.
После создания общего обезболивания желудок
интубируется назогастральным зондом.
Точки введения троакаров. Сначала вводят пара-
умбиликальный троакар для оптики, затем — два
манипуляционных троакара по правой и левой сред-
неключичным линиям на уровне пупка.
Дополнительный 4-й троакар располагается под
мечевидным отростком и служит для введения ретрактора
или трубки аспиратора-ирригатора. Помимо этого
при распространенном перитоните может
потребоваться введение 5-го троакара для санации нижнего
этажа брюшной полости.
Трубкой аспиратора-ирригатора при помощи
ретрактора, мягкого зажима и изменения положения
стола производят максимальную эвакуацию
выпота.
Закрытие перфорационного отверстия
производят однорядными узловыми швами,
накладываемыми иглодержателем и пинцетом.
При диаметре инфильтрата менее 2 см возможно
закрытие отверстия швами с интракорпоральным
формированием узлов. В таких случаях можно
использовать синтетический рассасывающийся
плетеный шовный материал (Polysorb № 2/0-3/0),
который лучше держит узлы при интракорпоральной
методике. Можно применять прямые хирургические
иглы, но только в тех случаях, когда ими можно
ушить отверстие без промежуточного выкола.
Однако большую свободу манипуляций предоставляют
изогнутые иглы.
При диаметре язвенного инфильтрата более 2 см
интракорпоральные швы не могут во всех случаях
обеспечить герметизм. Поэтому в таких ситуациях
применяется синтетический нерассасывающийся
129
Глава ~7
монофиламентный материал (полипропилен
№ 1/0-2/0) с экстракорпоральным формированием
узлов по Roeder. Монофиламентный материал
производит минимальный пилящий эффект, что важно
при проведении экстракорпорального шва через
инфильтрат.
При больших размерах инфильтрата
используются только изогнутые иглы. Они позволяют
осуществлять промежуточный перехват без излишней трав-
матизации инфильтрата. Зона ушивания
дополнительно перитонизируется прядью сальника.
Герметичность швов проверяют путем нагнетания через
назогастральный зонд воздуха при заполненном
физиологическим раствором подпеченочном
пространстве.
Возможно выполнение ушивания
перфорационного отверстия при помощи аппарата Endo Stitch.
Окончательную санацию брюшной полости
выполняют с помощью 10 мм отсоса, ретрактора и атрав-
матичных зажимов после изменения положения
операционного стола. Для промывания используют
6-8 л изотонического солевого раствора.
Антисептики не применяют. Дренирование производится
всегда: используются дренажи из силиконовой резины с
наружным диаметром 9 мм. Число и расположение
трубок зависит от распространенности перитонита.
13O
Лапароскопическая
хирургия
толстой кишки
ОБЩИЕ ПОЛОЖЕНИЯ
Первую лапароскопическую операцию на толстой
кишке выполнил Semm раньше, чем была
произведена первая холецистэктомия — в 1983 г. Он удалил
червеобразный отросток во время
гинекологического вмешательства. Широкое распространение эн-
дохирургия в колопроктологии стала получать
только в 1990-х гг. после первых колэктомий,
произведенных Fowler, Franklin и Jacobs. Однако до сих пор
мы не наблюдаем повсеместного бума
лапароскопической колопроктологии, несмотря на то, что
имеется достаточно большое количество
сторонников лапароскопических колэктомий.
Связано это с тем, что преимущества эндовидео-
хирургических методик в хирургии толстой кишки не
так очевидны, как в лечении желчнокаменной
болезни.
Основные причины:
1. Толстая кишка расположена в нескольких
областях брюшной полости. Как следствие троакары,
оптимально расположенные для работы в одной
области, могут не обеспечивать выполнения адекватных
действий в другой. Все это создает
дополнительные технические сложности для хирурга.
2. Недостаточные возможности тракции толстой
кишки из-за ограниченности пространства
брюшной полости являются плохими условиями создания
адекватной визуализации, особенно при высокой
перевязке сосудов у тучных больных.
3. 'Большая продолжительность наркоза при
длительном положении больного в положении Тренде-
ленбурга (как правило) создают предпосылки для
усиления отрицательных системных влияний кар-
боксипневмоперитонеума
4. Отсутствие убедительных данных о рецидивах
и диссеминации при раке.
Несмотря на это, логика развития и
многочисленные преимущества новых технологий в хирургии
предполагают интенсивное изучение места эндохи-
рургии в колопроктологии.
Существует две основных методики выполнения
лапароскопических колэктомий — полностью
лапароскопическая и лапароскопически ассистирован-
ная. В последнем случае для удаления органа и
наложения анастомоза используют микролапарото-
мию. В некоторых случаях перевязку магистральных
сосудов кишки осуществляют также через микрола-
паротомию.
С целью достижения единообразия в
терминологии и как следствие при проведении сравнительных
исследований следует различать:
1. Лапароскопическая операция — все этапы
выполняют интракорпорально или через троа-
карные доступы.
2. Лапароскопически ассистированная
операция — выполняют разрез для проведения
любого из этапов.
3. Конвертированная — предполагает любой
разрез, выполненный раньше, чем
планировалось, или больший, чем планировалось; или
любой разрез больший 5 см.
В большинстве случаев используют
лапароскопически ассистированные операции как более легко
131
Глава 8
выполнимые, дешевые, но при этом не менее
эффективные. Недостатками полностью
лапароскопических резекций толстой кишки являются:
значительное увеличение стоимости при использовании
сшивающих аппаратов, большая техническая
сложность. Выполняются они чаще при удалении левых
отделов, когда препарат может быть извлечен
трансанально, а анастомоз накладывают
циркулярным аппаратом.
В начале освоения лапароскопической хирургии
толстой кишки с методической целью следует
выделять вмешательства в порядке возрастания
сложности их технического исполнения:
1. Правосторонняя гемиколэктомия, резекция
сигмовидной кишки, операция Гартмана.
2. Низкая передняя резекция, брюшно-анальная
резекция.
3. Левосторонняя гемиколэктомия, резекция
поперечно-ободочной кишки.
При этом имеется три вида навыков выполнения
лапароскопической колэктомии: эндоскопическая
мобилизация, эндоскопическая деваскуляризация,
эндоскопический анастомоз. Освоение каждой из
операций можно проводить, постепенно и
последовательно совершенствуя каждый из них.
Следует различать — как при определении
показаний, так и в технике выполнения — операции при
доброкачественных и злокачественных заболеваниях.
При операциях по поводу рака толстой кишки
объем уносимых тканей не должен отличаться от
такового при традиционном способе оперирования.
Учитывая отсутствие на настоящий момент
однозначного мнения о благоприятных отдаленных
результатах при злокачественных образованиях,
можно считать, что лапароскопические резекции
толстой кишки являются методом выбора при таких
заболеваниях как дивертикулез, долихосигма.
Перспективно применение эндохирургических
методов при семейном аденоматозном полипозе, так
как этой доброкачественной болезнью страдают,
как правило, худые молодые люди.
Лапароскопические операции на толстой кишке
могут выполняться с приемлимым уровнем
осложнений и летальности. При правильном отборе
пациентов лапароскопически ассистированные операции
дают меньший процент осложнений, в частности
инфекционных, более благоприятный
послеоперационный период, меньший период госпитализации, чем
традиционные операции. Стоимость таких
вмешательств больше, однако за счет менее длительного
пребывания в стационаре она может быть снижена.
Что касается переходов на «открытые» операции,
то следует считать, что уровень конверсии в 20-25%
при низком уровне осложнений является
показателем грамотности хирурга. Эти цифры, по мнению
многих хирургов, характеризуют предел технологии
на данном этапе развития эндовидеохирургии.
Общий уровень осложнений, по различным
литературным данным, составляет от 6 до 28,5%. Такие
специфические осложнения как несостоятельность
швов анастомоза наблюдаются в 0,94-3,9%, раневая
инфекция — в 0,33-3,1%, длительный парез
кишечника — в 2,5-3,14% наблюдений. Эти показатели
лучше соответствующих при традиционных методиках.
При этом следует помнить об опасностях и
осложнениях, связанных с применением
лапароскопических технологий.
Так, отсутствие возможностей пальпаторного
исследования, трудности ориентировки
предопределяют, в некоторых случаях, сложности в
определении локализации опухоли во время операции. По
этой причине могут остаться незамеченными
синхронные опухоли толстой кишки. Эти же причины
лежат в основе ротации анастомоза.
При выполнении лапароскопически ассистиро-
ванных операций следует помнить о вероятности
тромбоза брыжеечной и воротной вен, причиной
которого могут стать грубые тракции кишки при
манипуляциях через микролапаротомию. Для того чтобы
избежать подобных проблем, необходимо
внимательно выбирать место для разреза — с целью
снижения травмы сосудов кишки.
Существует множество приемов для лучшей
ориентировки в брюшной полости при использовании
эндовидеохирургических методов в проктологии.
К ним относится техника двойной иллюминации:
лапароскоп + лапароскоп или лапароскоп + колоно-
скоп (рис. 8.1). Для облегчения нахождения малых
опухолей толстой кишки последние можно метить
активированным углеродом при колоноскопии для
того чтобы определять указанное место по черному
окрашиванию стенки кишки во время операции.
Одним из важных вопросов эндохирургии толстой
кишки остается возможность ее применения при
раке. Основными дискуссионными позициями
являются: радикальность лимфодиссекции, частота
рецидивов.
Многочисленные исследования показывают, что
радикальность резекции кишки и количество
удаляемых лимфоузлов не снижаются при использовании
лапароскопического метода. Количество последних
составляет по различным данным 2-12, что в
некоторых исследованиях даже превышает показатели
открытых операций.
В настоящее время в большинстве клиник нет
достаточного количества длительных наблюдений за
132
Лапароскопическая хирургия толстой кишки
больными, оперированными лапароскопически по
поводу рака толстой кишки. При этом большая
часть предварительных результатов обнадеживает.
Большинство хирургов не отмечают различий в
уровне и характере рецидивов при
лапароскопической и открытой методиках. Однако этот вопрос
требует дальнейшего тщательного изучения.
Одним из спорных моментов является проблема
рецидивов в области троакарных ран. Впервые
сообщение о таком рецидиве появилось в 1993 г. В
дальнейшем в литературе стали накапливаться
аналогичные случаи.
При этом следует отметить, что рецидивы
опухолей в области разрезов после открытых операций
являются хотя и редкой, но недооцененной
проблемой. Они встречаются в 0,6-1,1% случаев.
Последнее может оказаться вполне сопоставимым с
количеством троакарных рецидивов. Для
окончательного суждения по этому вопросу необходимо
проведение достоверного рандомизированного
исследования.
Таким образом, имеющиеся данные позволяют
обоснованно предполагать, что использование
лапароскопических операций на толстой кишке не
нарушает онкологичесчких принципов. Эти операции
могут широко использоваться в рамках
систематизированных исследований. Показаниями должны
служить прежде всего начальные стадии или
паллиативный характер вмешательства. При этом
лапароскопические паллиативые колэктомии могут
рассматриваться в ряде случаев как операции выбора.
ТЕХНИКА ЛАПАРОСКОПИЧЕСКИХ
ОПЕРАЦИЙ НА ТОЛСТОЙ КИШКЕ
Существует, как уже было отмечено, две
методики эндовидеохирургических колэктомии —
полностью лапароскопическая и ассистированная.
Различие заключается в способе наложения анастомоза
— эндоскопическом интракорпоральном или
традиционном — через микролапаротомию. Иногда мик-
ролапаротомию производят уже на этапе деваску-
ляризации кишки — перевязке магистральных
сосудов. Стандартную мобилизацию кишки во всех
случаях производят эндоскопически.
Лапароскопическая правосторонняя
гемиколэктомия
Положение больного — на спине, с
разведенными ногами. Монитор располагается справа от
больного, напротив хирурга, стоящего слева.
Целесообразно использование второго монитора, который
Рис. 8.1. Техника двойной иллюминации при
лапароскопической хирургии толстой кишки.
1. Лапароскоп
2. Колоноскоп
устанавливают у головного конца стола. Ассистенты
располагаются между ногами больного и справа —
между мониторами (рис. 8.2).
Как правило, использют 4-5 троакарных доступа
(рис. 8.3). Оптический 10 мм троакар вводят в пара-
умбиликальной области, еще два 10 мм троакара
вводят в подвздошной области и на границе эпи- и
мезогастральных областей по наружному краю
прямой мышцы живота слева. Так же два 10 мм
троакара могут быть установлены в правом подреберье и
правой подвздошной области. Последние
используют, как правило, при выполнении полностью
лапароскопической операции для наложения интракор-
порального анстомоза. В случае если
предполагается интракорпоральное пересечение кишки с
использованием сшивающих аппаратов типа EndoGIA,
133
Глава 8
Рис. 8.2. Положение пациента и операционной бригады при правосторонней гемиколэктомии.
1. Хирург
2. Ассистент
3. Ассистент
4. Операционная сестра и инструментальный стол
5. Монитор
В. Монитор
в одну из точек устанавливают троакар диаметром
12 м. Оптимально его использование в параумбили-
кальной области или в одной из точек справа, так
как именно эти разрезы приходится расширять при
извлечении препарата или наложении
экстракорпорального анастомоза.
Операция начинается с обеспечения условий
адекватной визуализации. Для этого петли тонкого
кишечника отводят влево с помощью мягких
зажимов и ретрактора. С этой же целью операционному
столу придается наклон влево. В дальнейшем, в
зависимости от области диссекции — купол слепой
134
Лапароскопическая хирургия толстой кишки
Рис. 8.3. Точки доступа при правосторонней гемико-
лэктомии.
1. Оптика
2. Рабочие троакары
кишки или печеночный угол, больного переводят в
положение Тренеделенбурга или противоположное
ему, соответственно.
Основным условием эффективной и безопасной
диссекции является создание адекватного
натяжения рассекаемых тканей, что позволяет четко
контролировать все манипуляции. Последнее
достигается использованием тракции и противотракции.
В основном для этого применяют атравматичные
зажимы типа Babcock или кишечные жомы.
Большую помощь оказывает применение марлевых туп-
феров. Диссекцию начинают в области купола
слепой кишки, который захватывается и отводится
медиально. При этом натягивается брюшина
латерального канала. Производят ее рассечение с
помощью ножниц с монополярной коагуляцией по
пограничной фасции (рис. 8.4). На этом этапе
операции, при выделении кишки из забрюшинного
пространства, должны быть визуализированы:
подвздошные сосуды, правый мочеточник, вверху раны
— нижнегоризонтальная ветвь двенадцатиперстной
кишки. Мочеточник может быть обнаружен по
перистальтике. В некоторых случаях, особенно при
подозрении на распространение опухоли в забрюшин-
ном пространстве, обоснована предварительная
катетеризация мочеточника с целью достоверной
визуализации.
Следующий этап — мобилизация печеночного
угла толстой кишки, наиболее трудный этап
операции. Для его выполнения необходимо осуществить
тракцию кишки вниз и медиально. Лапароскоп
нередко удобнее устанавливать в боковых троакарах
— в зависимости от условий мобилизации.
Большинство сосудов печеночно- и желудочно-ободоч-
ной связок коагулируется, а более крупные — клип-
пируются. Производят рассечение большого
сальника по линии резекции кишки.
На следующем этапе производят перевязку и
пересечение магистральных сосудов — подвздошно-
толстокишечной артерии. Этот этап может быть
произведен экстракорпорально. Для этого делают
разрез — длиной до 5 см. При проведении разреза
следует учитывать, что в дальнейшем через него же
будут временно выводиться петли анастомозируе-
мых подвздошной и поперечной кишки. Необходимо
сделать его так, чтобы при этом не травмировались
питающие их сосуды. Как правило, наилучшим
местом является параумбиликальная область (выше
пупка по средней линии) или правая параректальная.
Следует отметить, что интракорпоральная
обработка артерии не менее надежный метод. В случае
злокачественных новобразований сосуды должны и
могут быть выделены максимально высоко.
Предпочтительным способом перевязки является лигиро-
вание с экстракорпоральным формированием узла
или пересечение сшивающим аппаратом EndoGIA
(рис. 8.5). В редких случаях такие сосуды можно
клилпировать, накладывая не менее трех клипс на
проксимальный отрезок.
С целью облегчения диссекции и выделения
сосудов может быть использован второй лапароскоп
— для трансиллюминации.
Далее с помощью ножниц производят подготовку
кишки к наложению анастомоза, и кишка
пересекается (рис. 8.6 и 8.7). Этот этап может быть
произведен экстра- или интракорпорально.
В первом случае производится микролапарото-
мия способом, описанным выше. В рану выводится
мобилизованная кишка. Пересечение и анастомо-
зирование ее может быть осуществлено с исполь-
Глава 8
Рис. 8.4. Мобилизация восходящей
кишки при правосторонней гемико-
лэктомии.
1. Восходящая кишка
2. Грасперы
3. Ножницы
4. Разрез брюшины
Рис. 8.5. Пересечение сосудов при
правосторонней гемиколэктомии с
помощью сшивающего аппарата.
1. Восходящая кишка
2. Артериальный ствол
3. Сшивающий аппарат
136
Лапароскопическая хирургия толстой кишки
Рис. 8.В. Подготовка подвздошной
кишки к пересечению при
правосторонней гемиколэктомии.
1. Восходящая кишка
2. Подвздошная кишка
3. Граспер
Рис. 8.7. Пересечение подвздошной
кишки с помощью сшивающего
аппарата при правосторонней
гемиколэктомии.
1. Восходящая кишка
2. Подвздошная кишка
3. Сшивающий аппарат
4. Граспер
ПЗУ
Глава 8
Рис. 8.8. Наложение подвздошно-
толстокишечного анастомоза с
помощью сшивающего аппарата при
правосторонней гемиколэктомии.
1. Толстая кишка
2. Подвздошная кишка
3. Сшивающий аппарат
4. Линия скрепочного шва
Рис. 8.9. Закрытие общего отверстия для завершения
формирования подвздошно-толстокишечного
анастомоза при правосторонней гемиколэктомии.
1. Толстая кишка
2. Подвздошная кишка
3. Сшивающий аппарат
4. Линия скрепочного шва
5.Граспер
зованием техники ручного и аппаратного шва.
Последний предпочтительнее, так как значительно
сокращает время проведения процедуры, уменьшает
необходимость поворотов и других манипуляций с
кишкой в узкой ране. Все это способствует
уменьшению травматизации как питающих сосудов, так и
самой кишечной стенки в зоне анастомоза.
Используют сшивающие аппараты типа GIA. Необходимы
три прошивания — для отсечения и прошивания
подвздошной и поперечной кишки, сшивания
проксимального и дистального отрезков (рис. 8.8).
Образующийся при этом дефект в передней стенке
анастомоза может быть укрыт 3-5 ручными швами
или дополнительным прошиванием (рис. 8.9).
138
Лапароскопическая хирургия толстой кишки
Рис. 8.10. Выделение основания
сосудистого ствола при
лапароскопической резекции поперечной ободочной
кишки.
1. Поперечная ободочная кишка
2. Основание сосудистого ствола
3.Граспер
Техника полностью интракорпоральной резекции
и наложения анастомоза представляется более
сложной и неоправданной в случае правосторонней
гемиколэктомии, так как для удаления препарата
необходимо выполнять такой же разрез, как и при
ассистированной методике. В качестве
единственного преимущества можно рассматривать более
легкое помещение отсеченного препарата в
контейнер для извлечения из брюшной полости, что
теоретически снижает вероятность имплантационных
метастазов. При этом различие в технических приемах
заключается только в использовании сшивающих
аппаратов для наложения интракорпоральных
анастомозов.
После создания соустья необходимо в
обязательном порядке ликвидировать дефект брюшины с
помощью ручного непрерывного шва или аппарата
EndoStitch.
Операция заканчивается контролем гемостаза,
дренированием правого бокового канала, десуфля-
цией, ушиванием троакарных ран. Последнее
обязательно для всех случаев использования 12 мм
доступов.
Лапароскопическая резекция
поперечно-ободочной кишки
Техника эндовидеохирургической трансверзэкто-
мии принципиально не отличается от
правосторонней гемиколэктомии.
Троакары устанавливаются в тех же точках. Пара-
ректальные доступы из подреберных областей
следует располагать таким образом, чтобы иметь
возможность подводить инструменты к кишке со
стороны желудка. Это облегчает мобилизацию желудоч-
но-ободочной связки и позволяет легко
производить трансиллюминацию вторым лапароскопом при
обработке средней толстокишечной артерии.
Последняя должна быть пересечена, тем или иным
способом, у основания (рис. 8.10).
Оптимальное расположение бригады: хирург
между ногами больного, ассистенты — по обеим
сторонам. Чаще всего достаточно одного монитора,
который устанавливают у головного конца
операционного стола.
Операция начинается с пересечения желудочно-
ободочной связки. Большую часть проходящих в ней
сосудов следует клиппировать. Далее большой
сальник помещают кверху, визуализируют и пересекают у
основания среднюю прямокишечную артерию. Для
этого лучше использовать экстракорпоральное лиги-
рование или прошивание сшивающим аппаратом. На
этом этапе можно произвести микродоступ по белой
линии живота в проекции сосуда. Через него же в
дальнейшем накладывается анастомоз.
Этапы анастомозирования не отличаются от опи
санных выше для резекции правой половины тол
стой кишки. Следует обращать внимание на
возможность натяжения сшиваемых отрезков киш> и
при использовании аппаратного шва (экстра- или
интракорпорального). Это связано с тем, что полу
чающийся анастомоз является соединением «бок в
бок», а кишка при этом образует двухстволку. В не-
139
Глава 8
Рис. 8.11. Мобилизация нисходящей
ободочной кишки при
лапароскопической резекции.
1. Нисходящая ободочная кишка
2. Разрез брюшины
3. Граспер
4. Электрокрючок
Рис. 8.12. Пересечение толстой
кишки в дистальном отделе при помощи
сшивающего аппарата.
1. Толстая кишка
2. Сшивающий аппарат
которых случаях может создаваться натяжение
тканей по линии анастомозируемых поверхностей.
Заканчивается операция ушиванием дефекта
брюшины, десуфляцией и ушиванием троакарных ран.
Лапароскопическая резекция левых
отделов толстой кишки
Лапароскопические хирургические
вмешательства на левых отделах толстой кишки более
благоприятны из-за возможности использования обычных
циркулярных сшивающих аппаратов. Такие
операции также могут быть произведены либо полностью
лапароскопически, либо с использованием лапаро-
скопически ассистированных методик.
В первом случае препарат может быть извлечен
транеанально. Увеличения какого-либо из кожных
разрезов при этом не требуется, но могут быть
травмированы дистальные отрезки кишки,
особенно сфинктер. Кроме того, более вероятным
представляется имплантационное метастазирование.
Лапароскопически ассистированные операции —
левосторонняя гемиколэктомия, резекция
сигмовидной кишки, передняя резекция прямой кишки
являются оптимальными. Этапы хирургического
вмешательства при этом идентичны.
Первым этапом проводят мобилизацию удаляемой
части кишки в пределах здоровых тканей (рис. 8.11).
Перевязывают или прошивают магистральне сосуды.
14O
Лапароскопическая хирургия толстой кишки
Рис. 8.13. Выведение
приводящего конца толстой кишки,
пересеченного при помощи
сшивающего аппарата.
1. Выведенный приводящий
конец толстой кишки
2. Прошитый отводящий
конец толстой кишки
Рис. 8.14. Введение головки циркулярного
сшивающего аппарата в выведенный наружу приводящий конец
толстой кишки.
1. Выведенный приводящий конец толстой кишки
2. Линия кисетного шва
3. Головка циркулярного сшивающего аппарата
Вторым этапом с помощью сшивающего
аппарата типа EndoGIA пересекают кишку в дистальном
отделе (рис. 8.12). Через минилапаротомию,
произведенную в соответствующей проекции в левой
половине живота, удаляемую часть кишки выводят из
брюшной полости (рис. 8.13). Следует помнить, что
при вмешательствах по поводу злокачественных
образований на этом этапе операции следует
использовать контейнер для предупреждения имплантаци-
онного метастазирования в рану. При выполнении
обструктивной резекции на этом операция фактиче-
Рис. 8.15. Головка циркулярного сшивающего
аппарата фиксирована кисетным швом.
1. Выведенный приводящий конец толстой кишки
2. Затянутый кисетный шов
3. Головка циркулярного сшивающего аппарата, конту-
рирующаяся через стенку кишки
ски заканчивается. Кишка пересекается в
проксимальном отделе, и накладывается колостома.
Если вмешательство завершается наложением
анастомоза, то приступают к третьему этапу
операции. После пересечения выведенного наружу
проксимального отрезка толстой кишки в него вводят
головку от циркулярного сшивающего аппарата
(рис. 8.14), закрепляя ее кисетным швом по
правилам, принятым в традиционной хирургии (рис. 8.15).
Кишку погружают в брюшную полость, рану
ушивают. Далее, после восстановления пневмоперитоне-
Глава 8
Рис. 8.1 Б. Отводящий конец толстой кишки
прокалывается перфоратором циркулярного сшивающего
аппарата.
1. Ушитый отводящий конец толстой кишки
2. Корпус циркулярного сшивающего аппарата
3. Перфоратор циркулярного сшивающего аппарата
4. Линия линейного скрепочного шва
ума, трансанально вводят циркулярный сшивающий
аппарат. Стилетом прокалывают стенку дистального
отдела кишки (рис. 8.16), он совмещается с
головкой (рис. 8.17), и производят прошивание.
В том случае, когда после резекции пораженного
сегмента мобильность отводящего и/или
приводящего концов кишки оказывается недостаточной для
выведения их через минилапаротомию, кисетный
шов под головку и корпус циркулярного
сшивающего аппарата можно наложить интраабдоминально
при помощи иглодержателя (рис. 8.18 и 8.19).
Операция заканчивается проверкой анастомоза
на герметичность, ушиванием брюшины,
дренированием (при необходимости) брюшной полости, де-
суфляцией и ушиванием троакарных ран.
Наиболее трудным для мобилизации левых
отделов ободочной кишки является селезеночный угол.
Оптимальные условия для проведения диссекции в
этой области достигаются следующим образом.
Хирург располагается между ногами или справа
от пациента. Основной монитор устанавливают
слева, в головном конце операционного стола.
Троакары диаметром 10 мм вводят параумбиликально (для
оптики) и параректально в подвздошных и
подреберных областях, т.е. практически так же, как и при
правосторонней гемиколэктомии. Особенностями
является то, что в правой подвздошной области
целесообразно сразу же установить 12 мм троакар —
для прошивания и пересечения дистального отдела
кишки. Кроме того, в случае если пациент страдает
ожирением, или по конституции гиперстеник, имеет
смысл вводить троакары не параректально справа,
а по средней линии живота. При этом нужно следить
за тем, чтобы один из них обеспечивал доступ к
селезеночному углу сверху.
Рис. 8.17. Совмещение головки и
корпуса циркулярного
сшивающего аппарата.
1. Головка циркулярного
сшивающего аппарата, фиксированная
кисетным швом в приводящем
конце толстой кишки
2. Корпус циркулярного
сшивающего аппарата в отводящем
конце толстой кишки
3. Граспер
142
Лапароскопическая хирургия толстой кишки
Рис. 8.18. Интраабдоминальное
наложение кисетного шва при
помощи иглодержателя.
1. Край пересеченной толстой
кишки
2. Иглодержатель
3. Атравматическая игла с
нитью
4. Граспер
Рис. 8.19. Введение головки
циркулярного сшивающего
аппарата в приводящий конец
толстой кишки с наложенным
кисетным швом.
1. Приводящий конец толстой
кишки
2. Отводящий конец толстой
кишки
3. Головка циркулярного
сшивающего аппарата
4. Нить кисетного шва
Как и при других лапароскопических операциях,
следует максимально использовать изменения
углов наклона операционного стола для облегчения
визуализации. Диссекцию следует осуществлять
крючком или ножницами в условиях максимально
возможной тракции и противотракции, используя
для этого как кишечные мягкие жомы для захвата
стенки кишки, так и марлевые тупферы. В некото-
143
Глава 8
рых случаях большую помощь оказывает тракция
селезеночного угла книзу с помощью колоноскопа.
Резекция сигмовидной кишки и передняя
резекция прямой кишки являются одними из наиболее
благоприятных для лапароскопических
манипуляций, так как действия хирурга ограничиваются
фактически одной зоной — левым нижним квадрантом
живота. Места введения троакаров: супраумбили-
кально по средней линии, параректально справа —
в мезогастрии и над лоном, в левом подреберье.
Хирург располагается справа от пациента, монитор
— слева у ножного конца операционного стола.
Часто бывает удобнее вводить лапароскоп через
правый верхний параректальный доступ; при этом
оперирующий хирург работает двумя руками —
инструментами, вводимыми через параумбиликальный и
правый нижний параректальный троакары.
Рассечение брюшины можно начинать как с
медиальной, так и латеральной стороны. Последнее
предпочтительнее, так как позволяет
визуализировать мочеточник в самом начале операции, тем
самым предупредив его случайное повреждение.
Иногда при сомнениях в возможностях интраопера-
ционной визуализации следует произвести
катетеризацию его до операции.
Рассечение брыжейки кишки производят с
использованием любого режущего инструмента с
электрокоагуляцией мелких сосудов и клиппированием
более крупных. Магистральные артерии
предпочтительнее перевязывать или прошивать аппаратами.
Диссекцию тканей в области крестца позади
прямой кишки при ее резекции удобнее проводить
10 мм ножницами с электрокоагуляцией.
Что касается полностью лапароскопических
резекций левых отделов ободочной кишки, то они
оказываются более трудоемкими, более дорогими, не
давая при этом значимого облегчения
послеоперационного периода.
Лапароскопическая брюшно-промеж-
ностная экстирпация прямой кишки
Брюшно-промежностная экстирпация прямой
кишки так же является операцией, предоставляющей
хорошие возможности для применения эндовидеохи-
рургических методов. Это обусловлено тем, что при
проведении промежностного этапа создается
широкий доступ в брюшную полость из-за иссечения
анального сфинктера и мышц тазового дна. Как
следствие не возникает никаких трудностей с извлечением
объемного препарата. Абдоминальный этап при этом
выполняется из четырех-пяти троакарных доступов.
Положение больного — на спине с разведенными
и согнутыми в коленных и тазобедренных суставах
ногами. Оперирующий хирург становится справа от
больного, ассистенты — слева. В дальнейшем для
проведения промежностного этапа (он выполняется
обычным способом) один из помощников
располагается между ногами пациента.
Для проведения абдоминального этапа
используют 4 основных троакарных доступа. 10 мм троакар
для оптики вводят супраумбиликально. Еще два
10 мм троакара устанавливают в подвздошных
областях параректально. 12 мм троакар для рабочих
инструмента и сшивающего аппарата, который
используется для пересечения кишки,
устанавливается в правой паховой области, латеральнее. Еще один
10 мм троакар используют, как правило, для
удерживания матки у передней броюшной стенки с
помощью лепесткового ретрактора. Он вводится в левой
паховой области как можно латеральнее. В
некоторых случаях у женщин можно обойтись без этого
доступа. Для этого необходимо осуществлять тракцию
матки кпереди с помощью прошивания ее широких
связок швами, выведенными на переднюю брюшную
стенку.
В создании экспозиции большую роль играет
угол наклона операционного стола — пациент
должен находиться в положении Тренделенбурга с
наклоном вправо.
Принципы диссекции не отличаются от таковых
при других колопроктологических операциях. Она
должна проходить в условиях адекватной
визуализации при натяжении и четкой идентификации
рассекаемых структур.
Разрез брюшины целесообразно начинать с
латеральной стороны сигмовидной кищки,
продолжая его книзу. При этом необходимо
визуализировать мочеточник. Затем разрез продолжают по
переходной складке брюшины на заднемедиальную
брюшину прмой и сигмовидной кишки. Как
правило, в этот момент становится хорошо видна
пульсирующая верхняя прямокишечная артерия.
Разрез брюшины проводят по направлению к ее
основанию.
Далее создается окно в брыжейке сигмовидной
кишки, которая «вывешивается» в брюшной
полости с помощью двух грасперов. Верхняя
прямокишечная артерия выделяется максимально высоко.
При этом веточки сигмовидной артерии и вены
могут быть клиппированы. Магистральную артерию
лучше перевязать экстракорпорально сформио-
ванным узлом, или обработать сшивающим
аппаратом.
Следующим этапом проводят рассечение тканей
брыжейки сигмовидной кишки и выделение прямой
кишки в полости малого таза. Эти манипуляции на-
144
Лапароскопическая хирургия толстой кишки
иболее удобно производить с испольованием 10 мм
ножниц с электрокоагуляцией. Хорошо видимые
ветви средних прямокишечных артерий можно
клиппировать. Электрокоагуляция их также
оказывается достаточно эффективной.
На этом этапе может оказаться полезной помощь
ассистента со стороны промежности. Введение туп-
фера в прямую кишку и во влагалище у женщин
помогает хирургу, оперирующему со стороны
брюшной полости ориентироваться в тканях при
выделении прямой кишки. Это выделение продолжается до
мышц тазового дна.
При приближении к тазовым мышцам, начинается
промежностный этап. Мы не считаем обязательным
рассечение тканей до указанных мышц по всей
окружности кишки. В некоторых случаях (ожирение
больного, большая опухоль) оно может быть на
последних этапах затруднено, в то время как
выделение этой области со стороны промежности может
оказаться значительно более легким. При этом, все
же надо стремиться выделить кишку как можно
ниже в полости малого таза, так как
лапароскопический доступ обеспечивает визуальный контроль
этого этапа операции, сокращает время и кровопотерю
промежностного этапа.
Обычно заканчивать выделение кишки легче
после того, как она пересечена в проксимальном
отделе с помощью аппарата EndoGIA.
Препарат удаляется через промежностную рану,
ее зашивают, пневмоперитонеум
восстанавливается. Далее один из разрезов в левой половине
живота расширяют до размеров, необходимых для
наложения противоестественного заднего прохода.
Формируется колостома.
Операция заканчивается санацией брюшной
полости, обязательным ушивание брюшины, десуфля-
цией и ушиванием троакарных ран.
В заключение хотелось бы отметить, что
непосредственные результаты лапароскопических ко-
лэктомий обнадеживают — послеоперационный
период у таких пациентов облегчается. Сокращается
количество осложнений, сроки
нетрудоспособности. Лапароскопически ассистированные операции
могут производиться без значительных
материальных затрат. Окончательно судить о преимуществах
таких вмешательств станет возможным после
оценки отдаленных результатов при операциях по
поводу злокачественных заболеваний. Поэтому все
такие вмешательства следует проводить в рамках
рандомизированных исследований.
14Б
Лапароскопическая
аппендэктомия
Технику выполнения лапароскопической аппен-
дэктомии можно классифицировать по двум
основным принципам: на основе вида доступа и на
основе методики обработки отростка.
А. На основе доступа к червеобразному отростку
можно различить A) полностью
лапароскопическую аппендэктомию B) либо лапароскопи-
чески ассистированную аппендэктомию.
Б. На основе методики обработки
червеобразного отростка и его брыжейки можно различить
A) лигатурный способ либо B) аппендэктомию
с применением аппаратов механического шва.
ПОЛНОСТЬЮ ЛАПАРОСКОПИЧЕСКАЯ
АППЕНДЭКТОМИЯ
Пациент лежит на спине, ноги вместе. Хирург
расположен с левой стороны, монитор справа
(рис. 9.1). Если предполагаются ручные
манипуляции, в параумбиликальной области выполняют
стандартный косметический полукружный разрез и
вводят 10 мм троакар. Если предполагается
использование механического стейплера, устанавливают
12 мм троакар. Одним из вариантов введения
троакаров может быть следующий: после установки
первого троакара через него вводят 5 мм оптика и под
ее контролем по средней линии устанавливают два
5 мм троакара — один над 4 см выше лона, проявляя
осторожность во избежание повреждения мочевого
пузыря. Еще один 5 мм троакар устанавливают
между двумя первыми, и после этого в него
перемещают оптику (рис. 9.2).
Выполняют полный осмотр брюшной полости для
верификации диагноза.
Дальнейшие манипуляции различаются в
зависимости от методики операции. При этом могут
использоваться различные виды обработки брыжейки
червеобразного отростка и его культи. Кроме этого,
может иметь место комбинация различных
способов.
ЛИГАТУРНЫЙ СПОСОБ
АППЕНДЭКТОМИИ
После визуализации червеобразного отростка на
его верхушку можно завести и затянуть эндопетлю,
с помощью которой в последующем создают
необходимую тракцию отростка (рис. 9.3). Наличие
такой лигатуры на верхушке может помочь избежать
дополнительного контакта инструментов с
инфицированным отростком, кроме этого, снижает его
травмирование инструментами. С другой стороны,
можно выполнить операцию без использования
такой лигатуры. В таком случае тракцию отростка
осуществляют зажимом.
Способы обработки брыжейки червеобразного
отростка:
1. Коагуляция.
2. Лигирование нитью.
3. Наложение клипс.
4. Прошивание эндостейплером.
Коагуляцию отростка выполняют с
использованием монополярной и биполярной коагуляции, коагу-
14В
Лапароскопическая аппендэктомия
Рис. 9.1. Схема введения пациента и хирургов при лапароскопической аппендэктомии.
1. Хирург
2.Ассистент
3. Монитор
4. Операционная сестра
ляцией с использованием ультразвукового
диссектора и другими видами энергии.
Лигирование брыжейки отростка нитью
осуществляется, как правило, петлей Roeder. У
основания отростка в брыжейке выполняется отверстие,
через которое проводится лигатура, которая
завязывается экстракорпоральным узлом Roeder
(рис. 9.4). Для надежности можно использовать
двойное лигирование. После этого брыжейка
пересекается.
Брыжейку отростка можно лигировать
наложением клипс. При этом при минимальной диссекции
выявляется аппендикулярная артерия, которая
дважды клипируется, после чего брыжейка
пересекается.
При наличии сшивающего аппарата он
заряжается картриджем, предназначенным для сосудистых
структур. В области основания отростка в брыжейке
делают отверстие. Через него проводят браншу
сшивающего аппарата, аппарат закрывается, и
брыжейка прошивается и пересекается.
После того как отросток мобилизован, на
основание отростка заводится эндопетля и затягивается
узлом Roeder. На несколько миллиметров выше это-
147
Глава 9
Рис. 9.2. Схема введения троакаров при
лапароскопической аппендэктомии.
1. 10-мм троакар
2. 5-мм троакар
3. 5-мм троакар
Рис. 9.3. Фиксация верхушки отростка с помощью эн-
допетли.
1. Аппендикс
2. Лигатура для тракции
3. Слепая кишка
4. Подвздошная кишка
Рис. 9.4. Перевязка брыжейки
червеобразного отростка при
помощи лигатуры.
1. Аппендикс
2. Лигированная брыжейка
3. Слепая кишка
4. Подвздошная кишка
148
Лапароскопическая аппендэктомия
Рис. 9.5. Погружение
отсеченного червеобразного
отростка в контейнер для
его удаления.
1. Аппендикс
2.Контейнер
Рис. 9.Б. Создание окна в
брыжейке червеобразного
отростка для введения бранши
сшивающего аппарата.
1. Аппендикс
2. Брыжейка
3. Слепая кишка
4. Подвздошная кишка
5. Диссектор
го места на отросток накладывается и затягивается
вторая эндопетля. На 10 мм выше второй петли
накладывается третья эндопетля и отросток
пересекается между второй и третьей петлями.
Еще одним вариантом лигатурной аппендэкто-
мии является наложение на культю отростка двух
клипс.
Методика К. Zemm предусматривала
погружение культи отростка в кисетный шов. В настоящее
время от использования кисетного шва при
лапароскопической аппендэктомии практически
отказались.
Отсеченный отросток извлекают через умбили-
кальный троакар. Если величина отростка слишком
значительная для прохождения через троакар, его
следует удалить после извлечения умбиликального
троакара. Предварительно аппендикс помещают в
контейнер во избежание инфицирования передней
брюшной стенки (рис. 9.5).
ТЕХНИКА АППЕНДЭКТОМИИ ПРИ
ИСПОЛЬЗОВАНИИ СШИВАЮЩИХ
АППАРАТОВ ENDO GIA
Пересечение брыжейки отростка выполняют
картриджем, предназначенным для сосудистых
структур. В области основания отростка в
брыжейке делают отверстие (рис. 9.6), через которое
проводят браншу сшивающего аппарата, аппарат
закрывается, брыжейка прошивается и
пересекается.
149
Глава 9
Затем аппарат заряжают картриджем,
предназначенным для полых органов. Аппарат вводят через
12 мм умбиликальный троакар, раскрывается, его
бранши накладываются на основание отростка, и
выполняется его прошивание и пересечение (рис. 9.7).
Возможна обратная последовательность
действий, когда вначале пересекается отросток, а затем
его брыжейка (рис. 9.8).
Отсеченный отросток извлекают через
умбиликальный троакар. Если величина отростка слишком
значительная для прохождения через троакар, его
следует удалить после извлечения умбиликального
троакара. Предварительно аппендикс помещают в
контейнер во избежание инфицирования передней
брюшной стенки.
Вопрос о дренировании брюшной полости после
лапароскопической аппендэктомии решается в
зависимости от выраженности воспалительных и
деструктивных изменений червеобразного отростка,
наличия перитонита, трудностей во время
операции.
ЛАПАРОСКОПИЧЕСКИ
АССИСТИРОВАННАЯ АППЕНДЭКТОМИЯ
При этой методике первоначально выполняют
диагностическую лапароскопию. Телескоп вводят через
умбиликальный порт. В ходе лапароскопии
выполняют полный осмотр брюшной полости для
верификации диагноза. После того как хирург при осмотре
червеобразного отростка принимает решение о
необходимости выполнения аппендэктомии,
тщательно оценивают локализация отростка и его
подвижность. Затем, при наличии оптической трубки с
рабочим каналом через этот канал проводится зажим,
которым захватывают брыжейку отростка около
верхушки. После этого умбиликальный порт
расширяется, и через него червеобразный отросток
вытягивают наружу. Далее червеобразный отросток
удаляют по обычной для открытой хирургии методике.
Очевидно, что такая методика может
использоваться при свободно расположенном
червеобразном отростке и мобильной слепой кишке.
Рис. 9.7. Рассечение брыжейки
червеобразного отростка с помощью сшивающего
аппарата.
1. Аппендикс
2. Брыжейка
3. Слепая кишка
4. Сшивающий аппарат
Рис. 9.8. Отсечение червеобразного
отростка с помощью сшивающего аппарата.
1. Аппендикс
2. Брыжейка
3. Слепая кишка
4. Сшивающий аппарат
15O
Лапароскопическая
хирургия
паховых грыж
АНАТОМИЧЕСКИЙ ОБЗОР ПАХОВОЙ
ОБЛАСТИ ДЛЯ ЛАПАРОСКОПИЧЕСКОЙ
ГЕРНИОПЛАСТИКИ
Большинство из имеющихся на сегодняшний
день описаний топографической анатомии паховой
области начинается с описания поверхностных
слоев к глубоким структурам, как при препаровке трупа.
Для выполнения эндохирургической герниопласти-
ки паховой области хирург должен представлять
анатомию паховой области от глубоких структур к
более поверхностным слоям.
При осмотре передней брюшной стенки изнутри
со стороны брюшной полости можно увидеть пять
складок брюшины и углубления (ямки), являющиеся
местами выхождения грыж. Латеральная паховая
ямка является внутренним отверстием пахового
канала, она проецируется примерно над серединой
пупартовой связки на 1-1,5 см выше нее (рис. 10.1).
В норме паховый канал представляет собой ще-
левидное пространство, заполненное у мужчин
семенным канатиком и у женщин — круглой маточной
связкой. Паховый канал проходит наискось под
углом к пупартовой связке и имеет длину у мужчин
около 4-4,5 см. Стенки пахового канала:
передняя — апоневроз наружной косой мышцы живота;
нижняя — пупартова связка; задняя — поперечная
фасция живота; верхняя — свободный край
внутренней косой и поперечной мышц живота.
Наружное (поверхностное) отверстие пахового
канала образовано ножками апоневроза наружной
косой мышцы живота, одна из них прикрепляется к
лонному бугорку, другая — к лонному сращению.
Величина наружного отверстия пахового канала
различна. В поперечном диаметре она бывает
1,2-3 см, в продольном — 2,3-3 см. У женщин
наружное отверстие пахового канала несколько
меньше, чем у мужчин.
Внутренняя косая и поперечная мышцы живота в
паховой области трудно отделимы друг от друга.
Этот мышечный слой, располагаясь в желобке
пупартовой связки, подходит к семенному канатику и
перебрасывается через него, образуя разной
формы и величины паховый промежуток. Границы
пахового промежутка: снизу — пупартова связка,
сверху — край внутренней косой и поперечной мышц
живота, с медиальной стороны — наружный край
прямой мышцы живота.
Паховый промежуток может иметь щелевидную,
веретенообразную или треугольную форму.
Треугольная форма пахового промежутка
свидетельствует о слабости паховой области.
Поперечная фасция в паховой области в двух
местах укреплена сухожильными волокнами: по
боковому краю прямой мышцы живота идет Ид. Henle,
край внутреннего отверстия пахового канала
очерчен четко благодаря дуговидным волокнам Нд.
Hesselbachii (рис. 10.2).
На месте внутреннего отверстия пахового
канала поперечная фасция воронкообразно
загибается и переходит на семенной канатик, образуя
общую влагалищную оболочку семенного канатика и
яичка.
Круглая маточная связка на уровне наружного
отверстия пахового канала разделяется на волокна,
часть которых оканчивается на лобковой кости, дру-
1ST
Глава 1 О
Рис. 10.1. Анатомические ориентиры при
лапароскопической герниопластике. Вид при сохраненном
брюшинном покрове.
1. Срединная пупочная складка
2. Медиальная пупочная складка
3. Латеральная пупочная складка
4. Мочевой пузырь
5. Латеральная паховая ямка
В. Медиальная паховая ямка
7. Надпузырная ямка
8. Семявыносящий проток
9. Тестикулярные сосуды
10. Наружные подвздошные сосуды
11
Рис. 10.2. Анатомические ориентиры при
лапароскопической герниопластике. Вид при снятом брюшинном
покрове.
1. Облитерированный урахус
2. Облитерированная пупочная артерия
3. Нижние надчревные сосуды
4. Прямая мышца живота
5. Семявыносящий проток
6. Тестикулярные сосуды
7. Подвздошно-поясничная мышца
8. Надкостница лонной кости
9. Поперечная мышца живота
10. Мочевой пузырь
11. Связка Hesselbach
Лапароскопическая хирургия паховых грыж
гая — теряется в подкожной клетчатке лобковой
области.
ЭМБРИОЛОГИЧЕСКИЕ СВЕДЕНИЯ
С третьего месяца внутриутробного развития
зародыша мужского пола начинается процесс
опускания яичек. В области внутреннего пахового
кольца образуется выпячивание пристеночной
брюшины — брюшинно-паховый отросток. В
последующие месяцы внутриутробного развития
происходит дальнейшее выпячивание дивертикула
брюшины в паховый канал. В конце 6-7 мес. яички
начинают опускаться в мошонку. Ко дню рождения
ребенка яички находятся в мошонке, брюшинно-
паховый отросток зарастает. При незаращении
брюшинно-пахового отростка образуется
врожденная паховая грыжа. В случае неполного зара-
щения брюшинно-пахового отростка на отдельных
участках его возникают кисты-водянки семенного
канатика. Брюшинно-паховый отросток,
покрывающий яичко, образует собственную влагалищную
оболочку яичка. Поперечная фасция живота
образует общую влагалищную оболочку для яичка и
семенного канатика. Внутренняя косая и поперечная
мышцы участвуют в образовании мышцы,
поднимающей яичко.
ЭНДОСКОПИЧЕСКИЕ ОПЕРАЦИИ
ПРИ ПАХОВЫХ ГРЫЖАХ
Трансабдоминальная преперитонеальная герни-
опластика.
Положение больного на операционном столе.
Больной лежит на спине, ноги вместе. Хирург
стоит с противоположной стороны от места операции,
ассистент напротив хирурга. Монитор
располагается со стороны ног.
Точки введения троакаров.
Первый троакар для 10 мм косой оптики вводят
по стандартной методике в параумбиликальной
области после предварительного наложения пневмо-
перитонеума. После осмотра брюшной полости
вводят рабочие троакары. Они располагаются на
уровне пупка, по латеральному краю прямых мышц
(рис. 10.3). Следует избегать слишком низкого
введения троакара. Троакар со стороны оперирующего
хирурга является рабочим, поэтому при
использовании стандартного герниостейплера он должен
быть 12 мм, при использовании аппарата ProTack
троакар может быть 5 мм.
ТЕХНИКА ОПЕРАЦИИ
После введения оптики выполняют осмотр обеих
паховых областей. Грыжевой мешок при косой
паховой грыже легко определяется как углубление
брюшины латерально от нижних эпигастральных
сосудов. При прямой грыже визуальное определение
грыжевого мешка может быть затруднено ввиду его
большей ширины и возможного наличия жира в
предбрюшинной клетчатке.
Разрез брюшины выполняют ножницами либо
электрокрючком над грыжевым мешком. Разрез имеет
форму пологой полуокружности, выпуклостью
направленной вверх. Латерально разрез находится на
5 см латеральнее грыжевого мешка, медиально он
оканчивается на уровне медиальной пузырно-пупоч-
ной складки (облитерированной пупочной артерии)
Рис. 10.3. Точки доступа при трансабдоминальной
преперитонеальной герниопластике.
1. Оптика
2. Рабочие троакары
Глава 1 О
Рис. 10.4. Линия рассечения брюшины
при трансабдоминальной преперитоне-
альной герниопластике.
Пунктиром указана линия рассечения
брюшины.
(рис. 10.4). После этого нижний листок брюшины
начинают отделять вниз от подлежащих структур. Как
правило, применяют тупую диссекцию. Выделяют те-
стикулярные сосуды, внутреннее паховое кольцо.
При операции у полных пациентов в этой зоне часто
отмечается липома. Следует выделить важные
анатомические ориентиры: надкостницу лонной
кости — куперову связку, которая определяется как
белая плотная блестящая структура в нижней
медиальной зоне препаровки, фасцию прямой мышцы, под-
вздошно-лонный тракт, а также фасциальные
структуры поперечной мышцы живота. К этим
структурам впоследствии будет фиксироваться
протезирующая сетка. Следует избегать глубокой диссекции
в зоне, расположенной ниже и латерально от
прямого угла, ограниченного семявыносящим протоком и
подвздошно-лонным трактом (в этой зоне
располагаются крупные сосудистые структуры и нервы).
В том случае, если дефект в области грыжевых
ворот очень большой, и можно предположить, что
впоследствии под давлением органов в него будет
вворачиваться сетка, создавая предпосылки для
рецидива, этот дефект следует ушить.
После выделения данных анатомических структур
в брюшную полость в свернутом состоянии вводят
протезирующую сетку (рис. 10.5), которая должна
закрыть три потенциально слабых места в этой
зоне: латеральную и медиальную паховые ямки, а
также область сосудистой лакуны в зоне бедренного
канала (рис. 10.6). Считается, что сетка должна
заходить за эти слабые зоны не менее чем на 3 см.
Слишком большая сетка при ее расположении в
области фиксации может образовывать складки.
После введения сетки она расправляется и тем самым
готовится к фиксации.
Фиксация нераскроенной сетки
При этой методике сетка целиком, без разрезов в
ней, устанавливается в зоне фиксации. Если хирург
предпочитает данный вид пластики, при диссекции
154
Лапароскопическая хирургия паховых грыж
Рис. 10.5. Введение сетки при
лапароскопической герниоплас-
тике, вид изнутри.
1. Свернутая сетка
2. Троакар
3. Брюшная стенка изнутри
4. Зажим
Рис. 10.6. При
лапароскопической герниопластике сеткой
закрываются три потенциально
слабых места брюшной стенки
1. Сетка закрывает
латеральную паховую ямку
2. Сетка закрывает медиальную
паховую ямку
3. Сетка закрывает внутреннее
отверстие бедренного канала
4. Зажим
|М ^
155
Глава 1 О
Рис. 10.7. Использование герниостеп-
лера.
1.Герниостеплер
2. Сетка
3. Скрепка
Рис. 10.8. Фиксация сетки при
лапароскопической герниопластике при
помощи скрепок.
1. Сетка закрывает латеральную
паховую ямку
2. Сетка закрывает медиальную
паховую ямку
3. Сетка закрывает внутреннее
отверстие бедренного канала
4. Герниостеплер
тканей следует выполнить так называемую париета-
лизацию сосудов яичка, т.е. на значительном
протяжении отделить a.v. testicularis от брюшины. Это
нужно для того, чтобы при последующем закрытии
сетки брюшиной натягивающийся вверх нижний
листок брюшины с фиксированными к нему тестику-
лярными сосудами не вызвал бы подворачивания
сетки, так как это может быть причиной рецидива.
После установки и расправления сетки ее
фиксируют к следующим точкам — куперова связка и
фасция прямой мышцы медиально; поперечная фасция
и подвздошно-лонный тракт латерально. Не следует
фиксировать сетку в зоне, расположенной ниже и
латеральнее прямого угла, ограниченного семявы-
носящим протоком и подвздошно-лонным трактом
(в этой зоне располагаются крупные сосудистые
структуры и нервы, иногда эту зону называют
«роковым квадратом»), кроме этого, не следует
фиксировать сетку к нижним эпигастральным сосудам.
Сетку фиксируют при помощи скрепок (рис. 10.7 и
10.8). Фиксация сетки ручными швами в принципе
возможна, но значительно повышает трудоемкость
операции. Удобным средством фиксации является
использование аппарата ProTack, который
вкручивает в ткани титановые спирали.
Фиксация раскроенной сетки
При этой методике сетку до ее введения в
брюшную полость разрезают до середины. Через этот
разрез при фиксации сетки проводят тестикуляр-
ные сосуды. Учитывая это, тестикулярные сосуды
следует отделить от стенки малого таза так, чтобы
создать под ними канал для проведения одного из
листков раскроя сетки. После введения в брюшную
полость, сетку разворачивают и один из листков
раскроя сетки проводят под тестикулярными
сосудами. После установки разрез сетки должен быть
ориентирован латерально. Точки фиксации сетки те
же, что и при пластике нераскроенным
трансплантатом. Кроме этого, важно тщательно закрыть сам
раскрой, так как он может стать причиной рецидива.
Закрыть раскрой можно герниостейплером либо
полипропиленовой нитью ручным швом. Иногда
могут возникать технические трудности при фиксации
сетки по ее верхнему краю ввиду того, что герниос-
тейплер располагается под слишком острым углом
156
Лапароскопическая хирургия паховых грыж
Рис. 10.9. Закрытие
разреза брюшины при
лапароскопической герниопластике.
1. Края разреза брюшины
2. Сетка
3. Скрепочный шов
4. Герниостеплер
6
Рис. 10.10. Баллонная дис-
секция преперитонеального
пространства при экстрапе-
ритонеальной
эндоскопической герниопластике.
1. Преперитонеальное
пространство
2. Баллон
3. Трубка баллона
4. Видеокамера
5. Лонная кость
6. Мышечно-апоневротичес-
кий слой
7. Подкожно-жировая
клетчатка
8. Мочевой пузырь
9. Париетальная брюшина
10. Петли кишечника
к передней брюшной стенке. Для облегчения
фиксации можно надавить снаружи на переднюю
брюшную стенку, тем самым изменив угол и создав упор
для инструмента.
Закрытие сетки брюшиной
Контакт сетки с петлями кишечника и сальником
приводит к развитию спаек, что впоследствии
может стать причиной кишечной непроходимости.
Разрез брюшины можно закрыть ручным швом
рассасывающейся нитью либо с помощью герниос-
тейплера (рис. 10.9). Закрытие брюшины, как
правило, обеспечивает отсутствие спаечного процесса
в зоне операции.
Полностью экстраперитонеальная гер-
ниопластика.
Полностью экстраперитонеальная
эндоскопическая герниопластика предусматривает доступ в
преперитонеальное пространство, отделение
брюшины от структур паховой области, и введение
протезирующего материала между брюшиной и
дефектом поперечной фасции. В настоящее время
большинство оперативных вмешательств выполняют с
помощью баллонной диссекции. Положение
больного на операционном столе такое же, как и при
трансабдоминальном подходе.
Введение троакаров
Первый троакар вводят в нижней полуокружности
пупка в пространство между мышечно-апоневроти-
ческим слоем и брюшиной. После этого в каудальном
направлении вводят баллон, который раздувают, тем
самым создавая первичную полость, в которую
вводят оптическую трубку, и дальнейшие манипуляции
осуществляют под контролем зрения (рис. 10.10).
В предбрюшинное пространство инсуффлирует-
ся углекислый газ при пониженном давлении
157
Глава 1 О
A0-12 мм рт. ст.) для профилактики подкожной
эмфиземы. Рабочие инструменты вводят в следующих
точках: 5 мм троакар вводят над лоном по средней
линии и 12 мм троакар устанавливают между
первым и вторым, уже под контролем зрения.
Грыжевой мешок, который при таком подходе
изнутри не осматривается, следует отделить от
семенного канатика по методике, аналогичной в
открытой хирургии.
При диссекции паховой области следует
выделить те же анатомические ориентиры, что при
трансабдоминальном подходе. Выделяются купе-
рова связка, фасция прямой мышцы, элементы
семенного канатика, подвздошно-лонный тракт,
фасция поперечной мышцы.
Небольшие дефекты брюшины могут не
приводить к серьезным трудностям в операции, в то
время как большие повреждения могут заставить
хирурга перейти на трансабдоминальный доступ
E-10% случаев). Повреждения брюшины могут
иметь место при выделении грыжевого мешка, а
также у пациентов, ранее перенесших какие-либо
разрезы в подвздошно-паховой области. Дефект
брюшины следует закрыть эндопетлей.
После выделения указанных анатомических
ориентиров в полость вводят сетку, которую
разворачивают и устанавливают таким образом, чтобы
закрыть слабые места (аналогично
трансабдоминальной пластике). Сетку фиксируют скобками в
стандартных точках. В том случае, если сетка большая,
фиксации не требуется, так как она будет
удерживаться внутрибрюшным давлением.
Прорастание сетки соединительной тканью
начинается через 2-3 мес. после операции, до этого
срока прорастания сетки нет, и большинство
рецидивов происходит именно в этот период.
158
Лапароскопическая
хирургия
поджелудочной
железы
На современном этапе развития хирургической
науки стало очевидным, что при лапароскопических
операциях возможны любые виды внутрибрюшных
манипуляций. Операции на поджелудочной железе
при этом не являются исключением. Однако в
настоящий момент такие операции все еще не
получили широкого распространения и требуют
дальнейшего изучения и разработки некоторых технических
и анатомических аспектов.
Широкое использование существующих на
сегодняшний день эндохирургических методик при
лечении заболеваний поджелудочной железы
ограничивается лишь сравнительно небольшим опытом
выполнения подобных вмешательств. Тем не менее
имеющийся опыт уже достаточен для
обоснованного применения подобных методик, как в экстренной,
так и в плановой хирургии поджелудочной железы.
ВИДЕОЭНДОХИРУРГИЧЕСКИЙ ЭТАП
В ЛЕЧЕНИИ ОСТРОГО
ДЕСТРУКТИВНОГО ПАНКРЕАТИТА
Применение видеоэндоскопических технологий в
последние годы позволило пересмотреть подход к
комплексному лечению больных острым
панкреатитом, особенно тяжелых его форм.
Лапароскопическое исследование, являвшееся долгое время лишь
диагностической процедурой, рассматривается
теперь как основной этап в хирургическом лечении
острого панкреатита на ранних стадиях его
развития. Возможность проведения адекватной ревизии
брюшной полости под видеоконтролем позволяет
выполнить целый ряд лечебно-диагностических
мероприятий в условиях малоинвазивного доступа.
Объем лечебных мероприятий выполняемых под
видеоэндоскопическим контролем включает в себя:
- санацию и прицельное дренирование брюшной
полости
- вскрытие и дренирование сальниковой сумки
- панкреатоскопию
- холецистостомию
- санация гнойников в забрюшинном
пространстве
- новокаиновую блокаду корня брыжейки
ободочной кишки
- канюляцию круглой связки печени.
Наличие деструктивных изменений и выпота в
сальниковой сумке служит показанием к ее
дренированию, причем возможно как сквозное дренирование
двухпросветным дренажем, так и двумя трубками для
проточного диализа с активной аспирацией.
Распространение процесса на парапанкреатиче-
скую клетчатку с образованием гнойных затеков
приводит к значительному ухудшению прогноза
течения заболевания. Вскрытие и дренирование этих
гнойников так же возможно эндохирургическим
способом как из внутри-, так и внебрюшинного
доступа.
ЛАПАРОСКОПИЧЕСКАЯ ХИРУРГИЯ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Все лапароскопические вмешательства при
патологии поджелудочной железы можно разделить на
Глава 1 1
три направления: резекция поджелудочной железы,
наложение билиоэнтеро- или гастороэнтероанасто-
мозов при злокачественных опухолях железы и
внутреннее дренирование псевдокист поджелудочной
железы.
Поджелудочная железа не визуализируется сразу
после введения лапороскопа. Однако, изменив
положение тела больного, можно достаточно хорошо
разглядеть хвост железы через желудочно-ободоч-
ную связку. Для этого используют лапароскоп с
углом обзора 30° или 45°, вводимый через умбили-
кальный доступ. С целью лучшей визуализации,
пациенту на операционном столе следует придать
положение с возвышенным головным концом и
подложить под поясничную область валик. При
разделении желудочно-ободочной связки используют
моно- или биполярную электрокоагуляцию. Этого,
как правило, достаточно для адекватного доступа.
Таким же образом можно произвести мобилизацию
двенадцатиперстной кишки по Кохеру, отделяя
брюшину латерально в сторону дуоденум и используя
комбинацию острой и тупой диссекции, освобождая
заднюю стенку двенадцатиперстной кишки.
РЕЗЕКЦИЯ ПОДЖЕЛУДОЧНОЙ
ЖЕЛЕЗЫ
Резекцию поджелудочной железы обычно
выполняют при аденокарциноме и хроническом
панкреатите [4, 5]. Впервые панкреатодуоденальная
резекция (ПДР) была описана Whipple в 1935 г., а первые
42 случая подобных операций были доложены в
1941 г. [6, 7]. Не существует пока единого мнения по
поводу выполнения ПДР при лечении аденокарци-
номы поджелудочной железы. Длительное время
ПДР сопровождалась высокой смертностью, но за
последние годы благодаря развитию реанимациии
хирургии ее удалось снизить до 5% [10, 13-17].
Таким образом, при лечении больных с аденокар-
циномой и другими опухолями поджелудочной
железы, следует учитывать возможность выполнения
панкреатодуоденальной резекции [17].
Первая лапароскопическая
панкреатодуоденальная резекция (ЛПДР) была выполнена в 1992 г.
М. Gagner с коллегами в Hotel Dieu Hospital в
Монреале [24]. Операция была проведена 33-летней
женщине с удвоением панкреатического протока и, как
результат, хроническим панкреатитом,
затрагивающим преимущественно головку поджелудочной
железы. Операция продолжалась 12 ч. Больная
провела в стационаре еще 30 дней. Первый опыт Garner и
его коллег показывает, что ЛПДР технически
сложна, но выполнима. Осложнения после нее
встречаются точно такие же, как и после традиционной ПДР.
Информация о подобных операциях стала
доступной, однако вопрос о них окончательно не
решится, пока не будет накоплен достаточный опыт в
их выполнении, а поэтому на сегодняшний день
данную методику следует рассматривать как
научную разработку.
Дистальная резекция поджелудочной железы
(ДРПЖ) выполняется при различной патологии,
такой как хронический панкреатит,
доброкачественных и злокачественных опухолях [26].
Впервые лапароскопическую ДРПЖ без
технических сложностей была выполнена Soper на свиньях
[27]. Gagner и соавторы выполнили четыре
лапароскопических дистальных панкреатэктомий у
человека [28]. Каких-либо серьезных осложнений после
операции не возникло.
Лапароскопическая локальная эксцизия фатеро-
ва соска впервые была предпринята Litwin и Rossi
[29, 30]. Лапароскопически была мобилизована
двенадцатиперстная кишка, выполнена дуоденото-
мия и эксцизия фатеровой ампулы. Затем
отдельными швами Vicril 4-0 была выполнена сфинктеро-
пластика общего желчного протока и
панкреатического протока. Дефект после дуоденотомии был
ликвидирован эндоскопическим сшивающим
аппаратом (Endo GIA).
ОПЕРАТИВНАЯ ТЕХНИКА
ЛАПАРОСКОПИЧЕСКОЙ
ПАНКРЕАТОДУОДЕНАЛЬНОЙ РЕЗЕКЦИИ
В этой операции выделяют три основных этапа:
подготовка, резекция и реконструкция. Техника,
используемая во вмешательстве схожа с таковой при
открытом доступе с модификацией Longmire и
Traverso по сохранению привратника.
Подготовка
Больной находится на операционном столе в
положении лежа на спине в неглубоком положении
Тренделенбурга с разведенными ногами. Хирург
находится между ног пациента, а ассистенты
расположены по обе стороны от больного. Иглой Вереша в
умбиликальной области по стандартной методике
накладывают пневмоперитонеум, давлением до
15 мм рт. ст. В умбиликальную область вводят 10 мм
троакар, а затем 10 мм изогнутый на 30°
лапароскоп.
При отсутствии видимых метастазов на брюшине
и печени в эпигастральной области под визуальным
16O
Лапароскопическая хирургия поджелудочной железы
контролем устанавливают второй 10 мм троакар, а
также правый и левый парамедиальные троакары.
Через эпигастральный порт щипцами Бебкока за
большую кривизну поднимается желудок.
Лапароскоп перемещается в правый парамедиальный
троакар, и таким образом хирург манипулирует обеими
руками через умбиликальный и левый
парамедиальный троакары. Оба инструмента используют для
диссекции желудочно-ободочной связки ниже
w. gastroepiploici и входа в сальниковую сумку.
Поперечные ветви желудочно-сальниковых аркад кли-
пируются, но непосредственно сама аркада
сохраняется для кровоснабжения пилоруса и антрума.
После формирования окна в 10 см становится
возможным адекватный осмотр поджелудочной
железы (ПЖ). Также возможно осмотреть верхнюю часть
сальниковой сумки для создания окна рядом с
левой хвостатой долей печени и определить место
вмешательства.
Лапароскопическая мобилизация
двенадцатиперстной кишки по Кохеру осуществляется
наложением зажимов Бебкокка на дуоденум и поднимая ее
вверх по направлению к голове больного. Затем
диссекция продолжается, чтобы отделить
двенадцатиперстную кишку от поперечно-ободочной
кишки и полой вены. Это полностью освобождает
дуоденальную аркаду и заднюю часть головки ПЖ и
крючковидного отростка. Любые подозрительные
образования должны браться лапароскопичесчки-
ми щипцами для биопсии.
Когда идентифицированы общий желчный проток
и общий печеночный проток (обычно они
расширены), для лучшего определения топографии
протоков, можно выполнить чрезкожную холангиографию
прямо через переднюю стенку протока, используя
металлическую иглу для спинномозговой пункции
22-го калибра. В редких случаях в проксимальном
протоке обнаруживается холедохолитиаз или
разрастание опухоли. Желчный пузырь, при его
наличии, должен использоваться для ретракции печени,
чтобы экспонировать ворота печени во время
резекции.
Наконец, идентифицируется ветвь средней
ободочной вены и прослеживается, пока не достигает
передней и нижней части брыжеечной вены.
Производят осторожную тупую диссекцию, используя ир-
ригационно-промывную систему с
физиологическим раствором, введенную между шейкой ПЖ и
брыжеечной и воротной венами.
Резекция
Общий желчный проток, покрытый брюшиной,
открывается спереди и латерально так, чтобы
обеспечить безопасную, с сохранением воротной вены и
печеночной артерии, диссекцию. Используя сильно
закругленную иглу, через доступ в правом
подреберье под желчный проток подводят «держалку» и
производят его незначительную ретракцию. На
желчном протоке делают надрез длиной 2 см около
границы ПЖ или выше, над местом впадения
пузырного протока, используя лапароскопические ножницы.
Поступающая под давлением желчь аспирируется
и посылается для посева на флору. После этого нит-
ку-«держалку» удаляют. Следующая структура,
которая будет отделена, это первая порция
двенадцатиперстной кишки, приблизительно на 1 см дисталь-
нее пилоруса. Привратник легко дифференциирует-
ся при осмотре снизу по венам Мейо. При любом
сомнении следует выполнить интраоперационную
гастроскопию и выявить пилорус
трансиллюминацией. После рассечения желудочно-ободочной связки
желудочно-сальниковые сосуды, входящие в гастро-
дуоденальные сосуды, отсекают с предварительным
двойным клипированием титановыми клипсами.
Затем под пилорус проводят прямоугольный
диссектор для формирования окна в 1 см. Это позволяет
ввести под пилорус эндоскопический линейный
сшивающий аппарат (ЭЛСА).
Так как используется 60 мм ЭЛСА, 10 мм
умбиликальный троакар меняют на 18 мм троакар с исполь
зованием 10 мм пластикового редуктора. В даль
нейшем во время операции используют редукторы
от 18 мм до 10 мм и от 18 мм до 5 мм. Таким же ob
разом рассекают дуоденально-еюнальную связку
настолько близко к проксимальной части тощей
кишки, насколько это возможно, тем же самым сши
вающим аппаратом справа от брыжеечных сосудов
Проксимальная часть тощей кишки будет переме
щена в забрюшинное пространство и освобождена
от связки Трейца. После рассечения выявляется га
стродуоденальная артерия, так как антральная
часть желудка перемещена к левому верхнему квад
ранту. Артерия отделяется от шейки ПЖ и еще боль
ше кверху от печеночной артерии. Затем гастродуо-
денальная артерия пересекается после двойного
клинирования титановыми клипсами.
Таким же образом можно использовать ЭЛСА с
сосудистыми скобками. ПЖ пересекают ножницами
над брыжеечной веной и воротной веной, начиная
снизу вверх. Нижние и верхние сосудистые аркады
ПЖ комбинированно обрабатывают коагуляцией и
клипированием. Увеличенный на экране
панкреатический проток легко визуализируется, он обнажен
слева и может быть катетеризирован детским
зондом 5-F (около 2 мм). После достижения гемостаза
пересеченных панкреатических сосудов резециру-
161
Глава 1 1
ют крючковидный отросток, отступая
приблизительно 1 см от брыжеечных сосудов и используя ЭЛСА с
двумя катриджами длиной 60 мм. Резецированную
часть помещают в большой контейнер с
закрывающимся входом и опускается в нижний квадрант
брюшной полости для позднейшего извлечения.
Затянутый кисетный шов позволяет избежать диссе-
минацию потенциально злокачественных клеток или
желудочно-кишечного секрета в брюшную полость.
Реконструкция
Необходимо наложить три анастомоза, поэтому
здесь нужны хорошие навыки по быстрой двухруч-
ной методике интракорпорального формирования и
завязывания узлов. Для этой цели
подготавливается проксимальная часть тощей кишки путем
дальнейшей мобилизации связки Трейца, несколько
сосудов обрабатываются коагуляцией и
металлическими клипсами. Тощая кишка располагаетя позади
ободочной.
Используя мягкие кишечные зажимы, для
пассажа тощей кишки формируется окно в брыжейке по-
перечноободочной кишки. Реконструкция позволит
восстановить функцию двенадцатиперстной кишки
посредством наложения пилороеюнального
анастомоза «конец в конец», панкреато-еюнального
анастомоза «конец в бок» и гепатико-еюнального
анастомоза «конец в бок». Однако первым следует
формировать панкреатический анастомоз. Из-за
необходимости наложения прецизионных швов, его
легче наложить со свободным участком тощей
кишки. В панкреатический анастомоз вводят дренаж.
Анастомоз создается при использовании
абсорбирующихся швов 4-0 с полукруглой иглой, подшивая
проток к противобрыжеечной стороне тощей кишки,
через всю стенку, накладывая 4-6 отдельных швов
начиная сзади. После наложения швов
панкреатический и желчный анастомозы укрепляются фибри-
новым клеем, который подается катетером через
прокол в брюшной стенке. Печеночную еюностомию
выполняют подобным способом с интракорпораль-
ными швами, начиная с задней стороны. В этом
случае постановку дренажа не производят, а
накладывают 6-10 швов. Расстояние между каждым
анастомозом должно быть примерно 10 см. Избыток
проксимального участка тощей кишки резецируют и
накладывают пилоро-еюноанастомоз
рассасывающейся монофиламентной нитью 3-0 с изогнутой
иглой. Задний непрерывный шов сверху
прикрывается последующим передним. На завершающей
стадии можно произвести холецистэктомию Желчный
пузырь извлекают через 18 мм умбиликальный
троакар. Спереди и позади анастомоза устанавливают
два дренажа Джексона-Пратта и выводят через
троакарные проколы в правом подреберье и правой
парамедиальной области. Приводящая еюностома
располагается приблизительно на 30 см дистальнее
гепатоеюнального анастомоза на
противобрыжеечной стороне тощекишечного участка через левый
парамедиальный прокол. Назогастральный зонд
оставляют на месте. Все фасциальные раны ушивают
рассасывающимися нитями 2-0.
В послеоперационном периоде следует
применять Соматостатин или его аналоги п/к, через
каждые 8 ч в течение 7 дней или больше, если
содержание амилазы в отделяемом из дренажа больше, чем
в 5 раз от нормы для уменьшения вероятности
возникновения панкреатических свищей.
Назогастральный зонд держат 7 дней. Для исключения
несостоятельности анастомозов на 7-е сут. после
операции выполняют R-графию желудка с жидким
контрастом. Антибиотики вводят в течение 7 дней. В/в
вводят Н2-блокаторы для предупреждения
возникновения язв тощей кишки. Для профилактики
тромбоза глубоких вен используют гепарин п/к вплоть до
выписки на амбулаторное долечивание, затем фе-
нилин под контролем протромбина. Каждые 6 ч
определяют сахар крови; при полном парентеральном
питании может понадобиться введение небольшого
уколичества инсулина. Обязательна дыхательная
гимнастика для профилактики ателектаза и
пневмонии. Панкреатический дренаж остается на 6 нед.
ВНУТРЕННЕЕ ДРЕНИРОВАНИЕ
ПСЕВДОКИСТ ПОДЖЕЛУДОЧНОЙ
ЖЕЛЕЗЫ
Псевдокисты поджелудочной железы, не
поддающиеся консервативной терапии, обычно лечатся
внутренним дренированием в желудок,
двенадцатиперстную или в тощую кишку в зависимости от
локализации кисты [43]. Наиболее часто внутреннее
чрезжелудочное дренирование выполняют под
контролем УЗИ или рентген-контролем [44, 45]. В
литературе приводятся положительные результаты
использования такой методики с частотой от 60 до
80% случаев, однако до полного разрешения
псевдокисты при таком лечении проходит от 4 до 12 нед.
Преимущество лапароскопического внутреннего
дренирования псевдокист поджелудочной железы
заключается в возможности атравматического
наложения полноценных анастомозов и в отсутствии
необходимости наружного дренирования. Первая
лапароскопическая кистогастростомия была
выполнена J. Petelin в 1991 г. [46].
162
Лапароскопическая хирургия поджелудочной железы
Наиболее часто используется техника кистогаст-
ростомии, предложенная L. Way [47]. По этой
методике, через назогастральный зонд в желудок инсуф-
лирует углекислый газ, а затем в него вводят
троакар. Раздутый желудок используется как рабочее
пространство для операции.
ВЫВОДЫ
На сегодняшний день можно отметить
недостаточный опыт выполнения лапароскопических
операций на поджелудочной железе. Тем не менее
вероятно, что в ближайшее время эндохирургические
технологии сделают рывок в диагностике и лечении
болезней поджелудочной железы. Особенно это
относится к лапароскопическому наложению
паллиативных анастомозов при опухолях железы
терминальной стадии, которые эндохирургически
выполняются относительно легко. Минимально инвазив-
ные методики лечения псевдокист привлекают не
только хирургов, но и пациентов. Однако перед тем
как отдать приоритет тому или иному способу
вмешательства врачу следует самостоятельно
выполнить ряд подобных операций, оценить
непосредственные и отдаленные результаты.
ОПЕРАТИВНАЯ ТЕХНИКА
ЛАПАРОСКОПИЧЕСКОГО ЛЕЧЕНИЯ
КИСТОЗНЫХ ОПУХОЛЕЙ И КИСТ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Техника дистальной резекции
поджелудочной железы
Больной находится на операционном столе на
правом боку. Иглой Вереша накладывают пневмо-
перитонеум в левом подреберье на 2 см ниже края
реберной дуги. С левой стороны брюшной стенки
вводят четыре 11 мм троакара.
Для гистологического исследования выполняют
пункцию кисты под лапароскопическим
визуальным контролем. Может быть выявлена кистадено-
матозная опухоль. После тщательного
диагностического исследования 30-градусным
лапароскопом осматривают ретрогастральное
пространство. Вводят зажимы Бебкока. За нижнюю часть
большой кривизны желудок поднимают и отводят в
направлении головы больного. Желудочно-обо-
дочную связку рассекают диссектором и
ножницами, сосудистые структуры пересекаются между
титановыми клипсами.
Создается пространство около 8-10 см шириной
для обследования тела и хвоста ПЖ. Резекцию
выполняют в зависимости от локализации кисты.
Предпочтение отдается дистальной резекции с
сохранением селезенки.
Рассечение начинают от нижнего края хвоста ПЖ,
который мобилизуется от селезеночных артерий и
вены. Для диссекции поперечных панкреатических
сосудов (после их лигирования) удобно
использовать ножницы с изогнутыми браншами. Для лучшей
визуализации хвоста ПЖ должны быть
мобилизованы левый ободочный угол и селезеночно-ободочная
связка. Диссекция в этой области проводиться с
предельной осторожностью. В случае кровотечения
из селезеночных сосудов, их следует лигировать.
Селезенка будет достаточно кровоснабжаться
короткими желудочными и желудочно-сальниковыми
сосудами.
ПЖ пересекают 30 мм ЭЛСА (диаметр 12 мм) или
60 мм (диаметр 18 мм). Таким образом
панкреатический проток надежно закрывается. Однако
применение ЭЛСА может вызвать кровотечение из
верхних панкреатических сосудов, в этом случае
сосуды следует поочередно лигировать.
Резецированную часть органа помещают в контейнер
размерами 10 х 10 см и извлекают через расширенный
троакарный разрез, использованный для ЭЛСА.
После санации брюшной полости и контроля на
гемостаз около места резекции ПЖ оставляется дренаж.
Энтеральное питание после дистальной
резекции ПЖ может быть начато значительно раньше,
чем после ПДР. Назогастральный зонд удаляеют на
первые сутки после операции. Разрешается пить и
постепенно рацион расширяется до обычного.
Больным разрешается ходить со вторых суток
после вмешательства.
ЛАПАРОСКОПИЧЕСКАЯ
ТРАНСГАСТРАЛЬНАЯ
КИСТОГАСТРОСТОМИЯ
Существуют две методики подобной операции.
Первая начинается с диагностической лапапроско-
пии через умбиликальный доступ. Два
дополнительных троакара вводят для экспозиции в ретрогаст-
ральном пространстве. Интраоперационно
выполняют ЭГДС. В случае когда задняя стенка желудка
плохо визуализируется, можно установить дренаж.
Лапароскопический контроль позволяет
формировать анастомоз между задней стенкой желудка и
передней стенкой кисты под визуальным контролем и
по необходимости маневрировать псевдокистой.
163
Глава 1 1
Вторая методика трансгастральной кистогастро-
стомии выполняется внутрипросветно (из желудка)
с помощью специального троакара с
расширяющейся манжетой. Эти троакары имеют на конце
раздувающийся балон для фиксации в желудке так,
чтобы внутрипросветная операция могла
выполняться с двумя дополнительными троакарами.
Используемые троакары имеют диаметр 5 и 7 мм и
поэтому не позволяют использовать клипсовый апли-
катор или ЭЛСА. Однако из-за такого небольшого
диаметра отверстия в стенке желудка получаются
небольшие, и их возможно ушивать единичными
швами 2-0 (шелк или рассасывающийся материал).
Пациент на операционном столе находится в
положении лежа на спине. Накладывают пневмопери-
тонеум. Вводят три троакара: в умбиликальной
области A1 мм), слева от срединной линии A1 мм) и
на левой стороне E мм). Первый внутрипросветный
троакар вводят в эпигастральной области выше
псевдокисты сквозь брюшную стенку и переднюю
стенку желудка. После извлечения стилета манжета
троакара раздувается, фиксируя таким образом
инструмент к стенке желудка и создавая
герметичность в его просвете. Интраоперационное введение
гастроскопа позволяет установить назогастраль-
ный зонд и проводить инсуффляцию газа в желудок
в течение всей операции. Для визуализации задней
стенки желудка вводят 5 мм прямой лапароскоп.
Второй внутрипротоковый троакар устанавливают
примерно на 8 см левее или правее места иррига-
ционно-промывной системы.
Идентифицируется киста с помощью длинных игл,
вводимых чрезкожно через переднюю стенку
желудка, и под лапароскопическим внутрипросветным
визуальным контролем фиксируется задняя стенка
желудка в области локализации кисты. Аспирация
содержимого кисты подтверждает правильное
расположение инструментов и говорит об отсутствии
повреждения сосудов. Гастростомию длиной 4-5 см
выполняют по задней стенке с помощью «держалок».
Содержимое кисты эвакуируют, полость очищают и
исследуют. Для исключения кистаденоматозной
опухоли выполняют биопсию стенки кисты.
Назогастральный зонд остается в желудке, троа-
карные балоны десуфлируют и инструменты
извлекают. Проколы в желудке закрывают отдельными ин-
тракорпоральными швами шелком 2-0. На 24-48 ч к
области анастомоза подводят дренаж Джексо-
на-Пратта. Жидкость энтерально может даваться со
вторых суток после операции. Тогда же проверяют
состоятельность анастомоза — гастрография с
жидким контрастом. Пациентов можно выписывать
на пятые сутки.
СПИСОК ЛИТЕРАТУРЫ
1. Litwin D.E.M., Girotti M.J., Poulin E.C. et al. Laparoscopic
cholecystectomy: trans-Canada experience with 2201 cases //
CJS. 1992; 35:291-6.
2. Barkun J.S., Barkun A.N., Sampalis J.S. et al. Randomized
controlled trial of laparoscopic vs. minicholecystectomy //
Lancet. 1992; 2:1116-119.
3. Johnson D., Litwin D., Osachoff J. et al. Postoperative
respiratory function after laparoscopic cholecystectomy // Surg
Laparosc Endosc. 1992; 2: 221-226.
4. Jordan C.L. Pancreatic resection for pancreatic cancer in
surgical diseases of the pancreas. In: Howard J.M., Jordan G.L.,
Reber H.A. eds. Surgical Diseases of the Pancreas.
Philadelphia: Lea & Febiger, 1987: 666-714.
5. Howard J.M. Surgical treatment of chronic pancreatitis. In:
Howard J.M., Jordan G.L., Reber H.A. eds. Surgical Diseases of
the Pancreas. Philadelphia: Lea & Febiger, 1987:496-521.
6. Whipple A.O., Parsons W.B., Mullins C.R. Treatment of
carcinoma of the pancreas and ampullary region. // Ann. Surg.
1935; 102:763-779.
7. Whipple A.O. Rationale of radical surgery for cancer of the
ampullary region. Ann. Surg. 1941; 114: 612-615.
8. Cohen J.R., Kuchta N., Geller N. et al. Pancreaticoduode-
nectomy for benign disease // Ann Surg 1983; 197: 68-71.
9. Gudjonsson B. Cancer of the pancreas: fifty years of surgery.
Cancer. 1987; 60: 2284-2303.
10. Trede M., Schwall G., Saeger H.D. Survival after pancreatico-
duodenectomy//Ann. Surg. 1990; 211:447-458.
11. Cameron J.L, Crist D.W., Sitzmann J.V. et al. Factors
influencing survival after pancreaticoduodenectomy for pancreatic
surgery//Am. J. Surg. 1991; 161:120-5.
12. Tsuchiya R., Noda Т., Harada M. et al. Collective review of small
carcinomas of the pancreas. Ann. Surg. 1986; 203:77-81.
13. Crist D.W., Sitzmann J.V., Cameron J.L. Improved hospital
morbidity, mortality, and survival after the Whipple procedure //
Ann. Surg. 1987; 206: 358-365.
14. Grace PA, Pitt H.A., Tompkins R.K. et al. Decreased morbidity
and mortality after pancreaticoduodenectomy // Am. J. Surg.
1986; 151:141-8.
15. Braasch J.W., Rossi R.L., Watkins E. Jr. et al. Pyloric and gastric
preserving pancreatic resection // Ann. Surg. 1986; 204:
411-18.
16. Pellegrini C.A., Heck C.R, Raper S. et al. An analysis of the
reduced morbidity and mortality rates after
pancreaticoduodenectomy//Arch. Surg. 1989; 124:778-781.
17. Jones B.A., Langer В., Taylor B.R. et al. Periampullary tumors:
Which ones should be resected? // Am. J. Surg. 1985; 149:
46-52.
18. Peters J.H., Ortega A., Lehnerd S.L et al. The physiology of
laparoscopic surgery: pulmonary function after laparoscopic
cholecystectomy. Surg Lap arose Endosc 1993; 3: 370-74.
1Б4
Лапароскопическая хирургия поджелудочной железы
19. Frazee R.C., Roberts J.W., Okeson G.C. et al. Open versus
laparoscopic cholecystectomy: a comparison of postoperative
pulmonary function//Ann. Surg. 1991; 213: 651-4.
20. Harmon G., Senagore A., Kilbride M. et al. Cortisol and 1L-G
response attenuated following laparoscopic colectomy. Surg
Endosc 1993; 7: A66 (abstract).
21. Aktan A.O., Buyukgebiz 0., Yegen C. et al. How minimally
invasive is laparoscopic cholecystectomy // Br. J. Surg. 1993;
80: S43 (suppl).
22. Dominion L, Benevento A., Cacano G. et al. Acute phase
response after laparoscopic and open cholecystectomy// Br. J.
Surg. 1993; 80: S44 (suppl.)
23. Warshaw A., Fernandez-Del Castillo С Pancreatic carcinoma //
NEJM. 1992; 326: 455-65.
24. Personal communication with M. Gagner, 1993.
25. Frey CF, Child CG, Fry WJ. Pancreatectomy for chronic
pancreatitis //Ann. Surg. 1976; 184:403-414.
26. Sarle J.C, Nacchiero M., Garani F. et al. Surgical treatment of
chronic pancreatitis: Report of 134 cases treated by resection
or drainage //Am. J. Surg. 1982; 144: 317-321.
27. Soper N.J., Brunt L.M., Dunnegan D.L et al. Laparoscopic
distal pancreatectomy in the porcine model // Surg. Endosc.
1993; 7:120 A46 (abstract).
28. Personal communication with M. Gagner, 1993.
29. Wise L, Pizzimbono C, Dehner L.R Periampullary cancer: a
clinicopathologic study of sixty-two patients // Am. J. Surg.
1976; 131:141-8.
30. Schlippert W.f Lucke D., Anuras S. et al. Carcinoma of the
papilla of Vater//Am. J. Surg. 1978; 135:763-770.
31. Easter D.W., Cuschieri A., Nathanson L.K. et al. The utility of
diagnostic laparoscopy for abdominal disorders // Arch. Surg.
1992; 127: 379-383.
32. Warshal A.I., Zhuoyun G., Wittenberg J. et al. Preoperative
staging and assessment of resectability of pancreatic cancer //
Arch. Surg. 1990; 125: 230-233.
33. Huibregtse K., Katon R.M., Coene P.P. et al. Endoscopic pal
liative treatment in pancreatic cancer // Gastrointest. Endosc.
1986; 32: 334-8.
34. Soehendra N., Grimm H., Berger B. et al. Malignant jaun dice:
results of diagnostic and therapeutic endoscopy // World 1
Surg. 1989; 13:171-7.
35. Anderson J.R., Sorensen S.M., Kruse A. et al. Randomized trial
of endoscopic endoprosthesis versus operative bypass in
malignant obstructive jaundice // Gut. 1989; 30:1132-35.
36. Hyoty M.K., Nordback I.H. Biliary stent or surgical bypass in
unresectable pancreatic cancer with obstructive jaundice //
ActaChir. Scand. 1990; 156: 391-96.
37. Sarr M.G., Cameron J.L. Surgical management of unresect
able carcinoma of the pancreas // Surgery. 1982; 91:123-33.
38. Gough I.R., Mumm G. Biliary and duodenal bypass for car
cinomaof the head of the pancreas//J. Surg. Oncol. 1984; 26:
282-284.
39. Sarfeh J., Rypins E.B., Jakowatz J.G., Juler G.L A prospective
randomized clinical investigation of cholecystoenterostomy
and choledochoenterostomy // Am. 1 Surg. 1988; 155:
411-414.
40. Shimi S., Banting S., Cuschieri A. Laparoscopy in the man
agement of pancreatic cancer: endoscopic cholecystojeju
nostomy for advanced disease//Br. 1 Surg. 1992; 79:317-19.
41. Gagner M., Soulez J., Deslandre D. Hepaticojejunostomy
(Submitted for publication.).
42. Weaver D.W., Wiencek R.G., Bouwman D.L. et al. Gastro
jejunostomy: is it helpful in patients with pancreatic cancer //
Surgery. 1987; 102: 608-613.
43. Anderson M.C., Chapman W.C. Pseudocysts of the pancreas.
In: Howard J.M., Jordan G.L, Reber H.A., eds. Surgical Dis
eases of the Pancreas. Philadelphia: Lea & Febiger, 1987:
564-590.
44. Nunez D. Jr., Yrizrry J.M., Russell E. et al. Transgastric drainage
of pancreatic fluid collections // Am. J. Roentgenology. 1985;
145:815-818.
45. Matzinger F.R.K., Ho G.S., Yee A.C. et al. Pancreatic pseudo-
cysts drained through a percutaneous transgastric approach. //
Radiology 1988; 167:431-434.
46. Personal communication with J. Petelin, 1993.
47. Personal communication with L. Way, 1993.
48. Baldwin W.M. The pancreatic ducts in man together with a study
of microscopical structure of the minor duodenal pa pilla // The
Anatomical Record 1911; 5:197-228.
49. Stern CD. A historical perspective on the discovery of the
accessory duct of the pancreas, the ampulla «of Vater» and
pancreas divisum // Gut. 1986; 27: 203-202.
50. Cremer M., Deviere J., Delhaye M. et al. Stenting in severe
chronic pancreatitis: results of medium-term follow-up in
seventy-six patients//Endoscopy. 1991; 23:171-176.
51. Huibregtse K., Schneider В., Vrij A.A. et al. Endoscopic pan
creatic drainage in chronic pancreatitis // Gastrointest. Endosc
1988; 34: 9-15.
52. Carr-Locke D.L. Pancreas divisum: the controversy goes on*? //
Endoscopy. 1991; 23: 88-90.
53. Delhaye M., Engelholm L, Cremer M. Pancreas divisum: con
genital anatomic variant or anomaly? // Gastroenterol. 1985
89:951-958.
54. Burtin P., Person В., Charneau J. et al. Pancreas divisum and
pancreatitis: A coincidental association? // Endoscopy 1991;
23: 55-58.
55. Bernard J.R, Sahel J., Giovannini M. et al. Pancreas divisum is
a probably cause of acute pancreatitis: a report of 137 cases //
Pancreas 1990; 5: 248-254.
56. Widdison A.L., Alvarez C, Karanjia N.D. et al. Experimental
evidence of beneficial effects of ductal decompression in chronic
pancreatitis//Endoscopy 1991; 23:151-154.
57. Staritz M., Buschenfelde K.H. Elevated pressure in the dor sal
part of pancreas divisum: the cause of chronic pancre atitis? //
Pancreas. 1988; 3:108-110.
165
Глава 1 1
58. Warshaw A.L., Simeone J.F., Schapiro R.H. Evaluation and
treatment of the dominant dorsal duct syndrome // Amer. 1
Surg. 1990; 159: 59-66.
59. Blair A., Russel R., Cotton P. Resection for pancreatitis in
patients with pancreas divisum// Ann. Surg. 1984; 200:590-4.
60. McCarthy J., Geenan J.E., Hogan W.J. Preliminary experi ence
with endoscopic stent placement in benign pancreatic diseases
//Gastrointest. Endosc. 1988; 34:16-18.
61. Lans J., Geenan J.E., Johanson J. et al. Endoscopic therapy in
patients with pancreas divisum and acute pancreatitis: a
prospective randomized controlled clinical trial // Gastroen.
terology. 1991; 100: A831.
62. Lehman G.A., Sherman S., Nisi R. et al. Pancreas divisum:
results of minor papilla sphincterotomy // Gastrointest En dose
1993; 39:1-8.
63. Siegel J.H., Ben-Zvi J.S., Pullano W. et al. Effectiveness of
endoscopic drainage for pancreas divisum: endoscopic and
surgical results in 31 patients // Endoscopy. 1990; 22:
129-133.
64. Boyden E.A. Anatomy of the choledochoduodenal junction in
man // Surg. Gynecol. Obstet. 1957; 104:641-652.
65. Gregg J.A., Carr-Locke D.L Endoscopic pancreatic and bil iary
manometry in pancreatic, biliary, and papillary disease, and
after endoscopic sphincterotomy and surgical sphinc tero-
plasty//Gut. 1984; 25:1247-1254.
66. Raddawi H.M., Geenen J.E., Hogan W.J. et al. Pressure meas
urements from biliary and pancreatic segments of sphincter of
Oddi. Dig Dis Sci 1991; 36: 71-74.
67. Stobbe C.K., ReMine W.H., Baggenstoss A.H. Pancreatic li
thiasis//Surg. Gynecol. 1970; 131:1090-1099.
68. Pitchumoni C.S., Mohan AT. Pancreatic stones. In:
Gastroenterology Clinics of North America. Philadelphia: W.B.
Saunders. 1990; 19: 873-93.
69. Ammann R.W., Muench R., Otto R. et al. Evolution and
regression of pancreatic calcification in chronic pancreatitis //
Gastroenterol. 1988; 95:1018-1028.
70. Schneider M.U., Lux G. Floating pancreatic duct concre ments
in chronic pancreatitis // Endoscopy. 1985; 17: 8-10.
71. Fuji Т., Amano H., Harima K. et al. Pancreatic sphinctero tomy
and pancreatic drainage in chronic pancreatitis // Gas.
trointest. Endosc. 1988; 34: 9-15.
72. Huibregtse K., Schneider В., Vrij A.A. et al. Endoscopic pan
creatic drainage in chronic pancreatitis // Gastrointest. Endosc.
1988; 34: 9-15.
73. Fuji Т., Amano H., Ohmura R. et al. Endoscopic pancreatic
sphincterotomy: technique and evaluation. Endoscopy 1989;
21:27-30.
74. Sherman S., Lehman G.A., Hawes R.H. et al. Pancreatic ductal
stones: frequency of successful endoscopic removal and
improvement in symptoms // Gastrointest. Endosc. 1991; 37:
511-517.
75. Delhaye M., Vandermeeren A., Baize M. et al. Extracorporeal
shock-wave lithotripsy of pancreatic calculi //
Gastroenterology. 1992; 102: 610-620.
76. Provansal-Cheylan M., Bernard J.P., Mariani A. et al. Oc eluded
pancreatic endoprostheses: analysis of the clogging material.
// Endoscopy. 1989; 21:63-69.
77. Raijman I., Kortan P., Haber G.B. De novo formation of
pancreatic ductal stones after pancreatic endoprosthesis
(Submitted for publication).
78. Kozarek R.A. Pancreatic stents can induce ductal changes
consistent with chronic pancreatitis // Gastrointestinal. Endosc.
1990; 36: 93-95.
79. Grimm H., Meyer W.H., Nam V.C. et al. New modalities for
treating chronic pancreatitis // Endoscopy. 1989; 21:70-74.
80. Bradley E. Pancreatic duct pressure in chronic pancreatitis //
Am. 1 Surg. 1982; 144: 313-316.
81. Kozarek R.A., Ball T.J., Patterson D.J. et al. Endoscopic
transpapillary therapy for disrupted pancreatic duct and peri-
pancreatic fluid collections // Gastroenterology. 1991; 100:
1362-70.
82. Cremer M., Deviere J., Baize M. et al. New device for en
doscopic cysto-enterostomy//Endoscopy. 1990; 22:76.
83. Sahel J. Endoscopic drainage of pancreatic cysts //
Endoscopy. 1991; 23:181-184.
84. Cremer M., Deviere J., Engelholm L. Endoscopic manage ment
of cysts and pseudocysts in chronic pancreatitis: Long term
follow-up after 7 years of experience // Gastrointest. En. dose.
1989; 35:1-9.
85. Tajiri H., Kobayashi M., Niwa H. et al. Clinical application of an
ultrathin pancreatoscope using a sequential video con verier//
Gastrointest. Endosc. 1993; 39: 371-374.
86. Riemann J.F., Kohler B. Endoscopy of the pancreatic duct:
value of different endoscope types // Gastrointest Endosc
1993; 39: 367-370.
87. Neuhaus H., Hoffmann W., Classen M. Laser lithotripsy of
pancreatic and biliary stones via 3.4 mm and 3.7 mm miniscopes:
first clinical results // Endoscopy. 1992; 24: 208-214.
Лапароскопическая
спленэктомия
Спленэктомия — оперативное вмешательство,
выполненное впервые в 1549 г. Цакарелли, в
настоящее время с постоянно возрастающей частотой
производят с использованием лапароскопической
методики. Использование данной методики
обосновано самим принципом малоинвазивной
хирургии и анатомическим расположением селезенки.
Оперативная техника «классической» спленэкто-
мии конкретизирована и обоснована, однако
оперативные манипуляции при выполнении спленэк-
томии лапароскопическим способом все еще
требуют конкретизированного описания и
систематизации.
Показания к выполнению лапароскопической
спленэктомии несколько сужены, учитывая
определенные ограничения и возможности
лапароскопической техники, по сравнению с «классической»
операцией, и могут быть представлены следующим
образом:
1. Заболевания системы крови (апластическая
анемия, тромбоцитопеническая пурпура,
первичная спленогенная панцитопения и др.).
2. Травматические повреждения селезенки
(разрывы), при отсутствии признаков профузного
кровотечения.
3. Кисты, абсцессы и опухоли селезенки.
4. Лимфомы
Противопоказания к лапароскопической
спленэктомии включают в себя следующие положения:
1. Спленомегалия.
2. Острая кровопотеря (геморрагический шок).
3. Общие противопоказания к проведению
лапароскопических операций.
4. Коагулопатии неподдающиеся коррекции.
ТОПОГРАФИЧЕСКАЯ АНАТОМИЯ
Селезенка — непарный паренхиматозный орган
брюшной полости. Своей формой напоминает
плоды бобовых. Размеры ее у взрослых варьируют в
пределах 12-14 х 7-10 х 3-4 см, вес — 140-200 г.
Соответственно расположению в брюшной
полости в селезенке различают две поверхности —
верхненаружную, диафрагмальную, и нижне-внутрен-
нюю, висцеральную. На висцеральной поверхности
имеется неправильной формы щелевидное
углубление — ворота селезенки, к которому подходит
селезеночная сосудистая ножка.
Питание селезенки осуществляется самой
крупной ветвью чревной артерии — селезеночной
артерией, отдающей по пути к воротам органа ветви к
поджелудочной железе и дну желудка.
Селезеночная артерия имеет два типа ветвления, наиболее
часто встречающийся — рассыпной тип ветвления
G0%), артерия делится на несколько ветвей на
удалении от ворот селезенки, магистральный тип
ветвления селезеночной артерии встречается в 30%
случаев — артерия делится на конечные ветви
непосредственно в воротах селезенки. Венозная
система селезенки образуется несколькими венами,
сливающимися позади поджелудочной железы и под
селезеночной артерией в селезеночную вену. На
всем протяжении селезеночной вены в нее
последовательно впадают короткие вены желудка, левая
желудочно-сальниковая вены, вены поджелудочной
железы и двенадцатиперстной кишки.
Взаиморасположение селезеночной артерии и вены
варьирует — артерия может располагаться выше и кпереди
от вены; в другом случае, вена обвивает артерию, а
Глава 1 2
в воротах селезенки находится позади нее; реже
вена находится впереди артерии.
В брюшной полости селезенка располагается ин-
траперитонеально и фиксируется связками,
образуемыми складками брюшины, идущими от
диафрагмы, большой кривизны и дна желудка,
ободочной кишки, почки: желудочно-селезеночной, в
которой проходят короткие желудочные сосуды,
селезеночно-диафрагмальной, селезеночно-тол-
стокишечной, селезеночно-почечной.
Селезенка располагается в пространстве, как бы
замкнутом органами и различными анатомическими
образованиями. Сверху и снаружи к ней прилежит
левый купол диафрагмы, снизу — поперечноободоч-
ная кишка, поджелудочная железа (хвост
поджелудочной железы чаще прилежит к воротам селезенки
или отстоит от них на 1-2 см, реже хвост
поджелудочной железы располагается в области нижнего
полюса селезенки), спереди — желудок, сзади —
левая почка и надпочечник.
Четкая дифференциация топографо-анатоми-
ческого расположения селезенки и ее сосудисто-
связочного аппарата является ведущим
критерием успешного выполнения лапароскопической
спленэктомии.
ИНСТРУМЕНТАРИЙ И ОБОРУДОВАНИЕ
ДЛЯ ЛАПАРОСКОПИЧЕСКОЙ
СПЛЕНЭКТОМИИ
Стандартный эндовидеохирургический комплекс,
игла Вереша, троакары (три троакара 10 мм,
один — 12 мм и один — 5 мм), 30° лапароскоп, эндо-
ножницы, диссектор, эндоскопический вариант
зажима Babcoc, лепестковый ретрактор с
изменяющимся углом поворота, клипаппликатор с клипсами,
сшивающий аппарат (EndoGIA-ЗО) с кассетами,
контейнер для удаления селезенки — EndoCatch, набор
стандартных хирургических инструментов.
ОПЕРАТИВНАЯ ТЕХНИКА
ЛАПАРОСКОПИЧЕСКОЙ
СПЛЕНЭКТОМИИ
Лапароскопическую спленэктомию выполняют
под интубационным наркозом с искусственной
вентиляцией легких. Рекомендуется введение назогас-
трального зонда.
Первоначальное положение пациента на
операционном столе — на спине, после введения
инструментов пациента поворачивают в боковое
положение, головной конец стола приподнимают на 10-15°
(рис. 12.1).
Операционная бригада располагается
следующим образом: хирург находится справа от
пациента, на стороне противоположной расположению
селезенки, ассистент — слева от пациента, ассистент-
видеооператор — в ножном конце операционного
стола.
Оперативная техника лапароскопической
спленэктомии подразделяется на несколько основных
этапов:
1. Наложение пневмоперитонеума и
введение троакара для лапароскопа. Пневмоперито-
неум накладывают через прокол брюшной стенки, с
помощью иглы Вереша, со стандартными
параметрами 12-14 мм рт. ст., по верхнему краю параумби-
ликальной складки. Через данную точку вводят
1A0 мм) троакар, для введения лапароскопа
рекомендуется использовать 30° оптику.
2. Ревизия брюшной полости и введение
инструментальных троакаров. После проведения
ревизии органов брюшной полости под визуальным
контролем вводят инструментальные троакары:
II A0 мм) троакар вводят в правой мезогастральной
области по средней ключичной линии, он
предназначен для введения «эндобебкокка» (захват и
отведение желудка); III A0 мм) троакар вводят в левой
мезогастральной области, он предназначен для
введения «эндоретрактора» (отведение большого
сальника); IV A2 мм) — в левом подреберье по
средней ключичной линии, для введения «рабочих»
инструментов — клипаппликатор, ножницы,
диссектор, сшивающий аппарат); V E мм) троакар вводят
по средней линии на 3-5 см ниже мечевидного
отростка; предназначен для введения мягкого атрав-
матичного зажима.
3. Мобилизация селезенки. Мобилизацию
селезенки начинают с пересечения селезеночно-обо-
дочной связки с помощью биполярной и
монополярной коагуляции, тупо и остро (рис. 12.2). На дно
желудка накладывают зажим Babcock, при тракции
дна желудка вправо натягивается желудочно-селе-
зеночная связка. Желудочно-селезеночная связка
пересекается с последовательным клипированием
и пересечением коротких сосудов желудка. После
рассечения связки видимыми становятся ворота
селезенки и хвост поджелудочной железы.
4. Выделение и пересечение сосудистой
ножки селезенки. Данный этап лапароскопичес-
168
Лапароскопическая спленэктомия
Рис. 12.1. Положение пациента и
операционной бригады при
лапароскопической спленэктомии.
1. Хирург
2. Ассистент
3. Видеоператор
4. Монитор
кой спленэктомии является наиболее
ответственным, его проведение возможно двумя методиками.
1-я методика. Мобилизованная селезенка
отводится кпереди медиально, под всей сосудистой
ножкой формируется тоннель, достаточный для
подведения бранши сшивающего аппарата,
проводится тупая препаровка с помощью диссектора
позади сосудистой ножки. В тоннель вводят бранша
сшивающего аппарата, во избежание травмы
хвоста поджелудочной железы и развития в
послеоперационном периоде реактивного панкреатита,
аппарат необходимо накладывать как можно ближе к
воротам селезенки. Артерию и вену селезенки
прошивают и пересекают. В качестве сшивающего
аппарата рекомендуется использовать аппарат
«EndoGIA-30» («Auto Suture», США) с сосудистой
белой кассетой.
2-я методика. Селезенка отводится так же, как и
при использовании 1-й методики. Сосудистая
ножка выделяется целиком при помощи тупой
диссекции, под всей сосудистой ножкой проводится
шелковая лигатура, на которую набрасывается, но не
затягивается узел, она является страховкой при
дальнейшей препаровке сосудов. Препаровку
самой сосудистой ножки селезенки проводят с
раздельным выделением артерии и вены с помощью
тупой диссекции, их перевязыванием/клипировани-
ем и пересечением.
Первая методика выделения и пересечения
сосудистой ножки селезенки при помощи сшивающего
169
Глава 1 2
Рис. 12.2. Разделение связок
селезенки при лапароскопической спле-
нэктомии.
1. Селезенка
2. Желудок
3. Толстая кишка
4. Граспер
5. Ножницы
аппарата «EndoGIA-ЗО» несомненно является
наиболее надежной, удобной и быстрой.
5. Окончательное выделение селезенки.
После пересечения сосудистой ножки селезенка
отводится медиально и выполняется ее окончательное
выделение, путем рассечения селезеночно-почеч-
ной связки электрохирургическими ножницами.
Селезенка остается «подвешенной» на селезеночно-
диафрагмальной связке. В брюшную полость
вводят контейнер, в который помещают селезенку,
после чего селезеночно-диафрагмальная связка
пересекается.
6. Удаление селезенки из брюшной полости.
Удаление селезенки из брюшной полости
производят через один из оперативных портов, чаще всего
параумбиликальный, после его расширения.
Селезенку в контейнере подводят к передней брюшной
стенке, выводят шейку контейнера через порт,
открывают контейнер, удаляют селезенку кусками с
помощью ножниц или разрушая пальцем пульпу
органа, что позволяет сохранить материал для
гистологического исследования.
7. После удаления селезенки, в положении
больного на спине, выполняют следующие
манипуляции: восстановление пневмоперитонеума,
ревизия ложа селезенки и брюшной полости, проверка
гемостаза, постановка страховочного дренажа в
левое подциафрагмальное пространство, выведение
под визуальным контролем троакаров, ушивание
ран передней брюшной стенки.
Соблюдение основных этапов
лапароскопической спленэктомии, рекомендаций по их
выполнению, в сочетании с опытом хирурга и точной
техникой выполнения самой операции, а также
соответствующее техническое обеспечение являются
залогом успешного выполнения данного оперативного
вмешательства.
17O
Лапароскпическая
хирургия в урологии
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ЭНДОВИДЕОХИРУРГИЧЕСКИХ
ДОСТУПОВ ПРИ УРОЛОГИЧЕСКИХ
ОПЕРАЦИЯХ
Особенность эндовидеохирургических операций
в урологии определяется главным образом
анатомическим расположением органов мочевыделитель-
ной системы. Они располагаются забрюшинно. Как
следствие, на практике возможно использование
двух хирургических доступов: лапароскопического и
внебрюшинного — ретроперитонеоскопического.
Анализ литературы показывает, что однозначных
неоспоримых преимуществ не имеет ни один из них.
При этом очевидно, что доступ, позволяющий
создать адекватную экспозицию зоны операции и не
затрудняющий манипуляции хирурга, имеет
решающее значение в благоприятном исходе операции.
Данные литературы не позволяют сделать
однозначный вывод о преимуществах того или иного эн-
довидеохирургического доступа к органам забрю-
шинного пространства. И методика лапароскопии, и
методика ретроперитонеоскопии имеют свои
преимущества и недостатки в определенных случаях.
Поэтому выбор оптимального доступа при
эндовидеохирургических вмешательствах в урологии
должен оставаться предметом дальнейшего изучения.
Преимуществами ретроперитонеоскопии, по
сравнению с лапароскопическим доступом,
являются: отсутствие необходимости манипуляций в
брюшной полости — соответственно исключение
риска осложнений от создания пневмоперитонеума
и осложнений со стороны внутрибрюшных органов.
Ретроперитонеоскопический доступ может
использоваться как для диагностических манипуляций,
например стадирования злокачественного
опухолевого процесса, так и для лечебных процедур: неф-
рэктомии, резекции почки, надпочечника или кист
почек, уретеролитотомии, уретеростомии, а также
лимфаденэктомии.
НЕФРЭКТОМИЯ
История развития малоинвазивных доступов для
нефрэктомии насчитывает немногим более одного
десятилетия. В 1988 г. Smith et al. впервые
предприняли попытку удалить ткань почки свиньи с
помощью ультразвуковой аспирации через
единственный порт после предварительной эмболизации ее
артерий и вен. Несмотря на почти полное удаление
ткани, операция была неудачной из-за ранения
толстой кишки. В начале 1990 г. появилось сообщение
lkar>, Netto о чрескожной нефрэктомии с помощью
граспера — через нефростомический доступ также
после предварительной эмболизации почечных
сосудов. Было удалено около 16 г ткани, при этом
примерно столько же осталось. И наконец, 25 июня
1990 г. усилиями докторов dayman, Kavoussi была
произведена первая нефрэктомия справа по поводу
онкоцитомы через 5 троакарных доступов с
максимальным диаметром 12 мм.
По мнению S.Y Nakada, T.D. Moon, 1998,
существенную помощь в проведении нефрэктомии может
оказывать использование пневморукава — руки
помощи. Последнее значительно облегчает и ускоряет
171
Глава 1 3
Рис. 13.1. Точки доступа при лапароскопической неф-
рэктомии.
1. Оптика
2. 5-мм троакар
3. 10-мм троакар
диссекцию, гемостаз, улучшает тактильное
восприятие.
В целом, данные литературы свидетельствуют,
что эндовидеохирургическая нефрэктомия
является перспективной операцией, сохраняющей все
преимущества малоинвазивного доступа при
большинстве заболеваний почек без потери качества
хирургического лечения.
Показания
Показаниями для нефрэктомии являются
доброкачественные опухоли почек и заболевания,
вызванные поражением почек, например, гипертензия
почечного генеза, сморщенная нефункционирую-
щая почка, хронические инфекционные процессы в
почках.
В настоящее время значительное
распространение находят лапароскопические операции при
заборе почек у доноров для трансплантации, так как
операцию в таких случаях производят на здоровой почке,
что исключает технические трудности, нередко
сопутствующие хирургам при операциях по поводу
воспалений, гидронефротических трансформация и т.д.
Лапароскопическая нефрэктомия как метода
лечения злокачественных опухолей почек признается
не всеми специалистами по причине сомнений в
адекватности границ удаляемых тканей, трудностей
точного определения стадии заболевания и
опасности диссеминации процесса.
Подготовка к операции
Перед операцией пациенту очищают кишечник и
проводят курс антибиотикотерапии.
Непосредственно перед операцией под рентгеноскопическим
контролем устанавливают мочеточниковыи катетер
таким образом, чтобы его раздуваемая манжетка
достигла почечной лоханки. Конечное положение
манжетки является ориентиром для введения
троакара. Также перед операцией устанавливают назо-
гастральный зонд и катетер Фолеа в мочевой
пузырь.
Техника операции
Положение пациента и расстановка
операционной бригады
Первоначально пациент лежит на спине в
положении супинации, руки располагаются вдоль
туловища. Затем пациента поворачивают и фиксируют на
боку. Хирург становится перед пациентом,
ассистент — сзади, видеооператор — рядом с хирургом,
ближе к ногам пациента. Хирург осуществляет свои
манипуляции через среднеключичные порты, а
ассистент — через передне-подмышечные.
Точки доступа
После наложения пневмоперитонеума
устанавливают пупочный порт для лапароскопа, остальные
троакары вводят под контролем зрения: два по
среднеключичной линии: большой — в подреберье,
малый — ниже уровня пупка. По
передне-подмышечной линии, выше и ниже, устанавливают еще
два малых порта (рис. 13.1).
При операции важно учитывать топографию
почки и рядом расположенных органов. Топография
правой почки представлена на рис. 13.2 и левой
почки на рис. 13.3.
Карман брюшины вдоль восходящего или
нисходящего отдела ободочной кишки вскрывают по всей
длине, мобилизуют один из углов (печеночный или
селезеночный) кишечника. Сросшуюся фасцию
кишечника вскрывают в медиальном направлении как
можно дальше, с обнажением лежащей глубже по-
172
Лапароскпическая хирургия в урологии
Рис. 13.2.
Топография правой почки.
1. Правая почка
2. Мочеточник
3. Передняя
поверхность почечной
фасции
4. Карман брюшины
5. Печень
В. Желчный пузырь
7. Толстая кишка
8. Нижняя полая вена
9. Дуоденум
Рис. 13.3.
Топография левой почки.
1. Левая почка
2. Мочеточник
3. Передняя
поверхность почечной
фасции
4. Карман брюшины
5. Селезенка
6. Толстая кишка
7. Аорта
173
Глава 1 3
8
Рис. 13.4. Мобилизация мочеточника при лапароскопической нефрэктомии.
1. Мочеточник
2. Почка
3. Почечные сосуды
4. Восходящая ободочная кишка
5. Катетер с баллоном в мочеточнике
6. Держалка на мочеточнике
7. Грасперы
8. Ножницы
чечной фасции. Справа приподнимается
двенадцатиперстная кишка, закрывающая среднюю часть
почки. Для определения положения мочеточника
следует подвигать мочеточниковый катетер.
Участок мочеточника небольшой длины
мобилизуется и отводится кпереди и кнаружи (рис. 13.4),
что позволяет определить направление рассечения
тканей в сторону почечной лоханки. Сначала
производят вскрытие почечной фасции над нижним
полюсом почки, и эта сторона освобождается первой
(рис. 13.5). Затем рассекают ткани вдоль остальных
краев и поверхностей почки. По окончании
мобилизации ассистент захватывает почку за полюса и
отводит ее кнаружи, открывая область ворот и
проходящие в них сосуды. Ткани в области ворот следует
рассекать, соблюдая особую осторожность. После
обнажения почечной вены и ее ветвей ее основной
ствол отводится в сторону, открывая нижележащую
почечную артерию.
Деление правой почечной артерии может
начинаться сразу за нижней полой веной. Слева
почечная артерия чаще всего проходит за верхним краем
почечной вены. Первой клипируется артерия, на
которую накладывается 9 мм клипсы B-3
проксимально и два дистально), а затем пересекают
(рис. 13.6). Дополнительно может быть наложена
петлевая лигатура. Если после пересечения
артерии вена не спадается, это может указывать на
наличие дополнительной артерии, которая не была
обнаружена.
Не следует накладывать на все сосуды почки
единую массивную лигатуру, так как это может привес-
Лапароскпическая хирургия в урологии
8
Рис. 13.5.
Вскрытие почечной
фасции над нижним
полюсом почки при
лапароскопической
нефрэктомии.
1. Мочеточник
2. Почка
3. Почечные сосуды
4. Восходящая
ободочная кишка
5. Катетер с
баллоном в
мочеточнике
В. Держалка на
мочеточнике
7. Грасперы
8. Ножницы
Рис. 13.Б. Клипирование почечной артерии при лапароскопической нефрэктомии.
1. Почка
2. Мочеточник
3. Почечная артерия
4. Почечная вена
5. Держалка
6. Граспер
175
Глава 1 3
Рис. 13.7. Помещение отделенной почки
в контейнер при лапароскопической не-
фрэктомии.
1. Почка
2. Мочеточник
3. Почечные сосуды
4. Контейнер
5. Грасперы
ти к формированию крупного артериально-веноз-
ного шунта.
После пересечения артерий клипируют вены.
Слева сначала пересекают надпочечниковую и
гонадную вены, ветви поясничных вен, а затем —
основную почечную вену. Если диаметр вены велик, на
нее можно наложить встречные клипсы с
противоположных сторон или клипироватьдистальные
мелкие ветви по отдельности.
После полного отделения почки от всех структур
извлекают мочеточниковый катетер, а мочеточник
пережимают и пересекают. Удерживая почку за
культю мочеточника, ее смещают выше печени или
селезенки, чтобы через большой верхний среднеключич-
ный порт ввести в брюшную полость контейнер.
После помещения почки в контейнер (рис. 13.7),
лапароскоп переносят из пупочного порта в
среднеключичный. В просвет пупочного порта
втягивается контейнер. Пациента переворачивают на
спину, и пупочный троакар вместе с горловиной
контейнера извлекают. На поверхности тела контейнер
раскрывается, в него вводят аппарат для
измельчения почки. Фрагментацию и эвакуацию тканей почки
производят под прямым визуальным контролем.
Завершают операцию стандартным методом.
ЛАПАРОСКОПИЧЕСКОЕ ЛИГИРОВАНИЕ
ЯИЧКОВОЙ ВЕНЫ ПРИ ВАРИКОЦЕЛЕ
Лечение варикоцеле до настоящего времени не
является окончательно решенной проблемой, так
как все предлагаемые методики открытого или эн-
доваскулярного лечения имеют те или иные
недостатки. К ним относятся: травматичность
хирургического доступа, трудность идентификации яичковой
артерии, техническая невозможность выполнения
окклюзии при определенных анатомических
взаимоотношениях, возможность миграции склерозиру-
ющего вещества. Лапароскопическая операция
176
Лапароскпическая хирургия в урологии
Рис. 13.8. Точки доступа при лапароскопическом кли-
пировании левой яичковой вены.
1. Оптика
2. 5-мм троакар
3. 5-мм троакар
Рис. 13.9. Лапароскопическая анатомия при клипиро-
вании левой яичковой вены и схема разреза брюшины.
1. Левые яичковые сосуды
2. Семявыносящий проток
3. Нижние надчревные сосуды
4. Внутреннее паховое кольцо
5. Линия разреза брюшины
позволяет максимально прецизионно выделить и
клиппировать все вены с сохранением артерии и
лимфатических сосудов, что значительно снижает
вероятность послеоперационных осложнений.
Техника операции
Введение 5 мм троакаров при лапароскопической
операции по поводу варикоцеле производят в
следующих точках: оптика — в области пупка, 5 мм
троакар между пупком и лоном и 5 мм троакар над
лоном (рис. 13.8).
Хирург располагается справа от пациента,
монитор со стороны ног.
Целью операции является наложение лигатур на
внутреннюю семенную вену и ее колатерали. С
левой стороны для создания доступа к нижнему
отделу поясничной мышцы, наружным подвздошным
сосудам и паховой области иногда приходится
разделять спайки между сигмовидной кишкой и брюшной
стенкой. Брюшину рассекают поперечно к оси
a.v. testicularis, на3-4см проксимальнее
внутреннего пахового кольца. Длина разреза брюшины
составляет 2-3 см (рис. 13.9).
Для обнаружения венозных колатералей следует
достичь хорошей визуализации структур забрю-
шинного пространства. Следует учитывать
возможность повреждения семявыносящего протока и
аберрантной запирательной артерии, которая
имеется у 20% пациентов.
Пучок внутренних семенных сосудов выделяют
тупым путем, стараясь не повредить бедренно-по-
ловой нерв. Артериальный ствол может быть
отделен и сохранен либо лигирован вместе со всем
пучком. Выделение и отделение семенной артерии от
окружающих ее вен является наиболее тонкой и
продолжительной частью всей операции.
177
Глава 1 3
Рис. 13.10. Выделение вен из сосудистого пучка при лапароскопическом клипировании левой яичковой вены.
1. Вена
2. Артерия
3. Дополнительные вены
4. Диссектор
Семенные вены выделяются (рис. 13.10), на них
накладывают клипсы или выполняют их
биполярную коагуляцию с последующим пересечением.
Облитерации наружной семенной вены можно
достичь биполярной коагуляцией нижних надчревных
сосудов кнутри от глубокого пахового кольца,
вблизи от начала семенной вены. Пересечение
наружных семенных вен предотвращает 10-20%
рецидивов или персистенций варикоцеле, которые имеют
место при пересечении только внутренних
семенных вен.
В результате всех выполненных манипуляций
сохраняются тонкие вены семявыносящего протока,
коллатерали кремастерных сосудов с
проксимальными подкожными бедренными ветвями и коллате-
ралями вен мошонки.
17В
Лапароскопическая
адреналэктомия
Хирургия надпочечников является одним из
наиболее значимых направлений в развитии эндовиде-
оскопии.
Первое сообщение о лапароскопической адрена-
лэктомии появилось в 1992 г. — Gagner, Suzuki,
Kawabe и др. сообщили о первой выполненной ад-
реналэктомии с помощью эндовидеохирургической
технологии, трансабдоминальным доступом, по
поводу новообразования надпочечника.
В 1993 г. появилось первое сообщение об
использовании трансторакального доступа для биопсии
надпочечника — Mack et al.
Первые результаты выполненных в разных
клиниках эндовидеохирургических адреналэктомий
позволяют говорить о перспективности данного метода
в лечении заболеваний надпочечников.
Показаниями к выполнению
эндовидеохирургической адреналэктомий являются
доброкачественные гормонально активные и неактивные
образования надпочечников без признаков инвазии в
окружающие ткани, диаметром от 2,0 до 6,0 см.
Противопоказания для выполнения
эндовидеохирургической адреналэктомий (ограничения
применения эндовидеохирургических
технологий) — опухоли диаметром менее 2,0 см, из-за
трудностей идентификации надпочечника, и более
6,0 см, из-за технических трудностей и высокого
процента вероятной малигнизации данных
опухолей; воспалительные, гнойные заболевания.
Вопрос о возможности применения
эндовидеохирургической методики в хирургическом лечении
злокачественных опухолей надпочечников и в настоящее
время находится на стадии изучения и оценки.
ТОПОГРАФИЧЕСКАЯ АНАТОМИЯ
НАДПОЧЕЧНИКОВ
Сложность выполнения адреналэктомий связана
не только с техническими аспектами хирургических
манипуляций, но и с необходимостью работы в
процессе выполнения данной операции в забрюшин-
ном пространстве, имеющем довольно сложное
строение, и на органах, располагающихся в данном
пространстве.
Надпочечники располагаются в верхней
передней части забрюшинного пространства и тесно
связаны с почками. Они находятся на уровне X и XI
грудных позвонков и заключены в общую с почками
жировую капсулу, отделяясь от последних слабо
выраженной жировой прослойкой. Правый
надпочечник имеет треугольную форму, располагаясь
основанием на вершине почки, прилегая сзади к
диафрагме.
Спереди от надпочечника лежит задне-нижняя
поверхность печени. Внутренний край правого
надпочечника непосредственно прилежит к
нижней полой вене, а иногда располагается чуть кзади
от нее. Париетальная брюшина в большинстве
случаев не покрывает правый надпочечник, так как он
спереди прикрыт печенью и частично
двенадцатиперстной кишкой. Левый надпочечник имеет фор-
179
Глава 1 А
Рис. 14.1. Кровоснабжение надпочечника.
1. Аорта
2. Правый надпочечник
3. Левый надпочечник
4. Правая почечная артерия
5. Левая почечная артерия
6. Вена правого надпочечника
7. Вена левого надпочечника
8. Артериальные ветви от нижней диафрагмальной артерии
9. Артериальные ветви от аорты
10. Артериальные ветви от почечной артерии
му полуовала или полумесяца, прилежит к перед-
невнутренней поверхности верхнего полюса
почки. Нижний край соприкасается с хвостом
поджелудочной железы и с сосудами селезенки. Задняя
поверхность левого надпочечника прилежит к
диафрагме. Передняя поверхность покрыта
париетальной брюшиной.
Каждый надпочечник снабжается кровью тремя
артериями: верхненадпочечниковой — из бассейна
диафрагмальных артерий, средненадпочечнико-
вой — непосредственно из аорты и нижненадпочеч-
никовой — из ветвей почечных артерий. Кроме того,
надпочечники могут иметь несколько
дополнительных артерий, исходящих из почечных и других
рядом расположенных крупных артериальных стволов
(рис. 14.1). Отток венозной крови из надпочечника
осуществляется через одну крупную надпочечнико-
вую вену. Из правого надпочечника центральная
вена выходит на уровне верхней его части и впадает в
нижнюю полую вену, имеет в среднем
протяженность около 5-7 мм. Центральная вена левого
надпочечника выходит из нижнего края железы и впада-
1ВО
Лапароскопическая адреналэктомия
ет в левую почечную вену, ее средняя длина
составляет примерно 15 мм.
Таким образом, надпочечники имеют довольно
сложную топографическую анатомию, знание
особенностей которой является немаловажным
фактором успешного выполнения эндовидеохирургичес-
кой адреналэктомии.
ИНСТРУМЕНТАРИЙ И ОБОРУДОВАНИЕ
ДЛЯ ЭНДОВИДЕОХИРУРГИЧЕСКОЙ
АДРЕНАЛЭКТОМИИ
Стандартный эндовидеохирургический комплекс,
игла Вереша, троакары (три троакара 10 мм,
один — 5 мм), оптический троакар VISIPORT, прямой
и 30° лапароскоп, эндоножницы, диссектор,
эндоскопический вариант зажима Babcock, лепестковый
ретрактор с изменяющимся углом поворота, кли-
паппликатор с клипсами, контейнер для удаления
надпочечника — Endocatch, набор стандартных
хирургических инструментов.
ОПЕРАТИВНАЯ ТЕХНИКА
ЭНДОВИДЕОХИРУРГИЧЕСКОЙ АДРЕНАЛЭКТОМИИ
Выбор доступа при эндовидеохирургической
адреналэктомии относится к наиболее значимым
аспектам оперативной техники. Анатомическое
строение и расположение надпочечников предполагают
различные варианты хирургического доступа.
Основными являются трансабдоминальный — боковой
и прямой, забрюшинный и, активно изучаемый в по-
Рис. 14.2. Положение
пациента при
лапароскопической адреналэктомии.
следнее время, эндовидеохирургический торакоди-
афрагмальный доступ.
Трансабдоминальный доступ.
При выполнении эндовидеохирургических
адреналэктомии расположение операционной
бригады должно обеспечивать «комфортность»
выполнения манипуляций и оптимальную
доступность объекта хирургического интереса
(положение хирургической бригады при левосторонней
адреналэктомии соответствует таковому на
рис. 12.1). На рисунке изображено расположение
операционной бригады при левосторонней
адреналэктомии трансабдоминальным боковым
доступом: хирург и видеооператор располагаются
справа от пациента, ассистент и операционная
сестра — слева, оптимальным является
использование двух видеомониторов, для удобства работы
операционной бригады. При правосторонней
адреналэктомии данным доступом операционная
бригада располагается «зеркально».
При выполнении эндовидеохирургической
адреналэктомии трансабдоминальным боковым
доступом пациент находится на операционном столе в
положении лежа на боку, противоположном стороне
поражения надпочечника, при этом операционный
стол «ломается» на уровне поясницы под углом
приблизительно 30° (рис. 14.2). Такой излом позволяет
обеспечить максимальное расхождение
подвздошной кости и реберной дуги на стороне операции,
обеспечивая удобный подход. Пациент должен быть
надежно фиксирован к операционному столу для
предотвращения сползания его во время поворотов
стола в ходе операции.
181
Глава 1 А
Рис. 14.3. Точки доступа при лапароскопической адре-
налэктомии слева.
1. Оптика
2. Троакар по передней подмышечной линии
3. Троакар по средней подмышечной линии
4. Троакар по задней подмышечной линии
В оперативной технике эндовидеохирургической
адренапэктомии трансабдоминальным боковым
доступом выделяют несколько этапов:
Этап первый. Наложение карбоксиперитонеума.
Карбоксиперитонеум накладывают в подреберной
области по срединноключичной линии латеральнее
прямой мышцы живота. Давление газа в брюшной
полости устанавливается на уровне 15 мм Нд.
Этап второй. Введение троакаров в брюшную
полость. После удаления иглы Veress на ее место
устанавливают первый троакар и вводят лапароскоп.
Два дополнительных 10-11 мм троакара вводят под
визуальным контролем соответственно по
передней и средней подмышечным линиям ниже 12 ребра
и выше подвздошного гребня. Прежде чем
установить более дорсальный, четвертый порт, который
может быть помещен на уровне задней
подмышечной линии, производят мобилизацию
селезеночного угла толстой кишки при левосторонней адрена-
лэктомии и печеночного изгиба толстой кишки при
правосторонней операции (рис. 14.3).
Этап третий. Создание экспозиции
операционного поля. Экспозиция операционного поля для
удаления надпочечника, учитывая топографо-анатомиче-
ское расположение надпочечника в забрюшинном
пространстве, создается путем мобилизации
париетальной брюшины и отведением внутренних
органов в соответствующих областях по отношению к
надпочечнику. При левосторонней адреналэктомии
проводят мобилизацию селезеночного изгиба
ободочной кишки путем рассечения листка брюшины
между толстой кишкой и нижним полюсом
селезенки. Натяжение и хорошая визуализация места
операции достигаемы путем отведения селезеночного
угла при помощи атравматичного зажима в
нижнемедиальном направлении. Забрюшинное
пространство между селезенкой и почкой открывается при
рассечении селезеночно-почечной связки. По мере
прецизионного рассечения связки, селезенка
отводится ретрактором в медиальном направлении для
предотвращения повреждения ее сосудов.
Дополнительно для увеличения удобства
оперирования больному на операционном столе
придается положение с приподнятым головным концом.
Благодаря такому положению кишечник
перемещается в нижние отделы брюшной полости, создавая
благоприятную экспозицию печеночного и
селезеночного угла ободочной кишки. Кроме того,
неизбежно накапливающаяся в ходе операции жидкость
также стекает в малый таз. При правосторонней
адреналэктомии печеночно-ободочную связку
рассекают после отведения правой доли печени в цефа-
лическом направлении с использованием широкого
ретрактора.
Этап четвертый. Диссекция надпочечника. Дис-
секцию надпочечника производят точно по границе
его капсулы и окружающей клетчатки. Для
мобилизации железы рекомендуется использовать коагу-
ляционные ножницы диаметром 10 мм с двумя
длинными активными браншами. Достаточно
большая площадь рабочей части таких ножниц
позволяет эффективно использовать их для остановки
незначительного кровотечения неизбежно
возникающего в ходе выделения надпочечника в силу
рассеянного типа кровоснабжения и невозможности
лигирования каждого сосуда в отдельности.
Диссекция правого надпочечника представлена
на рис. 14.4.
Диссекция левого надпочечника см. рис. 14.5.
182
Лапароскопическая
адреналэктомия
Рис. 14.4. Диссекция
правого надпочечника при
лапароскопической адре-
налэктомии.
1. Надпочечник
2. Почка
3. Печень
4. Нижняя полая вена
5. Правая почечная вена
Рис. 14.5. Диссекция
левого надпочечника при
лапароскопической адрена-
лэктомии.
1. Надпочечник
2. Почка
3. Селезенка
4. Толстая кишка
5. Левая почечная вена
6. Вена левого
надпочечника
7. Почечная фасция
183
Глава 1 А
Рис. 14.Б. Клипирование и пересечение вены правого
надпочечника при лапароскопической адреналэкто-
мии.
1. Надпочечник
2. Нижняя полая вена
3. Клипированная и пересеченная вена правого
надпочечника
Этап пятый. Выделение, клипирование и
пересечение центральной вены надпочечника. Вена
правого надпочечника впадает непосредственно в
нижнюю полую вену и имеет протяженность всего около
0,5 см, поэтому, для точной идентификации она
верифицируется в ходе диссекции вдоль стенки
нижней полой вены сверху вниз (рис. 14.6).
Центральная вена левого надпочечника верифицируется в
области антеромедиального края левой почки, она
имеет протяженность около 1,5 см и впадает в
левую почечную вену.
После выделения производят двойное
клипирование титановыми клипсами и пересечение
центральной вены надпочечника.
Этап шестой. Окончательное выделение и
удаление надпочечника из брюшной полости. Для
окончательного выделения надпочечника используют
ножницы с электрокоагуляцией и атравматический
зажим. Удаление надпочечника из брюшной
полости осуществляют в стандартном пластиковом
контейнере через один из проколов брюшной стенки
после рассечения апоневроза.
Этап седьмой. Дренирование брюшной полости
и ушивание проколов брюшной стенки. В конце
каждой операции проводят обязательное
дренирование брюшной полости: устанавливают два
силиконовых дренажа — один дренаж подводят к зоне
операции, второй устанавливают в латеральный
канал брюшной полости с соответствующей стороны.
Оперативная техника лапароскопической адре-
налэктомии с использованием прямого доступа
аналогична оперативной технике лапароскпической
адреналэктомии из трансабдоминального бокового
доступа, по следующим критериям: расположение
операционной бригады, параметры карбоксипери-
тонеума и этапы самой операции.
Имеются и существенные отличия:
1. Положение пациента на операционном
столе — лежа на спине, при этом операционный стол
«ломается» под углом 30° на уровне поясницы пациента.
2. Точки введения троакаров — порт для
лапароскопа устанавливают в области пупка,
дополнительные манипуляционные порты располагают по сре-
динноключичной линии ниже реберной дуги и на
уровне пупка, основной оперативный порт
устанавливают на середине расстояния от пупка до
мечевидного отростка по средней линии.
Использование прямого и бокового
трансабдоминального доступа к надпочечнику в ходе
выполнения лапароскопических адреналэктомии
выявляет определенные преимущества и недостатки
одного варианта доступа над другим.
Прямой трансабдоминальный доступ к
надпочечнику обеспечивает больший «рабочий» объем
(ширина операционного поля), при сравнении с
«рабочим» объемом, создаваемым при удалении
надпочечника посредством бокового
трансабдоминального доступа, и позволяет вводить инструменты под
более тупым углом к зоне и объекту хирургического
интереса, т.е. угол наклонения оси операционного
действия приближается к 90°. Однако создание
экспозиции операционного поля в ходе операции с
применением данного доступа требует значитель-
184
Лапароскопическая адреналэктомия
ных усилий, затрачиваемых на отведение и
удержание внутренних органов, что практически
перекрывает первые два преимущества.
Использование бокового трансабдоминального
доступа при выполнении эндовидеохирургической
адреналэктомии позволяет вводить инструменты
непосредственно к зоне и объекту хирургического
интереса, положение пациента при данном
варианте доступа значительно уменьшает
интенсивность усилий по отведению внутренних органов
при создании экспозиции операционного поля.
Данный доступ по сравнению с прямым
трансабдоминальным обеспечивает меньший «рабочий»
объем и уменьшает угол подведения инструментов
к зоне и объекту хирургического интереса. Но эти
показатели — ширина операционного поля и угол
наклонения оси операционного действия при
выполнении эндовидеохирургической
адреналэктомии трансабдоминальным боковым доступом
являются достаточными для успешного выполнения
операции.
Забрюшинный доступ.
Выполнение эндовидеохирургической
адреналэктомии с использованием забрюшинного доступа
имеет также особенностей.
Положение пациента на операционном столе ~
стандартное, лежа на боку, противоположном
стороне хирургического интереса, при этом
операционный стол «ломается» на уровне поясницы под
углом приблизительно 30°, что обеспечивает
максимальное расхождение подвздошной кости и
реберной дуги на стороне операции, обеспечивая
удобный подход к забрюшинному пространству.
Область введения первого оптического
троакара — одно из наиболее тонких мест поясничной
области — четырехугольник Лесгафта-Грюнфельда.
Точкой введения первого троакара является
середина диагонали данного четырехугольника. Для
снижения вероятности ранения межреберной
артерии и нерва XII ребра при введении троакара, а
также для лучшей ориентации в слоях поясничной
области и определения момента вхождения в
забрюшинное пространство, рекомендуется
использовать оптический троакар VISIPORT, который вводят
через 15 мм разрез в краниальном направлении под
углом от 15 до 30° к позвоночнику, в зависимости от
конституциальных особенностей пациента. Фактом,
определяющим введение троакара в забрюшинное
пространство, является визуализация верхнего
полюса почки. Введение оптического троакара
сопровождается постоянной инсуффляцией углекислого
газа под давлением 12-14 мм рт. ст.
После визуализации верхнего полюса почки,
которую рекомендуется проводить, не выводя
оптическую систему из троакара, в забрюшинном
пространстве тупым путем, оптическим троакаром и с
помощью газа (ретрокарбокснпернтонеум) создается
манипуляционная полость. Создание манипуляци-
онной полости возможно безгазовым способом,
путем введения в забрюшинное пространство
троакара с пневматической манжетой, которая при
раздувании механически создает полость.
VISIPORT заменяют на крупноформатную оптику
бокового видения C0°). Проводят обязательная
ориентация в забрюшинном пространстве и мани-
пуляционной полости.
В манипуляционную полость под контролем опти
ческой системы вводят два троакара для манипуля
торов A0 мм и 5 мм).
Первый манипуляционный троакар вводят через
10 мм разрез в точке, образованной пересечением
реберной дуги и паравертебральной линией. Второй
троакар вводят через 5 мм разрез в точке пересече
ния задней подмышечной линии и реберной дуги.
После введения троакаров осуществляют препа
ровку тканей забрюшинного пространства верх, в
каудальном направлении. Надпочечник визуализи
руется в области антеро-медиального края почки.
При использовании забрюшинного доступа для
эндовидеохирургической адреналэктомии этап-
ность выполнения самой операции сохраняется и
аналогична этапам адреналэктомии
трансабдоминальным доступом, описанным выше.
Основным преимуществом забрюшинного
доступа является непосредственный доступ к сосудам
надпочечника до начала манипуляций с самой
железой, что предупреждает отрицательные
системные гемодинамические реакции.
В качестве недостатков данного доступа можно
отметить малое рабочее пространство,
ограничение числа вводимых троакаров, подведение
инструментов к зоне хирургического интереса под
вынужденным углом (меньшим 90°), что значительно
затрудняет выполнение операции.
Таким образом, выбор эндовидеохирургического
доступа к надпочечнику не имеет однозначного
решения. Наиболее удобным и безопасным является
трансабдоминальный боковой доступ.
Торако-диафрагмальный доступ.
Как упоминалось выше, в 1993 г. появилось
первое сообщение об использовании
трансторакального доступа для биопсии надпочечника — Mack et al.
В 1997-98 гг. появились первые данные об
экспериментальных исследованиях эндовидеохирургичес-
185
Глава 1 А
кого торако-диафрагмального доступа для адрена-
лэктомии [Емельянов СИ. исоавт., PompeoE. etal.].
Выбор подобного доступа к надпочечнику
обусловлен прежде всего его предлежанием задней
поверхностью к диафрагме и проекцией на
поясничную часть диафрагмы, в области ее медиальной
ножки. Данное взаиморасположение обеспечивает
достаточный объем создаваемой оперативной
полости, достаточную визуализацию и мобилизацию
адреналовых желез, а также кровеносных сосудов
надпочечника и других образований забрюшинного
пространства. Кроме того, торако-диафрагмальный
доступ к надпочечнику обеспечивает сохранение
целостности основных фасциальных и клетчаточных
структур забрюшинного пространства, что
упрощает ориентировку в образованиях забрюшинного
пространства и снижает травматичность и риск
возникновения осложнений со стороны клетчатки
забрюшинного пространства.
Рассматривая результаты вышеперечисленных
экспериментальных исследований, можно
сформулировать основные положения выполнения эндови-
деохирургической адреналэктомии торако-диа-
фрагмальным доступом с сохранением этапности
самой операции:
1. Расположение операционной бригады и эндо-
видеохирургического оборудования — хирург и
видеооператор размещают со стороны
соответствующей зоне хирургического интереса, ассистент — на
противоположной стороне, эндовидеохирургичес-
кий комплекс располагается в ножном конце
операционного стола для предотвращения
возникновения зеркального изображения.
2. Возможное положение пациента на
операционном столе — на животе.
3. Точки введения троакаров: I троакар A0 мм)
вводят в 6 межреберье на середине расстояния
между лопаточной и паравертебральной линией, по
верхнему краю 7 ребра (для введения оптической
системы в плевральную полость); под контролем
оптической системы в плевральную полость, в зоне
проекции реберно-диафрагмального синуса,
вводят инструментальные троакары: II — 5 мм троакар
вводят в 8 межреберье по задней подмышечной
линии, III — 5 мм троакар — в 8 межреберье на
границе 2/3 и 1/3 расстояния между лопаточной и
паравертебральной линией и IV — 10 мм троакар вводят
в 9 или 10 межреберье по лопаточной линии.
4. Создание операционного поля для разреза
диафрагмы. Проводят путем смещения легкого
лепестковым ретрактором, проведенным через II
троакар, медиальную ножку поясничной части
диафрагмы захватывают атравматичным зажимом.
5. Разрез диафрагмы проводят через
медиальную ножку, вдоль реберного края.
При правосторонней адреналэктомии основным
ориентиром является нижняя полая вена. При
левосторонней связка левого легкого, от места
прикрепления которой к диафрагме отступают вверх 5-7 см
и вдоль реберного края проводят разрез
медиальной ножки диафрагмы.
6. Создание экспозиции операционного поля.
В полученный разрез диафрагмы вводят
лепестковый ретрактор, справа для оттеснения печени вниз
и краниально и слева для удержания забрюшинной
клетчатки.
7. Визуализация надпочечника. Диссекцию
клетчатки забрюшинного пространства проводят тупым
и острым путем. Выбор направления диссекции
осуществляют по основным анатомическим
ориентирам: справа — в каудальном направлении, вдоль
нижней полой вены, слева основным ориентиром
является верхний полюс левой почки. Проводят
визуализацию и мобилизацию надпочечника.
8. Выделение, клипирование и пересечение
центральной вены надпочечника.
Центральная вена надпочечника визуализируется
при диссекции забрюшинной клетчатки: справа в
каудальном направлении, вдоль нижней полой
вены, слева в области антерио-медиального края
левой почки. Проводят мобилизацию, клипирование
титановыми клипсами, дважды на протяжении и
пересечении вены.
9. Окончательное выделение надпочечника.
Надпочечник полностью выделяют из окружающих тканей и
удаляют из оперативной полости через 10 мм порт.
10. Разрез медиальной ножки поясничной части
диафрагмы ушивают непрерывным
эндоскопическим швом.
Мы считаем эндовидеохирургический
торако-диафрагмальный доступ достаточно перспективным и
требующим дальнейшего изучения ввиду
возможности прямого доступа к надпочечнику, минуя
окружающие его органы брюшной полости и
забрюшинного пространства, а главное, максимально
удобного подхода к центральным сосудам в самом начале
операции.
ОСЛОЖНЕНИЯ ПРИ ВЫПОЛНЕНИИ
ЭНДОВИДЕОХИРУРГИЧЕСКОЙ
АДРЕНАЛЭКТОМИИ
Рассматривая опыт выполнения эндовидеохи-
рургических адреналэктомии в различных клиниках,
можно сделать вывод о том, что частота неудач и ос-
186
Лапароскопическая адреналэктомия
ложнении не превышает таковую при открытых
операциях.
Из послеоперационных осложнений можно
выделить несколько групп:
1. Осложнения, связанные с введением
троакаров (кровотечение из троакарных ран,
формирование гематом в точках проколов).
2. Тромботические осложнения вен нижних
конечностей (флеботромбоз, тромбоэмболия
легочной артерии).
3. Кровотечения (кровотечения из центральной
вены надпочечника и из сосудов окружающей
клетчатки).
4. Повреждения паренхиматозных органов
(печени, селезенки, поджелудочной железы).
5. Длительный парез кишечника- нехарактерное
осложнение для эндовидеохирургической ад-
реналэктомии, однако его возникновение
возможно и обусловлено манипуляциями в забрю-
шинном пространстве с последующим отеком
данной области, что и поддерживает парез.
6. Гнойно-воспалительные осложнения
(абсцессы развиваются при условии отсутствия
адекватного дренирования зоны операции.
В заключении уместно обобщить все
вышеизложенное, выделив ряд моментов, имеющих
принципиальное значение в обеспечении успешного и
безопасного выполнения эндовидеохирургической
адреналэктомии.
Эндовидеохирургическая адреналэктомия
показана при доброкачественных гормонально активных
и неактивных образованиях надпочечников
диаметром от 2,0 до 6,0 см, без признаков инвазии в
окружающие ткани. Вопрос о возможности применения
данного метода в хирургическом лечении
злокачественных опухолей, а также образований
надпочечников больших размеров нуждается в дальнейшем
изучении и оценке.
Предпочтительным хирургическим доступом
для эндовидеохирургической адреналэктомии
является трансабдоминальный боковой. Торако-ди-
афрагмальный эндовидеохирургический доступ
требует дальнейшего изучения и клинической
апробации.
Выделение надпочечника в ходе операции
должно проводиться строго экстракапсулярно, с
применением всего комплекса современной
эндовидеохирургической аппаратуры.
187
Лапароскопическая
хирургия
в гинекологии
Общие принципы оперативной
лапароскопии в гинекологии
Операционная бригада
Пренебрежительное отношение к лапароскопии,
как к «малой» операции миновало, но не всегда и не
во всех клиниках к подбору хирургической бригады
относятся ответственно: случается, что
хирург — высококвалифицированный специалист, а в
роли ассистентов выступают операционные сестры
и студенты. По-нашему мнению, это недопустимо.
Мы полагаем, что кроме хирурга в операционную
бригаду обязательно должен входить достаточно
подготовленный 1-й ассистент, а при гистерэкто-
миях и 2-й ассистент, манипулирующий маткой и
обеспечивающий экспозицию пересекаемых
образований. Нам известно, что в некоторых ведущих
клиниках роль 2-го ассистента во время сложных
гистерэктомии выполняют лишь самые опытные
врачи и заведующие отделениями, хорошо
владеющие техникой как лапаротомной, так и
лапароскопической гистерэктомии. Полагают, что в
обязанности 1-го ассистента входит работа с камерой,
контроль за показателями приборов (инсуффлятор,
коагулятор), работа с инструментами третьей
контрапертуры, если она есть. 1-й ассистент с целью
увеличения срока службы троакаров открывает
клапан при введении инструментов со своей
стороны. Второй ассистент обрабатывает промежность и
влагалище, вводит маточный манипулятор,
осуществляет хромосальпингоскопию. Возможность
выполнения симультанной гистероскопии 2-м
ассистентом определяется уровнем его подготовки, во
всяком случае, это не должен быть учащийся. В
нашей клинике при наличии показаний симультанную
гистероскопию выполняет сам хирург. Расстановка
участников операции, применяемая в нашей
клинике, схематично изображена на рис. 15.1.
Хирург располагается слева от больной, 1-й
ассистент — напротив, 2-й — между ног пациентки.
Пациентка располагается на столе в положении для
литотомии, а во время операции в положении Трен-
деленбурга, но угол между бедрами и плоскостью
передней брюшной стенки должен быть больше
130°, иначе при необходимости манипулировать в
верхних отделах брюшной полости (аспирация
крови, резекция большого сальника) создадутся
механические помехи из-за невозможности высоко
провести инструмент в брюшную полость. В некоторых
клиниках первый ассистент располагается между
ног больной и держит один из манипуляторов, а
хирург работает левой рукой и камерой. Считаем
такую расстановку устаревшей и полагаем
необходимым каждому хирургу, как и при обычных
операциях, научиться работать равноценно обеими руками.
Используемая иногда расстановка с
расположением 1-го ассистента за спиной у хирурга (камеру он
держит правой рукой) неоптимальна, так как
исключает активное участие ассистента в операции.
Положение монитора здесь особой роли не играет, так
как практикуемое нами расположение эндовидео-
стойки под углом в 45° к оси стола позволяет без
напряжения наблюдать за экраном и хирургу и
ассистентам. Тем не менее соглашаемся с А.Е. Бугеренко
A986) в том, что желательно иметь два монитора.
Принципы наложения пневмоперитонеума и
введения первого троакара являются общими
для эндохирургии и указаны в предыдущих
главах. Обзор внутренних гениталий при введе-
188
Лапароскопическая хирургия в гинекологии
Рис. 15.1. Расположение операционной бригады при лапароскопических вмешательствах в гинекологии.
1. Хирург
2. 1 -й ассистент
3. 2-й ассистент
4. Операционная сестра
5. Инструментальный стол
6. Монитор
189
Глава 1 5
Рис. 15.2. Обзор
внутренних гениталий при
введении лапароскопа в
центральном порте.
1. Лапароскоп с
видеокамерой
2. Матка с придатками
Рис. 15.3. Вид таза при
лапароскопии.
1. Лапароскоп с
видеокамерой
2. Матка с придатками
3. Мочевой пузырь
4. Прямая кишка
5. Дугласово пространство
6. Петли тонкой кишки
1ЭО
Лапароскопическая хирургия в гинекологии
Рис. 15.4. Тазовая анатомия
при гинекологической
лапароскопии.
1. Матка
2. Яичники
3. Маточные трубы
4. Мочевой пузырь
5. Крестцово-маточные
связки
В. Ректо-сигмоидный отдел
толстой кишки
7. Подвздошные сосуды
8. Круглые связки матки
9. Правый мочеточник
10. Воронко-тазовая связка
нии лапароскопа в центральном порте
представлен на рис. 15.2 и 15.3.
С целью сокращения пребывания больной в
операционной и оптимизации работы одновременно с
наложением пневмоперитонеума 2-й ассистент может
после катетеризации мочевого пузыря ввести и
зафиксировать внутриматочную канюлю. Для операций
на придатках матки очень удобны канюли Cohen и
Quinones-Neubuser, фиксированные к кольцам
пулевых щипцов. Обратим особое внимание на установку
манипуляторов. Оперируя на придатках матки,
можно устанавливать троакары довольно низко:
2,5-3,5 см над лоном и кнаружи от боковых пузырных
связок и глубоких эпигастральных сосудов,
определяемых при диафаноскопии. Полагаем, что большую
часть операций можно выполнить из двух
дополнительных контрапертур F мм). Клипирование может
потребовать расширение левой контрапертуры до
11 мм. Удобство манипуляций при
лапароскопической гистерэктомии обеспечивается более высоким
расположением контрапертур: 5-6 см над лоном.
Существует мнение, что для лапароскопической
гистерэктомии необходимы три контрапертуры. Однако,
как свидетельствует наш опыт, при наличии
качественного маточного манипулятора (например,
отечественного ООО «Апекс») возможно выполнение
гистерэктомии из двух 6 мм контрапертур.
В нашей клинике имеется определенный опыт
использования набора «Mini Site» (Auto Suture SA,
USSC), внешний диаметр троакаров которого равен
2 мм. Можно отметить, что говорить о комфортном
оперировании при использованиии этого набора не
приходится, но выполнить стерилизацию
несложный сальпинголизис можно с очень хорошим
последующим косметическим эффектом.
Схематично тазовая анатомия при
гинекологической лапароскопии представлена на рис. 15.4.
Пациентка находится в положении Тренделенбур-
га, и кишечные петли, как правило, удается отвести
за крестцовый мыс. Как и любая операция,
лапароскопия начинается с тщательной ревизии брюшной
полости по часовой стрелке: червеобразный
отросток, печень, диафрагма (особенно при опухолях
яичника), сальник. Если при наличии спаечного про-
Глава 1 5
цесса, не визуализируется поперечная ободочная
кишка, то необходимо слегка вывести основной
троакар, чтобы убедиться в том, что кишка не
подпаяна к брюшной стенке в области введения
первого троакара. Все манипуляции завершаются
обязательным обильным промыванием брюшной полости
и малого таза физиологическим раствором, что
позволяет удалить сгустки крови, детрит, снизить
риск посткоагуляционных осложнений. Извлечение
инструментов из дополнительных контрапертур
производят под контролем зрения, а основной порт
извлекают после снятия головки при поднятой
левой рукой брюшной стенке. Этот простой прием
позволяет избежать подсасывания в троакарное
отверстие кишечных петель и прядей сальника.
Операции невысокой степени сложности
Стерилизация
Создание искусственной непроходимости
маточных труб — ИНМТ (СВ. Штыров) с целью
стерилизации лапароскопическим доступом ведет свою
историю в России с 1990 г., когда появился приказ МЗ
РФ № 484, разрешающий стерилизацию и
определяющий показания к ней. Первоначально, а
лапароскопическим доступом вообще тогда оперировали
мало, казалось, что поток пациенток для ИНМТ
будет нескончаемым. Однако параллельно с
развитием оперативной лапароскопии интерес к
стерилизации угасал, а возможность обеспечить
контрацепцию без хирургической агрессии резко снизила
количество женщин, обращающихся с просьбой
выполнить эту процедуру. В некоторых мусульманских
странах стерилизация запрещена.
Нецелесообразно подробно останавливаться на
легитимных сторонах проблемы, показаниях и
противопоказаниях к лапароскопической
стерилизации, так какони подробно изложены в приказах
министра здравоохранения № 484 от 1990 г. и № 303 от
1993 г. Рассмотрим несколько подробнее методику
лапароскопической стерилизации.
Условно все методы ИНМТ можно разделить на
электрохирургические (моно- и биполярная
коагуляция) и механические (кольца Yoon, клипсы Fielshie,
Hulka). Используется также эндотермия по К. Semm.
Полагаем, что необходимо стремиться к
унификации методик, поэтому рассмотрим указанные
методы именно под этим углом зрения. Некоторые
авторы указывают, что механические методы могут
применяться у молодых пациенток, не исключающих
возможности изменения семейного статуса. Однако
широкий спектр контрацептивных средств,
имеющихся на рынке, позволяет подобрать любой
женщине достаточно эффективную обратимую
контрацепцию. Правда, имеется точка зрения, что
механические средства стерилизации создают обратимую
ИНМТ, обеспечивая при необходимости
восстановление проходимости у 80% пациенток. То же самое
можно сказать и о кольцах Yoon, накладываемых на
затянутый в инструмент участок трубы. Осложнения
@,12-3,75%) возникают при захвате кишечника или
ранении мезосальпинкса. При применении клипс
уровень осложнений 0,71%. Метод К. Semm
(эндотермия) выгоден отсутствием грубого
повреждающего электрокоагуляционного эффекта на ткани, но
требует наличия специального зажима и
эндотермического генератора. Сомнительно, что, комплектуя
эндовидеостойку для серьезной хирургии
лапароскопическим доступом, нужно затрачивать средства
на покупку редко используемого оборудования.
Исходя из сказанного, очевидно, что следует
иметь в виду возможность создания ИНМТ
посредством моно- и биполярной коагуляции.
Монополярную коагуляцию трубы в истмическом отделе
производят диссектором на расстоянии 2 см от матки в
режиме «коагуляция — резание» в течение 5-6 с. Эта
методика имеет свои недостатки: риск ожогов,
возможность изменения кровотока в яичнике,
происходящее, по-видимому, за счет распространения тока
и вызывающего изменения функции яичников. При
отсутствии биполярных щипцов риск осложнений
можно снизить, памятуя о всех опасностях
монополярной хирургии: следить, чтобы троакар не
«наползал» на рабочую часть инструмента; не работать из
операционного канала телескопа, а через
дополнительную контрапертуру; использовать
максимальное количество газа в брюшной полости,
коагулировать трубу короткими нажатиями на педаль,
захватывая ее малыми порциями и затем пересекать
«холодными» ножницами, не активировать зажим до
соприкосновения с тканью. Подобные
предосторожности позволяют полностью избежать осложнений и,
кстати говоря, полезны для работы с
монополярными инструментами вообще. При использовании
биполярной коагуляции щипцы накладывают на истми-
ческий отдел трубы в 2 см от матки и после
эффективной коагуляции трубу пересекают короткими
прямыми ножницами. Метод высокоэффективен, число
осложнений не превышает 0,1 %. Обратимость
стерилизации невысока. Наиболее вероятно
восстановление проходимости трубы при наложении Fielshie clips
путем реанастомоза конец в конец с наложением
четырех проленовых швов G/0) на 3, 6, 9 и 12 ч.
Операции по поводу апоплексии яичника
К сожалению, в XXI в. в некоторых стационарах
операции по поводу апоплексии яичника выполня-
192
Лапароскопическая хирургия в гинекологии
ют лапаротомным доступом. Строго говоря,
лапароскопия при апоплексии яичника — простая
операция, доступная начинающему врачу и имеющая,
при прочих равных, лишь одно противопоказание:
геморрагический шок. Т.е. независимо от объема
кровопотери можно произвести операцию
лапароскопическим доступом, если нет кризиса
циркуляции. Это тем более очевидно, что современная
аппаратура позволяет получать совершенные среды
для реинфузии крови и ее препаратов быстро и
эффективно. Первым этапом любой
гинекологической операции является установка маточного
манипулятора. Можно использовать канюли Cohen,
Quinones-Neubuser (К. Storz). Затем матку
фиксируют в гиперантефлексии и приступают
собственно к лапароскопии. Следует указать, что такое
положение матки блокирует шейку мочевого пузыря,
и если операция затягивается (например, из-за
необходимости эвакуировать большие сгустки
крови), мочевой пузырь может создать
определенные помехи. Поэтому надо обязательно оставлять
на время операции мочевой катетер (см. раздел
«Общие принципы оперативной лапароскопии в
гинекологии»).
После ревизии органов брюшной полости и
малого таза и выявления участка кровотечения из
яичника осуществляют оперативный прием. Считаем
апоплексией только кровотечение из стигмы
овуляции и, соответственно, коагулируем лишь
кровоточащий участок. Действия хирурга при разрывах кист
желтого тела будут рассмотрены в соответствующих
разделах. При хорошей визуализации источника
кровотечения иногда удается остановить его из
одной контрапертуры, но троакарная ранка настолько
мала, что в целом пренебрегать хорошей
экспозицией, экономя на дополнительной контрапертуре, не
стоит. Обычно бывает достаточно ввести в дефект
ткани яичника биполярный инструмент и в течение
8-10 сактивировать его. Длительность операции не
превышает в целом 8-10 мин, а выписку пациентки
можно осуществить на 1-2-е сут. после операции.
Операции по поводу параовариальных кист и
кист яичника
Операции по поводу параовариальных кист и
небольших F-10 см) кист яичников являются
наиболее эстетичными и приносят наибольшее
удовлетворение начинающему оперировать
лапароскопическим доступом.
Техника операции
Брюшину между маточной трубой и круглой
связкой матки выделяют в бессосудистой зоне, памятуя
о крупных сосудах на боковой стенке таза
(особенно при использовании монополярной коагуляции) и
о проходящем в заднем листке широкой связки
матки мочеточнике. Фиксируя «окошко» в брюшине
любым надежным инструментом, подтягивают кисту
кверху, вылущивая ее из клетчатки, например
диссектором. Кровотечения обычно не бывает. После
полного выделения кисты гемостаз в ложе
устанавливают биполярным коагулятором: скользящими
движениями изнутри к краям разреза, что приводит
к закрытию дефекта. Швов не требуется.
Необходимости в массивной коагуляции не бывает, и нужно
всячески этого избегать, так какможет пострадать
маточная труба. Желательно выделять образование
целиком и аспирацию содержимого производить
перед самым извлечением, которое иногда
возможно через 6 мм троакар.
Вылущивание кист яичника производят схожими
действиями. Следует обратить внимание, что
необходимо захватывать капсулу так, чтобы в
инструмент не попала тонкая стенка кисты.
После рассечения капсулы короткими прямыми
ножницами вылущивание кисты происходит легко.
Не нужно экономить, рассекая яичник; длинный
разрез позволит установить адекватный гемостаз. При
разрывах кист яичников, если граница между
тканью яичника и стенкой кисты четко не определяет
ся, допустимо «освежить» края разрыва, и тогда, как
правило, граница будет видна хорошо. У больший
ства пациенток удаление стенки кисты сразу сокра
щает интенсивность кровотечения, что позволяет в
спокойных условиях произвести прецизионный ге
мостаз.
О необходимости тщательной визуальной реви
зии стенок кисты изнутри и снаружи говорить из
лишне.
Обычно пациентки, перенесшие подобные опера
ции, активизируются уже через 8-10 ч и могут быть
выписаны домой на 1-2 сут. послеоперационно! о
периода.
Коагуляция очагов наружного эндометриоза
Эта простейшая процедура может быть
выполнена любым разрушающим инструментом: эндотер-
мом, моно- или биполярным коагулятором.
Необходимо, однако, помнить, что по современным
представлениям (Ph. Koenickx), рецидив эндометриоза
отсутствует, когда полностью иссечены все его
очаги. Поэтому идеальная техника подразумевает
приподнимание очага эндометриоза вместе с
брюшиной, иссечение его и коагуляцию дефекта тканей.
Более серьезные операции будут рассмотрены в
соответствующих главах.
193
Глава 1 5
Рис. 15.5. Экспозиция воронко-тазовой связки слева.
1. Воронкотазовая связка
2. Левые придатки
3.Граспер
Рис. 15.Б. Разделение воронко-тазовой связки с
применением линейного сшивающего аппарата.
1. Маточная труба
2.Яичник
3. Воронко-тазовая связка
4. Линейный сшивающий аппарат
5. Граспер
Операции умеренной сложности
Аднексэктомия представляет следующий этап
обучения, связанный с работой на крупных
анатомических структурах (воронкотазовая связка) и
иногда (интралигаментарное или псевдоинтралигамен-
тарное расположение опухоли после лапаротомных
операций) в параметрии.
Показаниями к односторонней аднексэктомии
являются доброкачественные опухоли яичников в
репродуктивном возрасте, перекрут придатков
матки при наличии некротических изменений, эндомет-
риоидные кисты больших размеров. При отсутствии
таковых возможно сохранение ткани яичников, но
необходимо проведение динамических
лапароскопии и санаций брюшной полости. Мы полностью
согласны с А.И. Серебровым, что брюшную полость
дренировать невозможно: 6-8 ч и к дренажной
трубке «подходит» кишечник и сальник. Динамическая
лапароскопия в этих случаях радикально улучшает
исходы, в том числе и репродуктивные, у этой
группы пациенток. Отметим, что подобные операции
могут быть крайне сложными. Крайне сложной
может быть и аднексэктомия у пациенток, перенесших
лапаротомию, и особенно, гистерэктомию лапаро-
томным доступом. Нам довелось оперировать
пациентку, у которой менее чем через год после лапаро-
томной гистерэктомии без придатков была
выявлена опухоль левого яичника. Во время повторной
операции произошло ранение сигмовидной кишки,
и от дальнейших манипуляций хирурги
воздержались. На операционной лапароскопии пришлось
обнажить левый параметрии, частично скелетировав
крупные сосуды таза и, отведя конгломерат с
опухолью к центру, пересечь воронкотазовую связку,
контролируя ход мочеточника. Отделив образование от
подпаянной пузырно-маточной складки,
конгломерат с сигмовидной кишкой расположили по центру
и, натягивая придатки в сторону брюшной стенки,
поэтапно отделили опухоль от кишечника.
Морфологически — простая серозная цистаденома и гид-
росальпинкс. Опишем технику традиционной нео-
сложненной аднексэктомии. Приобретя некоторый
опыт, хирург сам выберет вид энергии, которой он
будет пользоваться. Мы никогда не используем эн-
допетли, но категорических точек зрения
касательно применения тех или иных видов энергии в
брюшной полости («в брюшной полости нет места
монополярной коагуляции») мы не придерживаемся.
Выполняя аднексэктомию, необходимо пересечь
воронкотазовую связку (рис. 15.5), собственную
связку и угол трубы. При наличии линейных
сшивающих аппаратов этот этап операции можно
выполнить с их применением (рис. 15.6).
194
Лапароскопическая хирургия в гинекологии
Среди множества видов энергии (монополярная
коагуляция, биполярная коагуляция,
ультразвуковой скальпель и т.д.), как правило, используют тот,
который доступен. Опытные хирурги, давно
работающие с монополярным током, уверенно удаляют
придатки диссектором в режиме
«коагуляция — резка» (СВ. Штыров).
Этих же принципов придерживается и казанская
школа эндохирургов [И.В. Федоров и соавт., 1998].
Рекомендуем, особенно начинающим, а также
если рядом стенка кишки, использовать биполярную
коагуляцию и ножницы. Это займет чуть больше
времени, но приучит к точному (прецизионному)
гемостазу, так какрассчитывать на ударный
гемостаз «плюс — минус полтора метра от разреза» в
случае биполярной коагуляции не приходится.
Рекомендуем также мобилизовывать задний листок
широкой связки матки, так какдругие углы зрения
при лапароскопической хирургии иногда способны
«сыграть шутку» с мочеточником. Причем чем
тяжелее интраоперационная ситуация, тем
тщательнее мы рекомендуем следить за ходом
мочеточника. Случается, например, что процесс выделения
эндометриоидной кисты, «вмурованной» в задний
листок широкой связки матки, оказывается
сложнее ее удаления. После отсечения придатков,
малый таз обязательно промывают 1,0 л
физиологического раствора и контролируют гемостаз. В
наложении швов необходимости нет. Двусторонняя
аднексэктомия как изолированная процедура, по
нашему мнению, может проводиться пожилым,
соматически отягощенным больным, если
анестезиологи возражают против расширения объема
операции.
Техника овариоэктомии предусматривает те же
приемы, но с учетом сохранения трубы:
пересечение яичниковой порции воронкотазовой связки,
собственной связки яичника и его брыжейки
(анатомическая ножка яичника).
Раздел был бы неполным, если бы мы не
обсудили проблему перекрута придатков матки. Порочная
установка об обязательном удалении придатков
матки в этой ситуации никак не покинет умы наших
гинекологов. Опираясь на опыт ведущих клиник,
считаем, что вопрос о деторзии придатков и
выполнении органосохраняющих операций, при
отсутствии некротических изменений, следует признать
решенным.
Операции по поводу зрелых тератом яичников
Подавляющее большинство операций у
пациенток с тератомами яичников выполняют теми же
техническими приемами, которые были описаны в
разделе «Аднексэктомия и вылущивание кист
яичников». Нужно заметить, что в ситуации с
тератомами случайное вскрытие капсулы может привести
к излитию жира в таз, что затрудняет операцию,
поэтому необходимо «елико возможно» стараться
не травмировать опухоль, вылущивая ее из ткани
яичника. Драматического кровотечения при этом
обычно не бывает, поэтому снизить риск
перфорации можно, отказавшись на этом этапе от
коагуляции, особенно монополярной. Вылущив тератому,
восстанавливают целостность яичника, как это
было описано ранее, биполярной коагуляцией. Швов
обычно не требуется. При больших размерах
опухоли может возникнуть необходимость удаления
истонченных участков яичника, растянутых по
капсуле тератомы. Мы это делаем лишь в самом
конце, так какпри формировании яичника его ткань
хорошо сокращается под воздействием коагуляции.
Формирующие яичник швы приходится
накладывать лишь при размерах опухоли более 15 см в
наибольшем диаметре. Следует также обратить
внимание на то, что почти у четверти больных тератомы
могут быть двусторонними и при малейших
сомнениях (сглаженность контура, удлиненная
собственная связка яичника) не нужно стесняться
производить ревизию второго яичника. Необходимо
рассечь яичник продольно так, чтобы не пропустить
наличия тератомы до 1,5-2 см в диаметре.
Аднексэктомия при тератомах у молодых женщин
производится, только если полностью отсутствует
здоровая ткань яичника или множественные
тератомы локализуются близко к брыжейке и
«героические» усилия по сохранению яичника бессмысленны.
Так, нам однажды довелось удалить из одного
яичника семь тератом, но последние три из них
располагались в воротах яичника, и в итоге пришлось
произвести овариоэктомию.
Решающее значение имеет обильное
промывание брюшной полости, чтобы снизить риск
возникновения «токсического» перитонита. Мы
используем теплый физиологический раствор в количестве
3,0-3,5 л. При небольшом солидном компоненте
извлечение макропрепарата производиться через
левую контрапертуру, расширенную до 11 мм
троакара (переходник 5/10 Semm). Большой
солидный компонент требует выполнения кольпотомии с
помощью инструмента С. С. L. (К. Storz), через
операционный канал которого жестким граспером
и извлекают препарат. Влагалище можно не
ушивать. В наших ранних наблюдениях у пациентки,
оперированной по поводу зрелой тератомы,
развился левосторонний заднебоковой параметрит и
через отверстие во влагалище в течение трех дней
выделялись волосы и жировой детрит. С тех пор в
195
Глава 1 5
течение пяти лет мы санируем брюшную полость и
малый таз до исчезновения пятен жира в
промывных водах. Осложнений не было. При малейших
сомнениях в тщательности санации брюшной
полости рекомендуем заменить хотя бы частично пнев-
моперитонеум гидроперитонеумом в положении с
опущенным ножным концом стола, и еще раз
санировать брюшную полость и малый таз. Полезно,
поместив аспиратор-ирригатор в верхние отделы
брюшной полости, подавать промывную жидкость
в направлении диафрагмы, тогда даже те
элементы, которые не удается аспирировать
непосредственно, будут смещены в нижние отделы брюшной
полости, откуда их извлечение тем или иным
способом не составит труда.
Операции высокой степени сложности
Гистерэктомия лапароскопическим доступом
Первая гистерэктомия лапароскопическим
доступом была выполнена в январе 1988 г. в США
Н. Reich. В.И. Кулаков и соавт. различают
следующие виды гистерэктомии, выполняемых с помощью
лапароскопии. Диагностическая лапароскопия с
влагалищной гистерэктомией подразумевает
использование лапароскопии с целью оценки
состояния придатков матки, контроля гемостаза, удаления
сгустков крови после операции. Влагалищная
гистерэктомия с лапароскопической ассистенцией(ла-
пароскопически ассистированная влагалищная
гистерэктомия — LAVH), лапароскопию используют для
отсечения придатков, коагуляции эндометриоза.
Дальнейшие этапы операции производят
влагалищным доступом. Лапароскопическая
гистерэктомия — все этапы операции после лигирования
сосудов матки могут быть выполнены как
лапароскопическим, так и влагалищным доступом. Тотальная
лапароскопическая гистерэктомия — все этапы
операции выполняют лапароскопическим
доступом. Лапароскопическая субтотальная
гистерэктомия, в том числе классическая интрафасциальная
гистерэктомия по Semm (C.I.S.H.). С нашей точки
зрения в этой классификации много лишнего. Во-
первых, любой гинеколог термин «тотальная
лапароскопическая гистерэктомия» расценил бы как
синоним пангистерэктомии, т.е. прилагательное
«тотальное» соотнес бы не со словом
лапароскопическая, а с объемом операции. Во-вторых,
нецелесообразно чересчур подробное разделение
лапароскопически ассистированных операций. И
наконец, в основу классификации должен быть
положен какой-либо принцип: по объему операции, по
доступу, по технике операции, что не
прослеживается у упомянутых авторов.
Полагаем, что целесообразно подразделять
гистерэктомии с использованием лапароскопического
доступа по технике операции на:
1)лапароскопически ассистированные
влагалищные гистерэктомии (LAVH);
2) лапароскопическую гистерэктомию
(классическую и аппаратную);
3) лапароскопическую гистерэктомию с
предварительным уменьшением размеров матки
(например, C.I.S.H. по Semm).
Думается, что подробное рассмотрение
лапароскопически ассистированных операций в данной
книге излишне, так как по своей сути это операции
влагалищным доступом, а лапароскопия
используется лишь для ревизии органов таза и удаления
придатков. Полностью лапароскопическая
гистерэктомия является наиболее сложной для
овладения операцией, но именно в работах Н. Reich
указывается на опыт обучения лапароскопической
гистерэктомии (ЛГ) резидентов, т.е. ординаторов в
нашем понимании. ЛГ может быть выполнена
классическими лапароскопическими
инструментами либо с помощью сшивающих аппаратов. Период
массового увлечения сшивающими аппаратами
прошел, и в настоящее время можно с
уверенностью говорить, что стоимость аппаратных операций
значительно выше, чем обычных.
Осуществив ревизию брюшной полости и малого
таза, начинайте ЛГ. Если в клинике имеется
маточный манипулятор Clermont или его отечественный
аналог ООО «Апекс», то это сильно упрощает
операцию. Тем не менее, используя обычный гистерогра-
фический зонд, мы уверенно производили ЛГ, если
размеры матки не превышают 10-11 нед. Маточный
манипулятор типа Clermont (К. Storz) позволяет
оперировать, если размеры матки не превышают
16 нед. Работает с маточным манипулятором 2-й
ассистент, в нашей клинике, как правило,
ординатор, который вполне справляется с поставленной
задачей, если знает ход типичной лапаротомной
операции. Мы выполняем ЛГ из двух контрапертур
F мм), располагающихся в пахово-подвздошных
областях, чуть выше обычных так, чтобы тело матки
не мешало манипулировать в позадиматочном
пространстве. Первоначально пересекают круглую
связку матки (рис. 15.7).
Этот этап операции очень важен, так как
определяет хорошую визуализацию параметрия и, в
последующем, сосудов. Отводя матку контралате-
рально, приподнимают связку кверху жестким
зажимом так, чтобы сформировался треугольник из
жесткого зажима (вершина) и двух складок
брюшины, идущих к стенке таза и к трубе. Обратим внима-
196
Лапароскопическая хирургия в гинекологии
Рис. 15.7. Пересечение круглой связки матки с применением биполярной коагуляции.
1. Матка
2. Маточная труба
3.Яичник
4. Круглая связка
5. Зажим для биполярной коагуляции
ние, что место пересечения связки значительно
удалено от такового при лапаротомнои операции и
приближается к внутреннему кольцу пахового
канала. Пересекая связку нужно помнить, что под ней,
чуть ближе к маточной трубе, проходит небольшая
вена, которая, однако, может не попасть в зону
коагуляции и, имбибировать кровью рыхлую параме-
тральную клетчатку, может затруднить ход
операции. После пересечения круглой связки матки, тупо
раздвигают клетчатку верхних отделов бокового
параметрия, освобождая изнутри задний листок
широкой связки матки. Затем его перфорируют и
энергично раздвигают в стороны двумя
инструментами. Воронкотазовая и собственная связка с
углом трубы полностью доступны для любых
хирургических действий.
Большинство хирургов перевязывают указанные
анатомические структуры, завязывая узлы
экстракорпорально. Тем не менее можно пересечь их и
после обработки биполярной коагуляцией
прямыми ножницами. На первом этапе обучения это
упростит ход операции и уменьшит количество
инструментов, необходимых для ее проведения.
Вскрытие пузырно-маточной складки (рис. 15.8)
производят хорошими ножницами Метценбаума,
предварительно создав тоннель и приподняв ее в
виде «тента». Низведение мочевого пузыря
обязательно производят низко, независимо тотальная
ожидается гистерэктомия или субтотальная, но
вскрытие лоннопузырной фасции осуществляют
лишь после пересечения маточных сосудов. Во
время следующего этапа операции необходимо
энергичное натяжение матки кверху, как если бы во
время лапаротомнои операции это делалось
пулевыми щипцами или штопором. Указанный прием
обеспечивает натяжение «паутины» рыхлой клет-
1Э
Глава 1 5
Рис. 15.8. Вскрытие пузырно-маточной складки при лапароскопическом удалении матки.
1. Матка
2. Придатки
3. Пересеченная круглая связка матки
4. Линия рассечения пузырно-маточной складки
чатки параметрия, отсепаровка которой позволяет
обнажить маточные сосуды (рис. 15.9 и 15.10).
Мелкие кровоточащие участки обрабатывают
биполярным инструментом. Если указанные действия
не привели к хорошему обнажению маточных
сосудов, рекомендуется еще раз, отведя матку кпереди,
обработать задний листок широкой связки матки и
скальпировать от клетчатки переднюю поверхность
матки, по прежнему не вскрывая лоннопузырную
фасцию. Всегда нужно стремиться скелетировать
маточные сосуды. После этого маточные сосуды
либо прошивают, либо пересекают после обработки
биполярным инструментом. В своей работе после
пересечения маточных сосудов, отведя их книзу и в
сторону, мы вскрываем лоннопузырную фасцию (Те
Linde) и в дальнейшем работаем, как бы «защищаясь
от мочеточника» мощной фасциальной пластинкой.
Этот прием позволяет в дальнейшем очень
спокойно, лишь прямыми хорошими ножницами в режиме
«коагуляция» выделить и пересечь кардинальные и
крестцово-маточные связки. Влагалище вскрывают
монополярной лопаточкой, перемещая ее вслед за
«ступенькой» маточного манипулятора, которую
перемещает 2-й ассистент (рис. 15.11 и 15.12).
Препарат извлекают через влагалище.
Влагалище ушивают по центру, завязывая узлы
экстракорпорально. Учитывая современные данные о
направлении купола влагалища не кпереди, а кзади,
круглые маточные связки мы не прошиваем, а
крестцово-маточные фиксируем всегда (рис. 15.13).
Обычно проводим иглу через маточно-пузырную
складку, переднюю стенку, кардинальную связку,
198
Лапароскопическая хирургия в гинекологии
Рис. 15.9. Сосуды
матки и влагалища.
1. Тело матки
2. Шейка матки
3. Маточная артерия
Рис. 15.10.
Пересечение маточной
артерии при
лапароскопическом
удалении матки.
1. Тело матки
2. Пересеченная
правая маточная
артерия
3. Мочевой пузырь
199
Глава 1 5
Рис. 15.11. Вскрытие
переднего свода
влагалища при
лапароскопической гистерэктомии.
1. Тело матки
2. Шейка матки
3. Вскрытый передний
свод влагалища
Рис. 15.12. Вскрытие
заднего свода
влагалища при
лапароскопической гистерэктомии.
1. Тело матки
2. Шейка матки
3. Вскрытый задний
свод влагалища
боковую стенку, крестцово-маточную связку с
одной стороны, а затем в обратном порядке с другой.
При необходимости (тенденция к опущению) обли-
терируем маточно-прямокишечное углубление,
сшивая крестцово-маточные связки по McCall.
В конце операции гемостаз контролируют на фоне
гидроперитонеума, что позволяет хорошо
идентифицировать любые участки кровотечения. Инстру-
SOO
Лапароскопическая хирургия в гинекологии
Рис. 15.13. Ушивание вагины непрерывным швом.
1. Просвет влагалища
2. Крестцово-маточная связка
менты извлекают, кожные контрапертуры ушивают
одиночным швом.
Возможные дополнительные приемы,
облегчающие гистерэктомию
Введение 3-го дополнительного инструмента,
при наличии опытного ассистента, позволит
использовать эту контрапертуру для аспирации —
ирригации, натяжения пузырно-маточной складки,
низведения пузыря. Некоторые авторы (СВ.
Штыров) вводят когтеобразный зажим, который
используют для тракции.
Оценку маточного кровотока производят по
цвету матки: если матка цианотична, значит, сосуды
перевязаны правильно и гемостаз адекватный.
Если же после перевязки сохраняется розовый цвет
матки, необходима тщательная ревизия — что
перевязано и где.
Операции по поводу злокачественных
новообразований
В настоящее время тазовые лимфаденэктомии
применяют главным образом для стадирования
процесса, т.е. с диагностической целью. Такая
тактика обусловлена тем, что только гистологическое
исследование удаленных лимфоузлов дает
возможность наиболее точно установить стадию
опухолевого процесса, и соответственно выбрать
адекватную онкологическую тактику.
Схематически структура системы лимфооттока
таза представлена на рис. 15.14.
Рис. 15.15 отражает важные анатомические
ориентиры, имеющие значение при тазовой
лимфаденэктомии.
Операция начинается с рассечения брюшины
между круглой и воронкотазовой связками, параллельно
оси наружных подвздошных сосудов (рис. 15.16).
После этого обнажается паравазальная клетчатка,
содержащая лимфоузлы (рис. 15.17). Клетчатка
захватывается граспером в дистальном отделе и
начинается ее диссекция от подвздошных сосудов (рис. 15.18).
Такую диссекцию выполняют частично тупым,
частично отсрум путем, при необходимости применяют
электрокоагуляцию. В проксимальном направлении
отделение паравазальной клетчатки производят до
уровня мочеточника (рис. 15.19).
Далее операция продолжается в сторону
внутренних подвздошных сосудов (рис. 15.20). Важный
фактор безопасности — выделение мочеточника, и
отведение его к средней линии (рис. 15.21).
Выделение лимфоузлов в области запирательного отвер-
сия начинается от лона. При работе в этой зоне
следует проявлять осторожность, так как довольно час-
2 СП
Глава 1 5
Рис. 15.14. Цепочки
лимфоузлов в тазу.
1. Нижняя полая вена
2. Общая подвздошная вена
3. Матка
4. Цепочки лимфоузлов
Рис. 15.15. Анатомия паховой
области и крупных сосудов,
справа.
1. Симфиз
2. Куперова связка
3. Наружная подвздошная вена
4. Наружная подвздошная
артерия
5. Нижняя надчревная артерия
В. Лимфоузел Cloquet
7. Круглая связка матки
8. Запирательные сосуды
9. Запирательный нерв
SOS
Лапароскопическая хирургия в гинекологии
Рис. 15.1 Б. Вскрытие брюшины при тазовой лим-
фаденэктомии, справа.
1. Воронкотазовая связка.
2. Круглая связка и внутреннее паховое кольцо
3. Маточная труба
4. Линия рассечения брюшины
5. Мочеточник
Рис. 15.17. Тазовая лимфаденэктомия справа:
брюшина рассечена.
1. Края рассеченной брюшины
2. Клетчатка, содержащая лимфоузлы
3. Мочеточник
газ
Глава 1 5
Рис. 15.18. Тазовая лимфаденэктомия справа: начало
удаления клетчатки.
1. Края рассеченной брюшины
2. Клетчатка, содержащая лимфоузлы
3. Граспер
4. Подвздошные сосуды
5. Ножницы
В. Мочеточник
Рис. 15.19. Тазовая лимфаденэктомия: освобождение
наружных подвздошных сосудов.
1. Медиальный край рассеченной брюшины
2. Латеральный край рассеченной брюшины
3. Кдетчатка, содержащая лимфоузлы
4. Подвздошные сосуды
5. Мочеточник
то запирательная артерия является ветвью нижней
эпигастральной артерии, образуя так называемую
«corona mortis» (рис. 15.22). Операция завершается
скелетизацией соудов и мочеточника A5.23).
Удаленный препарат извлекают через супрапубикаль-
ный порт.
Резекция большого сальника хотя и требует
большого терпения и настойчивости, однако вполне
выполнима. Расположение операционной бригады
при лапароскопическом удалении большого
сальника показано на рис. 15.1.
Техника операции
Лапароскоп помещают в левую нижнюю
контрапертуру (влагалище остается открытым после
гистерэктомии). Справа от центрального порта на рас-
SO4
Лапароскопическая хирургия в гинекологии
Рис. 15.20. Тазовая лимфаденэктомия
справа: начало удаления внутренних подвздошных
лимфоузлов.
1. Медиальный край рассеченной брюшины
2. Клетчатка, содержащая лимфоузлы
3. Подвздошные сосуды
4. Граспер
5. Ножницы
Рис. 15.21. Тазовая лимфаденэктомия
справа: удаление внутренних подвздошных
лимфоузлов.
1. Край рассеченной брюшины
2. Общие подвздошные сосуды
3. Наружные подвздошные сосуды
4. Внутренние подвздошные сосуды
5. Мочеточник
В. Клетчатка, содержащая лимфоузлы
2O5
Глава 1 5
Рис. 15.22. Обтураторный
нерв и «corona mortis»,
справа.
1. Наружная подвздошная
вена
2. Наружная подвздошная
артерия
3. Нижние эпигастральные
сосуды
4. Аберрантная запиратель-
ная артерия
5. Запирательный нерв
Рис. 15.23. Тазовая лимфа-
денэктомия: сосуды и
мочеточник скелетированы.
1. Общие подвздошные
сосуды
2. Наружные подвздошные
сосуды
3. Внутренние подвздошные
сосуды
4. Мочеточник
5. Удаленная клетчатка,
содержащая лимфоузлы
гов
Лапароскопическая хирургия в гинекологии
стоянии 8-10 см вводят еще один троакар. Через
центральный троакар вводят граспер A0 мм или
через переходник 5 мм), а выбор инструмента для
правой верхней контрапертуры определяется тем
видом энергии, который планируется использовать.
Дело в том, что применение монополярного тока
опасно повреждением кишечника, а биполярная
коагуляция не всегда обеспечивает адекватный
гемостаз, особенно при пышном сальнике. Мы не
являемся сторонниками применения сшивающих
аппаратов, но, возможно, резекция сальника — как раз
та манипуляция, где они окажутся наиболее
сберегающими время. Пока же, натягивая сальник книзу
граспером, после визуализации поперечной
ободочной кишки, коагулируем сальник биполярным
зажимом порциями и пересекаем монополярными
ножницами, используя минимальную силу тока.
Трудности: гинекологу непривычно работать в
верхних отделах брюшной полости, поэтому все время
приходиться проверять свое местонахождение.
Операция требует большого терпения и
психологической устойчивости. И главное, никогда не нужно
жалеть времени на перемещение монитора в
головной конец стола (расстановка напоминает
«французскую» для лапароскопической холецистэкто-
мии), — это время окупится сторицей во время
вмешательства.
В заключение отметим, что собственно
выполнимость операции вызывает все меньше сомнений.
Доказано, что ятрогенный разрыв капсулы опухоли
[Surwit et al., 1994] не несет риска ухудшения
прогноза при раке яичников (в отличие от спонтанного).
Получены хорошие результаты при выполнении
самых сложных операций в онкогинекологии.
Изменяются представления о самом месте операций в
лечении тех или иных больных. Так, если Ф. Новак
A987) с сожалением указывал, что элегантная
радикальная влагалищная пангистерэктомия
(операция Шауты-Амрейха) имеет тот несомненный
недостаток, что не позволяет произвести лимфаденэк-
томию; то в настоящее время наступил ренессанс
этой операции, так как лимфаденэктомию, диссек-
цию мочеточников, и ревизию брюшной полости
можно провести во время лапароскопии.
SO7
Компьютерные
технологии
в эндохирургии
ВИРТУАЛЬНАЯ РЕАЛЬНОСТЬ
И ЭНДОХИРУРГИЯ
Одной из важнейших особенностей эндохирурги-
ческих манипуляций является опосредованная
визуализация объекта воздействия. Вынужденная
фиксация оптического прибора позволяет
осмотреть внутренние структуры лишь в определенном
оптическом ракурсе. Эту проблему частично решает
использование угловой оптики, позволяющей
изменять угол зрения на объект, однако даже 30°
эндоскоп далеко не всегда может помочь при создании
необходимой операционной экспозиции.
Возникновение проблемы всестороннего осмотра зоны
интереса связано с самой концепцией малоинвазивной
хирургии, не позволяющей пожеланию перемещать
оптический порт, увеличивая операционную травму.
Частичное решение этой проблемы связано с
использованием компьютерных технологий,
позволяющих восполнять дефекты визуализации зоны
оперативного вмешательства. Это может быть сделано
с помощью трехмерного графического образа
органа, созданного на базе дооперационного
сканирования, или графической модели, полученной в
результате обработки интраоперационных
изображений.
Понятия «киберпространство» и «виртуальная
реальность» используются достаточно давно,
несмотря на это, технология виртуальной реальности как
часть медицинской индустрии делает пока свои
первые шаги.
Начало разработки систем виртуальной
реальности было положено еще во время Второй мировой
войны. Основной задачей при этом являлось
создание систем для обучения военных летчиков — авиа-
симуляторов. Впоследствии именно авиасимулято-
ры и компьютерные игры стали областями, в
которых технологии виртуальной реальности применяют
наиболее широко. Первоначально авиасимуляторы
были лишены графической составляющей:
моделировалось только физическое воздействие на
пилота — вибрация, перемещение, изменение
положения тела относительно линии горизонта. В конце
1950-х гг. электроинженер Douglas Engelbart,
бывший специалист по радарам, предположил, что
компьютеры могут служить не только для
математических расчетов, но и для графического представления
данных, однако его предположение было
отвергнуто экспертами. Примитивная компьютерная
графика заменила аналоговые видеоданные только в
70-х гг. XX в.
Первая система виртуальной реальности была
создана еще до того, как нога человека ступила на
поверхность Луны, кинематографистом, который
даже не был знаком с находившимися тогда еще в
стадии разработки компьютерами, но обладал
богатым воображением. В 1956 г. Мортон Хейлиг
(Morton Heilig) изобрел «Сенсораму» («Sensorama»).
При помощи звуковых и кинематографических
эффектов, вибрации и искусственных ароматов у
зрителя создавалось впечатление участия в фильме.
В 1957 г. тот же Мортон Хейлиг запатентовал
устройство, послужившее прототипом современных
шлемов виртуальной реальности: источником
изображения были два миниатюрных телевизора,
крепившиеся на голове перед глазами. В 1965 г. Ivan
Sutherland описал наголовный монитор (шлем), в
котором видимая картинка менялась в соответст-
2O8
Компьютерные технологии в эндохирургии
вии с положением головы в пространстве благодаря
устройству определения пространственных
координат. Разработка устройства велась в Массачусет-
ском технологическом институте и в 1969 г.
описанный монитор был создан. В 1985 г. Mike McGreevy и
Jim Humphries сконструировали первый наголовный
монитор с жидкокристаллическими экранами от
карманных телевизоров, но первый коммерческий
наголовный монитор появился на рынке только в
1989 г.
Понятие «виртуальная реальность» (virtual reality)
было введено в 1989 г. Jaron Lanier, сотрудником
фирмы «VPL Research» (США), который считал, что
это «средство, способное воссоздавать сны наяву».
Первая многопользовательская система
виртуальной реальности была продемонстрирована фирмой
Division в 1992 г.
В настоящее время существует несколько
способов «погружения» в виртуальную реальность:
- кабинные симуляторы (Cab Simulators):
пользователь находится в подвижной кабине, снабженной
системами объемного звука, полностью
имитирующей внутреннее обустройство кабины самолета или
сухопутного средства передвижения. Окна кабины
заменены компьютерными мониторами высокого
разрешения.
- спроецированная реальность (Projected Reality):
виртуальные объекты проецируются на большой
экран, пользователь как бы становится участником
фильма.
- расширенная реальность (Augmented Reality):
графическая информация проецируется на
прозрачный экран, сквозь который пользователь может
видеть предметы реального мира, получая, таким
образом, информацию о скрытых деталях.
Подобные системы в настоящее время используют в
открытой хирургии, особенно успешно в
травматологии и ортопедии. Работавшие с такими системами
врачи с восхищением отзываются о них,
характеризуя их как «сбывшуюся мечту о рентгеновском
зрении». В лапароскопической хирургии объекты
виртуальной реальности проецируются
непосредственно на операционный монитор, что позволяет
хирургу «видеть» скрытые структуры:
- телеприсутствие (Telepresence): используя
камеры и микрофоны, передающие информацию по
каналам связи, пользователь наблюдает за
происходящим на расстоянии. Подобные технологии
используют в телемедицине. При наличии
двусторонних каналов связи пользователь может не только
общаться с противоположной стороной, но и
осуществлять управление различными механизмами,
например роботами;
- виртуальная реальность на рабочем столе
(Desktop VR): смоделированные объекты
отображаются на мониторе персонального компьютера.
Возможно сочетание трехмерной и стерео графики при
применении специальных очков;
- спаренные мониторы (Visually Coupled Displays):
благодаря голливудским кинематографистам этот
тип технических устройств наиболее прочно
ассоциирован с понятием виртуальной реальности и
представляет собой шлем, в котором размещены
экраны, способные передавать как обычное
изображение, так и отдельно для правого и левого глаза
для создания стереоэффекта. Специальным
устройством отслеживают пространственные
координаты головы пользователя, в соответствии с
которыми изменяется видимое изображение.
Под виртуальной реальностью понимается
созданная искусственными средствами
аудиовизуальная (и воздействующая на иные органы
восприятия) смысловая среда, которая принимается
субъектом ее воздействия как подлинная или близкая к
подлинной. Системы виртуальной реальности
состоят из шлемов, очков, обычных и стереодисплеев,
перчаток, видео- и аудиосистем, графических
станций и персональных компьютеров, специальных
костюмов и многого другого.
На конференции в Штутгарте «Мир Виртуальной
реальности '95» было предложено разделить
виртуальную реальность на область, связанную с
моделированием представления, и область, связанную с
моделированием взаимодействия
(интерактивности). Первая создает независимый от реальности
образ, задача которого представить пользователю
особый мир. Задача интерактивных
алгоритмов — дать возможность пользователю соотносить
этот образ с реальностью, произвольно изменять
его и как-то ощущать внесенные изменения.
Именно виртуальная реальность взаимодействия
позволяет хирургу отработать во всех деталях
предстоящую операцию. Поэтому понятие
«интерактивность» является сегодня одним из основных
понятий, описывающих практически все разработки в
области не только хирургического, но и
медицинского компьютерного моделирования в целом.
МЕТОДЫ ИНТРАОПЕРАЦИОННОЙ
ВИЗУАЛИЗАЦИИ
Использование стереоскопических
изображений
При выполнении эндоскопических манипуляций
хирург контролирует свои действия, видя на мони-
2ОЭ
Глава 1 Б
торе «плоское» изображение, что затрудняет его
оценку пространственных взаимоотношений
объектов в зоне оперативного вмешательства, особенно
при прецизионных манипуляциях, выполняемых
хирургами, имеющими относительно небольшой опыт.
Применение аппаратуры для создания
стереоскопических изображений сохраняет возможность
использования присущего человеку бинокулярного
зрения, обеспечивающего точность движений в
трехмерном пространстве. Известны три метода,
использование которых позволяет использовать
обычные мониторы в качестве источников
высококачественного стерео изображения.
Цветофильтрующий метод позволяет получить
стерео изображения при помощи двухцветных
(обычно красно-синих) очков. Это самый простой и
дешевый метод получения стерео изображений, не
требующий специального электронного
оборудования. Однако при его применении, во-первых,
полностью или частично утрачивается цветопередача
полученных трехмерных изображений, во-вторых,
просмотр изображений через очки с чрезмерным
цветовым отклонением создает большую нагрузку
на зрение оператора.
Метод параллакса состоит в том, что перед левым
глазом помещают полностью прозрачный фильтр, а
перед правым мало прозрачный. Трехмерные
изображения получаются только при просмотре
движущихся объектов. Этот метод использует разное
время распознавания объектов через фильтры с
различными оптическими характеристиками. Этот
метод эффективен для быстро движущихся объектов и
не эффективен для статичных изображений, в связи
с чем его применение в эндовидеохирургии на
сегодня представляется бесперспективным.
Метод жидкокристаллического затвора (LCD
Shutter) — наиболее современный метод
воспроизведения стерео изображений. Он состоит в том, что
перед глазами наблюдателя помещают две
жидкокристаллические ячейки, которые,
последовательно чередуясь, перекрывают глаза наблюдателя.
В тот момент, когда на мониторе появляется
изображение для левого глаза, правый глаз
закрывается, а когда показывается изображение для правого
глаза — закрывается левый. Таким образом,
производят сортировку выдаваемых монитором
изображений. Этот метод требует специального
электронного оборудования, но позволяет сохранить цвет
изображений. К недостаткам такого способа
визуализации относятся снижение эффективной частоты
кадров для каждого глаза, более чем в два раза, а
также уменьшение яркости изображения, так как
половину времени каждый глаз «не видит».
Кроме этого существуют специальные мониторы,
позволяющие отображать стереоскопические
изображения, которые пользователь может
воспринимать без дополнительных приспособлений. Первый
в мире монитор с трехмерным изображением — 3D
Hyper Monitor — был разработан и выпущен на
рынок в 1999 г. корпорацией Samsung Electronics.
Экран такого монитора состоит из двух
жидкокристаллических панелей, каждая из которых отражает
половину светового потока, создавая разные
изображения для правого и левого глаза. В пресс-релизе,
посвященном выпуску монитора, представители
Samsung Electronics указывают, что первой
областью применения нового устройства, кроме
компьютерных игр станет разработка «трехмерных систем
для эндоскопической хирургии».
Применение наголовных мониторов
Бригада хирургов, оперирующих с
использованием эндоскопической техники, находится у
операционного стола в вынужденном положении: взгляд
прикован к монитору, находящемуся на
определенном удалении от глаз оператора. При длительных
вмешательствах неизбежно наступает усталость
мышц шеи, из-за длительной фиксации взгляда
могут появиться нарушения зрения и головные боли.
Максимальное удобство при выполнении
операций под видеоконтролем достигается при
достижении нормальной оси «рука — глаз», т.е.
использовании таких геометрических соотношений, при
которых рабочее пространство (операционное поле)
находится между хирургом и видеомонитором,
причем ось оптической трубки должна быть
параллельна оптической оси зрения хирурга. Такое
соотношение позволяет хирургу работать в «зрительной
арене», которая приближается к обычным
зрительным геометрическим соотношениям. Однако
проведение сложных процедур требует смещения
зрительной оси в ходе их выполнения. Такое нарушение
оси «рука — глаз» негативно сказывается на
эффективности манипуляций и безопасности операции в
целом. Более того, какое-либо незапланированное
изменение хода операции зачастую заставляет
персонал перемещать монитор из одного места
операционной в другое, для восстановления нормальных
геометрических взаимоотношений.
Для преодоления этих трудностей при
проведении сложных процедур, при которых приходится
работать в разных областях брюшной полости и
грудной клетки, возможно использование
индивидуального видеодисплея, фиксируемого к голове
оператора (HMD — Head Mounted Display). Это позволяет
избежать нарушения геометрической оси «ру-
21 О
Компьютерные технологии в эндохирургии
ка — глаз» при перемещениях оптической трубки и
инструментария от одной зоны оперирования к
другой. В наголовном мониторе хирург может
повернуть голову в сторону направления лапароскопа, что
в ряде случаев позволяет избежать эффекта
«зеркального отражения» и значительно облегчает
манипуляции. При этом не возникает необходимости
работать в парадоксальном направлении, так как
хирург всегда имеет возможность повернуть голову
в нужном направлении. Возможность этого
значительно повышает эффективность манипуляций и их
разнообразие. При применении индивидуальных
видеодисплеев не требуется уменьшения общей
освещенности в операционной, что облегчает
работу операционной сестры и всего персонала. Во
время операции могут использоваться один, два и
более (для всей хирургической бригады) мониторов.
Конструктивное решение HMD, которое имеет
бинокулярный дизайн, не только дает хирургу
ощущение объема и улучшает глубинное восприятие, но
сохраняет периферическое зрение, дает
возможность видеть операционное поле и все, что
происходит в операционной. Это очень важно, например,
при наложении трансректального анастомоза
толстой кишки после резекции сигмовидной кишки.
Хирург с HMD, находясь под стерильными простынями
между ног больного, продвигает циркулярный
сшивающий аппарат через прямую кишку,
одновременно наблюдая процесс введения с помощью
периферического зрения и то, что происходит в брюшной
полости с помощью HMD.
В настоящее время качество изображения,
достигаемого в экономически доступных устройствах,
позволяет работать в них без перерыва не более
15-20 мин. Кроме того, разрешение оптических
элементов доступных шлемов существенно ниже
разрешения операционных видеомониторов. К
использованию при эндохирургических операциях
можно рекомендовать только модели шлемов с
разрешением более 800 х 600 пикселей.
Интересные перспективы имеют шлемы, в
которых используются стереоскопические технологии,
при этом, каждый глаз получает свое изображение
от бинокулярной оптической трубки или стереока-
меры.
ВИРТУАЛЬНАЯ ЭНДОСКОПИЯ
Актуальность проблем неинвазивного
распознавания хирургических заболеваний органов
брюшной полости не нуждается в каком-либо особом
обосновании и тем более представлении.
Диагностические методы непрямой визуализации,
такие как рентгеновская компьютерная томография
(КТ), магнитно-резонансная (МРТ) томография,
трансабдоминальная ультрасонография
эффективные при распознавании хирургических заболеваний
билиарного тракта, печени и поджелудочной железы,
долгое время играли роль дополнительных
диагностических средств при исследовании желудка и
толстой кишки. Объективные трудности при
эндоскопическом исследовании правой половины толстой
кишки, невозможность рутинной эндоскопической
визуализации полости тонкой кишки, наконец, риск
опасных для жизни осложнений, связанных с
выполнением любого эндоскопического исследования, его
инвазивный характер заставляли
врачей-исследователей снова и снова обращаться к поиску менее ин-
вазивной и более эффективной диагностической
альтернативы.
К середине 1990-х гг. были определены
принципиальные схемы замены любых эндоскопических
исследований методами визуализации трехмерных
моделей внутренних органов по данным КТ, МРТ или
ультрасонографии. Сущность этих методов не
изменилась и по сей день и заключается в
объединении упорядоченных рентгеновских,
ядерно-магнитных или ультразвуковых сечений зоны
диагностического интереса в единый для визуального
восприятия массив. Этот массив может представлять собой
растровую совокупность полученных изображений,
когда диагностические изображения поставлены
одно за другим в порядке их получения, или
являться трехмерным каркасом, каждое сечение которого
является контуром, выделенным особо.
Семантически понятие «виртуальная эндоскопия»
означает «визуальную оценку потенциально
существующих внутренних структур объекта». Технология
виртуальной эндоскопии подразумевает осмотр
внутренностей любого объекта, будь он полым или нет,
существующего реально или не существующего.
Считается, что термин «виртуальная эндоскопия» является
недостаточно корректным с синтаксической точки
зрения. Определение слова «виртуальный»
подразумевает два основных компонента: «обладающий
определенными физическими свойствами» и
«производящий такие эффекты, которые нельзя распознать
формально». Определение слова эндоскопия также
имеет два значения: 1) визуализация внутренней
поверхности полых органов и 2) осмотр какой-либо
полости тела. Поэтому простое совмещение
определений слова «виртуальный» и слова «эндоскопия» не
даст синтаксически корректную фразу.
На самом деле синтаксически и семантологичес-
ки корректная фраза «виртуальная эндоскопия» оз-
211
Глава 1 В
начает, что производится «визуальная оценка
потенциально существующих внутренних структур
объекта». При этом технология виртуальной
эндоскопии подразумевает осмотр внутренностей
любого объекта, полого или нет, существующего
реального или нет. Кроме этого, поскольку
производится визуализация изображений, полученных
исключительно с помощью компьютера, можно
предположить, что термин «компьютерная
эндоскопия» был бы еще более точным (по аналогии с
компьютерной томографией и обычной томографией).
Тем не менее уже сложившиеся практика
употребления термина «виртуальная эндоскопия»,
связанная с практическим его применением,
заставляет использовать именно это словосочетание,
означающее к тому же, по оригинальному определению
R.M. Satava, «эндоскопию виртуальности».
Разумеется, виртуальная эндоскопия лишена
таких недостатков, как неудобство для больного,
возможность перфорации органов, кровотечения или
инфицирования, и могла бы вытеснить обычное
эндоскопическое исследование при условии
достаточной диагностической эффективности. Другими
привлекательными сторонами виртуальной
эндоскопии является ее универсальность и особая
польза при исследовании полостей, в которых реальное
эндоскопическое исследование по тем или иным
причинам провести нельзя, возможность прямого
перехода из одной полости в другую,
проникновение сквозь стенки органов и полостей, восприятие
топографических особенностей зоны
диагностического интереса в целом. Использование цветного и
структурного моделирования наружных и
внутренних поверхностей органов позволяет, при этом,
достичь уровня представления виртуальных объектов,
близкого к реальному.
Первые сообщения о корректно построенных
трехмерных компьютерных графических моделях
полых и паренхиматозных органов по данным КТ и
МРТ по времени их появления совпали с
достижениями персональной вычислительной техники,
которые позволили анимировать их в режиме реального
времени. В 1990 г. в Сиднее состоялся Первый
международный симпозиум, посвященный
компьютерному моделированию в медицинской эндоскопии.
В настоящее время выполнены работы по
трехмерной визуализации полостей внутреннего уха,
параназальных синусов, крупных сосудов,
пищевода, желудка, билиарных и панкреатического
протоков, толстой кишки, женской репродуктивной
системы, просветов бронхов.
Специалисты-радиологи Nakagohri T et al. из
Гарвардской медицинской школы (США) использовали
технологию виртуальной эндоскопии для
прояснения деталей хирургической анатомии
поджелудочной железы и муцин-продуцирующих опухолей.
Авторы обозначили такое исследование как
«виртуальная пакреатоскопия». Трехмерные изображения
были построены по данным МРТ. При этом удалось
не только реконструировать трехмерный образ
поджелудочной железы в целом, но и провести
визуализацию внутренней поверхности
панкреатического и желчного протоков. Полученные данные в
последствии были использованы для планирования
прецизионных резекций поджелудочной железы.
Другой очевидной клинической перспективой,
связанной с развитием виртуальной эндоскопии,
явилось принципиальное изменение содержания
такого понятия, как «интраоперационная
навигация». Теперь оно стало включать также
видеосовмещение реальных и виртуальных данных, что в
условиях выраженных анатомических или
патологических особенностей может оказать решающее
влияние на успех хирургического вмешательства в
целом.
Наиболее бурно виртуальная эндоскопия и
интраоперационная навигация стали развиваться в ней-
ро- и ЛОР-хирургии, где основные зоны
оперативного вмешательства представлены относительно
малоподвижными мягкотканными и костными
структурами, а также полостями, заполненными воздухом и
обладающими естественной рентгеноконтрастнос-
тью. Одним из первых эндоскопических
исследований, в отношении которого виртуальный метод
исследования практически с момента своего
возникновения стал расцениваться как альтернативный
реальному, была фиброоптическая бронхоскопия.
Вскоре выяснилось, что для реальных
клинических задач решающее значение имеют не разработка
методов построения трехмерной каркасной модели
и ее последующее воспроизведение, не
возможность виртуальных перемещений по ней, а
регистрация достаточно контрастных изображений в зоне
диагностического интереса и их сегментация
(экспертное или автоматизированное выделение
контуров органов, патологических образований и т.п.).
Последняя задача наиболее сложна в отношении
медицинских изображений в целом и
диагностических изображений органов брюшной полости в
особенности, что связано с невысокой или даже низкой
степенью естественной рентгеновской, магнитно-
ядерной и ультразвуковой контрастностью
желудочно-кишечного тракта, внутри- и забрюшинных
паренхиматозных органов.
В гастроэнтерологии наиболее популярным
приложением виртуальной эндоскопии оказалось ис-
212
Компьютерные технологии в эндохирургии
следование толстой кишки. Здесь виртуальный
диагностический метод прошел тщательную проверку
путем неоднократного прямого сравнения с
оптической фиброколоноскопией. В отделении
диагностической радиологии клиники Мейо в 1996 г. А. Нага и
соавт., одними из первых в мире провели
исследование по всесторонней оценке возможностей
двухмерной и трехмерной КТ-колонографии в неинва-
зивном выявлении колоректальных полипов. Как
тем, так и другим диагностическим методом не
были выявлены полипы диаметром менее 2 мм, в
остальном (для полипов размером от 2 до 10 мм)
различия не были статистически достоверными. Тем не
менее комбинация двухмерной и трехмерной
КТ-колонографии позволила выявлять полипы с большой
частотой и оказалась наиболее диагностически
информативной.
Можно с полным основанием утверждать, что при
дальнейшем повышении разрешающей
способности КТ и МРТ и унификации аппаратуры для
воспроизведения виртуальной колоноскопии этот метод
исследования может оказаться основным в коло-
проктологии. Сейчас он, по крайней мере, не
уступает обычной колоноскопии в исследовании правой
половины толстой кишки и выявлении
новообразований, размер которых превышает 5 мм. Тем не
менее в настоящее время наиболее обоснованна в ко-
лопроктологии диагностическая стратегия, по
которой наибольшей диагностической эффективности
можно достичь при сочетании двух- и трехмерных
КТ- или МРТ-методов, дополненных в неясных
случаях оптической фиброколоноскопией.
Возможно, качественно новому решению задач
построения трехмерных моделей в хирургической
гастроэнтерологии для проведения виртуальной
эндоскопии будет способствовать расширение
возможностей как трансабдоминального, так и
эндоскопического ультразвукового исследования.
Одна из таких возможностей связана с
использованием внутривенных и внутриполостных эхоконт-
растных препаратов. В роли контрастного вещества
при этом выступают пузырьки газа, растворенные в
галактозе и обладающие достаточно малым
размером, что позволяет им проникать через легочные
капилляры. Находясь в просвете сосуда, такие
пузырьки остаются некоторое время достаточно
стабильными и при взаимодействии с ультразвуковым
лучом увеличивают его отражение на три (!)
порядка. Контрастные препараты третьего поколения
позволяют получить более четкое изображение
паренхимы органа и обеспечивают отчетливую
визуализацию новообразований размером в несколько
миллиметров. Еще более заманчивые перспективы
в отношении разрешающей способности
ультразвукового исследования связаны с так называемым
«методом второй гармоники», сущность которого
заключается в сверхселективной регистрации
частот, отраженных только от микропузырьков газа,
находящихся в сосудистом русле.
Высокая диагностическая ценность метода, а
также отсутствие противопоказаний к применению
эхоконтрастных препаратов уже сейчас позволяют в
ряде случаев заменять рентгеновскую ангиографию
ультразвуковым исследованием с контрастным
усилением. Недостаточная продолжительность
эффекта эхоконтрастирования пока сдерживает
повсеместное распространение контрастной эхографии.
Постоянное совершенствование ультразвуковой
диагностической аппаратуры также расширило
возможности сонографии до пределов, которые вряд
ли кто-либо мог представить себе еще несколько
лет назад, когда в хирургической
гастроэнтерологии казалось очевидным нарастающее
преимущество КТ и МРТ.
Очевидно, что на протяжении текущего
десятилетия мы являемся свидетелями не только
принципиальных изменений в области эндохирургических
технологий, но и замены целого ряда
диагностических методов и стратегий, традиционных для
хирургической гастроэнтерологии. Венцом усилий
исследователей, стремящихся к повышению
разрешающей способности методов непрямой визуализации,
уже в ближайшее время может явиться полный
отказ от проведения эндоскопических манипуляций
исключительно с диагностическими целями. Кроме
этого, максимально точное графическое
воспроизведение трехмерных диагностических данных
служит основой для проведения виртуальных
эндохирургических манипуляций, которые в свою очередь
позволяют провести «репетицию» реального
хирургического вмешательства с учетом индивидуальных
топографо-анатомических особенностей и
характера патологии.
ВИРТУАЛЬНАЯ ЭНДОХИРУРГИЯ
Как это ни парадоксально, но, возможно, одним
из основоположников виртуальной хирургии был
наш великий соотечественник Н.И. Пирогов, ведь
именно он предложил для изучения хирургической
анатомии использовать замороженные срезы
человеческого тела.
Каково же может быть практическое применение
виртуальной хирургии? Что это: красивая игрушка
или рабочий инструмент?
213
Глава 1 В
Если рассматривать возможности, имеющиеся
на сегодняшний день, то скорее — первое. Но если
попытаться «всмотреться» в будущее, то можно
увидеть студентов, которые вместо перекладывания
спичек в примитивных эндохирургических
тренажерах, отрабатывают элементарные навыки и сложные
операции на виртуальных моделях, визуальные и
«физические» свойства которых близки к свойствам
реальных органов и тканей. Такое обучение
обойдется дешевле, так как можно завязать миллионы
узлов, используя километры виртуальных нитей,
наложить сотни клипс и испытать в действии
бесчисленное множество одноразовых инструментов, не
заботясь об их стоимости.
Напрашивается возражение: «Разве можно
обучать делу, которое связано с ответственностью за
жизнь и здоровье, используя бездушные машины?»
Но ведь и летчиков, в том числе и для гражданской
авиации, обучают на компьютерных симуляторах, а
ведь во время полета летчик отвечает за сотни
жизней, включая свою собственную.
Не меньшим потенциалом обладает виртуальная
хирургия в области предоперационного
планирования.
Еще несколько лет назад планирование хода
предстоящей операции могло иметь место только в
сознании хирурга, где формировалось
индивидуальное представление, как о топографо-анатомиче-
ских взаимоотношениях в зоне операции, так и об
их возможных изменениях в ходе оперативного
вмешательства. Сегодня новые технологии
компьютерной графики позволяют хирургам не только
подтвердить свои предположения, но и воочию
убедиться в эффективности и безопасности
планируемой операции, используя их компьютерное
моделирование.
Уже несколько лет в экономически развитых
странах начало развиваться новое направление
медицинской науки — компьютерно-ассистированная
хирургия — computer-aided surgery (CAS), которая
изучает методы, позволяющие осуществлять
предоперационное планирование и интраоперацион-
ную навигацию, основываясь на данных различных
методов исследования, полученных в
предоперационный период. Благодаря этому множество
нейрохирургических, пластических и ортопедических
операций планируются с использованием
компьютеров. На очереди — внедрение предоперационного
моделирования в гастроэнтерологию.
Разработка и испытание нового хирургического
инструментария в виртуальном мире становятся
более дешевыми и быстрыми, так как нет
необходимости изготавливать бесчисленные пробные образцы.
«ОБРАТНАЯ СВЯЗЬ»
Если создание манипуляторов, по внешнему виду
не отличающихся от реальных инструментов, не
связано со значительными сложностями, то
моделирование взаимодействия реальных
манипуляторов с виртуальными органами и порождаемых этим
взаимодействием тактильных ощущений является
нетривиальной задачей. Тем не менее к настоящему
времени получен уже целый ряд успешных решений
этой задачи.
Технология, с помощью которой события,
происходящие в виртуальном мире, можно не только
увидеть, но и почувствовать, носит название Force
Feedback («силовая обратная связь»).
«Силовая обратная связь», также известная как
«силовое отражение», относится к технологиям,
которые позволяют компьютерам передавать
реалистичные физические ощущения пользователям.
Такие силовые ощущения используются, чтобы
передать информацию с уровнем реализма, не
предусмотренного традиционными видео и звуковыми
технологиями. Представьте себе чувство ощущения
биологической ткани, когда имитированная игла
прокалывает имитированный орган». Такое
описание дает фирма Immersion Corporation, создавшая
одно из наиболее удачных устройств
взаимодействия с виртуальным миром. Более того, в арсенале
этой фирмы есть специализированные разработки
именно для эндо- и лапароскопической хирургии,
среди которых: Laparoscopic Impulse Engine —
манипулятор, созданный с использованием
технологии Force Feedback для взаимодействия с
программами моделирования лапароскопических и
эндоскопических операций, а также виртуальный
гистероскоп, бронхоскоп и уретроскоп.
Формирование тактильных ощущений от
взаимодействия с объектами виртуального мира можно
представить следующим образом. Положение
манипуляторов отслеживается и передается в
компьютер при помощи специальных датчиков
перемещения, обладающих гораздо более высокой
чувствительностью, чем датчики, применяемые в
обычных компьютерных манипуляторах. В соответствии
с полученными таким образом данными
рассчитывают координаты и производят анимацию
виртуальных инструментов. В случае когда координаты
управляемого в данный момент виртуального
инструмента совпадают с координатами других объектов
виртуальной сцены в соответствии с параметрами,
определяющими их физические свойства,
происходит механическое ограничение движения
манипулятора в данном направлении, в результате чего у
21 4
Компьютерные технологии в эндохирургии
пользователя создается тактильное ощущение
соприкосновения с виртуальным объектом. При этом
на мониторе воспроизводится анимационная
последовательность, отражающая процесс
взаимодействия виртуальных объектов.
ТЕЛЕХИРУРГИЯ
Телемедицина, как это ни парадоксально звучит,
начала свою историю раньше, чем Интернет. Это
объясняется существованием других способов
передачи медицинской информации, которые
применялись на ограниченной территории и не имели
связи с остальным миром. Но на сегодняшний день
создание между медицинскими учреждениями
локальных сетей, не соединенных с Интернет и
строящихся на несовместимых технологиях,
нецелесообразно, так как при сопоставимых затратах
достигаемый результат крайне недостаточен в
современных условиях.
Одно из первых сообщений, посвященных
применению глобальных сетей в качестве средства
общения между оперирующими хирургами и
консультантами, относится к 1993 г. В письме, опубликованном
в международном журнале Lancet Fisk, NM et al.
сообщали об удачном опыте применения Интернет
для пересылки изображений на этапе подготовки к
оперативному вмешательству.
Впервые интраоперационное изображение в
реальном масштабе времени было передано через
Интернет 29 августа 1996 г. Посредством модемной
связи во время выполнения лапароскопической хо-
лецистэктомии изображение с эндовидеокамеры
передавалось из операционной университетской
клиники города Понтиак (штат Мичиган, США) в
одну из Калифорнийских клиник. Пациенткой стала
72-летняя женщина, длительное время страдавшая
желчнокаменной болезнью. Во время выполнения
операции врачи из Аргентины могли не только
наблюдать за ходом операции, но и задавать вопросы
и получать ответы в реальном времени. Позднее
C сентября) была выполнена еще одна операция,
во время которой изображение с эндовидеокамеры
также передавалось через Интернет, но уже на
гораздо большее расстояние, а именно в
Буэнос-Айрес (Аргентина). Обе операции прошли успешно,
среднее время сеанса видеосвязи составило 1,5 ч
± 30 мин. При этом стоимость сеанса связи
равнялась сумме оплаты за местный телефонный звонок,
как для американских, так и для аргентинских
участников видеоконференции. Доктор Alejandro
Gandsas (координатор проекта) отметил, что «если
раньше для того, чтобы обучаться мастерству у
американских хирургов, аргентинский врач должен
был покупать билет на самолет, бронировать
гостиницу и оплачивать свое проживание в Соединенных
Штатах в течение нескольких дней, то теперь
достаточно просто включить компьютер и
подключиться к Интернет».
Более совершенная система с большей
скоростью обмена данными, а следовательно, и лучшим
качеством видеоизображения и звука, но при этом и
гораздо более дорогая была разработана и
опробована в действии в 1997 г. специалистами
физической лаборатории Университета имени Джона Хоп-
кинса (Johns Hopkins). Целью этого проекта была
проверка эффективности современных
телекоммуникационных технологий в сфере разработки
обучающих систем для эндохирургии. Расстояние между
пунктами проведения операции и контроля
составило 3,5 мили. Большая пропускная способность
линии связи, использованной в данном случае,
позволила получать изображение не только с
эндовидеокамеры, но и с камеры, передающей общий вид
операционной, а также сделала возможным
голосовое общение между сторонами. Но самым
впечатляющим является тот факт, что хирурги,
находившиеся на достаточно большом от места проведения
операции расстоянии, могли не только наблюдать
за ее ходом, но и участвовать в ней! Ими
осуществлялся контроль за роботом, управляющим эндови-
деокамерой, а также имелся доступ к управлению
электрокоагуляционной аппаратурой. Всего было
прооперированно семь пациентов, при этом,
оперирующие хирурги имели ограниченный опыт
выполнения операций через лапароскопический
доступ, несмотря на это все семь операций были
успешно завершены, и ни в одном случае не возникло
осложнений.
РОБОТЫ В ЭНДОХИРУРГИИ
Успехи технологий компьютерной обработки
графической информации в реальном времени,
совершенствование систем интраоперационного
определения координат инструментов дали толчок к
разработке устройств, которые в массовом сознании
являются персонажами фантастических книг и
фильмов, — роботов. Под «роботом» понимается
высокоточное электромеханическое устройство,
управляемое либо компьютерной программой
(«активные роботы»), либо человеком — опосредованно
через компьютер («пассивные роботы», «роботы-
манипуляторы»).
Самая успешная разработка в этой области —
система AESOP (Automated Endocopic System for
Optimum Positioning of the laparoscope —
автоматизированная эндоскопическая система
оптимального позиционирования лапароскопа) фирмы-лидера
в области создания медицинских
роботов — Comuter Motion, Inc. Первая модель — AESOP
1000 была выпущена в 1994 г. и являлась первым в
мире роботом, применяемым в операционной,
вторая — AESOP 2000, ставшая первым в мире
хирургическим роботом, управляемым голосом — в 1996
г., последняя на сегодняшний день модель AESOP
3000 поступила на рынок в январе 1998 г. и стала
первым в мире хирургическим роботом, имеющим
семь степеней свободы движения. Клиническая
эффективность изделий фирмы Comuter Motion была
подтверждена результатами более чем 70 тыс.
хирургических процедур. Потребность в подобных
изделиях оценивается в 17 тыс. штук, на сегодняшний
день она удовлетворена менее чем на одну треть.
Опыт зарубежных клиник свидетельствует, что
использование роботов экономически выгодно не
только потому, что себестоимость операции при
использовании роботов сокращается, но и потому, что
время обучения управлению роботом меньше, чем
время, необходимое для освоения управления эн-
довидеокамерой вручную.
Hubens G et al. из Департамента хирургии
Университетского госпиталя города Антверпен (Бельгия)
использовали AESOP 2000 для контроля
лапароскопа при проведении адреналэктомии. Авторы
указывают, что обеспечиваемая этим устройством
стабильность изображения позволяют хирургической
бригаде полностью сосредоточиться на
проводимой операции.
Применение роботов, управляющих эндовидео-
камерой, позволяет хирургу «в одиночку» (solo
surgery) выполнять операции любой сложности. Так,
например, в отделении урологии медицинской
школы университета Китасато (Япония) было
выполнено шесть адреналэктомии, во время которых эндо-
видеокамера управлялась роботом AESOP. Авторы
отмечают, что число технических перерывов,
вызванных необходимостью очистки линз
лапароскопа, снизилось на одну четверть, по сравнению с
операциями, в ходе которых эндовидеокамерой
управляет человек.
Неправильный выбор человеко-машинного
интерфейса, т.е. способа передачи команд человека
роботу, способен перечеркнуть любые
преимущества от использования роботов. Allaf ME et al. в 1998 г.
в журнале Surgical Endoscopy опубликовали
результаты сравнения разных моделей роботов AESOP,
управляемые голосом и посредством педалей.
Авторы пришли к выводу, что хотя использование
педалей и обеспечивает более быстрое перемещение
лапароскопа, однако управление голосом
гарантирует более точное его позиционирование, кроме
того, применение голосового управления позволяет
хирургу не отвлекаться от изображения на
мониторе. Совершенствование компьютерных систем
распознавания речи, безусловно, повысит
привлекательность и улучшит потребительские качества
роботов с голосовым управлением.
Расширение спектра операций, выполняемых из
лапароскопического доступа, и как следствие
повышение требований к точности хирургических
манипуляций подтолкнули ряд исследовательских групп
и компаний по производству медицинской техники к
разработке систем, призванных, с одной стороны,
«отсеивать» непроизвольные движения рук хирурга,
например тремор, а с другой — передавать его
целенаправленные движения без искажений.
Это — еще одна задача, с которой роботы могут
справляться более успешно, чем люди. Только
роботы могут производить движения практически с
любой заданной точностью, продолжительность
операции и освещенность операционного поля на
точности их движений не сказываются.
В результате были созданы системы, не только
решающие обозначенные выше задачи, но и
позволяющие осуществлять хирургические манипуляции
дистанционно. Кроме того, их возможности по
селективной передаче движений рук хирурга могут
использоваться при выполнении микрохирургических
манипуляций. При этом производится
«масштабирование» объема движений хирурга в соответствии
с выполняемой в данный момент задачей. Хирург
контролирует движения удаленных манипуляторов
на мониторе.
Первые роботы, способные выполнять
высокоточные манипуляции под непосредственным
управлением человека или по заранее заданной
программе впервые были использованы в нейрохирургии и
оториноларингологии. Уже в конце 1980-х гг.
появились публикации, описывающие преимущества
применения подобных роботов при выполнении
биопсии опухолевых поражений головного мозга.
Предоперационная навигация и контроль за
выполнением манипуляции осуществлялся при помощи
компьютерного томографа.
Das H et al из Калифорнийского Технологического
Института исследовали результаты использования
микрохирургической телеманипуляционной
системы позиционирования инструментов. Авторы
указывают, что, несмотря на то, что применение подоб-
ных систем удлиняет время проведения
манипуляций, их точность при этом значительно возрастает.
Кроме того, такие системы позволяют выполнять
сложные хирургические манипуляции хирургам,
имеющим небольшой опыт, а также проводить
новые хирургические процедуры, ранее недоступные
даже высококвалифицированным хирургам.
Одной из самых удачных на сегодняшний день
роботизированных систем, обеспечивающих
повторение действий хирурга на расстоянии, является da
Vinci™ Surgical System. Находясь в нескольких
метрах от операционного стола, врач управляет
миниатюрными хирургическими инструментами.
Контроль за выполняемыми действиями производится
при помощи эндовидеовидеокамеры.
Первоначально система da Vinci™ создавалась
для целей кардиохирургии и в дальнейшем стала с
успехом применяться в ортопетидеческой,
гинекологической практике, а также в хирургии
пищеварительного тракта.
Сегодня можно говорить и о существовании
прототипов роботов, самостоятельно выполняющих
манипуляции. Так, в 1998 г. итальянскими учеными
Dario et al. была создана и протестирована in vitro
роботизированная системы для проведения коло-
носкопии. Передвигаясь подобно паразиту по
кишечнику, робот перемещает за собой миниатюрную
камеру, давая возможность полноценного изучения
состояния кишечной стенки. Более того, в системе
предусмотрено наличие инструментального канала
для взятия образцов тканей. Авторы указывают, что
изменение принципа продвижения колоноскопа с
«толкай» на «тяни» позволит существенно снизить
ощущения дискомфорта, которые сопровождают
традиционную колоноскопию, а также уменьшит
травматичность данного метода исследования.
Разработка роботов для эндохирургии находится
в состоянии «накопления первоначального
капитала», который составляют технологии. Но
имеющиеся на сегодняшний день образцы и технологические
решения позволяют предположить, что в будущем,
когда потребность в таких роботах неминуемо
возрастет, можно ожидать существенное ускорение
темпов развития хирургической робототехники.