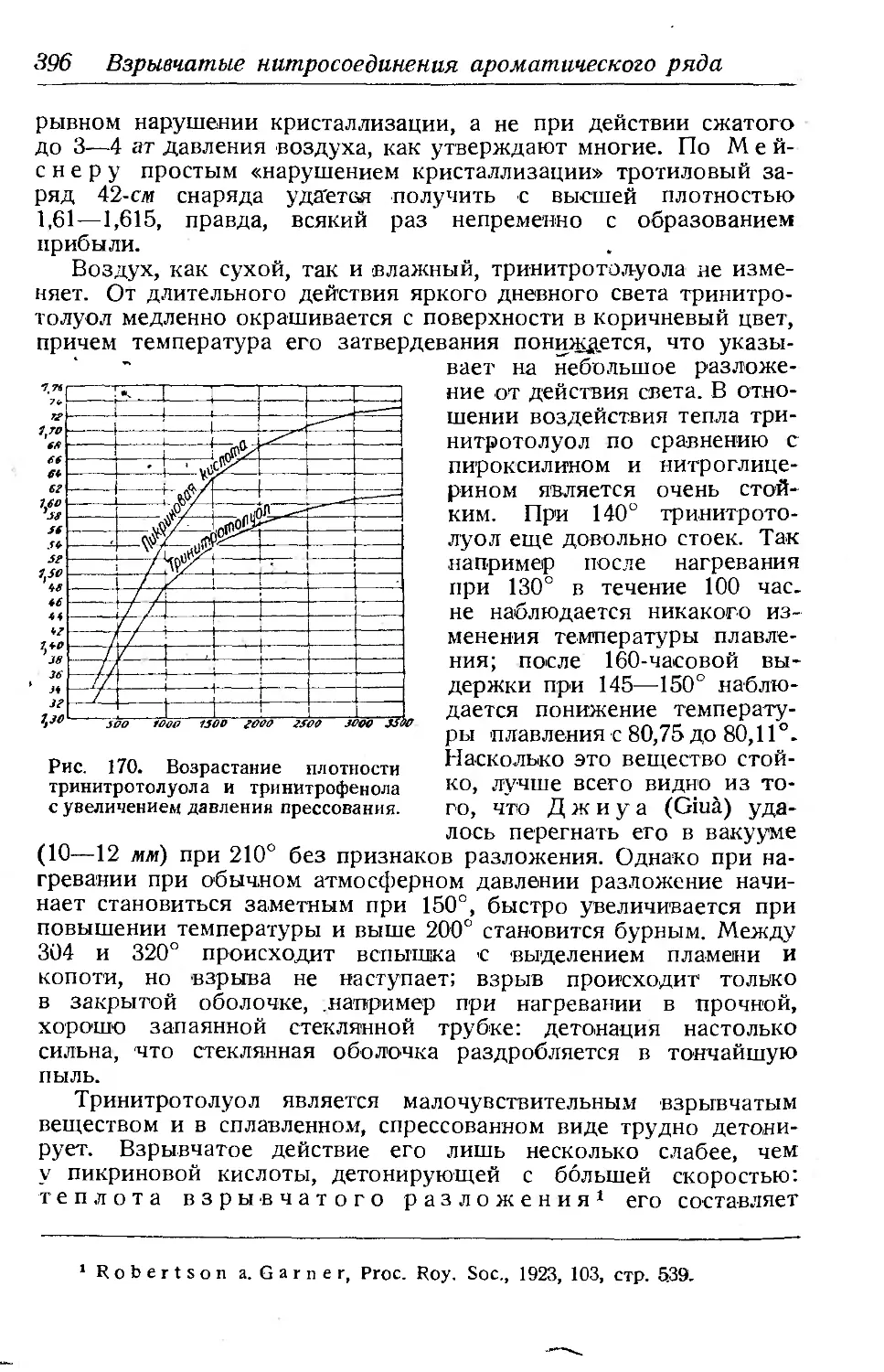
Текст
226
Нитроглицерин
при искусственном охлаждении и температуре реакции, не пре-
вышающей 18°.
На практике согласно этому всегда теряется около 10%
нитроглицерина, если исходить из 98%-ного динамитного гли-
церина. Потеря эта является по преимуществу следствием не-
полной этерификации глицерина и значительной растворимости
низших нитратов в отработанной кислоте и кислой промывной
воде. По Г офвиммеру1 постоянно присутствующий моно-
нитроглицерин полностью растворяется в отработанной кислоте,
тогда как динитрат удаляется уже при первой (кислой) про-
мывке. Полноценный с точки зрения взрывной техники д и -
нитроглицерин может быть получен только по способу
Гофвиммера, по которому азотная кислота нейтрализуется
уже при первой промывке небольшим избытком 10%-ного рас-
твора соды, причем образующийся нитрат натрия вытесняет,
высаливает эфир из раствора? Таким путем получается выход,
равный 236—237%. Удельный вес и содержание азота у такого
нитроглицерина, содержащего динитроглицерин, лишь немного
меньше, чем у промытого обычным способом продукта. Однако
интересное с теоретической точки зрения предложение Гоф-
виммера не привилось на практике (повидимому из-за обра-
зования значительных количеств углекислого газа и темпера-
туры, при которой производится нейтрализация, равной 9—10°),
и способ щелочной промывки, несмотря на экономию
30—40% сжатого воздуха и 60—80% воды, окончательно
оставлен.
И. Производство нитроглицерина
Так как производство нитроглицерина связано с известной
опасностью, то каждый рабочий процесс осуществляется в от-
дельном помещении, в небольших мастерских, построенных из
легкого материала и окруженных валами. Ниже кратко описы-
ваются старый периодический способ, а также новый
непрерывный способ нитрации.
Порядок операций для обоих способов примерно одинаков:
1. Дестилляция глицерина и предварительный подогрев по-
следнего в запасном баке (склад глицерина).
2. Составление и хранение нитрующей смеси в резервуарах
склада кислот.
3. Перекачка глицерина и нитрующей смеси из хранилищ
в мастерскую нитрации и смешение обеих жидкостей в нитра-
ционном аппарате.
4. Отделение нитроглицерина от отработанной кислоты в се-
параторе.
1 Beitrage zur Kenntnis der Nitroglycerinerzeugung u. liber ein neues Ver-
fahren zur Verminderung der Salpetersaure- u. Glycerinverluste, Z. f. Schiess-
u. Sprw. 1919.
Рис. 91. Схема непрерывного нроизводстваЦнитроглицерпна.
228
Нитроглицерин
5. Предварительная промывка кислого нитроглицерина.
6. Нейтральная промывка в чанах промывной мастерской и
последующая обработка содой в стабилизаторе.
7. Фильтрация и слив в гуттаперчевые сосуды.
За этими операциями следует отстаивание отрабо-
танной кислоты, денитрация и затем очистка про-
мывных вод от унесенного ими нитроглицерина в так называе-
мых лабиринтах.
1. Кислотная (нитрующая) смесь
Для составления кислотной смеси, употребляемой для нитра-
ции глицерина, некоторое количество концентрированной серной
кислоты (1,845) и дымящей азотной кислоты (1,5) смешивается
сжатым воздухом в предписанных пропорциях в котлах из
кислотоупорного чугуна. Обычно смешивают, как и при про-
изводстве пироксилина, большое количество, передавливают его
с помощью монтежю в запасные баки и оттуда расходуют для
нитрации. Установка соответствует расположению, представлен-
ному на рис. 79 и 83. Резервуары для кислоты емкостью до
50 000 л следует устанавливать на такой высоте, чтобы необхо-
димое для загрузки количество смеси самотеком стекало в нитра-
ционный аппарат, предварительно пройдя весы или через мерник
с мерным стеклом.
Так как в настоящее время на больших производствах упо-
требляются безводные кислотные смеси (состоящие
из моногидратов HNO3 и H2SO4), что достигается смешением
дымящей азотной кислоты с 18—20%-ным олеумом, то следует
не только сильно охлаждать смесь, но и позаботиться о конден-
сации испаряющейся азотной кислоты.
2. Нитрация
В отепленном складе глицерина в резервуаре хранится запас
в размере нескольких суточных загрузок. Резервуар предста-
вляет собой большой, выложенный свинцом, совершенно закры-
тый бак, снабженный вверху круглым отверстием, покрытым
тонкой латунной проволочной сеткой. Таким образом открытый
бак с глицерином предохраняется от возможного попадания
таких загрязняющих примесей, как ржавчина и песок. Темпера-
тура здания поддерживается паровым отоплением равной 25°;
глицерин в этих условиях более текуч и легче поддается извле-
чению из хранилища и передаче по назначению. При каждой
загрузке в нитраторы глицерин взвешивается и в переносных
кувшинах или же пневматическим путем- передается в резер-
вуары для глицерина, помещающиеся в мастерской нитрации.
Эти резервуары имеют форму цилиндра с коническим дном, сде-
ланы из свинца, внутри снабжены латунной сеткой и паропровод-
II. Производство нитроглицерина
229
ной трубой для поддержания глицерина в состоянии желаемой
текучести при 25—27°. После того как в резервуары мастерской
нитрации поступит
нитрация.
Применяющиеся
для этой цели аппа-
раты конструируют-
ся всюду по одному
и тому же прин-
ципу, хотя и отли-
чаются по внешней
форме и характеру
выполнения. В Аме-
рике предпочитают
большие сталь-
ные котлы1 с ме-
ническим перемеши-
ванием; в Европе —
свинцовые ци-
линдры (рис. 92) с
коническим дном и
крышкой толщиной
8—10 мм; высота их
меняется в зависи-
мости от обстоя-
тельств от 1,3 до
2,6 м. Одна загруз-
ка занимает при-
мерно 2/з объема
аппарата. Крышка
снабжена несколь-
кими застекленными
отверстиями для на-
блюдения за про-
цессом в аппарате
и широкой впаян-
ной свинцовой тру-
бой со стеклянной
насадкой для отво-
да нитрозных газов
и избыточного сжа-
того воздуха. Вы-
тяжная труба имеет
кислотная смесь, может быть начата
Рис. 92.^Нитратор (разрез):
а — основание аппарата; b — рубашка для охлаждающей Гводы;
с — деревянный чан; d — свинцовый резервуар; е — крышка
аппарата; /— спускная труба; g — спускной кран; h —вытяжная
труба; i— стеклянный фонарь; k~керамиковая труба; I—труба
для подвода глицерина; т — термометр; п — подвод сжатого
воздуха для смешения и охлаждения; о—воронка для глицерина;
р — охлаждающий змеевик; г — набивка; S — сток охлаждаю-
щей воды.
своим продолжением керамиковую трубу и
ведет в абсорбционную башню.
На одном швейцарском динамитном заводе нитрацию прово-
дят следующим образом.
Е. М. Simin es, Expl. Eng. 1928, 372.
230
Нитроглицерин
340 кг охлажденной безводной кислотной смеси, состоящей из 46%
азотной кислоты и 54% серной кислоты, передавливается или перекачи-
вается из запасного бака в резервуар для нитрующей смеси и оттуда
быстро спускается в нитрационный аппарат. В то время как в рубашку
аппарата и двойной змеевик впускается охлаждающая вода, а кислота пе-
ремешивается сжатым воздухом, в аппарат вливается тонкой струей 58 кг
глицерина с таким расчетом, чтобы температура ни в коем случае не поды-
малась выше 23°. При постоянном! контролировании хода процесса с по-
мощью трех термометров и наблюдении через смотровые стекла в крышке
и стеклянную часть вытяжной трубы, не появились ли бурые пары, ни-
трация заканчивается в течение 18—20 мин. В первую половину дня могут
быть проведены 6 нитраций с общим выходом в 800 кг нитроглицерина;
это соответствует суточной продукции в 4000 кг безопасного динамита.
Одна загрузка дает при этом выход в 132 кг нитроглицерина, т. е. 228%.
К аппарату подведены две перфорированных трубы для впуска
сжатого воздуха, одна из которых доходит до спускной трубы,
а другая — до дна аппарата. Обе трубы снабжены тонкими вы-
ходными отверстиями. Если подача сжатого воздуха почему-
либо прекращается, то открывают баллон с углекислотой, кото-
рый должен быть постоянно присоединен к подводке. Если
выделение тепла при нитрации даст резкий скачок и пары в вы-
тяжной трубе окрасятся в темнобурый цвет, то подачу глице-
рина прекращают и содержимое возможно более энергично
охлаждают углекислотой. Если саморазложение, сопровождаю-
щееся выделением тепла и нитрозных газов, все же пойдет
дальше и будет грозить взрывом, приступают к спуску («зато-
плению») всей загрузки, т. е. спускают ее через широкий спускной
кран в предохранительный бак. На этот случай вне
валов имеются приспособления для открывания спускного крана
и кран для подвода сжатого воздуха в предохранительный бак.
В некоторых странах нитрацию ведут при более высокой
температуре (26—28° и еще выше). Следят лишь за тем, чтобы
она не поднималась выше 30J. При таком способе работы тре-
буются глицерин равномерно хорошего качества и постоянный
контроль за аппаратом, так как разложение при этой темпера-
туре связано с бурным выделением тепла, для которого имею-
щиеся средства охлаждения оказываются недостаточными. Кроме
того при этих температурах имеет место окисление небольших
количеств глицерина, в связи с чем выход уменьшается.
Слив глицерина не везде ведется одинаково; испытывались
различные приспособления для наиболее целесообразного спо-
соба смешения глицерина с кислотой. Однако оказалось, что
общеупотребительный способ, по которому глицерин нагревается
до 25° и с помощью сжатого воздуха впрыскивается в кислоту
через форсунку, является вполне удовлетворительным.
Загрузка глицерина соответствует величине установки. В то
время как раньше за одну загрузку перерабатывали до 100 кг,
в настоящее время, особенно в Америке, загружается 400 и до
600 кг глицерина. Процесс и в этом случае длится не больше
20—30 мин., так что охлаждение должно быть соответственно
II. Производство нитроглицерина
231
усилено (обычно ставят три змеевика). По окончании нитрации
прекращают перемешивание сжатым воздухом и спускают напо-
минающую молоко смесь в сепаратор.
В интересах безопасности производства рекомендуется уда-
лять распылитель или форсунку, с тем чтобы в нитратор не по-
падало ни одной лишней капли глицерина, а перед спуском из
аппарата подвергать в течение 4—5 мин. все содержимое энер-
гичному перемешиванию; кроме того для обеспечения более
быстрого отделения следует охлаждать до 12°. Сепаратор
также представляет собой цилиндрический свинцовый сосуд со
стенками толщиною в 1 см, устанавливаемый над упоминавшимся
выше предохранительным чаном. На вышеупомянутом динамит-
ном заводе установлены сепараторы высотою 1,6 м, снабженные
вверху смотровыми стеклами, термометром и подводом сжатого
воздуха, чтобы иметь возможность немедленно предотвратить
нежелательные реакции. К коническому дну припаяна свинцовая
труба, снабженная керамиковым краном, от.которого отходят
три разветвления: одно — к аппарату для предварительной про-
мывки, другое — к предохранительному баку и третье — к до-
полнительному сепаратору. Перед краном помещена вставленная
в трубу короткая стеклянная труба для определения поверхности
раздела нитроглицерина и отработанной кислоты; кроме того
в средней части передней стенки имеется смотровое стекло дли-
ною 20 см, через которое наблюдают за процессом разделения.
Благодаря различному удельному весу нитроглицерина (1,6)
и отработанной кислоты (1,7) в течение 30—-40 мин. происходит
почти полное разделение. Нитроглицерин собирается над отра-
ботанной кислотой в виде слоя желтоватого масла с резкой по-
верхностью раздела и может быть спущен непосредственно через
боковой кран в аппарат для предварительной промывки или
отделен „от отработанной кислоты с помощью вышеописанного
крана со смотровым стеклом. Чем чище был глицерин, тем ско-
рее наступает разделение и тем лучше выход.
Образование эмульсии нитроглицерина в отработанной кислоте пред- '
ставляет собой известного рода опасность, особенно в летнее время, и за
этим следует наблюдать вплоть до момента спуска нитроглицерина. Во
времена Нобеля не делалось никаких попыток сократить время сепа-
рации (которое в то время благодаря присутствию в глицерине вязких и
хлопьевидных примесей было несомненно очень продолжительным) каким-
либо искусственным путем. Впервые это удалось Науму в 1904 г. путем
добавления парафинового масла. Позднее с большим успехом стали при-
менять фтористый натрий с кизельгуром или кремнефтори-
стоводородный натрий, которых прибавляли в количестве около 30 г на
400 кг за несколько минут до окончания нитрации. В случае фтористых
•солей под влиянием отработанной серной кислоты образуется SiF<, про-
низывающий жидкость огромным количеством мельчайших пузырьков, ко-
торые, подымаясь, ускоряют разделение эмульсии. Сравнительно недавно
в качестве ускорителей процесса разделения были предложены производ-
ные мочевины, как например ацетамид и дициандиамид1
Герм. пат. 534534 (1931).
232
Нитроглицерин
3. Промывка
1
Прежде чем подвергнуть кислый нитроглицерин собственно
промывке, его освобождают от основной массы удерживаемой
им кислоты (составляющей 10% от всей отсепарированной кис-
лоты), пропуская через аппарат для предварительной промывки.
Последний не так велик, как сепаратор, и имеет наклейное дно,
в которое впаян дырчатый змеевик для сжатого воздуха. В са-
мой нижней части дна находится снабженный краном свинцовый
трубопровод для нитроглицерина, ведущий в здание промывки..
Рис. 93. Здание промывки нитроглицерина.
Аппарат этот наполняется до половины холодной водой (15°), и
содержимое его после впуска нитроглицерина энергично пере-
мешивается. И в этом случае за ходом процесса следят через
смотровое стекло в крышке.
Нитроглицерин вскоре собирается на дне аппарата и оттуда
спускается в снабженные смотровыми стеклами и термометрами
чаны промывной мастерской; здесь нитроглицерин промывается
теплой водой при перемешивании сжатым воздухом. Процесс
промывки длится 5 мин., после чего нитроглицерину дают осесть,,
а воду спускают; затем из находящегося вне мастерской про-
мывки котла подают нагретую до 50° воду и снова в течение
5 мин. ведут промывку. Отсюда нитроглицерин поступает
II. Производство нитроглицерина
233:
в стабилизатор, где он промывается 1—1%%-ным раство-
ром соды и по удалении раствора соды — еще раз водой. Про-
мытый нитроглицерин испытывается в лаборатории: если он
окажется вполне нейтральным, то его спускают на фильтр, если
ясе в нем обнаружено присутствие кислоты, то его еще раз про-
мывают. На 100 кг нитроглицерина требуется 800—900 л воды,,
распределяемых на 5—7 операций промывки. После того как
окончательно убедились (с помощью лакмуса или фенолфта-
леина) в отсутствии следов как кислоты, так и щелочи, нитро-
глицерин фильтруют и в гуттаперчевых кувшинах доставляют
в мешательную мастерскую. Безопаснее однако передавать
нитроглицерин по трубам в расположенную в стороне мастер-
скую фильтрации; здесь он из общего сборника с помощью рас-
пределительных кранов поступает на фильтры.
В отношении промывки следует еще раз отметить, что нитро-
глицерин, как и все эфиры азотной кислоты, обладает способ-
ностью чрезвычайно прочно удерживать некоторое количество
свободных нитрационных кислот, благодаря чему последние
следы свободной кислоты с трудом удаляются даже при про-
должительной промывке щелочами. Нитроглицерин, самым тес-
ным образом смешиваемый посредством воздуха с теплым рас-
твором соды, все еще содержит даже после промывки от соды
следы кислот. Если через несколько дней такой кажущийся
нейтральным нитроглицерин испытать на лакмусовую бумажку,
то она сейчас же краснеет. Из этого видно, насколько тщательно
следует испытывать нитроглицерин, чтобы избегнуть дурных
последствий.
4. Фильтрация
Готовый и хорошо промытый нитроглицерин всегда бывает
мутным из-за присутствия воды и различного рода взвешенных
примесей, Появляющихся отчасти вследствие загрязнения исход-
ных материалов, отчасти из промывной воды, а частично пред-
ставляющих собой продукт коррозии стенок свинцовых сосудов.
Фильтрация нитроглицерина производится через два натянутых
фланелевых полотнища, между которыми находится слой сухой
поваренной соли в 10 см толщины, назначение которого удер-
живать мелкие взвешенные частицы и большую часть влаги.
Однако в настоящее время «высаливание» применяется редко, и
продажный нитроглицерин содержит 0,3% воды, прочно им удер-
живаемой. Осветленный нитроглицерин из сборника для филь-
трата поступает через эбонитовый кран в жолоб и отсюда по
свинцовому трубопроводу — в мастерскую желатинизации.
5. Последующее разделение
Отработанная кислота из сепаратора собирается в особых
свинцовых резервуарах (сепараторах), рассчитанных на
загрузку 3000 кг и снабженных наклонным дном, трубопроводом
234
Нитроглицери н
для сжатого воздуха и термометром. Верхняя широкая впускная
труба изготовляется из стекла и в самом низу снабжена
стеклянным краном. Отработанная кислота подается в аппарат
непосредственно или из более высоко расположенного бака, ко-
торый наполняют до верхней части стеклянной трубы. Посте-
пенно над кислотой собирается нитроглицерин—составляющий
впрочем всего до 2% от всего выхода — обычно в форме вяз-
кого темного масла; он непрерывно отводится через располо-
женный внизу • стеклянный кран. Чтобы уровень жидкости
в аппарате оставался одним и тем же, время от времени впу-
Рис. 94. Чаны для последующего отделения нитроглицерина.
.скают соответствующее количество отработанной кислоты. По
прошествии 8—10, часто даже 14 дней отделяются уже только
следы нитроглицерина; свободная от нитроглицерина отрабо-
танная кислота с целью регенерации передавли-
вается с помощью монтежю на установку для денитрации.
Отработанная кислота через 12 час. содержит 3,2%, а через
4 недели 0,7% нитроглицерина. Только если оставить отрабо-
танную кислоту отстаиваться в течение нескольких лет, из нее
выделится весь нитроглицерин, и азотная кислота превратится
в нитрозилсерную кислоту
1 W. Joun g, Beitrag zur Analyse der Nitroglycerinabfallsaure mit genauer
Bestimmung des Nitroglycerins, J. soc. Ind., 1928, T, стр. 126.
II. Производство нитроглицерина
235
6. Очистка сточных вод
Промывная вода уносит из аппарата для предвари-
тельной промывки, промывных чанов и стабилизатора мельчай-
шие частицы нитроглицерина, от которого ее необходимо осво-
бодить перед спуском в реку. Прежде, когда такие воды, а также
отработанная кислота из сепаратора удалялись из цикла, произ-
водства без предварительной обработки, из-за кристаллизации
нитроглицерина в наиболее низких местах сточного трубопро-
вода нередко имели место взрывы, особенно в холодное время
года. С другой стороны, в местах соединения труб образуется
течь, причем нитроглицерин пропитывает землю, и таким обра- '
зом получаются мины, доставляющие много хлопот и чрезвы-
чайно опасные для жизни тех, кому приходится работать
в этих местах. Такое заражение нитроглицерином окружающей
местности должно, естественно, предотвращаться всеми мерами;
в связи с этим скоро пришли к выводу, что следует пропускать
промывные воды через большие деревянные чаны особого
устройства или выложенные свинцом, расположенные один за
другим отстойники, предназначенные для седиментации нитро-
глицерина.
В настоящее время предпочитают пользоваться лабиринтом —
каскадным аппаратом, состоящим из 12 расположенных один над
другим керамиковых прямоугольных сосудов. Путь воды в та-
ком аппарате благодаря поперечным перегородкам — зигзаго-
образный,. благодаря чему суспендированный нитроглицерин
легко оседает и затем через особые краны спускается обратно '
в промывной аппарат. Однако кислые сточные воды и сточные
воды после нейтрализации, еще содержащие довольно значи-
тельное количество азотной кислоты, обычно спускаются в реку,
так как предлагавшиеся до настоящего времени способы ула-
вливания из них нитроглицерина оказались невыгодными.
7. Непрерывный процесс производства нитроглицерина,
предложенный А. Шмидом
Благодаря появлению этого способа впервые стало возможно
непрерывное производство взрывчатого вещества без разделе-
ния операций вплоть до выхода готового продукта. Такой авто-
матический процесс обладает преимуществами как с технической,
так и с экономической стороны; во всех случаях, где речь шла
о новых установках, он вытеснил существовавший до него пре-
рывный процесс. Это нововведение, имеющее колоссальное зна-
чение, является заслугой австрийца А. Шмида, который
сначала разработал способ в лаборатории, а затем при содей-
ствии Мейсснера проверил его на полузаводской опытной
установке Societe Suisse d’Explosifs в Гамзене, близ Брига. Вскоре
236
Нитроглицерин
«система Шмида» стала эксплоатироваться в заводском мас-
штабе, и по этому способу стал работать построенный в Швеции
завод Гитторп с производительностью 600 кг/час, работающий
с большим успехом уже более 3 лет.
С помощью рис. 95 кратко опишем принцип и схему способа
производства нитроглицерина по этому способу.
Исходные материалы—глицерин и нитрующая смесь, с одной
стороны, и промывная жидкость, с другой — дозируются с по-
II. Производство нитроглицерина
237
мощью надежных автоматических приспособлений и непрерывно
поступают в аппараты, а после окончания реакции или 'Соответ-
ствующего использования также автоматически покидают по-
следние. Для наиболее точного контроля и измерения подачи
установлена специальная система двойных сопел. Нитра-
ционный аппарат снабжен механической мешалкой с боль-
шим числом оборотов и наряду с небольшим объемом обладает
большой поверхностью охлаждения; его объем равен лишь
0,1 объема обыкновенного нитратора одинаковой производи-
тельности.
Согласно схеме реагирующие жидкости, как-то: нитрующая
смесь, глицерин, промывная вода и промывная жидкость,
хранятся в резервуарах, рассчитанных на давление. Такие ре-
зервуары испытываются на давление в 3 ат, и по наполнении
давление в них доводится сжатым воздухом до указанной выше
величины. Регулирование давления сжатого воздуха произво-
дится с помощью точного регулятора системы «Агса». Неболь-
шой воздушный резервуар „служит для выравнивания давления;
постоянное внутреннее давление составляет 1—1,5 ат. Труба,
подводящая сжатый воздух, доходит до дна хранилища, так что
независимо от уровня жидкости в нем поддерживается постоян-
ное давление. Если подача сжатого воздуха по какой-либо
причине прекратится, то особые приборы препятствуют подъему
жидкости в воздушный резервуар. Так как слишком большая
вязкость глицерина при низких температурах затрудняет мани-
пулирование с ним, то для обеспечения возможно более точной
дозировки глицерина его вязкость понижают нагреванием
до 35°.
Жидкости после предварительной фильтрации поступают
к месту потребления по трубам, доходящим до дна хранилища.
В питающйх трубопроводах в двух местах установлены сопла.
В трубопроводе для подачи свежей нитрующей смеси второе
сопло помещено за запорным вентилем. Сопло для глицерина
служит кроме того спускным отверстием особого приспособле-
ния с отсекающим клапаном. В подводке для воды и для про-
мывной жидкости расположены инжекторы, снабженные вторым
запорным приспособлением. В основном расположение таково:
резервуар, фильтр, затем сопло с запорным вентилем, снова
сопло и наконец выход. Оба сопла дозируют при определенном
давлении необходимое количество каждой жидкости. Для кон-
троля протекающего количества служат нагнетательные трубки,
соединяющие первое сопло с ртутным манометром. По показа-
ниям этого манометра сразу можно обнаружить все неполадки
в подаче исходных материалов.
Нитрация протекает во внутренней камере смешения нитратора
с большой скоростью. Значительное число оборотов винтовой мешалки
заставляет реакционную смесь под влиянием центробежной силы циркули-
ровать между системой параллельных охлаждающих трубок. С точки эре-
238
Нитроглицерин
ния безопасности необходимо отметить, что эмульсия нитроглицерина в от-
работанной кислоте, образующаяся в нитраторе, не может подвергнуться
взрыву. Благодаря быстрому течению процесса нитрации, а также механи-
ческому перемешиванию и отсутствию потерь азотной кислоты вследствие
испарения выходы при непрерывной нитрации по крайней мере на 1% бо-
лее, чем при обычных способах.
Разделение нитроглицерина и отработанной кис-
лоты происходит в специальном аппарате новой конструкции, служащем
для непрерывного предварительного и последующего разделения. Для со-
кращения срока разделения необходимо уменьшить высоту подъема капель
нитроглицерина, что достигается в наклонно установленном сепараторе,
снабженном большим числом плоскостей, расположенных под одним и тем
же углом. Эмульсия, поступая в сепаратор, поднимается в верхнюю часть
аппарата, где и происходит разделение. Нитроглицерин всплывает и попа-
дает в предназначенное для него сточное приспособление; кислота, прежде
чем попасть в сточную трубу, должна пройти через систему плоскостей;,
отсюда капли нитроглицерина попадают на нижние поверхности плоскостей
по укороченному пути; здесь они собираются, поднимаются вверх и при-
соединяются к основной массе нитроглицерина. Отводы для нитроглице-
рина и отработанной кислоты расположены один над другим таким обра-
зом, что поверхность раздела нитроглицерина и кислоты при нормальной
работе находится несколько выше впускной трубы; поверхность раздела
можно наблюдать через специальное смотровое стекло. С помощью дрос-
сельного крана в трубопроводе для отработанной кислоты уровень нитро-
глицерина можно установить над соплом последнего. Этим достигается точ-
ность подачи необходимого количества нитроглицерина со всякого уровня.
Отработанная кислота поступает в резервуар или по естественному
уклону — в денитрационную установку. С помощью трехходового крана
резервуар отработанной кислоты можно соединять с насосом для передачи
содержимого нитратора и сепаратора в конце операции в промывную ко-
лонну. Оба резервуара остаются наполненными отработанной кислотой до
начала новой операции. При часовой производительности в 100 кг нитро-
глицерина в отработанной кислоте остается обычно до 0,1 и не более 0,3%'
суспендированного нитроглицерина.
Промывка. Из сточного приспособления сепаратора вытекает
вполне прозрачный нитроглицерин, свободный от суспендированной кис-
лоты, но содержащий все же в растворенном состоянии несколько процен-
тов азотной кислоты. Эта кислота может быть очень быстро удалена обра-
боткой водою, аммиаком или раствором соды. Тем не менее последние
следы кислоты удерживаются весьма прочно и удаляются лишь при очень
продолжительной обработке, сопровождаемой тщательным перемешиванием.
На схеме представлена промывка, состоящая из двух колонн с обяза-
тельным включением инжектора. В первой колонне для предварительной
промывки в качестве промывной жидкости употребляется вода, во второй
колонне для окончательной промывки — аммиак или разбавленный раствор
соды. Нитроглицерин из сепаратора попадает в инжектор; здесь он с по-
мощью воды эмульгируется под давлением и стекает в колонну. Сжатым
воздухом эмульсия через перфорированные тарелки передается наверх-
С верхней части колонны эмульсия при непрерывном подводе сжатого воз-
духа спускается в отстойник.
В отстойнике эмульсия проходит через дырчатую перегородку, причем
крупные взвешенные частицы отделяются, и расслаивается на воду и ни-
троглицерин. За ходом процесса наблюдают через смотровое стекло. Со-
бирающийся в конце отстойника нитроглицерин проходит через щелевид-
ное отверстие и по закону сообщающихся сосудов поднимается до тех
пор, пока подобно отделившейся воде не перельется в предназначенное
для него место. Расположенные ниже уровня воды перегородки удержи-
вают осадок и всплывающие капли нитроглицерина.
Нитроглицерин поступает затем в главную промывную ко-
лонну, здесь снова эмульгируется с промывной жидкостью и оконча-
II. Производство нитроглицерина
239
тельно промывается. Пропущенная затем через сетку эмульсия попадает
в сепаратор и здесь расслаивается на воду и нитроглицерин. Нитроглице-
рин остается на дне сепаратора, служащего одновременно сборником,
а промывная жидкость отводится. Нитроглицерин может быть спущен по
мере надобности с помощью резинового шланга, закрытого зажимом. Стек-
лянная трубка, снабженная шкалой, указывает уровень нитроглицерина не-
посредственно в килограммах.
Ввиду возможности различных неполадок или разложения нитроглице-
рина и здесь устанавливаются предохранительные чаны. Устройство в этом
случае таково, что, если температура превысит критическую, начинает дей-
ствовать автоматическое приспособление, с помощью которого содержимое
нитратора и верхней части сепаратора выпускается в чан. Предохрани-
1
Рис. 96. Часть мастерской для непрерывного производства нитро-
глицерина с часовой производительностью 600 кг:
1 — сепаратор; 2—нитратор (с изоляцией).
тельное приспособление состоит из контактных термометров, сухой бата-
реи и реле, освобождающего предохранительный противовес, благодаря
чему открывается предохранительный кран.
Приведем цифры, характеризующие величину аппаратов, а
также некоторые производственные данные для малой и боль-
шой установок непрерывного получения нитроглицерина.
Преимущества непрерывного способа производства нитро-
глицерина заключаются прежде всего в большей его
безопасности благодаря применению значительно более
производительных аппаратов, затем в уменьшении затраты энер-
гии и в объединении процесса в одном здании, что значительно
сужает размер района, подлежащего защите по существующим
законам.
240
Н итроглицерин
Часовая производи-
тельность 100 кг
600 кг нитроглицерина
Емкость нитратора ....
Охлаждающая поверхность
Охлаждающая среда:
Вода, поступающая при
10°....................
Рассол, охлажденный до
низкой температуры . .
Температура нитрации . .
Употребляемая кислотная
смесь..................
Соотношение глицерин-ни-
трующая смесь..........
Выход..................
Температура уходящей —
воды 20°
— —10°
23° +18°
50% серной кислоты и 50% азотной кислоты
1:5
231% 231,5% (для смеси глице-
рин—гликоль 80/20%)
8. Требования, предъявляемые к нитроглицерину
Нитроглицерин должен иметь слабожелтую окраску, давать
нейтральную реакцию и не изменяться при хранении. Если
окраска лакмусовой бумажки изменяется, то 50 г нитроглице-
рйна взбалтываются с 150 г воды, и последняя титруется в при-
сутствии метилоранжа 0,1 N щелочью или 0,1 N соляной кисло-
той. 1 г (0,6 см3) хорошего нитроглицерина выдерживает пробу
с иодцинккрахмальной бумажкой при 80° в течение по крайней
мере 10 мин. По пробе Эбля при нагревании нитроглицерина
(3,24 г) в пробирке до 71° окрашивание иодкрахмальной бу-
мажки, смоченной 40%-ным раствором глицерина, не должно
появляться в течение 15 мин. При применении для военных целей
минимальное время стойкости составляет 20 мин. при 82°.
Определение содержания азота (теоретическое содер-
жание N равно 18,5%) производится в целях идентификации,
а не установления чистоты продукта. Влажность, содержание
которой должно быть не более 0,5%’, определяется продолжи-
тельным выдерживанием в эксикаторе над хлористым кальцием
или серной кислотой.
III. Свойства нитроглицерина
1. Физические и химические свойства
Нитроглицерин представляет собой при обыкновенной темпе-
ратуре маслянистую, лишенную запаха жидкость от слабожел-
того до коричнево-желтого цвета, обладающую жгучим сладким
III. Свойства нитроглицерина
241
вкусом; нитроглицерин бесцветен только1 в совершенно1 чистом
состоянии. Удельный вес его при 15° равен 1,601. При заморажи-
вании происходит сокращение объема, на 10/121, и при + 10°
удельный вес равен 1,735. Нитроглицерин негигроскопичен
и согласно Науму растворим вводе при 20° только в коли-
честве 1,8°/оо. В с пи-рте он растворим значительно лучше: так,
1 см3 нитроглицерина растворяется при 20° в 3,7 сти3 абсолют-
ного и 5 см3 96%-ного спирта; с эфиром, ацетоном, бензолом,
нитротолуолом, ледяной уксусной кислотой и хлороформом
нитроглицерин при комнатной температуре смешивается во всех
отношениях. Нитроглицерин улетучивается уже при обыкновен-
ной температуре, при 75° он в 8 раз более летуч, чем при 50°,
и может быть нацело перегнан с водяным паром. Перегнать
нитроглицерин удается в очень хорошем вакууме. Отношение
нитроглицерина к нагреванию подробно изучали Снеллинг
и Шторм.
1. Разложение нитроглицерина начинается при 50—60°; при 70е выде-
ляется так много нитрозных паров, что иодкрахмальная бумажка синеет
уже через 15—30 мин. При 135° нитроглицерин окрашивается в красный цвет;
при 145° разложение протекает столь бурно, что жидкость «кипит».
2. Разложение нитроглицерина сопровождается значительным выделе-
нием тепла, продолжающимся и тогда, когда подвод тепла извне прекра-
щается. При 165° жидкость кипит очень бурно, при 185° она загустевает
и делается вязкой и при 218° сильно детонирует. Нцже этой температуры
нитроглицерин перегоняется, причем дестиллат состоит из нитроглицерина,
разбавленной азотной кислоты и небольшого количества примесей. Оста-
ток состоит главным образом из глицерина и незначительной части
моно- и динитроглицерина и практически не обладает взрывчатыми
свойствами.
Нитроглицерин в высокой степени обладает способностью
к переохлаждению, т. е. при температурах значительно более
низких, чем его температура замерзания, — до —70°, он часто
остается жидким и моментально затвердевает, если в него внести
небольшой кристаллик нитроглицерина. Каст в 1906 г. устано-
вил, что нитроглицерин имеет две кристаллических модифика-
ции; первая — лабильная форма в виде триклинических листоч-
ков, имеющих температуру затвердевания +2°, в виде которой
-затвердевший нитроглицерин не обладает достаточной твер-
достью; вторая — стабильная твердая форма в виде бипирами-
дальных ромбических игл, имеющих температуру затвердева-
ния + 13°.
Низкоплавкая форма (например при соприкосновении с кри-
сталлами стабильной формы) полностью переходит в плавящуюся
при более высокой температуре стабильную форму; теплота пре-
вращения равна 28 б. кая.
Гибберт в 1912 г. подтвердил наблюдение Каста и изу-
чил, кроме метода выделения, также и свойства каждой кристал-
лической модификации; он считает однако, что химическая
изомерия здесь вероятнее, чем чисто физическая. Можно
16 Зак. 3171. — Штетбахер.
242
Нитроглицерин
предполагать две следующие
формы нитроглицерина:
структурно изомерные
СН2 —О —ЬГ
°о°
СН — О —N
Это предположение дает 'следовательно основание думать, что
оба изомера сохраняют свои особенности как в жидком, так
и в твердом состоянии. Дзержкович и Андреев1 недавно
пытались подтвердить это предположение опытом. По их мне-
нию в случае справедливости этого предположения стабиль-
ный нитроглицерин должен быть очень бризантен, а ла-
бильный должен обладать незначительной бризант-
ностью; наоборот, лабильная форма в бомбе должна дать
большое расширение, а стабильная — незначи-
тельное. Как в техническом нитроглицерине, так и в нитро-
глицерине, входящем в состав динамита, постоянно присут-
ствуют в переменных соотношениях оба изомера, так что — в за-
висимости от преобладания стабильного или лабильного, изо-
мера— скорость детонации должна постоянно стремиться то
к высшему, то к низшему пределу. Насколько малообоснованно
такое предположение, было указано ранее на стр. 64—65;
По своим физиологическим свойствам нитрогли-
церин является чрезвычайно быстро действующим органическим:
ядом. Даже следы его, например незначительное количество
паров, задержавшихся в волосах или на платье, могут впослед-
ствии причинить неприятность! Уже 2—3 мг понижают давление
крови в течение 25 мин. со 130 до 100 мм рт„ ст. 2. В большин-
стве случаев достаточно войти в помещение для производства
динамита и вдохнуть испаряющийся нитроглицерин, чтобы нача-
лась мигрень, которая не прекращается весь день и проходит
только на утро следующего дня после сна. Принятый внутрь
нитроглицерин также действует как сильный яд: сначала чув-
ствуется характерное царапание в горле, через несколько минут
начинается глухая, тяжелая головная боль со стуком во лбу
и в висках, завершающаяся тошнотой, головокружением и по-
терей сознания. Есть люди, не подверженные действию нитро-
глицерина; другие привыкают к нему в течение 4—5 дней и при-
обретают известный иммунитет, в то время как отдельные лица
1 Z. f. Schiess- u. Sprw., 1930, 400.
2 D б 11 k e n, Munch, med. Wschr. 1928, 294.
III. Свойства нитроглицерина 243
bCIo жизнь не могут отделаться от этой идиосинкразии. Продол-
жительность действия нитроглицерина еще не выяснена. Под на-
званием глоноина он употреблялся раньше в дозах от 1-—5 мг
в качестве средства от мигрени, головокружения и обморока.
Являясь эфиром, нитроглицерин омыляется крепкими едкими
щелочами с образованием глицерина. Эта сложная реакция со-
провождается расщеплением глицерина и для спиртового рас-
твора едкого кали протекает еще не вполне изученным образом;
приводимое ниже уравнение
СзНз(ОМО2)з + 5КОН = KNO3 + 2KNO2 + НСООК +
+ СНзСООК + ЗН2О
лишь частично отображает процесс, так как при омылении
кроме того образуются еще аммиак, щавелевая кислота и неко-
торые другие вещества.
Нитроглицерин воспламеняется не особенно легко. При со-
прикосновении с горящими или тлеющими телами он спокойно
горит светлозеленым пламенем. Наоборот, при внезапном силь-
ном нагреве происходит взрыв; в зависимости от количества
и скорости передачи тепла температура вспышки его лежит
между 200 и 225°. Если капли нитроглйцерина падают с высоты
1 л! на постепенно нагреваемую железную пластинку, то первые
^апли высыхают сначала медленно и беззвучно, затем все быстрее
и с шипеньем и наконец при 200° детонируют с оглушительным
шумом. Когда температура поднимается выше 250°, сила взрыва
уменьшается, и при температуре красного каления имеет место
беззвучное разбрызгивание. Медленное разложение молекулы
нитроглицерина происходит уже при обыкновенной температуре,
если (вследствие недостаточной промывки) в нем содержится
азотная или азотистая кислота. Продукт разложения окраши-
вается в зеленый цвет с образованием азотистой кислоты, закиси
азота и углекислого газа; постепенно появляются кристаллы ща-
велевой кислоты, и по прошествии нескольких месяцев нитро-
глицерин превращается в студенистую массу. В открытых сосу-
дах и для небольших количеств такое саморазложение не пред-
ставляет особой опасности, но в закрытых сосудах вследствие
аккумулирования тепла происходит взрыв.
При нагревании нитроглицерин разлагается быстрее пирокси-
лина, но при хранении в нормальных условиях более стоек, чем
более высокомолекулярная и не индивидуальная нитроклетчатка.
Замечено, что нитроглицерин под действием рассеянного света
и при всех температурах в тени может даже в условиях тропиче-
ского климата оставаться без изменения в течение десятилетий.
2. Взрывчатые свойства
Из всех применяемых в технике взрывчатых веществ самой
большой чувствительностью к механическому
16*
244
Нитроглицерин
воздействию обладает нитроглицерин, — обстоятельство,
сразу же воспрепятствовавшее возможности его применения для
военных целей и /перевозки по железной дороге как в чистом,
так и в растворенном состоянии.
Согласно германским правилам жидкий нитроглицерин не
разрешается к перевозке, а перевозка твердых нитроглицерино-
вых взрывчатых веществ (гурдинамит, гремучий студень) допу-
скается в особых динамитных поездах.
По своей чувствительности к удару нитроглицерин близок
к инициирующим взрывчатым веществам; автор получил на аппа-
рате Лентца при весе падающего груза, равном 2 кг, следующие
цифры:
Гремучая ртуть.................. 4,5 см
Азид свинца............ ..... 9
Нитроглицерин......................10 „
Гремучий студень.................15
Тринитрофенилметилнитрамин.......35
Тринитротолуол............свыше 100
Каст и Билль получили детонацию в приборе Каста со
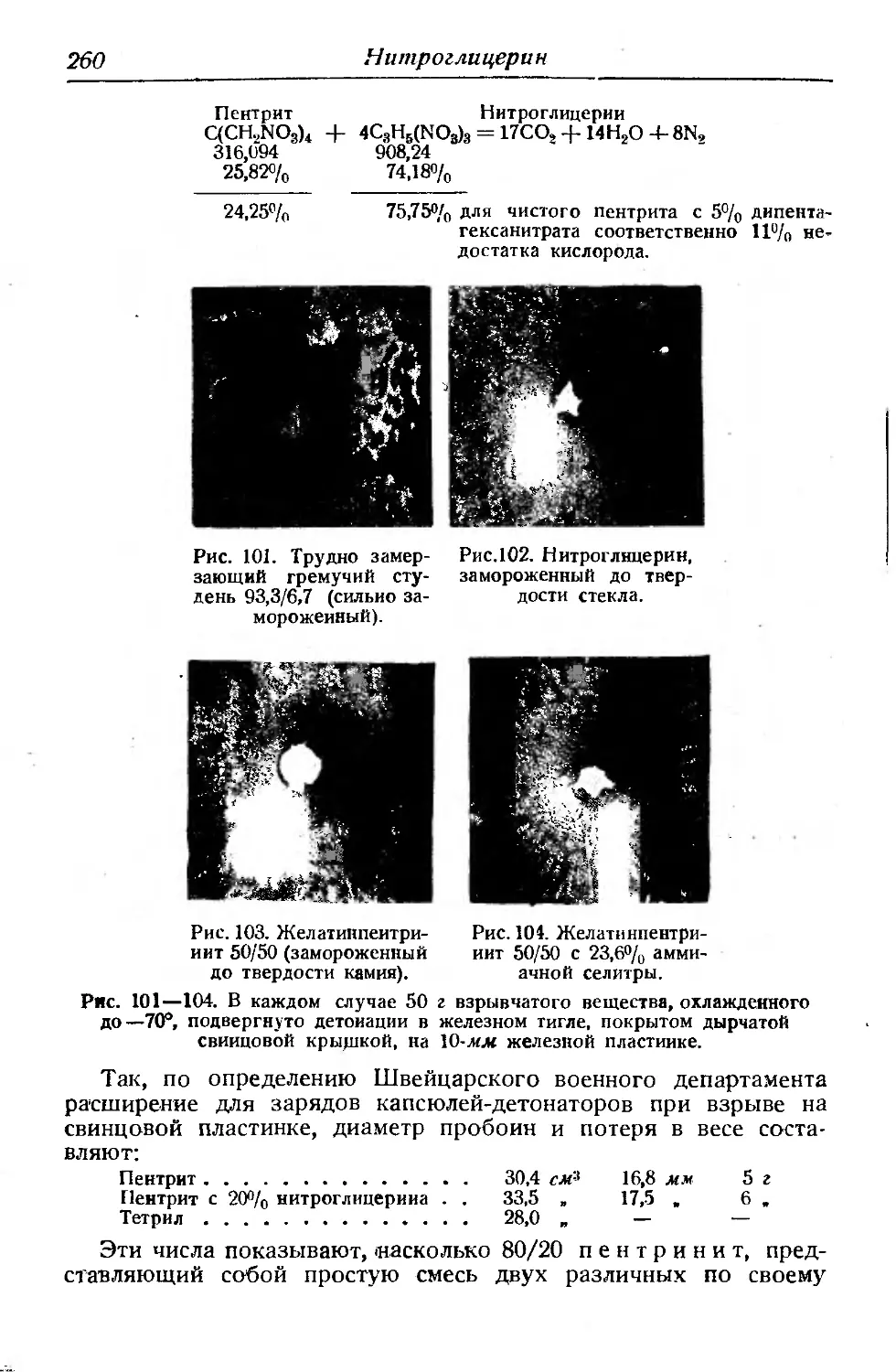
штемпельным аппаратом с грузом в 2 кг и при 4 йв и с грузом
10 кг при высоте 2 см. При нагревании чувствительность к удару
увеличивается: нагретый до 90° нитроглицерин детонирует при
Рис. 97. Нитроглице-
рин, замороженный
при —35°.
Рис. 98. Пентринит Рис. 99. Пентринит
60/40, пластичный. 60/40, замороженный
при —35°.
Рис. 97—99. 30 г каждого из указанных взрывчатых веществ подвергнуто
детонации на 1-мм железной пластинке. (Рис. 99 иллюстрирует пожалуй
наибольшую из наблюдавшихся до сих пор скоростей детонации.)
ударе с высоты, равной половине высоты, необходимой при
обыкновенной температуре. Замерзший тринитроглицерин
значительно менее чувствителен, чем жидкий; работа удара, вы-
зывающая детонацию твердого продукта, приблизительно
в 3 раза больше. Билль определил, что от груза в 1 кг замерз-
ший нитроглицерин при —20° детонирует только при 38—40 см,
тогда как для жидкого нитроглицерина при +15° достаточно
всего 10 см.
IV. Низшие глицериннитраты
245
Странно и загадочно поведение нитроглицерина во время
детонации. Согласно первым систематическим измерениям
Коме я нитроглицерин обладает двумя скоростями детонации:
одна незначительна, другая чрезвычайно велика
и наблюдается редко (см. табл. 4). Бо-
лее ранние определения Бертл о, Эбля и
Меттеганга давали только лишь низшие
значения скорости — до 2000 м. К о м е й, ко-
торый взрывал нитроглицерин в 25-лгл желез-
ной трубке, получил два ряда совершенно от-
личных цифр со средними значениями, рав-
ными 1451 и 7960 м/сек. В 38-с/и железной
трубке была получена с капсюлем в 0,8 г средняя
скорость, равная 2019 м, а при капсюле в 1,6 г —
колоссальная скорость детонации, равная 8527 м.
В соответствии с этими величинами К о м е й
определил сжатие свинцового цилин-
дра, который сдавливается в первом случае
слабо', а во втором — раздробляется.
Тем не .менее мнение Обера о том, что ска-
чкообразно изменяющаяся скорость детонации
нитроглицерина является следствием одного
лишь изменения содержания воздуха
и что не содержащий воздуха и находящийся
в разреженном пространстве нитроглицерин де-
тонирует со скоростью, равной всего 800 м/сек,
нельзя считать основательным, так как автором
для содержащего воздух продукта были полу-
чены другие результаты.
Проведенные 28 сентября 1932 г. в лабора-
тории взрывчатых веществ в Париже официаль-
ные опыты доказывают, что нитроглицерин и
динамиты при нормальных условиях неспо-
собны взрывать с более высокой скоростью.
Даже капсюль-детонатор с пикриновой кисло-
той не обеспечивает детонации нитроглицерина
с предельной скоростью и не дает возможности
достичь для него бризантности а м м о н-
пентринита, взрываемого самым неболь-
шим капсюлем-детонатором. Испытанный ни-
троглицерин содержал воздух и за день
до пробы был извлечен из смеси с инфузорной
землей.
IV. Низшие глицериннитраты
Для предохранения тринитроглицерина от
замерзания к нему в свое время рекомендовали
Рис. 100. В каждом
случае 100 г взрыв-
чатого гещества
подвергнуто дето-
нации в толсто-
стенном ручной
ковки тигле с дыр-
чатой крышкой на
12-лгл стальной
пластинке:
1 — аммонпентри-
нит с 45%
NH4NO3, d= 1,3;
2—нитроглицерин
с промежуточным
зарядом пикрино-
вой кислоты,
«/=1,6;
3— нитроглицерин
с обыкновенным
капсюлем - детона-
тором (2г), </= 1,6.
246
Нитроглицерин
прибавлять продукты низшей степени нитрации глицерина.
Вместо них теперь обычно вводится нитрогликоль, а также
употребляемый .в Германии динитромонохлоргидрин.
Первым из таких препаратов, предохраняющих нитроглицерин
от замерзания, явился приготовленный в 1903 г. Миколай-
ч а к о м динитроглицерин.
1. Глицериндинитрат
Глицериндинитрат (динитроглицерин, основной нитроглице-
рин) есть эфир с двумя остатками азотной кислоты и существует
в двух структурно изомерных формах; первая из них — симме-
тричная — может кристаллизоваться, вторая — асимметричная —
даже при низких температурах остается в жидком состоянии
Обе формы одновременно образуются при нитрации в виде гу-
стого масла, которое затвердевает при —40° в стеклообразную
массу и перегоняется без разложения. Динитроглицерин при
комнатной температуре в 2 раза более летуч, чем тринитрогли-
церин, и также обладает жгучим вкусом и ядовитыми свой-
ствами
сн2о • no2
I
симметричный снон
сно2 • no2
а-форма
асимметричный
СН2О • NO,
СНО • NO,
СН2ОН
Р-форма
ТАБЛИЦА 19
Сравнение -взрывчатых свойств динитроглицерина с т ри-
нит р о г л ицернном
(по Науму и Блохманну)
Уд. в (15°) Гигроскопич- ность через 1 день Растворимость в воде при^15° Температура вспышки Теплота взрыва в б. кал. (Н2О парообразная) Высота падения груза в 2 кг Расширение под водой Скорость дето- нации жидк. {м[сек} Проба Эбля при 72° ,
Глицериндинитрат . 1,51 з.з% 12,5% 167° 1201 8 см 500 1525 Через 60 мин. окра- шивания не появилось
Глицеринтрииитрат . 1,60 6% 0,16% 184° 1485 4 см 600 1525 Через 20 мин. на- чалось по- темнение
IV. Низшие глицериннитраты
247
2. Глицеринмононитрат
Глицеринмононитрат (мононитроглицерин) также получен и
известен, подобно динитрату в двух изомерных формах, из кото-
рых первая, так называемая a-форма, представляет собой первич-
ный эфир СНгОН • СНОН • СНгО-МОг, а вторая — В-форма — вто-
ричный эфир СНгОН • СНО NO2 • СНгОН. Обе формы дымящей
азотной кислотой превращаются в ди- и тринитрат, причем
f-мононитрат превращается в асимметричный динитрат. Удель-
ный вес (15°) по определению Наума равен 1,42, температура
кипения обоих изомеров 155—160° при 15 мм. Мононитроглице-
рин смешивается с водой во всех отношениях: гигроскопичность
его необычайно высока и составляет до 50%. Глицеринмоно-
нитрат нечувствителен к удару и благодаря незначительному
запасу энергии не имеет никакого значения для взрывной тех-
ники.
3. Монохлоргидриндинитрат
Монохлоргидриндинитрат (динитрохлоргидрин, а-монохлор-
гидринитроглицерин) имеет формулу CH2ONO2 • CHONO2 • CH2CI.
Кроме чистых эфиров азотной кислоты для глицерина полу-
чены также смешанные эфиры, один из которых, динитромоно-
хлоргидрин, приобрел с 1904 г. значение в качестве средства для
понижения температуры замерзания динамитов.
Мои охлоргидр ни получается при 15-часовом нагревании в авто-
клаве 100 кг динамитного глицерина со 150 кг соляной кислоты (уд. в. 1,19)
при 120° и 1 ат давления; из реакционной массы хлоргидрин выделяют
дробной перегонкой, собирая фракцию между 130 и 150° при 12—15 мм
давления после предварительной отгонки воды и избытка соляной кислоты.
Под конед между 165—180° перегоняется невступивший в реакцию глице-
рин, на практике его однако не отделяют. Содержащий 20—-25% глице-
рина монохлоргидрин, представляющий собою смесь двух изомеров с пре-
обладанием а-соедннения СНгОН СНОН • СНгС1, нитруется, так же как и
глицерин, смесью азотной и серной кислот, сепарируется, промывается и
стабилизируется.
Согласно Науму 100 вес. ч. чистого монохлоргидрина дают
с 450 ч. кислотной смеси, состоящей из 40% азотной и 60% сер-
ной кислоты, при температуре нитрации 10—15° 161% динитро-
хлоргидрина, теоретически же должно получиться 181,5%. На
практике выходы для 80/20%-ной смеси хлоргидрина и глице-
рина достигают 175%,
Технический динитрохлоргидрин представляет
собой жидкость от желтоватого до коричневого цвета со слабым
ароматичным запахом, которая подобно тринитроглицерину
растворяется в воде при 15° лишь в количестве 2,3%, а в отра-
ботанной кислоте до 1,9%. Удельный вес при 15° равен. 1,541.
Динитрохлоргидрин легко растворим в органических растворите-
лях, как например в 'спирте, эфире и ацетоне; вдвое более подви-
248
Нитроглицерин
жен, чем нитроглицерин, соответственно и летучесть его значи-
тельно больше; также вызывает мигрень. Нагретая до 170°
жидкость выделяет желтые пары и кипит при 190° при обыкно-
венном давлении с сильным разложением, но без взрыва. Дини-
трохлоргидрин воспламеняется труднее, чем нитроглицерин,
и в 10 раз менее чувствителен к удару, чем этот последний (вы-
сота падения 40 см против 4 см для груза в 2 кг). Химическая
стойкость выше, чем у нитроглицерина. Согласно Науму 1 кт
динитрохлоргидрина выделяет 1030 б. кал (вода и соляная кис-
лота в парообразном состоянии) и дает в свинцовой бомбе рас-
ширение в 475 см3. Скорость детонации взрывчатых смесей
меньше, чем для чистых динамитов, хотя способность к детона-
ции весьма нечувствительного к удару динитрохлоргидрина,
к удивлению, значительно больше.
Чистый динитрохлоргидрин недостаточно желатинируется
нитроклетчаткой. На практике динитрохлоргидрин перерабаты-
вается в желатинированные взрывчатые вещества только в смеси
с нитроглицерином. Динамит, в котором 25% нитроглицерина
заменено динитрохлоргидрином, является в нашем климате
(Швейцария) незамерзающим.
4. Ацетилдинитроглицерин
Ацетилдинитроглицерин (динитроацетин) CH2ONO2 • СНОМОг-
СН2ОСОСН3 и формилдинитроглицерин (динитрофор-
мин) СзН5(ОКО2)2 • (ОСНО) получены в 1906 г. Бендером
с целью приготовления незамерзающего динамита; по сравнению
с динитрохлоргидрином эти вещества не имеют никаких техни-
ческих преимуществ, к тому же производство их очень дорого.
Практического значения эти патентные предложения не имеют.
5. Диглицеринтетранитрат
Диглицеринтетранитрат (тетранитродиглицерин)
СН2 • ONO2
CH -ONO
СН2 - ONO2
СН • ONO2
СН2
Четырехзамещенный эфир азотной кислоты и ангидрида ди-
глицерина впервые был получен Лоуренцо (1861) и позднее
V. Прочие взрывчатые эфиры спиртов
249
В о л е м1 и предложен для изготовления незамерзающего дина-
мита. Исходным продуктом является диглицерин, очень
тягучая, прозрачная, как вода, сладковатая на вкус жидкость
удельного веса 1,33, щ 11 раз более вязкая, чем глицерин. Если
глицерин при добавке 0,5—1% щелочного катализатора (ацетата
натрия, бикарбоната, соды) нагревать в течение 1—2 час. до 275°,
то имеет место полимеризация с выделением воды, и образуются
30—40% диглицерина и очень небольшое количество три- и
полиглицеринов. Такую смесь с 60—70% непрореагиро-
вавшего глицерина в Америке и Англии одно время непосред-
ственно подвергали нитрации и применяли для приготовления
незамерзающего желатиндинамита.
Чистый диглицерин нитруется тем же способом, что и глицерин. По-
лучается тетранитрат в виде очень густого нерастворимого в воде
масла, очень сходного - с нитроглицерином, однако не замерзающего зимой.
Выход 168%, теоретический — 208,4%. Примерно так же, как нитроглице-
рин, растворим в обычных органических растворителях и несколько труд-
нее детонирует от удара или от капсюля-детонатора, чем этот последний.
Несмотря на свою значительную мощность и другие преимущества перед
ранее названными средствами защиты от замерзания, тетранитродиглице-
рин не может конкурировать с легко получаемым динитрохлоргидрином.
6. Нитроизобутилглицеринтринитрат
Нитроизобутилглицеринтринитрат. Это иде-
ально распадающееся взрывчатое вещество NO2 • С • (СНзОГЮг)з,
в одно и то же время являющееся эфиром и нитросоедине-
нием, впервые было получено Г офвим мерой2 и предложено
ввиду способности сильно понижать температуру затвердевания
в качестве суррогата для частичной или полной замены нитро-
глицерина. Этот «нитроэфир» образует желтоватое более густое
и менее летучее, чем нитроглицерин, масло удельного веса 1,68.
Его растворимость одинакова с растворимостью нитроглицерина.
Теплота взрыва на 7% больше теплоты взрыва нитроглицерина.
Некоторые другие положительные свойства заранее обеспе-
чили бы первенство нитроизобутилглицеринтринитрату, если бы
не низкие выхода при производстве исходного продукта из ни-
трометана и формальдегида и соответственно высокие затраты.
V. Прочие взрывчатые эфиры спиртов
1. Гликольдинитрат (динитрогликоль)
Ближайшим гомологом нитроглицерина является эфир азот-
ной кислоты и двухатомного спирта гликоля, обычно называе-
мый нитрогликолем, который так же как и смешанный
1 Герм. пат. 58957.
2 Z. f. Schiess- u. Sprw., 1912, 43.
250
Нитроглицерин
нитрат изобутилглицерина, представляет собой «идеальное»
(в отношении кислородного баланса) взрывчатое вещество, вы-
деляющее к тому же при разложении наибольшее из наблюдае-
мых количеств тепла на единицу веса. Полученный в 1870 г.
А н р и и ранее известный лишь по лабораторным опытам нитро-
гликоль приобрел во время войны большое значение и в настоя-
щее время широко применяется при изготовлении «незамерзаю-
щих» динамитов. Уже в 1927 г. в США наряду с 22 000 г
динамитного глицерина было получено 15000 т гликоля. Такой
быстрый рост потребления гликоля в США явился результатом
его дешевого производства из земляного газа 4.
Получаемый из земляного газа при компримировании и охлаждении
этилен превращается хлорированием в хлористый этилен, омы-
ляемый щелочью под давлением. Полученный раствор техниче-
ского гликоля, содержащий поваренную соль, концентрируют в ва-
кууме и по удалении основной массы соли подвергают перегонке, причем
гликоль перегоняется при сильном разрежении при 110°. Теоретически
1 моль хлористого этилена СН»С1 CHaCl (98,94 г) с 1 молем соды (106 г)
или 2 молями бикарбоната натрия (168 г) дает 1 моль, или 62,05 г гликоля.
Омыление лучше всего проводить в автоклавах2. При этом по отноше-
нию к хлористому этилену берется 12—20-кратное количество воды; вна-
чале добавляется лишь часть потребного для гидролиза количества карбо-
ната, и расходуемый карбонат постепенно возмещается едким натром, ко-
торый под давлением образует с углекислотой новые количества карбоната,
чем расщепление поддерживается в наиболее целесообразных границах.
Например омыление длится при 150° и 40 ат 48 час., и выход гликоля
в виде 9%-ного водного раствора равен 82% теоретического.
В отношении способа производства гликоля последовали в дальнейшем
различные предложения, из которых можно указать элементарный синтез
этилена, из ацетилена и водорода в присутствии порошкообразного никеля
при температуре выше 180° и окисление полученного этилена перманга-
натом 3.
Чистый гликоль представляет собой по своей подвиж-
ности более близкую к воде, чем к глицерину, бесцветну-ю, без
запаха и очень сладкого вкуса жидкость. Удельный вес его по
определению Тейлора и Ринкенбаха4 равен 1,1132
при 20°, температура плавления от —12 до —17° и температура
кипения 197° при 760 мм. Гликоль (также этиленгликоль; интер-
национальное название — этандиол) так же гигроскопичен, как
и глицерин, смешивается с водой и со спиртом во всех отноше-
ниях, в эфире растворим лишь в количестве 1,1%. «Динамит-
ный» гликоль должен быть по крайней мере 97%-ным. Опреде-
ление степени чистоты производится по удельному весу,
который, начиная с 100%-ного гликоля (1,096) и до 95%-ного
(1,060), уменьшается на каждый 1% содержания воды на 0,0007.
1 Ср. Stettbacher, Sprengstoffortschrittsbericht, 1924—1928, Z. f.
Schiess- u. Sprw., 1929, 21 (оттиск).
2 Герм. пат. 298931 (1915), 299074 (1916) и 369502.
3 Chem. Ztg., англ. пат. 251652 (1926), 1927, 827; далее фраиц. пат. 612825
.(1926).
4 Ind. Eng. Chem., 1926, 676.
V. Прочие взрывчатые эфиры спиртов
251
Диэтиленгликоль СНаОН СНа — О — СНа • СНаОН бесцветная,
без запаха, подобная глицерину густая жидкость удельного веса 1,1177 при
20°. Это вещество приобрело в последние годы известное значение в ка-
честве исходного .продукта для одной из составных частей пороха. Темпе-
ратура затвердевания —10,5°, температура кипения 190° при 25 мм рт. ст.
Получение нитрогликоля
гликоль нитрогликоль
СН2ОН — СН2ОН + 2HNO3 = CH9ONO„ — CHQONO2 + 2Н2О
100 203,2 245,2 “ “ 58,1
Количественные соотношения — в пределах 1 % — довольно
точно соответствуют таковым при нитрации глицерина. Уста-
новка и аппаратура для сепарации и последующего разделения
и промывки также примерно одинаковы. Вследствие значитель-
ной летучести и растворимости в воде выходы нитрогликоля
на 3% меньше, чем для нитроглицерина. Согласно' Науму2
100 г безводного гликоля и 625 г нитрующей смеси, состоящей
из 58% серной кислоты, 41% азотной кислоты и 1% воды, дают
в лучшем случае
I
222,2 г иитрогликоля при температуре нитрации 10—12°, или 90,6% от теории
218,3 г „ „ „ „ 29—30°, или 8 г1,1"/0 от теории
Между тем А. Шмид3 при опытной нитрации (особенно
тщательно проведенной) получил из 98,5$ -ного гликоля и кис-
лотной смеси 50 : 50 выход 230%, что соответствует 93,9% теоре-
тического.
Вышеуказанная нитрующая смесь требует для ее составле-
ния дымящей азотной кислоты, которую не всегда так легко
получиуь. Автор часто работал с кислотой удельного веса всего
лишь 1,38 и может рекомендовать для быстрого лабора-
торного способа получения следующие количественные
соотношения;
В 2-л колбе смешиваются 500 см3 азотной кислоты удельного веса 1,38,
что соответствует 62% НЬЮз, и 800 см3 концентрированной серной кислоты,
содержащей 96% HsSCh, причем колба снаружи охлаждается водой, и затем
при взбалтывании по каплям вводится 100 г гликоля. Операция при тем-
пературе, не превышающей 20—25°, длится 20, максимум 30 мин. Затем
продукт реакции отделяется и промывается, как это описано для нитро-
глицерина. В связи с содержанием в кислотной смеси воды (24,1% HNO3;
59,3%; HaSO«; 16,6% НаО) получается 151 см3 = 226,5 г, или 206%, кислого
нитрогликоля, количество которого уменьшается после промывки до 207 г,
или 188%; такой выход при столь быстром получении нитрогликоля, про-
водимом без предварительной подготовки, можно считать удовлетвори-
тельным.
1 Rinkenbach, Ind. Eng. Chem., 1927, 474.
2 Нитроглицерин и нитроглицериновые взрывчатые вещества, Госхим-
техиздат, 1934.
3 Z. f. Schiess- u. Sprw., 1927, 273.
252
Нитроглицерин
Так же как и нитрация, сепарация нитрогликоля протекает скорее и
лучше, чем у нитроглицерина; люди, предрасположенные к действию па-
ров этого летучего эфира, должны быть очень осторожны.
В заводских условиях редко нитруют чистый гликоль,
обычно же нитрации подвергается такая его смесь с глицерином,
что в результате реакции образуется смесь с очень низкой тем-
пературой затвердевания, содержащая нитрогликоль и нитрогли-
церин в отношении 1 :3 или 1 : 4.
Свойства. Нитрогликоль вследствие его происхождения
из этилена называемый иначе этиленгликольдинитратом, пред-
ставляет собой прозрачную, как вода, жидкость удельного веса
1,496 при 15°; температура затвердевания его —22°. В вакууме,
создаваемом с помощью водяного насоса, он кипит без разло-
жения при 95° и может быть легко 'перегнан с водяным паром.
Нитрогликоль, так же как и нитроглицерин, не поглощает влаги,
но растворим в воде при 20° в количестве в 4 раза большем, чем
нитроглицерин, а именно 6,8 г на литр. Легко растворяется
(так же как и нитроглицерин) в спирте, эфире, ацетоне и бен-
золе. Недостатком его является высокая летучесть, которая
по Шмиду при температуре 35—38° в 13 раз больше, чем
у нитроглицерина, и в 69 раз больше, чем у гремучего студня
(90/10). Однако в патронных гильзах из парафинированной
бумаги разница в потере веса значительно меньше:0,80 и 0,15%
для нитрогликолевого и нитроглицеринового гремучего студня
90/10 за 30 дней при 35°. Способность нитрогликоля же-
латинироваться значительно больше, чем у нитроглице-
рина, и протекает уже при комнатной температуре столь быстро,
что для целесообразного приготовления желатины вполне доста-
точно охлаждения до 10 или 0°.
При воспламенении нитрогликоль подобно нитроглицерину
сгорает с шипением, а при больших количествах вследствие мест-
ных перегревов происходит взрыв. Чувствительность в отноше-
нии капсюля-детонатора в жидком состоянии больше, а ,в твер-
дом неожиданно меньше, чем у нитроглицерина. При продолжи-
тельном нагревании при 75° нитрогликоль оказывается химиче-
ски более стойким, чем нитроглицерин, хотя в начале испы-
тания по Эблю имеет место реакция, которая однако по
данным Наума является следствием небольшой диссоциации
паров, факт, что нитрогликоль менее склонен к разложению,
чем нитроглицерин, был подтвержден определением концентра-
ции водородных ионов при 75 и ПО01. Среднее место по чув-
ствительности занимает технический динитрохлоргидрин с 30%
нитроглицерина. Согласно данным Костевича чистый жид-
кий нитрогликоль меньше действует на сталь и на сплав для
гильз, чем нитроглицерин, в тех же условиях.
*Metz, Priifung der chem. Bestandigkeit von Pulvern u. Sprengstoffen',
Z. f. Schiess- u. Sprw., 1929, 337.
К Прочие взрывчатые эфиры спиртов
253
Из сравнения с различными стандартными взрывчатыми веще-
ствами видно, что нитрогликоль недостаточно чувствителен
к удару. Так, испытания, произведенные Буркгардтом на
швейцарском динамитном заводе в Ислетене с 0,1 г взрывчатого
вещества и падающим грузом в 5 кг при температуре 10—11е,
дали следующие результаты:
Нитроглицерин..................................
Смесь нитроглицерина и иитрогликоля 3:1........
Нитрогликоль...................................
Пенгаэритриттетранитрат........................
Триннтрофенилметилнитрамин.....................
Тринитротолуол ................................
5 см
5,5 „
7 .
27 ,
31 „
НО „
Из табл. 9 (на стр. 146) видно, что нитрогликоль, выделяющий
1655 б. кал тепла на 1 кг, является одним из наиболее мощных
и бризантных взрывчатых веществ; по расширению в свинцовой
бомбе он превосходит даже гремучий студень. Правда, если
отнести это расширение к единице объема взрывчатого веще-
ства, т. е. к 1 л, то гремучий студень все же останется на первом
месте. Скорость детонации нитрогликоля, так же как и
у нитроглицерина, имеет высший и низший пределы, хотя склон-
ности к более быстрому распространению взрывной волны в та-
кой сравнительно подвижной жидкости, какой является динитрат,
отрицать нельзя Г
Р-нитроэтилнитрат CHaNOa— СН»О NOa, близкий по своим взрывчатым
свойствам к гликольдинитрату, является интересным соединением смешан-
ного типа, которое в качестве эфира азотной кислоты дает цветную реак-
цию с дифениламином, а как первичное нитросоединение реагирует в ще-
лочном растворе с .диазосоединениями; нитроэтилнитрат получен Вилан-
дом1 2 3 4 в виде бесцветного масла с температурой кипения 120—122° при
17 мм. Удельный вес его равен 1,47. Пары нитроэтилнитрата обладают
чрезвычайно резким запахом и очень ядовиты; стоит только нанести не-
сколько капель его на пятиокись фосфора, как появляется невыносимый за-
пах нитроэтилена.
Гликольмононитрат СНаОН • CHaONOa, являющийся эфиром азот-
ной кислоты и гликоля, представляет собой бесцветную со слабым арома-
тическим запахом жидкость удельного веса 1,35; благодаря низкому кисло-
родному балансу в 37"% и большой растворимости в воде никакого значе-
ния в технике взрывчатых веществ не имеет. Большой интерес как сурро-
гат для замены нитроглицерина в порохе представляет диэтиленгли-
кольдинитрат, образующийся как побочный продукт при получении
тетранитродиглицерина “, и затем моно- и динитрофенилгликольдинитрат *.
Мети л нитрат СН3О • NO2, простейший представитель жирного
ряда5, получается при осторожной перегонке метилового спирта с обыкпо-
1 Rep. investig, 2935 (1929); The effect of substituting Glycoldinitrate in
permissible explosives.
2 Ber. 53, 206 (1920).
3 W. Rinkenbach и Aaronson, Ind. Eng. Chem., 1931, 160.
4 Герм. пат. 558126 (1931) (Westf.-Anh. Spr. A.-G.).
5 Подробнее о моно- и полизамещенных эфирах азотной кислоты см.
Наум, Нитроглицерин и нитроглицериновые взрывчатые вещества, Гос-
химтехиздат, 1934. Прим. ред.
254
Нитроглицерин
венной азотной кислотой удельного веса 1,4 <и небольшой примесью моче-
вины (для связывания образующейся в качестве промежуточного продукта
азотистой кислоты, наличие которой приводит к разложению, сопрово-
ждающемуся взрывом) в виде бесцветной жидкости с приятным запахом,
кипящей при 65°. Пары метилнитрата чрезвычайно взрывчаты, а в жидком
виде (d = 1,21) метилнитрат взрывает уже от слабого термического
импульса, причем звук напоминает взрыв нитроглицерина (взрыв в Сен-
Деии в 1874 г.). Из-за своей чрезвычайной летучести этот эфир азотной
кислоты и метилового спирта, не нашел практического применения, хотя
нет ни одного равного ему по силе взрывчатого вещества, которое полу-
чалось бы столь быстрым и простым путем, заключающимся в одной пере-
гонке. То' же можно сказать о кипящем при 86° и еще менее растворимом
в воде эти л нитрате, к применению которого побуждают легкость и
дешевизна его производства.
Все алифатические эфиры азотной кислоты,
являющиеся жидкостями, легко детонируют. Уже под
действием самого маленького капсюля-детонатора № 1 они на-
цело разлагаются. Недаром особым по сравнению с большин-
ством других взрывчатых веществ преимуществом нитроглице-
рина является способность легко и надежно поддаваться взрыву.
Недавно возникшая идея «сенсибилизации» нитроглицериновых
взрывчатых веществ примесью твердых высокобризатных нитра-
тов (как при «пентринизации» и «гексонитизации») в сущности
излишня и ошибочна, так как нитроглицерин с примесью таких
веществ ни в коем случае не разлагается более легко и совершенно
на углекислоту и воду, а лишь быстрее и надежнее достигает
высшего предела детонации. Вместо того чтобы заниматься во-
просами «сенсибилизации», следовало бы говорить об увеличе-
нии скорости детонации и об обеспечении бризантности.
2. Пентаэритриттетранитрат, или нитропентаэритрит (пентрит)1
Значение для будущего, которое имеет этот твердый нитрат,
употребляемый в виде пентринита или какой-либо другой
флегматизированной смеси, оправдывает подробное описание
этого наиболее бризантного из всех технических
взрывчатых веществ соединения, в частности также и потому,
что пентрит является первым взрывчатым веществом, полученным
синтетически из таких материалов, как уголь, вода и воздух.
Исходным продуктом служит твердый кристаллический
четырехатомный спирт — пентраэритрит, который нигде в при-
роде не встречается и производится синтетическим путем. Впер-
вые синтез этого вещества был предложен в 1891 г. Т о л л е н-
сом и Вигандом2; в 1916 г. автор3 опубликовал способ
приготовления пентаэритрита в полузаводском масштабе.
1 Это же взрывчатое вещество называется еще тетранитропентаэритрит,,
иногда нитропента; в русском языке установился термин тэн. Прим. ред.
г Annalen, 265, 316—319 (1891) и 276, 58 (1893).
3 Z. f. Schiess- u. Sprw., 1916, 182—184.
V. Прочие взрывчатые эфиры спиртов
255
Образование четырехатомиого спирта, пентаэритрита, происхо-
дит в щелочном растворе по уравнению:
Формальдегид Ацетальдегид Вода Пентаэритрит Муравьиная Известь
кислота
4СН.,О + СН3СНО + Н2О = С (СН2ОН)4 + НСООН 4-1/2 СаО
120,08 + 44,03 + 18 = 136,10 + 46,0 + 28,0
10 кг 40°,,с-ного формалина и 1,467 кг 4,533 кг 1,532 кг 0,933 кг
ацетальдегида пентаэритрита
На практике формальдегид, а также известь, которая в форме извест-
кового молока (гидроокиси кальция) употребляется для перевода образую-
щейся муравьиной кислоты в соответствующую соль, берутся с некоторым
избытком. На 10 кг 40%-ного формальдегида берут поэтому всего около
1,4 кг ацетальдегида и минимум 1,1 кг извести, вместо полагающихся по
уравнению 0,93 кг. Гашеная известь размешивается с 16 л воды в извест-
ковое молоко, и к нему медленно или при охлаждении приливают раствор
формалина, так чтобы температура не превышала 15°. Затем при пере-
мешивании и при той же температуре прибавляют 1,4 кг ацетальдегида,
растворенного в 5 л воды; после этого температуру доводят до 40°.
Согласно новому рецепту1 можно обойтись значительно меныпим количе-
ством воды, если к суспензии 800 г параформальдегида и 210 г ацеталь-
дегида в 5,5 л воды медленно при 35е прибавлять 180 г СаО. Выход
продукта при работе по этому рецепту составляет 54%; температура пла-
вления 250°.
Целесообразнее однако получать пентаэритрит по новому непрерыв-
ному способу, где сырой пентаэритрит в твердом состоянии пропу-
скается через сушильные вальцы. Однако дальнейшая очистка и перекри-
сталлизация, имеющие целью отделение от твердого спирта примеси му-
равьиной кислоты и извести, составляют отдельные операции, которые
могут быть выполнены лишь обычным путем и нарушают непрерывность
процесса.
Даже перекристаллизованный, очищенный пентаэритрит не
имеет резкой температуры плавления и обычно спекается
в интервале 238—248°. Как показали новейшие исследования2,
Наряду с пентаэритритом образуется не вполне удаляемый даже
при перекристаллизации дипентаэритрит, который пред-
ставляет собой эфирный ангидрид, получающийся при взаимо-
действии двух молекул пентаэритрита. Это соединение, содержа-
щее шесть гидроксильных групп, плавится в чистом состоянии
при 221°, тогда как химически чистый пентаэритрит,
полученный сублимацией в высоком вакууме при 130°, плавится
лишь при 260° (перекристаллизация дает температуру плавления
не выше 254°). Диаграмма плавкости бинарных смесей показы-
вает, что примесь 5% дипентаэритрита снижает температуру пла-
вления пентаэритрита до 251°, а 10% дипентаэритрита — до 235°.
Технический пентаэритрит часто содержит 5—10% дипентаэри-
трита; присутствие его не отражается однако на процессе нитра-
ции и не ухудшает заметным образом действия полученного
нитрата.
1Schurink, Organic Synthesis 1, 417 (1932); см. русский перевод:.
Синтезы органических препаратов, т. I, стр. 166 (1932).
2Friederich и В г й п, Вег., 1930, 2681; L. Е b ё г t, Вег., 1931, 114..
256
Нитроглицерин
Нитрация пентаэритрита протекает по уравнению:
С(СН2ОН)4 + 4HNO3 = C(CH2ONO2)4 4- 4Н.,О
136,10 252,1 316,094 72,1
Теоретически . . 100 185,2 232,3 52,9 г
Практически . . 100 г 400 см? 225 г = 97% предварительно
промытого продукта
216 г s= 94% стабилизированного
продукта
Пользуясь исходным продуктом с температурой плавления
240—248°, выход в производстве можно несколько увеличить.
В действительности выход еще больше, так как пентаэритрит со-
держит дипентаэритрит:
Дипентаэритрит Дипентаэритритгексанитрат
С10Н22О7 -|- 6HNO3 — C10H16N6O19 -j- 6НО,
100 148,7 206,2 42,5 г
Если скомбинировать оба уравнения для технического пента-
эритрита (темп. пл. 235°), что соответствует 90% пентаэритрита
и 10% дипентаэритрита, то наибольший возможный выход равен
лишь 229,7%, т. е. вместо указанных выше 97 и 94% следует счи-
тать соответственно 98 и 95%.
100 г порошкообразного пентаэритрита1 * постепенно вносят в 400 см3
дымящей азотной кислоты (уд. в. 1,51—1,52), причем следует позаботиться
о том, чтобы не дать температуре превысить 25° (для чего необходимо
охлаждение). В этом случае достаточен 3,3-кратный избыток азотной кис-
лоты; если взять кислоты меньше чем 400 см3 или кислоту меньшей кон-
центрации (ниже уд. в. 1,48), то легко может иметь место окисление и
перегрев содержимого, тогда как при той же концентрации, но при более
высокой температуре нитрации возникает опасность воспламенения и даже
взрыва загрузки. При применении мешалки со взбалтывающим приспо-
соблением нитрация заканчивается в течение % часа; при охлаждении
ледяной водой или рассолом — еще скорее. К желтой реакционной смеси,
в которой эфир находится отчасти в растворенном состоянии, отчасти
в виде суспензии кристаллов, прибавляют при перемешивании 400 см3
концентрированной серной кислоты, причем в данном случае температура
поддерживается не выше 25°. Пентаэритриттетранитрат выделяется в виде
массы мелких кристаллов, и реакционная жидкость осветляется. Пента-
эритриттетранитрат может быть быстро отделен от кислотной смеси филь-
трованием через асбест или стеклянный ну ч-фильтр (емкостью до
2,5 л). После тщательного отсасывания при помощи водоструйного насоса
кристаллическую массу, содержащую еще значительное количество смеси
серной и азотной кислот, вносят в литр ледяной или двойное количество
водопроводной воды и быстрым перемешиванием и погружением предот-
вращают возможность разложения, сопровождающегося выделением нитроз-
ных газов. Пентаэритриттетранитрат, осаждающийся на дне сосуда в виде
белого порошка, промывается на нуч-фильтре с обыкновенным бумажным
фильтром большим количеством воды почти до нейтральной реакции.
Сырой продукт всегда содержит небольшое количество кислоты, кото-
рая полностью не удаляется ни при нагревании с водой, ни даже с рас-
1Stettbacher, Z. f. angew. Chemie, 1928, 716—718; Z. f. Schiess- u
Sprw., 1928, 345—348.
V. Прочие взрывчатые эфиры спиртов
257
твором соды. Окончательная стабилизация возможна только в среде рас-
творителя, так как в этих условиях кислота легче поддается нейтрализации.
Для этой цели растворяют 100 г сырого нитропентаэритрита, не высушен-
ного и могущего содержать 16—25% воды в не менее чем 300, лучше
в 400 см3 ацетона в колбе с обратным холодильником, добавляют 2—3 г
измельченного карбоната аммония и кипящий раствор (желтая, изменив-
шаяся окраска которого указывает на нейтрализацию кислоты) сливают
через воронку для горячего фильтрования с бумажным- фильтром в 800 см3
дестиллированной, непрерывно размешиваемой воды. Пентаэритриттетра-
нитрат почти количественно выделяется в виде мелких кристаллов, еще
раз промывается на нуч-фильтре водой и после этого сушится. Преиму-
щества, приписываемые недавно предложенному способу перекристаллиза-
ции из нитробензола *, докажет только опыт.
Подобным же способом осуществляется производство пен-
трита и на заводе. Сейчас ведутся опыты по непрерывной
нитрации пентаэритрита, отчего значительно увеличилась бы
безопасность производства пентаэритриттетранитрата — как и для
всех подобного рода непрерывных процессов, при которых избе-
гается местное скопление опасных веществ. Такой способ как
будто приобрел промышленное значение и дает 98% выхода ни-
трата.
Каждый пентритный завод имеет установку для переработки
ацетона, на который из водного (приблизительно 30%-ного
раствора ацетона) регенерируется 96%-ный ацетон. Стабилизи-
рованный пентаэритриттетранитрат образует белую мелко-
кристаллическую, отчасти порошкообразную, массу, имеющую
гравиметрическую плотность 0,2—0,3. Он нерастворим в воде по-
добно нитроглицерину, трудно растворим в спирте и эфире и
легко — только в ацетоне, служащем хорошим растворителем для
всех без исключения взрывчатых веществ, представляющих со-
бою индивидуальные химические соединения. Твердый эфир уже
при комнатной температуре несколько летуч и частично субли-
мируется цри нагревании до 75°. У чувствительных людей он,
как и нитроглицерин, вызывает головную боль, однако его фи-
зиологическое действие значительно слабее, чем нитроглицерина.
Игольчатые кристаллы имеют удельный вес 1,75—1,77; удельный
вес примешанного к нему дипентаэритритгексанитрата 1,63. Пен-
трит плавится при 141—142° в тяжелое бесцветное масло, кото-
рое при охлаждении закристаллизовывается вновь. Выше темпе-
ратуры плавления начинается разложение, сопровождающееся
выделением пузырьков газа, что при 160—170° приводит к вспе-
ниванию, вызываемому разложением с отщеплением NOg. В ко-
личестве нескольких граммов в пробирке на голом пламени га-
зовой горелки пентрит горит подобно 80/20 пентриниту сильным,
сопровождаемым резким звуком пламенем; при медленном раз-
ложении на проволочной сетке в пламени газовой горелки взры-
вает при определенной температуре чрезвычайно бризантно. По-
дожженный пентрит по данным официальных испытаний взры-
вает лишь в количестве не меньшем чем 1 ,кг. Благодаря симме-
1 Англ. пат. 378500 (1931).
17 Зак. 3171. — Штетбахер.
258
Нитроглицерин
тричному строению пентрит значительно более стоек, чем все
до сих пор известные алифатические нитраты: после 8-часового
нагревания до 100° химическая стойкость его не изменяется;
4-часовое выдерживание при 120° ведет к начинающемуся вы-
делению окислов азота (Метц). Температура плавления нитро-
пентаэритрита в присутствии ди'пентаэ1ритритгексанитрата пони-
жается очень незначительно. Так например смесь 80% пентрита
и 20% дипентагексаэфира плавится при 134° Ч
O,N-OH2Q /CH2O-NO2
O2N • ОН3С/\СН2О • NO,
/CHjO • NO,
C—CH2O NO2
%CH2O • NO2
ch2
>o
/CH2
C-CH2O • no2
\CH2O • NO,
CH,O • no;
/CH2O.NO»
C<CH,0 • NO,
\CH2 2
/н I
c---о
/CH2ONO2
c(ch2ono,
xCH2ONO2
пентаэрнтриттетранитрат, темп,
пл. 142°
„центрированные связи^
дипентаэритриттетра* ангыдроэниеагептитпента-
нмтрат, темп. пл. 75° нитрат, темп. пл. 132°
Кислородный баланс ....
Расширение в cms..........
Скорость детонации в м/сек .
Пеитаэритрит-
тетраиитрат
- Ю,1%
470
8340 (d = 1,71) 7410 (d = 1,59)
Дипеитаэритрит-
гексаиитрат
-27,5%
380
Аигидроэнне-
агептитпента-
иитрат
—зо,о%
Благодаря тому что дипентаэритритгексанитрат в 2 раза менее
чувствителен к удару и к трению, чем тетранитрат, и его темпе-
ратура воспламенения примерно на 100° выше, он в известной
мере оказывает на пентрит флегматизирующее действие. Такому
желательному свойству противополагается однако очень незна-
чительная скорость детонации, так что примесь дипентагексани-
трата к пентриту в количестве 10% уже оказывается заметной.
Так как дипентаэритритгексанитрат растворим в азотной кислоте
значительно больше, чем пентрит, то часть его остается в отра-
ботанной кислоте, т. е. тетранитрат содержит дипентагексанитрат
уже в меньшем количестве, чем можно было ожидать по содер-
жанию обоих спиртов в исходном продукте. Поэтому мы не со-
вершим ошибки, если примем, что в техническом стабилизиро-
ванном пентрите содержится максимум 5% дипентагексанитрата,
что соответствует дефициту кислорода в 11,0%. С точки зрения
взрывной техники разница между химически чистым и техни-
ческим пентритом (в противоположность тетрилу) настолько не-
значительна, что она не играет никакой роли. Производившийся
в Швейцарии для военных целей продукт, которым автор поль-
* Brun, Die sprengtechnischen Eigenschaften des Dipentahexanitrates, Z. f.
Schiess- u. Sprw., 1932, 73—67.
I/. Прочие взрывчатые эфиры спиртов
259
зовался при опытах с пентрииитом, плавился обычно при 142°
и являлся таким образом химически чистым веществом. Равным
образом температура плавления большой французской партии
пентрита, имевшего слабую окраску, колебалась в пределах
141,5—142°.
Ан г и др о э нн е а г е п ти тпе н та нитр а т. Подобно кон-
денсации с образованием пентаэритрита из ацетона и формаль-
дегида может быть получен эннеагептитангидроспирт с пятью
гидроксильными группами, пентанитрат которого (см. приве-
денную выше формулу) образует молекулу с центральным обра-
зованием в форме цепи. Благодаря большому недостатку кисло-
рода мощность гептитпентанитрата значительно меньше, чем
у пентрита \ но тем не менее больше, чем у дипентагексанитрата
или тетрила (рис. 20). Вопрос о применении его на практике не
может быть поставлен из-за низких выходов исходного про-
дукта, имеющего довольно сложную молекулу и помимо того
плохо кристаллизующегося.
В качестве одного из наиболее бризантных и
обладающих одной из самых больших скоро-
стей детонации веществ пентрит нашел себе широкое
применение в качестве примеси к другим взрывчатым веществам.
Столь сильный взрыв, который сопровождает детонацию этого
вещества (рис. 37), не может дать ни одно другое взрывчатое
вещество; это свойство пентрит сохраняет даже и зимой при
низкой температуре. На рис. 101—104 изображены результаты
детонации 50 г взрывчатого вещества, охлажденного
твердой углекислотой до —60, —70°, в железном
тигле, прикрытом свинцовой пластинкой, с помошью капсюля-
детонатора № 8 на 10-Л1М железной пластинке1 2.
Рис. 101 дает ясное представление об «ослабляющем» дей-
ствии, оказываемом нитроклетчаткой на нитроглицерин, в то
время как достаточное количество прибавленного пентрита обес-
печивает даже в самых трудных случаях абсолютную бризант-
ность. Желатинированные и нежелатинированные динамиты,
имеющие в своем составе 10% кристаллического пентрита, на-
званы по предложению автора пентринитами. Пентринит
является практическим осуществлением нобелевской идеи
динамита, поскольку пентринит при любой продолжительности
хранения в любом климате и для любого диаметра патрона по-
стоянно детонирует с наивысшей возможной скоростью3.
Подобно коллоксилинам пентрит, обладающий меньшим дефи-
цитом кислорода, дает с нитроглицерином идеально распадаю-
щиеся смеси, запас энергии которых несколько больше, чем
число больших калорий обоих компонентов:
1Stettbacher, Pentrinit als Geschossfiillmitel, I и П, Chem. Ztg., 1929,
533 и 554.
2 Hochbrisanzstudien HI, Z. f. Schiess- u. Sprw., 1931, 8—10.
3 Der Kampf urn das Pentrinit, Chem. Ztg., 1931, 653 и 671.
17*
260
Нитроглицерин
Пентрит
C(CH.,NO3)4
316,094
25,82%
Нитроглицерин
+ 4C3H5(NO3)3 = 17СО»-f-14Н2О-4-8N»
908,24
74,18%
24,25% 75,75% для чистого пентрита с 5% дипента-
гексанитрата соответственно 11% не-
достатка кислорода.
Рис.102. Нитроглицерин,
замороженный до твер-
дости стекла.
Рис. 101. Трудно замер-
зающий гремучий сту-
день 93,3/6,7 (сильно за-
мороженный).
Рис. 103. Желатинпеитри-
иит 50/50 (замороженный
до твердости камня).
Рис. 101—104. В каждом случае 50
до—70°, подвергнуто детонации в
свинцовой крыщкой, на
Рис. 104. Желатинпентри-
иит 50/50 с 23,6% амми-
ачной селитры.
г взрывчатого вещества, охлажденного
железном тигле, покрытом дырчатой
10-л<л< железной пластинке.
Так, по определению Швейцарского военного департамента
расширение для зарядов капсюлей-детонаторов при взрыве на
свинцовой пластинке, диаметр пробоин и потеря в весе соста-
вляют:
Пентрит.....................
Пентрит с 20% нитроглицерина
Тетрил .....................
30,4 см* 16,8 мм 5 г
33,5 „ 17,5 . 6 .
28,0 „ - -
Эти числа показывают, насколько 80/20 пентринит, пред-
ставляющий собой простую смесь двух различных по своему
V. Прочие взрывчатые эфиры спиртов
261
агрегатному состоянию, но химически родственных эфиров азот-
ной кислоты, взрывает сильнее, чем чистый пентрит.
3. Маннитгексанитрат CH2ONO2 — (CHONO2>4 — CH2ONO2
Маннитгексанитрат, обычно называемый нитроманнитом, был
открыт вскоре после нитроглицерина, в 1847 г., Собреро и
предложен в качестве превосходной замены для гремучей ртути
в ударных составах. Из всех алифатических эфиров азотной кис-
лоты нитроманнит один является высокомолекулярным веще-
ством, которое может быть получено в химически чистом виде;
это единственное взрывчатое вещество, обладающее согласно
уравнению горения избытком кислорода, равным 7%. Чрезвы-
чайно ценный с точки зрения теоретической нитроманнит тем не
менее не имеет никакого практического значения. Все же дадим
о нем некоторые сведения.
Исходным продуктом является d-м а н н и т, гексоза, которая
добывается из сока манны в Сицилии. Сбыт этого продукта на
мировой рынок производится через гавань Палермо. В 1927 г.
он достигал 15 110 кг стоимостью 915 000 лир. Чистый маннит,
транспортируемый обычно в виде конусов, подобных сахарной
голове, кристаллизуется в иглах или призмах, легко растворим
в воде и плавится в химически чистом виде при 166°, а чистый
продажный продукт при 162—166°.
Нитрация маннита протекает так же, как и для пентаэритрита,
но отделение объемистого и тестообразного склеивающегося
нитроманнита идет хуже, чем отделение крупнокристаллического
и тяжелого центрита:
С6ЩОН)6 + 6HNO3 = CbH8(ONO2)6 + 6НаО
182.11 378,12 452,11 108,12
100 20,78 248,4 —
37,5 г чистого раздробленного маннита медленно вносятся порциями
при взбалтывании и охлаждении водой в 125 см3 дымящей азотной кисло-
тый удельного веса 1,5, помещенной в %-л колбу. Сахар быстро раство-
ряется с небольшим выделением тепла. Когда весь маннит растворится,
доливают в 3—4 приема при сильном встряхивании 200 ей3 концентриро-
ванной серной кислоты: после первых 40—50 см3 серной кислоты все
содержимое колбы превращается в почти твердую массу, которую энер-
гичным взбалтыванием и одновременным охлаждением водой нужно пре-
дохранять от местных перегревов. После прибавки следующих порций
серной кислоты осадок вновь становится более подвижным, и наконец
после прибавления 9—10 вес. ч.1 он становится пригодным для фильтрации.
Отработанную кислоту возможно лучше отсасывают на нуч-фильтре (с пред-
варительно пронитрованным круглым фильтром или толстым асбестом),
затем все еще сильнокислое содержимое нуч-фильтра делится на 6—8 ч.
и смешивается приблизительно с 1% л холодной воды, после чего вновь
отсасывается на нуч-фильтре и несколько раз промывается водой. Для
удаления последних остатков кислоты нитроманнит вновь суспендируют
в воде и прибавляют раствор карбоната аммония до щелочной реакции
(отсасываемая вода должна давать сильную щелочную реакцию на метил-
1 По оригиналу нельзя понять,., какое вещество добавляется в коли-
честве 9—10 вес. ч. Повидимому серная кислота. Прим. ред.
262
Нитроглицерин
оранж), раствор фильтруют иа нуч-фильтре и осадок промывают чистой
водой. После сушки при 30—40° .маннитгексанитрат получается в виде
рыхлого, совершенно белого тонкого порошка. Выход 89 г, соответствую-
щий 238%', или 96% от теории.
Для того, чтобы получить совершенно чистый нитроманнит,
содержащий теоретическое количество азота, т. е. 18,58%, его
нужно один или два раза перекристаллизовать из кипящего
спирта, растворяя полученные 89 г в 600 сл3 кипящего 90%-ного
или более крепкого спирта, при добавлении 0,5—1 г раздроблен-
Нитроманиит. Тетранитропентаэритрит.
Рис. 105. 18 г каждого из указанных веществ (а = 0,7) подвергнуто
детонации в железном тигле на 1-мм железной пластинке.
ного карбоната аммония и отфильтровать через горячую во-
ронку; нитроманнит быстро выделяется при этом в виде объеми-
стой массы мелких игольчатых кристаллов. Остающийся в ма-
точном растворе нитроманнит лучше всего выделять не выпа-
риванием, а разбавлением водой. Потеря при перекристаллиза-
ции достигает 2—3%.
Выкристаллизованный или осажденный из спирта маннитгек-
санитрат представляет собой объемистую, совершенно белую
массу, нерастворимую в воде, мало растворимую в холодном
спирте и хорошо растворимую в кипящем спирте, эфире и осо-
бенно в ацетоне. Однократно перекристаллизованный нитроман-
нит плавится при 110°, а химически чистый продукт при 112°.
Удельный вес кристаллов не менее 1,72 и таким образом не
вполне соответствует удельному весу пентрита. С нитроглице-
рином и нитрогликолем нитроманнит образует (растворимость
его в смеси нитроглицерина и нитрогликоля довольно значи-
тельна) пластическую массу, похожую на пентринит, однако бри-
зантность подобной смеси при том же содержании твердого гек-
санитрата оказывается меньше (ср. рис. 113 и 114). По своим
взрывчатым свойствам (табл. 9) нитроманнит ближе всего под-
ходит к нитроглицерину; однако чувствительность
к удару у него больше, а химическая стойкость благо-
даря вдвое более длинной открытой углеродной цепи значи-
VI. Другие высокобризантные взрывчатые вещества
263
гельно меньше. Из двух последних обстоятельств, не говоря
уже о цене нитроманнита, ясно, почему он не мог найти себе
до сих пор промышленного применения Ч
4. Нитросахар и нитрокрахмал
В США с 1911 г. в качестве примеси к безопасным взрывча-
тым веществам употребляются такие высокомолекулярные эфиры,
как нитрованный сахар и особенно нитрованный крахмал1 2. Го-
воря о нитратах сахара, во всех случаях имеют в виду
растворы нитрованной сахарозы (тростниковый сахар, свекло-
вичный сахар) в нитроглицерине: рафинированный сахар в виде
мелкого порошка растворяется в количестве 20—25% в нагретом
глицерине, нитруется аналогично чистому глицерину и промы-
вается. Выход едва достигает 150% против теоретических 192%
гептанитрата сахара. Маслообразный нитросахар3 вдвое более
вязок, чем нитроглицерин; он обладает взрывчатой силой, при-
близительно равной взрывчатой силе нитроглицерина, и частично
применялся во время войны в целях экономии запасов глицерина.
Однако благодаря его очень незначительной стойкости, требую-
щей обязательной добавки дифениламина и пониженной в жела-
тинированном состоянии детонационной способности, в Европе
совершенно отказались от употребления нитросахара.
Большое значение и все растущее практическое применение
имеет нитрокрахмал4, также употребляемый в качестве при-
меси к порошкообразным безопасным взрывчатым веществам. Он
приготовляется в США из обычного продажного крахмала пу-
тем нитрации различными способами смесью серной и азотной
кислот. Нитрокрахмал подобно нитроклетчатке представляетсобой
смесь продуктов различной степени нитрации, содержание азота
в которых колеблется в пределах 12—13,3% и в среднем соста-
вляет 12,6%. Имеет вид бледножелтого порошка, обладает не-
большим удельным весом (1,1), нерастворим в воде и эфире,
растворим в спирто-эфирной смеси и ацетоне.
VI. Другие высокобризантные взрывчатые вещества
и смеси
1. Эфиры спиртов и хлорноватой и хлорной кислот
Теоретически рассуждая, для образования взрывчатого вещества хлор-
новатая и хлорные кислоты пригодны гораздо более, нежели азотная кис-
1 Почему этот нитрат все же является предметом патентных заявок
последнего ;времени, остается непонятным, так как известно, что по патент-
ному праву всех стран требуется, чтобы предметом заявки было новое
и по крайней мере практически осуществимое предложение.
3 Ch. Е. R eie s е 25 year’s progress in explosives, Journ. Franklin Inst.,
1924, 745—768.
3 H a у m, Нитроглицерин и нитроглицериновые взрывчатые вещества,
Госхимтехиздат, 1934. См. далее ам. пат. 1811633 (1931) и 1852041 (1932)
Hercules Powder Со.
’Taylor u. Rinkenbach, Explosives, Bull. 219 Bureau of Mines, 1923, 88.
264
Нитроглицерин
лота, та-к как реакции образования этих кислот, за исключением хлорной
кислоты, сильно эндотермичны и при разложении подобного рода соеди-
нений, помимо теплоты окисления, выделяется еще значительное количе-
ство освобождающейся молекулярной энергии. Наиболее пригодной могла
бы быть богатая кислородом хлорноватая кислота, эфиры которой
являлись бы сильнейшими взрывчатыми веществами, если бы они обладали
достаточной стойкостью. Однако достаточно стабильными оказываются
только эфиры хлорной кислоты; их пригодность для целей взрывчатой
техники выявил еще Берт л о; он рекомендовал идеально разлагающуюся
смесь из 2 молей мети л перхлората и 1 моля эти л перхлорат а.
Перхлорат монохлоргидрина глицерина СНгС!—СИОН—
—СНг • СЮ4—бесцветное тяжелое масло со слабым запахом-—взрывает
еще более оглушительно, чем нитроглицерин. При соприкосновении с пла-
менем он сгорает очень бурио, так же как и студни, получаемые с по-
мощью нитроклетчатки. Его значение умаляется однако большой чувстви-
тельностью к влаге (легкая омыляемость), так что возможность практиче-
ского применения этого соединения заранее представляется сомнительной.
Трилерх лор ат глицерин вообще не может быть получен, так как
он гидролизуется в момент образования.
2. Циклотриметилентринитрамин, или гексоген
Это нитросоединеиие, изображаемое нижеследующей пред-
полагаемой формулой, наряду с пентритом является одним из
наиболее выдающихся представителей бризантных взрывчатых
веществ и вследствие этого, несмотря на свое до сих пор скорее
теоретическое, чем практическое, значение, заслуживает более
подробного описания. Это соединение впервые было получено
в 1898 г. Геннингом1 нитрацией гексаметилентетрамина.
Рецепт, описанный в патенте, оказывается однако недостаточ-
ным, и процесс лучше всего вести следующим образом;
Сложный процесс нитрации суммарно может быть выражен уравнением:
Гексаметилентетрамин
+ 6HNOj =
Гексоген 100
Пентрит
Циклотри м етилен-
трииитрамин
no2
I
/ N \
СИ, СН,
O2N — N N—NO,
Х'СН2/
/ т
4-6HjOзсо2-f-2 N
/100
(.пентаэритрит
4- 269,9 = 158,5
4- 185,2 = 232,2
4-77,1
4- 52,9’
Герм. пат. 104280 (1898) д-ра G. F. Henning, Берлин.
VL Другие высокобризантные взрывчатые вещества 265
Так как почти половина молекулы исходного вещества разрушается,
То и расход азотной кислоты оказывается несоразмерно большим, а выход
иитросоединения — соответственно незначительным. Помимо этого недо-
статком является образование значительного количества воды и выделение
газа, что вместе с избытком теплоты реакции мешает правильному взаимо-
действию с азотной кислотой, так что нитрация гексогена протекает зна-
чительно хуже, чем отлично разработанный процесс получения пентрита ’.
В %-л колбе растворяют 100 г гексаметил ентетрамина
в 400 см3 воды. Растворение ведется при слабом нагревании. Колбу поме-
щают в ледяную воду и постепенно прибавляют азотную кислоту средней
концентрации (1,4) так, чтобы температура поднялась до 10—15°, самое
большее 20°. Содержимое колбы постепенно превращается в белую каши-
цеобразную массу, которую после прибавления новой порции кислоты вся-
кий раз следует взбалтывать. Когда наконец будет прибавлено 250 см3
азотной кислоты, содержимое колбы переносится на нуч-фильтр, отсасы-
вается через обыкновенный круглый фильтр, промывается 5—6 раз ледяной
водой и столько же раз 90%-ным спиртом, предварительно охлажденным
с помощью льда; всего на промывку уходит около 150 см3 спирта. Про-
питанный спиртом нитрат гексаметилентетрамина раскладывается на филь-
тровальной бумаге и сушится при 30—40°. Из прозрачного водного'
фильтрата при добавлении к нему промывного спирта выделяется еще
некоторый остаток блестящих чешуйчатых кристаллов соли, который и
присоединяют к основной массе. Выход равен 175 г нитрата, 'слабо
пахнущего формальдегидом; азотнокислая соль невидимому довольно
стойка и может в течение месяцев храниться при комнатной температуре.
Если нитрат воспламенить, то он горит светящимся некоптящим пламенем.
Нитрацию выгодно проводить с помощью возможно более сильно охла-
жденной азотной кислоты и лучше всего—пользуясь значительным избытком
кислоты. При 15° в конце нитрации вследствие повышения температуры
легко может иметь место вспенивание. При 20 или 25° уже следует опа-
саться грозящего продукту разложения, если немедленно не позаботиться
о сильном охлаждении. 175 г полученного гексаметилентетраминнитрата
лорциями загружают в 450 см3 дымящей азотной кислоты удельного веса
1,51 при постоянном внешнем охлаждении льдом, с тем чтобы температура
не подымалась выше 10°. После каждой вновь добавленной порции содер-
жимое колбы встряхивается до тех пор, пока прекратится вспенивание и
все перейдет в раствор. Сопровождающее каждую операцию выделение
газов объясняется окислением метиленовых групп и гексаметилентетрамина.
Под конец нитрации замечается помутнение и выделение кристаллов (а если
было слишком мало кислоты, то и обесцвечивание). Продукт реакции при
перемешивании переносят в 1 л ледяной воды, причем гексоген полностью
выделяется в виде белой мелкораздробленной суспендированной массы.
Его отсасывают, промывают несколько раз холодной водой и снова разме-
шивают почти свободный от кислоты продукт с водой, к которой для
нейтрализации последних остатков азотной кислоты прибавлено несколько
граммов карбоната аммония. Обработанный щелочным раствором и вновь
промытый на нуч-фильтре водой продукт подвергается стабилизации
основательным 8—10-кратным кипячением с дестиллированной водой. После
сушки получается 88 г циклотриметилентринитрамина в виде белого по-
рошка. Почти половина взятого нитрата разложилась со вспениванием под
действием дымящей азотной кислоты. В целях очистки можно раство-
рить 50 г сухого нитропродукта в 400 см3 свежеперегнанного ацетона
(обратный холодильник) и отфильтровать в 2-кратный объем дестиллиро-
ванной воды; выделяющийся при этом почти количественно гексоген про-
мывается на нуч-фильтре водой и сушится. Большие кристаллы получаются
непосредственно из раствора в ацетоне. Прокипяченный сырой продукт
плавится с разложением при 200—201°, перекристаллизованный из аце- * 1
тона — при 200°.____________________________________
1 S t е 11 b а с h е г, Мёт. de 1’Art. fran£., 1932, тетрадь IV.
266
Нитроглицерин
Свойства. Гексоген, стабилизированный непосредственным
кипячением в воде, представляет собой поразительно белый, без
запаха и вкуса, порошок, растворимый в воде при 20е в коли-
честве 0,01%, плохо растворимый в эфире и кипящем спирте и
хорошо растворимый только в ацетоне. Из кипящей воды (в ко-
торой он растворяется в количестве до 0,1%) гексоген выпадает
при охлаждении в виде очень мелких кристаллов, которые при
увеличении в 600 раз оказываются правильно образованными
блестящими, лучепреломляющими ромбоэдрами. Циклотримети-
лентринитрамин согласно Брунсвигу1 абсолютно стоек при
хранении и не теряет в весе даже при 152-часовом нагревании
до 110°,. Однако из опытов, поставленных автором настоящей
Рис. 106. 80% тетрани-
тропентаэритрита с 20%
нитроглицерина, /7=1,22.
Рис. 107. 80% циклотри-
метилентринитрамина с
20% нитроглицерина,
/7=1,27.
30 г каждого из указанных взрывчатых веществ под-
вергнуто детонации в железном тигле на 1-мм желез-
ной пластинке.
книги, видно, что даже тщательно промытый гексоген через не-
сколько недель или месяцев приобретает в большинстве случаев
кислую реакцию, так что для действительной его стабилизации
требуется гораздо более длительная обработка кипящей водой
(в течение нескольких дней), чем при стабилизации пентрита.
Зажженный гексоген горит сильно светящимся шипящим пла-
менем, причем часть плавится и остается на подставке в виде
желтой корки. При нагревании в пробирке до температуры выше
’температуры плавления начинается разложение с выделением
плотного дыма и со вспышками пламени без взрыва. Удельный
вес кристаллов 1,8, по Герцу до 1,822. Согласно данным
Авогадро даже при давлении прессования в 3800 ат нельзя
получить удельный вес выше 1,69, Гексоген не желатинируется
нитроклетчаткой, но образует с нитроглицерином или гремучим
1 Герм. пат. 299028 (1916), Zentralstelle Neubabelsberg.
2 Швейц, пат. 88759 (1920).
VI- Другие высокобризантные взрывчатые вещества 267
студнем пластические массы (г е к с о н и т), немного более
мягкие и маслянистые, чем соответствующие пентриниты1.
По чувствительности к удару, соответствующей 29 см, гексо-
ген занимает промежуточное положение между пентритом (27 еж)
и тетрилом (30 сж); скорость детонации (табл. 4), если не считать
пентрита, у гексогена наибольшая. Расширение, равное 520 сж3,
кажется непропорционально большим по сравнению с недостат-
ком кислорода в 21,6%, так что для этого вещества, имеющего
невыясненное до сих пор строение, следует принимать эндотер-
мический характер образования. Новейшие указания Иццо2
и Наума3 о том, что гексоген дает расширение, равное 450
(470), а пентрит 470 (510) еж3, противоречат более ранним дан-
Рис. 108. Гексоген-тро-
тил, d= 1,15.
Рис. 109. Пентрит-тротил,
d = 1,05.
40 г каждого из указанных взрывчатых веществ взор-
вано иа 1-мм железной пластинке.
ным, а также опытам на пробивание пластинки, проведенным
автором, и требуют еще выяснения.
Несмотря на то что запас энергии гексогена выше чем у пен-
трита, примесь его в динамитах не дает того же ускорения, как
пентринит (рис. 36 и 37) из-за несколько меньшей скорости дето-
нации. То же самое имеет место и для сплавленных смесей с 50%
тринитротолуола (рис. 108 и 109), так что военное при-
менение гексогена вместо пентрита оказывается невыгодным.
Гексоген, исходный продукт для производства которого полу-
чается из формальдегида и аммиака, более прост и универсален,
чем пентаэритрит, был бы в некотором отношении взрывчатым
веществом будущего, если бы получение гексогена протекало без
промежуточного образования соли азотной кислоты и если бы
благодаря этому нитрация не давала столь незначительных вы-
1 Stettbacher, Der Kampf um das Pentrinit, Chem. Ztg., 1931, 654.
- Rivista d’Artigleria et Genio, 1932. 379.
3 Z. f. Schiess- u. Sprw., 1932, 230.
268
Нитроглицерин
ходов. Указанные выше теоретические сравнительные величины
показывают, что с экономической точки зрения и это нитросое-
динение неспособно конкурировать с пентритом V
3. Взрычатые смеси, содержащие двуокись азота
Панкластит
Открытый Тюр пеном в 1881 г. панкластит, в свое время
не нашедший применения, впоследствии в форме жидкой смеси
двуокиси азота с нитробензолом и сероуглеродом был исполь-
зован французами как высокобризантное средство для снаря-
жения авиабомб. Успех этой смеси был настолько велик, что
к концу мировой войны, в 1918 г., ежедневно для этих целей про-
изводилось 80 т двуокиси азота. Такие авиабомбы содержали
большей частью нитробензол и двуокись азота
в соотношении 30: 70 вес. ч. и обладали беспримерным бризант-
ным, дробящим действием. Снаряд конструировался таким обра-
зом, что смешение обеих жидкостей происходило в результате
действия двух пропеллеров только спустя некоторое время после
сбрасывания бомбы. Взрыватель с замедлением вызывал дето-
нацию лишь после пробития препятствия (крыша и верхний
этаж). Случалось, что бомбы не взрывали; это бывало в тех
случаях, когда: нитробензол замерзал на большой высоте.
Двуокись азота представляет собой при комнатной температуре
прозрачную красновато-коричневую жидкость, которая затвердевает при
—10° в бесцветные кристаллы и кипит при 21,2°. Ниже 0° существуют
только бесцветные молекулы N2O4, которые с (повышением температуры
(до 150°) вновь распадаются на темные красновато-бурые молекулы NO2.
Удельный вес жидкости 1,47 при 15°. Количество теплоты, выделяющейся
при взрыве, по Касту равно +2,6 б. кал на моль жидкой N2O4; соеди-
нение само по себе не является взрывчатым веществом, но как окисляющее
средство несомненно превосходит азотную кислоту; так, согласно Ф а у-
з е р у1 2 синтетическое образование азотной кислоты термически протекает
по уравнению:
2N2O4 + 2Н2О + 02 = 4HNOs + 18,8 кал.
В лабораторной обстановке двуокись азота в чистом состоя-
нии 3 можно получить, нагревая до красного каления предварительно вы-
сушенный азотнокислый свинец, смешанный с одинаковым объемом раска-
ленного кварцевого песка
2Pb(NOs>2 = 2РЬО + 4ЬЮг + О2,
и пропуская выделяющийся газ через лнбиховскнй холодильник в прием-
ник, охлаждаемый смесью льда и поваренной соли. Стеклянная реторта
лопается обычно прежде, чем разложился весь азотнокислый свинец. По-
этому оперируют с небольшими количествами (50—100 г) и, как только
колба лопнет, начинают новый процесс 1перегонки. Собранная в приемнике
1Stettbacher, Мёт. de 1’Art. franf., 1932, тетрадь IV.
2 Die chem. Fabrik, 1932, 412.
3 Приготовление N2O4 в совершенно чистом виде см. Lambrey, Ann.
de physique, 1930, 177.
VI. Другие высокобризантные взрывчатые вещества 269
N2O4 сливается в предварительно охлажденный н взвешенный баллон с хо-
рошо притертым стеклянным краном н хранится в проточной воде (баллон
следует накрыть стеклянным стаканом) прн температуре ниже температуры
кипения N2O4. Простой и дешевый метод восстановления азотной кислоты
в лаборатории мышьяковистой кислотой или серой не может быть реко-
мендован, так как он дает окрашенный в синий цвет продукт, содержащий
большее или меньшее количество воды и N2O3. Однако с точки зрения
военной техники иногда, как например прн получении двуокиси азота вос-
становлением отработанной кислоты серой, бывает желательно, чтобы N2O4
содержала небольшое количество ангидрида азотистой кислоты, так как
уже 5% N2O3 понижают температуру плавления N2O4 до —100° *.
Несмотря на сильное окислительное действие, благодаря от-
' сутствию гидроксильной группы двуокись азота можно безопасно
Рис. 110. N2O*-нитробензол Рис. 111. Пентринит 50/50.
(70 : 3Q).
75 г каждого из указанных взрывчатых веществ подвергнуто детонации
, в железном тнгле на 12-жж железной пластинке.
смешивать с органическими жидкостями. При смешении с ни-
тробензолом например появляется лишь темное окрашивание.
Смесь достаточно стойка; по крайней мере при обычной темпе-
ратуре не наблюдается ни разложения, ни разогревания (ср.
взрыв в Бодио в 1921 г.).
Каст и Гюнтер2 подвергли эти своеобразные взрывча-
тые смеси подробному исследованию; результаты этих испыта-
ний, имеющие большое значение, представлены на диаграмме
(рис. 112). Оказалось, что смесь нитробензола с дву-
окисью азота при подходящем соотношении (теоретически
29,99 : 70,01) как в отношении расширения в свинцовом цилиндре,
так и в отношении обжатия несколько сильнее нитроглицерина.
1 Ср. Паскаль, Взрывчатые вещества, пороха, боевые газы. Госхим-
технздат, 1932.
в Versuche mit Stickstofftetroxydsprengstoffen, Z. f. Schiess- u. Sprw.,
1919, 82.
270
Нитроглицерин
Однако максимум на кривой расширений выражен очень резко,
т. е. при неточном или неполном смешении составных частей
мощность взрывчатого вещества значительно уменьшается;
с практической точки зрения это очень ценный вывод. Смесь
сероуглерода с двуокисью азота обладает мень-
шей энергией; она превосходит при наилучшем составе (35 : 65)
пикриновую кислоту лишь по величине расширения. Максимум
Рис. 112. Сравнение смесей, изготовленных на
основе жидкой двуокиси азота, — с нитрогли-
церином и пикриновой кислотой.
кривой в этом случае вы-
ражен менее резко, отку-
да следует, что недоста-
точное смешение обеих
'составных частей не имеет
такого значения. Это
удивительное явление
объясняется незначитель-
ной разницей в количе-
стве теплоты окисления
серы в дву- и трехокись,
так что небольшой избы-
ток или недостаток кис-
лорода лишь незначи-
тельно меняет термиче-
ский эффект. Во всяком
случае эта смесь, кото-
рую Т ю р п е н считал
чрезвычайно мощной, об-
ладает настолько малым
запасом энергии, что бла-
годаря неудобству упо-
требления жидкой дву-
окиси азота и сероугле-
рода вопрос об ее прак-
тическом применении не
может быть даже поста-
влен. Напротив, стехио-
метрическая смесь нитро-
бензола и двуокиси азота превосходит по мощности все из-
вестные в настоящее время технические взрывчатые средства и
уступает лишь соответствующим смесям тетранитрометана. Так
как удельный вес нитробензольного панкластита едва достигает
1,35, то его действие при одинаковом объеме уступает 50/50 пен-
триниту. Чувствительность к удару панкластита равна чувстви-
тельности нитроглицерина, однако он не взрывает от острого
пламени зажигательного шнура.
Получение двуокиси азота является в настоящее время одной
из последних стадий производства азотной кислоты окислением
аммиака. Поэтому легко себе представить ее значение в буду-
щей воздушной войне.
VI. Другие высокобризантные взрывчатые вещества 271
4. Смеси тетранитрометана с углеводородами
Тетранитрометан с научной точки зрения имеет особое зна-
чение, ибо он, будучи чисто органическим соединением, содержит
большой избыток кислорода и образует с углеводородами,
а именно с бензолом, толуолом или нитробензолом, одно из са-
мых бризантных и разрушительных взрывчатых средств,
какое только было получено до сих пор.
Это соединение было впервые получено в 1861 г. Шишко-
вым; промышленное производство тетранитрометана осущест-
вляется по нескольким способам, патентное описание которых
частично недостаточно. Небольшие количества тетранитрометана
получаются при смешении ангидрида уксусной кислоты с дымя-
щей азотной кислотой наивысшей концентрации в стехиометри-
ческих соотношениях Ч
4(CHSCOO)., -J- 4HNO3 = C:1(NO2)4 + СО» + 7СН3СООН
4-102,05" 4-63,02 196,03
100 61,7 48,02
К 200 г уксусного ангидрида, помещенного в %-л плоскодонную колбу,
по каплям приливают 124 г дымящей азотной кислоты. При этом происхо-
дит умеренное разогревание, н температура путем взбалтывания и охла-
ждения водой поддерживается прн 12—15°. Первые 2 дня колбу охлаждают
проточной водой, с тем чтобы реакция протекала без сильного саморазо-
гревания и связанных с этим потерь, затем оставляют стоять в течение
6—8 дней, неплотно закрыв колбу, чтобы образующаяся углекислота имела
выход. После 8 дней стояния выливают окрашенную нитрознымн парами
в красновато-коричневый цвет реакционную смесь на лед нли 3—4-кратный
объем холодной воды: тетраннтрометан выделяется -в виде капель н соби-
рается благодаря своему большому удельному весу на дне. Тетраннтро-
метан в делнтельиой воронке отделяется от уксуснокислой реакционной
жидкости, после чего последняя подвергается перегонке с водяным паром;
прн этом получается еще несколько граммов тетраннтрометана. Это не-
большое количество присоединяется к основной массе продукта н в капель-
ной воронке емкостью 100 см3 осторожно взбалтывается с дестиллнроваи-
ной водой, содержащей карбонат аммония, до тех пор, пока не появится
ясно выраженная щелочная реакция на лакмус, после чего, хорошо закрыв
воронку, оставляют смесь на 1—2 дня до полного разделения слоев. Изо-
лированный таким путем тетраннтрометан слегка окрашен еще в зелено-
ватый цвет, что не мешает его применению во взрывной технике ни в ко-
личественном, ии в качественном отношении. Чтобы получить абсолютно
чистый и прозрачный тетраннтрометан, необходимо отогнать его с водяным
паром из нейтрализованной карбонатом аммония жидкости и в заключение
отфильтровать непосредственно из маленькой делительной Воронин через
безводный сульфат натрия или хлористый кальций. Выход составляет
около 25 см3 <42 г), т. е. всего 44% от теоретического.
По Бергеру1 2 выход получается несколько больше, если
вместо продажной азотной кислоты удельного веса 1,5 употреб-
лять свежеприготовленную абсолютную азотную кислоту (полу-
1Stettbacher, Hochbrisanzstudien I, Z. f. Schiess- u. Sprwj., 1930,
439—441.
= C. r. de I’Acad. d. Sc., 1910, 815; ср. C. 1911, la, 9.
272
Нитроглицерин
ченную перегонкой в вакууме смеси равных весовых частей сер-
ной и дымящей азотной кислот).
Тетранитрометан Йредставляет собой бецветную легкоподвиж-
ную нерастворимую в воде жидкость, имеющую удельный вес
1,65 и температуру замерзания 13°. Он кипит без разложения
при 126°, летуч уже при комнатной температуре и распознается
по своеобразному резкому запаху. Тетранитрометан является
сильным раздражающим веществом, при вдыхании которого
очень скоро появляется сухой кашель. Бергер вычислил по
уравнению разложения и горения тетранитрометана
C(NO2)4 = СО2 + 2N2 + ЗО2 + 89,6 б. кал
Рис. ИЗ. Ннтроман-
нит 73%.
Тринитротолуол 7%.
Динитрогликоль 20%.
d — 1,6.
Кислородный баланс
±0%.
Рис. 114. Пентрит
70%-
Нитроглицерин 29,3%.
Коллодионный хлопок
0,7%.
d = 1,4.
Кислородный баланс
-6,3%.
Рис. 115. Тетранитро-
метан 100 в. ч.
Толуол 20,9 в. ч.
d= 1,4.
Кислородный баланс
-13,4%.
33 г каждого из указанных взрывчатых веществ подвергнуто дето-
нации в высоком железном тигле на твердой 8-мм железной
пластинке.
теплоту образования его, которая оказалась равной +4,7 б. кал.
Эти величины в свою очередь дают очень большую те-
плоту взрыва, которую выделяет например тетранитроме-
тан в смеси с толуолом:
3C(NO2)4 + СбН5СН3 = 10СО2 + 4Н2О + 6Ы2.
100 15.66
1 кг такой смеси со стехиометрическим соотношением
100 : 15,66 дает при постоянном давлении и парообразной воде
колоссальную величину в 1701,5 б. кал. Из рис. 113—115 видно,
что смесь тетранитрометана с толуолом даже при недостатке
кислорода в 13,4% взрывает с беспримерной бризантностью,
а в связи с двое более высокой, чем все вычисленные, температу-
рой взрыва в самом деле представляет самую необыкновенную
реакцию распада.
ГЛАВА ВОСЬМАЯ
БЕЗДЫМНЫЕ ПОРОХА
Появление бездымного пороха (Poudre colloidale) было в свое
время следствием необходимости уменьшения размеров ручного
оружия, снижения калибра ружья. Стало очевидно, что дымный
порох использован в балистическом отношении до конца и что
дальнейший успех может быть достигнут только при условии
изыскания более мощного и сильного метательного вещества,
которое при уменьшении размеров орудия восполнило бы свя-
занные с этим потери увеличением начальной скорости пули.
В качестве такого вещества был предложен пир о к силин,
который кроме того обладает свойством гореть без дыма и не
давать остатка. Но прежде всего необходимо было понизить
его бризантность, быстроту разложения; пироксилин пред-
стояло превратить в медленно горящий порох, который
не был бы опасен для оружия и давал бы достаточное время
для движения пули по нарезам. Это превращение бризантного
пироксилина в равномерно горящий порох достигалось жела-
тинизацией, т. е. его растворением в подходящих раство-
рителях и последующим удалением растворителя. Оставшаяся
при этом нитроцеллюлоза представляла собой коллоидаль-
ную роговидную массу, которую оставалось только уплотнить
и придать ей соответствующую форму прессованием, чтобы по-
лучить порох с любой желаемой скоростью горения. Естественно,
что потребовались долголетние исследования и опыты, прежде
чем перешли к заводскому изготовлению пороха.
Выбор растворителя с самого начала предопределял
характер бездымного пороха и обусловил подразделение его на
два главных вида: чистый пироксилиновый порох, у ко-
торого растворитель или вещество, его желатинирующее, после
фабрикации улетучивается, и нитроглицериновый по-
рох, для которого в качестве желатинизатора применяется жид-
кий нитроглицерин, после фабрикации пороха остающийся в пи-
роксилине.
Нитроглицериновые пороха в свою очередь разделяются на
Два типа:
1. Нитроглицериновый порох с высоким содержанием нитро-
глицерина без растворителя. Представитель его — созданный
Нобелем балистит.
18 Зак. 3171. — Штетбахер.
274
Бездымные пороха
2. Нитроглицериновый порох с различным содержанием ни-
троглицерина от ничтожного и до самого высокого, но изго-
товленный на более высокоазотном пироксилине с применением
ацетона как средства для желатинизации. Представитель —
изготовляемый в Англии кордит.
Необходимо >было бы еще назвать промежуточную группу —
3. Нитроглицериновый порох с небольшим содержанием ни-
троглицерина, без жидкого растворителя, но содержащий такие
вещества, которые одновременно играют роль пластифика-
тора и стабилизатора (централит). Этот порох на нелетучем
растворителе с 23—30% нитроглицерина имел громадное значе-
ние во время мировой войны, когда немцы стрельбой по Парижу
из дальнобойных пушек показали высокую мощность изго-
товленного таким образом метательного средства.
Основным материалом для изготовления всех современных
военных порохов служит следовательно нитроцеллюлоза. Чем
выше в ней содержание азота, тем больше мощность пороха.
Наиболее мощным метательным средством является нитроглице-
риновый порох. Он применяется преимущественно для тяжелой
артиллерии, пироксилиновый же порох употребляется главным
образом для полевой артиллерии. Чем выше содержание нитро-
глицерина, тем больше дальнобойность, тем выше также темпе-
датура горения пороха и выгорание и изнашивание канала ору-
дия. Чистый же пироксилиновый порох слабее, дает1 меньшую
дальность, но дольше сохраняет пригодность оружия. В целях
дальнейшего «смягчения» действия пороха итальянцы в послед-
нее время успешно применяют для изготовления пороха смесь
сложных эфиров в форме нитроацетилцеллюлозы.
Бездымный порох большей частью применяется для военных
целей, и только небольшая его часть находит применение в ка-
честве охотничьего пороха. Хороший военный порох должен
сгорать без остатка и развивать возможно большее количество
газа без чрезмерного повышения давления в канале орудия.
Температура горения пороха не должна быть очень высокой.
Первое условие — это неизменяемость пороха при хранении; из
других условий следует упомянуть необходимость соблюдения
однообразного размера зерен вплоть до долей миллиметра, опре-
деленное содержание влажности, определенную температуру
вспышки и т. д.
Изготовление пироксилинового пороха1 вкратце
заключается в следующем.
Стабилизированный пироксилин с содержанием 12,5—12,7% N обработ-
кой в мешателе смесью спирта с эфиром (реже ацетоном) переводят в же-
латинированное состояние. Желатинированную массу вальцуют в пластины
желаемой толщины и режут на станках в форме кубиков илн пластинок
1 Относительно дополнительного «пиро» пороха н его усовершенствован-
ных образцов N. Н. и F. N. Н. (flashless non-hygroscopic) ср. R. G. W о о d b г i d g е,
Coast Artillerie Journ., янв.-февр. 1932.
1. Фабрикация бездымных порохов
275
любой величины. Чем меньше и тоньше пластинки, тем резче действие
пороха. Поверхность пластинок после прибавления графита или спирто-
вого раствора централита подвергают особой обработке и полируют.
Отдельные приемы этого процесса составляют самую значительную и труд-
ную часть изготовления ружейного пороха и держатся большей частью
в секрете. Таким способом можно регулировать отношение между давле-
нием в .канале орудия и начальной скоростью, так как после полировки
горение пластинки снаружи идет медленнее, а внутри быстрее (прогрессив-
ный порох).
К процессу изготовления коллоидного раствора пироксилина
в спирто-эфирной смеси тесно примыкает метод желатини-
зации в нитроглицерине.
Нобель нашел, что прн изготовлении взрывчатой желатины нельзя
получить однообразную массу с содержанием нитроклетчатки более 15%.
Для уменьшения бризантности нитроглицерина, чтобы он мог служить
средством для метания снаряда, к нему нужно прибавить 50—60% нитро-
клетчатки. Этого Нобель добился продолжительным перемешиванием
сырой, напитанной водой нитроклетчатки с жидким взрывчатым веществом,
получив смесь вышеуказанного состава. По мере того как нитроцеллюлоза
поглощается нитроглицерином, вода из нее вытесняется и может быть уда-
лена. При повышенной температуре, между 60 н 90°, при вальцевании на
горячих вальцах происходит собственно желатинизация, н удаляется оста-
ток воды. Таким образом Нобель получил свой балнстит, состоящий
из 60% нитроклетчатки и 40% нитроглицерина.
Если содержание нитроглицерина желательно понизить еще больше,
то необходимо по предложению Нобеля подобрать подходящий раство-
ритель, чтобы получить однородную прожелатинированную массу. Смешав
нитроглицерин и сухую нитроцеллюлозу с ацетоном до желатинизации,
прессуют массу на пороховом прессе, откуда она выходит в форме трубок
нлн ленты. Этот способ значительно дороже, чем предыдущий, но допу-
скает применение высоко нитрованного пироксилина, потому
что он растворим в ацетоне, и после удаления растворителя масса остается
равномерно желатинированной. Обработке мокрым способом поддается
только хорошо растворимая нитроклетчатка, образующая гомогенную
массу. Представителем нитроглицеринового пороха с нерастворимым (вы-
соконитровйнным) пироксилином является кордит, который прн высоком
содержании нитроглицерина вместе с дополняющим его пироксилином дает
самый сильный из всех современных порохов (кордит I).
Как при изготовлении чисто пироксилинового, так и нитро-
глицеринового пороха необходимо испытывать отдельные су-
точные партии его и после их смешения по определенному ме-
тоду проверять, чтобы балистические свойства общей партии
пороха отвечали требованиям для изготовляемой марки пороха.
Окончательные испытания общей партии производятся на стрель-
бище. Для нитроглицеринового пороха крупных калибров пред-
варительная проверка стрельбой суточных партий не произ-
водится.
I. Фабрикация бездымных порохов
1. Пироксилиновый порох
Завод для производства пироксилинового пороха в настоя-
щее время в соответствии с последовательностью операций со-
стоит из следующих отделений:
18*
276
Бездымные пороха
1. Мастерская для обезвоживания пироксилина
с баками для отмеривания спирта и приемным баком для отра-
ботанного водного спирта.
2. Мастерская для желатинизации с мешателями,
баком для эфира, мерником и бидонами для транспортирования
пороховой массы.
3. Прессовое отделение, где пороховой массе при-
дается определенная форма, с автоматической обрезкой лент и
приспособлением для передачи предназначенного для изготовле-
ния пластинчатого пороха материала герметически закрытым
транспортером в сушильный шкаф. При изготовлении же труб-
чатого пороха выходящая из пресса трубка собирается
в алюминиевый сосуд и по намотке на рамы переносится в шкаф
для провяливания.
4. Шкаф д-ля провяливания, куда на лотках загружаются
пороховые ленты, предназначенные для пластинчатого и куби-
ческого порохов. Мастерские под номерами 2, 3, 4 и 5 соединены
с рекуперационной установкой, где производится улавливание
летучих растворителей, применяемых при изготовлении пороха.
5. Мастерская автоматических резательных стан-
ков, в которой имеется отделение для резки пластинчатого или
кубического и трубчатого порохов. Нарезанный материал
поступает на сортировку.
6. Сортировка и разымка, откуда порох поступает
в вакуум-сушильный шкаф.
7. В а к у у м-с утильный шкаф, соединенный также
с установкой для улавливания растворителя.
Подготовленный к последней операции порох направляется
для удаления остатков растворителя на вымочку.
8. Вымочка в чанах (или бассейнах). Осевшая на лен-
тах влага удаляется в упомянутых выше в а к у у м-с утиль-
ных шкафах. Далее для улучшения балистических качеств
пороха следует очень важная операция полировки наружной по-
верхности.
9. Полировочные барабаны, в которых сухой порох
обрызгивается раствором стабилизатора в спирто-эфирной смеси
и полируется с бакаутовыми шарами.
Полировка заканчивается еще одной разымкой (сортировкой)
и отсеиванием пыли. Далее порох смешивается в одну общую
суточную партию и, пройдя последний этап — станок для про-
сеивания, — укупоривается.
Доставляемая из пироксилинового производства нитроцеллю-
лоза содержит около 30—35% воды, которую перед желатини-
зацией необходимо удалить, так как иначе плохо растворимый
в воде эфир не окажет действия на нитроцеллюлозу. Опасной
и обременительной сушки избегают, а вместо этого оставшуюся
в волокне влагу вытесняют спиртом. Для этого волок-
нистую массу приводят в тесное соприкосновение со спиртом;
I. Фабрикация бездымных порохов 277
при этом вследствие удаления растворимых в слабом спирте
продуктов разложения качество нитроцеллюлозы значительно
повышается.
Обезвоживание (вытеснение воды) производится или заливкой
спиртом и отжимом в специальных центрофугах \ или в закры-
тых медных цилиндрах — диффузорах, в которых гидра-
влически запрессованый материал обрабатывается спиртом до
тех пор, пока он не будет выходить безводным. При 12 ат ра-
бочего давления цилиндр вмещает около 40 кг влажного пирокси-
лина и 50 кг спирта; обыкновенно шесть таких диффузоров
с относящимися к ним мерником и приемником отработанного
спирта объединяют в одну группу. При той скорости, с которой
проходит спирт через массу, процесс обезвоживания заканчи-
вается в течение 2—4 час. Затем нитроцеллюлоза с содержанием
спирта в 30—35%, т. е. с таким количеством его, какое потребно
для желатинизации, через открывающееся дно выталкивается на-
ружу. На предлагаемый нередко вопрос, какой из этих спосо-
бов обезвоживания дешевле и целесообразнее, нельзя дать опре-
деленного ответа, так как все зависит от свойств самого пи-
роксилина и цели, для которой он предназначается. По Шварцу
при обезвоживании пироксилина на прессе потери в 2—3 раза
более, чем на центрофуге, где отходящий спирт содержит 1,5—
3 г нитроцеллюлозы на 1 л.
Спирт после обезвоживания поступает в ректификационную
колонку для разгонки (рис. 169), регенерируется и опять идет
в производство.
Желатинизация в метателе
Из диффузора или из центрофуги пироксилин, напитанный
спиртом, поступает в мешатель, где при добавлении эфира жела-
тинируется. Сначала для этой цели применяли у к с у с н о-
этиловый эфир, затем ацетон, в настоящее время при-
меняют обычно смесь эфира и спирта. Основное тре-
бование, предъявляемое к летучему растворителю, заключается
в том, чтобы он полностью мог быть удален из пороха или
остающееся в порохе количество его было настолько мало, чтобы
это совершенно не влияло на балистические свойства пороха, и
второе, чтобы растворитель не оказывал на массу никакого хи-
мического воздействия. По этой причине применявшийся ранее
во Франции труднолетучий амиловый спирт в настоящее время
вышел из употребления.
Обычно мешатели делают из железа, стали и бронзы с рабо-
чей емкостью в 400 л. Форма и устройство в смысле внешности
1 Ср. Н. Schwarz, Der Alkoholverdrangungsprozess in der Celluloidfabrika-
tion, Kunststoffe, 1913, 421.
/78 Бездымные пороха
соответствует метателю, изображенному на рис. 138Обе вра-
щающиеся друг другу навстречу лопасти метателя состоят из
бронзы особого сплава и герметизированы в подшипниках. Уста-
новка шестеренок допускает перемену направления вращения
в целях лучшего перемешивания. Чтобы препятствовать испаре-
нию легколетучего растворителя, бак герметически закрывается
крышкой. На баке находится мерник для эфира. С помощью
пара или воды, впускаемых в рубашку мешателя, можно его
содержимое в зависимости от необходимости нагревать или
охлаждать.
Степень желатинизации зависит от количества и относитель-
ного состава спирто-эфирной смеси, особенно от содержания
в ней воды, которой должно быть не более 7%. Смеси бывают
различного состава и при возможно малом содержании воды
состоят большей частью из 4 объемов эфира и 3 объемов
спирта. Добавки в мешатель, как например отходы от предыду-
щей фабрикации, стабилизаторы, или вещества, замедляющие
скорость горения, растворяют в эфире и вливают в массу; неор-
ганические соли, добавляемые в порох для уменьшения дульного
пламени орудия, или кислородсодержащие соли, обычно нерас-
творимые, всыпают в мешатель во время перемешивания. Жела-
тинизация оканчивается через 1—2 часа. Содержимое мешателя
становится постепенно все более однородным и по окончании
перекладывается простым опрокидыванием в хорошо закрываю-
щиеся сосуды для транспортировки и сохранения до последую-
щей операции прессования. По Паскалю2 для получения
французского пороха Poudre В обрабатывают 25 кг нитроцеллю-
лозы, растворимость которой в эфире составляет около 40%,
125—135% спирто-эфирной смеси и к концу операции добавляют
в качестве стабилизатора 400 г дифениламина, растворенного
в 2 л смеси того же состава.
Прессование пороховой массы
Желатинированная сырая масса прежде несколько раз про-
пускалась через полые обогреваемые или охлаждаемые лощиль-
ные вальцы, пока не становилось возможным разрезание ее на
пластинки толщиной 0,3 мм. В настоящее время обыкновенно
применяют гидравлический пороховой пресс (ма-
каронный, рис. 120), в который вставляется требуемая для полу-
чения ленты, шнура или трубки матрица. Как только выходящая
из пресса нить или трубка достигает длины около 3 м она авто-
матически обрезается и бесконечной транспортной лентой пере-
1 Neuere Misch.- u. Pressmaschinen, герм. пат. 305566 <1927).
8 Пороха, взрывчатые вещества и боевые газы, Госхимтехиздат, 4932;
Венне и, Б го р л о и Лекорше, Пороха и взрывчатые вещества, ОНТИ,
1936.
I. Фабрикация бездымных порохов
279
кидывается через рамку, которая также автоматически подвеши-
вается на петле. Когда на рамку поступило достаточное число
лент, она вешается для провялки в закрывающийся шкаф
и содержится в токе нагретого до 40° воздуха до тех пор, пока
запах эфира не исчезнет почти полностью.
Резка пороха
Пороховые ленты, соединенные в пучки резиновыми коль-
цами, разрезаются автоматическими станками на
зерна желаемой длины. Иногда для крупных размеров приме-
няется ручной станок для резки. Автоматические станки для
Рис. 116. Станок для резки пластинчатого и кубичес-
кого пороха.
резки применяются двух конструкций: одна — для резки р у-
жейного пластинчатого пороха, а другая — для
трубчатого пороха к тяжелым орудиям.
С помощью салазок пучки пороха подаются к ножу. Поступательное
движение салазок производится стальными лентами, которые передвигаются
роликами. На валу этих роликов сидит шайба с миллиметровыми деле-
ниями для установки желаемой длины пороха. Поступательное движение
пороха составляет 0,5—8 мм и может изменяться от */з до */в мм. Отпрес-
сованный порох после резки выходит в форме пластинок, кубиков и
цилиндров совершенно одинаковых размеров.
Здесь порох получает свою окончательную форму, которая
соответствует типу оружия. Но несмотря на всю автоматическую
точность станка для резки, отдельные пластинки всегда полу-
чаются больше или меньше. Поэтому после резки необходима
разымка. Она производится на станке с ситами и спускным же-
лобчатым лотком. Пропускная способность его около 250 кг
в час при затрате энергии в 2 1. с.
280
Бездымные пороха
В а к у у м-с ушка
Нарезанный и рассортированный пироксилиновый порох, рас-
сыпанный тонким слоем на лотках или в чашах, поступает в ва-
куум-сушильный аппарат, где между железными полыми пол-
Рис. 117. Вакуум-сушильный шкаф для бездымного
пороха с чугунным корпусом и 10 полками, вмещаю-
щий 80 алюминиевых лотков.
ками, нагреваемыми горячей водой до 60—70°, создается вы-
сокий вакуум.
Наряду с прямоугольными сушильными шкафами раз-
личных размеров имеются также цилиндрические шкафы,
изготовленные из железа, которые по сравнению с тяжелыми
чугунными шкафами обладают большей прочностью, безопас-
ностью и герметичностью, но в них менее выгодно используется
кубатура. С помощью теле-термометра можно наблюдать за
температурой шкафа; на случай, если произойдет разложение,
шкафы снабжены специальным приспособлением, работающим
так, что одна или несколько крышек, прижатых внешним давле-
I. Фабрикация бездымных порохов
281
нием, при появлении давления изнутри тотчас же открываются:
и образовавшиеся газы свободно выходят наружу. Чтобы пре-
дупредить -опасность взрыва, сушильные шкафы разделяют
валами.
Вакуум-сушильный шкаф с целью улавливания содержащегося
в порохе спирта соединен с конденсационной уста-
новкой, которая с своей стороны соединена с вакуум-
насосом.
Для улавливания летучих растворителей из помещений для
мешателей, прессов, сушильных шкафов и станков для резки
насыщенный эфиром, спиртом или ацетоном воздух засасывают и
направляют вентилятором на установку для рекупера-
ции растворителя. Здесь пары растворителя абсорби-
руются из воздуха соответствующими средствами или улавли-
ваются по крезольному способу (система Б р е ж а, X е-
м и н о в а) или по байеровскому способу с активи-
рованным углем1 и после нагревания выделяются снова.
Мелкоизмельченный порох сохнет значительно скорей, чем:
крупный ленточный или трубчатый. Время сушки колеблется
между 6 часами и 2 днями 2. Длинные толстые стержни требуют
большей частью повторной вакуум-сушки с 24-часовыми проме-
жутками охлаждения. Одна сушильня с двумя вакуум-сушиль-
ными шкафами пропускает в течение 8 час. 450 кг нормального
пороха.
От сушки наружный поверхностный слой желатинированного
порохового зерна быстро уплотняется, приобретая рогообразный
характер, и последние остатки растворителя удаляются все ме-
дленнее; поэтому под конец порох на один или несколько часов
поступает на вымочку при 50—60°. Чан для вымочки ем-
костью в 2,5 м3 вмещает около 400 кг пороха. Процесс вымачи-
вания часть приходится повторять; продолжительность вымочки
также нельзя предвидеть; вследствие этого чаны для вымачива-
ния устраиваются сериями. После обработки порох для удаления
удержанной им воды отжимают на центрофуге и снова сушат
в вакууме.
Обработка наружной поверхности
Такая обработка производится с целью возможного умень-
шения скорости горения пороха с наружной поверхности, с тем
чтобы в самом начале движения пули создать постепенное про-
грессивное нарастание газообразования и не позволять газооб-
разованию итти по крутой кривой вверх (рис. 34). Такая обра-
1 Bode wig, Z. f. Schiess- u. Sprw., 1927, 166—169; L. Piatti, Die Wie-
dergewinnung fliichtiger Losemittel, Берлин 1932, Verlag Pansegrau.
2 Там же, 1931, 225.
282
Бездымные пороха
ботка производится только для мелкозернистых ружейных
порохов, имеющих большую поверхность, а также для пи-
роксилинового пороха, зерна которого, как сухого коллоида,
пронизаны бесчисленными мельчайшими порами, снижающими
удельный вес желатинированной массы с 1,66 до 1,60. В проти-
воположность нитроглицериновым порохам, отличающимся ком-
пактностью, такая масса способна поглощать вещества, вводимые
в нее в виде раствора. Наиболее пригодными для этой цели
материалами являются камфора, централи т, уретан и
динитротолуол в
8—10%-ном спиртовом
1 растворе или в жид-
ком виде, поскольку
температура плавления
1 таких веществ, как
уретан и динитрото-
; луол, допускает это
без опасности разло-
жения для пороха.
С тою же целью
были предложены так-
же парафин и различ-
ные нитропродукты в
бензольном и эфир-
J ном растворах. Во вра-
щающийся барабан,
Рис. 118. Полировочный барабан для пластин-
чатого пороха (большое зубчатое колесо для
предохранения от образования искр снабжено
деревянными зубьями).
нагреваемый водяной
рубашкой до 50°, за-
гружают сухой порох,
опрысканный одним из
названных растворов
таким образом, чтобы пластинки или кубики не были сильно
смочены; иногда прибавляют небольшое количество (1%) гра-
фита, чтобы избежать электризации пороха; в этом случае по-
лировка производится в барабане с бакаутовыми шарами.
После обработки поверхности следует опять сушка в вакууме
с предварительным увлажнением водой при 70—80° для удале-
ния спирта. Далее следует сортировка, отсеивание пыли, и длин-
ный ряд операций заканчивается мешкой и укупоркой.
В некоторых странах, например в Бельгии, чистый пирокси-
линовый порох из высоконитрованного пироксилина (до 13,5%)
желатинируют ацетоном. В этом случае необходимо сушить
пироксилин до содержания 2—1% влажности, что небезопасно.
Вся остальная часть обработки соответствует принятой при
спирто-эфирном растворителе, с тою разницей, что ацетон, не-
смотря на то что температура кипения его много ниже, чем
у спирта, значительно труднее удаляется из коллоидальной по-
роховой массы.
I. Фабрикация бездымных порохов
283
2. Нитроглицериновый порох
Опишем кратко одну современную установку для
изготовления нитроглицериновых порохов для
артиллерийского, пехотного, а также и охот-
ничьего оружия.
Эта установка оборудована таким образом, что на ней с оди-
наковым успехом можно фабриковать нитроглицериновый порох
без растворителя (типа балистита) и с растворителем
в виде ацетона (порох типа кордита). Фабрикация обоих
сортов пороха производится при помощи одного и того же обо-
рудования и в одних и тех же зданиях; единственное различие
Рис. 119. Вальцы с обогревом для желатинизации.
заключается в том, что при прессовании пороховой массы для
балистита, не содержащего растворителя, применяются два обо-
греваемых пресса с изложницей в 15 л, а для кордита — два
пресса без нагревания с изложницей в 32 jf.
Существует несколько конструкций таких гидравлических или масляных
прессов (с предварительной подпрессовкой содержимого изложницы). Пор-
шень пресса постепенно входит в изложницу и продавливает пороховую
массу через втулку с отверстиями — матрицу. Вторая изложница спарена
е первой, и -простым поворотом их можно заменять одну другой. В то
время как одна изложница прессуется, другая наполняется пороховой мас-
сой по другую сторону колонки. Когда ход пресса окончен, поршень под-
нимают до самого высокого положения, передвигают пустую изложницу
на стол, поворачивая ее на 180°, и подставляют новую наполненную излож-
ницу под пресс. Пресс рассчитан на максимальное давление в 300 000 кг
и имеет особое приспособление, благодаря которому при работе он не
Может перейти определенного предела давления. Нормальное рабочее да-
вление колеблется между 120 и 180 ат.
284
Бездымные пороха
Из вставленной матрицы выходит нить того или иного сечения в виде
трубки или другой любой формы ст 0,1 до 8 или 10 мм в диаметре. Чтобы
ие засорялись каналы матрицы, внутрь изложницы положена сетка, которая
задерживает примеси и комки.
Изготовление несодержащего растворителя балистита
производится следующим образом:
Нитроцеллюлоза с пироксилинового завода, отжатая на центрофуге
или под прессом и содержащая 35—30% воды, поступает для фабрикации
пороха в помещение для просейки, протирается вручную через сита из
бронзовой проволоки, 'взвешивается и в резиновых мешках передается
в помещение для пропитки нитроглицерином, где в особого
устройства цилиндрах пропитывается определенным количеством нитрогли-
церина. Масло вытесняет воду из пироксилина, и под давлением специаль-
ного пресса, который стоит в том же здании, отжимают большую часть
воды. Уплотненную пироксилино-нитроглицериновую массу вынимают из
пресса в форме лепешек, которые предварительно измельчаются по-
средством особого приспособления и переносятся в помещение для окон-
чательного измельчения и просеивания. После вторичного измельчения
масса еще раз вручную перетирается через сита. Подготовленная таким
образом нитроцеллюлоза, пропитанная нитроглицерином, поступает в по-
ме щ е и и е для взвешивания, и определенные количества ее вместе
с отвешенными количествами тех или иных перемешиваемых веществ по-
ступают в помещение для смешивания и обработки в двух-
лопастных мешателях (рис. 138), и здесь смешиваются до состояния гото-
вой пороховой массы. Смешанная масса разделяется на партии опре-
деленного веса и транспортируется в помещение с сушильными
вальцами. В данном случае эта установка служит не для сушки, как
при фабрикации кордита, а для желатинизации. Для фабрикации нитро-
глицеринового пороха типа балистита при одновременном изготовлении
кордита необходимо поэтому иметь еще второе помещение с вальцами
для желатинизации такой же конструкции. Находящаяся в помещении для
желатинизации пороховая масса, развешенная на отдельные партии, жела-
тинируется на четырех вальцах, завальцовывается в виде рулонов и
отсюда переносится в смежное помещение для прессования прес-
сом, который при этой операции обогревается паром (рис. 120). Здесь
происходит дальнейшее уплотнение пороховой массы. Если во время хода
процесса нельзя провести немедленное прессование подготовленных руло-
нов, то можно их поместить для предварительного хранения в пороховые
шкафы, нагреваемые паром и находящиеся в помещении для прессов.
С помощью представленного на рис. 120 порохового пресса изгото-
вляют только трубчатый порох, который непосредственно после
пресса режется обычно вручную на части требуемой длины. Отсюда наре-
занный порох поступает в помещения для сортировки, вязки
в пучки и укупорки, где он сортируется, смешивается и укупори-
вается.
При изготовлении кубического пороха для орудий
и пластинчатого для ружей работа производится следую-
щим образом.
Приготовленные на желатинирующих вальцах рулоны поступают на
точно регулируемые каландры, где развальцовываются в тонкие листы, тол-
щиной соответственно пластинчатому или кубическому пороху. В этом же
здании находится также и обогреваемый шкаф для хранения поступающих
на вальцы рулонов, которые не могут быть немедленно провальцованы.
Из помещения тонкого вальцевания пороховые листы поступают в поме-
щение для резки н там на одном станке (рис. 116) с нагретым столом раз-
резаются на ленты, а на другом станке с таким же столом — на пластинки
или кубики.
I. Фабрикация бездымных порохов
285
Нарезанные элементы однако не представляют собою готового пороха.
Пластинки нужно еще многократно сортировать и полировать. После поли-
ровки они поступают в помещение для сортировки и мешки,
вторично проходят сортировочный станок (разымку) и тогда смешиваются
в помещении для мешки в особом аппарате до получения однородного про-
дукта. Фирма Дюпон смешивает и выпускает за один раз около 45 т
окончательно проверенного пороха. Смешанный порох поступает в поме-
Рис. 120. Пресс с обогревом для бездымного пороха
(Акц. о-во Bofors Nobelkrut).
гцение для просейки н укупорки; там он отсеивается на веялке от
пыли и наконец после окончательной упаковки направляется на хранение
в пороховой склад.
По новым предложениям вместо нитроглицерина для изго-
товления пороха без растворителя рекомендуется применять
нитраты ди- и триэтиленгликоля. Так, смесь, приготовленная
из дигликольдинитрата и нитроцеллюлозы с примесью
286
Бездымные пороха
централита, после многократного вальцевания при 60—70° дает
массу, очень близкую к балиститу
При изготовлении нитроглицеринового пороха
типа кордита с ацетоном в качестве раствори-
теля весь процесс до операции желатинизации остается при-
близительно тем же, что и при балиститном порохе, только для
кордита берется меньше нитроглицерина, но соответственно упо-
требляется более высокоазотный пироксилин с 13,2—13,5% N и
растворимостью, равной всего 10—12%.
После отделения /преобладающей массы воды, измельчения и протирки
через сита пропитанный нитроглицерином пироксилин по-
ступает в помещение для сушки и отсюда, все еще с небольшим- со-
держанием воды, направляется в .помещение .горячих вальцов, где,
проходя между горячими вальцами, почти совсем освобождается от воды.
Из помещения горячих вальцов высушенная пороховая масса после разве-
шивания в особом здании поступает отдельными порциями вместе с раз-
личными добавляемыми к ней веществами в отделение мешателей,
где перерабатывается с добавлением ацетона, служащего желатинирую-
щим средством для нерастворимого пироксилина, в готовую пороховую
массу. Соотношение берется примерно такое: для сырой массы на 65 /вес. ч.
сырого пироксилина (считая на сухой продукт) и 30 ч. нитроглицерина
на 73 вес. ч. ацетона, причем сначала в мешатель дают около 2/з этого
количества. По мере промешивания и желатинизации к кордитной массе
постепенно добавляют остальную часть ацетона. После З'/i час. обработки
в мешатель прибавляют 5 ч. вазелина, и вновь обрабатывают 3% часа.
Ставшая равномерной масса из мешателей в герметически закрытых
сосудах поступает в мастерскую прессов и проходит без нагревания
пороховой пресс, из которого выходит в виде нитей, лент и
трубок. Пластичные мягкие пороховые ленты обрезают у пресса и укла-
дывают на стол, сортируя их по длине; один только трубчатый порох,
нарезанный точно по размеру, собирают сначала в алюминиевые сосуды
и затем навешивают на рамы. Как мотки лент на медных палках, так и
трубчатый порох на рамах загружают в шкафы для провялки, где
ацетон почти нацело удаляется током нагретого воздуха и направляется
в помещение для рекуперации. Чтобы регенерировать ацетон,
испарившийся прн работе на пороховом прессе и на приспособлении для
приемки ленты от пресса, и чтобы одновременно избежать действия ацетона
на обслуживающий персонал, пары ацетона током холодного воздуха на-
правляют в помещение для улавливания растворителя. Ту же цель пре-
следует отсасывающий вентилятор в сортировочной для готового нарезан-
ного ружейного пороха.
Находящиеся в помещении предварительной сушки (провялки) нити,
ленты и тонкие пучки трубчатого пороха направляются в мастерскую для
резки пороха, где на двух станках для резки ружейного пороха ему
придают желаемую форму. Наконец следует сортировка на ситах. Труб-
чатый орудийный порох, натянутый на рамы, также направляется на
резку, и на станках для резки трубчатых порохов его обре-
зают до требуемой длины. После сортировки и связывания в пучки труб-
чатый порох поступает в помещение вакуум-сушки, где регенери-
руются остатки ацетона. Такой же обработке подвергают готовый, отсор- '
тированный ружейный порох, но ружейный порох после сушки поступает
кроме того в помещение для разымки, обработки поверхности
и полировки. В тех случаях, когда растворителем служит спирт, наруж-
ной обработке предшествует вымочка в теплой воде, затем снова сушка.
Герм. пат. 548427 (1931)
I. Фабрикация бездымных порохов
287
в воздушной или вакуум-сушилке1, и после этого порох проходит свой
последний путь на сортировку и просейку. Пройдя мешку, он развеши-
вается и укупоривается, а затем поступает в склад для хранения. Посту-
пающий в вакуум-сушилку трубчатый порох также сортируется, мешается,
укупоривается и отправляется на хранение в пороховой склад.
3. Стабилизаторы
Желатинированная обычным путем, посредством раствори-
теля, нитроцеллюлоза представляет собою уплотненную коллои-
дальную пороховую массу, обладающую по сравнению с исход-
ным материалом пониженной стойкостью. То же имеет место и
в случае нитроглицеринового пороха, где при простом смешении
жидкого и твердого эфиров окрашивание иодкрахмальной бу-
мажки при пробе Эбля наступает быстрее, чем у каждого
из компонентов в отдельности. В порохе типа кордита введен-
ный в качестве растворителя ацетон еще более ослабляет стой-
кость с течением времени, хотя как в этом, так и в указанном
выше случае наступившее изменение носит чисто физический
характер. О причине этого понижения стойкости существуют
различные мнения; по мнению Брунсвига виною всему
является кислород воздуха, который разрушительно действует
на пороховой гель во время процесса сушки.
Это взаимное вредное влияние составных частей пороха
можно предотвратить добавкою особых веществ — стабилизато-
ров. Применявшиеся для пироксилина в прежнее время неорга-
нические стабилизаторы, как двууглекислый натрий, углекислые
кальций и магний, винный камень (кислый виннокислый калий
CiHsOeK), вследствие своей нерастворимости трудно распреде-
ляются в массе пороха, и поэтому действие их недостаточно эф-
фективно. -С другой стороны, стабилизаторы в форме раство-
рителей, таких как амиловый спирт (Вье ль, 1886), вследствие
их летучести и свойства постоянно изменять порох в балистиче-
ском отношении во время хранения (старый французский «по-
рох В» содержал до 8% амилового спирта) уже давно оставлены.
Наиболее пригодны для этой цели оказались слабые органиче-
ские основания, которые не омыляют, не окисляют и не восста-
навливают составных частей пороха. Так, впервые предложен-
ный Нобелем в 1889 г. дифениламин оказался одним их
наиболее действительных и надежных средств для сохранения
стойкости бездымного пироксилинового пороха. Неприятно
только, что это основание окрашивает в большей или меньшей
степени все сорта пороха в грязнозеленый до темносинего цвет;
нужно также отметить, что по отношению к нитроглицерину это
основание частично проявляет омыляющую и восстановительную
способность2.
1 В о d е w i g, Z. f. Schiess- u. Sprw., 1927, 166—169.
2 H. Mur ao ur, La decomposition des poudres et explosifs, Ghimie et Ind.»
октябрь 1928; L ё co r ch ё et Jovinet, Мёт. d. Poudres, 1928, 69.
288
Бездымные пороха
Позднее, около 1906 г. в Центральной научно-технической ла-
боратории в Нейбабельсберге удалось получить стабилиза-
тор, являющийся производным мочевины, удовлетворяю-
щий всем требованиям. Это — симметрический централит и
асимметрический а к а р д и т; позднее вошел в практику заме-
няющий их продукт — уретан
централит I
темп. пл. 71,5°
со
уретан
50°
По причине своей высокой температуры плавления (121°) реже
применяется централит II — симметрическая диметилдифенилмо-
чевина.
Централиты имеют все преимущества стабилизаторов; как
«твердые растворители» они применялись в Германии с 1912 г.
.в качестве желатинизаторов нитроглицеринового пороха без по-
мощи летучего растворителя и позволили быстро изготовлять
эти пороха. Подобно дифениламину они образуют с отщепляю-
щимися нитропродуктами производные нитроцентралита; в при-
сутствии кислоты происходит помимо того гидролиз на угле-
кислоту и монометиланилин: вот почему иногда с большим
шумом происходит растрескивание пороха, стабилизированного
иентралитом, вследствие скопившейся .'внутри него углекислоты.
Для целого ряда пироксилиновых порохов еще с 1889 г. при-
менялся в качестве стабилизатора вазелин, так как он со-
держит непредельные углеводороды, которые окисляются под
влиянием окислов азота.
Насколько хороший стабилизатор повышает стойкость, можно
видеть на примере одного шведского нитроглицеринового по-
роха, который после 5-летнего непрерывного нагревания при 65°
-полностью сохранил свою стойкость; это испытание было про-
делано на неопределенно долгое время.
II. Свойства бездымных порохов
Хотя бездымные пороха тесно связаны общностью главной
«составной части — нитроклетчатки, однако балистические и фи-
зические свойства их сильно разнятся. Даже внешний вид их
может быть различен. Ружейный пластинчатый порох предста-
вляет собою четырехугольные роговидные пластинки длиною
1—2 мм и толщиною 0,2—0,4 мм', кордитный ружейный порох —
II. Свойства бездымных порохов
289
светлокоричневые./шнуры диаметром 1 мм и длиною 4—5 см~-
настолько мягок/ что режется ногтем. Обычно употребляемый
трубчатый порох имеет 3—17 мм в диаметре и внутренний канал
шириною 1—5 мм. Порох, употребляемый для тяжелых орудий,
имеет большие размеры и изготовляется в форме палок или тру-
бок толщиною до дюймй и длиною до метра и окрашен в светло-
желтый до темнокоричневого цвет. Самые малые размеры имеет
охотничий порох: диаметр зерен его колеблется между 0,5 и
1 мм; в зависимости от степени желатинизации .зерна охотничьего
пороха более или менее прочны при раздавливании и сохраняют
заметную волокнистую структуру пироксилина. В то время как
охотничий порох преднамеренно окрашивают в яркие цвета —
зеленый, красный,' или желтый, — военные пироксилиновый и
нитроглицериновый пороха малых размеров благодаря обра-
ботке поверхности их графитом имеют блестящий серый или
черный цвет. Содержание графита1 в них — от 0,2 до 0,25%.
Удельный вес вполне прожелатинированного пороха колеблется
от 1,55 до 1,63; гравиметрическая плотность остается даже для
специальных тяжелых порохов ниже единицы. Многие пороха
сохраняют долгие годы запах применявшегося при изготовлении
их растворителя; так же легко обнаруживается примесь камфоры.
Нитроглицериновый порох вследствие содержания в своем со-
ставе маслянистых веществ менее порист и поэтому менее гигро-
скопичен, чем пироксилиновый порох; но, с другой стороны, он
вследствие вытеснения маслянистых веществ легче изменяется под
действием воды, чем вполне прожелатинированный пластинчатый
порох, который без ущерба можно кипятить с водой. Замерза-
ние нитроглицеринового пороха с большим содержанием нитро-
глицерина делает применение его в таких странах, как Россия и
Канада, неудобным. Нечувствительный к влаге порох изгото-
вляется на 'ацетоне, так как в ацетоне растворяется даже высоко-
нитрованный пироксилин, в то время как спирто-эфирная смесь
дает в данном случае только набухание. Содержание влаги
в пироксилиновом порохе колеблется от 1 до 2%, в нитроглице-
риновом-— от 0,5 до 1%. Чувствительность к удару
всех бездымных порохов значительно больше, чем у черного
пороха, но не настолько велика, как можно было ждать,
исходя из чувствительности к удару основных ингредиентов —
нитроглицерина и пироксилина. Кубический нитроглицериновый
порох детонирует от удара 2-кг груза подобно динамитной же-
латине при падении груза с высоты 20 см, нитроглицериновый
порох, как тетрил, — при падении груза с высоты 30 см.
Зажженный на воздухе, хорошо прожелатинированный порох
горит интенсивным желтоватым пламенем; удары молнии, попа-
давшие в такой порох, вызывали только пожары, но не взрывы.
1 Kostevitch, The Austrian Navy smokeless Powder in 1914—1918„
Analytical data. Russian Edition, Париж 1932.
19 Зак. 8171. •—Штетбахер.
290
Бездымные пороха
Он более безопасен, чем черный порох, так как локальный взрыв,
как правило, дальше не распространяется. Однако при большой
массе и в результате повышения давления дефлаграция может
перейти в детонацию. '
Так, 12 января 1917 г., на заводе Дюпон (Hackell, New Jersey) произо-
шел взрыв 190 т бездымного пороха, находившегося в пещере. Взрыв имел
совершенно неслыханное действие и силу. Громадный завод был уничто-
жен до основания, а местность опустошена. В шести городах на расстоя-
нии до 100 миль был слышен удар гигантского взрыва.
Температура вспышки желатинированного пороха,
как показывает большинство результатов испытаний, значительно
ниже, чем у основных его полуфабрикатов — пироксилина и
нитроглицерина, если в порохе имеются примеси, которые при
нагревании вступают в реакцию с пироксилином. Хороший по-
рох, нарезанный кусками величиной в 2 мм, не должен давать
Рис. 121. Рис. 122.
Бездымный американский ружейный порох (увеличено в 4 раза).
вспышку ниже 170°. Германские железнодорожные правила
снижают этот предел до 160°. В противоположность этому
при помощи нового прибора для определения вспышки
М и ш е л я и Мюра ура (стр. 539) установлено, что темпера-
тура воспламенения как пироксилинового, так и нитроглицери-
нового порохов любого происхождения лежит между 199 и 203°,
в то время как воспламенение нежелатинированной смеси обеих
составных частей пороха наступает уже при 197°. На основании
своих продолжительных работ по испытанию на 'стойкость Метц
указывает на кажущийся странным факт, что наиболее стойкие
пороха имеют более низкую температуру вспышки, чем пороха
менее стойкие. Это явление объясняется повидимому тем, что
получающаяся в большом количестве у нестойких образцов
окись азота удаляется из пороха легче, чем у стойких образцов,
где незначительное количество газа долго остается в порохе и,
вызывая разложение, понижает температуру вспышки.
Никакой желатинированный порох не бывает абсолютно стой-
ким при хранении. Огромное число отдельных фактов, имевших
место на протяжении десятилетий, показывает, что, несмотря
П. Свойства бездымных порохов
291
па тщательный выбор исходных материалов и одинаково тща-
тельную обработку, многие желатинированные пороха разлага-
лись в относительно короткое время без видимых причин.
Такое катастрофическое разложение случается чаще всего
во флоте, где вследствие хранения пороха в теплом помещении про-
исходит самовоспламенение и затем взрыв камер с боеприпасами. Таким
путем погибли корабли «Jena» 12 марта 1907 г. и «Liberte» 25 сентября
1911 г. При гибели последнего было убито 204 чел. и ранено —136 тяжело
и 48 — легко. Подобное же опустошение вследствие разложения бездым-
ного пороха произошло в 1906 г. на японском линейном корабле «Mikasa»,
в 1907 г. — на бразильском линейном корабле «Aquidaban», в 1908 г. — на
японском крейсере «Matsushima» и в 1915 г. — на итальянском военном судне
«Benedetto Brin». Температура в помещении для хранения пороха ни в коем
случае не должна превышать 40°; камера для хранения пороха должна
хорошо вентилироваться и находиться в достаточном удалении от топок
и машинного помещения.
Хранение желатинированного пороха в прохладном помеще-
нии необходимо не только для предотвращения взрыва, но также
в целях сохранения постоянства балистических свойств пороха.
Так например опыты со снарядом DWM 1 при весе заряда 3,35 г
дали следующие результаты:
В нормальном состоянии...............
После 8 дней нагревания при 50° в откры-
том сосуде .........................
После 8 дней дальнейшего хранения без
нагревания..........................
Начальная скорость (м/сек) Наибольшее давление (кг/см2)
870 3277
923 3926
898 3563
Различие в результатах показывает, что порох, хранившийся
в условиях двух последних опытов, оказался совершенно непри-
годным.
Взрыв пороха можно вызвать не только ударом и трением, но
и капсюлем-детонатором. Накопившиеся к концу войны во мно-
гих странах запасы пороха можно было вследствие этого исполь-
зовать как взрывчатые вещества. Необходимо было только
измельчить порох до величины пластинчатого пороха, что в слу-
чае более грубой формы пороха производилось на мельницах
«Эксцельзиор» со стальными шайбами при обильном смачивании
водой. Измельченный нитроглицериновый порох производил
расширение от 330—'350 см3 и в прочной оболочке давал ско-
рость детонации от 3 000 до 5 000 м/сек.
Поэтому капсюли-воспламенители в патронах не могут иметь
заряд выше некоторого определенного веса. Сила самого зажи-
гания зависит от способности воспламеняться у применяемого
1 Германские заводы оружия и боевых припасов. Прим. рея.
19*
292
Бездымные пороха
при этом сорта пороха. Крупные медленно загорающиеся отдель-
ные элементы пороха можно быстро зажечь только посредством
промежуточного заряда из черного пороха; без этого дополни-
тельного заряда медленно горящий порох для тяжелых орудий
не даст полного действия. Продукты взрыва состоят из паров
воды, окиси углерода, углекислого газа и азота и содержат на-
ряду с этим также водород и метан, образующийся при повы-
шении плотности заряжания в количестве до 10%. Избыток со-
единений углерода, т. е. горючих газов, желателен, так как при
этом стенки орудия менее подвержены выгоранию. Температура
горения бездымного пороха колеблется от 1800 до 3400° *. Для
чисто пироксилинового пороха Вье ль дает температуру 2670°.
Скорость горения пороха называют живостью пороха.
Этот термин соответствует термину «бризантность» взрывчатых
веществ. «Живость» пороха не должна переходить известного пре-
дела, так как горение может перейти в детонацию и орудие может
сильно пострадать. Полужелатинированный и нежелатинирован-
ный охотничьи пороха в этом отношении хуже, чем военный
порох для тяжелых орудий, содержащий нитроглицерин; вели-
чину «живости» пороха можно приблизительно установить
в свинцовой бомбе Т р а у ц л я. Расширение с капсюлем-дето-
натором в 0,54 г не должно превышать более чем на 10% расши-
рение, вызываемое нитроглицериновым кубическим порохом раз-
мером 2 мм. Расширение тем сильнее, чем более порох способен
к детонации.
1. Испытание на стойкость
Чтобы предотвратить несчастные случаи вследствие самовос-
пламенения и изъять из употребления нестойкий порох, необхо-
димо периодически производить испытания. Помимо этого от-
дельные государства через определенное число лет изымают
имеющийся в военных запасах порох. На больших пороховых
заводах практикуют испытание пороха путем подражания есте-
ственным условиям разложения — хранением при 50°
в особых зданиях с изолированными стенами. Образцы пороха
весом 1 кг, помещенные в неплотно закрытые стеклянные сосуды
и поставленные в эксикатор, хранятся неопределенно долгое
время в сухой или же влажной атмосфере. Все заметные измене-
ния, в особенности появление газообразных окислов азота, отме-
чаются через определенные промежутки времени. В дополнение
к этому длительному испытанию производят более кратковремен-
ные испытания на хранение при более высокой температуре, при
которых 10 г того же испытуемого пороха нагреваются в тер-
мостате при 75° (постоянная температура поддерживается кипя-
1 Muraour, La vivacitfi de combustion des poudres colloidales. La Techni-
que moderne, 1931, 180.
II. Свойства бездымных порохов
293
щим четыреххлористым углеродом), при 85° (трихлорэтилен) и
при 100° (вода) до появления бурых паров. Так, стойкость
при хранении нитроглицеринового пороха с 1% централита со-
ставляет свыше 300 дней при 75°, 70 дней при 85° и всего 10 дней
при 100°. Наряду с методом хранения особенно целесообразным
является определение pH по Гансену при 100°. Нагревание
пороха с водой (гидролиз) при 90° дает ценные результаты.
Остальные методы испытания бездымного пороха почти те же,
какие применяются для испытания нитроцеллюлозы. В дополне-
ние к указанному отметим следующее.
Непригодность иодной пробы Эбля в этом случае, где
имеется много веществ, маскирующих появление окрашенной
полоски, особенно наглядна. В Германии этим мото дом испы-
тывается частично только нитроглицериновый порох: иодкрах-
мальная бумажка не должна окрашиваться при 80° в течение
10 мин. Жестче условия испытания в Англии: 30 мин. по
Эблю при 82° для новых морских кордитных порохов. По
американской метилвиолетов ой пробе при 134,5° полное
окрашивание реактивной бумажки допускается минимум за
40 мин. для пироксилинового пороха и за 14 мин. — для нитро-
глицеринового пороха. Проба для хорошо желатинированного
пироксилинового пороха со стабилизатором должна выдерживать
нагревание при 132° в течение 5—6 час., для нитроглицеринового
пороха с примесью 1% централита — всего только минимум
30 мин. и для морского нитроглицеринового пороха на нелету-
чем растворителе с 7% централита — 1 час (до появления бурых
паров). При пробе на потерю веса наблюдают ежедневное
уменьшение веса пороха при 8-часовом нагревании до 115°; при
(английской) пробе в посеребренном сосуде отме-
чают повышение температуры, которое происходит в большом
образчике в 50—80 г, нагретом до 70 или 80°, в связи с насту-
пающим в нем разложением.
Сопоставление указанных проб обнаруживает чрезвычайно
различное отношение одного и того же пороха к различным спо-
собам испытаний *. Так например оказывается, что нестабилизи-
рованный итальянский порох по первым трем пробам (на реак-
тивные бумажки) в некоторых случаях превосходит оба хорошо
стабилизированные трубчатые пороха, тогда как хранение с на-
греванием дает обратный результат. Поэтому качественные
пробы, производимые (с помощью реактивной бумажки) для
испытания на стойкость, можно признать годными только
условно.
1 Новая литература по химическому испытанию порохов на стойкость:
Lenze и Metz, Z. f. Schiess- u. Sprw., 1928, 340; Metz, там же, 1932, 118,
150 и 188; Wiggam и Goodyear, Ind. Eng. Chem., anal, ed., 1932, 72;
E. Berl и Kunze, Halbmikroverfahren nach Will, Z. f. angew. Chemie.,
1932, 669.
294
Бездымные пороха
II. Свойства бездымных порохов
295
Из табл. 21 видно, что пироксилиновые пороха, а также
и пороха с примесью нитроглицерина применяются для всех
видов оружия.
Так, пироксилиновый порох в форме пластинок
служит главным образом для малых калибров — для писто-
летов, ружей, механического оружия и пулеметов; в форме
коротких и длинных трубок он применяется для гаубиц, мино-
метов и полевых пушек. Более сильные нитроглицерино-
вые пороха пригодны как для гаубиц, так и для дально-
бойных пушек с большой начальной скоростью. Это преиму-
щество нитроглицеринового пороха искупается однако быстрым
износом канала орудия. Только нитроглицериновый порох, изго-
товленный с 4—7% централита или уретана, применяемых в ка-
честве нелетучих растворителей, в отношении температуры
горения и связанного с нею срока службы оружия столь же
приемлем, как и толстый пироксилиновый порох.
Среди других нашедших временное применение метательных
средств необходимо еще назвать аммиачноселитренный порох.
Эта смесь, состоящая из 80—90% аммиачной селитры и 20—10%
древесного угля, применялась во время мировой войны как до-
вески к заряду пироксилинового' пороха в полевых орудиях. Его
преимущество по сравнению с другими порохами заключается
в легкости и дешевизне изготовления, а также в необыкновенно
низкой температуре горения, которая не дает ни выгорания, ни
дульного пламени и способствует сохранению ствола при непре-
рывной стрельбе. Но, с другой стороны, по энергии этот
порох не выше дымного, и кроме того гигроскопичность селитры
настолько понижает ценные свойства пороха, что он не удовлет-
воряет минимальным балистическим требованиям, которые
предъявляются в настоящее время к пороху.
Производство бездымного пороха в военное
время превосходило производство всех остальных взрывчатых
веществ. В Америке после перемирия осталось 100 000 т одного
только желатинированного пороха, который был превращен
в промышленные взрывчатые вещества под названием д у м о-
р и т (Dumont) с добавкою около 35 процентов натриевой се-
литры.
2. Метательные средства большой мощности. Порох для
дальнобойных орудий
Старый дымный порох давал при стрельбе из полевого ору-
дия наивысшую начальную скорость в 430 м/сек, тогда как без-
дымный пироксилиновый порох дает при стрельбе из современ-
ного орудия скорость в 860 м/сек, Несмотря на то что энергия
бездымного пироксилинового пороха превосходит энергию дым-
ного пороха только на 215 б. кал (32%), начальная скорость
в орудии удваивается.
ТАБЛИЦА 21
Состав наиболее важных бездымных пироксилиновых и нитроглицериновых порохов1
Коллодион- ный ХЛОПОК2 Пирокси- лин 2 Нитрогли- церин Нитраты и нитропро- дукты Стабилизаторы Другие примеси Влажность Желатини- затор (рас- творитель)
Военный ружейный порох Германский S-nopox . . . Швейцарский нормальный порох Французский порох В. . . Североамериканский по- рох V Германский кубический порох . . . . Итальянский порох (соле- нит) . . Английский | Кордит I . • порох ( „ М. D.. Австрийский военный по- рох 3 Австрийский военный по- рох Орудийный порох Германский трубчатый по- рох Французский порох В . . Североамериканский труб- чатый порох Германский кубический порох Германский кубический порох Итальянский порох (фнлит). Максим (стабилит II) . . . Охотничий порох Шульце Саксония Французский порох J . . . Итальянский порох (Polvere С2) . . г Револьверный по- рох 24 30 30 60 37 1 67 21 40 95 29 30 49 30 40 35 72,5 95 67 47 24 36 63 42 38,5 36 57 30 40 26 40 20 49 5 24 15 барие- вой 5 ка- лиевой се- литры 16 бариевой селитры 3,5 ди- 14 тринитрото- луола 34 тринит- роанизол а 10 бариевой селитры 4 тринитро- толуола 1,0 бариевой селитры 0,5 централ ита % 0,5 ди- фениламина 0 д фенилами на 1,0 цеитралита'цпи акар- дита 3,0 вазелина 5,0 5,0 2,0 2,0 вазелина -4- диэтило- вого эфира фталевой кислоты 5,0 централита или акар- дита 2,0 дифениламина 1,0 дифениламина 1,0 централита 0,3 централита 0,5 анилина +1,0 кам- форы 8,0 вазелина • 5,0 вазелина 1,5 дифениламина 0,7 щаве- левоки- слого натрия 2,0 смолы 1,0 мела 2,0 винно- кислого ка- лия 17 бихрома- та аммония 1,0 бикарбо- ната натрия 1,3 0,5 1,0 1,5 0,5 0,5 0,5 0,7 0,5 2,5 1,5 1,5 1,5
70 50 $ 29 31 30 40 95 79 35 96 1,3 1,0 1,0 0,7 0,5 1,0 1,5 1,0 1,5 1,0 сл 1 Сп О СП II 1 1 1 Ъ '
1 Брунс в и г, Бездымный порох, Госхимтехиздат, 1933, с некоторыми поправками, внесенными автором книги.
а Коллодионным хлопком называют в настоящее время нитроклетчатку с содержанием азота не ниже 12,1%, а пи-
роксилином— нитроклетчатку с содержанием не менее 13,25% азота.
3 По М. Костевичу (Untersuchungen osterreichischer Marinepulver, 1914 — 1918)
296 Бездымные пороха II. Свойства бездымных порохов 297
298
Бездымные пороха
ТАБЛИЦА 22
Сравнение применяемых метательных средств
1 кг пороха Нитроглицери- новый порох с 50% нитроглицерина Пироксили- новый порох Дымный порох
Теплота взрыва в кал/кг . . . 1290 900 685
Объем газа л/кг 840 830 285
Начальная скорость м/сек . . 960 860 430
Переходя от пироксилинового пороха к нитроглицериновому,
замечаем, что при повышении энергии на 390 б. кал, или на 43%,
против пироксилинового пороха скорость, сообщаемая нитро-
глицериновым порохом, должна была бы возрасти более
чем вдвое, если бы прирост скорости происходил с одной
и той же пропорциональностью. Таким образом скорость
возросла бы до 2000 м/сек, что конечно не соответствует
действительности: нужно учесть, что разница между ско-
ростью разложения и ростом развиваемого давления у
химически близких между собою пироксилинового и нитро-
глицеринового порохов значительно больше, чем у весьма
различных в химическом отношении дымного и пироксилинового
порохов. Кроме того объем образующихся при горении дым-
ного пороха газообразных продуктов значительно
меньше, чем у бездымного пороха, в то время как между послед-
ним и нитроглицериновым порохом различия почти нет*. Все же
можно согласиться с тем, что если вместо ружейного пластинча-
того пороха применить сильный нитроглицериновый орудийный
порох с тем же зарядом в 3,2 г, то скорость пули могла бы уве-
личиться на сотню метров на первом километре. У длинных мор-
ских орудий скорость достигает в настоящее время всего
960 м/сек, потому что длина их ствола по отношению к калибру
составляет немного более половины по сравнению с ружейным
стволом, и в соответствии с этим энергия пороха используется
не полностью.
С принципиальной точки зрения поднять энергию сильных
порохов выше современной, имеющей величину 1300 б. кал,—не-
трудно. Нужно только увеличить в них содержание нитроглице-
рина выше 50%; дойдя наконец до гремучего студня
(92% нитроглицерина и 8% пироксилина), состав которого отве-
чает идеальному соотношению с точки зрения полноты горения,
мы достигнем величины в 1620 б. кал и увеличим энергию на
25%. Однако с практической точки зрения создать такую кон-
1 Это не совсем верно у автора. Прим. ред.
II. Свойства бездымных порохов
299
центрацию пороховой массы представляется почти невозможным.
Надо принять во внимание, что по мере того, как энеогия горе-
ния увеличивается и смесь по составу все более приближается
к гремучему студню, порох все более и более приобретает хара-
ктер взрывчатого вещества, пока наконец эта смесь не превра-
тится в одно из сильнейших, хотя и детонирующих с умеренной
скоростью, взрывчатых веществ.
Применение гремучего студня как метательного средства мыс-
лимо еще представить себе в мелкокалиберной гильзе пехотного
ружья. Здесь начальная скорость достигает только около
700 м/сек (рис. 223), т. е. немного больше, чем для дымного по-
роха. Во всяком случае нельзя отрицать возможности примене-
ния гремучего студня для малокалиберного оружия с не-
большой стабилизирующей примесью, так же как и желати-
нированных и стабилизированных смесей из
нитроглицерина с пентритом и гексогеном,
которые оба в идеальном соотношении для горения (74,2/25,8%
и 86,0/14,0%) развивают минимум 1600 б. кал. Для больших
калибров от применения таких смесей приходится решительно
отказаться, так как «горение» нитроглицерина в них может пе-
рейти в «детонацию» с низшей предельной скоростью — от 1000
до 3000 м/сек — и вызвать разрыв толстостенной пороховой
каморы орудий. Такой порох имел бы слишком высокое бри-
зантное действие. Можно было бы сделать попытку умерить
быстроту образования газов и обратить эту смесь в метательное
средство с прогрессивным горением. В настоящее время выпол-
нить это возможно только добавкою примесей, содержащих угле-
род, которые ослабляют кислородный баланс и вместе с тем
соответственно снижают энергию. Таким образом увеличение энер-
гии орудийного пороха связано с двумя неудачными факторами,
которые решительно направлены друг против друга. Выходом
из положения не является также и предложение 1 изготовить осо-
бенно сильное метательное средство, применяя гексанитроэтан
Сг(МО2)б с 42,7% избытка кислорода: предложенная для орудий-
ного пороха смесь из 68% пироксилина, 16% гексанитроэтана,
9% тринитротолуола и 7% диэтилдифенилмочевины (централит I)
имеет недостаточный кислородный баланс, иначе у нее слишком
сильно проявлялась бы наклонность к детонации. Не последнее
значение имеют летучесть и нестойкость гексанитроэтана, кото-
рые являются основным препятствием для дальнейшего развития
этих порохов. Поэтому при дальнобойной стрельбе по Парижу,
опасаясь выгорания ствола, довольствовались средним, не осо-
бенно сильным нитроглицериновым порохом, а потребную энер-
гию получали вследствие необычайно большого по отношению
к весу снаряда заряда.
1 Герм. пат. 277594 (1913) (Zentralstelle в Нейбабельсберге).
300
Бездымные пороха
III. Действие пороха в оружии
О германских военных порохах имеются следующие данные:
Ружейный порох (для остроконечной пули)
Размеры пластинок 1,8 X 1 X 0,4 мм
Удельный вес..........................................1,62
Влажность.............................................1,16%
Число пластинок в 1 г................................912
Состав:
Пироксилин.........................................97,14%
Спирт этиловый •...................................0,30%
Камфора.............................................1.08%
Этиловый эфир......................................0,6О7о
Производные мочевины................................0,75%
Графит..............................................0,13%
Содержание N в пироксилине..........................13,2%
Объем газообразных продуктов......................... 897 л/кг
Температура горения..................................2475°
Начальная скорость.................................... 860 м/сек
Наибольшее давление при заряде в 3,5 г •.............. 3235 кг/см2
Трубчатый порох (для полевых орудий)
Размеры 130 х 4Х 1.5 мм
Удельный вес........................................1,61
Влажность...........................................1,77%
Камфора...................................... . . . 1,3%
Вес снаряда.........................................6,85 кг
Вес заряда................................................. 450 г
Скорость................................................... 406 м/сек
Давление (среднее)........................................ 1594 кг/см2
Французский трубчатый порох ВМ15
(300 X 50 X 3,5 мм) дает в 24-см орудии при
весе заряда 76 кг и
весе снаряда 170 кг
начальную скорость о0 = 920 м/сек,
среднее давление рт = 2600 кг/см2
1 кг бездымного пороха дает около 900 я газов и 1300 б. кал
для их расширения, в то время как дымный порох может дать
максимум 280 л1 при половинном количестве тепла.
Брунсвиг указывает на следующие преимущества бездым-
ного пороха по сравнению с дымным:
1. Мощность выше ,в 2 или 3 раза.
2. Отсутствие неприятного образования дыма, что дает возможность-
полностью использовать магазинные винтовки, пулеметы, орудия с откатом
и скорострельные пушки.
III. Действие пороха в оружии
301
3. Широкая возможность подбора соответствующей марки пороха для
каждого орудия.
4. Большая однородность действия вследствие большего однообразия
пороховой массы.
5. Малая чувствительность к влажности и сырой погоде.
6. Отсутствие пыли даже после длительной перевозки.
7. Меньшая опасность при изготовлении, так как при работе приходится
иметь дело с влажной пластичной пороховой массой.
Табл. 23 показывает балистические преимущества бездым-
ного 'пороха то сравнению с дымным,
ТАБЛИЦА 23
Б ал и ст ичес кое развитие ручного огнестрельного
оружия
Дымный порох Бездымный порох
1740 г. 1841 г. 1870 г. 1884 г. 1888 г. 1905 г. 1911 г.
Калибр винтовки . . . (мм) Вес пули (г) Вес заряда (г) Начальная скорость (м/сек) Дульная энергия . . . кгм Поражаемое пространство при высоте пели 1,7 м Число прицельных выстре- лов в минуту Наибольшая дальность при- цельного выстрела . . (м) Дальность полета пули . (м) 20,1 30 14,5 150 34 100 4 300 1200 15,4 31 4,8 280 122 200 5 460 2000 15,4 21,5 4,8 340 125 250 8 1200 2500 11,0 25 5,0 430 231 350 12 1600 3000 7,9 14,7 2,6 620 283 550 20—25 2000 4000 7,9 10,1 3,2 860 374 550 20-25 2000 4000 7,54 11,3 3,2 805 372 700 20-25 2000 4000
Швейцарские винтовки относятся к лучшим. По-
этому мы приводим балистические данные для ручного огне-
стрельного оружия этой страны. Заряд состоит из чистого же-
латинированного и стабилизированного пироксилинового пороха
(пластинчатый порох).
На рис. 123 обе кривые должны плавно подниматься, как они полу-
чаются например при определении давления индикатором Р у м п ф а. Но так
как они представляют результат вычисленных значений, то они дают лишь
приблизительное направление. При рассмотрении кривой давления видно, что
максимальное давление в 4'5611 2 кг наступает через одну сорокатысячную се-
кунды, после того как снаряд прошел в канале 112 мм. В этот промежуток
времени подъем происходит скачкообразно, что вряд ли может быть объ-
яснено ошибкой опыта, так как химическое разложение пороха перед тем,
как пойти на убыль, дает две ясных ступени. Кривая скорости показывает,
1 Этот столбец содержит цифровые данные, относящиеся к новой швей-
царской винтовке.
2 Это теоретически вычисленное число не соответствует фактическому
давлению. Измеритель газового давления Маузера дал в среднем
-4130—3890 ktIcm- (Z. f. Schiess- u. Sprw., 1932, 403).
302
Бездымные пороха
Пехотная образца 1889 г. 1 ландштурм) винтовка Ordonnanz М,11 Ордонанц Карабин образца 1911 г. Военный пистолет образца 1906 г.
Длина ствола (мм) Калибр (мм) Вес пула (г) Ве< заряда (г) Начальная скорость . . (м 'сек) Длина нарезки Число оборотов в секунду . . %о подъема траектории пули 500 м %о подъема траектории пули 1500 м Угол падения 500 м „ , 1500 м 780 7,5 13,8 2,0 605 270 мм 2241 10,56 = 36' 67,7 = 3°52' 15,7 = 54' 131,8 = 7°30' 780 7,54 11,3 3,2 805 270ллт=4°50' 2981 .4,55= 15' 25,7 = 1°1У 5,6 = 19' 51,2 = 2°56' 592 7,54 11,3 3,2 770 270 2852 120 7,65 6,0 0,3 350 250 1460 прицел для 50 л 12%»
что ускорение в последние десятитысячные доли секунды падает очень
мало и что при уменьшении пути пули в канале с 690,2 до 494,7 мм (длина
карабина) скорость у дульного среза уменьшается только на 26,5 м.
рости пули для германской винтовки 98 с пулей S(no
Роне).
Действие ружейного огня на дальние дистанции, свыше 1200 м,
до войны чаще всего преувеличивали, что в боевой обстановке
вызвало разочарование. Поэтому в настоящее время прицели-
вание ограничивают действительной дальностью огня, а от длин-
ноствольных винтовок все более и более переходят к коротким
III. Действие пороха в оружии
303
карабинам, которые на тех же дистанциях имеют почти ту же
отлогую траекторию пули.
У современной пехотной винтовки значительно увеличена про-
тив прежнего начальная скорость пули и связанная с ней настиль-
ность, которая всегда сопровождается отлогой траекторией, от-
чего увеличиваются пробивная сила и меткость. Так, современ-
ные пехотные пули на дистанции 1000 м пробивают двух человек,
на дистанции же 2000 м — одного человека. Пуля, выстреленная
вертикально вверх, теряет свою живую силу быстрее: выше
1500 м способность к поражению (самолетов) уже падает; на
2650 м кончается поражаемость для германской винтовки и на
2700 м— для швейцарской. Для достижения наивысшей точки
остроконечной пулей, имеющей начальную скорость 875 м/сек,
необходимо 18,5 сек.; после этого, когда скорость пули стано-
вится равной нулю, она начинает падать тупым концом вниз,
вращение же вокруг оси все же продолжается; через 57 сек. она
падает в пункт вылета. Уменьшение скорости и пробивной силы
при горизонтальном выстреле приведено в следующей
таблице:
Дистанция Германская винтовка (пуля S) Швейцарская винтовка (пуля D) Французская 75-мм пушка 28-лм пушка
0 895 805 529 975
300 649 6<">5 495 957
500 511 581 473 946
1000 294 412 422 916
2 000 153 250 346 8 8
5000 .— -— 246 701
20000 — — — 349
Числа этой таблицы показывают, какое преимущество имеет
швейцарская винтовка перед германской в смысле большей ско-
рости у дульного среза. Уже начиная с 300 м и при дальнейшем
увеличении расстояния швейцарская винтовка превосходит гер-
манскую в этом смысле. Два других столбца показывают, что с по-
вышением веса снаряда скорость становится более постоянной
вследствие возрастания инерции благодаря увеличению попереч-
ной нагрузки снаряда по сравнению с сопротивлением воздуха.
Насколько поперечная нагрузка (вес снаряда в кг, деленный
на поперечное сечение в см2) влияет на практическую дальность выстрела,
Генерт1 показывает на следующем сравнении: теоретически можно было
бы снаряд, безразлично какого калибра и веса, послать в безвоздушном
пространстве со скоростью 800 м и под углом возвышения в 50° на рас-
стояние в 64,3 км, практически же снаряд 38-см морской пушки летит
только на 34 км, снаряд небольшой полевой пушки — только на 3,2 км.
Далее, оказывается, что вследствие сопротивления воздуха путь при боль-
Geschiitz u. Schuss, Берлин 1928, 356 стр., 154 рис.
304
Бездымные пороха
шой скорости соответственно укорачивается быстрее, чем при малой ско-
.роста. Так например для 38-см морского снаряда потеря дальности против
теоретической при начальной скорости 700 м для большого заряда соста-
вляет 50% и около 40% для скорости 535 м. Естественно, что форма сна-
ряда при этом играет не последнюю роль.
1. Энергетический и балистический балансы пороха в оружии
Максимальное давление газов измеряется крешерным прибо-
ром Нобля (1860 г.), кривую же газового давления или, что
то же, развивающуюся силу определяют с помощью велосиметра
Себера (1881 г.). При этом откат выражается как функция
времени с помощью камертона, вращающегося барабана или
фотографически — лучом от зеркала. Скорость, которую имеет
снаряд при вылете из дула орудия, так называемая начальная ско-
рость, измеряется на возможно меньшем расстоянии от дула.
Для этого служит чаще всего хронограф ле-Б у л а н ж е (1864 г.)
с отсчетом 0,2—0,001 сек. или искровой хронограф Сименса
(0,1—0,000001 сек.), С помощью конденсаторного хронографа
Сабине-Радоковиц (0,001—0,0000001 сек.) удается опреде-
лить скорость снаряда на расстоянии в 20 см от среза дула
с ошибкой измерения до 0,2%.
Выстрел из германской пехотной винтовки М/98 дает по
Кранцу следующий баланс работы:
В 3,3 г пороховом заряде...........
Дульная энергия ...................
Энергия вращения у дульного среза . .
Энергия отдачи для того же момента .
Нагревание ствола..................
.5. Остаток..........................
2762 кал = 1179 кгм
905 п = 386 п = 32,8%
4 п = 67 = 0,14%
3 = 1,3 V = 0,12%
620 » = 265 = 22,5%
1230 » = 525 V = 44,5%
1.
2.
3.
4.
Значительный остаток —это то количество тепла, которое уходит с го-
рячими газами и бесполезно теряется частью как движущая энергия в воз-
духе (вспышка), частью как энергия вибрации в стволе; примерно вдвое
меньшее количество идет на нагревание ствола: при каждом выстреле про-
исходит повышение температуры его на 3° (1 выстрел в 20 сек.).
Абсолютная величина дульной энергии колеблется между
400 кгм для винтовки и 41 400 000 кгм для морского орудия,
имеющего калибр 40,64 см и длину ствола 50 калибров. Чтобы
сделать более наглядной величину энергии снаряда такого ору-
дия, Швинн инг сравнивает ее с живой силой движущегося
курьерского поезда. Тяжелый снаряд в 620 кг для 35,5-сти мор-
ской пушки в 50 калибров длиной требует в среднем пороховой
заряд в 255 кг трубчатого пороха и развивает дульную энергию
в 27 650 тм. Это в 2,9 раза больше энергии движущегося со ско-
ростью 90 км/час курьерского поезда весом в 300 т в составе
локомотива с тендером, багажного вагона и 4 шестиосных пасса-
жирских вагонов.
III. Действие пороха в оружии
305
2. Поведение пороха при стрельбе
Образование дыма. В ручном огнестрельном оружии
порох сгорает почти без дыма. С увеличением калибра количе-
ство дыма при выстреле возрастает. Для воспламенения бездым-
ного, с толстым сводом, орудийного пороха необходим дополни-
тельный заряд (воспламенитель) из дымного (черного) пороха.
С увеличением порохового заряда увеличенное количество вос-
пламенителя дает больше дыма. Далее увеличивается количество
получающейся при сгорании пороха воды, которая пропорцио-
нально величине заряда увеличивает дымность. В наибольшей
степени увеличивает образование дыма однако неполное сгора-
ние пороха при большом заряде, ибо весь процесс выстрела про-
исходит в течение нескольких тысячных долей секунды, и нитро-
глицериновый порох с толстым сводом трубки не успевает
сгореть полностью. Поэтому процесс горения заканчивается у са-
мого дула орудия, сопровождаясь нежелательно большим раз-
витием дыма, причем из-за неполного разложения в орудиях
больших калибров пороховой дым часто получает красную
окраску от окислов азота.
Выбрасывание пламени при открывании
затвора
Неполностью сгоревшие пороховые газы после выстрела, сме-
шиваясь с атмосферным воздухом, образуют взрывчатую смесь,
которая от соприкосновения с горячими стенками воспламеняется
внутри канала. Поэтому воспламенение газов внутри канала ору-
дия наблюдается чаще всего при длительной и быстрой стрельбе
в горячем стволе орудия. Если со стороны дула орудия имеет
место встречный поток воздуха, то при открывании затвора
пламя может вырваться после выстрела назад; это пламя может
стать особенно опасным, если в камору сейчас же вкладывается
новый пороховой заряд. Жертвой такого обратного пламени при
открывании затвора были уже целые команды орудийной при-
слуги. Такой весьма поучительный случай произошел 13 апреля
1904 г. на американском военном судне «Миссури»; это стоило
жизни 32 человекам и вследствие воспламенения лежавших по со-
седству пороховых зарядов едва не повлекло за собою ката-
строфы всего судна. И ранее при стрельбе из тяжелых морских
орудий наблюдалось, что если тотчас после выстрела открыть за-
твор, то из канала орудия вырываются пламя и горячие газы,
которые обжигают волосы и платье орудийной прислуге*
Поэтому в настоящее время при стрельбе из морских орудий
после каждого выстрела и перед открыванием затвора канал
орудия продувается сжатым воздухом, благодаря чему при
вкладывании нового заряда воспламенения произойти не может.
20 Вак. 3171.—Штетбахер.
306
Бездымные пороха
Дульное пламя
Так называют большой огненный шар перед дулом, который
подобно обратному пламени из казенной части орудия по-
является вследствие воспламенения после выстрела газов, бога-
тых окисью углерода, водородом и метаном. Дульное пламя
представляет собою поэтому вторичное явление, и его нельзя
смешивать с тем пламенем, которое, как пороховое пламя
в собственном смысле, вылетает из дула каждого орудия. Звук
Рис. 124. Дым и щуплое пламя тяжелых морских орудий.
вспышки дульного пламени следует так быстро за
выстрелом, что на-слух оба эти звука нельзя отделить один
от другого и на барабане прибора для записи звуковых волн
промежуток между ними отмечается только одним изгибом.
Звук от обоих взрывов следует один за другим и восприни-
мается как один усиленный звук. Дульное пламя и пламя от
выстрела хорошо и далеко видны ночью и в пасмурную погоду;
этим они обнаруживают местонахождение орудия. При стрельбе
из большой мортиры иногда образуются огненные змеи, кото-
рые кай бы выползают из дула короткого ствола.
Эти явления пламени слабее проявляются при пироксилино-
вом и сильнее при нитроглицериновом порохе вследствие того,
что пороха с высокой теплотой и температурой сгорания,
III. Действие пороха в оружии
307
а также вследствие более слабой способности горения особенно
легко дают дульное пламя. Причинная зависимость между спо-
собностью горения, температурой взрыва, дульным пламенем и
пламенем от пороховых газов чрезвычайно сложна, и эти явле-
ния еще не получили своего объяснения.
Подобно тому как это делается для взрывчатых веществ,
предназначенных для работ в атмосфере рудничного газа, для
гашения дульного пламени подбирают средства, пони-
жающие его температуру. К ним относятся углекислый натрий,
щелочные мыла, мочевина, нитрогуанидин, которые уменьшают
или совсем уничтожают пламя. Большинство из этих примесей
имеет однако другие недостатки, так как они или снижают стой-
кость пороха, или увеличивают образование дыма. Дымность
и пламенность при выстреле находятся в обратной зависи-
мости. Особенно следует иметь в виду, что вещества, которые
лучше всего гасят пламя, в то же время увеличивают дымность.
Примеси, которые идеально удовлетворяют всем требованиям,
едва ли будут когда-нибудь найдены. Необходимо затем не
только устранять дымность и пламенность, но также заглушать
звук выстрела. Звук выстрела и пламя являются .вообще обла-
стью, в которой необходимо произвести еще обширные иссле-
дования.
Эрозия каналов орудий
' Износ каналов огнестрельного оружия зависит не столько от
давления, сколько главным образом от температуры по-
роховых газов. Чем выше последняя, тем больше выгорание, или
эрозия, канала ствола. При этом крупнокалиберные орудия,
имеющие заряды исключительно нитроглицеринового пороха —
пороха наиболее сильного, но вместе с тем образующего газо-
образные продукты, нагретые до наиболее высокой темпера-
туры, — обнаруживают самый короткий срок службы. В то
время как 75-лш полевое орудие, стреляющее пироксилиновым
порохом, может сделать 10 000 выстрелов, до тех пор пока его
ствол не износится вследствие истирания нарезов и полей и рас-
ширения канала, орудие калибром 21 см может сделать всего
400 выстрелов, орудие калибром 30 см— 150, и для орудия-ка-
либром 38 см с зарядом сильного нитроглицеринового пороха
число выстрелов снижается даже до 130—80. Для 42-см мор-
тиры или дальнобойного гигантского орудия, в которых упо-
требляются особенно сильные и соответственно этому сгораю-
щие при высокой температуре пороха, число выстрелов еще
меньше.
С каждым выстрелом часть внутренней поверхности канала
разъедается, выгорает и выбрасывается вместе с пороховыми
газами в воздух. По данным С и в и при каждом выстреле из
мощной 28-см пушки выбрасывается 1/з кг железа. После того
20-
308
Бездымные пороха
как сначала на поверхности металла становятся заметными лишь
тонкие черточки, в дальнейшем меткость уменьшается по мере
того, как расширяется камора и часть пороховых газов проры-
вается между ведущим пояском снаряда и выгоревшей трубой.
Точно так же теряется конечно обтюрация частей затвора, в ре-
зультате чего износ орудия ускоряется.
IV. Пули и снаряды и их действие
1. Пули (дум-дум, расширяющиеся, разрывные, зажигательные
и трассирующие)
Для повышения действия пуль ручного оружия выше извест-
ного предела пробиваемости, характеризуемого узкой входной
и выходной пробоинами, можно пользоваться тремя типами
пуль. Это пули следующих типов:
1) пули дум-дум, действие которых основано на рас-
ширении или разрыве, получающемся благодаря спе-
циальной форме и составу металлического сердечника
пули;
2) пули с зарядом взрывчатого вещества и
ударным воспламенителем;
3) пули с чисто механическим разрывным дей-
ствием, получаемым от большой живой силы их («ультра-
пуля»), Пули этого типа серьезно изучались только в последние
годы.
С появлением малокалиберной пули с оболочкой нарезное
оружие стало давать значительное снижение в поражении целей
по сравнению с прежними тяжелыми свинцовыми пулями, совер-
шенно не имевшими наружной оболочки или имевшими ее ча-
стично. Чтобы исправить этот «недостаток», английские войска
в Индии стали впервые надрезать вершины пуль с оболочками
тогдашней винтовки Ли-Митфорд таким образом, что свинцовый
сердечник значительно выступал. При попадании в твердый пред-
мет, например в кость, пуля расплющивалась, причем свинец
одновременно выступал из прочной железной оболочки, мягкий
сердечник в передней части получал форму гриба и при дальней-
шем проникании вызывал тяжелые, зияющие раны с широким
разрывом тканей. По месту производства этих пуль в местечке
Д у м-Д у м, расположенном около Калькутты, такие пули стали
называть этим зловещим именем. Во время бурской войны
действие пуль типа дум-дум достигалось крестообразным надре-
занием вершины оболочки пули; мягкий свинец выступал из
сплюснутой в виде чашечки пули и производил ранения, анало-
гичные описанным выше. С тех пор пуля дум-дум претерпела
много изменений, а во время мировой войны она вопреки суще-
IV. Пули и снаряды и их действие
309
ствовавшим международным соглашениям1 снова появилась на
сцене, причем простым надрезанием пули более не удовлетворя-
лись, но чаще всего переднюю часть вытачивали на большую или
меньшую глубину, так что к расширению, имевшему место в пулях
дум-дум первоначального типа, прибавилось еще пневматиче-
ское действие сжатого и затем снова расширяющегося
воздуха. В этих модернизированных пулях дум-дум внутренний
канал имеет воронкообразное расширение, и пуля, начиная
с места попадания, разрывает все, что ей встречается на пути
внутри конуса с углом в 90°. Дальность полета таких тупых пуль,
естественно, сильно уменьшилась, а меткость становится тем
Рис. 125. Ружейные пули:
а — обыкновенная пуля (пуля D); Ь — современная тупая пуля дум-дум со срезан-
ной головкой и с углублением в сердечнике; с — пуля дум-дум со свинцовой го-
ловкой без оболочки; d — современная охотничья разрывная пуля; е — бризант-
* ная пуля РА а тт е р а (увеличено в 3 раза):
1—никелированная стальная оболочка; 2 — свинцовый сердечник; 3—свинцовая
головка; 4—пустотелая головка; 5—мягкий свинец; 6— стальной шарик, d —
6,6 мм; 7 — оболочка (с желобками); 8 — свободное пространство; 9 — гартблей;
10 — ударник; 11— предохранительная пластинка; 12 — ударный состав (гремучая
ртуть); 13—разрывной заряд (пентрит).
меньше, чем больше сплющивание или пустота. Пулям дум-дум
отдается предпочтение на охоте 2 за крупным зверем, и в настоя-
щее время существуют различные образцы, которые соединяют
в себе наивысшую степень действенности с минимумом раз-
рушения мускулов. На рис. 125, d, представлена такая расширяю-
По Петербургской конвенции от 4 ноября 1868 г. приме-
нение разрывных снарядов весом ниже 400 г ib сухопутной и морской войне
было запрещено. Это международное соглашение было снова подтверждено
третьей Гаагской декларацией, так называемой дум-дум-декларацией 1889 г.,
подписанной 15 державами. 11 держав отклонили подписание этой декла-
рации.
2 Подробнее об этом см. в отличном охотничьем учебнике и справоч-
нике: F. von Raasfeld, Das deutsche Weidwerk под редакцией E. G. Silva-
Taronca, Берлин 1931, 698 стр., 310 рис.
310
Бездымные пороха
щаяся пуля Штендебаха, пуля Торпедо, калибром 8 мм,
рассчитанная на скорости до 550 м/сек. При попадании передняя
часть, состоящая из свинца, благодаря давлению стального ша-
рика сначала сплющивается и входит в виде веера в цель (мус-
кулы животного), вызывая удар, который калечит поранен-
ный ею организм. Непосредственно за этим следует сжатие зад-
ней части пули, состоящей из гартблея, вследствие чего имеет
место вторичное замедленное («гидродинамическое») действие,
сопровождающееся расширением, результатом чего является
более значительная глубина проникания пули. Такие крокодило-
вые пули пригодны для всех животных — «от серны до самого
толстокожего животного нашей планеты».
В новейшее время, после того как боевые средства, приме-
ненные в последней войне, сделали ссылки на международное
право смешными, получили гласность предложения М а т т е р а,
касающиеся еще более действительных ружейных разрывных
(бризантных) пуль г. На рис. 125, е представлен в разрезе слож-
ный взрыватель, расположенный в головной части одной из
таких пуль. Разрывным зарядом служит высокобризантный те-
транитропентаэритрит, на который в качестве ударного состава
напрессовано немного гремучей ртути или азида свинца (воспла-
меняющихся от накола ударника). Разрушительное действие,
производимое этими пулями, превосходит таковое пуль дум-дум;
однако эффект этого достижения ослабляется частыми отказами,
преждевременными разрывами в канале орудия, что и неудиви-
тельно, принимая во внимание микроскопические размеры взры-
вателя. Кроме того дорогая работа, сходная с работой часового
мастера, ни в какой степени не окупается ничтожным с абсолют-
ной точки зрения осколочным и взрывным действием. Наконец
весьма важное значение имеет понижение качеств такой пусто-
телой пули в балистическом отношении; меткость массивной
ружейной пули объясняется именно ее балистическими каче-
ствами.
Следующим образцом специальной пули, который примыкает
к этой же группе, является безгильзовая пуля Лю-
до р ф а. В этой пуле пороховой заряд и средство воспламене-
ния находятся в самом пустотелом корпусе пули. Благодаря
этому тяжелая латунная гильза, занимающая большой объем,
становится излишней, и при том же весе и объеме можно распо-
лагать соответственно большим числом выстрелов. В свое время
автор был свидетелем того, как 6 таких пуль, выстреленных из
военной винтовки на дистанцию 300 м, дали 5 попаданий в ми-
шень. Конечно по сравнению с нормальной пулей вследствие
малой дистанции и недостаточной пробивной силы они отступают
на второй план; однако удивительно, что в этом направлении не
1 F о с k е, Explosivgeschosse kleiner und kleinster Kaliber, Heerestechnik
1929, 269—277; франц, пат. 651781.
IV. Пули и снаряды и их действие
311
найдено еще удовлетворительного решения для оружия ближнего
боя (револьверов); такое положение зависит скорее от того, что
меньшее внимание уделяется точности попадания, чем большому
числу выстрелов в единицу времени.
Зажигательные и осветительные пули и снаряды нашли об-
ширное применение во время мировой войны как в пехотном
оружии, так и в оружии более крупного калибра; в будущем они
сыграют не меньшую роль.
Из многочисленных образцов фосфорных зажига-
тельных пуль самой действительной является пуля,
представленная на рис. 126; кроме того она произво-
дит то же действие, что и пуля дум-дум. При попа-
дании в
Рис. Г26.
Фосфор-
ная зажи-
гательная
пуля:
/—мельхио-
ровая обо-
лочка, 2 —
•белый фос-
фор; 3— по-
движной
стальной
цилиндрик;
4~ свинцо-
вый сердеч-
ник.
цель ее оболочка расплющивается, подвиж-
ной же стальной сердечник по инерции
движется вперед и выталкивает горящий
фосфор из пули. При этом горючие ве-
щества, содержащиеся в баллонах, напри-
мер бензин в аэропланных резервуарах,
воспламеняются, а живые цели получают
тяжелые поражения.
Из группы трассирующих и зажига-
тельных пуль (рис. 127) все чаще и чаще
встречаются бронебойные пули,
применяемые для поражения воздушных
и других целей, защищаемых легкой бро-
ней. «Трасса» имеет в данном случае толь-
ко вспомогательное значение, а именно:
дает возможность стрелку видеть место
падения пули и тем самым облегчает при-
целивание; связанная с этим возможность
производства пожара тоже не менее же-
лательна. Большая пробивная сила это-
го рода пуль основывается на том извест-
ном явлении, что если стальной сердеч-
ник при ударе проходит сперва сплющи-
вающуюся в виде кольца оболочку из лег-
кого металла, которая замедляет его по-
Рис. 127.
Бронебой-
ная трасси-
рующая
пуля:
/ — оболочка
из мягкой стали
(покрыта
медью); 2 —сер-
дечник из гарт-
блея; 3— бро-
небойный сер-
дечник нз твер-
дой стали; 4~
гильза из мяг-
кой стали; 5—
трассирующий
и зажигатель-
ный состав; 6—
воспламени-
тель; 7—отвер-
стие для вос-
пламенения.
ступательное движение и сообщает ему направление, то он мо-
жет проникнуть глубже, чем 'обыкновенно г.
Эти пули находят применение особенно в сверхмощных пуле-
метах (11 мм). В качестве трассирующего состава на-
ряду с фосфором применяется смесь, состоящая из порошко-
образного магния и перекиси бария. Воспламенение в момент
1 Новейшие опыты с закаленным 2-см сплошным стальным снарядом
показали однако, что пробивная сила в отношении брони достигает той же
величины, как и в случае мягкой оболочки, снаряженной стальным сер-
дечником.
* "
tv
312
Бездымные пороха
выстрела происходит через то же отверстие в дне, через которое
появляются затем видимые на полете дым или огонь. Нормаль-
ная пехотная пуля видима до 1000 м.
Пехотную винтовку стремятся во всех отношениях усовершен-
ствовать и сделать ее наиболее удобной в обращении, насколько
возможно легкой и пригодной к применению во всех возможных
случаях; при такой постановке вопроса все предыдущие предло-
жения
Ll
Рис. 128. Фран-
цузская ружей-
ная граната:
1—взрыватель; 2—
корпус гранаты
(сталь илн литая
сталь); 3— стабили-
затор.
не давали удовлетворительного решения. Новый шаг
в этой области сделали французы, использовав;
винтовку для метания ружейной гранаты
весом 450 г с прицельной дальностью 325 м\
при разрывном заряде в 50 г ружейная гра-
ната дает весьма действительные осколки
(рис. 128).
Наряду с расширяющимися пулями
дум-дум известны также пули, которые произво-
дят разрывное действие чисто мт х ани ч е-
с к о г о происхождения. Если пехотная пуля,
имеющая большую скорость, проникает в какой-
нибудь материал, частицы которого обладают
малой силой сцепления, например в жидкие или
полужидкие массы, как вода или как влажная,
глина, мозг, сердце, печень, костный мозг, то
разрывное действие получается такое же, как
если бы внутри материала находился бы заряд,
который был подвергнут воспламенению. Неболь-
шое количество воды разбрызгивается во все сто-
роны и, что особенно замечательно, главным обра-
зом в направлении стрелка; в шашке из пласти-
ческой глины получается расширение, объем ко-
торого приблизительно в 400 раз больше пули,
попавшей в шашку. Глиняный шарик диаметром
30 см, пронизанный остроконечной пулей (пуля S,
скорость 870 м/сек), прошедшей через центр,
раздробляется нацело, как будто он взорвался.
Шарик же диаметром 45 см хотя и остается целым,
но при этом внутри него образуется почти шаро-
образное расширение диаметром 25 см, имеющее
входное и выходное отверстия диаметром со-
ответственно 4 и 8 см.
Такие процессы пробивания удалось зафиксировать на фото-
графии и разложить затем снимки кинематографическим путем
(до 100 0D0 изображений в секунду)1. Так например выстрел из
пехотной винтовки в свиной пузырь, наполненный водой, обна-
1 Application de la chrono-phot'ographie paretincelleelec-
trique a 1’etude des phenomdnes de ballistique, Bulletin off. de la direct,
des recherches scient. et industr. et des inventions, Париж 1919, 48—54.
IV. Пули и снаряды и их действие
31$
ружил следующие явления Ч Сначала конус разбрызгивания ча-
стиц воды обращен вершиной к входной стороне, затем к выход-
ной стороне и увеличивается все больше и больше. Весь пузырь
остается в покое довольно продолжительное время, и только
тогда, когда пуля находится на расстоянии 245 см от выходного
отверстия, начинается собственно разрыв пузыря. То же явление
наблюдалось на глиняном шаре и жестяном сосуде, наполненном
водою: разрыв или раздробление начинались лишь после того,
когда пуля уже вышла. При попадании пули в голову
с близкого расстояния в большинстве случаев сносится черепная
крышка. Так например жертвы революции, расстрелянные в лицо
в упор, все без исключения представляют ужасающую картину:
в более легких случаях голова принимает такую форму, как
будто по ней произведен удар обухом топора, в более же
тяжелых случаях бывает оторван череп, и часто так, что от него
остается только небольшая часть. Мозг в большинстве случаев-
разбрызгивается. (Револьверные пули, обладающие вдвое мень-
шей скоростью по сравнению с винтовочными, не обнаруживают,
естественно, указанных выше явлений, напоминающих взрыв)..
Все описанные явления, как указано выше, относятся к массам,,
более или менее легко меняющим свою форму, подвижным;
в свинце это действие уменьшается, в песке или дереве оно почти'
полностью исчезает.
Если однако перейти от обычных применявшихся до настоя-
щего времени скоростей полета пуль в область ультраско-
ростей порядка 1500 м/сек, то механическое разрывное дей-
ствие распространяется и на самые прочные препятствия. Так
например Гер л их2 указывает, что его 7-мм ультрапуля, имев-
шая начальную скорость 1450 м, пробивала твердозакаленную-
12-ти/и броневую плиту; пробоина получалась в виде круга с вну-
тренним дфаметром, равным 15 мм, причем материал плиты ока-
зался вогнутым внутрь в виде круга диаметром около 25 мм. Пуля
весила всего лишь 6,5 г и состояла из мягкого свинцового сердеч-
ника, заключенного в тонкую мягкую железную оболочку. Обык-
новенная же 7,9-льм пуля со стальным сердечником дала лишь
пробоину равную диаметру пули.
При этих чрезвычайно больших скоростях полета пуль механико-
динамические процессы протекают так быстро, что даже мягкая пуля
не успевает сплющиться и разбиться на поверхности плиты; точно так же
не имеют значения упругие свойства стальной плиты: два тела, сталкиваю-
щиеся с некоторой критической (предельной) скоростью, практически
являются по отношению друг к другу несжимаемыми и абсолютно твер-
дыми. При рассмотрении пробоин в буферах железнодорожных вагонов,
получившихся от беспримерного по своей бризантности взрыва в Бодио,
я уже давно высказал предположение, что в данном случае пробоины
ч 1 С. С г a n z, Lehrbuch der Ballistik, т. IV, 1918, табл. 8; далее М. М а-
s i m a u. S. Sasaki, Effets des balles de fusil sur les matidres plastiques^
Mem. de 1’Art. franc. 1932, 563—580.
3 Ku gel u. S ch rot, 1931,96—103.
314
Бездымные пороха
должны были образоваться благодаря тому, что железо расплавилось.
Теми же причинами объясняется проникание осколков тигля в поверхность
железной плиты, получаемое при бризантном взрыве; в данном случае энер-
гия, выделяющаяся при взрыве, несомненно приводит к расплавлению ме-
талла.
На основании этих наблюдений механический процесс разрыва
можно представить себе следующим образом.
Часть энергии движения пули передается предмету, по которому про-
изводится стрельба; частицы материала, с которыми непосредственно стал-
кивается пуля, в свою очередь передают остаток энергии близлежащим
слоям, и таким образом механическая энергия распространяется от частицы
к частице до тех пор, пока образование осколков совершенно не прекра-
тится. Следовательно частицы материала приобретают в известной мере
скорость пули, движение и ускорение которой направлено по линии наи-
меньшего сопротивления. Явление весьма сходно с раздроблением тела
зарядом взрывчатого вещества; разница лишь в том, что при ударе пули
частицы материала получают ускорение от нее, а прн взрыве — в резуль-
тате давления, производимого газообразными продуктами.
Первые сведения об ультрапуле были восприняты с удивле-
нием, достойным профанов; не раз ставился вопрос о том, воз-
можно ли вообще получить такие скорости при стрельбе из обык-
новенной пехотной винтовки. Коснемся кратко этого вопроса
и дадим на него ответ, основываясь на элементарных понятиях
термохимии и балистики.
Соответственно изложенному на стр. 72 энергия пороха используется
в канале винтовки приблизительно на */3. Следовательно, зная дульную
энергию пули, можно рассчитать вер порохового заряда, требуемого для
достижения определенной начальной скорости. Пусть скорость vo, сообщае-
мая пуле, равна 1500 м/сек, а минимальный вес самой пули составляет 8,5 г
(ультрапуля калибром 7 мм по понятным соображениям весит всего 6,5 г);
тогда дульная энергия будет:
8,5-15002
---— = 97о 577 гм (граммометров).
Пусть для порохового заряда взят особо сильный нитроглицериновый
порох, выделяющий не менее 1400 кал/г. Этому количеству теплоты экви-
валентно 1 400 427 гм механической работы. Вычисленная дульная энергия,
равная 975 577 гм, составляет только у3 всей энергии, развиваемой порохом;
•отсюда пороховой заряд в граммах равен:
3 • 97-> 577 4 0
1400 • 427 ’
Этот пороховый заряд необходим для сообщения пуле требуемой началь-
ной скорости в 1500 м/сек. Если мы увеличим вычисленный вес порохового
заряда, равный 4,9 г, еще на 10%, т. е. доведем его в общем до 5,40 г
(чтобы компенсировать несколько усиливающееся падение давления в ре-
зультате значительного повышения температуры и более низкого исполь-
зования энергии пороха в канале винтовки), то такое количество пороха
может уместиться в винтовочной гильзе емкостью в 3,5 см3 при плотности
заряжания, равной 1,54 ( =—• (Наибольшая плотность этого сорта
пороха составляет 1,60.) Но в каком же соотношении находится давление
газообразных продуктов при такой плотности заряжания к сопротивлению
«оружия? При калибре, равном 0,754 см, и длине пути снаряда в 69 см объем
IV. Пули и снаряды и их действие
315
составляет 30,8 см. Это соответствует плотности заряжания при выстреле
—— 0,104 для нормального заряжания и *’ о = 0,175 для нашего
0V,O £>и,О
у л ь т р а-заряда. Однако на основании многочисленных опытов в бомбе
невозможно допустить, чтобы при плотности заряжания 0,175 давление пре-
восходило 3000 кг/см-, так что, если порох сгорает на более длинном пути
с плоским максимумом (рис. 34), ствол оружия увеличивается соответственно
рассматриваемым давлениям.
Менее благоприятные результаты получаются по формуле Г ейден-
рейха, приведенной на стр. 73, проверенной для среднего давления газо-
образных продуктов:
п________(8-5+ 2,7)-10 ~3-1 500* ,
2 9,81 • 0,69 - 0,376* • г. 1,0333 4 0-0 '<г СМ~
При таких условиях максимальное давление уже переходит пределы
упругого сопротивления стали ствола винтовки, и оружие должно нахо-
диться на крайнем пределе применения его, что несомненно и может быть
обнаружено уже при опытах с малокалиберной винтовкой и пулей в 6,5 г.
2. Звук выстрела орудия и звук, производимый снарядом
Вылет снаряда, как правило, сопровождается тремя звуками:
сначала слышен звук выстрела орудия, вызываемый газообраз-
ными продуктами порохового заряда, непосредственно за ним
следует более или менее продолжительный звук, производимый
полетом снаряда, и наконец — звук взрыва снаряда у цели. Прежде
всего обращает на себя внимание звук, производимый современ-
ными снарядами и при больших начальных скоростях выделяю-
щийся значительно более резко, чем звук снаряда времен чер-
ного пороха. Этот «звук перемещения» снаряда объясняется
уплотнением воздуха, который образует кольцеобразную волну
перед снарядом, летящим со скоростью большей, чем скорость
звука (340 м/сек), и распространяется сферически подобно волне
перед носом движущегося корабля. Смотря по скорости, звук,
производимый снарядом, опережает звук выстрела из орудия
приблизительно в 1—3 раза: звук, производимый снарядом, резок,
громок и чист, звук выстрела более глух и слаб (в любом тире
эти звуки очень хорошо отличимы один от другого). Например
звук, производимый снарядом сверхдальнобойного орудия,
стрелявшего по Парижу, предшествовал на целых 3 мин. звуку
выстрела того же орудия, т. е. время полета снаряда до цели со-
ставляло 3 мин., а время распространения звука 6 мин.
Длительный шум, производимый болидами и метеорами, объ-
ясняется теми же причинами, что и звук, производимый снарядом. Косми-
ческие скорости вызывают волну, которая даже в высоких разреженных
слоях атмосферы должна давать звук сильного выстрела. Вследствие ко-
лоссальной энергии этого движения (в среднем 50 км/сек) воздух перед
метеором сжимается почти адиабатически, быстро раскаляется и с колос-
сальным трением о близлежащие слои отходит назад, причем увлеченные
им и испарившиеся частицы образуют хвост огненного шара. Часто масса
метеора разрывается, и светящееся ядро наподобие взрыва разлетается
в стороны; но легко понять, что этот процесс является второстепенной при-
316
Бездымные пороха
чиной звука, производимого метеорами. Автор в детстве слышал неза-
бываемый звук большого метеора, который спокойно совершал свой огнен-
ный путь и не взорвался; это явление на секунду сопровождалось громом,
и замечательно продолжительным эхо (явление чистого звука, производи,-
мого снарядом с большой высоты *).
3. Унитарные патроны (ружейные и
орудийные)
Еще лет 50 назад пришли к мысли о необ-
ходимости такого усовершенствования руч-
Рис. 129. Герман-
ский ружейный па-
трон (пуля S, гиль-
за, пороховой
заряд и капсюль).
ного (огнестрельного ору-
жия, при котором средство
воспламенения, метатель-
ный заряд и пуля (снаряд)
собраны в одно целое, в
унитарный патрон,
вследствие чего не только
значительно повысилась
скорострельность, но было
достигнуто предохранение
пороха и капсюля-воспла-
менителя от действия вла-
ги. При состоянии техники
того времени нельзя было
и думать о введении подоб-
ного усовершенствования
для артиллерийских боевых
припасов. Лишь значитель-
но позднее, примерно лет
20 назад, удалось заменить
обычные тогда картуз-
ные заряды, содержав-
шие только пороховой за-
ряд, большими латун-
ными гильзами, в ко-
торые вкладывались поро-
ховые заряды, вставлялись
снаряды, а в централь-
7Jmm германский
ушИерсалЬнкн) споря!
Рис. 130. Современ-
ная бризантная шрап-
нель с гильзой и
пороховым зарядом.
ное очко дна ввинчивалось усиленное средство воспламенения
(капсюль-воспламенитель, усиленный зарядом дымного пороха).
Пороховой заряд для 75-лш французской полевой гранаты со-
ставляет 720 г, a 30,5-с/и гранаты— 100 кг. Для 38-с/и стандартной
гранаты весом 760 кг заряд нитроглицеринового пороха изме-
няется в пределах 207—318 кг, смотря по длине канала орудия.
1 Замечательный метеор, который пронесся 21 мая 1902 г. и за 10 ми-
нут до захода солнца был слышен и наблюдался во всей восточной части
Швейцарии.
IV. Пули и снаряды и их действие
317
Рис. 131 и 132. 7,5-см, универсальный снаряд1 после разрыва в виде гранаты и в виде шрапнели.
Вес снаряда 6,5 кг. Вас разрывного заряда 230 г. Вас пули 9 г. Число пула (при алюминиааой дистанционной трубке) 335.
1 R. Е s с a I е s, Die Nitrosprengstoffe VI, 317, Лейпциг 1915.
318
Бездымные порога
Разрывной заряд 7Ь-мм гранаты составляет 850 г, 15,5-слг снаряда
гаубицы Римальо 12 кг, и 30,5-слт снаряда 130 кг бризантного
взрывчатого вещества г.
Стоимость одного выстрела быстро возрастает с увели-
чением калибра. По германским данным выстрел легкого поле-
вого орудия расценивается в 25 марок, тяжелого 28-сти орудия —
уже 10000 марок, включая износ канала орудия, которое для
данного калибра расценивается в 230 000 марок.
Насколько сильно отличаются по своей величине осколки сна-
ряда в зависимости от большей или меньшей твердости
металла оболочки и понижения бризантности разрывного заряда,
показывают опыты порохового завода Севран (около
Парижа), произведенные 28 сентября 1932 г.
В качестве бризантных снарядов применялись строго цен-
трированные, пустотелые цилиндры из мягкой и средней
твердости стали высотою 25 см, диаметром 8 см, с 16-лш
центральным каналом, глубиною 22 см. Твердые взрывчатые ве-
щества запрессовывались до одной и той же плотности 1,20;
только жидкий нитроглицерин имел значительно большую плот-
ность (1,6). Воспламенение производилось электрическим путем
от капсюля-детонатора, содержавшего 2 г чистой гремучей
ртути.
ТАБЛИЦА 24
аздробление снаряда при оболочках различной твердо-
стин различных взрывчатых веществах
Сталь Вес несна- ряженного цилиндра Вес 10 ос- колков (са- мых круп- ных) Общий вес собранных осколков Число ос- колков
Тринитротолуол Пентринит 80,20, флегматизи- Средней твердо- 9,38 5,96 9,178 71
рованный ; ........ Мелинит D (чистая пикрнно- сти 9,38 3,22 8,920 226
вая кислота) Пентринит (как и выше) ... Нитроглицерин Мягкая 9,76 9,76 9,76 8,455 6,450 9,720 8,686 9,150 9,720 17 61 3
4. Сверхдальнобойное орудие, стрелявшее по Парижу
Из всех боевых средств, изобретенных в течение последней
войны, ни одно не было столь неожиданным и не вызвало такого
La Revue des Produits chimiques, 1918, 293.
IV. Пули и снаряды и их действие
319
удивления, как сверхдальнобойное орудие, стрелявшее по Па-
рижу. Замечательнее всего то, что это чудо артиллерийской тех-
ники, предназначенное для разрушения с дистанции в 128 км,
превосходило все тогдашние открытия и что с научно-техниче-
ской точки зрения оно считалось неосуществимым; в это чудо
поверили лишь тогда, когда снаряды, подобно метеорам, стали
падать с неба.
Хотя в настоящее время дальнобойные орудия этого типа
отошли в прошлое \ так как транспорт боевых материалов на
большие расстояния лучше обеспечивается самолетами, все же
мы приводим важнейшие данные1 2 об этом орудии.
Общая длина составляла 37 м, калибр 21 см; срок службы трубы со-
ставлял 50 выстрелов. Снаряд весил 120 кг; заряд состоял из трех частей:
из 50 кг пороха, помещенных в шелковый картуз, затем еще 75 кг, также
СЯЛзр часть
Длина 38,1см пушки
Г"-------
Нарезная часть
(3,060 -
. I см снаряда
2Асм »
•—6.Q0 13,870
^—Длинапути снаряда-33 м g
1------------------------ 37,00а-----
Рис. 133. Орудие сверхдальней стрельбы образца 1918 г. (разрез).
помещенных в шелковый картуз, и 70 кг — в латунной гильзе, а всего>
следовательно 195 кг; заряд вкладывался в пороховую 1гамору длиною
в 3,1 м. После износа канала ствола вследствие выгорания производилось
рассверливание канала до 24 см, после чего дальнобойную стрельбу можно
„ „ 243
было продолжать. После рассверливания применялся снаряд в —=
21“
= 1,5 раза более тяжелый, что было предусмотрено конструктивно, т. е. вес
снаряда составлял 180 кг, а соответствующий заряд весил 292,5 кг. Вес
порохового заряда был рассчитан с избытком, так как для начальной ско-
рости г?о= 1700 м/сек снаряда весом 120 кг и порохового заряда в 195 кг
нитроглицеринового пороха (до 1100 б. кал) коэфициент полезного действия
(см. стр. 72) получается равным 18,2%, что указывает на применение пороха
малой энергии и живости. Наши балиститы сгорали бы значительно эф-
фективнее в длинных каналах, но их применение соответственно укоро-
тило бы срок службы орудия. По мнению Брунсвига 3 применялся:
нитроглицериновый порох, желатинированный без растворителя, содержав-
ший немного нитроглицерина и действовавший подобно пироксилиновому
пороху.
1 Впрочем французские проекты дальнобойных орудий, относящиеся
к послевоенному времени, предусматривают дальность стрельбы в 200 ги.
другие ограничиваются 50—80 км!
2 Ср. Artill. Rundschau 1930, 170.
3 Бездымный порох, Госхимтехиздат, 1933.
320
Бездымные пороха
При угле возвышения в 50° и начальной скорости 1700 м/сек время
полета снаряда на дистанцию 125 км составляло 186 сек.; вершина траекто-
рии находилась на высоте 38,6 км; на такую высоту в мировое пространство
до настоящего времени не проникало еще ни одно творение человеческих
рук. Отдача в прочно бетонированную орудийную площадку достигала 453 т.
Стрельба велась с позиции, располо-
Рис. 134. Разрез 21-см снаряда для
^*... сверхдальней стрельбы.
женной в лесу (возле Крепи), нача-
лась 21 марта 1918 г. и с перерывами
продолжалась до августа месяца того
же года. Первоначально с четырех
выбранных в различных местах пози-
ций стреляли 5 орудий; из них были
использованы до полного износа 4,
одно же разорвалось. «Длинная Бер-
та» всегда стреляла только днем,
причем снаряды с промежутками при-
мерно в полчаса и постоянно в одном
и том же направлении располагались
по большому диаметру Парижа, про-
изводя при падении сильнейший шум.
Не было найдено ни одного невзор-
вавшегося снаряда. В Париж попало
всего 367 снарядов, причем было
убито 250 человек и ранено 640. При-
чиненные убытки достигли 50 млн.
золотых франков. Эта жуткая бом-
бардировка вызвала такую панику
среди населения, что город покинули
около 1 млн. жителей.
Для сравнения современного,
обладающего значительной под-
вижностью зенитного ору-
дия с значительно более лег-
кими и скорострельными малокалиберными автома-
тами приведем следующие цифры:
Калибр ..........................
Длина трубы......................
Начальная скорость . . . . • . . .
Дальность ......................
Вершина траектории..............
Вес снаряда.....................
Вес орудия....................•
Число выстрелов в минуту . . . .
Скорость на походе..............
Автоматические пушкм
8,0 см 2,0 см 3,7 см
50 калибров 70 калибров
750 м сек 850 м/сек 850 м/сек
15 км 5 км
9 . 3,5 ,
8 кг 130 г
3,8 т 0,25 т 1,0 т
25 120
35 км/час (с переме-
ной мага-
зина)
Переход из походного положения
в боевое................- . . . .
Предельный угол возвышения . . .
Горизонтальный обстрел .........
Крестообразный лафет. . . . . .
Срок службы.....................
Откат (переменный)..............
4 мин.
от—3°
до -|- 80°
360°
4 ветви
1500 вы-
стрелов
57 — 110 см
IV. Пули и снаряды U их действие
321
2 ] Зак. 3171. — Штетбахер. \
Die Schiffs- u. Kiistengeschiitze der GrossmSchte, Kriegstechn. Zeitschr., 1918, 95 — 102.
322
Бездымные пороха
При применении обладающего особенно высокой подвижностью 2-слг
автоматического орудия, вес которого в боевом положении 218, а в поход-
ном 260 кг и разогретый ствол которого весом 17 кг можно сменить в не-
сколько секунд, радиус действия против самолетов достигает только 2500 м;
время полета снаряда на 2000 м составляет 5% сек., 2-см граната весом
130 г (унитарный патрон 300 г), снаряжена примерно 10 г взрывчатого-
вещества и кроме того трассирующим составом и взрывателем, предназна-
ченным для разрыва снаряда в воздухе в случае непопадания в самолет
(рис. 136).
Боевые дистанции в морском бою составляют
в настоящее время 20—18 км, что является почти максимальным
Рис. 135. Осколок одного
из дальнобойных снаря-
дов, которыми произво-
дилась стрельба по
Парижу.
расстоянием, в пределах которого сохра-
няется видимость. Пристрелка требует не
более 2 мин., после чего почти всегда сле-
дуют попадания. Крейсерский бой в Се-
верном море, у Ютландии (Доггербанк),
24 января 1915 г. начался с дистанции в
20 км, но затем скоро расстояние умень-
шилось до 14 ад. В бою у Скагеррака1
31 мая 1916 г. первые выстрелы были про-
изведены в условиях кристально чистого
воздуха с расстояния 15 км, а главные бои
велись на дистанции 12 км. В этом бою
обе враждебные эскадры начали стрель-
бу почти одновременно, а именно в 3 ч.
48 м. и уже в 3 ч. 51 м. в английский
флагманский корабль попал первый снаряд.
Спустя 10 минут потонул «Indefatigable»,
взорвавшийся от двух залпов противника,
а в 4 ч. 26 м. взлетел на воздух английский
линейный крейсер «Queen Магу». Герман-
ский крейсер «Seydlitz», наиболее постра-
давший, получил три тяжелых попадания,
из них одно — 38-с/и снарядом. Несмотря
на продолжение боя и на то, что «Seydlitz»
получил еще 20 попаданий, он смог своими
собственными силами добраться до гавани
(и это замечательное обстоятельство лег-
ко объясняется тем фактом, что англи-
чане снаряжали тогда свои тяжелые снаряды дымным порохом
вместо более сильных бризантных взрывчатых веществ).
Несмотря на все имеющиеся вспомогательные средства, в мор-
ском бою, так же как и в сухопутном, вероятность попадания
обеспечивается только высоким качеством боевых припасов. Так
например в бою 18 марта 1916 г. балистическая вероятность
попадания артиллерии корабля «Queen Elisabeth» с дистан-
ции 13—15 км составляла только 0,5%. При таких обстоятель-
* Т i г р i t z, Erinnerungen, стр. 333.
IV. Пули и снаряды и их действие
323
ствах 38-си орудие, имеющее боевой комплект
в 100 снарядов, которые при скорости огня
2 выстрела в минуту могут быть израсходо-
ваны за 50 мйн., может даже не начинать
стрельбы.
Меткобб'йность и вероятность
поражения. Действительность современ-
ного артиллерийского, пулеметного и ружей-
ного огня зависит не только от механических
качеств оружия, разрывного действия и про-
бивной силы снарядов, но и в не меньшей
степени от такого важного* обстоятельства,
как меткость стрельбы. Так например по
французским данным на одного убитого фран-
цуза в 1917 г. необходимо было израсхо-
довать 395 германских снарядов и на одного
раненого — 76. Едва ли условия лучше при
обстреле укрепления, несмотря на то, что в этом
случае действует тяжелая артиллерия, устано-
вленная по правилам инженерного искусства
и стреляющая весьма точно. Из общего числа
73 бельгийских броневых башен 7400 крупно-
калиберными снарядами были приведены в не-
годность лишь 10, а чтобы вывести из строя
только одну броневую башню, немцам потре-
бовался 181 снаряд 42-см калибра весом по
900 кг каждый и 181 выстрел 30,5-с/и снарядами
по 455 кг, т. е. 122 т, или 12 полностью груже-
ных железнодорожных вагонов. Отсюда ясно,
каких чудовищных размеров достигнет в бу-
дущей войне расходование боевых припасов
при ураганном огне по окопам и блиндажам,
неудовлетворительной стрельбе по танкам и
самолетам, при большом рассеивании на дале-
ких расстояниях в морском бое и наконец при
часто безрезультатном сбрасывании огромного
количества аэробомб -— бризантных, зажига-
тельных и химических.
Роне указывает, что по сравнению с
1870/71 г. полезное действие современных ору-
дий при одном и том же весе повысилось не
меньше, чем в 15 раз. Тем не менее результат
их действия в отношении веса затрачиваемых
боевых припасов сейчас меньше, чем во время
войны 1870/71 г., так как, с одной стороны,
дальность стрельбы больше, а с другой —
укрытия строятся более искусно. В то время
как еще в 1870 г. для вывода из строя
Рис. 136. Совре-
менная 40-мм трас-
си реющая граната
для зенитной
артиллерии (Во-
fors, Швеция):
/ — сверхчувствитель-
ный головной ударный
взрыватель; 2-разрыв-
ной за^ яд (ТНТ); в—
состав для взрыва за-
ряда в случае непопа-
дания; 4—корпус (каче-
ственная сталь); 5—
трассирующ й с став;
б--медный ведущий
поясок; 7 латун ая
гильза; 8 — донный
взрыватель; 9— оре-
ховой заряд; /б—ла-
тунная гильза; 11 —
капсюль.
324
Бездымные пороха
одного бойца было достаточно 22 снарядов весом около 100 кг,
в боях в Шампани в 1915 г., где французы израсходовали больше
I млу. снарядов, для этой цели потребовалось 600 кг.
Расход боевых припасов
По английским данным с начала войны и до перемирия
(1914—1918 гг.) было изготовлено 200 млн. снарядов и 26 430 ору-
дий. Общее количество пулеметов достигло четверти миллиона.
При прорыве линии Гинденбурга в течение одного дня было
израсходовано 943 300 снарядов весом 40 000 т.
ГЛАВА ШЕСТАЯ
НИТРОГЛИЦЕРИНОВЫЕ ВЗРЫВЧАТЫЕ ВЕЩЕСТВА.
ДИНАМИТЫ
Под общим названием «динамиты» в настоящее время подра-
зумевают почти исключительно взрывчатые вещества, предста-
вляющие собой пластические продукты, главной составной частью
которых является нитроглицерин. В зависимости от способа при-
готовления и в зависимости от добавок, с которыми (нитрогли-
церин смешан или которые применяются для поглощения его,
различают следующие основные сорта этих взрывчатых веществ:
1. Гурдинамит, или так называемый «старый» динамит,
содержащий недеятельное основание; кизельгур, в настоя-
щее время употребляется редко.
2. Гремучий студень — нитроглицерин, желатинирован-
ный КОЛЛОДИОННЫМ ХЛОПКОМ'.
3. Динамиты, являющиеся смесью нитроглицерина
с деятельными основаниями, как древесная мука и нитраты; при
низком содержании нитроглицерина (12—4%) они представляют
собой особую подгруппу так называемых аммиачноселитренных
взрывчатых веществ.
4. Ж е Л а т и нд и н а м и ты, приготовляемые из жидкой
взрывчатой желатины смешением ее с деятельными порошко-
образными добавками; сюда же относятся и трудно замерзающие
«безопасные» динамиты, содержащие динитрогликоль, динитро-
хлоргидрин или ароматические нитросоединения, понижающие
температуру замерзания нитроглицерина.
5. Антигризутные динамиты, желатинированные и
нежелатинированные, безопасные при взрыве в атмосфере руд-
ничного газа и угольной пыли.
I. Гурдинамиты
Нитроглицерин, как жидкое вещество, представлял вначале
для применения в качестве взрывчатого вещества большие труд-
ности, что побудило Нобеля еще в 1863 г. перевести это
взрывчатое масло путем смешения с твердыми пористыми ве-
ществами, как например черным порохом, древесным углем, бу-
мажной массой, в такое состояние, чтобы его можно было бы
326
Нитроглицериновые взрывчатые вещества
применять удобно и безопасно *. Длительные опыты с черным
порохом из-за его плохой впитывающей способности потерпели
неудачу. Наилучшим объектом для впитывания масла, как это
случайно обнаружилось, оказался кизельгур. Однажды при
перевозке жидкого нитроглицерина одна из жестяных банок
дала течь, и вытекающее масло было полностью поглощено ки-
зельгуром, которым эта банка была обложена1 2.
Кизельгур — особо пористая, состоящая из микроскопически
маленьких чешуек инфузорная земля, которая добывается в Лю-
ыебургских степях, в Шотландии и в Италии; после прокалива-
ния он может впитать до 82% нитроглицерина. При рассмотре-
нии кизельгура под микроскопом видно множество вытянутых
желобчатых трубочек, наполненных нитроглицерином, в кото-
рых он удерживается благодаря поверхностному натяжению.
Полученная таким образом пластическая пригодная для патро-
нирования масса была названа Нобелем «динамитом»; под
этим названием появилась первая форма применения нитрогли-
церина, в виде которой последний должен был сыграть свою
всемирноисторическую роль.
Производство динамита чрезвычайно просто. Кизельгур сначала про-
каливается в особых печах и тем самым освобождается от воды и орга-
нических примесей. После охлаждения легкий порошок гура всыпают в на-
литый в освинцованные деревянные ящики профильтрованный нитроглице-
рин, количество которого берется в соотношении 3 ч. на 1 ч. кизельгура;
вся масса вручную месится и несколько раз протирается через медное сито
с крупными отверстиями (5 мм). Рыхлая пластичная масса подается после
этого в патронировочную нашивку, из которой она выходит
в форме колбаски, после чего завертывается в парафинированную или перга-
ментную бумагу (рис. 152).
Кизельгурдинамит представляет собою лишенную запаха пла-
стическую массу с удельным весом, равным в среднем 1,6; в за-
висимости от чистоты кизельгура (окись железа) масса бывает
окрашена в цвета от оранжевого до красно-бурого. Неприятные
свойства нитроглицерина — ядовитость и способность замерзать—
1 Опасные свойства нитроглицерина вначале, т. е. примерно в 1864—
1867 гг., недооценивались в такой степени, что в обращении с ним допу-
скались самые невероятные вещи. Например транспортировали нитрогли-
церин в винных бутылках, а с корзинами, в которые эти бутылки упако-
вывались, обращались, как с пивными ящиками; оставляли без внимания
и то, что проливавшееся масло замерзало на колесах телеги, и были
даже случаи, когда нитроглицерин употребляли вместо колесной мази.
Один из сотрудников Нобеля, шведский офицер инженерных войск,
Адельскьельд писал в своих воспоминаниях: «Наиболее странным и
непонятным является для меня то, что мы в течение этих шести дней не
взлетели на воздух, а это могло случиться по крайней мере по 50 раз
в день. В данном случае старинная пословица «больше удачи, чем ума»,
оправдалась более чем когда-либо».
2 В настоящее время в литературе имеются указания, что применение
кизельгура для поглощения нитроглицерина было открыто еще ранее Но-
беля германским горным инженером Шеллом (Schell) в Гарце, что однако
оспаривает Ф е л ь д г а у з (Z. f. Schiess.- u. Sprw., 6, 1936). Прим. ред.
I. Гурдинамиты
327
сохраняются и у динамита, .благодаря чему одно из самых основ-
ных его преимуществ — эластичность и способность хорошо
Рис. 137. Схема расположения производств на современном динамитном заводе:
/—котельная и механическая мастерская; 2—мастерская тары; з—склад селитры; 4#—хранение кис-
лот и приготовление нитрующей смеси; 4Ь—компрессорная и холодильная установка; 4с-храни-
лище глицерина; 5—насосная; 6—миграционная мастерская; 7—отделение фильтрации; 8а—дени-
трация и концентрация азотиой кислоты; 8Ь— абсорбционная установка; 8с—концентрация серной
кислоты; 9—хранилище кислот; 10—мастерская приготовления порошкообразных добавок; 11—сушка
коллодионного хлопка; 12 и 13— мастерские желатинизации и смешения; 14—укупорка и промежу-
точный склад; 15 и /6—отстаивание отработанных кислот; 17—40—патронировочные будки.
заполнять шпуры — теряет свое значение. Более того, чистый
нитроглицерин неделями может оставаться жидким при самых
328 Нитроглицериновые взрывчатые вещества
суровых зимних холодах, в то время как динамит под влиянием
присутствующих в нем твердых частичек кизельгура быстро за-
мерзает. Следующим недостатком динамита является то, что
вода в состоянии постепенно вытеснять из него весь нитроглице-
рин, что очень мешает применению динамита в сырых шпурах.
Но, с другой стороны, гурдинамит обладает относительно высо-
кой постоянной скоростью детонации, которая выгодно
отличает его от других динамитов, так что в некоторых жарких
странах гурдинамит еще до сих пор применяется как невыпоте-
вающее (неэксудирующее), нестареющее нитроглицериновое
взрывчатое вещество. Чувствительность его к удару несколько
выше, чем у нитроглицерина, но зато взрывчатая сила вследст-
вие разбавления нитроглицерина недеятельным основанием зна-
чительно ниже (табл, на стр. 102 и 106). Зажженный в небольших
количествах динамит сгорает без взрыва светящимся пламенем;
при больших количествах горение, напротив, вследствие пере-
грева легко переходит во взрыв.
3 ноября 1893 г. в гавани Сантандер на пароходе, нагруженном при-
мерно 2000. т железа и 1810 ящиками динамита, произошел пожар. Три-
дцать ящиков со взрывчатым веществом были быстро выгружены в безо-
пасное место. Пожар на судне тем временем быстро распространялся; на
заданный вопрос капитан заверил, что динамита на борту больше нет. На
набережной между тем собралось большое количество зрителей, желавших
насладиться необыкновенным зрелищем горящего судна. Спустя около
2% час. после того, как на корабле был обнаружен огонь, произошел
страшный взрыв, причем силой разброшенных железных частей было убито
на месте 510 чел. и около 1000 чел. получили различные ранения.
II. Гремучий студень (Gelatine explosive, blasting gelatine}
Упорные работы Нобеля по изысканию для нитроглице-
рина вместо недеятельного кизельгура другого деятельного осно-
вания, которое по возможности само являлось бы взрывчатым
веществом, счастливо завершились в 1875 г.Жидкое гремучее
масло добавкой незначительного количества пироксилина было
превращено в желатину, из которой нитроглицерин не вытеснялся
водой и которая по своей взрывчатой силе превосходила все
существовавшие до тех пор взрывчатые вещества. Этим исклю-
чительным открытием Нобеля, имевшим чрезвычайно важные
последствия, было открытие гремучего студня («взрывчатой же-
латины»),
1. Приготовление
7—10% растворимой нитроклетчатки (коллодионного хлопка)
растворяются в 90—93% нитроглицерина, образуя однородную
прозрачную и эластичную резиноподобную массу, которая совме-
щает в себе почти все свойства идеального взрывчатого веще-
------------------------------------------------------------
1 Англ. пат. 4179 от 2 декабря 1875 г.
II. Гремучий студень
329
ства. Так как коллодионный хлопок играет здесь роль активного'
компонента, то стремятся к максимальному содержанию1
в нем азота, насколько это возможно без нарушения надлежа-
щих растворимости, вязкости и способности желатинировать?
этот предел находится между 11,1 и 12,5% азота. Очень хороший'
коллодионный хлопок содержит 12—12,3% азота и растворим
в этом случае до 95%. Он должен содержать возможно меньше
нерастворимого пироксилина и ненитрованной клетчатки; пре-
восходная желатина была получена из образца коллодионного
хлопка, содержавшего примерно 11,64% азота и состоявшего из
99,1% растворимой нитроцеллюлозы, 0,6% нерастворимого пи-
роксилина и 0,3% нен|итрованной клетчатки. Небольшое содер-
жание воды, примерно до 1 %, не мешает процессу желатини-
зации.
Сушка коллодионного хлопка, доставляемого во влажном,
виде с содержанием 30—35% воды, производится большей
частью в отдельном здании, .окруженном, валами (рис. 88). Влаж-
ная нитроклетчатка раскладывается слоем толщиной в 4—5 см на
деревянных лотках с дном из натянутой ткани или из проволоч-
ной сетки мягкого металла (медь, бронза). Слабым током нагре-
того до 40° воздуха коллодионный хлопок высушивается в тече-
ние нескольких дней до содержания 0,5% влаги. При употребле-
нии проволочной сетки необходимо обеспечить отвод накапли-
вающихся на сетках электрических зарядов. Высушенный про-
дукт протирается через сито с отверстиями 3—4 мм и собирается
в подставленный ящик, а затем перекладывается в водонепрони-
цаемую цинковую или каучуковую тару.
Так как желатинирующая способность колло-
дионного хлопка не находится в точном соответствии ни с со-
ставом нитрующей смеси, ни с содержанием азота, т. е. бывает
различной в разных партиях коллодионного хлопка, то в практи-
ческой пригодности последнего всегда убеждаются пробой на
желатинизацию.
В толстостенный стеклянный стакан емкостью 200 см3 или, еще лучше,
в фарфоровую кастрюлю с ручкой отвешивают 125 г нитроглицерина и
добавляют к нему 5 г высушенного и просеянного через мелкое сито
коллодионного хлопка, который сейчас же с -помощью рогового шпателя
хорошо перемешивается с нитроглицерином. Наиболее безопасно и осно-
вательно удается высушить коллодионный хлопок до постоянного минималь-
ного содержания влаги, если поместить его в широкогорлую колбочку или
стаканчик для взвешивания и в течение одного или нескольких дней дер-
жать в маленьком эксикаторе над свежепрокаленной СаО. Стакан со смесью-
нитроглицерина и коллодионного хлопка помещается в 1—1% л теплой
воды с температурой 65—70° и при частом перемешивании, а в конце —
переминании шпателем медленно охлаждается до комнатной температуры.
При хорошо желатинирующем коллодионном хлопке (желатинирующая
способность I) уже в течение первых минут наступает загустевание и после
10 мин. — полное застывание содержимого стакана. При дальнейшем пере-
мешивании в течение 20 мин. при падении температуры градусов до 40
желатина хорошо отделяется от стенок сосуда, не приставая к ним. В тече-
ние следующих 10 мин. в температурных ппелелах 40—35° желатина стана-
330
Нитроглицериновые взрывчатые вещества
вится еще более вязкой и легко может быть отделена от стенок стакана
в виде комка. По истечении 40 мин. (при 30°) разбухшее содержимое дости-
гает такой вязкости, что размешиванием шпателем уже никак нельзя
добиться вытягивания нитеобразной массы, что после первых 20 мин.
частично было еще возможно. Коллодионный хлопок с худшей желатини-
рующей способностью, с квалификацией II—V, дает с нитроглицерином при
указанных условиях неполностью связанную, клейкую и даже мажущуюся
массу. Один и тот же завод иногда доставляет коллодионный хлопок
с 12,08% азота со средней желатинирующей способностью, а иногда —
превосходно связывающий продукт с большим содержанием азота (12,27%).
При приготовлении гремучего студня в лабора-
торном масштабе поступают точно так, как при получении
«жидкой желатины» в пробе на желатинизацию. Надо только
учесть, что прибавление приблизительно двойного количества
коллодионного хлопка ускоряет набухание, и переработка студня
из-за большой вязкости и жесткости желатины затрудняется.
Если вместо нитроглицерина применять трудно замерзающую
смесь его с нитрогликолем (4:1 или 3 : 1), то желати-
низация наступает уже при комнатной температуре спустя
15—30 мин.
Недостаточно набухающие сорта коллодионного хлопка, по-
лучавшиеся во время войны из-за недостатка хлопка нитрова-
нием древесной целлюлозы, могут быть улучшены в смысле же-
латинирующей способности, если предварительно растворить
в нитроглицерине 1—3% какого-либо тетраалкилированного про-
изводного мочевины, например централита. Эта добавка
служит одновременно и стабилизатором и флегма-
тизатором, в частности для военных пентринитов.
В заводской практике обычно производят раздельно пред-
варительную желатинизацию и последующую
переработку массы в мешателях.
В плоских снабженных рубашкой медных желатинаторах раз-
мером 1 X 1,5 да и высотою 30—40 еда 100 кг нитроглицерина пе-
ремешиваются деревянным веслом или вручную с соответствую-
щим количеством коллодионного-хлопка; затем в рубашку
пускают воду, нагретую до 65—70°, так что желатинирующая
масса принимает температуру около 50°. Равномерно распределив
массу по желатинизатору, дают ей минут 20—25 постоять при
этой температуре, а потом подготовленный таким образом гре-
мучий студень перекладывают в деревянные корыта и при по-
мощи месильных машин перемешивают в совершенно однород-
ную массу.
В метательной мастерской одного швейцарского динамитного завода
смешение производится в 12 медных прямоугольных корытах. Нитроглице-
рин доставляется в мастерскую либо в гуттаперчевых ведрах, либо в эбо-
нитовых кувшинах, заливается в корыта и в него всыпается высушенный,
не содержащий комков коллодионный хлопок (в соотношении 8 :92). После
получасового перемешивания вручную масса нагревается циркуляцией теплой
•(70°) во'ды и оставляется на дожелатинизацию до следующего утра. Чем
прозрачнее получающийся при этом продукт, тем основательнее прошла
.желатинизация и тем лучше будет его действие.
II. Гремучий студень
331
При применении все больше входящих в практику вертикальных
мешалок (рис. 151) можно н предварительную желатинизацию и окон-
чательное смешение производить в одном и том же сосуде.
Рис. 138. Метательная машина с электрическим приводом;
мотор из-за опасности искрения отделен от мешателя капи-
тальной стеной.
В заводской практике гремучий студень редко составляют из
расчета на полноту сгорания продуктов взрыва; иногда стараются
расходовать такое количество дорогостоящего коллодионного
Рис. 139. Патронирование желатиндинамита на одном из швед-
ских заводов взрывчатых веществ.
332
Нитроглицериновые взрывчатые вещества
хлопка, какое необходимо лишь для полного связывания нитро-
глицерина. Наивысшее содержание нитроклетчатки достигает
10% и то только при изготовлении экспортных динамитов для
жарких стран, где требования в отношении выпотевания (эксуда-
ции) иногда .бывают очень строгими.
Патронирование эластичного «гремучего студня» про-
исходит в представленных на рис. 139 колбасных машинах. Диа-
метр патрона колеблется от 18 до 25 л/и; наиболее употребителен
размер 22 мм.
2. Свойства
Нитроглицерин в гремучем студне прочно связан в гомоген-
ную плотную массу, из которой он не вытесняется ни водой, ни
под давлением. Желатина представляет собой мягкую эластичную
прозрачножелтую или несколько темнее окрашенную массу, ко-
торая режется и сгибается не изменяя формы; чистые свежена-
резанные куски желатины при соприкосновении довольно быстро
склеиваются друг с другом. Гремучий студень рассматривается
как коллоидальный раствор нитроцеллюлозы в нитро-
глицерине, как золь, в котором нитроклетчатка диспергирована
не только до мицелл, но по всей вероятности разрыхлена
проникающим (в молекулярно тонких слоях) нитроглицерином
до длинных пучкообразносвязанных цепей главных валентностей.
Взаимное проникание компонентов студня достигает вследствие
этого наивысшей степени коллоидального дробления и находится
близко к состоянию «раствора»; это делает понятным, почему
плотная взрывчатая желатина, по внешнему виду так силыно от-
личающаяся от нитроглицерина, мало уступает ему в смысле де-
тонационной способности.
В применении к системе нитроцеллюлоза-нитроглицерин
особенно плодотворной оказалась теория Ш т а у д и нг е р а1,
стоящего на точке зрения макромолекулярной структуры. При
таком подходе мы должны рассматривать гремучий» студень как
истинный раствор, с тем однако ограничением, что в противопо-
ложность сказанному на стр. 189 растворенные молекулы нитрата
целлюлозы обладают по длине размерами такой величины, что.
их можно было бы обнаружить под микроскопом.
По Штаудингеру самые большие молекулы целлюлозы при диа-
метре в 7,5 А (А = 0,0000001 мм) имеют длину в 4000 А (= 0,4 р). Благодаря
такой длине их можно было бы видеть под микроскопом, если бы они
не были столь чрезвычайно тонки. Естественно, что с размерами такого же
порядка мы имеем дело и в нитрованной целлюлозе, особенно в недеструк-
тированных высоковязких пироксилинах.
Нитевидные или палочкообразные молекулы, длина ко-
торых примерно в 500 раз превышает их толщину, включают в сферу своего
действия в растворе большой обт.ем, почему вязкость увеличивается про-
1 Die hochmolekularen Verbindungen, Берлин 1932 (540 стр., 113 рис.).
II. Гремучий студень
333
порционально квадрату длины молекул. Поэтому уже низкопроцентные
растворы таких молекул не образуют нормальных растворов, так как от-
дельные нити, несмотря на полное растворение, мешают друг другу и
взаимно переплетаются наподобие вьющихся водорослей, что в высокой
степени уменьшает их подвижность в растворителе, обычно являющуюся
основным признаком, отличающим раствор. Такие растворы называются
гелями. Для каждого вещества существует определенная вязкость рас-
твора— предельная вязкость, при которой наступает взаимное сцепление
молекул.
Таким образом гремучий студень, 'начиная от полужелатини-
рованного прозрачного масла и до мутной «взрывчатой жела-
тины», следует рассматривать как вязкий (behindert) раствор,
который уже в стадии растворения настолько загустевает, что
некоторая часть нитроцеллюлозы вообще не в состоянии до-
Рис. 140. Смесь нитро-
глицерина и нитрогли-
коля 50/50 (заморожен-
ная до кашицеобразного
состояния).
Рис. 141. Гремучий сту-
тень после 36 часов хра-
нения, замороженный.
Рис. 142. Гремучий сту-
день, совершенно све-
жий, еще теплый, через
2 часа после приготовле-
ния.
-30 г каждого из указанных взрывчатых веществ подвергнуто детонации
капСолем № 8 в железном тигле на 7-мм железной пластинке.
стигнуть молекулярного распределения в растворителе. Вот от-
чего необходима «дожелатинизация» при вылеживании массы;
вот отчего нитроглицерин при известных температурных усло-
виях и давлении выделяется из студня, и вот почему мы часто
встречаем столь произвольно колеблющиеся эмпирические со-
ставы гремучего студня: при обычном содержании 6—8% кол-
лодионного хлопка ни чисто коллоидальный, ни тем более одно-
родный химический раствор его в нитроглицерине невозможны.
Подобно самому нитроглицерину гремучий студень уже после
нескольких дней детонирует с низшей скоростью—в 2000—
3000 м/сек, а высшая скорость (в среднем 7600 м/сек) никогда
не достигает высшей скорости детонации нитроглицерина, пре-
вышающей 8000 м/сек. Таким образом нитроцеллюлоза, коллои-
дально распределенная в нитроглицерине в среднем в количестве
8%, уже препятствует распространению детонационной волны
с тою легкостью, с какой это происходит в самом нитроглице-
334
Нитроглицериновые взрывчатые вещества
рине; это проявляется как в свежеприготовленном пластиче-
ском, так ив замерзшем гремучем студне, что явствует из
рис. 140—143 и 101—102. В противоположность чистому нитро-
глицерину или его смеси с нитрогликолем, дающим на пластинке
многочисленные и правильные лучи, у гремучего студня вслед-
ствие вышеуказанной причины мы замечаем наклонность к «раз-
брызгиванию». При очень низких зимних температурах (до —50°)
капсюль № 8 уже вообще не дает полной детонации гремучего
студня, в то время как нитроглицерин еще полностью взрывает
при точке замерзания углекислоты.
Особо наглядно проявляет себя «фактор коллоидальной струк-
туры», если гремучий студень, смешанный с родственным ему,
Рис. 143. Гремучий студень
после двух недель хране-
ния, размятый.
Рис. 144. Пентринит 50/50,
приготовленный из того же
гремучего студня.
40 г каждого из указанных взрывчатых веществ подвергнуто
детонации в железном тигле, покрытом свинцовой пластин-
кой, на 8-лл стальной пластинке.
но химически однородным кристаллическим пентритом, взрывать
на твердой подставке.
Совершенно аналогичные результаты получились при сравни-
тельных взрывах рельсов, которые были проведены 29 сен-
тября 1932 г. к о м и с с и е й по взрывчатым веществам
на пороховом заводе в Севрине. Гремучий студень, взорванный
15 г запрессованной пикриновой кислоты, дал 8 кусков и одну
трещину, а пентринит 50/50—11 кусков и две сквозных трещины.
С физической и химической точки зрения гремучий студень
является более постоянным, чем гурдинамит. При продолжитель-
ном хранении под водой на его поверхности образуется только
молочная муть; вес и взрывчатая сила при этом не изменяются.
Точно так же замерзание нитроглицерина в студне проис-
ходит гораздо труднее, а оттаивание, наоборот, гораздо легче и
быстрее, чем в динамитах с инертным поглотителем, которые
после этого приобретают неприятный маслянистый характер,.
II. Гремучий студень
335
связанный с частичным выделением нитроглицерина. Гремучий
студень более постоянен и по отношению к повышенной темпе-
ратуре; его патроны могут храниться 48 час. при температуре
75° без каких-либо признаков разложения (образования NO-?).
Однако при более высокой температуре разложение обязательно
переходит во Взрыв: при медленном подъеме температуры —
при 200°, а при быстром нагреве — при 230—240°.
Будучи зажжен, гремучий студень сгорает бледным, слабо
шипящим пламенем, при растирании же в фарфоровой ступке
или от удара молотком гремучий студень детонирует с оглуши-
тельным тупым (нерезким) хлопком. По отношению к удару и
трению гремучий студень менее чувствителен, чем гурдинамит
(соответствующие высоты падения груза 12 и 7 см). Однако для
замерзших динамитов это соотношение становится обрат-
ным (15 см и 20 см для гур динамита). Но эти цифры отнюдь не
доказывают, что замерзшее взрывчатое вещество практически
менее опасно в обращении. В пластическом состоянии отдель-
ные частички могут легко скользить одна по отношению к дру-
гой, тогда как в застывшем состоянии они менее податливы и
таким образом более восприимчивы к местным механическим
воздействиям; в результате этого замерзшее взрывчатое веще-
ство, несмотря на меньшую чувствительность, взрывает легче.
При детонации гремучего студня наряду с азотом образуются
почти исключительно углекислота и вода (табл. 6); теоретиче-
ские количественные соотношения при применении девятиазот-
ной нитроцеллюлозы с 11,97% N определяются следующим
уравнением:
51С3Не (NO3)3 + C24H31N9O33= 177СО24- 143H2O + 81N2.
91,66’;0 Ь,34°о
Для более низконитрованной восьмиазотной нитроцеллю-
лозы с 11,12% N это соотношение составляет 92,65:7,35, а для
наиболее высокоазотного применяемого на практике коллодион-
ного хлопка с 12,3% N — 91,3:8,7.
Удельный вес гремучего студня, из которого удален воздух,
достигает 1,63; таким образом каждый килограмм гремучего
студня занимает объем, равный 0,614 л. ~ Согласно подсчету одна
весовая единица его дает (при соотношении 91,66:8,34) 711,4 л
газообразных продуктов, т. е. 1153-кратный объем. Вследствие
идеально подобранного состава, дающего сгорание бее остатка,
гремучий студень из всех других твердых технических взрывча-
тых веществ является наиболее мощным в смысле содержания
энергии взрывчатым веществом. Из всех нитроглицериновых
взрывчатых веществ гремучий студень передает детонацию наи-
худшим образом; вместе с тем он требует более сильных средств
инициирования, особенно при повышенном содержании нитро-
клетчатки и после долгого хранения, в частности в теплом кли-
мате. Наум описывает случай, когда гремучий студень, который
336
Нитроглицериновые взрывчатые вещества
после двух лет был возвращен из Африки за непригодностью,
так как не мог быть полностью сдетонировав даже капсюлем
№8, не передавал детонации от патрона к патрону и давал нео-
бычно низкие величины по расширению в бомбе Трауцля и об-
жатию свинцовых цилиндриков.
Это нежелательное падение бризантности1 нобе-
левского гремучего студня обнаруживается не только при от-
.Рис. 145. Стальная трубка 20X35 мм, длиною 1,5 м, один конец которой (пра-
вый) заварен; трубка помещена на кусок %-мм таврового железа длиной 1,4 м.
.крыто уложенных зарядах, но в такой же степени и при поме-
щении его в толстостенную, цельнотянутую стальную трубу2,
заваренную с одного конца (рис. 145). Эффект взрыва показан
на рис. 146 и 147.
Если в качестве детонатора вместо пентринита употреблять
пикриновую кислоту, набивая ее в трубу ручным спо-
Ж
Рис. 146. Гремучий студень, подвергнутый детонации d-см
промежуточным патроном нз пеитрииита (наверху). Размятый
гремучий студень (внизу). Цельнотянутые стальные трубы
15 X 30 мм, снаряженные взрывчатым веществом на длину
в 120 см с песчаной забойкой.
щобом, то получается лишь примерно половинная скорость дето-
нации, что грубо соответствует соотношению между скоростями
.детонаторов (8000 и 5000 м/сеж).
Таким образом включением в начале цепи или в любом ее
.месте половинных и целых патронов пентринита имеется воз-
1 Hochbrisanzstudien IV: Pentrinit gegen Dynamit, Z. f. Schiess- u. Sprw.
1931, 38—40.
2 Der Kampf um das Pentrinit, Chem.-Ztg. 1931, 653—655.
II. Гремучий студень
337
можность достигнуть в любых условиях полноты детонации как
удлиненных, так и круглых зарядов гремучего студня. По наблю-
дениям автора сильно высушенный гремучий студень (вы-
держивавшийся неделями и месяцами над хлористым кальцием)
детонирует с высшей скоростью гораздо легче и лучше; разу-
меется, такой способ подготовки студня не имеет никакого прак-
тического значения.
Рис. 147.580 г гремучего студня (после четырех месяцев хра-
нения), размятого перед заряжанием и подвергнутого детона-
ции в цельнотянутых стальных трубах 20 X 35 мм. Наверху
показаны результаты детонации с промежуточным S-см патро-
ном из пентринита, винзу — результаты детонации непосред-
ственно капсюлем № 8.
3. Применение
В граните и гнейсе гремучий студень при диаметрах шпуров
минимум 30 мм является непревзойденным взрывчатым вещест-
вом; особенно предпочитают гремучий студень для взрывов под
водой. Благодаря той концентрации энергии, которой обладает
гремучий студень, он употребляется в виде патронов довольно
большого диаметра для ускорения работ при проходке туннелей
в твердой породе, что имело например решающее значение при
постройке швейцарских альпийских туннелей.
Напротив, в мягких породах гремучий студень в виде
обыкновенных патронов диаметром меньше 25 мм действует плохо:
стенки шпуров образующимися газами взрыва разрушаются уже
До того, как последует главный удар от максимального объема
газов. Расширяющиеся газы взрыва встречают в расширенном
шпуре вредное пространство, последующая сила удара рассеи-
вается, и сила взрывчатого вещества, как говорят горняки, «па-
рализуется» мягкой породой. Это явление может быть объяснено
лишь сравнительно медленным и постепенным распространением
взрыва и во всяком случае является убедительным опроверже-
22 Зак. 3171. — Штетбахер.
338
Нитроглицериновые взрывчатые вещества
нием общепринятого взгляда, что гремучий студень всегда отли-
чается высокой скоростью детонации. Отмечаемая чрезвычайная
бризантность гремучего студня объясняется его колоссальной
энергией.
4. Труднозамерзающий гремучий студень
Эта разновидность студня более или менее совершенного со-
става, который раньше не удавалось подобрать, сейчас полу- ~
чается без особого труда желатинизацией смеси нитроглицерина
с нитро гликолем (см. табл. 26). Из прежних составов
более или менее трудно замерзающего студня надо упомянуть
так называемый специальный гремучий студень, который в свое
время в больших количествах и с успехом применялся при по-
стройке туннелей на железной дороге, проходящей через Юнг-
фрау. Специальный гремучий студень содержал незначительные
добавки ароматических нитросоединений, которые понижали
температуру замерзания до нескольких градусов ниже нуля и
одновременно примерно наполовину снижали чувствительность
к удару; расширение в бомбе Трауцля у этого студня получалось
лишь на 20 с/и3 меньше, чем у обыкновенного гремучего студня.
5. Военный гремучий студень
Гремучий студень не безопасен при выстреле и поэтому не-
удобен для применения для военных целей, хотя для сна-
ряжения бомб, предназначенных для разрушения зданий и ка-
менных стен, он являлся непревзойденным по своему действию
веществом. В Австрии раньше1 был в употреблении так назы-
ваемый военный гремучий с т у д е н ь, флегматизиро-
ванный приблизительно 4% камфоры, отчего взрывчатые свой-
ства студня не претерпевали существенного ослабления. В Италии
к 100 вес. ч. взрывчатой желатины прибавляли 5 ч. камфоры,
в то время как в России во время мировой войны для снаряже-
ния аэробомб пользовались составом из 90% нитроглицерина,
7% коллодионного хлопка и 3% камфоры. Но так как флегма-
тизированный военный гремучий студень со временем теряет свои
взрывчатые свойства еще сильнее, чем обыкновенный, то его
применение длилось недолго и не получило широкого распро-
странения.
Камфорированный гремучий студень становится полно-
ценным взрывчатым веществом только при введении «ускоряю-
щей» добавки пентрита и в таком виде «безопасного» при
выстреле военного желатинпентринита2, обладаю-
1 Герм. пат. 5528 (1878).
8 Stettbacher, Ein neuer Universalsprengstoff, Z. f. angew. Chemie 1930,
844—847.
III. Желатиндинамиты
339
щего постоянной бризантностью и восприимчивостью к детона-
ции, может служить первоначально намеченным целям.
Все динамиты, содержащие нитрогликоль, трудно замерзают;
в обычных, более дешевых составах вместо нитрогликоля про-
сто прибавляется соответствующее количество нитроглицерина.
Оба типа — обычный и трудно замерзающий — вырабатываются
во Франции, Италии и Швейцарии примерно в рав-
ных количествах. В Англии желатиндинамиты называются г е-
лигнитами (Gelignite), в Бельгии — форситами (Forcite).
В Германии согласно перечню применяемых в горном
деле взрывчатых веществ от 1929 г., кроме гремучего
студня, изготовляется еще «динамит 1» (65%), «динамит 3»
(40%) и «динамит 5» (20%), а также трудно замерзаю-
щие аммонжелатины 1 и 2 с 30 и 20% дийитрохлор-
гидрина, разрешаемые железными дорогами к' перевозке
багажом. Особо многочисленны сорта динамитов в США; там
различают 4 класса динамитов, а именно следующие торговые
марки Е straight, gelatin, ammonia gelatin и ammonia, из которых
каждый изготовляется в виде 20, 30, 40, 50, 60 и 80%-ного ди-
намита. Однако это деление является произвольным и вводит
в заблуждение, так как лишь класс straight-динамитов содержит
указанное для этого класса количество нитроглицерина, осталь-
ные же три представителя содержат меньше нитроглицерина;
содержание нитроглицерина в ammonia-динамитах составляет
всего лишь 1/з того количества, которое ему номинально соот-
ветствует. Американские динамиты отличаются от соответствую-
. щих им динамитов европейского континента тем, что они за-
частую содержат в виде добавки серу и большие количества
нейтрализующих веществ (сода, мел, углекислый магний),
а также тем, что они значительно слабее желатинированы. Не-
желатинированные «смешанные динамиты» типов ammonia и
straight в Европе уже давно оставлены.
III. Желатиндинамиты
Из всех современных нитроглицериновых взрывчатых ве-
ществ наиболее важный и чаще всего применяемый тип пред-
ставляют желатиндинамиты. Желатиндинамит подобно грему-
чему студню, частным типом которого он по существу является,
был открыт Нобелем, который в 1876 г., изучая про-
блему динамитов на деятельном основании,
нашел, что слабожелатинированный нитроглицерин, так назы-
ваемое желатинированное масло, в состоянии прочно удержи-
вать примешиваемые к нему азотнокислые соли и древесную
муку, не теряя при этом сколько-нибудь значительно в пластич-
* Подробное сопоставление см. в Rep. of. invest. 2975 (декабрь 1929 г.)
Bureau of Mines.
22=:
340 Нитроглицериновые взрывчатые вещества
ности и не выделяя из полученного состава нитроглицерин. Та-
ким образом возникли желатиндинамиты, класс взрыв-
чатых веществ, которые соединяют в себе высокую мощность,
удобство в обращении, возможность почти повсеместного при-
менения и, что не менее важно, дешевизну, т. е. все желатель-
ные преимущества гражданского взрывчатого вещества.
Эти «желатинозные» нитроглицериновые взрывчатые ве-
щества в настоящее время изготовляются трех основных
видов:
1) обыкновенный и трудно замерзающий желатиндинамит;
2) флегматизированный, безопасный в перевозке желатин-
динамит;
3) антигризутный желатиндинамит. .
Все три вида содержат 20—65% желатинированного масла и
80—35% порошкообразных веществ. Для отдельных сортов ди-
намитов соответственно подбираются необходимые добавки,
которые либо понижают температуру замерзания, либо умень-
шают чувствительность, либо являются пламегасителями.
1. Обыкновенный желатиндинамит и пентринит
Основным типом этого рода взрывчатых веществ можно счи-
тать долгое время применявшийся германский 65%-ный жела-
тиндинамит, состоявший из 65 %? желатинированного нитрогли-
церина и 35% порошкообразных веществ. Его нормальный
состав (с небольшими отклонениями) выражался в следующем:
Нитроглицерина или трудно замерзающей смеси его с нитрогликолем . . 62,5%
Коллодионного хлопка....................................2,5%
Натриевой селитры (калиевой селитры, перхлората калия).27,6%
Древесной муки (ржаной муки).........................8,0%
(0 — 0,4%, отмученного мела)
Этот состав по современной германской классификации со-
ответствует динамиту 1. Желатинированное масло
состоит из 96—98% нитроглицерина и 4—2% коллодионного
хлопка. Для экспортных сортов с целью повышения прочности
желатины берут больше коллодионного хлопка, а вместо гигро-
скопичных натриевой или аммиачной селитр применяется калий-
ная селитра. Наиболее деятельной из примесей является пер-
хлорат калия, который впрочем из-за его дороговизны при-
меняется очень мало, но при применении которого уже для
низкопроцентных динамитов можно достигнуть такой мощности,
которая соответствует высокопроцентным динамитам, приго-
товленным на селитре. Германская порошкообразная до-
бавка нормально содержит 77% натриевой селитры, 22,5%
древесной муки и 0,5% мела. Для экспорта в жаркие страны
берут 80% калиевой селитры, 19,5% древесной муки и 0,5%
мела. Прибавление углекислого кальция имеет целью нейтра-
III. Желатиндинамшпы
341
T АБЛИЦА 26 Сводка новых составов евро и ейских и американских торговых сортов динамитов Американские динамиты ’ ицеро И1чн-%001 о СП О) ° 1 1 Ыо- | | | | | СИ 0,8 — 0,1 5,0 о
ицвро ини-о/oog тГ О Ю J2 1 1 см" 1 1 1 1 2 1 1,7 10,1 0,7 4,0 6 940»
ЕЩОШШу ннн-%09 Ю СО 0- Й 1 1 1 1 1 1 12 = г CO г* O l-'coo t~* 4 690
ицврЗ -вшошшу и'мн-о/оое 29,9 0,4 43.0 o'ei тг ib^O О to c«d cToc tF 3 580
инн-и/оог ®*1 । । । । । 1§ CO тГ СИ Ю [ о uo 3590
.Безопасные" динамиты | НН1ЕК0Ж -HOWWB I |^TOCqS 1 IS!? Illi 1 Скорость детонации м/сек (в 3,2-с.и железной трубе)
1И1ГО1ЭВ1Г11 из i “о | 2 | О O' 1 1 1 1 1
1HEWEJ ‘1ИЕЧ1ГЭ1 О тГ 1 -о 1 2 1 I о Illi 1
| Желатиндина- ( МИТЫ 1 (•яэнвнйэз) ‘g 1ИИВНИ1Г Й 1 11 1 5 Mill 1
I аэицврэ ио ио 1ТО=о- М 1$ Mill 1
WWH-O/oee д ашшог) St М” 1 Iе1 1 Mill 1
рнн-^/огб Г эшшоо чнатГАхэ {jHhAwadj £2 Iю 1 1 1 1 1 1 1 1 1 1 1
Название веществ, входящих в состав динамита О Id ГЗ К • • • ’ • • 03 • «в • • • • • S »Й ' • •••° ‘ о Д ’ о ' . . . х §•«•.... s S . «г . . »> © ч § ® . 3 » р : -.ss; • -£-s£| - £l -£s г; ч О S д £2 л? ё* ° ‘ S У rt ООНООд-HSSgci. • Un 2 Н Ч н н д о t {х«а — *2 о <-> SSXOCXESca/’SSSO^UE-'O Г X X<LQ Ul >> CQ О
ca co
342
Нитроглицериновые взрывчатые вещества
лизацию возможных следов образующейся кислоты; сода дей-
ствует омыляющим образом и поэтому непригодна для этой
цели.
Селитра подготовляется в отдельной мастерской рядом
последовательных операций: измельчения, сушки, размола и
просеивания; перхлорат калия большей частью доста-
вляется на завод уже*-в готовом виде — именно в виде тонкой
кристаллической муки. Древесная мука также обычно
покупается в готовом виде, но с целью придания ей необходи-
мой однородности и тонкости пропускается через сито с отвер-
стиями в 1—2 мм. Слишком сильное измельчение понижает
способность древесной муки впитывать масло. Часто поль-
зуются воздушно-сухой древесной мукой с влажностью 8—10%;
Рис. 148. 65%-ный
желатиндинамит
(свежепригото-
• вленный).
Рис. 150. Альдор-
-, фит.
Рис. 149. Шеддит.
Максимальное действие от взрыва 30 г каждого из указанных
взрывчатых веществ на железной пластинке толщиною 4, 8 мм.
но, как правило, она должна предварительно высушиваться
в нагреваемых паром корытообразных сушилках, после чего
следует просеивание в специальном герметизированном поме-
щении, в котором производится также и насыпание муки в тару.
Вместо древесной муки применяют также и ржаную муку,
которую сушат при температуре от 100 до 120е и слегка обжи-
гают. Растительная мука хотя и однороднее и мельче древесной
муки, но дороже ее и обладает меньшей способностью впитывать
масло.
Подготовленные таким образом компоненты хорошо смеши-
ваются в барабане (с бакаутовыми шарами) и в виде готового
для добавки к желатинированному нитроглицерину порошка
(Zumischpulver) сохраняются в полотняных мешках или, лучше,
в оцинкованных жестяных барабанах, поскольку, как это
обыкновенно и бывает, порошок не сразу идет на дальнейшую
переработку.
ИI. Желатиндинамиты
343
Мастерская для приготовления порошкооб-
разной добавки на больших динамитных заводах (рис. 137)
имеет такие установки:
1. Установка для измельчения, сушки, размола и просеи-
вания натриевой или калийной селитр производительностью
500 кг в час, состоящая из:
1 загрузочного ковша и вальцовой дробилки для раздробления
комков селитры,
1 железного ковшевого транспортера, плотно закрытого,
чтобы пыль не попадала в помещения,
1 аппарата для сушки селитры непрерывного действия с кало-
риферным обогревом, вентилятором, пылеуловителем и другими принад-
лежностями,
1 грохота для селитры с ситами и транспортирующим венти-
лятором,
1 шнека для распределения селитры по мешкам, с во-
ронкой, мотора и трансмиссии для вышеуказанных машин.
2. а) Установка для переработки древесной муки про-
изводительностью 100 кг в час, состоящая из:
1 мельничного постава с жерновами и трясучкой для подачи,
1 транспортера с воронкой, передвижным ложем и соединитель-
ным ^трубопроводом,
1 машины для просеивания, с воронкой,
1 установки для п ы л е о с а ж дени я с эксгаустером и пыле-
собирателем,
мотора и трансмиссии для соответствующих машин.
Сюда же относится
б) установка для сушки и просеивания древесной
муки производительностью 125 кг в час, состоящая из:
1 железного герметически закрытого транспортера,
1 корытообразной сушилки, обогреваемой паром без давления,
1 машины для просеивания с пыленепроницаемым^ кожухом и
цилиндрическим ситом,
трансмиссии и мотора в 5 л. с.
3. Установка для сушки и измельчения других добавок:
1 подогреваемый паром до 4 ат тарелочный сушильный аппа-
рате железным бортом чаши, снабженный теркой и скребком, коническим
дробильным вальцом с паровой рубашкой; он служит для сушки перхло-
рата калия, охры, растительной муки и тому подобных материалов,
2 шаровые мельницы с железным барабаном, с набором шаров
для размола угля, красок, нитросоединений,
1 мельница «Эксцельсиор» для размола остающихся на ситах
комков,
трансмиссия и мотор для этих 4 машин.
4. Установка для мешки и сушильные шкафы:
3 специальных смесительных мельницы для приготовле-
ния смеси всех добавок; емкость одного аппарата 600 л; аппарат состоит
из железного барабана с набором шаров; снабжен внутренним змеевиком
для обогрева паром, ситом с трясучкой и другими принадлежностями.
1 установка сушильных шкафов, состоящая из 16 шкафов
с предохранительными дверцами, пластинчатыми медными калориферами
для обогрева и электрическим вентилятором,
мотор и необходимая трансмиссия.
Если на установке одновременно изготовляются антигризутные
динамиты, то для этого необходима дополнительно:
5. Одна установка для измельчения, сушки, размола и про-
сеивания поваренной соли или других подобных пламегася-
щих солей; эта установка аналогична той, которая описана выше для
переработки селитры.
344
Нитроглицериновые взрывчатые вещества
Для изготовления желатиндинамита приго-
товляют сначала в корытах для желатинизации «жидкую» 3—
4%-ную взрывчатую желатину и потом переносят ее в мета-
тельную мастерскую, где она тщательно перемешивается в ме-
тателях (рис. 138) с порошкообразными добавками. Один ме-
татель перерабатывает загрузку, равную 100 кг желатиндина-
мита, в течение 25—30 мин. Продолжительность смешения
зависит главным образом от вязкости желатинированного масла.
Работа на метателях не является безопасной и требует тем
большей осторожности, чем более вязкой является желатина и
чем большее количество порошкообразных добавок в нее вво-
г
Рис. 151. Мешатель планетарной системы (перед
началом работы; мешалка поднята).
дится. Поэтому низкопроцентные 30—40%-ные динамиты пере-
рабатывать труднее и опаснее, и несчастные случаи от взрыва
при этой работе отнюдь не являются редкостью.
20 февраля 1914 г. в мешательной мастерской на заводе Nobel Explo-
sives Со в Ардире взрывом 1880 кг взрывчатой желатины и гелигнита было
убито 8 чел. Несчастный случай произошел в деревянном здании, в кото-
ром было установлено 8 мешателей. Взрыв произошел вероятно во время
загрузки мешателя из-за недозволенного приема, допущенного рабочим.
III. Желатиндинамиты
345
В то время как раньше почти на всех динамитных заводах
во всех странах применялись мешатели с двумя вращающимися
в разные стороны горизонтальными (или вертикальными, как
в Англии) установленными на отдельных валах лопастными ме-
«щалками, в настоящее время повсюду переходят к применению
мешалок планетарной системы, в которой две ме-
шалки, связанные с одним вертикальным валом, вращаются
вокруг общей оси и кроме того каждая вокруг собственной оси
в противоположных направлениях. Благодаря такому устройству
повышаются надежность, экономичность и чистота процесса
смешения.
Мешалки планетарного типа идеально подходят не только'
для производства динамитов, но и для смешения взрывчатых
веществ с незначительным содержанием нитроглицерина и даже
для приготовления порошкообразных взрывчатых веществ. Про-
изведенные в последние годы усовершенствования мешателей
делают этот тип машин одной из наиболее законченных кон-
струкций современной технологии взрывчатых веществ. Аппараты
изготовляются трех размеров емкостью 200, 300 и 400 л, что
соответствует загрузкам 150, 200 и 300 кг взрывчатого вещества./
Наиболее важными преимуществами этой системы мешате-
лей являются:
1. Большая безопасность в смысле взрыва, так как валы мешалки и их
подшипники расположены вне самого аппарата, в котором происходит
смешение, и таким образом ни жидкий нитроглицерин, ни готовое взрыв-
чатое вещество не могут притти в непосредственное соприкосновение с тру-
щимися поверхностями. Невозможно также «выпирание» загрузки из меша-
теля (как это получалось в старых мешателях вдоль лопастей мешалки).
2. Почти удвоенная мощность мешатели. Один аппарат с емкостью
корыта 400 л может при загрузке 300 кг за 8 рабочих часов переработать.
5000 кг динамита, так как длительность смешения — максимум 10 мин., в то
время каково всех старых системах мешателей смешение длилось от 15
до 30 мин.
3. Непосредственная желатинизация нитроглицерина в обогреваемых
или охлаждаемых мешателях, так как эти последние, имея роликовый ход
на шарикоподшипниках, легко передвигаются в желатинизационную мастер-
скую и пододвигаются под мешалку, либо выдвигаются из-под нее.
Основное преимущество этих машин состоит таким образом в том, что
отпадают предварительное смешение желатины в желатинаторах и пере-
грузка полуготовой массы в мешатели. Вместе с тем уменьшается и стои-
мость самой установки, так как можно отказаться от второго здания для:
желатинизации, требующего обвалования.
Патронирование. Дальнейшая переработка пригото-
вленного в мешателях желатиндинамита происходит в упомя-
нутых уже раньше патронировочных машинках; ясное предста-
вление об одной из новейших конструкций этих машин (с эле-
ктрическим приводом) дает рис. 152.
Машинка имеет чаще всего два или три рожка, так что
пресс одновременно выжимает несколько колбасок, что осо-
бенно целесообразно при патронах малых диаметров. В Аме-
рике при массовой фабрикации динамитов выходящая из ма-
346
Нитроглицериновые взрывчатые вещества
шинки колбаска попадает на ленточный транспортер и через
люк подается в соседнее помещение, где автоматически разре-
зается на куски желаемой длины и непосредственно заверты-
вается в бумагу. Предпочитаемая на больших заводах машинка1
Галля (Hallmaschine) упаковывает таким образом в бумажные
гильзы с почти автоматической последовательностью по 30 ди-
намитных патронов и перерабатывает за 8 час. около 20 000 кг
желатины.
Свойства. При обыкновенной температуре желатиндина-
миты представляют собою мягкую пластическую массу, которая
Рис. 15'2. Патронировочиая машинка для динамитов с автоматическим
выключателем.
при высоком содержании нитроглицерина очень похожа на
эластичный гремучий студень. Плотность ее при наличии се-
литры достигает 1,5—1,6 и около 1,8 при наличии перхлората
калия. Вследствие обволакивания всех добавок нитроглицери-
новой желатиной стойкость динамита к влажности довольно
велика. Желатиндинамит все же имеет наклонность к впитыва-
нию влаги, возрастающую с увеличением содержания аммиачной
и натриевой селитры, так что для динамитов, предназначенных
к экспорту в тропические страны, применяют исключительно
негигроскопические соли: калиевую селитру и перхлорат калия.
Желатиндинамит замерзает скорее, чем гремучий студень, и пре-
Е. М. S у in m е s, The Expl. Eng., 1928, 373.
III. Желатиндинамиты
347
вращается в твердую, трудно детонирующую массу, которая
оттаивает только при температуре выше 13°. Чувствительность
к удару примерно такая же, как и у гурдинамитов и гремучего
студня, но вследствие содержания древесного порошка, особенно
при плотной желатине, большей частью бывает несколько ниже.
Соответственно этому высота падения 2-кг груза колеблется
в пределах от 15 до 25 см.
Свежеприготовленный желатиндинамит легко детонирует и
притом с такой силой, которая значительно выше, чем у других
порошкообразных аммиачноселитренных или хлоратных взрывча-
тых веществ (рис. 148). Способность к передаче детонации
у желатиндинамита более чем вдвое выше, нежели у гремучего
студня. Так например патрон 65%-ного динамита диаметром
25 мм передает детонацию такому же патрону, находящемуся
на расстоянии 10—12 см; расстояние, на которое динамит пере-
дает детонацию, часто служит критерием качества смешения
компонентов и хода производства.
Высокая чувствительность к детонации, ко-
торой обладает этот класс взрывчатых веществ при диа-
метрах патронов более 16 мм, объясняется наличием
пронизывающих желатину порошкообразных добавок; это осо-
бенно относится к рыхлой, содержащей в себе воздух древесной
муке. Несмотря на это, желатиндинамит обнаруживает уже
спустя несколько дней после изготовления (а через 1—2 недели,
как правило) некоторое падение чувствительности, которая,
точно так же как и у гремучего студня, ведет к неизбежному
уменьшению бризантности, что является 'неприятным
недостатком всех желатинированных нобелевских динами-
тов х. Этот недостаток устраняется, если к желатине прибавить
в виде ^ускорителя детонации1 2 необходимое коли-
чество пентрита; в этом случае получается желатинпен-
т р и н и т, всегда детонирующий с постоянной максимальной
скоростью (табл. 27). Близкие к пентриту, более богатые энер-
гией маннитгексанитрат и циклотриметилентринитрамин вслед-
ствие их несколько меньшей скорости детонации оказывают
в этом смысле меньшее действие; и, естественно, еще меньше
влияют многие другие взрывчатые вещества, предложенные по
простой аналогии, как например пикрат калия. Интересно отме-
тить, что расширение в бомбе Трауцля как обыкновенных ди-
намитов, так и пентринитдинамитов почти не зависит от ско-
рости детонации и что достаточно уже незначительной добавки
1 Herlin, Z. f. Schiess- u. Sprw., 1914, 401; Selle, там же, 1929, 469—474;
Stettbacher, Hochbrisanzstudien, там же, 1931, 8.
2 Stettbacher, герм. пат. заявка 45495, опубликованная
27 октября 1932 г., а также добавление к герм. пат. 500272, опубли-
кованному 29 декабря 1932 г., далее, герм. пат. заявка 48781 от 30 де
кабря 1931 г.
348
Нитроглицериновые взрывчатые вещества
окислителя (соли), чтобы большое расширение, которое дает
гремучий студень, резко уменьшилось до сравнительно низких
величин, характерных для желатиндинамита или желатинпен-
тринита.
2. «Безопасные» динамиты
Современными «безопасными» динамитами служат более или
менее трудно замерзающие желатиндинамиты, содержа-
щие в качестве флегматизирующих добавок или ароматиче-
ские нитросоединения (нитрожелатиндинамиты), или
динитрохлоргидрин (аммонжелатины). Эти «безопас-
ные» смешанные динамиты менее мощны, чем обыкновенные, но
Рис. 153. Железнодорожный рельс длиной 85cjk, подорванный
в двух местах равными по весу зарядами различных взрывча-
тых веществ; вес заряда 80 г; патрон взрывчатого вещества
в бумажной гильзе диаметром 27 мм помещался свободно над
головкой рельса.
Гремучий студень
после 14-дневиого
хранения.
Желатинпентринит
41% пентрита.
41% нитроглицерина.
1,5% коллодионного хлопка.
16,5% аммиачной селитры.
Взрыв произведен капсюлем № 8.
зато значительно менее чувствительны к удару и разрешены
к перевозке багажом по железным дорогам.
Обнаруженная уже в самом начале непригодность к употреблению
замерзших нитроглицериновых взрывчатых веществ быстро привела к тому,
что температуру замерзания нитроглицерина соответствующими прибавками
стали понижать настолько, чтобы приготовленные из него динамиты не
замерзали при обычных зимних температурах. Уже в 1866 г. РуДберг
предложил добавлять нитробензол, между тем как Нобель в 1875 г.
стремился достигнуть той же цели при помощи метил- или этилнитрата и
ацетина. Позднее стали применять ароматические нитросоединения, в част-
ности ортонитротолуол, жидкое вещество, при прибавления кото-
рого температура замерзания нитроглицерина сильно снижается, а жела-
тинирующая способность не претерпевает никакого изменения.
В настоящее время флегматизирующими сред-
ствами служат ароматические нитросоединения, которые
с нитроглицерином как в чистом, так и в желатинированном со-
стоянии образуют эвтектические смеси с низкой темпе-
ратурой замерзания и незначительной склонностью к кристалли-
III. Желатиндинамиты
349
зации. В 1905 г. швед Н а у к г о ф первый указал на это об-
стоятельство, а в 1913 г. его соотечественник Г е р л и н система-
тически изучал зависимость температур замерзания таких смесей
нитроглицерина с нитросоединениями от соотношения компонен-
тов. Понятно, что, применяя жидкие мононитроуглеводороды, на-
пример c-нитротолуол, можно достигнуть гораздо большей флег-
матизации и большего снижения температуры замерзания, чем
«ели применять более высоконитрованные и более трудно рас-
творимые соединения, как например динитротолуол; зато в пер-
вом случае одновременно понижается бризантность нитроглице-
рина, и кислородный баланс получается менее благоприятным.
Поэтому, если трудная замерзаемость желательна как основное
свойство, то с целью возможного сохранения у нитрожелатин-
динамитов той же мощности, что и у обыкновенных динамитов,
обычно добавляют еще нитрогликоль.
Из нитросоединений преимущественно применяют полутвер-
дый динитротолуол (смесь изомеров); кроме того как во
время войны, так и теперь в больших количествах применяют
дешевые буро-черные отходы от кристаллизации тринитрото-
луола в виде так называемого тротилового масла. Смешивая
жидкие или расплавленные нитросоединения с желатинирован-
ным маслом, получают пластические, трудно замер-
зающие и менее чувствительные к удару желатины \ в кото-
рых даже твердые, плавящиеся при 50—60° смеси динитро- или
тринитросоединений находятся в растворенном состоянии в виде
мягкой пастообразной массы; замечательно при этом, что даже
при низких температурах эти нитросоединения не замерзают.
В полученную массу можно потом замесить необходимые окис-
лители (соли) и другие порошкообразные добавки; патронирова-
ние и предварительная обработка происходят совершенно так
же, как уже было описано выше.
2 января 1927 г. на шведском динамитном заводе в Гренгесберге, веро-
ятно вследствие перегрева, произошел взрыв 1500 кг такой флегматизи-
рованной нитросоединениями взрывчатой желатины, причем под обломками
осталось 2700 кг невзорвавшейся взрывчатой желатины. Эта масса в те-
чение недели опрыскивалась большим количеством метилового спирта (на
нее было вылито не меньше 25 000 кг метилового спирта, что обошлось
страховому обществу все же дешевле, чем второй взрыв), и затем большая
часть взрывчатой желатины была уничтожена сжиганием.
Употребительные в настоящее время нитрожелатиндинамиты
содержат от 14 до 28% желатинированного нитроглицерина и
12—14% ароматических, чаще всего динитросоединений. В Швей-
царии для проходки альпийских туннелей специально изготовля-
лись два таких успешно применявшихся нитродинамита: ж е л а-
тинтельзит (Ислетен) и гамзит (Гамзен у Брига), со-
ставы которых, принятые в настоящее время, даны в табл. 26.
1 Ам. пат. 1667038 (1926).
350
Нитроглицериновые взрывчатые вещества
Ill. Желатиндинамиты
351
ТАБЛИЦА 27
Взрывчатые свойства важнейших динамитов (по данным Наума и собственным определениям автора)
В отношении внешних свойств, особенно в отношении пла-
стичности и детонационной способности, эти смеси обладают
всеми преимуществами желатиндинамитов, но так же, как и по-
следние, при хранении уменьшают свою бризантность.
Взрывчатые вещества, содержащие динит-
рохлоргидрин. Эти взрывчатые вещества в новых герман-
ских официальных списках значатся как амм он желатин 1
и 2; они изготовляются только в Германии и принадлежат
Рис. 154. Метательная мастерская для желатиндинамитов на заводе
Ardeer Nobels Explosives Со Ltd, в Стевенстоне (Шотландия); мастерская
оборудована метателями системы Me Roberts.
к типу наименее чувствительных и одновременно трудно замер-
зающих «безопасных» динамитов. Главной составной частью их
является нитрохлорин, представляющий собою смесь
динитрохлоргидрина с 15—20% нитроглицерина, — технический
продукт, непосредственно получаемый при нитровании пригото-
вляемого из глицерина хлоргидрина. Пластические свойства их
повышаются добавкой 6—12% динитропроизводных толуола
или нафталина; здесь эта добавка служит больше для связыва-
ния «тощей» хлоринжелатины, чем для флегматизации.
ГЛАВА ДЕСЯТАЯ
АНТИГРИЗУТНЫЕ ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
С внедрением взрывных работ в каменноугольную промыш-
ленность участились несчастные случаи в угольных шахтах.
Пользуются ли для подрыва угольных пластов дымным порохом
или динамитом или каким-либо бризантным составом, — во всех
случаях можно не сомневаться в том, что воспламенение
рудничного таза объясняется применением взрывчатого
вещества, или, точнее, взрывом.
Лет 50 назад стали, насколько это было возможно, ближе
изучать этот вопрос и, особо подбирая и изменяя взрывчатые
вещества, стремились устранить или по крайней мере уменьшить
опасность воспламенения рудничного газа. Эти старания, увен-
чавшиеся успехом, дали антигризутные взрывчатые вещества,
т. е. вещества, безопасные в отношении рудничного газа или,
как их называют в некоторых странах, «безопасные» взрывча-
тые вещества.
I. Взрывы рудничного газа
Взрывы в угольных шахтах происходят либо от руднич-
ного газа, либо от угольной пыли. Взрывы могут
иметь место одновременно и от обеих причин. Чаще все же
происходят взрывы первого рода, которые вследствие быстрого
и хорошего распространения рудничного газа ведут к наиболее
разрушительным катастрофам. Рудничный газ состоит из почти
чистого м'е тана CHi; он скапливается между пластами пори-
стого угля, местами в больших количествах и под большим
давлением, так что при разработке этих пластов он вырывается,
смешивается с воздухом шахты и образует взрывчатую, так
называемую гремучую смесь, для которой достаточно ничтож-
ного пламени или искры, чтобы она взорвалась с разрушитель-
ной силой.
Воспламеняемость смеси рудничного газа с воздухом ограничена опре-
деленными пределами. Взрыв происходит легче всего при содержании ме-
тана в количестве 7,5% и сильнее всего при содержании 9,5%, в то время
как при количествах метана ниже 6% и выше 14% опасность воспламенения
исчезает. Для американского натурального газа, состоящего из 88%
метана, 10,8% этана и 1,2% азота, эти пределы еще уже, и гремучей смесью
в США «официально» считается состав, содержащий 8+0,3% метана.
I. Взрывы рудничного газа
353
Важнее конечно установить нижний предел воспламеняе-
мости, потому что воздух чаще всего имеется в избытке и по-
тому что пересыщенные метаном смеси всегда могут разбав-
ляться воздухом до пределов воспламеняемости. По Эйтнеру
пределы воспламеняемости смесей различных газов с воздухом
колеблются в следующих пределах:
Объемные про-
центы
Температура
воспламенения
Водород...........................
Светильный газ....................
Водяной газ.......................
Бензол ...........................
Бензин ...........................
Эфир..............................
Спирт 96%-ный.....................
Окись углерода •............. . .
Ацетилен..........................
Этилен ...........................
Метан.............................
9,5—66,3
8,0—19,0
12,5—66,6
2,7— 6,3
2,4— 4,9
2,7— 7,7
4,0—13,7
16,6—74,8
3,5—52,2
4,2—14,5
•6,2—12,7
585°
651°
429°
543°
640—750°
Взрыв бывает сильнее всего в том случае, когда содержание
кислорода в воздухе в точности соответствует количеству, не-
обходимому для полного окисления горючего газа. Цифры при
этом также и здесь весьма пестры: так например светильный
газ дает с воздухом наилучшим образом воспламеняющуюся
смесь при содержании его в воздухе в количестве 16 объем-
ных процентов, петролейный эфир — уже при содержании в ко-
личестве 2 объемных процентов. С научной точки зрения заслу-
живает внимания то обстоятельство, что целый ряд газов
в чистом и совершенно сухом состоянии вообще не взрывает,
и лишь присутствие каталитически действующих примесей,
прежде всего водяных паров, обусловливает возможность вос-
пламенения взрывчатых смесей. Например было установлено,
что для воспламенения 24 000 молей окиси углерода необходимо
прибавить по крайней мере 1 моль воды.
Впоследствии Диксон установил поразительный факт, что
прибавка 0,001 иода или брома вполне достаточна для того,'
чтобы смесь рудничного газа с воздухом сделать менее чувстви-
тельной к воспламенению, т. е. значительно поднять темпера-
туру воспламенения смеси. Основываясь на этом, П е й м е н 1
говорит уже о возможности устранять воспламеняемость руд-
ничного газа наиболее простым образом — введением этих за-
медлителей в шпуры забоя или непосредственно в само
взрывчатое вещество.
1 Trans, of. Inst, of Mining Eng., Лондон 1930, 11—23.
23 Зак. 3171. — ПГтетВахер.
354
Антигризутные взрывчатые вещества
В отношении воспламеняемости смесям взрывчатых газов
совершенно аналогичны тонкоизмельченные горючие твердые
тела, примешанные в виде пыли во взвешенном состоянии (аэро-
золи). Взрывы смесей воздуха с серной, сахарной и мучной
пылью нередко встречаются в практике; также нередко происхо-
дят на мельницах и взрывы металлической пыли, особенно брон-
зовой и алюминиевой. Так например общая сумма убытков,
причиненных взрывами пыли1 * в США в 1924 ir., составляла
свыше 3 млн. долларов. Соотношения между количествами го-
рючей пыли и воздуха, приводящие к взрыву, также бывают
весьма различны. Так например смеси, содержащие в 1 м3 воз-
духа 72 г сахара или 330 г алюминия — взрывчаты. Но наиболее
чувствительной является угольная пыль, 10 г которой в 1
воздуха уже вполне достаточно для образования взрывчатой
смеси, а наиболее сильный взрыв происходит при содержании
300—400 г угольной пыли на 1 м3 воздуха.
Взрывы угольной пыли стали изучать только в по-
следнее время; до этого о них ничего не знали и даже не пред-
ставляли себе, что они возможны. Было сделано казавшееся
весьма странным наблюдение, что сама по себе угольная пыль
менее опасна, чем в том случае, если она содержит адсорбиро-
ванные газы, делающие ее особо чувствительной. Определялась
также зависимость изменения чувствительности от величины
частиц и содержания влаги. Оказалось, что пыль с содержанием
газа 22—35% обладает наибольшей воспламеняемостью, в то
время как при меньшем или большем содержании газа пыль
менее опасна в этом отношении. В зависимости от совокупности
тех или иных свойств пыли температура воспламенения ее
может колебаться в пределах от 400 до 1400°. Взрыв угольной
пыли в настоящее время объясняют таким образом, что облако
пыли, образующееся при взрыве рудничного газа или просто при
взрыве закладываемого заряда, отдает благодаря высокой тем-
пературе адсорбированные газы; мгновенно образующаяся при
этом газовая смесь взрывает от пламени взрыва или искры от
выхлопа заряда. Вследствие того что угольной пыли в копях
очень, много и ее очень трудно избежать, она является наиболее
опасным источником взрывов; поэтому пыль, так же как и ско-
пление газов, следует удалять при помощи соответствующих
вентиляционных устройств. Поразительно, что смеси угольной
пыли с воздухом при смешении с незначительными количествами
рудничного газа, не способными воспламениться, становятся
более восприимчивыми к воспламенению. Опыты Бейлинга
показывают, что даже взрывчатые вещества, безопасные в атмо-
сфере рудничного газа, при взрывах в узких шпурах могут вос-
пламенить угольную пыль, в результате чего может последовать
1 О взрывах пыли ср. Langhans, Z. f. Schiess. u. Sprw., 1930, оттиск,
стр. 61—67.
I. Взрывы рудничного газа
355
взрыв рудничного газа, который в свою очередь снова приведет
к взрыву угольной пыли. В опытном штреке длиною 200 м,
в Дерне \ было найдено, что достаточно 70 г угольной пыли
в 1 м3 воздуха для того, чтобы взрыв распространился дальше,
если только сила начального взрыва была достаточна.
На какое протяжение могут распространяться такие взрывы
двойного действия, т. е. взрыв скоплений рудничного газа в ре-
зультате взрыва отделенной известным пространством угольной
пыли, показывает ужасный взрыв в угольных копях Курьер,
где 10 марта 1906 г. в 7 час. утра произошла одна из наиболее
опустошительных катастроф, какие знает история горного дела.
Взрыв распространился на 5 шахт, которые были соединены
между собой под землей. Воспламенение сухой угольной пыли
произошло от взрыва взрывчатых веществ, и вследствие авто-
матически происходящих завихрений пыли пламя распространи-
лось из шахты в шахту и вызвало такой взрыв угольной
пыли, какого до тех пор еще не бывало. Из 1400 горнорабо-
чих 1219 лишились жизни; кроме того было убито 97 лошадей.
Со времени этого несчастья и до конца 1930 г. хроника насчи-
тывает еще десять больших взрывов рудничного газа и уголь-
ной пыли с общим количеством 1856 человеческих жертв; прус-
ская горная статистика отметила за период 1900—1918 гг. всего
607 взрывов, в том числе 146 в результате взрывных работ. По-
следний большой взрыв двойного действия произошел 21 октя-
бря 1930 г. в германской каменноугольной шахте «Анна П»;
количество пострадавших составило 575 чел., из коих 271-
умерли.
Условия воспламеняемости рудничного газа при взрывных
работах впервые начали изучать во Франции в начале 80-х годов
прошлого столетия, после того как учрежденная в 1877 г. «анти-
гризутная комиссия» (Commission du grisou) пришла к выводам,
что причиной воспламеняемости является высокая температура
газов взрыва и пламя, образующееся при взрыве. М а л л я р и
Л е-Ш ателье нашли, что температура воспламенения грему-
чего газа находится около 650°; при этой температуре взрыв,
хотя и не мгновенно, но безотказно происходит через 10 сек.
При повышении температуры этот интервал уменьшается все
больше и больше, пока наконец при 1000° он становится почти
неуловимым. (Эти данные, естественно, относятся только к усло-
виям атмосферного давления: сжатые газы имеют более низкую
температуру воспламенения, чем разреженные.) Французская
комиссия установила тогда на основе практических опытов, что
в шахты, опасные в смысле газа, могут быть допущены только
такие взрывчатые вещества, вычисленная температура взрыва
которых не превышает 2200°; впоследствии (в 1888 г.) однако
были зафиксированы температуры: 1500° для угольных
1 Z. f. Schiess- u. Sprw., 1917, 59.
23-
356
Антигризутные взрывчатые вещества
пластов и 1900° для пластов пустой породы, рас-
положенных в угольных пластах в виде более или менее толстых
слоев. Комиссия исходила из того, что газы взрыва по про-
изведении ими разрушительной работы охлаждаются ниже тем-
пературы воспламенения гремучего газа (650°). Кроме того
к взрывчатым веществам было предъявлено требование, чтобы
они не давали в продуктах взрыва горючих газов или других
остатков.
II. Фотографирование пламени
О зависимости между пламенем взрыва и безопасностью при-
менения взрывчатого вещества в рудниках главное было уже
сказано в общей части. Ниже мы приводим еще некоторые «по-
движные» снимки1 пламени, могущие служить для характери-
стики необычайно различной степени безопасности взрывчатых
веществ. Некоторые данные о характере пламени важнейших
германских взрывчатых веществ даются в следующей сводке2:
Продолжи- тельность пламени в тысячных сек. Длина пламени (см) Темпера- тура взрыва t Удельное давление (ат)
Веттердетонит В . . . . . 0,44 38 , 1540° 5300
А 0,54 41 , 1540° 5800
Веттернобелит В 1,11 65 1820° 4000
» А 1.17 70 1930° 4600
Аммонит 1 1,49 85 2150° 8300
Аммонжелатнн 1 3,70 116 2530° 8200
Хлоратит.3 4,80 122 3480° 4700
Динамит 1 5,30 154 2950° 7400
Аммонит 5 8,80 200 2490° 8700
Между продолжительностью пламени и температурой взрыва,
как видно из таблицы, строгой пропорциональности не наблю-
дается. Вопреки теоретическим предпосылкам и всяким прави-
лам данные опытного штрека в Дерне также показывают, что
веттернобелит, несмотря на то что продолжительность пламени
у него в 2 раза больше, чем у веттердетонита, все же более без-
опасен (табл. 28). Мнение Наума о том, что здесь решаю-
щими являются величина удельного давления и связанная с ним
высокая температура адиабатического нагревания (в среде гре-
мучего газа), нельзя признать основательным, так как степень
1 По Nao urn u. Bertman, Z. f. Schiess- u. Sprw., 1930, 194—196.
s Там же, стр. 193—196.
П. Фотографирование”пламени
357
адиабатического нагревания является функцией главным образом
соответствующего давления бризантности, а давление
бризантности (как видно из данных скорости детонации и рас-
ширения в свинцовой бомбе) у нобелита значительно больше,
чем у детонита.
ТАБЛИЦА 28
Характеристики некоторых типичных предохранитель-
ных и обыкновенных^ „безопасных" взрывчатых веществ
(по Науму)
Веттернобелит Веттердетонит (донарнт) Аммонит
А Bi А Bi 1 (астра- лит) 5 (альдор- фит)
Кислородный баланс . . . Расширение в свинцовой +4,1% +6,1% +Ю,9% +16,1% +2% +1,0%
бомбе (с.и3) Сжатие свинцового цилин- 215 205 230 220 330 375
дра (лл) 14,6 12 8,5 8,3 16,2 16,0
Детонирует от капсюля № 1 1 3 3 1 3
Передает детонацию на (см) — .—. 4 4 12 8
Плотность в патронах . . . 1,8 1,7 1,04 1,06 1,09 1,03
Скорость детонации (м/сек) 4 200 4 900 3 600 3650 5400 4 900
Теплота взрыва (б. кал) . . 590 510 550 460 960 1010
Температура взрыва .... Безопасность в отношении 1 820° 1 690° 1520° 1 390° 2170° 2 220°
рудничного газа Безопасность в отношении 600 650 600 550 не безопасны
угольной пыли 700 700 600 500
Это сопоставление также показывает, что безопасность в от-
ношении рудничного газа зависит не от одного какого-нибудь,
а от многих факторов, которые не удается уловить при испы-
тании взрывчатых веществ. Иначе веттернобелиты с их высокой
скоростью детонации и высокой температурой взрыва не могли
бы быть безопаснее, чем веттердетониты. Прямая зависимость
существует невидимому лишь в отношении расширения в'свин-
цовой бомбе, но и в данном) случае веттердетонит является
исключением. Само собой понятно, что как то, так и другое
аммиачноселитренное взрывчатое вещество с температурой
взрыва, превышающей 2000°, не может быть безопасным.
Простые рассуждения показывают, что время превращения
взрывчатого вещества в газообразное состояние может не быть
идентичным продолжительности пламени и что световой
эффект должен длиться дольше, во-первых, потому, что газы
взрыва после достижения наивысшей температуры и наиболь-
1 Эти взрывчатые вещества по своему составу не вполне соответствх ют
образцам, приведенным в табл. 29.
358
Антигризутные взрывчатые вещества
шего объема имеют еще некоторое время достаточно высокую
температуру для того, чтобы испускать свет, и, во-вторых, по-
тому, что в той же стадии химические реакции сами по себе
идут дальше и могут увеличить продолжительность пламени или
даже возобновить его. Это наблюдается, как правило, у взрыв-
чатых веществ, которые из-за недостаточно-
го количества кислорода образуют горючие
газы, содержащие чаще всего окись угле-
рода и водород, которые при соприкоснове-
нии с кислородом воздуха дают втор ич-
объ-
н о е пламя. Этим же
Рис. 155. Вет-
тердетонит В
38 см.
0,43 милл'сек.
ясняется образование пла>-
мени при стрельбе у дула
тяжелых орудий и при от-
крывании затвора их. Про-
Рнс. 156. Аммонит 1
89 см.
1,53 милл’сек.
должительность этого вто-
ричного пламени, которая на-
ходится в различной для ка-
ждого взрывчатого вещества
зависимости от скорости детонации, имеет решающее значе-
ние для безопасности применения взрывчатых веществ в ат-
мосфере рудничного газа. Она может быть точно определена
цри помощи описанного выше аппарата для фотографирова-
ния пламени. Чем меньше отношение продолжительности пла-
Рис. 157. Гурдииамнт 8,5 милли, сек.
мени к скорости детонации, тем больше безопасность; для
взрывов в угольных шахтах принято максимальное отноше-
ние 1 : 10. Зависимость между продолжительностью пламени
и скоростью детонации получают путем пересчета длины рас-
пространения пламени, выраженной в метрах, на время, рав-
ное 1 сек., и путем сопоставления этой цифры со скоростью
детонации. Например если отношение вторичного
II. Фотографирование пламени
359
пламени веттердетонита А равно 1 :5, то это значит, что
продолжительность пламени в 5 раз дольше по времени, чем
скорость детонации. Для веттернобелита А это соотношение по
подсчету составляет 1 : 7, для аммонита — 1:10, для динамита
1 (высшая скорость детонации) — 1 :24, для черного пороха
1 :300, а для гремучего студня даже 1 :800.
Как видно из рис. 65 и 155, вторичное пламя бывает и у на-
стоящих «антигризутных» взрывчатых веществ. Достигаю-
щая лишь 1230° температура взрыва сильно преобладающей
в некоторых взрывчатых веществах аммиачной селитры снижает
световой эффект этих смесей до пределов, при которых фото-
графированием обнаружить пламя уже нельзя. У «антигризутных»
взрывчатых веществ, базируемых на нитроглицерине, тех же
результатов можно достигнуть прибавлением неорганических
солей, особенно поваренной соли, которая испаряется при взрыве
и благодаря поглощению тепла «гасит» пламя.
Один из распространенных способов фотографиче-
ского метода анализа пламени взрыва вкратце
описан Т. Урбанским1. Аппарат состоит из 12 объективов
большой светосилы, позади которых вращается с большой ско-
ростью снабженный 13 щелеобразными отверстиями диск; диск
12 раз последовательно дает короткие интервалы освещения
фотопластинки продолжительностью в 1/9000 сек. Промежуток
времени между отдельными снимками составляет 1/11000 сек.,
так что общая продолжительность времени от начала первого и
примерно до конца пятого снимка составляет 5 •
----la —;—
9000Г 11000
= 0,96 миллисекунды. При помощи дополнительных светофиль-
тров съемку производят так, что улавливаются отдельно ультра-
красные, красные, зеленые и синие лучи в интервале, соответ-
ствующем длине волн в 390—860 рр. Таким образом при взрыве
400—500 г запрессованной пикриновой кислоты (1,65) было най-
дено, что синие, т. е. самые горячие лучи, сильно пре-
обладают после воспламенения в течение первой 1/9000 сек., в то
время как красные лучи только что начинают обнаруживать на
пластинке возникающее пламя. Начиная с третьего и четвер-
того снимков, соотношение меняется в обратную сторону.
Снимки зеленого цвета вначале больше соответствуют серии
синих цветов, а дальше уже сходны с серией красных лучей.
Эти «фильтрованные» снимки позволяют сделать вывод, что
взрыв пикриновой кислоты уже в первой своей стадии резко
ведет к температуре детонации. Кроме того при помощи сним-
ков удается наглядно показать, что взрыв может распростра-
няться «спиралеобразно» не только в газообразной
фазе, но также и в твердых смесях взрывчатых ве-
ществ.
Диссертация, Варшава 1932, 55 стр., с 119 рис. на 8 табл.
360
Антигризутные взрывчатые вещества
Ш. Опытный штрек для испытаний на антигризутносп»
Три основных понятия — длина пламени, продолжительность
пламени и вторичное пламя — теоретически хотя и исчерпывают
комплекс факторов, влияющих на антигризутность, но на прак-
тике они все же не дают окончательной гарантии безопасности.
Как уже видно из таблиц на стр. 356 и 357, приходится счи-
таться еще и с другими свойствами взрывчатых веществ, и при-
том с такими, которые выходят за рамки наших обычных пред-
Рис. 158. Опытный штрек для испытания антигризутных взрывчатых веществ
ставлений и которые не удается установить ни химически, ни
оптическим путем с помощью фотоснимка.
Так например то вещество, которое при взрыве не дает
светящегося пламени, быть может, лучше воспламеняет
рудничный газ, чем то, которое дает отпечаток на светочувстви-
тельной пластинке. Опыты показали, что горячее пламя грему-
чего газа было бы совершенно невидимым, если бы оно не све-
тилось благодаря летучим частицам, отрывающимся от горелки.
Так как уже заранее можно было предвидеть, что чисто-
тивно-теоретический путь подбора составов взрывчатых веществ
не в состоянии полностью разрешить проблему безопасности
взрывных работ в атмосфере рудничного газа, то скоро были
начаты практические опыты, приспособленные к условиям, суще-
ствующим в шахте. В 1885 г. Ломанн в Нейкирхене (Вестфа-
лия) построил первый опытный штрек для испытания на
взрыв в рудничном газе и тем самым создал установку,
1П. Опытный штрек для испытаний на антигризутностъ 361
послужившую образцом для многих опытных штреков, которые
вскоре были установлены во многих индустриальных странах.
Опытный штрек представлял собой длинную, открытую с одного
конца штольню, в которой можно было искусственно создавать
по желанию атмосферу смеси рудничного газа или угольной
пыли с воздухом. У закрытого конца штрека в мортирке взры-
валось испытуемое взрывчатое вещество и определялось коли-
чество взрывчатого вещества, необходимое для воспламенения.
Устройство современного опытного штрека1 показано на
рис. 158.
Новая обширная установка в Дерне2, у Дортмунда, состоит из трех
различных штреков, служащих для испытания взрывчатых веществ; так
называемый «штрек для стрельбы» согласно установленным междуна-
родным нормам — длиною 25 м, высотою 1,82 м и шириною 1,32 м — имеет
в поперечном разрезе эллиптическую форму. Стенки штрека построены и»
досок, уложенных в три ряда; передняя часть штрека длиною в 5 м, слу-
жащая взрывной камерой для искусственных смесей рудничного
газа и угольной пыли с воздухом, имеет стенки двойной толщины (12 см),
обитые помимо того железным листом толщиной 7 мм. Задний конец
штольнн заключен в кирпичную кладку, скрепленную железными анкерными
болтами. На потолке штрека на расстоянии 2—3 м друг от друга пробиты
отверстия, заклеиваемые бумагой н служащие предохранительными клапа-
нами в случае сильных взрывов. В самом конце в кирпичную кладку
плотно вделана стальная мортирка длиной 850 мм с наружным диаметром
530 мм, имеющая камеру глубиной 600 мм и диаметром 55 мм. (В коротких
и узких мортирках — глубиной 180 мм и 30 мм диаметром — где газы взрыва
охлаждаются менее быстро, испытание протекает в более жестких усло-
виях.) Мортирка устанавливается под таким углом, чтобы ее ось пересекала
Потолок штрека на расстоянии 10 м от мортиры.
Взрывная камера имеет объем 10 м3, отапливается (температура равна
в среднем 25°) и перед каждым опытом закрывается бумажной крышкой,,
зажимаемой двумя железными кругами. Рудничный газ вводится в сере-
дину камеры и с помощью двух железных вращающихся лопастей равно-
мерно смешивается с воздухом. Свежеполученная угольная пыль, пригото-
вленная ргФмолом жирных углей и просеянная через сито с 9150 отвер-
стиями на 1 см2 вводится в штрек при помощи воронки через имеющееся
а стенке небольшое отверстие. Пыль получается примерно такой же мел-
кой, как и в естественных условиях. Уголь содержит 73,2% углерода,
25,4% летучих веществ н 1,4% воды; зольность его равна 7,4%-. Особое
значение имеют содержащиеся в угольной пыли летучие вещества: в угле,
применяемом для опыта в Бельгии (Frameries), количество летучих дости-
гает 22%, в то время как английский опытный уголь (Buxton) содержит не
менее 35% летучих. Для наблюдения за происходящим в штреке процессом
имеется 14 окон размером 14,5 X 27 см с зеркальным стеклом толщиной
2,5 см.
Вентиляция штрека производится при помощи небольшого вентиля-
тора, труба которого проложена через кирпичную кладку. Устье трубы,
выходящее в камеру, может закрываться конусообразной заслонкой. На
расстоянии 14,5 м находится помещение для наблюдений, из ко-
торого через амбразуру, закрытую зеркальным стеклом, наблюдателю виден
весь штрек.
1 Brunswig, Explosivstoffe 1909, 108; Schrimpff, Schiess- u. Sprw._
1929, 288.
2 Gliickauf, 1913, 433—442.
-362
Антигризутные взрывчатые вещества
Рядом расположен еще небольшой опытный штрек длиною
4 м, высотой 1,8 м н шириной 1,4 м, который служит для других опытов,
например для испытания ламп и электрических машин в атмосфере руд-
ничного газа.
Один нз наиболее современных опытных штреков построен в конце
1928 г. в саксонском буроугольном районе во Фрейберге (Саксония). Кроме
самого штрека в установку входят здание для наблюдений, вентиляторное
помещение, газометр, а также мастерская, которая может быть исполь-
зована как помещение для производства испытаний по технике безопас-
ности в шахтах.
В последнее время стали строить опытные штреки длиною
100 и более метров; это делается главным образом для того,
чтобы можно было проводить опыты по изучению двух важ-
Рис. 159. Опытный штрек Bureau of Mines для испытания взрывчатых
веществ в Бруцтоне. Длина 30, 5 м, высота 1,9 м. Взрыв при воспла-
менении неантигризутного взрывчатого вещества в атмосфере смеси
воздуха с рудничным газом и угольной пылью.
мейших способов борьбы с распространением взрыва — посред-
ством «мокрых зон» и добавкою «минеральной пыли». Такого
рода штреки имеются в Льевене (Франция), в Олтофте (Англия),
в Фрамери (Бельгия) и в Россице (Австрия). Кроме двух опи-
санных выше штреков в Дерне был построен еще один о п ы т-
н ы й штрек с круглым сечением длиною 300 к и диаметром
1,8 м, служащий главным образом для опытов по изучению рас-
пространения взрывов рудничного газа через зоны, орошаемые
водой, и для испытания действия минеральной пыли как сред-
ства предупреждения возможных в шахтах .взрывов угольной
пыли. Американский штрек в Брустоне (Пенсильвания), по-
строенный при одной опытной шахте, наполняется гремучей
смесью из натурального газа.
III. Опытный штрек для испытаний на антигризутность 363
Испытание взрывчатого вещества на безопасность его применения
в угольных шахтах проводится таким образом, что сначала взрывают заряд
около 300 г взрывчатого вещества, и если воспламенения не происходит,
то последовательно увеличивают каждый следующий заряд на 50 г. Если
воспламенение произошло уже от заряда 300 г, то в следующих взрывах
заряд в такой же последовательности уменьшают и устанавливают величину
предельного заряда. Предельным зарядом называют (наибольшее
количество взрывчатого вещества, которое не вызывает воспламенения при
5 взрывах. Испытания производятся чаще всего с патронами диаметром
35 мм; в верхний патрон вставляется капсюль № 8, и после введения
в штрек наиболее взрывчатой смеси метана с воздухом 9,91% или наполне-
ния штрека облаком определенного количества тонкоизмолотой угольной
ныли заряд воспламеняют электрическим током. В мортнрке взрыв произ-
водят без всякой забойки, в то время как для взрывных
работ в шахтах строго предписано забивать шпур твер-
дой забойкой определенной длины. Таким образом опыт-
ные испытания намеренно проводятся в более жестких
условиях, чем это бывает на практике, с тем чтобы при-
близить опыт к наиболее опасному случаю «выбросов»
взрыва из шпура, при которых тепло, выделяемое взры-
вом, идет не на совершение взрывной работы, а на вы-
брасывание из шпура газообразных продуктов, имеющих
высокую температуру.
В отличие от довоенного времени сейчас со-
став всех антигризутных взрывчатых веществ
подбирается с расчетом на полное сгорание за
счет избытка кисло род а^ Положительный
кислородный баланс в антигризутных взрывчатых
веществах французского образца достигается бла-
годаря высокому содержанию аммиачной се-
литры, которая не только дает полное сгорание
Рис. 160. Мор-
тнрка из специ-
альной стали
для испытания
антигризутных
всех углеродсодержащих компонентов, но и в за-
висимости от взятого количества ее способна
понижать температуру газообразных продуктов
взрыва до желаемых пределов. В Германии, на-
оборот, предпочитают подбирать составные части
антигризутных взрывчатых веществ с расчетом взрывчатых
на наибольшую силу взрыва, но для понижения веществ.
получающейся при этом высокой температуры
продуктов взрыва прибавляют достаточное количество ка-
кого-либо хлорида щелочного металла; хлорид при-
бавляется с таким расчетам, что за счет теплоты, идущей
на его испарение, температура взрыва понижается до уста-
новленных пределов. Германские антигризутные взрывчатые
вещества группы 1 согласно предписаниям горнорудного надзора
от 1923 г. содержат 4% нитроглицерина; примесь нитро-
глицерина обеспечивает воспламеняемость и передачу детонации
Даже в тех случаях, когда патроны вследствие поглощения влаги
ври длительном хранении становятся менее чувствительными.
Германские антигризутные полужелатинированные нитроглице-
риновые взрывчатые вещества содержат до 30%, а желатиниро-
ванные — даже 40% хлорида, и нет ничего удивительного в том,
364
Антигризутные взрывчатые вещества
что при таком балласте динамит в отношении своих взрывчатых
свойств оказывается в сильной степени парализованным, но зато
приобретает антигризутные свойства. В настоящее время анти-
гризутность может быть достигнута только за счет энергии и
бризантности.
Результаты испытаний, получаемые в опытных штреках, не
дают конечно картины, наблюдаемой непосредственно в камен-
ноугольных копях. Но тем не менее наличие опытных данных
позволяет избегнуть многих опасностей, сопряженных с работой
в атмосфере рудничного газа, и проливает свет на взаимодей-
ствие взрывчатого вещества с взрывчатыми смесями рудничного
газа и угольной пыли с воздухом. Благодаря опытным испыта-
ниям удалось прежде всего установить, что нет ни одного
абсолютно безопасного взрывчатого вещества и что,
начиная с некоторой определенной величины заряда, для каж-
дого взрывчатого вещества, независимо от того, высока ли или
низка его температура взрыва, безопасность исчезает.
ТАБЛИЦА 29
Антигризутные взрывчатые вещества различных классов
|с указанием их новейших составов
(Предельный заряд для всех 4 германских образцов как в случае рудничного
газа, так и угольной пыли составляет 800 г)
1. Группа а м м и ач н ос е л и т р е н н ы х взрывчатых веществ
Для угольных пластов предпочтительно пред- назначаются Гризунафталиты (Фавье)
веттерде- тонит В (%) веттерлиг- нознт А (%) угольный пласт (%) пустая порода (%)
Аммиачная селитра .... 72 20 90 91,5
Натриевая , .... — 30 — —
Калийная _ .... .— — 5 —
Нитроглицерин (также и
желатинированный) . . . 4 4 —— —
Динитротолуол 2 — .— —
Тротил — 5 — —
Древесная мука 3 2 — —
Тринитронафталии — — 5 8,5
Хлористый калий 19 — — —
» натрий — 14 — —
„ аммоний *. . . . -— 25 •— —
Кислородный баланс (%) 4-8,7 4-12,2 +15,0 +9,8
Вычисленная температура +Ь0
взрыва (с учетом 1465° 1875°
NH.,C1) «
III. Опытный штрек для испытаний, на антигризутностъ 365
2. Группа нитроглицериновых взрывчатых веществ,
желатинированных и полужелатинированных
Для пустой породы Гризутииы 1 Американ- ский аммиач- носели- тренный динамит (%)
веттер- нобелит (%) веттерба- варит А (%) пустая порода (7о) угольный пласт (%)
Нитроглицерин (желатини- рованный) 30 12
Нитроглицерин — -— 23 10 9,5
Нитрогликоль — — 6 9 —.
Аммиачная селитра .... 26,5 55 67,5 86 70
Натриевая селитра .... — — — -—. 10
50%-ныЙ раствор кальцие- вой селитры 3 _—. —. —_
Дннитротолуол — 3 -— —
Уголь — 1 — —
Древесная мука (целлю- лоза) . . 0,5 1 2,5 1,5 10
Коллодионный хлопок . . _— — 1 0,5 -—
Хлористый натрий .... 40 28 — — —
Нейтрализующие вещества (сода, известь) — — — — 0,5
Жидкая углекислота как аитигризутное в от-
ношении рудничного газа и угольной пыли
взрывчатое вещество (Carbox blasting device)
Оригинальный способ взрывания, превосходящий все сделан-
ное до сих пор в отношении безопасности, применяется с 1928 г.
в каменноугольной промышленности США2. Жидкая угле-
кислота вводится в стальную оболочку, которая помещается
в шпур, забивается, как обыкновенный патрон, и подрывается
специальным воспламенителем; при этом углекислота преодоле-
вает сопротивление запорной шайбы, выдерживающей давление
до 700 ат.
Американский углекислотный снаряд кардокс (Cardox Shell) представляет
собою длинный стальной открытый с обоих концов баллон длиною 80,6 см,
Диаметром 7,6 см, а минимальной толщиной стенок 1,27 см. Стальной бал-
лон изготовляется из хромово-молибденовой стали; конец баллона, через
который вводится углекислота, закрывается навинчиваемым вентилем и
снабжен подводом электрического тока; другой конец закрывается смен-
ным металлическим диском с навинчиваемым разрядным капсюлем. Из трех
моделей самой простой и самой легкой является модель G весом 18 кг.
Имеющая объем зарядной камеры 1,38 л. Заряд состоит из 900—1250 г
1 Обыкновенные (замерзающие) гризутины содержат вместо нитрогликоля
Нитроглицерин, т. е. 29 илн 12% нитроглицерина.
8 Rep. of invest. 2920 (1929) и 3084 (1931), Bureau of Mines.
366 Антигризутные взрывчатые вещества
жидкой углекислоты и запала (heater element), воспламеняемого электриче-
ским путем. Теплота взрыва запала передается жидкой углекислоте, кото-
рая обращается в газообразное состояние и, развивая давление от 1000
до максимум 2800 ат, вырывается из стального цилиндра через 4 отверстия
разрядного капсюля. Нарастание давления длится 0,01 сек. и плавно до-
стигает максимума. В качестве запала применяется смесь алюминиевого’
порошка, древесного угля и хлората натрия; его вес 100—160 г; эта масса
во время взрыва совершенно обезвреживается, так как она окружена вну-
три цилиндра жидкой инертной углекислотой.
Взрывное действие жидкой углекислоты подобно действию
дымного пороха, однако преимущество ее состоит в том, что
при ее применении образуется меньше потолочных трещин и
пыли. Опыты, произведенные до сих пор, дали положительные
результаты. Оболочка снаряда допускает повторное применение;
только запал и металлический диск каждый раз подлежат замене.
ГЛАВА ОДИННАДЦАТАЯ
ВЗРЫВЧАТЫЕ НИТРОСОЕДИНЕНИЯ
АРОМАТИЧЕСКОГО РЯДА
1. Исходные и промежуточные продукты
Исходные продукты для производства взрывчатых веществ
ароматического ряда добываются исключительно из каменно-
угольной смолы1. Каменноугольная смола, называемая
также газовой смолой или просто смолой, получается при кок-
совании (сухой перегонке каменного угля) и как побочный
продукт* при производстве светильного г'аза, являясь
смесью чрезвычайно большого числа и притом весьма ценных
соединений.
Прежде чем произвести химическое или физическое разделе-
ние смолы на составные части, ее подвергают перегонке и раз-
бивают на следующие главные фракции:
1) легкое масло (до 170°);
2) среднее или фенольное масло (170—240°);
3) тяжелое масло (240—270");
4) антраценовое масло (270—400°).
Эта первичная разгонка на фракции производится большей
частью на самих газовых заводах. Дальнейшая переработка про-
исходит на особых установках, где масла разгоняются на
составные части с помощью ректификационных колонн. Для про-
изводства взрывчатых веществ основное значение имеет л е г-
к о е масло, которое составляет 3—4% общего количества
смолы. Около одной трети дестиллата легкого масла составляют
бензол и толуол, причем первый составляет 0,8%, а второй —
около 1,7% общего количества смолы. До бензола, т. е. до 80°
отгоняется фракция, состоящая из большого числа низкокипя
Щих соединений, как ацетальдегид, сероуглерод и ациклические
углеводороды. После бензола (80°) отгоняется толуол
(111°), потом ксилолы (137—142°), сольвент-нафта
1 Пирогенетическое разложение нефти дает очень большие количества
углеводородов, также являющихся исходными материалами для пригото-
вления нитросоединеиий, например тринитротолуола из нефтяного толуола..
Прим. ред.
<368 Взрывчатые нитросоединения ароматического ряда
(150—200°) и наконец твердый нафталин (218°). В обеих
последних фракциях содержится также фенол (181°).
Между бензолом и толуолом, а также между толуолом и кси-
лолом перегоняются особые, так называемые промежуточ-
ные фракции, состоящие из ненитрующихся, главным обра-
зом алифатических углеводородов, которые прежде,
когда способы дестилляции были недостаточно совершенными,
загрязняли бензол и толуол.
В нижеследующей таблице дан перечень важнейших углево-
дородов легкого масла.
Темп. кип. Темп. пл. Уд. вес
Бензол 80,4° 5,4° 0,879
Толуол (метилбеизол) . . . 110,8° —95° 0,870
Ксилолы (диметилбензолы) О-КСИЛОЛ 'I л-ксилол I технический 141° 139° —27° -54° 0,863 0,862
л-ксилол | КСИЛОЛ 138° 4-15° 0,861
Этилбензол J Триметилбензолы 1-2-3 (гемеллитол) . . 1-2-4 (псевдокумол) . . 1-3-5 (мезитилен) . . . Пропилбентолы Нормальный пропилбеизол Изопропилбензол (кумол) . -Метил изопропилбензол (цимол) ........ Нафталин сольвеит- иафта 136° 176° 168° 163° 159° 153° 175° 218° -94° —15° •' —46° жидкость 79,6° 0,867 0,901 0,878 0,860 0,862 0,864 0,863 1,145
1. Бензол СвНб. В чистом виде бензол представляет собою
бесцветную лучепреломляющую подвижную жидкость со свое-
образным «ароматическим» запахом. Темп. кип. 80,4°, темп. пл.
5,5°, уд. в. при 20° 0,879.
2. Толуол СбНб • СНз. Бесцветная, сильно лучепреломляющая
подвижная жидкость уд. в. 0,871; темп. кип. 110,8°. В отличие от
бензола толуол не затвердевает даже при самых низких зимних
температурах. Оба углеводорода нерастворимы в воде и легко
растворимы в спирте, эфире и ацетоне.
Бензол и толуол, производимые в настоящее время для тех-
нических целей, почти абсолютно чисты и перегоняются в пре-
делах 0,3—0,5° и даже 0,2 и 0,1°. Поэтому проба на чистоту
в настоящее время значительно упростилась, между тем как
ранее приходилось количественно определять не только нени-
трующиеся углеводороды, но также и примесь тиофена и серо-
углерода.
1. Исходные и промежуточные продукты
369
Исследование
Анализ бензола и толуола производится по одной и той же схеме и
(Одинаковыми средствами.
1. Запах должен быть нормальным, т. е. не должен обнаружи-
вать присутствия ненасыщенных жирных углеводородов и сернистых со-
•единений.
2. Внешний вид. Жидкость должна быть бесцветной, прозрачной,
ме должна быть мутной от наличия воды и не должна содержать приме-
сей твердых веществ.'
3. Удельный вес определяется ареометром, снабженным точным
термометром.
4. Определение степени чистоты выполняется следующим
образом: 5 см3 исследуемого углеводорода взбалтывают с 5 см3 чистой
серией кислоты в маленьком цилиндре с притертой пробкой в течение
3 мин. и после отстаивания наблюдают окраску кислоты, образующей ниж-
ний слой. В случае бензола кислота должна оставаться бесцветной
или максимум приобретать светложелтую окраску, а в случае
толуола — окрашиваться в винножелтый цвет. Окрашенный слой
.должен быть, само собой разумеется, прозрачным. При длительном стоянии
проба темнеет, поэтому сравнительная оценка окраски должна произво-
диться вскоре после взбалтывания. Красное или коричневое окрашивание
указывает на недостаточную чистоту и следовательно на непригодность
бензола или толуола.
5. Температура кипения. Если предыдущие пробы дали удо-
влетворительный результат, то производят последнее, наиболее важное и
притом уже количественное испытание — определение температуры кипения.
100 см3 углеводорода перегоняются из медной колбочки в мерный цилиндр
емкостью 100 см3 таким образом, чтобы в секунду переходило приблизи-
тельно по 2 капли. Отсчитанные температуры приводятся потом к 0° и
760 мм давления. Ниже в виде примера приведены температуры кипения
технического продукта, а также протокол записи некоторых других опре-
делений.
• Бензол Толуол Отсчет
Ъ = 723 мм поправка 1,5° Температура кипе- ния Пределы кипения . . Запах Внешний вид .... Удельный вес .... •Степень чистоты . . 'Тиофеи 77,6° 79,0°— 79,0° I 79,1° 1 79,1° 0,2° 79,1° 79,2°— 79,2° 80,6° (0,2) не совсем чистый прозрачный 0,880 хорошая менее 1%0 108,2° 108,9°— 109,0° 1 109,1° 1 109,1° 0,4° 109,2° | 109,3°— 110,0° 110,6° (0,4) нормальный прозрачный 0,866 очень хорошая (цвет кислоты слабожелтый) следы при 1-й капле при 10 см3 » 20 . » 40 . „ 60 , . 80 , . 90 , . «5 ,
24 Зак. 3171. — Штетбехер.
370 Взрывчатые нитросоединения ароматического ряда
Понятно, что чистота и выход нитросоединений зависят от
качества исходных углеводородов. Так, из прежнего, менее чи-
стого толуола сырой тринитротолуол постоянно получался
с темп. пл. 71—72°, в то время как ныне при том же составе ни-
трующей смеси из более чистого толуола получается продукт
с темп. пл. 77—77,5°.
3. Ксилол СЙН4(СНз)2 представляет собою смесь трех изоме-
ров, содержащую около 60% м-ксилола и 10—25% о- и п-ксило-
лов. В техническом ксилоле, наряду с изомерным этилбензолом
(до 10%), содержатся также небольшие количества триметил-
бензола, парафины и тиоксен. Разделение изомеров ксилола
фракционной перегонкой очень затруднительно благодаря близ-
ким температурам кипения (138,4°, 139°, 141°), однако с по-
мощью новейших ректификационных колонн кипящий при 139°"
ти-ксилол удается довольно полно отделить от ниже кипящего
п-ксилола и выше кипящего о-ксилола.
Чистый м-ксилол должен перегоняться по крайней мере в пределах 1°;
техническая смесь изомеров должна на 95% перегоняться в пределах 4,5°,
т. е. в пределах 136 и 141°. Требования к степени чистоты в дан-
ном случае ниже, и продукт, дающий лимонножелтое окрашивание кис-
лоты, считается вполне приемлемым.
4. Сольвентнафтой называют смесь углеводородов, перего-
няющуюся вслед за ксилолами. Температуры кипения коле-
блются в пределах 145—180° или до 200° и выше — до начала
перегонки нафталина. Главными составными частями являются
триметилбензолы, пропилбензолы и цимол. Сольвентнафта —
бесцветная незамерзающая жидкость; окраска кислоты при
испытании на степень чистоты может доходить до желто-
коричневого цвета. Средний уд. в. 0,875.
5. Нафталин СюНв образует бесцветные кристаллические ли-
сточки с пронизывающим запахом, нерастворим в воде, легко
растворим в спирте, эфире и бензоле, плавится при 79,6° и кипит
при 217—218°. Неочищенный нафталин обычно содержит в каче-
стве примесей фенол и хинолиновые основания, которые обна-
руживаются по запаху.
Продажный нафталин является почти химически чистым
продуктом'. Он должен быть совершенно белого цвета, улету-
чиваться без остатка, плавиться не ниже 79° и перегоняться
почти в пределах 1°. От действия воздуха и света нафталин
не должен желтеть и при растворении в чистой концентрирован-
ной серной кислоте должен сообщать раствору только слабое
розово-красное окрашивание.
6. Фенол (карболовая кислота) СеГГОН получается или син-
тетически из бензола (щелочной плавкой бензолсульфокислоты),
или выщелачиванием фракций легкого масла. Продажный фенол
образует более или менее окрашенные в розовый цвет призмы
с темп. пл. 36—40° и кипит при 183—186° (температура кипения
чистого продукта 181°).
II. Нитропр оизводные бензола н его гомологов
371
Наиболее чистым является синтетический фенол, плавящийся
при 40,6°; фенол, идущий для изготовления пикриновой кислоты,
должен плавиться не ниже 36°. Небольшие примеси крезолов
понижают температуру плавления и повышают растворимость;
особенно сильно влияет на температуру плавления наличие воды.
7. Анизол СяНзОСНз, метиловый эфир фенола — приятно
пахнущая жидкость с темп. кип. 154°. Получается из фенола и
метилового спирта с окисью тория в качестве катализатора.
Уд. в. 1,00.
8. Крезол СеНЮН • СНз является смесью трех изомеров; про-
зрачная, как вода, жидкость, кипящая при 190—210°, получаемая
наряду с фенолом при выщелачивании легкого масла. Темпе-
ратуры кипения о-, м- и п-крезолов 190, 201 и 200°.
9. Анилин C6H5NH2, или фениламин, представляет собою бес-
цветную, сильно лучепреломляющую жидкость уд. в. 1,022
с темп. кип. 184,2°.
10. Диметиланилин CeHsN(CHs)2 получается метилированием
анилина метиловым спиртом в автоклавах; кипит при 193° и дол-
жен перегоняться в пределах 1—РА0. Для получения тетрила
применим только продукт высокой степени чистоты; впрочем
небольшая примесь монометиланилина (темп. кип. 194°) не
является вредной в этом случае и даже повышает выход.
II. Нитропроизводные бензола и его гомологрв
1. Нитробензол
Раньше бензол нитровали в аппаратах, снабженных простыми
рычажными мешалками, делавшими всего 40—60 об/мин, вслед-
ствие чего*процесс длился очень долго; кроме того в результате
плохого перемешивания получался неоднородный продукт. Позд-
нее стали применять усовершенствованные быстровращающиеся
пропеллерные мешалки, делающие до 400 оборотов. Такие аппа-
раты с интенсивным внутренним охлаждением1 по большей
части используются и ныне не только для получения нитробен-
зола, но также и для получения жидких нитросоединений во-
обще; неоднократно предлагавшиеся разнообразные полунепре-
рывные или непрерывные способы до сих пор еще нигде
не используются в большом масштабе. Чрезвычайно удивительно,
что для процесса нитрования ароматических углеводородов,
сравнительно куда менее опасного, не найдено еще изящного
способа автоматического нитрования, подобного применяемому
при получении нитроглицерина.
При нитровании бензола нитрующую смесь приливают к бензолу (при
нитровании толуола углеводород приливается к нитрующей смеси). Это
Делается отчасти для того, чтобы умерить довольно бурную реакцию,
1 Ср. Ullmann, Encycl., т. II, 271.
24'
372 Взрывчатые нитросоединения ароматического ряда
а также чтобы избежать образования динитробензола, поскольку нитро-
вание ведется до мононитробеизола. Во избежание образования дииитро-
бензола бензол берется кроме того в неб'олыпом избытке: 100 кг бензола
на 300 кг нитрующей смеси, состоящей из 120 кг азотной кислоты уд. в. 1,40
и 180 кг серной кислоты уд. в. 1,84. Кислотная смесь приливается тонкой
струей; при этом температура охлаждением поддерживается при 25—30°,
а под конец охлаждение выключают и дают температуре подняться до 50°.
По окончании нитрования загрузка передавливается в резервуар, где смесь
разделяется на 2 слоя —верхний слой нитробензола и нижний — отрабо-
танной кислоты, которую спускают. Затем к нитробензолу прибавляют
раствор соды или слабый раствор едкого натра и промывают до совер-
шенно нейтральной реакции, после чего освобождают от оставшегося
бензола перегонкой с паром и в заключение ректифицируют перегонкой.
Из 100 ч. бензола получаются 154 ч. нитробензола вместо 157,6 ч. по теории.
На заводе Aktiengesellschaft fiir Anilinfabrikation в Руммельс-
бурге, близ Берлина, бензол нитруют в трех аппаратах емкостью
по 6000 л каждый. К 1600 кг бензола в течение примерно 2 час.
приливают нитрующую смесь, состоящую из 1900 кг азотной и
2700 кг серной кислот; прибавление смеси регулируют таким
образом, чтобы температура не превышала 50°, а под конец
поддерживают некоторое время температуру 50°. Нитробензол
отделяется и промывается в смежном помещении.
26 февраля 1914 г. на этом заводе произошел взрыв, при котором
было убито 11 чел. и 14 чел. более или менее тяжело ранено. Очень ве-
роятно, что аппаратчик, не пустив в ход мешалку и охлаждение, открыл
кран кислотной смеси; последняя собралась под бензолом на дне аппарата
и потом, когда мешалка была приведена в движение, в реакцию с кисло-
той сразу вступило большое количество бензола. Вследствие выделения
большого количества тепла бензол и азотная кислота могли притти в со-
стояние кипения, с образованием большого количества окислов азота; труба
диаметром 24 см, предназначенная для удаления их вместе с парами бен-
зола, оказалась недостаточной, и в результате сильное давление внутри
аппарата сорвало тяжелую крышку. Искры от падения железной крышки
вероятно оказалось достаточно для того, чтобы вызвать ужасный взрыв
смеси бензола, нитробензола, воздуха и окислов азота.
Свойства нитробензола. Современный технически
чистый продукт кипит при 209°, обладает уд. в. 1,21 при 15° и
плавится около 4°; нитробензол бесцветен или окрашен в слабо-
желтый цвет, но часто бывает и темного цвета, обладает запа-
хом горьких миндалей, жгучим вкусом и как в жидком состоя-
нии, так и в виде паров очень ядовит. В воде растворим очень
мало; напротив, легко растворим в. эфире, спирте, бензоле и
крепкой азотной кислоте, способен растворять нитроклетчатку,
образуя желатинообразную массу.
Нитробензол в жидком виде совершенно не обладает взрыв-
чатыми свойствами, но в парообразном состоянии в сильно на-
гретом сосуде под давлением способен разлагаться с невероят-
ной силой. Для полного сгорания в нем нехватает не менее
163% кислорода. Как составная часть взрывчатых веществ он
заменен в настоящее время неядовитым нитротолуолом; следо-
вательно он имеет значение только как исходный продукт для
«военного» динитробензола.
II. Нитропрсизводные бензола и его гомологов
373
2. Динитробензол
При нитровании нитробензола, а также при обработке бен-
зола более крепкой нитрующей смесью и при повышенной тем-
пературе получается динитробензол (в виде смеси трех его изо-
меров).
Например 400 кг бензола нитруют непосредственно до динитробеизола
2 400 кг смеси, состоящей из 2 ч. азотной кислоты уд. в. 1,45 и 3 ч. серной
кислоты уд. в. 1,84, или же сырой нитробензол, полученный из 400 кг бен-
зола, тут же подвергают дальнейшему нитрованию, приливая в течение
2 час. кислотную смесь, составленную из 1350 кг серной кислоты уд. в. 1,84
и 450 кг азотной кислоты уд. в. 1,49 (рис. 161); температуре дают быстро
подняться до 115° и на этом уровне поддерживают ее в течение послед-
него получаса. Реакция считается оконченной, если взятая через 3 часа
проба затвердевает. Если нитрование бензола производят в две операции,
то отработанную кислоту от второй операции (получения динитробензола)
освежают н после добавления необходимого количества азотной кислоты
применяют для приготовления нитробензола. Динитробензол в расплавлен-
ном состоянии отделяется от отработанной кислоты и должен быть под-
вергнут многократной и весьма тщательной промывке горячей водой,
так как кислота удаляется из него труднее, чем из тринитротолуола. Боль-
шие затруднения представляют довольно значительная ядовитость дииитро-
беизола, что является особенно опасным вследствие летучести этого со-
единения с водяным паром. После промывки (до нейтральной реакции)
I раиулированная масса центрофугируется и высушивается; после такой
обработки продукт без дальнейшей перекристаллизации является пригод-
ным для снаряжения снарядов. Большинство указанных операций будет
описано подробнее при ди- и тринитротолуоле.
Затвердевший динитробензол представляет собой красивую
светложелтую твердую, волокнисто-кристаллическую массу, кото-
рая плавится около 80—81° и на 91—94% состоит из м-изомера
(темп. пл. 89,7°). Растворимость в горячей воде незначительна;
продукт может быть перекристаллизован из спирта или бен-
зола.
В свое время динитробензол находил обширное приме-
нение во взрывной технике. Новым является его исполь-
зование для снаряжения снарядов. Полую форму напол-
няют расплавленным взрывчатым веществом и образую-
щуюся при застывании динитробензола воронку заливают
тринитротолуолом. Таким образом получают сильный дето-
натор, который надежно взрывает динитробензол. Применять
смесь динитробензола и тринитротолуола вследствие низ-
кой точки плавления не представляется возможным.
Динитробензол является крайне нечувствительным взрывча-
тым веществом, детонирующим только в прочной оболочке и от
сильного детонатора. Ранее динитробензол являлся главной со-
ставной частью многих важнейших хлоратных и аммиачносе-
литренных взрывчатых веществ.
Динитрохлорбензол (1-хлор-2,4-динитробензол) пред-
ставляет собою вещество светложелтого цвета, нерастворим
374 Взрывчатые нитросоединения ароматического ряда
Рис. 161. Нитратор периодического действия для низкоплавких
нитропроизводных:
/—охлаждающая вода; 2—пар; з—нитропродукт; 4—смотровое стекло; 5—вытяжная
труба (керамика); 6—кислота; 7—сжатый воздух; 8—труба для подвода моио- или
динитропродукта; 9—толуол; /0—смотровое стекло для наблюдения за поступле-
нием углеводорода; 11— термометр; 12—крышка люка с предохранителем (на случай
повышения давления); 13—-отбор проб; 14— напорная труба; 15—пропеллерная
.мешалка; 16—сток холодной воды; 17— к конденсационному горшку; 18—цемент-
ный пол; 19—стойки.
II. Нитропро изводнле бензола и его гомологов
375
в воде, очень ядовит, плавится около 50°, удельный вес его
равен 1,70. Прежде применялся для изготовления робуритов, во
время же войны приготовлялся как промежуточный продукт для
получения пикриновой кислоты и гексанитродифениламина.
3. Тринитробензол
Нитрование бензола до тринитробензола протекает значи-
тельно труднее, чем нитрование ближайшего гомолога бензола —
толуола, наличие метильной группы в котором облегчает нитро-
вание. Даже наиболее концентрированные кислоты не превра-
щают динитробензол полностью в тринитробензол; хорошие
выходы могут быть получены только при работе под давлением,
что делает процесс нитрования столь же затруднительным, как
' и опасным. Поэтому предпочитают получить тринитробензол
окислением тринитротолуола в крепкой серной кислоте, хромовой
кислотой в тринитробензойную кислоту, с последующим превра-
щением ее в тринитробензол простым нагреванием.
Все три теоретически возможных изомера тринитробензола
.получены. Раньше всего в 1894 г. Л о б р и де - Бр ю йн ом
€>ыл получен 1, 3, 4-тринитробензол, плавящийся при 57,5°. Тре-
тий, рядовой 1,2,3-тринитробензол был получен впервые
в 1914 г. Кернером и Контарди обходным путем через
диазосоединения. Этот изомер плавится при 127,5° и отличается
подвижностью и нестойкостью третьей нитрогруппы. Во взрыв-
ной технике имеет значение только симметричный изомер
или 1, 3, 5-т р и н и т р о б е н з о л: белые листочки или иглы
•с темп. пл. 122°; плавлением или прессованием его плотность
может быть доведена до 1,67. Как по энергии, так и по скорости
детонации 1, 3, 5-тринитробензол превосходит тринитротолуол.
Его чувствительность является средней между чувствительностью
пикриновой кислоты и тринитротолуола, так что тринитробензол
был бы одним из наиболее подходящих военных взрывчатых
веществ, если бы его изготовление — как показал в свое время
опыт войны — не было связано с большими затруднениями.
Хотя введение в бензольное ядро уже третьей нитрогруппы возможно
только при особо жестких условиях реакции, Борше* в 1923 г. удалось
обходным путем, нагреванием пикрилгидроксиламина с большим количе-
ством дымящей азотной кислоты, получить 1, 2, 3, 5-т е тр а н и тр о б е н-
з о л. Это вещество кристаллизуется в желтых иглах с темп. пл. 125—126°;
при действии воды или аммиака нитрогруппа, повидимому в положении 2,
легко замещается гидроксильной или аминогруппой.
Тринитро хлорбензо л, или пикрил хлорид
(1 -хлор- 2, 4, 6-тринитробензол), можно получить двумя пу-
тями: в лаборатории — действием на пикриновую кислоту двой-
ного количества пятихлористого фосфора с последующей отгон-
1 Вег., 1923, 1942.
376 Взрывчатые нитросоединения ароматического ряда
кой образующейся хлорокиси фосфора, промывкой остатка
водой и перекристаллизацией последнего из спирта, ив тех-
нике — нитрованием хлорбензола с промежуточным образова-
нием 1, 2,4-хлортринитробензола Ч Последняя операция — ни-
трование —- производится в присутствии избытка1 олеума и
при температуре 140—150° в конце процесса. Пикрилхлорид
служит исходным продуктом для приготовления гексанитродифе-
нилсульфида и гексанитродифенилсульфона; он образует бес-
цветные нерастворимые в воде иглы с темп. пл. 83° и предста-
вляет собою очень сильно взрывчатое и бризантное вещество, но
вследствие большой ядовитости (образование злокачественной
экземы) и сложности получения нашел только временное и очень
ограниченное применение.
4. Нитротолуол
Мононитротолуол приготовляется в таких же аппаратах и
таким же способом, как и нитробензол, с той лишь разницей, что
вследствие более высокой температуры кипения толуола углево-
дород можно приливать к нитрующей смеси, что для периоди-
ческого способа нитрации представляет некоторые преимущества.
В зависимости от состава нитрующей смеси и температуры нитро-
вания образуются различные количества о- и л-нитротолуолов
и очень небольшое количество льнитротолуола. В среднем обра-
зуется около 40% жидкого о-соединения и 60% твердого л-со-
единения. Константы изомеров следующие:
Температура кипе- ния Температура плавле- ния о-Нитротолуол ж-Нитротолуол «-Нитротолуол
222° жидкость (—4°) 231° 15° 238° (твердое тело) б?0"
Технический нитротолуол подобно нитробензолу — желтая
жидкость уд. в. 1,16. Он служит исходным продуктом для полу-
чения высших нитросоединений и его применение, за исключе-
нием применения в . качестве небольших добавок в некоторые
безопасные взрывчатые вещества, имеет только второстепенное,
значение.
5. Динитротолуол
Технический динитротолуол — твердая желтая масса, темпе-
ратура плавления которой сильно колеблется. В зависимости от
способа получения состав его изменяется; наряду со всеми пятью
изомерами динитротолуол всегда содержит небольшие количества
1 Герм. пат. 78309.
11. Нитропроизводные бензола и его гомологов
377
мононитротолуола и тринитротолуола. Если исходным продук-
том является толуол, то нитрование протекает по следующему
уравнению:
сн3 сн3
(A i/4|NO2
I J + 2HNO3 = || + 2H2O
^NOg
92,06 126,04 182,06 36,04
500 684 988 196
Практически на 500 кг толуола берут нитрующую смесь, со-
стоящую приблизительно из 2400 кг концентрированной серной
кислоты и 900 кг концентрированной азотной кислоты уд. в. 1,48
и получают почти теоретический выход — 900 кг динитротолуола
с темп. пл. 50°. В производстве тринитротолуола отработанную
кислоту третьей нитрации почти всегда освежают необходимым
количеством азотной кислоты и используют для получения ди-
нитротолуола. Так как отработанная кислота всегда содержит
в растворенном состоянии значительные количества тринитрото-
луола, то температура плавления образующегося динитропро-
дукта понижается, несмотря на то что нитрование в данном слу-
чае протекает полнее, чем нитрование свежими кислотами ука-
занного выше состава. Обыкновенно температура затвердевания
в этом случае не превышает 35°.
В зависимости от интенсивности охлаждения и перемешивания прилива-
ние толуола продолжается 4—8 час.; температуру нитрования поддержи-
вают около 50° и по окончании приливания нагревают еще в течение
% часа при 80—90°. Более длительное и сильное нагревание нецелесо-
образно, так* как после окончания приливания толуола нитрование вряд ли
продолжается. Например при продолжении нагревания при 90° в течение
21’2 час. температура затвердевания динитротолуола повысилась в одном
случае с 33,7° только до 35,6°. По окончании нитрования содержимое
аппарата охлаждают до температуры несколько, более высокой, чем тем-
пература плавления динитропродукта, и передавливают содержимое ии-
тратора с помощью сжатого воздуха в одни из освинцованных сепарато-
ров (1,2), смешивая реакционную смесь с таким количеством воды, чтобы
разбавление достигало приблизительно 15%. При этом вначале происходит
очень сильное выделение окислов азота, для отвода которых требуется
достаточно мощная вытяжная труба. После отстаивания в течение несколь-
ких часов при температуре несколько более высокой, чем температура пла-
вления нитропродукта, кислота отделяется от продукта, образующего-
верхний слой.
Отработанная кислота (предназначенная для денитрации) по-
ступает затем в освинцованные деревянные ящики, отстаивается по их на-
полнении не менее недели, и выделившийся на поверхности динитропро-
дукт тщательно отделяется. Удельный вес отработанной кислоты 1,66-
(55° Вё), средний состав ее: 68% H2SO4, 4—5% HNO3, остальное — вода. Эта
разбавленная отработанная кислота все же содержит еще в растворе незна-
чительное количество нитропродуктов, но дальнейшее разбавление (ниже
65% H2SO4) невыгодно, так как последующая переработка отработанной
кислоты на серную кислоту становится невыгодной.
378 Взрывчатые нитросоединения ароматического ряда
Более чистый динитротолуол (темп, затвердевания 40—50е),..
.выделяющийся в ящиках для отстаивания отработанной кислоты,
собирается в особом свинцовом котле, плавится и при третьей
нитрации равномерно добавляется к основной массе динитрото-
луола. По данным Паскаля1 технический ди нитро-
.толуол представляет собою смесь пяти изомеров:
СН3 СН3
Л O.N./^NO.
I | Г I 1, 3, 4 1, 2, 3 1, 2, 5
\4/ 4 Z
NOo
Темп. пл. 70,5 66° 59° 48°
74,8% 20,7% 2,5% 1.Р/,, 0,9%
Кроме того известен еще 1, 3, 5-динитротолуол, плавящийся
?при 92°. Тринитротолуол получается только из двух первых
изомеров, составляющих вместе 95,5% получаемого динитро-
толуола.
По новейшему предложению Г офвиммера2 того же выхода ди-
нитротолуола можно достигнуть при значительно меньшей затрате нитрую-
щей смеси. Для этого необходимо только иначе проводить процесс нитро-
вания, а именно: раздельно приливать в аппарат 2000 кг моногидрата
серной кислоты и 920 кг толуола и 1350 кг 98%-ной азотной кислоты,
причем температура не должна превышать 70°. По окончании нитрования
.добавляется 480 л воды; вес выделяющегося нитропродукта составляет
1800 кг, т. е. близок к теоретическому выходу.
Технический динитротолуол представляет собою
волокнистую массу умеренной твердости и хрупкости, плавя-
щуюся в наиболее чистом состоянии около 66°, обычно же при
50°, 35° или еще ниже, в то время как главная составная часть,
л-динитротолуол, плавится при 70,5°. Из некоторых продуктов,
особенно в теплое время года, выделяется густое масло, образую-
щее так называемый жидкий динитротолуол (Tropfol). Динитро-
толуол нерастворим в воде, легко растворим в горячем спирте,
а также в эфире и бензине. Около 300° начинает кипеть с частич-
ным разложением и сгорает, оставляя пористую массу угля.
.Динитротолуол детонирует еще труднее, чем динитробензол, и
еще более нечувствителен, но его детонацию, как и детонацию
динитробензола, можно вызвать ударом и сильным детонатором.
.Динитротолуол разрывает толстые трубки из сварочного железа
на большое количество осколков.
Вследствие легкости и дешевизны приготовления динитрото-
луол является составной частью большого количества аммиачно-
.селитренных и хлоратных взрывчатых веществ, но сам по себе
1 Взрывчатые вещества, пороха, боевые газы, Госхимтехиздат, 1932.
2 Аргл. пат. 360833 (1930).
II. Нитропроизводные бензола и его гомологов 379
обладает незначительной взрывчатой силой. Главная масса ди-
нитротолуола производится в качестве промежуточного про-
дукта для производства тринитротолуола и подвергается даль-
нейшему нитрованию без какой-либо очистки.
6. Тринитротолуол (тротил, ТНТ)
Тринитротолуол можно получать нитрованием нитротолуола
в одну или несколько стадий, в зависимости от того, что является
исходным продуктом — моно- или динитротолуол. Но по про-
изводственно-техническим и экономическим соображениям нитро-
вание никогда не проводят в одну, а всегда в несколько стадий.
Последней стадией чаще всего является нитрование динитрото-
луола; готовый тринитропродукт всплывает на поверхность кис-
лоты, отделяется, промывается водой до нейтральной реакции
и — по крайней мере для военных целей — перекристаллизовы-
вается из спирта. Такой продукт может считаться химически
чистым и длительно сохраняется не изменяясь.
Наиболее простым и употребительным, особенно для неболь-
ших производств, является нитрование толуола до динитропро-
дукта с последующим нитрованием его до тринитротолуола. Дру-
гие способы более пригодны для больших, обширных произ-
водств, которые получают дешевый мононитротолуол непрерыв-
ным способом и легко могут превратить его в тринитропродукт.
Нитрующие кислотные смеси, применяемые на различных заводах
для получения динитротолуола, содержат около 10-—22% азот-
ной кислоты, т. е. 1,5—1,8-кратный избыток, считая на толуол;
в противном случае получается плохой недонитрованный масля-
нистый продукт.
Вторая операция нитрования, т. е. превращение динитрото-
луола в тринитротолуол, производится совершенно безвод-
ной смесью азотной и серной кислот с содер-
жанием азотной кислоты 20—25% при соотношении азотной
кислоты и динитротолуола 1 : 4 или 1 :5. Динитропродукт начи-
нает реагировать с кислотной смесью уже при обыкновенной
температуре, и при энергичном перемешивании процесс идет
самопроизвольно, причем температура достигает 100—120° и
выше.
Нитрование динитротолуола до тринитротолуола стехиометри-
чески протекает по следующему уравнению:
сн8 ’ сн8
/\nO., NOZ^NO.,
| | + HNOS =| | * + H8O
^NOs, ^NO.,
182,06 63,02 227,Off 18,02
“980 - 339 1222,2 96
380 Взрывчатые нитросоединения ароматического ряда
Но на практике азотную кислоту приходится брать в значи-
тельно большем количестве. На указанные 980 кг динитротолуола
(как конечного продукта из 500 кг толуола) расходуют например
2650 кг безводной нитрующей смеси, что при содержании 24%
НЬЮз соответствует 1,87-кратному избытку; эта избыточная
кислота используется затем в кислотной смеси для второй нитра-
ции. Нитрующая смесь составляется из
- . азотной кислоты (меланж), концентриро-
| ’ ванной серной кислоты и высокопроцент-
| ного олеума так, чтобы вся содержащаяся
в смеси в°Да находилась в связанном со-
j стоянии в моногидрате H2SO4; чтобы по
* возможности ослабить влияние воды, об-
I разующейся при нитровании, 2650 кг ни-
I ! трующей смеси укрепляются еще одно-
I ! временно 1000 кг моногидрата. Про-
цесс нитрования ведется следующим,
образом: к жидкому, нагретому до 50—
60° динитропродукту быстро и непрерыв-
но приливают 1000 кг моногидрата (ни-
тратор изображен на рис. 162). При этом
не происходит никаких реакций, и если
случайно температура самопроизвольно-
не понизится до 40°, то быстро включают
охлаждающую рубашку. В зависимости от
размеров впускной трубы приливание кис-
лоты оканчивается за 10—15 мин. Затем
открывают кран мерника и сразу приба-
вляют 2650 кг нитрующей смеси. Охла-
ждение оставляют выключенным. ’ Продол-
жительность приливания смеси — 15—
20 мин., температура содержимого нитра-
тора снижается под конец до 30° или еще
ниже. После этого начинается реакция
образования тринитротолуола, сопрово-
ждаемая в начале медленным, а затем бо-
лее быстрым повышением температуры,,
так что за ходом • реакции необходимо
внимательно наблюдать. Если температура
повышается слишком быстро, необходимо
Рис. 162. Нитратор для
получения тринитрото-
луола (для ТНТ — чугун-
ный, для ДНТ — желез-
ный).
тотчас же включить охлаждение, бели же, наоборот, температура
повышается слишком медленно, то ее можно поднять, но не
сразу, а постепенно, не более чем на 5—10° в один прием.
Наибольшая опасность скачкообразного повышения температурь»
имеется конечно вначале, когда еще не вся- теплота реакции нитрования
равномерно распределилась. Случалось, что реакционная смесь в течение-
1 мин. разогревалась от 60 до 110° и даже до 140°, так что слишком за-
поздалое включение охлаждения не могло остановить повышения темпе-
ратуры. В одном особенно неприятном случае температура повысилась
II. Нитропроизводные бензола и его гомологов
381
и течение 30 сек. от 60 до 140° и выше. Произошла бурная реакция: ни-
•грозньге газы, выделявшиеся в огромном количестве и имевшие выход че-
рез широкую вытяжную трубу, в силу возросшего давления выбили смо-
тровые стекла, быстро заполнили нитрационную мастерскую и пошли из
абсорбционной башни обратно. Затем из разбитого смотрового стекла
дважды вырвалось короткое пламя. Если бы внутреннее давление было не-
сколько больше и ие выравнялось так быстро при помощи вытяжной трубы,
то внутри аппарата оно прогрессивно в течение нескольких секунд воз-
росло бы до величины взрывчатого разложения. На случай по-
добных происшествий . на крышке широкого лаза необходимо иметь пре-
дохранительное приспособление, которое позволило бы крышке подняться
•от толчка в результате повышения давления в аппарате (ср. например упру-
гую пружину на крышке лаза аппарата, изображенного на рис. 204). Это
исключительное происшествие вероятно может быть объяснено тем, что
нитрование на динитропродукт прошло не до конца и что при смешении
с концентрированной нитрующей смесью сразу началось образование ди-
нитропродукта, что наряду с одновременно происходившей тринитрацней
привело к очень бурному течению процесса. Между тем продукт имел
нормальный цвет и обычную температуру затвердевания.
Не менее опасный случай имел место между прочим и при обычно спо-
койно протекающей динитрации. Температура также поднялась до 150°
(может быть, и выше: термометр был всего на 150°), содержимое аппарата
вспенилось и через разбитый смотровый фонарь вытяжной трубы было вы-
брошено из аппарата в рабочее помещение. Продукт почернел, частично
обуглился, и загрузка была испорчена. Такое исключительное течение про-
цесса может быть объяснено тем, что нитрующая смесь (вследствие ошибки
при ее составлении) была слишком слабой, чтобы тотчас же пронитровать
поступающий толуол, и только после того, как весь толуол был прибавлен,
при некоторой температуре вся масса вступила в реакцию одновременно.
&ти два примера показывают, какое тщательное наблюдение необходимо
даже за простейшими процессами, чтобы исключить возможность неприят-
ных случайностей.
Процесс нитрования продолжается 2—2^ часа, после чего не-
обходимо повысить температуру на некоторое время до 100—
110°. Прежде чем опорожнить аппарат, необходимо взять пробу
продукта ц. определить температуру его затвердевания. Затем все
отверстия аппарата герметически закрываются, и содержимое,
составляющее около 4600 кг, с помощью сжатого воздуха пере-
давливается в сепаратор. Второй сепаратор служит запасным
хранилищем для отработанной кислоты тринитрации.
Тринитрация протекает менее гладко и совершенно, чем ди-
нитрация. Это особенно обнаруживается по сильному выделению
иитрозных газов, которые удаляются из аппарата через вытяж-
ную трубу. Процесс тринитрации сопровождается побочным
процессом окисления. Начиная с температуры 75°, как
правило, образуются закись азота и азот, двуокись и окись
углерода1, между тем как при нитровании мононитротолуола
до динитротолуола никаких потерь азотной кислоты не происхо-
дит. Повышение температуры, продолжительность процесса и
особенно повышение давления ведут к образованию тр ин и т-
робензойной кислоты, а затем и тетранитроме-
1 О газообразовании при приготовлении тринитротолуола см. Z. f. Schiess-
u. Sprw., 1932, 218.
1Mb..
382 Взрывчатые нитросоединения ароматического ряда
тана с полным разрушением бензольного ядра. В подобных
производствах всегда имеется своеобразный запах тетранитроме-
тана, сходный с запахом азотистой кислоты. По данным.
Ф о й г т а в присутствии нитратов окисление может итти на-
столько далеко, что после введения второй нитрогруппы нитро-
вание останавливается и вместо дальнейшего нитрования про-
исходит образование нитробензойных кислот. Хотя
образование тринитробензойной кислоты в условиях тринитрации
толуола не могло быть доказано, однако очень возможно, что
Рис. 163. Сепаратор непрерывного
действия (для ТНТ — железный, го-
могенно освинцованный изнутри,
емкостью 1,5 м3).
но до тринитротолуола, го по
следующим образом.
именно побочные продукты об-
условливают красноватое окра-
шивание сырого тринитрото-
луола и повышенную чувстви-
тельность к удару. Этими по-
бочными явлениями объясняет-
ся то, что выход вместо воз-
можных 1222 кг достигает всего
приблизительно 1060 кг сыро-
го тринитропродукта. Довольно-
большое сходство с приведен-
ным процессом производства
имеет способ, предложенный
Томасом, по которому 1000 кг
расплавленного динитротолуола
приливаются при 80° и переме-
шивании к кислотной смеси,
составленной из 2665 кг, 20% -
ного олеума и 704 кг азотной
кислоты уд. в. 1,5. При темпера-
туре, не превышающей 95°, по-
лучается 1100 кг тринитро-
толуола, имеющего темп. пл.
77—79° !.
Если требуется нитровать,
мононитротолуол непосредствен-
Лацгеншейдту поступают
500 кг о-н итротолуола растворяют в 1400 кг моногидрата
(100%-ной серной кислоты) и подогревают до 60—70°. Потом приливают
тонкой, но непрерывной струей кислотную смесь, состоящую из 700 кг мо-
ногидрата и 700 кг азотной кислоты 48° Вё (примерно 1,4-кратный избы-
ток). Вначале реакция протекает очень энергично и требует сильного охла-
ждения. Последующее падение температуры указывает на то, что о-нитро-
толуол превратился в динитропродукт; когда нитрующая смесь
будет прибавлена, медленно подогревают до начала новой реакции — ни-
трования динитротолуола до тринитротолуола. Выделение тепла в даль-
нейшем протекает не так сильно, как при первой реакции. Без охлажде-
1 Ам. пат. 1814980 (1927).
II. Нитропроизводные бензола и его гомологов 383'
ния температура самопроизвольно повышается до 120—130°, и на этом
уровне ее целесообразно поддерживать с помощью подогрева паром еще-
в течение 1 часа. Затем охлаждают до 100° (?) и для полноты выделения
тринитропродукта прибавляют 200 л воды (!). Такой способ выделения:
тринитротолуола по мнению автора книги вследствие взрывообразного
выделения тепла, паров и газов является невыполнимым.
В другом, также употребительном способе производства исхо-
дят из «жидкого динитротолуола» — продукта, выделяемого
в виде жидкого масла при получении чистого о-, п-динитрото-
луола из сырого динитротолуола, полученного нитрованием
моно,нитротолуола. Это масло, содержащее, наряду с динитро-
Рис. 164. Нитраторы Акц. О-ва Bofors Nobelkrut.
толуолами, еще оба моно- и немного динитропродукта, прибли-
зительно соответствует 1%-кратной степени нитрования.
До войны особый способ производства употреблялся в Ита-
лии. Вследствие высоких налогов на спирт не приходилось и
думать о перекристаллизации сырого тринитротолуола из этого
растворителя, вследствие чего по необходимости приходилось
брать в качестве исходного продукта возможно более чистый
динитротолуол, из которого после нитрования при простой про-
мывке без какой-либо очистки получался годный продукт, имев-
ший темп. пл. 80°.
Проблема автоматического непрерывного нитрования толуола
До тринитротолуола еще не разрешена удовлетворительным обра-
зом; по крайней мере все крупные заводы взрывчатых веществ
До сих пор еще работают на аппаратах периодического действия..
384 Взрывчатые нитросоединения ароматического ряда
Промывка кислого тринитротолуола
После приблизительно 2-часового отстаивания загрузки в се-
параторе при 80—90° отработанная кислота отделяется от пла-
З’ис. 165. Гомогенно освинцованный аппарат
для промывки низкоплавких нитропродуктов
горячей водой:
1—подвод горячей воды из резервуара; 2—тринитрото-
луол; з—термометр; -/—пар—сжатый воздух; 5—вытяж-
ная труба; 6—крышка люка; 7—вода; 8— труба для горя-
чей воды; 9— гильза термометра; 10—тринитротолуол;
11—свинцовый змеевик; 12— впуск пара; 13—сток кон-
денсата; 14— спускной кран с обогревом; /5—платформа.
вающего поверх нее три-
нитротолуола. Отрабо-
танная кислота, содержа-
щая в растворенном со-
стоянии приблизительно
% общего количества
тринитротолуола, пред-
ставляет собою желтую
густую жидкость, кото-
рая ниже 70° затвердевает
и поэтому может пере-
давливаться только по
предварительно нагретым
трубам и по возможно-
сти через обогреваемые
краны. Закупоривание
кислотного трубопрово-
да — явление чрезвычай-
но неприятное, и пред-
отвращение его — основ-
ное условие для беспере-
бойного хода производ-
ства тринитротолуола.
Отработанная кис-
лота сливается в мон-
тежю и из него) переда-
вливается в аппараты для
второй нитрации, и пос-
ле освежения 650 кг
концентрированной азот-
ной кислоты (46—47° Вё)
ею можно пронитровать
500 кг толуола. Под
спускным краном сепара-
тора в трубу вставляется
цилиндрическое смотро-
вое стекло, которое по-
зволяет наблюдать мо-
мент появления тринитротолуола в трубе и своевременно
прерывать спуск кислоты. Этот момент определяется очень
легко, так как кислота бывает всегда зеленовато-желтого цвета,
непрозрачная и мутная; нитропродукт, напротив, темного
желтоватого цвета и прозрачен. Тротил в среднем в количестве
П. Нитропроизводные бензола и его гомологов 385
1060 кг (в установившемся производстве продукт, растворенный
в отработанной кислоте, получаемой при тринитрации, в первой
нитрации вновь вступает в оборот) поступает в промывной аппа-
рат (рис. 165), который наполняется приблизительно 2500 л воды,
нагретой до 75—80°. Непосредственно после этого производится
перемешивание острым паром, для чего через имеющийся на дне
промывного аппарата спиралеобразный свинцовый змеевик
с большим количеством отверстий в течение 2—3 мин.
пропускают пар так, что жидкий тринитропродукт эмуль-
гируется в воде. Температура промывной воды при этом
повышается на 5—10°, и выделяется большое количество
белых раздражающих глаза паров тетранитрометана,
которые следует тщательно отводить вытяжной вентиля-
цией. По прошествии % часа промытой продукт отстаи-
вается и сливается в расположенный ниже второй промыв-
ной аппарат, в который налито такое же количество воды, нагре-
той до 80°. Этот аппарат снабжен подобными же приспособле-
ниями, так же тщательно освинцован и посредством широкой
вытяжной трубы связан с керамиковым центробежным насосом.
Наиболее пригодным является гомогенное освинцование,
т. е. такое, при котором слой свинца посредством слоя олова
припаян непосредственно к чугуну. Эти аппараты нагреваются
значительно быстрее и при небольших неплотностях в свинцовой
рубашке деформируются и приходят в негодность не так быстро,
как при обычном свинцевании. Удобны, даже необходимы для
беспрепятственного спуска легко застывающего сырого три-
нитропродукта обогреваемые краны из типографского сплава.
Вторичное перемешивание 2—2%-атмосферным паром длится
2—3 мин., и после отстаивания эту операцию повторяют
в третьем, расположенном ниже промывном аппарате такой же
конструкции и величины. После такой обработки тринитротолуол
совершенно не содержит кислоты и после отстаивания в течение
% часа может быть слит в керамиковый противень. Горячая
слабокислая вода' из нижних аппаратов сливается в монтежю и
передавливается из него в аппарат, расположенный наверху, где
используется для первой промывки. Свежая вода наливается
только в оба нижних аппарата, соединенных с мерником
емкостью приблизительно 6000 л, который расположен выше аппа-
ратов и в котором вода может быть быстро нагрета острым
паром до необходимой температуры. Перед выгрузкой тринитро-
толуола необходимо произвести испытание образчика его на
нейтральность. Отбирают несколько килограммов тротила,
50—100 г из отобранной пробы нагревают с равным количеством
воды, затем дают пробе охладиться, раствор фильтруют, и если
этот раствор с дифениламином в присутствии серной кислоты
дает не более чем слабосинее окрашивание, то продукт при-
знается хорошим и может быть выгружен. Температура затвер-
девания вполне сухого продукта колеблется между 76 и 77,5°.
25 Зак. 3171. —Штетбахер.
386 Взрывчатые нитросоединения ароматического ряда
Сырой тринитропродукт после промывки в освинцованном
аппарате имеет вид прозрачной маслообразной жидкости от тем-
нокрасного до коричневого цвета, которая при затвердевании
становится более светлой. Вследствие летучести тринитротолуола
при этой температуре и раздражающего глаза действия паров
тетранитрометана эта работа причисляется к наиболее неприят-
Рис. 166. Промывной аппарат для тринитрото-
луола из кислотоупорной стали (Bofors).
ным из всего цикла производства тринитротолуола; эта работа
не столько вредна и опасна для здоровья, сколько тягостна.
По истечении 6—8 час. сырой тринитротолуол затвердевает на
противнях в виде блоков по 30—40 кг, внутри которых обра-
зуются большие пустоты с прекрасными образованиями (дру-
зами) кристаллов и включением паров тетранитрометана, запах
которого сходен с запахом нитрозных газов, вследствие чего
продукт часто ошибочно принимают за кислый и непригодный-
II. Нитропроизводные бензола и его гомологов
387
Промывку сырого тринитротолуола необходимо производить
возможно быстро и при не слишком высокой температуре. Чем
больше удалено кислоты и чем больше реакция промывных вод
приближается к нейтральной, тем быстрее темнеет окраска пер-
воначально желтого продукта. Если готовый промытый сырой
тринитротолуол обрабатывать дальше в освинцованном промыв-
ном аппарате, то при каждом впуске пара он темнеет все больше,
становится коричневым, темнокоричневым и наконец черным.
Одновременно замечено, что кислота не отмывается полностью,
как бы длительно ни производилась промывка, и всякий раз
обнаруживается наличие следов кислоты, которые с дифенилами-
ном дают слабое синее окрашивание. Если исследовать промыв-
ные воды, то также обнаруживается кислотность. К о п и с а-
р о в у удалось показать, что расплавленный тринитротолуол
в кипящей воде несколько гидролизуется с расщеплением на азо-
тистую кислоту и производные фенола (динитрокрезол), кото-
рые способны реагировать со свинцом промывного аппарата,
образуя темнокоричневые тяжелые свинцовые соединения, в част-
ности динитрокрезилат свинца, собирающиеся на дне промывного
аппарата и примешивающиеся к сырому тринитротолуолу. От
времени до времени эти соединения из промывного аппарата не-
обходимо удалять, иначе они переходят на фильтр и загрязняют
его. Вследствие этого все больше и больше появляется стремле-
ние заменить освинцованные промывные аппараты аппара-
тами из стали марки V2A, так как в этом случае не при-
ходится опасаться ни изменения окраски, ни образования
солей.
Готовый, промытый до нейтральной реакции сырой три-
нитротолуол для промышленного применения по большей ча-
сти тотчас же гранулируется, т. е. превращается в зерна
округлой формы путем медленного приливания расплавлен-
ного тринитротолуола из горячего промывного аппарата
в большое количество холодной воды, находящейся в сильном
движении.
Тяжелым бременем для производства тринитротолуола
являются красно-коричневые кислые промывные воды, которые
ежедневно собираются в большом количестве. Эти горячие про-
мывные воды содержат немного тринитротолуола, который по
охлаждении и разбавлении выделяется в виде чрезвычайно тон-
кого и рыхлого шламма. Из-за ядовитости и опасности закупо-
ривания трубопроводов промывную воду не следует сразу спу-
скать в сток; ее нужно пропустить сначала через ряд чанов для
охлаждения и разбавления, чтобы здесь, а затем в ящиках для
отстаивания из нее могла высадиться большая часть тринитро-
толуола. Тротиловый шламм периодически извлекается из чанов
и ящиков для отстаивания промывных вод, переплавляется и
применяется для приготовления аммиачноселитренных взрывча-
тых веществ.
25*
388 Взрывчатые нитросоединения ароматического ряда
Очистка
По данным Паскаля сырой тринитротолуол состоит из
следующих изомеров:
а- или 1, 2, 4, 6-тринитротолуол 95,5%, теми. пл. 80,6°
1, 3, 4, 6- „ 2,90/о
1, 2. 3, 4- . J,3P/0
1. 2, 3, 6- „ 0,3%
Из них только симметричный тринитротолуол собственно счи-
тается стойким взрывчатым веществом, остальные изомеры сле-
дует возможно полнее удалить. Во время войны в странах Ан-
танты это удаление осуществлялось обработкой 3—5%-ным рас-
твором сульфита \ с помощью которого удаляются асимметрич-
ные тринитротолуолы, тетранитрометан и постоянные спутники —
продукты окисления; симметричное же a-соединение, а также
динитротолуолы, динитробензол и тринитро-л-ксилол остаются
неизмененными. Этим способом из сырого тринитротолуола,
имеющего температуру затвердевания 78°, можно легко полу-
чить продукт с температурой затвердевания 80,5°.
Однако более совершенная очистка производится по способу,
применявшемуся еще раньше, а именно перекристалли-
зацией из спирта. Неочищенный продукт не удовлетворяет
современным военным требованиям в отношении температуры
затвердевания, равной 80,5—80,6°. Растворение и кристаллизация
сырого тринитротолуола производятся в высоких, по крайней
мере трехэтажных зданиях, которые расположены несколько
в стороне от других установок. Практика показала, что в про-
изводстве тринитротолуола несчастные случаи происходят по
большей части в здании кристаллизации. При этом опасность
представляет не взрывчатое вещество, а спирт; в отделении кри-
сталлизаторов, в частности на центрофугах, для смеси спирта
с воздухом достаточно небольшой искры, чтобы вызвать пожар,
который трудно потушить.
Кристаллизация производится в аппаратах, расположенных друг над
другом по вертикали. На самом верху находятся два эмалированных р е-
зервуара для растворения емкостью 3000 л каждый, рядом рас-
положен резервуар емкостью около 6000 л, из которого можно спускать
требующееся количество растворителя, наблюдая за мерным стеклом с де-
лениями. Так как спирт способен растворять тринитротолуол в количестве,
равном всего лишь около У» своего веса, то наиболее пригодной оказалась
смесь 92 ч. 95%-ного спирта и 8 ч. бензола, которая, будучи на-
грета до кипения, растворяет тринитротолуол до */.-> своего веса. Резер-
вуары для растворения подобно кристаллизаторам (рис. 167) имеют широ-
кие и плоские днища и снабжаются медленно вращающимися мешалками
с оставлением между последними и стенками и днищем лишь небольших
пространств. Над этими резервуарами устанавливается обратный холодиль-
М urao u г, Bull. Chim. de France, 1924, 367—370.
II. Нитропроизводные бензола н его гомологов 389
ник высотой 2—3 м, в котором конденсируется испаряющийся раствори-
тель. Тринитротолуол измельчается деревянными молотками на деревянном
помосте н в кусках величиною с кулак загружается в резервуар для рас-
творения; на 500 кг тринитротолуола требуется 2500—2600 л спирта. При
медленном подогревании растворителя до кипения (78°) происходит рас-
творение; по истечении 1—1% час., содержимое сливается на фильтр,
соединенный с кристаллизатором и включенный в вакуум-линию. Чтобы
избежать кристаллизации почти насыщенного раствора во время фильтрова-
ния и слива в кристаллизатор, все трубопроводы, фильтры и сливной кран
Рис. 167. Кристаллизаторы - для тринитротолуола из обыкновенного
чугуна (на одном из заводов Westfalisch-Anhaltische Sprengstoff A.-G.,
Берлин).
обогреваются паром. Через —3Л часа в зависимости от продолжительно-
сти службы фильтровального сукна раствор собирается в кристаллизато-
рах, где кристаллизация тринитротолуола ускоряется при помощи охла-
ждающей рубашки и мешалки. Эти аппараты имеют несколько конические
днища и так же, как и мешалки, покрыты эмалью.
За 6—8 час. выделение тринитротолуола заканчивается; при
этом целесообразно прерывать кристаллизацию уже при 25°, так
как ниже 30° кривая растворимости становится очень плоской и
увеличение выхода при все более замедляющемся охлаждении не
может итти ни в какое сравнение с соответствующей потерей
времени. (Как редкий случай следует указать, что на одном
испанском заводе до войны позволяли себе роскошь охлаждать
кристаллизаторы с помощью холодильных машин до
390 Взрывчатые нитросоединения ароматического ряда
—8 и —10°; точно так же там считали необходимым промытый
до нейтральной реакции сырой тринитротолуол обрабатывать
в стабилизаторах с ацетоном и содой, причем никакого
улучшения стойкости продукта не происходило, но зато имело
место потемнение и осмоление его поверхности.) Кристал-
лическая масса в виде кашицы спускается на большой нуч-фильтр
Рис. 168. Кристаллизатор с железной рубашкой для нагрева-
ния паром и охлаждения водой:
/—фичьтрат; 2—термометр; 3—приспособление для задержки жидкости;
4—вакуум; 5—вакуумметр; ~6 впуск пара; 7—охлаждающая вода; в—сток
охлаждающей воды; 9—конденсационный горшок; 10— к нучу; //—камен-
ный пол.
и в два или три приема с помощью вакуума отделяется от темно-
красного маточного раствора. Затем влажная кристаллическая
масса поступает в две расположенные рядом центрофуги и в них
промывкою небольшим количеством спирта совершенно освобо-
ждается от маточного раствора. После центрофугирования про-
дукт получается от слабожелтого до белого цвета (серовато-
белый) и содержит всего лишь 2,5% спирта, который удаляется
в сушилках при 50—60°. Для ускорения высушивания содер-
жимое сушилок перемешивается и через 6—7 час. кристаллизо-
ванный тринитротолуол содержит в среднем всего около 0,03%
влаги. Выход 400 кг чистого тринитротолуола с температурой
затвердевания 80,4—80,6е, или 80% от взятого для кристаллиза-
II. Ннтропронзводные бензола и его гомологов
391
ции сырого тринитротолуола, что на исходный толуол составляет
приблизительно 1,7.
Кроме общепринятого способа перекристаллизации из спирта
необходимо указать еще на перекристаллизацию из толуола
или из о-н итротолуола, причем при пользовании последним
в той же самой аппаратуре можно перекристаллизовывать коли-
чества в 4—5 раз большие с затратой меньшего количества вре-
мени и с более высоким выходом конечного продукта.
2000 кг сырого тринитротолуола нагреваются до 80° с 7000 кг о-нитро-
голуола, в результате чего получается сильно пересыщенный раствор, ко-
торый фильтруется н охлаждается в кристаллизаторе; чтобы избежать кри-
сталлизации продуктов низших степеней нитрации, охлаждение целесо-
образно вести не ниже 16°; процесс охлаждения протекает значительно
быстрей, чем прн кристаллизации из спирта. Кристаллическая масса отжи-
мается на нуч-фнльтре, затем центрофугируется и для окончательного уда-
ления нитротолуола промывается небольшим количеством холодного спирта.
При конечной температуре 16° выход кристаллизованного, очень светлого
продукта с температурой затвердевания не ниже 80° достигает 90%. Кроме
упомянутой выгоды главное достоинство этого способа заключается в том,
что продукты низших степеней нитрации остаются в растворителе, кото-
рый служит исходным продуктом для производства тринитротолуола и мо-
жет быть непосредственно подвергнут нитрованию.
Ректификация растворителя
Коричнево-красный сиропообразный маточный раствор, отде-
ляемый в здании кристаллизации, должен непрерывно подвер-
гаться регенерации, разделению на спирт и жидкий тро-
тиловый остаток (тротиловое масло). Это разделение
производилось прежде, да и теперь еще производится, в перио-
дически работающих перегонных аппаратах с колонкой, снабжен-
ной насадкой; эта система ныне устарела и все более и более
вытесняется ректификационным процессом непрерывного
действия.
Аппарат, установленный в высоком пятиэтажном здании, состоит нз
дестилляционной колонны, нагреваемой непосредственным впуском пара,
и из установленной на ней ректификационной колонны немного меньшего
диаметра. Обе колонны снабжены особыми колоколообразны мн
тарелками, разделяющими их на ряд камер. Жидкость, подвергаемая рек-
тификации, в данном случае спиртовой маточник от кристалли-
зации тринитротолуола, непрерывно вводится в переходную
часть, находящуюся между колоннами. Растворитель — этиловый спирт —
испаряется и поступает в верхнюю ректификационную колонну, в то время
как остающаяся богатая водой жидкость поступает в дестилляционную ко-
лонну и выходит из нижней части ее совершенно освобожденной от спирта.
В верхней части ректификационной колонны имеется труба, по которой
пары отгоняемой жидкости поступают в конденсатор, к которому присо-
единяется второй маленький конденсатор (воздушный холодильник). В кон-
денсаторе пары конденсируются, и дестнллат частично обратно стекает
в ректификационную колонну, а частично отбирается из конденсатора и
отводится через холодильник, снабженный двумя змеевиками, таким обра-
зом, что продукт, стекающий из первого конденсатора, можно собирать
отдельно от конденсата из воздушного холодильника (конденсат из воз-
душного холодильника часто содержит легколетучие примеси). Освобо-
392 Взрывчатые нитросоединения ароматического ряда
ж денная от спирта жидкость, вытекающая из нижней части колонны, по-
ступает в сепаратор, в котором «производится отделение нитропродуктов,
содержащихся в исходной смеси. Горячая остаточная жидкость обычно
отводится через теплообменник, где происходит отдача части содержаще-
гося в ней тепла жидкости, поступающей на дестилляцию.
С помощью особых регуляторов поступления ректифицируемой
жидкости, греющего пара н охлаждающей воды обеспечивается совершенно
автоматическая работа аппарата.
Рис. 169. Ректификационный1 аппарат для растворителей (спирт,
эфир, ацетон, вода) непрерывного действия с одновременным отде-
лением воды
1 вид спереди 2 вид сбоку
D—дестилляциоиная колонна; /?—ректификационная колония; К—конденсатор;
й—малый конденсатор (воздушный холодильник); V— холодильник; IF—водяной
бак; а—отделитель; w—теплообменник; г—регулятор пара.
В этой непрерывно действующей системекак правило, полу-
чают спирт крепостью 94% (весовых). Обыкновенно из кристал-
лизационных установок в производствах тринитротолуола на
регенерацию отходит громадное количество спирта, достигающее
30 000 л в день.
1 Герм. пат. 300127 от 15 сентября 1916 г., далее Р. Wonneberger,
Die Kontinuitat der Rektifikation, insbesondere von alkoholischen Fliissigkeiten,
Z. f. Schiess- u. Sprw., 1915.
II. Нитропроизводные бензола и его гомологов
393
Если остаток от перегонки, так называемый жидкий тринитро-
толуол, не удалять периодически или непрерывно, то он, являясь
плохим проводником тепла, может легко перегреться около на-
греваемых паром труб и разложиться. Синевато-черная масса при
этом загустевает и при охлаждении затвердевает в асфальто-
образную твердую смолу, причем опасность возрастает еще
больше, так как остаток обладает значительно боль-
шей чувствительностью, чем чистый тринитротолуол.
Помимо этого замечено, что чем выше уровень жидкого остатка
в перегонном аппарате, тем больше бурых паров (двуокиси
азота) выделяется из вентиляционной трубы. Насколько опасна
совокупность обоих этих моментов, показывает случай, имевший
место в одной лаборатории, где остаток от дестилляции в коли-
честве 500 г осторожно нагревался на песчаной бане. Как только
отогнался весь спирт и температура достигла 97°, произошла вне-
запная взрывоподобная вспышка, сопровождавшаяся
выделением темнокрасного пламени и облака сажи. Этот случай
дает общее представление о том, что может произойти на заводе
в колонне Рашига периодического действия, если испаритель
окажется неразгруженным своевременно.
Маточный спиртовой раствор всегда содержит небольшое
количество азотнокислого эфира, а иногда также не-
большое количество кислоты. Поэтому в начале и в конце
перегонки всегда происходит выделение небольших количеств,
бурых паров, которые частично отходят со спиртом, но в боль-
шей своей части удаляются через вентиляционную трубу. Далее,
в большинстве случаев непосредственно после появления первых
капель конденсата в приемнике наблюдаются белые пары, обла-
дающие эфирным запахом, представляющие собою по всей ве-
роятности этилнитрит, кипящий при 18°. Часто замечается,
также сильный запах остающегося в спирте летучего тетра-
нитрометана.
Кроме нормальной дестилляции маточного раствора от кри-
сталлизации время от времени приходится производить де-
стилляцию водного спирта с содержанием 40—45%
спирта, получаемого из абсорбционных устройств для улавлива-
ния паров из воздуха (от вакуум-установок); спирт перекачи-
вается в особые резервуары и после накопления в количестве
около 8000 л подвергается ректификации.
Подача спирта в здание кристаллизации, на склад или
в здание дестилляционной установки, а равно из одного из;
указанных помещений в другое производится с помощью
центробежных насосов.
Описанный процесс производства тринитротолуола является
одним из множества возможных вариантов, которые реа-
лизуются в зависимости от наличия в данной стране тех или
иных механических и химических вспомогательных средств.
Крупные заводы, например германские или американские, имею-
394 Взрывчатые нитросоединения ароматического ряда
щие за плечами десятилетия производственного опыта и рабо-
тающие на основе новейших данных, оборудованные, так сказать,
со всем современным техническим комфортом, обладающие всеми
средствами и видами энергии и безукоризненно разработанными
способами, естественно, во многом превосходят мелкие производ-
ства, втиснутые в жалкие рамки в сотни раз меньшего капитала.
Вообще в таких производствах, где исходные продукты до
превращения в конечный продукт проходят большое число про-
межуточных стадий, мелкие производства всегда невыгодны.
Крупные производства дают возможность изготовлять каждый
промежуточный продукт технически наиболее совершенным спо-
собом, соблюдать наиболее целесообразные и экономичные усло-
вия использования аппаратуры и кислот, а также переработки
побочных продуктов, для чего при постройке заводов необхо-
димо предусмотреть возможность непрерывной работы всех рас-
положенных вблизи друг от друга производств и по возможности
выравнивать невыгодность промежуточных стадий. Чем меньше
производство, чем более скудно оно оборудовано, тем труднее
предохранить его от неполадок и остановок. Незначительные по-
вреждения, необходимость небольшого переоборудования доста-
точны для того, чтобы остановился весь ряд последовательных
операций, а это связано с тягостными заминками или останов-
кой производства, при которой вдвойне страдает аппаратура и
нормальный ход производства дается только с большим трудом.
Свойства тринитротолуола
Тринитротолуол бывает двух сортов: так называемый некри-
сталлизованный и кристаллизованный. Некристаллизованный три-
нитротолуол представляет собою массу, окрашенную в -желтый до
красного, часто коричневатый цвет и плавящуюся при 76—78°, пе-
рекристаллизованный же — рыхлый кристаллический порошок
от желтого до белого цвета, имеющий темп. пл. 80—81,5°, т. е.
являющийся почти химически чистым а-, или 1, 2, 4, 6-тринитро-
толуолом. Из шести теоретически возможных изомеров известны
л ять, а именно:
II. Нитропроизводные бензола и его гомологов
395
₽- и г-тринитротолуолы были изолированы Виллем1 из
отходов производства симметричного a-продукта и получены не-
посредственным нитрованием м-нитротолуола, между тем как
четвертый, тоже симметричный 8-, или 1, 3, 4, 5-тринитротолуол
был получен Кернером2 и Контарди обходным путем,
через симметричный динитродиазотолуол. Пятый, 1, 2, 3, 6-изо-
мер содержится по Костевичу3 в сыром тринитротолуоле
в количестве около 0,3%. 1, 3, 5, 6-тринитротолуол еще не син-
тезирован.
Под взрывчатым веществом, называемым «тринитротолуолом»,
обыкновенно подразумевается a-соединение; оно плавится, как
установил с помощью чистейшего продукта Р и н т у л ь, при
80,8—80,85°, образуя прозрачную желтую жидкость, и при даль-
нейшем нагревании сначала немного возгоняется, а затем разла-
гается с образованием тяжелых, крайне неприятных паров. Быст-
рое нагревание до 240—250° может иногда вызвать взрыв, но
чаще всего происходит сгорание с обильным дымообразованием.
От пламени тринитротолуол воспламеняется трудно и при доста-
точном нагревании медленно горит с темнокрасным пламенем и
выделением обильного количества копоти. Тринитротолуол
растворим в воде очень трудно: всего в количестве 0,02% при
15° и 0,16% при 100°. Соответственно мала также его гигро-
скопичность, которая составляет всего 0,05%. Тринитротолуол
легко растворим в эфире, ацетоне, бензоле, толуоле и лигроине,
труднее в спирте (1,6% при 22°) и еще труднее — в сероугле-
роде. Хорошим растворителем для а-тринитротолуола является
также концентрированная серная кислота, из которой он может
быть высажден добавлением воды.
Тринитротолуол считается нейтральным соединением, но он
легко реагирует со щелочами, а с углеводородами, фенолами и
аминами образует продукты присоединения. Соли, образующиеся
при взаимодействии его со щелочами, окрашены в темнокрасный
цвет и взрывчаты: по Кописарову тринитротолуол, нагретый
с небольшим количеством едкого кали, взрывает уже при 160°.
Как и большинство нитросоединений, тринитротолуол медленно
окрашивает кожу в красновато-коричневый
цвет.
Плотность кристаллического тринитротолуола при ручной
упаковке достигает не выше 1,1, плавленого не более чем 1,54,
прессованием же под давлением 3000—4000 ат можно получить
плотность 1,60—1,62.
При затвердевании расплавленного тринитротолуола в вакууме
его плотность по удалении воздуха повышается с 1,54 до 1,58;
более высокую плотность (1,615) получают только при непре-
1 Вег., 1914, 704.
’ Z. f. Schiess- u. Sprw., 1915—65; Gazz. cbim. italiana I, 227 (1917).
3 Tarry-matter, II, Париж 1927.
396 Взрывчатые нитросоединения ароматического ряда
Рис. 170. Возрастание плотности
тринитротолуола и тринитрофенола
с увеличением давления прессования.
рывном нарушении кристаллизации, а не при действии сжатого
до 3—4 ат давления воздуха, как утверждают многие. По Мей-
снеру простым «нарушением кристаллизации» тротиловый за-
ряд 42-см снаряда уда'етвя получить с высшей плотностью
1,61—1,615, правда, всякий раз непременно с образованием
прибыли.
Воздух, как сухой, так и влажный, тринитротолуола не изме-
няет. От длительного действия яркого дневного света тринитро-
толуол медленно окрашивается с поверхности в коричневый цвет,
причем температура его затвердевания понижается, что указы-
вает на небольшое разложе-
ние от действия света. В отно-
шении воздействия тепла три-
нитротолуол по сравнению с
пироксилином и нитроглице-
рином является очень стой-
ким. При 140° тринитрото-
луол еще довольно стоек. Так
например после нагревания
при 130° в течение 100 час.
не наблюдается никакого из-
менения температуры плавле-
ния; после 160-часовой вы-
держки при 145—150° наблю-
дается понижение температу-
ры плавления с 80,75 до 80,11°.
Насколько это вещество стой-
ко, лучше всего видно из то-
го, что Д ж и у a (Giua) уда-
лось перегнать его в вакууме
(10—12 мм) при 210° без признаков разложения. Однако при на-
гревании при обычном атмосферном давлении разложение начи-
нает становиться заметным при 150°, быстро увеличивается при
повышении температуры и выше 200° становится бурным. Между
304 и 320° происходит вспышка с выделением пламени и
копоти, но взрыва не наступает; взрыв происходит только
в закрытой оболочке, .например при нагревании в прочной,
хорошо запаянной стеклянной трубке: детонация настолько
сильна, что стеклянная оболочка раздробляется в тончайшую
пыль.
Тринитротолуол является малочувствительным взрывчатым
веществом и в сплавленном, спрессованном виде трудно детони-
рует. Взрывчатое действие его лишь несколько слабее, чем
у пикриновой кислоты, детонирующей с большей скоростью:
теплота взрывчатого разложения1 его составляет
1 Robertson a. Garner, Proc. Roy. Soc., 1923, 103, стр. 539.
II. Нитропроизводные бензола и его гомологов
397
925—937 б. кал/кг (вода парообразная). Бихе ле м были най-
дены следующие величины (сравнительно с пироксилином):
Взрывчатое вещество
Тринитротолуол . . .
Пикриновая кислота .
Пироксилин сухой . .
Пироксилин влажный
1,55 плавленый
1,60 затвердевший
под давлением
1,60 прессованный
1,64 плавленая
1,22 прессованный
1,35
80 850 1485
20 768 1520
5 887 1810
40 902 1 400
Ценность тринитротолуола для военных целей заключается
в безопасности его при стрельбе, т. е. нечувстви-
тельности к толчкам и резким ударам, которые испытывают
днища и разрывные заряды при выстрелах. Тринитротолуол
в этом отношении является лучшим взрывчатым веществом; при
свойственном ему хорошем бризантном действии он вполне безо-
пасен в отношении преждевременных разрывов.
Вообще безопасность в отношении взрыва считается самым цен-
ным, самым выгодным свойством этого взрывчатого вещества:
доказательством этого может служить взрыв спирта в тротиловом
корпусе завода взрывчатых веществ б. Аллендорф в Шёне-
беке на Эльбе.
5 мая 1909 г. в кристаллизационном отделении тротилового корпуса
вследствие разогревания одной центрофуги от трения произошел взрыв
смеси паров спирта с воздухом, которым было разрушено здание и убито
несколько человек. Находившийся в центрофуге, в которой произошел
взрыв паров спирта, а также нагроможденный вблизи в количестве более
1000 кг тринитротолуол горел спокойно, хотя и мощным пламенем, сопро-
вождавшимся резким шумом. Наиболее поразительной оказалась стойкость
тринитротолуола, находившегося в трех кристаллизаторах, в которых в мо-
мент взрыва был спиртовый раствор тринитротолуола. После продолжав-
шегося в течение двух суток пожара обнаружилось, что тринитротолуол,
находившийся в кристаллизаторах, даже не сгорел; таким образом даже
тепла от горения спирта, увеличенного внешней теплотой пожара, было
недостаточно, чтобы вызвать горение и взрыв влажного тринитротолуола.
Точно так же тринитротолуол, находившийся в жестяной упаковке .в уку-
порочном кирпичном здании в количестве более 1000 кг, полностью сгорел
без каких-либо явлений взрыва, причем вся жесть и даже кирпичная
кладка расплавились от исключительно высокой температуры.
Но наряду с этими почти несокрушимыми доводами в пользу
безопасности тринитротолуола в обращении известны и случаи
противоположного характера. Так, на одном германском троги-
398 Взрывчатые нитросоединения ароматического ряда
ловом заводе в 1915 г. от неизвестной причины взорвалось 100 кг
готового тринитротолуола, находившегося в чане промывного
Рис. 171. Совре-
менная 7,5-см по-
отдела. Все промывные и сушильные устрой-
ства были разрушены и четверо рабочих, ра-
ботавших поблизости, были убиты, а четверо
других тяжело ранены обломками. Несмотря на
серьезное расследование, причина взрыва так и
осталась невыясненной.
Военные требования, предъявляе-
мые к тринитротолуолу
левая граната
Разрыиной
заряд:
Тринитро-
толуол . 248 г
Пераммон . 137 г
Лет онатор;
Тринитро-
толу >л . . 10 г
395
г
Вес окончательно сна-
ряженного снаряда-
5,72 кг. Пороховой за-
ряд: 555 г пироксили-
нового пластинчатого
пороха (т70=517 м/сек);
1—детонатор; 2— пер-
аммон; 3— тринитрото-
луол.
Требования, предъявляемые к тринитрото-
луолу, идущему на военное снаряжение, очень
разнообразны; так, во Франции различают че-
тыре сорта тринитротолуола, имеющие темпе-
ратуру затвердевания 80,6 80,1, 79 и 78°. В то
время как хорошо промытый сырой продукт
несомненно может применяться для большин-
ства целей, если он, как это было во время вой-
ны, быстро идет в употребление, для длитель-
ного хранения и прежде всего для снаряжения
боевых припасов от продукта требуется высо-
кая чистота. В этом отношении требования
очень высоки и находятся на уровне почти хи-
мически чистого продукта. Условия при-
емки кристаллизованного тринитротолуола
следующие.
1. Влажность не должна быть более 0,1%.
Две пробы, по 20 г каждая, высушиваются в сушиль-
ном шкафу в течение 3—4 час. при 60—70°. Нагревать
при более высокой температуре не рекомендуется, так
как тринитротолуол начинает спекаться и улетучи-
ваться. Потеря в весе (за счет остаточного раствори-
теля— спирта, бензола) должна составлять не более
0,02 г.
2. Нерастворимых примесей должно быть
не более 0,05%, (0,1%); золы не более 0,02%. 100 г
тринитротолуола должны полностью раствориться
в смеси 300 см3 бензола и 100 см3 лигроина; нераство-
римый остаток на беззольном взвешенном фильтре
после промывки горячими бензолами и высушивания
должен весить не более 0,05 г, после сожжения вес
остатка должен составлять не более 0,02 г.
3. В расплавленном состоянии тринитро-
толуол должен быть прозрачен, цвета не темнее жел-
того, и не должен иметь запаха. Красное или коричне-
вое окрашивание или тем более наличие коричневых
хлопьев указывают на плохую (слишком длительную)
промывку и на примесь свинца из промывного аппарата. Окраска и про-
зрачность расплавленного тротила не должны изменяться после 5—6 час.
нагревания при 110°.
II. Нитропроизводные бензола и его гомологов 399
4. Температура плавления и температура затверде-
вания. Первым и важнейшим критерием чистоты тринитротолуола (так
же как и других плавящихся нитросоединений) является температура пла-
вления, которая может колебаться только в узких пределах, например не
более чем на 0,8—0,4° в ту или иную сторону. Но так как точное опреде-
ление температуры плавления является затруднительным, то вместо этого
в правилах приемки предписано определение температуры затвер-
девания; она ниже температуры плавления на 0,5—1° и должна быть не
ниже 80,5°.
50—100 г хорошо высушенного тринитротолуола расплавляются в фар-
форовом тигле при 90—100° и затем охлаждаются при перемешивании ма-
леньким выверенным термометром, так называемым термометром для опре-
деления температуры плавления. Температура постепенно понижается до
температуры, несколько более низкой, чем температура затвердевания, по-
сле чего вскоре начинается кристаллизация; при этом температура вновь
начинает повышаться и быстро достигает некоторого максимального пре-
дела, который и является температурой затвердевания. Например при
испытании очень хорошего образца тринитротолуола температура понизи-
лась до 79,6°, а потом при затвердевании повысилась до 80,4°; температура
же плавления была равна 80,9°. Хороший продукт имеет температуру за-
твердевания от 80,3 до 80,4°; наиболее низкая температура затвердевания
может доходить до 79,6°, что соответствует содержанию около 0,75% ди-
нитротолуола; сырой неперекристаллизованный тринитротолуол имеет тем-
пературу затвердевания 75—77°, если же он влажный, то она понижается
до 73—75°. Кислый, плохо промытый, хотя и хорошо пронитрованный три-
нитротолуол может иметь температуру затвердевания, равную всего 70—71°.
Из этого следует, что необходимо определять температуру затвердевания
только нейтральной и высушенной пробы.
По опытам В а н-Д у и н а температуру затвердевания никоим образом
нельзя считать критерием восприимчивости тринитротолуола к воспламене-
нию. Так, пробы с температурой затвердевания 80,3° многократно давали
отказы, в то время как просто промытый холодным спиртом продукт,,
имевший температуру затвердевания 79°, не дал ни одного отказа. В ре-
зультате этих опытов в Голландии кристаллизацию заменили простой про-
мывкой спиртом *.
5. Свободные кислоты, азотная и серная, допускаются только
в виде следов (до 0,01%). Равные количества тринитротолуола и дестил-
лированной .воды при перемешивании кипятят в фарфоровой чашке не-
сколько минут и дают охладиться. Затем отфильтрованную пробу водного
раствора смешивают с равным объемом химически чистой концентрирован-
ной серной кислоты и добавляют раствор дифениламина в серной кислоте
(1:100); при этом не должно наступать окрашивания или должно быть
только слабое синее окрашивание. Если проба дала удовлетворительный
результат, то от испытания на серную кислоту можно отказаться. Дифе-
ниламиновая проба настолько чувствительна, что при невозможности от-
крыть азотную кислоту можно быть уверенным, что в продукте не содер-
жится также и серной кислоты. Определение кислотности титрованием 0,lN
раствором NaOH неточно н является непригодным по причинам, упомянутым
ранее.
Прессованный и плавленый тринитротолуол должен быть
однороден, без раковин и иметь равномерную плотность. Наибо-
- лее надежный путь определения удельного веса — по потере веса
в воде; для разрывного заряда удельный вес должен составлять
1,55—1,61, а для детонатора— не ниже 1,50. В снарядах для
стрельбы с большой начальной скоростью удельный вес трини-
1 Ср. Е. de W. S. С о 1 v е г. High Explosives, Лондон 1918, 201.
400 Взрывчатые нитросоединения ароматического ряда
тротолуола в детонаторах (из-за опасности преждевременного
взрыва) должен достигать 1,58. Как последнюю пробу, приме-
няемую во взрывной технике, можно еще упомянуть пробу, ко-
торая принята например в Голландии и считается очень надеж-
ной: 5 патронов, содержащих по 200 г прессованного тринитро-
толуола с удельным весом приблизительно 1,55, воспламеняются
капсюлем-детонатором, заключающим 1 г смеси гремучей ртути
с хлоратом калия —- при этом должно полностью детонировать
не менее 3 патронов.
Применение тринитротолуола
Тринитротолуол имеет широкое распространение во всех обла-
стях взрывной техники. Как военное взрывчатое вещество он
просто незаменим; его применение еще более многосторонне,
чем применение нитроглицерина, так как большинство граждан-
ских взрывчатых веществ содержит тринитротолуол как состав-
ную часть, причем во многих из них он является главной состав-
ной частью. Но ведущую роль тротил играет конечно в области
военного применения, где он используется как универсальный
материал для снаряжения всех видов снарядов, бомб, мин, тор-
пед. Так, недельная выработка его во время войны составляла
в Германии 700 т, в Англии 500 т; суммарная годовая выработка
тротила составляла 55 000 т. После заключения перемирия в Аме-
рике имелся в наличии запас 50'000 т тротила, который был
переработан на безопасное взрывчатое вещество «содатол»,
содержащее 55% натриевой селитры. Для снаряжения гранат
и шрапнелей тротил является наиболее подходящим из всех
взрывчатых веществ; его достоинство заключается в универ-
сальности заряда, т. е. в возможности применять сна-
ряды, снаряженные им, одновременно и в качестве гранат и
в качестве шрапнели. На рис. 131 и 132 представлено разрывное
действие тринитротолуолового заряда в универсальном снаряде
весом 6,5 кг, в котором заключалось 300 пуль, залитых 230 г
тротила, и в донной каморе содержалось 75 г дымного пороха.
Рис. 131 изображает разрыв снаряда как разрывной гранаты,
а рис. 132 — применение его как шрапнели.
Тетранитротолуол. Недавно Г оллеману1 удалось получить
обходным путем 2, 3, 4, 6-тетранитропроизводное толуола; оно плавится
при 136,5° более стойко, чем соответствующее производное бензола, и
окрашивает воду в желтый цвет лишь по прошествии одного дня.
Следует отметить поразительно малую чувствительность тетранитро-
толуола к удару по сравнению с тетранитробензолом, именно 50 см вместо
25 см с 2~кг ударником, а также значительно меньшее расширение в свин-
цовой бомбе (327 см3, а для нитропроизводного бензола 447 см3). Оба ни-
тросоединения представляют только теоретический интерес.
1 Rec. Trav. Chim. Pays-Bas, 49, 501—502 (1930).
II. Нитропроизводные бензола и его гомологов
401
7. Нитроксилолы и тринитроксилол
Мононитроксилолы представляют собою жидкости
с удельным весом, равным в среднем 1,13 и темп. кип. 225—250°;
все динитроксилолы, напротив, твердые тела
(температура плавления 4,6-динитро-1,3-ксилола 93°) и большей
частью трудно растворимы в спирте; тринитроксилолы
имеют еще более высокие температуры плавления и также рас-
творимы более трудно.
Если нитровать технический ксилол (темп. кип.
137—142°), так же как толуол, в две стадии, то сначала по-
лучается динитропродукт, имеющий консистен-
цию мази, а затем твердый, но все же пластичный
мягкий тринитроксилол, который сохраняет такую
консистенцию даже при очень энергичных условиях нитрования.
Технический ксилол, представляющий собою смесь изомеров,
ни при каких условиях не удается пронитровать сразу до трини-
тропродукта, так как он содержит изомеры, которые не могут
быть превращены в тринитросоединения. Технический тринитро-
ксисол содержит поэтому только от 80 до 85% Тринитропродук-
тов; остаток, так называемый жидкий три нитроксило л,
представляет собою смесь моно-, ди- и немного тринитроксило-
лов. Если нитрование проводить при более жестких условиях, то
происходит окисление соединений, не поддающихся более
высокой нитрации, и благодаря этому уменьшается выход.
При многократной обработке пластичного технического три-
нитроксилола горячим спиртом жидкие примеси переходят в рас-
твор, а в остатке остается около Vs чистого м-2, 4, 6-т р и н и-
троксилола в виде кристаллического, похожего на тротил
порошка, который чрезвычайно трудно растворим в спирте и
бензоле.
СН3
no//x.no2
\JcH3
no2
темп. затв. 182
Чистый тринитроксилол, так же как и сырой пластический
продукт, в прочной оболочке и от сильного воспламенителя дето-
нирует с резким звуком; бризантное действие его несколько
слабее, чем тринитротолуола. В США 1 во время мировой войны
морское ведомство предпочитало снаряжать снаряды сплавом, со-
стоящим из 40% тринитроксилола и 60% тринитротолуола.
Пластический тринитроксилол пригоден преимущественно для
флегматизации и изготовления безопасных взрывчатых веществ.
1 Ам. пат. 1309588 (1919), Reese.
26 Зак. 3171. — ПГтетбахер.
402 Взрывчатые нитросоединения ароматического ряда
8. Нитропроизводные сольвентнафты
При нитровании в две стадии более высококипящих фракций
легкого масла, собираемых в пределах 10 или 5°, получаются
жидкие и твердые нитропродуктыкоторые применяются для
изготовления аммиачноселитренных взрывчатых веществ (мона-
хит). Во время войны подобные безопасные смеси использова-
лись в Германии для снаряжения гранат.
III. Нитронафталины
Нитронафталины получаются обычйо в виде смесей различ-
ных изомеров, число которых увеличивается с увеличением сте-
пени нитрации; технический продукт нередко представляет со-
бою смесь производных нафталина различной степени нитрации,
вследствие чего содержание азота и температура плавления тех-
нического продукта непостоянны и часто колеблются в очень
широких пределах.
В противоположность большинству государств во Франции
и Бельгии нитронафталины с давних пор находят широкое при-
менение для аммиачноселитренных взрывчатых веществ типа
Ф а в ь е.
1. Мононитронафталин CioH7(N02)
Из двух мононитропроизводных нафталина во взрывной тех-
нике наиболее важное значение имеет а-соединение:
NO2
CwHft 4- HNO3
128,06 г 63,02 г
100 + 76 (d= 1,40)
темп. пл. 56,4°
135,1 нитрочафталина
Теоретически)
Получение нитронафталина, точно так же как и нитропроизводных
ароматических углеводородов, производится в больших чугунных, лучше
ферросилициевых нитраторах. Нафталин (темп. пл. 79- 80°) вводится при
перемешивании в нитрующую смесь в виде порошка или в расплавленном
состоянии. На 100 кг нафталина берут смесь, состоящую нз 80 кг азотной
кислоты уд. в. 1,40 (теоретическое количество 76 кг) и 100 кг концентри-
рованной серной кислоты уд. в. 1,84. Вначале реакция протекает очень
бурно, поэтому нафталин вводится медленно. Температуру реакции при
непрерывном перемешивании поддерживают ниже 50°, и только по окон-
чании прибавления всего нафталина производят нагревание до 70°, т. е.
Герм. пат. 212906, 214887, 242731.
Ш. Нитро нафталины
403
выше температуры плавления нитронафталина. При этой же температуре
производят сепарацию; сырой нитронафталин подвергают несколько раз
декантации, промывают горячей водой и затем при сильном перемешива-
нии (сжатым воздухом) выливают в холодную воду, где темнокрасное
масло, опускаясь на дно, гранулируется в более светлые зерна.
Простая реакция нитрования нафталина является операцией
более неприятной и длительной, чем нитрование бензола или
толуола; это объясняется, во-первых, легкостью сублимации,
ведущей к частому закупориванию вентиляционных труб, и, во-
вторых, вторичными реакциями, в результате которых, наряду
с образованием большого количества нитрозных газов, происхо-
дит частичное окисление нафталина с образованием нитробен-
зойной и нитрофталевой кислот и потемнение массы. Вследствие
этого получающийся продукт обладает интенсивным неприятным
запахом, и выход его на 100 ч. нафталина составляет всего 130 ч.
сырого нитронафталина вместо 135 по теории.
Продажный а-нитронафталин, плавящийся в пределах 54-—58°,
является смесью a-соединения (темп. пл. 56°) и ^-соединения
(темп. пл. 79 ). Технический нитронафталин, применяемый во
взрывной технике, плавится часто еще ниже; он чрезвычайно
легко растворим в спирте и бензоле и кристаллизуется из них
в виде рыхлых волокнистых игл. Температура кипения его 304°.
Нитронафталин не детонирует и может быть использован во
взрывчатых веществах только в смеси с богатыми кислородом
веществами. Во время мировой войны во Франции его приме-
няли для снаряжения в виде сплава с 70% пикри-
новой кислоты под маркой MMN.
2. Динитронафталин СюНб(НОг)2
Динитронафталин приготовляется или действием нитрующей смеси на
мононитронафталин, или непосредственно из нафталина с соответственным
увеличением количества нитрующей смеси. Вследствие бурного течения
реакции и происходящего при нитровании нафталина до динитронафталина
процесса разложения предпочитают исходить из нитронафталина. Во Фран-
ции процесс ведется следующим образом. К 1150 кг нитрующей смеси,
состоящей из 51% серной кислоты, 26,5% азотной кислоты и 22,5% воды,
в течение 3—4 час. при перемешивании присыпают 400 кг грубоизмельчен-
ного нитронафталина; температуру поддерживают при 45°, а после окон-
чания присыпания нитронафталина повышают до 55°. Раствор, окрашенный
вначале в темнокрасный цвет, осветляясь, превращается затем в желтую
кашицу; при этом происходит выделение нитрозных газов. После отделе-
ния кислоты на нуч-фильтре или центрофуге продукт несколько раз
промывается горячей водой. Выход указывается равным 91%, считая на
нафталин.
Технический динитронафталин представляет собою желтовато-
серый землистый порошок, мало растворимый в спирте и легко
растворимый в бензоле и ацетоне; температура плавления его
колеблется между 130 и 155°. Так, пробная нитрация нитро-
нафталина дала динитропродукт с темп. пл. 125—155°. Техниче-
ский динитронафталин содержит главным образом 1,8-(₽)-динитро-
26»
404 Взрывчатые нитросоединения ароматического ряда
нафталин с тем. пл. 170° (2% части) и 1,5 (а)-динитронафталин
с темп. пл. 214° (- часть). При медленном нагревании динитро-
нафталина до 318° происходйт разложение со вспениванием.
Как и нитронафталин, динитронафталин отличается очень низ-
кой чувствительностью, но зато, подобно динитротолуолу, он
способен детонировать (рис. 14). Динитронафталин является
главной составной частью некоторых взрывчатых веществ типа
Фавье, безопасных в отношении взрыва рудничных газов; во
Франции он был использован также для снаряжения снарядов
с 80% мелинита под маркой MDN.
3. Тринитронафталин Ci«Hs(NOt)s
При нитровании нафталина до тринитронафталина по П fl-
скалю1 образуются четыре изомера приблизительно в следую-
щих количествах:
56% 1, 3; 8-тринитронафталина, имеющего темп. пл. 154°
23% 1, 2. 5- „ „ 122=
13% 1, 3, 5-
8% 1, 4, 5-
218°
96=
Тринитронафталин производится преимущественно из мононитросоеди-
нення, которое обладает низкой температурой плавления и которое можно
вводить в кислотную смесь в жидком состоянии. Твердый динитронафта-
лин менее пригоден для этой цели, потому что он производится большей
частью из дешевого сырого нафталина и поэтому содержит примеси, ко-
торые при применении крепких нитрующих смесей вызывают вредные про-
цессы окисления и осмоления. Для триннтрации по Паскалю необхо-
димо, чтобы содержание воды в отработанной кислотной смеси было ниже
25%. По некоторым данным нитронафталин растворяют в 6—7-кратном
количестве концентрированной серной кислоты и затем добавлением в виде
кислотной смеси необходимого количества азотной кислоты превращают
в тринитропродукт. Отработанная кислота вследствие загрязнения органи-
ческими примесями неприменима для мононитрации. Очистка трнннтро-
нафталина удается только при длительном1 кипячении с водой и еще более
затруднительна, чем промывка дннитропродукта. По Касту выход три-
нитронафталина составляет 85%.
Тринитронафталин обычно окрашен несколько темнее, чем
динитронафталин, и температура плавления его колеблется в еще
более широких пределах (125—160°). Он трудно растворим
в спирте и хорошо растворим только в ледяной уксусной кислоте
и хлороформе. К удару он так же еще довольно мало чувстви-
телен, взрывчатое действие его приблизительно равно действию
динитробензола. Во Франции тринитронафталин в смеси с аммиач-
ной селитрой под названием «шнейдерита» применяли в каче-
стве мощного и безопасного, но обладающего средним дробя-
щим действием взрывчатого ..вещества для снаряжения снарядов.
Германский «военный» тринитронафталин, имеющий темп. пл.
Взрывчатые вещества, порох, боевые газы, Госхимтехиздат, 1932.
IV. Нитропроизводные фенолов и их производных 405
145—155°, содержит 14,1% азота и приближается поэтому
больше к динитропродукту, содержание азота в котором равно
12,9%, чем к тринитропродукту, содержащему 16,0% азота.
Однако, несмотря на это, в прессованном до плотности 1,4 виде
при применении сильного детонатора германский тринитронаф-
талин детонирует со скоростью до 6000 м/сек. Ч
4. Тетранитронафталин СюНцМОг)^
Тетранитронафталин С1оН4(КОг)4 — продукты высшей степени
нитрации нафталина, вряд ли имеющий практическое применение,
может быть получен в жестких условиях при нитровании дини-
тронафталина 15-кратным количеством нитрующей смеси, содер-
жащей олеум, и при повышенной температуре (120—130°). Те-
транитронафталин представляет собою смесь двух изомеров,
имеющих темп. пл. 269 и 203°. Из ледяной уксусной кислоты
кристаллизуется в виде тонких игл, плавящихся около 220°.
Тетранитронафталин является уже сильным взрывчатым ве-
ществом; уравнение разложения его более благоприятно, чем
у тринитротолуола. Он также малочувствителен к удару и сго-
рает без взрыва. Хотя тетранитронафталин и обладает свой-
ствами, не уступающими тротилу, он все же находит очень
незначительное применение. Для его производства требуется
слишком большое количество олеума, и продукт часто полу-
чается неоднородным и неплавким — вот причины, которые за-
трудняют использование тетранитронафталина для военных целей.
Высшие нафталиновые фракции (200—280°) каменноугольной
смолы после небольшой предварительной подготовки можно
также непосредственно подвергать нитрованию; при этом полу-
чаются динитропроизводные различных изомеров метил-, диме-
тил- и подиметилнафталинов, а также динитропроизводные ан-
трацена.
IV. Нитропроизводные фенолов и их производных
1. Нитрофенол
Нитрование фенола благодаря наличию гидроксильной
группы, облегчающей замещение, легко происходит уже при
обыкновенной температуре и при пользовании слабой азотной
кислотой, причем одновременно образуются о- и л-нитрофенолы;
что касается м-нитрофенола, то его можно получить только ки-
пячением сернокислого льнитрофенилдиазония. Однако в на-
-стоящее время нитрофенол получают в технике не из фенола,
а почти всегда из хлорбензола и после легко выполнимого раз-
деления смеси о- и л-нитрохлорбензолов омыляют их приблизи-
1 Jahresber., 1929 der Ghem.-Techn. Reichsanstalt (Sprengstoffe), стр. 120.
406 Взрывчатые ншпросоединения ароматического ряда
тельно 10%-ным раствором едкого натра под давлением и при
нагревании в соответствующие нитрофенолы.
оЛЧ итрофено л — вещество желтого цвета, трудно раство-
римое в холодной воде, плавящееся при 45° и при 214° перего-
няющееся без разложения; о-нитрофенол отделяется от нелету-
чего л-соединения перегонкой с водяным паром; л-нитрофенол
более растворим в воде и кристаллизуется в виде бесцветных
игл, плавящихся при 114°. Нитрофенолы совершенно невзрыв-
чаты, обладают кислыми свойствами и дают соли металлов
(нитрофеноляты), которые однако также невзрывчаты.
2. Дйнитрофенол
Вторая степень нитрации фенола достигается тоже значи-
тельно легче, чем в случае какого-либо ароматического углево-
дорода.
ОН
Ano*
no2
Из шести теоретически возможных изомерных динитрофено-
лов известны пять; для техники взрывчатых веществ имеет зна-
чение только 2, 4-динитрофенол.
Подобно 'пикриновой.кислоте его можно получать из фенола
через соответствующую сульфокислоту; однако в технике пред-
почитают пользоваться уже упомянутым выше способом полу-
чения из хлорбензола через динитрохлорбензол с омылением
последнего 20%-ным раствором едкого натра в автоклавах1.
2, 4-динитрофенол — вещество слабожелтого цвета, трудно рас-
творимое в воде и легко в горячем спирте и эфире; плавится
при 114° и при быстром нагревании разлагается со слабым взры-
вом. По чувствительности к удару он занимает среднее место
между тринитротолуолом и динитробензолом, но по силе взрыва
несколько превосходит последний. Во время мировой войны он
под названиями пикроло (Pikrolo) и шеллит (Shellit) применяется
в громадных количествах наряду с динитробензолом для снаря-
жения снарядов; добавляемый приблизительно в количестве 1/s
к пикриновой кислоте, динитрофенол понижает температуру пла-
вления ее и чувствительность к удару, без заметного понижения
силы взрыва. Динитрофенол образует взрывчатые соли оран-
жево-желтого цвета; из них средняя свинцовая соль считается
очень сильно детонирующим соединением.
1 G i u a, Riv. chim. scient. е industriale, 1930, 22 (оттиск).
IV. Нитропроизводные фенолов и их производных 407
3. Тринитрофенол (пикриновая кислота)
До настоящего времени получено четыре изомерных трини-
грофенола; из них симметричное а-соединение, называемое пи-
криновой кислотой, представляет собою известное военное взрыв-
чатое вещество.
п-икри новая кислота,
темп, пл 122,5°
Три остальных изомера, а именно: или~3, 4, 6-тринитро-
фенол, с темп. пл. 96°, у-, или 2, 3, 6-тринитрофенол, с темп. пл.
Рис. 172. Опрокидной аппарат с крышкой, мешалкой и же-
лезной рубашкой для нагрева и охлаждения, служащий для
сульфирования и нитрования фенолов:
1—охлаждающая вода; 2—спуск охлаждающей воды; 3—отвод паров; /—вы-
тяжная труба; 5— спуск конденсата; б—в 1уск пара.
117 е и 2, 3, 5-тринитрофенол с темп. пл. 119е не имеют никакого
практического значения.
Исходным материалом почти всегда является карболовая кис-
лота, или фенол; только во время мировой войны англичане
вновь использовали старый германский способ1 и, исходя из
1 Jahresber. Militarversuchsamt, 1898, 11.
408 Взрывчатые нитросоединения ароматического ряда
бензола, получали хлорбензол, затем динитрохлорбензол, а омы-
ляя последний едким натром' — динитрофенол1, который затем
обычной кислотной смесью нитровался без нагревания до трини-
трофенола. Во Франции динитрофенол суспендировали в двух
весовых частях концентрированной серной кислоты (99%-ной)
и затем нитровали кислотной смесью, содержащей одинаковые
количества азотной и серной кислот (при общем содержании
воды 3,5%). Азотная кислота бралась в количестве, точно необ-
ходимом для введения третьей нитрогруппы. Окончательная
температура достигала 90°. Выход довольно чистой пикриновой
кислоты с темп. пл. 120,5° указывается равным 96%. Чрезвы-
чайно изящный способ непосредственного нитрования бензола
до тринитрофенола в присутствии ртути в качестве
катализатора до сих пор не имел успеха вследствие ма-
лого выхода, достигающего лишь 140% ,и значительного образо-
вания пикрата ртути 2.
Непосредственное нитрование фенола протекает чрезвычайно
бурно и сопровождается большими потерями; поэтому фенол
обрабатывают сначала серной кислотой и нитруют образовав-
шуюся л-ф ено л сульфокислот у:
ОН он
I |_f-H2SO4-> I I +3HNO3 =
^SOgH
189,06
94,05
98,09
Теорети- чески: 100 104,3
Практи- чески: 100 г 400 г (1,84)
201,02
700 г (1,40)
ОН
А<О2
| J +H2SO4+2H.4O.
229,05
243,54
178 г
Сначала обе нитрогруппы вступают
замещается сульфогруппа.
в о-положение, а затем
Лабораторный метод получения пикриновой
кислоты
В стеклянном стакане емкостью 200 см3 смешивают 50 г кристалличе-
ского фенола с 200 г серной кислоты уд. в. 1,84 (= 109 см3); перемешива-
ние производится термометром: происходит разогревание до 65—70°, и
образуется зеленоватый раствор; в случае, если фенол не вполне чист и
содержит воду, температура поднимается до 80°, раствор получается непро-
зрачным и окрашенным в зеленовато-черный цвет; раствор после охлажде-
ния до комнатной температуры по каплям или тонкой струей приливается
к 350 г или 250 см3 азотной кислоты уд. в. 1,38—1,40, т. е. азотная кис-
лота берется с 2,26-кратным избытком. Операцию целесообразно произво-
1 Англ. пат. 9962 (1915) и 124490 (1916); J. Soc. chem. Ind., 1919, 368 R.
2 A. Haller, Bull, de la Soc. d’encourag. pour 1’ind. nat., Париж 1920,
стр. 808, затем J. Am. .Chem. Soc., 1921, 595—607.
IV. Нитропроизводные фенолов и их производных 409
лить б стеклянном стакане емкостью 800 см3. При непрерывном переме-
шивании термометром температура медленно повышается, реакционная
жидкость окрашивается в красный цвет, н замечается образование красно-
вато-бурых нитрозных газов; при 50° начинается выделение газов, и вслед-
ствие этого наступает кажущееся кипение жидкости. При 70—80° из стакана
выделяются густые пары окислов азота, поэтому необходимо позабо-
титься о хорошей тяге. Реакция получения пикриновой кислоты безопасна
и легко поддается регулированию; фенолсульфокислоту приливают таким
образом, чтобы к концу температура достигла 90—100°, после чего, перио-
дически перемешивая термометром, нагревают смесь на водяной бане до
окончания выделения нитрозных газов, а затем нагревают на песчаной бане
или на асбестовой сетке до 112°. Через 5—15 мин. нитрация заканчивается,
что замечается по резкому ослаблению выделения окислов азота; одно-
временно начинает выделяться пикриновая кислота, всплывающая на по-
верхность, и по мере охлаждения содержимое стакана постепенно превра-
щается в кашицу блестящих крупных кристаллов.
Отработанную кислоту можно отделить непосредственно, но лучше
вылить реакционную массу в 6—7-кратное количество воды (2—2У> л), а за-
тем отсосать на нуч-фильтре и промыть холодной водой, в случае необ-
ходимости — промыть декантацией. Выход составляет 88—89 г почти чи-
стого тринитрофенола (= максимум 178%) с темп. пл. 120—121°. Если при
нитровании держать температуру-не выше 100°, то выход получается еще
меньше. С другой стороны, при нагревании до ПО—112° невозможно по-
лучить указанный Маркейролем выход 200—205% пикриновой кис-,
лоты. Для этого необходимо с самого начала сульфировать более энер-
гично. Вообще говоря, имеется много совершенно неудовлетворительных
рецептов получения пикриновой кислоты, которые должны наконец исчез-
нуть из литературы.
Нет такого нитросоединения, в отношении которого суще-
ствовало бы столько путаных данных, сколько существует о по-
лучении и выходах тринитрофенола. Однако суть дела очень
проста. По поучительному сопоставлению Д ж и у а 1 при ни-
тровании 100 вес. ч. фенола пикриновая кислота получается
с выходом:
1) через фенолмоносульфокислоту — не более 160 вес. ч.,
2) через фенолдисульфокислоту (2,4) — около 200 вес. ч.,
3) через фенолтрисульфокислоту (2, 4, 6) — около 220 вес. ч.
При еще более энергичном сульфировании фенола с частич-
ным образованием фено л тетрасульфокислоты вы-
ход возрастает до 235% 2. Колебания выходов получаются по-
тому, что фенол редко нитруется в виде фенолсульфокислоты
определенной степени сульфирования, но почти всегда в виде
смеси различных фенолсульфокислот. Так, при самых несовер-
шенных в техническом отношении условиях работы, близких
к вышеупомянутому лабораторному способу, из смеси п-фенол-
моносульфокислоты и небольшого количества фенол- 2, 4-дисуль-
фокислоты получается в среднем 180 ч. пикриновой кислоты.
Во Франции, на «родине» пикриновой кислоты, процесс ни-
трования фенолмоносульфокислоты производился во время
1 Industria dell’acido picrico, Riv. chim. scient. e industrials, 1930, стр. 25.
2 Olsen a. Goldstein, Ind. Eng. Chem., 1924, 25, указывают выход
220—235%.
410 Взрывчатые нитросоединения ароматического ряда
войны в колоссальных размерах в закрытых керами-
ковых горшках, нагревавшихся паром на водяных банях;
горшки посредством широкой керамиковой трубы для отвода
нитрозных газов соединялись с абсорбционными башнями. Эта
военная «импровизация» приготовления пикриновой кислоты тре-
бовала по сообщению Паскаля1 слишком много рабочих
рук и давала часто настолько малые выходы, что здесь можно
говорить просто о растрачивании фенола. Поэтому в Германии
сразу же перешли к механизированному способу нитрования
в железных аппаратах ив один прием перерабаты-
вали до 2000 кг фенола. Осуществление этого усовершенствован-
ного способа возможно только при применении высококонцен-
трированной азотной кислоты, которая не разъедает железа;
кроме того азотная кислота высокой концентрации необходима
для нитрования столь мало реакционноспособного промежуточ-
ного продукта, как получающаяся при этом способе фенолди-
сульфокислота. С тех пор как кислотоупорная сталь получила
всеобщее распространение, этот способ приобрел еще большее
значение.
По этому способу2 94 вес. ч. фенола при перемешивании и температуре
100° сульфируются 400 ч. 20%-ного олеума до дисульфокислоты (с при-
месью небольшого количества трисульфокислоты), и охлажденная др
50—40° реакционная смесь разбавляется 200 ч. концентрированной серной
кислоты уд. в. 1,84. После этого приливают 80 ч. азотной кислоты уд. в.
1,46 (=80%), затем при 6Q—80° еще 80 ч._ и наконец выше 80° —100 ч.
той же кислоты, а всего 260 ч., что составляет 1,1-кратный избыток
против теории. Пикриновая кислота выпадает в виде желтых кристаллов:
реакция считается законченной, если при добавлении азотной кислоты
к отфильтрованной пробе не происходит выделения пикриновой кислоты.
Выход около 205%. В Америке подобным же образом проводят монони-
трацию при 70°, а затем тринитрацию при 110° и получают выход
210—215%'3.
Отмывка от кислот в настоящее время повсюду производится
взмучиванием продукта в холодной воде в деревянных чанах или в же-
лезных котлах с гладкой поверхностью. Кристаллическая масса после
центрофугирования до содержания около 5% влаги, окончательно высуши-
вается на деревянных лотках в камерных сушилках или, лучше, в нагре-
ваемых вращающихся барабанах непрерывного дей-
ствия.
Чистота пикриновой кислоты и ее выход зависят прежде
всего от качества фенола. Наилучшие результаты получаются
в случае применения синтетического ректифицированного в ва-
кууме фенола, имеющего температуру плавления не ниже 40е.
Низкие выхода, составляющие даже при нитровании фенолди-
сульфокислоты всего 205%, что значительно ниже теоретиче-
ского, равного 243,9%, показывают, что часть фенолсульфокис-
1 Взрывчатые вещества, порох, боевые газы, Госхимтехиздат, 1932.
2 Герм. пат. 298021 (1915); Engineering 1919, 541.
3 Веннен, Бюрло, Лекорше, Порох и взрывчатые вещества. Перев.
с франц. ОНТИ, 1936, стр. 388.
IV. Нитропроизводные фенолов и их производных 411
лоты или нитрофенолсульфокислоты разрушается вследствие
сильного окисления избытком азотной кислоты. Результатом
этого расщепления, постоянно сопровождающего процесс,
является образование побочного продукта — щавелевой кислоты,
всегда содержащейся в маточном растворе. Но получить сво-
бодную от продуктов низших степеней нитрации пикриновую
кислоту без применения избытка азотной кислоты не удается.
Совершенно чистая пикриновая кислота получается только
осаждением в виде труднорастворимых пикратов калия
или натрия с последующим разложением их серной кисло-
той. 1 ч. пикрата калия при 15° растворяется в 260 ч. воды.
В последние годы мировой войны производство пикриновой
кислоты достигло колоссальных размеров. Так, в Англии недель-
ная выработка составляла в 1917 г. 1000 т, а во Франции в не-
которые периоды еще больше.
Свойства
Абсолютно чистая пикриновая кислота (так же как и у-изо-
мер) бесцветна и только на воздухе, вероятно от действия следов
аммиака, образующего с нею интенсивно желтый пикрат аммония,
окрашивается в желтый цвет. Возможно, что причину окраши-
вания следует искать в частичном превращении первоначальной
бесцветной бензоидной формы в желтую хиноидную
форму, тем более что пикрат аммония х, употреблявшийся аме-
риканцами как до мировой войны, так и во время нее, суще-
ствует в двух хромоизомерных формах
ОН
OaN^NO,
NO.,
бесцветная
II
-> °2^Х| = NO •он
желтая (до красной)
пикриновая кислота
из них желтая форма по силе взрыва на 15% слабее красной
хиноидной формы. Чистая продажная пикриновая кислота пред-
ставляет собою блестящие бледножелтые листочки с темп. пл.
121,5—122,5°. По новейшим определениям химически чистый
продукт имеет темп. пл. 122,5°, темп, затвердевания 121,9°; однако
данные эти не проверены и не пользуются всеобщим признанием.
Пикриновая кислота мало растворима в холодной воде: при 0°
растворимость составляет всего 0,7%, при 25° — 1,2%, при тем-
пературе кипения растворимость повышается до 7,2%. Лучше
растворима в спирте, эфире, бензоле и особенно хорошо в кон-
3 Hale, Army Ordn. VI, стр. 39—40; Reese, J. Franklin Inst., 1924, 766.
412 Взрывчатые нитросоединения ароматического ряда
центрированной азотной кислоте. Безводные растворы бесцветны.
При растворении пикриновой кислоты в воде имеет место диссо-
циация, сопровождающаяся образованием желтого окрашивания;
водные растворы показывают кислую реакцию и окрашивают
кожу, а также все животные ткани в интенсивный желтый цвет.
Пикриновая кислота имеет очень горький вкус, ядовита и осо-
бенно неприятна в виде пыли при переработке в сухом состоя-
нии. Абсолютный удельный вес кристаллов равен 1,76. Прессо-
ванием под давлением до 4000 ат (рис. 170) можно достигнуть
плотности 1,74, а при плавлении — всего 1,64. В плавленом виде
пикриновая кислота трудно восприимчива к детонации и ну-
ждается в детонаторе из слабо спрессованной пикриновой ки-
слоты.
Если нагреть пикриновую кислоту выше температуры пла-
вления, то при 160° начинается выделение газов, и при 300—310°
происходит воспламенение без вспышки. Зажженная пикриновая
кислота медленно сгорает с сильно коптящим пламенем; даже
при сгорании в количестве до 1000 кг никакого взрыва не про-
исходит.
В отношении трения, толчка и удара пикриновая кислота зна-
чительно менее чувствительна, чем нитроглицерин и пироксилин;
поэтому она была применена для снаряжения снарядов как пер-
вое безопасное при стрельбе взрывчатое вещество.
Однако вскоре обнаружилось чрезвычайно вредное свойство три-
нитрофенола— способность образовывать с металлами соли—
пикраты, которые очень чувствительны к удару и детона-
цией которых можно вызвать взрыв пикриновой кислоты. От
этой причины произошло несколько чрезвычайно тяжелых ката-
строфических взрывов, а именно взрыв пикриновой кислоты
в Корнбруке, близ Манчестера, в 1887 г., затем еще более
сильный взрыв в Гуддерсфильде в мае 1900 г. и наконец ката-
строфа на большом анилиновом заводе в Грисгейме 25 апреля
1901 г. Необходимо заметить, что сама по себе пикриновая
кислота сгорает спокойно, но при соприкосновении с желе-
зом, гашеной известью, электропроводкой, компонентами ма-
териала стен, имеющими основной характер, образует соли,
детонация которых вызывает взрыв всей массы. В частности
установлено, что при взрыве в Корнбруке детонацию вызвал
пикрат свинца, образовавшийся от взаимодействия рас-
плавленной горячей пикриновой кислоты со свинцовым
глетом.
Кислотный характер пикриновой кислоты выражается в том;
что в присутствии влаги она разлагает нитроглицерин, нитроклет-
чатку и даже калийную селитру с отщеплением азотной кис-
лоты. Поэтому от первоначального мелинита, представлявшего
смесь пикриновой кислоты с коллодионным хлопком, вслед-
ствие его способности к саморазложению' быстро пришлось
отказаться.
IV. Нитропроизводные фенолов и их производных 413
Испытание
Согласно указанным выше свойствам пикриновой кислоты ее
качественное определение не представляет никаких затруднений
(цветные реакции). Хлоргидрат акридина осаждает ее почти ко-
личественно, и в растворе 1 :50 000 пикриновая кислота еще мо-
жет быть обнаружена этим путем. Еще труднее растворим
пикрат нитрона, соль пикриновой кислоты и дифенилэнда-
нилогидротриазола, так называемого нитрона, который является
наиболее подходящим реактивом для количественного опреде-
ления пикриновой кислоты, а также азотной кислоты и нитратов.
Температура плавления чистой пикриновой кислоты (122,5°)
сильно понижается уже от наличия незначительного количества
примесей. Военные требования в большинстве случаев довольно
разнообразны. Общим требованием является лишь температура
затвердевания, которая не должна быть ниже 120°; между тем
влажность и содержание золы допускаются от 0,1 до 0,2 и даже
0,3% (Англия). Серной кислоты допускается не более 0,1%.
Применение
С 1886 г. пикриновая кислота в качестве первого бризантного
взрывчатого вещества для снаряжения снарядов была введена
в большинстве государств: во Франции под названием м е л и-
н и т; в Англии — лиддит (Бурская война), в Италии — пер-
тит, в Японии — шимозе (русско-японская война). Вслед-
ствие высокой плотности заряжания и скорости детонации
пикриновая кислота принадлежит к сильнейшим военным взрывча-
тым веществам; до мировой войны она оставалась наиболее бри-
зантным Материалом для снаряжения снарядов. Правда, несколько
более чем на десятилетие она была почти совершенно вытеснена
нейтральным и более удобным и лишь несколько более слабым
тринитротолуолом, однако вовремя мировой войны она вновь во-
шла в употребление в громадных количествах как в чистом виде,
так и в смеси с тринитрокрезолом и динитрофенолом. Американ-
ские снаряды долгое время снаряжались почти исключительно
пикриновой кислотой. Первые транспорты (вследствие действия
морского воздуха) дали большое количество неполных взрывов
снарядов, благодаря чему содержимое снарядов, окрашивающее
в прочный желтый цвет, распылялось и частично испарялось,
так что подвергавшиеся обстрелу люди («канарейки») прокли-
нали пикриновую кислоту не столько за ее взрывчатую силу,
сколько за вызываемую ею окраску.
Чтобы избежать образования пикратов и тем самым опасных
преждевременных разрывов снарядов в канале орудия, поверх-
ности снарядов, соприкасающиеся с плавленым зарядом, лаки-
руют или лудят металлом, на который пикриновая кислота не
414 Взрывчатые нитросоединения ароматического ряда
действует. Задолго до введения мелинита, уже в 1867 г., пикри-
новая кислота смешивалась с богатыми кислородом солями для
получения взрывчатых составов (порохов), из которых в свое
время нашли применение оксонит, дионит и викторит; последний
представлял собою смесь 50% пикриновой кислоты и 40% хло-
рата калия с примесью небольшого количества касторового
масла. В настоящее время пикриновая кислота из этих областей
применения повсюду вытеснена другими нитропроизводными
углеводородов.
4. Тринитроанизол и тетранитроанизол
Тринитрофенол, обладающий кислотными свойствами, во время войны
пытались заменить его эфиром — тринитроанизолом, веществом зе-
леновато-желтого цвета, которое получали из динитрохлорбензола, метило-
вого спирта и щелочи с последующим нитрованием получаемого таким
способом динитроанизола *. Метилпикрат C(iH2(NO2)..1OCH3 имеет темп. пл.
65,°, очень мало чувствителен и в смысле безопасности стрельбы является
отличным взрывчатым веществом; странно, что его скорость детонации,
равная по Д ж и у а 7600 м, превосходит скорость детонации пикриновой
кислоты; тринитроанизол (нитролит) применялся в Германии для снаря-
жения дальнобойных снарядов и являлся основным компонентом тяжелых
германских авиабомб. Тринитроанизол легко омыляется на метиловый'
спирт и пикриновую кислоту и способен даже к гидролизу, почему рас-
сматривается не как простой, а как сложный эфир пикриновой кис-
лоты. Вследствие сильного раздражающего действия на кожу, умеренной
стойкости и высокой стоимости, имеющей не последнее значение, этот
эфир как врывчатое вещество был -после войны оставлен.
То же самое, но еще в большей мере относится и к обоим т е т р а ни-
тро а н и з о л а м, которые по Клессену1 2 безопасно- получаются про-
стым нитрованием, с одной стороны, симметрического динитроанизола, и,
с другой стороны, м-нитроанизола. Однако ни 2, 3, 5, 6-тетранитроанизол,
имеющий темп. пл. 112°, ни изомерный 2, 3, 4, 6-тетранитроанизол с темп,
пл. 94° не являются достаточно стойкими веществами, так что до сих пор,
несмотря на высокую бризантность и способность желатинировать нитро-
клетчатку, ни один из них не нашел никакого применения.
5. Тетранитрофенол и пентанитрофенол
По Б л анке м а3 2, 3, 4, 6’тетранитрофеиол получают в виде светло-
желтых кристаллов нитрованием м-нитрофенола, который после 2-кратной
кристаллизации из сухого хлороформа плавится при 140° и около 240Сг
энергично взрывает.
Бризантное действие тетранитрофенола сильнее, -чем тетранитроани-
лина, подобно тому как бризантное действие тринитрофенола сильнее, чем
пикрамида.
Нитрованием 3, 5-динитрофенола удается получить продукт высшей
степени замещения, именно пентанитрофеиол — желтые кристаллы,
плавящиеся с разложением около 190° и при кипячении с водой превра-
щающиеся в тринитрофлороглюцин. Аналогичным способом Ф л юр-
шей м4 при нитровании с применением олеума получил пентанитро-
анилин.
1 G i u a, Riv. chim. scient. е industriale, 1930.
2 Герм. пат. 288655 и 289466 (1914).
3 Rec. trav. chim. Pays-Bas, 21, 264 (1902); реферат Chem. Zentralblatt
1902, II, 518.
4 J. Chem. Soc. Лондон, 1928, 3041.
IV. Нитропроизводные фенолов и их производных 415
6. Тринитрокрезол (крезилит)
В технике снаряжения боевых припасов применяется продукт,,
состоящий главным образом из 2, 4, 6-тринитрометакрезола
СеН • СНз • ОН • (ЬЮ2)з; этот аналог пикриновой кислоты пла-
вится около 100° в желтую жидкость, также обладает кислот-
ными свойствами и способностью окрашивать животные ткани
в желтый цвет. Чистый тринитрометакрезол плавится при 109,5°;
при 20° 1 ч. его растворяется в 450 ч. воды.
Тринитрокрезол получают через крезолсульфокислоту, и если
в качестве исходного продукта взять лт-крезол, то выход соста-
вляет максимум 178% против 225% теоретического. При при-
близительно равной чувствительности к удару тринитрокрезол
менее восприимчив к детонации и обладает несколько меньшей
взрывчатой силой, чем пикриновая кислота. Под названием «кре-
зилит» тринитрокрезол применялся прежде во франции в виде
сплава с пикриновой кислотой; удельный вес сплава равен 1,76;
во время войны крезилит был вновь широко использован для
снаряжения снарядов.
Наиболее удобна в работе смесь из 40% пикриновой кислоты
и 60% тринитрометакрезола; эта смесь плавится при 85°, но и
при 65—70° остается еще пластичной и может быть запрессована
в любую полую форму. В литературе неоднократно упоминалось
взрывчатое вещество, употреблявшееся в Австрии под названием
«эк раз ит»; «экразит» не содержал крезилита, а представлял
собою или чистую пикриновую кислоту, или смесь ее с 10% ни-
тронафталина. Никогда не применялась под этим названием и
аммонийная соль, потому что пикрат аммония, так же как и три-
нитрокрезилат аммония, трудно детонирует и кроме того обе
соли растворимы в воде, что делает их применение весьма не-
удобным. Последним напоминанием об «экразите» явились ко-
лоссальные взрывы в Киеве, где летом 1918 г. были уничтожены
старые запасы австрийских боевых припасов.
7. Тринитрорезорцин, или оксипикриновая кислота
Тринитрорезорцин, или оксипикриновая ки-
слота, называемая также стифниновой кислотой,
СбН(ОН)г(МО2)з кристаллизуется в виде желтых призм, раство-
рима в 140 ч. воды и легко растворима в спирте и эфире. Темп,
пл. 175°. Оксипикриновая кислота дает кислые и нейтральные
соли, бризантность которых весьма велика, но потенциальная
энергия незначительна. Вследствие этого нейтральный т р и н и-
трорезорцинат свинца ' (тенерес) нашел техническое
применение в качестве вещества, облегчающего воспламенение
азида свинца. На примере тринитрорезорцина1 автор впервые
416 Взрывчатые нитросое Синения ароматического ряда
доказал, что .нитросоединения, имеющие две или три гидроксиль-
ных группы, несмотря на высокое содержание в них кислорода,
уступают в отношении энергии веществам, содержащим одну
гидроксильную группу или совсем не содержащим ее (тринитро-
бензол).
V. Ароматические нитрамины
1. Пикрамид
Первым и простейшим сильным взрывчатым представителем этого
класса является тринитроанилин, или пикрамид, который по
строению представляет соответствующий пикриновой кислоте тринитрофе-
ниламин СеНз NH2(NO2)s, нейтральное вещество оранжево-красного цвета,
нерастворимое в воде, имеющее темп. пл. 188°. Никакого практического
применения пока еще не нашел.
То же можно сказать о замечательно стойком 2, 4, 6-тр и н ит р о м е-
тафенилеидиамине1 2 *, который плавится при 288° и без заметного
изменения может выдерживать нагревание .при 95° в течение 30 дней по
.8 час. ежедневно.
2. Тринитрофенилметилнитрамин (тетранитрометиланилин, тетрил)
Тринитрофенилметилнитрамин, сокращенно тетрил, предста-
вляет собою не тетранитросоединение, как неправильно гласит
одно из его названий, а тринитросоединение, и имеет следующее
строение: 1 | j ^'i
/СН,,
J^NO2
О.пГ !NO2
2 I I 2
no2
Впервые был получен в 1877 г. Мертенсом8; около
, 1906 г. его начали изготовлять в Германии; затем благодаря его
выдающимся свойствам он быстро вошел в практику, а во время
мировой войны приобрел военно-историческое значение в каче-
стве высокобризантного взрывчатого вещества.
Производство тетрила было неоднократно и обстоятельно опи-
сано 4 * * *. Для получения тринитрофенилметилнитрамина (тетрила)
1 Chemie und Sprengstoffideal, Z. f. Schiess- u. Sprw., 1916, 115; затем
E. von Herz, там же, 1918, 368 и 385.
2 C. F. van Diiin, диссертация, 1918, 79.
® Диссертация, Лейден 1877.
4 Langenscheidt, Z. f. Schiess- u. Sprw., 1912, 445; Rec. trav. chim.
Pays-Bas, 1917, 11—113; Lee Tanner, там же 1924, 26; Bain, Army Ordn.,
1926, 435—439 (Semi-Works Tetryl Plant); Ind. Chem. (Лондон), 1927, 304
^Nobels Explosives Co.).
V. Ароматические нитрамины
417
в лаборатории по мнению автора может быть рекомендован сле-
дующий рецепт:
5C6H6N (СН3)2 + 26HNOS = 5C7H5N5O8 + 5СО2 + 28Н2О + 3NS
5 • 121,10 26 . 63,02 5 278,08
100 271 237 тетрила (теоретически)
Сначала в бензольное ядро вступают три нитрогруппы, потом
происходит окисление одной метильной группы и одновременно
вступает четвертая нитрогруппа, что сопровождается сильным
вспениванием нитруемой жидкости. В действительности однако
расход азотной кислоты составляет (эолее 271 вес. ч., так как
процесс сопровождается реакциями окисления и расщепления,
которые понижают выход до 215 ч. (90%) и меньше.
К 50 г диметиланилина, по большей части окрашенного в красновато-
коричневый цвет, помещенного в колбу Эрленмейера емкостью 400—500 см3,
постепенно приливается 500 г (= 272 см3) концентрированной серной кис-
лоты. Обычно бывает достаточно водяного охлаждения при взбалтывании
от руки; прибавление серной кислоты, особенно вначале, необходимо про-
изводить осторожно, контролируя температуру • термометром. Целесо-
образно поддерживать температуру не выше 40—50°, хотя временные пере-
гревы до 100° почти безвредны. После прибавления пятой части серной
кислоты и образования сульфата остаток кислоты играет уже роль раство-
рителя и поэтому может быть прилит быстро. Полученный таким образом
раствор диметиланилина в серной кислоте окрашен в более
илн менее темный оливково-зелейый цвет и даже после двухдневного хра-
нения заметно не темнеет.
При нитровании сернокислый раствор диметиланилина медленно, по
каплям, приливают к 350 г (= 237 см3) 85%-ной азотной кислоты уд. в.
1,475, помещенной в 1%-л эрленмейеровскую колбу; при этом достаточно
водяного охлаждения и простого взбалтывания реакционной смеси, но
температуру необходимо контролировать термометром. При нитровании
происходит умеренное разогревание, которое легко регулировать. Темпе-
ратуре даЮу повыситься до 35—40° и после добавления всего сернокислого
раствора диметиланилина охлаждение прекращают. После этого в колбе
жидкость окрашивается в черновато-красный цвет, который вскоре стано-
вится грязновато-мутным, и затем при выделении мельчайших пузырьков
газа появляются кристаллы тетрила, всплывающие на поверхность жидко-
сти и собирающиеся на стенках стакана в виде светложелтого осадка. Тем-
пература чаще всего держится между 40 и 45°; если же реакция протекает
слишком быстро и с усиленным .вспениванием, то ее замедляют повторным
охлаждением водой. Через 20—30 мин. процесс в основном заканчивается,
но так как температура реакционной массы держится выше комнатной
Довольно долго, что свидетельствует о незавершенности реакции, то через
несколько часов реакцию доводят до конца непродолжительным нагрева-
нием на водяной бане при 60°. После охлаждения содержимое колбы при
энергичном перемешивании стеклянной палочкой выливается тонкой струей
в 2%—3 л холодной воды; при этом тетрил равномерно выделяется в виде
светложелтого порошка. Приставшие к внутренним стенкам колбы кри-
сталлы после 2-кратного споласкивания холодной водой (необходимо осте-
регаться разложения и выделения нитрозных газов) и затем теплой водой
легко смываются и присоединяются к главной массе. Затем блестящая
кристаллическая масса отфильтровывается на нуч-фильтре, промывается не-
сколько раз холодной водой и наконец — дважды горячей водой. Выход
составляет 208—209 г сырого продукта, или 217—218% от взятого диметил-
анилина. Температура плавления сравнительно низка: 120—122°.
27 Зак. 3171. — Штетбахер.
418 Взрывчатые нитросоединения ароматического ряда
Для удаления остатков кислоты и понижающих температуру плавления
примесей 100 г сухого технического продукта растворяют в 300 см3 аце-
тона, добавляют несколько граммов измельченного карбоната аммония для
нейтрализации, сильно взбалтывают, фильтруют и медленно сливают при
перемешивании в литр дестиллированной воды, которая почти полностью
выделяет из раствора тринитрофенилметилнитрамин. Отсасывают на нуч-
Рис. 173. Аппарат для сульфирова-
ния и нитрования со спускным краном
из кислотоупорной стали (V2A):
/—серная кислота; 2—люк; 3—термометр;
впуск охлаждающей воды; 5—сток воды;
6— сток конденсата; 7—к ну чу.
фильтре и после многократного про-
мывания водой получают порошок,
свободный от кислоты, имеющий темп,
пл. 127°. Для получения химически
чистого продукта необходимо еще
раз растворить в 3—4-кратном коли-
честве бензола, отфильтровать на го-
рячей воронке и оставить кристалли-
зоваться.
Вместо применяющейся обычно
азотной кислоты уд. в. 1,47—1,49 в
крайнем случае можно обойтись также
кислотой уд. в. 1,40. Например при
нитровании сернокислого раствора ди-
метиланилина, состоящего из 20 г
основания и 100 см3 концентрирован-
ной серной кислоты, смесью 130 см®
азотной кислоты уд. в. 1,38 и 50 см
серной кислоты уд. в. 1,84 получается
выход до 210%. Реакция, протекаю-
щая вначале медленно, при 40° бы-
стро переходит в бурную, так что
в пределах этой температуры реак-
ционную смесь необходимо охла-
ждать и перемешивать. Продукт,
слегка осмелившийся с поверхности,
окрашен в темножелтый или корич-
невый цвет, но плавится также при
120—122° и, несмотря на этот чисто
внешний недостаток, вполне приго-
ден как взрывчатое вещество.
Опасность -’’технического изгото-
вления тетрила заключается в возмож-
ности быстрого скачкообразного по-
вышения температуры, которое мо-
жет повести к самовозгоранию или
взрыву реакционной массы, особенно
если процесс ведется при темпера-
туре около 85°. По окончании нитро-
вания реакционную массу охлаждают
и на следующее утро отделяют от-
работанную кислоту от всплывшего
на ее поверхность порошкообразно-
го тетрила. Тетрил промывается на
нуч-фильтре холодной водой до нейтральной реакции фильтрата. Затем сле-
дует 2-кратное кипячение с водой или реже — однократная промывка не-
большим количеством спирта, главным образом с целью удаления нестойких
примесей из сырого тетрила, благодаря чему продукт после перекристалли-
зации из бензола становится более светлым и стойким.
После промывки спиртом тетрил становится почти белым и
плавится при 127°. При перекристаллизации из 3—4-кратного ко-
личества бензола получается чистый продукт с темп. пл. ISO0*
V. Ароматические нитрамины
419
и темп, затвердевания 128,7°. Германский продажный тетрил пла-
вится в пределах 125—126°.
Стойкость тетрила считается отличной. Однако по
шведским данным (Бофоре) даже чистый плавящийся при
130° -продукт выдерживает пробу Эбля при 80° не более
50 мин. По Наулесу1 такая нестойкость объясняется при-
месью тетранитрофен и лм ети л нитрамин а (лт-нитро-
тетрила), который образуется из содержащегося в диметилани-
лине монометиланилина и уже кипящей водой гидролизуется на
кислый тринитрофенилметилнитраминофенол и азотистую кис-
лоту. Аналогичный результат дает раствор сод ы, от действия
которого м-нитротетрил превращается в средний стифнат на-
трия, а незначительная часть тетрила одновременно переходит
Рис. 175. 70% тетрила.
30% тротила.
Недостаток кислорода—
55,4%.
Рис. 176. 80% пентри-
нит, флегматизироваи-
ный.
Недостаток кислорода—
13°/о-
Рис. 174. Сплав
50% пентрита.
50% тротила.
Недостаток кислорода—
42,1%.
Рис. 174—176. 25 г каждого из указанных взрывчатых веществ подвергнуто дето-
нации капсюлем-детонатором № 8 в железном тигле на 1-мм железной пластинке.
даже в пикрат натрия. Исключительно этим объясняется кислая
реакция, «мнимая кислотность» этого основного нитрамидосое-
динения.
Свойства. Перекристаллизованный тринитрофенилметил-
нитрамин представляет собою рыхлый мелкий порошок светло-
желтого цвета. Удельный вес кристаллов равен 1,725. В воде
при 20° растворяются всего лишь 0,007%, в холодном спирте —
всего 0,5% тетрила; легко растворим в бензоле и особенно в аце-
тоне. Тетрил окрашивает кожу в красный цвет и довольно ядо-
вит. Воспламеняется при нагревании до 190° и быстро с шумом
•сгорает светлым ярким пламенем. Тетрил более чувствителен
к удару и легче детонирует, чем пикриновая кислота, вследствие
чего в больших зарядах он не совсем безопасен при стрельбе;
поэтому в крупных снарядах тетрил, подобно гексилу, приме-
няется в смеси с 30—40% тринитротолуола2. Эта смесь для сна-
1 Knowless, J. Ind. Eng. Chem. XII, 246—248 (Du Pont de Nemours Co).
2 Taylor a. Rinkenbach, J. Ind. Eng. Chem. 1923, 73 (THT — тетрил),
там же, 1923, 1070 (пикриновая кислота — тетрил).
27*
420 Взрывчатые нитросоединения ароматического ряда
ряжения приготовляется при температуре выше температуры
плавления тринитротолуола, после чего она набивается в какую-
либо полую форму и по охлаждении затвердевает в виде ком-
пактной массы, имеющей уд. в. 1,65. В таком виде тетрил во
время мировой войны явился первым взрывчатым веществом для
снаряжения торпед.
Но важнейшим применением тринитрофенилметилнитрамина
было применение его для детонаторов. Рыхлый порошок
под давлением в 2000—4000 ат прессовался в твердую, подобно
сере, блестящую шашку, которая легко детонировала от кап-
сюля-детонатора и вследствие высокого удельного веса (до 1,7)
обладала скоростью детонации около 7700 м/сек.
До введения пентрита и пентринита тетрил оставался наиболее
сильным, хотя и самым дорогим из применяемых военных взрыв-
чатых веществ. Его сила однако часто переоценивалась, так как
в действительности технический продукт, содержащий низко-
плавкие примеси, обладает меньшей энергией, чем химически чи-
стый, и дает расширение в свинцовой бомбе, равное всего 345 ои3
вместо 390 см* для химически чистого вещества.
В новой патентной литературе1 встречается производное тетрила —
тринитрофенилэтанолнитраминнитрат, получаемый смеше-
нием ₽-аминоэтилового алкоголя (этаноламина) СНаОН CH«NHa и пикрилх^о-
рида с последующей нитрацией тринитрофениламиноэтанола. Этаноламин —
бесцветное густое масло с сильными основными свойствами, имеющее темп,
кип. 171° и удельный вес при 20е 1,022.
/\°2 3 /NO,
[ 1--N\
ХСН, —CH,NO3
NO2^JnO,
Это жирноароматическое нитросоединение обладает повидимому свой-
ствами, подобными свойствам тетрила, плавится при 126°, но вспыхивает
только при 187°, нерастворимо в воде, мало растворимо в спирте и легко
в ацетоне и бензоле. Так как его получение не только более сложно, но
и повидимому значительно дороже, чем получение тетрила, то тринитро-
фенилэтанолнитрамин, обладающий еще кроме того недостатком кислорода
в 35%, не имеет шансов на применение^ То же относится к нитрованным
ацильным производным моноэтаноламина, из которых динитродиэтанол-
нитратоксамид предложен в смеси с тринитротолуолом или тетрилом в ка-
честве материала для снаряжения 2.
3. Тетранитроанилин
Это прекрасное по своим взрывчатым свойствам соединение
было получено в 1910 г. Флюршеймом3 нитрованием м-ни-
1 Герм. пат. 530704 (1930), Ed. v. Herz; далее герм. пат. 514955, 516284,
517832, D у n a m i t AG.
2 Герм. пат. 543174 (1930).
3 Proc. Chem. Soc. London 1910, 81; герм. пат. 241697 и 243079; J. soc.
chem. Ind. 1921, 97—107.
V. Ароматические нитрамины
421
троанилина и описано как самое сильное из всех взрывчатых ве-
ществ ароматического ряда (рис. 29).
Автор, пользуясь данными Флюршейма *, повторил эти опыты
и нашел, что это настоящее, тетранитросоединение указанной
формулы строения чрезвычайно бризантно 1 2, однако очень мало
стойко и технической ценности не имеет.
NH2
o2n/\no2
\JnO2
no.2
Получить тетранитроанилин лучше всего по рецепту В ан-
Ду и н а 3.
26 г анилина растворяют в 700 с/и3 высококонцентрированной серной
кислоты и при —5° превращают в м-н ит р о а н и л и н добавлением ни
трующей смеси, состоящей из 16 см3 азотной кислоты уд. в. 1,49 и 80 с/и8
концентрированной серной кислоты. После этого оставляют массу на 2 часа
в охладительной смеси, затем- добавляют 117 г высушенной и измельченной
калийной селитры так, чтобы температура не поднималась выше 50°, оста-
вляют на 24 часа, снова нагревают 1 % часа при 50° и оставляют стоять
еще один день. Тетранитроанилин выделяется в виде желтоватого рыхлого
порошка, который отфильтровывают через стеклянную вату от кислоты
и промывают сначала 50%-ной серной кислотой, а затем водой до ней-
тральной реакции. Выход 26 г, темп. пл. 207° (с разложением).
Наилучшим растворителем для перекристаллизации тетранитро-
анилина является чистая ледяная уксусная кислота. Уже не
вполне безводный ацетон ведет к образованию 2, 4, 6-т р и н и-
траминофенола (темп. пл. 178°). При растворении сырого
тетранитроанилина вследствие разложения примесей всегда вы-
деляются.нитрозные газы, которые по удалении при второй пере-
кристаллизации уже больше не появляются. Очищенный тетра-
нитроанилин имеет темп. пл. 217—220° и около 240° дает
вспышку с резким треском; зажженный продукт сгорает очень
быстро с шипящим красным пламенем.
Хотя тетранитроанилин по отношению к нагреванию оказы-
вается поразительно стойким и выдерживает иодкрахмальную
пробу при 70° более долгое время, чем нитроглицерин, но при
обыкновенной температуре тетранитроанилин совершенно не-
стоек. После 1—2-месячного хранения начинается его разложе-
ние с выделением кислых нитроз,ных газов, причем нитрогруппа,
находящаяся в метаположении (3), отщепляется. Эта четвертая
нитрогруппа настолько неустойчива, что уже при кипячении с во-
дой и даже с влажным ацетоном тетранитроанилин полностью
гидролизуется в 2, 4, 6-тринитраминофенол.
1 Z. f. Schiess- u. Sprw., 1916, 114, 187.
2 Там же, 1916, 114.
3 Rec. trav. chim. Pays-Bas, 1917, 115.
422 Взрывчатые нитросоединепия ароматического ряда
Вследствие своей нестойкости тетранитроанилин до сих пор
не нашел никакого технического применения. Завод для произ-
водства тетранитроанилина, оконченный постройкой ко времени
перемирия 1918 г., не был пущен в эксплоатацию Ч Тем не менее
Флюршейму принадлежит заслуга подготовки своими рабо-
тами пути для получения современных высокобризантных взрыв-
чатых веществ.
4. Гексанитро дифениламин (гексил)
Гексанитродифениламин, дипикриламин, имеющий строение,
изображаемое формулой
может быть получен по данным открывавших его химиков1 2
двумя путями. По более простому рецепту, рекомендуемому для
лабораторных работ, исходным веществом служит дифениламин.
50 г грубоизмельченного дифениламина, помещенного в 1-л колбе,
растворяют при взбалтывании приблизительно в 500 см3 концентрирован-
ной серной кислоты (1,84), что происходит довольно быстро и сопрово-
ждается слабым разогреванием и потемнением содержимого колбы. Этот
раствор сернокислого дифениламина при постоянном взбалтывании по
каплям прибавляется из капельной воронки к 500 г (=333 см8) дымящей
азотной кислоты (1,5), помещенной в 5-л колбу. Немедленно наступает
интенсивная синяя окраска, характерная для известной реакции на дифе-
ниламин, и происходит повышение температуры, которую с .помощью водя-
ного охлаждения поддерживают ниже 40°, а еще лучше ниже 30°. После
окончания прибавления сернокислого дифениламина образующийся в колбе
густой непрозрачный синий продукт реакции осторожно нагревают на во-
дяной бане. Как только начнется реакция, сопровождаемая саморазогрева-
нием, колбу снимают с бани и при непрерывном взбалтывании следят за
начинающимся выделением нитрозных газов и сильным образованием пены;
по мере исчезновения синего окрашивания происходит выделение желтых
блестящих кристаллов гексанитродифениламина. После того как «кипение»
азотной кислоты ослабеет и нитропродукт в виде объемистой массы выде-
лится на поверхности жидкости, смесь охлаждают и нацело выделяют
продукт, выливая реакционную смесь в 4—6-кратное количество холодной
воды, отсасывают на нуч-фильтре и промывают сначала холодной, а потом
горячей водой — в случае необходимости со взмучиванием и при кипячении
осадка с водой до нейтральной, реакции. Выход около 88 г сырого про-
дукта с темп. пл. 238°, что при расчете на дифениламин составляет 175%
(теоретически 259,8%). Из кипящей азотной кислоты уд. в. 1,4 или кипя-
щей ледяной уксусной кислоты, являющихся единственными приемлемыми
растворителями, гексанитропродукт вследствие незначительной растворимо-
сти перекристаллизовывается плохо, но при кипячении с азотной кислотой
1 H:st.:ry of tie Explosives Industry in America, Нью-Йорк 1927, 953.
2 Austen. Eer.. 1250; Gnehm. Ber., 7, 1399 (1874).
V. Ароматические нитрамины
423
ул. в. 1,36—1,40 примеси растворяются, и продукт становится чище и пла-
вится при 249°.
Если применять, как указывается в некоторых рецептах, только 10-крат-
ное весовое количество серной кислоты, то после прибавления к азотной
кислоте масса легко затвердевает в кристаллическую кашицу, благодаря
чему могут возникнуть местные перегревы, особенно во время последую-
щего нагревания при донитровании. Нитрование можно производить и
в обратном порядке, т. е. приливать азотную кислоту к сернокислому
дифениламину, однако выход при этом, вероятно в результате окисления,
получается еще меньше.
Технический способ получения. Продукт, получаемый опи-
санным выше способом, чаще всего содержит небольшие количества масля-
нистых примесей; опасность воспламенения при его получении довольно
значительна. Поэтому в технике для получения больших количеств гекса-
нитродифениламина пользуются другим способом *, а именно конденсацией
1, 2, 4-х л о р д и н и т р об е нз о л а с одним молем анилина в 2Уг-кратном
количестве спирта.
При сильном выделении тепла образуется асимметричный д и н и т р о-
дифениламин; образующаяся при этом соляная кислота связывается
динитрофениламином, и реакционная смесь застывает в темнокрасную массу
После нейтрализации мелом с добавлением воды динитродифениламин выде-
ляется в виде мелких красных игл, плавящихся при 150—154°.
Дальнейшее нитрование до гексанитродифениламина производится
в две фазы: первая, в керамиковых аппаратах — слабой, а затем в кислото-
упорных чугунных аппаратах — концентрированной азотной кислотой. Поль-
зование нитрующей смесью в данном случае невозможно, так как динитро-
днфениламин нерастворим в серной кислоте и нитрование шло бы плохо.
Предварительное нитрование динитродифениламина в симметричный тетра-
нитродифениламин производилось в свое время в стойких к колебаниям
температуру керамиковых горшках; красное динитросоединение лопаточ-
ками вносят в 4—5-кратное количество предварительно подогретой азотной
кислоты уд. в. 1,33 и под конец нагревают до 90—100°. Масса переходит
в раствор, теряя при этом красную окраску, и тетранитросоединение выде-
ляется нз слабой кислоты по охлаждении в виде грязножелтого порошка.
Тетранитродифениламин (иголочки, темп. пл. 180—190°) отфильтровывается
от кислоты на нуч-фильтре или отжимается на центрофуге и непосред-
ственно с остатком азотной кислоты подвергается окончательному нитрова-
нию. Целесообразно одновременно подвергать окончательному нитрованию
продукт, получаемый от нескольких операций предварительного нитрова-
ния, и вести реакцию с избытком азотной кислоты 48° Вё в больших эма-
лированных нитраторах.
Введение шестой нитрогруппы достигается с большим трудом; без
соблюдения известных условий, благодаря которым процесс непрерывно
развивается дальше, можно даже при кипячении с дымящей азотной кис-
лотой в течение нескольких часов не получить продукта с хорошей темпе-
ратурой плавления. При работе же по способу Ван-Дуина в лаборатор-
ных масштабах шестая нитрогруппа вступает в ядро легче, если только
брать концентрированную азотную кислоту с удельным весом выше 1,49.
1 Р. A. D am е, J. Am. Chem. Soc., 1919, 1013; Z. f. Schiess- u Sprw.,
1921, 19.
424 Взрывчатые нитросоединения ароматического ряда
После охлаждения отсасывают на нуч-фильтре, промывают небольшим ко-
личеством сначала концентрированной, потом слабой азотной кислоты и
наконец — водой. Промывка гексанитродифениламина небольшим количе-
ством азотной кислоты имеет целью полное удаление небольших количеств
растворенных нитропродуктов, которые при непосредственном прибавлении
воды могут выделиться в виде грязных клейких веществ. Конечный про-
дукт, освобожденный от большей части кислоты, промывается при пере-
мешивании в особых промывных аппаратах, стабилизируется, отжимается
от воды на центрофугах и высушивается при 50—60° в сушильных шкафах.
Отработанная кислота от второй стадии нитрования и азотная кислота,
служившая для первой промывки, применяются вместо свежей кислоты для
предварительного нитрования.
Гексанитро дифениламин представляет собою чистый желтый
кристаллический, сильно пылящий порошок, плавящийся в сыром
виде при 238°, а после перекристаллизации — при 249° с разло-
жением. Шведский гексил, плавящийся не ниже 240°, выдержи-
вает пробу Эбля при 135° не менее 60 мин. и является следова-
тельно значительно более стойким, чем тетрил. Нерастворимый
в обычных растворителях, если не считать эпихлоргидрина, явля-
ющегося для него лучшим растворителем, гексанитродифенил-
амин можно перекристаллизовать из дымящей азотной кислоты
и с значительно худшими результатами — из ледяной уксусной
кислоты. Он обладает кислыми свойствами и дает соли, из кото-
рых аммонийная соль под названием «ауранция» (Aurantia) уже
давно известна как красящее вещество. Гексанитродифениламин
является наиболее неприятным и ядовитым взрывчатым
веществом; его пыль, даже в едва заметных количествах, уже
через час вызывает воспаление слизистой оболочки носа и осо-
бенно глотки, т. е. катар горла, который через 1—2 дня исче-
зает. Как кожный яд и отвратительная желтая краска, гексил
значительно хуже пикриновой кислоты, и кажется весьма стран-
ным, что это взрывчатое вещество, по своему действию занимаю-
щее среднее положение между тротилом и тетрилом (рис. 16—18),
вообще изготовляется еще до сих пор.
Раньше на гексил обращали мало внимания; во время же
войны он нашел применение главным образом в качестве бри-
_зантного материала для снаряжения торпед и морских
мин. В смеси с 30—40% тринитротолуола1 он образует
мягкую пластичную массу, которую в теплом виде можно удобно
запрессовывать в любую полую форму, но уже при температуре
немного ниже температуры плавления тротила эта масса стано-
вится монолитным твердым телом.
Такие разрывные заряды, которые в настоящее время приго-
товляются некоторыми заводами (шведский «новит»), позволяют
при плотности, достигающей 1,70, получить такую концентрацию
взрывчатого вещества, какая до сих пор не достигалась ни
в одном заряде мин. И так как скорость детонации этого взрыв-
чатого вещества несколько превосходит скорость детонации тро-
1 Герм пат 315306 и 315303.
V. Ароматические нитрамины
425
тила, то понятно, что подводное взрывное действие таких гекси-
ловых зарядов заметно, хотя и не очень много, превосходит дей-
ствие других взрывчатых веществ.
Наряду с симметричным гексанитродифениламином В а н - Д у и н полу-
чил еще 2, 4, 6, 2', 3', 4'-гексанитродифениламин, имеющий темп. пл. 274°.
Последний однако обладает одной подвижной нитрогруппой и
уже после часового нагревания при 95° дает сильную реакцию с иодкрах-
мальной бумажкой, между тем как дипикриламин нисколько не изменяется
даже после 240 час. нагревания. Кроме того это соединение еще более
ядовито, чем симметричное.
К тому же классу гексанитросоединений принадлежат еще сле-
дующие соединения, запатентованные незадолго до войны и во
время войны.
5. Гексанитродифенил
Гексанитродифенил *, простейший и одновременно сильнейший
представитель этого класса соединений, «удвоенный тринитробензол», был'
получен обработкой раствора тринитрохлорбензола в толуоле или нитро-
бензоле медью, взятой приблизительно в количестве */« от веса тринитро-
хлорбензола. После окончания реакции растворитель отгоняется с водяным
паром, CU2CI2 удаляется промыванием разбавленной соляной кислотой, и
гексанитродифенил перекристаллизовывается из азотной кислоты. Он обра-
зует светложелтые кристаллы, совершенно нейтрален, стоек и мало чувстви-
телен к толчку и удару. Температура вспышки выше 320°, темп. пл. 230°.
Его взрывчатое действие приблизительно на 10% выше действия гекса-
нитродифениламина и еще выше по сравнению с пикриновой кислотой.
6. Гексанитродифенилоксид
Г е к с а н и т р о д и ф е н и л о к с и д <2, 4, 6, 3', 4', б'-гексанитродифе-
ниловый эфир) получается нитрованием при 100° 2, 4, 6, З'-тетранитроди-
фенилового эфира2 (приготовляемого из м-нитрофенола и пикрилхлорида).
Он плавится при 227°, нерастворим в воде и по патентным данным очень
стоек при хранении.
7, Гексанитродифенилсульфид (пикрилсульфид)
Гексанитродифенилсульфид был получен обработкой раствора 100 кг
1-хлор-2,4,6-тринитробензола в 500 кг спирта, 50 кг тиосульфата натрия
в присутствии 19 кг углекислого магния3. Выход около 80%; по В а н-
Д у ину4 плавится при 234°; трудно растворим в спирте и эфире и легко
в ацетоне.
8. Гексанитросульфобензид
Гексанитросульфобензид, или правильнее—гексанитродифенилсульфон,
СвНг(КОг)з — SO2 — СвН2(КОг)з получается окислением гексанитродифенил-
сульфида азотной кислотой °. Желтовато-белые нейтральные, нерастворимые
в воде кристаллы, стойкие в отношении нагревания и плавящиеся при 307°.
Это соединение, как и гексанитродифенилсульфид, неоднократно применя-
лось во время мировой войны, так как к его значительному взрывному
действию присоединялось отравляющее действие, вызываемое образованием
окислов серы. Германские авиационные бомбы частично содержали смесь-
Равных частей тротила и гексанитродифенилсульфида.
1 Герм. пат. 286736.
2 Герм. пат. 281035.
3 Герм. пат. 275037.
4 Диссертация, стр. 46.
5 Герм. пат. 269826.
ГЛАВА ДВЕНАДЦАТАЯ
АММИАЧНОСЕЛИТРЕННЫЕ, ИЛИ БЕЗОПАСНЫЕ
ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
Безопасными взрывчатыми веществами (Sicherheits-
sprengstoffe, explosifs de surete) в узком смысле слова называются
взрывчатые смеси, безопасные в обращении и допускаемые к пе-
ревозке по железным дорогам на льготных условиях; их пре-
обладающей составной частью является аммиачная селитра, ко-
торую они содержат в количестве 70—90%, и потому называются
также аммиачноселитренными взрывчатыми ве-
ществами. Антигризутные взрывчатые вещества по своему
составу также относятся к этой группе, хотя значительная часть
из них не является безопасной в обращении в указанном выше
смысле и допускается к перевозке по железным дорогам с неко-
торыми ограничениями.
Безопасные взрывчатые вещества представляют собою сухие
порошкообразные, наощупь часто как бы влажные смеси, очень
малочувствительные к толчкам и ударам. Они совер-
шенно безопасны также в отношении искры или пламени; в боль-
шинстве случаев их воспламеняемость настолько незначительна,
что даже начавшееся горение дальше почти не распространяется
и чаще всего происходит затухание, так как аммиачная селитра
не представляет собою горючего вещества.
Большим недостатком всех аммиачноселитренных составов
является их чувствительность к влаге. Устранение
гигроскопичности и связанное с этим повышение постоянства
при хранении и по настоящее время все еще остается проблемой,
которая, как и получение пластичных аммиачноселитренных
взрывчатых веществ, не содержащих нитроглицерина, ожидает
своего разрешения.
Безопасные взрывчатые вещества, употребляемые в Германии
и с 1923 г. известные под названием аммонитов, чаще всего пред-
ставляют собою смеси азотнокислого аммония с нитронафтали-
нами [составы Ф а в ь е (explosifs Favier)] или вообще с нитро-
соединениями ароматического ряда, как например ди- и трини-
тротолуолом (германские донарит, альдорфит); к этим
«смесям в небольших кэличествах добавляется древесная или ра-
I. Аммиачная селитра, азотнокислый аммоний
427
стительная мука для предотвращения слеживания. Кроме того
существует бесчисленное множество вариантов этих составов, со-
держащих часто немного нитроглицерина и образующих целую
гамму взрывчатых веществ от вполне безопасных в обращении
до антигризутных.
Углеродсодержащими компонентами могут служить, вообще
говоря, все горючие вещества, поскольку они образуют тесные
смеси и не дают маслянистых тестообразных составов. Указан-
ное ограничение в отношении углеродсодержащих материалов
основывается на том, что способность к детонации аммиачносе-
литренных взрывчатых веществ, за исключением тех случаев, ко-
гда они содержат чистый или желатинированный нитроглицерин,
связана с их порошкообразным состоянием, причем имеются
в виду сухие порошки; как только порошкообразная масса спрес-
сована или благодаря употреблению жидких углеродсодержа-
щих веществ становится компактной, получаются отказы.
В качестве окислителей существенную роль играют также и
другие азотнокислые соли, прежде всего натриевая селитра, а
в последнее время и кальциевая, особенно в тех случаях, когда
безопасные взрывчатые вещества являются одновременно и анти-
гризутными. Равным образом в аммиачноселитренные взрывчатые
составы с целью оживления этих инертных смесей вводят в не-
больших количествах перекиси, хроматы, хлораты и перхлораты.
I. Аммиачная селитра, азотнокислый аммоний NH4NO3
Аммиачная селитра в прежнее время чаще всего приготовля-
лась путем нейтрализации подсмольной воды азотной кислотой,
полученной из чилийской селитры; в настоящее время она почти
повсюду получается искусственным путем из синтетического ам-
миака и продукта его окисления — азотной кислоты.
В чисто синтетическом процессе Габера-Оствальда1 2, например, при ко-
тором аммиак получается в газообразном виде, а азотная кислота — в виде
водного раствора, аммиак нагнетается под давлением 0,5—1 ат в азотно-
кислый раствор нитрата аммония, которым1 он нацело поглощается. Одно-
временно с адсорбцией аммиака к раствору непрерывно приливают соот-
ветствующие количества азотной ’ кислоты; при этом требуется сильное
охлаждение, так как должна быть отнята не только теплота нейтрализации,
но также и теплота растворения аммиака. В последнее время Фаузер1
стал вести процесс под давлением с использованием выделяющегося в боль-
ших количествах тепла реакции для выпаривания растворов азотнокислого
аммония.
Как в этом, так и в других технически важных способах азотнокислый
аммоний получается в виде более или менее концентрированных растворов.
Для получения твердой чистой соли необходимо осветленные, профильтро-
ванные растворы подвергать выпариванию в вакууме, причем в последнее
время на первый план выступило непрерывное выделение соли.
1 U 11 m а п п, Encycl. т. I, стр. 436.
2 Ind. chimica 1931, 870—875.
428
Аммиачноселитренные вещества
Ни одна соль не производится в настоящее время в таких гро-
мадных количествах, как азотнокислый аммоний; общая м и р о-
вая продукция синтетических азотнокислых солей достигла
в 1928 г. максимума, а именно 1 838 600 т связанного азота, из
которого на долю Германии приходилось 38,1, а на долю Аме-
рики 37,8%.
Свойства. Азотнокислый аммоний представляет собою
бесцветные, очень гигроскопические кристаллы, расплывающиеся
во влажном воздухе; удельный вес его равен 1,64—1,79
(обычно 1,73); в воде растворяется чрезвычайно легко, причем
происходит сильное охлаждение; в спирте растворим также до-
вольно легко; 100 г воды растворяют при 0е 118, при 25° 214,
при 40° 297 и при 100° 871 г соли. При медленном охлаждении
соль кристаллизуется в виде ромбических призм, при быстром —
выделяется в виде длинных гибких нитей. В отличие от других
солей аммиачная селитра обладает замечательным свойством
изменять свою структуру, т. е. при умеренной тем-
пературе она попеременно то расширяется, то сжимается. Эти
изменения структуры происходят в трех точках перехода,
а именно при 32, 84 и 125°. При нагревании (особенно в присут-
ствии небольшого количества влаги) происходит расширение и
удельный вес уменьшается. Если желательно обойти эти струк-
турные изменения, то рекомендуется селитру сильно высушить
при температуре выше второй точки перехода, т. е. 84°, и затем
тщательно укупорить.
При повышении температуры соль улетучивается (возгоняется)
и разлагается: выше 90° наблюдаются уже потери в весе, при
166° происходит плавление и около 200° соль разлагается. При
240° разложение происходит все еще медленно, при 290° —
быстро и при 300° — уже энергично. От 240 до 290° выделяются
главным образом N2O и Н2О, а в остатке образуются NH3 и
HNO31; при температуре выше 300° аммиачная! селитра дает
вспышку, причем образуются вода и закись азота. В зависимости
от температуры и начального импульса азотнокислый аммоний
может ‘разлагаться весьма различным образом, причем количе-
ства образующихся газообразных продуктов и количества выде-
ляющегося Tenjfa изменяются. Таким образом аммиачная селитра
сама по себе является взрывчатым веществом, но конечно весьма
малочувствительным; явление взрыва может иметь место только
при сильном детонаторе и в прочных оболочках или в случае
самоинициирования при взрыве отвердевшей при хранении массы
соли. Историческим примером взрыва в указанных условиях
является катастрофический взрыв в Оппау 21 сентября 1921 г.
на складе, в котором хранилось 4500 т искусственных удобрений,
представлявших собою смесь сульфата и нитрата
1 J. Chem. Soc. (Лондон), 1932, 725—736.
I. Аммиачная селитра, азотнокислый аммоний 429
аммония; взрыв произошел при раздроблении этой смеси
сильными зарядами взрывчатых веществ.
Разложение этой смеси происходит по уравнению:
2NH4NO3 +(NH4)2SO4=8H2O SO2 + 3Na -р 74,2 кал (=254 кал/кг)
54,8о/о 45,2%
Хотя эта смесь, предназначающаяся для целей искусственного
удобрения, чрезвычайно малочувствительна и может детониро-
вать лишь при особо форсированных условиях, тем не менее
вследствие неблагоприятного стечения обстоятельств такой слу-
чай все же имел место незадолго до катастрофы в Оппау —
26 июля 1921 г. — в Кривальде, где в аналогичных условиях взо-
рвался вагон с чистой аммиачной селитрой
Рис. 179. Гексо-
ген 61,2%. Перхлорат
аммония 38,8%.
Рис. 177. Гексо-
ген 48%. Аммиачная
селитра 52%.
Рис. 178. Гексо-
ген 67,6%. Хлорат
натрия 32,4%.
Рис. 177—179. 50 г каждого из указанных взрывчатых веществ
подвергнуто детонации капсюлем-детонатором № 8 в железном
тигле на 1-мм железной пластинке.
После несчастного случая, происшедшего в Оппау, на взрыв-
чатое разложение были исследованы другие неорганические
аммонийные соли. Результаты этих исследований приведены
в табл. 30 (см. след, стран.).
Судя по этим данным, перхлорат аммония при любых усло-
виях должен был бы развить меньшую энергию, чем азотно-
кислый аммоний при полной детонации. В действительности же
все перхлоратные смеси по своему взрывчатому действию пре-
восходят соответствующие селитренные смеси, в чем можно убе-
диться при взгляде на рис. 177—179, а также 194—196.
То, что перхлорат аммония в самом деле по своему взрывча-
тому действию стоит выше нитрата аммония и что этот факт не
связан с повышенным содержанием гексогена, представляющего
собою индивидуальное химическое соединение и могущего обес-
печить больший эффект по сравнению с аммиачноселитренной
смесью, лучше всего доказывает пониженный взрывной эффект
1 Kast, Uber explosible Ammonsalze, Z. f. Schiess- u. Sprw., 1926 и 1927,
оттиск, 27 стр. и 12 рис.
A
Аммиачноселитренные вещества
ТАБЛИЦА зо
Данные, характеризующие взрывчатые свойства важней-
ших аммонийных солей (по Касту)
Теплота взрыва б. кал{кг Расшире- ние см3 Температу- ра взрыва Объем га- зообразных продуктов на кило- грамм в л 1 Скорость детонации Шеек) Проба нагрева- нием в метал- лической бане (5 г)
Азотнокислый аммо-
ннй (неполное раз- ложение) 207 165—190 800° 945 1200—1500 Разлагается при 180—220, выше 250° вспенивается с в ыделением
Азотнокислый аммо- окислов азота
ний (полное разло- жение) 350 220 1230° 980 2000—2500 Выше 300° в ыделяются
Перхлорат аммония 266 220 1180° 810 ок. 3000
Хлорат аммония (не- окисли азота
устойчивый) . . . 459 245-255 1850° 828 3300 При 130° во- спламеняется и сгорает с
Азотистокислый ам- шипением
моний 803 — 2210° 1050 ок. 4000 —
Азид аммония . . . 1040 — 1400° 1148 — —
Важнейшие уравнения разложения нитрата аммония:
на килограмм
газообраз- -
ных про-
кал
дуктов
1. При нагревании выше температуры плавления:
NH4NO3 = 2Н2О (парообразн.) -f- N3O -I- 30 б. кал . . 838 л 375
2. При неполной детонации:
8NH4NO3 = 16Н2О (парообразн.) -f- 5N24-2NO.,-j-4NO +
+ 132,6 б. кал............................'............ 945 л 207
3. При полной детонации в очень прочной оболочке под
действием сильного детонатора:
2NH4NO3 = 4H2O (парообразн.)-f-2N2-}-O2-f-56 б. кал 980 л 350
Разложение перхлората аммония под действием достаточно
сильного начального импульса выражается уравнением:
4ЫН4С1О4 = 6Н2О (парообразн.) -f- 4НС1 -f- 5О2 -j- 2N2 -f-
+123,2 б. кал.......................................... 810 л 266
или
2NH4C1O4 = 4Н2Ь -|- С12 + N2 + 2О2 + 76,6 б. кал при t
меньшем объеме получается большее количество тепла '
и температура взрыва также выше, а именно равна
1410°................................................ 763 л 312
смеси, изготовленной на основе хлората натрия, ибо в этой
смеси гексогена содержится наибольшее количество, а сам хло-
II. Производство аммиачноселитренных взрывчатых веществ 431
рат натрия характеризуется чрезвычайно выгодным кислород-
ным балансом.
Вещества, заменяющие аммиачную селитру
Уже несколько десятилетий назад для замены чрезвычайно
гигроскопичной аммиачной селитры были предложены н и-
траты различных содержащих азот оснований;
благодаря тому что эти нитраты имеют те или иные преимуще-
ства, они все время являются предметом различных патентных
заявок; однако до сих пор эти суррогаты аммиачной селитры ни
разу не нашли практического применения.
Нитрат мочевины CO(NHa)2 • HNOs вследствие своего кислотного
характера и недостатка кислорода, достигающего 6,5%, не имеет реши-
тельно никаких преимуществ. Несколько лучше нитромочевина
NO2 • NH • СО NHs, которая получается из предыдущего нитр'ата отня-
тием одной молекулы воды; однако преимущества, связанные с примене-
нием нитромочевины, не находятся ни в каком соответствии с расходами
по ее получению. То же самое справедливо в отношении кислого н и-
трата гидразина N2H4 • HNOa и этилендиаминдинитрата (—СНг • NH2 -
• НЫОз)2, который кроме того очень гигроскопичен; расширение в свинцо-
вом цилиндре для нитрата гидразина составляет 320 и для этилендиамин-
динитрата 345 см3 (К а с т).
Большего внимания повидимому заслуживают соединения, получаемые
в последнее время с хорошими выходами действием азотной кислоты на
гуанидин1, а именно нитрат гуанидина и нитрогуанидин:
yNH2
С — NH • CN
nh4no3
zNH2
C-NH2 • HNO3
^NH
— Н2О
дициандиамид,
темп. пл. 207,5°
аммиачная
селитра
гуанидинни-
трат
темп. пл. 217°
/NIL
С—NH • N02
%JH
нитрогуанидин,
темп. пл. 232°
Нитрогуалидин получается действием сильно охлажденной серной кис-
лоты на гуанидиннитрат, причем температура реакции поддерживается
ниже 0°; в этой реакции происходит отнятие одной молекулы воды. Это
нитросоединение растворяется в воде при 20° всего в количестве 0,3% и,
судя по некоторым патентам, могло бы заменить аммиачную селитру в по-
рохах. Наконец следовало бы упомянуть еще о стойком перхлорате
гуанидина, представляющем! собою сильное взрывчатое вещество (рас-
ширение в свинцовом цилиндре 400 см3, скорость детонации почти
6000 м/сек при плотности 1,15).
II. Производство аммиачноселитренных взрывчатых
веществ
Приготовление этих взрывчатых веществ очень несложно и
состоит главным образом в простом смешении предварительно
подготовленной аммиачной селитры с соответствующим нитро-
соединением и добавлением некоторого количества ржаной или
древесной муки. Прежде, особенно во Франции, для этой цели
‘Smith, Sabetta a. S t е i п Ь а с h, J. Ind. Eng. Chem., 1931, 1124—1129.
432
Аммиачноселитренные вещества
употребляли моио- и динитронафталин, а позднее весьма под-
ходящий для данной цели, но очень ядовитый динитробензол;
в настоящее время в качестве углеродсодержащего компонента
пользуются тринитротолуолом, не имеющим ядовитых
свойств и запаха. Наряду с ним часто находит применение
также и динитротолуол.
Производство распадается на следующий непрерывный ряд
операций:
1) сушка аммиачной селитры,
2) измельчение аммиачной селитры,
3) смешение компонентов и остывание порошкообразной
массы в железных барабанах,
4) просеивание (зернение),
5) патронирование,
6) парафинирование патронов и пакетов.
1. Подготовка аммиачной селитры
Сушка и измельчение аммиачной селитры
производятся так же, как и в случае приготовления «добавок»
(Zumischpulver) в производстве динамита.
Для перевозки селитра укупоривается в деревянные бочки1
весом 100—200 кг; бочки обыкновенно выкладываются бумагой;
укупоренная в них селитра почти всегда образует более или
Рис. 180. Паровой сушильный шкаф с циркуляцией воздуха.
менее прочную и влажную слежавшуюся массу, которую перед
тем, как передавать на сушку в шкафах, необходимо
измельчить в дробилке или деревянной толчее. Один из таких
сушильных шкафов, изготовленный из жести и снабженный па-
ровыми нагревательными приборами, представлен на рис. 180.
Обыкновенно три, четыре и более таких шкафов связаны с одним
и тем же паропроводом. После того как селитра достаточно из-
мельчена, ее насыпают на плоские противни слоем толщиною
1 В настоящее время для укупорки аммиачной селитры успешно при-
меняются бумажные мешки. Прим. ред.
II. Производство аммиачноселитренных взрывчатых веществ 433
в 10 см и сушат при 50—70° в течение 24 час. *; после сушки еще
не остывшая селитра пропускается через мельницу «Экс-
цел ь с и о р» или, еще лучше, через дезинтегратор. Эти
мельницы устроены таким образом, что в герметически закрытом
чугунном корпусе вращаются навстречу друг другу два диска,
из которых каждый несет один или несколько рядов, располо-
женных по окружностям стальных штифтов. В мельницах «Экс-
цельсиор» и в дисмембраторах (дробилка с бильными пальцами)
один из этих дисков неподвижен, в дезинтеграторах же, измель-
чающих более совершенным образом, оба диска вращаются
навстречу друг другу со скоростью приблизительно 500—
1500 об/мин.
Из многочисленных образцов таких штифтовых мель-
ниц следует назвать мельницу «Перплекс», а также мель-
ницу Ideal-Memag, представляющую универсальный механизм
с неограниченными возможностями применения для материалов,
предназначаемых к измельчению (всевозможных структур и твер-
дости), в котором желаемая степень измельчения достигается
соответственным установлением зазора между зубьями.
Внутри герметически закрытого корпуса на скрытых в корпусах шари-
коподшипниках «ставлен диск, снабженный билами.
При быстром вращении диска била проходят между несколькими ря-
дами штифтов, расположенными в крышке корпуса. Штифты представляют
собою отдельные ввинчиваемые зубья особого сечения; посредством махо-
вичка, расположенного на крышке, они могут быть утоплены во время
работы мельницы настолько, что в зависимости от обрабатываемого мате-
риала и желаемой степени измельчения может быть установлена
надлежащая ширина зазора между билами вращающегося диска и штиф-
тами. При этом сдвиг зубьев, расположенных на всех окружностях, про-
исходит на один и тот же угол, так что ширина зазоров от центра мель-
ницы к сетке все время становится меньше, и потому материал измель-
чается постепенно все мельче и мельче. Самые зубья с целью повышения
режущего действия и образования подходящих ударных поверхностей
имеют поперечное сечение, ограниченное большим числом граней; в случае
повреждения каждый из них в отдельности может быть заменен новым.
Мельница «Идеал» (Ideal-Memagmiihle) имеется четырех размеров; из
них мельница наименьшего размера весит 600 кг и делает до 3000 оборотов,
расходуя 6—8 л. с.
Грубое измельчение, сушку и тонкий размол селитры целесо-
образно производить в одном и том же хорошо отапливаемом
помещении. Тотчас по измельчении еще теплая селитра в коли-
честве около 120 кг навешивается в хорошо закрываемые желез-
ные барабаны и перевозится в мастерскую смешения для даль-
нейшей переработки.
Менее распространены шариковые мельницы. Хотя
они могут дать любую желаемую степень измельчения, однако
работа на них производится медленнее и стоит дороже. Так на-
1 Такой способ сушки аммиачной селитры редко применяется как
мало производительный; обычно селитру сушат в барабанных сушилках.
Прим. ред.
28 Звк. 3171. — Штетбнхер.