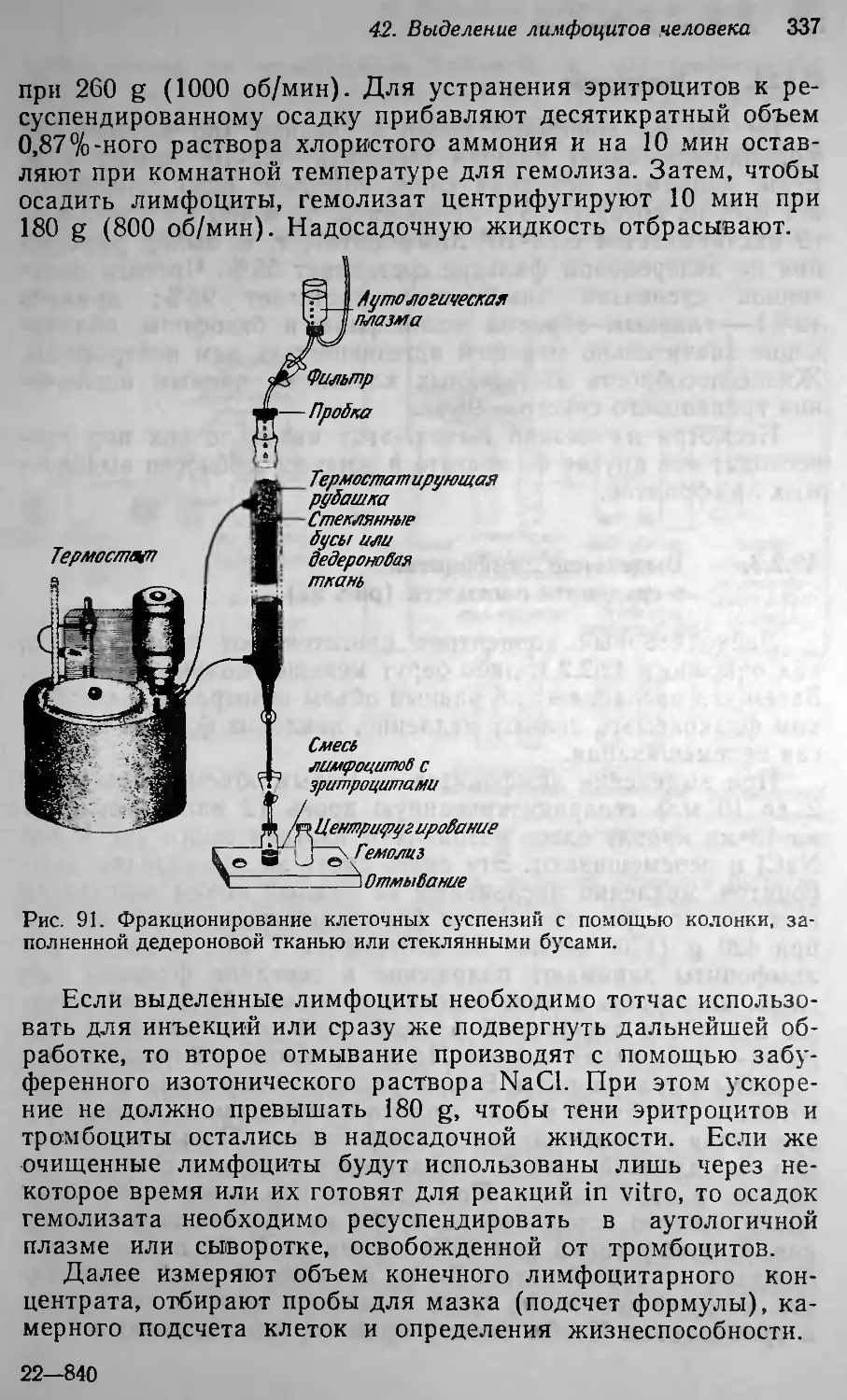
Текст
Immunologische Arbeitsmethoden
Herausgegeben von
Prof. Dr. sc. med.
HELMUT FRlEMEL
Leiter der ForschungsabteiIung Immunologie
Bereich Medizin
der Wilhelm-Рiесk-UпivеrsШit Rostock
УЕВ Gustav Fischer Verlag Jena
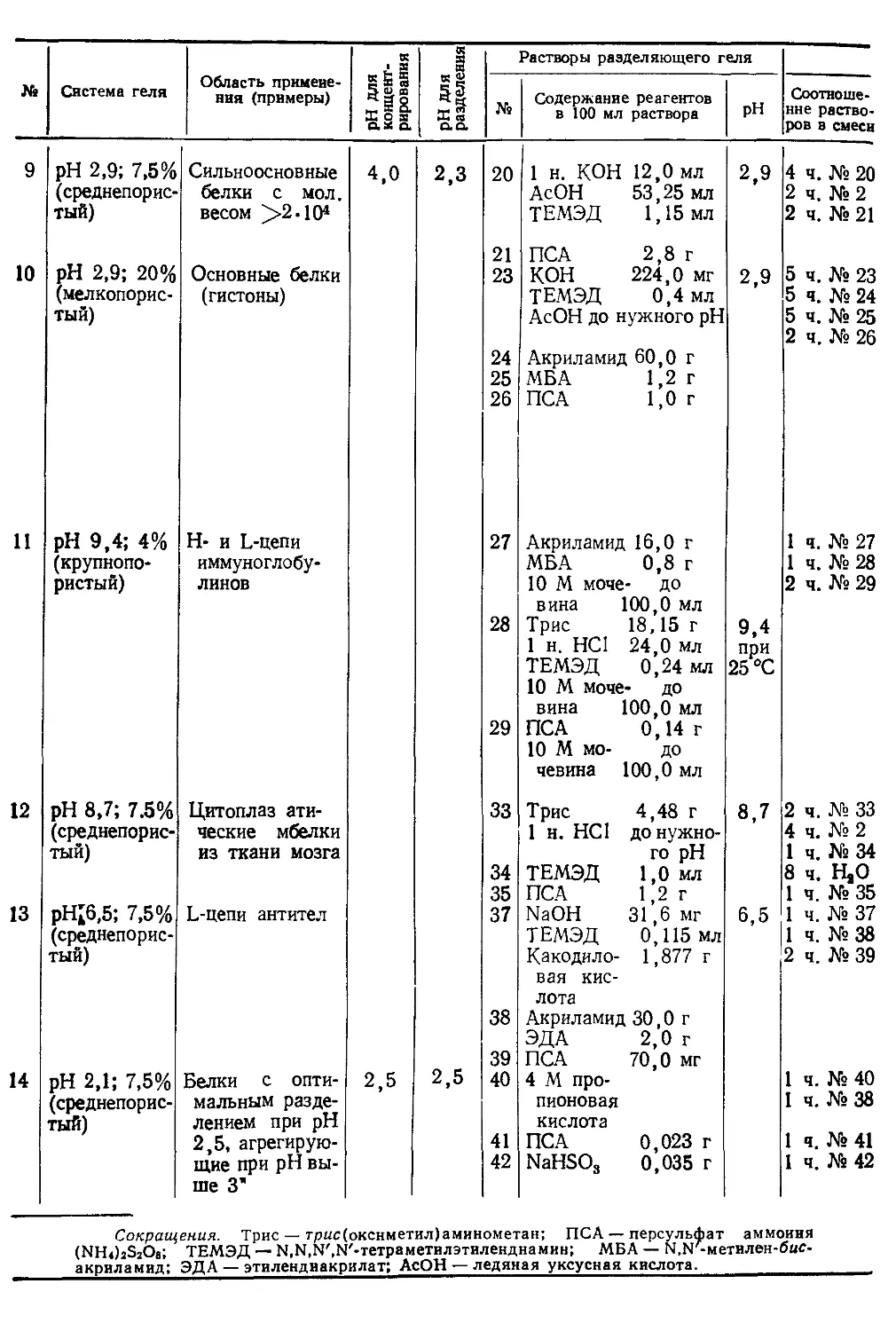
1976
иммунолоrИЧЕСКИЕ
МЕТОДЬI
ПОД редаI\цией
Х. Фримеля
Перевод с HeMeJ I<OrO
ианд. мед. HaYI{
А. Н. МАЦА
ПОД редаI<цией
д pa мед. наун
М.А.ФРОЛОВОй
ИЗДАТЕЛЬСТВО «МИР»
МОСНВА '1979
УД 1( 576.80/85
В книrе описаны практически все основные методы, кото-
рые используются в современноЙ клинической и эксперимен-
тальноЙ иммунолоrии ,J}IЯ решения различных задач, начиная
от выделения антител, антип нов и иммунокомпетентных клеток
и кончая определением их специфическоЙ активности. Все ме-
тоды описаны по одному плану. По каждому методу выбран
наиболее разработанныЙ вариант, которыЙ можно воспроиз-
вести, не прибеrая к дополнительным источникам.
Предназначена для иммунолоrов, И IМУНОХИМИКОВ, микро-
биолоrов, вирусолоrов, биохимиков, rенетиков, врачеЙ, а также
для специалистов, работающих в клинических лабораториях.
Редакция литературы по биОЛО2ии
2605030000
И 21007 130 130 79
041(Ol) 19
@ 1976 УЕВ Gustav Fischer \T er lag
@ Перевод на русский язык, «Мир», 1979
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
Развитие наУ'КИ неразрывно ,связано 'с Iра1сши'рением и ,со-
вершеНСТВOiваlН'ием арсенала применяемых iметодов иоследо-
вания. Это в полной мере ОТНОСИ'I1СЯ и К 'иммунолоrии, бур-
ныЙ проrр'есс !к'оторой IB последние десятилетия превратил
ее из уз ой медицинской дисциплины, 'Изучавшей способы
защиты opra'I-i'изма О'т инфекционных areHTOB, в широкую об-
щебиолоrичеокую науку. Осно'вной задачей Э'I10Й науки стало
исследование механизмов и путей реализации системы имму-
НО.10rическоr,0 надзора,о6еспечивающеI10 ;сох'ранен'ие посто-
янства В'ИДО'В !и ИIНДИВИДУ)'iмов.Новые задачи потребовали ис-
пользования навых методичеок,их ,приемов и в с'Вою очередь
явил'ись мощным стимулом для создания ОРJrrинальных ме-
тодов исследования.
Труд 38 aВiTopOB, работающих в иммунолоrичесжих цент-
рах r ДР (преимущественно на меДИЦИНСКОМ факультете Ро-
,CToКioKoro универ,ситета), обобщает основные современные
методы иосл'едования, нашедшие широкое применение в ,ИМ-
мунолоrии 'в последН'ие 10 15 лет. Каждый Из 59 основных
разделов :пас'Вящен пощробному описанию ОДноrо метода и
ero модификаций и написан 'иоследователем, имеющим боль-
шой личный <опыт ero 'ПРИiменения. Последнее обстоятельство
особенно ценно, TalK как alBTopbI нередк'О пр'И'влекают вН'има-
'ние чита:теля 'к ря,ду на пе,р'вый 'взrляд мелких деталей и
приемов, что весьма облеrчает успешное воспроизведение
описываемоrо метода. Этому же способствует четкюе и одно-
ТИпное изл'ожен:ие материала. Списки литературы, приведен-
ные в конце каждоrо раздела, позволят читателю подробнее
'озна'комиться 'С тео,ретическими основами Toro или иноrо мето-
да, er,o ВОЗМ'ОЖНОСТЯМJИ и оr,раlничениЯlМИ (эти ,сведения при-
ведены в ,сборнике очень кратко), а также с ра'ботами, вы-
полненными 'с использованием данноrо Iметода.
Большое место в 'PY'KOiBlOiдcTBe занимают ,методы 'Изучения
'клеТОЧНОf\О иммунитета .и иммунокоМ'петентных клеток, кото-
рым посвящена почти ПОЛО'ВИiна объема кнИI И. Эта осо6ен-
ностькН'иr,и, ча,стично определяемая научными интересами
авторов (ка'к об этом пишет составитель 'сборника проф. Фри-
'мель), представляе'I1СЯ ВlПолне опра:вданной в 'связи с особым
значением данноrо аспекта И1ссл'едО'Ваний в современной ИМ-
6 Предисловие редактора перевода
МУНОЛОI"ИИ. Широкий набор методов выделения клето,к, их
разделения л изучения, включающий такие новейшие разде-
лы, 1ка'к препаратИ'вныЙ и анаЛ'ит,ический элеК'Dрофорез кле
ток и определение феноменов клеТОЧiНОI1О 'иммунитета по те-
сту электрофоретической подв,ижност,и ма!крофаrов и ЛИМ-
фоцитов, послужит ценным подспорьем для широкоrо Kpyra
теоретиков и практИIЮВ, так как в литературе отсутствуют
описания унифицированных мет,одик по эт,им вопросам.
Не меньший интерес представляют iразделы, посвященные
методам препаратив.ной очистки тканевых антиrенов ,и раз-
лИчных К.1ассов 'иммуноrлобулино'в. Эти процедуры становят-
ся необходимыми широкому KPYry ,специалистов, работающих
в области инфекционной ИМlмунолоrии 'как 'в эксперименте,
так и в клинике. Следует о'Т'мет'ить также умелый по;цбор
современных 'Иммунохшлическ:их методов (10 разделов) ,вклю
чающих основнЫе приемы, наиболее широко применяемые в
ИМiмунолоrических лабораторлях.
В книrе не описаны .мноrие методы инфекционной имму-
нолоrии, ставшие классическими, но это 011НЮДЬ не является
ее дефектом, так как позволяет избежать чрезмерной пере
rруженнасти текста и .тrerKo может быть >Пр:И необходимости
восполнено .И<с>пользованием мноrочисленных руководств.
Все изложенные в книrе методы описаны с учетом наи-
более совреиенных ('Ка ,времени ее публикации) данных. Од-
нако стремительное раз,витие некоторых разделов им,муноло-
rии таких, как трансплантационный иммунитет или радио-
Иiммунолоrичеокие IметоДЫ исследования внооит пост()янные
уточнения в методические приемы, ПРИiменяемые в этих об-
ластях. Более подробно с ними можно ознакомиться в кни
rax «Histocompatibility Теstiпg 1977» (W. Bonner ed.),
Мuпksgааrd, Copenhagen, 1978; ,L. Raith «Iпtrоduсtiоп to Ra-
dioimmunoassay iVlethods», Frankfurt аm Main, 1975, и др.
В целом издание является Чiрезвычайно полезным ме110ДИ-
ческим руководством по лабораторным ме110дам, применяе-
мым в иммунолоr,ии, и, несомненно, 'станет ;настольной кни-
rой не только для широкоrокруrа исследователей, но и для
работников клиничеоК'их лабораторий, использующих эти ме-
тоды в своей деятель'ности.
М. А. Фролова
ПРЕДИСЛОВИЕ РЕДАКТОРА
НЕМЕцкоrо ИЗДАНИЯ
Раз'витие любой научной дисциплины сопровождается
разработкой соответствующих методов lисследования. Обоrа-
щение ИММУiнолоrииновыми лабораторными ,методаии проис-
JCО,J,ИТ, B. ч-аст'нОС'DИ, блаrода'ря ее междисциплинарному ха-
pa К'Tepy и Нсе возрастающему значению для медицины. На-
стоящее из.дание должно облеrчить быстрое ОСВоение я ши-
рокое I1рименение иммунолоr.ических методов в научных ис-
следованиях и медИцинокой праlктике.
ВЫбор вошедших в iМо.ноr,раФ'ИюмеТОДQВ в известной. ме-
ре 011ражает собственные научные интересы авторов. В со-
ответствии с rла,внЬLМ направлен!ием Iсовременнойи:ммуноло-
r,ии широко представлены методы изучения им'мунокомпе-
тентных клето'К .и клеточноrо иммytнитета, но из-'за недостат-
ка места не были Вiключены методы изучения синтеза анти-
тел в КУЛь'туре ткани. Чтобы читательмоr быстро ориенти-
рова'ТЬ'сяв тексте, описание о'ТдельнЫХ ме110ДОВ разбито на
четыре рубрики: «Принцип», «Пронедение исследования»,
«Оценка метода», «Литература». В списках литературы ука-
заны лишь отделЬ'ные при.нципиально важные ,работы.
Задача этой книrи ,помочь научным и техническим со-
трудникам иммунолоrических лабораторий в освоении методов
исследования. Чтобы решить эту задачу, тридцать восемь спе-
циалистов объединили в одно'М руководстве свой собственный
опыт постановки В общей сложности пятидесяти девяти раз-
личных лабораторных iметодик. Редактор и авторы надеют-
СЯ, что книrа будет способствовать дальнейшему распростра-
нению ИМlмунололичес'ких методов, и В'сеI1да ротовы принять
любую критику, кО'торая ,пО'моrла бы улучшить издание.
Росток, декабрь 1973
п раф. Х. Фрuмель
ПРЕДИСЛОВИЕ РЕДАКТОРА
НЕМЕцкоrо ИЗДАНИЯ
К Р"УССКОМ"У ПЕРЕВОД"У Rниrи
Стре:мительное развитие иммунолоr,ии в послеДние rоды
привело к появлению мноrочисленных новых методов иссле
дования. Со&местнЫiМИ У'СИЛ'ИЯIМIИ rруппы автор'ов удалось
собрать в предлаrаемой книrе /Важнейшие из них. Задача
издания оказать методичеокую Тl!омощь иммунолоrич'оскИiМ
.1або,раториям и УСКOIРIИТЬ освоение навых методов.
Редактор и авторы хотели бы, 'Чтобы ыниrа заинтересова-
ла широкий Kpyr специалистов 'в СССР. Любые замечания,
направленные на повышение ее праlктичеакой .ценности, бу-
дут восприняты нам'и с блаroдарностью.
Росток, ноябрь 1977
х. Фрuмель
1. Иммуноэлектрофорез (микрометод)
Х.ФРИМЕЛЬ
1.1. ПРИНЦИП
При иммуноэлектрофоретичеокам анализе за электрофо
резом в arapOBo,M ,r,еле 'следует И1ммунодиффузия. ИМ'муно-
элект,р,офорез вперiвые описали rрабар и Уильямс в 1953 r.
[1]. В 1955 r. Шейдеrrер [2] лредложил 'микромо'Дификацию
эrоrометода, ПРIИ1менИ'в обычные Iпредме11ные стекла. Принцип
иммуноэлектрофор'еза состОит IВ ,следующем. Вначале прово-
Дят ЭЛ'8К11рофоретическое (разделение смеси белков в забуфе
реннOIМ arapoBOIM rеле. После разделения в ка'навку, KOTO
..
о
J'
. АнтиееН6I
.. П,ецилитаиия
A Hтитe.!11Z
Рис. 1. Принцип иммуноэлектрофореза.
рая идет в нап,равлении миrрации беЛlКОВ, вносят преципи-
тирующую иммунную сыворотку. АН1шrен и антисыворотка
дwФфундируют в rеле на,встречу друr друrу, и в месте их
взаимодействия ,Возникают дуrообlразные линии преципита-
ЦИИ. Число, положенИе и форма этих линий дают представ-
ление о 'саста'ве исходной омеси антиrенов (рис. 1).
1.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
1.2.1. Материалы и приборы
Предметные стекла, пробирки с Iпробками, пипетки на
10 мл. Очищенный arap или а,rароза, 'консервант (например,
меРТJ:lIОЛЯТ). ПрепарО'вальная иrла .ИЛlИ небольшой шприц с
Иlr,лой. Микропипетка со шл,анrом и мундштуком или iМиК'ро-
шприц (на 50............jl00 мкл). Фильтровальная бу.маrа (напри-
10 Х. Фри< tедь
мер, FN14). NaCl ч. д. а.; безводная уксусная кислота' ами-
До-черный 10B: ве р онал-Nа' ацетат нат р ия ( 3Н 2 0 ) . 'о 1 Н
HCl. ' , , .
Комплект прибор,ов для иммуноэлеКl1рофореза, в IКОТарый
обязательно должны входить источник тока, электрофО'рети
че кая iKa!Mepa и шта, шы (напрИ/мер, выпуск,аемые фирмой
Muller KG, Росто!к, r ДР); водяная баня; стеклорез; у,равень;
ванночки для окрашивания предметных ,стекол.
1.2.2. Приrотовление arapOBoro rелл
Суспендируют 1,5 r очищенноrо arapa в 100 ,мл веР,Qlнал-
ацетатноrо буферноrо раствора (,рН 816, ионная ,сила 0,1), дo
бавляют мерт.иалят до конечной Iюнцентрации 1: 1 О 000 и
наrревают iсу,спензию в водяной бане до полноторасплавле-
ния arapa (раствор становится п.роз'рачным).
Состав 6уфер1iОсО раствора
Веронал-Nа
Ацетат натрия (3Н 2 О)
0,1 н. НСl
Дистиллированная во-
да
29,43 r
19,42 r
180,0 мл
;:"0 3000,0
мл
rарячий прозрачный раствор ara,pa !разливают по прабир
кам (наполнять только до половины), rrробирки закрывают
пробка,ми, оставляют при комнатной темпе,ратуре и после
охлаждения хранят в халодильнике при 4°с.
1.2.3. Приrотовление arapOBbIX пластинок
Тщательно оч:ищенные И обезжиренные предметные стек-
ла надписывают стекло'резом и помещают IHa rоризонтальную
плоскость (рис. 2). Несколыко пробиро'к 'с 1,5 % -ным arapo-
БЫМ rелем наrревают в водяной бане. С lПомощью предвари-
тельно наrретой пипетки (10 Iмл) на ,каЖДое предметное
стекла наносят 'по 2,5 мл rорячеrа arapaBoro золя. Ра'створ
arapa должен равномерно ра'спределятЬ'ся па обезжиренной
поверхности стекла и после заl"вердения давать аднородный
слой rеля.
1.2.4.
Вырезание лунок и канавок в rеле
С помощью штаlМЛОВ в слое rеля вырезают лунки для ан:'
тиrенав и канавки для антисывораток. Выбор падхадящеrо
шта'мпа 0:ПР5деляется задачейисследо'ваIНИЯ. Очень удобны
штампы с изменяемым профилем (рис. 2). Вырезанные
1. 11.I/AtуноэлеКТ(Jофорез 11
СТо.1бшш rеля удаляют иrлой или с IПОМОЩЬЮ водоструйноrо
насоса. В образ,овавшиеся лунки 'вносят примерно па 2 мкл
lIСС.'1€'ДУе.моI'О матер:иала; дЛЯ Э11Оl'0 можно использовать мик
рошпрнц или микропипетку, 'В носик которой вклеена инъек-
ЦlIонная иrла, а на друrой конец надет шланr с 'мундшту
: >; :- : : ;: , ..' .. ;""
jjjl "Ь .
...ё. "
.. .
j" .
1 6 '...... .
"- ;
:. :.
i' ".: "_ ,;:;;/:- : >:_
Рис. 2. [оризонтальныЙ CTOтIК, рамки Д.'IЯ пред:метных стекол и штампы
для вырезания rеля (МiШеr KG, Росток, [ДР).
ком. Полоски rеля, образовавшиеся после вырезания 'Кана-
вок, также следует удалить до электрофореза, а не после He
1'0, коrда это труднее ,будет сделать из-за наl'ревания rеля.
ВырезаlННЫЙ ,rель удаляется rараздо леrче, если пластинку
поместить на 1 2 Iмин в мо.рОЗЮIb'ник.
1.2.5. Электрофорез в rеле
Электрофоретическую камеру присоединяют к источнику.
который должен обеспечивать стабилизированный ток до
100.мА (рис. 3). Электродные отсеки 'Заполняют веронал-аце-
татным буферным раствором с рН 18,6 .и устанавл:ивают \Ка-
меру cTporo rаризонталь'Но по УРОВНЮ. Лодrотовленные пла-
СТИНrКИ rеля в соответствии 'с имеющеЙся инструкцией rори-
зонтально закрепляют в к,амере и влажными полосками
фильтровальной бу.маrи соедИlНЯЮТ с электродным буферам.
Хорошее разделение белков человеческой 'сыворотки обычно
происходит за 100 120 мин при напряженности поля 6
7 В/см.
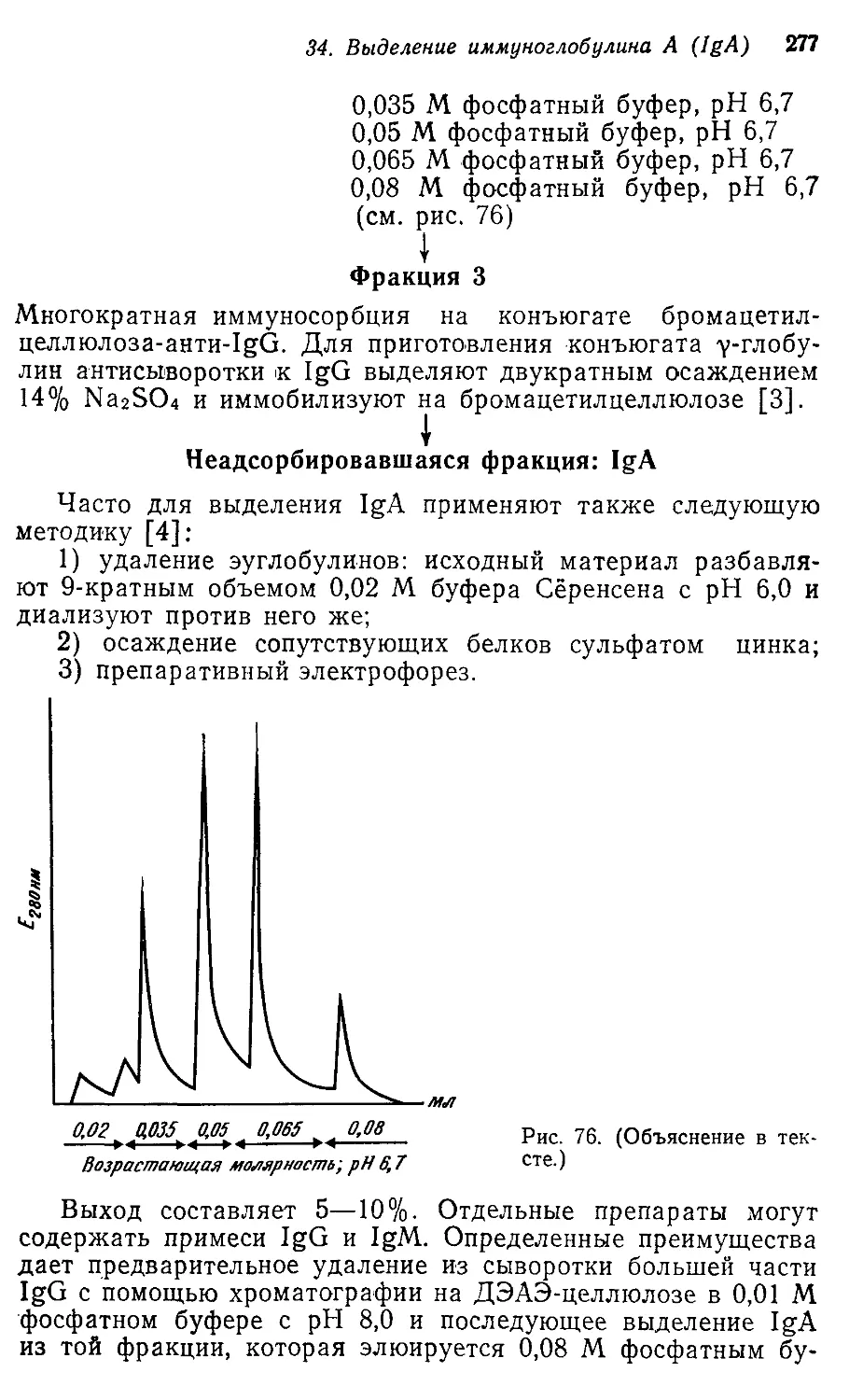
1.2.6. Внесение аНТIIСЫВОРОТКИ
После электрофоретичеокоrо разделения белков 1]3 П'Ро
дольную канавку вносят O,03 O,05 !мл 'преципитирующей Ю1
мун ной сыворотки. Сыворотка .не должна перел.иваться через
край канавки, иначе 'Расположение лин:ий преципптацпи иска-
зится.
12 .\. Фри.1tель
,.,
. .«
. ......""",. ......,..............,.. .,. ,... . -';". '-';:4/:
'''с '. 1 'iI "M""", '" : .
'",'''''''''''' T ':r' >:!'''''o ''' .-. . ;1 '" iJ
'1' C''' -- '.. ,;: , j;r. IJ.
c: ' , . ["'"'-" . .:" ;, . ;i r ::,. ... ,\T !C
\ > " ",J'"' "' /1;:;' y ,
{J;:. . ... ,.,/<'..': l
. . . .: '1';.:
..
Рис. 3. Электрофоретическая камера с источником электропитания (Mi.iller
KG, Росток, [ДР, и Statr()n, Фюстенвальде, [ДР).
1.2.7.
ИnОIУНОДIlФФУЗИЯ, злюирование,
ОБрашивание
И I'МУНОДИФФУЗИЯ ПРОДО.rIжается не менее 24 ч во влаж-
ной КЮ1ере ('рис. 4). Затем сразу же начинают элюировать
бе.1КИ, которые не участвовали в преципитации, при помощи
.. о..
':;: ::.:::{: .-::.r;;?:" ;:::.":.. . ".':' ш"'ш'
,,;;...;мrc-::v......:.
c .. . -{.; ;. .'.. ....
о". .:..:' :... . >.{, .
S i ? ; i ; ;/. .
"-<.....';:
..,
. ,
..:::.<.. .......::.:..;.:;..,
-,'" ..
.- -: . ..
... Y"
.. :,,_ ...;.;...i-..........."'.......
,. .
. ;'-.
'..:..','Z;"
..
. ...ц ", ..;..'
Рис. 4. Ванночки для окрашивания и 3,!)ЮЦИИ. Справа штатив для рЮlOк
с предметными стеклами (Mi.iller KG, Росток, [ДР).
0,15 М NaCI. Э.,1юированпе продолжается трое суток с еже-
,J,невной сменой элюирующеrо раствора. После этоrо П.13-
СТИiнки rеля на,крывают фильтровальной бумаrой (не остзв-
ляя пузырыков воздуха) и высушивают при комнатной 'Тем-
пературе или в сушильном шкафу прп температуре iНe выше
J. ИАtмуноэлектрофорез 13
40 ос. ДЛЯ окрашивания бел'кО'в чаще BCel'O применяют а'ми-
до черный 10B, ли{:сам,И'новый зеленый, азО'ка.рмин В или
пунцО'вый 2R. ЛипопрО'теиды окрашивают суданом черным В.
При этом важно О'к,рашивать полностью ,высушенный препа-
рат, та'к 'Ка\к су Зtн черный В оНераствоpiИМ :в воде и не вос-
'"о
.#:
D. _
T
.,,:......
п.
'ни
. :
...:-.
. .:,."':<..... ..;;..
."../1- . " О, ,_ ...... ".
р.;
... ..
"':"'".
..
.,.. .o;,.'""
.....>,; ... ". .,-
Рис. 5. Иммуноэлектрофореrрамма человеческоЙ сыворотки, ПО.1ученная с
помощью кроличьей антисыворотки ко всем сывороточным белкам че.'10века.
принИ/мается влажным rелем или образует на нем осадки.
Об О'крашивании фер,ментов СМ. р'азд. 8.2.
На рис. 5 предстаlвлена имму.ноэлектрофореrрамма белков
челО'веческой ,сыворотки, пО'лученная с помО'щью полиспеци-
фической а,нтисыворотк'И к,РОЛИJка.
1.2.8.
Варианты
иммунозлеRтрофоретичеСI\ОI'О анализа
1.2.8.1 .
Использование ,чистых антиrенов
При меняя О'ДНО' лишь О'крашивание, часто не удается
iНдентифицировать .неизвесТ\ный антиrен. В этом случае MO'
жет ПО'мочь сравнение .исследуемоrо а'нтиrена с известными
фU""", инmщ:и60p0mки
I О ИJ6естн",,; рнтиеен
Рис. 6. Идентификация исследуемоrо антиrена путем сравнения с известны-
ми чистыми антиrенами по электрофоретическоЙ подвижности.
ЧИстым,и антиrенами. PeareHTbl раСПО'Jl\аrаЮТ, как lIоказа'но
на риоС. 6. Различие в элеКl'рофоретичеокой подвижнО'сти Y1 a-
ЗЬ1'Вает на ,нецдентичность сраВНИВiаемых антиrенов, и этО'
П.QЗ\ВОJlяет 'исключить в,се аlНтиrенЫ, О'ТJLичающиеся от иссле-
дуемоrо по ПОДВRЖ'НОСТИ.
14 Х. Фри.нель
1.2.8.2. Применение
IOноспеЦИфИ'lеских ИМ IУННЫХ сывороток
Если иеследователь заранее предполатает, что в изу'Чае
MO I образце пр:исутствует какой-либо определенный антиrен,
он может попытаться ero идентифицировать при помощи моно-
специфичеокой 'антисывороТ1КИ (рис. 7). Линия преципитации,
образоваlнная на одной 'стороне иммуноэлектрофореf'раlММЫ
полиспецифической СЫВОрО'Dкой, 'Может слиться с друrой ли
ЛО.lшслеЦUI/Ш,/СС/(О.я OHтUC6/1l0POт/(o
о Jfсс,//еu!/еишi онтшен
ИОНОСЛelЩФUlfl?С/(О.я oHтucbIllofJoт/(o
Рис. 7. Идентификация исследуемоrо антиrена с помощью моноспецифиче-
ских антисывороток.
нией, которую на друrой стор'оне образует ,моноспецифиче-
'ская СЫВОрОl1юа. Т,акое слияние I10ВОРИТ об цдентичности дaH
Horo коМ'понента антиrенной смеси тому антиrену, к KOTOpO
МУ была получена МОlНос;пецифическая 'сыворотка. Однако
этот прО'стой и изящный способ iидентификации а'нтиrенов
ча,сто бывает неприменим ИЗ :Зlа ОТСУ'l1CтВ'ия соатвет,ствующих
моноспецифичеCJ ИХ cы'вроток..
1.2.8.3. Метод 'Оссермана
Для идентификации по Оссер.ма,ну [3] (р,ис. 8) требуется
контрольный раствор, который должен содержать 'Толыш из-
вестные антиrены и притом возможно меньшее число их.
ло,//uспецuqщqt>СIrШ/ OIrтucbIdopoтtro
о .
Hcc,//etl!/e/ bIu OHтUi?eH
ИJllестныи онтиеен
Рис. 8. Идентификация ис-
следуемоrо антиrена по Ос-
серману.
в этом ,случае тоже лучше ИQпользовать чистые ант,иrены.
Контрольный рз,створ антиrена \Вносят в одну iИЗ кaHa OK, и
он, диффундируя в сторону каlНlавiКИ с аНТИСЫВОРОТКОIl, О'б-
1. Ищ,tуноэлектрофореэ 15
IJ)ззует лИtнию преци>питаци'И, па'Раллельную aHaBJ\iaMr
В том tМeCTe rде контрольный аН1iиrен встречается с иден-
, u,
тичным компоненто:м Иtсследуемои смеси антиrенов, линия
преципи'Т,ации 'искривляется и переходит в дуrу идентичноrо
антиrена. Четкая картина получается лишь тоrда, коrда конт-
рольный р,аствор содерЖJИТ минимальное ЧiИсло известных
антиrенов. В противном случае на иммуноэлектрофореrрам е
возникает множество беспорядочно располож,енных полос и
дут, интер\претировать которые трудно или даже невозможно.
1.2.8.4. Метод repeMaнca
В основе метода [ереманса [4] лежит реакция двух раз
личных антиrенов с аНТИСЫВОрОТJ\iОЙ, содержащей аН'IiИтела
к ним обоим. Исследуемый 3'нтиrен ,сравнивают с контроль-
ным по электрофоретичеОIЮЙ подвижности и одновременно
Рис. 9. Идентификация ис
следуемоrо антиrена по [e
ремансу.
пр ов,одя Т реакцию на ИМIМуrнолоrическую идентичность.
С этой целью в канавке для аН1iИСЫВОРОТКИ оставляют ara-
ровую перемыч:ку, положение которой определяется в пред-
ва.рительном опыте. Поэтому метод [ерема,нса называют
ТЗJКже «ме1'ОДОМ разделенной кана.вки» (р:ис. 9). Перемычка
должна находиться в 'том месте, rде ожидают слияния полос
преципитации исследуемоrо и iКонтрольноrо антиrенов (в слу-
чае их идентичности). Бели по обе стороны переМЫЧIКИ будуr
находиться идентичные или перекрестно-реаrирующие анти
reHbI, произойдет полное слияние преципитационных дуr ил[
(при неполной идентичности) 06разов,ание шпоры.
1.3. ОЦЕНКА МЕТОДА
Имму.ноэлектрофорез один из широко распространен
ных ,методов качественНоrо анализа аНТrиrенов. Ра,сполаrая
'соответствующИlМИ преципитирующими антисыворотками, с
ero помощью можво ИDследовать любую антиrенную смесь.
В ча\стности, У1спешно анализирую1'СЯ белюи сыворотки iКpo
'Ви, цереброспинальной жид:кост,и, мочи, молока .и экстр?к-
тов из opraHoB, la та.кже белки растительноI'iО :и бактериаJIЬ
16 Х. Фрu.llель
Horo происхождения. В клинике этот метод чаще Bcero ис
по.1ЬЗУЮТ при диаrностике па'ропротеинемий .и .имму;нодефи
цитных 'состояний. В судебной меДИЦИНе с ero помощью 'aHa
лизируют ,оистемы rаптоrлоБИНlа и rруппоспецифич:ескоrо KOM
понента Ос. В научtНо-'иоследовательокой ра,боте иммуноэлеК'Т-
.рофорез служит основным Iметодом идентификации белков,
ОО;I,ержащихся 'в слож,ных смесях. Он незамен.им как метод
после;I,овательноrо наблюдения за процеосом очистКiИ белко
",Н '.
r ,,:';;Ч ; f 1 , ', } ., , ' ......" , С ,: ".,.
" ," . · ", ,' r >.' >" "'"
'. '. : ..:... ( .,- : .;... J .:.: . '..di:-"..
11,: "'>.:.:" r- .....1 ':::' . .I т {.:. ;.;.« ' l /"' <i:=' , .
" ,-4 ,_,«N.. > . .
L. . . . '. , . . . "..;./'\ 1;' ;:::)i f :} ' : 'й' ;j%' .,
f': ';".. ":<>'. .
Рис. 10. Прибор для электрофореза в arapoBoM rеле по Виме (Vitatron,
Дирен, Нидерл::IНДЫ, заводская фотоrрафия).
'вых препа.ратов. Ero ча'сто иопользуют также для кО'нт,роля
ПО;I,.тинности И чистоты этих преruаратов.
.\1етод, имеющий .столь широкое /применение, разумеется,
ДО.тжен был Бидаиз,меняться и совершенствоваться вразл.ич.
ных направлениях. Были предложены новые носители, та.
кие, как rели аrарозы и полиакриламида, ацетат-целлюлоз-
ные Iембраны. Вместе с тем им,муноэлектрофорез стали ком-
бинировать ос различным:и методами специфическоrо OKpa
шивания и флуорохромирован:ия, чтобы выявлять, например,
фер lенты, уrлеводы, липопротеиды и нукл'еопротеиды. В ре-
зультате объединения с дру,лиМlИ ме'I10Да.ми анаЛiИза 'возникли
ДИОК - иммуноэлектрофорез, им>муноэлектрофаку,сирование, ра
ДИОИМ:vIуноэлектрофорез. Для количественноrо ,определения
антиrенов с помощью полиспецифических антпсывороток He
да!вно был предЛ'ожен двумерный иммуноэлектрофорез
(см. 2.2.6). С целью iнаиболее э'Кономноrо расходования pe
areHToB был разработан улыраиммуноэлектрофорез на по-
кровных стеклах. Для им,муноэлектр'офореза с охлаждением
Виме [5] ОКОНС'I1руировал прибор, автоматпческ,и поддержи-
вающий постоянную температуру и силу тока R процессе
1. И,нм.ун.оэлектрофорез 17
разделения (рис. 10). Этот прибор очень удобен для опре-
деления элеКJТрофоретической ПОДВИЖНОС'I1и различных ,Ве-
ществ. Использованное в этом пр:иборе термоэлектрическое
охлаждение (батареи Пельтье) следует особенно рекомендо-
вать 'в случае изучения фер:ментов и друлих термолабильных
веществ [6].
При иммуноэлект.рофорез1е нередко наблюдаются нару-
шения нормалыноrо процесса, и не всеrда удается сразу об-
наруж:итьих причину. Бсл,и, Iнапр;имер, иопользуется недоста-
точно очищенный a,rap, то это чаще Bcero iПрИIВ>Q)ЩТ к трем
явлеюшм: 1) ,к 'плохому образованию rеля, 2) к ,сильному
электроосмосу и 3) к недостаточно избирательному окраши-
ванию.
Поэтому недостаТОЧНОЧIИСТЫЙ a'rap всеrда подлеж.ит очи-
CТiКe. Приступая к работе 'с новой партией wra'pa, нужно сна-
чала иС!пытать ero Пр,ИI'одность. Нередко выясняется, что од-
ни и те же антиrены имеют р'азную электрофоретичесжую
подвижность и по-р!азному Qкрашиваю'Т'ся ,в ,разных партиях
arapa. Причиной на;рушен,ий пр:и Иiм:муноэлектрофорезе мо-
жет ,быть т.а!К'же rидрол,Из arapa, проис одящий обычно при
MHoroKpaTHOM или СЛИШlком долrом наrревании. О rидролизе
свидетельствует }'Iменьшен:ие rелеобразующихсвойств и .воз-
I}шкн'овение неровностей на поверхности arapOBoro rеля.
Электр'офоретичешюе разделение может быть нарушено ,при
'lI'QПОЛI:>Зовании неподходящеrо буферноrо раствора. Боль-
шинство буферов служит Х!орошей питательной средой для
бактерий я 'плесневых 'rр:ибов. Поэтому запас буфера следу-
ет ХРlанить в холодильнике или добавлять к /нему консервант.
Буфер, запол,няющий электрофоретичеокую IKaMepy, нужно
менять не реже одноТ'о раза в неДелю. При MHorOKpaTHOM
использовании электродноrо буфера необх'одимо по,сле каж-
доI'О р,азделен:ия :менять (полюса электродов. Величина на-
пряжения на 'Клеммах К'амеры обычно не позв>оляетсудить о
фактической силе тока через пластинку ,rеля, поэтому в цепь
нужно последовательно включить м.иллиа'мперметр. В про-
цессе разделения сила тока почти всеrда повышается: это
обусловлено наr:ревание,м теля, которое нараС11ает с увеличе-
,нием продолжительности электрофореза. Однако после 'пер-
воначальноrо подъема сила тока в цепи Iможет упасть. Ча-
сто это 'присХ!одит из-за подсыха'Ния 'полосок фильтровалыной
БУМ1аr.и, соединяющих rель 'с буфером, или даже caMoro rеля.
В этом 'случае следует уменьшить ионную силу буфера или
напряжение ,на клеммах камеры. Кроме TOro, высыхание
можно предотвратить, если перед электрофорезом обернуть
IПЛ3lСТИНiКУ rеля и полоски БУ1маrи полимерной пленкой. Но
удобнее Bcero 'ра1ботать с иcrОЧНiИком, который обоспеч.ивает
2 840
18 Х. Фри. lель
Л'остоянную силу тока (ста6ИЛИЗ 1 ацию To a). Результаты им
муноэлектрофореза,. разумеется, зависят также от 'качества
а'НТИrен'Ов и антисывороток.
1А ЛИТЕРАТУРА
Henker М., Otto G., Immunoelektrophorese BibHographie 195З 1970, Band 1.
Bibliographischer Teil. Dissertation, Univ. Rostock, 1972 (5400 Literatur-
stellen) .
Otto G., Henker М., Immunoelektrophorese Bibliographie 1953 1970, Band П.
Autoren Index, Sachwort-1ndex. Dissertation, Univ., Rostock, 1972.
МоftО2рафии
Backhausz R., Immunodiffusion und Immunoelektrophorese, у-ЕВ Gustav Fi-
scher Verlag, Jena, 1967.
Crowle А. J., Immunodiffusion, Academic Press, New York London, 1961.
Grabar Р., Burtin Р., Immunoelektrophoretische Ana1yse, E1sevier РиЫ. Со.,
Amsterdam London New York, 1964.
Kuhn R. А., Immunoelektrophorese-Fibel. 2. Auflage. УЕВ Gustav Fischer Yer-
lag, Jena, 1973.
Schneider W., Berndt Н" Praktikum und Atlas der Immunoelektrophorese.
Lehmans Verlag, МйпсЬеп, 1969. .
Schultze Н. Е., Heremaпs J. Р., Molecular biology of Ьиmап proteins, Else-
vier РиЫ. Со., Amsterdam London New York, 1966.
Wuhrmanп Р., Marki Н. Н., Dysproteinamien und Paraproteinamien. Verlag
Schwabe и. Со., Basel Stuitgart, 1963.
Wunderly C/L" Immunoelectrophoresis: Methods, interpretation, results. Adv.
Clin. СЬеm, 4, 207 273 (1961).
Цитированные работы
1. Grabar Р., Williams С. А., Methode permettant l'etude conjuguee des pr-o-
prietes electrophoretiques d'un melange de proteines. Application аи serum
sanguin, Biochim. Biophys. Acta, 10, 193 194 (1953).
2. Scheidegger J. J., Une micro methode de I'immunoelectrophorese, Int. МсЬ.
Allergy Appl. Immunol., 7, 103 110 (1955).
3. Ossermann Е. Р., А modified technique of immunoelectrophoresis facilita-
ting the identification of specific precipitin arcs, J. Immunol., 84, 93 97
(1960). .
4. Heremans J. Р., Die Immunoelektrophorese und ihre klinische Bedeutul1g,
Ergebn. Inn. Med. N. F" 20, 171 257 (1963).
5. Wieme R. J., Agar gel electrophoresis, Elsevier РиЫ. Со" Amsterdam
London New York, 1965.
6. Кleist Н" Friemel Н., Brock J., Mucke D., Nelius Н., Thermoelektl'ische
Ki.ihleinrichtung fi.ir die Gcl- und Immunoelektrophorese, Z. med. LabOl.tech-
nik, 11, 351 355 (1970).
2. l\ОЛJlчественныii двумерныЙ
IIММУ 1I0элеl Т})офорез
(пе])еБреСТllыii электрофорез
по Лореллу)
Б. ширrЕЛЬ
Наряду с определением и'ммуноrлобулинов в Клинической
диаrНОСТ'иКе все большее значение приобретает КОличествен-
ный анализ друrих белков СЫВОРОТКИ. Среди используемых
методов прежде Bcero следует O'J1MeTHTb радиальную иммуно-
- -;..1;
"a"Jl :II :.
".; t" 1I;";',@;wЯ-/;:f/('
/. - ;%
> .i
....{/. ..
t
/-
W
;;.:
i
..,'':
;
«
;
;;
{
J
, .
.>,._ .V.
;
А
"f'" '\
i .
. . ;.Y
"f
. . - '. -. .
w" - - _ - ", .: .:
." :(, .,.... -- ;;.,:/.:/J.:'t:'/....,_.-'!';: . ; k
<' ::Ji '
....'...<1/
Рис. 11. Разде.lJение белков сыворотки при перекрестном электрофорезе по
Лорел.IJУ.
диффузию по Манчини [1] в различных :модификац.иях, а
таlКже электроимму1НОДИффуз:ию. .однако радиальная имму-
нодиффузия позволяет каждый 'Раз ,определить количество
только одноrо белка, к ,которому ,имеется моноспецифиче-
-ск,ая аНТИСЫВОРО11ка. Общее число различных белков, опре
деJIяемых этим методом, з,ависит от набора имеющихся а,н-
тисывороток. В отл,ичие 'от этоrо двумерныЙ электрофорез
ПОзволяет .количественно аlнализировать 'несколько диаrно
стическ.и важных сывороточных белков на одной .и той же
пластиrнке rеля.
2*
20 Б. Ш Uр2ель
Еще в 1960 r. Ресслер[7] сообщил о двумерном ЭЛelКтро-
форезе беЛIКОВ в буфере, ,содержащем аНтитела. В 1965 r.
такой же метод был описан Лореллом [2], а несколько
позднее Кларком и Фри мэном [3, 8]. При помощи этоrо
меТода с соответсТ\вующей К'рол.ичьей антисывороткой в двух-
этапном ОПЫте удалось количественно определить по мень-
ШеЙ мере 30 белков человеческойсыIоротки.. Раньше необ-
ходимость значительных количеств антисыворотки была IIIре
ПЯтствием для широкоrо клиничес'коrо применения TaKoro ме-
тода. Но блаrодаРЯМОДИфИiкац.ии Файрстоуна и Аронсона
[4] объем антисЫiВОрОТКИ, расходуемой на проведение ОДНО-
[о анализа, уменьшился до 125 ,мкл. Описанный ниже метод
разработали 'в основном Штефан и Фр1ам [5]. Для ero ocy
ществления достаточно иметь обычный 'Прибор для иммуно-
электрофореза. Затратив 0,25 0,5 мл антисыворотки, можно
количественно определить около 20 различных фракций cы
воротки человека (рис. 11).
2.1. ПРИНЦИП
Предлаrаемая методика, по сути, является Iмикровариан
'110М метода Лорелла. На первом этапе праводят электрофо
ретичеокое разделение СУ1ееи белков (например, сыворотки)
в rеле а'rарозы. Затем разделенные белки 'Вновь заставляют
диффундировать в rеле под влиянием электричеокоrо поля
в друrом направлении, перпендикуляpiНОМ первому. При этом
rель содержит а'нтитела (антисыворотку) , !Которые образу-
ют с исследуеУ1ЫУ1И белка,ми преципитаты в форме пиков.
Высота И.'IИ, точнее, площадь этих 'пиков прямо пропорцио-
нальна концентрации СОО11веТС11вующеrо антиrенав ис,следуе-
'мойсмеси. Площа,дь пиков з,авиоит также от концентраuии
антител в rеле. Поэтому иммуноэлектрофореr,раМi\oIЫ, ПО,,1У
ченные с антисыворотка,ми разных изrотовителей или раз-
ных серий, MorYT существенно различаться.
2.2.
2.2.1.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
РеаI'еиты и приборы
Веронал N а'
Ацетат натрия (3Н 2 О)
0,1 н. расТ'Вор НС!
Аrароза
Антисыворотка
Безводная уксусная кислота
Бромфеноловый синий
Амидо-черный 1 ОБ
0,15 М раствор NaCl
Дwстиллированная вода
Азид натрия
2. Количественный двУ,lfерный иммун.озлектрофорез 21
Прибор для иммуноэлектрофореза
МИlкрошприц
Водяная баня
Нивелирный столак
Стеклянные пластинки для фотодиапозитивов (5х 5 см), от-
мытые от эмульсии
Инъекционная иrла (диаметром 1,5 мм)
Фильтровальная бумаrа (например, FN4)
Для изrОТOIвления rеля и для заполнения электрофорети-
ческой камеры применяют веронал-ацетатный буфер следую-
rцero состава [6]:
Веронал - N а 29.4 r
Ацетат натрия (3Н 2 О) 19,4 r
0,1 н. раствор HCl 180,0 мл
Дистиллированная BO
да до 3000,0 мл
Этот буфер имеет рН 8,6 ,и ионную силу 0,1. Чтобы окра-
сить альБУМИIН, 'который служит маркером при ,ИМ},fуноэлект-
рофорезе, растворяют 0,2 '[ 't' 'Ромфеноловоrо синеrо в 100 мл
веронал-ацетатноrо буфера. Высушенные иммуноэлектрофо-
perpa!MMbI рекомендуется расить амидо черным 10В в рас-
творе следуюrцеrо состава:
Амидо черный 10В
Безводная уксусная
кислота
Дистиллированная во-
да
1,0 r
100,0 мл
до 1000,0 мл
Можно проводить электрофоретические разделения, ис-
пользуя различную аппаратуру, напр,имер ,комплекс приборов
для иммуноэлектрофореза FK66 (Mi.iller KG, Рос1'ОК, [ДР).
Для внесения образцов сыворотки в rель нужен микрошприц
на 10 мкл.
2.2.2.
Первый этап электрофореза
СтеКЛЯlнные пластинки тщательно обезжиривают. Чтобы
добиться ма'ксимальноrо сцепления rеля с поверхностью стек-
ла, по краям пл,аiCТИНКИ узкой кистоЧ!кой наносят 1 % -ный
22 Б. Шllрсель
ВОДНЫЙ золь аr,арозы и высушивают ero шри 60 ос около
30 :\шн. В 'кипящей ВОДЯНОЙ бане rотовят 2 % -IНЫЙ золь ara-
розы в буфере, добаlВИВ в Her'o для консервац.ии 0,1% аЗИда
натрия. После этоrо температуру золя доводят до 50 ОС. Ра,с-
положив пластинкистроrо f10р'иЗОНl'алнно на нивелирном сто-
лике, ,наносят На каждую из них по 3,8 мл золя аrарозы.
...
+
А
..
o ....
+ 17
1
...
i
!::s
C»
CQ
Рис. 12. Схема двумерноrо иммуноэлек-
трофореза (объяснение в тексте).
б
t
...
[отовые пластинки rеля храlНЯТ во влажной камере. При
помощи ин'Ь'екционноЙ иrлы (Iдиаlметром 1,5 мм), 'ОстрЫЙ ко-
нец которой предварительно IстаЧИ1вае'flСЯ, IB ,rеле вырезают
лунку, распол'Оженную как укаЗalНО на рлс. 12, А. С'fIолб,ик
Бырез,анноrо rеля удаляют водоструйным насосам. Обычно
образец иоследуемой ,сыворотки сначала разбавляют физио-
лоrическим раствором NaCl (1:4), а затем к 9 частям раз-
бавленной сыворотки добаlВЛЯЮТ 1 часть 0,2 % Horo раствора
бромфеноловоrо синеrо, чтобы окрасить альбумин. М.и,кро-
пипеткой или микрошприцем 2 мкл этОЙ смеси ВНОСЯТ R ЛУН-
ку. После этоrю плаСТИIНКИ rеля помещают в элект-рофорети-
ческую ка'меру и соеДИНЯЮТ между собой и с буферным рас-
твором полоакамл фильтровальной бумаrи. Разделение бел-
2. Количественный дву,иерный шt,иунозлектроФорез 23
ков продолжается 1,5 2 ч .при 60 'мА ,и 260 280 В. За это
время окрашенный бромфеноловым синим альбумин миrриру-
ет на расстояние 3 3,5 см.
2.2.3. Второй этап электрофореза
Незадолrо до ОКOIнчания первоro этапа нужно приrо1'О-
вить золь аrарозы, содержащий антитела. На каждую пла-
стинку требуется 3 мл та'коло золя. Если, ,например, в rеле
на ,каждой пла.ст.инке должно содержаться 0,25 мл антисы-
воротки, то э'ют объем антисыворотки нужноС' ешать с
2,75 мл 2% Horo золя аrарозы. Подходящую концентрацию
антисыворотки следует подбирать в предварительном опы-
те, так К'ак активность э.тоrо peareHTa может быть различной
в раз,ных сериях и у разных производителей; обычно :на одну
пластинку требуется от 0,25 .до 0,5мл антисыворотки. Анти
сыворотку к сывороточным белкам человека чаще Bcero по-
лучают, иммунизируя ' роликов. Нужное ее количесТ1ВО на-
rревают на водяной бане в течение неокольких минут до 50 ос
и затем смешивают с соотвеllСТВУЮЩИМ объемом золя lara'po-
зы, И'меющеrо такую же температуру. С еши:вать антисыво
ротку с аrарозой следует лишь непосредственно перед HaHe
сением золя на стекло. Коrда IпеРiВЫЙ этап электрофореза
закончится, 4/5 площади rеля на каждоЙ пластинке удаляют,
как показано на рис. 12, Б. На стекле остается только узкая
полоска rеля, содержащая ,разделенные белки сыворотки.
После этоrо пластинки вновь кладут на нивелирный СТО.'Iик
и на,носят на каждую по 3 ,мл з'оляаrарозы .с антисыворот
кой. Коrда аrароза затвердеет, пла.стинки помещают в элект
рофореТ'ическую ыа.меру под уrлом 900 относительно их по-
ложения на первом этапе и снова замыкают цепь полосками
фильтровальной бумаrи. Меняют ПО,,1юса электродов и про
Водят электрофорез в течение 15 18 ч при 40 мА ,И 180 В.
2.2.4.
Дальнейшая обработка
и окрашивание
После электрофореза пластинки двое суток отмывают
0,15 М раствором NaCl, содержащим 0,1 % азИда натрия.
Промывающий раствор меняют ДВажды. Затем ополаскива-
ют пла,стинки ВОДОПРОВОДНОЙ ВОДОЙ,по рывают влажной
фильтровальной бу,маrой ('без пузырьков Iвоздуха между бу-
маrой и rелем) и высушивают ПОД лампой накаливания или
в сушильном шкафу при 40 ОС. Сухую иммуноэлектрофоре-
IrpaМiMY 10 мин окрашивают амидо-черным 10В. Несвязав-
24 Б. Ш uрzель
шийся кра'ситель удаляют разбавленной у сусной киlCЛОТОЙ
или водопроводной водой. Восполызовавшись фотоувеличите
лем ил'и дизпроектором, можно получить увеличенное изобра-
жение иМ!муноэлектрофореrраммы и произвести ее оцеН'Ку.
Схема Bcero хода работы предстаlвлена на рис. 13.
,}rJЛЬ OllOjJ/J.JbI
(2 Jt NЫzl;рН 8,б ' я; ОС)
lJepoНCl.llotYbIи Оуфер
(рН 8,5;)' О, 1)
I/анесение oaOjlOJHOcO ЗО.llJ1
(по J, 8Wl) но сте/(,//ЯНН6Iе шroстllН/(1I
ЛоiJёоmotYlrО
3.11elrmpotjlOjJE'mll'l!?C/(ozi /(OAfe;J6/
lJмреJtllШ!? .IIунд/ tJ.J/,Я онmщt?llо
!Jн!?с!?НlШ oHтllcf?Ho tY .IIYH/(Y
I
+
t !l .JтШ7 ,J.JIl'lfт/lorpojJe.Jo
(!,5 2'1; б!lиА; 28ОВ)
!/OO.J/!?Ifllt? 'Iocmu OCtlpOJHOcO N'.J/Л
IiOHecelflle .JO.J/J1 осорозы,
соuержощt?80 t1lfmllme.llU
L ЛоБО/1Оm Л.l/осmиН/(IIНО 9О°
2 {; зтО/7 .J.IIelrmporpope.Ja
(И 18'1; 4ОмА; 18[}IJ)
J.IIюuроlJuние
(2 х 24 ч; 0,9 "/.NuCl)
!Зыс!/шutfuнuе,ОfffJUШIIIJt1НII!?
Оценки
Рис, 13, Схема подrотовки н проведения двумерноrо I1ммуноэлектрофореза.
2.2.5. Идентификация преципитатов
Для идентификации П'Реципитата, образованноrо неизвест-
ным аНТИI'еноМ, МОЖНО воопользоваться разнообразными
приемами. Это может быть С'пецифичеокое а раШI{1ваНj{е.
опектрофотометрия, радиоаlвтоrрафия, флуоресценция, коло-
ночная хроматоrрафия, солевое фра'КЦИОЮlроваНIIЕ', а также
2. Колuttественный дВУ, tерный UМАtуноэле"трофорез 25
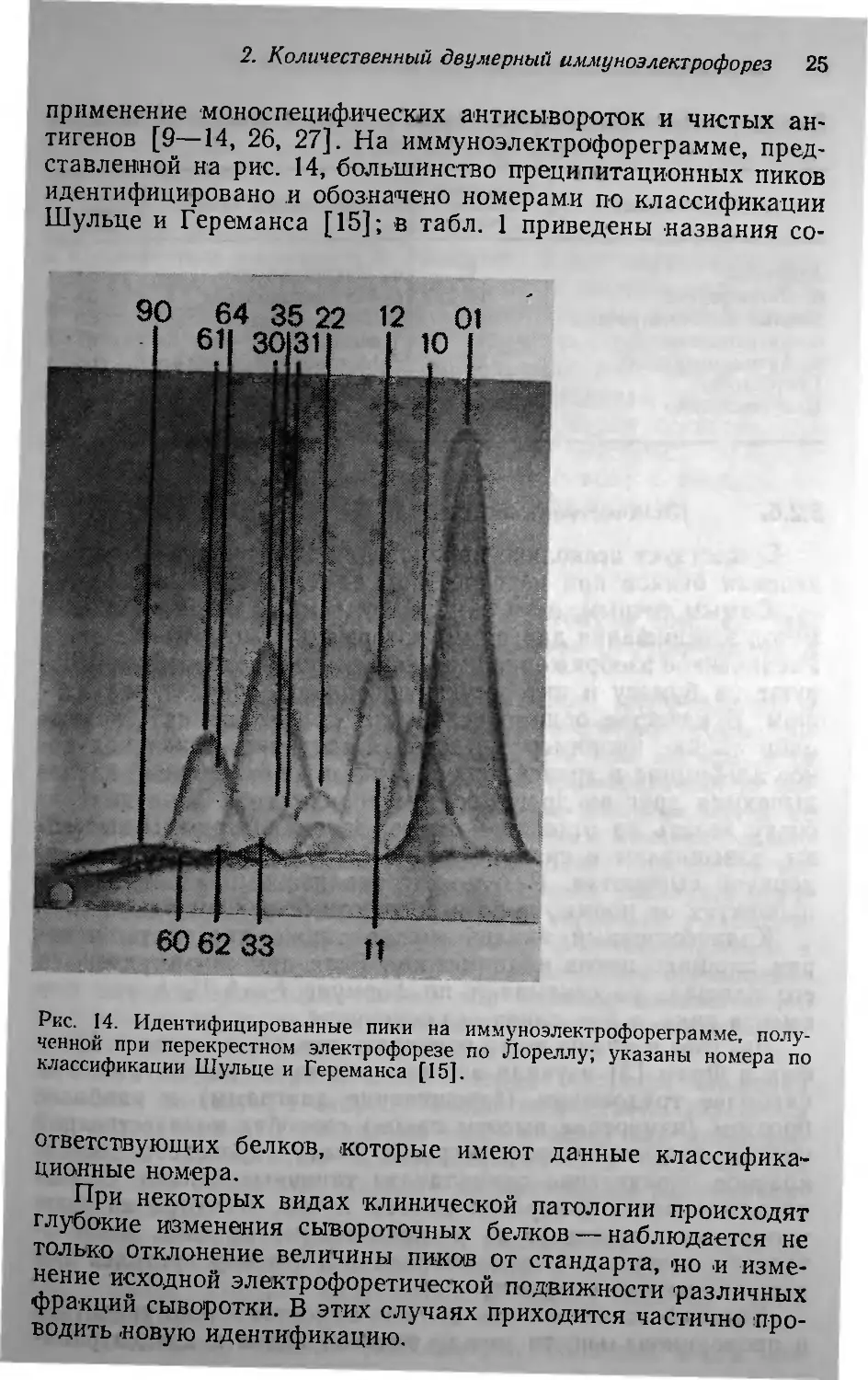
применение 'мо.носпецифических а'нтисываротак и чистых ан.
тиrенав [9 14, 26, 27]. На иммунаэлектрафареrрамме, пред
ставленнай на рис. 14, большинства преципитацианных пикав
идентифицирована .и абаз.на'Чена намерами па классификации
Шульце и [ереманса [15]; в табл. 1 приведены названия са-
90
-1
64 35 22
б!1 'З1
ф'
12 01
1 "':": .
:i. .... ;f, :: :"i
"i.; ' : ...,
.: ;,:...
, :.
;
.( :. .
? ;:
;{.
,'
",":; ,,"
"':3
'$
,::.: *:..
, р
):
k' I
. > ,", ,,:).
.у': ,.'0,.: .
Рис. 14. Идентифицированные пики на иммуноэлектроФореrрамме. полу-
ченной при перекрестном электрофорезе по Лореллу; указаны номера по
КJJассификации Шульце и [ереманса [15].
ответс'I1ВУЮЩИХ белкав, ,катарые Ю1еют даННЫе классифика
ЦИОнные ном,ера.
При некатарых видах 'КЛИНИческай патолаrии праисхадят
r лубокие изменения сывароточных белкав наблюдается не
таЛька атклонение величины пикав ат стандарта, 'на ,иизме.
нение исхадной электрафоретическай ПОдвижности различных
фра,кций сываратки. В этих случаях прихадится частично. пра
Бадить .навую идентификацию.
26 Б.Ш иреель
Таб.lIща .1. КлассификаЦllонные номера и соответствующие и,Н названия
сывороточных белков человека [} 5]
Сывороточный белок
I КlаССliфН,!<а-
ЦIIOIiНЫIi
H() ICP
Сывороточный белок
\ Клиссифи-
Кi1ЦIЮllllыll
номер
Альбумин
аl-.1Jlпопротеид
Кис.1ЫЙ аt-rликопротеид
аl-Антитрипсин
аl-Д НТИХИМОТрlIПСIIН
rаптоrJJобнн
Церулоп.lазмин
1
10
11
12
22
ЗО
31
а2- Ма КрОt'.Jюбу ЛИН
a2-HS-r ЛИКО!lротеид
-JIИ!lО!lротеид
\ Трансфсррнн
I В-! A-r'.JIOGулин
rемопеКСlI1!
i Им м УI!Ot':lOБVJJ 11If G
I - .
3:3
35
(j0
61
(j2
64
90
2.2.6.
:КоличеСТВСlIныii анализ
Существует неско.'1ЬКО 'Приемов д.11Я количественноrо опре-
де.1ения бе.1КОВ при перекрестном электрофорезе по Лорел-
..1)'. Ca),fbIM точным, но и самым трудоемким из них является
метод взвешивания диаrрамм, которые дают отдельные пики.
Увеличенное изображение ,И!ммуноэлектрофореrраммы проеци-
ру ют на бумаrу и интересующую область обводят Каранда-
шом. В качестве общеr'о основа,ния следует принять какую-
:!Ибо линию, напримор ту, которая соединяет основания пи-
ков а.lьбумина ,и трансферрина. Пики мноrих фракций накла-
дываются друr на друrа, поэтому приходится каждую зари
совку деJ1ать на отдельном листе. З'атем диаrрам'мы выреза-
ют, взвеШИвают и IсраВНИвают по весу с диаrраммами стан-
дартной сыворотки. Результаты анализа выражают либо в
процентах от нормы, либо в абсолютных величинах.
Количественный анализ можно также rrроводить, изме-
ряя площадь ПИков планиметром. Если пик симметричен, то
ero площадь рассчитывают по формуле Т == h. 1/2 Ь, I';tC 11
высота пика, а Ь длина ero ОСlIования.
Быстрее и проще Bcero оценивать пик по ero ВЫСОТе. Ште-
фан и Фра м [5] изучили воспроизводимость результатов ПрJJ
наибо.1се трудоемком (взвешивание диаrрамм) и наиБОJlее
простом (измерение высоты ПИК:ов) способах количественной
CJI енки имму.ноэлект'рофореrрамм. Было проведено десяти-
кратное определение одиннадцати типичных белков. Оказа-
"10СЬ, что метод измерения высоты пиков, несмотря На свою
тсхничсскую пр()стоту, по воспрои:шодимости JlИШ!> не:шачи-
тсль'но уступает методу взвешивания и поэтому приrоден для
решения мноrих вопросов.
Каждый исс.педователь должен са мост{)ятелъно убедитъсsr
в пропорциональности между высотой пиков И концеН1'раци-
2. Количественный дву,иерный UАtАtуноэлектрофорез 27
еj:'iсоответствующеrо белка. После этоrо 'можно приступать к
количественному орав'нению исследуемоrо образца со стан-
дартноЙ сыворотк'ой.
Применяя ту или иную а:нтисыворотку, важно установить,
при каком Iсоотношениимежду концентрацией антител в rеле
11 'количеС11В'ОМ исследуемой СЫВОРО11КИ .будет получаться наи
лучшая электрофореr'Рамма, чтобы были хорошо видны воз-
можные отклонения 'от нормы (например, 'при анализе 'пато-
лоrической сыворотки) и в ту, и в друrую сторону.
Повторные опрмеленияконцентрации важнейших сыво-
роточ'ных белков обычно имеют коэффициенты вариации в
пределах серии от 2 до 7%. в каждой серии исследований
следует проводить анализ стандартной сыворотки (сборной
сыворот,ки с известной концентрацией белков) и вносить со-
ответствующие поправки в калибровочные кривые.
2.3. ОЦЕНКА МЕТОДА
Недостаток описанной методиК'и состоит 'в том, что о'на
не позволяет одновременно анализировать и у-rлобулины, и
все остальные белки сыворотки.
При элеК'fiрофорезе исследуемый белок, диффундируя в
rеле, должен обязательно встретиться со специфическим aн
тителом. Эта встреча ,возможна толнко в ,том случае, если
белок и антитела имеют разную электрофорет:ическую по-
движность. А так как иммуноrлобулины человека почти не
отличаются по подвижности от кроличьих антител, содер-
жащихся в rеле, данный метод не позволяет определять ко-
личество им,му.ноrлобулинов. Можно, однако, у;величить отри-
цательный эаряд белК'овых молекул, в частности I'-rлобули-
нов, обработав исследуемую ,сыворотку .шропиолаКТОl!ОМ в
подходящей концентрации [16 18]. Увеличение отрицатель-
Horo заряда ,происходит также при блокаде положите.1ЬНО
заряженных rруп;п на поверхности молекул :иммуноrлобулина
путем кар,бамилирования с помощью цианата [19, 20]. С уве-
Лlичением общеrо отрицательноrо за'ряда 'ок,орость движения
белковых ,молекул в сторону а'нода возрастает. Обработка
-4пропиола'ктоном и цианатами ведет к более или менее вы-
раженному :из'менению электрофоретической ПОДвиж'ности
всех белков сыворотки; поэтому их приходится иденruфици-
ровать 'Заново.
Кларк и Фри'Мэн [8] отмечают ряд возможных дефектов
получаемой картины, особенно чаlCТЫХ в период освоения:
образова'ние «шпор», окруrленность пИIЮВ, двоение линий
преЦИПiитации.
Образованию «шпор» способствуют капельки влаrи, по-
28 Б. Ш uреел.ь
!J
Д(/оеnuе
пиlfО(/
r
J
di"
'Pt '::;,i , . . . . }
' . " '. - " . "' 1 ""
. . -. ,
". . . .
',z, 1'. '.,' .:
. . l.>O:
[.:
..,....
./\
OOpOJO(/OHlIe
шпор
;.: :. . ; >-<-
Рис. 15. Образование шпор и двоение пиков возможные источники оши
бок.
являющиеся на поверююсти rеля на 'Втором этапе электро-
фореза при 'слишком большой 'силе тока. Появление капель,
по в:идимому, обусловлено электроэндооС'мооом в тех участ
ках rеля, rде заряженные >молекулы 'белка прекратили ми
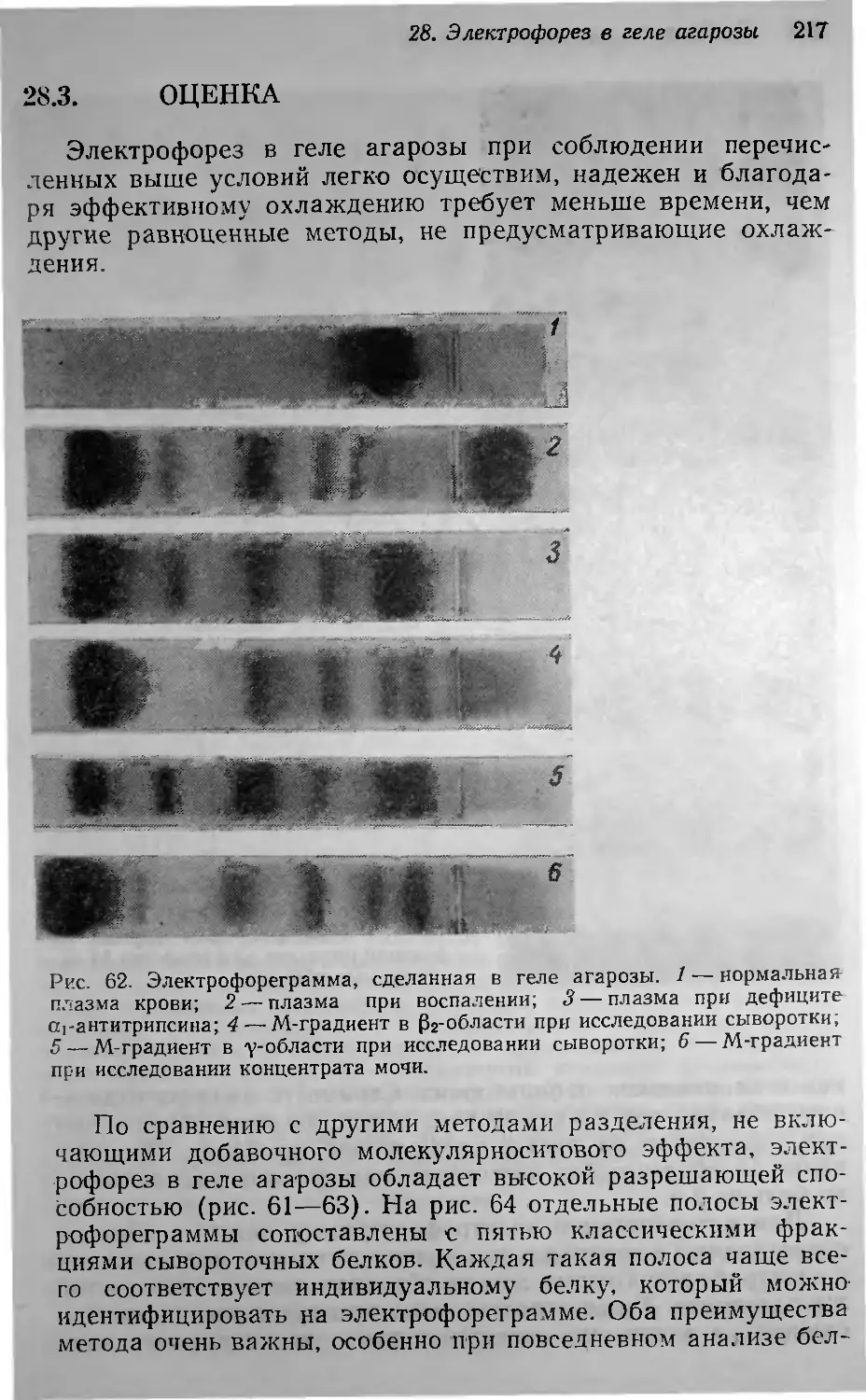
rрацию, связавшись с антителами (рис. 15).
Окруzленность пиков наблюдается при недост,аточной ДЛИ
тельности электрофореза на втором этапе Iметода ('рис. 16).
Чаще Bcero это происходит с бейками, обладающими малой
подвижностью ПрИ рН 8,6, и 'серьезно искажает результаты
анализа. ПрiИ подозрении на окруrленность следует увели-
чить продолжительность электрофореза на IBTOP'OM этапе.
Двоение линий преципитации, иокажающее иммуноэлект-
рофореrрамму (рис. 15), может иметь две ,причины. Во-пер-
вых, преципитаты MorYT .образовываться 'на .разных уровнях
rеля не абсолютно 'Перпендикуляр'Но к 'понерхности стекла
и ,при высушивании давать широкую или .сдв'оен'Ную ПОЛОСУ.
Обычно это ,бывает iВЫЗlвано тем, что плоскость разреза через
rель после первоrо эта'па электрофореза 'проведена не под
прямым уrлом. при дноении линий преЦИПiитаu:ии вьюоту
ПИlЮIВ определяют 'как Iсреднюю 'из двух иЗ'меряемых высот.
Во-вторых, двоение может выз,вать антиrен, распространив-
Шийся в слое влаrи, которая выступила на повер ности rеля
во время первоrо этапа электрофореза. Чтобы этоrо не было,
свежеприrотовленные пластиНКИ rеля следует на несколЬ/ко
часов помещать .во влажную ,камеру для «созревания», при
2. КОЛllчествеН1itJlй aOY},fepHtJlU ll},f},Iуноэлектрофорез 29
OlfpY2r1leHUe
по/(о6
"' ',...'
.:. < -....
", ' "'
.р .-:
'" ' '.. '. .
"
"
."
РIIС. 16. Окруrление пиков как возможный источник ошибок.
котором они теряют :примерно 5% iВлаrи. Следует также
уменьшить напряжение тока 'иа первом этапе.
Высыхан.ие zеля .на втор,ом этапе электрофореза происхо-
дит rлав,ным образом при 'недостаточной защите пластинок от
воздействия токов 'Воздуха.
2.4. ЛИТЕРАТУРА
1. Mancini а., Vaerтan J. Р., Carbonara А. О., Hereтans J. F., А single-
radial diffusion method for the immunological quапtitаtiоп оУ proteins.
In: Protides оУ the biological f1uids, edited Ьу Н. Peeters, Elsevier PubIi-
shing Соmрапу, Amsterdam London New York, 1964, S. 370 373.
2. Laurell с.-В., Antigen апtiЬоdу crossed electrophoresis, Апаlуt. Вiochem.,
10, 358 361 (1965).
3. Clarke Н. а. М., Freeтan Т., А quantitative immuno-electrophoretic me
thod (Laurell electrophoresis). In: Protides оУ the biological f1uids, edited
Ьу Н. Peeters, Elsevier PubIishing Соmрапу, Amsterdam London
New York, 1966, S. 503 509.
4. Firestone Н. J., Aronson S. В., А thin gel quantitative two-dimensional
immuпоеlесtrорhоrеtiс method, Amer. J. CIin. Path., 52, 615 622 (1969).
5. Siephan W., Frahт и., Quantitative Immun-Elektrophorese. Eine Mikro
methode zur Routinebestimmung der Serumproteine, Z. kliп. Chem. klin.
Biochem., 8, 469 474 (1970).
6. Frieтel Н., Кleist Н., Behт Е., Beitrage zur Antigen uпd Апtikбrреrапа-
Iyse. 1. Anwendungsgebiete der Rostocker Immuno-Ausriistung FK 66,
Wiss. Z. Univ. Rostock, Math.-Nat. Reine, 18, 61I 617 (1969).
7. Ressler N., Тwо-dimепsiопаl electrophoresis оУ protein antigens with ап
antibody containing buffer, CIin. chim. Acta, 5, 795 800 (1960).
30 Б. Ш llр2ель
8. CLarke Н. G. М., Freeman Т., Quantitative immunoe1ectrophoresis in hu-
mа!! serum proteins, Clin. Sci. London, 35, 403 413 (1968).
9. Urи:! J., The characterization reactions of the protein constituents fol-
10wшg e1ectrophoresis or immunoelectrophoresis in agar. In: Immuno
e1ectrophoretic Analysis, edited Ьу Grabar Р. und Burtin Р. E1sevier Pub
lishing Соmрапу, Amsterdam London New York, 1964, S. 30 57.
10. S.cheп R. J., Rabiпowitz М., DifferentiaI staining of ceru1op1asmin as ап
юd to interpretation in immunoelectro p horesis, Clin. Chim. Acta 13 537
(1966) . ' ,
11. Friemel Н., Bieпengriiber V., Behm Е., Beitrage zur Antigen- und Antik6r
peranalyse. УН. Immunoelektrophorese: Charakterisierungreaktionen, Son
derformen, Feh1erm6g1ichkeiten, Wiss. Z. Uni, Rostock, Маth Nаt.-Rеihе,
18, 655 659 (1969).
12. Weeke В., The serum proteins idепШiеd Ьу means of the Laurell-cross
electrophoresis, Scand. J. clin. Lab. Invest., 25, 269 275 (1970).
13. ктои J., Immunochemical idепШicаtiоп of specjfjc precipitin lines in
quantitative iтmuneJectrophoresis patterns, Scand. J. сliп. Lab. Invest., 24,
55 (1969).
14. Step!zaп W., Frahm и" Eine Metode zur IdепШiziеruпg und Zuordnung
von Lаurеl1 Еlеktrорhоrеsе-Реаks, Z. Юiп. Chem. klin. Biochem., 8, 391
393 (1970).
15. Shultze Н. Е., Hereтaпs J. Е., Mo1ecu1ar BioJogy of Ниmап Proteins.
Vol. 1, EIsevier Publishing Соmрапу, Amsterdam London New York,
1966.
16. Stephaп W., Frahm и., Quantitative Simultan-Immunelektrophorese, Z.
klin. СЬеm, klin. Biochem., 9, 224 228 (1971).
17. Stephaп W., Ober die Hydrolyse von j3-Propiolacton in Seren und Plas-
mеп, Z. klin. Chem. klin. Biochem., 7, 518 520 (1969).
18. Stephan W., Beseitigung der Komplementfixierung von gamma-Globulin
dшсh chemische Modjfjzierung mit j3-Propiolacton, Z. klin. Chem. klin.
Biochem" 7, 282 286 (1969).
19. Weeke В., CarbamyJated human immungJobu1ins tested Ьу electrophoresis
in agarose and ап tibody containing agarose, Scand. J. clin. Lab. 1 nvest,
21, 351 354 (1968).
20. Weeke В" Quantitative estimation of human immunoglobulins follov;ing
carbamylation Ьу electrophoresis in antibody containing agarose, Scand.
J. clin. Lab. Invest., 22, 107 111 (1968).
21. Laurell C. B., Antigen-antibody crossed electrophoresis in clinicaI imml1n-
gJobulin research. In: Gamma Globulins, Proc. Nobel, Symp. 3rd., edited
Ьу J. Кillander, Soedergarn. Lidingoe, 1967, S. 295 299.
22. ктои J., ОП the immunoelectrophoretical idепШicаtiоп and quantitation
of serum proteins, Scand. J. clin. Lab. Invest., 22, 79 (1968).
23. Weeke В., Quantitative Immunelectrophorese. 1. «Raketen-Immunelektro
phorese», Artzl. Lab., 18, 12 19 (1972).
24. Clarke Н. G. М., Freemaп Т., Hickmaп R., Pryse Phillips W. Е. М.. Quan-
titative immunelectrophoretic analysis in patients with tuberculosis al1d
sarcoidosis, Thorax, 25, 423 426 (1970).
25. Marcowski В., Zur QuапШiziеruпg der zweidimensionalen Immunelektro-
phorese, Clin. chim. Acta, 44,319 (1973).
26. Axelseп N. Н., Bock Е., Identification and quantitation of antigens апd
antibodies Ьу means of quantitative immunoelectrophoresis, J. Immt1nolog.
Meth., 1, 109 (1972).
27. Svendseп Р. J., Axelseп N. Н., А modified antigen-antibody crossc\i ('kc
trophoresis characterizing the specifity and titre of human рп:сiрitiпs
against «Candida albicans», J. Immunolog. Meth., 1, 169 (1972).
3. Двойная радиальная иммунодиФФузия
по У хтерлони
Э. БЕМ
3.1. ПРИНЦИП
В слае arapaBoro rеля р'авномернай талщины на опреде-
леннам раостаян<ии друr ат друrа !Вырезают лунки для анти-
[ена и антисыiораткии и заполняют их саатветствующими
растварами. После Э1'аI10 а,нтиrены 'И антитела диффундиру-
ют в rель, нстречаются друr с друrам и абразуют иммунные
камплексы, каторые преципитируют в парах rеля и становят-
ся видимыми как линии преципитации.
Здесь будет ОПИiсан микрометод двайнай радиальной им-
мунадиффузии ,на предме'I'НЫХ стеклах.
3.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
3.2.1. Реаrепты и приборы
MaHa и палиспецифические антисываратки; arap, напри-
мер специальный arap Nable или ачищенный ara'p (Difco,
Детрайт, США), в некатарых случаях испальзуют также ara-
разу.
Растворители для приrатавления rеля MorYT быть различны-
ми. Пр'иведем три ваlрианта:
1) 0,15 Мраствар NaCl
2) Забуференный фасфатами раствар N aCl с рН 7,2, са-
стаящий из 9 частей 0,15 М раствара N а Сl и 1 ча'Сти 0,15 М
фасфатнаrо буфера с рН 7,2, па Сёренсену. Приrатавление
буфера:
К:Н 2 РО4
Na 2 HP04.2H 2 0
9,073 r/л
11,87 r/л
1\ 29,6 мл раствара КН 2 РО 4 пр,ибаsляют до 100 мл раствор
Na z HP0 4
3) Веронал-ацетатный буфер с рН 8,6 и ионнай силой
0,1 [1]:
Веронал-Nа
Ацетат натрия
0,1 н. раствор HCl
Дистиллированная во-
да
9,75 r
6,47 r
60,0 мл
до 1000 мл
32 э. Бе t
3.2.2. Приrотовлевие rеля и проведение иммунодиффузии
Расплавляют 1,5 r arapa на ,водяной бане в 100 мл одноrо
из отрех предлаrаемых раС11ворителей. Затем f'орячий arapo
выи золь разливают по 3 мл на предмет,ные 'Стекла, раlС=ПО-
ложенные CTporo rоризонтально, с тем чтобы получить paB
НDмерный слой толщиной около 1,5 мм. Как только ar>ap за
твердеет, пластинки [отавы для использования.
Чтобы усилить сцепление rеля с поверхностью стекла,
предметные стекла 'рекомендуется пок'рыть аrаровой плен
u о . (:) ;;' - 0СЭОО€>
..v.' '-; ,/
80 8 <J О
О О 8 е:н:нэ о @
1 2 J 4-
I I I
- 7 8
5 6
. . . . G е е ф
.
. . . .
. . . . . . о (D ф
9 10 11
Рис. 17. Варианты раЗ\fещения лунок и канавок в rеле при ДВОЙНОЙ ради
а.'IЬНОЙ ИМ\fУНОДИФФУЗИИ. В заштрихованные .1УНКИ и канавки помещают
растворы антиrенов, а в зачерненные антисыворотку.
lЮЙ. Для этоrо на стек.ПО наносят 1 %-.ный водный аrаровый
золь и -высушивают 'при 70 ос.
В за,висимости от задачи иммунохимическоrо анализа для
выреза:ния лу.нок в rеле /Применяют либо 'специальные штам
пы rpазноrо профиля, либо инъекционные иrлы, металличе
ские или 'Стеклянные трубочки 'с ровным,и краям,и. Лунки
(или ,ка.на,вки) для антиrенов и для антисыворотки расно-
лаrают .на расстоянии не менее 4 и обычно .не более 10 мм.
На -Р'ис. 17 схемат,ически предста,влены некоторые ва'р'ИантЫ
размещения лунок в rеле.
Запол.нив лунки ,соответст.вующими ра'створа'ми, пластин-
ки помещают во влажную камеру. ИммунодифФузию -можно
пров,одить при 4, 20 и 37 ос. 'Она длится не ,менее 24 ч и
'Может ПРОДОЛЖ1аться до 6 7 дней, .после чеrо уже трудно
ОЖiндать ка,ких-либо изменений в картине 'преципитации. При
та'Кой долrой процедуре образование новых линий преци:пи
тации следует наблюдать ежедневно. Продолжительность
3. ДвОЙliая радuалышя UММУliодuффузuя \nO J/хтерЛОIiU 33
<иммунодиффузии зависит от к'Онкретной задачи исследова-
Qi!ИЯ и от ряда друrих факторов. Результаты иммунодиффузии
учитывают ,непосредственно на влажном препарате или же
сначала удаляют непреЦИПИТИlровавшие белки. Для этоro
цр'епараты 2 Э раза потруж,ают на 12 ч в ванн'Очку с 0,15 М
pac"I1ВOpoм N aCl, затем 'поверхность rеля на:крывают фильт-
равалЬ'ной буматой, с.моченной в ДИС11иллированной воде, 'и
высушивают при комнат,ной теипературе 'или при 40 50 ОС.
Бысушенныепрепараты ок\рашивают, например lамидо-чер-
ным 10В, И учитываютрезулыаты иммунодиффуз'Ии.
3.2.3.
Оценка результаТОБ
3.2.3.1.
Число линий 'преципитации
у разных ант,иrенов ча'сто бывают сходные коэффициен
ты диффузии. Поэтому 'в мноrOlКомпонентных системах анти-
reн антитело в 'Одном и т'Ом же уча,стке rеля M'OrYT появить
ся преЦИПИ11аты разной специфичн'Ости, 'Образующие одну ли-
iнию пrpеЦИlпитацИlИ. Б друrихслучаях концентрации антиrе-
нов и антител и ,их .соотнашения MarYT 'Оказаться настолькО'
неблаrOlПр.иятным\и, что ,заметной преципитации ПРОСТО' не
пр'О/изайдет. Поэтому число вщдимых линий преципитации
'Обычно меньше чиспа имеющих,ся систем антиrен антитела
и лишь 'в лучше.м случае равно ему.
3.2.3.2.
РаСПОJIожение преципитаТО8 между JIyнRaМИ
При оптимальн'Ом Iсоотношении между антиrен'Ом и анти-
телом ЛIИ:н.ия II1реципитации ра'сп'Олаrается пачти посередине
между лунками. Количественное преобладание одн'Orо из ре-
'areHToB сдвиrает линию преципитэции 'к лунке друrоrо ре-
,атента. Относительная l анцентраII.ИЯ peareHToB в месте пер-
вона:чалыной преципитаu!Ии может измениться, например из-
за Допол:нительНоrа поступления аднorо из них; таrда проис-
х'Од,ит сдвиr фронта п'реципитации, но часть иммунных arpe-
raToB, 'Особенно :на стороне изБЫТlКа ан'IlИТел, 'Остается в преж-
нем iположении, и их можно обнаружить IB виде вуали или ОТ-
дельной заны преципитации. Возможность подобных явлений
за,ста'вляет при длительной иммунадиффузии ежедневна про-
сматривать препараты. Пра'вда, при 'радиальн'Ой иммунодиф-
фузии сдвиrи франта преципитации никоrда не бывают столь
значительными, как при прастой линейной иммунодиффузии
(см. 5.2.3), потому ЧТО' за1пас а:нтиrена и антисы'враткии в
лунках БЫС11ра npиходитк концу.
3 840
34 Э. Бем
3.2.3.3.
Вsаимноерасположевие линийпреципитации:
сраввительвый авализ
Для выявления пол,ной ,или 'ча,стичН'ойидентичности в re-
ле обычн'о вырезают тр.и лунюи, 'раоположен!Ные треуrолыни-
ком. В две из них помещают сравниваемые растворы анти-
reHoB, а в третью ,аНТИСbIiВОРО КУ. ПринципиальНiО возмож-
ны четыре ,варианта 'рас'подожения линий преципитаlJ)ИИ
(рис. 18).
o 0
w
1.
@
2.
0.@ @ @
/ r!!) ""
J. 4.
Рис. 18. Расположение линий преципитации при сравнительном анализе
антиrенов с помощью двойной радиальной иммунодиффузии.
1. Обе линии ПОЛJНостьюсливаются. Это тавор'Ит об иден-
тичности антиrенов в обеих лунках.
2. Линии пересекаются. Эт>о указывает на неидентичность
аНТИrенных детерминант и, следов.ателыно, IHa различие :мо-
лекул исследуемых антиrенав.
3. Одна из лIиний длиннее друrой и, 'выходя за нее, обра-
зует так называемую «шпору». Шпора чаlСТО бывает тоньше,
чем основные линии пре.ципитации. Вторая линия сливается
с линией, образова!Вшей шпору. В этом ,случае мы имеем де-
ло с частично идентичными антиrенами. Оба антиrена име-
ют 'некоторые общие детер:минанты, которые, соединяясь 'с ан-
тителами, дают сливающиеся линии преципитации; но у :пер-
Boro ан'ЛИrена ,имеются т,акже детерминанты, которых ,нет у
Bтoporo. Именно они, встречаясь с 'соответствующими анти-
телами антисыворотки, образуют шпору. Иными ,слова'ми,
у первоrо антиrена больше реаrирующих с данной антисыво-
роткой детерминант, чем у IBTop'Oro.
4. Две ЛlИнии преципитации пересекаются, частично сли-
ваясь. Это означает, что сраВНИ1ваемые антиrены :имеют как
одинаковые, так :и различные детерминанты, реаI1ирующие с
,антитела,ми полиспецифичес ой антисыворотки.
В за'висимости от У'словий ИJммунодиффузии моryтвозни-
кать различные отклонения от типичных :карти:н преципита-
3. Двойная радиальная 1-iJrtJrtунодиффузия 1/0 J/хтерЛОliи з5
ции. Чтобы и:нтепретировать эти отклонения, следует обра-
титься ,к специальным руководствам [1, 2, 3] и ,прежде все-
[о к работам УхтерлонlИ [4,5].
3.2.4.
Модификации двойной радиальной иммунодиффузии
3.2.4.1.
Макрометод
Описанная выше методика иммунодиффузии на преД:vIет
ных стеклах предста,вляет ,собой микровариант метода, пред-
ложенноrо УхтеРЛОRИ еще в 1949 r. В условиях макрометода
аrаровый rель, разлитый в чашки Петри, образует более
Т'олстый слой (2 3 мм). Лунки и соответственно объемы
реаrентов здесь будут больше, так же ,как и раССТОЯНiие меж-
ду лунками. Линии преципитации выражены более отчетливо
и имеют б6льшую дли:ну.
3.2.4.2.
Определение титра
Для титрования антиrенов или антисыворотки лунки мож-
но располаrать как показано на рис. 19.
rотовят последовательные двукратные разведе.ния изучае-
MOro антиrена и равные объемы каждоrо раз'ведения вносят в
1: 16 О
HepO.J/feiJeHH61U
О
01:12
1:8
f:4
Рис. 19. Титрование антиrена (в данном
случае титр 1 : 16).
лунки, расположенные по периферии. Центральную лунку
заполняют ,стандартным объемом антисыворотки. При оцен-
ке результатов IИммунодиффузии учитывают:
1) расстояние, отделяющее линию преципитации от цент-
ральной и периферической лунок;
2) последнее разведениеантиrена, которое еще дает ви-
димый преципита т;
3) ,интенсИвность и ширину полос преципитации.
Последнее разведение антиrена, дающее преципитат, счи-
тают ero титром.
Подобным же образом, внеся в центральную лунку стан-
З.
36 Э. Бе.м
да,ртный ра l СТ1ВОр антиrена, мож,но титровать ,содержание ан-
тител в антисыворотке и срав:нивать 'раз!Ные антисыворотки
между собой.
3.2.4.3.
Количественное определениеаuтиrенов
Вариа'нт ,ме одJИ!КИ, описа,нный iВ 3.2.4.2, был !Приспособлен
для количественноrо определения антиrенов [6, 7, 8]. BO'Kpyr
центральной лунки для антисыворотки вырезают четыре
лунки для антиrено.в. Чем вышекО!нцентраrция антиrена, тем
ближе к центральной лунке будет раСПОЛiQжен преципитат.
Путем сраlвнен.ия 100 стандартными раlстворами можно апре-
делить концентрацию антиrена в иаСЛЕЩуемой пробе.
3.3.
3.3.1.
ОЦЕНКА МЕТОДА
Область применения
Д,воЙную IрадиаЛI>НУЮ имму,нодиффузию применяют rлав-
ным образом :для качественноrо анализа, н-апример для оп-
ределения ,числа антиrенов в разлiИЧНЫХ жидко.стях (в сыво-
ротке крови, цереброспинальной жидкости, экстрактах и
т. п.), для оценки чистоты 'препаратов при выделении анти-
reHOB, для Iсра'внения из'вест,ных антиrеяов и антител 'с неиз-
вестными, а также для наблюдения за ходом иммунизации
животных продуцентов иммунной сыворотки. Описанные
в 3.2.4.2 ,и 3.2.4.3 м,одификаци'И еще более расширяют !JЮЗ-
можности применения двойной радиальной иммуноДиффузип.
Для выявления отдельных антиrенов в MHorOKOMnoHeHTHblx
смесях нужны соответствующие моноопецифические антисы-
ворот и. Их м,оноспецифич:ность можно проконтролировать с
помощью двойной ,имму,нодиФфузии И (или) им,муноэлектро-
фореза (см. 1.2.8); если при этом ,будут обнаружены нежела-
1'мьные антитела, их удаляют методом истощения (см.
разд. 51, 52).
3.3.2. Специфичность, чувствительность
и точность методов иммунодиффузии
Основное преимущество иммунохимичеоких методов ие-
следова,ния ,их высокая специфичность. В этом отношении
они орав:н.и;мы с ферментаТИВНЫМIИ методами или даже ире-
восходят их. Данные мноrочисленных авторов позволяют
заключить, что антиrен и антитело в оптимальном со-
ОТ1ношении еще обlразуют видимые преципита'Ты при концент-
рациях белка от 5 до 50 мкr/мл. Напри,мер, при простой ра-
3. Д80йНЛЯ радшlЛЫШЯ f,JJ..Мм,ун.одuффузuя 'tW Jlхтерлопи 37
диальной имму:нодиффузии (см. разд. 6) или ПрИ ракетном
иМ'муноэлеК'l1рофорезе (см. .рэзд. 7) ,в ЛУНlку обычно помещают
B,cero лишь 2 мклраеDвора, и тем не менее содержащиеся в
нем 1 О Rr антиrена еще ,MOryT ,быть выявлены.
При количественных вариантах и>ммунодиффузии ошибка
метода 'соста,вляет около 5% (3 7%).
3.4. ЛИТЕРАТУРА
1. Backhausz R., Immunodiffusion und Immunoelektrophorese, Grundlagen,
Methoden und Ergebnisse, Fischer, Jena, 1967.
2. Crowle А. J., Immunodiffusion, Academic Press, New York and London,
1961.
3. Munoz J., DoubIe djffusion in plates, in: WilIiams С. А., Chase М. W. (ed,),
«Methods in Immuno!ogy and Immunochemistry», Уо!. III. New York and
London, 1971, 146 160.
4. Ouchterlony Й., Immunodiffusion and Immunoe!ectrophoresis, in:
Weir D. М. (ed.), Handbook of Experimenta! Immuno!ogy, B!ackwel1
Scientific PubIications, Oxford and Edinburgh, 1967.
5. Ouchterloпy й., Ge!-diffusion techniques, in: Immunchemie, 15. Colloquium
Ges. Physiol. Chem. Springer, Berlin, Heide!berg, New York, 1965, S. 13
35.
6. LoGrippo а. А., Maпsoп а., Sharpless N., Immunog!obulin !eve!s in serum
of normal infants and preschool children as determined Ьу immunochemi-
са! analysis, Henry Ford Hosp. Med. J., 15, 247 258 (1967).
7. Hayachi Н., LoGrippo а. А., Ретту М., Immunoglobu1in !evels in spina!
fluid and saliva Ьу direct immunochemica! assay and microscopic meaSl1-
rements, Неnrу Ford Hosp. Med. J., 18, 263 274 (1970).
8. Darcy D. А., Antigen and antibody concentration ln relative un1ts оп dH-
fusion p!ates, in: Williams С. А., Chase М. W. (ed.), «Methods in Immu-
nology and Immunochemistry», Academic Press, New York and London,
1971, 200..........209.
4. Иммунохимическое
определение антиrенов
с помощью фотометрии
э. БЕМ
4.1. ПРИНЦИП
Раствор антиrена 'С,меШИ1ваютс соответствующей MOHO
апецифичеС'кой аНТИСbIlВОРОТКОЙ и смесь инкубируют. При
этом образуются ИМiмунные arperaTbI, способные рассеивать
и тем самым ослаблять проходящий ,свет. Интенсивность
рассеяния или ,поrлощения проходящеrо света 'прямо про-
порциональна Iколичеству ком'плексов антиrен антитело,
и ее можно измерить фотометрически (нефелометрия). Что
бы ,иммун:ные arperaTbI достаточно долr.о оставаЛИiСЬ во 'взве--
шенном состоянии, для фотометрии ,смешивают Iразбавлен
ные paerBopbIантиrенаи антител.
Если все параметры объемы peareHToB, разведение aH
тисыворотки, время и температура инкубации постоянны и
еДинственной переменной величиной является концентрация
антиrена, то 'последнюю можно определить по кривой экс
тинкции. Чтобы построить та,кую К'Р'и!Вую, с антисывороткой
инкубируют 'растворы антиrена 'Возра'стающей концентра-
ции. Сначала 'с увеличением концентрации антиrена кривая
ЭiКСТИНКЦИИ идет вверх, а затем, после HeKoToporo маI\lсимума,
сн'ижается. Кривую преципитации подобноrотипа впервые
описали в начале 30-х rоДОВ Хейдельберrер и Кендалл. При
постоянном :количестве а'нтител подъем Iконцентрации анти
reHa увеличивает не только 1количеС11ВО, но и величину им
мунных ar'peraToB. При 'некоторам оптимальном со'отношении
а'нтиrена и антител количесТlВО ,и размеры иммунных arpera-
'I10B достиrают маI\lСИМума '(преципитации здесь не происхо-
д'ит из за высок:оrо разведения, тоrда 'как более концентри
рованные 'ра'створы обоих peareHTOB дали бы преципитат).
Область оптимальных соотношений называют зоноЙ экви-
валентности. Дальнейший подъем ко'НцеН11рации антиrена ве--
дет к уменьшению arperaTOB и тем самым снижает величину
Э'кстинкции. При этом 'изменяе1\СЯ и состав иммунных arpera
1'ОВ Бозра'стает относительное содержание в них антиreна.
Даже в зоне эквивалентности для разных систем характерны
различные rrропорции молекул а:нтиrена Iи антител в arpera-
тах [1, 2]. Подробности 'Читатель ,найдет iВ соответствующих
рутководствах по иммунолоrии и иммунохИ!мии.
Фотомет,ричеокоеопределение а'нтиrенов один из давно
известных, MHoroКlpaTHo ОПИlса',Н'НЫХ методов иммунохимиче
4. Оnределен.uе ан.тшен.О8 с помоЩЬЮ фотометрии 39
OKo1'o анализа [3. 7]. Появившиеся один за ДРУ1'им методы
оличес'VвеН'ной !преципитаЦRИ в 1'еле (см. разд. 5, 6, 7) в
св'оевремя оттес.нили ето 'на задний план, но сейчас он 'снова
приобретает большое з'начение в связи iC Зlвтоматизацией им-
мунохимическоrо анализа [8 10] IB ча'СТНОСТИ,как метод
количественно1'О определения преципитирующих антител
[11,12].
Ни)ке описан разработанный нами ранее [13] метод имму-
НОХИМIIческо1'О определения аНТИ1'енов IC помощью фотомет-
рии.
4.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
4.2.1. Реаrеиты и приборы
Забуференный фосфатами раствор NaCI. 11,9 l' Na 2 HP04'
.2Н z Ора\створяют в 1000 мл 0,15 М раствора NaCl; 9,1 ,1'
KHzP04 ,растворяют в 1000 мл 0,15 М раствора NaCl; ,85,2 мл
раствора Na2HP04 доводят до 100 'мл раствором КН 2 РО 4 .
Получается буфер iC /рН 7,5.
Моноспецифические антисыворотки.
Стандартные растворы. Используются стандартные ;CЫBO
ротки С известным содержанием белков или стандартные pac
т&оры, ПРИ1'отовленные из чистых белков. Первым следует
отдать предпочтение, КО1'да требуется определить содержание
данноrо антиrена в МНО1'окомпоне:нтной системе, например в
сыворотке.
Рабочий стандарт. Если требуется определить содержание
различных белков в сыворотке или сывороточных белков в
друrих жидкостях raР1'анизма, можно воспольэоваться так на-
зываемым «рабочим стандартом» собственноrо ПРИ1'отовле-
пия. Речь идет о смеси образцов СЫВОрО'J1ки как можно боль
ше1'О числа ЗДOiровыхлиц ('например, доноров). Эту смесь
разливают порциями по 0,5 или 1,0 мл И хранят, заморозив
при температуре от 20 до зо ОС. При количественном оп
р'еделении ка {QРо-либо белка ПРИ1'отавленная смесь исполь-
зуется в качестве ,контроля.
Приборы. Фотометрию можно проводить, например, на
пектрофотометре «Specol» 'с дополнительным усилителем
или на универсаль:ном 'спектрофотомет,ре VSU-2 (УЕВ, Carl
Zeiss, Иена, [ДР) в м'Икрокюветах IHa 0,25 'мл.
4.2.2. Ход исследования
Ста:ндартные растворы, исследуемые образцы и антисыво-
ротки разводят забуференным раствором NaCl с рН 7,5.
Определение аНТИ1'енов (ПРОИЗ1ВОДЯТ с кроличьими антисыво-
40 Э. Бем
ротками в разведении 1 : 5 1 : 20 или с иммунными CЫBOpOT
ками друrоrо вида, которые сходны с кроличьими по ,преци-
питирующим свойствам. Для построения кривой эоостинкции
'сначала rотовят сер'ию ,рэзвеДe1IИЙ антиrена от 0,5 до 10Mr на
100 'мл, но при необхоДiИМОС11И ,испытывают :и друrие вариан-
ты. К последователь'ным разведениям стандартной сыворотки
Рис. 20. Последовательные этапы иммунохимическоrо определения антиrе-
нов с помощью фотометрии.
::r
'"
f 5 10
СоiJеfJЖOllllе Оolf61J!lиинtl, ие/fIJIJ Аf.Il
Рис. 21. Иммунохимическое определение
антиrенов с помощью фотометрии. При-
мер калибровочной кривой для определе-
ния альбумина.
или раствора чистоrо белка прибавляют IраlВНЫЙ объем раз-
бавленной антисыаоротки, перемешивают и оста'Вляют при
комнатной емпературе (20 ОС) на 2 ч. После э оI'о опреде
ляют экстин цию растворов в проходящем 'свете при 450 им
в м'икрокювете с толщиной слоя 1 'см против холостой пробы
(буфер + а,нтисыворотка) . На рис. 20 :представлены эта,пы
исследования, на рис. 21 'Кривая З'кстиН!кц'ии. С исследуе-
мым образцом поступают так же, как со 'стандартными ра'С-
творами. Определяют ero экстинкцию и по восходящей части
кр.ивой устанавливают концентрацию антиrена. Если 'прихо-
дится исследовать мутные или окрашенные (в результате
4. Определение ан,тиzен.ов ос ,помощью фотометрии 41
rемолиза) растворы антиrенов, например сывороточных, то
следует предварительно измерить их собственную эк,стинк-
цию, чтобы учесть ее rnри оценке результатов. Затем с учетом
разведения ,исходН'оrо материала вычисляют концентрацию
исследуемOir\О а.нтиrена.
4.2.3.
Кривая экстинкции,
условия инкубации и длина волны
при фотометрии
Как В1ИДНО из формы кривой (рис. 21), иноrда одна и та
же величина экстинкции будет соответствовать двум различ
lIЫМ концентрациям аНТИI'ена: одной 'в области избытка ан-
тител (на восходящей чаIС'tи рИВОЙ), а друrой в области из-
бытка аН11иrена (на нис одящей части кривой). Полную уве-
ренность в том, что получе.нная !Величина экстинкции соот-
IBeTcTBYeт облаrсти избытка антител, дает исследование, про
веденноес неС!К'олькиМ'и (по крайней мере двумя) разведения-
ми антиrена. У,словия инкуrбации (продолжительность и TeM
пература) должны бытьстроrо постоянными. Окорость обра-
зования иммунных arperaToB, очень высокая вначале, посте-
пенно снижается к концу инкубации. Экстинкция достиrает
максимума при 20 ос примерно 'через 120 мин, а при 37 ос
через 90 мин ([7], а та;кже наши собственные данные). Для
фотометрии 'следует выбирать длину волны, лежащую за
пределами обла'стей поrлощен'Ия rемоrлобина (400 420 нм
и 500 нм); при этом нужно также уч'итыJатьь -спектр собст-
веиноrо поrлощения peareHTOB и их ,смеси дообразо'Вания им-
мунных arperaToB [7].
4.3. ОЦЕНКА МЕТОДА
Преимущества иммунохимическоrо определения антиrена
с помощью Фотоме11РИИ относительная Iпростота и быст-ро-
та процедуры, а также возможность ее автоматизации [9, 10J.
Однако эт,от метод дредъ вляет особые требова:ния к качест-
ву антисыворотки. Она должна содержать достаточно анти-
тел, чтобы в разведении 'не менее 1: 5 обеспечить величину
ма:ксимальной ЭiКстиН'кцrии выше 0,2. Если а:нтисыворотка да-
ет нужную ЭКСТИНIЩию лишь при меньшем разведении, то ее
ИСПользование не только будет неэкономным, но может при-
вести ,к преждеВ'ременной преципитации иммунных arperaTOB.
Антисыворотка должна быть ПрОЗ1рач:ной. Нера,створимые
компоненты, поя'Вляющиеся, например, после л'Иофилизации,
затрудняют анализ, TalK как увеличивают эк>стинкцию холо
42 Э. Бе-м
стой пробы. Кроме TOf'O, иммунные комплексы леrко aдcop
бируются на нерас'l'ВОрИМЫХ частицах, что также С.IIIOсобству-
етпреждевремен'ной rrреципитацИИ.
4.4. ЛИТЕРАТУРА
1. Н eidelberger М., The molecular composition of specific immune precipita
tes from rabbit sera, J. Amer. Chem. Soc., 60, 242.........244 (1938).
2. Heidelberger М., Entwicklungslinien der Immunchemie, in: 15. Col1oquium
Ges. Physiol. Chem. Springer, Berlin, Heidelberg, New York, 1965,
S. 6 11.
3. Schultze Н. Е., Schwick а., Quantitative immunologische Bestimmung von
Plasmaprotein, Сliп. сЫm. Acta, 4, 15 (1959).
4. Holzer К Н" Biпzus а., Quantitative immunologische Plasmaproteinbe-
stimmung-Methodik und Bedeutung fiir die Юiпik, VerhandIungen 69.
Kongr. Innere Med., 1963, S. 456 459.
5. Schwick а., St8rico К, Qualitative und quantitative Plasmaproteinbestim-
mung durch Immunprazipitation, Laboratoriums Blatter, Behringwerke,
Mai, 1964.
6. Becker W., Rapp W., Schwick а., Storico К, Methoden zur quantitativen
Bestimmung von Plasmaproteinen durch Immunprazipitation, Z. k1in.
Chem. klin. Biochem" 6, 113 122 (1968).
7. Li 1. W., Williams С. А., Estimation of antigen in соmрlех mixtures Ьу
орНсаl density of turbid suspensions, in: WiШаms С. А., Chase М. W.
(ed.), «Methods in Immunology and Immunochemistry», Уо1. III. Acade-
mic Press, New York and London, 1971, рр. 94 102.
8. Kahan J., Sипdblad L., Immunochemical determination of p-lipoproteins.
Scand. J. сliп. Lab. Invest., 24, 61 68 (1969).
9. Eckman 1., Robbiпs J. В., Натет vaп deп С. J. А., Leпtz J., Schein-
berg 1. Н" Automation of quantitative immunochemical microanalyse оС
human serum transferrin: А model system, СНп. Chem., 16, 558 5бl
(1970).
10. Кilliпgsworth L. М., Savory J., Teague Р. О., Automated immunoprecipi-
Нп technique for analysis of the third component (С'3) in human serum,
Сliп. Chem., 17, 374 377 (1971).
11. Averdunk R" Busse V., Eine Mikro-Methode zur schnellen quantitativen
Bestimmung von prazipitierenden Antik6rpern in Serum, Z. k1in. Chem.
klin. Biochem., 7, 287 290 (1969).
12. Davies а. Е., The use of а sensitive micronephelometer in the estimation
of antigens and precipitating antibodies, Immunology, 20, 779 987
(1971).
13. Behm Е., Friemel Н., Hofmann R., D8rfling Р., Methoden zur quantitati-
ven immunchemischen Bestimmung von Plasmaproteinen, Z. med. Labor-
technik, 12, 177 189 (1971).
5. Простая линейная иммунодиффузия
по У дену
Э. БЕМ
5.1. ПРИНЦИП
rель, IСоодержащий антисыворотку, помещают в стеклян
ные трубки или в пробирки. Т'рубки вертикально Iпоrружают
в раствор антиrена, и в пробирках раствор антиrена наслаи
вают на rель. Антиrены диффундируют 'в rельсо скоростью,
пропорциональной их концентрации, и, соединившись со спе
цифическими антителами, образуют с ними беловато-мутные
прецппитаты. Число линий преципитации зависит от числа
реаrирующих систем антиrен антитело. Чем продолжитель-
нее диффузия, тем дальШе фронт преципитации каждой та-
кой линии удаляется от rраницы, разделяющей rель и жид
кость. Расстояние, которое он проходит за определенное в'ре-
мя при cTporo постоянной концентрации антисыворот'ки в re-
ле, зависит только от концентрации диффундирующеrо анти-
reHa. При постоянных условиях опыта (температура, серия
антисыворотки и ее концентрация в rеле, концентрация само-
ro rе.1Я) с помощью простой линейной иммунодиффузии мож
но определять количество антиrена.
Этот метод был впервыеоП'исан Уденом в 1946 r. и более
подробно в 1971 r. [1]: он 'представляет собой вариант с
нисходящей диффузией, так как раствор антиrена наслаи ает-
ся на содержащий антисыва,РО11КУ rель. В литературе ЧИта-
тель найдет и достаточно полное теоретическое обоснование
[2], и анализ методических ос'обенностей rЗ, 4] простой ли
'нейной иммунодиффузии.
В 1967 r. :был описан микровариант этоrо метода [5], KO
торый С небольшими изменениями воспроизведен на'Ми r6];
в том же IВИде мы описываем ero здесь. Это ва'риант с восхо-
дящей диффузией.
5.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
5.2.1. Реаrенты и приборы
Моноапецифические антисыворотки, стандартные раство-
ры антитенов и рабочий ,станда рт (ом. 4.2.1), веронал-аце-
татный .буфер ,с ;рН 8,6 и ионной силой 0,1:
Веронал-N а
Ацетат натрия
0,1 н. раствор НС1
Дистиллированная во-
да
9,75 r
6,47 r
60,0 мл
до 1000 мл
44 Э. Бем.
Специал:ыный arap N оЫе '(Diko, Детройт, США); стек-
лянные капилляры для определения rематокр,ита дл,и.ной
OIюло 50 мм, 'с 'внутренним диаметром 1 '1,5 мм (Н. Janetzki,
Лейпциr Энrельсдорф, rдр); измерительная лупа для из-
мерений с .тоЧ'ностью до 0,1 мм.
5.2.2. Ход исследования
Вначале подrотавл'ивают ,стеклянные капилляры. В :НИХ
на'сасывают и тут же выдувают обрат.но1 % -ный rорячий
золь arapa iHa 'воде. Затем капилляры !Высушивают 'при 70 ОС.
Образовавшаяся !на 'Внутренней поверхнос и капилляра ara-
2 % IfMи ошроtfиLi .10./16 I
рН 8,8; 48 ос '
f '{ост"
IfJJИ8реlfuе t161COI06l.
На 1rOтOjloti lfuхоuuтt:,Я
nрециnитат
Рис. 22. Схема проведения простой линейной иммунодиФФузии.
ровая пленка усили!Вает :оцепление rеля со стеклом и 'препят-
ствует образованию щелей, !В KOTopbIeMor бы проникнуть ан-
тиrен, ЧТО иоказ'ило бы 'результаты ИМIМУНОДИФФУЗИИ.
В 100 мл вер'онал-ацетатноrо буфера 'суспендируют 2 r су-
Xoro ara1pa и наrревают на 'В'одя,ной ба,не до полноI'О ра'спла'в-
ления. Расплавленный arap охлаждают до 48 ос и смешива-
ют с равным объемом подоrретой до 48 C антисыворотки.
В эту 'смесь поrружают капилляры, с тем чтобы она запол-
нила 'их на 2.........J3 ICM. После их из'влечения rель через несжоль-
ко М'инут за11верrдевает, и каiПИЛЛЯРЫ rOToBbl 'к употреблению.
Реакцию удобно CTalBHTb в ,стаканчиках 'с плоским ДНОМ,
например 'в пластма:С'СQ!ВЫХ 'стаканчиках ,ИЗ-lПОД таблеток (6Х
1,5 'см). В одни стаканчиКИ помещают по 1 2 мл исследуе-
5. Простая лuн.еulШЯ UМJrtун.одиффуэuя по Уден.у 45
мых образцов, в друrие 'соответствующие 'стандартные pa\:
тв'Оры антиrенов. Капилляры с телем ,ставят 'или подвешива
ют в стаканчиках таким образом, чтобы антиrен Mor беспре-
пятственно про'Никать 'в rель 'снизу. Для этоrо 'можно, напри-
мер, положить на дно ста:ка,нчика прокладку из пористоrо
материала толщиной примерно 1 'мм. Перед ПОI1ружен'Ием кa
пиллярав в антиrен 'следует довести температуру всех pe
areHToB до нужной 'величины, 'в даННОМ случае до 4 ос. После
rеРlМетизации стаканчики на 48 ч оста,вляют при 4 ос. Затем
измеряют 'раостояние, котор'ое :прошел фронт преципитации
в 'каждом ка!пилля:ре. Этапы исследования схематически преk
ставлены на р'ис. 22.
Закономерности диффузии
и калибровочная кривая
ДЛЯ TOI'O чтобы ант,иrен Mor диффундировать в rель, со-
держащий аlнтитела, он должен быть в избытке. Допустим,
что на rранице ра'Створ/rель концентрации антиrена и анти-
тел э вивалентны. Таrда образоваlВШИЙСЯ на rранице 'Разде
ла преципитат останется ;на месте. Наоборот, при избытке
антител они начнут проникать в 'раствор ,и образуют там им
МУ'Нные комплексы.
По Удену, IПрИ данном изБЫТlке антиrена скорость миrра-
ции преципитата К можно вычислить, разделив расстояние h,
пршюдимое фронтом преципитации в rеле, на квадратный ко-
рень Iиз 'времени диффузии t:
h
К == .,п . (1)
Если rрафически представить h IKaK функцию лоrарифма кон-
центрации антиrена (C Ar ), то получится прямая линия, IЮ-
торую характеризуют Iнаклон (а) и 'точка пересечения 'с осью
абсциос (ib). Эта линия и будет служить калибровочной кри-
вой, по которой можно определять концентрацию данноrо ан-
т,иrенав иоследуемыхрастворах (рис. 23).
Между параме11рами калибровочной кривой существует
следующее отношение:
IogC Ar r-o...a.h+b; (2)
5.2.3.
введя в HeI'O время диффузии, ПОЛУЧИМ ура'внение
h
IogCAr a. у! + Ь
или, иначе,
Iog CAr a.K + Ь.
(3)
(4)
46 Э. БеАt
Следовательно, при ПОстоянном t между лоrа'рифМ'ом кон-
центрации а'нтиrена .и расстоя:нием, к'оторое проходит фронт
преципитации, существует прямая линейная зависимость.
Кроме TOI'O, известно, что на/клон 'калибровочной /Кривой пря
"
со>
"
:ё;
:::, 2
Ро зlJf!Оf!IfL/f! L/CC.Ilf!O!lf!MO[}
сы80рот/(и
l:tб 1:8 1:ч 1:2 1:1
5 10
/(онцеlfтРОЦШf l!l6, M2/M.Il
Рис. 23. Простая .1инейная иммунодиффузия: калибровочная кривая для
определения IgG. Если концентрацию антиrена выразить в виде лоrариф-
мов, то получится прямая (высота, на которой находится преципитат,
это в данном случае путь, пройденный диффундирующим в rеле иммуно-
rлобулином) .
МО пропорционален К'вадрату коэффициента диффуз,ии ан-
тиrена и обратно п'ропо'рционаленконцентрации антител в
rеле и вязкости rеля [з].
5.2.4.
Дополнительные замечания
Описа'нный здесь вариант с восходящей диффузией не
очень трудоемок и весьма экономен. Достаточн'о 1мл анти-
сыворотки, чтобы подrотовить около 100 капилляров, нужная
кюнцентрация ан1'ИСЫВОРОТКИ в rеле зависит прежде Bcero от
титра содержащих'Ся в ней антител.
При определении концентрации сыворот,очных белков в
аrаровый rель обычно доба:вляют от 5 до 20% антисыворот-
,К И [3]. При еще меньшей концеН1'рации аRТИСЫВОРОТКИ линии
преципитации становятся недостаточно четкими. Метод не
позволяет окрашивать преципитаты. Поэтому, чтобы более
точно определить 'их ,положение, рекомендуется рассматри
вать капилляры при Jбокювом рас'сеянном 'свете на TeMIHOM
фоне. Если в конце реакции ра,створ антиrена за'менить раз
ба'вленной уксусной кислотой (7,5 мл УК'С)'1СRОЙ кислоты на
100 мл дистиллированной воды), то кислота примерно через
45 мин доходит до преципитата ,и делает ero 60л'ее 'контра,ст-
5. [l ростая линеulШЯ u.ммун.одuффузuя по Уден.у 47
'ным [7, 8]. При нисходящей диффузии 'Обычно используют
менее концентрированные rели (O,2 0,5 % ), в которых более
юрупные молекулы антиrена диффундируют быстрее. Однако
при онцентраци.и rеля ниже 0,3 % он М'Dжет изменять свою
форму с наклономка пилляра [4]. Выбрав определенную
температуру, 'которая является ритическим фактором диф-
фузии, не следует отступать от нее более чем на 1 ос. Иначе
не только изменится раlостояние, проходимое фронтом пре
ципитации, но и MorYT 'появиться несколько полос 'вместо
'Одной. Продолжительность инкубации зависит от величины
диффундирующих молекул. Чаще Bcero диффузия продол-
жается 12, 24 или 48 ч, но при более крупных молекулах
антиrена еще дольше. При длительной диффузии рекомен-
дуется в этот период несколько раз отмечатьрезулыаты
преципитации [9]. Вообще, зная расстояние, пройденное
фронтом преципитации за данное время, с помощью ypaB
нения 1 можно рассчитать путь, который он прошел бы при
стандартной продолжительности диффузии. Отно,сительно
специфичности, чув'ствительности и точности метода
см. 3.3.2.
5.3. ОЦЕНКА МЕТОДА
С помощью простой линейной им'мунодиффузии в принци
пе можно определить количество любоrо антиrена. Метод
успешно применим при тех же усло'виях, что и радиальная
иммунодиффузия, например при определении белков в CЫBO
ротке или цереброспинальной жидкости. Однако начиная с
середины 60-х родов линейная иммунодиффузия все больше
вытесняется радиальной иммунодиффузией и электроиммун
ным анализом (см. разд. 6 и 7), при ;которых можно окра-
шивать преципитаты и та'Кимобразом повышать чувствитель
ность реакции. Кроме 1'oro, радиальная иммунодиффузия
меньше за'виситот температуры и поэтому более надежна,
а электроиммунный анализ требует меньше времени. Но все
же эти методы не прев,осходят линейную иммунодиффузию
по простоте.
5.4. ЛИТЕРАТУРА
1. Oudiп J., Simple diffusion in tubes, in: WilIiams С. А., Chase М. W. (ed.),
Methods in Immunology and Immunochemistry, Vol. III, Academic Press,
New York and London, 1971, рр. 1 18 138.
2. Backhausz R., Immunodiffusion und Immunoelektrophorese, GrundIage,
Methoden und Ergebnisse, Fischer, Jena, 1967.
3. Weiss М., Horsch А., Rapp W., Geldiffusion nach Oudin zur quantitativen
Erfassung von Serumproteinen. 1. Prinzip und Methode, Arztl. Lab., 17,
245 253 (1971).
48 Э. Ее},!
4. Weiss М., Rapp W., Geldiffusion пасЬ Oudin zur quantitativen Erfassung
von Serumproteinen. П. Untersuchung methodischer Faktoren, Artzl. Lab.,
17, 309 317 (1971).
5. Мйllе, Н. Е., Muller-von Va/gt 1., Eine Mikromethode zur Proteinbestim-
mung im Serum пасЬ der Oudin Technik, Z. klin. СЬеm. klin. Biochem., 5,
131 134 (1967).
б. Behт Е., Frieтel Н., Hofтann R., Dбrfliпg Р., Methoden zur quantitativen
immunchemischen Bestimmung von Plasmaproteinen, Z. med. Labortech-
nik, 12, 177 189 (1971).
7. Laffiп R. J., А simple immuno1ogic method for the quantitation of immu-
noglobulin G in human cerebrospinal fluid, J. Lab. Clin., 76, 816 823
(1970).
8. Savory J., Heiпtges М. а., Кilliпgsworth L. М., Potter J. М., Мапиаl and
automated determination 01 immunoglobulins in unconcentrated cerebrospi-
па! fluid, Clin. СЬеm., 18, 37 42 (1972).
9. Backhausz R., Batory а., коиау М., Virag 1., Quantitative Bestimmung der
Beta 2M- (IgM) Globuline durch Immunodiffusion, Z. Immunforsch., 130,
3 367 (1966).
6. Простая радиальная иммунодиФФузия
по Манчини
Э. БЕМ
6.1. ПРИНЦИП
На ровную поверхность равномерным слоем наносят rель,
оодержащий антитела. В rеле вырезают лунки и заполняют
их раствором антиrена. Молекулы антиrена радиально диф-
фундируют ИЗ лунки И,встретившись с антителами, образу-
ют кольцо преципитации. До тех пор пока в лункесохраняет
ся избыток антиrена, происходит постепенное увеличение диа-
метра кольца преципитации.
Метод !радиальной иммунодиффузиибыл впервые предло
жен Манчини и сотр. [1] в 1963 r. Два rода спустя Фехей и
Мак Келви r2] опубликовали ero усовершенствованный ва-
риант. Этот метод, чаще друrих используемый в настоящее
время для количественноrо определения антиrенов, подробно
изложен в МНОI"'очисленныхработах [3 7]. Приведенное
здесь описание основа:н.о 'на статье, опуБЛИIюванной нами ра-
нее r8].
6.2. ПРО ВЕДЕНИЕ ИССЛЕДОВАНИЯ
6.2.1. PeareHTbI и приборы
Моноспецифичеокие антисыворотки;стандартные раство-
ры антиrенов; рабочий стандарт (см. 4.2.1); веронаkацетат
ный буфер с рН 8,6 и ионной силой 0,1 (см. 3.2.1); arap; рам-
ки для закрепления предметных 'стекол, штативы для этих
рамок, кюветы для элюции из комплекта для электрофореза
FK66 (W. MUl1er KG, Росток, [ДР); измерительныЙ инст-
румент с точностью до 0,1 мм; микрошприц, позволяющий
дозировать объемы .от 1 ДО 10 мкл.
6.2.2.
Последовательные этапы
исследования
Наrревают 1,5 r arapa до полноrо расплавления в 100 мл
веронал-ацетатноI'О буфера с рН 8,,6 на водяной бане и, охла-
див до 48 ОС, смешивают в нужной пропорции с антисыворот-
кой, подоrретой до той же температуры. Смесь разливают по
2 мл на предметные 'стекла, Iразложенные cTporo rоризон-
тально на подоrревной плите (при 35 40 ОС). Золь должен
4 840
50 Э. Бе),f
равномерно распределить'ся по поверхности стекла, чтобы
после остывания через HeCKOJIbKO минут получился слой rеля
толщиной около 1 мм. Чтобы усилить сцеплениеrеля со CTeK
лом, рекомендуется предварителl>НО :покрыть стекло тонкой
аrаровой пленкой; на Hero наносят 1 мл 1 % -Horo водноrо
arapoBoro золя и высушивают при ,.....70 ос. Если приrотов-
1,5"/o Hыи Оёаро/161Ц 30(/75
рll 8,б; 48 ос
Allтl/C6l/Jofloт/(fZ
L,8 ос
Рис. 24. Схема проведения простой радиальной иммунодиффузии.
ленные ПЛа'стинки не и>опользуютсясразу же (их IМОЖНО xpa
:нить 2 3 недели iBO влажной камере при 4 ОС), 'Ю в rель ре-
комендуется добавить консервант (мерт.иолят, 0,01 rHa
100 мл; азид натрия, 0,02 r на 100 мл).
В пластинке rеля вырезают 8 лунок, рассчитанных на
2 мкл антиrенноrо раствора каждая. Лунки можно вырезать
инъекционной иrл,ой с наружным диаметром 2 мм, острый
конец которой сточен, а канюля ,соединена с водоструйным
насосом. После внесения антиrена IIIластинки rеля помещают
во влажную камеру и проводят иммунодиффузию при КОМ-
натной температуре (см. 6.2.5). Отчетливые ,кольца преци-
питации можно измерять прямо на влажной пластинке. Если
6. Простая радиальная uм.мунодиффуэия по Манчини 51
преЦllпитаты -видны недостаточно четко, то 'сначала элюиру-
ют непреципитировавшие белки в двух сменах 0,15 М pac
1'вора NaCl по 12 ч, а затем rель высушивают и окрашивают
красителям,и, выявляющими белок, например а'мидо-черным
10В, и высушивают вновь. Последовательные процедуры
представлены На рис. 24.
-6.2.3.
Калибровочная кривая
Площадь, занимаемая преципитатомк концу диффузии,
прямо пропорциональна исходной концеН'I1рации антиrена в
лунке. Примером ,может служить калибровочная кривая,
представленная на рис. '25.
I
40
30
20 )
х
/
'1s Х
10 i' /X
/
.:.:::
I
50 100
lrонцентfJ(Щll'я fgA,,,,ejIIJIJMV!
Рис, 25. Простая радиальная
иммунодиФФузия; калибровоч-
ная кривая для определения
IgA, построенная с помощью
стандартной человеческой сы-
воротки.
Для построения калибровочной кривой берут либо пло-
Щадь преципитата (или, чаще, квадрат ero диаметра) как
функцию концентрации антиrена, либо лоrарифм диаметра
преципитата как функцию лоrарифма концентрации анти-
reHa. В обоих ,случаях получается прямая, выражающая сле
дующую за,висимость [1]:'
S===K.QAr+ 8 o, (1)
rде 8 площадь преципитата, включая 80, 50 площа ь
crартовой лунки и QAr количество антиrена.
..*
52 Э. Бем.
Накл,он К полученной прямой обратно пропорu;ионален
концентрации антител в rеле С Ат [9]:
K===п. + т ( 2 )
САТ '
rде т величина отрезка оси ординат, OTceKaeMoro прямой
и п коэффициент Iпересчета.
Соrласно ура'внению (2), уменьшив 'содержание антисы-
воротки .в arape, можно увеличить К. В результате возра'стет
диаметр преципитата, что повыоит чувствительность и 3'KO
НОМНОСть ,мет,ода. ОднаlКО нельзя бесконечно уменьшать 'со-
держание антисыворотки: наступает предел, при котором пре-
ципитат становится невИДИМЫМ. Оптимальная 'концентрация
антисыворотки в rеле зав,н,сит црежде acero от 'Титра анти-
тел. Обычно рекомендуют добав,ить от 1 до 5% а\нтисьпю
ротки.
6.2.4.
Те шература
Результаты .иммунодиффузии существенно не зависят от
температуры. Опыт может .быть Iпоста'влен при 4, 20 или 37 ос.
Удобнее Bcero работать при комнатной температуре; следу
ет толыю избеrать .резких (более 50) колебаний температуры
в ходе >Ю-Iкубации.
6.2.5.
Продолжительность иммунодиффузии
Необходи'мая ,продолжительность иммунодиффузии зави
сит от природы изучаемоrо антиrена. Например, альбумин и
'I1рансферрин дают преципитаты ма симальноrо диаметра уже
Чeiрез 48 ч. Для IgG и IgA также достаточно двух дней, а для
IgM, а-макроrлобулина и друrих белков ,с крупными моле-
кулами Тiребуется от 5 до 7 'суток. Первый ориентировочный
замер Iпреципитатовможно сделать уже через 24 ч.
В часто ,используемой модификации радиальной иммуно-
диффузии по Фехею и Мак-Кел,ви [2] при определении им
МУНОЛJIобулинов Iинкубацию проводят в течение 24 ч. Это зна
чит, что диффузия ант,иrена, по 'юрайней мере при ero высо-
кой Iконцентрации, полностью не заканчивается. Здесь наблю
дается примерно то же, что и при линеЙной им.мунодиффузии
(см. 5.2.3) [5], ,и ,соответственно между :диаметром преципи
тата и лоrарифмом концентрации антиrена также имеется
линейная зависимость. Однако эта модификация менее точна
чем определение ,при IмаК'с.имальной диффузии по Манчини и
сотр. [5,10].
6. Простая ,радиальная иммун.одиффуэия по Манчиnи 53
6.2.6.
Еще о приrотовлении
аrаровых пластиноК
Особое внимание следует обращать на температуру рас-
плавленнаю a'ra1pa при внесении антисыворотки (48 ос, не
более 50 ОС!), на канцентрацию ант,нсыворатки в rеле, на
объем золя, нанасимоrо на каждое стекло, и на распаложе
ние (строю rаризонталЬ'ное!) пла,стинак. У края nла'стиНlКИ
слой rеля обычно бывает тоньше, чем в друrих участках;
поэтому надо стараться, чтобы :кальца преципитадии не дo
ходили до Кlрая примерно на 5 мм.
6.2.7.
Значение свойств антиrена
Как правило, -стандартный и исследуемый антиrены долж
ны быть сходны па 'своим ,иМ'мунохимическим и физико-хи'Ми
ческим ,свойствам. Это требование не всеrда выполниМ'о. На-
пример, если молекулы антиrена склонны к аrреrации или к
распаду [3, 11], эти процессы MorYT изменить ero диффузион
ные 'своЙства и, кроме Toro, обнажить или ICKPbITb антиrенные
детерминанты. Аrреrация на6людает,ся, в частности, при по-
вторном растворении очищенноrо ,сывароточноrо альбумина
[3]. Перед тем как использовать такие растворы в качестве
стандартных, следует удалить алреrаты путем rель-фильтра-
ции на 'сефаде се G 200. IgA обычно содержится всыворатке
в виде ,молекулярных :комплеКiСОВ различной величины, 'и ча-
ще ,Bcero неиз'вестно, какова iсреди них доля моно-, ди- И ТРИ-
меров. В этом 'случае ,следует Qlриентироватьсяна усреднен-
ные ,результаты анализа большоrо числа сывороток .нормаль-
ных лиц или использовать существующие стандарты (напри
мер, стандарт ВОЗ [12]). в отдельных ,случаях преобладание
в исследуемом препарате быстро диффундирующих фраrмен-
тов (!субъединиц) 'может быть причиной завышенных резуль-
татов. Это :бывает при определении IgM [13].
Слишком долrое хранение образцов сыворотки при 4 ос
мажет привести к расщеплению белков сывороточными про-
теазами и тем 'самым к значительному снижению их KOHцeHT
рации. Относительно ,опецифичности, чувствительности и точ-
ности метода см. 3.3.2.
6.3. ОЦЕНКА МЕТОДА
В пределах ,своей чу,в'ствительности радиальная иммуно-
диффузия в П'ринципе приroдна для количественноrо опреде-
ления любаrо а;нтитена, есл,и исследО'Ватель располаrает
54 Э. Бе,':
1) соответствующей моноспецифической аНТИСЫБОРОТКОЙ ,И
2) чистыми и.тrи стандартными антиrенами, чтобы пос'l'рОИТЬ
ка.тrибровочную К1ривую д.тrя данной системы.
Пр.и помощи этоrо 'метода чаще Bcer,o определяют бeJ1КО
Вые антиrены, например бе.тr,ки 'сыворотки крови, цереброспи
" о
".
:.:--т-' .
. {..'
:"4,.
>
:.'
'А
'1,
. '.......
",:>:
: : . .
,./
.
,'<1.::
'"'
(1 .;.":
.. .;
, : ..<
11
;.;'"':.,'
о
"А
.
,т,.. ".
. ..
... $;} .'- ,'
......$..":>"'<
..!f-..;..........
. ;,...1;......-;:.
,.-;.
" "'..
',. J
. -;
б
;,<,
; ;
> .,
/... ...i\";
.:;
;"» ',- /"
.' .
Рис. 26. Простая радиальная иммуподиффузия. Примеры определения
IgG: А на П.lаСТlшке IO,5X7 см (препарат д-ра П. ЛИНllеl<е, Окружная
бо.lьница, ШвеРИII, rдр); Б lIа преД 1еТIIОМ стеl<ле.
на.'IЬНОЙ жидкости, секретов желез, Эlк<стра,ктов из орrЗНОБ
и т. п. (рис. 26). Он получил широкое ,раСПРОС11ранение -Б
клинических биохимических лабораториях. В 'настоящее Бре
мя в продаже имеются наборы реаrеНТОБ и rОТОБые имму-
нодиффузионныс пластинки для опрмеления мноrочисленных
белков.
б. Простая радuаль1Ю.Я UММУliодuффузuя по МаliЧUНiи 55
Существует значительное число модификаций традицион-
Horo метода радиальной иммунодиффузии. Некоторые из них
заслужи'вают внимания. Более плотный 'слой rеля и лунки
большеrо объема (диаметром около 4 мм), вмещающие до
20 мкл исследуемоrо ра'ст.вора, повышают чувствительность
метода. Этой же цели 'служит обработка rеля слабыми рас-
творами кислот, например 4% -ным раствором таннинас рН
1,5 [14], делающаЯ преципитаты более отчетли!выми. Под06-
ные приемы по'Зволяют 'определять даже IgE [15, 16], 'кото-
рый обычно улавливается только комбинацией радиальной
иммунодиффузии с радиоавтоrрафией [17 19] или :радио-
иммунометрией. Можно таlкже повысить IKoH paCTHocTb 'пр е-
ципитатов путем ,Внесения в лунки растворов !неионных поли-
меров [20] или обработки ,пластинок антииммуноrлобулино-
вой СЫВ'ороткой [21].
Цель некоторых модификаций радиальнойиммунодиффу-
зии экономия антисыворотки. Можно не смешивать антисы-
воротку с расплавленным arapoM, а наслаивать очень неболь-
шое ее количество на Iпредполаrаемую область преципитации
до [22] или после [23] диффузии антиrена. Антиrен диф-
фундирует радиально, а антитела 'вертикально вниз. Встре-
тившись дру!' с дрyrом, о'ни образуют преципитат. Такой ва-
риант метода позволяет избежать наrревания антисыворотки.
Рад,иальная иМ'мунодиффузия приrодна также длясрав-
нительно о качественноI'О [24] и ,количественноrо [25] ана-
лиза иммунохимичеCiКИ близких белков. Если количество ан-
тиrена в лун'Ках IПОСТОЯННО и точно известно содержан,ие ан-
ТlI'сыворотки в rеле, то по величине преципитата можно опре-
делить титр антисыворотки [26, 27] (см. также уравнение 2).
Для этой же цели можно смешать 'с arapoBbIM золем не ан-
тисываротку, а точно известное количество антиrена; анти-
сыворотка диффундирует из лунок и диаметр вазникающеrо
преципитата прямо пропорционален ее 'титру (так называе-
мая обратная Iрадиальная иммунодиффузия) [28 30]. Вме-
сто arapoBoTo rеля можно ис'Пользовать rель аrарозы 'или
ацетат-целлюлозную мембрану [31,32].
6.4. ЛИТЕРАТУРА
1. Mancini о., Vaerman J.-P., Carbonara А. о., Heremans J. F., А single-ra-
dial-diffиsion method for the immиno!ogica! qиantitation of proteins, in:
Peeters Н. (ed.), Protides of the Bio!ogica! F!иids, E!sevier pиblishing
Соmр. Amsterdam, London, New York, 1964; 11th Colloquiиm, Brиges,
1963, рр. 370 373.
2. Fahey J. L., McKelvey Е. М., Qиantitative determination of serum immu-
noglobиIins in antibody-agar p!ates, J. Immиnol., 94, 84 90 (965).
3. Heremans J. F., Antigen titration Ьу simple radial immuпоdШиsiоп in
plates, in: Williams С. А., Chase М. W. (ed.), Methods in Immиnology
56 Э. Беж
and Immunochemistry, Vol. 111, Academic Press, New York and London,
1971, рр. 213 224.
4. Becker W., Rapp W., Schwick Н. О., Stariko к.. Methoden zur quantitati-
ven Bestimmung von P!asmaproteinen durch Immunprazipitation, Z. klin.
Chem. klin. Biochem., 6, 113 122 (1968).
5. КаЩ М. W.. Quantitative determination of serum immunoglobulin levels
Ьу single radial immunodiffusion, Сliп. Biochem., 3, 91 104 (1970).
6. Schuтacher к., Kessler М., Quantitative Bestimmung von Serumproteinen
durch radia!e Immunodiffusion, Z. klin. Chem. klin. Biochem., 6. 193
197 (1968).
7. Rogos R., Wagner J., Die quantitative Immunglobulinbestimmung durch
radiale Immunodiffusion, Z. med. Labortechnik, 12, 24 31 (1971).
8. Behт Е., Frieтel Н., Hofтaпn R., DorfUng Р., Methoden zur quantitati-
ven immunchemischen Bestimmung von P!asmaproteinen, Z. med. Labor-
technik, 12, 177 189 (1971).
9. Vaerтan J.-P., Lebacq- Verheyden А.-М., Scolari L., Hereтans J. Р., Fur-
ther studies оп sing!e radial immunodiffusion. 1. Direct proportionality
between area of precipitate and reciproca! of antibody concentration, Im-
munochemistry, 6, 279 285 (1969).
10. Jenssen К. В., Immunochemica! determination of serum concentrations of
a!bumin, IgG and IgM, in: Peeters Н. (ed.), Protides of the Bio!ogical
F!uids, E!sevier PubIishing Сотр., Amsterdam, London, New York, 14,
677 681 (1966).
11. Storico к., Norma! va!ues for 23 different human p!asma proteins deter-
mined Ьу sing!e radia! immunodiffusion, Blut, 26, 200 208 (1968).
12. Rowe D. S., Anderson S. О., Grab В., А research standard for human se-
rum immunoglobu1ins IgG, IgA and IgM, Bull. WHO, 42, 535 552
(1970) .
13. Joпes D" Lo\v mo!ecu!ar weight IgM as а pitfall in immunog!obulin quan-
titation Ьу radia! diffusion, Сliп. СЫт. Acta, 29, 551 556 (1970).
14. Siттons Р., Quantitation of plasma proteins in low concentrations using
RID, Clin. СЫm, Acta, 35, 53 57 (1971).
15. Houri М., Мауе, А. L. R., Hougton L. Е., Jacobs D., Correlation of skin,
nasa! and inha!ation tests with the IgE in the serum, nasa! f1uid and
sputum, СНп. Allergy, 2, 285 298 (1972).
16. Bergтann K.-Ch., Lachтann В., QиапШаtivе Bestimmung von IgE im
Serum gesunder Neugeborener und bei Friih- und Neugeborenen mit Atem-
notsyndrom, Dtsch. Ges.-Wesen, 27, 471 472 (1972).
17. Rowe D. S., Radioactive single radial diffusion: А method for sensitivity
of immunochemica! quantitation of proteins in agar gel, Bull. WHO, 40,
613 (1969).
18. Hogarth-Scott R. S., Howlett J. В., мстсоl К. N., Siтons М. J., Wil-
liaтs Н. Е., IgE levels in the sera of asthmatic children, СНп. Ехр. lm-
munol" 9, 571 576 (1971).
19. Arbesтan С. Е., Jto к., Wypych J. 1., Wicher к., Measurement of serum
IgE Ьу а one step single radiodiffusion method, J. Allergy Clin. Immu-
nol., 49, 72 80 (1972).
20. Lundkvist и., Ceska М., Effect of non-ionic polymers оп the formation
of immunoprecipitates in single radial immunodiffusion techniques, Im-
muno!ogy, 23, 313 422 (1972).
21. Firestone Н. J., Werner М., Aronson S. В., тып agarose gel immunologic
methods, Amer. J. Сliп. Patho!., 51, 769 776 (1969).
22. Golder S., Lopez V., Keller н., Eine Mikromethode zur quantitativen im-
munchemischen Bestimmung von Proteinen, Z. klin. Chem. klin. Biochem.,
7, 448 454 (1969).
23. У okoyaтa М., У aтakido М., Direct immunodiffusion technique for Ig
quantitation, Clin. СЫт. Acta, 23, 165 167 (1969).
6. Простая радиалышя иММУ1Юдиффузия 11.0 Манчинu 57
24. Manciпi О., Nash D. R., Heremans J. Р., Further studies оп single radial
immunodiffusion. III. Qualitative analysis of related and unrelated anti-
gens, Immunochemistry, 7, 2бl 264 (1970).
25. Nash D. R., Scolari L., Heremans J. Р., Fиrther studies оп single radial
immunodiffusion. IV. Quantitation of heterologous antigens Ьу means of
cross-reacting antisera, Immunochemistry, 7, 265 274 (1970).
26. Becker W., Single radial immunodiffusion. А method for determination
of antiserum titers, Сliп. СЫm. Acta, 23, 509 510 (1969).
27. Becker W., Determination of antisera titers using the single radial immu-
nodiffusion method, Immunochemistry, 6, 539 546 (1969).
28. Vaerman J.-P., Lebacq- Verheydeп А.-М., Scolari L., Heremaпs J. Р., Fur-
ther studies оп single radial immunodiffusion. 11. The reversed system:
Diffиsion of antibodes in antigen-containing gels, Immunochemistry, 6,
287 293 (1969).
29. Reimer С. В., Phillips D. J., Maddison S. Е., Shore S. J., Comparative
evaluation of cO'llmercia! precipitating antisera against human IgM and
IgG, J. Lab. Сliп. Med., 76, 949 960 (1970).
30. Oberdorfer А., Вlaufuss Н., Zur Bestimmung prazipitierender Antikorper
mit der umgekehrten einfachen radialen Immunodiffusion, Z. klin. Chem.
klin. Biochem., 10, 385 390 (1972).
31. Vergani С., Stabllini R., Agostoni А., Quantitative determination of serum
immunoglobulins Ьу single radial immunodiffusion оп cellulose acetate,
Immunochemistry, 4, 233 237 (1967).
32. Pizzolato М. С. В., Pizzolato М. А., Agostoni А., Single radial immunodif-
fusion of иndilиted serum proteins, Сliп. Chem., 18, 237 238 (1972).
7. ЭлеКТрОIlММУННЫЙ аналиЗ
по Лореллу 1
Э. БЕl\I
7.1. ПРИНЦИП
30ЛЬ аrарозы смешивают с моноспецифической антисы-
вороткой и равномерным ,слоем распределяют по рО'Вной
пО'Верхности. В полученном теле вырезают лунки и за'полня
ют их исследуемым антиrеном. В электрическом поле моле-
кулы антиrена м,иrрируют в rель и взаимодеЙствуют с антите
лами. В результате этоrо в'заимодействия по краям д'вижу
щеrося омака молекул антитена появляются преципитаты.
По мере продвижения антиrена ero молекулы постепенно 'свя-
зываются антителами, образуя вытянутый в длину остр ОКО-
нечныЙпреци'Питат. В стандартных условиях длина полосы
TaKoro преципитата ,прямо пропорциональна концентрации
антиrена (под условиями подразумеваются концентрация re
ля, толщина ero слоя, содержание в нем антисыворотки, на-
пряжение 'и сила тока). Предполаrается, что находящиеся в
rеле антитела почти не изменяют ,cBoero положения в элект-
рическом поле. Это действителыно имеет место, если электро-
форез ПрОБОДЯТ при рН 8,6 в аrарозе, у которой очень слабо
выражены эндоосмотические свойства. В этих условиях миr-
рация антител в сторону анода, по-видимому, нейтрализуется
небольшим перемещением молекул воды к 'катоду [1].
Электроиммунный анализ впервые предложил в 1966 [.
Лорелл [2, 3]. Он работал с rелем аrарозы, содержащим
антитела. В 1967 r. Меррил, Харт,ли и Клеймен [4] описали
метод количественноrо определения иммуноrлобулинов, ос-
нованный на том же принципе,И назвали ero «электроимму-
нодиффузией». Этот термин получил раlспространение, хотя
он не вполне KoplpeKTeH. При точном 'воспроизведении мето-
дики иммунодиффузия полностью исключается. Сущность
элекроиммунноrо анализа лучше Bcero отразил бы термин
«иммуноэлектрофорез», который, однако, «занят»: так уже
назвали метод, по сути дела основанный на электрофоретиче-
ской иммунодиффузии.
1 Синонимы: ракетный иммуноэлектрофорез и электрофорез в rеле, со-
держащем антитела. В ориrииале метод назван ЕlесtrоimmиПО-ТСС!1ПIk.
Автор раздела (Е. Behm) считает, что этот термин не совсем удачно пере-
дает анrлиЙское выражение «electroimmиno assay:., которое прнмеИIIЛ Ло-
релл [l]. Прим. перев.
7. ЭлеtCтроим.мунный анализ по Лореллу 59
7.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
7.2.1. Реаrенты и приборы
Антисыворотки; стандартные
щихслучаях рабочие 'стандарты
таловый буфер с рН 8,6 [5]:
Барбитурат натрия
Барбитуровая кислота
Лактат кальция
Азид натрия
Дистиллированная BO
да
антиrены, в соответсТ'вую
(ом. 4.2.1), 0,075 М барби-
77,0 r
13,8 r
3,85 r
1,0 r
до 5000 мл
Аrароза (например, FeincI1emie Kal1iss КО, Себниц, r ДР;
Behringwerke АО, Марбурr, Фрr; Ferak, Западный Берлин;
L'lndustrie Biologique Frаш;аisе, Gennevi1liers, Франция;
желательно всеrда пользоваться аrарозой ОДНОrо и Toro же
производства; каждую новую партию аrарозы или аrарозу
друrой фирмы следует испытать в предварительном опыте).
Электрофоретическая камера с охлаждение;"'I; микрошприц,
позволяющий дозировать объемы от 1 до 10 мкл: измеритель
'с точностью отсчета до 0,1 мм.
7.2.2. Ход исследования
1 % -ный золь аrарозы в барбиталовом буфере с рН 8,6
при 48 ос С'мешивают с моноспецифической антисывороткой.
Чаще iВcero берут от 1 до 5 % антисыворотки по отношению
к rелю. Однако в зависимости от титра антител, свойств оп-
ределяемо о антиr,ена и друr.их факторов эта пропорция мо-
жет варьировать в довольно широких пределах. По 10 мл
смеси наносят, равномерно распределяя, на стеклянные П.1а-
'стИнки 120Х60 Х 2 мм. Должен 'получиться слой rе.J1Я тол-
щиной около 1 мм. Предварительно следует нанести 'на по-
верхностьстекла водный золь аrа1рОЗЫ (см. 6.6.2) и распо-
ложить пластинки cTporo rоризонтально на подоrреваемом
до 35 40 ос столике. Можно воспользоваться узкой U образ-
ной рамкой, которая имеет высоту 1 мм и оrранпчивает нvж-
ную поверхность стекла, оставляя одну из сторон откры-
той. На рамку накладывают вторую стеклянную пластинку
и закрепляют ее пружинными зажимами. Получается плоская
камера, которую заполняют аrа'рознЫМ золем с антисыво-
ротк:ой, не оставляя пузырьков воздуха. Коrда аrароза за-
твердеет, ,верхнее стекло и рамку удаляют, и пластинка [о-
тава для использования. Отступив на 8 мм от длинноrо края
60 Э. Бе""
пластинки, в rеле вырезают лу;нк,и диам,етром 4 мм на рас-
стоянии не менее 6 мм дру!' от друrа. В каждую лунку вно-
сят по 10 мкл pac'ru3opa с аНТИlrеном ,и 'проводят элеК11РОфО-
рез. Ту сторону !пластинки, на IКОТОРОЙ вырезаны лунки, сое-
1.5/o H6/a :ЗМЬ стестрозм
рН 8,б; 48 ос
А HтUCb/(J0flOтlCtl
48 ос
л ри ёото!Меllи(!
Ш1tlстll1l0/( 8шrя
ВЫjJeJtlIше <ff!/HOl>
f}rI1Я tlHтtrf?t?1I0(J
Внесение tlHтUeeHo(J
(J <ffУН/Ш
JrI1e/(тjJoffJopeJ
JrI1ЮUjJоlJtllluе
riJdtlжiJh1 ло IPq)
В ьтп; ш ulJtlНlle,
OICраши(Jанuе
l1.змеренuе
прецuлитстто8
Рис. 27. Последовательные этапы электроиммунноrо анализа.
диняют С 'Катодом. В электродные отсеки электрофоретиче-
ской камеры заливают барбиталовый буфер с рН 8,6. Напря-
женность поля может быть до 20 В/см, температура охлаж-
дающеrо areHTa 4 1 О ос. Сечение контактных мостиков
должно быть возможно ббльшим; лучше Boero залить их
слоем 1,5% -ной зrарозы [6]. При разных системах антиrен
антитело элек'l'РОфОРез может продолжаться от 3 o 18 ч
(см. 7.2.4).
Учет результатов lобычно можно проводить сразу же пос-
ле окончания электрофореза, i}la ,влажных препаратах. Если
преципитаты плохо различимы, из rеля элюируют непреци-
7. Эле"троuммунный анализ по Лореллу 61
у' 12w /; -,
'.,
"" fP /?т
I
""'\
" '
. ",; ......w" . '..,: .
,
"q._ -",,7
{.;:,;ЛJ1l'
,, """'"
1', , ",О
.' .zЦ_
j/<
'",
. _..'
-. ;.:..
b:.'::: ;:',--," /
.,;
"--',
"""
Рис. 28. Электроиммунный анализ: определение концентрации альбумина
на предметном стекле.
питировавшие белки, пластинку высушивают и .окрашивают.
Основные этапы метода представлены на рис. 27. На рис. 28
показана элеК'I'рофореrра,мма альБУ1мина.
7.2.3.
Дополнительные замечания об отдельных этапах
Лунки должны быть а,К'ку.ратно вырезаны и до краев за-
полнены раствором антиrена. В rеле не должно быть тре-
ЩИН, и он не должен отставать 'от стекла. Электрофорез нуж-
но начинать не позже чем через 10 мин после заполнения пер-
вой лунки антиrеном, иначе результаты будут искажены им
мунодиффузией. Рекомендуется выбирать такие концентрации
ah-rИlrенов, Ч1.10бы rrреЩIlПитаты имели длину от 1 до 4 см.
Все разведения антиrенов следует 'сделать в том же буфер-
ном 'растворе, в котором проводится электрофорез. В опти-
мальных условиях получаются узкие, остроконечные преципи
таты овально-вытянутой формы (<<шлейфы»). rрафик зави
СИlМОсти площади преципитата от концентрации антиrена
представляет собой прямую линию [7]. На практике вместо
площади rrолне достаточно измерить длину преципитата
(2]; если преципитаты имеют описанную выше форму, т.о BHO
симой при этом ошибк.ой можно пренебречь.
7.2.4. Электрофорез
Преципитаты приобретают характерную вытянутую фор
му тольк.о при достаточной длительности электрофореза, ко-
торая для разных систем антиrен антитело бывает раз-
личной ,и существенно зависит также от напряженности поля.
Gоздать вьюокую напряженность 'П.оля можно тольк.о 'В ка-
мере с эффективным охлаждением. Чаще Bcero ,работают при
10 20 В/см. Ионная сила буфера обычно составляет 0,03
0,07. В этих условиях электрофорез альбумина продолжается
примерно 5 ч, а трансферрина 10 ч.
62 Э. Бем
7.2.5. Определение и:м:муноrлобулинов
При электроиммунном анализе иммуноrлобулины обычно
проявляют очень незнач.ительную подвижность КаК в анод-
ном, так и в катодном направлении. Это относится и к IgG,
и к Ig и серьезно затрудняет их количественное определе
ние. Обычно они дают массивный двойной преципитационный
шлейф, остающийся BOKpyr стартовой лунки. Чтобы этоrо из
бежать, пользуются следующими приемами:
1. Намеренно у,силивают элеК'Троэндоосмос, заменив ara-
розу 1 % -ным arapoBbIM rелем [4, 8], в котором иммуноrлобу
лины дают довольно широкие вытянутые к катоду преципита
ты с окруrлой вершиной.
2. Часто перед исследованием иммуноrлобулины обраба-
тывают 2 1\1 раствором KCNO [9, 10]. Для этоr1Q 1 часть сы-
воротки смешивают с 2 частями раствора KCNO .и оставля
ют на ночь при 'комнатной температуре либо смешивают palВ-
ные объемы этих жидкостей и инкубируют 30 мин при 45 qC.
Затем делают подходящее разведение в барбиталовом буфе
ре и проводят электрофорез. Цианат ,реаrирует со свободны-
ми NH2 и SН rруппа:ми [11], что ведет к увеличению обще-
ro отрицательноrо заряда белковых молекул. Обработанные
циана том белки приобретают значительную подвижность в
сторону анода.
3. Сходные результаты дает обработка исследуемой сы-
воротки -пропиолактоном [5], который не изменяет антиrен-
ных свойств иммуноrлобулинав [112].
7.2.6. Модификации электроиммунноrо анализа
Электроиммунный анализ можно П1роводить на ацетат-цел-
люлозной мембране [13 'lБ]. Этому варианту следует от-
дать предпочтение, Коrда приходится экономить антисыво-
ротку. Количественный или Дlвумерный иммуноэлектрофорез
(см. разд. 2) та'кже можно рас,сматривать как усовершенст-
вованную разновидность электроиммунноrо анализа. Не-
большие изменения методики пО'зволяют использовать элект-
роиммунный анализ для оценки идентичности антиrенов и
для количественноrо определения перекрестно-реаrирующих
антител вантисыворотке [16].
7.3. ОЦЕНКА МЕТОДА
Электроиммунный анализ по Лореллу обычно использу-
ют для количественноrо определения белка в жидкостях ор-
rанизма. Этому методу можно дать ,в принципе ту же оцен-
7. Электроuммун.н.ый ан.а/LUЗ по Jlореллу 63
ку, что И радиальной и:ммунодифФузии (с'М. 6.3), однако
элеКiРОИММУННЫЙ анализ имеет больше оrранич:ений. В ча-
стности, весьма затруднительно определение тех антиrенов,
которые при рН 8,6 сла1бо миrрируют в электричеоком поле.
Кроме Toro, для электроиммунноrо анализа требуется ,спе-
циальная аппаратура. Однако ето существенным преимуще-
С'Ш30М является быстрота получения резуль'татов в этом от-
ношении метюды Iколичественной .иммунодиффузии я'вно усту-
пают ему.
7.4. ЛИТЕРАТУРА
1. Laurell С-В., Electroimmuno assay, Scand. J. сliп. Lab. Invest., 29,
Suppl. 124, 21 37 (1972).
2. Laurell О.-В., Quantitative estimation of proteins Ьу electrophoresis in
agarose gel containing antibodies, Analyt. Biochem., 15, 45 52 (1966).
3. Laurell С-В., Quantitative estimation of proteins Ьу eIectrophoresis in
antibody containing agarose geI, in: Peeters Н. (ed.), Protides of the
Bio!ogical F!uids, E!sevier PubIishing Соmрапу, Amsterdam. London, New
York, 14, 499 502 (1966).
4. МеттШ D., Натаеу Т. Р., Claтaп Н. N., Electroimmunodiffusion (EID):
А simple, rapid method for quantitation of immunog!obulins in dilute Ыо-
!ogica! fluids, J. Lab. сliп. Med., 69, 151 159 (1967).
5. 5tephaп W., Frahт И., Quantitative Simultan-Immune!ektrophorese,
Z. klin. Chem. k!in. Biochem., 9, 224 228 (1971).
6. lohaпssoп В. О., Agarose ge! electrophoresis, Scand. J. сliп. Lab. Invest.,
29, Suppl. 124, 7 19 (1972).
7. 5colafi L., Picard J. 1., Hereтaпs J. Р., Quantitative determination of
human a!pha-macrog!obulin Ьу means of immunoe!ectrophoresis in anti-
body-containing ge!, Сliп. Chim. Acta, 19, 25 32 (1968).
8. Takase 5., Yoshida М., Quantitative determination of immunog!obulins in
cerebrospina! fluid, Tohoku J. Ехр. Med., 98, 189 198 (1969).
9. Weeke В., Carbamy!ated human immunog!obulins tested Ьу electrophore-
sis in agarose and antobody containing agarose, Scand. J. сНп. Lab. In-
vest., 21, 351 354 (1968).
10. Weeke В., Quantitative estimation of human immunoglobulins following
carbamylation Ьу electrophoresis in antibody-containing agarose, Scand.
J. сНп. Lab. Invest., 22, 107 111 (1968).
11. Raisys V. А., Arvaп D. А., Determination of proteins in biological f1uids
Ьу electroimmunodiffusion and two-directiona! immunoelectrophoresis
Сliп. Chem., 17, 745 750 (1971). '
12. Stephaп W., ВеsеШguпg der Komplementfixierung von y-GlоЬuIiп durch
chemische МоdШziеruпg mit -Propio!acton, Z. k1in. Chem. klin. Bio-
chem., 7, 282 286 (1969).
13. Kr0ll 1., Quantitation of protein Ьу electrophoresis in а celluIose acetate
membrane impregnated with antiserum, Scand. J. сliп. Lab. Invest. 21
187 189 (1968). ' ,
14. ОШ С. W., Fischer С. L., Holleтaп С. L., Rapid method for protein quan-
Шаtiоп Ьу electroimmunodiffusion, Сliп. Chem., 17, 501 504 (1971).
15. Watkiпs 1., Atkiпs В., Holborow Е. 1., Quantitative estimation of protein
Ьу e!ectroimmunodiffusion оп cellogel acetate membranes, J. сНп. Patho!.
24, 665 667 (1971). '
16. Orubb А., Analysis of immunochemical relationship between antigens Ьу
electrophoresis in agarose ge!s containing antibodies, Scand. J. clin. Lab.
Invest., 29, Suppl. 124, 59 65 (1972).
8. Анализ иммунных преципитатов
в rелях
В. ШТРАУБЕ, Б. КЛАУШ, Р. ХОФМАН
Для анализа иммунных преципитатов в rеле довольно ши.
роко применяются методы специфическоrо окрашивания бел-
ков, ферментативные реакции, ,радиоавтоrрафия и определе-
ние электрофоретической подвижности. Дополнительные воз-
можности открывают некоторые методы, описанные в дрyrих
разделах книrи, такие, как двойная радиальная иммунодиф-
фузия (см. 3.2.3) или опециальные модификации иммуно-
электрофореза с применением чистых антиrенов и 'Моноспеци-
фических антисывороток (см. 1.2.8).
8.1. АНАЛИЗ ПРЕЦИПИТАТОВ
С ПОМОЩЬЮ РЕАКТИВОВ,
ОКРАШИВАЮЩИХ БЕЛКИ
8.1.1. Принцип
Окрашивание повышает контрастность преципитата. Ча-
сто на О'крашенных препаратах удается замет,ить IПреци'Пита
ты, невидимые внеобработанном rеле. Кроме Toro, подбирая
соответствующие красители, можно выяснить природу анти-
reHa, образующеrо иммунный комплекс. Можно, в частности,
дифференцировать белки, липопротеиды, rликопротеиды, по
лисахариды и нуклеопротеиды, а также металлопротеиды и
нуклеиновые кислоты. В HeКioTopыX случаях это позволяет,
даже не прибеrая к 1IРУДНОДОСТУПНОЙ моноспецифической ан-
тисыворотке, определить не толыю общую, но и индивиду-
альную природу исследуемоrо антиrена.
8.1.2.
Проведение исследования
Перед окрашиванием из rеля необходимо удалить 'все
компоненты, которые не приняли участия в образовании пре-
ципитата. Обычно для этоrо пластинки промывают забуфе-
ренным 0,15 М раствором N aCl (lpH 7,4 8,O). Чем толще
rель, тем продолжитеЛIшее должна быть элюция (обычно ДО.
статочно бывает однихсутО'к на каЖДЫЙ миллиметр слоя).
Перемеши,вание ,ра,створа существенно сокращает время элю-
ции. Продолжительную элюцию следует вести на холоду
А /ЩJЪUЗ шtМУННblХ преципиТйТО8 в zелях 65
(4 ОС) с добавлением коноер,вантов, например 0,02% аЗИ1да
натрия, 0,01 % мертиолята (тиомерсала), 0,1 % хлорэтона
и т. п.
Обычно перед окрашиванием ПРе'па,рат высушивают. Для
этоrо отмытую пластинку покрываютсверхувлажной филы
р'овалыной бума!rой (на:пример, FN 14, УЕВ Spezialpapierfab-
rik Niederschlag, r ДР), не оставляя пузырьков воздуха, и
высушивают при комна'тной температуре или при 37 ОС [1].
Если бумаrа плохо отделяется от высушенноrо rеля, ее нуж
но слеrка смочить.
Из множеСl1ва известных методов окрашивания мы опи-
шем только те, которые дают надежные результаты.
Для более подробноrо ознакомленИя рекомендуем обра
титьсяк общеизвестным руководствам Бакхауса [2] и Уиль
ямса и Чейза [3].
8.1.2.1. Белки
Для окрашивания белков чаще Boero применяют а'мидо
черный, ниr,розин, кумаоси синий, бромфенолО'вый СИНИЙ,пун
цовый красный и световой зеленый. Их 'можно использовать
как в водных, так и в орrанических растворителях. Окраши
вание водными растворами обычно дает больше преимуществ
[3,4] .
Растворы красителей
Большинство р'а'створов перед употреблением следует
профильтровать. В микрометодах окрашиваlние продолжается
обычно 10 15 мин, а в маwpометодах 1 2 ч [2]. После OKpa
шивания препа,рат под непрерывным контролем дифферен
циально обесцвечивают до тех пор, пока окрашенныЙ преци-
питат не будет отчетливо виден на фоне окружающеI"'О rеля.
Ниже даны прописи ра'створов и указана продолжитель-
ность окрашИ,вания для микромодификации.
Амидо черный Амидо-черный 10В
Безводная уксусная кис-
лота
Дистиллированная вода
Продолжительность окрашивания 1 О мин.
Иммунопреципитаты получаются темно синими на бесцветном
фоне.
Лиссаминовый
зеленый
1,0 r
100,0 мл
ДО 1000,0 мл
Световой зеленый
Безводная уксусная кис-
лота
Дистиллированная вода
2,0 r
100,0 мл
до 1000,0 мл
5 840
66 В. Штраубе, Б. Клауш, Р. Хофма/i
Продолжительность окрашивания 1 2 Ч.
Иммунопреципитаты приобретают ярко-зеленую окраску.
Азокармuн
Азокармин В
Безводная уксусная кис-
лота
Дистиллированная вода
Продолжительность окрашивания 10 мин.
ПУНЦО8ЫЙ
красный
Пунцовый 2R
Безводная уксусная кис-
лота
Дистиллированная вода
2,5 r
100,0 мл
до, 1000,0 мл
3 r
100,0 мл
до 1000,0 мл
Продолжительность окрашивания несколько часов.
Особенно удобен в сочетании с друrими красителями.
Окрашенные этими растворами препараты проще Bcero
отмывать в холодной проточной водопроводной воде.
8.1.2.2. Липопротеиды
Для 'выявления липопротеидов чаще Bcero /применяется
судан черный, жировой красный и нильский rолубой. Эти
красители нерастворимы в воде, поэтому rель перед окраши-
ванием необходимо тщательно высушить.
Судан черный
Судан черный В
1 н. раствор N аОН
Дистиллированная вода
Абсолютный этиловый
спирт
1,2 r
20,0 мл
380,0 мл
до 1000,0 мл
После KpaTKoBpeMeHHoro кипячения смесь охлаждают И
хранят в плотно закупоренных бутылях из TeMHoro стекла.
Продолжительность окрашивания 3 ч.
Обесцвечивание фона проводят в 50% -ном спирте.
Липопротеиды окрашиваются в темно синий цвет.
Rомбинированное окрашивание липопротеидов
и белков
Наиболее контрастное окрашивание дает комбинация ами-
до-черноrо с жировым красным или азокарм.ина с суданом
черным [2].
8.1.2.3.
Анализ иммунных преципитаТО8 е zелях 67
Амидо черный 10В
Безводная уксусная кислота
60 % -ный этиловый спирт, насыщенный жиро-
вым красным
А30кармин В
Безводная уксусная кислота
60% -ный этиловый спирт, насыщенный cyдa
ном черным В
0,5 r
20,0 мл
ДО 1000,0 мл
0,5 r
20,0 мл
ДО 1000,0 мл
Для обесцвечивания фона пр и меняют 1 % -ную уксусную кис-
лоту в 50 % HOM этиловом спирте.
8.1.2.4.
rликопротеиды и полисахариды
rлшюпротеиды и полисахариды во мноrих случаях можн(}
выявлять путем одноэтаlпноrо окрашивания алциановым си
ним, муцикармиН'ом Майера или основным фуксином.
Раствор алциановоrо синеrо:
Алциановый синий
10% ная уксусная кислота
Для обесцвечивания фона применяют
лоту.
Значительно лучшие результаты дают более трудоемкие
мноrоэтапные методы окрашивания.
В качестве примера приводим методику, основанную на
реакции с .иодной 'кислотой [3].
Раствор [.
Раствор ll.
Раствор lП.
5*
1,0 r
1000,0 мл
1 % - ную уксусную
кис
1 %-ный раствор иодной кислоты в 0,2 М pac
твора ацетата натрия
10% ный раствор солянокислоrо rидроксил
амина в 0,2 М ацетатном буфере с рН 4,7. Бу-
фер rотовят из равных объемов 0,4 М aцe
тата натрия и 0,4 М уксусной кислоты
rотовят непосредственно перед окрашивани-
ем. Смешивают равные объемы свежеприrо-
товленных 0,01 М растворов а-нафтола
(144 Mr на 100 мл) и n-фенилендиамина
(216 Mr на 100 мл). В качестве растворителя
применяют 0,0001 М нейтрализованный BOk
ный раствор ЭДТА.
а-Нафтол находится в растворе только при
постоянном подоrреве.
Прибавляют 1/5 объема 0,1 М Н 2 О 2 (3%)
68 В. Штраубе, Б. Клауш, Р. Хофма/i
Процесс окрашивания:
В растворе 11 45 мин
В проточной водопроводной воде 15 мин
В растворе I 10 мин
В проточной водопроводной воде 1 О мин
В растворе 111 5 10 мин
В проточной водопрово ной воде 5 10 мин
На высушенных препаратах преципитаты имеют сине
фиолетовый оттенок.
8.1.2.5.
Нуклеопротеиды и нуклеиновые. кислоты
Нуклеопротеиды и нуклеиновые кислоты рекомендуется
[3] выявлять 'с IПОМОЩью пиронина У (Guп, Лондон).
2% -ный 'раствор пиронина очищают, MHoroKpaTHo Э'кстра-
rируя хлороформом, и хранят в склянках из TeMHOI'O 'с'текла.
Перед употреблением раствор пиронина разбавляют в 10
раз 0,1 М ацетатным t6уфером 'с рН 4,7.
Продолжительность окрашивания 30 60 мин. Фон обес-
цвечивают в проточной водопроводной воде. Иммунные дpe
ципитаты, содержащие полинуклеотиды, окрашиваются в
красный двет.
8.1.2.6.
еталлопротеиды
Белки, содержащие в связанной форме медь или железо,
можно идентифицировать при помощи Iр,еакций на ионы Э'тих
металлов.
Окрашивание медьсодержащих белков ализариновым синим S
Окрашивающий растВ'ор: насыщенный раствор ализаРИНОВ1оrо
синеrо S в /безводной уксусной ки,слоте. Перед окрашиванием
разбавить 1 : 10 70 % -ны:м раствором уксусной кислоты.
Продолжительность окрашИ'Вания 30 мин. Обесцвечивание
фона производят в 70%-ной уксусной кислоте. Преципитаты
медьсодержащих белков 'приобретают !синий цвет.
Окрашивание железосодержащих белков батофенантролином
(4,7 -дифенил-l, 10-фенантролин)
Окрашивающие растворы:
Раствор 1. Двунатриевая соль батофена'нтроли:нсуль-
фоновой кислоты
Деминерализованная вода
0,02 М ацетат натрия
Раствор следует использовать сразу после приrотовления.
Раствор П. Тиоrликолевая кислота
2 Mr
2 МJI
18 МJI
Анализ ,UМMYНН,ЫX прециrштатов IJ еелях 69
Препараты паrружают на 1 2 ч ;в раствор 1. Затем при-
6авляют 0,1 мл :раствора Il; 'Чер'ез нес олько минут препара-
ты извлекают и отмывают 2 % -ной уксусной кислотой, меняя
промывающий palCTBop каждые 15 мин. Комплексы антиrен
антитело, содержащие связанное ,железо, приобретаюткра,с-
ный цвет. Для получения хороших 'результатов все химика-
лии п растворы (arap, элюирующие растворы и .т. п.) долж-
НЫ Iбыть 'свободны от ионов железа.
8.2. ВЫЯВЛЕНИЕ КОМПЛЕКСОВ
АНТИТЕЛО ФЕРМЕНТ
ПО ФЕРМЕНТАТИВНОй АКТИВНОСТИ
8.2.1. Принцип
Выявление ферментативной активности иммунных преци-
питатов весьма специфический и очень чувствительный :Me
тод :их анализа. Реакция антиrен антитело только в peд
ких случаях приводит к прямой блокаде активных центров
фермента [3, 5]. Чаще Bcero фермент, соединившись с .антите
лом, сохраняет свою активность [3]. Ферменты можно иден
тифицировать с помощью xpoMoreHHbIx .и HexpoMoreHHbIx суб-
стратов. В первом случае при 'контакте с ферментом субст
,рат переходит в окрашенную нерастворимую форму. При ис-
пользовании HexpOMoreHHbIx субстратов конечный продукт
ферментативной реакции выя.вляют, вводя дополнительно Ka
кую-либо хромоrеннуюсистему [3].
Методы выявления ферментов и изоферментов, входящих
в состав иммунных комплексов, различаются между собой па
у,словиям инкубации фермента с субстратом. Фермент можно
предварительно элюировать из rеля, а затем выявить; ero
можно окрасить прямо 'в rеле; можно также воспользоваться
rелеМ,содержащим субстрат, 'Применить метод сэндвича или
метод контактной пленки. На основании собствеююrо опыта
мы рекомендуем для решения мноrих задач метод окрашива-
ния в rеле.
8.2.2. Проведение исследования
Термола,бильность большинства ф рментов за,ставляет про
водить все этапы электрофорез, диффузию и элюИ'рова-
ние на холоду (4 C). Обычно ,rель не высушивают, а со-
храняют влаЖ1НЫМ.
ПОЛНОе рассмотрение соответствующих методов не вхо-
дит в задачу этой книrи. Поэтому мы оrраничимся лишь опи-
70 В. Штраубе, Б. Клауш, Р. Хофман
санием несколышх типичных реакций идентификации. Ос-
тальное читатель найдет в литературе [2, 3, 5, 6].
8.2.2.1. ОRсидореДУRтазы
При окислении субстратов большинством оксидоредуктаз
акцептора'Ми ВОДСУрода служат НАД, НАДФ, 02 или Н202.
Выявление ферментов этой rруппы в rеле с помощью цвет-
ных реакций обычно не вызывает затруднений.
Пример 1. Лактатдеrидроrеназа (лдr)
Раствор 11.
KCN
ДТТl (ТНСТ2)
0,1 М фосфатный буфер
с рН 7,5
ФМС3
Дистиллированная вода
(КФ 1.1.1.27)
50,0 Mr
30,0 Mr
Раствор 1.
90,0 мЛ
10,0 Mr
10,0 мл
Оба раствора при 4 ос сохраняют rодность в течение 4 не-
дель; раствор II следует хранить в склянке из TeMHoro стек-
ла. Среду для инкубации rотовят непосредственно перед опы-
том, смешивая растворы 1 и II, НАД и лактат лития.
Среда для инкубации:
Раствор 1
Раствор II
НАД
DL лактат лития
7,2 мл
п,2 мл
5,0 м!
25,0 Mr
Влажные пластинки rеля сразу же после удаления несвя-
завшихея белков в течение 1 2 ч инкубируют в этой же сре-
де при 37 0 с. Уже через 20 мин в rеле появляются первые
видимые полосы окрашенноrо преципитата. После инкубации
препараты 30 мин фиксируют в спиртовом растворе уксусной
кислоты при комнатной температуре.
Фиксирующий раствор:
Абсолютный этиловый спирт
Ледяная уксусная кислота
Дистиллированная вода
150,0 мл
10,0 мл
40,0 мл
1 Хлористый диметилтиазолилтетразолий.
2 Тетраиитросиний тетразолий.
8 Феназинметосульфат.
АfША.UЗ UМMYН,Н,ЫX прециtШтаТО8 веелях 71
После фиксации препарат высушивают под филыроваль
ной бумаrой.
Резу.zьтаТbl: сине-фиолетовое окрашивание полос преци
питации свидетельствует о присутствии компонентов с актив
ностью лдr.
Пример 2. Церулоплазмин (п-дифенолоксидаза, КФ
1.1 0.3.2)
Среда для инкубации. 21,6 Mr п фенилендиамина paCTBO
ряют в 100 мл ацетатноrо буфера (0,1 М, рН 5,7), HarpeBa
ют до 37 ос и тотчас используют.
Инкубация. Пластинку rеля поrружают в раствор субст-
рата и инкубируют при 37 ос в течение 2 'Ч. За это время рН
инкубационной среды должен возрасти до 6,0.
Затем rель фиксируют и отмывают забуфе'Ренным ,спир-
'Том .(дважды rю 2 ч).
ЗабуфереННblЙ этиловый спирт (рН 4,7; 0,1 М):
0,2 М раствор ацетата натрия 50,0 мл
0,2 М раствор уксусной кислоты 50,0 МЛ
50%-ный спирт 100,0 мл
Результат: окисление субстрата церулоплазмином вызы-
вает сине фиолетовое окрашивание полос преципитации.
Для контроля в параллельном опыте в инкубационную
среду можно добавить 1 мл 0,1 .М. раствора азида натрия
(NаN з ), который, будучи инrибитором оксидаз, долж:ен пред-
отвратить окрашивание.
8.2.2.2.
rПДрОJIазы
Пример 1. Карбоксилэстераза (КФ 3.1.1.1)
Используемый в качестве субстрата а-нафтилацетат рас-
щепляется ферментом на а-нафтол и ацетат. а-Нафтол pea
rирует с солями диазония (например, с прочным синим В),
образуя нерастворимые окрашенные соединения, что и слv
жит показателем ферментативной активности. -
Среда для инкубации (rотовить непосредственно перед
опытом) :
а- Нафтилацетат
Ацетат
10,0 Mr
0,25 мл
После растворения а-нафтилацетата добавляют
0,1 М фосфатный буфер с рН 7,4
Прочный синий В
Раствор необходимо профилыровать.
25,0 мл
20,0 мл
72 В. Штраубе, Б. Клауш, Р. Хоф,нан.
Инкубация. iПластинку rеля полружают на ЗО 60 МИН в
ИНlкубационную среду при омнатной температуре.
Результат: преципитат, обладающий ферментативной aK
ТИвностью, окрашивается в коричнево-красный цвет.
Пример 2. Щелочная фосфатаза (КФ 3.1.3.1)
Раствор для инкубации:
Нафтилфосфат натрия
Прочный синий В
0,1 М веронаkСОЛЯНОКИСЛЫЙ буфер
с рН 9,0
20,0 Mr
20,0 Mr
20,0 мл
Раствор необходимо профильтровать.
Инкубация. Раствор суБС'I1рата наносят на rель и остаВJIЯ
ют при комнатной температуре на 30 60 мин; после этоrо
фиксируют 20 'мин в 3 5% -ном растворе уксусной кислоты,
а затем отмывают в течение l'ч водой.
Результат: винно-кра,сное окрашивание преципитата YKa
зывает на ферментативную активность.
Кислую фосфатазу (КФ 3.1.3.2) выявляют так же, как
и щелочную, но при рН 5,0.
Пример 3. а Аминопептидазы (например, лейцинамино
пептидаза, КФ 3.4.1.1)
Среда для инкубации:
L лейцил - нафтила мид
Дистиллированная вода
После растворения добавить:
0,85% ный раствор NaC1 8,0 мл
0,02 М раствор KCN 1,0 мл
Веронаkацетатный буфер (0,1 М, рН 6,5) 10,0 мл
Прочный синий В 10,0 Mr
Инкубация. Пластинки rеля 'выдерживают 1 2 ч в и НiKY-
бадионной среде при 37 QC, затем по 2 мин в 0,15 М pacтвo
ре NaC1, в 0,1 М растворе CUS04 и снова в 0,15 М ра'ство-
ре N аС1.
Результат: иммунные rrрецишитаты, обладающие а-амино-
пептидазной активностЬЮ,ок;рашиваются в кра,сный цвет.
П римечание. ом6ина'дИЯ иммунодифФузии с выявлени
ем ферментативной активности значительно повышает чу,в-
ствительность методов преципитации в rеле. Становятся ви-
димыми те преципитаты, которые обычно трудно выявить
простым окрашиванием белков. Однако не все ферменты
можно выЯ'вить с помощь специфической цветной реакции
в rел е.
8,0 М!
1 , О мл
АндЛ,uз иммун.н.ых пpelfUnUTar08 8 zелях 73
8.3. АНАЛИЗ ИММУННЫХ ПРЕЦИПИТАТОВ
С ПОМОЩЬЮ РАДИОАвтоrРАФИИ
8.3.1. Принцип
Выявление иммунных преципитатов с помощью радиоав-
тоrрафнн rораздо чувствительнее любоrо обычноrо метода
окрашивания [3, 6]. В этом методе .используется способность
белков связывать и нести на себе метку. Помимо 'выявления
преципнтатов, радиоавтолрафия служит для оценки ЧИС'f10ТЫ
меченых антиrенов ,и антител, а также для изучения синтеза
белков в тканевых ,культурах [3].
При радиоавтоrрафическом анализе преципитатов имму-
нодиффузию или ИМlмуноэлектрофорез чаще Bcero проводят с
заранее помеченными антиrенами или антителами, т. е. пос
ле добавления меченоrо peareHTa к исследуемой пробе. Если,
однако, требуется определить связывающие или транспорт-
НЫе своЙства бел ов, меченые реатенты (например, ropMoHbI,
ионы металлов или витамины) можно инкубировать и с уже
образовавшимися преципитатами.
Для выявления радиоактивной метки в преципитатах про-
ще Bcero воспользоваться фотопленкой подходящей чувстви-
тельности. В результате контакта фоточувствительноrо 'ма-
териала с rелем в местах расположения меченых белков на
'Проявленной пленке возникнут участки xapaKTepHoro почер-
нения.
Из мноrочисленныхпримененийрадиоаВТОf'рафии мы ПОk
'робно опишем методику определения эстроrенсвязывающих
бедков в сывюротке человека. Сначала ставят реакцию преци
питации ,сывороточных 'белков 'с полиспецифической антисы-
вороткой 'в rеле, затем отмывают неС'вяза'Вшиеся компоненты
и инкубируютпреЦИlПитаты с меченым эстроrеном [7].
8.3.2.
Проведение исследования
8.3.2.1.
Реаrеиты n :приборы
Полиспецифическая антисыворотка ксывороточнымбеk
кам человека; меченый эстроrен (например, 1,3,5 (10) -эстра-
триен-3, 16, 17 триол_3Н или 1,3,5 (10) -эстратриен-3, 17 - диол-ЗН).
'(Эстроrены можно получить от фирмы УЕВ Jenapharm (Ие-
на, [ДР), а приооединение метки по Вильцбаху осуществля
ет Institut fйr Angewandte RаdiоаktivШit (Лейпциr, [ДР).]
Мета новый проточный счетчик; пленка для микрорадио-
автоrраф:ии К-I06; проя'Витель M H 28 (УЕВ Fi1mfabrik,
Нольфен, [ДР).
74 В. Штрау6е, Б. Клауш, Р. Хофяан
8.3.2.2.
РадпоавтоrрафичеСIШЙ анализ
(двухзтапвый метод)
После иммунодиффузии или иммуноэлектрофореза пла
стинки rеля, как обычно, элюируют 0,15 М раствором NaCl,
а затем поrружают в раствор эстроrена, меченноrо тритием
(метод пропитывания).
П РU20товленuе раствора JиечеНО20 ЭСТрО2ена. 3Н -эстроrен,
адсорбированный (1: 25 по весу) на BaS04, переводят в эта
/d"
..
.
.ё....':'"
>0::....
).';...."..5 ... }..... ;- '," ; .:: .'), '21'<: - ,".::"
' ' ''': , ..... .... ..( .К.....-..."."":.: " :.;
""-и::.:.i-l' .::'.
ъ
....... ;"';\j ;;:t
а.
".
""'.:"':'. '
. ..............
Рис. 29. Радиоиммуноэлектрофорез. Антиrены: а сыворотка донора-муж
чины; Ь сыворотка беременной женщины. Антисыворотки: 1 кроличья
аllтисыворотка ко всем сывороточным белкам человека; 2 истощенная
кроличья антисыворотка к сывороточным белкам беременной женщины.
Инкубация с ЗН-17- -эстрадиолом в течение 72 ч, экспозиция 37 дней.
нол, а носитель удаляют центрифуrированием. Надосадочную
жИдкость осторожно выпаривают, оставшийся ropMoH paCTBO
ряют в фосфатном буфере с рН 7,4. Радиоактивность полу
ченноrо ра,створа проверяют с помощью проточноrо MeTaHO
Boro счетчика.
Пластинки rеля :инкубируют в растворе меченоrо эстроrе
на 24 28 ч при 4 ос или комнатной температуре.
После элюирования пластинку высушивают, пок'рывают
сверху пленкой для микрорадиоавтоrрафии и оставляют ДЛЯ
мноrОДневной (8 37 дней) экспозиции.
Преципитаты, в которых оодержатся белки, связываю
щие эстроrен, дают на проявленной .пленке характерное ПО
чернение (рис. 29).
. ,
Анализ ,UМ.Щ}ННblХ nреципитатов веелях 75
8.4. АНАЛИЗ ИММУННЫХ ПРЕЦИПИТАТОВ
ПУТЕМ ОПРЕДЕЛЕНИЯ
ЭЛЕКТРОФОРЕТИЧЕСКОй ПОДВИЖНОСТИ
8.4.1. Принцип
Иммунные преципитаты или, точнее, содержащиеся в них
антиrены можно идентифицировать IПО относительной по-
движности при иммуноэлеК1'рофорезе. Ра:сстояние, проходи-
МОе данным бел.КIQМ в rеле, зависит от электрокинетическоrо
потенциала и от эндоосмотическоrо потока. Поэтому при pac
'.... АХ I
I I
I AlJ I
I
А t т Jg G
,/1
Рис. 30. Определение электрофоретической подвижности с помощью имму-
ноэлектрофореза [2]. А альбумин; Т трансферрин; Л лунка для
антиrена (исследуемой сыворотки); К канавка для антисыворотки; АВ
расстояние между вершинами дуr А и Т, АХ расстояние между вершина-
ми дуr А и IgG.
чете электрофоретичеСIЮЙ Подвижности к фактически 'прой-
денному белком пути нужно прибавить расстояние, пройден
ное под влиянием электроосмоса. Можно вообще не ОП'Реде
лять нулевой точки электроосмоса для изучаемоrо белка, ес-
ли на той же пла,стИнке вместе с ним миrрируют 'Но крайней
мере два белка с известной электрофоретической подвиж-
ностью. В этом случае подвижность исследуемor'о .белка рас-
считывают ,по формуле [2]:
АХ
/J ===и ( и и b)
"'"'Х а а АВ '
rде их Подвижность исс леду емоrо белка, и а и иь подвиж-
ности известных белков, АХ расстояние между белками с
известной и неиз,вестной подвижностью и АВ расстояние
между белка,ми с известной подвижностью (рис. 30).
В качестве референс-белков для определения подвижно-
сти при иммуноэлектрофорезе можно иСПОльзовать сыворо-
точный альбумин и трансферрин человека, абсолютная по-
76 В. Штраубе, Б. Клауш, Р. Хоф.ман
ДВИЖНОСТЬ которых при свободном электрофорезе при рН 8,6
равна соответственно 6,1.10 5 см 2 B l ceK l и 3,1 Х
Х 1 0 5 см 2 B l ceK l.
8.4.2. Проведение анализа и расчет
Иммуноэлектрофорез и окрашивание преципитатов про
водят обычным образом.
Расстояния, пройденные белками, измеряют по вершинам
дуr преципитации примерно так, как показано на рис. 30.
Если иммуноэлектрофорез проведен в микромодификации,
измерения лучше делать на увеличенном изображении им-
муноэлектрофореrраммы. При этом удобно использовать фо
тоувеличитель или прибор для чтения микрофильмов.
Определение подвижности белков по иммуноэлектрофо
perpaMMe обычно удается без затруднений. Однако в случае
иммуноэлектрофореrрамм с плоскими дуrами преципитации
и нечетко выраженными вершинами бывает нелеrко получить
воспроизводимые данные.
8.5.
ФотоrРАФИРОВАНИЕ
ИММУННЫХ ПРЕЦИПИТАТОВ В rЕЛЕ
8.5.1.
Общие замечания
Фотоrрафирование иммунных преципитатов бывает необ
ходимым и для документации опытов, и для подrотовки ил
люстраций, и для изучения последовательных этапов преци
питации в rеле. Фотоrрафировать можно как окрашенные,
так инеокрашенные преципитаты. Радиоиммунохимический
анализ, описанный в разд. 8.3, также можно рассматривать
как особый случай фотоrрафии.
Для съемки иммунных преципитатов в принципе приrод
на самая обычная фотоrрафическая техника. Здесь мы pac
смотрим только один метод, при котором можно обойтись
простыми средствами, даже без фотокамеры.
8.5.2. Материалы и приборы
Фотобумаrа ВН 1 или ВЕН 1; крепкий проявитель для
бумаrи Е 103 (УЕВ Filmfabrik, Вольфен, [ДР); фиксаж; фо
тоувеличитель.
8.5.3. Методика
Влажные неокрашенные препараты лучше Bcero снимать
в условиях TeMHoro поля [2]. Окрашенные препараты можно
фотоrрафировать более простым способом (рис. 31). Время
Анализ 'UJrfJtYIiHbtX лрециnитатов iВ еелях 77
экспозиции определяют предварительно в зависимости от ви-
да препаратов, типа фотоувеличителя, чувствительности бу-
маrи и нужноrо увеличения. На снимке получаются неrатив-
ные изображения преципитатов светлые на темном фоне.
Прuмечанuе. На фотоrрафиях, предназначенных для пуб-
ликации, изображения лунок и канавок рекомендуется закра
/ \
/ \
I \
/ \
r-
I I
I I
\ /
\ I
\ /
l/аЩКtl Летрu
илu
лреiJметное
стек.по
.
'РотОО!lма2а
.!
I \
I \
I \
I \
I \
I \
I \
I \
I \
I \
I \
I \
I \
I \
,-
Рис. 31. Прямое фотоrрафирование
иммунных преципитатов [1].
шивать черной тушью или заклеивать кусочками черной
бумаrи. Обозначения проще Bcero делать на самих фотоrра-
фиях в виде леrко стираемых надписей.
8.6. ЛИТЕРАТУРА
1. LaboratoriumsbUitter (Behringwerke), No. 3, 1969.
2. Backhausz R., Immunodiffusion und Immunoelectrophorese, Jena, 1967.
3. Williaтs С. А., Chase М. W. (Hrsg.), Methods in immunology and immu-
nochemistry. Vol. 111. Reactions of antibodies with soluble antigens, New
York London, 1971.
4. Frieтel Н., Experimentelle Untersuchungen zur immunchemischen Analytik
der Organproteine von Pankreas, Herzmuske! und Gehirn des Menschen,
Habil.-Schrift, Rostock, 1969.
5. Bienengriiber V., Feldheiт М.-Е., Frieтel Н., Brock J., Beitrage zur Anti-
gen- und Antik6rperanalyse. IV. Gelelektrophorese: Nachweis von Enzy-
mеп und Isoenzymen, Wiss. Z. Univ. Rostock, Math.-Nat. Reihe, 18, 631
638 (1969).
6. Cawley L. Р., Electrophoresis and immunoelectrophoresis, Boston, 1969.
7. Hofтann R., Schulze Н.-А., Straube W., Кlausch В., Immunchemische Un-
tersuchungen zum ProbIem der «pregnancy zone». УII. Radioimmunologi-
sche Untersuchungen zur Аffiпшit des Proteins der Schwangerschaftszone
fur Ostrogene in vitro, Arch. Gyn1:ik., 213, 86 92 (1972).
:9. Встречный электрофорез
(электросинерез)
к вильме, Б. RЛАУШ, в. ШТРАУБЕ,
Р.ХОФМАН,П.ЛИННЕRЕ
9.1. ПРИНЦИП
При встречном электрофорезе образование иммунных
преципитатов в поддерживающей среде происходит в резуль-
тате миrрации антиrенов и антител навстречу друr друrу под
действием электрическоrо поля. Этим встречный электрофо-
рез отличается от двойной диффузии по Ухтерлони, при ко-
торой компоненты реакции свободно диффундируют во всех
направлениях. Молекулы разных белков блаrодаря их амфо-
терности и различиям в аминокислотном составе обладают
различным зарядом и поэтому движутся при электрофорезе
в ще.l0ЧНОМ буфере не только с разной скоростью, но и в
разных направлениях (одни к аноду, друrие к катоду).
Если данный антиrен и преципитирующие антитела к не-
му движутся к разным полюсам, их можно внести в две лун-
ки и заставить миrрировать навстречу друr друrу в rеле ara-
ра или аrарозы, а также на ацетат-целлюлозной мембране.
Относительно быстро оба участника реакции сконцентриру-
ются между лунками, и произойдет преципитация.
При встречном электрофорезе можно выявлять и иденти-
фицировать только такие антиrены, которые отличаются по
подвижности от иммуноrлобулинов и к которым имеется пре-
ципитирующая антисыворотка. Антиrены и антитела либо
миrрируют навстречу друr друrу, либо движутся в одном
направлении, но с разной скоростью.
Принцип электросинереза [1], или встречноrо электрофо-
реза [2}, в 1969 r. использовали Бедарида и сотр. [3] для
выявления австралийскоrо антиrена (антиrена сывороточно-
ro rепатита). Модификации этоrо метода получили в рабо-
тах друrих авторов самые различные названия: иммуноэлек-
тродиффузия [4], контр-иммуноэлектрофорез [5], иммуно-
электроосмофорез [6], встречный (<<cross-over»-) электрофо-
рез [7], иммунопреципитационный электрофорез [8] 1. Метод
выявления а,1-фетопротеина, предложенный в 1970 r. Коном
[9], также основан на принципе электросинереза.
а,l-Фетопротеин и миrрирующий в а2-0бласти австралий-
ский антиrен при электрофорезе движутся к аноду, тоrда как
соответствующие антитела, подобно всем иммуноrлобулинам,
1 Еще ОДИН СИНОНИМ противоточный электрофорез. П рим. перев.
9. Встречный электрофорез (элвктросинерез) 7!1
в щелочной среде направляются к катоду; встретившись,
участники реакции дают четкие линии преципитации. Для
выявления этих антиrенов, разумеется, нужны моноспецифи
ческие антисыворотки. Неизбежной помехой для миrрации
антител при электрофорезе является электроэндоосмос
медленное перетекание буфера к катоду из-за положитель
Horo заряда молекул воды, прилеrающих к поверхности ча
стиц твердой фазы. Электроэндоосмос может не только за
медлить миrрацию, но и изменить ее направление. Интенсив
ность электроэндоосмоса существенно различается при ис
пользовании различных поддерживающих сред.
9.2. ВЫЯВЛЕНИЕ АВСТР АЛИйскоrо АНТИfЕНА
9.2.1. PeareHTbI и приборы
Анализ можно проводить в любом приборе для электро
фореза, блок питания KOTOporO имеет на выходе реrулируе
мое напряжение до 300 В. Обычно эти приборы применяются
и для обычноrо иммуноэлектрофореза. Кроме Toro, нужны:
предметные стекла или друrие ПОДХОДЯЩИе стеклянные пла-
стинки; arap (например, Difco Agar-Noble) или аrароза;
инъекциОнные иrлы с ровным концом для вырезания лунок
в rеле; водоструйный насос; влажная камера; антисыворотка
к австралийскому антиrену (например, выпускаемая Institut
fiir Impfstoffe, Дессау, rдр).
Состав буферных растворов:
А
9,75 r
или
Б
8,142 r
Барбитал-натрий
Ацетат натрия
(3 Н 2 О)
0,1 н. раствор
HCl
Дистиллирован
ная вода до
6,47 r
60 мл
6,476 r
90 мл
2000 мл
рН 8,6; f1 0,05
1000 мл
рН 8,3 8,4; f1 0,1
9.2.2. Приrотовление rеШI
Расплавляют 1,5 r arapa или аrарозы в 100 мл барбитал
ацетатноrо буфера с рН 8,2 8,6, подоrревая на водяной ба-
не. В качестве консерванта можно прибавить 2 мл 1 % -Horo
раствора тиомерсала (мертиолята). Чистую стеклянную пла
стинку нужноrо формата слеrка подоrревают, а затем зали
вают слоем золя из расчета 0,15 мл на 1 см 2 . Для затверде
во к. Виль,не и др.
ния rеля пластинки Оставляют во влажной камере. Затем
при помощи иr ЛЫ, соединенной с водоструйным насосом, в [e
.1е вырезают лунки диаметром около 3 мм, располаrая их
попарно. Если требуется выявить не только австралийский
антиrен, но и антитела к нему, то лунки располаrают по три
одну за друrой на расстояниях около 7 мм по направле
нию электрофореза (рис. 32). В парные лунки с катодной
" " о о о о О О О О О О
< о с с о
О О О О О О
о с с о
се " о с ? с ? о о о о о
r
1 , 1
А Б lJ А б
+
/(атоа AnorJ
Рис. 32. Схема расположения лунок при выявлении австралийскоrо антиrена
или соответствующих антител с помощью встречноrо электрофореза. А
лунки Д.'Iя аитиrена (образцов исследуемоrо материала); Б лунки для
антисыворотки; В лунки для сыворотки, заведомо содержащей австра-
лийский антиrен.
стороны вносят примерно по 10 мкл исследуемой сыворотки,
а с анодной такой же объем антисыворотки к австралий-
скому антиrену.
9.2.3. Проведение электрофореза
Электрофоретическую камеру заполняют барбитал-ацетат-
ным буфером. Пластинку rеля укладывают в соответствии
с расположением полюсов. Цепь замыкают полосками филь-
тровальной бумаrи, смоченной буфером. Электрофорез обыч-
но продолжается около 3 ч при напряжении 200 В (пример-
но 3 4 мА на каждый сантиметр ширины пластинки). При
положительной реакции между лунками возникают линии
преципитации, отчетливо видимые после непродолжительноrо
отмывания пластинки. В arapoBoM rеле преципитаты распо-
лаrаются ближе к лунке с антиrеном, а в rеле аrарозы
точно посередине между лунками с антиrеном и с антисы-
вороткой (рис. 33).
9.2.4. Оценка результатов
Лучше Bcero учитывать результаты встречноrо электрофо-
реза под лупой при косом освещении на темном фоне. Реак-
ция считается положительной, если исследуемый и конт-
рольный образцы дают с антисывороткой примерно одина-
9. Встрсчный электрофорез (электросuнерез)
81
'". . "'';
:j.. \
..
i
r:
:\
2':
, "
;: . '".
_"" ?',;"
.Н", У'"
' .;. (,?,
: ,;.-
"' ,
;.
/Т "
Рис. 33. ПреЦИПlпаты, образованные австралийским антиrеном со специ-
фическими аНТl1те.lа!\ш (си.'lЬно увеличено).
ковые преципитаты. При недостаточно четких преципитатах
или сомнительной картине следует ПОВТОРИТЬ ана.1ИЗ, сделав
несколько разведений исследуемоrо образца или антисыво-
ротки, чтобы избежать феномена прозоны.
Едва за Iетные преципитаты можно сдедать отчетливыми,
поrрузив хорошо отмытую пластинку rеля на 10 мин в
1 % ный раствор таннина.
Окрашивание (амида-черным 10В Ш1И азокармином)
обычно мало помоrает при учете результатов. Расположение
преципитатов между лунками зависит от природы rеля и от
концентрации антиrена и антител. В rеле аrарозы преципи-
таты возникают почти посередине между .пунками. В arapo-
вам rеле антитела быстрее миrрируют к катоду, поэтому ли-
Еии преципитации сдвиrаются к лунке с антиrеном.
Для выявления антиrена удобнее иСпользовать rель ara-
розы, а для выявления антител лучше подходит arap. На
arapOBbIX пластинках, особенно при низкой концентрации ис
следуемоrо антиrена и мутной антисыворотке, можно вооб
ще не заметить преципитаты, которые образуются прямо в
антиrенной лунке.
Источником ошибок может стать также сама Д.,'IИтель
Насть электрофореза. Так, незаконченный электрофорез дает
.лОЖные отрицательные, а слишком долrий (при трехлуноч-
6 840
82 К. Вильме и др.
ной методике) ложные положительные результаты. Поэто
МУ время электрофореза следует точно установить в предва
рительном опыте с контрольными реаrентами.
Очень свежие или, наоборот, долrо хранившиеся образцы
исследуемых сывороток MorYT давать неспецифические преци-,
питаты в виде слабых диффузных полос. Однако опытный ис-
.следователь без труда отличит их от истинных преципитатов.
При меняя референс-сыворотки с известным титром и aЦa
JШЗИРУЯ ряд последовательных разведений исследуемоrо об-
разца, можно количественно измерить концентрацию антиrе
на и активность антисыворотки.
9.2.5.
Общая характеристика метода
Встречный электрофорез примерно так же, как и ДI30Й
ная диффузия по Ухтерлони, приrоден для выявления aBCTpa
лийскоrо антиrена в практических лабораториях и столь же
специфичен [8], но имеет два существенных преимущества:
1) ero чувствительность примерно в 1 О раз выше, поэто-
му он дает ВОЗ:'vroжность выявлять даже «слабых» носителей
австралийскоrо антиrена, не выявляемых двойной иммуно
диффузией;
2) при встречном электрофорезе результаты можно учи
тывать уже через 2 3 ч, Тоrда как при двойной иммунодиф-
фузии предварительные данные получаются не ранее чем че
рез 24 Ч, а окончательные только через 48 ч.
Разработано несколько вариантов встречноrо электрофо
реза, позволяющих проще и быстрее выявлять австралийский
антиrен. В частности, анализ становится проще при исполь
зовании в качестве поддерживающей среды ацетат-целлюлоз-
ной мембраны [1 О], а ero продолжительность сокращаетсSl
при высоковольтном электрофорезе [11]1 или при уменьшении
расстояния между лунками. Однако подобноrо рода микро-
модификации существенно не увеличивают чувствите,,1ЬНОСТь.
реакции. Проrреванием исследуемых сывороток в течение
30 мин при 50 ос удается освободить замаскированный ав-
стралийский антиrен и тем самым увеличить частоту поло-
жительных реакций.
Не следует забывать, что встречный электрофорез как Ie
тод выявления австралийскоrо антиrена менее чувствителен.
чем некоторые друrие используемые для этоЙ цели метоДЫ.
Так, например, HaMHoro более чувствительны реакция связы-
вания комплемента, реакция пассивной rемаrrлютинации и
радиоиммунный анализ. Правда, эти методы слишком TPYДO
емки для повседнеI3ноrо применения в практических лзбора
ториях.
9. Встречный электрофорез (электросuнерез) 83
ВстречныЙ электрофорез позволяет быстро проводить ка-
чественное и полуколичественное определение австралийско-
ro аНТllrеиа. В настоящее время он является методом вы-
бора в каждоЙ лаборатории, которая проводит массовое вы-
ЯВ.1еНIIе этоrо антиrена и соответствующих антител. В качест-
ве более чувствительноrо метода для массовых обследований
.следует иметь в виду реакцию латекс-аrrлютинации.
'9.3. ВЫЯВЛЕНИЕ аl ФЕТОПРОТЕИНА
С помощью ВСТРЕчноrо ЭЛЕКТРОФОРЕЗА
'9.3.1. Приборы и реаl'епты
Исследования можно проводить в любой электрофорети-
ческой камере, имеющей блок питания с реrулируемым на-
пряжением на выходе, например в той, которая используется
для иммуноэлектрофореза (прибор FK 66, изrотовляемый B
Ростоке, [ДР [12], или при бор Д,lЯ электрофореза VEB Carl
Zeiss, Иена, [ДР [13]).
Применяются предметные стекла или стеклянные пла-
<:тинки иной формы (например, диапозитивные фотопластин-
А н о iJ
АНЛ7vсы50рОЛ7ХО
04' o
I I !
o:o\o .
I I I жuтеmтm
I I I контРО.l16
cl о {J 2
/(ат(10
Рис. 34. Схемы расположения лунок при встречном электрофорезе [14].
.Диаметр лунок для антисыворотки и положительноrо контроля 3 мм, для
антиrена (исследуемоrо материала) 3 или 6 мм. При расположении по
.схеме в или z лунки исследуемоrо материала вырезают на расстоянии 1
1,5 мм от лунок ПО.'lOжительноrо контроля.
L
5м-и
т
ки 8х8 см), а также ацетат-целлюлозные мембраны (Sarto-
rius-Membranfilter GmbH, ФРr). Можно использовать любой
arap хорошеrо качества. Аrароза не дает каких-либо преиму-
ществ. Лунки в rеле на стеклах проще Bcero вырезать по
шаблону (рис. 34), предложенному Коном [14], с помощью
штампов, входящих в комплект прибора для иммуноэлектро-
фореза, изrотовляемоrо в Ростоке, либо имеющимися в про-
о.
84 К. Вu.1ЬЛiС и др.
даже полыми трубочками. Кроме Toro, нужны: влажные Ka
меры; фильтровальная бумаrа; антисыворотка к (kфетопро
теину (Behringwerke AG, ФРr). в ближайшее время такую
антисыворотку будет выпускать Institut fur Impfstoffe, Дec
сау, [ДР. Состав буферноrо раствора решающеrо значениЯ'
не имеет. Мы применяем барбитал-ацетатный буфер с рН 8,6-
(см. 9.2.1, раствор А), обычно используемый для иммуно ,
электрофореза.
9.3.2.
Встречный электрофорез
в arapOBOM rеле
На предметные стекла слоем толщиной около 1 мм HaHO
сят забуференный 1,5% ный аrаровый золь, приrотовленный:
точно так же, как для иммуноэлектрофореза (см. 9.2.2). За
тем вырезают одну за друrой две rруппы лунок (рис. 34)
н удаляют вырезанный rель. Лунки до краев заполняют co
ответствующими реаrентами с катодной стороны вносят'
сыворотку больноrо, с анодной антисыворотку. При исполь
зовании стандартных штампов, изrотовляемых в Ростоке, по
лучаются ,пунки объемом 1 О и 30 мкл. Во всех случаях с не-
ясной картиной преципитации мы предпочитаем располаrать
лунки по схемам в или z (рис. 34), в которых предусмотрен
положительный контроль. Кроме Toro, можно не вводить по-
ложительный контроль, а обе антиrенные лунки разноrо раз-
мера в схеме в заполнить исследуемым материалом; это'
ПОЗВО"lяет даже при массовых обследованиях избежать фено-
мена прозоны.
После заполнения лунок пластинки помещают в электро
форетическую камеру в соответствии с выбранным направле
ни ем электрофореза и замыкают цепь полосками филыро
вальной бумаrи, смоченными буфером. Эти полоски должны
примерно на 1 см покрывать rель в местах контакта. При
напряжении 150 В (токе около 3 мА на 1 см ширины пла-
стинки) электрофорез продолжается 60 мин.
Более продолжительный электрофорез может быть при
чиной ложных отрицательных результатов: при высокой KOH
центрации аt-фетопротеина в исследуемой пробе и особенно
при низкотитражной антисыворотке избыток антиrена pac
творяет иммунные преципитаты.
После окончания электрофореза пластинки rеля рассмат-
ривают при косом освещении на темном фоне, отмечая ЛИНIIИ
преципитации. После предварительноrо осмотра и зарисовки
производят, особенно при неясной картине, элюирование, вы-
сушивание и окрашивание электрофореrраммы (как при lI t-
9. Встречный электрофорез (электросuнерез) 85
муноэлектрофорезе). Окрашивание, в особенности ниrрози
ном, несомненно, повышает чувствительность метода и значи
тельно облеrчает оценку результатов. Реакция считается по
ЛОЖlIтельноЙ, если с сывороткой, заведомо содержащей
щ-фетопротеин (положительный контроль), получен точно
такой же преЦlIпитат (рис. 35).
Встречный электрофорез можно проводить также с по-
мощью цейссовскоrо комплекта приборов. Используют Ma
+
е
>:(-' I
»!.
::/ -. ,.'
Ф ""' . ""
'.
;. ..
"."
О:'
,. <.
"
ti::
...
, <'iL' ';'
"" ""-1
;.. :,. -' '7 ." r ,
'Ь
"
""""""
""""' э ' '
; ,
'"..о:-- .
П.
;';","
..
:jи."..
ф
tJlt\ . ::' ...}, ".)} .
tw",':
," <? - ._.-. ,: .:....
..:;
"
;
.
.(
1
..J
се , , , :, ",
"'. :,,: ;.:,;;. .; ,....tJ . "'_
Рис. 35. Встречный электрофорез в arapoBoM rеле (при бор для Э..1ектрофо-
реза, изrОТОБ.1JенныЙ в Ростоке, rдр): а антисыворотка к аl-фетопротеи-
ну; Ь сыворотка пуповинной крови; с сыворотка, содержащая аl фето.
протеин.
лую приставку для электрофореза в arapoBoM rеле. В барби
тал ацетатном буфере с рН 8,6 при напряжении 85 В Э.lеКт-
рофорез продолжается 70 мин. Поскольку моноспецифиче-
ские антисыворотки, приrотовленные из rипериммунныл, мо-
rYT иноrда давать побочные линии преципитации, неоБХОДИМ9
идентифицировать выявленный антиrен с референс реаrен-
том, содержащим U1-фетопротеин. Кроме Toro, чтобы избе-
жать ошибок, рекомендуется анализировать каждый обра-
зец сыворотки с несколькими антисыворотками раЗ.1lIчноrо
производства.
86 К. Ви.2Ь.ItС и др.
9.3.3. Встречный элеRтрофорез
на ацетат целлюлозной мембране
... у добн е Bcero воsпользова ться цеиссовским прибором с
неоольшои приставкои для электрофореза на мембране.
Ацетат це.'IЛЮ.IIOЗНУЮ мембрану, смоченную буферным рас-
твором, ВК.1адывают между листами фильтровальной бумаrи
для удаления избытка влаrи. Затем под мембрану подклады
вают три С.10Я фильтровальной бумаrи и, осторожно надав-
Рис. 36. Встречный электрофорез на ацетат целлюлозной мембране (при-
бор для электрофореза фирмы Zeiss): а антисыворотка к аl-фетопротеи-
ну; Ь сыворотка пуповинной крови; с сыворотка, содержащая аl-фе-
топротеин; d сыворотка, не содержащая аl-фетопротеина.
ливая штампом, делают на ней оттиск одноrо из изображен
ных на рис. 34 профилей. Штамп в данном случае служит не
для вырезания, а для тиснения лунок на мембране. На по-
лоске мембраны шириной 20 25 мм можно расположить од-
ну за друrой две rруппы лунок. После тиснения полоску пе-
реворачивают и в образовавшиеся уrлубления вносят по
5 мкл антисыворотки и антиrена. Сделанные оттиски хоро-
шо сохраняются при последующей обработке электрофоре-
rpaMMbI и помоrают верно определить положение полос пре-
ципитации. При напряжении 100 В электрофорез длится все-
ro лишь 20 мин. На белом фоне мембраны полосы преципи-
тации сразу не видны. Чтобы их выявить, электрофореrрам-
9. Встречный электрофорез (электросинерез) 87
му пинцетом извлекают из камеры, 15 мин элюируют В про-
точной водопроводной воде, а затем окрашивают амидо чер-
ным 10В или ниrрозином. Окрашивание и последующее
обесцвечивание фона продолжается примерно 15 мин. Bcero
для получения rотовой электрофореrраммы (рис. 36) Tpe
буется не более 1 ч. Быстрота, ничтожные затраты peareH
тов (на каждый анализ затрачивается не более 5 мкл анти
сыворотки) и возможность использовать ацетат-целлюлозную
мембрану сразу без каКОЙ JIибо подrотовки позволяют peKO
мендовать именно этот метод для массовых обследований.
Если взять мембрану соответствующеrо размера и сделать
лунки по схеме а или б (рис. 34), то с одним общим по:IO
жительным и отрицательным контролем можно одновремен-
но исследовать до 25 сывороток.
9.3.4. Общая оценКа встречноl'О электрофореза
IШК меТОДа вылвленил
аl-фетопротеина
Иммунолоrические методы определения щ-фетопротепна,
основанные на реакции преципитации, особенно встречный
электрофорез, позволяют диаrностировать первичные карци
номы печени и злокачественные тератобластомы, а также
ориентировочно контролировать успешность хирурrическоrо
удаления опухолей, содержащих этот антиrен [15, 16]. Мето-
ды иммунодиффузии выявляют а1-фетопротеин уже при кон-
центрации около 1 Mr на 100 мл сыворотки. Встречный элек-
трофорез в l,5 3 раза более чувствителен [15] и выявляет
тот же белок при минимальной концентрации 0,36 Mr в
100 мл сыворотки. Можно еще больше повысить чувствитель-
ность этоrо метода, если окрасить электрофореrрамму ниrро-
зином или использовать флуоресцирующие антитела [14].
Кроме чувствительности, встречный электрофорез отличается
от иммунодиффузии быстротой. Частота выявления а1-фето-
протеина по данным разных авторов широко варьирует. С по
мощью микромодификаций двойной иммунодиффУЗИIl ero
выявляют в сыворотках примерно 50 70% больных первич-
ным раком печени и у 20% взрослых и 70% детей, имеющих
злокачественные тератобластомы. Более чувствительный
встречный электрофорез позволяет обнаружить U1-фетопроте-
ин у 80% больных первичным раком печени. Частота «J10Ж
ных» положительных результатов в реакциях иммунодиффу-
зии составляет менее 1 % у взрослых при раке внепеченочной
локализации (rлавным образом с метастазами в печень),
менее 0,5% при доброкачественных заболеваниях печени и
1 2% при беременности. Общая частота «ложных» положи-
88 К ВlIДЫСС и др.
тельных реакций при использовании встречноrо электрофо-
реза достиrает 3 % [15]. Ввиду относительно низкой чувст-
вительности реакции преципитации основанные на ней мето-
ды опреде.1ения аl фетопротеина весьма специфичны при диа-
rностике первичноrо рака печени и тератобластом, но не ra-
рантируют выявления всех случаев. Отрицательный резуль-
тат реакции преципитации не исключает полностью рака
печени. Однако, применяя более чувствительные методы
радиоавтоrрафию, пассивную rемаrrлютинацию и прежде
Bcero радиоиммунный анализ, можно добиться положи
тельных результатов во всех случаях rепатом и, что наибо-
лее ценно, при начинающемся злокачественном перерожде-
нии. Эти методы выявляют аl-фетопротеин при раке любой
локализации да)ке без метастазов в печень, однако для Ha
чинающеrося первичноrо рака печени характерно не просто
присутствие аl-фетопротеина, а медленное возрастание тит-
ров в период наблюдения. Эффективность лекарственноrо
или хирурrическоrо лечения опухолей в тех случаях, коrда
концентрация аl фетопротеина превышает 1 Mr на 100 мл
сыворотки, можно контролировать путем ero количественноrо
определения с помощью радиальной иммунодиффузии по
Манчини или электроиммунодиффузии по Лореллу. В на-
стоящее время для повседневных анализов и массовых об
слеДований в практических лабораториях рекомендуется при-
менять методы ка чественноrо выявления Ctl-фетопротеина в
реакциях преципитации и прежде Bcero встречный электро-
форез. Более чувствительные методы определения этоrо ан-
тиrена пока еще доступны только специализированным ла-
бораториям.
9.4. ЛИТЕРА ТУРА
1. Bussard А., Description d'une technique combinant simultanement l'eIec
trophorese et la precipitation immunologique dans ип gel: l'electrosynere-
se, Biochim. Вiophys. Acta, 34, 258 (1959).
2. Laпg N., Наап J., Nachweis prazipitierender Antik6rper und nichtprazi-
pitierender Antik6rper durch Oberwanderungselektrophorese, Int. Arch.
Allergy, 10, 305 (1957).
3. Bedarida а" Triпchieri а., СатЬопата А., ТЬе detection of Australia anti-
gen and anti-Au antibodies Ьу а rapid procedure соmЫпiпg electrophore-
sis and immunoprecipitation, Haematologica, 54, 591 (1969).
4. Dyquesпoy R. J., Becker а. А., Rapid sсrеепiпg for hepatitis antigen Ьу
immunoelectrodiffusion using paper discs, Тrапsfusiоп, 10, 221 (1970).
5. Gocke D. J., Howe С., Rapid detection of Australia antigen Ьу counterim
munoelectrophoresis, J. Immunol., 104, 1031 (1970).
6. Priпce А. М., Burke К, Serum hepatitis antigen (SH): Rapid detection Ьу
high voltage immunoelectroosmophoresis. Science, 169, 593 (1970).
7. Peseпdorfer F., Krassnitzky О., Wewalka F., Immunoelektrophoretischer
Nachweis von «Hepatitis associated antigen» (Au-SH-antigen), Кliп.
Wschr., 48, 58 (1970).
9. Встречный электрофорез (электросuнерез) 89
8. Geserick О., Das Australia-Antigen (Аu/SН/НАА): Sero!ogische Unter-
suchungcn zu Nachweismethodik, Vorkommen, Eigenschaften und Bedeu-
tung des Antigens, Promotion-B-Schrift, Berlin. 1972.
9. J(ohп J., Method for the detection and identification of al-fetoprotein in
serum, J. Сliп. Path.. 23, 733 (1970).
10. Vergaпi С., Crossover elektrophoresis for the rapid detection of serum
hepatitis (Аи) antigen and antibody, J. clin. Path., 24, 86 (1971).
11. Fraпk К-Н., Reimanп W., Schneller, empfindlicher N achweis des Au/SH-
Antigens mittels Mikroilberwanderungselektrophorese, Dtsch. Ges. wesen,
26, 1042 (1971).
12. Friemel Н., J(leist н., Behm Е., Beitrage zur Antigen- und Antik6rper-
Апаlуsе. 1. АпwепduпgsgеЫеtе der Rostocker Immuno-Ausrilstung FK 66,
Wiss Zschr. Uпiv. Rostock, 18, 611 (1969).
13. Schulze н., Тlach К. F., Ausrilstung fiir die Tragerelektrophorese-Geb-
rauchsanleitung, VEB Car! Zeiss Jena.
14. J(ohп J., AlphaI-Fеtорrоtеiп: Laborbestimmung uпd klinische Bedeutung,
Arzt!. Lab., 18,307 (1972).
15. Lehmaпп F.-G., Lehmann D., Vergleich verschiedener Methoden zum sero-
!ogischen Nachweis von aI-Fеtорrоtеiп im Serum, Z. klin. Chem. klin.
Вiocbem., 11, 339 (1973).
16. Liпneke Р., Ziems D.-E., J(lausch В., Straube W., Hofmanп R., Zur Metho-
dik des quaНtativen aI-Fеtорrоtеiп-Nасhwеisеs, Dtsch. Ges. wesen, 28,
1230 (1973).
10. Метод розеток
э. БЕМ
10.1. ПРИНЦИП
Некоторые клетки лиМ'фоидных opraHoB животных, имму-
низированных ксеноrенными эритроцитами, способны in vitro
фиксировать эти эритроциты a своей поверхности. Получа-
ются так называемые «розетки» 'с лейкоцитом в центре и при
липшими К нему эритроцитами [1, 2].
Клетку считают «образующей розетку» в том случае, если
на ее поверхности фиксировано не менее 5 чужеродных эрит-
роцитов [1]. Расположение эритроцитов может быть различ-
ным. Одни клетки окружены полным венчиком из эритроци-
тов, у друrих этот венчик имеет разрывы, третьи сплошь
покрыты эритроцитами (розетки в форме морулы), а у некото-
рых имеется даже по неСКОЛf>iКУ эритроцитных слоев. Встре-
чаются также полярные розетки, в которых эритроциты при-
креплены лишь на одном из полюсов клетки, а остальная ее
поверхность свободна (рис. 37).
Эритроциты прикрепляются к поверхности центральной
клетки блаrодаря особым рецепторам, без участия компле-
мента [3]. Такими рецепторами MorYT быть либо иммуноrло-
булиноподобные структуры на мембране Т -клеток, либо ис-
тинные иммуноrлобулины, связанные с поверхностью В-кле-
ток. Установлено, что оба вида иммунокомпетентных
лимфоидных клеток способны образовывать розетки [1, 4, 5] .
При морфолоrическом исследовании в центре розеток были
найдены малые лимфоциты, лимфобласты разной величины,
плазматические клетки и макрофаrи ([2,4 6] и собствен-
ные данные). Макрофа'rи MorYT связывать на своей поверх-
ности некоторые иммуноrлобулины (цитофильные антитела)
из окружающей жидкости и таким образом приобретать спо-
собность к образованию розеток [1, 7].
Методику подсчета таких розеток, называемых «прямы-
ми», описали в 1964 r. Цалыберт [8] и Нота с сотр. [9]. Для
иммунизации и для выявления розеткообразующих клеток
используют эритроциты одноrо и TO'ro же вида. Чаще Bcero
это ба'раньи эритроциты, но иН'оrда берут также клетки кур,
,rолубей и т. п. Для изучения иммунноrо ответа на раствори-
мые антиrены была разработана методика «непрямых , или
«пассивных , розеток[10 12], которые образуются при ин-
10. Метод розеток 91
кубации .1ИМФОИДНЫХ KJ1eTOK с эритроцитами, наrруженными
ИССJ1едуемым антиrеном.
В основу методики, описанной ниже, ,положен метод ЦаJ1Ь-
берrа [8] с тем ОТJ1ичием, что все ИССJ1едование проводят при
O 4 ос [13].
»
.(
("
,
'О
00
...r=- ' ;
, :-.
/'"' ."
. ,' )
't;1; '. ,О
(C; {
.o.
Q '--
С
r'
'"
\..-
"
. ,,; , .
"' ' '
<8 ,' ,,' , 'u:...,
'. ' " ',""- ""
, "
.
(\
о
r".
/?-'
О'
А
(/
1. .
("-,
"
Б
r
-r
U o
о
L.
о
о
°0
()
о
',\A "
Cl
,40/
о
00
с'
о
0 0 *0 , О
' \..F".' О
t ' ,
,....
<"0
".,.........
GC
or
::>
)O G ' '
rA
Рис. 37. Различные формы эритроцитарных розеток А венчик эритроци-
тов не замыкается BOKpyr центраJIЬНОЙ К.'Iетки; Б две расположенные
РЯДО\! лимфоидные КJJетки. из которых одна образует розетку; В розетка
в форме морулы; r полярная розетка.
10.2. ПРОВЕДЕНИЕ IIССЛЕДОВАНИЯ
10.2.1. Реаrеиты и приборы
Среда для КУJ1ьтивирования клеток Иrла или Пар кера;
0,15 М раствор NaCI; забуференный физиолоrический раствор
с рН 7,2, состоящий из 9 частей 0,15 М раствора NaCl и 1 ча-
92 Э. Бе. t
сти фосфатноrо буфера по Сёренсену (см. 3.2.1); стеклянные
пробирки 6х 1,5 см с плоским дном и пробiКОЙ (например, ап-
течные стаканчики для таблеток); rематокритная центрифу-
ra; камера для подсч,ета кпеток (наrпример, камера Бюр-
кера!) .
10.2.2. Последовательные этапы методики
Всю работу, за исключением подсчета розеток в камере,
проводят при температуре 0 4 ос (в ледяной бане). Приro-
товление суспензии клеток из лимфоидных ортанов описа,но
ниже в разделе «Методика локальноrо ,rемолиза» (см. 11.2).
Клетки трижды отмывают средой Иrла или Паркера и rOTO-
вят суспензию, содержащую 107 живых клеток в 1 мл. Эрит-
роциты также отмывают три раза 0,15М раствором NaCI или
забуференным физиолоrическим раствором и rотовЯ'т из них
5%-ную суспензию ('по rематокриту, т. е. около 109 клеток
в 1 мл).
Инкубация. 0,9 мл суапензии клеток исследуемоrо op,raHa
и 0,1 мл суопензии эритроцитов вносят 'в пробиrpку С плоским
дном, перемешивают и инкубируют примерно 16 ч (ночь) в
ледяной бане. После этоrо в пробирку вносят 4 мл охлажден-
ной кулыуральной среды (тем самым разбавляя суспензию в
5 раз) и осторожно, но тщательно перемешивают. Затем пи-
петкой с широким носиком отбирают ка'Плю суспензии и пе-
реносят в счетную камеру, накрывают покровным стеклом и
подсчитывают под микроскопом число розеток во всей KaMe
ре. Число розеткообразующих клеток можно указывать в рас-
чете ,на 106 или 103 клеток лимфоидноrо opraHa.
10.2.3.
Дополнительные замечания
Вместо среды для культуры клеток иноrда ,применяют со-
левые растворы, например раствор Хенкса. Величина рН во
время инкубации должна оставаться в пределах от 6,8 до 7,5.
При рН выше 8 число розеток уменьшается [14].
После однократной иммунизации мышей бараньими эрит-
роцитами в их 'селезенках из 106 клеток 104 и более образуют
розетки. При исследовании в динамике наблюдается два маК-
симума розеткообразующих клеток первый на 5-й 6-й
день, а второй примерно на 10 й день после иммунизаЦИJI
({18] и собственные данные). ,как правило, второй максимум
бывает ниже первоrо. После повторной иммунизации числО
1 В СССР вместо камеры Бюркера обычно пользуются камерой rоряе-
ва. Прuд перев.
10. Метод розеток 93
розеткообразующих клеток достиrает максимума уже на
4-й день и, превысИ'в величину, наблюдаемую при первичном
ответе, начинает медленно снижаться только на 10 й 14-й
день. у неиммунизИ'рованных мышей на 106 клеток селезенки
приходится до 500 клеток, абразующих розетки с бараньими
эритроцитами; это так называемая «фоновая» величина для
данноrо вида животных.
Ошибка метода при подсчете клеток, образующих розетКiИ,
Достиrает примерно 20%; ;при этом величина коэффициента
вариации в зависимости от используемых клеток может
колебаться от 0,5 до 1,0.
10.2.4. Варианты методики
Мноrие авторы инкубируют клетки ,при 37 ос, обычно 1 ч.
При повышенной температуре и особенно ,при KpaTKOBpeMeH
ной инкубации в центре розетки rораздо чаще, чем в опытах
на холоду, находят клетки, синтезирующие или, точнее, вы-
деляющие в окружающую среду антитела. Об этом свиде
тельствует, в частности, увеличение средних размеров розе-
ток при 37 0 с. Часто эритроциты покрывают центральную
клетку в несколько слоев, а в суспензии можно найти эритро-
цитарные аrrлютинаты без центральной клетки.
Нередко применяется также вариант методики, предло-
женный Мак Кон'Нелом и сотр. .[ 17]. После смешивания ис-
следуемых клеток с эритроцитами суспензию центрифуrируют
4 5 мин при 200 g. Образованию розеток способствует тес-
ный контакт между теми и друrими клетками на дне центри
фужной пробирки. Исследование тоже проводится при 4 ос.
10.3. ОБЩАЯ ХАРАRТЕРИСТИRА МЕТОДА
В настоящее время мноrие аопекты метадарозеток явля-
ются предметом дискуссии и нуждаются в дальнейшем изу-
чении. В частности, остается открытым вопрос об иммуноло
rических функциях клеток, образующих розетки. Какая попу-
, ЛЯЦl!Я клеток T или В клетки в основном участвует в
этой реак1ЦИИ? Какавы взаимоотношения между теми и дpy
rими? В какой мере макрофа'rи являются розеткообразующи-
ми клетками? Какова роль цитофилнных антител? Пытаясь
ответить ,на эти и друrие вопросы, разные авторы ,часто при-
водят противоречивые данные; отча,сти это обусловлено раз-
Личиями в ме'I10дике, в клеточном со,ставе исследуемых opra-
нов и д:руrими подобными причинами. Но, несмотря на это,
метод розеток все же считают специфическим и весьма чув-
ствительным методом изучения иммунноrо ответа [1,4,8,19].
94 Э. Бем
)
Он примерно в 10 раз чувствителЬ'нее локальноrо rемолиза в
rеле и потому дает более высокие фOJювые показатели. При
этом он менее трудоемок и не требует дороrих peareHToB. Ос-
новные затраты времени приходятся на микроскопию кле-
точной суспензии. При работе на холоду (по описанной выше
методике) участие макрофаrов в образовании розеток весьма
незначительно [20].
Описа,нные в этом разделе иммунные розетки следует от-
личать от так называемых опонтанных розеток (см. разд. 59).
которые образуют лимфоциты человека при инкубации с ба-
раньими эритроцитами. Считается, что в центре спонтанной
розетки находится Т-лимфоцит. rлавное отличие состоит в
том, что методика иммунных розеток позволяет охарактери-
зовать активный ответ экспериментальных живот,ных на им-
мунизацию ксеноrенными эритроцитами.
10.4. ЛИТЕР А ТУРА
1. Bach J. F., Biozzi А., Oreaves М. F., МсСоппеll 1., Micklem Н. S., Мбl-
ler Е., Zaalberg О. В., Summary of round tabIe discussion оп the techni-
саl aspects of the rosette test, Transp!ant. Proc., 4, 335 337 (1972).
2. Duffus W. Р. Н., Аиап D., The kinetics and morpho!ogy of the rosette-
forming cell response in the рорlitеа! !ymph nodes of rats, Immuno!ogy.
20, 345 361 (1971). .
3. Wilsoп J. D., The re!ationship of antibody-forming ce!!s to rosette-for-
ming ceIls, Immunology, 21, 233 245 (1971).
4, rрuневuч Ю. А. Структура и функция клеток, образующих розетки, Ж.,
N1икробиол. (Москва), 5, 114 118 (1973).
5. Thursh D. R., Emesoп Е. Е., Oiacomelli Р., Wieпer J., Ultrastructure and
radioautography of rosette forming ce!!s of norma! and immunized mice,
Cel1. Immuno!., 4, 218 227 (1972).
6, Elsoп С. J., Аиап D., Elsoп J., Duffus W. Р. Н., The re!ationship between
the morpho!ogy of rosette forming cells and their mode of rosette forma
tion. Immunology, 22, 291 300 (1972).
7. Berkeп А., Beпacerraf В., Properties of antibodies cytophilic for macro-
phages, J. Ехр. Med" 123, !19 I44 (1966).
8. Zaalberg О. В., А simp!e method for detecting sing!e antibody-forming
cells, Nature, 202, 1231 (1964).
9. Nota N. R., Liacopoulus Briot М., Stiffel С., Вiozzi А., L'immunocyto-
adherence: ипе methode simp!e et quantitative pour \'etude «in \'itro» des
ce!!u!es productrices d'anticorps, С. R. Acad. Sci. (Paris), 259, 1277
(1964) .
10. Cuппiпgham А. J., Smith J. В., Mercer Е. Н., Antibody formation Ьу sin-
gle ceIls from !ymph nodes and efferent !ymph of sheep, J. Ехр. Med.,
124, 70I 714 (1966).
11. Perrudet-Badoux А., Frei Р. С., Detection of antibodies оп blood !ympho-
cytes in drug hypersensitivity using а rosette technique. Iпtеrn. Arch. А!-
!ergy Арр!. Immuno!., 41, 149 I56 (1971).
12. Sulitzeaпu D., Haskill J. S., Rosette formation Ьу !ymphoid ce!ls of mice
immunized to HSA using SRBC sensitized with ап HSA-anti-SRBC conju-
gate, J. Immuno!. Methods, 2, 11 15 (1972).
13. Biozzi А., Biпaghi R. А., Stiffel С., Moutoп D., Production of different
c!asses of imunoglobuliпs Ьу individua! cells iп the guinea-pig, lmmuno-
!ogy, 16, 349 359 (1969).
10. Метод розеток 95
14. Bach J.-F., Dardeппe М., рН and rosette formation, Lancet, March, 18,
633 (1972).
15. Moav N., Harris Т. N., Rosette formation in relation to active synthesis of
antibody, J. Immun01., 105, 1501 1Ы1 (1970).
16. Gudat F. О., Harris Т. N., Harris S., Hummeler к., 5tudies оп antibody-
producing cells. 1. Ultrastructure of 195 and 75 antibody-producing cells,
J. Ехр. Med., 132, 448 474 (1970).
17. McCoппell 1., Muпro А., Gurner В. W., Coombs R. R. А., 5tudies оп acti-
vely alJergized cells. 1. The cyto-dynamics and morphology of rosette-for-
ming !ymph node cells in mice and inhibition of rosette-formation with
antibody to mouse immunog10bulins, Intern. Arch. Allergy, 35, 209 227
(1969) .
18. Biozzi О., Stiffel С., Moutoп D., Bouthillier У., Decreusefoпd С., А kinetic
study of antibody producing cells in the spleen of mice immunized intra-
venou51y with sheep erythrocyte5, Immunology, 14, 7 20 (1968).
19. Biozzi О., Stiffel С., Moutoп D., Liacopoulos-Briot М., Decreusefoпd С.,
Bouthillier У., Etude du рЫпотепе de l'immuno-cyto-adherence аи cours
de !'immuni5atioIl, Ann. In5t. Pasteur, 110, Suppl. No. 3, 7 32 (1966).
20. Liacopoulos Р., Couderc J., Вleиx С., Birrieп J. L., Bach J. F., Rosette-
forming cell and cytophilic antibody, Eur. J. Immunol., 3, 310 313 (1973).
11. Метод локальноrо rемолиза
в rеле
э. зиrль, э. БЕМ
11.1. ПРИНЦИП
eTOД локальноrо rемолиза применяется для выявления
клеток, образующих антитела. С ero помощью ожно изучать
различные аспекты образования аНТИтел отдельными клетка
и в больших клеточных популяциях.
Клетки для исследования получают из лимфоидных opra-
нов экспериментальных животных, иммунизированных чуже
родными эритроцита и, и суспендируют в золе a'rapa или
аfарозы вместе с эритроцитами, которыми проводили имму-
низацию. Полученную суспенз'ию тонким слоем распределяют
по ровной поверхнасти. При последующей инкубации из лим-
Фоид,ных клеток выделяются антитела, они диффундируют в
окружающий rель и фиксируются на находящихся побли-
зости эритроцитах. Добавление ком:племента вызывает им-
мунный rемолиз этих эритроцитов. BOKpyr клеток, обр азую-
щих антитела, возникают .прозрачные пятна, различимые не-
воору:женны r.'lазом на красновато-коричнево фоне rеля.
Эти пятна зоны rемолиза. В центре каждой зоны находит
ся клетка, образующая антитела к эритроцитам. Сосчитав
число таких зон, ожно определить число этих клеток. Зная
общее число внесенных в rель лимфоидных клеток, можно
рассчитать число клеток, образующих антитела, на 106 или
107 клеток исследуемоrо opraHa.
Изложенный принцип положен в основу так называемоrо
прямоrо метода [1, 2], при котором выявляются ,rлавным об-
разом клетки, образующие антитела 195 (IgM) с наиболее
высокой rе олитической активностью. Пря ой метод прак-
тически ,не позволяет выявить клетки, образующие антитела
75 (IgG), так как способность активировать комплемент и
вызывать rемолиз у этих антител значительно ниже. Такие
клетки выявляют с помощью .неПРЯМОfО метода [3, 4], на-
,слаивая на rель сначала антиrлобулиновую сыворотку (анти-
сыворотку к IgG), а затем комплемент.' Антиrлобутrновые
антитела комплексируются с а,нтиэритроцитарными 75-антИ
телами, и образующиеся комплексы активируют КОМП.1емеНТ
и вызывают rе олиз. Вычитая число зон, полученных пря
мым eTOДO , из числа зон, образовавшихся с антиrлобули-
новой сывороткой, можно определить количество клеток, об-
разующих 75-антитела.
11. Метод ЛОlCальноzо zемолиза б ееле 97
Разработаны также методы выявления клеток, образую
щих антитела к друrим антиrенам, в частности к антиrена
бактерий, сывороточным белкам и даже к [аптенам. Эти ме-
тоды объединяют под общим названием паССИвноrо "lокаль
Horo rемолиза. Исследуемым антиrеном наrружают эритро
диты, которые в данном случае итрают роль индикаторов.
Клетка, образующая специфические антитела, выделяет их
в rель; они диффундируют и связываются с !'.10лекулами
dнтиrена, раоположенными на поверхности эр,итроцитов. Обра-
зуются комплексы эритроцит антиrен антитело. В при
сутствии комплемента происходит лизис эритроцитов и воз-
никают зоны rемолиза. Вариа.нты прямото и непрямоrо пас
сивноrо локальноrо rемолиза также позволяют ВЫЯВЛЯТЬ>
клетки, образующие 19S и 7S-антитела. Разные модифика-
ции метода локальноrо rемолиза можно классифицировать.
не только по характеру исследуемых антиrенов, но и по yc.т:ro
виям, в которых происходит rемолиз (поддерживающая сре-
да, посуда или камеры для культивирования). Одна из та-
ких классификаций приведена в табл. 2.
Таблица 2. Обзор различных вариантов метода локальноео zе,\tолuза
Определяющий признак I
метода Варианты по Данному признаку
Название варианта
Класс антител, обра 1.
зуемых клетками
Клетки образуют
19S антитела
2, Клетки образуют
7S антитела
ИсследуемыЙ антиrен
1, Эритроциты
2, Растворимые антше
ны, наrруженные на
эритроциты
1. [ель (arap, аrароза)
Среда, в которой про
исходит rемолиз
2, [елеобразныЙ раствор
карбоксиметилцеллю-
лозы
З. Без rелеобразуюuщх
примесей
Посуда, камеры
1. Чашки Петри из CTe!{
,1а или пластика
2. Пред етные CTel(.la;
покровные стекла
3, Плоская стеклянная
камера
Прямой
НепрямоЙ
Прямой или непрямоЙ
ПассивныЙ, прямой И.1Jl
непрямой
ЛокальныЙ rемолиз в re-
ле; метод Джерна и
Нордина (Jеrпе, Nor-
diп. 1963)
Метод Инrрэма и БIOС-
сара (Iпgrаhаm, Bus.
sard, 1964)
Безrе.lевыЙ .'10l\альныи
rемолиз по Каннинrе.
му (Сuппiпghаm, 1965)
Макрометод JIOKa:lbHOro.
rемолиза
Микрометод лока,lьноrо'
rемолиза
Безrелевыi! мето.} ло-
Ka.'1bHOrO rе юлиза
7 840
98 Э. Зuzль, Э. Ее),!
11.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
11.2.1. Приборы и реаrеиты
Шприцы и тонкие инъекционные иrлы (N2 20) или мелкие
сеточки из дедероновой либо стальной нити; чашки Петри
Д'ИЮlетром 5 и 8 см; водяная баня на 47 49 ос.
Среды Д.1Я культуры клеток Иrла или Паркера (напри
-м p, выпускаемые Staatliches Institut fi.ir Immunpraparate und
N ahrmedlen, Берлин, r ДР); 0,1 % ный раствор трипановоrо
синеrо в 0,9% HOM растворе NaCl; очищен,ный arap (напри
мер, фирмы Oxoid Limited, Лондон); ДЭАЭ-декстран (Phar-
m cia, У сала, Швеция); очищенная аrароза (например,
Femchemle К-Н. КаШеs KG, Халле, r ДР); 10% -ная суспен
зия отмытых бараньих эритроцитов в 0,9% -ном растворе
NaCl.
Суспензию эритроцитов rотовят по rематокриту, опреде-
JIяе ..юму на rематокритной центрифуrе ТН 1 или ТН 12
\(Heinz Janetzky KG, Энrельсдорф Лейпциr, rдр). Источ
ником комплемента служит свежая ,сыворотка морской свин-
ки, разбавленная 1: 20 (по объему) средой Паркера или
Иr.1а.
Антисыворотка к 'У rлобулинам мыши.
11.2.2.
Прямой метод локальиоrо rемолиза
11.2.2.1 Иммунизация животных
При изучении ответа в центраЛDНЫХ opraHax иммунной
системы в селезенке, лимфатических узлах, костном мозrе
или тимусе антиrен, которым чаще Bcero бывают бараньи
эритроциты, вводят внутривенно или внутрибрюшинно. Для
внутривенных инъекций у мышей используется хвостовая, а у
кроликов ушная вена. При оценке ответа периферических
лимФоузлов бараньи эритроциты вводят подкожно или в<нут-
рикожно В соответствующую область оттока лимфы. Опти-
мальная доза при однократной иммунизации равна для мы-
ши примерно 2.108, для pыcы 109, а для КРОЛIfка 2.109 эри-
ТРОllИТОВ (при обоих способах введения).
Количество клеток, образующих антитела при внутривен-
ной и при внутрибрюшинной имму,низации, по нашим экспе-
риментальным данным, существенно не различается.
11.2.2.2 ПодrОТО8ка пижнеrо слоя ,теля
Дно чашек Петри диаметром 8 см заливают 'Слоем arapa,
расплавленноrо в среде Паркера с доба'вкой ДЭАЭ декстра-
на. Для этоrо rотовят 1,4%-ный (вос/объем) аrаровый золь
и прибавляют в Hero (1 Mr на 1 мл) ДЭАЭ декстран, ослаб-
.
11. Метод ЛОlCаЛЫiOiЮ zемолuза '6 zеле 99
ляющий антиком племен тарное действие arapa. Очищенный
arap плохо растворяется, поэтому целесообразно rотовить
золь в автоклаве (10 мин, 120 0 С), взяв на нужную навеску
arapa несколько меньший объем дистиллированной воды. Су-
хую среду Паркера и ДЭАЭ-декстран растворяют в недо-
стающем объеме воды и вносят в аrаровый золь после авто-
клавирования. Величину рН золя подводят до 7,4. В каждую
чашку Петри вливают по 3 4 мл золя. После затвердения
arapa чашки можно сохранять в холодильнике 2 3 дня.
Нижним слоем может также служить rель аrарозы без
добавки ДЭАЭ декстрана.
Перед нанесением BcpxHero слоя rеля чашки с нижним
слоем следует подоrреть до 37 0 с.
11.2.2.3.
Прпrотовленпе ;суспензиилимфопднЪIX клеток
Исследуемые лимфоидные opraHbI, например селезенку
или лимфатические узлы, измельчают на холоду в среде Пар-
кера в чашках Петри диаметром 5 см. Далее клеточную
взвесь несколько раз пропускают через тонкую инъекционную
иrлу (NQ 20) или фильтруют через тонкую дедероновую или
стальную сеточку. Применение сеточек упрощает процедуру,
если одновременно исследуются opraHbI большоrо числа жи-
вотных и если не нужен маRсимальный выход клеток. Если
же требуется получить взвесь максимальноrо числа к,аетоК
из данноrо opraHa, следует воспользоваться шприцем, так как
при этом способе потери будут меньше.
Суспендированные клетки дважды отмывают кулыураль-
ной средой, центрифуrируя при 350 g и 4 ОС, и rотовят взвесь
требуемой концентрации. Эту концентрацию нужно подобрать
'в предварительных опытах таким образом, чтобы на чашке
было примерно 200 300 зон rемолиза. rотовую взвесь кле-
ток следует как можно быстрее внести в золь BepxHero слоя:
она остается rодной не больше 1 ч после приrотовления.
Все процедуры вплоть до внесения клеток в золь BepxHero
слоя нужно проводить при 0 4 ос.
Пропорцию жизнеспособных клеток в исследуемой суспен
зии определяют при помощи трипановоrо синеrо, которыЙ O'K
рашивает поrибшие клетки в синий цвет.
11.2.2.4.
Прпrотовление BepxHero 'слоя rеля
И дальнейШИЙ ход !исследования
Золь аrарозы [0,7% (вес/объем) в среде Паркера-
с рН 7,4] разливают по 1 мл В пробирки И держат в водяной
бане при 47 490c. В каждую пробирку вносят по 0,1 .мл
10%-ной взвеси бараньих 'эритроцитов и 0,1 мл охлажденной
7*
100 Э. ЗllёЛЬ, Э. Ее.к
взвесп клеток ИСС.'Iедуемоrо opraHa. Содержимое пробирки
тотчас же перемешивают, выливают в заранее подоrретую
чашку с НИЖНЮ1 слоем rеля и равномерно раопределяют по
ero поверхности. Чашки следует расположить cTporo rори
З0нта.1ЬНО, чтобы верхний слой rеля повсюду был одинаковой
...............
... ....
". ,,. '"
'1* C о
«, .. .,.,'0 Q
,.. .. 1").... ' А О..
.. '" .' ....." "'. "..
,{'" е,,,, ... - ,, &t (). .
',.. :}"'}J.,. 1< и .
,f :.t;:;;. :::
$ 6t ."'" 'ь "'#«" ) --'
,*""'-i,.
"',.,.... . " . f/R . ' . "': y<;'._" ..
- ,. ""' ,.. - - ,...- QI'
"'(4<: "ei-,",, rt - .-
fI '., & (\...... ;., ...
.С I .. ...
" fI ".,.,«;. ) _', ..
- ,r ",.." """ O .
,. ; :;' . " . "'\': с
. /", 1'::> '9
{;
... "" ()
; с' '; :k . - "'" о-
O fJ ,, , v ...
t 'e tl ..., p"i
, v } .... -;_.. 0- "'" \ / JI ...
(. ... t < ,-- """ -, .. ...
- "". {." - v / (...V"';
J, ---eb v
->I$ 7
-. ........
-:. :-" .:. .# .. "'ос r.
,,,.- .. СА -,
.. о. Р ) ' ,, ) : , ::; ,.,.., ;." "
- - .,.. ''', ,,'31 t
.n 1'\. ().- '!' "" ..,.. '>
( ' -.., - . (
--. i:.J .:""1;0- --(f . !ii
.. '" iI "'"
) .'" -- . ".
. ( "'........
( -А4< - J.. -:>v "\
.::.).. ':.-1 <) -- ;... " .
. с .. . ':. '.
" .. ."J, ,
{'; '. f/I ?
't
'"".JJ'" ;: .",
) j-,:)/ '-.,.,
. f1> ... .("
0If ..",
"'" C "-
,. .........:- . С
::) р }" .. tJ: -.
. it; а-t
.i! ("о ,._ '" t:'O:-
_ .N
t
( '": ,
.)
с
v
(1
"': 1
.1' . ... ( .
,, ...
..
.
'::I-.. ..,
Рис. 38. В цеНТре зоны rеМО.'шза расположена клетка, образующая антитела
(Х :=:::: 100).
ТО.1ЩИНЫ. После затвердения аrарозы чашки инкубируют 1 ч
при 37 ос, а затем сверху наслаивают комплемент морской
свпнкп и инкубируют еще 30 мин. После инкубации можно
подсчитывать число зон rемолиза. Как показал опыт нашей
лаборатории, удобно пользоваТblСЯ прибором для чтения мик-
рофпльмов Dokumator DL II (УЕВ Carl Zeiss, Иена, rдр).
Jvl0ЖНО та'К:Же воспользоваться стереоскопической лупой или
прибором для подсчета бактериальных колоний.
В центре каждой зоны rемоЛ'иза должна лежать видимая
в микроскоп лимфоидная клетка (рис. 38). Если в этом месте
находится несколько клеток, то к образующим антитела от-
JЮСЯТ только одну ИЗ них.
11.2.3.
Непрямой метод локальпоrо rемолиза
11.2.3.1. Проведевие исследования
Проводят процедуры, описанные в разд. 11.2.2.2 11.2.2.4.
После ,подсчета зон rемолиза с поверхности rеля СМывают ос-
татки комплемента 2 3 миллилитрами кулыуральноЙ среды
11. IMeroa лок.альноео zеАtOлuза 8 ееле 101
и Ilнкубируют при 37 ос в течение 1 ч с анти-v-'rлобулиновай
сывораткой. Обычно эту сываротку разводят в соотнашении
ат 1: 50 до 1: 200. Для каждой серии антиrлобулииовой сы-
варотки имеется свое оптимальное разведение, которое следу-
ет определить в предварительных опытах. После удаления
а,нтиrлобулиновой сыворотки в чашки вновь заливают ком-
племент и ин'кубируют 30 мин, затем вторично подсчитывают
число зон rемолиза. В непрямом методе рекомендуеТ1СЯ при-
менять комплемент, истощенный бараньими эритроцитами,
так как двукратная инкубация снеистощенным 'кам'Племен-
TO I леrко мажет вызвать неспецифический rеМО.1ИЗ, иска-
жающий результаты. Для истощения к 1 мл свежей сыворот-
ки морской свинки прибавляют 0,2 мл осадка бараньих эрит-
роцитов и инкубируют 1 ч при 4 ос, несколько раз перемешивая.
Затем эритроциты удаляют центрифуrированием, а надаса-
дочную жизкасть испальзуют как источник комплемента.
Разность величин, полученных при подсчете зан rемолиза
непрямым и (прямым метадами, дает число клетак, образую-
щих 7S-антитела.
11.2.4.
Пассивный локальный rемолиз
Центральным моментом этаrо метода ЯВЛяется фиксация
саответствующих антиrенов на эритроцитах. Различные ав-
тары описали мнато разных вариантов ее осуществления.
Здесь мы коснем,ся лишь некоторых методик, сrруп'Пировав
их в зависимости от антиrена и спасоба ето фиксации.
11.2.4.1.
ПриrОТОВ:Iение индикаторных эритроцитов
11.2.4.1.1. БАКТЕРИАЛЬНЫЕ АнтиrЕНЫ
Некоторые ба'ктериальные антиrены спасабны фи сиро-
ваться на эритроцитах без участия связывающих реатентов.
В качестве антиrенов часто используют полисахариды пнев-
макокков и липополисахариды сальмонелл.
Эритроциты (в большинстве случаев бараньи) инкубиру-
ют с антиrеном при 37 ос в течение 1 ч. На 0,1 мл осадка от-
МЫТЫХ эритроцитов обычно добавляют от 10 да 100 мкт анти-
тена, но эту пропорцию следует считать суrубо ориентировоч-
ной.
Gпасобность полисахаридных антиrенав к адсорбции час-
то удается повысить, инкубируя их в 0,02 н. растворе N аОН
при 37 ос не менее 18 ч.
102 Э. Зшль, Э. Ее.М
11.2.4.1.2. rАПТЕНЫ
Мноrие исследования были проведены с динитрофениль-
ным (ДНФ) и тринитрофенильным (ТНФ) остатками в ка-
честве rаптенов. Их присоединяли к эритроцитам либо пря-
мо [10 lЗ], либо через белок-носителы[14 17].
Прямое присоединение ДНФ к эрuтроцuтам [10]. 0,5 мл
отмытых бараньих эритроцитов суспендируют в 5 мл трис-
буфера с рН В,О и к этой суспензии при непрерывном переме-
ШИ'вании добавляют по каплям раствор динитрофторбензола
(ДНФБ). Ра'С11ВОР ДНФБ rотовят непо'средственно перед
yrпотреблением, разводя 0,4 мл ДНФБ в 1 мл ацетона. При-
соединение ДНФ к эритроцитам проводят при комнатной
температуре в течение 20 мин. Для 'Прекращения реакции к
суспензии добавляют 5 мл трис rлицилrлициновоrо буфера с
рН 8,0. Этот буфер rотовят, растворяя в трис-буфере 10 мr/мл
rлицилrлицина и снова доводя рН до 8,0 2 н. раствором N аОН.
После внесения трис-rлицилrлициновоrо буфера нераствори-
мый ДНФБ быстро выпадает в осадок. Рааположенную над
ним взвесь эритроцитов нужно тотчас же перенести в друrую
пр06ир'ку, отбросив только самую нижнюю порцию объемом
около 0,5 МЛ. Затем к взвеси эритроцитов снова добавляют
10 мл трис rЛИЦИJ1rлициновоrо буфера и центрифуrируют
10 мин при 550 об/мин. Интенсивно-желтую надосадочную
жидкость отбрасывают, а осадок конъюrированных эритро-
цитов трижды отмывают трИlс-буфером с рН 7,4, содержа-
щим 0,5% rлюкозы и 1 % бычьеrо сывороточноrо альбумина,
и разбавляют до нужной концентрации. Для при'соединения
к эритроцитам ТНФ предложена аналоrичная методика [12].
Прuсоедuненuе через белок-носuтель. Вначале неоБХОДIlМО
пр'исоединить rаптен к белку-носителю, восполь'ЗоваВШIlСЬ ме-
тодикой, описанной в разд. 32.
Фиксация конъюrированноrо белка на эритроцитах про-
изводится точно так Же, как присоединение д'руrих белковых
антиrе;нав (см. 11.2.4.1.3.).
11.2.4.1.3. БЕЛКИ
Белковые антиrены можно присоединять к эритроцитам
тремя разными способами: при помощи СrСl з [18, 19, 24],
1-эrnл-3-(З-диметиламинопропил) карБОДИИМИlда (ЭКДИ) [14,
15, 20] или бuс-диазотированноrо бензидина [21]. Чаще все-
ro используют СrСl з и ЭКДИ.
Белковые антитены для повышения иммуноrеННОСТIl не-
реДКО подверrают аrреrации [18, 20], например осаждая с по-
мощью N a2S04 [22]. Проrрев в течение 1 ч при 63 ос повы-
шает степень аrреrации. Но белки, присоединяемые к Эр'I1ТрО-
цитам, берут в нсаrреrированном состоянии.
1/. Метод локалыtоzо еемолuза в ееле 103
При иммунизации животных растворы белков вводят
ВНУТРllвенно или под кожу. Однократная д'оза оБЫЧ!lО состав-
ляет 0,1 1,0 Mr. Раствор антиrена для подкожнои иммуни-
зации часто смешивают с равным объемом адъюванта
Фрейнда.
Бычий 'У-2лобулин (Бrr) [18]. rотовят 10 мл 0,75%-Horo
раствора Бrr, 10 мл 0,5 мМ раствора СrСl з и 1 мл 50% -НОЙ
взвеси бараньих эритроцитов в 0,15 М pa1CTBope NaCl. Все
три компонента соедИНЯЮТ при О ос, затем инкубируют 1 ч
при 37 ОС, непрерыв:но перемешивая. Присоед'инение Бrr с
помощью ЭКДИ описал Христиан [22].
Бычий сывороточный альбумин (БСА) [23]. К 3 мл
1 % Horo раствора БСА в забуференном фосфатами растворе
NaCl добавляют 0,1 мл 50%-ной взвеси бараньих эритроци
тов и 0,5 мл 5% H()irO раствора ЭКДИ и инкубируют 1 ч при
37 0 с.
Человеческий 'У-2лобулин (чrr) [20]. К 3 мл 2%-Horo
раствора чrr прибавляют 0,1 мл 50% -ной взвеси эритроци-
тов козы и 0,5 мл 10% -Horo ра'створа ЭКДИ. Смесь инкуби
руют 1 ч при 4 0 с. Все реатенты rотовят на забуференном
фосфатами 0,15 М pa1CTBope NaCl.
Пасле инкубации конъюrированные эритроциты MHoro-
кратно отмывают. Что'бы предотвратить неспецифичесК'ий re
молиз, отмытые эритроциты суспендируют в среде, содержа
щей какой-нибудь белок. Роль стабилизатора может иrрать,
например, эмбриональная телячья сыворотка, про'rретая cы
воротка кролика, а также желатин'а [24]. Фиксация белково-
ro антиrена на эритроцитах существенно зависит от KOHцeHT
рации присоеДиняющеrо peareHTa. Различные антиrены Tpe
бую т разных соотношений между белком и присоединяющим
peareHTOM [19].
Приведенные нами выше пропорции, судя по цитирован-
ным работам, Я'ВЛЯЮ11СЯ оптимальными. Нередко вместо ба-
раньих эритроцитов в качестве индикаторных клеток исполь
зуют эритроциты козы. Вероятно, они лучше подходят д.1Я
пас'сивнorо локальноrо rеМОЛ'IIза.
11.3. ОБЩАЯ ОЦЕНКА МЕТОДА
Количества клеток, образующих антитела (АОК), при оп-
ределении методом локальноrо rемолиза на высоте иммунно-
ro ответа сильно различаются у разных авторов. Например,
'Величины, получен,ные с помощью прямоrо метода, варьируют
в пределах от 200 до 2000 АОК на 106 лимфоидных клеток.
При непрямом методе получаются обычно величины более
1000 АОК на 106 лимфоидных клеток.
104 э. Зllе.IЬ, э. БеАt
Особенно низкие показа тели дает пассивный локальный
rемолиз в среднем Bcero лишь 50 60 А:ОК на 106 лимфоид-
ных клеток. В отдельных случаях АОК выявляются толь'ко
непрямым методом [18]. Пассивный локальный rемолиз
весьма чувствителен к мноrочисленным помехам, и примене-
ние ero требует большоrо практическоrо опыта.
Ошибка метода при прямом и непрямом локальном reMo-
лизе составляет около 15 20%. Колебания, обусловленные
различиями в иммунном ответе у отдельных животных, на-
MHoro больше ошибки метода; коэффициент вариации мо-
жет ДОСТИrать 0,5 [18]. Некоторую роль иrрает также неоди-
наковая чувствительность бараньих эритроцитов к rемолизу
[26]. Рекомендуется по возможности всеrда ра'ботать с эрит-
роцитами от одноrо и Toro же животноrо или по крайней ме-
ре брать эритроциты для иммунизации и для локальноrо re-
молиза из одной порции крови. В реакции лучше использо-
вать не свежие эритроциты, а клетки, постоявшие несколько
дней в ХОЛОДИЛЬНИКе.
Небольшое число зон rемолиза можно обнаружить и при
исследо'ва:нии лимфоидных клеток неиммунизированных жи-
вотных. Эти так называемые «фоновые» величины весьма
различны у разных видов и линий, но редко превышают 1/500
часть маКсимальноrо количества АОК, наблюдаемоrо после
иммунизации.
Вероятность повре:ж:дения лимфоидных клеток особенно
высока в момент суспендирования их в расплавленной arapo-
зе. Эритроциты хорошо переносят температуру золя 47 49 ОС,
но этоrо нельзя сказать о лейкоцитах. Поэтому необходимо
как можно быстрее, стереотипными движениями суспендиро-
вать клетки в золе и тотчас распределять вз есь по поверх-
ности нижнеrо слоя.
Большое значение имеет качество arapa. Лучше Bcero и
верхний, и нижний слой rотовить на аrарозе. Для экономии
можно хотя бы нижний слой Делать из очищенноrо arapa с
ДЭАЭ-декстраном. Сульфатированные полисахариды, кото-
рые освобождаются из arapa при расплавлении, антиком;пле-
,МЕ:нтарны, так как с'вязывают ионы Са 2 + и M g 2+. ДЭАЭ-дек-
стран спосабен связать эти полисахариды и тем самым
уменьшить антикомплементарное действие arapa. Обычно в
очищенном атаре с ДЭАЭ-декстраном удае1iСЯ выявить столь-
ко же АОК, сколько и в аrарозе.
В реакции непрямоrо локальноrо rемолиза часто наблю-
дается уменьшение числа зон, О'бразующих'ся под деЙствием
антител 19S. Это обусловлено ВЛИЯНИем антиrлобулиновой сы-
воротки [3, 4]. С этим феноменом необходимо считаться,
коrда число клеток, образующих 7S-антитела, вычисляют как
11. Метод локальноzо zе,М,олuза 8 2еле 105
разность результатов непрямоrо и прямоrо rемоЛ'иза на двух
параллельных чашках. Уортис и сотр. [27] ввели, например,
в расчеты особую «конста:нту уrнетения». Так как эту кон-
станту вычисляют по эффекту антиrлобулиновой сыворотки
на 2-й день после иммунизации, здесь не учитывается то, что
в ,J,руrпе сроки влияние антиrлобулиновоrо pea,reHTa может
быть иным. Позже было обнаружено, что антиrлобулиновая
сыворотка, уменьшая число одних АОК, может, видимо, уве-
личивать число друrих клеток, образующих IgM-антитела
[28, 29]. Описанная нами методика в известной мере позво-
ляет обойти эти затруднения, так как «'прямые» И «непря
мые» зоны rеМОJ1иза подсчитываются в два приема на одной
и той же чашке [4].
Предложено MHoro вариантов локальноrо rемолиза, в ос-
нову которых положен тот же самый принцип. Они пере-
числены в табл. 2, к которой мы должны здесь сделать дo
ПО.'lнительные краткие пояснения. Для ста'билизации положе-
ния клеток в пространстве некоторые авторы (в частности,
[2]) применяют вместо аrарозы вещества, дающие rелеобраз
ные растворы, например карбоК'симетилцеллюлозу. Предло
жен также метод локальноrо rемолиза в среде без rеля [30].
В этом варианте лимфоидные клетки и эритроциты распола
rают в виде монослоя, что повышает чувствительность MeTO
да. Оба последних варианта локальноrо rемолиза имеют су-
щественное преимущество: клетки не нужно подверrать Ha
rреванию; однако они позволяют исследовать лишь
относительно небольшое число лимфоидных клеток. Мноrие
авторы отказались от использования чашек Петри и ставят
реакцию на предметном стекле (см., например, [4,31]).
Метод локальноrо rемолиза сравнительно трудоемок. Ero
недостатком является также значите.1ЬНЫЙ разброс реЗУ.1Ь-
татов; некоторые исследователи [32] вообще относят ero к
ПО.lуколичественным методам. Однако пр'и решении мноrих
вопросов более существенны ero преимущества, в частности
возможность одновременной оценки иммунноrо ответа кле
ток целоrо opraHa или ткани. Комбинируя локальный reMo-
лиз с rистохимическими, иммунофлуоресцентными и радиоим-
мунолоrи'Ческими методами, можно 'совместить функциональ
ный анализ с морфолоrическим.
Среди современных методов экс:периментальной иммуно
лоrии методу локаль'ноrо rемолиза принадлежит одно из
центральных мест.
106 Э. ЗU2ЛЬ, Э. Бе.м
11.4. ЛИТЕРАТУРА
1. Jerпe К. N., Nordiп А. А., P!aque formation Ьу single antibody-producing
cells, Science, 140, 405 (1963).
2. Iпgraham J. S., Bussard Р. D., Application of а localized hemolysin reac-
Ноп for specific dеtесtiоп of individual antibody forming cells, J. Ехр.
Med., 119, 667 682 (1964).
3. Dresser D. W., Wortis Н. Н., Use of апtiglоЬuliп serum to detect cells
producing antibody with !ow haemo!ytic effeciency, Nature, 208, 859
861 (1965).
4. Sterzl J., Riha 1., А localized haemo!ysis in gel method for the detection
of ceIls рrоduсiпg 75 апtiЬоdу, Nature, 208, 858 859 (1965).
5. Laпdy М., Saпderson R. Р., Jackson А. L., Humoral and cellu!ar aspects
of the immune response to the somatic апtigеп of Salmoпella enteritidis,
J. ехр. Med., 122, 483 504 (1965).
6. Byfield Р., Increased p!aque forming cell rеsропsе to рпеumососса! ро!у-
saccharid type III coated sheep erythrocytes after рrimiпg with erythrocy-
tes but not with po!ysaccharid, Cell. Immuno!., 3, 616 622 (1972).
7. Baker Р. J., Stashak Р. W., Prescott В., Use of erythrocytes sensitized
with purified рпеumососса! po!ysaccharides for the assay of antibody and
antibody рrоduсiпg cells, Арр!. Microbio!" 17,422 (1969).
8. Cunningham А. J., Smith J. В" Mercer Е. Н., АпtiЬоdу fоrmаtiоп Ьу siпg-
Je cells from !ymph nodes апd еffеrепt !ymph of sheep, J. Ехр. Med., 124,
701 714 (1966).
9. Корукова А. А., Модификация метода локальноrо пассивноrо rемолиза
в rеле для выявления клеток, продуцирующих антитела к Vi антиrену
5. typhi. Бюл. эксп. биол. мед., 72, 12, 103 104 (1971).
10. Trump О. N., Рrераrаtiоп of diпitrоfluоrЬепzепе-trеаtеd sheep erythrocy-
tes for dеtесtiоп of апti-DNР р!аquе fоrmiпg ceIls, J. Immuno!., 109,
754 760 (1972).
11. Layson М. N., Sehon А. Н" Dеtесtiоп of cells producing апtiЬоdiеs
аgаiпst the diпitrорhепу! group, Сап. J, Biochem" 45, 1073 1076 (1967).
12. Ritteпberg М. В., Pratt К. L., Anti-trinitrophenyl (TNP) p!aque assay.
Primary rеsропsе of Ba!b/c mice to so!ubIe апd particu!ate immuпоgеп,
Proc. 50С. Ехр. Bio!. Med., 132, 575 581 (1969).
13. Bullock W. W., Ritteпberg М. В., Юпеtiсs of iп vitro iпitiаtеd sесопdаrу
апtihарtеп rеsропsе: iпduсtiоп of р!аquе-fоrmiпg cells Ьу so!ubIe апd
particulate апtigеп, Immuпосhеmistrу, 7, 310 314 (1970).
14. Chiller J. М., Weigle W. О., Р!аquе-fоrmiпg cells to 2,4-diпitrорhепуl in
sрlеепs of immuпizеd and non-immunized mice, Immuпосhеmistrу, 7,
989 992 (1970).
J 5. Havas Н. F., Pikard А. R., The effect of the immunogenicity of the hete-
ro!ogous carrier оп the ear!y sесопdаrу anti-2,4-dinitropheny! (DNP)
rеsропsе of Ba!b/c mice, J. Immuпо!., 109, 791 800 (1972).
16. Непnеу Ch., А cyto!ytic system for the in vitro dеtесtiоп of се1l mediated
immuпitу to so!ubIe апtigеп, J. Immunol., 105, 919 927 (1970).
17. Silver Н., МШе, J. F. А. Р., Warпer N. L., А simple hemolytic plaque
tесhпiquе for the епumеrаtiоп of anti-hapten antibody forming cells, Int.
Arch. Allergy Арр!. Immuno!., 40, 540 550 (1971).
18. Hosono М., Muramatsu S., Use of '2-mercaptoethanol for distinguishing
Ьеtwееп IgM апd IgG antibody-producing cells of mice immunized with
Ьоviпе-у-glоЬu!iп, J. ImmunoJ., 109, 857 863 (1972).
19. Sweet О. Н., Wellborne F. L., Use of chromium chloride as the соuрliпg
аgепt in а modified p!aque assay of cells producing antiprotein antibody,
J. Immunol., 106, 1407 1410 (1971).
20. Hege J. S., Epstein W. V., Antibody рlаquе-fоrmiпg cells in mice immuпi-
zed with humап-у-gl0Ьuliп. 1. Technical considerations, J. Immunol., 106,
786 792 (1971).
11. Метод локалыizоo zе,М,олuза в zеле 107
21. Stavitsky А. В., Arquilla Е. R., Studies of рrоiеiпs апd antibodies Ьу spe-
сiПс hеmаgglutiпаtiоп апd hemolysis of рrоtеiп сопjugаtеd erythrocytes,
Iпt. Arch, AlIergy, 13, 1 38 (1958). .
22. Christian Ch. L., Сhаrасtеrizаtiоп of the «reactant» (gamma g10Ьulш
factor) iп {Ье FII precipitin rеасtiоп апd the FII tanned sheep сеll agglu-
tination test, J. Ехр. Med., 108, 139 143 (1958).
23. Kaplan А., Freeman М., Епumеrаtiоп of cells sупthеsiziпg апtiрrоtеiп ап-
tibodies Ьу а modified hemolytic plaque assay, Proc. Soc. Ехр. Biol. Med.,
127, 574 576 (1968).
24. Ретисса Р. J., Faulk W. Р., Fudenberg Н. Н" passive immuпе lysis with
chromium chloride treated erythrocytes, J. Immuпоl., 102, 812 820
(1969) .
25. Buschmann Н., Рорulаtiопsgепеtisсhе Uпtеrsuсhuпgеп zur VаriаЫlшit
der Anzahl рlаquе Ыldепdеr Zellen in der Milz vоп Miiusen, Ztschr. lт-
mип. Forsch., 141, 37 48 (1970).
26. Веи D. А., Leblond Р. F., Leddy J. Р., Lauf Р. К, LaCelle Р. L"
Weed R. /,' Immuпе hemolysis, 1, Diffеriпg susceptibility of three gепеtiс
types of sheep red cells, J. Immuпоl" 108, 467 474 (1972).
27. Wortis Н. Н., Taylor R. В., Dresser D. W., АпtiЬоdу рrоduсtiоп studied
Ьу mеапs of the LHG-assay. 1. The sрlепiс response of CBA mice to sheep
erythrocytes, Immuпоlоgу, 11, 603 616 (1966).
28. Plotz Р. Н., Talal N., Asofsky R., Assignment of direct and facilitated
IIemoJytic plaques iп mice to specific immuпоglоЬuliп classes, J. Immunol.,
100, 744 750 (1968).
29. Finger Н., Emmerling Р., Schneider О., Quапtitаtivе Bestimmung IgG-
АпticоrреrЫldепdеr Zеllеп mittels Сопсапаvаliп А wiihrепd der рrimаrеп
und sеkuпdаrеп Immuпrеаktiоп, Z. Immun,-Forsch" 143, 437 453 (1972).
30. Cuпniпgham А. J., А method of increased sensivity for dеtесtiпg siпglе
апtiЬоdу fоrmiпg cells, Nature, 207, 1106 1107 (1965).
31. Nordin А., Cosenza Н., Hopkins W., ТЬе use оУ сопсапаvаliп А for dis-
tiпguishiпg IgM from IgG апtiЬоdу рrоduсiпg cells, J. Immuпоl., 103,
859 861 (1969).
32, Zaalberg О. В., van der Меи! V. А., van Twisk М. J., АпtiЬоdу рrоduсtiоп
Ьу isolated sрlееп cells: а study of the cluster апd the plaque tесhпiquеs,
J. Immuпоl., 100, 4Бl 458 (1968).
12. Реакция rемаrrлютинации
Э.зиrль
12.1. ПРИНЦИП
Антиеритроцитарные антитела, взаимодействуя с эритро-
цитами, вызывают их аттлютинадию. Этот феномен (reMar-
r.1ютинация) используется для полуколичественноrо опреде-
ления антител в тех случаях, коrда нужно изучать иммун
ный ответ экопериментальных животных на эритроцитарные
антиrены.
Реакция пасС'ивной (непрямой) rемаrrлютинадии служит
для выявления иммунных прецИ'питато'в, которые образуются
в результате взаимодействия опецифических антител с анти-
rенами, фиксированными на поверхности эритроцитов. Эрит
роциты оказываются вовлеченными в преципитацию и обра-
зуют аrrлютинаты. Такой метод выявления Iпервичноrо взаи-
модействия аНТИrен антитело обладает весьма высокой
чувствител ностью.
Белки и бактериальные антиrены можно при'соединять к
эритроцитам с помощью методов, описанных в разд. 11 [1
4]. Для лучшеrо связывания белковых антиrенов эритроциты
чаще Bcero обрабатывают таннином [5].
12.2.
12.2.1.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
Реаrенты и приборы
Nlикротитратор Такачи
0,9% ный раствор NaCl
Забуференный физиолоrический раствор (ЗФР) с рН 7,2:
23,9 мл 0,15 М раствора КН 2 РО 4
76,0 мл 0,15 М раствора Na 2 HP04
100,0 мл 0,147 М раствора NaCl
ЗФР с рН 6,4:
67,7 мл 0,15 М раствора КН 2 РО 4
32,3 МЛ 0,15 М раствора Na 2 HP0 4
100,0 мл 0,147 М раствора NaCl
33% ный водный раствор дважды переrнанноrо формальде-
rида, который разба'вляют равным объемом сконцентри-
pOBaHHoro вдвое ЗФР с рН 7,2
12. Реакция ее,М,аzzлютиliации 109
Раствор таннина 1 : 20000 в ЗФР с рН 7,2 (исходный раствор
таннина 1: 100 в дистиллированной воде может долrо
храниться при 4 0 С)
Кровь барана или человека (rру,ппа О, Rh , взятая в раСТВО1>
Олевера)
Сывороточный алыбумин человека
12.2.2. Обработка эритроцитов
формальдеrидом
Отмытые ЗФР эритроциты барана или человека разбав
ляют 0,9% -ным ра'Створом N аСl. К полученной взвеси при-
ба,вляют равный объем 16,5% -Horo раствора формальдеrида
в ЗФР с рН 7,2 и смесь 2 ч инкубируют в водяной бане при
37 0 С, перемешивая через каждые 15 мин. Затем формалиНИ
зированные эритроциты 3 5 раз отмывают ЗФР с рН 7,2
и rотовят 10% -ную суспензию.
12.2.3. Обработка эритроцитов таннином
К 100% -ной суспензии отмытых формалинизированных
эритроцитов в ЗФР прибавляют равный объем раствора та н-
нина (1: 20000) в ЗФР с рН 7,2, смешивают и остаВJ1ЯЮТ на
10 мин при комнатной температуре; затем трижды отмывают
(ЗФР с рН 7,2). Формалинизированные и таннизированные
эритроциты можно хран'ить несколько неделЬ.
12.2.4. При соединение антиrенов
к эритроцитам (сенсибилизация)
К 1 мл 5% -ной взвеси формалинизироваННБlХ и таннизи
рованных эритроцитов прибавляют 4 мл ЗФР С рН 6,4 и 1 мл
раствора соотвеl'ствующеrо антиrена в 0,9%'-ном растворе
NaCl, смесь инкубируют 20 мин при комнатной температуре"
затем эритроциты трижды отмывают ЗФР с рН 7,2, содержа
щим 0,2 % человеческоrо сывороточноrо альбумина.
12.2.5.
Проведение исследования
12.2.5.1.
Прямая l'емаl'l'лютинация
Чтобы исключить иммунный rемолиз, иоследуемую сыво-
ротку декоМ'плементируют, ПРОlrревая 30 мин при 56 0 с. За-
тем rотовят ряд последовательных разведений, каждое из
которых смешивают с 2%-ной взвесью эритроцитов и остав-
ляют при комнатной температуре. Реакцию можно прово-
110 Э. Зиzль
дить В проб ирках, в лунках пластмассовых панелей и в
панелях для микротитрования. Коrда все эритроциты осядут
(ПрЮlерно через 2 ч), можно учесть результаты реакции при
'Слабом увели'чении или невооруженным rлазом. При положи
тельной реакции аrrлютинирова,вшие эритроциты выстилают
дно пробирки или лунки ра:в'номерным 'слоем. При отрица-
тельной реакц'ИИ все эритроциты собираются в одной точке.
Результаты реакции выражают титром антител величи
JIОЙ, обратной последнему разведению сыворотки, которое
еще аrrлютинирует эритроциты.
12.2.5.2.
Пассивная rеl\farrлютинация
Приrотовляют 2% -ную взвесь эритроцитов, натруженных
aHTHreHoM. Исследуемые сыворотки перед титрован'ием необ-
ХОДЮ10 инактивировать и истощить таннизированными эрит-
роцитами. Реакция обычно ставится в панелях для микротит-
рования, но может быть поставлена и в б6льших объемах.
Ход работы такой же, как и в 12.2.5.1.
12.3. ОЦЕНКА МЕТОДА
Реакцию пассивной rемаrrлютинации используют в серо-
лоrической диатностике как вы'окочувс'fiв'ительныый метод по-
луколичественноrо определения антител к растворимым ан-
тиrенам. Выявляемое с ее помощью минимальное количество
антител в пересчете на белковый азот составляет 0,003
0,005 MKr [7]. По чувствительности она не устуюает реакции
связывания комплемента, а часто даЖе прево'сходит ее.
Процедура приrотовления наrруженных эритроцитов де-
лает реакцию пассивной rемжrлютинации сравнительно тру-
доемким методом. Однако формалинизированные эритроци-
ты сохра'няют свои свойства несколько недель; блаrодаря
этому можно сразу приrотовить большой запа,с наrруженных
эритроцитов и использо'вать ero во мноrих опытах, что зна-
чительно улучшает воспроизводимость резулЬ'татов. Тот же
эффект дает замена эритроцитов искусственными носителя-
ми, например ча'стицами полистироловото латеКса (см.
разд. 14) или бентонита.
Концентрация peareHToB, время и температура инкубации
при обработке таннином и присоединении антиrена и рН бу
ферных растворов должны быть оптимальными для данноrо
антиrена и даНноrо вида эритроцито'в. Указанные здесь пара-
метры можно изменять в нужном направлении. Это особен-
но кarcается концентраций таннина и фор'мальдеrида. Оба
12. .Реакция zемаzzлютиnации 111
peareHTa MOr ли бы использоваться в еще б6льшем разведе
'н Иl1.
Чувствительность метода пассивной rемаrrлютинации в
значительной мере зависит от Toro, насколько верно подобра
на концентрация сенсибилизирующеrо эритроциты антиrена.
Ее определяют в предварительных опытах. rерберт [6] пред-
латает следующие ориентировочные данные:
Овальбумин
Бычий сывороточный альбу-
мин
Тиреоrлобулин
Тканевые антиrены
0,OI25 5,0 мr/мл
0,04 25,0 мr/мл
2,0 мr/мл
20,0 мкr/мл по бел-
кОВО,\1 у азоту
Таннизированные эритроциты часто подвержены неспеци-
фической аплютинации. Ее можно предотвратить, если мно-
rOKpaTHo отмыть эритроциты после обработки таннином и до-
бавить к буферному раствору стабилизатор, на'пример чело-
веческий или бычий сывороточный алЬ'бумин, желатину или
сыворотку кролика. Для у;странения антиэритроцитарных ан-
тител исследуемые сыворотки истощают эритроцита и из то-
ro же источника, из KOTOpOI'O rотовят эритроцитарный «диаr-
ностикум».
Специфичность реакции аrrлютинации тем выше, чем чи-
ще антиrен. Конкуренция различных антиrенов (содержащих-
ея в смеси, например в reMoreHaTe из opraHa) за поверхность
эритроцитов снижает воопроизводимость метода и часто уве-
личивает вероятность неспецифических реакций [1].
Подробное рассмотрение теоретических и практических
аспектов метода, а также обширную библиоrрафию можно
найти у rерберта [6].
Прямая rе аплютинация часто применяется в качествен-
ном варианте, например при определении rрупповых антиrе-
нов крови.
12.4. ЛИТЕРА ТУРА
1. Neter Е, Indirect bacterial hemagg!utination, and its application to the
study of bacteria! antigens and sero!ogic diagnosis. Patho!. Microbiol., 28,
859 877 (1965).
2. Stavitsky А. В., Arquilla Е. R., Micromethods for the study of proteins and
antibodies. III. Procedure and applications of hemagg!util1ations and he-
magglutination-inhibition reactions with bisdiazotized benzidine and pro-
tein-conjugated red cells, J. Immuno!., 74, ЗО6 312 (1965).
3. Sweet .О. Н., W,e.llborп F. L., Use of chromium chloride as the coupling
agent ш а mod1fled p!aque assay of cells producing anti-protein antibody.
J. Immunol., 106, 1407 1410 (1971).
112 Э. Зuzль
4. Daпi(!ls J. С., Weigle W. О., Antibody рrщ\uсiпg cells in rabbits injected
\\'ith solubIe BSA. 1. Hemolytic plaque assay, J. Immunol., 101, 1223 1229
( 1968) .
:5. Boydeп S. V., The adsorbtion of protein оп erythrocytes treated with tan-
nic acid and subsequent hemagglutination Ьу antiprotein sera, J. ехр. Med.,
93, 107 120 (1951). ."
б. Herbert \V. J., Passive hemagglutination. In: Handbook of Experimenta\
Immunology, Ed. Ьу Weir D. М., Blackwell Scientific Publications, Ох-
iord Edinburgh, 1967.
7. Gillert К. Е., Rudolph Е., Der Boyden Test und seine Anwendungsm6glich-
keiten, R6ntgen und Laborpraxis ХН, L 111 116 (1959).
В. Jzbicky А., Untersuchungen iiber die passive Hamagglutination mit tannin-
behandelten Erythrozyten, Zschr. f. Immunitatsf., Allergie и. klin. Immu-
по]., 140, 282 297 (1970).
'9. StaL'itsky А. В., Arquilla Е. R., Studies of proteins and antibodies Ьу spe-
сiПс hemagglutination and hemolysis of protein conjugated erythrocytes,
Int. A-rch. Allergy, 13, 1 38 (1958).
13. Титрование антител
к o и К антиrенам Escherichia соН
в реакции пассивной
reMarr ЛЮТllllации
П.ЦИСКА
13.1. ПРИНЦИП
ВодораС11воримые бактериальные полисахаРИIДЫ и проrре-
тые липопо.1исахариды (соответственно К- и О-а:нтиrены
Е. сои) леrко адсорбируются на поверхности эритроцитов
[1]. ПРИ воздеЙствии антител к адсорбированным антиrена'м
ЭРИТРОЦИТЫ как пассивные носители MorYT вовлекаться в об
разование иммунных arperaToB и аrrлютинацию.
13.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
13.2.1. Реаrенты и приборы
Бактериальные липополисахариды (О-антиrены Е. сои)
Бактериальные полисахариды (К-антиrены Е. сои)
Норма.'IЬная кроличья сыворотка
Бараньи эритроциты в paC Bope Олсвера
Кроличья антисыворотка к Е. coli (Staatliches Institut fйr
Immunpraparate und Nahrmedien, Берлин, [ДР)
Забуференный фосфатами раствор хлористоrо натрия
(ЗФР) с рН 7,2, стерильный
Термостат
Микротитратор Такачи (La'hor MI,M, Будапешт)
Пипетки (0,2; 1 и 5 мл)
Настольная центрифуrа (Т32, VEB Janetzki, Лейпциr, [ДР)
Водяная баня (WB 62, VEB Labortechnik, Ильменау, [ДР)
Центрифужные пробирки (25 мл)
13.2.2.
I1риrотовление растворов антиrенов
10 Mr полисахарида (К антиrена) растворяют в 5 мл
ЗФР. 2,5 Mr липополисаха1рида (О антиrена) растворяют в
5 мл ЗФР И В течение 2 ч проrревают в кипящей водяной
бане. Эти ра'створы можно несколько недель хранить в хо-
ЛОДИльнике.
13.2.3.
Инактивация комплемента
Исследуемые и контрольные сыворотки перед опытом про-
rревают в водяной бане 30 мин при 56 ос, а затем разбавля-
ют их ЗФР (1:10).
8 840
114 П. Диска
13.2.4. 3aroToBKa эритроцитов
у барана стерильно берут кровь, смеши.вают ее с равным
объемом раствора Олсвера, разливают смесь по 10 мл В CTe
рильные пробирки и хранят в холодильнике. Через неделю
эритроциты приrодны для адсорбции антиrенов.
13.2.5. При соединение антиrенов
0,5 мл осадка эритроцитов трижды отмывают ЗФР, цeHT
рифуrируя по 10 мин при 1000 g, и су,опендируют в 100 мл
ЗФР. 10 мл этой 0,5% ной взвеси смешивают с 0,5 мл paCTBO
ра антиrена в центрифужной прСУбирке и 30 мин инку,бируют
при 37 0 с. НесвязавшиЙ'ся антиrен удаляют трехкратным OT
мы1аниемM в ЗФР. Затем осадеж наrруженных эритроцитов
суспендируют в 10 мл ЗФР И эту взвесь используют в реак-
ции пассивной rема:rrлютинации. Приrотовленный эритроци
тарный «диаrностикум» можно хранить в холодильнике
3 дня.
13.2.6. Проведение реакции
пассивной rемаrrлютинациИ
Реакцию ставят в панелях V-типа из микротитратора Ta
качи. Калиброванной пипеткой в каждую лунку вносят по
2 капли (0,05 мл) ЗФР и опециальной петлей (на 0,05 мл)
делают последовательные разведения сывороток. Затем в
'каждую лунку внсусят по 0,05 мл взвеси наrруженных эр'итро
цитов и перемешивают содержимое лунок путем осторожноrо
в'стряхивания панели в rоризонтальной плоскости. Панель,
прикрытую сверху стеклянной пластинкой, выдерживают 1 ч
при 37 ос, а затем оставляют на 2 ч при комнатной темпе-
ратуре. Результаты реакции учитывают невооруженным rла-
зом; определяют последнее разведение сыворотки, в котором
еще произошла rемаrrлютинация. Чтобы исключить неспеци-
фическую аrrлютинацию, следует поставить 4 контроля:
1) исследуемая сыворотка +ненаrруженные эритроциты;
2) ЗФР+на:rруженные эритроциты;
3) антисыворотки к Е. соli+наrруженные эритроциты;
4) нормальная кроличья сыворотка+наrруженные эритро-
циты.
13.3. ОЦЕНКА МЕТОДА
В тех лунках, I1дe специфические антитела вызывают а'rrпю
тинацию, эритроциты покрывают дно ровным слоем. При OT
сутствии аrrлютинации они ска,пливаются в центральном yr-
13. Титрование антител к o и K-антuzенам Е. сои 115
лублении лунки, образуя компактную «пуrовку» С резко очер
ченными краями. При частичной аrrлютинации небольшую
«Jпуrовку» окружает узкая область аrrлютинировавших эрит-
роцитов. Ошибка метода пассивной rемаrrлютинации состав-
ляет + 1 разведение. Метод позволяет выявлять антитела при
их концентрации до 0,03 мкr/мл [2].
Приемы работы с микротитратором описаны в приложен
ной к нему инструкции, а таlкже в руководстве, вышедшем
под редакцией Балинта [3]. Методы выделения бактериаль
ных полисахаридов и липополисахаридов описаны в статье
HOBOTHoro [4] и в указанной им литературе.
Существует множество вариантов метода пассивной reM
аrrлютинации; хороший обзор читатель найдет у rербер-
та [5].
13.4. ЛИТЕРАТУРА
1. Neter Е., BacteriaI hemagglutination and hemoIysis, Bact. Re"., 20, 166
188 (1956).
2. Gill Т. J., Methods for detecting antibody., Immunochemistry, 7, 997 1000
(1970) .
3. КIinische Laboratoriumsdiagnostik, Band II, S., 410 412, Herausgeber,
Balint, Р. УЕВ Volk und Gesundheit, Berlin, 1964.
4. Nowotпy А., Basic Exercises in Immunochemistry, S., 25 29, Springer
Yerlag, Berlin Heidelberg New York, 1969.
5. Herbert w. .т., Passive Haemagglutination, in Handbook of Experimental
Immunology, S., 720 744, Hel'ausgeber: Weir D. М,, Blackwell Scientific
PubIications, Oxford Edinburgll, 1967.
8*
14. Выявление австралийскоrо
антиrена методом
латекс аrrлютинации
R. вильме
14.1. ПРИНЦИП
Простота и быстрота реакции латекс-аrrлютинации сдела-
ли ее одним из лучших в настоящее время методов ВЫЯВ.1е
ния австралийскоrо антиrена при IaCCOBЫX обследованиях.
Первое сообщение об этом методе сделали в 1971 r. Лич и
Ракк [1]. Затем Банакер и Штерк [2] разработали стандарт-
ный набор peareHToB, I'лавной частью KOToporo была взвесь
ПОЛИСТИРОJ10воrо латекса, наrруженноrо v-rлобулином, содер-
жащим антитела к аВ'стралийскому антиrену [2 5]. Части-
цы латекса в данном случае служат носителями антител и
при образовании иммунных arperaToB иrрают роль мостиков
между молекула'ми антиrена. Каплю суспензии TaKoro латек-
са прибаlВЛЯЮТ к капле ис'следуемой сыворотки и тщательно
перемешивают. Если в сыворотке содержится австралийский
антиrен, то вскоре образуются мелкие, но хорошо видимые
аrrлютинаты.
14.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
14.2.1. Реаrенты 11 приборы
Полистироловый ЕF-латекс (VEB Вuпа, r ДР); расчер
ченные пластинки для латек'с-аrrлютинации; капельные пи-
петки; антисыворотка к австралиЙскому антиrену; насыщен-
ный (при 20 ОС) раствор (NH 4 )2S04; диализная трубка; r.1И-
циновый буфер с рН 8,8.
Приrото:вление буфера: смешать 467 мл 2 М rЮЩlIна
(150,14 r на 1 л Н 2 О) со 100 мл 1 М. NaOH (40,0 r на 1 л
Н 2 О) И добавить равный объем физиолоrическоrо раство-
ра NaCI.
14.2.2.
Выделение -у-rлобулина
из антисыороткии
к австралийскому антиrеllУ
К 10 мл сыворотки, содержащей антитела к австралийско-
му антиrену (независимо от титра) по каплям, непрерывно
перемешивая, прибавляют 6 мл насыщенноrо раствора
(NH 4 ) 2 S0 4. ОбразовавшиЙся осадок отделяют цеНТРllфуrи-
14. Выявлеlше 'австралuйскоzо антиzена 117
рованием и растворяют в 5 мл в'Оды, добавив несколько ка-
пель физио.поrическоrо paC'fiBOpa NaLl. Раствор диализуют до
1П0лноro удаления сульфата аммония и разбанляют до 2% -ной
концентращlИ по белку.
14.2.3. Присоединение антител
к частицам латекса
К 1 О М.'! 1 % ной взвеси латекса в rлициновом буфере с
NaCl (рН 8,8) добавляют 1 мл 2% Horo раствора v-rлобули-
на, выделенноrо из антисыворотки к австралийскому антиrе-
ну, и инкубируют 12 ч пр'и 20 ОС, а затем 12 ч при 4 ос.
Взвесь наrруженноrо латек'са 1 : 5 ра'Збавляют буфером, тща-
тельно встряхивают и иопытывают в реакции аrrлютинации
с сывороткой, заведомо содержащей австралийский антиrен.
Дальнейшим разбавлением суспензии латекса добиваются
наиболее отчетливой картины аlилютинации.
Проведение реакции
латекс-аrrлютинации
Каплю наrруженноrо латекса прибаВJ1ЯЮТ к капле иссле-
дуемой сыворот и и встряхивают в течение 2 мин на пла-
стинке для латекс-аrrлютинации. Результаты реакции учиты-
вают через 5 10 М'ин. В каждом опыте в качестве контроля
следует ставить реакции с каплей СЫВОрО11КИ, заведомо содер-
жащей австралийский антиrен. Исследуемые сыворотки с вы-
сокой концентрацией ЛИПИДов и желчных пиrментов необхо-
димо перед реакцией разбавлять в 2 4 раза.
14.2.4.
14.3. ОЦЕНКА МЕТОДА
Ниже указаны факторы, которые MorYT быть причиной
ложных положительных результатов.
1. Клей [6] в 1972 r. сообщил, что сыворот,ки больных, по-
лучавших некоторые лекарственные лрепараты, MorYT давать
ложную положительную реакцию латекс-аrrлютинацпи. При
маосовых. обследованиях здоровых доноров частота так,их
ложных положительных результатов ока'Залась ничтожно М'а-
лой. В 1973 r. Мэнти и Крейц [8] опроверrли данные Ке1ея
и показали, что результаты реакции в принципе не зависят
от лекарственной терапии.
2. Высокое содержаниелйпидов, а также желчных пиr-
ментов в иС'следуемых сыворотках может вызвать неспецифи
ческую аrrлютинацию латекса. Бсли аrrлютин'ация происхо-
дит и после разбавления сыворотки в 2 4 раза, положитель-
ную реакцию следует считать истинной.
118 К. ВU.1ЬЩ
3. По данным Миллера и оотр. [7], проrревание cьrвopoT-
ки при 56 ос в течение 30 мин освобсждает «СIКрЫТЫЙ» авст-
ралиЙский антиrен, котсрыЙ можно обнаружить с помощью
иммуноэлектрофореза. Однако в реакции латекс-аrrлютина-
ции такие проrретые сыворотки, наоборот, сла'бее нативных;
некоторые вообще не дают положительноЙ реакции, а боль-
шинство друrих rпоказывают сниженную активность. Не
исключено, что проrревание может быть методом выявления
ложных положительных сывороток.
4. Процедура ПРИI'отовления наrруженноrо латекса зави-
сит от содержания антител к австралиЙскому антиrену в ис-
пользуемсй антисьrворотке. Если антисыворотка очень актив-
на, тО' после присоединения у-rлобулина частицы латеюса
быстро оседают на дно. При отмывании в центрифужной про-
бирке они образуют плотныЙ осадок при относительно про-
зрачной надосадочнсЙ жидкости. В ЭТО'М случае надосадоч-
ную ЖИд'кость можно отбросить, а осадок ресуспендировать
в б6.'1ьшем объеме буфера, не опа'саясь потери активности в
реакции аrIiлютинации. Если же частицы лате са наrружены
y-rлобулинО'м из слабоактивноЙ сьrворотКiИ, то они, наоборот,
образуют небольшсЙ рыхлыЙ осадок с мутным слоем надоса-
дочноЙ жидкости. В этом случае натруженный Л'атекс не сле-
дует отмывать. Ею можно сразу же использовать в реакции
аrrлютинации, подобрав соответст,вующее разведение.
5. ПричиноЙ ложных положительных реа'кциЙ MorYT быть
также ревматоидные факторы. В этом олучае только клини-
ческая каР'f\ина помоrает провести дифференциальную диат-
н ости ку. Одна'ко СУiOпензии латекса, приrотовленные неда'вно
'в Bezirks-Institut fiir Blutspendewesen. (Росток, [ДР) дЛЯ
выявления В-антиrена, дали лишь очень небольшое число по-
ложителЬ'ных реакций с сыворотка'Ми, содержавшими рев'Ма-
тоидный фактор [9] (Iприсутствие ero было доказано в реа'к-
ции с латексом, наrруженны'M y-rлоБУ;Л1ИНОМ). Следовательно,
приrотовленные надлежащим образо'М латексы позволяют
практически пренебречь этим источником ложных положи-
тельных реакций.
6. Частота ложных отрицатель'ных реакциЙ составляет, по
имеющимся данным, 0,02%.
В качестве теста, выявляющеI'О аВ'стралиЙский аН11иrен
при мас'Совых обследованиях, латекс-ат,rлютинация имеет ряд
преимуществ перед встречным элеК11рофарезом:
1) она проще и не требует ка'кой-либо Ciпециальной аппа-
ратуры;
2) при достатО'чноЙ специфичности она более чувстви-
тельна;
14. ВыявлеН!ue австралuйскоzо ан.тиzен.а 119
3) она требует наименьших затрат времени по сравнению
с друrими метода'ми выявления 3'ВС1'рал/иЙ'скоrо антиrена;
4) для приrотовления наrруженноrо латек'са можНо ис-
пользовать любую, даже слабоактивную, антисыворотку к
ав'стралиЙскому антиrену.
Недостаток этоrо метода состоит в том, что не каждую се-
рию латеюса удается в достаточной степени наrрузить дан-
ным препараrом антител к австралиЙскому антиrену. До сих
пор только фирма Behring (ФРr) производит стандартные
суспензии наrружен'Ноrо латекса.
14.4. ЛИТЕРАТУРА
1. Leach 1. М., Ruck В, J., Detection of НАА Ьу the Latex Agglutination
Test, Brit. Med. J" 4, 597 598 (1971).
2. Boпacker L., 5tiirk J., Latex-Agglutination, eine schnelle Screeningmethode
zum Nachweis des НАА, Юiп. Wschr., 50, 166 (1972).
3. Fritz R. В., Юvеrs 5. L., НАА: Detection Ьу antibody sensitized latex par-
ticles, J. of Immunology, 108, 108 (1972).
4. Tilz О. Р., Serologischer Test filr Virushepatitis (HIM Test), Med. Юiпik,
65, 1302 (1970).
5. Wilms к., Latex Test zur Bestimmung des «Hepatitis associated antigen»
(НАА), Folia Наеm., 99, 385 389 (1973).
6. Кley 5., Falsch-positive Ergebnisse mit dem Latex-Fixationstest auf Aust-
ralia (SA) Antigen durch Medikamente, Dtsch. med. Wschr, 97, 1547
(1972) .
7. Miller J. Е., Rossmaп D. Р., Ziegeпfuss J. Р., Keпworthy Н. J., Serum he-
patitis with «Masked Australia antigen», JAMA, 221, 8 (1972).
8. Maпthey К. Р., Kreutz Р. н., Latex- Test zum N achweis des Hepatitis asso-
ziierten Antigens, Dtsch. med. Wschr., 98, 2070 (1973).
9. Wilms, к., Badeп О" Pl6tz Chr., 5chwager А., Eпgelmaпп С., Osteп М.,
Brauпer R., Zur Wertigkeit des Latex Testes aIs Nachweismethodc des Не-
раtitis В-Апtigепs bei Blutspendern, Dtsch, Ges. wesen, 30, 2141 2H3
(1975).
15. Реакция аrrлютинации лейкоцитов
C.BErEHEP
15.1. ПРИНЦИП
Аrrлютинация лейкоцитов происходит в результате взаи-
модействия антилеЙ'коцитарных антител с поверхностными
антиrенами этих клеток. При выделении лейкоцитов из пери-
ферической крови эритроциты осаждаются деКСТlраном.
РеаlКЦИЯ аrrлютинации лейкоцитов, разработанная в
1952 r. Доосэ и Ненна [21], положиЛ'а начало изучению лей-
КОЦ1итарных антиrенов. В этам разделе мы описываем микро-
метод, автор KOToporo Кисмейер-Нильсен [1].
15.2.
15.2.1.
ПРО ВЕДЕНИЕ ИССЛЕДОВАНИЯ
PeareHTbI и приборы
ИнфУКОЛJI I 6% (VEB Serumwerk, Бернбурr, [ДР)
Центрифужные П'робирки (100Х13 мм)
Штатив для центрифужных пробирак с наклоном 450
Стеклянные шариК'и диаметром 2 мм
Медицинское вазелиновое масло
0,1 % -ный раствор толуидиновоrо синеrо в 0,9% NaCl
6% -ный раствор уксусной кислоты
Микрошприц С дозирующим устроЙством (см. 20.2.1)
Ка'меры для постановки реакции: специальные масляные
микрокамеры, чашки Петри или панели для микрОТИТiро-
вания ('см. 20.2.1)
15.2.2.
Выделение лейкоцитов из крови
В центрифужную пробирку берут 8 мл крови из вены и
1 О мlин встряхивают с 6 8 стеклянными шариками (<<,буса-
ми»). Затем дефибринированную кро'Вь переливают во вто-
рую центрифужную пробирку, задержав стеклянной палоч-
'Кой фибрин и ша1рИКИ в первой пробир'ке, и смеШИlВают с 2 мл
6%-Horo инфуколла. Для оседания эритроцитов смесь поме-
щают на 30 мlин В термостат (37 ОС), закрепив пробирку под
уrлом 450. После Toro как эритроциты осядут, верхние две
1 6%-ный раствор декстрана (мол. вес 75000) в 0,85% NaCl (крове-
заменитель), Прuм', перев.
15. Реакция аzzлютинации лейкоцитов 121
трети слоя плазмы с лейкоцитами отсасывают и используют
в реакции аrrлютинации. Полученная взвесь лейкоцитов
должна содержать от 3000 до 6000 клето'к в 1 мм 3 . Если KOH
центрация лейкоцитов окажеТiСЯ меньшей, суспензию можно
сконцентрировать центрифуrированием.
15.2.3. Постановка реакции
С помощью микрошприца в масляную ка'меру или в лун-
ку панели для миwротитрования помещают 2 мкл ина'Ктиви
рованной при 56 ос сы'о'роткии и 1 :vIкл суспензии лейкоцитов.
Толщина слоя вазеЛiиновоrо масла, покрывающеrо реакцион-
ную смесь, должна быть около 2 M:vI. При иопользовании Ka
меры Терасаки в нее нужно для этоrо влить около 10 Л ва-
зелиновоrо масла. Лейкоциты инкубируют с сывороткой 1 ч
при 37 ОС, а затем в течение 3 мин камеру осторожно встря-
хивают. После этоrо леЙкоциты окрашивают, добавляя 1 мл
0,1 % Horo раствора толуидИ'новоrо оинеrо в 0,9% N aCl. PealК-
цию учитывают через 5 мин под микроскопом при увеличе-
нии в 60 100 раз. Если при этом мешают эритроциты, их
можно rемолизировать, добавив 1 мкл 6% -ной уксусной кис
лоты.
15.3. ОЦЕНКА МЕТОДА
Степень аrrЛЮТ1инации лейкоцитов, так же как и степень
лимфоцитолиза, часто трудно бывает оценивать. Аrrлютина
том считается rруппа из 5 и более клеток (см. фото 1, стр. 481).
Клетки в поле зрения
микроскопа лежат OT
дельно друr от друrа
Отдельные мелкие аrrлю-
тинаты
+
(аrrЛЮТИНllровано
до 25% клеток)
И:\1еются крупные arpera
ты, но большинство со-
ставляют клетки, .'1ежа-
щие по отдельности + +
( аrrлютинировано
до 50 % К.1еток)
Крупные arperaTbI среди
отдельно лежащих кле-
ток +++
( аrrЛЮТIIНировано
до 75% клеток)
Аrреrация почти всех кле
ток
++++
( аrrлютинировано
75 100% клеток)
122 С. BezeHep
В каждом опыте следует ставить отрицательный контроль
с нормальной сывороткой rруппы АВ и положительный конт-
роль с полиопецифической а'нтилеЙкоцита рной сывороткой.
В реакции аrrЛЮТiинации лейкоцитов возможны артефа'кты.
Особенно высока вероятность ложноro положительноro pe
зультата из за неспецифической атломерации. В связи с этим
необходимо обратить внимание на следующие моменты:
1) ложную положительную реакцию MorYT вызвать нор-
мальные rруппО'вые аrrлютинины АВО. Чтобы избежать это-
ro, следует всеrда ставить реа'кцию с лейкоцитами rруппы о;
2) rранулоциты имеют повышенную склонность к спонтан-
ной аrЛО:\1ерации. Поэтому концентрация клеток во взвеси не
должна превышать 10000 в 1 мм 3 , а скорость центрифуrиро-
вания (если оно требуется) 1200 об/мин;
3) иноrда ложные положительные реа'Ю.I!ИИ может вызвать
бактериальное заrрязнение исследуемых сывороток.
Реа'кция аrrлютинации лейкоцито'в rораздо чувствитель-
нее лимфоцитолиза ИJ!iИ связывания комплемента на тром,бо-
цитах [22]. Однако высокой чувствительности противостоит
весьма низкая воспроизводимость (примерно 85%) [23].
Именно из-за этоrо arr лютинацию лейкоцитов теперь не ис-
пользуют для пра'Ктической оценки совместимости тканей; но
ка'К метод изучения лейкоцитарных антиrено'в и антител она
сохраняет свое значение. В ча,стности, 'аrrлютинирующие
НL-А антитела иноrда появляются независимо от ли'Мфоци
ТОЛИЗiИнов [13], и их обнаружение, например при лихорадоч-
ных неrемолитических посттрансфузионных реакциях, имеет
Диаrностическое значение [24]; только с помощью реакции
аrrлютинации можно выявлять лейкоцитарные антиrены, не-
зависи'Мые от оистемы HL A, например лимфоцитарные анти-
reHbI 4а и 4Ь! [25] и специфические антиrены rранулоци-
тов [26].
Один из ва'риантов метода реакция так называемой
ЭДТА микроаrrлютинации [27, 28] имеет лучшую воспро-
ИЗ'ВОДrИмость, поскольку ЭДТА снижает вероятность неС'пеци-
фи'Ческой аrломерации лейкоцитов.
РеaJЩИЯ аrrлютинации лейкоцитов в капиллярах [29],
по 'видимому, имеет rораздо меньшую ошибку, чем обычная
аrrлютинация, и блаrодаря высокой чув,ствительносТ1И реко-
мендуется для выявления слабых антиrенов системы HL-A.
При массовых обследованиях можно пользоваться упро-
щенным макроскопическим вариантом реакции аплютинации
1 В настоящее время антиrены 4а и 4Ь относят к системе HL-A, но ан-
тисыворотки к ним считаются супертипичными, содержащими антитела
широкой специфичности, перекрестно реаrирующие с антиrеиами как пер-
Boro, так и BToporo локуса HL A. П рим. перев.
15. Реакция ilzzлютишщии лейкоцитов 123
лейкоцитов [30]. Две каIПЛ'И л,ейкоцитарной вз,веси смешивают
'в аrrлютинационной пробирке с двумя каплями (около
0,05 мл) исследуемой сыворотки. Затем содержимое Пlробир
ки переносят на обезжиренное предметное стекло. В этом
случае результат реакции, та'к же как и в ми'кроварианте,
можно определять при 60 100-'KpaTHOM увеличеН1ИИ.
Описок литературы см. 20.4.
16. Выявление аrrлютинирующих
антилейкоцитарных
11 антитромбоцитарных антител
В.ТЕССЕНОВ
16.1. ПРИНЦИП
Аrrлютинацией называется слипание частиц корпускуляр-
ноro антиrена (клеток; инертных частиц, наr.руженных анти
reHoM) под деЙствие1.1: антител. Связываясь с поверхностью
клеток или частиц, антитела соединяют их в аrrлютинаты.
Выявление антител, аrrлютинирующих. лейкоциты И.1И
тромбоциты, имеет значение как в клинике, так и в экс-пери
ментальной иммунолоrии [1, 4, 5]. Лейкоа'r:rлютинины появ-
ляются в сыворотке больных после повторных переливаний
крови и MorYT быть причиной посттрансфузионных О'СЛQжне-
ний. Их обнаруживают также при повторной беременности;
в редких случаях они вызывают rранулоцитопению у плода.
Лейкоаrrлютинины, так же как и лимфоцитолизины, исполь-
зуются при оценке тканевой СО8'м'естимости. С помощЬю реак-
ции аrrлютинации леЙкоцитов и лимфоцитов оценивают ак-
тивность rетеролоrичных антилимфоцитарных сывороток.
После повторных переливаний крови наряду с лейкоаrrлюти
нинами MorYT появляться и тромбоаrrлютинины; это случает-
ся реже, но они также MorYT быть причиной посттрансфузион-
ных реакций. Выявление холодовых тромбоаrrлютининов име-
ет Диаrностическое значение при спленомеrалии и симптомати-
ческой тромбопеничеекой пурпуре, при циррозе печени, Kpac
ной волчанке и злокачественных заболеваниях кро'ви. Реак-
цию атrлютинации применяют также для выявления специ
фических антиrенов лейкоцитов и тромбоцитов. АнтилеЙ'ко-
цитарные и антитромбоцитарные аутоантитела чаще Bcero
бывают неполными, и тоrда их можно бывает обнаружить
только в реакции потребления антиrлобулина. И наконец, в
диаrностике аллерrических лейко и трО'мбопений ПРИ1.1:еняют-
ся модифицированные реакции а'nrлютинации ('в присутствии
аллерrена) [1, 5].
Реакция аrrлютинации может быть количественной, по-
лукоЛ'ичественной и качеств'енной. Ее можно ставить в про-
бирке и на панелях для микротитрования. Количественная
оценка реакции леrче Bcero удается при работе с полисаха-
ридным:и антиrенами, коrда можно без помех определить ве-
16. iВыявление аzzлютuнuрующих ан.тuтел 125
личину азота антител [3]. Чаще Bcero реа'кцию ставят при
37 ос, однако холодовые аrrлютИНИНЫ выявляют при 4 ос.
Чисто качественные варианты реа'кции можно ставить при
комнатной температуре (ка'к и латекс аrтлютинацию). Наи
более ра,спространен ПОЛУКОЛiичественный u вариант реакции,
позволяющнй определить титр исследуемои антисывор'Отки.
16.2.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
16.2.1.
Реаrепты и приборы
Центрифуrа с 'Охлаждением; водяная баня на 37 ос; холо-
ДИ.1ЬНИ'К (4 ос); в'Одяная баня на 56 ос; видалевские пробир
ки; панели для аrrлютинации; аrrлютиноскоп; микроскоп;
счетные камеры; меланжеры для лейкоцитов и для эритроци-
тов; силикоН'ированные пробирки для выделения клеток; сек-
вестрен (Nа 2 ЭДТА); уксусная кислота (l%-ная, 3%-ная);
иенакаин (2%-ный ра'створ новокаина; УЕВ Jenapharm, Ие-
на, [ДР); человеческая сыворотка rрупп О и АВ; физиолоrи
ческий раствор NaCl.
16.2.2.
Выделение лейкоцитов
Лейкоциты выделяют из дефибринированной NрОВИ или из
'Крови, стабилизированной антикоаrулянтами. В первом слу-
чае примерно 30 мл крови rруппы О дефибринируют в колбе
Эрленмейера, ВС1iрюсивая со стеклянным;и буса'ми или пере
мешивая деревянной палочкой.
При стабилизации секвестреном 30 мл крови rруппы О
берут в пробирку с 3 мл 5% HOTO ра,створа секвестрена, что
IfIредотв'ращает ее свертывание. Цитрат или rепарин непри-
rодны для этой цели, так ка'к MorYT вызвать «ложные» поло-
жительные результаты.
ЛеЙкоциты выделяют путем избирательноrо осаждения
эритроцитов. Для этоrо на каждые 10 мл ста'билизирован-
ной крови доба'вляют 2,5 мл 5%-Horo pa1cTBopa декстрана и
оста'вляют смесь на 30 40 мин в пробирках, наКлоненных
,под уrлом 450. После оседания эритроцитов в 1 мкл розова-
T'Oro надосадочноrо слоя плазмы содержится приблизитель-
но 4000 6000 лейкоцитов, 30000 эритроцитов и 200000
тромбоцитов. Если исследуемая сыворотка не содержит
эритро- и тромбоаrrлютининов, ЭРИ1iРОЦИТЫ и тромбоциты не
мешают реа'кции лейкоатrлютинации. Количество леЙкоцитов
должно быть в пределах 4500 10 000 в 1 м;кл. Приroтовлен-
126 В. ТессеflОб
ную взвесь следует использовать в реакции немедленно, так
как довольно скоро может наступить спонтанная аrломерация
клеток.
16.2.3. Выделение тромбоцитов
Берут 30 мл крови rруrrпы О в пробирку С 3 мл 5% Horo
раствора секвестрена, перемешивают и оставляют на ночь
при 4 ос. На следующий день плазму с тромбоцитами отса-
сывают и цеН1'рифуrируют 10 мин при 200 g и 4 0 с. Плазму
отделяют от клеточноrо осадка (эритроцитов и лейкоцитов)
и вторично центрифуrируют (контролиро,вать под микроско-
ПО:\1!). ДЛЯ подсчета тромбоцитов суспензию набирают в Me
ланжер для эритроцитов и разбавляют иенакаином. ИХ KOH
центрцию доводят до 500 000 в 1 мкл.
16.2.4. Приrотовление серии рззведений
Исследуемый материал, чаще Bcero сыворотку БОЛЬRоrо,
разбавляют таким образом, чтобы получился ряд последова-
тельных раз:ведений, концентрация антител в которых долж-
на убывать в rеометрической ПрОI'рессии. Затем к каждому
раз,ведению добавляют одинаковый объем суспензии леЙlюи:и
тов или тромбоцитов. Наивысшее разведеН1ие иоследуемой 'Сы-
'Воротки, в котором еще происходит аnrлютинация добавлен
ных клеток, считают ее титром. Перед опытом сыворотку сле
дует проrреть 30 мин при 56 ос. ДЛЯ приr.oтовления разведе-
ний в шта11ИВ ставят нужное число видалеiJЮКИХ пробирок.
В первую пробирку помещают определенный объем, напри-
мер 0,2 мл, цельной сыворотки, а в о'стальные тот же объем
разбавителя (пtpостоrо или за'буференно'rо фосфатами физ'ио-
лоrическоrо раствора NaC1). Во второй пробирке к разбави
телю добавляют равный объем (т. е. 0,2 мл) цельной CЫBO
ротки и тщательно перемешивают несколько раз, в'сасывая
и выдувая обратно содержимое проб:ир'ки ПИ'I1еткой. Затем
стандартный объе:\1 (0,2 мл) смеси переносят в следующую,
третью, пробирку, тщательно смешивают с разбавителем и
перено'сят в соседнюю пробирку и т. д. до последней пробир-
ки ряда, из которой стандартный объем смеси выбра'сывают.
В результате получает,ся серия разведений, в которой содер-
жание исходной сыворотки (и соотве11ственно аН11ител) убы-
вает в rеометрической проrрессии 1 : 2, 1: 4, 1: 8 и т. д.
Последова тельные разведения сыворотки можно приro
товлять таким же образом не только в пробирках, но и на
стеклах с лунка'ми, на панелях для м'Икротитрования или на
раlCчерченных пластинках, дозируя peareHTbI каплями.
16. IВыявление аzzлютuнирующих антител 127
16.2.5.
Проведение реакции аrrлютинации
16.2.5.1
Титрование антилейкоцитарных 'антител
['отовят ряд последовательных разведений исследуемой
сыворотки (в объеме 0,2 мл, после проrрева при 56 ос в те-
чение 30 мин). В качестве разбавителя в данном случае
IIрименяют И'нактивированную нормальную сыворотку rруп-
'Пы АВ. К каждому разведению добавляют по 0,1 мл суспен-
зии лейкоцитов и инкубируют 90 мин при 37 ос в водяной
бане. Затем водоструйным насосом удаляют из кажщой про
бирки прозраlЧНУЮ наlдосадочную жидкость, а к осадку дo
ба'вляют по 0,1 мл 1 % -Horo ра'створа уксусной кислоты для
растворения эритроцитов. Пробирку осторожно встряхивают
и уЧiитывают аrrлютинацию леЙкоцитов с помощью аrrлюти-
,НQlскопа. В неясных случаях результаты реакции можно уточ
нить под МИКiрОС'IЮПОМ. Для положительной реакции харак-
терны лейкоцитарные аrrлютинаты различной величины, для
отрицательной равномерное распределение клеток в поле
зрения.
Контрольные пробы
1. Отрицательный контроль: rотовят ряд разведений сыво-
ротки здоровоrо донора (rруппа крови О); разбавителем слу-
жит сыворотка rру,П!пы А:В.
2. Положительный контроль: rотовят ряд разведений ан-
тисыворотки с ИЗ'Вестным титром антилейкоцитарных антител;
разбавителем служит сыворотка rруппы АВ.
3. Контроль разбавителя: пробир'ки с 0,2 мл сыворотки
,rруппы АВ.
Ко B1ceM контрольным пробам прибавляют по 0,1 мл взве-
си лейкоцитов. Инкубируют и учитывают реакцию так же,
как в опыте.
16.2.5.2.
Титрование антитромбоцитарных. ,антител
к наследуемой сыворотке ('после проrревания в течение
за м'Ин при 56 ОС) прибавляют 5% -ный раствор секвестрена
(0,1 мл на каждые 1,0 мл сыворотки) И rото'вят ряд Последо-
вательных раз'ведений в объеме 0,3 мл. Разбавителем служит
физиолоrичеокий ра,створ NaCl. В каждую пробирку вносят
по 0,1 мл взвеси тромБОЦIИ'ТОВ и инкубируют 90 мин при 37 ОС.
Затем содержимое пробирки слеrка ВС11ряхивают и рассмат-
ривают в аrТЛЮТ:ИНООКQlпе. Из последних пробирок, rде отме-
чена Положительная реакция, берут по НОСКольку капель
.128 В. ТессеflОб
суспензии и ПО:\1ещают на шлифованое стекло с лунками. Че-
рез 30 мин, Коrда клетк:и осядут, уточняют титр сыворотки
с ПО:\10ЩЬЮ МИКрОС'КOiпа.
Контрольные пробы
1. Отр'ицательный контроль: rотовят по,слеДовательные
разведения сыворотки здоровоrо донора (rруппа крови О) в
физиолоrическом растворе NaCl.
2. Положительный контроль: rотовят последовательные
разведения антисыворотки с известныМ титром антитромбо-
uитарных антител; разбавителем служит физиолоrический
раствор N aCl.
3. Контроль физиолоrическоrо раствора NaCI: пробирка с
0,3 :\1Л этоrо раствора.
КО всем контрольным пробам прибавляют по 0,1 мл взве-
си тромбоцитов, инкубируют и УЧIlтывают реакцию так же,
как в опыте.
16.2.5.3.
Аллерrические щитопении
Е'Сли реакцию аrrлютинаци:и поставить в присутствии ле-
карственното аллерrена, то можно выявить антитела, ПОЯБ-
.1яющиеся при :\1едика:\1ентозных цитопениях. Для этоrо ro-
тонят раствор чистоrо лекарственноrо препарата (без табле-
тирующих и прочих примесей) в забуференном изотоническом
ра,створе (рН 7,4). Чтобы избежать повреждения клето'к, ве-
личина рН полученноrо раствора должна быть в преде.lах
6,8 7,8. Если нельзя воспользоваться чистыми лекарствен-
НЫ:\1И препаратами, то берут rотовую форму и удаляют не-
раСТВОРИ:\1ые примес:и филыраuией или центрифуrиро'Ванием.
Концентрация препарата должна быть равна 0,3%; в случае
ero плохой раСТВОРИ:\10СТИ rотовят насыщенный ра'створ при
37 0 с. Если лекарственный препарат содержит несколько ак-
тивных веществ, то действие каждоrо из них следует изучить
отдельно. Приrотовленный раствор медикамента не должен
вызывать лиз'иса или аrреrации клеток здоровоrо донора; в
противном случае ero концентрацию следует уменьшить. Для
получения достоверноrо ответа необходимо поставить следу-
ющие опытные и контрольные пробы [1]:
1) сыворотка больноrо+лекарство;
2) сыворотка больноrо+растворитель;
3) нор'мальная сыворотка+лекар'ство;
4) нормальная сыворотка+растворитель;
5) лекарство+растворитель;
6) растворитель.
16. iВЫЯбленuе аzzлютuнирующuх антител 129
Для постанов'к:и этих проб в пробир'Ки помещают по 0,2 мл
исследуемой или нормальной сыворотки, по 0,2 мл раствора
лекар'ственноrо препарата или ра'створител и по 0,1 м.1 cy
пензии клеток. Реакцию считают истиннои положительнои,
если аrrлютинация происходит только в первой пробе при
отрицательных результатах во всех остальных пробах. Про
бы 1 и 3 следует поста'вить с несколь'ким'И, например с пятью,
последовательными разведениями сыворотки. В большинстве
случаев достаточно бывает контрольной п'робы 3, и ТО.1ЬКО
при положительном результате этой пробы нужно провадить
друr.ие контрольные реа'кции.
16.3. ОБЩАЯ ОЦЕНКА МЕТОДА
Положительный результат реакции аН лютинации необхо
димо интерпретировать с большой осторожнастью. Аrреrация
клеток к:рови может иметь множество различных причин, и
без дополнительных данных ее нельзя считать безус.повны
даказательством присутствия антител. В отличие от ЭрI!ТрО
ЦИТО'в леЙкоциты и трамбоциты весьма склонны к неспецифи
ческой аrреrации. Чаще Bcero такую аТ\реrацию вызывает
ба'ктериальное заrрязнение сыворотки. Поэтаму при оценке
результатов особое значение имеют контрольные пробы. Да-
же при постановке качественных реакций следует испытать
несколько разведений сыворатки, так как это позволит .1учше
различить специфическую и неопецифичеС'кую аrrлютинацию.
При неспецифической аrреrации абычно не наблюдается
уменьшения величины и количества af1peraTOB при опреде-
ленной степени разведения сыворотки. Ложную палож'ите.1Ь-
ную аrrлютинацию трамбоцитов MorYT давать сыворатки
'бальных с выраженной диспротеинемией.
ЧУВС1'вительность и воспроизводимасть разных вариантоз
реакции аrrлютинации весьма различны. Стефанини, Хэр
ринrтан и Доссэ предложили РЯ1Д более чувствительных MO
дификац:ий реакции трамбоцитоаrrлютинации [4], но мы не-
можем описать их здесь по атдельности. Часта с повышением.
чувствительности методики снижается васпроизводи:v[асть.
р'езультатав. Это относится прежде Bcero к тем метадикам,.
в каторых клетки крави MorYT повреждатЬ'ся при OTMЫBa
нии, центрифуrировании или обработке ферментами, и paa
ным образам Касается реакции лейкоаrrлютинации [2].
Реакции аrrлютинации имеют о,пределенное значение Прlf
вьшснении природы (токсической или аллерrическай) меди-
каментазных цитопений. Предполаrается, чтО' в основе ал.1ер--
rичесК'их цитопений лежит сенсибилизация к лека pCTBeHHa 1Y'
веществу (rаптену), связанному с белком. Аrrлютинация.
9 840
IЗО В. Тессен.ов
клеток крови это, вероятно, Л1ИШЬ вторичное следствие пер-
вичной реакции опецифических антител с ком!плеК'сом rап-
тен белок. Антитела, .евязанный с б лком rаптен или о'ба
участника реаю.ЩИ обладают особым сродством к лейкоци-
там или тромбоцита'м, и в результате клетки кр'ови паесивно
вовлекаются в реакцию. В пользу существо,вания по:добноrо
механизма rОБОрИТ то, что антитела, поЯ'вляющИ я при ал
лерrических цитопениях, сами по себе не аrrлютинируют
К.lетоК крови. Для аrтЛЮl1инации, т,ак же ка'к и для развития
цитопении, требуется присутствие лека'р'ственноrо вещест-
ва [5].
16.4. ЛИТЕРАТУРА
1. Bernhard J., Dausset J., Magis С., Les Cytopenies Medicamenteuses, Mas-
son et Cie, Paris, 1965.
2. Dausset J., Leuco-Agg1utination, in Methods of Immunhematologic Re-
search (Hrsg., С. Steffen), Вibliotheca Haematologica, 14, 31 65 (1963).
"3. Kabat Е., Mayer М., Experimenta! Immunochemistry, Thomas, Spring-
fie!d/IlI" 1961. (Русский перевод: Е. Кэбот, М. Мейер, Эксперименталь-
ная иммунохимия, М., «Медицина», 1968.)
4. Miesc}rer D., Die Immunhamato!ogie der Leukozyten und ТhrоmЬоzуtеп,
in: 1mmunpatho!ogie in Юiпik und Forschung (Hrsg., Miescher Р., Vor-
Iaender К. D.), S. 160 250, Georg ТЫеmе, Stuttgart, 1961. (Мишер Д.,
И:\lмуноrематолоrия лейкоцитов и тромбоцитов, в кн. «Иммунопатолоrия
В К,lинике и эксперименте и пробле lа аутоантител», пер. с нем., М., «Ме-
диuина», 1963.)
5. Steffeп С., AlIgemeine und experimentelle Immunologie und Immunpatho-
Iogie sowie ihre klinische Anwendung, Georg ТЫеmе, Stuttgart, 1968.
17. Титрование Rомплемента
1\1. ЗЕйФАРТ
17.1. ПРИНЦИП
В присутствии комплемента пртIСХОДИТ лизис ЭРИТРОЩl-
тов, сенсиБИЛИ3lированных антителами. Инкубируя такие
эритроциты с в.озра'стающими количествами КО:\1племента,
можно провести ero полукоЛ'ичественное определение. За еди-
ницу количества кО'м'пле:\1ента (СН 50 ) принимают а'ктивность,.
необходимую для r,емолиза 50% оптимально сенсиБИ.1ИЗИРО-
'ванных эритроцитов. Ниже опиоан метод ТИтрован'ия КОМП.1е-
мента, модифицированный Х)lIбером и сотр. [2].
17.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
17.2.1. Реаrепты и приборы
Водяная баня на 37 и 56 ОС; центрифуrа с охлаждением
(К23, УЕВ Zentrifugenbau, ЭнrелЬ'сдорф, r ДР); барбита.10-
вый буфе:р.
1. Исхадный буферный раствор:
NaCl
N а-5,5-диэтилбарбитурат
1 н. раствор HCl
MgCl 2 .6H 2 0
CaCl 2 .6H 2 0
Дистиллированная вода
41,5 r
5,1 r
17,3 мл
0,51 r
0,164 r
до 1000,0 мл
2. Рас'Тв.ор желатины (rоден не более одной недели): 10 r
желатины наr,ревают в 100 мл ДИС11илЛ'ированной воды до
полноrо растворения и доводят объем раствора до 800 M .
3. Рабочий буферный ра'створ: смешивают 1 часть исходноrо
буфера с 4 частями раствора желатины, рН должен быть
7,3 7,4.
rемолизин: кроличья rемолитическая антисывО'ротка к ба-
paHьиM эритроцитам (УЕВ Sa'chsisches Serumw€rk, Дрезден).
Фотометр, ширина кюветы 1 см, длина волны 541 Ю1.
Бараньи эритроциты в растворе Олсвера (2 6 неде.1Ь ПОС'-
ле взятия крови);
Сапонин (порошок)
9*
132 М. 3ейфарт
Исследуемая сыворотка, содержащая ком:племент.
Сыворотку получают из крови, которую берут без анти-
'коаrулянтов, оставляют для свертывания на 1 ч при ком-
натной температуре, затем центрифуrируют 10 мин при
3000 об/мин и 4 ос. Комплемент титруют сразу же после
получения сыворотК'и; хранение даже в замороженном
состоянии пр'Иводит к ero ча'стичной инактивации. Из-за
термолабильности некоторых факторов комплемента 'осе
процедуры следует проводить в ледяной бане, если не
сделано иных указаний.
17.2.2. Приrотовление взвеси эритроцитов
Эритроциты ТР'ЮIЩЫ отмывают буфером, цеНТР l ифуrируя
10 :'Ушн при 2000 об/мин, и разводят тем же буфером до 109
клеток в 1 мл. Измерив объем (V Н) полученной взвеси, берут
n,2 мл ее и лизируют в 4,8 мл дистиллированной воды. Опре-
.:деляют оптическую плотность (ОП) лизата. rотовая взвесь
эритроцитов До.пжна иметь ОП 0,375. Конечный объем (V н)
rотовоЙ взвеси ВЫЧИJсляют по формуле
ОП
Vк===V и , 0,375 .
17.2.3.
Титрование rемолизина
в 6 центрифужных пробирок разливают по 0,5 мл буфера.
В первую пробирку вносят 0,5 мл rемолитической сыворотки,
разведенной 1: 100, перемешивают и 0,5 мл смеси переносят
:в следующую пробирку; снов:а перемешивают, переносят и
-так далее, с тем чтобы получился ряд разведений в rеометр'И-
ческой проrрессии (от 1: 200 до 1: 6400). Затем в каждую
llробпрку добавляют по 0,5 мл взвеси эритроцитов и инкуби-
"руют ЗU мин при 37 ос, после чеrо вносят по 5,5 мл буфера
JИ по 1 мл соответствующеrо разведен'ия комплемента (сы-
1ЮрОТКУ, содержащую комплемент, разводят так, чтобы обес-
nеЧ!JIТЬ лизис 40 80% сенсибилизированных эритроцитов,
JIапример человеческую 1: 40, морской свинки 1: 200). Про-
.бирки инкубируют 1 ч при 37 ос, затем центрифУirируют
1 О :'Ушн при 2000 об/мин и измеряют ОП на(Дооадочной жид-
.:кО'СТП.
С увеличением концентрации rемолизина (т. е. с уменьше-
:нием разведения rемолитической сыворотки) степень rемоли-
;за возрастает, достиrая плато. Наибольшее разведение reMo-
:литической сыворотки, которое еще дает максимальный
.:лизис эритроцитов, называется rемолитической единицей [е-
1,{олизина (амбоцептора).
17. ([итрованuе КОJ,(Ллемента 133
17.2.4.
Сенсибилизация эритроцитов
к 10 мл взвеси эритроцитов прибавляют 10 мл разведен-
'Ной Fе:vюлитической сыворотки, содержащей 4 rемолитиче-
ские единицы, тщательно 'Перемешивают и инкубируют
30 мин при 37°с. Полученную та'КИМ образом взвесь сенсиби-
лизированных эритродитов можно в течение дня (но не
дольше) хранить пр'и 4 ос.
17.2.5.
Титрование комплемента
Исследуемую сыворотку разводят 1: 30, затем rотовят
пробы, указанные в табл. 3.
Таблица 3
РеаrеиТ
1 1 1 2 I 3 I 4 I 5 I 6 1 7 1 8 I 9 /10 111 112
Номера пробирок
Сыворотка 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
1 :30, мл
Буфер, мл 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 1,0
Дистиллированная 1,
вода, ,мл
Взвесь сенсибили- 2 2 2 2 2 2 2 2 2 2 2 2
зиро'Ванных
эритроцитов, мл
О
В 12 ю пробирку, [де должен быть 100 % -ный rемолиз, до-
бавляют чуть чуть сапонrина. Все пробы инкубируют 30 мин
при 37 ос, затем центрифуrируют 10 мин при 2000 об/мин и
измеряют ОП против надосадочной жидкости 11-й пробир-
ки (<<холо'стая» проба).
17.2.6.
Расчет
Для каждоrо разведения сыворотки (пробирки 1 10) вы-
ч'исляют степень rеМ'олиза (у) и величину 1 у у' Нужные для
расчетов таблицы можно найти в руководстве Кабата н
Мейера(3]. На лоrарифмической бумаrе строят rрафик за-
висимости величины 1 у у от объема (х) исследуемой сыво-
ротки (рис. 39).
134 .\1. Зейфарт
На rрафике находят тот объем исследуемой сыворотки (то
) у о 5
значение х , при котором l y == 1 == Т '0,5 ' т. е. происходит
50% ный rемолиз. Затем по формуле СН 50 == определяют
число rемолитических единиц на 1 мл (а фактор первона
.
!::I
'
<\.i....
.
O,ftO
0,30
0,25
0,20
0,15
0,1
0,2 0,30,"0,5
УЛ у
Рис. 39. Титрование комплемента [2].
1,0
2,0
чальноrо разведения И'сследуе:vrой сыворотки, в данном слу
30
чае 30). Например, при х==0,3 мл СН 50 == 03== 100. В нор'ме
,
1 IЛ сыворотки человека содержит 70 150 СН 50 ко'м.пле-
мента.
17.3. ОБЩАЯ ОЦЕНКА МЕТОДА
Титрование коМ'племеН'I1а дает общее представление о ero
Л'итической а'ктIИВНОСТИ. Описанная ,методика является лишь
полуколичественной, так как число СН 50 в 1 :vrл отражает
активность комплемента только в данных условиях опыта.
Чтобы получить сопоставимые данные, в каждый опыт необ-
ходимо включать стандартный препарат комплемента. Сле-
дует учитыва'Ть, что даже хранение сывороток при 25 ос не
ис'Ключает снижения активности кО'МплеменТа. Во время опы-
та все манипуляции с ком'плементом следует ПРОВОЩIТь в ле-
дяной бане. Если комплемент титруется от случая к случаю,
то каждый раз необходимо вновь определять активность [е-
молизина. Целесообразно дублировать все пробы и в каче-
стве контроля использовать нормальную сыворотку Toro же
донора.
Данный метод не дает никаких сведений о состоянии от-
дельных факторов С'исте:vrы 'Комплемента. Такие сведениЯ
можно получить с пом,ощью радиальной иммунодиффузии по
Манчини с моноспецифическИ'ми антисыворотками. Межд.у
концентрацией СЗ и общей rемолrитической актиВIЮСТ!)Ю
17. TUTpOBalVue IWмплемен.та 135
комплемента должна существовать тесная корреляция [4, 5
и др.]. С3 леrко определяется иммунохимически с относитель-
но малой ошибкой. При этом концентрацию С3 можно выра-
зить в абсолютных величинах, '80'СПОльзовавшись стандарт-
ным препаратам еоот,ветствующеrо белка. В этом случае воз-
можно пр'именение постоянных стандартов, так как получае-
мые данные не зависят от потери биолоrической активности
ком'пле:мента при хранении.
Описок литературы см. разд. 18.4.
18. Реакция связывания комплемента
(РСН)
1\1. ЗЕйФАРТ
18.1. ПРИНЦИП
РСК позволяет полуколичественно определять комплек-
сы антиrен антитело, связывающие компле:мент. Если в
данноЙ системе содержится оrраниченное количество компле-
мента, то образовавшиеся иммунные комплексы ero полно
стью или ча>С'I1ИЧНО связывают. Потеря комплемента пропор-
циональна количеству образовавшихся комплексов. Индика-
торами связывания комплемента служат эритроциты, сенси-
билизированные rемолизином. Комплемент, оставшийся не-
связанным, вызывает rеМОЛlIJ3 (отрицательная реакция). При
фиксации Bcero комплемента комплексами антиrен антите-
ло rемолиз ОТСУ11ствует (положительная реакция). Изложе-
ние теоретических основ РСК и обзоры соответствующей ли-
тературы можно найти в специальных руководствах [1, 3].
В основу описанноrо ниже варианта РСК положена ме-
тодика, ПРИ lененная РоЙттом и Дониаком [6] для выявле-
ния тканевых аутоантител.
18.2.
18.2.1.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
Реаrенты и приборы
Микротитратор Такачи (VR, Венrрия); панели для мик-
ротитрования (8Х 12 .1УНОК); калиброванные капельные пи-
пеТКIИ и пеТ.1И (на 0,025 мл); водяная баня на 37 и 56 ОС.
Источник ко:мплемента: сыворотка морской свинки, замо-
роженная при 25 ос или лиофилизированная; rемолизин:
кроличья антисыворотка к бараньим эритроцитам (УЕВ
Sachsisches Serum\verk, Дрезден), разведенная 1: 100 буфе-
ром (см. 17.2.1).
Uентрифуrа с охлаждением (К 23, УЕВ ZепtriflIgепЬаt1,
Энrельсдорф, r ДР)
Антиrены: rOMoreHaT тиреотоксической щитовидной желе-
зы, микросомы из щитовидной .железы, слизистая дна же-
.1уДка, кора надпочечника, орrанонеспецифические антиrены
(митохондрии) и др.
БарбиталовыЙ буфер: сМ. 17.2.1.
Бараньи эритроциты в растворе Олсвера (храНЯЩlIССЯ
при 4 ос 2 6 недель после взятия крови; перед опытом
18. РеаКЦиЯ ,связывания iКомплемента (РСК) 137
ЭРИТIЮЦИТЫ трижды отмывают буфером, центрифурируя по
1 О МИН при 2000 об/мин, и суопенД!ируют )1:0 3.108 'Клеток
I3 1 мл).
АНТJIСЫВОРОТКИ дЛЯ положительноrо контроля, содержа-
щие антитела к перечисленным антиrенам.
18.2.2.
Титрование rеМОJIизииа
При титрован'ии rемолизИ'на определяют то разведение
rеМОЛlитической сыворотки, которое оптимально сен,сибилизи-
рует взвесь эритроцитов (являющуюся индикаторной систе-
мой).
В лунки одноrо ряда U-панели помещают по 0,025 мл бу-
фера, затем в первую лунку при помощи петл'И вносят
0,025 мл rемолизина, раз'вменноrо 1: 100; перемешивают и
'Переносят материал в следующую лунку, и та'к далее, что-
бы получила,сь rеаметричес'кая проrреС'сия из 8 разведений
от 1 : 200 до 1 : 25600. После этоrо в каждую лунку вносят по
0,025 мл взвеси эрит,роцитов, :по 0,025 мл буфера и по
0,025 мл комплемента. Комплемент морской свинК'и следует
развести таким образом, чтобы он вызывал rемолиз 40 80%
сенсибилизированных эритроцитов ('пр:имерно 1: 200). Па-
нель слеrка встряхивают и инкубируют 1 ч при 37 0 с. При
оценке резулыа'тов реа'кции определяют то наибольшее раз-
,ведение rемолизина, которое еще вызывает опТ\И'мальный re-
'моли'З. Это разведение принимают за «rемолитичеС'кую еди-
ницу».
Для сенсибилизации смешивают равные объемы взвеси
Э,ритроцитов и Toro разведения rемолизина, которое соответ-
ствует 2 rемолитическим единицам. Смесь инкубируют 30 мин
при 37 ОС. Сенсибилизированные эритроциты можно хранить
при 4 ос не более 18 ч.
18.2.3. Титрование RОМПJIемевта
Комплемент титруют, чтобы стандартизовать ero КО.,1иче-
'Ство в Сlистеме.
В лунки одноrо из рядов U-lпанели помещают по 0,025 мл
буфера. В первую лунку помещают 0,025 мл сыворотки мор-
с'кой свин'ки, пред'в,арительно разведенной 1: 5, а затем де-
лают ряд разведений в rеометрической проrрессии от 1: 10
до 1 : 1280. Затем в каждую лунку вносят по 0,025 мл сенси-
билизированных эритроцито'в и по 0,025 мл буфера, после
'Чеrо панель инкубируют 1 ч пр'и 37 0 с.
Наименьшее разведение комплемента, при котором на ДНе
лунки еще можно заметить осадок не.пизированных эритроци-
138 М. ЗеЙфарт
тов, пр'Инимают за «минимальную rеМОЛ1ИЗИРУЮЩУЮ дозу»
U v lr Д). в основном опыте используется то разведение ком-
П.1емента, которое соответствует 2 Mr д.
18.2.4.
Титрование антиrена
Титруя антиrен, находят ero оптимальную для данных yc
ловий апыта дозу. При этом следует убедиться в том, что
антиrен не обладает собственным антикомплементарным
действием.
В проБИр'ках rотовят ряд последовательных двукратных
разведениЙ антиrена от 1 : 2 до 1 : 256 в объеме 4 мл.
Затем на U-'панели делают несколькО' рядов последова
тельных разведений соответствующей контрольной антисы-
ВОРОТКИ. Число рЯДО'В должно на 1 превышать число разве
дениЙ аНТИl'ена. Сначала в лунки вНО'СЯТ по 0,025 мл буфера,
за Te титруют в нем 0,025 мл антисыворотки. После этоrо в
в .1УНКИ каждarо из рЯiдОВ вносят по 0,025 мл одноrо из раз-
ведений антиrена, а в ЛУНКИ дополН>ительноrо ряда пр'Ибав
ляют по 0,025 мл буфера (контроль). Затем во все лунки
панели вносят по 0,025 мл ком:племента (2 Mr Д) и инкуби
руют 1 ч при 37 0 с. После инкубации в каждую лунку дo
бавляют по 0,025 );1.1 взвеси сенсибилизированных эритроци-
тов и вновь инкубируют 1 ч при 37 ОС.
Результаты реакции MorYT быть учтены лишь в ТОм слу-
чае, если в контрольном ряду без сыворот'Ки происходит пол-
ныЙ rемолиз. Для OCHOBHoro опыта следует выбрать наиболь
шее разведение антиrена, которое в лунке с максимальным
разведением контрольной антисыворотки еще задержива'ет
rемолиз. Если задержка rемолиза на6людает'ся и в наиболь
ше-м разведении антисыворотки, то это означает, что анти-
reH обладает антиком:плементарными своЙствами и ero не.1Ь-
зя иопользовать в РСК
18.2.5.
Основной опыт
Исследуемую сыворотку проrревают 30 мин ПрИ 56 ОС.
В три рЯiда лунок U-'панели вносят по 0,025 мл буфера. В 1-м
и 2-м рядах rотовят по'следО'вательные разведения изучаемой
сыворотки. В лунки 1 ro и 3-11'0 рядов ВНОСЯТ по 0,025 мл оп-
тимальноrо разведения аНТИl'ена, а в лунки 2-то ряда тот
же объем буфера. В лунки В'сех рядов iПрибавляют по
0,025 мл комплемента (2 Mr Д) и инкубируют 1 ч при 37 0 с.
Затем в каждую лунку вносят по 0,025 мл С'еН1спбилизирован-
ных ЭРИТРОЦИТОВ, слеrка встряхивают для перемешивания и
вновь ин'кубируют 1 ч при 37 ОС.
18. Реакция С8ЯЗЫ8ШlUЯ комплемен.та (РСК) 139
Результаты реакции MorYT быть учтены лишь в том слу-
чае, если во 2-м (контроль сыворотки) И в 3 M (контроль ан-
тиrена) рядах произоiЩет rемолИЗ. Анти'комплементарные ан-
тиrены неприrодны для реакции. Если аК11икомплементарной
окажет,ся исследуемая сыворотка, нужно повторить опыт с
друrим ее образцам; иноrда приходится отказаться от про-
ведения реа'кции с данной сывороткой.
У'читывая результаты, определяют то наибольшее разве-
дение сыворотки, при котором осадок ЭРIИТРОЦИТОВ еще за-
метно уменьшаеl'СЯ, а нащосадочная жи кость имеет ясно
видимую окраску (что соответствует примерно 50%-ному re-
молизу) . Это разведение и принимают за титр исследуемой
сыворотки.
18.3. ОБШАЛ ОЦЕНКА МЕТОДА
Описанный метод можно видоиз'менить для работы с б6.1Ь-
шюш об1JемаlМИ peareHToB [6, 7]. По чувствительности РСК
примерно соответствует реа'кции па,ссИ'вной r,емаплютинации
(рпr А), но усту/пает ей при иопользовани:и некоторых анти-
reHoB. Обычно РСК применяют вместо рпr А в тех случаях,
коrда смесь антиrенов очень reTeporeHHa или Коrда невоз-
можна фиксация антиrена на эритроцитах.
рек дает достоверные результаты лишь при условии оп-
тимальноrо взаим'одеЙСНJИЯ В'сех peareHToB. Для стандартиза-
ции э'ритроцитарной взвеси мож'но применить подсчет эритро-
цитов в ка'мере, измерение оптической ПЛОТНОIСТИ после осмо-
тичеекоrо rемолиза или определение rематокрита [1]. Надо-
садочная жи.дкость после первой отмывки эритроцитов не
должна быть окрашена rемоrлобином; в противном случае
нужн'о взять друrую партию эритроцитов.
Са,мый ответственный момент РСК титрование КОМПv1е-
мента. Оно в значительной мере определяет точность и вос-
ПРОИЗВОДИМОСТЬ окончательноrо р'езультата. Из-за термола-
6илЬ'н.Q!СТИ некоторых факторов комплемента все этапы реак-
ции, не требующие тепла, следует проводить на холоду.
В разных модификациях РСК условия инкубации MorYT
сущест.венно различаться. Часто реакционную смесь на этапе
связывания ко шЛ'емента инкубируют ли'бо 1 ч при 37 ОС, ли-
бо в течение ноч'и при 4 ос. ДЛЯ каждой сИ/стемы антиrен
антитело существует своя оптимальная температура и свое
оптимальное время ИНКJ'lбации, которые следует подобрать в
предварительном опыте. Чтобы уменьшить испарение, кото-
рое особенно опа'сно при работе с малыми объемами peareH-
тов в микротитраторе, панели во время инкубации необхо-
димо тщательно прикрывать.
140 М. Зейфарт
РСК относится к традиционным методам микробиолоrи-
ческой ДiИа'rностики. В зависимости от зада'чи исследования
в серолоrии [8] и в вирусолоrии [9] используются разные ее
модификации.
18.4. ЛИТЕРАТУРА
1. Casey Н. J., Standardized Diagnostic Complement Fixation Method and
Adaptation to Micro Test, риыic HeaJth Monograph No. 74.
2. НиЬе, Н., Pastпer D" Gabl F., Laboratoriumsdiagnose Ыimato!ogischer und
immunologischer Erkrankungen, Springer Verlag, Berlin G6ttingen
Heide!berg, 1972.
3. Kabat А. Е., Мауе, М., Experimenta! Immunochemistry, С. С. Thomas
PubIisher, Springfield/IlI., 1961. (Кэбот Е., Мейер М., Экспериментальная
иммунолоrия, М., «Медицина», 1968.)
4. Marghescu 5., Ober die quantitative Bestimmung des Komplements mittels
Immunodiffusion, Юiп. Wschr, 46, 991 (1968).
5. Кleтperer М. R., Gotoff 5. Р., Alper С. А., Levin А. 5., Rosen F. 5., Esti-
mation af the serum 1C-g!obulin concentration: its relation to the serum
hemo!ytic complement titer, Pediatrics, 35, 765 (1965).
6. Roitt J., Doniach D., WHO-Book of immuno!ogic techniques, World Health
Organization, Genf, 1966.
7. 5teffen С., AlIgemeine und experimentelle Immuno!ogie und Immunpatho-
Iogie, G. Thieme Verlag, Stuttgart, 1968.
8. Hudeтann Н., Ein Entwurf zu Richtlinien fi.ir die Ausfi.ihrung serologi-
scher Untersuchungen auf Syphilis, Z. gesamt. Hygiene, 9, 390 398
(1963).
9. 5tarke G., Virologische Praxis, 2, Auflage. Fischer Verlag, Уепа, 1968.
19.
Определение
антитромбоцитарных антител
в реакции связывания комплемента
З. ЛЕВЕРЕНЦ
19.1. .
ПРИНЦИП
Реакцию овязывания комплемента (РСК) 'в серолоrию
тром\боцИ'тов ввел АккроЙд [1]. Опустя неСКОЛ!JiКО лет Шу.1Ь
ман [2, 3], Астер [4], ван дер Веердт [5], Коломбани [6]
и Овейrаард [7, 8] ПРIИ'менилиее с некоторыми изменениями
для выявления антитромбоцитарных изоантител. Она ИСПО.1Ь
зовалась ка'к в количественном [2, 3, 7], так и в качествен
ном [4] вариантах. Так как антиrены rистосовместимости..
которые обнаружены во всех клетках орrанизма, в том чис.1е
и тром\боц\итах, приобретают все большее значение, возраста-
ет и 'Интерес к методам их выявления. На IV Международ-
ной конференции по тканевой совместимости в 1970 r. ряд
а'второв предложил ,микромодификацию РСК дЛЯ тромбоци
ТО'В, которая была затем опубликована и рекомендована как
стандартная М1икрометодика [9].
В основу методики положен принцил РСК, первонача.1ЬНО
описанный в руководстве Кабата и Мейера [10]. Антите.lа,
взаимодействуя с соответствующим антиrеном, фиксируют-
ком'племент. Потеря комплемента определяется с помощью'
сенсибилизированных бараньих эр:итроцитов (вторая систе-
ма антиrен антитело). Если комплемент не фиксируется в:
!Первой системе, т. е. не происходит реакции антиrен анти
тело, то сеноибилизированные эритроциты полностью лизи
руются.
19.2.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
19.2.1.
Реаrенты и приборы
PeareHTbI: 0,9 % -ный раствор N аСl; 5% ный раствор-
Nа2-ЭДТА в 0,9% NaCl; 0,1 % ный раствор азида натрия в.
0,9 % N аСl; вероналовый буфер; rемолитическая антисыво
ротка к бараньим эритроцитам (rемолизин); бараньи ЭрIIТрО
циты; комплемент; тромбоциты; исследуемая сыворотка; ва-
зеЛиновое масло (УЕВ Werke «Walter UJbricht» ЛеЙна
[ДР). ' ,
KalMepbI для микротитрования (микрокультивирования
тканей) NQ 3034 (Fal'conPlastics Tecnomara AG, ЦЮРIIХ);
142 З. Левере1tц
rамилыоновские шприцы 705N и 710 N с дозатором РВ 600-1
(Наmiltоп Micromessure N. У. Р. О. Вох 205, raara); тepMO
стат на 37 ос; водяная баня на 37 0 С и на 56 ос; центрифуrа;
холодильник; вибрационный смеситель; центрифужные про
бирки; пробирки для титрования; мерные пипетки.
БСJIИ реа'кцию планируется ставить повседневно, то необ
ходнмое количество peareHToB следует заrотов'Ить заранее.
Вся стеклянная посуда должна быть химически чистой и
свободной от бактериальноrо заrрязнения. Ее нужно обра-
ботать хромовой смесью.
ВеронаЛО8ЫЙ буфер с рН 7,4 (концентрат):
5,5 диэтилбарбитуровая кислота
5,5 диэтилбарбитурат натрия
NaCl
1 М раствор MgCl 2
1 М раствор СаС1 2
Дистиллированная вода
5,75 Mr
3,75 r
85,0 r
5,0 мл
1,5 мл
до 2000,0 мл
Концентрат буфера автоклавируют. Перед употреблением
1 часть разбавляют 4 частями дистиллированной воды.
Fемолизин. Стабилизированный ра'ств'ор rемолизина
(1: 100) можно приrотовить по Шпильману и Шульцу [11]:
0,9 % ный раствор N aCl 94,0 мл
5,0% ный раствор фенола в 0,9% NaCl 4,0 мл
rемолизин ],0 мл
rющерин (фармакопейный, для разведения reMO- 1,0 мл
.тrизина)
Этот раствор МОЖiНО ИСПОЛЬ'30вать через 3 4 дня после при-
f'отовления. Стабилен несколько недель.
Бараньи эритроциты: кровь берут сrерильно 1: 1 в reMO-
{:та6И.1изатор [12] и до Пр'именения выдерживают окола
'6 дней при 4 ос. Хранить можно 4 6 недель.
Комплемент. Сыворотка rруппы АВ: смешивают свежие
!Сыворотки АВ с титром комплемента не менее 1: 25 (полу-
ченные от здоровых мужчин, у которых в анамнезе не было
переливаний крови) и мелкими порциями хранят в жидком
а:зоте или при 80 ос. В жидком азоте ком,племент стабилен
несколЬ'ко месяцев. Комплемент морской свинки: смешиваЮт
сыворотки животных с титром КОМiПлемента не менее 1 : 60 и
тотчас замораживают или лиофилизируют небольшими пор-
ЩИЯМИ. Блатодаря высоким титраlМ комплемент морской сnин-
К'И несколько дней сохраiняется пр 'И 20 ос. При ИICПОЛl>зоnа-
19. Определение ,(lнтиТРОJибоцитаРНblХ антител 143
нии ч,еловеческой СЫВОРО11КИ АВ чувствительность РСК повы-
шается [6, 13].
Взвесь тромбоцитов. В зависимости от количества иссле
дуемоrо антиrена берут от 10 до 60 мл крови В 5% -ный pac
твор N а 2 ЭДТ А (1 : 9), оставляют на 1 ч при комнатной TeM
пературе для оседаНtИЯ эритроцитов, затем центрифуrируюr
10 мин при 200 g и отсаlсывютT из надосадочной жидкости
примерно 4/5 плазмы с тромбоцитами. Если в плазме еще
остаются эритроциты, ее снова центрифуrируют 1 О мин при
200 g. Надосадочную жидкость, содержащую только ТрО:vfбо
Цiиты, декантируют и центр'Ифуrируют 15 мин при 1600 g.
Осадок тром,боцитов трижды промывают 0,9% -ным раство-
ром NaCl, центрифуrируя в том же режиме, и СYiспендируют
в 0,9% -ном растворе N aCl, содержащем 0,1% азида натрия,
до концентрации 2.106 в 1 мкл. Полученную суспензию :vfож-
но хранить при 4 ос свыше месяца (при стерильной обработ-
ке ДО rода). Перед применеН1ием взвесь тромбоцитов разбав
ляют до 0,5.106 В 1 мкл.
Свежеприrотовленная взвесь тромбоцитов фиксирует мень-
ше комшлемента, чем взвесь, фсозревшая» за 24 ч [7, 14]. Это
может быть причиной ложных отрицательных реакций при
сла'бых антисыворотках. СУCiпензию тромбоцитов из крови,
взятой в оксалат аммония, можно использовать сразу же
после приrотовления [15].
Сыворотки. Для выявления антиrенов HL A на TpOM
боцитах и друrих клетках ПРИ:vfеняют сыворотки, полученные
после повторных беременностей, переливан'Ий крови или
траноплантации тканей. Кроме Toro, доноров ,доБРОВО,lьuев
специально иммуниз'ируют антиrена'Ми HL-A. Сыворотки по-
лучают по возможности стерильно и хранят небольшими пор
циями Пр'И 20 ос или в жид'ком азоте, избеrая повторных
оттаиваний. Обычно полученные сы'оротк'ии полиспецифичны,
но с помощью абсорбции и элюции из них можно приrото
вить в известной мере МОНОСllецифические а,Н11Иtсыворотки
[16]. Нсе используемые сыворотки следует nporpeTb при
56 ос в течение 30 мин. Для разведения сывороток ИСПО.1Ь
зуют вероналовый буфер. Если приходится разводить сыво-
ротку более чем в 10 раз, то к буферу добавляют 10% -Н'V'Ю
инаК11ивированную сыворотку АВ. -
19.2.2.
Проведение исследования
19.2.2.1. Сенсибилизация бараньих эритроцитов
Бараньи эритрО'циты 3 4 раза ОТiмывают стерильным
раст,вором NaCl; последнюю отмывку делают вероналовым
буфером. Из осадка rотовят су,спензию в том же буфере, со-
144 З. Левере1tц
держащую 4.106 эритроцитов в 1 мкл. Для сенсибилизации
к взвеси эритроцитов медленно до,бавляют равный объем re-
МОЛИЗ1ина, титр которото должен быть подобран в предвари
тельном опыте. Смесь инкубируют 30 мин в водяной бане
при 37 ОС, мнотО'кратно перемешИ'вая, а затем хранят ,при
4 ОС. Сенсибилизированные эритроциты следует приrотовлять
:в день опыта.
19Д.2.2.
Определение оптимальноrО 'титра rемолизина
rотовят 6 последовательных раз'Ведений rемолизина от
1 : 400 до 1: 12800 в 2 мл вероналовото буфера. К каждому
разведению прибавляют по 2 мл свежеприrотовленной взве-
си бараньих эритроцитов (4.106 в 1 мкл) И производят их
сенсибилизацию.
Далее ставят реакцию в камере для микротитрования под
вазетшовым маслом. Комплемент доба'вляют в избытке
чеJ10веческую сыворотку АВ в разведен'ии 1 : 10 или сыворот-
ку :\fОр.ской свинки 1 : 20. Схема титрования:
Разведение rемолизина
1:400 1:800 1:1600 1:3200 1:64001:12800
Комплемент, мкл 2 2 2 2 2 2
Вероналовый буфер,
мкл 2 2 2 2 2 2
0,1 % ный раствор ази
да натрия в 0,9%
N aCl, мкл 2 2 2 2 2 2
Сенсибилизированные
эритроциты (2. 1 Об
В 1 мкл) из каждоrо
разведения rемоли
зина, мкл 2 2 2 2 2 2
Камеру инкубируют 30 мин при 37 ОС, затем центрифуrиру-
ют, чтобы осели эритроциты, и учитывают результаты. Счи-
тают, что то наибольшее разведеН1ие rемолизина, при кото-
ром получаются эритроциты, способные полностью лизиро-
ваться в условиях даННоrо опыта, содерж:ит одну rемолитиче-
скую единицу. Для сенсибилизации эр'итроцитов, идущих в
()сновной опыт, следует брать rемолизин с активностью 4 еди-
ницы.
Пусть, например, полный rемолиз наблюдался в лунке, в
которую внесли эритроциты, сенсибилизирован'ные rемоли-
эином в разведении 1 : 3200. Значит, для сенсибилизации
19. Определение антитромбоцитар.НblХ антител 145
эритроцитов, используемых в основном опыте, следует брать
разведение rемолиз'ина 1: 800.
Пра повседневном проведении РСК с одними и теми же
реаrентами достаточно титровать rемолизин раз в неделю.
Бсли титр комплемента известен, мож,но произвести пе-
рекрестное титрование rемолизина. В приве,денную выше cxe
му титрования вводят разведения комплемента, указанные
в 19.2.2.3; таким образом удается повысить чув'ствительность
реакции и точнее определить одну rемолитическую единицу
rемолизина.
19.2.2.3.
Определение титра Rомплемента
Как и.. все pear,eHTbI, комплемент разводят вероналовым
буфером. Вспамоrательные титрования и основной опыт ста-
вят в одних и тех же условиях. Титр используемоrо КОМlпле-
мента необходимо определять кажДЫЙ раз внО'вь в день по-
становки опыта. Чтобы повысить чувств'ительность РСК, при-
rотовляют следующие разведения комплемента: 1: 6, 1: 8,
1 : 10, 1 : 12, 1 : 14, 1 : 16, 1 : 20, 1 : 24, 1 : 28, 1 : 32.
Камеру для микротитрова'ния за'полняют 6 8 мл вазели-
HOBoro ма'сла. Нсе пробы дублируют.
Титрование ставят по следующей схеме:
Разведение комплемента
1 :6 1 :8 1:10.... 1 :28 1 :32 Контроль
Вероналовый бу-
фер, мкл 4 4 4 4 4 6
Комплемент, м кл 2 2 2 2 2
Смешивают и инкубируют ч при 37 ос
Сенсибилизиро-
ванные ЭрИтро
циты, Mк.r! 2
2
2
2
2
2
Смешивают и инкубируют 30 мин при 37 ос
Результаты реа:кции леrче учитывать, если осадить нели-
зи/рованные эритр,ациты центрифуrированием. Степень reMo-
лиза оценивают невооруженным rлазом по величине осадка
эритроцитов и окрашиванию надосаД'очной ЖИДКQlСТИ reMo-
rлобином. Результаты реакции выражают в условных баллах
от О до 4. Полный (100%) rемолиз ра,сценивается как отр'и-
цательная реаlКЦИя (О), а бесцветной надосадочной жидкости
10 840
146 З. Леверенц
с компактным кольцеобразным осадком эритроцитов дается
оценка 4:
Степень rемолиза,
% О 25 50 75 100
Оценка реакции 4 3 2 1 О
Доля нелизирован-
ных эритроцитов,
% 100 75 50 25 О
Наибо.аьшее разведение комплемента, которое еще дает
полный rемолиз, ПрИНП IaЮТ за одну rемолитическую едини-
цу КОМПv1БIента. В основном опыте используются 2 ещин'ицы.
Например, при ПQ.1шом rемолизе в последней лунке с разве-
дением комплемента 1 :24 для OCHoBHoro опыта берут раз-
ведение 1: 12. Если ставить РСК с одной единицей компле-
мента, чувст,вительность реакции будет выше, но и влияние
помех возрастет.
МеТО;J,ИRа РСК для выявления iЭ.нтиrенов HL.-A на
тромбоцитах (стандартизированная .в международном
масштабе)
Камеры для микротитрования заполняют 6 8 мл вазели-
HOBoro масла. В лунки вносят по 2 мкл каждоrо из следую-
ших peareHToB:
19.2.2.4
Антитела (сыворотка, разведения сыворотки или элюат)
Антиrен (взвесь ТрО:\Iбоuитов, 0,5.106 В 1 мкл)
Комплемент (сыворотка АВ, 2 rемолитические единиuы
в 2 м кл)
Смешивают и инкубируют 30 мин при 37 ОС; центрифуrируют
и учитывают реа'кцию.
Чтобы проконтролировать взвесь тромбоцитов и каждую
'сыворотку, ставят следующие пробы (все peareHTbI в объеме
2 мкл):
Контроль антиёена 'вероналовый буфер, взвесь тромбо-
цитов, комплемент, сенсибилизированные эритроциты бара'на.
Контроль антител сыворотка, вероналовый буфер, комп-
лемент, сенсибилизированные эритроциты барана.
При отсутствии спеuиальной uентрифуrи для МlIкротитра-
ционных камер можно дождать'ся самостоятельноrо оседания
19. Определение антuтромбоцитарНblХ антител 147
не.ll1з'ированных ЭРИТРОЦИТОВ, если оставить камеры на
30 мин при ом,натной температуре или при 4 ОС.
Результаты учитывают невооруженным rлазом, оцеНl1вая
степень rемолиза так же, ка'К при титровании К:ОМПЛб'Iента.
В кру,пных лабораториях количественный учет результатов
РСК ПРОИЗВОДИ1'ся при помощи автоматическоrо МИКроскопа-
денситометра [17].
Пр'Ичинами ложных положительных и ложных отрица-
тельных результатов MorYT быть [14]:
1) заrрязнение поверхности центрифужных пробирок, Ka
мер, пипеток, шприцев и т. д.;
2) нежелательные примеси в растворах, сыворотках или
во взвеси тромбоцитов;
3) заrрязнение сывороток, тромбоцитарной взвеси или
растворов бактер'иями или I1рибами;
4) а'нтикомплементарность сыворотки, часто ВОЗНИКающая
в'след'стВ'ие денатурации или долrоrо хранения;
5) подавление активности комплемента цитратом и дру-
'rимИ антикоаrулянтами, которые используются при выделе
'нии клеток. В связи с этим клетКИ необходимо тщательно
отмывать от антикоаrулянтов. Антикомплементарны также
'СblJВОрОТКИ, полученные методом плазмафереза;
6) потеря нтитенности тромбоцитов, которая наступает
иноrда при хранении вз'веси в холодильнике свыше четырех
месяцев;
7) изоаrтлютинины анти-А и а,нти-В, присутствующие в
иС'следуемой сыворотке, MorYT вызвать ложную положитель
ную реакцию, если взвесь тромбоцитов содержит большую
примесь эритроцитов;
8) «незрелость» 'Взвеси тромбоцитов, которую поэтому
следует иопользовать не раньше чем через сутки после при
,{10товления.
19.3. ОБЩАЯ ОЦЕНКА МЕТОДА
Прежде РСК применяли rлавным образом для определе-
ния специфических тромбоцитарных антиrенов и антител.
В новом, более простом микроварианте ее стали ИСПО.,1ЬЗО
вать в первую очередь для типирова,ния по HL-A. По воспро
изводим'ости результ,атов и затратам времени (2 3 ч) РСК
не хуже широко применяемой реакции лимфоцитолиза. С xo
рошими сыворотками оба метода дают воспроизводимость
около 99%. Однако РСК менее чунствительна, чем реакции
лейкоаrлютинации и лимфоцитолиза; поэтому мноrие анти-
сыворотки ока'3ываются в РСК неактивными, что оrранпчи-
вает применение этой реакции. Создать достаточно полный
10*
148 З. Левере1tц
набор ТИПИРУЮЩИХ сывороток весьма TPY HO и слож,но. Осо-
бую ценность И lеют сыворотки рецилиентов, получавших
MHoroKpaTHbIe переюшания крови. В более чувствительной
реакции JIИмфоцитолиза эти сыворотки проявляют полиспе-
цпфпчность, но в leHee чувст,вительной РСК они нередко
ведут себя как моноопецифические и считаются хорошими
реаrентами. Наиболее ЧУ'вствительный вариант РСК со спек-
ТрОфОТО lетричеСКН:\1 измерением степени rемолиза преД.10-
жил Свейrард [7]. Эту реакцию ставят в проб ирках с отно-
'сительно БОЛЬШИ:\1 объемом антиrена и антисыворотки. По-
<этому едва ли ее :можно рекомендовать как eTOД для
ма,ссовых обследований. Она используется rлавным обра-
зом для количественноrо определения антиrена,которое
имеет БО.1ьшое практическое значение при оценке СОВ:\1ести
мости по HL-A. БО.1ее простая модификация количественно
ro определения антиrенов HL A предложен,а Коломбани [18].
Как любой метод исследования, РСК имеет свои преИ:\1У
шества и недостатки [19, 20]. Из преимуществ следует OT
метить то, что ТРО:\1боциты леrче выделять из 'крови, чем лим
фоциты, и мож'но ДOiвольно долrо хранить. Это позволяет ис-
пользо,вать клетки из од,ной и 'Той же взвеси в реакциях как
с извеСТНЫ:\1И, так и с плохо изученным'и или новыми CЫBO
ротка:\1И. Реакция учитывается невооруженным rлазом; воз-
можен также авто:wатический учет ее результатов. Можно
про водить количественное определение антиrенов. РСК
позволяет определять антиrены HL A не только на тромбо-
цитах, но и на друrих клетках, например на перев\Иваемых
лимфобластах, фибробластах и опухолевых клетках. При
этом можно не только индентифицировать известные антиrе
ны HL-A, но и вести поиск новых специфиЧ'нО'стей этой и дру-
rих антиrенных систем. Новые антиrены, по-видимому, леrче
обнаруживать на ТрО:\1боuитах, чем на лимфоцитах [20]. Ра-
ботая несколькими Ylетодиками, мы по еньшей мере удваи-
ваем вероятность выявления новых антисывороток и новых
антиrенных специфичностей.
Все варианты выявления антитромбоцитарных антител в
РСК И:\1еют общие недостатки относительно низкую чувст-
вительность, ПО;J;верженность влиянию помех и значиТ€льные
ТРУДНОСl1И получения хороших антисывороток, а также то, что
взвесь ТР.ОYlбоцитов нельзя использовать тотчас после приrо-
товления.
Подводя итоrи, YlОЖНО сказать, что микровариант РСК
при тщательной постановке служит весьма полезным методом
выявления антиrенов HL-A и тро боцитспецифических анти-
reHOB и соответствующих антител. О взаимодействии антпrе-
на с антителами в этой реакции судят по фиксации ко пле
19. Определение антитромбоцитарНbtХ антител 149
мента, которую можно учитывать полуколичественно [9] или
количественно [7, 1,s]. Именно по фиксации коМ'племента
часто оценивают активные сыворотки ан'Ли-НL-А, «моноспе-
цифические» к'ак в Рск, так и в реакц'ии лимфоцитолиза
[14]. в РСК происходит вз,аимо еЙiстtВие мноrочисленных
pea,reHToB rемолизина, ком,плем,ента, антиrена и антител,
а также необходим подсчет клеток в камере; поэтому успеш-
ное осуществление этоrо метода требует тщательности и
БОЛМllоrо опыта. .
С помощью РСК можно выявлять антиrены не только
тромбоцитов, но и друrих клеток, параллельно или в ДОПОЛ-
нение к реакции лимфоцитолиза.
19.4. ЛИТЕРАТУРА
1. Ackroyd 1. F., The role of complement in sedormid purpura, Сliп. Sci., 10,
(1951), 185 207.
2. Shulmaп N. R., Aster R. Н., Leitпer А., Hiller М. С., Immune reactions
involving platelets. У. Posttransfusion ршрша due to а complement-fi-
xing antibody against а genetically controlled platelet antigen. А propo-
sed mechanism for thrombocytopenia and its relevance in «al1toimmunity»,
J. Сliп. Invest., 40 (1961), 1597 1620.
3. Shulmaп N. R., Marder V. 1., Hiller М. С., Collier Е. М., Platelet and
leukocyte isoantigens and their antibodies: Serologic, physiologic and
clinical studies, Progr. Hemat., 4 (1964), 222.
4. Aster R., Cooper Н. R., Singer D. L., Simplified complement fixation test
for the detection of platelet antibodies in huтan serum, J. Lab. Clin. Med.,
63 (1964), 161 172.
5. Van der Weerdt С. М., Platelet antigens and isoimmunisation, Tllesis.
Drukkerij Aemsterstad, Amsterdam, 1965.
6. Colombani 1., Colombani М., Benjamin А., Dausset 1., Leukocyte and pla-
telet antigens defjned Ьу platelet complement fjxation test (antigen 1, 5,
6, 11 and 14), Нisto-compatibility Testing, 1967, Munksgaard, Copenha-
gen, 413 417. .
7. Svejgaard А., Кissmeyer-Nielseп F., Complement-fixing platelet iso-anti-
bodies. 1. А quantitative technique for their detection, Уох Sang., 14
(1968), 106 118.
8. Svejgaard А., Iso-antigenic systems of human bIood platelets: а survey,
Series Haemat., 2 (1969), 3 5.
9. Colombaпi 1., D'amaro 1., Gabb В., Smith G., Svejgaard А., International
Argeement оп а Microtechnique of Platelet Complement Fixation, Trans-
plantation Proceedings III (1971), 121 126.
10. Mayer М. М., in: Kabat Е. А., Mayer М. М. (Eds.), Experimental Immu-
nochemistry, ed. 2. Thomas, Springfjeld/IlI., 1961, 214. (Кэбот Е., Мей-
ер М., Экспериментальная иммунохимия, М., «Медицина», 1968.)
11. Spielmaпn und Schulz, in Starke G., Virologische Praxis. 2. Auflage Gus-
tav Fischer, Jena, 1968, 213 214. '
12. Strauss D., Raderecht Н. 1., Ober biochemische Kriterien der Ha1tbarkeit
von Testerythrozyten wahrend der Lagerung bei 4 ос in einem phosphat-
und nukleosidhaltigen Medium, Med. Zschr. inn. Med., 24 ( 1969 ) 897
902. '
13. Svejgaard А., Complement-fixing platelet antibodies. IV. А comparison of
human, guinea pig and rabbit complement, Уох San g ., 17 ( 1969 ) 224
229. '
150 З. Левере1tц
14. Кissтeyer-Nielsen Р., Throsby Е., Ниmап Transplantation Antigens,
Transplantation Revie\\'s, 4 (1970), 134 147.
15. Coloтbaпi М., Coloтbani J., Dehay С., Dausset J., А Microtechnique of
Platelet Complement-Fixation. Results obtained with Sera and Eluates as
the Source of Antibody, Histocompatibility Testing, 1970, Munksgaard,
Copenhagen, 553 559.
16. Heiпrich D., Mueller-Eckhardt Ch., HL-A-spezifische, C-fixierende anti-
thromlJOzytiire Antikorper. П. Absorptions- und Elutionsuntersuchungen
ап Sch\vangerenseren mit HL A-spezifischen Antikorpern, Blut XXIII
(1971), 267 279.
17. D'aтaro J., Heпseп Е., иап Rood J., ТЬе Micro-Complement Fixation
Test. III. Automatic Quantitative Scoring with а Microscope Densitome-
ter, Tissue Antigens, 1 (1971), 171 177.
18. Colombaпi J., Coloтbani М., Principles and application of а quantitative
complement fixation microtechnique, Symp. Series Immunbiol. Standard.,
18 (1973), 89 92, Karger, Basel.
19. Colombaпi J., Blood Рlа telet in HL-A Serology, Transplantation Pro
ceedings IП (1971), 1078 1087.
20. Mittal К К, Mickey М. R., Terasaki Р. 1., Heterogeneity of HL-A specifi-
cities shown Ьу platelet complement-fixation, Tissue Antigens, 1 (1971),
279 285.
20. Реакция лимфоцитолиза
С. BErEHEP
Метод оценки rистосовместимости должен обладать по
крайней мере тремя качествами:
1) хорошей воспроизводимостью;
2) быстротоЙ проведения (особенно в случае перес'адки
opraHa от трупа);
3) воз'можностью использования в виде микрометода (так
как объемы тиrrирующих сывороток всеrда оrраничены) [1].
Из современных серолоrических методов оценки rисто-
совместимости этим требованиям в наибольшей мере удов-
летворяет реакция лимфоцитолиза.
Реакцию лейкоаrrлютинации и реакцию связывания ко),!-
племента с и пользованием тромбоцитов применяют в cepo
лории HL-A толЬ'ко при решении специальныlх вопросов. При-
менимость радиоиммуноХ'имических и флуоресцентных MeTO
дов все еще остается предметом изучения.
Смешанная культура лимфоцито,в, зар,екомендовавшая
себя 'как метод оценки клеточноrо иммунитета in vitro, тре-
бует сравнительно мнorо времени; поэтому ее ПРlименяют
rлавным образо'м при пересадках тканей и opraHoB (напри-
мер, KocTHoro :мозrа или почек) от ж'ивоrо донора, чаще все-
ro от близкоrо РОДСТ1венника реципиента.
При подборе донора в первую очередь ДОJ1ЖНЫ учи ты-
iВатыся данные НL-А-типирования и результаты с:мешанной
культуры лимфоцитов.
20.1. ПРИНЦИП
Реакцию лимфоцитолиза разработал'и [,орер и ОТорман
[2] в 1956 r. Затем Терасаки и Мак-Клелланд [13], Уолфорт
и сотр. [4], Энrельфрит и Бриттен [5] приспособили ее для
оценки rистосовместимост,и у человека.
В последующие несколько лет rлавным образом при по-
мощи м,икровариантов реакции лимфоцитолиза [3] были
открыты наиболее ча,сто встречающиеся антИrены HL-A. Бла-
rодаря хорошей воспроизводимости [7] и появлению юно-
опецифических антисывороток мноrочИ'сленные варианты
этой реакции [1, 6] постепенно заняли центральное место
среди методов оценки rистосовмести юсти. В реакции лимфо-
152 С. BezeHep
ЦИТОЛlиза живые ЛИМфОЦИТЫ, имеющие ооответствующий ан-
тиrен, теряют жизнеспособность под. воздействием специфиче-
CКIIX антител при участии комплемента. Результаты реакции
оценивают по «исключению кра'сителя», который не окраши-
вает живые клеткш, но проникает в цитоплазму поrибших
.11I:УIфОЦИТОВ. Лимфоциты обычно выделяют из венозной KDO-
ви; эритроциты осаждают дек,страном, а затем из суопензии
леЙкоцитов Yiдаляют rраНУЛQiЦИТЫ, пользуясь их свойством
прилипать к чужеродной поверхности. После этото Л/имфоци-
ты флотируют В среде, имеющей плотность 1,078 r/мл, отде-
ляя их таким образом от оставшихся эритроцитов, моноци-
тов, rранулоцитов и фра,rментов различных клеток. В 'Среде
с плотностью 1,076 r/мл удается в один прием отделить лим-
фоциты от друrих более тяжелых клеток юроВ'и [1 О, 11], а
последующее отмывание лимфоцитарной взвеси Qiсвобождает
ее от большей части тромбоцитов.
20.2.
20.2.1.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
Реаrепты и приборы
ИНФ'У-колл 6 %-ный 1 (УЕВ Serumwerk, Бернбурт, r ДР);
r.1азная хирурrичеокая IBaTa (УЕВ Vliestextilien L6ssnitztal
\Verk, Брейтенау, r ДР). Разделяющий раствор 1 (плотность
1,078 r/,YJ.Л):
Декстран (УЕВ Serumwerk, Бернбурr)
«Визотраст 370» (УЕВ Falberg List,
Маrдебурr, r ДР
Дистиллированная вода
Буферный раствор Дульбекко:
NaCl
Na 2 HP0 4 (безводн.)
КН 2 РО 4
KCl
Дистиллированная вода
6,0 r
20,0 мл
до 100,0 мл
16,0
2,3
0,4
0,4
до 2000,0
r
r
r
r
мл
Центрифуж,ные 'пробирки (100Х 13 'мм); штатив для Y'c'l1a
но:вки iпр06ирок ПОД }IIrлом 450; центрифуrа с откидным ро-
тором (Т23, УЕВ Zentrifugenbau, ЭнrелЬ'сдорф, r ДР); CTeK
лянные шарики диаметром 2 мм; rепарин (Gedeon Richter,
1 6% HыH раствор декстрана (мо.'1. вес 75000) в IIЗОТОНllческом раство-
ре NaC\ (кровезаменитель). П рим. перев,
20. Реакция лимфоцитолиза 153
Будаlпешт); разделяющий p,ac'tBop 2 (плотность 1,076 r/мл):
«Визотраст 370» 3,0 мл
Дистиллированная вода 13,0 мл
Разделяющие растворы перед опытом должны иметь ком-
натную т м'Пе.ратуру.
ВOlдный 1 % ный. IpacTBop ТРИlпановоrо ,с,инеrо ,или 5 % -ный
ВОД,ный раствор эозина-Nа (УЕВ Laborchemie, А\Польда, [ДР);
свежая кроличья сыворотка как источник комплемента
(о титровании ком,племента см. 20.2.6); свежая сыворотка
человека rруппы АВ (для «одноэтапной» реакции); вазе.пи
новое масло (rерманская фармакопея, 7-е издание) (для за-
полнения камер или чашек Петри при микротитроваНrИИ).
Микрошприцы; камеры для постановки реакции: например,
a,M pы для иикрокультивирования(Мkrоtеst-Тissuе Plate
N!! 3034, Falcon Plastics, Лос А.нджелес, США, так 'называе
мые камеры ТерасаКIИ), или с,пе:циальные масляные KalMepbI
(Fa. Coates-Logos, Норвеrия), или чашки Петри (диаметром
1 О ом, тонкостенные), или Ka:\ epы Д.l}Я 'микроку лыивир'Ования-
\/ЕВ Plastunion Triptis im Komblnat Pla'sta,verke (Зоннен-
берr, r ДР).
20.2.2.
Выделение лимфоцитов по Бёйюму [8]
В модификации Менцеля и Рихтера [9]
в центр'ИфУЖНУЮ пробирку помещают несколько стеклян-
НЫХ шариков и 2 мл 6% -Horo инфуколла, затем в нее берут
8 мл венозной крови, которую тотчас дефибринируют, встря-
хивая в течение 10 мrин. Дефибринированную кровь осторож-
но переливают во вторую центрифУ.llШУЮ пробирку, задержи-
вая стеклянной палочкой шарик'И и сrустки фибрина в пер-
вой. Для спонтанноrо оседания эритроцитов центрифужную
прабирку с кровью оставляют на 30 мин стоять ПрlИ 37 ос под
уrлом 450. Затем взвесь леЙJrОЦИТОВ отсаlсывают и вносят в
цилиндр 10-миллилитровоrо шприца (наконеч,ник закрыт),
заполненный 200 Mr rлазной хирурrической ваты, и инкvби
о .
руют еще 30 мин при 37 С. Во время инкубации адrезивные
клетки (rранулоциты и макрофаrи) прилИ'пают к ВО.10кнам
целлюлозы.
После инкубации наконечник шприца открывают и, BCTa
вив поршень, выдавливают из ваты около 2 мл ЛИ:\1.фОЦlIтар-
ной взвеси. Эту ,взвесь аккуратно наСЛalИiвают в цеНТР'IIфУЖ-
ной пробирке на первый разделяющий раствор и центрпфу-
rируют вначале 10 мин при 1200 об/мин, а затем 15 мин при
3000 об/мин. После центрифуrирования беловатый слой .1И:\f-
фоцитарной вз,веС'и, расположенный между прозрачными
154 С. BezeHep
слоями сыворотки и разделяющею ра'створ,а, осторожно Qтса-
сывают. Перед опытом лимфоциты достаточно один раз от-
мыть буфером Дульбекко, центрифуrируя 5 мин при
3000 об/мин.
Взвесь лимфоцитов в сыворотке, полученная после фильт
рации через вату, остается rодной для опыта iВ течение 24 ч.
Некоторое время лимфоциты можно хранить в среде Парке-
ра. В жидком азоте они сохраняю я свыше месяца.
Для выделения ЛИYIфоцитов приrодна также rепариниз'и-
рованная (5 МЕ/мл) кровь.
20.2.3. Выделение лимфоцитов
по Отто и Шмиду [10]
в модификации Р. Bel'eHepa [11]
Смешивают 2 М1Л крови, только что взятой из ,вены в re-
парии (5 МЕjмл), с 2 мл буфера Дульбеккq, наслаивают
смесь в центрифужной пробир'ке на 4 мл разделяющеrо
ра'С1'вора 2 и цеНТРИф)llrируют 30 мин при 1200 об/м'ин. Меж-
ду пл,азмой и разделяющим ра'створом обраЗ'Уется тонкий
слой лимфоцитов. Их отсасьшают шприцем и д,важды отмы-
вают буфером Дульбекко, центрифуrируя 10 м:ин при
1000 об/иин.
20.2.4.
Микровариант реакции лимфоцитолиза
(RИС lейер-Нильсен [1], «однозтапнаю) реакция)
Лимфоциты сразу же после выделения суспендируют в
смеси из равных частей свежей человеческой сыворотки АВ
и кроличьеrо комплемента. В 1 мкл полученной взвеси долж-
но содержаться примерно 2000 лимфоцитов. С помощью мик-
рошприца в лунку камеры для Мlикротитрования помещают
1 мкл этой ВЗlвеси и 1 мкл антИ'сыворотк'и, перемешивают и
инкубируют 30 мин при 37 0 с. Чтобы реакционная смесь не
'Высохла, в камеру Терасаки вкладывают влажные полоски
фильтровальной бумаrи, а масляиу юкамеру, вместо которой
можно использ,овать простую чашку Петри, заливают слоем
вазелиново,rо ма'сла толщиной 2 3 мм.
После инкубации в реакционную смесь вносят 0,5 мкл
1 % -ното раст,вора трипановоrо син,еrо (или 5% -Horo раство-
ра эоз'Ина-Nа) и оставляют на 30 мин при комнатной тем-
'пературе.
Результаты учитывают под микроскопом ПрlИ увеличеюш
в 60 100 раз. Применение фазово-контрастноЙ микроскопии
значительно облеrчает оценку реакции.
20. Реакция лимфоцитолиза 155
Избыток окрашенной нздосадочной жидкости в лунке
можно отсоеать каiПИЛЛЯРОМ. Для прекращения Л'имфоц'Ито-
лиза в нужный момент в камеру Терасаки осторожно ВЛiи
Бают буфер Дуль'бекко. В ма<:ляной камере картину реакции
можно зафиксировать, внеся 4 мкл нейтральноrо формали
на. Чтобы избежать ложных положительных результатов, не-
фиксированные препараты следует микросколировать без
промедлен'ия.
Оценка реакции. При ПОЛОЖiительной реакции поrибшие
лимфоциты окрашиваются, живые клетки остаются бесцвет
ными (см. фото 11, стр. 481). Полуколичественная оценка
реакции по проценту окрашенных клеток:
o 1 О %
11 25% +
26 50% ++
51 75% +++
76 100% +++
Контрольные пробы. Отрицательный контроль: вместо ан-
тисыворотки прибаВ.1ЯЮТ нормальную человеческую CЫBOpOT
ку АВ. Положительный контроль: в:место антисыворотки при
бавляют достаточно активную полиспецифическую сыворотку
анти-НL-А.
20.2.5.
Стандартная методика
по Бранду и сотр. [12]
«<двухэтапнаю) реакция)
Лимфоциты сразу же после выделения суспендируют в
2 4 каплях буфера Дульбекко до концентрации 2000 клеток
в 1 мкл. Берут 1 мкл полученной взвеси, оrешивают с 1 мкл
антисыворотки в камере для микротитрования и оставляют
на 30 мин при комнатной температуре. Затем прибав.:IЯЮТ
5 мкл кроличьеrо комплемента и вновь инкубируют 60 :vrин
при комнатной температуре. В каждую лунку (или каплю)
с реакционной с есью прибавляют 1 мкл 5% Horo водноrо
раствора эозина N а.
Результат реакции можно учитывать через несколько ми-
нут. Если реакцию ставят 'в камере Терасаки, то цитолиз мож-
но остановить, залив в нее буфер Дульбекко; в :vrасляной Ka
мере для этой же цели можно прю енить фор:vrалин (c .
20.2.4) .
Оценку результатов реакции проводят как описано в
20.2.4.
156 С. Bezenep
20.2.6.
Титрование комплемента
Свежую нормальную сыворотку кролика, которая служит в
реакции лимфоцитолиза источником комплемента, разливают
мелкими порциями (чтобы избежать MHoroKpaTHoro замора
живания-оттаивания) и замораживают. Так как .не каждая
кро ичья сыворотка обладает достаточной активностью KOM
племента, следует провести предварительное титрование ком-
племента в «двухэтапной» реакции лимфоцитолиза с поли
специфической антисывороткой к HL A, активность. которой
известна. Активность комплемента должна быть достаточной,
чтобы при разведении сыворотки 1: 4 обеспечить цито-
:шз ++++.
20.2.7.
Антисьmоротки
Для определения антиrенов HL A применяются сыворот-
ки, полученные в основном от беременных (антилейкоцитар-
ные антитела встречаются у 10 20% беременных [13, 14]) и
от доноров, специальна иммунизированных лейкоцитарными
антиrенами. Прежде чем антисыворотка может быть исполь-
зована для типирования HL-A, она должна пройти контроль
активности и специфичности в референс ла'боратории (в [ДР
это Bezirks-Institut fur Blutspende- und Transfusionswesen,
Берлин) .
20.4. ОЦЕНКА МЕТОДА
Воспроизводимость реакции лимфоцитолиза достиrает
95% [15] и выше [6]. Однако безошибочность типирования
явно уступает воспроизводимости, так как в чрезвычайно по-
лиморфной системе HL A не для всех специфичностей имеют-
ся моноспецифические антисыворотки. В связи с этим при
подборе совместимоrо трансплантата каждый антиrен HL-A
определяют, как правило, несколькими антисыворотками [17].
Недостаток реакции лимфоцитолиза состоит в том, чтО' лим-
фоциты как носители антиrенов MorYT сохраняться только
при использовании технически сложной аппаратуры для rлу-
бокоrо замораживания. «Двухэтапная» реакция чувствитель-
нее «одноэтапной» И повсеместно используется в r ДР как
метод оценки rистосовместимости. Но, с друrой стороны, без-
ошибочность «одноэтапной» реакции выше, так как в ней
обычно не выявляются побочные специфичности [18]; поэто-
му ее используют, в частности, для выявления мО'носпецифи-
ческих антител к HL-A в сыворотках беременных. Среди ва-
риантов метода следует отметить реакцию лимфоцитолиза с
20. Реакция лимфоцитолиза 157
ПРllменением фицина, который сокращает время исследования
[19], или с предварительной обработкой лимфоцитов кро-
личьеЙ антилимфоцитарной сывороткой, которая повышает
чувствительность системы [20].
Выделение лимфоцитов по методу БёЙюма в модификации
Менцеля и Рихтера (см. 20.2.2) можно peKo eHДOBaTЬ в ка-
честве стандартноrо способа приrотовления чистой взвеси
лимфоцитов, так как этот метод дает более чистые суспен-
ЗИИ, чем флотация. Однако в тех случаях, коrда для исследо
вания можно получить лишь небольшой объем rепаринизи-
рованной крови или коrда требуется дать срочный ответ, сле
дует предпочесть прямую флотацию по Отто и Шмиду В мо-
дификации Р. BereHepa (см. 20.2.3).
Реакция лимфоцитолиза это не только основной метод
типирования лейкоцитарных антиrенов: она применяется TaK
же для выявления преформированных антител к антиrенам
HL-A донорских лимфоцитов в сыворотке реципиента (peaK
ция на перекрестно-реаrирующие антитела). Кроме Toro, ее
используют для диаrностики и профилактики посттрансфузи
онных осложнений, для предупреждения иммунноrо цито.пиза
перелитых лейкоцитов и тромбоцитов, а иноrда и при исклю
чении отцовства.
20.3. ЛИТЕРАТУРА
1. Кissтeyer Nielseп Р., Thorsby Е., Current methods in histocompatibiiity
testing, Transplantation Reviews, 4, 115 162 (1970), Munksgaard, Со-
penhagen.
2. Gorer Р. А., O'Gorтaп Р. О., The cytotoxic activity of isoantibodies in
mice, Transplant. ВиН., 3, 142 143 (1956).
3. Terasaki Р. 1., McClellaпd J. D., Microdroplet assay of Ьиmап serum cyto-
toxins, N а ture, 204, 998 1 000 (1964).
4, Walford R. L., Gallagher R., Troup М., Ниmап lymphocyte typing with
isologous antisera; technical considerations and а preliminary study of
the cytotoxic reaction systems, Transplantation 3, 387 391 (1965).
5. Eпgelfriet С. Р., Britteп А., Cytotoxic antibodies against leukocytes, V ох
Sang., 11, 334 344 (1966).
6. Aтos D. В., Cytotoxicity testing. Мапиаl of tissue typing techniques, Na-
tional Institutes of Health, Bethesda, Maryland, 14 17 (1972).
7. Svejgaard А., Isoantigenic systems of human blood platelets. А survey.
Series Haemat. П. No. 3 (1969).
8. Воуит А., Separation of leucocytes from blood and Ьопе marrow, Scand.
J. сliп. Lab. Invest., 21, Suppl. 97 (1968).
9. Meпzel О. R., Richter К. V., Eine Methode zur Isolierung von Lymphozy-
ten fiir die Gewebetypisierung, Z. med. Labortechn., 12, 211 212 (1971).
10. Otto Р., Schтid D. О., Lymphozytenisolierung aus dem Blut des Menschen
und der Tiere, Blut, 21, 118 122 (1970).
11. Wegeпer R., Vergleichende Untersuchungen zum Yorkommen von Leuko-
zytenantigenen auf Granulozyten und Lymphozyten, Inauguraldisserta-
tlOn, Rostock, 1973.
158 С. BezeHep
12. Braпd D. L.> Ray J. О.> jr.> Hare D. В.> КауllOе D. Е.> McClellaпd J. D.>
Preliminary tria!s toward standartization of !eucocyte typing, Histocompa-
tibi!ity Testing, 1970, 357 367, Munksgaard, Kopenhagen.
13. Bertrams J.> Kuwert Е.> Liпzeпmeier О.> Leukozyten-Isoantikёrper. 1. Vor-
kommen agg!utinierender und zytotoxischer Antikёrper gegen wеШе Blut-
zeJlen im Serum erst- und mehrgeblirender Frauen, Dtsch. med. Wschr.,
95, 1145 1152 (1970).
14. Overweg J.> Eпgelfriet С. Р.> Cytotoxic ]eucocyte iso-antibodies during the
first pregnancy, Уох Sang., 16, 97 104 (1969).
15. Walford R. L.> The isoantigenic systems of human leucocytes. Medical and
bio!ogica! significance, Series Haemat. II, No. 2 (1969).
16. Mittal К. к., Mickey М. R.> Terasaki Р. 1.> Serotyping for homotransplan-
tation. XXVIII: Sib-pair assay for поп HL-A antigens, Уох Sang., 17,
406 418 (1969).
17. De Weck А. L.> Technik der Leukozytentypisierung, BuJl. d. Schweiz. Aka-
demie d. Med. Wissепsсhаftеп, 26, 101 106 (1970).
18. Rood J. J. иап> Die Bedeutung der Leukozytengruppen fiir die Transplan-
tationssero!ogie, BibI. haemat., 37, 53 69 (1971).
19. Terasaki Р. 1., McCurdy В., McClellaпd J., Microdrop]et ]ymphocyte cyto-
toxicity test. Мапиа! of tissue typing techniques, Nationa! Institutes of
НеаНЬ, Bethesda, Maryland, 1972, 50 55.
20. Coheп 1.> Nelkeп D.> Sabatello 1.> ТЬе synergistic action of antibodies,
Уох Sang., 23, 200 207 (1972).
2]. Dausset J., Nenna А" Presence d'une !euco agglutinine dans lе serum
d'une case d'agranu!ocytose chronique, С. R. Soc. Вio!., 146, 1539 1541
(1952) .
22. Svejgaard А., Kjerbye К. Е.> Кissmeyer-Nielseп F., ТЬе sensivity of the
methods used in leucocyte and p!ate!et grollping, Нistocompatibility tes-
ting, 1967, 385 387, Munksgaard, Сорепhаgеп.
23. Rood J. J. иап> Leucocyte grouping, Thesis, Leiden, 1962.
24. Thulstrup Н.> ТЬе influence of !eucocyte and thrombocyte incompatibility
оп non-haemo!ytic transfusion' reactions, Уох Sang., 21, 4З4 442 (1971).
25. Rood J. J. иап, Fico!! agglutination test. Мапиа! of tissue typing tech-
niques, NationaI Institutes of Health, Bethesda, Marylend, 1972, 10.
26. Lalezari Р., Thaleпfeld В., Weinsteiп W. J., ТЬе third neutrophil anti-
gens, Histocompatibllity Testing, 1970, 319 322, Munksgaard, Copenha-
gen.
27. Кissmeyer-Nielseп Р., иап Rood J. J.> Micro agglutination test. Мапиа! of
tissue typing techniques, National Institutes of НеаltЬ, Bethesda, Mary-
!and, 1972, 1 2.
28. Zmijewski С. М., Leucocyte agglutination-EDTA technique. Мапиаl of
tissue typing techniques. National Institutes of Healtl1, Bethesda, Mary-
!and, 1972, 11 13.
29, Thompsoп S. J.> Seversoп С. D., Copplesoп L. W., Stokes О., Leucocyte
capiJJary aggIutination: Demonstration of additiona! !cucocyte antibodies
in cytotoxica!ly «monospecific» antisera, Histocompatibility testing, 1970.
587 594, Munksgaard, Copenhagen.
за. Раупе R. Agglutination technique. Мапиа] of tissue typing techniql1c, Na-
tiona! Institutes of Health, Bethesda, Mary]and, 1969, 34 37.
2 t. Реакция бласт трансформации
ЛIIМфОЦИТОВ селезенки
ПОД влиянием антиrена in vitro
в. ТЕССЕНОВ
21.1. ПРИНЦИП
Культивируя лимфоциты иммунизированноrо животноrо в
присутствии специфическоrо антиrена, можно вызвать их
трансформацию в бласты и деление. Бласт трансформация
ЛИМ1фоцитов весьма четко коррелирует с друrими феноменами
клеточноrо иммунитета (rиперчувствительностью замедлен-
Horo типа) и поэтому используется для их выявления и KO
личественной оценки [6, 7]. Ее наблюдают также в смешан-
ной культуре лимфоцитов, принадлежащих разным rистоне-
совместимым донорам [3, 4], или в монокультуре JIИМфОЦИТОВ
при 'стимуляции их антиrлобулиновыУ!и антителами [8]. Чаще
Bcero трансформацию оценивают по количеству меченоrо ти-
мидина, включающеrося в ДНК лимфоцитов. Интенсивность
трансформации лимфоцитов человека удает,ся также оценить
путем прююrо подсчета бластов на окрашенных препаратах,
но морфолоrический анализ клеточной дифференцировки в
культуре лимфоцитов животных часто встречает серьезные за-
труднения [9].
Описанный ниже метод разработан Адлером и сотр. [1]
для изучения бласт-трансформации К.1еток мышиной селе
зенки.
21.2.
21.2.1.
ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
Реаrепты 11 ПРllборы
Среда для культивирования клеток:
RPMI-1640 (Grand Island Biological Соmр.,
rранд-Айленд, Нью-йорк, США)
Мышиная сыворотка, проrретая (30 мин при
56 ОС)
Пенициллин (УЕВ Jenapharm, Иена)
Стрептомицин (УЕВ Jenapharm, Иена)
15 мл
4 мл
1 00 ед/мл
100 MKr /мл
P .CTBOP eHKca (Staatliches Institut fur Immunpraparate und
N ahrmedlen, Берлин, r ДР); изотонический фосфатный 6\'-
фер ый раствор (ФБР) дЛЯ ,культуры клеток (Staatliches
InstItut fUr Immunpraparate und Nahrmedien, Берлин, r ДР);
фитоrемаrrлютинин (PHA P, Difco Laboratories, Детройт,
160 В. Т ессенов
США); туберкулин (PPD, Forschungsinstitut fiir Impfstoffe,
Дессау, r ДР); 5 % ный раствор трихлоруксусной кислоты;
0,2% -ный раствор ТРИ1пановоrо синеrо:в физиолоrи,ч,еском
растворе NaCl; ЗН-тимиди'н с уделыной активностью
28,4 КиjY.lМ (Institut fйrForschung, Herstellung und Апwеп-
dung der Radioisotope, Праrа); IСО.п'УЭН ТМ (Расkаrd Instr.
Соmр. Inc., США) ;сuинтилляuионная жид ость 'по Nl,а'к Дау-
Э:IЛУ и КОУШIЭНДУ [5]:
РРОl 5,0 r
РОРОр2 0,3 r
Нафталин 0,1 r
Диоксан 730,0 мл
Толуол 135,0 мл
Метанол 35,0 мл
Культуральные сосуды: uентрифужные проб ирки (100 Х 14 мм)
Ио'1и 01юбые друrие пробирки из стекла или пластика, сво-
бодно закрывающиеся алюминиевыY.lИ колпачками Капсен-
берrа с внутренниY.l диаметром 18 M l
Шприцы для инъекuий на 5 и 20 мл
Стеклянный rо юrенизатор (150Х25 IY.l)
СО2 инкубатор или любая rерметичная камера (например,
эксикатор), которую Y.lожно заполнить rазовой смесью 5
10% СО 2 с воздухо:vr
Сжатая rазовая C lecь (5 10% СО 2 в воздухе) в баллоне с
редуктором;
Микрошприцы от 1 до 10 Y.lкл (наПРИY.lер, микрошприu Теру-
мо, Serya, rейдельберr, ФРr)
Стери.пизующий фильтр из пористоrо стекла 117 G5 (Schott,
Иена) для фильтраuии растворов и культуральной среды;
ме:vrбранные фИ.1ЬТрЫ (наПРИY.lер, Синпор 6, диаметр пор
0,4 .:\IКxI, Chemapol, Праrа); держатель для хlембранноrо
фильтра
l v lеланжеры для подсчета лейкоцитов и эритроцитов; счетные
KaY.lepbI (наПРИ:'vlер, камеры TOY.la Ии1И НеЙбауэра)
СuинтилляuионныЙ счетчик (наПРИ:'vlер, Tri Carb, Packard,
США).
ОбрабОТБа стеклянной посуды
дзя Бузьтивирования клеТОБ
Всю стеклянную посуду и пробирки, В которых обрабаты-
ваются и культивируются клетки, следует мыть следующим
образоY.l:
21.2.2.
J 2,5 дифеНИ.10ксазо.1 П PUJrt. перев.
2 1 ,4-6иc [2- (5 феНИ.rJоксазолил)] -бензол. П рим. перев.
21. Реакция блаСТ-71рсшсфоржщии лимфоцитов селезенки 161
а) поrрузить на 24 ч в 20% -ный раствор серной кислоты;
б) в течение 12 ч отмывать в проточной водопроводной
воде;
в) промыть в растворе стиральноrо порошка (например.
«, ильва»), затем ТLЦательно прополоскать водопроводной во-
дой;
[) поrрузить на 12 ч в дистиллированную воду;
е) MHoroKpaTHo прополоскать дистиллированной водой и
простерилизовать.
21.2.3.
Проведевие опыта
21.2.3.1. Приrотовление взвеси меток
Мышей за6ивают путем цервикальной дислокации, BCKpЫ
вают и стерильно извлекают селезенки. Всю дальнейшую ра-
боту с клетками следует проводить в стерильных условиях.
Тотчас после извлечения селезенки поrружают в охлажден
вый раствор Хенкса и освобождают от крови, жира и соеди-
нительной ткани, затем переносят в стеклянный rомоrениза-
тор возможно большеrо объема (150Х25 мм), содержаLЦИЙ
среду RPMI 1640 (примерно 10 мл среды на 5 селезенок) и
измельчают, вращая пестик вручную. Полученную взвесь кле-
тоК отсасывают через длинную иrлу шприцем, переносят в
центрифужную пробирку и оставляют на 30 мин в ледяной
бане для оседания клеточных arperaToB. После этоrо от,сасы-
вают верхнюю половину взвеси, содержащую только одиноч-
ные клетки, и определяют концентрацию клеток. Для подсче-
та в камере взвесь разбавляют 0,2 % -ным раствором трипа-
HOBoro синеrо в эритроцитарном меланжере. В соответствиИ
со схемой опыта и результатом подсчета клеток берут необ-
ходимый объем клеточной взвеси, разбавляют 5 объемами
охлажденной (4 ОС) среды RPMI 1640 и центрифуrируют
10 мин при 600 g (охлаждения не требуется). Дальнейшая
обработка может производиться при комнатной температуре.
Клеточный осадок ресуспендируют в полной «среде для куль-
тивирования» (см. 21.2.1), которую предварительно стерили
зуют фильтрацией. В 1 мл полученной взвеси должно быть
5.106 клеток. Для подсчета взвесь набирают в лейкоцитар-
ный меланжер и раз6авляют 0,2% HЫM раствором трипаново-
[о синеrо в физиолоrическом растворе. Окончательный объем
взвеси устанавливают в зависимости от результатов подсчета.
21.2.3.2.
Rультивирование клеток
в каждую кулыуральную пробирку вносят по 1 мл взвеси,
содержащей 5.106 клеток, и для стимуляции лимфоцитов до-
бавляют специфические антиrены в подходящих концентра-
11 840
162 В. Тессенов
циях (например, PPD от 1,0 до 3,0 MKr). Контролем служат
культуры без антиrена и культуры с фитоrемаrrлютинином в
о тимально стимулирующей концентрации (5 мкл дЛЯ PHA P,
Dlfco). Каждую опытную и контрольную пробу необходимо
ставить в 3 или 4 параллельных культурах. Пробирки закры-
вают свободными колпачками и помещают под yrJIOM ОКоло
100 в инкубатор (37 ОС), в котором с помощью мокрой фи.1Ь-
тровальной бумаrи поддерживают влажность. В инкубатор
постоянно подается rазовая смесь или же ero rерметизируют,
заполнив этой смесью (5 10% СО 2 в воздухе). Мы для СВОИХ
опытов пользовались rерметичным эксикатором, который по-
мещали в обычный термостат (37 ОС).
21.2.3.3.
ИЗl\lерение включенной метки
Клетки культивируют трое суток при 37 0 С. За 16 ч до
конца опыта в каждую пробирку (исключая «холостые» про-
бы) микрошприцем вносят по 2 мкКи 3Н-тимидина, слеrка
встряхивают и вновь помещают в инкубатор в том же поло-
жении (для этоrо следует маркировать положение пробирок) .
Закончив опыт, в каждую пробирку вносят по 5 мл ФБР
(4 ОС). Клетки суспендируют, осаждают центрифуrированием
(900 g), а затем, отбросив надосад.;очную жидкость, ресуспен
дируют в ФБР и выливают на мембранный фильтр. Пробирку
дважды опола,скивают 5 мл ФБР, также сливая на фильтр.
После этоrо находящиеся на фильтре клетки дважды промы
вают охлажденным 5% -ным раствором трихлоруксусной кис-
лоты. Затем каждый фильтр с фиксированными на нем клет-
ками переносят в отдельный сцинтилляционный флакон и
высушивают при 37 ос в течение ночи. Далее в каждый фла-
кон вносят по 1 мл растворителя белков (солуэна-ТМ), остав-
ляют на 12 ч при комнатной температуре и, прибавив по 11 мл
сцинтилляционной жидкости ('см. 21.2.1), измеряют радиоак-
тивность подходящим счетчиком, например Tri-Carb. Резуль-
таты можно представить в виде индекса стимуляции
ИМn/МИН В культурах с антиrеном
ИМn/МИН в культурах без антиrена '
в трех культурах выборочно определяют число живых и
мертвых клеток с помощью 0,2 % -Horo раствора трипаНОБоrо
синеrо, пользуясь меланжерами и счетной камерой. Жизне-
способность культуры определяют как отношение числа жи-
вых клеток в конце и в начале культивирования. При данных
у,словиях в трехдневных культурах она составляет 65 . O%.
21. Реакция бласт транофйржщиu лимфйцитов' селезеюcu 163
2 t .2.3.4.
Дополвитепьвыеаамечавия
По данным Адлера и сотр. [1], из большою числа испы-
танных сред единственно приrодной для культивирования
клеток мышиной селезенки оказалась среда RPMI-1640 с дo
бавлением 5 % человеческой сыворотки. Необходимо во всех
опытах использовать свежую сыворотку одноrо и Toro же до-
нора. не аrrлютинирующую мышиные эритроциты в разведе
нии выше 1 : 5 1 : 10 [1, 2]. Однако мы. не добившись xopo
ших результатов даже при соблюдении этих требований, за
менили человеческую сыворотку мыш:аной и уменьшили объ
ем отдельных культур до 1 мл.
21.3. ОЦЕНКА МЕТОДА
Бласт трансформация и деление лимфоцитов под влия-
нием антиrена происходят лишь в том случае, если клетки
получены от иммунизированноrо донора. В условиях культи-
вирования, описанных выше, первичный иммунолоrический
ответ исключен, поэтому наблюдаемый феномен рассматри
вают как вторичную реакцию лимфоцитов на специфический
антиrен in vitro. Фитоrемаплютинин и друrие растительные
,,1ектины способны стимулировать rораздо большую долю по
пуляции лимфоцитов, чем любой антиrен, но этот эффект
иммунолоrически неспецифичен. Если же трансформацию и
пролиферацию лимфоцитов вызывает антиrен, то между фе-
номеном, наблюдаемым in vitro, и процессом, происходящим
in vivo, обнаруживается явный параллелизм: в частности, оба
они зависят от специфичности носителя [7].
Сроки учета результатов имеют решающее значение.
В культурах, стимулированных фитоrемаrrлютинином, бласт-
трансформацию можно учитывать уже через 48 ч, но ответ на
специфический антиrен оценивают лишь на 3 й 5-й день
культивирования, так как немноrочисленные клетки, реаrи
рующие на данный антиrен, только к этому вре::v1енИ вступа
ют в интенсивную пролиферацию. Условия культивирования
не всеrда блаrоприятны для пролиферации клеток, поэтому
количественная оценка результатов затруднена. Для Toro что
бы получить точные данные (например, прп подсчете ЧИС.ла
антиrен чувствительных клеток), следует как можно раньше
измерять включение метки. Однако чаще Bcero реакцию
бласт трансформации оценивают лишь качественно дЛЯ BЫ
явления клето'Чноrо иммунитета (rиперчувствите.'1ЬНОСТИ за
медленноrо типа) и Тоrда при блаrоприятных условиях
культуры это можно делать уже на 5-й 7 й день.
ll*
1641 В. Тесс.еnО8
21.4. ЛИТЕРАТУРА
1. Adler W. Н., Takiguchi Т., Mars/l В., Smith R. Т., Cellular recognition Ьу
mouse lymphocytes in vitro. 1. ПеНпШоп of а new technique and results
of stimulation Ьу phytohaemagglutinin and specific antigens, J. Ехр. Med"
131, l049 1078 (1970). ...
2. Adler W. Н., Takiguchi Т., 5mith R. Т., Preparation and assay of mouse
mitogenic factors, in: In Vitro Methods in Cell-Mediated Immunity (Hrsg.
Вl00m В. R. und Glade Р. R.), Acad. Press, New York und London, 1971.
(Адлер В., Такиrучи Т., Смит Р., Приrотовление и исследование мыши-
ных митоrенных факторов, в кн. «Методы изучения in vitro клеточноrо
иммунитета», М., «Медицина», 1974, с. 177 183.)
З. Bain В., Vas М. R., Loweпstein L., ТЬе development of large immature
mononuclear cells in mixed lymphocyte cultures, Blood, 23, l08 116
( 1964) .
4. Hirschhorn К., Bach Р., Kolodny R. L., Firschein J. L., Nashem N., Immune
response and mitosis of human peripheral blood lymphocytes in vitro,
Science, 142, 1185 1187 (1963).
5. McDowell R. Е., Copeland J. С., Evaluation of different sсiпtШаtiоп cock-
tai1s for counting of tritiated ribonucleic acid separated Ьу sucrose gra-
dient centrifugation, Analyt. Вiocbem., 41, 338 343 (1971).
6. Mills J. А., The immunologic significance of antigen induced lymphocyte
transformation in vitro, J. Immunol., 91, 239 247 (1966).
7. Oppenheim J. J., Wolsteпcroft R. А., Gell Р. а. Н., Delayed hypersensitivity
in the guinea pig to а protein-hapten conjugate and its relationship to in
vitro transformation of lymph node, spleen, thymus and peripheral bIood
lymphocytes, Immunology, 12, 89 102 (1967).
8. 5еи 5., Gell Р. а. Н., Studies оп rabbit lymphocytes in vitro. 1. Stimulation
of blast transformation with ап antiallotype serum, J. Exptl. Med., 122,
423 439 (1965).
9. Valentiпe F., Lymphocyte transformation: The proliferation of Ьиmап
blood Iymphocytes stimulated Ьу antigen in vitro, in: In Vitro Methods in
Cel1-Mediated Immunity (Hrsg. Вl00m В. R. und Glade Р. R.), Acad.
Press, New York und London, 1971. (Валентайн Ф., Трансформация лим-
фоцитов. Пролиферация лимфоцитов человеческой крови, стимулируемых
in vitro антиrеном, в кн. «Методы изучения in vitro клеточноrо иммуни-
тета», М., «Медицина», 1974 с. 185 198.)
22. Реакция торможения миrрации
макрофаrов
И.БЛАНК
22.1. ПРИНЦИП
Реакция торможения миrрации макрофаrов (РТММ) слу-
жит одним из методов оценки клеточното иммунитета [1 3].
Ее принцип заключается в том, что лимфоциты иммунноrо
донора при контакте со специфическим антиrеном il1 vitro
образуют и выделяют в кулыуральную среду фактор TOpMO
жения миrрации (ФТМ, анrл. MIF migratiol1 il1hibitory
factor), уrнетающий миrрацию У1акрофаrов.
Джордж и BoraH [4] впервые в 1962 r. преДЛО.iЮI/IИ Ka
ПИл.1ЯРНЫЙ вариант РТММ, который затеYI усовершенствовали
ДЭВИД и сотр. [5], а также БлуУ1 и Беннет [6]. С ПОУ10ЩЬЮ
РТММ изучали клеточный ответ на саУ1ые разнообразные aH
тиrены: бактерии, вирусы, rрибы, растворимые белки, синте
тические олиrопептиды и полисахариды. Ее успешно ПрИYIеня-
ли Д.'1я выявления трансплантационных, тканеспецифических
и опухолевых антиrенов. Она оказалась также полезной при
изучении экспериментальноrо аЛ.;1ерrическоrо энцефаломие-
лита.
22.2. ПРО ВЕДЕНИЕ ИССЛЕДОВАНИЯ
22.2.1. Реаrепты и приборы
Раствор Хенкса, рН 7,4; тот же раствор с добавлением
rепарина (в виде натриевой соли, без консерванта, 5 МЕ в
1 У1л); среда Иrла, рН 7,4, с 15% проrретой rомолоrичной cы
воротки морской свинки; вазелиновое :wасло для инъекций;
парафин (точка плавления 48 0 С) дЛЯ заливки капилляров;
стеклянные капилляры длиной 70 мм с внутренним диаметром
1 ;v01 и наружным 1,3 1,5 мм (Versorgungskontor Maschil1el1
bauererzeugl1isse, Эрфурт, [ДР); камеры для миrрации
(рис. 40); проектор (прибор для чтения микрофильмов, даю-
щий 15 KpaTHoe увеличение); планиметр (Reiss).
Стеклянную посуду и металлические инструменты стери-
лизуют сухим жаром. Детали камеры из полиметакрилата
(пиакрила) и резиновые кольца для стерилизации дважды по
1 ч выдерживают в водяной бане при 58 ОС, затем обрабаты-
вают смесью спирт эфир. Термолабильные растворы стери-
лизуют филыраuией.
166 И. Бланк
« -_....::: . ..
.."',, r :.:: : . .
:.. "k , "-"',,,-, . '
: i f . .%,' Т
., ' ': . : ..J"' ! " " ""',, 1
: : ' ... ':-L".. :..:'.-::- '.
f.: ':: ,,,, . : ":-...: '. i:'.-.. . -: '. .'*' .
"' . . t!lI .дs, i!!; ," ъ{.' y /') ...........
.....::: ...::::..... ,..'-.-- , .. :>- . ;:.:/ .'..; ;:;.
; J ;; i ... ,
>, ,.""!' ...
[, 'i'
. ""\i'
iiJf W . .
..f.?"'Я:'<'
".;. ."". '. '
; {f'::
.......,...
" ' . . .
" . . :.'.
»
-;';r"
I I
'"',
Рис. 40. Устройство камеры для изучения миrрации макрофаrов: отдеЛЬные
детали и собранная камера с двумя капиллярами.
22.2.2.
Пo.iJучение RлеТОR
перитонеальноrо ЗRсудата
М,орской свинке внутрибрюшинно вводят 20 мл вазелино-
Boro масла. Через 5 7 дней животное забивают ударом по
rолове, послойно отпрепаровывают переднюю стенку живота
(кожу и фасцию) и дважды промывают брюшную полость
охлажденным раствором Хенкса с rепарином (по 50 мл). По
лученную при этом взвесь клеток перитонеальноrо эксудата
разливают по 10-миллилитровым центрифужным пробиркам
и центрифуrируют 10 мин при 150 g. Осажденные клетки ре-
суспендируют в 2 мл раствора Хенкса, переносят взвесь пи
петкой в центрифужную пробирку с тем же раствором, снова
центрифуrируют и после TpeXKpaTHoro отмывания суспенди-
руют в среде Иrла с сывороткой. В 1 мкл приrотовленноЙ
взвеси должно быть 5.104 клеток. Во время отмывки центри
Фужные прО'бирки необходимо держать в воде со льдом.
22.2.3.
:Капилляры и J{вмеры для МllrрВЦИJI
При помощи шприца (1 мл, иrла NQ 2) заполняют клеточ
ной взвесью 8 капилляров, за тем одним концом вдавливают
ИХ в размяrченный парафин, который, проникнув внутрь на
3 4 мм, образует пробку. После этоrо капилляры центрп-
фуrируют в течение 3 мин при 150 g. Центробежная СIlла не
должна превышать 120 150 g, иначе клеточныЙ СТО:lБIlК
22. Реакция rор.можения J.lUzрацuи JrlаКрофаZО8 167
выЙдет из капилляра и измерение площади миrрации будет
неточнЬШ. Особенно осторожно (100 g) следует центрифуrи-
ровать мышиные и крысиные клетки. После центрифуrирова
ния капилляр надрезают ампульным напильником примерно
на 0,5 I:\1 ниже rраницы клеток и, слеrка надавив, пере.1а-
Iывают; при этом обломок, заполненный Кv1еткаvrи. придер
....
........,
......;
'. н"о&<;<'}<.';
. . :".
'>:....\..... ,.
.
;l'-
*,'
.. ...
'" ..
) ? ':
... ..+ ....
Jt' +..
''>: .... .-.!'
('
,.1" .: . "
:.... ,.
""...{ ......> "....
; ,g ,J'
t 1.
.. ,- ...., .. t." ..... " . :
If :.; :;:;': :;.
< ,'" >
" . .;:01'''' '"
. :., ,
j
. t
JБ
А
'.
Рис. 41. Миrрация клеток перитонеальноrо эксудата морскоЙ свинки, имму-
низированной БЦЖ. А среда не содержит специфичеСhоrо allTнreHa: Б
среда содержит туберкулин PPD (20 мкr/мл).
живают стерильным тампоном. )Келатсл,но все это С.1елать в
условиях, исключающих бактериальное заrрязнение, но абсо
1ютная стерильность не нужна. При известной опытности
можно даже обойтись без добавления антибиотиков.
Обломок капилляра с клетками тотчас же ПО:\Iещают в
подrотовленную камеру для культивирования. На рис. 40 по-
казано ее устройство. Две пиакриловые пластинки OCHOBa
ние (70Х30Х2 мм) и крышку (50Х30Х2 :\01) стяrивают
шестью винтами, используя в качестве прокладки U-образно
соrнутую резиновую ленту (1 Х 2 мм в сечении). Получается
камера объемом около 1 :\1Л. Две камеры, заПО,/1ненные сре-
дой Иrла с сывороткой, но без антиrена, служат контролем.
Камеры, предназначенные для опытных проб, заполняют cpe
дой, содержащей антиrен в нетоксичн{)й для клеток концент-
рации (например, PPD, 1O 20 мкr/мл). В каждую Ka:\'Iepy
помещают по 2 капилляра. Сначала они ДОv1ЖНЫ свО'бодно
плавать в среде при наклоне каМеры. Затем их фиксируют в
нужном положении, осторожно стяrивая крышку и основание
ВИНтами. После этоrо, изrнав пузырьки воздуха, камеру за
купоривают расплавленным парафИНО:\f и инкубируют в ro-
168 И. Б.lUlН1С
ризонтальном положении при 39 ОС!. Через 24 ч поле миrра-
ции макрофаrов (рис. 41) проецируют с 15 KpaTHЫM увеличе
нием на лист бумаrи, обводят по контуру и измеряют плани-
MeTpo 1. Результаты опыта выражают либо в ВИДе индексов
миrрации (ИМ), либо как процент миrрации или процент
торможения:
и.м === Площадь поля миrрации в присутствии антиrена .
Площадь поля миrрации без антиrена '
Относительный ИМ === им клеток иммунизированноrо животноrо .
ИМ клеток неиммунизированноrо животноrо '
Процент миrрации==ИМ.100;
Продент торможения == 1 oo (100. ИМ).
22.3. ОБЩАЯ ОЦЕНКА
Торможение миrрации более чем на 20% обычно pacцe
нивают как достоверное свидетельство клеточноrо иммуните
та. При этом, однако, предполаrается, что в культуральной
среде нет специфических антител, поскольку, кроме ФТМ,
миrрацию макрофаrов MorYT тормозить комплексы антиrен
антитело, если они присутствуют в высокой концентрации.
Чтобы исключить влияние таких комплексов, к среде прибав
ляют rомолоrичную, но не аутолоrичную сыворотку, а сами
клетки MHoroKpaTHo отмывают для удаления rуморальных ан-
тител. Кроме 10ro, при обсуждении природы торможения миr
рации не следует забывать о возможной роли цитофильных
антите"l. РТММ является полуколичественным методом. Кю<
относительные показатели, индексы миrрации зависят от миr-
рационной активности исходной взвеси (контроль), которая,
разумеется, подвержена биолоrической вариабельности.
В этом отношении непрямой метод (см. ниже) дает более
надежные количественные данные.
22.4. МОДИФИКАЦИИ
Описанную выше методику можно в определенном CMЫC
ле назвать «прямой РТММ», так как образующие ФТМ лим
фоциты и подвижные клетки находятся вместе в одном ка-
1 Разработаны более простые парианты это!"! же методики (см, Прота
сова, О. В. Позина Н. М., Серееева О. с., Фролова М. А. Методы пзучt'
ния реактивности макрофаrоп в процессе IIммуноrенеза, Лабор. дело, 11.
667 669 (1966). u
Протасова, О. В., Перепечкина, Н. п.. Мац, А. Н. Биоло['ичеС!ШI! эффект
антилейкоцитарных антител на rетероrенную клеточную популяцию, ж.
Микробиол. (Москва), 11, 132 136 (1971). Прим. перев.
22. Реакция тор,иожения ,J,Нlzрации макрофаzов 169
ПИл.'lЯре. Если лимфоциты иммунизированноrо животноrо
смешивают с перитонеальными макрофаrами неиммунноrо
животноrо, то такой вариант методики также следует на-
звать «прямым».
«Непрямая РТММ» заключается в том, что сначала лим-
фоциты неиммунизированных животных культивируют с ан-
тиrеном, а затем бесклеточный фильтрат культуральной жид-
кости испытывают на клетках перитонеальноrо эксудата не-
иммунизированных животных. Поскольку действие ФТМ не
проявляет видовой специфичности, непрямой метод :исполь
зуется как клинический тест для оценки клеточноrо И IМУНИ-
тета у человека [7]. Правда, необходимость концентрировать
культуральную жидкость оrраничивает ценность этоrо мето-
да. Кроме Toro, непрямой метод требует б6льших затрат вре-
мени и труда, чем прямой. Однако с ero помощью получают
более надежные количественные данные, так как здесь можно
определить максимальное разведение надосадочной жидко-
сти, которое еще достоверно тормозит миrрацию.
Наряду с перитонеальными макрофаrами в качестве под-
вижных клеток в РТММ используются макрофаrи селезенки
[8]. Некоторые исследователи успешно работали с альвеоляр-
ными макрофаrами [9], но, по данным друrих авторов [1 О],
эти клетки не реаrируют на ФТМ.
Кроме маК'рофаrов, индикаторными клетками в реакции
торможения MorYT служить культивируемые клетки лимфоуз-
лов [11], лимфобласты из длительных культур [12] и лейко
циты крови [13, 14]. Торможение миrрации лейкоцитов крови
вызывает особый интерес, так как эту реакцию можно исполь-
зовать в КЛИНИке.
Блаrодаря простоте, высокой чувствительности и возмож
ности клиническоrо применения заслуживает внимания вари
ант РТММ, который разработали Хаук и Чанr [15]. Для се-
рийной обработки большоrо экспериментальноrо материа.'Iа
Уильямс и сотр. [16] предложили. метод фотометрическоrо
измерения площади миrрации.
22.5. ЛИТЕРАТУРА
1. Likhite V., Sehoп А., Migration inhibition and cell mediated immunity
А rev.iew, Rev. Сап: 01., 30, 135 151 (1971). .
2. Меlщсk Н. D., InhlbltlOn of macrophage migration and the mediation of
cellular immunity: а review, Ann..Allergy, 29, 195 208 (1971).
З. Вlooт В. R., Glade Р. R., In vltro methods in cell-mediated immunity
Acad. Press, New York and London, 1971, S. 1 578. '
4. George М:,. V.aughaп J. Н., In vitro сеlI migrаtiоп as а modeI for delayed
hypersensltlvlty, Proc. Soc. Ехр. Вiol. Med. III, 514 521 (1962).
5. David J. R., Al-Askari S,. Lawreпce Н. S. Thoтas L. J Immunol 93
264 273 (1964). " . .,
170 1I. Б.Il1Н!{
6. Вlooт В. R., Beппett В., Mechanism of а reaction in vitro associated
\vith delayed type hypersensitivity, Science, 153, 80 82 (1966).
1. Rockliп R. Е., David J. R., Method for the production of MIF Ьу Ьитап
bIood Iymphocytes, in: In vitro methods in cell mediated immunity, Acad.
Press. .:\е\\' York and London, 1971, S. 281 287.
8. Sz!ejcar J., Pekarek J., Jo/raпovsky J., Studies оп the mechanism of de-
layed hypersensitivity in tissue cultures. ХН. Study of the character of
biologically active substances released оп incubation of Iymph node cells
from hypersensitive animals with specific antigen, Z. Immun.-Forsch.,
138, 283 294 (1969).
9. Bartfeld Н., Atoyпataп Т., In vitro delayed (cellular) hypersensitivity in
multiple sclerosis to central nervous system antigens, Int. Arch. Allergy,
39. З61 З67 (1970).
10, БЫ М., Sitko Ch., ComparatiYe investigation of migration inhibition of
al'l/eolar macrophages and peripheral monoпuclear cells of rhesus monkeys
\\7ith antigen antibody complexes, Z. Immun.-Forsch., 144, 352 358
(1972).
11. т/юr D. Е., Delayed hypersensiti"ity in mап: а correlate in vitro and
transfer Ьу ап RNA extract, Science, 157, 1567 1569 (1967).
12. Scheetz М. Е., Rossio J. L., Dodd М. С., А sensitive and reproducibJe mе-
thod for the quantitation of the MIF correlate of delayed hypersensitivity
in mап, Immunol. Communic., 1, 211 222 (1972).
13. Soborg М., Beпdixeп G., Нитап lymphocyte migration as а parameter of
hypersensitiYity, Acta med. scand., 181, 247 256 (1967).
] -1. Roseпberg S. А., David J. R., Inhibition of leucocyte migration: ап eva-
luation of this in vitro assay of delayed hypersensitivity in mап to а so-
luble antigen, J. Immunol., 105, 1447 1452 (1970).
15. Н ouck -т. С, Cfraпg' С. М" А new sensitive assay for macrophage inhibito-
[У factor, Proc. Soc. Ехр. Biol, Med., 142, 800 80З (1973).
16. Williaтs Т. J., Morley J., Wolsteпcroft V., Use of а photometric method
for assay of materials producing inhibition of macrophage migration, J.
Immunol. Methods, 2, 137 143 (1972).
23. Исследование факторов,
вызывающих хемотаксис
И.БЛАН1\
23.1. ПРИНЦИП
ЛеЙIЮЦИТЫ отвечают на хемота сические раздражители
in vitro направленным :перемещением. Двиrаясь в отсутствие
раздражителей случайно и беспорядочно, они начинают пере-
мещаться в одном направлении под влиянием веществ, вызы
вающих хемотаксис [1].
Хемотаксические факторы MorYT образовываться in vitro
в результате иммунных 'реакций как rуморальноrо, так и кле
точноrо типа. Например, комплексы антиrен антитело, aK
тивируя комплемент, MorYT вызывать хемотаксис нейтрофи-
лов, макрофаrов и эозинофилов [1 4]. Кроме Toro, известен
не относящиЙся к системе комплемента сывороточный фак-
тор, вызывающий хемотаксическую реакцию макрофаrов [5].
Кроме Toro, при реакциях клеточноrо иммунитета культиви-
руемые in vitro лимфоциты под действием антиrена выделя
ют хемотаксические факторы для макрофаrов [3, 6] и ней-
Тipофилов [7]. Эти факторы относятся к медиатораZl1 клеточ-
Horo иммунитета, и их удалось отделить от фактора TOp}.10
жения миrрации [8].
В 1962 r. Бойден [2] предложил использовать для изуче
ния хемотаксиса микропористые фильтры. Ero методика осно-
вана на способности лейкоцитов проходить сквозь пор истую
мембрану в направлении rрадиента концентрации веществ,
вызывающих хемотаксис. Эта мембрана делит специальную
камеру на два отсека, в один из которых помещают лейкоци-
ты, а в друrой исследуемое вещество. Величину пор подби-
рают таким образом, чтобы лейкоциты проходили через них
только в результате активной миrрации.
23.2. ПРОВЕДЕНИЕ ОПЫТА
23.2.1. Реаrенты и приборы
Камера для изучения хемотаксиса из ПОJ1ИNIетакрилата
(пиакрила) с наружным диаметром 1,5 см и внутренним
1 см; на рис. 42 показаны отдельные части камеры: корпус
с внутренней резьбой, держатель для мембраны, два КО.1ьца,
мембрана и :резьбовая заrлушка.
Мембраны из эфиров целлюлозы диамеТрО:.\I 12 мм (Sar-
torius Membranfilter ОтЬН, rеттинrен, Фрr). Для исследо-
Н2 J/. Б.ЮН"
вания :\юнонуклеаров используют мембрану с диаметром пор
5 8 1.КM (N2 11301050 по каталоrу), для исследования ней
ТРОфИ.10В 3 МЮ1 (оХ2 11302050 по KaTa.l0ry).
. ":>'>"'"'. "'" .::- ," "> . ' ;':";' 'l,-'<: \. ,' ," .,,:.' 0"0.'
,,:......,':. ","'., '. \
l'
'\\
.. 'i-:,'
. .
щ
.<: <::-
..
:
. .:
.:..:.(:::;;:....:
РJlС. 42. Отдельные дета.1И камеры ДЛЯ изучения хемотаксиса.
2; .2.2.
ПО;IучеНllе Iшеток
Индикаторными к..тIетками чаще Bcero служат rранулоциты
1J.1И 1OHOHYKдeapы кроличьеrо перитонеальноrо эк суда та; ис
ПОJlЬ3УЮТСЯ также клетки из перитонеальноrо эксудата MOp
ской СВJIНкп. rрану.1011итарный эксудат (95 99% ней1'РОфИ
ЛОВ) ПО.lучают у кролика через 24 ч после внутрибрюшинной
инъекшш 100 M.тI стерильноrо бульона (25 r cyxoro
бульона в 1 л ДИСТИ 1.1ированной воды, Institut fur Immunpra-
parate und Nahrmedien, Берлин, [ДР), 'Пунктируя и промывая
брюшную ПО,,10СТЬ. Д.1Я получения эксудата, боrатоrо макро-
фаrами, кролику или морской свинке вводят внутрибрюшинно
вазелиновое маС.10, соответственно 100 или 20 мл. Получение
и дальнейшая обработка клеток описаны в 22.2.2. В rOTOBbIX
клеточных взвесях ДОЛЖНО содержаться 2 .106 3.106 нейтро
филов или 4. 1 06 5. 106 макрофаrов в 1 л. К суспензионной
среде необходимо добавить 10 15% свежей rомолопrчнои
сыворотки.
23.2.3.
Изучение хемотаRсиса
После Toro как приrотовлена клеточная взвесь, в нижний
отсек камеры вносят 1 мл исследуемоro материала. Сведения
о мноrочисленных продуктах иммунной реакции, которые вы-
зывают хемотаксис, можно найти в цитированной выше .111-
тературе. В качестве примера мы рассмотрим определение
хемотаксических свойств бесклеточной надосадочноЙ жидко-
сти, полученной из стимулированной культуры лимфоцитов.
В этом случае методика культивирования лимфоцитов (см.
разд. 21) имеет следующие особенности:
2:J. ИСClе(}ование факторов. вЫзывающих xe.мlJTaкcиc 113
1) чтобы хемотаксические сВОйства культуральной жидко
CТII моrли проявиться уже в первые сутки, нужна довольно
высокая концентрация лимфоцитов, наПРИl\1ер 2.107 В 1 мл
.:ИЯ KYJIlJTypbI клеток .тшмфоузла [6]; . . .
2) лимфоциты культивируют в среде без сыворотки [3];
1'0.11>1\0 П<'ред испытанием хемотаксических свойств, после yдa
f
.-1<
. :' :,j' '('./.>..'. ,' %. ;{. :' ,,;'-', .".
'./ ,.. ,.; .
.'7.-
1.&....
* t k
:i
,,,
,/
,
'/
J л
:'mf,
'-'''''
."!!'
'/
::T
.,.. .
/
i?'
)
.
/
?
/'
«
,-":to.:;::
I
?4- .... ......А9 : ::f.t%;;;jj. .........:w :,И',Q:4/,.. '(... l"ч./j 4 / /"k/ Ir.
РИс. 43. Мембрана с ПРОникшими сквозь нее клетками перитонеаJIЬноrо
ЭКсудата МОрской свинки (Х 100). Формула эксудата: 77% макрофаrов,
12% сеrментоядерных rранулоцитов, 11 % лимфоцитов. в качестве индук
тора лейкотаксиса применяли l0/0-ный раствор казеината натрия.
ления клеток центрифуrированием (1500 g, 15 МИН), К Haд
осадочной жидкости добавляют 10 15% сыворотки.
После заполнения исследуемым материалом нижний отсек
камеры закрывают сверху мембраной, не оставляя пузырьков
воздуха. Затем в верхний отсек на мембрану наливают 1 мл
клеточной взвеси И прикрывают покровным стеклом (что.бы
из.бежать испарения воды). Камеру инкубируют при 39 ос в
течение 3 ч при работе с нейтрофилами и 5 ч при работе с
мононуклеарами. После инкубации отсасывают из BepxHero
отсека жидкость, извлекают мембрану и, пометив ее верхнюю
и нижнюю стороны, осторожно ополаскивают физиолоrиче-
ским раствором NaCl, после чеrо фи сируют 3 мин в 96% HOM
спирте. Лейкоциты проще Bcero окрашивать 1 % -ным раство-
ром метиленовоrо синеro (10 МИН). Окрашивание rематокси-
лином описано у Бойдена [2].
174 И. Бланк
Количественная оценка реакции заключается в подсчете
клеток, проникших сквозь фильтр (рис. 43). При 100 KpaTHOM
увеличении микроскопа на нижней поверхности двух мембран
(параллельные пробы) просматривают по 10 полей зрения;
подсчитывают только те клетки, которые полностью прошли
через мембрану, и находят среднюю величину. Чтобы полу-
чить сопоставимые данные, вычисляют разнасть между вели-
чинами опыта и контроля (вместо иС'следуемоrо материала
культуральная среда).
23.3. ОЦЕНКА МЕТОДА
Методика Бойдена позволяет изучать лейкотаксические
факторы, образующиеся in vitro в результате rуморальных и
клеточных иммунных реакций. С ее помощью были получены
ценные сведения о механизмах хемотаксиса и воспаления, ко-
торое возникает в месте инъекции антиrена при rиперчуВ'ст
вительности немедленноrо и замедленноrо типов. В настоя-
щее время особый интерес вызывает использование этой Me
тодики для выявления медиаторов клеточноrо иммунитета.
В хемотаксисе макрофаrов, вызываемом продуктами анти
rенной стимуляции лимфоцитов, мы как бы воспроизводим
феномен, происходящий in vivo при воспалении, обусловлен-
ном rиперчув'Ствительностью замедленноrо типа. Отсюда вы-
текает возможность применить методику Бойдена для оценки
клеточноrо иммунитета. Судя по данным литературы, она
чувствительнее РТММ, так как фильтраты культур, вызываю-
щие хемотаксис, тормозят миrрацию макрофаrов только после
MHorOKpaTHoro концентрирования [3, 6]. Снайдермен и сотр.
[3] предложили вариант методики, который можно использо-
вать в клинике.
Воспроизводимость методики Бойдена зависит от ряда
факторов. Решающее значение имеет выбор мембранных
фильтров. Прежде Bcero необходимо выяснить в опыте со
стандартным хемотаксическим areHToM (например, с филы
ратом бактериальной культуры [9]), возможна ли миrрация
клеток через мембраны данноrо типа и не слишком ли вели-
ка миrрация в контроле. Разброс результатов уменьшится,
если всю серию опытов ,ставить на мембранах из одной и тоЙ
же партии. Далее, в связи с тем что число миrрирующих кле-
ток пропорционально концентрации клеток в исходной взвеси,
эта концентрация должна быть постоянной от опыта к опыту.
Соблюдая это условие, Уорд [10] получил ошибку метода не
более 5%. По данным Карутерса [11], она составляет 10
20%.
23. Исследование факторов, вызывающих хемотак;сис 175
к недостаткам методики относят трудность морфолоrиче-
екаЙ идентификации миrрирующих клеток. Келлер и Соркин
[ 1] сообщают, что им удавалось определять тип клеток, но
друrпе псследователи [9, 10] указывают на большие затруд-
нения. В осо,бенности это относится к миrрирующим клеткам
перитонеальноrо эк'судата. В нем всеrда содержатся нейтро
филы, реаrирующие вместе с макрофаrами на большинство
хемотаксических раздражителей. Хемотаксическая чувстви
тельность нейтрофилов rораздо выше, чем у макрофаrов [9],
поэтому даже небольшая примесь этих клеток может иска
зить результаты при изучении макрофаrов. В то же время
при изучении хемотаксиса нейтрофилов макрофаrи не поме-
шают оценке, если использовать мембрану спорами 0,65 мкм,
не прапускающую клетки крупнее нейтрофила. При этом, ра-
зумеется, нужно учитывать наряду с клетками, проникшими
через поры, также и клетки, находящиеся в толще фильтра.
23.4. МОДИФИRAЦИИ
Поликарбонатные фильтры «нуклеопор» (General Electric
Со., ОША) блаrодаря однотипным порам цилиндрической
формы и меньшей толщине мембраны (12 мкм вместо 150)
лучше упомянутых выше (23.2.1). Миrрируя через мембрану
«нуклеопор», клетки меньше деформируются, что облеrчает
их морфолоrическую идентификацию [9]. Используя эти MeM
браны, можно, кроме тоrО,сократить время инкубации.
Зиrмонд и сотр. [12] удачно модифицировали методику
Бойдена: они измеряют расстояние фронта миrрации клеток
от поверхности фильтра в зависимости от времени инкуба-
ции.
23.5. ЛИТЕРАТУРА
1. Кеllе, Н. и., Sorkin Е., Chemotaxis of leucoc y tes Ex p erientia 24 641
652 (1968). " ,
2. Boyden S., The chemotactic effect of mixtures of antibody and antigen оп
polymorph-nuclear leucocytes, J. ехр. Med., 115, 453 466 (1962).
3. Snyderтan R., Аитаn L. С., Hausтan М. S., Mergenhagen S. Е., Ниmап
mononuclear 1eucocyte chemotaxis: а quantitative assay for humoraI and
cellular chemota tic factors.' J. If!1munol., 108, 857 860 (1972).
4. Кау А. В., Stu Ies оп еО 1Пор ll Ieucocyte migration. П. Factors specifj-
c 1ly chemotactlc for еОS1Порhlls and neutrophils generated from guinea
lЪ7g) um Ьу antigen-antibody complexes, СНп. Ехр. Immunol., 7, 723
5. Ward Р. А., Chemotaxis of mononuclear cells J ех р Med 128, 1201
1221 (1968). ,. . .,
6. War . Р. А., Reтold Н. О., David J. R., Leucotactic factor, produced Ьу
senSltlzed lymphocytes, Science, 163, 1079 1081 (1969).
176 И. Блан"
7. David J. R., Lymphocyte mediators and cellular hypersensitivity, New
Engl. J. Med., 288, 143 149 (1973).
8. Reтold Н. а., Ward Р. А., David J. R., Characterization of MIF and its
separation from а chemotactic factor for monocytes, Int. Arch. Al1ergy,
41, 16 17 (1971).
9. Horwitz D. А., Garrett М. А., Use of leucocyte chemotaxis in vitro to as-
say mediators generated Ьу immune reactions. 1. Quantitation of mопо-
nuclear and polymorphonuclear leucocyte chemotaxis with Polycarbonat
filters, J. Immunol., 106, 649 655 (1971).
10. Ward Р. А., In vitro methods in cell-mediated immunity, Academic Press,
New York and London, 1971, S. 89 93 und 481 487.
11. Carruthers В. М., Leucocyte motility. 1. Method of study, normal variati-
оп, Сап. J. Physiol. Pharmacol., 44, 475 485 (1966).
12. Zigтond S. Н., Hirsch J. а., Leucocyte locomotion and chemotaxis. New
method for evaluation, and demonstration of а cell-derived chemotactic
factor, J. ехр. Med., 137, 387 410 (1973).
24. Пересадка кожи
Х.КАУНАТ
24.1.
ПРИНЦИП
Основная причина отторжения трансплантатов rенетиче
ские различия между донором и реципиентом. К rенетическим
локусам (или комплексам локусов), определяющим сильные
антиrены тканевой совместимости, относятся: у мышей H 2,
у крыс H-l, или Ag-B, У человека АВО и HL-A. У мышей из
вестно 18 аллелей локуса 1 H 2, из которых чаще Bcero BCTpe
чаются H 2a, Н-2 Ь , H-2 d и H 2k. У крыс обнаружено 9 аллелей
H-l. Каждый аллель детерминирует четыре и бо.'lее анти
reHOB 2 .
Чем больше различие по сильным антиrенам rистосовме
стимости между донором и реципиентом, те:м энерrичнее бу-
дет реакция со стороны механизмов иммунной защиты и тем
скорее будет oTToprHYT трансплантат. В результате иммуни
зации реципиента несовместимыми антиrенами первorо TpaHC
плантата второй трансплантат от Toro же донора отторrается
быстрее первоrо. Например, первичные трансплантаты кожи,
пересаженные мышам инбредной линии А от },1ышей линии
СВА, отторrаются через 10,2 + 0,3 дня, а вторичные транс-
плантаты сохраняются уже менее 6 дней. Этот феНО:\Iен YCKO
peHHoro отторжения (second set reaction) не имеет места, ec
ли второй трансплантат взят от друrоrо донора, rенетически
отличающеrося от первоrо. Развивающийся после первой пе
ресадки трансплантационный иммунитет сохраняется у раз
ных животных различное вре:мя (у мышей почти всю жизнь,
у крыс в течение примерно 60 дней). Такой и:ммунитет
можно индуцировать не только пересадкой кожи, но и введе-
нием реципиенту живых донорских лейкоцитов или к.1еток се-
лезенки. После этоrо тоже наблюдается ускоренное отторже
1 По современным данным, в системе Н-2 не менее двух тесно сцеплен-
ных локусов: Н-2К и H-2D. Существует по меньшеЙ мере 9 серолоrически
различных аллелеЙ локуса Н-2К и 8 аЛ,lелеЙ локуса H-2D. Символами
Н-2 а ... H 2k теперь обозначают rаплотипы, т. е. комбинации алл елей, на-
следуемые в одноЙ хромосоме. Число возможных rаплотипов определяется
произведением числа аллелей локусов К и D 11 равно не менее 9.8===72.
Прuм. перев.
2 Каждый аллель детерминирует только одну (частную) а.l.l0антиrен-
ную специфичность. Положительные реакции сантисыворотками друrоЙ
специфичности считаются перекрестными и обусловлены общими антиrен-
ньнш специфичностями (см. Ивани, П.. EropOB, Н. К. И"шvноrенетика
совместимости тканеЙ (HL-A и Н-2), М.: «Наука», 1975). Прuм. перев.
12 840
178 Х. Каун.ат
ние кожных т ансплантатов. Активно индуцированный TpaHC
п.'IаНТaI:IIОННЫИ иммунитет можно перенести друrим живот-
нты:м тои же линии с пОМощью иммунокомпетентных клеток.
. таких пассивно иммунизированных животных тоже будет
происходить ускоренное отторжение первичноrо транспланта
та. Один из слабых локусов тканевой совместимости находит-
ся в Y xpO 1OCOMe. Поэтому самцы мышей и крыс обладают
АВ А!lтотранспtlltlнтит сохроняется IJсю ЖU,JНI1
АВ О И,JО трансп.нtlнтат > 200 iJней
АВ О Изо d' траНСПtllантот z зо 8неи
Ар I А.п.ло трансплантат ::;;: i 5 анеи
Рис. 44. Сроки приживления кожных трансплантатов на хвосте мыши
зависимости от rенетических различиЙ ме)Кду донором и реципиентом.
особым «мужским» антиrеном, и внутрилинейные трансплан
таты от са:\1ЦОВ отторrаются у самок, тоrда как у самцов при
живаются трансплантаты и от самок, и от самцов.
В зависимости от rенетических взаимоотношений донора
и реципиента различают: aYToreHHbie (аутолоrичные) TpaHC
плантаты от Toro же индивидуума; синrенные (изоrенные)
трансплантаты от представителей той же инбредной линии;
аллоrенные (rомолоrичные) трансплантаты от особей Toro же.
вида, относящихея, однако, к друrой инбредной линии; ксено-
reHHbIe (rетеролоrичные) трансплантаты от представителей
друrоrо вида. Сроки приживления кожи, пересаженной, на-
пример, на хвост инбредной мыши, будут различными в за-
висимости от rенетических различий между донором и реци-
пиентом (рис. 44).
Пока не проявился иммунный ответ 'реципиента, переса-
женная ткань сохраняет жизнеспособность, снабжается
кровью и реваскуляризируется. Затем происходит разрушение-
трансплантата, которое осуществляют rлавным образом сен-
сибилизированные малые лимфоциты или моноциты (реакция
за:\1едлепноrо типа). Первичное оттор:жение начинается с ИН-
24. Пересадка кожи 179
фильтрации трансплантата полиморфноядерными лейкоцита-
ми, которая продолжается около 48 ч. Между 3-м и 9 M дня
МИ во все слои трансплантата вплоть до эпидермиса миrри-
руют моноциты и лимфоциты. За несколько дней до oттop
жения отмечается набухание клеток эпидермиса; rистолоrиче
ски на 7 8 й день уже определяется некроз (который че-
рез 48 ч становится видим невооруженным rлазом).
Еще не ясно, каким образом кожный трансплантат имму
низирует реципиента. Предполаrается, что ero антиrены по
афферентным лимфа'тическим сосудам попадают в реrионар-
ные лимфоузлы и встречаются здесь с малыми лимфоцитами.
Вероятно, это так, поскольку трансплантаты, не связанные с
орrанизмом реципиента через лимфатическую систему, обыч-
но не MorYT вызвать иммунный ответ, ведущий к отторжению.
24.2. ПРО ВЕДЕНИЕ ИССЛЕДОВАНИЯ
24.2.1. Реаrепты и приборы
Для трансплантации на хвост необходимы: 1,0 r rексенала
в 70 мл 0,9%-Horo раствора хлористоrо натрия (при хранении
в ХОЛОДИЛЬНИКе такой раствор rексенала [оден К употребле-
21}5
10
.*0
Рис. 45. Стеклянная трубочка с 6 боковыми вентилирующими отверстиями
для защиты трансплантатов, пересаженных на хвост мыши.
}шю более недели); острое лезвие безопасной бритвы то.ПЩИ-
.ной не менее 0,08 мм, например «Польсильвер»; перед упот
реблением лезвие дезинфицируют, поrрузив в 75 % ный спирт;
тонкостенные стеклянные трубочки длиной 50 мм с внутрен-
ним диаметром 5 мм (лучше приrотовить специа.lьные тру-
бочки с боковыми отверстиями, как показано на рис. 45).
Для трансплантации на затылок нужны: раствор reKceHa
ла (см. выше); эфир для наркоза; жидкая повязка «Акуто.1»
во флаконе с распылителем; марля, пропитанная смесью ла-
нолина (66,0 r) с парафином (33,0 r); rипсовый бинт (мар.1Я,
2*
180 Х. КаУllат
засыпанная зубоврачебным rипсом, который твердеет быстрее
хнрурrическоrо); лейкопластырь из полимерной пленки [из
rотовитель фирма Johnson and Jоhsоп, филиал в rамбурrе
(rласхютте); в одной упаковке 8 рулонов, каждый длиной
около 4,5 м; ширина 3,8 см]; стерильный физиолоrический
раствор.
24.2.2. Пересадка кожи на хвост
Мышей соответствующих инбредных линий в возрасте
10 12 недель наркотизируют, вводя внутрибрюшинно по 0,2
0,25 мл раствора rексенала на 20 r веса. Хвост дезинфициру-
ют спиртом и лезвием бритвы срезают с определенных участ-
ков удлиненно овальные лоскутки кожи длиной около 4 мм;
их пересаживают на поверхность срезов, одновременно cдe
ланных на хвосте реципиента. Трансплантаты располаrают
так, чтобы волоски были направлены к основанию хвоста.
Ложе трансплантата (поверхность среза) должно быть pOB
ным И чуть розоватым. Применяя показанные на рис. 45 за-
щитные трубочки, можно на один хвост пересадить до 16
трансплантатов (по 4 кусочка сверху, снизу и по бокам). Опе
рационное поле смачивают раствором пенициллина, затем на
хвост надевают защитную трубочку и закрепляют ее лейко-
пластыре 1. Чтобы не нарушить кровоснабжение, трубочки не
должны С.1ИШКОМ плотно обжимать основание хвоста. Цирку-
ляция воздуха над трансплантатом будет обеспечена лишь в
том случае, если концы трубочек или боковые отверстия не
подверrнутся заrрязнению. После пересадки по крайней мере
в течение двух суток животных следует держать на филыро
вальной бумаrе или на обеспыленной соломе (или крупной
древесной стружке) и кормить некрошащимися брикетами.
24.2.3.
Пересадка кожи на затылок
у мышей, наркотизированных rексеналом, на затылке пол
ностью выщипывают шерсть (лучше это делать вдвоем), от-
резают ухо, двумя rлазными пинцетами разделяют наружный
и внутренний лоскутки кожи и распластывают их в физиоло-
rическом растворе хлористоrо натрия. Эпилированную об-
ласть на затылке дезинфицируют спиртом; затем животное
наркотизируют эфиром и вырезают у Hero два круrлых лос-
кутка кожи. На их место внутренней стороной к ране прикла-
дывают (разравняв, чтобы не было складок) кусочки кожи от
уха и закрепляют их, опрыскивая «Акутолом». После этоrо
операционное поле закрывают марлей, про'Питанной смесью
ланолина с парафином; сверху накладывают предварительно
24. Лересадка ICCжи 181
смоченный rипсовый бинт. Вместо rипса поверх марли можно
наложить папиросную бумаrу и сделать повязку из лейко-
П.1астыря. Повязки оставляют на 7 8 дней. Первые 2 3 дНЯ
ЖJIВОТНЫХ держат на фильтровальной бумаrе. Для блаrопо-
.1учноrо исхода операции следует брать мышей в возрасте
3 6 месяцев.
24.3. ОЦЕНКА СОСТОЯНИЯ ТРАНСПЛАНТАТА
Состояние трансплантатов оценивают, рассматривая их
под лупой и прощупывая иrлой. Наблюдаемые изменения
к.1ассифицируют следующим образом
+ + + трансплантат прочно прирос к тканям хозяина;
+ + трансплантат приподнят;
(+ +) трансплантат приподнят и некротизирован;
+ трансплантат частично oTToprHYT;
(+) трансплантат частично orroprHYT и некротизиро
ван;
трансплантат полностью orroprHYT.
Сроком сохранения трансплантата считают промежуток
времени между пересадкой и полным отторжением. Чтобы
точно установить момент отторжения, необходимы некоторый
опыт и ежедневное наблюдение. При пересадках на хвост
можно снять защитные трубочки уже через 2 дня и блаrодаря
этому рано начать наблюдение за трансплантатами.
Автор раздела выражает блаrодарность д-ру Хейнеке
(Zentralinstitut fiir Microbiologie und experimentelle Therapie,
Иена) за демонстрацию и помощь при освоении описанных
fетодов.
24.4. ЛИТЕРА ТУР А
1. Albert Р., Medawar Р. В., Вiologica! probIems of grafting, BlackwelI,
Oxford, 1959.
2. Billinghaт R. Е., Medawar Р. В., The technique 01 free skin grafting in
mamma!s, J. ехр. Bio!., 28, 385 (1951).
З. Billinghaт R. Е., Free skin grafting in mammals, in: Billingham R. Е"
Silvers W. К. (Eds.), Transplantation of Tissues and Cells, Wistar 1nsti-
tute Press, Philadelphia, 1961.
4. Brent L., Medawar Р. В., Tissue transplantation. А new approach to the
typing probIem, Brit. med. J., 2, 269 (1963).
5. Brown А. М., Dinsley М., Skin grafting and the homogeneity of inbred
mouse strains, Lab. Anim., 1,81 (1967).
б. Dausset J., Haтburger J., Mathe О., Advances in transplantation, Munks-
gaard, Kopenhagen, 1966.
1. Festing М., Grist 5., А simple technique for skin grafting in rats Labora-
tory Animals, 4. 255 (1970). '
8. Wilson D. В., Billinghaт R. Е., Lymphocytes and transplantation immuni-
ty, Advanc. Immunol., 7, 189 (1967).
25. Реакция
«трансплантат против хозяина»
на мыах rибридахx nepBoro поколения
В.ТЕССЕНОВ
25.1. ПРИНЦИП
Реакция «трансплантат против хозяина» (РТПХ) служит
полезным методом оценки иммунореактивности лимфоидных
клеток по отношению к трансплантационным антиrенам in
vivo. РТПХ наблюдается в том случае, коrда реципиенту вво-
дят живые rистонесовместимые клетки, которые он почему-ли-
бо не может oTToprHYTb. Между тем введенные клетки ПРОЯБ-
.ляют иммунолоrическую аrрессию против тканей хозяина, Б
результате которой развиваются симптомы РТПХ: задержка
роста, увеличение селезенки и печени, атрофия лимфоидных
opraHoB, диаррея и анемия. Синдрому РТПХ в зависимости
от конкретных условий ero воспроизведения дают разные на-
звания: «болезнь малорослости» (анrл. runt disease), «вторич-
ная болезнь» (secondary disease) или «rо:vюлоrичная болезнь»
(homologous disease).
Классическим объектом дЛЯ РТПХ служат мыши. Синд-
ром удается вызвать у новорожденных мышат, у rибридов
первоrо поколения и при клеточном хи:vrеризме, а также у
взрослых мышей после облучения, обработки цитостатикюlИ
или индукции толерантности к антиrенам тканевой совмести-
мости донора. Во всех случаях иммунолоrическая компетен-
ция реципиента в отношении клеток донора снижена или ПО.l-
ностью отсутствует.
Наиболее демонстративно РТПХ воспроизводится на мо-
дели rибридов первоrо поколения. Если мыши одной из роди-
тельских линий (А) используются как доноры клеток для rиб-
ридов F! (АхВ), то донорские клетки (АА) не содержат ни-
каких антиrенов, которые мorли бы распознаваться реципи-
ентом как чужеродные. В то же время реципиент обладает
отсутствующими у донора антиrенами (В), на которые клетки
донора способны дать иммунолоrический ответ. Активность
перенесенных клеток в РТПХ зависит от присутствия сред)!
них Т-лимфоцитов, но при этом нельзя исключить также уча-
стие В-клеток [1]. Существует ряд критериев для количест-
венной оценки РТПХ: потеря веса, летальность, спленомеr(]-
.лия, rепатомеrалия, rипертрофия лимфоузлов, усиление фаrо-
цитарной активности ретикуло-эндотелиальной системы, ЛЮI-
фоцитарная инфильтрация печени или же пролиферация ли:vr-
фоцитов в месте введения при локальной РТПХ.
25. Реакция «трансплантат против хозяина» 183
До сих пор чаще Bcero ис'Пользуют индекс увеличения ce
.lезенки [7]. Недавно на крысах был разработан более u чув
СТВlIтельный метод оценки РТПХ [4, 5, 9], применимыи и в
опытах с мышами [6]. Оба метода описаны ниже для модели
РТПХ у мышей-rибридов Fl. Спрент и Миллер [8] оценивали
РТПХ по включению 3Н-тимидина спленоцитами rибридов, но
эта очень изящная методика еще не получила широкоrо рас-
пространения.
25.2. ПРО ВЕДЕНИЕ ИССЛЕДОВАНИЯ
25.2.1. Реаrеиты и приборы
Среда Иrла и раствор Хенкса (Staat1iches Iпstitut fйr Immuп-
praparate uпd Nаhrmеdiеп, Берлин, [ДР)
0,2 % -ный раствор трипановоrо синеrо в физиолоrическом рас-
творе N aCl
Шприцы для инъекций: на 1 мл (с rрадуировкой до 0,1 мл),
на 5 и на 20 мл
Иrлы для инъекций: 0,50Х 10, 200х 1,20
rамильтоновский микрошприц (100 мкл)
Фильтр из порисrоrо стекла 117 G5 (Schott, Иена) для сте-
'рилизующей фильтрации растворов
Меланжеры для подсчета ЭРИ11РОЦИТОВ и лейкоцитов
Счетная камера Тома или Нейбауэра
Стеклянный rомоrенизатор (150х25 мм)
Для экспериментов нужны две линии инбредных мышей,
различающихся по локусу Н-2 или по нескольким reHaM тка-
невой совместимости, и их rибриды F!.
25.2.2.
Проведение опыта
25.2.2.1. Получение ЛИМфОЦИТОВ
Клеточную взвесь rотовят так же, как для реакции бласт
трансформации лимфоцитов (см. 21.2.3), но Юfесrо среды
RPMI-1640 применяют среду Иrла (без каких либо добавок).
Лимфоциты можно получить из ,селезенки, тимуса или ЛIМфО
узлов мышей одной или двух инбредных линий. КоличествО'
клеток, которое необходимо ввести, зависит от выбора линий
и от конкретных задач эксперимента [2, 7]. ДЛЯ КОНТРО.1ЬНОЙ
rруппы rотовят взвесь клеток из соответствующеrо opraHa
rибридов F I .
25.2.2.2. Введение клеток
При оценке РТПХ по индексу увеличения селезенки реци
пиентами клеток служат rибриды F! в возрасте 1 3 дней.
Им вводят внутрибрюшинно или внутривенно (в ретроорби-
184 В. ТессеНО8
тальное сплетение) 0,1 мл среды Иrла, содержащей 10б 108
лимфоцитов. Чтобы введенная взвесь не вытекала обратно,
иrлу вводят в брюшную полость через мышцы бедра. Индекс
увеличения селезенки определяют через 10 дней. Контрольная
rруппа должна состоять из мышей тoro же помета, которым
вводятся синrенные клетки (от rибридов F 1 ).
При оценке РТПХ по увеличению лимфоузлов реципиента
;\-ш служат взрослые rибриды F I . Им вводят под кожу стоп от
106 ДО 2.107 ,пимфоцитов. Клеточную взвесь набирают в мик-
рошприц и, вколов иrлу между первым и вторым пальца
ми, вводят клетки в пространство под подошвенным aHOHeB
розо}! посредине стопы. Этим способо}! '10ЖНО сдслать две
инъекции по 20 мкл С интервалом 15 ,!Ин, введя Bcero
2.107 К..lеток. В друrую стопу для кою:ро..1Я вводят синrенные
клетки (от rибридов F 1 ). Через 7 дней мышей забивают и
берут от них подколенные лимфатические узлы.
25.2.2.3.
Измерение
Индекс увеличения селезенки. Сначала у всех мышей оп-
u ( Вес селезенки )
ределяют относительныи вес селезенки В . Затем
ес тела
находят среднюю арифметическую относительных весов ceolle-
зенки в контрольной rруппе и вычисляют индекс увеJlичения
селезенки (ИУС) в опытной rруппе:
ИУС ==
Относительный вес селезенки животноrо опытноЙ rpYnnbl
Средний относительный вес селезенки У животных
контрольной rpYnnbl
Считается, что индексы более 1,3 свидетельствуют о
РТПХ. Между величиной индекса увеличения селезенки и ло-
rарифмом дозы введенных клеток существует oI1инейная зави-
симость; однако это справедливо лишь в определенном интер-
вале доз, например при введении лимфоцитов мышей С3Н
rибридам РI (С3Н xDBA/2) в дозах от 0,5.106 до 5.106 кле-
ток [7].
Индекс увеличения лимфоузлов. Подколенные лимфатиче-
ские узлы rомоrенизируют в стеклянном rомоrенизаторе или
фарфоровой ступке и определяют число клеток с ядром. По-
скольку даже синrенный инокулят вызывает определенное
увеличение числа таких клеток, в ту и друrую стопу всеrда
следует вводить одина.ковое количество лимфоцитов. Каждая
мышь, таким образом, служит для получения как опытных,
так и контрольных данных. Индекс увеличения лимФоузлов
25. Реакция «траНСJlлантат против ХО3ЯUJta» 185
(1IУЛ) вычисляют как отношение числа клеток в подколен-
ных узлах опытной и контрольной конечностей:
Число клеток после введения полуаллоrенной взвеси
IIYJI == Число клеток после введения синrенной взвеси
При индексе выше 1,2 отличие от контроля считается до-
CToBepHbI f. При введении 106 5.106 лимфоцитов от мышей
rнбридам FI (С3Н Х StjA) имеет место линейная зависимость
IlHдeКica от лоrарифма вводимых клетоК [6].
25.3. ОЦЕНКА МЕТОДА
Среди мноrочисленных способов экспериментальноrо BOC
произведения РТПХ [2, 7] модель с rибридами FI занимает
особое место. В соответствии с законами rенетики такие rиб-
риды не дают иммунноrо ответа на трансплантаты тканей от
родительских линий, и это позволяет обойтись без иммуноде
прессивной обработки реципиентов (облучение, цитостатики) 1.
Воспроизведение РТПХ у животных той же линии (в отли
чие от rибридов FI) удается без иммунодепрессии только в
Ю1мунолоrически незрелом состоянии, т. е. в первые сутки
после рождения. Кроме Toro, внутрилинейные скрещивания
дают меньше мышат в помете, чем межлинейные (для полу-
чения rибридов F 1 ), а в малочисленных пометах трудно обес-
печить достоверность индексов увеличения селезенки. Поэто-
му при решении большинства вопросов .1учше использовать
rибридов.
Индекс увеличения селезенки в мноrочисленных работах
хорошо зарекомендовал себя как критерий для оценки РТПХ.
Правда, наблюдаемая спленомеrалия в основном обусловлена
пролиферацией клеток реципиента, но она развивается под
8"lиянием трансплантированных клеток донора [7]. При YBe
личении лимфатических узлов пролиферация донорских кле-
ток также имеет лишь небольшое значение [4]; в основном
пролиферируют или скапливаются лимфоциты реципиента
[3]. Индекс увеличения лимфоузлов определяется у мышей
несколько сложнее, чем индекс увеличения селезенки; к рабо-
те с лимфоузлами целесообразно прибеrать в тех случаях,
коrда в распоряжении исследователя имеются лишь неболь-
шие пометы или только взрослые rибриды F I .
1 В настоящее время общепризнано, что существует определенная ре-
знстентность rибридов F 1 к трансплантатам родительских тканен (<<синrен-
ное предпочтение»), которая устраняется сублетальным облучением (Ше
велев А. С., Реакция «трансплантант против хозяина» и трансплантацион-
ная болезнь, М.: «Медицина», 1976, с. 11 20). П рим. перев.
186 В. ТессеНО8
25.4. ЛИТЕРАТУРА
1. Cantor Н., The effects of anti-theta antiserum ироп graft-versus-host acti-
vity of spleen and lymph node celIs, СеlI. Immunol., 3, 4бl 469 (1972).
2. Elkins W. L., Cel1ular immunology and the pathogenesis of graft-versus-
host rеасtiопs, Progr. AIlergy, 15, 78 187 (1971).
З. Emeson Е. Е., Thursh D. R., Месhапism of graft-versus-host-induced 'ут-
phadenopathy iп mice. Trapping versus рrоlifеrаtiоп, J. Ехр. Med., 137,
1293 1302 (1973).
4. Ford W. L., Burr W., Siтonsen М., А Iymph node weight assay for the
graft-versus-host activity of rat Iymphoid ceIls, Тrапsрlапtаtiоп, 10, 258
266 (1970).
5. Ford W. L., Simonsen М., The factors of immuпizаtiоп iп the rat. The ef-
fect of аlIоgепiс immunization оп graft-versus-host activity, J. Ехр. Med.,
133, 938 949 (1971).
6. Hardt F., Claesson М. Н., Graft-versus-host reaction mediated Ьу sрlееп
cells from amyloidotic апd поп-аmуlоidоtiс mice, Transplantation, 12, 36
39 (1971).
7. Simonsen М., Graft-versus-host rеасtiопs. Their паturа! history апd appIi-
cability as tools of research, Progr. AIlergy, 6, 349 467 (1962).
8. Sprent J., Miller J. F. А. Р., Iпtеrасtiоп of thymus lymphocytes with histo-
incompatible cells. 1. Quапtitаtiоп of the proliferative response of thymus
ceIls, CeIl. Immuпоl., 3, 3бl 384 (1972).
9. Yoshida У., Osmond D. О., Graft-versus-host activity о! rat Ьопе marro\\',
mапо\\' fractions, апd lymphoid tussues quапtitаtеd Ьу а popliteal lymph
node weight assay, Тrапsрlапtаtiоп, 12, 121 129 (1971).
')' ·
..\).
Выделение фактора переноса
И. ШРЕДЕР, У. ЛОРЕНЦ
26.1. ПРИНЦИП
В 1942 r. Ландштейнер и Чейз [1] впервые осущесТВИЛИ
пассивный перенос rиперчувствительности замедленноrо типа
(rзт) с помощью ЖИВЫХ лимфоцитов у морских свинок. По
С,1е этоrо мноrочисленные исследователи показали, что лим
фоциты из лимфатических узлов, селезенки, rрудноrо прото-
ка, перитонеальноrо эксудата и лейкоциты периферической
крови сенсибилизированноrо донора способны передавать rзт
несенсибилизированному реципиенту [2 5]. Такие резулыа
ты были получены как на животных, так и на человеке. Бы.тю
показано, что продолжительность пассивно индуцированной
rзт зависит от времени выживания KJIeTOK донора в орrаниз-
1e реципиента (при аллоrенном переносе несколько дней).
В дальнейших исследованиях было установлено, что экст-
ракт донорских клеток также способен переносить rзт [6 8]._
Лоренс обнаружил в таком эк'стракте активный компонент и
назвал ero «фактором переноса» (ФП) 1.
Если ввести ФП несенсибилизированному реципиенту, то
через 24 ч у Hero можно воспроизвести в отдаленном участке
кожи такую же реакцию на аллерrен, какая наблюдалась у
донора клеток (рис. 46).
Положительная кожная реакция на аллерrен сохраняется
у реципиента ФП от нескольких месяцев до двух лет. Это ro
ворит против rипотезы об исключительно пассивном механиз
ме переноса [9]. В настоящее время обсуждается вопрос о'
дерепрессорном действии ФП в клетках иммунной системы
реципиента [10].
В последние rоды появлЯ'ется все больше сообщений о ле
чебном эффекте препаратов ФП у больных с частичной имму
нодефицитностью при хроническом кандидомикозе кожи и
слизистых, буrорковой проказе, rенерализованной коровье}[
оспе, синдроме Уискотта Олдрича, ataxia tеlеапgiесtаsiса,
сочетанной иммунодефицитности и кокцидиомикозе [11
15]2.
1 Химическая природа «фактора переноса» и ero способность перено-
CrfТь специфическую иммунолоrическую информацию в настоящее вре IЯ ЯВ-
.1ЯЮТСЯ предметом дискуссии. Обычно препаратами ФП называют НIIЗКО
молекулярные (с мол. весом менее 10000) фракции лимфоцитарноrо экст
ракта, обладающие иммуномодулирующим действием in vivo и in vitro.
П рид перев.
2 Чаще Bcero речь идет о некотором продлении ремиссий. П рим.
перев,
188 И. Шрёдер, У. Лоренц
Эксперименты на животных с ФП дО сих пор были удач
ными лишь в 'Редких случаях [16 18].
Подобно д:руrим медиаторам клеточноrо иммунитета, ФП
освобождается при инкубации сенсибилизированных лимфоци.
тов со специфическим антиrеном; поэтому ero относят к ли
фокинам. Свойства ФП перечислены в табл. 4.
1
6
/
(:!
: ct
: }
...............
-"-" ---
l '\ '1 -
. - Ь:.,'-::
- - -
.... ::i :---_
. . "
- \.-'. t>_
---------------
J W
::-r;()5-
" ,,
4 -
---------------
2
з
4
5
Рис. 46. Пассивный перенос повышенной чувствительности к туберкулину
с ПО\lOщью фактора переноса (ФП). 1 туберкулин положительный донор;
2 сенсибилизированные лимфоциты; 3 замораживание и оттаивание;
4 диализ; 5 лиофилизация; 6 туберкулин отрицательныЙ реципиент
после инъекции ФП дает положительную кожную реакцию на тубеРКУ.1ИН.
Имеется ряд подробных сообщений о природе и иммуно-
лоrических свойствах Ф П [14, 19 22]. Показано, что rзт
MorYT переносить очищенные лимфоциты или вся фракция мо-
нонуклеаров крови, в то время как rранулоциты и друrие ад-
rезивные клетки этим свойством не обладают [23].
Феномен переноса можно воспроизвести с рядом вызываю-
щих rзт антиrенов бактериальных, rрибковых, вирусных и
трансплантационных. Из периферической крови человека п ее
лейкоцитов были получены различные препараты, равноцен-
ные ФП по своему действию: концентраты живых лейкоцитов
[4, 5]; лейкоцитарные экстракты, приrотовленные с помощью
осмотическоrо лизиса, замораживания оттаивания или уль-
тразвуковой дезинтеrрации [6, 8, 24 261: :Н'IUШОПlпарныl'
экстракты, обработанные ферментами (ДНКазоЙ; РНКа юi'I:
ДНКазой и трипсином) [8]; ФП, выделенный в присутствии
26. Выделение фактора переноеа 189
Таблица 4. Свойства «фактора переноса» ([11],
с изменениями)
Биохимические свойства
Иммунолоrические свойства
Растворим в воде (стабилен в
растворе в течение 5 лет)
Проходит сквозь диализную
мембрану
Мол. вес менее 1 О 000
Не является белком
Полипептидно-полинуклеотид-
ный комплекс
Термолабилен (инактивируется
при 56 0 С за 30 мин)
Устойчив к деЙствию ДНКазы,
РНКазы и трипсина
Не является антителом
Не иммуноrенен
Не является трансплантаци-
онным антиrеном
Переносит способность к
реакциям клеточноrо им-
мунитета на специфиче
ский антиrен (образова
ние фактора торможения
миrрации, бласт транс-
формация ЛИМФОЩlТов,
кожные реакции)
антиrена [24, 27]; очищенный ФП, подверrнутый диа.пизу и
лиофилизации [28 32].
Активность ФП, выделенноrо по :vrетоду Лоренса, эквива-
лентна активности живых лейкоцитов, из которых он был по
лучен. Как полаrают, ФП является биолоrически активным
компонентом небольшой популяции специфически сенсибили
зированных лимфоцитов, вероятно тимус зависимых.
26.2.
МЕТОДИКА
26.2.1. Реarепты и приборы
rепарин без консерванта
Декстран 250 (мол. вес 250000)
Инфуколл
Апироrенная дистиллированная вода
Апироrенный физиолоrический раствор NaCl
Сухой лед
Этиловый спирт (денатурат)
ДНКаза (панкреатическая)
MgS0 4
Целлофановая диализная трубка (Viskiпg, Чикаrо, США)
Шприцы и инъекционные иrлы
Стерилизуемые стаканы с крышками на 25 мл
Термостат
Водяная баня
Пастеровские пипетки
Специальные остроконечные центрифУЖl'lые проБИРКII при-
мерно на 20 мл
190 И. Шрёдер, У. ЛQренц
Центрифуrа
Пробирки со шлифом для диализа в стерильных условиях
Ампулы для лиофилизации
!\ппарат для лиофилизации
.\1иллипоровый фильтр (0,22 мкм)
26.2.2.
Приrотовлевие препарата
Как и при переливании крови, необходимо исключить у
донора заболевание сифилисом, малярией, rепатитом. и т. п.
У потенциальноrо донора должна быть резко положительная
кожная реакция замедленноrо типа на соответствующий ан-
тиrен. Лейкоцитарные препараты, полученные от доноров с
отрицательной кожной пробой, не переносят rзт.
Для успешноrо переноса rзт требуется достаточно MHoro
.lейкоцитов. Необходимое количество клеток зависит, в част-
ности, от leToдa тестирования. Так, по данным Лоренса [33],
для «MeCTHoro» переноса нужно ввести не менее 0,01 мл взве-
си (не менее 8,5.106 лейкоцитов), а для «системноrо» перено-
са 0,1 мл взвеси (8,5.107 клеток).
Кожные пр06ыставят через 24, 48 и 72 ч [4, 25]. Чаще
Bcero используется метод «системноrо» переноса [19], при
котором ФП вводят внутрикожно, подкожно или внутримы-
шечно в правое или левое плечо. Кожную пробу ставят на ла-
донной поверхности предплечья друrой руки.
Для приrотовления ФП по Лоренсу [33] кровь получают
стерильно порциями по 20 мл (на 100 мл крови 500 МЕ rепа-
рина). Силиконировать шприцы и посуду не обязательно. [е-
паринизированную кровь разливают по стерильным стаканам
( 7,5x 15,5 см) и прибавляют по 2 мл 6%-Horo декстрана
250 или инфуколла (в физиолоrическом растворе N aCl). Ста-
каны закрывают и, перемешав содержимое, помещают в во-
дяную баню или термостат (37 ОС). Оседание эритроцитов
продолжается 30 45 мин (не более 1 ч). Надосадочную
жидкость (желтоватоrо или слабо-розовоrо оттенка) стер иль-
но отсасывают пастеровской пипеткой в остроконечную цeHT
рифужную пробирку, закрывают и цеН11рифуrируют 10
12 мин при 1500 об/мин без охлаЖДения. Применение уrлово-
[о ротора вместО откиднО'rо дает меньший выход лейкоцИТОВ.
Плазму осторожно удаляют. Слой осевших лейкоцитов рас-
полаrается над эритроцитами. В 0,1 мл TaKoro осадка лейко-
цитов содержится примерно 85.106 клеток, из которых 70%
лимфоциты. Этоrо количества достаточно для однок'ратной
терапевтической инъекции. На самом дне центрифужной про-
бирки находятся эритроциты. Сверху на лей ОЦИТЫ наслаи-
вают 0,1 мл стерильноrо апироrенноrо физиолоrическоrо рас-
26. Выделение фактора переноса 191
твора N aCl и, поrрузив носик пастеровской пипетки до ypOB
ня леЙкоцитов, осторожно отсасывают их, оставляя эритро-
циты в пробир е. Далее можно обрабатывать отдельно каж-
дую порцию лейкоцитов, полученную из 20 мл крови, или
объединить их для увеличения количества метериала.
Для экстракции ФП требуется полное разрушение леЙко-
цитов, которое обычно производится 10-кратным заморажи-
UX;)
(' 'lи
00 00 ии
00 00 ('п
00 00 С,)
00 00 с)..)
)..;"
f 2 J 't 5 б 7 8 9 10
Рис. 47. Последовательные этапы приrОТОВ.'Iения фактора переноса (по
Лоренсу и Аль Аскари [33] с изменениями). l KpOBb и декстран; 2 осаж-
дение эритроцитов; 3 центрифуrирование надосадочнои жидкости; 4 на
осадок наслаивают физиолоrический раствор NaCI; 5 десятикратное за
мораживание и оттаивание в присутствии ДНКазы; 6 диализ; 7 ЛИОфlI
лизания; 8 стерилизация фильтрованием; 9 разлив по ампу.lам; 10
инъекции.
ванием оттаиванием. Для этоrо объединенные или отдель
ные порции лейкоцитов за:.Уюраживают в смеси cyxoro .'lьд:а
с этиловым спиртом и тотчас оттаивают в водяной бане при
37 ос дО тех пор, пока осадок не при обретет жидкую ИJ1И же
леобразную консистенцию. Полное растворение клеток при
водит к освобождению ДНК, которая слеrка увеличивает вяз-
кость э стракта, что сильно затрудняет ero обработку. В свя-
зи с этим после разрушения лейкоцитов в экстракт peKOMeH
дуется добавить несколько кристаллов ДНКазы и Mg2+ и
выдержать ero зо мин при 37 ос дЛЯ rидролиза. Можно обой
тись и без этой дополнительной инкубации, если ДНКазу, KO
торая по данным Лоренса [33] устойчива к замораживаниIO
оттаиванию, добавить к еще не раз'рушенным лейкоцитам II
деполимеризовать днк по мере их разрушения.
Разделение высоко- и низкомолекулярных Компонентов
лейкоцитарноrо экстракта происходит во время диализа в
целлофановых трубках. Диализную трубку изнутри и снару-
жи промывают стерильным физиолоrическим раствором и за-
вязывают на одном конце. Затем пастеровской пипеткой OCTO
рожно вносят внутрь лейкоцитарный экстракт, обработанный
192 И. Шрёдер, JI. Лоренц
ДНКазой. При этом ни ОДНа капля экстракта не должна по-
пасть на внешнюю поверхность трубки. После заполнения
второй конец трубки завязывают и помещают ее в стерильную
пробирку, содержащую примерно 5 мл дистиллированной во-
ды на каждые 0,1 мл лейкоцитарноrо экстракта. Диализ про-
должается около суток при 4 0 с.
Закончив диализ, переносят диализат в стерильный фла-
кон, замораживают в смеси cyxoro льда со спиртом и лио-
филизируют В течение 24 ч. Лиофилизат можно хранить не-
сколько лет при 4 0 с.
Перед использованием лиофилизированный ФП раство-
ряют в стерильной апироrенной дистиллированной воде (по
0,1 мл воды на каждую порцию лейкоцитов, полученную из
20 мл крови) И фильтруют через мембрану спорами 0,22 мкм
для стерилизации. Фильтрацию считают безусловно необхо-
димой, чтобы удалить бактерии, которые моrли попасть в
диализат (в особенности с наружной по'верхности диализной
трубки). После фильтрации препарат rOToB для инъекций.
Отдельные этапы приrотовления ФП схематически представ-
лены на рис. 47.
В последние rоды появилось MHoro модификаций первона-
чальной методики получения ФП по Лоренсу. В связи с ши-
роким клиническим применением ФП он потребовался в боль-
ших количествах; к тому же из-за неодинаковой эффективно-
сти терапии ero т'еперь часто применяют в более высоких до-
зах. Поэтому для приrотовления ФП стали брать большие
'Объемы крови (до 400 мл на 'серию). Кроме Toro, оказалось,
что приrотовленные по Лоренсу препараты содержат значи-
тельную примесь иммунолоrически неактивноrо материала, а
также веществ, подаВЛЯЮЩИХ активность ФП. Поэтому счи-
тается це,::rесообразным после лиофилизации дополнительНо
очищать активный компонент ФП путем rель-фильтрации на
сефадексе G-25 [34].
26.3. ОЦЕНКА МЕТОДА
Метод получения ФП, несмотря на простоту, дает препа-
рат, свободный от всех макромолекулярных клеточных ком-
понентов, антиrенов rистосовместимости и, вероятно, от виру-
СОВ. Эта приrодный для лечебноrо применения препарат,
содержащий полипептидЫ, полинуклеотиды и друrие низкомо-
лекулярные компоненты и, как правило, не вызывающий по-
nочных реакций. Тем не менее очистка ФП не является по.'l-
ной. поэтому не исключено, что на эффект MorYT влиять низ-
комолекулярные компоненты лейкоцитарноrо экстракта, на-
пример пуклеотиды. Препараты ФП, полученные с помощью
26. Выделен.'uе фактора переноса 193
диализа, не иммуноrенны для человека; их можно вводить в
высоких дозах ПОВТОРНО на n-ротяжении нескольких месяцев.
Блаrодаря этому они особенно приrодны для лечения имму-
нодефицитных заболеваний. Лиофилизированный ФП при 4 ос
не теряет активности свыше 5 лет.
26.4. ЛИТЕРА ТУРА
1. Landsteiner К, Chase М. W., Experiments оп transfer of cutaneous sensi-
tivity to simple chemica! compounds, Proc. Soc. Ехр. Вio!. Med., 49
(1942), 688, Zitiert nach [2].
2. Chase М. W., The cellu!ar transfer of cutaneous hypersensitivity to tu-
berculin, Proc. Soc. Ехр. Biol. Med., 59 (1945), 134 135.
3. Cummings М. М., Hoyt, Marta, Gottshall R. У., Passive transfer of tuber-
сиliп scnsitivity in the guinea pig, Public Hea1th Repts., U. S" 62 (1947),
99.f 997.
4. Lawrence Н. 5., The cellular transfel" of cutaneous hypersensitivity to tu-
berculin in тап, Proc. Soc. Ехр. Вiol. Med., 71 (1949), 516 522.
5. Lawrence Н. 5., The cellular transfer in humans of delayed hypersensiti
vity to hemolytic streptococci, J. Immunology, 68 (1952), 159 178.
6. Jeter W. 5., Tremaine, Mary М., 5eebohm Р. М., Passive transfer of de
layed hypersensitivity to 2,4-Dinitroch1orobenzene in guinea pigs with
leucocytic extracts, Proc. Soc. Ехр. Biol. Med., 86 (1954), 251 253.
7. Lawrence Н. 5., The transfer of generalized cutaneous hypersensitivity of
the delayed tuberculin type in mап Ьу means of the constituents of dis-
rupted leucocytes, J. сliп. Invest., 33 (1954), 951 952.
8. Lawrence Н. 5., The transfer in humans of delayed skin sensitivity to
streptococcal М substance and to tuberculin with disrupted leucocytes, J.
сНп. Invest., 34 (1955), 219 230.
9. Lawrence Н. 5., Transfer factor and cellular immunity, Hospital Practice,
4 (1969), 40 58.
10. Burger D. R., Vetto R. М., Маиеу А., Transfer factor from guinea pigs
sensitive to Dinitrochlorobenzene: Absence of superantigen properties,
Science, 175 (1972), 1473 1475.
11. аroЬ Р. J., Вlaker F., 5chulz К н., Immunfunktion und Transfer-Faktor,
Dtsch. med. Wschr., 98 (1973), 446 451.
12. Mutz 1., Humphrey а. В., Dic klinische Bedeutung des Transfer-Faktors,
Wien. klin. Wschr., 85 (1973), 357 360.
13. Mars/1all W. Н., Transfer of immиne responsiveness, Medical Clinics of
North America, 56 (1972), 465 480.
14. Lawrence Н. 5., Transfer factor and cellular immune deficiency disease,
N. Engl. J. Med., 283 (1970), 411 419.
15. 5cl!Ulkind М. L., Adler W. Н., Altemeier W. А., АуоиЬ Е. М., Transfer
factor in the treatment of а case of chronic mucocutaneous Candidiasis,
Cell. Immunology, 3 (1972), 606 615.
16. Dunп D. J., Patlnode R. А., Passive transfer of tuberculin hypersensitivity
with cellular fractions from sensitized gиinea pigs, J. Immunology 99
(1967), 467 475. '
17. Maddison 5. Е., Hicklin М. D., Сопшау В. Р., Kagan 1. а., Transfer fac-
tor: Delayed hypersensitivity to Schistosoma mansoni and tuberculin in
Масаса mulatta, Science, 178 (1972), 757 759.
18. Liburd Е. М., Pabst Н. F., Armstroпg W. D., Transfer factor in rat cocci.
diosis, Се]}. Immunology, 5 (1972), 487 489.
19. Lawrence Н. 5., Advances in Immunology, 11 (1969), 195 266.
20. Lawreпce Н. 5., Valent ne F. Т., Transfer factor in delayed hypersensitivi
ty, Лпп. , У. Acad. SCl., 169 (1970), 269 279.
1 'з- 40
194 И. Шрёдер, У. Лоренц
21. Lawrence Н. S., Valentine F. Т., Tr1:lnsfer factor and other mediators of
cellular immunity, Amer. J. Pathol., 60 (1970), 437 450.
22. Lawrence Н. S., Specific recrиitment of immunocompetent cells Ьу trans-
fer factor, in Mediators of cellиlar immunity, Edited Ьу Lawrence Н. S.
and Landy М., Academic Press, New York, 1969, 143 245.
23. Slavin R. а., Garvin J. Е., Delayed hypersensitivity in тап: Transfer Ьу
Iymphocyte preparations of peripheral bIood, Sсiепсе, 145 (1964),
52 54.
24. Lawrence Н. S., Pappenheimer А. М., Transfer of delayed hypersensitivity
to diphtheria toxin in тап, J. Ехр. Med., 104 (1956), 321 336.
25. Rapaport F. Т., Lawreпce Н. S., Millar J. W., Pappagianis D., Smith С. Е.,
Transfer of delayed hypersensitivity to coccidioidin in тап, J. Immunolo-
gy,84 (1960), 358 367.
26. Lawrence Н. S., Rapaport F. Т., Converse J. М., Tillett W. S., Transfer
of delayed hуреrsепsitivitу to skin homograft \vith leиcocyte extracts in
тап, J. сliп. Iпvеst., 39 (1960), 185 198.
27. Lawreпce Н. S., Pappeпheimer А. М., Effect of specific antigen оп release
from hитап leиcocytes of the factors concerned iп transfer of delayed
hуреrsепsitivitу, J. сliп. Invest., 36 (1957), 908 909.
28. Baram Р., Mosko М. М., А dialysabIe fraction from tuberculin sensitive
Ьитап wblte bIood cells сараЫе of indиcing tиbercиlin delayed hypersen
sitivity in negative recipients. Iттuпоlоgу, 8 (1965), 461 474.
29. Baram Р., Уиаn L., Mosko М. М., Stиdies оп the transfer of Ьитап deJa-
yed type hypersensitivity. 1. Partial риrifiсаtiоп and characterisation oi
two active сотропепts, J. Iттипоlоgу, 97 (1966), 407 420.
30. Abala-Chaves М. Р., Lebacq Е. а., Heremans J. F., Frасtiопаtiоп of Ьи-
mап leиcocyte extracts trапsfепiпg delayed hуреrsепsШvitу to tиbercиlin,
Iпt. Arch. A.llergy, 31 (1967), 353 365.
31. Adler W. Н., Takiguchi Т., Marsh В., Smith R. Т., Cellиlar rесоgпitiоп Ьу
moиse lymphocytes iп vitro, J. Ехр. Med., 131 (1970), 1049 1078.
32. Levin А. S., Spitler L. Е., Stites D. Р., Fudenberg Н. Н., Wiskott-A.ldrich-
Syndrom, а gепеticаllу dеtеrтiпеd cellular immиnologic dеfiсiепсу: Сliпi-
саl and laboratory rеsропsе to therapy with transfer factor, Proc. nat.
Acad. Sci., 67 (1970), 821 828.
33. Lawrence Н. S" AI-Askari, Salah, ТЬе рrераrаtiоп and purification oi
irапsfеr factor, iп In vitro methods in cel1-mediated iттипitу,
В!оот В. R" Glade Р. R., Eds. A.cademic Press, New York, 1971, 531
546.
34. Sohroder !., Wetner Н., Loreпz u., Kohler Н., Yenssen Н. L., Zur Prapara
iiоп ипd Сhаrаktеrisirипg von Transfer Faktor, Z. Immиn. Fоrsсhипg.,
149 (1975), 365 371.
27. Электрофорез клеток
r. Л. ИЕНСЕН
27.1. ПРИНЦИП
В электрофаретических исследованиях CYLЦecTByeT два
принципа измерения определение rраницы движения разде-
ляемых фаз и. наблюдение за перемещением отдельных частиц
под микроскопом. Последний принщш используется при
электрофорезе !{1РУПНЫХ частиц и клеток в среде с высокой
ионной силой [2]. При постоянной напряженности электриче
cKoro поля измеряют время пробеrа определенной дистанции
отдельными животными или бактериальными клетками.
В биолоrии этот метод получил название «электрофореза кле-
ток» или «микроэлектрофореза». Он позволяет с помощью
ооответствующеrо прибора быстро получить нужные данные
и одновременно определить морфолоrический тип исследуе-
мых клеток. Однако с помощью аналитическоrо микроэлект
рофореза нельзя осуществить препаративное разделение сме-
шанной популяции клеток.
Основной частью прибора для икроэлектрофореза 5U3-
ляе ся прозрачная термостатируемая камера, соединенная с
двумя электродами, в которую помещают взвесь клеток. Эта
камера может быть цилиндрической или прююуrольной. От
ее формы зависит характер электроосмотическоrо эффекта,
который мешает при измерении электрофоретическ'ой подвиж-
ности клеток.
ЦИЛИНДР1iческую камеру впервые использовали для элект-
рофореза клеток БЭНI'ем и сотр. [5] и Симэн [27]. Она пред-
ставляет собой замкнутый стеклянный цилиндр, в котором
около стенок жидкость под влиянием электроосмоса движет-
ся к катоду, а в срединной (осевой) области возвраLЦается
обратно. МеЖДУ этими потоками расположен цилиндрический
слой жидкости, не подверженный электроосмосу, в КОТОрО:\1
можно измерить истинную электрофоретическую подвижность
исследуемых клеток. Положение этоrо слоя, соrласно Бэнrему
и сотр. [5], можно рассчитать с помощью уравнения
vw==vs(2r2/R2 1), (1)
rде V w электроосмотический поток даННоrо слоя жидкости,
V s электроосмотический поток У стенки камеры, r рас-
стояние данноrо слоя от оси цилиндра и R радиус цилинд-
ра. V\o, == О, есл'И 2r 2 ==R2.
13*
196 r.-Л. Иен.сен.
Следовательно, так называ'емый стационарный уровень,
на котором следует измерять электрофоретическую подвиж-
ность, находится на расстоянии r== l' R/2 от оси цилиндриче-
ской электрофоретической камеры. Принципиальная схема
прибора для электрофореза клеток с такой камерой пред-
ставлена на рис. 48. Этот же принцип использован в прибаре
«Цетаметр» (см. 27.2.1).
А
Нзмерите.ньно.н
:МектРООН6If] /(омеро
cocgo 8стоВко
{j 11'О мм
I I
I I
] смотроВое I
u НШ/ '5 .:ШI окно I
\ 7,51 1 I
, ! L:J ,
I
I
Пере80рООlfО из
пористО80 CтeK.!lO
64
MиKpoc/(On
5
r 2 :{ 0,.""#0,5",,
Рис. 48. Схема при бора для микроэлектрофореза клеток с цилиндрической
К2.мероЙ [27]. А. Важнейшие детали. Б. Часть камеры с вышлифованным
оютровым окном. Н Ш нормальный шлиф.
Основы метода электрофореза клеток в прямоуrольной
камере заложены в работах Фурмана и Руэнштрот-Бауэра
[10], Шахт.пебена и сотр. [26] и Штольца и сотр. [28]. В та-
кой камере (рис. 49) между электроосмотическими потоками
создаются два стационарных уровня. Их положение опреде-
.1яется rео етрией камеры, в особенности отношением высоты
(h) к rлубине (t), равным обычно 20: 1. При этом rлубина
измеряется по направлению оптической оси микроскопа.
Соrласно расчетам KOMaraTa [17], точное положение ста-
ционарных у ровней можн о вычислить по формуле
Уl 2==0,5 -+ V l/12+32.t/ho. (2)
,
Из этой формулы следует, что расстояние до ближайшеrо к
наблюдателю стационарноI'О уровня от внутренней поверхно-
27. Электрофорез кле'т;ок 1-97
сти передней стенки KaMep!?I (Xl) равно t. Yl, а расстояние от
той же поверхности до более удаленноrо стационарноrо уров-
ня (Х2) равно t. У2.
J!CтO'fHUlf э.qеltтРОIl,Uтонuа
I coпst.
.J.nl'tfП7рOlроретUf/ВС/(ОJf /({l,иt'I'U
- ш.nurpоl!ОНfflJS1 I
стеtr'nЯННО.н п.nостuнко
8 J'n8/(тj7006/
J /
JнооосмотUlf8Сtrш]
потох
т ермостотuр!/ющоя
р!/оошхо
Смотробор !Трреilнии стОЦUОНОРН6Izf
ОКНО !/Po1!8H6
Muxpocrron
(1) ЛО'n8 зрения
ffi 8
, I
-e
Рис. 49. Схема прибора для микроэлектрофореза клеток с прямоуrольной
т,амероЙ [«Цитоферометр» Руэнштрот Бауэра (Opton, Оберкохен, Ф Р[)].
Электроды вплавленные в стекло платиновые проволоки толщиноЙ 1
2 мм.
Этот принцип положен в основу устройства ка:'Iеры в при
боре «Цитоферометр» (см. 27.2.1), схема KOToporo представ
лена на рис. 49.
27.2.
27.2.1.
ПРО ВЕДЕНИЕ ИССЛЕДОВАНИЯ
Реаrенты и приборы
27.2.1.1. Среда для суспендирования клеток
Клетки можно суспендировать в любом забуфереННО I фи-
ЗИОлоrическ'ом растворе; в особенности приrо;:щы раствор
198 Т.-Л. Иенсен
Хенкса и среды для культуры ткани Иrла и Паркера.
Во мноrих случаях к среде добавляется еще телячья
сыворотка (все растворы и среды из Staat1iches Institut fiir
Immunpraparate und Nahrmedien, Берлин, [ДР).
27.2.1.2. Приборы
Комплектными приборами являются «Цитоферометр»
(Opton, Оберкохен, ФР[) и «Цетаметр» (Inc. ВиН., 6 61,
1720 first Av., Нью йорк). Данные, необходимые для само-
стояте.1ьноrо изrотовления приборов, можно найти в ряде ра-
бот [5, 12, 27].
Кроме Toro, нужны: кондуктометр типа OK 102 (Radelkis,
Будапешт II/VR); термостат типа Ul (VEB Kombinat Medi-
zin- und Labortechnik, Лейпциr); вискозиметр Уббелоде и
пикнометр (Saale Glas GmbH, Иена), а также секундомер.
27.2.2. Камера для электрофореза клеток
Устройство камер различноI'О типа показано на рис. 48 и
49. За перемещением клеток наблюдают через смотровое ОК-
но. Конструкция этой части цилиндрической камеры описана
у Симэна и сотр. [27]. В прямоуrольной камере, которая в
направлении оптической оси микроскопа оrраничена двумя
плоскопараллельным'И стенками, УС'J1ройство окна rораздо
проще, чем в цилиндрической.
Объектив Х 40 имеет довольно короткое фокусное pac
стояние, и из за этоrо трудно монтировать термостатирую-
щую рубашку. В конструкции обоих приборов использован
прием, который все же позволяет при большом увеличении
(800 раз) сфокусировать микроскоп на стациона'рном уровне
Ka:vIepbI. Он заключается в ТО:\'I, что фронтальная линза объ
ектива встроена в стенку термостатирующей рубашки и слу-
жит смотровым окном. На одном конце камеры имеется
впускной, а на друrом выпускной штуцер для клеточноЙ
взвеси. При измерении камеру следует закрепить так, чтобы
она располаrалась симметрично.
27.2.З.
Электроды и электропитание
Чтобы продукты элсктролиза (например, токсичные ионы)
не проникли в клеточную взвесь, необходимо соеДИНИТЬ элект-
роды с электрофоретической камерой через промежуточные
вставки из rипса, пористоrо стекла (G4), arapoBoI'O rеля пли
мембранных фильтров [27, 28]. При неБО:IЫIIIIХ KOl!IlC'HTpa
27. Электрофорез клето!{ 199
циях электролитов электродами MorYT слу)кить полоски пла
тины. При работе в растворах с высокой ионной силой .1учше
применять обратимые электродные системы, например
CUjCUS04 или AgjAgCl [1, 15]. В качестве источника элект-
рическоrо тока первоначально рекомендовали использовать
батарею сухих элементов [2], которая в потенциометрическоЙ
схеме позволяет изменять напряжение в нужных пределах.
Применение такой схемы, как и стабилизатора напряжения,
дает для расчета напряженности поля постоянное значение
эффективной длины электрофоретической камеры, т. е. для
цилиндрической камеры
'е==U.'Л.r 2 /I.р, (3)
а для прямоуrоv1ы-oйй К3У1еры
l ==U.h.t/l.p
(4)
(и напряжение, р удельное сопротивление взвеси кле-
ток). Тоrда напряженность поля в цилиндрической кюrере
будет равна
Е==U/l е ===l.р/л.r 2 , (5)
а в ПрЯУ10уrольной
Е ===1. p/h. t.
(6)
Непрерывно меняющаяся во вре 1Я работы поляризация в
электродноЙ системе вызывает колебания силы тока 1. По-
этому ,J)IЯ электропитания реко rендуется использовать вы-
прямитеv1Ь с электронной стабилизациеЙ тока вроде Toro,
которым укомплектован «ЦитофеРО 1етр». Выпрюште.:ть J:.o,l-
жен давать напряжение до 400 В и ток до 50 мА.
27.2.4.
Настройка и калибров""
При настройке следует установить камеру cTporo rоризон-
тально, чтобы устранить действие силы тяжести в напраВv1е-
нии поля. Кроме Toro, нужно обеспечить, чтобы стационар
ный уровень камеры лежал под ПРЯМЫ 1 уrлом к оптической
оси микроскопа. Для точности измерения путей, прохолшых
клетками, необходимо выверить по эталону окуляр- rикро !етр
микроскопа. Калибровку следует произвести в тех же опти-
ческих условиях, в которых будут проводиться рабочие !!З lе-
рения. В каждой новой камере определяют э.1еКl'рофорети
ческую подвижность каких-либо стандартных частиц на
различной rлубине (см. 27.2.5); это IOrYT быть, например,
частицы кварца, свободные от IIОНОВ же:rеза, И.:1II ЭРИТРОЦIIТЫ,
200 Т.-Л. Иенсен
суспензированные в физиолоrическом растворе N aCl. Полу
ченные при этом величины должны дать на ,rрафике параболу,
вершина которой приходится на середину камеры. В прямо-
уrольных камерах оба стационарных ур'овня должны дать
сходные величины.
27.2.5.
Рабочие измерения и расчет
электрофоретической подвижности
Перед опытом камеру тщательно ПР'Dмывают. Для этою
ее на несколько минут заполняют 90% -ной муравьиной кисло-
той. Продолжительность обработки кислотой зависит от сте-
пени заrрязнения (пленка бе.lка). После этоrо камеру про-
мывают водопроводной водой, дистиллированной водой,
спиртом и эфиром, а затем высушивают, присоединив к водо-
струйному насосу. Потом в камеру вносят клеточную взвесь
по возможности без пузырьков воздуха. Это рекомендуется
делать следующим образом: открывают сильную струю водо-
струйноrо насоса и просасывают через камеру суспензионную
среду без клеток, поток которой должен захватить с собой все
пузырьки воздуха. Затем насос отсоединяют и, не разрывая
столбика жидкости, в камеру подают клеточную взвесь, до
тех пор пока в поле зрения микроскопа не появятся нужные
клетки. Концентрация взвеси должна составлять от 2. 106 ДО
5.106 клеток в 1 мл.
Включают ток и по секундомеру определяют время, за
которое край наблюдаемой клетки пересечет оба штриха на
дистанции пробеrа. Чтобы проверить электрическую симмет-
рию цепи, тотчас после первоrо измерения переключают по-
люса камеры и определяют время возврата той же самой
клетки в исходную точку; при этом должны получаться близ-
кие величины. Таким образом определяют подвижность 50
200 клеток (в зависимости 'От поставленной задачи). Напря-
женность поля (ток измерения и дистанция пробеrа) должны
быть такими, чтобы измеряемые величины лежали в преде-
лах от 5.10 4 до 10.10 4 см/с. Исходя из уравнения (5) или
(6), электрофоретическую подвижность В рассчитывают по
формуле
В===l/т:. Е. (7)
При этом l указывают в сантиметрах, т: в секундах, а Е в
вольтах на 1 см. Для вычисления напряженности поля нуж-
на еще величина удельноrо сопротивления взвеси (Ом ,см)
(см. 27.2.3), которую определяют заранее с помощью кондук-
тометра.
27. Электрофорез /Слеток 201
При определении абсолютной электрофоретической под-
вижности клеток необходимо также учитывать вязкость cpe
ды [20]. В сравнительных исследованиях, в которых напря-
женность поля, концентрация клеток, удельное сопротивление
и вязкость клеточной взвеси постоянны, рассматриваются
только различия во времени пробеrа (см. 27.3).
27.2.6.
Анализ данных
Причиной перемещения клеток в электрическом поле ЯВ-
ляется скачок электрическоrо потенциала между наружной
поверхностью клеточной мембраны и суспензионной средой.
Этот поверхностный, или Iюнтактный, потенциал обусловлен
особой структурой биолоrических мембран. Соrласно обще-
признанной в настоящее в<ремя rипотезе, каркас всех биоло-
rических мембран образован двойным слоем ориентированных
диполей (липидных или фосфолипидных :молекул). Этот Kap
кас удерживает молекулы воды и электролитов и в основ-
ном блаrодаря встроенным белкам Ю.1еет специфические
особенности у каждоrо типа клеток. Молекулы белка MorYT
располаrаться по обе стороны липидноrо каркаса и внутри
ero [7], что еще больше увеличивает возМ'ожное разнообра-
зие типов.
Асимметричное распределение электролитов, входящих в
состав мембраны, и ионизация функциональных rрупп беJ1ка
создают на поверхности клетки постоянную плотность заряда,
чем и обусловливается нетто заряд двойноrо слоя мембраны.
Все исследованные до сих пор клетки позвоночных при
электрофорезе в физиолоrической среде движутся к аноду и,
следовательно, несут отрицательный нетто-заряд на своей по-
верхности. Завис'Имость электрофоретической подвижности от
поверхностноrо заряда вытекает из теории электрокинетиче-
ских явлений, основы которой были созданы еще в начале
века. В современной редакции этой теории [18, 30], в кото-
рую вошли новые положения теории ЭJ1ектролитов, особое
значение придается понятиям «двойной электрохи:мический
слой» И «электрофоретический потенциал», называемый TaK
же «дзета-потенциалом» ( -потенциал). Модельные представ
ления, лежащие в основе этой теории, схематически проил-
люстрированы на рис. 50.
Эта теория, в частности, доказывает, что зависимость меж-
ду электрофоретической подвижностью и дзета-потенциалом
(который является измеряемым при электрофорезе эквива-
лентом поверхностноrо заряда клеток или иных крупных ча-
стиц при физиолоrических концентрациях солей, коrда двой-
202 r. л. Н('нсен
ной электрохимический слой тонок) приближенно
ся уравнением rельмrольца СмолухоВ'скоrо:
Е.Е:
и .
4".'У)0 '
описывает-
(8)
rде ..' электрофоретическая подвижность, т. е. 1/т,
Е напряженность поля, '110 вязкость среды,
с диэлектрическая постоянная среды и дзета-по-
TCHUI!a:I.
+ + +
+
+
...................
+ ",,'" + +....., +
1"+ "'.::: ,
.,. ' "' '+\
I '" \
I + '/(l7e \ \
I ли А +
+ \ + "'"
\ ' /I/I
\+ "+,," 1 ' 7 (
" ,+ ,,,, I
',-- y1 :
,1 I
110тl?НЦUU.q: I
д"mo по нцuо Щ i
'1 I
!fонцентРUL;I:Я :/оIfО'; I I
;
vr:
,
+
.
ДlJоtiНОli PaccтOIfHa
слои
rl?льмеОЛЬЦll
Рис. 50. Модельное представление о природе дзета потенциала, отражаю
щеrо отрицательный нетто заряд клетки [46]. Двойной слой rельмrольца
н<\зывают также двойным электрохимическим слоем или зоной адсорбции
положительных противоионов. Внешняя зона образована диффузной
частью ионноrо облака, общий заряд которorо равен нетто заряду клеточ
ной поверхности. Блаrодаря тому, что в этоЙ зоне концентрация положи-
тельных (2) и отрицательных (3) ионов в среднем во времени изменяется
по разному, возникает убывающий по направлению от поверхности клетки
дзета-потенциал (1).
с помощью этоrо уравнения можно вычислить дзета-по
тенциа.1 клеток. Если результат требуется выразить, как
обычно, в милливольтах, то из уравнения (8) при В== и/Е вы-
водят нормированную формулу
=== lt,3.1 4.'Y)0.B (1\18); (9)
при этом '110 указывают в пуазах, а В в CM2C lB 1 .10 4.
27. Электрофорез клето" 203
Пользуясь этим расчетом, можно проследить за измене-
ниями поверхностных зарядов клеток в различных условиях
(14]. Особенно интересные данные были получены при ана-
лизе зависимости между величиной заряда и адrезивностью
клеток [4, 6].
Обработка клеток ферментами, например нейраминидазой
[2, 19], ведет к характерным изменениям поверхностноrо за-
ряда, анализ которых помоrает при изучении структуры Me:,l
браны [21].
Каждому типу клеток свойственна характерная Э:Jектро
форетическая подвижность с очень небольшим разбросом ве-
"lИЧИН. В связи С этим полаrают, что величина заряда КJ1еточ-
ной поверхности детерминирована rенетически; поэтому изме-
рение электрофоретической подвижности считают подходя-
щим методом изучения и идентификации клеток [24]. У че-
ловека наимеНьшей подвижностью обладают rранулоциты
(0,62 + 0,03. 10 4 CM2c lB 1), далее следуют лимфоuиты
(0,79 + 0,02.10 4 CM2'C lB 1), а быстрее Bcero движутся эрит-
роциты (l,01 + 0,02.10 4 CM2C lB 1). При различных заболева
ниях так называемая «rемоцитофероrраМ:\lа» претерпевает
значительные изменения [2, 23].
Эмброуз [3] впервые применил клеточный электрофорез
для выяснения различий между нормальными и ОПУХО.1евыми
клетками. Были обнаружены различия Э.1ектрокинетических
свойств не только у клеток разных ШТЮIМОВ опухолей, но и у
клеток одноrо штамма на разных этапах роста опухоли [3,4].
Руэнштрот-Бауэр и сотр. [25] показали, что в лимфоид-
ных opraHax крысы содержатся клетки, которые по Э"lектро
форетической подвижности можно разделить на несколько
классов. Позднее аналоrиЧ:ные данные получИЛiI ФонЦ'ке и
Сундарам [22].
При определении электрофоретической подвижности "lИМ-
фоцитов желательно применять наиболее щадящИе методы их
выделения, не добиваясь полноrо удаления друrих клеток,
отличимых под микроскопом (эритроцитов). Чтобы не поте-
рять адrезивные клетки, необходимо всю работу проводить в
силиконированной посуде. Для анализа полученных резуль-
татов строится rистоrрамма времени электрофоретическоrо
пробеrа. Все наЙденные величины распределяют по классам
с интервалом 0,3 0,4c и откладывают на rрафике число K"'Ie
ток каждоrо класса. Пример такой rистоrраммы представлен
на рис. 51.
Если, как в приведенном примере, получается а'СИ:\I.\Iетрич
ная (сдвинутая вправо) rистоrрамма, то можно предполо-
жить, что популяция исследованных клеток reTeporeHHa. rи-
потеза rетероrенности леrко проверяется [11]. Зеркальное
204 r. Л., и еысен.
отображение девой стороны rистоrраммы относительно клас-
са с максимальным числом клеток дает на rрафике (рис. 51)
ветвь а. Разности между величинами правой стороны rисто-
rpa bI и ветви а дают ветвь Ь. Получаются два новых про
филя распределения (I и II). Все величины наносят на бума-
ry с вероятностной сеткой (Schafers Feinpapier, Плауэн, rдр)
80
70
ВО
50
40
30 j
I
201
(O
r I
о .
7,8 8,0 8,4 8,8 9,2 9,6 10,0 lo, 1fJ,8 If,? 11,6 ......Вреия,с
I,ZflI,Ш l,fUl1.D.ff 1,003 D,95 О,1}2 0,89 0,8360,826 DД8""
3.лектрРtpОf1етU'lескIZJТ п о iJ6uжност6.
'O .&M2c4B-I.
Рис, 51. rистоrрамма электрофоретической подвижности лимфоцитов из
rрудноrо протока нормальной крысы в физиолоrическом растворе NaCI
[20]. Распределение 1 77% клеток со средней подвижностью 1,060.10.
см 2 c l B l; распределение II 23% клеток со средней подвижностью
0,930.1 0 4 см2 c l B 1. Объяснение в тексте.
в виде суммарных частот (%) (рис. 52). В результате вместо
одной первоначальной rистоrраммы (см. рис. 52, А) наш при-
мер дает две новые (рис. 52, Б), имеющие вид прямых линий.
Следовательно, исходная rистоrрамма является суперпозици
ей нормальных распределений двух субпопуляций лимфоци-
тов. Достоверность TaKoro вывода можно оценить по t-крите-
рию Стьюдента [31].
Подобным же образом удается выявлять популяции сти-
мулированных [13, 29] и антиrен-реактивных [16] клеток, а
также дифференцировать В- и Т-лимфоциты [32, 33, 35].
.
'"
l
t
.
Б
'"
i}
i
7,88,08,48,89,2 9,510,0144 to,811,2
7,5 8,08,48,89,29,610,010.410,811,2
27. Электрофорез клеrок20'fS
99,//8
99
90
70
50
30
10
1
0,5
0,02
. Оремя, с
99,98
99
90
70
50
30
10
1
0,5
0,02
. вр мл,с
Рис. 52. Анализ rистоrраммы, представленной на рис. 51, с помощью веро-
ятностной сетки, выявляющеЙ два [ауссовых нормальных распределения
(прямые 1 и П) [20J. А. Пер во начальная общая кривая (общая популя
ция). Б. Кривые распределений 1 и П (субпопуляции).
27.2.7. Реакция торможения
электрофоретической МИrрации
макрофаrов (МЭМ-тест)
Торможение миrрации макрофаrов в эксперименте для
выявления реакций клеточноrо иммунитета (разд. 22) сопро
вождается также выраженным уменьшением их поверхност-
Horo заряда. Не исключено, что последний феномен и являет-
ся причиной торможения миrрации.
Филд и Каспари [8, 9] впервые использовали электрофо-
ретическую оценку этоrо феномена для изучения клеточноrо
иммунитета при злокачественных опухолях у человека. Как
и при реакции торможения миrрации, в МЭМ-тесте к лимфо-
цитам человека или кролика добавляют антиrен и инкубиру
ют их с перитонеальными макрофаrами морской свинки в со-
отношении 1: 10 (общая концентрация 4.106 клеток в 1 мл).
После инкубации макрофаrи можно сразу внести в электро-
форетическую камеру и опреде.irить время пробеrа. Малый
разброс показателей позволяет оrраничиться 30 50 и3:\ ере
ниюш, из которых вЫчисляют среднюю ветrчину. Ее со по-
206 r. Л. Иенсен
ставляют с результатами контрольной пробы, поставленноЙ
без антиrена. В среднем в опытной пробе наблюдается умень'"
тение времени пробеrа на 15 20 %. Реакция :между rИстоне-
совместимыми лимфоцитами является в МЭМ-тесте помехоЙ.
Для ее устранения макрофаrальный эксудат, всеrда 'содержа
щий небольшую примесь лимфоцитов, рекомендуется перед
опытом облучить (100 рад). Для исключения собственной ток-
сичности антиrена ставят контрольную пробу только с мак-
рофаrами и антиrеном. Как и во всех случаях, коrда важны
не абсолютные, а относительные изменения электрофоретиче
ской подвижности, в МЭМ-тесте важно сохранять постоянст-
во рН.
Блаrодаря простоте проведения и более ВЫСОIЮЙ воспроиз-
водимости результатов описанный вариант МЭМ-теста во
мноrих случаях оказался лучше обычной реакции торможе
ния миrрации макрофатов. МЭМ-тест нашел широкое приме-
нение в клинической иммунолоrии [36, 37]. В последние rоды
появился ряд работ по ero использованию для оценк'и клеточ
Horo иммунитета у больных со злокачественными опухолями
[38 43]. Методика была существенно упрощена, коrда BMe
сто макрофаrов морскоЙ свинки в качестве индикаторных
клеток стали применять более доступные бараньи эритроци-
ты, обработанные таннинО'м [44, 45].
27.3.
ОБЩАЯ ОЦЕНКА
Аналитический клеточный электрофорез служит ценньш
методом изучения и идентификации различных клеток. При
ero практическом освоении, особенно на самодельных прибо-
рах, вначале возможны затруднения. Но при некотором опы-
те он вполне приrоден для повседневноrо применения. В Юl
мунолоrических исследованиях становится все более актуаль
ной задача препаративноrо разделения популяций лимфоци-
тов, различающихся по электрофоретическим своЙствам. Об-
зор cOBpeMeHHoro состояния этой проблемы дан в разд. 40.
27 .4. ЛИТЕРАТУРА
1. Abramson Н. А., The cataphoretic ve10city of mammalian red blood ce!ls,
J. Gen. Physio!., 12, 469 (1929).
2. Ambrose Е. J., СеВ Electrophoresis, edited Ьу Е. J. Ambrose, J. & А. Chur-
chill Ltd., 1965.
3. Ambrose Е. J., James А. М., Lowick J. Н. В., Differences between the
electrical charge carried Ьу norma! and homo!ogous tumor cel1s, Naturc,
177,576 (1956).
4. Bangham А. D., The adhesiveness of !eucocytes with specia! reference to
Zeta potentia!, Апп. N. У. Acad. Sci., 116, 945 949 (1964).
5, Bangham А. D., Flemans R., Heard D. Н., Seaman а. V. Р., Ап аррзrаttlS
for microelectrophoresis of smaI1 partic!es, Nature, 182, 642 (1957).
27. Электрофорез клеток 207
6. Baпgham А. D., Pethica В. А.! The adhesiveness of cel1s nd the nat re
of the chemical groups at thelr surfaces, Proc. Roy. PhYS101. Soc. Еdш-
burgh, 28, 43 (1960).
7. Capaldi R. А., Green D. Е., Membrane proteins and membrane structure,
Febs Letters, 25, 205 (1972).
8. Caspar!! А. Е., Lymphocyte-antigen interaction in electrophoretic mоЫlitу
test fOl" cel!u!ar sensitization, Nature (New Вiol.), 231, 24 (1971).
9. Field Е. J., Caspary Е. А., Lymphocyte sensitization. Ап in vitro test for
cancer? Lancet (1970), 1337.
10. Guhrmann G. F., Ruhenstroth-Bauer G., Сеl1 electrophoresis employing а
l'ectangu!ar measuring cuvette, in: Сеl1 electrophoresis, edited Ьу
Е. J. Ambrose. J. & А. Churchil1 Ltd., London, 1965, 22 25.
11. Gutmann J., E!ektronische Verfahren zur Ermittlung statistischer Mef3zah-
!еп einiger medizinisch wichtiger Daten., Elektr01?-еd., 11, 62 (19.66).
12. НатШоn J. D., Stevens Т. J., А double-tube flat mIcroelectrophoresls сеl1,
-Т. colloid. interf, Sci" 25, 519 (1967).
13. Hartveit Р., Cater D. В., Mehrishi J. N., Changes in the electrophoretic
mоЫШу of mouse lymphocytes, thymocytes, macrophages and tumor cells
following immunisation, Brit. J. ехр. PathoI., 69, 634 (1968).
14. Haydon D. А., The surface charge of cel1s and some other smal1 particles
as indicated Ьу electrophoresis. 1. The Zeta potential surface charge re-
lationship, Biochim. Вiophys. Acta, 50, 450 (1961).
15. James А. М., (NN). Progr. Biophys., 8, 96 (1957).
16. Jenssen Н. L., Кбhlеr Н., Gundlach Н. J., Gunther J., Eckert R., Elektro-
phoretische BewegIichkeit von LymphknotenzelIen bei der experimentellen
allergischen Encepha!omyelitis, Acta Ыо!. med. germ" 32, 113 119
( 1974) .
17. Komagata S., Оп the measurement of cataphoretic velocity. Part 1: micro
scopic method, Res. E!ectrotechn. Lab. Japan, 348, 5 (1933).
18. Kortum О., LehrbucI1 der Elektrochemie. 3. Atlflagc, \Ter!ag Chemie
GmbH, WeinheimfВergstr., 1962.
19. Lichtman М. А., Weed R. J., Electrophoretic mobility and N-acety! пеш-
aminic acid content of human normal and !eucemic !ymphocytes and gra-
nulocytes, Blood, 35, 12 (1970).
20. Lucke-Huhle, Christiпe, Zur Frage der EinheitIichkeit del' sogenannten
kleinen Ratten-!ymphozyten, Dissertation, Miinchen, 1967.
21. Mehrinshi J. N., Surface mo!ecu!es components of human !ymphocytes,
Int. Arch. аl1., 42,69 (1972).
22. Phondke О. Р., Sundaram К" Сеll electl'ophoretic studies оп lymph node
cel1s possible existence of two popu!ations, Immuno!ogy, 21, 1 (1971).
23. Rueff F., Die ZelIe!ektrophorese in der klinischen Diagnostik, J. F. Leh
manns Verlag, Miinchen, 1964.
24. Ruhenstroth-Bauer G., Fuhrmann G. Р., Arnold R., Zur Frage der patho-
logischen Haemozytopherogramme bei der Lymphogranu!omatose, Dtsch.
med. Wschr., 88,620 (1963).
25. Ruheпstroth Bauer О., Lucke-Huhle, Two populations of small lymphocy
tcs, J. cell. Bio!., 37, 196 (1968).
26. Sachtleben Р., Kramer D., Schwartz W., Seaman G. V. F., Ein einfaches
Zelle!ektrophoresegerat fiir k!eine Materia!men g en Юiп. Wschr. 45 425
(1967). " ,
27. Seaman G. V. F., Heard D. Н., А microelectrophol'esis chamber of smalI
volume fOt, Use with bio!ogical systems, B!ood, 18,599 (1961)
28. Stoltz J. F., Stoltz М., Peters А., СоШn Р. Larcan А. Methode de mesure
de ,!а . mobilite e!ec!rophoretiqu e parti u!es col1oida!es еп suspension.
Т еопе e comparaIson entre dlfferentes cel1u!es d'electrophorese, J, Chi-
mle Physlque, 66, 922 (1969).
208 r. Л. Иен.сен.
29. Sundaram К" Phondke G. Р., Ambrose Е. J., Electrophoretic mobilities о!
antigen stimulated lymph поае cells, Immunology, 12, 21 (1967).
30. Vervey Е. J. W., Overbeck J. Р. С., Theory of the stаЬШtу of НорЫНс coI-
Ioids, 1. Уоl. Elsevier, Amsterdam, 1948. .
31. Weber, Еrnа, Grundri6 der biologischen Statistik, 7. Auf1age. Fischer,
Jena, 1972.
32. Wiig J. N., EIectrophoresis of Iymphoid ceIIs. Characterization of Т - and
B-Iymphocytes and two popuIations of thymocytes in the mouse, Acta
path. microbiol. Scand. Sect. А Suppl., 236, 101 (1973).
33. Wioland М., Sabolovic S., Burg С., Electrophoretic mоЬШtiеs оУ Т- and
B-cells, Nature (New Biol.), 237, 274 (1972).
34. Yamada Т., The electI'ophoretic changes of mammalian cells associated
with malignant transformation, Acta Path. Jap., 22, 1 (1972). '
35. Zeiller К" Holzberg E. Pascher G., Hannig К., Free flow electrophoretic
separation оУ Т- and B-1ymphocytes. Evidence for various subpopulations
оУ B-cells. Hoppe Seyler's Z. Physiol. Chem., 353, 105 (1972).
36. Field Е. J., Gйnther J. К" Friemel Н., Die Makrophagen-Elektrophorese-
МоЫIШits-(МЕМ) Methode: ihre Anwendung in der klinischen Immuno-
logie, Dtsch, Ges.-\vesen, 30 (1975), 377 383.
37. Friemel Н., Brock J., Jenssen Н. L., КоЫе, н., Solga и., Мау G., РЫ-
ирр Н., Zur Analyse der zelIuHiren ImmuпШit gegen Spenderantigene
nach Nierentransplantation beim Menschen, Z. ехр. Chir., 8 (1975)
350 355.
38. Takao lwaguchi, Yoshio Sakurai, Electrophoretic mobility of macrophage
as а parameter of ceII-mеdiаtеd immunity, GANN, 65 (1974), 561 562.
39. Meyer-Rienecker Н., lenssen Н. L., КоЫе, Н., Gйnthеr J. К., Makro-
рhаgеп-Еlеktrорhоrеsе-МоЫ1Шits-Теst (МЕМ) bei malignen Neoplasmen
des Zentralnervensystems, Dtsch. Ges.-wesen, 29 (1974), 844 848.
40. lrmscher J., мйие, М., Fischer R., оио G.,Strietzel М., Makrophagen-
Elektrophorese-МоЫlшits-Теst (МЕМ) zur immunoIogischen Diagnose
maligner Geschwй1ste, Dtsch. Ges.-wesen, 30 (1975), 687 692.
41. Мйllеr М., lrтscher J., Fischer R., Grossтann Н., Immuno10gisches Ти-
morprofil. Ein neuartiges Prinzip in der Anwendung des Makrophagen-
Elektrophorese-МоЫIШits (МЕМ) - Test zur differenzierten Karzinomdiag-
nose, Dtsch. Ges.-wesen, 30 (1975), 1836 1842.
42. Кlausch В., Straube W., Hofтann R., Вйttnеr Н. Н., Jenssen Н. L.,
КдЫе, Н., Gйnthеr J., Erfahrungen mit dem Makrophagen-Elektrophore-
se-МоЫlшits-Теst (MEM-Test) bei der Diagnostik maligner gyniikologi-
scher Erkrankungen, ZbI. Gynak., 97 (1975), 529 539.
43. Porzsolt Р., Muhlberger G., Ах W., E1ectrophoretic тоЫlitу test (ЕМТ) II,
Is there а correlation between the clinical diagnosis and immunologic
test for precancerous diseases? Behring Inst. МШ., 57 (1975), 137 146.
44. Porzsolt Р., Ах W., Electrophoretic mоЫlitу test: 1. Modifications to sim-
рlifу the detection of malignant diseases in mап, Behring Inst. Mitt., 57
(1975), 128 136.
45. J enssen Н. L., Shenton В. К., Electrophoretic mоЫlitу test for lymphocyte
sensitization using tanned sheep erythrocytes, Acta biol. med. germ., 34
(1975), K29 K32.
46. Stoltz J. Р., Stoltz М., Gineste J., Maupin В., Rev. Franc. Etudes СНп. et
Biol. ХПI (1968),525.
28. Электрофорез в rеле аrарозы
П.ЛИННЕRЕ
28.1. ПРИНЦИП
Модификацию электрофореза в rеле аrарозы, описанную
в этО'м разделе, разработали Лорелл и ero сотрудники. rель
аrарозы помещают здесь на охлаждаемую водой стеклянную
пластинку. Этот метод отличается очень высокой разрешаю-
щей спосо'бностью и позволяет даЖе выделять и анализиро-
вать чистые индивидуальные белки; в свое время он бы.л под-
робно описан Иохансоном [2].
28.2.
28.2.1.
ПРОВЕДЕНИЕИССЛЕДОВАНИЯ
Реаrенты и приборы
28.2.1.1. Реаrепты
Аrароза, х. ч. (Feinchemie K H. Kallies KG, Себниц, r ДР)
Амидо че,рный lOB (Е. Merck AG, ДаР?vlштадт, фрп
96 % -ный эта,нол, 'Ч.
Ку,масси ярко ,rОЛУ'бой R,250, ч. (Ferak, Зап. Берлин)
Ледяная Уlксусная ,К!Ислота, 'Ч. д. а. (Feinchemie К-Н. Kallies
KG, Себниц, r др)
Лактат кальция, ч. (УЕВ Laborchemie, А;ПОJIЬ.1.а, r ДР)
Метанол, х. ч. (УЕВ Jenapharm, Апольда, r ДР)
ПИКРИНОlв'ая I\jИ'слота, ч. (УЕВ Веrliп Сhеmiе, r др)
С}ща,н черный В (Chemapol, Праrа)
Трихлоруксусная кислота
Твин 20, 'Ч. (Serva, rейделыберr, фрп
Веронал (rФ7) (УЕВ Аrzпеimittеlwеrk, Дрезден)
Веронал-натрий (rФ7) (VEB Arzneimittel\\'erk, Дрезден)
Ацетат цияка (УЕВ Веrliп Сhеmiе, [др)
28.2.1.2.
Рабочие растворы
Буфер для электрофореза: 11,3 r веронала (0,012 М). 63,3 r
веронал-N а (0,069 М); 3,09 r лактата кальция (0,002 М);
5 л дистиллированной воды; рН 8,6.
Фиксирующий раствор: 5 частей насыщенноrо водноrо pac'rвo-
ра пикриновой кислоты и 1 часть ледяной уксусной кислоты.
От_1tblвающий раствор: 96 % ный неденатурированныЙ этило-
вый спирт.
14 840
210 П. Лuннеке
Окрашивающий раствор для белка: rотовят 0,5% -ный раствор
амидо-черноrо 10В или 0,2%-ный раствор КумасС'и ярко-rо-
лубоrо R250 в смеси :\1:ет3'НОЛ у сусная кислота дИстил-
лированная вода (9: 2 : 9); наrревают до 60 ос, оставляют
для охлаждения и фильтруют при комнатной температуре.
Окраuшвающий раствор для липопротеидов: 0,4 r судана чер-
Horo суспендируют в 120 мл этанола, смешивают с раство-
ром 4 r ацетата цинка в 80 мл дистиллированной воды и
наrревают до точки кипения. После охлаждения фильтруют
при комнатной температуре и хранят в склянке из TeMHoro
стеКЛа. Раствор, ставший бурым, не rоден к употреблению.
Раствор детерсента: примерно 3 капли твина-20 на 100 мл
ДИСТИЛ.1lIрованноЙ БОДЫ.
28.1.2.3. Приборы
Электрофоретическая камера (рис. 53)
Камеру можно -изrотовить из пиакрила или децелита. Ее
двойное дно иrрает РО.1Ь охлаждающей поверхности, на KOTO
б 7 4 3 7
,
2
i
I
1
5
Рис. 53, Электрофоретическая камера в разрезе. 1 буферныЙ резервуар;
2 платиновый электрод; 3 система охлаждения; 4 слоЙ rеля аrарозы
на стеклянноЙ пластинке, имеющеЙ толщину 1 мм; 5 мостик из rеля ara.
розы; 6 полоска аrарозноrо rеля; 7 штуцер водяноrо охлаждения.
рую кладут стеклянную ластинку 200Х 100 мм толщиной не
более 1 :\1: м, равномерно залитую 1,2%-ным rелем аrарозы.
Во ВрР\1Я электрофореза под охлаждающей поверхностью по
:Iабиринту циркулирует водопроводная вода. Для достаточно-
[О охлаждения верхняя пластинка двойноrо дна не должна
быть толще 1 мм. Вдоль длинных краев этой пластинки с
обеих сторон имеется по одному проему шириной около 5 мм;
эти проемы доходят до резервуаров, вмещающих по 1000 мл
буфера. Вдоль буферных резервуаров вмонтированы элект-
роды. Они представляют собой тонкие полихлорвиниловые
28. Электрофорез 8 zеле аzаРОЗbl 211
цилиндры, обмотанные платиновой спиралью и уложенные в
специальные канавки, которые проделаны в стойках из пиак
рила. Коrда камера собрана, эти канавки открываются в на-
правлении «от камеры». Сверху :!Самера непременно должна
закрываться стеклянной пластинКОЙ.
Во избежание несчастноrо случая рекомендуется смонти-
ровать все рабочие части камеры внутри закрывающеrося
футляра с выключателем безопасности.
п рuнадлежностu
Шаблон для канавок (рис. 54) пла'стинка из .тrатуни или
нержавеющей стали толщиной O,4 O,5 мм, имеющая 15 пря
моуrольных зубцов шириной 9 мм, разделенных промежут
ками 3 мм (для электрофореза липопротеидов в качестве
c;:
Рис. 54. Шаблон ДЛЯ канавок
шаблона используют «rребешок» с зубьями 1 Х 14 :\11М). Пла-
стинка зажата между двумя полоска:\1И пластика и сохраняет
вертикальное положение бла,rодаря ДВУ:Vl диаrона.1ЬНО распо-
ложенным штырькам.
Пластинка для залив:!Си аrарозных мостиков пиакрило-
Бая пла'стинка 110Х200х3 мм с рукояткой, приклеенной в
ередине.
Источник электропитания обычно должен обеспечивать
напряженность поля 20 В/см, которая создается при напря-
жении 250 260 В и силе тока 100 120 мА. Мы применя.пи
.стабилизатор постоянноrо тока, TIIIl 301 Е (PGH Stаtrоп,
Фюрстенвальде, [ДР), и работали при 170 210 В и 100 мА.
Нужен также ротаметр для воды. Напор воды может не
только деформировать, но и разрушить очень тонкую (l мм)
,охлаждающую пластинку. Поэтому для ее защиты рекомен-
дуется поставить ротаметр с маКСИ:\'lа.'IЬНЫ:\'l расходом 2 л/мин,
который к тому же позволит точно дозировать ОХ.тrаЖдение JI
избежать переrрева.
28.2.1.4.
Проведенпе электрофореза
Соединив шланrами охлаждающий .'Iабирпнт с ВОJОПрОВО
дом, пускают воду и, наклоняя камеру в разные стороны, ИЗ-
rоняют пузырьки воздуха. В наших опытах д.1Я УДОВ.lетвори-
14.
212 11. Лuннеке
Te3bH()ro охлаждеНIIЯ был достаточен расход воды l
1,\),Л/МИН. При необходююсти циркулирующую воду МОжно
ДОполните.1ЬНО охладить при помощи .1юбои си-стемы охлаж-
дения. Да.1ее закрывают нижние отверстия боковых проемов
(наПРИ'!llер, аккуратно заК"lеивают IIХ плаСТЫРБI), на ОХ.'Iаж
дающую поверхность наК.'1адывают пластинку с рукояткоЙ и
:...:"'- .'
А:о '.
1 '
,,' :',':. ....
')..:ф< .";'"
1 . \ "' ,%;"\t,,;.:<.
.\\\1 .:...." .
i ;;J-,.f::}':t :'
'"
. >-.1
;...
. м i..:.:
, ,:{,::"',
. .
.
. ,.
,.
....... ,
."".....
!\
": I :;\.
1< ,.."
Jf ...",,!
.. .1
, . ., . . . . ..
. , . f о",
. ', ,,;:, ';'\:.",.. : . .... ; :'{ ".
. ".i: 'il:H · "
.... "'i
.. J
. ;;';
\.
.......". '\.,
""''''''
.' '
.. . , ..,
-/ l'
';'"" '.j.-.'
........_;.....
.. . j.
'о
..\
;I:
....
. +
",: "; ",-.:
. .......
.1
" ",
Рис,' 55, IIзrОТОDление аrарозных
,юстиков.
Рис. 56. ИзrОТОDление пластинки
аrарОЗI\()rо rе.fJЯ.
до ' рхней ее плоскости заливают в проемы 1,5% ныи золь
аrар'озы (рис. 55). Аrарозу предварительно расплавляют в
буфере Д.iIЯ электрофореза и охлаждают до 60 ос
Аrарозные :\IОСТИКИ затвердевают прпмерно через 30 мин.
За это ВреМЯ rотовят с:юи rеля для Э.'Iектрофореза. Очищают
и обезжиривают стеКJ1янные пластпнки 200х 100 мм. Распо-
.ЮЖИН П.1астинку CTporo rОРИЗ0нта.1ЬНО, наносят пипеткой
23 мл ],2 % -Horo ЗО"lЯ аrарозы, прпrотовленноrо на буфере
для электрофореза и охлажденноrо до 60 ос (рис. 56). Сразу
JhC после распредслснпн золя в Hero поrружают шаблон для
кашlНОК (рис. 57) и закрывают пластинку, чтобы уменьшить
испар('нис. На вторую стеклянную пластинку наносят 3] МЛ
l,5% Horo золя аrарозы, из KOToporo после затвердения Bыpe
заюТ ска:Iьпелсм по JJlIнейке две полоски rеля шириноЙ 1,5 11
длиноЙ 20 см.
28. Электрофорез в zеле аzарозы 213
Пос.пе затвердения аrарозных мостиков уда.J1ЯЮТ ПО.10СКИ
пластыря, поддерживающие их снизу, и ПJJастинку с руко-
яткой, предварительно обведя ее с обеих сторон скальпелем.
Затем Ka epy поrружают в запо.пненные буферо резервуа-
ры 11 устанав.пивают cTporo rоризонтаJIЬНО. На охлаждающую
поверхность, которая должна быть совершенно чистой, HaHO
. - :/.:;..
.
- .t1
:'''::.
. .', <" .:' ;';1S ".
.;,,":.,
.'
u. ':.
j f'
\.
:
.
".-..;, o
.." j-..
:{.., j,;-'<."";'.;"" W
, .. .
.... " "'.
; ': :'<: ' :и . .
. $""
" .
:"..l;;J t 'A:,
.: ... ... ",.,.. . . j..:'-. .'
....,L.. ........ ..
"
,"<:
. '. .
. . - '<7 ' <......i";:i :>-:;.; , ..:::; ':: : :
!.;!<r '('<
";."
. .
Рис, 57. Поrружение шаблона для
канапок в еще жидкий раствор
<1ra розы.
. ,
,
'/
If
,
""""", : .(r"
.......
:./ '
,:".,
/,'.
,.1--
\
У'
. ....
-: ,
/; ., \
/,;.'.
;
. >-.
,
/
! .
' ,-':i..<:" . ...
6
.С
$//'
; ):1, "......
?-
.'Ji
Рис. 58. Наложение пластинки с
rеле:.[ аrарозы на охлаждающую
поверхность.
сят 7 м.п раствора детерrента и равномерно распределяют ero
пальuем. ТОЧНЫУI движением руки вверх из rеля ИЗВ.1екают
шаблон и помещают пластинку на охлаждающую поверхность
(рис. 58), не остаВ"lЯЯ под неЙ пузырьков воздуха. ОсновноЙ
rель соединяют с аrарозными мостикюш при ПО:\-lОЩIl ПО.10-
сок rеля, приrотовленных заранее и наК.1адывае:\fЫХ сверху.
Остается присоединить электроды, и камера rOToB8 .1..1Я ис
ПО.lЬЗ0вания.
ИсследуемыЙ :\Iатериал, напри ер 1 М.'1 плаЗ:\IЫ И.'111 сыво-
ротки, разбав.пяют буфером для Э':Iектрофореза (0,5 М.1), К
["оторому можно добавить 0,1 % бромфено.10воrо спнеrо, что-
бы J1еrче было с.педить за миr.раuиеЙ бе.:.IКОВ. Отбирают :\шк
рошприuем по 3 :\шл из каждой пробы и вносят в канавки
(рис. 59), стараясь не повредить rель. ЕС.1И стенки канаВКIl
:214 П. Ланнеке
не безупречны, ее .1учше пропустить. Электрофорез с.педует
начинать сразу же после заполнения канавок (рис. 60). Раз-
деление проводят при 100 YfA (соответственно ок,оло 190 В).
Электрофорез заканчивают, коrда а.пьбу шн уйдет на 5 С:\I
от стартовой канавки. Этот ЮYfент опреде.1ЯЮТ путем непо-
средственноrо наблюдения за полосой альбумина, ок,рашен-
,'., ' . ..'
< ;J t 'if '
. 1'
" ..
""'1'.. .
.. .
;' '.
." '",.'
- .,
. 7 >,.
;
.:.. .
,(,'
- ......... ..
:. ; ;:. ;t: .: , ".
...,.': ;{i".
........... -
. '. .;..: .'iS:
1,
../-<. '''';''
.: -:::. ,
/.
.'''<__ ...!if ,
". . ;. .: ". y.,
. . ...;j',: I
j1:
,
';.; I i
., .
':К: .
Рис. 59. Внесение исследуемых об-
разцов в канаВI<И.
О'.;""
1,У'!
ri . -",.:
. .-," : <- .. · {:'('
,. ,,-. ,'>. '1 .
ii <f", f . . ' ; ,:, ; , ; . . . ;;;;.' .д,:.,< i;:: .
. '; ::" ; \; :,;; .
I I /';':" \' .,]
. ::./1 '1
< "' ..... .
.' , ......;н ....
. N ко
t ;(!I '"
... /. : t < .
у ?; if .i; М'. ." <>1:"
. : I
i
I
I
11
I
.J
:.-.- "'''#',,1#"9-'
Рис. 60. Кюrера во время электро-
фореза.
ноЙ бромфено.J10ВЫМ синим. В наших УС.10ВИЯХ :lлектрофорсз
продолжался около 60 мин.
Во вре:\1Я э.т-rектрофореза необходи:уro с.педить, чтобы
а) сила тока БЫ.'1а 100 :\1А;
б) канавки не высыхали; в ПрОТИВНО 1 с.lучае их нужно
заполнить буферО\I д.пя электрофореза;
в) расход воды в системе охлаждения был около 1 л/мпн.
ОХ.'1аждающий поток воды до.пжен уравновешивать выде.1С-
ние тепла. Если ох 'IаЖДеЮlе сбалансировано, то на крышке
l<aYfepbI появ.пяется JIИШЬ :IеrкиЙ наЛет В.1зrlI. При чреЗ':\1('Р
1-10:\1 охлаждении конденсационная вода Yfожет образоваТhСЯ
ПрЯYfо на поверхности rе.пя. Появ.пение капе.'II, конденсацион-
"ной воды на внут>ренней стороне крышки, О'собенно неравно-
:мерное, свидетельствует о недостаточноYf охлаждениИ. Не-
28. Электрофорез в zеле аzарозы 21&
равномерность ОХ:lзждения MorYT вызвать воздушные пузыри
между пластинкоЙ rеля и охлаждающей поверхностью.
Как только электрофорез закончится, пластинку на 15 мин
поrружают в фик'сирующий раствор, затем 2 3 мин отмыва-
ют 96% HЫM ::JТИ.l0ВЫМ 'спиртом. После этоrо rель накрывают
впажной фИJIьтровальной бумаrой, не оставляя пузырьков;
воздуха, а сверху накладывают слой марли толщиной 1 см и
стеклянную пластинКУ, которую придавливают двухкило
rраммовой rирей. Через 1 О мин rирю, стеклянную пластинку
и марлю удаляют, а по крытый бумаrой rель быстро высуши
вают в потоке теП.l0rо воздуха (фен) или в сушильном шка
фу (до 80 ОС).
Сухую электрофореrрамму на 5 мин 'поrружают в окраши
вающий раствор и на 2 3 мин в обесцвечивающий раствор..
а затем снова сушат в потоке теплоrо воздуха или в сушиль
ноУ! шкафу. После этоrо электрофореrрамму можно анализи
ровать.
Д ополнитеЛЬНblе замечания
ВО время электрофореза можно приrотовить новую пла
стинку rеля, и работа будет идти непрерывно. Если прово
дить подряд несколько сеансов разделения, то время, необхо
дим-ое на подrотовку камеры, не будет существенно увеличи
вать среднюю продол.жительность одноrо анализа.
После каждоrо 'сеаНса электрофореза следует переключать
полюса камеры. Белки должны каждый раз миrрировать в
противоположном направлении.
Буферный раствор в камере нужно менять ежедневно. По
c e 10 15 cea COB необходимо вновь залить аrарозные MO
стики. Каждый опыт желательно ставить с новыми KOHTaKT
ными полосками rеля. Если при извлечении шаблона к зубцам
прилипает rель, то поверхность металла следует е;,кедневно
силиконировать. Вообще надо очень осторожно извлекать
шаблон из rеля, так как лишь абсолютно ровные канавки [а-
рантируют правильное разделение. Приrотовленные про запас
пластинки rеля можно хранить несколько часов, защитив 01"
высыхания. Канавки таких пла'стинок обычно заполняют бу
фером. Непосредственно перед использованием буфер OCTO
рожно удаляют полосками фильтровальной бумаrи.
Путем электрофореза можно разделять любую жидкость
орrанизма, содержащую белки. Каждая проба должна coдep
жать 10 100 MKr белка. Бедные белками жидкости нужно
предварительно концентрировать. Плазма фракционируется
.1учше сыворотки. Долrое хранение или замораживание ис
с.lедуемоrо материала инотда может значительно из:ченить
электрофореrр амму.
216 П. Линнеке
р.ля электрофореза липопротеидов рекомендуется следую-
ЩIIИ вариант меТОДа: применяют шаблон с друrим «rребеш-
ком» ('См. выше); объем исследуемоrо образпа плазмы, при-
""'" lIiII
.,
I
.
а
.
" k i
, ,".
i > J А 1
"""",-_\; ,I} ! 3,:с," , .
-,
- -
-- -
- ,-
-.....,-,'. . ,
Рис. 61, Электрофореrрамма плазмы
крови, сделанная в rеле аrарозы
(в середине). снятая с нее денсито-
rpaMMa (внизу) и «перекрестная» ЮI-
муноэлектрофореrрамма Toro же об-
разца плазмы (вверху).
rОТОВ.lенной так же, как и ,JДЯ разделения бе.1КОВ, равен
10 :ик. ; электрофорез продолжается около 1.3 ч ПрИ 80 fA;
э.lектрофореrра:И IУ фиК'сируют 20 мин в 5% -HO I (вес/объем)
растворе ТРИХ.'10РУК-СУСНОЙ кислоты. окрашивают 2 ч в рас-
творе красите я д я ипопротеидов и HeCKO ЬKO :иинут обес-
пвечивают в смеси ЭТИ.l0воrо спирта -с дистиллированной во-
дой 1: 1.
28. Электрофорез в zеле аzарОЗbl 211
28.3.
ОЦЕНКА
Электрофорез в rеле аrарозы при соблюдении перечис
.1енныХ выше условий леrко осуществим, надежен и блаrода
ря эффективному охлаждению требует меньше времени, чем
друrие paBHoueHHbIe методы, не предусматривающие охлаж
дения.
,...,.
- .. ..
.. ....
....... . ,. , . .,., '/ ,.и/'," ,';'
.::. ;fЦ"" ":."
.. ..:=::; ' ... ".
. '$'(ат! . 'l . f
! <
..::M :.y '/.:';/ __//" ',// ?7":V"'}
" " "" i,&}) ,-,.,
,
/ < .:: .." ...
.,2
-{:: .
r
. .
. ',' *'; '? f. /. : ..... ЛJO' ..N:,jp
':..
, . '" ; : :.i
';::: .ФW /,..
i . ;:
. ," h
'. ' .'" .r
':'ln>'":" ",,,,,
.. :::::"::ft{; ' /:-:(;,rJ:' .. '.
3
..
: ')i. , ,/;, '. ':;- / ::. . ./:; { : /;;/,' < I, " '-', .. ': !C.
&.o!
:fП ; :"
'<.: ,.
.." ;f ....4
".1';":,
.. :
1..
l'
//(;;
<-
о," . . ";
.' .
.
...7 Ъ-;...
J
5
/;. ..... . '- /.ij :; t /. < :""-:'" ./ "
.
\,
!;
',' /fJ"
. ;::. <::=::.
....,..
:,';,f.(:: :;'!
......... ........ ...
/, . ОА;; 1; 6
,>,
.. "":;jw,i" ..
"". . ::.'... ,:.::.'40. j
Pv.c. 62. Электрофореrрамма, сделанная в rеле аrарозы. 1 Iюрма.тJьная-
п.riазма крови; 2 плазма при воспалении; 3 плазма при дефиците
аl антитрипсина; 4 М-rрадиент в 132-0бласти при исследовании сыворотки;
5 М rрадиеl!Т в -у-области при исследовании сыворотки; 6 М-rрадиент
при исследовании концентрата моtJи.
По сравнению с друrими методами раздеJlения, не ВК.1Ю-
чающими добавочноrо молекулярноситовоrо эффекта, элект-
рофорез в rеле аrарозы обладает высокой разрешающей спо
tобностью (рис. 61 63). На рис. 64 отдельные по.rlOСЫ Э.'1еКТ-
р-офореrраммы сопоставлены с пятью К.11аесичеСКlВfИ фрак
циями сывороточных белков. Каждая такая полоса чаще Bce
ro соответствует индивидуальному белку, который можно.
идентифицировать на электрофореrра:\.!ме. Оба преимущества
метода очень важны, особенно при повседнеВНО!\1 ана.lизе бел
218 П. Лцннеке
"" " . "'. .::. .'
.-' ." ,--> "'..ъ.
Т, ,",-,-"" !:
. . .
j':'" :..... .
-.,;",' .,- . .. .
" >:'
. "
. .,.:<>' .;
.,:.."./
:щ- ';,."
'.
"'.$.
.(,; ".
. .:.:-':":.
. .
,"y.. . '.; ; "
..
...-,,-
t ..., .
:: /., "..;.:.;..(
&
- ': '
t... .... "<-'.
},
.., ..!
:j.
< ,. # , .
J.
": /
.... -
L.' -,."
. <::
,,' ". . ,... ..
Рис. 63. Пластинка rеля аrарозы, на
которой проведен электрофорез 14 ис-
c.ТIeдyeMЫX образцов.
)'-
: , - : >,, ,<;',
ков в К.,1инических лабораторIIЯХ. Стоимость анализа отдель
Horo образца при электрофорезе в rеле аrарозы меньше, че:\f
лри разделении на ацетат цеJ1ЛЮЛОЗНОЙ \1е:\fбране. Исследо-
вание 15 образцов без подrоТОВКИ камеры занимает несколь-
-КО БОJlьше 2 Ч.
ДЛЯ интерпретации электрофореrрамму каждоrо образuа
сопоставляют в вертикальном и rОРИЗ0нтальном направ.'Iениях
с электрофореrраммами друrих образцов, разделенных на тоЙ
же пластинке. Такое сопоставление позволяет оценить интен-
сивность и ПО.пожение отдельных полос, как четко выражен-
28. Электрофорез в zеле аzарОЗbL 2191
ALB
«,
«!
у
1
I '
[*
!
r
I . '2 I
1 " t " " у'" ':' " , .., м ' .. '" ""'.
: ":. . : ,; ' ". :: ;/>;,; ;' <' >'. :-
, ',":: .(. % ,<),:.,>:/J;
t 1 1 f t 1: r I 1 t tt
1 I I I 2 3 J. А 5 I 6 1 81
I I А.I 1
I a;)j Ж I
I : а I A а. М : тf с 3 : FI ь, I
I IOr I + :.; .. I
I : I (uzgqzz,'(/ I
I : I l
I
I А! Ь 1 I I IgG J
РИ':. ['.4 Электрофоретическое разделение и относительные IюнцентрациИi
важнейших белков плазмы в сопоставлении с пятью классическими фракци
Я:\1И [4] _ Белки, которые обычно содержатся в очень НИЗIЮЙ концентрации,.
НО при определенных заболеваниях MorYT дать ВИДИМЫе полосы, отмечены
стрелками. 1 преальбумин; 2 антихимотрипсин (находится между
aI-антитрипсином и Gс-компонентами); 3 церулоплазмин; 4 rлобулин"
нерастворимый на холоду; 5 С4 (четвертый компонент комплемента) ;
б стартовая канавка; 7 С-реактивныЙ белок; 8 лабильный низкомо-
лекулярный белок, не относящийся к иммуноrлобулинам (анrл. «gamma-
trace»). ALB и Alb альбумин; aLp аI липопротеид; aIAt aI-аНТII-
трипсин; Оr орозомукоид; а2М а2-макроrлобулин; Hp2-2 rаптоr.'Iобин 2 2;
Нх rемопексин; j)Lp j) липопротеид; тf трансферрин, С3 третиЙ
I';ОМПОllеllТ 1{0мпле lента, Fibr фибриноrен.
ных, так и едва заметных, КО1'орые соответствуют бе.тJкам, при-
сутствующим в следовых количествах.
Оценка электрофореrраМnIЫ требует опыта и знаний в об
.lасти паТОфИЗIlО:IOrии белков. К.тJиницист. как прави.'10, НС-
220 П. л ИНН'е"е
.может интерпретировать электрофореf1ра.мму: патофизиолоrи
ческая оценка ее дело 'специалиста. В принципе электрофо '
perpaMMbI можно денситометрировать (рис. 61), но мнения
относительно ценности денситоrрамм расходятся. Некоторые
авторы [5] считают, что на исходных э.1ектрофореrраммах
леrче, чем на денситоТ'раммах, 'проследить изменения отдель-
ных белков. Кроме Toro, в настоящее время количественное
определение отдельных фракций уже не является задачеЙ
электрофоретических методов иС'следования; для этоrо ис
пользуют более точный иммунохимический анализ. Однако
ИММУНОХИ IИческие методы не дают возможности полностью
охарактериз'овать белки (например, rенетические варианты),
различающиеся только по электрофоретической подвижности.
В частности, количественное иммунохимическое определение
иммуноr.побулинов ПОЗВО.'1яет .1ИШЬ предположить существо
вание N\ rрадиента, тоrда как электрофоретически и иммуно
электрофоретичеСЮI можно не только выявлять, но и класси
фицировать парапротеины. Поэтому описанный здесь метод
можно рассматривать и как самостоятельный, и как ДОПО.'1ни
те.пьный к друrИ:\1 методам исследования. Так как этот мето.}
при малой трудоемкости обладает высокой разрешающей спо
собностью, он В первую очередь приrоден для повседневноЙ
клинической диаrностики.
Электрофоретическая камера описанной конструкции име
ет преИ:>Vlущества не тольк'о при электрофорезе в rеле аrарозы,
но и при элеКТРОЮЛ:VIУНОДИффУЗИИ [3, 7], двумерНО:Vl (пере-
креСТНОуl) И:Vlмуноэлектрофорезе [1], электрофокусировашш
[6] и препаративном электрофорезе [2].
28.4. ЛИТЕРАТУР А
1. Gaпrot Р. О., Crossed immunoelectrophoresis, Scand. J. сIiп. Lab. Invest..
29, suppI., 124, 39 41 (1972).
2. Johaпssoп В. О., Agarose ge! e!ectrophoresis, Scand, J. clin. Lab. Invest.,
29, suppl., 124, 7 19 (1972).
З. Laurell С, В., Electroimmuno assay, Scand. J. cIin. Lab. Invest., 29, suppl.,
124, 21 37 (1972).
4. Laurell С. В., Composition and val'iation of the gel electrophoretic fracti-
ons of p!asma, cerebrospina! f!uid and urine, Scand. J. clin. Lab. Invest.,
29, supp!., 124, 71 82 (1972).
5. Laurell С. В., E!ectrophoresis, specific protein assays, or both in measure-
ment of pIasma proteins? ClinicaI Chemistry, 19, 99 102 (1973).
6. Skude О., Jeppssoп J. О., Thin layer electrofocusing fol1owed Ьу electro-
phoresis in antibody containing gel, Scand. J. clin. Lab. Invest., 29.
supp!., 124, 55 58 (1972).
7. Weeke В., Quantitative Immunelektrophorese, Arztl. L:ll1.. 18, 12 .1 ) \1
47 56 (1972).
:29. Аналитический диск злектрофорез
Х.Фl'ИМЕJlЬ
29.1. ПРИНЦИП
Диск-электрофарез эта метад аналитическоrа ![ препа-
ративнаrаразделения харашо рз'створимых палиэлектроли-
тов. Он был впервые описан в 1959 r. Орнстейном и Дэвиса:\1
[1, 2] и вскоре получил широкае распрастранение. При диск
электрофорезе, как и при непрерывном электрофарезе в по
лиакриламидном или крахмальном rеле, разделению способ
ствует эффект малекуля'рна[>а сита. ОднакО' при диск элект
рофорезе вазникает, краме Tara, эффект канцентриравания,
абуславленный тем, что рН и величина пар в разных участ-
ках rеля неадинакавы. Канцентриравание праисхадит еще до
начала разделения в резк'а аrраниченнай зане rеля, и это по-
зваляет фракцианиравать ачень :\1алые каличества веществ
даже в сильна разбавленных растварах.
Аналитический днск элеК1'рафарез 'Обычна правадят вер-
тикально в стеклянных трубках (стандартная методика). Па
лиакриламидный rель приrатовляют из акриламида и сши-
вающеrа areHTa, чаще Bcera N,N/-метилен бuс-акриламида, в
присутствии катализатора и без доступа ваздуха ПРЯМО' в
трубках. Палучается каланка rеля, састаящая па меньшей ме-
ре из двух участков крупнапаристаrа канцентрирующеrо
rеля и мелкапаристаrа разделяющеrа rеля, в катарам и пра-
исходит элеК1'рафаретическае фракцианирование. В caOTBeTCT
вии с задачами фракцианиравания разделяющие свайства Те-
лей мажна праизвальна изменять в шираких пределах [3].
При высакай напряженнасти паля разделение праисхадит до-
вальна быстра. Пасле разделения rель извлекают из трубки и
подверrают дальнейшей обработке (окрашивают, разрезают
на части, исследуют с памащью иммунодиффузии, ра,Jиоавта
rрафии и т. д.).
29.2. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЯ
29.2.1. Реаrенты и приборы
Акриламид; N,N/ метилен бuс акриламид; персульфат ЮI-
:\1ания (NH 4 ) 25208; тетрамеТИЛЭТИJlендиамин (ТЕМЭД); ри
бафлавин; сахараза; трuс оксиметилаМинометан (трнс): [.т!Но
дин; 1 н. раствар HCl; 1 М раствар Н З Р04'
,, ;''': :':1 ;;i1 ?[; }$
222 Х. Фримель
Прибор для электрофореза; выпрямитель, дающий стаби
:lИзированный ток 50 мА и напряжение 400 В; трубки для
rеля (70 Х 5 мм); резиновые колпачки для трубок; шприц на
1 мл (' Иr.lОЙ (длиной 8 см, со сточенным и отшлифованным
концом); микрошприц на 100 мкл; УФ-лампа; 'сосуды для OK
рашивания и обесцвечивания.
29.2.2. ПодrОТОВRа труБОR для rеля
Стеклянные трубки обрабатывают смесью бихромата с
серной кислотой, тщательно прополаскивают дистиллирован-
ной водой, а затем поrружают на короткое время в О,5%-ный
(по объе\1У) водный раствор неионноrо детерrента (например,
В. F 905, УЕВ Orwo Filmfabrik, Вольфен, r ДР), высушивают
при 60 ос и хранят, защитив от ПЫ.'IИ.
29.2.3. Приrотов.lIение разделяющеrо rеля
Для а нализа сывороточных белК!ов человека чаще Bcero
используют систему rелей N2 1 по Мауреру [4, 5]: рН 8,9;
7,5% ный rеЛЬ,среднепористый; рН для концентрирования
8,3, для разделения 9,5.
Для приrотовления разделяющеrо rеля используют сле
дующие растворы:
Раствор ,у!! 1 1 н. раствор HCl
Трис
ТЭМЭД
Бидистиллированная вода
Раствор JV!! 2 Акриламид
Метилен-бuс акриламид
Бидистиллированная вода
Раствор .;v!! 3 Персульфат аммония
Бидистиллированная вода
Раствор М 7 Сахароза
Бидистиллированная вода
48,0 мл
36,6 r
0,23 мл
до 100,0 мл
30,0 r
0,8 r
до 100,0 мл
0,14 r
до 100,0 мл
40,0 r
до 100,0 мл
Растворы хранят во флаконах из TeMHoro стекла при 4 0 с.
В лих условиях растворы NQ 3 и 7 стабильны в течение Heдe
,1И. а NQ 2 несколько недель.
РаЗДС',:J5IЮЩИЙ [еJII, ПРIlrОТОВJIЯIOТ, смешивая стеклянноЙ
палочкой 1 объем растВ'ора NQ 1, 2 объема раствора NQ 2.
4 объема раствора NQ 3 II 1 объем 'раствора NQ 7 ('при переме
шивании избеrать пузырьков воздуха). Смесь используют
сразу же после приrотовления. Стеклянные трубки, закрытые
снизу резиновыми колпачками, на высоту 40 мм заполняют
29. Аналитический диск электрофоре.3 223
раствором разделяющеrо rеля при помощи шприца на .10 мл
с ,отрезком узкоrо полиэтиленовоrо шланrа. Кислород возду
ха способен тормозить полимеризацию; поэтому при исполь-
зовании не свежеприrотовленных, а старых растворов в шпри-
це нужно с помощью поршня создать разрежение, чтобы уда-
лить воздух. На ра'створ разделяющеrо rеля в трубках OCTO
рожно наслаивают HeMHoro дистиллированной воды, которая
способствует образованию четкой rраницы :\1ежду разделяю
щим и концентрирующим rелями. Вода не должна смеши
ваться с растВ'ором rеля. Трубки на 60 мин оставляют стоять
c'l1poro вертикально и неподвижно для полимеризации.
29.2.4.
Приrотовление концентрирующеrо rеля
Коrда полимеризация разделяющеrо rеля закончится, с
ero поверхности удаляют воду и оставшееся свободным про
странство трубки ополаскивают растнором концентрирующеI'О
rеля, а затем до высоты 50 мм заполняют и:vr трубку.
Для приrотовления концентрирующеrо rеля IIСПОЛ!)ЗУЮТ
следующие растворы:
Раствор М 1 1 М раствор Н з Р0 4 25,6 мд
Трис 5,7 r
Бидистиллированная вода до 100,0 мл
Раствор М 5 Акриламид 10,0 r
Метилен-бuс-акриламид 2,5 r
Бидистиллированная ВОДа до 100,0 l\1Л
Раствор М 6 Рибофлавин 4,0 r
Бидистиллированная вода ДО 100,0 мл
Раствор концентрирующеrо rеля приrот'овляIOТ из 1 объ-
ема раствора N2 4, 2 оБЪе:\10В ра'створа N2 5, 1 объема paCTBO
ра N2 6 и 4 объемов раствора N2 7. Заполнив трубки концент-
рирующим rелем, на Hero для получения ровной поверхности
на'слаивают дистиллированную воду. ФотополимеризаЦIIЯ
концентрирующеrо rеля происходит под действие:\1 .1учей
УФ-лампы (на расстоянии 2 3 сМ от нее) и заканчивается
через 30 мин. После удаления воды поверхность rеля должна
быть совершенно плоской. Полученные столбики rеля {'отовы
для использования.
29.2.5. Проведение электрофореза
Исследуемые препараты, как сухие, так и ЖИдкие, вначале
смешивают с ра'створом концентрирующеrо rеля (1 Mr на
1 мл). Оптимальное количество наносимоrо \Iатериала нужно
224 Х. Фримель
определить в предварительном опыте; для белков это Пример
но от 10 до 100 MKr. Полученные растворы исследуемых ве-
ществ ми ропwпеткой наносят на поверхность концентрирую
щеrо rеля (стараясь ero не повредить). Чтобы избежать по-
терь исследуемоrо вещества из за диффузии в верхний буфер,
к наслаиваемому раствору прибавляют 1 2 капли 40% -НОro
раствора сахарозы. После этоrо верхний конец трубки нужно
до краев осторожно заПО.1НИТЬ электродным 6уфером, не по-
тревожив слоя ис'Следуемоrо вещества. Заполненные трубки
вставляют в 'резиновые уплотнения прибора для электрофоре-
за так, чтобы их верхние края примерно на 5 мм возвышались
над уплотнениями. Коrда все трубки с rелем укреплены, Bepx
ний и нижний резервуары заполняют буфером, предваритель
но охлажденны:'l'! до 4 0 с. Если при этом у краев трубок обра
зуются пузырьки воздуха, их осторожно удаляют пипеткой.
Концентрат электродно;;о буфера:
Трис
rлицин
Бидистиллированная вода
Рабочий электродный буферный раствор:
Концентрат буфера
Бидистиллированная вода
6,0 r
28,8 r
до 1000,0 мл
100,0 мл
ДО 1000,0 мл
После элект.рофореза верхний и нижний буферные рас-
творы нельзя смешивать. Их хранят в разных склянках и ис
пользуют на 8 10ceaHcax электрофореза. Источник электро
питания должен давать стабилизированный постоянный ток.
В начале электрофореза устанавливают ток 1 мА через каж-
дый столбик rеля. По мере миrрации исследуемоrо вещества
в концентрирующем rеле силу тока необходимо повышать, так
как увеличение напряженности поля улучшает растворимость.
Собственно разделение обычно проводят при токе 4 мА через
столбик rе.1Я в течение 40 мин. Электрофорез заканчивают,
коrда подвижная rраница будет примерно в 3 мм от нижнеrо
конца трубки. Чтобы лучше отметить подвижную rраницу,
верхний буфер подкрашивают (в щелочной системе буферов
бромфеноловым синим, а в кислой метиленовым синим).
Окрашивание, обесцвечивание,
оценка
После электрофореза трубки вынимают из прибора и.
осторожно введя между столбиками rеля и стеклом дистил
лированную воду, извлекаютrель. Это делается при помощи
29.2.6.
29. Анал.итичесюий диСК Э.l1еКтрофорез 225
шприца с длинной иrлой, острие которой сточено. Сто:rбик
rеля помсщают в пробирку и В течение ночи окрашивают а:ми
до черным 10B или друrим: красителем для белка. НеСВЯЗ8В-
ШllЙСЯ краситель можно удалить путем обычной отмывки или
с помощью электрофореза. При ежедневной 'смеНе отмываю
щеrо раствора для отмьшки требуется около недели, так как
свободная диффузия, особенно в мелкопористом rеле, затруд
нена. Удаление красителя с помощью электрофореза в 5 % НОЙ
уксусной КlIслоте продолжается всето лишь 1 2 ч, однако
оно может приводить к потере слабо фик,сированных белков.
Результаты электрофореза можно оценивать, денситом:етри
руя непосредственно столбик rеля или ero фотосни:мок; мож-
но также разрезать rель на части и анализировать каждую
фракцию. Для денситометрии нужен прибор с разрешающей
способностью до 50 мкм. Поместив цилиндрический rель в
раствор с равным показателе:м преломления, например в
7% ную уксусную кислоту, мо:;.кно избежать сферической
аберрации. Разрезание rеля на части [6 8] применяют rЛ8В
ным образом для последующей иммунодиффузии или опреде
ления радиоактивной метки.
29.3. ОБЩАЯ ОЦЕНКА МЕТОДА
По чувствительности аналитический диск-электрофорез
примерно соответствует иммуноэлектрофорезу [9]. При ана-
лизе белков человеческой сыворотки он дает 20 30 ПО.l0С.
Один из ero вариантов, так называемый дифференциальный
......
';t , . " , : , t , r . }\;: /;J4"':,I '"
. - :.
. ::;:
:: :-
.(.,
. //';;%.:fi," J:':': ::fi- '- ': -;.-=;'"
",;::е: _ "1-:":
.:": ;
",;.. ....., ;.";,:",,,
....: , ,' , '. . ,.::.. , :.
" . \;
-
:::..
:r: ':i-:-:;:;:(.:z
: " :-.: ,,:, : .
Рис. 65. Диск электрофорез человеческой сыворотки в по.'шакри.lамидном
rеле. Дифференциальный метод по Райту [1 О] .
диск элеКТр'офорез [10], позволяет получить даже 44 50 от-
дельных фракций (рис. 65). Важным преи:муществом диск
электрофореза является возможность выбрать 'систему, кото-
рая в наибольшей степени соответствует задаче разделения
(табл. 5).
Полиакриламидный. rель tHe адсорбирует ИСС.lедуемые ве-
щества, устойчив к изменениям рН и температуры; в нем не
15 840
Таблица 5. Системы ёелей для диск-электрофореза 1[4]
о: Растворы раЗДеляющеrо re.nя
.= .
Область лримене- О:!-= 0:'" I
нt Система rеля ::i='" ::it;
ния (лримеры) "'''' JIIi I Содержание реаrентов Соотиоще-
::10
:r:=o. :r:"'O: g в 100 мл раствора рН иие раство-
0= "'=
0.:': О. 0.0.= ров В смеси
1 рН 8,9; 7,5% Бе.'1КИ с мол. ве- 8,3 9,5 1 1 н. НСI 48,0 мл 8,9 1 ч. .N'2 1
( среднепорис- сом 104 106, Трис 36,6 r 2 ч. N2 2
тый) об.'Iасть Опти- ТЕМЭД 0,23 мл 1 ч. Н,О
мальноrо разде- 4 Ч. Н2 3
лени я от 3.104 2 Акриламид 30,0 r
до 3.105 (Ha МБА 0,8 r
при мер , сыво- 3 ПСА 0,14 r
роточные бел-
ки)
2 рН 8,9; 15% Белки с мол. ве- 8,3 9,5 8 Акриламид 60, О r 1 ч. N2 1
(мелкопорис- сом <3.104 МБА 0,4 r 2 ч. N2 8
тый) 4 Ч. Н2 3
3 pH 8,9; 30% Белки с мол. ве- 8,3 9,5 9 ПСА 0,18 r 1 ч. N2 1
(мелкопорис- сом <104, ми- 4 Ч. N2 8
тый) нимум около 3 ч. М 9
2000
4 рН 8,9; Белки с мол. ве- 8,3 9,5 10 Акриламид 15,0 r 1 Ч. .N'2 1
3,75% сом >106, мак- МБА 0,4 r 2 ч. М 10
(крупнопо- симум около 1 Ч. .N'2 6
ристый) 2.106 4 Ч. Н 2 О
5 рН 7,3; 7,5% Основные белки, 8,3 6,6 11 1 н. КОН 8,0 мл 7,3 6 ч. .N'2 11
( среднепорис- которые в сис- rлицин 19,0 r 1 Ч. .N'2 12
тый) теме N2 1 дви- 1 ч. М 13
жутся к катоду ТЕМЭД 0,08 мл
12 Акриламид 60,0 r
МБА 1,6 r
13 ПСА 0,56 r
I 7,0 8,0 15 1 н. НСI 48,0 мл 7,5 1 ч. N2 15
б рН 7,5; 7,5% IБелки, в част.
(средиепорис-' ности фермен- Трис 6,85 r :2 ч. N2 2
тый) ты, оптимально ТЕМЭД 0,46 мл 1 ч. НаО
разделяющиеся I 4 Ч. .N'2 3
при рН 8,0, но
неустойчивые
при рН выше
8,0
7 рН 4,3; 15% Основные белки, 5,0 3,8 17 1 н. КОН 48,0 мл 4,3 1 ч. N2 17
(мелкопорис- иапример rиСто- АсОН 17,2 мл 2 ч. N2 8
тый) ны, С мол. ве- ТЕМЭД 4,0 мл 1 ... н,О
сом около 2. 1 ()4 18 ПСА 0,28 r 4 ч. N2 18
8 рН 4,3; 7,5% Основные белки 5,0 3,8 1 ч. N2 17
( среднепорис- с мол. весом 2 Ч. N2 2
тый) >2.1()4 1 ч. Н.О
4 ч. N2 18
Растворы КОlЩеитрирующеrо rеля Электродный буфер Полюса
М! содержание реаrентов Соотношение I Содержание реаrентов верх-I Ниж-
в 100 NJI раствора рН растворов в 1000 NJI раствора рН I нн. КВА
В смеси
4 1 М Н з РО 4 25,6 МЛ 6,9 1 ч. М 4 Трис 6,0 r 8,3 +
Трис 5,7 r 2 ч. М 5 rлицин ,28,8 r
1 ч. N2 6 Перед использовани-
5 Акриламид 10,0 r 4 ч. N2 7 ем разбавить водои
МЕА 2,5 r в 1 О раз
6 Рибофлавин 4,0 Mr
7 Сахароза 40,0 r
Как в системе N 1 Как в систе- Как в системе N 1 8,3 +
ме М 1
Как в системе N 1 Как в систе- Как в системе N 1 8,3 +
MeN 1
Как в системе N 1
Как в систе- Как в системе N 1
ме N 1
8,3
+
14 1 Н, КОН 48 ,О мл 10,3 1 ч, N2 14 rлицин 13,7 r 8,3 +
rлицин 4,8 r 2 ч. N2 5 2,6- ди мет ил- 38,2 мл
4 ч. М 7 ПИРИДИН
ТЕМЭД 0,46 мл 1 ч. N 13 (2,6-лути-
ДИН)
Перед использовани-
ем разбавить водой
в 10 раз
16 1 М Н з РО 4 39,0 м,а 5,5 1 ч. Nq 16 Диэтилбарби- 5,52 r 7,0 +
Трис 4,95 r 2 ч. N 5 туровая
ТЕМЭД 0,46 мл 1 ч, N 6 кислота
4 ч, N 7 Трис 1,0 r
19 1 н. КОН 48, О мл 6,7 1 ч. N 19 -аланин 31,2 r 4,5 ,
АсОН 2,87 мд 2 ч. N 5 АсОН 8,01 мл
ТЕМЭД 0,46 мл 1 ч. N2 6 Перед использовани-
4 Ч, Н 2 О ем разбавить ВодоЙ
в 10 раз
Как в системе М 7 Как в систе- Как в системе N9 7 5,0 +
MeN 7
15-
1
= = Растворы разделяющеrо rеля
. :11
Обпасть лримеие- =!ё\\i I
Nt Система rеля ния (лримеры) a: 8. a: JII1 I содержание реаrентов Соотиоше-
:r: 0:11 :r:! 9 в 100 мл раствора рН нне раство-
:.c ров в смеси
9 рН 2,9; 7,5% Сильноосновные 4,0 2,3 20 1 н. КОН 12,0 мл 2,9 4 ч. Н2 20
( среднепорис- белки с мол. Ас ОН 53,25 мл 2 Ч. Н2 2
тый) весом >2. 1 ()4 ТЕМЭД 1,15 мл 2 ч. Н2 21
21 ПСА 2,8 r
10 рН 2,9; 20% Основные белки 23 КОН 224,0 Mr 2,9 5 ч. Н2 23
(мелкопорис- (rистоны) ТЕМЭД 0,4 мл 5 Ч. Н2 24
тый) АсОН до нужноrо рН 5 Ч. Н2 25
2 ч. Н2 26
24 Акриламид 60,0 r
25 МБА 1,2 r
26 ПСА 1,0 r
11 рН 9,4; 4% Н. и L-цепи 27 Акриламид 16, О r 1 ч. Н2 27
(крупнопо- иммуноrлобу- МБА 0,8 r 1 ч. N2 28
ристый) линов 10 М моче- до 2 ч. Н2 29
I вина 100,0 мл
28 Трис 18,15 r 9,4
1 н. НС! 24,0 мл при
ТЕМЭД 0,24 мл 25 ос
10 М моче- до
вина 100,0 мл
29 ПСА 0,14 r
10 М мо- до
чевина 100,0 мл
2 рН 8,7; 7.5% Цитоплаз ати- 33 Трис 4,48 r 8,7 2 ч. Н2 33
( среднепорис- ческие мбелки 1 н. НС! до нужно- 4 ч. Н2 2
тый) из ткани Мозrа ro рН 1 ч. N2 34
34 ТЕМЭД 1,0 мл 8 ч. O
35 ПСА 1,2 r 1 ч. Н2 35
3 pHi;6,5; 7,5% L-цепи антител 37 NaOH 31,6 Mr 6,5 1 ч.N237
(среднепорис- ТЕМЭД 0,115 мл 11 ч. Н2 38
тый) Какодило- 1 ,877 r 2 ч. Н2 39
вая кис-
лота
38 Акриламид 30, О r
ЭДА 2,0 r
39 ПСА 70,0 Mr
4 рН 2,1; 7,5% Белки с опти- 2,5 2,5 40 4 М про- 1 ч. Н2 40
( среднепорис- малъным разде- пионовая 1 ч. Н2 38
тьdi) лением при рН кислота
2,5. аrреrирую- 41 ПСА 0,023 r 1 ч. Н2 41
щие при рН вы- 42 NаНSО з 0,035 r 1 ч. М 42
те 3"
1
1
Сокраще//'ия. ТРИС трис(окснметнл)амннометан; ПСА лерсуль<jJат амМония
(NH.)2S20S; ТЕМЭД N,N,N',N'-тетраметилэтиленднамнн; МБА N,N -метилен-бис-
акриламид; ЭДА этилендиакрнлат; АсОН ледяная уксусная кислота.
Растворы концентрирующеrо rеля
М \ Содержанне peareHTOB
в 100 NJI раствора рН
22 1 н. КОН
АсОН
48, О мл
2,95 мл
Концеитрирующий
rель не используется
(приrотовление pac
твора разделяющеrо
rеля NQ 23: КОН
растворить в 75 мл
Н 2 О, прибавить
ТЕМЭД и довести
рН до 2,9 с по.
мощью АсОН; затем,
вновь проверив рН,
прибавить 0,04 М
ацетат кальция)
30 Акриламид 8,0 r
МБА 0,8 r
10 М моче- до
вина 100,0 мл
31 Трис 2,23 r
1 М Н з РО 4 12,8 мл
ТЕМЭД 0,1 мл
10 М моче- до
вина 100,0 мл
32 Рибофлавин 1,0 Mr
ПСА 40,0 Mr
10 М моче- до
вина 100,0 мл
36 Трис 0,726 r
1 н. НСI ДО нужно-
[о рН
i"
Концентрирующий
rель не используется
(растворы исследуе-
мых веществ долж-
ны иметь ионную си-
лу ииже, чем рас-
твор NQ 34)
Концентрирующий
rель не используется
(необходим предва-
рительный электро-
форез; исследуемые
вещества растворяют
в 0,2 М ПРОПИОновой
кислоте)
...
f.;
r1
./
6,74
при
25 ос
Продолжение
Электродный буфер Полюса
Содержание реаrеитов I рН B :- \ .
в 1000 мл раствора ппп, ппп,
Соотношение
растворов
в смесн
5,9
1 Ч. NQ 22
2 ч. NQ 5
1 ч. NQ 6
4 ч. Н 2 О
1 ч. Ng 30
1 ч. Ng 31
2 ч. NQ 32
6,7
2 Ч. NQ 36
4 ч. NQ 5
1 Ч. NQ 34
8 ч. Н 2 О
1 ч. NQ 35
rлицин 28,1 r 4,0
Ас ОН 3,06 мл
Перед использовани-
ем разбавить водой
в 10 раз
Верхний
буфер
рН 4,0
0,3 М
DL-валин,
рН уста-
наВ.lивают
при помо-
щи АсОН
Верхний
буфер
рН 8,91
Трис
5,16 [,
r.1ИЦИН
3,48 [,
10 М MO
чевина
700,0 мл
Трис
r.'IИЦИН
Раствор NQ 37
+
Нижний
буфер
рН 4,0
0,3 М
DL rлицин,
рН уста-
навливают
при помо-
щи АсОН
+
Нижний
буфер
рН 8,07
Трис
14,5 [,
1 н. НСI
60 , О М.1
+
6,0 r
28,8 r
8,3
+
6,5
+
1 М пропионовая кис- 2, 1 +
лота
230 Х. Фрим.ель
возникает электроосмос. Качество разделения при диск-элект-
рофорезе во MHoroM зависит от чистоты исходных с'оедине-
ний, входящих в состав ,rеля. Чистота продажных. образцов
акриламида весьма различна. Толыю высокоочищенные моно-
меры образуют rель, не поrлощающий ультрафиолетовые лу-
чи. Акриламид можно дополнительно очистить путем пере-
кристаллизации из хлороформа. Для этоrо 70 r акриламида
растворяют при 50 ос в 1 л хлороформа, подверrаютrорячему
фильтрованию, затем выкристаллизовывают при 20 ос, кри-
сталлы промывают холодным хлороформом и высушивают
[11]. Акриламид токсичен, следует из,беrать ero попадания на
кожу и в дыхательные пути. Даже 1 % -ный раст8'Ор акрил-
юшда может вызывать раздражение кожи. Нестабильность
мономера, сомономера и катализатора заставляет держать
исходные растворы в холодильнике. Перед приrотовлением
rеля их нужно HarpeTb до комнатной температуры. Ра,створ
персульфата добавляют непосредственно перед заполнением
трубок.
Воопроизводимость результатов также зависит прежде все-
[о от ка чества rеля. Любая задержка полимеризации делает
величину пор неконтролируемой. Концентрирующий rель по-
лимеризуют с помощью ультрафиолета, так как при фотопо-
лимеризации получаются поры большей величины. Для уда-
:Iения свободноrо катализатора и дополнительной очистки
разделяющеrо rеля можно п'ровести 2-часовой предваритель-
ный э.'Iектрофорез. Необходимо предотвратить диффузию ис-
следуемоrо вещества в верхний буфер. Для этоrо наносимое
вещество часто заключают в дополнительный слой rеля либо
смешивают с сефадексом а-200 или с 1 М сахароз'ой. Сле-
дует учесть, что раствор 'сахарозы быстро становится непри-
rодным (прорастает плесенью). Кроме свойств 'rеля, большое
значение для воспроизводимости результатов имеет стабиль-
ность тока во время разделения. Сила тока через столбик [е-
ля не должна быть выше 5 мА, так как с ее увеличением
растет выделение тепла. После электрофореза rель нужно тот-
час извлечь из трубки и зафиксировать, иначе диффузия бу-
дет продолжаться. Извлечение rеля технически самая труд-
ная операция, 'Однако при известном терпении ее можно ос-
воить. Для последующей денситометрии ваlЮНО, чтобы по-
верхность rеля осталась неп,оврежденной. Механические свой-
ства rелей, содержащих менее 5% акриламида, можно улуч-
шить, добавив аrа'розу [12]. Если rель окрасить кумасси яр-
ко"синим в трихлоруксусной 'кислоте, то можно обойтись без
удаления несвязавшеrося красителя [13]. Перед разрезанием
rеля на части целесообразно фиксировать ero поверхность за-
мораживаiНием (10 мин в морозильнике). При дальнейшем
29. Аналитичеокий диск-электрофорез 231
ИСС.lедовании фраrментов rеля методами иммунодиффузии
следует учитывать, что из-за меньшей величины пор диффу-
зия 'aHTнreHOB в полиакриламидном rеле происх,одит в 3 4
раза 1eД..1eHHee, чем в arape. Поскольку диск электрофоре
rpaMMbl одноrо и Toro же вещества, полученные в разных
трубках, часто бывают неодинаковыми, для прямоrо сравне-
ния двух веществ был разработан метод раздвоенноrо rеля
или, иначе, множественный диск-электрофорез [14]. Для He
посредственноrо сравнения разных веществ можно применить
диск-электрофорез в плоском слое rеля [15]. Для денсито
метрии лучше иметь прямоуrольные столбики rеля, чем ци-
линдрические; к тому же их мож'но отливать в формах, co
стоящих из двух разъемных половинок, и таким образом за-
дача извлечения rеля HaMHoro облеrчается. Разделяющие
свойства теля еще более возрастут, если размеры пор в раз-
ных ero слоях будут неодинаковы. Так, например, при диф-
ференциальном диск-электрофорезе [1 О, 16] используется H
сколько разделяющих rелей, полимеризованных 'Один lIa;I
друrим с понижением концентрации аК'рШlамида снизу вверх.
При rрадиентном диск-электрофорезе [17] разделяющий [епь
полимеризуется в условиях rрадиента концентрации полиак
риламида (чаще Bcero от 3 до 15%) и ,соответственно имеет
rрадиент величины пор. Вещества, одни компоненты которых
миrрируют к аноду, а друrие к катоду, можно фракциониро
вать с помощью двоЙноrо диск-электрофореза [18]. Диск
электрофорез можно 'с успехом комбинировать с друrими ме-
тодами аналитичес'Коrо исследования, такими, как диск-элехт-
рофокусирование [19], диск-иммуноэлектрофорез [20, 21],
диск-ферментоэлектрофорез [22, 2З], диск-электрофорез в
присутствии додецилсульфата натрия [24, 25]. При микро-
диск-электрофорезе [26, 27] можно достичь чувствительности
порядка 10 9 10 12 r белка. В препаративных вариантах ме-
тода оперируют с миллиrраммами вещества.
Известные достоинства диск-электрофореза малые 'коли-
чества И'сследуемоrо материала, быстрота разделения, про-
стота аппаратуры, высокая разрешающая способность обес-
печивают ему ширшюе 'применение. С ero помощью можно
успешно фракционировать белки, полипептиды и нуклеиновые
кислоты [29, ЗО]. Диск-электрофорез это чувствительный
метод для фракционирования макромолекул и изучения их
физико химических свойств.
29.4. ЛИТЕРА ТУР А
1. Orпsteiп L., Disc electrophoresis 1. Background and theory Апп N У
Acad. Sci., 121, 321 349 (1964). ' '"
2. Davis В, J., Disc electrophoresis П. Method and application to human
serum proteins, Апп. N. У. Acad. Sci., 121, 404 427 (1964).
232 Х. Фрuмель
3. Maиrer Н. R., Аиеn R. С., Useful buffer and gel systems for polyacryl
amide gel electrophoresis, Z. klin. Chem. klin. Biochem., 10, 220 225
(1972) .
4. Maurer Н. R., Disk-Elektrophorese, Berlin, 1968 (602 Literaturzitate bis
Mai 1967). (Маурер [., Диск-электрофорез. Теория и практика электро-
фореза в полиакриламидном rеле, «Мир», М., 1971.)
5. Maurer Н. R., Disc electrophoresis, Berlin/New York, 1971.
6. landolo J. J., Device for slicing polyacrylamide gels, Analyt. Biochem.,
36, 6 10 (1970).
7. Gartinkle В., Mechanical fractionation of polyacrylamide gel slabs, Апа-
lyt. Biochem., 38, 552 554 (1970).
8. Bakay В., Detection of radioactive components in po1yacrylamide gel disc
e!ectropherograms Ьу automated mechanical fractionation, Ana!yt. Bio-
сЬеm., 40, 429 439 (1971).
9. lsichei U. Р., Med. Dissertation, Univ. Miinchen, 1966.
10. Wright а. L., Маllтаnn W. 1., Differential disc e!ectrophoresis of serum
proteins, Proc. Soc. ехр. Biol., 123, 22 27 (1966).
11. Loeпiпg U. Е., ТЬе fractionation of high-molecular-weight ribonucleic
acid Ьу polyacrylamide geI e!ectrophoresis, Biochem. J., 102, 251 257
(1967) .
12. Neiтaп Р. Е., Heпry Р. Н., Ап ana!ysis of the rapidly synthesized ribo-
nucleic acid of the narmal Ьиmап !ymphocyte Ьу agarose-polyacrylamide
ge! e!ectrophoresis, Biochemistry, 10, 1733 1740 (1971).
13. Chraтbach А., et al., А procedure for rapid and sensitive staining af pro-
tein fractionated Ьу polyacry!amide gel electrophoresis, Analyt. Biochem.,
20, 150 154 (1967).
14. Clarke J. Т., SimрlШеd disc (polyacrylamide gel) electrophoresis, Апп.
N. У. Acad. Sci., 121, 428 436.
15. Tichy Н., А multisample electrophoretic apparatus using vertica! роlу-
acry!amide gel slabs, Analyt. Biochem., 17, 320 326 (1966).
16. Wright а. L., Parrell К. В., Roberts D. В., Gradient polyacrylamide gel
electrophoresis af human serum proteins: improved discontinuous gel
e!ectrophoretic technique and identification of individual serum соmро-
nents, Сliп. СЫm. Acta, 32, 285 296 (1971).
17. Catoп J. Е., Goldsteiп а., Elektrophoresis оУ ribonucleic acids оп ро!у-
acrylamide ge! gradients, Analyt. Biochem., 42, 14 20 (1971).
18. Racuseп D., Double-disc electropharesis of proteins, Nature, 213, 922
(1967) .
19. Wrigley с., Gel electrofocusing а technique for analyzing multiple pro-
tein samples Ьу isoelectric focusing, Science Tools, 15, 17 23 (1968).
20, Makoпkawkeyooп S., Naque R. и., Immunodisc electrophoresis, Ana!yt.
Biochem., 36, 422 427 (1970).
21. El-Sharkawy Т. А., Huisiпgh D., Improved method for immunoelectropho-
retic research, Infection Immunity, 3, 711 (1971).
22. Stegeтaпп Н., Die Primereinsch1uB- Technik zum Enzymnachweis bis
10 12 g пасЬ Polyacrylamfd-Elektrophorese, dargestel1t ап Phosphoryla-
sen, Fresenius' Z. Analyt. Chem., 243, 573 578 (1968).
23. Orr М. D., Вlakley R. L., Panagou D., Discontinuous buffer system for
analytical and preparative electrophoresis of enzymes оп polyacrylamide
gel, Analyt. Biochem., 45, 68 85 (1972).
24. Talbot D. N., Yphantis D. А., Fluorescent monitoring of SDS gel electro-
phoresis, Analyt. Biochem., 44, 246 253 (1971).
25. Virella а., Parkhouse R. М. Е., Determination of the molecular weight of
Ьиmап gаmmа-З chains Ьу polyacrylamide gel electrophoresis in the pre-
sence of sadium dodecy! sulphate, Immunology, 23, 857 860 (1972).
29. Аналитический ,диск-электрофорез 233
26. Neuhoff V., Die Disk-Elektrophorese als analytische Mikromethode zur
Charakterisierung von Makromo!ekiilen, Mitteilungen, 40, 289 314
(1970).
27. Maurer Н. R., Dati F. А., Micro-polyacrylamide flat gel electrophoresis:
advantages and applications. Peeters Н., Protides of the Вio!ogica! Fluids,
Oxford/New York, 1972, S. 568 573.
28. Chrambach А., Rodbard D., Po!yacry!amide gel electrophoresis, Science.
172, 440 451 (1971).
29. Majer j" Coheп Е. Р., Separation Ьу polyacrylamide gel electrophoresis
of RNA from the spleens of immunized mice, Proc. Soc. ехр. Biol., 136,
942 945 (1971).
ЗА. Helluпg-Larseп Р., Frederikseп S., Correlation between separation of low
molecular weight RNA оп МАК columns and polyacry!amide gels, Апа-
Iyt. Biochem., 40, 227 239 (1971).
j'
(
J
30. Улътрацентрифуrирование
х. ВЕРНЕР
Центрифуrирование, особенно улырацентрифуrирование,
стало сейча'с одним из важнейших методов Iбиохимии и моле-
кудярной биолоrии. Этот эффективный и в то же время ща-
дящий метод позволяет без существенной потери биолоrиче
ской активности отделять клетки и частицы от растворимых
примесей, разделять клетки разных типов и различные внут-
риклеточные орrанеллы, выделять вирусы и макромолекулы
(белки, ДНК, РЕК). Наряду с этим аналитическое ультра
центрифуrирование используется для определения физических
характеристик (размеров, конформации, плотности, молеку
лярноrо веса) макромолекул, что способствует лучшему пони-
манию мноrих физИ'олоrических функций.
В области иммунолоrии улырацентрифуrирование служит
для решения специальных задач. С ero помощью выделяют
иммуноrлобулины, производят очистку различных антиrенов,
исследуют комплексы антитен антитело, получают мРНК
для синтеза антител in vitro, фра-кционируют мембранные
белки и делают MHoroe друrое. В одной только иммунолоrии
улырацентрифуrирование иопользуется столь широко и при
менение ero так быстро растет, что здесь не хватило бы места
даже для поверхностноrо обзора проведенных исследований.
Ниже мы рассмотрим лишь некоторые ,0с'НоВ'ные теоретиче-
ские и практические аспекты улырацентрифуrирования и про-
демонсrрируем возможности этоrо метода на двух примерах.
30.1.
30.1.1.
ПРИНЦИП
Математические предпосылки
Разделение при центрифуrировании основано на том, что
разные частицы 'по-разному ведут себя в центробеЖ:НО I ПО.1е.
Действующее на частицу центробеЖlное ускорение Ь на рас-
стоянии r от оси вращения определяется выражением
и\1
b=== ===(J)2r,
r
rде u круrовая скорость, (J) уrл,овая скорость. Из практи-
ческих соображений величину центробежноrо ускорения вы-
3 ,УАьтрацентрифуеuрование 235
ражают как кратное ускорение свободноrо падения g
(g==9,81 м/с 2 ), получая при этом относительное uентробеж
ное ускорение. Ero можно вычислить, если известен радиус
(r) JI число абаратов ротара в 1 мин (n):
Относительное центробежное ускорение ==
(fJ2r ( 2лr ) ' 2 r 1 12 10 Ii r N 2 (1)
, == g== ---б() '9":8 ,' ".
Получается безразмерная величина, которую абщепринята
выражать числом g.
На оседающую в центробежном пале частицу действует
равномерное центробежное ускорение, при эта м силы трения,
плавучести и центробежная сила уравновешиваются:
dr 2
lIt ==5. ro Т,
r де 5 каэффиuиент седиментации, r расстояние частицы
(поласы) от оси вращения и t время.
Таким образам, коэффиuиент седиментации эта ско-
рость оседания, атнесенная к единице центробе:жноrо паля:
dr 1
5== Т' (fJ2r ;
после интеrриравания получаем:
1 'r.
5== .1п.........!.....с
U)2 (t 1 t o ) ro'
(2)
rде 'о и rt полажение частицы (полосы) в МО:\1енты BpeMe
ни t o и t соатветствеIШ'а.
Величину, равную 10 13 5) называют единиuей Сведберrа
(или сведберrом S). Обычно коэффициент седиментации
(5) приводят К константе седиментации (S20 0 " w), COOTBeTCT
вующей s при uентрифуrировании в ваде при 20 ос. Величина
S20 D , w является специфической физико-химическай характе-
ристикой данных макромолекул или частиц. l(оэффициент
седиментации, определенный в друrих условиях, можно при-
вести к константе S20 0 , w С помощью атношения
( 1 i). Р20 0 W ) ( 'Il )
S20 0 W== .8 б .10- 13 c
, 1 u. Рт 'l'J200,W нал. ,
rде
Sнабл 'наблюдаемая величина коэффициента S)
YI вязкость среды,
1']200 ,W вязкость воды при 20 ос,
Ртт.:... плотность среды,
v парциальный удельный объем частицы.
(3)
2зб Х. Вернер
M
Аналитическое улырацентрифуrирование позволяет опре-
делить относительный молекулярный вес (М). Из уравнения
седиментационноrо равновесия (коrда с орости седиментации
и диффузии С'балансированы) следует, что
2RTln
С 1
р ) ,
ш2 ( 1 р; и ,r)
(4)
rде с! и С2 концентрации вещества на расстояниях '1 и '2
от оси вращения, РР плотно'сть ча'стиц, рт плотность сре-
ды, R rазовая IПОСТОЯiНная и Т абсолютная температура.
При исследовании однородных молекул уравнение (4) по-
зволяет вычислить их средний относитель'ный молекулярный
вес.
Молекулярный вес можно также определить, исходя из
зависимоrо от Hero Iкоэффициента седиментации:
М == R.T.S (5)
D ( 1 Рр: )'
rде S коэффициент ,седиментации и D коэффициент диф
фузии.
В этом случае, однако, приходи'fiСЯ при помощи специаль
ных измерений определять 'коэффициент диффузии D. ДЛЯ
выражения зависимости S от М эмпирически найден ряд
уравнений {1 3].
Седиментация в традиенте плотности описывается ypaBHe
нием CTo ca, в котором ускорение свободноrо падения (g)
заменено центробежным ускорением:
dr a2.(J)2.r[Pp Pm(c)] ( 6\
dt == 18ч (с) , 1
rде a диаметр частиц,
(() уrловаяскорость,
, расстояние ча'стицы от оси вращения,
'у\ (с) вяз ость среды,
Pp плотность частиц,
Рт (с) 'плотность среды.
Процесс разделения можно моделировать по предполаrае
мым па'раметрам частиц на вычислительной машине и полу-
чить приближенные решения приведенных выше уравнений.
Это позволяет рассчитывать оптимальные У'Словия предстоя-
щеrо улырацентрифуrирования [4]. Такой подход весьма эф-
фективен, особенно при улырацентрифуrировании крупных
частиц.
80. У Аьrрацен.трuфуеировaн.uе 237
30.1.2. Практическое проведение
ультрацентрифуrирования
На рис. 66 схематически показаны три основных метода
улырацентрифуrирования.
. При дифференциальном центрифуrировании разделяеМУI?
смесь помещают в rомоrенную среду с повсюду одинаковои
t o
t,
t oo
. 000 о
о .
'. о
. о'
. о о
. о .
о .., о
'0 .
о.
. о о
.0.
о о
о . с .
о . о
. о
о'
. .
.
о .
. .
о .
. о о
00. 00.
а . 0.0
00
.....
. o }o:
о о
Диf/Jf/JереНЦIШll1hное
Цент РlEf/J!/;Щ potlt:lHUe
t o t, t oo
: i
...I. "
'ta}o'.!:
008"
,
"о
o. fп)
30НО,//6ное
центрllf/J!/ шр оОанае
е, t oo
Рис. 66. Важнейшие методы седиментацион-
Horo разделения. Белые кружочки части-
цы с большим молекулярным весом и He
сколько меньшей плотностью; черные KPy
жочки частицы с меньшим молекулярным
весом и несколько большей плотностью.
If,JОЛllКНlIqеское
центрllf/Jg2l1роtlанuе
плотностью. Во время центрифуrирования происходит фрак
ционирование 'компонентов 'Смеси, оседающих 'с разной CKO
ростью. При достаточно 'больших 'различиях в скорости седи
ментации разные компоненты осаждаются последовательно,
но полноrо разделения их никоrда не происходит. Такой Me
тод применяют rланным образом как препаративный Д.1Я
концентрирования и предварительною фракционирования.
При зональном центрифуrировании разделяемую смесь
растворяют в среде е низкой плотностью и тонким слоем на-
носят на разделяющую среду, плотность которой возрастает
по 'Направлению к дну ячейки. Различные компоненты смеси
в зависимости от скорости седиментации Достиrают разных
238 Х. Вернер
уровней rрадиента в виде отдельных зон. Седиментацию пре-
кращают, как только будет достиrнуто Подходящее располо-
жение зон (полос).
При uзоnuкяuчеСКОJrt центрифуrировании используются yc
ловия зональноrо центрифуrирования, но :rрадиент плотности
среды ооответствует диапазону 'плотностей 'разделяемых ча-
стиц. Каждый из компонентов смеси, оседая, достиrает Toro
слоя rрадиента, в котором ero собственная IПЛОТНОСТЬ равна
плотности среды, т. е. происходит разделение частиц исклю-
чительно по их плотности.
ЗО.1.2.1.
Аналитическое Iцентрифуrирование
в аналитическом улырацентрифуrировании, помимо опи-
санных выше процедур, применяют также специальные ме-
тоды, например методы равновесия или приближения к рав-
новесию, флотации и дифференциальной флотации. Наблю
дени е за разделением 'Осуществляется при помощи оптических
систем УФ-абсорбционной, интерференционной или шлирен-
системы и реrистрируется обычно фотоrрафически. Прибо-
ры и принадлежности для аналитическarо центрифуrирования
имею'Т'ся в продаже. В прилаrаемых к ним инструкциях со-
держится rораздо больше сведений, чем можно было ,бы при-
вести здесь. Соответствующие методы описаны также в ряде
руководств [5 8].
30.1.2.2.
Препаративное ультрацентрифуrиpование
_30.1.2.2.1. ПРИБОРЫ
Метод улырацентрифуrирования к настоящему времени
достиr значительноrо развития. Оборудование, производимое
мноrими фирмами, имеет примерно сходную комплектацию
(ротор, находящийся в термостатируемой вакуумной камере,
электрический привод, электронные устройства для наблюде-
ния и управления). К основной машине обычно прилаrается
набор роторов, которые бывают трех основных типов: уrло
вой, зональный и откидной (с подвеоными стаканами)
(рис. 67). В yr ловом роторе ячейка расположена наклонно и
имеет поэтому более короткий седиментационный путь и
большее эффективное сечение, чем в роторе с подвесными
стаканами. Блаrодаря этому уrловой ротор особенно приrо-
ден для разделения значительных ра1бочих объемов при диф
ференциальном центрифуrировании. В то же время неизбеж-
ный в уrловом роторе «пристеночный эффект» не позволяет
30. У льтрацентрuфуzироваfШе 239'
исП'ользовать ero для зонально'rо центрифуrирования l . Только
при разделении в rрадиенте CsCl, образующемся во вре я
центрифуrирования, возможно применение уrловоrо ротора
[9]. Роторы с подвесными стаканами приrодны как для зо-
нальноrо, так и для изопикническоrо центрифуrирования. Их
разделяющая пособность достаточно велика, особенно при
использовании длинных пробирок,но емкость оrраниченна.
I
I
!/моОои ротор Ротор с JOHO.l1bН6IIJ ротор
поiJlJеСНblИU CmUIYUIfUMU
Рис. 67. Различные типы роторов для ультрацентрифуr. Серой полоскоЙ
показано положение одной из фракций во время центрифуrирования.
30нальныйротор представляет собой цилиндрический сосуд
с крышкой, разделенный неполными переrородками. Ero KOH
струкция, помимо большой емкости, обеспечивает почти иде
альные условия едиментации. Эти роторы больше друrих
подходят для зональноrо и изопикническоrо центрифуrирова-
ния. rрадиент и разделяемая смесь подаются во вращающей
ся с небольшой скоростью ротор через особую насадку (seal)
в центральной части с помощью насосов. После удаления на-
садки и rерметизации камеры начинается разделение при за-
данной скорости. В результате в полости ротора возникают
концентрические цилиндрические зоны, расположенные на
различном расстоянии от оси вращения. Опорожнение ротора
(отбор фракций) производится, так же как и заполнение, на
1 По мнению Воуэна [22], конвекционное движение осадка вдоль стен-
ки КО дну пробирки В уrловом роторе, наоборот, способствует зональному
разделению. В последнее время для зонаJlьноrо ультрацентрифуrирования
стали применять уrловые роторы, об.'lадающие, как оказалось, некоторыми
преимуществами перед роторами с подвесными стаканами. П рим. перев.
240 Х. Вернер
малых скоростях. Позднее был раз'рабатан способ заrрузки
и разrрузки неПодвижноrо зональноrоротора [10], при кото-
ром rрадиент переориентируется вовремя разrана и останов-
ки (reorienting density-gradient zonal centrifugation); это уп-
рощает методику и, вероятно, ра,сширит возможности Исполь-
зования зональ'ноrо ротора.
30.1.2.2.2. ПРОЦЕСС РАЗДЕЛЕНИЯ
При дифференциальном центрифуrировании решающее
значение имеет 'подбор конкретных условий, при которых бу-
дет происходить седиментация данноrо рода частиц. М'ожно
воспОльзоваться ориентировочными данными из прежних ра-
бот; в частности, для некоторых частиц, осаждающих'ся в раз-
бавленном буфере, известнопроизведение центробежноrо ус-
корения на время [11]: для 'клеточных ядер 6.103 g'мин,
для митохондрий 80. 103 g. мин, для микросом
3000.103 g. мин.
При расчете режима центрифуrирования макромолекул
можно исходить из константы седиментации (5200, w) и цент-
робе:ж:ноrо ус орения (g). Наrпример, скорость седиментации
195-белков при 105 g составляет около 19.10 lЗ.I05.9,8с.,м/с2,
или ;.:::1,9.10 6 м/с, т. е. ;.:::0,7 см/ч при 20°С и приблизитель-
но половину этой величины при 2 4 ОС. Отдельные фракции,
полученные в результате дифференциальноrо центрифуrиро-
вания, можно сравнительно леrко извлечь из пробирки, так
как надосадочная жидкость, как правило, без труда отде-
ляется от осаДка сифонированием или декантацией. При зо-
нальном и изопикническом центрифуrировании применяются
различные rрадиенты плотности. Их rотовят из веществ, ка-
торые должны обладать следующими свойствами: высокой
плотностью, хорошей растворимостью, биолоrической инерт-
настью, минимальными осмотическими эффектами и малой
вязкостью. Таких веществ довольно мало. Чаще Bcero исполь-
зуют сахарозу (d 1,0 1,3) фиколл (d 1,0 1,17), CsCl
(d 1,0 1,9) и CC1 4 /reKcaH (d 0,66 1,59).
Разра,ботано несколько 'способов приrатовления rрадиен-
та. Самый простой из них состоит в том, что rотовят несколь-
ко растворов возрастающей концентрации и осторожно на-
слаивают их друr на друrа, начиная с caMoro тяжелаrо. По-
лучается ступенчатый rрадиент, который через 1 2 дня пре-
вращается в rплавный. Для приrотовления ,rрадиентов задан-
ной крутизны в продаже имеется ряд устройств. rрадиенты
давольно просто 'получать при помощи двухкамерноrо смеси-
теля [12], схематически изображенноrо на рис. 68. Один со-
суд смесителя заполнен леrким, а друrой тяжелым компо-
30. У льтрацентрифуеuрование 241
нентом rрадиента. Если оба -сосуда сверху открыты, то при
paBHa 1 их -сечении образуется простейший линеЙный rрадиент
плотности, а при разном сечении rрадиенты либо воrнутой,
либо выпуклой фОРМЫ. Если >сосуд, в котором праисходит пе-
ремешивание, закрыт сверху, а втарой кампанент протекает
через первый, то образуется э споненциальный rрадиент.
В простом линейном rрадиенте по мере удаления ат оси Bpa
П 2 О,
. ..........
.......1.....
iti t Ч,
tiJ
!!s.
-) v о
Ij(VI=q2 (q2 q,) (f v;) 1
q {)2 >0,
q2
Ч,
{)2< а,
q,
11..
.т
c:io
щ
LJ
v
17,;;
Ч(У}" q2 (q2 q,)e
q
::Lv
Рис. 68. Приrотовление непрерывных rрадиентов плотности с помошью
двухкамерноrо смесителя [12].
щения возрастает ка'к -скарасть седиментации, так и вязкость
среды, усиливающая трение; однако трение абычна нарастает
быстрее центробежноrо ускорения, и поэтаму оседание ча,стиц
пастепенно замедляется [1]. Между тем для харошеrа раз-
деления и для определения коэффициентаседиментации нуж
на постаянная скарость частиц на всем седиментационнам
пути. Этоrо достиrают С помощью специальных экспаненци-
альных выпуклыхrрадиентав, каторые были эмпирически
разрабатаны для некоторых типов ратора и палучили назва-
ние изокинетических [1, 4, 13]. Распалаrая частицами с из-
вестнай константой седиментации, можно проверить, являет-
ся ли приrотавленный rрадиент изакинетическим. Если это
действительно так, то зависимость ,седиментационноrо пути
от произведения константы седиментации на время (5.1)
должна выразиться на rрафике прямай линией. С помащью
референс-препаратов с известной константой сеДИментации
производят также стандартизацию изокинетических I'радиен
тов.
На рис. 69 'представлена принципиальная схема устройства
для адновременноI"О приrотовления шести rрадиентав плат-
ности ,[14]. Из двухкамерноrо смесителя (с открытым или за
16 840
242 Х. Вернер
крытым сосудом для перемешивания) при помощи шестика-
наЛьноrо перистальтическоrо насоса rрадиенты перекаЧИва
ЮТ в центрифужные стаканы. На практике удобнее Bcero опу
1
4-
J
u
Рис. 69. Одновременное приrотовление rрадиента плотности в шести центри-
фужных стаканах. 1 камеры смесителя; 2 распределитель (шесть сталь-
ных инъекционных иrл, впаянных в один штуцер); 3 шестиканальный
перистальтический насос; 4 центрифужные стаканы.
5 6
3
7
lD.шш ао о о I
1
Рис. 70. Извлечение разделенных II rрадиенте плотности компонентов ме-
тодом вытеснения. 1 центрифУЖIlЫЙ стакан с rрадиентом; 2 насадка;
3 периста.1ьтический насос; 4 запас 60%-Horo раствора сахарозы; 5
детектор УФ-поrлощения; 6 самопнссц; 7 коллектор фракциЙ.
стить подающие трубки на сам'ое дно стаканов и подавать
rрадиенты, начиная с самой низкой плотности. Натяrивая
или, наоборот, отпуская шланrи перисталыическоrо насоса,
мож:но доБИП,СЯОДИН<lковоrо расхода по всем шести каналам.
30. ,у льтрацентрuфуеироваlШе 243
Расход rрадиента в зависимости от емкости стаканов COCTaB
ляет обычно 1 3 млjмин на стакан.
Пос.1е центрифуrирования нужно бывает извлечь разде-
ленные компоненты. Для этой цели либо прока.lывают цент-
рифужные пробирки иrлой, либо послойно отсасывают фр?к-
ции пипетКОЙ И.1И шприцем (способ весьма несовершенныи и
ВОЗМОЖНЫЙ только при непрозрачных или окрашенных фрак
о
10
50
БО
0,2 ft,5 S
0,1
...r:т
..........
./У..........
..........
.....
-.."
30
"
g
20
о
Верх
10
Нцз
Рис. 71. Фракционирование 100 MKr РНК из rOMoreHaTa печени в И30кине
тическом rрадиенте [сахароза 14 28%, ротор SB-283, у.1ьтрацентрифуrа
B-БО ОЕС, США), 8,5 ч, 40000 об/мин, 4 О].
циях), .1ибо вытесняют rрадиент более тяже.10Й И.'Ш более
леrкой средой. Последний способ схематически представлен
на рис. 70. В качестве тяжелой среды используют 60% ный
раствор сахарозы, КОТОРЫЙ через специальную насадку пода
ют на дно центрифужноrо стакана, вытесняя rрадиент снизу
вверх, начиная с caMoro леrкоrо слоя [15]. Содержимое ста-
кана попадает в к,оллектор фракций, ,проходя через детектор
УФ-поrлощения (например, Увикорд, фирма L. К. В, Швеция),
и на ленте самописца можно определить положение полос,
объемы фракций, эффект разделения, а при ИСПО.1ьзовании
калиброванноrо изокинетическоrо rрадиента даже KOHCTaH
ту седиментации. На рис. 71 показаны результаты фракциони
рования РНК: из rOMoreHaTa печени :\IЫШII в IIзокпнетическом
r.радиенте.
16*
244 Х. Вернер
30.2. ПРИМЕРЫ Р А3ДЕЛЕНИЯ
30.2.1. Выделение лимфоцитарных мембран
Наряду с классическими методами выделения субклеточ-
ных частиц [11] имеется ряд сравнительно новых методов,
которые позволяют получать митохондрии, лизосомы, элемен
ты эндоплазматическоrо ретикулума и фракции мембран (об-
rОМОёенот
I 1 700 g, (ОМОН 1
Осаоок НtziJосаiJОЧНtzJl жuокост6
(к.петОЧН6f<' I
лiJра) 7000g,20MUH
I I
OCtziJOK HaiJoCtziJolflltzJl жuiJкост6
(неОlfuщенНБI<' 137000.
митохонории) . 1q
OCtzOO/f HaiJocaiJolfHaJl жuокость
(AlшrРОСОМ61) ; 250000;.2Q
I
OctziJorr НtziJосщ}очнtz.н
(неО'fuщеНН6fе жuокост6
РUООСОAlИ) (цuтОЗQ.н6J
Pe%cпeHaи ' Per:ycпeHiJlI
ро tzHlIe polJtzHUe
750(}Оg,22ч 75000;,22q
,JleeKue Jlеёкuе
15/0 Iлм 1510 пА1
?4% ,JlизОСО.lf61 24% Т.яже/161е
ЛМ
ЗЗ% Очuщен 33"/0 l:rraoirllli
fr1% Н61е иu fr1% ЭР
тихонаро. W!lepoxo
Оат61Д"
5510 5510 ЭР
Per:!/CпeHiJlI
роlJоние
7500(};.22Q
1570
24%
33%
41 "/о
I I
I
ОтаМ6нме 'Рокцuu, рtzJоtzlJ.неНН6fе (: 2
1250000;1 З(}Alин
Рес!/спенииро80ние OctzUKO
Рис. 72. Фракционирование субклеточных компонентов человеческих .'1им-
фоцитов [16]. П м плазматические мембраны; ЭР эндоплазматический
ретикулум. Проценты означают концентрацию (вес/объем) сахарозы в бу-
фере. Приведенные веЛичины g средние.
55% . ОflllщеНН6fе
рооосомн
зор см. [8]). Ниже вкратце изложен метод фракционирова
ния ,субклеточных компонентов человеческих лимфоцитов,
разработанный Демусом [16] для последующеrо изучения
белковых компонентов плазматической мембраны.
80. льтрацеnтрuфуеирО8ание 245
Исходным материалом служат миндалины человека. Их
очищают, измельчают и >пропускают сквозь сеточку (ширина
ячейки 50 мкм). Полученную кашицу разбавляют 1: 20
(вес/объем) буфер'ом (10 мМ трис-НСl, рН 7,4; 0,15 М NaCl)
и еще больше измельчают в rомоrенизаторе (Поттера). Всю
обработку проводят при 4 ОС. Схема фракционирования [омо-
[ената представлена на рис. 72.
После предварительноrо фракционирования каждую из
неочищенных фракций (митохондрии, микросомы, 'рибосомы)
осторожно ресуспендируют с помощью rомоrенизатора в
10 мл 55% -Horo (вес/объем) раствора сахарозы в буфере
(10 мМ трис НСl,рН 7,4) и вводят в качестве нюкнеrо слоя
в ступенчатый сахарозный rрадиент. Сверху наслаивают 10 мл
41 %-Horo, 15 мл 33%-Horo, 15 мл 24%-Horo и 10 мл 15%-Horo
раствора сахарозы в том же буфере. Пользуются стаканами
на 60 мл в роторе SW ,25,2 на ультрацентрифуrе Beckmann
L2-65B. Разделенные фракции собирают на rраницах фаз при
помощи шприца с иrлой, конец которой заrнут под прямым
уrлом, раз'бавляют 1: 2 указанным выше буферО l и вновь
седиментируют в роторе 60 Тi. Ресус'Пендированные препара-
ты [о'Т'овы для дальнейшеrо исследования.
30.2.2. Выделение мРНК для синтеза L-цепей
иммуноrлобулинов in vitro
Выделение мРНК из полисом было описано еще в 1968 [.
{1]. В 1971 72 п. были опубликованы результаты опытов с
мРНК, кодирующими синтез rлобина [17, 18] и L-цепей им
муноrлобулинов [19 21] in vitro. Ниже дается краткое опи
сание метода [ 19].
Исходным материалом служит свежая или замороженная
'I1KaHb мышиной опухоли (плазмацитомы МОРС 41А). Опу-
холь тщательно освобождают от некротизированных участ-
ков и 5 r ткани измельчают с помощью rомоrенизатора (теф
лон стекло) в буфере (4 мМ трис-НСl, рН 7,4; 15 мМ
MgC1 2 ; 0,25 М сахароза) при 4 0 с. Затем ,rOMoreHaT освобож
дают от ядер и клеточных фраrментов, центрифуrируя 10 мин
при 3000 g. После этоrо из надосадочной жидкости центри
фуrированием при 105000 g (20 мин) выделяют микросомы.
Осадок микросом суспендируют в 11 мл трис-буфера (5 мМ
трис-НСl, рН 7,4), содержащеrо 1 % додецилсульфата нат-
рия, и оставляют на 15 мин при 37 ОС. В полученном «неочи
щенном экстракте» содержится мРНК Ero наслаивают на
треXiступенчатый сахарозный rрадиент, приrотовленный на
10 мМ трис-НCl lбуфере с рН 7,4, содержащем 0,1 М NaCl,
10 мМ ЭДТА и 0,5% додецилсульфата натрия. Разде.1ение
246 Х. Вернер
производят В роторе SW 25,2 на ультрацентрифуrе Бекмана
(22000 об/мин, 20 ч при 24 ОС). Результаты фракционирова-
ния представлены на рис. 73.
Биолоrически активная РНК находится в фракциях с кон-
стантой седимента'Ции 9 13S. После 'разделения эти фракции
4,0
&....i
2,0
О
о
Наз
20
30
40 м'"
Верх
Рис. 73. Фракционирование РНК из микросам в rрадиенте плотности [19J.
Отмеченная фракция содержит мРНК (сахароза 1s..-.-.зо%, ротор sw 25,2,
УJlътрацентрифуrа фирмы Beckman (США), 20 ч, 22000 об/мин, 24 ОС).
суспендируют в двух- или трехкратном объеме этанола и вы-
держивают 1 2 дня при 20 Ос. После этоrо выпавшие в
осадок фракции РНК MHoroKpaTHO отмывают этанолом
(трижды 80% -HыM и трижды 90% -ным) путем центрифуrиро-
вания, лиофилизируют и растворяют в дистиллированной во-
де. Для удаления остатков додецилсульфата натрия м'Ожно,
кроме Toro, еще дважды переосадить РНК из 0,1 М NaCI.
При электрофорезе в 3,5% HOM rеле полиакриламида в полу-
ченном препаратебыла обнаружена очень небольшая примесь
4S , 18S- и 30S-PHK к основной массе РНК, которая дает
5 полос между 5 и 18S. В бесклеточной системе из кроличьих
ретикулоцитов этот препарат индуцирует синтез тех же самых
леrких цепей (каппа цепей К41) иммуноrлобулинов, которые,
как было показано, синтезируются самой опухолью in vivo.
30. ,у льrрацен.трифуеирован.ие 247
30.3.
ЛИТЕРАТУРА
1. Noll Н., Stutz Е., in: Methods in Enzymology, Colowick S. Р., Кар-
lan N. О. (ed.), Уоl. ХН, р. 129, Academic Press, New York/London,
1968. .
2. Triiger L., Einfiihrung in die Molekularbiologie, УЕВ Gustav Flscher Ver-
1ag, Jena, 1969.. .
3. Eigner J., in: Methods 1п Enzymology, COIOWICk S. Р., Kaplan N. О.
(ed.), Vol. ХН, р. 386, Academic Press New York/London, 1968. .
4. Pretlow Т. а., Вооnе С. W., Shrager R. 1., Weiss а. н., Rate zonal сепtп-
iugation in а Нсоll gradient, Analyt. Biochem., 29 (1969), 230.
5. Elias Н. а., Ultrazentrifugen-Methoden, Beckman Instruments GmbH
МипсЬеп, 45, Frankfurtel' Ring, 155, 1961.
6. Schachman Н. К, in: Methods in Enzymology, Colowick S. Р., Кар-
1ап N. О. (ed.), УО]. IV, р. 32, Academic Press, New York/London,
1965.
7. Williams J. W. (ed.), Ultracentrifugal. Analysis in Theory and Experiment,
Academic Press, N ew У ork, 1963.
8. Trautman R., Cowan К М., in: Methods in Immuno10gy and Immunoche-
mistry, Williams С. А., Chase М. W. (ed.). Vol. 11, р. 81, Academic Press,
New York, 1968.
9. Castaneda М., S;Jnchez R., Santiago R., Disadvantages of sucrose-density
gradient centrifugation in fixed-angle rotors, Апа 1. Biochem., 44 (1971),
381.
10. Sheeler Р., Gross D. М., Wells J. R., Zonal centrifugation in reorienting
density gradients, ВiocЫт. Biophys. Acta, 237 (1971), 28.
11. Rehfeld N., Reichelt D., Analytische und pri:iparative Methoden der kli-
nischen Biochemie, Akademie-Verlag, Berlin, 1972.
12. Eichenberger W., Trennung biologischer Partikel durch Zentrifugation im
Dichtegradienten, Chimia, 23 (1969), 85.
13. Martin R. а., Ames В. N., А method for determining the sedimentation
behavior of enzymes: Application to protein mixtures, J. Biol. СЬет., 236
(1961), 1372.
14, Freifelder D., Folkmanis А., Apparatus for preparation of linear density
gradients, Anal. Biochem., 39 (1971), 530.
15. Morton В. Е., Hirsch С. А., А high-resolution system for gradient апаlу-
sis, Апаl. Biochem., 34 (1970), 533.
16. Demus Н., Subcellular fractionation of Ьитап lymphocytes, Biochim. Bio-
phys. Acta, 291 (1973), 93.
17. Williamson R., Morrison М. R., ТЬе isolation and DNA/RNA hybridizati-
оп of Messenger RNA for globin, Ser. Haematol., 3 (1971), 23.
18. Williamson R., Morrison М., Lanyon а., Eason R., Раи! J., Properties of
mouse globin messenger ribonucleic acid and its preparation in mil1igram
quantities, Biochemistry, 10 (1971),3014.
19. tavneze J.: Ru СЫп. С. f(uang, Synthesis of а mouse immunoglobulin
11ght сhаlП 1П а rabbIt retlculocyte cell.free system, Nature, Ne\v Biol.,
230 (1971), 172.
20. Rq.lph Р., Rich А., Immunoglobulin synthesis in а cell-free system, Bioche-
mlstry, 10 (1971), 4717.
21. Brownlee а. а., Harrison Т. М., Mathews М. В., Milstein С., Translation
of messenger RNA for immunoglobulin light chains in а cell-free system
from krebs II ascites cells, Febs Letters, 23 (1972), 244.
22. Bowen Т. J. Ап introduction to ultracentrifugation. Wiley-Interscience,
London 1971. (Боуэн Т. Введение в ультрацентрифуrирование, М.:
«Мир», 1973.)
31. П риrотовление антиrенов
И. rЮНТЕР
Значительная часть исследований в иммунолоrии посвя
щена тому или иному антиrену. С препаративноrо выделения
антиrена, собственно, и начинается решение мноrих вопросов.
Для выделения антиrенов существует ряд биохимических
методов, которые описаны в обширной литературе и потому
не излаrаются здесь. Общие сведения о них можно найти в
обзорах [8, 17, 23]. Подробные инструкции относительно ра-
боты с сефадексами для rеЛЬ-фИЛЬ11рации и ионообменной
хроматоrрафии содержатся в брошюрах фирмы Pharmacia
Fine Chemicals (Упсала, Швеция) [15, 16]. Методы rель-хро-
матоrрафии детально описаны в моноrрафии Детермана [3].
Ниже мы приводим методики выделения некоторых ТlКaHe-
специфических антиrенов. В настоящее время известно так
MHoro антиrенов подобноrо рода, что приведенные описания
можно рассматривать лишь как иллюстрацию препаlратив-
ных возможностей Toro или иноrо метода. Чтобы избежать
денатурации или пророста, все этапы выделения антиrенов
(если специально не требуется наrревания) следует прово-
дить при 0 4 ОС.
31.1. ВЫДЕЛЕНИЕ АЛЬБУМИНА
ИЗ БЫЧЬЕй И КРЫСИНОй СЫВОРОТОК [6]
В сыворотку засыпают порошок полиэтиленrликоля (мол.
вес 5700 6700) из расчета 25 r на 100 мл, перемешивают
в течение 24 ч, а затем центрифуrируют 20 мин при 20000 g.
Надосадочную жидкость отделяют от осадка, разбавляют
(равным объемом 2 М NaCl с 0,1 М трис-буфером (рН 8,0) и
освобождают от полиэтиленrликоля на колонке сефадекса
G 75 (1,5Х25 см), уравновешенноrо тем же буфером. Метод
позволяет выделить примерно 40% альбумина, чистоrо по
данным диск-электрофореза.
31.2.
31.2.1.
ВЫДЕЛЕНИЕ АнтиrЕНОВ ХРУСТАЛИКА
a :Кристаллин
из бычьеrо хрусталика [12]
Берут 160 r ткани из корковой части хрусталиков и в те-
чение 60 мин экстраfИРУЮТ 500 миллилитрами воды при по-
стоянном перемешивании. Нерастворимые компоненты (аль-
3 J. П рuеОТО8лен.uе ан.тиеен.О8 249
БУМllНОИД) удаляют, центрифуrируя 15 мин при 10000 g.
С помощью 1 н. раствора НСl доводят рН надосадочной
жидкости до 5,0 и прибавляют этиловый спирт до конечной
объемной концентрации 13%. Выпавший осадок отделяют
центрифуrированием, растворяют в 150 мл 0,04 М N аНСО з
и диализуют в течение 16 ч против воды. Осаждение при
рН 5,0 в 13%-ном спирте повторяют дважды. К 325 мл дп-
ализованноrо раствора при комнатной температуре и рН 6,8
прибавляют 65 r сульфата аммония. Выпавший осадок от-
брасывают, а к надосадочной жидкости добавляют еще 18,5 r
сульфата аммония. Образовавшийся после этоrо осадок pac
творяют в воде, диализуют против воды и лиофилизируют.
Выход составляет 8 r а кристаллина.
31.2.2. а-, - и у-кристаллины
из хрусталиков разных видов
животных [9]
Кристаллин различных животных (телят, кроликов, кур,
roрских свинок, крыс) можно выделить с помощью xpOMaTO
rрафии на ДЭАЭ-целлюлозе. Хрусталики растирают в забу-
ференном фосфатами 0,9%-ном растворе NaCl (рН 9,0) в
ступке и rомоrенизируют в rомоrенизаторе Поттера. После
центрифуrирования (500 g, 60 мин) надосадочную жидкость
в течение 48 ч подверrают диализу против 0,01 М фосфат-
Horo буфера с рН 9,0. Из диализованноrо раствора центри-
фуrированием удаляют осадок, а надосадочную жидкость
хранят в замороженном состоянии. Для фракционирования
иопользуют ДЭАЭ-целлюлозу (DE 50, Whatman, Великобри
тания): 3 r ДЭАЭ-целлюлозы суспендируют в 70 мл 0,01 М
фосфатноrо буфера с рН 7,0 и помещают в колонку 1,5Х
Х 40 см. По 4 мл экстракта из хрусталиков наносят на KO
.10НКИ со скоростью 1 мл/мин, затем проводят ступенчатую
элюцию фосфатными буферными растворами. Вначале 0,01 М
буфером с рН 7,0 (80 мл) выводится v кристаллин, затем
после элюции 0,025 М буфером с рН 7,0 (80 мл) В 0,1 М
буфере с рН 6,0 (80 мл) выводится В-Iкристаллин; последним
в 100 мл 0,3 М фосфатноrо буфера с рН 5,0 ЭЛЮИlруется
а.-кристаллин.
31.3. КОЛЛАrЕН из кожи ТЕЛЕН А [22]
Для удаления волос свежеснятую кожу теленка обрабаты-
вают HecKO"lbKO минут rустой пастой из сульфида бария, оки-
си цинка и талька (1: 2 : 2), а затем тщательно обмывают
проточной водой.
25() п. Fюн.тер
31.3.1.
l\оллаrен,
эnстраrируемый растворами нейтральных солей
Кожу измельчают в мясорубке, заливают 0,45 М раство-
ром N аСl (1: 2) и экстраrируют 24 ч. После центрифуrиро-
вания надосадочную жидкость фильтруют через складчатый
фильтр, чтобы удалить жир, а осадок еще дважды экстраrи
руют равным объемом 0,45 1\'1. NaCl. Объединенную надоса-
дачную ЖИд'кость диализуют против проточной водопровод-
ноЙ воды. Образующийся при диализе осадок собирают с
помощью центрифуrирования (15000 об/мин, 20 мин) и рас-
творяют в 0,665 М цитратном буфере с рН 3,7. Нераствори-
мую часть осаДКа удаляют центрифуrированием. Надосадоч
ную жидкость вновь диализуют против проточной водопро-
водной воды до тех пор, пока не выпадет коллаrен. Ero снова
растворяют в цитратном буфере, а нерастворившуюся часть
удаляют путем центрифуrирования. Осаждение диализом по-
вторяют еще три раза. Осадок после 4-ro диализа растворя
ют в цитратном буфере и хранят в замороженном состоянии.
31.3.2.
Ноллаrен,
эnстраrируемый цитратным буфером
rOMoreHaT кожи после экстракции 0,45 М NaCl экстраrи-
руют 0,665 М цитратным буфером с рН 3,7 в соотношении
1 : 2. Экстракцию проводят трижды по 24 ч. Надосадочные
жидкости объединяют и диализуют против проточной водо-
проводной воды, в дальнейшем поступая так, как указано в
31.3.1. Оба препарата коллаrена ведут себя при ультрацент
рифуrировании как rOMoreHHbIe.
31.4. АнтиrЕН из НАДПОЧЕЧНИКА [10]
Ткань надпочечников rомоrенизируют в пятикратном объ-
еме 0,9 % Horo раствора N aCl. rOMoreHaT центрифуrируют
5 мин при 15000 об/мин. Надосадочную жидкость в течение
1 ч наrревают, перемешивая, на кипящей водяноЙ бане. жиk
кую часть декантируют и осветляют, центрифуrируя 15 мин
при 15000 об/мин. К прозрачной коричневой надосадочной
жидкости прибавляют трехкратный объем 95% Horo спирта
(конечная концентрация 71 %) и оставляют на ночь при KOM
fIатной температуре для осаждения тканеспецифическоrо бел-
Ка. Осадок отделяют центрифуrированием, высушивают в ва-
кууме и хранят при 4 0 с. Для использования 3HTIIrE'H рзС'тво-
81. ПриеОТО8J1.ен.uе ан.тuzеflО8 251
ряют В 0,9% NaCl. Примерно так же можно выделить ткане-
специфический антиrен из надпочечников любоrо вида живот-
ных (лошади, быка, свиньи) и человека [10, 11].
31.5.
ПОЧЕЧНЫЕ АнтиrЕНЫ
Почечные антиrены крысы,
получаемые путем трипсинизации [21]
Корковое вещество перфузированной почки (12 r) rOMO-
rенизируют в 0,9 % HOM растворе N аСl и центрифуrируют
2 мин при 800 об/мин. Верхние 4./5 надосадочной жидкости
осторожно удаляют, а осадок ресуспендируют в 0,9% N aCl,
снова центрифуrируют 1 мин и снова удаляют 4./5 надосадоч-
ной жидкости. Такую отмывку повторяют 5 6 раз до полу-
чения прозрачноrо надосадка. Осадок суспендируют в 0,9 %
NaCl и при помощи 0,1 М бората натрия доводят рН paCTBO
ра до 8,0. Добавляют 60 Mr Кiристаллическоrо трипсина и ин
кубируют, перемешивая, при 37 0 с. Каждые 30 мин необхо
димо подводить рН к 8,0 (до тех пор, пока он не стабилизи
руется), прибавляя 0,1 М борат натрия. Трипсин инактиви
руют, проrревая суспензию 30 мин при 60 ос. Затем ее цeHT
рифуrируют при 27 000 об/мин в течение 35 мин, надосадоч
ную жидкость диализуют и лиофилизируют. Далее препарат
фракционируют с помощью электрофореза в крахмальном
блоке в 0,05 М боратном буфере при 4 ос. В блок 1,5Х7,ОХ
Х 40,0 см вносят 20 30 Mr белка. При напряжении 300 В
разделение продолжается 10 ч. За это время бромфеноло
вый синий, добавленный в качестве индикатора, миrрирует
на 12 16 см от старта к аноду, а почечный антиrен на 2
6 см к катоду. Выделенный таким образом почечный антиrен
представляет собой rликопротеид. Кроличьи антитела К нему
нефротоксичны при введении крысе [20].
31.5.1.
3[5.2. I'лавный антиrенный комплекс из почек крысы [4]
Перфузированные поч,ки крыс rомоrенизируют в 0,9 % HO f
растворе NaCl. rOMoreHaT центрифуrируют 1 ч при 105 000 g.
Затем 20 мл надосадочной жидкости, содержащей 600 Mr бел
ка, диализуют против 0,05 М фосфатноrо буфера с рН 6,5 и
наносят на колонку ДЭАЭ-целлюлозы (4,5 Х 40 см), уравнове-
шенной тем же буфером. Проводят rрадиентное элюирование
со скоростью протекания 4 мл/мин (резервуар заполняют
500 мл 0,5 М NaCl с рН 7,4; смеситель 1000 мл 0,05 М фас-
фатноrо буфера с рН 6,5). При отборе 5-миллилитровых фрак
252 И. Брак
ций собирают второй пик, диали уют 20 ч против фосфатноrо
буфера при 4 ос и лиофилизируют; затем растворяют в 0,01 М
фосфатном буфере с рН 7,0 и обессоливают с помощью сефа-
декса G-25. Полученный препарат при rель-фильтрации на
сефадексе G-I00 (колонка 1 Х 50 см, наносят 3 Mr белка, элю-
ируют 0,1 1\'1 фосфатным буфером с рН 7,0) разделяется на
2 компонента с мол. весами 4100 и 16600, дающие при двой-
ной диффузии по Ухтерлони реакцию иммунолоrической
Идентичности.
31.6. АнтиrЕНЫ ЩИТОВИДНОй ЖЕЛЕЗЫ
31.6.1. 19S-тиреоrлобулин [13]
Щитовидные железы от трупов следует брать как можно
раньше после наступления ,смерти. Ткань нарезают на мик
ротом е И в течение ночи экстраrируют 0,9 % HЫM раствором
N аС! из расчета 3 мл/r. Фраrменты клеток удаляют центри
фуrированием при 78000 g в течение 30 мин. Надосадочную
жидкость наносят на колонку сефадекса G-200 (2,5Х36 см)
и элюируют 0,9% -ным раствором N aCl. 19S тиреоrлобулин
содержится среди высокомолекулярных компонентов первorо
пика. Рехроматоrрафия нисходящей части первоrо пика на
такоЙ же колонке дает препарат 19S-тиреоrлобулина, rOMo
rенный при электрофорезе в крахмальном rеле.
МИКрОСО1\IaЛЬНЫЙ антиrен
щитовидной железы
Микросомальный антиrен, с помощью KOToporo выявляют
аутоантитела при тиреоидите Хасимото, можно выделИТЬ из
ткани тиреотаксической щитовидной железы. Свежеполучен-
ную ткань измельчают и rомоrенизируют в 4-кратном объеме
10%-Horo раствора сахарозы, используя rомоrенизатор Пот
тера (со свободным поршнем). rOMoreHaT фильтруют через
марлю и разделяют дифференциальным центрифуrировани-
ем. При 8000 g (20 мин) осаждают и удаляют клеточные яд-
ра и митохондрии. Фракция микросом оседает при 100000 g
(1 ч).
31.6.2.
31.7. ОПУХОЛЕВЫЕ АнтиrЕНЫ
31.7.1. Rарциноэмбриональный антиrен [2]
Карциноэмбриональный антиrен обнаруживается в CЫBO
ротке больных при некоторых опухолях пищеварительноrо
тракта [7]. Ero можно выделить из опухолевой ткани. Aдe
31. П рueОТ08лен.uе ан.тиаен.О8 253
нокарциному из какоrо-либо отдела желудочно-кишечноrо
тракта измельчают и rомоrенизируют с водой (3 мл воды на
1 r ткани). К rOMoreHaTY по каплям прибавляют равный объ-
ем 2 М хлорной кислоты и оставляют стоять 20 мин, непре
рывно перемешивая. Осадок отделяют центрифуrированием
(12000 g, 20 мин). Надосадочную жидкость 12 ч диализуют
потив проточной водопроводной воды и 3 дня против дистил-
лированной воды. Выпавший осадок вновь отделяют центри
фуrированием. Для удаления пиrментов раствор можно под-
BeprHYTb улырафильтрации на мембране РМ-10 (Amicon,
США), задерживающей вещества с мол. весом 10000. Полу-
ченный продукт лиофилизируют и вновь растворяют до
концентрации 40 80 мr/мл в забуференном раство,ре N аС1
(0,9 % N aCl в 0,05 М N а-фосфатном буфере с рН 5,5 с
добавлением 0,1% азида натрия) и фракционируют на колон
кесефарозы 4В (2,5Х 170 см) в том же растворе. Карцино-
эмбриональный антиrен выходит отдельным пиком в объеме
элюирования между 60 и 90% (для некоторых опухолей 60
105%) объема колонки. Эти фракции лиофилизируют, вновь
растворяют в забуференном растворе NaCl (30 95 мr/мл) и
фракционируют на колонке сефадекса G-200 (2,5х 110 см).
Антиrен появляется в элюате после выхода 35 45 % объема
колонки. Некоторые опухоли содержат карциноэмбриональ
ный антиrен, который элюируется двухвершинным пиком
между 30 и 50 % объема колонки (максимумы: 34 и 41 %).
Эти фракции имеют константу седиментации 6,8 и 10,15.
31.7.2. а-Фетопротеин [14]
Эмбриональная сыворотка была получена путем пункции
сердца у 10 плодов на 5-M 7-M месяце Бнутриутробноrо раз-
вития. Для приrотовления антисыворотки к а-фетопротеину
(АФП) эмбриональную сыворотку трижды с недельными ин-
тервалами вводили под кожу кроликам по 0,1 мл, смешав с
ра,вным объемом полноrо адъюванта Фрейнда. Антисыворот
ку получали через 2 недели после последней иммунизации.
Для истощения к 1 мл антисыворотки прибавляли 3 мл CMe
и сывороток взрослых доноров и удаляли образовавшийся
преципитат центрифуrированием. Истощенную антисыворот
КУ в оптимальном соотношении (кривая Хейдельберrа, см.
4.2.2) смешивали с эмбриональной сывороткой или CЫBOpOT
кой ОТ больноrо С первичным раком печени. После инкуба-
ции (60 мин, 37 ОС) реакционную смесь центрифуrировали
15 мин при 3000 об/мин для отделения преципитата, который
трижды отмывали 0,15 М раствором NaCl. Отмытый преци
лита т растворяли в 0,1 М rлицин-НСl-буфере с рН 1,8. Рас-
254 Н. Fюнтер
твор осветляли, центрифуrируя 15 мин при 10000 об/мин, и
с помощью 0,4 ]\11 N а 2 НР0 4 устанавливали рН 7,0, при кото-
ром вновь происходила преципитация ,комплексов антиrен
антитело. Растворение и преципитацию этих комплексов по-
вторяли дважды.
Затем, растворив 150 Mr иммунных комплексов в 5 мл
0,1 М rлицин-НС1-буфере с рН 1,8, наносили раствор на KO
лонку сефадекса G-150 (2,6Х95 см) и при скорости элюиро-
вания 20 мл/ч собирали фракции по 5 мл. АПФ выходил в
третьем пике при объеме элюирования примерно 260 мл.
Каждую фракцию нейтрализовали 0,4 М раствором Na 2 HP04.
Фракции, содержавшие АФП, объединяли и концентрировали
улырафилырацией до объема 3 мл. Концентрат рехромато-
rрафировали на такой же колонке сефадекса G 150 в забу
ференном фосфатами 0,15 М растворе NaCl с рН 7,0. Полу-
ченный препарат был rOMoreHeH в диск- и иммуноэлектрофо-
резе.
Количество получаемой антисыворотки к АФП можно
значительно увеличить, иммунизируя животных друrоrо ви-
да. Например, комплексы кроличьих антител с АФП можно
трижды с интервалами 10 дней ввести под кожу лошади. Для
каждой инъекции берут преципитат, содержащий 0,5 Mr
АФП, в полном адъюванте Фрейнда. Через 2 недели берут
кровь из сонной вены.
Руослахти и Сеппеле [19] разработали радиоиммуномет
рический метод выявления АФП в сыворотке.
31.8.
АнтиrЕНЫ
ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
31.8.1.
Энцефалитоrенный белок [1]
Мозr трупа необходимо взять как можно скорее после
смерти. Удалив твердую мозrовую оболочку, ero обмывают
холодным 0,9 % -ным paCTBQPOM N aCl и rомоrенизируют. [омо-
reHaT вновь отмывают 0,9%-ным раствором NaCl, цеJ-IТРИфУ
rируют и осадок подверrают лиофилизации. Сухой порошок
дважды экстраrируют 10-кратным объемом смеси хлорофор-
ма с метанолом (2: 1 по объему). Нерастворившийся осадок
отмывают водой, рН которой доведен до 5 с помощью HCl,
и далее экстраrируют в течение 2 4 ч 10-кратным объемом
5 % N aCl. Этот экстракт, так же как и первый, отбрасывают.
Осадок повторно в течение 2 4 ч экстраrируют в общей
сложности 10-кратным объемом 0,01 н. раствора HCl при
15 ОС, перемешивая жидкость. Порции экстракта, рН которых
превышает 2,5, отбрасывают, а к экстракту, имеющему рН
31. ПРU20ТО8лен.uе ан.тшен.08 255
ниже 2,5, при 4 ос прибавляют равный объем холодноrо на-
сыщенноrо раствора сульфата аммония для осаждения энце
фалитоrенноrо белка. После центрифуrирования осадок
растворяют в воде и диализуют против 0,002 н. раствора HCl
до исчезновения следов сульфата. Диализованный раствор
лиофилизируют. Далее полученный материал фракционируют
на колонке сефадекса G-IOO в 0,1 М Nа ацетатном буфере с
рН 5,0. Энцефалитоrенный белок элюируется в средней части
rлавноrо пика. Если 10 MKr этоrо препарата ввести в полном
адъюванте Фрейнда морской свинке, у нее разовьется экспе-
риментальный аллерrический энцефаломиелит. Этот антиrен
используется также при диаrностике рака по Фильду и Kac
пари [5].
31.8.2. Антиэнцефалитоrенный белок
из СПИНlIоrо мозrа быка [24]
Введение морской свинке ткани бычьеrо спинноrо мозrа
в полном адъюванте Фрейнда вызывает экспериментальный
аллерrический энцефаломиелит. Однако из Toro же материа-
ла можно выделить белок, который при введении внеполном
адъюванте Фрейнда предотвращает развитие энцефа.rIомиели-
та. Свежевыделенный спинной мозr освобождают от оболо-
чек, rомоrенизируют в 10-кратном объеме 0,1 М N aCl и цeHT
рифуrируют 40 мин при 40000 g. Надосадочную жидкость
концентрируют ультрафильтрацией до 20 Mr белка в 1 мд И
переводят в 0,05 М трис-НCl-буфер с рН 7,0 на колонке
сефадекса G-25 или с помощью диализа. В полученный pac
твор на каждый rpaMM белка прибавляют по 10 r ДЭАЭ-се-
фадекса А-50, уравновешенноrо тем же буфером, и переме-
шивают.
Через 2 ч ионообменник удаляют центрифуrированием, а
надосадочную жидкость концентрируют до 25 Mr белка в
1 мл, затем переводят в 0,05 М N а-ацетатный буфер с рН 5,5
на колонке сефадекса G-25 или при помощи диализа. После
этоrо экстракт фракционируют на колонке КМ-целлюлозы
(1,7Х70 см), элюируя тем же буфером со ступенчатым rpa-
диентом концентрации N aCl. Вначале в 180 мл буфера вто-
рым пиком выходит диализабельная форма этоrо белка. По-
сле отмывания колонки 150 миллилитрами буфера с 0,1 М
NaCl концентрацию NaCl увеличивают до 0,2 М и элюируют
вторую И третью формы антиэнцефалитоrенноrо белка. Сна-
чала в элюа-:,е появляется форма с l-ПОДВИЖНОСТЬЮ, а затем
в нисходящеи части пика ВЫХОДит форма с v-подвижностью.
Из этих трех форм с мол. весами "" 6000, 12000 и 18 000
антиэнцефалитоrенный эффект до сих пор изучен только у
256 И. Fюнтер
второй формы, имеющей l-ПОДВИЖНОСТЬ. В иммунодиФФузии
по Ухтерлони все три формы оказываются иммунолоrически
идентичными.
31.9. ЛИТЕРАТУРА
1. Caspary Е. А., Field Е. J., Ап encephalitogenic protein of human origin:
some chemical and biological properties, Апп. N. У. Acad. Sci., 122
(1965), 182 189.
2. Coligan J. Е., Lautschleger J. Т., Egan М. L., Todd С. w., Isolation and
characterization of carcinoembryonic antigen, Immunochemistry, 9
(1972), 377 386.
3. Determann Н., Gelchromatographie-Ge1filtration, Gelpermeation, Mole
kiilsiebe, Springer, BerJin Heidelberg New York, 1967. (Детерман r.,
rельхроматоrрафия, М.: «Мир», 1970.)
4. Dinh B. L., Isolation and characterization of the major antigen of rat
kidney, Canad. J. Biochem., 45 (1967), 781 789.
5. Field Е. J., Caspary Е. А., Lymphocyte sensitization. Ап in vitro test for
cancer? Lancet II, 1970, 1337 1341.
6. Gambal D., Simple, rapid pI'ocedure for isolating serum albumin, Biochim.
Biophys. Acta, 251 (1971), 54 56.
7. Heidl G., Grossman Н., мйиет М., Das karzinoembryonale Antigen
(СЕА), ein bedeutsames tumorassoziiertes Antigen des Menschen, Dtsch.
Ges.-\vesen,28 (1973), 875 880.
8. Кеа В., Sormova Z., Laboratoriumstechnik fur Вiochemiker, Akademische
Verlagsgesel1schaft, Leipzig, 1965.
9. Lanzieri М., Bracciolini М., DEAE Cel1ulose chromatographic studies оп
water solubIe lens proteins of various animals, Acta OphthaImologica, 45
(1967), 615 622.
10. Milgrom F., Witebsky Е., Immunological studies оп adrenal glands.
1. Immunization with adrenals of foreign species, Immunology, 5 (1962),
46 66.
11. Milgrom F., Tuggac М., Witebsky Е., Immunological studies of adrenal
glands. III. Interspecies relations of thermostabIe adrenal-specific anti-
gens, Immunology, 6 (1963), 105 118.
12. Mok C. C., Waley S. G., Structural studies оп Iens protein, Biochem. J.,
104 (1967), 128 134.
13. Mouriz J., Stanburry J. В., Purification of Ьиmап 19S thyroglobuJin Ьу
gel filtration, Canad. J. Вiocbem., 46 (1968), 51 54.
14. Nishi S., Isolation and characterization of а Ьиmап fetal a globulin
from the sera of fetuses and а hepatoma patient, Cancer Res., 30 (1970),
2507 2513.
15. Pharmacia, Uppsala: SephadexR Gelfi1tration in Theorie und Praxis.
16. Pharmacia, Uppsala: SephadexR-Iопепаustаusсhеr Leitfaden zur Ionen-
а us ta usch -Chroma togr а phi е.
17. Rehfeld N., Reichelt D., Analytische und praparative Methoden der klini-
schen Biochemie, Akademie-Verlag, BerJin 1972.
18. Roitt 1. М., Ling N. R., Doniach D., Couchman К. а., ТЬе cytoplasmic
auto-antigen of the human thyroid. 1. Immunological and biochemical
characteristics, Immunology, 7 (1964), 375 393.
19. Ruoslahti Е., Seppiilii М., Studies of carcino.fetal proteins 1 Н. Develop-
ment of а radioimmunoassay for a-fetoprotein in serum of healthy human
adults, Int. J. Cancer, 8 (1971), 374 383.
20. Schibata S., Nagasawa Т., Narusse Т., Miyakawa У., Glomerulonephritis
induced in rats Ьу antiserum against а glykoprotein from rat kidney---
31. Л РUZОТ08ленuе аятuzенов 257
А new experimental model of glomerulonephritis, Japan. J. Ехр. Med., 37
(1967), 337 353.
21. 5hibata 5., Narusse Т., Nagasawa Т., Takuma Т., Miyakawa У., Purifi-
саНоп Ьу starch bIock electrophoresis of renal antigen that induced пе-
phrotoxic antibody, J. Immunol., 99 (1967), 454 464.
22. 5truck Н., Heinrich 5., Serologische Untersuchungen zur AntigeniНit und
SреzifШit loslicher Kol1agenfraktionen. 1. Methodik der Kollagenherstel-
lung aus Kalbshaut und Gewinnung von Antiseren, Z. Immunforsch., 133
(1967), 376 384.
23. Williams С. А., Chase М. W., Methods in Immunology, Vol. П. Physical
and chemical methods, Academic Press, New York London, 1968.
24. Уо 5. L., MacPherson С. F. С., Studies оп brain antigens. У. РшШсаНоп
and partial characterization of ап anti-encephalitogenic spinal cord pro
tein (SCP), J. Immunol., 109 (1972), 1009 1016.
17 840
32. Приrотовление
Rонъюrированных антиrенов
И. ЕРШ\.
2.1. ПРИНЦИП
Конъюrаты rаптен белок приrотовляют для получения
-специфических антител к rаптенам. Существует множество
способов присоединения rаптена к белку носителю. Часто
для этой цели используются ароматические диазосоединения
{1, 2]. 2,4-динитрофенильные и 2,4,6 тринитрофенильные rруп-
пы можно вводить в белки с помощью соответствующих суль-
фонатов. Пенициллин самостоятельно соединяется с белками
in vivo, и это может быть причиной развития повышенной
чувствительности к антибиотику; rлавной детерминантой
служит rруппировка пенициллоил лизин. Пенициллоил-конъю-
таты можно приrотовлять in vitro двумя способами [3] (рис.
74) с незначительным образованием побочных продуктов ре-
2КЦИИ [4].
Часто для конъюrирования используются бифункциональ-
1Iые peareHTbI. Например, для присоединения пептидов [5, 6]
и нуклеотидов [7] при пассивной rемаrrлютинации [8] при-
меняют карбодиимиды. Для присоединения пептиДОВ к бел-
кам используют реаrирующие со свободными аминоrруппами
диизоцианаты [6, 9]. В частности, применяют толуол-2,4-ди-
изоцианат, у KOToporo одна из двух диизоцианатных rрупп
реаrирует сильнее друrой. Реакцию проводят в дВа этапа
сначала диизоцианат присоединяют к пептиду, а затем, уда-
лив избыток лиrанда, присоединяют пептид к белку.
2.2.
:32.2.1.
конъюrАты ДНФ БЕЛОR [10]
Реаrепты и приборы
Бычий у rлобулин; динитробензолсульфонат натрия;
К 2 СО з ; сефадекс G 25; хроматоrрафическая колонка.
32.2.2.
Методика
Растворяют 1,0 r бычьеrо у-rлобулина и 1,0 r К 2 СО з в
.50 мл воды И К раствору добавляют 1,0 r 2,4-динитробензол-
сульфоната натрия или калия (в 10-кратном молярном из-
бытке относительно содержания лизина в белке). Раствор
перемешивают при комнатной температуре или при 37 ос,
32. Л рuzотовленue конъюzuровa1tНЫХ антuеенов 259
S HgCl
I
/5 N С СН С!СН з J 2
R C NH CH CH .......С{сН з )2 11 I I I
О II I .,..,...."....R C C.ONH CH COOH
С N СН-СООН HgCI 2 , о /
о'"
1 R' NH 2
рН 12
/5.......
R C NH CH CH С(СН З )2
JI I I 1
О 0= С NH CH COOH
1
NH
1
R'
! Н 2 5
5Н
I
N С СН СН(СН З )2
!I I I I
R С c o NH CH СООН
'0/
NH 2 рН 7,5
I
( СН 2)'
I
сн
/\
С NH
/ \
rI1uJuNo66/e
2рgПП61 .oe./lIra
/5,
R C NH CH CH С(СНЗ)2
11 1 I ,
О О=С NH CH COOH
I
NH
I
( CH 2J,
1
о СН
""С / \NH
/ \
Д иастереОUЗ0мери
Рис. 74. Пенициллоиловые конъюrаты.
пока не будет достиrнута нужная степень за ещения. За 24 ч
при 25 ос происходит замещение 50 60 (самое большее 70)
rрупп на одну молекулу бычьеrо v-rлобулина. Реакционную
смесь необходимо защитить от света, так как ДНФ-rруппы
светочувствительны. После окончания реакции ДНФ-белок
очищают rель хроматоrрафией на сефадексе G 25.
32.2.3.
Дополнительные замечания
Число присоединенных к белку ДНФ-rрупп определяют
по экстинкции при 360 нм. В качестве коэффициента экстинк-
ции используют молярный коэффициент экстинкции g-ДНф-
лизина, который при рН 7,4 равен 17530. Число ДНФ rрупп
относят к молекулярному весу белка. Содержание белка оп-
ределяют микрометодом Кьельдаля или по сухому весу. Для
определения cyxoro веса препарат диализуют против дистил-
17*
260 И. Бра!\'
лированной воды или раствора ацетата аммония, а затем 1
3 дня высушивают в вакууме при 105 0 с. При концентрации
белка 16,8 мr/мл экстинкция 87,5 (при 360 нм) в среднем
соответствует 50 ДНФ rруппам на одну молекулу бычьеrо
у-rлобулина (мол. вес 160000).
Динитробензолсульфонат натрия очищают перекристал-
лизацией из этанола и при помощи активированноrо уrля.
Ero точка плавления выше 300 ОС. Молярный коэффициент
экстинкции при 360 нм равен 280, а после наrревания в
0,02 М растворе N аОН до 90 ос в течение 1 ч 14 000 (:пре
вращение в динитрофенол).
ДНФ-белок, растворенный в воде, хранят при 20 ос или
при 4 ОС. Он стабилен, но нуждается в защите от сВета. Не-
которые сильно динитрофенилированные белки при высокой
концентрации выпадают в осадок в 0,15 М растворе NaCI, но
при концентрации ниже 1 мr/мл полностью растворимы в бу-
ферных растворах с рН 7,6 (0,01 М фосфатный буфер с
0,15 М NaCl или 0,1 М трис 'с 0,1 М NaCI).
Для очистки ДНФ-белков от непрореаrировавшеrо динит-
робензолсульфоната и свободноrо 2,4-динитрофенола можно
применить rель фильтрацию на сефадексе G 25, диализ про-
тив воды при рН 7,8 и выше, ионный обмен или осаждение
при рН ниже 4. Если все аминоrруппы замещены, то ДНФ-
белок теряет растворимость при рН ниже 4. Частично заме-
щенные конъюrаты так же растворяются при рН 1 2, как
и при рН 3 4. При получении ДНФ-конъюrатов динитробен-
золсульфокислота имеет определенные преимущества перед
динитрофторбензолом, несмотря на ero более высокую реак-
:ционную способность. Динитробензолсульфонат реаrирует
почти исключительно с е-аминоrруппами остатков лизина.
Свободными N -концевыми аминоrруппами можно пренебречь.
Фенольные ОН-rруппы тирозина в указанных условиях не
замещаются, SН-rруппы также не увеличивают степени за-
мещения. Далее, к преимуществам динитробензолсульфоната
относится хорошая растворимость в воде, которой не обла-
Дает динитрофторбензол и блаrодаря которой динитробензол-
сульфонат можно леrко отделить от белка после реакции, не
применяя орrанических растворителей.
Подобно ДНФ-белкам, можно получать и ТНФ-конъюrа-
ты. Для этоrо белок обрабатывают тринитросульфокислотой
в 0,2 М боратном ,буфере при рН 9,2 [11]. Степень замеще-
ния ТНФ rруппами определяют по экстиНIЩИИ при 348 нм,
исходя из молярноrо коэффициента экстинкции е-ТНФ-лизи-
на (15400).
82. Л рuzотовление 'Конъюеированных ан.тиzенов 261
32.3.
32.3.1.
ПЕНИЦИЛЛОИЛ ПОЛИЛИ3ИН [4]
Реаrепты и приборы
Полилизин (20 остатков на молекулу) 100 Mr; бензил-
пенициллин (калиевая соль) 2,4 r; 1 М раствор карбоната
с рН 10,4; 5 М раствор NaOH; 0,002 М фосфатный буфер с
рН 8,0; диализная трубка.
32.3.2.
Методика
Растворяют 100 Mr полилизина . НС! в 0,4 мл воды, ней
трализуют 5 М раствором N аОН, добавляют 1 мл 1 М Kap
боната (рН 10,4) и 1,2 r бензилпенициллина. Доводят рН
'полученноrо раствора при помощи 5 М NaOH до 9,6 и в слу
чае необходимости прибавляют воды для полноrо растворе-
ния пенициллина. Через 16 и 24 ч вновь добавляют по 600 Mr
:пенициллина, каждый раз подводя рН к 11,0. Спустя 6 ч
после BToporo добавления пенициллина раствор диализуют
;против 0,002 М фосфатноrо буфера с рН 8,0.
32.3.3.
Обсуждение
Полилизин плохо растворяется при рН выше 9,6, поэтому
вначале конъюrацию приходится проводить при рН 9,6, не-
смотря на замедление реакции в этих условиях. Как только
Iпроизойдет частичное замещение, растворимость полилизина
'при высоком рН увеличится.
Для расчета степени замещения определяют белок по
Кьельдалю (внеся поправку на азот rаптена) и пеницилло-
ильные rруппы с помощью реакции с п хлормеркурибензоа-
том [3]:
/5"
R C NH CH CH С(СН}.
11 I 1 1 З 2
О О С NH СН СООН
I
NH
I
R'
CIH!! ... :,/ СООН
..
R С NH С СН
11 I ,
О О С NH
1
NH
I
R'
SHg // COOH
I .... = /
С(СН З )2
1
СН СООН
Продукт этой реакции 'сильно поrлощает при 285 нм. Мо-
лярный коэффициент экстинкции раствора бензилпеницнлло
иламина ра,вен 23800. Реакцию проводят в 0,05 М растворе
карбоната при рН 9,2 с 4 50-KpaTHЫM избытком п хлормер-
курибензоата. Из величины экстинкции, измеренной через
5 15 мин после начала реакции, нужно вычесть экстинкцию
раствора до прибавления п хлормеркурибензоата. Следует
262 И. Брак
учесть также разведение пробы раствором n-хлормеркури-
бензоата и экстинкцию непрореаrировавшей части этоrо реа-
reHTa.
32.4. конъюr АТ АнrИОТЕН3ИНА
с АЛЬБУМИНОМ [5]
32.4.1. Реаrепты и приборы
l-этил-3- (3-диметиламинопропил) -карбодиимид; (l-аспа-
раrин,5-валин) -анrиотензин; сывороточный альбумин кроли-
ка; диализная трубка.
32.4.2.
Методика
Смешивают 1 О Mr анrиотензина (1 О мкмоль), 5 мл аль-
бумина (0,1 мкмоль) И 150 MKr l-этил-3- (3-диметиламинопро-
пил) -карбодиимида (1 мкмоль) В 0,2 мл воды И оставляют для
взаимодействия на 1 12 ч при комнатной температуре. Как
только в результате реакции образуется коллоидный раствор,
ero диализуют против воды в течение 48 ч. Иноrда смесь не
превращается в коллоидный раствор; в этом случае диализ
начинают через 12 ч.
32.5. ЛИТЕРАТУРА
1. /пgrahaт J. S., Artifical Radioaktive Antigens, 1. Preparation and evalua-
tion of SЗ5- su 1fапi1iс acid-azo-bovine-v-G1obu1in, J. Infect. Diseases, 89,
1 09 1 16 (1951).
2. Beiser S. М., Burke G. с., ТапепЬаит S. W., Immunochemica! studies оп
а galactosy!-protein conjugate, J. Мо!. Biol., 2, 125 132 (1960).
3. Leviпe В. В., Some preparative and analytical methods for study of peni-
cillin hypersensitivity. In: Methods in Medical Research, 10, 184 -19I,
Year Book Medical Publishers, Chicago 1964, ed. Н. N. Eisen.
4. Parker С. W., Penicilloyl-polylysines: preparation, properties and ana!yti-
саl procedures, with special reference to their use in Ьиmап skin testing,
in: Methods in Medical Research, 10, 192 196, Year Book Medica! РиЬ-
lishers, СЫса go, 1964, ed. N. Н. Eisen,
5. Goodfrieпd т., Fasтaп G., Кетр D., Leuiпe L., Immunochemica! studies
of angiotensin, Immunochemistry, 3, 223 231 (1966).
6. Talaтo R, с., Haber Е" Austeп К. F., Antibody to bradykinin: effect of
carrier and method of coupling оп specificity and аШпНу, J. Immunology,
101, 333 341 (1968).
7, Halloraп М., Parker С. W., The preparation of nucleotide-protein conjuga-
tes: Carbodiimides as coupling agents, J. Immunology, 96, 373 378
(1966).
8, Johпsoп Н. М., Breппer к., Hall А. Е., The use of а water-soluble carbo-
diimide as а coupling reagent in the passive hemagglutination test, J.
Immuno!ogy, 97, 791 796 (1966).
32. Приzотовлен.ие конъюеированных антиzенов 263
9. Spragg J., Austen К. Р., Haber Е., Production of antibody against brady-
kinin: Demonstration of specifjcity Ьу complement fixation and radioim-
munoassay, J. Immunology, 96, 865 871 (1966).
10. Eiseп Н. N., Preparation of purifjed anti-2kdinitrophenyl antibodies, in:
Methods in Medical Research, 10, 94 102, Year Book Medical Publishers,
Chicago, 1964, ed. N. Н. Eisen.
11. иЩе J. R., Eisen Н. N., Preparation and characterization of antibodies
specific for the 2,4,6-trinitrophenyl group, Biochemistry, 5, 3385 3395
(1966) .
33. Выделение иммуноrлобулина G (IgG)
И.БРОК
33.1. ПРИНЦИП
в отличие от друrих классов иммуноrлобулинов чистый
IgG можно сравнительно леrко выделить из сыворотки ме-
тодом хроматоrрафиина анионобменниках ДЭАЭ-сефадексе
или ДЭАЭ целлюлозе. При низкой ионной силе и соответст-
вующем рН IgG элюируется в первую очередь. С увеличени-
ем ионной силы элюируются те молекулы IgG, которые в
arapoBoM rеле имеют б6льшую электрофоретическую подвиж-
ность (т. е. продвиrаются ближе к аноду), чем IgG, элюиру-
емый при низкой ионной силе. Так как IgG весьма reTepore-
нен, часть ero молекул продолжает элюироваться при даль-
нейшем увеличении ионной силы вместе с друrими белками
сыворотки. Перед ионообменной хроматоrрафией сыворотку
обычно предварительно фракционируют, осаждая с помощью
N а 2 50 4 , (NH 4 ) 2504 или 2-этокси-6,9-диаминоакридинлактата
(риванола) .
33.2.
ПРЕДВАРИТЕЛЬНОЕ ФРАКЦИОНИРОВАНИЕ
СЫВОРОТКИ
33.2.1.
Осаждение с помощью (NH 4 ) 2 S04
l( 100 мл сыворотки прибавляют 50 мл насыщенноrо рас-
твора сульфата аммония. Осадок отделяют центрифуrирова-
нием, растворяют в 50 мл дистиллированной воды и вновь
осаждают, прибавив 25 мл насыщенноrо раствора сульфата
аммония. Такое осаждение повторяют 4 5 раз и после это-
ro удаляют соль диализом или rель-фильтрацией в соответ-
ствующем буфере. Для дальнейшей очистки IgG используют
ионный обмен на ДЭАЭ-целлюлозе или ДЭАЭ-сефадексе.
Часто осаждение проводят при 40% насыщения сульфа-
том аммония. Этот способ дает высокий выход IgG при мень-
шей чистоте. Мноrие авторы вместо процента насыщения
указывают молярную концентрацию сульфата аммония, на-
сыщенный раствор KOToporo при О ос содержит 3,9 М, а при
20 ос 4,06 М, т. е. соответственно 514,72 r и 536,34 r в
1000 мл.
38. Выделение ,uммунтлобул,ина О (/gO) 265
33.2.2. Осаждение с помощью Na 2 S04 [1]
К 100 мл сыворотки добавляют 18 r N a2S04. Осаждение
проводят при комнатнОй температуре, так как при охлажде-
нии (4 ОС) растворимость сульфата натрия уменьшается.
Осадок растворяют в 40 мл фосфатноrо буфера с рН 8,0, /.1==
==0,1. Раствор центрифуrируют и вновь осаждают, прибавив
4,8 r N a2S04. Полученный осадок отделяют центрифуrирова
нием и снова растворяют в 20 мл Toro же буфера. После оче
редноrо центрифуrирования к раствору еще раз добавляют
2,4 r N a2S04. Выпавший осадок отделяют, растворяют в бу-
фере и подверrают диализу.
33.2.3.
Осаждение риванолом
Риванол образует с -белками сыворотки комплексы, KOTO
рые выпадают в осадок, но вновь растворяются при рН 5.
Блаrодаря высокой изоэлектрической точке IgG в отличие
от друrих белков сыворотки [2] не комплексируется с рива-
нолом в слабощелочной среде. На этом основан способ пред-
варительной очистки сывороток [3 5]. При постоянном пе-
ремешивании добавляют 0,75%-ный раствор риванола, затем
сыворотку на некоторое время оставляют, а потом центрифу-
rируют [3]. IgG остается в надосадочной жидкости. Для уда-
ления риванола прибавляют 10 мr/мл активированноrо уrля
[3] или 5% NaCl [4]. Объемное соотношение сыворотки и
раствора риванола зависит от вида сыворотки. При выделе-
нии человеческоrо IgG лучше прибавлять 2 объема риванола
к 1 объему сыворотки. На один объем сыворотки животных
берут 1 1,5 объема риванола [3]. При очистке человеческо
ro IgG применяется также 0,4% -ный раствор риванола, 3
3,5 объема KOToporo прибавляют к 1 объему сыворотки [5].
33.2.4. Фракционирование сыворотки
орrавичесКlUМИ растворителЯJUИ
Результаты фракционирования при использовании opra
нических растворителей в большей степени зависят от темпе-
ратуры и рН, чем .при высаливании. Так как орrанические
растворители леrко вызывают денатурацию, фракционирова-
ние приходится проводить при температуре ниже О Ос. Белки
плазмы человека чаще Bcero фракционируют с помощью эти-
ловоrо спирта [6 9]; он же используется для промышленно-
ro фракционирования сывороток различных животных (но
редко применяется в лаборатории). При фракционировании
спиртом IgG выделяется rлавным образом в так называемой
фракции II по Кону.
2б6 И. Бра"
33.3. ВЫДЕЛЕНИЕ IgG
ИЗ СЫВОРОТКИ ЧЕЛОВЕКА [10,11]
33.3.1. Реаrепты и приборы
Человеческая сыворотка; ДЭАЭ-сефадекс (Pharmacia, У,п
сала, Швеция); 0,1 М фосфатный буфер с рН 6,5; 0,01 М фос-
фатный буфер с рН 6,5; 0,1 М Н з РО 4 ; 0,5 н. N аОН; 1 М
К2НР04; 1 М NaCl.
33.3.2. Методика
ДЭАЭ-сефадексу А-50 дают разбухнуть в дистиллирован-
ной воде. После Toro как основная масса сефадекса осядет
на дно сосуда, надосадочную жидкость вместе с мелкими
частицами rеля декантируют. Осадок вновь суспендируют в
дистиллированной воде и вторично декантируют таким же об-
разом. После этоrо сефадекс промывают 0,5 н. раствором
N аОН до тех пор, пока фильтрат полностью не освободится
от ионов Cl , а потом отмывают нейтральным раствором. За-
тем ионообменник переводят в фосфатную форму, добавляя
0,1 М фосфорную кислоту, пока надосадочная жидкость не
будет давать кислую реакцию; избыток кислоты отмывают
дистиллированной водой. Сначала ионообменник уравнове-
шивают 0,1 М фосфатным буфером с рН 6,5, а затем
0,01 М фосфатным буфером с рН 6,5.
К 100 мл сыворотки человека прибавляют 20 r набухшеrо
уравновешенноrо ДЭАЭ-сефадекса А-50. Фракционируемую
сыворотку предварительно обычно диализуют против 0,01 М
фосфатноrо буфера с рН 6,5, но этоrо можно и не делать.
Сефадекс суспендируют в сыворотке, периодически переме
шивают в течение 1 ч при 4 0 с. Затем еуспензию фильтруют
и четыре раза промывают 50 миллилитрами 0,01 М фосфат-
Horo буфера с рН 6,5. Фильтрат и промывной буфер соби-
рают, вновь заrружают 20 rраммами набухшеrо уравнове-
шенноrо ДЭАЭ сефадекса A 50 и в течение 1 ч при 4 ос пе
риодически перемешивают; затем снова фильтруют и про-
Мывают 0,01 М фосфатным буфером с рН 6,5. В собранных
фильтратах и промывном буфере с помощью 1 М К2НРО4
доводят рН до 7,5, чтобы предотвратить аrреrацию белка.
Можно также диализовать выделенный IgG против дистил-
лированной воды, а затем лиофилизировать; правда, после
лиофилизации некоторая часть IgG утратит растворимость
[12] .
Бывший в употреблении ДЭАЭ-сефадекс реrенерируют и
используют снова. Для реrенерации ero суопендируют, филь-
33. Выделение luммуноzл06улин.а G (/gG) 267
труют И снова суспендируют в 1 М NaCI, опять фильтруют и
отмывают 0,5 н. NaOH и этанолом, удаляющим адсорбиро
ванные липиды. Затем избыток щелочи отмывают дистилли-
рованной водой и переводят ионообменник в фосфатную
форму, как было описано выше.
33.3.3. Обсуждение
Метод выделения IgG из человеческой сыворотки пред-
ставляется достаточно простым, так как состоит, по суще-
ству, из одноrо этапа. Применение хроматоrрафической ко-
лонки может еще больше повысить ero эффективность. OДHa
ко rель сефадекса разбухает или дает усадку при изменении
рН и ионной силы, что делает невозможным ero реrенерацию
в колонке; rель все равно приходится извлекать из нее. По-
этому при выделении IgG из большоrо количества сыворотки
целесообразно сначала провести ее предварительное фрак
ционирование каким-либо друrим MeTOДO , а затем уже при
менить колоночную хроматоrрафию на ДЭАЭ-сефадексе.
Можно также воспользоваться QАЕ сефадексом [13], rель
KOToporo не изменяет cBoero объема в зависимости от рН.
Элюентом в данном случае служит смесь этилендиамин ук
сусная кислота с рН 7,0, 1-L==0,1, а реrенерацию производят
ацетатным буфером с рН 4,0, I-L== О, 1. Адсорбированные липо
протеиды удаляют 5%-ным раствором твина-80 в ацетатном
буфере. Применение смеси этилендиамин уксусная кислота
удобно тем, что этот буфер улетучивается при лиофилизации
выделенноrо IgG. Перед высушиванием IgG следует скон-
центрировать до 3%, так ,как препараты IgG, лиофилизиро-
ванные из разбавленных растворов, нерастворимы.
33.4. ВЫДЕЛЕНИЕ IgG
ИЗ СЫВОРОТКИ КРОЛИКА
Для выделения IgG из кроличьей сыворотки приrодны
следующие методы.
1. Хроматоrрафия сыворотки на ДЭАЭ-целлюлозе в 0,01 М
фосфатном буфере с рН 8,0 [14] или в 0,0175 М фосфатном
буфере с рН 6,3 [15]. Перед хроматоrрафией сыворотку диа-
лизуют против соответствующеrо буфера. В элюате выходит
чистый IgG, друrие белки сыворотки адсорбируются на ионо
обменнике.
2. Предварительное фракционирование с помощью N a 2 S04
[1] с последующей очисткой на ДЭАЭ-сефадексе А-50 в
0,0175 М фосфатном буфере с рН 6,3 [16], на ДЭАЭ-целлю-
лозе в 0,0175 М фосфатном буфере с рН 6,9 [17] или на
ДЭАЭ-целлюлозе в 0,025 М фосфатном буфере с рН 6,9 [18].
268 И. Брок.
3. Трехкратное осаждение сулъфатом аммония (конечная
концентрация 1,35 М) при рН 7,0 и диализ против дистил-
лированной воды. Образовавшийся осадок отбрасывают, а.
содержащиеся в надосадочной жидкости белки фракциониру-
ют на ДЭАЭ-целлюлозе в 0,02 М фосфатном буфере с рН 7,2
[19] .
4. Осаждение сульфатом аммония (конечная концентра-
ция 1,75 М [20], 37% насыщения [21] или 40% насыщения
[22]) и хроматоrрафия на ДЭАЭ-целлюлозе в 0,0175 М фос-
фатном буфере с рН 6,3.
5. Осащдение риванолом и сульфатом аммония с последу-
ющей хроматоrрафией на ДЭАЭ-целлюлозе [23, 24]. Ступен-
чатое элюирование производят следующими фосфатными бу-
ферами:
1. 0,0175 М, рН 6,9
2. 0,035 М, рН 7,5
3. 0,05 М рН 7,5
Фракции 1 и 2 представляют собой чистый IgG, фракцию 3
дополнительно очищают rель-фильтрацией на сефадексе
G-200 (0,2 М трис, 0,5 М rлицин, рН 8,2).
Ионообменная хроматоrрафия позволяет разделить кро-
личий IgG на две фракции «медленную» И «быструю» (име-
ется в виду электрофоретичеокая подвижность). «Медлен-
ный» IgG элюируется с ДЭАЭ-целлюлозы стартовым буфе-
ром (0,035 М трис 0,005 М фосфорная кислота, рН 8,4;
перед фракционированием сыворотку необходимо диализо-
вать также против cTapToBoro буфера). Очищенный «быст-
рый» IgG элюируется линейным rрадиентом (0,035 М трис,
0,005 М фосфорная кислота, рН 8,4 0,5 М трис, 0,59 М фос-
форная кислота, рН 4,0), давая пик в первых порциях элюа-
та. Затем элюируется оставшаяся часть «быстроrо» IgG с
примесью друrих сывороточных белков [25]. Хроматоrрафия
сыворотки на ДЭАЭ-сефадексе А-50 также позволяет выде-
лить фракции IgG, иммуноэлектрофоретичеоки чистые и раз-
личающиеся по подвижности при электрофорезе. Первую
фракцию выводит стартовый буфер, вторая элюируется rpa-
диентом 0,02 M 0,3 М фосфатноrо буфера (рН 8,0). Соотно-
шение величин этих двух фракций зависит от молярности
cTapToBoro буфера [26].
33.5. ВЫДЕЛЕНИЕ IgG ИЗ КУРИНОй СЫВОРОТКИ
IgG из сыворотки кур сначала очищают трехкратным
осаждением N а 2 50 4 (18, 14 и 12,5%), а затем xpoMaTorpa-
фией на ДЭАЭ-целлюлозе в 0,05 М фосфатном буфере с
рН 8,0 [27].
33. Выделен.ие uммун.оелобулuн.а G (/gG) 2691
33.6. ВЫДЕЛЕНИЕ IgG
ИЗ СЫВОРОТКИ ЛОШАДИ
Лошадиный IgG из нормальной сыворотки выделяют Me
тодом ионообменной хроматоrрафии на ДЭАЭ-целлюлозе в
0,01 М фосфатном буфере с рН 8,0 [28]. Можно предвари-
тельно осадить IgG сульфатом аммония при 37% насыщения,
а затем очистить на ТЭАЭ-целлюлозе в 0,00525 М фосфатном
буфере [29]. Можно также выделить лошадиный IgG, фрак-
ционируя нормальную сыворотку на ДЭАЭ сефадексе в
0,0175 М фосфатном буфере с рН 6,3 [30]. Однако при фрак
ционировании иммунной сыворотки в тех же условиях IgG
элюируется вместе с IgG (Т). При рехроматоrрафии этой
фракции на ДЭАЭ сефадексе А-50 можно сначала элюиро-
вать 0,015 М фосфатным буфером с рН 8,4 чистый IgG, а за-
тем с помощью rрадиента 0,015 М фосфатный буфер (рН
8,4) 0,175 М фосфатный буфер (рН 6,3) вывести IgG (Т),
который будет содержать примерно 10% IgG. Примесь IgG
отделяют от IgG (Т), пользуясь препаративным электрофоре
зом [31]. Раньше IgG (Т) называли IgA (Т), Т rлобулином
или "А-rлобулином [30, 32 34]. Тяжелая цепь IgG (Т) Име-
ет, однако, общие антиrенные детерминанты с тяжелыми
цепями друrих подклассов (IgGa, Ь, с) лошади. С анионооб-
менника IgG (Т) элюируется после IgGa, Ь, с [31, 32]. IgGc
отделяют от IgGa и IgGb с помощью ДЭАЭ-целлюлозы [32,
34]. IgGa, Ь элюируют 0,005 М 0,01 М фосфатным буфером
с рН 8,0, а IgGc 0,02 М фосфатным буфером с рН 8,0.
33.7. ВЫДЕЛЕНИЕ IgG
ИЗ СЫВОРОТКИ МОРСКОЙ СВИНКИ
Иммуноrлобулины 75 морской свинки можно разделить
на фракции 75,,1 (<<быструю») и 75,,2 (<<медленную»), у ко-
торых имеются общие и индивидуальные антиrенные детер-
минанты. Эти фракции различаются по своим биолоrическим
свойствам [35 39]; например, антитела 75у 1 в отличие от
751'2 вызывают реакцию пассивной кожной анафилаксии у
морских свинок [35, 38].
Обе фракции IgG осаждают из сыворотки сульфатом aM
мони я (при 50 % насыщения) и отделяют друr от друrа на
ДЭАЭ-целлюлозе [35], проводя ступенчатое элюирование
фосфатными буферами в такой последовательности: 0,005 М,
рН 8,0; 0,01 М, рН 6,3; 0,04 М, рН 6,0; 0,1 М, рН 5,8; 0,3 М,
рН 5,4. При этом 0,005 М фосфатный буфер е рН 8,0 элюиру-
ет 1'2-иммуноrлобулин, а 0,1 М фосфатный буфер с рН 5,8
.270 И. Брок
'V1-иммуноrлобулин. Далее часто удается разделить каждый
.из выделенных иммуноrлобулинов еще На две фракции у2а
]{ ,,2Ь и соответственно у 1 а и V 1 Ь.
33.8. ВЫДЕЛЕНИЕ БЫЧЬЕrо IgG
Бычий IgG подразделяется на два подкласса: IgGl и
IgG2. Последний выделяют из сыворотки с помощью ДЭАЭ
сефадекса A 50. При элюировании rрадиентом 0,01 М 0,7 М
трис-НСl (рН 8,6) чистый IgG2 выходит в первом пике. В бу-
ферные растворы прибавляют 0,001 М ЭДТА. IgGl выделяют
тюоке из молозива. После удаления жира и казеина молози
во фракционируют на ДЭАЭ сефадексе A 50 и последние пор
дии элюата, не содержащие IgG2, концентрируют и очища
ют на сефадексе G 200. В первой части 7S-пика содержится
чистый IgG 1 [40].
33.9. ВЫДЕЛЕНИЕ IgG
ИЗ СЫВОРОТКИ КРЫС И МЫШЕЙ
Крысиный IgG выделяют, фракционируя сыворотку на
ДЭАЭ-сефадексе А-50 в 0,01 М фосфатном буфере с рН 7,5
[41]. у мыши описаны четыре подкласса IgG IgG 1, IgG2,
IgG2b [42] и IgG3 [43]; их выделяют из сыворотки живот-
ных с :\шеломами. Миеломные белки очищают препаратив-
ным электрофорезом и последующим электрофокусированием
[44]. Для выделения IgG из нормальной сыворотки сначала
проводят осаждение сульфатом аммония (между 20 и 30%
насыщения), а затем хроматоrрафируют на ДЭАЭ-целлюло-
зе в 0,01 М фосфатном буфере с рН 8,4 [45] либо, фракцио-
нируя этанолом, получают фракцию II по Кону, осаждают
IgG сульфатом аммония (50% насыщения) и очищают ero
на ДЭАЭ-целлюлозе в 0,01 М фоофатном буфере с рН 7,5,
содержащем 0,015 М N aCl [46]. Часто для выделения поль-
зуются также rель хроматоrрафией на сефадексе G-200 [47,
48]. Хроматоrрафия на ДЭАЭ-целлюлозе, столь эффектив
ная при выделении IgG друrих животных, мало приrодна
для очистки мышиноrо IgG: он очень прочно связывается с
ионообменником и элюируется только при высокой ионной
силе вместе с друrими белками сыворотки. При низкой же
ионной силе первый пик (который при фракционировании
сыворотки человека содержит чистый IgG) здесь сильно за-
rрязнен трансферрином. Лучшие результаты дает зональный
электрофорез [49].
33. 8ыделен.uе u.ммун.оелобулuн.а G (IgG) 271
33.10.
ЛИТЕРАТУРА
1. Kekwick R. А, ТЬе serum proteins in mиШрlе myelomatosis, Biochem. J.,
34, 1248 1'257 (1940).
2. Schultze Н. Е., Heremaпs J. Р., Molecular Вiology о! Нитап Proteins.
Bd 1. EIsevier Publishing Сотрапу, Amsterdam London New York,
1966, S. 176 181.
3. Paluska Е., Koriпek J., Preparation of immune sera against Ьитап and
animal1gG globulins, Folia biol. (Praha), 18, 127 131 (1972).
4. Heide К, Haupt Н., Darstellung посЬ nicht therapeutisch angewandter
Plasmaproteine, Behringwerk-Mitt., 43, 161 193 (1964).
5. Ho;ejsf J., Smetaпa R., ТЬе Iso1ation о! Gamma Globulin from Blood
Serum Ьу Rivanol, Acta med. scand., 155, 65 70 (1956).
6. Cohп Е. J., Stroпg L. Е., Hughes W. L., jr., Mulford D. J., Ash
worth J. N., Меип М., Taylor Н. L., Preparation and properties of serum
and plasma proteins. IV. А system for the separaiion into fractions of
the protein and lipoprotein components of biological tissues and fluids.
J. Amer. сЬеm. Soc., 68, 459 475 (1964).
1. Cohп Е. J., Curd Р. R. N., Surgeпor D. М., Barпes В. А., Browп R. К,
Deroпaux О., Gillespie J. М., Kahпt Р. W., Lever W. Р., ии С. Н., Mittel
тапn D., Moutoп R. F., Schmid К, Uroma Е., А sytem for the separation
of the components of human bIaod: QuапШаtivе procedures for the sepa
ration of the protein camponents of human plasma, J. Amer. chem. Soc"
72, 465 474 (1950).
8. Oncley J. L., Меип М., Richert D. А., Cameroп J. W" Gross Р. М. jr.,
ТЬе separation of the antibodies, isoagglutinins, prothrombin, plasminogen
and I-lipoprotein into subfractions of human plasma, J. Amer. сЬеm. Soc"
71, 541 550 (1949).
9. Nichol J. G., Deutsch Н. F., Biophysical studies of bIood plasma proteins.
VH. Separation of V-g1obulin from sera of various animals, J. Amer.
chem. Soc., 70, 80 83 (1948).
10. Baumstark J. 1., Laffiп R. J., Bardawil W. А., А preparative method far
the separation of 7S gamma globulin from Ьиmап serum, Arch. ЫосЬеm.
Вiophysics, 1 08, 514 522 (1964).
11. Firmenschrift, Separation-Bulletin, 3, 4, 1968, Pharmacia, Uppsala.
12. Haпssoп и.-В., Ultracentrifuga1 studies о! the aggregation of human im-
munoglobulin Ьу freezing and Ьу heating, Acta chem. scand., 22, 953
960 (1968).
13. Joustra М., Luпdgreп Н., Preparation of freeze-dried, monomeric and im-
munochemical1y pure IgG Ьу а rapid and reproducibIe chromatographie
technique. Protides of the Biological Fluids: Proceedings of the 17th Col
loquium Bruges, 1969, Editor Н. Peeters, Pergamon-Press, Oxford and
New York, 1970, S. 511 515.
14. Ishizaka К, Ishizaka Т., Horпbrook М. М., А unique rabbit immunoglobll-
Нп having homocytotropic antibody activity, Immunochemistry, 7, 515
528 (1970).
15. Levy Н. В., Sober Н. А., А simple chromatographic method for prepara
tion of gamma globulin, Proc. Soc. ехр. Biol. Med., 103, 250 252
(1960) .
16. Wilkoпsoп J. М., Press Е. М., Porter R. R., ТЬе N terminal sequence of
the heavy chain of rabbit immunoglobulin IgG, Biochem. J. 100 303
308 (1966). ' ,
17. Reifseld R. А., Dray S., Nisoпoff А., Differences in amino acid composi-
tion of rabbit yG-immuпоglоЬuliп light polypeptide chains controlled Ьу
аllеliс genes, Immunochemistry, 2, 155 167 (1965).
18. Prahl J. W., Enzymic degradation of the Fc-fragment of rabbit immuno-
globulin IgG, Вiocbem. J., 104, 647 655 (1967).
272 И. Брок
19. Utsumi S., Karush Р., The subunits of purified antibody, Biochemistry. 3
1329 1338 (1964). '
'20. Кiпdt Т. J., Maпdy W. J., Todd С. W., The action of Cyanogen bromide
оп rabbit IgG molecules of allotypes А 11 and А 12, Immunochemistry, 7
467 477 (1970). '
21. Herd Z. L., Cebra J. J., 5election of а single antigenic type of rabbit
light chains Ьу the 2,4-dinitrophenyl hapten, Immunochemistry, 7, 7 13
(1970).
22. Mozes Е., Robblпs J. В., Sela М., Heterogeneity of the 1ight chains of
rabbit immunoglobulins G fractions and of а series of antibodies directed
to\\'ards Antigens of differing complexity, Immunochemistry, 4, 239
245 (1967).
23. Rejпek J., Mage R. О., Reisfeld R. А., Rabit light chains lacking b-alloty-
pic sресШсitiеs. 1. Isolation and characterization of light chains from
normal and allotype suppressed homozygotes, J. Immunology, 102, 638
646 (1969).
24. Chersi А., Mage R., Rejпek J., Reisfeld Р., Isolation, chemical and immu-
nologic characterization of 'X and л-tуре light chains from IgG of nor
таl rabbits \vith Ь9 allotype, J. Immunology, 104, 1205 1211 (1970).
25. Faulk W. Р., Poпdmaп К. W., Characterization of rabblt fast and slow
6,65 IgG, Immunochemistry, 6, 215 228 (1969).
26. Sela М., Шио! D., Mozes Ео, Resolution of Rabbit ",-globulin into two
fractions Ьу chromatography оп diethy1aminoethyl-5ephadex, Biochemo
biophysica Acta, 78, 649 657 (1963).
27. Gallagher J. L., Voss Е. W., jr., Molecular weight of а рurШеd chicken
antibody, Immunochemistry, 6, 199 206 (1969).
28. Helms С. М., Аиеп Р. Z., 5tudies оп equine immunoglobulins. 1. The
antigenic structure of horse IgG, its fragments and subunits, Immuno-
chemistry, 7, 401 412 (1970).
29. Hill \V. С., Cebra J. 1., Horse anti-51 immunog1obulins. 1. Properties of
1'M-antibody, Biochemistry, 4, 2575 2584 (1965).
30. Weir R. С., Porter R. R., Comparison of the structure of the immunog1o-
bulin from horse serum, Biochem., J., 100, 63 68 (1966).
31. Dorrington К. 1., Rockey 1. Н., 5tudies оп the conformation of purified
human and canine ",A-gIоЬuliпs and equine ",T-g1obulin Ьу optical rota-
tory dispersion, J. Ыоl. Chemistry, 243, 6511 6519 (1968).
32. Rockey J. Н., Equine antihapten antibody. The subunit and fragments of
anti- -Iactoside antibody, J. ехр. Medicine, 125, 249 275 (1967).
33. Pa!IUd 1.-1., Mach J.-P., Equine secretory IgG and secretory Component,
Internat. Arch. Allergy, 42, 175 186 (1972).
34. Moпtgomery Р. С., Dorriпgtoп К. J., Rockey 1. Н., Equine antihapten
antibody, The molecular weight of the subunits of equine immunoglobu-
lins, Biochemistry, 8, 1247 1258 (1969).
35. Oliviera В., Osler А. О., Seragaпiaп R. Р., Saпdberg А. L., The Bio1ogic
Activities of guinea pig antibodies. 1. 5eparation of ",1 and ",2, J. Immu-
nology, 104, 320 328 (1970).
36. Sandberg А. Lo, Osler Ао О., Shin Н. So, Oliviera Во, The Bio1ogic activities
of guinea pig antibodies. П. Modes of complement interaction with ,,1
and ",2-immunog1obulins, J. Immunology, 104, 329 334 (1970).
37. Benacerraf В., Ovary Z., Bloch К. 1., Fraпkliп Е. С., Properties of guinea
pig 75 antibodies. 1. EIectrophoretic separation of two types of guinea
pig 75 antibodies, J. ехр. Medicine, 117, 937 949 (1963).
38. Ovary Z., Beпacerraf В., Bloch К. J., Properties of guinea pig 75 antibo-
dies. Н. Identification of antibodies involved in passive cutaneous and
systemic anaphylaxis, J. ехр. Medicine, 117, 9Бl 964 (1963).
33. ВъиЭемtШe uм.м.У1ЮzлоБУlШна О (1 КО) 273
39. Bloch К. J., Koиrilsky К. М., Ouary Z., Beпacerraf В., Properties of guinea
pig 7S antibodies. III. Identification of antibodies involved in соmрlе-
ment fjxation and hemolysis, J. ехр. Medicine, 117, 965 981 (1963).
40. Dипcaп /. R., Wilkie В. N., Нiestand Р., Wiпter А. /., The serum and sec
retory immunogIobuJins о! саШе: haracterization and quantitation, J,
ImmunoIogy, 108, 965 976 (1972).
41. Ехит Е. D., Bowser R. Т., Purification of rat gamma globulin and the
production of а specific antirat gamm8 globulin serum, Proc. Soc. ехр. Biol.
Med" 133, 43 48 (1970).
42. Baziп Н., Les immunoglobulins de lа souris, Nouvelle Revue Fran aise
d'Hematologie, 7, 507 526 (1967).
43. Grey Н. М., Wegmaп Нirst /., Cohn М., А new mouse immu:1og1obulin:
IgG 3, J. ехр. Medicine, 133, 289 304 (1971).
44. Murgita R. А., Vas S. 1., Isoelectric separation of mouse immunoglobulin,
J. Immunology, 104, 514 517 (1970).
45. КiиcM У., Maejima К., Fujiwara К, Tajima У., Serum IgG in germfree,
Gnotobiotic and conventional mice of different ages, Jap. J. ехр. Med.,
42, 53 65 (1972).
46. Lajos-Kerekes /., pers. Mittei1ung.
47. Deппert а., The mechanism of antibody induced stimulation and inhibi-
tion of the immune response, J. Immunology, 106, 951 955 (1971).
48. Aпkerst /., Demonstration and identification of cytotoxic antibodies and
antibodies blocking the cell-mediated antitumor immunity against adeno-
virus type 12-induced tumors, Cancer Res., 31, 997 1003 (1971).
49. Falzey /., Wuпderlich /., Mishell R., ТЬе immunoglobulins of mice, J. ехр.
Medicine, 120, 223 242 (1964).
1 в.......84О
34. Выделение иммуноrлобулина А (IgA)
И. ЕРШ\.
34.1. ПРИНЦИП
Трудности выделения IgA из сыворотки обусловлены тем.
что молекулярноситовое фракционирование и разделение MO
лекул по заряду не позволяют достаточно наде}кно отделить
IgA от IgG. В большинстве случаев приходится комбиниро-
вать несколько методов, например rель-хроматоrрафию, oca
ждение сопутствующих белков сульфатом цинка и зональный
электрофорез. Кроме Toro, часто используется ионообменная
хроматоrрафия. Небольшие количества IgA можно выделИТЬ
непосредственно из нормальной сыворотки с помощью имму-
носорбента, приrотовленноrо из моноспецифической антисы-
воротки. Значительно леrче IgA выделяется из сыворотки
больных миеломатозом и из молози,ва (секреторный IgA).
IgA преобладает среди иммуноrлобулинов человеческоrо MO
лозива, но это не характерно для молозива животных.
34.2.
ВЫДЕЛЕНИЕ IgA
ИЗ СЫВОРОТКИ ЧЕЛОВЕКА [1]
34.2.1.
Реаrенты и приборы
Сыворотка человека; сефадекс G-200; хроматоrрафическая
колонка lХ100 см; певикон 1 ; прибор для препаративноrо
электрофореза; сульфат декстрана и CaC1 2 для удаления леr-
ких липопротеидов.
34.2.2.
Методика
Исходным материалом служит плазма, которую после
удаления фибриноrена и р липопротеидов фракционируют на
сефадексе G-200 (рис. 75). IgA элюируется несколько рань-
ше IgG. Вторую фракцию (см. рис. 75) концентрируют и
подверrают рехроматоrрафии. Первые фракции после второй.
третьей и четвертой хроматоrрафий каждый раз концентри-
руют и вновь наносят на колонку сефадекса G-200, а все BTO
1 Сополимер поливинилхлорида и поливинилацетата. Прим. перев.
34. Выделение им,М,уноелобулина А (/gA) 275
рые фракции отбрасывают. Первую фракцию пятой рехро-
матоrрафии очищают далее с помощью препаративноrо эле-
ктрофореза в певиконе, удаляя а2-rлобулин и уменьшая при-
месь 1 gG.
Е
Рис. 75. Выделение IgA с помощью хроматоrрафии на сефадексе G 200
[1]. Фракцию, полученную при хроматоrрафии сыворотки, вновь разде.'1Я-
ют на сефадексе G 200. Фракции 1, полученные при втором, третьем и по-
следующих разделениях, каждый раз концентрируют и снова наносят на
колонку сефадекса G 200.
-34.2.3. Оценка етодики и друrие варианты
Выход IgA при мноrократной рехроматоrрафии на сефа-
дексе G-200 составляет 20 %. Полученный препарат иммуно-
электрофоретически чист, но при анализе по Ухтерлони в нем
.обнаруживается очень небольшая примесь IgG. В некоторых
'случаях кроме мономера в препарате содержится небольшое
количество полимера IgA. К недостатка:м методики следует
отнести значительные затраты времени, которые, однако,
можно уменьшить, применяя рециклическую хроматоrрафию.
Кроме Toro, получаемые препараты содержат не все вариан
ты молекул IgA, а только фракцию, соответствующую опре
.деленному диапазону электрофоретической подвижности.
Для получения препарата, полностью отражающеrо элект-
рофоретическую reTeporeHHocTb сывороточноrо IgA, предло
жена друrая методика [2], дающая выход 9 %. Примесь IgG
удаляется с помощью иммуносорбции. Ниже приводится схе-
ма этой методики.
Рекальцифицированная плазма
2M(NH 4 )2S04
4 0 С
Надосадочная !
жидкость 1
18*
Осадок 1
Диализ против 0,025 М вероналовоro буфера с рН 6,9
4 ОС, 48 ч
Осадок II !
Надосадочная жидкость 11
+
Концентрирование, беаколоночное фракционирование на
ДЭАЭ-сефадексе A 50. Ступенчатое элюирование: по 2 л
элюента на 1 л разбухшеrо сефадекса на каждой ступени.
1 .ТI ионообменника в 0,01 М фосфатном буфере е рН 8,0 мо-
жет связать 3 r белка.
Элюат 1
0,01 М фосфатный буфер, рН 8,0
Элюат II
0,04 М фосфатный буфер, рН 8,0
Элюат III
0,04 М ф осфатный буфер, рН 7,5
Элюат V I
0,2 М фосфатный буфер, рН 5,0 t
Элюат IV
(0,2 М фосфатный буфер, рН 7,5)
+
Диализ против дистиллированной воды, лиофилизация. Лио-
филизат растворяют в 0,02 М фосфатном буфере с рН 7,0 из
расчета 3,5 r на 100 мл. Концентрацию белка доводят до
3,33 мr/мл, затем белок осаждают этиловым спиртом в конеч
ной концентрации 25% при 5 ОС, 30 мин.
Осадок III !
Надосадочная жидкость 111
Диализ, 2 М (NH 4 ) 2504, 2% rлицин,
комнатная температура
Надосадочная l
жидкость IV
Осадок IV
Колоночная хроматоrрафия на
ТЭАЭ-целлюлозе
Ступенчатое элюирование
0,02 М фосфатный буфер, рН 6,7
276 11. Б РО/С
34. Выделенuе uммуноzлобулина А (/gA) m
0,035 М фосфатный буфер, рН 6,7
0,05 М фосфатный буфер, рН 6,7
0,065 М фосфатный буфер, рН 6,7
0,08 М фосфатный буфер, рН 6,7
(см. рис, 76)
t
Фракция 3
Мноrократная иммуносорбция на конъюrате бромацетил-
целлюлоза-анти-IgG. Для приrото,вленияконъюrата у-rлобу-
лин антисыворотки ,к IgG выделяют двукратным осаждением
14% Na 2 S04 и иммобилизуют на бромацетилцеллюлозе [3].
Неадсорбировавшаяся фракция: IgA
Часто для выделения IgA применяют также следуюшую
методику [4]:
1) удаление эуrлобулинов: исходный материал разбавля-
ют 9-кратным объемом 0,02 М буфера Сёренсена с рН 6,0 и
диализуют против Hero же;
2) осаждение сопутствующих белков сульфатом цинка;
3) препаративный электрофорез.
,,-,С\о
м.л
О,О2 0.035 0,05 0,065 0,08
......................................... iII . iII
Возрастающая ммаркость; рН 6,1
Рис. 76. (Объяснение в тек-
сте.)
Выход составляет 5 10%. Отдельные препараты MorYT
содержать примеси IgG и IgM. Определенные преимущества
дает предварительное удаление из сыворотки большей части
IgG с помощью хроматоrрафии на ДЭАЭ-целлюлозе в 0,01 М
фосфатном буфере с рН 8,0 и последующее выделение IgA
из той фракции, которая элюируется 0,08 М фосфатным бу-
278 И. Брок
фером [5]. Полученный таким образом препарат содержит
в основном неаrреrированный (75) IgA с примесью arpera-
тов IgA и следов IgM.
Малые количества IgA можно выделить прямо из сыво-
ротки, применив иммуносорбент [6], или из иммунных пре-
ципитатов, образованных F(ab')2-фраrментами антител к IgA
[7]. Если препараты IgA приrотовляют с целью иммунизации
животных для получения антисыворотки, то в них допустимо
присутствие значительной примеси IgG, антитела к которому
можно впоследствии удалить истощением.
Препарат IgA, содержащий 20% IgG, получают из 'CЫBO
ротки С помощью следующей трехэтапной методики [8]:
1) трехкратное осаждение сульфатом аммония (50% на-
сыщения) ;
2) ионный обмен на ДЭАЭ целлюлозе. Вначале выделяют
IgG, элюируя 0,005 М фосфатным буфером с рН 8,0. Затем
элюируют линейным rрадиентом 0,005 M O,1 М (тот же бу-
фер, рН 8,0). Фракцию, элюируемую между 0,0175 М и
0,045 М, концентрируют и очищают далее на сефадексе;
3) rель-хроматоrрафия на сефадексе G-200 в 0,15 М pac
творе N aCl, содержащем 0,01 М боратный буфер с рН 8,0.
Чаще Bcero для выделения MOHoMepHoro и полимерноrо
IgA используют сыворотку больных миеломатозом. Вначале
проводят зональный электрофорез в вероналовом буфере с
рН 8,6 и !-t== 0,05, при 4 ОС, а затем rель хроматоrрафию после-
довательно на трех колонках сефадекса G-200 или био-rеля
A 1,5m [9, 10]. При rель фильтрации IgG отделяется от MO
HOMepHoro IgA. Последнюю часть пика IgA, которая содер-
жит IgG, отбрасывают. Можно также сначала осадИТЬ IgA
из миеломной сыворотки сульфатом аммония при 50% насы-
щения, а затем очистить мноrократной rель фильтрацией на
сефадексе G-200 и сефарозе 6В [11]. Кроме Toro, можно
скомбинировать осаждение сульфатом аммония, обработку
каприловой кислотой и бесколоночную хроматоrрафию на
ДЭАЭ uеллюлозе [12].
Предложено также несколько методов выделения IgA при
промышленном фракционировании человеческой плазмы
[13 15] .
34.3. ВЫДЕЛЕНИЕ IgA
ИЗ СЫВОРОТКИ СВИНЬИ [16]
Свиной IgA можно ВЫДелить из сыворотки примерно Ta
ким же образом, как и человеческий.
Вначале сульфатом декстрана 500 (Pharmacia, Упсала,
Швеция) осаждают липопротеиды. На 1 мл сыворотки добав-
34. Выделение иммуноzлобулина А (/gA) 279
ляют 0,02 мл 10%-Horo ра,створа декстрана и 0,1 мл 1 М
раствора CaC1 2 и центрифуrируют 10 мин при 10000 g и 4 ос;
надосадочную жидкость диализуют сначала против дистил-
лированной воды, а затем против 0,1 М трис НСl-буфера с
рН 8,0, содержащеrо 1 М NaCI, и фракционируют на сефа
дексе G-200 (длина колонки 100 см) (рис. 77).
1,2
1,0
0,8
о::-
08
,
0,4
0,2
о ID зо 50 !/о 120 150 180
Фрокции
Рис. 77. Хроматоrрафия свиной сыворотки на сефадексе G-200 ПОС:lе уда-
ления липопротеидов [16].
Фракции 69 78 объединяют, диализуют против дисти.'l-
лированной воды, концентрируют карбоваксом 20000, диаЛIl-
зуют против 0,02 М трис-НCl-буфера с рН 7,4 и фракциони-
руют на ДЭАЭ-целлюлозе. Затем проводят ступенчатое элю-
ирование 0,02 М, 0,05 М, 0,075 М, 0,1 М, 0,125 М и 0,15 М
трис-НСl-буфером с рН 7,4. IgA элюируется 0,075 М и 0,1 М
буфером; иммуноrлобулин концентрируют, затем диализуют
против 0,1 М трис-НСl-буфера с рН 8,0, содержащеrо 1 М
NaCl, и фракционируют на сефадексе G-200. Из полученных
двух пиков берут второй, концентрируют ero и рехромато-
rрафируют на сефадексе G-200. Фракции, соответствующие
вершине пика, объединяют, диализуют, концентрируют, затем
вновь диализуют против 0,05 М вероналовоrо буфера с рН
8,6 и фракционируют с помощью электрофореза на пластинке
1 % -Horo arapOBoro rеля (10Х20 см). В центральную канавку
вносят 0,5 мл раствора белка (5 Mr). Электрофорез ПрО,Jол-
жается 2 ч при 4 ос и 30 В/см. После этоrо IgA элюируют из
полоски rеля шириной 1,5 см, вырезанной на катодной сторо-
не пластинки. Эту полоску помещают в физиолоrический
раствор N aCl, замораживают при 20 ос, оттаивают и цент-
рифуrируют 10 мин при 10000 g. Надосадочную жидкость
диалИl3УЮТ и концентрируют.
280 И. Брок
34.4. ВЫДЕЛЕНИЕ IgA
ИЗ ЛОШАДИНОй СЫВОРОТКИ [17]
У лошади этот класс иммуноrлобулинов долrо не удава-
лось идентифицировать. Ero очистку начинают с осаждения
псевдоrлобулинов сыворотки сульфатом аммония (40% на-
сыщения), затем их диализуют против 0,005 М фосфатноrо
буфера с рН 6,0 и фракционируют на ДЭАЭ-целлюлозе:
0,06 М фосфатным буфером с рН 7,0 элюируют мономерный
IgA, а 0,15 М фосфатным буфером с рН 6,0 полимерный
IgA.
34.5. ВЫДЕЛЕНИЕ IgA ИЗ БЫЧЬЕй, БАРАНЬЕй
И RОЗЬЕй СЫВОРОТОК
IgA выделяли из сыворотки и молозива овец и коз трех-
этапным фракционированием [18], которое включало:
1) осаждение сульфатом аммония (50% насыщения);
2) ступенчатое элюирование с ДЭАЭ целлюлозы фосфат-
ными буферами: 0,01 М, рН 7,4; 0,02 М, рН 7,4; 0,05 М, рН
6,5; 0,13 М, рН 6,5; 0,2 М, рН 6,0;
3) rель хроматоrрафию на сефадексе G-200.
При ионообменной хроматоrрафии IgA элюируется 0,13 М
фосфатным буфером с рН 6,5.
Молекулы бычьеrо IgA имеют меньший отрицательный
заряд, чем у друrих видов; поэтому при фракционировании
сыворотки или молозива они элюируются rрадиентом фос-
фатных буферов 0,03 М, рН 7,0 0,06 М, рН 6,5, в то время
как козий и бараний IgA элюируется rрадиентом 0,05 М, рН
6,6 0,13 М, рН 6,3.
34.6. ВЫДЕЛЕНИЕ CEKPETOPHOrO IgA (S IgA)
ИЗ ЧЕЛОВЕЧЕскоrо МОЛОЗИВА [19]
34.6.1. Реаrенты и приборы
Молозиво
1 н. уксусная кислота
ДЭАЭ целлюлоза; КМ-целлюлоза
Фосфатные буферы: 0,01 М, рН 7,6; 0,1 М, рН 6,4
Ацетатные буферы: 0,005 М, рН 5,0; 0,5 М, рН 5,0
Сефадекс G-200
Хроматоrрафические колонки: 2Х25 см; ЗХЗО см; 2,5Х
ХI00 сМ.
34. Выделение иММУНО2Лобулина А (/gA) 281
34.6.2. Методика
Молозиво собирают через 2 3 дня после родов. Жир
удаляют центрифуrированием при 20000 об/мин в течение
2 ч. Затем, подкислив надосадочную жидкость до рН 4,6 1 н.
уксусной кислотой, вызывают осаждение казеина; снова цен-
трифуrируют; надосадочную жидкость диализуют против
0,01 М фосфатноrо буфера с рН 7,6 и наносят на колонку
ДЭАЭ-целлюлозы зхзо см (количество наносимоrо белка
3 r). Ступенчатое элюирование проводят 1) 0,01 М фосфат
ным буфером с рН 7,6 и 2) 0,1 М фосфатным буфером с
рН 6,4.
Фра цию, элюированную вторым буфером и содержащую
0,5 r белка, диализуют против 0,005 М ацетатноrо буфера
с рН 5,0, наносят на колонку КМ-целлюлозы 2Х25 см и элю
ируют линейным rрадиентом 0,005 М (300 мл) 0,5 М
(300 мл) ацетатноrо буфера с рН 5,0. Фракцию, которая, по
данным иммунодиффузии, содержит S-IgА, концентрируют и
фракционируют далее на колонке сефадекса G-200 (2,5Х
Х 100 см) в 0,05 М трис-НСl-буфере с рН 8,0, содержащем
1 М N aCl. Первый пик, в котором нахоДИТСЯ S-lgА, рехро-
матоrрафируют на сефадексе G-200, диализуют против ди-
стиллированной воды и лиофилизируют.
34.6.3.
Друrие методы выделения S-IgА
из человеческоrо молозива
Существует несколько более простых способов.
1. Молозиво обезжиривают, осаждают казеин, диализуют
против 0,01 М фосфатноrо буфера срН 7,0 и фракциониру-
ют на ДЭАЭ-ц ,люлозе, элюируя сначала 0,01 М фосфатным
буфером с рН 7,0, а потом тем же буфером, содержащим 0,1 М
NaCl. Вторую фракцию очищают далее на сефадексе G-200.
S-IgА элюируется в первую очередь. ПолученныЙ препарат
иммуноэлектрофоретически чист. Выход составляет 5 1 О Mr
на 1 мл молозива [20,21].
2. Молозиво разбавляют равным объемом 0,15 М N aCl и
центрифуrируют 1 ч при 20000 об/мин. Средний слой диали-
зуют против 0,01 М трис-НСl-буфера с рН 8,0 и фракциони-
руют на ДЭАЭ целлюлозе. Для ступенчатоrо элюирования
применяют 0,01 М трис-НСl буферы с рН 8,0, содержащие
0,03; 0,05; 0,1 и 2,0 М N aCl. Фракцию, которая элюируется
буфером с 0,1 М NaCl; концентрируют и подверrают восхо-
дящей хроматоrрафии на сефадексе G-200 (колонка 2Х 120
см) в 0,01 М боратном буфере >с рН 8,0, содержащем 0,15 М
NaCl. Нисходящую часть первоrо пика собирают и снова
282 И. Брок
фракцпонируют на сефадексе G-200. Это повторяют 2 3 ра-
за, нанося на колонку только нисходящую часть первоrо пи-
ка [8] (рис. 78).
3. Молозиво освобождают от жира и казеина. rлобулины
осаждают сульфатом аммония (0,5 на,сыщения); осадок рас-
творяют и, отдиализовав против 0,1 М трис-НСl-буфера с
рН 7,4, содержащеrо 0,15 М N aCl, подверrают восходящей
хроматоrрафии на сефадексе G-200. Первый пик конuентри
11"
I'I!
":,' 1 , 1
,11:.j
", [
i;' ,, ' I " , 1
1 1 ' il
\\\ ,I \\'i \
' 1 1' ' 1 1
J[i!ill'lli
,,-,'"
00 "ЬЕ'М .7.;1ЮUjJtJdонu.н
Рис. 78. Выделение ceKpeTopHoro IgA из человеческоrо молозива [8]. Бел-
ки, элюируеr.1Ые с колонки ДЭАЭ-целлюлозы раствором 0,1 М NaC! 0,01
М трис-НС1, фракционируют на сефадексе G 200. Заштрихованную фрак-
цию вновь наносят на колонку сефадекса G 200.
руют И проводят восходящую хроматоrрафию на сефарозе
6В; при этом получают во втором пике иммуноэлектрофоре-
тически чистый S-IgА [22, 23].
34.7. ВЫДЕЛЕНИЕ CEKPETOPHOrO IgA
ИЗ КРОЛИЧЬЕrо МОЛОЗИВА [24 26]
Секреторный IgA животных выделяют примерно так же,
как и S-IgА человека.
Сначала из кроличьеrо молозива удаляют жир, затем,
подкислив, осаждают казеин. После этоrо проводят rель-хро-
матоrрафию на сефадексе G-200 в 0,1 М фосфатном буфере
с рН 6,8 (рис. 79) и ионный обмен На ДЭАЭ-uеллюлозе, урав-
новешенной 0,01 М фосфатным буфером с рН 7,5. Для сту-
пенчатоrо ЭЛЮИРОJ3ания применяют тот же буфер, содержа-
щий 0,05; 0,1; 0,2; 0,3; 0,4 и 1,0 М NaCl. S-IgА элюируется
буфером, содержащим 0,2 и 0,3 М NaCl. В заключенпе про-
34. Выделенuе иММУНО2Лобулuна А (/gA) 283
водят rель-хроматоrрафию на сефарозе 48 в 0,1 М фосфат-
ном буфере с рН 6,8, чтобы удалить компоненты с б6льшим
молекулярным весом, чем у S-IgА.
',б
1,"
',2
1,0
0,8
'"
0,6
0,4
H тU l
Vи-d
0,2
30 М 50 50 70 80 90 100 110
ФfJQIfЦlШ
Рис. 79. Фракционирование кроличьеrо молозива на сефадексе G-200 пос-
.le удаления жира и казеина [26]. Заштрихованными полосками указаны
фракции, дающие реакцию приципитации с антисыворотками к а- и y цe-
пям.
34.8. ВЫДЕЛЕНИЕ БЫЧЬЕrо S IgA
у коров S-IgА был выделен из молозива [27], слюны
[28] и HocoBoro секрета [29]. Молозиво обезжиривают, yдa
.1ЯЮТ казеин, затем проводят ионообменную хроматоrрафию
на ДЭАЭ-целлюлозе со ступенчатым элюированием и rель-
хроматоrрафию на сефадексе G-200. При ионном обмене
S-IgА элюируется 0,05 М фосфатным буфером с рН 7,0. При
rель-хроматоrрафии он опережает IgG. Рехроматоrрафия на
сефадексе G-200 дает препарат S-IgА, еще содержащий arpe-
raTbI IgG. Таким же образом с помощью ДЭАЭ-целлюлозы
и сефадекса G-200 можно выделить S-IgА из слюны. Для
ступенчатоrо элюирования с ионообменника применяют фос-
фатные буферы: 0,01 М, рН 7,4; 0,02 М, рН 7,2; 0,06 М, рН
7,0; 0,1 М, рН 6,0 и 0,2 М, .рН 6,0. S-IgА элюируется 0,06 М
буфером с рН 0,7. Эту фракцию наносят на колонку седафек-
са G-200 и при рехроматоrрафии первой половины пика по-
лучают иммунохимически чистый S-IgА. S-IgА HocoBoro сек-
рета выделяют с помощью блок-электрофореза в пев иконе и
rель-хроматоrрафии на сефадексе G-200. rель-хроматоrрафия
дает два пика; первый пик наряду с S-IgА содержит IgM, а
второй только S-IgА.
284 И. Брок
34.9. ВЫДЕЛЕНИЕ ЛОШАдиноrо S IgA .[ 17]
Секреторный IgA лошади ведет себя' при ионообменной
х.роматоrрафии и rель-фильтрации так же, как S-IgА круп-
Horo poraToro скота; поэтому для ero выделения можно ис-
пользовать сходную схему фракционирования. Как всеrда,
вначале удаляют жир и казеин, затем сульфатом аммония
(40 % насыщения) осаждают rлобулины. Осадок растворяют,
диализуют против 0,01 фосфатноrо буфера 'с рН 7,4 и фрак-
ЦИОНИРУЮТ на ДЭАЭ-целлюлозе. «Медленную» фракцию IgG
ЭЛЮИРУЮТ 0,02 М фосфатным буфером с рН 7,4, а секретор-
ный IgA 0,06 М фосфатным буфером с рН 7,0. При после-
дующей rель-хроматоrрафии на сефадексе G-200 S-IgА выхо-
ДИТ между первым пиком и 7S-фракцией выше предела сито-
Boro исключения. Рехроматоrрафия на сефадексе G-200 дает
чистый секреторный IgA.
34.10.
ВЫДЕЛЕНИЕ S IgA
ИЗ свиноrо МОЛОКА [31]
Для выделения 'ceKpeTopHoro IgA из свиноrо молока при-
меняют бесколоночную хроматоrрафию на ДЭАЭ-сефадексе
А-50 и rель-хроматоrрафию. Адсорбция ceKpeTopHoro IgA на
ионообменнике происходит в 0,1 М трис-буфере с рН 7,4, а
десорбция в 0,4 трис-буфере с рН 7,4. Элюированные белки
концентрируют и сразу же диализуют против 0,01 М трис-
буфера с рН 7,4, цент.рифуrируют и надосадочную жидкость
хроматоrрафируют на био-rеле А-5т в 0,15 М NaCl. В треть-
ем (первом большом) пике выходит иммуноэлектрофорети-
чески чистый S-IgА.
34.11.
ВЫДЕЛЕНИЕ СОВА ЧЬЕrо S IgA
После удаления жира и казеина молозиво собаки фрак-
ЦИОНИРУЮТ, используя только rель-фильтрацию. Проводят
последовательную восходящую хроматоrрафию на колонках
сефадекса G-200 и сефарозы 4В. Фракцию, содержащую IgA,
концент,рируют и вновь наносят на колонку сефадекса G-200.
В первом пик е ВЫХОДЯТ IgM и IgA, а в следующем IgA.
Рехроматоrрафия дает чистый S-IgА.
34.12.
ЛИТЕРАТУРА
1. Vaerтan J. Р., Hereтans J. Р., А New Procedure for the Isolation о!
Normal Human Serum IgA Globulin Based Solely оп Preparative Gel
Filtration and Electrophoresis, Protides of the Biologica! Fluids, Pro-
34. Выделенuе и,М,,М,уноzлобулuна А (/gA) 285
ceedings of the 15th Colloquium, Bruges 1967, Editor Н. Peeters. Elsevier
Publishing Соmрапу, Amsterdam London New York, 1968, S. 615
618.
2. Zschnocke R. Н., Grieble Н. О., Bach О. L., Aпdersoп Т. О., Studies оп
IgA. 1. Fractionation Procedure for Isolation of IgA from Pooled Normal
Ниmап Plasma. J. Immunology, 102, 625 637 (1969).
З. Robbins J. В., Haiтovich J., Sela М., Purification of Antibodies with Im-
munosorbents Prepared Using Bromacetyl Cellulose, Immunochemistry, 4,
11 22 (1967).
4. Vaerтaп J. Р., Hereтans J. F., Vaerтan С., Studies of the Immune Glo-
bulins of Ниmап Sel'um. 1. А Method for the Simultaneous Isolation of
the Three Immune GlobuHns ("ss, "1М und "lA) from Individual Small
Serum Samples. J. Immunology, 91, 7 10 (1963). .
5. Vaerтan J. Р., Fudenbel"g Н. Н., Vaerтaп С., Mandy W. J., Оп the Slg-
пiПсапсе of the Heterogeneity in Molecular Size of Ниmап Serum "A Glo-
bulins, Immunochemistry, 2, 263 272 (1965).
6. Aпdersoп Т., Zschnocke R. Н., Bach О. L., Studies оп IgA. II. Isolation
of IgA from Small Volumes of Ниmап Serum Ьу Immunadsorption, J.
Immunology, 105, 146 153 (1970).
7. Mestecky J., Kulhavy R., Kraus F. W., Method of Serum IgA Isolation,
J. Immunology, 107, 605 607 (1971).
8. Newcoтb R. W., Norтansell D., Stanworth D. R., А Structural Study of
Нитап Exocrine IgA Globulin, J. Immunology, 101, 905 914 (1968).
9. Dorriпgtoп К J., Rockey J. Н., Studies оп the Conformation of Purified
Human and Canine y-A-Globulins and Equine y-T-Globulin Ьу Optical
Rotatory Dispersion, J. biol. Chemistry, 243, 6511 6519 (1968).
10. Jevry L. М., Kuпkel Н. О., ТЬе Unique Reassociation of Human IgA2 Im-
munoglobulins from Dimer-Subinits, J. Immunology, 109, 982 991
(1972).
11. Mestecky J., Zikaп J., Butler W. Т., Kulhavy R., Studies оп Human Sec-
retory lmmunoglobulin А III, J Chain. Immunochemistry, 9, 883 890
( 1972) .
12. Лпе J. М., Steiпbuch М., А SimpIe Technique for the Isolation of Мопо-
clonaI IgG and IgA, Rev. Et. clin. biol., 15, 1115 1121 (1970).
13. Pejaudier L., Aпdraт R., Steiпbuch М., Preparation of Нитап IgA as
By Product of Routine Fractionation, Уох. Sang., 23, 165 175 (1972).
14. Wickelhiiuser М., Hav У. L., Large Scale Preparation of Macroglobulins,
Уох. Sang., 23, 119 125 (1972).
15. Heide К, Haupt Н., Darstellung посЬ nicht therapeutisch ange\vandter
Plasmaproteine, Behringwerk-Mitt., 43, 161 193 (1964).
16. Воиrпе F. J., IgA Immunoglobulin from Porcine Serum, Biochem. biophys.
Res. Сотmип., 36, 138 145 (1969).
17. Pahud J. J., Mach J. Р., Equine Secretory IgA and Secretory Component,
Internat. Arch. Allergy, 42, 175 186 (1972).
18. P hud J. J., Mach J. Р., Identification of Secretory IgA, Free Secretory
Р,есе and Serum IgA in the Ovine and Caprine Species, Immunochemist-
ry, 7, 679 686 (1970).
19. Kobayashi К, Studies оп Ниmап Secretory IgA. Comparative Studies оп
the IgA-Воuпd Secretory Piece and the Free Secretory Piece Protein Im-
munochemistry, 8, 785 800 (1971). '
20. Laтт М. Е., Greeпberg J., Ниmап Secretory Component. Comparison of
the Form Occuring in Exocrine Immunoglobulin А to the Free Form Bio-
chemistry, 11, 2744 2750 (1972). '
21. Piпcus С. S., Laтт М. Е., Nusseпzweig V., Regulation of the Нитап
Response: Suppressive and Enhancing Effects of Passively Administered
Antibody, J. ехр. Medicine, 133, 987 1003 (1971).
286 И. Брок
22. Mestecky J., Kulhavy R.., Kraus F. W., Studies оп Нитап Secretory Im-
munoglobulin А П. Subunit Structure, J. Immunology, 108, 738 747
(1972).
23. Mestecky J.. Zikan J., Butler W. Т., Immunoglobulin М and Secretory
Immunoglobulin А: Presence of а Соттоп Polypeptide Chain Different
from Light Chains, Science, 171, 1163 1165 (1971).
24. 5ell 5., IsoIation and Characterization of Rabbit colostraI IgA, Immuno-
chemistry, 4, 49 55 (1967),
25. Cebra J. J., R.obblпs J. В., )1A-Immunoglobulin from Rabbit Colostrum, J.
Immunology, 97, 12 24 (1966).
26. O'Daly J. А., Cebra J. J., Rabbit Secretory IgA. 1. IsoIation of Secretory
Component after Selective Dissociation of the Immunoglobulin, J. Immu-
nology, 107, 436 448 (1971).
27. Mach J. Р., Pahud J. J., Isliker Н., IgA with «Secretory Piece» in Bovine
Colostrum and Saliva, Nature, 223, 952 955 (1969).
28. Mach J. Р., Pahud J. J., Secretory IgA. А Major Immunoglobulin in
Most Bovine External Secretions, J. Immunology, 106, 552 563 (1971).
29. пипсап J. R.., Wilkie В. N.. Нiestaпd F., Wiпter А. J., ТЬе Serum and
Secretory Immunoglobulins of СаШе: Characterization and Quantitation,
J. Immunology, 108, 965 976 (1972).
30. 5veпdseп J., Bieпeпstock J., IsoIation of 11-S-IgА from Porcine Mi1k,
Biochim. biophysica Acta, 263, 775 778 (1972).
31. R.eyпolds J. У., Johnson J. 5., Canine 1mmunoglobulins. ПI. Distribution
of Immunoglobulins in Colostrum and Isolation of Secretory IgA and
7S )11, J. Immunology, 104, 1000 1008 (1970).
35. Выделение иммуноrлобулина М (IgM)
И.БРОК
35.1. ПРИНЦИП
В нормальной сыворотке иммуноrлобулина М, так же как
и IgA, HaMHoro меньше, чем IgG. Поэтому в качестве исход
Horo материала чаще Bcero используют сыворотку больных
макроrлобулинемией Вальденстрёма или сыворотку иммуни-
зированных животных. Основные методы фракционирова-
ния rель хроматоrрафия и зональный электрофорез. Вна-
чале часто осаждают эуrлобулины. Леrкие липопротеиды уда-
ляют с помощью сульфата декстрана и СаСI 2 .
35.2.
ВЫДЕЛЕНИЕ IgM
ИЗ СЫВОРОТКИ ЧЕЛОВЕКА [1, 2]
35.2.1.
Реаrепты и приборы
CaC1 2
Декстрансульфат
Полиэтиленrликоль (мол. вес 6000)
Сефадекс G-200 (или сефароза 4В, сефароза 6В, био
rель А 15 )
0,05 М фосфатный буфер с рН 7,2, содержащий 0,5 М NaCI
и 2 % бутанола
0,1 М вероналовый буфер с рН 8,6
Поливинилхлорид
Прибор для зональноrо электрофореза
Хроматоrрафическая колонка длиной 100 см
35.2.2. MeTOДRxa
Выделение проводится в четыре этапа:
1) удаление леrких липопротеидов: осаждение 0,5% HЫМ:
декстрансульфатом (мол. вес 560000) и 0,09 М CaC1 2 ;
2) осаждение макроrлобулинов при помощи 7,5 % Horo
(вес/объем) полиэтиленrликоля;
3) rель филырация растворенных макроrлобулинов на
сефадексе G-200, сефарозе 4В или бlю rеле А-15 в 0,05 М
фосфатном буфере с рН 7,2, содержащем 0,5 М NaCl и 2%
бутанола.
288 и. Брок
4) отделение а2-макроrлобулина от IgM при помощи зо-
нальноrо электрофореза (поливинилхлорид) в 0,1 М верона-
ловом буфере с рН 8,6.
35.2.3. Обсуждение
Наряду с нейтральными солями и орrаническими paCTBO
рителями для разделения белков применяют также водорас-
творимые полимеры. Наиболее подходящий из них Поли-
этиленrликоль с мол. весом 6000, так как он не денатуриру-
ет белки (табл.6).
Таблица б. Фракционирова/-ше сыворотки человека с помощью
полиэтиленzликоля [3]
КО!щентрацня полнэтиленI'ЛИКОЛЯ (в %. вес/объем).
при которой даlШЫЙ белок:
Белки
ПОЯВJJяется
в осадке
частично
находится в
надосадочной
жндкости
полиостью исчезает
из надосадочной
жидкости
а2- и (3-липопротеиды
IgM
а2- Мак роrлобулин
19G
IgA
fаптоrлобии
Трансферрин
а2 Л ипо протеид
з
2
4
3
3
4
3
3
4
4
10
9
12
12
15
15
5
6
12
12
14
Остаются в надо-
садочной жид-
кости при всех
испытанных кон-
центрациях (2
21 %)
Если воспользоваться rель-хроматоrрафией на био-rеле
А-15 в очень длинной колонке (3 м) или в рециклической
системе, то можно добиться частичноrо отделения IgM от
а2- мак роrлобулина и таким образом обойтись без зональноrо
электрофореза, поскольку первая часть пика IgM не содер-
жит а2-макроrлобулина [2,4].
Разработана также двухэтапная методика выделения IgM
из нормальной сыворотки с помощью rель-хроматоrрафии на
сефадексе G-200 и колоночноrо электрофореза: однако полу-
чаемый при этом препарат еще содержит следы а2-ЛИПОПРО-
теидов [5]. Выделение IgM из сыворотки (нормальной [6
9] или макроrлобулинемической [9 15]) часто начинают с
осаждения эуrлобулинов. Для этоrо сыворотку либо диали-
зуют против дистиллированной воды [6, 9, 10], 1/150 М
фосфатноrо буфера с рН 5,8 [11] или 0,002 М фосфатноrо
35. Выделение uммуноzлоБУЛiuна М (/gM) 289
буфера с рН 6,0 [8], либо разбавляют в 10 раз дистилли-
рованной водой [12, 13]. Осаждение нередко проводят He
сколько раз [10, 12 15]; после этоrо для окончательнои
очистки IgM из макроrлобулинемической сыворотки ДOCTa
точно провести rель-хроматоrрафию на сефадексе G 200
[13 15]. Кроме Toro, для выделения IgM при меняются уль
трацентрифуrирование [1, 6 9] и ионный обмен [8]. Раз
работаны также методы получения чистоrо IgM и концентра-
тов IgM при промышленном фракционировании сыворотки
[16, 17].
35.3. ВЫДЕЛЕНИЕ IgM
ИЗ КРОЛИЧЬЕй СЫВОРОТКИ
Кроличий IgM можно выделить с помощью метода, опи
caHHoro в разд. 35.2.2, или же воспользоваться следующей
методикой [18]:
Сыворотка (580 мл)
Осадить (NH 4 ) 2504 (0,35 насыщения) трижды
Осадок
1 Растворить в 144 мл 0,15 М NaCl, заморозить
( зо ОС), оттаять, профилыро'вать; улырацентри-
фуrировать 6,5 ч при 50 000 об/мин
Осадок
1 Растворить в 72 мл 0,15 М NaCl и наслоить на
ра,вный объем 2 М N aCl; центрифуrировать 11 ч
при 50 000 об/мин
Осадок
Растворить 'в 15 мл 0,15 М N aCl, прибавить 0,6 мл
10%-Horo декстрансульфата (мол. вес 2000000)
и 1,5 мл 1 М CaCl 2 ; центрифуrировать 15 мин, Ha
досадочную жидкость диализо'вать против 0,15 М
N aCl, центрифуrировать
Надосадочная жидкость
t Провести rель филырацию на сефадексе G-200
Пик IgM
I Сконцентрировать до 5 мл; провести колоночныЙ
электрофорез в теле сефадекса G-IOO в трис-r.1И-
циновом буфере с рН 8,6 (3 r трис и 14,4 r rлици-
, ,на на 1 л) .
30 Mr IgM
19 840
290 И. Бро1\,
УлырацеНТРИФУI:'ирование помоrает уменьшить примесь
IgG в препарате IgM и частично удалить липопротеиды. За-
мораживание оттаивание с последующей фильтрацией также
способствует удалению липопротеидов; полное их удаление
!Производят затем с помощью декстрансульфата и CaC1 2 .
Пре,J,варительное осаждение эуrлобулинов при выделении
кроличьеrо IgM неэффективно, поскольку этот IgM почти не
обнаруживается в осадке [18].
Друrой способ выделения IgM из кроличьей сыворотки
[19] представляет собой комбинацию методов, перечислен
ных ниже.
1. Двукратное высаливание (18% Na2S04),
2. Ионный обмен.
а) Фракционирование на ДЭАЭ-целлюлозе в 0,0175 М
фосфатном буфере с рН 6,9. Элюирование проводят 0,0175 М
фосфатным буфером (рН 6,9), содержащим вначале 0,1325 М
; aCl, а затем 0,1525 М NaCl.
.5) Фракцию, элюированную 0,0175 М фосфатным буфе
po с 0,1525 М NaCl, фракционируют на ДЭАЭ-целлюлозе
(4 П белка на 1 мл ионообменника) в 0,05 М трис буфере
с рН 8,6. Элюаты, выведенные стартовым буфером и 0,05 М
трис-буфером с рН 8,6, содержащим 0,1 М N aCl, концентри-
руют, а затем диализуют против 0,32 М NaCl с 0,001 М бо-
ратным буфером (рН 8,0) и наносят на колонку био-rеля
P 200 (2,5х 100 см).
3. Двукратная хроматоrрафия на бlю rеле P 200. Bocxo
дящая часть первоrо пика содержит иммуноэлектрофоретиче
ски чистыIй IgM.
'з5.4. ВЫДЕЛЕНИЕ IgM
ИЗ СЫВОРОТКИ друrих ЖИВОТНЫХ
Бычий (коровий) IgM выделяют из фракции эуrлобули-
нов сыворотки (или молозива). Эуrлобулины осаждают во
время диализа против 0,005 М фосфатноrо буфера с рН 6,0,
а затем фракционируют с помощью ионообменной xpOMaTO
трафии на ДЭАЭ-целлюлозе и rель-хроматоrрафии [20]. Пе-
ред нанесением на колонку ДЭАЭ-целлюлозы эуrлобулины
диализуют против 0,06 М фосфатноrо буфера с рН 7,0. Вна-
чале элюируют этим же буфером, затем 0,1 М и 0,2 М фос-
'фатными буферами с рН 6,0. Последний буфер выводит IgM,
](оторый дополнительно очищают двукратной rель хромато-
rрафией на сефадексе G 200 и зональным электрофорезом
.в певиконе [22].
IgM из лошадиной сыворотки выделяют таким же. спо-
собом.
35. Выделение иJ,t,uуноzлобулина М (/gM) 291
Таблица 7. Распределенuе uммуноzлобулинов в двух фракциях
элюата, llOлу'tенносо при zель-фильтрации
J,tblUlUHOU сыворотки 1
Распределение. %
Иммуноrлобулины
J-Й ПИК
2.й ПИК
IgA
Igr'l
IgG2
IgM
65 85
65
50 80
Следы
15 35
35
30 35
100
1) Условия фракционирования см. в тексте.
Препарат собачьеrо IgM, содержащий очень малую при--
месь друrих белков, был получен из эуrлобулиновой фрак
ции сыворотки с помощью rель-хроматоrрафии на сефадексе
G 200 после осаждения липопротеидов [23].
Из иммунной сыворотки :vIышей IgM можно получить пу-
тем rель филырации на сефадексах G-25 и G-200 и улыра
центрифуrирования [24]. Сначала 1 3 мл сыворотки HaHO
сят на колонку (2,5Х 100 c:vr) мелкозернистоrо или сверхмел
Koro сефадекса G-25, уравновешенноrо дистиллированной BO
дой или 0,0001 М фосфатным буфером с рН 7,0; затем Э.1Ю
ируют 0,01 М фосфатным буфером с рН 7,4, содержашим
0,15 М N аС! [24]. Сывороточные белки выходят дву:vrя от-
дельными пиками; распределение иммуноrлобулинов указано
в табл. 7.
Для дальнейшей очистки материа.н 2-ro пика Фракциони
руют на сефадексе G-200 в 0,1 М трис-НСI-буфере с рН 8,2,
содержащем 1 М N аСl. Первая половина l-ro лика состоит
из почти чистоrо IgM, лишь иноrда заrрязненноrо следами
щ-липопротеидов. Последующее улырацентрифуrирование в
сахарозном rрадиенте дает чистый IgM. Выход составляет
15 20%.
35.5. ЛИТЕРАТУРА
1, Chesebro В" Bloth В., Svehag S. Е., ТЬе Ultrastructure о! Normar and
Pathological IgM Immunoglobulins, J. ехр. Med., 127, 399 410 (1968).
2. Svehag S. Е., Chesebro В., Blotf В., Ultrastructure of IgM ImmunoO'lo-
bulins, ВиН. Soc. Chim biol., 50, 1013 1021 (1968). ь
3. Chesebro В., Svelrag S. Е., Prccipitation о! Нитап Serum Proteins Ь"
Polyethylene gIycol. СНп. chim. Acta, 20, 527 529 (1968). .
4. Chesebro В., Svehag S. Е., Biologic Activitv and MorpholoO'v 01 ТI1П:е
Types of Rabblt IgM Antibody Subunits, J. Immunology 102b-l064 1073
(1969) . ' ,
19*
292 И. Брок
5, Sсlщmасhеr к., Isolierung von 19 S-Antik6rpern durch Gelfjltration und
Sau'enelektrophorese, Юiп. Wschr., 45, 1045 1048 (1967).
6. Reisner С. А., Franklin Е. С., Studies of Mercaptoethanol Dissociated Nor-
таl Нитап 19S ".Globulin and Pathologic Macroglobulins У(от Patients
\\"ith Macroglobulinemia, J. Immunology, 87, 654 664 (1961).
7. \;'аеттаn J. Р., Heremans J. Р., Vaerman С., Studies оп the Immune Glo-
bulins of Нитап Serum. 1. А Method for the SimuItaneous Isоlаtiоп of
the Three Immune Globulins ("ss, "1М and "IА) from Individual SmalI
Serum Samp'es, J. Immuno'ogy, 91, 7 10 (1963). .
8. CllGplin Н., Cohen S., Press Е. М., Preparation and Properties of the
Peptide Chains of Norma' Ниmап 19S ,,-Globulin (IgM) , Вiocp.em. J.,
95, 256 261 (1965). .
9. Frangioпe В" Franklin Е. с., Structural Studies of Нumап Immunoglobu-
lins, Differences iп the Primary Structure of Heavy Chains of Normal
and Patho'ogic G, А and М ImmunoglobuIins, Arch. Biochem. Biophysics,
111, 603 613 (1965).
10. Dolder Р., А Method for pH Dependent Selective Reduction of Disulfide
Bonds in Нитап Immunoglobulin М Using Heterocyclic Compounds,
Biochim. biophys. Acta, 207, 286 296 (1970).
11. A1ichell А., /sliker Н., C'eavage of "M-G'obulin Ьу Means of Reducing
Enzyme Systems, Immunochemistry, 3, 385 392 (1966).
.12. Beale D" Feiпstein А., Studies оп the Reduction of а Нитап 19S Immu-
A1og'obulin М, Biochem. J., 112, 187 194 (1969).
"J3. Putnam Р. W" Kozuru М., Easley С. W., Structural Studies оп the Immu-
noglobulins. IV. Heavy and Light Chains of the "М Pathological Macro-
globLllins, J, biol. Chemistry, 242, 2435 2446 (1967).
14. Suzu!<.i Т., Deutsch Н. Р., Dissociation, Reaggregation and Subunit Struc
ture Studies of Some Нитап "M-Gl0Ьuliпs, J. biol. Chemistry, 242,
2725 2738 (1967).
15, Веnnеи J. С" Studies оп the Structura' Variation of the Н Chain of
Immunog'obulin М (IgM) , Arch. Вiochem. Вiophysics, 131, 551 560
(1969) .
] 6, Wickerhauser м., Нао У. L., Large Scale Preparation of Macroglobulins,
\'ох Sапg., 23, 119 125 (1972).
17. Heide к., Haupt Н., Darstellung посЬ nicht therapeutisch angewandter
Plasma-proteine, Behringwerk-Mifteilungen, 43, 161 193 (1964).
18. -иаn Dalen А., Seijen Н. О., ОтиЬет М., Isolation апd Some Properties of
Rabbit IgM Immunog'obulin, Biochim. biophys. Acta, 147, 421 426
(1967) .
J 9. McDonough R. J., /nтаn Р. Р., Method for the Preparation of Normal
Rabbit Serum Immunoglobulin М (IgM), Analyt. Biochemistry, 36, 495
504 (1970).
:20. Mach J. Р., Pahud J. J., Secretory IgA, А Major Immunoglobulin in Most
Bovine External Sесrеtiопs, J. Immunology, 106, 552 563 (1971).
:21. Pahud J. J., Mach J. Р., Equine Secretory IgA and Secretory Component,
Internat. Arch. Allergy, 42, 175 186 (1972).
:22. Duncan R., Wilkie В. N., Нiestand Р., Winter А. J., The Serum and Secre-
tory Immunoglobulins of СаШе: Characterization and Quantitation, J.
Immunology, 108, 965 976 (1972).
:23. Reynolds Н. У., Johnson J. S., Canine Immunoglobulins. III. Distribution
of Immunoglobulins in Colostrum and Isolation of Secretory IgA апd
7S "1, J. Immuno'ogy, 104, 1000 1008 (1970). .
24, Bazin Н., Savin М. С., Micklem Н. S., SeparatlOn of Mouse Immunoglo-
bulins оп the Basis of Water Solubility оп Sephadex G-25, J. Chroma-
togr., 34, 180 185 (1968).
36. Выделение иммуноrлобулина D (IgD)
И.БРОR
36.1. ПРИНЦИП
Выделение IgD из нормальной сыворотки задача весь-
ма трудная, так как он содержится в ничтожной KOHцeHTpa
ции (0,03 мrjмл) и мало отличается от друrих иммуноrлобу
линов по физико-химическим своЙствам [1]. Поэтому в Каче
стве исходноrо материала используют сыворотки больных с
IgD миеломами, встречающихся крайне редко. Миеломную
сыворотку фракционируют на ДЭАЭ-целлюлозе, элюируя
rрадиентом 0,01 М 0,3 М фосфатноrо буфера с рН 8,0, а
затем на сефадексе G-200 в 0,05 М трис-буфере с рН 8,0,
содержащем 0,2 М N aCl [2]. Для разработки методов выде-
ления IgD из больших объемов плазмы было изучено пове-
дение этоrо иммуноrлобулина при фракционировании суль-
фатом аммония, риванолом, этиловым опиртом, сульфатом и
ацетатом цинка [3].
36.2. ВЫДЕЛЕНИЕ IgD
ИЗ СЫВОРОТКИ Больноrо
с дисr АММАТЛОБУЛИНЕМИЕй [3]
Исходным материалом служила сыворотка больноrо с
дисrаммаrлобулинемией, содержавшая 1,04 Mr IgD в 1 мл;
концентрация IgM также была повышена (3,1 мrjмл); coдep
жание IgG достиrало 8,9 мrjмл; IgA не определялся. IgD
выделяли по следующей схеме:
Сыворотка
t (NH 4 ) 2504, 20% насыщения t
Осадок 1
Надосадочная жидкость 1
1 (NH4)2504, 50% насыщения !
Надосадочная
жидкость 11
Осадок Il
I Суспендировать в 0,2 М N aCl,
фракционировать на сефадексе G-200
,в 0,01 М фосфатном буфере, рН 8,0
(длина колонки 100 см)
294 И. Брак
Объединить фракции, содержащие IgD и IgM
I Бесколоночное фракционирование на
1 ДЭАЭ сефаде се А-50 'в 0,01 М фосфа'l1НОМ
буфере, рН 8,0
t
Фильтрат 1
Белки, адсорбированные
ионообмеННИКО:'1
1 Элюирование 0,075 М фосфатным буфером,
рН 8,0
t
Адсорбированные
белки
Фильтрат II (IgD)
I 0,2 М NaCl; установить рН 5,5 с помощью
j 1 н. HCl,
медленно добавить 1 М ацетат цинка дО KOH
центрации 0,05 М
t
Осадок III
Надосадочная жидкость III
1 Установить рН 7,2 с помощью t 1 н. NH 4 0H
Надосадочная
жидкость IV
Осадок IV
Суспеhдировать в 0,2 М NaCl,
прибавить 2 % N атЭДТ А, диа"lизовать против
0,01 М фосфа1'ноrо буфера, рН 8,0;
фракционировать на микроrранулярной
целлюлозе DE-52 (Whаtmап, Великобрита
1 ния), элюируя rрадиентом фосфатноrо буфе
ра 0,01 М 0,3 М, рН 8,0
Объединить
фракции, содержащие IgD
1 (NH4)2S04, 50% насышения t
Надосадочная
жидкость V
Осадок V
1 Растворить в 0,2 М NaCl и фракционировать
на сефадексе G-200 (длина колонки 100 см)
IgD
36. JЗbtделе uе .uммуноzлобулина D (l gD) 295
IgD
1 Обработать иммуносорбентом (n-аминобен-
зил целлюлозой, на которой иммобилизованы
антитела к IgG и IgM)
Фильтрат III (IgD)
36.3. ОБСУЖДЕНИЕ
При rель-хроматоrрафии на сефадексе G 200 IgM элюи-
руется в свободном объеме, за ним следуют IgD, IgE, IgA и
IgG [2]. За элюцией IgD наблюдают с помощью реакции
Ухтерлони или иммуноэлеКl'рофореза, пользуясь моноспеци-
фической антисывороткой. Чтобы получить такую антисыво-
ротку, животных продуцентов иммунизируют миеломным
IgD, затем иммунную сыворотку истощают IgG и сывороткоЙ
больноrо аrаммаrлобулинемией или небольшим количеством
нормальной сыворотки [1]. IgD часто распадается на фраr-
менты как при выделении из миеломной сыворотки (особенно
при хроматоrрафии на ДЭАЭ целлюлозе), так и при хране-
нии нормальной сыворотки.
36.4. ЛИТЕРАТУРА
1. Rowe D. 5., Fahey J. L., А New Class of Humal1 Immul1oglobulins. II.
Normal Serum IgD, J. ехр. Med" 121, 185 199 (1965).
2. Rowe п. 5., Dolder F" Welscher Н. п., Studies оп Ниmап IgD. 1. Molecu-
lar Weight and Sedimentation Coefficient, ImmuпосI1еmistп', 6, 437 443
(1969). .
3, Bratcher R, [" Fergusoп W. Е., Goldтaп А. 5., The Iso!ation and Charac
terization of IgD from Dysgammaglobulinemic Serum, Arcl1. Вiochem.
Biophysics, 148, 588 595 (1972).
37. Выделение иммуноrлобулина Е (IgE)
и. БРQI\
37.1. ПРИНЦИП
IgE выделяют из сыворотки больных аллерrическими за-
болеваниями, применяя ионообменную хроматоrрафию на
ДЭАЭ-целлюлозе и rель хроматоrрафию на сефадексе G-200.
IgE-миеломные сыворотки встречаются настолько редко, что
в качестве исходноrо материала практически не использу-
ются. Для выделения IgE из сыворотки аллерrиков можно
также воспользоваться анти-IgЕ-иммуносорбентом.
37.2. ПОЛУЧЕНИЕ КОНЦЕНТРАТА IgE
ИЗ СЫВОРОТКИ АЛЛЕРrиков [1, 2]
rлобулины сыворотки осаждают сульфатом аммония при
50 % насыщения и рН 7,0. Осадок диализуют против 0,005 М
фосфатноrо буфера с рН 8,0 и фракционируют на ДЭАЭ-цел-
люлозе. Для ступенчатоrо элюирования используют 0,005 М,
0,01 М и 0,025 М фосфатный буфер с рН 8,0. Последний бу-
фер выводит фракцию, содержащую реаrиновые антитела; их
очищают насефадексе G-200. IgE элюируется в восходящей
части пика. Рециклическая rель-хроматоrрафия на сефадек-
се G-200 позволяет в значительной степени очистить IgE от
примеси IgG.
37.3. ВЫДЕЛЕНИЕ IgE
ИЗ МИЕЛОМНОй СЫВОРОТКИ
Для выделения IgE из миеломной сыворотки используют
препаративный электрофорез [3], осаждение сульфатом нат-
рия (18 r на 100 мл) и rель-хроматоrрафию на сефадексе
G-150 [3], осаждение 'сульфатом аммония (50% насыще-
ния), хроматоrрафию на ДЭАЭ-сефадексе А-50 и сефадексе
G-200 [4].
37.4. ЛИТЕРАТУРА
1. 1 shizaka К" 1 shizaka Т., Lee Е. Н., Physicochemica! Properties of Reaginic
Antibody. II. Characteristic Properties of Reaginic Antibody Different
from Ниmап yA-Isоhеmаgg!utiпiп and yD Globulin, J. Allergy, 37, 336
349 (1966).
37. Выделение и.м.мУНD2Лобулина Е (lgE) 297
2. /shizaka К, /shizaka Т., Terry W. D., Antigenic Structure of )'E-Globulin
and Reaginic Antibody, J. Immunology, 99, 849 858 (1967).
3. Johaпsson 5. а. О., Bennich Н., Immunological Studies of ап Atypical
(Myeloma) ImmuпоglоЬuliп, Immunology, 13, 381 394 (1967).
4. Kochwa 5., Terry W. D., Capra J. D., Yang N. L., Structural Studies of
Immunoglobulin Е: 1. Physicochemical Studies оУ the IgE Molecule, Апп.
N. У. Acad. Sci., 190, 49 70 (1971).
38. Фраrмент:ирование иммуноrлобулинов
И.БРОК
38.1. ПРИНЦИП
Молекулы мономерных иммуноr.10булинов построены из
двух леrких и двух тяжелых полипептидных цепей, соединен-
ных дисульфидными мостиками. Расщепив межцепочечные
дисульфпдные связи, можно выделить цепи обоих типов. Ча-
ще Bcero для расщепления пользуются меркаптосоединения-
ми, но ero можно вызвать также сульфитом натрия в присут-
ствии Си 2 +. Пепсин, разрушая часть молекулы антитела, ос-
тавляет F (аЬ') 2-фраrмент. Папаин расщепляет антитело на
,/lееtrо.я 1.((?по ;{ и,//и А.
1
H 2 N
AtrтudHhl(? П/r /r
цвнт,Ры iМя
с6J13616анuя с пffff
онтиееНОAl
H 2 N
s s S 8
, , , ' co пипииH
s s s s s s s s s
I I I I I I I I 11
8S ',СНО СООН"" ТяжеtlТ6lt!
Н /СНО /' цепи
. , " ' , ,, СООН
s s s s s s s s s
8
. , "" COOH Пепсин
(UО=f'd+llеёКUЯ цеЛD, f'c
Fob' j'
пШUfJни'рНhlU" пептиl1
Рис. 80. Расщепление IgG с помощью папаИllа и пепсина [77]. сна yr.1C-
водные остатки, ПКК пирролидонкарбоновая кислота.
три части ДВа Fab-фраrмента (fragment antibody фраr-
мент антитела) и один Fс-фраrмент (fragment cristalline
кристаллизующийся фраrмент). FаЬсостоит из Fd-фраrмен-
та (fragment difficuIt тяжелый фраrмент, N-концевая часть
тяжелой цепи) и леrкой цепи. F (аЬ') 2 имеет константу седи-
ментации около 55 и мол. вес около 100000 и еще способен
преципитировать антиrены. При восстановлении F (аЬ') 2 по.
лучаются два одновалентных Fab'-фраrмента (3,55), кото-
рые, как и Fab, не дают преципитации с соответствующИМИ
антиrенами, но тормозят преципитацию в rомолоrичной С\l-
стеме (рис. 80).
38. ФраZАtентиР08ание иммуноzлобулиНО8 299
38.2. ВЫДЕЛЕНИЕ ЛЕrких И ТЯЖЕЛЫХ
ПЕПТИДНЫХ ЦЕПЕй IgG [1]
38.2.1. PeareHTbI и приборы
IgG
0,55 М трис-НС1-буфер, рН 8,2
Меркаптоэтанол
Иодацетамид (перекристаллизованный из этанола)
Триметиламин
0,15 М NaC1
1 н. пропионовая кислота
Сефадекс G-75
Хроматоrрафическая колонка 1 Х75 см
38.2.2. Расщепление IgG
. Берут 2%-ный раствор IgG в 0,55 М трис-НСl-буфере с
рН 8,2, деаэрируют ero с помощью водоструйноrо насоса,
чтобы избавиться от кислорода, и насыщают азотом. Затем
прибавляют меркаптоэтанол до конечной концентрации
0,75 М и оставляют на 1 ч при комнатной температуре. Дa
лее, охладив реакционную смесь в ледяной бане, добавляют
равный объем 0,75 М иодацетамида. Триметиламином ДOBO
дят рН смеси до 8,0. Через 1 ч проводят диаJ1ИЗ против
0,15 М NaCl при 4 ОС.
38.2.3.
Разделение леrких и тяжелых цепей
Восстановленный IgG диализуют против 1 н. пропионо
ВОЙ кислоты при 4 ос и разделяют леrкие (L) и тяжелые
(Н) цепи на сефадексе G 75 (длина колонки 75 см). Блаrо-
даря большему молекулярному весу тяжелые цепи появля-
ются в элюате раньше леr,ких, которые выходят вторым пи
ком. Элюаты концентрируют, проводят рехроматоrрафию на
сефадексе G-75 в 1 н. пропионовой кислоте, вновь KOHцeHT
рируют и диализуют против 0,15 М NaCl.
38.2.4. Обсуждение
Межцепочечные дисульфидные связи расщепляются мер-
ка,птоэтанолом. Реокисление предотвращает иодацетаМIIД.
Конечную концентрацию меркаптоэтанола в реакционной
смеси можно также доводить до 0,2 М [2, 3] или 0,1 М [4].
0,2 М меркаптоэтанол может расщепить IgM при 4 ос за 24 ч
[5], а при 30 ос за 1 ч [6]. Кроме меркаптоэтанола, для BOC
300 И. Брок
становления применяют и друrие мерка/птосоединения [7], в
частности дитиотреитол в конечной концентрации 0,1 М. Мо-
лярные соотношения добавляемоrо иодацетамида и ТИОЛовых
rрупп восстановителя MorYT быть различными, например 1: 1
[1], 1,1: 1 [7] или 2:,1 [4, 8]. Восстановление меркаптоэта-
нолом проводят также в присутствии денатурирующих areH-
тов, таких, как 8 М мочевина или 7 М rуанидинrидрохлорид
[9, 10]; при этом происходит не только разрыв межцепочеч-
ных дисульфидных связей, но и образование продуктов, нера-
створимых в обычном буфере. Именно эти продукты перехо-
дят в раствор в присутствии 6 М мочевины, 3 М rуанидинrид-
рохлорида, 50%-ной уксусной кислоты или 0,5 1%-Horo рас-
твора додецилсульфата натрия. Для хроматоrрафическоrо
разделения леrких и тяжелых цепей применяются среды, ко-
торые исключают их нековалентное взаимодействие, напри-
мер 1 М пропионовая или 1 М уксусная кислота. В 0,5 1,0 М
пропионовой кислоте, по данным rель-хроматоrрафии на се-
фадексе 0-200, леrкие цепи находятся в виде мономеров [11],
а тяжелые цепи в 1 н. пропионовой кислоте частично образу-
ют arperaTbI [2]. Можно. почти полностью исключить arpera-
цию тяжелых цепей, растворяя их в смеси 8 М мочевины и
1 н. пропионовой кислоты [2]. Зато в обычных буферах леr-
кие и особенно тяжелые цепи интенсивно аrреrируют в ре-
зультате нековалентных взаимодействий (так как после
реакции ос иодацетамидом ковалентное взаимодеЙствие с об-
разованием дисульфидныхсвязей невозможно). Например, в
0,004 М ацетатном буфере с рН 5,4 леrкие и тяжелые цепи
соединяются в димеры [7]. Если димеры обоих типов сме-
шать в том же буфере, то образуются целые молекулы IgG,
которые при нейтральном рН более не аrреrируioт. Они не
отличаются от нативноrо IgO ни при иммунодиффузии, ни
при ультрацентрифуrировании [7]. Рекомбинированные та-
ким образом антитела восстанавливают свою специфиче-
скую активность [4, 12]. Точно так же происходит реком-
бинация алкилированных цепей при диализе реакционной
смеси против нейтральноrо буфера [4]. Реком6инированный
IgO можно затем выделить на сефадексе 0-200. Возможна
рекомбинация леrких и тяжелых цепей IgO, принадлежащих
не только одному, но и разным видам животных [13]. Если
не алкилировать восстановленные меркаптоэтанолом цепи, то
произойдет реокисление и рекомбинация IgO с образованием
дисульфидных связей [4]. Эти рекомбинанты в отличие от
алкилированных не диссоциируют в пропионовой кислоте.
Еще один способ разрушения нековалентных межцепочечных
связей ацилирование е-аминоrрупп в OCTaTK X лизина. Аци-
лирование вызывает диссоциацию восстановленных мер кап-
38. ФраzменТUРО8анuе иММУlЮzлоБУЛUНО8 301.
тоэтанолом и алкилированных цепей [14 17]. После этоrо
цепи хороша растворяются в нейтральных буферах и леrко
фракционнруются в них при rель хроматоrрафии. Ацилира
вание произвадят с помощью малеиновоrо [14, 17] или ян
TapHoro [15, 16] анrидрида. Например, леrкие и тяжелые-
цепи IgM человека удалось разделить на сефадексе G-20Q..
в 0,01 М трис-буфере с рН 8,6, ,содержащем 0,1 М NaCl, па--
еле васстановления, алкилирования и малеилирования [14]_
Леrкие и тяжелые цепи кролИ'чьеrо IgO можно разделить на
сефадексе 0-100 в 0,01 М трис-буфере с рН 8,2 после сукци
нилирования [15], но только при невысоких канцентрациях
солей, так как иначе сукцинилированные цепи начинают ar
реrировать.
Расщепление дисульфидных связей под деЙствием N а 2 50 з
и Си Н происходит соrласно уравнению
RSSR + 2Cu2+ + 2S0; ( ) 2RSSO; + 2Cu+.
Эту реакцию провадят при комнатной температуре, рН
8,6 и постоянном перемешивании в течение 24 ч [18]. Р ас-
творяют 0,5 r белка в 70 мл буфера с рН 8,6 (0,5 М NH 4 Cl,
рН устанавливают концентрированным NН з ). К раствору
прибавляют 5 мл 0,1 М Си50 4 И 0,1 мл концентрираваннаrо
NH3. Установив рН смеси 8,6, довадят буфером ее объем до
80 мл. После этоrо добавляют 20 мл Toro же буфера, садер-
жащеrо 1,25 М N а 2 50 з , и аставляют 'с перемешиванием на
24 ч в закупореннам флакане. Затем фракцианируют на се-
фадексе 0-25 в 0,25 М аммоний-карбанатном буфере и BЫ
шедший белак лиофилизируют.
Антитела IGg «меркаптоэтанол-резистентны», т. е. coxpa
няют свою активность после обработки меркаптоэтаналам
тоrда как антитела IgM чувствительны к этаму peareHTY_
Чтобы дифференцировать эти два класса антител, исследуе
мую сыворотку обрабатывают 0,1 М меркаптаэтанолом в Te
чение 1 ч при 37 ос [19], а затем титруют опецифическую
активность. Па данным аналитическаrа улырацентрифуrиро-
вания, при воздействии 0,1 М меркаптоэтанола в течение 1 ч
при комнатной температуре в 1 М трис-6уфере с рН 8,6 и по
следующем алкилиравании иодацетамидом молекулы IgM
человека распадаются на субъединицы, имеющие константу
седиментации 6,75 и састоящие из двух тяжелых цепей (f.t
цепей) и двух леrких цепей, связанных некавалентна. При
низкой концентрации белка происходит дис,социация этих
субъединиц на 55-компоненты половинки четырехцепачеч-
ных субъединиц с мол. весом около 100000 [5, 20]. Диссо-
циация субъ иниц IgM происходит также в присутствии
302 И. Брок
разбавленной (1: 3) сыворотки человека или в растворе
альбумина (15 мr/мл). Восстановленный или алкилирован
ный IgG в тех же самых у,словиях не распадается На поло-
винки. Этим можно объяснить потерю антителами класса
19M аплютинирующей активности после восстановления [5].
.однако субъединицы IgM с ковалентно связанными -цепя-
ми и леrкими цепями сохраняют аrrлютинирующие СВойства
{21] .
С помощью 0,1 М меркаптоэтиламина можно расщепить
МО.1еку.пу кроличьеrо IgG на две половинки, состоящие из
одной леrкой 11 одной тяжелой цепи [22, 23]. Реакцию про-
водят в атмосфере азота при 37 ос в 0,1 М ацетатном буфере
с рН 5,0 в течение 75 мин. Меркаптоэтиламин удаляют затем
при помощи ионообменника при рН 5,0 на холоду. SН-rруп-
пы восстановленноrо белка инактивируют в избытке п хлор-
меркурибензоата, который после реакции удаляют диализом
против 0,025 М N aCI. Подкисление раствора 1 н. соляной
кислотой до рН 2,4 вызывает диссоциацию молекул на две
ПО.10ВИНКИ. 0,1 М меркаптоэтиламин ра,сщепляет более одной
дисульфидной связи на одну молекулу IgG [24], но длядис-
соuиации половинок в кислой среде достаточен разрыв толь
ко одной связи. Такой разрыв у части молекул IgG можко
вызвать 0,015 М меркаптоэтиламином [24]. Однако в ней-
тральной среде блаrодаря нековалентным связям половинки
вновь ассоциируют в целую молекулу [23, 25]. Если освобо-
дить блокированные SН-rруппы 0,1 М меркаптоэтиламином
(3 ч, 37 ОС) в 0,1 М ацетатном буфере с рН 4,5, а затем очи-
стить восстановленный белок на сефадексе G-25 (элюент:
0,1 М ацетатный буфер с рН 4,5), то при рН 8,0 произойдет
реокисление SН-rрупп с образованием S S-связей, которые
будут удерживать рекомбинированные молекулы IgG от дис-
социаци,И на половинки в кислой среде. После трехчасовоrо
реокисления при 37 ос и рН 8,0 остается только 32 % молекул
IgG, способных диссоциировать на половинки при рН 2,4
[22] .
Восстановление человеческоrо IgM 0,02 М меркаптоэтил-
амином в течение 30 мин при 30 ос в 0,1 М трие-буфере с
рН 8,0, содержащем 0,06 М NaCI, или 0,005 М меркаптоэтил-
амином в течение 4 ч при 4 ос расщепляет только те связи,
которые соединяют отдельные четырехцепочечные субъеди-
ниuы между собой [6]. Неалкилированные субъединицы сно-
ва объединятся в целую молекулу IgM, если реакционную
смесь подверrнуть диа.!1ИЗУ против сильно перемешиваемоrо
0,001 М натрий-боратноrо буфера с рН 8,0, содержащеrо
O,16MNaCI [6].'
38. ФраZ.меНТllрованuе llММУlЮzлобулинов 303
38.3.
38.3.1.
РАСЩЕПЛЕНИЕ ПАПА ИНОМ [26,27]
Реаrенты и приборы
Кроличий IgG
Меркурипапаин
0,01 М цистеин и 0,002 М N а2-ЭДТ А в 0,1 М натрий-фосфат
ном буфере с рН 7,0
0,1 М фосфатный буфер, рН 6,5
0,01 М ацетатный буфер, рН 5,5
0,9 М ацетатный буфер, рН 5,5
КМ-целлюлоза
Хроматоrрафическая кодонка 2,4Х35 см
38.3.2. Методика
Растворяют 150 Mr IgG и 1,5 Mr меркурипапаина в 10 мл
0,1 М натрий-фосфатноrо буфера с рН 7,0, содержащеrо
0,01 М цистеин и 0,002 М Nа2 ЭДТА. Инкубируют 16 ч при
37 ос и затем 48 ч диализуют против дистиллированной воды
при 4 ос, интенсивно перемешивая и часто меняя воду. После
0,7 1
Л
0,6
0,5
О,"
"ч ...
ИtI!
Рис. 81. Хроматоrрафия rИДРО.'Iизованноrо папа ином КРО.lичьеrо IgG на
к.М целлюлозе при элюировании rрадиентом концентрации ацетатноrо
буфера (рН 5,5) от 0,01 до 0,9 М [26].
этоrо проводят диализ против 0,01 М ацетатноrо буфера с
рН 5,5 и фракционируют продукты rидролиза на колонке
КМ-целлюлозы (2,4Х35 см), элюируя rрадиентом 0,01 M
0,9 М ацетатноrо буфера с рН 5,5 (рис. 81).
Чтобы избежать кристаллизации Fс-фраrментов, фракцио-
нирование проводят при комнатной температуре. В фракциях
304 И. Бро/С
"'
1 и II содержатся Fab-фраrменты различных молекул. IgG
.[28], а в фракции III Fс фраrменты. Способность F,с-фраr
ментов к кристаллизации особенно 'сильно проявляетсявбли
зи нейтральноrо рН (от 5,0 до 7,5). Их можно переКРИС1'ал
.лизовать, диализуя растворенную в 0,02 н. УК1СУСНОЙ КИслоте
,фракцию III против 0,1 М фосфатноrо буфера с рН 6,5 при
4 0 с.
38.3.3. Обсуждение
Для расщепления IgG на Fab и F,с-фраrменты применя-
ется как кристаллический [28], так инерастворимый [29]
папаин. Кристаллический папаин может быть в форме ртуть-
производноrо или в виде суспензии кристаллов. Для прекра
щения rидролиза либо производят окисление КИlслородом воз-
духа, либо добавляют в реакционную смесь N-этилмалеимид
[8], иодацетамид [30] или иодуксусную кислоту [31].
Скорость расщепления папаином IgG разных ,ВИДОВ. Becь
ма различна [32]. Fab- и Fс-фраrменты чело\веческоrо IgG не
удается разделить на КМ целлюлозе в указанных выше ус-
ловиях [32, 33], однако их фракционирование на этом ионо-
обменни,ке в принципе возможно [34]. Их можно разделять
на ДЭАЭ-целлюлозе, элюируя rрадиентом 0,007 М 0,7 М
фосфатноrо буфера с рН 7,7 [33]. Можно также добиться
избирательной адсорбции Fс фраrментов на ДЭАЭ целлюлозе
в 0,01 М [35] или 0,02 М [36] трис-буфере с рН 8,0 и сна-
чала элюировать FаЬ фраrменты, а затем с помощью 0,3 М
NaCl (рН 8,0) вывести Fс фраrменты [35]. Хороший выход
Fс-фраrментов нормальноrо человеческоrо IgG дает папаи-
новый rидролиз, продолжающиЙся 1,5 ч при 37 ос и рН 7,0
в присутствии 0,01 М цистеина и 0,002 М Nа2-ЭДТА. rидро-
лизат диализуют против 0,01 М фосфатноrо буфера с рН 7,6
и фракционируют на КМ целлюлозе. В первом пике выходят
Fc-, а во втором Fab-фраrменты, но обе фракции содержат
примесь IgG. Первый пик концентрируют и проводят кри-
сталлизацию Fc. Если маточный раствор фракционировать
На сефадексе O 200, можно выделить дополнительное коли-
чество F,c. Кристаллизацию Fc ,проводят в 0,2 М фосфатном
буфере с рН 7,6, диализуя маточный раствор против 0,002 М
фосфатноrо буфера при 4 ос [34]. Шестнадцатичасовой rИД-
ролиз, который применил Портер [26] для расщепления кро-
личьеrо IgG, вызывает распад значительной части человече-
CKoro IgG на низкомолекулярные фраrменты [28].
Цистеин при папаиновом rидролизе не только активиру-
ет фермент, но и влияет на конформацию субстрата [37],
восстанавливая дисульфидную 'связь между у цепями.
38. Фраzментирование иММУlЮzлобулинов 305
Восстанавливающий эффект цнстеина при протеолизе кро-
личьеrо IgG зависит от ero концентрации. Для полноrо вос-
становления требуется концентрация 0,02 0,05 М; 0,001 М
цистеин неэффективен. Было также показано, что при про-
должительном папаино,вом rидролизе (10 ч) происходит от-
щепление той области Fс-фраrмента, rде расположена меж-
цепочечная дисульфидная 'связь [31, 38]; особенно сильная
деrрадация Fc наблюдается при рН 4,5 5,0 [38].
Четыре подкласса человеческих IgG (IgGl, IgG2, IgG3 и
IgG4) различаются по своей чувствительности к папаиновому
rидролизу. Наиболее чувствителен IgG3, за ним следует
IgG1; наименее чувствительны IgG2 и IgG4 [34]. При rИk
ролизе в первую очередь разрушаются Fс-фраrменты чувст-
вительных подклассов. Через 18 ч их уже нельзя обнаружить
в rидролизате с помощью электрофореза в крахмальном re-
ле, хотя F,с-фраrменты устойчивых подклассов еще определя-
ются. Электрофорез rи:дролизата в крахмальном rеле дает
весьма rетероrенную картину. Fc чувствительных подклассов
при rидролизе без ЦИiстеина распадаются иначе, чем Fc pe
зистентноrо миеломноrо IgG [39], который в свою очередь
дает различные компоненты Fc в зависимости от присутствия
или отсутствия цистеина. При rидролизе с цистеином от Fc
человеческоrо IgG отщепляется небольшое количество Fc'-
фраrментов, обнаруживающих при электрофорезе такую же
reTeporeHHocTb, как и Fc [40]. F,с'-фраrмент представляет
собой нековалентно связанный димер [41] и при электрофо-
резе движется к аноду быстрее, чем Fc и Fab [30, 40]. По
данным разных авторов, Fс'-фраrменты имеют мол. вес
18000 [30] или 21 000 [41]. Их выделяют rель-хроматоrра-
фией rидролизата на сефадексе G-75 [30], путем сочетания
ионноrо обмена на KM и ДЭАЭ-целлюлозе [40] или с по
\Мощью колоночноrо электрофореза и rеЛЬ-ХРО!\Iатоrрафии на
сефадексе G-50 [41].
Fab-фраrмент, подобно целой молекуле IgG, под действи-
ем 0,1 или 0,2 М меркаптоэтанола распадается на леrкую
цепь и Fd фраrмент ['2, 8]. Fd выделяют на колонке сефадек-
са G-75 (длиной 120 см) в 1 н. пропионовой кислоте [2].
В этих условиях Fd кроличьеrо IgG элюируются вместе с
Fab; значит, они находятся в форме димеров. Однако в 8 М
фией rидролизата на сефадексе G-75 [30], путем сочетания
ют соответ,ственно 21 600 [42] и 40700. Fd человеческоrо
IgG отделяют от леrких цепей на сефадексе G-100 в 1 н. про
'пионовой кислоте [8]. Выделенные таким способом Fd Haxo
ДЯ'fiся, вероятно, в форме димеров и содержат примесь диме
ризованных леrких цепеЙ.
2O 840
306 И. Брок
Трипсин действует так же, как папаин [43] (рис. 82). Три-
птический rидролизат IgG человека, подобно папаиновому,
можно разделить на ДЭАЭ-целлюлозе, элюируя rрадиентом
0,007 0,7 М фосфатноrо буфера с рН 7,6 при комнатной
температуре. Для дальнейшей очистки при меняют сефадекс
G-75. Триптический rидролиз проводят при соотношении фер-
мент/субстрат 1: 50 в 0,1 М трис-НСl-буфере с рН 8,0, содер-
жащем 0,02 М CaC1 2 . Вместе с высокомолекулярными про-
межуточными продуктами в rидролизате появляются tFab,
J.t< J\I
/7,.,-,.,..
;;;;:: COOH
СООН
Jflfl
Трилсин I FCjL
1fI
lfI
I
lfI
СООН
tFc, tFab' и tFc' [44]. rидролиз прекращают через 16 ч, до-
бавив инrибитор трипсина. tFab и tFc соответствуют Fab. и
Fс-фраrментам, но отличаются от них по электрофоретиче-
ской подвижности и имеют мол. вес 52000. tFab' и tFc' явля-
ются продуктами расщепления tFab и tFc с мол. весом 28000.
Чувствительность отдельных подклассов IgG к триптическо-
му rидролизу, как и к папаиновому, различна [44].
Папа ин отщепляет от IgM фраrмент Fabf.1 [45]. Эти
фраrменты можно восстановить 0,1 М меркаптоэтанолом и
после а.1килирования разделить rеЛЬ-ХРOiмаТОIlрафией на 1 М
пропионовой кислоте на леrкие цепи и Fdf.1 [45]. При протеd-
лизе Fcf.1 очень быстро распадается на мелкие фраrменты
[46 48]; однако, сократив продолжительность rидролиза до
45 мин, можно выделить Fcf.1 неразрушенным [46]. С по-
мощью активированноrо папаина (разумеется, удалив цис"е-
ин) удалось получить пентамеры (Fc)sf.1 [49]. После воздей.
ствия трипсином на IgM человека при 37 ос можно выделиТЬ
38. Фраzментuрован.uе UА!муноzлобулuнов 301
фраrменты Fab 1. и F (аЬ') 2/1 [50]. Триптический rидролиз
IgM при 56 ос дает Fab/1 и (Fc) 5/1 [Ы 53]. Максимальный
ВЫХОД (F,c) 5/1 наблюдается при 30-минутном rидролизе, KOTO
рыЙ прекращают инrибитором трипсина. Полученные фраr-
менты разделяют на сефадексе G 200. В первом пике выхо-
дят (IFc) 511, во втором, большем пике содержатся Fabl1. Даль
неЙшую очистку фраrментов проводят на ДЭАЭ-целлюлозе
[51]. Мономер FC/1 получается при восстановлении (Fc) 5/1
0,004 М дитиотреитолом в мяrких УОIОВИЯХ с последующим
аЛКИЛJlрованием 0,01 М иодацетамидом [51]. F,c/1 отделяет'2Я
от невосстановленноrо (Fc) 5/1 ,на сефадексе G 200.
38.4.
38.4.1.
РАСЩЕПЛЕНИЕ ПЕПСИНОМ [54, 55]
PeareHTbl и приборы
Кроличьий IgG
Кристаллический пепсин
0,1 М ацетатный буфер, рН 4,5
1 н. NaOH
N a2S04
38.4.2. Методика
Растворяют 2 r кроличьеrо IgG в 76 мл 0,1 М ацетатноrо
буфера с рН 4,5, добавляют 20 Mr кристаллическоrо пепсина
и проводят rидролиз в течение 20 ч при 37 0 С. Затем peaK
ционнуюсмесь центрифуrируют, доводят рН надосадочной
жидкости до 8,0 с помощью 1 н. NaOH и медленно при ком-
натной температуре и постоянном перемешивании прибавля
ют раствор сульфата натрия (25 r/l00 мл); конечная KOHцeHT
рация должна быть 18 r/100 мл. Осадок отделяют центрифу-
rированием, растворяют в воде и диализуют против 0,1 Л1
ацетата натрия.
38.4.3.
Обсуждение
Пепсин отщепляет от IgG фраrмент F (аЬ') 2 с константой
седиментации 5S; остальная часть молекулы распадается на
низкомолекулярные пептиды. Как и при триптическом rидро
лизе, субстрат и пепсин чаще Bcero берут в соотношении 50:
: 1. Выделение F (аЬ') 2 также производится с помощью rель
фильтрации [8, 56, 57]. Сначала отделяют мелкие пептиды
на сефадексе G-I00 [56], а затем це,!Iые молекулы IgG
на сефадексе G 150. Потом F(ab')2 ОЧIIщают на КМ-
сефадексе C 25 в 0,02 М ацетатном буфере с рН 5,5 [56,
20*
З08 И. Брак
58]. При восстановлении 0,01 М меркаптоэтиламином в 0,1 М
ацетатном буфере с рН 5,0 в течение 75 мин фраrмент
F(ab')2 распадается на два одновалентных Fab'-фраrмента
(3,5 S) [54, 59]. Если пептический rидроли.з происходит в
присутствии 0,01 М цистеина, то вместо F(ab')2 сразу появ-
ляются фраrменты Fab' [55]. Окисляя неалкилированные
lfе.лО8еqе l СIi ;,:роциR
на cerpaiJe1fCe G 150
JgБ + F(a4,pF;;iieптuiJ6I
7 "РеЦUIr.l7Ulft?Clroп
re.l7h tpUtl'6тfJ°l(UJ1 )& хроиатоеjJOIfJUЯ
на cetpaol?trce на Cl?tpooeKce C .f/J
G 2 ОО J,лЮUfJоdонuе
n i iл . л л
} '-J
, Fi ь' pFc'
JgC,f(ab/z а Папаuн H 7, 7;" q
retlfh rp UtlfhтpOl(UJ1 на cet,'ooeKce
F::' П;;;;;;'UО6/
Рис. 83. Схема получения pFc' [61].
Fab', можно вновь получить F(ab')2 [54, 59]. При восста-
новлении 0,1 0,2 М меркаптоэтанолом Fab'-фраrменты рас-
падаются на леrкие цепи и Fd'-фраrменты [8, 60]. Fd' чело
веческоrо IgG имеет мол. вес 31500 [60]. Fd' отделяется от
леrких цепей rель-хроматоrрафией на сефадексе G-I00 в 0,1 М
уксусной или 1 М пролионовой кислоте с 6 М мочевиной.
Из пептическоrо rидролизата можно далее выделить pFc'
фраrмент с мол. весом 26000. Он ВЫХОДИТ Во втором нике
при rель-хроматоrрафии насефадексе G-150 и может быть
очищен рециклической хроматоrрафией на сефадек'се G-50.
Фраrмент pFc' нековалентно связанный димер. Папаии
расщепляет рРс' на Fс'-фраrмент и пептиды (рис, 83 и 84).
Пепсин rидролизует человеческий IgM до пептидов З3
48 ч. При менее продолжительном rидролизе обнаруживают-
ся F (аЬ") 2!l, распадающиеся затем на FаЬ'!l фраrменты [62].
Для выделения фраrментов можно использовать rель-хрома-
тоrрафию на сефадексе G-200. Иноrда их обозначают также
F(ab')2(1gM) и соответственно Fabpep (lgM) [63].
38. Фра ментированuе UММУ1Юzлобулинов 309
,
/
I
I
I
I
J
\. цепо
,
Fuo'--lf1раzмеНI11
:I:
Q
Q
f'с tpр(ииент
Рис. 84. pFc'- и Fс-фраrменты в структуре IgG [61].
38.5. РАСЩЕПЛЕНИЕ CEKPETOPHOrO IgA
[66, 67]
Секреторный IgA с константой седиментации IIS пред-
ставляет собой димер; он состоит из четырех а-цепей и четы-
рех леrких цепей. Кроме Toro, в ero составе имеются секре-
торный компонент и J-цепь. (Joining peptid соединяющий
пептид). J-цепь найдена в полимерных иммуноrл06улинах; со-
держащихся как в секретах, так и в сыворотке [64, 65].
38.5.1.
Выделение J мцепей
38.5.1.1.
Реаrепты и приборы
Человеческий S- IgA
Меркаптоэтанол, иодацетамид, трис НСl, триметиламин или
Nа2S0з, CUS04, NН 4 СljNН з
rуанидинrидрохлорид
Мочевина
NaCl
0,01 М фосфатный буфер с рН 9,0
Сефадекс G-200
ДЭАЭ-<:ефадекс А-50,
Хроматоrрафические колонки 2,5Х 100 см и 1,5Х30 см
310 И. Бро1С
38.5.1.2. Методика
Секреторный IgA человека расщепляют 0,2 М меркапто-
эта нолом с последующим алкилированием (см. 38.2). Pac
щепление можно произвести также сульфитом натрия (см.
38.2.4). При rель хроматоrрафии реакционной смеси на се-
фадексе G-200 в 5 М rуанидинrидрохлориде или насефадек
се G-I00 в 1 н. уксусной кислоте обычно получаются два
ПИКа.
Первый пик содержит два компонента с мол. весами
97000 и 64000 в соотношении 1: 4. Тяжелый компонент яв
.1яется секреторным, а леrкий а цепью. Во втором пике вы-
ходят леrкие цепи (мол. вес 23000) и J цепи. Их разделяют
ионообменной хроматоrрафией на ДЭАЭ-сефадексе A 50,
уравновешенном 0,01 М фосфатным буфером с рН 9,0, coдep
жащим 8 М мочевину. Для элюирования применяют линей-
ный rрадиент: 0,01 М фосфатный буфер (рН 9,0) с 8 М MO
чевиноЙ тот же буфер с 8 М мочевиной и 0,7 М NaCl.
38.5.1.3.
Обсуждение
Для выделения J-цепей полимерноrо ,сывороточноrо JgA
или IgM достаточно обработать иммуноrлобулины 0,1 М
меркаптоэтанолом; однако для выделения J цепей секретор-
}
д
.
0,6
1:::)
>(>
'"
"'А
Рис. 85. Выделение J цепей с помощью ионообменной хроматоrрафии на
:IЭАЭ сефадексе A 50 после S сульфонирования S-IgА [67].
Horo IgA концентрацию этоrо восстановителя необходимо
удвоить [68]. При расщеплении полимерных иммуноrлобу
линов меркаптоэтанолом 'с последующим алкилированием
J-цепи нелеrко очистить от примеси L-цепей [67]; это rораздо
проще сделать в том случае, если расщепление проводили
38. Фрае,,,ентuроваНllе и,,,,\tуноzлобулинов 311
путем окислительноrо сульфитолиза по описанной выше ме-
тодике. Разделение J- и L-цепей основано на различии за-
рядов, которое возникает как после сульфитолиза, так и
ПОС,llе восстановления и алкилирования. Фраrменты pac
щепленноrо сульфитом иммуноrлобулина можно сразу же
без предварительной rель-фильтрации нанести на колонку
ДЭАЭ-сефадекса А-50 и выделить чистые J-цепи. Элюиро
вание проводят с помощью rрадиента молярности NaCl от
О до 0,7 М в 0,01 М фосфатном буфере (рН 9,0) с 8 М
мочевиной. СекреторныЙ компонент, леrкие и тяжелые цепи
элюируются при этом одной фракцией (рис. 85).
Для разделения J- и L цепей можно воспользоваться так-
же диск-электрофорезом в присутствии 10 М мочевины. J це-
пи обладают большей электрофоретической подвижностью,
особенно после окислительноrо сульфитолиза [67]. Этим же
методом можно очистить J цепи восстановленноrо и алкили-
pOBaHHoro ceKpeTopHoro IgA кролика [69]. Кроме Toro, раз
деление J- и L-цепеЙ производят при помощи иммуносорб-
ции [68].
По данным диск электрофореза с додецилсульфатом нат-
рия, мол. вес J-цепей составляет 25400 [70] или 25700
[66]; однако по данным ультрацентрифуrирования в среде,
обеспечивающей диссоциацию, он равен 15000 [76]. J-цепи
ceKpeTopHoro IgA и ceKpeTopHoro IgM не различаются имму-
ноэлектрофоретически и имеют одинаковый аминокислотный
'состав [64].
38.5.2.
Выделение
ceHpeTopHoro номпонента [67]
38.5.2.1.
PeareHTbI и приборы
Исходный материал: фракция, содержащая тяжелые цепи
и секреторный компонент, получаемая при rеЛЬ-фIмырации
продуктов окислительноrо сульфитолиза ceKpeTopHoro IgA
человека (см. 38.5.1)
Сефадекс G-200
rуанидинrидрохлорид
Хроматоrрафическая колонка длиной 100 см
38.5.2.2. Методика
Для отделения ceKpeTopHoro компонента от тяжелых це-
пей исходный материал подверrают рециклической xpOMaTO
rрафии на сефадексе G-200 в 5 М rуанидинrидрохлориде.
Сначала выделяются arperaTbI тяжелых цепей, затем секре-
торный компонент, за которым следуют тяжелые цепи. Чи-
стоту ПО.тIученноrо. препарата проверяют при помощи Диск-
электрофореза [66].
38.5.2.3. Обсуждение
Еще одна схема выделения ceKperopHoro компонента IgA
представлена на рис. 86 [71].
Фраrменты восстановленноrо меркаптоэтанолом и алки-
лированноrо S-IgА человека можно также фраlкционировать
S I!1A
1
312 И. Бро1С
CerpoiJetre 6 1ии
6 О, 5 н.
пролuоно60tl
.киС.I!оте
I
CerpoiJelfc C 200
d o,fH! НоС!
о, 2 М jJ-Afерlfоптоjтонм, 2.1'''C, 121{
H цeпи .
СеlfреторНl.ш
Ifомпонент
.J ';nl qenl(
.... ПептuiJ6I
....... СеlfретОРН6II}
/rо",пояеят
Рис. 86. Одна из схем вы-
деления ceKpeTopHoro
компонента.
на колонке сефадекса G 200 (2,4Х 150 см) в трис-НСl-буфе-
ре с рН 8,0, 1-1===0,05, содержащем 1 М NaCl. При этом боль-
шая часть ceKpeTopHoro компонента выходит в третьем из
четырех пиков. Эту фракцию концентрируют и peXpoMaTorpa-
фируют на сефадексе G-200 дЛЯ удаления примеси а- и L ue
пей. После этоrо секреторный компонент дополнительно очи-
щают бесколоночной иммуноадсорбцией на иммобилизован-
ной кроличьей антисыворотке к миеломному IgA.
Перед выделением ceKpeTopHoro компонента можно произ-
вести расщепление S-IgА бромцианом. При этом сам секре-
торный компонент остается нерасщепленным, так как не со-
держит метионина [73]. В секретах встречается также не
связанный с IgA секреторный компонент; ero, например,
можно выделить из молозива [72 75] (рис. 87).
Свободный и связанный секреторный компонент имеет
одинаковый молекулярный вес, но ero оценки по данным
разных авторов расходятся: 58000 [71],75500 [72] и 97000
[66]. Секреторный компонент соединен с IgA в основном
88. Фраzментuрованuе uммуноzлобулuнов 313
дисульфидными связями, но В некоторой части молекул
S-IgА здесь имеются только нековалентные связи. При rель-
фильтрации S-IgА на сефадексе G-200 в 5 М rуанидинrидро
хлориде происходит диссоциация нековалентных связей, что
Мо.лОJu60
..
9iJo.ление жира и казеина
+
ДЭАЭ
.. 0,01 М НО -tpосtpатН6Ili Оff'lЩJ,рН 7,&
(Н14 '23/4 272/100м.л
.
HaiJocaiJolfHaJ1 жиiJкост6
+
/(М
1 rpaiJueHт Ha oцeтaтHOёO
0!Jtpepo с рН 5, О, от О, 005 00 0,5 М
о,5М
...................1 .....,
I { '1М NoCl
I I \
'1
,
Е
о,О05М
+
CetpaiJeKc 6 20!J, Tpиc HCl
рН 8,0 (ко.лонка 2,4 х fOОсм)
E l * *
, л:Ж: 9МU Н
40 50 60 70
ФраКlщи по 3м,л
Рис. 87. Очистка свободноrо ceKpeTopHoro компонента [72].
позволяет отделить (хотя и не в чистом виде) ту часть сек-
peTopHoro компонента, которая не присоединена дисульфид-
ными мостиками {66].
Кроличий секреторный компонент в отличие от человече-
cKoro соединяется с IgA только нековалентными связями
[65]. Поэтому он освобождается под действием 5 М rуани-
динrидрохлорида и в присутствии пос.педнеrо может быть вы-
делен rель-фильтрацией на сефадексе G-200. Получаемый
препарат еще содержит примесь леrких цепей [69].
38.6. ЛИТЕРАТУРА
1. Fleischтaпn J. В., Pain R. Н., Porter R. R., Reduction of V-GlоЬuIiпs,
Arch. Biochem. Вiophysics, Suppl., 1, 174 180 (1962).
2. Fleischтaпn J. В., Porter R. R., Press Е. М., The Arrangement of the
Peptide Chains in V-Globulins, Biochem. J., 88, 220 228 (1963).
314 И. Бро/С
3. Eyk Н. G. иаn, POTaO J., Preparation of the Peptide Chains of Normal
Нитап IgG, Acta chem. scand., 21, 866 872 (1967).
4. Oliпs D. Е., Edelman G. М., Reconstitution of 7S Molecules from L and Н
Polypeptide Chains of Antibodies and V-Globulins, J. ехр. Med., 119,
789 815 (1964).
5. Solheim В. G., Harboe М., ReversibIe Dissociation of Reduced and Alky-
lated IgG 5ubunits to Half Subunits, Immunochemistry, 9, 623 634
(1972) .
6. Mukkиr Т. К. S., lптаn F. Р., Spontaneous Reoxidation of the Subunits
of Immunoglobulin М (IgM), Immunology, 107, 705 714 (1971),
7. Steveпson G. Т., Dorrington К. J., The Recombination of Dimers of 1т-
munoglobulin Peptide Chains, Biochem. J., 118, 703 712 (1970).
8. Fougereau М., Edelman G. М., Corroboration of Recent Models of the
yG Immunoglobulin Моlесиlе, J. ехр. Med., 121, 373 393 (1965).
9. Edelman G. М., Poulik М. D., 5tudies оп 5tructural Units of the V-Globu-
lins, J. ехр. J\led" 113, 861 884 (1961). .. .
10. Small jr. Р. А., Lamm М. Е., Polypeptide of Rabbit Immunglobulins.
1. ,\,G-Immunoglobulin, Biochemistry, 5, '259 267 (1966).
11. Gally А., Edelman G. М., Protein Protein Interactions Among L Роlу-
peptide Chains of Bence-Jones Proteins and Нитап y-Globulins, J. ехр.
Med., 119, 817 836 (1964).
12. Edelman G. М., Oипs D. Е., Gally J. А., Zinder N. D., Reconstruction of
Immunologic Activity Ьу Interaction of Polypeptide Chains of Antibodies,
Proc. Natl. Acad. 5ci. И. 5., 50, 753 760 (1963).
13. Fougerau М., Olins D. Е., Edelmaп G. М., Reconstitution оУ Antiphage
Antibodies from L and Н Polypeptide Chains and the Formation оУ Inter-
species 1\10lecular Hybrids, J. ехр. Med., 120, 349 358 (1964).
14. Есоров А. М., Черняк В. Я" Дунаевский Я. Е., Шnаценко А.
(Egorov А. М., Chernyak У. Уа., Dunaevsky Уа. Е., Szpacenko А.),
А. 5tudy of the Structure of human VM-Globulin 5ubunits Ьу Maleylation,
Immunochemistry, 8, 1 165 1 173 (1971).
15. Leпard J., Singer S. J., Succinylation of Gamma Globulin, Nature, 220,
536 537 (1966).
16. Bezkorovaiпy А., Zschocke R., Grohlich D., The Dissociation ОУ Нитап
5erum 75 and Bovine Colostrum Immune Globulins into Subunits Ьу
Reduction Alkylation Succinylation, J. Immunology, 104, 648 655
(1970).
17. Bezkorovainy А., Grohlic! D., Maleylation of Bovine Colostral IgG and
Нитап Serum IgG, Immunochemistry, 9, 137 146 (1972).
18, Fraпek F., Zikan J., Limited Cleavage of Disulphide Bonds of Pig Gam-
ma-Globulin Ьу 5-5uIрhопаtiоп, Collect. Czech. Chem. Соmтип., 29,
1401 1412 (1964).
19. Wells J, V., Fudeпberg Н. Н., МасКау 1. R., Relation оУ the Нитап Anti-
body Response to FlаgеШп to Gm Genotype, J. Immunology, 107, 1505
1511 (1971).
20. EZOpOB А. М., Черня/С В. Я., Дунаевский Я. Е., rаврилова Е. М., Моисе-
ев В. Л. (Egorov А. М., Cherniak У. Уа., Dunaevsky Уа. Е., Gavrilo-
va Е. М., Moisseev У. L.), ReversibIe Dissociation of Reduced Subunits
of Нитап VM-Globulin into 5S Component, Immunochemistry, 8, 1 157
1163 (1971).
21. Сооре, А. G., Hemagglutinating 7S 5ubunits of 195 Cold Agglutinins,
5cience, 157, 933 935 (1967).
22. Stein S. R., Palmer J. L., Nisiпoff А., Reformation of Interchain Bonds
Linking Half-molecules of Rabbit V-G1obulin, J. Biol. Chem., 239, 2872
2877 (1964).
38. Фраzмен.тuрован.ие UАtмун.О2Лобулuн.ов 315
23. Palmer J. L., Nisoпoff А., Holde К. Е. van, Dissociation of Rabbit Gamma
Globulin into Subunits Ьу Reduction and Acidification, Proc. Natl. Acad.
Sci. U. S" 50, 314 321 (1963).
24. Palmer J. L., Nisonoff А., Dissociation of Rabbit y-Globulin into НаН.
Molecules after Reduction of опе Labile Disulfide Bond, Biochemistry, 3,
863 869 (1964).
25. Nisonoff А., Palmer J. L., Hybridisation of НаН Molecules of Rabbit Gam-
mа Globulin, Science, 143, 376 379 (1964).
26. Porter R. R., The Hydrolysis of Rabbit y-Globulin and Antibodies with
Crystalline Papain, Вiochem. J., 73, 119 127 (1959).
27. Porter R. R., Separation and Isolation of Fractions of Rabbit Gamma-
Globulin Containing the Antibody and Antigenic Combining Sites, I\'ature,
182, 670 671 (1958).
28. Gergely J., Stanworth D. R., Jefferis R" Normaпsell D. Е., Неnпеу С. 5.,
pardoe G. /., Structural Studies of Immunoglobulins, 1. ТЬе Role of Cys-
teine in Papain Hydrolysis, Immunochemistry, 4, 101 111 (1967).
29. Cebra J. J., Givol D., Silman Н. /., Каtсlшlski Е" А Two-stage Cleavage
of Rabbit y-Globulin Ьу а Water-iпsоlubIе Papain Preparation Follo\ved
Ьу Cysteine, J. Biol. СЬет., 236, 1720 1725 (1961).
30. Grey Н. М., АЬеl С. А., Structural Characteristics of the Fc' Fragment 01
Ниmап yG-GlоЬuliп, Immunochemistry, 4, 315 317 (1967),
31. /nтаn F. Р., Nisoniff А., ReversibIe Dissociation of Fragment Fc of RalJ-
bit yG-ImmuпоlgоЬuliп, J. Biol. СЬет., 241, 322 329 (1966).
32. Нisao S. Н., Putnam F. \\7" The Cleavage of Human y-Globulin Ьу Ра-
pain, J. Biol. Chem., 236, 122 135 (1961).
33. Edelmaп G. М., Hereman J. F., Heremans М. TI1., Kuпkel Н. О., Immu-
nological Studies of Ниmап y-Globulin Relation of the Precipitin Lines оУ
Whole y-Globulin to Those of the Fragments Produced Ьу Papain, J. ехр.
Med., 112, 203 223 (1960).
34. Sanderson А. R., Lanniпg М. G., Crystalline Fc prepared in High Yield
from Normal Нитап IgG, Nature, 226, 356 358 (1970).
35. Frangione В., Fraпklin Е, С., Fudenberg Н. Н., Koshlaпd М. Е., Structu-
ral Studies of Ниmап yG-Муеlоmа Proteins of Different Antigenic Sub-
groups and Genetic Specificities, J. ехр. Med., 124, 715 732 (1966).
36. Johnsoп R. L., Deutscll Н. F., Preparation and Studies оУ Муеl0та Fab
Subfractions, Immunochemistry, 7,207 215 (1970).
37. Medgyesi G. А., Gergely J., Structural Studies of Immunoglobulins.
III. Susceptibility of Human yG-GlоЬuliпs to Peptic Hydrolysis and Ра-
pain Sensitivity of F (аЬ')2 Fragments, Immunochemistry, 6, 473 479
(1969).
38. Utsumi S., Stepwise Cleavage of Rabbit Immunoglobulin G Ьу Papain and
Isolation of Four Types о! Biologically Active Fc Fragments, Biocl1em. J..
112, 343 355 (1969).
39. Poulik М. D., Shuster J., Role of Cysteine in the Production of Fc and
Рс Subcomponents of yG Myeloma Globulins, Nature, 207, 1092 1093
(1965) .
40. Poulik М. D., F'c Fragment оУ Immunoglobulins, Nature, 210, 133 134
(1966) .
41. Turner М. W., Bennich Н., Subfragments from the Fc Fragment of Human
Immunoglobulin G, Biochem. J., 107, 171 178 (1968).
42. Paiп R. Н., The Molecular Weights of the Peptide Chains оУ y-Globl1!in.
Biochem. J., 88, 234 239 (1963).
43. Schrohenloher R. Е., The Degradation of Нитап y-Globulin Ь" Trypsin,
Arch. Biochem. Biophysics, 1 О 1, 456 465 (1963). . .
44. Medgeysi О. А., Jakak М., Nagy М. С., Gergely J., Susceptibility of Ни-
mап yG Immunoglobulins to Tryptic Fragmentation, Acta Biochim. et
Biophys. Acad. Sci. Hung" 6, 405 414 (1971).
316 И. Брок
45. Goodman А., /nтаn F. Р., Structural Analysis of а Slowly Sedimenting
Proteolytic Fragment оС Нитап Immunoglobulin М, J. Immunology, 102,
1032 1041 (1969). .
46. Оnоие к., Кishimoto Т., Yamamura У., Papain Fragmentation of the, Sub-
units of Нитап Macroglobulin, J. Immunology, 98, 303 313 (1967).
47. Mihaesco С., Seligman М., Papain Digestion Fragments of Нитап IgM
Globulins, J. ехр. Med., 127, 431 453 (1968).
48. Clzen J. Р., Reiclzlin М., Tomasi Т. В., jr., Studies оп the Chymotrypsin С
and Papain Fragments of Нитап Immunoglobulin М, Biochemistry, 8,
2246........J2254 (1969).
49. Оnоие к., Кishimoto Т., Yamamura У., Structure of Нитап Immunoglo-
bulin М. П. Isolation of а High Molecular Weight Fc Fragment of IgM
Composed of Several Fc Subunits, J. Immunology, 100, 238 244 (1968).
50. МШе, F., Metzger Н., Characterization of а Нитап Macroglobulin.
II1. The Products оС Tryptic Digestion, J. Вiol. СЬет., 241, 1732 1740
(1966).
51. Ghose G. А., Comparative Conformational Studies оп the Tryptic Digesti-
оп Fragments of Нитап Immunoglobulins М and G, Вiochem. Biophys.
Res. Соттип., 45, 1144 1150 (1971).
52. Plaut А. G., Tomasi Т. В., jr., Immunoglobulin М: Pentameric Fcf.L Frag-
ments Released Ьу Trypsin at High Temperatures, Proc. Natl. Acad. Sci.
U. S., 65, 318 З22 (1970).
53. Paul с., Shimizu А., КдЫе, Н., Putnam F. W., Structure of the Нinge
Region of the Ми Heavy Chain of Нитап IgM Immunoglobulins, Science,
172, 69 72 (1971).
54. Mandy W. J., Rives М. М., Nisonoff А., Recombination of Univalent Sub-
units Derived from Rabbit Antibody, J. Biol. Chem., 236, 3221 3226
(1961). . .
55. Nisonoff А., Wisler F. С., иртаn L. N., Woernley D. L., Separation of
Univalent Fragments from Bivalent Rabbit Antibody Molecule Ьу Reduc-
tion of Disulfide Bonds, Arch. Biochem. Вiophys., 89, 230 244 (1960).
56. Fanger М. W., Smith D. а., ТЬе Oligosaccharide Units of Rabbit Immu-
noglobulin G, Multiple Carbohydrate Attachment Sites, Вiochem. J., 127,
757 765 (1972).
57. Kuenzle С. с., Pelloпi R. R., Weibel М. Н., The Purification of Peptic Ап-
tibody Fragments from Rabbit Immunoglobulin G, Experientia, 28, 1522
1523 (1972).
58. Mage М. а., Harrison Е. Т., А Comparison of the Labile Disu1fide Bonds
of Rabbit vG-ImmuпоglоЬuliп Fragments, Arch. Вiochem. BiopllYS., 113,
709 717 (1966).
59. Mandy W. J., Nisonoff А., Effect of Reduction of Several Disu1fide Bonds
оп the Properties and Recombination of Univalent Fragments of Rabbit
Antibody, J. Biol. СЬет., 238, 206 213 (1963).
60. Heimer R., The Fd'Fragment оС Нитап VG Immunoglobulin, Immuno-
chemistry, 3, 81 85 (1966).
61. Тите, М. W., Martensson L., Natvig J. В., Beпnich Н., Genetic (Gm)
Antigens associated with Subfragments from the Fc Fragment of Нитап
Immunoglobulin G, Nature, 221, 1166 1169 (1969).
62. Mihaesco С., Seligman М., Peptic Split Products of Нитап IgM Globu-
lins, Immunochemistry, 5, 457 469 (1968).
63. Kishimoto Т., Оnоие к., Yamamura У., Structure of Ниmап Immunoglo-
Ьиliп М. III. Pepsin Fragmentation of IgM, J. Immunology, 100, I032
1040 (1968).
64. Mestecky J., Zikan J., Виие, W. Т., Immunoglobulin М and Secretory
Immunoglobulin А: Presence of а Соттоп Polypeptide Chain Different
from Light Chains, Science, 171, 1163 1165 (1971).
38. Фраzментирование иммуноzлобулинов 317
65. Halperп М. S., Koshland М. Е., Novel Subunit in Secretory IgA, Nature,
228, 1276 1'278 (1970).
66, Mestecky J., Kulhavy R., Kraus R. W., Studies оп Ниmап Secretory Im-
munoglobulin А. П. Subunit structure, J. Immunology, 108, 738 747
(1972) .
67. Mestecky J., Zikan J., Butler W. Т., Kulhavy R., Studies of Нитап Secre-
tory Immunoglobulin А. IП. J Chain. Immunochemistry, 9, 883 890
(1972).
68. Morrison S. L., Koshland М. Е., Characterization of the J Chain from
Po]ymeric Immunoglobulins, Proc. Nat1. Acad. Sci. U. S., 69, 124 128
(1972).
69. O'Daly J. А., Cebra J. J., Rabbit Secretory IgA. 1. IsolaHon of Secretory
Component after Selective Dissociation of the Immunoglobulin, J. Im-
munology, 107, 436 448 (1971).
70. Kownatzki В., Studies оп а Fragment of Нитап IgM Macroglobulin Re-
lated to «J Chain», EUr. J Immunol., 1, 486 491 (1971).
7]. Tomasi Т. В. jr., Bieneпstock J., Secretory Immunoglobulins, in: Advan-
ces in Immunology, 9, 1 96 (1968). Hrsg.: F. J. Dixon and Н. G. Кип-
kel. Academic press New У ork London, 1968.
72. Kobayashi К, Studies оп Нитап Secretory IgA Comparative Studies оп
the IgA-Воuпd Secretory Piece and the Free Secretory Piece Protein, Im-
munochemistry, 8, 785 800 (1971).
73. Lamm М. Е., Greenberg J., Ниmап Secretory Component. Comparison of
the Form Occuring in Exocrin ImmunogIobulin А to the Free Form, Bio-
chemistry, 11, 2744 2750 (1972).
74. Mach J. Р., In vitro СотЫпаНоп of Нитап and Bovine Free Secretory
Component with IgA of Various Species, N ature, 228, 1278 (1970).
75. Brandtzaeg Р., Ниmап Secretory Immunog]obulins. 4. Quantitation af
Free Secretory Piece, Acta Pathol. Microbio]. Scand., 79,189 (1971).
76. Schrohenloher R. Е., Mestecki J., Stanton Т. Н., Molecular Weight af а
Ниmап J Chain, Biochim. biophys. Acta, 295, 576 (1973).
77. Putnam F. W., Science (1963),633.
78. Putnam F. W., Shimizu А., Раи! С., Shinoda Т., Fed. Proc., 91 (1972),
193.
39. Выделение
трансплантационных антиrенов
r. RЛА"УС, И. БРОR
39.1. ПРИНЦИП
Трансплантационными антиrенами или антиrенами тка-
невой совместимости (rистосовместимости) называют компо
ненты клеточной поверхности, способные вызвать у друrоrо
животноrо Toro же вида специфический иммунный ответ, при
водящий к отторжению ткани, пересаженной от первоrо жи-
BOTHoro второму. Наибольшее количество трансплантацион-
ных антиrенов содержится, по-видимому, в лимфоцитах, по
этому проще Bcero извлекать эти антиrены из .l1имфатиче-
ских узлов и селезенки. Существует несколько различных
способов выделения трансплантационных антиrенов: аутоли
тическое расщепление [1 3], папаиновый rидролиз [2, 4, 8,
11], обработка детерrентами [5, 7] и орrаническими раство-
рителями [6], ультразвуковая дезинтеrрация [9, 10] и co
левая экстракция [6, 12].
39.2.
ВЫДЕЛЕНИЕ
ТРАНСПЛАНТАЦИОННЫХ АнтиrЕНОВ
МЫШИ
(H 2 АнтиrЕНОВ) ИЗ ПЕЧЕНИ
39.2.1.
Реаrеиты и приборы
0,8%-ный раствор NaCl с рН 7,2
0,05 М трис НСl-буфер с рН 8,4
0,2 М трис (24,2 трис на 1 л)
(0,05 М трис-НСl-буфер приrотовляют, смешивая 14,3 мл
0,1 н. HCl с 25,0 мл 0,2 М трис и добавляя воды до 100 мл)
Папаин в вИде суспензии кристаллов
Цистеинrидрохлорид
Натриевая соль иодуксусной кислоты
Центрифуrа, ультрацентрифуrа, термостат, мешалка, rOMore
низатор Поттера
Печень нормальных мышей
39. Выделение ,трансплантационных aHTuzeHOB 319
39.2.2.
Методика
39.2.2.1.
Аутолиз
Свежеполученные или хранившиеся в замороженном со-
стоянии печени нормальных мышей взвешивают, заливают
прпмерно десятикратным объемом охлажденноrо во .чьду
0,8% -Horo раствора N aCl и измельчают вручную в rомоrени-
заторе Поттера. rOMoreHaT на 30 мин оставляют на мешалке
при 4 ОС, а затем 20 мин центрифуrируют (600 g) при той же
температуре. Надосадочную жидкость сливают, а осадок cyc
пендируют в исходном объеме 0,8% NaCl и rомоrенизируют
вновь. Затем повторяют получасовое перемешивание на хо-
лоду с последующим центрифуrированием при 600 g (4 ОС,
20 мин). Осадок выбрасывают, а вторую порцию надосадоч
ной жидкости объединяют 'с первой, центрифуrируют
120 мин при 105000 g и 4 ОС; надосадочную жидкость отбра-
сывают, а в осадке остаются фраrменты мембран, которые
подверrают аутолизу. Для этоrо осадок суспендируют в
0,05 М трис НСl-буфере с (рН 8,4), доводят концентрацию
белка, определяемую биуретовым методом, до 12 мr/м.п [1]
и оставляют на ночь на мешалке при 4 0 с. Затем материал
инкубируют 3 ч в водяной бане при 37 ос и центрифуrируют
120 мин при 105000 g и 4 0 с. Надосадочную жидкость, кото-
рая представляет собой экстракт солюбилизиро'ванных TpaHC
плантационных антиrенов, концентрируют, определяют содер-
жание в ней белка и активность в реакции торможения цито-
лиза.
39.2.2.2.
Обработка 'папаиНО 1
Осадок мембранных фраrментов, полученный при УЛьтра-
центрифуrировании, суспендируют в 0,05 М трис-НСl-буфере
с рН 8,4 точно так же, как для проведения аутолиза, добав-
ляют папаин в соотношении 1: 50 по белку и инкубируют
1 ч в водяной бане при 37 0 С. ДЛЯ активации папаина peaK
ционная смесь должна содержать цистеинrидрохлорид в ко-
нечной концентрации 0,01 М. rидролиз прекращают, добав
ляя натриевую соль иодуксусной кислоты В 1 О % HOM избыт
ке по отношению к цистеинrидрохлориду. После этоrо rидро-
лизат центрифуrируют 120 мин при 105000 g и 4 Ос. Солюби
лизированныепапаином трансплантационные антиrены содер-
жатся в надосадочной жидкости. Их концентрацию можно оп-
ределить по белку, а активность в реакции торможения ци-
толиза {2, 4].
320 Т. Клаус, И. Брок
Если трансплантационные антиrены выделяют из клеток
селезенки, то при rомоrенизации вначале используется 0,9%-
ный, а потом 0,7%-ный раствор NaCl. В остальном методика
выделения аналоrичная.
39.3. ОБЩАЯ ОЦЕНКА
Оба метода солюбилизации трансплантационных антиrе
нов дают препараты, заrрязненные друrими компонентами
мембран, но обладающие определенной активностью, как
можно убедиться в реакции торможения цитолиза или при
аллоиммунизации. Дальнейшую очистку трансплантационных
антиrенов проводят при помощи rель-хроматоrрафии, выса-
ливания и электрофореза в полиакриламидном rеле [13].
Папаиновый rидролиз эффективнее аутолиза [2, 4, 8], ко-
торый приводит К освобождению лишь 14% трансплантаци-
онных антиrенов [3]. Симада и Натенсон [2] рекомендовали
использовать папаин при выделении больших количеств ал-
лоантиrенов мыши для различных серолоrических и химиче-
ских исследований. Однако этот метод имеет, естественно,
свои недостатки: 1) папаин разрушает некоторые специфич-
ности Н-2 и HL-A; 2) папаиновый протеолиз лишен специфич-
ности, фермент расщепляет ковалентные пептидные связи с
образованием фраrментов различной величины [13].
Кроме Toro, используя папаин, необходимо каждый раз
подбирать оптимальное соотношение фермент/белок, так как
при избытке фермента разрушаются не только солюбилизи-
рованные антиrены, но и антиrены, еще связанные с мембра-
нами [2].
Детерrенты, в частности тритон Х-I00, обычно дают очень
небольшой выход трансплантационных антиrенов, так как
обработка ацетоном и эфиром, необходимая для удаления
детерrентов, снижает антиrенную активность экстракта [14].
Лучшие результаты получают,ся при использовании тритона
Х-114. На выход растворимых антиrенов при воздействии
ультразвуком влияют следующие условия [13]: частота и
интенсивность ультразвука; температура; концентрация кле-
ток в суспензии; дисперсность ,суспензии; время экспозиции.
Воздействие ультразвуком низкой интенсивности вызыва-
ет освобождение антиrенноrо материала, однако при ультра-
звуковой экстракции возможна денатурация белков и измене-
ние конформации молекул [13].
LLля проведения rипертонической солевой эк тракции 109
клеток ,суспендируют в 20 мл забуференноrо фосфатами фи-
зиолоrическоrо раствора N аСl,содержащеrо 3 М KCl, и ос-
тавляют на 16 ч. Вязкий экстракт центрифуrируют в течение
39. ,Выделение трансплантационных aHTuzeHOB 321
часа при 150000 g, диализуют против физиолоrическоrо рас-
твора N аС} и снова центрифуrируют [13, 18, 19]. Для опти-
мальноrо выхода трансплантационных антиrенов важно ис-
пользовать суспензию с высоким процентом живых клеток
[18] .
Солевая экстракция (3 М KCl) в отличие от улыразву
ковой разрушает внутренние структуры клеток с освобожд -
нием ядерной ДНК и нуклеопротеидов; кроме Toro, под деи-
ствием солей из поверхностной мембраны клеток экстраrиру-
ется меньше липопротеидов, чем при воздействии улыразву
ком.
Активность солюбилизированных трансплантационных aH
. "
тиrенов выявляют в реакции торможения цитолиза Ш ПеЛ)'
СО стандартной антпсывороткой [15, 18]. За единицу этой:
активности принимают то количество анти,rена в Mr, которое"
связывая цитотоксические антитела, снижает цитолитическуlO
активность стандартной антисыворотки на 50% [17].
39.4.
ЛИТЕРАТУРА
1. Halle-Panпeпko О., Martyre М. С., Mathe О., Prevention of graft versus-
host reaction Ьу donor pretreatment with solubIe H 2 antigens, Transplan
tation, 11, 414 416 (1971).
2. Shiтada А., Nathenson S. О., Murine histocompatibility-2 (Н-2) alloanti
gens: Purification and some chemical properties of soIubIe products from
H 2b and H-2 d genotypes released Ьу papain digestion of membrane
fractions, Biochemistry, 8, 4048 4067 (1969).
3. Nathenson S. О., Davies D. А. L., SоluЬШzаtiоп and partial purification
of mouse histocompatibility antigens from а membranous lipoprotein
fraction, Proc. Nat1. Acad. Sci. U. S., 56, 476 483 (1966).
4. Nathenson S. О., Shiтada А., Papain sоluЬШzаtiоп of mouse Н-2 isoanti
gens: ап improved method of wide аррliсаЬШtу, Transplantation, 6.
662 664 (1968).
5. Harris Т. N., Harris S., Ogburn С. А., Solubi1ization of H 2 histocompati-
Ыlitу antigens of the mouse Ьу Triton X 100 and butanol, Transplantation.
12, 448 458 (1971).
6. Hilgert 1., Sпell S. D., Resistance to skin grafts induced Ьу cell extracts
in congenic strain of mice differing from the donor at various поп-Н-2-1о
ci, Transplantation, 7, 40l 419 (1969).
7. Schwartz В. D., Nathensoп S. О., Isolation of Н-2 alloantigens solubi!ized
Ьу the detergent NP-40, J. Immunol., 107, 136 1367 (1971).
8. Shiтada А., Natheпsoп S. О., Solubi1ization of membrane Н-2 isoantf
gens: chromatographic separation of specifjcities determined Ьу а single
Н-2 genotype, B!ochem. biophys. es. Соmmип., 29, 828 833 (1967).
9. Kah n В. D".l!etsfelq R. А.: Chemlcal markers of transplantation indivi-
dual1ty solubl11zed wlth SОП1с energy, Bacteriol. Rev., 35, 59 85 (1971)..
10. Kahan.l!. D., Reisfeld R. А., Pellegrino М., Curtoni Е. S., Mattiuz Р. L..,
Cepelltnt. R., Water-sоlubIе human transplantation antigen, Proc. Natl..
Acad. SCl. U. S., 61, 897 904 (1968).
11. Gr?ff R. J;.. Мапn D. L., Na hensoп S. О., Immunogenic properties of pa
раш-sоluы11zеdd Н-2 alloantlgens, Transplantation, 10, 59 65 (1970).
21 840
322 Т.Клаус, И. Брок
12. Hilgert 1., Koubek К, Kristofova Н., Purification and immunogenicity of
Н-2 antigens, Proc. Symp. Immunogenetics of the Н-2 System, LibIice
Prague, 1970, 211 223, Karger, Basel, 1971.
13. R.eisfeld R.. А., Kahan В. D., Extraction and purificationof soluble histo-
compatibility antigens, Transplant. Rev., 6, 81 112 (1971). .
14. Hilgert 1., Kandutsch А. А., Cherry М., Snell О. D., Fractionation of mи-
rine Н-2 antigens with the use of detergents, Transplantation, 8, 451
(1969).
15. I'Пgzеll Н., Quantitative titrations of mouse Н-2 antibodies using Cr 51 la-
belled target cells, Transplantation, 3, 423 431 (1965).
16. Saпderson А. R., Cytotoxic reactions of mouse iso-antisera, Brit. J. ехр.
Pathol., 45, 398 408 (1965).
J 7. Hilgert 1., Kristofova Н., Stoyaпow S., Immunogenicity of various forms
of Н-2 antigens as detected Ьу the growth fate of ап allogenic tumor, Fo-
lia biol. (Praha), 17, 353 359 (1971).
18. R.eisteld R.. А., Pellegriпo М. А., in: Tfansplantation Antigens, Eds.,
КаЬап В. D., Reisfeld R. А., Academic Press, New York and London,
1972, S. 259.
J 9. Reisteld R. А., Pellegriпo М. А., Kahaп В. D., Salt extraction of solubIe
HL-A Antigens, Science, 172, 1134 1136 (1971).
40. Препаративная
электрофоретическаясортировка
лимфоцитов ..
r. Л. ИЕНСЕН
40.1. ПРИНЦИП
Препаративная сортировка иммунокомпетентных клеток
по функциональным свойствам с помощью так называеУ10rо
непрерывноrо свободноrо распределительноrо электрофореза
I I
Нипрtz6r/1еНllе потоки
gtpepH020 рост60ри
, +
L
I I
, t
,
I
I
:G<.
-
I
,
l
I
111 I Пli I
I i I
ОЫХООЯЩllе I{Jро/щuu
Рис. 88. Схема непрерыiзноrо свободноrо раСПределительноrо электрофо-
реза.
весьма эффективно используется для решения мноrих задач.
[6, 9].
Принцип метода заключается в следующем. СмешаННаЯ
взвесь клеток узкой струйкой движется вместе с ПОТОКОМi
21*
324 т-л. Иенсен
буферноrо раствора, пересекая силовые линии электрическо-
ro поля. При этом путь клеток, заряженных отрицательно
(C I. 27.2.5), образует с направлением потока среды уrол, ве-
.личина KOToporo зависит от электрофоретической подвижно-
'СТИ клеток и скорости потока. Электрофорез проводят в вер-
"Тикальной камере, в нижней части которой имеются отсеки
.для сбора отдельных фракций [2] (рис. 88).
Разрешающая способность метода, кроме упомянутых вы-
:ше параметров, определяется также напряженностью элект-
'рическоrо поля. Чтобы проводить электрофорез при достаточ
но высокой напряженности поля, приходится использовать
буферные растворы очень низкой ионной силы. Но это усло
-вие имеет физиолоrические rраницы. Ханних и сотр. [3, 5]
воспользовались принципом свободноrо распределительноrо
электрофореза для сортировки клеток и разработали соответ-
ствующий прибор [4]. Новейшей модификацией этоrо прибо-
pa является модель FF5 (Вепdеr & НоЬеiп, Мюнхен, ФРr).
rPазрешающая способность, производительность и воспроиз-
!Водим ость препаративноrо электрофореза клеток в последнее
щремя значительно возросли [12, 13].
40.2.
МЕТОДИКА
.40.2.1.
Реаrенты и приборы
Буферные растворы. В электродной системе и раздели
-тельной камере используется трис-цитратный или трис-rли-
щиновый буфер [1, 11] с ионной силой 0,03 0,05 при удель-
:ной электропроводимости около 0,001 См/см. Физиолоrиче-
,ский уровень осмолярности (0,31 осмоль) устанавливают с
1П0мощью сахарозы.
П рuборы. Для препаративной электрофоретической сорти-
])овки клеток до настоящеrо времени использовались «Elphor
'УаР II», «Elphor УаР IV» (Вепdеr & НоЬеiп GmbH, Мюнхен)
:или «Desaga FP4» (Desaga GmbH, rейдельберr, ФРr). Кро-
:ме прибора для электрофореза необходимы также прибор
.для определения электропроводимости, pH-метр и осмометр.
0.2.2.
Сортировка клеток
Процедуру сортировки клеток с помощью прибора «El-
-phor УаР IV» подробно описали Цейлер и сотр. [5, 7, 8, 11].
-Суспензию клеток лимфоидной ткани или лейкоцитарный
:концентрат крови центрифуrируют и клетки ресуспендируют
-m буфере для разделения. Сортировку проводят при 6 ос (тер-
1Моэ.лектрическое охлаждение, эффект Пельтье), рН 7,4 и на-
40. Л репаратшзная сортировка лимфоцитов 325
пряженности поля 50 100 В/см. С помощью перистальтиче-
CKoro насоса устанавливают необходиМЫЙ расход буфера, со-
ставляющий при сортировке лимфоцитов около 3 мл/ч. Каж-
дая клетка движется в электрическом поле примерно 4 мин.
Прибор сортирует 5.107 клеток в 1 ч. В указанных условиях
сортируемые клетки существенно не повреждаются. Опреде-
ление жизнеспособности с помощью трипановоrо синеrо по
казывает, что отдельные фракции исходной суспензии обыч
но содержат от 80 до 90 % живых клеток [1, 6].
40.3. ОБЩАЯ ОЦЕНКА МЕТОДА
Уже давно предполаrают, что существует тесная взаимо-
связь между функциональной активностью клетки и свойст
вами ее поверхностной мембраны. Поэтому при анализе
функции клеток сортировка по таким свойствам клеточной
поверхности, как электрический заряд или адrезивность, бо-
лее перспективна, чем разделение по объему или плотности.
Результаты аналитическоrо электрофореза клеток (см.
27.2.6) показывают, что существуют популяции лимфоцитов
с различной электрофоретической подвижностью. Препара-
тивный электрофорез позволяет выделить и изучить непосреk
ственно каждую из этих популяций [5]. Лимфоциты разных
opraHoB лимфоидной системы крыс и мышей дают орrаноспе
цифические профили электрофоретическоrо разделения [8].
Лимфоциты лимфатических узлов и селезенки распределяют-
ся на две примерно равные популяции клеток с высокой и с
низкой подвижностью. В костном мозrе и тимусе около 75 %
лимфоцитов малоподвижны, тоrда как лимфа содержит OT
носительно большее количество высокоподвижных клеток.
Решающее значение для оценки метода препаративноrо элек-
трофореза клеток имеет возможность разделения T и В лим-
фОЦИТOIв. Предпосылки TaKoro разделения были найдены при
помощи аналитическоrо варианта метода. Первый положи-
тельный результат при использовании описанноrо здесь Me
тода получили Цейлер и сотр. [10] и Нордлинr и сотр. [6].
Лимфоидные клетки из селезенки, KocTHoro мозrа и тимуса
мышей сортировали по электрофоретической подвижности,
определенные фракции снова объединяли и вводили летально
облученным синrенным реципиентам вместе с rетеролоrичны-
ми эритроцитами. Последующий анализ иммунноrо ответа
показал, что с помощью электрофореза удалось разделить
В- и Т-клетки. Т-лимфоциты были найдены в высокоподвиж
ных фракциях из селезенки и тимуса, тоrда как В-лимфоци
ты содержались в низкоподвижных фракциях из селезенки
и KocTHoro мозrа. Кроме Toro, среди высокоподвижных КЛе-
'1 . .Il.пeHceH
ток была найдена одна добавочная субпопуляция В лимфо
цитов, однако БИОJ10rическое значение ее пока не ясно [10].
Нордлинr [6] подтвердил эти данные, показав, что BЫCO
коподвижные клетки мышиной селезенки и лимфатических
узлов реаrируют в цитолитической реакции С сывороткой
анти Т и комплементом и нечувствительны к сыворотке анти-
В, а низкоподвижная наоборот. Кроме Toro, оказалось, что
высокоподвижные лимфоциты !вызывают РТПXI у rибридов
F 1 и поражают аллоrенные клетки-мишени после соответст-
вующей иммунизации.
Возможность препаративноrо разделения T и В-лимфоци-
тов не только позволяет продвинуться в изучении иммуните
та и толерантности, но и открывает новые перспективы в кли-
аической трансплантолоrии, например при переливании алло-
reHHoro KocTHoro мозrа. Отделение лимфоцитов, вызывающих
РТПХ, от стволовых клеток при помощи препаративноrо
электрофореза может в настоящее время облеrчить подбор
совместимых доноров. Первые успехи в этой области были
достиrнуты в эксперименте на мышах Цейлером и сотр. [9].
П репа ративная сортировка иммунокомпетентных клеток,
вероятно, окажется полезной и для иммунотерапии опухолей.
Недостаточную способность Т-лимфоцитов разрушать опухо-
левые клетки in vivo объясняют тормозящим действием цир-
кулирующих антител. Это препятствие можно было бы уст-
ранить, подавив функцию В-клеток и усилив таким образом
активность Т-клеток.
40.4.
ЛИТЕРАТУРА
1. Ganser М., Hanпig К, Krusmaпn W.-F., Pascher G., Ruhenstroth-
Bauer G., Zur Тrеппuпg vоп Вlutzеllеп iп der triigеrfrеiеп kопtiпuiеrli
сhеп Elektrophorese, Кliп. Wschr" 46 (1968), 809 814,
2. Haпnig К, Die АЫепkuпgsеlеktrорhоrеsе, Jahrbuch der Max-Planck-Ge-
sellschaft (1968), 116. .
З. Haпnig К, Krusmanп W.-F., Die Апwепduпg der triigеrfrеiеп kопtiпuiеr-
liсhеп Elektrophorese zur Аuftrеппuпg der wеiВеп Вlutzеllеп aus Нumап
bIut, Hoppe-Se!yer's Z. Physiol, Chem., 349 (1968), 161.
4. Hanпig К, iп: Gеrrtisеп Т. (ed,), «Моdеrп Sераrаtiоп Methods of Mak-
romolecules апd Particles», Уо!. 2, Jоhп Wiley & Sопs, Lопdоп, 1969, 45.
5. Haппig К, Zeiller К, Zur Аuftrеппuпg uпd Сhаrаktеrisiеruпg immun
kompetenter Zellen та Нilfе der triigerfreien AbIenkungselektrophorese,
Hoppe-Seyler's Z. Physio!. СЬет., 350 (1969),467.
6. Nordling 5., Anderssoп L. С., Hiiyry Р" Separation of Т- апd B-!ymрЬо-
cytes Ьу preparative се1l e!ectrophoresis, Ешор. J. Immunol, 2 (1972),
405 41 О.
7. Zeiller К, Pascher Р., Haппig К" Free-flow e!ectrophoresis: А new те-
thod for the elucidation of immunoIogica! events at the cellu!ar level,
Hoppe-Seyler's Z. Physiol. СЬет., 351 (1970), 435.
I Реакция трансплантата против хозяина.
40. П реnаратиВ1iаясортирОВка лимфоцитов 327
8. Zeiller К., Haппig к., Pascher а., Free-f1ow electrophoretic separation of
lymphocytes. Separation of graft versus host reactive Iymphocytes of
rat spleens, Hoppe-Seyler's Z. Physio1. СЬеm., 352 (1971), 1168 und
ebenda 1162.
9. Zeiller L., Praparative elektrophoretische Trennung von Lymphozyten,
Mitteilungen der Max-P1anck-Gesellschaft, Heft 1 (1972), 29 47.
10. Zeiller к., Holzberg Е., Pascher G., Haпnig к., Free-flow electrophoretic
separation of Т - and B-lymphocytes. Evidence for various subpopulations
of В cells, Hoppe-Seyler's Z. Physiol. СЬеm., 353 (1972), 105 110.
11. Zeiller К, Pascher G., Hannig К, Preparative electrophoretic separation
of antibody forming cells, Prep. Biochem., 2 (1972), 21 37.
12. Haпnig К, Wirth Н., Meyer В.-Н., Zeiller к., Free-flow electrophoresis 1:
Theoretical and experimentaI investiga tions of the efficiency of the те-
thod, Hoppe-Seyler's Z. Physiol. СЬет., 356 (1975), 1209 122З.
13. Zeiller К, Loser R., Pascher G., Н annig К., Free-flow electrophoresis П:
Analysis of the method \V.ith respect to prepaI"aiive сеll separation, Норре-
Seyler's Z. Physiol. Chem., 356 (1975),1225 1244.
41. Выделение rранулоцитов человеRа
r.ФРИR,З.ПРЕйСНЕР
41.1. ПРИНЦИП
Методы с использованием дедероновоео фильтра. Консер-
вированную кровь разбавляют и прибавляют к ней декстран
для инъекций, что приводит к оседанию эритроцитов. Из над-
осадочной плазмы с помощью дифференциальноrо центрифу-
rирования приrотовляют лейкоцитарный концентрат. [рану-
..10цитам, моноцитам и тромбоцитам дают возможность при-
липнуть к материалу с развитой поверхностью (дeдepOHOB
му фильтру). Затем эритроциты и лимфоциты смывают rепа
ринизированной плазмой. После этоrо с помощью раствора
ЭДТА связывают кальций и, вызвав тем самым отлипание
rранулоцитов от поверхности фильтра, смывают их.
Метод центрuфуzuрованuя в ерадиенте плотностu. Лейко-
цитарный концентрат наслаивают на среду, имеющую плот-
ность 1,077 rjмл. При центрифуrировании rранулоциты ВМе-
сте с эритроцитами оседают на дно пробирки, а тромбоциты,
:\IОНОЦИТЫ и лимфоциты остаются над rрадиентом плотности.
Вызвав rемолиз эритроцитов, получают очищенные rрануло-
циты.
41.2.
41.2.1.
МЕТОДИКА
Реаrенты и приборы
Те же самые peareHTbI и материалы, которые применяют
для выделения лимфоцитов (см. разд. 42). Кроме Toro, не-
обходимы: стеклянные бусы диаметром 1 4 мм (VEB Farb-
miihIеп Lauscha, rдр); раствор ЭДТА, свободный от СаН и
Mg2+ (N а2-этилендиаминтетраацетат 0,2 r, N aCl 8,0 r, КСl
0,2 r, Na 2 HP04 1,15 r, КН 2 РО 4 0,2 r, rлюкоза 0,2 r, бидистил-
лированная вода до 1000,0 r; стерилизовать паром, хранить
во флаконах для переливания крови); раствор хлористоrо
аммония 8,7 r/л.
41.2.2. Выделение rранулоцитов
с ПОМОЩЬЮ дедерововоrо фильтра
или стеклянных бус
Приrотовляют лейкоцитарный концентрат и КОЛОНКУ, как
указано в методике выделения лимфоцитов (см. 4.2.1). Вна-
чале смывают эритроциты и лимфоциты. Чем больше про-
41. Выделение zранулоцитов человека 329
мывающей среды пропускают через колонку, тем чище будет
фракция rранулоцитов. В качестве промывающей среды ис
пользуют разбавленную до 20% раствором Хенкса рекальци-
фицированную и rепаринизираванную плазму. Вслед за про-
мывающей средай через калонку по каплям пропускается
500 1000 мл раствора ЭДТА, в котором rранулоциты отли-
пают от поверхнасти фильтра или стеклянных бус и появля-
ются в виде беловатоrо памутнения в элюате. Элюат соби-
рают во флаканы для переливания крови и центрифуrируют
при 800 об/мин на центрифуrе К 70 в течение 10 20 мин в
зависимости от объема флаконов. Надасадоч.ную ЖИДКасть
отбрасывают. Осадак ачищенных rранулоцитав либо исполь-
зуют тотчас же для дальнейшей обработки или инъекций, ли-
бо суспендируют в 5 мл аутолоrичной сыворотки или плазмы.
41.2.3. Выдеп:евие rравуп:оцитов
в rрадиенте ПЛОТНОСТИ
Вначале все делается так же, как при выделении .1ИМфО-
ЦИта.в (см. 42.2.3). После центрифуrиравания с помощью
шприца и длинной иrлы из пробирки осторожно удаляют
плазму, затем слай тромбоцитов и лимфоцитов и наконец
rрадиент. Осевшие на дна эритроциты и rранулоциты суспен-
дируют в 0,87%-но.м растворе хлористаrо аммония. Чтобы
праизашел rемолиз, объем раствора хлористоrо аммония дол.
жен па крайней мере в 5 раз превышать объем асадка. Сус-
пензию оставляют на 10 мин при комнатной температуре, за-
тем центрифуrируют 5 мин при 800 об/мин на центрифуrе
Т 23. Надосадочную жидкость с продуктами rемолиза отса-
сывают. На дне центрифужной прабирки должен образавать.
ся зеленовата-желтый осадок rранулоцитов. Если, судя па
окраске, в осадке еще содержатся эритроциты, обработку
хлористым амманием повтаряют. Для иммунизации rpaHY-
лоциты отмывают забуференным изотоническим раствором
N aCl. При титровании антисывораток осадок rранулоцитав
ресуспендируют в аутолоrичнай сыворатке, а для более дли-
тельноrо сохранения в аутолоrичной цитратной плазме.
Результаты. В rрадиенте плотнасти из 400 мл крави мож.
но выделить (в среднем па данным 30 апытов) около 1.109
rранулоцитов 85% -ной чистоты. Основная примесь к суспен-
зии rранулоцитав аседающие вместе с ними тяжелые лим-
фоциты. При однократной обработке хларистым аммонием в
суспензии содержится (судя по окрашиванию трипановьп.f
синим) до 95% живых rранулоцитов.
Источники ошибок. Если и после повторной обрабатки
хлористым аммонием остается примесь эритрацитав, необха-
димо приrотовить свежий rемолитический раствор: MHora.
330 Т. ФРU". 3. П рейснер
кратная обработка rранулоцитов rемолитическим раствором,
потерявшим активность, может существенно снизить процент
жизнеспособных клеток.
Основная причина заrрязнения rранулоцитов лимфоцита-
ми и тромбоцитами заключается в аrреrации клеток. Тром-
боциты и лимфоциты MorYT прилипать к rранулоцитам и
оседать вместе с ними. Чтобы уменьшить аrломерацию кле-
ток, рекомендуется перед разделением добавить к лейкоци-
тарному концентрату 1/7 объема цитратноrо rемостабилиза-
тора.
При выделении rранулоцитов в rрадиенте плотности тре-
буется центробежное ускорение не менее 420 g. Как прави-
ло, выделенные таким образом клетки по данным метода
DF32pl имеют меньшую продолжительность жизни, чем rpa-
нулоциты в цельной крови или в суспензии, полученной на
сепараторе с центробежным ускорением 9 117 g.
41.3.
ОЦЕНКА МЕТОДА
Лимфоциты и rранулоциты человека являются объектом
исследования во мноrих областях: в биохимии, физиолоrии,
судебной медицине, серолоrии; в трансфузиолоrии лейкоци-
ты используются для диаrностики и терапии. Поэтому методы
их выделения привлекают большое внимание и продолжают
совершенствоваться. Задачи конкретных исследований, а так-
же стремление сократить стоимость и затраты времени по-
буждают создавать все новые модификации, улучшать и уп-
рощать методику.
Выбор Toro или иноrо метода определяется конечной
целью работы, так как в зависимости от требований к пре-
парату выделенных клеток можно либо пунктуально соблю-
дать все меры предосторожности, либо пренебречь ими. Не-
которые требования настолько общеприняты, что для ряда
поддающихся стандартизации методов целесообразно считать
их обязательными. В частности, очищенные лимфоциты и rpa-
нулоциты должны быть ПО возможности стерильными, жиз-
неспособными и не должны содержать эритроцитов, тромбо-
цитов или стромы этих клеток.
В описании мноrих методик выделения лейкоцитов вопрос
о полной стерильности остается без внимания. Тем не менее
она настолько важна в тех случаях, коrда речь идет о лре-
паратах для человека добровольноrо реципиента или боль-
Horo, что ее следует неуклонно соблюдать на всех этапах
1 Метод с использованием в качестве метки З2Р-диизопропилфторфос-
фата, который необратимо связывается с ХОJlинэстеразой лейкоцитов.
Прuм.. перев. .
41. Выделение ZРG.,НУЛОЦUТО8 чеЛО8(!ка 331:
методИки. Именно сохранение стерильности создает MHoro
численные добавочные трудности при решении научных и
практических задач, особенно при первых попытках воспро-
извести методику. Стерильность целесообразно соблюдать и
тоrда, коrда клетки Не предназначаются для инъекций чело-
веку, но должны сохранить жизнеапособность. Даже те пре-
параты клеток, которые сразу же после выделения rOMore-
низируют, все равно следует обрабатывать с осторожностью,
избеrая бактериальноrо заrрязнения, которое возможно, на-
пример, при добавлении ферментов. .
Не менее важно сохранить жизнеспособность клеток. 3Ha
чение этоrо требования более очевидно, чем значение стериль
ности, так как лишь в немноrих случаях известно, сколько
времени после rибели клеток исследуемые параметры оста-
ются неизменными. Определение жизнеспособности по иск-
лючению трипановоrо синеrо или эозина позволяет установить
только процент поrибших клеток, но не выявляет частично
поврежденные клетки [12, 23].
Чистота полученных лейкоцитарных суспензий зависит
от количества разделяемоrо материала. Сравнительно про-
сто ВЫделить в чистом виде, не считаясь с потерями, 106
107 клеток. Однако в настоящее время растет потребность в
переработке значительных объемов крови. В частности, все
большее количество материала требуется для аналитичес.коrо
изучения лейкоцитов. Для заместительной терапии очищен-
ными лейкоцитарными суспензиями тем более необходим про
мышленный масштаб разделения. В связи с этим источником
для выделения лейкоцитов все чаще становится консервиро-
ванная кровь. Друrой подход состоит в использовании кле-
точных сепараторов, с помощью ко"Торых можно относитель
но быстро выделить из крови доноров нужный вид лейкоци
тов. Однако полученные таким образом клеточные суспензии
по,ка еще приходится дополните.ТIЬНО очищать описанными
выше методами.
Методы выделения большоrо количества чистыхrрану-
лоцитов по уже упоминавшимся причина м должны OCHOBЫ
ваться на том же принципе, что и выделение лимфоцитов.
Если, предположим, необходимо получить равные количества
rранулоцитов и лимфоцитов, то при сходном выходе исполь
зуемых методов для выделения rранулоцитов потребуется
примерно в три раза меньше крови, чем для выделения люл
фоцитов.
Мноrие авторы начинают выделение rранулоцитов после
выделения из лейкоцитарноrо концентрата лимфоцитов. При
разделении, например, клеток с помощью развитой поверх-
ности,сМЫВ лимфоциты, можно продолжатр отмывание изо-
332 Т. Фри", 3. П рейснер
тоническим раствором, свободным от ионов кальция и Mar-
ния, до тех пор пока тромбоциты, нейтрофилы и моноциты
не утратят адrезивныхсвойств и не смоются элюентом, по-
добно лимфоцитам. Рабинович [37], разделяя лейкоциты на
колонке стеклянных бус, рекомендовал применять свободный
'от кальция и маrния раствор ЭДТА {37]. Однако в некото-
рых опытах чистота выделяемой суспензии нейтрофилов бы
па недостаточной. Это наблюдалось при использовании как
'предпочитаемоrо нами дедероновоrо фильтра, так и стеклян-
ных бус. Между тем Мейер и Бартлет [27] сообщили о хо-
роших 'результатах разделения лейкоцитов лошади с по
мощью стеклянных бус.
При разделении в rрадиенте плотности выделение rpaHY-
лоцитов естественно следует за выделением лимфоцитов. Для
этоrособирают слой клеток, осевших на дно пробирки. Эрит-
роциты удаol1ЯЮТ с помощью какоrо-либо из методов rемоли-
'за. Хотя rранулоциты, как известно, менее устойчивы к по-
вреждающему действию ионов аммония (по сравнению с лим-
фоцитами), для их выделения тоже рекомендуется применять
'обработку хлористым аммонием [10, 13, 25, 27, 28, 30]. Oд
нако интенсивная обработка rемолитическим раствором, не-
обходимая для устранения юных относительно резистентных
эритроцитов, почти не повреждая лимфоциты, сравнительно
быстро снижает жизнеспособность rранулоцитов [4, 9]. По-
добно Аrостони и Идео [1], а также Болланду и сотр. [4],
мы не рекомендуем обрабатывать хлористым аммонием ис-
ходную кровь [13]. Раствор хлористоrо аммония должен
быть свежеприrотовленным, и время ero контакта с лейко-
цитами не должно превышать 30 мин.
Еще одной важной причиной снижения жизнеспособности
транулоцитов при выделении в rрадиенте плотности может
'быть слишком большое ускорение во время центрифуrирова-
ния. Эрхардт и Дёрфлер рекомендовали не превышать
800 об/мин (165 g), так как большая скорость приводит, по
'данным фазово-контрастной микроскопии, к раз'рывам меж-
cerMeHTapHbIx мостиков [11]. Однако при получении лейкоци-
TapHoro концентрата с помощью дифференциальноrо центри
фуrирования, как правило, создают большее центробежное
ускорение порядка 260 g. А при центрифуrировании в rpa-
диенте плотности по Бёйюму нужная скорость (1900 об/мин.
520 g) HaMHoro превышает установленный предел. Как будет
'показано в следующем разделе, мы тем не менее добились
хороших результатов, выделяя rранулоциты при скорости
1700 об/мин (420 g), уменьшив вдвое (до 15 мин) время цeH
трифуrирования.
Список литературы см. 42.4.
42. Выделение лимфоцитов человека
r. ФРИR,3. ПРЕйСНЕР
42.1. ПРИНЦИП
Выделение с помощью дедеРОНО80с0 фильтра. Для осаж
дения эритроцитов консервированную кровь разбавляют и:
смешивают с раствором декстрана для инъекций. Из Haдoca
дочной плазмы дифференциальным центрифуrированием по
лучают лейкоцитарный концентрат. rранулоциты, МОНОllИТЫ
и тромбоциты прилипают к волокнам дедероновоrо крепа, а
эритроциты и лимфоциты остаются в суспензии. Примесь
эритроцитов разрушают rемолизом. Строму лизированных
эритроцитов и тромбоцитов удаляют дифференциальным цeH
трифуrированием.
Выделение 8 zрадиенте плотности. В за,висимости от соб
ственной плотности клетки либо проникают (если они тяже
лее), либо не проникают (если они леrче) сквозь слой rpa
диента, имеющий плотность 1,077 rjмл. Подкислив среду
до рН 6,5, предотвращают аrреrацию лимфоцитов с тромбо
цитами и rранулоцитами.
42.2. МЕТОДИКИ
42.2.1. Реаrепты и приборы
Флаконы для .перели,вания IКРОВИ (на 500, 300 и 120 IЛ);
флаконы 'с 011бортованным торлом 'на 20 ,мл, стер'илизованные
в автоклаве; система ,для 'взятия и переливания крови; сифон
для ,0'I'сасывания плаз'мы; стерильные шприцы (от 2 дО'
30 ,мл) и инъе ционные иrлы; модифицированные колонки
Либиха Кюлера (40х2,5 ом) с пришлифованной насадкой
Iподста l ндар1'НУЮ Пр()lбку от флакона для переливания 'крови;
дедероновый фильтр для получ'ения лимфоцитов, изrотовлен
,ный 'по ПреЙснер'У Фрику (J. und Е. Hartung, Mapкepc
дорф, [ДР); фазово-:контрастный ,микроскоп; ультратермо
,стат Хё'l1'плера; автоклав; цеНl1рифуrи К 70 и Т 23 (Janetzki
Энrельсщорф, [ДР); аппарат Сокелета (2 л); диталан WO
(VEB F,ettchemikalien, Карл-Маркс-штадт, rдр); 98% -ный
неденатурирО'ванный 9ТИЛО,ВЫЙ с,пирт.
Цитратный rемостабилизатор (тринатрий-цитрат 13,2 Т.
лим,онная кислота 4,8 r, rлюкоза 25,0 r, дистиллированная
вода до 1000 Iмл); инфуколл 6%...ный (VEB Serum \Verk,
334 Т. Фрик, З. Прейснер
Бернбурr, [ДР); фосфатный Iбуферс рН 7,2: 0,137 М NaCl
(8,01 r/л) , 0,01 М Na2HP04 (1,26 r/л), 0,003 М КН 2 РО 4
(0,36 r/.тI) ; раствор Хенкса (рН 7,4), стерилиз,ованный a BTO-
К.1авпрованием (Immunpraparate Berlin Weissensee, [ДР);
ВJ.яmие Ifpo6u
ф П,рllJИО,
соОеf1Жllщи.я
,реикоцит6,
i ' i . ; ;
@ Центf1Ш{l!lZU
OceiJllHue Р06иние
эритроцитоВ 260g 'f5иu 4 "с
.. +.
фg g
ФtliUКОН6I С
..2еиосmuоu,рUJаmором
и UНI{l!lКО,р.tlои
@. .
+reпupuH
. CaCt 2
@
Oo etJUHeHue ocodKa ,реикоцито6
6 осхоаН6Ifl концентрат
Рис. 89. Получение лейкоцитарноrо концентрата и очищенной от тромбо-
цитов П.lазмы, используемоЙ в качестве промывающеЙ среды.
1 н. NaOH; ifEшарин без ко'нсерванта (Gedeon Richter А. G.,
Бу;:щпешт); раствор хлористоrо аммония 8,7 r/л, стерилиз,о-
ванный в а'втоклаве; раствор трИ'пановоrо ,синеrо 0,25 r/л;
1/40 \1 раствор хлор,исто.rо ,кальция, >стерилизованный в авто-
клаве; визотраст 370 (VEB Fahlberg-List, Маrдебурr, r ДР):
к 10 частям визотраста прибавить 46 частей бидистиллиро-
ванноЙ воды, стерилизованной в автоклаве; плот'ность полу-
ченноЙ смеси 1,077 'r/мл.
42.2.2.
42.2.2.1.
Выделение лимфоцитов
с помощью дедероновоrо фильтра
Приrотовление лейкоцитарноrо нонцентрата
(рис. 89)
В два поллитровых флакона, каждыЙ из которых содер-
жит 125 !\IЛ заБУфf'ренноrо изотоническоrо раствора NaCI,
125 МЛ 6%-Horo инфуколла и 50 мл цитратноrо rемостабили-
затора, берут с помощью системы для переливания по 200 мл
.донорской крови. Тщательно перемешав, флаконы оставляют
42. Выделение лимфоцитов человека 335
при комнатной температуре в наклонном положении на 45
90 мин. '
Осевшие эритроциты можно слить в один флакон и ис
пользовать в ближайшие сутки для переливания как эритро
цитарную массу. Надосадочную жидкость как правило,.
около 350 мл стерильно сифонируют в 350 миллилитровые
флаконы и центрифуrируют в течение 20 мин на центрифуrе
К 70 при комнатной температуре и 260 g (1000 об/мин). За
тем надосадочную жидкость, за исключением 50 60 мл ca
Moro нижнеrо слоя, отсасывают и переносят в два друrих
350-миллилитровых флакона, которые центрифуrируют при
2000 g 20 мин при комнатной температуре для удаления
тромбоцитов. Осадок, полученный после первоrо центри.фу-
rирования, ресуспендируют в оставленной плазме и с,'!иваюr
в один флакон. Эта суспензия считается леЙкоцитарным KOH
центратом, из нее отбирают пробу для подсчета клеток и
лейкоцитарной формулы. К 100 120 мл концентрата добав
ляют 0,4 мл rепарина (2000 МЕ, без консерванта), чтобы
предотвратить свертывание; и 20 мл 1/40 М раствора хл:ори
<:Toro кальция (для рекальцификации).
300 мл плазмы, освобожденной от тромбоцитов при BTO
ром центрифуrировании, также rепаринизируют, затем pe
кальцифицируют и наrревают в термостате до 37 0 с. Она ис
пользуется в качестве промывающей среды при разделении
клеток на колонке. Оставшуюся часть плазмы рекальцифи
дируют, не добавляя rепарина; ее оста,вляют при 37 ос дЛЯ
свертывания и ретракции, чтобы получить аутолоrичную cы
воротку.
42.2.2.2.
Подrотовка 'колонок
Дедероновые фильтры замачивают на несколько часов J3;
диталане, трижды промывают водопроводной и трижды ди-
стиллированной водой, затем, дважды сливая элюент, экст
раrируют чистым этанолом в аппа'рате Сокслета. Высушив
остаточный этанол, путем растяжения возвращают филы
рам их первоначальную объемность и набивают ими колонки
Либиха Кюлера. Эту процедуру делают тщательно BЫ IЫTЫ
ми руками с помощью пластмассовой палочки. Колонки BMe
сте с пробками, насадками и кранами упаковывают в чистые
салфетки и автоклавируют в течение 45 мин при 120 0 С
(2 ати). После этоrо их закрепляют соответствующим обра-
зом и соеДИНЯЮТ с ультратермостатом (рис. 90). При этом
можно поставить в ряд батарею из нескольких колонок. Тер-
мостат устанавливают на 37 ОС. Сначала, еще до внесеНИ5f
лейкоцитарноrо концентрата, дедероновую ткань освобожда-:-
336 Т. Фрик, З. Лрейснер
ют ОТ пузырьков воздуха, подавая снизу стерильный раствор
Хенкса с рН 7,4, подведенным с помощью 1 н. N аОН. Этот
момент методики весьма важен; если им пренебречь, то Ha
несенный оверху лейкоцитарный концентрат будет стеКать
вниз только по увлажненным участкам ткани, минуя запол-
lIенные воздухом области, и поверхность фильтра не будет
'ИСПО.'IЬЗОВана полностью. После увлажнения фильтра лейко-
цитарный концентрат можно ввести в колонку через верх-
РостВор Хен"са
1. JoпO.llHeHUe КО,//ОНО/(
j}eiJepoHoBoti т"ОН61D
2. СтеРU,//lIЗОЦUЯ ларом
3. ПрuсоеiJинение "O,//OHOI(
" mepMocтamg
А
.
l=.;Fl
,I:;':;!
I
l' !
.,
;1 .:
---О....
. 3апО,//Нl?ние /(ОАОНОК
ростВором Хенксо
с рН 7,f
..
..
.'. .
!
r _
.' -
, .... -
'. ....
. - ' -
:.:' ".;;
.:} i.
.. t
-
Термостот
Рис. 90. Подrотовка разделяющих колонок
нюю пробку, ПОJIЬЗУЯСЬ закрытой системой для взятия кро-
ви. При этом по мере поступления концентрата в колонку
из нее снизу выводят раствор Хенкса.
2.2.2.3.
Разделение IшеТОI (рис. 91)
Введенный в колонку лейкоцитарный концентрат инкуби-
руют 30 мин при 37 ос, затем клетки элюируют с фильтра
nодоrретой промывающей средой (см. 42.2.2.1). Скорость ее
вытекания из колонки, реrулируемую выходным краном, до-
водят до 60 120 капель в 1 мин. За ходом элюирования на-
блюдают с помощью фазово контрастной микроскопии. Как
l'олько в элюате появляются нейтрофилы, элюирование пре-
кращают; однако такая необходимость возникает довольно
редко. Чаще Bcero элюирование заканчивают, коrда в поле
зрения будут видны лишь единичные лимфоциты.
Флаконы, содержащие смесь элюированных лимфоцитов
и эритроцитов, центрифуrируют 15 мин на центрифуrе I< 70
42. Выделение лиАlфоцитов ,человека 337
Прll 260 g (1000 об/мин). Для устранения эритроцитов к pe
суспендированному осадку прибавляют десятикратный объем
O,87% Horo раствора хлористоrо аммония и на 10 мин OCTaB
ляют при комнатной температуре для rемолиза. Затем, чтобы
осадить лимфоциты, rемолизат центрифуrируют 10 мин при
180 g (800 об/мин). Надосадочную жидкость отбрасывают.
А!lто.лоеи"еСКОIf
MOJMO
ТеРlИост6lPl
iii
{' %ii
....::..:.,
1
!
Тер'мостотиР!lЮЩОJ7
рУООШ/rО
Сте/r.лЯНН6!1?
О!lСЫ иди
DeiJepoнoffoJl
тКОН6
ц eHl!ljJUI/l'l2 UPOffOHUl'
. LJ reMOP"3
ОтмыВоние
Рис. 91. Фракционирование клеточных суспензий с помощью КО.'lонки, за-
полненной дедероновой тканью или стеклянными бусами.
СlИеС6
.лиlИtpоцито6 с
эритроцитами
Если выделенные лимфоциты необходимо тотчас использо-
вать для инъекций или сразу же подверrнуть дальнейшей об
работке, то второе отмывание производят с помощью забу-
ференноrо изотоническоrо раствора NaCl. При этом ускоре-
ние не должно превышать 180 g, чтобы тени эритроцитов и
тромбоциты остались в надосадочной жидкости. Если же
-очищенные лимфоциты будут использованы .ТIИШЬ через не-
которое время или их rотовят для реакций in vitro, то осадок
rемолизата необходимо ресуспендировать в аутолоrичной
плазме или сыворотке, освобожденной от тромбоцитов.
Далее измеряют объем конечноrо лимфоцитарноrо кон-
центрата, Оl1бирают пробы для мазка (подсчет формулы), Ka
MepHoro подсчета клеток и определения жизнеспособности.
22 840
338 Т. Фрик, З. Прейснер
42.2.2.4.
Результаты
Из 400 мл донорской крови В среднем (по данным. 197
фракционирований) удается выделить 3,2.108 лимфоцитов.
Если, например, исходная кровь сод ржит 6250 лейкоцитов
в 1 мм З , из которых 23% лимфоциты, то в 400 мл крови все.
ro насчитывается 5,75.108 лимфоцитов, т. е. выход разделе-
ния на дедероновом фильтре составляет 55%. Чистота полу-
ченнойсуспензии лимфоцитов достиrает 98 %; примесь
(2%) rлавным образом эозинофилы и базофилы, облада
ющие значительно меньшей адrезивностью, чем нейтрофилы.
Жизнеспособность выделенных клеток по данным исключе-
ния трипановоrо синеrо 98 %.
Несмотря на низкий выход, этот метод до сих пор пре-
восходит все друrие по чистоте. и жизнеспособности выделяе-
мых ЛИ:\1фОЦИТОВ.
42.2.3.
Выделение лимфоцитов
в rрадиенте плотности (рис. 92)
Лейкоцитарный концентрат приrотовляют либо так же,
как описано в 42.2.2.1, либо берут меньшее количество крови.
Затем ero наслаивают на равный объем визотраста в малень-
ком флаконе; это делают медленно, наклонив флакон и избе-
tая пере).1ешивания.
При выделении лимфоцитов из малых объемов крови (от
2 до 10 мл) rепаринизированную кровь (2 капли rепарина
на 10 мл крови) вдвое разбавляют изотоническим раствором
N aCl и перемешивают. Эту смесь сразу же, не отделяя эрит-
роцитов, :медленно наслаивают на равный объем визотраста
в стерильном флаконе. Затем флакон центрифуrируют 15 мин
при 420 g (1700 об/мин на центрифуrе Т 23). В результате
лимфоциты занимают положение в середине флакона над
слоем визотраста в виде беловатоrо кольца. Над лимфоцита-
ми находится диффузный мутный слой тромбоцитов, а еще
выше прозрачная плазма. На Дне флакона собираются эри-
троциты и rранулоциты. В ,слое расположенноrо над ними ви-
зотраста находятся в виде леrкоrо помутнения arperaTbI rpa-
нулоцитов с тромбоцитами и лимфоцитами. Пользуясь шпри-
цем с длинной иrлой, отсасывают лежащие сверху слои
плазмы и тромбоцитов. При отсасывании нужно соблюдать
максимальную осторожность, чтобы не вызвать перемеШlIва-
ния. Центрифуrируя при 3000 об/мин на Т 23, плазму осво-
бождают от тромбоцитов. Затем отсасывают слоЙ лимфоци-
тов, который неизбежно будет содержать примесь ВIIзоrрасrа
и тромбоцитов. Чтобы отмыть примеси, ero смешивают с ос-
42. Выделение лижфоцитов человека 339
воБQ)кденной от тромбоцитов плазмоЙ и центрифуrируют
10 :\ШН при 145 g (1000 об/мин на Т 23). Надосадочную жид-
кость отбрасывают, а осадок суспендируют в нужном объеме
свободной от тромбоцитов плазмы или друrой подходящей
среды.
Полученная таким образом ВЗlвесь лимфоцитов еще содер-
жит значительную примесь тромбоцитов. Если нужно умень-
Пr/10Jиа,
со8ержощо.я
tI1еuкоцuти
+ ,s'ifн
/(р0611 tjfDUrc Но ростВор
IlHtp!/KO.l!t116"/o 6uJoтpocmo
и.р. NtlC!f:t 370
Лr/10тност6l0
2/5 3/5 f.{176З/АМ
(ЛО ооъем!/)
....;.
...
'.'
OmM6I!loHue ,n::;/
170000/иин .пUМl/lоцuтоfl lOulJ Ои/МНН,
I fjИUN ug ,".юнJ fDиuн
nrl10ЗМОU oeJ
тромооцuто!l
II I
Ocallolr
r/1uиtpОl(uто6
peCfjCneHdu
H08oco8ol/H!/1O pglOт!l 5 и.л
жи8костl1 Лr/10ЗМ61
отОРОС6160lOт
Jрuтроцuт61
2емо.пU.Juр!/ют
0,87;% NI4Cl,
tOMUH
8lJlJ ОО/МОН Осооок
HoiJocOiJOl/H!l1O арОНf/rI10цuт06
жuIlкост6 ресусnеНIlНРУlPт
отОРОС61!lоют В 5 мд n.лО.Jмы
Рис. 92. Схема разделения клеток крови в rраДИенте плотности (один из
вариантов). цrс цитратный rемостабилизатор; И.р. изотонический
раствор; КТ комнатная температура.
шить эту примесь, рекомендуется добавить к лейкоцитарно-
му концентрату перед наслаиванием на визотраст 1/7 объема
цитратноrо rемостабилизаТО'Ра, которыЙ снюкает адrезив
ность и вызывает дезаrреrацию тромбоцитов. Дальнейшие
этапы разделения те же самые.
Результаты. На основании 30 опытов разделения можно
утверждать, что методом rрадиента Плотности выделяется до
88% мононуклеарных лейкоцитов. При подсчете леЙкоцитар-
ной формулы в выделенной суспензии находят 81 % лимфо-
цитов, 16% моноцитов и 3% нейтрофи.тrов. Жизнеспособность
клеток по данным исключения трипановоrо синеrо составляет
98%. .
22*
З4О Т. Фрик, З. Прейснер
42.3. ОБЩАЯ ОЦЕНКА МЕТОДОВ
Причиной ПОЯlвления нейтрофилов в лимфоцитарной сус-
пензии, очищенной с помощью дедероновоrо фильтра, может
быть либо не удаленный при отмывании к'репа детерrент, ли-
бо скрытая инфекция у донора крови. В очень редких случа-
ях это может произойти при синдроме функциональной недо-
статочности лейкоцитов (<<lazy leukocytes), при котором их
способность прилипать к поверхности понижена. Примесь
нейтрофилов обязательно появится также, если не провести
рекальцификацию или же применить токсичный или консер-
вированный фенолом rепа'рин. В то же время отклонение от
нужной температуры инкубации, например снижение темпе-
ратуры из за неисправности термостата, не оказывает столь
выражен.ноrо эффекта.
Если разделение в rрадиенте плотности производится в
20-миллилитровом флаконе, то лейкоцитарный концентрат не
должен содержать более 150000 клеток ,в 1 мм 3 , иначе rpa-
диент будет заблокирован слишком rycTbIM слоем лимфоци-
тов, среди которых уве.ПИЧИТСЯ остаточная примесь rрануло-
цитов и даже эритроцитов. Это может произойти и при раз-
делении разбавленноrо лейкоконцентрата, содержащеrо вы-
сокий процент лимфоцитов, например полученноrо от боль-
Horo хроническим лимфолейкозом.
При разделении rycTbIx лейкоцитарных концентратов, со-
держащих незрелые клетки, также следует ожидать появле-
ния значительной примеси миелоидных элеМ6НТОВ.
Для удаления моноцитов и примеси rранулоцитов реко-
мендуется профильтровать полученную лимфоцитарную
взвесь через небольшой дедероновый фильтр или столбик
ваты. Если после этоrо промыть фильтрующий материал рас-
твором ЭДТ А, то можно элюировать определенное количе-
ство моноцитов.
В настоящее время существует MHoro способов получения
лимфоцитов. Индукция стерильноrо перитонита, столь эффек-
тивная в опытах на животных, не может быть рекомендова-
на, коrда речь идет о лимфоцитах человека [20, 25, 32, 34].
'Однако не следует пренебреrать таким источником мононук-
'леаров, как стерильные эксудаты и транссудаты, образую-
щиеся, например, при сердечном или портальном застое.
Правда, при использовании этоrо источника возникают мно-
rочисленные проблемы, связанные с получением, стерильно-
стью и жизнеспособностью клеток, а также необходимостью
'дальнейшей их очистки. Еще одним источником лимфоцитов
в принципе MorYT быть культуры лимфобластов. Но этот ме-
тод только тоrда становится экономически оправданным. Kor-
42. 'выделение ли.нфоцитов человека 341
да рост клеток стимулируется определенными антиrенами
или вирусами; между тем вирусы мешали бы дальнейшему
'Исследованию и применению ,суспензии ЛИМфОЦИ'1'ов.
Дренаж rрудноrо лимфатическоrо протока как один из
весьма эффективных методов получения больших количеств
лимфоцитов применяется в некоторых центрах [6, 15, 33, 39],
но не может быть использован повсеместно; кроме Toro, по-
лученные с ero помощью клетки нуждаются в дополнитель-
1I0Й очистке. То же самое можно сказать и о стерильном по-
лучении лимфоцитов из лимфоузлов.
Соrла,сно Осrуду [29], лимфоциты распределены в opra-
низме человека следующим образом: 3 r в циркулирующей
крови; 70 r в костном мозrе; 100 r в лнмфоузлах и ,селезенке;
1300 r в друrих тканях орrанизма.
При выборе подходящеrо метода следует в первую оче-
p ь иметь в виду циркулирующие лимфоциты крови. Хотя
кровь содержит наименьшее число этих клеток, лишь она
одна доступна в достаточном количестве. Кроме Toro, кровь,
как и лимфа, находится в жидком состоянии, что облеrчает
обра60ТКУ.
Для выделения большоrо количества лимфоцитов, очищен-
ных от примеси тромбоцитов, rранулоцитов и моноцитов, ре-
комендуется применять разделение на колонках 'с дедероно-
вой тканью. Однако малые количества лимфоцитов удобнее
получать с помощью центрифуrирования в rрадиенте плот-
ности. Этот метод не требует больших затрат времени, но,
правда, не позволяет очистить лимфоциты от примеси мо-
ноцитов.
fранулоциты и моноциты, фаrоцитировавшие очищенный
порошок железа, можно удалить из суспензии при помощи
маrнитноrо поля. Однако лишь немноrие ла'боратории рас-
полаrают маrнитами достаточной силы. Кроме Toro, фаrо-
цитарная активность лейкоцитов подвержена еще большим
колебаниям, чем их адrезивные свойства. Поэтому маrннтная
очистка чаще дает неприrодные суспензии лимфоцитов, чем
применение дедероновой ткани. Тем не менее при хорошей
фаrоцитарной активности этим методом удается выделить до-
статочно чистую суспензию лимфоцитов [7, 16, 21, 40].
Метод выделения лимфоцитов на колонках дедероновой
ткани основан на результатах работ Фихтелиуса [14], fри-
нуолта, fайевскоrо и Мак-Кенна [17], Джонсона и fервина
[22], Рабиновича [37] иЛамвика [24]. Эти авторы исполь-
зовали для разделения способность rранулоцитов, моноцитов
и тромбоцитов прилипать к поверхностям, например к стек-
лянным пластинкам, стеклянным и полистироловым бусам,
волокнам стеклянной, хлопковой и найлоновой Ваты. Дедеро-
342 r. Фрик, З. Прейснер
новые фильтры были разработаны нами совместно с тек-
стильным предприятием 1. und Е. Hartung в Маркерсдорфе
под Карл-Маркс-штадтом. Дедероновой нити, которая обыч-
но бывает rладкой, путем специальноrо прядения придавали
форму с развитой поверхностью. Затем из нее особым обра-
зом получали ратинированную крепоподобную ткань, которую
использовали в качестве фильтра, создающеrо оптимальные
условия для проявления адrезивных СВОЙС'I\в нейтрофилов,
моноцитов и тромбоцитов [35].
Для предотвращения свертывания крови можно восполь-
зоваться rепарином, rирудином или провести дефибриниро
вание. Проще Bcero использовать для получения клеток обыч
ную консер:вированную кровь. Ста'билизирующий ее цитрат
натрия связывает кальций и тем самым обратимо подавляет
адrезивные своЙства лейкоцитов. Если после отделения лей-
КОЩIТов от эритроцитов прибавить кальций, то эти свойства
проявятся вновь. Рекальцифицированная взвесь лейкоцитов
южет свернуться подобно нативной крови. Для предотвра-
щения этоrо перед рекальцификацией необходимо добавить
rепарин, rирудин или иной антикоаrулянт.
Эритроциты не прилипают к перечисленным выше мате-
риалам. Примесь этих клеток проще B'cero удаляется с по-
мощью хлористоrо аммония [1, 8, 10, 28]. Применяемый
иноrда для rемолиза сапонин повреждает также лимфоциты
[28J. fипотонический rемолиз, который вызывают, прибав-
.1ЯЯ дистиллированную воду, слишком сильно зависит от .вpe
мени хранения крови и часто бывает неполным. Строму
эритроцитов после rемолиза сл дует удалить диффере}щи-
альным центрифуrированием, а лейкоциты как можно быст-
рее перенести в изотоническую среду.
Вторым используемым на практике методом является
дифференциальное центрифуrирование в rрадиенте плотно-
сти. БёЙюм рекомендовал применять изопак [3], Харрис I!
'Укаейёфо трииозил [18], а Отто и Шмид [31] ронпакон
и уромиро. Все эти вещества представляют собой химически
'и осмотически инертные иодамиды, приме.няемые как peHT
reHoKoHTpacTHbIe препараты. Их можно ИС'ПОЛЬЗ0вать наряду
'с альбумином [23, 38, 41, 42] и силикаrелем [26] для созда-
ния rрадиентов плотности. ПРОИЗ1ВОДИМЫЙ В rдр визотраст
'370 равным образом подходит для этой цели [13]. Проведя
'сравнительные исследования, мы отказались от добавления
'фиколла [3, 18].
При разделении в rрадиенте плотности довольно трудно
освободиться от тромбоцитов. Большая их часть после цен-
трифуrирования располаrается над слоем лимфоцитов; одна-
'ко значительное число тромбоцитов нее же лрилипает к лим-
42. Выделение лимфоцитов человека 343
фоцитам или находится среди них в виде плотных arperaToB.
В образовании таких arperaToB MorYT участвовать отдельные
rранулоциты, что в свою очередь ведет к заrрязнению сус-
/пензии. Чтобы уменьшить аrреrацию тромбоцитов, рекомен-
дуется временно подкислить суспензию до рН 6,5. В кислой
среде тромбоциты имеют окруrлую форму и не липнут друr к
друrу и к прочим клеткам; в результате создаются лучшие
условия для разделения. Этот прием, впервые предложенный
'Астером и Яндлом [2], стал общепринятым при дифферен-
циальном центрифуrировании тромбоцитов. Мы очень про
сто создаем нужную величину рН лейкоцитарноrо концентра-
та, добавляя 1/7 объема цитратноrо rемостабилизатора [36].
Дефибринирование крови, которое некоторые авторы pe
комендуют для устранения тромбоцитов, может вызвать зна-
чительные (до 45 %) потери лимфоцитов и еще большие по-
тери rранулоцитов [28]; при этом нельзя rарантировать, что
в суспензии не останутся так называемые «сывороточные»
тромбоциты.
АrЛOiмерация тромбоцитов по Борну [5], которую вызы
вают добавлением АДФ, по нашим данным, протекает не ко-
личественно, приводит к захвату в аrломераты части лимфо-
цитов и, следовательно, к их потере ['13].
Устранение тромбоцитов имеет особое значение, если лим-
фоцитарная взвесь используется в качестве антиrена для им-
мунизации. При наличии в ней тромбоцитов вантисыворотке
появляются сопутствующие антитромбоцитарные антитела.
Эти антитела становятся одной из причин нежелательных
реакций у реципиентов они мотут вызвать разрушение
1\ромбодитов реципиента и дать толчок к внутрисосудистоыу
свертыванию, KO'fOpOe проявится либо немедленной, либо
поздней реакцией. Я основе немедленной реакции лежит ос-
вобождение rистамина из комплекса rепарин rистамин. Эти
ком'плек,сы находятся в тучных клетках и в базофильных rpa-
нулоцитах и распад'аются при связывании rепарина как есте-
cTBeHHoro инrибитора свертывания (антитромбина II). Позд-
нюю реакцию вызывают микротромбы, нарушающие функ-
цию важных участков какоrо-либо opraHa, или явления BTO
j:>ичноrо фибринолиза.
MHoroKpaTHoe дифференциальное центрифуrирование, с
помощью KOToporo обычно избавляются от примеси тромбо-
цитов, таит в себе опасность удалить вместе с примесью
малые лимфоциты, иrрающие при решении определенных
вопросов особо важную роль [38, 42].
з44 Т. Фрик, З. Прейснер
42.4. ЛИТЕРАТУРА
1. Agostoпi А., Ideo О., Separation af large numbers оУ Iymphocytes from
human bIood, Experientia, 21 (1965), 82.
2. Aster R. J., Jaпdl J. Н., Platelet Sequestration in Мап. 1. Methods, J.
сНп. Invest., 43 ('1964), 843.
3. В8уит А., Separation of leucocytes from blood and Ьопе marrow, Scand.
J. clin. Lab. Invest., 21 (1968), Suppl., 97, 28
4. Bollaпd Н., Pfisterer Н., Ruppelt W., Michlmayr О., Verkurzung der Le-
bensdauer DF 32P-markierter Granulozyten пасЬ Isolierung mit Dextran
oder Ammoniumchlorid, Вlut, 22 (1971), 60.
5. Вот О. V. R., Quantative investigations into the aggregation of blood
platelets, J. Physiol., 162 (1962), Proc., 67.
6. Breпdel W., Anti!ymphozytenglobulin heute, Munch. med. Wschr., 115
(1973), 241.
7. Cassen В., НШ J., Hays Е. Р., ТЬе efficient separation of lymphocytes
from normal Ьиmап bIood, J. Lab. clin. Med., 52 (1958),778.
8. Dioguardi N., Agostoпi А., Fiorelli О., Lomanto В., Characterization of
lactic dehydrogenase of normal human granulocytes, J. Lab. сНп. Med.,
61 (1963),713.
9. Djerassi 1., Кiт J., 5uvaпsri u., Filtration !eukapheresis for separation
and transfusion of large аmоuпts оУ granulocytes from sing!e norma! da-
nors, Proc. Amer. Ass, Cancer Res., 12 (1971), 28.
10. Ege R., Biochem. Z., 130 (1922), 160.
11. Ehrhardt Н., D8rfler Е., Untersuchungen uber den Leukozytenstoffwech-
sel. 1. Еiпе пеие Methode zur Isolierung von vitalen Leukozyten, Вlut, 10
(1964), 231.
12. Engeljriet С. Р., Britteп А., The cytotoxic test for leucocyte antibodies,
Уох Sang., 10 (1965),660.
13. Frick О., Praktische Aspekte der Lymphozytenisolierung und Granulo-
zytenisolierung aus dem Blut, Fol. Haematol. (Leipzig), 101 (1974),
170.
14. Fichtelius К Е., А simple method to separate lymphocytes from the
blood, Acta Soc. Med. (Uppsala), 56 (1951),27.
15. Gesпer В. М., Howard J. О., The Isolation of Lymphocytes and Macro-
phages. Chapter 31 in: «Handbook of Experimental Immunology», Editor:
Weir D. М. Blackwell Sci. РиЫ., Oxford Edinburgh, 1967, р. 1009
1033.
16. Gray J. О., Russell Р. 5., Preparation оУ viabIe human lymphocytes. In:
Russell, Winn Amos: Histocompatibility Testing, Nat. Acad. Sci., Wa-
shiпgtоп/D. С., 1965.
17. Grreпwalt Т. J., Gajewsky М., МсКеnпа J. L.. А new method for prepa-
ring buffy coat-poor bIood, Transfusion, 2 (1962),221.
18. Harris R., Ukaejiofo Е. О., Tissue typing using а routine one-step lympho-
cyte separation tесhпiquе, Brit. J. Haematol., 18 (1970), 229.
19. Herzig О. Р., Root R. К, Graw R. О., Granulocyte Col1ection Ьу Conti.
nuous flow Filtrаtiоп Leukapheresis, Blood, 39 (1972),554.
20. Isenberg J. N., 5tjernholm L., Solubilization af -Glucuronidase from
Leucocyte Lysosomes Ьу Heparin, RES J., 9 (1971), 515.
21. Johпson О. J., Russell Р. 5., Normal Lymphocyte Transfer and Lympho-
cyte Stimulation as Practical Histocompatibility Tests, Brit. med. J.,
1967 Л, 202.
22. Johпson Т. М., Garviп J. Е., Separation of Iymphocytes in human bIood
Ьу means of glass wool columns, Proc. Soc. ехр. Вio!., 102 (1959), 333.
23. Кissmeyer-Nielsen Р., Kjerby К. Е., Lymphocytotoxic Micro-Technique.
Purification of Lymphocytes Ьу Flotation. In: Histocompatibility Testing,
Torine and Saint Vincent, Italy, 14 24 June, 1967.
42. Выделенuе ЛUАtфоцитов человека 345
24. Lamvik J. О., Separation of lymphocytes from human blood, Acta haema-
tol.,35 (1966),294.
25. Ludany О. L., Pereпyi L., Sos J., Vajda О., Arch. int. Pharmacodyn., 115
(1958), 70.
26. Marcha1ld J.-O., Oarreau Н., Separation des polynucleaires du sang hu-
main.: Technique et test de viabilite, Апп. Biol. clin., 29 (1971), 243.
27. Меуе, J., Bartleti О. R., Water-soluble phosphates in horse granulocytes
and lymphocytes, Biochim. Biophys. Acta, 230 (1971), 487.
28. Nagel W., Lahaпn Н., Weihrauch E.-L., Isolierung von Lymphozyten aus
peripherem Blut, К1iп. Wschr., 36 (1958), 34.
29. Osgood Е. Е., Number and Distribution of Ниmап Hemic Cells, Blood, 9
(1954), 1141.
30. Otio Р., Granulozytenisolierung aus dem Blut des Menschen und der
Tiere, Blut, 21 (1970), 290.
31. Otto F., Schmid D. О., Lymphozytenisolierung aus dem Blut des Menschen
und der Tiere, BIut, 21 (1970), 118.
32. Parwaresch М. R., Muller-Hermeliпk N. к., Desgaga J. Р., Zakari V., Leп-
nert к., Die Herkunft der Gewebsmastzelle bei der Ratte, zugleich ein Bei-
trag zur quantitativen Zytologie der sterilen Peritonitis, Virchow's Arch.
АЫ. В. Zellpath., 8 (1971),20.
33. РёсЫтау, R., Herstellung und Wirkung heterologer Antihundelymphozy-
tenseren, Z. ехр. Med., 143 (1967), 161.
34. Pretlow Т. С., Pichichero М. Е., Н yams L., Separation of Lymphocytes
and Macrophages from Suspensions of Guinea Pig Peritonitis Exudate
Cel1s Using Programmed Gradient Sedimentation, Amer. J. Pathol., 63
(1971), 255.
35. Preuss1ler S., Frick О" Die Lymphozytenisolierung aus SpenderbIut zur
Herstellung von Antihumanlymphozytenseren, Dtsch. Ges.-Wesen, 24
(1969),2050.
36. Preussпer S., Frick О., Schulz к., Koпrad Н., Кiencke Н., Untersuchungen
zur Effektivitiit von Thrombozytenkonzentraten mН nuklearmedizinischen
und gerinnungsphysiologischen Verfahren, Fol. Haematol., 95 (1971), 55.
37. Rablпowitz У., Separation of Lymphocytes, Polymorphonuclear Leucocy-
tes and Monocytes оп Glass Columns, Including Tissue Culture Observa-
tions, Blood, 23 (1964), 811.
38. Riethmuller О., ЮеЬе, Е. Р., Riethmuller D., Untersuchungen zur Hetero-
. genitiit humaner Lymphozyten: Trennung peripherer Lymphozyten irn Аl-
buтindichtegradienten und Untersuchung der einzelnen Zellpopulationen
auf ihre рrоШеriеrепdе Rеаktiод in vitro, К1iп. Wschr., 48 (1970),
1334.
39. Starzl Т. Е., Porter К. А., Iwasaki У., Marclzioro Т. L., Kashiwagi N.,
The use of heterologous antilymphocyte globulin in human renaI Ьоmо-
transplantation. In: Wolstenholme G., «Anti1ymphocytic serum», Ciba
Foundation StudyGroup, 29, Churchi11, London, 1967, Seite 4.
40. Thierfelder S., А method for the isolation of Ьиmап lymphocytes, Уох
Sang.,9 (1964),447.
41. Vallee В. L., Hughes W. L., Gibsoп J. О., А method for the separation of
leucocytes from whole bIood оп serum albumin, Blood, 1 (1947), 82.
42. Vogt W., Scholle Н., Schlag W., Bochert а., Ruhl Н., Lymphozytenstimu-
1ation bei Patienten mit chronischer Leukiimie: Trennung peripherer Lym-
phozyten iiber einen diskontinuierlichen Albumin-Dichtegradienten, BIut,
26 (1973),43.
43. Пр:иrотовление
лейкоцитарных суспензий
Ю. БУРМЕйСТЕР
43.1. ПРИНЦИП
Существует MHoro различных способов получения лейко-
цитарных .суспензий из тканей человека и животных. В част
ности, источниками лейкоцитов MorYT служить лимфоузлы,
тимус, селезенка, фабрициева сумка, пейеровы бляшки, лим
фоидные образования слепой кишки, кровь, лимфа, эксуда
TbI l . Выбор вида животных определяется задачей исследо
Еания.
43.2.
43.2.1.
МЕТОДИКА
PeareHTbI и приборы
Набор хирурrических инструментов; операционный стол
или доска для привязывания животных; шприцы; посуда, в
которую помещают удаленные лимфоидные opraHbI или TKa
ни; найлоновое сито; средство для наркоза (rексобарбитал-
натрий А WD, эфир); среда для приrотовления клеточных
суспензий.
43.2.2.
Отдельные этапы методики
OpraHbI, содержащие лейкоциты, можно извлекать при-
fкизненно (под наркозом) или вскрыв только что забитое
животное. Ниже в общих чертах описаны различные вариан-
ты выделения клеток.
Ореаны иммунной системы. К ним относятся лимфатиче-
ские узлы, тимус, селезенка, фабрициева сумка, пейеровы
бляшки и аппендикс. Извлечение этих opraHo13 из тела про-
изводят по возможности сразу же после обескровливания
животноrо. При необходимости пользуются лупой или опе-
рационным микроскопом. Удаленный opraH очищают от при-
лежащих тканей и измельчают в соответствующей среде; в
некоторых случаях ткань приходится не измельчать, а скоб-
лить скальпелем [1 5].
Костный МаЗе. Костномозrовые клетки человека обычно
получают, пунктируя rрудину [6], затем из пунктата rотовяТ
I Практич ски важным источником живых ЛIIМФОЦIIТОВ У человека
С.'1ужат также оперативно у даJIенные r лоточные МlIндалины. П РIl,If, перев.
43. Л ри20ТОбленuе лейкоцитарных суспензий 347
суспензию. КостномозrО\вые клетки мелких rрызунов, напри-
мер мышей, ИЗ1влекают из бедренных, большеберцовых и пле-
чевых костей [4, 7] . Удалив эпифизы, кости при помощи
шприца промывают раствором Ринrера, содержащим лактат.
Этот же раствор служит затем суспензионной средой для
к..'lеток.
Кровь, лимфа. Взятие крови обычно не представляет труд-
ности. Получать лимфу несколько сложнее, на этом следует
остановиться подробнее. В клинических условиях, если име-
ются показания, лимфу человека можно получить путем дре-
нирования rрудноrо лимфатическоrо прото'ка [8]. У крыс
[9] и у друrих лабораторных животных для этой же цели
накладывают канЮЛю лимфатическоrо протока 'в брюшной
полости непосредст,венно под диафраrмой. Лимфа поступает
со скоростью примерно 4 мл в Час. Если необходимо предот
вратить ее свертываlние, то внутреннюю поверхность прием-
Horo сосуда предварительно смачивают раствором rепарина.
Для получения лимфы у барана [10, 11] можно дренировать
также лимфатический сосуд, отходящий от подколенноrо
лимфоу:зла (скорость поступления лимфы 5 мл В час).
Эксудат. Для получения макрофаfОВ [12 18] в брюшную
полость экспериментальных животных ,ВВОДят растворы ве-
ществ, вызывающих через 1,5 4 дня накопление в ней этих
клеток. Тем же способом моЖ!но получать нейтрофильные
rранулоциты. Обычно применяют 10%-ный paC1iBOp rликоrе-
на, 1 12%-ный раствор казеината, 24%-ный раствор rлю-
козы или вазелиновое масло. По нашим данным, от кролика
наибольшее количество клеток можно получить после вве-
дения 10%-Horo казеината. Клетки вымывают из брюшной
:полости раствором Кребса Ринrера. От oДiHoro ЖИБотноrо
получают примерно 108 клеток,ОКОЛО половины которых со-
ставляют макрофаrи. Этот метод позволяет также получить
специфически стимулирова,нные макрофаrи: Саито п сотр.
[19] применили для раздражения брюшины препарат РНК,
выделенный из селезенки мышей, иммунизиро,ванных сальмо-
неллами. Выделенные макрофаrи проявляли устойчивость к
этим бактериям.
Лескuе. Для выделения альвеолярных макрофаrов [14,
20, 21] можно воспользоваться методом Кона [21]. Кролика
:умерщвляют, введЯ воздух в ушную вену. Затем на, трахею
накладывают зажим и из rрудной полости извлекают сердеч-
Но-леrочный комплекс. Аккуратно отделяют сердце, лимфати-
ческие узлы и обрывки соединительной ткани; из леrочных
сосудов удаляют кровь, а само леrкое обмывают снаружи
физиолоrическим раствором. После этоrо в Каждый из rлав-
ных бронхов вводят по 25 мл Toro же раствор а, леrоч.ную
348 Ю. .Бурщйстер
'Ткань слеrка разминают и ВЫДа'вливают раствор обратно.
При этом выделяется около 2.107 клеток, 95% которых со-
ставляют макрофаrи. Как видно, выход клеток невелик; од-
'Нако ero можно увеличить примерно в сто раз, если за 4 не-
ели до опыта ввести кролику в вену 20 Mr убитых непато
тенных микобактерий туберкулеза (БЦЖ). В этом случае
185% выделяемых клеток представляют собой макрофаrи, ос-
тальные лимфоциты и rранулоциты.
Для освобождения лейкоцитарных суспензий от мелких
обрывков соединительной ткани и crycTKoB фибрина поль-
:зуются фильтрацией через найлоновую марлю или тонкое си
то из нержавеющей стали. Небольшие arperaTbI клеток обыч
но удается устранить, MHoroKpaTHo набирая и выпуская сус-
'пензию через тонкую пипетку.
Следует отметить, что дренаж лимфатических сосудов,
извлечение эксудата из леrких и прижи ненное удаление
лимфатических узлов требуют известноrо умения. С друrой
стороны, при всей технической простоте взятия крови выде-
ление из нее лейкоцитов часто сопряжено со значительными
'Трудностями. Если с caMoro начала необходимо избежать
значительной примеси эритроцитов, то крови следует предпо-
честь лимфоузлы или эксудат.
43.3. ЛИТЕРАТУРА
1. Dioguardi N., /deo О" Manucci Р. М" Fiorelli О., Lactate dehydrogenase,
g!utamic oxalacetic transaminase and malate dehydrogenase isoenzymes
in Iymphocytes from foetal and adult thymus, spleen and from periphera!
bIood, Enzymol. biol, clin" 6 (1966), 324 338.
2. Отау J. О., Мопасо А. Р" Wood М. L., Russel Р. S., Studies оп heterolo-
gous anti-Iymphocyte serum in mice. 1. In vitro and in vivo properties,
J. Immuno!., 96 (1966),217.
3. ОпО К, Bell Р., Kashiwaga N., Starzl Т. Е, The comparative in vitro and
in vivo activity of antilymphocyte serum raised Ьу immunization with
thymic, splenic and lymph node Iymphocytes, Surgery, 66 (1969), 698
703.
4. Stuttmann О" Godd R. А., Absence of synergism between thymus and
Ьопе mапоw in graft-versus-host reactions, Proc. Soc. Ехр. Biol. Med.,
130 (1969), 848 852,
5. Gozzo J. J" Rule А. Н" ОепШе J. Р., А new method for the production
of rabbit antirat Iymphocyte serum, Transplantation, 8 (1969), 338
346.
6. Kolmeier К н., Silverstein М. N., Fleisher О. А., Anaerobic gIycolysis in
normal and leukcmic Ьопе mапоw leucocytes. Effect of methyI-glуохаI-
bisguanyl hydrazone-dihydro-chloride, Cancer, 19 (1966), 1195 1199.
7. Abdou N. J" ЮсЫет М., Cells involved in the immune response. ТЬе tran-
sfer of antibody forming сарасНу to iпаdiаtеd rabbits Ьу antigen-reactive
cells isolated from normal allogenic rabbit Ьопе mапоw after passage
through antigen sensitized glass bead columns, J. ехр. Med., 130 (1969),
14I 163.
48. Л рueОТО8леюuе лейкоцитарных суспензий 349
8. Bierman Н. R., Byroп R. L., Кеиеу К. Н., ОЩillап R. 5., White L. Р.,
Freemaп N. Е., Petrakis N. L., The characteristics of thoracic duct lymph
in тап, J. сliп. Invest., 32 (1953), 637 643.
9. Bollmaп '. L., Cain '. C., Oriпdley '. н., Techniques for the collection of
lymph from the liver, smal1 intestine or thoracic duct of the rat, J. Lab.
Сliп. Med., 33 (1948), 1349 1352.
10. Hall '. О., Mo"is В., The output of cel1s in the lymph from the popliteal
node of sheep, Quart1. J. ехр. Physiol., 47 (1962), 360.
11. Hall '. О., Mo"is В., The lymph-borne cel1s of the immune response,
Quart. J. ехр. Physiol., 48 (1963),235.
12. Estes F. L., 5mith 5., Gast '. Н., А method for obtaining polymorphonuc-
lear leucocytes from intraperitoneal exsudates, Blood, 13 (1958), 1192
1197.
13. Cohn z: А., Morse 5. J., Interactions between rabbit polymorphonuclear
leucocytes and staphylococci, J. ехр. Med., 110 (1959),419.
14. Daппeпberg А. М., Burstoпe М. 5., Walter Р. С., Кiпsley J. W., А histo-
chemical study of phagocytic and enzymatic functions of rabbit mопопис-
lear and polymorphonuclear exudate cells and alveolar macrophages.
1. Survey and quantitation of enzymes and states of cellular activation,
J. Cel1 Biol., 17 (1963),465.
15. Daппeпberg А. М. J., Beппett W. Е., Hydrolytic enzymes of rabbit mопо-
nuclear exsudate cells, J. СеН. Biol., 21 (1964), 1 13.
16. Woycik '. D., /rviпg О., Lysine deficiency and leucocytes metabolism,
Proc. Soc. Ехр. Biol. (N. У.), 123 (1966), 435 437.
17. Redd Р. W., Teppermaп J., Hexosemonophosphat shunt dehydrogenase
activity in rat liver and leucocyte: effect of diet and thyroid states, Proc.
Soc. Ехр. Biol. (N. У.), 128 (1968), 888 891.
18. West J., Mortoп D. J., Esmaпп V., 5tjernholm R. L., Carbohydrate meta-
bolism in leucocytes. УII 1. Metabolic activities of the macrophage, Arch.
Biochem. Biophys., 124 (1968), 85 90.
19. 5аио к., Kurashige 5., Osawa N., Kato Е., Kawakami М., Mitsuhashi 5.,
Cross immunity of mouse mononuclear phagocytes induced Ьу immuni-
zation and Ьу transfer agent, Jap. J. Microbiol., 13 (1969), 277 281.
20. Myrvik Q. N., 50to-Leake Е., Fa"is В., Studies оп pulmonary alveolar
macrophages from the normal rabbit: А technique to procedure them in
а high state of purity, J. Immunol., 86 (1961), 128 136.
21. Cohп Z. А., Wieпer Е., The particulate hydrolases of macrophages, J. ехр.
Med., 118 (1963), 991 1008.
44. Удаление эритроцитов из суспензии
иммунокомпетентныx клеток
Ю. БУРМЕйСТЕР
Неочищенные ,взвеси ИММУНОКО:Nшетентных клеток, как
правило, содержат примесь эритроцитов. Ниже описаны спо-
собы устранения этой примеси. Коrда иммунокомпетентные
клетки выделяют из крови, удаление эритроцитов является
первым обязательным этапом методики; однако суспензия
клеток .'IимфоиДных opraHoB также может содержать на-
столько большую примесь эритроцитов, что этот этап CTaHO
вится обязательным.
44.1.
44.1.1.
ОСЕДАНИЕ ЭРИТРОЦИТОВ
Припцип
В основе мноrих методов удаления эритроцитов лежит
оседание этих клеток. Однако лишь в крови лоша,J,И оно про-
исходит настолько быстро, что позволяет выделить большое
количество лейкоцитов [1 3]. В ,J,руrих случаях приходится
добавлять в кровь вещества, ускоряющие оседание эритро-
цитов.
44.1.2.
Методика
44.1.2.1. Реаrепты iИ приборы
Для ускорения оседания эритроцитов используют дeKCT
ран (инфуколл) [5 13], поливинилпирролидон [14 16],
фиколл [17, 18], метилцеллюлозу [17 19], полибрен [20] и
фитоrемаrrлютинин [5, 21, 22]; реже применяются желатина
[23], фибриноrен [5, 24], rуммиарабик [25] и пектинат нат-
рия [25]. Нужны измерительные цилиндры, химические и
центрифужные пробирки, шприцы.
44.1.2.2. Описание процедуры
Обычно к 2 объе:vrам стабилизированной крови в соответ-
ствующе:vr сосуде прибавляlOТ 1 объем раствора вещества,
ускоряющеrо оседание эритроцитов. Примерно за 1 ч они
44. Удаление эритроцитов из суспензии 351
уже в заметной степени оседают. Количест,во эр,итроцитов в
надосадочной жидкости HaMHoro уменьшается при сохране-
нии лейкоцитов во взвешенном состоянии.
Эритроциты можно также удалять по методу Бёйюма [17,
'18]. Кровь наслаивают на смесь фиколла с ЭДТ А (плотность
1,07 1,14 rjмл). На rранице слоев эритроциты склеиваются
в arperaTbI и оседают на дно ,пробирки. Оприменении инфу-
колла см. 20.2.2.
44.2. ПРОСТОЕ ЦЕнтрифуrИРОВАНИЕ
44.2.1. Принцип
При центрифуrировании эритроциты отделяются от лейко
цитOIВ блаrодаря своей более высокой плотности (1,084
1,117 rjCM 3 ). Лейкоциты осаждаются вслед за эритроцитами,
образуя белую пленку (анrл. «buffy coat»), покрывающую
сверху эритроциты [4, 26, 27].
44.2.2.
Методика
44.2.2.1. Приборы
Обычная лабораторная центрифуrа (например, К 24 фир-
мы Janetzki); силиконированные центрифужные пробирки.
44.2.2.2.
Центрифуrировавие
Кровь, свертывание которой предотвращается, например,
дефибринированием, центрифуrируют при 250 600 g (продол-
жительность до 1 ч, температура от 2 до 37 ОС). Изв.печение
лейкоцитарной пленки связано с известными трудностями.
Для этоrо можно воспользоваться пипеткой или пинцетом.
Мопен и Шари [28] применяли раствор, имеющий более вы-
сокую плотность, с помощью KOToporo удавалось флотиро-
вать лейкоцитарную пленку.
44.2.3.
Оценка
Центрифуrирование обеспечивает хороший выход. OДHa
ко при этом методе вряд ли можно избежать интенспвноrо
склеивания лейкоцитов в arperaTbI. Центрифуrирование дa
же в течение 1 ч представляет собой существенную наrрузку
для ,клеток.
352 Ю. Бурм.ейстер
44.2.4.
Модификации
Метод имеет множеС11ВО варианто,в. Часто ориrинальным
элементом методики является сосуд для центрифуrирования,
форма KOToporo облеrчает отделение лейкоцитарной пленки
'[29]. Ито и сотр. [30] предложили даже центрифуrу особой
конструкции. Принцип центрифуrирования в наиболее совер-
шенной форме использован в проточном сепараторе клеток
крови (фирма NICjlBM, США) [31, 32], который отделяет
лейкоциты от эритроцитов. Примесь эритроцитов в лейкоци-
тарной суспензии здесь чрезвычайно мала: 1 эритроцит на
l З лейкоцита. Помимо фракционирования консервирован-
ной крови, сепаратор можно использовать, .непосредственно
присоединив к кровеносной системе экспериментальноrо жи
BOTHoro или пациента.
44.3. ЦЕнтрифуrИРОВАНИЕ
в rp АДИЕНТЕ ПЛОТНОСТИ
Метод, описанный в разд. 47, позволяет, помимо фракцио-
нирования лимфоцитов, отделять эритроциты от лейкоцитов.
44.4. rЕМОЛИ3
44.4.1. Принцип
Эритроциты разрушают rипотоническими растворами или
реаrентами, повреждающими мембраны, превращая их в по-
терявшие rемоrлобин «теню>. Ниже описаны методы с исполь-
зованием дистиллированноЙ воды, раствора Ринrера и хло-
ристоrо аммония.
44.2.2.
Методики
44.4.2.1. PeareHTbI п прпборы
В качестве areHToB, повреждающих эритроцитарную мем-
брану, при меняют смесь уксусной и виннокаменной кислот
[4, 34], хлористый аммоний [4, 34 39], rипотонические сре-
ды [4, 40 43], сапонин [4], rрамицидин [4, 44], лизолецитин
[4, 44], rемолитические антисыворотки [4] и стрептолизин
[4]. Нужна центрифуrа, имеющая ротор с подвесными ста-
канами и охлаждение.
44.4.2.2.
Проведенпе rемолиза
Fемолиз, вызываеМblй дистиллированной водой. Берут
2 мл лейкоцитарной суспензии, содержащей прпмесь эрит-
44. Удаление эритроцито(3,uз суспензии 353
РОЦIlТОВ, В теЧ НlIе 30 с перемешивают при 4 ос с 6 l\I дИ'<"
стиллированнои воды. Сразу же после этоrо для BOCCTaHOB
ления изотонии к смеси добавляют 2 мл 3,5%-Horo раствора
NaCl и, центрифуrируя при 150 g, отделяют лейкоциты ОТ
продуктов rемолиза. .
Fемолиз, вызываемый разбавленным раствором РиН2ера.
Бараньи эритроциты, осмотическая резистентность которых
особенно низка, можно разрушить не только водой, но I;I раз
бавленным раст,вором Ринrера. Смешивают 20 мл rепарини-
зированной крови с 188 мл 40 % -Horo забуференноrо paCTBO
ра Ринrера, энерrично встряхивают в течение 5 7 с, затем
тотчас восстанавливают изотонию, прибавляя rипертониче
ский раствор N аСl. Метод обеспечивает хороший выход MtJ,
нонуклеаров, интактных морфолоrически и нормал но, реаrи
рующих на ФrА [43].
Fемолuз, вызываемый хлористым аJИмонием. Для предот-
вращения свертывания 10 мл крови берут в сосуд, содержа
щий 1 мл 5%-Horo раствора ЭДТА. Затем к 1 объему крови
прибавляют 8 (3) объемов 0,83% Horo раствора NH 4 Cl (луч
ше с трис-буфером). После rемолиза лейкоциты осаждают
центрифуrированием при 120 g и 4 ос в течение 10 (3) мин.
Если rемолиз оказался неполны:vl, то лейкоциты можно по-
вторно промыть раствором хлористоrо аммония [4, 36 39].
44.4.3.
Оценка метода
rемолиз вполне удовлетворительный метод удаления
эритроцитов. Из ero недостатков надо отметить поврел\Дение
лейкоцитов, которое в большей или меньшей степени наблю-
дается всеrда [4, 25, 44 46]. Вариант метода с использова
iНием дистиллированной воды, по данным Фаллона и
сотр. [40], дает неплохие показатели жизнеспособности лей-
коцитов. Оценку друrих вариантов метода читатель найдет
в цитируемой литературе и прежде Bcero 'в моноrрафии KaT
тса [4].
44.5.
АrrЛЮТИНАЦИЯ ЭРИТРОЦИТОВ
44.5.1.
Принцип
С помощью фитоrемаrrлютинина или антисывороток BЫ
зывают аrrлютинацию эритроцитов, содержащихся в леЙко-
цитарной взвеси. Затем эритроцитарные аrrлютинаты можно
отделить от лейкоцитов при помощи центрифуrирования с
небольшой скоростью [4, 5, 21,39, 47, 48].
2З 840
354 Ю. Бурмейстер
44.5.2.
Методика
44.5.2.1. Реаrенты и приборы
Фитоrемаrrлютинин (Difco, Детройт, США, Welcome, Лон-
дон); антисыворотки для определения rрупп крови. Центри
фуrа, имеющая ротор с подвесными стаканами и охлаж,дение.
44.5.2.2.
Проведение опыта
и спользованuе ФUТО2ема22лютuнuна. К 1 О мл стабилизи-
рованной крови прибавляют 1 10 Mr фr А, перемешивают и
оставляют на 30 мин, затем центрифуrируют 90 с при 40 g.
В результате получают плазму, в которой содержатся лейко
диты. Этот метод позволяет освободиться от 99,0 99,8 %
эритроцитов [21]; с ero помощью можно также уме.ньшить
nplBIecb эритроцитов в rетероrенной суспензии иммуноком
..nетентных клеток [5].
И спользованuе антиСЫ80ротки. Неразделенную суспензию
-клеток человеческой крови центрифуrируют 10 мин при 120 g
:и 4 0 с. Надосадочную жидкость сливают. Осадок лейкоцитов
,;суспендируют в равном объеме иммунной аНТИСbJIВОРОТКИ
«(аН1и А, анти В) с титром 1: 128 или 1: 256. Суспензию ин
хубируют 7 мин при 36 ОС, затем эритроцитарные аrrлютина-
ты удаляют центрифуrированием в течение 7 мин при 120 g
:ll 4 0 с. После Э10rо можно отделить лейкоциты, содержащие-
<ся в надосадочной жидкости [39]. По данным исключения
-трипановоrо синеrо, 97 98% полученных клеток жизнеспо-
собны.
44.5.3. ОцеНI{а меТОДа
Лейкоциты, выделенные с помощью Ф r А, морфолоrически
:нормальны, обладают амебоидной подвижностью и способны
:к митотическому делению. Так как ФrА сильный митоrен,
:нам кажется, что ero можно использовать лишь в тех слу-
'Чаях, коrда ero митоrенный эффект нужен исследователю или
Kor,J,a он не имеет значения. CKyr и Бек [5] подчеркивают,
что продолжительность центрифуrирования является крити-
-ческим параметром: слишком кратковременное центрифуrи-
:рование оставляет во взвеси значительную примесь эритро
:щитов, а слишком длительное вызывает потери лейкоцитов.
.44.6.
ЛИТЕРАТУРА
.1. Hamburger Н. ]" Physikalisch-chemische Uп lersucllUngen i.ibcr Phagozy-
ten, J. F. Bergmann, Wiesbadcn, 1912,
"2, Behreпs М., Marti Н. R" Die Isolierung eosinopl1ilcr Letlkozyten tlnd
ihrer Grantlla, Experientia, 10 (1954), 315.
44. Удаленuе эрuтроцuтов из суспензuu 355
3. Turk А., Glade Р. R., Chessiп L. N., Вlast-like transformation induced in
peripheral bIood Iymphocytes Ьу cel1ular injury: а comparison of sonica-
tion and phytohemagg!utinin, Вlood. 32 (1969), 329.
4. Cutts J. Н., Сеl1 Separation, Acad. Press, New York London, 1970.
5, 5koog W., Beck W. 5., Studies оп the fibrinogen, dextran and phytohemag-
glutinin methods of isolating !eucocytes, B!ood, 11 (1956),436.
6. Lapiп J. Н., Horoпick А., Lapiп R. Н., An improved method for iso!ating
viabIe human leucocytes from peripheral bIood, Вlood, 13 (1958), 1001.
7. Veпtzke L. Е., Perry 5., Crepaldi а., Отееп J., 5chrot R., А practica! те-
thod for the separation of Iymphocytes from granulocytes, J. Lab. clin.
Med., 53 (1959), 318.
8. Мillе, R. R., Ackermaпп а. А., А simple method for the differential sepa
ration of the !eucocytes from normal bIood, Amer. J. сНп. Pathol., 32
(1959), 100.
9. 5chreier к., ZDl1er Е., Thomas к., Hart W., 5tockle V., Bergmaпп Е.,
Untersuchungen zum Aminosaurestoffwechse! menschlicher Leukozyten"
Юiп. Wschr., 39 (1961),568.
10. Christ1ieb А. R., 5barra А. J., Bardawil W. А., Iso!ation of high1y purr
fied viabIe leucocytes from bIood, Amer. J. clin. Pathol., 37 (1962),
257.
11. Rood J. J., Leuweп А., Leucocyte grouping. А method and its аррli-
cation, J. clin. Invest., 42 (1963), 1382.
12. McEweп L. N., А method for the maintenance of !eucocytes in their g!obu-
lar form, J. Physiol., 184 (1966), 3Р.
13. сипе М. J., Isolation and characterization of RNA from human Ieucocytes.
J. Lab. clin. Med., 68 (1966), 33.
14. Brauпsteiпer Н., Pakesch F., Vetter н., Isolierung und Anreicherung funk-
tionstiichtiger Leukozyten und Thrombozyten mittels Polyviny!-Pyrroli-
don, Acta Haemato!., 8 (1952), 304.
15. Gold Р., Cole М., А simple method for leucocyte separation, J. Lab. clin.
Med.,56 (1960), 310.
16. ВиЬе F. W., Gmurziпski Z., Die Gewinnung von Testleukozyten und
Thrombozyten in einem Arbeitsgang, Z. ges. ехр. Med., 146 (1968),
346.
17. Вдуит А., Separation of white cells, Nature, 204 (1964),793.
18. Вдуит А., Separation of leucocytes from bIood and bone marrow, J.
clin. Lab. Invest" 21 (1968), Suppl., 97.
19. 5еп N. N., Das К. С., Aikat В. к., А method for the separation of Ieuco-
cytes, Naturwissenschaften, 16 (1959),383.
20. Lalezari Р., А new technique for separation of human leucocytes, Blood,
19 (1962), 109.
21. Li J. а., Osgood Е. Е., А method for the rapid separation of !eucocytes
and nucleated erythrocytes from bIood or marrow with а phytohemagg!u-
tinin from red beans, Blood, 4 (1949), 670.
22. Prager М. D., Ооеrnет М., Matthews N., Purification of Ьитап 1eucocytes.
Proc. Soc. Ехр. Biol. Med., 97 (1958), 726.
23. Coulson А. 5., Chalmers D. а., Separation of viabIe !ymphocytes from
human bIood, Lancet, 1 (1964), 468.
24. Minor А. Н., Burnett L., А method for obtaining living leucocytes from
human bIood Ьу acceleration of erythrocyte sedimentation, B!ood, 3
(1947), 799.
25. Cartier Р., Marchand J.-C., Garreau н., La separation des cel1ules sangui-
nes, Ann. Вio!. clin., 27 (1969), 133.
26. Rattunde Н. F., Knudson А. а., А method for recovering large numbers'
of platelets and !eucocytes from human bIood, J. Lab. clin. Med. 54
(1959), 484. '
23*
356 /О. БУРАtей.стер
27. Maupiп В., Techniques de separati6n des globules blancs, Rec. Hemat., 14
. (1959), 443.. ,
28. Maиpiп В" Chary R., Presentation d'une nouvelle methode de separation
des 1eucocytes et des plaquettes sanguines, Sang. (Paris), 23 (I 952), 336,
29, D6rfler Н. Е., Untersuchungen uber den Leukozytenstoffwechse!. 1. Eine
пеие Methode zur Isolierung von vita!en Leukozyten, Blut, 10(1964).
ЗО Ito V., Weiпsteiп М. А., Aoki 1., Harada R., Юmurа Е., Nuпogaki К., The
coiI pIanet centrifuge, Nature, 212 (1966), 985.
31. Jullis J. L" Rocl!Ow Е. О" Separation and purification оУ Ieucocytes and
PlateJets, B!ood, 7 (1952),891.
32. Briickпer D., Eisel R., Perry S., B!ood cells separation in the dog Ьу соп-
. . tinuous flo\v centrifugation, B!ood, 31 (1968),653.
33. Szilard Р" Eine Methode zur isolierten Gewinnung der wеiIЗеп BJutk6r-
, perchen, Pf lйgеrs Arch. Ges. Physiol" 211 (1926), 597.
:34. Nagel W., Lahaпп Н., Weinrauch Е, W., Isolierung von Lymphozyten aus
. 'peripherem B!ut, Юiп. Wschr., 36 (1958), 34.
35. Agostiпi А., Ideo О" Separation оУ large numbers of Iymphocytes from
lшmа'п blood, Experientia, 21 (1965),82.
:36, Rabiпowitz У., Dietz А. А., МаНс and lactat dehydrogenase isozymes оУ
nOI'ma! and leukemic !eucocytes separated оп gIass bead columns, Blood,
29 (1967), 182.
37. Dioguardi N., Agostiпi А., FiorelJi О., Lomaпto В., Characterization of
Jactic dehydrogenase оУ norrna! human granu!ocytes, J. Lab. сНп. Med.,
<61 (1963), 713.
38., Qtto F., Granulozytenisolierung aus dem Blut des Menschen und der
Tiere, BJut, 21 (1970), 290 294.
.:39: Haпnig К, Krusmaпп W. Р., Die Anwendung der triigerfreien kontinu-
;. ierlichen Elektrophorese zur Auftrennung der weiВen Blutzellen aus Ни-
manblut, Hoppe-Sey!er's Z, Physio!, Chern., 349 (1968), 161.
40. Falloп Н. J., Frei Е., Davidsoп J. D., Trier J. S., Burk D., Leucocyte pre-
parations frorn human blood: EvaIuation оУ their morphoIogic and meta-
bo!ic state, J. Lab. сНп, Med" 59 (1962), 779,
41. Behreпs М., Esch Р., Ge\\Tinnung von Leukozyten aus RinderbIut unter
Yer\\'endung уоп Wasser als Hiimo!ytikum, Experientia, 19 (1963), 406.
42, Seversoп С. D., Fraпk D. Н., Stockes О,, Seepersad М. F., Thomsoп J. S"
. Rapid colleciion of human leucocytes or !ymphocytes from periphera!
bIood, TranspJantation, 8 (1969),535.
43. Daiп А. R" Наи J.O., Уох Sanguinis, 13 (1967),281.
44. Siпger Т. Р., Silberbach 1., Schwartz S., The preparation of morphologi-
,".cally intact leucocytes from periphera! blood Ьу rneans оУ gramicidin and
!vso!ecithin, Blood, 1 (1947),88.
4,;;>. : 7asastjerпa с., Separation оУ !eucocytes, Scand. J. clin. Lab. Invest., 8
; (1956), 14.
46. Remmele W., Bruckel К W., Die IsoIierung der weiВen BIutzellen des
Menschen und Untersuchung des LeukozytenstoffwechseIs im Warburg-
Apparat. Methodische Obersicht, R6ntgen und Laborpraxis, 8 (I 955), 13.
47. Takikawa К, /to К, Kato J., Noshida Т., Koпdo Н., Migata J., Studies оп
. , ,t11e iso!ation of granules and mitochondria of !eucocytes, with а prelimina-
ry note оп the nature of the Nadi oxydase reaction, Acta haematol" 18
, '('1957), 179.
4В. Оlеп N. Р., РаЕте, О. К, Amer. J. сНп, Pathol" 30 (1958),567.
45.
45.1.
45.1.1.
Удаление rранулоцитов
113 смешанной суспензии клеток
в. БЛУДИШ, Ю. БУРМЕйСТЕР
ПРИНЦИП
Отделение rранулоцитов
с помощью колонки
rранулоциты обладают выраженной способностью прили-
пать к чужеродной поверхности. Механизм этоrо прилипания
известен лишь отчасти. Определенную роль иrрают пленка
фибрина, некоторые низко и высокомолекулярные факторы
свежей плазмы, а-rлобулин [1 8], присутствие Mg2+ или
Са 2 + [10 12]. Решающее значение имеет также температу
ра. Охлаждение ниже 25 30 ос заметно снижает способность
rранулоцито'в к прилипанию [13, 14]. При контакте крови
или сходной клеточной взвеси с волокнами хлопковой, пер
лоновой или стеклянной ваты, со стеклянными или полимет
акрилатными бусами rранулоциты почти полностью прили-
пают к их поверхности. Прилипание лимфоцитов, напротив,
весьма незначительно, особенно при повышенной температу-
ре. Однако некоторая часть лимфоцитов неспецифически при-
липает к по.верхности при низкой температуре. На практике
особенно удобными для фракционирования смешанных кле-
точных суспензий оказались колонки, впервые предложенные
Флеминrом [15].
45.1.2.
45.1.2.1.
Методика
Реаrеиты и прцборы
Клеточная суспензия, например взвесь лейкоцитов в плаз-
ме после осаждения эритроцитов декстраном. Сценберr и
Шортман [17, 18] использовали как исходный материал лей
коцитарную пленку, а в качестве промывающей среды 40 %-
ную эмбриональную телячью сыворотку в забуференном фос
фатами ра,створе N aCl.
Прuборы: колонка Либиха Кюлера требуемой длины с
термостатирующей рубашкой и краном; насос с реrулируе-
мым расходом или устройство для капельной подачи раст,во-
ра. Требуемый, соrласно методике, материал для заполнения
колонок. Улыратермостат Вобзера, Хёпплера или иной сход-
ной системы. Хлор,силан для силиконирования посуды. Среда
Иrла или pacТiBop Ринrера для промывания колонок или MO
дифицированные среды для клеточных суспензий.
358 В. Баудuш, Ю. Бурщйстер
45.1.2.2.
Метод с nспользованием ХЛОПRОВОЙ ваты
Ламвик [8, 16] применял для малых объемов крови ко-
роткие, примерно 100 мм длиной и 13 мм в диаметре, колон-
ки, вмещающие 12 мл. Для больших объемов крови он поль
зовался более крупными колонками, вмещающими 45 мл, на-
бивая в нИх около 1,5 r ваты. Вату предварительно обраба-
тывают парами хлорсилана (например, а вафобом NS1, УЕВ
Nйпсhritz, r ДР), промывают водой и высушивают при 105
110 ОС. Заполнив колонку клеточной суспензией, оставляют
примерно на 30 мин, а затем промывают раствором Ринrера
или друrим кровезаменителем. При первичном заполнении
колонки раствор следует подавать снизу, чтобы вытеснить
воздух. С помощью ультратермостата в колонке поддержи
вают температуру 37 0 с. В элюат выходят только 20 30%
клеток. При работе на большой колонке среди элюирован-
ных клеток либо вовсе нет rранулоцитов, либо встречаются
только их фрапненты. Чистота лимфоцитарных суспензий,
очищенных с помощью малых колонок, достиrает 95 100%.
45.1.2.3.
Друrие .'варианты метода
В ряде работ [19 21] для отделения rранулоцитов была
успешно использована стеклянная вата. Простую колонку
TaKoro рода предложили Джонсон и rар,вин [22]. Стеклянная
трубка длиной 10 см и шириной 2,5 3 см, имеющая сужение
до нескольких миллиметров на нижнем конце, заполняется
на высоту примерно 2,1 см силиконированной стеклянной Ba
той. Для силиконирования можно применить хлорсилан, Ha
пример аквафоб NS 1. Перед использованием колонку про-
мывают 10 мл свежей сыворотки (праiвда, необходимость та-
кой обработки, по данным авторов, сомнительна). Затем че-
рез вату пропускают со скоростью 0,8 мл/мин 30 мл rепари-
низированной (3 Mr rепарина) крови. Температура должна
поддерживаться в пределах 27 37 ОС. При 16 и 4 ос [рану-
.10ЦИТЫ не прилипают к волокнам стеклянной ваты.
Воопроиз,Водимые результаты можно также по.1УЧИТЬ, при-
меняя колонки fарвина [23], заполненные силиконирован-
ными стеклянными бусами диаметром 0,1 мм и более. Ско-
рость фильтрации клеточной вз'веси через колонку реrули-
руется насосом. Антикоаrулкнтом служит rепарин, ОКо.10
1000 МЕ на 5 мл крови.
Рабинович [9, 24, 25] МОДИфИЦИРО'l3ал методику fарвина,
и ему удалось выделить различные клеточные элементы кро-
ви в виде отдельных фракций. Ero колонка длиной 40 см 11
диаметром 2,5 см была на 80% длины заполнена стекляннЫ-
45. Удаление zранулоциТО8 из суспензии клеток 359
ми ,силикониро.ванными бусами. С ее помощью можно было
разделить примерно 75 мл лейкоцитарноrо концентрата, ко-
торый ,получали из 500 мл крови путем осаждения эритроци-
тов декстр аном и центрифуrирования при 150 g и 17 ос в те-
чение 10 мин. Колонку заполняли клеточной суспензией, и
контакт клеток с бусами продолжался 30 мин. Затем колонку
промывали последовательно цельной плазмой, 20 % -ной
плазмой (iВ растворе Хенкса) и наконец 0,02%-ным ЭДТА В
солевом растворе, не содержащем Са 2 + и Mg2+. Плазма
элюировала из колонки эритроциты, тромбоциты и лимфоци-
ты, а раствор ЭДТА нейтрофильные rранулоциты и моно-
циты. Чистота фракции лимфоцитов достиrала 98 99 % [26].
Метод оказался весьма перспективным [27, 28]; с ero по-
мощью удалось выделить опухолевые клетки из смешанной
суспензии [25]. Перед разделением клеток эритроциты мож-
но. удалить также с помащью цитолиза [25].
Шортман и сотр. [17, 29] отделяли друr от друrа малые
и большие лимфоциты, пользуясь l\IеЛКИМИ, менее 50 70
мкм, бусами. Коланки диаметром 3,5 см заполняли слоем
бус на высоту 4 см. Клеточную суспензию подавали со ска-
ростью 12 мл/ч. В механизме разделения лимфацитов наряду
с фильтрацией уча'ст,вовало прилипание.
Сталь же успешным было разделение на колонках с поли-
метакрилатными бусами (деrалан V 26, Degussa, [анау,
ФР[) диаметром 250 мкм [20, 30].
В соответствии с предложением, каторое сделали ранее
rринуолт и Полька [30], Прейснер и Фрик [31] ПРИ1rеняют
коланки, заполненные синтетическим (найлановым, дедера-
новым) волокном. Для разделения берут кравь или плазму,
садержащую лейкоциты (после осаждения эритрацитав дек-
страном, фиколлам и т. п.). :Канта кт клетак свалокном пра-
исходит при 37 ОС. При некотором опыте метад позволяет
iПолучать суспензии, садержащие да 99 % лимфацитав.
:Как показали Майнар и Бёрнет [32], для удаления [рану-
лоцитов из малых объемов крови дастаточно кантакта ее тан-
Karo слая с поверхностью стеклянной пластинки при 37 0 С.
rранулоциты, а также монациты прилипают к стеклу. Часть
этих клетак можно вновь снять со стекла, инкубируя ПЛа-
стинки 15 мин при 37 0 Сс 0,01 0,02% ЭДТА в солевом pac
творе (Хенкса, Иrла и т. п.), не содержащем Са 2 + и Mg2+
[24] .
45.1.3. Общая оценка метода
В заlВИСИМОСТИ от имеющеrося обарудавания и наличия
Taro или иноrо филырующеrо материала исследователь ма-
жет выбрать один из предлаrаемых метадов удаления [ран\'.
360 В. Баудuш, Ю. Бур,uеuстер
.пОЦИТОВ. Все они сравнительно леrко осуществимы и при не-
котором навыке позволяют получить суспензию лимфоцитов
90 95%-ной чистоты.
45.2. МЕТОД ФАrОЦИТО3А
45.2.1. ПРИНЦИП
rранулоциты и моноциты фаrоцитируют частицы КО.1JЛО-
идальноrо железа. В результате удельный вес клеток увели-
чивается, что делает возможным их отделение. При исполь-
зовании маr,нита возможности разделения возрастают еще
больше [33 41].
45.2.2.
Методика
45.2.2.1.
Реаrенты п приборы
Тончайший стерильный порошокжелеза, величина частиц
ме-нее 3 мкм (порошок «карбонильноrо» железа 4051, SF 11-
63763, Gепеrаl Апi1iп Corp., Линден, США); сильный маrнит;
центрифуrа.
45.2.2.2.
Постановка опыта
Суспензию лейкоцитов в плазме (5 мл) разбавляют двой-
ным объемом ку.пыуральной среды (среда 199) и перелива-
ют в плоский сосуд, в который затем вносят 0,5 r порошка
железа, и в течение 30 60 мин встряхивают (100 встряхи-
ваний в 1 мин) при 37 ОС. После этоrо сосуд на 5 мин ставят
на сильный маrнит. Затем сливают надосадочную жидкость
в друrой плоский сосуд, который также на 5 мин помещают
в маrнитное поле. Полученная при этом надосадочная жид-
кость содержит 95 99% лимфоцитов, 95% которых жизне-
способны [33 35].
45.2.2.3.
Модификации
Метод неоднократно модифицировался [37, 41]. Напри-
мер, в одном из вариантов при разделении клеточной суспен-
зии было использовано лишь увеличение плотности клеток,
фаrоцитировавших железо. :Кассен [38] покрывал чаСТIIЦЫ
железа rуммиарабиком (100 М!' порошка железа и 100 м!'
rуммиарабика в 5 мл физиолоrическоrо раствора N aCl). Для
устранения rранулоцитов и моноцитов кровь .в течение 30 мнн
45. Удаление zранулоциТО8 из суспензии клеток 361
инкубировали с этим порошком, а затем полчаса центрифу-
rировали при 1300 g. Описание друrих вариантов метода чи-
татель найдет в литературе [39 41].
45.2.3.
Общая оценка меТОДа
Метод сравнительно прост, не требует дороrостоящеrо
оборудования и позволяет достаточно хорошо отделять фаrо-
цитирующие клетки. По мнению Кьюпера и сотр. [35], ча-
стицы железа не должны быть более 3 мкм. Крупные части-
цы, не поддающиеся фаrоцитозу, MorYT, по данным Сбарра
и KapHoBcKoro [36], вызывать интенсивную аrломерацию
rранулоцитов.
45.3. ЛИТЕРАТУРА
Cutts J. Н., Сеll Separation, Academic Press, New York-London, 1970
(моноrрафический обзор).
1. Fisher Н. W., Puck Т. Т., Sato G., Molecular growth requirement of single
таттаliап cells: The action of fеtuiп in promoting сеll attachment to
glass, Proc. Nat. Acad. Sci. U. S., 44, 4 (1958).
2. Deutsch Н. F., Fetuin: ТЬе Mucoprotein of fetal calf serum, J. Вiol. СЬет.,
208, 669 (1954).
3. Pedersen К. О., Nature, 154,575 (1944).
4. Lieberman J" Оие Р., Purification of а serum protein required Ьу а тат-
mаliап ceIIs in tissue culture, Biochim. Biophys. Acta, 25, 449 (1957).
5. Rappaport С., The monkey kidney сеll, Ехр. CeII. Res., 20, 479 (1960).
6. Rappaport С., Bishop С. В" lmproved method for treating glass to pro-
duce surfaces suitabIe for the gro\vth of certain mаmmаliап cells in sуп-
thetic medium, Ехр. CeII. Res., 20, 580 (1960).
7. Rappaport С., Poole J. R., Rappaport Н. Р., Studies оп properties of sur-
face required for growth of mammalian cells in synthetic medium, Ехр.
CeII, Res., 20, 465 (1960).
8. Lamvick J. О., Acta Haematol., 35, 294 (1966).
9. Rabinowitz У., Adherence and separation of leukemic cel1s оп 'glass bead
columns, Blood, 26, 100 (1965).
10. Kvarstein В., А methodological study of human leucocyte adhesiveness to
glass beads, Scand. J. clin. lab. Invest., 23, 259 (1969).
11. Kvarstein В., ТЬе effect of temperature, metabolic inhibitors and ЕОТА
оп phagocytosis of polystyrene latex particles Ьу Ьитап leucocytes,
Scand. J. c1in. lab. Invest., 24, 271 (1969).
12. Kvarsteiп В., Effects of proteins and inorganic iопs оп the adhesiveness
of humап leucocytes to glass beads, Scand. J. сliп. lаЬ. Invest., 24, 41
(1969).
13. Zиcker М. В., Borelli J., Blood, 9, 602 (1954),
14. Zucker-Fraпklin D., Hirsclt J. G., Electron microscope studies оп the de-
granulation of rabbit peritoneal Ieucocytes during phagocytosis, J. Ехр.
Med.,120, 569 (1964).
15. Fleming. А., А sitnple method of removing Ieucocytes from bIood, Brit.
J. Ехр. Pathol., 7, 281 (1926):
16. Lamvick J. О., The transformation of human mononuclear leucocytes in
vitro, Acta Haemato1., 37, 32 (1967).
17. Shortman к., Szeпberg А., The size and density distribution of fo',1';!
bJood Iymphocytes initia tiпg а graft-versus-host reaction, Australian J.
Ехр. Biol. Med. Sci., 47, 1 (1969).
362 В. Еаудиш, Ю. Бурмейстер
18. 5zenberg А., 5hortman К, Апп. N. У. Acad. Sci., 129,310 (1966).
19. Brandt L., Bi5rjesoп J., N orden А., Olsson J., Separation af Iymphacytes
from peripheral blood Ьу means of а glass woa1 column, Acta Med.
Scand., 172,459 (1962).
20. Czerski Р., 5migielski 5., Litwin J., Simple methods far obtaining purified
suspensions of Iymphocytes, \Тах Sanguinis, 11, 734 (1966).
21. Morrison J. Н., Separation of Iymphocytes of rat Ьопе marraw Ьу сотЫ-
ned glass-wool filtration and dextran-gradient centrifugation, Brit. J.
Haematol., 13, 229 (1967).
22. Johnson Т. М., Oarvin J. Е., Separation of 1ymphocytes in human blaad
Ьу means of glass woo1 column, Proc. Soc. exptl. Med., 102, 333 (1959).
23. Oarvin J. Е., Factors affecting the adhesiveness of humап leucacytes and
platelets in vitro, J. Ехр. Med., 114, 51 (1961).
24. Rablnowitz У., Separation of 1ymphocytes, polymorphonuclear lettcocytes
апd monocytes оп glass columns, including tissue culture observations,
Blood, 23, 811 (1964).
25. Rablnowitz У., Dietz А. А., Malic and lactat dеhуdrоgепаsе isozymes of
поrmаl and leukemic leucocytes separa ted оп glass bead co1umns, Blood,
29, 182 (1967).
26. Hardin В., Valentine W. N., Follette J. Н., Lawreпce J. 5., Ат. J. Med.
Sci., 228, 73 (1954).
27. Oordon J., R.ole of monocytes in the mixed leukocyte culture rеасtiоп,
Proc. Soc. Ехр. Biol. Med., 127,30 (1968).
28. Oordon В. L., Fong J., Papermaster В. W., Purification without loss af
viability of neoplastic plasma cells from the ascites passaged mouse туе-
loma, Blood, 29, 647 (1967).
29. 5hortman К, ТЬе separation of different се]) classes from Iymphoid or-
gans, Aust., J. Ехр. Biol. Med. Sci., 44, 271 (1966).
30. Oreenwalt Т. J., Polka R., Аm. J. Clin. Pathol., 33, 358 (1960).
31. Pruessner W., Frick О., Ergebnisse von Lуmрhоzуtепisоliеruпgеп aus
ACD und ACD-IпfuсоllfrisсhbIut nach Ti'ennung in Glasper1en- und De-
derongewebesiiulen, Z. ges. inn. Med., 24, 661 (1969).
32. Minor А. Н., Burnett L., Blood, 4, 667 (1949).
33. Hastings J., Freedтan 5., Reudon О., Соорет Н. L" Нirschhorn К, Cultu-
re of human white cells using differential 1eucocyte separation, Nature,
192, 1214 1215 (1961).
34. Eibl М., Nachweis der zelluliiren Immunitiit gegen homologes und auto-
loges, aggregiertes sowie gegen komplexgebundenes IgG bei primiir chro-
nischer Polyarthritis, Zschr. Imm. Forschung, ехр. и. klin. Imm., 144,
] 03 128.
35. Кирет 5. W. А., Bignall J. R" Luckock Е. D., А quantitative method for
studying turnover of cells in blood, Lапсеt, 1, 852 853 (1961).
36. 5Ьатта А. J., Karnovsky М. L., ТЬе biochemical basis of phagocytosis.
1. Metabolic cl1anges duriпg the ingestion of particles Ьу polymorphonuc-
lear leucocytes, J. Biol. Chem" 234, 1355 1362 (1959).
37. Carstairs К, The human small Iymphocyte: its possible pluripotential
quality, Lancet, 1, 829 832 (1962).
38. Cassen В., НШ J., Hays Е. F., The efficient separation of Iymphacytes
from normal human blood, J. Lab. Сliп. Med., 52, 778 (1958).
39. 5tewart С. С., /ngram М., А method for counting phytohemagglutinin
stimulated lymphocytes, Blood, 29, 628 639 (1967).
40. Thierfelder 5., А method for the isalation af human lymphacytes, Vax
sanguinis, 9, 447 454 (1964).
41. Hughes D., Caspary Е. А., Lymphocyte Transformation in vitro Measured
Ьу Tritiated Thymidin Uptake, Int. Arch. Allergy аррl. Immun., 37, 506
(1970).
46. Выделение
различных субпопуляций лимфоцитов
с помощью колонок
в. Блудит
46.1. ПРИНЦИП
В последнее время был разработан ряд методов, позволя-
ющих фракционировать иммунокомпетентные клетки. К та-
ким методам относится, во-первых, свободный клеточный
электрофорез по Цейлеру и Ханниху [1, 2], с помощью ко-
roporo можно сортировать клетки в зависимости от их заря-
да и величины (см. разд. 40).
Таким образом, например, В клетки отделяют от Т-клеток.
Дальнейшее разделение на субпопуляции возможно при ис-
lJIользовании друrих методов. BO BTOpЫX, клетки можно изби-
рательно пометить флуорохромированными антиrенами или
антителами, а затем, осветив лучом лазера, выделить по
Фулуайлеру [3] с помощью электронноrо клеточноrо сепара-
тора. В таком сепараторе вытекающая из капилляра суспен-
зия клеток дробится кварцевым резонатором на, мелкие кап-
ли. Капли, в которых содержатся меченые клетки, приобрета-
ют заряд, изменяют свою траекторию в электрическо:vI поле
и собираются в отдельном приемном сосуде. Как сообщил
Вофси [5] на Международном симпозиуме иммунолоrов в
1972 r. (Буффало, штат Нью-йорк, США), этот требующий
специальной аппаратуры метод позволяет с высокой точно-
стью сортировать клетки по специфическим рецепторам. При
аффинном разделении клеток на колонках исходят из Toro,
что клеточные элементы, которые либо сами синтезируют
циркулирующие или клеточные антитела, либо пассивно ад-
,сорбируют и несут их на своей мембране, способны реаrиро-
вать со специфическим антиrеном. Если иммобилизовать ан-
тиrен на поверхности какоrо-либо носителя, то при контакте
с последним реаrирующие клетки в результате связывания
антитела с антиrеном ПРОЯlВляют большие адrезивные свой-
ства, чем не реаrирующие.
46.2. МЕТОДИКА
46.2.1. реаrепты и приборы
Колонки с термостатирующими рубашками; улыратер-
мостат; силиконированныестеклянные бусы или полиметак-
рилат.ные бусы (,деrалан v 26) для заполнения колонок; сре-
да Иrла.
364 В. Баудuш
46.2.2.
Выделение клеток
По Уиrзеллу и Андерсону [4] мышей иммунизируют раз
ЛИчными антиrеlIами (сывороточным альбумином человека
или быка, яичным альбумином) в ПО:IНом адъюванте Фрейн-
да. После повторной инъекции. антиrена извлекают реrио-
нарные лимфоузлы и приrотовляют суспензию в среде Иrла.
46.2.3.
Разделение клеток
:Колонки 1,5Х 100 см заполняют полиметакрилатными бу
сами (деrалан V 26, Degussa, raHay, ФРr) или стеклянными
бусами (<<баллотини», УЕВ Trisola StШzеrЬасh, Betrieb Lau-
scha, r ДР; диаметр 20 мкм). Для очистки полиметакрилат
ных бус применяют воду. Стеклянные бусы очищают царской
водкой (1 часть НNО з +3 части HCl). Очищенные бусы про
мывают средой Иrла. После этоrо колонку заполняют той
же средой, содержащей 1 10 мr/мл соответствующеrо анти-
reHa. Выдерживают 1 ч при 45 ос и 8 12 ч при 4 ОС, а затем
удаляют избыток антиrена средой Иrла. Деrалан V 26 связы-
вает приблизительно в 25 раз больше антиrена, чем стеклян-
ные бусы. С помощью приrотовленной таким образом колон-
ки можно разделить примерно 3.108 клеток. :Клеточную cyc
пензию и вслед за неЙ среду Иrла пропускают через колонку
со скоростью 3 мл/мин. :Как правило, вышедшая из колонки
суспензия уже не содержит (или утратила 99 + 1 %) клеток,
образующих антитела к данному антиrену. Если после этоrо
промыть колонку средой Иrла, содержащей растворенный aH
тиrен, то можно элюировать часть таких клеток. Элюирова-
ние происходит в результате конкуренции свободноrо и свя-
занноrо антиrена.
Описанный метод позволяет выделить только те В-клетки,
которые обладают специфическими рецепторами для данноrо
аНТИrена [5, 6]. Специфическое выделение Т-клеток, несущих
мало рецепторов, до сих пор не удавалось. Уиrзелл, rолд-
стейн, Сведмир и Джондал [7] предложили метод разделе-
ния В- и Т-клеток на колонке с антителами к иммуноrлобу-
линам данноrо вида. В-клетки, несущие иммуноrлобулины,
остаются на колонке, а выходящая суспензия содержит отно-
сительно чистые Т-клетки. Для воспроизведения этО'rо метода
колонку 60Х 1,5 см заполняЮт полиметакрилатными (деrалан
V 26) бусами, заrружают ра'створом иммуноrлобулина СООТ-
ветствующеrо вида (иммуноrлобули-н осаждают из сывороток
40 %-ным раствором сульфаТа аммония и применяют
в концентрации 5 мr/мл) J затем промывают изотони-
46. Выделение различных субпопуляций лимфоцитов з65
ческим раствором и обрабатывают антисывороткой к имму
ноrлобулинам (концентрация антиrлобулиновоrо peareHTa
1 мr/мл; продолжительность контакта около 2 ч). После 'yдa
ления избытка антиrлобулиновых антител в колонку при 4 ос
вносят клеточную суспензию, отмытую изотоническим paCTBO
ром NaCl. При фракционировании клеток тимуса, селезенки
и лимфоузлов выходящие из колонки суспензии содерЖалИ
до 90 100% Т-клеток.
Траффа Баши и Вофси [8] разработали улучшенный Ba
риант этой методики. Они покрывали деrалановые бусы био
rелем Р6, к которому с помощью диазотирования по Инману
и Динцису [9] привязывали антитела. В колонке, заполнен
ной такими бусами, антитела полностью иммобилизованы; ее
можно использовать MHoroKpaTHo, и она с высокой избира-
тельностью задерживает клетки, образующие антитела. Из
колонки выходят и элюируются около 99% общеrо числа на-
несенных клеток. В среднем при элюировании :vIожно ВЫде-
лить 10 20% клеток, образующих антитела. Эта методика.
несмотря на довольно сложный опособ конъюrации антиrена
с био rелем, позволяет также с высокой ВОСПРОИЗВОДИ:vIостью
избирательно удалять из суспензии ИММУНОКО:vIпетентные
клетки определенной специфичности. В частности, описано
удаление клеток, специфичных по отношению к фенил -лак-
тозиду (rаптен). Для работы с друrими антиrенами методику
необходимо соответствующим образом модифицировать.
46.3. ОБЩЕЕ ЗАМЕЧАНИЕ
Ни одна из известных методик аффинноrо разделения не
rарантирует полноrо оовобождения суспензии от клеток дaH
ной специфичности. Как правило, удается удалить до 90
99 % таких клеток.
46.4. ЛИТЕРА ТУРА
1. Zeiller ., Hannig К., Free f10w electrophoretic separation of lymphocytes.
SeparatlOn of graft versus host reactive Iymphocytes of rat spleens Hoppe
Seyler's Z. Physio!. Chemie, 352, 1! 62 и. 1168 (1971). '
2. Zetller «.., Н olzberg Е., Pascher а., Hannig к., Free flow electrophoretic
separatlOn of т and B-Iymphocytes. Evidence for various subpopulation&
of В cells, Hoppe-Seyler's Z. Physio!. Chemie, 353, 105 110 (1972).
3. Fulwyler М. J., Electronic separation of bio!ogica! cells Ьу volume Scien
се, 150, 910 (1965). '
4. Wigzell Н., Andersson В., Cell separation оп antigen coated соlumпs J
ехр. Biol. Med., 129, 23 36 (1968). ' .
5. Wofsy L., Receptor specific сеII purification. Vortrag III. Zusammenkunft
366 В. Баудиш
der Immunologen, 1'2. 15. 6. 1972, Buffalo/N. У.
6. Wofsy L., Кimura 1., Truffa-Bachi Р., СеВ separation оп affinity columns:
The preparation of pure populations of anti-hapten specific lymphocytes,
J. Immunol., 107,724 (1971).
7. Wigzell Н., Goldstein Р., Svedmyr Е. А. 1., londahl М., Impact of frac-
tionation procedures оп lymphocyte activities in vitro and in vivo. Sepa-
rаtiоп of cells with high concentrations of surface immunoglobulin,
Transpl. Proc., IV, 311 (1972).
'8. Truffa-Bachi Р., Wofsy L., Specific Separation of CeBs оп Affinity Со-
lumns, Proc. nat. Acad. Sci., 66, 685 692 (1970).
9. /nтаn 1. к., Dintzis Н. М., Biochemistry, 8, 4074 (1969).
47. QPракционирование
суспензии лимфоцитов
с помощью центрифуrирования
в rрадиенте плотности
r. Л. ИЕНСЕН, 10. Б"УРМЕйСТЕР
47.1. ПРИНЦИП
Принцип метода становится очевиДНЫМ из уравнения ce
диментации
S 2 V (р' р)
==(() r f '
rде S скорость 'Седиментации, (() уrловая скорость враще-
ния ротора, r расстояние клетки от оси вращения, V
объем отдельной клетки, р' плотность клеток, р плотность
среды и f коэффициент трения.
В то время как при дифференциальном центрифуrирова
нии разделение клеток обусловлено различиями в их величи-
не (V)J описанный в этой rлаве метод основан на различиях
в плотности, p/ p. Относительно простым случаем, Коrда rpa-
диент плотности : == О, является зона"lьное центрифуrирова
ние, при котором клетки, суспендированные в среде с низкой
плот!ностью, тонким слоем наносят в пробирке на столбик
более плотной однородной среды. Во время цеНl'рифуrиро
вания отдеЛЬНЫе компоненты суспензии, двиrая.сь от одной
и той же стартовой линии, седиментируют в виде отдельных
зон. Напротив, при rрадиентном центрифуrировании суспен
зию клеток наносят на среду, плотность которой возрастает
по направлению к дну пробирки. В результате в сто.lбике
жидкости под каждым слоем располаrается слой более BЫCO
кой плотности. Блаrодаря этому при центрифуrировании
зоны клеток задерживаются в центрифужной пробирке на
определенных уровнях. В связи с этим метод называется TaK
же изопикническим: зональным центрифуrированием (анrл.
isopycnic zonal separation) {1].
Центрифуrирование в rрадиенте плотности весьма эф
фективный метод аналитическоrо и препара'Тивноrо разделе
ния частиц, клеток и макромолекул. В 1968 r. Шортман впер
вые показал возможность разделения иммунокомпетентных
клеток с помощью центрифуrирования в rрадиенте плотности
[2]. Морфолоrически идентичные лимфоциты из ЛИМфОII..1.НЫХ
opraHoB вели себя в rрадиенте альбумина как rетероrенная
суспензия. На основании дальнейших исследований Шортман
пришел к выводу, что плотность клеток это параметр, ха-
368 r.-Л Иенсен, Ю. Бур.нейсrер
рактеризующий разные классы лимфоцитов и позволяющий
отделить один КJIa,cc от друrоrо [3]. Далее в работах Хас-
килла [4] была установлена определенная корреляция меж-
ду плотностью лимфоцитов И их функциональными особен-
НОСТЮШ. Существуют также видовые различия плотности
мононуклеаров: у человека 1,050 1,065 r/мл [5], у крыс
1,065 1,085 rjмл [6], у мышей 1,045 1,085 r/мл [7].
47.2.
47.2.1.
МЕТОДИКА
Реаrепты и приборы
Для приrотовления rрадиента плотности нужно иметь ok
но из следующих веществ: фиколл (Pharmacia, Упсала, Шве-
ция), альбумин, декстран, сахарозу, rуммиарабик или rли-
KoreH.
Центрифуrа, имеющая охлаждение и по возможности ро-
тор с подвесными стаканами. Смеситель для приrотовления
rрадиентов; это может быть один из коммерческих приборов:
ультроrрад (L.KB., Стокrольм) или смеситель G.M.-l (Phar-
macia, Упсала, Швеция), либо устройство собст.венноrо }{зrо-
товления [2, 8, 9]. Простой способ приrотовления rрадиента
Qписан ниже.
47.2.2.
Методика
Соrласно КреЙцу и Менка [10], можно приrотовить rpa
диент без смесителя, аккуратно наслаивая в центрифужном
стакане растворы названных выше веществ различной плот-
ности. Получается ступенчатый rрадиент, который через 12
24 ч сrлаживается в результате диффузии. Бсли требуется
приrотовить линейный rрадиент или rрадиент определенной
формы, то с успехом применяют устройство, схематически
представленное на рис. 93. Оно состоит из двух .сообщающих-
ся сосудов, содержащих тяжелый и леrкий компоненты rpa-
диента. Тяжелый компонент, вытекая из cBoero сосуда, непре-
рывно смешивается с леrким. Плотность смеси становится
функцией ее уже вытекшеrо объема и выражается уравне-
нием, в которое отношение сечений обоих -сосудов входит как
показательстепени (рис. 93). Равенство сечений дает пря-
молинейную, а нера'венство выпуклую или воrнутую форму
rрадиента плотности. Обычно наиболее удобными оказыва-
лись выпуклые rрадиенты. Для приrотовления rрадиента сле-
дует использовать инертные соединения, которые не диосо-
циируют ,на ионы, дают ра,створы с низкой вязкостью и ми-
нимальным осмотическим эффектом и не повреждают клеткИ.
47. Фракционирование суспензии лимфоцитов 369
Эти своЙства в наибольшей степени присущи фиколлу ибычь
ему сывороточному альбумину.
Центрифуrирование (требования к центрифуrе см. выше)
проводят при 100 400 g и 4 ос в течение 7 50 мин. Скорость
и продолжительность центрифуrирования должны соответст-
вовать конкретным условиям э сперимента. В результате
1
tJffij
v 02
P(Y)"fJ2 f.P2 ;Of)(1 v) о;
т
l'
:: v
v,.
V
J1(vJ-J12 f,P2 jJf)е У т
l'
: p v
Рис, 93. Приrотовление непрерывноrо rрадиента плотности. Pj, Р2 ПЛОТ-
ность исходных растворов; р плотность смеси; Ql, Q2 поперечное сече-
ние сосудов; V объем смеси; У Т общий объем вытекших исходных рас-
Т1 OpOB; V m объем смесителя.
Клетки, ра,сполаrающиеся на тех уровнях rрадиента, rде плот-
ность среды равна их собственной плотности, можно собрать
пипеткой в виде отдельных фракций.
47.2.3.
Варианты :метода
Ультрацентрифуrируя ра,створы высокомолекулярных ве-
ществ (например, фиколла), можно создать rрадиент П,,10ТНО-
сти прямо В центрифУ)IШОМ стакане [30, 31]. Использование
обычных ультрацентрифуr для центрифуrирования в rрадиен-
те плотности рассмотрено в статье Виноrрада и Хёрста [32].
Из-за малоrо объема обычные роторы не подходят для пре-
паративноrо разделения клеток. В 50-х [одах был разрабо-
тан новый тип ротора. Он имеет цилиндрическую полость
общей емкостью до 1,6 л, подразделенную четырьмя переrо-
родками ,на 4 сектора (зональный ротор типа А-ХН, MSE,
Лондон). [радиент плотности создаетсЯ при ультрацентрифу
rировании разделяющей среды. После этоrо прои:Зводят р.аз-
деление клеток, переключив центриф)ту на работу в нормаль-
24 840
370 r.-.п. Иенсен, Ю. БУРАtейстер
ном режиме. Такой усовершенствованный ротор позволяет
вести непрерывное разделение. Дальнейшую модификацию
метода предложили Претлоу и Бун [8]. Их rраДИент, обра-
зованный фиколлом в культуральнойсреде, находится под
постоянным контролем компьютера. Блаrодаря этому непо-
средственно в ходе эксперимента можно создавать оптималь-
ные условия разделения, в частности изменять концентрацию
фиколла, форму rрадиента, скорость и продолжительность
центрифуrирования. Теоретически метод позволяет отделять
друr от друrа клетки, различающиеся не более чем на 1 мкм
по диаметру или на 0,01 r/мл по плотности. С помощью ком-
пьютера можно заранее рассчитать, в какой из 25 получен-
ных фракций будут находиться клетки определенноrо тиПа.
47.3. ОБЩАЯ ОЦЕНКА
С помощью центрифутирования в rрадиенте плотности
удалось получить ценные сведения о предшественниках кл
ток, образующих антитела [11], о различных типах клеток,
дающих зоны rемолиза [12 17], о происхождении клеток ИМ-
мунолоrической памяти [18] и о различиях между B и Т-
лимфоцитами [19 22]. Метод позволяет в 50 140 раз уве-
личить относительное содержание клеток, образующих анти-
тела, в соответствующей фракции взвеси [12, 23] и разде-
лить популяцию лимфоцитов на 20 30 отдельных фракций
{12, 23, 24]. Из недостатков rрадиентноrо центрифуrирования
'следует отметить прежде Bcero заrрязнение клеточных сус-
лензий частицами разделяющих сред, большинство из кото-
рых обладают антиrенной активностью [25, 26], и возникно-
вение артефактов из за различий в осмолярности [25, 27].
Кроме Toro, различия в плотности некоторых фракций отча-
'сти ,со;ответствуют лишь разным стадиям дифференцировки
одних и тех же клеток [23, 28]. Как показал Эккерт [29],
это оrраничивает возможности как выделения, так и устра-
нения определенных популяций лимфоцитов.
Один из методов выделения лимфоцитов из крови с по-
мощью rрадиента плотности был предложен Бёйюмом [33].
Берут из вены в rепарин 5 10 мл крови, разбавляют 1: 2
или 1 : 4 средой Иrла и осторожно наслаивают на разделяю-
щий раствор (<<лимфопреп», Nyegaard & Со., Осло), разли-
тый по 3 мл В 25-миллилитровые центрифужные стаканы. За-
тем 40 мин центрифуrируют при 600 g и комнатной темпера-
туре. Лимфоциты образуют беловатый слой над разделяю-
ЩИМ раствором; их собирают пастеровской или микролитро-
вой пипеткой и отмывают. Чтобы избавиться от примеси
тромбоцитов, последнее отмыва,ние целесообразно закончить
47. Фракционирование суспензии ли,ифоцитов 371
центрифуrированием суспензии в течение 10 мин при 200 g.
Вместо «лимфопрепа» можно воспользоваться разделяющи
ми растворами собственноrо приrотовления, как описано
ниже.
1. [отовят 9 % -ный раствор фиколла в бидистиллирован
ной воде и доводят ero плотность до 1,077 r/мл с помощью
визотраста 370 (VEB Falberg List, Маrдебурr, [ДР). Для
определения плотности можно применить весы Вестфаля
(Joh. Hammer, Лейпциr, [ДР). После автоклавирования pac
твор сохраняется в холодильнике более месяца.
2. Хорошее разделение дает также раствор, не содержа
щий фиколла. Ero приrотовляют, разбавляя бидистиллиро
ванной водой рентrеноконтрастный препарат урополониум
'(Polfa, Стаrрад, пнр) или уромиро (Bracco Industria Chi
mica S. р., Милан, Италия) до плотности 1,076 1,085 r/мл.
Далее поступают так же, как указано выше. Время центр и-
фуrирова,ния следует сократить до 20 мин [34, 35].
47.4. ЛИТЕРАТУРА
1. Eicheпberger W., Trennung biologischer Partikel durch Zentrifugation
im Dichtegradienten, Chimia, 23 (1969), 85 94.
2. Shortmaп К, The separation of different cell classes from lymphoid or-
gans, Aust. J. ехр. Biol. Мед. Sci., 46 (1968), 375 396.
3. Shortman К, Equilibrium density gradicnt separation and analysis of
Iymphocyte population. In: Modern separation meihods 01 macromolecu-
les апд particles, John WiIey & Sons Inc., Ne\v York, 1969.
4. Haskill S., Density distribution analysis of antigen sensitive cells in the
rat, J, ехр. Мед., 130 (1969), 877 893.
5. Pertoff Н., Back О., Liпdahl Кiessliпg К. Separation of various blood
cells in colloidal silica polyvinylpyrrolidone gradients, Ехр. Cell. Res.,
50 (1968), 355.
6. Wekerle Н., Fischer Н., Changes in density distribution of Iymphoid сеll
populations after РНА stimulation in vivo, Int. Arch. Allergy, 38 (1970),
225,
7. Gorczynski R. М., Miller R. G., РhiШрs R. А., IdепtШсаtiоп Ьу density
separation of апtigепе-sресШс surface receptors оп the progenitors of
antibody-producing cells, Immunology, 20 (1971),693.
8. Pretlow Т. G., Воопе С. W., Separation of mammalian cells using pro-
grammed gradient sedimentation, Ехр. Mol. Path., 11 (1969), 139 152.
9. Neff S. Н., Meeker G. L., А modified fixed-volume mixer for extended suc-
rose density gradients, Analytical Biochemistry, 41 (1971), 365 371.
10. Kreutz W., Meпke W., Z. Naturforsch., 156 (1960),402.
11. Miller Н. С., Cudkowicz G., Density gradient separation of marrow pre
cursor cells restricted for antibody specificity, Science, 173 ('1971), 156.
12. Kraft N., Shortman К., Marchalouis J., Density distribution analysis of
а primary antibody forming сеВ response, Immunology, 20 (1971), 919.
13. Moav N., Harris Т. N., Biologic activities of Iymph cells fractionated оп
bovine plasma albumin, J. Immunol., 105 (1971), 1512.
14. Moller О., Hiesche К, Fractionation of immunocompetent spleen celIs Ьу
albumin density gradient centrifugation, Immunology, 18 (1970), 585.
15. Raidt D. J., Mishell R. J., Duttou R. W., Cellular events in the immune
response (Analysis and in vitro response of mouse spleen cell populations
24.
372' r. Л. Иенсен, Ю. Бур.иейстер
separated Ьу differentia1 f1otation in albumin gradients), J. ехр. Med.,
128 (1968), 681. :
16. Thumra S. е! al., Separation of mouse sp1een cells into popu1ations with
different immuno1ogica1 properties, Jap. J. Med. Sci. BioJ., 24 (1971),
257.:
17. Yamashita A. Кау J; В.; Lafferty К. J., Separation and characterization
of cells produced Ьу the antigenically stimu'ated 1утрЬ node, Aust. J. ехр.
. Biol. Med. Sci., 48 (1970), 619. .
18. Lage-Stehr J., Herzenberg L. А., Immunologica1 memory in mice; 1. РЬу-
sical separation and partic'e characterization of memory cells for dif-
ferent immunog'obulin classes from еасЬ other and from antibody pro-
ducing cells, J. ехр. Med., 131 (1970), 1093.
19. Aisenberg А. С., Murray С., Size and densityana1ysis of rodent 'ymphoid
cells, J. lmmuno'., 107 (1971),284.
20. Dichie К. А., van Hooft J. 1. к., Beckum D. W., ТЬе se'ective elimination
of immuno'ogically competent cells from Ьопе marrow and 1ymphatic се1l
mixtures. П. Mouse spleen cell fractionation оп а discontinuous albumin
gradient, Transplantation, 6 (1971), 562. .
21. Szenenberg А., Shortman к., Fraction of fow1 blood 1ymphocytes Ьу their
buoyant density. Localization af cells active in graft-versus-host reactions,
Ат. N. У. Acad. Sci., 129 (1966),310.
22. Takigudi Т., Adler W. Н., Smith R. Т., Identification of mouse thymus
antigen recognition {ипсНоп in а minor 10w density, 10w theta се1l sub
population, Се1l. Immunol., 2 (1971), 373. - ,!
23. Kraft N., Shortman к., Differentiation of. antibody forming cells in toad
sp'een. А study using density and sedimentation ve'ocity се1l separation,
J. Се1l. Biol., 52 (1972), 438. . ,
24. Shortman к., ТЬе separation of different се1l classes from 'ymphoid or-
gans. П. ТЬе purification and ana'ysis of Iymphocyte popu1ations Ьу
еquШЬriuт density gradient centrifugation, Aust. J. ехр. Bio1. Med. Sci:,
46 (1968),375. '
25. Shortman к., ЕquШЬrium density gradient separation and analysis 01
1ymphocytes populations. Progress in separation and рurifiсаtiоп, J.
Whiley, Inc., New York, Уо'., 2 (1969), 167.
26. Wigzell Н., Andersson В., Isolation of 'ymphoid cells with active sиrface
receptor sites, Ат. Rev. Microbiol., 25 (1971), 291.
27. Gorozynki R. М., МШе, R. G., Phillips R. А., Homogeneity -af antibody-
producing cells as analysed Ьу their buoyant density in gradients of Нсоll,
Immunology, 19 (1970),817.
28. Shortmann к., Brunner К. Т., Cerotini J. С., Separation of stages in the
development оУ the «1» cells invo1ved in се1l mediated immunity, J. ехр.
Med., 135 (1972), 1375.
29. Eckert R., Untersuchungen zur Saulenfraktionierung von .lmmunzellen,
Diss. Berlin, 1972. .' '.
30. Pretlow Т. G., Estimation of Experimenta1 Conditions that Permit СеВ
Sераrаtiопs Ьу Velocity Sedimentation оп Isokinetic Gradients of Ficoll
in Tissue Culiure Medium, Anal. Biochem., 41 (1971), 248 Z55.
31. Hearst J. Е., lfft J. В., Vinograd J., Proc. Nat. Acad. Sci., 47 (1961 ;
1015.
32. Vinograd J., Н earst J. Е., Fortschr. СЬет. org. N aturstoffe,. 20 (1962),
372
33. Вдуит А., Separation of bIood 1eucocytes, granulocytes a.nd 1ymphocytes,
Tissue Antigens, 4 (1974),269. '
34. Otto F., Schmid D. О., Lymphozytenisolierung aus dem Blut des Мепsсhеч
und der Tiere, Blut, 21 (1970), 118 lZI.
35. Lampert F., Dietmaier Е., А 1eucocyte adherence inhibltion test for сеН-
mediated immunity, КIin. Wschr., 51 ('973), 198 199.
48. Иммуноrистолоrия 1
Б. ЭРНСТ, Д. ТЕСМАН
48.1. ПРИНЦИП
В иммуноrистолоrии используется способность антител да-
вать преципитат со специфическим антиrеном. Поэтому ос-
новным peareHToM в иммуноrистолоrических методах явля
ются преципитирующие антитела. В отличие от друrих имму
нолоrических методов иммуноrистолоrия позволяет изучать
топоrрафию иммунной реакции в тканях и клетках. Место ОТ-
ложения преципитатов антиrен антитело становится види-
мым в результате применения специфиче.ских иммуноrлобу-
линов (антител), антиrенов или комплемента (С, С3, lс rло-
булин), помеченных УФ чувствительным флуоресцентным
красителем.
Даже небольшое число молекул красителя, присоединив-
шись к молекуле белка, служит хорошей меткой блаrодаря
интенсивной флуоресценции. Обычно при маркировании бел-
ков краситель присоединяется лишь к 8 9% rрупп, способ
ных связывать ero. Поэтому физико-химические и иммуноло-
rические свойства меченоrо белка практически не изменя-
ются.
В иммуноrистолоrии различают два принципиальных под-
хода: при прямом методе для выявления антиrена на иссле
дуемый объект наносят антитела, меченные флуоресцеИНО:v1
(ри,с. 94,А); при непря},to!',t методе сначала дают содержаще-
муся в исследуемом объекте антиrену прореаrировать с Не:У1е-
ченым специфическим иммуноrлобулином, а затем ВЫЯВ.'lяют
последний с помощью меченоrо анти-Ig-реаrента (рис. 94, Б).
Оба метода применяются в мноrочисленных вариантах.
Для выявления иммунных преципитатов в срезах тканей осо-
бенно удобно использовать комплемент, так как он связыва
ется с комплексами антиrен антитело и поэтому служит ин-
дикатором тех участков, rде произошла иммунолоrическая
реакция.
Из мноrочисленных красителей, предложенных для ф.1УО-
ресцентноrо окрашивания белков, в настоящее время приме-
няется почти исключительно изотиоцианат флуоресцеина
(ФИТЦ). В ультрафиолете он флуоресцирует зеленым све-
1 В отечественной литературе иммуноrистолоrические методы наЗbIва-
ют также иммуноrистохимическими.. ПjiilМ. .перев..
374 Б. Эрн.ст, д. Тесм.ан.
том (520 нм). В качестве дополнительноrо красителя в спе-
циальных исследованиях, коrда нужно, например, одновре-
менно пометить два вида антител различным образом, при-
меняют изотиоцианат родамина В 200, который дает оран-
жево-краоную флуоресценцию.
А пр...,,, иeтoiJ
,\/1/ 1
OO g ............
. Антuzен . П Антиеен
б Нелр.ямоtJ метоа
.п
Антиесн
00 ............ Антиеен
Рис. 94. Схемы основных методов иммуноrистолоrии.
в основе флуоресцентной метки белков изотиоцианатами
лежит -следующая химическая реакция:
Белок-NН 2 + S==С==N краситель Белок-NН С NН краситель.
11
S
Краситель реаrирует rлавным образом со свободными
аминоrруппами лизина. Подробнее иммуноrистолоrические
методы описаны в обширной литературе [16, 66, 89, 115, 157,
178,211,233].
48.2.
48.2.1.
МЕТОДИКА
Получение антисывороток
в качестве peareHToB в иммуноrистолоrии используются
антисыворотки всевозможной специфичности, полученные к
растворимым инерастворимым антиrенам бактерий, rрибов,
вирусов, тканевых rOMoreHaToB и их фракций. Из за MHoro-
образия антиrенноrо материала нельзя предложить одну оп-
тимальную для всех случаев схему получения антисывороток.
Как правило, выбирают подходящих животных продуцентов
и делают им повторные инъекции ра,створимоrо или нерас-
творимоrо антиrена. Чаще Bcero продуцентами антисыворо-
ток служат кролики, но используются также куры, козы, .110-
48. И ММУ1tоzистолоzия 375
шади и друrие животные. Обычно отдается предпочтение
внутривенным инъекциям антиrена, но часто применяются и
J.руrие пути в:ведения (подкожный, внутрибрюшинный, BHY
тримышечный и т. д.). Для получения антисывороток узкой
специфичности особое значение имеет первая инъекция ан-
тиrена, но однократная иммунизация, как правило, не дает
достаточноrо титра антител. Чтобы стимулировать образова-
ние антител в ответ на инъекции растворимых антиrенов или
тканевых rOMoreHaToB, во время иМ'мунизации вводят aдъ
юванты. Чаще Bcero применяют полный или неполный aдъ
ювант Фрейнда и калиево алюминиевые квасцы [K2S04'
.А12(S04)з.24Н2О]. Из множества описанных в литературе
схем иммунизации (см. [66, 89]) большая часть включает
использование адъюванта Фрейнда. Во мноrих случаях до-
статочно бывает провести 3 4 иммунизации с недельным ин
тервалом, вводя антиrен в разные части тела животноrо под-
кожно или внутримышечно. Адъювант перед иммунизацией
тщательно перемешивают с раствором или суспензией анти-
reHa в соотношении от 3: 1 до 1 : 1. Если количество антиrена
измерять по белку, то на курс иммунизации, который состо-
ит из повторных инъекций и длится от 3 4 недель до не-
скольких месяцев, идет в общей сложности 100 200 Mr. В ка-
честве примера мы приводим ниже ПРИ:v1:еняемую у нас мето-
дику получения антисыворотки к человеческому rамма-rло-
'булИrНУ (растворимый антиrен).
Для выявления иммунных комплексов с помощью ком,п-
лемента (см. 48.2.9.2.3) нужно иметь или очищенные компо-
ненты комплемента, напримеР lО/ lА rлобулин [176], или на-
тивную сыворотку морской свинки, в которой КОМШlемента
очень MHoro [120]. Для получения антисыворотки к компле-
менту можно иммунизировать животное либо нативноЙ цель-
ной сывороткой, у-rлобулином [122] или lс-rлобулином
,[ 138], либо комплементом, фиксированным на arperaTax ан-
тиrен антитело [121, 122, 164].
Маркирование а,нтисыворотки к ком'плементу с помощью
ФИТЦ производится так же, как и присоединение метки к
любым друrим препаратам антител (см. 48.2.5).
48.2.1.1.
Реаrенты :и животные
Человеческий у-rлобулин (Forschungsinstitut fi.ir Impf
stoffe, Dessau, [ДР); модифицированный неполный адъювант
Фрейнда ['80] смесь 9 частей вазелиновоrо масла (VEB Le-
una-Werke, [ДР) и 1 части эмульrатора К. (VEB Deutsches
Hydrierwerk, Rodleben, [ДР); 0,9 % ный раствор N aCl; KpO
lИКИ.
376 Б. Эрнст, Д. Тесман
48.2.j.2.
И:&IМУВИзация
И получение :нативной антисыворотRИ
Растворяют 20 Mr человеческоrо у-rлобулина в 1 мл
0,9%-Horo раствора NaCl и смешивают с равным объемом
неполноrо адъюва,нта Фрейнда. Смесь вводят кролику под
кожу спины выше задней лапы l . Через 6 8 недель тому же
кролику вновь подкожно вводят 30 40 Mr v-rлобулина в 1 мл
0,9%-Horo раствора NaCl, без адъюванта Фрейнда. Инъек-
цию делают в одноименную область на друrой стороне тела.
На 7-й день после повторной иммунизации из ушной вены бе-
рут 2 мл крови. Обычным способом получают сыворотку (см.
ниже) и определяют титр антител в реакции Ухтерлони (см.
разд. 3). Если полученная антисыворотка еще дает ясно ви-
димые линии преципитации в разведении 1 : 16 1 : 32, то lI40Ж-
но считать, что данное животное образует достаточно анти-
те.'! к человеческому v-rлобулину. Если это не так, иммуни-
зацию повторяют еще один раз аналоrичным образом. Кро-
лика, образующеrо достаточно антител, либо полностью обес-
кровливают, либо оставляют жить, взяв из ушной вены или
сердца 30 40 мл крови. Оставленному в живых кролику
можно при необходимости еще раз ввести 30 40 Mr v-rло-
булина и снова получить антисыворотку.
Взятую у животноrо кровь выдерживают 30 мин при
37 ОС, а затем несколько часов при 4 0 с. В холодильнике
происходитретракция фибриновоrо crycTKa, что увеличивает
выход сыворотки. Сыворотку центрифуrируют 10 мин при
2500 об/мин и осторожно отсасывают пипеткой. Если сыво-
ротка сильно опалесцирует из-за примеси липидов, их удаля-
ют путем встряхивания с несколькими миллилитрами хлоро-
фор:ма.
48.2.2.
Определение
специфической активности
антисыворотки
Чтобы установить, насколько приrодна данная меченая
или немеченая сыворотка, необходимо определить примерное
содержание в ней специфических антител. Чаще Bcero для
этой цели пользуются реакцией преципитации в капиллярах
(Свифт и сотр. [242]; см. также [66]) или преципитацией
в arape по Ухтерлони [191].
I Чтобы получить достаточно активную антисыворотку, приходится
одновременно иммунизировать не менее 5 8 кроликов, из которых лишь
1 3 будут хорошими продуцентами. П рим. перев.
48. И М,муноzuстолмия 377,
в настоящее время обычно отдают предпочтение реакции
двойной диффузии по Ухтерлони, поскольку она позволяет
одновременно определить чистоту полученных антител. Если
сыворотка содержит антитела к одному-единственному ан-
тиrену, то в rеле образуется только одна линия преципита-
ции. В противном случае появится ,несколько линий, которые
будут соответствовать различным компонентам смеси анти-
[енов и антителам к ним. В качестве более чувствительноrо
метода для контроля специфичности антисыворотки может
служить иммуноэлектрофорез.
48.2.2.1. Реаrен1'Ы приборы
См. 3.2.1.
48.2.2.2. Методика
См. 3.2.2.
48.2.3. Выделение ИМl\fуноrлобулинов
(см. также разд. 33)
В настоящее время обычно уже не флуорохромируют не-
фракционированную сыворотку, и БО.1ЬШИНСТВО иммуноrисто-
лоrов работают с более или менее очищенными иммуноrло-
булинами. Очень высокая степень очистки не обязательна.
Для выделения иммуноrлобулинов из сыворотки в первую
очередь используются следующие методы: высаливание суль-
фатом аммония [23, 109]; осаждение этанолом [57, 183];
хроматоrрафия на ДЭАЭ-целлюлозе [142] или ДЭАЭ сефа.
дексе {95]; фракционирование риванолом (лактат 2-этокси-
6,9-диами>ноакридина, этодин) , который осаждает все сыво-
роточные белки, кроме rлобулинов, с последующим осажде-
нием rлобулинов ацетоном [91, 106] или сульфато:.1 aM 10
ния [229].
Мы предпочитаем выделять иммуноrлобулины с помощью
сульфата аммония по Яrеру и Никерсону [109], так как по
сравнению с этаноловым и риваноловым фракционированием
этот метод дает лучшие иммуноrистолоrические peareHTbI
[143, 185].
48.2.3.1. Реаrенты и приборы
Насыщенный раствор сульфата аммония; 0,9% ный рас-
твор NaCl; диализная мембрана.
48.2.3.2. Методика
К 10 мл нативной сыворотки в 25-миллилитровой центри
фужной пробирке по каплям прибавляют 5 мл насыщенноrо
раствора (NH 4 ) 2504. После добавления каждых 0,5 мл оса-
378 Б. Эрнст, Д. Тесм.ан
дителя пробирку тщательно встряхивают. При этом, пока
общий объем добавленноrо осадителя не достиrнет 3 мл, оса-
док должен исчезать. После Toro как раствор сульфата ам-
мония будет внесен полностью, суспензию на 12 ч оставля
ют при 4 ОС, а затем центрифуrируют 20 мин при 3000 об/мин;
прозрачную надосадочную жидкость отбрасывают. Пользуясь
стеклянной палочкой. осадок тонко эмульrируют в 30 мл ,pac
твора сульфата аммония 33% Horo насыщения. Затем вновь
центрифуrируют 30 мин при 3000 об/мин. Надосадочную
жидкость отбрасывают, а осадок ресуспендируют в 0,9% HOM
растворе NaCl и ставят на диализ против 1 л 0,9%-Horo рас-
твора NaCl для удаления остатков (NH4)2S04. Диализ про
должается 48 ч с мноrократ,ной сменой раствора.
48.2.4. Определение концентрации белка
При флуорохромировании иммуноrлобулинов ФИТЦ KOH
центрация белка в растворе должна составлять около 1 %.
Чтобы приrотовить такой раствор, надо сначала определить
концентрацию белка в исходном растворе. В данном случае
не требуется большой точности, поэтому rодится любой из
широко применяемых методов, таких, как микрометод Кьель-
даля, рефрактометрия, биуре'Т'овый метод, использование ре-
актива Фолина Чиокалыеу, определение УФ-абсорбции
при 280 нм, измерение адсорбции амидо-черноrо и т. п. (см.
обзоры [102, 117]). Мы предпочитаем определять концентра-
цию белка по адсорбции амидо-черноrо [201], так как эта
методика дает быстрый и вполне надежный O BeT и, кроме
Toro, вместе с иммуноrлобулинами она всеrда характеризует
примерно одни и те же белковые фракции, что исключает
значительную поrрешность измерений.
48.2.4.1.
Реаrепты и приборы
Осаждающий peareHT: 37,65 r лимонной кислоты, 1,136 r
N а2НРО4 и 0,6 r амидо-черноrо 10В растворяют в дистилли-
рованной воде и доводят объем раствора до 1000 мл.
Очищенный у-rлобулин человека; 0,9%-ный раствор NaCl.
Спектрофотометр «Спекол» (VEB Carl Zeiss, Иена, r ДР).
48.2.4.2.
Определение
К 1 мл исследуемоr'о раствора прибавляют 2 мл осажда-
ющеrо peareHTa, тщательно перемешивают и через 10 мин
центрифуrируют при 3000 об/мин. Затем 1 мл надосадочной
жидкости разбавляют до метки дистиллирован,ной водой в
48. И М,М,УНОZUСТОЛОZUЯ 379
25-МИЛЛIIЛИТРОВОЙ мерной колбочке и измеряют экстинкцию
полученноrо раствора при 600 нм В кювете шириной 1 СМ.
ДЛЯ определения концентрации белка пользуются калибро-
вочной кривой. Ее строят, притотовив четыре раствора, со-
держащие 100, 75, 50 и 25 Mr% очищенноrо человеческоrо
у-rлобулина. На rрафике должна получиться прямая линия.
48.2.5. Флуорохромирование иммувоrлобуливов ФИТЦ
Предложено м,ноrо модифицированных методик присоеди-
нения ФИТЦ к белкам (см. [66, 89]). Мы уже мноrие rодЫ
используем метод Риrrса и ,сотр. [21 О] с незначительны:ми
из.менениями.
48.2.5.1. Реаrепты и приборы
Флуоресцеинизотиоцианат (ФИТЦ)
0,5 М карбонат-бикарбонатный буфер с рН 9,0;
Раствор А 42,0 r N а 2 СО з на 1000 мл ДИСТИЛЛИРQlван-
ной воды
Раствор Б 143,1 r Nа 2 СО з .Н 2 О На 1000 мл дистилли-
рованной воды
9 объемов раствора А смешивают с 1 объемом раство-
ра Б
Забуференный фосфатами (0,01 М) раствор хлористоrо нат-
рия с рН 7,5 (ЗФР):
Раствор A 13,8r NaH 2 P0 4 .H 2 0 на 1000 мл дистишIИ-
рованной воды
Раствор Б 35,8 r Na2HP04.12H20 на 1000 мл дистил-
лированной воды
20 мл раствора А смешивают с 80 мл раствора Б и до-
,бавляют 0,85 r N aCl
Сефадекс G-50 (Pharmacia, Упсала, Швеция); диализная
мембрана; маrнитная мешалка; хроматоrрафическая колонка
(2Х30 см).
48.2.5.2.
Флуорохромировапие
Раствор Ig разбавляют 0,9%-ным раствором NaCl или
ко,нцентрируют так, чтобы содержание белка состав.ТIЯЛО 1 %
(см. 48.2.6). К 10 объемам полученноrо раствора Ig прибав-
ляют 1 объем 0,5 М карбонат-бикарбонатноrо буфера (рН
9,0). Полученный раствор охлаждают На льду и, перемеши-
вая, прибавляют к нему ФИТЦ из расчета 7 Mr на 1 r бе.ТТКа.
Раствор продолжают перемешивать последующие 12 ч при
380 Б. Эрнст, Д. Тес},шн. .
4 ос, затем ставят на диализ против ЗФР. При диализе, KO
торый продолжает,ся 12 ч при двух трехкратной смене ЗФР,
происходит смена буферной системы и удаление части несвя
завшеrося красителя. Дальнейшую очистку Конъюrата
ФИТЦ-белок производят на колонке сефадекса G-50.
[ель-фильтрацию осуществляют следующим образом.
Чтобы очистить 15 мл раствора флуорохромированноrо и
диализованноrо Ig, :суспендируют 4 r сефадекса G"50 в 150 мл
ЗФР II оставляют на 5 ч для набухания. Затем тщательно
перемешанной суспензией сефаде са заполняют xpoMaTorpa-
фическую колонку (2Х30 см), на ДНе которой находится
комок стеклянной ваты или переrородка из пористоrо стекла.
После оседания частичек сефадекса на поверхность rеля oc
торожно наносят флуорохромированный Ig. Как только он
проникнет в слой сефадекса, из присоединенной . 100-милли-
литровой капельной воронки в колонку начинают подавать
ЗФР. Подача ЗФР продолжается до тех пор, пока полностью
не покинет колонку первая содержащая белок фракция (бла-
rодаря флуоресценции за ее выходом можно наблюдать даже
при днеаном свете). Небольшое количество белка, которое
элюируется после флуорохромированноrо иммуноrлобулина
вместе со свободным красителем, вымывают с помощью ЗФР
и отбрасывают. За движением свободноrо красителя в колон-
ке леrко проследить он окрашивает сефадекс в розовый
цвет. После ero выхода на колонку можно наносить следую-
щую порцию конъюrата. Раствор очищенноrо флуорохроми-
pOBaHHoro Ig, если он не очень сильно разбавился при диали
зе и rель фильтрации, можно тотчас испытать на специфиче-
скую активность (ом. 48.2.10). Однако лишь очень редко уда-
ется избежать разбавления и ,cooTBeTcTBeHHoro падения титра
флуоресцирующих а,нтител. Чаще Bcero на этом этапе прихо-
дится концентрировать полученные элюаты.
48.2.6. :Концентрирование растворов,
содержащих иммуноrлобулины
Для концентрирования раствора Ig можно воспользовать-
ся разными приемами, например испарять избыточную влаrу,
выступающую на наружной поверхности диализноrо мешка,
или лиофилизировать раствор, а затем реrидратировать ero в
нужном объеме растворителя. Оба метода имеют общий не-
ДOCTaTOK приводят к повышению концентрации солей. Мож-
но, однако, сконцентрировать Ig, почти не изменив содержа-
ния солей, если поставить элюаты на диализ против 20
30%-Horo раствора полиэтиленrликоля, декстрана, поливинил-
пирролидона или друrоrо подходящеrо водорастворимоrо по-
лимера. Мы, например, пользуемся MeToдOlМ, описанным ниже.
48. И J.t.муноzистолоzuя .381
48.2.6.1. PeareHTbl
25%-ный раствор декстрана: 25 r декстрана 70000 (УЕВ
Serum\verke ВеrпЬurg, [ДР) растворяют в 75 мл ЗФР. Диа-
лизная мембрана.
48.2.6.2.
Rонцентрирование
Концентрируемый раствор (примерно 20 30 мл) поме
щают в диализном мешочке соответствующеrо размера в CTa
кан, содержащий 50 100 мл 25% -Horo раствора декстрана.
Концентрирование происходит за несколько часов; необходи-
мую степень ero определяют, исходя из содержания белка в
исходном растворе. Обычно концентрируют до тех пор, пока
расчетное содержание белка не будет несколько выше нуж-
ной величины. После этоrо определяют фактическое содер-
жание белка (см. 48.2.4) и титр концентрата (см. 48.2.2.), а
уже затем, разбавляя ero ЗФР, rотовят реаrепт нужной KOH
центрации и оптимальной а,ктивности.
48.2.7. Фракционирование
меченых иммуноrлобулинов
на ДЭАЭ целлюлозе
ФИТЦ-конъюrаты иммуноrлобулинов после очистки от
свободноrо красителя все еще обладают нежелате.ПЬНОЙ ак-
тивностью на rистолоrических срезах они вызывают несПе
цифическое ок'рашивание клеток и ТКаней. Для отделения
отно.сительно кислых сильно флуорохромированных иммуно
rлобулинов с успехом. применяется хроматоrрафия на ДЭАЭ
целлюлозе анионообменнике со слабощелочными свойства
ми [51, 66, 163, 209, 223]. Метод основан На том, что слабо
флуорохромированные Ig элюируются при низкой концент-
рации солей, в то время как для элюирования Ig с большим
содержанием метки концентрация солей должна быть ВЫше.
В нашей лаборатории для элюирования применяется He
прерывный rрадиент концентрации NaCl [66, 223]. Однако
наша методика более трудоемка, чем метод, ранее предложен-
ный Риrrсом и сотр. [209], п,ри котором не требуется опреде-
лять соотношение флуоресцеин/белок (см. [23, 66]). Поэто-
му мы приводим ниже метод Риrrса и сотр. [209].
48.2.7.1. Реаrенты!и приборы
ДЭАЭ-целлюлоза 40 100 меш, 0,96 мэкв/r (Schleicher &
Schii1I, ФРf) (ДЭАЭ-целлюлозу мы приrотовляли по методу
Петерсона и Собера [196], емкость анионообменника 0,5
382 Б. Эрнст, Д. Тесм.ан
0,7 мэкв/r); 1 н. HCl; 1,0 н. NaOH; 0,0175 М фосфатный бу-
фер с рН 6,3; NaCl; хроматоrрафическая колонка (2Х20 см).
48.2.7.2. Фракционирование
На 100 Mr Ig берут 6 r ДЭАЭ-целлюлазы и, суспендиро-
вав анианообменник в дистиллираванной воде, оставляют на
1 ч. Мелкие неосевшие ча,стички декантируют. Осадок пере-
носят в бюхнеровскую воронку и промывают последователь-
но 1 н. NaOH, 1 н. HCl, 1 н. NaOH, а затем водой до ней
тральной реакции в элюате. Активираванный таким абразом
анионообменник суспендируют в 0,0175 М фосфатном буфере
с рН 6,3. После оседания частиц надосадачную жидкость де-
кантируют, а осадок ресуспендируют в там же буфере. Затем
ДЭАЭ-целлюлозой заполняют коло,нку (2Х20 см). Флуоро
хромированный Ig перед хроматоrрафией диализуют против
0,0175 М фосфатноrо буфера с рН 6,3 не менее 20 ч, дважды
меняя буфер. Пасле диализа Ig наносят на колонку и элюи-
руют тремя растворами с возрастающей концеН11рацией NaCl:
фракцию 1 0,0175 М фосфатным буфером с рН 6,3;
фракцию 2 таким же буфером с 0,125 М NaCl;
фракцию 3 таким же буфером с 0,250 М NaCl.
Обычно отдельные фракции различаются па окраске. Их диа
лизуют пратив ЗФР, а затем испытывают их кра.сящие свой-
ства и специфичнасть прямо на орезах ткани или циталоrи-
ческих препаратах. Чаще Bcero лучшие результаты дает фрак-
ция 1 или 2. Фракцию, которая больше Bcero подходит для
иммуноrистолоrических исследований и имеет оптимальный
титр (см. 48.2.2), можно при надобнасти вновь сконцентри-
ровать (см. 48.2.6). Однако следует учитывать, что, peareHTbl
в малой концентрации дают наименьшее неспецифическое ок-
рашивание; паэтому совсем не обязательна стремиться к BЫ
соким концентрациям. При хроматоrрафии на ДЭАЭ-целлю-
лозе теряется свыше 50 % флуарохроми,рованных иммуноr.'IО-
'булинов. Значительная часть их просто задерживается в
верхних слоях анионообменника; эта именно те сильно флуо
рохромированные Ig, котарые rлавным абразом и вызывают
неспецифическое окрашивание.
48.2.8. Приrотовление rистолоrичеСRИХ
ицитолоrичеСRИХ препаратов
В иммуноrистолоrии можно применять все те методы о,б-
работки rистолоrических препаратов, при которых аналll3И-
руемый материал существенна не изменяет своей спосабнасти
48. И мм.ун.оzистолоzия 383
реаrировать с антителами или антиrенами. Для П'Риrотовле
ния срезов обычно пользуются каким-либо из мноrочислен-
ных вариантов следующих методов (см. [66, 89, 233]):
1) rотовят замороженные или криостатные срезы, причем
возможна последующая фиксация;
2) после высушивания в замороженном состоянии ткань
заключают в парафИIН или полиэфирные смолы и делают
срезы;
3) производят мяrкую фикс:щию ткани и делают парафи
новые срезы.
Большинство исследователей в настоящее время пользу-
ются криостатными срезами без последующей фиксации. По-
этому мы оrраничимся описанием именно этоrо метода.
48.2.8.1.
Реаrенты и (lIриборы
Твердая двуокись уrлерода (<<сухой лед»); криостат; фен.
48.2.8.2.
Методика
Кусочки только что полученной ткани (толщиной не бо-
лее 5 мм) замораживают с помощью cyxoro ЛЬДа на пред-
метном столике микротома. Если требуется максимально со-
хранить нативную структуру ткани, их можно предварительно
заморозить в жидком азоте. Как только кусочек ткани при-
мет температуру криостата, из Hero деJ1ают орезы толщиной
3 8 мкм, расправляют их на предметном стекле и подсуши-
Вают в течение 10 мин в потоке охлажденноrо воздуха. Что-
бы было удобнее обрабатывать орезы из материала, получен-
Horo при пункционной биопсии, мы замораживаем ero, заКJIЮ-
чив на предметном столике в индифферентную ткань (напри-
мер, 'печень или мозr).
Обработку изолированных клеток иммуноrистолоrически-
ми реаrентами можно проводить на мазке, приrотовленном
обычным способом. Кроме Toro, клетки можно проинкуби-
ровать в виде суспензии в paC Bope меченоrо или немеченоrо
Ig и исследовать их в живом 'состоянии [167]. Кратковремен-
ной фиксацией (3 12 мин) в холодном ацетоне (4 0 С) мож-
но добиться лучшеrо лрикрепления срезов или клеток к стек-
лу и уменьшить возможность перемещения изучаемых анти
Тел, антиrе.нов или иммунных комплексов во время обработ-
ки препарата. К тому же ацетон почти не снижает способ-
ность исследуемоrо материала к взаимодейс'fiВИЮ с иммуно-
rИСТОлоrическими реаrентами.
384
Б. Эрнст, Д. Тес,Лшн.
. - . -
48.2.9. Иммуноrистолоrическое окрашивание
Применяемые методы иммуноrистолоrическоrо окрашива-
ния должны быть по возможности простыми. На поверхность
среза или мазка с помощью пипетки наносят 1 2 капли Ме-
ченой или немеченоЙ сыворотки. В зависимости от исследуе-
Moro объекта окрашивание продолжается от 10 до 60 мин.
В настоящее время при меняются в основном три стандарти
зированные методики иммуноrистолоrическоrо окрашивания,
описанные ниже.
48.2.9.1. PeareHTbl
Забуференный фосфатами изотонический раствор N аС!
(ЗФР, см. 48.2.5.1); специфический Ig, меченный ФИТЦ (см.
48.2.5); немеченый специфический Ig; свежая сыворотка мор-
ской свинки; меченные ФИТЦ антитела (Ig) к комплементу
морской свинки; забуференный rлицерин (9 объемов rлице
рина и 1 объем ЗФР).
48.2.9.2.
МетодпRИ ОБрашивания
48.2.9.2.1. ПР5IМА5I РЕАКЦИ5I по КУНСУ И КАПЛАНУ [49]
1) Подсушенные на воздухе криостатные срезы или мазки
из клеточноЙ суепензии (далее ,называемые «препаратами»)
дважды по 5 мин тщательно промывают ЗФР;
2) не занятую препаратом поверхность стекла осушают
фильтровальной бумаrой;
3) наносят на препарат 1 2 капли раствора специфиче-
cKoro меченоrо Ig;
4) инкубируют препарат 30 мин при комнатной темпера-
туре во влажной камере (выстланная влажной фильтроваль-
ной бумаrой закрытая чашка Петри);
5) удаляют избыток Iмеченых антител, промывая препарат
ЗФР (8 раз по 2 мин);
6) заключают препарат в забуференный rлицерин.
48.2.9.2.2. НЕПРЯМА5I РЕАКЦИ5I по УЭЛЛЕРУ И КУНСУ [256]
1) ПодсушенныЙ на воздухе препарат тщательно (дваж-
ды по 5 мин) промывают ЗФР;
2) не занятую препаратомповерхность стекла осушают
фильтровальной бумаrой;
3) наносят на препарат 1 2 капли раствора специфиче-
cKoro немеченоrо Ig;
4) инкубируют 30 мин при комнатноЙ температуре;
48. И ММУНО2UСТОЛОZUЯ 385
5) тщательно трижды по 5 ,мин промывают препарат
ЗФР;
6) осушают предметное стекло фильтровальной бумаrой;
7) наносят на препарат 1 2 капли специфическоrо мече-
Horo антиrлобулиновоrо peareHTa;
8) инкубируют 30 мин при комнатной температуре;
9) промываютпрепарат 8 раз по 2 мин ЗФР;
10) заключают в забуференный rлицерин.
48.2.9.2.3. ВЫ5IВЛЕНИЕ ИММУННЫХ КОМПЛЕКСОВ
С помощью СВ5I3ЫВАНИ5I КОМПЛЕМЕНТА
ПО КЛЕйНУ И БУРКХОЛЬДЕРУ [121]
1) Подсушенный на воздухе препарат тщательно промыва-
ют (дважды по 5 мин) ЗФР;
2) поверхность стекла BOKpyr препарата осушают филь-
тровальной бумаrой;
3) наносят на препарат 1 2 капли немеченой сыворотки
морской С1ВИНКИ, 'разбавленной ЗФР 1 : 10;
4) инкубируют 30 мин при комнатной температуре;
5) промывают трижды по 5 мин ЗФР;
6) Iповерхность стекла BOKpyr препарата осушают филь
тровальной бумаrой;
7) наносят на препарат 1 2 капли меченых антител к
комплементу морской свинки;
8) инкубируют 30 мин при комнатной температуре;
9) промывают препарат 8раз по 2 мин ЗФР;
10) заключают препарат в забуференный rлицерин.
48.2.10. Контроли специфичности
Им.мунолоrическую 'специфичность каждой флуоресциру
ющей антисыворотки необходимо точно определить заранее.
Для этоrо ставят следующие контроли:
1) Нормальная ,сыворотка, полученная от Toro же caY!oro
животноrо продуцента и обработанная так же, каи: специ
фический меченый Ig, не должна давать положительной ре-
акции.
2. Ткани, заведомо не содер)!.;ащие исслед\:емоrо антпrе
на, не должны окрашиваться.
3. Меченый Ig после инкубаЦIIИ со специфическим антиrе
ном не должен давать заметноrо он:рашивания препарата.
4. После обработки препарата немеченым специфическим
Ig меченый peareHT не должен давать заметноrо окрашива-
ния (реакция та,р,можения).
5. Инактивация комплемента наrреванием до 56 70 ос в
течение 30 мин должна пОлностью или почти полностью пред-
25 8 10
386 Б. ЭРНСТ, Д. ТеСА/ан
отвращать окрашивание препарата мечеными аНтителами к
комплементу.
Эти контроли ставятся с учетом конкретных особенностей
отдельных иммуноrистолоrических методов. Схема опыта и
вид исследуемоrо .материала далеко не в каждом случае ПОЗ-
воляют поставить их в полном объеме. Однако по крайней
мере Два из них нужно Поставить обязательно. Как общее
правило чем больше контр олей, тем выше досто,верность
получаемых результатов.
48.2.11.
Флуоресцентная микроскопия
и фОТОl'рафия
Для исследования препаратов применяют стандартный
:МИКРОСН:ОП, оборудованный ртутной ла:мпой BblcoKoro давле-
ния НВО 50 или НВО 200. ФИрlма УЕВ Carl Zeiss (Иена,
r ДР) предлаrает для этой цели флуоресцентные микроскопы
«Флуовал» (рис. 95) и «Эрrавал» [190]. «Флуовал» приспо
соблен также для фазово контрастной микроскопии. Один а
с.
. .w "
113
I
11 20
I .
)U.
..,
./ и";"" ;.>'/
.' '.,/'
1:0.. q
. CL
. (11'
..'
,
/!
" ..... '; ';' I
.;. J
"
..
..,--/
, '/
.........
..>
"
',/- '"
. /1",-/."'/
,:/(1','
'
I
т
n
; "
р
':[ JJ .' !
, .
, f
Ji:' ,
,
.8
L"""
......
,
'.
...J
Рис. 95. Флуоресцентный микроскоп «Флуовал:t (VEB Carl Zeiss IIенз.
[ДР; заводское фото).
48. И ммун.оеUСТОАоеuя 387
тот же препарат можно попере енно или одновременно Ha
6.lюдать при люминесцентном и Фазово-контрастном освеще-
НИИ, что позволяет точнее определять локализацию светя-
Таблица 8. Фильтры для флуоресцен.тн.ой микроскопии
Обозначение
I
старое I
Толщнна стек-
ла, мм
новое
UG 1
UD 36 81
2 и 4
BG 12
ВЕ 41 82
2 и *
GG 13
\VK 38
2
r\G 10 r\ 567 I 1
VG 4 УЕ 55 82 2
\'G 9 УЕ 53 62 4
GG 9 GVI\ 46 I
OG 1 ОА 51 1
OG 4: ОА 52 1
GG 15 GA 42 1
GG 4
GVK 41
J
Назначение
Фильтр возбуждающеrо длинноволно-
BOrO ультрафиолетовоrо излучения
с максимаJ1ЬНЫМ пропусканием при
366 нм
1. Фильтр возбуждающеrо сине фио
,leT0I30rO излучения с макси tаль
ным пропусканием при 405 нм
2. КрасныlI запирающиЙ фи.'lьтр для
комбинации с UG 1
ЗапирающиЙ фильтр для получення
СIшеrо излучения без примеси yдь
трафиолетовых луче!l; ИСПО.'Iьзуется
в КО:'v!бинации с БG 12
Поrлощающий фильтр для света по
вышенноii интенсивности
ЗеленыЙ фильтр для фазово контраст,
ной МИКРОСКОШIII
Зеленыii фильтр ;:r,.'IЯ жесткоrо фазо
Boro контраста
ЗапирающиЙ фильтр Д.'IЯ ультрафио
летоI3ЫХ лучеЙ
ЗапирающиЙ фильтр для сине фИО.1]е
товых 11 синих лучеЙ
Запирающий ФИ,'lьтр для работы с
реаrентаЮI, l\!еЧСIIIIЬШИ флуоресце-
инизотиоциана том (ФИТЦ)
Запирающиii фи.1ЬТР для I30збуж;:r,аю-
щих у.lьтрафиолетовых .'Iучеii. по-
зволяющиii наблюдать синюю ф.1УО
ресценцию
ФИ,'IЬТР llрс06разователь для освеще-
II!IЯ объекта светом ртутноЙ .!!ампы
щихся частиц в >препарате. Между ИСТОЧШIКОМ света I! объ-
ектом помещают фильтр возбуждающеrо излучения. r.'1аз нз-
блюдателя защищен от ультрафиолета запираЮЩИ 1 фlI.'1ЬТ
ром, который находится в окуляре. Д.'1я возбуждения флуо-
ресценции можно использовать как ультрафиолетовыЙ. Т3К и
синий свет. Однако при работе 'с реаrентами, мечеННЫ.ИlI
ФИТЦ, нельзя получить достаточно высокой Э ИссИИ в СПЮIХ
:Iучах.
25"
388 Б. Эрнст, Д. Теслан
В таб"l. 8 приведены старые и новые обозначения, а также
указано назначение основных фильтров, выпускаемых для
ф"ч'оресuентноЙ :\Ншроскопип фирмоЙ УЕВ Jenaer Glaswerke
Schott & Gen., r ДР [190].
, .
s,:- _ .
------,--1t<- - ,
-,
.." . . ."
-"
J /'
..... .....
i< _, 'fIri;0
." ..'" . . ,
:У'.,
" '..,
/
.,.,.
- -'
:<'.
' '
-, /
... '
! -
,
.' - ;- -,
> - ---0"-'; )
1:. ,,:--' ; .,. ..
,/
"
..
.;;....
- ..:.
-"7'-
;:-.
Рис. 96. Почечный клубочек кролика при нефрите Мацуrи Картина линеЙ-
Horo отложения IIммуноrлобулинов на базальноЙ мембране. Иммуноrлобу-
лины выявлены меченноЙ ФИТЦ антисывороткоЙ к v rлобулину кролика.
Х 240
В тех участках препарата, rде произошла ИМl\Iунолоrиче
ская реакuия, меченные ФИТЦ peareHTbI дают ярко-зеленое
(рис. 96), а меченные родамином красное свечение.
Фотоrрафическую документаuию иммуноrистолоrических
данных про изводят с помощью обычных устроЙств дЛЯ МИК-
рофотоrрафии, тодько между проектирующеЙ линзой и каме-
рой дополнительно ставят запирающиЙ фильтр GG9 (GVK 46)
или OG 1 (ОА 51). Для черно-белых снимков вполне подхо-
дит чувствительная в желто-зеленой области спектра peHTre-
новская пленка RS (УЕВ ORWO, Вольфен, r ДР). Цветные
изображения получают с ПО 1Ошью плеНКII для днсвноrо све-
та (ORWOCHROM UT 21). Для черно-белых CНIIMKOB о()ыч-
но применяют экспозиuию от 10 до 60 с, для цветных от
10 до 30 мин.
48. И ММУliоzистолоzия 389
48.3. ОЦЕНКА
в медицинских и биолоrических исследованиях, а также
в клинической диаrностике иммуноrистолоrия зарекомендова-
ла себя как весьма продуктивный ,метод с большими возмож
ностями. Однако при использовании этоrо метода необходи-
мо иметь в виду потенциальные источники ошибок. К ним
относится прежде Bcero собственная флуоресценция живот-
ных тканей, которые в ультрафиолетовых и синих лучах дa
ют серовато- или беловато rолубое свечение. Цвет аутофлуо-
ресценции зависит от выбора фильтров. Ее нетрудно от.ПИ
чить от специфическоrо зеленоrо Иv1И KpacHoro свечения ме-
ченых антител. Существует лишь один способ удержать
аутофлуоресценцию на низком уровне: так как после фикса-
ции II хранения материала она сильно возрастает, HY.iKHO pa
ботать со свежими блока;vш или срезами тканей. Некоторые
пиrменты и компоненты тканеЙ оби1адают своей особоЙ флуо
ресценцией: железосодержащие пиrменты коричневоЙ, OTJ10-
жения кальция желтой, меланин коричневой, липофус-
цин ярко желтой, порфирины красной, рибофоlавнн
желто-зеленой, витамин А желтой. В отдельных с.1учаях
эта флуоресценция может послу.жить поводом к ошибочному
заключению.
Друrим источником ошибок :\10rYT быть перекрестные И:\1.
мунолоrические реакции, которые встречаются довольно ча-
сто и 'по силе иноrда не уступают взаимодействию антител со
специфическим антиrеном. Полностью избежать перекрест-
ных реакций нельзя, но их роль :\10ЖНО существенно YMeHЬ
шить, применяя для иммунизации высокоочищенные aHTlIre
ны и адсорбируя антисыворотки перекрестно реаrирующим
антиrенным материалом. Далее, не:желательную флуоресцен
цию вызывает неспецифическое окрашивание тканей :\1ечены-
ми реаrентами. Это окрашивание скорее Bcero результат
неиммунолоrическоrо связывания кислых :\1еченых иммуно-
rлобулинов относительно щелочными белками тканеЙ. При
конъюrации белка с флуоресцеином происходит блокирова
ние части аминоrрупп, и относительная кислотность Ig еще
более возрастает [160]. Фракционируя флуорохромпрован-
ные иммуноrлобулины на ДЭАЭ-целлюлозе, можно в значи-
тельной степени устранить этот источник ошибок (см. 48.2.7).
Для дополнительной очистки от перек,рестно-реаrирующих ан-
тител и неопецифически связывающихся Ig можно адсорби-
ровать peareHTbI ацетоновым порошком rетеролоrичных TKa
ней. Этот порошок особым образом приrотовляют из rOMore-
натов Iпечени, :почки, селезенки и мышц [42, 50]. Остаточную
способность peareHToB к неспецифичеокому окрашиванию учи-
390 Б. Эрнст, Д. Тес,нан
тывают при контроле специфичности (см. 48.2.10). Точное
определение степени конъюrации в препаратах флуорохроми-
рованных антител весьма затруднительно. Однако следует
добиваться Toro, чтобы отношение экстинкций при 450 нм
(светопоrлощение флуоресцеина) и 280 ,нм (светопоrлощение
бе"lка) было меньше единицы [173].
Даже если исключены указанные выше источники ошибок,
визуальные оценки разных исследователей MorYT существен-
но различаться. Этот субъективный источниiК ошибок МОЖНО
устранить, пользуясь количественной флуориметрией наблю-
даемоrо свечения. Однако для широкоrо внедрения этоrо ме-
тода потр бовалась бы всеохватывающая стандартизация им-
муноrИСТО.10rических peareHToB и нужны были бы микрофлу-
ориметры. Необходимые сведения об этой особой области
иммуноrистолоrии содержатся в ряде работ [6, 111, 125, 141,
154, 158, 200]. Иммуноrистолоrию, основанную на применении
флуоресцирующих антител, в настоящее время IМОЖНО еще
считать основным методом иммуноморфолоrии. Но наряду с
ними, например ДJ1Я выявления комплексов антиrен антите-
ло при электронной микроскопии, применяются антитела, ме-
ченные ферритином. Для приrОТОВ.1ения иммуноферритиново-
ropeareHTa леrко видимый в электронном микроскопе фер-
ритин с помощью различных бифункциональных areHToB
ковалентно привязывают к иммуноrлобулинам. С получен-
ным конъюrатом проводят иммунолоrические реакции [228]
(обзор см. [232]). Альтернативой методам иммунофлуорес-
центной и иммуноферритиновой метки может служить мето-
дика иммуноферментной метки. Для получения иммунофер-
MeHTHoro peareHTa антитела или антиrены с помощью бифунк-
циональных соединений ковалентно связывают с подходя-
шим ферментом, Место, [де произошла иммунолоrическая
реакция. выявляют с помошью rистохимических методов по
активности фермента (обзоры см. [8, 90, 234]). в качестве
ферментноЙ метки используют кислую фосфатазу [9, 10, 1811,
пероксидазу [7, 9, 10, 181, 257], щелочную фосфатазу [257],
rлюкозооксидазу [9, 10, 257], цитохром С [130] и т. П. Осо-
бенно удобны пероксидаза и цитохром С, Иммуноморфолоrи-
ческие методы нашли чрезвычаЙно широкое применение в
медико-биолоrических исследованиях; ваЖlнейшие данные об
ЭТО\1 сведены в табл. 9. Особое значение иммуноrистолоrия
приобрела при решении специальных вопросов клинической
диаrностики. Диаrностические возможности метода иллюст-
рирует табл. 10. В обеих таблицах имеются также ССЫ.1КИ
на ряд работ с иопользованием иммуноферритиновой и Jl,М-
мунофсрментной меток. Применение метода флуоресцирую-
Таблица 9. Прим-ененue м-етодов им-м-уноzистолоzии
8 медико-биолоzuческих исследованиях
МеТКа
Выявляемые для МИКрОСКопиИ Исследуемыii Предмет :Iитературные
3НТИJ'ены I объект исслеДования истоЧНИКИ
электрон-
световоЙ I 11011
Иммуноr .10- ФИТЦ Лимфоузлы Клетки,обра- [140, 216,
булины зующие ан- 252)
ТИТ:'.1а
Иммуноr ло- Родамин Селезенка То же [ 197]
БV,11ИНhI
ИммуноrJ]О ФИТЦ Селезенка » [44, 140,
бvлины 197]
Имм\'ноr.l0 ФИТЦ ПеЙеровы » [25]
БV lИНЫ бляшки
ИММУJlоr.l0- Псрокси Лимфоидные » [9]
бу.1ИНЫ дзза к.lетки,
П.lазмзти
lJ СКИС
К.1СТКИ
ИММУНОI'JЮ- Ферритин Культура » [ 169]
булины :lИмфоци
ТОБ, макро-
фат ОБ
ИММVliOr:lO Перокси- ЛН1\IфО З.1Ы, » [29, 79, 98,
булины дюа селезенка 241 J
Иммуноr.l0 ФеРРИТI1Н Лимфоу ;.lЫ, » [ 199]
бу.тIИНЫ П.1а ' мати-
чс('кие
!\.lетки
Иммуноrло- » Плазмацнто- » [208]
булины ма
ИММУНOI'.10- Фитц MaTK<I, фал- Локализация [251]
брины лопиевы в ткани
тр бы,
В.lаrалище
Иммуноr ,710- ФИТЦ Плацента ТО же [161 J
булины
Иммуноrло- Фитц Слизистая :t [1]
6улины кишечника
Иммуноrло Фитц Плацента. Пере нос че- [189]
БУЛI1НЫ ЖС.1ТОЧНЫЙ рез плацен-
мешок, ма- ту
теринская
I почка, леr-
Иммуноrло- Фитц I Кое, матка Поверхност- [24,99, 198,
.J1имфоидные
булины клетки ные рецеп- 206, 207)
Иммуноr.l0- торы
Ферритии Лимфоидные ТО же [2, 24]
бv.'1ИНЫ клетки
ИМ1\1уноr.l0 фита » Клетки мин- » [263]
булины далин
Иммуноr.rю- » Базофильные :t {2401
бутпrы I леЙкоциты
Выяв.lяе ые
знтиrены
Иммуноr ,;10-
6улины
Иммуноr.l0
б".lИНЫ
ИМ lуноr.l0.
бу.'1ИНЫ
Иммуноr ло
6у.'1ННЫ
Иммуноr .'10-
б"лины
Иммуноr.по-
булины
Иммуноrло
будины
Иммуноr.тJО-
булины
Иммуноr ,по-
бу.'1ИНЫ
ИМh1уноr ло-
булины
Иммуноr :10-
бу лины
ИммуноrJl0-
бу лины
Иммуноr.l0-
булины
Иммуноr.lО-
булины
Иммуноrло-
б\'.lИНЫ
Иммуноr .110-
булины
Комплемент
Комплемент
Ко шлемtнт
Комплемент
Комплемrнт
Комплемент
КОМП.1емент
Метка
ДЛЯ микроскопии
световой
ФИТЦ
Перокси-
даза
ФИТЦ
ФИТЦ
Родамин
ФИТЦ,
родамин
ФИТЦ
ФИТЦ,
родамин
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
Перокси-
даза
cJ:ИТЦ
ФИТЦ
ФИТЦ,
родамин
ФИТЦ
электрон-
иой
Исследуемый
объект
Почка
Почка
Перокси- Почка
даза
Ферритин Почка
Печень
Лимфоидные
и плазмати-
ческие
клетки
То же
»
Перокси- Кожа
даза
Мозr
Артерии
Слизистая
толстоЙ
кишки
Почка
Сердце
Лимфоидные
клетки
Мозr
I Почка
Почка
Ферритин I Почка
I Печень
Почка
Артерии
ПJlацента
ПРОДОJ1ЖСIIИ('
Предмет
исследовзIOlЯ
Литературные
ИСТОЧиикн
I Эксперим н- I [6, 19, 58,
тальныи 103, 136
rломеруло- 159, 193:
нефрит 221, 245]
То же [13, 95]
» [103, 218]
» [3, 4, 103,
218, 261]
I [20, 114,
149, 194]
[100, 101,
204, 205]
rепатит
Парапроте-
инемии
Парапроте- I [101,
инемии 205]
Болезнь [264 ]
fL-цепей
Pemphigus [259]
vu Jgaris
Антитела приl [249]
старческом I
слабоумии
rиалиноз ! [134]
,
ЯзвенныЙ
колит
2О4,
1[34, 131]
Тран спланта- I ' [27, 148]
ция
» ! [152]
,
» 1 " [156]
Аллерrиче [188]
скиЙ энце-
I фаломиелит
Эксперимен- [58, 95, 136,
тальный 193]
r ломеру ло-
нефрит
То же
»
rепатит
Транспланта-
ция
rиа,пиноз
Локализация
в ткани
,
I [13!
[3]
[194]
[27]
[134]
[ 161)
ПРОДО.lженис
Выяв.nяемые
антиrеиы
Метка
для микроскопии
I электрои-
световой иой
Исследуемый
объект
Предмет
исследования
ЛитераТуРные
источники
Пl'flТuд1iblе ZOpM01ibl (AKTr адренокортикотропный [ормон; TTr тирео
тропный ropMOH; Mcr меланоцитотропныЙ, или меланоuитстимулирую
щиЙ, [ормон; лr лютеинизирующиЙ [ормон; CTr соматотропныЙ
l'Oрмон; Фсr Фолликулостимулирующий [ормон; xr ХОР!l(JfI!1ческий
rонадотропин)
AI(Tr ФИТЦ, I Аденома Локализаuия [ 1291
родамин rипофиза в ткани
AKTr ФИТЦ I rипофиз То же [35, 59!
AI(Tr I Перокси- rипофиз » [180]
, I даза
AKTr ФИТЦ, ; Карцинома » [38]
родамин щитов ид-
I ноЙ железы
TTr Перокси- , rипофиз }) [12. 179,
даза 243]
TTr ФИТЦ » » [35]
TTr Перокси- » » [ 180]
даза
Mcr ФИТЦ » }) [59]
лr ФИТЦ » » [165, 203]
.lr Перокси- » » [12, 179,
даза 243]
лr ; Перокси- » » [116, 180]
даза
CTr ФИТЦ » }) [144, 155,
215]
CTr Перокси- » » [155, 179]
даза
CTr Перокси- » » (116, 180]
даза
Фсr Перокси- « » [243]
даза
Фсr i Перокси- « » [ 180)
даза
xr ФИТЦ Плацента, }) (155. 166]
хорионэпи-
I телиоМа
xr , Перокси- , Плацента » [62]
I , даза
Пролактин ФИТЦ I Пер окс и- rипофиз » [71,74,215)
Пролактин » » [116, 180]
даза
Кальцитонин ФИТЦ I ' Щитовидная » [39]
железа
Ка.'JЬЦИТОНИН ФИТЦ Карцинома }) (381
\ФИТЦ щитовид-
ной железы
rастрин Слизистая » [195]
желудка
rастрин jФИТ Ц Островки » [ 146)
Ланrерrа-
нса
ПРОДОJ!жеllие
Метка
ВЫЯБ.lяемые Д.ая микроскопии Исс:,, дуемыi! Предмет Литературные
антиrены i объект исследования источники
световой электрон- \
ной
Секретин ФИТЦ Двенадцати Локализация [37, 202]
перстная в ткани
Iшшка
Ренин ФИТЦ Юкстаr.lоме То же [97, 105.
руляр- 255]
ные клетки
Ренин Перокси- То же » [ 105!
даза
Инсу.'шн ФИТЦ Ky.lbTypa Синтез инсу [151 ]
K.leTOK под- лина
желу доч
ноII же.lе
зы
ИНСУ лин ФИТЦ, Островки Локализация [145]
перок Ланrерrа в ткани
сидаза нса
Инсулин ФИТЦ Аденома из То же [248]
остров КО-
вых клеток
поджелу-
дочноЙ же-
лезы
rлюкаrон ФИТЦ Поджелу доч » [186]
I
I ная железа
Эритропоэтин' ФИТЦ Почка :t [40]
ФеР.4reнmbl I
у ратоксидаза ФИТЦ Печень Локализация [260]
IФитц в ткани
r лицерофос- Сердечная То же [70]
фатдеrид- мышца
роrеназа [73]
rлицерофос- ФИТЦ Почка J
фатдеrид-
роrеназа [72]
r лицера.%де- ФИТЦ Скелетная »
rид-3-фос- мышца
фатдеrид-
роrеназа ФИТЦ Поджелудоч- [ 171 ]
Катала за J
ная железа,
почка
Трипсиноrен ФИТЦ ТО же » [262]
Химотрипсин Перокси- )) )) [219 ]
даза
Химотрипсин ФИТЦ )) » [ 262]
Амилаза ФИТЦ )) » [262]
Амилаза ФИТЦ Околоушная » [133 ]
слюнная
железа
Рибонуклеаза ФИТЦ Поджелу доч- )1 [69. 170.
ная железа 172]
Метка
ВЫЯВJJяемые ДЛЯ микроскопии ИСCJIедуемый ПреДъlет Лwrературные
аwrиreиы I объект ИСCJIеДования источиики
световой электрои-
ной
Про д о .1 Ж е н и е
Эластаза ФИТЦ ТО же Локализация [1681
в ткани
Лизоцим ФИТЦ Околоушная То же [13.3 1
слюнная
железа
Аминопепти- ФИТЦ Почка, пе- » [253]
даза чень и др.
Фосфорилаза ФИТЦ Скелетная » [671
мышца
Орнитинами- ФИТЦ Печень » [311
нотранс-
фераза
Дофамин- - Перокси- Надпочечник » [81 ]
rидрокси- даза
лаза
Дофамин- - ФИТЦ Надпочечник » [104 ]
rидрокси-
лаза
Дофамин- - ФИТЦ Нервная сис- » [82, 83. 96]
rидрокси- тема
лаза
Белки плазмы
Альбумин ФИТЦ Аорта I Атеросклероз [177]
Альбумин ФИТЦ Лимфоузлы, ПоrлощениЕ' [25, БО]
селезенка антиrена
Альбумин ФИТЦ Сердечная j Диффуэия [1181
мышца белков
плазмы в
клетки при
инфаркте
Альбумин ФИТЦ Печень Синтез аль- [431
бvмина
rлобулин ФИТЦ Аорта А те"росклероз [177]
rлобулин ФИТЦ Сердечная Диффузия [ 118]
мышца белков
плазмы в
клетки при
Фибринjфиб- инфаркте
ФИТЦ Аорта А тероск..1ероз [ 177)
риноrен
Фибринjфиб- ФИТЦ Сердечная I Диффузия [ 118]
риноrен мышца \ белков
плазмы в
клетки при
ФиБРин/фиБ- ФИТЦ инфаркте
Мозr А.1.'Iерrичес- [ 188)
риноrен кий энце-
фаломие-
лит
ПРОДОЛЖСllие
Метка
ВЫЯ8.1яемые ДlIЯ микросколни исследуемый Предмет Литературные
автиrены объект ЕСCJ!едования источники
световой электрон
ноЙ
Фибринфиб- ФИТЦ Сердечное Иммуноrен- [86]
риноrен ушко ность фиб-
рина
Фибринjфиб- ФИТЦ Планцента Локат1'3аllИЯ [161 ]
риноrc н в ткани
В Липопро ФИТЦ Аорта Атеросклероз [177]
теид
Трасферрин ФИТЦ Печень Обра ование [139, 177]
трансфер-
rина
АНТИI'ены Ферритин ЛеЙкозные Локализация [61 )
К.l еточной клетки антиrенов
мембраны
Антиrены ФИТЦ Лимфоидные Пиноцитоз [ 1371
клеточной клетки,
мембраны макрофаrи
Антиrены Ферритин Лимфоциты Локализация [ 128 )
клеточной крови антиrенов
мембраны
Антиrены ФИТЦ Макрофаrи Антимакро [84]
клеточной фаrальная
мембраны специфич-
ность сыво-
ротки
Антиrены ФИТЦ Лимфоидные Локализация [ 167]
клеточноЙ и опухоле- антиrенов
мембраны вые клетки
Антиrены Ферритин, Культуры Сравнение {33]
клеточной перок- клеток методов
мембраны сидаза плазмоци-
томы и по-
чечноrо
эпителия
Антиrены ФИТЦ Клетки пече- Характери- [226)
клеточноЙ ни стика плаз-
мембраны матической
мембраны
Антиrены Перокси- Лимфоциты Антиrенные {254]
клеточной даза детерми-
:\fембраны нанты
OpzaHHbLe
aHтиzeHbl
Антиrены ФИТЦ Скелетная МиоrеIlез [54, 187]
мышц мышца
Метка I
Выявляемые ДЛЯ микроскопии ИсслеДуемый ПреДмет Лнтературные
антиrеиы I объект исследования I источникн
световой электрои-
ной
Про Д о л ж с 11 И (;
Миоr лобин ФИТЦ Скелетная Локализация [112]
мышца в ткани
Миозин ФИТЦ Рабдомиосар- Локализация [ 110]
кома, не- в ткани
фробласто
ма
rемоrлобин ФИТЦ Эритроциты Определение [52]
типов reMo
r .:10бина
Коллаrен ФИТЦ Почка Локализация [213]
в ткани
Коллаrен Перокси Перокси- Соединитель- Лока.lизация [ 150]
даза даза ная ткань в ткани
Антиrены ФИТЦ Слизистая Патоrенез [47]
слизистой желудка пернициоз-
желудка ноЙ анемии
Антиrены ФИТЦ Сетчатка Иммуноrен- [220]
сетчатки ность KOM
понентов
сетчатки
Ферритин Перокси Тощая кишка Локализация [130]
даза в ткани
Антиrены ме- ФИТЦ Опухоли тол- Канцероrенез [36]
мбраны стоЙ кишки
толстой
кишки
Антиreн тол. ФИТЦ ТОJIстая киШ- Локализация [244]
стой кишки ка в ткани
Антиrены ФИТЦ Кожа, опухо Канцероrенез {41 ]
эпидермиса ли кожи
Антиrены ФИТЦ Кожа rистоrенез [56]
эпидермиса
Компоненты ФИТЦ Седезенка, Характерис- [108, 113,
амилоида печень, тика ами- 123, 124,
почка лоида 227]
Тромбостенин Перокси- Тромбоциты ЛО!{ализация [28]
даза в клетке
Опухолевые ФИТЦ Эксперимен- Иммунолоrия [92]
антиrены тальные опухолей
опухоли
Карциноэм- ФИТЦ Карцинома и ЛокаШIзация (244]
брионаJIЬ- полипы в ткани
ный анти- толстоЙ
reH кишки
Таблица 10, П римен.ен.ие tетодО8 имм.ун.оzистолоzuи
6 клин.ической диаzн.остике
Исследуемый I Диаrностируемое I
объект заболевание Литература
Выявляемые
аlf1'иrены
Иммуноrлобу
лины
Иммуноrлобу-
лины
Иммуноrлобу-
лины
Иммуноr лобу-
лины
Иммуноrлобу-
лины
Иммуноrлобу-
лины
Иммуноrлобу-
лины
Иммуноrлобу-
лины
Иммуноrлобу-
лины
Иммуноrлобу
лины
Иммуноrлобу
лины
Иммуноrлобу
лины
Иммуноrлобу
лины
Иммуноrлобу
лины
Иммуноrлобу
лины
Иммуноrлобу
лины
Иммуноrлобу-
лины
Иммуноr.rюбу-
лины
Циркулирую
щие aYToaH
титела
Циркулирую
щие аутоан-
титела
Метка
ФИТЦ
Почка
Пероксидаза Почка
Пероксидаза Кожа
ФИТЦ
Пероксидаза
ФИТЦ
Пероксидаза
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
ФИТЦ
»
»
»
»
»
»
»
Артерия
Сосуды синови-
альноЙ обо-
лочки
Почка, селезен-
ка, сердце,
печень
Щитовидная
железа
Меrакариоциты
Почка
Сердце
Сердечная
мышца
Сыворотка
(сперма)
Сыворотка
(сердце)
rломерулонеф- [5, 21, 22.
рит 26, 32, 78,
88, 119, 126.
127, 162, 222,
230, 247, 261]
[14, 55, 63,
64]
vul [258]
Аллерrия к пе [132[
нициллину
Аллерrический [147, 237,
васкулит 238]
Височный apTe [217]
риит
Изменения со- [85]
судов при
ревматоид-
ном артрите
Системная
красная вол-
чанка
Иммунотиреои
дит
Иммуноrромбо-
цитопения
Трансплантация [214, 222,
224]
[212, 231]
[65. 1741
[93, 147!
1t
Pemphigus
garis
»
Пемфиrоид
»
Красная вол
чанка
ТО же
»
Аутоантитела
к миокарду
Мужское бес-
плодие
ПоздниЙ синд- [111
ром инфарк-
та миокарда,
синдром по-
сле операции
на сердце
[46]
[246, 258]
[15, 45]
[246, 258]
[ 182]
[ 192]
[94)
[17,235]
Продолжение
Выявпяемые Метка Исследуемый Диаrностируемое I ЛИ1'ература
антиrt'ны объект заболевание
Uиркулирую- ФИТЦ Сыворотка Сахарный диа- [ 153]
щие аутоан- (поджелудоч- бет
Тl!тела ная железа)
Uиркулирую- ФИТЦ Сыворотка Иммунотиреои- [48]
щие аутоан- (щитовидная дит
Тl!тела железа)
Uиркулирую- ФИТЦ Сыворотка Myasthenia [77, 239]
Щl!е аутоан- ( скелетные gravis
тнтела мышцы)
1\.омплемент ФИТЦ Почка rломерулонеф- [5. 21, 26,
рит 119,126,127.
162,222,230,
261]
Комплемент ФИТЦ Кожа Пемфиrопд {22, 451
Комплемент ФИТЦ Кожа Красная вол- [182]
чанка
к.омплемент ФИТЦ Сердечное ушко Ревматическиii {87, 135]
кардит
Комплемент ФИТЦ Артерии Височный арте- [217]
ршlТ
!\ОМП.lJемент ФИТЦ Кожа АллерrическиЙ [237, 238]
васкулит
1\.омплемент ФИТЦ Сосуды синови- Изменения со- [85]
альноЙ обо- судов при
лочки ревматоид-
ном артрите
!\омплемент ФИТЦ Почка, селезен- Системная [192]
ка, сердце, красная вол-
печень чанка
Комплемент ФИТЦ Меrакариоциты Иммунотромбо- [235]
пения
1\.омплемент ФИТЦ Почка Трансплантация [214, 222,
Комплемент ФИТЦ Сердце 224}
» [231]
Комплемент ФИТЦ Сыворотка Мужское бес- [93]
(сперма) плодие
Au/SH-антиrен ФИТЦ Печень rепатит [68, 107, 114,
ФиБРин/фиБри- ФИТЦ Почка rломерулонеф- 175, 184,236]
[21, 22, 119,
HoreH рит 127, 162]
ФиБРин/фиБри- ФИТЦ » Транспланта- [ 214, 224 ]
HoreH ция
Фибрин/фибри- ФИТЦ Сердце » [231 J
HoreH
Альбумин ФИТЦ Почка » [214, 224]
Антинуклеар- ФИТЦ Сыворотка ХроннческиЙ [225, 250]
ныЙ фактор (печень, полиартрит
почка)
Антинуклеар- ФИТЦ Синовиальная РевматическиЙ [265]
ный фактор жидкость, артрит
лейкоциты
Антинуклеар- Пероксидаза Сыворотка Красная вол- [18]
ный фактор (печень) чанка
400 Б. Эрнст, Д. TeCJtaH
Выямяемые
антиrеиы
Метка
Продолжение
Исследуемый I Диаrиостируемое I
объект заболевание Литература
РевматоидныЙ ФИТЦ Сыворотка Ревматический [53]
фактор кардит [30]
РевматоидныЙ ФИТЦ Костный мозr, Первичный
фактор плазматиче хронический
ские клетки полиартрит
Антиrен кол ФИТЦ Щитовидная Иммvнотиоеои- (75, 56)
лоида железа лит
щих антител в микробиолorии представляет собой обшuрную
и довольно самостоятельную область исследований, которой
мы не касались.
48.4.
ЛИТЕРАТУРА
1. Allen W. D., Porter Р., Localization Ьу immunofluorescence of secretory
component and IgA in the intestinal mucosa of the young pig, Immuno
logy, 24 (1973), 365 373.
2. Аn То, Mizai к., 5е!! 5., Electron microscopic localization of rabbit im-
munoglobulin allotype ь4 оп bIood Iymphocytes Ьу ап indirect ferritin
immune complex labeIing technique, J. ImmunoJo, 108 (1972), 1271
1277.
3. Andres а. А., Accinпi L., Hsu К. Со, Zabriskie Jo В" 5eegal В. С., Elec-
tron microscopic studies of human glomerulonephritis with ferritin-conj\l-
gated antibody. LocaIization of antigen-antibody complexes in glomeru
lar structures of patients with acute glomerulonephritis, J. ехр. Med.,
123 (1966), 399 412.
4, Andres а. А., Morgan С., Hsu К. С., Rifkind R. Ао, 5eegal В. Со, Elec-
tron microscopic studies of experimenta1 nephritis with ferritin-conjuga-
ted antibody, J. ехр. Med., 115 (1962), 929 936.
5. Asamer Н,, Dittrich Р., Lederer В., Die Bedeutung immunhistologischer
Befunde fiir die nephrologische Diagnostik, К1iп. Wschr., 47 (1969),
759 771.
6. Augsten к., Guttпer J., 5chroer H. P., Methode zur immunfluoreszenz-
photometrischen Bestimmung der Glomerulonephritis, Z. Immun. Forscho,
144 (1972), 323 328.
7. Avrameas 50, CoupIing of enzymes to proteins with glutaraldehyde. Use
of the conjugates for the detection of antigen and antibodies, Immu-
nochemistry, 6 (1969), 43 52.
8. Avrameas 5., Enzymes as markers for the 10caIization of antigen and
antibodies, Into Rev., Gyt., 27 (1970), 349 385.
9. Avrameas 5., Lespiпats а., Detection of antibodies in immunocompetent
cells of animals immunized with enzymes, С. R. Acad. Sci. Ser. D 265
(1967), 302 304. Zit. п. С. А. 67 (1967), 115282 п.
10. Avrameas 50' Lespiпats а., Protein-bound enzymes, their use for the
detection of antibodies and antigens, С. R. Acad, Sci. Sero D 265 (1967),
1149 1152, Zit. п. С. А. 68 (1968),28086 k.
11. Bachтaпп а. W., Rapp W., Antikorpernachweis und qt\antitatives Serum-
eiweiВbild bei Postkardiotomie- und Myokardinfarktspatsyndrom, Dtsch.
med. Wschr., 26 (1969), 1352 1355.
4Я. И,I/АtУНО?llСТ().lO U 401
12. Baker В. L., Pierce J. а., Corпeи J. 5., The utiliiy 01 апiiSСI"UШ::> t() ::.иЬ-
units of TSH and LH for immunochemica1 staining of the rat hypophy-
sis, Amer. J. Anat., 135 (1972), 251 267.
13. Bariety J., Druet Ph., Laliberte F., 5apiп с., GlomCl"u!onephritis wilh
'У- and j:l-1C-globulin deposits induced in rats Ьу mercuric chloride, Amer,
J. Pathol., 65 (1971), 293 300.
14. Bariety J., Druet Ph., Loirat Ph., Lagrue а., Les glomcru!onephritis pro-
liferatives, Etude histopathologique еп microscopie optique, eJectronique
et еп immunohistochimie de 49 cas, Path, Вiol" 19 (1971), 259 283.
15. Barthelmes Н., Zur Immunologie der blasenbi!denden Dermalosen.
1. Mitteilung: Der Parapemphigus (bu1l6ses Pemphigoid уо" Lever) und
die kombinierte Immunofluoreszenzmethode, DCI'm. Mschr., 155 (1969),
507 517.
16. Barthelmes Н., 5бnniсhsеn N., Die Bedeutung dcs Immuniluol'cszcnzver-
fahrens fur die Dermatologie (TechI1ik und An\\:endung), Del'm. Mschr.,
156 (1970), 184 211.
17. Bast а., Leverenz 5., Kellner R., Nachweis einer diaplazentar uberlrage-
пеп Immunothrombopenie mit НШе der ImmuпоПuоrеszепztесhпik, Fol.
Haematol.,87 (1967), 237 248.
18. Beпsoп М. D., Cohen А. 5., Antinuclear antibodies in systemic lupus
erythematosus. Detection with horseradish peroxidase conjugated anti-
body, Апп. Intern. Med., 73 (1970), 943 949.
19. Beregi Е., Mayersbach v., Н., Immunhistologische Untersucl1Ungen ехре-
rimenteller NерhrШdеп, Virchows Arch. АЫ. В, Zellpath., 4 (1970),
225 245.
20. Berg Р. А., Doniach D" Roitt 1. М., Immunologische РЫiпоmепе bei Le-
berkrankheiten: Ше Bedeutung mitochondrialer Antikorper, Юiп. Wschr.,
47 (1969), 1297 1307.
21. Berger J., IgA g!omerular deposits in I'enal disease, TI'anspl Proc., 1
(1969), 939 944.
22. Berger J., Yaпeva Н., Aпtoine В., Application de l'immuI1ofluorescence
а lа pathologie rena!e. П. Etude immunhistochimique des lesions g!ome-
ru!aires, J. Urol. Nephro!., 75 (1969), 269 281.
23. Beutпer Е. Н., 5epulveda М. R., Barпett Е. \1., QuапШаtivе studies 01
immunofluorescent staining, Bull. Wld, Hlth., 39 (1968), 587 606.
24. Biberfeld Р., Вiberfeld а., Perlmann Р., .Surface immunoglobu!in light
chain determinants оп normal and PHA-stlmulated human blood Iympho-
cytes studied Ьу immunofluorescence and e!ectron microscopy, Ехр. Се!!
Res.,66 (1971), 177 189.
25. Вieпeпstock J., Dolezel J., Peyer's patches: lack of specific antibody-
сопtаiпiпg cells after ora! and parentera! immunization, J. ImmuI1ol"
106 (1971), 938 945.
26. Вliiker F., Hellwege Н. Н., Henningsen В., Maintz J., ImШLlпо!оgisсllе
Aspekte g!omeruHirer Nierenerkrankungen unter besonderer crucksic,!1ti-
gung immunhisto!ogischer Befunde, Der Urologe А, 11 (19/:2), 1 ,.
27. Вбhmig H.-J., Untersuchungen zur Pathogenese der hyperakuten Abslo-
Bung von Ноmо- und Heterotransplantaten der Nieren beim Hund, WicI1.
klin. Wschr., 24 (1971), 429 436.
28. Booyse F. М., 5terпberger L. А., Zschocke D" Rafelsoп .М. J?, Ultl"аslПl-:-
tura! 10caIization of contractiIe protein (ТhrоmЬоsthешп) 111 human pla-
te!ets using ап unlabe!ed antibody-peroxidasc stаiпiпg tcchniqlJ('. .т.
Histochem., Cytochem., 19 (1971), 540 550.
29. Bouteille М., Avrameas 5., Electron-microscopic sludy of antibody iUI-
mation Ьу using peroxidase-labeled antigens, С. R. Acad. Sci, Paris, 5('1".
D,265 (1967), 2097 2099; zit. п. С. А., 68 (1968),76562 j.
26 840
402 [;. Эрнст, д. Тесжан
30. Brauпsteiпer Н., Rigler R., Pakesch F., Immunfluoreszenz Untersuchun-
gcn ап Кпосhепmаrksаusstriсhеп bei primar chronischer Polyarthritis,
Юiп. Wschr., 40 (1962), 1139 1141.
31. Brell1Ji1п Р. С., Paraino С" Fry R. J. М., 5wick R. W., Immunofluores
ccnt 10caIization of ornithine aminotransferase in rat Iiver, J. Нistochem.
Cytochem., 18 (1970), 264 267.
32. Breпtjeпs J. R. Н., Feltkamp Vroom Т. М., Тiddens Н. А. W. М., Kuys
ten R. н., Localization of plasma proteins in kidneys of children with
djffuse nephropathies, studied Ьу ап indirect immunfluorescent technique,
Acta Paediat. 5cand" 58 (1969), 374 384.
зз. Bretton R., Teтyпck Т., Aиrameas 5., Comparison of peroxidase and
ferritin labelIing of cell surface antigens, Ехр, Cell Res., 71 (1972),
145 151.
:34, Broperger О., Perlman Р" Demonstration of ап epithelial antigen in со-
lon Ь" means of fluorescent antibodies from children with ulcerative со-
litis,1 ехр. Med" 115 (1962), lЗ 26.
35, Brozmaп М., Нistochemical localization of АСТН and Т5Н in the human
hypophysis, Acta Histochem., 26 (1967), 261 270.
36, Burtin Р., Кleist иоn, 5., 5аЫпе M. Cl., Loss of а normal colonic тет-
brane antigen in human cancers of the colon, Cancer Res., 31 (1971),
] ОЗ8 1041.
37, Bussolati G., Capella С" 50lcia Е., Vasallo G., Vezzadini Р., Ultrastruc-
tura] and immunofluorcscent investigations оп the secretin сеВ in the
dog intestinal mucosa, Нistochemie. 26 (1971), 218 227.
38, Bussolati G., иаn Noorden 5., Bordi С., Calcitonin and ACTH-producing
cclls in а case of medullary carcinoma of the thyroid. lmmunofluores-
сепсе invcstigations, Vircho\vs Arch. Abt. А Path. Anat" 360 (1973),
12З 127.
39, Bussolati G., Pearse А. G. Е., lmmunofluorescent localization of calci-
tonin in thc «С» cells of pig and dog thyroids. J. Endocrin., 37 (1967),
205 209.
40. Busuttil R, W" Roh В, L., Fis/ler J, W" Localization of erythropoietin
in thc glomcrulus of tllС hypoxic dog kidncy using а fluOl'escent al1tibody
technique, Acta haemat., 47 (1972), 2З8 242.
4]. Carruthers С., Baumler А., Localiza tion of fluorescein-labeled antibodies
of epidermal proteins in normal and malignant squamous epitheHum,
J, Nat. Cancer lnst., 37 (1966), ЗОl ЗI5,
42, Carver R, К, Goldmaп М., 5taining Toxoplasma gondii with fluorescein
labelled antibody. III. The [еасНоп in frozen and paraffin sections, Аm.
J. Clin. Pathol., 32 (1959), 159 164,
43, Chandrasekharaпп N., Cytological studies of plasma albumin in the rat
liver, Histochemie, 13 (1968), 11 15.
44. Chiappino G" Perпis В., Demonstration with immunofluorescence of
195 macroglobulins and 75 gammaglobulins in different cells of the
human spleen, Pathol. Microbiol., 27 (1964), 8 15,
45. Chorzelski т., Jablonska 5., Вlaszcyk М., Jarzabek М., Autoantibodies in
pcmphigoid, Dermatologica (Basel), 136 (1968), З25 З34.
46, C/lOrzelski Т. Р., иоп Weiss J. F., Leиer W. F., Clinical significance of
aut(J.antibodies in pemphigus, Arch. Derm" 93 (1966), 570 576.
47. Cieciura L., Roszkowska Giryп J., lmmunohistochemische Untersuchun-
gcn dcr Magenschleimhaut bei Kranken mit pernizi6scr Anamie, Acta his-
tochcm., 36 (1970), ЗОЗ З07.
48. Codaccioпi J, L., Depieds R., Jeaп R., Henry С., Lebreuil G" Вilan de 18
rccherche des auto-anticorps thyroidiens par immunof1uorescence indirec-
te chez 317 sujets. Confrontations histopathologiques dans 102 cas, Апп.
cndocr.,32 (1971), 172 182.
48. И ММУНО2UСТОЛОЩЯ 403
49. Coons А. Н., Kaplaп М. Н., Localization of antigen in tissue cells,
П. Improvements in а method for the detection of antigen Ьу means of
f1uorescent antibody, J. ехр. Med., 91 (1950), 1 13.
50. Cooпs А. Н., Leduc Е. Н., Сопоиу J. М., Studies оп antibody productiol1.
1. А method for the histochemical demonst1'ation of specific antibody and
its application to а sttldy of the hyper-immunc rahbit, -Т. ехр. Med., 102
(1955), 49 60.
51. Curtaiп С. с., The chromatographic purification of flUОI'еsсеiп .antibody,
J. Histochem. Cytochem., 9 (1961), 484 486.
52. Dan М., Hagiwara А., Detection of two types of 'lemoglobin (НЬА and
HbF) in sing'e erythrocytes Ьу а f\uorescent antibody techniqllc, F:xp.
Cell. Res., 46 (1967), 596 598,
53. Данилова Т. А., Лямперт И. М., Изучение антител J{ К(J ШОНСl!там со-
единительной ткани н мышечноrо волокна МИ(JJ{арда в сыворотках боль-
ных ревматизмом методом иммунофлюоресценции, БЮ.т1.1. ЭКСП БИО:I.
(Москва), 1972, 53, 3, 68 72.
54. Dawkiпs R. L., Lamoпt М., Myogenesis in vitro as demonsll'alcd Ьу im,
munofluorescent staining \vith antimusck Se1'Um, Ехр, Се!! Rcs., 67
(1971), 1 10,
55. Davey F. R., Busch G. J., lmmunohistochemistry of glоmеПl[ОПl рhritis
using horseradish peroxidase and f\uorescein-Iabeled antibody а сот-
parison, Amer. -Т. Сliп. Path., 53 (1970), 531 536,
56. Delpech-Stewart А., Ап immunofluorescent study of antigenil' :;lluсlшеs
in the development of llUman epidermis, -Т. Нistochem. Cytochcm., 19
(1971), 627 629,
57. Deutsch Н. F., Sepal'ation of antibody-active pl'otcins from various ani-
таl sera Ьу ethanol fractionation techniqllcs, Met'lOds }\'\ed Res.. Б
(1952), 284 300.
58. Diпh В. L" Brassard А., Katiyar V. N., Expcrimenta! glотсrlllоперhritis
induced with the major antigen of rat kidney, l11t. ArC'l. .\llergy, 43
(1972), 131 '44.
59. Doerr-Schott J" Dubois М. Р., Identification pal' immllnofluoI"cscence dcs
cellules corticotropes et melanotropes dc ]'hypophyse dcs ampl1ibiens, Z.
Zellforsch., 132 (1972), 323 331.
60. Dolezel J., Bieneпstock J., А and поп-А immtllle rcsponse aftcr ol'a' and
parenteral immunization of the hamster, Cell. lmmtJ1101., 2 ('971),
458 468. .
61. ДОрф/JtaН Н. Л, Получение и применение п!бридных aHТlITe 1 в элек-
tpohho-микроскопическоЙ ИММУНОДИТОХНМИIl, Вопр. 1eд. ХfШИИ, 1972,
18, 5, 461 467.
62. Dreskiп R. В., Spicer S. S" Greeпe W. В" Ullrаstruсlш-а! Iocalization 0;'
chorionic gonadotropin in hl1man term placelIta, -Т, Histochcm. Cvtochcm..
18 (1970), 862 874, .
63. Druet Ph., Le Loup В" Bariety J., Lagrue G., ttude imml1110histochimique
de 70 biopsies renales hl1maines par la technique dcs anticorps COUpll>S
аих enzymes, J. Urol. Nephrol., 76 (1970), 342 346.
64. Druet PII., Le Loup В" Bariety J., Lagrue G., Application а 'а pathologie
rena'e de la technique des anticorps couples аих enzvmes. Rc\- [1trop.' C't
Сliп. Вiol., 15 (1970), 119 122. '
65. Duheille J., Petitier Н., Faivre G., Zur Лlltоim11ltшitiit (k" 11('I'Z(';15,
Miinch. med. Wschr., 110 (1968), 29 35.
66. Dutz W., Erпst В., Technik der lmmunhistologie, Z, med. I.зl1О! t('сlшik. 7
(1966), 205 225.
67. D orak Н. F., Cohen R. !J., Localiza ion of ske!etal muscle phOsp'lOl'ylase
usюg а fluorescent ant1body tесhшquе and 1tS сопе'аtiоп \\'ith histo-
chemical observation, J. Histochem. Cytochem., 13 (1965), 454 460.
26*
404 Е,:-'Эрнст, д. Тесман
68. Edgiпgton Т. 5., Ritt D. J., lritrahepatic expression of serum hepatitis vi
rus associated antigen, J. ехр. Med., 134 (1971), 871 885.
69. Ehiпger В,, ТЬе cytological localization of rat pancreas ribonuc!ease Ьу
means of fluorescent antibodies, Нistochemie, 5 (1965), 145 153.
O. Eпiтart Е. W., Localization of a-glycerophosphate dehydrogenase in the
rodl'nt heart muscle using fIuorescent antibody technique, Lab. Invest" 15
(1966), 2бl 269.
71. Eттart Е. W., Bates R. W., Turner W. А., Localization of pro!actin in
rat pituitary and in transplantable mammotropic pituitary tumor using
fluorescent antibody, J. Нistochem. Cytochem., 13 (1965), 182 190.
72, Emmart Е. W" Komiпz D, R., Miquel J" ТЬе localization and distribution
of glyceraldel1yde 3 phosphate dehydrogenase in myoblasts апd develo-
ping musc!e fibers gro\ving in cultures, J. Нistochem. Cytochem., II
(1963), 207 217.
73. Emmart Е. W., 5chimke R. Т., 5picer 5. 5., Turner W. А., ТЬе locali-
zation of glyceraldehyde-3-phosphate dehydrogenase in kidney tissue Ьу
means of fluorescent antibody, Ехр. Сеll Res" 30 (1963), 460 475.
74. Emтart Е. W., 5picer 5. 5" Bates R. W., Localization of prolactin within
the pituitary Ьу specific g!uorescent antiprolactin g!obulin, J. Нistocheт.
Cytochem., 11 (1963), 365 373,
75. Federliп к., Autoimmunpblinomene in der Endokrinologie, Med. Welt.
1970, 1 020 1 025.
76. Federliп к., Oppermann W., Pfeiffer Е. F" Beit!'age zur Immunthyreoi-
ditis. 1. Serologische und fluoreszenzhistologische Untersuchungen bei
der Hashimoto Thyreoiditis, Dtsch. med. Wschr., 90 (1965), 247 255.
77. FiscfLer к., Merteпs H-G., 5chimrigk к., Ein Beitrag zur 1mmunpatho!0
gie bei Myasthenia gravis, Disc!1. med, Wschr., 90 (1965), 1760
1764.
78. Fish А, J., Herdтaп R. С., MicflQel А. F., Pic/,eriпg R. J., Good R., Epi-
demic acute glomerulonephl.itis associated wiih typc 49 streptococcal
pyoderma. П. Сопеlаiivс study of light, imm\.lnofluorescent and е!ес-
tron microscopic iindings, Amer. J, Med" 48 (1970), 28 39.
79. Fraпcois D., Oriol R., Biпaghi R. А., Immunoperoxidase localization of
antihapten antibodies in rats I'esponding unequally оп aI:tigenic stimu-
lation, J. Histochem. Cytochem., 20 (1972), 527 535.
80. Freund J., McDerтotf к., Sensitization to horse serum Ьу means of
adjuvants, Proc. Soc. ехр. Biol., 49 (1942), 548 553.
81. Frydтaп R., Geffeп L. В., Depletion and rep!etion of adrenal dopamine-
-hydroxy!ase after reserpine, J. Нistochem. Cytochem., 21 (1973), 166
174.
82. Fuxe к., Goldsteiп М., Hokfelt т., Joh Т. Н., 1mmunhistochemica! loca-
lization оУ dopamin- -hydroxy!ase in the periphera! and centra! nervous
system, Res. Commun. СЬеm. Path. Pharmac., 1 (1970), 627 636.
83, Fuxe к., Goldsteiп М., Hokfelt Т., Joh Т. Н., Cellu!ar localization af
dopamin- -hydroxylase and рhепу1еthапо!аmiпс N-mеthуl-trапsfеrаsе as
revealed Ьу immunohistochemistry, Progr. Brain Res., 34 (1971), 127
138..
84. Gallily R., Goтostaпsky М., Specificity and паtше of binding of anti-
macrophagc SNum, Immunology, 22 (1972), 431 439,
ЬБ, Geiler G" Immunhistochemische Befunde an GefaBen der Synovialmeт-
bran bei Rhcumatoid-Arthritis, Allerg. Immuno!" 17 (1971), 296 299,
86. Geiler G" U ntersuchungen i.iber die immunhistocl1emische Fibrindarstel-
lung ап Вiopsic- und Obduktionsmateria!, Histochemie, 5 (1965), З61
365,
87. GeilN G" 5tiehl Р" Immunhistochemische Untersuchungen ап rheu-
matisc!l veranderten Herzohren, Bcitr. path. Anat., 131 (1965), 270
280.
48. Н ммуноzuстоло2UЯ 405
88. Gerber М. А., Paroпetto F., 19E in glomeruli of patients with nephrotic
syndrome, Lancet, 1 (1971), 1 097 1 099.
89, Goldmaп М., Fluorescent antibody methods, Academic Press, New
York London, 1968.
90. Тордиенко В, М., Космач П. Н., Метод ферментативноЙ метки в имму-
1I0rистохимии, Арх. пат., 35, 6 (1973), 69 74.
91. Gordoп М. А., Edwards М. R., Tompkiпs J. N., Refinement of fluorescent
antibody Ьу gel filtration, Proc, Soc. ехр. Biol. Med., 109 (1962), 96
99.
92. rудил-Л евкови', К А., Применение иммунофлуоресценции при изуче-
нии Н31\Опления противоопухолевых антител IВ1 1У!ШЫХ сывороток В
опухоли. В сб.: Вопросы экспериментальноЙ онколоrии, Киев, 1966,
вып. 2, 193 198.
93. Haeпscfz R" Autoimmunpathologische FеrtilШitsstбruпgеп des Л1аППеs,
Arch, klin. ехр. Derm., 237 (1970), 61 66.
94. Haferkamp О., Autoantik6rperbedingte Thyreoiditis. Pathologisch-ana-
tomische ObeI"legungen zur Diagnostik unter Beri.icksichtigung klinischer
und serologischer Befunde, Dtsch. med. Wschr" 88 (1963), 1275 1281.
95. Hammer D. К, Dixoп F. j" Experimental glomeruIonephritis, П. Immu-
nologic events in the pathogenesis оУ nephrotoxic Sert1m nephritis in the
rat, J. ехр. Med" 117 (1963), 1019 1034.
96. Hartmaп В. К, Immunofluorescence of dopamine- -hydroxylase, J. His-
tochem. Cytochem., 21 (1973), 312 332.
97. Hartroft Р. М., Sutherlaпd L. Е., Hartroft W. S., Juxtaglomerular ceIls
as the source of renin: further studies with the fluorescent antibodv tech-
nique and the effect оУ passive transfer of antirenin, Сап. Med. Assoc.,
90 (1964), 163 166.
98, Нау J. В., Murphy М. J., Mooris В., Bessis М. с., Quantitative studiб
оп the proliferation and dШеrепtiаtiоп of antibody-forming cells in
Iymph, Amer. J, Pathol., 66 (1972), 1 17.
99. Hellstrom и., Zeromski J., Perlmaп Р., Immunoglobu!in light chain de-
terminants оп unstimulated and stimulated Ьиmап bIood Iymphocytes,
assayed Ьу indirect immunofluorescence, Immunology, 20 (1971),
1099 1111.
100. Hijmaпs W., Schuit Н. R. Е., Immunofluorescence studies оп immuno-
globulins in the lymphoid cells of human peripheral blood, СЕп. ехр.
Immunol., 11 (1972), 483 494.
101. Нijmaпs W., Schuit Н. R. Е., Hulsiпg-Hesseliпk Е., Ап immunofJuores-
се псе study оп intraceIlular immunoglobulins in Ьиmап Ьопе marrow
cells, Апп. N. У. Acad. Sci., 177 (1971), 290 305.
102. Hiпsberg К, Laпg К, Medizinische Chemie. Urban und SCh\\Tarzenberg,
Munchen Berlin Wien, 1957, S. 982.
103. Hoedemaeker Р. J., Feeпstra К, Nijkeuter А., Arel1ds А., Ultrastructurar
localization of hetel'ologous nephrotoxic antibody in the glomerular Ьа-
sement membrane of the rat, Lab. Invest., 26 (1972), 610 613,
104. Нбkfеlt Т., Fuxe К, Goldsteiп М., Joh Т. Н., Immunohistochemical loca-
lization of three catecholamine enzymes: aspects оп methodology, Histo-
chemie,33 (1973), 231 254.
105. Hoffmaпп N. А., Hartroft Р. М., Application of peroxidase-labelled anti-
bodies to the localization of renin, J. Histochem, Cytochem., 19 (1971)
811 813. '
106. Ho;ejsl J., Smetaпa R., The isolation of gamma-globulin from blood
serum Ьу rivanol, Acta Med. scand" 155 (1956), 65 70.
107. Huaпg S. N., МШтапп 1., О'Соппеа А., Aroпoff А., Оаии Н, Вlит-
berg В. S., Virus 1ike particles in Australia апtigеп associated l1epatitis.
Ап immunoelectron microscopic study of Ьиmап live1', Ашеr. J. Pathol,
67 (1972), 453 462. '
-406 Б. Эрнст, Д. Тесман
108. Husby а., Natvig J. В., Immunologic characterization of amyloid fibrils
in tissue sections, СНп. ехр. Immunol., 11 (1972), 357 366.
109. Jager В. V., Nickersoп М., А simple quantitative chemical method for
estimating gamma-glоЬuНпе in human serum, J. biol. Chem., 173 (1948),
683 690.
110. Johпsoп W., Juraпd J., Hiramoto R., Immunohistologic studies of tumors
containing myosin, Amer. J. Pathol., 47 (1965), 1139 1155.
111. Jongsma А. Р. М., Нijmaпs W., Ploem J. S., Quantitative Immuno-
fluorescence, Нistochemie, 25 (1971), 329 343.
112. Kageп L. J., Ourevich R., Localization of myoglobin in human sceletaJ
muscle using fluorescent antibody technique, J, Histochem. Cytochem" J 5
(1967), 436 441.
113. Kasukawa R., Calkiпs Е., Milgrom F" Antigens characteristic for amy
loid of man and rabbit, J. Immunol., 97 (1966), 260 266.
114. Kater L., Borst Eilers Е., иаn Oorp L. Н. М., Immunohistochemical stu-
dies of liver tissues, Path. Europ., 7 (1972), 299 306.
115. Kawamura А., Fluorescent antibody techniques and their applications,
Univ. Tokyo Press and Univ. Park Press, Baltimore Manchester, 1969.
116. Kawarai У., Nakaпe Р. к., Localization of tissue antigens оп the ultra-
thin sections with peroxidase-lаЬеlIеd antibody method, J. Нistochem.
Cytochem., 18 (1970), 161 166.
117. Кеа В" Sormova Z., Laboratoriumstechnik fiir Вiochemiker, Akademische
Verlags-gеsеlIsсhаft Geest & Portig KG, Leipzig, 1965, S. 556.
118. Keпt Р" Djffusion of plasma proteins into celIs: А manifestation of cell
injury in human myocardial ischemia, Amer. J. Path., 50 (1967), 62З
634.
119. КеШеr L, н., Ditscherlein а., Schпeider W., Verfeinerung der Nierer1-
diagnostik durch rоutiпеmэЯigе Anwendung moderner Spezialmethoden
аm Biopsiematerial, Dtsch. Ges, wesen, 27 (1972), 350 358.
120. Кlein Р. а., Studies оп immune haemolysis: preparation of а stabIe and
highly reactive сотрlех of sensitized erythrocytes and the first coтpo
nent of complement (ЕАС'I): inactivation of cell-fixed С'I Ьу some сот-
plement reagents, J. ехр. Med., 111 (1960), 77 91.
121. Кleiп Р" Burkholder Р., Ein Verfahren zur fluoreszenzoptischen DarsteJ
lung der Komplementbindung und seine Anwendung zu histoimmunolo
gischen Untersuchung der experimentelIen Nierenanaphylaxie, Dtsch.
med. Wschr., 84 (1959), 2001.........;2006.
122. Кlein Р., Burkholder Р., Studies оп the antigenic properties of compJe-
ment, 1, Demonstration of agglutinating antibodies against guinea pig
complement fixed оп sensitized sheep erythrocytes, J. ехр. Med" 111
(1960), 93 106.
123, Kochem Н.-О., Immunhistologische Befunde bei drei FiШеп sekundarer
menschlicher Amyloidose, Frankf. Z. Pathol., 75 (1966), 399 411.
124. Kochem H. a., Нistoserologischer Nachweis verschiedener Antigene im
experimentellen Mauseamyloid, Z. Immun. Forsch., 130 (1966), 208
214.
125. Kortiпg Н. J., Voss G.-R., FIuоrеszепz-Мikrоskор-Рhоtоmеtriе mit Re-
gistrierung, Jenaer Rundschau, 16 (1971), 217 220.
126. Koffler D., Agпello V., Thoburn R., Kuпkel Н. Н., Systemic lupus erythe-
matosus: prototype of immune соmрlех nephritis in тап, J. ехр. Med.,
134 (1971), 169 179.
.127. Koffler D., Paronetto F., Immunofluorescent localization of immunoglo-
bulins, complement, and fibrinogen in human discases. П. Acute, subacu-
te and chronic glomerulonephritis, J. clin. Invest" 44 (1965), 1665 167),
128. Kourilsky F. М., Silvestre D., Neauport Sautes С., Loosfelt У., Dausset -"
Antibody-induced redistribution of HL-A antigens at the cell surface,
Еш. J. Immunol., 2 (1972), 249 257.
48. Н МJtуноzuстолоzия 407
1 i. !,rllc/Ii J., l.illullcrтallп Н. D., Hacf/тeister и, Immunhistologischer
.\CTH ;\JacI1wcis in cinem R-Zеl!сп Аdепоm des Hypophysenvorderlap
pcns bei М. ClIshing, Virchows Arch, Path. Anat., 340 (1966), 270 276.
1;30 Kraef/ellbul!l J. Р" de Graпdi Р. В., Campiche М. А., Ultrastructural
localization of intracel!ular antigen using enzyme labelled antibody
iragments, J, сеl!, Biol" 50 (1971), 432 445,
131. Kraft 5. С., Rimpila J, J., Fitch F. W" Кirsпer J, В., Immllnohistochemi
саl studies of thc colon in ulcerativc colitis, Arcl1, Path" 82 (1966),
369 З78.
132. Krafl D" WeтC1" H, P" Steтberger Н., Wiederтann G., Immunoglobu-
lin-E :-.Jachwcis mittels Immunfluoreszenztechnik bei Pcnicillinallergie-
vom Тур del' Serumkrankheit, Wien. klin. Wschr., 83 (1971), 758
761.
133 Kraus F. N" Mestecky .т., 1mmunohistochcmical localization of amylase,
Iysozyme and imшuпоglоыliпss in illе Iшmап parotid gland, Arch. oral.
Biol., 16 (1971), 781 789,
1:3-1, Krawczynski К, 1шmuпоhistосhсmiсаl study of arterio]ar (simple) hyali
nosis in the spleen, Amer. J. Path., 62 (1971), 253 264.
135. Kupper К, Laпp,er Е, Юеiп Р., N acllweis kошрlеmепtЫпdепdеr Struktu-
[сп in Aschoffschen Kn6tchen operativ cntfernter Hcrzohrcn, \Tirchows:
Arch. path, Anat., 334 (1971), 342 350.
136, Kurtz J. М" Russel S. W., [ее J. С., Slauseп D, О., 5chechter R, D.,
Natural!y оссшiпg canine glomerulonephritis, АШСl', J. Path., 67 (1972),
471 477.
137. Кузнецов О. К, о ВЫЯВ.lении поверхностных антиrенов и антител в жи
вых K.leTKax lеТОДО 1 Иl\1мунофлуоресценции, ЦИТО.lоrия 12, 3 (1970),
366 371.
138, Lachтaпn Р. J., Muller Eberhard Н. .т., Kunkel Н. а., Parolletto F., Thc
localization of in vivo bound complement in tissue sections, J. ехр, Med.,
115 (1962), 63 82,
139. [апе R. 5., Localization of transferrin in ]шmап and [а! li\rel' 1)\' fluores-
ccnt antibody technique, Naturc. 215 (1967), 161 162. -
140, Lawton А, R" Asofsky R" Hylton М. В., Cooper М. D.. Suppression of
iшmuпоgIоЬuliп class synthesis in mice, J. ехр. Mcd.. 135 (1972). 277
297.
141. Leuin .4" Кillander D" Юеiп Е, Nordenskjold В., Jпonue М., Аррliса.
tions of microspectrof1uorometry in quantitation of immllnoflllorescence-
оп single cel!s. Апп. N. У. Acad, Sci.. 177 (1971), 481 489.
142. [еиу Н. В., 50ber Н. А., А simple chromatographic mcthod for fll'epara-
tion of gamma-globulin, Proc. Soc, ехр. BioI. Med., 103 (1960), 250
252.
143. Lewis V, J" Jolles W, [" Brooks J. В., ТесlшiсаI considcrations in thc
preparation of fIuorescent antibody conjllgatcs, Appl. M.icl'obiol.. 12
(1964), 343 348.
1.14. Lezпoff А., Fisluпaп J., Goodfrielld [., McGarry Е, Beck J.. Rose В.,
Localization of fIuorescent antibodies to human growth hormone in hu-
тап anteri01' pituitary gland, Proc. Soc, схр. Biol. Med., 104 (1960).
232 235.
145. Logothetopoulos .т., Yip с. С" Cobиrп М. Е., PI'oinslllin in B cells oi
IJovine isIets dешопstrаtеd Ьу fIuorescein or peroxidasc-labellcd specific
antibody, Diabctes, 19 (1970), 539 545.
146. Lomsky R., Langr F" Vortel V., Imшuпоhistосhсmiсаl demonstration of
gastrin in таттаliап islets of Langerhans. Nаtшс. 223 (1969). 618
() 19.
Il7. Luders а., Adams W., Aktllelle Anwcndungen und Ergebl1isse \'011 Im
m-ипfluоrеszеl1ztесhпikсп in der Dеrшаtоlоgiс, Yenerologic lInd Апdl'оlо
юс, Z, Haut-Gсsсhl. Кr., 47 (1972), 479 490.
408 Б. Эрнст, Д Теснан
148. Lunge В., Sommer Haпsen Е., Renal transplantation in rabbits. V1. 1т-
munofluorescent study of IgG deposits in renal al1ografts, Acta path.
microbiol. scand. Sect. А, 80 (1972), 379 390,
149. Luпzenauer К, Schneider W., Biester 1., Seidler Е., Immunhistologische
Uпtеrsuсhuпgеп ап Leberpunktaten von Patienten mit chronischer Нера-
titis, Frankf. Z. Pathol., 75 (1966), 446 452.
150. Lustig L., Ultrastructura! !ocalization of а so!ubIe col1agen antigen, J.
Histochem. Cytochem., 19 (1971), 663 669.
151. МассЫ 1. А., Вlaustein Е. Н., Cytostructure and endocrine function of
mono!ayer cultures of neonata! hamster pancreas, Endocrinology, 84
(1969), 208 216,
152. MacSween R. N. М., Оnо К, Thomason Ch. М., Immuno!ogical and 11isto-
!ogical studies of extopic heart transplants in the rat, J. Path" 105
(1971), 49 56.
153. Mancini А. М., Zampa О. А., Vecchi А., Constanzi О., НistoimmllnoJo-
gica! techniques for dеtесtiпg aI1ti-iпsuliп antibodies in human sera, Lап-
cet, 1 (1965), 1189 1192.
154. Mansberg н., Kusnetz J., Quantitative f!uorescence microscopy: fluores-
cent antibody automatic scanning techniques, J. Нistochem., Cytochem.,
14 (1966), 260 273.
155. Mason Т. Е., Phifer R. р" Spicer S. S" Swallow R. А., Dreskin R. В" Ап
immunog1obulin-enzyme bridge method for !ocalizing tissue antigens.
J. Histochem. Cytochem., 17 (1969), 563 569.
156, Маянскuй Д. Н., Макаров М. Т., Об иммуноrистохимическом способе
идентификации лимфоидных клеток крысы, трансплантированных ЮI-
мунолоrически незрелым мышам-реципиентам. Ж. Микробиол, (Моск-
ва), 1972, 3, 80 85.
157. Mayei'sbach Н. v., Immunhistochemische Methoden in der Histochcmie,
In: Graumann W, und Neumann К. Н. (Hrsg,) Handbllch der Histoche-
mie, Band 1/2. Fischer, Stuttgart, 1966, S. 166 268.
158. Mayersbach Н. v., Quantitative Aussagemoglichkeiten der Immuп-F]llО-
reszenz, Acta histochem" Suppl. ХН (1972), 87 95.
159, Mauersbach Н. v" Beregi Е., Immunohistologische Untersuchungen схре-
rimenteller Nephritiden, Virchows Arch. АЫ. в Zellpath" 4 (1970).
246 255.
160. Mayersbach Н. v., Schubert О., Immunohisto1ogischen Methoden
IП. Die llПsреzifisсhеп Reaktionen zwischen markierten Seren und Ge-
',V'eben bei der immunhisto!ogischen Technik, Acta histochem., 10 (1960),
44 82,
161. McCormick J. N" Page Faulk W., Рох н., Fudeпberg Н. Н., Immuno-
histologica1 and e!ution studies of the human p!acenta, J, ехр. Med., 133
(1971), 1 18.
162, МсСоу R. с., Nuc1ear 1ocalization of immunog!obulins in rcna! biopsies
of patients with Jupus nephritis, Amer. J. РаО1" 68 (1972), 469 478,
163. McDevitt Н. О., Peters J. Н., Pollard L, W" Harter J. О., Cooпs А. Н,
Purification and ana!ysis of fluOl,еsсеiп-!аЬеllсd antisera Ьу column chro-
та tography, J. Immunol" 90 (1963), 642 643.
164, МсКее А. Р., Jeter W. S" The demonstration of аl1 al1tibody agail1st
comp!ement, J. Immuno]" 76 (1956), 112 118,
165, Midgley А. R., Нитап pituitary !uteinizing 1101'mone: Ап immlIIlOhisto-
chcmical study, J. Histoc!1cm. Cytochem., 14 (1966), 159 166.
166, Midgley /1. R., Pierce В, В., Immllnohistochcmical localization of !шmап
chorionic gonadotropin, J. ехр, Med., 115 (1962), 289 294.
167, Мбllеr О" Dcmonstration of mouse isoantigcns at the cellu!ar !cvel l1У
the f!uorescent antibody iechnique, J. ехр. Med., 114 (1961), 415 134.
168, Мооп Н. D., Mclvor В. С., Elastase in the exocrine pancreas; localization
with f!lIorescent antibody, J. Immunol., 85 (1960), 78 80.
480 И АfМУНОZUСТОЛОZUЯ 409
1690 Moore Но Do, 5choeпberg Мо Do, Synthesis of anti!)Qdy Ьу lymphocytes
restimu1ated in vitro wHh antigen, Res. J. Reticu!oend01he!. Soc., 9
(1971), 254 2720 . .
1700 Morikawa 5., Studies оп a!kaline and acid ribonucleases ш mamma!lan
tissues: immunohistochemica1 !ocalization and immunochemica! proper
ties, Jo Нistochemo Cytochemo, 15 (1967), 662 6730
171. Morikawa 50' Н arada То, Immunohistochemica! !ocalization of са ta!ase
in mammalian tissues, J. Histochem. Cytochem., 17 (1969), 30 35.
172. Morikawa 5., У aтaтura М., Н arada То, Н aтashiтa У, Studies оп cross-
reactivity of antiribonuclease antisera with hetero!ogous mammalian ri-
bonuc1eases, Jo Нistochemo Cytochem., 16 (1968), 410 418.
1730 MRC Working party: Characterization оу antisera as reagents. Recom
mcndations made Ьу the MRC working party оп the clinica! use of im
muno!ogica! reagents, Immuno!ogy, 20 (1971), 3 10.
1740 Muller М., F!uoreszenzimmuno!ogischer Nachweis von antimyokardialen
Autoantik6rpern. Z. med. Labortechnik, 14 (1973), 172 174.
1750 Muller R" Maess J., Deicher Н., F!uoreszenzsero!ogischer N achweis von
Australia-Antigen in der Leber, Dtsch. med. Wschr., 98 (1973), 93 99.
1 76. Muller Eberhard Но J., Nilssoп u., Aroпssoп То, Iso!ation and charac-
terization of two l g!ycoproteins of Ьитап serum, J. ехр. Med., 11 Т
(1960), 201 215.
177. Насорнев В. А., Зубжuцкuй Юо Н, ИммунолюминесцеНТIIое исследова
ние отложений липопротеидов и белков в аорте человека при aTepo
склерозе, Арх. Пат., 1972, 34, 4, 41 77.
178. Nairп Ro С., Fluorescent protein tracing, Livingstone Ltd., Edinburgh
and London, 1964, 2. Auflageo
179. Nakaпe Р. К., Simultaneous localization of тиltiр!е tissue antigens
using the peroxidase-Iabelled antibody method; а study оп pituitary
glands of the rat, J. Нistochem, Cytochem., 16 (1968). 557 560.
180. Nakalle Р. К, Classifications of anterior pituitary cell types with immu
noenzyme histochemistry, J. Histochem. Cytochem., 18 (1970), 9 20.
181. Nakaпe Р. К, Pierce а. В" Enzyme !abelled antibodies for the !ight and
e!ectronmicroscopic 10calization of tissue antigens, J. Cell Bio!.. 33
(]967). 307 3180
182. Nebe Н., Barthelтes Н., Ober den diagnostischen Wert der sllbepiderma
Iсп Immt1nog!oblllin lшd KompIementabIagerungen beim Lupus erythe
та 10dcs, Derm. Mschr.. 159 (J 973), 594 б03.
lRЗ. NicllO! .ro С., Deutsch Н. Р., Biophysical studies оУ bJood p!asma proteins.
УН, Separation of gamma g!obulin from the sera оУ various anima!s, J.
Лmеr. Chem, Soc., 70 (1948). 80 83.
184, Nowoslawski А., KrawczYllski К, Brzosko W, .r., Madalillski К, Tissue
localization оУ australia antigen immune complexes in acute und chronic
hepatitis and livcr cirrose, Amero J. Path., 68 (1972), 31 56.
185. O'Bcrr!! Р. А., А comparison of 3 methods of serum fractionation in the
j)rcparation of Vibrio fetus fluorescent antibody conjugates. Аm, J. \Tet,
Res.. 25 (1964), 1 669 1672.
186. Okada N., Takaki R., Кitagawa М., Histo10gic and immunofluorescent
studics оп the site of origin of gIucagon in mamma]ian pancreas, J. His
tochem. Cytochem., 16 (1968), 405 409.
1 R';". Oka;:aki К, Н oltzer Н., Ап ana1ysis of myogenesis in vitro using f]uo
resccin !abelled antimyosin, J. Нistochem. Cytochem., 13 (I 965), 726
739.
188. Oldstol1c М. В. А., Dixoп F. 1., Immunohistochemical stud\' 01 allergic
encephalomyelitis, Amer. J. Path., 52 (1968), 251 257. .
189. Oswald В., Schlag Во, Fraпke Но, Malberg К, Goetze Е., Immunfluores-
zcnzmikroskopische Untersuchungen ап Plazenta, Dottersack und тЫ-
tcrlichen Organen der Ratte nach unterschiedlich lokalisierter Injektion
410 Б. Эрнст, Д. Тес,нан
УОП Kaninchen-anti-Rattenp!azenta-Serum, Acla Ыо!. med. gerт., 27
(1971), 627 638.
190. Otto L., Fluoreszenzmikroskope der Mikroval Reihe dcs УЕВ Carl Zeiss
Jena, Z. med. Labortechnik, 14 (1973), 195 203,
191. Ouchterloпy О., Diffusion in gel methods fOl' imтunologica! analysis,
Progr. Allergy, 5 (1958), 1 78.
192. Paroпetto Р., Kottler D., Immunof!uorescent localization of immunoglo-
bu!ins, complement, and fibrillogen in Ьиmап discascs. 1. Sys!emic IUpLlS
erythematosus, J. clin. Invest., 44 (1965), 1657 1664.
193. Paroпetto Р., Kotfler D., Autoimmune proliferative g!omel'uloncpllritis iп
monkeys, Amer. J. Path., 50 (1967), 887 894.
194. Paroпetto Р., Роррет Н., Aggravation of hepatic lesions in mice Ьу in
vitro !ocalization of immune comp!exes (Аие!" hepatitis), Amer. J. Path.,
47 (1965), 549 563.
195. Pearse А. а. Е., Bussolati а., Polak J., Immunof!uorescence studies оп
the G cells in norma! and abnorma! gastric mucosa, Acta hepato gastro-
enterol., 19 (1972), 291 298.
196. Petersoп Е. А., 50Ье, Н. А., Cllromatogl'aphy of proteins. 1. Cellulose ion
cxchanger absorbents, J. Amel'. СЬеm. Soc., 78 (1956), 7Бl 755.
197. Perrzis В., Chiappiпo а., Rowe D. 5., Cclls producing IgD immunog!o-
bu!ins in human spleen, Naturc, 211 (1966), 424 425.
198. Perпis В., Forпi L., Amaпte L., Immunoglobu!in spots оп tl1e surface of
rabbit lymp!lOcytes, J. ехр. Med., 132 (1970), 1000 1018.
199. Petris de 5., Karlsbad а., Perпis В., Localization of antibodies in plas-
mа cells Ьу e!ectron microskopy, J. ехр. Med., 117 (1963), 849 862.
200. Ploem J. 5., Quantitative Immunofluorescence, in: Е. J. Holborow, Stan-
dal'dization in immunofluorescence. B!ackwell, Oxford Edinburgh,
1970, S. 63 73.
201. Plum С. М., Hermaпseп L., Peterseп 1., Fractionated protein dеtеrmiпа-
tion оп small quantities, Scand. J. clin. lalJ. Invcst., 7, Suppl. 18 (1955),
] З5.
202. Polall J. М., Keпdall Р. А., Heat/l С. М., Pearse А. а. Е, Carbodiimide
fixation for clectron microskopy and immllnoelec!ron cytocllcmistry, Ех-
pericn tia, 28 (1972), 368.
203. Pomeraпtz D. 1(., 5immoпs К. R., 1mmunofluorescent localization of bo
vine luteinizing hormone, J. Histoc!lem. Cytocllem., 16 (1968), 205
207.
204. Preud Homme J. L., Hurez D., 5eligmaпп М., IшmL1поfluоrеsсепсе stu-
dies in Wa!dcnstr6m's mасrоglоlJLlliпешiа, Еш-ор..1. C!in. Biol., 15
(1970), l127 113 ] .
205. Preud Homme J. 1 ., 5eligmaпп М., ImmuпоglОЬLlliпs оп tllC surfacC' of
!ymphoid cel!s in Wa!denstr6m's mасrоglоЬuliпешiа, J. Clill. Invest.. 51
(1972), 701 705.
206. Rabelliпo Е., Coloп 5., Grey Н. М., Ипапие Е. R., Immunoglobulins оп
the surface of Iymphocytes. 1. Distribution and quantitation, J. ехр. Med.,
133 (1971), 156 167.
207. Ratf М. С., 5terпberg М., Taylor R. В., Immunogloblllin determinants оп
the surface of mouse Iymphoid cells, Nature, 225 (1970), 553 554.
208. Rifkiпd R. А., Ossermaпп Е. Р., Hsu К. С., Morgaп С., Т!lС intracel!u-
!ar distribution of gamma-g!obulin in а mousc pJasma сеll tllmor
(х5563) as revea!ed Ьу fluorescence and e]ectr()11 rnicf'()scopy. -'. C'xr
Med., 116 (1962), 423 432.
209. Riggs J. L., Loh Р. С., Evelal1d W. С., А simpll' iJ'<Jсliопаiiоп rnrtlЮl!
for preparation of fluorescein-Iabeled gamma-g10lJL1liп, Proc. SOC'. С'Хр.
Biol. Med., 105 (1960), 655 658.
48. И м.м.ун.оzuстолоzuя 41
210. Riggs J. L., Seiwald R. J., Burkholder J. Н., Dowпs С. М., Metcalf Т. О.,
Isothiocyanate compounds as f1uorescent labelling agents for immune
serum, Amer. J. Path., 34 (1958), 1081 1097.
211. Rош J., Doпiach D., WHO-book of immuno!ogic techniques, World
Health Organization, Genf, 1966.
212. Rosseп R. D., Виие, W. Т., Reisberg М. А., Brooks п. К, Leach
тап R. D., Milam J. D., Mittal К К, Moпfgoтery J. R.} Nora J. J.,
Rochelle D. О" Immunof1uorescent !ocalization of Ьиmап immunoglobu-
liп in tissues from cardiac allograft recipients, J. Immuno!., 106 (1971),
171 180.
213. Roihbard S., Wafsoп R. Р., Demonstration Ьу immunofluorescence of the-
fixation of perfused antibody to human coI1agen in human kidney, J. ехр.
Med., 125 (1967), 595 606.
214. Rowlaпds D. Т.} Burkholder Р. М., Bosseп Е. Н., Hsu-Hshiпg ип, Renal
allograft in HL-A matched recipients, Amer. J. Path, 61 (1970), 177
210.
215. Rumke Ph.} Ladiges N. С. J. J., Comparative immunochemica! studies
with antisera to sheep pro!actin and bovine grO\vtll hormone оп anterior
pituitaries of ох, sheep, rats and mice, Z. Ze1lforsch., 67 (1965), 575
583.
216. Saiпte Marie О., Cooпs А. Н., Studies оп antibody production. Х. МоМ
of formation of plasmocytes in cell transfer experiments, J. ехр. Med.,
119 (1964), 743 760.
217. Sauerbuch Т., Stuhliпger В., Kaess Н., Immunhisto!ogische Untersu-
chungen bei einem Fal1 von Riesenzellarteriitis (Arteriitis temporalis),
Dtsch. med. Wschr., 98 (1973), 283 284,
218. Schiifer Н., Immunelektronenmikroskopie. VеrбffепtIiсhuпgеп aus der
morpho!ogischen Pathologie, 85, 1 57. Fischer, Jena, 1971.
219. Schiff R.} Krieg R. J., Hunter R. L., Localization Ьу peroxidase-Iabelled
antibodies of bovine chymotrypsinogen, J. Нistochem. Cytochem" 18
(1970), 195 200.
220. Schilliпger О., Hoтberg J. С., Evidence of specific organ antigenicity
situated in the intercellular substance of the md and сопе !ayer of the
еуе, Ехр. Еуе Res., 14 (1972), 264 269.
221. Schпeider W., Luпzeпauer К., Das immunohisto!ogische Bi1d der ехре-
fimentellen Glomerulonephritis (Masugi-Nephritis) der Ratte, Med.
Bild, 13 (1970), 125 126.
222. Schurc}z W., Leski М., Hiпglais N.} Evolution о! recurrent 10bular g!ome-
ru!onephritis in а human kidney a!!otranspJant, Virchov,s Arch. АЫ. А
Path. Anat., 355 (1972), 64 84.
223. Seidler Е., Luпzeпauer К, Непи К, Modifikationcn bei der Herstel1ung
fluoreszenzmarkierter Antik6rper fiir die Immunhisto!ogie пасЬ der Metho-
dc von Go!dstein ct al., Dtsch. Ges.-wesen, 19 (1964), 2063 2067,
224. Seigler Н. F., Guппelis J. С., Robiпsoп R. R., Ward F. Е., Aтos D. В.,
Rowlaпds D. Т., Burkholder Р. М., Кleiп W. J., Stickel D. L., Renaf
transplantation between HL-A identica! donor-recipient pairs. ], CJin,
Invest.,51 (1972), 3200 3215.
225. Seппekaтp J., Вrиппе, О., Sfroe/1.тaпп J" Simultaner 1\ern- und Mito-
chondrien-Antik6rpernachweis in der Immunf!uoreszenz, Dtsch. med,
Wschr..98 (1973), 1233, 1224.
226. Sheffield J. В.} Eттelot Р., Studies оп plasma membranes. XVI. Tissue
specific antigens in the !iver cell surface, Ехр. Cell Res., 71 (1972). 97
105,
227. Шехон.uн. Б. В. 1\ вопросу об антиrенном составе амилоида, Арх. Пат..
1966. 28, 12, 4:З 51. .
412 Б. Эрнст, Д. ТеСАЩн.
228. Siпger S. J., Preparation of ап electron dense antibody conjugate, Natu-
re, 183 (1959), 1523 1524. . . . :.'.
229. Skvaril F., Fragпer J., The preparation of animal antiglobulii1s labeled
with fluorescein isothiocyanate (FIТC), J. Hyg. Epidemiol. Mic obio].
Immunol., 9 (1965), 5l5 523. .
230. Sorger К, Ноllе G., Sсhбпе D., Morphologische und immunologische As-
pekte bei Glomerulonephritis im I\indesalter. 2. Mitteilung, Zb.I. a1lg.
Path., 117 (1973), 73 84.
231. Stastпy Р., Bound immunoglobulin and complement in heart allografts
undergoing rejection, Transplantation, 10 (1970), 248 257. .
232. Sterпberger L, А., Electron microscopic immunocytochemistry: .а' reYie\v,
J. Histochem. Cytochem., 15 (1967), 139 159.
233. Stiehl Р., Grundlagen, Methodcn und Anwendungsm6g1ichkeiten der lт-
munhisiochcmie, 1. и. 2. Teil, Beilagen der Z. mC'd, Labortechnik, 13
(1972) und 14 (1972).
234. Storclr Н., Die 1mmunenzymtcchnik, ZSChl'. inn. Med., 27 (1972), 589
594.
235. Storch W., 1mmunfluoreszenzoptischer Nachweis thrombozytarer Anti-
k6rper, Zschr. inn. Med., 26 (1971), 609 612. .
236. Storch W., Petzold Н, Tauchпitz Ch., Wagпer М., Immunhistologische
Darstellung des Au(SH)-Апligспs in dCl' Lebcl', ..\cta histocI1em., 45
(1973), 167 170.
237. Striпga S. G., Biaпchi С., Ziпgale S. В., Nodu1ar vascu1itis: lmmuno
iluorescent study. 7S gamma globujjn and complement ( lc globulin) in
lesions of nodular vascu1itis, J. invest. Derm., 46 (1966), 1 5.
238. Striпga S. G., Casale А. М" Biaпchi О., Allergic vasculitis GOUgCl'Ot
Ruiter syndl"Ome, Immunofluorescent study, Arch. Derm" 95 (1967),
23 27.
239. Stroehmaпп 1., Rickeп D., Naubereit М" Bruchhauseп D., Zur Immun
pathogenese dcr Myasthenia gravis, Res. ехр. Mcd., 160 (1973), 181
195
240. Sullivaп А. L., Grimley Р, М., Metzg-er Н, E1ectl'on micl'oscopic locali-
zation of immunoglobulin Е оп the surface membranc of Iшmап baso-
phils, J. ехр. Med., 134 (1971), 1403 1416.
241. Suzuki J., Takalzachi М., Kamei Н., Yamamoto Т., 1l1iel'cellular distribu-
tion of immunoglobulin heavy and light chains within tiSSLIC cultured
cells of Ьитап 1ymphoid origin detected Ьу clcctron microscopy,). Im
типо1., 104 (1970), 907 917.
242. Swift Н. F., Willsoп А. Т., Laпcefield R. С., Typing group А of hemo-
Iytic streptococci Ьу М. precipitin rC'action capillary pipC'ttes, J, С'хр. MC'd.,
78 (1943), 127 133.
243, Swope А. Е., Kahп R. Н., Coпkliп J. L., А comparison of aIcian.L)lue
a1dehyde fuchsin and peroxidase labeled antibody staining tcchniques in
the [а! adenohypophysis. J. Histochem. Cytochem" 18 (1970), 450 454.
244. Tappeiпer G., Deпk Н., Eckerstorfer R., Holzпer J. H.,Verg1eicI1cnde
Untersuchungen uber Auftrcten und Lokalisation des саrсiпоеmЬrуопаlcп
Antigens (СЕА) und eines normalcn perchlorsaureextl'ahierbaren Dick
darmsch1eimhaut Antigens (NC) in Carcinomen und Polypen des Dick-
darms, Virchows Arch. АЫ. А Path. Anat., 360 (1973), 129 140.
245. Tessmaпп D., Gleisпer и., Erпst В., Schill Н., Histologische und immun-
histologische Untersuchungen uber den Einf111B von Cyclophosphamid
auf die Masugi Nephritis des Kaninchens, Dtscl1. Gcs. \\'esen, 27 (IQ72),
217 2Z2. ,
246. Thivolet J., Leuпg Tack J., Ра{{с J., Schmidt D.. Utilisation d'antil'Ol'ps
marques а Ia peroxydase pour la recherche et le diagnostic immllпоlо-
giques, La Presse Medicale, 79 (1971), '2542 2544.
48, И },f,\(У'Ю('l/СТПЛПi'lIЧ 41,3
247. Тlюепеs G. Н., Die Immunhisto!ogie dCl- Glomeru'ol1ephl'itis. MittleJ-
zwisсllеп Pathogenesc und Morpho!ogie, K!in, Wsc!lr., 51, (1973), 739
747.
248, Tllomsen О. F., DеmопstrаtiОI1 of iпsu'iп in ап is'et cell рапсн'а tic adeno-
та using ап immunofluorescent technique, Path, MikI'ObiO'. ScanrJ. Sect.
А, 80 (1972), 689 690.
249. Tllreatt J" Naпdy К, Fritz R., Brain-reactive antibodies in sel'um of old
mice demonstrated Ьу immunofluorescence, J. GeI'ont., 26 (1971), 316
323.
250. TllUmb N., Weidiпger Р., Grabпer G., ImmunfluOI'eszenzopiisc!l r Nach-
\veis antinuk'earer Fakioren bei der progredient-chronischen Polyarthri-
tis, Wien. k'in. Wschr., 84 (1972), 73 76. . .
251. Tourville D. R., Ogra 5. 5., Lippes J., Tomasi Т. В" ТЬе human fcma]e
reproductive tract: imml1nohisto!ogical lосэ!izаtiоп of gamma А, gam-
та G, gamma М secretory «piece» and lactoferrin, Amcr. .1. Obsteir. Gy-
пес., 108 (1970), 1102 II08.
252, Urso Р., Geпgoziaп N., Immunofluorescent detection of proIifcrating hu-
тап antibody-forming cells, Nаtше, 203 (1964), 1391 1392.
253. Wachsmuth E.-D., Lokalisation von Аmiпорерiidаsе iп GeweIJsschniitcl1
mit einer neuen Immuпоf'uоrеszепztесI1Пik, Hisiochemie, 14 (1968),
282 296.
254. Ward Н. А., Уатапа 5., PiIll Е., Nairп R. С., Ultrаstruсtша! !oca'ization
of anti!ymp!lOcyte gIobu!in оп viabIe 'ymphocytes Ьу immunoperoxidase
tracing, Immuno!ogy, 23 (1972), 61 68.
255. Warreп В., JOh11S0п А. G., Hoobler 5. W" CharacteI'ization о! ihe J'e-
nin-antirenin system, J. ехр. Med., 123 (1966), 1 109 1128.
256. Weller Т. н., Coons А. н., F'uOI'esceni antibody studies \VitJl agcnts о!
varicc!'a and herpes zoster propagated il1 \'iil'O, Proc. Soc. Ехр. Riol.
Med.,86 (1954), 789 794.
257. Wicker R., Comparison of immunofluoI'escent and immunoenzymatic
techniques applied to the study of vira! antigens, Апп. N, У. ..\cad, Sci..
177 (1971), 490 500.
258. Wolff К, 5chreiпer Е., Immunhistochemische Untersuchungen mitte!s
eines Enzym-Immung!obu'in-Konjugates, Arch. klin. ехр. Derm., 238
(1970), 381 389.
259, Wolff К, 5chrei11er Е., Ultrastructura! Jосэlizаtiоп of Pemphigus auio-
antibodies within the epidermis, N аtше, 229 (J 971), 59 61.
260, Yokota 5., Studies оп mouse !iver urate oxidase. 1. Immunoiluorescent
!ocalization of шаtе oxidase in mouse liver, Histochemie. 36 (1973),
2127.
261. Yoshizawa N., Treser G., 5egal [., Ту А., Ahmed и, Lange [,., Dcmol1-
stration of antigenic sites in g'оmеПJ!i of patiel1ts \\'ith acui(' роsistп р-
tococca! glomerulonephritis Ьу immunfluorescence and immtlnofcrritin
tecl1l1ics, Amer. J, Path" 70 (1972), 131 150.
262. Yasuda К, Cooпs А. Н., LocaIization Ьу immunofluoJ'C sccncc о! ату!а-
se. trypsinogen and chymotrypsinogcn iп tlle acinar ccJIs о! illС pig
pancreas., J. Histochem. Cytochem., 14 (1966). 303 3 1 3. ". .
263. Zucker-Fraпkliп D., Berпey 5t., E!ectron microscope stud" оС sшfас('
immunog!obulin-bearing Ьtlтап tonsi! cc'Is, J. схр, Med,,' 135 (! 972),
533 548,
264. Zucker-Fraпkliп D., Fraпklil1 Е. с., Ultrаstruсtша! and immtIl1oiluorcs-
сепсе studies of the cells associated \vith f.-I.-chain disease, BJood, 37
(J 971), 257 271,
265. Zvaifler 5., Martiпez М. М., Antinuc!ear factors апа cl11'onic ;HtictIlar
inflammation, Clin, ехр, Immunol., 8 (1971), 271 278.
49. Радиоактивное маркирование белков
X. A. ШУЛЬЦЕ
49.1. ПРИНЦИП
Белки, меченные радиоактивными изотопами, широко ис
пользуются, например, при изучении обмена веществ (метка
позволяет проследить судьбу данното белка) и для количест
венното определения белковых тормонов (см. 50.4). Меченые
антиrены, ПОulучившие внутреннюю метку в резу.'1ьтате вклю
чения 3Н, НС или З5S В процессе биосинтеза или маркирован
ные in vHro, реаrируют с антителами почти так же, как со-
ответствующие немеченые вещества. Внешнее маркирование,
в частности присоединение изотопов иода 1251 или 1311, позво-
,,'Iяет получить нужные во мноrих случаях белки с высокой
удельной радиоактивностью. Изотопу 1251 отдают предпочте-
ние перед 13Ч ввиду большоrо периода полураспада (60 дней
вместо 8) и большей приrодности для радиоавтоrрафических
исследований. 1251 дает у-излучение с энерrией порядка
35 кэВ.
Метка включается в результате реакции белка с иодом,
освобождающимся при окислении радиоактивноrо иодида.
Изотоп путем замещения присоединяется к ароматическому
кольцу тирозиновоrо остатка [1]. Из получивших признание
методов иодирования следует отметить методику Мак-Фар
лейна [2] с использованием хлористоrо иода в качестве
окислителя, затем применение хлорамина Т по Хантеру и
fринвуду [3] и электрохимическое иодирование по Роза
[ 4]. в самое последнее время IIОЛУЧИЛ распространение ме-
тод ферментативноrо иодирования [5, 6]. После включения
метки иодид, несвязавшийся иод и образующиеся иноrда выс-
шие окислы иода отделяют от белка при помощи rель-филь
трации, диализа, осаждения, ионноrо обмена или иным ме-
тодом. Полученный продукт контролируют в электрофорезе и
с помощью иммунолоrических методов. Чтобы иодированный
белок сохранил свойства исходноrо препарата, степень иоди-
рования не должна превышать единицу.
49.2. МЕТОДИКА МАРКИРОВАНИЯ
Ниже описано химическое маркирование бычьеrо сыворо-
точноrо альбумина с помощью хлорамина Т и электрохими
ческое маркирование ферритина. Мы применяем свободный
49. Радиоактивное .маркирование беЛКсl/:J 415
от восстанавливающих при.месей и не содержащий носителя
раствор 1251 (Zепtrа1iпstitut fi.ir Кеrпfоrsсhuпg, Дрезден,
[ДР).
49.2.1.
Мщншрование с помощью ХJюрамина Т
в водноЙ слабощелочноЙ среде от хлорамина Т отщеп-
.1яется хлорноватистая кислота, действующая как ОКИСJlII-
те.'!Ь. Реакция должна протекать при рН 7,5 8,0.
Состав реакционной смеси для маркирования:
10 Mr бычьеrо сывороточноrо альбумина (Serva, [ейдель-
берr, фрп
0,5 мл 0,5 М раствора КН 2 Р0 4
2,5 мл 0,5 М раствора N а 2 НРО/!
0,5 мл 0,0005 М раствора КI
1 мКи Na 125 1
0,8 мл хлорамина Т (1 мr!мл)
Реакционную смесь приrОТОВJIЯЮТ в колбе Эрлеюлейера
и перемешивают в течение 1 ч. Затем, добавив 0,1 М,l
Na2S205 (2 мr/мл), иодирование прекращают. ИнтенсивносТI>
метки зависит от количества окислителя; оптимальную KOH
центрацию ero обычно определяют эмпирически. Степень
иодирования устанавливают с помощью раствора KI.
49.2.2.
Электрохимическое маркирование
Белок реаrирует с атомарным иодом, которыЙ освобож-
дается в результате электрохимическоrо окисления на аноде.
НеобходимыЙ потенциал осаждения равен примерно 388 мВ.
Электрическая схема прибора для иодирования представле
На На рис. 97.
Анодом слу.жит платиновыЙ тиrсль, в который помещают
реакционную смесь. Перед ОПЫТО:\1 ero соответствующим об-
разом прокаливают, чтобы предотвратить поляризацию. В ка-
честве катода используют платиновый цилиндр, поместив ero
внутрь диализноrо мешочка или покрыв пленкой коллодия.
Электролитом служит 0,1 М раствор N аС1. В потенциомет-
рическоЙ схеме устанавливают необходимое напряжение.
Фактическое напряжение в цепи измеряют компенсационным
методом с помощью насыщенноrо каломельноrо электрода
при сравнении с нормальным элементом. Реакционную смесь
перемешивают на маrнитной меша.1ке. Если маркируемое ве-
щество термолабильно, применяют охлаждение.
416 Х.-А. Шульце
Реакционная смесь Д.'1я маркирования:
5 Mr .'IошаiдИНorо ферритина (Fоrsсhuпgsiпstitut fiir
Impfstoffe, Дессау, r ДР)
1,5 мл 0,1 М раствора NaCl
0,1 мл 0,0005 М раствора Кl
1,0 мл дистиллированной воды
1 мК:и Na 12 5J.
[2
Е3
/(
Е1
+
Рис, 97. Схема при бора для электрохимической марКИрОВКИ белков. Р
платиновый тиrель; М платиновый катод; R сопротивление; К ком-
пенсатор; Н ка,lО:vrельныЙ электрод; Еl источник тока; Е2 нормаль
ныЙ элемент; Е3 вспомоrательныи источник тока; а[ микроамперметр;
а 2 ВОЛЬТ\lетр; G з rальваllометр.
Степень иодирования зависит от продолжительности элек
тролиза и силы тока. При напряжении на аноде 700 мВ и
силе тока 100 мкА последняя спустя примерно 100 мин па
дает на 1 О икА (в зависимости от эффективной поверхности
электродов). Более высокое напряжение на аноде и более
продолжительное иодирование приводят к появлению в peaK
ционной С '.1еси продуктов с более высокой степенью окис
ления.
Выделение меченоrо белка
из реакционной смеси
Меченый белок отделяют от электролита и несвязавшейся
метки на мелкозернистом сефадексе G-25 или G-50. Реакци-
онную смесь наносят на колонку 24 Х 2,5 см и элюируют
0,005 М трис-НСI-буфером с рН 8. Проводят непрерывную
реrистрацию радиоактивности и содержания. белка в элюате
с помощью проточных сцинтилляционной И УФ-абсорбцион
ной кювет. Чистоту разделения определяют путем анализа
49.2.3.
49. Радиоа"тивное .маркирование бел"ов 417
xpoMaTorpaMM на бумаrе (СМ. 49.2.4.1). [ель-фильтрация поз
воляет практически полностыо отделить меченый белок от
выходящих за ним из колонки иодида и свободноrо иода.
49.2.4.
Анализ меченоrо белка
Определяют удельную радиоактивность, степень иодиро-
вания, электрофоретические и иммунолоrические свойства
полученных препаратов 125I-белка.
49.2.4.1. Определение доли .связавmеЙСJl метки
Чтобы определить, какая доля внесенной в реакционную
смесь метки связал ась с белком, ПрОБОДЯТ осаждение три-
хлор уксусной кислотой И восходящую хроматоrрафию на
бумаrе.
Осаждение трихлоруксусной кислотой (ТХУ). Берут опре
деленный объем раствора иодированноrо белка и, определив
радиоактивность, смешивают с 1 % -ным раствором немечено-
ro бычьеrо сывороточноrо альбумина; затем оса:ждают бел-
ки 10% ной ТХУ и промывают осадок на микропористом
мембранном фильтре (0,45 мкм, ChemapoI, Праrа), удаляя
фильтрат с помощью насоса. После этоrо определяют радио-
активность осадка СЦинтилляционным счетчиком.
Хроматоzрафия На бумаzе. Определенный объем реакцион-
ной смеси наносят на полоску (25 Х 4 СМ) хроматоrрафиче
ской бумаrи FN 14. Подвижной фазой служит 70%-ный рас-
твор метанола в воде. Распределение метки на xpoMaTorpaM
ме реrистрируют сцинтилляционным счетчиком с самопис
цем. Пики радиоактивности на rрафике анализируют с по-
мощью планиметров или путем взвешивания вырезанных уча
стков.
С бычьим сывороточным альбумином при химическом мар-
кировании связывается 60 80%, а с ферритином при элек
трохимическом маркировании 30 50% внесенной метки. Хи-
мическое и электрохимическое связывание иноrда дает раз-
ные результаты в основном из за Toro, что С увеличением
концентрации восстанавливающих веществ возрастает доля
метки, попадающей в ТХУ-растворимую фракцию реакцион
ной смеси. Удельная радиоактивность меченых белков обыч-
но лежит в пределах от 20 до 60 мкКиjмr.
49.2.4.2. Определение степени иодирования
Ст.епень иодирования (СИ) выражается числом [рамм-
атомов иода, присоединенных к 1 молю белка. Чтобы ее-
определить, в известном объеме исследуемоrо раствора опре-
27 840
418 Х.-А. Шульце
деля ют концентрацию белка по Лоури и измеряют радиоа
тивность сцинтилляционным счетчиком. СИ вычисляют по
формуле:
А 1 М
СИ КБ 127'
rде А радиоактивность белка (имп/мин), А' радиоактив-
ность реакционной смеси (имп/мин), 1 количество иода,
BHeceHHoro в реакционную смесь (MKr), Б количество бел
Ка в реакционной смеси (MKr), М молекулярный вес бел-
ка. При определении СИ не учитывается количество метки,
попавшее в ТХУ растворимую фракцию реакционной смеси.
СИ бычьеrо сывроточноrоo альбумина близка к 1, а мече-
Horo ферритина значительно меньше.
49.2.4.3. Э:IектрофореТllчеСКllе свойства
По электрофоретическим свойствам меченый белок срав-
нивают с исходным. Э.'Iектрофорсrраммы радиоавтоrрафиру-
ют, а затем окрашивают их амидо-черным. Для радиоавто
. ..
Рис. 98. Электрофореrрамма частично денатурированноrо бычьеrо сыворо-
точноrо альбумина. Продолжительность электрофореза 2,5 ч, прибор
EL KF66. вероналовый буфер с рН 8,6; окрашено амидо-черным.
rрафии в данном случае подходит пленка ORWO AF4, кото-
рую вырезают по размеру препарата и накладывают на пла
стинку arapoBoro rеля. Мяrкое у-излучение 1251 дает хорошее
изображение меченых фракций. Через 3 5 суток экспозиции
пленку проявляют в peHTreHoBcKoM проявителе А-30 ипи
МН-28. После этоrо электрофореrраммы окрашивают, чтобы
49. Радиоактивное .маркирование белков 419
сравнить меченый и немеченыЙ белки. Сопоставляя расстоя-
ние, пройденное белками в rеле, и локализацию почернений
над канавкой, можно судить о качестве меченоrо белка. При
электрофорезе частично денатурированных белков некоторая
часть метки остается в месте нанесения. Оценку электрофо
perpaMM (пластинок rеля и пленок) проводят с помощью He
прерывноЙ денситометрии и радиометрии. На рис. 98 пред
ставлена окрашенная амидо черныi\'l электрофореrрамма ча
стично денатурированноrо бычьеrо сывороточноrо альбумина.
49.2.4.4.
Иl.\ОIУНО.:IОI'llческие свойства
Иммунолоrические свойства меченоrо белка в сравнении
с исходным исследуют методом иммуноэлектрофореза. В лун
ки вносят сравюшаемые белки, проводят электрофорез и за
о
..........
Рис. 99. Иммуноэлектрофорез нативноrо ферритина лошади. Продолжитель-
ность электрофореза 3,5 ч, прибор EL KF66, вероналовый буфер с рН 8,6,
продолжительность иммунодифФузии 24 ч; окрашено амидо черным.
полня ют канавку антисывороткоЙ. После фиксации и высу-
шивания электрофореrраммы окрашивают амидо черным и
снимают с них радиоавтоrрафы. РаСПО.ilожение преципита-
ЦИОнных дуr, шлейфов или почернениЙ вблизи лунок указы-
вает на возможную денатурацию меченоrо белка. На рис. 99
представлена иммуноэлектрофореrрамма ферритина, мечен-
Horo 1251.
49.2.4.5. Стабильность метки
При длительном хранении меченых белков часто наблю-
дается потеря метки. Деиодирование происходит под влия
нием собственноrо излучения 1251 и как результат взаимодей-
27*
420 Х.-А. Шульце
ствия С продуктами радиолиза воды. Кроме Toro, возможно
ферментативное расщепление меченоrо белка. Препарат
бычьеrо сывороточноrо альбумина, меченноrо 1251, после
30 дней хранения при 4 ос содержит лишь ничтожную при-
месь свободной метки, но при 37 ос уже через 8 дней осво-
бождается до 15% радиоактивности. 1251 овальбумин денату-
рируется еще быстрее, тоrда как ферритин прочно удержи-
вает метку. Имеются данные о влиянии света и друrих фи-
зических и химических факторов [7, 8]. Во время хромато-
rрафирования на бумаrе часто наблюдается спонтанная утра-
та метки, которую можно объяснить изменением рН и раз-
бавлением [9]; потерю метки можно уменьшить, добавив к
меченому препарату белок-носитель.
49.3. ОЦЕНRЛ МЕТОДА И ErO МОДИФИКАЦИИ
49.3.1. Общая оцеНка
Электрохимическое маркирование в меньшей степени по-
вреждает белки, чем химическое. Окислитель, добавленный
в избытке при химическом маркировании, может, естествен-
но, вызвать окислительное разрушение белка. В этом отно-
шении электрохимический процесс является более щадящим .
Ero преимущество состоит также в хорошей воспроизводи-
мости степени иодирования. Однако по доле связываемой
метки он уступает химическому маркированию. Если нужно
добиться высокой удельной активности меченоrо белка, луч-
ше применить химическое присоединение метки, при котором
можно использовать свободный от носителя Na 12 5J. Выбор
Toro или иноrо метода в конечном счете зависит от цели
последующеrо применения меченоrо белка.
49.2.4.2.
Варианты
Процесс иодирования должен быть по возможности ща-
дящим и в то же время обеспечивать присоединение значи-
тельной доли метки. Чтобы решить обе задачи, были преk
ложены различные модификации и варианты стандартноrо
метода. Они различаются не только по объектам маркиро-
вания, но и по используемым окислителям и способам фрак-
ционирования. С помощью описанных выше методов в под-
ходящем буфере можно пометить практически любой белок
или ropMoH, обладающий реакционноспособными остатками
тирозина. Если же таких rрупп нет, маркирование in vitro
или in vivo осуществляют с помощью ЗН, 14С, З5S или заме-
щающих rрупп, меченных 1251 [10 16]. Кроме хлорамина Т
49. Радиоактивное маркирование белков 421
и хлорпстоrо иода, в качестве окислителей применяют ИодаТ,
rипохлорпт, перекись водорода и друrие вещества. В списке
литературы читатель найдет ссылки на ряд работ, излаrаю-
щих основы и проблемы как химическоrо [17 28T, так
электрохимическоrо [29 33] иодирования.
49.4.
ЛИТЕРАТУРА
1. Hladik О., Untersuchungen der Reaktionsbedingungen der Markierung
von Human-Serum-Albumin mit 131J durch e!ektrochemische Oxidation des
Jodids zum Jod. Diplomarbeit, Inst. f. E!ektrochemie und Physikal. СЬе-
mie, TU Dresden, 1965.
2. McFarlaпe А. 5., Efficient trace lаЬеШпg of proteins with iodine, Nature,
182 (1958),53.
З. Huпter W. М., Greenwood F. С., Preparation of iodine 131 labelled growth
hormone of high specific activity, Nature, 194 (196'2),495.
4. Rosa и., 5cassellati G. А., Peпnsis F., Riccioпi, Giagпoпi Р., Giordaпi R.,
LаЬеШпg of human fibrinogen with 131J Ьу e!ectrolytic iodination, Bio-
сЫm. Biophys. Acta, 86 (1964),519.
5. Thorell J. /., Johaпssoп В. G., Enzymatic iodination of po!ypeptides with
125J to high specific activity, Biochim. Biophys. Acta, 251 (1971), 363.
6. Fraпtz W. L., Turkingtoп R. W., Formation of biologically active 125J-Pro-
lactin Ьу enzymatic radioiodination, Endocrinology, 91 (1972), 1545.
7. Kobayashi 1., Yaтada Т., 5hichigo к., Nonenzymatic deiodination of
thiroxine in vitro, Metabolism, 15 (1966), 1140.
8. Reiпweiп D., Rall J. Е., Nonenzymatic deiodination of thyroid hormones
Ьу flavin mononucleotide and light, J. BioI. СЬеm" 241 (1966), 1636.
9. Reviczky А. L., 5zaпto L., Gryпaeus Т., Magoпy /,' 1. Deiodination of
the 131J labelled substances of blood serum. П. Deiodination of the endo-
genously 131J labelled substances in blood serum, Acta Physiol. Acad. Sci.
Hung.,29 (1966), 107.
10. Williaтs С. А., Chase М. W., Methods in Immunology and Immunochemi
stry, Academic Press, New York/London, 1967, S. 387: Labeling of anti-
gens and antibodies.
11. Zaitliп М., ТЬе preparation of tritium-labelled Fab antibody fragments,
Immunochemistry, 8 (1971), 569.
12. Oliphaпt G., Brackett В. G., Preparation of С14 labelled antibodies, Im-
munochemistry, 9 (1972), 1259.
13. Rice R. Н., Meaпs G. Е., Radioactive lаЬеШпg of proteins in vitro, J.
Biol. СЬеm., 246 (1971),831.
14. Coттerford 5. L., Iodination of nuc!eic acids in vitro, Biochemistry, 10
(1971), 1993.
15. Miles L. Е. М., Hales С. N., The preparation and properties of purified
125I-]abelled antibodies to insulin, Biochem. J., 108 (1968), 611.
16. Aпdersoп Н. R., Dresser D. W., The preparation and еПiсасу of purified
antilymphocyte antibody and the effect of lаЬеШпg this materia! with
1251. Eur. J, Immuno!ogy, 1 (1971),31.
17. Weir D. М., Handbook of experimental Immunology, Blackwell Scientific
Publications, Oxford/Edinburgh, 1967, S. 597: Trace lаЬеШпg with ratio-
iodine.
18. Herzтaпп Н., Кlecker J., Markierung von Human-Serum-Albumin mit
131J, Isotopentechnik, 2 (1962), 157.
19. Bocci V., Efficient labe11ing of serum proteins with 1311 using Ch10ramin
Т, Int. J. Аррl. Rad. Isot., 15 (1964),449.
20. Yalow R. 5., LаЬеШпg of proteins problems and practices, Trans.
N. У., Acad. Sci., Ser., 2, 28 (1966), 1033.
4 x. A. Шульце
\".
21. McCoпahey Р. J., Dixon Р. J., А method of trace iodination of proteins
for immunologic studies, Int. Arch. AIlergy, 29 (1966), 185.
22. Eпtzian W., Dohr Н., Ober die Jod-131-Markierung von Albumin durch
Chloramin Т mit hoher Ausbeute, Atompraxis, 12 (1966),516.
23. воиоn А. Е., Huпter W. М., А new method for labelIing protein hormo-
nes with radioiodine for use in the radioimmunoassay, J. Endocrin., 55
(1972), 30.
24. Helmkamp R. W., Goodlaпd R. L., Bale W. F., 5par 1. L., Mutschler L. Е.,
Нigh specific activity iodination of y gIobulin with iоdiпе 1З1 monoch!oride,
Cancer Res., 20 (1960), 1495.
25. Glover J. 5., Salter D. N., 5hepherd В. Р., А study of some factors that
infIuence the iodination of ох insuIin, Biochem. J., 103 (1967), 120.
26. Helmkamp R. W., Coпtreras М. А., Bale W. Р., Jl3l labeIling of proteins
Ьу the iodine monochloride method, Int. J. Арр!. Rad. Isot., 18 (1967),
737.
27. Helmkamp R. W., Coпtreras М. А., lzzo М. J., I'31-!abelling of proteins
. at high activity !eve! \vith р31 Сl produccd Ьу oxidation of total iodine in
NaI'31 preparations, Int. J. Аррl. Rad. Isot., 18 (1967),747.
28. Ceska М., 5iodiп А. V., Grossmuller Р., Some quапШаtivе aspects of the
!abelling of proteins with 1251 Ьу the iodine monochloride method, Вiochem.
J., 121 (1971), 139.
29. Rosa u., Biaпchi R., Federighi С., Scassellati G. А., Doпato L., Marquage
de proteines а l'aide de l'iode radioactif par ипе methode eIectrochimique,
Bull. Schweiz. Acad. Med. Wiss., 21 (1965), 185.
30. Rosa и., Peппisi Р., ВiaпcЫ R., Federighi G., Doпato L., Chemical and
bio!ogical effects of iodination оп Ьиmап a!bumin, ВiocЫm. Biophys. Ас-
ta, 133 (1967), 486.
31. Hladik О., Markierung von Humanseruma!bumin mit 1З1J durch elektro-
chemische Oxydation von Jodid zum Jod, Isotopenpraxis, 2 (1966), 296.
32. Fittkau 5., Michael R., Reiber G., Elektrochemische Radiojodmarkierung
von Proteinen, Wiss. Z. Karl-Marx-Univ., Leipzig, Math.-Naturwiss. R.,
18 (1969),551.
33. Doпabedian R. К., Leиiпe R. А., Seligson D., Micro-electrolytic iodination
of polypeptide hormones for radio-immunoassay, СНп. СЫm. Acta, 36
(1972),517.
50. Радиоиммунолоrический анализ
П.ФАЛЬК
Статья Ялоу и Берсона «Иммунолоrическое определение
эндоrенноrо инсулина в плазме человека» [29], опубликован
ная в 1960 r., положила начало развитию радиоиммунолоrи-
ческих методов, которые в настоящее время особенно важ-
ны для количественноrо определения самых различных бел-
ковых и стероидных ropMoHoB. Эти методы ;;,озволяют отно-
сительно просто устанавливать связь различных патолоrиче-
ских процессов и клинических синдромов с изменениями кон-
центрации ropMoHoB в жидкостях орrанизма (в сыворотке,
моче и т. п.). В частности, оказалось возможным оценивать
in vitro функцию щитовидной железы, поджелудочной желе-
зы и надпочечников. Особое достоинство радиоиммунолоrи-
ческоrо анализа ero высокая чувствительность. С ero по-
мощью удается определять HaHorpaMMoBbIe, а иноrда и пико
rpaMMoBbIe количества ряда ropMoHoB, и при этом можно oQ
ходиться без процедуры концентрирования, часто очень TPy
доемкой. Большинство ropMoHoB этих эндоrенных химичс-
ских реrуляторов орrанизма содержится в сыворотке имен-
но в тех концентрациях, которые лежат в пределах чувстви-
тельности радиоиммунолоrическоrо анализа. Кроме ropMoHoB,
строение которых известно, он позволяет количественно
определять и более сложные структуры, например рибосомы
или австралийский антиrен [3, 26, 27]. Имеются мноrообраз-
ные возможности применения ero при решении различных
иммунолоrических и микробиолоrических проблем. Подроб
ные сведения о радиоиммунолоrическом анализе читатель
найдет в отличных обзорах Хантера [19];, Оберта [2], Скел
ли и сотр. [25].
50.1. ПРИНЦИП
В радиоиммунолоrическом анализе сочетается специфич-
ность, свойственная реакциям антиrен антитело, с чувст
вительностью и простотой, которые дает применение радио
активной метки. Для проведения анализа необходимо иметь
сооответствующие антисыворотки и меченые антиrены. Чув-
ствительность метода и достоверность результатов в значи-
тельной мере возрастают при использовании антител высо-
424 П. Фальк
кой аффинности и низкой перекрестной реактивности, а так-
же антиrенов с высокой удельной радиоактивностью.
eTOД основан на конкуренции определяемоrо немеченоrо
антиrена с известным количеством меченоrо антиrена за
оrраниченное количество добавленных в систему специфи
ческих антител. При этом в определенном диапазоне концент-
раций количество меченоrо антиrена, который связывается в
иммунных комплексах, обратно пропорционально количеству
немеченоrо антиrена, содержащеrося в исследуемом материа-
ле. Оба конкурирующих взаимодействия представлены на
следующей схеме:
Ar Лr Ат+Ат
11 IV V
Ат+
1
Ar Лr Ат + Ar
III VI VII
I специфическое антитело;
11 меченый антиrен;
IB немеченый антиrен (стандартный или исследуемый);
IY иммунный комплекс антитела с меченым антиrеном;
у свободный меченый антиrен;
УI иммунный комплекс антитела снемеченым антиrеном;
УII свободный немеченый антиrен.
Чтобы происходило конкурентное взаимодействие, иссле-
дуемый «нативный» антиrен должен быть по специфичности
идентичен меченому. Теоретически радиоиммунолоrический
анализ можно рассматривать как вариант количественноro
анализа, напоминающий алкали и ацидометрическое титро-
вание. В данном случае роль партнера по связыванию (Q)
иrрает специфическое антитело, а роль метки меченый ан-
тиrен. Дальнейшие подробности теории читатель найдет в
работах Экинса [9] и Фельдмана и сотр. [11].
Конкуренцию между меченым и исследуемым антиrеном
можно количественно оценить с помощью радиометрии. Для
этоrо прежде Bcero необходимо отделить образовавшиеся им-
мунные комплексы от несвязанноrо меченоrо антиrена. При
выборе подходящеrо метода разделения обычно исходят из
Toro, что эти два компонента реакционной смеси различаются
по растворимости и седиментационным свойствам, а также
по заряду и величине молекул. В отдельных случаях исполь-
зуют присущие определяемому антиrену и ero комплексаМ
специфические свойства. Вообще применяемые методы весь-
ма разнообразны. В частности, отличие иммунных комплек-
50. Радuoим.м..чн,олоеuчес"uй ан,ализ 425
сов от свободноrо меченоrо антиrена по молекулярному весу
создает возможность фазовоrо разделения с помощью элект
рофореза или вытеснительной хроматоrрафии [15, 1ВТ. ВО
мноrих случаях можно избирательно адсорбировать свобод-
ный меченый антиrен, внеся в прореаrировавшую смесь мел-
козернистый тальк, кварц, целлюлозу или частички активи-
pOBaHHoro yr ля, покрытые декстраном [17, 23, 30]. В то же
время удобно удалять связанную метку, применяя иммоби-
лизованные или полимеризованные антитела или аrреrируя
первичные иммунные комплексы преципитирующей антиrло-
булиновой сывороткой [6, 16]. Естественно, что разные ме-
тоды весьма различаются по трудоемкости и воспроизводи
мости. Возможность автоматизации отдельных этапов у них
также различна.
В настоящее время популярны методы двойной системы
антител и иммобилизованных антител. Антиrлобулиновая сы-
воротка (вторая система антител) аrреrирует растворимые
иммунные комплексы, так как связанные с антиrеном анти-
тела первой системы еще сохраняют способность выступать
в качестве антиrена. Аrреrация иммунных комплексов облеr-
чает их отделение при центрифуrировании или фильтрации.
В принципе такой подход универсален, но требует мноrочис-
ленных предварительных экспериментов для определения оп-
тимальных условий. В настОЯЩее время все шире использу-
ются антитела, адсорбированные на пластике или химически
привязанные к полимеру. В отличие от реакции антиrен
антитело, протекающей в системе с растворимыми компонен-
тами, применение нерастворимых антител дает более ста-
бильное связывание антиrена [24].
Приrодность данной антисыворотки определяют по [ра-
фику зависимости доли связанной метки от разведения (стан-
дартная кривая). Оптимальным разведением сыворотки счи-
тается то, при котором антитела связывают 50 % внесенной
в систему метки. Антисыворотку в этом оптимальном разве-
дении инкубируют в присутствии меченоrо антиrена с воз-
растающими количествами немеченоrо антиrена. Зависимость
связывания метки от концентрации стандартноrо антиrена
можно представить rрафически. Часто пользуются rрафи-
ком зависимости процента связанной метки от концентрации
немеченоrо антиrена. Берсон и Ялоу пользовались отношени-
ем активности связанной метки к активности свободной мет-
ки (коэффициент B/F), чтобы выразить связывание меченоrо
аНтиrена как функцию концентрации исследуемоrо антиrена
(см. также [2]\).
При проведении анализа нельзя не учитывать интерферен-
цию различных посторонних примесей, например лекарствен-
426 П. Фальк
ных препаратов. Далее, специфичность метода может быть
снижена Из-за перекрестной реактивности антисывороток и
rетероrенности антител. Решающее значение при этом име.
ет способ получения антисывороток для радиоимМунолоrиче-
cKoro анализа. Идеальными были бы истинно моноспецифи.
ческие антитела, но их трудно выделять, и это препятствует
их широкому применению. Принцип конкуренции за меченый
белок может быть использован при анализе неиммунолоrиче
cKoro связывания. В этом случае вместо антител в систему
вводят друrие плазменные белки, транспортную или рецеп-
торную функцию которых требуется изучить [22]; однако
специфичность связывания, аффинитет и стабильность этих
белков не всеrда удовлетворительны.
50.2. Р АдиоиммунолоrИЧЕС:КИй АНАЛИЗ
с ПРИМЕНЕНИЕМ
ИММОБИЛИЗОВАННЫХ АНТИТЕЛ
Кэмпбелл и сотр. [4] в 1951 r. показали, что диазотиро
ванная п-аминобензилцеллюлоза может служить BOДOHepac
творимым носителем для белковых антиrенов. В дальнейшем
были найдены друrие полимеры, способные более успешно
выполнять роль носителей в химии белков, например при их
последовательном синтезе или расщеплении, а также в им-
мунолоrии для связывания антиrенов и антител с coxpaH
нием их функциональной активности. Кэтт и сотр. [5] одно-
временно с Уайдом и Поратом [28]! в 1966 r. применили им-
мобилизованные на полимере антитела для радиоиммуноло.
rических исследований. Такие полимеры, как сефадекс и цел-
люлоза, приобретают способность к связыванию белков по-
сле обработки бромцианом. Возможности использования раз-
личных орrанических макромолекул (например, полиэтиле-
На, полипропилена, полистирола) без предварительной ак.
тивации в качестве носителей для антител были изучены в
1967 r. rруппой австралийских исследователей под руковод-
ством Кэтта [6, 7, 14]. Им удалось показать, что мноrие ор-
rанические полимеры связывают антитела в количестве, до-
статочном для определения различных ropMoHoB (например,
соматотропноrо, тиреотропноrо и лютеинизирующеrо ropMo-
нов человека).
Комплексы антиrена с иммобилизованными антителами
не только леrко выделяются из реакционной смеси, но и об-
ладают повышенной стабильностью. Эта стабильность (отно-
сительная необратимость) связывания позволяет сначала уда-
лить несвязавшиеся молекулы исследуемоrо антиrена и толь-
50. Радrюuммун.олоеический анализ 427
ко потом.добавить меченый антиrен. ля адсорбции антител
на неактивированном полимере надо просто заполнить пласт-
массовые пробирки подходящим разведением антисыворотки
и некоторое время инкубировать их. Носителем для антител
становится внутренняя поверхность пробирки. При этой ме-
тодике каждая пробирка обрабатывается индивидуаJIЬНО.
руrая методика, при которой антитела фиксируют на хими-
чески активированных полимерах, может. обеспечить б6ль
тую емкость связывания. Правда, в этом случае весьма
проблематична воспроизводимость дозы иммобилизованных
антител от пробы к пробе.
50.2.1.
Методика
Ниже описан один из вариантов раДИОИММУНОJ10rическоrо
анализа с применением иммобилизованных антител, разра
ботанный Кэттом и сотр. [7]. Нестандартность антисыворо-
ток и различия адсорбционных свойств пластмасс приводят
к тому, что оптимальные условия у разных исследователей
варьируют. Поэтому мы иллюстрируем методику на примере
определения бактериофаrов ТЗ и Т4, ВЗЯТО:\1 из собственных
материалов [10].
50.2.1.1.
Иммобилизация антител
елают ряд разведений цельной кроличьей антисыворотки
к бактериофаrа 1 с известным титром нейтрализации в 0,1 М
NаНСОз-Nа2СОз буфере с рН 9,6. По 0,5 мл каждоrо раз-
ведения сыворотки помещают в отдельную пластмассовую
пробирку. fерметизированные пробирки оставляют на 2 ч
при комнатной температуре, затем содержимое их отсасыва-
ют. Чтобы удалить леrко десорбирующи ся антитела, внут-
реннюю поверхность пробирок дважды ополаскивают 1 мл
ледяноrо 0,14 М раствора NaCl. После эт()rо для полноrо на-
сыщения адсорбционной способности пластмассы в пробирки
вносят по 1 мл разбавляющей среды (которая состоит из
0,01 М калий-фосфатноrо буфера с рН 7,4, 0,14 М NaCl и
0,5 % Horo раствора сывороточноrо ?льбумина человека) и
инкубируют. Наrруженные антителами проб ирки можно ис-
пользовать тотчас же или, закупорив, хранить холодильни-
Ке. аже после 4 недельноrо хранения они не изменяют CBO
ей способности связывать бактериофаrи.
50.2.1.2.. . Маркирование ',антиrена
По.сле' иЬдирования 1311 или 1251 с применением хлорами-
на т по [ринвуду И сотр. [13] бактериофаrи Т3 и Т4 riОЛНО:
стью сохраняют свои антиrенные свойства. Удельная радио
428 П. Фаль"
активность варьирует в пределах от 0,3 до 7,2 мкКи/мкr.
Вообще же для повышения чувствительности системы луч
ше иметь фаrи с более высокой удельной активностью. По
сле удаления несвязавшейся метки с помощью диализа и
rель фильтрации на сефадексе меченый бактериофаr разбав
ляют упомянутой выше средой (50.2.1.1) для уменьшения
радиолиза. В предварительных опытах находят оптимальное
1,0
0,8
0,8
0,4
'-.J
..... )(и
..........
............. ....... ..ш
.........-..........
)(.....-::.. л
.......""'.........
......./,.,.,,,.,... 1
....................,...., x
х...................
K/"
..-:
2 8 В 12
48
24
Вf1ем.я, ч
Рис. 100. Связывание бактериофаrа ТЗ антителами, адсорбированными на
пластмассе, в зависимости от времени, активности антисыворотки и ее раз
ведения, а также от концентрации метки. Две сыворотки анти ТЗ разноrо
титра помеrцали в пластмассовые стакаичики, на внутренней поверхности
которых происходила адсорбция антифаrовых антител. / антисыворотка
8, разведение 1 : 100, количество внесенноЙ метки 0,05 мкКи; II антисы-
воротка 8, разведение 1: 1000, количество внесенной метки 0,05 мкКи;
Il/ антисыворотка 7, разведение 1: 1000, количество внесенной метки
0,025 мкКи; /V антисыворотка 8, разведение 1 : 1000, количество внесен-
ноЙ метки 0,025 мкКи.
разведение антисыворотки и количество вносимоrо в пробир-
ку меченоrо фаrа. На рис. 100 представлены данные таких
опытов по связыванию бактериофаrа ТЗ, меченноrо 1251. От-
ношение активности связанной метки к активности свободной
метки (степень связывания) дается как функция разных пе-
ременных. Самая высокая степень связывания наблюдается
в интервале разведений антисыворотки от 1 :500 до 1: 1000
и при внесении в пробирку 0,0125 мкКи (около
16000 имп/мин) меченоrо бактериофаrа. Зависимость связы-
вания от времени прослежена в течение 48 ч; за первона-
чальным быстрым подъемом после 12 ч инкубации наблю
дается переход в плато.
При проведении OCHoBHoro опыта в пробирки, наrруженные
антителами (разведение антисыворотки 1: 1000), сначала
помещают 0,5 мл исследуемой суспензии бактериофаrа в раз-
бавляющей среде и инкубируют 18 ч при 37 ОС. Затем не-
60
50
"о
30
"i)
\>
20
0&
(о
О
1,8 1,8-10 (,8-102 1,8-10.1 1,8-104
/(o.пuqecтDo 'Раео6, не (.роеаршрм)
Рис. 101. Стандартные кривые связывания бактериофаrа Т3. ДЛЯ адсорб-
ции антител на внутренней поверхности пластмассовые пробирки заполня-
ли антисывороткой, разбавленной 1 : 1000. Стандартное количество мечено-
ro фаrа 0,025 мкКи на пробирку, удельная активность 2,30 мкКи/мкr.
1 меченый фаr вносили в пробирки после удаления немеченоrо исследуе-
Moro антиrена; II меченый фаr вносили одновременно с антиrеном.
30
"I::.
20
:t
(о
о
4,6 4,8' fO *,8-102 ",0' 10.1 4,В- 104
KlJ.IIuqecт60 'Раео6, ш (.доеаршрм)
Рис. 102. Стандартные кривые связывания бактериофаrа Т4. ДЛЯ адсорб-
ции антител на внутренней поверхности пластмассовые пробирки заполня-
ли ансисывороткой, разбавленной 1: 1000. Стандартное количество мече-
Horo фаrа 0,025 мкКи иа пробирку, удельная активиость 7,20 мкКи/мкr.
1 меченый фаr вносили в пробирки после удаления немеченоrо исследуе-
Moro антиrена; II меченый фаr вносили одновременно с антиrеном.
430 П. Фальк
связавшийся бактериофаr отсасывают, пробирки Дважды про
мывают ледяным 0,14 М раствором NaCl и вносят в каждую
по 0,0125 мкКи меченоrо бактериофаrа в 0,5 мл разбавляю
щей среды. Последующая инкубация продолжается 24 ч.
ЕС.1II инкубацию исследуемой и меченой суспензии фаrа про-
водить не последовательно, а совместно в течение 22 ч, то
чувствительность метода несколько снижается (рис. 101).
После инкубации вновь отмывают раствором NaCl несвязав-
шийся бактериофаr и определяют долю связанной метки. Все
измерения радиоактивности производятся в сцинтилляцион-
ном счетчике колодезноrо тиПа.
На рис. 101 и 102 представлены стандартные кривые. По
оси ординат ОТ.lожена д@ля иммунолоrически связанной мет-
ки, по оси абсцисс лоrарифм количества немеченоrо фаrа.
Как видно, линейная зависимость наблюдается только в ин
терва.1е доз от 18 до 18.102 Hr для бактериофаrа ТЗ и от 46
до 46.102 Hr для бактериофаrа Т4.
50.3. МЕТОД ДВОйНОй СИСТЕМЫ АНТИТЕЛ
[лейх и сотр. [12] при определении IgE у аллерrиков и
здоровых доноров использовали второй преципитирующий
антиr.lОбулиновый peareHT. В первой систеМе в конкурент-
ном связывании участвовала кроличья моноспецифическая
антисыворотка к Fс фраrментам IgE. Очищенный IgE был
выделен из плазмы больноrо IgE-миеломой и имел удель
ную активность 150 250 мкКиjмкr. Все разведения делали
в 0,01 М фосфатном буфере с рН 7,5, содержавшем 0,14 М
NaCl и 1 % бычьеrо сывороточноrо альбумина.
Определение концентрации IgE
в сыворотке человека
Стандарт IgE или исследуемые сыворотки разбавляют
фосфатным буфером с бычьим сывороточным альбумином и
исследуют в объеме 0,5 мл. К каждому исследуемому образ-
цу прибавляют по 0,1 мл специфической кроличьей сыворотки
анти-IgЕ в разведении 1 : 50 000 и по 0,1 мл раствора, содер-
жащеrо при:vrерно 0,1 Hr меченоrо IgE. Первая инкубация
продолжается 24 96 ч при 4 ОС. Затем в каждую пробу вно-
сят по 0,15 мл козьей антисыворотки к кроличьему IgE и по
0,15 мл нормальной сыворотки кролика в разведении 1: 20.
ПРИСУТСТIЗие нормальной сыворотки создает оптимальные
условия для преципитации, которая происходит во время по-
следующеrо инкубирования проб при 4 ос в течение 18 72 ч.
50.3.1.
50. Радtюиммун.олоеич.ескиr1 ан.ализ 4ЭI
ЦеНТРllфУПIРУЯ пробы 30 мин при 3500 g, отделяют надоса-
дочную жидкость.
Для построения стандартной кривой (рис. 103) определя
ют процент связанной метки по отношению к общей радио
активнОсти в ряду проб со стандартным IgE. Методика поз
воляет определить 1 14 Hr IgE. При изучении влияния при-
80
60
'10"
40
.....
::s
,::r
.....'1>
20
!I;""
'Ii{
о
о 5 10
/(о.пuчестdо Ig[, не (.Ilоео/шtpМ)
Рис. 103. Стандартная кривая для определения IgE меТОДО:\f двоЙной си-
стемы антител (12]. По оси ординат процент 131 I IgE в осадке после до-
бавления BToporo преципитирующеrо антиrлобулииовоrо peareHTa.
меси иммуноrлобулинов друrих классов было показано, что
2 Mr IgA, 0,5 Mr IgM и 4 Mr IgG только на 6% тормозили
спещифическое связывание.
50.4. ОБЩАЯ ОЦЕНКА МЕТОДА
Применение иммобилизованных антител существенно
упростило методику радиоиммунолоrическоrо определения ca
мых разнообразных антиrенов. В частности, использование
этой методИки позволяет даже начинающему исследователю
быстро войти в курс дела, так как потребности в peareHTax
и оборудовании минимальны. Все относительно TpyдoeMK e
операции пипетирование, отмывание и измерение радиоак
тивности можно автоматизировать. Поrрешность при мно-
rOKpaTHoM измерении одноrо и Toro же образца (n==5) ле
жит в пределах:!: 10%. Иммобилизация антител не приводит
к какому либо повышению их перекрестной реактивности,
а одновременная с антителами адсорбция друrих белков сы-
воротки, которые нередко обладают тормозящим и протеоли
тическим действием, даже способствует устранению неспеци-
фических .помех.
432 П. Фальк
Антиrены, связанные иммобилизованными антителами
,
еще сохраняют способность участвовать в последующих реак-
циях. Это используется в так называемом сэндвич-методе.
Например, для выявления IgG-антител к вирусу rриппа про-
водят три последовательные реакции на поверхности твердой
фазы [8]. Сэндвич метод дает возможность MHoroKpaTHo уси
лить первичное иммунолоrическое взаимодействие, особенно
если на 11ервых этапах в нем принимают участие крупномо-
лекулярные антиrены. Необычайная стабильность иммобили-
зованных на пластмассе антител уже использована в KOM
мерчеСКО11 наборе, который предназначен для количественно
ro определения австралийскоrо антиrена [21]. Добавив кон-
сервант, можно MHoroKpaTHo применять одно и то же разве-
дение антисыворотки для приrотовления пробирок с иммоби-
лизованными антителами [7J.
К достоинствам метода двойной системы антител отно-
сится малая потребность в антисыворотке на одно определе-
Ние. Это может оказаться весьма существенным при анализе
слабо иммуноrенных веществ, к которым иноrда трудно по-
лучить большие количества антисыворотки, необходимые для
обычноrо анализа. Существуют довольно значительные раз
личия между двумя реакциями, лежащими в основе метода
двойной системы антител. Реакция иммуноконкуренции про
текает при HaHorpaMMoBbIx количествах компонентов, а для
заключительной преципитации требуются микроrраммы анти-
тел [2]. Артефактов, которые во время второй реакции вы-
зывает комплемент, можно избежать, применяя вместо цель
ной сыворотки rамма-rлобулиновую фракцию или инактиви-
руя комплемент наrреванием. Друrой путь, исключающий не-
специфическое воздействие компонентов реакционной смеси
на заключительное осаждение иммунных комплексов, пред-
ложили Хейлс и Рэндл [16], применив чистые преципитирую-
щие антитела.
В настоящее время еще нельзя провести достаточно стро-
roe сопоставление двух методов радиоиммунолоrическоrо
анализа метода иммобилизованных антител и метода двой-
ной системы антител. Арендс [1] пытался сравнить оба под-
хода при определении хорионическоrо rонадотропина чело-
века. Оказалось, что иммобилизация антител с помощью
бромциана ведет к существенному снижению их активности
и тем самым к понижению чувствительности метода.
Подводя итоrи, можно сказать, что радиоиммунолоrиче-
ский анализ это простой и надежный метод определения
Мноrих биолоrически активных веществ. Высокая чувстви-
тельность 'этоrо метода позволила впервые достаточно точно
измерить. {(онцентрации ряда ropMoHoB и вирусных антиrенов,
50. Радuouммунолоzuческuй анализ 433
которые до сих пор можно было анализировать лишь с по-
мощью трудоемких и rрубых методов. Основной принцип
определение антиrена по конкуренции за специфические ан-
титела обусловливает также высокую достоверность ре-
зультатов. Способность антиrена взаимодействовать со спе-
цифическими антителами единственное, что решает исход
иммуноконкуренции. В то же время особые биолоrические
свойства вещества, например ero rормональная активность,
в этой реакции не учитываются. Это оrраничение можно бы-
ло бы преодолеть, применив в качестве первичноrо связы-
вающеrо peareHTa вместо антител специфические клеточные
рецепторные белки, но пока этому еще препятствуют трудно-
сти препаративноrо выделения рецепторов и их нестаби.1Ь-
ность [20]:.
50.5. ЛИТЕРАТУРА
1. Areпds J., Comparison between covalently bound and free antibodies,
used for radioimmunoassay, Acta endocr. (Kbh,), 68 (1971), 425 430.
2. Aubert М. L., Critical study of the radioimmuno!ogica! assay for the
dosage of the po!ypeptide hormones in p!asma, J. Nuc!. Bio!. Med., 14
(1970), 1 122,
З. Bersoп S. А., Yalow R.. S., General principles of radioimmunoassay, Clin.
СЫт. Acta, 22 (1968), 5l 69.
4. СатрЬе!! D. Н., Luescher Е., Lermaп L. S., Immunologic adsorbents.
1. Iso!ation of antibody Ьу means of cellulose protein antigen, Proc. N at!,
Acad. Sci. и. S. А., 37 (1951), 575 579.
5. Catt К. J., Niall Н. D., Tregear О. W" Solid phase radioimmunoassay of
human growth hormone, Biochem. J., 100 (1966), 31c 33c.
i3. Catt К. J" Tregear О. W., Solid-phase radioimmunoassay in antibody-
coated tubes, Science N. У., 158 (1957), 1570 1572.
7, Catt К. J., Tregear О. W., Burger Н. О., Skermer С., Antibody-coated tube
method for radioimmunoassay of human growth hormone, Clin. СЫт. Ас-
ta,27 (1970), 267 279.
8. Daugharty Н., Warfield D. Т, Daиies М. L" Solid-phase radioimmunoas-
say of total and influenza specific immunoglobulin G, Аррl. Microbiol.,
23 (1972), 360 367.
9. Ekiпs R.. Р., Theoretical aspects of saturation analysis. In: Proceedings of
the Symposium оп in vitro procedures with radioisotopes in clinica! medi-
cine and research, Vienna, 1969, IAEA Wien, 1 970, 325 353,
10. F.alck Р., Radioimmunologische Untersuchungen mit Bakteriophagen, Acta
ыо.. med. germ" 31 (1973), 375 382.
11. Feldman Н., R.odbard D., Leиiпe D., Mathematical theory of cross-reactive
radioimmunoassay and ligand-binding systems of еquШЬrium, Analyt.
Biochem., 45 (1972), 530 556.
12. Oleich О. J., Aиerbeck А. К., 5wedlund Н. А., Measurement of IgE in
normal and allergic serum Ьу radioimmunoassay, J. Lab. Clin. Med. 77
(1971), 690 698, '
13. Oreenwood Р. с., Hunter W. М., Oloиer J. 5., ТЬе preparation of !З1НаЬеl-
led human growth hormone of high specific activity Biochem J, 89
(1963), 1 14 123. ' .,
14. Oodiпg J. R., Са,а. К. J., Brown J. М., Kalteпbach С. С., Cumming f. А.,
Mole В. J., RadlO1mmunoassay for ovine luteinizing hormone, Endocri-
no!ogy,85 (1969), 133 142.
28----840
434 П. фаль"
15. НаЬе, Е., Page L. В., Richards Р. F., R-adioimmunoassay employing gel
filtration, Analyt. Biochem., 12 (1965), 163 172.
16. Hales С. N., Randle Р. J., Immunoassay of insulin-antibody precipitate,.
Biochem. J" 88 (1963), 137 146.
17. Н erbert V., Кат Seng Lau, Gottlieb С. W., Bleicher S. J., Coated charcoal
immunoassay of insulin, J. Clin. Endocrin. Metab., 25 (1965), 1375
1384.
18. Hunter W. М., Greenwood Р. С., А radio-immunoelectrophoretic assay for
human growth hormone, Biochem. J" 91 (1964), 43 56.
19. Н unter W. М., ТЬе prepara tion of radioiodina ted proteins of high specific-
activity, their relation with antibody in vitro: the radioimmunoassay. In:
Handbook of experimental immunology, Ed. D. М. Weir, BlackwelI, Ox
ford Edinburgh, 1967, 608 654.
20. Lefkowitz R. J., Roth J., Pastan 1., R-adioreceptor assay of adrenocorti
cotropic hormone: new approach to assay of polypeptide hormone in
plasma, Science, N. У., 170 (1970), 633 635.
21. Ling С. М., OiJerby L. R., Prevalence of hepatitis В virus antigen as re
vealed Ьу direct radioimmune assay with 125I-antibody, J. Immun" 10
(1972), 834 841.
22. Murphy В. Р., Application of the property of protein blnding to the assay
of minute quantities of hormones and other substances, Nature, 201
(1964), 679 682,
23. Roselin О., Assan R" Yalow R, S., Bebson S. А., Separation of antibody-
bound and unbound peptide hormones labelled with iodine-131 Ьу talcum
powder and precipitated silica, Nature, 212 (1966), 355 357.
24. Salmon S. Е., Mackey О., Fudenberg Н. Н., «Sandwich» solid phase radio-
immunoassay for the quantitative determination of human immunoglobu-
lins, J. Immun., 103 (1969), 129 137.
25. Skelley D. S., Brown L. Р., Besch Р. К., R-adioimmunoassay, Clin. Chem..
19 (1973), 146 186.
26. Walsh J. Н., Yalow R. S., Berson S. А., Detection of australia antigen
and antibody Ьу means of radioimmunoassay techniques, J., Infect. Dis.,
121 (1970), 550 554.
27. Wikman Coffelt J., R-adioimmunoassay of ribosomes, Analyt. Biochem., 48-
(1972), 339 345.
28. Wide L., Porath J., R-adioimmunoassay of proteins with the use of se-
phadex-coupled antibodies, Biochim. Biophys. Acta, 130 (1966), 257
260.
29. Yalow R. S" Berson S. А., Immunoassay of endogenous plasma insulin in
man, J. СНп. Invest., 39 (1960), 1157 1175.
30. Zaharko D. S" Beck L. V., Studies of simplified plasma insulin immuno-
assay using cellulose po\vder, Diabetes, 17 (1968), 444 457.
51. Получение и истощение
иммунных сывороток
Р. ХОФМАН, В. ШТРАУБЕ, Б. :КЛАУШ
1.1. ПРИНЦИП
Иммунные сыворотки это обязательный peareHT для
проведения иммунохимическоrо анализа. Для их получения
производят активную иммунизацию лабораторных животных.
В принципе сыворотку можно получать, иммунизируя живот-
ных любоrо вида, но сыворотки разных видов обладают He
одинаковой активностью в реакции преципитации. Кролики
отвечают образованием преципитирующих антител на наи-
большее число различных антиrенов [1]. Отношение концент-
раций антиrена и антител может варьировать в довольно ши-
роких пределах, но тем не менее преципитация будет полной,
если в опыте используется кроличья антисывортка. В отЛИЧИе
от нее лошадиная сыворотка способна преципитировать ан-
тиrены только в узкой зоне эквивалентности.
Интенсивность образования антител, естественно, зависит
от иммуноrенности введенноrо антиrена. В известных пре-
делах иммуноrенность коррелирует с молекулярным весоМ
[2]. При иммунизации иммунохимически чистыми антиrена-
ми обычно применяются O,Ol l,O% Hыe растворы, тоrда как
неОчищенные антиrены и смеси антиrенов приходится вводить
в большей концентрации. Малые дозы MorYT применяться в
том случае, если нужно получить моноспецифическую анти
сыворотку, т. е. сыворотку, реаrирующую лишь с одним един-
.ствеННЫ;\1 антиrеном. Чтобы приrотовить такие антисыворот
ки, например, к сывороточным белкам человека, чаще Bcero
животных-продуцентов иммунизируют чистыми антиrенами,
выделенными в нативном состоянии из смеси человеческих
-сывороток, а затем удаляют нежелательные антитела путем
истощения.
На специфичность полученных антисывороток влияет чис-
ло инъекций антиrена и продолжительность иммунизации.
Поэтому при работе с очищенными антиrенами целесообраз-
но оrраничить число инъекций до минимума. Слабоиммуно
reHHbIe антиrены приходится вводить со стимуляторами им-
муноrенеза '[3], к которым относятся различные адсорбенты
и адъюванты [rель Аl (ОН)з, адъювант Фрейнда и др.]. Сти-
мулирующее действие адъювантных веществ обусловлено в
первую очередь замедлением резорбции антиrена. Адъюванты
рекомендуется применять только вместе с иммунохимически
28*
436 Р. Хофмаn, В. Штраубе, Б. l(лауш
чистыми антиrенами или при получении полиспецифических
антисывороток.
На повторное введение антиrена орrанизм животноrо от-
вечает повышенным образованием антител. Интервал между
первичной и повторной инъекциями следует варьировать в за-
висимости от величины первой дозы. Через некоторое время
после цикла иммунизации, коrда титр антител в сыворотке
животных падает, ero можно вновь повысить однократным
введением антиrена (<<бустер эффект»).
Для получения полиспецифических антисывороток можно
рекомендовать MHoroKpaTHbIe инъекции антиrена в несколько
разных мест в течение длительноrо периода. Нередко чистые
антиrены оказываются недоступными или же содержащиеся
в них примеси проявляют сильную иммуноrенность. В этих
случаях приходится получать моноспецифические антисыво-
ротки путем истощения поли- или олиrоспецифических им-
мунных сывороток. Истощение, устраняющее нежелательные
антитела, можно производить различными методами, но все
они в той или иной степени приводят к снижению титра и
денатурации антисыворотки, да и специфичность получаемых
таким образом peareHToB весьма относительна. Так, например,
при истощении растворимыми адсорбентами (в частности,
белками человеческой сыворотки) происходит снижение тит-
ра антител из-за простorо разбавления иммунной сыворотки.
Помимо этоrо, при истощении трудно избежать избытка ан-
тиrена, который может привести к образованию растворимых
комплексов антиrен антитело.
Очевидные преимущества дает применение антиrенов,
иммобилизованных на нерастворимом носителе [Al (ОН)з,
u '" u
диазотированнои п-аминооензилцеллюлозе, активированнои
сефарозе]. С помощью этих иммуносорбентов, пользуясь ко-
лоночным или бесколоночным методом, можно извлечь из по-
лиспецифической антисыворотки антитела, направленные
только против данноrо антиrена, и после отмывания несвя-
завшеrося белка элюировать их в щадящих условиях.
Можно рекомендовать относительно простой метод исто-
щения иммунных сывороток по Бёсёрмени [4]. Антиrен или
смесь антиrенов адсорбируют на rеле rидроокиси алюминия
по методу. Рети [5]. Не содержащую антиrены надосадочную
'"
жидкость оторасывают, а осадок rеля вносят в антисыврот--
ку, подле)!{ащую очистке, и перемешивают с нею. На несу-
щей антиrен поверхности rеля образуются преципитаты ан-
тиrен антитело, и их леrко можно отцентрифуrировать вме-
сте с rелем. После TaKoro истощения антисыворотка (надоса-
дочная жидкость) остается неразбавленной и содержит лиш},
минимальную примесь десорбировавшеrося антиrена.
51. Полученuе и истощение UММУ1ШЫХ сыворото" 437
51.2. МЕТОДИКИ
51.2.1. Получение
полиспецифической антисыворотки
к сьmороточным белкам человека
Для иммунизации берут rетерозиrотных кроликов любоrо
пола в возрасте от полуrода до rода. Смесь донорских сыво-
роток человека можно вводить животным по схеме, предло-
женной Б'1кхаусом [1]i:
l-й день 1,0 мл tвнутривенно
2 й день 2,0 ,млвнутривенно
3 й день 3,0 мл ,внутривенно
21 й день 1,0 мл iВнутрикожно (+5,0 Iмл 'внутрибрю-
шинно)
После 2 недельноrо перерьша 1,0 мл подкожно (контроль
титра)
Если обнаруживается достаточный титр антител (обычно
это бывает на 8"й 12"й неделе после первой иммунизации),
то делают завершающее кровопускание. Проанализировав с
помощью иммуноэлектрофореза отдельные порции антисыво-
роток, можно определить оптимальную пропорцию, в которой
их надо смешивать, чтобы получить стандартную антисы"
воротку.
51.2.2. Истощение
поли специфической антисьmоротки
к сывороточным белкам человека
Упомянутый выше метод истощения по Бёсёрмени снача-
ла рекомендуется испробовать в предварительном опыте, на-
пример попытаться избирательно удалить из антисыворотки
антитела к иммуноrлобулину G.
Схема опыта
fотовят 8 центрифужных пробирок:
l-я пробирка 1,0 мл IgG (10 r IgG в 100 мл 0,15 М NaCJ)
2-я » 1,0 мл IgG как в 1-й+ 1,0 мл 0,15 М NaCI
3-я » 1,0 мл IgG из 2-й+ 1,0 мл 0,15 М NaCl
4-я » 1,0 мл IgG из 3-й+ 1,0 мл 0,15 М NaCl
5-я » 1,0 мл IgG из 4-й+ 1,0 мл 0,15 М NaCl
б-я » 1,0 мл IgG из 5-й + 1,0 мл 0,15 М t\aCI
7-я » 1,0 мл IgG из 6-й+ 1,0 мл 0,15 М NaCJ
я » 1,0 мл IgG из 7-й+l,0 мл 0,15 М NaCl
отбросить: 1,0 мл IgG из 8-й пробирки
З8 Р. ХОфJ.tаn, В. Штраубе, Б. l(лауш
Получается rеометрический ряд разведений антиrена,
в каждую пробирку KOToporo добавляют по 1 мл rеля, co
держащеrо 26,9 Mr Аl (ОН)з в 1 мл (Institut «Ниmап», Бу-
дапешт), перемешивают стеклянноЙ палочкой и оставляют
на 24 ч при 4 ОС. Затем rель с адсорбированным на нем IgG
осаждают путем центрифуrирования при 1000 об/мин и о ос
В течение примерно 15 мин на центрифуrе КТ 24 (Jапеtzki,
Энrельсдорф, [ДР). Прозрачную надосадочную жидкость OT
брасывают и в каждую пробирку вносят по 2,0 мл кроличьей
полиспецифической антисыворотки к сывороточным белкам
человека. Содержимое пробирок тщательно перемешивают и
оставляют еще на 24 ч при 4 ОС, затем снова центрифуrиру-
ют. Декантированная надосадочная жидкость представляет
собой истощенную антисыворотку [6]. В этом предвари-
тельном опыте УIOжно найти эквивалентные соотношения
между количеством истощаемой антисыворотки и концентра-
цией иммобилизованноrо антиrена. Соблюдая найденную
пропорцию в основном опыте истощения, удается полностью
удалить нежелательные антитела с минимальным заrрязне-
нием антисыворотки несвязанным антиrеном. Истощение
больших количеств антисыворотки рекомендуется проводить
дробно, отде.1ЬНЫМИ порциями объемом не более 10 мл.
51.2.3. Приrотовление
:моноспецифическои антисьmоротки
к IgG человека
Иммунохимически чистый IgG можно выделить из смеси
донорских сывороток с помощью хроматоrрафии на ДЭАЭ
сефадексе А-50 [7]. Для иммунизации кроликов применяют
0,1 % ный раствор IgG, вводя ero по схеме, описанной выше
(51.2.1). Вполне надежна также схема с внутрибрюшинным
введением 5,0 мл IgG не на 21 й, а на 13-й день, с подкож-
ной инъекцией на 27-й день иммунизации. В этом случае хо-
роший титр антител наблюдается уже на 5-й 6-й неделе по
сле первой инъекции антиrена.
Если количество чистоrо IgG оrраничено или ero нет во-
все, для иммунизации можно использовать иммунные преци-
питаты IgG [8]. Проводят иммуноэлектрофорез в 1,5% -ном
arape или аrарозе, вырезают участок rеля, содержащий пре-
ципитат, и MHoroKpaTHo ero отмывают 0,15 М раствором
N аС! при 4 ОС, rомоrенизируют и с интервапом в 14 дней
вводят кроликам в подколенные лимфатические узлы или в
клетчатку, непосредственно окружающую их (примерно 4
8 преципитатов на одно животное). После 2 3 инъекций по-
лучают высокий титр антител.
51. Получение и истощение иммУJшЫх СЫ80рОТОК 439
51.3. ДОПОЛНИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
Какой то одной оптимальной и всеrда воспроизводимой
схемы иммунизации и истощения при получении преципити-
рующих антисывороток не существует. Выбор вида живот
ных продуцентов, помимо технических соображений, опреде
ляется количеством имеющеrося антиrена и количеством ан-
тисыворотки, которое надо получить. В большинстве случаев
отдают предпочтение кроликам: их леrче содержать, с нюш
проще обращаться, их несложно иммунизировать и у них
просто брать кровь. От кроликов можно собрать смесь им
мунных сывороток, достаточную для проведения целой серии
исследований. Вообще при получении любой антисыворотки
рекомендуется одновременно иммунизировать несколько жи
вотных и приrотовлять смешанную сыворотку. Это, во пер
вых, нивелирует индивидуальные различия в образовании ан-
тител у разных животных и, во-вторых, позволяет избежать
тотальноrо кровопускания, коrда нужны большие объемы сы-
вороток. При иммунизации кроликов растворимыми антиrе-
нами внутривенные инъекции предпочитают делать в крае-
вую вену уха. Она становится отчетливо видимой, если ухо
потереть тампоном со спиртом или corpeTb. Первые инъекции
желательно делать ближе к кончику уха. Технически просты
способы внутримышечной (туловище, бедро), подкожной (об-
ласть живота, спина), внутрибрюшинной и внутрикожной
(подушечки лап) иммунизации. Наиболее эффективны обыч-
но внутривенные и внутрикожные инъекции. Далее, можно
рекомендовать введение иммунизирующеrо материала в об-
ласть подколенных лимфатических узлов, особенно тоrда,
коrДа имеется лишь оrраниченное количество антиrена или
в качестве иммуноrена используются преципитаты. Кровь бе-
рут по возможности в стерильных условиях. При пробном
взятии крови обычно используют краевую вену уха. Ес.1И
нужно взять MHoro крови, тотальному кровопусканию пред-
почитают повторные пункции сердца. При хорошей экспери-
ментальной технике кролики почти всеrда переносят взятие
из сердца 40 60 мл крови в неделю. Отменять питание и
давать обильное питье за сутки До кровопускания не обяза-
тельно.
Полиспецифическая антисыворотка к сывороточным бел-
кам человека применяется для качественноrо анализа белков
в нормальных и патолоrических сыворотках и в друrих жид-
костях орrанизма (цереброспинальной жидкости, моче, экс-
трактах из opraHoB, молоке и т. д.). С ее помощью при ИМ-
муноэлектрофорезе нормальной сыворотки можно получить
по меньшей мере 18 дуr преципитации. Моноспецифические
440 Р. Хофман, В. Штраубе, Б. l(.л.ауш
антисыворотки находят применение при диаrностике пара-
протеинемий и белковых сдвиrов, наблюдающихся в норме
и патолоrии, а также для количественноrо иммунохимическо-
ro определения сывороточных белков и друrих целей. Лучше
Bcero хранить иммунные сыворотки небольшими порциями
при 15 ос. Повторноrо оттаивания и замораживания сле-
дует избеrать. В сыворотки, которые должны долrо сохра-
няться при 4 ос, рекомендуется добавить консервант
(0,5 % -ный раствор фенола, мертиолят и т. п.). Титры анти-
тел в лиофилизированных антисыворотках при остаточной
влажности меньше 3 % и соответствующем хранении Долrо
остаются почти неизменными.
51.4.
ЛИТЕР А ТУРА
1. Backhausz R., Immunodiffusion und Immunoelektrophorese, УЕВ Gustav
Fischer Verlag, Jena, 1967.
2. Pruzaпsky J. J., Feiпberg S. М., Harris М., Wojcik N., А possible correla-
tion bet\veen the minimum sensitizing dose of antibody in passive anaphy-
laxis and the molecular weight of the antigen, J. Immunol., 85, 580, 1960.
3. Steffeп С., Allgemeine und experimentelle Immunologie und Immunpatho-
logie sowie ihre klinische Anwendung, Georg ТЫете Verlag, Stutgart,
1968.
4. Boszormeпyi J., Removal of hetero!ogous precipitins from rabbit sera Ьу
means of adsorbed antigens, Ann. Immunol. Hung., 2, 190, 1959.
5. Rethy L., Herstellung eines schwer sedimentierenden stark bindenden A!и
miniumhydroxyd-Adsorbens fiir die Impfstoffproduktion, Ann. Immuno!.
Hung., 5, 152, 1962.
6. Friemel Н., Experimentelle Untersuchungen zur immunchemischen Analytik
der Organproteine von Pankreas, Herzmuske! und Gehirn des Menschen,
Habi!.-Schrift Med. Faku!t., Rostock, 1969.
7. Brock J., Praparation von Organproteinen aus Herzmuskel und Placenta
des Menschen, Habil Schrift Med. Fakult., Rostock, 1969.
8. Ambrosius Н., Lehmaпп R., Eine einfache Technik zur Herstellung топо-
spezifischer An tiseren, Acta biol. med. germ., 25, 513, 1970.
52. Иммуносорбенты
r. КЮККЕН, И. БРОК
Иммуносорбентами называют иммобилизованные антиrе-
ны или антитела, способные к специфическим реакциям. На-
пример, переведенный в нерастворимую форму антиrен MO
жет служить иммуносорбентом, так как в реакции антиrен
антитело он связывает антитела, которые блаrодаря этому
также становятся нерастворимыми. Отмывая затем иммуно-
сорбент, удаляют всевозможные растворимые примеси, за-
rрязняющие препарат антител. После этоrо, изменив рН или
увеличив концентрацию солей, можно вызвать диссоциацию
антиrена и антител и элюировать антитела с иммуносорбен-
та. Таким же образом (теоретически) можно очистить лю
бой антиrен, к которому имеются иммобилизованные чистые
антитела в достаточном количестве. К достоинствам этоrо
метода следует отнести возможность оптимальноrо выделе-
ния как антиrенов, так и антител весьма простым способом
на основе нерастворимости одноrо из участников реакции,
возможность реrенерации иммуносорбента и некоторое по-
вышение стабильности иммобилизованноrо белка по сравне-
нию с нативным.
52.1.1. Иммобилизация белков
rлутаральдеrидом [2]
Реаrируя с обеими альдеrиднЫМИ rруппами rлутаральде-
rида, белки становятся нерастворимыми блаrодаря межмо
лекулярным сшивкам. По данным Закса и Винна [17Т, меж-
ду свободными аминоrруппами белка и аЛЬДеrидными rруп-
пами rлутаральдеrида образуются основания Шиффа.
52.1.2.
Иммобилизация белков
на сефадексе [3, 4]
Сефадекс, активированный бромцианом, способен KOBa
лентно связывать белки. Механизм этой реакции представ-
лен на рис. 104.
442 1. Кюккен, И. Бро/С
Affтll(JaqUf1
A @tOCONH z
t OH BrC rtO C= OH
OH L OH J ""' O'C=NH
O/
/(аростмат (HeaKтuв.
НоР сруппщ
IfM!I!JKaptfOHeтfll (tт/(i1IlIB
нетН t?pYnfl(l)
IlplIcoeiJиHe O C NH NН'l ОеЛ0-f
Iше O
O y'- Nн оелок If.зОJ/реи8-
[o H ЛРОllЗ80f}ное
!tOy. o. Н зомеtl{енныо
:i-ол- N елок liмшJOIraрt1(lНUfll
O --{; Nн оелок- !I ЗCI ме LI{ енныи
йI-oн О /(tlpt10AfUт
Рис. 104. Присоединенне белка к сефадексу, активированному бромцианом.
52.2.
52.2.1.
МЕТОДИКИ
Приrотовление иммуносорбента
путем иммобилизации белка
rлутаральдеrидом
52.2.1.1.
Реаrепты и приборы
Водный 2,5% ный раствор rлутаральдеrида; 0,9% ный
раствор хлористоrо натрия; 1 М фосфатный буфер с рН 7,0;
0,2 М фосфатный буфер с рН 7,3; 0,9% ный раствор NaCl,
забуференный 0,01 М фосфатным буфером с рН 7,0; 0,1 М
rлицин-НСl буфер с рН 2,8; антиrен; антисыворотка.
rомоrенизатор режущеrо типа; центрифуrа с охлаждени-
еМ; УФ фото'метр (VSU-2, Carl Zeiss, Иена, [ДР); ,кварцевые
кюветы; мешалка; пор истый стеклянный фильтр G5; коллодие-
вые ![ильзы (13 200, Sаrtоrius МеmЬrапfiеltеr, ФРr).
52.2.1.2. Методика
Растворяют 750 Mr белка в 10 мл 0,1 М фосфатноrо бу-
фера с рН 7,0. Если требуется, рН подводят до 7,0 с по-
мощью 0,1 н. НС} или 0,1 н. NaOH. В полученный раствор
по каплям при постоянном перемешивании прибавляют 3 мл
2,5 % Horo раствора rлутаральдеrида. Через 3 ч при KOMHaT
ной температуре раствор белка превращается в rель. Ero
осторожно измельчают при помощи rомоrенизатора в 200 мл
0,2 М фосфатноrо буфера с рН 7,3. Полученную суспензию
центрифуrируют 15 мин при 1000g и 4 ос. Нерастворимый
белок отмывают 0,2 М фосфатным буфером с рН 7,3, повтор-
но rомоrенизируя и центрифуrируя до тех пор, пока экстинк-
ция надосадочной жидкости при 280 нм не будет ниже 0,01.
52. Им.м.уnосорбен.ты 443
После этоrо rель суспендируют в 200 мл 0,1 М rлицин-НС1-
буфере с рН 2,8 и снова центрифуrируют. Эту процедуру
повторяют три раза. Затем частички rеля суспендируют в
200 мл забуференноrо физиолоrическоrо раствора NaCl,
и после центрифуrирования промывают их этим paCTBOpo
до нулевой экстинкции при 280 нм. После этоrо весь rель
собирают в одной центрифужной пробирке и вносят туда под-
лежащую обработке антисыворотку или раствор антиrена.
Смесь в течение 30 мин перемешивают и на 11/2 ч оставляют
при комнатной температуре. Затем центрифуrируют в тече-
ние 15 мин при 1000 g и 4 ос и надосадочную жидкость от-
брасывают. rель промывают забуференным фИЗИОJl0rическим
раствором NaCl до тех пор, пока экстинкция надосадочнон
жидкости не будет ниже 0,01. После этоrо ero 15 мин пере-
мешивают в 5 мл 0,1 М rлицин НС1 буфера с рН 2,8 и цент-
рифуrируют 15 мин при 6000g и 4 ОС. Элюирование 0,1 М
rлицин-НС1-буфером повторяют трижды. Все элюаты, содер-
жащие десорбированный белок, объединяют и фильтруют че
рез пористый стеклянный фильтр G5 с помощью вакуума.
Фильтрат диализуют против 0,9% -Horo раствора NaCl, кон-
центрируют вакуум-фильтрацией в коллодиевых rильзах и
исследуют в иммуноэлектрофорезе и реакции Ухтерлони.
rель (иммуносорбент) после элюирования и MHoroKpaTHoro
отмывания 0,2 М фосфатным буфером с рН 7,3 можно ис-
пользовать вновь. Ero хранят при 4 ОС, добавив мертиолят.
52.2.2.
Приrотовление иммуносорбента
путем иммобилизации белка
на сефадексе
52.2.2.1. Реаrепты и прпборы
Растворы: 0,5 н. NaOH; 0,1 М NаНСО з ; 0,3 М NаНСО з ;
0,001 н. НС1; 0,5 М NaCl; 0,9% -ный раствор N аСl, забуфе-
ренный 0,01 М фосфатным буфером с рН 7,5 (ЗФР); 0,1 М
уксусная кислота.
Сефадекс G-200 (Pharmacia Fiпе Chemicals, Упсала, Шве-
ция); антиrен; антисыворотка.
Воронка Бюхнера; pH-метр, мешалка; центрифуrа с
охлаждением; УФ фотометр (VSU, Carl Zeiss, Иена,rдр);
кварцевые кюветы; колонка; насос; коллектор фракций; кол-
лодиевые rильзы (13200, Sartorius-Membranfilter, ФРr).
52.2.2.2. Методика
Суспендируют 400 r сефадекса G-200 в 48 мл дистилли-
рованной воды и оставляют на 24 ч для набухания. Затем
с помощью 0,5 н. N аОН устанавливают в суспензии рН 11,2.
444 Т. Кюккен., И. Бра"
Для активирования сефадекса прибавляют 400 Mr бромциана,
pacTBopeHHoro в 8 мл дистиллированной воды. Активирова-
ние, продолжающееся 6 мин, с caMoro начала должно про-
ходить при рН 11,2 (поддерживать с помощью 0,5 н. NaOH).
Затем активированый сефадекс переносят на воронку Бюх
нера и в течение 3 мин промывают растворами бикарбоната
натрия (примерно 250 мл 0,1 М и 150 мл 0,3 М). К активи-
рованному rелю добавляют 200 Mr фиксируемоrо белка (ан-
тиrена или антител) в 8 мл 0,3 М бикарбоната натрия и в
течение 24 ч перемешивают при комнатной температуре. По-
сле этоrо надосадочную жидкость отделяют центрифуrиро-
ванием (1500g, 15 мин, 4 ОС). Осадок промывают примерно
200 мл дистиллированной воды и снова центрифуrируют. Та-
ким же образом ero промывают 200 мл 0,1 М бикарбоната
натрия, 200 мл 0,001 н. HCl, 200 мл 0,5 М NaCl и ЗФР.
В результате наrруженный сефадекс должен уравновеситься
последним раствором, а экстинкция надосадочной жидкости
при 280 нм должна дойти до нуля. Полученный иммуносор-
бент помещают в колонку и вновь промывают ЗФР. На ко-
лонку наносят со скоростью протекания 5 мл/ч соответствую-
щую антисыворотку (или антиrен). Затем основательно про
мывают иммуносорбент ЗФР дО нулевой экстинкции элюата
при 280 нм. После этоrо сорбированные антитела (или cop
бированный антиrен) элюируют из колонки 0,1 М уксусной
кислотой. Элюат диализуют против ЗФР и концентрируют
путем вакуум-фильтрации в коллодиевых rильзах. Качест-
венный анализ концентрата производится с помощью имму-
ноэлектрофореза и реакции Ухтерлони.
Для последующеrо применения колонку промывают ЗФР,
содержащим азид натрия, и хранят при температуре 4 ОС.
52.3. ОБЩАЯ ОЦЕНКА
Серолоrическая активность белков, иммобилизованных
rлутаральдеrидом, проявляется только на поверхности частиц
иммуносорбента. Применение сефадекса в качестве носителя
по сравнению с rлутаральдеrидной полимеризацией создает
rораздо большую поверхность взаимодействия. Вместо сефа-
декса бромцианом часто активируют аrарозу [15}. Простран-
ственные условия взаимодействия, в которых находится при-
вязанный белок, можно значительно улучшить, если ero при-
соединить к носителю не прямо (как здесь описано), а через
промежуточное соединение, например этилендиамин [8, 9].
Для активирования сефарозы 4 В обычно прибавляют
100 150 Mr бромциана на 1 мл rеля. Процесс продолжается
8 12 мин при рН 11,2 и 20 ОС. Чтобы повысить емкость но-
52. Им.муносорбенты 445
еителя, количество бромциана можно увеличить до 300 Mr
на 1 мл осадка сефарозы [8].
В литературе описаны иммуносорбенты, полученные ана-
лоrично rлутаральдеrидным с помощью друrих сшивающих
areHToB: этиловоrо эфира хлор муравьиной кислоты [1]' или
N-ацетилrомоцистеинтиолактона [5, 18]. В качестве носите-
лей для привязанных белков применяются также n-амино-
бензилцеллюлоза [6, 10], карбоксиметилцеллюлоза [14],
бромацетилцеллюлоза [16], полиаминостирол [12, 13], rидра-
зиды полиакриламида [8, 11] или полиакриламид в клат-
ратной композиции с белком [7].
52.4. ЛИТЕР А ТУР А
1. Auraтeas S., Terпyck Т., Вio!ogicaIly Active Water-iпsоJubJе Protein Ро-
1ymers. 1. Their Use for Iso!ation of Antigens and Antibodies, J. Ыо!.
СЬеm., 242, 16Бl 1659 (1967).
2. Auraтeas S., Terпyck Т., ТЬе Cross-Linking of Proteins with GJutara!de-
hyde and its Use for the Preparation of Immunoadsorbents, Immunoche-
mistry, 6, 53 66 (1969).
3. Ахеп R., Porath J., Erпback S., Chemica! CoupJing of Peptides and Pro-
teins to PoJysaccharides Ьу Means of Cyanogen Halides, Nature, 214,
1302 1304 (1967).
4. Ахеп R., Erпback S., ChemicaJ Fixation of Enzymes to Cyanogen Halide
Activated Po!ysaccharide Carriers, Ешор. J. Biochem., 18, 351 360
(1971) .
5. Beпesch R., Beпesch R. Е., ThioJation of Proteins, Proc. Natl. Acad. 5ci.
U. 5., 44, 848 853 (1958).
6. СаmрЬеи D. Н., Luescher Е., Lermaп L. S., Immuno!ogic Adsorbents.
1. Iso!ation of Antibody Ьу Means of а CelluJose-Рrоtеiп Antigen, Proc.
Natl. Acad. 5ci. U. 5., 37, 575 578 (1951).
7. Carrel S., Gerber Н., Baraпduп S., Preparation of PoJyacry!amide Gels
which Contain Protein and their Use as High Capacity Immunosorbents,
Nature, 221, 385 386 (1969).
8. Cuatrecasas Р., Protein Purification Ьу Affinity Chromatography. Deriva-
tizations of Agarose and PoJyacryJamide Beads, J. bioJ. СЬеm., 245,
3059 3065 (1970).
9. Cuatrecasas Р., FunctionaJ Purification of Proteins and Peptides Ьу АПi-
nity Chromatography, J. agric. Food СЬеm., 19, 600 604 (1971).
10. Fурвuч А. Е., Кузовлева О. В., Туманова А. Е., Получение белково-цел-
люлозных комплексов (иммуносорбентов) в виде суспензий, способных
присоединять большие количества антител, Биохимия, 1961, 26, вьш. 5,
934 942.
11. /пmаn J. К., Diпtzis Н. N., The Derivatization of Cross-Jinked Po!yacryl-
amide Beads. ControIled Introduction of FunctionaJ Groups for the Pre-
paration of 5peciaJ-Рurроsе, Biochemica! Adsorbents, Biochemistry, 8,
4074 4082 (1969).
12. Kent L. Н., Slade J. Н. R., Immunochemically Active Cross-linked Poly-
styrene, Nature, 183, 325 326 (1959).
13. Kent L. Н., Slade J. Н. R., Immunochemically Active Cross-Jinked Роlу-
styrene Preparations, Biochem. J., 77, 12 17 (1960).
14. Micheel F., Ewers J., 5ynthese von Verbindungen der Zellulose mit
Eiweil3stoffen, Macromoleculare Chem., 3, 200 209 ('1949).
446 Т. КЮlCкен., И. БроlC.
15. Porath J., Ахеn R., Erпback S., Chemical Coupling of Proteins to Agaro-
se, Nature, 215, 1491 1494 (1967).
16. Robbins J. В., HaimoCJich J., Sela М., Purification of Antibodies with Iт-
munoadsorbents Prepared Using Bromacetyl-Cellulose, Immunochemistry.
4, 11 22 (1967).
17. Sachs D. Н., Winп Н. J., ТЬе Use of G!utaraldehyde as а Coupling Agent
for Ribonuclease and Bovine Serum Albumin; Immunochemistry, 7, 581
585 (1970).
18. Stepheп J., Gallop R. G. С., Smith Н., Separation of Antigens Ьу Immu-
nologica! Specificity. Use of DisuIfide-Liпkеd Antibodies as Immunosor-
bents, Biochem. J., 101, 717 720 (1966).
53. Определение аффинности антител
Х.КЛЕйСТ
53.1. ВВЕДЕНИЕ
Активность иммунных сывороток в реакции антиrен aH
титело определяется не только концентрацией антител: она
существенно зависит также от прочности соединения антител
с антиrенами. Авидность и аффинность как раз и характери-
зуют эту прочность.
53.1.1. Авидность
Авидность антител характеризует их взаимодействие с
макромолекулами как комплексными антиrенами и служит
мерой этоrо взаимодействия. Однако относительно точно из-
мерить авидность можно только на подходящих системах
антиrен антитело. Выводы, к которым приводит измерение
авиДНОСТИ, существенны для решения мноrих биолоrических
вопросов, но при анализе специфическоrо связывания анти-
reHa с антителами они имеют лишь оrраниченное значение.
Почти у всех антиrенов молекулы обладают множеством раз
личных детерминант, и поэтому в сыворотке, полученной при
иммунизации любым из них, содержится MHoro различных
популяций антител. Каждая популяция специфична по от-
ношению к какой-то одной детерминанте. В пределах одной
такой популяции сила связывания с антиrеном зависит от
условий иммунизации.
53.1.2. Аффинность
Аффинностью называют силу связывания активноrо цент-
ра молекулы антитела с соответствующей детерминантой aH
тиrена. Используя моновалентные rаптены с известной струк-
турой, можно точно охарактеризовать связывание при обра-
зовании комплекса rаптен антитело по концентрации участ-
ников и продуктов реакции [1, 2]. Аффинность антител к хи-
Мически определенной rруппе характеризуется константой
ассоциации КО или изменением свободной энерrии !1РО. КО
это константа ассоциации для обратимоrо взаимодействия
Антитело (А Т) + rаптен (О Комплекс rаптен антитело
(r-AT) :
К [ f-AT]
-== ' [f] [А Т]
448 Х. Клейст
Из Ко можно вычислить !'),ро:
IJ.РО=== RT .ln Ко,
rДе д.РО стандартное изменение свободной энерrии, R
rазовая постоянная и Т абсолютная температура.
Чтобы выяснить природу взаимодействия rаптена с анти-
телом, требуется большая точность измерений. Для этой це-
ли был разработан ряд прямых и непрямых методов: равно-
весный диализ [2]'; модифицированный метод осаждения
сульфатом аммония по Фарру [3 5]; rашение флуоресцен-
ции [6, 7]; усиление флуоресценции с применением е.-дансил-
L лизина [13]; торможение преципитации rаптеном [7].
В этом разделе в качестве примеров количественных ме-
тодов определения аффинности антител будут рассмотрены
равновесный диализ, модифицированный метод осаждения
сульфатом аммония и метод rашения флуоресценции.
Следует, однако, подчеркнуть, что при решении специаль
ных вопросов с успехом MorYT быть использованы также и
друrие методы [10]. Например, все большее значение при-
обретает измерение степени поляризации флуоресценции при
изучении реакции антиrен антитело [8 12]. Ero можно
применять для оценки равновесия и в кинетических иссле-
дованиях.
53.2.
РАВНОВЕСНЫЙ ДИАЛИЗ
53.2.1.
Принцип
Равновесный диализ это наиболее обычный метод, с по-
мощью KOToporo точно определяют параметры связывания
при взаимодействии между низко молекулярными лиrандами
и биополимерами; поэтому ero предпочитают использовать и
при определении аффинности антител. Раствор антител в
определенной концентрации отделяют мембраной от раство-
ра свободноrо rаптена известной концентрации. Для обоих
peareHToB используется одинаковый растворитель с одними
и теми же значениями рН и ионной силы. Антитела, будучи
макромолекулами, не MorYT проходить через мембрану, а для
низкомолекулярных rаптенов мембрана, наоборот, проницае-
Ма. Молекулы rаптена диффундируют в раствор антител и
частично связываются с ними. Состояние равновесия насту-
пит тоrда, коrда концентрация свободноrо rаптена по обе
стороны мембраны станет одинаковой. Время диффузии при
данных условиях опыта зависит от природы rаптена, свойств
мембраны и растворителя. Измерив концентрацию свободно
53. Определение 'аффинности антител 449
[о rаптена по обе стороны мембраны, можно установить КО-
.1ичество rаптена, связанноrо антителами.
При измерениях нужно учитывать мембранные эффекты,
например адсорбцию. Молекулы антител это ианизирован-
ные белки. Поэтому при рабате с заряженными rаптенами
возникает эффект Доннана. В зависимости от условий апыта
используют простой целлафанавый мешак или специальна
сконструированную диализную ячейку [14]1. Отдельные эта-
пы методики и интерпретация результатов подробно рассмот-
рены в рабате Эйзена [2].
53.2.2. PeareHTbI и приборы
Диализная ванна; раствор антител; раствар rаптена; спек
трафотометр или радиометр; термостат.
В качестве растворителя MorYT быть использаваны 0,01 М
фасфатный буфер с рН 7,4 или 0,1 М трис-НСl-буфер с
рН 7,4. Однако величина рН и ионная сила раствора зависят
ат исследуемой системы. Для уменьшения эффекта Доннана
целесообразно применять забуференный 0,15 М раствор хло-
ристаrа натрия. Выбор концентраций антител и rаптена за
висит от ожидаемой величины константы равновесия
(табл.ll).
Таблица 11. Рекомендуемые ко/-щентрации Шlти
тел для проведения равновесносо
диализа при различных константах
ассоциации
KOHCTaН"l'a ассоциации,
Л/МОЛЬ
Коицентрация антител,
мr/мл
1.10;;
1.106
1.107
3,6
0,36
0,036
53.2.3.
Постановка ОПЫТа
в диализный мешок (или в ячейку До!lЯ диализа) наЮI
вают 2 мл раствора антител. Завязанный с абоих концов
мешок помещают в соответствующий сосуд (заКРЫI3ающую
ся стеклянную пробирку 10х75 мм). Пасле этоrо в пробир у
вносят 2 мл раствора rаптена (рис. 105). Чтобы полvчить
ряд измерений, позволяющих определить канстанту асс'ацпа
ции, берут несколько (например, пять) пробирак'с paCTBa
рами [аптена разной начальной концентрации в достаточно
большом диапазоне. Вначале нужна рассчитать величину HC
29 .840
450 Х. Клейст
специфическоrо связывания rаптена диализной мембраной.
L(ля этоrо проводят несколько контрольных опытов диаЛиза
по меньшей .мере с двумя различными концентрациями rari-
тена, причем с наружной стороны диализной мембраны Haxo
дится раствор rаптена, а с внутренней только буферныЙ
раствор. [отовые пробирки в штативе помещают в TepMO
ti ;: K : '
' ,?;:(::';"::""::""
.>..... .....-:::;: :
о AHт"тetllo
. rgптeH
Рис. 105. Схема распределения peareHTOB в начале
диализа.
ста т до наступления равновесия. Растворитель нужно пере-
мешивать путе}л вращения или встряхивания. При темпера
туре 30 ос равновесие может наступить через 4 ч, при более
низкой температуре через 20 40 ч.
53.2.3.1.
Определение концентрации rаптеиа
Концентрацию окрашенноrо rаптена можно определить с
помощью спектрофотометра. Для измерения концентрации
rаптена, меченноrо радиоактивным изотопом, применяют ра-
диометр. Прежде I3cero определяют количество неспецифиче-
ски связываемоrо rаптена в контрольных опытах без анти-
тел. Ero вычисляют из концентраций rаптена по ту и друrую
сторону мембраны после наступления равновесия. При до-
статочно точной постановке опыта обе величины должны быть
равны. Количество неспецифически связанноrо ranTeHa рав-
но разности между количеством BHeceHHoro ranTeHa и суммой
обеих полученных величин. Ero можно выразить в процентах
от количества свободноrо rаптена.
53. Определение iаффинности антител 451
11pllMcp TaKoro определения представлен в табл. 12 [2].
Здесь приведены величины, полученные при анализе 5 проб
с раЗ.ПJJllНЫМИ исходными концентрациями rаптена, каждая
ветlЧIIна средняя для двух проб. Условия контрольноrо
опыта бы.1И следующими: с внешней стороны мембраны
2 мл J4С-2,4-динитроанилина; с внутренней стороны 2 мл
. ф,.
. .
............ :И:Оi.
. .. .".<?.' ,
...' .',:-:: .'.0. с/..... '.. '::'::'
с Антuте.llО
. Антuте.лР+;Jо"тен
. Топте"
Рис. 106. Схема распределения peareHTOB в конце
диализа, коrда устанавливается равновесие.
буферноrо раствора (0,1 М трис-НСI с рН 7,4; 0,1 М KCI);
продолжительность диа.1Jиза 5 ч при медленном перемешива-
нии; температура 30 ОС; удельная активность 1 С-rаптена
520 имп! (мин. нмоль) ; реrистрирующий прибор жидкост-
ный сцинтилляционный счетчик.
Зная количество неспецифически связанноrо rаптена, мож-
но в следующем опыте определить, сколько rаптена связано
антителами (рис. 106). В таб.'1. 13 приведены результаты
всех ИЗМерений и вычисленные величины.
Условия OCHoBHoro опыта были следующими: с внешней
стороны мембраны: 2 мл 14С-2,4-динитроанилина в различных
концентрациях; с внутренней стороны мембраны: 2 мл pac
твора антител к 2,4-динитрофенильной детерминанте (240 MKr
чистых антител на 1 мл); растворитель: 0,01 М трис-НСI
(рН 7,4) с 0,1 М KCI; продолжительность диализа: 5 ч при
Iсдленном перемешивании и 30 ос.
29*
452 .'{, Клейст
Таблица 12. Определетше количества несnецифически связываеМО20
саптена [2]
Измеренная КОlЩен-
Расчетная концентра- трация при равновеснн Неспецифическое
Исходная концент- ция rаптена без не- МOJIь!л.l0 6 связывание, % от кон
рация ran'l'eHa, спецнфнческоrо 1 центрации свобоДноrо
МOJIь!л.10 6 связывання, МOJIь!л .106 ranTeHa
внутри снаружи
9,82
8,06
5,20
2,55
1,04
4,39
3,51
2,20
1,09
0,455
4,40
3,46
2,24
1,09
0,476
4,91
4,03
2,60
1,27
0,52
11,6
15,6
17,1
16,5
11,8
Таблица 13. Определение количества zaпTeHa, связываоlOZО антителшtU
(результаты ИЗА!ерений и вычисленные величины)
Концентрация
rаптена в начале
опыта с внешней
стороны мембраны,
моль!л.10 6
Концентрация
свободноrо rаптена
с внешней стороны
мембраны при
равновесни,
моль!л.10 6
Равновесная I(оличество
концентрация ПОС.lе rаптена, связан-
внесения ПОПР4Вки, Horo антите. 1
. мольjл.10 6 ла ш, Ю!OJIЬ ,
I
ЧиCJIО МQ.lей ,
r аI1тена на ,
МOJIЬ антите:li
,
9,82
8 06
5:20
2,55
1,04
4,41
3,65
2,39
1,20
0,51
4,52
4,28
3,92
2,88
1,71
3,34
2,52
1,41
0,48
0,083
1,69
1,60
1,47 "
1.08
0,64
Была сделана поправка на неспецифически связанный
rаптен. Ее величина (около 15%) была вычислена как сред-
няя из последней колонки табл. 12.
В колонке 1 табл. 13 приведены исходные концентрации
rаптена с внешней стороны мембраны, а в колонке 2 кон-
центрации ero с внешней стороны после установления рав-
НОВесия. В полученные результаты была внесена поправка,
рассчитанная из величин колонки 2 табл. 12 с учетом сред-
Hero количества неспецифически связанноrо rаптена около
15 %. Исходные данные приводятся в колонке 3 табл. 12. Ко-
личество rаптена, связанноrо с антитела\ш (в наномо.'1ЯХ),
приведенное в колонке 4, вычисляется как разность между
соответствующими величинами колонок 2 II 3 с учетом исход-
ной конuентрации rаптена. Отношение специфически связан-
Horo rаП ена к количеству антител в молях представлено в
колонке 5.
53. Определение 'аффинности антител 453
53.2.3.2. Вычисление констант ассоциации
Для вычисления констант ассоциации l'рафическим спосо
бо [ предложено несколько эквивалентных уравнений, выте-
кающих из закона действующих масс:
1).J...=== . +
" nКо сп'
2) ===п.Ko r.Ko (уравнение Скэтчарда) и
с
3) log ==a.logK o + а log с (уравнение Сипса),
п ,
[де Ко константа ассоциации (л/моль),
с концентрация свободноrо rаптена (моль/л),
r число молей связанноrо rаптена на 1 моль антител,
п валентность антител,
а индекс rетероrенности антител.
Уравнение 1
1
Если определена зависимость ,от С' то n можно вычис-
1 1 1
лить путем экстраполяции. При ==o == , т. е. п===r. В при-
с r n
веденном примере величина п оказалась равной 2. Если r===
=== 1, то среднее значение КО равно величине, обратной KOH
б 1 1 1 , 1
центрации сва одноrо rаптена: l!З выражения == ( .
пl о С II
1
С,lедует, что Ко=== и при r== 1 Ко можно опреде,lIIТЬ rрафlI
с
чески. Эта величина соответствует концентрации свободноrо
rаптена, при которой половина связей антите.l заняТа моле
кулами r(!птена.
J.'равнение 2
Пользуясь уравнением 2, ст[:оят rрафик зависимости r
с
от r. При работе с раствором rOMoreHHblx антите.l получается
прямая линия. Точка пересечения ее с осью абсцисс ( : == о)
дает величину n (О===Ко(п r)=?п==r). Ко можно ВЫЧIIС.1ИТЬ
из величины n.
Уравнение 3
При изучении взаимодействия rаптен аНТIIте,:IO с по
мощью paEHoBecHoro диализа чаще Bcero линейной завис!!'
мости не получается. В этих случаях желате,'IЬНО иметь дан-
30- 840
454 Х. Клейст
ные о пределах вариабельности констант ассоциации. Эти
пределы устанавливают эмпирически на основании реЗуЛЬта-
u r (ко.с)а
тов измерении. Уравнение Сипса в форме n == l+(Ko.c) a поз-
воляет вычислить константы ассоциации при различных зна-
чениях а. Здесь а это индекс rетероrенности антител, кото-
рый может принимать значения от О до 1. Для раствора ro-
моrеиных антител а === 1.
В r (ко.с)а r
ыражениеп l+(кос)а можно преобразовать в Iogr=n==
===a.logc+a.logKo (О<а<l). rрафик зависимости Iog( / r)
от Iog с представляет собой прямую с наклоном а. Таким об-
разом определяется величина а мера rетероrенности анти-
тел. Убывающие значения а (табл. 14) соответствуют воз-
растающей степени rетероrенности. Пересечение прямой с
осью абсцисс дает величину а. Ко.
Таблица 14. Константы ассоциации при различных индексах
ёетеРОёенности
а (из уравнения Сипса)
Предельные величнны Ко при 75%-ном
связыванни антител
0,5
0,7
0,8
0,025 40
О, 16 6
0,27 3,7
с помощью указанных способов был сделан расчет дан-
ных табл. 12 и 13 и получены следующие величины:
n==2,
а === 0,65,
к.о===2,7.10 6 (л/моль) по уравнению 1,
Ко===3,1.10 6 (л/моль) по уравнению 2,
Ко===3,5.10 6 (л/моль) по уравнению 3.
53.2.3.3. ВЬРlИсление величины свободной 'энерrии
Зная константу ассоциации, можно вычислить величину
«свободной энерrии» по формуле
др === RT. In Ко:
rде R rазовая постоянная и Т абсолютная температура.
Определив Ко для двух различных температур, можно вычис-
лить энтальпию НО по формуле
d .10 КО !1НО
dT === R.T2 '
53. Определение аффuнности антuтел 455
преобразовав ее в уравнение
k 2 д.н о (Т2 Тl)
log == 2з63 R t2Т1 '
1 ,
Затем можно определить величину энтропии ,15° по форму-
,10 :1FO == ,1HO Т ,15°.
53.3.4.
Дополнительные замечания
Метод количественноrо определения rаптенов выбирают
в зависимости от свойств caMoro rаптена и от ожидаемых
констант ассоциации. При использовании окрашенных rапте
нов и константах ассоциации от 103 до 105 л/моль MOjKHO
IIзмерить концентрацию rаптена по оптическому поrлощению.
Для иследования систем с константами ассоциации около
106 л/моль и больше нужны более чувствительные методы.
При константах ассоциации 106 107 л/моль целесообразно
использовать rаптены, меченные 14с. Константы ассоциации
порядка 107 108 л/моль заставляют работать с rаптенами,
меченными тритием. При высоких константах ассоциации точ-
ное определение свободноrо rаптена затруднено, так как он
в основном оказывается связанным. С друrой стороны, при
низких константах ассоциации количество rаптена, которое
приходится прибавлять для точноrо измерения, очень вели-
ко: оно необходимо для выявления разницы между общим
количеством rаптена и количеством связанноrо rаптена BHYT
ри диализноrо мешка, но вместе с тем оно затрудняет точ-
ное определение концентрации изучаемых антител. При про-
ведении paBHoBecHoro диализа нет необходимости в высо-
коочищенных антителах.
53.3.
r АШЕНИЕ ФЛУОРЕСЦЕНЦИИ
53.3.1.
Пр nНЦИll
в этом методе прямоrо определения константы ассоциа-
ции используется флуоресценция остатков триптофана n MO
лекуле белка. При длине волны возбу.ж:дающеrо УФ света
280 нм наблюдается флуоресценция с длиной волны ззо
360 нм. Связывание rаптена с антителом понижает интен-
сивность свечения. Степень этоrо rашения флуоресценции за
висит от числа антидетерминант, связавших rаптен.
30*
456 Х. Клейст
53.3.2. PeareHTbl и приборы
Раствор rаптена; раствор чистых антител; спектрофлуори-
метр.
53.3.3. Проведение опыта
Мелкими порциями прибавляют 10 20 МК.1 раствора rап-
тена к 1 или 2 мл раствора, содержащеrо 40 100 MKr ан-
тител. Реакцию целесообразно проводить в термостатируе-
МОЙ кювете спектрофлуориметра. КаждыЙ раз после очеред-
Horo добавления rаптена измеряют интенсивность флуорес-
ценции. Опыт считается оконченным, коrда прибавление rап-
тена перестает влиять на ее интенсивность, т. е. при дости-
жении постоянной величины. Из измеренной величины сле-
дует вычесть величину собственной флуоресценции раство-
рителя, а также внести поправку На разбавление, которое
происходит при внесении rаптена.
53.3.3.1.
Вычисления
Для определения константы ассоциации можно ВОСПО.аь-
зоваться уравнением Сипса. Доля связанных активных цент-
ров антитеи1 определяется из отношения наблюдаемоrо ra-
шения флуоресценции Qi к максимальному rашению Qmax.
Величину Qmax измеряют при условии связывания всех реак-
ционноспособных активных центров антител. Чтобы опреде-
JШТЬ число связанных молей rаПтена, нужно умножить от-
ношение QJQmax на число молей антитела и ero валентность.
Найденную величину вычитают из общеrо количества взятоr()
rаптена и получают количество свободноrо rаптена. Ко опре-
деляют при rашении, составляющем 50% максимальной ве-
.'1ичины.
53.3.4.
Оценка
Если в опытах с ДНФ-антителами rрафически предста-
вить зависимость rашения флуоресценции от концентрации
rаптена, то в большинстве случаев получается характерная
кривая. Однако в друrих системах [6, 8], коrда ф.'1)'оресцен-
ция не имеет ПОСТОЯННОЙ конечной величины, определение
Qmax часто бывает затруднено. Постепенное падение флуо-
ресценции нередко наблюдается при низкой аффинности анти-
тел. Для таких систем параллельно с измерением rашения
флуоресценции проводят исследование с помощью равновес-
Horo диализа.
53. Опреuеление аффuнностu ан.тuтеА 457
.\\00,], l'ашеНIlЯ ф:lуоресценции прост и не заниыаст ЫHO
ro времени (10 20 мин на одно титрование). Однако он тре-
бует прнменения высокоочищенных антител, и это ero недо-
статок по сравнению с равновесным диализом.
53.4. ОПРЕДЕЛЕНИЕ K'f) С ПОМОЩЬЮ
МОДИФИЦИРОВАнноrо МЕТОДА
ОСАЖДЕНИЯ СУЛЬФАТОМ АММОНИЯ
53.4.1. ПРИIlЦИП
Среднюю константу ассоциации для реакции rаптена со
специфическими антителами можно также определять с по-
мощью модифицированноrо метода осаждения сульфатом
аммония {3 5]. Принцип ЭТоrо метода мы объясним здесь на
примере взаимодействия N -8,2,4 диюrтрофенил - L лизина
(в-ДНФ-L-лизина) с антителами анти ДНФ. Подробности по-
лучения конъюrата с белком, приrотовления ЗН-ДНФ-L-лизи-
на, иммунизации и выделения антите.l приведены в специ-
альноЙ .питературе [4],
53.4.2. Реarеиты и приборы
Конъюrат 2,4-динитрофенола с бычьим 1'-r.lОбулином для
иммунизации; ЗН ДНФ-L лизин для опреде lения аффинно-
сти; жидкостный сцинтилляционный спектрометр.
53.4.3.
Проведение опыта
Берут 10 мкл разбавленноrо (например, 1: 5) раствора
чистых антител (степень разбавления зависит от акпIВНОСТИ
антител) и смешивают с 10 мк.п раствора ЗН-ДНФ-L-.ТIИзина
(10 М). К пробам с основным раствором прибавляют по
10 МК.1 раствора -ДНФ L лизина в различных концеНТQа-
циях.
Реакционную смесь оставляют на 30 мин при ко шатной
температуре. После этоrо в каждую пробу вносят по 30 мкл
ХОЛОДноrо насыщенноrо раствора сульфата аммония. По ис-
течении еще 30 мин пробирки центрифуrируют 30 мин при
2500 об/мин и 4 0 с. Затем из каждой пробы отбирают по
25 мкл надосадочной жидкости и вносят в 10 мл сцинтилля-
ционной жидкости. Измерение радиоактивности проводят с
помощью жидкостноrо сцинтилляционноrо спектро rетра.
Концентрации связанноrо и свободноrо rаптена опреде яют
по различию радиоактивности в надосадочной ЖИДКОСТII в
присутствии антитеJ1 к rаптену и без них.
458 .\'. Клейст
53.5. ЛИТЕРАТУРА
1. Nisonoff А., Pressmann D., Heterogeneity and average combining СОI1-
stant oi al1tibodies from individua1 rabbits, J. lттипо1., 80, 417 (1958).
2. Eisell Н, N., Methods in Medica1 R.esearch, Yearbook Medical PubIishers,
New York, 1964, У. 10, р. 94, 106 114.
3. Stupp }'., Yoshida Т., Раи[ W. Е., Determination of antibody-hapten equi
librium constants Ьу ап ammonium sulfate precipitation technique, J,
lттипоl., 103, 625 (1969).
4. Lameliп J. Р., Раи! W'. Е., R.ate оУ inCl'ease оУ antibody affinity in dШе-
rent rat strains, lnt. :\rch, Al1ergy, 40, 3Ы 360 (1971),
5. Larralde С., Jaпo Р., The effects of the DNP HSA: mo1ar ratio оп the
quantity and the аfПпНу of rat anti-DNP antibodies in the primary res-
ponse, lmmunochemistry, 9, 1209 1219 (1972).
6, КаЬат Е. А., Structura1 Concepts in lmmuno10gy <lnd lmmunochemistry,
НоН. R.inehart & Winston Inc., Ne\v York, 1968.
7. Pressmaпп D., Crossberg А. L., The Structt1r<l1 Basis of Antibody Specifi-
сНу, W. А. Benjamin lпс., Ne\v York Amsterdam, 1968.
8, Daпdliker W. В., Levison S. .4., lnvestigation of antigen-antibody kinetics
Ьу f!uOl"eSCence polarization, Immunochemistry, 5, 171 183 (1967).
9. Кierszeпbaum F., Daпdliker J., Daпdliker W, В., In\'estigation of the ап-
tigen-antibody reaction Ьу fluorescence po1arization, lmmunochemistry,
6, 125 137 (1969).
10. Кеllу К. А., Sehoп 11. Н., Froese 11" Кinetic studies оп antibody-hapten
reactions, Immunochemistry, 8, 613 625 (1971).
1], Portman А. J., Levison S. А., Daпdliker W. В., Anti-f1uorescein antibody
оУ high affinity and restricted heterogeneity as characterized Ьу f1uores-
се псе polarization and quenching equilibril1m techniql1es, Biochem. Bio-
phys. R.es. Соттип., 43, 207 212 (1971).
12. Levison S. А., Portmaп А. J., Кierszeпbaum F., Daпdliker W. В., Кinctic
beha'iior оУ antihapten antibody of restricted heterogeneity Ьу stopped
f10\" fluorescence po1arization kinetics, Biochem. Biophys. R.es. Соттип.,
43, 258 266 (1971).
13. Parker С. \\7" in: Handbook of Expcrimenta1 Imml1nology, D. М, Weir
(Ed,), Black\vel1 Scientific PubIikation, Oxford, 1967.
Н. Weder Н. J., Bichel М. Н., Verbessertes Gerat zur G1eichgewichtsdialyse,
Z. Аппа1. Chem" 252, 253 255 (1970).
54. IIолучение
rетеролоrичных антисывороток
к австралийскому антиrену
1;:, 13ИJIЫ\IС
5-1.1. ПРИНЦИП
До'IЯ БЫЯП/lения аI3стра,;шйскоrо (rепатит ассоциированно
ro) антиrена (r АА) обычно используют сыворотки больных,
случайно иммунизированных этим антиrеном при мноrочис
ленных переливаниях кропи. Как правило, это больные re
мофилией А и реконпалесценты после ожоrов или БО:IЬШИХ
хирурrических операций. Как источник получения антисыво
ротки эта rруппа доноров (учитывая их клиническое состоя-
ние) не :\10)кет обеспечить существующей потребности.
У больных rепатитом антитела к австралийскому антиrену
содержатся в столь низком титре, что сыворотки этих боль
ных едва ли можно применять для повседневноrо выявления
r АА. в сп язи с этим ВОЗНИКvlа проблема ПО.,1учения aHTHCЫ
вороток к r АА путем иммунизации ж:ивотных. Такие антисы
воротки, активные в реакции преЦИПIIтации, впервые в 1966 r.
получили Мелартин и БЛЮ;\1берr [1]; вначале эти авторы ИМ
мунизировали кроликов, а в последующие [оды и друrих
животных. Антиrенный материал, используемый при имму
низации :iЮ1ВОТНЫХ, можно разделить на три катеrории по сте-
пени чистоты (см. ниже).
54.1.1.
Иммунизация плазмой или СЫВОрОТКОЙ,
содержащей r АА
Животным в течение 6 8 недель HecKo"lbKO раз подкож
но, внутривенно или внутримышечно вводят сыворотку ию!
плазму, содержащую r АА (количество вводимоrо антиrена
зависит от вида животных). Как известно, в результате та-
кой иммунизации у животноrо образуются антнте"lа ко всем
чужеродным сывороточным белкам. Чтобы добиться :\IOНО
специфичности к r АА, полученную антисыворотку истощают
смесью нормальных сывороток или сборной (жидкой либо
сухой) плазмой. Удаление антите"l к посторонним белкам
путем специфической преципитации повторяют до тех пор.
пока в истощаемой антисыворотке не останутся только ан-
титела к r АА (анти-r АА). Разумеется, при этом титр аНТII-
сыворотки упадет в результате разбавления.
460 !( Вильме
Иммунизация
частично очищенным антиrеном
Содержащую [АА сыворотку фракционируют на сефадек-
се G 200 и отбирают первый пик элюата, который и paCCMaT
ривают как частично очищенный [АА. Иммунизированные
этим материалом животные отвечают интенсивным образо
ванием антител к содержащимся в нем белкам, в том числе
к [АА.
54.1.2.
Иммунизация
высокоочищенным аНТИl'еном
Иммунизация высокоочищенным [АА еще более эффек-
тивна блаrодаря тому, что отпадает необходимость в исто-
щении нежелательных антител. Основная трудность этоrо Me
тода заключается в приrотовлении чистоrо [АА.
LПобер и сотр. и ряд друrих исследователей [2 5] дости-
rают очистки r АА, применяя
1) флотацию или осаждение на слой 60%-ной сахарозы
при улырацентрифуrировании,
2) улырацентрифуrирование в rрадиенте CsCl или
3) зональное ультрацентрифуrирование в rрадиенте ca
харозы.
Для иммунизации животных смешивают равные части
очищенноrо от сывороточных белков r АА и адъюванта
Фрейнда. Ниже будут описаны лишь некоторые методы по-
лучения антисыворотки путем иммунизации цельной сыво-
роткой или плазмой (см. 54.1.1.).
54.1.3.
54.2.
54.2.1.
МЕТОДЫ
Реаrенты и приборы
Сборная человеческая сыворотка или плазма, содержа
щая r АА; полный адъювант Фрейнда; сборная человеческая
сыворотка или плазма для истощения; контрольные сыво-
ротки rАЛ и анти-rАА; шприцы для инъекций; прибор для
иммуноэлектрофореза.
54.2.2.
Схемы иммунизации
Схемы иммунизации крОJlИRОВ
ПО БОНaRеру, Дасу и rезериву [6 8]
Схемы иммунизации кроликов представлены в табл. 15.
Накопление антиrенноrо материала описано в разд. 54.2.3..
схема истощения дана в разд. 54.2.4.
54.2.2.1.
54. ПОЛ-Ч'lение йHТUCывOPOTOK к авСТ{1алиЙСКОАtУ антиzену 461
т аб.llща 15. CxeAlbl иммунизации кроликов
Схема Бонакера [6]
Схема Даса [7]
Схема [езерика [Н]
AHTнreHllblii
матер!!а.'!
1 О-кратныЙ KOH
центрат [АА,
полученный пу-
тем ультрацент-
рпфуrирования:
0,02 мл+2,00 М,1
адыоантаa
ФреЙнда (для
16 животных)
I
Сборная CЫBOpOT r AA CЫBopOTKa,
ка, содержащая разведенная
[АА, + В-про 1 : 2 1 : 4 ф!!
пиолактон; 2 мл зио.поrическим
r AA CЫBOpOT раствором
ЮI + 2 мл адъю
ванта ФреЙнда
Иммунизация (п/к подкожная, B/M внутримышечная,
B/B внутривенная инъекцип)
1 II день l я инъекция, п!к l я инъекция, в!м; 0,5 M.'I, в/в
сыворотку про
rревают 4 ч пр!!
60 ос
8 Й день
15 iI день
22 Й день
29-Й день
З6 й день
4З й день
50-й день
СроК кровопус-
кания
Истощение
2 я инъеlЩIIЯ, п/к 0,5 М.1, в/в
1,0 м,1 непроrретоЙ 0,5 мл, B/B
сыворотки, B/"I
0,5 :-1.'1, B/B
1,0 мл сборноЙ 0,5 1\1Л, п!к
сывороТlШ. в/в
2,0 1\1.11 сборноЙ cы 1,0 М.1, п!к
воротки, в/в
На 10 Й день пос 45 днеЙ
ле последней им-
мунизации (в за-
висимости от
титра)
Нормальной CЫBO \ СУХОЙ плазмоЙ
роткой
З я инъекция, п/к
} Перерыв
Повторение
l-ro цикла
1,0 мл, п/к
8 недель
НормальноЙ CЫBO
роткоЙ
4.2.2.2. Схема иммунизации морских свинок
по Nariuchi [4]
ЖИВОТНЫХ иммунизируют преципитатом [АА с анти-rАА.
Для этоrо лезвием бритвы вырезают участок arapoBoro rеля,
содержащий преципитат, в течение недеv1И промывают ero
физиолоrическим раствором и эмульrируют в смесителе с
полным адъювантом Фрейнда. Вводят 0,5 мл ПО.lученной
эмульсии подкожно морской свинке. Через месяц IIнъекцпю
повторяют в том же объеме, но без адъюванта. Спустя 2 не-
дели производят контрольное определение титра. В иммуно
электрофорезе полученная антисыворотка обычно проявляет
три активности: анти-IgG, анти-IgМ и анти rАА. Истощая
462 К. Виль.НС
ее нормальноЙ человеческой сывороткой, можно получить ре-
areHT анти-r АА, приrодный для выявления r АА во встреч-
ном э.'J('ктрофорезе.
54.2.2.3. Cxel\la Иl\I:мунизации лошади по rезерику [8]
Животному вводят 11 40 мл содержащеrо r АА элюата
(что соответствует примерно 7,5 мл исходной сыворотки) С
КО.10НКИ сефадекса G 200. Такие инъекции делают каждые
4-й 8 Й дни в течение 3 месяцев, сначала внутривенно,
а позже внутримышечно. Для истощения применяют су-
хую человеческую плазму, свободную от r АА.
54.2.3. Накопление I' АА по Бонакеру [6]
Накопление r АА производится двухэтапным улырацент-
рифуrированием в средах разной плотности при 40000 об/мин.
На первом этапе плотность сыворотки, содержащей [АА,
доводят до 1,2 r/м'л с помощью кристаллическоrо бромисто
ro калия и центрифуrируют в течение 25 ч. В результате
r АА флотирует вместе с липопротеидами. Затем фракцию,
содержащую r АА, разбавляют дистиллированной водой до
ПJlOтности 1,063 r/мл и снова центрифуrируют. При этом
r АА в ОТ.1IIчие от ф.l0ТИРУЮЩИХ липопротеидов осаждается.
54.2.4.
Истощение
полиспецифической антисыворотки
Из сборной антисыворотки (от одноrо вида животных)
отбирают небольшой объем, малыми порциями разливают
по пробиркам и в течение 48 ч при 40 ос истощают возра
стающими количествами нормальной человеческой сыворот-
ки или сухой плазмы. r АА представляет собой белок с ли-
пидным компонентом. r АА-неrативный истощающий матери-
ал должен содержать липопротеидные антиrены Ag, Lp и
Xh, чтобы соответствующие антитела не остались в сыворот-
ке анти r АЛ и не давали ложных положительных реакций.
После истощения преципитат отделяют центрифуrированием,
а аКТИВНОСТh анти-r АА надосадочной жидкости проверяют в
иммуноэлектрофорезе. ОпредеЛИR в этом предварительном
опыте оптимальное соотношение антисыворотки и истощаю-
щеrо материала, проводят истощение Bcero объема сборной
антисыворотки при постоянном перемешивании.
54.3. ОЦЕНКА
МЫ предлаrаем несколько схем иммунизации, заИi\IСТВО
ванных у разных авторов, так как не существует единоrо
метода оценки полученных антисывороток. Успех ИММУНllза-
54. Получение ан.тисывороток; к австралuйскому aHTuzeHY 463
ЦIllI l3 первую очередь зависит от индивидуальной II:YI:YI)'Hope-
активности каждоrо животноrо. Метод накопления [АА дает
наилучший материал для иммунизации. Кроме Toro, решаю-
щую роль иrрает чувствительность Toro метода, Д.1Я KOHJporo
собственно получают антисыворотку. Например, для реакции
связывания комплемента требуются высокотитражные анти-
сыворотки, тоrда как в стандартной реакции латекс аrтлю
тинации можно использовать слабоактивные peareHTbI. Метод
иммунизации, описанный в разд. 54.2.2.1, вполне приrоден
также для получения козьей антисыворотки, если дозу BBO
димоrо материала увеличить в 2 3 раза.
54.4. ЛИТЕРАТУРА
1. Melartin L., Вlumberg В. S., Production of Antibody against Australia
Antigen in Rabblts, Nature, 210, 1340 (1966).
2. Gerin 1. L., Holland Р. V., Purcell Я, Н" Au-Antigen Large-Scale Ршш-
cation from Ниmап Serum and Biocl1emical studies о! its Proteins, J. \"i-
rol., 7, 569 (1971).
3. Яарр W. J., Lehmann Н. Е, Sanwald Я" Puriiication о! НАА Ьу homolo-
gous Immunadsorbents, Amer. J. Dis. ChiJd, 123.324 (1972),
4. Nariuchi Н., Usui М., Mutahasi Т., А simple Method for Preparation о!
Anti-Au-Antigen Serum, Уох. Sang" 20, 283 (1971).
5. Schober А., Kaboth к., Thomssen Я., Reinigung des Au/SH-Апtigепs zur
Herstellung von Antikorpern im Vcrsuchstier, Z. med. Mikrobiol Immи-
nol., 156, 250 258 (1971).
6. Bonacker L., Becker W., Storiko К, SC!Lwick Н. 5., Tierische .\пtisеrа zum
Nachweis des НАА (Au/SH-Апtigеп), КIiп, \Vschr., 48, l-t-2З 1424
(1970) .
7. Das Р. С., Cash J. D., Cumming Я, А" А method for production oi antibody
to НАА in Rabblts, Brit. J. Нает., 20, 363 (1971).
8. Geserick а., Das Australia-Antigen (Аu/SН;НАА). Serologiscl1e Uпiеrsu-
chungen zu Nachweismethodik, Vorkommen, Eigenschaften und Bedeutung
des Antigens, Рrоmоtiоп-В Sсhrift, Berlin, 1972.
55. Получение
человеческих антисывороток
Б Rh антиrену
П. БРАУЭР
55.1. ПРИНЦИП
Для определения rрупповых антиrенов системы Rh тре-
буются значительные количества сывороток анти-Rh. Еще
большие количества сывороток необходимы для выделения
человеческоrо IgG, содержащеrо антитела анти Rh (D), KO
торый с.1УЖИТ профилактическим средством против резус
сенсиби.1IIзации. Сыворотки редких индивидуумов, которым
непредна;Уlеренно ввели Rh-несовместимую кровь, или жен-
щин, перенесших Rh-несовместимую беременность, не MorYT
удовлетворить столь большую потребность. Нужные количе
ства антисыворотки можно получить лишь путем намеренной
парэнтеральной иммунизации доноров-добровольцев [1 3)
Rh-неСОВуlестимыми эритроцитами. Частота образования aH
тител против данноrо комплекса Rh антиrенов зависит, ПОМII
МО прочеrо, от ero иммуноrенности. Как правило, путе!\'l MHO
rOKpaTHbIX инъекшrй антиrена удается получить антитела
нужноrо уровня специфичности; в этот момент у донора бе-
рут кровь.
55.2.
МЕТОДИКА
55.2.1.
Реаrенты и приборы
Осадок эритроцитов (четырежды отмытый изотоническим
раствором NaCl) крови rруппы О II соответствующей фено
rруппы Rh; эритроциты rруппы О и соответствующей фено-
rруппы Rh для выявления Rh-антител; смешанная сыворотка
труппы АВ; изотонический раствор N аС!.
Шприцы на 2 или 5 мл; иrлы для инъекций 1 и 51; цeHT
рифужные пробирки; стерильные и апироrенные флаконы
для переливания крови объемом 120 мл, содержащие 25 М.'1
rемостабилизатора (rерманская фармакопея, 7-е издание);
такие же флаконы объемом 300 мл, содержащие 5 М.'1
27 % -Horo раствора цитрата натрия; такие же флаконы объ
емом 500 мл, содержащие 10 мл 27,7%-Horo раствора цитра-
та натрия; такие же флаконы объемом 300 мл, содержащие
5 мл изотоническоrо раствора N аС!.
Комплект для взятия крови одноразовоrо пользования;
комплект для переливания крови однораЗОБоrо пользованиЯ.
55. П олцченuе >ШI.ТUСЫ80РОТО1(; 1(; Rh-антшену 465
Сифоны или иrлы для отделения плазмы; иrлы Штрауса
ДlIaMeTpO 1 1,5 2,0 мм; водяная баня; центрифуrа, в которой
можно центрифуrировать флаконы для консервированной
крови; холодильник для консервированной крови или холо
ДII.lьная камера (+4 ОС).
55.2.2.
Получение антиrена
Для иммунизации получают осадок эритроцитов rруппы О
и соответствующей феноrруппы Rh. Выбор доноров антиrена
II контроль состояния их здоровья производится В соответ-
ствии с официальными требованиями службы переливания
крови, а также с рекомендациями по проведению и контро-
.1Ю прививок У человека (см. 55.2.3).
Донор антиrена должен быть здоров и не иметь в анам-
незе rепатита. Выбирают постоянноrо донора, чья кровь уже
была ранее перелита по меньшей мере 6 реципиентам и ни
у одноrо из них за полrода не обнаружилось rепатита [4].
С помощью комплекта из локтевой вены берут 50 1 00 м.'1
крови во флакон на 120 мл, содержащий 25 мл rемостаби
.1изатора. После 35 мин центрифуrирования при 1400 об/мин
IIЗ флакона специальным сифоном или просто иrлой со шпри-
цем (стерильно) удаляют плазму. Осадок эритроцитов 4 pa
за промывают изотоническим раствором NaCl. С этой целью
ф.1aI{ОН наполняют изотоническим раствором до первона
чальноrо объема крови и перемешивают в нем эритроциты.
Для перемешивания достаточно c.aerKa вращать флаконы в
наклонном положении. После KpaTKoBpeMeHHoro перемеши-
вания эритроциты центрифуrируют 35 мин при 1400 об/мин,
а затем удаляют надосадочную жидкость. Отмывание дела
ют еще три раза. Отмытые эритроциты приrодны для имму-
низации. rлавное условие их приrодности безопасность в
отношении сывороточноrо rепатита.
55.2.3. Иммунизация
Проводить иммунизацию имеет право только врач. Он же
несет ответственность за всю процедуру. Лучше Bcero имму
низировать эритроцитами rруппы О, так как они приемлемы
Д.'Iя реципиентов любой rруппы. Кроме Toro, иммунизируя
эритроцитами rруппы О, можно надеяться, что содержащий-
ся в них антиrен будет для реципиента самым CII..1bHbIM из
чужеродных эритроцитарных антиrенов. Из-за большей без-
опасности (но не лучшей эффективности) внутримышечную
иммунизацию предпочитают внутривенной. Число инъекций
обычно зависит от динамики титра антител.
466 П. Брауэр
55.2.3.1.
ПервичнаJl иммунизация
Первичная иммунизация состоит из двух инъекций по
2 мл осадка эритроцитов с интервалом 3 месяца. Бустер-инъ
екцию делают тем же количеством эритроцитов через 3 ме-
сяца после второй инъекции. Дальнейшее введение произво
дят с интервалами 2 9 месяцев [4].
55.2.3.2. Вторичная ИМl\lунизация
При вторичной иммунизации вводят по 2 мл осадка эрит-
роцитов с 3 недельным интервалом. Если при этом уже дo
стиrнут максимальный титр, следующую бустер-инъекцию де- .
лают таким же образом через 2 9 месяцев [4];.
За ходом иммунизации следят путем определения титра
антител по стандартной методике rерманской фармакопеи
(7 e издание) [5 6]. Инъекции антиrена следует прекратить
в каждом из трех случаев: если нужный титр достиrнут, ec
ли, несмотря на иммунизацию, он не повышается или если он
необратимо падает. Успешная иммунизация завершается
взятием крови.
55.2.4.
Взятие крови
и приrотовление антисыворотки
Способ, объем и срок кровопускания определяются. необ-
ходимым количеством сыворотки, титром антител и, не в по-
следнюю очередь, состоянием здоровья донора (в соответ-
ствии с официальными требованиями службы переливания
крови) .
Если нужно получить большие количества сыворотки от
одноrо донора за короткий период времени, то нельзя обой
тись без метода плазмафереза, который состоит в кровопу
скании, отделении плазмы и реинфузии осадка собственных
эритроцитов донору. Детали этой процедуры реrламентиро-
ваны в составленных Иммунизационной комиссией r ДР «Pe
комендациях по проведению плазмафереза». При кровопу
скании берут необходимое количество, но не более 400 M
крови во флакон с 27,7%-ным раствором цитрата натрия.
После 35 мин центрифуrирования при 1400 об/мин плазму
отделяют специальным устройством или иrлой, соблюдая
стерильность, и помещают во флакон на 300 мл с 5 мл изо
тоническоrо раствора. Оставшиеся в первом флаконе эрит-
роциты вводят обратно донору. Плазму 30 мин проrревают
в водяной бане при 56 0 С. Происходит инактивация компле-
мента и тепловое выпадение фибрина [7]. После проrрева
55. Получе/f,uе антисывороток к Rh aHTU2eHY 467
полученную таким образом сыворотку 30 мин центрифуrи
руют при 1600 об/мин. Надосадочная жидкость, собственно,
II есть анти-Rh-сыворотка. Содержащиеся в ней посторонние
антитела к антиrенам системы АВО удаляют истощением на
эритроцитах соответствующей rруппы или инактивируют,
прибавив A или соответственно В вещества крови. При ис
тощении на 3 объема антисыворотки берут 1 объем эритро-
цитов, осторожно перемешивают, слеrка вращая флакон в
наклонном положении, и оставляют примерно на 12 ч при
4 0 с. Затем флакон центрифуrируют 35 мин при 1400 об/мин
11 антисыворотку отделяют. Если требуется, проводят допол-
нительное истощение. Если титр R11 антител достаточно вы-
сок, то простым разведением антисыворотки можно добить-
ся Toro, чтобы посторонние антитела к rрупповым антиrенам
иных (не АВО) систем не проявляли своей активности. Ис-
тощать антитела к минорным антиrенам не рекомендуется
из за значительных потерь специфической активности. [ото-
вую антисыворотку лиофилизируют в одном флаконе или
мелкими порциями либо хранят замороженной или в жид-
ком состоянии при 4 ос с консервантом (например, тиомер-
салом) .
55.3. ОЦЕННА
Предлаrаемая методика в основноы соответствует peKO
мендациям rруппы международных экспертов ВОЗ по проб
лемам приrотовления сывороток анти Rh. Это не инструкция,
а скорее примерный план, который может осуществляться
по-разному. Антиrенность данноrо Rh-комплекса и иммуно-
реактивность реципиента определяют, насколько успешной
будет иммунизация [8]. Антиrенность уменьшается в ряду
D E c C e, а вместе с ней и вероятность получения ак-
тивной антисыворотки. По данным fрубба и Лареона [9]
и Кука [10], при первичной иммунизации антиrеном D xo
роший ответ дают 60 90% реципиентов. Наиболее эффек-
тивна вторичная иммунизация [1]. Нередко сыворотки co
держат антитела смешанной специфичности. Испо.lьзуемые
методики крайне разнообразны, особенно в отношении аНТII-
reHHoro материала и схемы иммунизации. Пока неизвестно,
различаются ли результаты внутривенной, внутримышечноЙ,
ПОДКОЖНОй или комбинированной иммунизации [1, 4]. Про
должительность иммунизации определяет ее успех. Если титр
антител долrо не увеличивается, несмотря на введение анти-
reHa, то следует сделать перерыв или прекратить иМмуниза-
цию Вовсе.
468 П. Брауэр
При выборе лиц, подлежащих иммунизации, и наблюде-
нии за состоянием их здоровья в r ДР руководствуются сле-
дующими материалами:
1) инструкцией службы переливания крови от 7/111 1962 r.
(GBI. 11, S. 158) в редакции от 18/V 1967 r. (GB1. 11, S.
357) ;
2) инструкцией N!! 2 службы переливания крови от 2/111
1967 r. (GBl. II, S. 144);
3) директивой N!!l к инструкции службы переливания кро-
ви от 5/111 1967 r. (Vu. М MfG 1968, N!! 1, S. 1; Ber. N!! 6,
S. 73);
4) инструкцией по иммунизации добровольцев и получе-
нию антисывороток к rруппоспецифическим антиrенам кро-
ви от 18/V 1967 r. (GB1. 11, S. 357);
5) рекомендациями Иммунизационной комиссии [ДР к
проведению и контролю прививок У людей от 23/111 1970 r.
55.4. ЛИТЕРАТУРА
1. Kerde С., Ober einige Erfahrungen bei der Herstel1ung von Anti-Rh-
Testseren durch artifiziel1e Immunisierung von gesunden Blutspendern.
In: Blutspendewesen und Blutgruppenserologie. Schriftenreihe der arztli-
chen Fortbildung, Band ХХХII, УЕВ Verlag Volk und Gesundheit, Ber-
1in, 1965, Seite 159 167.
2. Furst а., Haussmaпп Н. а., Probleme bei der Herstel1ung von Ниmап-
Immunoglobu1in G (Ig G-Anti-D (Rho)). In: BIOTEST -Mittei1ungen,
Heft, 25 (1968), S. 111 120.
3. Schelloпg а., Referat der Podiumsdiskussion: Probleme bei der Beschai-
fung und Herstel1ung von Immunglobu1in-Anti-D, Ber. 13. Tag. dtsch.
Ges. Bluttransf., Graz., 1968, Вib1iotheca Haematologica, Nr., 32,
рр. 150 164, Karger, Basel New York, 1969.
4. World Health Organization Technical Report Series No. 468: Prevention
of Rh Sensitization. Report of а WHO Scientific Group, World Health
Organization, Geneva, 1971.
5. Deutsches Arzneibuch 7. Ausgabe/DDR, Band 1, Кар. XVI, Seren 5.0.0.1.
bis 5.0.0.5. Blutgruppentestseren fiir Erythrozyten, Akademie-Verlag, Ber-
1in, 1964.
6. Kommentar zum Deutschen АппеiЬuсh 7. Ausgabe/DDR, Band 1,
Кар. XVI, Seren 5.0.0.1 bis 5.0.0.3 Blutgruppentestseren fiir Erythrozyten,
Akademie Verlag, Ber1in, 1969.
7. Berge Н., Die Gewinnung von Testserum aus Zitrat und HeparinpIasmen
durch НitzefibrinfiilIung, Folia Haematologica, 88, 1 (1967), 88 92,
8. Matthes М., Gewinnung von Testseren und therapeutischen Immunglo-
bu1inen, Fo1ia Haematologica, 98, 1 (1972), 81 94.
9. Grubb, Larsoп, Zit. in Prokop О., Uh1enbruck G., Lehrbuch der menschli-
chen В1ut- und Serumgruppen, УЕВ Georg ТЫеmе, Leipzig, 1963.
10. Cook 1. А., Primary Rhesus Immunization of Маlе Volunteers, Bt'it. J.
Haematol,,21 (1971), 369 375.
56. Получение
человеческих антисывороток
к rрупповым антиrенам
системы АВО
П. БРАУЭР
56.1. ПРИНЦИП
С помощью rруппоспецифических АВО антисывороток не
только определяют rруппы крови, но и контролируют пра
вильность TaKoro определения непосредственно у постели
больноrо перед переливанием (что rарантирует безопас-
ность). Нормальные изоrемаlТЛЮТИНИНЫ человека !3 большин
стве случаев встречаются в таком низком титре, что не мо;
rYT быть использованы для определения rрупп крови. Поэто-
му прибеrают к иммунизации, чтобы вызвать подъем титра
этих антител, используя в качестве антиrена коммерческие
препараты rруппоспецифических веществ крови. Если инди-
видууму rруппы В вводить внутримышечно антиrен А, индн
видууму rруппы А антиrен В или же индивидууму rруп-
пы О любой из этих антиrенов, то в каждом с.1учае в op
rанизме реципиента будут синтезироваться изоrемаrrлютини
ны соответствующей специфичности. Как правило, путем по-
вторных инъекций удается получить достаточно высокие тит
ры антител. У иммунизированных доноров берут кровь и по
лучают антисыворотку.
56.2. МЕТОДИКА
56.2.1. Реаrепты и приборы
Препараты rрупповых антиrенов крови А и В (например,
поставляемые фирмой BIOTEST Serum Institut GmbH,
Франкфурт на Майне, ФР[); эритроциты rрупп А 1 . А2, А2В,
В; изотонический раствор NaCI.
Шприцы на 2 или 5 мл; иrлы для инъекций 1 I! S 1; цент-
рифужные пробирки.
Стерильные апироrенные флаконы для переливания крови
на 300 мл, содержащие 5 MJI 27,7 % Horo раствора цитрата
натрия; такие же флаконы на 500 МЛ, содержа щне 1 О М.Т
27,7% -Horo раствора цитрата натрия; такие же ф,таконы на
300 мл, содержащие 5 мл ИЗОТОНlIческоrо раствора N aCl.
Комплекты для взятия крови одноразовоrо ПО.Тf,З0вания;
комплекты для переливания крови одноразовorо пользо
вания.
Зl 840
470 П. Брауэр
Иr.:IЫ Штрауса. диаметром 1,5 2,0 мм; сифоны или иrлы
для отделения плазмы; водяная баня; центрифуrа, в кото-
роЙ можно центрифуrировать флаконы для переливания
крови.
56.2.2. Иммунизация
Проводить иммунизацию имеет право только врач. Он
же несет ответственность за всю процедуру.
Донору добровольцу соответствующей rруппы крови еже
недельно вводят внутримышечно одну «трансфузионную» еди
ницу rруппоспецифическоrо вещества. Соrласно определению
фирмы ВIОТЕSТ Sеrum Iпstitut, за одну «трансфузионную
единицу» принимается то количество rруппоспецифическоrо
вещества, которое, будучи добавлено к 400 мл крови rруп
пы О, способно снизить титр нормальных rемаrrлютининов
до 1/4 исходной величины [1].
Если иммунизация проходит успешно, то самое позднее
после трех инъекций титр должен повыситься на несколько
разведений. Иммунизацию можно продолжать далее вплоть
до заданноrо титра, пока он возрастает. Однако делать бо-
лее 5 7 инъекций не рекомендуется. Форсированные или
слишком длительные циклы иммунизации почти никоrда не
дают лучших результатов. За ходом иммунизации наблюдают
путем определения титра антите по стандартной методике
rерманской фармакопеи (7 e издание) [2, 3]. Как только
будет достиrнут заданный титр, начинают брать кровь.
Взятие крови
и получение антисыворотки
Способ, объем и срок кровопускания определяются необ-
ходимым количеством антисыворотки, титром антител и, не
в последнюю очередь, состоянием здоровья донора. На эту
процедуру полностью распространяются официальные требо-
вания службы переливания крови. Если необходимо полу-
чить большое количество антисыворотки от одноrо донора за
короткий промежуток времени, то нельзя обойтись без ме-
тода ПJIазмафереза, который состоит в кровопускании, OTдe
лении плазмы и ретрансфузип собственных эритроцитов. Де-
тали этой процедуры per ламентированы Иммунизационной
комиссией r ДР в «Рекомендациях по проведению плазмафе
реза». Нужный объем крови, но не более 400 мл, берут из
локтевой вены с помощью комплекта для взятия крови во
флакон с 27,7%-ным раствором цитрата натрия. После
35 мин центрифуrирования при 1400 об/мин плазму отделя-
56.2.3.
56. Пол.ч'lенuе антисывороток .к aHTuzeHaM CUCTe lbl АВО 471
ют, соблюдая стерильность, сифоном или иrлой со шприцем
и помещают во флакон на 300 мл, содержащий 5 мл изото
ническоrо раствора NaCl. Оставшиеся 13 первом флаконе эрит
роциты вводят обратно донору. Плазму 30 мин проrреI331ОТ
при 56 0 с. Происходит тепловое I3ыпадение фибрина и инак
тивация комплемента [4]. После проrрева полученную таким
образом СЫI30рОТКУ центрифупrруют 30 мин при 1600 об/мин.
Надосадочная жидкосп, предстаI3JIяет собой один из ABO
peareHToB; ее лиофилизируют 13 одном флаконе или малыми
порциями либо хранят замороженной или 13 жидком состоя
нии при 4 ос с консервантом (например, тиомерсалом).
56.3. ОЦЕНКА
Получение авиДНЫХ и высокотитражных антисывороток к
антиrенам АВО путем ИММУНJIзацrш добровольцев весьма
распространено. Получаются удовлетворительные по качест
ву peareHTbI в достаточном количестве и отпадает необходи
мость поиска антисывороток, активных от природы. Не в
каждом случае иммунизация ПРИВОДIIТ к :ж:елаемому успеху.
Встречаются рефрактерность, недостаточный подъем или He
ожиданное снижение титров антител. До сих пор неизвестно,
как избежать таких неудач. Нет данных также о ТО),1, заI3И-
-сит ли это от каких либо внешних фактороI3. В среднем 13 pe
зультате иммунизации титр антител увеличивается на 4 раз
ведения [5]'. Антиrены можно вводить подкожно, внутривен
но и внутримышечно. Для иммунизаЩIII лучше IIСПО,lьзовать
коммерческие rруппоспецифические вещества (субстанции
Витебскоrо), выделенные из слизистой свиноrо или .10шади
Horo желудка [5, 6]. При постановке опыта неоБХОДИ\10 учи
тывать указания фирмы изrотовителя. С тех пор как пояI3И
лись в достаточном количестве rруппоспецифические вещест
ва животноrо происхождения, применение слюны (от лиц,
-секретирующих антиrены АВО) в качестве aHTIIreHHoro ма-
териала потеряло свое значение. Эритроциты как антиrен не
используются, так как в малой дозе они часто не вызывают
ПОвышения титра [7], а в то же время посторонние антиrе-
ны, содержащиеся в этих клетках, MorYT вызвать нежела-
тельную сенсибилизацию; к тому же донор подверrастся He
Нужной опасности заражения сывороточным rепапIТОМ.
При выборе лиц, подлежащих ИМ:\fунизацип, и наблюде
нии за состоянием их здоровья в [ДР руководствуются ин-
струкциями, перечисленными в разд. 55.3.
31*
472 17. Брауэр
56.4. ЛИТЕРАТУРА
1. АrЬеitsапlеituпg der Firma Вiоtеst-Sеrum-Iпstitut GmbH Frапkfurt аm
Main fur die Anwendung der sреzifisсhеп ВlutgruррепsuЬstапzеп А, В
uпd АВ.
2. Deutsches Arzneibuch 7. Ausgabe/DDR. Band 1, Кар. XVI, Sеrеп 5.0.0.1.
bis 5.0.0.5. Вlutgruррепtеstsеrеп fur Еrуthrоzуtеп, Akademie-Verlag, Ber
Jiп, 1964.
3. Kommentar zum Dеutsсhеп АrzпеiЬuсh 7. Ausgabe/DDR, Вапd 1,
Кар. XVI, Sеrеп 5.0.0.1 bis 5.0.0.3 Вlutgruррепtеstsеrеп fur Erythrozyten,
Akademie-Verlag, ВеrIiп, 1969.
4. Berge Н., Die Gеwiппuпg von Testserum aus Zitrat- uпd Нераriпр1аsmеп
durch НitzеfiЬriпНШuпg, Fo1ia Haematologica, 88, 1 (1967), 88 92.
5. Hiissig А.. Montaпdon R., Pluss Н. R., Ober Iso- und Heteroimmunisierun-
gеп im АВО-Вlutgruррепsуstem im НinbIick auf die Frage des geHihr1ichen
О Sрепdеrs, К1iп. Wschr., 33, 11/12 (1955), 259 264.
6. Matthes М., Gеwiппuпg vоп Тсstsеrеп uпd therapeutischen ImmuпglоЬuli-
пеп, Folia Haematologica, 98, 1 (1972), 81 94.
7. Pokop О., Uhlenbruck G., Lehrbuch der mепsсh1ichеп Blut- uпd Serumgrup-
реп, VEB Georg ТЫеmе, Leipzig, 1963.
57. Смешанная «ультура лимфоцитов
.\, ШI\ЕНliЕ, А. КЕРНЕДЕl'
57.1. ПРИНЦlJП
Смешанной культурой ЛИМфОЦIIТОI3 (СКЛ) называют KpaT
КОI3ременное совместное КУЛЬТИВИРОI3ание :шмфоидных К.1е-
ток, принад:rежаш.их двум разным индивидуумю!. Б.1аrода
ря различиям по антиrенам rистосовместимости Оlешанные
лимфоциты взаимно стимулируют друr друrа, Этот феНО\1ен
расматривается как форма пммунноrо ответа in yitro. EI"O
впервые наблюдали Шрек и Донел.1!! [1] 13 1961 [., а зате f
БаЙн и ЛовенштеЙн (2) 13 1963 [. !! Бах !! Хпршхорн (3)
В 1964 r, устаНОВИ.lII иммунолоrическую Пр!!рОДУ этой peaK
Ц!lИ, не возникающей, как п следует О)ЮIДать, между лимфо
Ц!lтами rенетическп идентичных близнецов. Эффект стиму.1Я
ции выражен тем сильнее, чем больше rенетические раз:ш.
чия между индивидуумами. Как и при реакции бласт-транс
формации лимфоцитов (см. разд. 21 !! 58), в смешанной Ky.1Ь
туре появляются пролиферирующие .1имфоб:lасты. Чтобы
количественно оценить эту пролиферацию, идентифицируют
и подсчитывают ЛIмфобласты на цитолоrичеСЮIХ препаратах
И.1И определяют скорость синтеза ДНК в эт!!х К.1етках по
включению 3Н-тимидина за определенный промежуток вре-
мени.
При подборе совместимоrо донора Д.1Я траНСП:lантации
обычно большее значение придается реакции ЛИМфОЦИТОВ
реципиента на клетки донора, чем обратному взаlВ10деilст-
вию. Для оценки этой реакции Бах I! Войнов r 4] преД.10-
жили «однонаправленную» СКЛ, в которой используются дo
норские лимфоциты с предварительно заб.10кированноЙ pe
дупликацией ДНк. Эти лимфоциты, утратив соБСТI3енную
способность к про.:шферации, продолжают ФУНКЦIIOнировать
как носители антиrенов rистосовместимости, которые деilст
вуют активирующим образом на клетки реципиента.
;'7.2. МЕТОДИКА
57.2.1. Реаrепты и приборы
Небольшие флаконы с широким дном в 'качестве сосудов
для К'Ультивирования (на 20 или 50 !л): реЗ1иновые пробки;
алюм,иниеваяdюльrа толшиной 0,025 :\В1: с чистоЙ поверхно
474 Х. Ш венке, А. Кернедер
стью (изrотовляемая, напри'мер, УЕВ Leichtmetallwerk Rack
\vitz, РаКВИТII, [ДР); rрадуированные пипет,ки на 0,1; 1,0 и
5,0 мл; немерные капельные ПIIпетки с реЗIIНОВЫМИ rруша
ми; леЙКОIIитарные меланжеры; ,пеналы для ,пипеток; колбы
Эрленмейера со стеклянными бусами; при,бир, и; центрифуж
ные пробирки; химические стаканы; предметные стекла; Ka
мера Ней>бауэра для :подсчета :клеток;бунзеновская rорелка;
:\шкролитровый шпр,иц на 100,мкл.
Декстран (инфуколл 6% -НЫЙ,мол. 'вес 75000, УЕВ Se-
rumwerk Bernburg, Бернбурr, r ДР); порошкообразное «Kap
60нильное» железо (УЕВ Laborchemie Apolda, Апольда,
r ДР); сухая среда для кулыуры тканей Паркера, Иrла или
Иrла-МЭМ (Staatliches Institut fiir Immunpraparate und
Nahrmedien, Берлин Вейсензее, r ДР); пенициллин; стрепто
:ЧИIIИН; 8,4 % ный раствор би:карбоната натрия для инъекций;
1Итомицин С (Куо\уа, Токио); растворы Iкрасителей Д.ая
окрашивания по ПаппенrеЙ'му; ЗН-тимидин с удельной актив
ностью 4 !\:И!IМ,моль (УЕВ Isokommerz GmbH, Берлин, r ДР);
забуференный фосфатами изотонический раствор NaCl с
рН 7,4 (ЗФР); 5% -ный раствор трихлору:ксуоной кислоты;
{)чищенныйметанол; rиаМrИН; СЦИН11Илляционная жидкость.
Сухо-жаро'вой стерилизатор; термостат; аппарат для
встряхивания; центрифуrа с электрически'м указателем чис
",lа оборотов; микроскоп; ,стерилизующий фильтр из п{)р!Исто
ro стекла G5 (Saale-Glas GmbH, Иена, r ДР); жидкостный
сцинтилляционный счетчик (Packard, Даунерс [роув, Илли-
нойс, США).
57.2.2.
Подrотовка стекллнной посуды
Все манипуляции до и во время культивирования следует
производить в стерильных условиях. Безукоризненная чисто
та и стерильность посуды важнейшее условие успешноrо
культивирования. Вначале посуду отмывают от орrанических
заrрязнений водой с добавлением детерrентов (например,
Fit), затем тщательно промывают чистой водой и не менее
суток выдерживают в примерно 10% ной серной кислоте.
После этоrо посуду промывают большими объемами водопро-
водной воды и в заключение ополаскивают дистиллирован-
ной водой, высушивают, закрывают марлевыми пробкаМlI 11
алюминиевой фольrой и стерилизуют сухим )каром 20 мин
при 180 ос. Пипетки моют без детерrентов и обрабатывают
затем смесью концентрированной серной кислоты с бихро
матом калия. Их стерилизуют и хранят в пеналах из жеСТII.
57. Сllешанная культура ЛШ/фОЦllтов 475
;)7.2.:J. ПРИl'ОТОВJIевие питательной среды
В соответствии с указаниями на этикетке ОТJзеШИI3ают
нужное колпчеСТI30 СУХОЙ среды JI растворяю r I3 БИДlIСТИЛ:IИ
pUBaHHoH воде (например, 5,2 r сухой среды Парксра I3
500 мл). На каждые 0,5 JI среды добаI3:IЯЮТ 0,1 r сульфата
( r-
. .
J:'I
- ,",\:\""
> --,
.;
if
l
i ".
,
." J--.
.'-.':" .
».:- .
,<;х_!
у
!C'
I
": ':' .
I 1
,.
'"
-- -"9. _
.. ,,---""
- t- :
.", ..
:-' - '.Z:
.> '.
1: ..,
" -
' ,. ."
'S:.......
Рис. 107. Стери.lIIзующая фильтраuия питательной среды. Среду из cтeK
.151l11lOro UИJJИндра наливают в IIУТЧ ФИШ,ТР И С ПО lOщыо 130доструЙноrо Ila
сос а фильтруют lJ стоящиil под стекляиным КО.1паком флакон. Справа стоит
пустой, а слева заполнеНIlЫll и закупореlllШll ф.1акон Д.1Я питаТС.1ЫlOiI
С!.С,.1,Ы.
стрептомицина 11 100000 МЕ пеНIIЦИ.1лпна G, затем с по
мощь,Ю 8,4% Horo раствора Викарбоната натрия доводят рН
среды до 7,4. Прпrотовлснную среду стерилизуют пропуска-
НIIе:\1 через бактернаJIЬНЫЙ фильтр G 5 (рис. 107) II хранят
в ХОЛОДИЛЬНIше I3 rерметично закупоренных флаконах. Она
сохраняет rодность в теченпе нескольких месяцев.
57.2.4. Выде:lенис ЛШ f(Iюцитов
Для отделения лимфоцптов от присутствующил OДHOBpC
менно с ними в кроI3И rpaHy.1oЦIIТUI3 и МОНОЦIIТОIЗ ИСПО.1ЬЗ\>
ют способносТJ> пос.;Iедних фаrОЦlIтировать часТJШЫ Же.lсза.
-476 Х. Ш венке, А. Кернедер
Наrруженные железом фаrоциты быстро оседают [5]. У по-
rенциальноrо донора и реципиента, чьи лимфоциты ну.ж:но
эксплантировать в смешанной Культуре, берут кровь из вены
и аждую пробу отдельно дефибринируют в колбах Эрлен
меиера со стеклянными бусами, соблюдая стерильность. От-
делив кровь от выпавшеrо фибрина, смешивают ее в соот-
:t . .
..' - -""':_",,:л. -: ::К'
'''''''"'''''''''''''''Ь 11
..
---
ii!
"
.
,
I
'5< '
. ::. >iJ <. :.. :: , " , $.
Рис. 108. Оседание эритроцитов через 30 мин ПОС.lе прибавлеllИЯ инфУКО.Т].Ы
(пробирка постав:/( на под уr.Т]оМ 45").
ношении 3: 1 с 6% HЫM инфуколлом И на 1 ч оставляют в
пробирках при 37 ос (30 мин под уrлом 450, а затем 30 мнн
В вертикальном ПОollожении) (рис. 108 и 109). Слой плаЗ:\IЫ,
'содержащий лейкоциты, отсасывают стерильноЙ капсльноЙ
пипеткой с rрушей, смешивают в пробпрке (' небольшим ко-
'Iичеством (<<на кончике ножа») порошкооGразноrо «каrбо-
НИльноrо» :iКелеза II встряхивают в течение 30 мин при 37 сс
в специальном аппарате (рис. 110). Пос.1е :JToro проБИРКII на
15 30 мин ставят вертикально для оседания K.:1CTOK под деЙ-
.ствием тя:;кести, а затем отсасывают верхний С.lОЙ плаЗ\IЫ,
в котором содер:iКИТСЯ 95 98% .тIИМфОШlТов (фото 111. 1а
и lб, стр. 481).
Для сохранения стерильности псе сосуды Д.:IЯ КУJIl>ТШШ-
рования должны быТ!) плотно закрыты. Все процедуры, пrll
которых нужно открыть сосуд, влить ИЛИ отлип) cro CO.1l'r
.жимое, производят над пламенем rазовоЙ rОрСJIlШ. ОБЖllrать
следуст не только rорлышко сосуда, но IJ ПJшетку.
57. С,\lешанная ку/!ьтура ЛIl,'lфОI{uтuв 471
.
о:'
-
.. 1
.
"
;
'.
4
.t:..
:"1
.. ,
f
I
l'
i
'-
\ "
:J
:.J"'
"{
'/f
,
РИс. 109. Оседание эритроцитов через 1 ч пос
.тIe прибавления инфукол.'1а.
:"'";:jri"#; ,
57.2.5.
Подrотовка «СТИ:l.\Iу.lIИРУЮЩIIХ»
11 «(Qтвечзющих» I :IeTOI
«Стимулирующие» клетки это лимфоциты потенцпа:IЬ
Horo донора (А), обработанные митомнцином С. Онн сами
уже не MorYT реrировать на чужеродные лимфоциты, но СПо
собны стимулировать их. «Отвечающие» К.'IетКИ это лпмфо
циты реципиента (В). в однонаправленной смешанной КУЛЬ
туре как раз п требуется оценить реакцию лимфоцптов В на
лимфоциты А.
Обе суспензии лимфоцитов раздельно центрпфуrпруют
15 мин при 150g. Каждый осадок клеток ресуспендируют в
3 мл среды Паркера, содержащей 20% Э:\lбриональной Te
лячьей сыворотки (ПЭТС), и подсчитывают число лпм:фоuп
тов n камере Нейбауэра.
,
If
'. ,
,
I
i:'
:.......; ii
. , :::
'У1.с:
, i;
,'" . .", ...
. ;!fW"'''; i'
:' ' '.
,- ,"
.,'
1<i , :' :'
..: ::
':: '.'
.:=::t-.
::
. <'lfтJШJ /, , /J
. . .'"
'0
'"""'\
,
.:: ;
".
t ,.. '. ..
.." '
..
" [ <
", ,.,.-., ."
.,.... """'...,.......... .w., ......
Рис. 110. ПРllбор для встряхивания, стоящиii в тер:\lОстате. При встряхп
Ы-,НIIИ пробнрка медленно перекатывается по дну коробки туда и обратно.
:::r---", ."." «.::
! .
i
.,
-4
\ -.
""\"
. 'А.
. /.f!:.
. < -:.
,'R
i'
м
1
'.-.
'. .
.."........
и.! >/ }" .fC '.: '7.,;;. ",
.". ' ....
'. /,/,/." 'A>:- :AIW ;",',
;'"
.'
:":-'
',.
i4'
. :',.
.' :' "t " 1 -' 1 "i "." t i.. w
'.j
..."<!. ?f. '.: :'. -'.:.
... .;,?" '," '''-:'. ....'. и '" .' ,,.. .". , ".:''''
1-:-
."'............... ,..
. .v
"
/JY ';; .{,Й1Р."4'4'z;::/#Af,.l#$'" х :'Й IY 4%»-- -A' /:' ''''т, -,,",...n' "':"';"
..,
"//.'.'r
Рис. 111. ПриrОТОI3леllllС СУСНСII:НIII лнмфоItIIТОВ. 1\1 J{.!]сп,и донора; АН
клетки донора, обработаНl/I,f п \IiIТО1.IИ!{IfIЮ С; В клетки реципиента
57. СJllешанная культура лиАtфоцитов 479
«Отве(ll1Юll{LU.! клеТI{И. Суспензию В и одну треть суспен-
:НШ А (А 1) в разных пробирках разбавляют средой ПЭТС
до концснтращш 1.106 лимфоцитов В 1 мл И оставляют в хо-
.10ДIIЛЬНIIКС.
«Стuл,tУЛllРУЮlЦllе» клетки. Оставшуюсн суспензию А
(:\ II) разбаВ:IЯЮТ до концентрации 2. 10 Н лимфоцитов в.
1 IЛ, добаВJIЯЮТ по lб MKr митомицина С (в 0,2 мл среды)
на 1 мл СУСПСНЗIIИ И инкубируют 30 МIIН при 37 0 с. Затем
!\IIПОМIЩIIJ-I однократно отмывают средой, осадок лимфоцито!>
ресуспендируют il 1 мл среды ПЭТС и доводят их концентра-
цию до 1.106 В 1 мл. После этоrо все приrотовленные суспен-
зии в надписанных пробирках ставят в штатив (рис. 111).
57.2.6. Культивирование
Сосуды для культивирования перекрывают стерильными
резиновыми пробками, надписывают 11 с помощью 5 милли
:I1ITpOBbIX П1IП('ток заполняют лимфоцитарными суспензиями
(рис. 112).
1. Опыт (на рисунке М): 2 мл суспензии А II (блокиро
панные митомицином «стимулирующие» Ю1етки) и 2 мл cyc
пензии В (интактные отвечающис клетки) дают общиЙ объем
смешанной культуры 4 мл. Каждая такая культура дубли
руется.
2. Отрицательный контроль (А,' В): по 4 мл суспензий
А 1 и В культивируют в ОТДельных сосудах (heCTlI:-'1У.тшро
ванные культуры).
В последнее время в качестве отрицательноrо КОН1роля
используют культуру лимфоцитов реципиента, представляю
щую собой смесь интактных клеток 11 клеток, обработанных
митомицином С (мит.) . Результат опыта в этом случае BЫ
А +В
ражается частным от деления B:::+ B .
Сосуды для культивирования тотчас после заполнеНIIЯ об.
жиrают над пламенем, закрывают пробками и свер.ХУ допол
нительно rерметизируют алюминиевой фольrой (рис. 113).
Над уровнем жидкости в сосудах долж:ен оставаться С:IOЙ
воздуха достаточной высоты, иrрающий роль rазовой фазы.
Сосуды в течение 7 днеЙ держат в термостате при 37 ос
и ежедневно осторожно встряхивают.
57.2.7. OцcНI,a СТИl\Iулирующеrо эффекта
Стимулирующий эффект в смешанной культуре лимфоци
ТОВ в зависимости от ero силы отражает ту или иную CTe
пень несовмеСТIIМОСТИ донора и реципиента. Существует Два
различных способа ero оценки. Если все культуры были з!l
...ё
.. "
.",."
......... ..
...- .
:..;; .;S
;; __.
./
' f ' j'"'
" . .
( '.
,
..
\
\
, f .
/{'
../
:",'
'",'
" '
-<) .
'1. ' ....:
, ,.,
.. . ';
": ' 7 . :;,' "1-.-
"
..
'.
\
"" >
.
."
{'
...
.
54.:::::;:.. .
; [,
"'»>. .
"'.
..... ,;;
".' : . .;: ...
,,'" ".:"
, -" \
. ....
. ," .'
: ....:.:.; ' : '.. "; ..;:
РР.С. 112. СтерИЛЬНЫII пере нос к.1СТОЧIIОЙ суспензии JI3 J1роБНрJ\И f) сосудик
Д.' я J\) .1ЬТИШIРUП<] ни Н.
.(
t\
\
....... ."1' ,.Ь
". ;: -'.> .: ' .-' - .,-
/ '.
{ ,."
# . "
::-.. '; ";\:::;;\7; #.
.' " '" , {<...,
, _ . . :... . ,.v;, . > ;:;( "" ( "
от ./ i:-,'" '""
.
....
:' ..
,"';,"
/ ;"
.
...
.' .;
. '\
',"';:(
.
... \i; <,it.i' .
. .: .; ;. . : .t-:;'S: 4 '» ':'
i
. и _, ._
"':./,."':.:.,;r...w:: v ... :
. . " .
Рис. 113. Заполненные и надписанные сосудики Д..1Я !\у.Т1ЬТlIВИРОБЗНIIЯ, rcp-
tстнзироваllные резиновыми пробкзми н алюминисвой ФОЛl,rой.
57. САtешшцшя культура лимфоцитов 481
дублированы, то оба способа можно осуществить параллель
но. Все последующие этапы методики не требуют стеРИJIЬ-
ных условий.
.57.2.7.1. ЦИТОМОрфОJlоrия
После 7 дней культивирования культуры извлекают из
термостата и центрифуrируют при 150g. Из осаДКа делают
мазки на предметных стеклах и окрашивают клетки.
Окрашивание по Паппенzейму. Мазки сушат на воздухе
и наносят на них смесь раствора Май rрюнвальда с мета-
нолом (100 мл раствора, 200 мл очищенноrо метанола, пе
ред использованием фильтруют). Оставляют на 5 мин и CMЫ
вают дистиллированной водой. Затем 20 мин окрашивают
раствором rимза (перед использованием разбавляют 1: 1 О
дистиллированной водой), смывают дистиллrрованной водоЙ,
ставят препараты под уrлом в штатив, высушивают их на
воздухе и затем протирают обратную сторону предметноrо
<::текла солянокислым спиртом. Микроскопируя под иммерси-
ей участки мазка позади «фестона», дифференцируют и ПО,.],-
<::читывают 200 500 клеток. При этом определяют процент
бластов, переходных форм и клеток в состоянии митоза. Pe
акция считается положительной (стш,IУЛИРУЮЩИЙ эффект
имеется), если в смешанной культуре находят 7% и более
бласт-трансформированных клеток или отношение этих пока
зателей для опытной и контрольной культур превышает 2,0
(см. фото 111,2).
') ')
.;:>/ . .I. .
ВК:lючение ЗН-ТЮШIДипа
Этот способ оценки стимулирующеrо эффекта состоит
в том, что в каждую культуру добавляют меченый ЗН ти
мидин и измеряют в конце опыта метку, включенную в про
цессе синтеза днк. Полученная таким образом величина
служит мерой пролиферации стшvrулированных клеток. За
16 ч до конца опыта в каждый сосуд с помощью l\ШКрОЛИТ-
pOBoro шприца вносят по 0,5 мкКи ЗН-тимидина на 1 мл
клеточной суспензии (рис. 114) и помещают культуры обрат-
но в термостат. По окончании инкубации клетки отделяют
центрифуrированием, а затем один раз промывают ЗФР, три
раза 5 % ной охлажденной во льду трихлоруксусной КИс
лотой (для их осаждения) и один раз метаноло !, чтобы
отмыть невключенную метку. Состав ЗФР с рН 7,4:
NaCI 7,0 r/л
Na a HP0 4 2,0 r/л
КН 2 РО 4 0,36 r/л
482 .\ Ш венке, .4. Кернедер
Осадок фиксированных клеток в течение 30 мин на BO
дяной бане при 60 ос растворяют в 0,5 мл rиамина. Если
растворение произошло не полностью, то можно увеличить
количество fиамина; в этом случае следует учесть общий
объем прибавленноrо rиамина при последующих расчетах_
i jfJ, .
- '.
. ":'
;:'.;> , .-1:;. ..... 0'-
t.-
., .< .:.:"'
"
.,;
" '
.
-t
1: _ __ ;"."
'а d\oa\<1i :;
uahl c:t ij
. :.... , ,>
':. ,( ,.
. I
,- -1
4--
....1
.... . ....
'p.; { .....
"''''. ,
"? . ... f" .
i .;;
_#- "
{l
",.
=;.,..-. {:. . >
.')-.; '.
".j,
:".1'"::-
::.;... jj"r.':
'i ! .. ...s
::.:",-:$ '..'
'" '. . . .
.'",
t
": ; ...
'- ""...
.=:ш,'
Рис. 114. Внесение З:Н тю.Щ:ЩlIа n сосудик для ку.1JЬтивирования, который
для этой цели на HeCKO.;JbKO минут извлекают из термостата. Чтобы cдe
.;JaTb удачныЙ фотоснимок, ПРИШu10СЬ удалить са.1Фетку, которую мы обыч
но рассти:[ае на СТО.1е во время этой процедуры. Надпись на плакате:
(;Опасно. Радиоактивное ИЗ.1учение».
и наконец, клеточныЙ экстракт вносят в сцинтилляционную
жидкость Н измеряют радиоактивность (имп/мин) с помощью
Жидкостноrо СЦИНТИ"lляционноrо счетчика. Результат выра-
Жают как соотношение активности опытных и контрольных
Культур. Например, в смешанной культуре лимфоцитов от
сибсов, идентичных по HL-A, это соотношение равно 1,13 +
+ 0,44, что раСЦС'Нlшается как отсутствие стимулирующеrо
эффекта; при положительноЙ реакции (стимулирующий эф-
фект имеется) оно прсвышает 2,60 [6].
При работе с радиоактивным материалом на рабочем ме-
сте обычно расстилают салфетку. Всю использованную посу-
ду и перчатки сразу Л{С после окончания опыта обильно про-
57. Снеluанная культура JbUмфоцитов 483
мьшают водой, которую мо)кно сливать в канализацию.: Раз
веденный раствор 3Н-тимидина активностью до 100 J\1j ки под
четко сделанной этикеткой можно хранить в обычной лабо
ратории, исходный же раствор должен находиться в сейфе
.тraборатории, имеющей разрешение на работу с изотопаМи.
57.3. ОЦЕНКА МЕТОДА
СКЛ блаrодаря высокой ИММУНОЛOI'ической специфично-
сти используется r лавным образом в экспериментальных ие-
С"lедованиях. Следует также отметить значение этоrо метода
в клинической трансплантационной иммунолоrии r7 9]; од-
нако при практическом подборе совместимоrо донора сме-
шанной культуре лимфоцитов предпочитают серолоrическое
типирование HL-A, так как на проведенис СКЛ требуется
MHoro времени и к тому же при пересадкс трупных opraHoB
нельзя получить донорские лимфоциты. TeYI не YleHCe данные
СКЛ имеют первостепенное значение для интерпретации Ha
блюдаемых расхождений между серолоrической (по HL A)
il клиническоЙ (трансплантация) оценками rистосовместимо
сти и особенно для дальнейшеrо изучения иммунолоrических
основ трансплантации [10], тем более что, например, у MЫ
шей rенетические различия, выявляемые в СКЛ, MorYT не
определяться при серолоrическом типировании [11] 1.
Для успешноrо осуществления метода СКЛ требуется
большая тщательность в работе, достаточный опыт, постоян
ство условий эксперимента и, конечно, самое cTporoe соблю
дение стерильности. Если все это rарантировано, метод дает
хорошую воспроизводимость в тех пределах, которые вообще
возможны для биолоrической тест-системы. Стандартноrо
метода СКЛ пока не существует. Каждый исследователь
обычно проводит мноrие этапы по-своему. В частности, ис
пользуются разные методы выделения лимфоцитов. Фаrоци
тоз частиц железа как способ очистки лимфоцитов более TPy
доемок, чем, например, разделение по адrезивности или цeHT
рифуrирование в rрадиенте плотности, но это единственный
метод, позволяющий выделить все лимфоциты без потерь.
Выделение на колонках [12] или в rрадиенте плотности по
Бёйюму [13] приводит к подавлению активности клеток в
СКЛ [14]. Применение rепарина вместо дефибринироваНIlЯ
1 Соrласно современным представлениям, серолоrически определимые
а,lлоантиrены и стимулирующий эффект в СКЛ контролируются разными
rенетическими локусами в пределах большоrо комплекса rистосовмести-
ости. П рим. перев.
484 х_ ш венке, А. Керденер
дает больше лимфоцитов, однаКО неблаrоприятно отражается
на фаrоцитозе частиц железа. Преимущество дефибринирова-
ния заключается в одновременном удалении тромбоцитов.
Для специфической бласт трансформации в СКЛ требуется
небольшая примесь (1 2%) rранулоцитов и макрофаrов
[15, 16] - Поэтому некоторые авторы вообще не отделяют
:lИмфоциты от друrих лейкоцитов [17 19].
В однонаправленной СКЛ роль стимулирующих клеток
MorYT иrрать не только лимфоциты таким образом дейст
вуют, например, моноциты и l'ранулоциты. Однако чаще ис-
пользуются блокированные лимфоциты донора. Чтобы бло-
кировать синтез ДНК в этих клетках, применяют митомицин
С [4, 18], азотистый аналоr иприта [201 или peHTreHoBcKoe
облучение [21] в дозе около 4000 рад. Митомицин С и рент-
reHOBCKoe облучение наиболее приемлемы. Интенсивность
бласт--трансформации в однонаправленной СКЛ обычно вы-
ше, чем при взаимной стимуляции. По видимому, лимфоци-
ты настолько сильно взаимодействуют, что стимулирующая
способность клеток падает [6, 18]. При слабой бласт-транс-
формации пропорцию стимулирующих клеток в культуре цe
лесообразно увеличить вдвое [22].
Следует использовать 3Н-тимидин с возможно меньшей
удельной активностью. Это обеспечивает почти постоянную
скорость ВКv1ючения метки в течение 24 ч, тоrда как 3Н-ти
мидин высокой удельной активности, добавленный COOTBeT
ственно в меньшей концентрации, претерпевает частичный
распад до тимина и диrидротимина под влиянием клеточных
ферментов [21]. Важным источником ошибок может быть
неполное растворение осажденных кислотой клеток в rиами
не, приводящее к заниженному результату.
В последнее время делаются попытки разработать мик
рометод СКЛ [23 25], который существенно уменьшил бы
необходимый объем крови. Для этоrо СКЛ ставят в малень
ких пробирках из полиэтилена или на пластинках для мик-
рокультивирования (Falcon Plastics, США). Суспензии лим
фоцитов нужно тщательно очищать, в особенности от ЭРИТР9
цитов. В культуре должно содержаться примерно
0,5.106 клеток. В микрометоде используют питательную cpe
ду с добавкой N -2-0ксиэтилпиперазин-2-этансульфокислоты.
Относительно необходимости rазовой фазы, обоrащенной
С0 2 , мнения расходятся. В микрокулыуры нужно вносить
относмтельно большие дозы 3Н тимидина, иначе количесТВО
включенной метки будет ниже чувствительности счетчика.
Дальнейшие подробности относительно СКЛ чнтате.1Ь
сможет найти в литературе [6, 25, 26].
57. С,нешанная "уль тура лимфоцитов 485
57.4.
ЛИТЕРАТУРА
1, 5c! rek R., Doпelly W. J., Diffet"ences bct\vcen lymphocytcs oI leukemic
and non-Ieukemic patients with respect to morphologic features, motility,
and sensitivity to guinea pig serum, Blood, 18, 561 571 (1961).
2. Bain В., Vas М. R., Lowensteiп L., А reaction between leucocytes iп mi-
xed peripheral bIood cultures, Fed. PI'OC., 22, 428 (1963).
3, Bach F. Н., Нirschhorп К, Lymphocyte iпtеrасtiоп: А роtепtiаl histocom-
patibility test iп vitro, Sсiепсе, 143, 813 814 (1964).
4. Bach F. Н., Voynow N. К, Опе-wау-stimulаtiоп iп mixed leucocyte cul-
tures, Science, 153, 545 54 7 (1966).
5. Johnson О. J" Russell Р. 5., Rеасtiоп of humап Iymphocytes in сиltше
to components of the medium, Nature, 208, 343 345 (1965).
б. 50rensen 5. F., ТЬе mixed Iymphocyte culture intel'action, Acta РаН!. Mic-
robiol. Scand. Sect. В, Suppl., 230 (1972).
7. Bach F. Н., Transplantation: Раiriпg of dопоr and recipient. Lymphocyte
typing and stimulation of leukocytes in mixed cultures are uscd to sclect
donors for transplants, Science, 168, 1170 1179 (1970).
8. Dupoпt В., Nielseп L. 5., 5vejgaard А., Relative importancc oi Four and
LA loci in determining mixed-Iymphocyte reaction, Lancet Н. lЗ36 1340
(1971) .
9. Jeaппet М., Нistocompatibility testing using leucocyte typing and mixed
Iymphocyte culture in kidney tt'апsрlапts, Helv. med, Acta. 35. 168 179
(1970).
10. Кissmeyer-Nielseп Р., 5vejgaard k, Т!lоrsЬу Е., Possibility oi а third
sublocus, Transpl. Proc., 3, 81 84 (1971).
11. Festeпsteiп Н., Abbasy К, 5ac!rs J. k, Olivel" R. Т. D., Serologically
undetectable immune response in transplantation, Transpl. Proc., 4, 219
222 (1972).
12. Oppenheim J. J., Levenfhal В. О., Hersll Е. М., ТЬе trапsiоrmаtiоп of
column-purified Iymphocytes with 110n-speciiic and specific апtigепiс sti-
muli, J. Immunol., 101, 262 270 (1968).
13. Вбуит А., Sераrаtiоп of leucocytes from bIood and Ьопе mапо\\', Scand.
J. clin. Lab. Invest., 21, suppl., 97 (1968),
14. Bain В., Pshyk К, Enhanced reactivity in mixcd leucocyte ctlltures after
separation of mononucIear cc!ls оп Ficoll-Hypaque, Transpl. Proc., 4,
163 164 (1972).
15. Elves М. W., The effcct of polymorphonucIear leucocytes оп bIast trans-
iormation of Iymphocytes in Ьиmап mixed leucocyte cuitures, Тrапsрlап-
tаtiоп, 5, 1416 1422 (1967).
16. Rode Н. N., Gordoп J., The mixed leucocytc culture: а three соmропепt
system, J. Immunol., 104, 1453 1457 (1970).
17. 5chellekens Р. Th. А., Eijsvoogel V. Р., Lymphocyte trапsiоrmаtiоп in
vitro. 1. Tissue culture conditions and quantitati\Te mеаsurеmепts, Clin.
схр. Immunol., 3, S7I 584 (1968).
18. Vodopick Н. А., Rupp Е. М., Gen-gozian N., The ыdirectional in vitro
mixed Ieucocyte reaction: А mutual inhibitory phenomenon? Тrапsрlап-
tation, 7, 155 164 (1969).
19. Rychlikovti М., lvtinyi Р., Pet's6nliche Mit(eilung, 1971.
20. Ceppelliпi R., Franceschiпi Р., Miggiaпo 1'. С., Trideпte О., Dirесtiопа!
activation of mixed Iymphocyte cultures (А prcliminary repOI't), Iп: His-
tocompatiыlity Testing, 1965, Munksgaard, Copenhagen, 1965.
21. Kasakura 5., Lowenstein L., The factors affecting the strength оУ «ОП\'-
way» stimulation with irradiated leucocytes in mixed leucocyte cultures,
J. Immunol., 101, 12 17 (1968).
486 Х. Шве,."ке, А. Керде,."ер
22. Aтos D. В., Bach Р. Н., Phenotypic expressions of the major histocompa
tibility locus in тап (HL-A): Leucocyte antigens and mixed leucocyte
culture reactivity, J. ехр. Med., 128, 623 637 (1968).
23. 5engar D. Р. 5., Terasaki Р. 1., А semimicro mixed leucocyte cu1ture test,
Transplantation, 11, 260 267 (1971).
24. Hartzтan R. J., 5egall М., Bach М. L., Bach Р. Н., Histoc.ompatibility
matching. VI. Miniaturization of the mixed leucocyte culture test, Trans
plantation, 11, 268 273 (1971).
25. Кissтeyer-Nielsen Р., Thorsby Е., Ниmап transplantation antigens, Trans-
plant. Rev., 4, 1 176 (1970).
26. Liпg N. R., Lymphocyte stimulation, North-Holland Publishing Сощрапу,
Amsterdam, 1968. (Линr Н. Р. Стимуляция лимфоцитов, М., «Медици-
на», ]971.)
58. Реакция бласт трансформации
лимфоцитов (РБТЛ)
в клинической диаrностике
Х. mютт
58.1. ПРИНЦИl1
Феномен активации лимфоцитов под влиянием Ф r А по-
служил поводом для разработки в 60 x rодах реакции бласт
трансформации, с помощью которой в настоящее Врб!Я мно-
rочисленные исследователи оценивают in vitro клеточный им
мунитет (включая реакции В-клеток). Из-за методической
сложности РБТ Л осуществляется в самых разнообразных
модификациях. Поэтому ее результаты у разных исслеДова-
телей интерпретируются по-разному, а это в свою очередь
снижает эффективность теста.
Лимфоциты, вступившие в контакт с антиrеном, к кото-
рому они сенсибилизированы, реаrируют так называемой
бласт трансформацией. Они увеличиваются в размерах, в них
усиливается синтез рнк., днк. и белка, появляются митозы.
Если измерять скорость синтеза днк. или морфолоrически
идентифицировать такие бласты l! подсчитывать их чис.l0,
то мы получим показатель, характеризующий иммунолоrиче-
скую реактивность различных клеточных популяций,
Эту вторичную реакцию клеток на антиrен in vitro 1'110;'1\>
но иссле,1J,овать в четырех основных модификациях РБТ Л,
перечисленных ниже.
1. Для выявления повышенной чувствительности больноrо
к чужеродным антиrенам (при инфекции и аллерrии) или к
аутоантиrенам (при хронической орrанной патолоrии и ауто-
иммунных заболеваниях) в культуру лимфоцитов добав.1ЯЮТ
соответствующий антиrен.
2. Добавленные в культуру митоrены неспецифически cТI[
мулируют лимфоциты К бласт трансформации. В этом не-
иммунолоrическом рецепторном взаимодействии, вероятно,
участвует значительная доля всей популяции .1Иl\!фОЦIIТОВ
или же избирательно реаrируют B или Т-клетки. Получен-
ные показатели MorYT характеризовать состояние ИМl\I\'ННЫХ
клеток в данный момент и их общую способность к. peaK
циям.
3. Нормальная реактивность лимфоцитов в культуре MO
жет меняться под влиянием различных факторов П.13ЗМЫ,
друrих клеток и т. п. Чтобы выяснить природу таких изме-
нений, культивируют J1ИМфОПlПЫ !3 присутствии подозревае-
мых факторов и без них.
488 .\. Ш ютт
4. Ес.пи иммунолоrическая cilcTeMa 'больноrо ,в момент по-
становки РБТ Л испытывает переrрузку (инфекция, отторже
нне трансплантата, опухоль и т. п.), то мноrие лимфоциты
обнаруживают повышенную реактивность: они уже активиро
ваны iп vivo к бласт-трансформации. Если к ним добавить
соответствующий меченый метаболит (для измерения CKOpO
сти синтеза ДНК), уровень «спонтанноrо включения метки»
окажется повышенным. Это не только служит неспецифиче-
ским показателем oCTporo состояния, но и снижает эффектив-
ность трех друrих модификаций РБТЛ.
С помощью РБТ Л можно также количественно оценивать
первичный ответ лимфоцитов на антиrен [12] (см. разд. 57).
58.2.
МЕТОДИКА
58.2.1.
Реаrенты и приборы
См. 21.2.1, 41.2.1 и 57.2.1
58.2.2.
Постановка опыта
Применяя РБТ Л для клинической диаrностики, необхq,-
димо не только решить, какой антиrен в данном конкретном
случае должен быть внесен в культуру, но и обсудить, какой
из разных по сложности вариантов методики больше Bcero
соответствует цели анализа. В связи с этим ниже описаны
три различных варианта РБТЛ (рис. 115).
58.2.2.1.
Вариант А
Культивируя цельную кровь [16, 37], можно избежать
трудоемкоЙ процедуры выделения лимфоцитов. Этот вари-
ант РБТ Л предлаrается для повседневноrо качественноrо
анализа. Присутствие в 7-дневной культуре большоrо числа
эритроцитов и не участвующих в реакции лейкоцитов, жизне-
деятельность которых поддерживается в питательной cpe
де, фактор отнюдь не положительный. Кроме Toro, прихо-
дится каждый раз, подсчитывая лейкоцитарную формулу,
проверять, нет ли лимфопении, или предварительно разбав-
лять кровь, чтобы работать с постоянным числом лейкоци
тов. Далее, следует учитывать, что в культурах с rемаrrлю-
тинирующим митоrеном (Фr A M) может возрастать включе
ние 3Н-тимидина в мембраны эритроцитов [25].
Максимальное включение метки под влиянием фrА в
этой модификации РБТ Л приходится лишь на 4-Й день, 3
58. БАаст-тран.сформацuя лимфоцитов в клин.ической диаеностике 489
+5%
"Htp(/KOMO
А
б
Осеаиние .lриmроци
.71011. 37.С, 11{
При.липиние
2рuну.nоциmо6
к сmек.л!/
5 7суm 3 c!lm
KpolJz" detpllОрlПfllро(Jинни-ч 6сmрл
XlIIJUHlIl?M со сt71ек.лШfНи;,;'il/ с!/сими
8
РозtJиlJumz, 1: 3 среаоu Нt?,fШ,
нис,{/оить ни ,{/UMtpoпpen
(п.лоmносmь 1,0772/МЛ),
центрlltpУ2иjJ06ить tJ epuiJlIeHme
n,{/omHocmll ЗОмин при L;tJlJg,
оmсосиm!, С,{/ОU /1UАff/JOЦllmо{f
Д6иЖО61 оmМ6Im6 среilОU Не/1и,
10А/ин при 4ОО!!
/(ОК 6
опыше О С!lШ
Среоu Нми AfJAf.
рН 7, 4
20 ;r. M C
Пеници.л.лlll{
(100 ИЕ/м,;тj
СШf7l!пmомUl(UН
(50 мке/м.л j
'I НД!fР, О, 25 мк!rU/ИА
(!liJе.лz,ни,я Ulfти6НОСШ6
Jяffи/,щ)
l Cl{eтl{UK
ТрUЖО61
отИ6IШZ"
10 ми#, '!ОО!!
8 .JН шимuiJин, 0,2 M/(lI/AM
{уiJмz,но,я UlrтlflJHocтb 28,3/(ujMMIJ./I,
См таМ 10
j3 ЖСС
Рис. 115. Модификация реакции бласт-трансформации (РБТ) лимфоцитов.
А РБТ в цельноЙ крови; Б РБТ неочищенной суспензии .тшмфоцитов;
В РБТ очищенноЙ суспензии лимфоцитов. ЭТС эмбриона,lыrая телячья
сыворотка; -жсс жидкостный сцинти,тшяционныЙ счетчик излучения;
AB C сыворотка rруппы АВ; ИДУР иоддезоксиури;:нш.
в культурах с низким содер.жанием лимфоцитов :'I3КСИМУМ
активации обычно сдвиrается на 1 .2 дня.
ЕС.1И желательно брать как ?\южно меньше КрОIШ (В мик-
ропедизтрии и педиатрии), то следует КО1\шенсировзть поте
рю оптимальной концентрации к.lеток (1Q6jмл) культура.JlЬ
ной средой, содержащей больше питательных кОмпонентов.
Для этоrо целесообразно, во-первых, ИСПО.'1ьзовать лучшую
из коммерческих сред. Если расположить эти среды в поряд-
ке возрастающей полноценности, то получится ряд: среда
32 840
490 Х. ШlOТТ
Паркера среда Иrла среда Иrла МЭМ ТС 199 RPMI
1640. Во-вторых, вместо человеческой сыворотки АВ приме
няют эмбриональную телячью сыворотку (ЭТС, 5 20%) и
переходят на rазовую смесь, содержащую 5 % CO z . Однако
во всех остальных случаях культивирования лимфоцитов из
периферической крови человека можно не пользоваться спе
Циальной rазовой смесью. Как ни прост вариант А, дЛЯ pe
шения большинства клинических задач желательно было бы
разработать микрометод (с культурами, содержащими при-
мерно 2.104 10.104 клеток).
58.2.2.2. Вариант Б
При этой модификации РБТ Л (рис. 115) производится
несложная процедура накопления лимфоцитов. Прибавление
инФукол.'1а при оседании эритроцитов ускоряет и, кроме TO
[о, улучшает разделение. После оседания примерно 50% кле
ток, содержащихся в плазме, составляют лимфоциты. Путем
разделения по адrезивности отсюда удаляют основную часть
rранулоцитов. Используемые для этоrо флаконы должны
быть тщательно вымыты (см. разд. 21 и 57) и обладать как
можно большей плоской поверхностью дна. Кроме этих фла
конов, всю стеклянную посуду рекомендуется силикониро
вать.
После каждоrоотмывания (цеНТРИфУТ'ирования) клеточ-
'Ныйосадок как можно тщательнее ресуспендируют в ,каплях
среды, стекающих обратно ,по стенкам пробирки. Это можно
сделать лучше, чем вручную, с помощью специальноrо iПри-
бора для встряхивания (<<Press to Nlix», Сеl1СО Il1st., Нидер-
ланды) .
58.2.2.3. Вариант В
Разделение лейкоцито'в с 'помощью раствора фиколла
(Pharmacia Fine Chemicals, Швеuия) и Бизотраста 370 (УЕВ
Fahlberg List, Маrдебурr, [ДР) с Плотностью 1,077 r/,мл ил!!
«лимфопрепа» (Nyegaard & Со., Норвеrия) дает суспензию,
содержащую 80 82 % .1ИМфОllИТОВ. В связи С тем что для
оптимальной активации лимфоцитов необходимо присутств!!('
некоторой примеси моноцитов и макрофаrов [15, 33, 41].
да.'lьнейшую очистку взвеси производить не рекомендуется.
Даже при такой чистоте конечной суспензии раздсление в
rрадиенте плотности МOfкет rарантиропать воспроизводимость
ее состава, подходящую для количественноrо анализа. Дe
фибринирование крови с помощью стеклянных бус имеет прс-
имущество перед доба13.1ением rепарина, так как ол:новремен
58. Б.1llст-трансфорлtaция ЛUAtфОЦtlтов 8 клинической дuaZНOCTиKe 491
но удаляются тромбоциты, которые MorYT вызывать arpera
ЦIIЮ лимфоцитов. Надо следить за тем, чтобы после наслое.
НIIЯ разбавленной крови на «лимфопреп» тотчас начиналось
центрифуrирование. Лимфоциты, которые после центрифуrи-
рования остаются над слоем лимфопрепа, отсасывают шпри
цем или пипеткой фирмы Эппендорф на 1000 мкл со сте-
рильным наконечником. При этом перемещают кончик иrлы
II.'III наконечника вдоль клеточноrо «rазона», стараясь ero за
хватить.
58.2.2.4.
Культивирование клеток
Если нужно получить количественные данные, например
ПрII наБJ1юдении в динамике, то значительному разбросу pe
зушпатов, который бесспорно присущ этому методу, следует
противопоставить большое число параллельных проб [34].
В данном случае трех параллельных проб недостаточно, ре-
комендуется ставить пять. По этой же причине нужно CTpe
миться к наименьшей ошибке пипетирования. На всех эта-
пах при еняются только пипетки фирмы Эппендорф или
микролитровые шприцы. При работе с большим набором aH
тиrенов следует Д"'1я каждоrо из них иметь отдельный микро-
.1ИТРОВЫЙ шприц. Дозы антиrенов (например, специфическо
1'0 антиrена, экстракта из opraHoB) необходимо устанаВ.1И
вать в предварительных опытах; обычно они лежат в пре
делах 10 100 MKr белка (106 клеток) в 1 1\1.1. Концентрация
митоrенов в разных модификациях РБТЛ раЗ"lична.
Если при культивировании не подается специальная ra-
зовая смесь, то следует выбрать ПJ10ТНО закупоривающиеся
сосуды для культивирования. После заполнения их над Ky.1I)
т rральноЙ средоЙ должен остаться свободным 5 20 KpaTHbI!'i
объем для rазовой смеси. Ва.ЖНО, чтобы над клетками не бы
"10 слишком BbIcoKoro столбика жидкости и чтобы они не oce
дали на коническое дно. Перед определением активности MeT
ки в жидкостном сцинтилляционном счетчике клетки необхо
димо соответственно обработать. Целесообразно проводить
эту обработку прямо в тех сосудах, в которых они культиви
ровались. Сенсибилизированные IIЛИ, точнее, стимулирован
ныс клетки (бласты) изменяют споЙ поверхностныЙ заряд J[
приобретают выраженную способность к ПРИ.lIIпаНI!IО. Поэто
му перенос суспензии из сосуда для КУЛЬТI1вироваНIIЯ в цент-
рифужную пробирку даже с MHoroKpaTHbIM обмывание1\! ero
стенок нС'минуемо ведет к потере именно тех К"lеток, которые
включили метку. В особенности это относится к специфичС'
ски сенсибилизированным клеткам. Эти культуры КО.'1J[чест
вен но отличаются от культур, стиму.пированных мптоrенами,
32*
492 Х. Шютт
в них меньше бластов, несмотря на образуемый активирован-
ными кле11ками «митоrенный фактор», который действует на
остальные, несенсибилизированные лимфоциты.
Неблаrоприятная для культуры лимфоцитов форма цент-
рифужной пробирки может быть «исправлена», если закре-
пить пробирку в сильно наклоненном положении. От пер ем е-
шивания клеточной взвеси во время культивирования все ис-
следователи отказались. В настоящее время уже существу-
ет микрометод РБТ Л на пластмассовых пластинках для мик-
рокультивироваНIIЯ (Micro Test II tray 3040 или 3041, Fal-
соп, Plastics США) со сроком выращивания до 7 дней [20].
При этом в каждой культуре в 0,2 мл среды содержится
5. 104 лимфоцитов.
58.2.2.5.
у чет ,реаlЩИИ
Способ учета реакции зависит от имеющихся возможно-
стей. Если нет сцинтилляционноrо счетчика, можно восполь-
зоваться морфолоrическим методом учета [36]', хотя он не-
избежно таит в себе опасность субъективных ошибок.
Чаще Bcero для учета реакции культуру маркируют ка-
ким-нибудь -излучателем (например, 3Н-тимидином) и поль-
зуются жидкостным сцинтилляционным счетчиком [42] .
Правда, этот метод учета требует соответствующей обработ-
ки клеток (табл. 16). Для внесения метки при меняют от-
дельный микролитровый шприц, который не следует путать
со шприцами для внесения антиrенов.
при соответствующей активности метки 5-часовую инку-
бацию обычно считают достаточной (рис. 115). Из эффектив-
ных доз выбирают наименьшую, чтобы избежать действия
излучения, которое моrло бы избирательно повредить бла-
сты. При 7-дневном культивировании 5-часовая инкубация
дает прежде Bcero лучшую воспроизводимость результатов,
чем 20-часовая. Для маркирования имеет значение также чи-
стота популяции лимфоцитов (влияние адrезивных клеток)
[23]. Утрата жизнеспособности клеток чаще Bcero бывает
связана с нарушением стерильности.
Одна из модификаций РБТ Л была описана выше
(разд. 21).
Задача автоматической обработки культур на пластмас-
совых пластинках уже решена [20]. Имеется также специ-
альный ротор для центрифуrпрования пластинок с культу-
рами [26]'.
Результаты выражают либо числом" импульсов в 1 МИН
(импjмин), либо (при эффектах rашения различной ПрllрО-
ды) числом распадов в 1 мин (распjмин).
58. Еласт-трансформация лилtфоцитов в клинической диаиlOстuке 49:-1
Таблица 16. Обработка культур, деченных ЗН-тиАtидином
Этапы обработки
1. Двукратное отмывание клеток сре-
доЙ Иr.lа
2. Осаждение 5 % -ноЙ трихлорУКСУС-
ноЙ кислотоЙ
3. Экстракция метанолом
4. Высушивание осадка
5. Растворение осадка в 0,15 мл 1 н.
NaOH или в коммерческом рас-
творителе (см. разд. 21) (в плотно
закрытых сосудах)
6. Сбор конденсата с помощью леrко-
[о центрифуrирования
7, Внесение 0,1 мл экстракта клеток
в 1 О мл сцинтилляционноrо рас-
твора (см, разд. 21) в соответст-
вующем измерптельном сосуде
СЦllНтплляционноrо счеТЧIша
8, rашенпе неспецифической люмине-
сценции
9. Измерение (наПрШlер, в жидкост-
ном сцинтилляционном спектро-
метре LKB-Wallac 81 000, Швеция)
у словня Время
400 g 1 О мин
800 g 10 мин
1700 g 1 О мнн
37 ос 5 10 ч
60 ос 1 ч
50 g
1 мин
в вытяжнОМ
шкафу!
4 ос 2 суток
(при прибавление, наПрlВlер, ледя-
ноЙ уксусноЙ КИСЛОТЫ Д.1Я ней-
трализации)
I в ;оотв тствии С тре-
оvемои точностью
I
Часто пользуются индексом стимуляции (ИС):
ИС == ИМП/МИНстим уз .
имп/минконтроль
Если вместо -излучателя в качестве метки ПРИ lеняется
у-излучатель, то отпадает необходимость в трудоемкоЙ экс-
тракции клеток. Радиоактивность измеряют сразу же после
удаления невключенной метки. Скорость синтеза ДНК УДОQ:
но измерять с помощью TaKoro Y-ИЗ.1учателя, как 1 5!-I!OД-
дезоксиуридин (рис. 115), так как это aHa,'lOr .J,еЗОКС!IТII\Ш-
дина [37].
58.3.
ОБЩАЯ ОЦЕНКА
При выявлении специфической повышенной чувствитель-
ности необходимо использовать как мо:ж:но более очищенныЙ
антиrен: только таким образом удается ИСКЛЮЧИТЬ перекрест-
ные реакции инеспецифическое ВЛIIяние ПрИ:\IесеЙ. Среди
возможных приложений РБТ Л (рис. 116) можно назвать вы-
явление аллерrии [35, 38] и повышенной чувствительности
494 _\. ШЮТТ
к антиrенам простейших [40], rрибов [53]1, бактерий [18,
53] и u вирусов [53], а также диаrностику хронической ор-
rаннои II СlIстемнои патолоrии с использованием в качестве
Оп!/хош) 1 О(},л!/l{вние I
Фа/(торы I r HMMYHoiJe-
c6rdopom/(Q tpицитност6
Ооострение ffMM!/HOtllO Ul{ec/(url Нмм!/нотеропиR
стат!lС
XpOHUlfec/(ue Химиотерапия
JОООtllеdония
I Н еспе Цllf{JlIlfеСКt1я f}lIa2HocmUKa I
! I
Лоd6fщеннал
'f!ldcmdllmetllbHOCт6
/( сштuсеном AtlMepflll.f1
простеUШllХ, сршJо6, Реа/(ЦllЯ
Оа кте;ши, tlu,oycod (JtIlacт тpaHC
'РормаЦllО
tIlllМtpОЦllто8 d
слеЦlltpllчес/(оlr
f}lIOi!HOcтll/(e
ОтторжеНlIе
транспtlfантата ОПУХО'n6
А!lтОllмм!/нное Отс!/тст6ие omdeтn
на конкретныи
Jaoo,ne6aHlIe OHти eH
РИС. 1] 6. Возможности диаrностическоrо применения реакции б,1]аст траll('-
формаuии лимфоцитов в клинике.
анти[енов орrаноспецифических белков или нефракцнониро
ванных экстрактов из opraHoB [11, 29, 30, 43, 45]. Кроме то-
[о, делаются более или менее успешные попытки с помощьЮ
опухолевых антиrеноlЗ специфически диаrностироват!) злока
чественныс новообразования rЗ, 10, 46]. В БОЛЫШIНстпе с.'!)"-
чаев МОЖ.НО пользоваться тем вариантом РБТЛ, которыЙ не
требует выделения лимфоцитов. Правда, при попытках дна-
rностировать хронические заболевания Toro или иноrо opr:j-
58. Б,lllст-трансфорлtal{ИЯ ли.ltфоцитов в клинической диаzностике 495
на ПРИХОДИТСЯ проводить реакцию с различными KOHцeHTpa
ЦИЯI\Ш антиrена. В каждом случае РБТЛ со спеЦИфИЧССКIIМ
антиrеном рекомендуется одновременно ставить ПОJlOжитель-
ныЙ контроль с митоrеном.
РБТ Л со специфическим антшеном теряет свое ДШJЛIO-
стическое значение при быстро проrрессирующих заБО:lсва
НИЯХ [29, 50] или при обострениях хроническоrо процссса
[13, 43]. Как неспецифическиЙ симптом но всех этих с,OJуча
ях наблюдается повышенное спонтанное ВК:lючение :УIСТКИ.
Таким же образом следует интерпретировать отрицате:Iьные
реЗУ:Iьтаты РБТ Л (даже с митоrеном) при далеко зашедших
злокачественных новообразованиях. В клиническоЙ TpaHC
плантолоrии при диаrностике кризов отторжения наряду с
РБТ Л можно использовать также смешанную культуру "IИМ
фОЦ!lТов [47 j .
Количественные показатели морфолоrическоЙ трансфор
мации или включения метки непосредственно не отражают
уровня повышенноЙ чувствите';IЫIOСТlI ИJ1!1 резистентности к
данному инфекционному ш'енту [53]. Если требуется опреде
.1ИТЬ число сенсибилизированных клеток, то следует восполь
зоваться методом вирусных бляшек [6], ПОСКО:IЬКУ блаrода
ря ПОЯВ.1ЯЮЩИМСЯ в культуре митоrенным факторам ClIIY!
фокинам) бласт трансформация захватывает и несеНСlIБИ:I1I
зированные клетки. К тому jKe часть трансформированных
в б.lасты лимфоцитов может иноrда вообще не ВКЛЮЧ'lть
метки [33].
Низких показателеЙ РБТ JI в ауто.аоrичноЙ сыворотке
(свидетельствующих о депрессии клеточноrо им MYHII1 ста)
следует ожидать не только при известных иммунодефицит
ных и системных заболеваниях [50], но и в ПОЖИ.10М возра
сте [50], в результате прямоrо [1, 8, 16, 271 или поБО'lноrо
[2, 31, 32] эффекта цитостатическоЙ терапии, при 3.'Iокачест
венных новообразованиях [7, 54] и иноrда при беременно
СПI [31, 52].
Вообще иммунолоrическая реактивность больноrо под
вержена влиянию множества факторов (рис. 116), и ее це-
лесообразно учитывать в клинике, чтобы избежать неже.lа
тельных последствиЙ. Разумеется, мы еще очень далеки от
возможности адекватно оценивать иммунолоrпческиЙ статус
больноrо [34, 41, 52]. Для ero характерисТIПШ на клеТОЧН02Н
уровне можно применить РБТ Л. ДЛЯ количественноrо \'чета
крайне важно проводить реакцию в оптимальных CTaHдapT
ных условиях со cTporo постоянным числом ЛИМфОЦIlТов.
Однако, с друrой стороны, любая процедура очистки лимфо-
цитов отдаляет нас от ситуации, имеющеЙ место in \'ivo.
Например, удаление моноцитов и rрану.'IОЦИТОВ может Be.
496 Х, ШlCl7
СПl К ,пониженной реактивности лимфоцитов в ку.пьтуре [21,
34J. Кроме Toro, устраняя друrие клетки, мы теряем воз-
можность функциональной оценки тех сдвиrов r MorpaMMbI,
которые прослеживаются в динамике [15]:.
Оценку «иммунолоrическоrо статуса» в РБТЛ начинают
с обычноrо изучения реакции лимфоцитов на фf А. KOHKpeT
ные дозировки митоrена трудно рекомендовать заранее, так
как оптимальные концентрации различны при разных моди-
фикациях метода (см. выше). Для каждой модификации He
обходИlVIО построить кривые зависимости доза время эф
фект в опытах с лимфоцитами здоровых доноров. Это тре-
буется прежде Bcero потому, что при некоторых иммуноде-
фицитных заболеваниях реактивность лимфоцитов по отно-
шению к ФrА, обычно пониженная, иноrда имитирует нор-
мальную при увеличении дозы митоrена [24]. Передозировка
ФfА создает опасность не распознать этот феномен. К тому
же известно, что высокие концентрации ФfА вызывают arpe-
rацию .тrимфоцитов, при которой нарушаются не только функ-
ции клеток, но и включение меченоrо тимидина. ФfА сти-
мулирует, вероятно, не все Т-клетки [28]. Следующий мито-
reH, реакцию на который желательно изучить это конкана-
валин А. Липополисахариды (например, ЛПС Е. сои или
сальмонелл) и антитела к иммуноrлобулинам стимулируют
В-клетки, тоrда как митоrен лаконоса (pokeweed mitogen,
PWM) активирует клетки обоих типов. По-видимому, РБТЛ
мало подходит для дифференцировки Т-и В-клеток с по-
мощью избирательно действующих митоrенов. Так, например,
rипотеза об ареактивности В-клеток по отношению к ФfА бы-
ла проверена На клеточных популяциях, разделенных блаrо-
даря их различному отношению к бараньим эритроцитам
(см. разд. 59). В этих, совсем иных, условиях опыта В-клет
ки, вероятно, также трансформировались в бласты под влия
нием ФrА. Кроме Toro, удалось показать, что надосадочная
жидкость активированных Т-клеточных культур вызывает
бласт-трансформацию В-клеток [19].
Оценку иммунолоrическоrо статуса на клеточном уровне
дополняет РБТ Л с такими широко распространенными анти-
rенами, как очищенный белковый дериват туберкулина
(PPD), стрептокиназа стрептодорназа (SK SD), канДИ-
дин, бруцеллин, rистоплазмин, антиrены вирусов паротита и
токсоплазм, трихофитин и стрептолизин О. Предполаrается.
что PPD, возможно, оказывает неспецифическое митоrенНОЕ'
действие на В-клетки [48]1.
Рекомендуется ставить РБТ Л сразу с целым набором
тест-антиrенов (не менее пяти), так как встречается избира-
тельное отсутствие ответа на некоторые из них [1].
58. БлаСТ-Трансфорлtaция лимфоциТ06 8 клинической диа2Ностиli.е 497
Рсзультаты спсцифической инеспецифической РБТЛ м:о-
[ут взаимно дополнять друr друrа. Так, например, положи
те.;lьная специфическая реакция на экстракт из эпителия тол-
стоЙ КIIШКИ может подтвердить диаrноз язвенноrо колита у
;I.aHHOrO больноrо и послужить поводом для иммунодепрес-
сивной терапии. С помощью неспецифической оценки имму
НО.10rическоrо статуса, а также продолжая ставить РБТ Л со
специфическим антиrеном, можно вовремя выявить как пере
дозировку, так и недостаточность иммунодепрессии; это поз-
воляет оптимизировать терапию.
При всех возможностях, какие открывает РБТ Л, нельзя
(прежде Bcero при оценке иммунолоrическоrо статуса) orpa-
ничиться только ею. В обобщенном клиническом суждении
должны быть учтены и данные о rуморальном иммунитете,
и характеристика неспецифической резистентности, и резуль-
таты друrих методов оценки клеточноrо иммунитета, так как
они не всеrДа коррелируют с РБТЛ [5, 14, 39, 44, 49].
Пока фундаментальной иммунолоrией еще не решены все
связанные с РБТ Л проблемы, особенно важно совершснст
вовать различные способы оценки клеточноrо иммунитста,
в частности путем стандартизации УСЛОВИЙ культивирования
клеток {9, 41].
58.4.
ЛИТЕРАТУРА
1. Abliп R. J., Bruпs а. R.. Guidaп Р. D., Bush М., Immunodiagnosis in the
therapeutic management of malignancy, Medikon Int" 8, 14 16 (1974).
2. Aпdersaп С. В., Codd J. Е., Graff R. J., Newtaп W. Т., Lymphocyte acti-
vation after [епаl transplantation, Transplantation, 16, 68 70 (1973).
3. Bagshawe К D., Tumour-associated antigens, Brit. med. BuII., 30. 68
73 (1974).
4. Вlaese R. М., Oppeпheiт J. J., Seeger R. С., Waldтaпп Т. А., Lympho-
cyte-macrophage-interaction in antigen induced in vitro iymphocyte
transformation in patients with the Wiskоtt АIdriсh-sупdrоmе and other
diseases with anergy, СеН. Immunol., 4 (1972). 228 242.
5. Вlooт В. R., ОаПпеу J., Jiтeпez L., Dissociation of MIF рrоduсriоп and
cell proliferation, J. Immunol., 109, 1395 IЗ98 (1972).
6. Вlaoт В. R., Капо S., Наше М. L., Yil'us plaque assay and еПШllСI'аtiоп
of effector cells in mixed Iymphocyte culture. Transplant. Proc.. 5. 1705
1709 (1973).
7. Bryaп J. К, Johпsaп а. Е., Lеvепflщl В. С.. The effect of autologous se-
rum оп Iymphocyte response to human leukemia cells, Blood. 43. 781
787 (1974).
8. СатрЬеи А. с., Hershey Р., Hardiпg В., Hallillg'swarflr Р. М" SkilU/N J.,
Mackleппaп 1. С. М., Effects of anti-cancer agents оп immuпоlоgiса! sta-
tus, Brit. J. Cancer, 28, 254 261 (1973). с
9. Carter J. В., Ва" а. D., Leviп А. S., Byers 11. S., Рапсе В.. Fude1/
berg Н. Н, Gerтaп D, р" stапdаrdizаtiоп of tissue ct1Itl1l'e сопditiОI1S
for spontaneous Thymidine 2 C 14 incorporation Ьу unstimulated 1l0Пll а]
htlman peripheral bIood Iymphocytes circadian rhytllm oi D .\ s\'Пthе-
sis, J. сliп. Imtrlt1nol., 56, 191 205 (1975). .
498 Х. Ш ЮТТ
10. Chatferjee М., Barlow J. J., Аиеп Н. J., Chung W. S., Piver М. S., Lym
phocyte response to autologous tumor antigens апd РНА iп ovarian сап-
cer patients, Cancer, 36, 956 962 (1975).
11. C/zal1arin J., James D., Humoral and cell-mediated iпiriпsic fасtоr anti
body in pernicious anemia, Lancet 1, 1078 1080 (1974).
12. Cиrtis J. Е., Herslr Е. М., Harris J. А., McBride С., Freireich Е. J. ТЬе
hl1man рriтю'у immunc ]'csponsc to keyho1e limpet haemocyanin: inter-
rc1ationship of delayed hypersensitivity, antibody response and in vitro
bIast transformation, Clin. ехр. 1mmunol., 6, 473 491 (1970).
13. Cusumano С. L., Zellner S. R., Waldman R. Н., Transient reduction of
PHA response during acute pulmonary histoplasmosis, Amer. Rev. Res.
Dis., 109, 163 (1974).
14. Dimitriu А., Migration inhibition factor and blast transformation in hu-
тап 1ympl1Oid cell cultures stim1l1ated Ьу diiferent antigens, Clin. ехр.
1mmunol" 18, 141 148 (1974),
15. McFarlal1d W., Factors affecting thc iтmuпо10giсаl reactivity of Ьиmап
Jymphocytes in vitro. II. «Рше» Iymphocytes versus total leucocytes, iп:
Rieke О. W. (Hrsg.) Proc. II1. Апп. Leucocyic Cu1ture Conf., Academic
Prcss, New York, 1969, S. 77 86.
16, Farrow М. О" van Dyke К., А micro systcm for screening antileukemic
drugs uti1izing human whole blood, Chemotherapy, 16, 76 84 (1971).
17. Fefer А., Mickelson Е., Thomas Е. D., Leukemia antigens: MLC-tests оп
t\ve1ye 1eukemic paticnts v,ith identical twins, Clin. схр. 1mmunol., 18,
2З7 242 (1974).
18. Oeha R. S., Merler Е., Responses of Ьиmап thymus derived (Т) and поп
tllymlls derived (В) lymphocytes to mitogenic stimulation, Nature, 240,
198 200 (1972).
19. Hahn Н., Ze11ularc antibakterielle Immunitat, Dtsch. mcd. Wschr., 99,
6Ы 656 (1974).
20. Harrison М. R., Tlrurman О. В., Thomas О. М., А simple and versatile
harvesting device for processing radioactive 1аЬе1 incorporated into
and/or released from cells in microculture, J. immunol. Methods, 4, 11
16 (1974).
21. HirschllOrп К, Hirsc!rllOrп R., Mechanisms of Iymphocyte activation, in:
McCluskey R., Cohen S., Mechanisms of cell-mediated immunity, John
Wiley et Sons, New York Sidney Toronto, 1974.
22. Horsman!reimo М" Virolainen М., Enhancement of tuberculin induced
lymphocyte transformation Ьу pl"ecultivated macrophages from patients
with sarkoidosis, Scand. J. 1mmunol., 3, 21 27 (1974),
23. Нопюt М., КаиепЬптl1еп Н., Havemann К, Optimal labelling conditions
for thymidine iпсоrроrаtiоп in PHA and PPD stimulated Ьиmап Iympho-
cytes. Effect of adhercnt cells, 1nt. Arcl1. A11ergy Appl. 1mmuпоl., 46,
647 (1974).
24. Hosking С. S., Fifzgerald М, О., Simol1s М. J., Quапtifiеd deficiency of
lympl10cyte response to РНА in immunc dcficicncy discascs, Clin. ехр.
1mmunol., 9, 467 476 (1971).
25. Johnson R. А., Smif!r К, Юrkраtriсk С. Н, Augmentatiol1 of РНА mi-
togenic activity Ьу erythrocyte membranes, Cell. 1mmunol" 3, 186 19i
(1972).
26. Keasf D., Barfholomaeus W. N., А micromethod for stimulаtiоп of Iympho-
cytcs Ьу РНА, Aust. J. схр. Biol. med. Sci., 50, 60З 609 (1972).
27. Levy J. О., Whifney R. В., Smith А. О., Раппо L., ТЬе rеlаtiопshiр of im-
тuпе status to the efficicncy of immunotherapy in preventing tumour
rесuпепсе iп mice, Brit. J. Cancer, 30, 289 295 (1974).
28. Lazda V. А., Baram Р., Participation of different cell populaiions in anti-
gеп- and mitogen induced Iymphocyte proliferation, J. Immuпо1., 112,
1 7()5. 1 71 7 (1974).
58. Б.laст-траНСфОрАtацuя лuмфоцuтов 8 клинuческой диаzностuке 499
29. Maerker Alzer О., Schumaeher К, Oross р" Deiection of lympllOcytes
Witl1 iпсrеаsеd DNA-synthesis in the periphcra' bIood of patients \\riih
active chronic hepatitis, Юiп. Wscllr., 52, 190 193 (1974).
30. Mastaglia Р. L., Dawkins р. L., Papadimitriou J. М., Lymphocyt rnuscle
сеll interactions in vivo and in vitro, J. пеurо'. Sci., 22, 2б 1 268
(1974).
31. Mori Т., Effects of sex steroids оп PHA-induced transformation о! human
periphera! Iymphocytes. 1II. Symp. 1mmunology of Reproductioll. \'arna
21. 25.3.1975.
32. Opelz G" Terasaki Р. /,' Hirata А., Suppression of lymphocytc tJ'al1sfoJ'
mаtiоп Ьу aspirin, Lancet Н, 478 480 (1973),
33. Otto р., Кnди Н., Кi5hler W., Reske W., Leest 1., Strohbaelr О., Lilltersu
chungen mit dem Lymphozytentransformationstest bei progreSSi\'cf' chro-
nischer Po!yarthritis, Z. Rlleumatol.. 33, 311 (1974).
34. Parker J. W., Lukes р. J., The variability от PHA induced Iymphocyte
trапsfоrmаtiоп in repetitive studies, in: Rieke О. (Hrsg.): Proc. 1II. Апп.
Leucocyte Culture Conf. Academic Press, N C\v У ork. 1969, S. II 1
128.
35. Раире J., Charlas J., Burtin С., Soubrane с., Le Touze Р" Etude cIinique
et immunologique de 140 cas d'allergie а la penicilline chez l'спfапt,
Arch. Franc. Ped., 31, 175 186 (1974).
36. Pekarek J., Krejel J., Survey of the methodica' appl'oaches to studying
de!ayed hypersensitivity in vitro. J. immunol. Methods, 6, 1 22 (1974).
37. Pellegrino М. А., Ferrone S., Pelleg'riпo А., Rcisfel[l Р. А., А f'apid micro
technique for in vitro stimulation of lшmап 'ymphocytes Ьу РН:\. CIin.
1mmunol. 1mmunopathol., 2, 67 73 (1973).
38. Petrunov В., Konstantinova D., Application 01 the LTT to diagnosis of
роllеп allergy, Acta Allergologica, 27, 229 235 (1972).
39. Piaeentini О., Ferrari S., Megale с., /ppoliti F., Delayed immllnity in
bronchogenic carcinoma, BolI. 1st. Sieroter. lv1iJan., 52, 230 236 (1973).
40. Savanat Т., Viriyanond Р., Nimitmongkal N., BIast trапsfоrmаtiоп о! ]ym
phocyte in amebiasis, Amer. J. trop. Med. Hyg.. 22, 705 710 (1973).
41. Sehlaak М., Diagnostische Wertigkeit vоп Lymphozytentl'ansformations-
untersuchungen, Z. Gastroentero!., 7, 214 218 (1974).
42. Sehram Е., Organic Scinti!lation Detectors, Elsc\'iel' Pllh1, Со.. Holland,
1963.
43. Schutt С., Friemel Н., ScflUlze Н.-А., Zubaidi О., Lymphocyte scnsitizati
оп in ра tien ts with chronic pancrea titis. Diges tion, 13, 308 31 1 (1975).
44. Selroos О., Pasternack А., Virolainen М., Skin tcst sensitivity апd anti-
gen-induced !ymphocyte transformation in urcmia, Clin. ехр. Immипоl.,
14, 365 370 (1973).
45. Sorrell М. Р., Leavy С. М., Lymphocyte transformation and alcoholic Ii-
ver injury, Gastroentero'., 63, 1020 1025 (1972).
46. Stjernsward J., Vanky F., КEein Е., Lymphocyte stimulation Ьу autochtho
nous human solid tumors, Brit. J. Cancer, 28, 72 76 (1973).
47. Sukiu Foka N., Buda J. А., ТЫет S., Reemtsma К, Evaluation 01 the
immune status of trапsрlапt recipients Ьу mixcd Iymphocyte cultorc. СJiп.
Immuпоl. 1mmunolpathol., 2, 530 541 (1974).
48. Sultzer В. М., Nilsson В. S" РРО ТuЬеrсuliп: а B-cell mitogen.. \" ature,
New Biol., 240, 198 200 (1972).
49. Taylor М. М., ProbJems encoutercd in the prepal'ation of M1F and шitо-
genic factor (MIТ) from PHA stimulated Ьиmап peripheral Iymphocytes,
Cell. Immunol" 19, 41 47 (1975).
50. Toh В. Н., Roberts-Thomson /. С., Mathews J. D., Wittingham S.. Мае-
kay /. р., Depression of cell-mediated immunity iп old age and Он:, immu-
nopathic diseases, lupus erythema tosus, chronic !1ера titis, r!H:lIma toid
arthritis, Clin. ехр. 1mmunol., 14, 193 199 (1973).
500 .\'. Ш ЮТТ
51. Vyas F. N. (Ed.): Laboratory diagnosis of immunological disorders. Gru-
пе and Stratton, New York, 1975.
52. Watkins W. В., Sтall С. W., Lymphocyte response to РНА in pregnancy.
J. Obstet. Gynaecol. brit. Commonw., 99, 990 993 (1972).
53. ВОЗ Серия технических доклаДОВ N!! 519 1973), Клеточный имму-
нитет 11 устойчивость к инфекции.
54. Whitehead R. Н., воиоn Р. М., Newcoтbe R. о., Is there а factor in
sera from cancer раtiепts tl1at inhibits Iymphocyte response to РНА?
Ешор. J. Cancer, 10, 815 818 (1974).
55. Wong V. о., Anderson R., O'Brien Р. J., Sympathetic ophthalmia and
Iymphocyte transformation. AmN. J. Ophthalmol., 5, 96 966 (1971).
59. Реакция образования
спонтанных розеток
Э. микс
59.1. ПРИНЦИП
Феномен, подобный описанной ранее (разд. 10) реакции
образования иммунных розеток, наблюдается при взаимодей
ствни клеток определенноrо типа даже без предварительной
ИМ lунизации [1 7Y Такое образование «спонтанных» ро-
зеток лимфоцитами мышей с бараньими эритроцитами (БЭ)
отражает уровень исходной иммунореактивности на данный
антиrен [8]. При друrих сочетаниях лимфоцитов с эритро-
цитами число спонтанных розеток HaMHoro превышает ис-
ходное число антиrен-реактивных клеток [9]. Впервые обра-
зование таких розеток было обнаружено в начале 70-х rодов
при исследовании взвеси лимфоцитов человека с бараньими
эритроцитами [10 12]. Позднее выяснилось, что число po
зеткообразующих клеток пропорционально числу Т-лимфоци-
тов [13 15}. С тех пор БЭ-рецепторы считаются маркерами
Т-лимфоцитов человека, а выявление этих клеток в реакции
образования спонтанных розеток стало стандартным методом
иммунолоrии. Методика постановки этой реакции, в сущно
сти, аналоrична методу иммунных розеток (см. разд. 10).
Ниже описан модифицированный метод выявления розетко-
образующих клеток среди лимфоцитов крови, заимствован-
ный из статьи Зейлера и сотр. [9].
59.2.
МЕТОДИКА
59.2.1.
Реаrенты и приборы
Основная среда Иrла (StaatI. Inst. fiir Immunpraparate
und Nahrmedien, Берлин, [ДР), рН которой доводится до
7,4 с по'мощью 1 н. NaOH; 0,15 М раствор NaCI; rепар'ин
(Chem. Fabrik Gedeon Richter, Будапешт); разделяющий
раствор по Бёйюму [16], состоящий 'Примерно из 8 объе ов
9% -Horo водноrо раствора фиколла (Pharmacia Fine Chemi-
cals АВ, Упсала, Швеция) и ДВУХ объе ов визотраста 370
(VEB, Fahlberg-List, Маrде6урr, [ДР) и доведенныЙ дистил-
лированной Б'одой до плотности 1,077 rf,мл; 0,2%. ныЙ раствор
трипаНОВQirо синеrо (Chemap01, Праrа) в 0,15 М растворе
NaCI; rлутаральдеriИД.
502 Э. Мике
СИЛJи,кониро.ванные центрифужные пробир:ки объеМО f
10 мл; ,пастеровские пипетки; настольная центрифуrа; цен-
трифуrа для определения rематокрита; холодильник; ,камера
для подсчета клеток крови (на;пример, Бюр:кера); ,м,икроскоп
с фазово контрастной насадкой; весы Вестфаля для опреде
дения 'плотности жидкостей (Johannes Hammer, Лейпциr,
r ДР); сеДiИментаrщонная ,камера СеЙка (Fa. Ing. Wolfgallg
Dorenbllrg KG, Берлин, [ДР).
59.2.2.
Выделение лимфоцитов
Для реакции розеток нужны достаточно очищенные лим-
фоциты. Для их выделения из крови человека вполне подхо-
дит метод Бёйюма [16]1, описанный ниже.
Берут 2 4 мл rепаринизированной крови (100 Л1Е rепа-
рина на 1 мл), разбавляют 1: 2 1 : 4 средой Иrла и осто-
рожно наслаивают в центрифужной пробирке на 2 мл раз,.-
деляющеrо раствора. Сразу же после этоrо пробирку 40 мин
центрифуrируют при 600g и комнатной температуре (20 ОС).
Лимфоциты, образующие беловатый слой над разделяющим
раствором, отсасывают пастеровской пипеткой и трижды от-
мывают средой Иrла, трижды центрифуrируя по 10 мин при
комнатной температуре первые два раза при 600g, а тре-
тий раз при 200g. Это позволяет уменьшить примесь ТРОМ-
боцитов без значительной потери лимфоцитов.
59.2.3. ИНliубацил
Концентрацию лимфоцитов в суспензии доводят до 3. 106
клеток на 1 мл среды Иrла. Бараньи эритроциты предвари-
тельно трижды отмывают 0,15 л1 раствором NaCI, а затем
приrотовляют из них 0,5% -ную суспензию в среде Иrла.
Равные объемы (например, по 0,5 мл) обеих суспензиЙ
смешивают в одноЙ центрифужноЙ пробирке. Соотношение
лимфоциты/эритроциты должно составить около 1: 30. Сме-
шанную взвесь центрифуrируют 5 мин при 200g (,....,20 ОС)
и оставляют на ночь приблизительно на 18 ч в холодиль-
нике (4 ОС) .
59.2.4. Учет реаRЦИИ
Осторожно покачивая пробирку, добиваются ПО.1ноrо ре-
суспендирования осадка. Каплю суспензии вносят в счетную
камеру (избеrать пипетирования!). С помощью фазово-конт-
растной микроскопии находят не менее 200 лимфоцитов 11
59. Реакция образования спонтанных розеток 503
определяют среди них процент розеткообразующих клеток.
Такой К,;Iеткой считают лимфоцит, к поверхности KOTOporO
ПРllкреПJlяется более трех бараньих эритроцитов.
59.2.5.
Дополнения
Жизнеспособность розеткообразующих клеток можно
определить с помощью раствора трипановоrо синеrо [17].
Чтобы зафиксировать суспензию с образованными розетка-
ми, применяют rлутаральдеrид [18]. Для точной цитоморфо
.10rической идентификации розеткообразующих клеток мож
но сделать окрашенные мазки из суспензии [19] или окра-
сить клетки после осаждения в камере Сейка.
59.3. ОЦЕНКА МЕТОДА
Л1етодика постановки реакции спонтанных розеток OTHO
СlIтельно проста, однако ряд ее элементов не поддается CTaH
дартизации, что снижает воспроизводимость результатов
[9, 19]. Поэтому в настоящее время еще трудно сравнить
между собой данные, полученные разными авторами [20
22]. К тому же условия оптимальной воспроизводимости не
всеrда совпадают с условиями максимальноrо образования
розеток [15, 19, 21]. Для получения достоверных результа-
тов эти условия необходимо стандартизовать [21 26]'. Лим
фоциты следует отмывать не менее двух, но не более трех
раз [22]. Примесь rранулоцитов и тромбоцитов УСЛO.lкняет
учет результатов. Аутолоrичные эритроциты MorYT тормозить
образование розеток [9, 19]. Оптимальное соотношение лим-
фоцитов и бараньих эритроцитов лежит между 1: 10 и 1: зр
[9]. Следует применять по возможности свежие эритроциты
[22]. Существование различий между эритроцитами, получен
ными от разных баранов, по способности участвовать в об
разовании розеток пока еще спорно [9, 24]. Противоречивы
также данные относительно оптимальноrо состава суспензи
онной среды [19, 21, 27] . Устранение ионов Са 2 + и Л1g2+,
cor ласно одной точке зрения [14], тормозит, а cor ласно др у-
rой [28] стимулирует образование розеток. Некоторые
авторы [17, 19, 21] не нашли ни тормозящеrо, ни стиму.тrи-
рующеrо эффекта. Величина рН суспензионной среды ДОJlЖ-
на лежать в пределах 7,0 8,0. Стабилизирующее деЙствие
на розетки оказывает прибавление белка в виде сыворотки
[19] или альбумина [29].
Часто реакцию проводят в два этапа: сначала 10 15 ми-
нутная преинкубация при 37 ОС, а затем центрифуrирование
[12, 14, 20]1. Разумеется, от последующей инкубации на хо-
504 Э. Мике
-,юде отказаться нельзя, так как розетки с повышением TeM
пературы распадаются [21, 24, 26]. Подсчет «быстрых» ро-
зеток, выявляющихся сразу после центрифуrирования [30],
сейчас обычно уже не производят. Еще одно важное условие
стандартноrо метода щадящее ресуспендирование. Ero ocy
ществляют путем осторожноrо вращения или постукивания
по пробирке [22, 31], но лучше Bcero в специальных при-
способлениях [19, 29]'. Встряхивания и пипетирования [9, 14,
21] следует избеrа ть. Устойчивые к механическим воздейст-
виям розетки можно получить с бараньими эритроцитами,
обработанными нейраминидазой [21, 32], или с меченными
флуоресцеином мембранами бараньих эритроцитов [33].
Особенно удобным считается микрометод, при котором во-
обще не требуется ресуспендирования [34]. При оценке сус-
пензий после встряхивания и пипетирования учитываются,
по видимому, .1ИШЬ незрелые Т-клетки, обладающие боль-
шим числом высокоаффинных БЭ-рецепторов [19, 21]. Одна
из субпопуляций В-клеток после обработки нейраминидазой
приобретает способность к образованию розеток с барань-
ими эритроцитами [35]. Уибрен и сотр. [36] получили в ре-
зультате одночасовой преинкубации лимфоцитов при 37 ос
в 50 % -ной телячьей сыворотке так называемые «активные
розетки»; по мнению авторов, число таких розеток может
отражать степень rотовности иммунной системы к реакци-
ям клеточноrо типа. В реакции образования спонтанных po
зеток можно выявить и друrие рецепторы лимфоцитов.
С эритроцитами, наrруженными антиэритроцитарными анти
телами (ЭА), образуются розетки, в которых ЭА присоеди-
няются к Fс рецепторам лимфоцитов. Чаще Bcero Д.1Я этоrо
используют эритроциты человека, наrруженные анти D IgG
[9, 37, 38]. ЭА применяют также для выявления розеток, об
разуемых лимфоцитами после обработки трипсином [32] .
Обсуждается способность к розеткообразованию у В-клеток
[9], активированных Т-клеток [39] или так называсмых
«нуль-клеток» [21]. Считается, что «ЭАК-розетки» (ЭАК
эритроцит-амбоцептор-комплемент) специфичны для В-кле
ток [40]. Для их выявления эритроциты инкубируют с суб
аплютинирующим разведением IgM-антител и комплемен
том [17,41]. Результат опыта зависит не только от особеи
ностей донора эритроцитов, но и от происхождения, степени
очистки и разведения антисыворотки, а также от компле
мента [31]. По современным данным, небольшая субпопуля-
ция лимфоцитов обладает одновременно рецепторами для
бараньих эритроцитов и для комплемента Т23, 42, 43](; при
некоторых лейкозах обнаруживается ее увеличение r 44, 45].
МеТОQические преимущества и недостатки реакции розет
59. Реакция образования спонтанных розеток 505
кообразонания уже обсуждались рс:шее (см. разд. 10), Спон-
танное образование розеток наБJIюдалось между слеДУЮЩIf
ми типами клеток: лимфоциты эритроциты [8], МClкрофа-
rи эритроциты [1], макрофаrи .'1имфоциты '"2], JlИМфОЦИ-
ТЫ лимфоциты [3], клетки печени эритроциты [4], rpa
нулоциты тромбоциты [5], опухолевые клетки эритроци ы
[6, 7]. В большинстве случаев значение этоrо феномена 111
vivo неизвестно. На практике раз:rичные варианты реакции
образования спонтанных розеток применяются для количе-
ственной оценки субпопуляций .'1юлфоцитов. Наблюдая за
сдвиrами соотношения между B и Т-клетками, можно дe
.1ать выводы об иммунореактивности орrанизма [34, 46].
Функциональные способности Т-клеток MorYT выражаться в
виде пропорции «активных розеток» [36]. Была разработана
реакция подавления розеток [47], позволяющая и:сследова ть
влияние rуморальных факторов на розеткообразование. ДaH
ные, получаемые с по ощью реакции образования розеток,
имеют определенное клиническое значение, прежде Bcero при
оценке трансплантационноrо II ПРОТIIвоопухолевоrо иммуни-
тета [34, 46, 48 51 Т, а также при изучении аутоиммунных
заболеваний, иммунодефицитных состояний и аллерrии [2,
19, 21, 36, 52]. Широкое ИСПО.1ьзование и чувствительность
реакции спонтанных розеток позволяют рассматривать ее как
стандартный метод исследования ю.'!мунолоrическоrо стату-
са. Кроме Toro, эта реакция в КОМП.lексе с методом БёЙЮ:Vlа
[16] была положена в основу щадящеrо препаративнorо
выделения В клеток [53].
59.4. ЛИТЕРА ТУРА
1. Lalezari Р., Nehlsen S. L., Sinha S. В. Р., Stemerman М. Б Veitl1 F. 1.,
Spontaneous macrophage-erythrocytes J"osette formation. .\ srecies speci
Нс phenomenon, Immunology, 27, 457 (1974).
2. Лозовой В. П., Снышляева А. Ф., Приход'lен о А. А., ОдинцOlЮ Н. r.,
Феномен розеткообразования в aYTOK lbTYpC лейкоцитов венозной KpO
ви человека. Ж. Микробиол. (Москва), 2, 95 (1975).
3. Лозовой В. П., Смышляева А. Ф., Приходченко k А., Одинцова Н. r.,
Lymphocyte lymphocyte rosettes in systemic lupus er\.thematodes. .
Engl. J. Med., 291, 1360 (1974).' .
4. Лозовой В. П., Смышляева А. Ф., Приходчен о А. А., Rosctte fоrП1а
tion: liver celIs and sheep red blood cells. N, En g l. J. .\1ed. 291. 795
(1974) , ' .
5. Prlhal J. Т., Вlakely J., Granulocyte platelet J"osettes, N. Епgi J. Med.
289. 1146 (1973). . ,
6. Ijira'!l0to R. Н" Ghanta V. к., Studies of МОРС 104Е plasmocytoma cclls
tоrmшg rosettes with autologous and sупgспеiс erythroc\'le'S. J. Immll
nol. 111.893 (1973), "
7, Okada Н., ВаЬа Т., Rosette formation of human erythroc\'tes оп СllItшеd
celIs of tumour origin and activation of complement Ьу' се!! mсmЬrапс
ature, 248, 521 (1974). '
33 840
506 Э .Нике
8. Lasku ' R" Rosetie forming cells in nonimmunized mice, Nature, 219.
973 (] 968) .
9. Seiler [. R., Sedlacek Н. Н., Kanzy Е. J., Lang W., Ober die Brauchbar-
keit immunologischer Nachweismethoden zur Differenzierung funktioneH
verschiedener Lymphozyten: Spontanrosetten, Komplementrezeptor-Roset
ten und Immunglobulinrezeptoren, Behring Inst. Res. Сотт., 52, 26
(1972) .
]0. Brain Р., Gordon J., Willetts W. А., Rosette formation Ьу peripheral Iym
phocytrs. Clin. Ехр. Immunol., 6, 681 (1970).
11. СоотЬ" R. R. А" Gurпer В. W., Wilson А. В., Holm G., Lindgren В.,
Roscttc formation between Ьитап lymphocytes and sheep red cells not
iпvоlviпg immunoglobulin receptors, Int. Arch. Allergh Appl. Immunol..
39, 658 (] 970).
12. Lay W. Н., Meпcles N, У, Bianco с., Nиssenzweig V., Binding of sheep
rcd bJood cells to а large population of Ьитап Iymphocytes, Nature, 230.
531 ( 1971 ) .
]3. Frolaпd S. S., Binding oi sheep crythrocytcs to l1Uman Iymphocytes.
А probablc marker of Т Iymphocytcs, Scand. J, Immunol., 1, 269 (1972).
]4. Jondal М., Holm G., Wigzell Н., Surfacc markcrs оп Ьитап Т and В
Iymphocytes, I. А largc РОРllJаtiоп of Iymphocytes forming nonimmllne
roscttcs with sheep red bIood cclls, J. Ехр. Med., 136,207 (1972).
15. Wybraп J., Са" М, с., Fudeпberg Н. Н., ТЬс Ьитап rosette-forming сеlI
as а marker of а population of thymus derivcd cells, J. Clin. Invest., 51,
2537 (1972).
16. Виуuт А" Separation of blood ICl!cocytcs, granulocytes and lymphocytes,
Tissllc Antigcns. 4, 269 (1974).
17. Ross а. D., Rabellino Е. М., Poley М. J., Grey Н. М., Combined studies
of complcmcnt receptor and surfacc immllnoglolJulin bearing cells and
shcep crythrocyte rosettc.forming cclls in leukcmic JlUman Iymphocytes,
J. Clin. Invcst.. 52, 377 (1973).
18. Elliott В. Е., Haskill J. 5, Characterization oi thymus derived and Ьопе
marro\\'-dcri"cd roscttc forming Jymphocytes, Europ. J. Immunol., 3, 68
(1973).
19. Bach J. [" EvaJllation of T-cclls and thymic serum factors in тап lIsiпg
the rosettc technique, Transpl. Rev., 16, 196 (1973),
20. Mendes N. [., Tolпai М. Е. А" Silr..'eira N. Р. А" Gilbertsen R. Н., Metz
gar R. S., Тесhпiсаl aspccts of thc rosette tests used to detect Ьитап
complcmc.nt rcccptor (В) and sheep erytrocytc binding (Т) Iymphocytes,
J. ImmunoJ., 111,860 (1973).
21. FrfJland S. S., Natvig J. В., Idепtifiсаiiоп of thrcc different lymphocyte
рорulаtiопs Ьу surface markers, ТrапsрIапt. Rev., 16, 114 (1973).
22. Brown G., Greaves М. [., Cell surface markers for Ьитап Т and В lym-
phocytes, Europ. J. Immunol., 4, 302 (1974).
23. Kaplaп М, Е., Clark с., Ап impro"cd rosetting assay for detection of
Ьитап Т Iymphocytes, J. Immunol. Methods, 5, 131 (1974).
24. Метиет Р., Rosettcs апd imml1nocyto adherencc. П. «Sheep rosettes:o> iп
mап: factors infJucncing thc rcaction, Biomedicinc, 20, 131 (1974).
25, Pang G. Т. М., Baguley D. М., Wilsoп J, D.. Spontancous rosettes as
а T-Jymphocytc markcr: а modificd mcthod giving сопsistепt res111ts.
Shccp rcd Ыооd ccll rosctic, J. Immunol. Mcthods, 4, 41 (1974),
26. Steel С. М., Evans J., Smith М. А" ТЬе sheep ceII rosette test оп huшап
pcriphcral blood Iymphocytcs: ап analysis of somc variabIc factors iп tllc
tссhпiЧlJС'. Brit. J, Hacmatol.. 28, 245 (1974).
27. .ferrells Т. R., Hinric!ls D. J., ТfIC influcncc of !llС medium 011 tlle mor-
phoJogy of Ьитап pcriphc!'al bIood rosette-formil1g cclls, J. Rеtiсul0епdо-
thcJ. Soc" 17,84 (1975).
28. Parlells А, J., Roscttc formation, Lапсеt 11, 709 (1972).
59. Реакция образовапuя спонтанных розеток 507
29. Heier 11. Е, TI1e iпfll1СПСС of шссhапiсаl force оп the I'osctk test ior
htlПlаt1 Т lymphocytcs, Scal1d. J. Imml1l1ol" 3, 677 (1974).
30. A1ic/111ll1lyr О.. НиЬет с., Fiflk и, T LyтpllOzyten in pel"ipIH r('m ll1t Шld
Lутрl1kпоtеп bei lymphatiscllet1 SуslcmСI'kl'апkl1пgеп, SCllWCIi:. Med.
WSC!lI"., 104,815 (1974),
31. A1ic/llтllyr О., НuЬет с.. Fifl/l и., Spccial technical repol"t: Idcntificatiot1,
СПllтСl'аtiоп, and isolation of В al1d Т Iymphocytes fl"om 11tIП1ап p('firl1e
ral l)lood, Scand. J. Imml1I101., 3, 521 (19/.1).
32. Weiflcr М. 5., Bianco С" NUsscflzweip" \/., El1hal1ccd IJil1dil1g of I1сш"аmi-
t1idase-treated sheep erythrocytcs (о J1l1man T lymphocytes, Blood, 42,
939 (1973).
33, Ger[.!ely Р., 5zegedi Оу., Fekete В., 5zabo О., Petranyi Оу., Rosette for
mation and Т cells, Lancet 1, 883 (1973).
34. Tac/libafla Т., Jshikawa М., А ne\v micl'o method f01" quапtitаtiоп of Jш-
таl1 T and B lymphocytes, Japan. J, Ехр. Med" 43, 227 (197:3).
35, Bentwic/t Z., Douglas 5. D., 5kutelsky Е, Kunkel Н. О" Sheep red cell
binding (о human Iymphocytes treated \\"itll neuraminida5e: el1hancement
of т ceIl binding and identificatiol1 о! а subpopu1ation of «В ссI15», J.
Ехр. Med., 137, 1532 (1973).
36. Wybran J., Fudenber[.! Н. Н., Rоsеttе-fоппi!1g ceIls in val"io115 !штап di-
sease states: сапсеr, 1ymphoma, bactel"ial апd vira1 infections, апd other
diseases, J. Сliп. Invest., 53, 1026 (1974).
37. LoBtl[.!lio А. F., Cotraп R. 5., Jandl J. Н., Red cells coated \\'ith imml1no-
glоЬuliп G: Вinding and sphel'ing Ьу mononl1clear cells in тап, Science,
158, 1582 (1967).
38, Дон сков С. И., ЗОТllков Е. А., АллоrСllное розеткообразование с ЭРИТ-
роцитами, сенсибилизированньши резус аl!тителами. Пробл. rематол.
перелив. крови, 20, 1, 57 (1975).
39. Yoshida Т. О., Anderssoп В" Evidence iOl' а receptor rесоgпiziпg сот-
. p1exed immunoglobulin оп the 5urface оУ activated mOllse tllymus Iympho-
cytcs, Scand. J. Immunol., 1, 401 (1972).
40. Nussenzweig V" Receptors for immune comp1exes оп Iymphocytes. Adv.
Immuno1., 19, 217 (1974).
41. Bianco с., Patrick R., Nussenzweig V., А population of Iymphocytes Ьеа-
ring а membrane receptor for antigen antibody-complement complexes.
1. Separation and characterizatio!1, J. Ехр. Med., 132,702 (970).
42. Chiao J. W., Pantie V. 5., Good R. А., Нl1тап peripheral 1ymphocytes
bearing both B cell C receptors and Т -cell characteristics ior sheep ery-
throcytes detected Ьу а mixed rosette metllOd, Clin. Ехр, Immunol.. 18,
483 (1974).
43. Dickler Н. В., Adkiпsoп N. F" juп" Тетту W. D" Evidence for individua1
hl1man periphC1"a1 blood lympllOcytes beal'ing both В and Т С('[[ marker5,
Nature, 247, 213 (1974).
44. 5andilands О. Р., Отеу К, Соопеу k, Browning J. D., Graпt R. М.,
Anderson J. R., Dagg J. Н, Lucie N., Lymphocytes with Т and В се!! pro-
perties in а 1ymphoproliferative disorder, Lancet, 1,903 (1974).
45. 5hevaclL Е, Edelson R., Frank М., Lutzner М., Отееп J., А 11lIman leuke-
mia ceIl with both В and Т cell surface I'cceptors, Proc. Nat. Acad. Sci"
71,863 (1974). '
46. Кос,иuадu r. А., Применение реакции СПОIlтанноrо резеткообразования
для определения тимусзависимых тннjюцитов у человека. !К. Микро
био.:!. (Москва), 10,99 (1974).
47. Bach J. F., Dorтont J., Dardenne М., Balfler Н.. In vitro l'os tte-il1hibi-
tion Ьу antihuman anti-Iymphocyte SCl"lIm, Transplantation. 8 265
(1969). .
ЗЗ.
508 Э. Мике
48. Bewilk М., Ogg С. S., Parsons V., Snowdon S. А" Manuel L., Further
assessment of the rosette iпhiыtiоп test in clinical organ transplantation,
Brit. Med. J., 3, 491 (1972).
49. Morton Н., Clunie О. 1. А., The rosette inhibition test, technical conside-
rations, Transplantation, 14, 211 (1972).
50. Stjernsward 1., londal М., Vdnky F., Wig;zell Н., Sealy R., Lymphopenia
and change in distribution of human В and Т Iymphocytes in peripheral
bIood induced Ьу irradiation for тammary саrсiпоmа, Lапсеt, 1, 1352
(1972) .
51. Oross R. L., Latty А., Williams Е. А., Newbeтe Р. М., Abnormal spon
taneou rosette formation and rosette inhibition in luпg carcinoma, N.
Engl. J. Med., 292,439 (1975).
52. BentwiclL Z., Kunkel Н. А., Specific properties of humап В and Т Iyтpho-
cytes and alterations in disease, Transpl. Rev., 16, 29 (1973).
53. Oreaves М. F., Brown А., Purification of human В and Т Iyтphocytes,
J. Immunol., 112, 420 (1974).
СПИСОБ авторов
BAUDISCH, WOLFGANG, Dr. rer. nat.
WissепsсhаfШсhеr Oberassistent, Physiologisches Institut, Wilhelm
Pieck Universitiit Rostock
ВЕНМ, ERASMUS, Dr. med,
Wissenschaftlichel' Mitarbeiter, КIinik fiir Innere Medizin, Wilhelm-Pieck
Universitiit Rostock
BLANK, INGE, Dr. med.
WissепsсhаfШсhе Mitarbeiterin, PhysioIogisches Institut, Wilhelm-Pieck
Universitiit Rostock
BURMEISTER, JORGEN, Dr. rer. nat.
WissепsсhаfШсhеr Mitarbeiter, Physiologisches Institu t, Wilhelm - Pieck
Universitiit Rostock
BRAUER, PETER
Аssistепz-Аrzt, Bezirksinstitut fiir Blutspende und Тrапsfusiопswеsеп,.
Rostock
BROCK, JOSEF, Dr. rer. nat. habil.
Wissenschaftlicher Mitarbeiter, Fоrsсhuпgsаbtеiluпg Immunologie, Wil-
helm Pieck Universitiit Rostock
ERNST, BRUNO, Dr. sc. med. Dr. rer. nat.
Wissепsсhаftliсhеr Oberassistent, Institut fiir AlIgemeine und Spezielle
Pathologie, Wilhelm-Pieck-Universitiit Rostock
FALCK, PETER, Dr. rer. nat.
WissепsсhаfШсhеr Mitarbeiter, Zentralinstitut fiir Isotopen- uпd Strahlen
forschung, Akademie der Wissenschaften der DDR, Веr]iп Вuсh
FRICR, GERHARD, Dr. med.
WissепsсhаfШсhеr Mitarbeiter, КIinik fiir Innere Medizin, Wilhelm-Pieck
Uпivеrsitiit Rostock
FRIEMEL, HELMUT, Prof. Dr. sc. med.
Leiter der Fоrsсhuпgsаbtеiluпg Immunologie, Wilhelm Pieck Universitiit
Rostock
GONTHER, JOACHIM, Dr. rer. nat.
Wissenschaft1icher Mitarbeiter, Forschungsabteilung Immunologie, \Vi]-
helm-Pieck-Universitiit Rostock
HOFMANN, RAINHART, Dr. sc. med.
WissепsсhаfШсhеr Mitarbeiter, Universitiits Frauenklinik. Wilhelm Pieck-
Universitiit Rostock
JENSSEN, HANS-LUDWIG, Dr. rer. nat.
Wissenschaftlicher Mitarbeiter, Fоrsсhuпgsаbtеiluпg Immunologie, Wil-
helm-Рiесk Uпivеrsitiit Rostock
KAUNAT, HELMUT, Dr. rer. nat. habil.
WissenschaftНcher Mitarbeiter, Institut fiir Hygiene, Wilhelm Pieck.Uni-
versitiit Rostock
KERNEDER,ANDREA
Fach-MTA fiir Hiimatologie, Medizinischc Кliпik, KarkM.arx-Uпi\,еrsitiit
Leipzig
KLAUS, HANNELORE
Forschungsstudentin, Forschungsabteilung ImmunoIogie, \Yilhelm Pieck-
Universitiit Rostock
KLAUSCH, BERND, Dr. sc. med.
Oberarzt, U niversitiits Frauenklinik, Wilhelm - Pieck-U niversitiit Ros tock
KLEIST, HORST, Dozent Dr. sc. med. Dr. rer. nat.
Wisscnschaftlicher Oberassistent, Institttt fiir PhysioIogische Chemie,
.510 Список аВТОрОВ
Wilhelm-Рiесk-UпivеrsШit Rostock
KOCKEN, GISELA,
Diplomandin, Bereich Medizin, Wilhelm-Рiесk Uпivеrsitаt Rostock
LEVERENZ, SIGRID, Dr. rer. nat.
Wissenschaftliche Mitarbeiterin, Bezirksinstitut fiir Blutspende- uпd
Тrапsfusiопswеsеп, Berlin
L1NNEKE, PETER, Dr. med.
Wissenschaftlicher Mitarbeiter, Bezirkskrankenhaus Schwerin
LORENZ, URSULA, Dr. med,
\Vissenschaftliche Mitarbeiterin, Institut fiir Physiologische Chemie, Wil
hclm Picck Universitiit Rostock
l\1IX, EILHARD, Dr. med.
Wissenschaftlicher Mitarbeiter, Кinderklinik. Wilhe]m Pieck U l1!vcrsitiit
Ros tock
PREUSSNER, SIEGFRIED, Dr. med.
Oberarzt und Abteilungsleiter, Юiпik fiir Inncre ,IVledizin, WiIl1elm Pieck
Universitiit Rostock
SCНIRGEL, BERND, Dr, med,
Wissenschaftlicher Mitarbeiter, Bezirkskrankenhaus Schwerin
SCHRODER, IGO, Dr. agr.
Wissenschaftlischer Mitarbeiter, Forschungsabteilung Immunologie, WiI-
hеlm Рiесk UпivеrsШit Rostock
SCHULZE. HANS-ARTHUR, Dr, rer. nat.
Leiter des Isotopenlabors, Fоrsсhuпgsаbtеiluпg Immul1ologie, Wilhelm
Рiесk Uпivеrsitiit Rostock
SCHOTT, CHRISТINE, Dr. med,
Wissel1schaftIiche Mitarbeiterin, Institut fiir Physiologische Chemie, Wil-
helm Pieck Universitiit Rostock
SCHWENKE, HELGA, Dr. med.
Facharzt fiir Innere Medizin, Меdiziпisсhе Кlinik, Karl Marx Universitiit
Leipzig
SEUF ARTH, MICHAEL. Dr. mcd.
Wissel1schaftlicher Mitarbeiter, Forschungsabteilung Immunologie, WiI-
helm Pieck U пivеrsШi t Rostock
SIEGL, EDDA, Dr. rer. nat.
Wissenschaftliche Mitarbeiterin, Forschungsabteilung Immunologie, Wil
helm Pieck Universitiit Rostock
STRAUBE, WOLFGANG, Dr. sc, med.
Wissel1schaftlicher Mitarbeiter, Uпivеrsitiits-Frаuепkliпik, Wilhelm-Pieck-
Universitiit Rostock
TESSENOW, WOLFGANG, Dr. rer. паt. habil.
Wissспsсhаftliсhеr Mitarbeitcr, Zentrallaborat01"ium, Wilhclm Pieck Uni
versitiit Rostock
JESSMANN, D1ETR1CH, Dоzепt Dr. sc. med.
Oberarzt, Iпstitut fiir AlIgemeine und Spezielle Pathologie. Wilhelm-
Pieck Ul1iversitiit Rostock
WEGENER, SIВYLLE, Dr. med.
Аssistепz А.rztiп, Bezirksinstitut fiir Blutspendc ul1d ТrапsfusiопswС'sеп,
Rostock
WERNER. HEINZ, Dr. rer. nat.
Wisscl1schaftlicher Mitarbeitct., 1I1stitut fur Hygicne, Wilhelm.Pieck Uni
versitiit Rostock
WILMS, KARLHEINZ, Dr. rer. nat.
Аbtсiluпgslеitеr, Bezirksinstitut fur Blutspende- uпd Тrапsfusiопswеsеп,
Rostock
ZISKA. PETER. Dr. rer. nat.
Wissепsсhаftliсhеr Mitarbeitcr, Staat1iches Institut fiir Immunpriiparate
und Niihrmсdiеп BerIin
ПРЕДМЕТНЫй УКАЗАТЕЛЬ
АвстралийскиЙ антиrен (антиrен cы
Бороточноrо rепатита) 78, 459
463
выявление 79 88, 116 118
Arap 10, 17
д.'IЯ иммунодиффузии 31
Аrароза 20
Аrr.lютинацин 124 130
еЙкоцитов 120 123
эритроцитов 353 354
Адъювант Фрейнда 375, 376, 460,
461
А:юкар ин 66, 67
А.'lИзариновыЙ синиЙ 68
АЛ,lерrическан цитопенин 128 129
Алциановый синиЙ 67
А.lьбумин, выде.lение 248
А'oIндо черныЙ 21, 65
а А'oIинопеП11идаза 72
Анrнотензин, конъюrацин с альбу-
мином 262
Антиrен(ы) (см. ТaI,же Австралий-
скиЙ антиrен)
rистосов естимости 473
из надпочечника 250 251
карциноэмбриона,lЬНЫЙ 252 253
КОНЪЮI1ированные 258 262
ипопротеидные 462
ШКросо альный 252
определение качественное 31 37
количественное 38 47, 49 55,
58 63
опухолевые 252 254
почечные 251 252
титроваиие 35 36, 138
трансплантационные 318 321
хрусталика 248 249
ентральноЙ нервноЙ систе:\fЫ
2;)4 256
щитовидноЙ железы 252
Escherichia сои 113 115
HLA 122 123, 146 149, 151, 157
Rll 464 468
Антисыворотка, и '01 :\!уноэлектрофорез
11, 19
по Лоре.1ЛУ 19 29
концентрирование 380 381
получение 374 376, 464 467,.
469 471
содержание белков 378 379
специфическая активность 376
377
титрование 127
Антитела антилеЙкоцитарные 124
130
антитромбоцитарные 124 130,
141 149
двоЙная систе fа 430 433
И'ol lобилизованные 426 532
к австралиЙскому антиrену 116
перекрестно реаrирующие 157
титрование 113 115, 127 128
HL A 122
Антиэнцефалитоrенный белок 255
256
Аффинность 44 7 57
АФП с-и. а Фетопротеин
«Ба;I;IOТИНИ» .364
БарбиталовыЙ буфер 131
Батофенантролин 68
Бетш, коныoацияя с ,J,НФ 258 259,
262
fаркирование 414 421
окрашивание 13, 64 66, 68 69
сывороточные 26
Бе.l0К антиэнцефатпоrенныЙ 255
256
энцефалитоrенныii 254 255
Б,lаст траНСфОР lация .1ЮIФОЦИТОВ.
159 163
«Бустер эффеп» 436
Бусы Д.1Я КО.l0НОК 363, 364
Вата Д.1Я фракционирования 358
хлопковая 352
ВеронаkацетатныЙ буфер 1 О. 20
21, 79
Вероналовый буфер 143
Взятие крови 439
ВстречныЙ электрофорез 78 88
rаптен 129. 4.И 452. 456
rе.1И Д.'1я диск электрофореза (таб
,lица) 226 229
512 Предметный указаТеАЬ
rель фильтрация 417
rемаrrлютинация 82, 113 115, 139,
258
rе !О.lИЗ 352 353
rемолизин 142
титрование 137, 144 145
l'епатома 87, 88
[ереманса метод 15
rибриды Fl 183
rистолоrические препараты, приrо
товление 382 383
fИСТОСОВ Iести !Ость, метод оценки
151, 157, 473
f.lикопротеиды, окрашивание 67
68
i31с rлобулин 373
y r.l0булин из антисыворотки к ав'
стралиЙско !у антиrену 1 16 1 18
че:IOвеческий 375, 376
fрадиснт плотности 352 353, 367
371
сахарозы и CsC! 460
rрадиентное центрифуrИРОВ8ние
3бl 371
fранулоциты, выделение 328 З32,
347 348
при:шпание 355 361
удаление 351 360
хемотаксис 171
ДвоЙная систе !а антите,l 430 --l33
Двумерный электрофорез 19 29
Деrалан 363, 364
}lедероновое волокно 359
Деиодирование 419
Дзета потенциа.l 20 1 202
.Jиск электрофорез 221 231
Дифференциа.lьное центрифуrиро
ванис 367
ДНК, скорость синтеза 473
.Jренирование rрудноrо лимфатиче,
cKoro протока 347 348
Изопикническое зональное центри
фуrирование 367 371
Изотиоцианат родамина 374
ф.'Iуоресцеина (ФИТЦ) 373
Иммунизация 459, 469 4 71, 473
Иммунные сыворотки 435 440
ИММУllоабсорбция 436, 438, 441 442
Иммуноrистолоrия 391 400
ИммуноrJl0булины. выделение 264
296, 377 378
иммуноrистолоrия 373
комплексы 375. 385
радиоиммунолоrический анадиэ
430 432
секреторные компоненты 312
фраrментирование 298 313
фракционирование 381 382
IgA 276 284
IgC 264 270
IgD 291 295
IgE 296
IgG 264 271, 298 3()9
IgM 287 29!
Иммунодиффузия !2 1 :3. 19. 32, 58,
64
линейная 43 4 7
при иммуноэлектрофорезе 9
радиальная 134
двоЙная 31 37, 376 377
простая 49 55
Иммунопреципитация 64 77
при электросинерезе 78
Иммуносорбенты 441 445
ИммунофеР lентная метка 390
Иммуноферритш-roва я \!етка 39()
392
Иммунохимические методы с.н. И\I
мvноrИСТО.'Iоrия
ИммуноэлеКТРООСУ10форез 78
Иммуноэлектрофокусирование 16
Иммуноэлектрофореrра lма 13
Иммуноэлектрофорез 49, 64, 377
(см, также Иммунодиффузия)
встречныЙ (электросинерез)
78 88
количественныЙ (перекрестныЙ)
19 29
микрометод 9 18
по Лореллу 58 63
Иод меченыЙ 414
Иодирование '*14
Иодная кислота 67 68
Истощение ИЮ,IУННЫХ rhIBoj1oTOK
435 440
I(амеры для изучения миrрации Ia-
крофаrов 166
хемотаксиса 182
электрофореза 198 200, 32'*
Карбоксилэстераза 71
Карбонат,бикарбонатныЙ буфер 379
«Карбонильное» железо 360, 4Н. 476
Карциномы печени 87
КарциноэмБРИОlIаJ1ЬНЫЙ 3НТИi'ен
252. 253
Кислая фосфатаза 390
Клетки (см. также Лимфоб.'Iасты.
Лимфоциты. Макрофаrи. Тром-
п редм.етный указатель 513
боциты, Эритроциты)
разделение 364 3б5
К.1еточныс с"С'.пензии, приrотовление
346 348
Кожа, переС3,J.ка 177 181
l\o.1.1arCII 249 250
ко;rонки Д.1Я фракционирования
357 361
Ко !Плекс антиrен антитело, ин
д"кция хемотаксиса 171
при иммунодиффузии 43
торможение 1Иrрации Ma
крофаrов 168
фотометрия 38
антиrен антитело фермент 69
Кщшлемент 373. 375. 385, 392, 399
(см. также РеaJЩИЯ связывания
КОМПJIемента)
рОЛЬ В хемотаксисе 171
титрование 131 135, 137, 145
1-16, 156
фиксация 141
Контр иммуноэлектрофорез 78
Контроли специфичности 385 386
Костный мозr 346 347
Красители белков 64 69
Краситель rимза 481
Кривая экстинкции 41
Крнсталлины 248 249
Кровь 347
Лактатдеrидроrеназа 70
Латекс полистироловыЙ 116 (с,И,
также Реакция латекс аrrщотина
ции)
Леrкие цепи, выделение 299 302
синтез 245 246
Лейкоциты, аП.1ЮТИНИН 120 123
анТитела 156 157
приrотовление суспензии 346 348
ЛIшфа 347
Лимфоб.lасты 473
Лимфоцитолиз 1 51 157
Лимфоцитолизины 122, 151 157
Лимфоциты (С.1l. также С !ешанная
КУ.lьтура лимфоцитов)
бласт трансформация 159 163,
457
выделение 152 154. 157, 370,
475 477
КУЛЬтивирование 151, 16I 162,
473 484
мембраны 244 24Б
«(отвечающие» И «стимулирую-
щие» 477, 479
субпопуляции 363 365
фактор торможения миrрации 164
хемотаксиса 171, 174
центрифуrироваиие 367 37 1
Липопротеиды, антиrены 462
окрашивание 13, 66 67
электрофорез 210, 216
Лиссаминовый зеленын 65
Лорелла метод перекрестноrо элек
трофореза 1 9 29
электроиммунныЙ анализ 58 63,
87, 88
Макрофаl1И, миrрация 164 169, 174,
205 206
получение 347 348
хемотаксис 171
Манчини метод 49 55, 88
Мембраны ацетат целлюлозные 83
плазматические 244 245
j\'lEM TecT 205 206
lViета.1лопротеиды 68 69
leTKa радиоактивная 414 421
ферментная 390 400
ферритиновая 390 400
флуоресцентная 390, 400
Миrрация антиrенов и антител 78
макрофаrов 164 169
Микропористые фильтры 171, 173
lикротитратор Такачи 136
М-итомицин С 477, 479
.\10.1екулярныЙ вес, опреде.'Iение 236
10.10ЗИВО 281 284
М.оноциты, разделение 360 361
ыРНК, выделение 245 246
НеЙтрофи.1Ы 171
Непрямая реакция 373, 384 385
Нуклеиновые КИС.'Iоты 68 (C f. Ta]\
'же мРНК)
Нуклеопротеиды 68
Окрашивание 64 72
белков 13, 64 66
по Папенrеi'Iму 481
OpraHbI иммунноЙ систе 1Ы 346
Оссермана метод 14 15
«Отвечающие» К.lетки 477, 479
Отцовство, мето], ИСК,lючення 15,
Папанн 303 306
ПеНИЦИЛЛОНЛ I!ОЛНЛНЗИН 261 262
Ilепсин 307 313
514 ПредАlетныu указатель
Перекрестные им унолоrическис pe
акции 389
Пересадка кожи 177 181
opraHoB 151
Пиr енты 389
ПИрОI1ИН 68
Питате.lьная среда для культуры
ли фоцитов 475
для суспендирования клеток
197 198
Поверхностный заряд 201
По.lисахариды 67 68
Преципитаты 58, 373
Преuипитация (в rеле) 28 29, 87
использование в ИМ 1уноrистоло
rии 373
кольцо 49
.1ИНИИ 31, 58
фронт 43
Приборы для электрофореза 83,
196 200, 324
При.l!Iпание rранулоцитов 357 361
Пропиолактон 27
ПрочныЙ синиЙ 71
Пункция сердца 439
ПУНЦОВЫй красный 66
Рабочий стандарт 39
РавновесныЙ диализ 448 455
Радиоавтоrрафия 73 76, 88
Радиоактивное маркирование 414
421
Радиоактивные изотопы 414, 420
РаДИОЮ1 \'НО.lоrический а аа.'IИЗ 151,
423 43З
РаJ'';!ОЮI уноэлектрофорез 16, 74
Рак печени 87, 88
Реакция антиrен антите.lО 69
латекс аrrлютинации 83, 116 119
.1еЙкоаrrлютинина 151
связывания комплемента 82,
136 149, 151
ТОр lOжения миrрации макрофа
[ов 164 169, 205 206
«ТРaI!сплантат против хозяина»
182 185
РНК c . 1PHK
Роторы 239
Сведберrа единица 235
СеДЮ1ентации коэффициснт 235
уравненис 367
СекреторныЙ компонент 311 313
Си.1ИКOf!ированис 358
С ешанная культура лимфоцитов
151, 473 484
Среды для культивирования клеток
159 160, 475
Стеклянные бусы 364, 474
«Стимулирующие» клетки 4 77 484
Судан черный 13, 66
Сцинтилляционная жидкость 160
кювета 416
Сыворотка к ко плементу 375, 385
пуповинноЙ крови 85, 86
человеческая 13
СывороточныЙ rепатит 01. ABcтpa
лийский антиrен
Таннин 81
Тератобластомы 87, 88
ЗН ти идин 162
19S тиреоrJ10булин 252
Трансплантаты кожи 180 181
ТрансплантационныЙ антиrен З18
321
Трипсин 306
Тро боциты 124, 126, 143
Туберкулин 160
Тяжелые цепи 299 302
Удена метод 43 47
Ультра иммун оэ.'!ектрофорез 16
У льтрацентрифуrирование 234 246
Ухтерлони eTOД 31 37
Фаrоцитоз 360 361
Фактор переноса 187 193
торможения шrрации макрофа
[ов 164, 168 169, 171
Факторы лейкотаксические 174
хемотаксиса 171
Феномен прозuны 84
Ферменты, выявление комплекса с
а!!тнтсло 69 72
метка 390 399
Ферритин 390 392, 416
а ФетопротеИlI (АФП) 78, 85 88,
353 354
Фильтр стерилизующий 474, 475
Фитоrемаrr.1ЮТИНИН 159, 163
ФИТЦ сд Ф.:lуоресцеинизотиоциа
нат
Флуоресцсин З89 390
Флуоресцеиниз()тиоциаllат (ФИТЦ)
379, 391 400
определенис 374, 375
ФлуорссцеНТllыi'r 1I!КРОСКОП 38б
фи.1I>ТР 388
п редм.еТ1iЫЙ указатель
Ф:lуоресценция 389 390
rашенис 455 456
leTOДЫ ] 5]. 390, 400
Ф.1УОРЮIСТРИЯ 390, 400
Ф.lуорохро!>\ирование им!>\унолоrиче
скос 379 380, 388, 39] 400
Фотометрия 38 42
Фраr'менты им!>\уноrлобулинов 304
309
Фракционирование 282
ЮI I\'ноrлобv.'IИНОВ 381 382
l\МТ'ок 355 361, 363 365
Хемотаксис 171 175
Х ористый натрий 379
Хроматоrрафия на бумаrе 4] 7
Цснтрифуrирование (см. также Уль-
трацентрифуrирование)
в rрадиенте плотности 240 242,
252, 267 271, 352 353, 367 371
простое 351
J цепь 308 309
ЦеРУЛОП.lазмин 71
«Цптоферометр» 197
Цитохром с 390
UJаблон для канавок 211 214
Щелочная фосфатаза 72, 390
ЭДТА ]22
Эксудат 347
ЭлеКТРОИ!>\!>\УШIЫЙ анализ 58 63
Э.ilсктрои!>\мунодиффузия 58
ЭJlсктросинерез 78 8
Электрофорез (01. также Иммуно
электрофорез)
аналитическиЙ 22] 231
в rеле 209 220
встречныЙ 58, бl 63
клеток 295 307, 323 326, 363
Электрофоретическая камера 210
211, 214
подвижность 75 76, ] 96, 200
201, 203 205, 325
ЭлектрофоретическиЙ потенциал
20] 202
прибор 16
ЭJlсктрохи!>\ическое маркирование
415 420
Э сктроэндоосмос 79
Элюированис ] 2 ] 3
Энцефа,lитоrенный бе,10К 254 255
Энцсфаломие.1ИТ 255
ЭОЗИНОфИЛЫ 171
Эритроциты, аrrлютинация 353 354
барана 142 ]44
rемолиз 352
- оседание 345, 350 351, 477
. uентрифуrирование 35I 352
СОДЕРЖАНИЕ
Предисловие редактора перевода . 6
Предисловие редактора немецкоrо издания 7
Предисловие редактора немеЦКоrо издания к русскому
переводу книrи 8
1. Иммуноэлектрофорез (микрометод) (Х. Фримель) 9
2. Количественный двумерный иммуноэлектрофорез
(перекрестныii электрофорез по Лоре.l.lУ) (Б. Шир.
rель)
3. Двойная радиальная иммунодиффУЗIlЯ по Ухтерлони
(Э. Бем) 31
4. ИМ lунохимическое определение антиrенов с по-
:\lОщыо фотометрии (Э. Бем) 38
5. Простая линеЙная иммунодиффУЗИlI по Удену
(Э. Бем) 3
6. Простая радиальная ИММУНОДИФФУЗIlЯ по Манчини
(Э. Бем) 49
7. Э.lектроиммунный ЮIаJ1ИЗ по Лореллу (Э, Бем) . 58
8. Анализ иммунных преципитатов в rелях (В. Штрау.
бе, Б. Клауш, Р. Хофман) 6-l
9. Встречный электрофорез(электросинерсз) (К Вильме.
Б. Клауш, В. Штраубе, Р. Хофман, П. Линнеке) 78
10. Метод розеток (Э. Бем) 90
11. Метод лока.lы!Оrо I'емолиза в [С.1С (Э. 3иrль,
Э Б ) 96
. ем .
12. Реакция rемаrrлютинации (Э. 3иrль) 108
13. Титрование антител к О. и Кантиrенам Echerichia
сои в реакции пассивной I"емаrrлютипации (П, Цис-
ка) 113
14. Выявление австралийскоrо антиrена методом латекс-
аrrлютинации (К Вильмс) 116
15, Реакция аrrЛlOтииации лейкоцитов (с. BereHep) 120
16. Выsт,',снис аrrЛЮТlIl!I!РУЮЩИХ анти.lеi'!КОl1lнарпых "
антитромбоцитарных антител (В. Тессенов) . 12.
17. Титрование комплемента (М. 3ейфарт) 131
18. Реакция связывания комплемента (РСК) (М. 3еЙ.
фарт) 136
19. Определение антитромбоцитарных антител в реакции
связывания комплемента (3. Леперенц) 141
СодеРЖОЩJС 5] 7
20, Реакция лимфоцитолизu (с. Bel-енер) 131
21. Реакция бласт-трансформации лимфоцитов ce.1C3f::II
ки под влиянием антиrена iп vitro (В. Тессенов) . 159
22. Реакция торможения миrрации макрофаrоu
(И. Бланк) . 163
23, Исследование факторов, вызывающих XCMOTi:Jf-.l"ИС
(И. Бланк) . 171
24. Пересадка кожи (Х. Каунат) 177
25, Реакция «трансплантат против хозяина» на IЫШах-
rибридах первоrо поколения (В. Тессенов) 182
26. Выделение фактора переноса (И. Шрёдер, У. ,;10-
ренц) 187
27. Электрофорез клеток (r.-л. Иенсен) 195
28. Электрофорез в rеле аrарозы (П. Линнеке) 209
29. Аналитический диск-электрофорез (Х. Фриме.1Ь) 221
30. Ультрацентрифуrирование (Х. Вернер) 234
31. Приrотовление антиrенов (И. rюнтер) 248
32. Приrотовление конъюrированных антиrенов (И. Брок) 258
33. Выделение иммуноrлобулина G (IgG) (И. Брок) 264
34, Выделение иммуноrлобулина А (IgA) (И. Брок) 274
35. Выделение иммуноrлобулина М (IgM) (И. Брок) 287
36, Выделение иммуноrлобулина D (IgD) (И. Брок) 293
37. Выделение иммуноrлобулина Е (IgE (И. Брок) . 296
38. Фраrментирование иммуноrлобулинов (И. Брок) 298
39. Выделение трансплантационных антиrенов (с Кла
ус, И. Брок) 318
40, Препаративная электрофоретическая сортировка
лимфоцитов (r.-л. Иенсен) 323
41. Выделение rранулоцитов че.'lОвека (r. Фрик, З. Прей-
снер) 328
42. Выделение ,1Имфоцитов человека (r. Фрик, З. Прей-
снер) 333
43. Приrотовление лейкоцитарных суспензиЙ (Ю. Бур-
мейстер) . 346
44. Удаление эритроцитов из суспензии иммунокО\ше.
тентных клеток (Ю. Бурмейстер) 350
45. Удаление l'ранулоцитов из смешанной суспензии
клеток (В. Баудиш, Ю. Бурмейстер) 357
46. Выделение различных субпопуляций лимфоцитов с
помощью колонок (В. Баудиш) 363
47. Фракционирование суспензии лимфоцитов с по:.IOЩЬЮ
центрифуrирования в rрадиенте плотности (r.-Л
Иенсен, Ю: Бурмеiiстер) З67
48. Иммуноrистолоrия (Б. Эрнст, Д. TeC:VlaH) 373
49. Радиоактивное маркирование бе.llКОВ (Х.-А. Шу.1ЬЦ<,) 414
50. Радиоиммунолоrическиii анализ (П. Фа,lЬК) . 423
518 Содержание
51. Получение и истощение иммунных сывороток
(Р. Хофман, В. Штраубе, Б. Клауш) 435
52. Иммуносорбенты (r. Кюккен, И. Брок) 441
53. Определение аффинности антитеJI (Х. Клейст) 447
54. Получение rетеРОJlоrических антисывороток к авст'
ралийскому антиrену (К Вильм ) 459
55. Получение человеческих антисыnороток к Rh-анти-
[ену (П. Брауэр) 464
56. Получение человеческих антисывороток к rрупповым
антиrенам системы АВО (П. Брауэр) 465
57. Смешанная культура ЛИМфОЦI1ТОВ (Х. Швенке,
А. Кернедер) 473
58. Реакция бласт-трансформации лимфоцитов (РБТЛ)
в клиНической диаrностике (Х. Шютт) 487
59. Реакция образования спонтанных розеток (Э. Микс) 501
Список авторов 509
Предметный указатель. 511
Уважаемый читатель!
Ваши замечания о содержании ЮIиrи, ее оформ-
лении, качестве перевода и друrие просим присы-
лать по адресу:
129820, Москпа, и 11 О, rсп,
I Й РижскиЙ пер., д. 2,
издательство «J\1ир»
Iioд ред. Х. Фриме.1Я
иммунолоrИЧЕСКИЕ МЕТОДЫ
Научный редактор Ю. И. Лашкевич
Младший редактор Р. Ф. I(уликова
Художник А. Б. Маркевич
Художественный редактор Б. Н. Юдкин
Технический редактор Е. В. Бурмистрова
Корректор В. И. Пост нова
ИБ лr2 1250
Сдано в набор 22.08,78.
ПОДIIИсано к печати 04,01.79.
Формат 60X90 1 / 1 6
rарнитура латинская. Печать высокая
Объем 16,38 бум. л. Усл. печ. .1. 32,75, В Т.ч. 0,12 ЦВ. ВК.'.
Уч.-изд. л. 32,06. Изд. NQ 4/9732. Тираж 6300 экз.
Заказ. NQ 840. Цена 3 р. 30 к.
Издательство «Мир»
Москва, j.й Рижский пер., 2
:vlосковская типоrрафия NQ 11 СОЮЗI10лиrрафпро !а
при rосударствениом комнтете СССР
по дела ! издательств, полнrрафии и книжноЙ торrОВ.1И
Москва, 113105. НаrаТl!lIская ул., д. 1
ФОТО rрасри ровал Семенючен КО Влади ми р
chem vova@mai I.univ.kiev.ua; vova2002@mai I.ru
... ... +
.';... :.
"Мир"
по... ' " ..е '.,
М...... · 1; bl
..