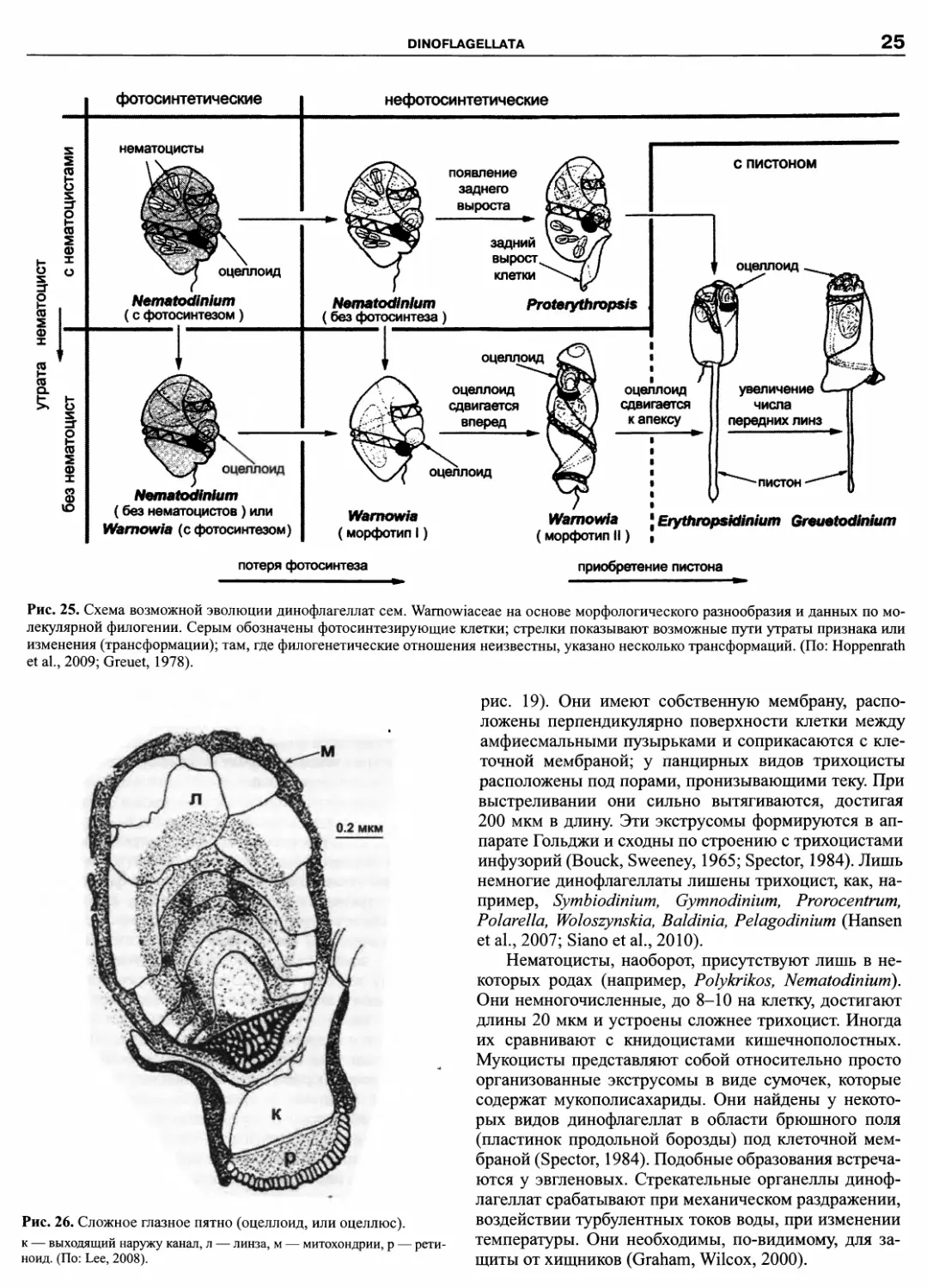
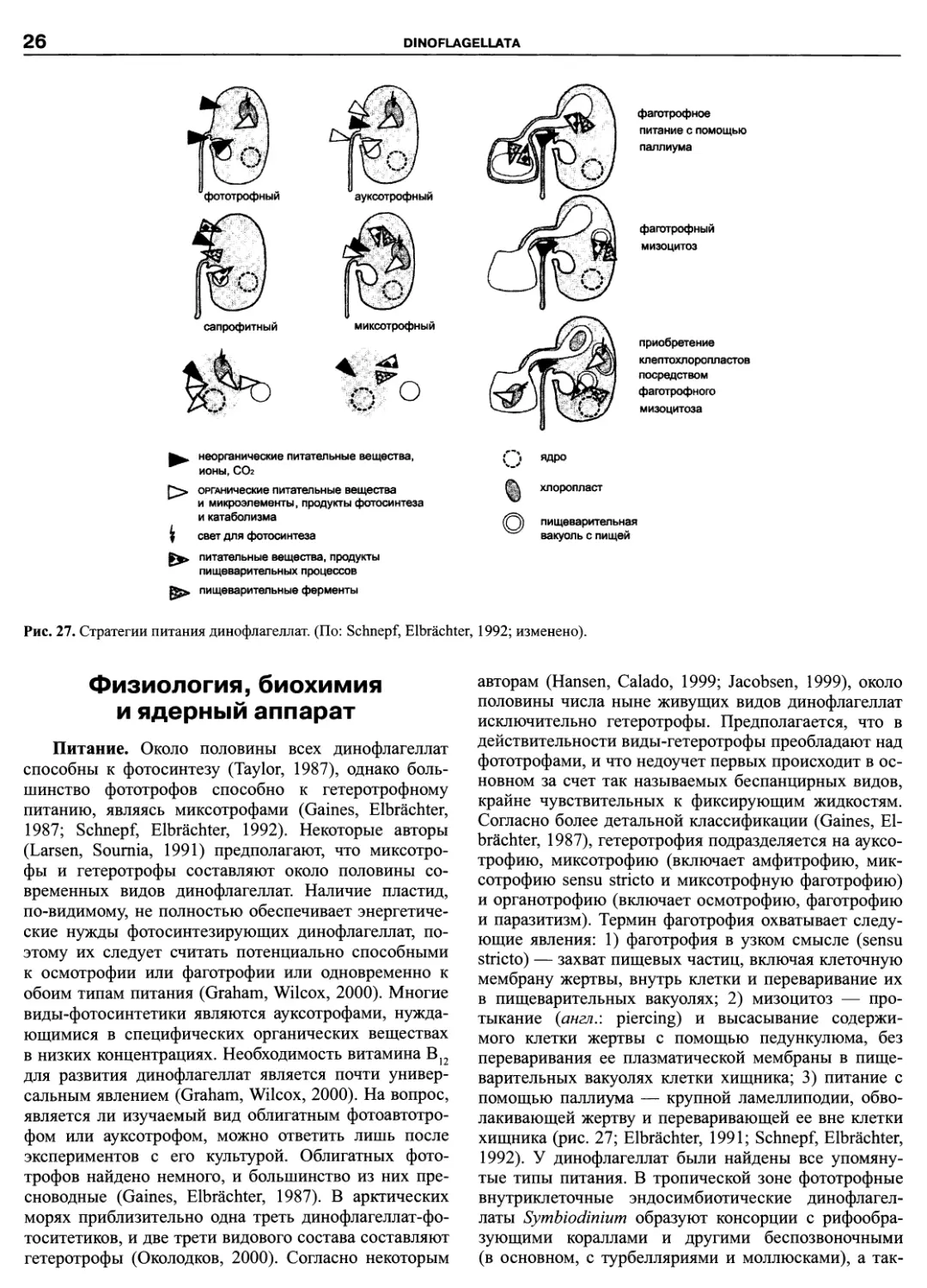
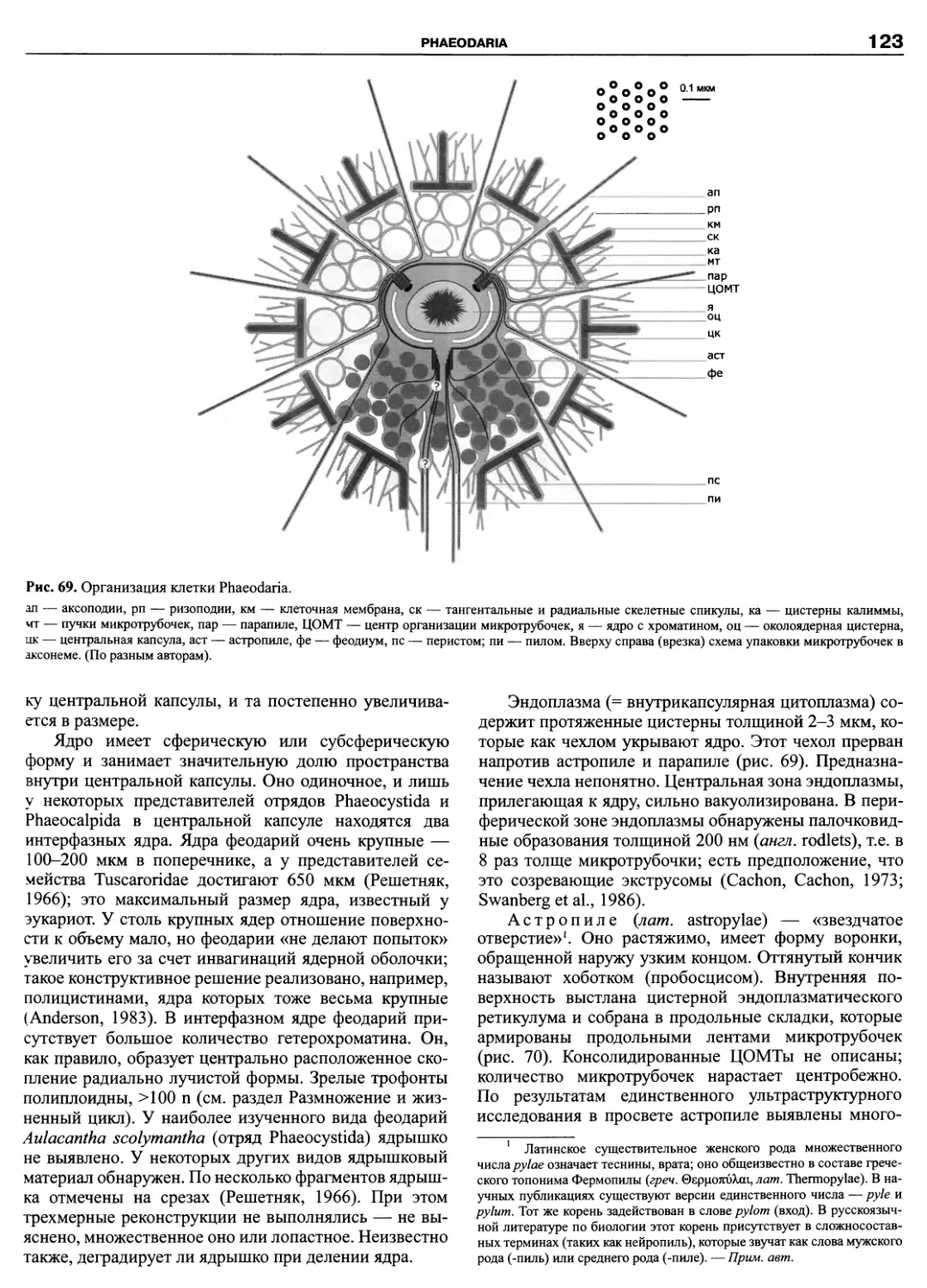
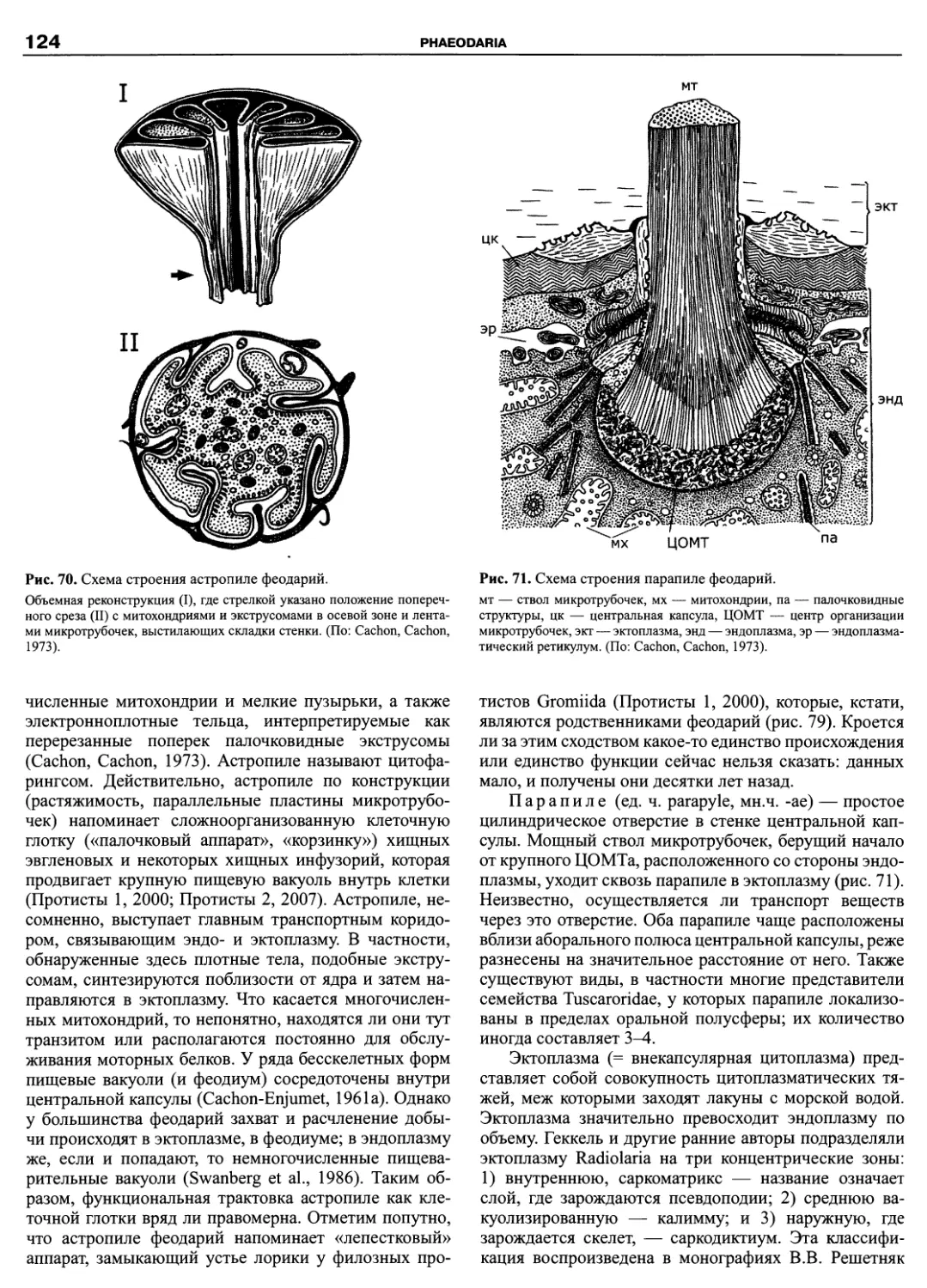
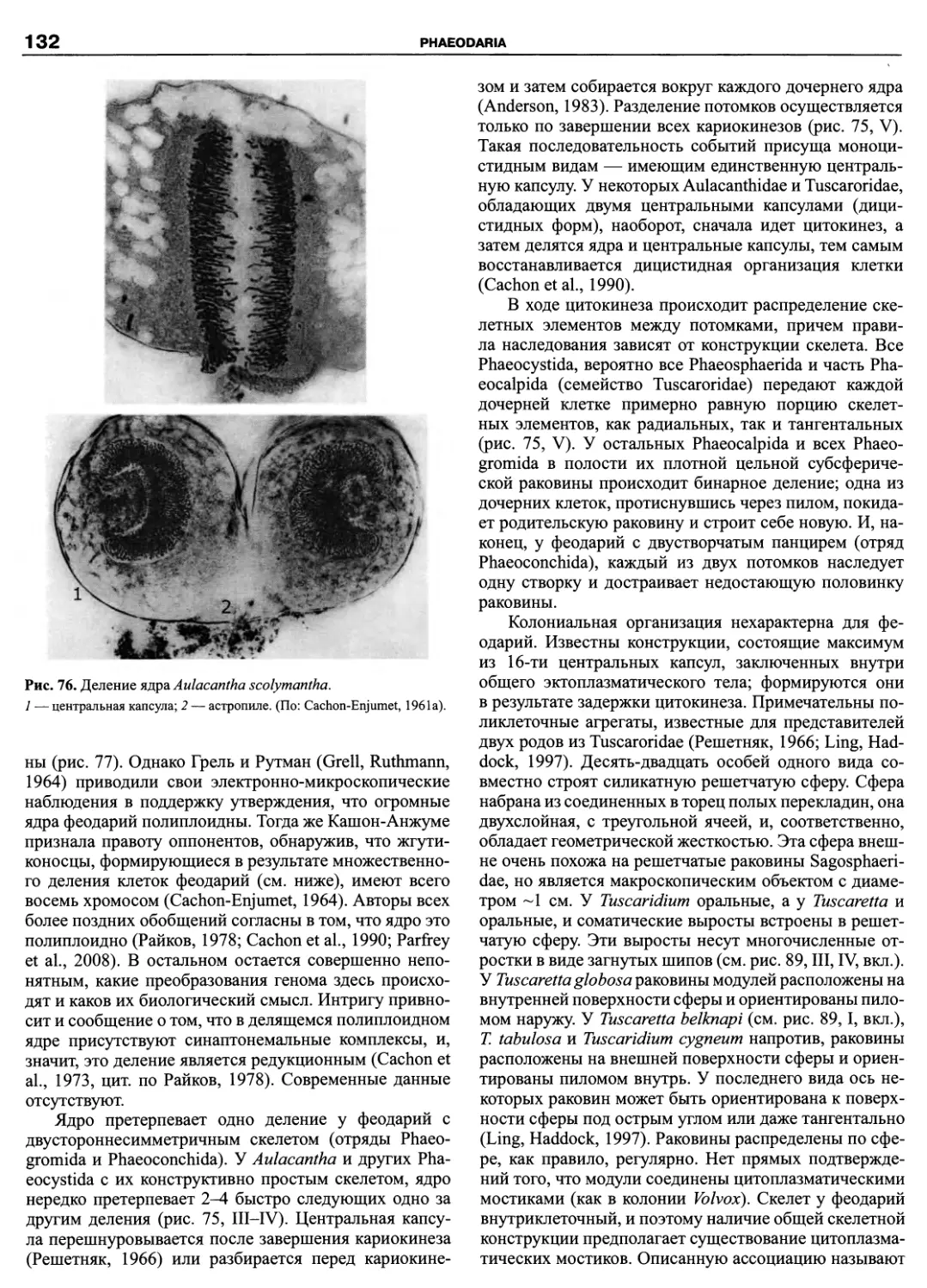
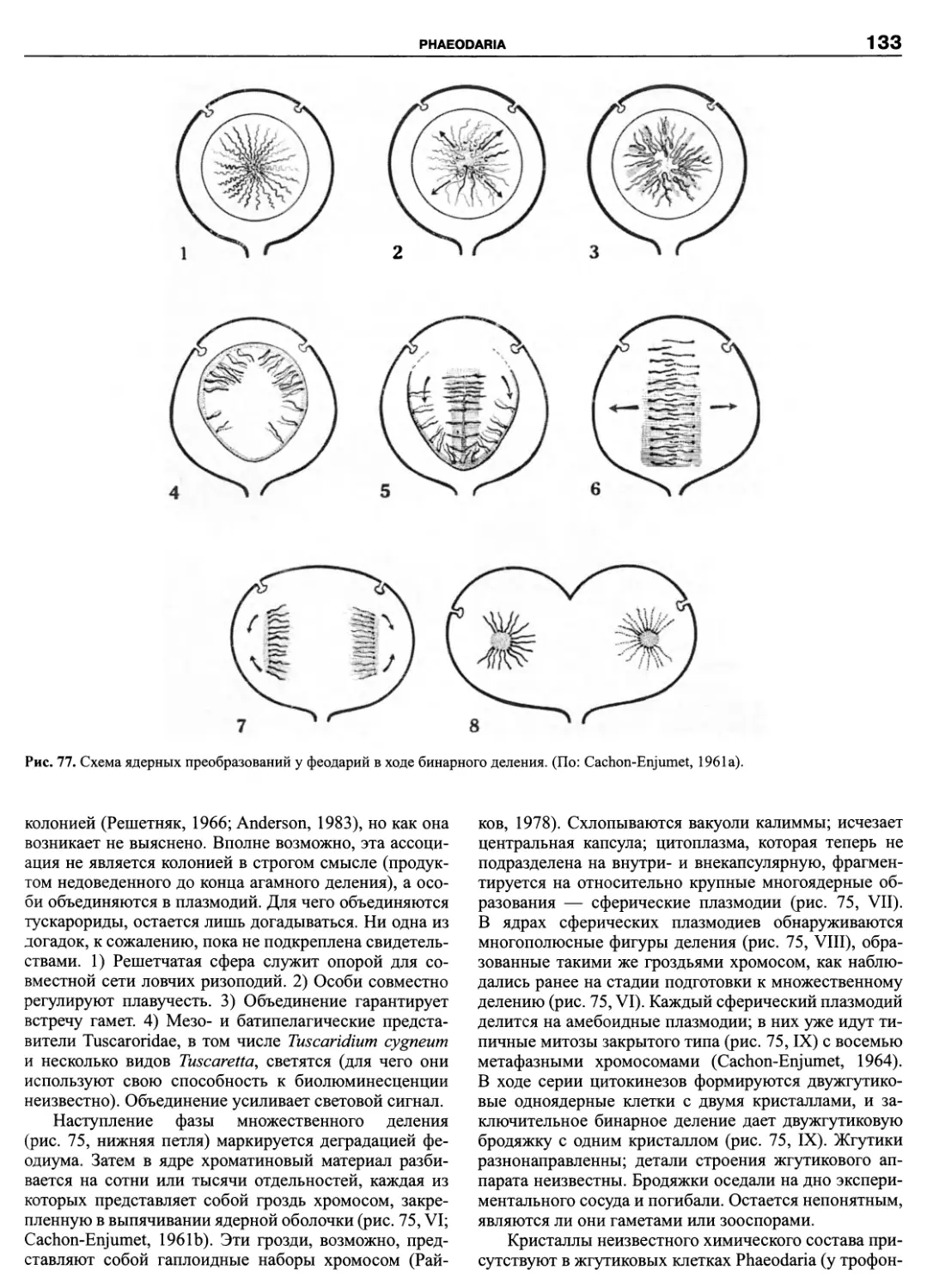
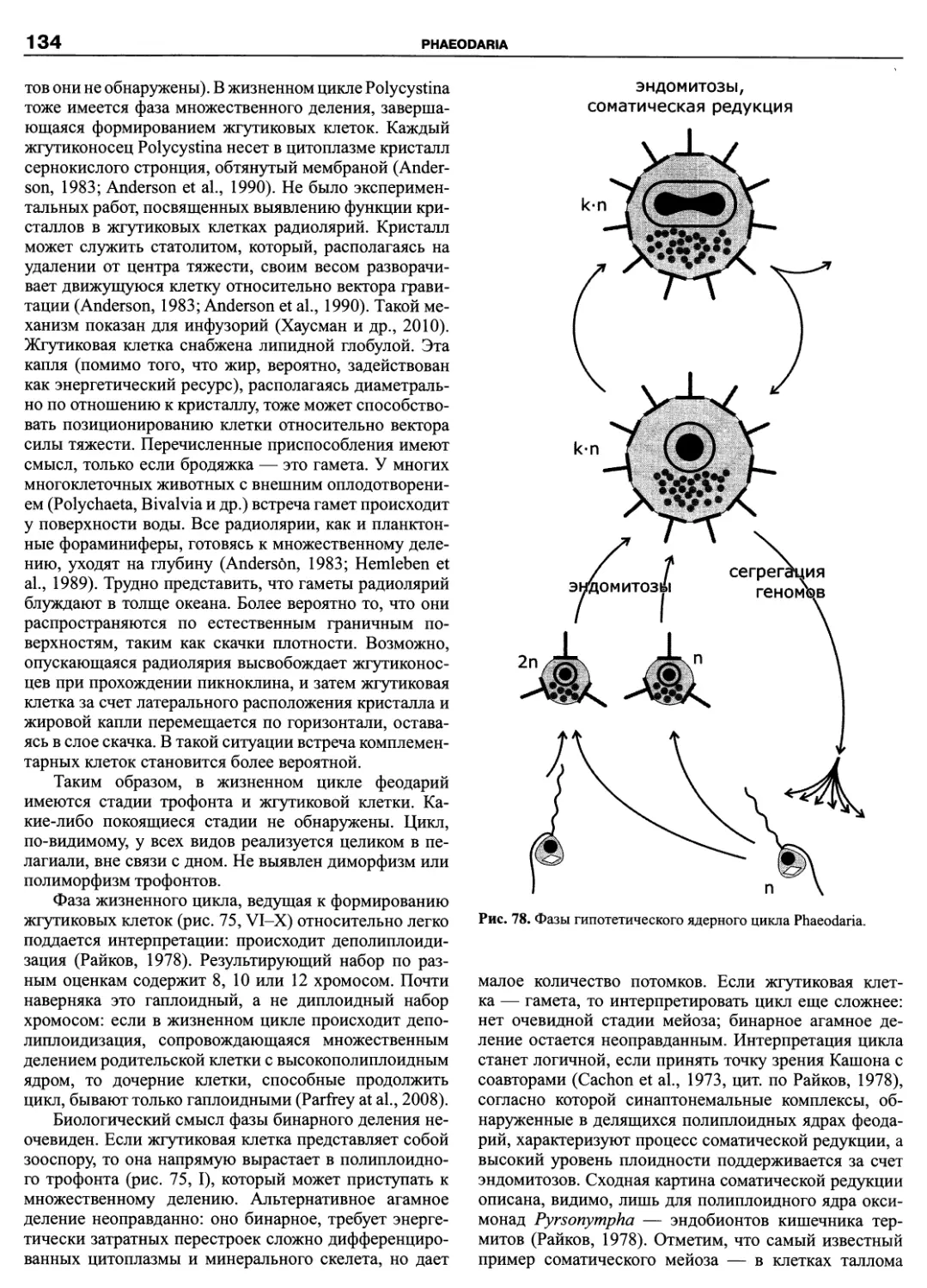
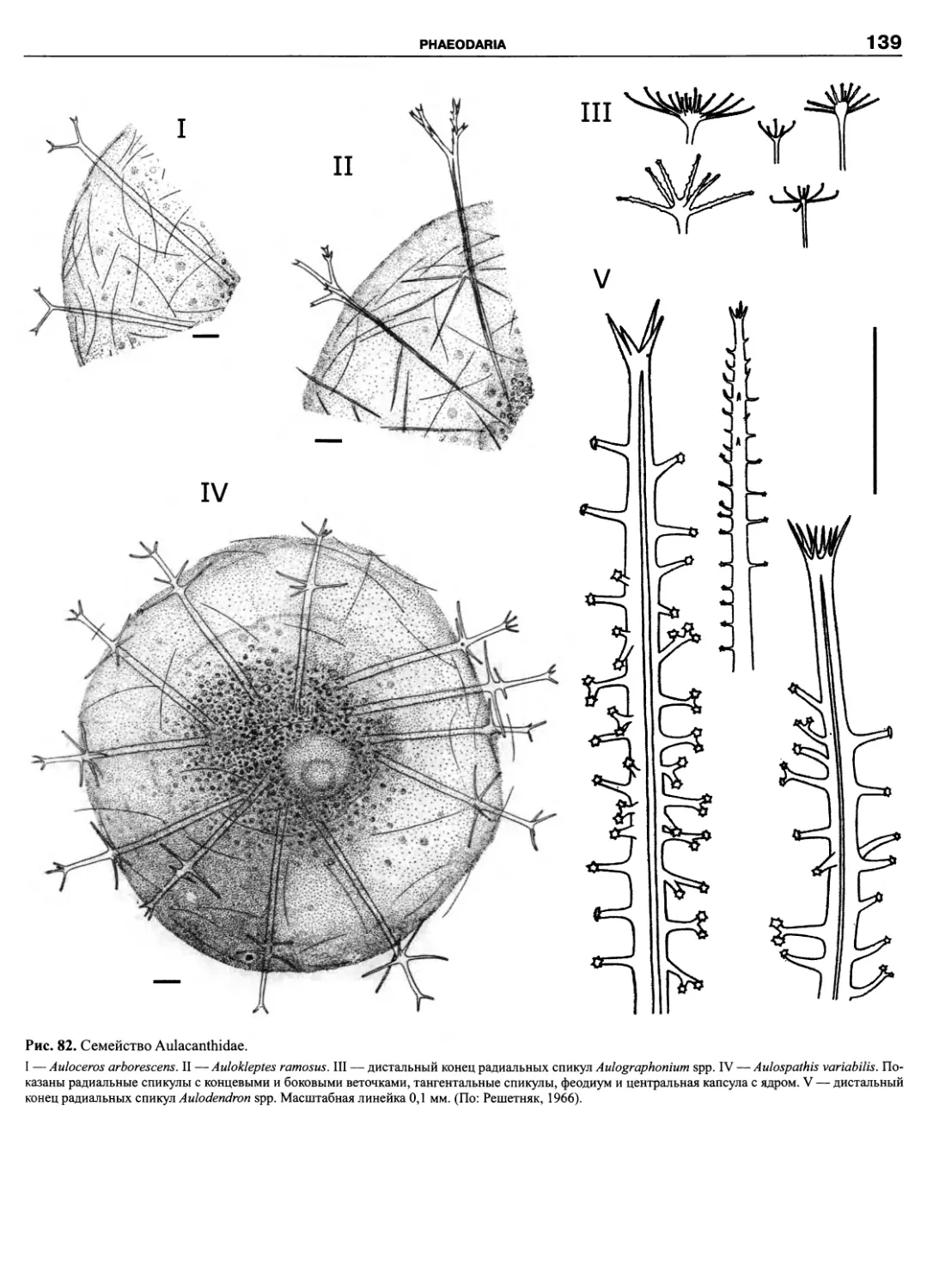
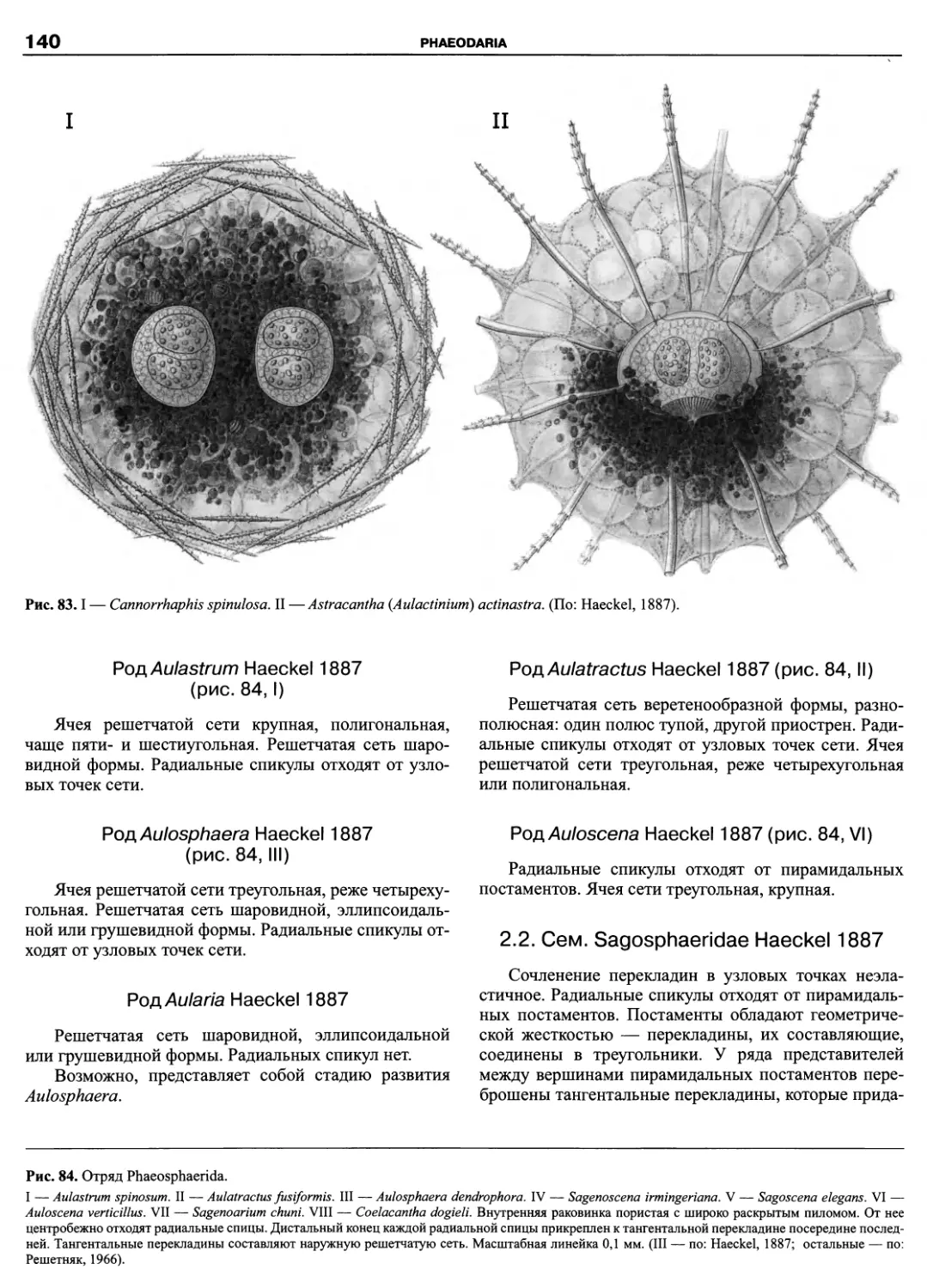
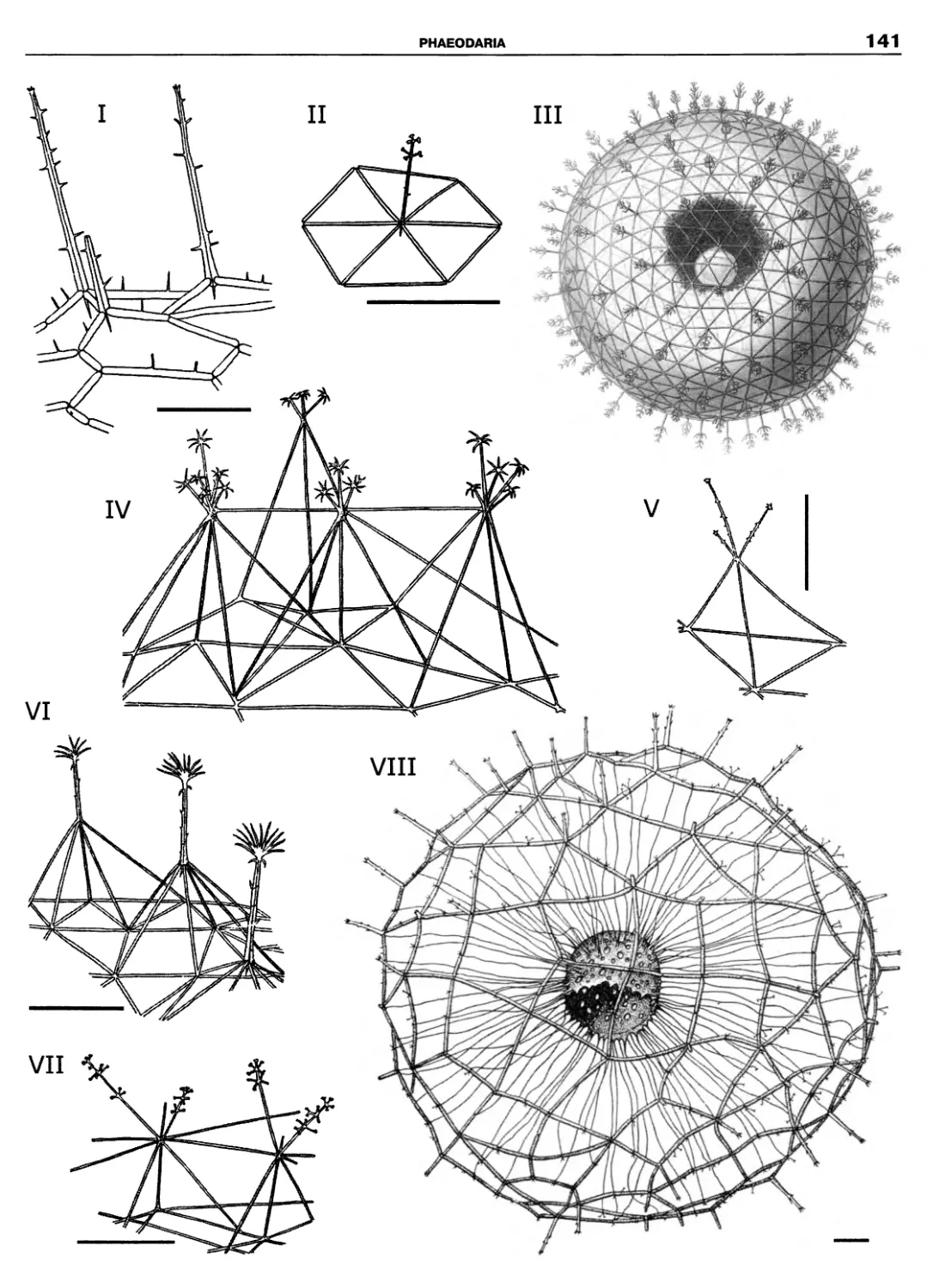
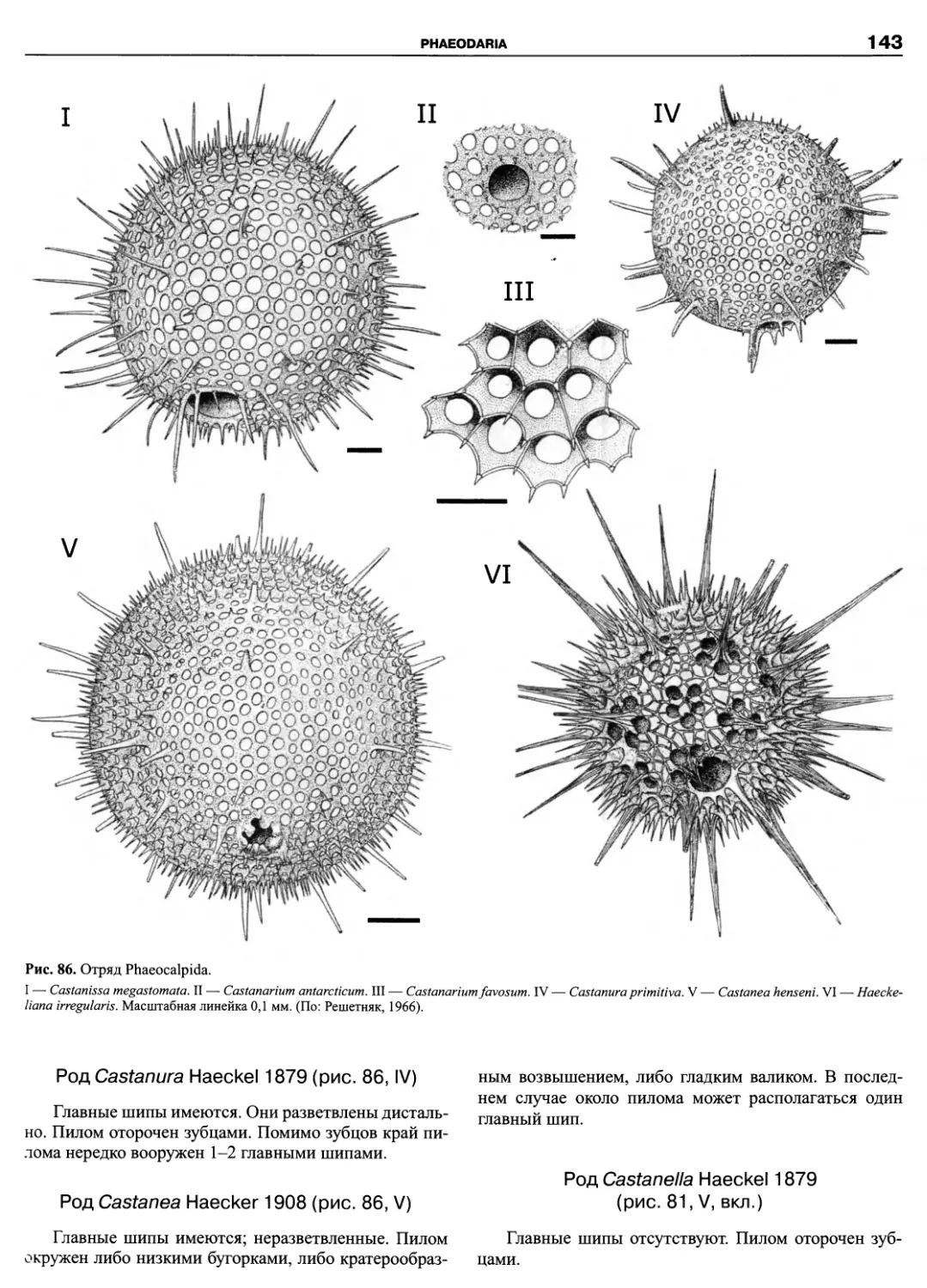
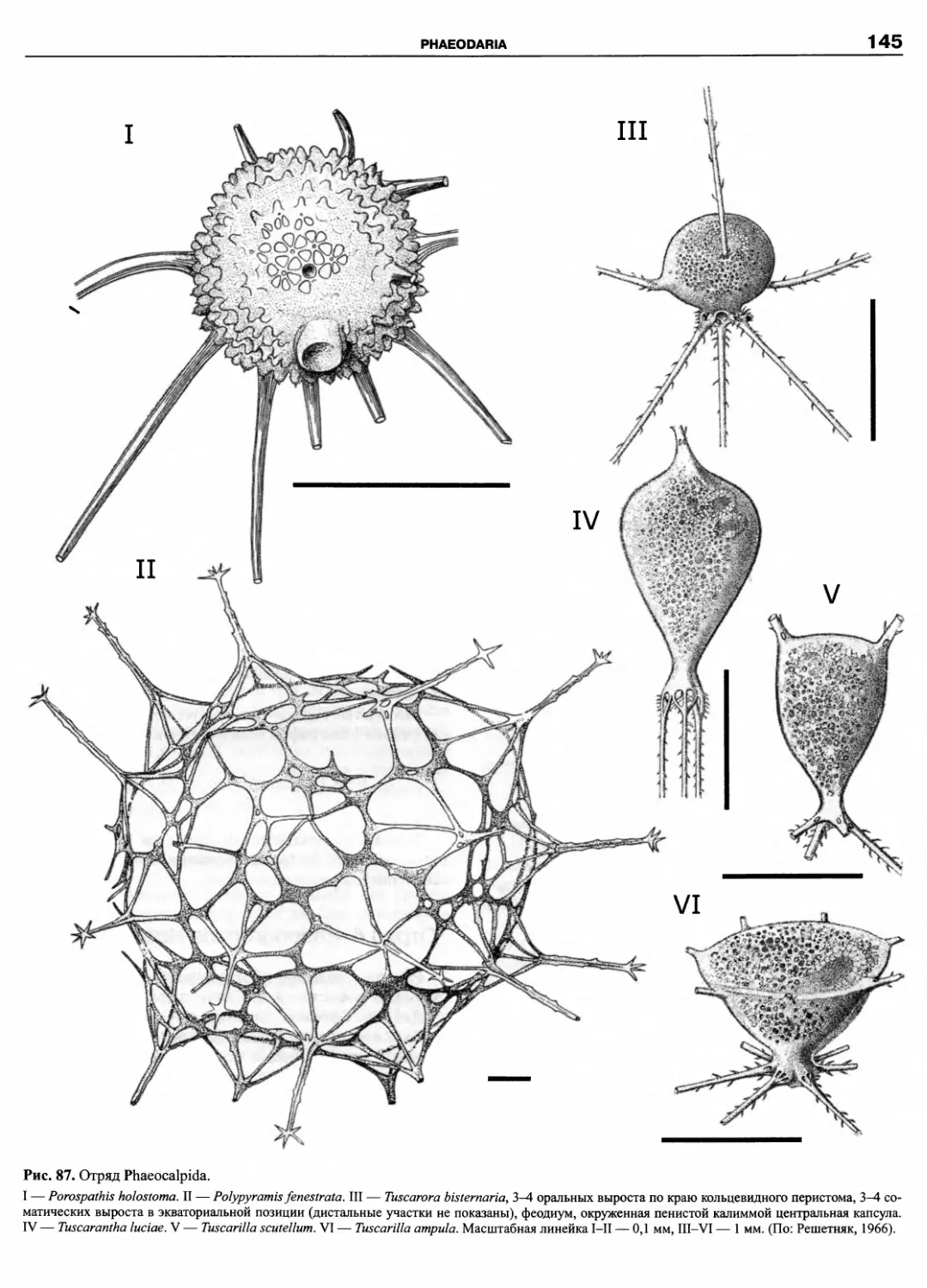
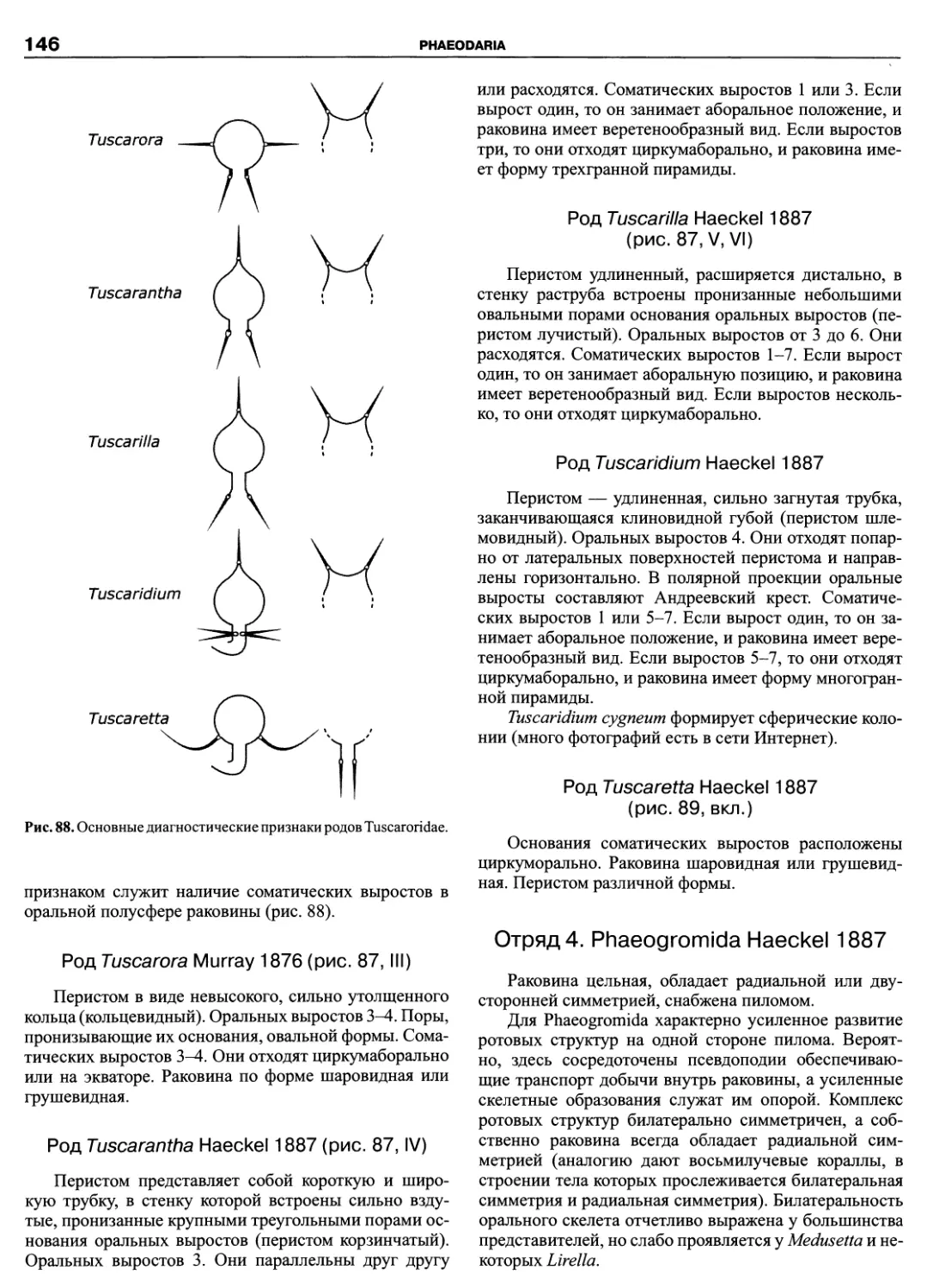
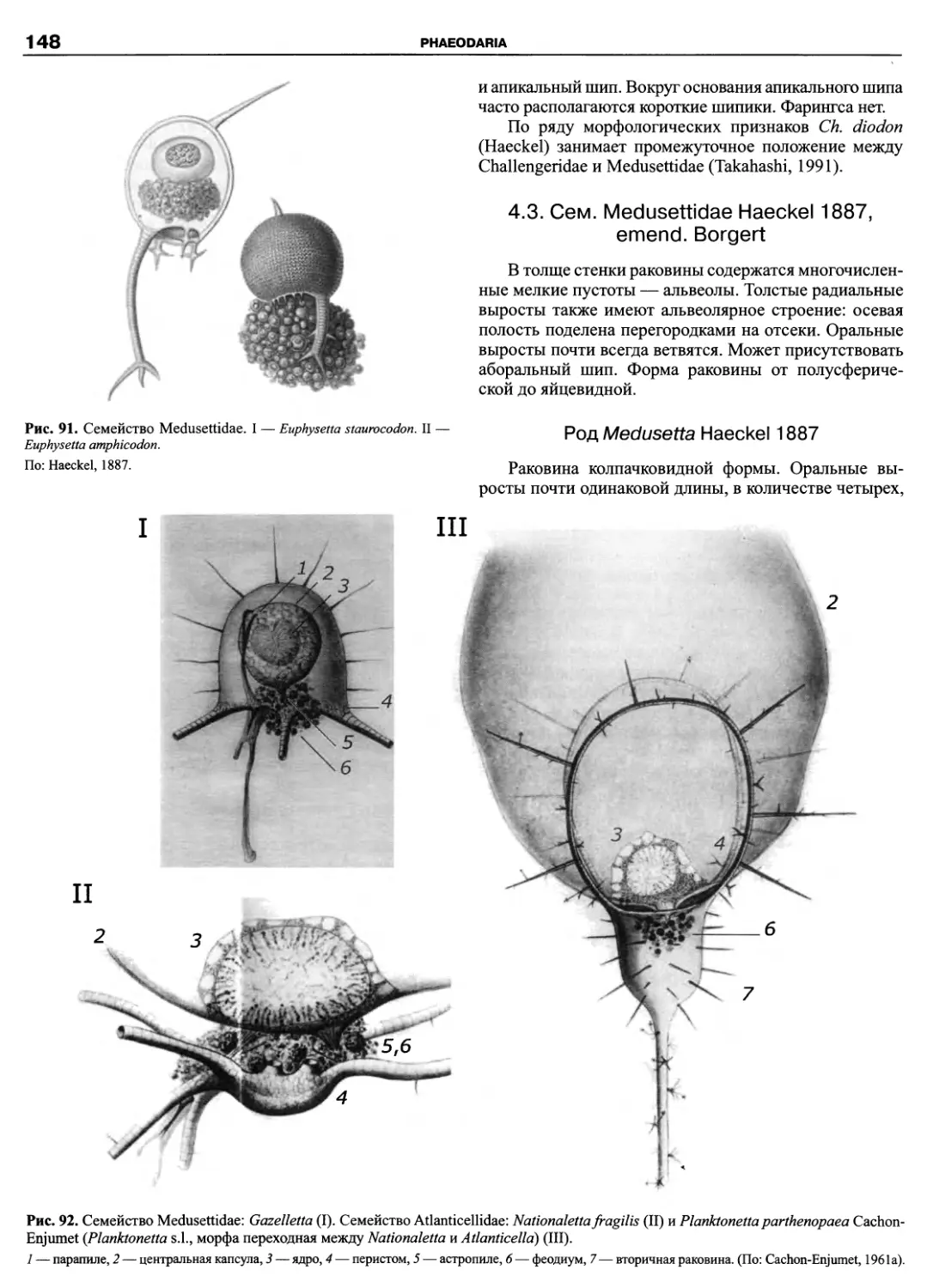
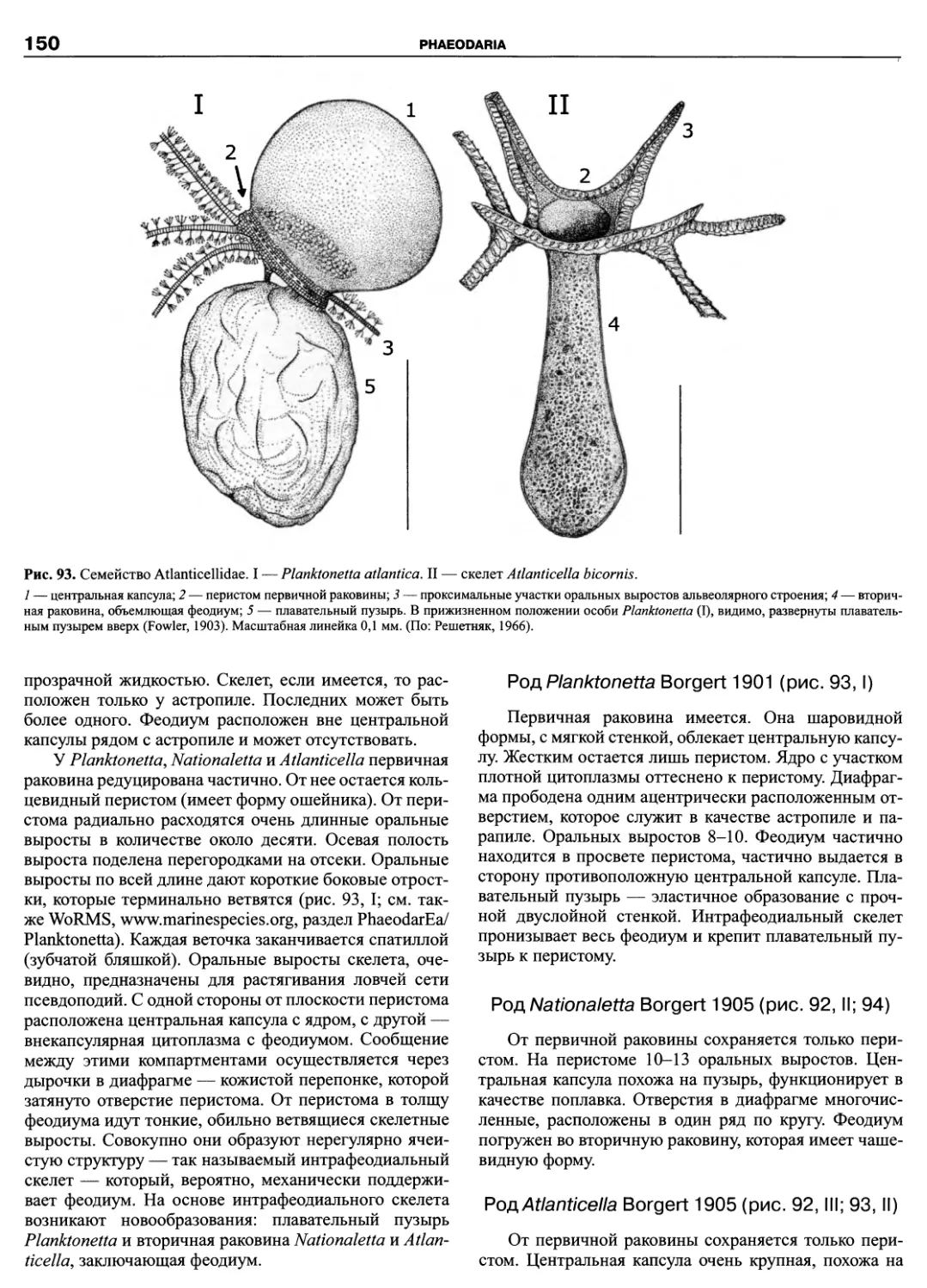
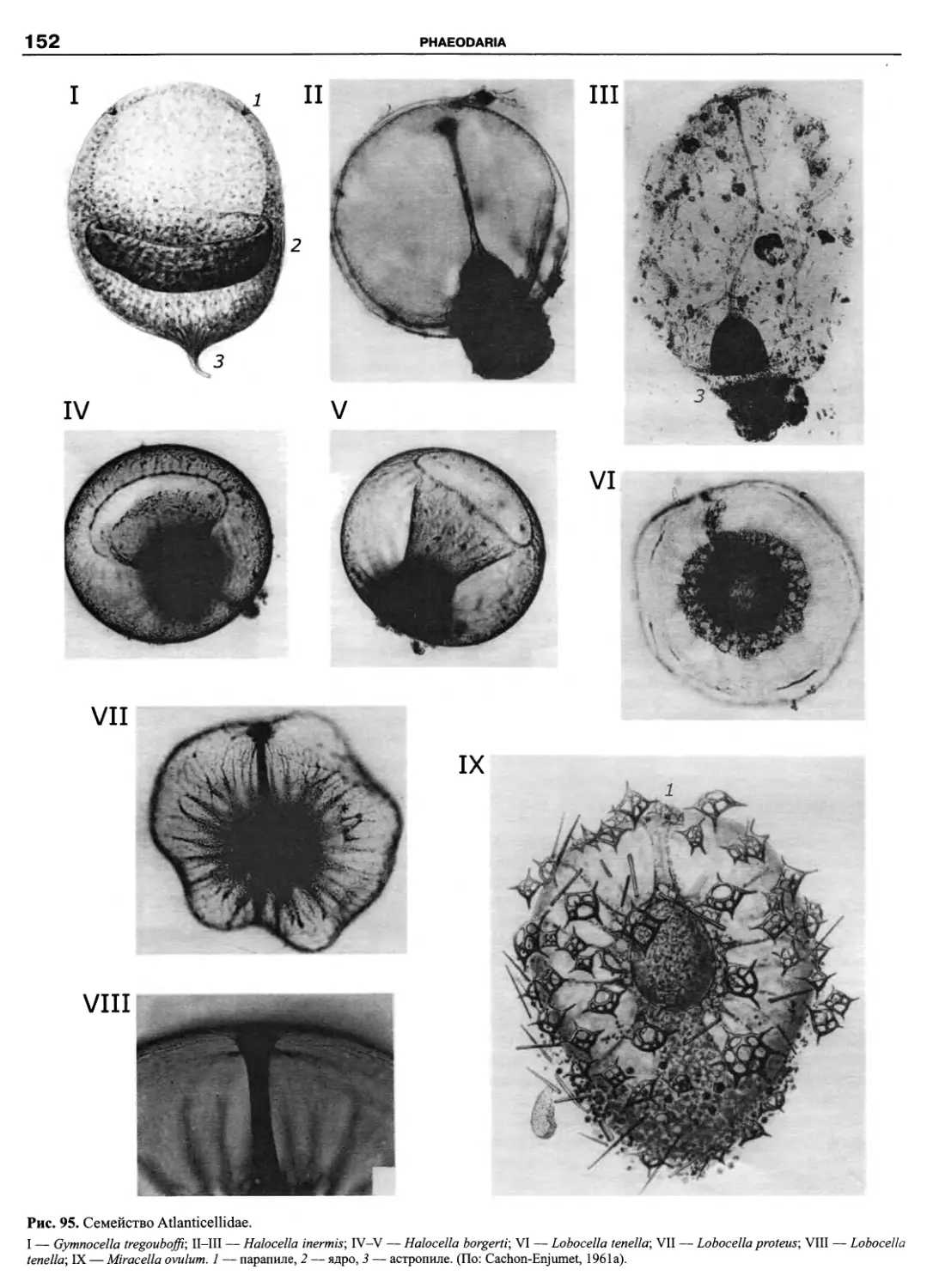
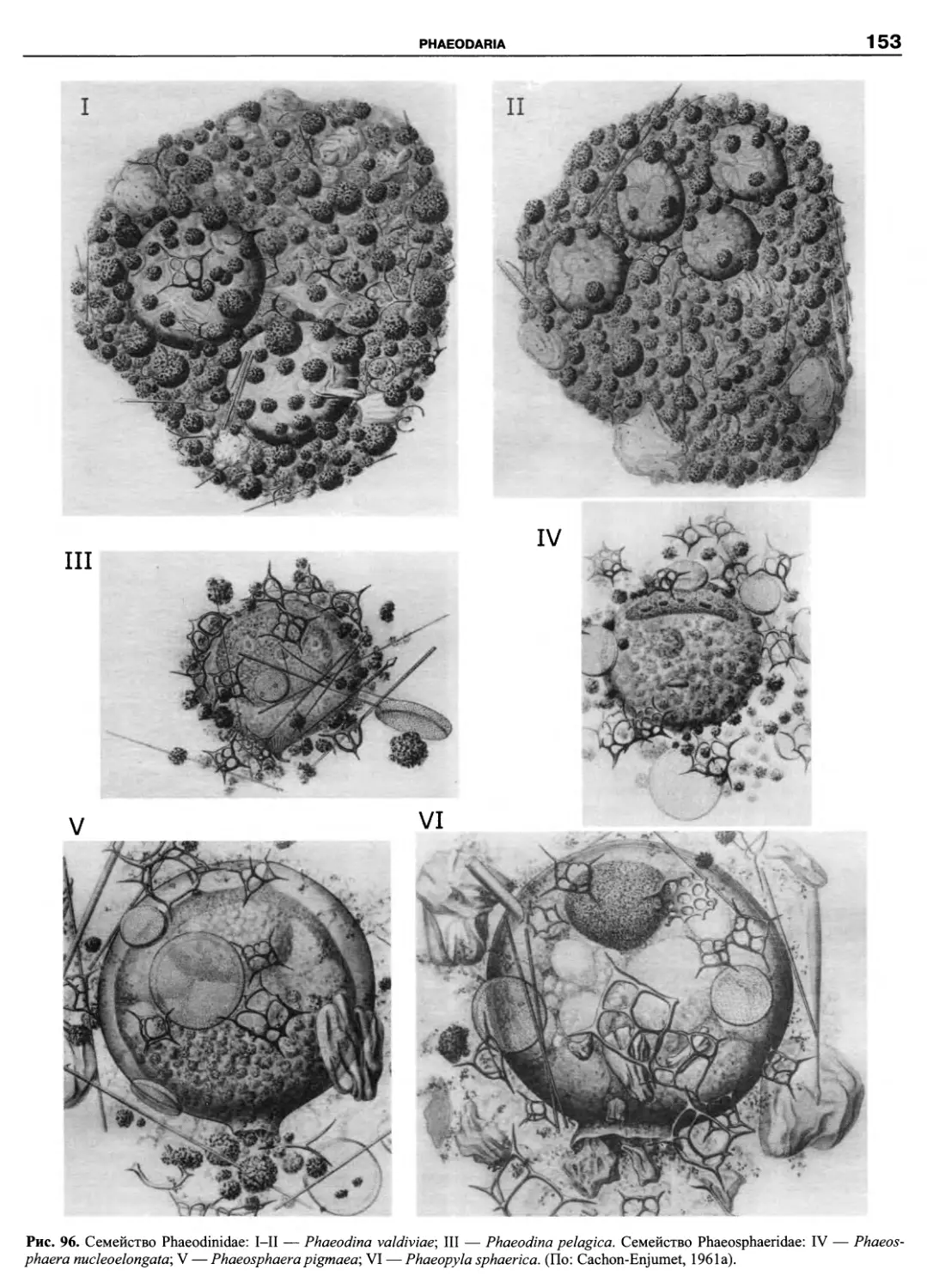
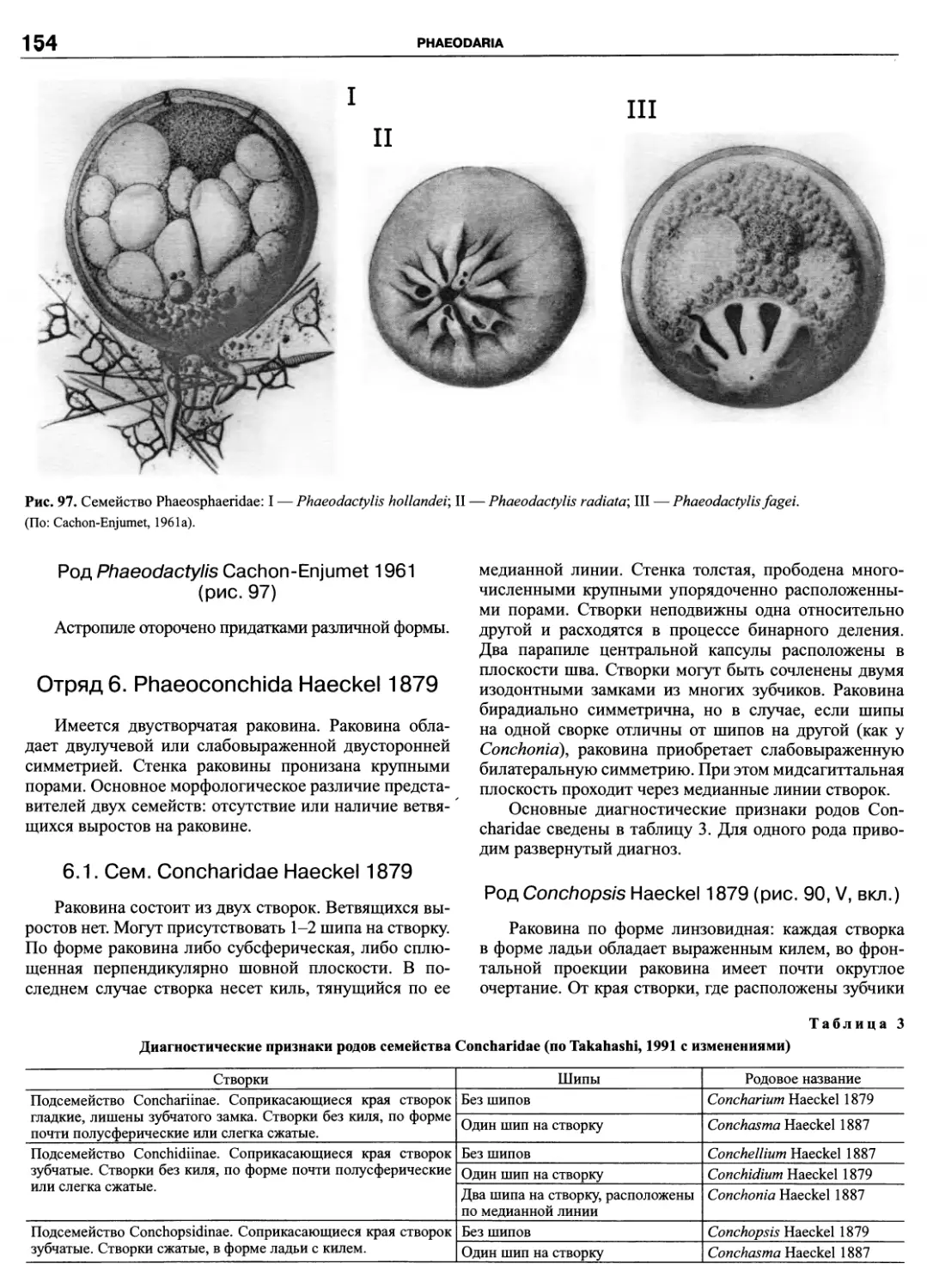
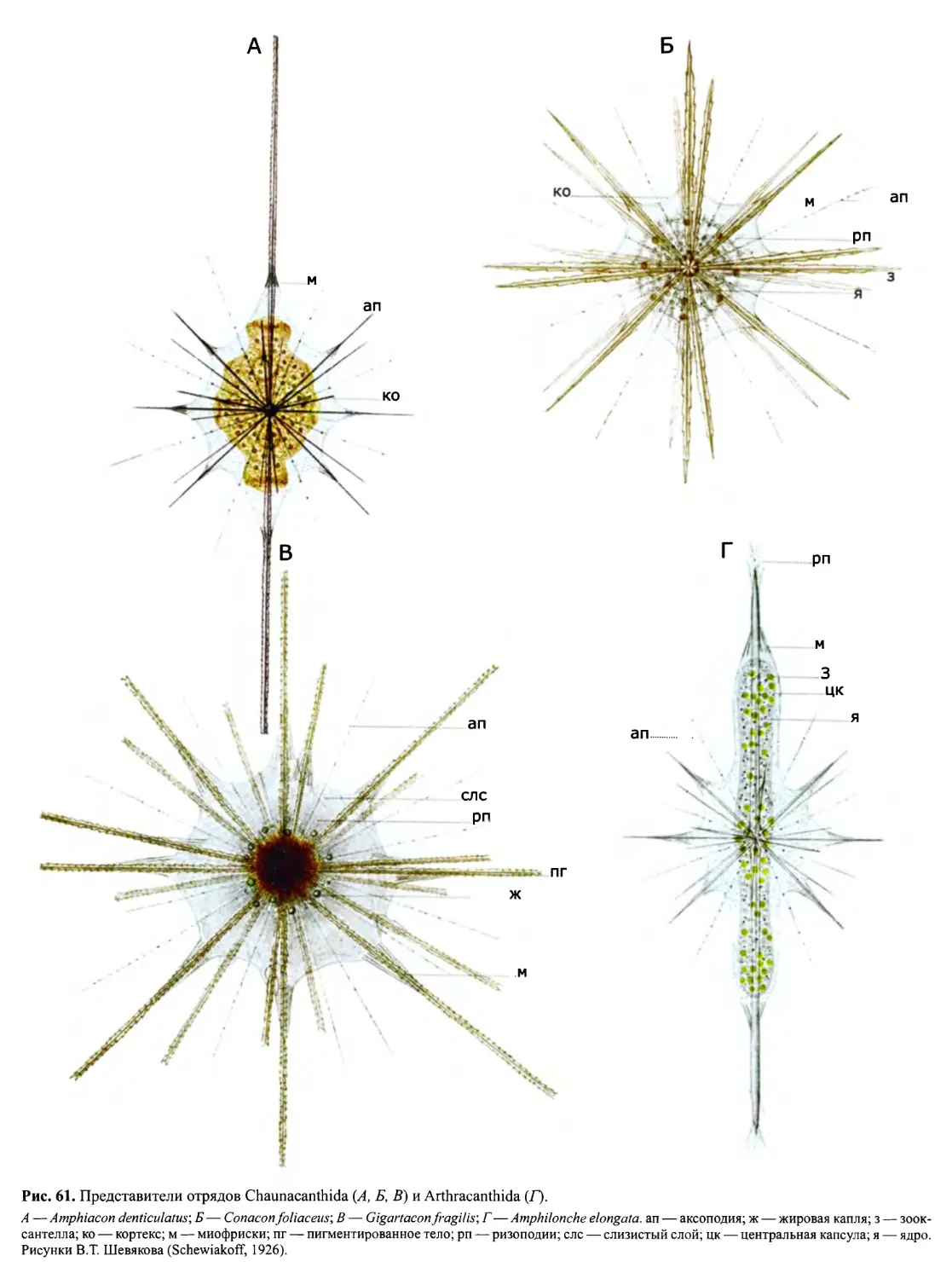
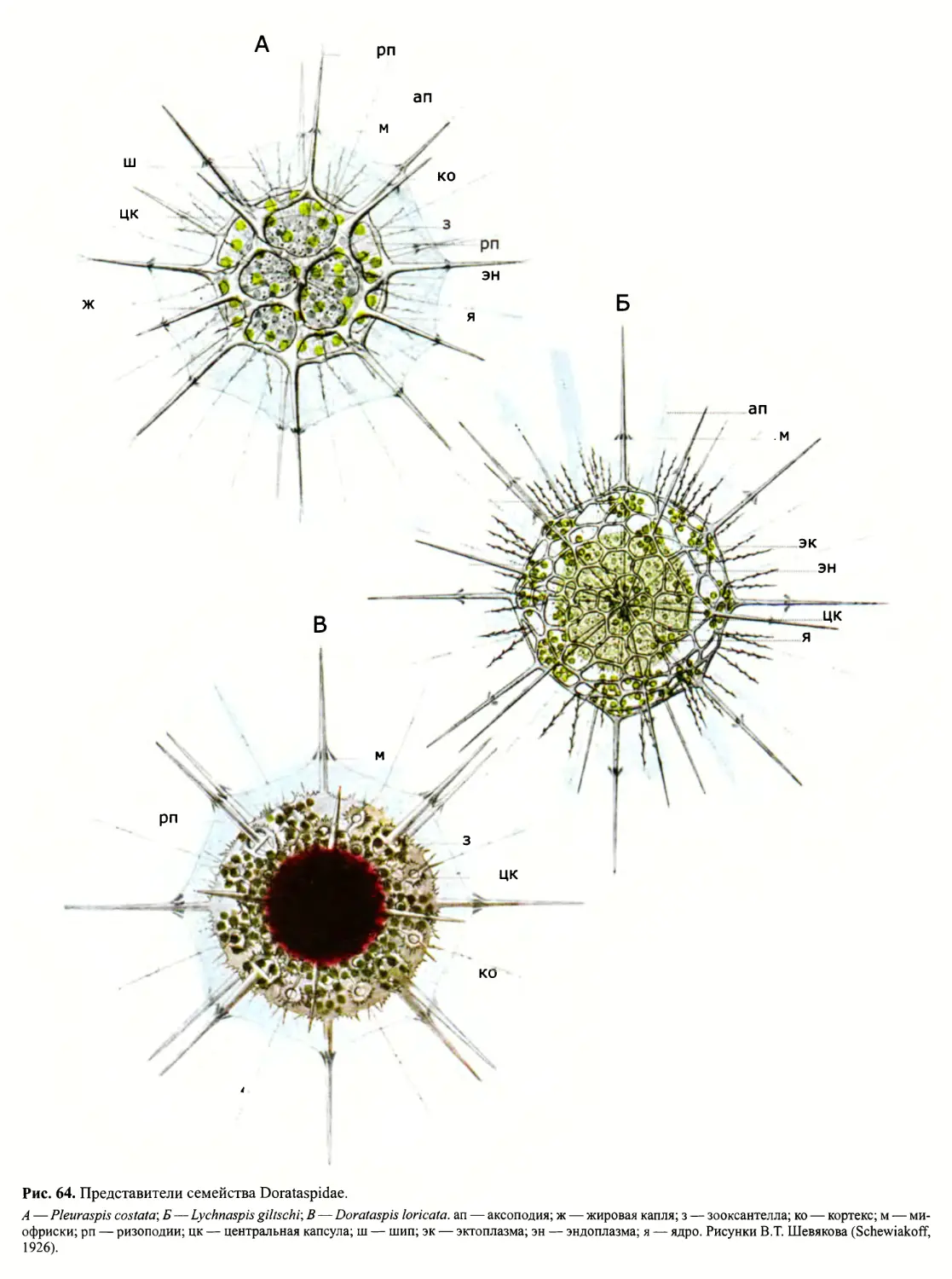
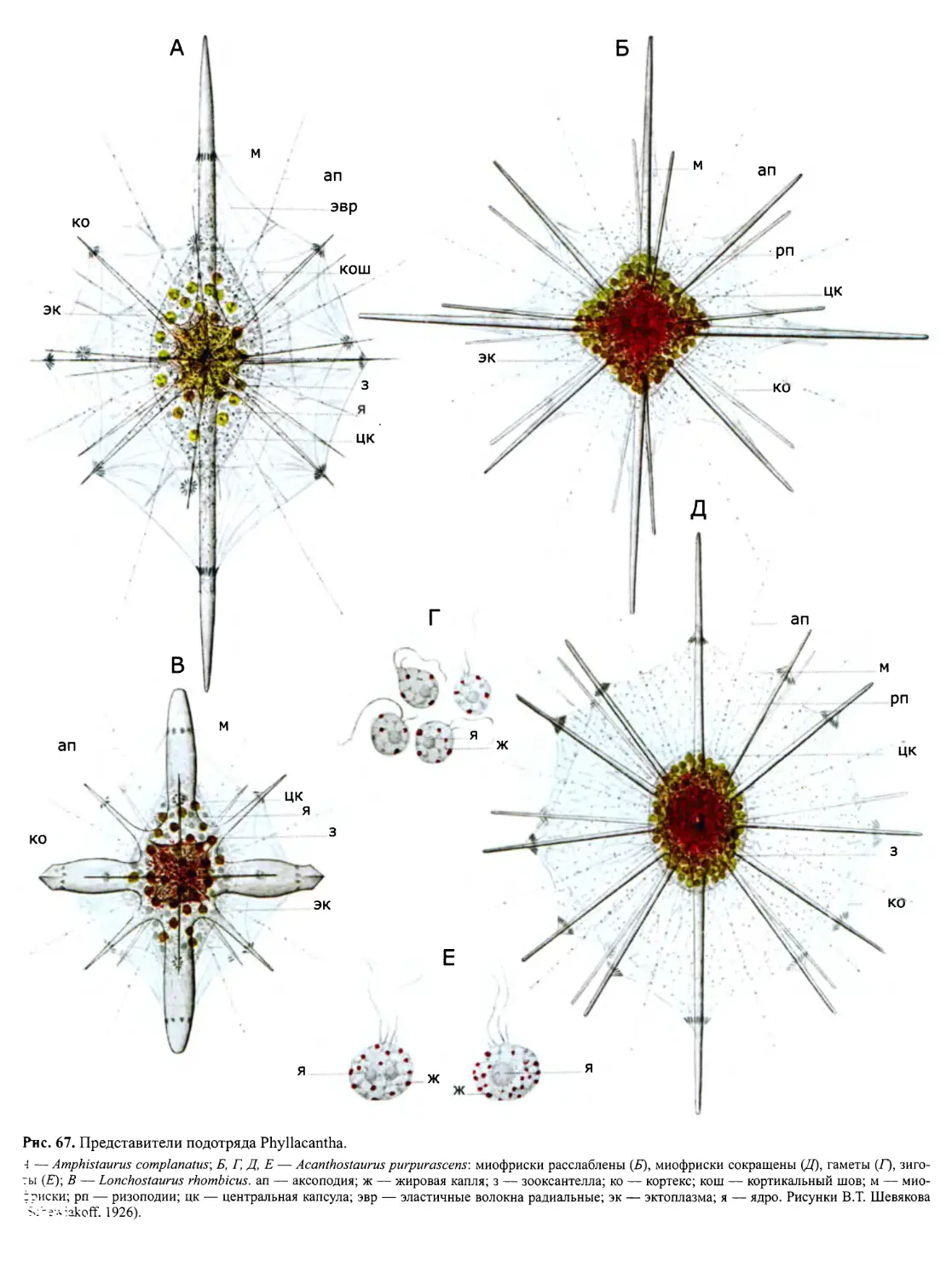
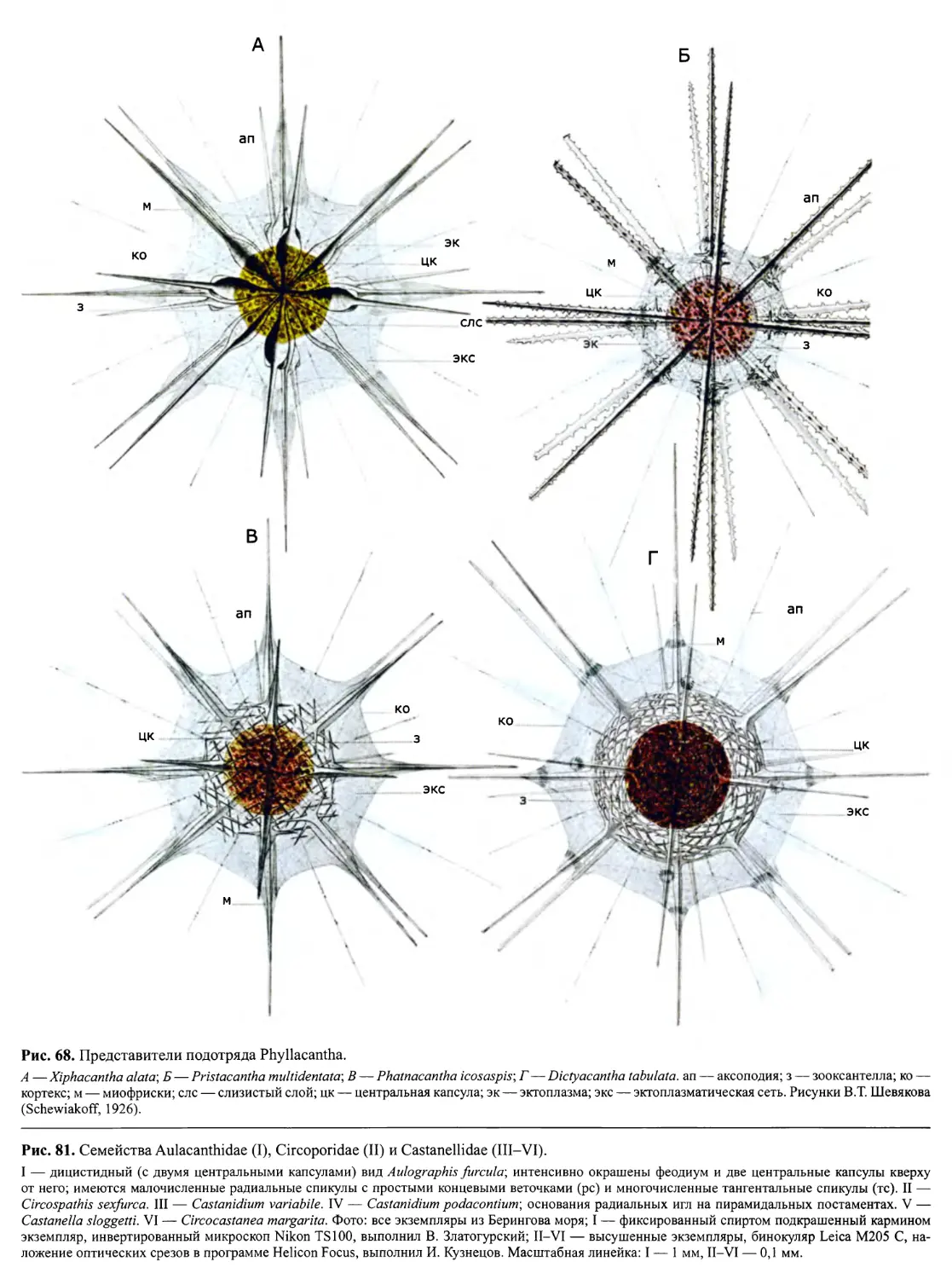
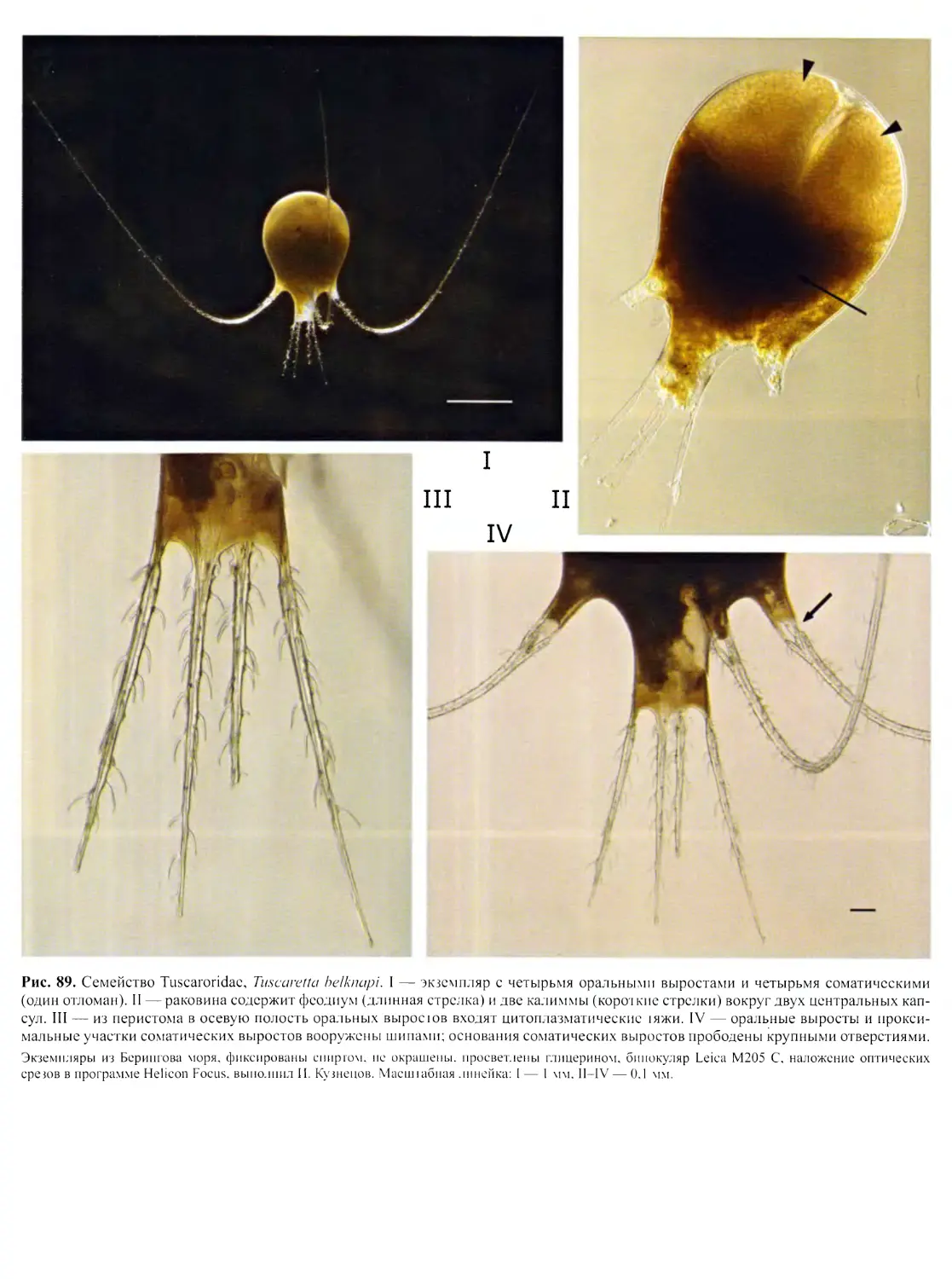
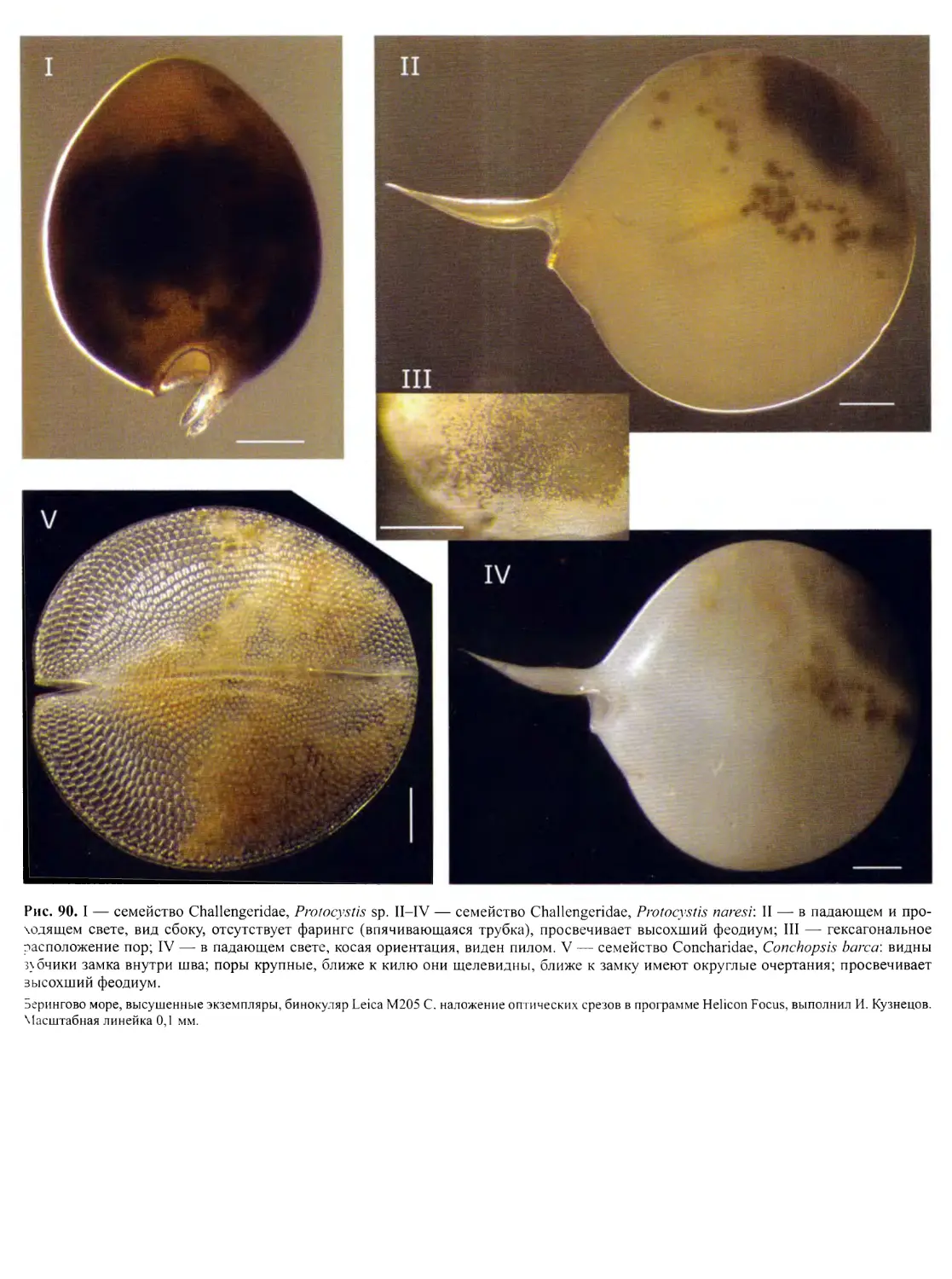
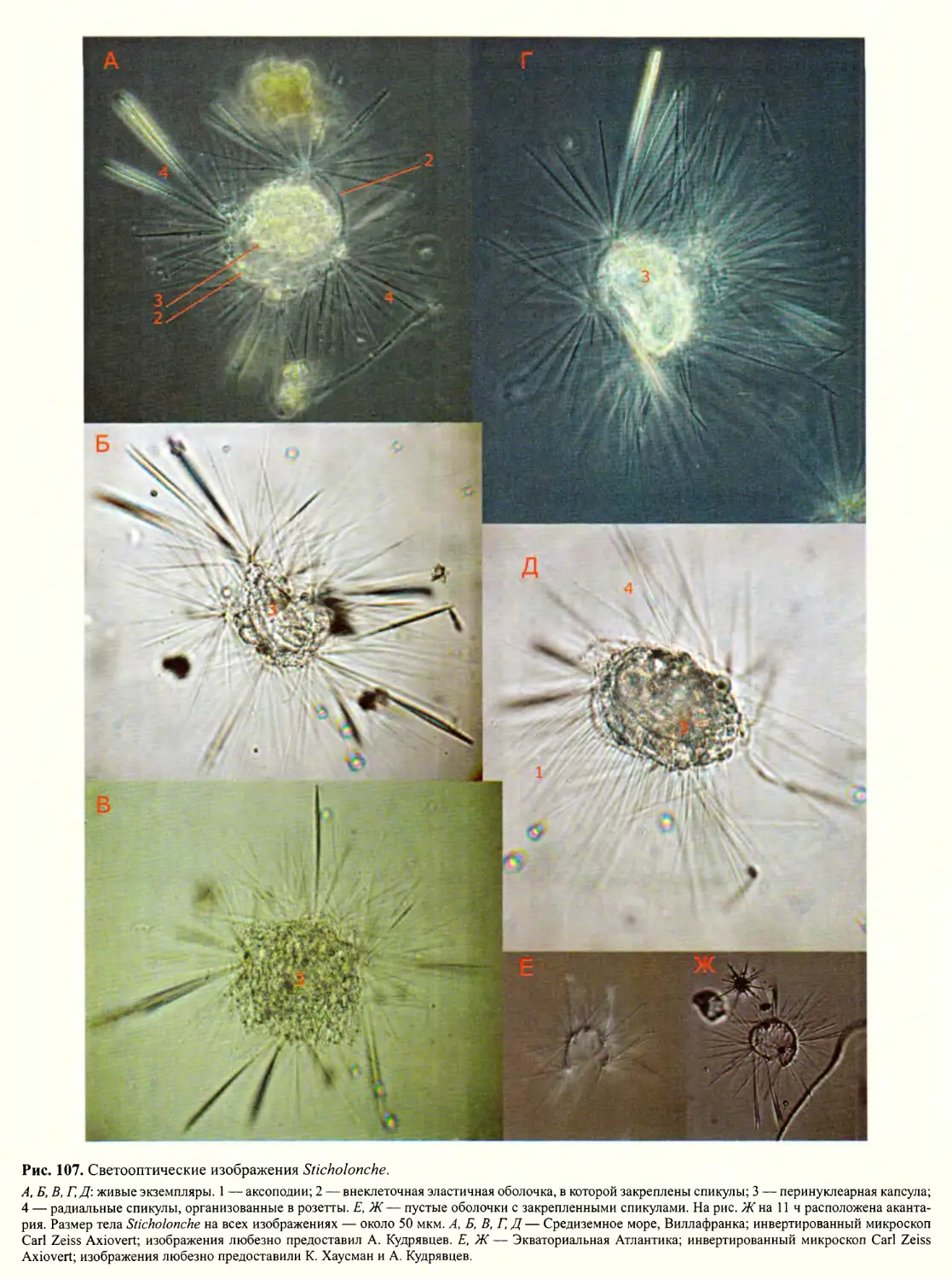
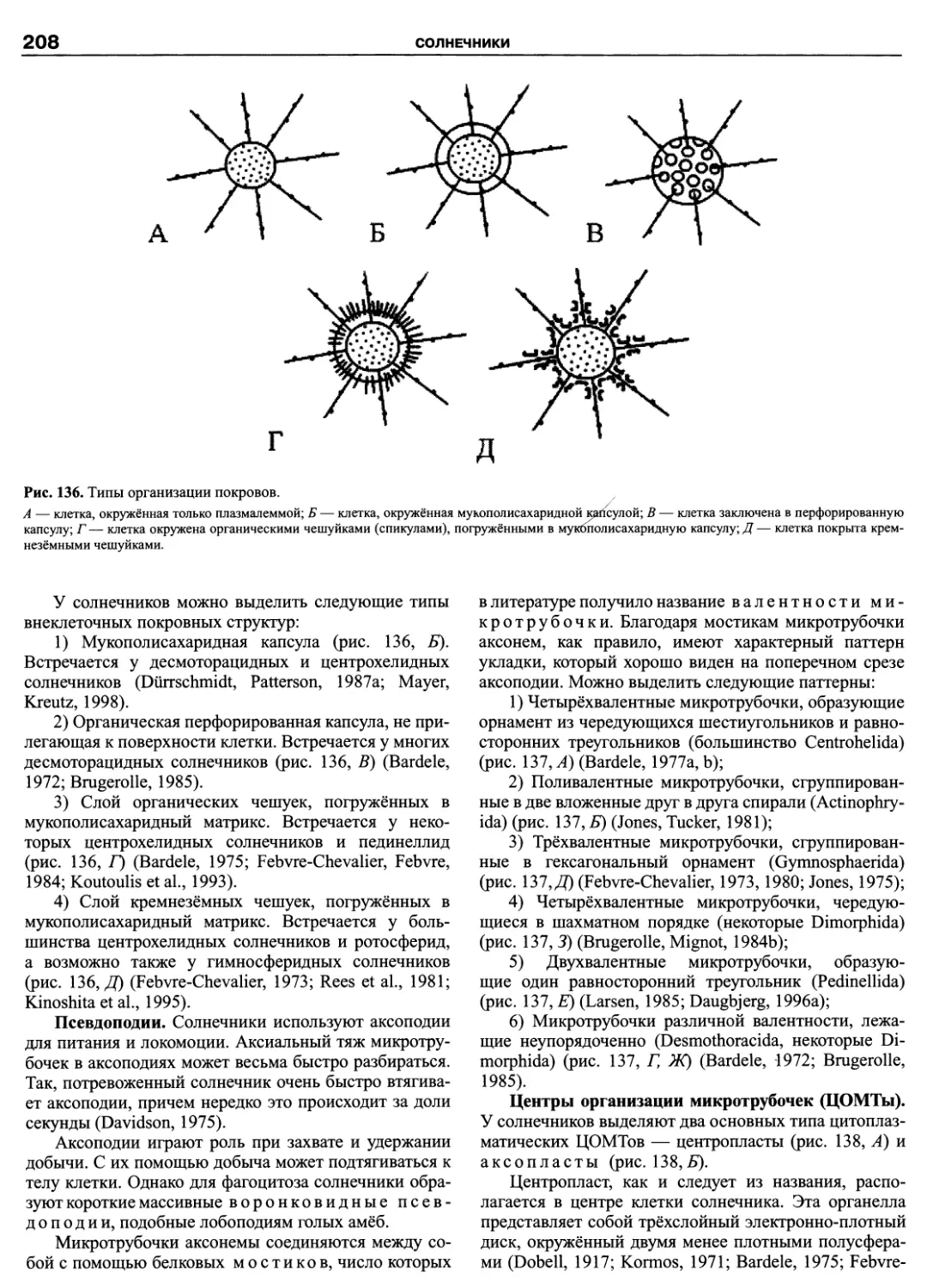
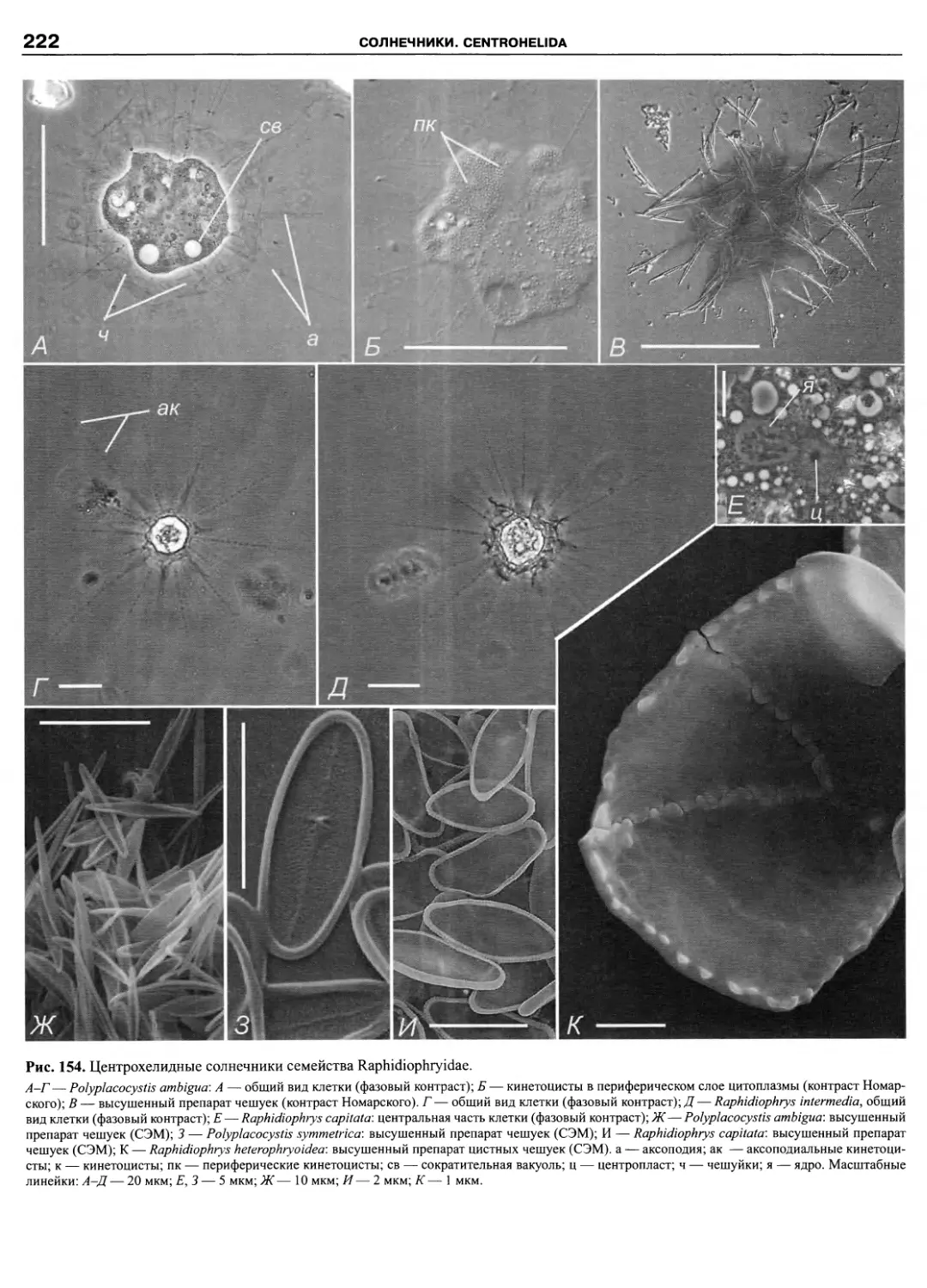
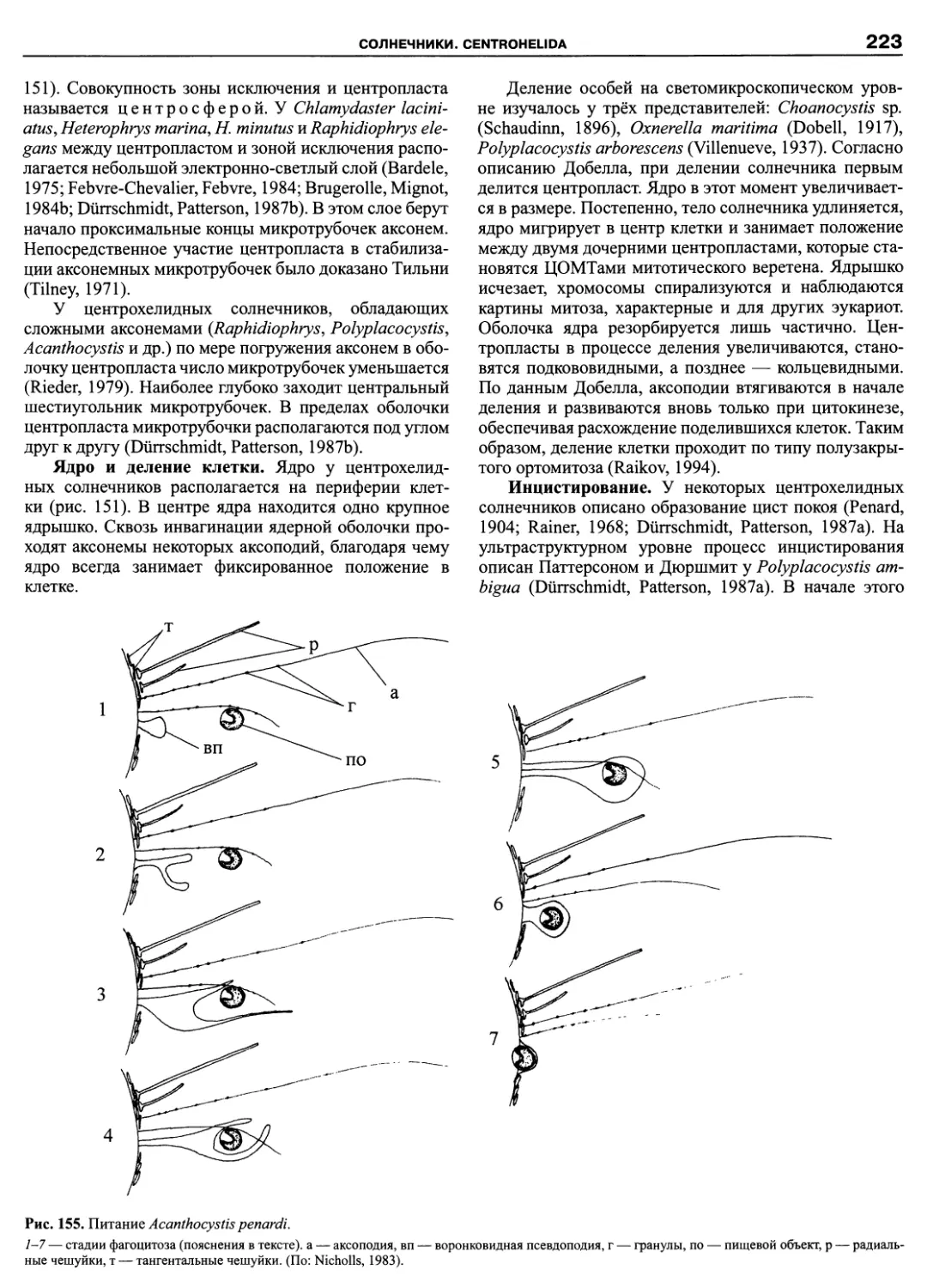
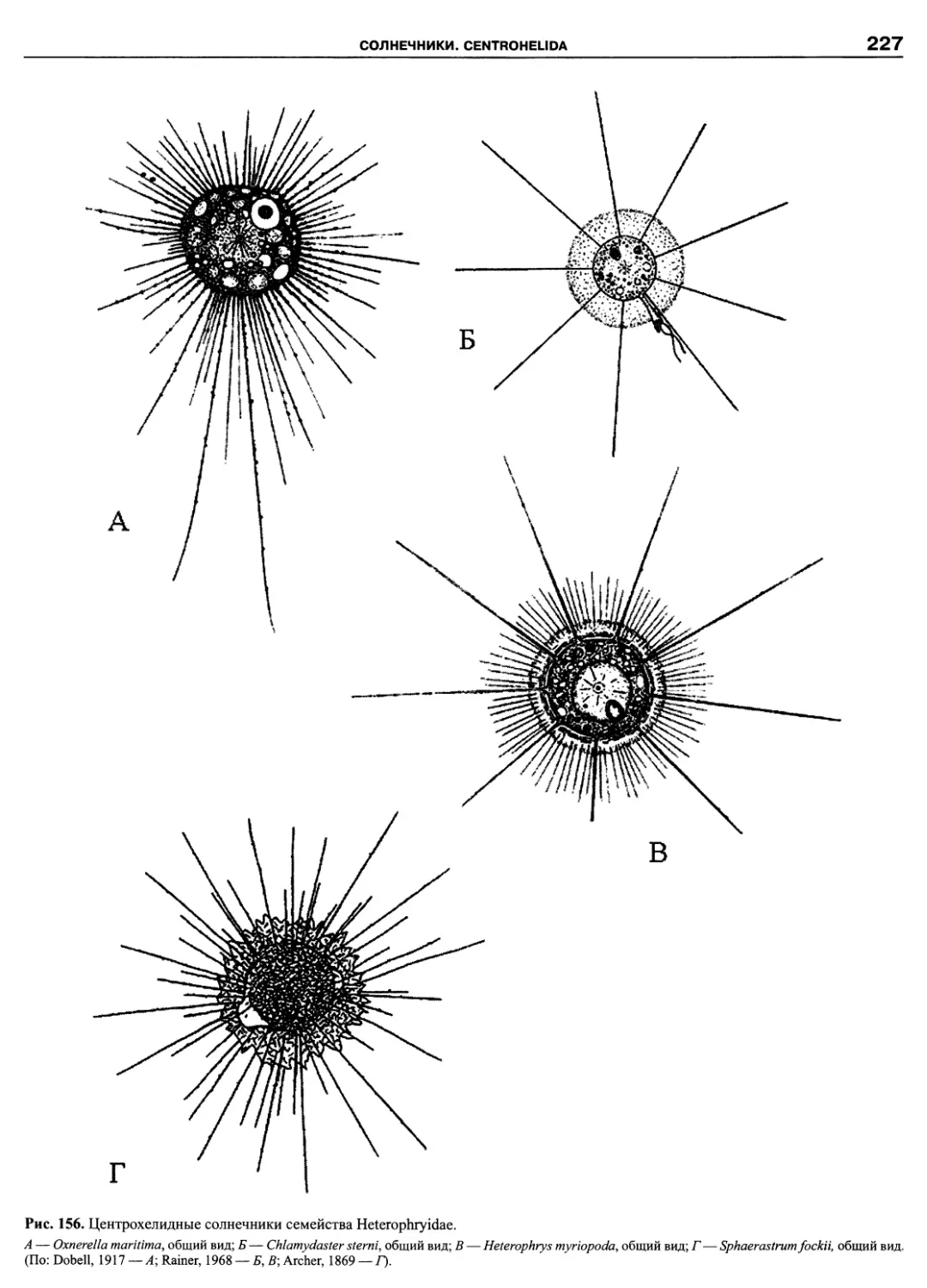
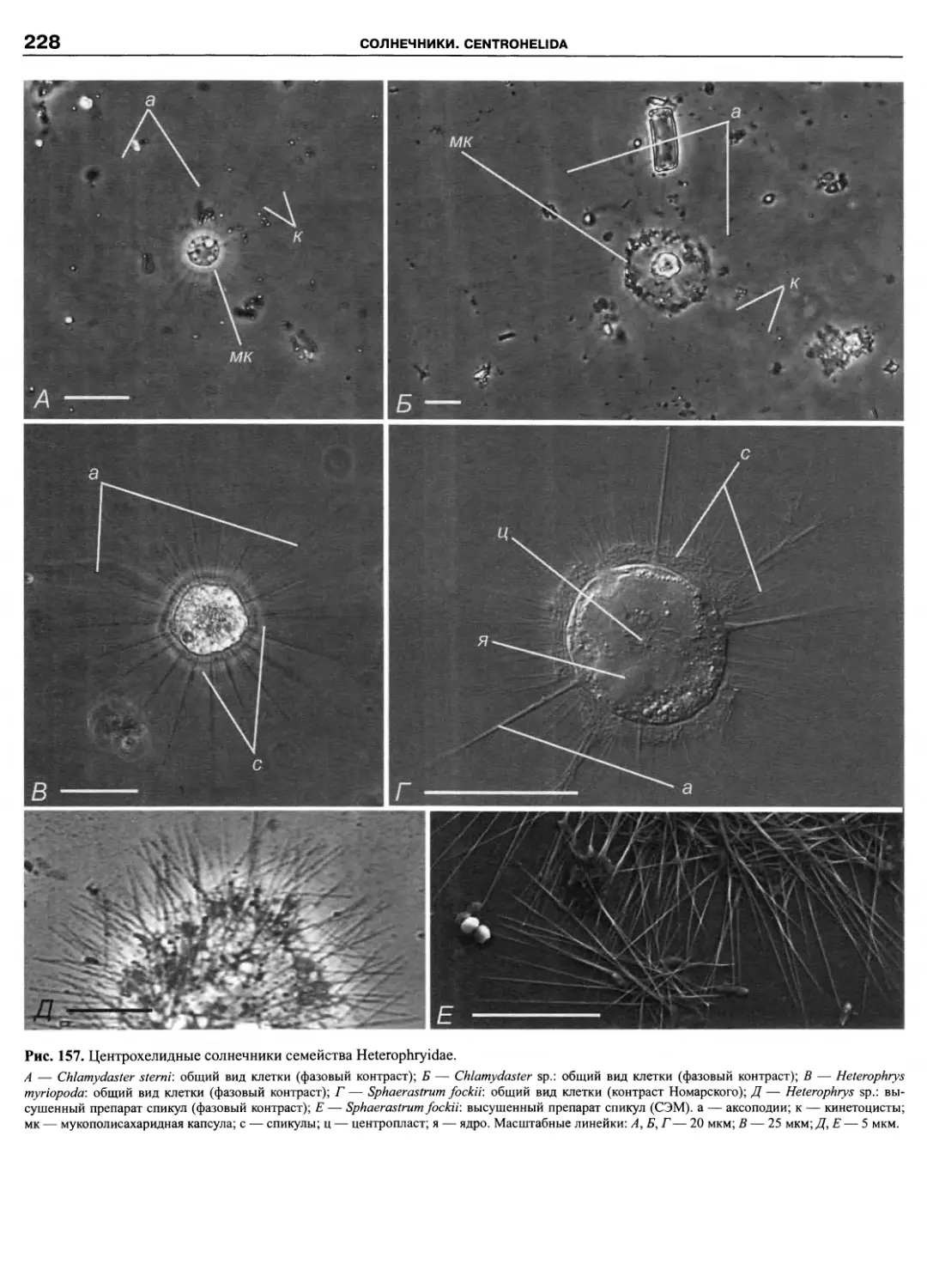
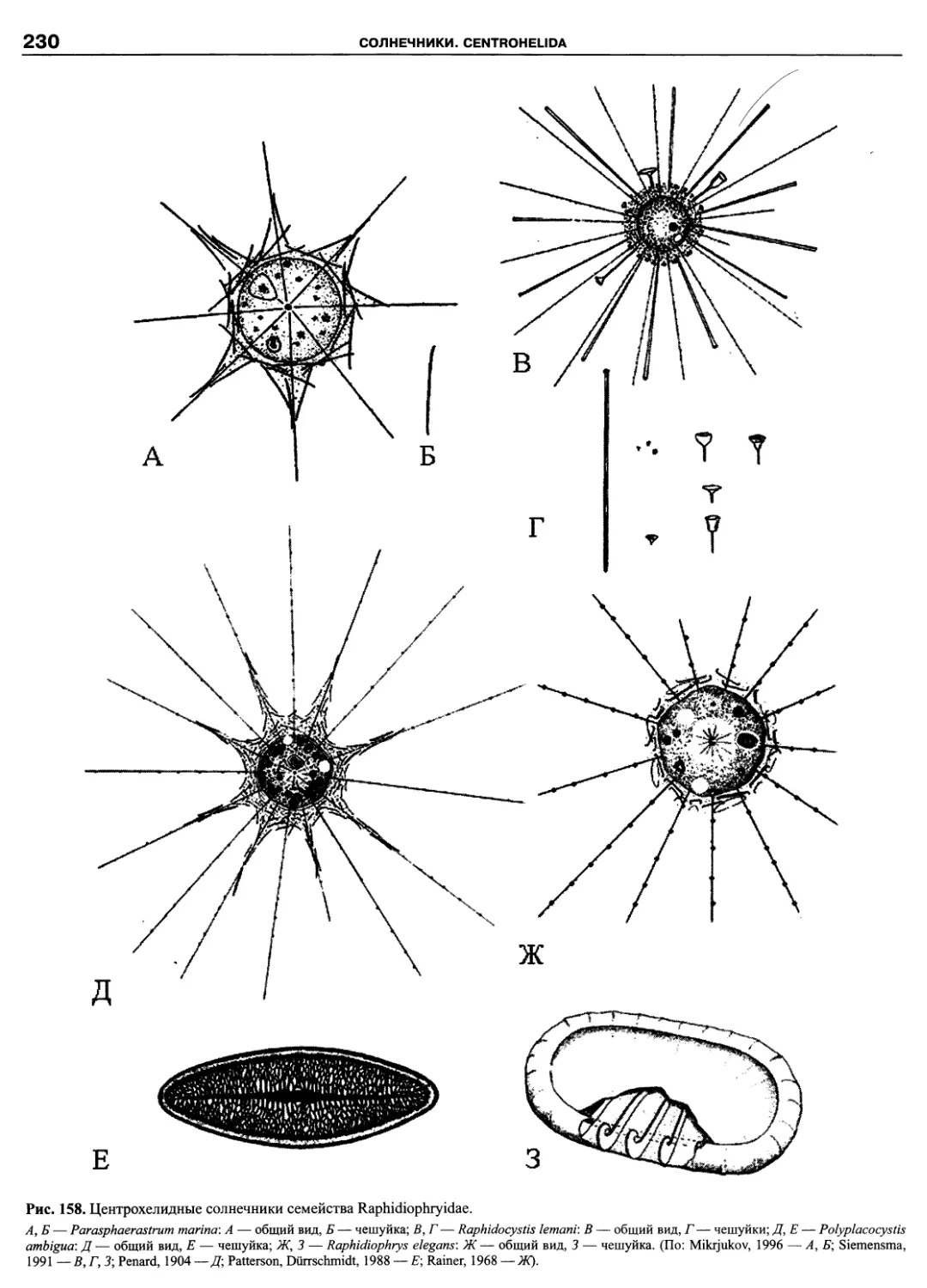
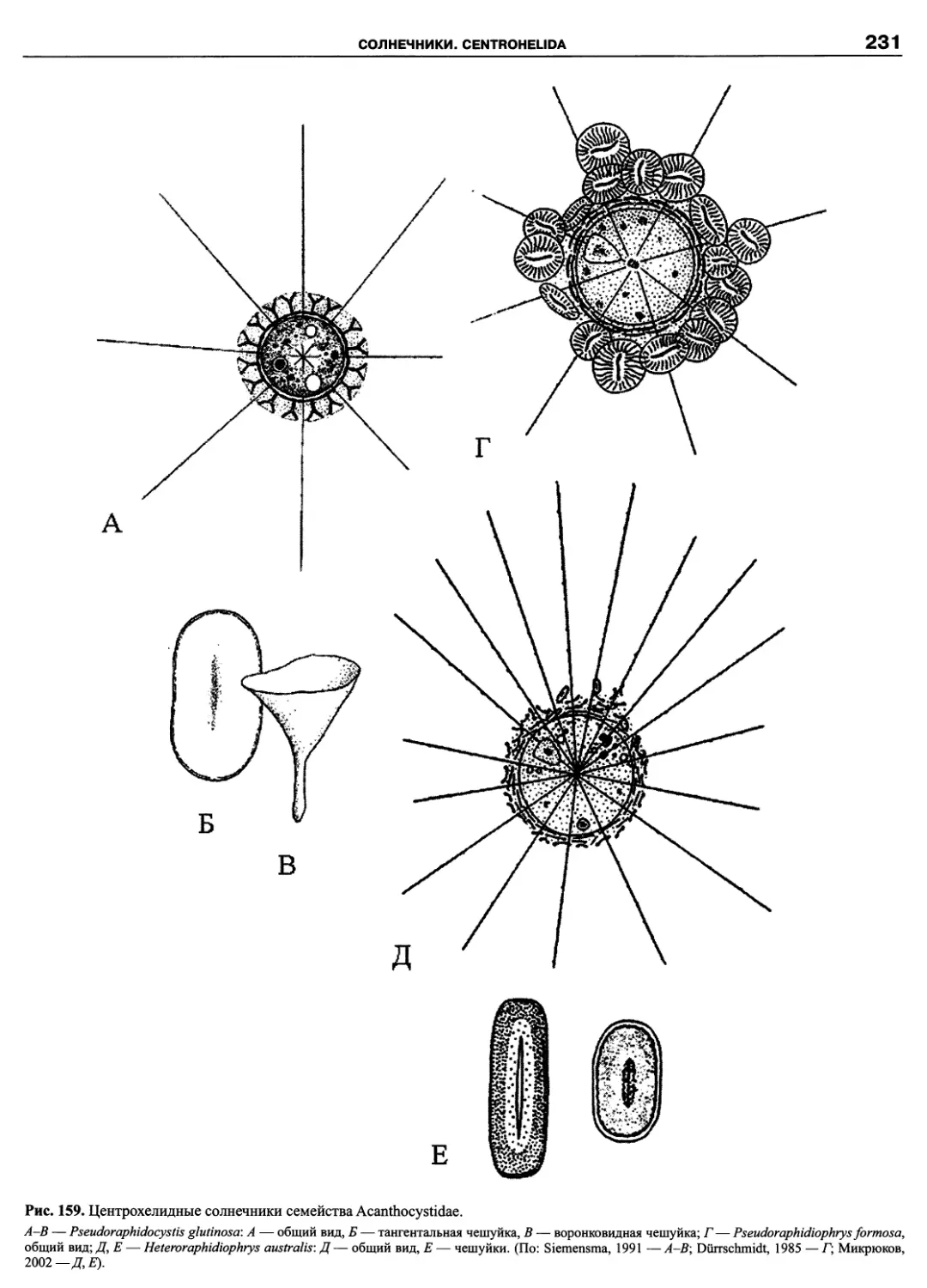
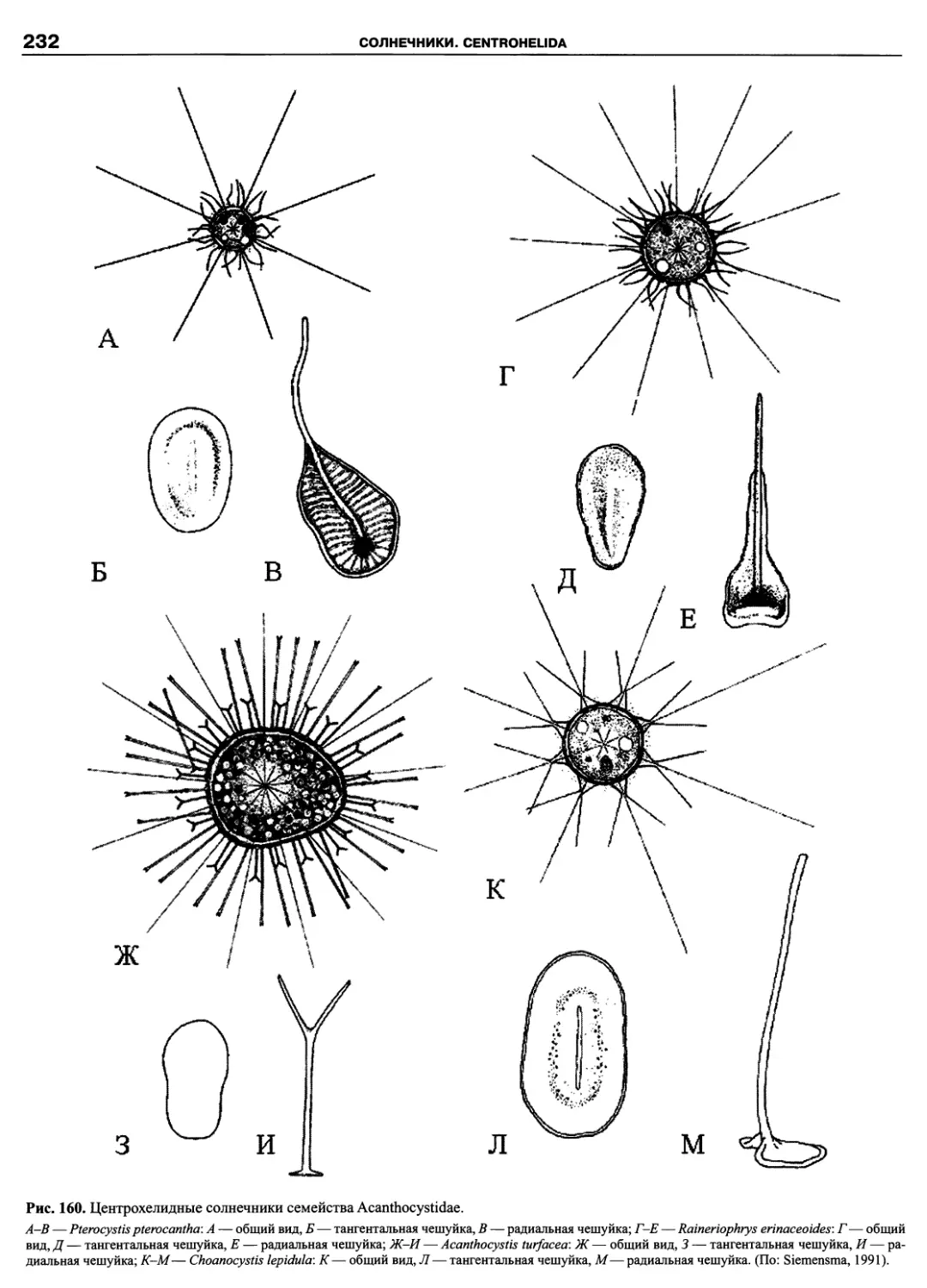
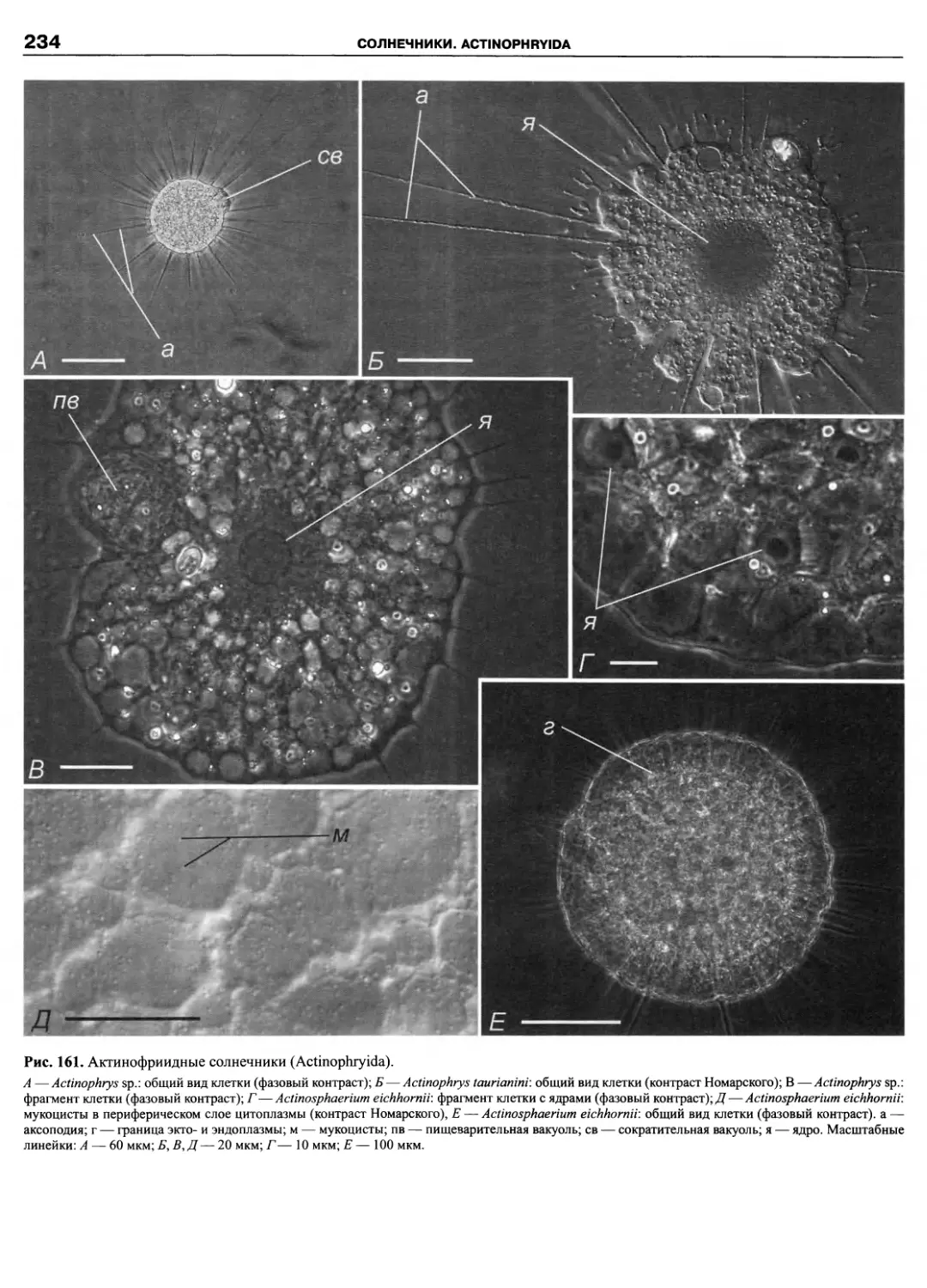
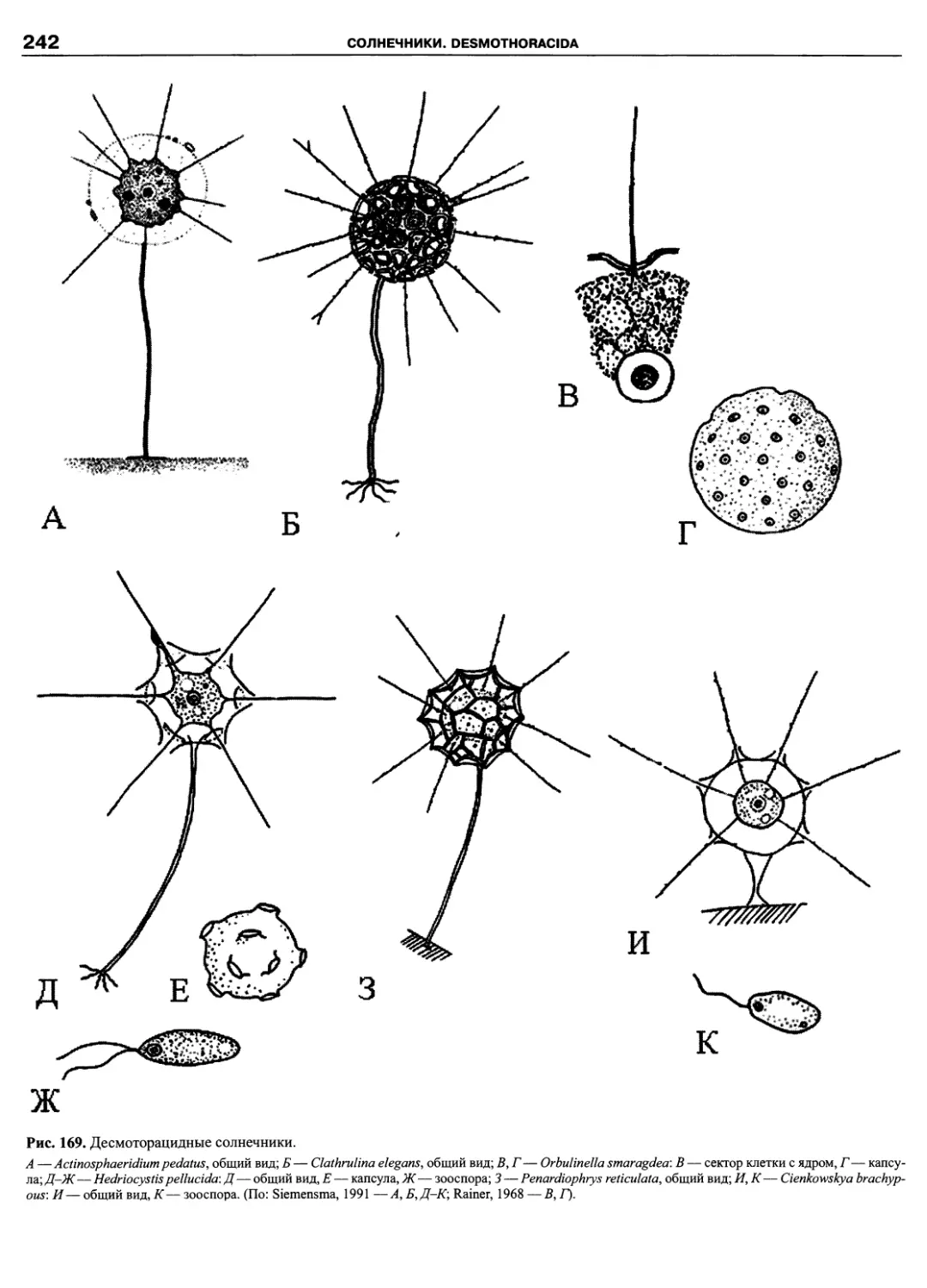
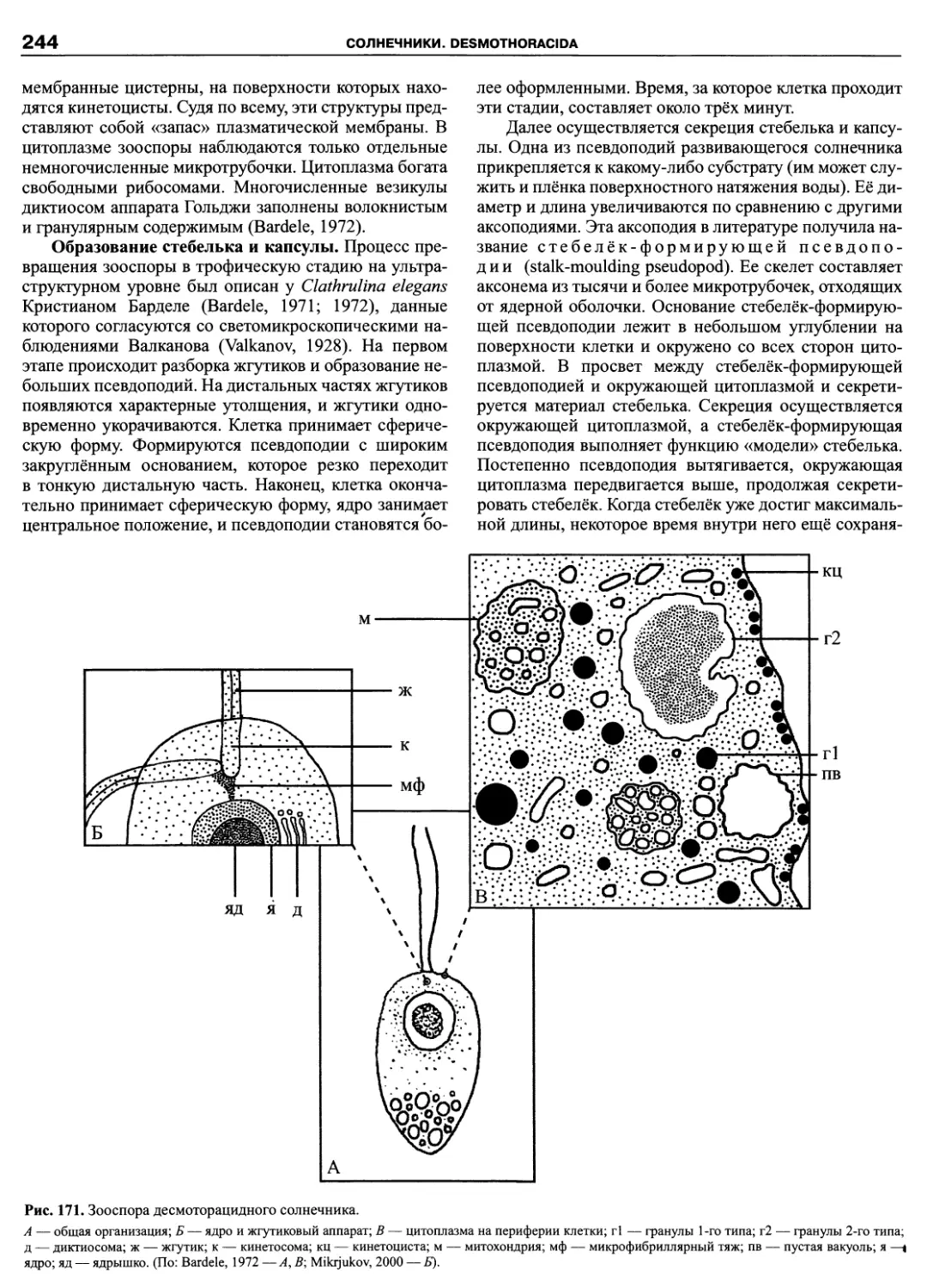
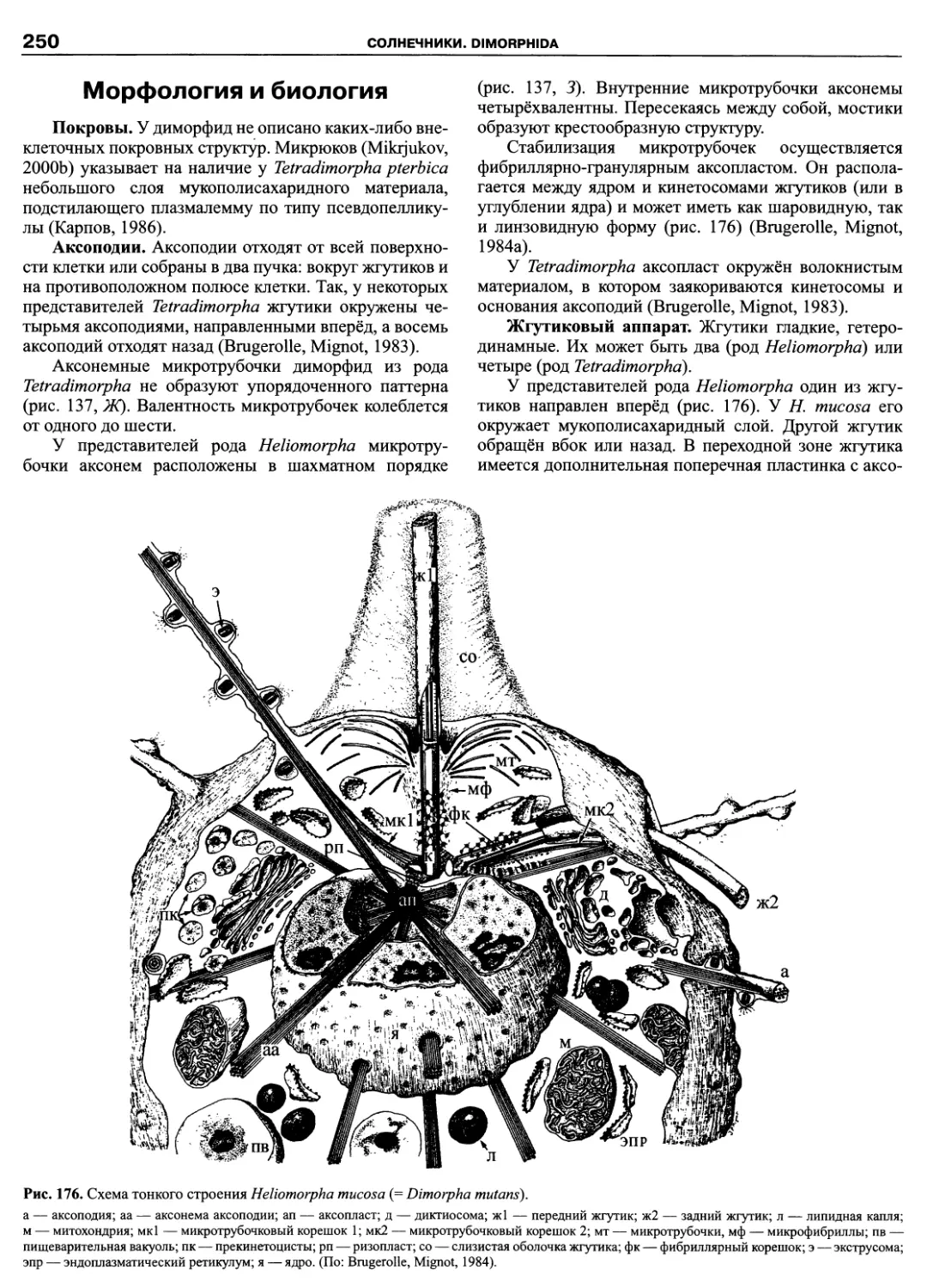
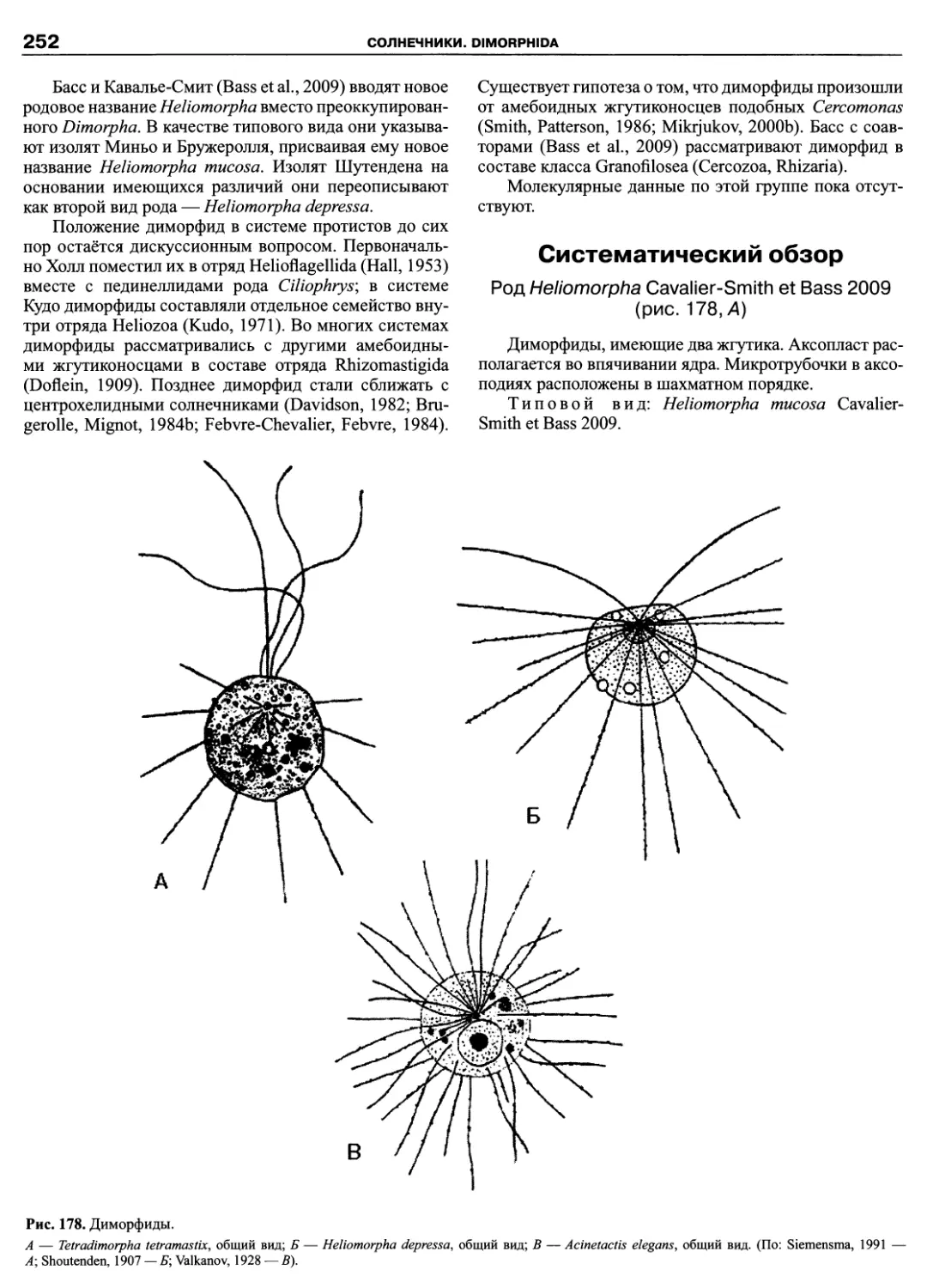
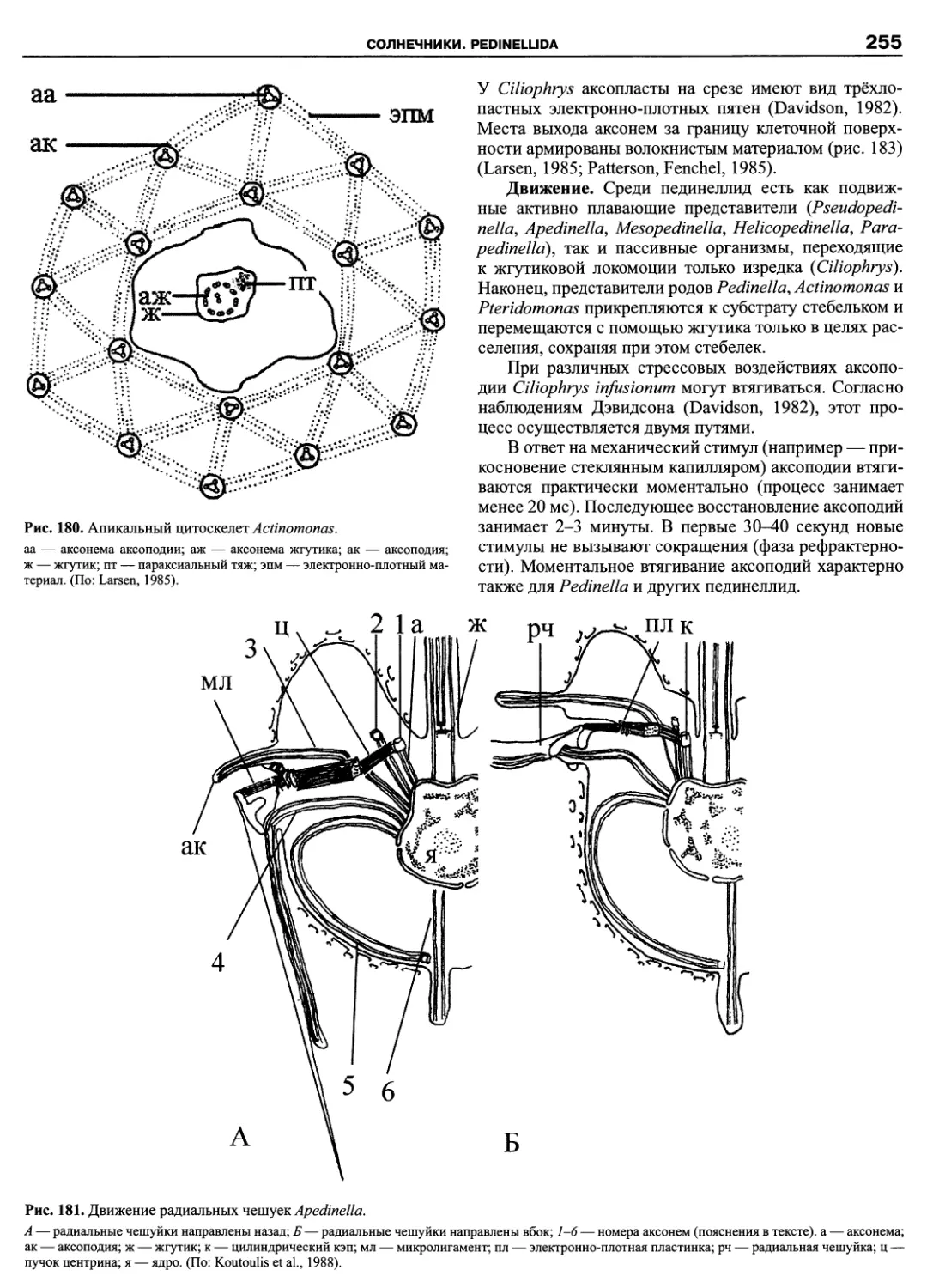
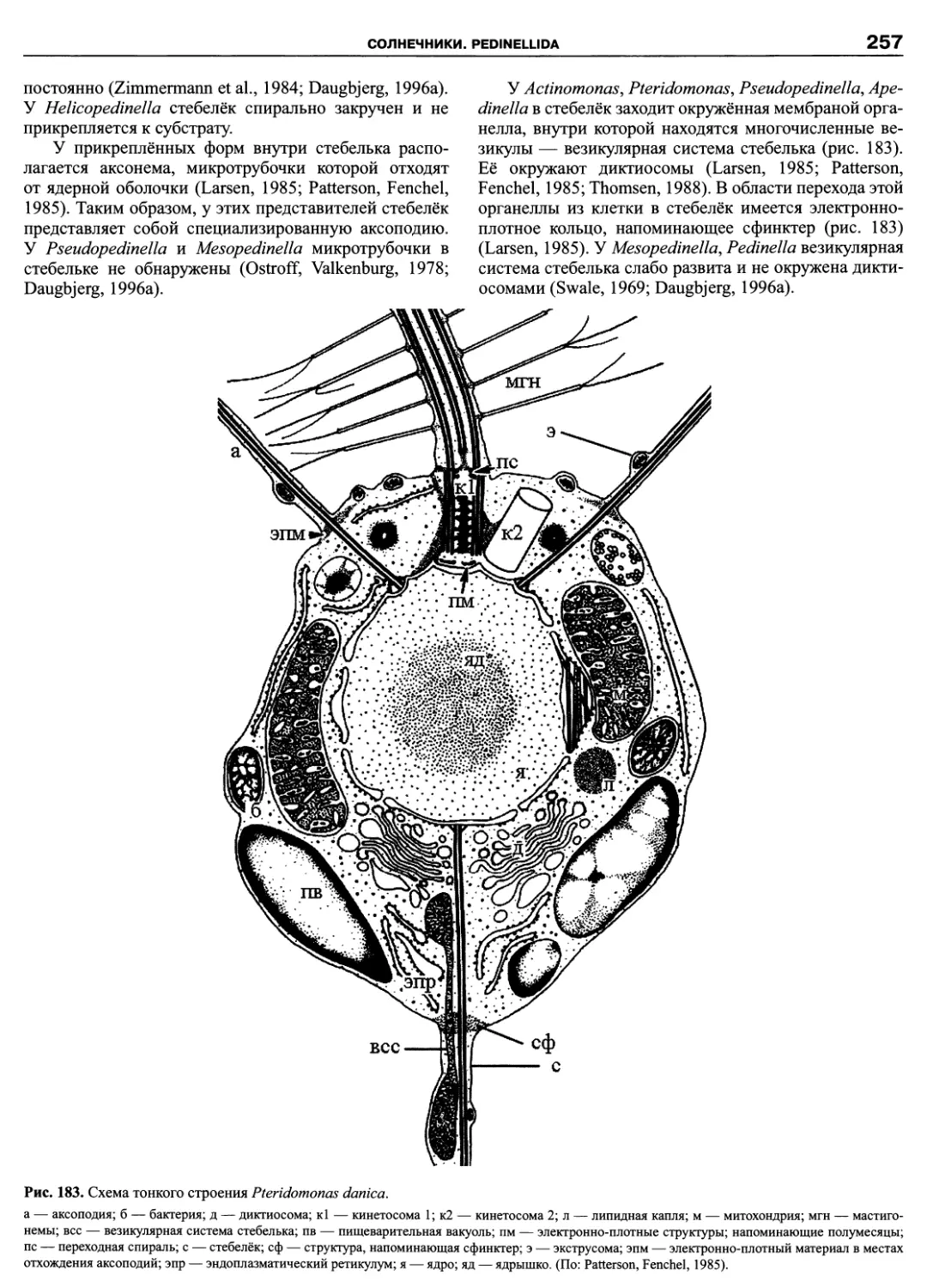
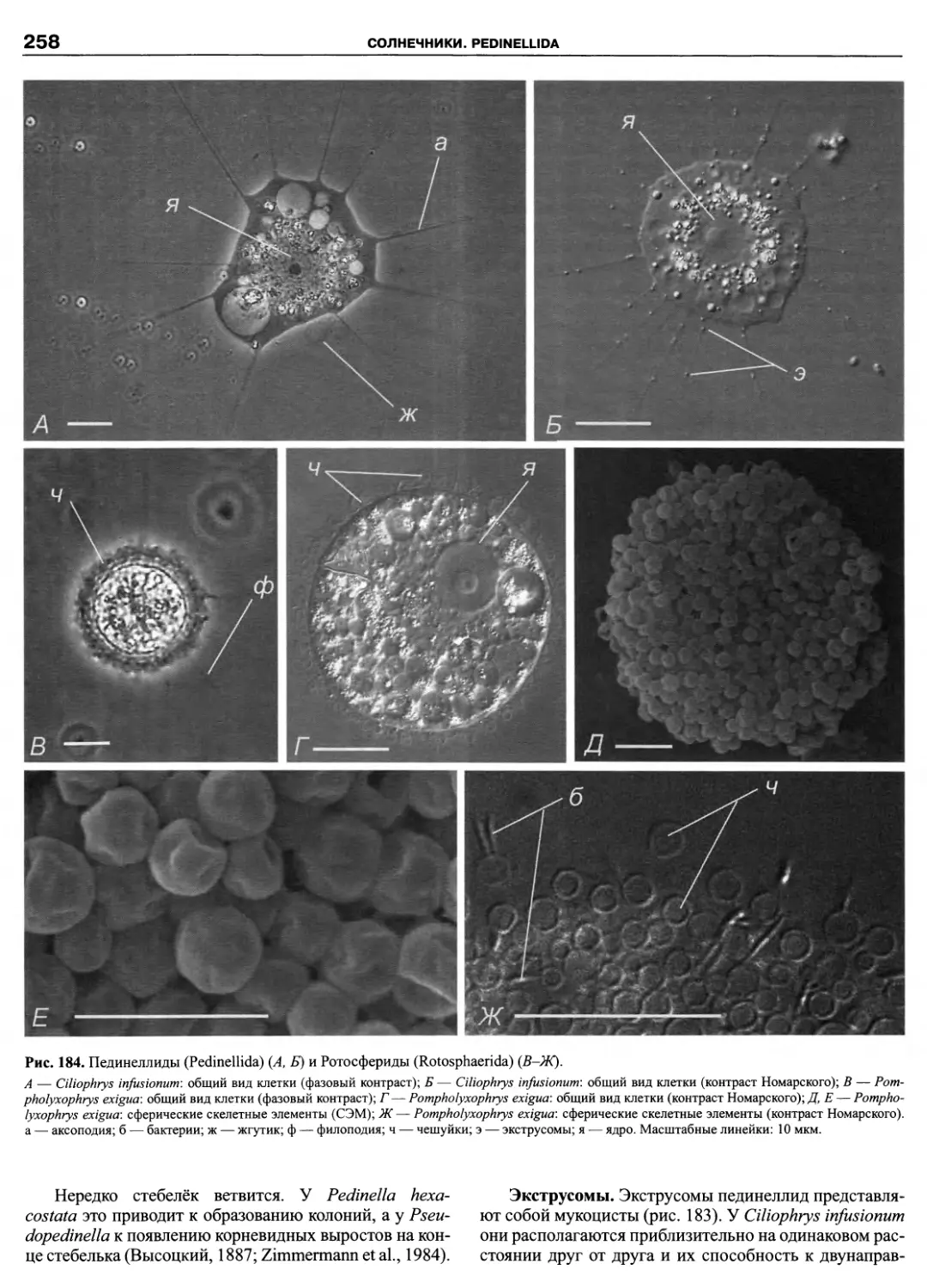
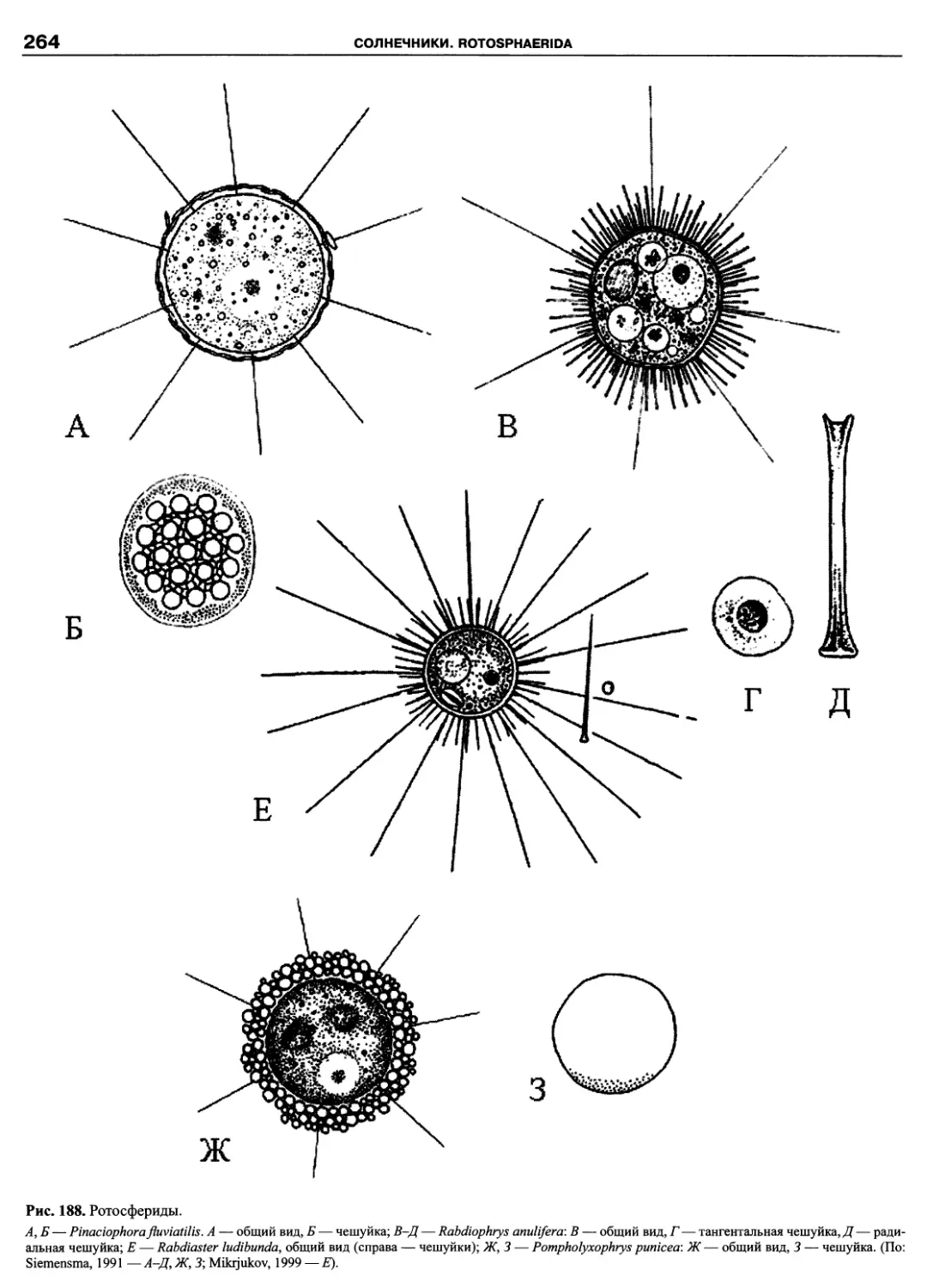
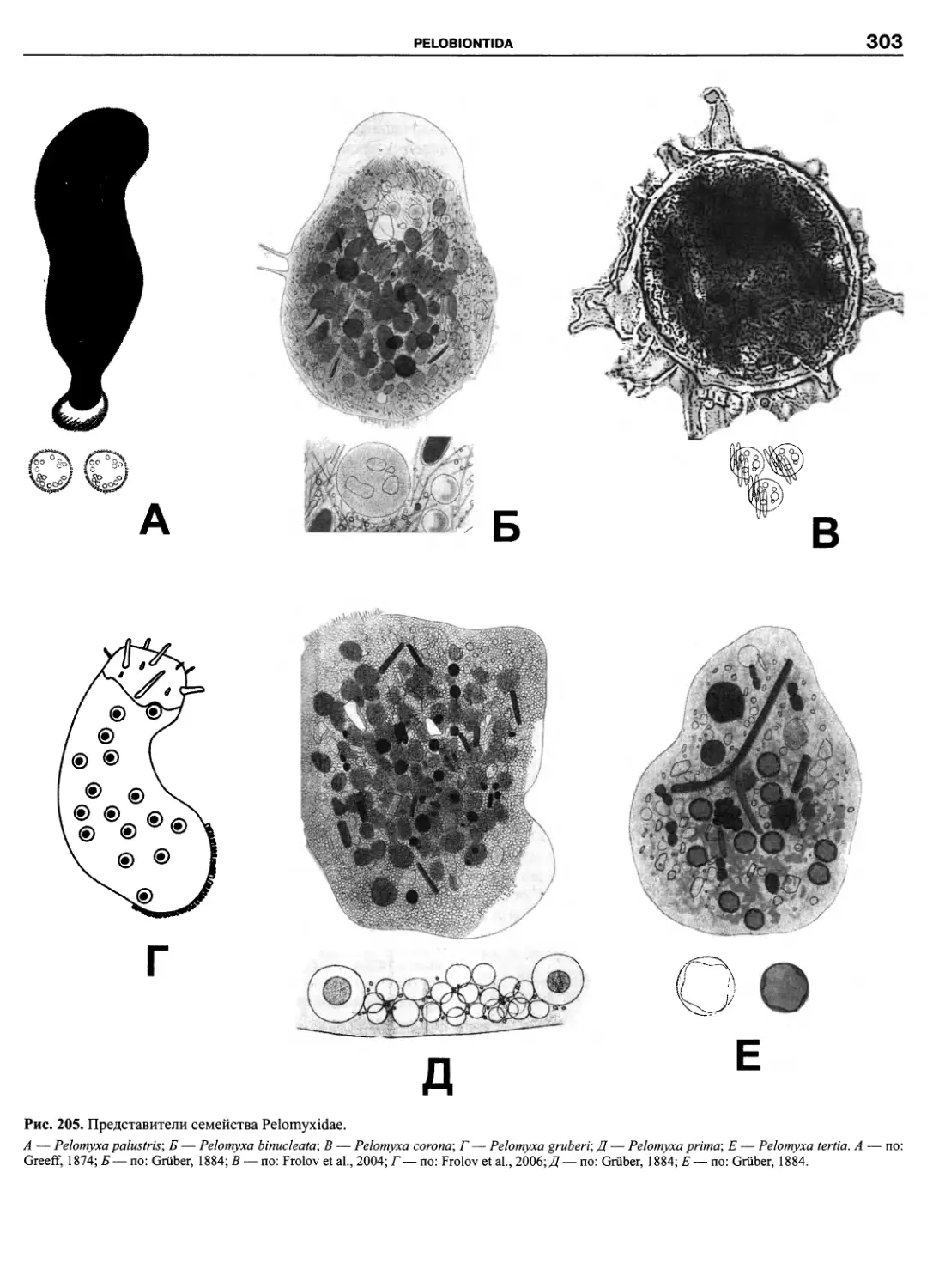
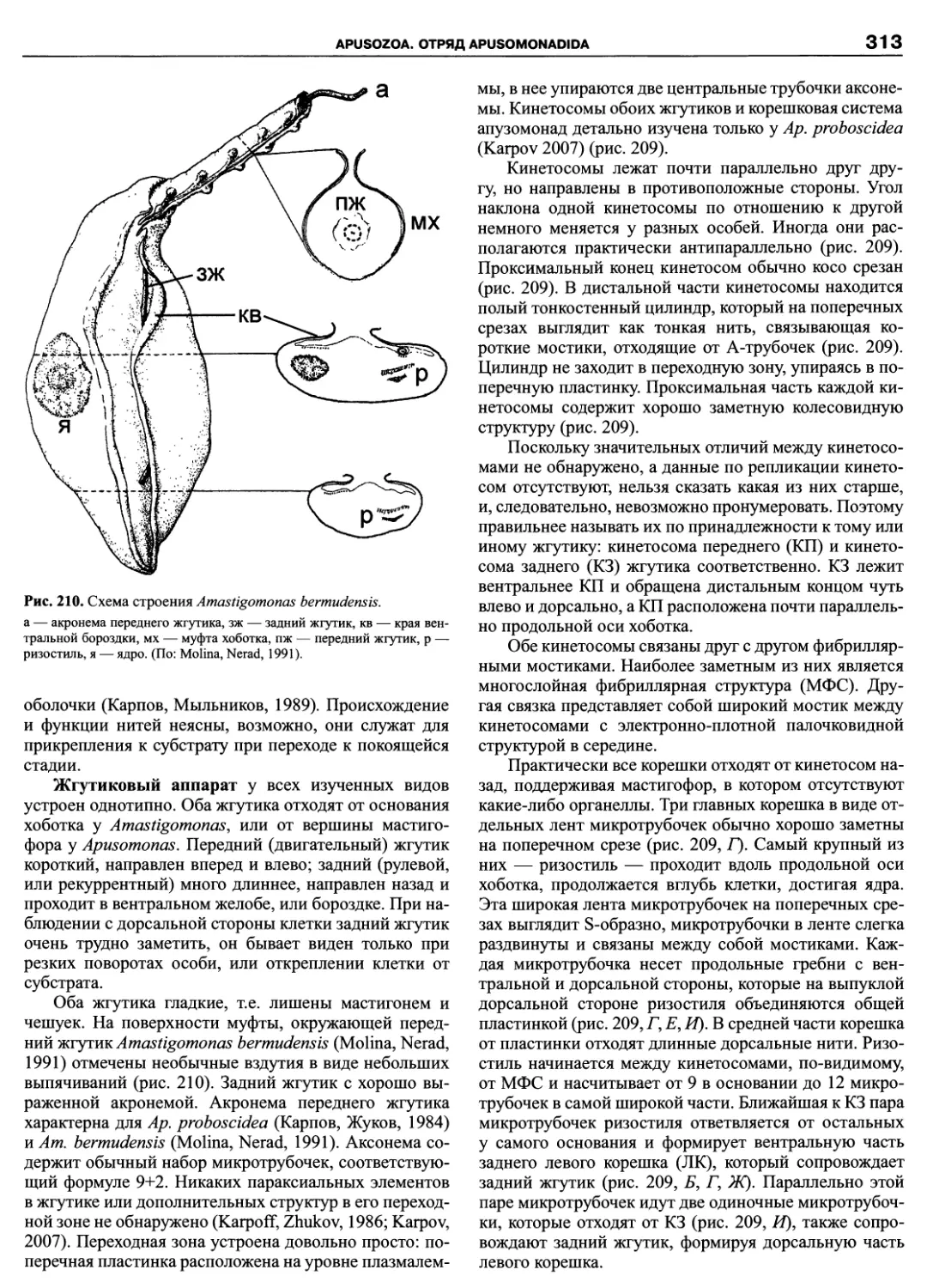
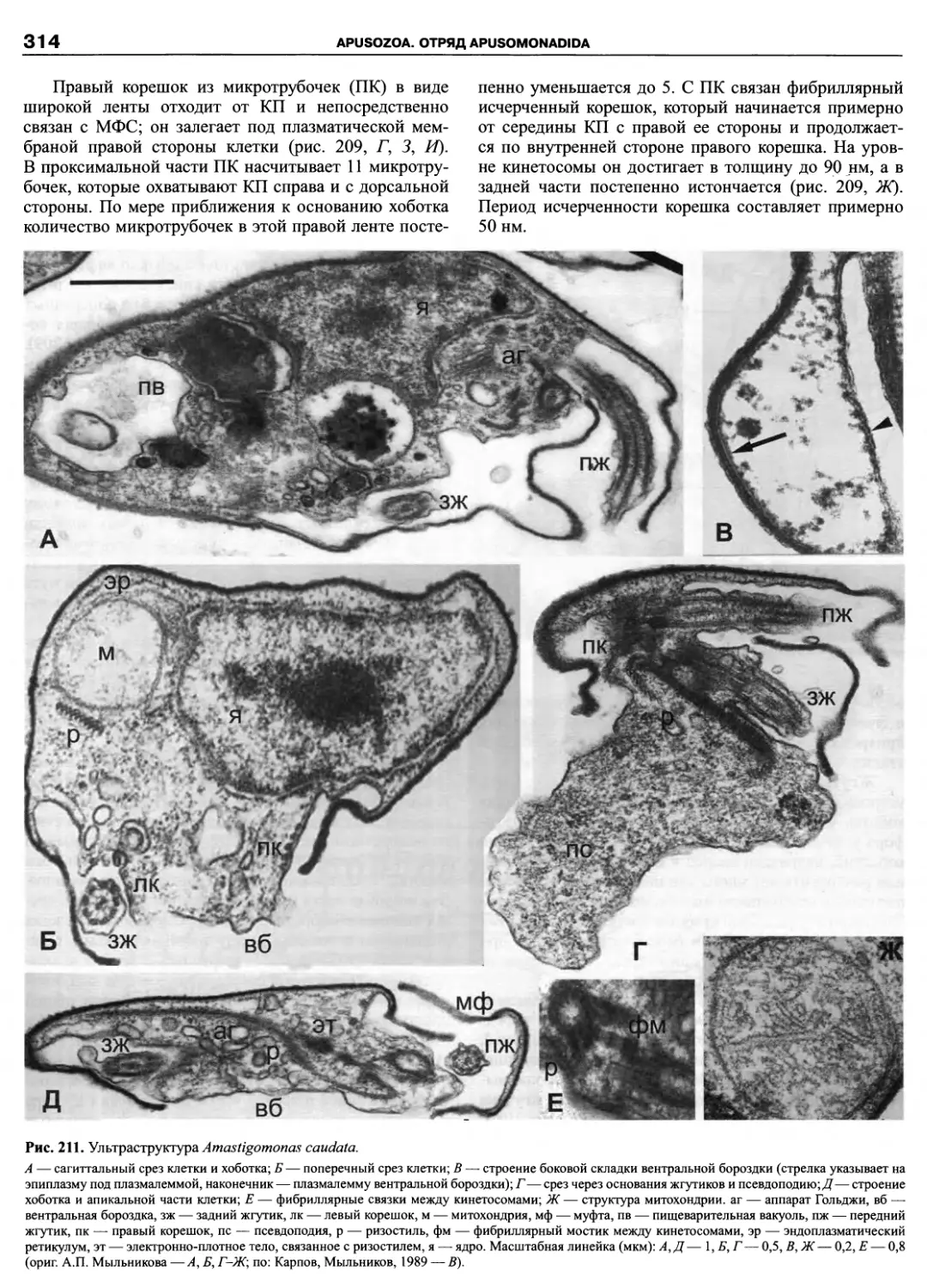
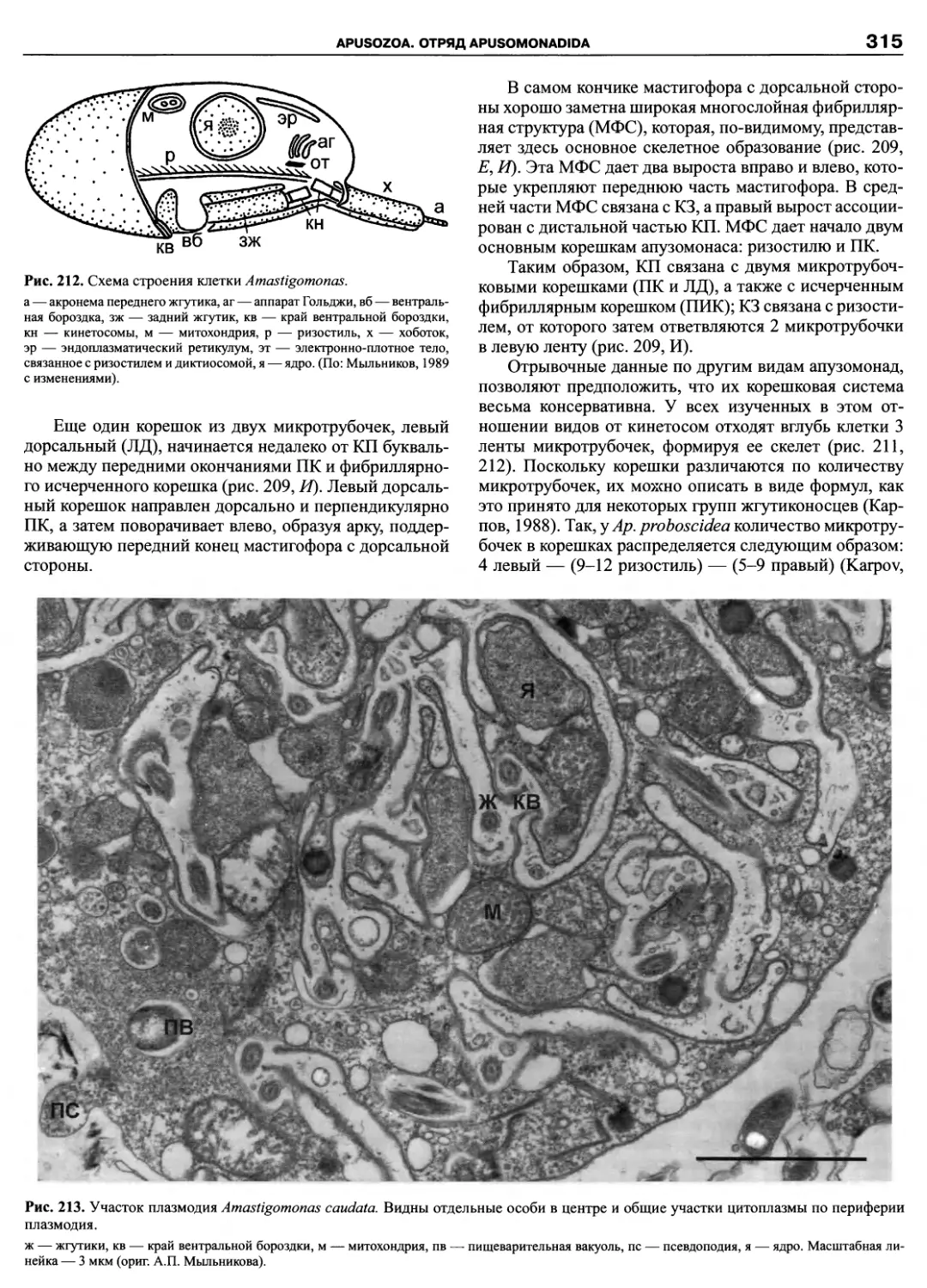
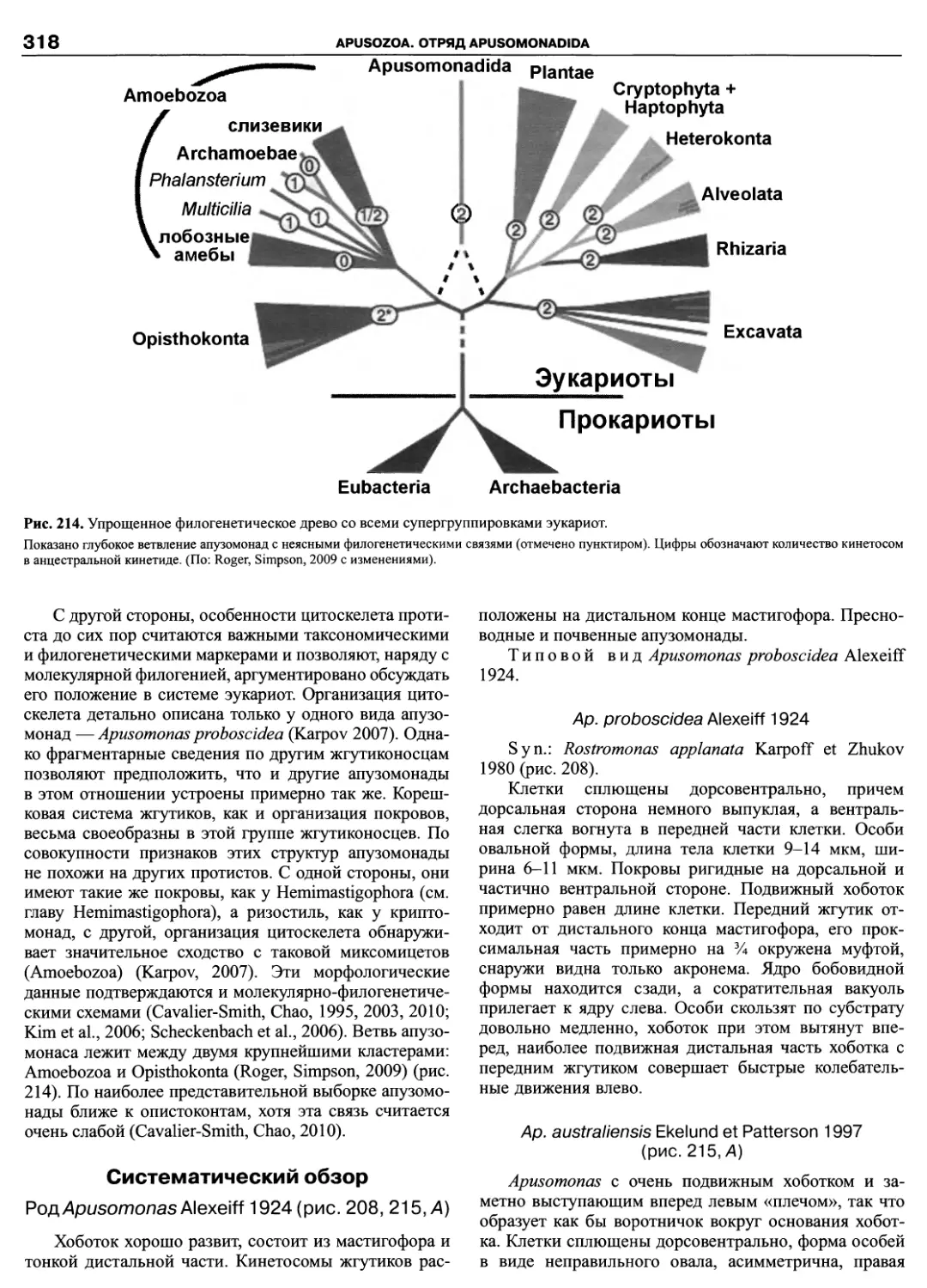
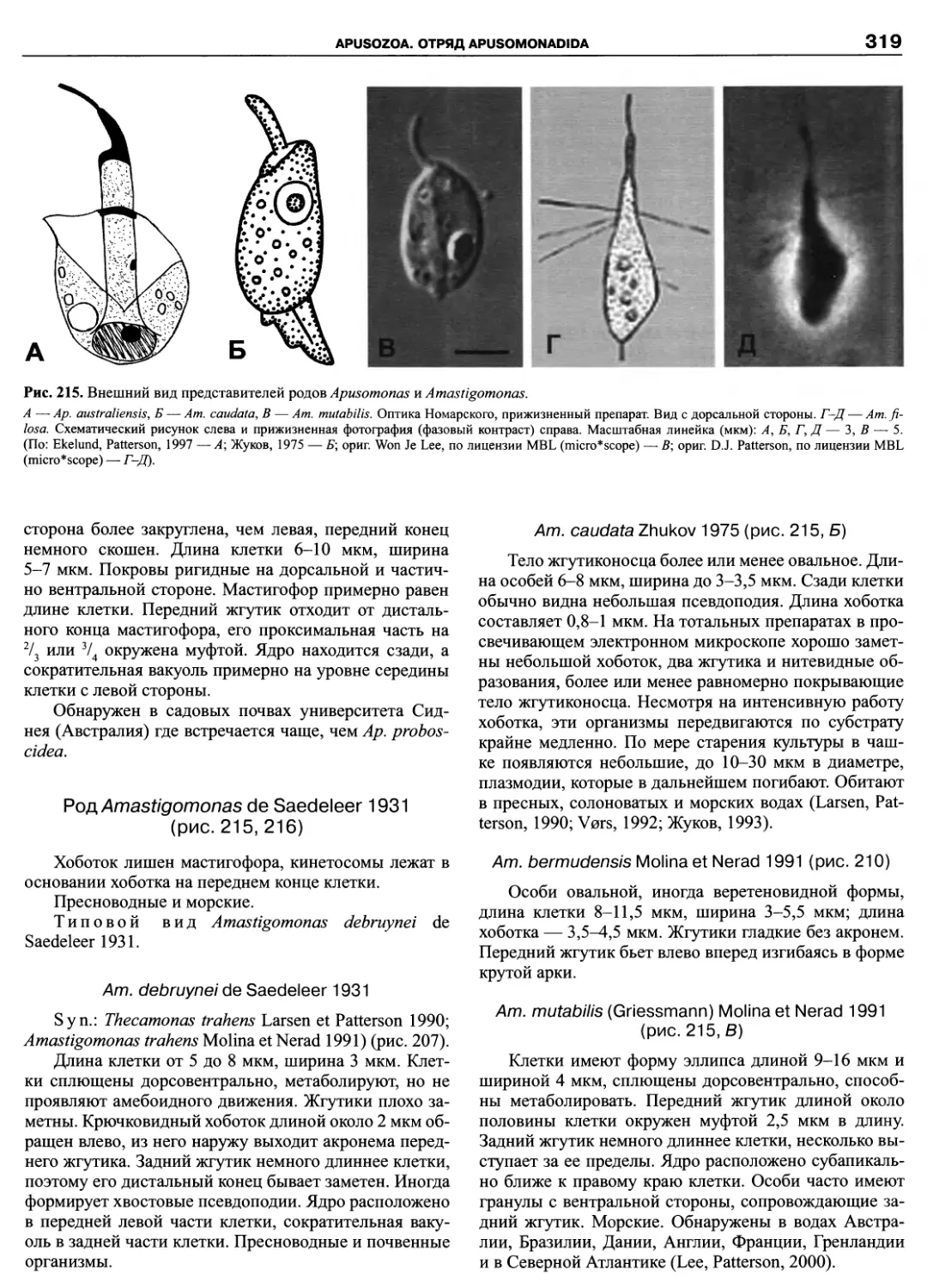
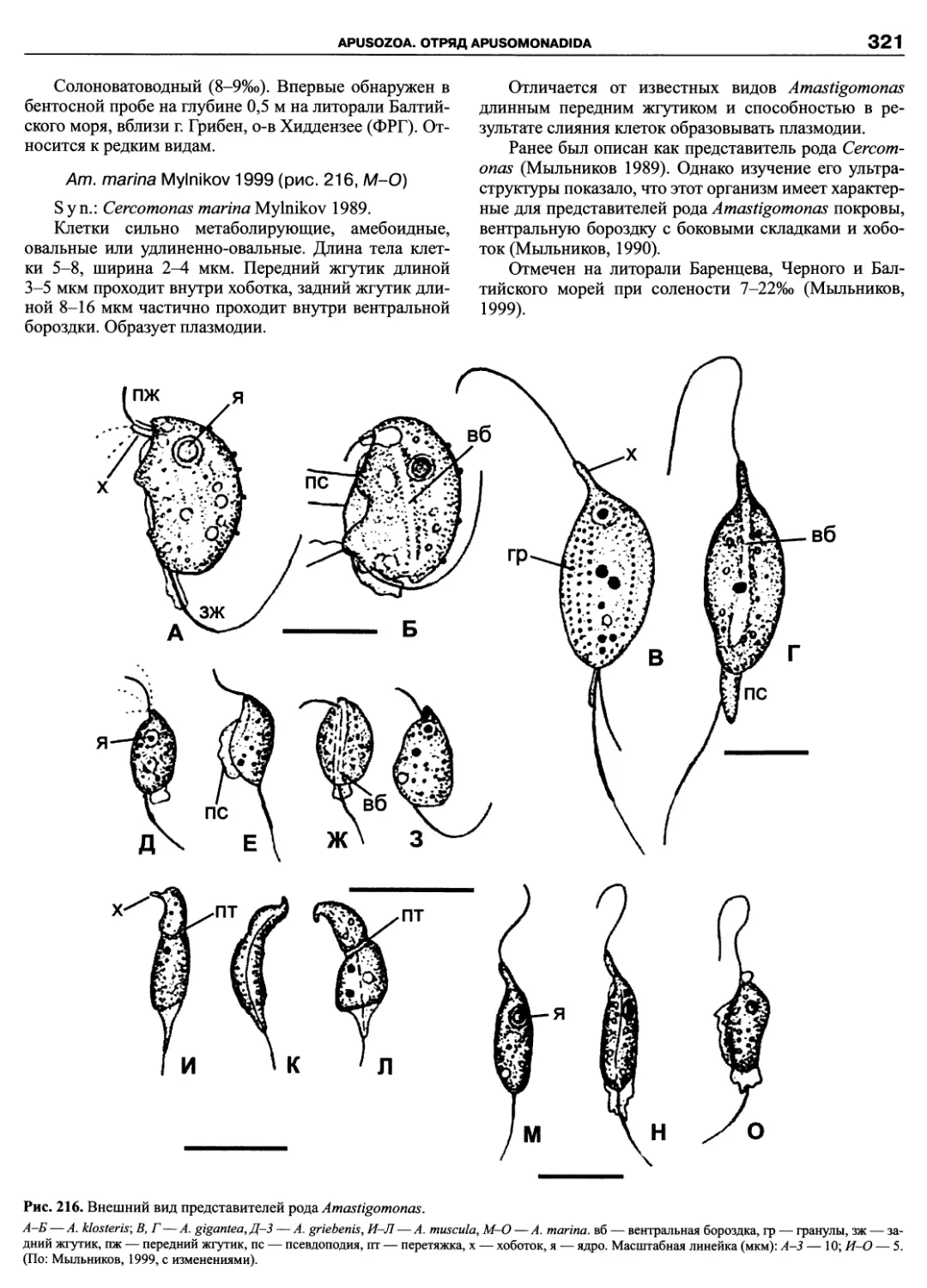
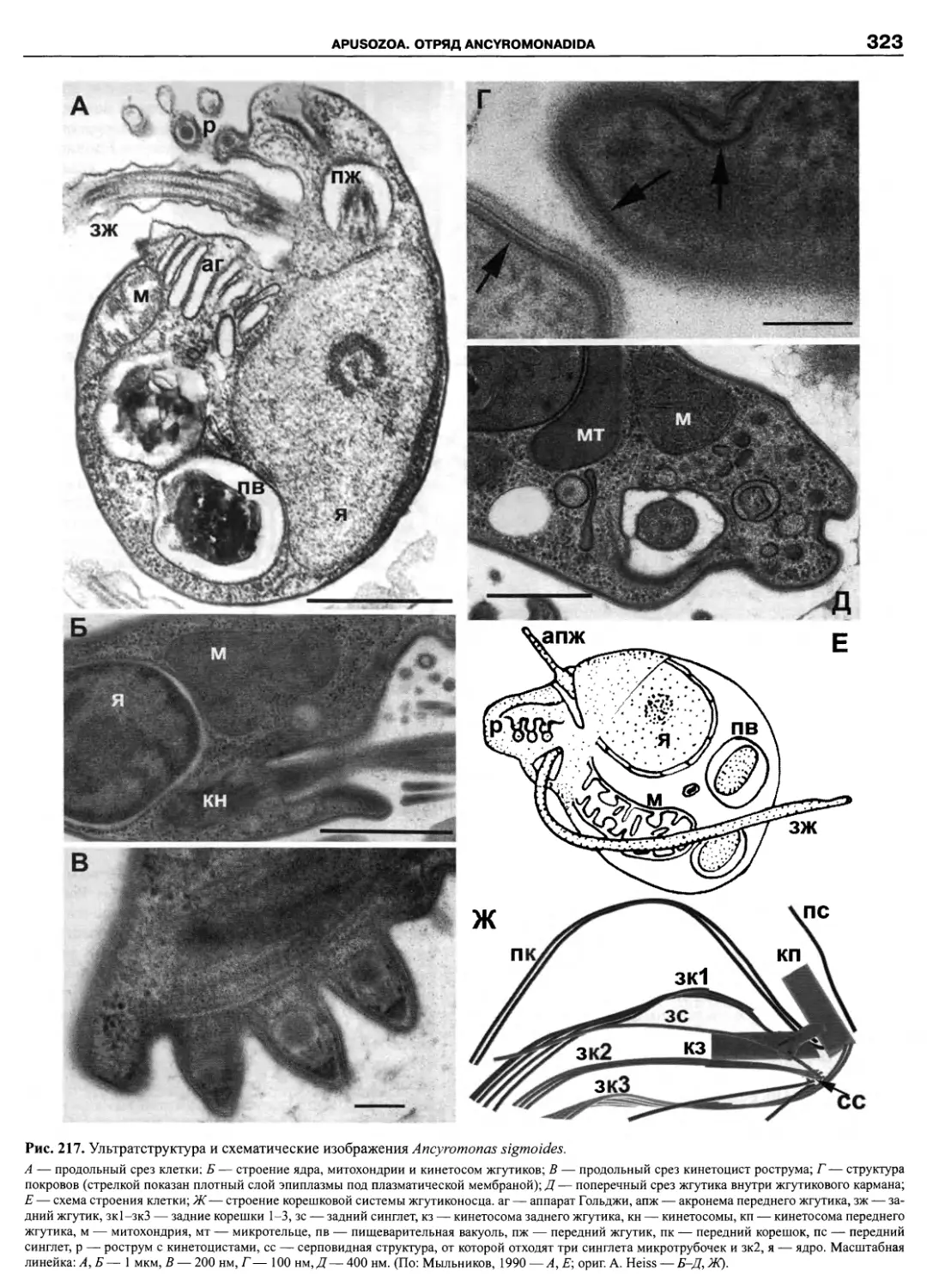
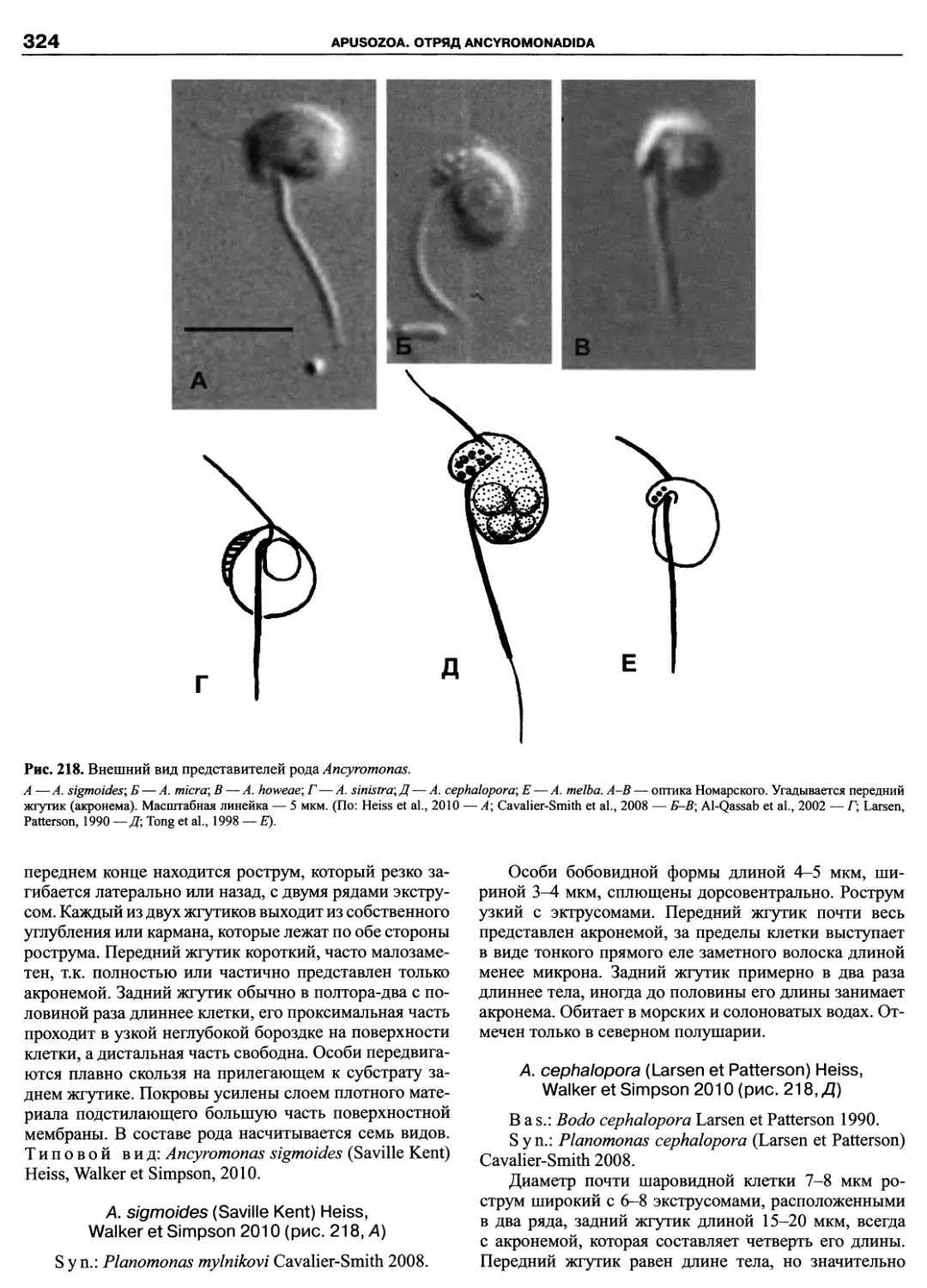
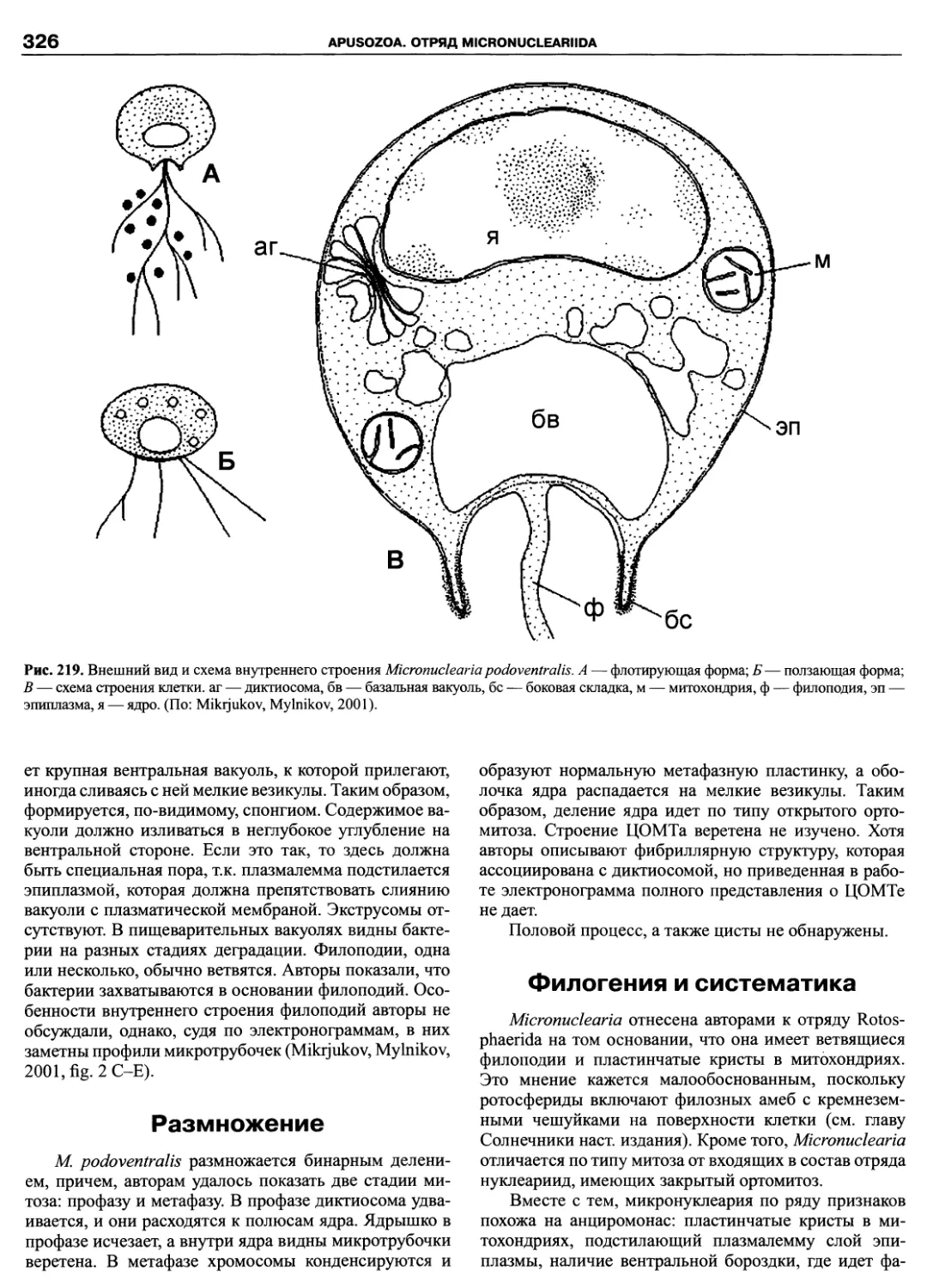
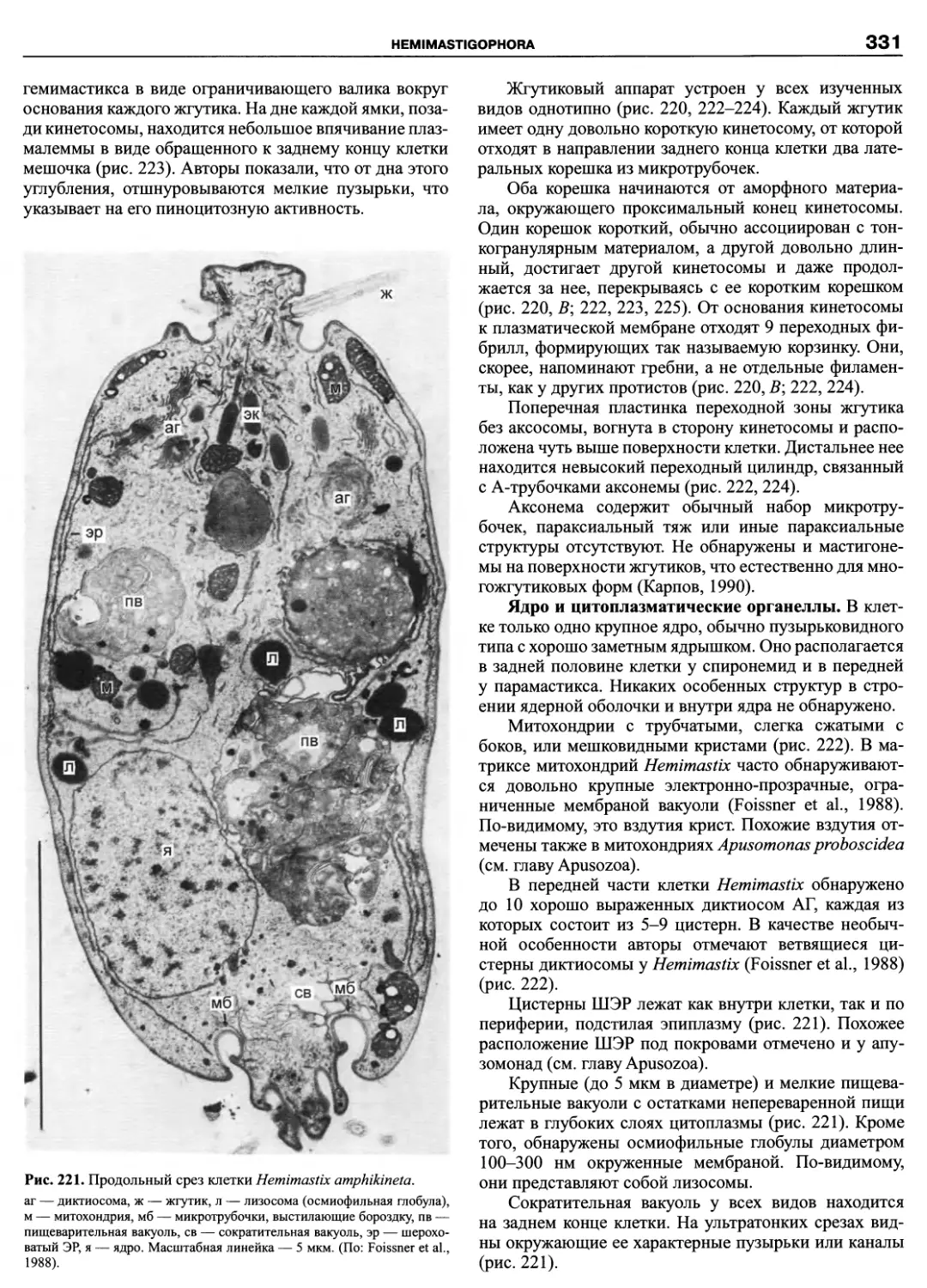
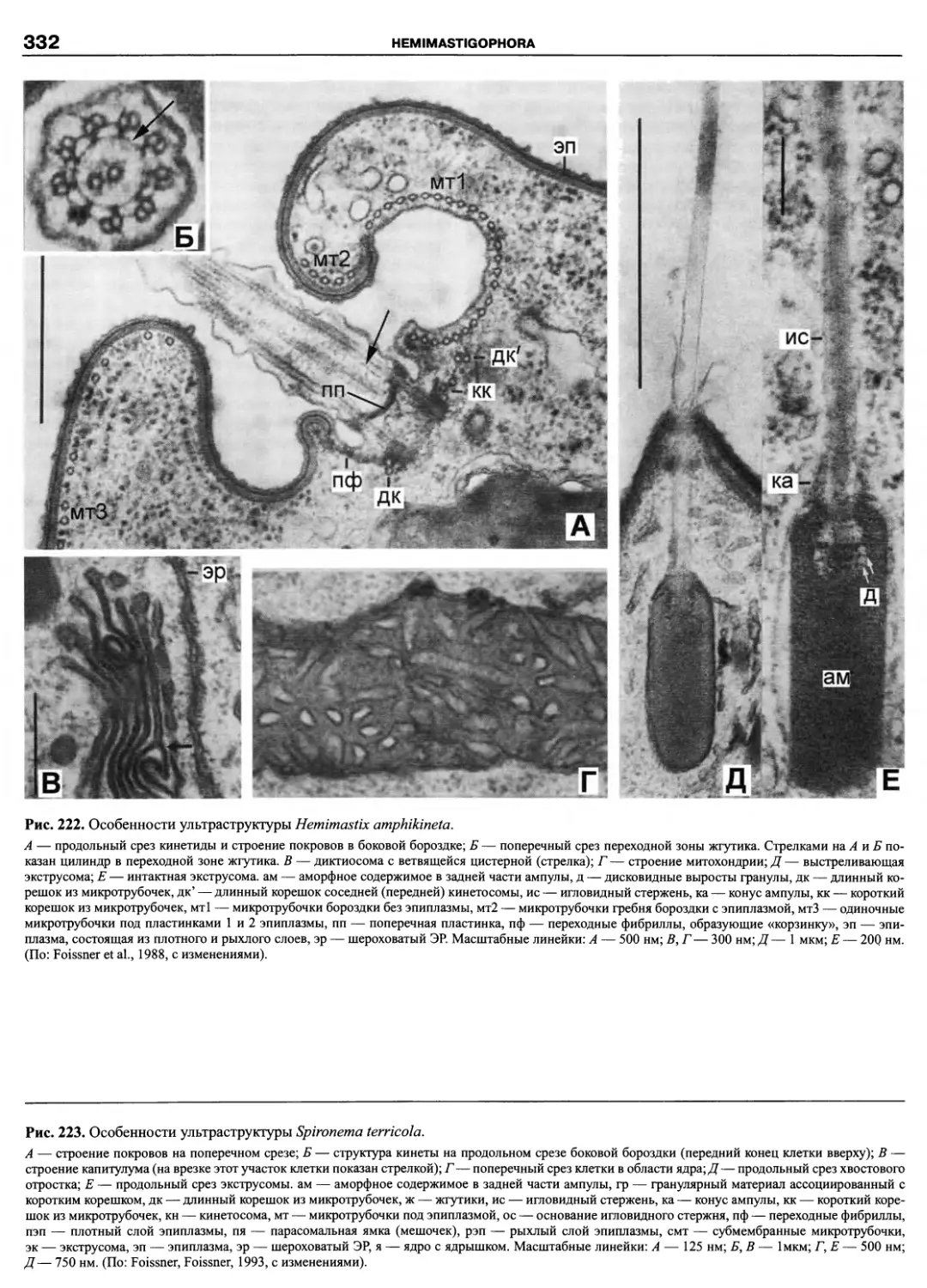
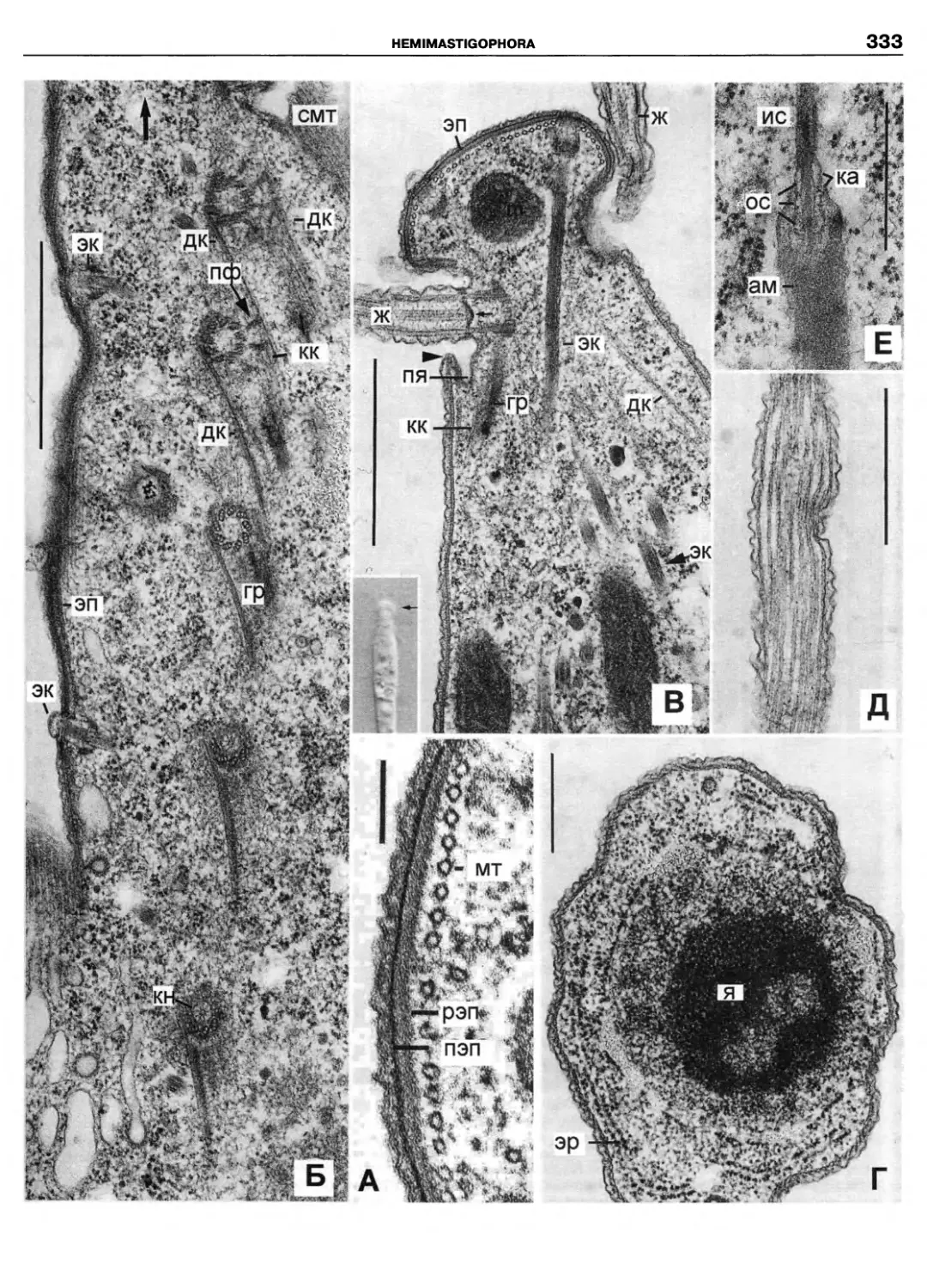
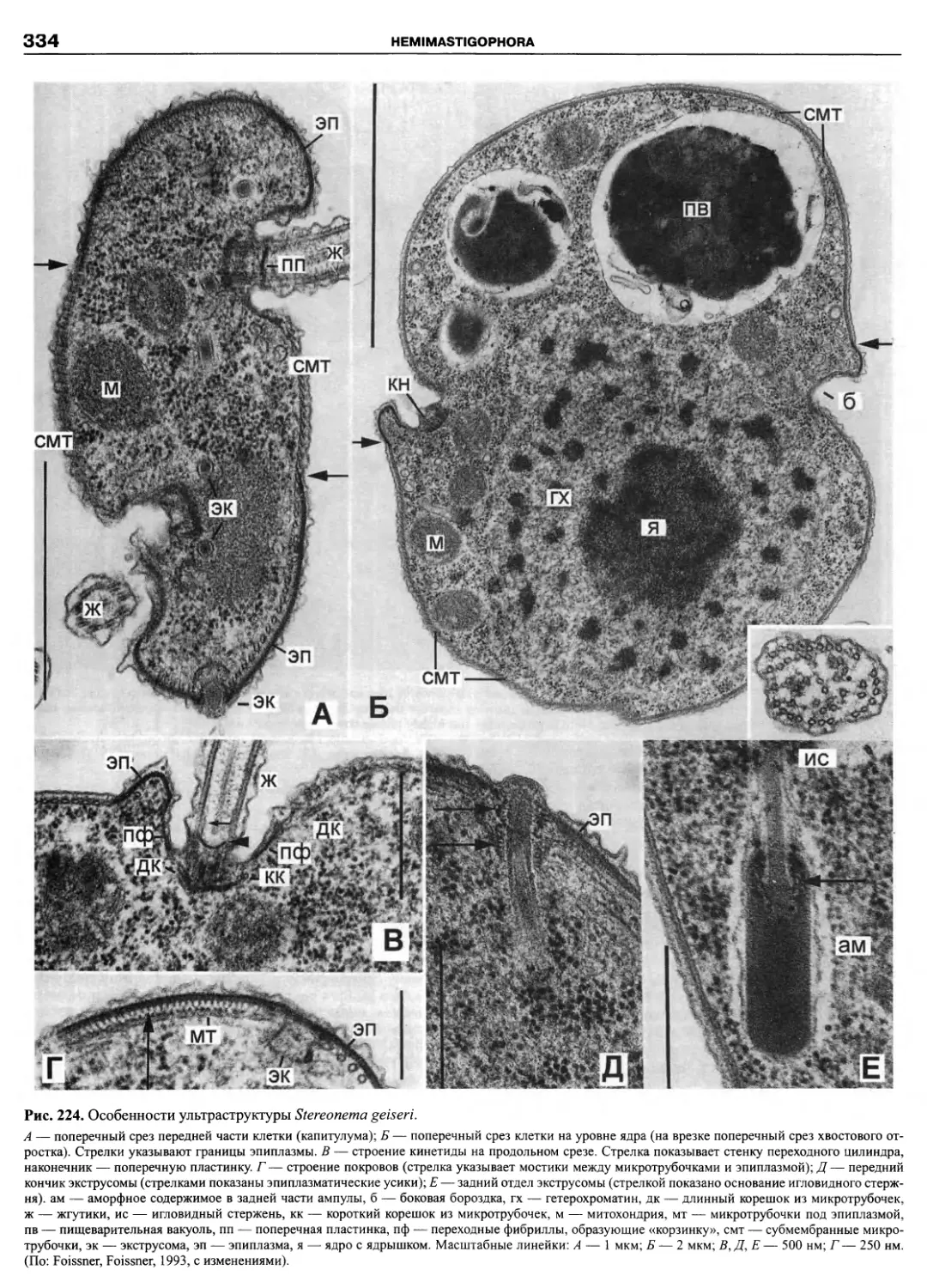
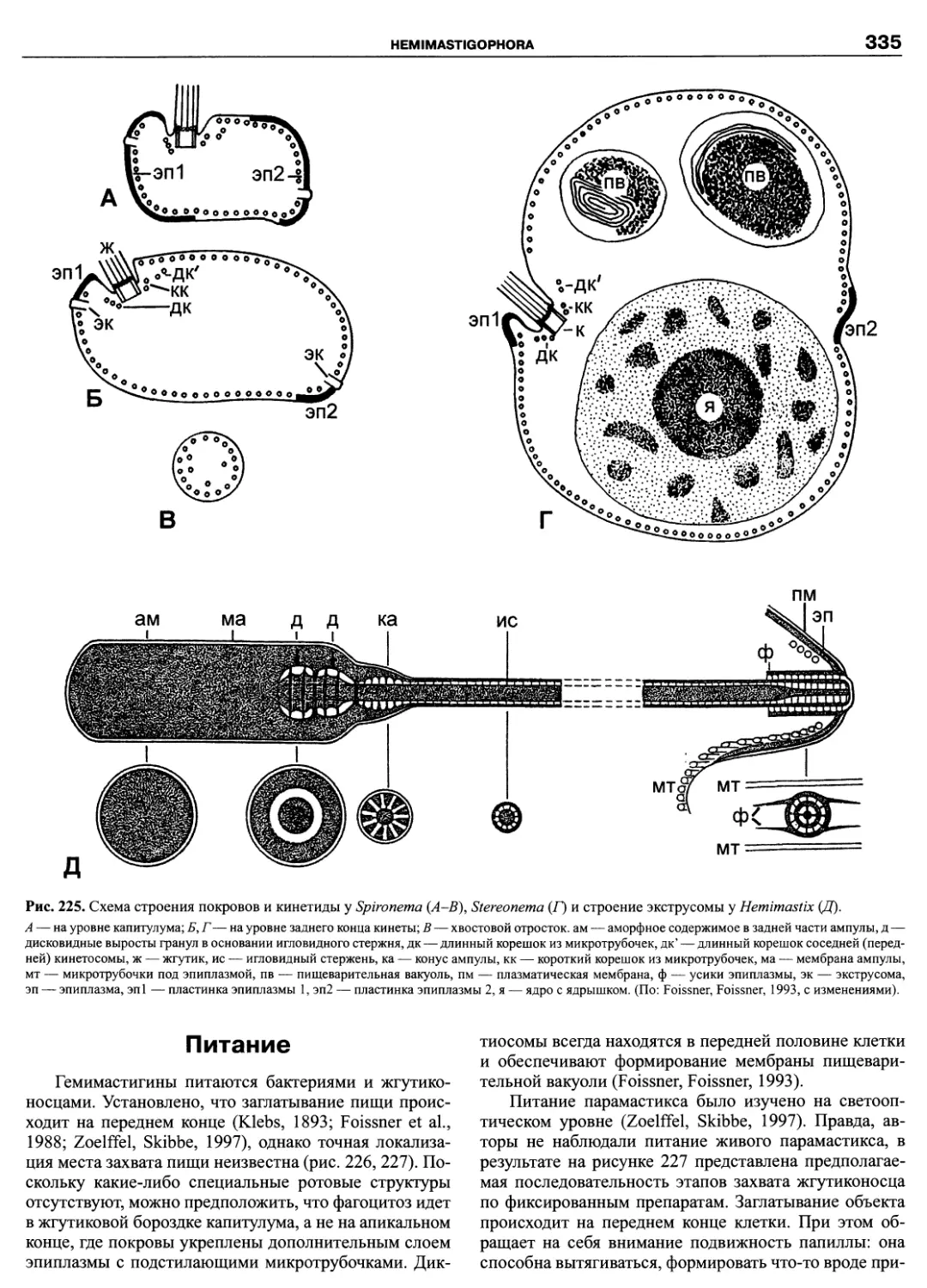
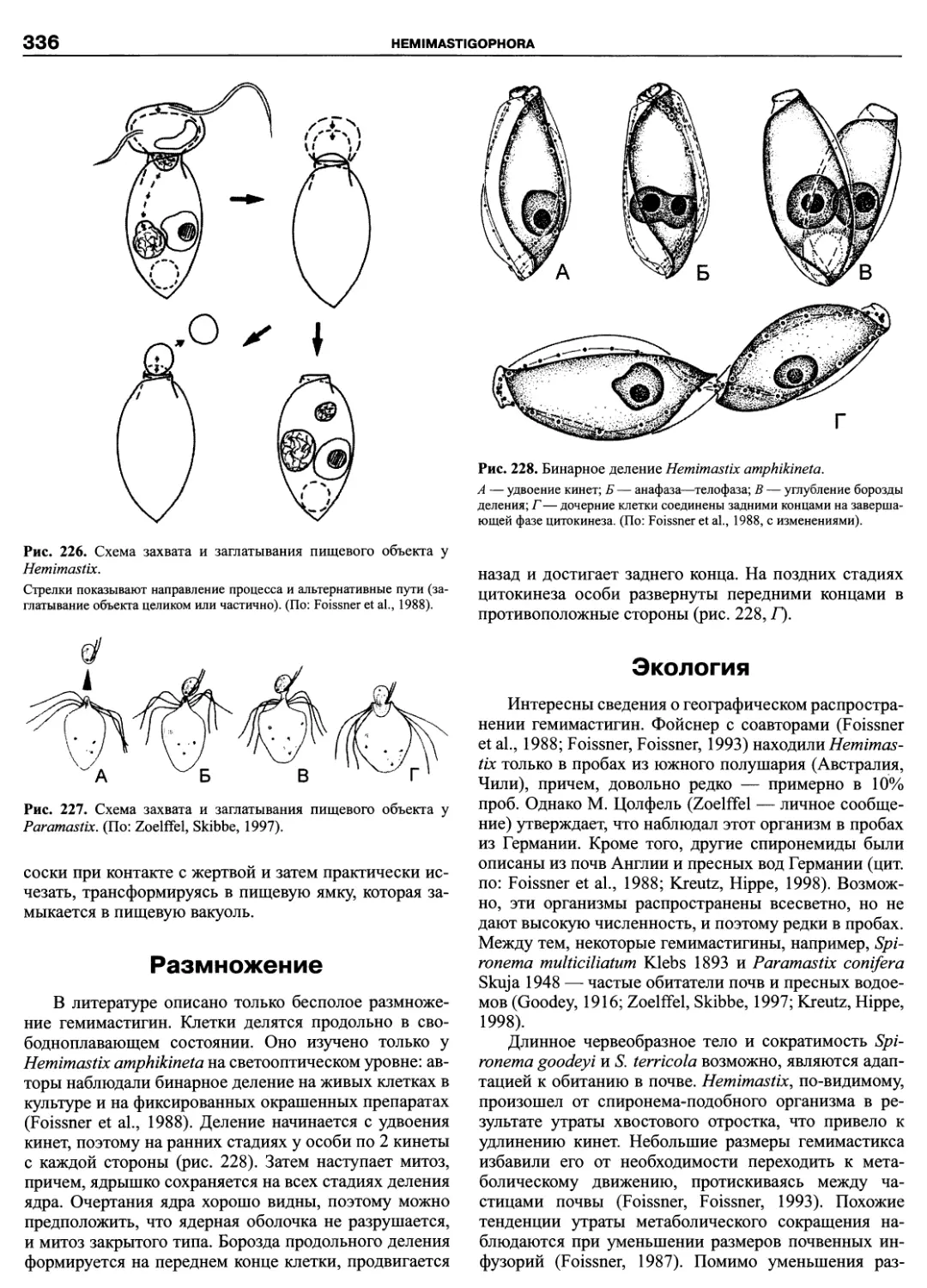
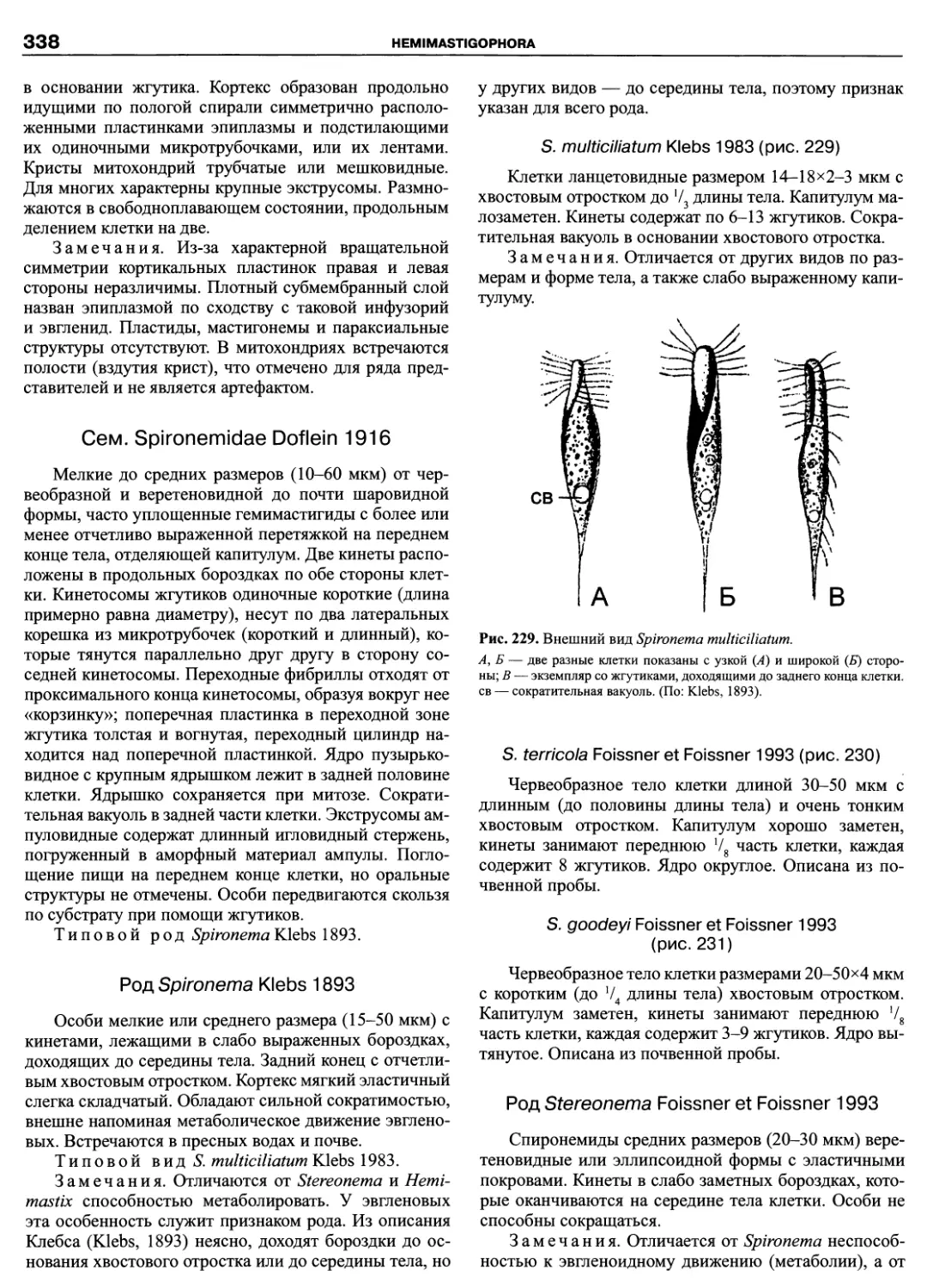
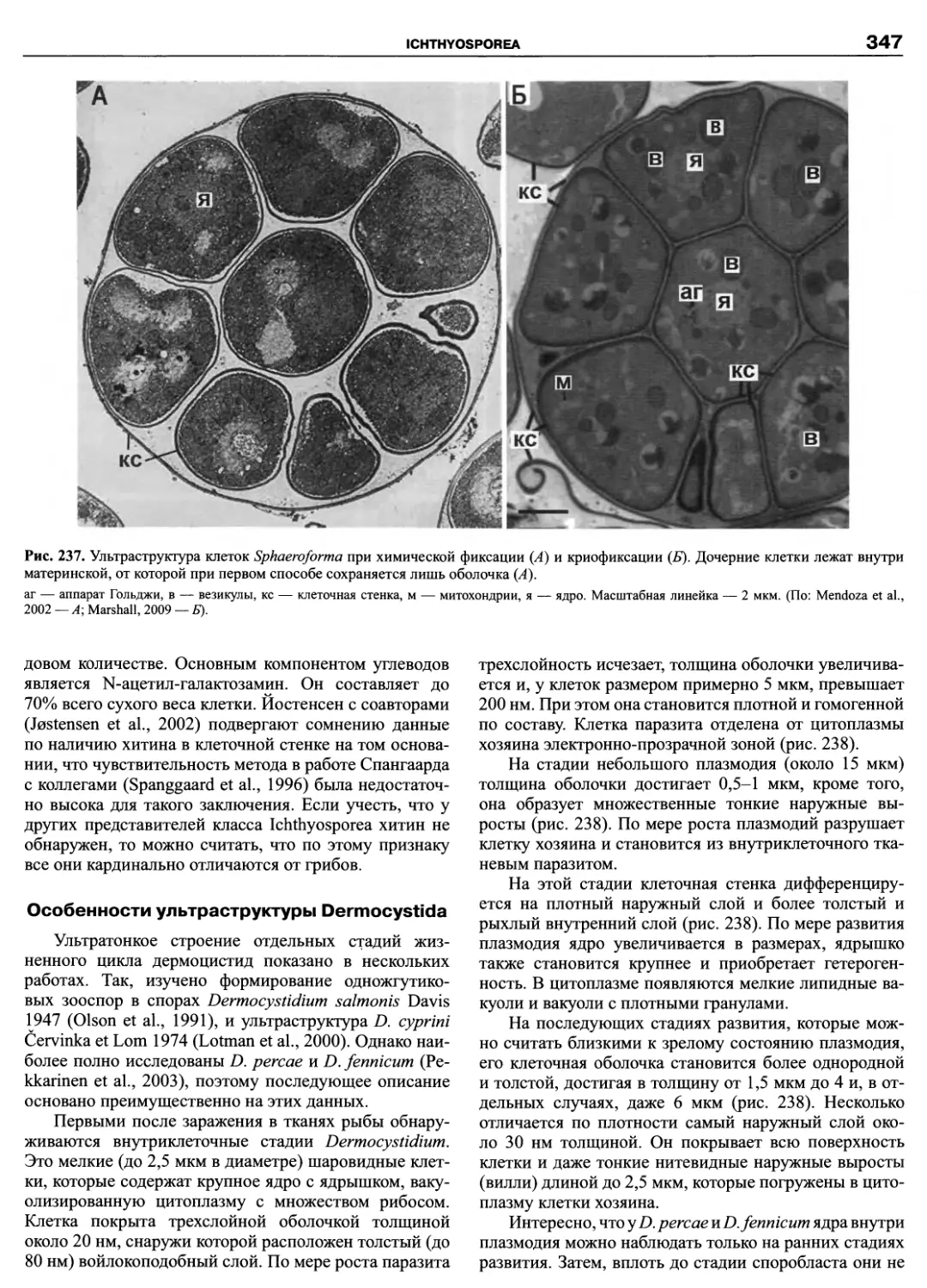
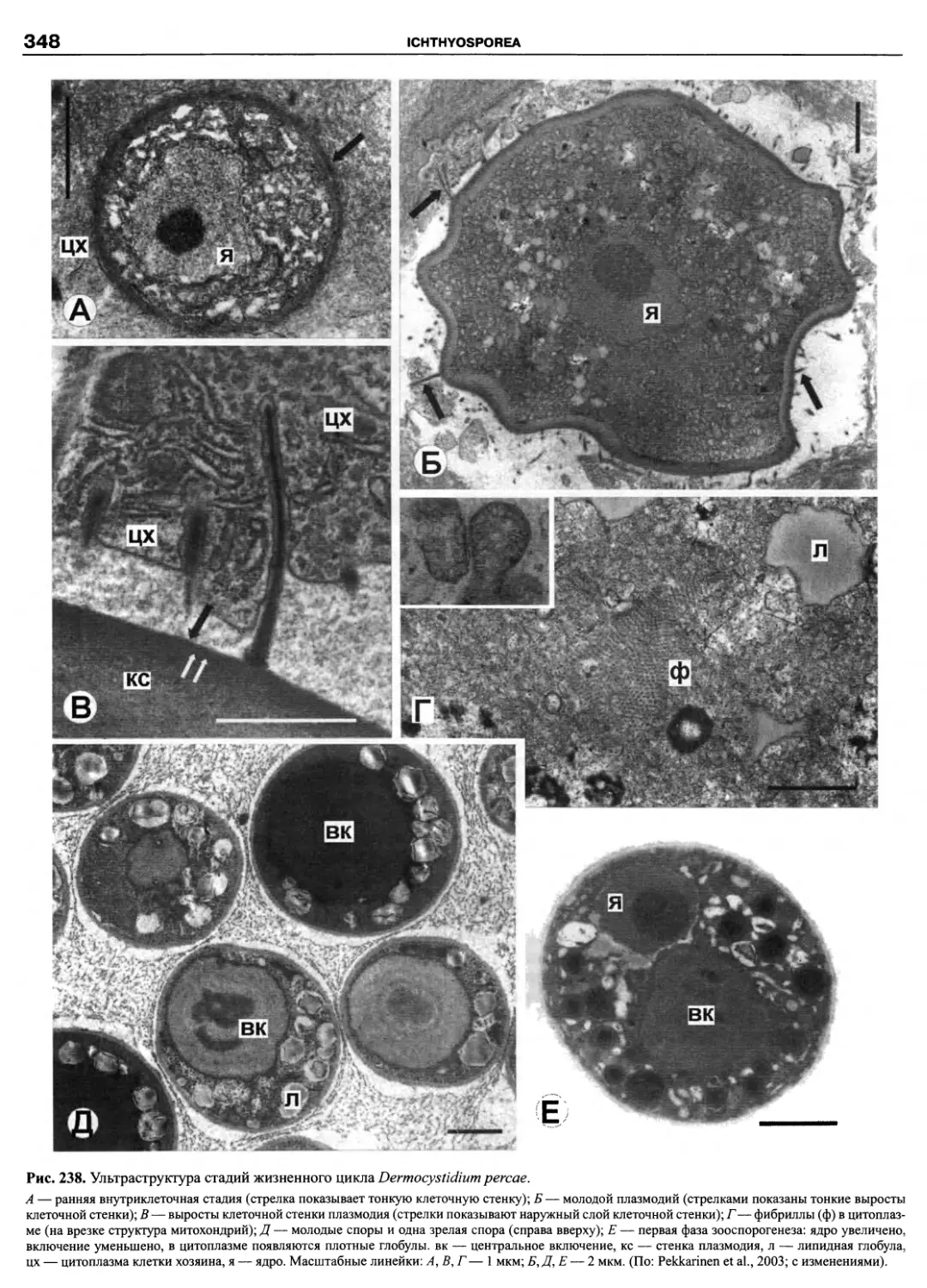
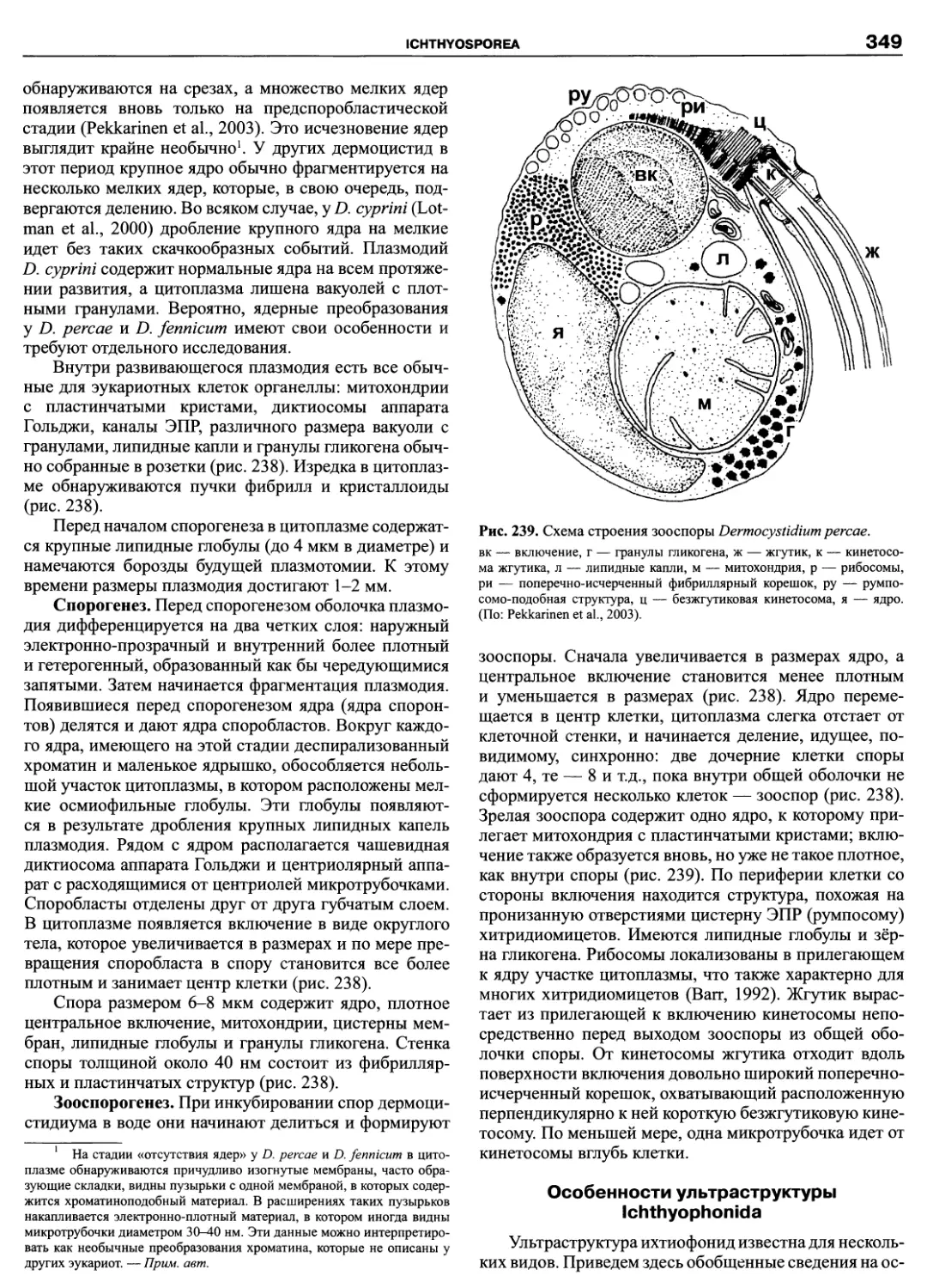
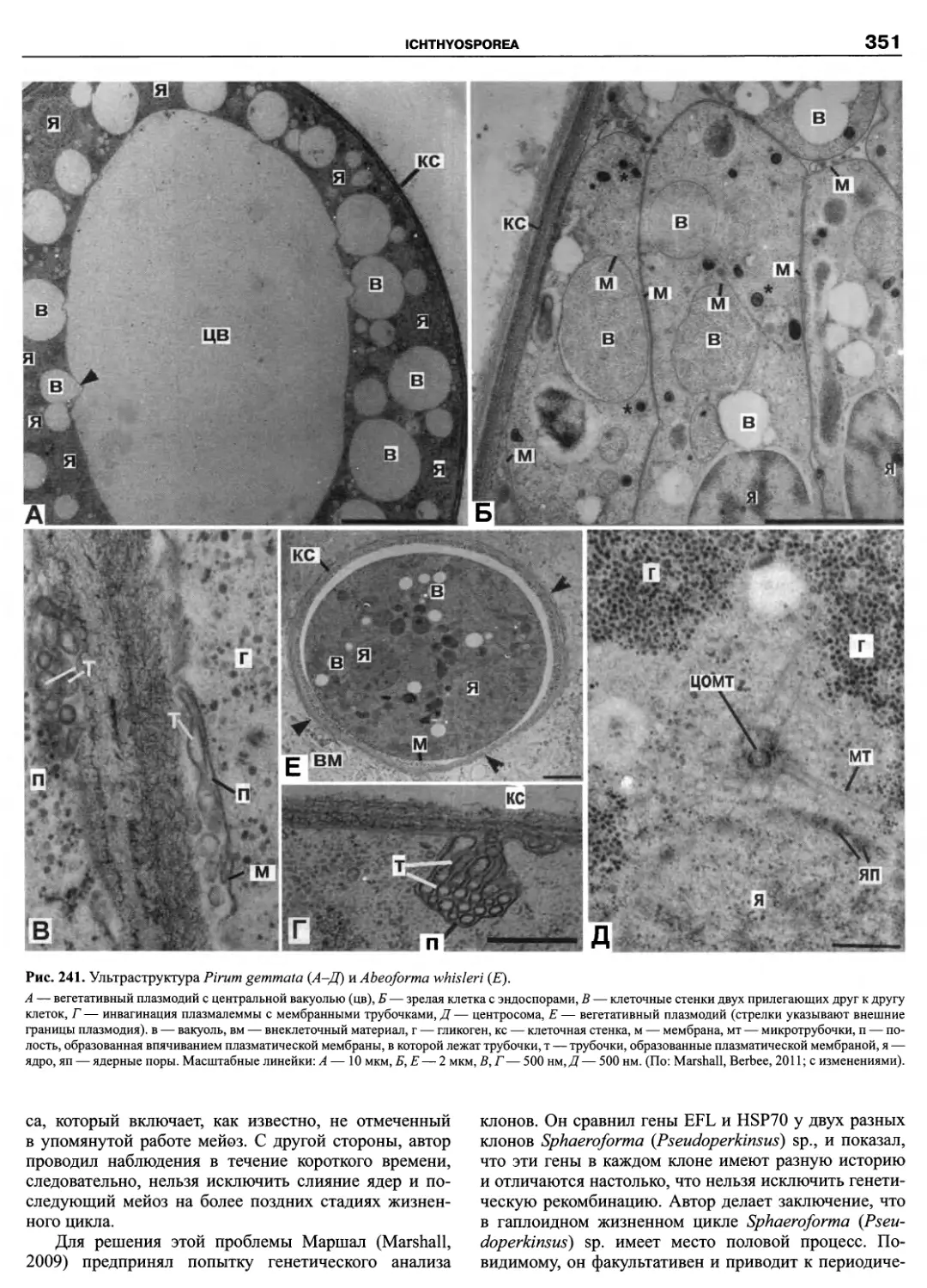
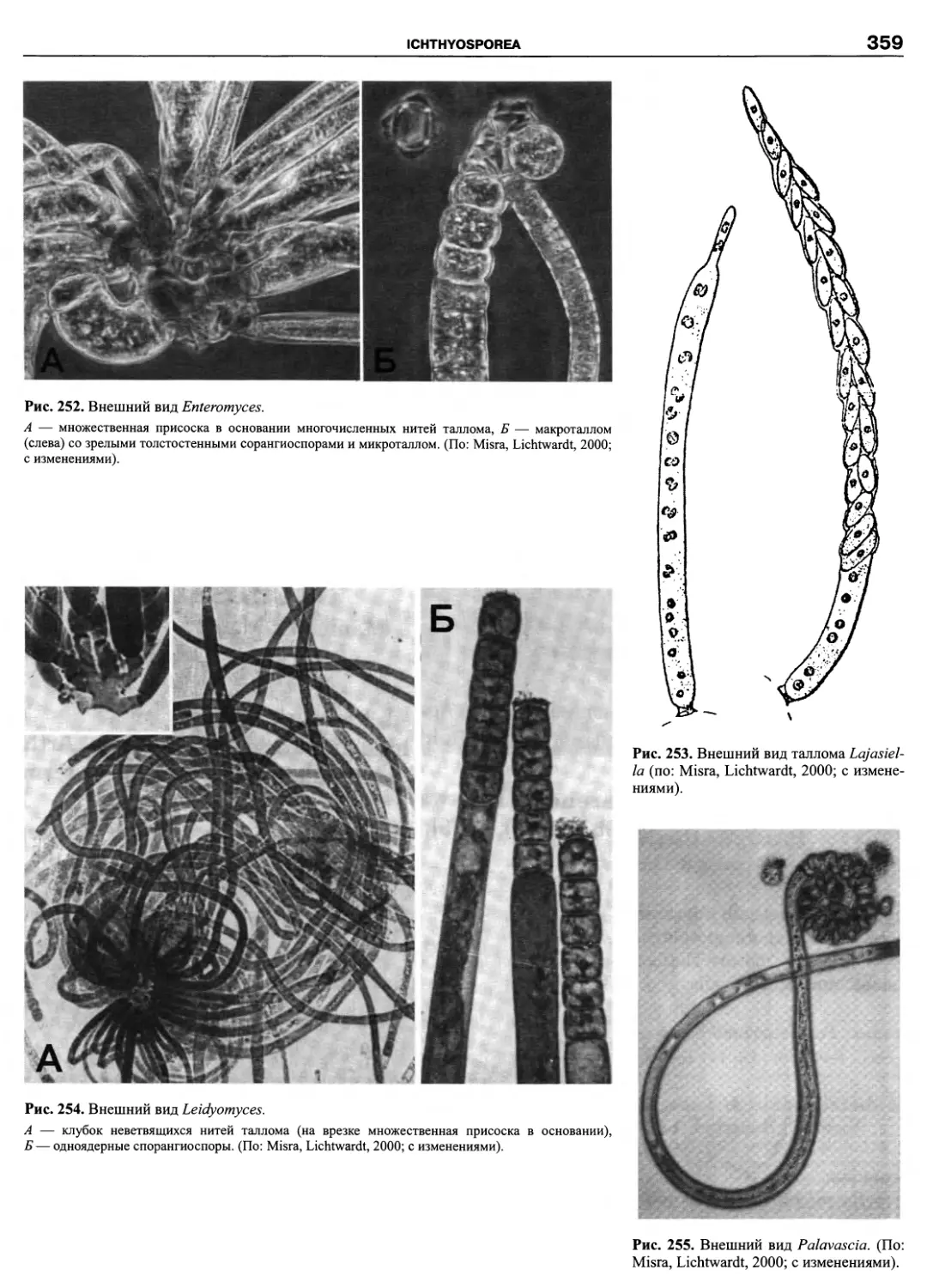
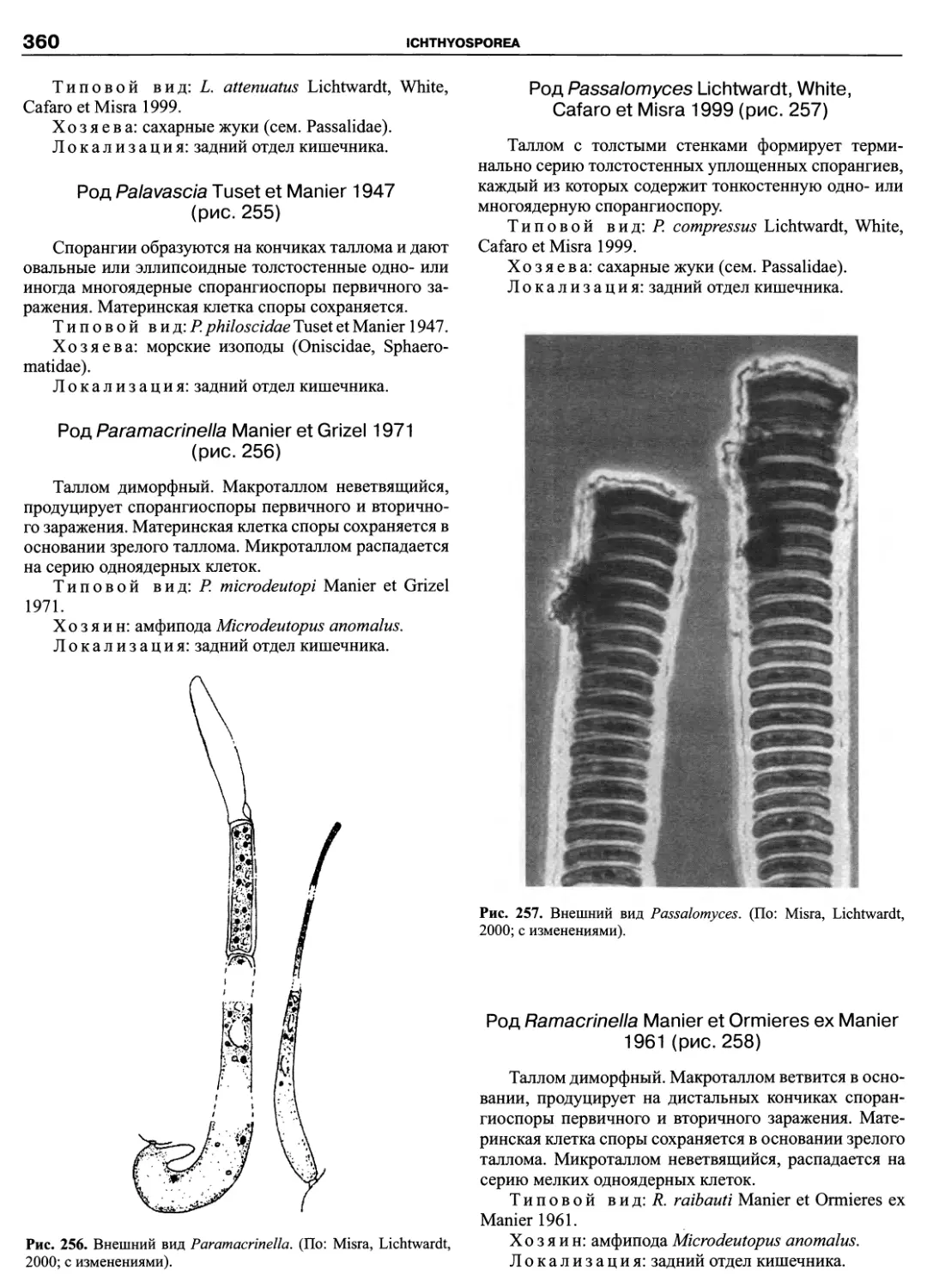
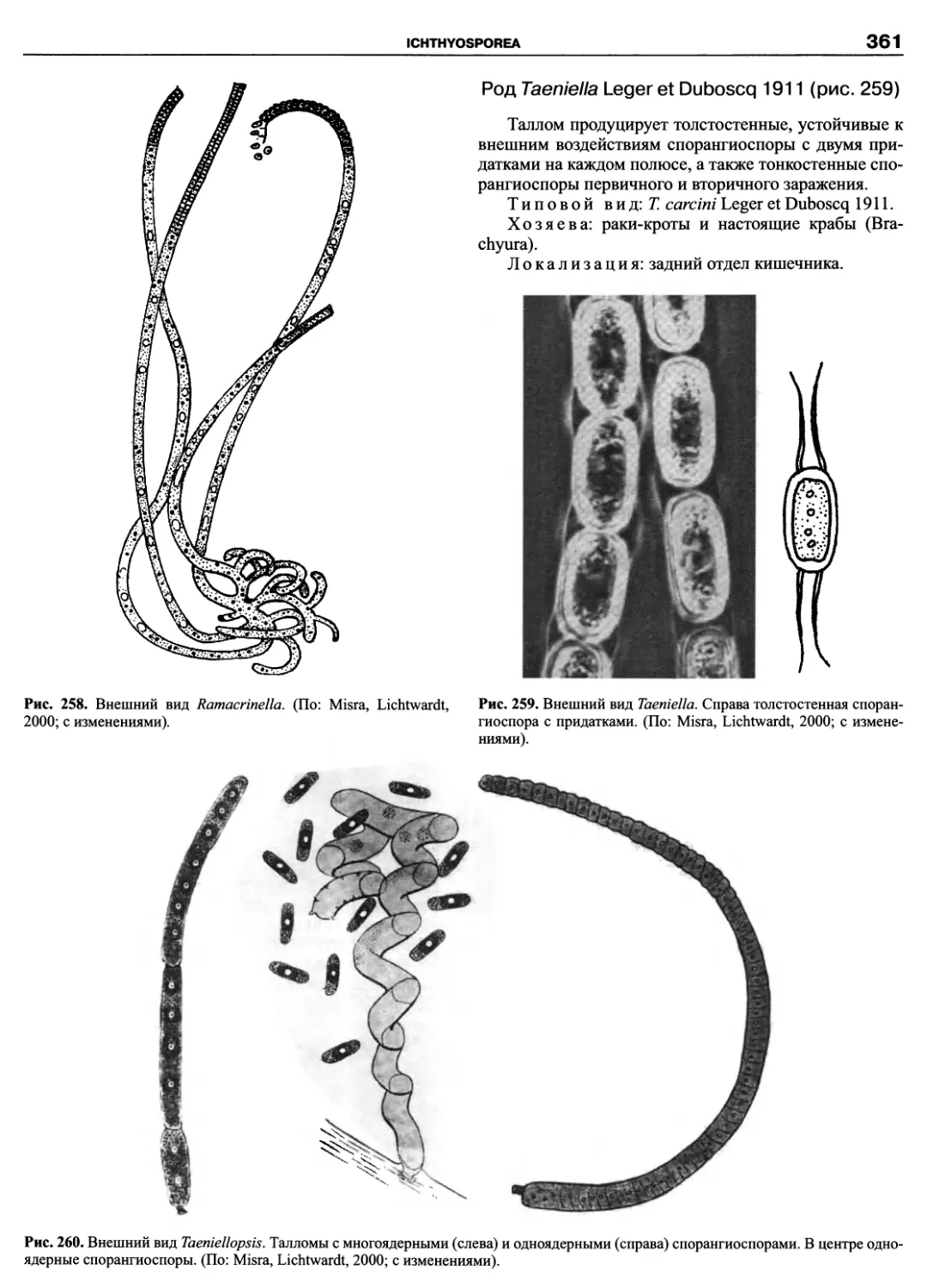
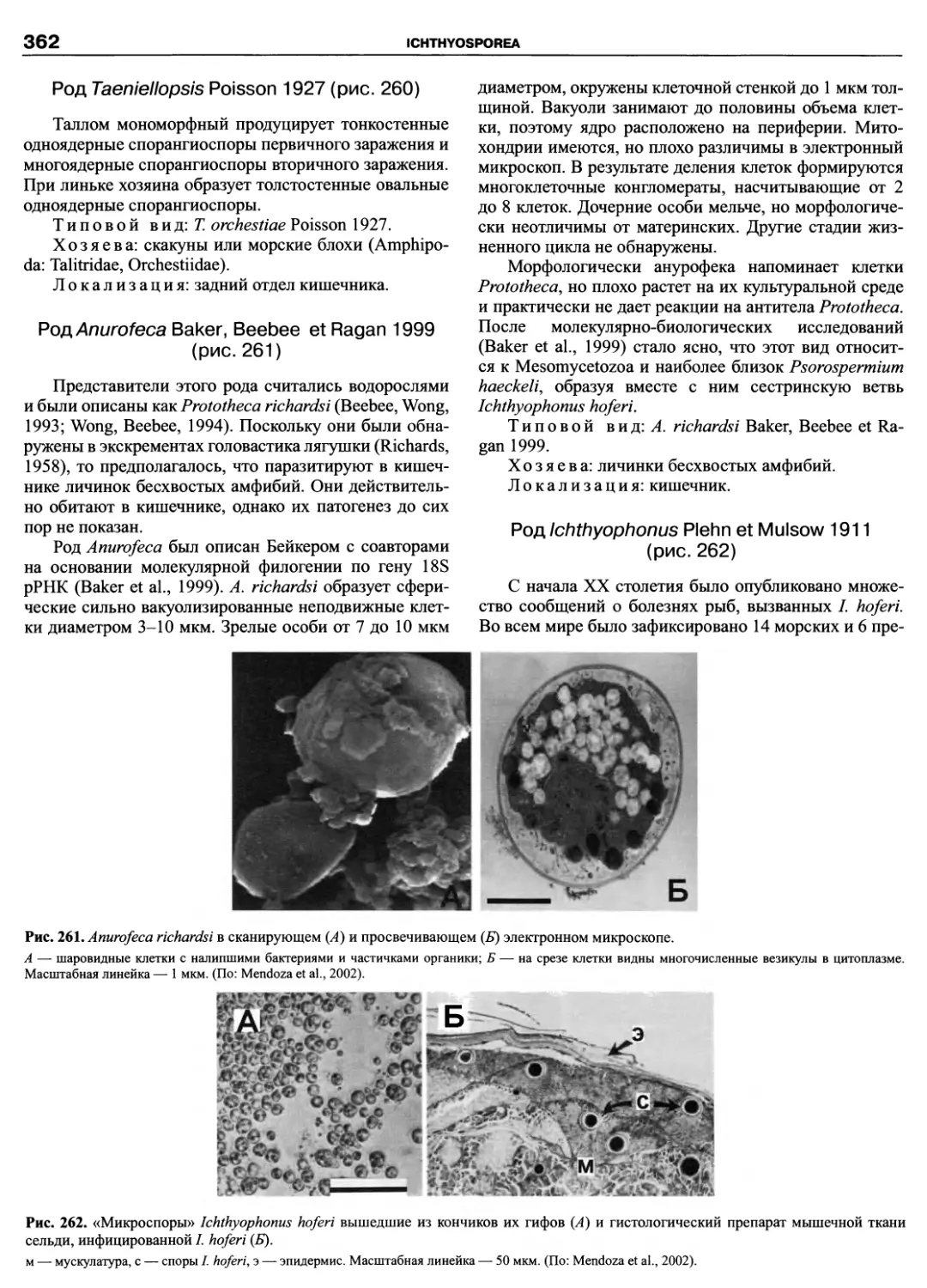
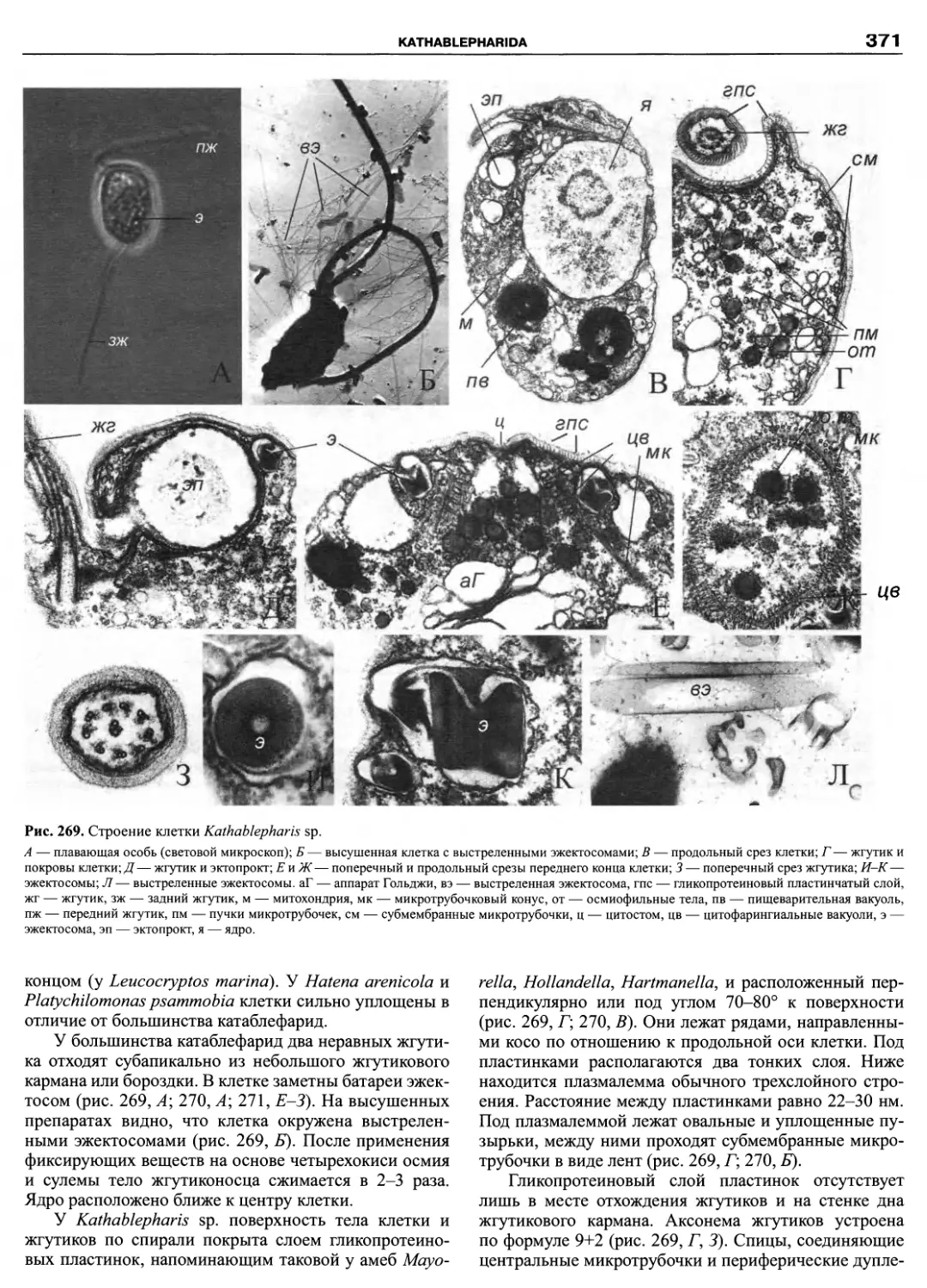
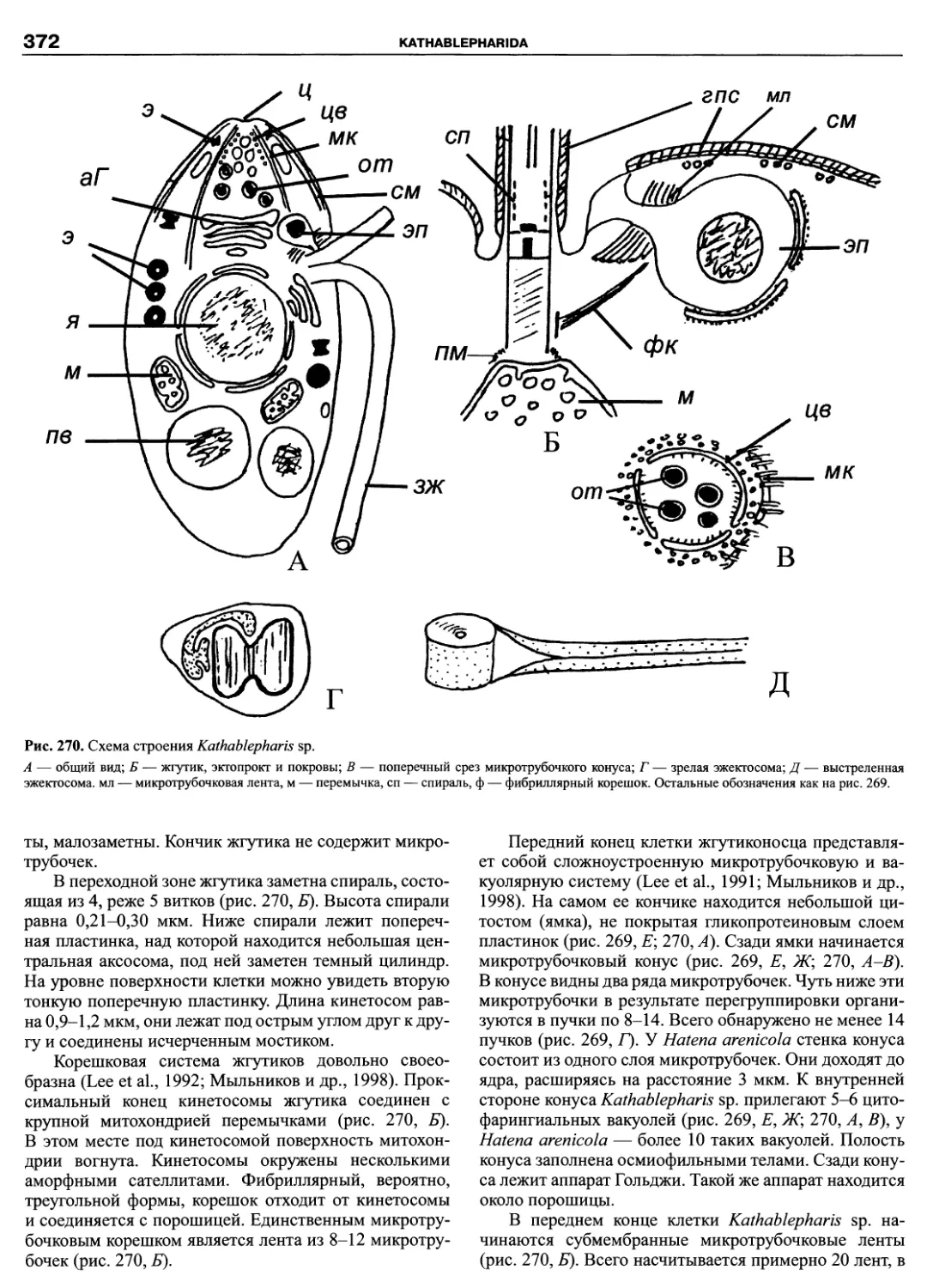
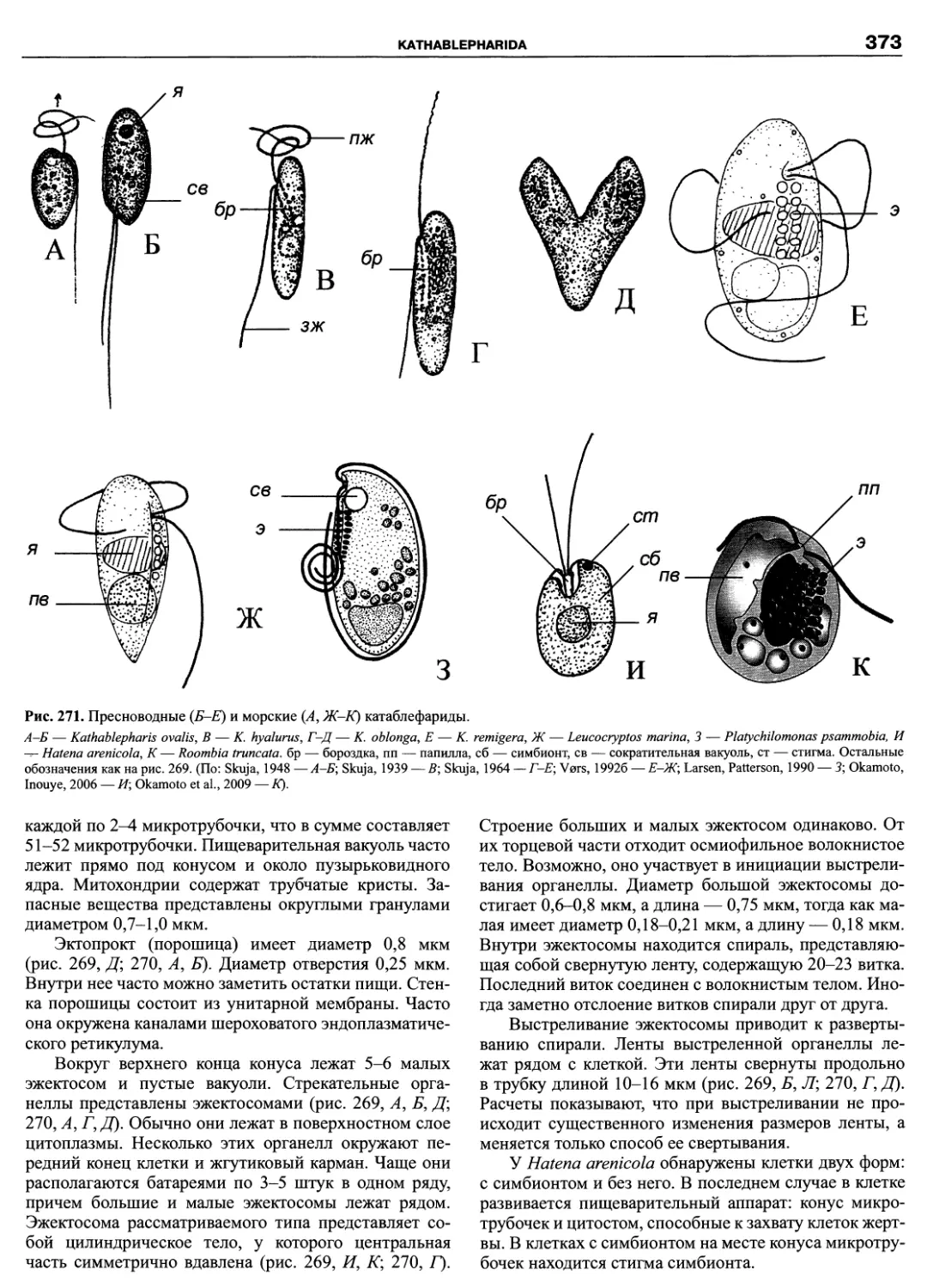
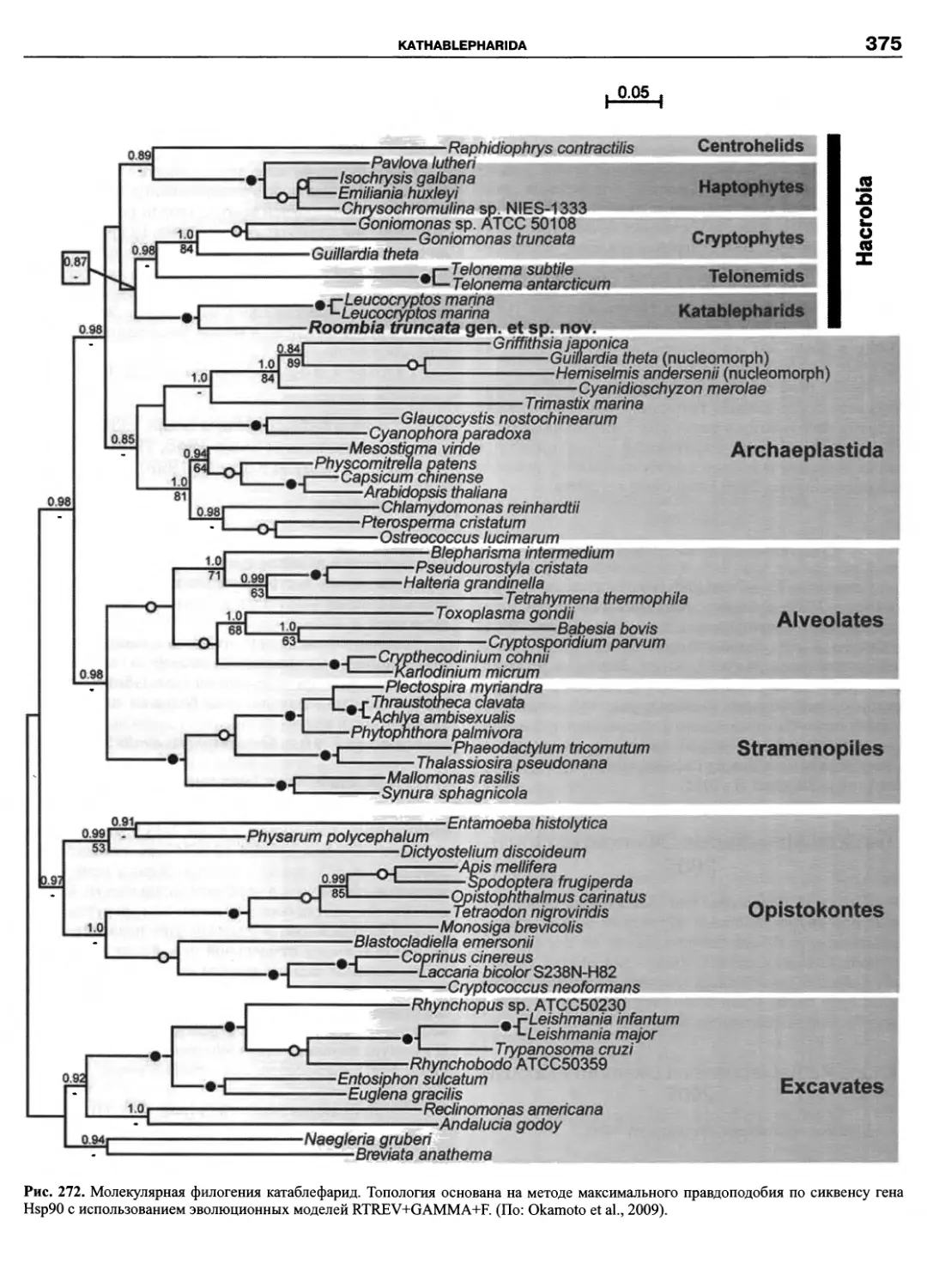
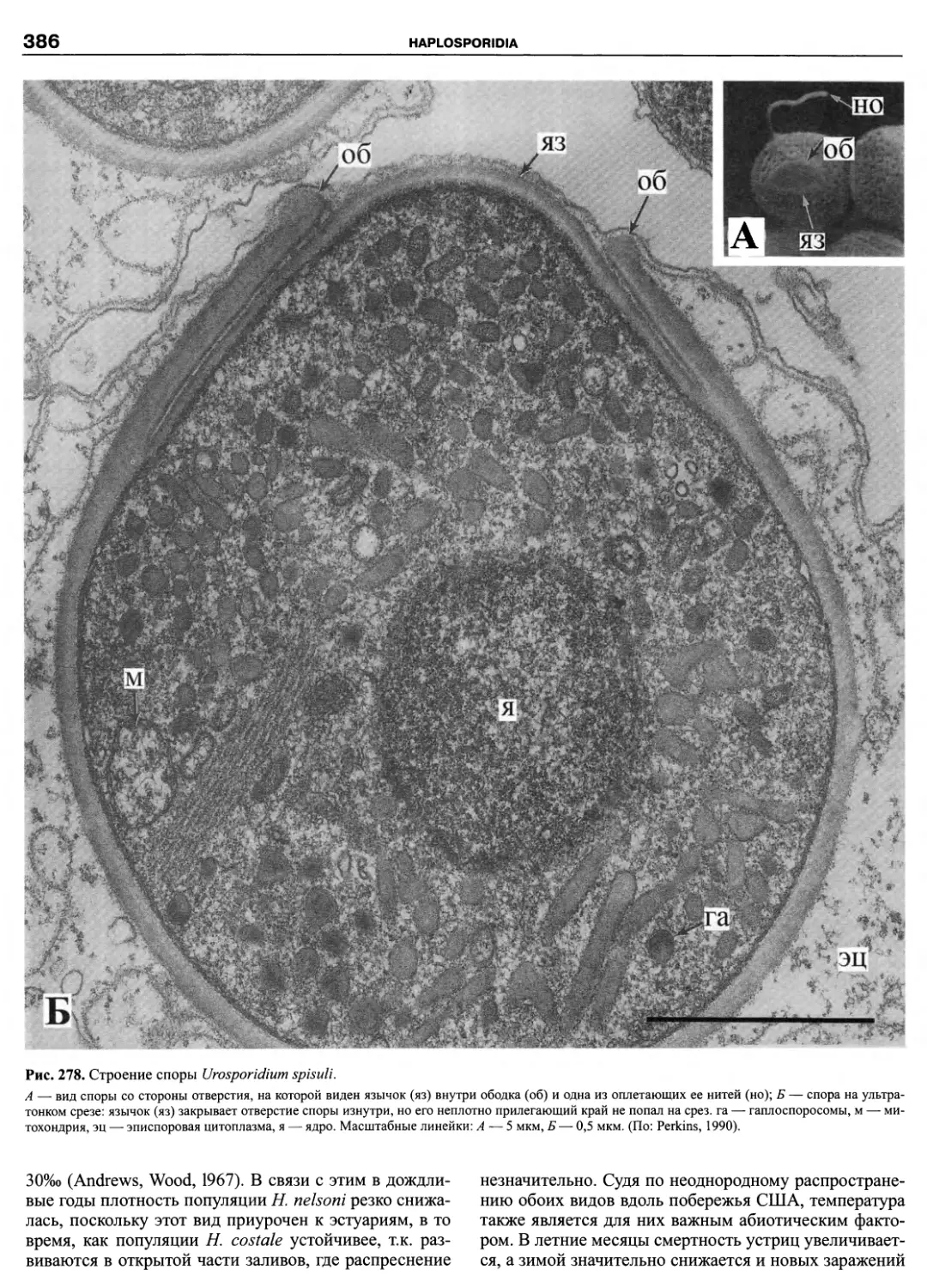
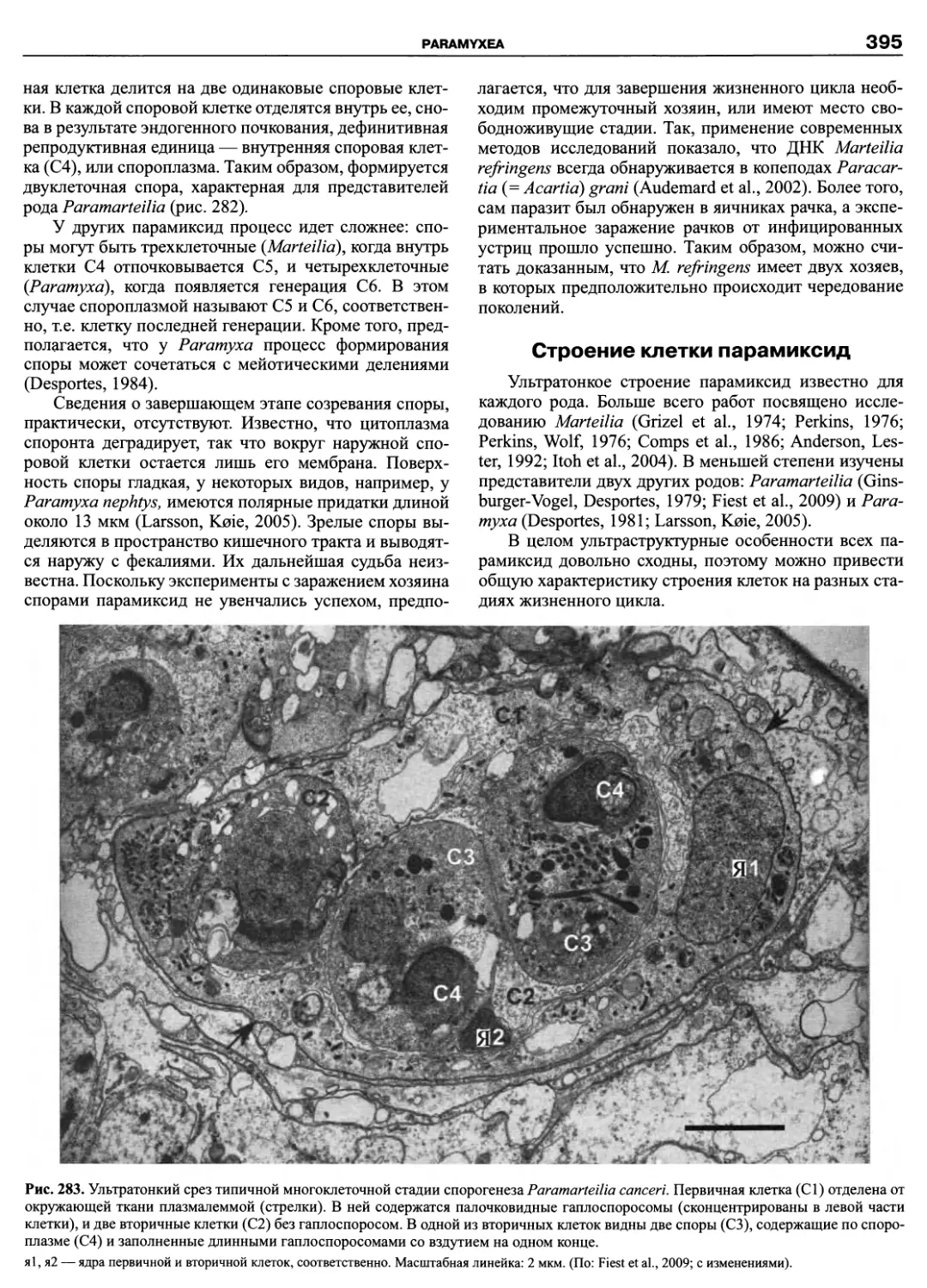
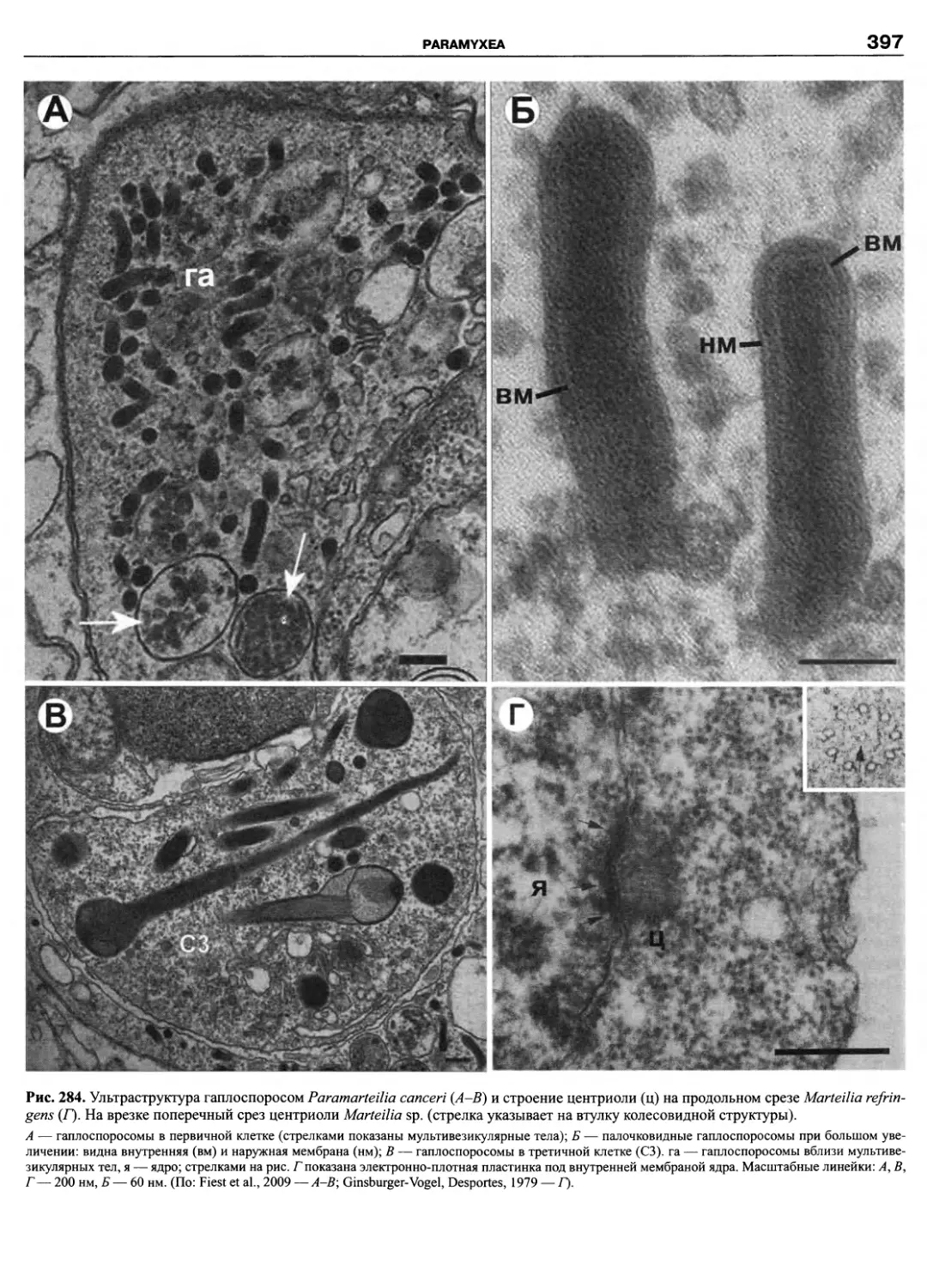
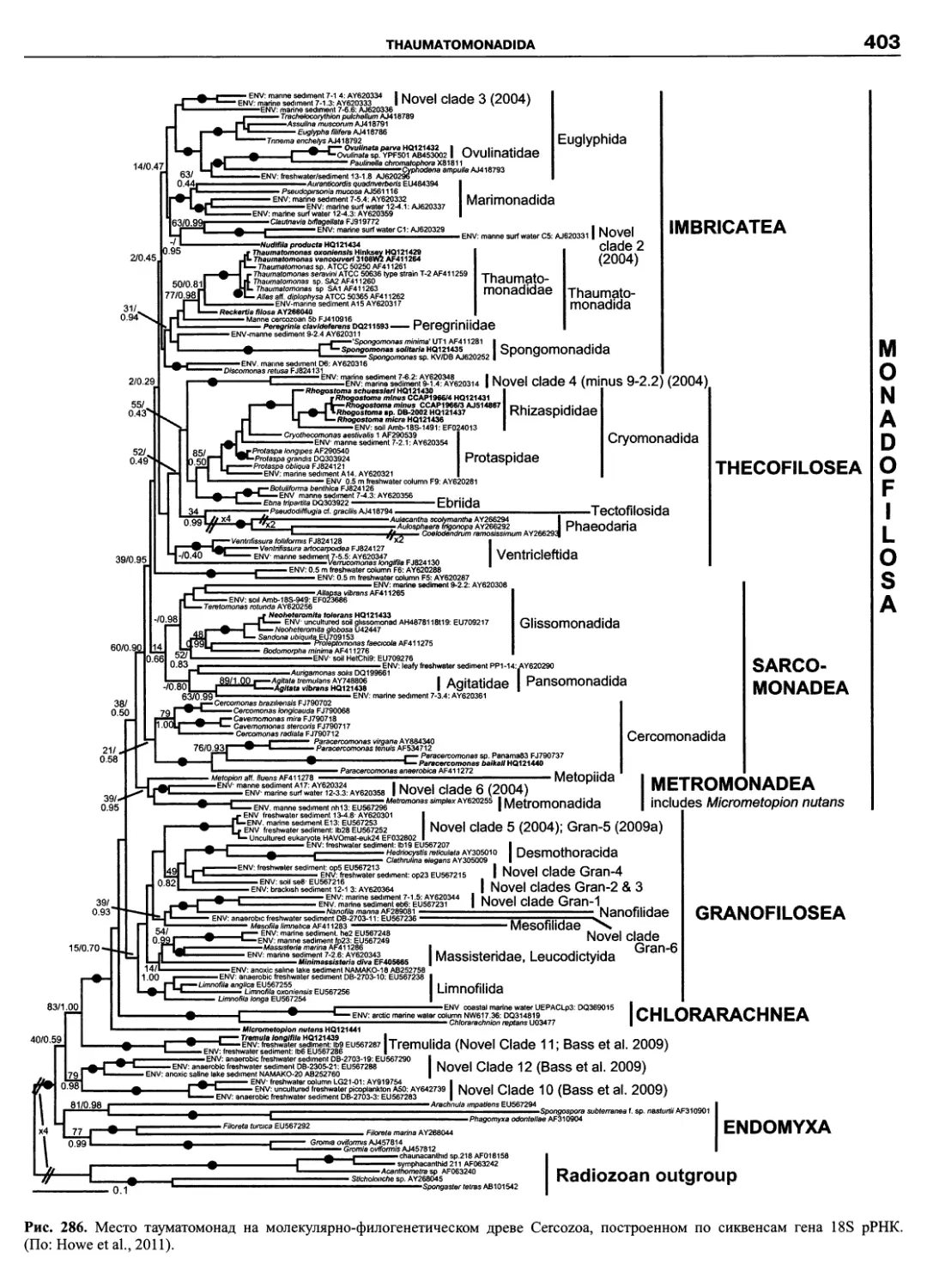
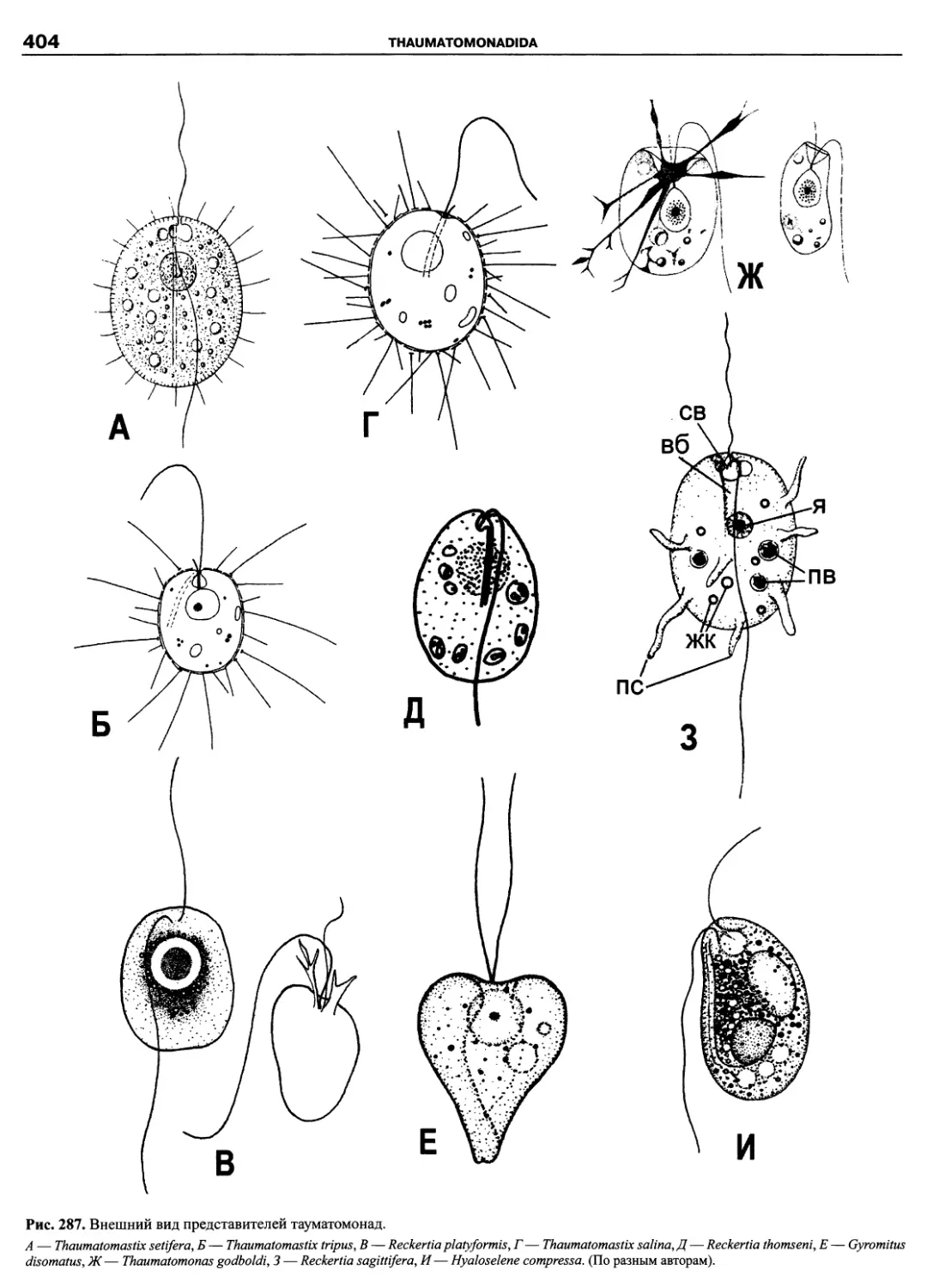
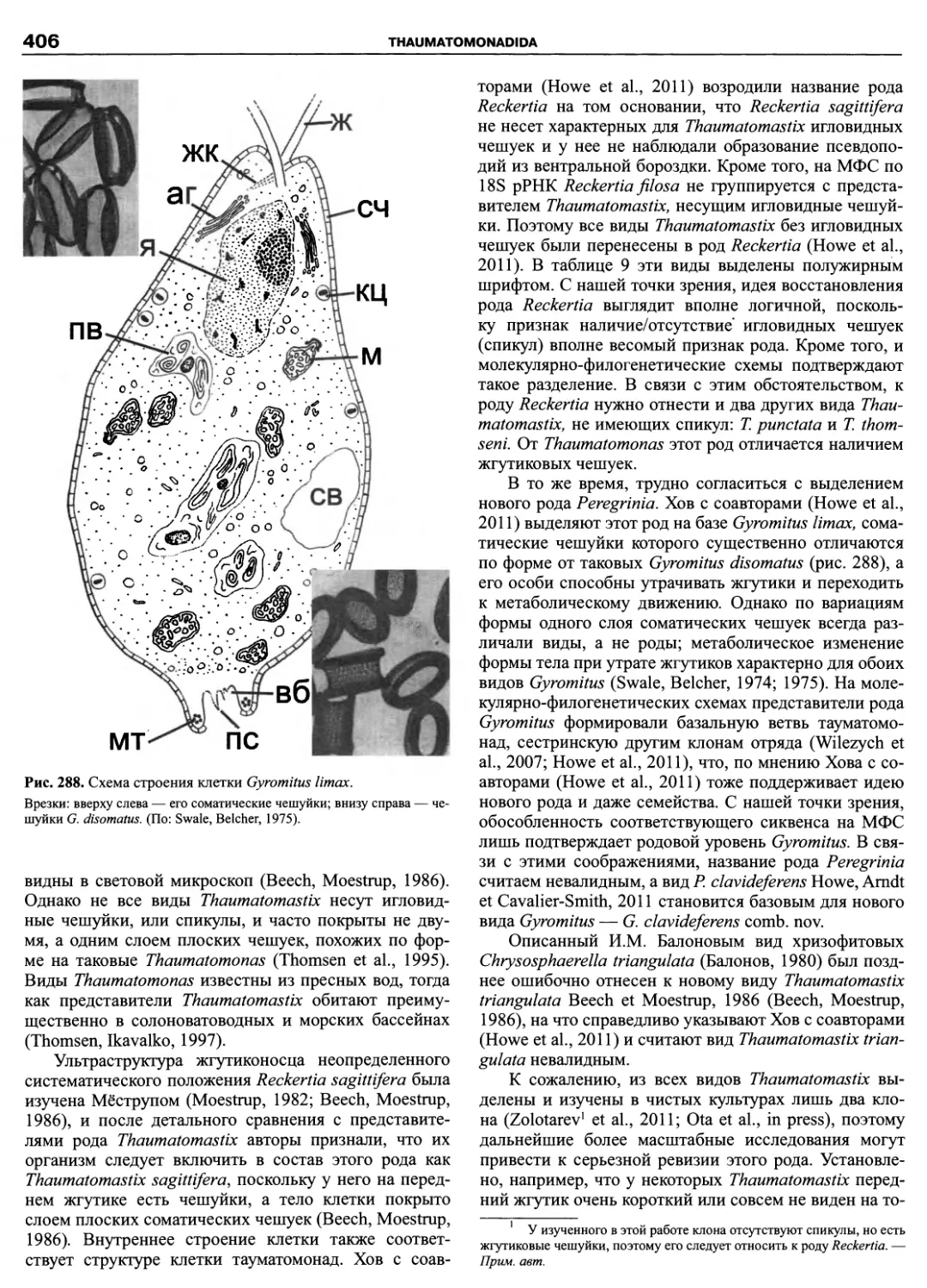
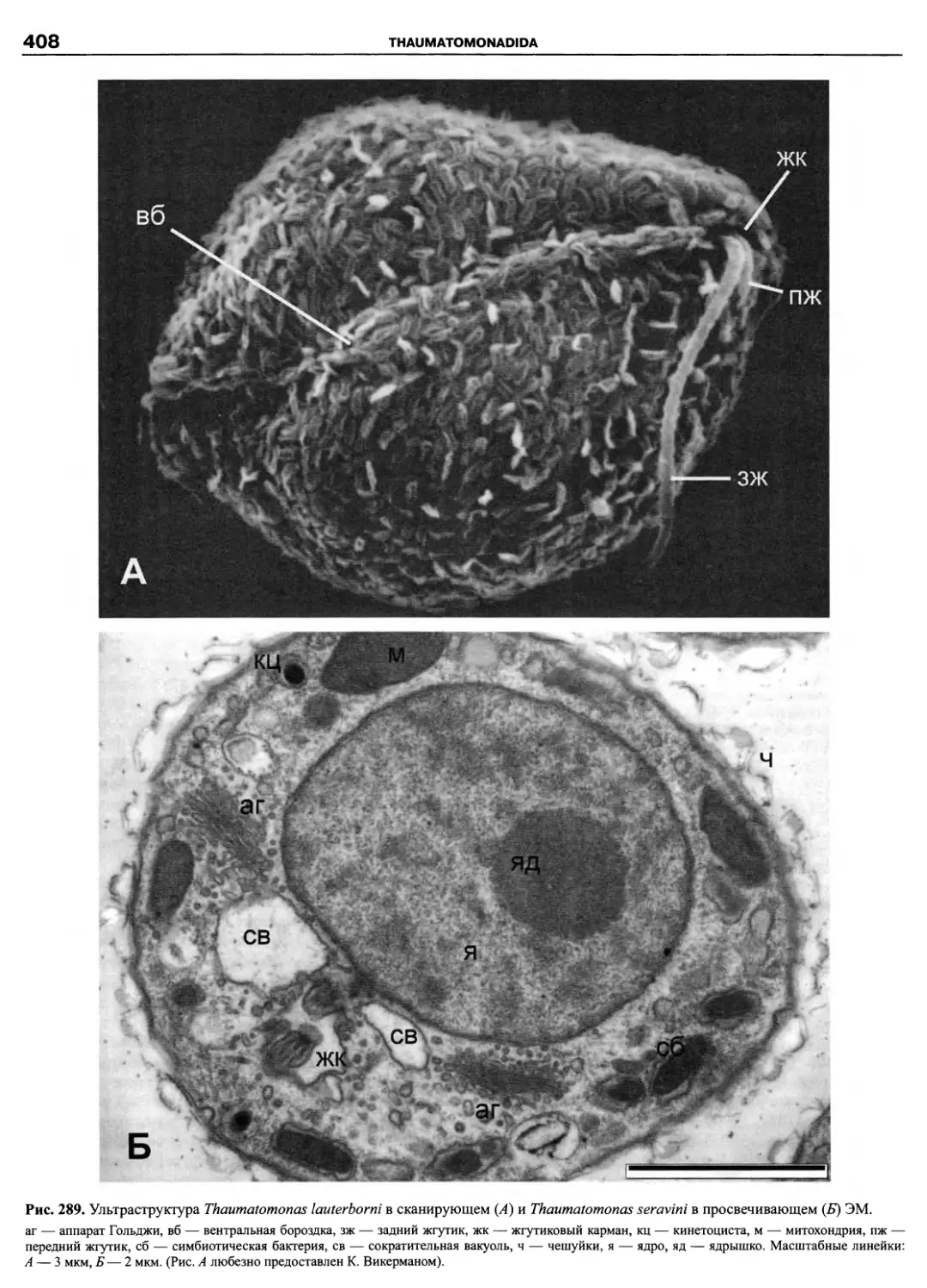
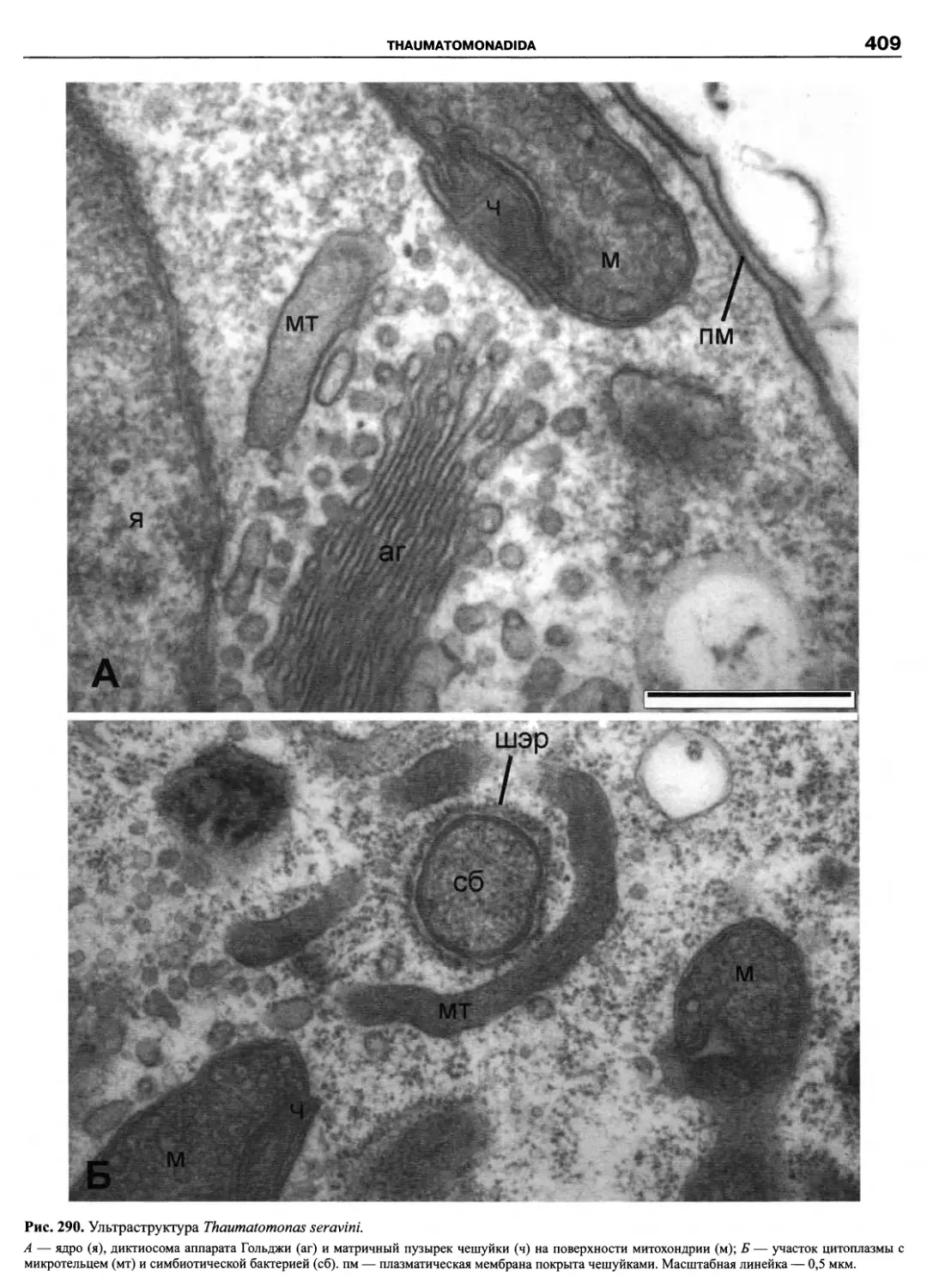
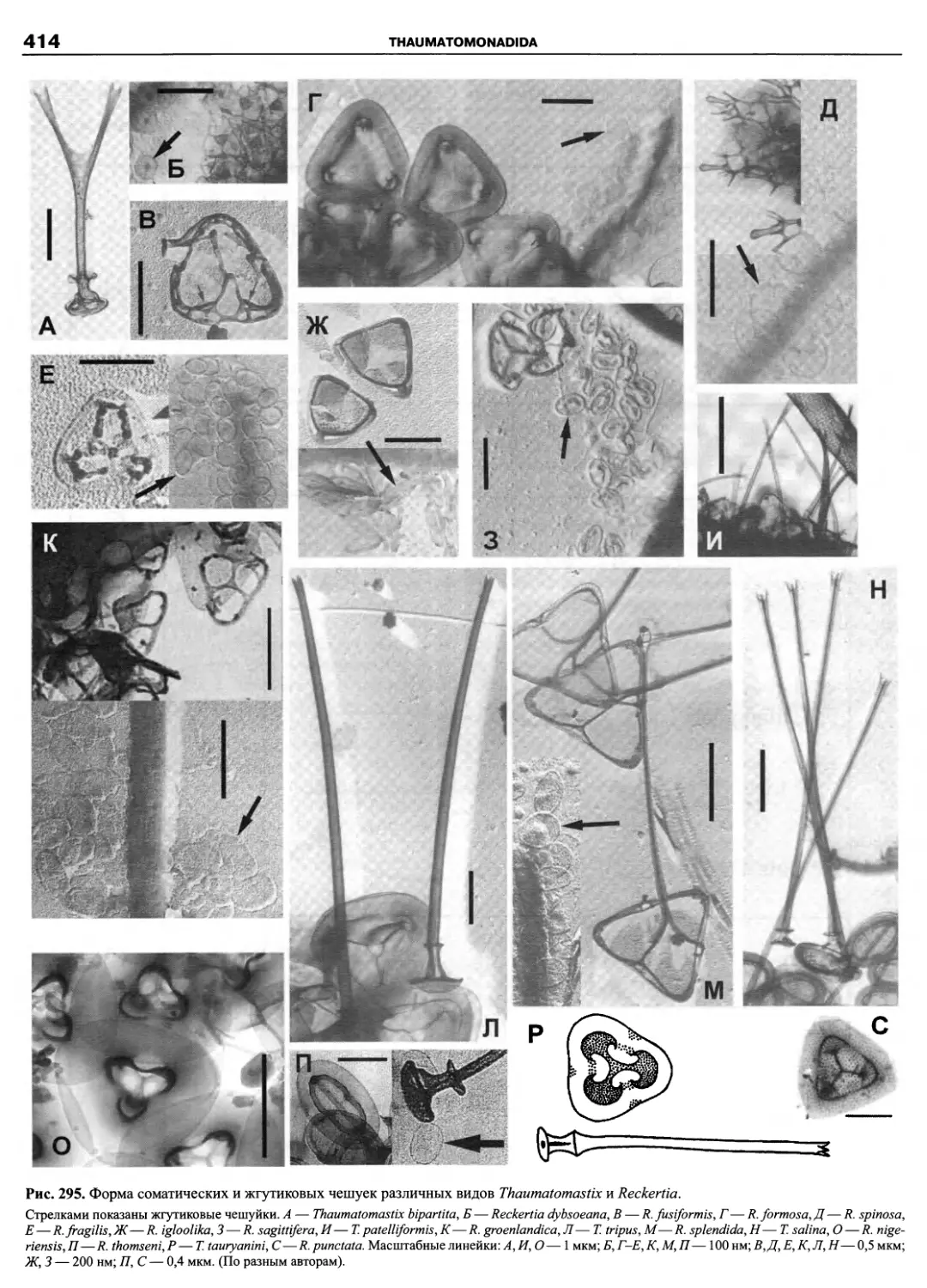
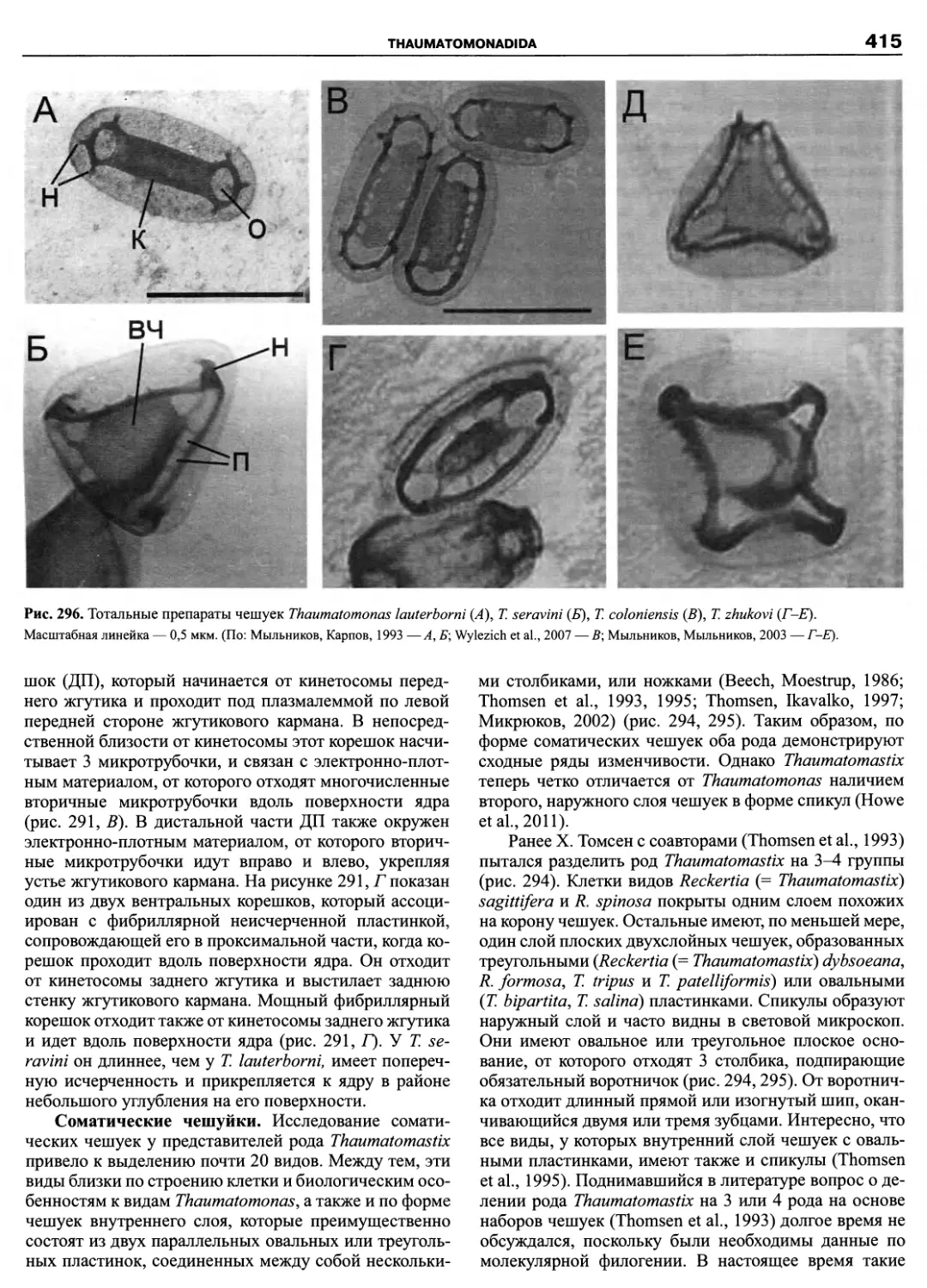
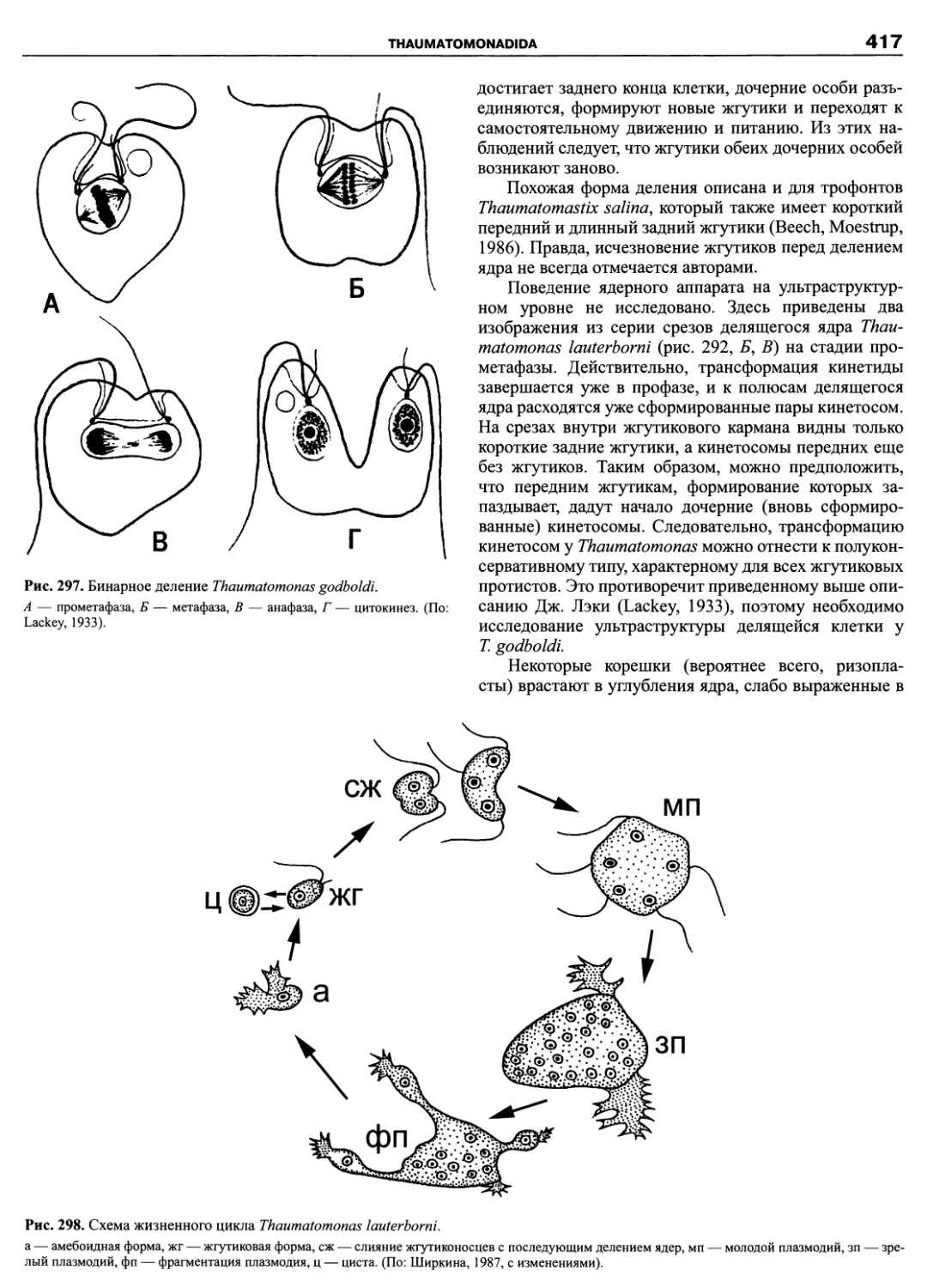
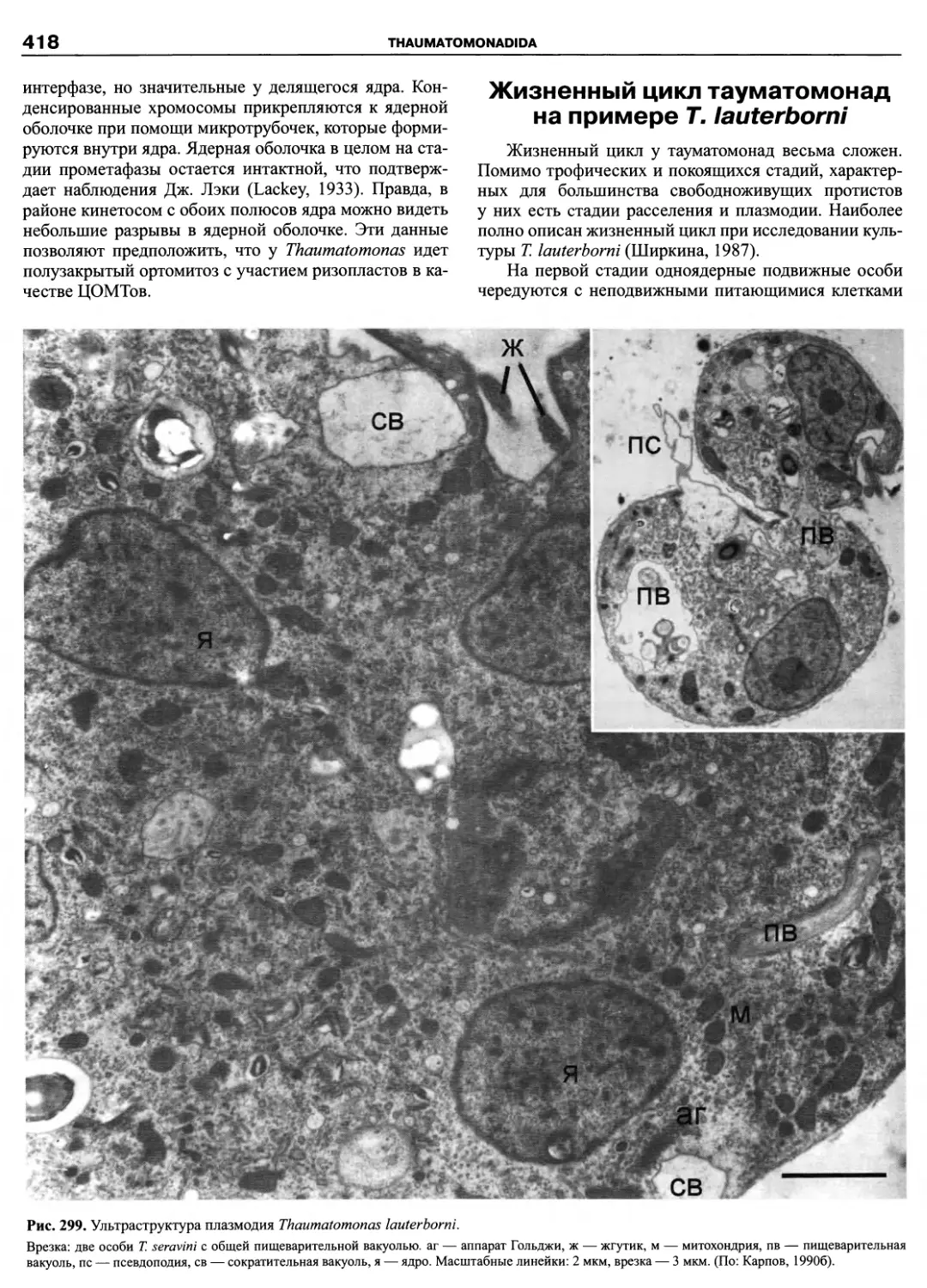
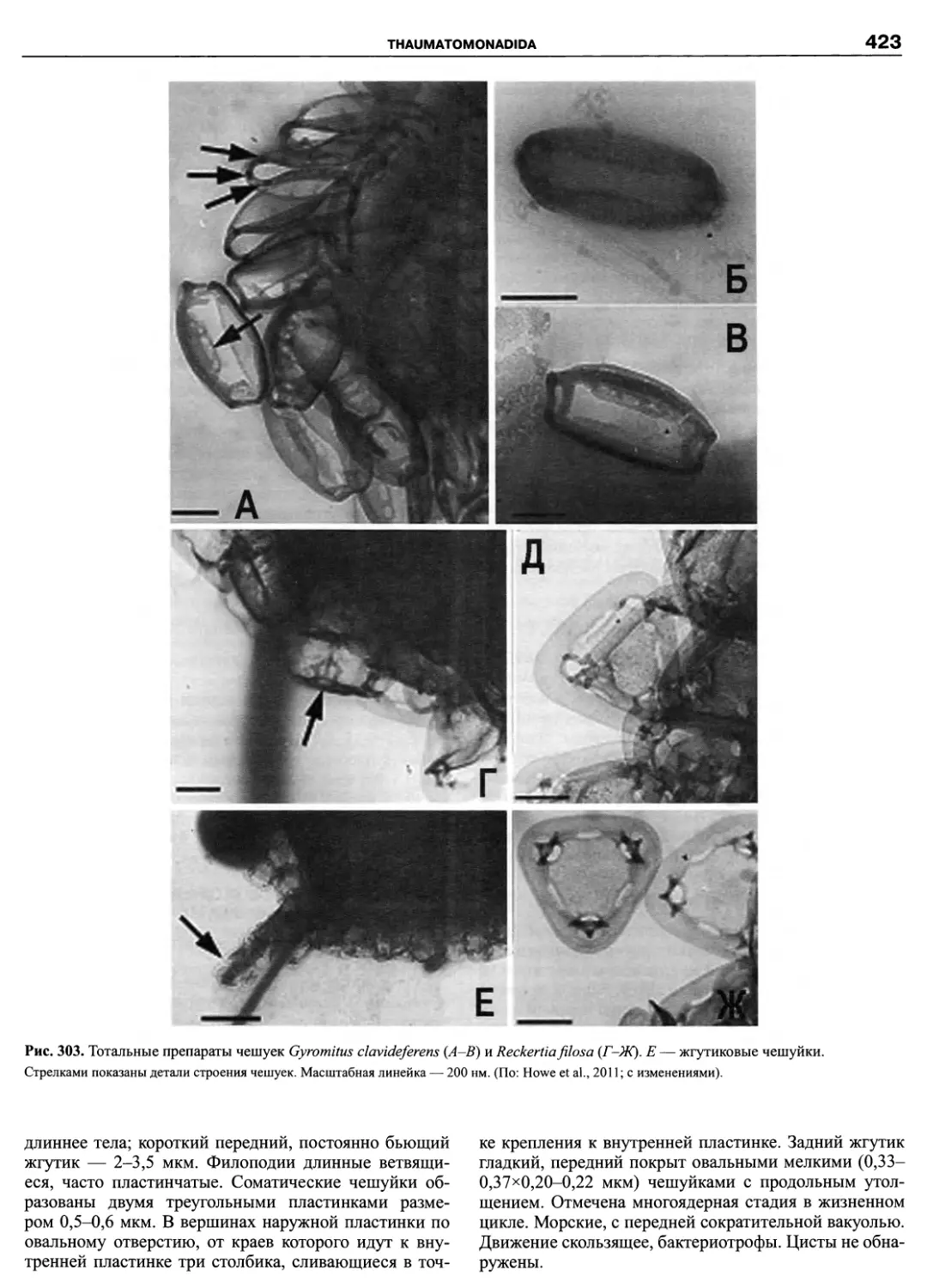
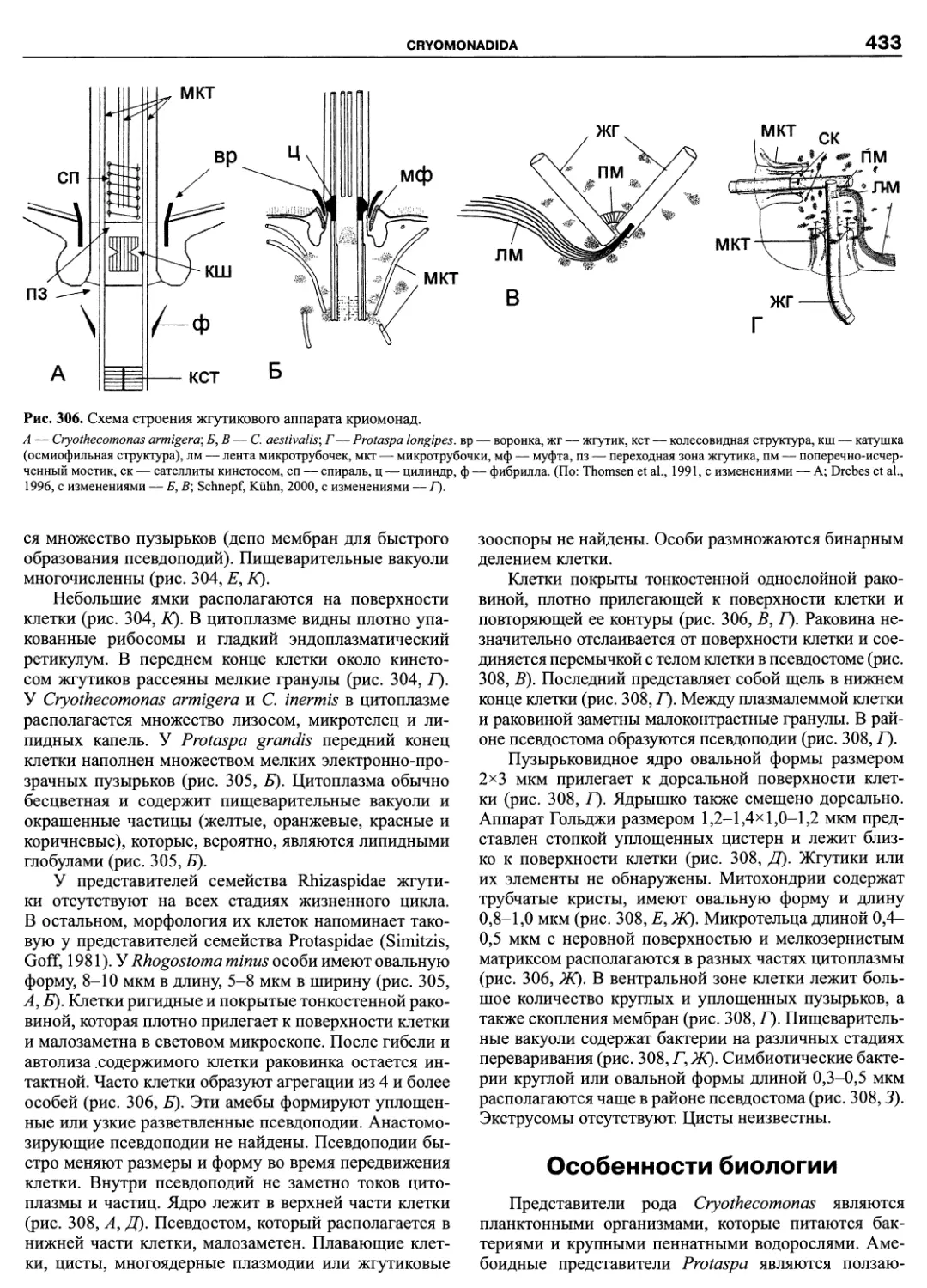
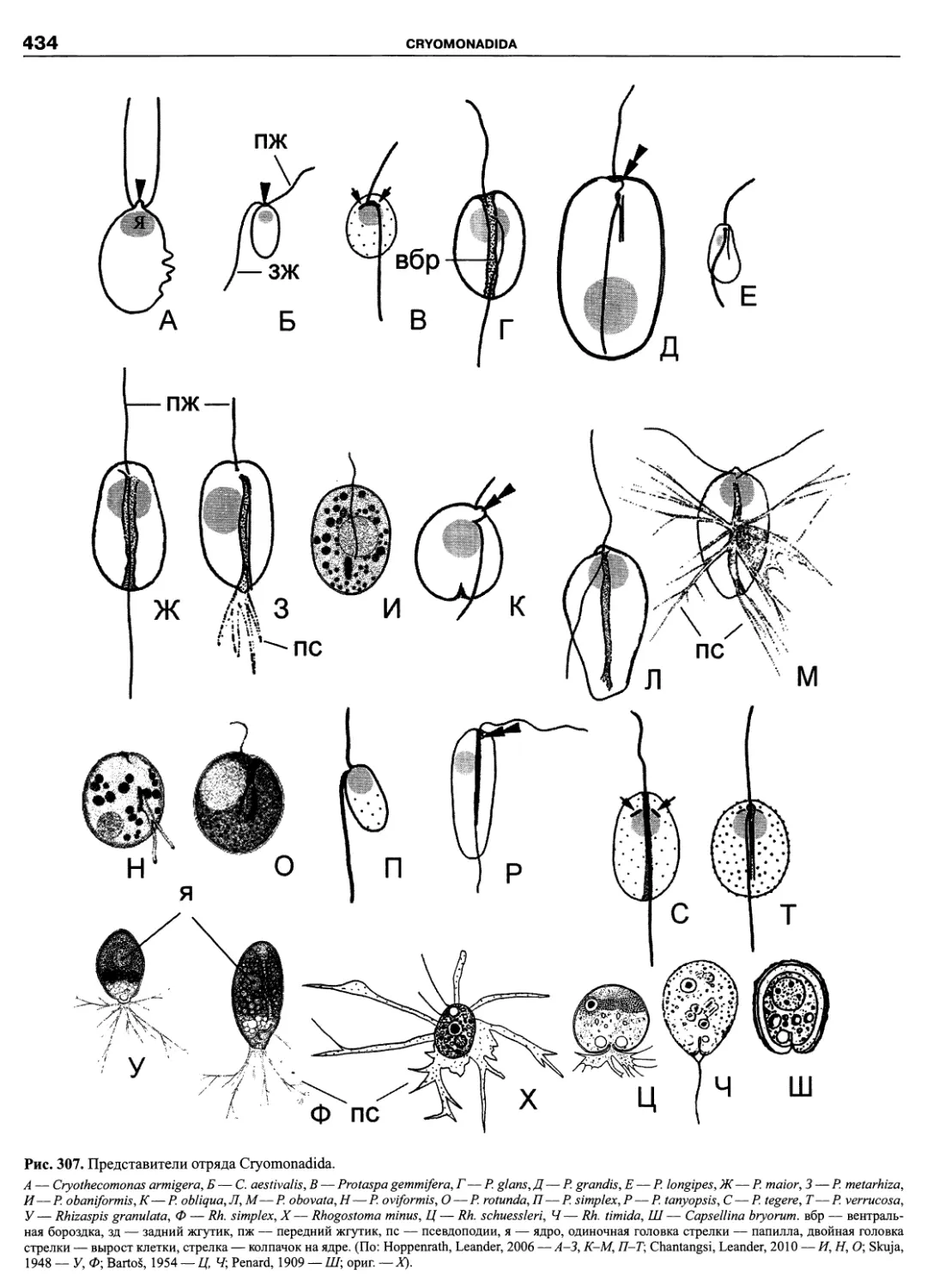
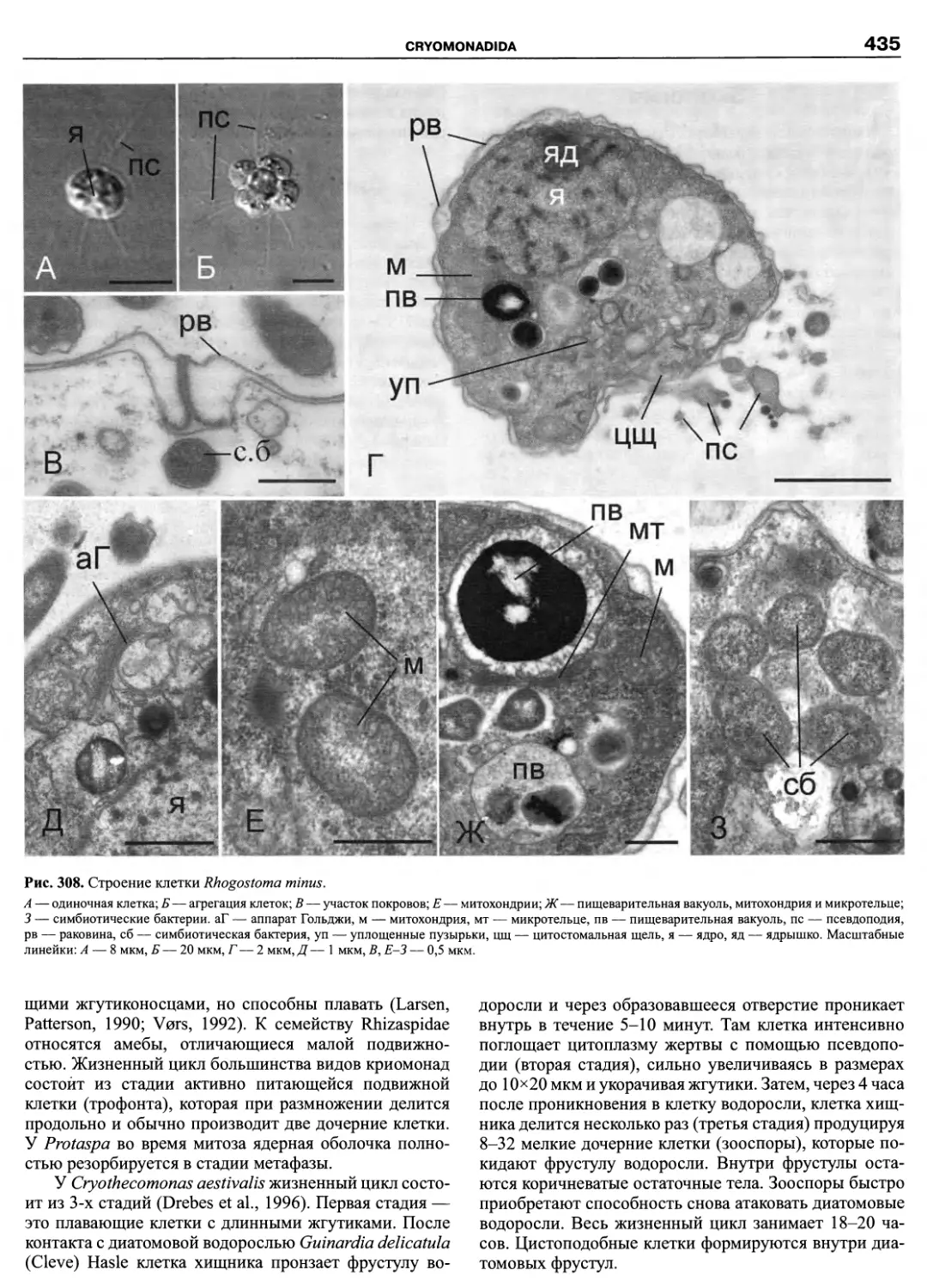
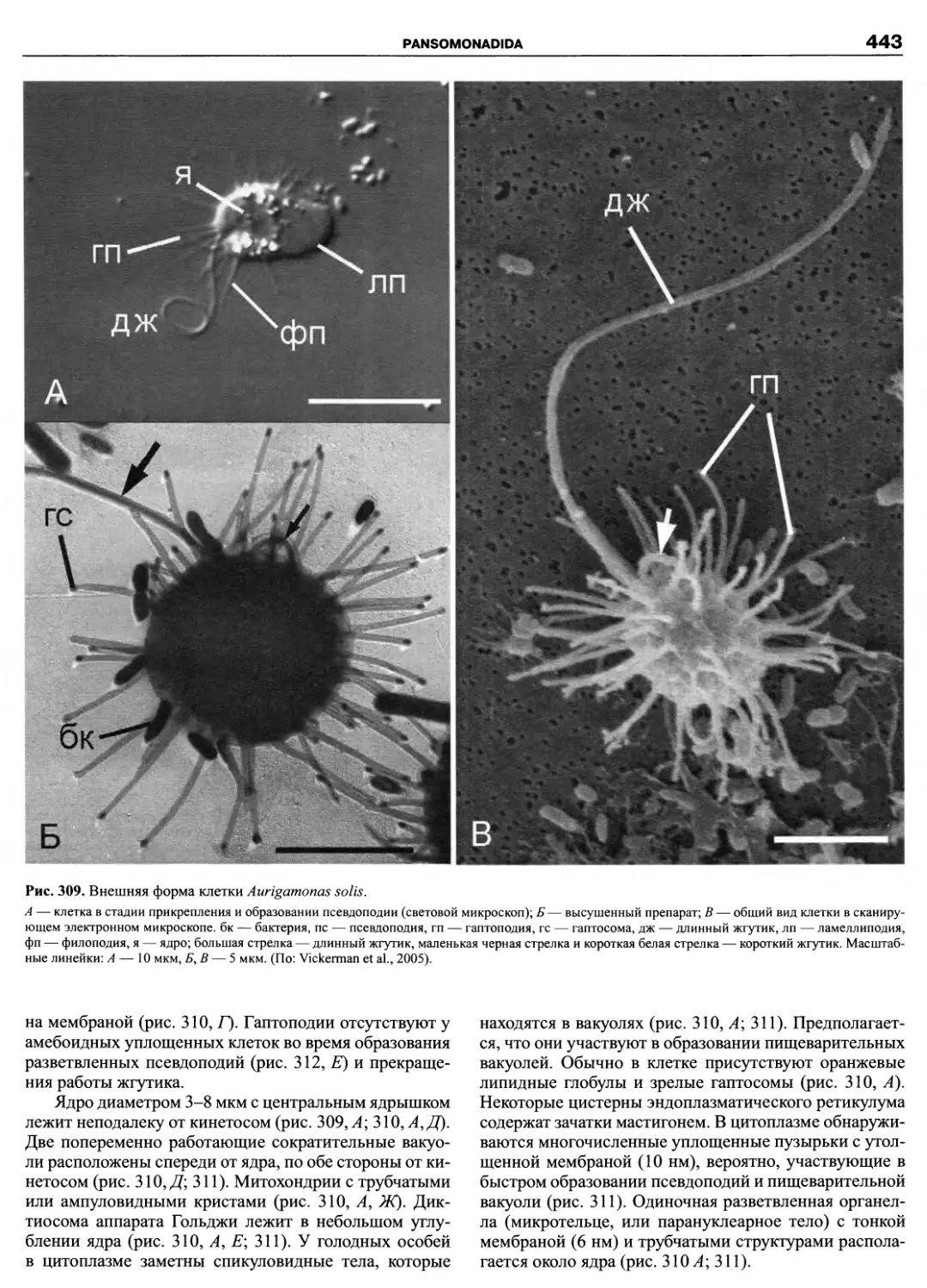
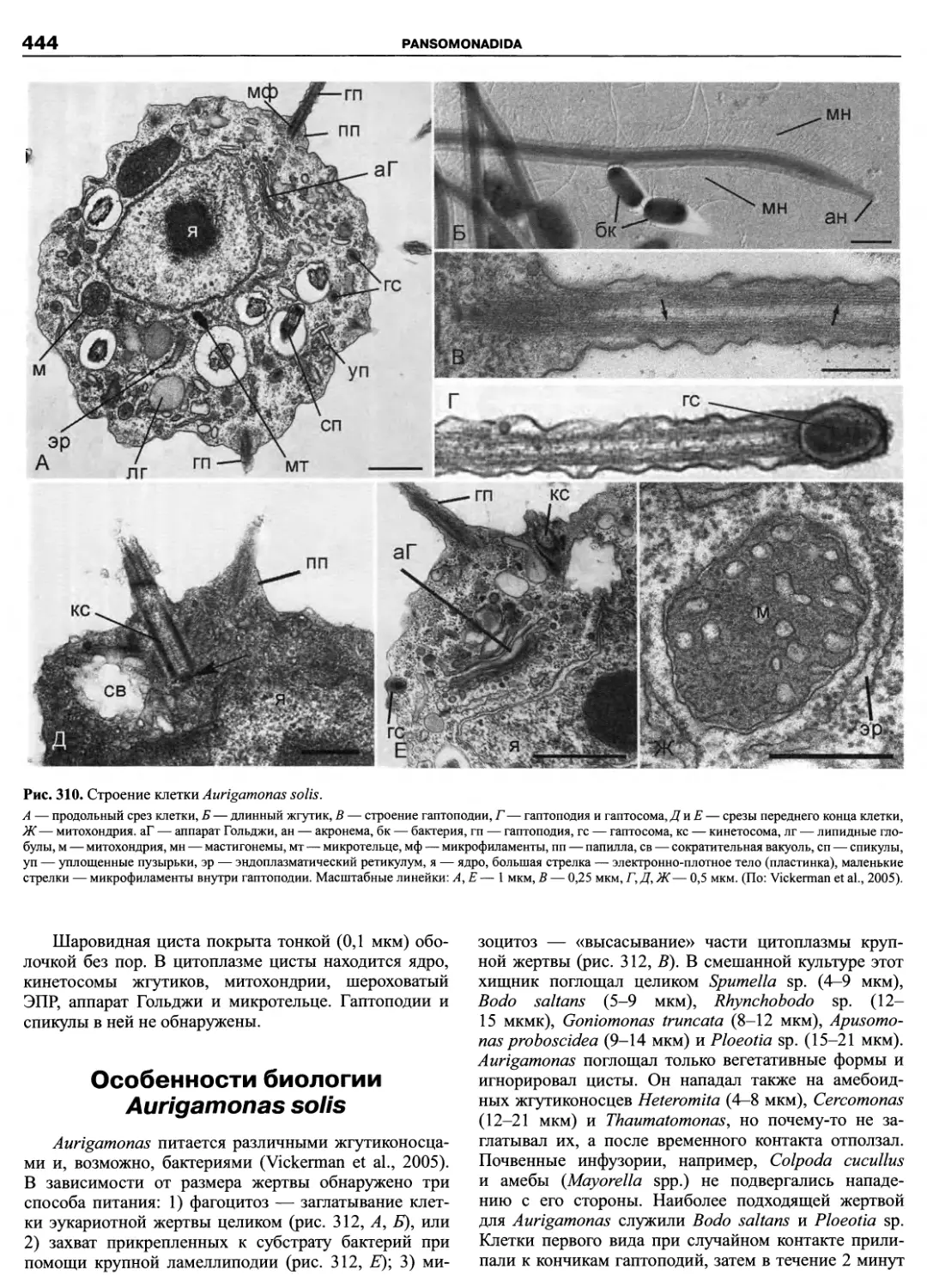
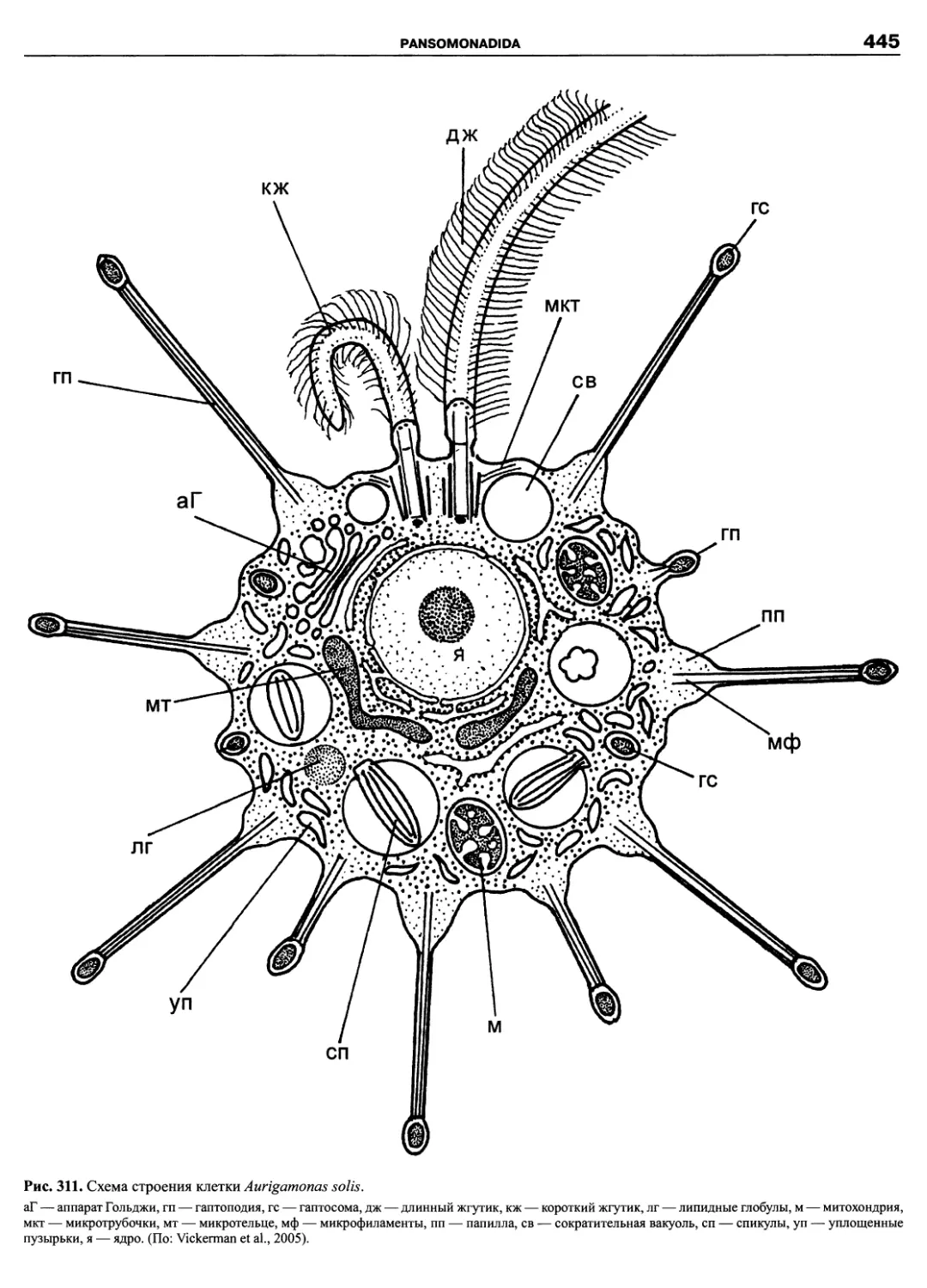
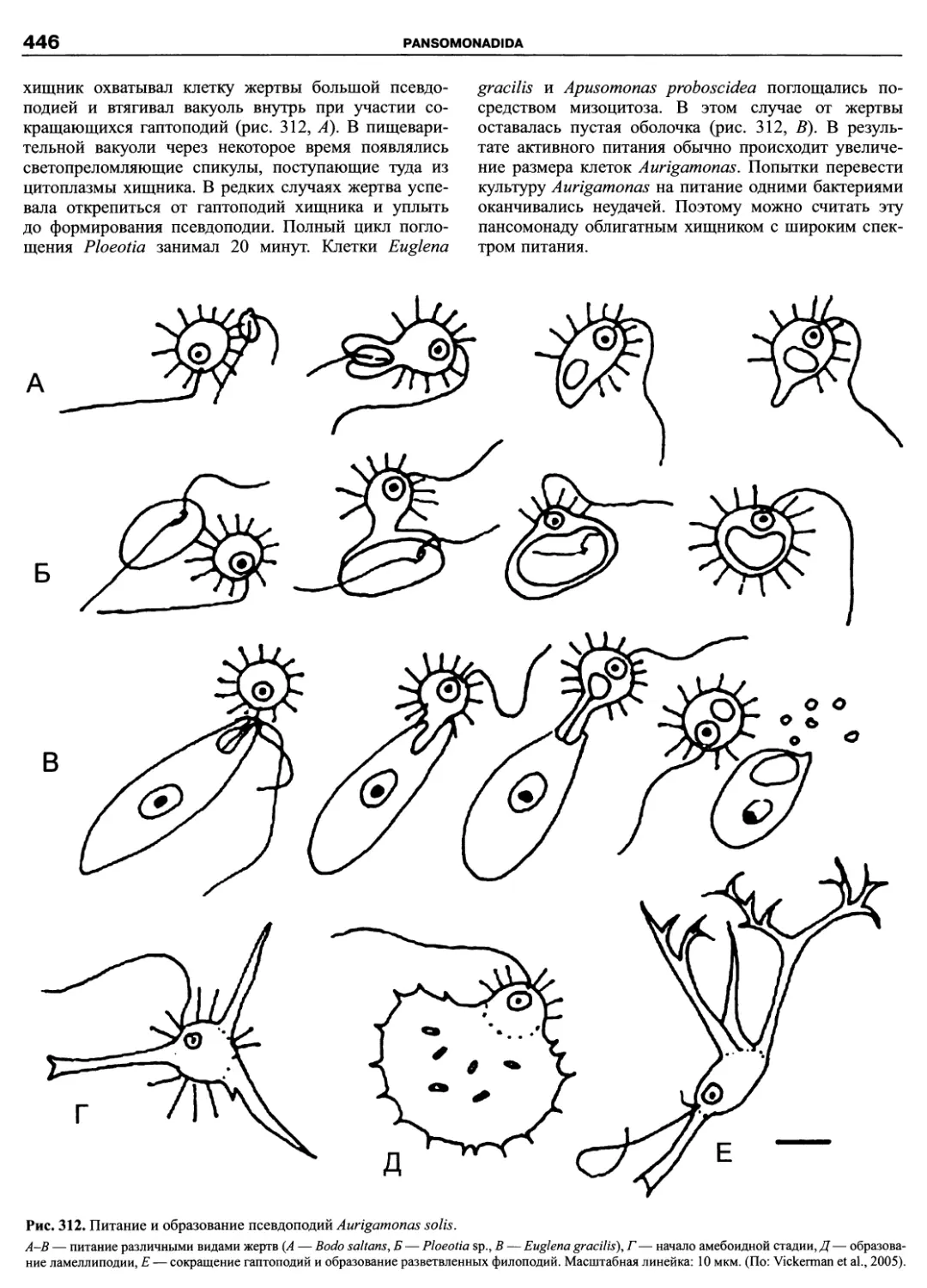
Автор: Пугачев О.Н.
Теги: protozoa систематика животных специальные зоологические науки биология зоология российская академия наук руководство по зоологии протисты анатомия эукариотов
ISBN: 978-5-87317-809-4
Год: 2011
ЧАСТЬ
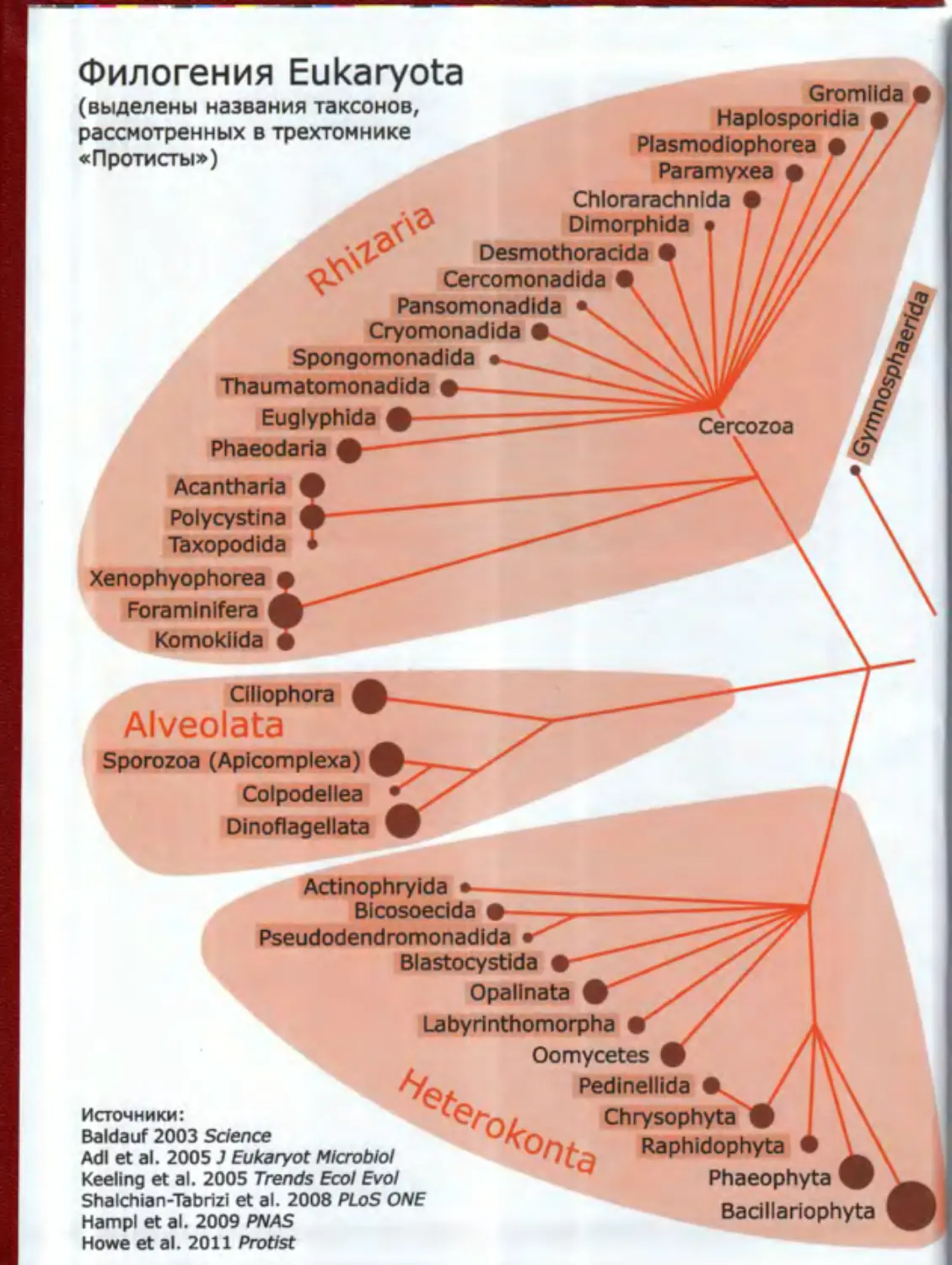
Филогения Eukaryota
(выделены названия таксонов,
рассмотренных в трехтомнике
«Протисты»)
Gromilda
Haplosporidia •
Plasmodiophorea • /
Paramyxea • / /
Chlorarachnlda •
Dimorphida / , ///
Desmothoracida •
Cercomonadida •
Pansomonadida •
Cryomonadida • c
Spongomonadida •
Thaumatomonadida • №
Euglyphida
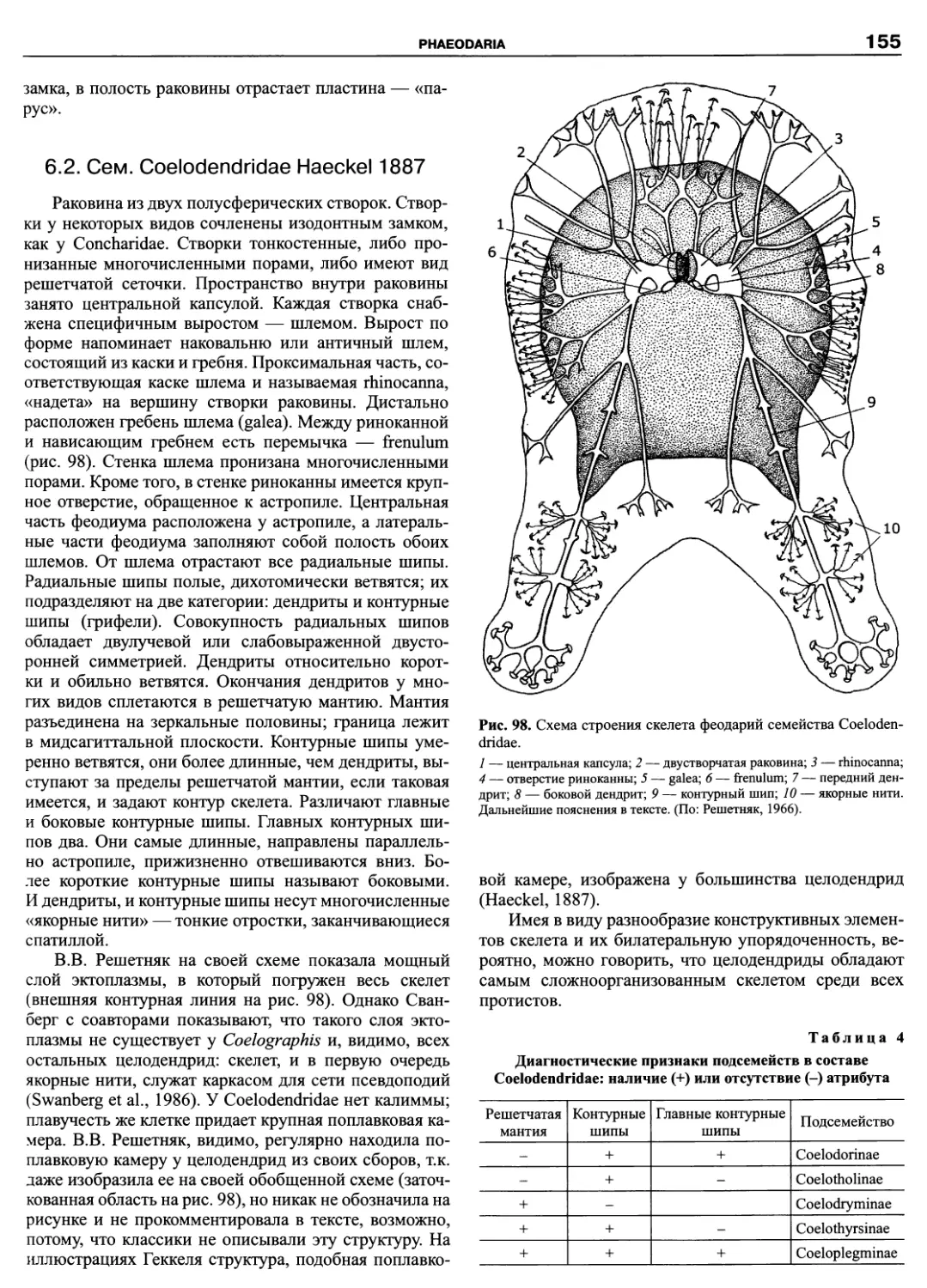
Phaeodaria ф-
Cercozoa
Acantharia
Polycystina
Taxopodida
Xenophyophorea (
Foramlnifera fl
Komokiida e
Clliophora g
Alveolata
Sporozoa (Apicomplexa) I
Colpodellea
Dinoflagellata
Actinophryida •
Bicosoedda e
Pseudodendromonadida
Blastocystida •
Opallnata ф
Labyrinthomorpha •
Oomycetes ф /
Pedinellida •
Chrysophyta Ф
Raphidophyta •
Phaeophyta W
Badllariophyta
Источники:
Baldauf 2003 Science
Adi et al. 2005 J Eukaryot Microbiol
Keeling et al. 2005 Trends Ecol Evol
Shalchian-Tabrizi et al. 2008 PLoS ONE
Hampl et al. 2009 PNAS
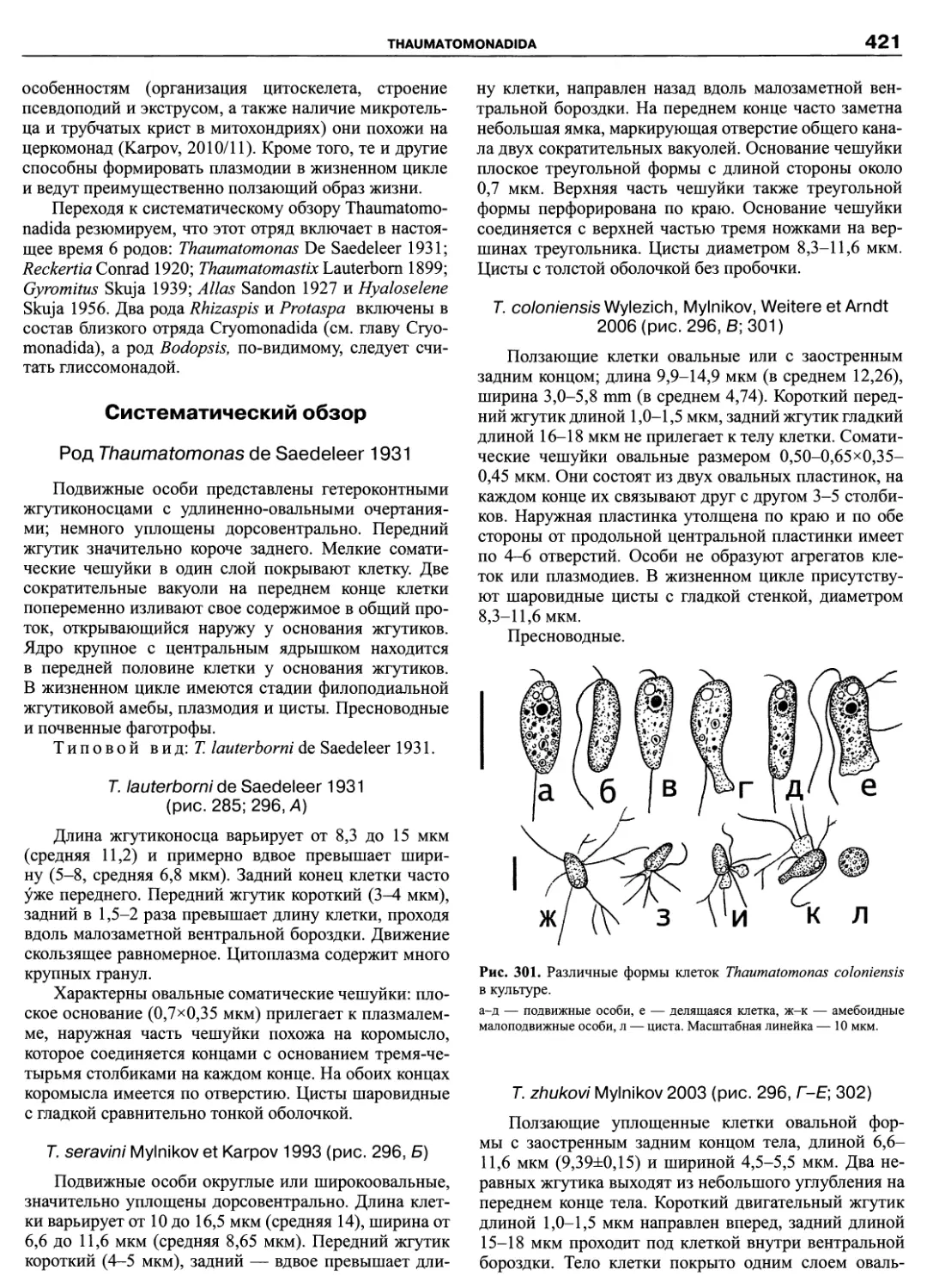
Howe et al. 2011 Protist
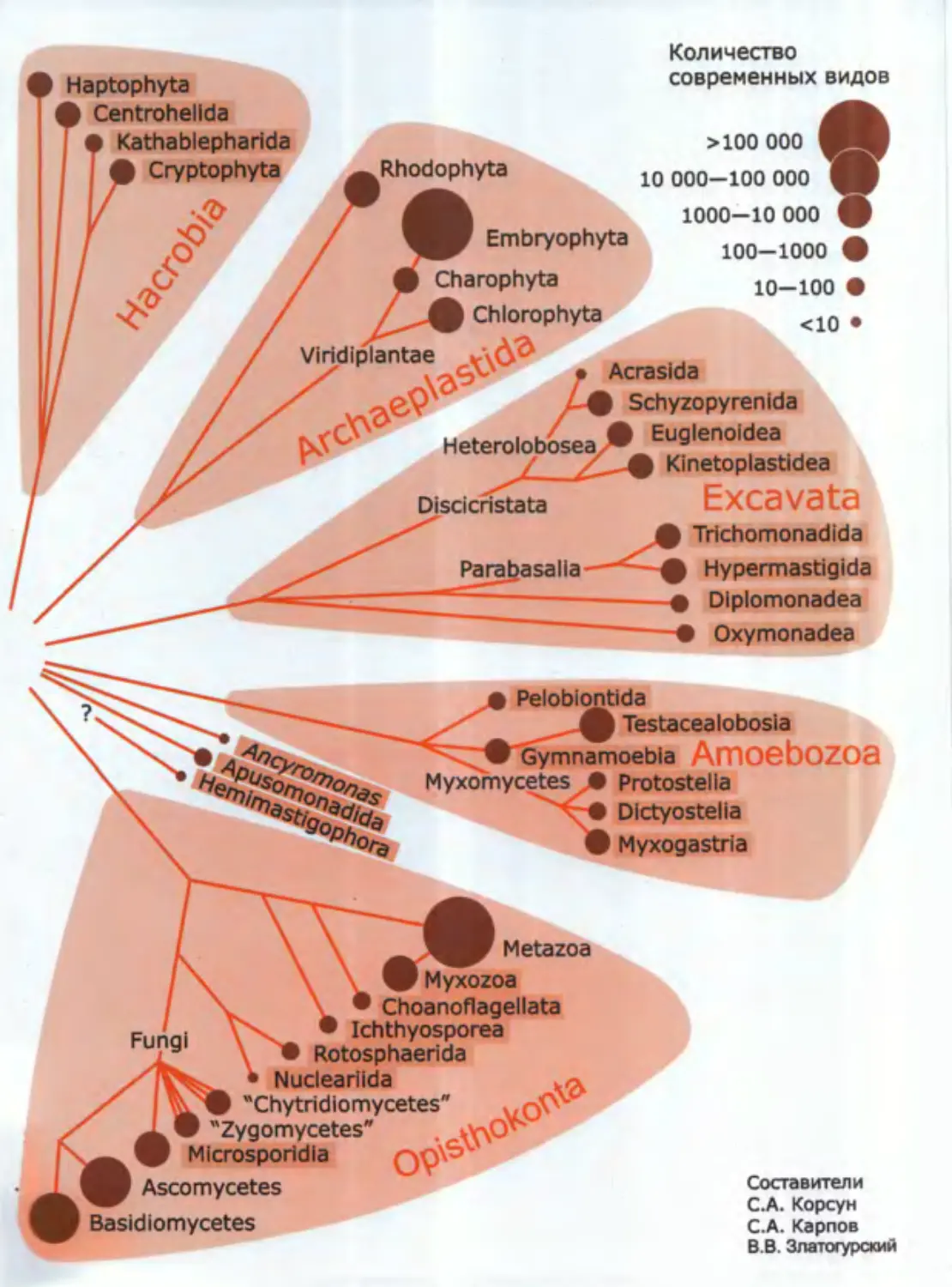
Количество
• Haptophyta
современных видов
Centrohellda
> Kathablepharida
Vlridiplantae
Heterolobosea
icristata
Acrasida
? Schyzopyrenida
ф Euglenoidea
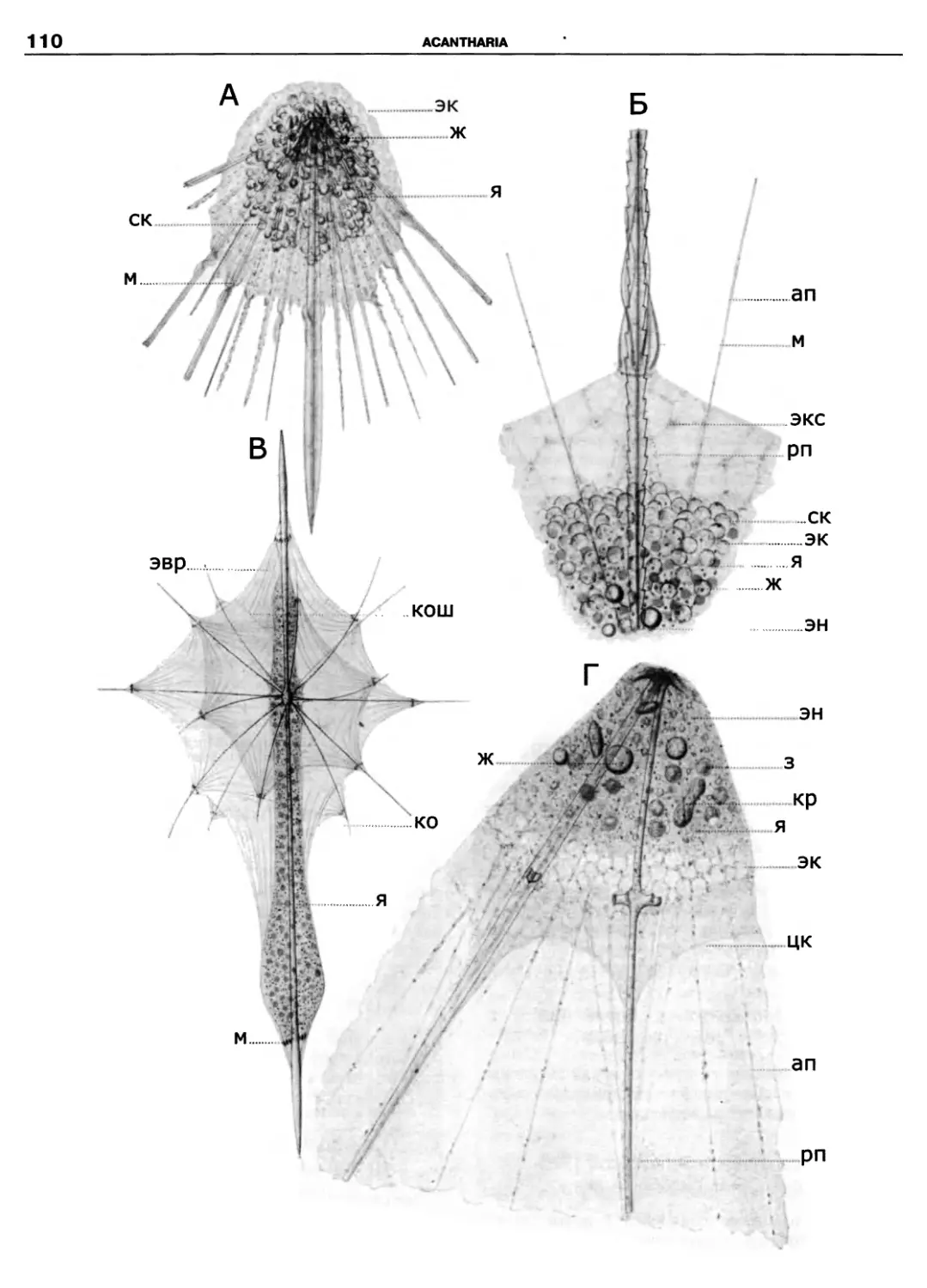
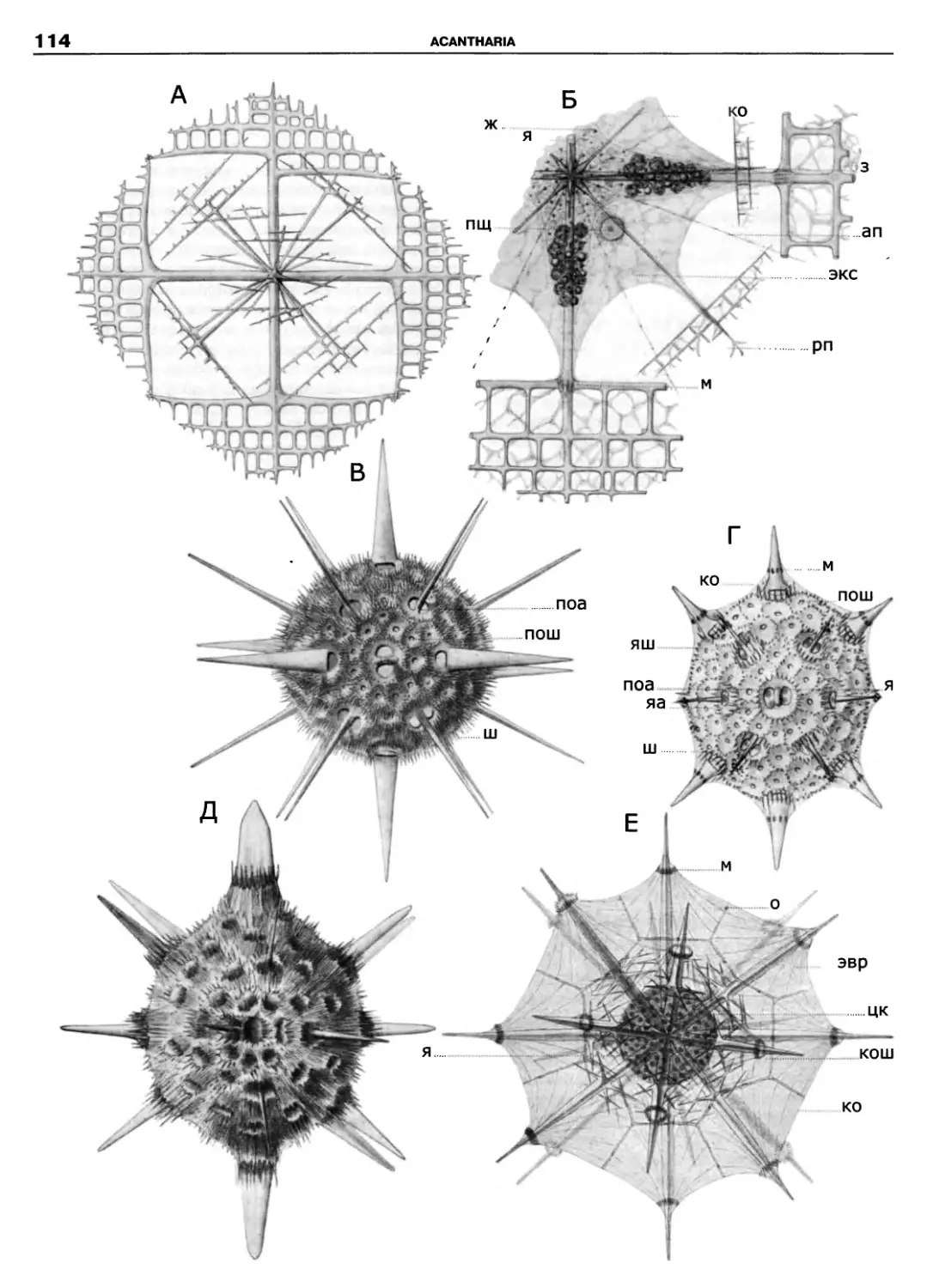
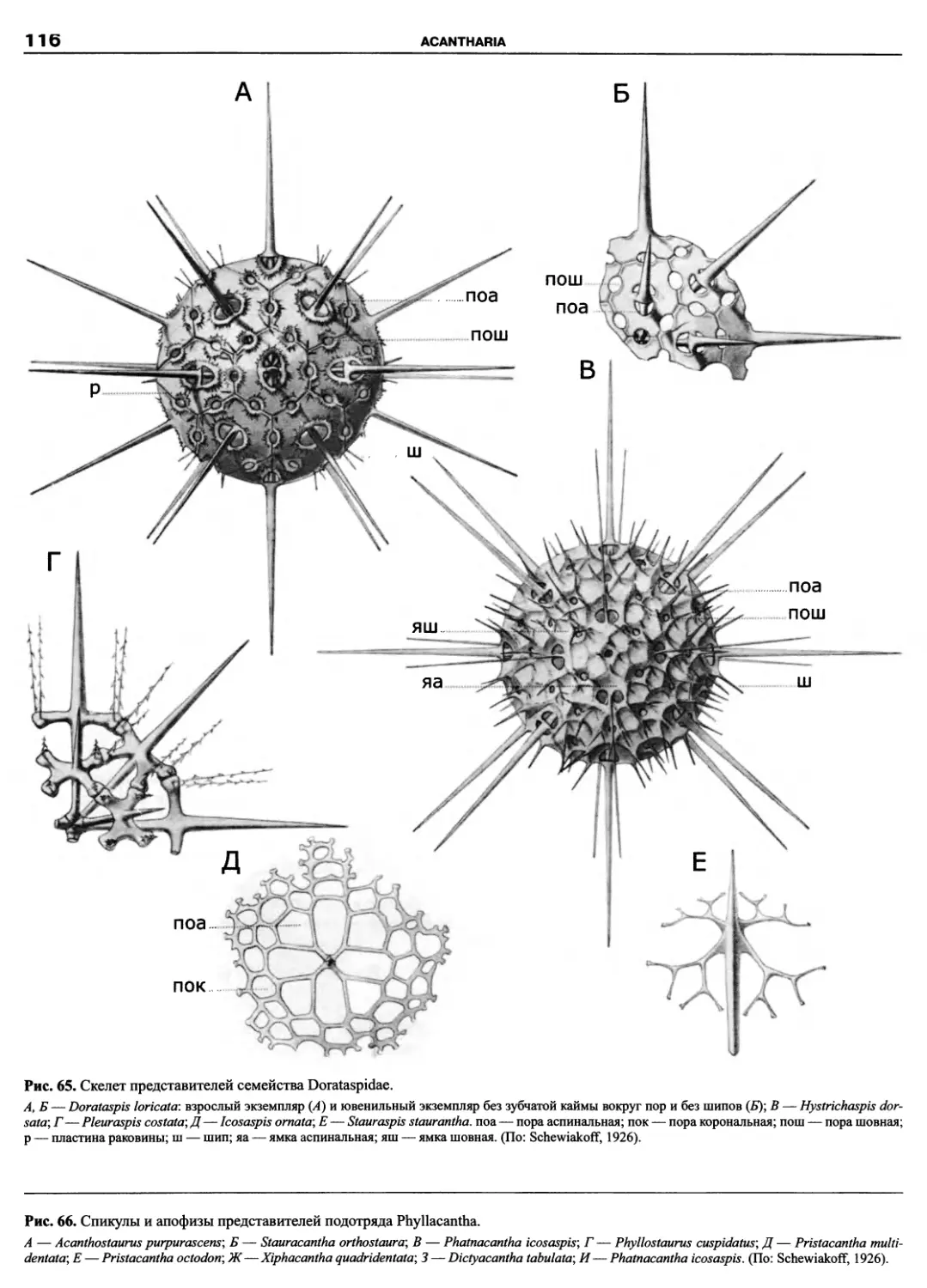
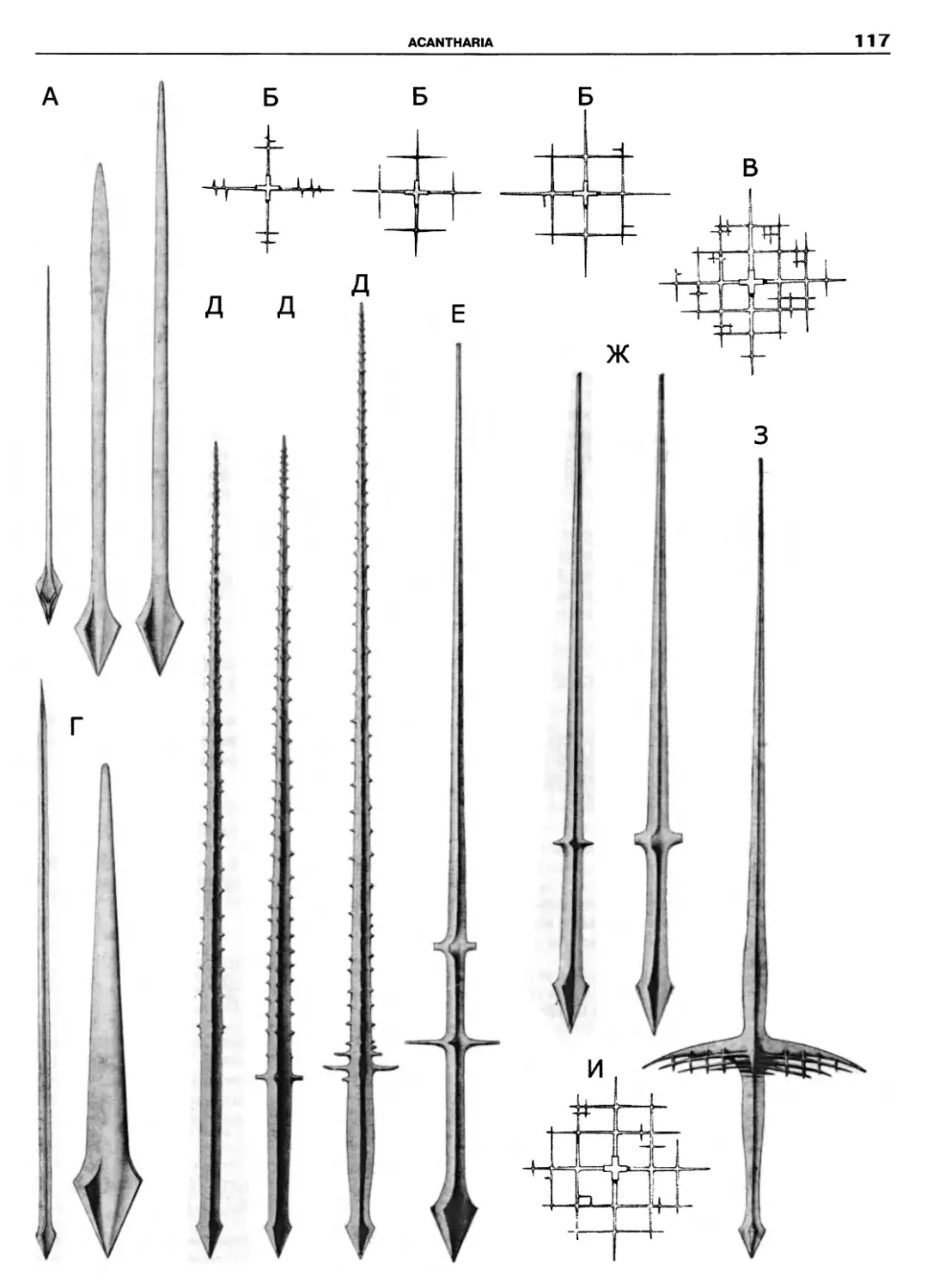
Kinetoplastidea
Excavata
ф Trichomonadida
ф Hypermastigida
—----• Dlplomonadea
---—• Oxymonadea
>100000 ф
10 000-100 000
1000-10 000 ф
100-1000 •
10-100 •
<10 •
ф Testacealobosla
♦ Gymnamoebla AmOObOZOB
Myxomycetes • Protostella
Dlctyostelia
Ф Myxogastria
Fungi
Metazoa
V Myxozoa
• Choanoflagellata
• Ichthyosporea
Rotosphaerida
* Nuclearilda
• "Chytridlomycetes"
I "Zygomycetes" .
Microsporidia
Ascomycetes
Basidiomycetes
Составители
C.A. Корсун
C.A. Карпов
B.B. Златогурский
RUSSIAN ACADEMY OF SCIENCES
Zoological Institute
PROTISTA
PART 5
GUIDE-BOOK ON ZOOLOGY
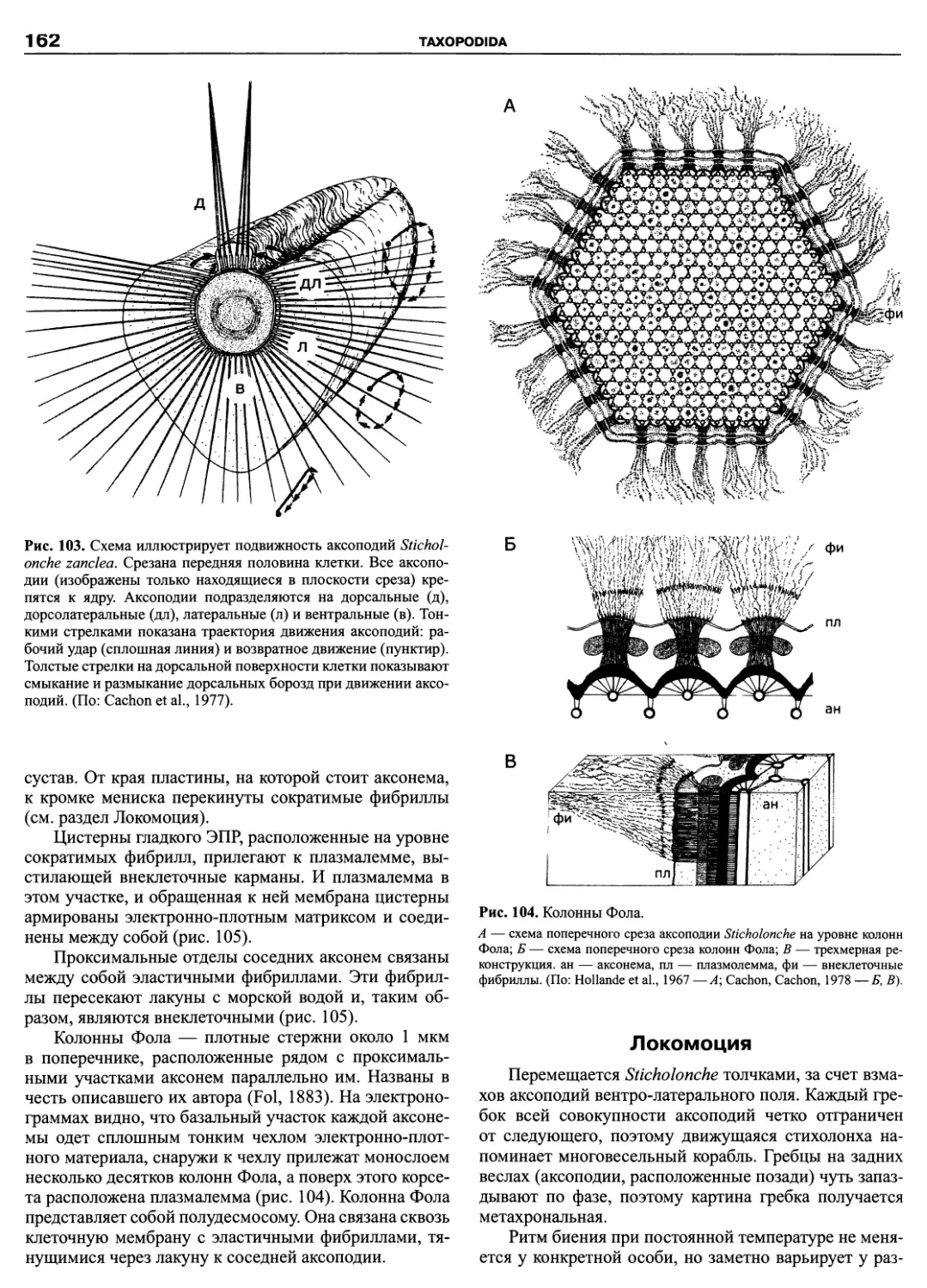
KMK Scientific Press Ltd.
St. Petersburg — Moscow ❖ 2011
российская академия наук
Зоологический институт
ПРОТИСТЫ
ЧАСТЬ 5
РУКОВОДСТВО по зоологии
Товарищество научных изданий КМК
Санкт-Петербург — Москва ❖ 2011
УДК 593.1
ББК 28.691
П82
П82 Протисты: Руководство по зоологии. — СПб.; М.: Товарищество научных изданий КМК. Ч. 3. — 474 с. +
26 с. цв. вкл.
Третья часть Руководства по зоологии «Протисты. 3» завершает сводку по протистам. Том представляет со-
бой фундаментальную сводку современных научных данных по радиоляриям, динофлагеллатам, солнечникам,
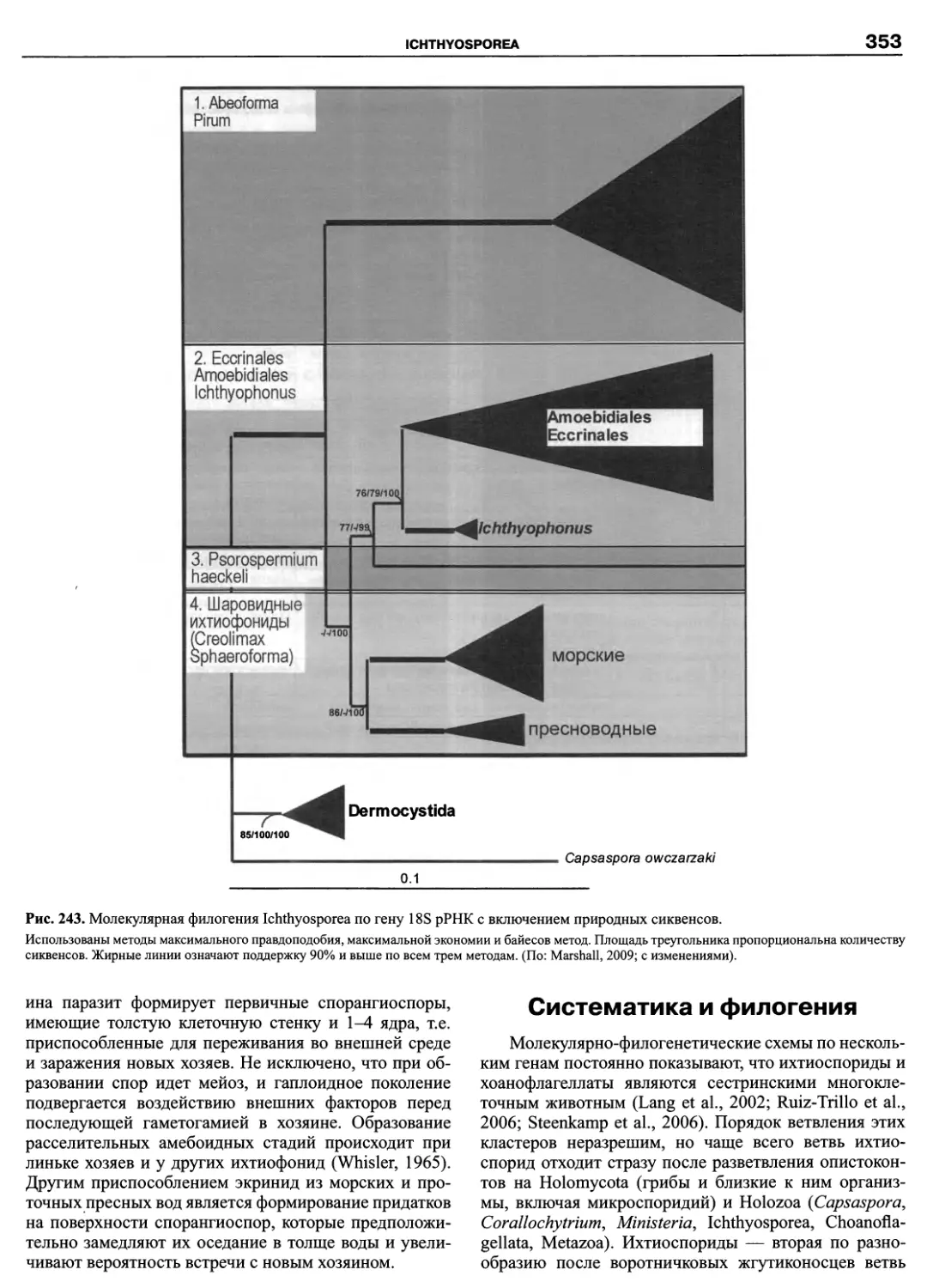
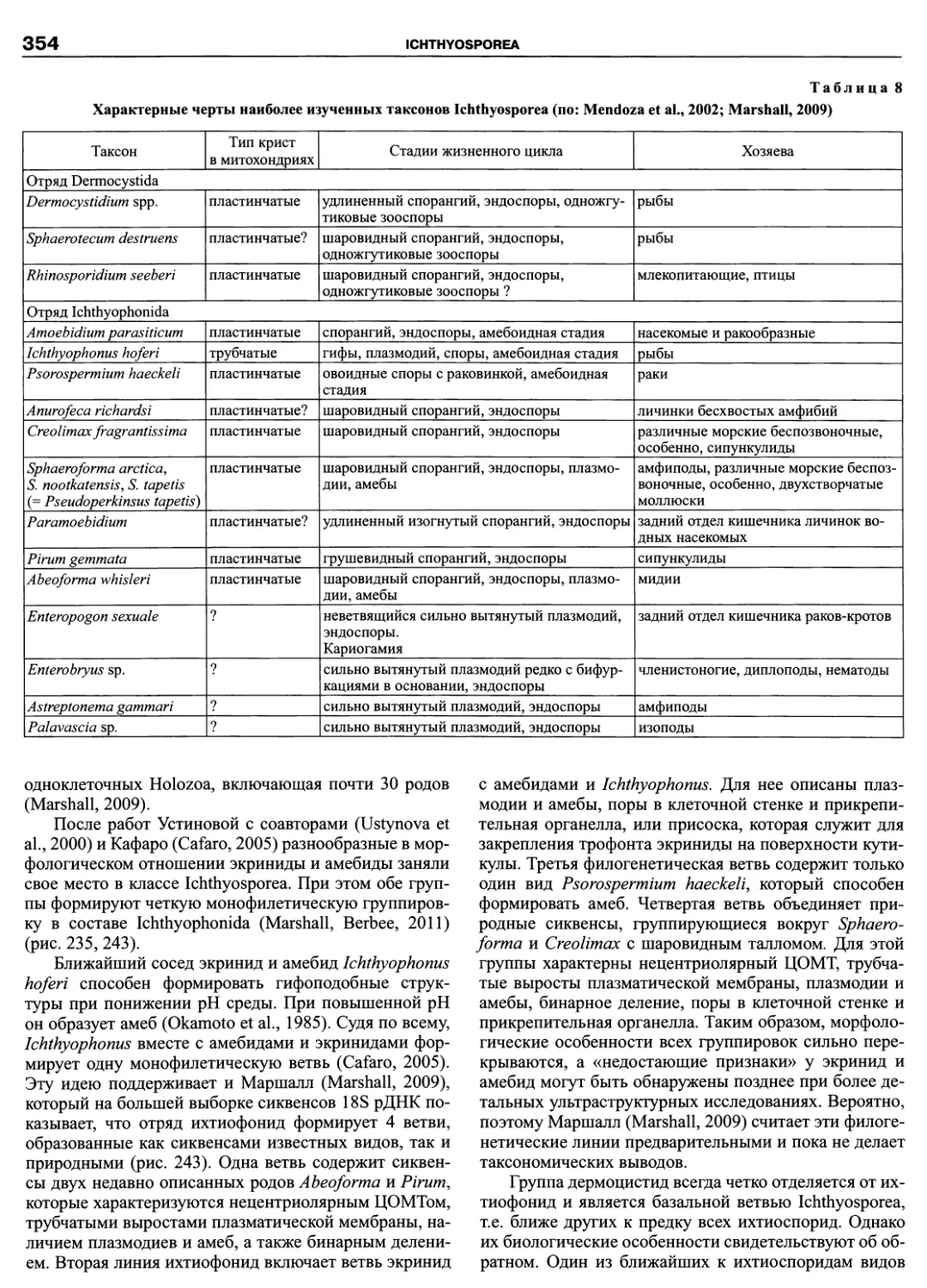
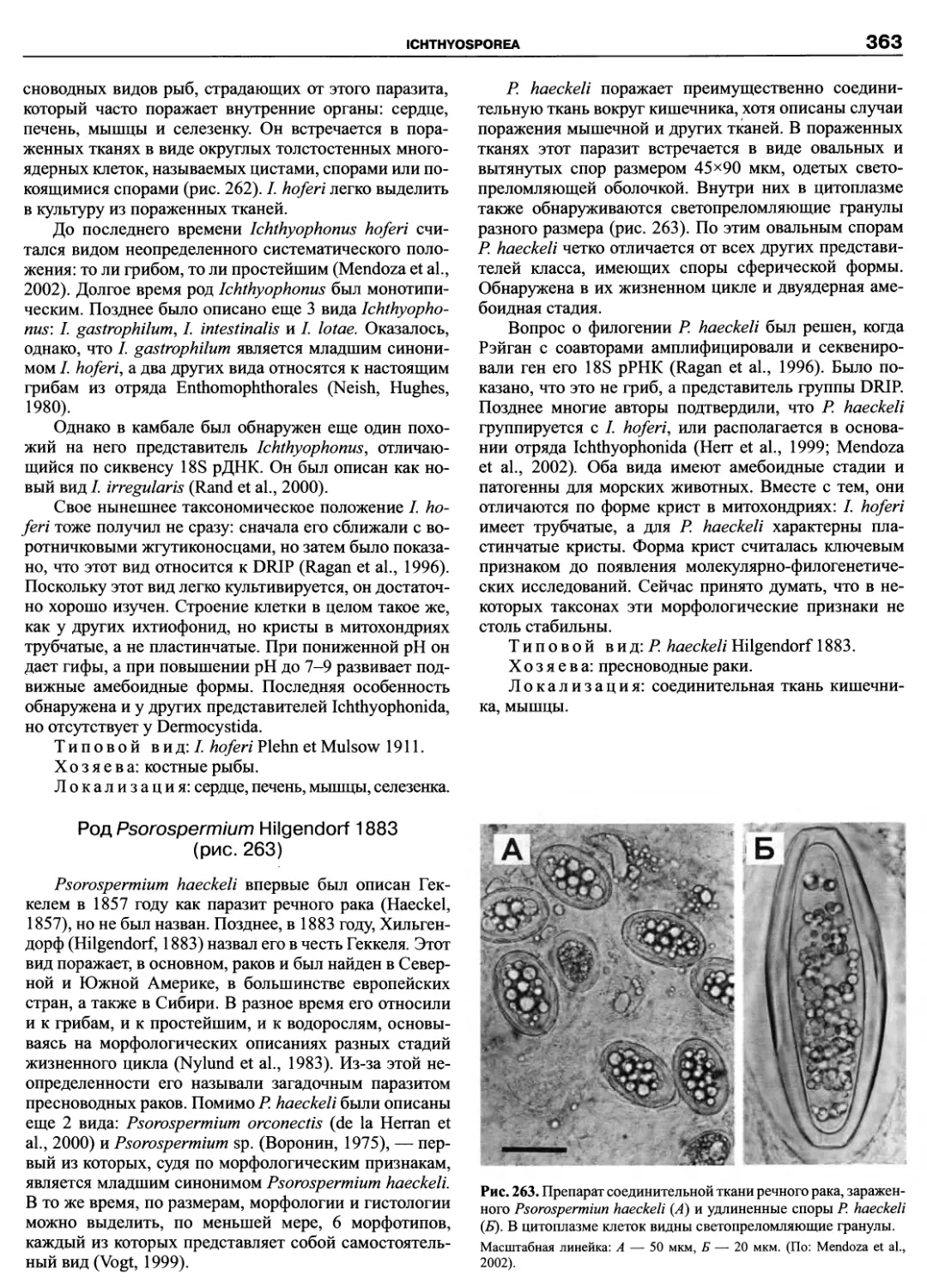
небольшим паразитическим таксонам (Paramyxida, Haplosporidia, Ichthyosporea), а также интенсивно изучаемым в
последнее время, филогенетически важным группировкам амеб (Pelobiontida) и жгутиконосцев (Apusomonadida,
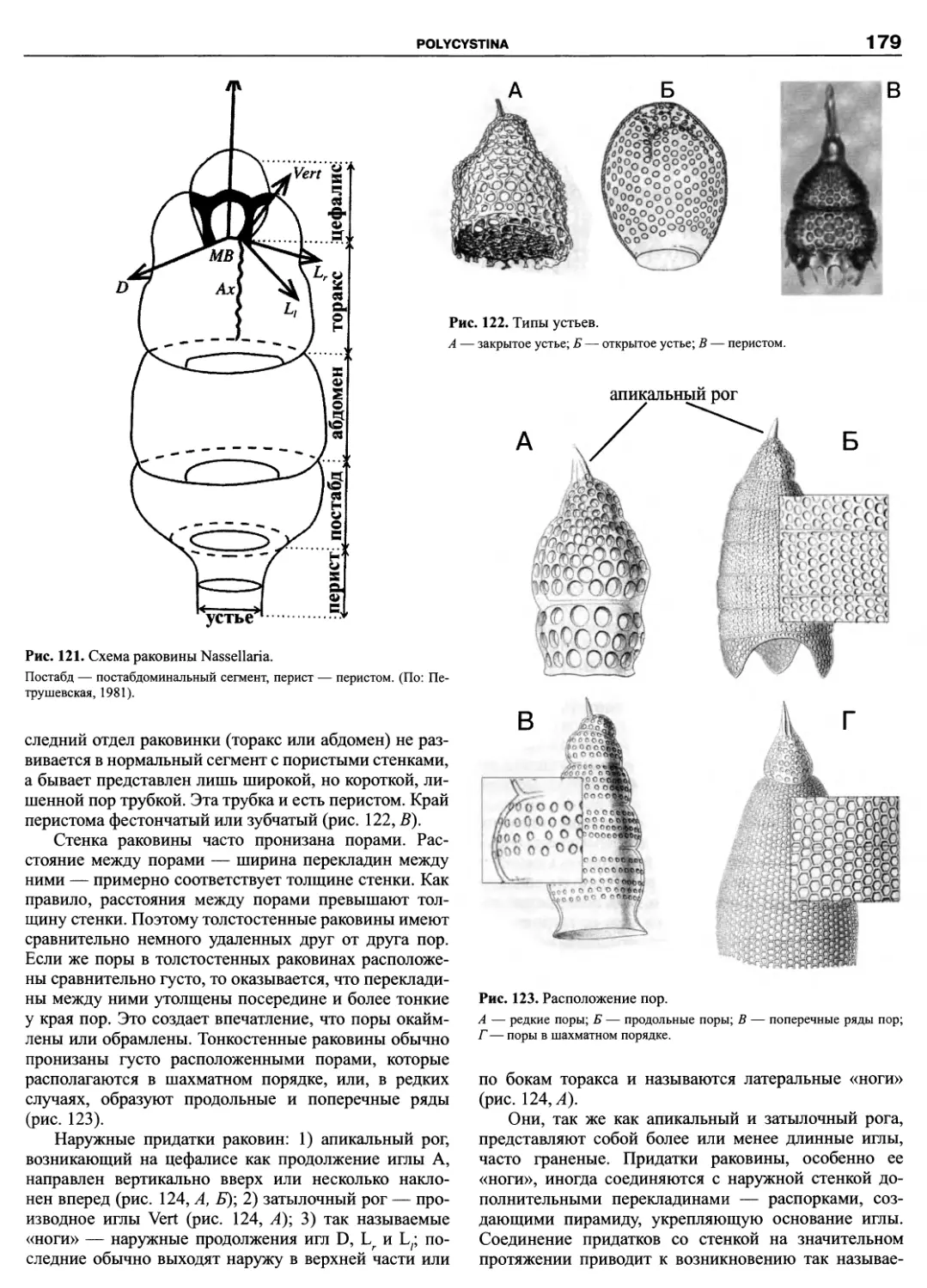
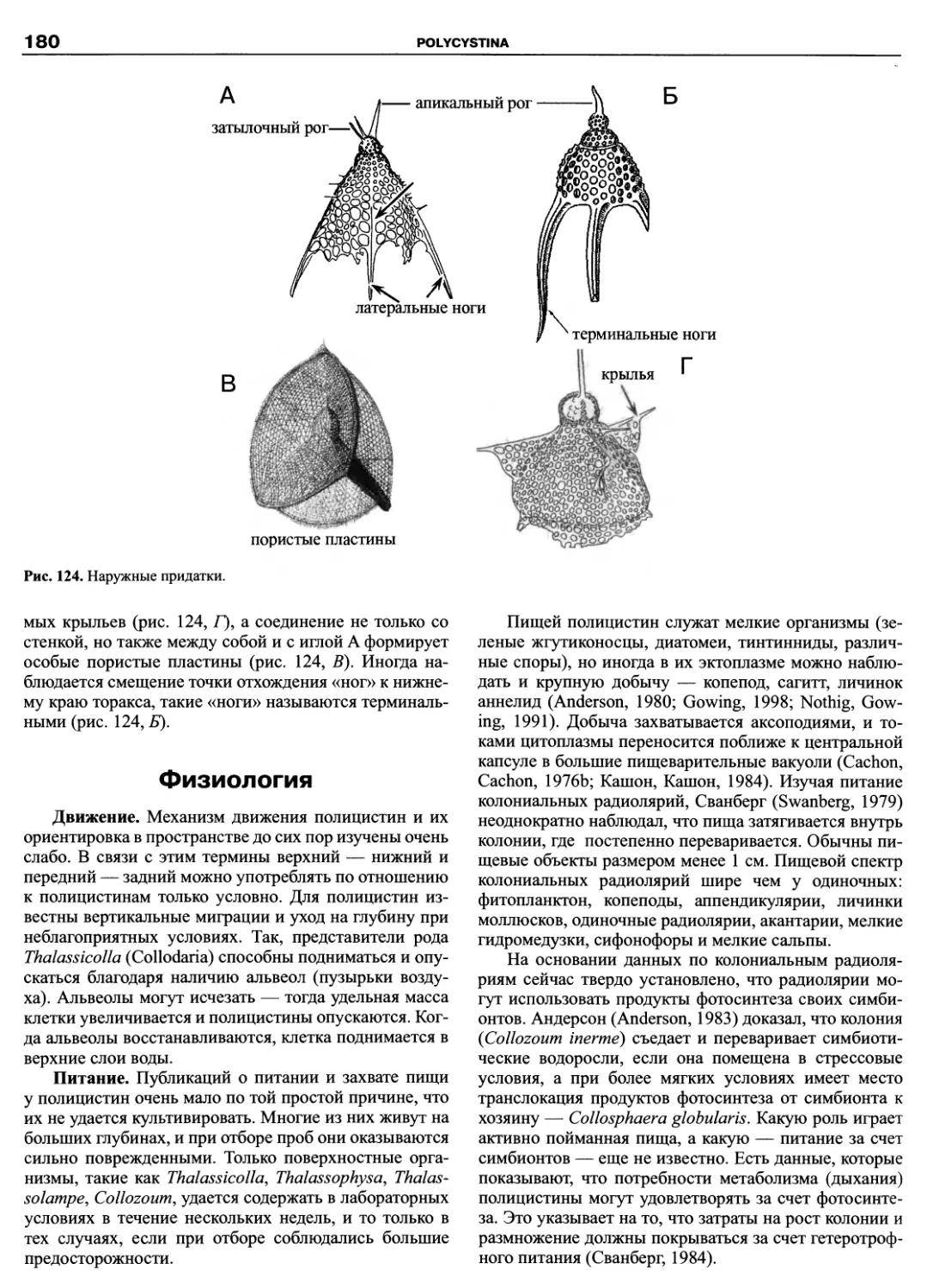
Hemimastigophora, Thaumatomonadida, Katablepharida, Pansomonadida, Cryomonadida). Материал изложен по еди-
ной схеме, позволяющей получить исчерпывающую информацию по любому из представленных таксонов от исто-
рии его изучения до новейших представлений об эволюции и филогении. Систематическая часть каждой из глав
содержит сведения по всем входящим таксонам до рода, а в небольших по объему группах до вида включительно.
Руководство ориентировано на широкую аудиторию как студентов и преподавателей вузов, так и профессио-
нальных биологов.
Главный редактор
директор Зоологического института РАН
чл.-корр. РАН, профессор О.Н. Пугачев
Редакционная коллегия:
А.Ф. Алимов, М.В. Крылов, Л.Н. Серавин
Научный редактор выпуска
С.А. Карпов
Рецензенты:
А.А. Добровольский, Т.Г Симдянов, А.В. Смирнов
Издание осуществлено при поддержке Российского фонда фундаментальных исследований
согласно проекту № 10-04-07041-д
Р
И
ISBN 978-5-87317-809-4
© Зоологический институт РАН, 2011
© Коллектив авторов, 2011
© Товарищество научных изданий КМК, 2011
Светлой памяти
Льва Николаевича Серавина —
выдающегося протистолога и зоолога,
учителя и друга
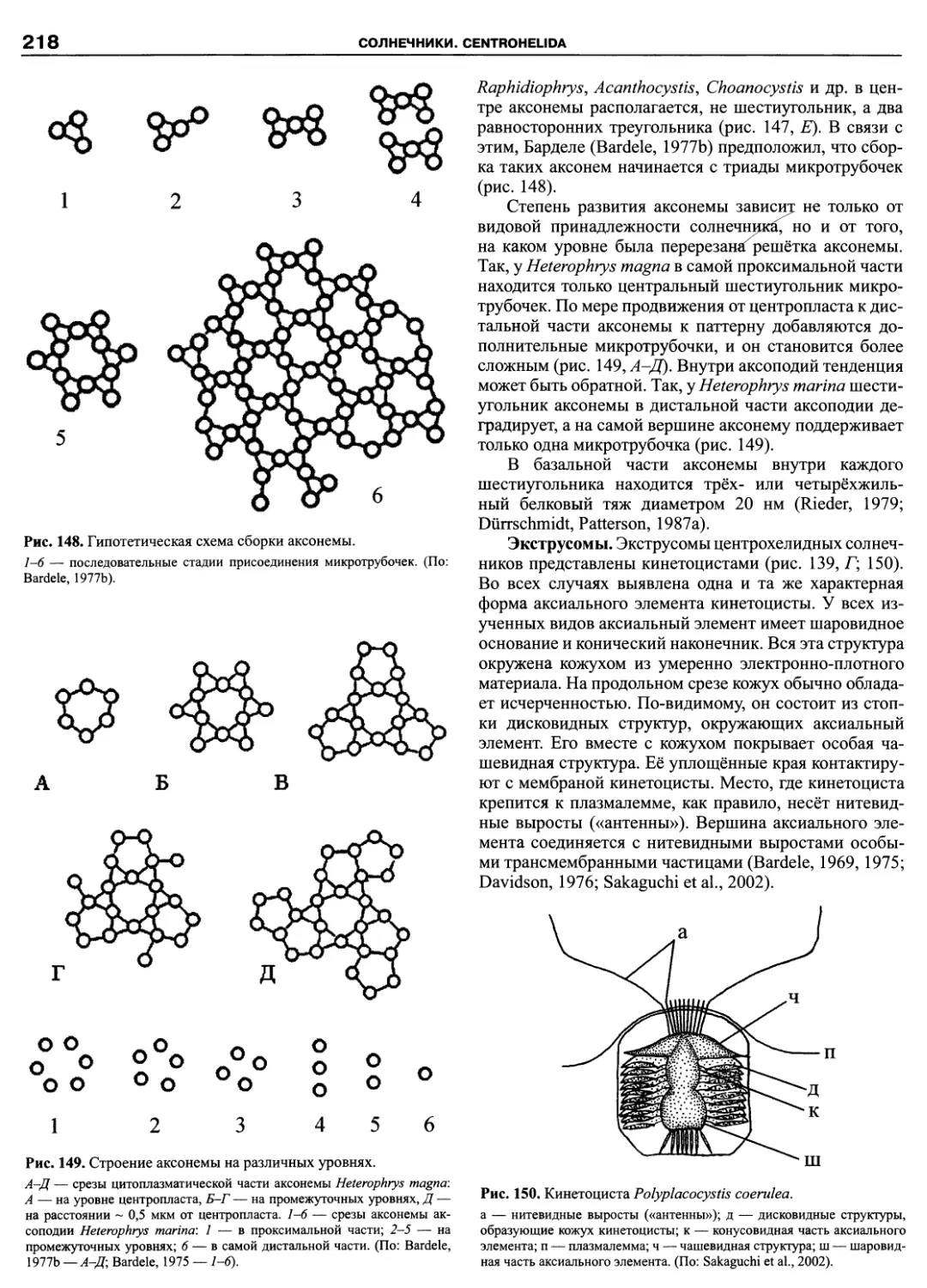
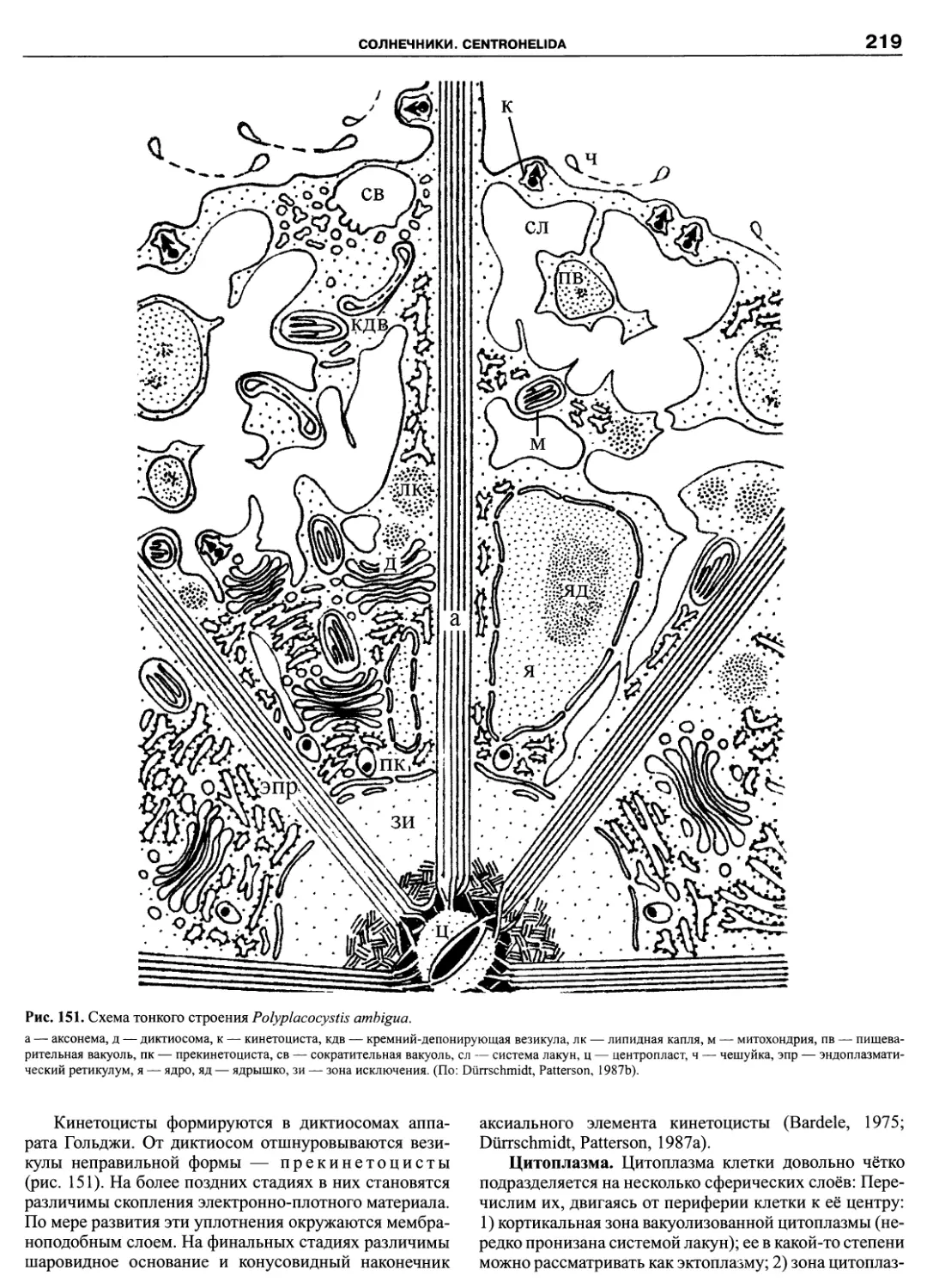
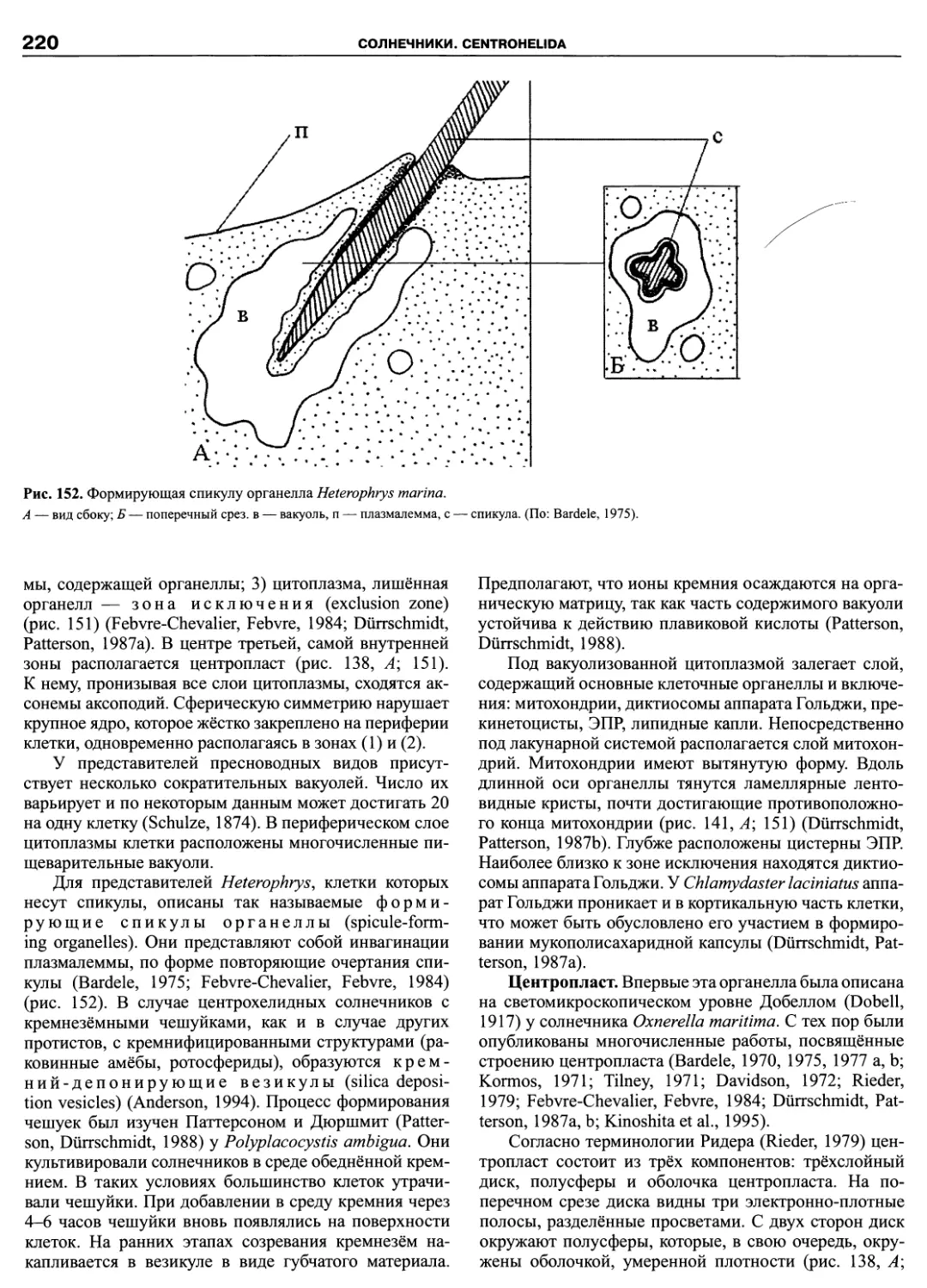
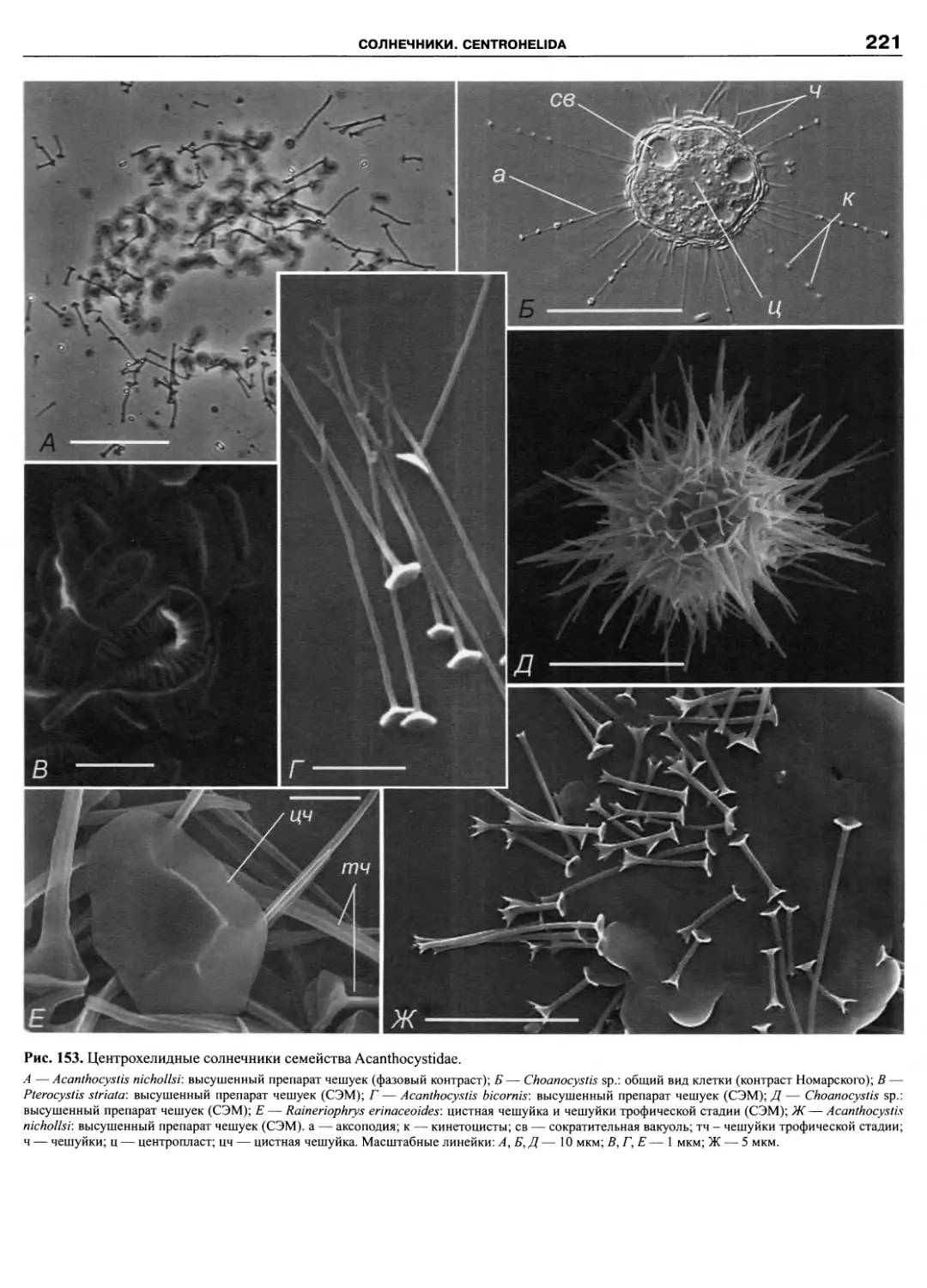
ПРЕДИСЛОВИЕ
Эта книга завершает посвященную протистам се-
рию из трех томов. Основное внимание было уделено
простейшим: жгутиконосцам, инфузориям, амебам и
споровикам. За рамками трехтомника оставлены тра-
диционно альгологические и микологические таксоны,
например, такие богатые видами группы протистов как
Bacillariophyta и Chytridiomycetes. Кроме них, не рас-
смотрены некоторые группы гетеротрофных жгутико-
носцев. Причина в том, что число таксономических
группировок, выделенных по молекулярным критери-
ям, множится год от года, и филогенетические схемы
быстро устаревают. Так, за последние годы появились
новые таксоны: Pansomonadida (Vickerman et al., 2005),
Telonemia (Shalchian-Tabrizi et al., 2006), Glissomonad-
ida (Howe et al., 2009), Planomonadida (Cavalier-Smith
et al., 2008), причем, последний таксон уже упразднен
(Heiss et al., 2010). На критическое осмысление новых
наработок требуется время, поэтому невозможно пред-
ставить во всей полноте те группы эукариот, которые
находятся в состоянии ревизии.
Система эукариот, которая была помещена на фор-
заце 1-го тома, полностью устарела, поэтому здесь при-
ведена новая, современная система эукариот, состав-
ленная по данным нескольких авторов (Baldauf, 2003;
Adi et al., 2005; Keeling et al., 2005; Shalchian-Tabrizi et
al., 2008; Howe et al., 2011). В эту филогенетическую
схему включены все таксоны, которым посвящены
главы трехтомника, а также наиболее крупные группы
эукариот: Metazoa, Fungi, Embryophyta, Phaeophyta и
другие. Детали этой системы, несомненно, будут уточ-
няться, но главные кластеры и ключевые точки ветвле-
ния не оспариваются специалистами уже восемь лет.
Это длительный срок для такой бурно развивающей
отрасли науки как молекулярная филогения, поэтому
можно надеяться, что приведенная на форзаце настоя-
щего тома система в ближайшее десятилетие не будет
противоречить основным представлениям о филогении
эукариот.
В третьем томе дано описание динофлагеллат,
радиолярий, солнечников и нескольких малых групп
протистов. Глава «Dinoflagellata» логически заверша-
ет тему Alveolata, которой был посвящен весь второй
том. Но поскольку он разросся до предельно мысли-
мого объема, крупную главу «Dinoflagellata» отложили
до публикации последнего тома серии. Актиноподы
(радиолярии и солнечники) не составляют филетиче-
ского кластера, однако конструктивно единообразны.
Главы, посвященные актиноподам, одним блоком по-
мещены вслед за «Dinoflagellata». Во всех последу-
ющих главах даны характеристики малоизвестных
групп протистов, как паразитических, так и свобод-
ноживущих. Эти главы упорядочены согласно распо-
ложению таксонов на молекулярно-филогенетическом
древе эукариот.
Как и в предыдущих томах, все главы построены
по единому плану, снабжены рисунками, в том чис-
ле, где это оправдано, и цветными; имеют резюме на
английском языке. Таксономические ранги предста-
вителей различных филогенетических ветвей эукари-
от зачастую несопоставимы, поэтому в публикациях,
посвященных филогенетическим взаимоотношени-
ям крупных подразделений, используют безранговую
классификацию (Adi et al., 2005; и др.). Из этих же
соображений ранги таксонов не включены в названия
глав. В систематической же части каждой главы ранго-
вая классификация уместна и задействована в полной
мере. Классификация динофлагеллат дана по ботани-
ческому кодексу номенклатуры в соответствии с обще-
принятой в настоящее время для этого таксона систе-
мой. В остальных главах таксоны классифицированы
согласно зоологическому кодексу. Такое изложение
материала оправдано, поскольку протесты несут черты
организации и животных и растений, а собственного
кодекса номенклатуры для них нет и, скорее всего, не
будет.
Пользуясь случаем, благодарим всех экспертов по
отдельным группам протистов, которые нашли время
и силы для рецензии глав этого тома. Большую призна-
тельность выражаем всем коллегам, приславшим изо-
бражения протистов.
Научный редактор выпуска
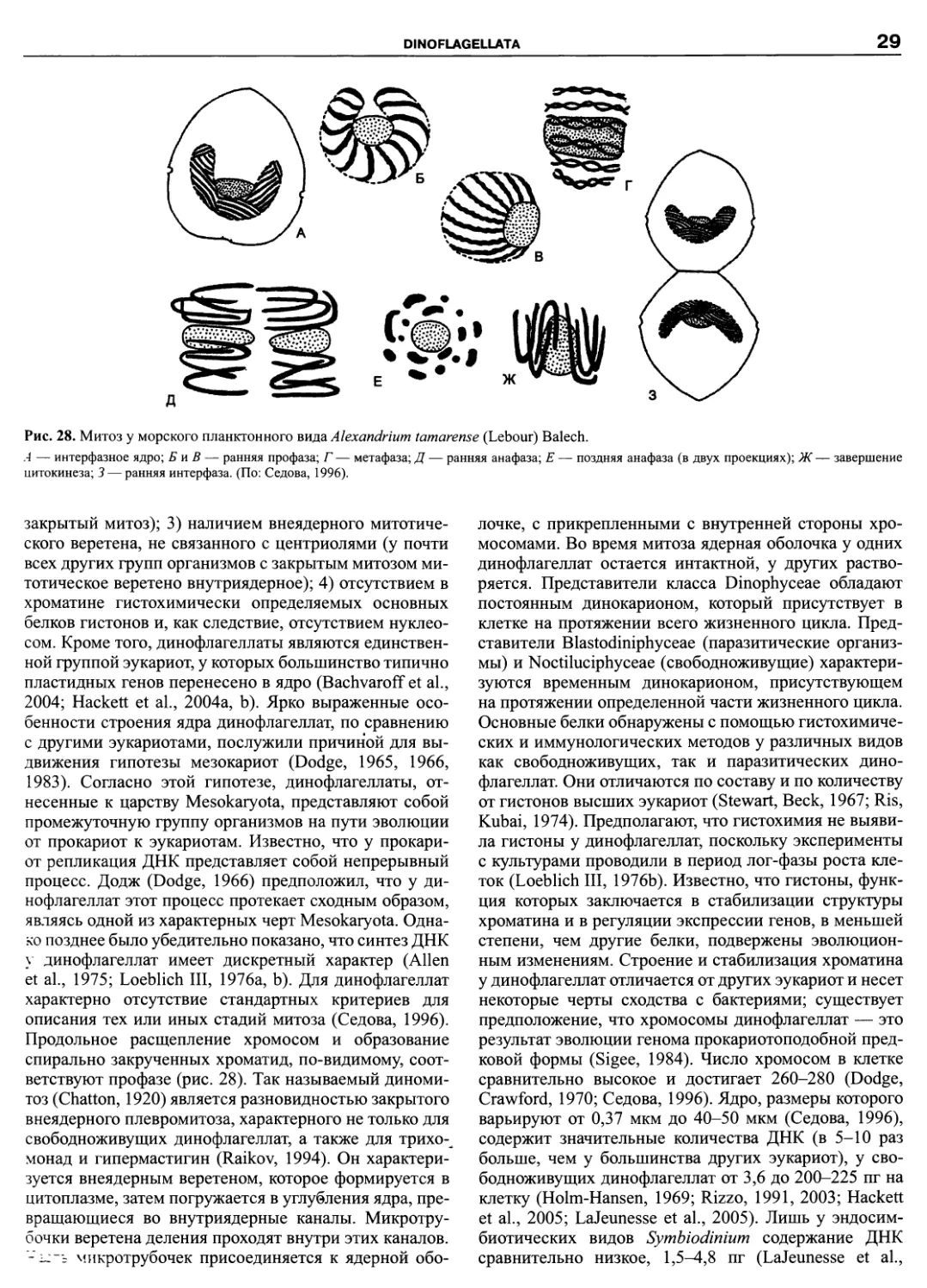
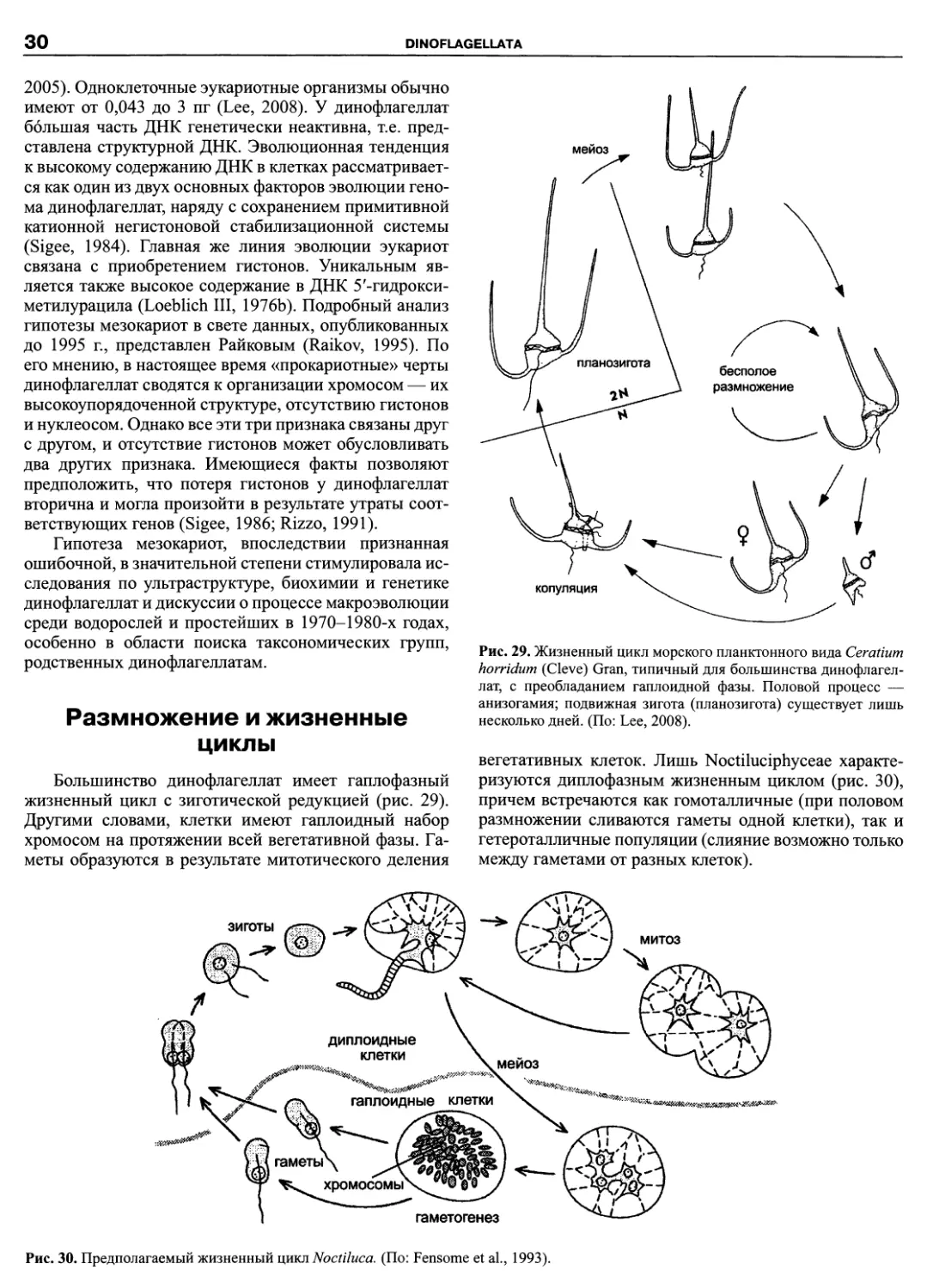
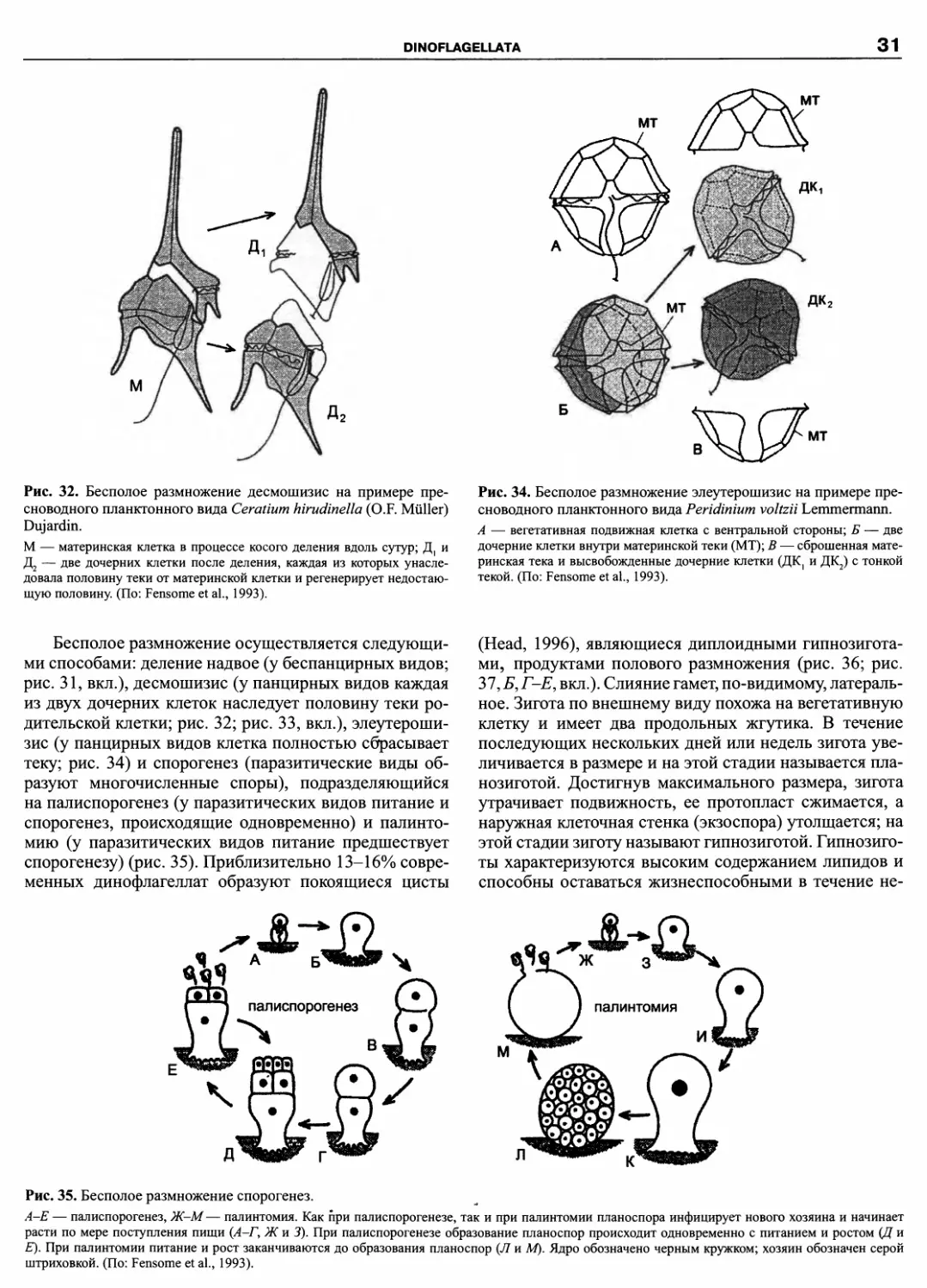
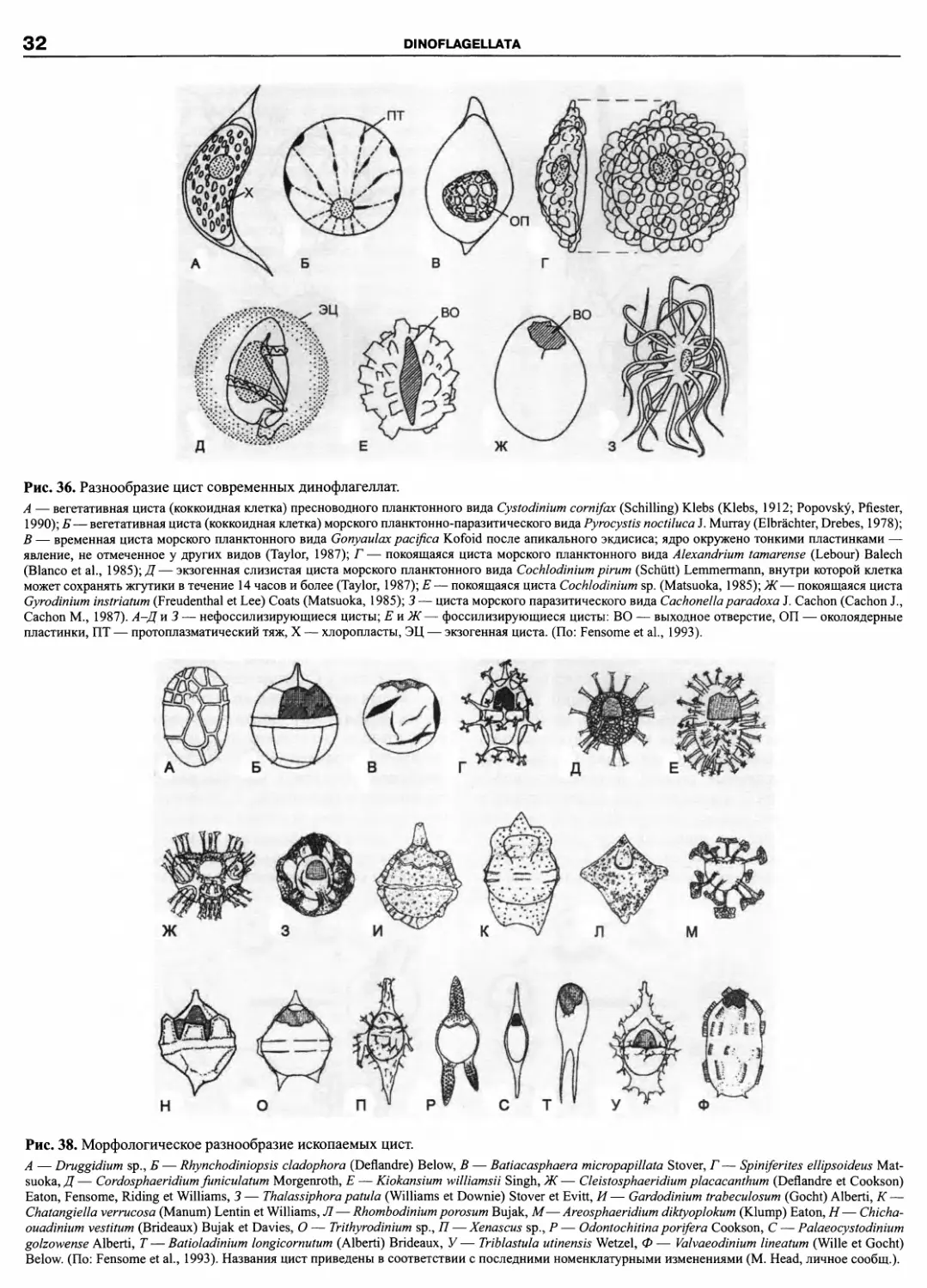
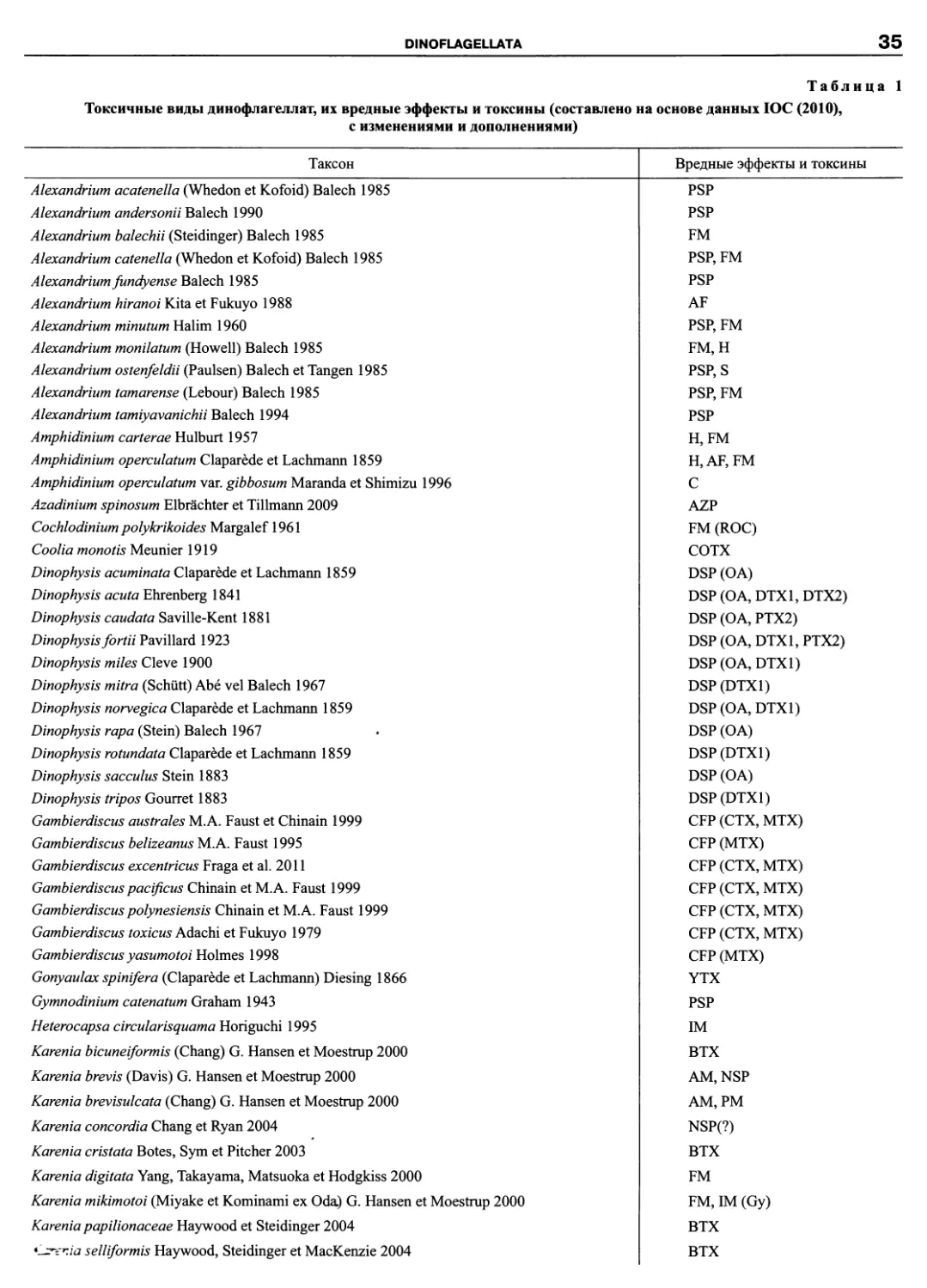
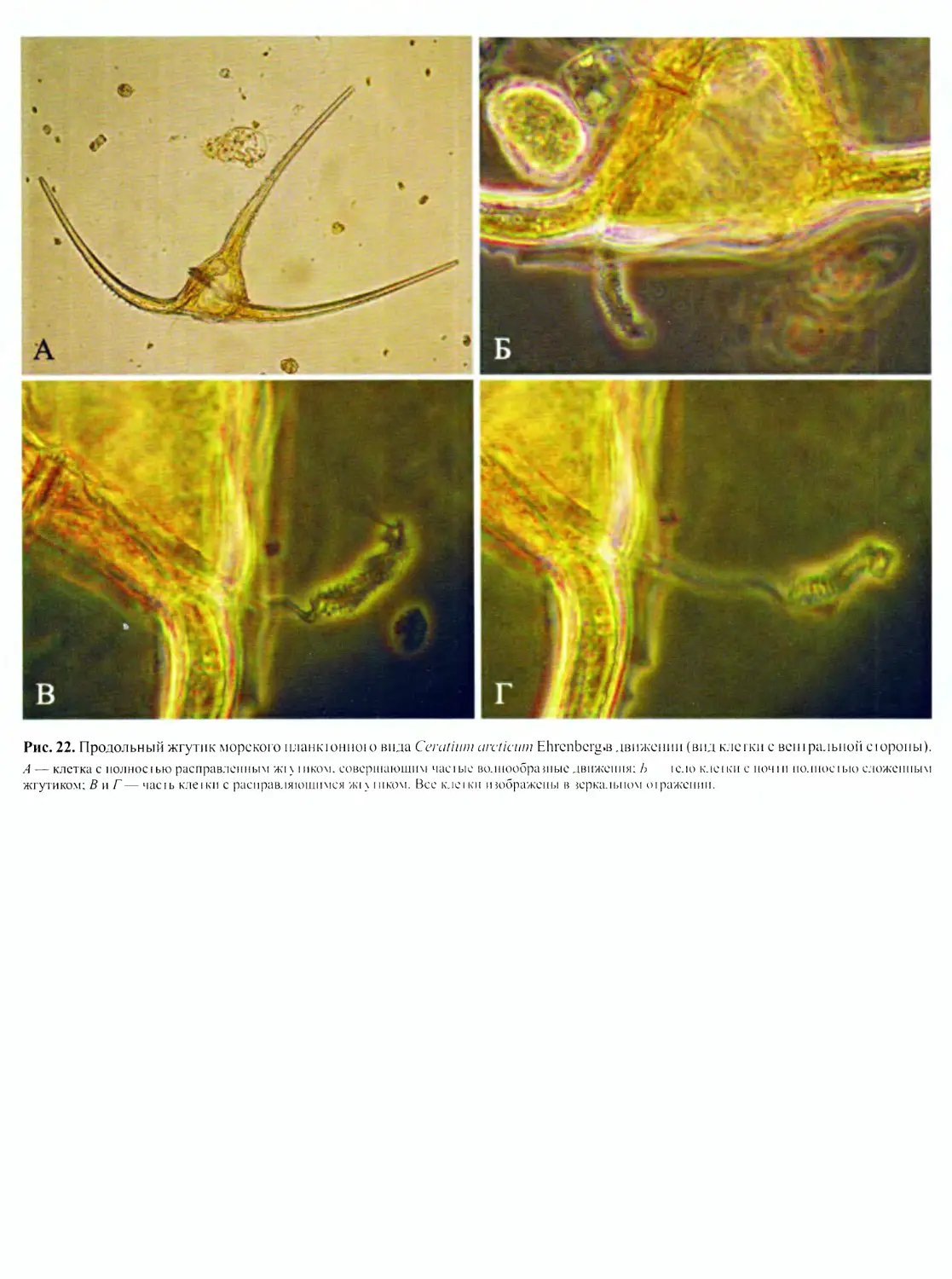
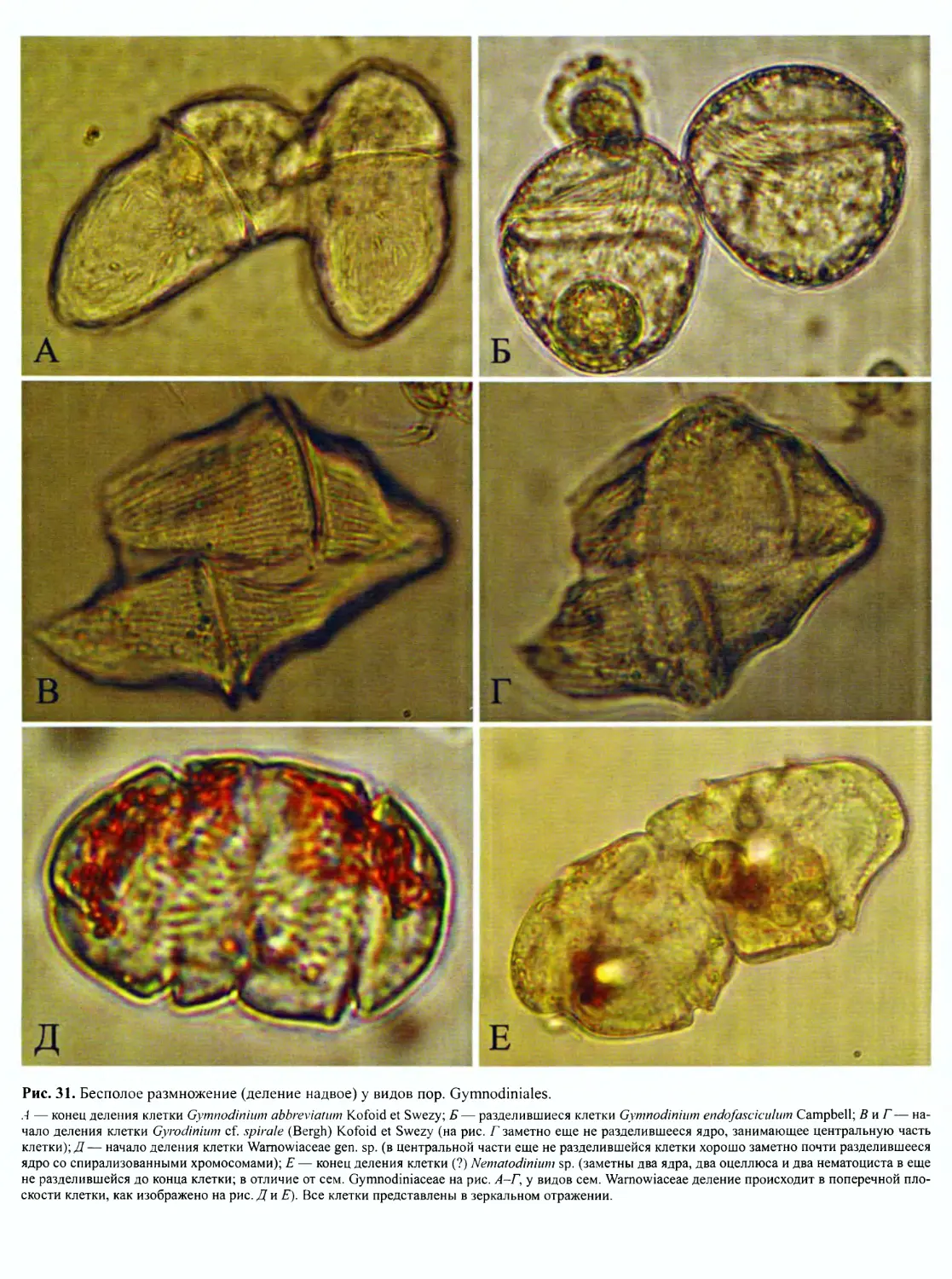
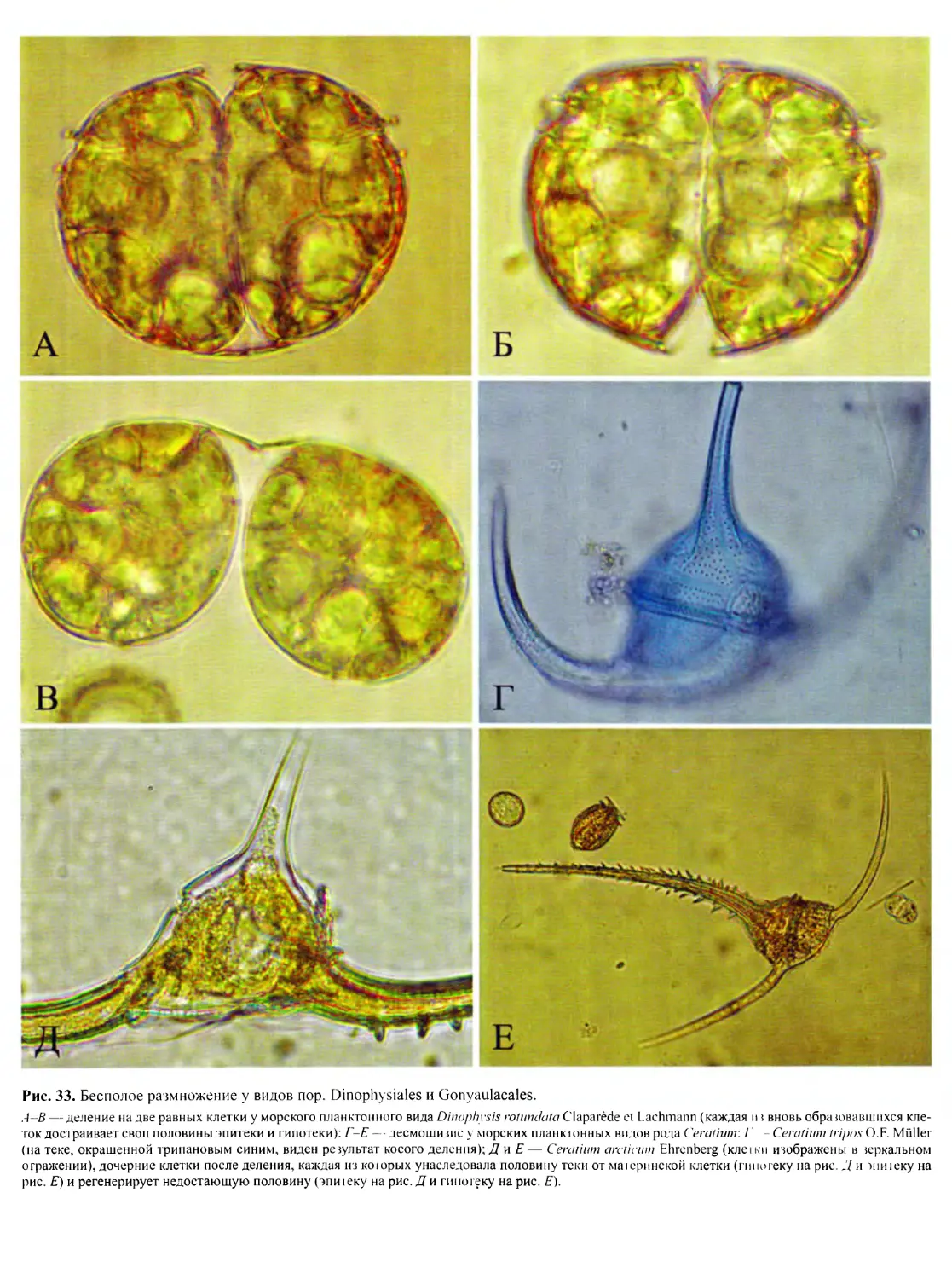
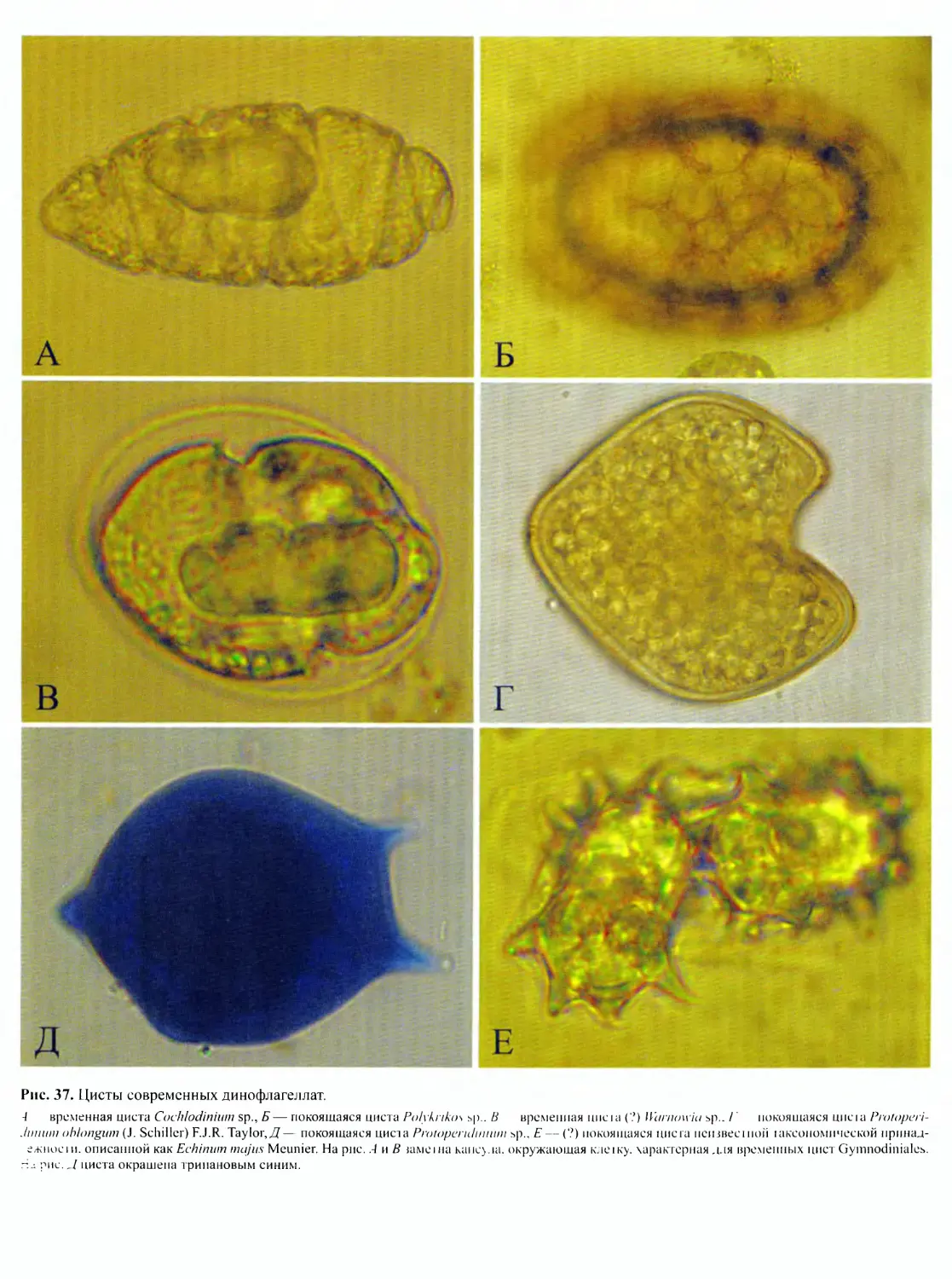
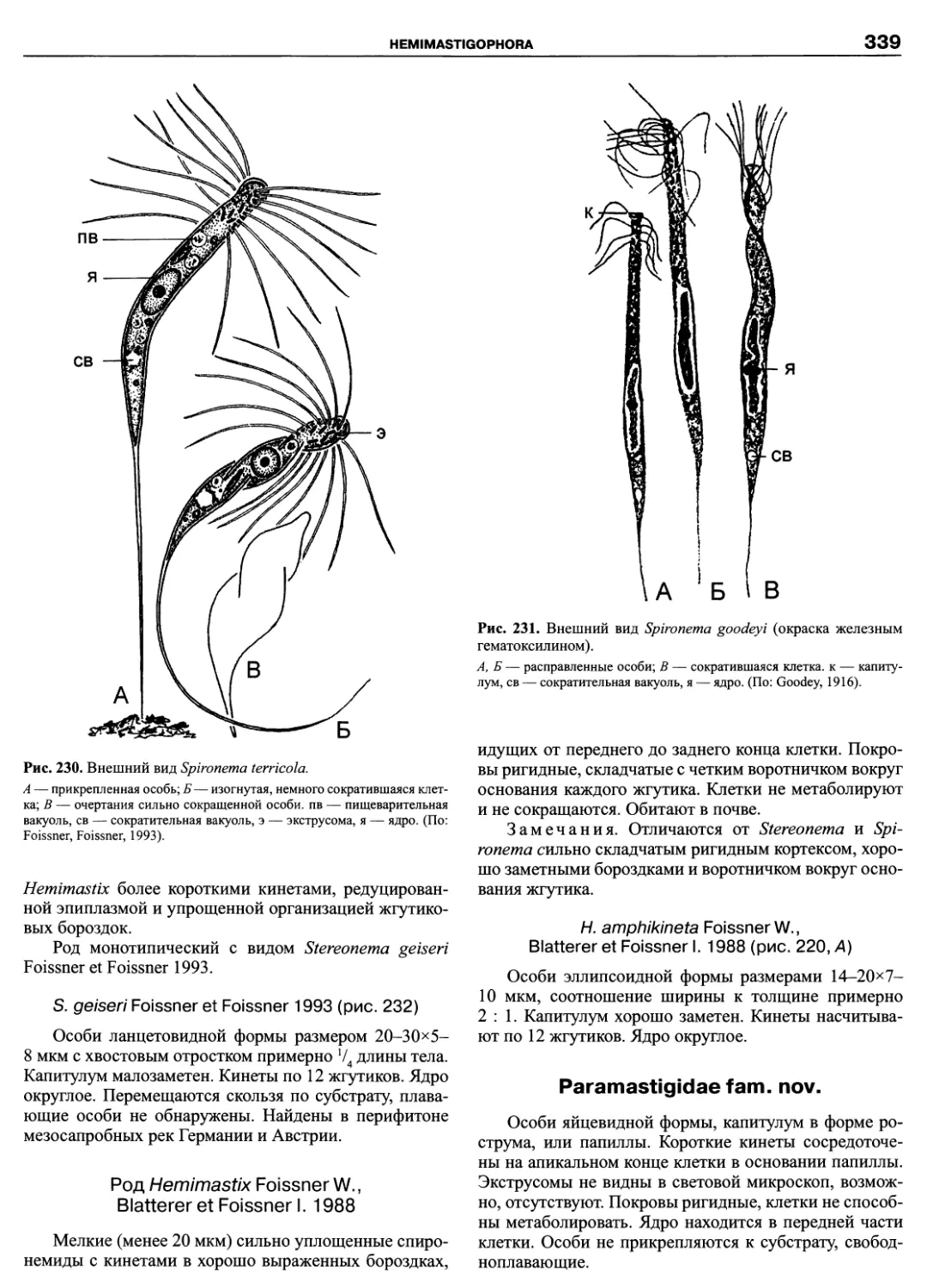
DINOFLAGELLATA (Butschli) Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
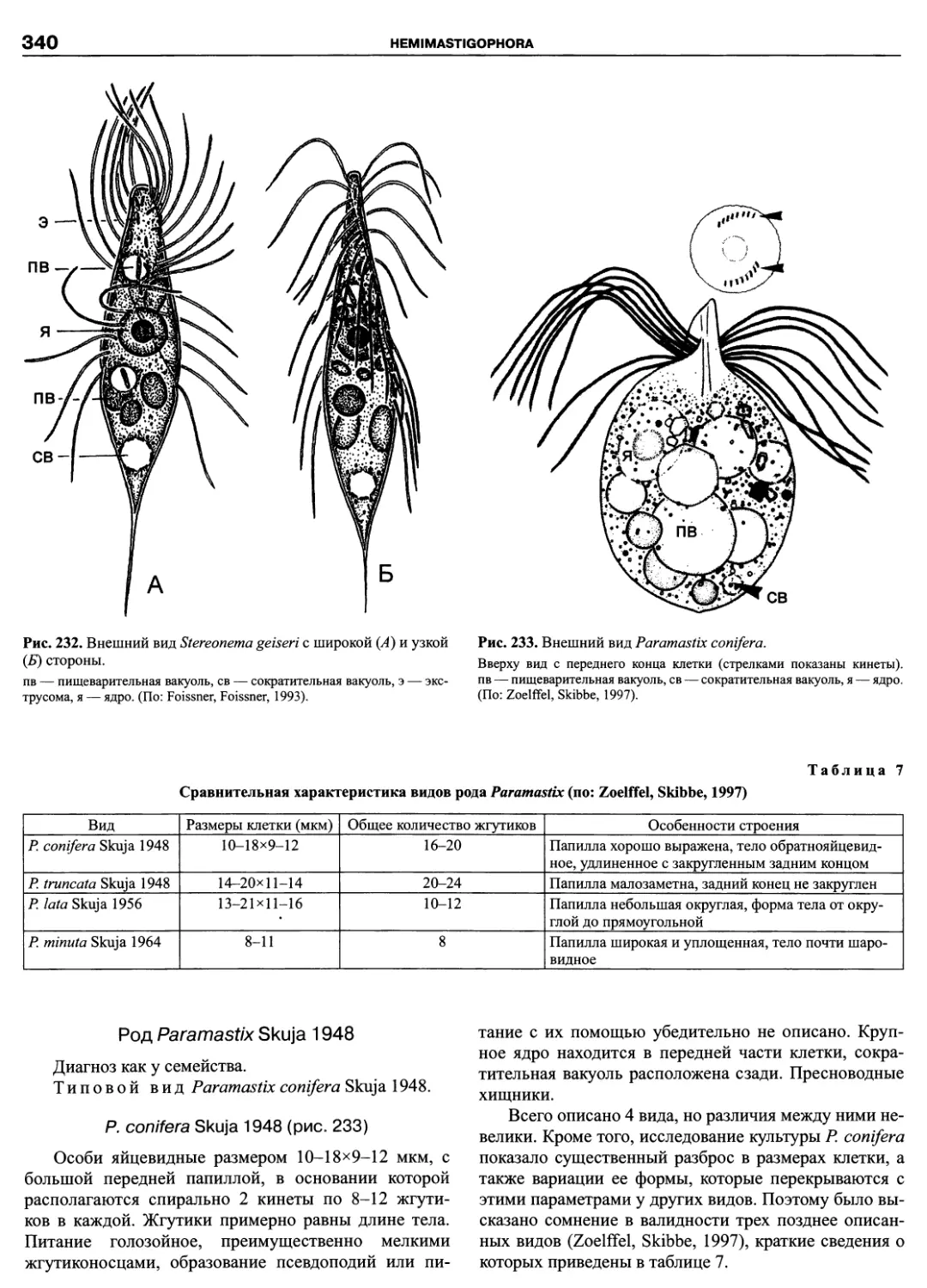
Динофлагелляты представляют собой широко распростра-
ненную группу преимущественно одноклеточных морских орга-
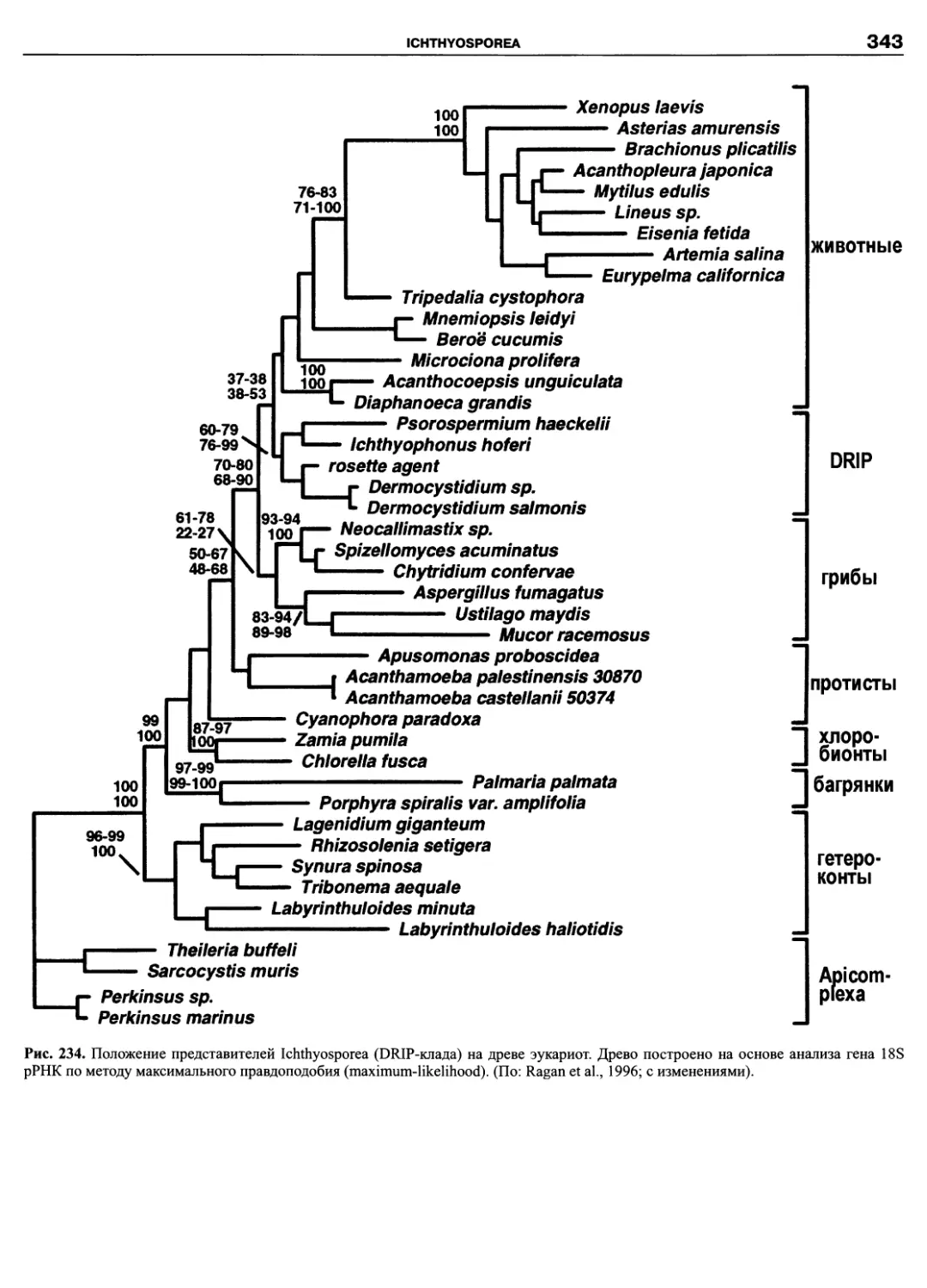
низмов, крайне разнообразных по строению клетки, с широким
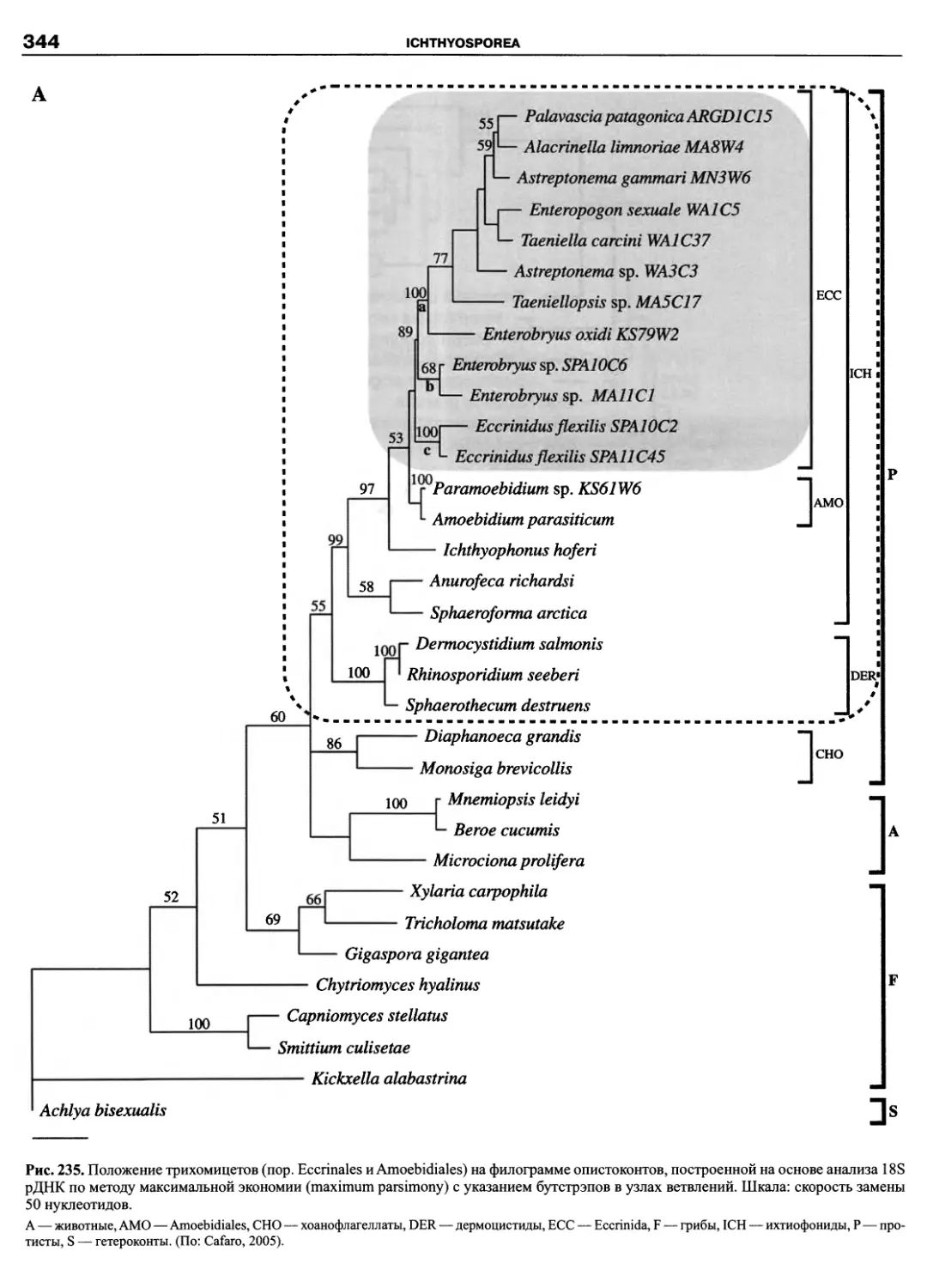
спектром типов питания. Для них характерны покровы в виде
теки. Подавляющее большинство содержит одно ядро, обеднен-
ное основными белками гистонами, митохондрии с тубулярны-
ми кристами и особую органеллу — пузулу. У многих видов есть
трихоцисты и другие экструсомы. Хлоропласты есть примерно у
половины видов. Они лежат в цитоплазме, оболочка состоит из
трех мембран, содержат хлорофиллы «а» и «с2». Среди них есть
фототрофы, гетеротрофы и миксотрофы. Из всех эукариотных
первичных продуцентов в прибрежных морских водах динофла-
гелляты уступают лишь диатомовым (Graham, Wilcox, 2000). До
недавнего времени насчитывали 1424-1772 вида из‘115-131 ро-
дов современных морских динофлагеллят (Soumia et al., 1991).
Как одна из доминирующих групп морского фитопланктона они
известны с триаса (Fensome et al., 1993). Предполагают, что в
мелу видовое богатство достигло расцвета и составляло около
3000 видов; в настоящее время насчитывается около 2000-2500
видов современных и 2500 ископаемых видов динофлагеллят
(Taylor et al., 2008; Hoppenrath et al., 2009a). Из современных
представителей 1555 видов — морские планктонные (Gomez,
2005), около 270 — пресноводные планктонные (Bourrelly, 1970,
1985; Taylor et al., 2008), приблизительно 160 — псаммофиль-
ные (живущие в песке) и эпифитные (Taylor et al., 2008), около
140 — паразитические (Shields, 1994) и неопределенное чис-
ло — симбиотические (в настоящее время известно около 10;
Loeblich III, Sherley, 1979; Trench, 1987). В более ранней оценке
видового богатства динофлагеллят упомянуто 2500 видов совре-
менных и 3800 ископаемых видов динофлагеллят (Williams et al.,
1998). Следует иметь в виду, что в настоящее время известно
приблизительно 40 тысяч видов простейших и 40 тысяч видов
водорослей (ныне живущих), однако, число еще не описанных
видов этих групп насчитывает соответственно 100-200 тысяч и
от 200 тысяч до 10 миллионов (Groombridge, 1992).
История изучения
(обзор классификаций)
Первым организмом, отнесенным к динофлагел-
~2там. была Noctiluca, известная в литературе с сере-
восемнадцатого века (Baker, 1753). Двадцать лет
Посвящается выдающемуся аргентинскому
исследователю динофлагеллат
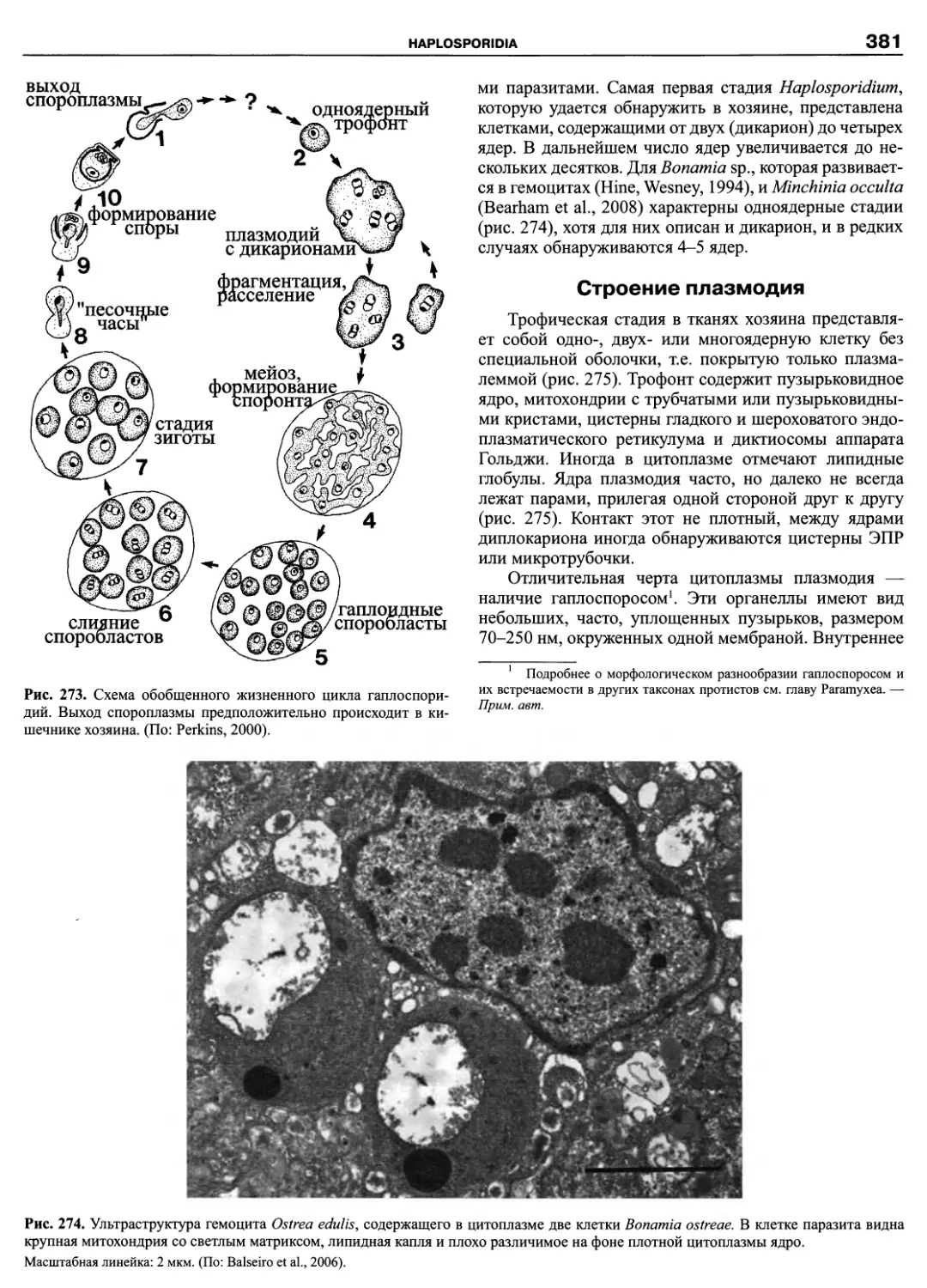
Энрике Балечу (Enrique Balech, 1912-2007)
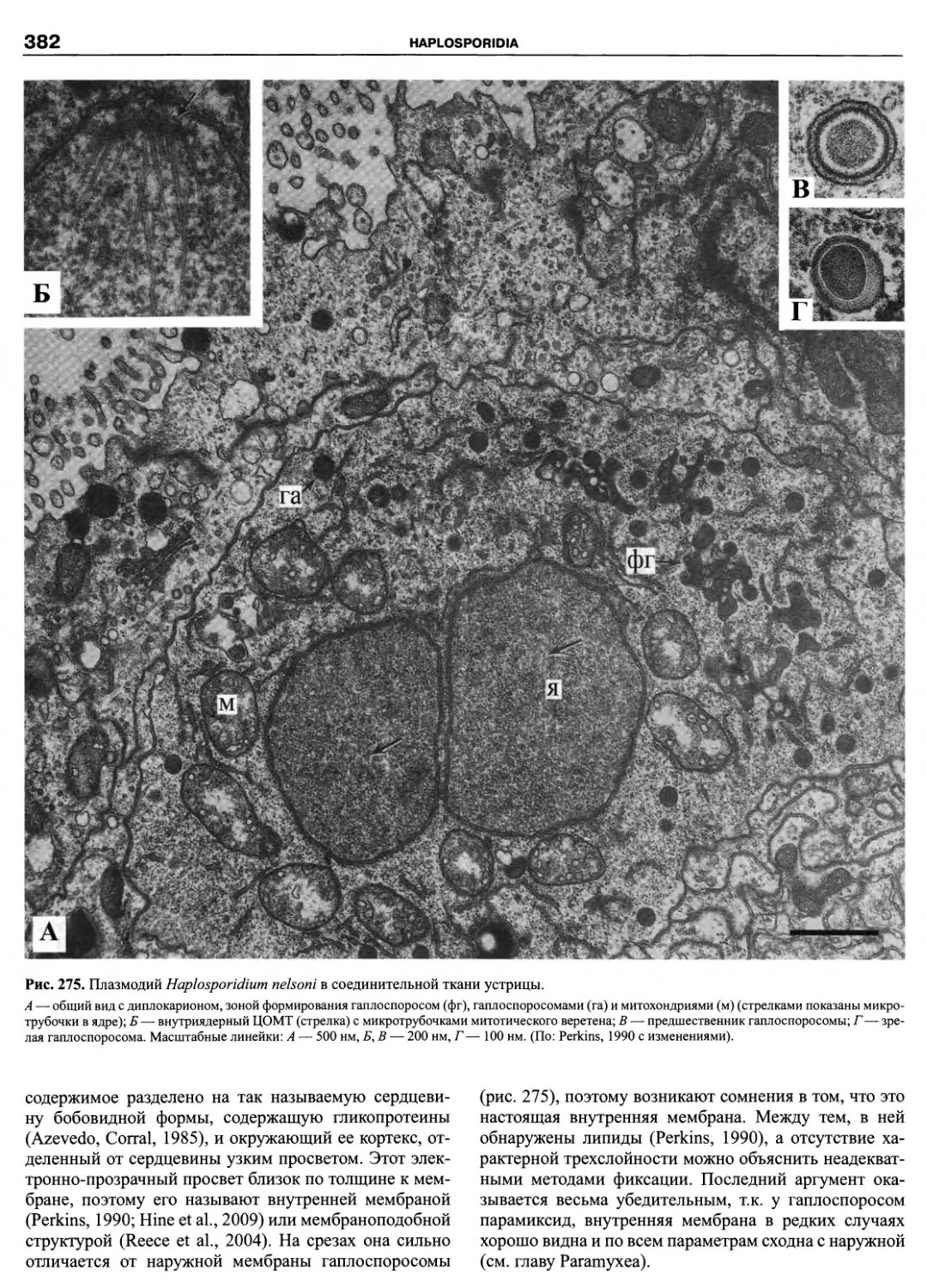
спустя Мюллер (Muller, 1773) описал два вида пресно-
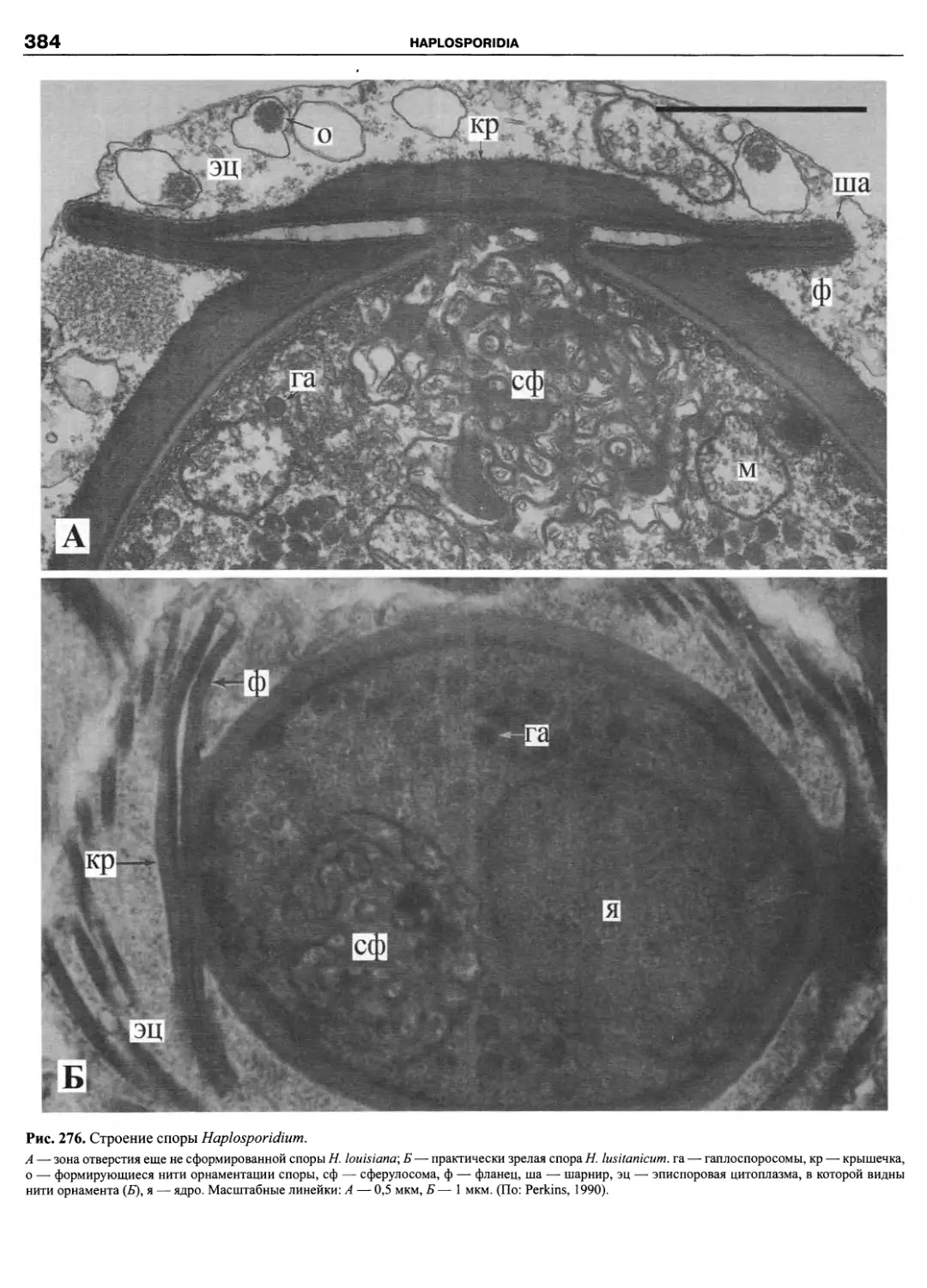
водных динофлагеллат, известных в настоящее вре-
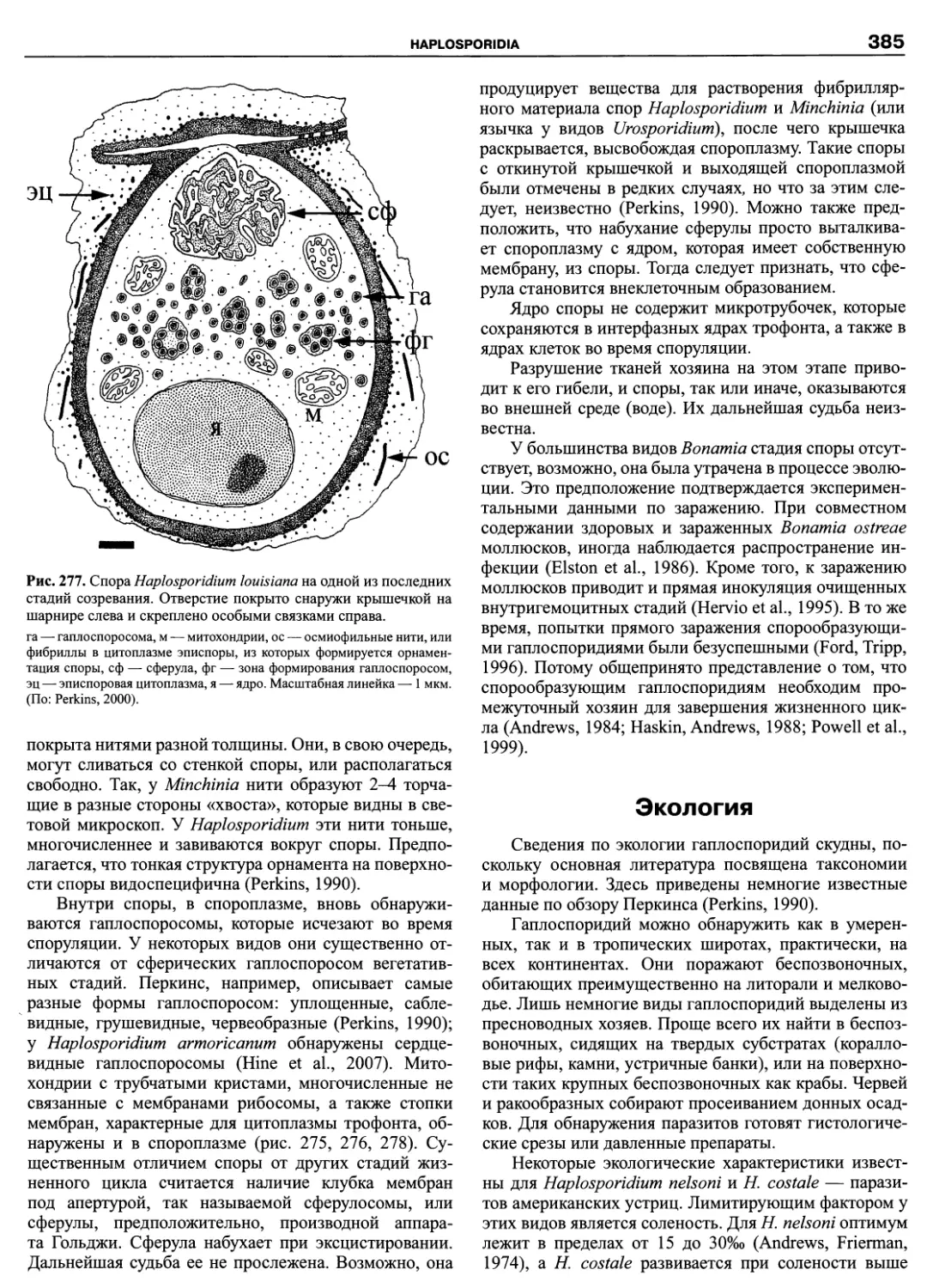
мя как Ceratium hirundinella (O.F. Muller) Dujardin и
Peridinium cinctum Penard. До середины 1880-х годов
считалось, что поясок — характерное для динофлагел-
лат образование — содержит ряд ресничек. По этой
причине их называли тогда ресничными флагеллатами,
или цилиофлагеллатами. После описания Эренбергом
(Ehrenberg, 1830) рода Peridinium представителей этой
группы также стали называть перидинеями.
Ранние классификации динофлагеллат включали
представителей нескольких родов в пределах одного
семейства. Для классификации динофлагеллат харак-
терна двойственность номенклатурного подхода. Мно-
гие авторы следовали правилам зоологической номен-
клатуры (Bergh, 1881; Saville-Kent, 1880-1882; Stein,
1883; Butschli, 1885; Kofoid, 1909; Lebour, 1925; Peters,
1930; Abe, 1981 и др.). Наблюдения за размножением
и обнаружение целлюлозы в составе клеточной стен-
ки позволили Уормингу (Warming, 1875) сделать вы-
вод о растительной природе динофлагеллат. Уорминг
(Warming, 1890) и Энглер (Engler, 1892) были первы-
ми, кто поместил динофлагеллат в царство растений.
В более поздних работах использовалась ботаническая
номенклатура в отношении динофлагеллат (Schutt,
1896; Lemmermann, 1899, 1910; Pascher, 1914, 1927,
1931; Lindemann, 1928; Schiller, 1933, 1937; Fott, 1959;
Bourrelly, 1970; Loeblich III, 1970, 1982; Taylor, 1976b;
Tappan, 1980; Dodge, 1984; Soumia, 1986; Popovsky,
Pfiester, 1990). Классификация Берга (Bergh, 1881)
определила ряд тенденций, часть из которых существу-
ет по сей день. Он разделил динофлагеллаты на десмо-
контные — с апикальным (передним) расположением
жгутиков, и диноконтные — с вентральным (боковым)
расположением жгутиков. Это различие в расположе-
нии жгутиков принималось во внимание многими авто-
рами в последующих классификациях. Пашер (Pascher,
1914, 1927, 1931) разработал систему, в которой объ-
8
DINOFLAGELLATA
единил динофлагеллят, рафидофицей и криптомонад
под названием Pyrrophyta (Pyrrhophyta в классифика-
ции 1931 г.). В пределах десмоконтов и диноконтов
он выделил несколько порядков на основе различий
в типах морфологической структуры тела (амебоид-
ный, коккоидный, нитчатый, монадный). В настоящее
время известно, что сходство типов структуры тела не
является достоверным показателем родства, так как
жизненный цикл одного вида может включать стадии
с различными типами структуры. Коккоидная стадия
присутствует в жизненных циклах пор. Phytodiniales
и сем. Pyrocystaceae, пор. Thoracosphaerales и некото-
рых представителей класса Blastodiniphyceae. Одними
из наиболее сложных жизненных циклов, известных в
настоящее время, являются многофазные циклы ток-
сичных видов сем. Pfiesteriaceae, включающие жгути-
ковые стадии, гипноцисты, временные и покоящиеся
цисты; многочисленные амебоидные стадии, о которых
сообщалось ранее, отсутствуют (Steidinger et al., 1996;
Burkholder et al., 2001; Litaker et al., 2002).
Эренберг (Ehrenberg, 1838) был первым, кто опу-
бликовал сведения об ископаемых динофлагеллятах.
В 1930-1940-х годах было описано много видов ис-
копаемых динофлагеллят и гистрихосфер — сборной
группы одноклеточных организмов неясного проис-
хождения и таксономической принадлежности. Ряд
ископаемых организмов был отнесен к родам совре-
менных динофлагеллят; например, цисты некоторых
современных видов Gonyaulax весьма сходны с гистри-
хосферами возрастом 150 миллионов лет. Дефландр
(Deflandre, 1952) опубликовал первую систему иско-
паемых динофлагеллят. До выхода его работы авторы
классификаций рассматривали динофлагеллят в целом.
В свою систему он поместил ископаемые роды и лишь
те из современных родов, которые в своем составе име-
ют ископаемые виды. Начиная с 1952 г., появилась не-
обходимость указывать, относится ли классификация
к современным или ископаемым организмам, или же
к тем и другим. Классификации Дефландра (Deflandre,
1952), Айзенака (Eisenack, 1961, 1964) и Возженнико-
вой (1965) представляли собой первые попытки вклю-
чить ископаемых представителей в систему современ-
ных динофлагеллят. Это было обусловлено недостатком
знаний о морфологии ископаемых представителей и о
жизненных циклах современных видов, в частности,
о соответствии покоящихся стадий, описываемых под
самостоятельными названиями в соответствии с би-
нарной номенклатурой, вегетативным стадиям извест-
ных видов современных динофлагеллят. Значительным
вкладом в понимание морфологии и родственных свя-
зей ископаемых динофлагеллят является работа Эвита
(Evitt, 1961), который показал, что ископаемые диноф-
лагелляты представляют собой, главным образом, ци-
сты, и что многие мезозойские и кайнозойские гистри-
хосферы — это также цисты динофлагеллят. Первую
систему, в которую были включены гистрихосферы,
предложили Сарджент и Дауни (Sarjeant, Downie, 1966).
Их система была в значительной степени формальной
и основана исключительно на данных световой микро-
скопии, так как сканирующий электронный микроскоп
был еще не доступен в качестве прибора для рутинных
исследований. Уол и Дэйл (Wall, Dale, 1968) отвергли
формальный подход к построению системы, включив
в нее некоторых современных представителей, образу-
ющих покоящиеся стадии. Они впервые показали, что
одни из наиболее распространенных родов современ-
ных динофлагеллят в морском планктоне, известные
в 1960-х годах как Peridinium и Gonyaulax, — поли-
филетические таксоны. В настоящее время известно
260 видов современных динофлагеллят, образующих
покоящиеся стадии (Head, 1996). Также было показа-
но, что акритархи (Acritarcha) — одноклеточные мор-
фологически разнообразные микрофоссилии со слабо
орнаментированными органическими клеточными
покровами — по морфологии и химическому составу
сходны с динофлагеллятами (Loeblich III, 1976а). Было
высказано предположение, что наиболее ранние иско-
паемые остатки динофлагеллят (раннепалеозойские)
могут быть найдены именно среди акритарх (Lister,
1970). Действительно, у акритарх, обнаруженных в
древних скалистых породах раннего кембрия возрас-
том в 520 миллионов лет, были найдены специфичные
для динофлагеллят диностерены и 4-а-метил-24-этил-
холестен. Поэтому предполагают, что динофлагелляты
связаны с акритархами и могли появиться 800 миллио-
нов лет назад (Moldowan, Talyzina, 1998).
Детальные классификации динофлагеллят были
созданы в 1980-х годах (Loeblich III, 1982; Dodge, 1984;
Soumia, 1986). Буйак и Дэвис (Bujak, Davies, 1983)
предложили систему перидиниоидных динофлагеллят,
объединив современные и ископаемые роды в единой
классификации. Особое внимание было уделено хими-
ческому составу клеточной стенки цист. Эта система
явилась важным вкладом на пути к созданию единой
классификации динофлагеллят.
В 1993 г. была опубликована единая классификация
современных и ископаемых динофлагеллят (до уровня
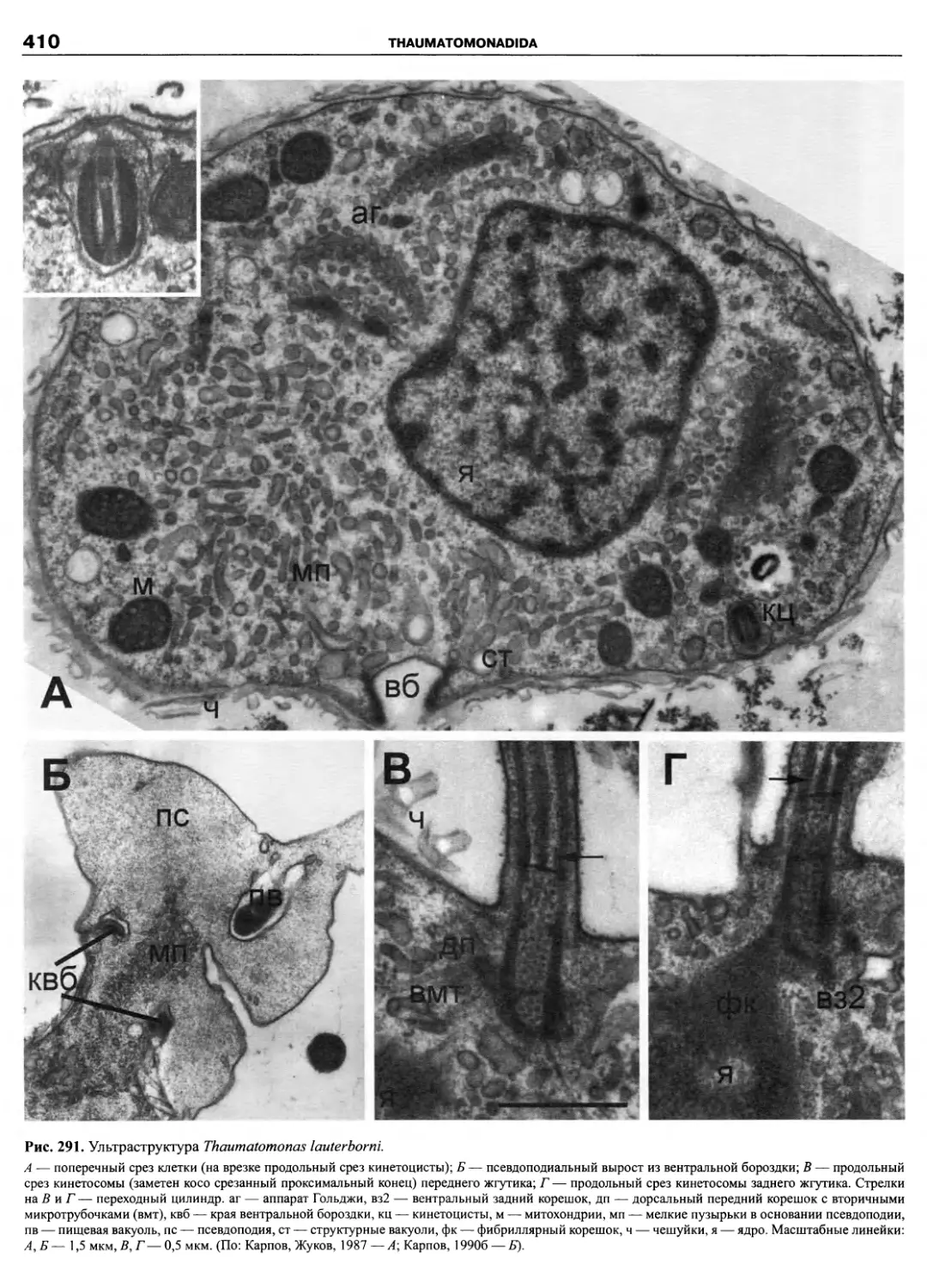
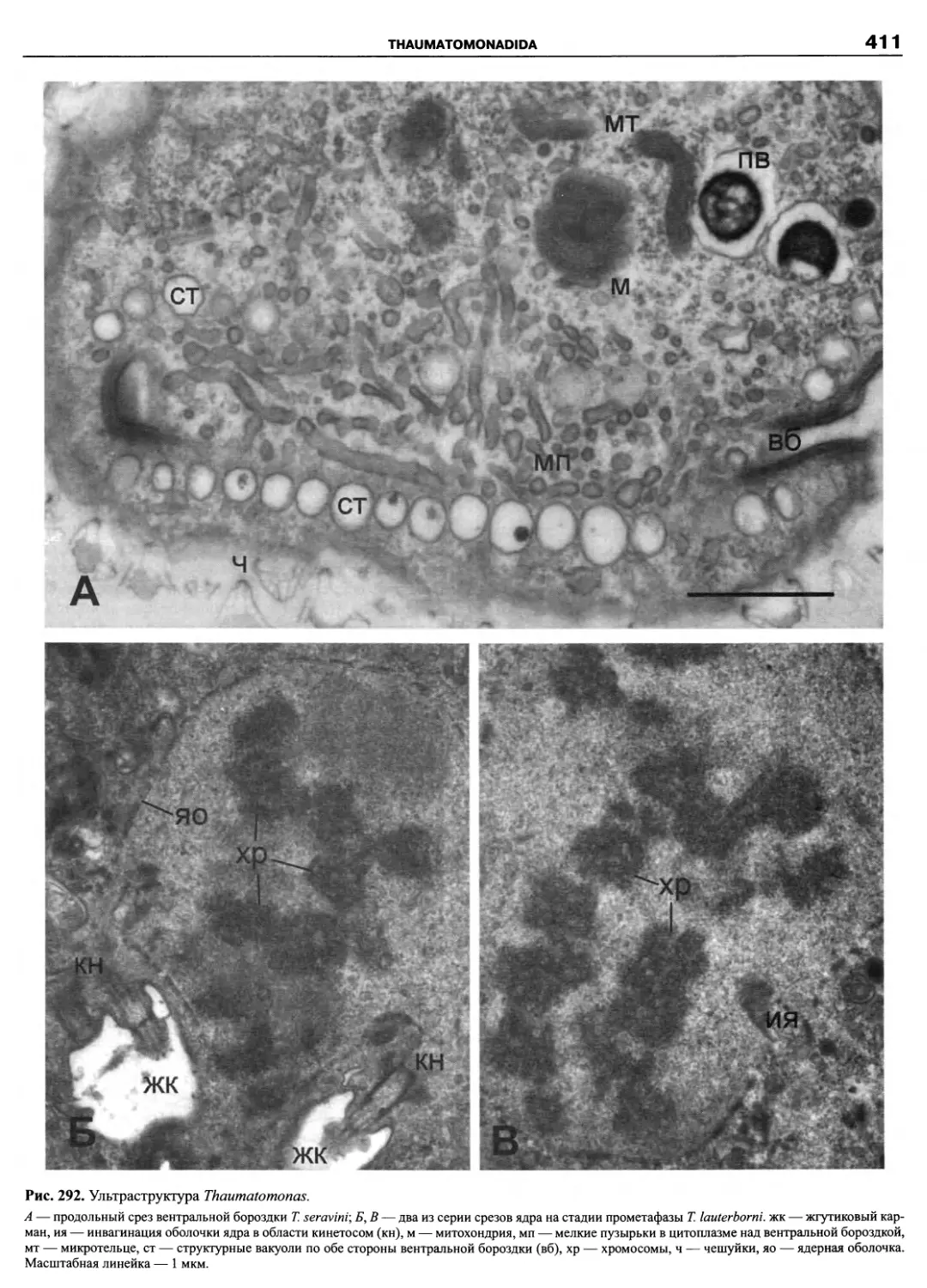
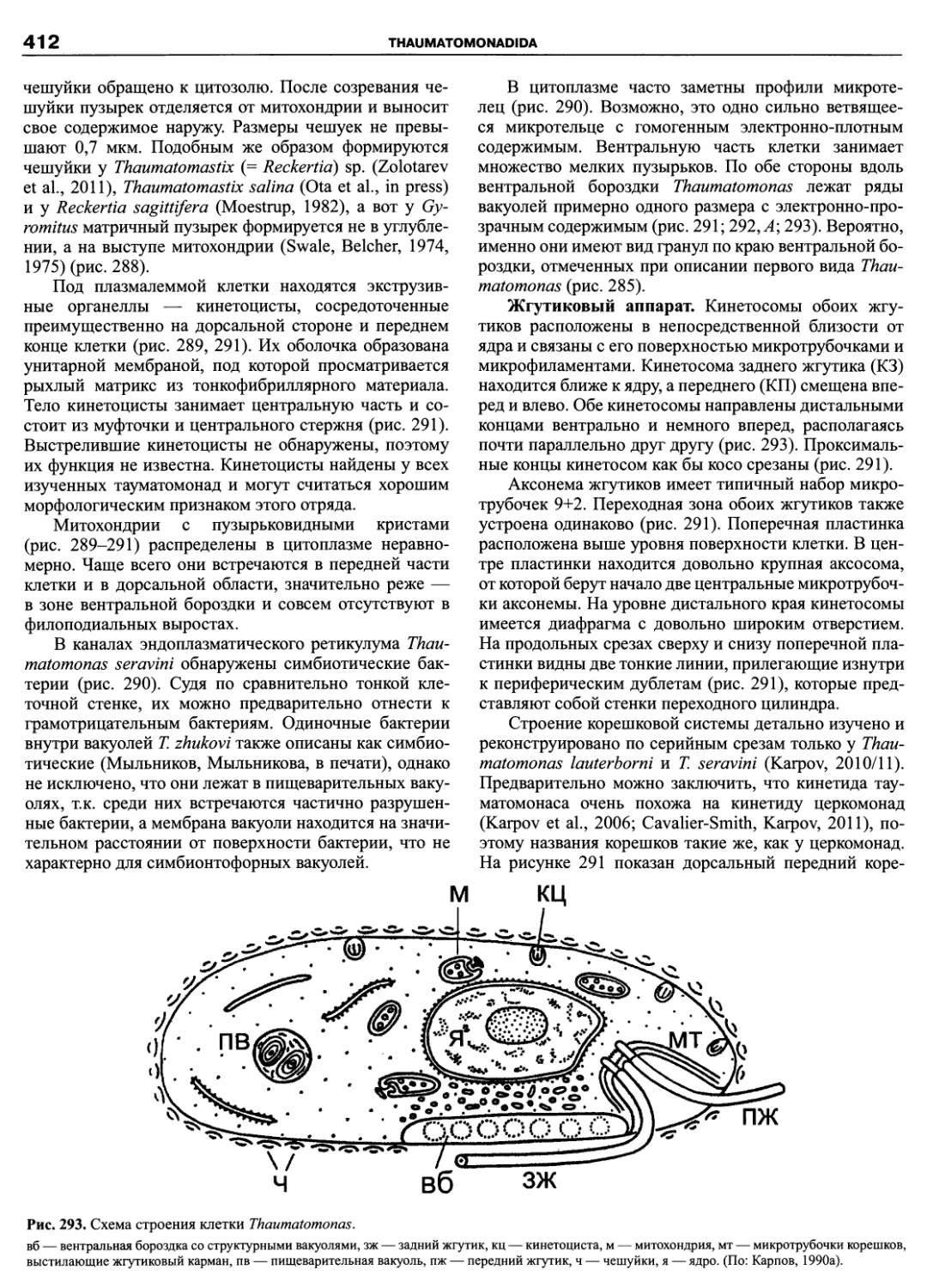
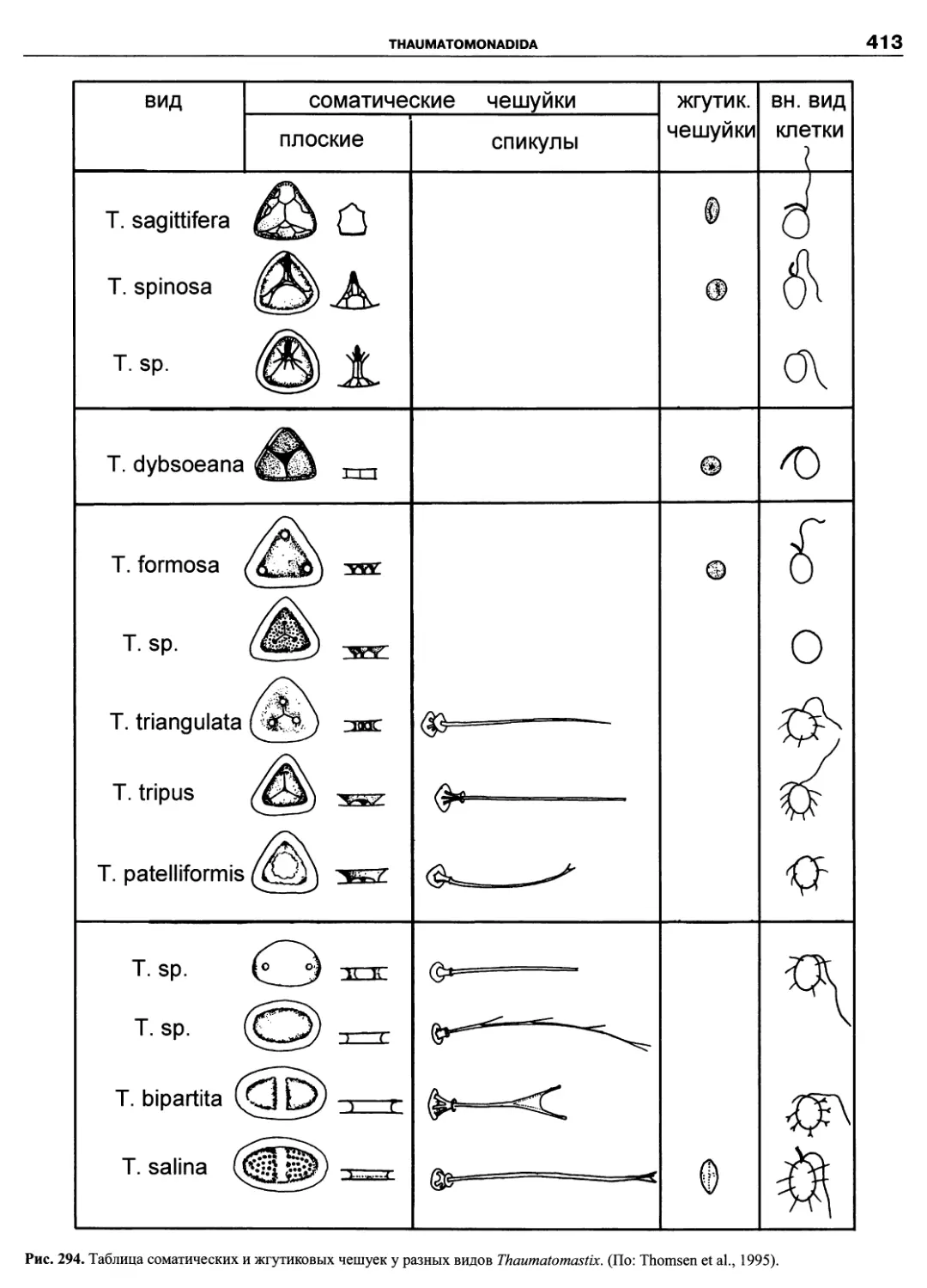
рода), в которой были обобщены все достижения в об-
ласти систематики и таксономии этой группы (Fensome
et al., 1993). Как признают сами авторы системы, их
классификация основана на детальных сведениях о по-
кровах клетки, в частности, о расположении пластинок
(табуляции) теки, и тщательном ранжировании таксо-
нов. В этом же году была опубликована классифика-
ция морского фитопланктона (Chretiennot-Dinet et al.,
1993), также до уровня рода, включающая динофла-
геллят и представляющая собой обновленный вариант
классификации Сурня (Soumia, 1986).
Исторически описание новых таксонов динофла-
геллят осуществлялось как зоологами-протистологами,
так и ботаниками-фикологами, как неонтологами, так и
палеонтологами, которые руководствовались правила-
ми и рекомендациями либо Международного кодекса
ботанической номенклатуры (МКБН), либо Междуна-
родного кодекса зоологической номенклатуры (МКЗН).
В ряде случаев такая ситуация создала дополнительные
сложности как при описании, так и при сведении в си-
нонимы названий некоторых таксонов. Если палеонто-
логи договорились подчиняться МКБН, следуя предло-
жению Дауни и соавторов (Downie et al., 1961), то среди
DINOFLAGELLATA
9
неонтологов до настоящего времени существуют раз-
ногласия, однако большинство из них следует МКБН.
Фенсом и соавторы (Fensome et al., 1993) не считают
динофлагеллаты ни растениями, ни животными, а рас-
сматривают их как протистов. Однако, ввиду того, что
не существует официально принятого кодекса про-
тистов, ими было решено следовать МКБН, т.к. боль-
шинство специалистов как неонтологов, так и палеон-
тологов следуют именно ему. Положение в таксономии
динофлагеллат усугублялось еще тем, что палеонтологи
вводили свои названия таксонов на основе морфологии
гипнозигот (покоящихся цист), независимо от неонто-
логов, которые в подавляющем большинстве случаев
описывают новые таксоны на основе вегетативных кле-
ток. Лишь в последние 40-45 лет наметился прогресс,
и выявилось биологическое соответствие около 260
названий покоящихся цист вегетативным стадиям. Эти
названия (родовые) приняты во внимание в настоящей
работе и даны в описаниях родов.
Классификация
Классификация дана по Фенсому и соавторам (Fen-
some et al., 1993) с дополнениями современных родов:
Akashiwo, Amphidiniella, Apicoporus, Azadinium, Baldinia,
Barrufeta, Biecheleria, Biecheleriopsis, Borghiella, Bysma-
trum, Cabra, Chimonodinium, Cryptoperidiniopsis, Echin-
idium, Esoptrodinium, Galeidinium, Glochidinium, Gyno-
gonadinium, Gyrodiniellum, Halostylodinium, Jadwigia,
Karenia, Karlodinium, Lessardia, Luciella, Moestrupia,
Palatinus, Paragymnodinium, Pfiesteria, Pileidinium, Pla-
giodinium, Polarella, Prosoaulax, Pseudopfiesteria, Pseu-
dothecadinium, Pyramidodinium, Rhinodinium, Steeckeria,
Takayama, Tintinnophagus, Togula, Tovellia, Tyranno-
dinium, Vulcanodinium, и семейств Borghiellaceae, Cen-
trodiniaceae, Kareniaceae, Lessardiaceae, Pfiesteriaceae
и Tovelliaceae (Horiguchi, 1995a; Steidinger et al., 1996,
2006; Javomicky, 1997; Zonneveld, 1997; Faust, Steiding-
er, 1998; Boltovskoy, 1999; Montresor et al., 1999; Daugb-
jerg et al., 2000; Horiguchi et al., 2000; de Salas et al., 2003;
Saldarriaga et al., 2003; Carbonell-Moore, 2004; Murray,
Patterson, 2004; Calado, Moestrup, 2005; Horiguchi, Suki-
gara, 2005; Jeong et al., 2005; Lindberg et al., 2005; Litaker
et al., 2005; Tamura, Horiguchi, 2005; Tamura et al. 2005;
Bergholtz et al., 2006; Murray et al., 2006; Gomez, 2007;
Hansen et al., 2007; Mason et al., 2007; Moestrup et al.,
2008; Sparmann et al., 2008; Calado et al., 2009; Craveiro
et al., 2009; Gomez et al., 2009b; Moestrup et al., 2009a, b;
Tillmann et al., 2009; Coats et al., 2010; Hemandez-Becer-
ril et al., 2010; Kang et al., 2010; Craveiro et al., 2011; Han-
sen, Daugbjerg, 2011; Kang et al., 2011; Nezan, Chomerat.
2011; Sampedro et al., 2011); символ «§» перед названием
рода означает ископаемый. Список родов современных
динофлагеллат с данными оригинальных литературных
источников доступен на сайте: http://www.dinophyta.
org/index.php (Elbrachter, ftoppenrath, 2010). Названия
новых таксонов динофлагеллат, включая видовые, так-
же доступны на сайте: http://www.algaebase.org/ (M.D.
Guiry, G.M Guiry, 2011).
Некоторые роды до настоящего времени остаются
«библиографическими призраками» (Larsen, Soumia,
1991); среди не упомянутых в данной работе ука-
занные авторы приводят Adinimonas Schiller 1928;
Dinasteromonas Bursa 1971; Dinoceras Schiller 1931;
Nephrodinium Meunier 1910; Pseudoactiniscus Bursa
1969.
Тип Dinoflagellata (Butschli) Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Подтип Dinokaryota Fensome, Taylor, Norris, Sarjeant, Wharton
et Williams 1993
Класс Dinophyceae Pascher 1914
Подкласс Gymnodiniphycidae Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993
Порядок Gymnodiniales Apstein 1909
Подпорядок Gymnodiniineae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Сем. Gymnodiniaceae (Bergh) Lankester 1885
Gymnodinium Stein 1878, emend. G. Hansen et Moes-
trup in Daugbjerg, G. Hansen, J. Larsen et Moestrup 2000; Akashi-
wo G. Hansen et Moestrup in Daugbjerg, G. Hansen, J. Larsen et
Moestrup 2000; §1Algidasphaeridium Matsuoka et Bujak 1988;
Amphidinium Claparede et Lachmann 1859, emend. Flo Jorgensen,
S. Murray et Daugbjerg 2004; Apicoporus Sparmann, Leander et
Hoppenrath 2008; Barrufeta N. Sampedro et S. Fraga in N. Sampe-
dro, S. Fraga, Penna, Casabianca, Zapata, Fuentes Grunewald, Riobo
et Camp 2011; Cochlodinium Schutt 1896; Esoptrodinium P. Javor-
nicky 1997; Filodinium J. Cachon et M. Cachon 1968; Gyrodiniel-
lum Kang, Jeong et Moestrup in Kang, Jeong, Moestrup et Park 2011;
Gyrodinium Kofoid et Swezy 1921, emend. G. Hansen et Moestrup
in Daugbjerg, G. Hansen, J. Larsen et Moestrup 2000; Katodinium
Fott 1957; Lepidodinium Watanabe, Suda, Inouye, Sawaguchi et Chi-
hara 1990, emend. G. Hansen, Botes et de Salas 2007; Paragymno-
dinium Kang, Jeong, Moestrup et Shin in Kang, Jeong, Moestrup,
Shin, Nam, Park, de Salas, Kim et Noh 2010; Paulsenella Chatton
1920; Pavillardia Kofoid et Swezy in Kofoid 1920; Pheopolykrikos
Chatton 1933, emend. Matsuoka et Fukuyo 1986; Prosoaulax Cala-
do et Moestrup 2005; Schizochytriodinium Elbrachter 1988; Sylto-
dinium Drebes 1988; Togula Flo Jorgensen, S. Murray et Daugbjerg
2004; Torodinium Kofoid et Swezy 1921; Woloszynskia Thompson
1951.
Сем. Kareniaceae Bergholtz, Daugbjerg, Moestrup et Feman-
dez-Tejedor 2006
Karenia G. Hansen et Moestrup in Daugbjerg, G. Hansen,
J. Larsen et Moestrup 2000; Karlodinium G. Hansen et Moestrup in
Daugbjerg, G. Hansen, J. Larsen et Moestrup 2000; Takayama de
Salas, Bolch, Botes et Hallegraeff in de Salas, Bolch, Botes, Nash,
Wright et Hallegraeff 2003.
Сем. Polykrikaceae Kofoid et Swezy 1921
Polykrikos Butschli 1873.
Сем. Tovelliaceae Moestrup, Lindberg et Daugbjerg in Lind-
berg, Moestrup et Daugbjerg 2005
Tovellia Moestrup, Lindberg et Daugbjerg in Lindberg,
Moestrup et Daugbjerg 2005; Bernardinium Chodat in Chodat et
Zender 1923; Jadwigia Moestrup, Lindberg et Daugbjerg in Lind-
berg, Moestrup et Daugbjerg 2005.
Сем. Wamowiaceae Lindemann 1928
Warnowia Lindemann in Engler et Prantl 1928; Erythropsi-
dinium P.C. Silva 1960; Greuetodinium Loeblich III 1980; Nemato-
dinium Kofoid et Swezy 1921; Nematopsides Greuet 1973; Protery-
thropsis Kofoid et Swezy in Kofoid 1920; Protopsis Kofoid et Swezy
1921.
Gymnodiniineae incertae sedis: Gynogonadinium Gomez
2007; Pyramidodinium Horiguchi et Sukigara 2005.
Подпорядок Actiniscineae (Soumia) Fensome, Tay-
lor, Norris, Sarjeant, Wharton et Williams 1993
10
DINOFLAGELLATA
Сем. Actiniscaceae Kutzing 1844
Actiniscus (Ehrenberg) Ehrenberg 1843; §Carduifolia Ho-
vasse 1932 ex Hovasse 1932; §Cinctactiniscus Dumitrica 1973; Dia-
ster Meunier 1910; §Foliactiniscus Dumitrica 1973.
Сем. Dicroerismaceae Fensome, Taylor, Norris, Saijeant,
Wharton et Williams 1993
Dicroerisma Taylor et Cattell 1969.
Порядок Ptychodiscales Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993
Сем. Ptychodiscaceae Willey et Hickson 1909
Подсем. Dinogymnioideae (Saijeant et Downie) Fensome
etal. 1993
§Dinogymnium Evitt, Clarke et Verdier 1967; §Alisogym-
nium Lentin et Vozzhennikova 1990; §Amphigymnium Lentin et
Vozzhennikova 1990; §Yolkinigymnium Lentin et Vozzhennikova
1990.
Подсем. Ptychodiscoideae (Schutt) Fensome, Taylor, Nor-
ris, Saijeant, Wharton et Williams 1993
Ptychodiscus Stein 1883; Balechina Loeblich Jr. et Loe-
blich III 1968; Berghiella Kofoid et Michener 1911; ICeratoperi-
dinium Margalef 1969 ex Loeblich III 1980; ILissai'ella Lindemann
in Engler et Prantl 1928; ILophodinium Lemmermann 1910.
Сем. Amphitholaceae Poche 1913 ex Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993
Amphitholus Schutt 1895; Achradina Lohmann 1903; ?Mo-
naster Schutt 1895; Sclerodinium Dodge 1981.
Сем. Brachydiniaceae Soumia 1972
Brachydinium Taylor 1963; Asterodinium Soumia 1972; Microcera-
tium Soumia 1972.
Порядок Suessiales Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Сем. Suessiaceae Fensome, Taylor, Norris, Sarjeant, Wharton
et Williams 1993, emend. Moestrup, Lindberg et Daugbjerg
2009
§Suessia Morbey 1975; §Beaumontella Below 1987; Bie-
cheleria Moestrup, Lindberg et Daugbjerg 2009; Biecheleriopsis
Moestrup, Lindberg et Daugbjerg 2009; §Noricysta Bujak et Fisher
1976; Pelagodinium Siano, Montresor, Probert et de Vargas in Siano,
Montresor, Probert, Not et de Vargas 2010; Polarella Montresor,
G. Procaccini et D.K. Stoecker 1999; Protodinium Lohmann 1908,
emend. Schiller 1928; §Wanneria Below 1987.
Сем. Borghiellaceae Moestrup, Lindberg et Daugbjerg 2009
Borghiella Moestrup, G. Hansen et Daugbjerg 2008; Baldi-
nia G. Hansen et Daugbjerg in G. Hansen, Daugbjerg et Henriksen
2007.
Сем. Symbiodiniaceae Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Symbiodinium Freudenthal 1962.
Подкласс Peridiniphycidae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993
Порядок Gonyaulacales Taylor 1980
Подпорядок Rhaetogonyaulacineae Norris 1978
Сем. Shublikodiniaceae Wiggins 1973
§Rhaetogonyaulax Saijeant 1966; §Dapcodinium Evitt
1961.
Сем. Mancodiniaceae Fensome, Taylor, Norris, Saijeant,
Wharton et Williams 1993
Подсем. Mancodinioideae (Below) Fensome, Taylor, Nor-
ris, Sarjeant, Wharton et Williams 1993
§Mancodinium Morgenroth 1970; §?Dinaurelia Wille et
Gocht 1985; §Maturodinium Morgenroth 1970; ^Rosswangia Wille
et Gocht 1985.
Подсем. Luehndeoideae Fensome, Taylor, Norris, Saijeant,
Wharton et Williams 1993: §Luehndea Morgenroth 1970.
Сем. Cladopyxiaceae Stein 1883
Cladopyxis Stein 1883; Amphidoma Stein 1883; ^IBey-
richodinium Below 1990; §Cladopyxidium McLean 1972; §Drug-
gidium Habib 1973; §Fibradinium Morgenroth 1968; §Freboldinium
Below 1990; ^Gillnia Cookson et Eisenack 1960; §Glyphanodini-
um Drugg 1964; §Histiocysta Davey 1969; Micracanthodinium De-
flandre 1937; §Microdinium Cookson et Eisenack 1960; §Mikrocysta
Bjaerke 1980; Palaeophalacroma Schiller 1928; Peridiniella Kofoid
et Michener 1911; §Praussia Williams, Lentin et Fensome 1998;
§Subtilidinium Morgenroth 1968; ^Walvisia Miles 1990; §Werveko-
dinium Below 1990.
Сем. Scriniocassiaceae Saijeant et Downie 1966
§Scriniocassis Gocht 1964; §lParascriniocassis Below
1990.
Сем. Lotharingiaceae Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
§Lotharingia Below 1990; §Saxodinium Below 1990.
Сем. Pareodiniaceae Gocht 1957
Подсем. Broomeoideae (Eisenack) Fensome, Taylor, Nor-
ris, Saijeant, Wharton et Williams 1993
§Broomea Cookson et Eisenack 1958; §Aprobolocysta
Duxbury 1977; §Batioladinium Brideaux 1975; §Cantulodinium Al-
berti 1961; §Carpathodinium Drugg 1978; §?Evansia Pocock 1972;
§Kalyptea Cookson et Eisenack 1960; §Netrelytron Saijeant 1961;
§Paraevansia Below 1990; Paranet rely tron Saijeant 1966.
Подсем. Pareodinioideae Below 1990
§Pareodinia Deflandre 1947; §Arkellea Below 1990;
§Gochteodinia Norris 1978; §Gresslyodinium Below 1990; §llm-
batodinium Vozzhennikova 1967; §Lacrymodinium Albert, Evitt et
Stein 1986; §Paragonyaulacysta Johnson et Hills 1973; §Protoba-
tioladinium Nohr-Hansen 1986.
Pareodiniaceae incertae sedis: §?Cornudinium Pocock 1972;
§Tabulodinium Dodekova 1990; §?Pluriarvalium Sarjeant
1962.
Rhaetogonyaulacineae incertae sedis: §Rhiptocorys Lejeune-
Carpentier et Sarjeant 1983.
Подпорядок Gonyaulacineae Fensome, Taylor, Nor-
ris, Saijeant, Wharton et Williams 1993
Сем. Gonyaulacaceae Lindemann 1928
Подсем. Leptodinioideae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993
§Leptodinium Klement 1960; §Acanthaulax Saijeant 1968;
§Ambonosphaera Fensome 1979; §Amphorula Dodekova 1969;
§Areosphaeridium Eaton 1971; §Carpodinium Cookson et Eisenack
1962; §Cernicysta Stover et Helby 1987; ^Clathroctenocystis Wig-
gins 1972; ^Conosphaeridium CooksonetEisenack 1969; §Ctenido-
dinium Deflandre 1939; §Cymososphaeridium Davey 1982; §Diac an-
thum Habib 1972; §Dichadogonyaulax Sarjeant 1966; §Durotrigia
Bailey 1987; §Eatonicysta Stover et Evitt 1978; ^Egmontodinium
Gitmez et Sarjeant 1972; §Emmetrocysta Stover 1975; §Endoscri-
nium (Klement) Vozzhennikova 1967; §?Energlynia Saijeant 1976;
§Eodinia Eisenack 1936; §Herendeenia Wiggins 1969; §Kleithrias-
phaeridium Davey 1974; §Lanterna Dodekova 1969; §Limbodinium
Riding 1987; §Lithodinia Eisenack 1935; §1Litosphaeridium Davey
et Williams 1966; §Lophocysta Manum 1979; §Meiourogonyaulax
Sarjeant 1966; §Occisucysta Gitmez 1970; ^Ochetodinium Dam-
assa 1979; §Oligosphaeridium Davey et Williams 1966; §Omatia
Cookson et Eisenack 1958; §?Perisseiasphaeridium Davey et Wil-
liams 1966; §Rhynchodiniopsis Deflandre 1935; §Rigaudella Below
1982; §Rotosphaeropsis Davey 1988; §Sirmiodinium Alberti 1961;
§lStiphrosphaeridium Davey 1982; §Systematophora Klement
1960; §Tehamadinium Jan du Chene, Becheler, Helenes et Masure
1986; ^IWanaea Cookson et Eisenack 1958.
Подсем. Cribroperidinioideae Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993
§Cribroperidinium Neale et Saijeant 1962; §Achilleo-
dinium Eaton 1976; §?Aldorfia Stover et Evitt 1978; §Apteodinium
Eisenack 1958; §Araneosphaera Eaton 1976; §Carpatella Grigoro-
vich 1969; §Conneximura May 1980; §Cordosphaeridium Eisenack
1963; §Cryptarchaeodinium Deflandre 1939; §Damassadinium Fen-
some, Taylor, Norris, Saijeant, Wharton et Williams 1993; §Diphyes
DINOFLAGELLATA
11
Cookson 1965; ^Disphaerogena O. Wetzel 1933; §Epitricysta
Stover et Helby 1987; §Florentinia Davey et Verdier 1973; §Hapso-
cysta Davey 1979; §Hystrichokolpoma Klumpp 1953; §Ifecysta Jan
du Chene et Adediran 1985; §lKallosphaeridium de Coninck 1969;
§Kenleyia Cookson et Eisenack 1965; §Korystocysta Woollam 1983;
LingplodimumVJa\\ 1967; §Meristaulax Saijeant 1984; ^Millioudo-
dinium Stover et Evitt 1978; §Muratodinium Drugg 1970; §4Panda-
dinium Courtinat 1989; Protoceratium Bergh 1881, emend. Kofoid
etMichener 1911; §Samlandia Eisenack 1954; §SilicisphaeraV>&NQy
et Verdier 1976; §Spongodinium Deflandre 1936; §Stoveracysta
Clowes 1985; §Thalassiphora Eisenack et Gocht 1960; §Subathua
Khanna et H.P. Singh 1980; §Turbiosphaera Archangelsky 1969;
§ Wigginsiella Lucas-Clark 1987.
Подсем. Gonyaulacoideae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993 ex Okolodkov 2001
Gonyaulax Diesing 1866, emend. Kofoid 1911; Acan-
thogonyaulax (Kofoid) Graham 1942; §Achomosphaera Evitt 1963;
Amylax Meunier 1910; §Ataxiodinium Reid 1974; §lAvellodinium
Duxbury 1977; §Bitectatodinium Wilson 1973; ^Cannosphae-
ropsis O. Wetzel 1933; ^Catastomocystis C. Singh 1983; §Cor-
rudinium Stover et Evitt 1978; ^lEctosphaeropsis Londeix et Jan
du Chene 1988; §Evittosphaerula Manum 1979; §Exiguisphaera
Duxbury 1979; §Gonyaulacysta Deflandre 1964; §Hystrichosphae-
ropsis Deflandre 1935; ^Hystrichostrogylon Agelopoulos 1964;
§Impagidinium Stover et Evitt 1978; §Nematosphaeropsis Deflan-
dre et Cookson 1955; §lOkerisphaeridium Kunz 1990; §Penta-
dinium Gerlach 1961; §Prionodinium Leffingwell et Morgan 1977;
§Psaligonyaulax Sarjeant 1966; §Pterodinium Eisenack 1958;
§Rottnestia Cookson et Eisenack 1961; §Spiniferites Mantell 1850;
Spiraulax Kofoid 1911, emend. Carbonell-Moore 1996; §Tectato-
dinium Wall 1967; §Trabeculidium Duxbury 1980; §?Triblastula
O. Wetzel 1933; §Tubotuberella Vbzzhennikova 1967; §Uniponti-
dinium Wrenn 1988.
Gonyaulacaceae incertae sedis: §Actinotheca Cookson et
Eisenack 1960; §Aireiana Cookson et Eisenack 1965; ^Ampho-
rosphaeridium Davey 1969; ^Arachnodinium Wilson et Clowes
1982; ^Archeotectatum Habib 1972; ^IBarbatacysta Courtinat
1989; §Belodinium Cookson et Eisenack 1960; §Callaiosphaeridium
Davey et Williams 1966; ^Chytroeisphaeridia (Sarjeant) Downie
et Saijeant 1965; ^Cometodinium Deflandre et Courteville 1939;
^Compositosphaeridium Dodekova 1974; §lCoronifera Cookson et
Eisenack 1958; ^Corradinisphaeridium Masure 1986; §lDiphasio-
sphaera Duxbury 1980; ^Discorsia Duxbury 1977; ^Dissiliodin-
ium Drugg 1978; ^lEmslandia Gerlach 1961; Eschar isphaeridia
Erkmen et Sarjeant 1980; ^Fibrocysta Stover et Evitt 1978; ^Fili-
sphaera Bujak 1984; ^Foucheria Monteil; §Furzidinium Stancliffe
1991; ^Galeacysta Corradini et Biffi 1988; §Gelatia Bujak 1984;
§Glossodinium loannides, Stavrinos et Downie 1980; ^Gongylodin-
ium Fenton, Neves et Piel 1980; ^Gordiacysta Miles 1990; ^IHabi-
bacysta Head, Norris et Mudie 1989; §lHelbydinium Snape 1992;
§Hemiplacophora Cookson et Eisenack 1965; §lHemisphaeridium
Bujak 1980; ^Histiophora Klement 1960; §Hurunuia Wilson 1984;
§?Hystrichodinium Deflandre 1935; §?Hystrichosphaerina Alberti
1961; ^.Invertocysta Edwards 1984; §Isthmocystis Duxbury 1979;
§?Kaiwaradinium Wilson 1978; ^Kiokansium Stover et Evitt 1978;
^.Komewuia Cookson et Eisenack 1960; ^Lagenorhytis Duxbury
1979; ^Lanternosphaeridium Morgenroth 1966; ^Liesbergia
Berger 1986; §?Melitasphaeridium Harland et Hill 1979; §Mosaico-
dinium Dodekova 1990; ^Muraticysta Head, Norris et Mudie 1989;
^Nelchinopsis Wiggins 1972; Neo diacrodium Fedorova-Shakh-
mundes 1975; ^Nexosispinum Davey 1979; ^IPervosphaeridium
Yun Hyesu 1981; ^Pilosidinium Courtinat 1989; §lPolystephane-
phorus Saijeant 1961; ^IProtoellipsodinium Davey et Verdier 1971;
^IPyxidinopsis Habib 1975; ^Sqturnodinium Brinkhuis, Powell et
Zevenboom 1992; §lScriniodinium Klement 1957; ^Sentusidinium
Saijeant et Stover 1978; §Sirmiodiniopsis Drugg 1978; ^IStepho-
dinium Deflandre 1936; ^Surculosphaeridium Davey, Downie,
Sarjeant et Williams 1966; §Taeniophora Klement 1960; §lTricho-
dinium Eisenack et Cookson 1960; ^Vexillocysta Harding 1990 ex
Harding in Williams, Lentin et Fensome 1998; ^IXenicodinium Kle-
ment 1960; ^lYalkalpodinium Morgan 1980.
Сем. Ceratocoryaceae Lindemann 1928
Ceratocorys Stein 1883; §Maghrebinia Below 1981.
Сем. Areoligeraceae Evitt 1963
§Areoligera Lejeune-Carpentier 1938; §Adnatosphaeridium
Williams et Downie 1966; §Atlantodinium Zotto, Drugg et Habib
1987; §Canningia Cookson et Eisenack 1960; §Canninginopsis Cook-
son et Eisenack, 1960; §Cassidium Drugg 1967; §Cauveridinium
Khowaja Ateequzzaman et Jain 1990; §Chiropteridium Gocht 1960;
§Circulodinium Alberti 1961; §Cyclonephelium Deflandre et Cookson
1955; §Gerdiocysta Liengjarem, Costa et Downie 1980; §Glaphyro-
cysta Stover et Evitt 1978; §Membranophoridium Gerlach 1961; §Pa-
lynodinium Gocht 1970; §Renidinium Morgenroth 1968; §Riculacysta
Stover 1977; §Schematophora Deflandre et Cookson 1955; §Senonias-
phaera Clarke et Verdier 1967; §Tenua Eisenack 1958.
Подпорядок Ceratiineae Fensome, Taylor, Norris,
Saijeant, Wharton et Williams 1993
Сем. Ceratiaceae Wiley et Hickson 1909
Ceratium Schrank 1793; §Aptea Eisenack 1958; §?Aus-
tralisphaera Davey 1978; §Balmula Bint 1986; §Endoceratium
Vbzzhennikova 1965; §Muderongia Cookson et Eisenack 1958;
§Nyktericysta Bint 1986; §Odontochitina Deflandre 1935; §Odonto-
chitinopsis Eisenack 1961; §Phoberocysta Millioud 1969; §Pseudo-
ceratium Gocht 1957; § Vesperopsis Bint 1986; §Xenascus Cookson
et Eisenack 1969.
Сем. Goniodomaceae Lindemann 1928
Подсем. Goniodomoideae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993 ex Okolodkov 2001
Goniodoma Stein 1883; §Heteraulacacysta Drugg et Loe-
blich Jr. 1967; Pachydinium Pavillard 1915.
Подсем. Gambierdiscoideae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993
Gambierdiscus Adachi et Fukuyo 1979; Coolia Meunier
1919; Ostreopsis Schmidt 1902.
Подсем. Helgolandinioideae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993
Helgolandinium von Stosch 1969; Alexandrium Halim
1960; Fragilidium Balech 1959 ex Loeblich III 1965; Pyrophacus
Stein 1883.
Подсем. Pyrodinioideae Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Pyrodinium L. Plate 1906.
Сем. Pyrocystaceae Apstein 1909
Pyrocystis Murray 1885 ex Haeckel 1890, emend. Elbrach-
ter et Drebes 1978.
Gonyaulacales incertae sedis
Сем. Heterodiniaceae Lindemann 1928
Heterodinium Kofoid 1906.
Сем. Crypthecodiniaceae Biecheler 1938 ex Chatton 1952
Crypthecodinium Biecheler 1938.
Сем. Thecadiniaceae Balech 1956
Thecadinium Kofoid et Skogsberg 1928, emend. Hoppen-
rath 2000; Plagiodinium M.A. Faust et Balech 1993; Planodinium
Saunders et Dodge 1984; Pseudothecadinium Hoppenrath et Selina
2006; Thecadiniopsis Croome, Hallegraeff et Tyler 1987.
Gonyaulacineae incertae sedis: §Aiora Cookson et Eisenack
1960; §Amiculosphaera Harland 1979; ‘lAmphidiniella Horiguchi
1995b; §Atopodinium Drugg 1978; §Balcattia Cookson et Eisenack
1974; §Balteocysta Stover et Evitt 1978; §Batiacasphaera Drugg
1970; §Boreocysta Stover et Evitt 1978; §Bourkidinium Morgan 1975;
§Bradleyella Woollam 1983; §Caligodinium Drugg 1970; §Carnar-
vonodinium Parker 1988; §Cassiculosphaeridia Davey 1969; §Cau-
ca Davey et Verdier 1971; Centrodinium Kofoid 1907; §Cerebro-
cysta Bujak 1980; §Chlamydophorella Cookson et Eisenack 1958;
§Cirrusphaera Monteil 1992; §Cleistosphaeridium Davey, Downie,
Saijeant et Williams 1966; §Codoniella Cookson et Eisenack 1961;
12
DINOFLAGELLATA
§Dapsilidinium Bujak, Downie, Eaton et Williams 1980; §Desmo-
cysta Duxbury 1983; §Dingodinium Cookson et Eisenack 1958;
^.Dissimulidinium May, Stevens et Partridge 1987; §Distatodinium
Eaton 1976; Dolichodinium Kofoid et Adamson 1933; §Dorocysta
Davey 1970; §Duosphaeridium Davey et Williams 1966; §Ellip-
sodinium Clarke et Verdier 1967; §Ellipsoidictyum Klement 1960;
§Elytrocysta Stover et Evitt 1978; §Epiplosphaera Klement 1960;
§Exochosphaeridium Davey, Downie, Saijeant et Williams 1966;
§Fistulacysta Davey 1988; §Flamingoia Stevens et Helby 1987;
§Fusiformacysta Morgan 1975; §Gagiella Backhouse 1988; §Gar-
dodinium Alberti 1961; Goniodinium Dangeard 1927; §Gramocysta
Lund et Lund-Christensen in Daniels, Lund, Lund-Christensen et
Uffenorde 1990; §Hapsidaulax Saijeant 1975; §Heslertonia Saijeant
1966; §Heterosphaeridium Cookson et Eisenack 1968; §Hurlandsia
Lister et Batten 1988; ^Impletosphaeridium Morgenroth 1966; §/и-
dodinium Kumar 1986; §Jansonia Pocock 1972; §Labyrinthodinium
Piasecki 1980; §Lacunodinium He Chengquan 1984; §Laticavodin-
ium Wilson et Sarjeant in Sarjeant 1984; §Levisphaera Davey 1988;
Membranilarnacia Eisenack 1963; §Membranilarnax O. Wetzel
1933; §Mendicodinium Morgenroth 1970; §Microsphaeridium Bene-
dek 1972; §Montanarocysta Corradini 1973; §Mooradinium Back-
house 1988; §Omatidium Courtinat in Courtinat et Gaillard 1980;
§Pannosiella Batten et Lister 1988; §Papuadinium Davey 1988;
§Parvocavatus Gitmez 1970; §Parvulodinium Dodekova 1975;
§lPaucibucina Jiabo 1978; §Paucisphaeridium Bujak, Downie, Ea-
ton et Williams 1980; §Peridictyocysta Cookson et Eisenack 1974;
§Phanerodinium Deflandre 1937; §Polygonifera Habib 1972; §Pro-
ductodinium Davey 1988; §Raetiaedinium Kirsch 1991; §Raphido-
dinium Deflandre 1936; §Resticulasphaera Harding 1990 ex Harding
in Williams, Lentin et Fensome 1998; §?Reticulatosphaera Matsuoka
1983; §Romanodinium Baltes 1971; §Sahulidinium Stover et Helby
1987; §Sokolovidinium Lentin et Vbzzhennikova 1990; §Spinifer-
opsis He Chengquan 1984; §Tanyosphaeridium Davey et Williams
1966; ^Tetrachacysta Backhouse 1988; Trigo nopyxidia Cookson
et Eisenack 1961; §Valensiella Eisenack 1963; §Warrenia Monteil
1992; §Xiphophoridium Saijeant 1966.
Порядок Peridiniales Haeckel 1894
Подпорядок Heterocapsineae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Сем. Heterocapsaceae Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Heterocapsa Stein 1883, emend. Iwataki et Fukuyo 2003;
§Andreedinium Below 1987; §Angustidinium Goodman et Evitt
1981; Cachonina Loeblich III 1968; §Facetodinium Bjaerke 1980;
§Liasidium Drugg 1978; §Moesiodinium Antonescu 1974; §Ovali-
cysta Bjaerke 1980; §Parvocysta Bjaerke 1980; §Reutlingia Drugg
1978; §Susadinium Dorhofer et Davies 1980.
Подпорядок Glenodiniineae Fensome, Taylor, Nor-
ris, Saijeant, Wharton et Williams 1993
Сем. Glenodiniaceae Wiley et Hickson 1909
Glenodinium Ehrenberg 1837; Glenodiniopsis Woloszynska
1916.
Подпорядок Peridiniineae Poche 1913
Сем. Peridiniaceae Ehrenberg 1831
Подсем. Palaeoperidinioideae (Vbzzhennikova) Bujak et
Davies 1983
§Palaeoperidinium Deflandre 1934; §Chichaouadinium
Below 1981; §Colonsaydinium Hunt in Hunt, Andrews et Gilbert-
son 1985; ^IDiconodinium Eisenack et Cookson 1960; §Dioxya
Cookson et Eisenack 1958; §Geiselodinium Krutzsch 1962; §Gingi-
nodinium Cookson et Eisenack 1960; §llndosphaera Kumar 1986;
§Jinhudinium Qian Zeshu, Chen Yongxiang et He Chengquan 1986;
§Laciniadinium McIntyre 1975; §Luxadinium Brideaux et McIntyre
1975; §Palaeohystrichophora Deflandre 1935; ^IPhthanoperidini-
um Drugg et Loeblich Jr. 1967; §Saeptodinium Harris 1974; §Soani-
ella Vbzzhennikova 1967; §Subtilisphaera Jain et Millipied 1973;
§Teneridinium Krutzsch 1962; §Vectidinium Liengjarem, Costa et
Downie 1980; §Williamsidinium Lentin 1983.
Подсем. Deflandreoideae Bujak et Davies 1983
§Deflandrea Eisenack 1938; §Abratopdinium Mao Shaozhi
et Mohr 1992; §Alterbidinium Lentin et Williams 1985; §Amphidi-
adema Cookson et Eisenack 1960; §Andalusiella Riegel 1974; §Ar-
validinium Lentin et Vbzzhennikova 1990; §Bulbodinium O. Wetzel
1960; §Cerodinium Vbzzhennikova 1967; §Chatangiella Vbzzhen-
nikova 1963; §Eucladinium Stover et Evitt 1978; §Eurydinium Sto-
ver et Evitt 1978; §lEvittodinium Deflandre 1964; §Gippslandia
Stover et Williams 1987; §Godavariella Mehrotra et Sarjeant 1987;
§Haxagonifera Cookson et Eisenack 1961; §Isabelidinium Lentin et
Williams 1977; §Lentinia Bujak 1980; §Manumiella Bujak et Davies
1983; §Nelsoniella Cookson et Eisenack 1960; §Palaeocystodinium
Alberti 1961; §Pierceites Habib et Drugg 1987; §Planoperidinium
de Coninck 1986; §lPyxidiella Cookson et Eisenack 1958; §Saty-
rodinium Lentin et Manum 1986; §Senegalinium Jain et Millipied
1973; §Smolenskiella Vbzzhennikova 1967; §Spinidinium Cookson
et Eisenack 1962; §lSumatradinium Lentin et Williams 1976; §Sval-
bardella Manum 1960; §Trivalvadinium Islam 1983; §Uvatodinium
Vbzzhennikova 1963; §Vozzhennikovia Lentin et Williams 1976;
§Xenikoon Cookson et Eisenack 1960; §lXuidinium Mao Shaozhi et
Norris 1988.
Подсем. Calciodinelloideae Fensome, Taylor, Norris, Sar-
jeant, Wharton et Williams 1993
§Calciodinellum Deflandre 1947; §Alasphaera Keupp
1979; §Bicarinellum Deflandre 1948; Bysmatrum M.A. Faust et
Steidinger 1998; §lCalcicarpinum Deflandre 1948; §Calcigonellum
Deflandre 1948; §Calcipterellum Deflandre 1948; §Carinellum Ke-
upp 1981; ^Cubodinellum Keupp 1987; ^Dimorphosphaera Ke-
upp 1980; ^Echinodinella Keupp 1980; Ensiculifera Balech 1967;
§Gonellum Keupp 1987; ^Heptasphaera Keupp 1979; §?Keup-
pisphaera Lentin et Williams 1989; §lNephrodinella Keupp 1981;
^Orthocarinellum Keupp 1987; §Orthopithonella Keupp in Keupp
et Mutterlose 1984; §Pirumella Bolli 1980; §Praecalcigonellum
Keupp et Versteegh 1989; ^Pithonella Lorenz 1902; Scrippsiella
Balech 1959 ex Loeblich III 1965; Sliter ia Krasheninnikov et Ba-
sov 1983; §Sphaerodinella Keupp et Versteegh 1989; §Tetrameros-
phaera Willems 1985; §Tetratropis Willems 1990.
Подсем. Ovoidinioideae (Norris) Bujak et Davies 1983
§Ovoidinium Davey 1970; §Ascodinium Cookson et
Eisenack 1960; §Bohaidina Jiabo 1978; §Bosedinia He Chengquan
1984; §Cepadinium Duxbury 1983; ^Corculodinium Batten et
Lister 1988; ^ICraspedodinium Cookson et Eisenack 1960; §Epeli-
dosphaeridia Davey 1969; §Holmwoodinium Batten 1985; §Huang-
hedinium Zhu Shenzhao, He Chengquan et Jin Guangxing in He
Chengquan, Zhu Shenzhao et Jin Guangxing 1989; §Leberidocysta
Stover et Evitt 1978; §Parabohaidina Jiabo 1978; ^Paraperidinium
Jin Guangxing, He Chengquan et Zhu Shenzhao in He Chengquan,
Zhu Shenzhao et Jin Guangxing 1989; §Prominangularia Jiabo
1978; §?Ripea Batten 1985.
Подсем. Wetzelielloideae (Vbzzhennikova) Bujak et Da-
vies 1983
§Wetzeliella Eisenack 1938; §Apectodinium (Costa et Dow-
nie) Lentin et Williams 1977; §Charlesdowniea Lentin et Vbzzhen-
nikova 1989; §Dracodinium Gocht 1955; §Kisselovia Vbzzhen-
nikova 1963; §Rhombodinium Gocht 1955; §Wilsonidium Lentin et
Williams 1976.
Подсем. Lithoperidinioideae (Deflandre) Fensome, Taylor,
Norris, Saijeant, Wharton et Williams 1993
§Lithoperidinium Deflandre 1933; Jus ell a Vbzzhenniko-
va 1963.
Подсем. Peridinioideae Bergh 1881
Peridinium Ehrenberg 1832; Durinskia Carty et Cox 1986;
Galeidinium Tamura et Horiguchi in Tamura, Shimada et Horigu-
chi 2005; Glochidinium Boltovskoy 1999; Kansodinium Carty et
Cox 1986; Kryptoperidinium Lindemann 1924; Palatinus Craveiro,
Calado, Daugbjerg et Moestrup 2009; Peridiniopsis Lemmermann
1904.
Peridiniaceae incertae sedis: §Maduradinium Cookson et
Eisenack 1970; §Morkallacysta Harris 1974; §Muiradinium Harland
DI NOFLAG ELLATA
13
et Sarjeant 1970; Pentapharsodinium Indelicate et Loeblich III 1986;
§Talimudinium Mao Shaozhi et Norris 1988; §Zhongyuandinium
Zhu Shenzhao, He Chengquan et Jin Guangxing in He Chengquan,
Zhu Shenzhao et Jin Guangxing 1989.
Сем. Congruentidiaceae Schiller 1935
Подсем. Congruentidioideae Schiller 1935
Congruentidium Abe 1927; §Brigantedinium Reid 1977;
§Capillicysta Matsuoka et Bujak in Matsuoka, Bujak et Shimazaki
1987; §Cristadinium Head, Norris et Mudie 1989; §Deflagymnium
Olaru 1978; §Gerlachidium Benedeket Sarjeant 1981; §Leipokatium
Bradford 1975; §Lejeunecysta Artzner et Dorhofer 1978; § Multispi-
nula Bradford 1975; §Omanodinium Bradford 1975; §Phelodinium
Stover et Evitt 1978; Protoperidinium Bergh 1881; §Pseudoalterbia
Mao Shaozhi et Norris 1988; §Quinquecuspis Harland 1977; §Sele-
nopemphix Benedek 1972; §Stelladinium Bradford 1975; §Trinov-
antedinium Reid 1977; §Votadinium Reid 1977; §Xandarodinium
Reid 1977.
Подсем. Diplopsalioideae Abe 1981
Diplopsalis Bergh 1881; Boreadinium Dodge et Hermes
1981; Diplopelta Stein 1883; Diplopsalopsis Meunier 1910; Disso-
diumAbe 1941; §Dubridinium Reid 1977; Gotoius Abe 1981; Kolk-
witziella Lindemann 1919; Lebouraia Abe 1941 ex Soumia 1986;
Oblea Balech 1964 ex Loeblich Jr. et Loeblich III 1966; Preperi-
dinium Mangin 1913.
Сем. Lessardiaceae Carbonell-Moore 2004
Lessardia Saldarriaga et Taylor in Saldarriaga, Leander,
Taylor et Keeling 2003.
Сем. Podolampaceae Lindemann 1928
Podolampas Stein 1883; Blepharocysta Ehrenberg 1873;
Gaarderia Carbonell-Moore 1994; Heterobractum Carbonell-Moore
1994; Lissodinium Matzenauer, 1933 emend. Carbonell-Moore 1991;
Mysticella Carbonell-Moore 1994.
Сем. Pfiesteriaceae Steidinger et Burkholder in Steidinger,
Burkholder, Glasgow Jr., Hobbs, Garrett, Truby, Noga et Smith
1996, emend. Litaker, Steidinger, P.L. Mason, Shields et Tester
in Litaker, Steidinger, P.L. Mason, Landsberg, Shields, Reece,
Haas, Vbgelbein, Vandersea, Kibler et Tester 2005
Pfiesteria Steidinger et Burkholder in Steidinger, Burkhold-
er, Glasgow Jr., Hobbs, Garrett, Truby, Noga et Smith 1996, emend.
Litaker, Steidinger, P.L. Mason, Shields et Tester in Litaker, Steiding-
er, Mason, Landsberg, Shields, Reece, Haas, Vbgelbein, Vandersea,
Kibler et Tester 2005; Chimonodinium Craveiro, Calado Daugb-
jerg, G. Hansen et Moestrup 2011; Cryptoperidiniopsis Steidinger,
Landsberg, P.L. Mason, Vbgelbein, Tester et Litaker 2006; Luciella
P.L. Mason, Jeong, Litaker, Reece et Steidinger in Mason, Litaker,
Jeong, Ha, Reece, Stokes, Park, Steidinger, Vandersea, Kibler, Tester
et Vbgelbein 2007; Pseudopfiesteria Litaker, Steidinger, P.L. Ma-
son, Shields et Tester in Litaker, Steidinger, P.L. Mason, Landsberg,
Shields, Reece, Haas, Vbgelbein, Vandersea, Kibler et Tester 2005;
Stoeckeria Jeong, J.S. Kim, Park, J.H. Kim, S. Kim, I. Lee, S.H. Lee,
Ha et Yih 2007; Tyrannodinium Calado, Craveiro, Daugbjerg et
Moestrup 2009.
Peridiniineae incertae sedis: Amphidiniopsis Woloszynska
1928; Cabra S. Murray et Patterson 2004; §Bellatudinium Yu Jingx-
ian, Sun Mongrong, Sun Suying et Mao Shaozhi 1981; Herdmania
Dodge 1981, emend. Hoppenrath 2000; §Octodinium Wrenn et Hart
1988; Rhinodinium S. Murray, Hoppenrath, Yoshimatsu, Toriumi et
J. Larsen in S. Murray, Hoppenrath, Preisfeld, J. Larsen, Yoshimatsu,
Toriumi et Patterson 2006; §Umbodinium Bint 1983.
Peridiniales incertae sedis: Chalubinskia Woloszynska 1916;
Staszicella Woloszynska 1916; Thaurilens Pavillard 1917; Vulcano-
dinium Nezan et Chomerat 2011.
Peridiniphycidae incertae sedis
Сем. Comparodiniaceae Vozzhennikova 1979
§Valvaeodinium Morgenroth 1970; §Biorbifera Habib
1972.
Сем. Oxytoxaceae Lindemann 1928
Oxytoxum Stein 1883.
Сем. Centrodiniaceae Hemandez-Becerril in Hemandez-
Becerril, Bravo-Sierra, Ceballos-Corona, Esqueda-Lange,
Escobar-Morales et Parra-Toriz 2010
Centrodinium Kofoid 1907.
Сем. Stephanelytraceae Stover, Saijeant et Drugg 1977
§Stephanelytron Sarjeant 1961; §Lagenadinium Piel 1985.
Сем. Dollidiniaceae Fensome, Taylor, Norris, Sarjeant, Whar-
ton et Williams 1993
§Dollidinium Helby et Stover 1987; §Horologinella Cook-
son et Eisenack 1962.
Peridiniphycidae incertae sedis: Adenoides Balech 1956; Am-
yloodinium Brown et Hovasse 1946; §Apiculadinium Yu Jingxian,
Sun Mongrong, Sun Suying et Mao Shaozhi 1981; §Aquadulcum
Harland et Sarjeant 1970; Archaeosphaerodiniopsis Rampi 1943;
Azadinium Elbrachter et Tillmann in Tillmann, Elbrachter, Krock,
John et Cembella 2009; Dinosphaera Kofoid et Michener 1912;
§Dodekovia Dorhofer et Davies 1980; §Gorkadinium Loeblich Jr.
et Loeblich III 1966; §Hebecysta Bujak et Fisher 1976; §Heiber-
gella Bujak et Fisher 1976; Heteraulacus Diesing 1850; §?Lobio-
nella Batten et Lister 1988; §Lunatadinium Brideaux et McIntyre
1975; Melanodinium Schiller 1935; §Mikropithon Agelopoulos
1967; §Muiriella Churchill et Sarjeant 1962; §Neuffenia Brenner
et Durr 1986; §Opaeopsomus Pocock 1972; §lOrobodinium Gocht
et Wille 1990; §Palaeoglenodinium Deflandre 1935; §Palaeohys-
trichodinium He Chengquan, Zhu Shenzhao et Jin Guangxing 1989;
§Palaeosphaerium Gorka 1965; §Palaeotetradinium Deflandre
1936; §Pentafidia Backhouse 1988; §Phallocysta Dorhofer et Da-
vies 1980; §Pseudodeflandrea Alberti 1959; §Pseudokomewuia He
Chengquan 1980; §Pseudostephodinium Yu Jingxian, Sun Mon-
grong, Sun Suying et Mao Shaozhi 1981; Roscoffia Balech 1956;
§Stenopyxinium Deflandre 1968; §Sverdrupiella Bujak et Fisher
1976; ^Tetranguladinium Yu Jingxian, Sun Mongrong, Sun Suying
et Mao Shaozhi 1983; Thompsodinium Bourrelly 1970; §Vectensia
Batten et Lister 1988.
Подкласс Dinophysiphycidae Mohn 1984 ex Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams 1993
Порядок Nannoceratopsiales Piel et Evitt 1980
Сем. Nannoceratopsiaceae Gocht 1970
§Nannoceratop sis Deflandre 1939.
Порядок Dinophysiales Kofoid 1926
Сем. Dinophysiaceae Stein 1883
Dinophysis Ehrenberg 1839; Citharistes Stein 1883; Dino-
furcula Kofoid et Skogsberg 1928; Heteroschisma Kofoid et Skogs-
berg 1928 ex Schiller 1931; Histioneis Stein 1883; Histiophysis Ko-
foid et Skogsberg 1928; Latifascia Loeblich Jr. et Loeblich III 1966;
Metadinophysis Nie et Wang 1941; Metaphalacroma Tai et Skogs-
berg 1934; Ornithocercus Stein 1883; ^Palaeodinophysis Vozzhen-
nikova et Sheshegova 1989; Pseudophalacroma Jorgensen 1923 ex
Lebour 1925; Sabulodinium Saunders et Dodge 1984; Sinophysis Nie
et Wang 1944; §TTernia Helby et Stover 1987; Mhaumatodinium
Bohm 1933.
Сем. Amphisoleniaceae Lindemann 1928
Amphisolenia Stein 1883; Triposolenia Kofoid 1906.
Сем. Oxyphysiaceae Soumia 1984
Oxyphysis Kofoid 1926.
Подкласс Prorocentrophycidae Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993
Порядок Prorocentrales Lemmermann 1910
Сем. Prorocentraceae Stein 1883
Prorocentrum Ehrenberg 1834; Haplodinium Klebs 1912;
Mesoporos Lillick 1937.
Dinophyceae incertae sedis
Порядок Desmocapsales Pascher 1914
Сем. Desmocapsaceae Pascher 1914
Desmocapsa Pascher 1914; Adinimonas Schiller 1928;
Desmomastix Pascher 1914; Pleromonas Pascher 1914.
14
DINOFLAGELLATA
Порядок Phytodiniales Christensen, 1962 ex Loeblich
III 1970
Сем. Phytodiniaceae Klebs 1912
Phytodinium Klebs 1912; Cystodinedria Pascher 1944;
Cystodinium Klebs 1912; Dinamoebidium Pascher 1916; Dinastrid-
ium Pascher 1927; Halostylodinium Horiguchi, Yoshizawa-Ebata in
Horiguchi, Yoshizawa-Ebata et Nakayama 2000; Hemidinium Stein
1878; Hypnodinium Klebs 1912; Manchudinium Skvortzov 1972;
Rhizodinium Baumeister in Bourrelly 1955, ex Loeblich Jr. et Loe-
blich III 1968; Spiniferodinium Horiguchi et Chihara 1987; Stylo-
dinium Klebs 1912; Tetradinium Klebs 1912.
Сем. Dinocloniaceae Pascher 1931
Dinoclonium Pascher 1927; Dinothrix Pascher 1914; IRu-
fusiella Loeblich III 1967.
Сем. Gloeodiniaceae Pascher ex Schiller 1937
Gloeodinium Klebs 1912.
Порядок Thoracosphaerales Tangen in Tangen, Brand,
Blackwelder et Guillard 1982
Сем. Thoracosphaeraceae Schiller 1930, emend. Tangen in
Tangen, Brand, Blackwelder et Guillard 1982
Thoracosphaera Kamptner 1927; ^Schizosphaerella De-
flandre et Dangeard 1938.
Dinophyceae incertae sedis
§Cobricosphaeridium Harland et Saijeant 1970; §Diacro-
canthidium Deflandre et Foucher 1967; §Prolixosphaeridium Davey,
Downie, Saijeant et Williams 1966; Pileidinium Tamura et Horigu-
chi 2005; Pseliodinium Soumia 1972; Pyramidodinium Horiguchi et
Sukigara 2005; §Suibindia Yu Jingxian 1982; Tintinnophagus Coats
in Coats, Kim, Bachvaroff, Handy et Delwiche 2010; §Xylochoarion
Erkmen et Saijeant 1978; Zoorhabdella Rhumbler 1909; Zooxan-
thella Brandt 1881.
Класс Blastodiniphyceae Fensome, Taylor, Norris, Saijeant,
Wharton et Williams 1993
Порядок Blastodiniales Chatton 1906
Сем. Blastodiniaceae Cavers 1913
Blastodinium Chatton 1906.
Сем. Protoodiniaceae J. Cachon 1964
Protoodinium Hovasse 1935.
Сем. Oodiniaceae Chatton 1920
Oodinium Chatton 1912; ‘IBargoniella Loeblich Jr. et Tap-
pan 1961; Caryotoma Hollande in Hollande et Cachon-Enjumet
1953; Crepidoodinium Lorn et Lawler in Lorn 1981; Piscinoodinium
Lorn 1981.
Сем. Apodiniaceae Chatton 1920
Apodinium Chatton 1907.
Сем. Cachonellaceae P.C. Silva 1980
Cachonella Rose et J. Cachon 1952; IDissodinium Klebs in
Pascher 1916, emend. Elbrachter et Drebes 1978.
Сем. Haplozoaceae Chatton 1920
Haplozoon Dogiel 1906.
Blastodiniales incertae sedis
Actinodinium Chatton et Hovasse 1937; Chytriodinium
Chatton 1912; Myxodinium J. Cachon, Cachon-Enjumet et Bouqua-
heux 1970; Oodinioides Reichenbach-Klinke 1970; Schizodinium
Chatton 1912.
Класс Noctiluciphyceae Fensome, Taylor, Norris, Saijeant,
Wharton et Williams 1993
Порядок Noctilucales Haeckel 1894
Сем. Noctilucaceae Saville-Kent 1881
Noctiluca Suriray in Lamarck 1816.
Сем. Kofoidiniaceae Taylor 1976
Kofoidinium Pavillard 1928; Pomatodinium J. Cachon et
Cachon-Enjumet 1966; Spatulodinium J. Cachon et M. Cachon
1967.
Сем. Leptodiscaceae Taylor 1976
Leptodiscus Hertwig 1877; Abedinium Loeblich Jr. et Loe-
blich III 1966; Cachonodinium Loeblich III 1980; Craspedotella
Kofoid 1905; Cymbodinium J. Cachon et M. Cachon 1967; Pet-
alodinium J. Cachon et M. Cachon 1969; Scaphodinium Margalef
1963.
Dinoflagellata incertae sedis: Agrosphaera Lo Bianco 1903;
Geodinium Chodat 1921; Gleba Bruguiere 1791; Glenoaulax
Diesing 1866; Halophilodinium Loeblich Jr. et Loeblich III 1966;
Parapodinium Chatton 1920; Proaulax Diesing 1866; Pterocystis
Lohmann 1904; Radiozoum Mingazzini 1904.
Подтип Syndinea (Corliss) Fensome, Taylor, Norris, Saijeant,
Wharton et Williams 1993
Класс Syndiniophyceae Loeblich III 1976
Порядок Syndiniales Loeblich III 1976
Сем. Syndiniaceae Chatton 1920
Syndinium Chatton 1910; Hematodinium Chatton et Pois-
son, 1930; Ichthyodinium Hollande et J. Cachon 1952; Merodinium
Chatton 1923; Solenodinium (Chatton) Chatton 1938; Trypanodini-
um Chatton 1912.
Сем. Amoebophryaceae J. Cachon 1964 ex Loeblich III
1970
Amoebophrya Koeppen 1894.
Сем. Sphaeriparaceae Loeblich III 1970
Sphaeripara Poche 1911; Atlanticellodinium J. Cachon et
Cachon-Enjumet 1965.
Сем. Duboscquellaceae Chatton, 1920 ex Loeblich III 1970
Duboscquella Chatton 1920; Dogelodinium Loeblich Jr. et
Loeblich III, 1966; Duboscquodinium Grasse in Chatton 1952; Kep-
penodinium Loeblich Jr. et Loeblich III 1966.
Syndiniales incertae sedis: Atelodinium Chatton 1920.
Dinoflagellata incertae sedis
Сем. Arpyloraceae Sarjeant 1978
§Arpylorus Calandra 1964.
Морфология
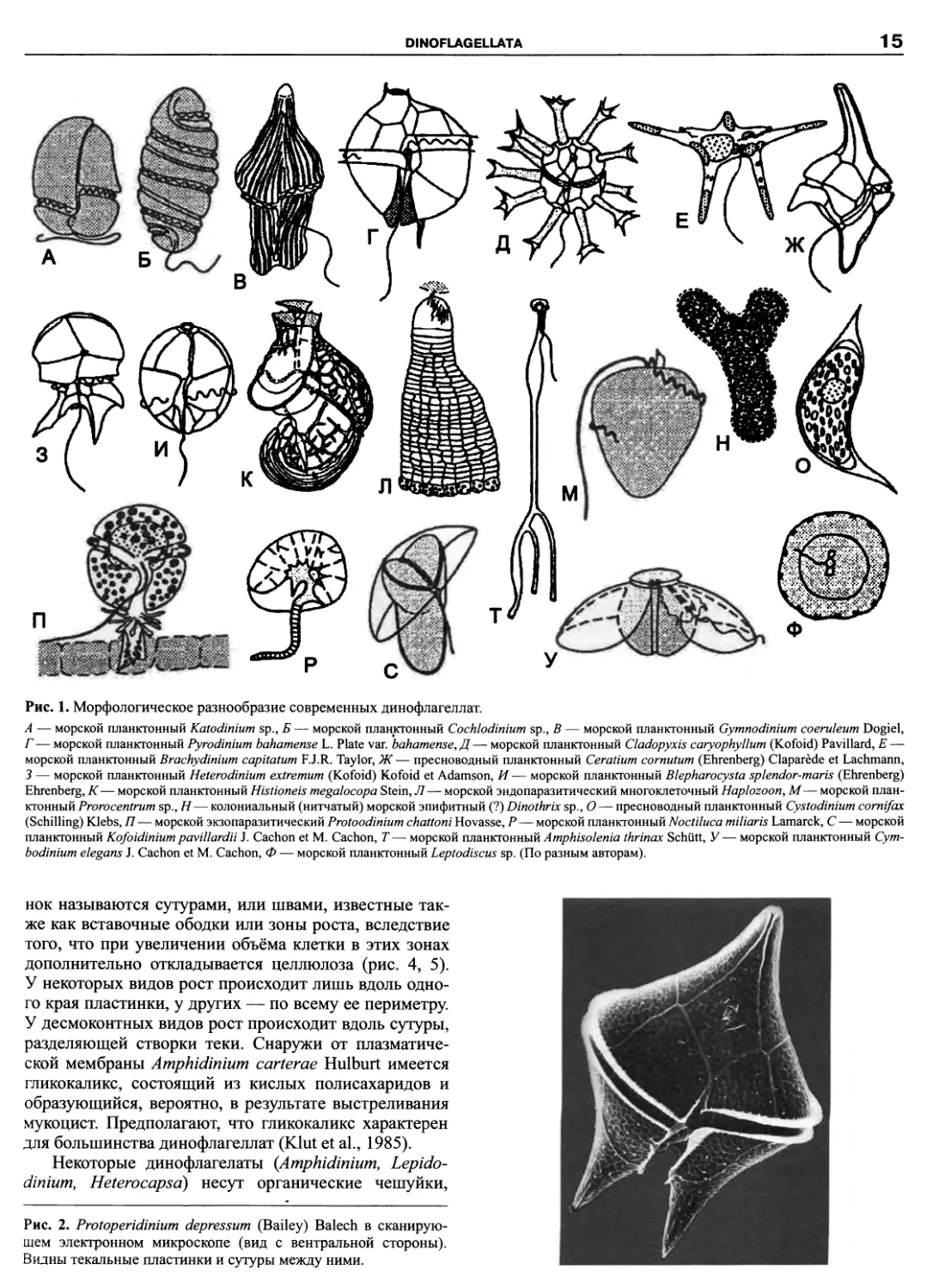
Большинство видов представлено одиночными
клетками. Некоторые образуют нитчатые колонии или
псевдоколонии, встречаются и многоклеточные формы.
Среди динофлагеллат преобладают виды с монадной
структурой, однако, также есть амебоидные, коккоид-
ные, пальмеллоидные и нитчатые организмы (рис. 1).
Морфологически динофлагеллат можно разделить
на панцирных и беспанцирных, или голых. Однако
клеточные покровы тех и других динофлагеллат имеют
единое строение и называются текой (Steidinger, Сох,
1980), амфиесмой (Loeblich III, 1970; Morrill, Loeblich
III, 1983a; Hohfeld, Melkonian, 1992), кортексом (Net-
zel, Durr, 1984) или аргиромом (Chatton, 1952). Под
плазматической мембраной лежит один или несколько
слоев текальных (амфиесмальных, или кортикальных)
пузырьков, под которым проходят микротрубочки. У
многих видов, классифицируемых в световом микро-
скопе как панцирные, амфиесмальные пузырьки содер-
жат текальные пластинки, состоящие из целлюлозы.
Клеточные покровы динофлагеллат могут содержать
сложный ароматический полимер диноспорин, сход-
ный со спорополенином наземных растений, но хи-
мически отличающийся от него (Kokinos et al., 1998).
Лишь клетки, содержащие диноспорин, могут сохра-
няться в ископаемом состоянии (Fensome et al., 1993).
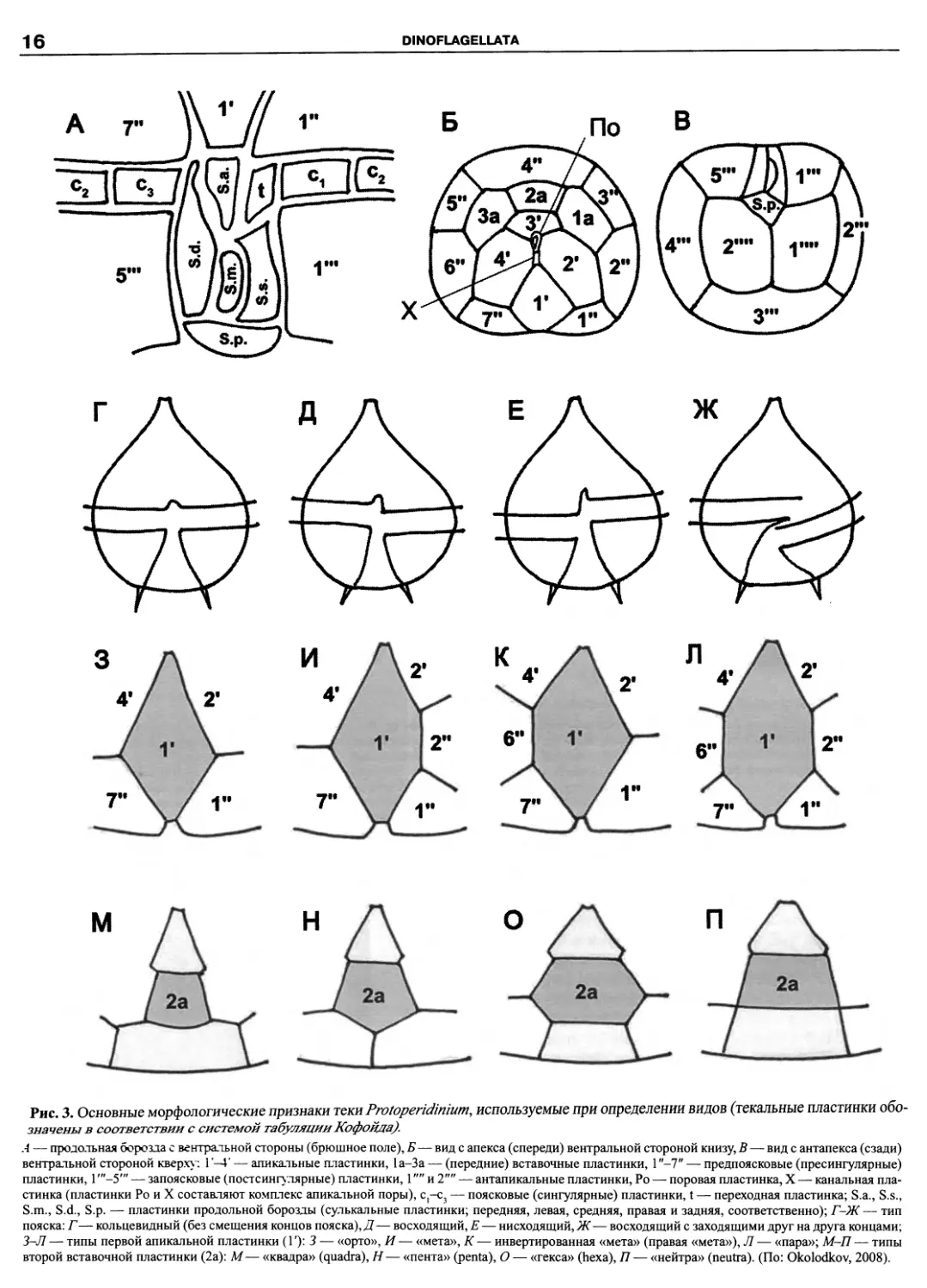
Текальные пластинки тесно примыкают друг к другу,
слегка перекрываясь между собой и образуя непрерыв-
ную поверхность (рис. 2, 3). Области контакта пласти-
DINOFLAGELLATA
15
Рис. 1. Морфологическое разнообразие современных динофлагеллат.
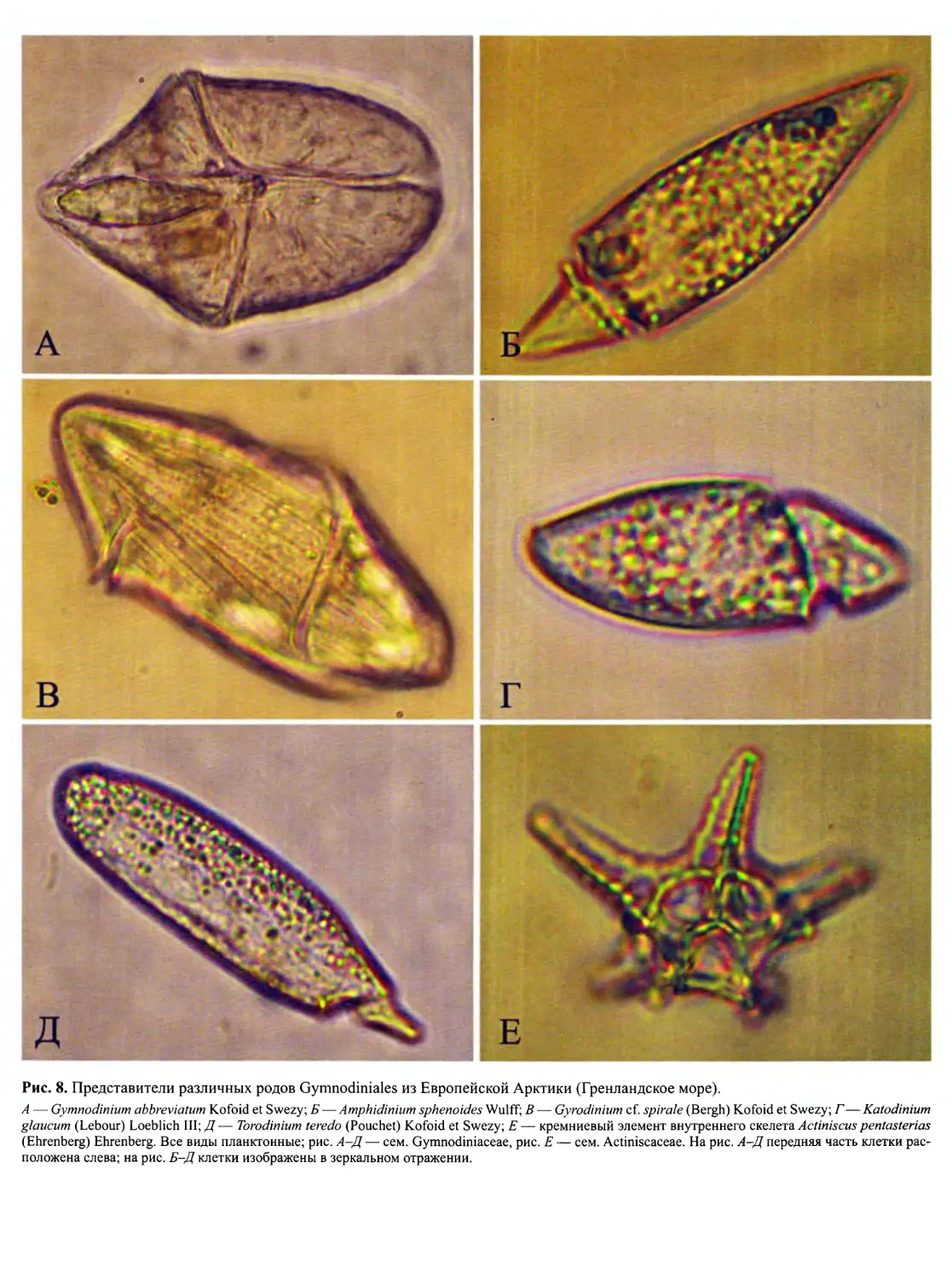
А — морской планктонный Katodinium sp., Б — морской планктонный Cochlodinium sp., В — морской планктонный Gymnodinium coeruleum Dogiel,
Г— морской планктонный Pyrodinium bahamense L. Plate var. bahamense, Д— морской планктонный Cladopyxis caryophyllum (Kofoid) Pavillard, E —
морской планктонный Brachydinium capitatum F.J.R. Taylor, Ж — пресноводный планктонный Ceratium cornutum (Ehrenberg) Claparede et Lachmann,
3 — морской планктонный Heterodinium extremum (Kofoid) Kofoid et Adamson, И — морской планктонный Blepharocysta splendor-maris (Ehrenberg)
Ehrenberg, К— морской планктонный Histioneis megalocopa Stein, Л— морской эндопаразитический многоклеточный Haplozoon, M— морской план-
ктонный Prorocentrum sp., Н— колониальный (нитчатый) морской эпифитный (?) Dinothrix sp., О — пресноводный планктонный Cystodinium comifax
(Schilling) Klebs, П— морской экзопаразитический Protoodinium chattoni Hovasse, P— морской планктонный Noctiluca miliaris Lamarck, C — морской
планктонный Kofoidinium pavillardii J. Cachon et M. Cachon, T — морской планктонный Amphisolenia thrinax Schutt, У — морской планктонный Cym-
bodinium elegans J. Cachon et M. Cachon, Ф — морской планктонный Leptodiscus sp. (По разным авторам).
нок называются сутурами, или швами, известные так-
же как вставочные ободки или зоны роста, вследствие
того, что при увеличении объёма клетки в этих зонах
дополнительно откладывается целлюлоза (рис. 4, 5).
У некоторых видов рост происходит лишь вдоль одно-
го края пластинки, у других — по всему ее периметру.
У десмоконтных видов рост происходит вдоль сутуры,
разделяющей створки теки. Снаружи от плазматиче-
ской мембраны Amphidinium carterae Hulburt имеется
гликокаликс, состоящий из кислых полисахаридов и
образующийся, вероятно, в результате выстреливания
мукоцист. Предполагают, что гликокаликс характерен
для большинства динофлагеллат (Klut et al., 1985).
Некоторые динофлагелаты (Amphidinium, Lepido-
dinium, Heterocapsa) несут органические чешуйки,
Рис. 2. Protoperidinium depressum (Bailey) Balech в сканирую-
щем электронном микроскопе (вид с вентральной стороны).
Видны текальные пластинки и сутуры между ними.
16
DINOFLAGELLATA
Рис. 3. Основные морфологические признаки теки Protoperidinium, используемые при определении видов (текальные пластинки обо-
значены в соответствии с системой табуляции Ко фонда).
А — продольная борозда с вентральной стороны (брюшное поле), Б— вид с апекса (спереди) вентральной стороной книзу, В — вид с антапекса (сзади)
вентральной стороной кверху: I'—Г — апикальные пластинки, 1а-3а — (передние) вставочные пластинки, 1 "-7" — предпоясковые (пресингулярные)
пластинки, Г"-5"' — запоясковые (постсингулярные) пластинки, 1и 2"" — антапикальные пластинки, Ро — поровая пластинка, X — канальная пла-
стинка (пластинки Ро и X составляют комплекс апикальной поры), С]-с3 — поясковые (сингулярные) пластинки, t — переходная пластинка; S.a., S.s.,
S.m., S.d., S.p. — пластинки продольной борозды (сулькальные пластинки; передняя, левая, средняя, правая и задняя, соответственно); Г-Ж — тип
пояска: Г— кольцевидный (без смещения концов пояска), Д— восходящий, Е— нисходящий, Ж— восходящий с заходящими друг на друга концами;
3-Л — типы первой апикальной пластинки (Г): 3 — «орто», И— «мета», А*— инвертированная «мета» (правая «мета»), Л— «пара»; М-П — типы
второй вставочной пластинки (2а): М— «квадра» (quadra), Н— «пента» (penta), О — «гекса» (hexa), 77— «нейтра» (neutra). (По: Okolodkov, 2008).
DINOFLAGELLATA
17
Рис. 4. Схема перекрывающихся текальных пластинок Proto-
peridinium grande (Kofoid) Balech.
3HT — зона, несущая трихоцисты; ЗР — зона роста; НП — налегающая
пластинка; ПП — подлегающая пластинка; ПТ — пора трихоцисты; С —
сутура. (По: Fensome et al., 1993).
подобно празинофитовым, примнезиофитовым и зо-
лотистым водорослям (рис. 6) (Pennick, Clarke, 1977;
Morrill, Loeblich III, 1981; Watanabe et al., 1990; Iwataki
et al., 2002, 2003, 2004, 2008; Sekida et al., 2003). У ви-
дов рода Heterocapsa чешуйки образуются в пузырь-
ках аппарата Гольджи (Morrill, Loeblich III, 1983b;
Hansen, 1989). Отдельные виды (Actiniscus pentasterias
(Ehrenberg) Ehrenberg) содержат внутренний кремние-
вый скелет.
Морфологи выделяют, по крайней мере, шесть ти-
пов табуляции теки динофлагеллат (рис. 7), или кор-
тикотипов (Netzel, Durr, 1984), в соответствии с назва-
ниями порядков: гимнодиниоидный (рис. 8, А-Е\ вкл.;
рис. 9, А-Д, вкл.), суессиоидный (рис. 9, Е, вкл.), про-
роцентроидный (рис. 10, A-В; рис. 11, вкл.), динофизо-
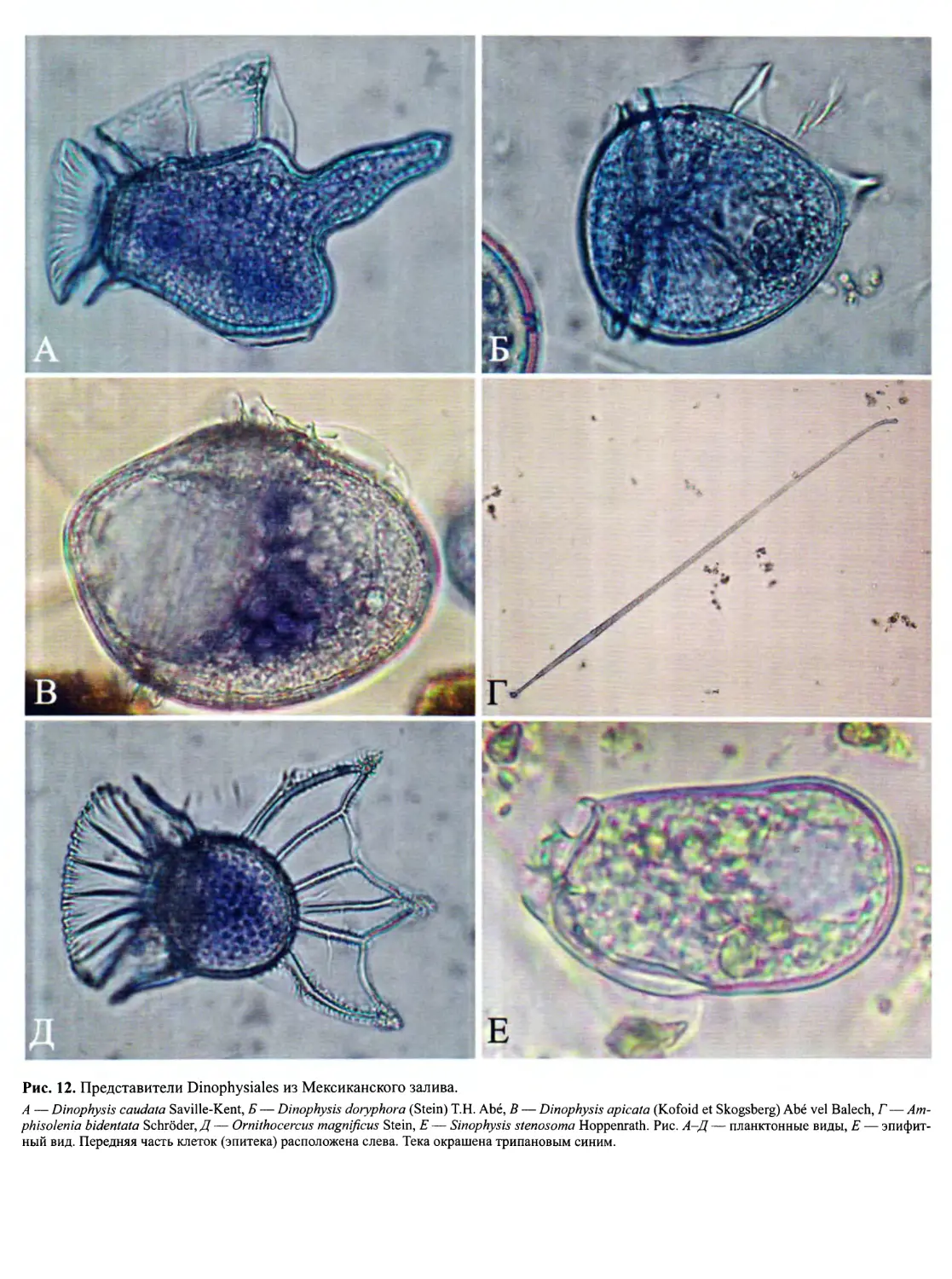
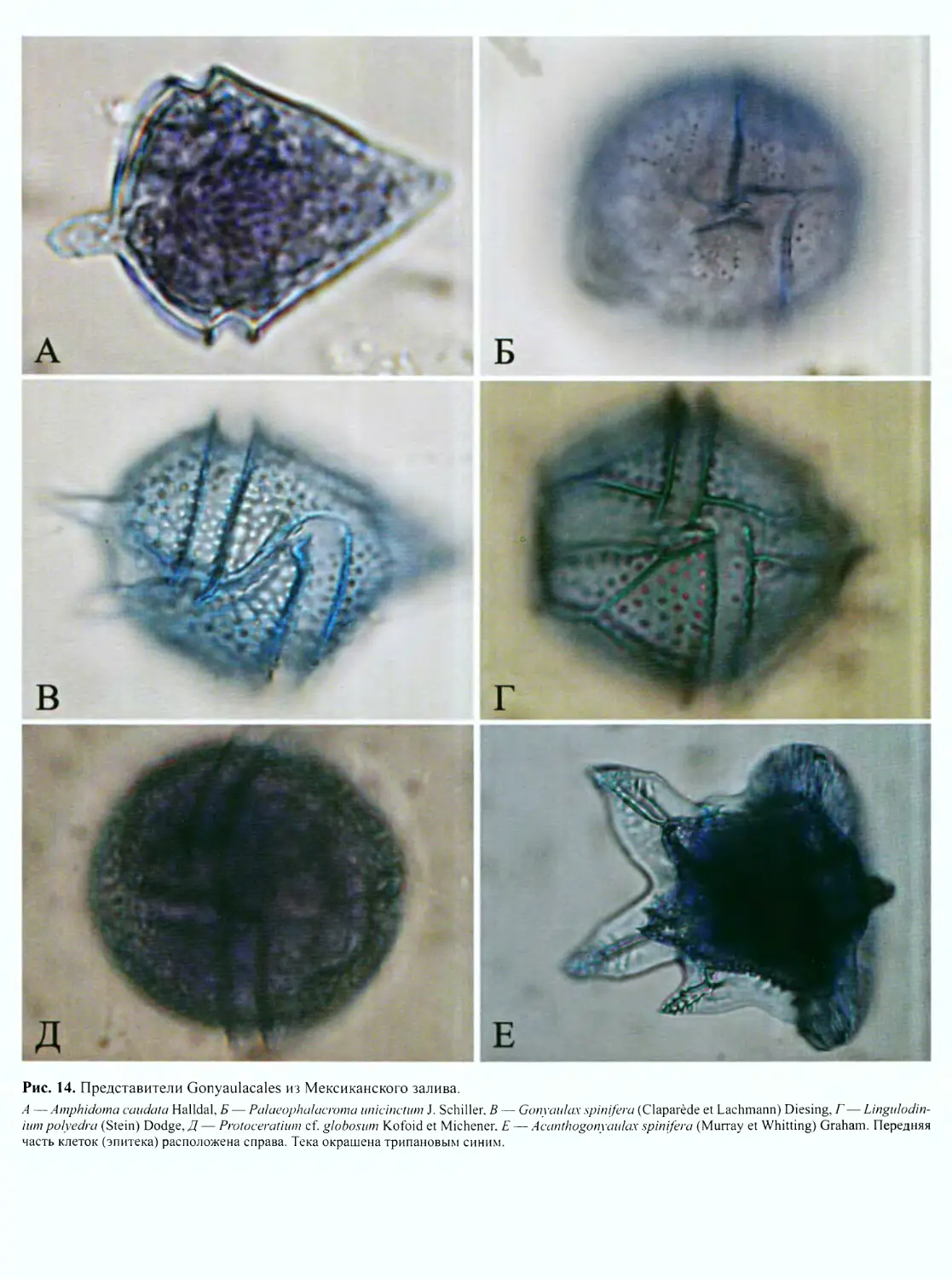
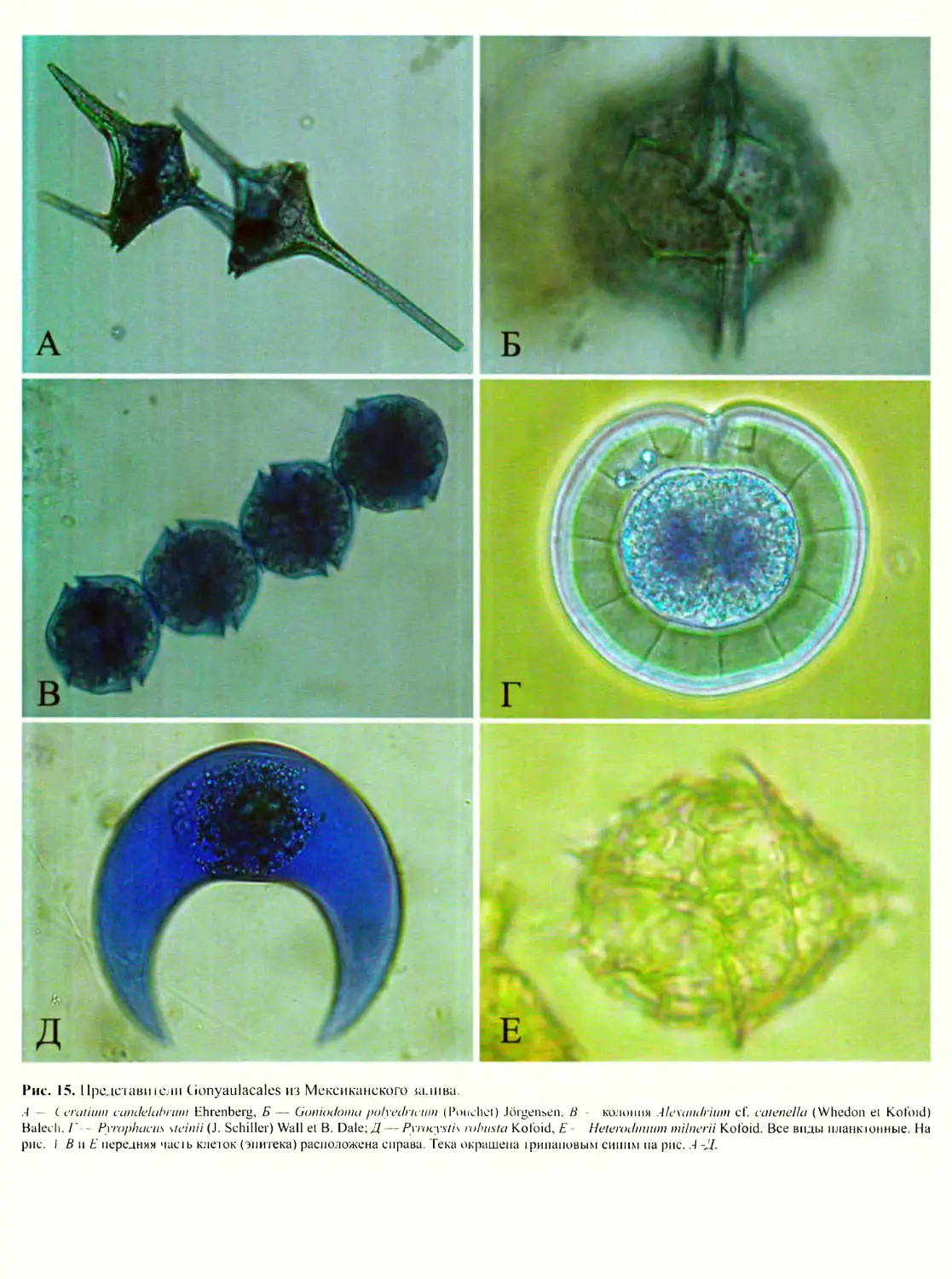
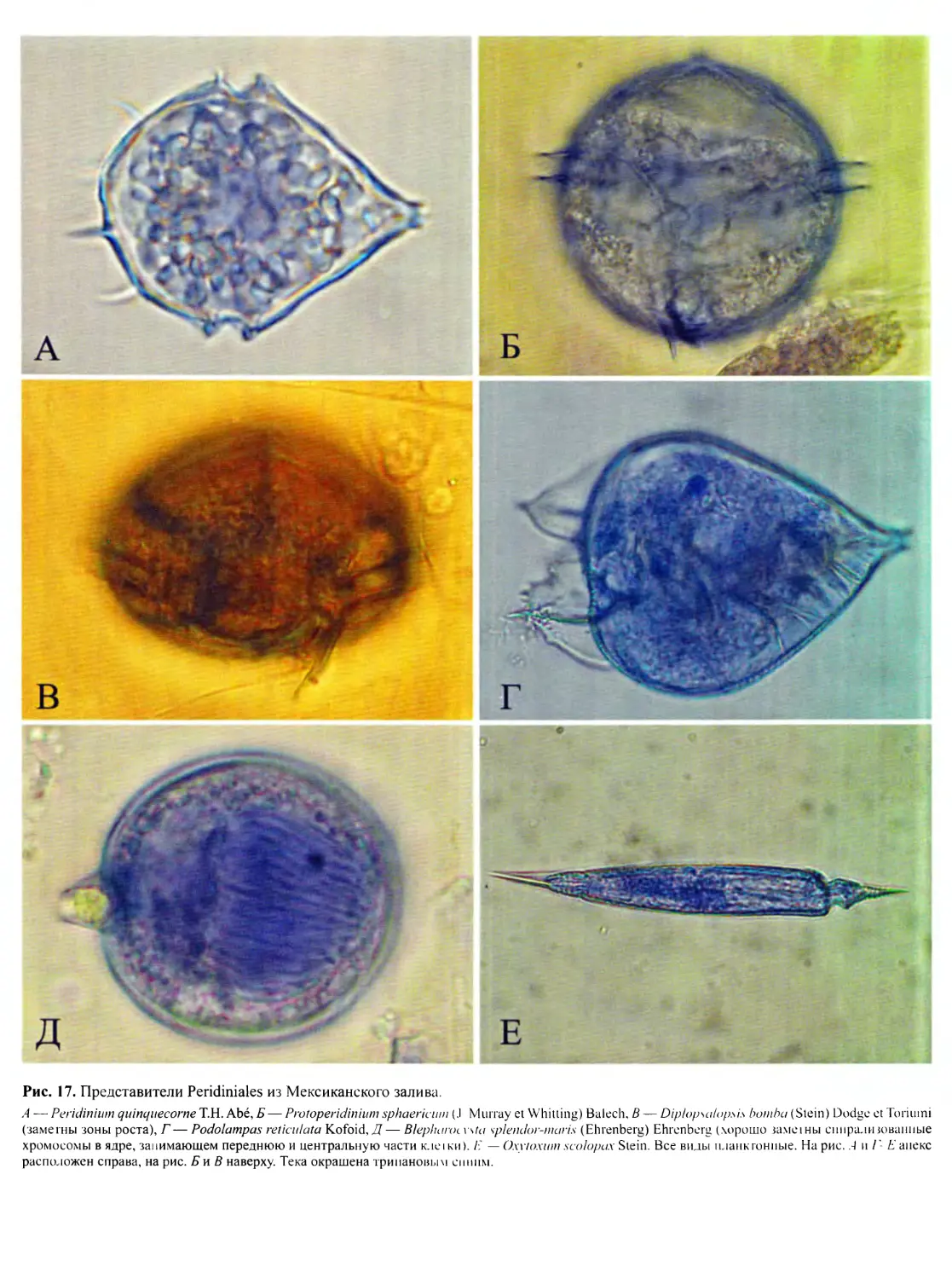
идный (рис. 10, Г, Д’, рис. 12, вкл.), гониаулакоидный
(рис. 10, Е; рис. 13; рис. 14, вкл.; рис. 15, вкл.) и пери-
диниоидный (рис. 16; рис. 17, вкл.); иногда последние
два типа объединяют в один. Кроме того, выделяют
наноцератопсоидный тип, известный лишь у ископае-
мых видов (Fensome et al., 1993). Пророцентроидный,
динофизоидный и наноцератопсоидный типы объеди-
няют в десмоконтный, который характеризуется тем,
что оба жгутика выходят из апикального конца клетки,
и наличием двух пластинок, покрывающих большую
часть клетки и называемых створками. Остальные, к
которым относится большинство видов, объединяют в
диноконтный тип, у которого оба жгутика выходят на
вентральной стороне, примерно посередине клетки.
При построении классификаций и филогенетических
схем динофлагеллат эти морфологические типы отра-
жают линии эволюции. Кроме того, иногда выделяют
рэтогониаулакоидную и цератиоидную линии (Loeblich
III, Loeblich Jr., 1984) и волошинскиоидный тип орга-
низации (Netzel, Durr, 1984), в значительной степени
сходный с гимнодиниодным, но с меньшим количе-
ством амфиесмальных пузырьков, от 47 до 360 (у пред-
ставителей гимнодиниоидного типа от 345 до 4 810).
При изучении морфологии теки динофлагеллат не-
онтологами, общепринятым стало следовать системе
табуляции Кофойда (Kofoid, 1907, 1909). Однако это
не единственная система. С точки зрения палеонто-
логов, главный недостаток системы Кофойда состоит
в том, что она во многих случаях не позволяет уста-
новить гомологию пластинок у разных динофлагеллат,
особенно среди представителей с перидиниоидным и
гониаулакоидным типами табуляции, преобладающих
среди ископаемых форм, что важно при выяснении
филогенетических отношений (Evitt, 1985; Edwards,
1990). Преимущественно палеонтологами были пред-
ложены другие системы, из которых наиболее извест-
ными стали системы Итона (Eaton, 1980), Тэйлора-
Эвита (Taylor, 1980; Evitt, 1985) и Эдвардс (Edwards,
1990). Исторический интерес представляют также ра-
боты Барроуса (Barrows, 1918), Эвита (Evitt, 1978) и
Балеча (Balech, 1980), которые послужили разработке
впоследствии опубликованных упомянутых систем
Рис. 5. Разъединенные текальные пластинки Protoperidinium grande с показом их подлегающих краев (закрашено серым).
А — эпитека (вид спереди), Б— гипотека (вид сзади). Буква V и перевернутая V показывают место выхода жгутиков. Текальные пластинки обозначе-
ны по системе Кофойда: 1 '~4' — апикальные, 1а-3а — вставочные, 1 "-7" — предпоясковые, 1-5'" — запоясковые, 1"" и 2"" — антапикальные. (По:
Fensome et al., 1993).
18
DINOFLAGELLATA
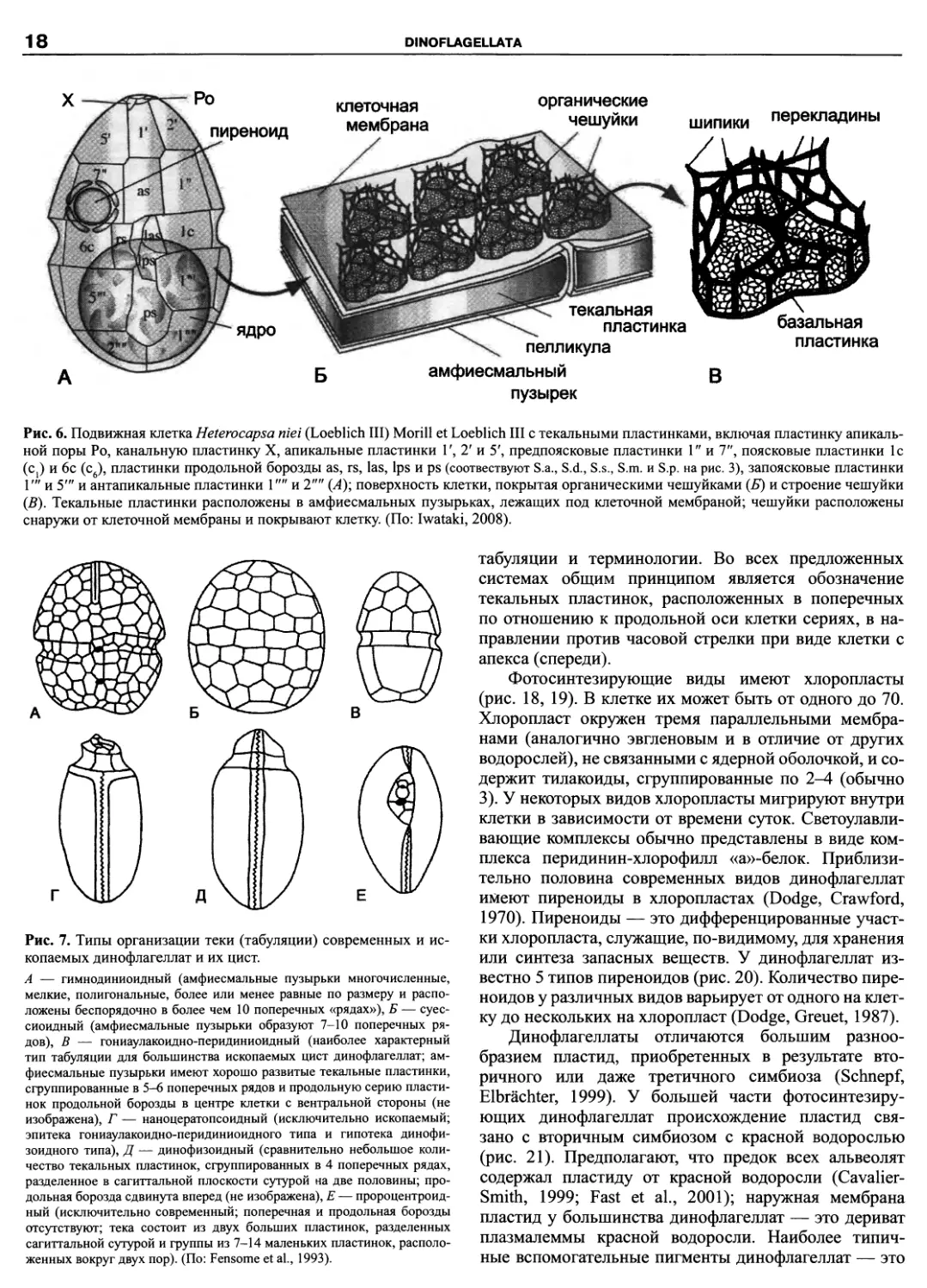
Рис. 6. Подвижная клетка Heterocapsa niei (Loeblich III) Morill et Loeblich III с текальными пластинками, включая пластинку апикаль-
ной поры Ро, канальную пластинку X, апикальные пластинки Г, Т и 5', предпоясковые пластинки 1" и 7", поясковые пластинки 1с
(Cj) и 6с (с6), пластинки продольной борозды as, rs, las, Ips и ps (соотвествуют S.a., S.d., S.s., S.m. и S.p. на рис. 3), запоясковые пластинки
Г" и 5"' и антапикальные пластинки V" и 2"" (А); поверхность клетки, покрытая органическими чешуйками (Б) и строение чешуйки
(В). Текальные пластинки расположены в амфиесмальных пузырьках, лежащих под клеточной мембраной; чешуйки расположены
снаружи от клеточной мембраны и покрывают клетку (По: Iwataki, 2008).
Рис. 7. Типы организации теки (табуляции) современных и ис-
копаемых динофлагеллат и их цист.
А — гимнодиниоидный (амфиесмальные пузырьки многочисленные,
мелкие, полигональные, более или менее равные по размеру и распо-
ложены беспорядочно в более чем 10 поперечных «рядах»), Б — суес-
сиоидный (амфиесмальные пузырьки образуют 7-10 поперечных ря-
дов), В — гониаулакоидно-перидиниоидный (наиболее характерный
тип табуляции для большинства ископаемых цист динофлагеллат; ам-
фиесмальные пузырьки имеют хорошо развитые текальные пластинки,
сгруппированные в 5-6 поперечных рядов и продольную серию пласти-
нок продольной борозды в центре клетки с вентральной стороны (не
изображена), Г — наноцератопсоидный (исключительно ископаемый;
эпитека гониаулакоидно-перидиниоидного типа и гипотека динофи-
зоидного типа), Д — динофизоидный (сравнительно небольшое коли-
чество текальных пластинок, сгруппированных в 4 поперечных рядах,
разделенное в сагиттальной плоскости сутурой на две половины; про-
дольная борозда сдвинута вперед (не изображена), Е — пророцентроид-
ный (исключительно современный; поперечная и продольная борозды
отсутствуют; тека состоит из двух больших пластинок, разделенных
сагиттальной сутурой и группы из 7-14 маленьких пластинок, располо-
женных вокруг двух пор). (По: Fensome et al., 1993).
табуляции и терминологии. Во всех предложенных
системах общим принципом является обозначение
текальных пластинок, расположенных в поперечных
по отношению к продольной оси клетки сериях, в на-
правлении против часовой стрелки при виде клетки с
апекса (спереди).
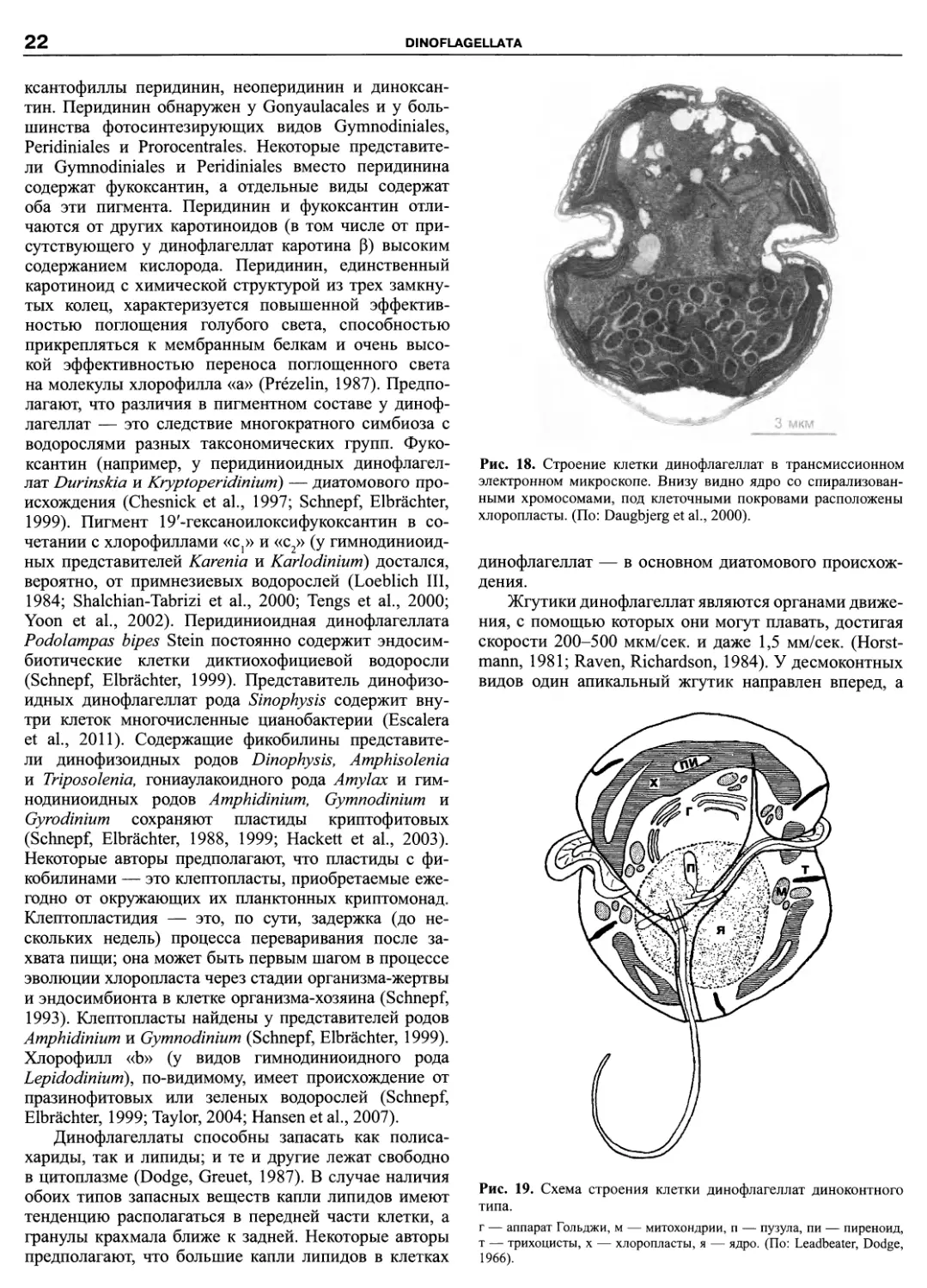
Фотосинтезирующие виды имеют хлоропласты
(рис. 18, 19). В клетке их может быть от одного до 70.
Хлоропласт окружен тремя параллельными мембра-
нами (аналогично эвгленовым и в отличие от других
водорослей), не связанными с ядерной оболочкой, и со-
держит тилакоиды, сгруппированные по 2-А (обычно
3). У некоторых видов хлоропласты мигрируют внутри
клетки в зависимости от времени суток. Светоулавли-
вающие комплексы обычно представлены в виде ком-
плекса перидинин-хлорофилл «а»-белок. Приблизи-
тельно половина современных видов динофлагеллат
имеют пиреноиды в хлоропластах (Dodge, Crawford,
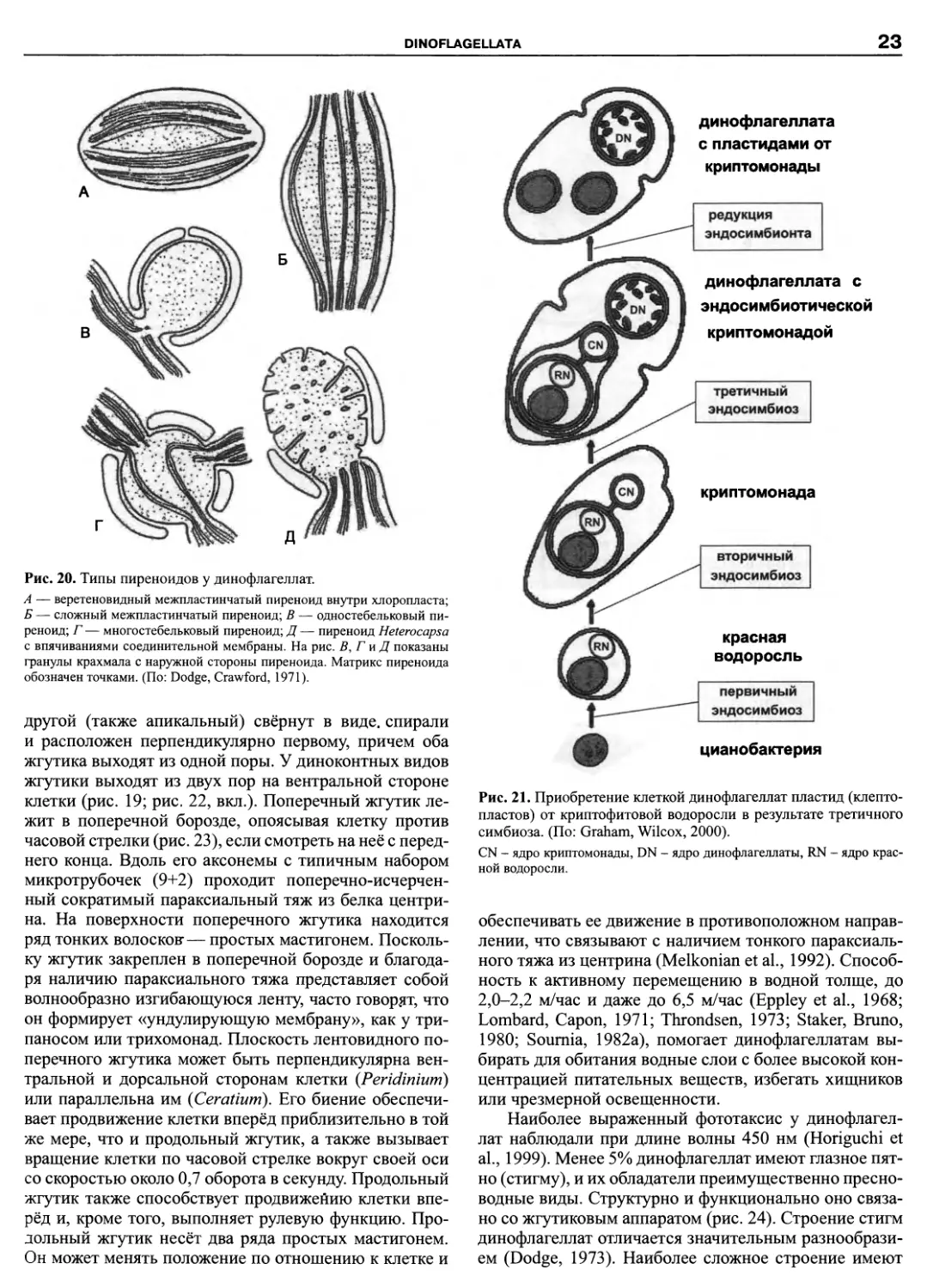
1970). Пиреноиды — это дифференцированные участ-
ки хлоропласта, служащие, по-видимому, для хранения
или синтеза запасных веществ. У динофлагеллат из-
вестно 5 типов пиреноидов (рис. 20). Количество пире-
ноидов у различных видов варьирует от одного на клет-
ку до нескольких на хлоропласт (Dodge, Greuet, 1987).
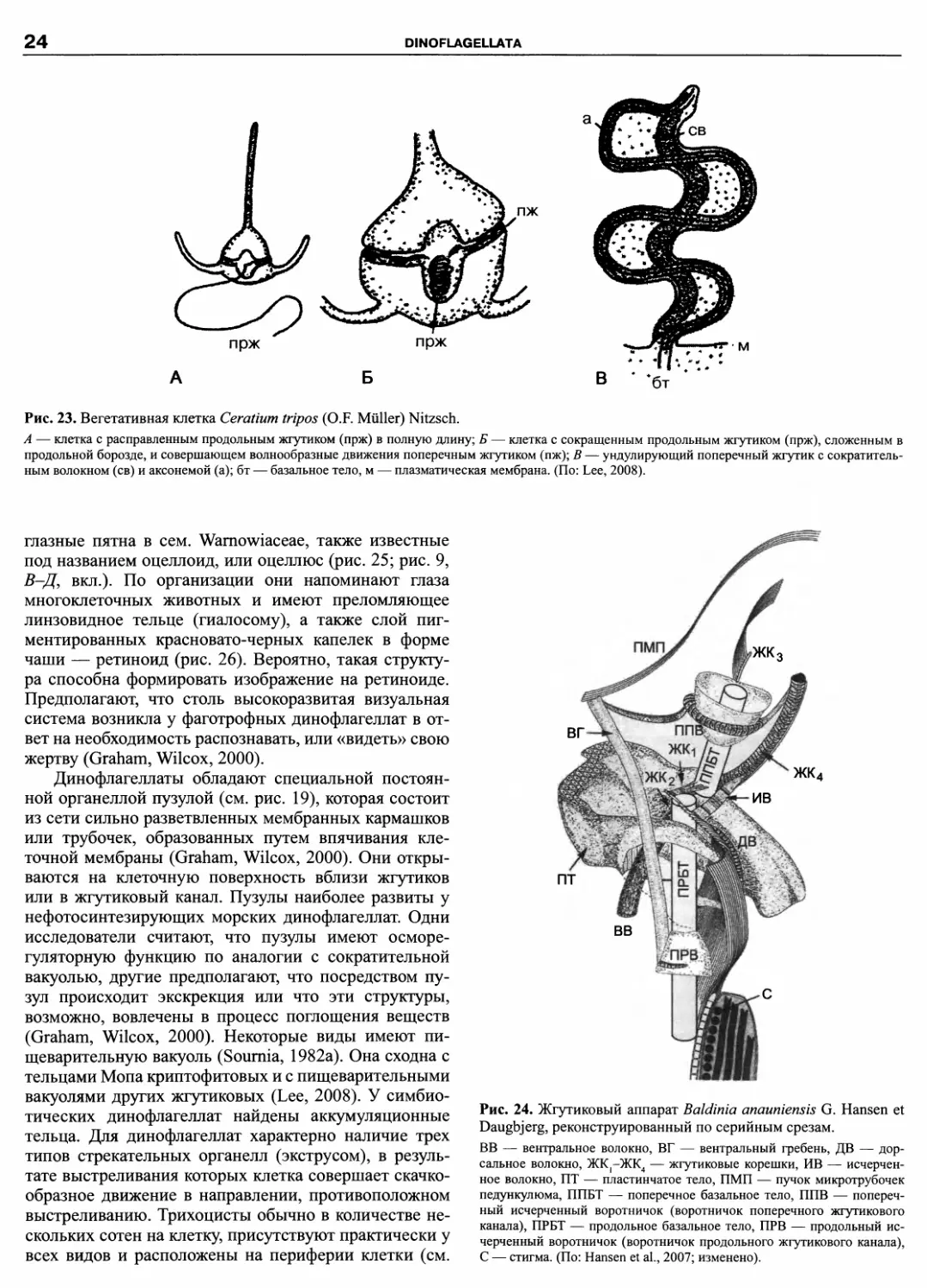
Динофлагеллаты отличаются большим разноо-
бразием пластид, приобретенных в результате вто-
ричного или даже третичного симбиоза (Schnepf,
Elbrachter, 1999). У большей части фотосинтезиру-
ющих динофлагеллат происхождение пластид свя-
зано с вторичным симбиозом с красной водорослью
(рис. 21). Предполагают, что предок всех альвеолят
содержал пластиду от красной водоросли (Cavalier-
Smith, 1999; Fast et al., 2001); наружная мембрана
пластид у большинства динофлагеллат — это дериват
плазмалеммы красной водоросли. Наиболее типич-
ные вспомогательные пигменты динофлагеллат — это
DINOFLAGELLATA
19
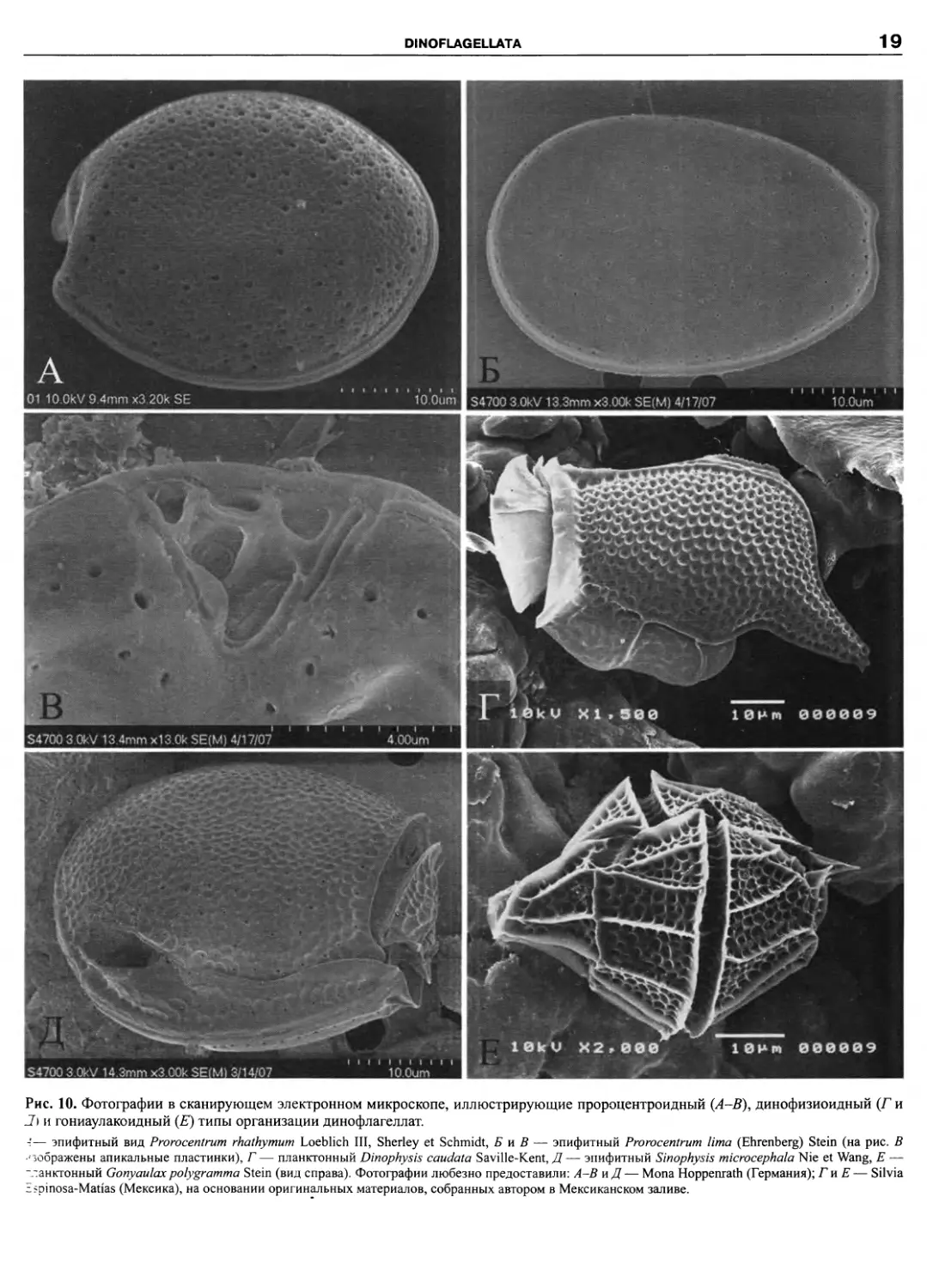
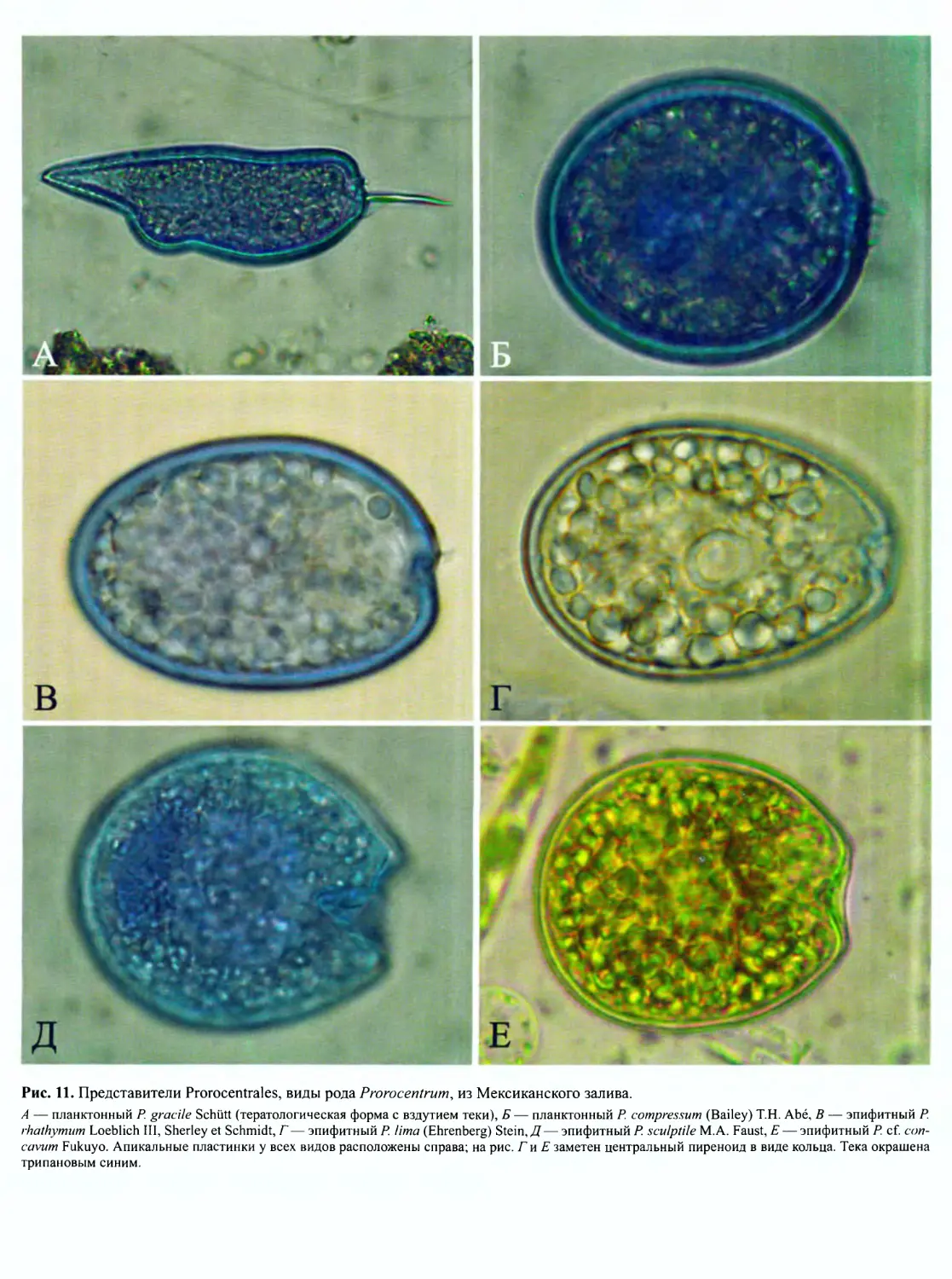
Рис. 10. Фотографии в сканирующем электронном микроскопе, иллюстрирующие пророцентроидный (A-В), динофизиоидный (Г и
J) и гониаулакоидный (£) типы организации динофлагеллат.
— эпифитный вид Prorocentrum rhathymum Loeblich III, Sherley et Schmidt, Б и В — эпифитный Prorocentrum lima (Ehrenberg) Stein (на рис. В
• зображены апикальные пластинки), Г— планктонный Dinophysis caudata Saville-Kent, Д— эпифитный Sinophysis microcephala Nie et Wang, E —
“ланктонный Gonyaulaxpolygramma Stein (вид справа). Фотографии любезно предоставили: A-В иД— Mona Hoppenrath (Германия); ГиЕ— Silvia
Espinosa-Matias (Мексика), на основании оригинальных материалов, собранных автором в Мексиканском заливе.
20
DINOFLAGELLATA
Рис. 13. Фотографии в сканирующем электронном микроскопе, иллюстрирующие гониаулакоидный типы организации динофлагеллат.
А-В — планктонный Pyrodinium bahamense L. Plate var. bahamense (A — вид с вентральной стороны справа, £ — вид спереди, В — комплекс апикаль-
ной поры); Г-Е — эпифитный Gambierdiscus cf. caribaeus Vandersea, Litaker, Faust, Kibler, Holland et Tester (Г— вид с вентральной стороны,//— вид
спереди, Е— комплекс апикальной поры). Фотографии любезно предоставила Silvia Espinosa-Matias (Мексика), на основании оригинальных матери-
алов, собранных автором в Мексиканском заливе.
DINOFLAGELLATA
21
Рис. 16. Фотографии в сканирующем электронном микроскопе, иллюстрирующие перидиниоидный тип организации динофлагеллат.
.4 и Б — планктонный Protoperidinium concinnum М.А. Faust (А — вид с вентральной стороны, Б — вид сзади); В — планктонный Protoperidinium
wassipes (Kofoid) Balech (вид спереди); Г— планктонный Diplopsalopsis bomba (Stein) Dodge et Toriumi (вид спереди); Д— эпифитный Bysmatrum
.aponii (Horiguchi et Pienaar) M.A. Faust et Steidinger (вид с вентральной стороны сзади); E — бентосный вид, обитающий в песке Durinskia capensis
Pienaar, Sakai et Horiguchi (вид с вентральной стороны). Фотографии любезно предоставили: А-Г— Silvia Espinosa-Matias (Мексика), Ди Е — Mona
Hoppenrath (Германия); на основании оригинальных материалов, собранных автором в Мексиканском заливе.
22
DINOFLAGELLATA
ксантофиллы перидинин, неоперидинин и диноксан-
тин. Перидинин обнаружен у Gonyaulacales и у боль-
шинства фотосинтезирующих видов Gymnodiniales,
Peridiniales и Prorocentrales. Некоторые представите-
ли Gymnodiniales и Peridiniales вместо перидинина
содержат фукоксантин, а отдельные виды содержат
оба эти пигмента. Перидинин и фукоксантин отли-
чаются от других каротиноидов (в том числе от при-
сутствующего у динофлагеллат каротина Р) высоким
содержанием кислорода. Перидинин, единственный
каротиноид с химической структурой из трех замкну-
тых колец, характеризуется повышенной эффектив-
ностью поглощения голубого света, способностью
прикрепляться к мембранным белкам и очень высо-
кой эффективностью переноса поглощенного света
на молекулы хлорофилла «а» (Prezelin, 1987). Предпо-
лагают, что различия в пигментном составе у диноф-
лагеллат — это следствие многократного симбиоза с
водорослями разных таксономических групп. Фуко-
ксантин (например, у перидиниоидных динофлагел-
лат Durinskia и Kryptoperidinium) — диатомового про-
исхождения (Chesnick et al., 1997; Schnepf, Elbrachter,
1999). Пигмент 19'-гексаноилоксифукоксантин в со-
четании с хлорофиллами «Cj» и «с2» (у гимнодиниоид-
ных представителей Karenia и Karlodinium) достался,
вероятно, от примнезиевых водорослей (Loeblich III,
1984; Shalchian-Tabrizi et al., 2000; Tengs et al., 2000;
Yoon et al., 2002). Перидиниоидная динофлагеллата
Podolampas bipes Stein постоянно содержит эндосим-
биотические клетки диктиохофициевой водоросли
(Schnepf, Elbrachter, 1999). Представитель динофизо-
идных динофлагеллат рода Sinophysis содержит вну-
три клеток многочисленные цианобактерии (Escalera
et al., 2011). Содержащие фикобилины представите-
ли динофизоидных родов Dinophysis, Amphisolenia
и Triposolenia, гониаулакоидного рода Amylax и гим-
нодиниоидных родов Amphidinium, Gymnodinium и
Gyrodinium сохраняют пластиды криптофитовых
(Schnepf, Elbrachter, 1988, 1999; Hackett et al., 2003).
Некоторые авторы предполагают, что пластиды с фи-
кобилинами — это клептопласты, приобретаемые еже-
годно от окружающих их планктонных криптомонад.
Клептопластидия — это, по сути, задержка (до не-
скольких недель) процесса переваривания после за-
хвата пищи; она может быть первым шагом в процессе
эволюции хлоропласта через стадии организма-жертвы
и эндосимбионта в клетке организма-хозяина (Schnepf,
1993). Клептопласты найдены у представителей родов
Amphidinium и Gymnodinium (Schnepf, Elbrachter, 1999).
Хлорофилл «Ь» (у видов гимнодиниоидного рода
Lepidodinium), по-видимому, имеет происхождение от
празинофитовых или зеленых водорослей (Schnepf,
Elbrachter, 1999; Taylor, 2004; Hansen et al., 2007).
Динофлагеллаты способны запасать как полиса-
хариды, так и липиды; и те и другие лежат свободно
в цитоплазме (Dodge, Greuet, 1987). В случае наличия
обоих типов запасных веществ капли липидов имеют
тенденцию располагаться в передней части клетки, а
гранулы крахмала ближе к задней. Некоторые авторы
предполагают, что большие капли липидов в клетках
Рис. 18. Строение клетки динофлагеллат в трансмиссионном
электронном микроскопе. Внизу видно ядро со спирализован-
ными хромосомами, под клеточными покровами расположены
хлоропласты. (По: Daugbjerg et al., 2000).
динофлагеллат — в основном диатомового происхож-
дения.
Жгутики динофлагеллат являются органами движе-
ния, с помощью которых они могут плавать, достигая
скорости 200-500 мкм/сек. и даже 1,5 мм/сек. (Horst-
mann, 1981; Raven, Richardson, 1984). У десмоконтных
видов один апикальный жгутик направлен вперед, а
Рис. 19. Схема строения клетки динофлагеллат диноконтного
типа.
г — аппарат Гольджи, м — митохондрии, п — пузула, пи — пиреноид,
т — трихоцисты, х — хлоропласты, я — ядро. (По: Leadbeater, Dodge,
1966).
DINOFLAGELLATA
23
Рис. 20. Типы пиреноидов у динофлагеллат.
А — веретеновидный межпластинчатый пиреноид внутри хлоропласта;
Б — сложный межпластинчатый пиреноид; В — одностебельковый пи-
реноид; Г — многостебельковый пиреноид; Д — пиреноид Heterocapsa
с впячиваниями соединительной мембраны. На рис. В, Г и Д показаны
гранулы крахмала с наружной стороны пиреноида. Матрикс пиреноида
обозначен точками. (По: Dodge, Crawford, 1971).
другой (также апикальный) свёрнут в виде, спирали
и расположен перпендикулярно первому, причем оба
жгутика выходят из одной поры. У диноконтных видов
жгутики выходят из двух пор на вентральной стороне
клетки (рис. 19; рис. 22, вкл.). Поперечный жгутик ле-
жит в поперечной борозде, опоясывая клетку против
часовой стрелки (рис. 23), если смотреть на неё с перед-
него конца. Вдоль его аксонемы с типичным набором
микротрубочек (9+2) проходит поперечно-исчерчен-
ный сократимый параксиальный тяж из белка центри-
на. На поверхности поперечного жгутика находится
ряд тонких волосков:— простых мастигонем. Посколь-
ку жгутик закреплен в поперечной борозде и благода-
ря наличию параксиального тяжа представляет собой
волнообразно изгибающуюся ленту, часто говорят, что
он формирует «ундулирующую мембрану», как у три-
паносом или трихомонад. Плоскость лентовидного по-
перечного жгутика может быть перпендикулярна вен-
тральной и дорсальной сторонам клетки (Peridinium)
или параллельна им (Ceratiurri). Его биение обеспечи-
вает продвижение клетки вперёд приблизительно в той
же мере, что и продольный жгутик, а также вызывает
вращение клетки по часовой стрелке вокруг своей оси
со скоростью около 0,7 оборота в секунду. Продольный
жгутик также способствует продвижению клетки впе-
рёд и, кроме того, выполняет рулевую функцию. Про-
дольный жгутик несёт два ряда простых мастигонем.
Он может менять положение по отношению к клетке и
динофлагеллата
с пластидами от
криптомонады
редукция
эндосимбионта
динофлагеллата с
эндосимбиотической
криптомонадой
третичный
эндосимбиоз
криптомонада
вторичный
эндосимбиоз
первичный
эндосимбиоз
красная
водоросль
цианобактерия
Рис. 21. Приобретение клеткой динофлагеллат пластид (клепто-
пластов) от криптофитовой водоросли в результате третичного
симбиоза. (По: Graham, Wilcox, 2000).
CN - ядро криптомонады, DN - ядро динофлагелляты, RN - ядро крас-
ной водоросли.
обеспечивать ее движение в противоположном направ-
лении, что связывают с наличием тонкого параксиаль-
ного тяжа из центрина (Melkonian et al., 1992). Способ-
ность к активному перемещению в водной толще, до
2,0-2,2 м/час и даже до 6,5 м/час (Eppley et al., 1968;
Lombard, Capon, 1971; Throndsen, 1973; Staker, Bruno,
1980; Soumia, 1982a), помогает динофлагеллатам вы-
бирать для обитания водные слои с более высокой кон-
центрацией питательных веществ, избегать хищников
или чрезмерной освещенности.
Наиболее выраженный фототаксис у динофлагел-
лат наблюдали при длине волны 450 нм (Horiguchi et
al., 1999). Менее 5% динофлагеллат имеют глазное пят-
но (стигму), и их обладатели преимущественно пресно-
водные виды. Структурно и функционально оно связа-
но со жгутиковым аппаратом (рис. 24). Строение стигм
динофлагеллат отличается значительным разнообрази-
ем (Dodge, 1973). Наиболее сложное строение имеют
24
DINOFLAGELLATA
Рис. 23. Вегетативная клетка Ceratium tripos (O.F. Muller) Nitzsch.
A — клетка с расправленным продольным жгутиком (прж) в полную длину; Б — клетка с сокращенным продольным жгутиком (прж), сложенным в
продольной борозде, и совершающем волнообразные движения поперечным жгутиком (пж); В — ундулирующий поперечный жгутик с сократитель-
ным волокном (св) и аксонемой (а); бт — базальное тело, м — плазматическая мембрана. (По: Lee, 2008).
глазные пятна в сем. Wamowiaceae, также известные
под названием оцеллоид, или оцеллюс (рис. 25; рис. 9,
В-Д, вкл.). По организации они напоминают глаза
многоклеточных животных и имеют преломляющее
линзовидное тельце (гиалосому), а также слой пиг-
ментированных красновато-черных капелек в форме
чаши — ретиноид (рис. 26). Вероятно, такая структу-
ра способна формировать изображение на ретиноиде.
Предполагают, что столь высокоразвитая визуальная
система возникла у фаготрофных динофлагеллат в от-
вет на необходимость распознавать, или «видеть» свою
жертву (Graham, Wilcox, 2000).
Динофлагеллаты обладают специальной постоян-
ной органеллой пузулой (см. рис. 19), которая состоит
из сети сильно разветвленных мембранных кармашков
или трубочек, образованных путем впячивания кле-
точной мембраны (Graham, Wilcox, 2000). Они откры-
ваются на клеточную поверхность вблизи жгутиков
или в жгутиковый канал. Пузулы наиболее развиты у
нефотосинтезирующих морских динофлагеллат. Одни
исследователи считают, что пузулы имеют осморе-
гуляторную функцию по аналогии с сократительной
вакуолью, другие предполагают, что посредством пу-
зул происходит экскрекция или что эти структуры,
возможно, вовлечены в процесс поглощения веществ
(Graham, Wilcox, 2000). Некоторые виды имеют пи-
щеварительную вакуоль (Soumia, 1982а). Она сходна с
тельцами Мопа криптофитовых и с пищеварительными
вакуолями других жгутиковых (Lee, 2008). У симбио-
тических динофлагеллат найдены аккумуляционные
тельца. Для динофлагеллат характерно наличие трех
типов стрекательных органелл (экструсом), в резуль-
тате выстреливания которых клетка совершает скачко-
образное движение в направлении, противоположном
выстреливанию. Трихоцисты обычно в количестве не-
скольких сотен на клетку, присутствуют практически у
всех видов и расположены на периферии клетки (см.
Рис. 24. Жгутиковый аппарат Baldinia anauniensis G. Hansen et
Daugbjerg, реконструированный по серийным срезам.
BB — вентральное волокно, ВГ — вентральный гребень, ДВ — дор-
сальное волокно, ЖК-ЖК4 — жгутиковые корешки, ИВ — исчерчен-
ное волокно, ПТ — пластинчатое тело, ПМП — пучок микротрубочек
педункулюма, ППБТ — поперечное базальное тело, ППВ — попереч-
ный исчерченный воротничок (воротничок поперечного жгутикового
канала), ПРБТ — продольное базальное тело, ПРВ — продольный ис-
черченный воротничок (воротничок продольного жгутикового канала),
С — стигма. (По: Hansen et al., 2007; изменено).
DINOFLAGELLATA
25
фотосинтетические
нефотосинтетические
нематоцисты
Nematodinium
(с фотосинтезом)
Nematodinium
(без нематоцистов) или
Wamowia (с фотосинтезом)
приобретение пистона
потеря фотосинтеза
Рис. 25. Схема возможной эволюции динофлагеллат сем. Wamowiaceae на основе морфологического разнообразия и данных по мо-
лекулярной филогении. Серым обозначены фотосинтезирующие клетки; стрелки показывают возможные пути утраты признака или
изменения (трансформации); там, где филогенетические отношения неизвестны, указано несколько трансформаций. (По: Hoppenrath
et al., 2009; Greuet, 1978).
Рис. 26. Сложное глазное пятно (оцеллоид, или оцеллюс).
к — выходящий наружу канал, л — линза, м — митохондрии, р — рети-
ноид. (По: Lee, 2008).
рис. 19). Они имеют собственную мембрану, распо-
ложены перпендикулярно поверхности клетки между
амфиесмальными пузырьками и соприкасаются с кле-
точной мембраной; у панцирных видов трихоцисты
расположены под порами, пронизывающими теку. При
выстреливании они сильно вытягиваются, достигая
200 мкм в длину. Эти экструсомы формируются в ап-
парате Гольджи и сходны по строению с трихоцистами
инфузорий (Bouck, Sweeney, 1965; Spector, 1984). Лишь
немногие динофлагеллаты лишены трихоцист, как, на-
пример, Symbiodinium, Gymnodinium, Prorocentrum,
Polarella, Woloszynskia, Baldinia, Pelagodinium (Hansen
et al., 2007; Siano et al., 2010).
Нематоцисты, наоборот, присутствуют лишь в не-
которых родах (например, Polykrikos, Nematodinium).
Они немногочисленные, до 8-10 на клетку, достигают
длины 20 мкм и устроены сложнее трихоцист. Иногда
их сравнивают с книдоцистами кишечнополостных.
Мукоцисты представляют собой относительно просто
организованные экструсомы в виде сумочек, которые
содержат мукополисахариды. Они найдены у некото-
рых видов динофлагеллат в области брюшного поля
(пластинок продольной борозды) под клеточной мем-
браной (Spector, 1984). Подобные образования встреча-
ются у эвгленовых. Стрекательные органеллы диноф-
лагеллат срабатывают при механическом раздражении,
воздействии турбулентных токов воды, при изменении
температуры. Они необходимы, по-видимому, для за-
щиты от хищников (Graham, Wilcox, 2000).
26
DINOFLAGELLATA
фаготрофное
питание с помощью
паллиума
фаготрофный
мизоцитоз
приобретение
клептохлоро пластов
посредством
фаготрофного
мизоцитоза
неорганические питательные вещества,
ионы, СО2
оргднические питательные вещества
и микроэлементы, продукты фотосинтеза
и катаболизма
свет для фотосинтеза
питательные вещества, продукты
пищеварительных процессов
пищеварительные ферменты
ядро
хлоропласт
пищеварительная
вакуоль с пищей
Рис. 27. Стратегии питания динофлагеллат. (По: Schnepf, Elbrachter, 1992; изменено).
Физиология, биохимия
и ядерный аппарат
Питание. Около половины всех динофлагеллат
способны к фотосинтезу (Taylor, 1987), однако боль-
шинство фототрофов способно к гетеротрофному
питанию, являясь миксотрофами (Gaines, Elbrachter,
1987; Schnepf, Elbrachter, 1992). Некоторые авторы
(Larsen, Soumia, 1991) предполагают, что миксотро-
фы и гетеротрофы составляют около половины со-
временных видов динофлагеллат. Наличие пластид,
по-видимому, не полностью обеспечивает энергетиче-
ские нужды фотосинтезирующих динофлагеллат, по-
этому их следует считать потенциально способными
к осмотрофии или фаготрофии или одновременно к
обоим типам питания (Graham, Wilcox, 2000). Многие
виды-фотосинтетики являются ауксотрофами, нужда-
ющимися в специфических органических веществах
в низких концентрациях. Необходимость витамина В12
для развития динофлагеллат является почти универ-
сальным явлением (Graham, Wilcox, 2000). На вопрос,
является ли изучаемый вид облигатным фотоавтотро-
фом или ауксотрофом, можно ответить лишь после
экспериментов с его культурой. Облигатных фото-
трофов найдено немного, и большинство из них пре-
сноводные (Gaines, Elbrachter, 1987). В арктических
морях приблизительно одна треть динофлагеллат-фо-
тоситетиков, и две трети видового состава составляют
гетеротрофы (Околодков, 2000). Согласно некоторым
авторам (Hansen, Calado, 1999; Jacobsen, 1999), около
половины числа ныне живущих видов динофлагеллат
исключительно гетеротрофы. Предполагается, что в
действительности виды-гетеротрофы преобладают над
фототрофами, и что недоучет первых происходит в ос-
новном за счет так называемых беспанцирных видов,
крайне чувствительных к фиксирующим жидкостям.
Согласно более детальной классификации (Gaines, El-
brachter, 1987), гетеротрофия подразделяется на ауксо-
трофию, миксотрофию (включает амфитрофию, мик-
сотрофию sensu stricto и миксотрофную фаготрофию)
и органотрофию (включает осмотрофию, фаготрофию
и паразитизм). Термин фаготрофия охватывает следу-
ющие явления: 1) фаготрофия в узком смысле (sensu
stricto) — захват пищевых частиц, включая клеточную
мембрану жертвы, внутрь клетки и переваривание их
в пищеварительных вакуолях; 2) мизоцитоз — про-
тыкание {англ.\ piercing) и высасывание содержи-
мого клетки жертвы с помощью педункулюма, без
переваривания ее плазматической мембраны в пище-
варительных вакуолях клетки хищника; 3) питание с
помощью паллиума — крупной ламеллиподии, обво-
лакивающей жертву и переваривающей ее вне клетки
хищника (рис. 27; Elbrachter, 1991; Schnepf, Elbrachter,
1992). У динофлагеллат были найдены все упомяну-
тые типы питания. В тропической зоне фототрофные
внутриклеточные эндосимбиотические динофлагел-
латы Symbiodinium образуют консорции с рифообра-
зующими кораллами и другими беспозвоночными
(в основном, с турбелляриями и моллюсками), а так-
DINOFLAGELLATA
27
же простейшими, главным образом, с радиоляриями и
фораминиферами (Trench, 1987; Trench, Blank, 1987).
Динофлагеллаты классов Blastodiniphyceae и Syndinea
являются паразитами многочисленных простейших,
беспозвоночных и рыб (в строгом смысле, Syndinea в
настоящее время считается сестринской группой по
отношению к динофлагеллатам). В качестве запасных
веществ в клетках динофлагеллат обычно присутству-
ет крахмал или масло, состоящее из длинных цепочек
ненасыщенных жирных кислот с14, с16, с18 и с20.
Биохимия. Среди наиболее специфических биохи-
мических характеристик динофлагеллат следует упо-
мянуть способность вырабатывать особые типы стеро-
лов, способность к биолюминесценции и способность
к выработке многочисленных токсинов, которые пред-
ставляют собой вторичные метаболиты. Предполага-
ют, что стеролы динофлагеллат связаны с клеточными
мембранами (предположительно являются их струк-
турными компонентами), аналогично холестеролу у
большинства эукариот (Moldowan et al., 1996). Основ-
ные типы стеролов — диностерол, амфистерол и пери-
диностерол характеризуются наличием 4а-метиловой
группы. В целом, по составу стеролов динофлагелла-
ты близки к прокариотам, что в прошлом расценива-
ли как примитивную черту с точки зрения биосинтеза
(Withers, 1987). В отличие от водорослей, динофлагел-
латы содержат некоторые уникальные 4-метилстеро-
ловые структуры (Leblond, Chapman, 2002; Giner et al.,
2003). На основе изучения распространения диносте-
ренов (производных диностеролов), которые считают-
ся биомаркерами динофлагеллат, в отложениях раннего
кембрия, предполагают, что динофлагеллаты могли по-
явиться еще в протерозое (Moldowan, Talyzina, 1998).
Диностеролы в морских осадках, ввиду высокой ста-
бильности их молекул названные «молекулярными ис-
копаемыми», и другие стеролы динофлагеллат помо-
гают обнаружить место и время «красных приливов»
в геологическом прошлом планеты (Boon et al., 1979).
Некоторые стеролы использовали в качестве маркеров
при изучении пищевых цепей в экосистеме коралловых
рифов (Steudler et al., 1977). Данные о нахождении ди-
ностеролов в образцах ископаемых кораллов помогают
получить ценную информацию о времени формиро-
вания симбиотических отношений между кораллами
и эндосимбиотическими динофлагеллатами (Withers,
1987).
Динофлагеллаты — единственные фотосинтези-
рующие протесты, способные к биолюминесценции,
которая также наблюдается у насекомых, гребневи-
ков, кишечнополостных, полихет и олигохет, моллю-
сков (в основном головоногих), ракообразных и рыб,
преимущественно батипелагических (Harvey, 1952;
Sweeney, 1980). В отличие от непрерывного излуча-
емого света бактерий и грибов, биолюминесценция
этих организмов прерывистая. Всего зарегистрирова-
но около 85 способных к люминесценции видов фото-
синтезирующих и гетеротрофных морских динофла-
геллат, больше половины которых относятся к родам
Protoperidinium и Ceratium (Евстигнеев и др., 1993).
Один и тот же вид может быть представлен светящи-
мися и несветящимися штаммами. Некоторые виды
люминесцируют только в определенные сезоны. Фото-
синтезирующие динофлагеллаты отчетливо демон-
стрируют циркадный (24-часовой) ритм биолюминес-
ценции. Явление обычно вызывается механическими
или химическими раздражителями, и максимум излу-
чения приходится приблизительно на 475 нм (видимая
часть спектра). Биолюминесценция динофлалеллат за-
висит от температуры и освещения и обычно обратно
пропорциональна этим факторам. Предполагают, что
специализированные молекулы люциферины (суб-
страт), связанные с клеточной мембраной, излучают
свет в результате реакции с ферментом люциферазой.
Люциферазы — это крупные белковые молекулы, слег-
ка различающиеся по молекулярному весу, а люцифе-
рины — мелкие, крайне нестабильные тетрапирроль-
ные соединения, сходные по строению с молекулами
хлорофилла (Sweeney, 1987). Считается, что источни-
ками излучения являются так называемые осциллоны,
структуры около 0,5 мкм в диаметре, образующиеся
в аппарате Гольджи и расположенные на периферии
клетки; они содержат люциферин, люциферазу и ино-
гда связанный с люциферином белок (Graham, Wilcox,
2000). В строгом смысле, явление биолюминесцен-
ции— это хемолюминесценция, по сути, процесс, об-
ратный фотосинтезу, энергетически высокоэффек-
тивный, при котором соотношение энергии света в
видимой части спектра к общему количеству энергии
излучаемого света составляет 20-90% (Нешиба, 1991).
Она отличается от фотолюминесценции, которая зави-
сит от предварительного воздействия светом на объект.
Энергетические характеристики излучаемого света
охватывают три порядка величин. Наиболее стабиль-
ной характеристикой является средняя интенсивность
вспышек, а длительность вспышек обычно варьирует
от 0,03 до 5 секунд, иногда до 30. Предполагают, что
биолюминесценция у динофлагеллат служит для отпу-
гивания хищников (Buskey, Swift, 1983; Sweeney, 1987).
Согласно другой теории, биолюминесценция является
своего рода сигналом о нападении на динофлагеллат
и концентрации их хищников, адресованным хищ-
никам второго порядка (Abrahams, Townsend, 1993).
У беспозвоночных она также служит для привлечения
партнеров противоположного пола или для создания
противотени с целью убежать от хищника. Биолюми-
несценция — один из наиболее типичных случаев цир-
кадных (24 часа) ритмов морского планктона, включа-
ющий эндогенный и экзогенный компоненты, и среди
пресноводных организмов она представляет редкое ис-
ключение (Soumia, 1974). Установлено, что две систе-
мы управляют циркадным ритмом: одна чувствительна
к красному свету, а другая к синему (Roenneberg, Deng,
1997).
Среди приблизительно 80 видов морского фито-
планктона, способных вырабатывать токсины, отме-
чено около 60 видов динофлагеллат (Hallegraeff et al.,
1996, 2003). Более половины из них относятся к трем
родам, Prorocentrum, Alexandrium и Dinophysis, и в
меньшей степени к Gambierdiscus, Ostreopsis и Karenia.
Остальные принадлежат в основном к примнезиевым,
28
DINOFLAGELLATA
рафидофитовым и диатомовым водорослям. Токсич-
ные пресноводные динофлагеллаты представлены не-
сколькими видами (например, Peridiniopsis polonicum
(Woloszynska) Bourrelly, вырабатывает токсин гленоди-
нин; Hashimoto, 1968; Shimizu, 1987). В пресных водое-
мах цианобактерии представлены наибольшим числом
видов, способных вырабатывать токсины, главным об-
разом, анатоксины, микроцистины, нодулярины и гепа-
тотоксины (Codd, 1984; Daranas et al., 2001; Landsberg,
2002; Cortes-Altamirano, Sierra-Beltran, 2008). Один и
тот же вид может быть токсичным и нетоксичным. Ток-
сины передаются по пищевой цепи в неизмененном или
частично трансформированном виде и могут накапли-
ваться в организмах-фильтраторах (преимущественно
в двустворчатых моллюсках), планктонных ракообраз-
ных, крабах, рыбах, морских птицах и млекопитаю-
щих. Токсичными могут быть не только вегетативные
клетки, но и покоящиеся цисты. Токсины могут выде-
ляться живыми клетками или высвобождаться после их
смерти. Популяция одного вида может содержать одно-
временно несколько токсинов различного действия.
Динофлагеллаты могут вырабатывать цитотоксины,
ихтиотоксины, гепатотоксины, гемолизины, спироли-
ды. Однако наиболее проблематичными с точки зрения
здоровья человека и состояния морских экосистем яв-
ляются сигуатоксины, майтотоксины и гамбиериковые
кислоты, или гамбиертоксины (все три исключительно
в тропиках и субтропиках; Gudger, 1930; Withers, 1982;
Lehane, Lewis, 2000; Lewis, 2001; Laurent et al., 2005;
Dickey, Plakas, 2010), бреветоксины, сакситоксины и
неосакситоксины, гониаутоксины и динофизис-ток-
сины (Hallegraeff et al., 1996, 2003). Некоторые виды
Prorocentrum и Dinophysis вырабатывают токсичную
окадаевую кислоту. Prorocentrum lima (Ehrenberg) Stein
способен также к выработке токсичной домоевой кис-
лоты (Kurisu et al., 2003), до недавнего времени считав-
шейся метаболитом исключительно диатомовых рода
Pseudo-nitzschia Н. Peragallo in Н. et М. Peragallo. Инте-
ресно отметить, что большинство токсичных видов, а
также видов, способных вызывать «красные приливы»
(массовые развития преимущественно одноклеточных
организмов, которые изменяют цвет воды), — фото-
синтезирующие. Поэтому предполагают, что способ-
ность динофлагеллат вырабатывать токсины связана с
наличием хлоропластов, которые, как известно, ведут
свое происхождение от эндосимбиотических циано-
бактерий (Lee, 2008).
Токсины значительно отличаются друг от дру-
га по молекулярному весу: от 312 у домоевой кисло-
ты (аналог, или дериват аминовых кислот) до 3 422 у
майтотоксина (Cembella et al., 1995). Часто наблюдае-
мые синдромы отравления человека — это результат
одновременного воздействия нескольких дериватов,
различающихся по химической структуре. Нейроток-
сины, вызывающие паралитическое отравление через
потребление в пищу морепродуктов (англ.: paralytic
shellfish poisoning, или PSP), такие как сакситоксины,
неосакситоксины и гониаутоксины, блокируют натри-
евые каналы в нервных и мышечных тканях, не да-
вая распространиться нервному импульсу и блокируя
сокращение мышц. Домоевая кислота, вызывающая
амнезийное отравление через потребление в пищу
морепродуктов (англ.', amnesic shellfish poisoning, или
ASP, также иногда называемое domoic acid poisoning,
или DAP; Fritz et al., 1992), действует как глутаматный
активатор на кайнатные рецепторы центральной нерв-
ной системы и участвует в процессах возбуждения и
торможения передающегося нервного импульса; она
перевозбуждает нервную систему и вызывает в ней де-
генеративные эффекты. Яды, вызывающие диарейное
отравление через потребление в пищу морепродуктов
(англ.', diarrheic shellfish poisoning, или DSP), такие как
динофизис-токсины и окадаевая кислота, являются ин-
гибиторами некоторых протеин-фосфатаз, провоцируя
дегенеративные эффекты в эпителии, выстилающем
тонкий кишечник, и иногда опухоли. Пектенотоксины
и ессотоксин, принадлежащие к этой же группе (DSP),
на экспериментальных мышах вызывали повреждение
сердечной мышцы после внутриполостной инъекции.
Бреветоксины, вызывающие нейрологическое отравле-
ние через потребление в пищу морепродуктов (англ.:
neurological shellfish poisoning, или NSP), в основном,
считаются ихтиотоксинами. Их эффект связан с воз-
действием на потенциал-зависимые натриевые каналы,
и симптомы NSP в организме человека сходны с сим-
птомами PSP. Кроме того, бреветоксины вызывают рас-
стройство респираторной системы, жжение в глазах и в
носу в случае непосредственного контакта с аэрозоль-
ными формами токсинов или при плавании в море. От-
равление через потребление в пищу сигуатерной рыбы
(англ.: ciguateric fish poisoning, или CFP), вызываемое
сигуатоксинами и майтотоксинами (обе группы — ци-
клические полиэфиры с высоким молекулярным ве-
сом), характеризуется сложным набором симптомов,
включающим расстройства пищеварительного тракта,
сердечно-сосудистой, периферической и центральной
нервной систем. Майтотоксины (в целом, считающи-
еся водорастворимыми) оказывают сильный возбуди-
тельный эффект на потенциал-зависимые кальциевые
каналы и при оральном введении в организм человека
намного менее токсичны, чем сигуатоксины. Сигуа-
токсины, аналогично бреветоксинам, воздействуют на
потенциал-зависимые натриевые каналы и именно в
том же месте, что и бреветоксины (Bidard et al., 1984;
Lehane, Lewis, 2000), чем, вероятно, объясняется сход-
ство нейропатологических симптомов, вызываемых у
млекопитающих этими разными группами ядов.
Ядерный аппарат. У большинства динофлагел-
лат одно ядро, так называемый динокарион (Chatton,
1920), также известное под названием хромосом-
ного ядра (Geitler, 1934). По крайней мере, два вида,
Kryptoperidinium foliaceum (Stein) Lindemann и Durin-
skia baltica (Levander) Carty et Сох, имеют два эукарио-
тических ядра вследствие симбиоза с диатомовой водо-
рослью (Chesnick et al., 1996,1997; Figueroa et al., 2009).
Динокарион характеризуется следующими признака-
ми: 1) постоянно конденсированными хромосомами,
при этом они обычно занимают все пространство ядра
(см. рис. 17, Д, вкл.; рис. 18); 2) ядерной оболочкой,
не разрушающейся во время митоза (так называемый
DINOFLAGELLATA
29
Рис. 28. Митоз у морского планктонного вида Alexandrium tamarense (Lebour) Balech.
A — интерфазное ядро; Б и В — ранняя профаза; Г — метафаза; Д — ранняя анафаза; Е — поздняя анафаза (в двух проекциях); Ж — завершение
цитокинеза; 3 — ранняя интерфаза. (По: Седова, 1996).
закрытый митоз); 3) наличием внеядерного митотиче-
ского веретена, не связанного с центриолями (у почти
всех других групп организмов с закрытым митозом ми-
тотическое веретено внутриядерное); 4) отсутствием в
хроматине гистохимически определяемых основных
белков гистонов и, как следствие, отсутствием нуклео-
сом. Кроме того, динофлагеллаты являются единствен-
ной группой эукариот, у которых большинство типично
пластидных генов перенесено в ядро (Bachvaroff et al.,
2004; Hackett et al., 2004a, b). Ярко выраженные осо-
бенности строения ядра динофлагеллат, по сравнению
с другими эукариотами, послужили причиной для вы-
движения гипотезы мезокариот (Dodge, 1965, 1966,
1983). Согласно этой гипотезе, динофлагеллаты, от-
несенные к царству Mesokaryota, представляют собой
промежуточную группу организмов на пути эволюции
от прокариот к эукариотам. Известно, что у прокари-
от репликация ДНК представляет собой непрерывный
процесс. Додж (Dodge, 1966) предположил, что у ди-
нофлагеллат этот процесс протекает сходным образом,
являясь одной из характерных черт Mesokaryota. Одна-
ко позднее было убедительно показано, что синтез ДНК
у динофлагеллат имеет дискретный характер (Allen
et al., 1975; Loeblich III, 1976a, b). Для динофлагеллат
характерно отсутствие стандартных критериев для
описания тех или иных стадий митоза (Седова, 1996).
Продольное расщепление хромосом и образование
спирально закрученных хроматид, по-видимому, соот-
ветствуют профазе (рис. 28). Так называемый диноми-
тоз (Chatton, 1920) является разновидностью закрытого
внеядерного плевромитоза, характерного не только для
свободноживущих динофлагеллат, а также для трихо-_
монад и гипермастигин (Raikov, 1994). Он характери-
зуется внеядерным веретеном, которое формируется в
цитоплазме, затем погружается в углубления ядра, пре-
вращающиеся во внутриядерные каналы. Микротру-
бочки веретена деления проходят внутри этих каналов.
микротрубочек присоединяется к ядерной обо-
лочке, с прикрепленными с внутренней стороны хро-
мосомами. Во время митоза ядерная оболочка у одних
динофлагеллат остается интактной, у других раство-
ряется. Представители класса Dinophyceae обладают
постоянным динокарионом, который присутствует в
клетке на протяжении всего жизненного цикла. Пред-
ставители Blastodiniphyceae (паразитические организ-
мы) и Noctiluciphyceae (свободноживущие) характери-
зуются временным динокарионом, присутствующем
на протяжении определенной части жизненного цикла.
Основные белки обнаружены с помощью гистохимиче-
ских и иммунологических методов у различных видов
как свободноживущих, так и паразитических дино-
флагеллат. Они отличаются по составу и по количеству
от гистонов высших эукариот (Stewart, Beck, 1967; Ris,
Kubai, 1974). Предполагают, что гистохимия не выяви-
ла гистоны у динофлагеллат, поскольку эксперименты
с культурами проводили в период лог-фазы роста кле-
ток (Loeblich III, 1976b). Известно, что гистоны, функ-
ция которых заключается в стабилизации структуры
хроматина и в регуляции экспрессии генов, в меньшей
степени, чем другие белки, подвержены эволюцион-
ным изменениям. Строение и стабилизация хроматина
у динофлагеллат отличается от других эукариот и несет
некоторые черты сходства с бактериями; существует
предположение, что хромосомы динофлагеллат — это
результат эволюции генома прокариотоподобной пред-
ковой формы (Sigee, 1984). Число хромосом в клетке
сравнительно высокое и достигает 260-280 (Dodge,
Crawford, 1970; Седова, 1996). Ядро, размеры которого
варьируют от 0,37 мкм до 40-50 мкм (Седова, 1996),
содержит значительные количества ДНК (в 5-10 раз
больше, чем у большинства других эукариот), у сво-
бодноживущих динофлагеллат от 3,6 до 200-225 пг на
клетку (Holm-Hansen, 1969; Rizzo, 1991, 2003; Hackett
et al., 2005; LaJeunesse et al., 2005). Лишь у эндосим-
биотических видов Symbiodinium содержание ДНК
сравнительно низкое, 1,5-^1,8 пг (LaJeunesse et al.,
30
DINOFLAGELLATA
2005). Одноклеточные эукариотные организмы обычно
имеют от 0,043 до 3 пг (Lee, 2008). У динофлагеллат
большая часть ДНК генетически неактивна, т.е. пред-
ставлена структурной ДНК. Эволюционная тенденция
к высокому содержанию ДНК в клетках рассматривает-
ся как один из двух основных факторов эволюции гено-
ма динофлагеллат, наряду с сохранением примитивной
катионной негистоновой стабилизационной системы
(Sigee, 1984). Главная же линия эволюции эукариот
связана с приобретением гистонов. Уникальным яв-
ляется также высокое содержание в ДНК 5'-гидрокси-
метилурацила (Loeblich III, 1976b). Подробный анализ
гипотезы мезокариот в свете данных, опубликованных
до 1995 г., представлен Райковым (Raikov, 1995). По
его мнению, в настоящее время «прокариотные» черты
динофлагеллат сводятся к организации хромосом — их
высокоупорядоченной структуре, отсутствию гистонов
и нуклеосом. Однако все эти три признака связаны друг
с другом, и отсутствие гистонов может обусловливать
два других признака. Имеющиеся факты позволяют
предположить, что потеря гистонов у динофлагеллат
вторична и могла произойти в результате утраты соот-
ветствующих генов (Sigee, 1986; Rizzo, 1991).
Гипотеза мезокариот, впоследствии признанная
ошибочной, в значительной степени стимулировала ис-
следования по ультраструктуре, биохимии и генетике
динофлагеллат и дискуссии о процессе макроэволюции
среди водорослей и простейших в 1970-1980-х годах,
особенно в области поиска таксономических групп,
родственных динофлагеллатам.
Размножение и жизненные
циклы
Большинство динофлагеллат имеет гаплофазный
жизненный цикл с зиготической редукцией (рис. 29).
Другими словами, клетки имеют гаплоидный набор
хромосом на протяжении всей вегетативной фазы. Га-
меты образуются в результате митотического деления
Рис. 29. Жизненный цикл морского планктонного вида Ceratium
horridum (Cleve) Gran, типичный для большинства динофлагел-
лат, с преобладанием гаплоидной фазы. Половой процесс —
анизогамия; подвижная зигота (планозигота) существует лишь
несколько дней. (По: Lee, 2008).
вегетативных клеток. Лишь Noctiluciphyceae характе-
ризуются диплофазным жизненным циклом (рис. 30),
причем встречаются как гомоталличные (при половом
размножении сливаются гаметы одной клетки), так и
гетероталличные популяции (слияние возможно только
между гаметами от разных клеток).
Рис. 30. Предполагаемый жизненный цикл Noctiluca. (По: Fensome et al., 1993).
DINOFLAGELLATA
31
Рис. 32. Бесполое размножение десмошизис на примере пре-
сноводного планктонного вида Ceratium hirudinella (O.F. Miiller)
Dujardin.
M — материнская клетка в процессе косого деления вдоль сутур; Д, и
Д2 — две дочерних клетки после деления, каждая из которых унасле-
довала половину теки от материнской клетки и регенерирует недостаю-
щую половину. (По: Fensome et al., 1993).
Рис. 34. Бесполое размножение элеутерошизис на примере пре-
сноводного планктонного вида Peridinium voltzii Lemmermann.
А — вегетативная подвижная клетка с вентральной стороны; Б — две
дочерние клетки внутри материнской теки (МТ); В — сброшенная мате-
ринская тека и высвобожденные дочерние клетки (ДК, и ДК2) с тонкой
текой. (По: Fensome et al., 1993).
Бесполое размножение осуществляется следующи-
ми способами: деление надвое (у беспанцирных видов;
рис. 31, вкл.), десмошизис (у панцирных видов каждая
из двух дочерних клеток наследует половину теки ро-
дительской клетки; рис. 32; рис. 33, вкл.), элеутероши-
зис (у панцирных видов клетка полностью сбрасывает
теку; рис. 34) и спорогенез (паразитические виды об-
разуют многочисленные споры), подразделяющийся
на палиспорогенез (у паразитических видов питание и
спорогенез, происходящие одновременно) и палинто-
мию (у паразитических видов питание предшествует
спорогенезу) (рис. 35). Приблизительно 13-16% совре-
менных динофлагеллат образуют покоящиеся цисты
(Head, 1996), являющиеся диплоидными гипнозигота-
ми, продуктами полового размножения (рис. 36; рис.
37, Б, Г-Е, вкл.). Слияние гамет, по-видимому, латераль-
ное. Зигота по внешнему виду похожа на вегетативную
клетку и имеет два продольных жгутика. В течение
последующих нескольких дней или недель зигота уве-
личивается в размере и на этой стадии называется пла-
нозиготой. Достигнув максимального размера, зигота
утрачивает подвижность, ее протопласт сжимается, а
наружная клеточная стенка (экзоспора) утолщается; на
этой стадии зиготу называют гипнозиготой. Гипнозиго-
ты характеризуются высоким содержанием липидов и
способны оставаться жизнеспособными в течение не-
Рис. 35. Бесполое размножение спорогенез.
А-Е — палиспорогенез, Ж-М — палинтомия. Как при палиспорогенезе, так и при палинтомии планоспора инфицирует нового хозяина и начинает
расти по мере поступления пищи (А-Г, Ж и 3). При палиспорогенезе образование планоспор происходит одновременно с питанием и ростом (Д и
Е). При палинтомии питание и рост заканчиваются до образования планоспор (Л и М). Ядро обозначено черным кружком; хозяин обозначен серой
штриховкой. (По: Fensome et al., 1993).
32
DINOFLAGELLATA
Рис. 36. Разнообразие цист современных динофлагеллат.
А — вегетативная циста (коккоидная клетка) пресноводного планктонного вида Cystodinium cormfax (Schilling) Klebs (Klebs, 1912; Popovsky, Pfiester,
1990); Б—вегетативная циста (коккоидная клетка) морского планктонно-паразитического вида Pyrocystis noctiluca J. Murray (Elbrachter, Drebes, 1978);
В — временная циста морского планктонного вида Gonyaulax pacifica Kofoid после апикального экдисиса; ядро окружено тонкими пластинками —
явление, не отмеченное у других видов (Taylor, 1987); Г— покоящаяся циста морского планктонного вида Alexandrium tamarense (Lebour) Balech
(Blanco et al., 1985); Д— экзогенная слизистая циста морского планктонного вида Cochlodinium pirum (Schutt) Lemmermann, внутри которой клетка
может сохранять жгутики в течение 14 часов и более (Taylor, 1987); Е — покоящаяся циста Cochlodinium sp. (Matsuoka, 1985); Ж — покоящаяся циста
Gyrodinium instriatum (Freudenthal et Lee) Coats (Matsuoka, 1985); 3 — циста морского паразитического вида Cachonellaparadoxa J. Cachon (Cachon J.,
Cachon M., 1987). А-Д и 3 — нефоссилизирующиеся цисты; E и Ж— фоссилизирующиеся цисты: ВО — выходное отверстие, ОП — околоядерные
пластинки, ПТ — протоплазматический тяж, X — хлоропласты, ЭЦ — экзогенная циста. (По: Fensome et al., 1993).
Рис. 38. Морфологическое разнообразие ископаемых цист.
А — Druggidium sp., Л — Rhynchodiniopsis cladophora (Deflandre) Below, В — Batiacasphaera micropapillata Stover, Г— Spiniferites ellipsoideus Mat-
suoka, Д — Cordosphaeridium funiculatum Morgenroth, E — Kiokansium williamsii Singh, Ж — Cleistosphaeridium placacanthum (Deflandre et Cookson)
Eaton, Fensome, Riding et Williams, 3 — Thalassiphora patula (Williams et Downie) Stover et Evitt, И— Gardodinium trabeculosum (Gocht) Alberti, К —
Chatangiella verrucosa (Manum) Lentin et Williams, Л — Rhombodinium porosum Bujak, M—Areosphaeridium diktyoplokum (Klump) Eaton, H— Chicha-
ouadinium vestitum (Brideaux) Bujak et Davies, О — Trithyrodinium sp., П — Xenascus sp., P — Odontochitina porifera Cookson, C — Palaeocystodinium
golzowense Alberti, T — Batioladinium longicornutum (Alberti) Brideaux, У — Triblastula utinensis Wetzel, Ф — Valvaeodinium lineatum (Wille et Gocht)
Below. (По: Fensome et al., 1993). Названия цист приведены в соответствии с последними номенклатурными изменениями (М. Head, личное сообщ.).
DINOFLAGELLATA
33
скольких лет; для некоторых видов известен обязатель-
ный период покоя. Предполагают, что ископаемые ци-
сты — это гипнозиготы (рис. 38). Клеточные покровы
покоящихся цист содержат диноспорин, по химическо-
му составу и свойствам сходный с высокоустойчивым
органическим веществом спорополленином пыльце-
вых зерен высших растений (Kokinos et al., 1998). Ци-
сты Ceratium hirundinella (O.F. Muller) Dujardin имеют
наружный кремнеземный слой (Chapman et al., 1982).
Цисты Scrippsiella trochoidea (Stein) Loeblich III содер-
жат полисахаридов в 10 раз выше, а интенсивность ды-
хания составляет всего 1,5%, по сравнению с вегетатив-
ными клетками (Brooks, Anderson, 1990). Образование
покоящихся цист происходит в результате сложного
взаимодействия продолжительности дня, температу-
ры и содержания питательных веществ (Kremp, 2001;
Sgrosso et al., 2001). Цисты могут играть важную роль
в начальной фазе «красных приливов», в известной
степени предопределяя место их возникновения и ди-
намику. В некоторых случаях, например, при массовой
патогенной атаке хитридиевыми грибами в пресных
водоемах, цисты динофлагеллат не выживают (Graham,
Wilcox, 2000). Сам процесс полового размножения в
виде изогамии или анизогамии наблюдали лишь у 1%
современных видов. Несмотря на это, есть основания
предполагать, что половое размножения гораздо более
широко распространено среди динофлагеллат или даже
может быть универсальным явлением. Наиболее слож-
ные жизненные циклы имеют паразитические виды
(Fensome et al., 1993).
Кроме покоящихся цист, динофлагеллаты могут
образовывать временные цисты (рис. 37, Л, В, вкл.) в
ответ на воздействие неблагоприятных условий (ме-
ханическое воздействие, резкое изменение темпе-
ратуры). Их часто наблюдают в лабораторных усло-
виях, но редко в натуральных планктонных пробах.
Временные цисты известны в литературе также под
названием пелликульных цист и экдисальных цист
(Dale, 1983). Они описаны для 25 видов динофлагел-
лат из 14 родов: Alexandrium, Amphidinium, Ceratium,
Coolia, Dissodinium, Gambierdiscus, Gymnodinium,
Gonyaulax, Heterocapsa, Kryptoperidinium, Peridinium,
Prorocentrum, Pyrodinium и Pyrocystis (Garces, 2002).
В настоящее время не известно, используют ли один и
тот же термин «временные цисты» для функционально
разных стадий жизненного цикла.
Экология
Пресноводные планктонные динофлагелла-
ты. В солоноватых и пресных водах динофлагеллаты
встречаются реже, чем в морских. Некоторые виды
пресноводных динофлагеллат, большинство которых
относится к родам Peridinium и Peridiniopsis, являются
стенотермными холодноводными, обитая в высокогор-
ных озерах зимой в поверхностном слое; а летом в глу-
5»: сих слоях (Pechlaner, 1971). Ряд видов развивается в
снегу. окрашивая его в красный цвет (Popovsky, Pfiester,
1990). Также известны галофобы и сфагнофилы. Пред-
полагают, что основными факторами, регулирующими
существование и распространение динофлагеллат в
пресных водах являются pH, температура, концентра-
ция органических веществ и ионов кальция, хлора, азо-
та, фосфора; кроме того, для фотосинтетических видов
важны интенсивность и спектральный состав света и
концентрация кислорода, которые могут влиять на вер-
тикальные миграции динофлагеллат в высокогорных
озерах (НбП, 1928; Pechlaner, 1971; Popovsky, Pfiester,
1990). Полиморфизм пресноводных видов Ceratium
(внутрипопуляционная изменчивость длины клеток
и количества выростов) можно объяснить влиянием
температуры (Huber, 1914; Huber, Nipkov, 1922, 1923).
Возрастающее использование удобрений в сельском
хозяйстве и лесоводстве вызывает эвтрофикацию и по-
вышение солености в пресноводных местообитаниях.
Посыпание дорог солью зимой вокруг городов также
существенно повышает соленость в окружающих во-
доемах. Поэтому вполне вероятно, что некоторые мор-
ские виды в будущем найдут прибежище в пресных
водоемах (Popovsky, Pfiester, 1990). Большинство пре-
сноводных динофлагеллат не толерантны к высоким
соленостям. В целом, их характеризуют как алкало-
филы (Pollingher, 1987). Виды Peridinium, Ceratium и
Peridiniopsis наиболее часто, по сравнению с другими
родами, вызывают цветения континентальных водо-
емов. Обычно они предпочитают воды с высоким со-
держанием ионов кальция, или жесткие воды. Пресно-
водные виды переживают зиму (иногда лето) в форме
бентосных цист. Первые вегетативные клетки, вышед-
шие из цист, обитают в поверхностных осадках или в
недавно перемешанных водах. В конце вегетационного
периода, вновь образуются цисты, численность кото-
рых определяет максимальный уровень популяции в
следующем вегетационном периоде. Немногие пресно-
водные виды имеют амебоидную стадию в жизненном
цикле, питающуюся на нитчатых водорослях (Graham,
Wilcox, 2000).
Морские планктонные динофлагеллаты.
Динофлагеллаты населяют в основном морские
воды. Несколько видов, например, Peridiniella cate-
nata (Levander) Balech, Polarella glacialis Montresor,
G. Procaccini et D.K. Stoecker и, вероятно, Apicoporus
glaber (Hoppenrath et Okolodkov) Sparmann, Leander et
Hoppenrath, связаны с морскими льдами (Okolodkov,
1999; Hoppenrath, Okolodkov, 2000; Montresor et al.,
2003; Taylor et al., 2008). Известен случай массового
развития динофлагеллат на нижней поверхности льда
(Околодков, 1989). Большинство динофлагеллат насе-
ляет неритическую (прибрежную) зону или адаптиро-
ваны к жизни как вблизи континентов, так и вдали от
берегов (панталассные виды). Лишь немногие виды ди-
нофлагеллат обитают исключительно в океанической
зоне. Представители родов Citharistes, Heterodinium и
Histioneis, и, по-видимому, Amphisolenia, Ornithocercus
и Triposolenia, предпочитают океанические воды. Неко-
торые виды Ceratium (главным образом), Heterodinium,
Pyrocystis и Triposolenia избегают поверхностных сло-
ёв и относятся к так называемой теневой флоре мор-
ского планктона (Karsten, 1907; Soumia, 1982а, b).
34
DINOFLAGELLATA
Адаптации к поглощению питательных веществ по-
зволяют динофлагеллатам обитать в океанических
тропических и субтропических районах с их низким
содержанием. Они могут образовывать максимумы
хлорофилла на глубине 75—150 м. Океанические виды
отличаются более развитыми клеточными выростами в
форме рогов (Protoperidinium, Ceratium} или крыльев
(Ornithocercus, Histioneis, Citharistes, Dinophysis), тем
самым, повышая соотношение поверхности клетки к
ее объему, что улучшает плавучесть и защищает от вы-
едания более мелкими хищниками, чем мезопланктон-
ные беспозвоночные и рыбы-планктофаги (Pollingher,
1988). Принято считать, что диатомовые в целом пред-
почитают холодные воды, а динофлагеллаты теплые.
Согласно другой точке зрения, диатомовые преобла-
дают в прибрежных морских водах в начале вегета-
ционного периода, а также в открытых арктических и
субарктических водах. Позднее, по мере того как в при-
брежной зоне умеренных районов и в открытом океа-
не истощаются запасы силикатов, крайне важных для
метаболизма диатомовых, динофлагеллаты получают
преимущество в потреблении питательных веществ за
счет способности к вертикальным миграциям и гетеро-
трофии (Graham, Wilcox, 2000).
Красные приливы. Явления, называемые «цве-
тениями» (англ.\ blooms) водорослей или водоемов,
«красными приливами» (англ.-, red tides), а также вре-
доносными «цветениями» водорослей (англ.: harmful
algal blooms), развиваются в основном в прибрежных
водах морей (Zingone, Wyatt, 2005). Они могут быть
токсичными или нетоксичными, в зависимости от вы-
зывающего его вида, его физиологических и генетиче-
ских особенностей и внешних экологических факторов
(табл. 1). Их начало и динамика еще не вполне объяс-
нимы, однако, начиная со времени проведения перво-
го международного конгресса по «красным приливам»
(LoCicero, 1975) отмечен значительный прогресс в из-
учении многочисленных аспектов «красных приливов»
и токсичных одноклеточных организмов. «Цветения»
отмечены во всех типах прибрежных экосистем, от
эвтрофированных и загрязненных до чистых, от фи-
зически изолированных водоемов до акваторий, где
преобладают мезомасштабные океанографические
процессы (Zingone, Wyatt, 2005). В то время как пи-
щевые отравления паралитическими ядами — широко
распространенное явление, желудочно-кишечные от-
равления, связанные с «красными приливами», огра-
ничены в основном европейскими морями и атланти-
ческими водами Канады. Сигуатера преимущественно
отмечена в отдельных районах Карибского бассейна и
тропической Пацифике. Массовая гибель рыб, связан-
ная с токсичными видами Pfiesteria, Pseudopfiesteria и
сходными с ними формами, характерна для эстуариев
восточного побережья США; кроме того, токсичные
виды сем. Pfiesteriaceae найдены у берегов северной
Европы и Новой Зеландии (Burkholder et al., 2001).
В морях России случаи «красных приливов» отмечены
на Дальнем Востоке (Коновалова, 1992а, б, 1995, 1999;
Konovalova, 1989, 1993а, b; Orlova et al., 2002; Орлова,
2005; Могильникова и др., 2007). Высказано предполо-
жение, что в связи с глобальным наступлением «крас-
ных приливов» и развитием судоходства, в настоящее
время возрастает угроза непроизвольного интродуци-
рования потенциально вредных и токсичных динофла-
геллат в моря Российской Арктики (Околодков, 1999,
2000). Вполне вероятно, что «красные приливы» об-
разовали месторождения нефти и угля в региональном
или даже планетарном масштабе (Downie, 1956; Abe,
1965; Gallois, 1976). Покоящиеся цисты динофлагеллат
служат геологам для оценки возраста предполагаемых
месторождений нефти. Нефть в древних отложениях
содержит 4-метилстероидные углеводороды, которые,
возможно, произошли из 4-метилстероидов динофла-
геллат (Robinson et al., 1984). Образование углеводоро-
дов было, по-видимому, довольно обычным явлением
в период с середины до конца архейской эры, от 3,2 до
2,63 миллиарда лет назад, на 1 миллиард лет раньше,
чем предполагалось, и с этим периодом можно связы-
вать начало образования нефти биогенного происхож-
дения (Rasmussen, 2005).
Влияние абиотических и биотических факторов.
Динофлагеллаты нуждаются в органическом углероде
и минеральных веществах, в первую очередь, в фос-
форных и азотных соединениях. Фаготрофные формы
получают их в форме взвешенных веществ, осмотроф-
ные — в виде растворенных соединений. В целом,
динофлагеллаты чувствительны к высокому уровню
турбуленции, которая задерживает их рост и клеточное
деление. Поэтому нередко можно наблюдать их массо-
вое развитие в спокойных водах и в отсутствие ветра.
Взаимодействие турбуленции и скорости оседания кле-
ток, вероятно, является причиной большинства сезон-
ных сукцессий фитопланктона (Hutchinson, 1967).
Между некоторыми динофлагеллатами и диато-
мовыми и между некоторыми динофлагеллатами и
криптофитовыми существуют, по-видимому, антаго-
нистические отношения (Aubert et al., 1977; Ushida,
1981; Rengefors, Legrand, 2001). К алелопатическим
соединениям, вырабатываемым динофлагеллатами, от-
носятся сакситоксины, жирные кислоты, полиэфиры,
цикличные иминные токсины. Среди алелопатических
соединений, прижизненно выделяемых клетками во-
дорослей, можно встретить альгициды, фунгициды,
вещества с антибактериальным и антивирусным эф-
фектом, которые влияют на сезонные сукцессии фито-
планктонных сообществ наряду с экзогенными факто-
рами (Burkholder et al., 1960; Trick et al., 1984; Cembella,
2003; Legrand et al., 2003).
Динофлагеллаты в целом проявляют, главным об-
разом, патентные свойства (Ильяш, 1998; Ильяш и
др., 1999), согласно классификации Раменского-Грай-
ма (Раменский, 1938; Grime, 1979), которая выделяет
три первичные жизненные стратегии: патиентность,
виолентность и эксплерентность. Патиентность харак-
теризуется высоким сродством к субстрату, исполь-
зованием внутриклеточных запасов минеральных ре-
сурсов, экономичностью метаболизма, компенсацией
дефицита минеральных ресурсов за счет ассимиляции
экзогенных органических субстратов, устойчивостью
к воздействию токсичных метаболитов, способностью
DINOFLAGELLATA
35
Т аблица 1
Токсичные виды динофлагеллат, их вредные эффекты и токсины (составлено на основе данных ЮС (2010),
с изменениями и дополнениями)
Таксон Вредные эффекты и токсины
Alexandrium acatenella (Whedon et Kofoid) Balech 1985 PSP
Alexandrium andersonii Balech 1990 PSP
Alexandrium balechii (Steidinger) Balech 1985 FM
Alexandrium catenella (Whedon et Kofoid) Balech 1985 PSP, FM
Alexandrium fundyense Balech 1985 PSP
Alexandrium hiranoi Kita et Fukuyo 1988 AF
Alexandrium minutum Halim 1960 PSP, FM
Alexandrium monilatum (Howell) Balech 1985 FM, H
Alexandrium ostenfeldii (Paulsen) Balech et Tangen 1985 PSP,S
Alexandrium tamarense (Lebour) Balech 1985 PSP, FM
Alexandrium tamiyavanichii Balech 1994 PSP
Amphidinium carterae Hulburt 1957 H, FM
Amphidinium operculatum Claparede et Lachmann 1859 H,AF, FM
Amphidinium operculatum var. gibbosum Maranda et Shimizu 1996 C
Azadinium spinosum Elbrachter et Tillmann 2009 AZP
Cochlodinium polykrikoides Margalef 1961 FM (ROC)
Coolia monotis Meunier 1919 COTX
Dinophysis acuminata Claparede et Lachmann 1859 DSP (OA)
Dinophysis acuta Ehrenberg 1841 DSP (OA, DTX1, DTX2)
Dinophysis caudata Saville-Kent 1881 DSP (OA, PTX2)
Dinophysis fortii Pavillard 1923 DSP (OA, DTX1, PTX2)
Dinophysis miles Cleve 1900 DSP (OA, DTX1)
Dinophysis mitra (Schutt) Abe vel Balech 1967 DSP (DTX1)
Dinophysis norvegica Claparede et Lachmann 1859 DSP (OA, DTX1)
Dinophysis rapa (Stein) Balech 1967 DSP (OA)
Dinophysis rotundata Claparede et Lachmann 1859 DSP (DTX1)
Dinophysis sacculus Stein 1883 DSP (OA)
Dinophysis tripos Gourret 1883 DSP (DTX1)
Gambierdiscus australes M.A. Faust et Chinain 1999 CFP (CTX, MTX)
Gambierdiscus belizeanus M.A. Faust 1995 CFP (MTX)
Gambierdiscus excentricus Fraga et al. 2011 CFP (CTX, MTX)
Gambierdiscus pacificus Chinain et M.A. Faust 1999 CFP (CTX, MTX)
Gambierdiscus polynesiensis Chinain et M.A. Faust 1999 CFP (CTX, MTX)
Gambierdiscus toxicus Adachi et Fukuyo 1979 CFP (CTX, MTX)
Gambierdiscus yasumotoi Holmes 1998 CFP (MTX)
Gonyaulax spinifera (Claparede et Lachmann) Diesing 1866 YTX
Gymnodinium catenatum Graham 1943 PSP
Heterocapsa circularisquama Horiguchi 1995 IM
Karenia bicuneiformis (Chang) G. Hansen et Moestrup 2000 BTX
Karenia brevis (Davis) G. Hansen et Moestrup 2000 AM, NSP
Karenia brevisulcata (Chang) G. Hansen et Moestrup 2000 AM, PM
Karenia concordia Chang et Ryan 2004 NSP(?)
Karenia cristata Botes, Sym et Pitcher 2003 BTX
Karenia digitata Yang, Takayama, Matsuoka et Hodgkiss 2000 FM
Karenia mikimotoi (Miyake et Kominami ex Oda.) G. Hansen et Moestrup 2000 FM, IM (Gy)
Karenia papilionaceae Haywood et Steidinger 2004 BTX
selliformis Haywood, Steidinger et MacKenzie 2004 BTX
36
DINOFLAGELLATA
Таблица 1 (окончание)
Таксон
Karenia umbella de Salas, Bolch et Hallegraeff 2004
Karlodinium armiger Bergholtz, Daugbjerg et Moestrup 2005
Karlodinium corsicum (Paulmier Berland, Billard et Nezan) Siano et Zingone 2009
Karlodinium micrum (Leadbeater et Dodge) J. Larsen 2000
Karlodinium veneficum (Ballantine) J. Larsen 2000
Ostreopsis lenticularis Fukuyo 1981
Ostreopsis mascarenensis Quod 1994
Ostreopsis ovata Fukuyo 1981
Ostreopsis siamensis J. Schmidt 1901
Peridiniopsis polonicum (Woloszynska) Bourrelly 1968
Peridinium aciculiferum Lemmermann 1900
Peridinium bipes Stein 1883
Pfiesteria piscicida Steidinger et Burkholder 1996
Prorocentrum arabianum Morton et Faust 2002
Prorocentrum arenarium Faust 1994
Prorocentrum belizeanum Faust 1993
Prorocentrum borbonicum Ten-Hage, Turquet, Quod, Puiseux-Dao et Coute 2000
Prorocentrum cassubicum (Woloszynska) Dodge 1975
Prorocentrum concavum Fukuyo 1981
Prorocentrum emarginatum Fukuyo 1981
Prorocentrum faustiae Morton 1998
Prorocentrum hoffmannianum Faust 1990
Prorocentrum lima (Ehrenberg) Stein 1878
Prorocentrum maculosum Faust 1993
Prorocentrum minimum (Pavillard) Schiller 1931
Prorocentrum rhathymum Loeblich III, Sherley et Schmidt 1979
Protoceratium reticulatum (Claparede et Lachmann) Biitschli 1885
Protoperidinium crassipes (Kofoid) Balech 1974
Pseudopfiesteria shumwayae (Glasgow et Burkholder) Litaker, Steidinger, P.L. Mason, Shields
et Tester 2005
Pyrodinium bahamense L. Plate, 1906 var. compressum (Bohm) Steidinger, Tester et Taylor, 1980
Takayama cladochroma (J. Larsen) de Salas, Bolch et Hallegraeff, 2003
Вредные эффекты и токсины
FM
FM
FM
FM
FM, IM
OTX, PTXA
PTXA
PTXA
PTXA
ITX (Gl)
H, A
A
FM
C (ITX)
DSP (OA)
DSP (OA)
NTX(?)
DSP
?
H
DSP (DTX1)
DSP (OA, FAT)
DSP (OA, DTX2), FAT, Pr, DA
DSP (OA), FAT, Pr
IM
H
YTX
AZP(?)
FM
PSP
FM, IM
Примечание. Вредные эффекты и токсины: А — algicidal effect (альгицидный эффект), AF — antifungal compounds (соединения
с противогрибковым действием), AM — animal mortalities (гибель животных), AZP — azaspiracid poisoning (отравление азаспирацидами,
азаспирациды — липофильные токсины; токсичны для подопытных мышей), ВТХ — brevetoxins (бреветоксины — нейротоксичные полиэфиры,
влияющие негативно на натриевые каналы; некоторые аналоги бреветоксинов имеют гемолитический эффект), С — cytotoxins (цитотоксины), CFP —
ciguatera fish poisoning (отравление сигуатерой в результате употребления в пищу тропических рыб, содержащих сигуатоксины и майтотоксины),
СОТХ — cooliatoxin (кулиятоксин — нейротоксичные полиэфиры, являющиеся, по-видимому, аналогами ессотоксинов; токсичны для подопытных
мышей), СТХ — ciguatoxins (сигуатоксины — нейротоксичные жирорастворимые соединения, активирующие натриевые каналы в клеточных
мембранах), DA — domoic acids (домоевые кислоты — аминокислоты нейрологического и желудочно-кишечного действия; токсины, типичные для
ряда видов планктонных диатомовых рода Pseudo-nitzschia), DSP — diarrheic shellfish poisoning (отравление диарейными ядами, вызывающими у
человека желудочно-кишечные расстройства в результате нарушения водного баланса), DTX1 — dinophysistoxin-1 (динофизистоксин-1 — полиэфиры
желудочно-кишечного действия), DTX2 — dinophysistoxin-2 (динофизистоксин-2 — полиэфиры желудочно-кишечного действия), FAT — fast acting
toxins (быстродействующие токсины: гимнодимин, пророцетролиды, спиролиды и пиннатоксины), FM — fish mortalities (гибель рыб), G1 — glenodinin
(гленодинин — ихтиотоксин), Gy — gymnodimine (гимнодимин — полиэфиры, быстродействующий токсин), Н —haemolytic compounds (соединения
с гемолитическим действием), IM — invertebrate mortalities (гибель беспозвоночных), ITX — ichthyotoxins (ихтиотоксины — токсины, вызывающие
гибель рыб посредством гемолитических ядов и соединений реактивного кислорода), МТХ — maitotoxins (майтотоксины — нейротоксичные
полиэфиры, водорастворимые соединения, влияющие негативно на транспорт ионов кальция), NTX — neurotoxins (нейротоксины с неизвестной
структурой), ОА — okadaic acid (окадаевая кислота — полиэфиры, ингибиторы протеин-фосфатазных энзимов; по-видимому, также способствует
развитию раковых опухолей), ОТХ — ostreotoxins (остреотоксины — водорастворимые нейротоксины), РМ — plant mortalities (гибель водных
растений), Рг — prorocentrolides (пророцетролиды — полиэфиры, быстродействующие токсины), PSP — paralytic shellfish poisoning (отравление
паралитическими ядами сакситоксинами и их производными — нейротоксичными алкалоидами), РТХА — pectenotoxin-A (аналоги палитоксинов —
полиэфиры; палитокисны воздействуют негативно на сердечно-сосудистую и мышечную системы и нервные волокна посредством деполяризации
клеточных мембран, цитотоксичные), РТХ2 — pectenotoxin-2 (пектенотоксин-2; гепатотоксичный полиэфир), ROC — reactive oxygen compounds
(соединения реактивного кислорода, вызывающие гибель рыб путем нарушения дыхательной и осморегуляторной функций в жабрах), S — spirolids
(спиролиды — нейротоксичные полиэфиры, быстродействующие токсины), YTX — yessotoxins — (ессотоксины — полиэфиры кардиотоксичного
действия, взаимодействующие с липидными мембранами).
DINOFLAGELLATA
37
развиваться в экстремальных условиях среды. Патен-
ты обладают умеренной конкурентной чувствительно-
стью, присутствуя в планктоне во время интенсивного
развития диатомовых с выраженными виолентными
свойствами, скорость роста популяций которых стре-
мится к максимальной для быстрой эксплуатации ре-
сурса (биогенных веществ). При истощении мине-
ральных ресурсов среды и возрастании нересурсной
составляющей фактора стресса (снижении температу-
ры воды, освещенности, уменьшении продолжитель-
ности светового дня) вклад динофлагеллат в общую
биомассу фитопланктона и их функциональная роль
в фотосинтетической и гетеротрофной активности со-
общества возрастают. Доминирование динофлагеллат
по численности и биомассе в летне-осенний период в
морях Евразийской Арктики (Околодков, 2000) под-
тверждает положение о преимущественной патиентно-
сти динофлагеллат.
Бентосные динофлагеллаты. Экология бентос-
ных динофлагеллат менее изучена и их видовое бо-
гатство гораздо ниже, по сравнению с планктонными.
Наиболее многочисленны и разнообразны две экологи-
ческие группы: интерстициальные (псаммофильные)
виды, обитающие в песчаном грунте (Baillie, 1971;
Hoppenrath, 2000а; Saburova et al., 2009; Al-Yamani,
Saburova. 2010), и эпифитные виды, живущие на мор-
ских водорослях и травах. Эпифитные динофлагел-
латы наиболее распространены в тропических и суб-
тропических водах (Turquet et al., 1998; Faust, 2004;
Mohammad-Noore et al., 2007; Okolodkov et al., 2007).
Prorocentrum lima и P mexicanum B.F. Osorio дости-
гают высокой численности также в умеренной зоне
(Levasseur et al., 2003). Кроме того, их можно найти на
мертвых кораллах и в плавающих скоплениях детрита
в манграх (Faust, 1995). Виды рода Gambierdiscus, вы-
зывающие сигуатеру и ранее находимые лишь в тропи-
ческой зоне, недавно обнаружены в Средиземном море
(Aligasaki et al., 2008). Кроме сигуатеры, бентосные
динофлагеллаты (Prorocentrum) могут вызывать желу-
дочно-кишечное отравление, возникающее вследствие
накопления токсинов в тканях моллюсков и потребле-
ния моллюсков человеком. В отличие от большинства
планктонных, клетки эпифитных видов часто сжаты,
и они обычно живут в слизистом матриксе, покрываю-
щем макрофиты, или прикрепляются к ним с помощью
короткой нити.
Эндосимбиотические динофлагеллаты. Эндо-
симбиотические динофлагеллаты, живущие в корал-
ловых рифах и связанных с ними организмах, наибо-
лее известны под названием «зооксантеллы», а также
«зоохлореллы». Они обитают в филогенетически отда-
ленных друг от друга группах организмов: в радиоля-
риях, фораминиферах, кораллах (преимущественно в
рифообразующих кораллах Madreporaria: Hexacorallia:
Anthozoa), актиниях, медузах Scyphozoa (как эндоци-
тосимбионты) и Hydrozoa, брюхоногих и двустворча-
тых моллюсках (как эндогистосимбиоцты), губках и
плоских червях (Spindler, Hemleben, 1980; Trench et al.,
1981; Spero, 1987; Trench, 1987, 1993; Lopes, Silveira,
1994; Scalera-Liaci et al., 1999; Baillie et al., 2000; Caron,
2000; Farmer et al., 2001; Gast, Caron, 2001; Leggat et
al., 2002; von Oppen et al., 2005; Stoecker et al., 2009;
Annenkova et al., 2011). Предполагают, что процветание
рифообразующих склерактиниевых кораллов со време-
ни их появления в триасе (210-245 миллионов лет на-
зад), и, вероятно, также фораминифер, было прямым
результатом приобретения кораллами эндосимбиотиче-
ских динофлагеллат и их совместной эволюции (Wells,
1956; Heckel, 1974; Lee et al., 1979). Это, по-видимому,
является одной из причин высокого видового богатства
и разнообразия современных экосистем коралловых
рифов. Плотность поселения Symbiodinium на здоровых
кораллах может превышать 1010 клеток/м2 (Baker, 2003b).
Более чем 60% углерода (согласно Lee, 2008 — 98%),
фиксированного клетками эндосимбионтов, передает-
ся организму-хозяину, благоприятствуя также процессу
обызвествлению кораллов. Обызвествление рифообра-
зующих кораллов на свету происходит в среднем в три
раза быстрее (у некоторых видов до 22,9 раз), чем в тем-
ноте, и у кораллов с эндосимбиотическими динофла-
геллатами в среднем в 1,9 быстрее, чем у кораллов без
эндосимбионтов (Goreau, Goreau, 1959; Goreau et al.,
1996; Gatusso et al., 1999). В темноте, по крайней мере,
у некоторых видов кораллов, наличие эндосимбионтов
также ускоряет процесс обызвествления, иногда до 3,1
раза. Клетки хозяина выделяют тауриновую аминокис-
лоту, которая вынуждает клетки динофлагеллат высво-
бодить продукты фотосинтеза (Wang, Douglas, 1997).
В целом, отношения между ними можно охарактери-
зовать как пищевой мутуализм. Со времени описания
рода Symbiodinium (Freudenthal, 1962) молекулярно-
биологические исследования были проведены лишь на
склерактиниевых и горгониевых кораллах, двуствор-
чатых моллюсках сем. Tridacnidae и фораминиферах.
Известно немногим более десятка видов Symbiodinium
(Trench, Blank, 1987; Banaszak et al., 1993), и молеку-
лярно-биологические исследования подтвердили су-
ществование 4-10 клад этого рода, причем показано,
что существует специфичность между этими кладами
и организмами-хозяевами (Baker, 2003а, Ь); предпола-
гают, однако, что видовое разнообразие Symbiodinium
намного больше. Нередко один хозяин содержит не-
сколько типов симбионтов. Виды Symbiodinium распро-
странены в тропических, субтропических и умеренных
(25-35°, до 48,5° с. ш.) водах. Кроме того, симбиоти-
ческие динофлагеллаты найдены среди представите-
лей родов Amphidinium, Gymnodinium, Gloeodinium,
Prorocentrum, Scrippsiella, Pelagodinium и, вероятно,
Woloszynskia (Banaszak et al., 1993; Siano et al., 2010;
Annenkova et al., 2011). Глобальное повышение тем-
пературы и участившиеся температурные аномалии,
такие как феномен Эль-Ниньо, на фоне повышения
кислотности океана, на протяжении последних трех де-
сятилетий явились причиной более частых и драмати-
ческих случаев «обесцвечивания» (англ.: bleaching) ко-
раллов и их гибели (Williams, Bunkley-Williams, 1990;
Glynn, 1991, 1993; Goreau, Hayes, 1994; Brown, 1997;
Reaser et al., 2000; Schuttenberg, 2001; Douglas, 2003;
Barton, Casey, 2005; Goreau et al., 2005; Hoegh-Guldberg,
2009; Idso, 2009). Эндосимбиотические динофлагелла-
38
DINOFLAGELLATA
Таблица 2
Список родов паразитических динофлагеллат морских и пресноводных организмов
Таксон Фотосинтези- рующая стадия Эктопаразит или эндопаразит Хозяин Литература
Gymnodiniales Paulsenella — Н водоросли 14, 28, 55
Syltodinium - Н яйца ракообразных и коловраток 22, 50
Schizochytriodinium Peridiniphycidae incertae sedis — Н яйца ракообразных 25,50
Tintinnophagus Phytodiniales — Н инфузории 59
Cystodinedria + Н водоросли 43,44
Cystodinium + Н 42
Stylodinium Blastodiniales + Н водоросли, книдарии 11,43,44
Myxodinium - Н водоросли 12
Caryotoma ? В радиолярии 30,31,58
Protoodinium + Н книдарии 7
Cachonella - Н книдарии и яйца ракообразных 3, 45, 50
Oodinium - Н саркодовые, книдарии, гребневики аннелиды, хетогнаты, аппендикулярии, молодь и икра рыб 3,6, 13,40,41,50
Actinodinium — В яйца ракообразных, копеподы 19, 50
Blastodinium + В яйца ракообразных, копеподы 14, 46, 47, 50
Chytriodinium - Н яйца ракообразных 5, 23, 47, 50, 56
Dissodinium + Н яйца ракообразных 24, 26, 50, 55, 56
Haplozoon - В аннелиды, икра рыб 3, 48, 49
Apodinium - Н молодь рыб аппендикулярии 8, 39, 50
Amyloodinium - Н молодь и икра рыб, плоские черви 2, 22, 35, 36, 50, 60
Crepidoodinium + Н икра рыб 36, 37, 50
Oodinioides - Н икра рыб 36
Piscinoodinium + н икра рыб 36, 50, 54
Syndiniales Atlanticellodinium — в саркодовые 9, 50
Dogelodinium - в саркодовые 3
Keppenodinium - в саркодовые 3, 50
Merodinium — в саркодовые 15,31,32, 50
Solenodinium - в саркодовые 15,32, 50,58
Amoebophrya — в саркодовые, динофлагеллаты, инфузории, хетогнаты, сифонофоры 1,3,34, 50,51
Coccidinium - в динофлагеллаты 17, 18
Duboscquella - в динофлагеллаты, тинтинниды 3,21,55
Duboscquodinium - в тинтинниды, радиолярии, акантарии 16, 50, 59
Hematodinium - в яйца ракообразных, ракообразные 20, 33, 47, 53
Trypanodinium - в яйца ракообразных 13,50
Syndinium - в яйца ракообразных, копеподы 14,38, 47, 50, 55
Sphaeripara - в молодь рыб, аппендикулярии 4, 40, 50
Ichthyodinium - в молодь и икра рыб 29, 36, 50, 57
Atelodinium - в копеподы 50
Примечание. Н — эктопаразиты, В — эндопаразиты; символы «+» и «-» означают соответственно наличие и отсутствие фотосинтезирующих
стадий в жизненном цикле паразита (по Coats (1999), с изменениями и дополнениями: ссылки 50-60).
Литература: 1 — Borgert, 1898; 2 — Brown, 1934; 3 — Cachon, 1964; 4—8 — J. Cachon, M. Cachon, 1966, 1968, 1971a, b, 1973; 9, 10 — Cachon,
Cachon-Enjumet, 1964, 1965; 11, 12 — Cachon et al., 1965, 1969; 13-16 — Chatton, 1912, 1920, 1923, 1952; 17, 18 —Chatton, Biecheler, 1934, 1936; 19 —
Chatton, Hovasse, 1938; 20 — Chatton, Poisson, 1931; 21 —Coats, 1988; 22 — Colomi, 1994; 23 — Dogiel, 1906; 24,25 — Drebes, 1969,1988; 26 — Drebes,
Schnepf, 1988; 27 — Elbrachter, 1988; 28 — Elbrachter, Drebes, 1978; 29 — Holland, Cachon, 1952; 30 — Hollande, Corbel, 1982; 31 — Hollande, Enjumet,
1953; 32 — Hovasse, Brown, 1953; 33 — Hudson, Schields, 1994; 34 — Koeppen, 1899; 35 — Landsberg et al., 1994; 36 — Lorn, 1981; 37 — Lorn et al.,
1993; 38 — Manier et al., 1971; 39 — McLean, Galt, 1990; 40 — McLean, Nielsen, 1989; 41 — Mills, McLean, 1991; 42 — Pfiester, Lynch, 1980; 43, 44 —
Pfiester, Popovsky, 1979; Popovsky, Pfiester, 1982; 45 — Rose, Cachon, 1951; 46 — Sewell, 1951; 47 — Schields, 1994; 48 — Shumway, 1924; 49 — Siebert,
1973; 50 — Ohtsuka et al., 2000; 51 — Garate-Lizarraga, Siqueiros-Beltrones, 2003; 52 — Skovgaard et al., 2005; 53 — Stentiford, Shields, 2005; 54 — Levy
et al., 2007; 55 — Коновалова, 2007; 56 — Gomez et al., 2009; 57 — Skovgaard et al., 2010; 58 — Gast, 2005; 59 — Coats et al., 2010; 60 — Colomi, 1994.
DINOFLAGELLATA
39
ты известны также из пресноводных местообитаний
(Annenkova et al., 2011). Консорции морских гетеро-
трофных динофлагеллат родов Ornithocercus, Histioneis
и Citharistes с экзосимбиотическими цианобактериями
родов Synechococcus Nageli и Synechocystis Sauvageau
(Norris, 1967; Taylor, 1982; Hallegraeff, Jeffrey, 1984;
Lucas, 1991; Gordon et al., 1994), способными к фикса-
ции азота, формируются преимущественно в периоды
дефицита азота в океанических тропических и субтро-
пических водах (Gordon et al., 1994). Иногда сами ди-
нофлагеллаты содержат эндосимбионты. Одна клетка
Noctiluca scintillans (Macartney) Kofoid et Swezy может
содержать до 12 000 зеленых флагеллат Pedinomonas
Korshikov, активно плавающих в жидкости внутри
больших вакуолей (Sweeney, 1976; Furuya et al., 2006;
Lee, 2008).
Паразитические динофлагеллаты. Динофла-
геллаты могут быть паразитами других одноклеточ-
ных организмов, многоклеточных животных (особен-
но морских ракообразных) или водорослей (табл. 2).
В действительности, гетеротрофные динофлагеллаты
образуют континуум в ряду хищник - паразит, и опре-
деление трофического статуса промежуточных форм
вызывает затруднения (Coats, 1999). Паразитические
виды имеют в жизненном цикле расселительные ста-
дии (диноспоры), морфологически сходные со свобод-
ноживущими. Большинство паразитических динофла-
геллат — облигатные гетеротрофы. Хлоропласты и
фотосинтезирующие пигменты наиболее характерны
для эктопаразитических видов. Класс Blastodiniphy-
сеае представлен внеклеточными фотосинтезирую-
щими и гетеротрофными паразитическими видами,
жизненный цикл которых всегда включает спороген-
ную стадию и может включать одну или более стадий
цист. За счет фотосинтеза виды Blastodinium получают
до 50% энергии, необходимой для роста (Пастернак и
др., 1984). Фототрофия также увеличивает возможно-
сти расселения вида на стадии диноспор. Спорогенез
происходит в форме палиспорогенеза или палинтомии
и заканчивается образованием подвижных диноспор,
способных инфицировать хозяина (см. рис. 9, А, Б,
вкл.; рис. 35).
Как правило, паразитические динофлагеллаты
специфичны в его выборе; однако, есть паразиты, име-
ющие от 2 до 4 видов-хозяев (Skovgaard, Saiz, 2006).
Среди всех родов, Oodinium отличается наиболее ши-
роким спектром хозяев. Amyloodinium ocellatum спосо-
бен инфицировать более 100 видов рыб из более, чем
40 семейств (Lorn, 1981). Большинство видов прикре-
пляется к хозяину с помощью специальной органеллы
в виде стилета (Haplozoon) или ризоида (Apodinium),
однако, представители сем. Blastodiniaceae остаются
неприкрепленными в течение всего жизненного цикла.
Динофлагеллаты паразитируют на копеподах (в пище-
варительном тракте и на яйцах), гидромедузах, сифо-
нофорах, круглых червях, аппендикуляриях и рыбах.
Виды Phytodiniales, большинство из которых фото-
синтезирующие, паразитируют на водных растениях,
включая водоросли, причем обычно прикрепляющейся
является коккоидная стадия и лишь иногда амебоидная
(Fensome et al., 1993). Диноспоры могут функциониро-
вать как зооспоры или как гаметы.
Большинство описанных паразитических видов
динофлагеллат пресноводные, однако есть и морские
(Paulsenella, Rufusiella). Представители Syndiniales —
морские виды, паразитирующие внутри клеток про-
стейших, во внутренних полостях копепод и аппен-
дикулярий, гемолимфе крабов, в яйцах копепод и
сардинах. Паразитические динофлагеллаты могут при-
крепляться к хозяину при помощи стебелька, который
одновременно представляет собой аппарат питания.
Он целиком или частично лежит на кутикуле хозяина и
образует систему разветвленных ризоидов (J. Cachon,
М. Cachon, 1987). У одних представителей прикрепи-
тельная органелла и питательный аппарат разобще-
ны (Amyloodinium), у других составляют одно целое
(Protoodinium). С их помощью инфицирующая клетка
может проникнуть сквозь кутикулу в хозяина в тече-
ние нескольких минут. В случае внутриклеточных па-
разитических динофлагеллат, организм-хозяин обычно
реагирует образованием вокруг паразита мембраны, за-
ключая его в паразитофорную вакуоль.
В целом, паразитические виды динофлагеллат (на-
пример, Amoebophrya) могут оказывать значительное
влияние на физиологию и поведение хозяина, динамику
«цветений» воды (сдвигая сроки наступления или даже
предотвращая их) и динамику планктонных сообществ,
а также на поток вещества в морских пищевых цепях
(Nishitani et al., 1985; Coats et al., 1996; Park et al., 2004).
Динофлагеллаты вызывают эпизоотии в популяциях
крабов и лангустов, губительно влияя на бентосные со-
общества (Shields, 1994). В естественных популяциях
рыб наиболее часты эпизоотии, вызванные динофла-
геллатами Amyloodinium ocellatum, Crepidoodinium spp.
и Ichthyodinium chabelardi Hollande et J. Cachon, пара-
зитирующем на икре рыб (Coats, 1999). В закрытых
системах наиболее обычными и патогенными дино-
флагеллатами считаются A. ocellatum, характерный для
тепловодных морских рыб, и Piscinoodinium pillulare,
паразит культивируемых пресноводных рыб.
Систематика и филогения
Результаты молекулярно-биологических исследо-
ваний динофлагеллат и некоторых других одноклеточ-
ных жгутиконосцев указывают на монофилетическое
происхождение группы организмов, включающей спо-
ровиков (Apicomplexa), инфузорий и динофлагеллат,
названной Alveolata (Kumazaki et al., 1983; Herzog,
Maroteaux, 1986; Krishnan et al., 1990; Schlegel, 1991;
Wolters, 1991; Cavalier-Smith, 1993; Corliss, 1994;
Inagaki et al., 1997; Saldarriaga et al., 2004). Эта группа
отделилась, вероятно, не от основания главной линии
эукариот, а значительно позже (Johnson, Baverstock,
1989; Lenaers et al., 1989, 1991; Sogin, 1989; McNally et
al., 1994 и др.). В настоящее время большинство спе-
циалистов разделяет точку зрения, согласно которой
Alveolata, наряду с гетероконтами входят в состав су-
перкластера эукариот Chromalveolata (Baldauf, 2003;
40
DINOFLAGELLATA
МИЛЛИОНЫ
лет
Рис. 39. Изменение числа видов ископаемых динофлагеллат с мезозоя до настоящего времени. (По: Taylor, 2008; изменено: подраз-
деление геологических эпох не дано).
Adi et al., 2005; Steencamp et al., 2006; Yoon et al., 2008).
Общим признаком альвеолат является наличие кор-
тикальных альвеол. Однако появление слоя альвеол у
динофлагеллат и инфузорий произошло, по-видимому,
независимо друг от друга, что позволяет предположить
независимое возникновение пелликулы в этих груп-
пах (Karpov, 2000). Анализ митохондриальной ДНК
и генов, кодирующих шесть белков, включая актин и
Р-тубулин, показал, что динофлагеллаты в наибольшей
степени родственны споровикам (Inagaki et al., 1997;
Fast et al., 2002). Кроме того, данные по ультраструк-
туре динофлагеллат свидетельствуют о филогенетиче-
ском единстве динофлагеллат, споровиков и инфузорий
(Карпов, 1990). Следует признать, что молекулярная
филогения подтвердила существование монофилети-
ческих групп организмов, установленных на основе
электронно-микроскопических исследований, но внес-
ла мало нового в наши знания о порядке возникнове-
ния групп (Philippe, Adoutte, 1998). Принимая точку
зрения Кавалье-Смита (Cavalier-Smith, 1993), Кусакин
и Дроздов (1998) в своей системе прокариот и низших
эукариот помещают динофлагеллат, инфузорий и спо-
ровиков (Apicomplexa) в царство Alveolates, причем
динофлагеллаты и споровики объединены в одно под-
царство. Кроме того, родственными таксонами по отно-
шению к динофлагеллатам являются Perkinsus Levine,
Parvilucifera Noren et Moestrup in Noren, Moestrup et
Rehnstam-Holm, Oxyrrhis Dujardin (Saldarriaga et al.,
2004) и паразиты ракообразных Ellobiopsidae, особенно
роды Ellobiopsis Caullery и Thalassomyces Niezabitowski
(Gomez et al., 2009a). К проальвеолятным также отно-
сят Colpodella Cienkowski (родственный Apicomplexa).
Динофлагеллаты известны со среднего триаса. Од-
нако находки двух родов, Arpylorus и Palaeodinophysis,
предположительно относящихся к динофлагеллатам,
датируются соответственно поздним силуром и дево-
ном. В раннем мезозое разнообразие динофлагеллат
резко возросло, при этом возникли основные морфо-
логические типы динофлагеллат (Fensome et al., 1996).
Известно, что в триасе возникли многие ископаемые
группы организмов. Они быстро эволюционировали и
заполнили экологические ниши, освободившиеся по-
сле массового вымирания организмов в перми-триасе,
которое, вероятно, было связано с распадом древнего
материка Пангея. Наивысшего видового (морфоло-
гического) разнообразия динофлагеллаты достигли
в мелу (рис. 39). С конца третичного периода наблю-
дается его уменьшение. По разнообразию клеточного
строения, способов питания и освоенных типов ме-
стообитаний динофлагеллаты превосходят любой из
отделов растений (Loeblich III, 1984). На основании
молекулярно-биологических данных предполагают,
что освоение морскими и озерными динофлагеллата-
ми холодноводных районов произошло сравнительно
недавно, около 0,5^1 миллионов лет назад (Logares et
al., 2008). Ископаемая летопись динофлагеллат свиде-
тельствует об удивительном морфологическом консер-
ватизме. После мезозоя не возникло ни одного нового
типа табуляции теки (Fensome et al., 1993). В частности,
на редкость стабильной является табуляция перидини-
оидных динофлагеллат. Так называемые беспанцирные
динофлагеллаты (принадлежащие в основном к по-
рядкам Gymnodiniales и Blastodiniales) возникли позже
панцирных, что подтверждается палеонтологически-
ми находками, и являются полифилетической группой
(Loeblich III, 1976а; Taylor, 1980; Fensome et al., 1993;
Saldarriaga et al., 2004; Taylor, 2004).
Изучение взаимоотношений между различными
линиями развития динофлагеллат, включая филогене-
тические связи на видовом и внутривидовом уровнях,
началось в 1990-х годах (Destombe et al., 1992; Scholin,
Sogin, 1993; McNally et al., 1994; Scholin, Anderson,
DINOFLAGELLATA
41
1994; Scholin et al., 1994, 1995; Zardoya et al., 1995;
Adachi et al., 1996, 1997; Saunders et al., 1997; Spalter
et al., 1997; Medlin et al., 1998; Fensome et al., 1999;
D’Onofrio et al., 1999). Саундерс и соавторы (Saunders
et al., 1997) обобщили результаты молекулярно-био-
логических исследований динофлагеллат, сопоставив
их с результатами морфологических исследований.
В классе Dinophyceae выявлено 4 филогенетические
линии: 1) Amphidinium, 2) Gonyaulacales, 3) группа
Symbiodinium, 4) комплекс Gymnodiniales-Peridiniales-
Prorocentrales sensu stricto (исключая Suessiales), или
GPP-комплекс. Обособленность рода Amphidinium яви-
лась в большой степени неожиданностью. Это означа-
ет, что положение Amphidinium среди морфологически
близких родов Gymnodinium и Gyrodinium в порядке
Gymnodiniales требует пересмотра. В свою очередь,
Amphidinium является полифилетической группой (Flo
Jorgensen et al., 2004a, b; Sparmann et al., 2008). О по-
рядке Gonyaulacales, представляющем собой хорошо
очерченную группу в молекулярно-биологических ис-
следованиях, высказано предположение, что, будучи
сестринской группой по отношению к GPP-комплексу,
его не следует рассматривать в качестве порядка в под-
классе Peridiniphycidae (Saunders et al., 1997). Порядок
Suessiales, включающий Symbiodinium-KQMnnQKC, заслу-
живает статуса подкласса в системе Фенсома и соавто-
ров (Fensome et al., 1993). По мнению Тэйлора (Taylor,
1999), Suessiales являются исходной группой по отноше-
нию к Symbiodiniaceae. Анализ рДНК у представителя
динофлагеллат, найденного в антарктическом льду, по-
казал, что Suessiales больше нельзя считать вымершей
группой (Montresor et al., 1999). Также показано, что не-
которые виды Woloszynskia, род Protodinium и, в опре-
деленной степени, недавно описанные роды Borghiella,
Baldinia, Biecheleria и Biecheleriopsis родственны Sym-
biodiniaceae и Polarella, относимые к Suessiales, а воло-
шинскиоидные динофлагеллаты в целом представляют
полифилетическую группу (Kremp et al., 2005; Moestrup
et al., 2008; Moestrup et al., 2009a, b; Siano et al., 2009).
GPP-комплекс включает представителей, относи-
мых в различных классификациях как к наиболее при-
митивным предковым, так и к наиболее продвинутым
в эволюционном отношении формам. В отличие от
точки зрения, согласно которой Prorocentrum считают
наиболее примитивным родом (Graham, 1951; Loeblich
III, 1976а; Taylor, 1980), все известные результаты по
молекулярной биологии, а также последние исследова-
ния по ультраструктуре динофлагеллат свидетельству-
ют о продвинутости Prorocentrales (Lenaers et al., 1991;
Roberts et al., 1995; Saunders et al., 1997; Grzebyk et al.,
1998; Taylor, 2004 и др.). Ленэрс и соавторы (Lenaers et al.
1991) утверждают, что представители Gymnodiniaceae
с многочисленными амфиесмальными пузырьками и
пластинками — также продвинутые формы. Порядок
Peridiniales не представляет собой монофилетическую
ветвь, и большинство его представителей требуют из-
учения с применением молекулярно-биологических
методов. По крайней мере, род Heterocapsa, помещае-
мый в порядок Peridiniales, нарушает его монофилетич-
ность (Taylor, 2004; Murray et al., 2005).
Предполагают, что фотосинтезирующие динофла-
геллаты произошли от общего гетеротрофного (веро-
ятно, облигатного фаготрофного) предка, который при-
обрел пластиды посредством симбиоза (Tomas, Сох,
1973; Steidinger, Сох, 1980). Наличие хлоропластов, ти-
пичных для динофлагеллат, у представителей всех ос-
новных линий эволюции, кроме порядка Dinophysiales,
позволяет предположить, что приобретение одного и
того же типа хлоропластов на ранней стадии эволюции
динофлагеллат произошло лишь однажды (Schnepf,
Elbrachter, 1999). В соответствии с этим предположе-
нием, маловероятно, что обладающие типичными для
динофлагеллат хлоропластами Prorocentrales произош-
ли от Dinophysiales, для фотосинтезирующих предста-
вителей которых характерно наличие фикобилинов.
Такая точка зрения противоречит филогенетической
схеме Фенсома и соавторов (Fensome et al., 1993). Бо-
лее поздний молекулярно-биологический анализ эво-
люции динофлагеллат предполагает, что Dinophysiales
и Suessiales, и в меньшей степени Gonyaulacales и
Prorocentrales — монофилетические группы; Peridi-
niales представляется парафилетической группой, от
которой произошли Prorocentrales, Dinophysiales, боль-
шинство Gymnodiniales и, вероятно, Gonyaulacales
(Saldarriaga et al., 2004). Согласно Мюррей и соавторам
(Murray et al., 2005), Prorocentrales — по-видимому, по-
лифилетическая группа, в то время как Gonyaulacales,
Dinophysiales и Suessiales — монофилетические таксо-
ны, причем Gonyaulacales является, вероятно, наиболее
молодым порядком.
Ранее предполагали, что Syndinea, Blastodiniphy-
сеае и Noctiluciphyceae раньше других отошли от ос-
новной линии динофлагеллат (Lenaers et al., 1991;
Saunders et al., 1997). На более поздней схеме эволю-
ции динофлагеллат (Saldarriaga et al., 2004) из упомя-
нутых таксонов лишь Syndinea остались среди рано
отошедших от основного ствола. Нельзя сказать, явля-
ются ли Syndinea более примитивными по сравнению с
Dinophyceae, так как ископаемые остатки паразитиче-
ских динофлагеллат не известны (Loeblich III, 1976а),
хотя гипотеза о постепенной утрате гистонов в ядре
динофлагеллат, по-видимому, верна. Согласно послед-
ним молекулярно-биологическим и морфологическим
исследованиям, Blastodiniphyceae — поздно отошед-
шая ветвь динокариотных динофлагеллат, а сам класс
таксономически не обоснован (Skovgaard et al., 2007).
Не ясна степень родства Syndinea и Blastodiniphyceae
по отношению к Noctiluciphyceae и Dinophyceae, хотя
есть основания предполагать, что Noctiluciphyceae про-
изошли от Syndinea (Gunderson et al., 1999). Syndinea
иногда рассматривают в качестве таксона с неопреде-
ленным таксономическим положением, родственного
динофлагеллатам (Карпов, 1990). Молекулярно-биоло-
гические данные о представителях Noctiluciphyceae и
Syndinea свидетельствуют о том, что динофлагеллаты
в начале эволюции не были способны к фотосинтезу
(Taylor, 1999). Морфология трофонтов (трофоцитов,
или трофомеров) паразитических видов настолько сво-
еобразная, что трудно сопоставить ее с морфологией
свободноживущих представителей. В целом, пара-
42
DINOFLAGELLATA
зитические динофлагеллаты могут представлять со-
бой полифилетическую группу (J. Cachon, М. Cachon,
1987). Порядок Dinophysiales на основе молекулярно-
биологических исследований можно разделить на два
клада: Amphisoleniaceae {Amphisolenia и Triposolenia)
и Dinophysiaceae. Последний таксон делится на
Dinophysiaceae sensu stricto {Dinophysis, Ornithocercus и
Histioneis) и Phalacroma, который включает единствен-
ного представителя Oxytoxum, подтверждая таким об-
разом самостоятельность родов Dinophysis sensu stricto
и Phalacroma (Handy et al., 2009; Gomez et al., 2011).
Определители, атласы и каталоги
Современные морские динофлагеллаты: Kofoid, Swezy
(1921), Lebour (1925), Kofoid, Skogsberg (1928), Schiller (1933,
1937), Graham (1942), Graham, Bronikovsky (1944), Киселев
(1950), Wood (1954, 1968), Balech (1962, 1971a, b, 1976, 1988,
1995), Steidinger et al. (1967), Soumia (1968, 1986), Subrahman-
yan (1968, 1971), Steidinger, Williams (1970), Drebes (1974), Taylor
(1976b), Rampi, Bernhard (1980); Dodge (1982, 1985a, b), Коно-
валова и др. (1989), Delgado, Fortuno (1991), Hallegraeff (1991,
2002), Dale, Dale, (1992), Licea et al. (1995), Wiktor, Okolodkov
(1995), Steidinger, Tangen (1996, 1997), Коновалова (1998), Be-
rard-Therriault et al. (1999), Botes (2001), Throndsen et al. (2003,
2007), Larsen, Nguyen (2004), Tenenbaum et al. (2004), Avancini et
al. (2006), Mohammad-Noor et al. (2007), Alonso-Rodriguez et al.
(2008), Al-Kandari et al. (2009), Hoppenrath et al. (2009a), Yongshui
(2009), Коновалова, Селина (2010), Al-Yamani, Saburova (2010),
Esqueda-Lara, Hemandez-Becerril (2010), Hallegraeff et al. (2010),
Kraberg et al. (2010).
Современные пресноводные динофлагеллаты: Schiller
(1933, 1937), Киселев (1950, 1954), Huber-Pestalozzi (1950), Bour-
relly (1970), Starmach (1974), Матвиенко, Литвиненко (1977), Po-
povsky, Pfiester (1990), Carty (2003), Dillard (2007).
Ископаемые динофлагеллаты: Возженникова (1965, 1967),
Bujak, Davies (1983), Evitt (1985), Head, Wrenn (1992), Rochon et
al. (1999).
Каталоги: Современные роды, подроды и секции: Loeblich
Jr., Loeblich III (1966, 1968, 1969, 1970a, b, 1972, 1974). Совре-
менные виды и внутривидовые таксоны: Soumia (1973, 1978,
1982, 1990, 1993), Soumia et al. (1975). Современные свобод-
ноживущие морские виды: Gomez (2005). Ископаемые роды и
виды: Lentin, Williams (1981).
Систематический обзор
Ниже приведены краткие описания таксонов от
типа до рода, включая 14 порядков и 64 семейств ис-
копаемых и современных представителей, а также 223
современных родов (из общего числа 253). По некото-
рым паразитическим родам и представителям неопре-
деленного систематического положения (30 родов) ин-
формация оказалась недоступной.
Тип DINOFLAGELLATA (Butschli)
Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Организмы, у которых подвижные стадии имеют
два жгутика: поперечный лентовидный направлен вле-
во и формирует «ундулирующую мембрану», и про-
дольный, направленный назад. Митоз закрытого типа,
с внеядерным веретеном.
Подтип Dinokaryota Fensome, Taylor,
Norris, Sarjeant,
Wharton et Williams 1993
Динофлагеллаты, у которых, по меньшей мере,
одна стадия жизненного цикла имеет динокарион.
Класс DINOPHYCEAE
Pascher1914
Динофлагеллаты с динокарионом, присутствую-
щим в течение всего жизненного цикла.
Подкласс Gymnodiniphycidae Fensome,
Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Динофициевые, у которых: 1) амфиесмальные пу-
зырьки многочисленные и расположены беспорядоч-
но или образуют более, чем 6 поперечных рядов; или
2) пелликула является основным компонентом амфиес-
мы; или 3) структура амфиесмы неопределенная, но не
состоит из 6 или менее поперечных рядов.
Порядок Gymnodiniales Apstein 1909
Гимнодиниофициевые, обычно свободноживущие,
у которых сравнительно многочисленные амфиесмаль-
ные пузырьки расположены беспорядочно. Пелликула
отсутствует или слабо развита.
Подпорядок Gymnodiniineae Fensome,
Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Представители Gymnodiniales без внутреннего
скелета.
Сем. Gymnodiniaceae (Bergh) Lankester
1885
Представители Gymnodiniineae с одним ядром, без
глазного пятна.
Крайне гетерогенная группа, включающая фото-
синтезирующие и гетеротрофные виды. Хотя отсут-
ствуют надежные доказательства ископаемых видов,
не исключено, что цисты могут быть найдены среди
акритархов. Последние изменения в таксономии и но-
менклатуре Gymnodiniineae содержатся в литературе
(Javomicky, 1997; Daugbjerg et al., 2000; de Salas et al.,
2003; Calado, Moestrup, 2005; Hansen et al., 2007b).
DINOFLAGELLATA
43
Род Gymnodinium Stein 1878,
emend. G. Hansen et Moestrup 2000
(в: Daugbjerg et aL, 2000)
(рис. 1,8; рис. 8, Д, вкл.; рис. 31, Д, Б, вкл.)
Син.: Peridinium Ehrenberg 1832, partim; IProau-
lax Diesing 1866; Melodinium Kent 1881; Chilodinium
Massart 1920; Ceratodinium Conrad 1926; Aureodinium
Dodge 1967; Balechina Loeblich Jr. et Loeblich III 1968.
Клетки преимущественно округлые, 5-200 мкм в
длину. Некоторые виды образуют колонии. Поясок и
продольная борозда хорошо развиты. Поясок более или
менее экваториальный, без смещения или со слабым
смещением (менее чем 0,2 длины клетки). У некоторых
видов поясок заходит на эпикон и может окружать апекс
в виде неполной петли против часовой стрелки при виде
спереди (апикальная бороздка, или акробаза). Хлоропла-
сты есть или отсутствуют. Некоторые виды со стигмой.
Пузулы могут быть развиты. У морских видов известны
временные цисты с гладкой, сетчатой или сильно орна-
ментированной поверхностью. Около десяти пресно-
водных видов образуют покоящиеся цисты. Некоторые
морские виды токсичны (по крайней мере, Gymnodinium
catenatum Graham). Описано более двухсот планктон-
ных видов (преимущественно морских, а также из пре-
сноводных и солоноватоводных местообитаний).
Типовой в и д: G. fuscum (Ehrenberg) Stein 1878.
Род Akashiwo G. Hansen et Moestrup 2000
(в: Daugbjerg etal., 2000)
Син.: Gymnodinium Stein 1878, partim.
Клетки овальные, 40-80 мкм в длину, сильно упло-
щенные дорсовентрально, с хорошо заметной антапи-
кальной выемкой. Апикальная бороздка образует на
вентральной стороне клетки неполную петлю, направ-
ленную по часовой стрелке. Хлоропласты содержат пе-
ридинин. Известен один морской вид, токсичный.
Типовой вид: A sanguinea (Hirasaka) G. Hansen
et Moestrup 2000.
PoRAmphidinium Claparede et Lachmann 1859,
emend. Flo Jorgensen, S. Murray et Daugbjerg
2004 (рис. 8, Б, вкл.)
Клетки с маленьким эпиконом и большим гипоко-
ном, 8-65 мкм в длину. Поясок расположен в передней
части клетки, обычно без смещения или со слабым
смещением, редко с сильным смещением. Продольная
борозда достигает антапекса. Поверхность гладкая или
продольно исчерченная. Хлоропласты есть или отсут-
ствуют. Некоторые виды образуют временные цисты.
Известно около 120 морских и пресноводных планк-
тонных и бентосных видов, из которых два морских
вида токсичны. Род до настоящего времени считается
полифилетическим и включает многочисленные виды
с неясным родством, в частности, 26 прегноводных ви-
дов (Calado, Moestrup, 2005).
Типовой вид: A. operculatum Claparede et Lach-
mann 1859.
Род Apicoporus Sparmann,
Leander et Hoppenrath 2008
Син.: Amphidinium Claparede et Lachmann 1859,
partim.
Клетки овальные, сжатые дорсовентрально, 34-
75 мкм в длину. Эпикон маленький, короткий и ши-
рокий, клювовидный, асимметричный, с апикальной
порой позади крючковидного выроста. Поясок нис-
ходящий. Продольная борозда узкая и неглубокая, за-
ходящая на эпикон и достигающая антапекса, где она
заканчивается в виде полукруглой выемки, прикрытой
с вентральной стороны мембрановидным выростом.
Хлоропласты имеются или отсутствуют. Известно два
морских вида, обитающих в песке и арктическом льду.
Типовой вид: A. glaber (Hoppenrath et Okolod-
kov) Sparmann, Leander et Hoppenrath 2008.
Род Barrufeta N. Sampedro et S. Fraga 2011
(в: Sampedro et aL, 2011)
Клетки овальные, 22-35 мкм в длину, сильно упло-
щенные дорсовентрально. Эпикон полушаровидный,
широко закругленный, часто с небольшим, еле замет-
ным выростом. Гипокон слегка асимметричный, при-
плюснутый сзади или с небольшой выемкой на анта-
пексе. Поясок экваториальный, нисходящий, смещен
на 1,5-2 ширины пояска. Продольная борозда доходит
до антапекса, на эпиконе она переходит в апикальную
бороздку, образующую широкую неполную петлю во-
круг апекса на вентральной и дорсальной сторонах
клетки, направленную против часовой стрелки и закан-
чивающуюся недалеко от места выхода петли, справа
от нее. Хлоропласты, содержащие в основном периди-
нин в качестве вспомогательного пигмента, многочис-
ленные, расположены радиально вокруг 2 пиреноидов,
лежащих в гипоконе. Ядро расположено в эпиконе. Пу-
зула имеется, сообщается со жгутиковым каналом. Об-
разует шаровидные или овальные покоящиеся цисты с
гладкой поверхностью и двойной оболочкой, окружен-
ной прозрачным слизистым веществом. Известен один
планктонный морской вид из западной части Среди-
земного моря.
Типовой вид: В. bravensisN. Sampedro et S. Fra-
ga 2011 (в: Sampedro et al., 2011).
Род Cochlodinium Schutt 1896
(рис. 1, Б; рис. 36, Д, E; рис. 37, Д, вкл.)
Син.: Gymnodinium Stein 1878, partim.
Клетки удлиненно-овальные, 30-110 мкм в длину,
могут образовывать цепочки. Поясок в виде левозакру-
ченной спирали в 1,5 оборота или более, с сильно сме-
щенными концами. Продольная борозда смещена на 0,5
оборота или более. Хлоропласты есть или отсутствуют.
Часто образует временные цисты (клетки окружены
слизистой капсулой). Известно около 40 планктонных
видов, из которых один вид токсичный, вызывающий
массовую гибель рыб.
44
DINOFLAGELLATA
Типовой вид: С. strangulatum (Schutt) Schutt
1896.
Род Esoptrodinium P. Javornicky 1997
Клетки овальные или грушевидные, часто слегка
сжатые дорсовентрально, 22-30 мкм в длину. Поясок
слегка нисходящий, неполный, приблизительно в 0,5
оборота, исчезающий на дорсальной стороне. Продоль-
ная борозда незаметная или достигающая антапекс и
образующая на нем неглубокую выемку. Известно два
вида, обитающих в пресных и солоноватых континен-
тальных водоемах. Возможно, что Esoptrodinium явля-
ется младшим синонимом Bernardinium (Moestrup et
al., 2009a: 203).
Типовой в и д: Е. gemma Р. Javornicky 1997.
Род Filodinium J. Cachon et М. Cachon 1968
Клетки неправильной формы, 10-50 мкм в длину.
Поясок в передней части клетки, косой. Псевдоподии
более или менее многочисленные. Хлоропласты при-
сутствуют. Известен один морской вид из Средиземно-
го моря.
Типовой вид: A hovassei J. Cachon et М. Cachon
1968.
Род Gyrodiniellum Kang, Jeong et Moestrup
2011 (в: Kang etal. 2011)
Клетки в целом овальные, 5-22 мкм в длину. Эпи-
кон чуть длиннее гипокона. Поясок широкий, сильно
нисходящий, смещен на 0,3-0,5 длины клетки. Дис-
тальная часть эпикона образует небольшой валик на
вентральной стороне клетки, справа от продольной бо-
розды, которая имеет форму буквы S и простирается от
антапекса, заходя на эпикон и соединяясь с апикальной
бороздкой на его левой части. Амфиесмальные пузырь-
ки многочисленные (около 260), шестиугольные или
пятиугольные, расположенные в 16 горизонтальных
рядах: 6 на эпиконе, 5 в пояске и 5 на гипоконе); апи-
кальную бороздка представляет собой специфическую
структуру и образована 5 амфиесмальными пузырька-
ми, несущими маленькие бугорки. Нематоцисты и пу-
зула имеются. Ядро расположено в левой части клет-
ки. Глазное пятно и хлоропласты отсутствуют. Описан
один вид из прибрежных вод Кореи с пониженной со-
леностью.
Типовой вид: G. shiwhaense Kang, Jeong et
Moestrup 2011 (в: Kang et al., 2011).
Род Gyrodinium Kofoid et Swezy 1921,
emend. G. Hansen et Moestrup in Daugbjerg,
G. Hansen, J. Larsen et Moestrup 2000
(рис. 8, В, вкл.; рис. 31,8, Г, вкл.; рис. 36, Ж)
Син.: Spirodinium Schutt in Engler et Prantl 1896
(non Spirodinium Fiorentini 1890); IPlectoninium Bieche-
ler 1934.
Клетки овальные или веретеновидные, 5-200 мкм
в длину, иногда образуют цепочки. Поясок в виде лево-
закрученной спирали от 1 до 1,5 оборотов, с концами,
смещенными более чем на 0,2 длины клетки. Продоль-
ная борозда может заходить на эпикон. Поверхность
продольно исчерчена. Хлоропласты есть или отсут-
ствуют. Для двух пресноводных видов известны поко-
ящиеся цисты. Некоторые виды образуют временные
цисты. Известно несколько десятков морских и пресно-
водных планктонных видов, из которых один вид, па-
разитирующий на морских диатомовых и яйцах план-
ктонных копепод и коловраток.
Типовой в и д: G. spirale (Bergh) Kofoidet Swezy
1921.
Род Katodinium Fott 1957
(рис. 1, А; рис. 8, Г, вкл.)
Син.: Amphidinium Claparede et Lachmann 1859,
partim; Gymnodinium Stein 1878, partim; Massartia
Conrad 1926 (non Massartia de Wildemann 1897).
Клетки овальные, 10-56 мкм в длину. Эпикон обыч-
но намного длиннее и шире гипокона. Поясок сильно
сдвинут кзади, кольцевидный или в виде левозакручен-
ной спирали со слабым смещением концов. Продоль-
ная борозда только на гипоконе. Поверхность клетки
иногда продольно исчерченная. Хлоропласты есть или
отсутствуют. Известно более 40 планктонных, преиму-
щественно пресноводных видов.
Типовой вид: АГ. nieuportensis (Conrad) Loeblich
Jr. et Loeblich III 1966.
Род Lepidodinium Watanabe, Suda, Inouye,
Sawaguchi et Chihara 1990, emend. G. Hansen,
Botes et de Salas 2007
Клетки округлые или овальные, 22-53 мкм в длину.
Эпикон слегка короче гипокона, с апикальной борозд-
кой. Поясок слегка нисходящий. Продольная борозда не
достигает антапекса. Поверхность клетки покрыта кор-
зинкообразными чешуйками (у одного вида), различи-
мыми в ТЕМ. Известно два морских планктонных вида.
Типовой вид:!,, viride Watanabe, Suda, Inouye,
Sawaguchi et Chihara 1990.
Род Paragymnodinium Kang, Jeong, Moestrup
et Shin 2010 (в: Kang et al., 2010)
Клетки в целом овальные, 8-19 мкм в длину. Эпи-
кон конический, гипокон полушаровидный. Поясок
слегка нисходящий. Продольная борозда заходит на
эпикон в виде узкой борозды и простирается почти до
апекса; апикальная бороздка отсутствует. Тека очень
тонкая, волошинскиоидного типа, амфиесмальные пу-
зырьки образуют 16 поперечных рядов. Клетки содер-
жат хлоропласты (основной вспомогательный пигмент
перидинин), нематоцисты, трихоцисты и педункулюм.
Глазные пятна, пиреноиды и пузулы отсутствуют. Из-
вестен один планктонный миксотрофный вид из при-
брежных морских вод Кореи.
DINOFLAGELLATA
45
Типовой вид: Р shiwhaense Kang, Jeong,
Moestrup et Shin 2010 (в: Kang et al., 2010).
Род Paulsenella Chatton 1920
Син.: Apodinium Chatton 1907, partim.
Клетки шаровидные или овальные, 12-25 мкм в
диаметре, с двуконтурной оболочкой, прикрепленные
с помощью короткого выроста к клеткам диатомовых
из родов Chaetoceros (часто к щетинкам), Cerataulina,
Eucampia, Streptotheca и Lithodesmium. При спороге-
незе образуются 2 или 4 спороцита, которые остают-
ся соединенными внутри общей слизистой оболочки.
Двужгутиковые диноспоры гимнодиниоидного типа
прикрепляются к хозяину, перфорируют мембрану и
питаются посредством сосущей органеллы. Известно
три паразитических морских вида.
Типовой в и д: Р chaetoceratis (Paulsen) Chatton
1920.
Род Pavillardia Kofoid et Swezy 1921
(в: Kofoid, 1920)
Клетки овальные, 60 мкм в длину. Тека продоль-
но исчерченная. Гипокон с трубчатым антапикальным
выростом. Поясок расположен чуть ниже середины
клетки, нисходящий. Продольная борозда простира-
ется почти от апекса до антапекса. Хлоропласты, по-
видимому, отсутствуют. Известен один планктонный
морской вид.
Типовой вид: Р tentaculifera Kofoid et Swezy
1920 (в: Kofoid, 1920).
Род Pheopolykrikos Chatton 1933
Клетки, по морфологии сходные с Gymnodinium,
образуют тандемные псевдоколонии из 2 зооидов, каж-
дый из которых имеет поперечный и продольный жгу-
тики. Поясок нисходящий. Продольная борозда прямая.
В псевдоколониях каждый зооид с ядром. Хлоропла-
сты имеются или отсутствуют. Нематоцисты отсут-
ствуют. Покоящиеся цисты отличаются от цист видов
Polykrikos. Известно 2-^4 планктонных морских вида.
Типовой в и д: .R beauchampii Chatton 1933.
Род Prosoaulax Calado et Moestrup 2005
Син.: Amphidinium Claparede et Lachmann 1859,
partim.
Клетки округлые, иногда слегка сжатые дорсовен-
трально, 6-16 мкм в длину. Эпикон короче и уже гипо-
кона, обычно около одной трети длины клетки. Поясок
кольцевидный, расположен в передней части клетки.
Продольная борозда слегка расширяется к антапексу.
Амфиесма состоит из нескольких сотен пластинок.
Стигма есть или отсутствует. Пузула имеется. Известно
три пресноводных вида.
Типовой вид: Р lacustris (Stein) Calado et
Moestrup 2005.
Род Schizochytriodinium Elbrachter
1988
Первичные и вторичные цисты 50-80 мкм в диа-
метре. Диноспоры 10—12 мкм в длину, около 8 мкм в
ширину, слегка сжатые дорсовентрально; образуют-
ся посредством палинтомии внутри вторичных цист.
Хлоропласты отсутствуют. Экзопаразиты яиц морских
планктонных копепод. Автор рода (Elbrachter, 1988)
считает этот род сходным с Apodinium и Chytriodinium
из порядка Blastodiniales и помещает его в сем. Chytrio-
diniaceae J. Cachon et Cachon-Enjumet. Описан один
вид.
Типовой вид: S’, calani Elbrachter 1988.
Род Syltodinium Drebes 1988
Клетки трофонта овальные, до 80 мкм в длину. На
стадии трофонта питается яйцами морских копепод
и коловраток, прикрепляясь к ним с помощью специ-
ализированной ножкообразной структуры. Зрелый
трофонт оседает на дно и переходит в пальмеллоидую
стадию деления, образуя в результате последователь-
ного деления надвое 16 или 32 гимнодиниоидных ди-
носпоры внутри слизистой оболочки 27-33 мкм в дли-
ну. Поясок диноспоры слегка нисходящий, продольная
борозда сигмовидная, достигает дорсальной стороны
клетки, проходя по ее правой стороне. Образует слизи-
стые временные цисты. Описан один морской парази-
тический вид.
Типовой вид: S. listii Drebes 1988.
Род Togula Flo Jorgensen,
S. Murray et Daugbjerg 2004
Син.: Amphidinium Claparede et Lachmann 1859.
Клетки овальные, слегка сжатые дорсовентрально,
20-70 мкм в длину. Поясок нисходящий, начинается
на середине клетки, направлен вперед, затем повора-
чивает влево на расстоянии, равном приблизительно
0,2 длины клетки. Хлоропласт один, с долями, направ-
ленными радиально от центра клетки к периферии, или
много. Известно три морских псаммофильных вида.
Типовой вид: Г britannica (Herdman) Flo Jorgen-
sen, S. Murray et Daugbjerg 2004.
Род Torodinium Kofoid et Swezy 1921
(рис. 8,Д, вкл.)
Клетки веретеновидные, 35-75 мкм в длину, длина
превышает ширину приблизительно в 4 раза. Эпикон в
несколько раз длиннее гипокона. Поясок в виде лево-
закрученной борозды со слегка смещенными концами.
Продольная борозда заходит на большую часть эпико-
на и не заходит на гипокон. Хлоропласты есть или от-
сутствуют. Пузула длинная и узкая. Известно два план-
ктонных морских вида.
Типовой вид: Г teredo (Pouchet) Kofoid et Swezy
1921.
46
DINOFLAGELLATA
Род Woloszynskia Thompson 1951
Син.: Gymnodinium Stein 1878, partim.
Клетки овальные или веретеновидные, 9-63 мкм в
длину. Амфиесма состоит из многочисленных, обыч-
но гексагональных пластинок. У типового вида 4-5
рядов пластинок на эпитеке, а гипотека состоит из 19
постэкваториальных, 14 вставочных, 9 антапикальных
вставочных и 4 антапикальных пластинок. Поясок эк-
ваториальный или слегка сдвинут кзади, слегка закру-
ченный влево или без смещения концов. Продольная
борозда может достигать антапекса. Хлоропласты есть
или отсутствуют. Стигма имеется. Образует покоящие-
ся цисты. Известно 10 планктонных пресноводных ви-
дов и, по крайней мере, два морских (Kremp et al., 2005;
Siano et al., 2009).
Типовой вид: W reticulata Thompson 1951.
Сем. Kareniaceae Bergholtz, Daugbjerg,
Moestrup et Fernandez-Tejedor 2006
Беспанцирные динофлагеллаты, у которых хлоро-
пласты лишены перидинина и содержат фукоксантин
или его производные. Апикальный желобок прямой
или в форме S (Steidinger et al., 2008).
Современные морские виды тропических и уме-
ренных вод. Многие из них содержат ихтиотоксины.
Род Karenia G. Hansen et Moestrup 2000
(в: Daugbjerg et aL, 2000)
С и н.: Gymnodinium Stein 1878, partim; Ptychodiscus
Stein 1883, partim?
Клетки округлые, сильно сжатые дорсовентрально,
18-45 мкм в длину, ширина иногда превышает длину.
Эпикон с прямой апикальной бороздкой на вентраль-
ной стороне клетки, без апикальной поры на его левой
стороне. Поясок слегка нисходящий. Хлоропласты
имеются, содержат фукоксантин. Известно 16 морских
видов, из которых 10 видов — токсичные (выделяют
бреветоксины, гимнодимин, гемолитические и цито-
токсичные соединения).
Типовой вид: АГ. brevis (Davis) G. Hansen et
Moestrup 2000 (в: Daugbjerg et al., 2000).
Род Karlodinium J. Larsen 2000
(в: Daugbjerg etal., 2000)
Син.: Gymnodinium Stein 1878, partim; Gyrodinium
Kofoid et Swezy 1921, partim; Woloszynskia Thompson
1951, partim.
Клетки округлые, 10-20 мкм в длину. Эпикон с
прямой апикальной бороздкой на вентральной сторо-
не клетки, с апикальной порой на его левой стороне.
Поясок слегка нисходящий. Хлоропласты имеются, со-
держат фукоксантин. Известно 10 морских видов, из
которых, по крайней мере, три вида — токсичные (кар-
лотоксины), вызывающие массовую гибель рыб.
Типовой вид: АГ. veneficum (D. Ballantine) J. Lar-
sen 2000 (в: Daugbjerg et al., 2000); голотип AT. micrum
(Leadbeater et Dodge) J. Larsen 2000, в настоящее время
рассматривают в качестве его синонима (Bergholtz et
al., 2006; http://www.algaebase.org/), хотя АГ. micrum ино-
гда продолжают считать типовым видом (http://www.
dinophyta.org/).
Род Такауата de Salas, Bolch, Botes et
Hallegraeff 2003 (в: de Salas et aL, 2003)
Син.: Gymnodinium Stein 1878, partim.
Клетки округлые или овальные, слегка сжатые
дорсовентрально, 20-45 мкм в длину. Эпикон с сигмо-
видной апикальной бороздкой на вентральной стороне
клетки, опоясывающей апекс, с апикальной порой на
левой стороне. Поясок слегка нисходящий. Хлоропла-
сты имеются, содержат фукоксантин. Известно пять
морских видов, некоторые из них — токсичные, вызы-
вающие массовую гибель рыб и беспозвоночных.
Типовой в и д: 7Г pulchella (J. Larsen) de Salas,
Bolch, Botes et Hallegraeff 2003 (в: de Salas et al., 2003).
Сем. Polykrikaceae Kofoid et Swezy 1921
Представители Gymnodiniineae, у которых зрелые
подвижные клетки многоядерны и объединены в псев-
доколонии.
Морские, преимущественно нефотосинтезирую-
щие виды, обитают в планктоне, среди морских водо-
рослей, во влажном песке. Ископаемые цисты извест-
ны в четвертичных отложениях.
Род Polykrikos Butschli 1873 (рис. 37, Б, вкл.)
Клетки, по морфологии сходные с Gymnodinium,
образуют цепочковидные псевдоколонии из 2, 4 или 8
зооидов, каждый из которых имеет поперечный и про-
дольный жгутики. Поясок слегка нисходящий. Акроба-
за в виде замкнутой петли. Продольная борозда прямая,
соединенная с акробазой и достигающая заднего конца
псевдоколонии. Количество ядер обычно в 2 или 4 раза
меньше, чем количество зооидов (лишь у одного вида
количество ядер и зооидов совпадает; Hoppenrath et aL,
2010). Характерно наличие комплекса нематоцист и те-
ниоболоцист. Хлоропласты имеются или отсутствуют.
Иногда присутствует пузула. Покоящиеся цисты с сет-
чатой поверхностью, образованной мембранами. Из-
вестно пять морских видов.
Типовой в и д: Р schwartzii Butschli 1873.
Сем. Tovelliaceae Moestrup,
Lindberg et Daugbjerg in Lindberg,
Moestrup et Daugbjerg 2005
Представители Gymnodiniineae с тонкой текой и
глазным пятном, образованным пигментированными
глобулами, лежащими вне хлоропласта и не окружены
DINOFLAGELLATA
47
мембранами. Апикальная борозда образована серией
удлиненных уплощенных пузырьков.
Исключительно пресноводные фотосинтезирую-
щие и гетеротрофные виды, ранее относимые к роду
Woloszynskia.
Род Tovellia Moestrup, Lindberg et Daugbjerg
2005 (в: Lindberg etal., 2005)
Син.: Gymnodinium Stein 1878, partim.
Клетки округлые, почти сферические, слегка сжа-
тые дорсовентрально, 25 мкм в длину. Эпикон слегка
больше гипокона. Тека состоит приблизительно из 9
поперечных рядов пятиугольных и шестиугольных
пластинок. Поясок слегка нисходящий. Хлоропласты
имеются, расположены в поверхностном слое цито-
плазмы. Стигма имеется. Образует цисты с апикаль-
ным и антапикальным рогами. Известно семь пресно-
водных видов.
Типовой вид: Т coronata (Wolosz.) Moestrup,
Lindberg et Daugbjerg 2005 (в: Lindberg et al., 2005).
Род Bernardinium Chodat in Chodat et Zender
1923
С и пл Hemidinium Stein 1883, partim; 1 Esoptrodinium
P. Javomicky 1997.
Клетки эллипсоидные, слегка сжатые дорсовен-
трально, 15-25 мкм в длину. Поясок неполный, направ-
лен влево назад. Тека не разделена на пластинки. Ядро
большое. Стигма присутствует, расположена ближе к
продольной борозде. Хлоропласты обычно отсутству-
ют. Известно три пресноводных вида из умеренной
зоны.
Типовой вид: В. bernardinense Chodat 1923.
Род Jadwigia Moestrup, Lindberg et Daugbjerg
2005 (в: Lindberg et al., 2005)
Клетки округлые, почти сферические, сильно сжа-
тые дорсовентрально, 27-30 мкм в длину. Эпикон и
гипокон приблизительно одного размера. Тека состоит
из пятиугольных и шестиугольных пластинок. Поясок
слегка нисходящий. Хлоропласты имеются, расположе-
ны в поверхностном слое цитоплазмы. Стигма имеется.
Образует округлые цисты с гладкой поверхностью. Из-
вестен один пресноводный вид.
Типовой в и д: J. applanata Moestrup, Lindberg et
Daugbjerg 2005 (в: Lindberg et al., 2005).
Сем. Warnowiaceae Lindemann 1928
Представители Gymnodiniineae, у которых подвиж-
ные клетки имеют одно или несколько глазных пятен
(оцеллоидов, или оцеллюсов).
Преимущественно нефотосинтезирующие виды,
обитающие в морском планктоне в основном умерен-
ных и тропических районов.
Род Warnowia Lindemann 1928
(в: Engler, Prantl, 1928)
(рис. 9, 8, вкл.; рис. 24; рис. 37, 8, вкл.)
Син.: Pouchetia Schutt 1895 (non Pouchetia Richard
1830); Protopsis Kofoid et Swezy 1921; IProterythropsis
Kofoid et Swezy 1921.
Представлен двумя морфотипами (Hoppenrath et
al., 2009b). Клетки округлые, овальные или сильно уд-
линенные, 30-145 мкм в длину. Тека иногда продольно
исчерчена. Поясок нисходящий, от 1,1 до 2,5 оборотов
вокруг клетки. Продольная борозда в 0,25-1,5 оборота,
простирается от апекса до антапекса. Хлоропласты от-
сутствуют. Оцеллоид имеется, расположен в задней или
передней части клетки. Нематоцисты отсутствуют. Мо-
жет образовывать цисты, покрытые тонкой мембраной.
Известно около 30 морских планктонных видов.
Типовой вид: ИСfusus (Schutt) Lindemann in En-
gler et Prantl 1928.
Род Erythropsidinium P.C. Silva 1960
(рис. 24)
Син.: Erythropsis Hertwig 1884 (non Erythropsis
Lindley ex Schott et Endlicher 1832); Pouchetia Schutt
1895, partim.
Клетки округлые, 50-120 мкм в длину (без учета
щупальца). Эпикон редуцирован. Поясок нисходящий.
Гипокон со щупальцем (пистоном), длина которого
может превышать длину тела клетки в 4 раза. Хлоро-
пласты отсутствуют. Оцеллоид имеется, расположен
с передней части клетки. Нематоцисты, по-видимому,
отсутствуют. Известно около 5-10 морских планктон-
ных видов.
Типовой вид:/?, agile (Hertwig) P.C. Silva 1960.
Род Greuetodinium Loeblich III 1980
(рис. 24)
Син.: Leucopsis Greuet 1968 (non Leucopsis Berthold
in Latreille 1827, nec Baker 1882).
Клетки почти прямоугольные при виде сбоку, около
115 мкм в длину (без учета щупальца). Эпикон реду-
цирован. Гипокон со щупальцем (пистоном), превы-
шающим длину клетки приблизительно вдвое. Поясок
нисходящий. Хлоропласты отсутствуют. Оцеллоид
имеется, расположен в передней части клетки и зани-
мает почти весь эпикон. Известен один морской план-
ктонный вид.
Типовой вид: G. cylindricum (Greuet) Loeblich
III 1980.
Род Nematodinium Kofoid et Swezy 1921
(рис. 24; рис. 9, Г, вкл.; рис. 31, Е, вкл.)
С и н.: Nematopsides Greuet 1973.
Клетки овальные или веретеновидные, около 80-
100 мкм в длину. Поясок нисходящий. Продольная бо-
розда простирается от апекса до антапекса. Щупальце
48
DINOFLAGELLATA
на гипоконе отсутствует. Хлоропласты и нематоцисты
имеются. Известно четыре морских планктонных вида.
Типовой в и д: A. partitum Kofoid et Swezy 1921.
Род Nematopsides Greuet 1973
Син.: Proterythropsis Kofoid et Swezy 1921, partim.
Клетки овальные, 38-58 мкм в длину. Поясок нис-
ходящий. Продольная борозда спиралевидная. Гипокон
с коротким щупальцем на вентральной стороне сзади.
Хлоропласты отсутствуют. Оцеллоид имеется, распо-
ложен в задней части клетки. Известно два морских
планктонных вида. Сомнительный род; согласно неко-
торым авторам (Soumia, 1986; Steidinger, Tangen, 1997)
является синонимом названия рода Warnowia.
Типовой в и д: A. vigilans (Marshall) Greuet 1973.
Род Proterythropsis Kofoid et Swezy 1920
(в: Kofoid, 1920) (рис. 9, Д, вкл.; рис. 24)
Клетки овальные, около 70 мкм в длину. Поясок
нисходящий. Гипокон с коротким щупальцем на вен-
тральной стороне сзади. Хлоропласты отсутствуют.
Нематоцисты имеются или отсутствуют. Оцеллоид
имеется, расположен в средней части клетки. Известно
два морских планктонных вида.
Типовой в и д: Р crassicaudata Kofoid et Swezy
1921.
Род Protopsis Kofoid et Swezy 1921
Син.: Gymnodinium Stein 1878, partim; Pouchetia
Schutt 1895, partim.
Клетки овальные, около 50-74 мкм в длину. Гипо-
кон без щупальца. Поясок нисходящий. Продольная
борозда прямая или слегка искривленная, не доходит
ни до апекса, ни до антапекса. Хлоропласты и немато-
цисты отсутствуют. Обычно образует цисты, покрытые
тонкой оболочкой. Известно пять морских планктон-
ных видов. Сомнительный род; согласно некоторым ав-
торам (Soumia, 1986; Steidinger, Tangen, 1997) является
синонимом имени рода Warnowia.
Типовой в и д: Р nigra (Pouchet) Kofoid et Swezy
1921.
Gymnodiniineae incertae sedis
Род Gynogonadinium Gomez 2007
Клетки с уплощенным телом треугольной формы,
90-110 мкм в длину и 43-55 мкм в ширину. Поясок
экваториальный, продольная борозда расположена в
более длинной части тела клетки. В дорсальной части
клетки поясок несет мембраны по краю. Два кривых
удлиненных выроста спереди и сзади, апикальный вы-
рост короче антапикального, апикальный вырост с ша-
ровидным концом с желобком в поперечной плоскости
клетки. Описан 1 морской планктонный вид.
Типовой вид: (7. aequatoriale Gomez 2007.
Род Pyramidodinium Horiguchi et Sukigara
2005
Клетки коккоидного типа, неподвижные, пирами-
дальной формы, 12-20 мкм в высоту и 27-32 мкм в диа-
метре (основная стадия жизненного цикла). Клеточная
стенка с 1 продольным и 2 поперечными гребнями,
покрыта многочисленными выростами. Подвижные
клетки, существующие в течение непродолжительно-
го периода, гимнодиниоидного типа, без апикального
желобка, 18-21 мкм в длину. Хлоропласты многочис-
ленные. Описан один вид из тропического континен-
тального водоема, расположенного вблизи морского
побережья.
Типовой в и д: Р atrofuscum Horiguchi et Sukigara
2005.
Подпорядок Actiniscineae (Sournia)
Fensome, Taylor, Norris, Sarjeant, Wharton
et Williams 1993
Представители Gymnodiniales с внутренним ске-
летом.
Сем. Actiniscaceae Kiitzing 1844
Представители Actiniscineae, у которых подвижные
клетки имеют кремниевый скелет, состоящий из двух
звездчатообразных кремниевых элементов, которые
вместе с уплотненным слоем околоядерной цитоплаз-
мы окружают ядро.
Морские планктонные гетеротрофные виды. Эле-
менты кремниевого скелета найдены в кайнозойских
отложениях, наибольшего видового богатства достигли
в третичном периоде.
Род Actiniscus Ehrenberg 1843
(рис. 8, Е, вкл.)
Син.: Gymnaster Schutt 1891; ?Diaster Meunier
1910.
Клетки округлые, иногда слегка сжатые в продоль-
ной плоскости, 30-70 мкм в диаметре. Поясок эквато-
риальный. Внутренний скелет (эндоскелет) состоит
из двух кремниевых элементов в форме пятилучевой
звезды (количество лучей варьирует от 4 до 8), рас-
положенных симметрично относительно продольной
оси клетки. Хлоропласты, по-видимому, отсутствуют.
Вероятно, один современный морской космополитный
вид.
Типовой вид: Л. pentasterias (Ehrenberg) Ehren-
berg 1854.
Род Diaster Meunier 1910
Согласно Сурня (Soumia, 1986: 44), это название
является синонимом Actiniscus.
Типовой вид:/), macrokaryon Meunier 1910.
DINOFLAGELLATA
49
Сем. Dicroerismaceae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Представители Actiniscineae с единственным ске-
летным элементом в форме Y.
Морские гетеротрофные виды, обитающие в мор-
ском планктоне умеренных и тропических районов.
Род Dicroerisma Taylor et Cattell 1969
Син.: Discroerisma lapsus calami (cm. Taylor, 1976:
54).
Клетки грушевидные, 23-32 мкм в длину, слегка
сжатые дорсовентрально, с коническим эпиконом. По-
ясок экваториальный, косой, слегка нисходящий. Про-
дольная борозда очень короткая. Эндоскелет в форме
латинской буквы Y с двумя выростами, расположен-
ными в гипоконе; его химический состав неизвестен.
Описан 1 морской вид.
Типовой вид:£>. psilonereiella Taylor et Cattell
1969.
Порядок Ptychodiscales Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Свободноживущие гимнодиниофициевые с сильно
развитой пелликулой, которая является основным струк-
турным элементом амфиесмы у подвижных клеток.
Сем. Ptychodiscaceae Willey et Hickson
1909
Представители Ptychodiscales, у которых подвиж-
ные клетки гимнодиниодного типа, лишенные специ-
ализированных рукообразных выростов. Пелликула
состоит преимущественно из целлюлозы или диноспо-
рина и не образует периферического скелета в форме
корзинки.
Фотосинтезирующие и гетеротрофные виды, пре-
имущественно морские. Ископаемые формы известны
из позднемеловых отложений.
Род Ptychodiscus Stein 1883
Клетки дисковидные, сжатые вдоль продольной
оси клетки, 60-120 мкм в диаметре, с упругой текой,
без заметного разделения на пластинки. Эпитека мень-
ше гипотеки, с апикальным гребнем, ориентированным
с дорсальной стороны к вентральной. Поясок кольце-
видный, без смещения его концов. Продольная борозда
короткая. Хлоропласты имеются. Известен 1 морской
планктонный вид. См. род Karenia.
Типовой в и д: Р noctiluca Stein 1883.
Род Balechina Loeblich Jr. et Loeblich III 1968
Син.: GymnodiniumStein 1878,partim;^Pachydinium
Kofoid et Swezy 1921 (non Pachydinium Pavillard 1915).
Клетки обычно овальные, слегка веретеновидные,
100-200 мкм и более в длину, с заостренным или окру-
глым апексом, с упругой, продольно исчерченной те-
кой. Эпитека одинакового размера с гипотекой или чуть
меньше нее. Апекс срезанный, слегка вогнутый. Поясок
нисходящий (смещен на 3-4 его ширины), экваториаль-
ный. Продольная борозда чуть шире пояска, достигает
антапекса, образуя на нем выемку, и распространяется
на эпитеку в виде узкой щели, достигая апекса. Хлоро-
пласты отсутствуют. Известно 2-3 морских планктон-
ных вида. Сурня (Soumia, 1986) и Гомес (Gomez, 2005),
в отличие от Тэйлора (Taylor, 1976b), считают Balechina
синонимом имени рода Gymnodinium Stein.
Типовой вид:В.pachydermata(KofoidetSwezy)
Loeblich Jr. et Loeblich III 1968.
Род Berghiella Kofoid et Michener 1911
Клетки сферические, 65-70 мкм в длину, 50-70 мкм
в ширину с коротким апикальным рогом. Поясок без
смещения концов или слегка нисходящий, экватори-
альный. Продольная борозда очень короткая, продол-
жающаяся до апекса в виде едва заметной линии. Тека
не разделена на пластинки. Описано два вида из тропи-
ческих морских вод.
Типовой вид:В.perplexaKofoidetMichener 1911.
Род Ceratoperidinium Margalef 1969
ex Loeblich III 1980
Тело клетки пятиугольное, уплощенное (по-види-
мому, дорсовентрально), 50-63 мкм в длину, с 2 длин-
ными задними выростами, с апикальным отростком
или без него (общая длина клеток 112-184 мкм). По-
ясок проходит по середине тела клетки. Хлоропласты
имеются. Известно три морских планктонных вида.
Типовой вид: С. yeye Margalef ex Loeblich III
1980.
Род Lissaiella Lindemann in Engler, Prantl 1928
Син.: Amphidinium Claparede et Lachmann 1859,
partim.
Клетки почти эллипсовидные, слегка сжатые дор-
совентрально, 25 мкм в длину. Эпитека широко закру-
гленная, без апикального отверстия. Гипотека очень
маленькая и короткая, треугольная, со слегка вогнуты-
ми сторонами и немного оттянутым кончиком в цен-
тре. Поясок кольцевидный, расположен в задней части
клетки. Тека не разделена на пластинки. Описан 1 пре-
сноводный вид.
Типовой вид:Л. obrae (Lindemann) Lindemann
in Engler, Prantl 1928.
Род Lophodinium Lemmermann 1910
Син.: Glenodinium Ehrenberg 1837, partim.
Клетки овальные или биконические, 70-85 мкм в
длину. Поясок кольцевидный, экваториальный. Про-
50
DINOFLAGELLATA
дольная борозда простирается от апекса до антапекса.
Поверхность несет продольные ребра, некоторые из
которых ветвятся ближе к пояску. Известен один вид.
Типовой вид:/,, polylophum (Daday) Lemmer-
mann 1928.
Сем. Amphitholaceae Poche 1913
ex Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Представители Ptychodiscales с крайне развитой
пелликулой в форме корзинки.
Современные морские тепловодные виды.
PoRAmphitholus Schutt 1895
Син.: Amphilothus Kofoid ex Poche 1913 (nomen re-
jic.); ?Monaster Schutt 1895.
Клетки овальные или биконические, 30-70 мкм в
длину. Поясок экваториальный. Эндоскелет не крем-
ниевый (вероятно, целлюлозный), состоящий из двух
элементов в виде скорлупок: один из них в виде удли-
ненных альвеол, другой в виде линий и сеточки. Хло-
ропласты, по-видимому, имеются. Описано два сомни-
тельных вида из морских вод.
Типовой вид: A. elegans Schutt 1895.
Род Achradina Lohmann 1903
Клетки овальные, со слегка оттянутым апексом,
15-55 мкм в диаметре. Поясок заметный, продольная
борозда не наблюдалась. Эндоскелет, по-видимому,
кремниевый, в виде сетчатой скорлупки, лежащий
близко к поверхности клетки. Хлоропласты отсутству-
ют. Известно 1-4 вида из морских вод.
Типовой вид: Л. pw/сЛга Lohmann 1903.
Род Monaster Schutt 1895
Клетки 80 мкм в длину. Продольная борозда не
наблюдалась. Эндоскелет в виде двух шлемовидных
скорлупок: передней из 5 продольных ребер с апикаль-
ным выростом и ареолированной задней. Хлоропласты
отсутствуют. Сомнительный род с двумя морскими ви-
дами (Soumia, 1986).
Типовой в и д: М rete Schutt 1895.
Род Sclerodinium Dodge 1981
Син.: Gyrodinium Kofoid et Swezy 1921, partim.
Клетки овальные, 20-30 мкм в длину, покрыты те-
кой, не разделенной на пластинки. Поясок нисходящий,
с концами, смещенными на одну треть длины клетки.
Продольная борозда простирается от апекса до анта-
пекса. Гипокон больше эпикона. На правой стороне
клетки, позади пояска имеется языковидная лопасть,
заходящая на продольную борозду; другая лопасть с
острым концом находится между концами пояска. Хло-
ропласты отсутствуют. Известен один морской план-
ктонный вид из умеренных вод.
Типовой в и д: £ calyptroglyphe (Lebour) Dodge
1981.
Сем. Brachydiniaceae Sournia 1972
Представители Ptychodiscales с 4-5 рукообразными
выростами, отходящими от клетки в радиальном на-
правлении.
Современные морские тепловодные виды.
Род Brachydinium Taylor 1963 (рис. 1, Е)
Клетки сжатые дорсовентрально, с 4 длинными вы-
ростами, расстояние между концами которых достигает
120 мкм. Поясок едва заметный. Продольная борозда не
наблюдалась. Эпитека редуцирована, с очень коротким
апикальным выростом. Гипотека с 2 длинными боковы-
ми и 2 задними выростами. Хлоропласты многочислен-
ные. Известно четыре морских планктонных вида.
Типовой вид: В. capitatum Taylor 1963.
Род Asterodinium Sournia 1972
Клетки сжатые дорсовентрально, с 5 длинными вы-
ростами, расстояние между концами которых состав-
ляет 49-80 мкм. Поясок едва заметный. Продольная
борозда не наблюдалась. Эпитека с 3 длинными выро-
стами (апикальный и 2 боковых). Гипотека с 2 длин-
ными задними выростами. Хлоропласты многочис-
ленные. Известно 2-3 морских вида из тропических и
субтропических вод.
Типовой вид: Л. gracile Soumia 1972.
Род Microceratium Sournia 1972
Клетки сжатые дорсовентрально, с 3 выростами,
18 мкм в диаметре (в зоне пояска). Эпитека треуголь-
ная, со слегка вогнутыми очертаниями, с относитель-
но коротким апикальным выростом. Гипотека с 2 более
длинными расходящимися выростами. Хлоропласты
имеются. Описан один морской вид из тропических вод.
Типовой в и д: М. orstomii Soumia 1972.
Порядок Suessiales Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Гимнодиниофициевые, у которых амфиесмальные
пузырьки (обычно содержащие текальные пластинки)
расположены в 7-10 поперечных рядах.
Сем. Suessiaceae Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993, emend.
Moestrup, Lindberg et Daugbjerg 2009
Suessiales, представители которых образуют ци-
сты, содержащие диноспорин, у которых амфиесмаль-
DINOFLAGELLATA
51
ные пузырьки расположены в 7-15 поперечных рядах
(в отдельных случаях более 20). Стигма, если присут-
ствует, состоит из пакета цистерн, содержащих мате-
риал в форме кирпичиков. Апикальная бороздка в виде
единственного удлиненного, очень узкого пузырька,
окруженного с каждой стороны 1 или 2 узкими амфи-
есмальными пузырьками и 1 маленьким пузырьком с
вентральной стороны. Основная стадия жизненного
цикла монадная или коккоидная.
Ранее были известны лишь из морских позднетри-
асовых отложений. Установлено, что Suessiales дожили
до настоящего времени (Montresor et al., 1999). Находки
Echinum majus Meunier и E. minus Meunier в полярных
водах Северного и Южного полушарий с большой ве-
роятностью следует отнести к роду Polarella (Meunier,
1910; Garrison, Buck, 1989; Buck, 1992; Stoecker et al.,
1992, 1997, 1998; Okolodkov, 1993, 1998; Ikavalko,
Gradinger, 1997; Montresor et al., 2003; Rengefors et al.,
2008).
Род Biecheleria Moestrup, Lindberg
et Daugbjerg 2009
Син.: Gymnodinium Stein 1878, partim; Woloszynskia
Thompson 1951, partim.
Клетки эллипсовидные или шаровидные, сжатые
дорсовентрально, 10-35 мкм в длину, с тонкой текой.
Поясок слегка нисходящий (со смещением концов на
его ширину), экваториальный или чуть сдвинут кзади.
Эпитека с пальцевидным выростом с правой стороны
в месте соединения пояска с продольной бороздой,
достигающей антапекса. Текальные пластинки распо-
ложены в 11-17 поперечных рядах: 5-8 на эпитеке, 2
в пояске и 3-7 на гипотеке. Апикальная борозда обра-
зована единственным удлиненным и узким пузырьком.
Хлоропласты и стигма имеются. Стигма в виде пакета
цистерн (аппарата Гольджи) с материалом в виде кир-
пичиков. Покоящиеся цисты сферические, с многочис-
ленными шипами или щетинками. Описано три соло-
новатоводных и морских вида.
Типовой вид:#, pseudopalustris (Schiller) Moes-
trup, Lindberg et Daugbjerg 2009.
Род Biecheleriopsis Moestrup,
Lindberg et Daugbjerg 2009
Клетки овальные, слегка грибовидные, немного
сжатые дорсовентрально, 13-15 мкм в длину, с тонкой
текой. Поясок слегка нисходящий (со смещением кон-
цов на 1,5 его ширины), экваториальный. Продольная
борозда достигает антапекса. Эпитека обычно немного
меньше гипотеки. Гипотека асимметричная, ее левая
часть короче правой, с глубокой выемкой на антапексе.
Текальные пластинки расположены в 10-12 попереч-
ных рядах: 4-5 на эпитеке, 2 в пояске и 4-5 на гипо-
теке. Апикальная борозда образована единственным
удлиненным и узким пузырьком. Хлоропласты много-
численные. Стигма в виде пакета цистерн с материа-
лом в виде кирпичиков. Имеются 2 пузулы. Жгутико-
вый аппарат соединен с пальцевидным выростом ядра
посредством фибриллярной структуры (ризопласта).
Покоящиеся цисты овальные, с многочисленными ко-
роткими шипиками. Известно два пресноводных вида.
Типовой вид:#, adriatica Moestrup, Lindberg et
Daugbjerg 2009.
Род Pelagodinium Siano, Montresor, Probert
et de Vargas 2010 (в: Siano et aL, 2010)
Син.: Gymnodinium Stein 1878, partim.
Клетки маленькие, 8,8-11,4 мкм в длину, в целом
овальные, с нисходящим пояском с концами, смещен-
ными на его ширину, чуть приплюснутым гипоконом,
пристенными хлоропластами, стебельчатыми пирено-
идами, глазным пятном и центральным ядром. Трихо-
цисты отсутствуют. Тека состоит из 8 серий амфиес-
мальных пузырьков: 4 на эпиконе, 1 на пояске и 3 на
гипоконе; шестая серия маленьких пузырьков располо-
жена непосредственно за пояском, окаймляя гипокон.
Характерно наличие удлиненного амфиесмального
пузырька и пластинки X, расположенных на апексе и
сходных с таковыми у Symbiodinium. Описан один мор-
ской вид — эндосимбионт планктонной фораминифе-
ры Orbulina universa d’Orbigny, обитающей в мелко-
водной фотической зоне. Одна клетка фораминиферы
может содержать до нескольких тысяч симбиотических
динофлагеллат.
Типовой вид:# beii (Spero) Siano, Montresor,
Probert et de Vargas 2010 (в: Siano et al., 2010).
Род Polarella Montresor, G. Procaccini
et D.K. Stoecker 1999 (рис. 9, E, вкл.)
Клетки овальные, сжатые дорсовентрально,
9-14 мкм в длину и 6-11 мкм в ширину. Эпитека ко-
роткая, полушаровидная. Гипотека удлиненная и сплю-
щена в дорсовентральной плоскости сильнее эпитеки.
Тека тонкая, состоящая из 8 рядов полигональных пла-
стинок (3 образуют эпитеку, 2 поясок и 4 гипотеку), ви-
димых в СЭМ. Поясок нисходящий. Продольная бороз-
да короткая. Апикальная борозда отсутствует. Образует
цисты с 7 рядами шипиков, отсутствующих в районе
пояска и продольной борозды. Хлоропласты имеются.
Известен один вид с биполярным распространением,
обитающий в морских льдах и в водной толще.
Типовой вид:# glacialis Montresor, G. Procacci-
ni et D.K. Stoecker 1999.
Род Protodinium Lohmann 1908,
emend. Schiller 1928
Клетки удлиненно-овальные, co слегка суженной
центральной частью, 8-35 мкм в длину. Апикальная
борозда, по-видимому, образована единственным уд-
линенным и узким пузырьком. Хлоропласты имеются.
Стигма присутствует. Образует цисты. Описано два
морских вида.
Типовой вид:# simplicius Schiller 1928.
52
DINOFLAGELLATA
Сем. Borghiellaceae Moestrup,
Lindberg et Daugbjerg 2009
Представители Suessiales, у которых стигма рас-
положена внутри пластид, с материалом в виде кир-
пичиков, расположенных в цистернах, на поверхности
хлоропластов. Апикальная бороздка состоит из 2 па-
раллельных удлиненных пузырьков или отсутствует.
Основная стадия жизненного цикла монадная. Цисты
гладкие с прозрачной стенкой.
Обитают в пресных водах.
Род Borghiella Moestrup, G. Hansen
et Daugbjerg 2008
Син.: Woloszynskia Thompson 1951, partim.
Клетки овальные, 12-22 мкм в длину. Тека со-
стоит из многочисленных, преимущественно шести-
угольных пластинок; на апексе имеются 2 ряда пятиу-
гольных и четырехугольных пластинок, параллельных
друг другу и ориентированных слева направо. Апи-
кальная борозда образована 2 удлиненными и узкими
пузырьками. Хлоропласты имеются, золотисто-зеле-
ные. Стигма присутствует. Образует гладкие круглые
или овальные покоящиеся цисты. Известно два пре-
сноводных вида.
Типовой вид:!?, dodgei Moestrup, G. Hansen et
Daugbjerg 2008.
Род Baldinia G. Hansen et Daugbjerg 2007
(в: Hansen et aL, 2007)
Син.: Glenodinium Ehrenberg 1837, partim.
Клетки овальные, 23-28 мкм в длину. Поясок эква-
ториальный, нисходящий, смещен на ширину пояска.
Продольная борозда узкая, не достигает антапекса.
Апикальная борозда образована 2 удлиненными и уз-
кими пузырьками. Хлоропласт 1, с расходящимися ра-
диально лопастями от центрального пиреноида. Пузула
имеется. Трихоцисты отсутствуют. Образует гладкие
покоящиеся споры. Известно два пресноводных вида.
Типовой в и д: В. anauniensis G. Hansen et Daugb-
jerg 2007 (в: Hansen et al., 2007b).
Сем. Symbiodiniaceae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Представители Suessiales, у которых преобладаю-
щая стадия жизненного цикла представлена коккоид-
ными клетками, являющимися эндосимбионтами дру-
гих организмов. Подвижные двужгутиковые клетки
редки и имеют амфиесмальные пузырьки, расположен-
ные в 7 поперечных рядах. Цисты, содержащие дино-
спорин, отсутствуют.
Обитают в радиоляриях, фораминиферах, инфузо-
риях, кораллах, актиниях, медузах (как эндоцитосим-
бионты), брюхоногих и двустворчатых моллюсках (как
эндогистосимбионты), губках.
Род Symbiodinium Freudenthal 1962
Син.: Zooxanthella Brandt 1881, partim?
Динофлагеллаты с основной стадией жизненного
цикла, как правило, в виде коккоидных клеток, живу-
щих в качестве эндосимбионтов в тканях всех классов
кишечнополостных (Hydrozoa, Scyphozoa, Anthozoa),
включая рифообразующие кораллы, губки, турбел-
лярии, брюхоногие и двустворчатые моллюски, и в
клетках фораминифер, радиолярий и инфузорий; ино-
гда встречаются на глубинах более 35 м. Свободно-
живущая стадия представлена подвижными клетками
гимнодиниоидного типа, покрытыми тонкими текаль-
ными пластинками. Известен 1 предположительно
свободноживущий вид в виде двужгутиковых клеток
9,5-11,5 мкм в длину, с хлоропластами, пиреноидом и
стигмой; формула теки: X, EAV, 4', 5а, 8", ?с, ?s, 6'",
2”" (EAV — удлиненный амфиесмальный пузырек,
расположенный на апексе; X — маленькая пластинка,
примыкающая к EAV с вентральной стороны клетки;
Hansen, Daugbjerg, 2009). Формула теки жгутиковой
стадии (Loeblich III, Sherley, 1979): Ipr, 5', 5-6a, 9—10",
ca. 20c, 8-9s, 7-8'", 3"" (у свободноживущего штамма),
Ipr, 5', 4-6a, 10-11", ca. 20c, 8-9s, 7-8'", 3"" (у симби-
отического штамма). Из литературы известно 11 на-
званий морских видов, из которых формально описаны
лишь 4; молекулярно-биологический анализ подтверж-
дает существование 4-10 видов (Banaszak et al., 1993;
Baker, 2003b). Сведения о других названиях родов сим-
биотических динофлагеллат даны при описании рода
Zooxanthella Brandt.
Типовой вид: S. microadriaticum Freudenthal
1962 (вид-хозяин Cassiopea sp. или Cotylorhiza sp. (Cni-
daria: Scyphozoa).
Подкласс Peridiniphycidae Fensome,
Taylor, Norris, Sarjeant, Wharton
et Williams 1993
Динофициевые с табуляцией, состоящей или про-
изводной из 5 или 6 поперечных рядов. Сагитальная
сутура отсутствует.
Порядок Gonyaulacales Taylor 1980
Представители Peridiniphycidae с табуляцией, со-
стоящей или производной из расположения текальных
пластинок, которое характеризуются двумя особен-
ностями или лишь одной из них: 1) первая апикальная
пластинка или ее гомолог (1и) асимметричная, ее левое
тройное соединение находится ближе к апексу, чем пра-
вое; 2) имеются 4 фундитальных пластинок (пластинок,
расположенных кзади от постсингулярной серии, за ис-
ключением продольной борозды), среди которых всегда
присутствуют задняя промежуточная и первая антапи-
кальная пластинки или их гомологи (X и Y). Пластинка
1"" (Y) всегда больше и расположена более дорсально,
чем другие (обозначения пластинок-гомологов даны в
соответствии с системой табуляции Тэйлора-Эвита).
DINOFLAGELLATA
53
Подпорядок Rhaetogonyaulacineae Norris
1978
Представители Gonyaulacales, у которых имеются,
по крайней мере, 3 фундальных пластинки, из которых
наиболее дорсальная не контактирует с наиболее дис-
тально расположенной постсингулярной пластинкой.
Имеется более чем 5 климактальных пластинок (пла-
стинок, расположенных кпереди от пресингулярной
серии, за исключением продольной борозды и апи-
кального порового комплекса). Рост пластинок может
происходить по всем направлениям, исключая направ-
ление в сторону поперечной борозды (в случае пласти-
нок, контактирующих с ней).
Сем. Shublikodiniaceae Wiggins 1973
Характеристики те же, что для подпорядка Rhaeto-
gonyaulacineae.
Только ископаемые, известны из морских отложе-
ний среднего триаса-ранней юры.
Подпорядок Cladopyxiineae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Представители Gonyaulacales с табуляцией, со-
стоящей или производной из расположения текаль-
ных пластинок, которое характеризуется: 1) наличи-
ем контакта между гомологом первой антапикальной
пластинки (Y) и гомологом наиболее дистально рас-
положенной постсингулярной пластинкой 6"" (VI), и
2) положением гомолога задней пластинки продоль-
ной борозды (Z) внутри этой борозды или ее более
лальним проникновением вперед, по сравнению с го-
мологом задней вставочной пластинки (X) таким обра-
зом, что Z контактирует с гомологом первой апикаль-
ной пластинки (1и).
Сем. Mancodiniaceae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Представители Cladopyxiineae, у которых гомолог
первой апикальной пластинки (1и) инсертного типа
(контактирует с апикальным поровым комплексом) и у
которых имеются, по крайней мере, 6 пресингулярных
и более чем 4 климактальных пластинки. Археопиль
соответствует всем или почти всем пластинкам теки,
хотя некоторые из них (особенно пресингулярные) мо-
гут оставаться не вовлеченными.
Только ископаемые, известны из морских ранне- и
среднеюрских отложений.
Сем. Cladopyxiaceae Stein 1883
Представители Cladopyxiineae, у которых гомолог
первой апикальной пластинки (1и) инсертного типа (1и
контактирует с апикальным поровым комплексом, а го-
мологи четвертой и второй апикальных пластинок и го-
молог четвертой апикальной и первой пресингулярной
не контактируют между собой попарно) и у которых
имеются, по крайней мере, 6 пресингулярных и 4 или
более (обычно) климактальных пластинок. Эпитекаль-
ные пластинки крайне вариабельны по размеру. Архе-
опиль соответствует определенной или определенным
пресингулярным, вставочным или апикальным пла-
стинкам.
Фотосинтезирующие морские тепловодные, пре-
имущественно океанические виды. Ископаемые виды
известны из раннеюрских отложений.
Род Cladopyxis Stein 1883
(рис. 1 ,Д)
Син.: Acanthodinium Kofoid 1907.
Клетки округлые или овальные с рукообразными
выростами, 25-65 мкм в длину (без учета выростов).
Выростов от 3 до 12, могут превышать по длине тело
клетки, заостренные или заканчивающиеся вилочкой.
Поясок слегка нисходящий, расположен в передней
части клетки. Поперечная борозда короткая. Формула
теки: Ро, 3\ 3-^4а, 7", 6с, 5-6s, 6'", 2"" (согласно другой
интерпретации, формула эпитеки: 3', За, 8"; Bourrelly,
1985). Хлоропласты имеются. Известно около 6 мор-
ских планктонных видов, главным образом, из тропи-
ческих вод.
Типовой вид: С. brachiolata Stein 1883, partim.
Pop,Amphidoma Stein 1883
(рис. 14, А, вкл.)
Син.: Murrayella Kofoid 1907; Pavillardinium De-
Toni 1936, partim.
Клетки грушевидные или биконические, 20-50 мкм
в длину. Поясок слегка нисходящий, сдвинут кзади или
экваториальный. Поперечная борозда очень короткая.
Гипотека с коротким рогом, заканчивающимся шипи-
ком. Сутуры плохо различимы, заметны лишь в СЭМ.
Формула теки: Ро, 6', 6", 6с, 4s, 6'", Ip, 1"". Хлоропла-
сты имеются или отсутствуют. Известно 9 планктон-
ных видов из морских вод, включая несколько сомни-
тельных таксонов.
Типовой вид: A. nucula Stein 1883.
Род Micracanthodinium Deflandre 1937
С и н.: Cladopyxis Stein 1883, partim.
Клетки округлые, слегка сплюснутые вдоль про-
дольной оси, 10-34 мкм в длину. Поясок слегка нисхо-
дящий, чуть сдвинут вперед. Тека с длинными тонкими
шипами, в несколько раз превышающими длину клет-
ки. Формула теки: Ро, 4', 7", 7с, ?s, 6'", 2"". Известно
три морских планктонных вида из тропических и уме-
ренных вод.
Типовой вид: М. setiferum (Lohmann) Deflandre
1937.
54
DINOFLAGELLATA
Род Palaeophalacroma Schiller 1928
(рис. 14, Б, вкл.)
Син.: Heterodinium Kofoid 1906, partim; Epiperidi-
nium Gaarder 1954; Sinodinium Nie 1945.
Клетки овальные, почти круглые, 18-^42 мкм в дли-
ну. Поясок мало заметный, слегка нисходящий, распо-
ложен в передней части клетки. Поперечная борозда
короткая и узкая. Формула теки: Ро, 4', За, 7", 6с, 6s,
6'", 2". Хлоропласты имеются. Известно 1-6 видов из
тропических и умеренных морских вод.
Типовой в и д: Р verrucosum Schiller 1928.
Род Peridiniella Kofoid et Michener 1911
С и н.: Gonyaulax Diesing 1866, partim; Amylax Meu-
nier 1910, partim.
Клетки округлые или почти пятиугольные, сжатые
дорсовентрально, 30-52 мкм в длину, одиночные или
соединенные в цепочки. Поясок нисходящий, со сме-
щением на его ширину. Продольная борозда значитель-
но расширяется к антапексу. В районе антапекса часто
имеются многочисленные мелкие шипики. Формула
теки: Ро, 4', 3-4а, 7", 6с, 6-7s, 6'", 1р, Г'". Хлоропласты
имеются. Известно три морских вида.
Типовой в и д: Р. sphaeroidea Kofoid et Michener
1911.
Сем. Scriniocassiaceae Sarjeant et Downie
1966
Представители Cladopyxiineae, у которых имеются
10 или менее пластинок эпитеки, включая 5 пресин-
гулярных пластинок, не считая апикального порового
комплекса. Гомолог первой апикальной пластинки (1и)
инсертного типа.
Только ископаемые, известны из ранне- и средне-
юрских морских отложений.
Сем. Lotharingiaceae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Представители Cladopyxiineae, у которых гомолог
первой апикальной пластинки (1и) метасертного типа
(lu не контактирует с апикальным поровым комплек-
сом, гомологи четвертой и второй апикальных пласти-
нок контактируют друг с другом, а гомолог четвертой
апикальной и первой пресингулярной пластинок не
имеют контакта между собой).
Только ископаемые, известны из ранне- и средне-
юрских морских отложений.
Сем. Pareodiniaceae Gocht 1957
Представители Cladopyxiineae, у которых гомо-
лог первой апикальной пластинки (lu) эксертного
типа (lu не контактирует с апикальным поровым ком-
плексом, а гомологи четвертой и второй апикальных
пластинок и гомолог четвертой апикальной и первой
пресингулярной пластинок контактируют друг с дру-
гом попарно).
Только ископаемые, известны из юрских и ранне-
меловых морских отложений.
Подпорядок Gonyaulacineae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Представители Gonyaulacales, у которых табуляция
гипотеки характеризуется наличием контакта между
гомологом первой антапикальной пластинки (Y) и го-
мологом шестой постсингулярной пластинки (VI), и
у которых гомолог задней вставочной пластинки (X)
проникает дальше вперед по сравнению с гомологом
задней пластинки продольной борозды (Z). Отличи-
тельные постсингулярные рога отсутствуют.
Сем. Gonyaulacaceae Lindemann 1928
Представители Gonyaulacineae, у которых продоль-
ная борозда расположена приблизительно на средней
линии с вентральной стороны, косая, направленная
справа вперед влево назад, или сигмовидная. Клетка
при виде с антапекса более или менее симметричная,
без сильного дорсовентрального сжатия. Имеются 6
пресингулярных пластинок.
Современные виды — преимущественно морские,
фотосинтезирующие формы. Ископаемые виды обиль-
ны в морских отложениях с юры до голоцена.
Род Gonyaulax Diesing 1866, emend. Kofoid
1911 (рис. 36, В; рис. 14, 6, вкл.)
Син.: Goniaulax lapsus pennae; Steiniella Schutt
1895, partim; Amylax Meunier 1910, partim.
Клетки в целом овальные или полигональные, 25-
175 мкм в длину, часто с шипами в районе антапекса.
Поясок экваториальный, нисходящий со смещением
на 1-5 его ширины, часто с сильно заходящими друг
на друга концами относительно продольной оси клет-
ки. Продольная борозда расширяется к антапексу. Тека
обычно сильно скульптурированная. Формула теки: Ро,
3', 2а, 6", 6с, 4—8s, 5'", Ip, 1". Пластинка Г с вентраль-
ной порой. Хлоропласты имеются. По крайней мере,
1 вид (типовой) способен вырабатывать ессотоксины.
Многие виды образуют покоящиеся цисты с шипами,
известные в палеонтологии под следующими родо-
выми названиями: Spiniferites Mantell (большинство),
Achomosphaera Evitt, Ataxiodinium Reid, Bitectatodinium
Wilson, Caledonidinum Reid (поздний синоним Bitecta-
todinium), Impagidinium Stover et Evitt, Nematosphae-
ropsis Deflandre et Cookson и Tectatodinium Wall (Head,
1996; Hoppenrath et al., 2009a). Известно один пресно-
водный и более 30 морских видов, обитающих преиму-
щественно в водной толще.
Типовой вид: G. spinifera (Claparede et Lach-
mann) Diesing 1866.
DINOFLAGELLATA
55
Род Lingulodinium\Na\\ 1967 (рис. 14, Г, вкл.)
С и н.: Gonyaulax Diesing 1866, partim.
Клетки пятиугольные, 42-50 мкм в диаметре. По-
ясок нисходящий, смещенный на 2 его ширины, без
заходящих друг за друга концов. Продольная борозда
расширяется к антапексу. Формула теки: Ро, 3', За, 6",
6с, 7s, 6'", 2"". Пластинка Г с вентральной порой. Хло-
ропласты имеются. Образует покоящиеся цисты. Опи-
сан 1 современный морской вид (тропические и теплые
умеренные воды), известный в виде ископаемых цист
под тем же родовым названием, а также под названием
Hystrichosphaeridium Deflandre.
Типовой в и д: I. machaeroporum (Deflandre et
Cookson) Wall 1967 (покоящаяся циста).
Род Acanthogonyaulax (Kofoid) Graham 1942
(рис. 14, E, вкл.)
Син.: Gonyaulax Diesing 1866, partim; Ceratocorys
Stein 1883, partim.
Клетки полигональные, с выростами в виде грубых
шипов, 75-100 мкм (включая выросты). Эпитека коро-
че гипотеки. Гипотека несет 4-7 шипов, соединенных
между собой мембранами. Поясок нисходящий, со сме-
щением на 3 его ширины, без заходящих друг за друга
концов, расположен в передней части клетки. Продоль-
ная борозда расширяется к антапексу. Формула теки:
Ро, 3', ?6", 6с, 7s, 6'", Ip, 1"". Пластинка Г с вентраль-
ной порой. Хлоропласты, по-видимому, имеются. Из-
вестен 1 морской планктонный тропический вид.
Типовой вид: Л. spinifera (Murray et Whitting)
Graham 1942.
Род Amylax Meunier 1910
Син.: Gonyaulax Diesing 1866, partim; Heterodinium
Kofoid 1906, partim.
Клетки почти грушевидные, угловатые, уплощен-
ные дорсовентрально, 50-75 мкм в длину. Поясок эк-
ваториальный, нисходящий, со смещением на 1-2 его
ширины, без заходящих друг за друга концов. В районе
антапекса имеются 2-7 шипов. Формула теки: Ро, 3',
За, 6", 6с, 7-8s, 6'", Ip, 1"". Пластинка Г без вентраль-
ной поры. Хлоропласты имеются. Известно три мор-
ских планктонных вида.
Типовой вид: A. lata Meunier 1910.
Род Protoceratium Bergh 1881, emend. Kofoid
et Michener 1911 (рис. 14, Д, вкл.)
С и н.: Gonyaulax Diesing 1866, partim.
Клетки округлые, эллипсовидные или почти гру-
шевидные, 25-85 мкм в длину. Поясок нисходящий со
смещением на его ширину, без заходящих друг за друга
концов, расположен в передней части клетки или почти
экваториальный. Продольная борозда не достигает анта-
пекса. Тека сильно скульптурированная, сетчатая. Фор-
мула теки: Ро, 3', 1а, 6", 6с, ?s, 6'", Ip, 1"". Пластинка Г с
вентральной порой. Хлоропласты имеются. По крайней
мере, 1 вид способен вырабатывать ессотоксины. Об-
разует покоящиеся цисты, известные в палеонтологии
в основном под родовым названием Operculodinium
Wall и Hystrichosphaeridium Deflandre. Из литературы
известно около 10 названий морских видов, из них по-
ловина сомнительных, описанных преимущественно
Кофойдом и Миченер (Kofoid, Michener, 1911).
Типовой вид: Р. aceros Bergh 1881.
Род Spiraulax Kofoid 1911,
emend. Carbonell-Moore 1996
Син.: Spiraulaxina Loeblich III 1970.
Клетки биконические, почти веретеновидные, 100—
170 мкм в длину. Поясок экваториальный, нисходящий,
со смещением на 3-4- его ширины, без заходящих друг
за друга концов. Продольная борозда слегка сигмовид-
ная, почти достигает антапекса. Формула теки: Ро, 3',
2а, 6", 6с, 6s, 6'", Ip, 1"". Пластинка Г без вентральной
поры. Хлоропласты имеются. Известен один морской
тропический вид.
Типовой вид: S. jollifei (Murray et Whitting)
Kofoid 1911, emend. Carbonell-Moore 1996.
Сем. Ceratocoryaceae Lindemann 1928
Представители Gonyaulacineae, у которых имеют-
ся 5 пресингулярных пластинок и продольная борозда,
расположенная приблизительно на средней линии с
вентральной стороны, в форме L.
Фотосинтезирующие морские тепловодные, преи-
мущественно океанические виды. Ископаемые извест-
ны из морских меловых отложений.
Род Ceratocorys Stein 1883
Клетки полигональные или овальные, с длинными
выростами в виде грубых шипов, 40-100 мкм в длину
(без учета выростов). Поясок обычно передний, реже
экваториальный, слегка или сильно нисходящий. Про-
дольная борозда прямая и широкая, не достигает ан-
тапекса. Гипотека с 2-8 шипами с широкими мембра-
нами. Формула теки: Ро, 3', 1а, 5", 6с, 6—10s, 5'", 0—1р,
1-2"". Хлоропласты присутствуют. Из литературы из-
вестно около 10 названий морских тропических видов,
из которых 3-4 сомнительных.
Типовой вид: С. horrida Stein 1883.
Сем. Areoligeraceae Evitt 1963
Представители Gonyaulacineae, у которых, по край-
ней мере, передняя часть продольной борозды смещена
влево. Ископаемые цисты демонстрируют тенденцию
к дорсовентральному сжатию и асимметрию при виде
клетки с антапекса.
Только ископаемые, известны из морских отложе-
ний с поздней юры до миоцена.
56
DINOFLAGELLATA
Подпорядок Ceratiineae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams
1993
Представители Gonyaulacineae преимущественно c
3 рогами, из которых 1 или 2 образованы постсингу-
лярными пластинками и у которых первая антапикаль-
ная пластинка (Y) контактирует с 6 или 7 пластинками,
включая наиболее отдаленную постсингулярную.
Сем. Ceratiaceae Wiley et Hickson 1909
Характеристики те же, что для подпорядка Ceratii-
neae.
Фотосинтезирующие, преимущественно морские
планктонные виды, с наибольшим видовым богатством
в тропической зоне. Род Ceratium. один из наиболее
представительных в современном морском планктоне,
насчитывает приблизительно 80 видов. Ископаемые
известны с раннего мела.
Род Ceratium Schrank 1793
(рис. 1,Ж; рис. 15, А, вкл.; рис. 22, Г, вкл.;
рис. 28, 30; рис. 33, Г-Е, вкл.)
Син.: Neoceratium F. Gomez, D. Moreira et P. Lo-
pez-Garcia 2010.
Клетки различной формы (веретеновидные, почти
треугольные или пятиугольные с округлыми очертани-
ями), одиночные или соединенные в цепочковидные
колонии. Большинство видов с 3 рогами (1 апикаль-
ным и 2 антапикальными), некоторые с 2 (1 апикаль-
ным и 1 антапикальным), 1 вид (пресноводный) с 1 ро-
гом (апикальным) и 1 вид (пресноводный) с 4 рогами
(1 апикальным и 3 антапикальными). Поясок непол-
ный, составляет приблизительно 0,75 оборота вокруг
тела клетки; состоит из 5 пластинок у морских видов
и из 6 у пресноводных. Продольная борозда видоизме-
ненная в обширную вогнутую вовнутрь вентральную
полость. Формула теки: 4', 6", 5-6с, ?s, 6'", 2". Пре-
сноводные виды образуют целлюлозные цисты, среди
морских видов они отмечены пока лишь для 2 видов,
Ceratium candelabrum Ehrenberg и С. furca Ehrenberg
(Gomez et al., 2010). Хлоропласты имеются. Известно
более 60 морских и 5 пресноводных видов (всего из ли-
тературы известно более 120 названий видов и внутри-
видовых таксонов).
Типовой вид: С. tetraceras Schrank 1793 (см.
Gomez et al., 2010: 36).
Подпорядок Goniodomineae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Представители Gonyaulacineae с табуляцией, со-
стоящей или производной из расположения, которое
характеризуются наличием 2 или 3 фундитальных пла-
стинок, всегда гомолога задней вставочной пластинки
(X) и гомолога первой антапикальной пластинки (Y)
и иногда также гомолога задней пластинки продоль-
ной борозды (Z). Из всех фундитальных пластинок Y
расположена наиболее дорсально, пятисторонняя, не
контактирует с наиболее дистально расположенными
пластинками, т.е. с гомологом шестой постсингуляр-
ной пластинкой (VI) и в случае, когда Y находится за
пределами продольной борозды, с гомологом правой
сулькальной пластинки (li). Обычно имеются 5 или ме-
нее климактальных пластинок. Рост пластинок проис-
ходит только на перекрывающихся краях.
Сем. Goniodomaceae Lindemann 1928
Представители Gonyaulacineae, у которых основная
часть жизненного цикла представлена подвижными
клетками, покрытыми текой.
Фотосинтезирующие морские, преимущественно
планктонные виды. Подсем. Helgolandinioideae вклю-
чает род Alexandrium. содержащий около 30 видов, в
том числе ряд токсичных. Подсем. Gambierdiscoideae
включает бентосные и эпифитные, преимущественно
токсичные виды Gambierdiscus. Coolia и Ostreopsis,
вызывающие сигуатеру и вырабатывающие ихтиоток-
сины. Ископаемые известны из морских отложений с
раннего мела до голоцена.
Род Goniodoma Stein 1883 (рис. 15, Б, вкл.)
Син.: Heteraulacus Diesing 1850, partim; Triadinium
Dodge 1981.
Клетки почти шаровидные или полигональные,
30-95 мкм в длину. Поясок слегка нисходящий, эквато-
риальный или немного сдвинут вперед. Формула теки:
Ро, У. Т'. 6с, 6-7s, 6"'. Ip, 1". Пластинка 1' с вентраль-
ной порой, не соприкасается с пояском. Хлоропласты
имеются. Известно 6-7 морских планктонных видов.
Типовой вид: G. acuminatum (Ehrenberg) Stein
1883.
Род Pachydinium Pavillard 1915
Клетки овальные, около 100 мкм в длину Поясок
экваториальный, слегка нисходящий. Формула теки
(гипотетическая): Ро, 3', 5", ?с, ?s, 5"'. 3"". Извест-
но два или более видов из тропических и субтропи-
ческих морских вод. См. род Balechina Loeblich Jr. et
Loeblich III.
Типовой в и д: Р. mediterraneum Pavillard 1915.
Подсем. Gambierdiscoideae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Род Gambierdiscus Adachi et Fukuyo 1979
(рис. 13, Г-E)
Клетки сплюснутые обычно относительно про-
дольной оси клетки, иногда латерально, 24-60 мкм в
DINOFLAGELLATA
57
длину и 42-140 мкм в ширину. Поясок экваториаль-
ный. Продольная борозда очень короткая, сильно во-
гнутая вовнутрь. Формула теки: Ро, 3', 7", 6с, 6-8s, 5'",
1р, Г'. Пластинки Г' и 7" редуцированы, расположены
между пояском и пластинкой 1' и они не контактируют
с пластинками 2' и 4'. Хлоропласты имеются. Известно
11 бентосных и эпифитных тропических видов (Litaker
et al., 2009; Fraga et al., 2011), из которых, по крайней
мере, половина способны вырабатывать гамбиертокси-
ны, сигуатоксины и майтотоксины, которые вызывают
сигуатеру.
Типовой в и д: G. toxicus Adachi et Fukuyo 1979;
эпитип: G. toxicus Chinain, M.A. Faust, Holmes,
Litaker et Tester 2009 (в: Litaker et al., 2009).
Род Coolia Meunier 1919
Син.: Glenodinium Ehrenberg 1837, partim; Ostreop-
sis Schmidt 1901, partim.
Клетки овальные, слегка сплюснутые вдоль про-
дольной оси, которая расположена косо по отношению
к пояску, 23-50 мкм в длину. Апекс немного смещен
дорсально и влево, а антапекс на вентральную сторону.
Поясок чуть нисходящий, экваториальный. Продоль-
ная борозда узкая, не достигает антапекса. Формула
теки: Ро, 3', 7", 6-7с, ?6-8s, 5'", 2"". Хлоропласты мно-
гочисленные. Известно шесть эпифитных и бентосных
морских видов из тропических и умеренных вод, из ко-
торых, по крайней мере, один способен вырабатывать
ихтиотоксины.
Типовой вид: С. monotis Meunier 1919.
Род Ostreopsis Schmidt 1902
Клетки сильно сплюснутые вдоль продольной
оси, каплевидной формы при виде с апекса или ан-
тапекса, 30-80 мкм в высоту. Апекс сильно смещен
дорсально и влево. Поясок экваториальный. Про-
дольная борозда короткая. Формула теки: Ро, 3', 7",
6с, ?6s, Vp, Rp, 5'", Ip, 2"" (Vp — вентральная пла-
стинка, Rp — гребневидная пластинка). Хлоропласты
многочисленные. Известно шесть эпифитных видов,
преимущественно из тропических вод. Некоторые
виды (по крайней мере, 4) токсичные; предположи-
тельно вызывают сигуатеру.
Типовой вид: О. siamensis Schmidt 1901.
Подсем. Helgoiandinioideae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Род Alexandrium Halim 1960
(рис. 15, В, вкл.; рис. 36, Г)
Син.: Gonyaulax Diesing 1866, partim; Goniodoma
Stein 1883, partim; Pyrodinium L. Plate 1906, partim;
Gessnerium Halim 1967 ex Halim 1969; Protogonyaulax
Taylor 1979.
Клетки шаровидные или овальные, 15-65 мкм в
длину. Поясок чуть нисходящий, экваториальный. Про-
дольная борозда широкая. Формула теки: Ро, ср, 4', 6",
6с, 9-10s, 5"', 2"". Хлоропласты имеются. Известно
приблизительно 30 планктонных видов, из которых, по
меньшей мере, 11 способны вырабатывать нейроток-
сины.
Типовой вид: A. minutum Halim 1960.
Род Fragilidium Balech, 1959 ex Loeblich III 1965
Син.: Goniodoma Stein 1883, partim; Helgolandi-
nium von Stosch 1969.
Клетки шаровидные, 24-56 мкм в ширину. Поясок
слегка нисходящий, экваториальный. Формула теки:
Ро, ср, 4(5)', 7-9", 9-12с, 6-8s, ?5-7'", 1р, 2"". Хлоро-
пласты имеются у двух видов. Известно шесть морских
планктонных видов.
Типовой в и д: F heterolobum Balech ex Loeblich
III 1965.
Род Pyrophacus Stein 1883 (рис. 15, Г, вкл.)
Клетки сильно сплюснутые относительно продоль-
ной оси, почти круглые при виде с апекса или анта-
пекса, 35-190 мкм в ширину. Поясок экваториальный.
Продольная борозда очень короткая. Формула теки: Ро,
?ср, 5-9', 0-8а, 7-15", 9-16с, 8s, 8-17'", 0-15р, 3"". Хло-
ропласты имеются. Покоящиеся цисты известны в па-
леонтологии под родовым названием Tuberculodinium
Wall. Известно три морских планктонных вида.
Типовой вид:/! horologium Stein 1883.
Подсем. Pyrodinioideae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Род Pyrodinium L. Plate 1906
(рис. 1,Г; 13, A-В)
Клетки в целом полигональные, с более коротким
апикальным и более длинным антапикальным шипом,
45-85 мкм в длину (включая шипы). Поясок слегка
нисходящий, экваториальный. Продольная борозда до-
стигает антапекса. Формула теки: Ро, ср, 4-5', 6", 6с,
6s, 6'", 2"". Хлоропласты многочисленные. Покоящие-
ся цисты известны в палеонтологии под родовыми на-
званиями Polysphaeridium Davey et Williams и Hemicys-
todinium Wall (синоним Polysphaeridinium). Известен
один морской планктонный вид с двумя разновидно-
стями, способный к биолюминесценции и выработке
нейротоксинов (Hallegraeff, Maclean, 1989).
Типовой в и д: Р bahamense L. Plate 1906.
Сем. Pyrocystaceae Apstein 1909
Представители Gonyaulacineae, у которых основная
часть жизненного цикла представлена неподвижными,
не подверженными к фоссилизации вегетативными ци-
стами.
58
DINOFLAGELLATA
Фотосинтезирующие морские, преимущественно
океанические, тепловодные, планктонные виды. Иско-
паемые не известны.
Род Pyrocystis Murray 1885 ex Haeckel 1890,
emend. Elbrachter et Drebes 1978
(рис. 15, Д, вкл.; рис. 36, Б)
Син.: Gymnodinium Stein 1878, partim; Murracystis
Haeckel 1890; Diplodinium Klebs 1912, partim; Disso-
dinium Klebs in Pascher 1916, partim, emend. Elbrachter
et Drebes 1978.
Коккоидные клетки, называемые цистами (доми-
нирующая в жизненном цикле стадия), шаровидные,
веретеновидные, ланцетовидные или полулунные,
100-1000 мкм в длину или в диаметре. Цитоплаз-
ма расположена у одного из полюсов клетки или в ее
центре. Ядро цилиндрическое или в форме подковы.
Хлоропласты многочисленные. Бесполое размножение
посредством 1-2 апланоспор или планоспор. Плано-
споры (стадии полового размножения) в виде одножгу-
тиковых или двужгутиковых клеток гимнодиниоидно-
го типа или двужгутиковых клеток типа Alexandrium,
с 1 или 2 жгутиками. Формула теки панцирных кле-
ток такая же, как у рода Alexandrium'. Ро, ср, 4', 6", 6с,
9-10s, 5"', 2"". Вскоре после высвобождения споры
увеличиваются в объеме, трансформируясь в новую
коккоидную стадию. Известно около 15 планктонных
видов в тропических и умеренных водах. Некоторые из
них биолюминесцентные. Циклы бесполого размноже-
ния подробно описаны у пяти видов (Elbrachter, Drebes,
1978).
Типовой вид: Р noctiluca Murray ex Haeckel
1890.
Gonyaulacales incertae sedis
Сем. Heterodiniaceae Lindemann 1928
Представители Gonyaulacineae, у которых вен-
тральная пора расположена на маленькой пластинке на
вентральной стороне эпитеки.
Нефотосинтезирующие морские, преимуществен-
но океанические, тепловодные, планктонные виды. Ис-
копаемые не известны.
Род Heterodinium Kofoid 1906
(рис. 15, Е, вкл.; рис. 24)
Син.: Peridinium sec. Murray et Whitting 1899,
partim.
Клетки овальные, сжатые дорсовентрально, 40-
250 мкм в длину. Гипотека часто с 2 антапикальными
рогами или 2-3 шипами, направленными назад. Поя-
сок экваториальный, обычно слегка нисходящий. Фор-
мула теки: Ро, 3', 1а, 6", 6с, ?s, 6'", 3"". Характерная
пластинка с вентральной порой расположена между
пластинками Г, 3', 1" и 6". Пластинка 2а расположе-
на слева на дорсальной стороне клетки. Хлоропласты
имеются или отсутствуют. Известно около 15 морских
планктонных видов из тропических и субтропических
вод.
Типовой вид: Я. scrippsae Kofoid 1906.
Сем. Crypthecodiniaceae Biecheler 1938
ex Chatton 1952
Представители Gonyaulacineae, у которых попереч-
ная борозда у подвижных клеток не контактирует с
правым краем продольной борозды вследствие боль-
шой пластинки, расположенной справа от нее, которая
простирается от гипотеки до эпитеки через плоскость
поперечной борозды.
Нефотосинтезирующие морские, сапрофитные
виды, обитающие на разлагающихся макрофитах.
Виды рода Crypthecodinium — один из излюблен-
ных объектов генетических исследований. Установ-
лено, что существуют 52 видов-близнецов комплекса
С. cohnii Biecheler (Beam, Himes, 1987; Steindinger,
Tangen, 1997).
Род Crypthecodinium Biecheler 1938
Клетки шаровидные или овальные, обычно 10-
30 мкм в длину. Поясок нисходящий, неполный (при-
близительно пол-оборота клетки). Продольная борозда
расширяется к антапексу. Формула теки: 4', За, 5", 6с,
5s, 5"', 3"", х. Характерно отсутствие апикальной по-
ровой пластики Ро и наличие пластинки х (добавочной
пластинки на правой стороне гипотеки, примыкающей
к концу пояска). Хлоропласты отсутствуют, клетки пи-
таются с помощью педункулюма (щупальца). Образует
цисты. Известен один эпифитный вид, хотя интенсив-
ные генетические исследования свидетельствуют о су-
ществовании, по крайней мере, 52 видов-двойников.
Типовой вид: С. s etense Biecheler 1938.
Сем. Thecadiniaceae Balech 1956
Представители динофлагеллат с эпитекой, намного
меньше гипотеки, наподобие Dinophysiales или Amphi-
dinium. Клетки сжатые в латеральном или дорсовен-
тральном направлении. Продольная борозда довольно
длинная, обычно без мембран. Эпитека состоит из до-
вольно большого числа пластинок, с порой более или
менее в апикальном положении. Гипотека с одной анта-
пикальной пластинкой, смещенной к вентральной сто-
роне, в направлении оси продольной борозды.
Современные морские бентосные, преимуществен-
но эпифитные виды. Ископаемые не известны.
Род Thecadinium Kofoid et Skogsberg 1928,
emend. Hoppenrath 2000
Син.: Amphidinium Claparede et Lachmann 1859,
partim; Phalacroma Stein 1883, partim.
Клетки в целом овальные, слегка или сильно сжа-
тые латерально, со сравнительно маленькой эпитекой
DINOFLAGELLATA
59
и большей по размеру гипотекой, 27-65 мкм в дли-
ну. Формула теки: Ро, 3-4', 0-1а, 4/6", 5(6)с, ?5-6s,
4-5'", 1"". Хлоропласты имеются или отсутствуют.
Thecadinium drageskoi Balech, относимый в настоящее
время к этому роду, имеет отличную от других видов
формулу теки: Ро, 5', 2а, 8", 6(7)с, ?s, 4"', х, 2р, 1"", и
должен быть исключен из него (Hoppenrath, 2000b).
Известно восемь морских псаммофильных видов, глав-
ным образом, в умеренной зоне.
Типовой вид: Т. kofoidii (Herdman) Larsen 1985.
Род Plagiodinium М.А. Faust et Balech 1993
Клетки овальные, сжатые латерально, с очень ма-
ленькой эпитекой и большой гипотекой, 26-31 мкм в
длину. Продольная борозда узкая и очень короткая.
Формула теки: Ро, 5', 0", 5с, 5s, 5"', 1"". Хлоропласты
имеются. Описан один морской бентосный вид из пла-
вающего детрита в манграх тропической зоны.
Типовой вид:/? belizeanum М.А. Faust etBalech
1993.
Род Planodinium Saunders et Dodge 1984
Син.: Thecadinium Kofoid et Skogsberg 1928, partim.
Клетки сжатые латерально, с очень маленькой эпи-
текой и большой гипотекой, 27-30 мкм в длину. Гипо-
тека в основном состоит из двух боковых пластинок 1'"
и 3"'. Формула теки: 3', 7", 6с, ?s, 3"', 1"". Хлоропласты
отсутствуют. Известен один морской псаммофильный
вид из умеренной зоны.
Типовой вид:/? striatum SaundersetDodge 1984.
Род Pseudothecadinium Hoppenrath et Selina
2006
Син.: Thecadinium Kofoid et Skogsberg 1928, partim.
Клетки в целом овальные, сжатые латерально, со
сравнительно маленькой эпитекой и большей по раз-
меру гипотекой, 37-53 мкм в длину. Поясок сильно
нисходящий (со смещением концов на 4-6 размеров
его ширины). Формула теки: Ро, 4', 2а, 4", 4с, ?5s, 5"',
1"". Характерная пластинка 2а с порой. Хлоропласты
имеются. Описан один морской планктонный вид из
умеренных вод.
Типовой вид:/? campbellii Hoppenrath et Selina
2006.
Род Thecadiniopsis Croome,
Hallegraeff et Tyler 1987
Клетки овальные, сжатые латерально, со срав-
нительно маленькой эпитекой и большей по размеру
гипотекой, 42-48 мкм в длину. Поясок сильно нисхо-
дящий (со смещением концов пояска, равным около
одной трети длины клетки), значительно сдвинут впе-
ред. Формула теки: Ро, 4', 1а, 4", 5с, ?5s, 5"', 1"". Хло-
ропласты имеются. Описан один планктонный вид из
дистрофных континентальных водоемов с низкой со-
леностью в субтропической зоне, недалеко от морского
побережья.
Типовой вид: Т tasmanica Croome, Hallegraeff
et Tyler 1987.
Gonyaulacineae incertae sedis
PonAmphidiniella Horiguchi 1995
Клетки овальные, сжатые дорсовентрально, 14-
20 мкм в длину. Эпитека маленькая. Поясок восходя-
щий (со смещением концов на 2 его ширины). Продоль-
ная борозда расширяется к антапексу, не достигая его.
Вентральная пора присутствует, расположена в месте
соединения пластинок Г, 4' и 7". Формула теки: Ро, 4',
1а, 7", 5с, 4s, 6"', 2"". Хлоропласт 1, с большим пире-
ноидом. Описан один морской псаммофильный вид из
субтропических вод.
Типовой вид: Л. sedentaria Horiguchi 1995.
Род Dolichodinium Kofoid et Adamson 1933
Син.: Heterodinium Kofoid et Michener 1911, partim.
Клетки в целом овальные, слегка угловатые, 58-
75 мкм в длину. Поясок нисходящий (со смещением
на его ширину). Формула теки не определена (4', 0а).
Пластинка 4' с вентральной порой, расположенной на
середине вентральной стороны клетки. Известен один
морской планктонный вид из тропических вод.
Типовой вид:/), lineatum (Kofoid et Michener)
Kofoid et Adamson 1933.
Порядок Peridiniales Haeckel 1894
Представители Peridiniphycidae с табуляцией, кото-
рая характеризуется двумя особенностями или лишь
одной из них, или с табуляцией, производной от этой:
1) первая апикальная пластинка симметричная, ее левое
тройное соединение или оба таких соединения находят-
ся приблизительно на одном уровне с правым или пра-
выми; 2) имеются две антапикальных пластинки, распо-
ложенные более или менее симметрично относительно
средневентральной/среднедорсальной плоскости.
Подпорядок Heterocapsineae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Представители Peridiniales c 5 апикальными пла-
стинками, согласно системе табуляции Кофойда.
Сем. Heterocapsaceae Fensome, Taylor,
Norris, Sarjeant, Wharton et Williams 1993
Характеристики те же, что для подпорядка Hetero-
capsineae.
Современные виды обитают в морском планктоне.
Ископаемые известны с юрского периода.
60
DINOFLAGELLATA
Род Heterocapsa Stein, 1883, emend.
Iwataki et Fukuyo 2003 (рис. 6)
Син.: Glenodinium Ehrenberg 1837, partim; Cacho-
nina Loeblich III 1968.
Клетки неправильной формы, в целом овальные,
эллипсовидные или ланцетовидные, 7-45 мкм в длину.
Формула теки: Ро, ср, 5', За, 7", 6с, 5s, 5'", 2"". Для рода
характерны кремнеземные чешуйки на поверхности
клеточной мембраны, треугольной формы, специфич-
ные для каждого вида и видимые лишь с помощью
ТЕМ. Эпитека по размеру равна или больше гипотеки.
Поясок вдавленный. Гипотека округлая, иногда с тон-
ким рогом на антапексе. Известно около 20 морских,
преимущественно планктонных видов (некоторые виды
псаммофильные); токсичный вид Н. circularisquama
наносит ущерб аквакультуре двустворчатых моллю-
сков в Японии (Horiguchi, 1995b).
Типовой вид:Н. triquetra(Ehrenberg) Stein 1883.
Подпорядок Glenodiniineae Fensome,
Taylor, Norris, Sarjeant, Wharton et Williams
1993
Представители Peridiniales c 4 апикальными и 6
постсингулярными пластинками, согласно системе та-
буляции Кофойда.
Сем. Glenodiniaceae Wiley et Hickson 1909
Характеристики те же, что для подпорядка Gleno-
diniineae.
Современные пресноводные виды.
Род Glenodinium Ehrenberg 1837
Син.: Sphaerodinium Woloszynska 1916.
Оригинальный диагноз его весьма неопределен-
ный. Название этого рода можно часто найти в старой
литературе. На практике он служил в качестве при-
юта для различных динофлагеллат маленького разме-
ра, у которых не удавалось определить формулу теки
(Soumia, 1986); впоследствии они были исключе-
ны из этого рода и перенесены в другие. Хотя Бурли
(Bourrelly, 1968) предложил больше не использовать
название рода, Леблич (Loeblich III, 1980) реабили-
тировал его с формулой теки: 4', 4а, 7", 6"', 2"", под-
черкнув, что морфологические черты типового вида
Glenodinium ясно определены и хорошо соответствуют
таковым у рода Sphaerodinium. К настоящему времени
не осталось, по крайней мере, ни одного морского вида,
относимого к роду Glenodinium (см. Soumia, 1986 : 97).
Типовой в и д: G. cinctum Ehrenberg 1837.
Род Glenodiniopsis Woloszynska 1916
Син.: Glenodinium Ehrenberg 1837, partim.
Клетки овальные, слегка сжатые дорсовентрально,
27-50 мкм в длину. Поясок слегка нисходящий, немно-
го сдвинут кзади. Продольная борозда простирается от
середины эпикона, где она узкая, почти до антапекса,
расширяясь к нему. Формула теки: 2-4', 3-4а, 8", (6-
8)'", 2"" (согласно другой интерпретации: 2-4', 4а, 8",
(6-7)'", 2""; Bourrelly, 1985). Хлоропласты многочис-
ленные. Известно два пресноводных вида из умерен-
ной и тропической зоны (дистрофные озера, торфяные
болота).
Типовой вид: G. steinii (Lemmermann) Wolo-
szynska 1916.
Подпорядок Peridiniineae Poche 1913
Представители Peridiniales с 4 апикальными и 5
постсингулярными пластинками, согласно системе та-
буляции Кофойда.
Сем. Peridiniaceae Ehrenberg 1831
Представители Peridiniales, у которых отчетливо
выражена поперечная борозда и которые имеют 4-6
сингулярных пластинки, не считая промежуточной
пластинки (если она присутствует), и, по крайней мере,
с одной сутурой на дорсальной стороне поперечной бо-
розды.
Современные пресноводные, фотосинтезирующие
и гетеротрофные виды. Известны из неморских отло-
жений кайнозоя.
Род Bysmatrum M.A. Faust et Steidinger 1998
(рис. 16, Д)
С и н.: Scrippsiella Balech, 1959 ex Loeblich III 1965,
partim.
Клетки почти шаровидные, слегка или сильно
сжатые дорсовентрально, 20-58 мкм в длину. Поясок
нисходящий (со смещением концов на 1,5-2 его шири-
ны), экваториальный или сдвинут вперед. Продольная
борозда сравнительно широкая, достигает или не до-
стигает антапекса. Формула теки: Ро, X, 4', За, 7", 6с,
4—5s, 5'", 2"" (X — канальная пластинка, примыкающая
к пластинке Ро с вентральной стороны). Пластинка Ро
в виде камеры. Пластинка 1' пятиугольная, асимме-
тричная. Пластинки 2а и За отделены друг от друга
пластинкой 3'. Хлоропласты имеются. Вид, описан-
ный под названием Peridinium sociale sensu Biecheler,
обнаруженный в гиперсоленых водоемах умеренной
зоны, имеет такую же формулу теки и расположение
пластинок эпитеки и, возможно, принадлежит к роду
Bysmatrum (Murray et al., 2006). Известно пять морских
бентосных видов Bysmatrum из прибрежных местооби-
таний тропических и субтропических вод.
Типовой вид:Яsubsalsum(Ostenfeld)M.A.Faust
et Steidinger 1998.
Род Ensiculifera Balech 1967
Клетки почти овальные, 33-45 мкм в длину, с кони-
ческой эпитекой и полушаровидной гипотекой. Поясок
DINOFLAGELLATA
61
слегка нисходящий, экваториальный. Формула теки: Ро,
X, 4', За, 7", 5с (4с +1), 5s, 5"', 2,,,г. Поясковая пластинка
Cj с длинным шипом (ensiculus), расположенным вдоль
внутреннего края первой пресингулярной пластинки
1", внутри эпикона, под первой апикальной пластинкой
1' (в отличие от родов Scrippsiella и Pentapharsodinium,
с которыми имеет большое сходство). Гипотека без ан-
тапикальных рогов, может нести короткий шипик. Хло-
ропласты имеются. Образует известковые шаровидные
цисты. Описано пять морских видов из умеренных и
тропических вод.
Типовой в и д: Е. mexicana Balech 1967.
Род Scrippsiella Balech, 1959
ex Loeblich 111 1965
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim; IDinocapsis Hardy et Sa-
gebiel 1975.
Клетки шарообразные, овальные или грушевидные,
20-64 мкм в длину. Поясок слегка нисходящий, эквато-
риальный. Продольная борозда не достигает антапекса,
расширяясь по направлению к нему. Гипотека иногда с
антапикальными шипиками. Формула теки: Ро, X, 4',
За, 6-7", 6с (5с + t), 4-7s, 5"', 2"". Хлоропласты много-
численные. Образует известковые покоящиеся цисты
(не менее 10 видов), известные в палеонтологии под
родовым названием Calciodinellum Deflandre. Известно
приблизительно 30 морских планктонных и планкто-
бентосных видов, большинство из которых обитает в
прибрежной зоне морей, включая лагуны.
Типовой вид: 5. sweeney ае Balech 1959 ex Loe-
blich III 1965.
Род Peridinium Ehrenberg 1832
(рис. 32)
Син.: Vorticella O.F. Muller 1786; Glenodinium Eh-
renberg 1837, partim.
Клетки шаровидные или овальные, 15-95 мкм в
длину. Поясок обычно нисходящий (со смещением кон-
цов на 0,5-2 его ширины), реже без смещения концов,
экваториальный. Гипотека полушаровидная, обычно
без выростов, иногда с 2-А маленькими шипами. Фор-
мула теки: (Ро), 4', 2-За, 7", 5-6с, 5-6s, 5"', 2"". У всех
известных видов пластинка Г типа «орто». Хлоропла-
сты имеются. По крайней мере, два вида способны к
выработке токсинов (Rengefors, 2001). Известно при-
близительно 20 пресноводных планктонных видов, не-
которые из которых встречаются также в прибрежной
зоне морей в непосредственной близости от берега.
Более половины из них образуют покоящиеся цисты.
Типовой в и д: Р cinctum (O.F. Muller) Ehrenberg
1832.
Род Durinskia Carty et Cox 1986 (рис. 16, E)
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim.
Клетки шаровидные или овальные, 22-30 мкм в
длину. Поясок слегка нисходящий, экваториальный
или немного сдвинутый кзади. Продольная борозда не
достигает антапекса. Формула теки: Ро, X, 4', 2а, 6", 5с,
4s, 5"', 2"". Хлоропласты имеются (от эндосимбиоти-
ческих диатомовых водорослей). Характерно наличие
глазного пятна. Может содержать 2 ядра в клетке. Из-
вестно 1-2 планктонных вида из морей, солоноватых
вод и континентальных соленых озер.
Типовой в и д: D. baltica (Levander) Carty et Сох
1986.
Род Galeidinium Tamura et Horiguchi 2005
(в: Tamura et al., 2005)
Жизненный цикл состоит из коккоидной (основ-
ная стадия; 9-15 мкм в длину) и жгутиковой стадий.
Коккоидные клетки с куполообразной оберткой, 10-20
хлоропластами от эндосимбиотических диатомовых
водорослей и стигмой; дополнительный пигмент фу-
коксантин. Жгутиковые клетки гимнодиниоидного
типа. Описан один морской псаммофильный вид из
тропической Пацифики.
Типовой в и д: G. rugatum Tamura et Horiguchi
2005 (в: Tamura et al., 2005).
Род Glochidinium Boltovskoy 1999
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim; Peridiniopsis Lemmermann
1904, partim.
Клетки почти шаровидные или овальные, сжатые
дорсовентрально, 18-55 мкм в длину. Поясок кольце-
видный, экваториальный. Продольная борозда не до-
стигает антапекса. Гипотека сзади слегка вогнутая, мо-
жет нести шипики. Формула теки: Ро, X, 4', 6", Зс, 4s,
5"', 2"" (согласно другой интерпретации: Ро, X, 3', 1а,
6", Зс, 4s, 5"', 2""). Пластинка Г типа «орто». Хлоро-
пласты имеются. Характерно наличие глазного пятна.
Описано два пресноводных планктонных вида.
Типовой в и д: G. penardiforme (Lindemann) Bol-
tovskoy 1999.
Род Kansodinium Carty et Cox 1986
Син.: Glenodinium Ehrenberg 1837, partim.
Клетки почти шаровидные или овальные, 32-42 мкм
в длину Поясок слегка нисходящий, экваториальный.
Продольная борозда не достигает антапекса. Форму-
ла теки: Ро, X, 3', 1а, 5", 5с, 4s, 5"', 2"". Хлоропласты
имеются. Характерно наличие глазного пятна. Известен
один морской планктонный вид из умеренной зоны.
Типовой вид: A?, ambiguum Carty et Сох 1986.
Род Kryptoperidinium Lindemann 1924
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim; IPhyllodinium Conrad 1926.
62
DINOFLAGELLATA
Клетки почти шаровидные, сжатые дорсовентраль-
но, 15-50 мкм в длину. Поясок кольцевидный, без сме-
щения его концов относительно друг друга, эквато-
риальный. Тека очень тонкая. Формула теки: Ро, З^Г,
2а, 6-7", ?с, ?s, 5"', 2"". Хлоропласты имеются. Стигма
присутствует. Кроме динокариона, имеется также ти-
пичное эукариотическое ядро. Известен один вид из
солоноватых вод.
Типовой вид: К. foliaceum (Stein) Lindemann
1924.
Род Palatinus Craveiro, Calado, Daugbjerg
et Moestrup 2009
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim.
Клетки грушевидные или овальные, с гладкой или
гранулированной текой, 32^48 мкм в длину. Эпитека
длиннее гипотеки. Поясок слегка нисходящий (со сме-
щением концов на 0,5-1 его ширины), сдвинут немного
кзади. Гипотека может нести многочисленные шипики
в антапикальной области. Формула теки: 4', 2а, 7", 6с,
5s, 5"', 2””. Характерно отсутствие апикального поро-
вого комплекса Ро. Хлоропласт L, дольчатый, с цен-
тральным пиреноидом. Стигма присутствует. Известно
два пресноводных вида из умеренной зоны.
Типовой в и д: Р apiculatus (Ehrenberg) Craveiro,
Calado, Daugbjerg et Moestrup 2009.
Род Peridiniopsis Lemmermann 1904
Син.: Glenodinium Ehrenberg 1837, partim; Stylo-
dinium Klebs 1912, partim; Diplopelta Stein in Pavillard
1913; Staszicella Woloszynska 1916.
Клетки в целом шаровидные или овальные, 10-
76 мкм в длину. Поясок кольцевидный или слегка нис-
ходящий, экваториальный или немного сдвинут кза-
ди или кпереди. Гипотека иногда с шипами. Формула
теки: Ро, X, 3-5', 0-1а, 6-7", 6с, 3-5s, 5"', 2"". Хлоро-
пласты имеются. Peridiniopsis polonicum — один из
немногих пресноводных видов динофлагеллат, спо-
собных вырабатывать токсины (гленодинин). Описано
около 20 пресноводных планктонных видов, из кото-
рых для 5-6 видов известны покоящиеся цисты.
Типовой в и д: Р borgei Lemmermann 1904.
Peridiniaceae incertae sedis
Род Pentapharsodinium Indelicate
et Loeblich III 1986
Син.: Peridinium Ehrenberg 1832, partim.
Клетки овальные или грушевидные, около 20 мкм
в длину. Поясок слегка нисходящий, экваториальный
или немного сдвинут кзади. Формула теки: Ро, X, 4',
За, 7", 5с (4с + t), 4-5s, 5"', 2"". Поясковая пластинка
Cj без длинного шипа (в отличие от рода Enciculiferd).
Описано пять морских видов. Известны органиче-
ские и известковые цисты. Солоноватоводно-морской
планкто-бентосный вид Peridinium quinquecorne Abe
(рис. 17, А, вкл.) с двумя вставочными пластинками,
возможно, также принадлежит этому роду (Steidinger,
Tangen, 1996: 524).
Типовой в и д: Р dalei Indelicate et Loeblich III
1986.
Сем. Congruentidiaceae Schiller 1935
Представители Peridiniales, у которых отчетливо
выражена поперечная борозда и которые имеют 3 син-
гулярных пластинки, не считая промежуточной пла-
стинки; сутуры на дорсальной стороне поперечной бо-
розды отсутствуют.
Современные виды морские, нефотосинтезирую-
щие. Наиболее распространенный в морском планкто-
не род Protoperidinium насчитывает около 300 видов.
Ископаемые достоверно известны с кайнозоя и, веро-
ятно, также с позднего мела.
Род Congruentidium Abe 1927
Клетки пятиугольные, сильно сжатые дорсовен-
трально, 62-65 мкм в длину. Эпитека с очень корот-
ким апикальным рогом. Поясок слегка восходящий,
экваториальный. Гипотека с 2 широко расставленны-
ми шипиками в задней части. Формула теки: Ро, 4',
1а, 5", 5с, 5s, 5"', 1р, 2"" (1р обозначена здесь как вста-
вочная антапикальная пластинка, согласно Abe (1927:
420); однако, ее можно интерпретировать как заднюю
сулькальную пластинку, тогда формула теки будет
иметь вид: Ро, 4', 1а, 5", 5с, 6s, 5"', 2""). Хотя формула
теки, описанная Абе (Abe, 1927) отличается от таковой
рода Protoperidinium, в современной литературе прак-
тически без исключения типовой вид Congruentidium
относят к Protoperidinium. Хлоропласты отсутствуют.
Покоящиеся цисты известны в палеонтологии под ро-
довым названием Stelladinium Bradford. Наличие пяти
пресингулярных пластинок (если это не ошибка ав-
тора Congruentidium) — серьезный аргумент в пользу
самостоятельности этого рода. Описан один морской
вид.
Типовой вид: С. compressum АЬё 1927.
Род Protoperidinium Bergh 1881
(рис. 2, 3, 5; 16, A-В] рис. 17, Б, вкл.;
рис. 37, вкл.)
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim; Archaeperidinium Jorgen-
sen 1912; Properidinium Meunier 1919; Minuscula Le-
bour, 1925; ?Congruentidium АЬё 1927.
Клетки различной формы, шаровидные, овальные,
грушевидные или биконические, не сжатые или сжатые
дорсовентрально, 15-275 мкм в длину. Поясок кольце-
видный или нисходящий, экваториальный или почти
экваториальный. Эпитека с апикальным рогом или без
него. Гипотека у многих видов заканчивается двумя ро-
гами или двумя шипами (реже одним). Формула теки:
DINOFLAGELLATA
63
Ро, 3^', 1—4a, 7", 4c (3c + t), 6-7s, 5"', 2"" (у большин-
ства видов: Ро, 4', За, 7", 4с, 6s, 5"', 2"").
Хлоропласты отсутствуют. Ряд видов образует по-
коящиеся цисты, известные в палеонтологии под ро-
довыми названиями Brigantedinium Reid, Dubridinium
Reid, Leipokatium Bradford, Lejeunecysta Artzner et
Dorhofer, Multispinula Bradford, Omanodinium Bradford
(синоним Selenopemphix), Peridimum, Quinquecuspis
Harland, Selenopemphix Benedek, IStelladinium Brad-
ford, Trinovantedinium Reid, Votadinium Reid и Xanda-
rodinium Reid. Известно около 300 морских планктон-
ных видов.
Типовой вид:/?pellucidum Bergh 1881.
Род Diplopsalis Bergh 1881
Син.: Glenodinium Ehrenberg 1837, partim; Disso-
dium Abe 1941, partim.
Клетки шаровидные, сжатые вдоль продольной
оси, 25-60 мкм в длину. Поясок кольцевидный, эква-
ториальный. Левая и правая половины эпитеки сим-
метричны относительно продольной плоскости. Фор-
мула теки: Ро, X, 3', 1а, 6", 4с, 6s, 5"', Г'". Пластинка
1' типа «орто». Задняя сулькальная пластинка Sp типа
«caspica» (см. Abe, 1936: 750, fig. 2b; 1981: 17; корот-
кая, расположена непосредственно позади поры про-
дольного жгутика). Хлоропласты отсутствуют. Из-
вестно два морских планктонных вида. Группа родов
Diplopsalis, Boreadinium, Diplopelta, Diplopsalopsis,
Dissodium, Gotoius, Kolkwitziella, Lebouraia, Oblea и
Preperidinium в литературе известна как «группа (ро-
дов) Diplopsalis», которая в целом включает 30-35 ви-
дов с 14 различными типами табуляции (Hoppenrath et
al., 2009а).
Типовой вид:/?, lenticula Bergh 1881.
Род Boreadinium Dodge et Hermes 1981
Син.: Diplopsalis Bergh 1881, partim.
Клетки шаровидные, 28^40 мкм в длину. Поясок
кольцевидный, экваториальный. Формула теки: Ро, X,
4', 1а, 7(6)", 4с, 5s, 5"', 1"". Пластинка Г типа «мета».
Задняя сулькальная пластинка Sp типа «caspica». Хло-
ропласты отсутствуют. Известно два морских план-
ктонных вида.
Типовой вид: В. pisiforme Dodge et Hermes
1981.
Род Diplopelta Stein 1883
Син.: Diplopsalis Bergh 1881, partim; Dissodium Abe
1941, partim; Peridiniopsis Lemmermann 1904, partim.
Клетки шаровидные, сжатые вдоль продольной
оси, 30-70 мкм в длину. Поясок кольцевидный, эквато-
риальный. Формула теки: Ро, X, 3', 2а, 6", 4с, ?s, 5"', 2"".
Пластинка Г типа «орто». Пластинка 1а очень малень-
кая, четырехугольная. Задняя сулькальная пластинка
Sp типа «asymmetrica»(cM. Abe, 1936: 750, fig. 2а; 1981:
17; длинная, расположена позади справа от поры про-
дольного жгутика). Хлоропласты отсутствуют. Извест-
но четыре морских планктонных вида.
Типовой вид: D. bomba Stein ex Jorgensen
1912.
Род Diplopsalopsis Meunier 1910
(рис. 16, Г; рис. 17, S, вкл.)
Син.: Peridinium Ehrenberg 1832, partim.
Клетки шаровидные, 35-55 мкм в длину. Поясок
кольцевидный, экваториальный. Формула теки: Ро, X,
3^4', 2а, 7", 4с, ?5s, 5-6"', 2"". Пластинка Г типа «орто».
Пластинка 1а большая, пятиугольная. Задняя сулькаль-
ная пластинка Sp типа «asymmetrica». Хлоропласты
отсутствуют. Известно шесть морских планктонных
видов.
Типовой вид:/?, orbicularis (Paulsen) Meunier
1910.
Род Dissodium Abe 1941
Син.: Diplopsalis Bergh 1881, partim; Diplopelta
Stein 1883, partim.
Клетки шаровидные, 40-41 мкм в длину. Поясок
кольцевидный или слегка восходящий, экваториаль-
ный. Формула теки: Ро, X, 3', 2а, 7", 4с, ?5s, 5"', 2"".
Пластинка Г типа «орто». Задняя сулькальная пластин-
ка Sp типа «caspica». Хлоропласты отсутствуют. Изве-
стен один морской планктонный вид.
Типовой вид: D.parvumXbt 1941.
Род Gotoius Abe 1981
С и н.: Diplopsalis Bergh 1881, partim.
Клетки шаровидные, сжатые вдоль продольной оси,
42-72 мкм в диаметре. Поясок кольцевидный, эквато-
риальный. Формула теки: 3', 2а, 5-6", Зс, 4—6s, 5"', 2"";
единственный род в «группе Diplopsalis» без апикаль-
ной поровой пластинки Ро. Пластинка Г типа «орто»
(за исключением одного вида с пластинкой «мета»).
Задняя сулькальная пластинка Sp типа «asymmetrica».
Хлоропласты отсутствуют. Известно четыре морских
планктонных вида.
Типовой вид: G. mutsuensisAbe 1981.
Род Kolkwitziella Lindemann 1919
Син.: Entzia Lebour 1922 (non Entzia Daday 1883
(Foraminifera); Apsteinia Abe 1981 (non Apsteinia Sch-
meil (Crustacea), nec Metcalf (Tunicata) (cm. Elbrachter,
1993).
Известно два сомнительных вида из пресных
вод. Согласно Эльбрехтеру (Elbrachter, 1993), типо-
вой вид представляет собой цисту ранее описанного
вида Glenodinium acutum Apstein. Поповски и Фистер
(Popovsky, Pfiester, 1990) считают типовый вид сино-
нимом единственного пресноводного представителя
рода Gonyaulax, G. apiculata (Penard) Entz. Однако как
Эльбрехтер (Elbrachter, 1993), так и Хоппенрат и со-
64
DINOFLAGELLATA
авторы (Hoppenrath et aL, 2009a) считают Kolkwitziella
родственным «группе Diplopsalis».
Типовой вид: A?, salebrosa Lindemann 1919.
Род Lebouraia Abe 1941 ex Sournia 1986
Клетки шаровидные, 23-28 мкм в диаметре. Поя-
сок кольцевидный, экваториальный. Формула теки: Ро,
X, 3', 2а, 6", ?с, ?s, 5"', 2"". Пластинка Г типа «мета».
Задняя сулькальная пластинка Sp типа «caspica». Хло-
ропласты отсутствуют. Известно два морских план-
ктонных вида.
Типовой вид: L. minutaAbe 1941.
Род Oblea Balech 1964 ex Loeblich Jr.
et Loeblich III 1966
Син.: Glenodinium Ehrenberg 1837, partim; Peridi-
niopsis Lemmermann 1904, partim.
Клетки шаровидные диаметром 20-35 мкм. Поясок
кольцевидный, экваториальный. Формула теки: Ро, X,
3', 1а, 6", 4с, 6s, 5"', 2"". Пластинка Г типа «мета». Пла-
стинка 1а очень большая, контактирует почти со всеми
другими пластинками эпитеки, кроме 6" и Ро. Задняя
сулькальная пластинка Sp типа «caspica». Хлоропласты
отсутствуют. Образует покоящиеся цисты. Известно
2-3 морских планктонных вида.
Типовой вид: О. baculifera Balech 1964 ex Loe-
blich Jr. et Loeblich III 1966.
Род Preperidinium Mangin 1913
Син.: Peridinium Ehrenberg 1832, partim; Gleno-
dinium Ehrenberg 1837, partim; Diplopsalis Bergh 1881,
partim; Peridiniopsis Lemmermann 1904, partim; Diplo-
peltopsis Pavillard 1913; Zygabikodinium Loeblich Jr. et
Loeblich III 1970.
Клетки шаровидные, сжатые или не сжатые вдоль
продольной оси, 25-50 мкм в длину. Поясок кольцевид-
ный, экваториальный. Формула теки: Ро, X, 3', 2а, 7",
4с, 6s, 5"', 1"". Пластинка Г типа «орто». Пластинка 1а
очень маленькая, четырехугольная. Задняя сулькальная
пластинка Sp типа «caspica». Хлоропласты отсутству-
ют. Образует покоящиеся цисты, известные в палеон-
тологии под родовым названием Dubridinium Reid. Из-
вестно четыре морских планктонных вида.
Типовой в и д: Р meunierii (Pavillard) Elbrachter
1993.
Сем. Lessardiaceae Carbonell-Moore 2004
Представители Peridiniales co слабо вдавленной по-
перечной бороздой, клетки овальные, не сжатые. Гипо-
тека с одним антапикальным шипом, 3 антапикальны-
ми и 4 постсингулярными пластинками.
Обитают в морских водах умеренных широт; по-
видимому, также встречаются в Арктике (Околодков,
неопубл, данные). Ископаемые не известны.
Род Lessardia Saldarriaga et Taylor 2003
(в: Saldarriaga et aL, 2003)
Клетки веретеновидные, с заостренными апексом и
антапексом, около 20 мкм в длину. Поясок кольцевид-
ный, экваториальный, плохо выраженный. Гипотека с
шипиком на правой антапикальной пластинке. Форму-
ла теки: Ро, Pi, ср, 3', 1-2а, 5", Зс, 6s, 4"', 3"" (Pi = Pt, ср =
X; Carbonell-Moore, 2004). Характерно наличие спец-
ифического апикального порового комплекса. Хлоро-
пласты отсутствуют. Известно 1-2 морских планктон-
ных вида, учитывая, что Pronoctiluca rostrata Taylor
может принадлежать к роду Lessardia (Saldrarriaga et
al, 2003: 376).
Типовой в и д: L. elongata Saldarriaga et Taylor
2003 (в: Saldarriaga et al, 2003).
Сем. Podolampaceae Lindemann 1928
Представители Peridiniales, у которых слабо выра-
жена или не выражена поперечная борозда и которые
имеют 3 пластинки кзади от экваториальной плоскости
клетки.
Морские тепловодные, преимущественно океани-
ческие виды. Ископаемые не известны.
Род Podolampas Stein 1883
(рис. 17, Г, вкл.)
С и н.: Parrocelia Gourret 1883.
Клетки грушевидные, 90-180 мкм в длину. Поясок
отсутствует. Гипотека сильно редуцирована, несет 1-3
шипа с мембранами. Формула теки: Ро, Pt, X, 3', la, 5",
Зс, 4s, 5"', Г'". Хлоропласты имеются. Известно 6-7
морских планктонных видов.
Типовой вид: Р. bipes Stein 1883.
Род Blepharocysta Ehrenberg 1873
(рис. 1, И; рис. 17, Д, вкл.)
Клетки шаровидные или слегка овальные, 40-
70 мкм в длину. Поясок отсутствует. Гипотека сильно
редуцирована, с двумя хорошо заметными мембранами,
прикрывающими продольную борозду и расположен-
ными в направлении продольной оси клетки. Формула
теки: Ро, Pt, X, 3', la, 5", Зс, 4s, 4-5"', 1"". Хлоропласты
имеются. Известен 1 морской планктонный вид.
Типовой вид: В. splendor-maris (Ehrenberg)
Stein 1883.
Род Gaarderia Carbonell-Moore 1994
С и н.: Blepharocysta Ehrenberg 1873, partim.
Клетки овальные, сжатые в косом направлении,
29-50 мкм в длину. Поясок отсутствует. Гипотека с 2
хорошо заметными мембранами, прикрывающими
продольную борозду и расположенными в направле-
нии продольной оси клетки. Формула теки: Ро, Pt, X, 3',
la, 5", Зс, 4s, 5"', 1"". Пластинка Pt с хорошо развитым
DINOFLAGELLATA
65
гребнем. Пластинки 2' и У соприкасаются между собой
на дорсальной стороне. Пластинка Г'" с характерной
зоной с плотно расположенными крупными порами на
левой стороне. Известно четыре морских планктонных
вида.
Типовой в и д: G. angusta Carbonell-Moore 1994.
Род Heterobractum Carbonell-Moore 1994
Клетки овальные, 35^46 мкм в длину. Поясок от-
сутствует. Формула теки: Ро, Pt, X, 3', la, 5", Зс, 4s, 5"',
1"". Пластинка Г" в несколько раз уже, чем 5"', а 4"'
намного уже, чем 2,,г и 3'". Описан один морской план-
ктонный вид.
Типовой вид://, striatum Carbonell-Moore 1994.
Род Lissodinium Matzenauer 1933,
emend. Carbonell-Moore 1991
С и н.: Blepharocysta Ehrenberg 1873, partim.
Клетки овальные, сильно сжатые латерально, 80-
90 мкм в ширину. Поясок отсутствует. Формула теки:
Ро, Pt, X, 3', la, 5", Зс, 5s, 5"', 1"". Хлоропласты отсут-
ствуют. Известно два морских планктонных вида.
Типовой вид:£. schilleri Matzenauer 1933.
Род Mysticella Carbonell-Moore 1994
С и н.: Blepharocysta Ehrenberg 1873, partim.
Клетки овальные, иногда сжатые дорсовентраль-
но, 38-57 мкм в длину. Поясок отсутствует. Гипотека
с 2 хорошо заметными мембранами, прикрывающими
продольную борозду и расположенными в направле-
нии продольной оси клетки; иногда с шипиками в об-
ласти антапекса. Формула теки: Ро, Pt, X, 3', la, 5", Зс,
4s, 5"', 1"". Пластика Pt с шипиком. Пластинки 2' и У
не соприкасаются между собой. Пластинка 1"" с харак-
терной зоной с плотно расположенными крупными по-
рами на левой стороне или по всей пластинке. Описано
два морских планктонных вида.
Типовой вид: М. striata (Schutt) Carbonell-
Moore 1994.
Сем. Pfiesteriaceae Steidinger et Burkholder
1996 (в: Steidinger et al., 1996), emend.
Litaker, Steidinger, P.L. Mason, Shields
et Tester 2005 (в: Litaker et aL, 2005)
Жизненный цикл включает ряд стадий, представ-
ленных одиночными клетками с 2 жгутиками, гипно-
цистами, временными и покоящимися цистами. Жгу-
тиковые стадии типично планктонные, существуют
непродолжительное время, сходны с гимнодиниоид-
ными формами, но, на самом деле, перидиниоидного
типа, с тонкой текой. Цисты сферические или продол-
говатые, со скульптурированной поверхностью и/или
чешуйками. Бесполое размножение происходит при
делении цисты, половое посредством слияния изога-
мет. Клетки содержат клептохлоропласты и способны
к фагоцитозу. Питание гетеротрофное и миксотрофное.
Тепловодные виды, предпочитают эстуарии. Иско-
паемые не известны.
Род Pfiesteria Steidinger et Burkholder 1996
(в: Steidinger et aL, 1996), emend. Litaker,
Steidinger, P.L. Mason, Shields et Tester 2005
(в: Litaker et al., 2005)
Жгутиковые клетки мелкие, 7-14 мкм, почти оваль-
ные, с экваториальным, слегка нисходящим пояском и
тонкой текой. Формула теки: Ро, ср, X, 4', 1а, 5", PC,
5+s, 5"', Op, 2"" (PC — кроющая пластика педункулю-
ма). Пластинка 1а треугольная. Хлоропласты отсут-
ствуют. Известен один вид (токсичный) из эстуариев
умеренной зоны, вызывающий массовую гибель рыб.
Типовой в и д: Рpiscicida Steidinger etBurkhold-
er 1996 (в: Steidinger et al., 1996).
Род Chimonodinium Craveiro, Calado
Daugbjerg, G. Hansen et Moestrup 2011
Син.: Peridinium Ehrenberg 1832, partim, Glenodini-
um Ehrenberg 1837, partim.
Клетки яйцевидные, слегка уплощенные дорсо-
вентрально, 27-38 мкм в длину. Поясок слегка нисхо-
дящий, чуть сдвинут кзади. Эпитека больше гипотеки.
Формула теки: Ро, ср, X, 4', За, 7", 6с, 5s, 5'", 2"". Хло-
ропласт один, лопастной, без видимых пиреноидов.
Глазное пятно и пузула имеются. Образует неизвест-
ковые покоящиеся цисты овальной или эллипсоидной
формы. Известен один вид с 3 разновидностями пре-
имущественно из холодных пресных водоемов Евро-
пы, Северной и Южной Америки, Тасмании, Японии
и Китая.
Типовой вид: С. lomnickii (Woloszynska)
Craveiro, Calado, Daugbjerg, G. Hansen et Moestrup 2011.
Род Cryptoperidiniopsis Steidinger, Landsberg,
P.L. Mason, Vogelbein, Tester et Litaker 2006
Жгутиковые клетки мелкие, 6-11 мкм, овальные, с
экваториальным, слегка нисходящим пояском и тонкой
текой. Формула теки: Ро, ср, X, 5', 6", 6с, PC, 5+s, 5"',
2"". Вставочные пластинки эпитеки отсутствуют. Хло-
ропласты отсутствуют. Известен один вид из эстуариев
умеренной зоны.
Типовой вид: С. brodyi Steidinger, Landsberg,
P.L. Mason, Vogelbein, Tester et Litaker 2006.
Род Luciella P.L. Mason, Jeong, Litaker, Reece
et Steidinger 2007 (в: Mason et al., 2007)
Вегетативные клетки мелкие, 9-21 мкм, почти
овальные, с субэкваториальным, слегка нисходящим
пояском и тонкой текой. Формула теки: Ро, ср, X, 4',
2а, 6", 6с, PC, 5+s, 5"', Op, 2"". Передние вставочные
66
DINOFLAGELLATA
пластинки четырехугольные. Жизненный цикл пред-
ставлен двужгутиковыми клетками (включая гаметы) и
трехжгутиковыми планозиготами. Ядро сферическое,
расположено в гипотеке. Образует временные и поко-
ящиеся цисты. Хлоропласты отсутствуют, питание пу-
тем мизоцитоза, посредством трубчатого педункулюма.
Описано два вида из эстуариев восточного побережья
США и Южной Кореи.
Типовой в и д: L. masanensis P.L. Mason, Jeong,
Litaker, Reece et Steidinger 2007 (в: Mason et al., 2007).
Род Pseudopfiesteria Litaker, Steidinger,
P.L. Mason, Shields et Tester 2005
Син.: Pfiesteria Steidinger et Burkholder 1996
(в: Steidinger et al., 1996), partim.
Жгутиковые клетки мелкие, 10-25 мкм, овальные,
с экваториальным, слегка нисходящим пояском и тон-
кой текой. Формула теки: Ро, ср, X, 4', 1а, 6", PC, 5+s,
5"', 2"". Пластинка la четырехугольная. Хлоропласты
отсутствуют. Известен один вид (токсичный) из эсту-
ариев умеренной зоны, вызывающий массовую гибель
рыб.
Типовой вид:/? shumwayae (Glasgow et Burk-
holder) Litaker, Steidinger, P.L. Mason, Shields et Tester
2005 (в: Litaker et al., 2005).
Род Stoeckeria Jeong, J.S. Kim, Park, J.H. Kim,
S. Kim, I. Lee, S.H. Lee, Ha etYih 2007
(согласно статье 36.2 МКБН (2006), незаконное название,
так как отсутствует латинский диагноз)
Вегетативные клетки двужгутиковые, овальные,
7-21 мкм в длину, с экваториальным, слегка нисходя-
щим пояском. Формула теки: Ро, ср, X, 4', 2а, 7", 6с,
6s, 5"' 0(р), 2"". Пластинка Г типа «орто». Тека глад-
кая, с редкими, беспорядочно разбросанными порами
и 2 поперечными рядами пор перед пояском и за ним.
Хлоропласты отсутствуют, питание гетеротрофное
посредством педункулюма. Жизненный цикл пред-
ставлен вегетативными клетками, гаметами, гипно-
зиготами, временными и, по-видимому, покоящимися
цистами. Описан один солоноватоводно-морской вид
из прибрежных вод Кореи. Найден во время массового
«цветения» ихтиотоксичной рафидофитовой водорос-
ли Heterosigma akashiwo (Y. Hada) Y. Hada ex Y. Hada
et M. Chihara; установлено, что 5. algicida способна
нанести существенный урон популяции Н. akashiwo.
В настоящей работе род условно помещен в сем. Pfi-
esteriaceae.
Типовой вид: 5. algicida Jeong, J.S. Kim, Park,
J.H. Kim, S. Kim, I. Lee, S.H. Lee, Ha etYih 2007.
Род Tyrannodinium Calado, Craveiro, Daugbjerg
et Moestrup 2009
Син.: Peridinium Ehrenberg 1832, partim; Glenodi-
nium Ehrenberg 1837, partim.
Клетки шаровидные, овальные или веретеновид-
ные (вид с вентральной стороны), с тонкой текой,
21-52 мкм в длину. Эпитека шлемовидная, обычно
немного больше гипотеки. Поясок слегка нисходящий
(со смещением концов на 0,25-0,5 его ширины), почти
экваториальный. Гипотека с 1-2 шипиками на антапек-
се. Формула теки: Ро, ср, X, 4', 6", 6с, PC, 5+s, 5"', 2"".
Характерно отсутствие вставочной пластинки на эпи-
теке и наличие питающей ножки. Хлоропласты иногда
присутствуют. Известны временные цисты, в которых
проходит деление клетки. Известен один гетеротроф-
ный широко распространенный пресноводный вид.
Типовой вид: Т berolinense (Lemmermann) Ca-
lado, Craveiro, Daugbjerg et Moestrup 2009.
Peridiniineae incertae sedis
Род Amphidiniopsis Woloszyriska 1928
С и н.: Thecadinium Kofoid et Skogsberg 1928, partim.
Клетки в целом овальные или почти прямоуголь-
ные, немного или сильно сжатые дорсовентрально или
латерально, 20-59 мкм в длину. Поясок слегка восхо-
дящий (со смещением его концов приблизительно на
1-3 его ширины), реже кольцевидный (без смещения
концов), сильно сдвинут кпереди. Гипотека значитель-
но больше эпитеки, может нести многочисленные мел-
кие зубчики или несколько шипиков. Формула теки:
Ро, 3^1', 1-За, 6-8", 5-8с, 3-5s (+ 1-2 асе.), 5-6"', 2""
(асе. — добавочные пластики продольной борозды).
Хлоропласты отсутствуют. Известно 10 псаммофиль-
ных (9 морских и 1 пресноводный) видов из умеренной
зоны.
Типовой вид: Л. kofoidii Woloszyhska 1928.
Род СаЬга S. Murray et Patterson 2004
Клетки овальные или почти прямоугольные, силь-
но сжатые дорсовентрально, 32^49 мкм в длину. Поя-
сок восходящий, неполный, передний. Гипотека намно-
го больше эпитеки, с внешней оторочкой, образующей
по углам широкие треугольные шипы. Формула теки:
Ро, 3', 0-1а, 4", х, Зс, ?s, 5"', Г'". Хлоропласты отсут-
ствуют. Описано 4 бентосных вида из тропических и
умеренных вод.
Типовой вид: С. matta Murray et Patterson 2004.
Род Herdmania Dodge 1981
Син.: Gymnodinium Stein 1878, partim.
Клетки округлые, с заметной апикальной выемкой,
сильно сжатые дорсовентрально, 25-37 мкм в длину.
Эпикон слегка больше гипокона. Характерно наличие
крючковидной апикальной выемки. Поясок эквато-
риальный или чуть сдвинут к апексу, слегка восходя-
щий, со смещением на одну ширину пояска, неполный
на вентральной стороне клетки, чуть превышает пол-
оборота. Продольная борозда расположена в левой ча-
сти гипокона и расширяется к антапексу. Поверхность
DINOFLAGELLATA
67
клетки покрыта тонкой текой, состоящей из несколь-
ких пластинок. Формула теки: Ро, 3', 2а, 6", х, 7с, 3s,
6"', 1р, Г'". Хлоропласты отсутствуют. Пузул одна или
две. Известен один морской псаммофильный вид из
умеренной зоны.
Типовой вид://, litoralis Dodge 1981, emend.
Hoppenrath 2000.
Род Rhinodinium S. Murray, Hoppenrath,
Yoshimatsu, Toriumi et J. Larsen 2006
(в: Murray et aL, 2006)
Клетки овальные, сжатые в наклонной по отно-
шению к продольной оси клетки плоскости (преиму-
щественно латерально), 48-70 мкм в длину. Поясок
кольцевидный (без смещения концов), смещен кзади.
Продольная борозда не достигает антапекса. Эпитека
слегка длиннее и больше гипотеки, с крючковидным
отростком на апексе, направленным к дорсальной сто-
роне и прикрывающим апикальную пору. Гипотека с
шипиком, расположенным слева от продольной бороз-
ды и направленным назад. Формула теки: Ро, 3', 1а, 5",
4с, ?s, 5'", Г'". Описан один псаммофильный вид из
тропической зоны.
Типовой вид:/?, broomeense S. Murray, Hoppen-
rath, Yoshimatsu, Toriumi et J. Larsen 2006 (в: Murray et
al., 2006).
Peridiniales incertae sedis
Род Chalubinskia Woloszynska 1916
Согласно Поповски и Фистер (Popovsky, Pfiester,
1990), является синонимом Peridinium Ehrenberg 1832.
Род Staszicella Woloszynska 1916
Согласно Поповски и Фистер (Popovsky, Pfiester,
1990), является синонимом Peridiniopsis Lemmermann
1904.
Род Thaurilens Pavillard 1917
Клетки линзовидные, в виде звезды, около 20 мкм
в длину (в диаметре), с эластичной клеточной стен-
кой, образующей шиповидные образования (от 3 до
6). Ядро большое. Вероятно, что название рода явля-
ется старшим синонимом Dinastridium Pascher 1927 из
Dinococcales (Soumia, 1986: 98).
Типовой вид: Т. denticulata Pavillard 1917.
Род Vulcanodinium Nezan et Chomerat 2011
Клетки биконические или овальные, 24-30 мкм в
длину. Эпитека коническая или полушаровидная, со
срезанным апексом, гипотека трапециевидная или по-
лушаровидная. Передние вставочные пластинки об-
тазуют непрерывный ряд. Поясок экваториальный, со
смещением концов на 1,5-2 его ширины. Продольная
борозда сигмовидной формы. Формула теки: Ро, X, 4',
За, 7", 6с, 6s, 5'", 2"". Пластинка Ро большая, с круглой
апикальной порой, пластинка Г узкая. Задняя суль-
кальная пластинка Sp не соприкасается с поперечной
бороздой. Тека продольно исчерчена. Описан один
планктонный вид из лагун Средиземного моря.
Типовой вид: И rugosum Nezan et Chomerat
2011.
Peridiniphycidae incertae sedis
Сем. Comparodiniaceae Vozzhennikova 1979
Представители Peridiniphycidae с табуляцией, со-
стоящей или производной из пяти пресингулярных,
пяти постсингулярных, пяти климактальных и одной
фундитальной (антапикальной) пластинок. Первая
постсингулярная пластинка не контактирует с послед-
ней постсингулярной.
По крайней мере, два рода из трех, приведенных
Фенсомом и соавторами (Fensome et al., 1993), явля-
ются синонимами пресноводных родов Peridinium и
Peridiniopsis (Popovsky, Pfiester, 1990).
Сем. Oxytoxaceae Lindemann 1928
Представители Peridiniphycidae с табуляцией, со-
стоящей или производной из пяти-шести пресингуляр-
ных, пяти постсингулярных, пяти климактальных и од-
ной фундитальной (антапикальной) пластинок.
Современные морские тепловодные, преимуще-
ственно фотосинтезирующие виды.
Род Oxytoxum Stein 1883 (рис. 17, Е, вкл.)
Син.: Pyrgidium Stein 1883; Corythodinium Loeblich
Jr. et Loeblich III 1966.
Клетки обычно веретеновидные, реже почти оваль-
ные, часто с заостренными апексом и антапексом,
15-110 мкм в длину. Длина клетки может превышать
ее ширину до семи раз. Эпитека всегда меньше гипоте-
ки, иногда сильно редуцирована. Поясок кольцевидный
или слегка нисходящий. Гипотека часто с антапикаль-
ным шипом. Хлоропласты имеются. Формула теки: Ро,
3', 2а, 3", 4-5с, 4s, 5"', Г'" (согласно другой интерпре-
тации: Ро, 5', 6", 5с, 4s, 5"', Г'"; Dodge, Saunders, 1985).
Известно приблизительно 50 морских планктонных
видов (около 70 видовых названий в литературе) пре-
имущественно из тропических вод.
Типовой вид: О. scolopax Stein 1883.
Сем. Centrodiniaceae Hernandez-Becerril
2010 (в: Hernandez-Becerril et al., 2010)
Представители Peridiniphycidae, сжатые латераль-
но, с апикальным рогом и антапикальным выростом.
Формула теки: 3', За, 6", 6с, 5s, 5"', 2р, Г'".
Современные морские тепловодные, фотосинтези-
рующие виды.
68
DINOFLAGELLATA
Род Centrodinium Kofoid 1907
Син.: Pavillardinium De-Toni 1936, partim; Murra-
yella Kofoid 1907.
Клетки биконические, веретеновидные, сжатые
латерально, особенно в средней части, 10СМ-00 мкм
в длину. Поясок слегка нисходящий, экваториаль-
ный. Формула теки: Ро, Зг, За, 6", 6с, 5s, 5"', 2р, Г'"
(Hemandez-Becerril et al., 2010), 2', За, 7", 5с, ?s, 5'",
2"" (Steidinger, Tangen, 1997) или ?Po, 2-3', 1-За, 6-7",
5-6c, ?s, 5"', l-2p, 1"" (Soumia, 1986). Хлоропласты
имеются. Известно 16 морских планктонных видов из
тропических вод.
Типовой вид: С. elongatum Kofoid 1907.
Сем. Stephanelytraceae Stover,
Sarjeant et Drugg 1977
Представители Peridiniphycidae, у которых цисты,
содержащие диноспорин, имеют антапикальную коро-
ну или короны и апикальный археопиль.
Ископаемые известны из юрских морских отло-
жений.
Сем. Dollidiniaceae Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993
Представители Peridiniphycidae, у которых име-
ются две симметрично расположенных фундиталь-
ных, 6 пресингулярных и более чем 4 климактальных
пластинки. Цисты содержат диноспорин, дольчатые в
очертании.
Ископаемые известны из позднеюрских и ранне-
кайнозойских морских отложений.
Peridiniphycidae incertae sedis
Род Adenoides Balech 1956
Клетки овальные или шаровидные, слегка сжатые
дорсовентрально, 27-35 мкм в длину. Поясок кольце-
видный, без смещения концов относительно друг дру-
га, сильно сдвинут вперед. Продольная борозда очень
короткая. Гипотека значительно больше эпитеки. Фор-
мула теки: Ро, 4', 6с, 4s, 5"', 5р, Г'" (согласно другой
интерпретации: Ро, 4', 6с, 5s, 5"', Зр, 2""; Hoppenrath et
aL, 2003). Хлоропластов два, имеющих пиреноиды. Из-
вестен один морской псаммофильный вид из умерен-
ных и субтропических вод.
Типовой вид: Л. eludens (Herdman) Balech 1956.
Род Amyloodinium Brown et Hovasse 1946
Син.: Oodinium Chatton 1912, partim.
Жгутиковые клетки (диноспоры) округлые, сжатые
вдоль продольной оси клетки, 6-7 мкм в длину, около
12 мкм в ширину. Поясок слегка нисходящий, эквато-
риальный. Формула теки: Ро, ср, X, 4', 1а, 7", PC, ?6-8с,
?s, 5"', 2"" (Landsberg et al., 1994). Пластинка la четыре-
хугольная. В жизненном цикле отмечены также другие
стадии, трофонт и томонт (томонт — стадия размноже-
ния). Известно 1-2 вида, паразитирующих на морских
рыбах.
Типовой вид: Л. ocellatum (Brown) Brown in
Brown et Hovasse 1946.
Род Archaeosphaerodiniopsis Rampi 1943
Клетки шаровидные, 20 мкм в длину и в ширину.
Поясок кольцевидный, экваториальный. Продольная
борозда не различима. Формула теки: 4' 3-4с, ?s, 4"'.
Описан один морской планктонный вид.
Типовой вид: Л. verrucosum Rampi 1943.
Род Azadinium Elbrachter et Tillmann 2009
(в: Tillmann et aL, 2009)
Клетки в целом овальные или эллипсовидные, сжа-
тые дорсовентрально, 12-18 мкм в длину, с тонкой те-
кой. Эпитека больше и немного шире гипотеки. Поясок
слегка нисходящий (со смещением концов на 0,5 его
ширины), широкий. Гипотека может нести шипик на
антапексе. Формула теки: Ро, 4', За, 6", 6с, ?5s, 6"', 2"".
Пластинка 1' с круглой вентральной порой у ее левого
края. Пластинка 2а очень маленькая, намного меньше
соседних 1а и За. Хлоропласт 1, париетальный, лопаст-
ной. Типовой вид способен вырабатывать токсины аза-
спирациды. Описано три морских планктонных вида
из умеренных вод.
Типовой вид: Л. spinosum Elbrachter et Tillmann
2009 (в: Tillmann et aL, 2009).
Род Dinosphaera Kofoid et Michener 1912
Син.: Glenodinium Ehrenberg 1837, partim; Gonyau-
lax Diesing 1866, partim.
Клетки почти шаровидные, 25-34 мкм в диаметре.
Поясок слегка нисходящий, экваториальный. Формула
теки: 3', 1а, 6', 5"', 1"". Характерно отсутствие пластин-
ки 1р. Описан один пресноводный планктонный вид.
Типовой вид:/?, palustris (Lemmermann) Kofoid
et Michener 1912.
Род Heteraulacus Diesing 1850
Почти все современные авторы отказываются от
использования этого названия в пользу Goniodoma
(Soumia, 1984: 348; Balech, 1979, 1988: 164) или Triadi-
nium (Dodge, 1981: 278).
Род Melanodinium Schiller 1935
Клетки почти шаровидные, около 64 мкм в длину,
слегка сжатые с вентральной стороны. Поясок нисходя-
щий (со смещением его концов на 2,5-3 его ширины).
Гипотека с несколькими шипиками в антапикальной
DINOFLAGELLATA
69
области. Тека сильно ареолированная. Единственный
вид, описанный из Красного моря. Род является со-
мнительным. Наиболее вероятно, он принадлежит к се-
мейству Gonyaulacaceae, а описанный вид к роду Proto-
ceratium Bergh.
Типовой вид: М. nigricans Schiller 1935.
Род Roscoffia Balech 1956
Клетки овальные, слегка сжатые дорсовентрально,
32^4-0 мкм в длину. Поясок слегка восходящий, сильно
сдвинут вперед. Формула теки: Ро, 3'(4'), 5", Зс, 4s, 5"',
1"" (Hoppenrath, Elbrachter, 1998). Хлоропласты отсут-
ствуют. Известен один морской псаммофильный вид из
умеренных и субтропических вод.
Типовой вид:/?, capitata Balech 1956.
Род Thompsodinium Bourrelly 1970
Син.: Peridinium Ehrenberg, 1832 partim.
Клетки шаровидные или овальные, немного сжа-
тые дорсовентрально, 32-39 мкм в длину. Поясок
слегка нисходящий. Продольная борозда широкая, не
достигает антапекса. Эпитека с симметричным рас-
положением пластинок. Хлоропласты имеются. Стиг-
ма присутствует. Формула теки: 3', 4а, 6", 5"', 1р, 2""
или 4', За, 6", 5'", 2р, Г". Описан один пресноводный
вид.
Типовой вид: Т. intermedium (Thompson) Bour-
relly 1970.
Подкласс Dinophysiphycidae Mohn,
1984 ex Fensome, Taylor, Norris,
Sarjeant, Wharton et Williams 1993
Динофициевые, у которых имеются поперечная и
продольная борозды и сагитальная сутура.
Порядок Nannoceratopsiales Piel et Evitt
1980
Представители Dinophysiphycidae с сагитальной
сутурой, простирающейся лишь на гипотеку.
Сем. Nannoceratopsiaceae Gocht
1970
Характеристики те же, что для подпорядка Nanno-
ceratopsiales.
Ископаемые известны из юрских морских отложе-
ний.
Порядок Dinophysiales Kofoid 1926
Представители Dinophysiphycidae с сагитальной
сутурой, простирающейся на всю клетку.
Сем. Dinophysiaceae Stein 1883
Представители Dinophysiales, у которых подвиж-
ные клетки округлые, яйцевидные или почковидные.
Длина клетки никогда не превышает ее ширину более
чем в 3 раза. Вентральная пора расположена на вен-
тральной стороне эпитеки. Жгутиковая пора находится
непосредственно за поперечной бороздой.
Современные морские планктонные виды обитают
во всех районах Мирового океана, однако большинство
из них предпочитает тропические воды. Фотосинте-
зирующие и нефотосинтезирующие. Некоторые виды
тропических нефотосинтезирующих Ornithocercus,
Histioneis и Citharistes живут в симбиозе с внеклеточ-
ными экзосимбиотическими цианобактериями родов
Synechococcus и Synechocystis, иногда называемые «фе-
осомами». Ряд видов Dinophysis токсичные. Ископае-
мые известны из девонских (Palaeo dinophysis) и юр-
ских морских отложений.
Род Dinophysis Ehrenberg 1839
(рис. 10, Г; рис. 12, A-В, вкл.;
рис. 33, A-В, вкл.)
Син.: Phalacroma Stein 1883 (non Phalacroma
Hawle et Corda 1847); Prodinophysis Balech 1944.
Клетки 30-100 мкм в длину, обычно сжатые с бо-
ков. Эпитека маленькая. Поясок не смещенный. Про-
дольная борозда короткая, окаймленная 2 умеренно
развитыми мембранами. Гипотека удлиненная, состав-
ляет одну треть длины клетки или более, антапекс мо-
жет нести вырост (шип или мембрану). Хлоропласты у
большинства видов отсутствуют. Описаны временные
цисты (Bardouil et al., 1991) и предполагают существо-
вание гипнозигот (Reguera, 2002). Известно около 200
морских планктонных видов, из которых 10 способ-
ны вырабатывать токсины. Леблич (Loeblich III, 1965,
1967) восстановил род Prodinophysis Balech и перевел
в него 24 вида из рода Phalacroma Stein. Некоторые
современные авторы, однако, отстаивают самостоя-
тельность рода Phalacroma, не признавая его синони-
мичность с родом Dinophysis (Hallegraeff, Lucas, 1988;
Steidinger, Tangen, 1997 ; Handy et al., 2009; Hastrup Jen-
sen, Daugbjerg, 2009; Gomez et al., 2011).
Типовой в и д: D. acuta Ehrenberg 1839.
Род Citharistes Stein 1883
Клетки 35-70 мкм в длину, слегка вогнутые с дор-
сальной стороны. Эпитека сильно редуцирована. Ги-
потека состоит из 6 пластинок, в отличие от других
Dinophysiaceae (4 пластинки). Известно два морских
планктонных тропических вида.
Типовой вид: С. regius Stein 1883.
Род Dinofurcula Kofoid etSkogsberg 1928
Клетки в форме коренного зуба, около 60 мкм в дли-
ну. Эпитека маленькая. Гипотека несет 2 рога, направ-
70
DINOFLAGELLATA
ленные назад. Поясок слегка нисходящий. Продольная
борозда смещена на правую сторону. Хлоропласты от-
сутствуют. Известно два морских планктонных вида.
Типовой вид: D. ultima (Kofoid) Kofoid et
Skogsberg 1928.
Род Heteroschisma Kofoid et Skogsberg 1928
ex Schiller 1931
Син.: Proheteroschisma Tai et Skogsberg 1934; ILa-
tifascia Loeblich Jr. et Loeblich III 1966.
Клетки округлые или яйцевидные, 30-55 мкм в
диаметре. Эпитека составляет 0,25-0,33 длины клетки,
с хорошо заметной апикальной порой. Левая мембрана
продольной борозды обычно без поддерживающих ши-
пов. Хлоропласты отсутствуют. Известно 5-6 морских
планктонных видов.
Типовой вид: Н. inaequale Kofoid et Skogsberg
1928.
Род Histioneis Stein 1883 (рис. 1, К)
Син.: Parahistioneis Kofoid et Skogsberg 1928.
Клетки почковидные, часто вдавленные спереди,
15-90 мкм в диаметре. Эпитека маленькая. Продоль-
ная борозда довольно длинная. Правая мембрана про-
дольной борозды еле заметная, левая очень развитая, с
ребрами и часто сетчатая. Хлоропласты отсутствуют.
Известно около 100 морских планктонных видов.
Типовой вид: Н. remora Stein 1883.
Род Histiophysis Kofoid et Skogsberg 1928
Син.: Dinophysis Ehrenberg 1839, partim.
Клетки по форме одновременно напоминают Dino-
physis и Histioneis. Эпитека маленькая. Правая мембра-
на продольной борозды еле заметная, левая хорошо
развита, с ребрами, имеет сетчатое строение. Известен
один морской планктонный вид.
Типовой вид://, rugosaKofoidetMichener 1911.
Род Latifascia Loeblich Jr. et Loeblich III 1966
Син.: IHeteroschisma Kofoid et Skogsberg 1928 ex
Schiller 1931, partim.
Это название, вероятно, является синонимом He-
teroschisma, однако оно законное, согласно МКБН,
и сохранено (nom. conserv.). Известно два морских
планктонных вида (Loeblich Jr., Loeblich III, 1966;
Okolodkov, Garate-Lizarraga, 2006).
Типовой вид:/, inaequale (Kofoid et Skogsberg)
Loeblich Jr. et Loeblich III 1966.
Род Metadinophysis Nie et Wang 1941
Клетки почти овальные, 41 -45 мкм в длину. Эпи-
тека маленькая, наклонена к вентральной стороне.
Поясок слегка нисходящий, со смещением его кон-
цов приблизительно на 0,5 его ширины. Гипотека за-
остренная или узкозакругленная сзади, со слегка
вогнутой левой и выпуклой правой створками (пла-
стинками). Наиболее вероятно, это название является
синонимом Dinophysis Ehrenberg (Soumia, 1986: 40).
Описан один планктонный вид из тропических вод
Пацифики.
Типовой вид: М. sinensis Nie et Wang 1941.
Род Metaphalacroma Tai et Skogsberg
1934
Клетки округлые, около 50 мкм в диаметре. Эпи-
тека маленькая. Обе мембраны продольной борозды
сильно редуцированы. Хлоропласты отсутствуют. Из-
вестно 1-3 морских планктонных вида.
Типовой в и д: М. skogsbergii Tai in Tai et Skogs-
berg 1934.
Род Ornithocercus Stein 1883 (рис. 12, Д, вкл.)
Клетки округлые, 30-80 мкм в диаметре. Эпитека
небольшая. Мембраны пояска и продольной борозды
сильно развиты, укреплены длинными ребрами и се-
тью маленьких ребрышек по краю мембран. Хлоропла-
сты отсутствуют. Известно около 22 морских планк-
тонных вида.
Типовой вид: О. magnificus Stein 1883.
Род Pseudophalacroma Jorgensen 1923
ex Lebour1925
Наиболее вероятно, это название является синони-
мом Dinophysis Ehrenberg (Soumia, 1986: 40). Описан
один морской планктонный вид из Средиземного моря.
Типовой вид:/? nasutum (Stein) Jorgensen 1923.
Род Sabulodinium Saunders et Dodge 1984
Клетки овальные, сильно сжатые латерально, 27-
52 мкм в длину. Эпитека очень маленькая, около 0,1
длины клетки. Формула теки: (АРС), 5', 1а, 6”, 5с, 4s,
6"', 1"" (АРС — apical pore complex, или комплекс апи-
кальной поры; Hoppenrath et al., 2007). Хлоропласты
отсутствуют. Известно два морских псаммофильных
вида из умеренной зоны.
Типовой вид: 5. undulatum Saunders et Dodge
1984.
Род Sinophysis Nie et Wang 1944
(рис. 10, Д; рис. 12, E, вкл.)
Син.: Dinophysis Ehrenberg 1839, partim; Phalacro-
ma Stein 1883, partim; Thecadinium Kofoid et Skogsberg
1928, partim.
Клетки эллипсовидные, сжатые с боков, 30-50 мкм
в длину. Эпитека очень маленькая. Продольная борозда
составляет около 0,66 длины клетки, окаймленная 2 уз-
DINOFLAGELLATA
71
кими мембранами, левая из которых заметнее и длин-
нее правой. Хлоропласты отсутствуют. Известно пять
морских бентосных (эпифитных и псаммофильных)
видов из умеренных и тропических вод.
Типовой вид: S', microcephala Nie et Wang 1944.
Род Thaumatodinium Bohm 1933
Организм динофизиоидного типа, 50-80 мкм в
длину, весьма необычной формы: на боковых сторонах
имеется по одной полушаровидной выпуклости диа-
метром в половину длины клетки. Описан один вид из
Средиземного моря.
Типовой вид: Z molischii Bohm 1933.
Сем. Amphisoleniaceae Lindemann 1928
Представители Dinophysiales, у которых длина под-
вижных клеток превышает их ширину более чем в 4
раза. Вентральная пора расположена на вентральной
стороне эпитеки. Жгутиковая пора находится на значи-
тельном расстоянии от поперечной борозды, сзади нее.
Современные морские планктонные виды тропиче-
ских вод. Некоторые виды содержат внутриклеточные
симбиотические цианобактерии.
Род Amphisolenia Stein 1883
(рис. 1, Г; рис. 12, Г, вкл.)
Клетки палочковидные, 150-1500 мкм в длину,
гипотека длиннее эпитеки, обычно с вилочковидным
антапексом с шипиками. Поясок слегка нисходящий, с
редуцированными мембранами. Хлоропласты присут-
ствуют или отсутствуют. Около 35 морских планктон-
ных видов.
Типовой вид: A. globifera Stein 1883.
Род Triposolenia Kofoid 1906
Клетки палочковидные, 100-250 мкм в длину, с
гипотекой, разветвленной от середины клетки. Хло-
ропласты обычно отсутствуют. Известно 10 морских
планктонных видов.
Типовой вид: Т. truncata Kofoid 1906.
Сем. Oxyphysiaceae Sournia 1984
Представители Dinophysiales, у которых гомолог
вентральной поры расположен вблизи апекса, а жгути-
ковая пора находится непосредственно за поперечной
бороздой.
Единственный современный род с единственным
морским планктонным видом, обитающим в умерен-
ных и тропических водах. Ископаемые не известны.
Род Oxyphysis Kofoid 1926
Клетки веретеновидные, 60-70 мкм в длину — в
4-5 раз больше ширины. Эпитека в виде асимметрич-
ного конуса, обычно с 1 шипиком. Поясок вдавленный
с редуцированными мембранами. Продольная бо-
розда короткая. Хлоропласты отсутствуют. Известен
один морской планктонный вид. На основе молеку-
лярно-биологических данных, Gomez с соавторами
(Gomez et al., 2011) считают его относящимся к роду
Phalacroma.
Типовой вид: О. oxytoxoides Kofoid 1926.
Подкласс Prorocentrophycidae
Fensome, Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Динофициевые, у которых оба жгутика выходят из
одной поры в апикальной части клетки, продольная и
поперечная борозды отсутствуют. Имеются текальные
пластинки (2 больших в виде створки и 7-14 малень-
ких в апикальной части клетки), один жгутик, гомоло-
гичный поперечному жгутику других динофлагеллат,
образует ундулирующую мембрану.
Порядок Prorocentrales Lemmermann
1910
Характеристики те же, что для подкласса Prorocen-
trophycidae.
Сем. Prorocentraceae Stein 1883
Характеристики те же, что для подкласса Prorocen-
trophycidae.
Современные морские планктонные и бентосные
(в основном эпифитные) виды преимущественно тро-
пических вод. Род Prorocentrum в настоящее время на-
считывает приблизительно 80 видов, некоторые из них
токсичные. Ископаемые не известны.
Род Prorocentrum Ehrenberg 1833
(рис. 1, М; 10, А-S; рис. 11, А-Е, вкл.)
Син.: Cercaria Michaelis 1830; Exuviaella Cien-
kowski 1881; Postprorocentrum Gourret 1883; Dinopyxis
Stein 1883.
Клетки округлые, ланцетовидные, эллипсовидные,
сердцевидные или сигмовидные, 6-100 мкм в длину
(преимущественно менее 50 мкм), сжатые с боков. Тека
состоит в основном из 2 больших створок и 7-14 ма-
леньких апикальных пластинок, одна из которых ино-
гда несет шипик или гребень. Хлоропластов один или
два, иногда присутствует пиреноид. Цисты обнаруже-
ны у бентосных видов. Известно приблизительно 80
видов, планктонных и бентосных, морских и солоно-
ватоводных, из которых, по крайней мере, 12 способны
вырабатывать токсины.
Типовой вид:/? micans Ehrenberg 1833.
72
DINOFLAGELLATA
Род Haplodinium Klebs 1912
Клетки округлые или яйцевидные, слегка сжатые с
боков, 20-40 мкм в длину, с сократительной вакуолью и
двумя или более хлоропластами. Известно 4 вида.
Типовой вид: Н. anjoliense Klebs 1912.
Род Mesoporos Lillick 1937
Син.: Exuviaella Cienkowski 1881, partim; Porel-
la Schiller 1928; Dinoporella Halim 1960; Porotheca
P.C. Silva 1960.
Клетки круглые, овальные, яйцевидные или серд-
цевидные, менее 14-27 мкм, сжатые или не сжатые с
боков, без апикального шипика, с 2 или более хлоро-
пластами. Тека состоит в основном из 2 больших ство-
рок, каждая из которых имеет посередине коническое
впячивание, перфорированное в центре. Хлоропла-
сты присутствуют. Известно 6 морских планктонных
видов.
Типовой в и д: М. perforates (Gran) Lillick 1937.
Dinophyceae incertae sedis
Род Moestrupia G. Hansen et Daugbjerg 2011
Син.: Gyrodinium Kofoid et Swezy 1921, partim.
Клетки в целом овальные, 14-25 мкм в длину. Поя-
сок сильно нисходящий, смещен приблизительно на 0,3
длины клетки, с хорошо заметной верхней и мало за-
метной нижней границей. Эпикон и гипокон приблизи-
тельно равны по размеру. Апикальная бороздка корот-
кая и искривленная. На эпиконе продольная борозда по
краю окаймлена характерным валиком, длина которого
около 0,5 длины клетки. Амфиесмальные пузырьки
многочисленные, пятиугольные или шестиугольные.
Имеется педункулюм, который, в отличие от большин-
ства других родов динофлагеллат, выходит из эпикона.
Хлоропласт сетчатый, с 1 стебельковым пиреноидом,
содержит перидинин. Пузула присутствует. Глазное
пятно отсутствует. Описан один морской бентосный
вид из Испании, также найденный в Австралии.
Типовой в и д: М. oblonga (J. Larsen et Patterson)
G. Hansen et Daugbjerg 2011.
Порядок Desmocapsales Pascher 1914
Представители динофициевых с двумя лентовид-
ными жгутиками, выходящими из апикальной части
клетки; ни один из жгутиков не образует ундулирукэ-
шей мембраны. Тека отсутствует или не заметна.
Сем. Desmocapsaceae Pascher 1914
Характеристики те же, что для порядка Desmocap-
sales.
Включает 4 монотипичных рода со слабо изучен-
ной морфологией. Ископаемые не известны.
Род Desmocapsa Pascher 1914
Клетки шаровидные, 8-10 в диаметре, известны в
виде жгутиковой стадии и в пальмеллоидном состоя-
нии. Хлоропласт 1 с пиреноидом.
Типовой вид:/), gelatinosa Pascher 1914.
Род Adinimonas Schiller 1928
Клетки яйцевидные, 30-34 мкм в длину, с двумя
шиповидными боковыми выростами. Описана только
жгутиковая стадия. Хлоропластов два. Морские.
Типовой вид: Л. oviforme Schiller 1928.
Род Desmomastix Pascher 1914
Клетки шаровидные или овальные, 10-15 мкм в
длину. Образует цисты с целлюлозной стенкой. Хлоро-
пластов два, имеющих пиреноиды. Пресноводные.
Типовой вид:/), globosa Pascher 1914.
Род Pleromonas Pascher 1914
Клетки яйцевидные, 15-20 мкм в длину, с упло-
щенным апексом. Хлоропласт один, с пиреноидом.
Пресноводные.
Типовой вид: Р erosa Pascher 1914.
Порядок Phytodiniales Christensen, 1962
ex Loeblich III 1970
Динофициевые, у которых: 1) основная стадия жиз-
ненного цикла представлена неизвестковыми коккоид-
ными клетками (вегетативные цисты) или 2) многокле-
точной стадией с непрерывной стенкой, или у которых
амебодная стадия присутствует в жизненном цикле,
включающим также коккоидную стадию.
Сем. Phytodiniaceae Klebs 1912
Представители Phytodiniales, в жизненном цикле
которых доминирует коккоидная или амебоидная ста-
дия. Нитчатые стадии отсутствуют.
Фотосинтезирующие пресноводные виды, неко-
торые имеют паразитическую стадию, обитают на во-
дных растениях, включая водоросли.
Род Phytodinium Klebs 1912
Клетки шаровидные или овальные, окруженные
толстой клеточной стенкой, 14-50 мкм в длину. Хло-
ропласты овальные, пристенные. Запасные вещества в
виде масла и крахмала. Размножение посредством 2 ав-
тоспор. Известно один или более пресноводных видов.
Типовой вид: Р simplex Klebs 1912.
Род Cystodinedria Pascher 1944
Син.: Cystodinium Klebs 1912, partim; Raciborskia
(Woloszynska) Pascher 1919, partim, emend. Geitler 1943;
DINOFLAGELLATA
73
Phytodinedria Pascher 1944; Dinococcus (Woloszynska)
Fott 1960, partim.
Клетки так называемой «стадии Cystodinedria»
овальные или эллипсоидные, прикрепленные к суб-
страту, 8-88 мкм в длину. Клеточная стенка целлюлоз-
ная, растягивающаяся, гладкая или с многочисленными
шипами. Хлоропласты дисковидные, лентовидные или
отсутствуют. Иногда имеются стигма и пиреноид. В ре-
зультате деления клетки образуются 1 неподвижная и
4 подвижные особи. Деление может проходить с обра-
зованием клеток различных типов: 1) 2^1 зооспоры со
стигмой и хлоропластами, 10-56 мкм; 2) 4 изогаметы,
отличающиеся от зооспор меньшими размерами, 15-
17 мкм в длину; 3) две амебы типа Vampyrella с мно-
гочисленными филоподиями («стадия Vampyrella»},
8-30 мкм в диаметре; 4) 2-3 шаровидные клетки типа
Actinophrys с многочисленными филоподиями («стадия
Actinophrys»}, 25-60 мкм в диаметре; 5) многочислен-
ные микроспоры шаровидной или овальной формы,
6-8 мкм в диаметре (Popovsky, Pfiester, 1990). Питание
автотрофное и голозойное. Известно более 10 пресно-
водных видов, обитающих на нитчатых цианобактери-
ях, зеленых водорослях, мхах и детрите.
Типовой вид: С. inermis (Geitler) Pascher 1944.
Род Cystodinium Klebs 1912
(рис. 1,0; 36, A)
Син.: Glenodinium Schilling 1891; Gymnodinium
Baumeister 1938, partim; IGymnocystodinium Baumeister
1957; Dinorbiculus Baumeister 1968.
Вегетативные клетки эллипсовидные и полулун-
ные, удлиненные, 33-200 мкм, с округлыми концами,
которые могут нести длинные шипы; планктонные, не-
подвижные. Клеточная стенка толстая. Поясок и про-
дольная борозда не различимы. Трихоцисты имеются.
Хлоропласты и стигма отсутствуют. При размножении
образуются 2^1 зооспоры, 2 автоспоры или 8-16 аме-
боидных клеток с большим количеством аксоподий
(содержат 2-3 дисковидных хлоропласта). Зооспоры
и гаметы гимнодиниоидного типа, со стигмой или без
неё и с многочисленными хлоропластами. Образует
покоящуюся стадию с толстой стенкой. Известно 3
или более пресноводных видов. Поповски и Фистер
(Popovsky, Pfiester, 1990) иллюстрируют многочислен-
ные жизненные стадии трех видов, а также приводят
список из 20 не валидных или неполно описанных ви-
дов Cystodinium.
Типовой вид: С. bataviense Klebs 1912.
Род Dinamoebidium Pascher 1916
Син.: Dinamoeba Pascher 1916 (non Dinamoeba Lei-
dy 1874).
Клетки амебоидные, 40-60 мкм. Цисты целлюлоз-
ные, полулунной формы, 20-70 мкм. Споры гимноди-
ниоидного типа, 8-14 мкм. Обитает как эпифит на бен-
тосных цианобактериях. Известно 1-2 вида.
Типовой вид:/), varians (Pascher) Pascher 1916.
Род Dinastridium Pascher 1927
Клетки коккоидные, веретеновидные, около 28 мкм
в длину, с тупыми концами, несущими по 3 шипика.
Размножается посредством автоспор или зооспор. Из-
вестно 4 пресноводных вида.
Типовой вид:/), sexangulare Pascher 1927.
Род Halostylodinium Horiguchi, Yoshizawa-Ebata
in Horiguchi, Yoshizawa-Ebata et Nakayama
2000
Коккоидные клетки округлые, овальные или яйце-
видные, 33—48 мкм в длину, с прикрепляющейся нож-
кой размером 11-29 мкм. Ножка состоит из толстой
трубочки, тонкой трубочки и базального диска; обра-
зуется из апикального комплекса жгутиковой клетки.
Хлоропласт 1, с радиально расположенными долями
и центральным пиреноидом. Ядро находится в центре
клетки. Жгутиковые зооспоры яйцевидные, с трапеци-
евидной округлой эпитекой и полушаровидной гипо-
текой. Поясок нисходящий (со смещением на 0,5-1,0
его ширины), сдвинут кзади клетки. Формула теки: Ро,
5', 2а, 7", 7с, 6s, 5"', 1 р, 2"". Стигма присутствует. Опи-
сан один морской бентосный вид, обитающий на кам-
нях и макроводорослях, из субтропических вод Паци-
фики.
Типовой вид://, arenarium Horiguchi et Yoshiza-
wa-Ebata in Horiguchi, Yoshizawa-Ebata et Nakayama
2000.
Род Hemidinium Stein 1878
Син.: IGloeodinium Klebs 1912.
Жгутиковые клетки овальные, асимметричные от-
носительно продольной оси, сжатые дорсовентрально,
11-50 мкм в длину. Поясок неполный, с вентральной
стороны лишь на левой половине клетки, на дорсаль-
ной стороне направлен влево назад. Продольная бороз-
да простирается от пояска до антапекса. Поверхность
покрыта тонкой текой, разделенной на еле видимые
пластинки. Многочисленные хлоропласты располо-
жены радиально. Неподвижные клетки шаровидные,
окруженные несколькими слоями слизи, без борозд и
текальных пластинок, с многочисленными хлоропла-
стами, иногда с капельками красного пигмента. Форма
колоний варьирует. Известно 1-3 пресноводных вида.
Типовой вид: Н. nasutum Stein 1878.
Род Hypnodinium Klebs 1912
Клетки шаровидные, 72-122 мкм в диаметре. Хло-
ропласты многочисленные. Стигма пристенная. Вакуо-
лей несколько, расположенных вокруг ядра. Размноже-
ние посредством гимнодиниоидных клеток, имеющих
поясок, продольную борозду и стигму, но лишенных
жгутиков. Известен один пресноводный планктонный
вид.
Типовой вид://, sphaericum Klebs 1912.
74
DINOFLAGELLATA
Род Manchudinium Skvortzov 1972
Клетки обычно с внешним контуром в форме вось-
мерки, обрезанной с полюсов, реже другой формы,
30 мкм в длину. Цитоплазма гранулированная. Жгути-
ки, по-видимому, отсутствуют. Описан один пресно-
водный вид. Принадлежность к динофлагеллатам со-
мнительна.
Типовой в ид: М. sinicum Skvortzov 1972.
Кроме рода Manchudinium, отнесенного к Peridinieae (Skvor-
tzov, 1972а), Скворцов (Skvortzov, 1972b) приводит сведения о не-
которых родах, также отнесенных им к Pyrrophyta, в частности,
к семейству Gomesiamonadaceae, без указания надкласса и клас-
са. В более ранней работе род криптомонад Protocryptomonas
Skvortzov был отнесен к Pyrrophyta, Cryptomonadineae (Skvor-
tzov, 1969).
Новые роды: Guttula Skvortzov et Noda 1969 (типовой вид:
G. bacillariophaga Skvortzov et Noda 1969), Refractocystis Skvor-
tzov et Noda 1969 (типовой вид: R. pluvialis Skvortzov et Noda
1969), Gomesiamonas Skvortzov et Noda 1969 (типовой вид:
G. stagnalis Skvortzov et Noda 1969), Refractodes Skvortzov et
Noda 1969 (типовой вид: R. brasiliana Skvortzov et Noda 1969),
Oyemonas Skvortzov et Noda 1969 (типовой вид: О. pulsulae
Skvortzov et Noda 1969), Refractomonas Skvortzov et Noda 1969
(типовой вид: R. brasiliana Skvortzov et Noda 1969), Hortobaggi-
omonas Skvortzov et Noda 1969 (типовой вид: H. plicata Skvortz-
ov et Noda 1969), Trichocyanella Skvortzov et Noda 1969 (типовой
вид: T. spiralis Skvortzov et Noda 1969). Очевидно, упомянутые
роды и семейство, судя по морфологии клеток и тому факту, что
они не приведены ни в одной монографии, посвященной дино-
флагеллатам, не принадлежат к Dinoflagellata.
Род Spiniferodinium Horiguchi et Chihara 1987
Неподвижные клетки овальные, сжатые дорсовен-
трально, 25-36 мкм в длину, лежащие вентральной
стороной к субстрату, с дорсальной стороны покрытые
шиповатой раковинкой, одетой слизью. Поясок коль-
цевидный, экваториальный. Продольная борозда об-
разует выемку в антапикальной области. Хлоропласты
многочисленные, эллипсовидные. Цитоплазма с мно-
жеством гранул крахмала различной величины. Ядро
сферическое, расположено в эпиконе. Стигма отсут-
ствует. Бесполое размножение овальными зооспорами
с небольшим апикальным вздутием. Они имеют выем-
ку в области антапекса, кольцевидный экваториальный
поясок и узкую продольную бороздку от апекса до ан-
тапекса. Тека не разделена на пластинки, общая орга-
низация клетки зооспор, как у неподвижных стадий.
Описан один морской псаммофильный вид из субтро-
пических вод Пацифики.
Типовой в и д: S. galeiforme Horiguchi et Chihara
1987.
Род Stylodinium Klebs 1912
Син.: IDinopodiella Pascher 1944.
Клетки шаровидные или овальные, 20-100 мкм,
прикрепляющиеся с помощью ножки с базальным дис-
ком, выходящей из апикальной поры. Поясок нисходя-
щий, неполный, экваториальный. Продольная борозда
не заметна. У прикрепленной стадии жгутики не на-
блюдались. Хлоропласты имеются или отсутствуют.
Споры гимнодиниоидного, перидиниоидного или аме-
боидного типа. Жизненный цикл типового вида деталь-
но описан (Popovsky, Pfiester, 1990). Для одного мор-
ского вида известна формула теки: Ро, 5', 2а, 7", X, 5с,
6s, 5'", Ip, Г'" (Horiguchi, Chihara, 1983). Большинство
видов Stylodinium населяет пресные воды. Из морских
местообитаний известно 2 вида, один — паразитирую-
щий на сифонофорах, другой — псаммофильный.
Типовой вид: У globosum Klebs 1912.
Род Tetradinium Klebs 1912
Клетки треугольные или четырехугольные, с 3^1
шипами на каждом углу, с ножкой (стебельком) или без
нее. Хлоропласты многочисленные, в форме овальных
дисков. Размножение посредством гимнодиниоидных
спор (2 на клетку). Известно 2 или более пресноводных
планкто-бентосных видов.
Типовой вид: Т. javanicum Klebs 1912.
Сем. Dinocloniaceae Pascher 1931
Представители Phytodiniales, в жизненном цикле
которых доминирует нитчатая стадия.
Фотосинтезирующие современные морские виды.
Род Dinoclonium Pascher 1927
Клетки 5-15 мкм, объединенные в разделяющиеся
надвое нити, утончающиеся к концам. Споры гимноди-
ниоидного типа, 8-12 мкм. Хлоропласты многочислен-
ные. Описан один морской вид, обитающий на водо-
рослях.
Типовой вид:/), paradoxa Pascher 1914.
Род Dinothrix Pascher 1914
(рис. 1, Н)
Клетки 12-20 мкм, объединенные в ветвящиеся
нити, состоящие, вероятно, не более чем из 10 клеток.
Споры гимнодиниоидного типа, 8-15 мкм. Хлоропла-
сты многочисленные. Описан один морской вид, веро-
ятно, эпифитный.
Типовой вид:/), conradii Pascher 1927.
Род Rufusiella Loeblich III 1967
Син.: ^Haematococcus C. Agardh 1828 (non Hae-
matococcus Flotow 1844); Ouracoccus (Hassall.) Lindley
1846; Urococcus Kutzing 1849, partim?
Клетки шаровидные, окруженные несколькими сло-
ями слизистого вещества, образующего с одной сторо-
ны более толстую оболочку. Размножение автоспорами
или зооидами гимнодиниоидного типа. В цитоплазме
находятся зерна крахмала и глобулы масла. Возможно
присутствие хлоропластов. Этот род, описанный из
пресных вод, также указан Кристенсеном (Christensen,
DINOFLAGELLATA
75
1975) для морских вод. Сурня (Soumia, 1986: 47) пред-
полагает, что он близок к Gloeodinium Klebs 1912, или
даже синонимичен ему
Типовой вид:/?, insignis (Hassall) Loeblich III
1967.
Сем. Gloeodiniaceae Pascher ex Schiller
1937
Представители Phytodiniales, жизненный цикл ко-
торых состоит из чередования коккоидной и жгутико-
вой стадий. Коккоидная стадия состоит из одной или
нескольких коккоидных клеток внутри общей слизи-
стой оболочки. Жгутиковая стадия представлена под-
вижными двужгутиковыми клетками.
Род Gloeodinium Klebs 1912
Син.: Urococcus Ktitzing 1849, partim?; IGlenodini-
opsis Woloszynska 1916, partim.
Жизненный цикл состоит из чередования коккоид-
ной и жгутиковой стадий. Клетки коккоидной стадии
(называемые вегетативными цистами) неподвижные,
шаровидные, 11-28 мкм в диаметре, делятся путем
продольного деления надвое, в результате чего клетки
(не более 4) остаются внутри общей слизистой обо-
лочки. Во время деления каждая клетка образует свою
оболочку и затем еще несколько, переходя в пальмел-
левидное состояние. Периодически образующиеся из
вегетативных цист «бродяжки» (подвижные двужгу-
тиковые зооспоры или гаметы, покрытые текальными
пластинками типа Hemidinium), группами по две или
четыре клетки, превращаются в цисты (гипноспоры),
менее 18-20 мкм в длину. Эндосимбиотический вид
G. viscum Banaszak, Iglesias-Prieto et Trench не имеет
трихоцист (Banaszak et al., 1993). Известно около че-
тырех пресноводных и морских видов, включая один
эндосимбиотический. Описан жизненный цикл беспо-
лого размножения (Kelley, Pfiester, 1989). Додж (Dodge,
1984) и Тэйлор (Taylor, 1987) считают род Gloeodinium
синонимичным роду Hemidinium Stein 1883.
Типовой в и д: G. montanum Klebs 1912.
Порядок Thoracosphaerales Tangen
in Tangen, Brand, Blackwelder et Guillard
1982
Свободноживущие динофициевые, у которых до-
минирующей стадией жизненного цикла является кок-
коидная клетка с непрерывной известковой внешней
стенкой. Подвижная стадия лишена теки.
Сем. Thoracosphaeraceae Schiller 1930,
emend. Tangen 1982 (в: Tangen et al. 1982)
Характеристики те же, что для порядка Thoraco-
sphaerales.
Современные виды морские, океанические, фото-
синтезирующие, обитающие в умеренных и теплых
водах. Предполагают, что ископаемые формы извест-
ны с триаса или ранее. До 1970-х годов представители
семейства классифицировались как кокколитофориды
или incertae sedis.
Род Thoracosphaera Kamptner 1927
Клетки (вегетативные) шаровидные, 10^45 мкм в
диаметре. Тека известковая, пористая. Хлоропласты
многочисленные, часто соединенные между собой. Ис-
копаемые виды известны преимущественно из мелово-
го периода, как из проб донных осадков, так и план-
ктонных. Известно несколько современных морских
планктонных видов.
Типовой в и д: Гheimii(Lohmann)Kamptner 1927.
Dinophyceae incertae sedis
Род Pileidinium Tamura et Horiguchi 2005
Клетки овальные, сжатые дорсовентрально, 14-
26 мкм в длину. Поясок неполный, сильно сдвинут впе-
ред. Гипотека намного больше эпитеки. Формула теки:
Г, 5", 4с, 4s, 5"', Г'". Хлоропласт один, снабженный
пиреноидом. Известен один псаммофильный вид из
тропической зоны.
Типовой вид:/? ciceropse Tamura et Horiguchi
2005.
Род Pseliodinium Sournia 1972
Клетки в виде браслета, тело клетки овальное,
18-30 мкм в диаметре, с 2 длинными рукообразными
выростами, превышающими длину клетки почти в 2
раза; одиночные или соединенные попарно. Поясок
экваториальный. Поверхность клетки не разделена на
пластинки. Хлоропласты отсутствуют. Описан один
морской вид из тропических вод.
Типовой вид:/? vaubanii Soumia 1972.
Род Tintinnophagus Coats 2010
(в: Coats et al., 2010)
(согласно статье 36.2 МКБН (2006), незаконное название,
так как отсутствует латинский диагноз)
Клетки диноконтного типа, с 2 жгутиками, 13-
16 мкм в длину, с заостренным эпиконом и шишко-
видной структурой на апексе, с глазным пятном у ос-
нования жгутиков. Эпитека длиннее гипотеки. Поясок
нисходящий. Трофонт варьирует по размеру в зависи-
мости от возраста, лишен жгутиков, хлоропластов и по-
яска. Питается путем мизоцитоза, размножается путем
палинтомического спорогенеза. Эктопаразит реснич-
ных инфузорий рода Tintinnopsis Stein. Описан один вид
из прибрежных умеренных вод западной Атлантики.
Типовой вид: Г acutus Coats 2010 (в: Coats et
al., 2010).
76
DINOFLAGELLATA
Род Zoorhabdella Rhumbler 1909
См. ниже (род Zooxanthella Brandt).
Род Zooxanthella Brandt 1881
В современной литературе большинство авторов счи-
тает это название синонимом Symbiodinium Freudenthal
1962. Леблич и Шерли (Loeblich III, Sherley, 1979) счи-
тают типовой вид рода Symbiodinium, S. microadriaticum,
принадлежащим к роду Zooxanthella. Однако следует
добавить, что в группу родов зооксантелл, кроме двух
упомянутых названий, включают еще четыре (Loeblich
Jr., Loeblich III, 1966): Philozoon Geddes 1882 (типовой
вид: P medusarum Geddes 1882; вид-хозяин Cotylorhiza
tuberculata (Macri) (Cnidaria: Scyphozoa)); Zoorhabdella
Rhumbler, 1909 (типовой вид: Z. truncatulinae Rhumbler
1909; вид-хозяин Truncatulina lobatula (Walker et Jacob)
(Foraminifera)); Chrysidella Pascher 1911 (незаконное на-
звание, согласно МКБН); Endodinium Hovasse 1922 (ти-
повой вид: Е. chattonii Hovasse 1922; вид-хозяин Velella
velella (L.) (Cnidaria: Hydrozoa)). К сожалению, авторы
всех родов, установленных после Zooxanthella, описы-
вали их лишь на основании морфологии коккоидных
клеток и не приводили различий между своими и ранее
описанными родами (Loeblich III, Sherley, 1979). Клетки
зооксантелл 6-12 мкм.
Типовой вид: Z. nutricula Brandt 1881 (вид-
хозяин Collozoum inerme (O.F. Muller) (Radiolaria)).
Класс BLASTODINIPHYCEAE Fensome,
Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Паразитические динофлагеллаты, имеющие дино-
карион лишь на протяжении определенной части жиз-
ненного цикла. Клетки не сильно вакуолированные.
Порядок Blastodiniales Chatton 1906
Характеристики те же, что для класса Blastodini-
phyceae.
Сем. Blastodiniaceae Cavers 1913
Представители Blastodiniales с неприкрепляющей-
ся паразитической стадией.
Фотосинтезирующие современные морские виды,
паразитирующие в пищеварительном тракте копепод.
Род Blastodinium Chatton 1906
Жизненный цикл состоит из стадии трофонта 200-
700 мкм в длину и образующихся в них диноспор 10-
13 мкм в длину. Диноспора, попадающая в организм
науплиуса или ранней копеподитной стадии, инфи-
цирует хозяина и превращается в большой трофоцит,
который делится на вторичный трофоцит и гоноцит.
Гоноцит претерпевает множественное деление и об-
разует первичные, вторичные и третичные спороциты.
Каждое поколение спороцитов окружено кутикулой.
Незрелые спороциты удаляются из организма с фека-
лиями и превращаются в зрелые диноспоры, которые
вскоре инцистируются. Диноспоры имеют теку пери-
диниоидного типа; формула теки: Ро, X, 4', За, 6", (t),
4-5/6с, ?s, 4/5'", 2"" (Skovgaard et al., 2007; Skovgaard,
Salomonsen, 2009). Трофоциты имеют хлоропласты.
Известно приблизительно 14 эндопаразитических ви-
дов, обитающих в морских планктонных каляноидных
копеподах. Обобщенный жизненный цикл видов Blas-
todinium представлен в работе Шилдса (Shields, 1994).
Типовой вид: В. pruvotii Chatton 1906.
Сем. Protoodiniaceae J. Cachon 1964
Представители Blastodiniales с прикрепляющейся
паразитической стадией, имеющей типичную морфо-
логию динофлагеллат: отчетливо развитые попереч-
ную и продольную борозды и жгутики.
Фотосинтезирующие современные морские виды,
паразитирующие на гидромедузах, сифонофорах и,
возможно, молоди рыб.
Род Protoodinium Hovasse 1935 (рис. 1, /7)
NonProtodinium Lohmann 1908, emend. Schiller 1928.
Клетки овальные или яйцевидные, более 40 мкм в
длину. Поясок кольцевидный или слегка нисходящий.
Хлоропласты и стигма присутствуют. Встречаются му-
коцисты и трихоцисты. В центре клетки, с вентраль-
ной стороны, находится подвижный вырост, служащий
для прикрепления и питания. Прикрепленный трофонт
превращается в спороцит, который образует много-
численные диноспоры. Жизненный цикл включает не-
сколько стадий бесполого размножения (спорогенез),
половое размножение неизвестно. Описан один или
более морских видов.
Типовой вид: Р chattoni Hovasse 1935.
Сем. Oodiniaceae Chatton 1920
Представители Blastodiniales, у которых паразити-
ческая стадия лишена типичной морфологии динофла-
геллат. Спорогенез происходит посредством палинто-
мии. Цисты отсутствуют.
Современные нефотосинтезирующие, преимуще-
ственно морские виды, паразитирующие на круглых
червях, аппендикуляриях и рыбах.
Род Oodinium Chatton 1912
Син.: Gymnodinium Schutt 1895, partim.
Экзопаразиты пелагических животных. Клетки
яйцевидные или шаровидные, 150-200 мкм в длину,
прикрепленные к хозяину посредством короткой нож-
ки, которая имеет волокнистую структуру. Борозды и
DINOFLAGELLATA
77
жгутики отсутствуют. Ядро крупное. Размножение осу-
ществляется диноспорами, образованными в результа-
те множественного деления на равные части тела не-
прикрепленной клетки. Известно 3 или более морских
видов.
Типовой вид: О. pouchetii Lemmerman 1899.
Род Bargoniella Loeblich Jr. et Tappan 1961
Типовой вид: В. amylacea (Bargoni) Loeblich Jr.
et Tappan 1961.
Род Caryotoma Hollande in Hollande
et Cachon-Enjumet 1953
Внутриядерные паразиты радиолярий.
Типовой вид: С. bernardi Hollande in Hollande et
Cachon-Enjumet 1953.
Род Crepidoodinium Lom et Lawler 1981
(в: Lom, 1981)
Син.: Oodinium Chatton 1912, partim.
Паразиты, живущие на жабрах морских и эстуар-
ных рыб. Питание преимущественно или исключи-
тельно фототрофное. Могут быть эктокоменсалами.
Типовой вид: С. cyprinodontum (Lawler) Lom
1981.
Род Piscinoodinium Lom 1981
Син.: Oodinium Chatton 1912, partim.
Эктопаразиты пресноводных рыб.
Типовой вид: Р pillulare (Schaperclaus) Lom
1981.
Сем. Apodiniaceae Chatton 1920
Представители Blastodiniales, у которых паразити-
ческая стадия прикрепляется посредством стебелька и
которые лишены типичной морфологии динофлагеллат.
Спорогенез происходит посредством палиспорогенеза;
питание продолжается во время спорогенеза, который
не приводит к образованию лентовидной многоклеточ-
ной стадии.
Нефотосинтезирующие паразиты аппендикулярий.
PonApodinium Chatton 1907
Non Apodinium Paulsen 1911.
Экзопаразит планктонных аппендикулярий. Клетки
спор шаровидные, около 10 мкм в диаметре, с толстой
стенкой и длинной ножкой, напоминающей мицелий
грибов. Имеется большая вакуоль в центре клетки. Ци-
топлазма довольно гомогенная. Ножка без ризоидов,
60-200 мкм в длину, 2-6 мкм в диаметре, слегка утол-
щенная у места прикрепления. По мере увеличения
клетки в объеме до 50-60 мкм, происходят изменения
формы (становится грушевидной) и структуры. Споро-
генез происходит в форме палиспорогенеза. Известно
4-5 морских видов.
Типовой в и д: Л. mycetoides Chatton 1907.
Сем. Cachonellaceae Р.С. Silva 1980
Представители Blastodiniales, имеющие в жизнен-
ном цикле 2 или более последовательные, независимые
друг от друга, стадии вегетативных цист в жизненном
цикле. Паразитическая стадия прикрепляющаяся и мо-
жет лишь изначально напоминать типичную динофла-
геллату. Спорогенез происходит посредством палинто-
мии.
Нефотосинтезирующие морские паразиты, обита-
ющие на яйцах копепод и аппендикуляриях.
Род Cachonella Rose et J. Cachon 1952
(рис. 36, 3)
Син.: Diplomorpha Rose et J. Cachon 1951 (non Di-
plomorpha Ancey 1884 (Mollusca).
Типовой вид: C. paradoxa (Rose et J. Cachon)
Rose et J. Cachon 1952.
Род Dissodinium Klebs in Pascher 1916,
emend. Elbrachter et Drebes 1978
Син.: Pyrocystis Murray 1885 ex Haeckel 1890, par-
tim, emend. Elbrachter et Drebes 1978; Gymnodinium
Schutt 1895, partim.
Эктопаразиты на яйцах ракообразных. Бесполое
размножение осуществляется посредством спороге-
неза, обязательным чередованием первичных и вто-
ричных цист, формированием планоспор (диноспор).
Первичные цисты шаровидные, с большой пищева-
рительной вакуолей. Ядро сферическое. Хлоропласты
имеются или отсутствуют. Внутри клеточной стенки
первичной цисты протопласт претерпевает повторное
деление надвое (палинтомия) на 2, 4, 8, 16 или более
вторичных цист. Вторичные цисты образуют 5-16 и бо-
лее (редко меньше 5) диноспор. Диноспоры маленькие,
гимнодиниоидного типа, двужгутиковые, лишенные
теки; они прикрепляются к хозяину, теряют подвиж-
ность и образуют сосущую органеллу. Далее следует
гипертрофический рост за счет фаготрофии. Фаза ро-
ста заканчивается формированием первичной цисты.
Спорогенез начинается много времени спустя после
завершения процесса питания. Известно два морских
вида с планктонными цистами (первичными и вторич-
ными), циклы бесполого размножения которых под-
робно описаны (Elbrachter, Drebes, 1978; Коновалова,
2007; Gomez et al., 2009b).
Типовой вид:/), pseudolunula Swift 1973, ex
Elbrachter et Drebes 1978.
Сем. Haplozoaceae Chatton 1920
Лентовидные, многоклеточные представители Bla-
stodiniales, у которых паразитическая стадия прикреп-
78
DINOFLAGELLATA
ляющаяся и лишена типичной внешней морфологии
динофлагеллат. Диноспоры образуются посредством
палиспорогенеза.
Нефотосинтезирующие морские паразиты, обита-
ющие внутри аппендикулярий и круглых червей.
Род Haplozoon Dogiel 1906
Клетка молодого паразита веретеновидная, одно-
ядерная, 35^40 мкм в длину, прикрепляется к стенке
кишечника полихеты с помощью присасывательной
органеллы и длинных псевдоподий. После этого она
делится на головную клетку (трофоцит) и заднюю (го-
ноцит), которая путем периодических поперечных или
косых по отношению к продольной оси колонии деле-
ний формирует на заднем конце спороциты. Деление
обычно происходит по двум направлениям, реже по
трем, в результате чего колония увеличивается в раз-
мере, до 200-350 мкм. Спороциты с хоботовидным
образованием, несущим один или несколько игловид-
ных стилетов, которые проникают в ткань хозяина, и
комплексом фибрилл (мионем), с помощью которых
стилеты могут втягиваться обратно. Часто имеются
многочисленные запасные стилеты. В результате по-
следовательных делений ядра один спороцит может
содержать 4 или более ядер. Зрелые спороциты отделя-
ются от колонии и инцистируются. В них образуются
по 2-А гимнодиниоидных клетки, которые в дальней-
шем инфицируют организм хозяина. Иногда размно-
жение осуществляется почкованием. Известно 6 или
более морских видов.
Типовой вид://, armatum Dogiel 1906.
Род Myxodinium J. Cachon, Cachon-Enjumet
et Bouquaheux 1970
Типовой в и д: М. pipiens J. Cachon, Cachon-En-
jumet et Bouquaheux 1970.
Род Oodinioides Reichenbach-Klinke 1970
Эктопаразиты пресноводных рыб.
Типовой вид: О. vastador Reichenbach-Klinke
1970.
Род Schizodinium Chatton 1912
Клетки почти шаровидные, с очень тонкой и глад-
кой текой, 20-50 мкм в диаметре. Хлоропласты и пи-
реноиды имеются. Клетки делятся надвое в экватори-
альной плоскости. Паразитируют в желудке копепод
надотряда Podoplea. Известен, по крайней мере, один
вид.
Типовой вид: S. sparsum Chatton 1912.
Класс NOCTILUCIPHYCEAE Fensome,
Taylor, Norris, Sarjeant,
Wharton et Williams 1993
Паразитические динофлагеллаты, имеющие дино-
карион на протяжении лишь определенной части жиз-
ненного цикла. Основная стадия жизненного цикла
представлена крупной, сильно вакуолизированной сво-
бодноживущей подвижной клеткой.
Blastodiniales incertae sedis
PoRActinodinium Chatton et Hovasse 1937
Типовой вид: A apsteinii Chatton et Hovasse
1937.
Род Chytriodinium Chatton 1912
Син.: Gymnodinium Schutt 1895, partim; Diplodi-
nium Klebs 1912 (non Diplodinium Schuberg 1888, nec
Fiorentini 1890).
Клетки трофонта шаровидные, 50-80 мкм в диа-
метре. Спорогенез происходит в форме палиспороге-
неза. Образовавшиеся диноспоры гимнодиниоидного
типа выходят в виде одиночных клеток 9 мкм в длину и
расселяются в водной толще. Диноспоры инфицируют
хозяина, прикрепляясь к нему гипоконом с помощью
трубковидной ножки с диском, и трансформируются в
трофонт. Известно 3 или более морских видов, парази-
тирующих на яйцах копепод. Жизненные циклы двух
видов подробно рассмотрены в литературе (Dogiel,
1906; Chatton, 1920; J. Cachon, M. Cachon, 1987; Shields,
1994; Gomez et al., 2009b).
Типовой в и д: С. roseum Dogiel 1906.
Порядок Noctilucales Haeckel 1894
Характеристики те же, что для класса Noctiluciphy-
сеае.
Сем. Noctilucaceae Saville-Kent 1881
Представители Noctilucales, у которых основная
стадия жизненного цикла в виде сильно вакуолизиро-
ванной подвижной клетки с одним жгутиком и хорошо
выраженным гибким щупальцем. Внеклеточный эпи-
сомальный купол отсутствует.
Свободноживущие нефотосинтезирующие мор-
ские виды.
Род Noctiluca Suriray 1816 (в: Lamarck, 1816)
(рис. 1,Р; 29)
Клетки шаровидные или овальные, их форма ва-
рьирует в зависимости от стадии жизненного цикла,
200-2000 мкм в диаметре. Эпитека практически от-
сутствует. Поясок неполный, плохо различимый. Про-
дольная борозда, по-видимому, присутствует в виде
короткого, широкого и глубокого впячивания, рас-
положенного между щупальцем и ротовой областью.
DINOFLAGELLATA
79
Жгутик один (вероятно, продольный), короткий, слу-
жит, по-видимому, для питания. Сложно устроенная
ротовая область имеет цитостом и стилет. Щупальце
поперечно-исчерченное, покрытое многочисленными
мукоцистами, на конце в виде лопатки, служащей для
захвата пищи. Вакуоль крупная, находится в центре
клетки. В цитоплазме расположено ядро с неконден-
сированными хромосомами и капельки липидов. На
поверхности клетки можно различить гексагональные
пластинки с порами. Трихоцисты имеются. Хлоропла-
сты отсутствуют, иногда можно обнаружить хлоропла-
сты эндосимбиотических водорослей. Известен один
биолюминесцирующий морской планктонный вид.
Типовой в и д: TV. miliaris Lamarck 1816.
Сем. Kofoidiniaceae Taylor 1976
Представители Noctilucales, у которых основная
стадия жизненного цикла в виде вакуолизированной
двужгутиковой подвижной клетки, на эписоме кото-
рой у зрелых индивидуумов имеется дисковидный или
полусферический внеклеточный купол (капсула). Щу-
пальце имеется или отсутствует.
Свободноживущие нефотосинтезирующие мор-
ские виды.
Род Kofoidinium Pavillard 1928
Форма клетки варьирует в зависимости от стадии
жизненного цикла, 100-800 мкм. Эпитека редуциро-
вана. Поясок полный. Продольная борозда развита,
заходит на дорсальную сторону в виде двух дуг, пер-
пендикулярных друг к другу и поддерживающих ши-
рокий мембрановидный вырост (велюм). Мукоцисты
расположены по краю велюма. Капсула полушаро-
видная, прозрачная, с тонкой сеточкой, прикреплена
к клетке в двух местах. Известно несколько стадий в
виде гимнодиниоидных спор. Морфологические из-
менения клеток в течение жизненного цикла детально
описаны (J. Cachon, М. Cachon, 1968b). Хлоропласты
отсутствуют, иногда можно обнаружить эндосимбио-
тические водоросли. Описано 3^4 морских планктон-
ных вида.
Типовой вид: К. velelloides Pavillard 1928.
Род Pomatodinium J. Cachon
et Cachon-Enjumet 1966
Клетки по внешнему виду напоминают брюхоного-
го моллюска, 90-200 мкм. Эпитека редуцирована, вы-
пуклая. Поясок полный. Продольная борозда опоясы-
вает всю гипотеку. Жгутиков два. Половина гипотеки
(предположительно, левая) вздута в виде большой ло-
пасти. Капсула полушаровидная, тонкая, ареолирован-
ная, прикреплена к продольной борозде в двух местах
крючковидными выростами. Клетка может сокращать-
ся посредством длинных миофибрилл. Известна одна
гимнодиниоидная стадия. Описан один морской планк-
тонный вид.
Типовой в и д: 7^ impatiens J. Cachon et Cachon-
Enjumet 1966.
Род Spatulodinium J. Cachon et M. Cachon
1967
Син.: Gymnodinium Stein 1878, partim.
Клетки дисковидные, около 100 мкм в диаметре, с
длинным трубковидным подвижным выростом в виде
щупальца. Эпитека сильно редуцирована. Поясок в
виде двух неравных параллельных ветвей. Продольная
борозда развита. Жгутиков два. Капсула полушаровид-
ная, прикрывает гипотеку, не прикрепляясь к ней. Из-
вестны гимнодиниоидные стадии. Морфологические
изменения клеток в течение жизненного цикла деталь-
но описаны (Gomez, Souissi, 2007). Известен один мор-
ской планктонный вид из субтропических и умеренных
вод.
Типовой вид: S'.pseudonoctiluca (Pouchet) J. Ca-
chon et M. Cachon 1967.
Сем. Leptodiscaceae Taylor 1976
Представители Noctilucales, у которых домини-
рующая стадия жизненного цикла в виде подвижной
клетки, ширина которой значительно увеличена за счет
апикально-антапикального сжатия или наличия крыло-
видного выроста. Щупальце и эписомальный внекле-
точный купол (капсула) не развиты.
Свободноживущие нефотосинтезирующие мор-
ские виды.
Род Leptodiscus Hertwig 1877 (рис. 1, Ф)
Син.: IClipeodinium Pascher 1917; IPratjetella
Lohmann 1919.
Клетки дисковидные, уплощенные, более тонкие
к периферии, медузоподобные, прозрачные и чрез-
вычайно нежные, 600-2000 мкм в диаметре. Жгутик
один, лентовидный, другой рудиментарный или отсут-
ствует. Цитостом конической формы, открывается на
верхней стороне клетки. Цитоплазма разделена на две
зоны, центральную с радиальной сеточкой и перифе-
рическую сетчатую. Хлоропласты отсутствуют, трихо-
цисты, по-видимому, тоже. Споры гимнодиниоидного
типа. Морфологические изменения клеток в течение
жизненного цикла детально описаны в литературе
(J. Cachon, М. Cachon, 1969). Известен один морской
вид из Средиземного моря и других районов Атланти-
ки, хотя Сурня (Soumia, 1986: 53) не исключает воз-
можности, что организмы с описанной морфологией
или сходной к ней представлены тремя родами.
Типовой в и д: L. medusoides Hertwig 1877.
PonAbedinium Loeblich Jr. et Loeblich III 1966
Син.: Leptophyllus J. Cachon et Cachon-Enjumet
1964.
80
DINOFLAGELLATA
Клетки удлиненно-овальные, 260 мкм в длину, по-
степенно расширяющиеся кзади, с прямыми боковыми
сторонами и широко округлой задней частью, снаб-
женные щупальцевидным подвижным, но не сокра-
щающимся выростом. Жгутиков два, один из которых
служит в качестве оси в щупальце. Миофибриллы рас-
положены несколькими группами. Трихоцисты и муко-
цисты имеются. Известен один морской вид из Среди-
земного моря.
Типовой вид: Л. dasypus (J. Cachon et Cachon-
Enjumet) Loeblich Jr. et Loeblich III 1966.
Род Cachonodinium Loeblich III 1980
Син.: Leptodinium J. Cachon et Cachon-Enjumet
1969.
Клетки крайне уплощенные, почти прямоугольные,
600 мкм в длину, 450 мкм в ширину, 8 мкм в высоту
(в центре), с 5 широкими лопастями. Апекс с коротким
выростом в виде щупальца. Поясок и продольная бо-
розда, по-видимому, отсутствуют. Жгутик один. Вну-
три клетки заметна сеточка в виде паутинки, по пери-
ферии которой проходит утолщенная каёмка. Клетка
совершает ундулирующие движения, подобно турбел-
лярии. Трихоцисты и хлороплаёты отсутствуют. Изве-
стен один морской вид из Средиземного моря.
Типовой вид: С. caudatum (J. Cachon etCachon-
Enjumet), Loeblich III 1980.
Род Craspedotella Kofoid 1905
Клетки в виде шляпы, уплощенные, слегка более
тонкие к периферии, 100-180 мкм в диаметре, с гори-
зонтальным велюмом внутри и верхней приподнятой
частью (предположительно, эпитека). Поясок и про-
дольная борозда, по-видимому, отсутствуют. Жгутик
один. Цитостом открывается на нижней стороне клет-
ки. Цитоплазма с фибриллами и линейно расположен-
ными сериями гранул. Движение клеток напоминает
движение медуз. Хлоропласты, по-видимому, отсут-
ствуют. Известен один морской вид из Средиземного
моря и тропической Пацифики.
Типовой вид: С. pileotus Kofoid 1905.
Род Cymbodinium J. Cachon et M. Cachon 1967
(рис. 1, У)
Клетки овальные или шаровидные, около 200 мкм
в диаметре, со своеобразным капюшоном (велюмом)
сверху (общий размер клеток приблизительно 500 мкм),
внешне напоминающие личинки пелагических мол-
люсков. Эпитека сильно редуцирована. Поясок перед-
ний, неполный. Продольная борозда развита. Жгутик,
по-видимому, один (предположительно, поперечный).
Велюм сокращающийся, прикреплен непосредственно
под пояском, с левой вентральной стороны снабжен ло-
пастью. Хлоропласты отсутствуют. Известен один мор-
ской вид из Средиземного моря.
Типовой вид: С. elegans J. Cachon et et M. Ca-
chon 1967.
Род Petalodinium J. Cachon et M. Cachon
1969
Клетки по форме напоминают Gyrodinium, утонча-
ющиеся к концам, без выростов, 230-500 мкм в дли-
ну. Жгутиков два. Поверхность (оболочка) образована
миофибриллами. Известен один морской вид из Среди-
земного моря.
Типовой в и д: Р porcelio J. Cachon et et M. Ca-
chon 1969.
Род Scaphodinium Margalef 1963
Син.: Leptospathium J. Cachon et Cachon-Enjumet
1964.
Клетки в целом удлиненно-овальные, 160^450 мкм
в длину, постепенно расширяющиеся к одному из кон-
цов, с 2 выростами (апикальным и антапикальным),
один из которых двулопастной и более короткий, а дру-
гой в виде круглой ножки. Жгутиков два. Цитоплазма
гомогенная, с сеточкой микрофибрилл. Трихоцисты и
хлоропласты отсутствуют. Известен один морской вид
из Средиземного моря.
Типовой вид: S', mirabile Margalef 1963.
Dinokaryota incertae sedis
Род Agrosphaera Lo Bianco 1903
Типовой вид: A pellucida Lo Bianco 1903.
Род Geodinium Chodat 1921
Типовой вид: 6. terrestre Chodat 1921.
Род Gleba Bruguiere 1791
Non Gleba Forskal 1776, nec Tilesius 1814, nec Otto
1823.
Тип не указан.
Род Glenoaulax Diesing 1866
Типовой в и д: 6. inaequalis Diesing 1866.
Род Halophilodinium Loeblich Jr. et Loeblich III
1966
Син.: Haematodmium Schiller 1956.
Типовой в ид: Я gessneri Loeblich Jr. et Loeblich
III 1966.
Род Parapodinium Chatton 1920
Клетки грушевидные, до 60 мкм в длину, с корот-
кой ножкой и диском, при помощи которых они при-
крепляются к хозяину. Известен 1 морской вид, парази-
тирующий на покровах аппендикулярий.
Типовой в и д: Р stylipes Chatton 1920.
DINOFLAGELLATA
81-
Род Proaa/ax Diesing 1866
С и н.: Peridinium Ehrenberg 1832, partim.
Типовой в и д: Р. corpusculum (Perty) Diesing 1866.
Род Pterocystis Lohmann 1904
Син.: Pterosphaera Jorgensen 1900, partim.
Предположительно, циста динофлагеллат.
Типовой вид: Р vanhoeffenii (Jorgensen) Loh-
mann 1904.
Род Radiozoum Mingazzini 1904
Типовой вид: A. lobatum Mingazzini 1904.
Подтип Syndinea (Corliss) Fensome,
Taylor, Norris, Sarjeant, Wharton et
Williams 1993
Паразитические динофлагеллаты co сложным жиз-
ненным циклом, у которых только подвижные ста-
дии бесполого и полового размножения (диноспоры
и гаметы) несут черты типа: пелликулу, диноконтное
расположение жгутиков, продольную и поперечную
борозды. Трофонты обычно многоядерные, как внутри-
клеточные, так и полостные. Ядро содержит гистоны.
Класс SYNDINIOPHYCEAE Loeblich III
1976
Характеристики те же, что для подтипа Syndinea.
Порядок Syndiniales Loeblich III 1976
Характеристики те же, что для подтипа Syndinea.
Gyrodinium, 8-15 мкм в длину, формируются перед вы-
ходом их хозяина; различают микроспоры, макроспо-
ры и споры с рострумом. Известно 3 внутриполостных
паразитических вида, обитающих в морских планктон-
ных каляноидных копеподах. Обобщенный жизнен-
ный цикл типового вида представлен в работе Шилдса
(Shields, 1994).
Типовой вид: S. turbo Chatton 1910.
Род Hematodinium Chatton et Poisson 1930
Non Haematodinium Schiller 1956.
Жизненный цикл включает стадии трофонта, спо-
ронта, споробласты, жгутиковые микро- и макроспоры.
Трофонт изначально червеобразный, нитчатый, с не-
сколькими ядрами, трансформируется последователь-
но в многолучевую колонию трофонтов (многоядерный
плазмодий), паукообразный трофонт и паукообразный
споронт, образующий споробласты. Посредством
спорогенеза споробласты дают начало микро- и ма-
кроспорам. Известен ряд видов, паразитирующих на
бентосных ракообразных (крабах, лангустах и амфи-
подах). Описаны жизненный цикл in vitro (Stentifords,
Shields, 2005) и обобщенный цикл видов Hematodinium
(Shields, 1994).
Типовой вид: Я. perezi Chatton et Poisson 1930.
Род Ichthyodinium Hollande et J. Cachon 1952
Типовой вид:/, chabelardi Hollande et J. Cachon
1952.
Род Merodinium Chatton 1923
Типовой вид: M. dolosum Chatton 1923.
Род Solenodinium (Chatton) Chatton 1938
Типовой вид: 5. fallax (Chatton) Chatton 1938.
Сем. Syndiniaceae Chatton 1920
Представители Syndiniales, у которых трофонт
(трофоцит, или трофомер) представлен многоядерным
плазмодием неопределенной формы, без полостей.
Морские виды, паразитирующие во внутренних по-
лостях копепод и аппендикулярий, гемолимфе крабов,
цитоплазме и ядре радиолярий, яйцах копепод и сар-
динах.
Род Syndinium Chatton 1910
Син.: Cochlosyndinium Chatton 1952; Synhemidinium
Chatton 1952.
Клетки в виде сферического плазмодия, до 20-
30 мкм в диаметре, содержащего 5-6 ядер. При росте
количество ядер увеличивается. Спорообразование
путем фрагментации плазмодия. Диноспоры типа
Род Trypanodinium Chatton 1912
Известен один морской вид, паразитирующий на
яйцах планктонных копепод и описанный исключи-
тельно по диноспорам.
Типовой вид: Т. ovicola Chatton 1912.
Сем. Amoebophryaceae J. Cachon, 1964
ex Loeblich III 1970
Представители Syndiniales, у которых высокоор-
ганизованный многоядерный трофонт вначале разви-
вается в форму с большой полостью в виде пчелиного
улья (мастигоцель) с узким отверстием, а затем, выходя
из хозяина, выворачивается наизнанку, превращаясь в
червеобразную многожгутиковую плавающую особь.
Морские паразиты простейших, включая самих ди-
нофлагеллат (обычно родов Ceratium к Protoperidinium).
82
DINOFLAGELLATA
Род Amoebophrya Koeppen 1894
Син.: Hyalosaccus Koeppen 1903.
Двужгутиковые клетки прикрепляются к хозяину,
перфорируют мембрану и проникают в цитоплазму.
Внутри хозяина клетки трансформируются в много-
ядерный трофонт, причем эписома погружается в ги-
посому. Впоследствие трофонт становится многожгу-
тиковым и занимает большую часть клетки хозяина.
Известен, по крайней мере, 1 внутриклеточный па-
разитический вид, обитающий в других динофлагел-
латах планктонных родов Ceratium, Protoperidinium,
Gonyaulax, Akashiwo и других.
Типовой вид: Л. ceratii (Koeppen) J. Cachon
1964.
Сем. Sphaeriparaceae Loeblich III 1970
Представители Syndiniales, у которых многоядер-
ный трофонт имеет переднюю часть наподобие эпи-
сомы и задний базальный диск наподобие гипосомы,
разделенные резким перехватом.
Морские паразиты аппендикулярий и радиолярий.
Род Sphaeripara Poche 1911
Син.: Lohmannia Neresheimer 1903 (non Lohmannia
Michael 1898 (Arachnida).
Типовой вид: S. catenata (Neresheimer) Loeblich
Jr. et Loeblich III 1966.
Род Atlanticellodinium J. Cachon
et Cachon-Enjumet 1965
Типовой в и д: A. tregouboffi J. Cachon et Cachon-
Enjumet 1965.
Сем. Duboscquellaceae Chatton, 1920
ex Loeblich III 1970
Внутриклеточные паразиты, имеющие ядро, харак-
терное для Syndiniales. Трофонт одноядерный.
Морские паразиты инфузорий, радиолярий, аканта-
рий и динофлагеллат.
Род Duboscquella Chatton 1920
Син.: Gymnodinium Stein 1878, partim.
Клетки в виде яйцевидных или овальных тел, с
большим ядром (до 20 мкм). При делении образуют-
ся множественные спороциты, из которых выходят
двужгутиковые споры (вероятно, гаметы) с передним
пальцевидным узким концом. Жгутики выходят сбоку
из углубления, один из них направлен вперед, другой
завит вокруг переднего конца. Описан один вид, пара-
зитирующий в цитоплазме инфузорий тинтиннид.
Типовой в и д: D. tintinnicola (Lohmann) Chatton
1920.
Род Dogelodinium Loeblich Jr. et Loeblich III 1966
Син.: Collinella J. Cachon 1964 (non Collinella Sch-
midt 1879, nec Chatton et Perard 1919, nec Duda 1918, nec
Colinella Owen 1981).
Типовой вид:/), ovoides (J. Cachon) Loeblich Jr.
et Loeblich III 1966.
Род Duboscquodinium Grasse in Chatton 1952
Типовой вид: D. collini Grasse in Chatton 1952.
Род Keppenodinium Loeblich Jr. et Loeblich III
1966
Син.: Hollandella J. Cachon 1964.
Типовой в ид: К mycetoides (J. Cachon) Loeblich
Jr. et Loeblich III 1966.
Syndiniales incertae sedis
PonAtelodinium Chatton 1920
Клетки в виде плазмодиев. В результате деления
плазмодия образуются многочисленные яйцевидные
споры 6 мкм в длину, со спиральной бороздкой на
переднем конце, без продольной борозды. Ядра много-
численные. Известен один вид, паразитирующий во
внутренней полости морских каляноидных копепод.
Типовой вид: Л. microsporum Chatton 1920.
Dinoflagellata incertae sedis
Сем. Arpyloraceae Sarjeant 1978
Динофлагеллаты, у которых имеются 3 эписомаль-
ные серии пластинок и 2 гипосомальные серии. Архе-
опиль дизентеграционного типа, в который могут быть
вовлечены все пластинки кпереди от пресингулярной
серии.
Известны лишь ископаемые (Arpylorus} из поздне-
силурийских морских отложений.
SUMMARY
Dinoflagellates, mostly due to molecular studies, have been
unanimously placed into the clade Alveolata, together with the
ciliates and apicomplexans since the early 1980s. The same
molecular tools have been used to erect new dinoflagellate taxa
from species through families, although the tabulation pattern
remains the principal criterium for practicing scientists in their daily
routine work. The present chapter offers an extensive overview
of this taxonomic group. The history of classification systems of
DINOFLAGELLATA
83
dinoflagellates, the classification itself (the authors and the year of
publication of all the taxa are given; the exclusively fossil genera
are marked), the most important information on cell morphology,
physiology, biochemistry, reproduction and life cycles, ecology,
systematics and phylogeny are presented. Marine and freshwater
planktonic, benthic, endosymbiotic and parasitic dinoflagellates
are discussed separately, with emphasis on red tides and toxins.
Molecular data published in literature are reviewed in more detail to
show the advances in the phylogeny of dinoflagellates. A systematic
review, including the descriptions of all major taxa and nearly all
recent genera (14 orders, 63 families and 223 genera out of 253 in
total), is given according to the classification system of Fensome
et al. (1993), updated with 39 new genera and five families
established since 1993, under the International Code of Botanical
Nomenclature. A short morphological description with the plate
formula where appropriate, size variation, ability to produce resting
cysts and toxins, the data on species diversity and general ecology
(habitat), synonymy and the type species are given for 213 genera.
Two tables with the updated information on toxic species and their
toxins as well as on the dinoflagellate parasitic genera accompanied
with bibliographic references are presented. Twenty-four text-
figures and 16 tables of light and scanning electron microscope
photographs of both planktonic and benthic marine dinoflagellates
sampled in the European Arctic and the Gulf of Mexico are given.
The bibliography contains 499 titles of literary sources, including
nomenclatural catalogues and the most important literature
for identification of modem marine and freshwater, and fossil
dinoflagellate genera and species.
За предоставление необходимой литературы приношу благодарность своим коллегам, без чьей помощи эта работа оказалась бы
намного менее информативной: Энрике Балечу (Enrique Balech) и Андресу Болтовскому (Andres Boltovskoy) из Аргентины, Алану
Сурня (Alain Soumia) и Николасу Хомера (Nicolas Chomerat) из Франции, Джону Доджу (John D. Dodge) из Великобритании, Ричарду
Крофорду (Richard М. Crawford) и Линде Медлин (Linda К. Medlin), Моне Хоппенрат (Mona Hoppenrath), Мальте Эльбрехтеру (Malte
Elbrachter) и Йенсу Матиссену (Jens Matthiessen) из Германии, Карен Стейдингер (Karen A. Steidinger) из США, Бланке Перес-Гарсия
(Blanca Perez-Garcia), Исмаэлю Гарате-Лисаррага (Ismael Garate-Lizarraga), Марии Кларе Рамирес-Хауреги (М.С. Ramirez-Jauregui) и
Фани-дель-Кармен Мерино-Вирхилио (Fany del Carmen Merino-Virgilio) из Мексики, Зденеку Дюришу (Zdenek Duris) из Чешской Ре-
спублики, Мартину Хеду (Martin Head) и Хуану Сальдарриаге (Juan F. Saldarriaga) из Канады, Катерине Алигисаки (Katerina Aligizaki)
из Греции, А.Ф. Крахмальному из Украины, Е.А. Павштикс, Г.В. Коноваловой, М.С. Селиной, ТА. Могильниковой и С.А. Карпову
из России. Также благодарен Андресу Болтовскому, Мартину Хеду, Л.В. Ильяш и М.С. Селиной за ценные замечания, Марше Гауин
(Marcia М. Gowing) из США за проверку английского текста и Н.А. Околодковой за большую техническую помощь при подготовке
иллюстраций.
ЛИТЕРАТУРА
Возженникова Т.Ф. 1965. Введение в изучение ископаемых пери-
динеевых водорослей. М.: Наука. 156 с.
Возженникова Т.Ф. 1967. Ископаемые перидинеи юрских, мело-
вых и палеогеновых отложений СССР. М.: Наука. 223 с.
Евстигнеев П.В., Битюков Э.П., Околодков Ю.Б. 1993. Видовой
состав и специфичность биолюминесценции морских динофитовых во-
дорослей И Бот. журн. Т. 78. № 6. С. 1-15.
Ильяш Л.В. 1998. Жизненные стратегии у морских планктонных
микроводорослей. Автореф. дисс. соиск. уч. степ. докт. биол. наук. М.:
Биол. фак., Моск. гос. унив. им. М.Л. Ломоносова. 48 с.
Ильяш Л.В., Кольцова Т.И., Сарухан-Бек К.К., Федоров В.Д.
1999. Эколого-ценотические стратегии популяций фитопланктона Бело-
го моря // Вестник Московск. ун-та. Сер. 16. № 2. С. 24-31.
Карпов С.А. 1990. Система протистов. 2-е изд. Омск: Межвузов-
ская типография ОМПИ. 261 с.
Киселев И.А. 1950. Панцирные жгутиконосцы. М., Л.: Изд-во АН
СССР. 280 с.
Киселев И.А. 1954. Пирофитовые водоросли. Определитель пре-
сноводных водорослей СССР. Вып. 6. М.: Советская наука. С. 166-168.
Коновалова Г.В. 1992а. «Красные приливы» в морях (некоторые
итоги изучения) // Альгология. Т. 2. № 3. С. 18-25.
Коновалова Г.В. 19926. «Красные приливы» в дальневосточных
морях России и прилегающих акваториях Тихого океана (обзор) // Аль-
гология. Т. 2. № 4. С. 87-93.
Коновалова Г.В. 1995. Красные приливы у восточной Камчатки
(Атлас-справочник). П.-Камчатский: КАМШАТ. 56 с.
Коновалова Г.В. 1998. Динофлагелляты (Dinophyta) дальневосточ-
ных морей России и сопредельных акваторий Тихого океана. Владиво-
сток: Дальнаука. 300 с.
Коновалова Г.В. 1999. «Красные приливы» и «цветение» воды в
дальневосточных морях России и прилежащих акваториях Тихого океа-
на // Биология моря. Т. 25. № 4. С. 263-273.
Коновалова Г.В. 2007. Паразитические перидинеи (Dinoflagellates)
и эллобиопсиды (Ellobiopsidae) прибрежных вод Японского моря И Био-
логия моря. Т. 33. № 3. С. 167-175.
Коновалова Г.В., Орлова Т.Ю., Паутова Л.А. 1989. Атлас фито-
планктона Японского моря. Л.: Наука. 185 с.
Коновалова Г.В., Селина М.С. 2010. Динофитовые водоросли
(Dinophyta). Биота российских вод Японского моря. Т. 8. Владивосток:
Дальнаука. 352 с.
Кусакин О.Г., Дроздов А.Л. 1998. Филема органического мира.
Ч. 2. Prokaryotes, Eukaryotes: Microsporobiontes, Archemonadobiontes,
Euglenobiontes, Myxobiontes, Rhodobiontes, Alveolates, Heterokontes.
СПб.: Наука. 358 с.
Матвиенко О.М., Литвиненко Р.М. 1977. Шрофггов! водоросп —
Pyrrophyta. Визначник пресноводних водоростей Украшьско!’ РСР. III.
Частина 2. КиТв: Наукова думка. 386 с.
Могильникова Т.А., Мотылькова И.В., Коновалова Г.В. 2007.
О развитии массовых токсичных видов фитопланктона и содержании
фикотоксинов в тканях гребешка Mizuhopecten yessoensis (Jay) в при-
брежных водах о. Сахалин И Тр. Сах. НИИ рыбн. хоз. и океаногр. Т. 9.
С.207-222.
Нешиба С. 1991. Океанология. Современные представления о жид-
кой оболочке Земли. Пер. с англ. М.: Мир. 414 с.
Околодков Ю.Б. 1989. Водоросли льдов Восточно-Сибирского
моря в мае 1987 г. // Нов. сист. низш. раст. Т. 26. С. 36-41.
Околодков Ю.Б. 1999. Потенциально вредные и токсичные ди-
нофлагеллаты (Dinophyceae) в морях евразийской Арктики И Бот. журн.
Т. 84. №11. С. 1-16.
Околодков Ю.Б. 2000. Динофлагеллаты (Dinophyceae) морей Ев-
разийской Арктики. Дисс. соиск. уч. степ. докт. биол. наук. СПб.: Бот.
инет. им. В.Л. Комарова РАН. 363 с.
Орлова Т.Ю. 2005. Красные приливы и токсические микрово-
доросли в дальневосточных морях России И Вестник ДВО РАН. № 1.
С. 27-31.
Пастернак А.Ф., Арашкевич Е.Г., Сорокин Ю.И. 1984. Роль па-
разитических водорослей рода Blastodinium в экологии планктонных ко-
пепод // Океанология. Т. 24. № 6. С. 994-998.
Раменский Л.Г. 1938. Введение в комплексное почвенно-геобота-
ническое исследование земель. М.: Сельхозгиз. 620 с.
Седова Т.В. 1996. Кариология водорослей. СПб.: Наука. 386 с.
АЬё Т.Н. 1927. Report of the biological survey of Mutsu Bay. 3. Notes
on the protozoan fauna of Mutsu Bay. I. Peridiniales I I Sci. Rep. Tohoku Im-
per. Univ., Sendai, Japan. Vol. 2. P. 383-438.
Abe Т.Н. 1936. Diplopsalis and its allied species // Zool. Mag. Vol. 48.
No. 8-10. P. 747-752.
Abe T. 1965. Red water and Dinoflagellates as primary sources of pe-
troleum // 2nd International Conference on Protozoology, London, August
1965 (reprinted from Excerpta Medica International Congress Series N 91),
abstract 10.
Abe Т.Н. 1981. Studies on the family Peridiniidae. An unfinished mono-
graph of the armoured Dinoflagellata. Tokyo, viii + 412 p.
Abrahams M.V., Townsend L.D. 1993. Bioluminescence in dinoflagel-
lates: a test of the burglar alarm hypothesis // Ecology. Vol. 74. P. 258-260.
84
DINOFLAGELLATA
Adachi M., Sako Y., Ishida Y. 1996. Analysis of Alexandrium (Dino-
phyceae) species using sequences of the 5.8S ribosomal DNA and internal
transcribed spacer regions H J. Phycol. Vol. 32. P. 424-432.
Adachi M., Sako Y., Ishida Y. 1997. Analysis of Gymnodinium cat-
enatum (Dinophyceae) using sequences of the 5.8S rDNA-ITS regions an-
drandom and random amplified polymorphic DNA 11 Fisheries Sci. Vol. 63.
No. 5. P. 701-707.
Adi S.M., Simpson A.G.B., Farmer M.A., Andersen R.A., An-
derson O.R., Barta J.R., Bowser S.S., Brugerolle G., Fensome R.A.,
Fredericq S., James T.Y., Karpov S., Kugrens P., Krug J., Lane C.E.,
Lewis L.A., Lodge J., Lynn D.H., Mann D.G., McCourt R.M., Mendoza
L., Moestrup 0., Mozley-Stanbridge S.E., Nerad T.A., Shearer C.A.,
Smirnov A.V., Spiegel F.W., Taylor M.F.J.R. 2005. The new higher level
classification of eukaryotes with emphasis on the taxonomy of protists I I J.
Eukaryot. Microbiol. Vol. 52. P. 399-451.
Aligizaki K., Nikolaididis G. 2008. Morphological identification of
two dinoflagellates of the genera Gambierdiscus and Sinophysis in the Medi-
terranean Sea H J. Biol. Res.-Tessaloniki. Vol. 9. P. 75-82.
Al-Kandari M., Al-Yamani E, Al-Rifaie K. 2009. Marine phytoplank-
ton atlas of Kuwait’s waters. Safat, Kuwait: Kuwait Institute for Scientific
Research. 350 p.
Allen J.R., Roberts T.M., Loeblich III A.R., Klotz L.C. 1975. Char-
acterization of the DNA from the dinoflagellate Crypthecodinium cohnii and
implications for nuclear organization H Cell. Vol. 6. P. 161-169.
Alonso-Rodnguez R., Hernandez-Becerril D.U., Garate-Lizarraga
I. 2008. Catalog© de microalgas de las lagunas costeras de Sinaloa. Serie La-
gunas Costeras de Sinaloa 4. M6xico, D.F.: Universidad Nacional Autonoma
de Мёхко. 198 p.
Al-Yamani E, Saburova M.A. 2010. Illustrated guide on the flagellates
of Kuwait’s intertidal soft sediments. Safat, Kuwait: Kuwait Institute for Sci-
entific Research, iv + 197 p.
Annenkova N.V., Lavrov D.V., Belikov S.I. 2011. Dinoflagellates as-
sociated with freshwater sponges from the ancient Lake Baikal I I Protist. Vol.
162. P. 222-236.
Aubert M., Gauthier M.J., Gastaud J.M. 1977. Interspecific relation-
ships in the field of bacteria and phytoplankton in a marine environment 11
Mar. Natur. Prod. Chem., N.Y., London. P. 415-423.
Avancini M., Cicero A.M., Di Girolamo I., Innamorati M., Magaletti
E., Sertorio Zunini T. (eds). 2006. Guida al riconoscimento del plankton dei
mari italiani. Vol. 1 — Fitoplancton. Roma: Minister© dell’Ambiente e della
Tutela del Territorio e del Mare — ICRAM. 503 p.
Bachvaroff T.R., Concepcion G.T., Rogers C.R., Herman E.M., Del-
wiche C.F. 2004. Dinoflagellate expressed sequence tag data indicate mas-
sive transfer of chloroplast genes to the nuclear genome // Protist. Vol. 155.
P. 65-78.
Baillie B.K., Belda-Baillie C.A., Maruyama T. 2000. Conspecific-
ity and Indo-Pacific distribution of Symbiodinium genotypes (Dinophyceae)
from giant clams // J. Phycol. Vol. 36. P. 1153-1161.
Baillie K.D. 1971. A taxonomic and ecological study of intertidal sand-
dwelling dinoflagellates of the north eastern Pacific Ocean. MS thesis. Van-
couver: Univ, of British Columbia. 110 p., 10 pl.
Baker A.C. 2003a. Symbiont diversity on coral reefs and its relationship
to bleaching resistance and resilience // E. Rosenberg, Y. Loya (eds). Coral
health and disease. Berlin: Springer-Verlag. P. 177-191.
Baker A.C. 2003b. Flexibility and specificity in coral-algal symbiosis:
Diversity, ecology, and biogeography of Symbiodinium I I Annu. Rev. Ecol.
Evol. Syst. Vol. 34. P. 661-689.
Baker H. 1753. Of luminous water insects // Employment for the micro-
scope. London. P. 399-403.
Baldauf S.L. 2003. The deep roots of eukaryotes // Science. Vol. 300.
P. 1703-1706.
Balech E. 1962. Plancton de las campanas oceanograficas Drake I у II //
Serv. Hidrogr. Naval (Argentina) Publ. H. 627. Buenos Aires. P. 1-57.
Balech E. 1971a. Microplancton de la campana oceanografica Produc-
tividad III. Rev. Mus. Argent. Cienc. Natur. “B. Rivadavia” Inst. Nac. Invest.
Cienc. Natur., Hidrobiol. 3(1). P. 1-202, lam. I-XXXIX.
Balech E. 1971b. Microplancton del Atlantic© ecuatorial oeste (Equa-
lant I) // Rep. Argentina, Armada Argentina, Publ. Serv. Hidrogr. Naval B.
Aires H654. P. 1-103, lam. I-XII.
Balech E. 1976. Clave ilustrada de dinoflagelados antarticos. Publicati-
on del Institute Antartico Argentine 11. Buenos Aires. 99 p.
Balech E. 1979. El g6nero Goniodoma Stein (Dinoflagellata) H Lilloa.
Vol. 35. No. 2. P. 97-109.
Balech E. 1980. On thecal morphology of dinoflagellates with special
emphasis on cingular and sulcal plates H An. Centro Cienc. Mar у Limnol.
Univ. Nat. Auton. M6xico. Vol. 7. P. 57-68.
Balech E. 1988. Los dinoflagelados del Atlantic© Sudoccidental. Minis-
terio de Agriculture Pesca у Alimentation, Publ. Espec. Inst. Esp. Oceanogr.
Nl, Madrid. 310 p.
Balech E. 1995. The genus Alexandrium Halim (Dinoflagellata). Publ.
Sherkin Is. Mar. Station, Sherkin Island, Co. Cork, Ireland. 151 p.
Banaszak A.T., Iglesias-Prieto R., Trench R.K. 1993. Scrippsiella
velellae sp. nov. (Peridiniales) and Gloeodinium viscum sp. nov. (Phytodini-
ales), dinoflagellate symbionts of two hydrozoans (Cnidaria) // J. Phycol.
Vol. 29. P. 517-528.
Bardouil M., Berland B., Grzebyk D., Lassus P. 1991. L’existence de
kystes chez les Dinophysales H C. R. Acad. Sci. Paris. T. 312. S6r. 3. P. 663-669.
Barrows A.L. 1918. The significance of skeletal variations in the genus
Peridinium 11 Univ. Calif. Publ. Zool. Vol. 18. P. 397-478.
Barton A.D., Casey K.S. 2005. Climatological context for large-scale
coral bleaching // Coral Reefs. Vol. 24. P. 536-554.
Beam C.A., Himes M. 1987. Electronic characterization of members of
the Crypthecodinium cohnii (Dinophyceae) species complex H J. Eukaryot.
Microbiol. Vol. 34. No. 2. P. 204-217.
Berard-Therriault L., Polulin M., Bosse L. 1999. Guide d’identi-
fication du phytoplancton marin de 1’estuaire et du golfo du Saint-Laurent
incluant 6galement certains protozoaires. Ottawa: Les Presses Scientifiques
de CNRC. 387 p.
Bergh R.S. 1881. Der Organismus der Cilioflagellaten. Eine phylogene-
tische Studie // Morphol. Jahrb. Bd 7. No. 2. S. 177-288, Taf. 12-16.
Bergholtz T., Daugbjerg N., Moestrup 0., Fernandez-Tejedor M. 2006.
On the identity of Karlodinium veneficum and description of Karlodinium ar-
miger sp. nov. (Dinophyceae), based on light and electron microscopy, nuclear-
encoded LSU rDNA, and pigment composition H J. Phycol. Vol. 42. P. 170-193.
Bidard J.-N., Vijverberg H.P.M., Frelin C., Chungue E., Legrand
A.-M., Bagnis R.A., Lazdunski M. 1984. Ciguatoxin is a novel type of Na+
channel toxin // J. Biol. Chem. Vol. 259. P. 8353-8357.
Boltovskoy A. 1999. The genus Glochidinium gen. nov., with two
species: G. penardiforme comb. nov. and G. platygaster sp. nov. H Grana.
Vol. 38. No. 2-3. P. 98-107.
Boon J.J., Ripstra W.I.C., DeLance E, DeLeeuw J.W., Yoshioka
M., Shimizu Y. 1979. Black Sea sterol - a molecular fosil for dinoflagellate
blooms // Nature (London). Vol. 277. P. 125-127.
Borgert A. 1898. Beitrage zur Kenntnis in Sticholonche zanclea und
Acanthometridenarten vorkommenden Parasiten (Spiralkorper Fol, Amoe-
bophrya Koppen) H Z. Wiss. Zool. Bd 63. S. 141-186.
Botes L. 2001. Phytoplankton identification catalogue - Saldanha Bay,
South Africa, April 2001 // GloBallast Monograph Series N7. London: Inter-
national Maritime Organization. 77 p.
Bouck G.B., Sweeney B.M. 1965. The fine structure and ontogeny of
trichocysts in marine dinoflagellates // Protoplasma. Vol. 61. P. 205-233.
Bourrelly P. 1968. Notes sur les P6ridiniens d’eau douce 11 Protistolo-
gica. Vol. 4. No. 1. P. 5-14, pl. 1-2.
Bourrelly P. 1970. Les algues d’eau douce. Initiation a la systematique.
III. Les algues bleues et rouges, les Eugkniens, P6ridiniens et Cryptomona-
dines. Paris: N. ВоиЬёе & Cie. 512 p.
Bourrelly P. 1985. Les algues d’eau douce. Initiation a la systematique.
III. Les algues bleues et rouges, les Eugteniens, Pёridiniens et Cryptomo-
nadines. Еётргеззюп revue et augmentёe. Paris: 5ос1ё1ё Nouvelle des Edi-
tions ВоиЬёе. 606 p.
Brooks B.J., Andersen D.M. 1990. Biochemical composition and
metabolic activity of Scrippsiella trochoidea (Dinophyceae) resting cysts //
J. Phycol. Vol. 26. P. 289-298.
Brown B.E. 1997. Coral bleaching: causes and consequences // Coral
Reefs. Vol. 16. P. 129-138.
Brown E.M. 1934. On Oodinium ocellatum Brown, a parasitic dino-
flagellate causing epidemic disease in marine fish // Proc. Zool. Soc. Lond.
Vol. 2. P. 583-607.
Buck K.R., Bolt P.A., Bentham W.N., Garrison D.L. 1992. A dinofla-
gellate cyst from Antarctic sea ice // J. Phycol. Vol. 28. P. 15-18.
Bujak J.P., Davies E.H. 1983. Modem and fossil Peridiniaceae //Amer-
ican Association of Stratigraphic Palynologists. Contribution Series 13. ix +
202 p., 12 pl.
Burkholder J.M., Glasgow H.B., Deamer-Melia N. 2001. Overview
and present status of the toxic Pfiesteria complex (Dinophyceae) I I Phycolo-
gia. Vol. 40. P. 186-214.
Burkholder P.R., Burkholder L.M., Almodovar I.R. 1960. Antibi-
otic activity of some marine algae of Puerto Rico // Botanica Marina. Vol. 2.
P. 149-156.
Buskey E.J., Swift E. 1983. Bihavioral responses of Acartia hudson-
ica to simulated dinoflagellate bioluminescence H J. Exp. Mar. Biol. Ecol.
Vol. 77. P. 43-58.
DINOFLAGELLATA
85
Biitschli О. 1885. Protozoa. Bd 1 I I H.G. Bronn’s Klassen und Ordun-
gen des Thier-Reichs, wissenschaftlich dargestellt in Wort und Bild. Leipzig,
Heidelberg. S. 865-1088, Taf. 39-55.
Cachon J. 1964. Contribution a 1’etude des peridiniens parasites. Cy-
tologie, cycles evolutifs //Ann. Sci. Nat. Zool. Vol. 6. P. 1-158.
Cachon J., Cachon M. 1966. Ultrastructure d’un peridnien parasite
d’Appendiculaires, Neresheimeria catenata (Neresheimer) // Protistologica.
Vol. 2. P. 17-25.
Cachon J., Cachon M. 1968a. Cytologie et cycle evolutif des Chytrio-
dinium (Chatton) // Protistologica. Vol. 4. P. 249-262.
Cachon J., Cachon M. 1968b. Contribution a 1’etude des Noctilucidae
Saville-Kent. I. Les Kofoidininae Cachon J. et M. Evolution morphologique
et syst6matique // Protistologica. Vol. 3 «1967». No. 4. P. 427-444, pl. 1-5.
Cachon J., Cachon M. 1969. Contribution a l’6tude des Noctilucidae
Saville-Kent. Evolution morphologique, cytologie, systematique. II. Les Lep-
todicinae Cachon J. et M. // Protistologica. Vol. 5. No. 1. P. 11-33, incl. pl.
1-5.
Cachon J., Cachon M. 1971a. Ultrastructures de genre Oodinium Chat-
ton. Differentiations cellulaires en rapport avec la vie parasitaire // Protisto-
logica. Vol. 7. P. 153-169.
Cachon J., Cachon M. 1971b. Protoodinium chattoni Hovasse. Mani-
festations ultrastructurales des rapports entre le P6ridinien et la M6duse-hdte:
fixation, phagocytose //Arch. Protistenk. Bd 113. S. 293-305.
Cachon J., Cachon M. 1973. Les Apodinidae Chatton revision syste-
matique rapports hote-parasite et m6tabolisme // Protistologica. Vol. 9.
P. 17-33.
Cachon J., Cachon M. 1987. Parasitic dinoflagellates H The biology of
dinoflagellates / F.J.R. Taylor (ed.). Botanical Monographs 21. Oxford et al.:
Blackwell Sci. Publ. P. 571-610.
Cachon J., Cachon M., Bouquaheux F. 1965. Stylodinium gastrophi-
lum Cachon, P6ridinien Dinococcide parasite de Siphonophores H Bull. Inst.
Oceanogr. Vol. 65. No. 1359. P. 8.
Cachon J., Cachon M., Bouquaheux F. 1969. Myxodinium pipiens
gen. nov., sp. nov., p6ridinien parasite KHalosphaera II Phycologia. Vol. 8.
P. 157-164.
Cachon J., Cachon-Enjumet M. 1964. Cycle 6volutif et cytologie de
Neresheimeria catenata (Neresheimer), P6ridinien parasite d’Appendiculaires.
Rapports de 1’hote et du parasite //Ann. Sci. Nat. Zool. Vol. 6. P. 779-800.
Cachon J., Cachon-Enjumet M. 1965. Atlanticellodinium tregouboffi
nov. gen. nov. sp., P6ridnien Blastuloidae Neresheimer, parasite de Plank-
tonetta atlantica Borgert, Phaeodarie Atlanticellide. Cytologie, cycle bi-
ologique, 6volution nucl6aire au cours de la sporogenese 11 Arch. Zool. Exp.
Gen. 1965. Vol. 105. P. 369-379.
Calado A.J., Craveiro S.C., Daugbjerg N., Moestrup 0. 2009. De-
scription of Tyrannodinium gen. nov., a freshwater dinoflagellate closely re-
lated to the marine Pfiesteria-Wke. species I I J. Phycol. Vol. 45. P. 1195-1205.
Calado A.J., Moestrup 0. 2005. On the freshwater dinoflagellates
presently included in the genus Amphidinium, with a description of Prosoau-
lax gen. sp. H Phycologia. Vol. 44. P. 112-119.
Cembella A.D. 2003. Chemical ecology of eukaryotic microalgae in
marine ecosystems H Phycologia. Vol. 42. No. 2. P. 420-447.
Carbonell-Moore M.C. 2004. On the taxonomical position of Lessar-
dia Saldarriaga et Taylor within the family Podolampaceae Lindemann (Di-
nophyceae) // Phycol. Res. Vol. 52. P. 340-345.
Caron D. 2000. Symbiosis and mixotrophy among pelagic microorgan-
isms 11 D.L. Kirchman (ed.). Microbial ecology of the oceans. N.Y.: Wiley-
Liss, Inc. P. 495-523.
Carty S. 2003. Dinoflagellates // J.D. Wehr, R.G. Sheath (eds). Fresh-
water algae of North America: Ecology and classification. San Diego, CA:
Academic Press. P. 685-714.
Cavalier-Smith T. 1993. Kingdom Protozoa and its 18 phyla // Micro-
biol. Rev. Vol. 57. No. 4. P. 953-994.
Cavalier-Smith T. 1999. Principles of protein and lipid targeting in
secondary symbiogenesis: euglenoid, dinoflagellate, and sporozoan plas-
tid origins and the eukaryotic family tree // J. Eukaryot. Microbiol. Vol. 46.
P. 347-366.
Cembella A.D., Milenkovic L., Doucette G., Fernandez M. 1995.
In vitro biochemical methods and mammalian bioassays for phycotoxins //
G.M. Hallegraeff, D.M. Anderson, A.D. Cembella (eds). Manual on harmful
marine microalgae. IOC Manuals and Guides, 33. Paris: UNESCO. P. 177—
179.
Chapman D.V., Dodge J.D., Heaney S.J. 1982. Cyst formation in the
freshwater dinoflagellate Ceratium hirundinella I I J. Phycol. Vol. 18. P. 121—
129.
Chatton Ё. 1912. Diagnoses preliminaires de P6ridiniens parasites nou-
\eaux H Bull. Soc. Zool. France. Vol. 37. P. 85-93.
Chatton Ё. 1920. Les peridiniens parasites. Morphologic, reproduction,
ethologie //Arch. Zool. Exp. Gen. Vol. 59. P. 1-475, pl. 1-18.
Chatton Ё. 1923. Les Peridiniens des Radiolaires H C. R. Acad. Sci.,*
Paris. Vol. 177. P. 1246-1249.
Chatton Ё. 1952. Classe des Dinoflagelles ou Peridiniens I I P.-P. Grasse
(ed.). Traite de zoologie. T.l. Fasc.l. Paris: Masson. P. 309-390.
Chatton Ё., Biecheler B. 1934. Les Coccinidae, Dinoflagelles cocci-
diomorphes parasite de Dinoflageltes, et le phylum des Phytodinozoa // C. R.
Acad. Sci., Paris. Vol. 199. P. 252-255.
Chatton Ё., Biecheler B. 1936. Documents nouveaux relatifs aux Coc-
cidinides (Dinoflageltes parasites). La sexualit6 du Coccidinium mesnili n.
sp. // C. R. Acad. Sci., Paris. Vol. 203. P. 573-576.
Chatton Ё., Hovasse R. 1937. Actinodinium apsteini n. g. n. sp., Peridi-
nien parasite ent6rocoelomique des Acartia (Cop6podes) H Arch. Zool. Exp.
Gen. Vol. 79. P. 24-29.
Chatton Ё., Poisson R. 1930. Sur 1’existence, dans le sang des Crabes,
de P6ridiniens parasites: Hematodinium perezi n. g., n. sp. (Syndinidae) H
C. R. Seances Soc. Biol., Paris. Vol. 105. P. 553-557.
Chesnick J.M., Kooistra W.H.C.F., Wellbrook U., Medlin L.K. 1997.
Ribosomal RNA analysis indicates a benthic pennate diatom ancestry for the
endosymbionts of the dinoflagellates Peridinium foliaceum and Peridinium
balticum (Pyrrophyta) 11 J. Eukaryot. Microbiol. Vol. 44. P. 314-320.
Chesnick J.M., Morden C.W., Schmeig A.M. 1996. Identity of the
endosymbiont of Peridinium foliaceum (Pyrrophyta): analysis of the rbcLS
operon 11 J. Phycol. Vol. 32. P. 850-857.
Chretiennot-Dinet M.-J., Sournia A., Ricard M., Billard C. 1993.
A classification of the marine phytoplankton of the world from class to ge-
nus I I Phycologia. Vol. 32. P. 159-179.
Christensen T. 1975. Some marine algae from West Greenland H Bot.
Tidsskr. Vol. 70. No. 2-3. P. 143-146.
Coats D.W. 1988. Duboscquella cachoni n. sp., a parasitic dinoflagellate
lethal to its tintinnine host Eutintinnuspectinis H J. Protozool. Vol. 35. P. 607-617.
Coats D.W. 1999. Parasitic life syles of marine dinoflagellates I I J. Eu-
karyot. Microbiol. Vol. 46. No. 4. P. 402-409.
Coats D.W., Adam E.J., Gallegos C.L., Hedrick S. 1996. Parasitism
of photosynthetic dinoflagellates in a shallow subestuary of Chesapeake Bay,
USA//Aquat. Microb. Ecol. Vol. 11. P. 1-9.
Coats D.W., Kim S., Bachvaroff T.R., Handy S.M., Delwiche C.F.
2010. Tintinnophagus acutus n. gen., n. sp. (Phylum Dinoflagellata), an ecto-
parasite of the ciliate Tintinnopsis cylindrical Dady 1887, and its relationship
to Duboscquodinium collini Grass6 1952 H J. Eukaryot. Microbiol. Vol. 57.
No. 6. P. 468-482.
Codd G. A. 1984. Toxins of freshwater cyanobacteria I I Microbiol. Sci.
Vol. l.P. 48-52.
Colorni A. 1994. Hyperparasitism of Amyloodinium ocellatum (Dino-
flagellida: Oodinidae) on Neobenedenia melleni (Monogenea: Capsalidae) H
Dis. Aquat. Org. Vol. 19. P. 157-159.
Corliss J.O. 1994. An interim utilitarian («user-friendly») hierarchical
classification of the protists //Acta Protozool. Vol. 33. P. 1-51.
Cortes-Altamirano R., Sierra-Beltran A.P. 2008. Biotoxins from
freshwater and marine harmful algal blooms occurring in Mexico 11 Toxin
Reviews. Vol. 27. P. 27-77.
Craveiro S.C., Calado A.J., Daugbjerg N., Moestrup 0. 2009. Ultra-
structure and LSU rDNA-based revision of Peridinium group palatinum (Di-
nophyceae) with the description of Palatinus gen. nov. 11 J. Phycol. Vol. 45.
P. 1175-1194.
Craveiro S.C., Calado A.J., Daugbjerg N., Hansen G., Moestrup 0.
2011. Ultrastructure and LSU rDNA-based phylogeny of Peridinium lom-
nickii and description of Chimonodinium gen. nov. (Dinophyceae) H "Protist.
Vol. 162. P. 590-615.
Dale B. 1983. Dinoflagellate resting cysts: “benthic plankton” H
G.A. Fryxell (ed.). Survival strategies of the algae. Cambridge: Cambridge
Univ. Press. P. 69-136.
Dale A.L., Dale B. 1992. Dinoflagellate contributions to the sediment
flux of the Nordic Seas // S. Honjo (ed.). Dinoflagellate contributions to the
deep sea. Ocean Biocoenosis Series N5. Woods Hole, MA: Woods Hole
Oceanographic Institution. P. 45-75.
Daranas A.H., Norte M., Fernandez J.J. 2001. Toxic marine microal-
gae//Toxicon. Vol. 39.P. 1101-1132.
Daugbjerg N., Hansen G., Larsen J., Moestrup 0. 2000. Phylogeny
of some of the major genera of dinoflagellates based on ultrastructure and
partial LSU rDNA sequence data, including the erection of three new genera
of unarmoured dinoflagellates I I Phycologia. Vol. 39. P. 302-317.
Deflandre G. 1952. Classe des Ebriediens (Ebriaceae Lemmermann
1900 emend. Ebriideae Deflandre 1936) I I P.-P. Grasse (ed.). Тгайё de zoolo-
gie. T.l. Fasc.l.Paris: Masson. P. 405-424.
86
DINOFLAGELLATA
Delgado M., Fortuno J.-M. 1991. Atlas de fitoplancton del Mar Medi-
terraneo. Sci. Mar. Vol. 55. Supl. 1. P. 1-133.
de Salas M.F., Bolch C.J.S., Botes L., Nash G., Wright S.W., Hal-
legraeff G.M. 2003. Takayama gen. nov. (Gymnodiniales, Dinophyceae), a
new genus of unarmoured dinoflagellates with sigmoid apical grooves, in-
cluding the description of two new species // J. Phycol. Vol. 39. P. 1233-1246.
Destombe C., Cembella A.D., Murphy C.A., Ragan M.A. 1992.
Nucleotide sequence of the 18S ribosomal RNA genes from the marine dino-
flagellate Alexandrium tamarense (Gonyaulacales, Dinophyta) 11 Phycologia.
Vol. 31. No. l.P. 121-124.
Dickey R.W., Plakas S.M. 2010. Ciguatera: a public health perspec-
tive H Toxicon. Vol. 56. No. 2. P. 123-136.
Dillard G.E. 2007. Freshwater algae of the Southeastern United States.
Part 8. Chrysophyceae, Xanthophyceae, Raphidophyceae, Cryptophyceae
and Dinophyceae. Berlin, Stuttgart: J. Cramer. 147 p.
Dodge J.D. 1965. Chromosome structure in the dinoflagellates and the
problem of the mesokaryotic cell 11 Progress in Protozoology. Abstr. 2nd Int.
Conf. Protozool. London. P. 264-265 (Excerpta Med. Int. Congr. Ser. 91.
P. 339-341).
Dodge J.D. 1966. The Dinophyceae I I M.B.E. Godward (ed.). The chro-
mosomes of the algae. N.Y.: St. Martin's Press. P. 96-115.
Dodge J.D. 1973. The fine structure of algal cells. London, N.Y.: Aca-
demic Press. 276 p.
Dodge J.D. 1981. Three generic names in the Dinophyceae: Herdmania,
Sclerodinium and Triadinium to replace Heteraulacus and Goniodoma // Br.
Phycol. J. Vol. 16. P. 273-280.
Dodge J.D. 1982. Marine dinoflagellates of the British Isles. London:
Her Majesty’s Stationary Office, vi + 303 p.
Dodge J.D. 1983. Dinoflagellates: Investigation and phylogenetic pecu-
lation // Br. Phycol. J. Vol. 18. P. 335-356.
Dodge J.D. 1984. Dinoflagellate taxonomy// D.L. Spector (ed.). Dino-
flagellates. Orlando et al.: Academic Press, Inc. P. 17-42.
Dodge J.D. 1985a. Marine dinoflagellates of the British Isles. London:
Her Majesty’s Stationary Office. 303 p.
Dodge J.D. 1985b. Atlas of dinoflagellates. London: Farrand Press. 119 p.
Dodge J.D., Crawford R.M. 1970. A survey of thecal fine structure in
the Dinophyceae // Bot. J. Linnean Soc. Vol. 63. P. 53-67.
Dodge J.D., Greuet C. 1987. Dinoflagellate ultrastructure and complex
organelles // F.J.R. Taylor (ed.). The biology of dinoflagellates. Botanical
Monographs 21. Oxford et al.: Blackwell Sci. Publ. P. 92-142.
Dodge J.D., Saunders R.D. 1985. A partial revision of the genus Oxy-
toxum (Dinophyceae) with the aid of scanning electron microscopy I I Bo-
tanica Marina. Vol. 28. P. 99-122.
Dogiel V. 1906. Beitrage zur Kenntnis der Peridineen // Mitt. Zool. Stat.
Neapel. Bd 18(1). S. 1-45, 2 Taf.
D’Onofrio G., Marino D., Bianco L., Busico E., Montresor M. 1999.
Towards an assessment on the taxonomy of dinoflagellates that produce cal-
careous cysts (Calciodinelloideae, Dinophyceae): a morphological and mo-
lecular approach I I J. Phycol. Vol. 35. P. 1063-1078.
Douglas A.E. 2003. Coral bleaching — how and why? H Mar. Poll. Bull.
Vol. 46. P. 385-392.
Downie C. 1956. Microplankton from the Kimmeridge Caly // Q. J.
Geol. Soc. Lond. Vol. 112. P. 413-434.
Downie C., Williams G.L., Sargeant W.A.S. 1961. Classification of
fossil microplankton // Nature. Vol. 192. No. 4801. P. 471.
Drebes G. 1969. Dissodinium pseudocalani sp. nov., ein parasitischer
Dinoflagellat auf Copepoeneiem // Helgol. Wiss. Meeresunters. Bd 19. S. 58-
67.
Drebes G. 1974. Marines Phytoplankton. Eine Auswahl der Helgolander
Planktonalgen (Diatomeen, Peridineen). Stuttgart: G. Thieme Verlag. 186 S.
Drebes G. 1988. Syltodinium listii gen. et spec, nov., a marine ectopara-
site dinoflagellate on eggs of copepods and rotifers // Helgol. Wiss. Meere-
sunters. Bd 42. S. 583-591.
Drebes G., Schnepf E. 1988. Paulsenella Chatton (Dinophyta), ec-
toparasites of marine diatoms: development and taxonomy H Helgol. Wiss.
Meeresunters. Bd 42. S. 563-581.
Eaton G.L. 1980. Nomenclature and homology in peridinialean dinofla-
gellate plate patterns 11 Palaeontology. Vol. 23. P. 667-688.
Edwards L.E. 1990. Peridinialean dinoflagellate plate patterns, labels
and homologies // Rev. Palaebot. Palynol. Vol. 65. P. 293-303.
Ehrenberg C.G. 1830. Beitrage zur Kenntnis der Organisation der Infu-
sorien und ihrer geographischen Verbreitung, besonders in Sibirien H Kongl.
Akad. Wiss. Berlin, Abh., Physik.-Mathemat. KI. S. 1-88, Taf. 1-8.
Ehrenberg C.G. 1838. Die Infusionsthierchen als volkommene Orga-
nismen. Ein Blick in das Tiefere organische Leben der Natur. Leipzig, xvii +
547 S., 64 Taf.
Eisenack A. 1961. Einige Erorterungen fiber fossile Dinoflagellaten
nebst Ubersicht fiber die zur Zeit bekannten Gattungen // Neues Jahrb. Geol.
Palaontol., Abh. Bd 112. No. 3. S. 281-324, Taf. 21-27.
Eisenack A. 1964. Erorterungen fiber einige Gattungen fossiler Dinofla-
gellaten und fiber die Einordung der Gattungen in das System 11 Neues Jahrb.
Geol. Palaontol., Monatshefte. S. 321-336.
Elbrachter M. 1988. Life cycle of Schizochytriodinium calani nov. gen.
nov. spec., a dinoflagellate parasitizing copepod eggs // Helgol. Wiss. Meere-
sunters. Bd 42. S. 593-599.
Elbrachter M. 1991. Food uptake mechanisms in phagotrophic dino-
flagellates and classification // D.J. Patterson, J. Larsen (eds). The biology of
free-living heterotrophic flagellates. Systematics Association Special Volume
45. Oxford: Clarendon Press. P. 303-312.
Elbrachter M. 1993. Kolkwitziella Lindemann 1919 and Preperidinium
Mangin 1913: correct names in the Diplopsalis-^owp (Dinophyceae) I I Nova
Hedwigia. Vol. 56. No. 1-2. P. 173-178.
Elbrachter M., Drebes G. 1978. Life cycles, phylogeny and taxonomy
of Dissodinium and Pyrocystis (Dinophyta) // Helgolander Wiss. Meeresunt-
ers. Vol. 31. P. 347-366.
Elbrachter M., Hoppenrath M. 2010. Check-list of living dinoflagel-
late genera. http://www.dinophyta.org/index.php?option=com_content&task
=view&id=32&Itemid=52
Engler A. 1892. Syllabus der Vbrlesungen fiber specialle und medicinisch-
pharmaceutische Botanik. Eine Ubersicht fiber das gesammte Pflanzensystem
mit Berucksichtigung der Medicinae- und Nutzpflanzen. Berlin, xxiii + 184 S.
Eppley R.W., Holm-Hansen O., Strickland J.D.H. 1968. Some observa-
tions on the vertical migration of dinoflagellates // J. Phycol. Vol. 4. P. 333-340.
Esqueda-Lara K., Hernandez-Becerril D.U. 2010. Dinoflagelados mi-
croplanctonicos marines del Pacifico central de M6xico (Isla Isabel, Nayarit у
costas de Jalisco у Colima). M6xico, D.F., Мёхко: Institute de Ciencias del
Mar у Limnologia, Universidad Nacional Autonoma de Mexico, x + 206 p.
Escalera L., Reguera B., Takishita K., Yoshimatsu S., Koike K.,
Koike K. 2011. Cyanobacterial endosymbionts in the benthic dinoflagellate
Sinophysis canaliculata (Dinophysiales, Dinophyceae) // Protist. Vol. 162.
P. 304-314.
Evitt W.R. 1961. Observations on the morphology of fossil dinoflagel-
lates // Micropaleontol. Vol. 7. No. 4. P. 385-420.
Evitt W.R. 1978. Special connotations of «quadra», «penta» and «hexa»
in descriptive terminology of dinoflagellates H Palynology. Vol. 2. P. 199-204.
Evitt W.R. 1985. Sporopollenin dinoflagellate cysts: their morphol-
ogy and interpretation. American Association of Stratigraphic Palynologists,
Monograph Series, 1. Dallas. 333 p.
Farmer M.A., Fitt W.K., Trench R.K. 2001. Morphology of the sym-
biosis between Corculum cardissa (Mollusca: Bivalvia) and Symbiodinium
corculorum (Dinophyceae) // Biol. Bull. Vol. 200. P. 336-343.
Fast N.M., Kissinger J.C., Roos D.S., Keeling P.J. 2001. Nuclear-
encoded, plastid-targeted genes suggest a single common origin for apicom-
plexan and dinoflagellate plastids 11 Mol. Biol. Evol. Vol. 18. P. 418-426.
Fast N.M., Xue L., Bungham S., Keeling P.J. 2002. Re-examining
alveolate evolution using protein molecular phylogenies // J. Eukaryot. Mi-
crobiol. Vol. 49. P. 30-37.
Faust M.A. 1995. Benthic toxic dinoflagellates: an overview 11 P. Las-
sus, G. Arzul, E. Erard, P. Gentien, C. Marcaillou (eds). Harmful marine algal
blooms. Lavoisier: Intercept Ltd. P. 847-854.
Faust M.A. 2004. The dinoflagellates of Twin Cays, Belize: Biodiver-
sity, distribution and vulnerability //Atoll Res. Bull. Vol. 514. P. 1-20.
Faust M.A., Steidinger K.A. 1998. Bysmatrum gen. nov. (Dinophy-
ceae) and three new combinations for benthic scrippsielloid species // Phyco-
logia. Vol. 37. No. l.P. 47-52.
Fensome R.A., MacRae R.A., Moldowan J.M., Taylor F.J.R., Wil-
liams G.L. 1996. The early Mesozoic radiation of dinoflagellates //Paleobiol.
Vol. 22. No. 3. P. 329-338.
Fensome R.A., Saldarriaga J.F., Taylor F.J.R. 1999. Dinoflagellate
phylogeny revisited: reconciling morphological and molecular based phylog-
enies // Grana. Vol. 38. P. 66-80.
Fensome R.A., Taylor F.J.R., Norris G., Sarjeant W.A.S., Wharton
D.L, Williams G.L. 1993. A classification of living and fossil dinoflagellates.
Hanover, PA: Sheridan Press. 351 p.
Figueroa R.I., Bravo L, Fraga S., Garces E., Llaveria G. 2009. The
life history and cell cycle of Kryptoperidinium foliaceum, a dinoflagellate
with two eukaryotic nuclei // Protist. Vol. 160. P. 285-300.
Flo Jorgensen M., Murray S., Daugbjerg N. 2004a. Amphidinium re-
visited. I. Redefinition of Amphidinium (Dinophyceae) based on cladistic and
molecular phylogenetic analyses // J. Phycol. Vol. 40. P. 351-365.
Flo Jorgensen M., Murray S., Daugbjerg N. 2004b. A new genus of
athecate interstitial dinoflagellates, Togula gen. nov., previously encompassed
DINOFLAGELLATA
87
within Amphidinium sensu lato — inferred from light and electron micros-
copy and phylogenetic analyses of partial LSU rDNA sequences // Phycol.
Res. Vol. 52. P. 284-299.
Fott B. 1959. Algenkunde. Jena: G. Fischer. 482 S.
Fraga S., Rodriguez F., Caillaud A., Diogene J., Raho N., Zapata M.
2011. Gambierdiscus excentricus sp. nov. (Dinophyceae), a benthic toxic di-
noflagellates from the Canary Islands (NE Atlantic Ocean) // Harmful Algae.
Vol. 11. P. 10-22.
Freudenthal H.D. 1962. Symbiodinium gen. nov. and 5. microadriati-
cum sp. nov., a zooxanthella: taxonomy, life cycle, and morphology H J. Pro-
tozool. Vol. 9. P. 45-52.
Fritz L., Quilliam M.A., Wright J.L.C., Beale A.M., Work T.M.
1992. An outbreak of domoic acid poisoning attributed to the pennate diatom
Pseudonitzschia australis 11 J. Phycol. Vol. 28. No. 4. P. 439^442.
Furuya K., Saito H., Sriwwon R., Omura T., Furio E.E., Borja V.M.,
Lirdwitayaprasit T. 2006. Vegetative growth of Noctiluca scintillans con-
taining the endosymbiont Pedinomonas noctilucae // Afr. J. Mar. Sci. Vol. 28.
No. 2. P. 305-308.
Gaines G., ElbrSchter M. 1987. Heterotrophic nutrition H F.J.R. Taylor
(ed.). The biology of dinoflagellates. Botanical Monographs 21. Oxford et al.:
Blackwell Sci. Publ. P. 224-268.
Gallois R.W. 1976. Coccolith blooms in the Kimmeridge Clay and ori-
gin of the North Sea oil H Nature. Vol. 259. P. 473-475.
Garate-Lizarraga L, Siqueiros-Beltrones D.A. 2003. Infection of
Ceratium furca by the parasitic dinoflagellate Amoebophrya ceratii (Amoe-
bophryidae) in the Mexican Pacific // Acta Bot. Mex. Vol. 65. P. 1-9.
Garces E. 2002. Temporary cysts in dinoflagellates // E. Garc6z, A. Zin-
gone, M. Montresor, B. Reguera, B. Dale (eds). Report on the workshop:
LIFEHAB: Life histories of microalgal species causing harmful blooms. Re-
search in Enclosed Seas series 12. Luxembourg: Office for Official Publica-
tions of the European Communities, European Commission. P. 46-48.
Garrison D.L., Buck K.R. 1989a. The biota of Antarctic pack ice in the
Weddell Sea and Antarctic Peninsula regions // Polar Biol. Vol. 10. P. 210—
219.
Gast R.J. 2005. Molecular phylogeny of a potentially parasitic dino-
flagellate isolated from the solitary radiolarian, Thalassicolla nucleata // J.
Eukar. Microbiol. Vol. 53. No. 1. P. 43-45.
Gast R.J., Caron D.A. 2001. Photosymbiotic associations in planktonic
foraminifera and radiolaria // Hydrobiologia. Vol. 461. P. 1-7.
Gattuso J.-P., AHemand D., FrankignouIIe M. 1999. Photosynthesis
and calcification at cellular, organismal and community levels in coral reefs:
a review on interactions and control by carbonate chemistry // Am. Zool.
Vol. 39. P. 160-183.
Geitler L. 1934. Grundriss der Cytologie. Berlin: Bomtrager. 339 S.
Giner J.-L., Faraldos J. A., Boyer G.L. 2003. Novel sterols of the toxic
dinoflagellate Karenia brevis (Dinophyceae): a defensive function for unusual
marine sterols H J. Phycol. Vol. 39. P. 315-319.
Glynn P.W. 1991. Coral reef bleaching in the 1980s and possible con-
nections with global warming I I Trends Ecol. Evol. Vol. 6. P. 175-179.
Glynn P.W. 1993. Coral reef bleaching - ecological perspectives //
Coral Reefs. Vol. 12. P. 1-17.
Gomez F. 2005. A list of free-living dinoflagellates species in the
world’s oceans // Acta Bot. Croat. Vol. 64. No. 1. P. 129-212.
Gomez F. 2007. Gynogonadinium aequatoriale gen. et sp. nov., a new
dinoflagellate from the open western equatorial Pacific // Algae. Vol. 22.
No. l.P. 11-15.
Gomez F., Lopez-Garcia P., Nowaczyk A., Moreira D. 2009a. The
crustacean parasites Ellobiopsis Caullery, 1910 and Thalassomyces Niez-
abitowski, 1913 form a monophyletic divergent clade within the Alveolata //
Syst. Parasitol. Vol. 74. P. 65-74.
Gomez F., Moreira D., Lopez-Garcia P. 2009b. Life cycle and mole-
cular phylogeny of the dinoflagellates Chytriodinium and Dissodinium, ecto-
parasites of copepod eggs // Europ. J. Protistol. Vol. 45. P. 260-270.
Gomez F., Moreira D., Lopez-Garcia P. 2010. Neoceratium gen. sp.,
a new genus for all marine species currently assigned to Ceratium (Dinophy-
ceae) // Protist. Vol. 161. P. 35-54.
Gomez E, Lopez-Garcia P., Moreira D. 2011. Molecular phylogeny of
dinophysoid dinoflagellates: the systematic position of Oxyphysis oxytoxoides
and the Dinophysis hastata group (Dinophysales, Dinophyceae) // J. Phycol.
Vol. 47. P. 393-406.
Gomez E, Souissi S. 2007. The distribution and life cycle of the dinofla-
gellates Spatulodinium pseudonoctiluca (Dinophyceae, Noctilucales) in the
northeastern English Channel H C. R. Biologies. Vol. 330. P. 231-236.
Goreau T.F., Goreau N.I. 1959. The physiology of skeleton formation
:n corals. II. Calcium deposition by hermatypic corals under various condi-
:ions in the reef // Biol. Bull. Vol. 117. P. 239-250.
Goreau T.F., Goreau N.I., Trench R.K., Hayes R.L. 1996. Calcifica-
tion rates in corals I I Science. Vol. 274. P. 117.
Goreau T.J., Hayes R.L. 1994. Coral bleaching and ocean “hot spots” H
Ambio. Vol. 23. P. 176-180.
Goreau T.J., Hayes R.L., McAllister D. 2005. Regional patterns of sea
surface temperature rise: implications for global ocean circulation change and
the future of coral reefs and fisheries // World Resource Rev. Vol. 17. No. 3.
P. 350-374.
Gordon N., Angel D.L., Neori A., Kress N., Kimor B. 1994. Hetero-
trophic dinoflagellates with symbiotic cyanobacteria and nitrogen limitation
in the Gulf of Aqaba 11 Mar. Ecol. Prog. Ser. Vol. 107. P. 83-88.
Graham H.W 1942. Studies in the morphology, taxonomy, and ecology of
the Peridiniales. Scientific results of cruise VII of the Carnegie during 1928-1929
under command of captain J.P. Ault. Biology - III. Washington, D.C. vii + 129 p.
Graham H.W., Bronikowsky N. 1944. The genus Ceratium in the Pa-
cific and North Atlantic oceans. Scientific results of cruise VII of the Carnegie
during 1928-1929 under command of captain J.P. Ault. Washington, D.C.
vii + 209 p.
Graham H.W. 1951. Pyrrhophyta // G.M. Smith (ed.). Manual of phy-
cology. Introduction to the algae and their biology. N.Y.: The Ronald Press
Company. P. 105-118.
Graham L.E., Wilcox L.W. 2000. Algae. Upper Saddle River, NJ:
Prentice Hall. 718 p.
Grime J.P. 1979. Plant strategies and vegetation processes. Chichester-
N.Y.-Brisbane-Toronto: John Wiley & Sons, Ltd. 222 p.
Groombridge B. (ed.). 1992. Global biodiversity: status of the Earth’s
living resources. World Conservation Monitoring Centre. London: Chapman
and Hall. 585 p.
Grzebyk D., Sako Y., Berland B. 1998. Phylogenetic analysis of nine
species of Prorocentrum (Dinophyceae) inferred from 18S ribosomal DNA
sequences, morphological comparisons, and description of Prorocentrum
panamensis, sp. nov. //J. Phycol. Vol. 34. P. 1055-1068.
Gudger E.W. 1930. Poisonous fishes and fish poisonings, with special
reference to ciguatera in the West Indies H Amer. J. Trop. Med. Vol. 10. No. 1.
P. 43-55.
Gunderson J.H., Goss S.H., Coats D.W. 1999. The phylogenetic posi-
tion of Amoebophrya sp. infecting Gymnodinium sanguineum 11 J. Eukaryot.
Microbiol. Vol. 46. P. 194-197.
Hackett J.D., Anderson D.M., Erdner D.L., Bhattacharya D. 2004a.
Dinoflagellates: a remarkable evolutionary experiment // Amer. J. Bot.
Vol. 91. P. 1523-1534.
Hackett J.D., Yoon H.S., Soares M.B., Bonaldo M.F., Casavant T.,
Scheetz T.E., Nosenko T., Bhattacharya D. 2004b. Migration of the plastid
genome to the nucleus in a peridinin dinoflagellate I I Current Biology. Vol. 14.
P. 213-218.
Hackett J.D., Maranda L., Yoon H.S., Bhattacharya D. 2003. Phy-
logenetic evidence for the cryptophytes origin of the plastid of Dinophysis
(Dinophysiales, Dinophyceae) // J. Phycol. Vol. 39. P. 440-448.
Hackett J.D., Scheetz T.E., Yoon H.S., Soares M.B., Ronaldo M.F.,
Casavant T.L., Bhattacharya D. 2005. Insights into a dinoflagellate ge-
nome through expressed sequence tag analysis I I BMC Genomics. Vol. 6: 80.
P. 1-13 (http://www.biomedcentral.eom/1471-2164/6/80).
Hallegraeff G.M. 1991. Aquaculturists’ guide to harmful Australian
microalgae. Hobart, Tasmania, Australia: Fishing Industry Training Board of
Tasmania/CSIRO Division of Fisheries. Hip.
Hallegraeff G.M. 2002. Aquaculturists’ guide to harmful Australian
microalgae. Hobart, Tasmania, Australia: School of Plant Science, Univ, of
Tasmania. 136 p.
Hallegraeff G.M., Anderson D.M., Cembella A.D. (eds). 1996.
Manual on harmful marine microalgae. IOC Manuals and Guides 33. Paris:
UNESCO, xv+ 551 p.
Hallegraeff G.M., Anderson D.M., Cembella A.D. (eds). 2003. Manu-
al on harmful marine microalgae. Monographs on Oceanolographic Method-
ology 11. Paris: UNESCO. 793 p.
Hallegraeff G.M., Bolch C.J.S., НШ D.R.A., Jameson I., LeRoi J.-M.,
McMinn A., Murray S., de Salas M.F., Saunders K. 2010. Algae of Austra-
lia: phytoplankton of temperate coastal waters. Canberra, Melbourne: AB RS,
CSIRO Publishing. 421 p.
Hallegraeff G.M., Jeffrey S.W. 1984. Tropical phytoplankton species
and pigments of continental shelf waters of North and North-West Australia I I
Mar. Ecol. Prog. Ser. Vol. 20. P. 59-74.
Hallegraeff G.M., Lucas I.A.N. 1988. The marine dinoflagellate genus
Dinophysis (Dinophyceae): Photosynthetic, neritic and non-photosynthetic,
oceanic species H Phycologia. Vol. 27. P. 25-42.
Hallegraeff G.M., Maclean J.L. 1989. Biology, epidemiology and
management of Pyrodinium red tides. Proceedings of the Management and
88
DINOFLAGELLATA
Training Workshop, Bandar Seri Begawan, Brunei Darussalam, 23-30 May
1989. ICLARM Conf. Proc. 21. Manila, Philippines: International Center for
Living Aquatic Resources Management, x + 286 p.
Handy S.M., Bachvaroff T.R., Timme R.E., Coats D.W., Kim S., Del-
wiche C.F. 2009. Phylogeny of four dinophysiacean genera (Dinophyceae,
Dinophysiales) based on rDNA sequences from single cells and environmen-
tal samples // J. Phycol. Vol. 45. No. 5. P. 1163-1174.
Hansen G. 1989. Ultrastructure and morphogenesis of scales in Ka-
todinium rotundatum (Lohmann) Loeblich (Dinophyceae) // Phycologia.
Vol. 28. P. 385-394.
Hansen G., Botes L., de Salas M. 2007a. Ultrastructure and large sub-
unit rDNA sequences of Lepidodinium viride reveal a close relationship to
Lepidodinium chlorophorum comb. nov. (= Gymnodinium chlorophorum} I I
Phycol. Res. Vol. 55. P. 25-41.
Hansen G., Daugbjerg N., Henriksen P. 2007b. Baldinia anauniensis
gen. et sp. nov.: a «new» dinoflagellate from Lake Tovel, N. Italy // Phycolo-
gia. Vol. 46. P. 86-108.
Hansen G., Daugbjerg N. 2009. Symbiodinium natans sp. nov.: a «free-
living» dinoflagellate from Tenerife (northeast-Atlantic Ocean) // J. Phycol.
Vol. 45. P. 251-263.
Hansen P.J., Calado A.J. 1999. Phagotrophic mechanisms and prey
selection in free-living dinoflagellates 11 J. Eukar. Microbiol. Vol. 46. P. 382-
389.
Harvey E.N. 1952. Bioluminescence. N.Y.: Academic Press, xvi +
649 p.
Hashimoto Y. 1968. Glenodinine, an ichthyotoxic substance produced
by a dinoflagellate, Peridinium polonicum H Nippon Suisan Gakkaishi.
Vol. 34. P. 528-534.
Hastrup Jensen M., Daugbjerg N. 2009. Molecular phylogeny of se-
lected species of the order Dinophysiales (Dinophyceae) — testing the hy-
pothesis of a dinophysioid radiation // J. Phycol. Vol. 45. No. 5. P. 1136-1152.
Head M.J. 1996. Modem dinoflagellate cysts and their biological affini-
ties // J. Jansonius, D.C. McGregor (eds). Palynology: principles and applica-
tions. Vol. 3. Amer. Assoc. Strat. Palynol. Found. P. 1197-1248.
Head M.J., Wrenn, J.H. (eds). 1992. Neogene and Quaternary dino-
flagellate cysts and acritarchs. Dallas, Texas, American Association of Strati-
graphic Palynologists Foundation, College Station. 438 p., 78 pl.
Heckel P.H. 1974. Carbonate buildup in the geologic record: a review //
L.F. Laporte (ed.). Reefs in time and space. Spec. Pubis. Soc. Econ. Paleont.
Miner. Tulsa, Oklahoma, No. 18. P. 90-154.
Hernandez-Becerril D.U., Bravo-Sierra E., Ceballos-Corona J.G.A.,
Esqueda-Lara K., Escobar-Morales S., Parra-Toriz D. 2010. Morphology
and taxonomy of the marine planktonic dinoflagellate Centrodinium pul-
chrum Bohm (Dinophyta) from the tropical Mexican Pacific, with comments
on the taxonomy and distribution of the genus Centrodinium // Phycologia.
Vol. 49. No. 5. P. 461-470.
Herzog M., Maroteaux L. 1986. Dinoflagellate 17S rRNA sequence
inferred from the gene sequence: evolutionary implications H Proc. Nat. Acad.
Sci. USA. Vol. 83. P. 8644-8648.
Hoegh-Guldberg O. 2009. Climate change and coral reefs: Trojan
horse or false prophecy? H Coral Reefs. Vol. 28. P. 569-575.
Hohfeld L, Melkonian M. 1992. Amphiesmal ultrastructure of dino-
flagellates: a reevaluation of pellicle formation // J. Phycol. Vol. 28. P. 82-89.
Holl K. 1928. Okologie der Peridineen I I Pflanzenforschung. Bd 11.
S. 1-105.
Hollande A., Cachon J. 1952. Un parasite des oeufs de Sardine: Vlch-
thyodinium chabelardi nov. gen., nov. sp. (P6ridinien parasite) H C.R. Acad.
Sci., Paris. Vol. 235. P. 976-977.
Hollande A., Corbel J.-C. 1982. Ultrastructure, cycle 6volutif et posi-
tion syst6matique de Caryotoma bernardi Holl, et Enj. (Dinoflagelles Oodi-
nides) parasite endocapsulaire des Thalassicolles (Radiolaires) 11 Protistolo-
gica. Vol. 18. P. 123-133.
Hollande A., Cachon-Enjumet M. 1953. Contribution a tetude des
Sphaerocollides (Radiolaires Collodaires et Radiolaire Polycyttaires) et de
leurs parasites. Partie I: Thalassiciollidae, Physematidea, Thalassophysidae //
Ann. Sci. Nat. Vol. 15. P. 99-183.
Holm-Hansen O. 1969. Algae: amounts of DNA and organic carbon in
single cells // Science. Vol. 163. P. 87-88.
Hoppenrath M. 2000a. Taxonomische und okologische Untersuchun-
gen von Flagellaten mariner Sande. Dissertation zur Eriangung des Doktor-
grades des Fachbereichs Biologie der Universitat Hamburg. Hamburg. 312 S.
Hoppenrath M. 2000b. Morphology and taxonomy of the marine sand-
dwelling genus Thecadinium (Dinophyceae), with the description of two new
species from the North German Wadden Sea // Phycologia. Vol. 39. P. 96-108.
Hoppenrath M., Bachvaroff T.R., Handy S.M., Delwiche C.E, Le-
ander B.S. 2009b. Molecular phylogeny of ocelloid-bearing dinoflagellates
(Wamowiaceae) as inferred from SSU and LSU rDNA sequences П BMC
Evol. Biol. 9: 16. doi: 10.1186/1471-2148-9-116.
Hoppenrath M., Elbrachter M. 1998. Roscoffia capitata (Dinophyce-
ae) refound: notes on morphology and biology // Phycologia. Vol. 37. No. 6.
P. 450-457.
Hoppenrath M., Elbrachter M., Drebes G. 2009a. Marine phyto-
plankton. Selected microphytoplankton species from the North Sea around
Helgoland and Sylt. Kleine Senckenberg-Reihe, Bd 49. Stuttgart. 264 p.
Hoppenrath M., Horiguchi T., Miyoshi Y., Taylor “Max” F.J.R., Le-
ander B.S. 2007. Taxonomy, phylogeny, biogeography, and ecology of Sabu-
lodinium undulatum (Dinophyceae), including an emended description of the
species // Phycol. Res. Vol. 55. No. 2. P. 159-175.
Hoppenrath M., Okolodkov Y.B. 2000. Amphidinium glabrum sp. nov.
(Dinophyceae) from the North German Wadden Sea and European Arctic sea
ice: morphology, distribution and ecology // Eur. J. Phycol. Vol. 35. P. 61-67.
Hoppenrath M., Schweikert M., Elbrachter M. 2003. Morphologi-
cal reinvestigation and characterization of the marine, sand-dwelling dinofla-
gellate Adenoides eludens (Dinophyceae) // Eur. J. Phycol. Vol. 38. P. 385—
394.
Hoppenrath M., Yubuki N., Bachvaroff T.R., Leander B. 2010. Re-
classification of Pheopolykrikos hartmannii as Polykrikos (Dinophyceae)
based partly on the ultrastructure of complex extrusomes // Europ. J. Protistol.
Vol. 46. P. 29-37.
Horiguchi T. 1995a. Amphidiniella sedentaria gen. et sp. nov. (Di-
nophyceae), a new sand-dwelling dinoflagellate from Japan H Phycol. Res.
Vol. 43. P. 93-99.
Horiguchi T. 1995b. Heterocapsa circularisquama sp. nov. (Peridini-
ales, Dinophyceae): A new marine dinoflagellate causing mass mortality of
bivalves in Japan. Phycol. Res. Vol. 43. P. 129-136.
Horiguchi T., Chihara M. 1983. Stylodinium littorale, a new marine
dinococcalean alga (Pyrrhophyta) // Phycologia. Vol. 22. No. 1. P. 23-28.
Horiguchi T., Kawai H., Kubota M., Takahashi T., Watanabe M.
1999. Phototactic responses of four marine dinoflagellates with different
types of eye-spot and chloroplast // Phycol. Res. Vol. 47. P. 101-107.
Horiguchi T., Sukigara C. 2005. Pyramidodinium atrofuscum gen. et
sp. nov. (Dinophyceae), a new marine sand-dwelling coccoid dinoflagellate
from tropical waters I I Phycol. Res. Vol. 53. P. 247-254.
Horiguchi T., Yoshizawa-Ebata J., Nakayama T. 2000. Halostylo-
dinium arenarium, gen. et sp. nov. (Dinophyceae), a coccoid sand-dwelling
dinoflagellate from subtropical Japan I I J. Phycol. Vol. 36. P. 960-971.
Horstmann U. 1981. Observations on the peculiar diurnal migration
of a red tide Dinophyceae in tropical shallow waters // J. Phycol. Vol. 16.
P. 481-485.
Hovasse R., Brown E.M. 1953. Contribution a la connaissance des Ra-
diolaires et de leurs parasites Syndiniens //Ann. Sci. Nat. Vol. 15. P. 405-438.
Huber G. 1914. Formanomalien bei Ceratium hirundinella O. F. M. H
Int. Rev. Ges. Hydrol. Hydrogr. Biol. Suppl.6. S. 1-40.
Huber G., Nipkov F. 1922. Experimentelle Untersuchungen fiber die
Entwicklung und Formbildung von Ceratium hirundinella O. F. Mfiller // Z.
Bot. Bd 14. S. 357-371.
Huber G., Nipkov F. 1923. Experimentelle Untersuchungen fiber die
Entwicklung und Formbildung von Ceratium hirundinella O. F. Mfiller //
Flora N. F. 1923. Bd 116. S. 114-215.
Huber-Pestalozzi G. 1950. Das Phytoplankton des Susswassers. Sys-
tematik und Biologie. 3. Cryptophyceen, Chloromonadinen, Peridineen. Die
Binnengewasser. Einzeldarstellungen aus der Limnologie und ihren Nach-
bargebieten. Stuttgart: E. Schweizerbart’sche Verlagsbuchhandlung (Erwin
Nagele). 310 S.
Hudson D.A., Shields J.D. 1994. Hematodinium australis n. sp., a para-
sitic dinoflagellate of the sand crab Portunus pelagicus from Moreton Bay,
Australia // Dis. Aquat. Org. Vol. 19. P. 109-119.
Hutchinson G.F. 1967. A treatise of limnology. Vol. 2. Introduction to
lake biology and the limnoplankton. N.Y.: Wiley. 115 p.
Idso C.D. 2009. CO2, global warming and coral reefs: prospects for the
future. Washington, D.C. : Center for the Study of Carbon Dioxide and Global
Change & Science and Public Policy Institute. 81 p.
Ikavalko J., Gradinger R. 1997. Flagellates and heliozoans in the
Greenland Sea ice studied alive using light microscopy // Polar Biol. Vol. 17.
P. 473-481.
Inagaki Y., Hayashi-Ishimaru Y., Ehara M., Igarashi L, Ohama T.
1997. Algae or Protozoa: phylogenetic position of euglenophytes and dino-
flagellates as inferred from mitochondrial sequences // J. Mol. Evol. Vol. 45.
P. 295-300.
Intergovernmental Oceanographic Commission (IOC). 2010. IOC
taxonomic reference list of toxic plankton algae, http://www.bi.ku.dk/ioc/
default, asp
DINOFLAGELLATA
89
International Code of Botanical Nomenclature (Vienna Code) ad-
opted by the Seventeenth International Botanical Congress, Vienna, Aus-
tria, July 2005. 2006. J. McNeill, F.R. Barrie, H.M. Burdet, V. Demoulin,
D.L. Hawksworth, K. Marhold, D.H. Nicolson, J. Prado, P.C. Silva, J.E. Skog,
J.H. Wiersema, N.J. Turland (eds). International Association for Plant Tax-
onomy. http://ibot.sav.sk/icbn/main.htm
Iwataki M. 2008. Taxonomy and identification of the armored dinofla-
gellate genus Heterocapsa (Peridiniales, Dinophyceae) H Plankton Benthos
Res. Vol. 3.P. 135-142.
Iwataki M., Botes L., Sawaguchi T., Sekiguchi K., Fukuyo Y. 2003.
Cellular and body scale structure of Heterocapsa ovata sp. nov. and Hetero-
capsa orientalis sp. nov. (Peridiniales, Dinophyceae) // Phycologia. Vol. 42.
P. 629-637.
Iwataki M., Hansen G., Sawaguchi T., Hiroishi S., Fukuyo Y. 2004.
Investigations of body scales in twelve Heterocapsa species (Peridiniales,
Dinophyceae), including a new species H. pseudotriquetra sp. nov. // Phyco-
logia. Vol. 43. P. 394-403.
Iwataki M., Takayama H., Matsuoka K., Fukuyo Y. 2002. Hetero-
capsa lanceolata sp. nov. and Heterocapsa horiguchi sp. nov. (Peridiniales,
Dinophyceae), two new marine dinoflagellates from coastal Japan // Phyco-
logia. Vol. 41. P. 470-479.
Jacobsen D.M. 1999. A brief history of dinoflagellate feeding research //
J. Eukar. Microbiol. Vol. 46. P. 376-381.
Javornicky P. 1997. Bernardinium Chodat (Dinophyceae), an athecate
dinoflagellate with reverse, right-handed course of the cingulum and trans-
verse flagellum, and Esoptrodinium genus novum, its mirror-symmetrical
pendant //Algol. Studies. Vol. 87. P. 29-42.
Jeong H.J., Kim J.S., Park J.Y., Kim J.H., Kim S., Lee L, Lee S.H.,
Ha J.H., Yih W.H. 2005. Stoeckeria algicida n. gen., n. sp. (Dinophyceae)
from the coastal waters off southern Korea: morphology and small subunit
ribosomal DNA gene sequence П J. Eukaryot. Microbiol. Vol. 52. No. 4.
P. 382-390.
Johnson A.M., Baverstock P.R. 1989. Rapid ribosomal RNA sequenc-
ing and the phylogenetic analysis of protists // Parasitol. Today. Vol. 74.
P. 847-860.
Kang N.S., Jeong H.J., Moestrup 0., Shin W., Nam S.W., Park, de
Salas M.F., Kim K.W., Noh J.H. 2010. Description of a new planktonic mix-
otrophic dinoflagellate Paragymnodinium shiwhaense n. gen., n. sp. from the
coastal waters off western Korea: morphology, pigments, and ribosomal DNA
gene sequence //J. Eukaryot. Microbiol. Vol. 57. No. 2. P. 121-144.
Kang N.S., Jeong H.J., Moestrup 0., Park T.G. 2011. Gyrodiniellum
shiwhaense n. gen., n. sp., a new planktonic heterotrophic dinoflagellate from
the coastal waters of western Korea: morphology and rhibosomal DNA gene
sequence 11 J. Eukaryot. Microbiol. Vol. 58. No. 4. P. 284-309.
Karsten G. 1907. Das Indische Phytoplankton nach dem Material der
Deutschen Tiefsee-Expedition, 1898-1899 // Wiss. Ergebn. Dtsch. Tiefsee-
Exped. Valdivia. Bd. 11(2). S. 221-548.
Karpov S.A. 2000. Flagellate phylogeny: An ultrastructural approach I I
B.S.C. Leadbeater, J.C. Green (eds). The.flagellates: Unity, diversity and evo-
lution.The Systematics Assoc. Spec. Vol. Ser. 59. London, N.Y.: Taylor &
Francis Ltd. P. 336-360.
Kelley L, Pfiester L.A. 1989. Vegetative reproduction of the freshwater
dinoflagellate Gloeodinium montanum 11 J. Phycol. Vol. 25. P. 241-247.
Klut M.E., Bisalputra T., Antia N.J. 1985. Some cytochemical studies
on the cell surface of Amphidinium carteri (Dinophyceae) // Protoplasma.
Vol. 129. P. 93-99.
Koeppen N. 1899. Hyalosaccus ceratii nov. gen. et sp., parazit ‘Dinofla-
gellat’ // Zap. Kievsk. Obshch. Estestvoisp. Vol. 16. P. 89-135.
Kofoid C.A. 1907. The plates of Ceratium with a note on the unity of the
genus 11 Zool. Anz. Bd 32. S. 177-183.
Kofoid C.A. 1909. On Peridinium steini Jorgensen, with a note on the
nomenclature of the skeleton of the Peridinidae // Arch. Protistenk. Bd 16.
No. l.S. 25-47, Taf. 2.
Kofoid C.A., Michener J.R. 1911. New genera and species of dino-
flagellates H Bull. Mus. Compar. Zool. Harvard Coll. Vol. 54. No. 7. P. 265-
302.
Kofoid C.A., Skogsberg T. 1928. The Dinoflagellata: the Dinophysoi-
dae // Mem. Mus. Compar. Zool. Harvard Coll. Vol. 51. P. 1-706, pl. 1-31.
Kofoid C.A., Swezy O. 1921. The free-living unarmored Dinoflagel-
lata // Mem. Univ. Calif. Vol. 5. Berkeley, California. 562 p.
Kokinos J.P., Eglinton T.I., Goni M., Boon J.J., Martoglio P.A., An-
derson D.A. 1998. Characterization of a highly resistant biomacromolecular
material in the cell wall of a marine dinoflagellate resting cyst // Org. Geo-
chem. Vol. 28. P. 265-288.
Konovalova G.V. 1989. Phytoplankton blooms and red tides in the Far
East coastal waters of the USSR H T. Okaichi, D.M. Anderson, T. Nemoto
(eds). Red tides: biology, environmental science and toxicology. Proceedings
of the First International Symposium on Red Tides. Takamatsu, November
1987. N.Y.: Elsevier. P. 97-100.
Konovalova G.V. 1993a. Toxic and potentially toxic dinoflagellates
from the Far East coastal waters of Russia H T. Smayda, Y. Shimizu (eds).
Toxic phytoplankton blooms in the sea. N.Y: Elsevier. P. 275-279.
Konovalova G.V. 1993b. Toxic and potentially toxic Alexandrium
Halim species (Dinophyta) from the coastal waters of eastern Kamchatka 11
Альгология. T. 3. № 3. C. 49-52.
Kraberg A., Baumann M., Diirselen C.-D. 2010. Coastal phytoplank-
ton: Photo guide for northern European seas. Munchen: Verlag Dr. Friedrich
Pfeil. 204 p.
Kremp A. 2001. Effects of cyst resuspension on germination and seed-
ing of two bloom-forming dinoflagellates in the Baltic Sea // Mar. Ecol. Progr.
Ser. Vol. 216. P. 57-66.
Kremp A., Elbrachter M., Schweikert M., Wolny J.L., Gottschling
M. 2005. Woloszynskia halophila (Biecheler) comb, nov.: a bloom-forming
cold-water dinoflagellate co-occuring with Scrippsiella hangoei (Dinophy-
ceae) in the Baltic Sea I I J. Phycol. Vol. 41. P. 629-642.
Krishnan S., Barnabas S., Barnabas J. 1990. Interrelationship among
major protistan groups based on parsimony network of 5S rRNA sequences //
BioSystems. Vol. 24. P. 135-144.
Kumazaki T., Hori H., Osawa S. 1983. Phylogeny of Protozoa de-
duced from 5S rRNA sequences // J. Mol. Evol. Vol. 19. P. 411-419.
Kurisu Y., Sato S., Kobayasi K., Ogata T., Kotaki Y. 2003. Detection
of domoic acid in the culture of Prorocentrum lima I IDINO7, Seventh Inter-
national Conference on Modem and Fossil Dinoflagellates, September 21-25,
2003, Yataro, Nagasaki, Japan. Abstracts. P. 67.
LaJeunesse T.C., Lambert G., Andersen R.A., Coffroth M.A., Gal-
braith D.W. 2005. Symbiodinium (Pyrrhophyta) genome sizes (DNA content)
are smallest among dinoflagellates // J. Phycol. Vol. 41. P. 880-886.
Landsberg J.H. 2002. The effects of harmful algal blooms on aquatic
organisms // Rev. Fish. Sci. Vol. 10. P. 113-390.
Landsberg J.H., Steidinger K.A., Blakesley B.A., Zondervan R.L.
1994. Scanning electron microscope study of dinospores of Amyloodinium
cf. ocellatum, a pathogenic dinoflagellate parasite of marine fish, and com-
ments on its relationship to the peridiniales // Dis. Aquat. Org. Vol. 20.
P. 23-32.
Larsen J., Nguyen N.L. (eds). 2004. Potentially toxic microalgae of
Vietnamese waters. Opera Botanica. Vol. 140. P. 5-216.
Larsen J., Sournia A. 1991. The diversity of heterotrophic dinoflagel-
lates // D.J. Patterson, J. Larsen (eds). The biology of free-living heterotrophic
flagellates. The Syst. Assoc. Special Issue N 45. Oxford: Clarendon Press.
P. 313-332.
Laurent D., Yeeting B., Labrosse P., Gaudechoux J.-P. 2005. Cigua-
tera: a field reference guide. Noumea, New Caledonia: Secretariat of the Pa-
cific Community and Institut de Recherche pour le D6veloppement. 88 p.
Leblond J.D., Chapman P.J. 2002. A survey of the sterol composition
of the marine dinoflagellates Karenia brevis, Karenia mikimoto, and Karlo-
dinium micrum\ distribution of sterols within other members of the class Di-
nophyceae // J. Phycol. Vol. 38. P. 670-682.
Lebour M.V. 1925. The dinoflagellates of northern seas. Plymouth: The
Marine Biological Association of the United Kingdom. 250 p.
Lee J.J., McEnery M.E., Kahn E.G., Schuster F.L. 1979. Symbio-
sis and the evolution of larger foraminifera 11 Micropaleontology. Vol. 25.
P. 118-140.
Lee R.E. 2008. Phycology. 4th ed. Cambridge: Cambridge Univ. Press.
547 p.
Leggat W., Marendy E.M., Baillie B., Whitney S.M., Ludwig M.,
Badger M.R., Yellowlees D. 2002. Dinoflagellate symbioses: strategies and
adaptations for the acquisition and fixation of inorganic carbon // Funct. Plant
Biol. Vol. 29. P. 309-322.
Legrand C., Rengefors K., Fistarol G.O., Graneli E. 2003. Allelopa-
thy in phytoplankton — biochemical, ecological and evolutionary aspects //
Phycologia. Vol. 42. P. 406-419.
Lehane L., Lewis R.J. 2000. Ciguatera: recent advances but the risk
remains // Int. J. Food Microbiol. Vol. 61. P. 91-125.
Lemmermann E. 1899. Ergebnisse einer Reise nach dem Pacific
(H. Schauinsland 1896/97) I I Abh. Naturwiss. Ver. Bremen. Bd 16. No. 2.
S. 313-398, Taf. 1-3.
Lemmermann E. 1910. Klasse Peridiniales 11 Kryptogamenflora der
Mark Brandenburg und angrenzender Gebeite, III Algen I (Schizophyceen,
Flagellaten, Peridineen). Leipzig. S. 563-712, 869.
Lenaers G., Maroteaux L., Michot B., Herzog M. 1989. Dinoflagel-
lates in evolution. A molecular phylogenetic analysis of large subunit ribo-
somal RNA// J. Mol. Evol. Vol. 29. P. 40-51.
90
DINOFLAGELLATA
Lenaers G., Scholin C., Bhaud Y., Saint-Hilaire D., Herzog M. 1991.
A molecular phylogeny of dinoflagellate protists (Pyrrhophyta) inferred from
the sequence of 24S rRNA divergent domains DI and D8 // J. Mol. Evol. Vol.
32. P. 53-63.
Lentin J.K., Williams G.L. 1981. Fossil dinoflagellates: index to gen-
era and species H Bedford Inst. Oceanogr. Rep. Ser. BI-81-12. vii + 345 p.
Levasseur M., Couture J.-Y., Weise A.M., Michaud S., Elbrachter
M., Sauve G., Bonneau E. 2003. Pelagic and epiphytic summer distributions
of Prorocentrum lima and P mexicanum at two mussel farms in the Gulf of St.
Lawrence, Canada //Aquat. Microb. Ecol. Vol. 30. P. 283-293.
Levy M.G., Litaker R.W., Goldstein R.J., Dykstra M.J., Vandersea
M.W., Noga E.J. 2007. Piscinoodinium, a fish-ectoparasitic dinoflagellate,
is a member of the class Dinophyceae, subclass Gymnodiniphycidae: con-
vergent evolution with Amyloodinium I I J. Parasitol. Vol. 93. No. 5. P. 1006-
1015.
Lewis R.J. 2001. The changing face of ciguatera // Toxicon. Vol. 39.
P. 97-106.
Licea-Dur&n S., Moreno-Ruiz J.L., Santoyo-Reyes H., Figueroa G.
1995. Dinoflageladas del Golfo de California. Mexico, D.F.: Universidad
Autonoma de Baja California Sur, SEP-FOMES, PROMARCO, ix + 165 p.
Lindberg K., Moestrup 0., Daugbjerg N. 2005. Studies on woloszyn-
skioid dinoflagellates I: Woloszynskia coronata re-examined using light and
electron microscopy and partial LSU rDNA sequences, with description of
Tovellia gen. nov. and Jadwigia gen. nov. (Tovelliaceae fam. nov.) I I Phyco-
logia. Vol. 44. P. 416-440.
Lindemann E. 1928. Peridineae (Dinoflagellatae) // A. Engler. &
K. Prantl (eds). Die naturlichen Pflanzenfamilien, 2 Aufl., 2. Leipzig: Engel-
mann, 104 S.
Lister T.R. 1970. The acritarchs and chitinozoa from the Wenlock and
Ludlow Series of the Ludlow and Millichope areas, Shropshire. Palaentologi-
cal Society Monographs 124 (publication 528). 100 p., pl. 1-13.
Litaker R.W., Steidinger K.A., Mason P.L., Landsberg J.H., Shields
J.D., Reece K.S., Haas L.W., Vogelbein W.K., Vendersea M.W., Kibler
S.R., Tester P.A. 2005. The reclassification of Pfiesteria shumwayae (Dino-
phyceae): Pseudopfiesteria, gen. nov. 11 J. Phycol. Vol. 41. P. 643-651.
Litaker R.W., Vendersea M.W., Faust M.A., Kibler S.R., Chinain M.,
Holmes M.J., Holland W.C., Tester P.A. 2009. Taxonomy of Gambierdiscus
including four new species, Gambierdiscus caribaeus, Gambierdiscus caro-
linianus, Gambierdiscus carpenteri and Gambierdiscus ruetzleri (Gonyaula-
cales, Dinophyceae) // Phycologia. Vol. 48. No. 5. P. 344-390.
Litaker R.W., Vendersea M.W., Kibler S.R., Madden V. J., Noga E.J.,
Tester P.A. 2002. Life cycle of the heterotrophic dinoflagellate Pfiesteria pi-
scicida (Dinophyceae)// J. Phycol. Vol. 38. P. 442-463.
LoCicero V.R. (ed.). 1975. Proceedings of the First International Con-
ference on Toxic Dinoflagellate Blooms I Wakefield, Massachusetts: Massa-
chusetts Science and Technology Foundation, viii + 541 p.
Loeblich III A.R. 1965. Dinoflagellate nomenclature 11 Taxon. Vol. 14.
No. l.P. 15-18.
Loeblich III A.R. 1967. Nomenclatural notes in the Pyrrhophyta, Xan-
thophyta and Euglenophyta // Taxon. Vol. 16. No. 1. P. 68-69.
Loeblich III A.R. 1970. The amphiesma or dinoflagellate cell cover-
ing // Proceedings of the North American Paleontological Convention, Sep-
tember 1969, Chicago. Part G. P. 867-929.
Loeblich III A.R. 1976a. Dinoflagellate evolution: speculation and evi-
dence H J. Protozool. Vol. 23. No. 1. P. 13-28.
Loeblich III A.R. 1976b. Dinoflagellate genetics and DNA characte-
rization I I Stadler Symposium, vol.8. Columbia, Univ, of Missouri, P. 111—
128.
Loeblich III A.R. 1980. Dinoflagellates nomenclature // Taxon. Vol. 29.
No. 2-3. P. 321-324.
Loeblich III A.R. 1982. General characteristics of phytoplankton: dino-
flagellates // CRC handbook of biosolar resources. Vol. 1. Part 2. Basic prin-
ciples / O.R. Zaborsky, A. Mitzui, C.C. Black (eds). Boca Raton, FL: CRC
Press, Inc. P. 37-47.
Loeblich III A.R. 1984. Dinoflagellate evolution // D.L. Spector (ed.).
Dinoflagellates. Orlando et al.: Academic Press, Inc. P. 481-522.
Loeblich III A.R., Loeblich L.A. 1984. Dinoflagellate cysts 11 D.L.
Spector (ed.). Orlando et al.: Academic Press, Inc. P. 443-480.
Loeblich III A.R., Sherley J.L. 1979. Observations on the theca of the
motile phase of free-living and symbiotic isolates of Zooxanthella microadri-
atica (Freudental) comb. nov. H J. Mar. Biol. Ass. U.K. Vol. 59. P. 195-205.
Loeblich A.R. Jr., Loeblich III A.R. 1966. Index to the genera, sub-
genera and sections of the Pyrrhophyta // Studies in Trop. Oceanogr. Univ.
Miami. Vol. 3. P. 1-94, pl. 1.
Loeblich A.R. Jr., Loeblich III A.R. 1968. Index to the genera, sub-
genera and sections of the Pyrrhophyta, IIH J. Paleontol. Vol. 42. P. 210-213.
Loeblich A.R. Jr., Loeblich HI A.R. 1969. Index to the genera, subgen-
era and sections of the Pyrrhophyta, III // J. Paleontol. Vol. 43. P. 193-198.
Loeblich A.R. Jr., Loeblich III A.R. 1970a. Index to the genera, sub-
genera and sections of the Pyrrhophyta, IV // J. Paleontol. Vol. 44. P. 536-543.
Loeblich A.R. Jr., Loeblich III A.R. 1970b. Index to the genera, sub-
genera and sections of the Pyrrhophyta, [V] H Phycologia. Vol. 9. P. 199-203.
Loeblich A.R. Jr., Loeblich III A.R. 1972. Index to the genera, sub-
genera and sections of the Pyrrhophyta, VII I Phycologia. Vol. 10. P. 309-314.
Loeblich A.R. Jr., Loeblich III A.R. 1974. Index to the genera, sub-
genera and sections of the Pyrrhophyta, VII // Phycologia. Vol. 13. P. 57-61.
Logares R., Daugbjerg N., Boltovskoy A., Kremp A., Laybourn-
Parry J., Rengefors K. 2008. Recent evolutionary diversification of a protest
lineage // Environm. Microbiol. Vol. 10. No. 5. P. 1231-1243.
Lorn J. 1981. Fish invading dinoflagellates: a sinopsis of existing and
newly proposed genera // Fol. Parasitol. Vol. 28. P. 3-11.
Lorn J., Rohde K., Dykova I. 1993. Crepidodinium australe n. sp., an
ectocommensal dinoflagellate from the gills of Sillago ciliata, an estuarine
fish from the New South Wales coast of Australia // Dis. Aquat. Org. Vol. 15.
P. 63-72.
Lombard E.H., Capon B. 1971. Observations on the tidepool ecology
and behaviour of Peridinium gregarium 11 J. Phycol. Vol. 7. P. 188-194.
Lopes R.M., Silveira M. 1994. Symbiosis between a pelagic flatworm
and a dinoflagellate from a tropical area-structural observations // Hydrobio-
logia. Vol. 287. P. 277-284.
Lucas LA.N. 1991. Symbionts of the tropical Dinophysiales (Dinophy-
ceae) // Ophelia. Vol. 33. P. 213-224.
Manier J.-F., Fize A., Grizel H. 1971. Syndinium gammari n. sp. Рёп-
dinien Duboscquonidida Syndinidae, parasite de Gammarus locusta (Lin.)
Crustac6 Amphipode // Protistologica. Vol. 7. P. 213-219.
Mason P.L., Litaker R.W., Jeong H.J., Ha J.H., Reece K.S., Stokes
N.A., Park J.Y., Steidinger K.A., Vandersea M.W., Kibler S., Tester P.A.,
Vogelbein W.K. 2007. Description of a new genus of PfiesteriaAike dinoflagel-
late, Luciella gen. nov. (Dinophyceae), including two new species: Luciella ma-
sanensis sp. nov. and Luciella atlantis sp. nov. I I J. Phycol. Vol. 43. P. 799-810.
McLean N., Galt C.P. 1990. Apodinium floodi n. sp., a dinoflagellate
(Dinoflagellata: Apodinidae) ectoparasitic on Oikopleura labradorensis (Uro-
chordata: Larvacea) // Dis. Aquat. Org. Vol. 9. P. 213-219.
McLean N., Nielsen C. 1989. Oodinium jordani n. sp., a dinoflagel-
late (Dinoflagellata: Oodinidae) ectoparasitic on Sagitta elegans (Chaetogna-
tha) // Dis. Aquat. Org. Vol. 7. P. 61-66.
McNally K.L., Govind N.S., Thome P.E., Trench R.K. 1994. Small-
subunit ribosomal DNA sequence analyses and a reconstruction of the in-
ferred phylogeny among symbiotic dinoflagellates (Pyrrophyta) // J. Phycol.
Vol. 30. P. 316-329.
Medlin L.K., Lange M., Wellbrock U., Donner G., Elbrachter M.,
Hummert C., Luckas B. 1998. Sequence comparisons link toxic European
isolates of Alexandrium tamarense from the Orkney Islands to toxic North
American stocks // Europ. J. Protistol. Vol. 34. P. 329-335.
Melkonian M., Beech P.L., Katsaros C., Schulze D. 1992. Centrin-
mediated cell motility in algae // M. Melkonian (ed.). Algal cell motility. N.Y.,
London: Chapman & Hall. P. 179-221.
Meunier A. 1910. Microplancton des mers de Barents et de Kara. Due
d’Orleans Campagne Arctique de 1907. Bruxelles. 355 p., pl. 1-37.
Mills C.E., McLean N. 1991. Ectoparasitism by a dinoflagellate (Di-
noflagellata: Oodinidae) on 5 ctenophores (Ctenophora) and a hydromedusa
(Cnidaria) // Dis. Aquat. Org. Vol. 10. P. 211-216.
Moestrup 0., Hansen G., Daugbjerg N. 2008. Studies on woloszyn-
skioid dinoflagellates III: on the ultrastructure and phylogeny of Borghiella
dodgei gen. et sp. nov., a cold-water species from Lake Tovel, N. Italy, and
on B. tenuissima comb. nov. (syn. Woloszynskia tenuissimd) // Phycologia.
Vol. 47. P. 54-78.
Moestrup 0., Lindberg K., Daugbjerg N. 2009a. Studies on wolo-
szynskioid dinoflagellates IV: The genus Biecheleria gen. sp. // Phycol. Res.
Vol. 57. P. 203-220.
Moestrup 0., Lindberg K., Daugbjerg N. 2009b. Studies on wolo-
szynskioid dinoflagellates V. Ultrastructure of Biecheleriopsis gen. sp., with
description of Biecheleriopsis adriatica sp. nov. // Phycol. Res. Vol. 57.
P. 221-237.
Mohammad-Noor N., Daugbjerg N., Moestrup 0., Anton A. 2007.
Marine epiphytic dinoflagellates from Malaysia — a study of live cultures and
preserved samples based on light and scanning electron microscopy 11 Nordic
J. Bot. Vol. 24. P. 629-690.
Moldowan J.M., Dahl J., Jacobson S.R., Huizinga B.J., Fago F.J.,
Shetty R., Watt D.S., Peters K.E. 1996. Chemostratigraphic reconstruction
of biofacies: Molecular evidence linking cyst-forming dinoflagellates with
pre-Triassic ancestors H Geology. Vol. 24. P. 159-162.
DINOFLAGELLATA
91
Moldowan J.M., Talyzina N.M. 1998. Biogeochemical evidence for
dinoflagellate ancestors in the early Cambrian // Science. Vol. 281. P. 1168—
1170.
Montresor M., Procaccini G., Stoecker D.K. 1999. Polarella glacia-
lis gen. sp., sp. nov. (Dinophyceae). Suessiaceae are still alive // J. Phycol.
Vol. 35. P. 186-197.
Montresor M., Lovejoy C., Orsini L., Procaccini G. 2003. Bipolar
distribution of the cyst-forming dinoflagellate Polarella glacialis // Polar
Biol. Vol. 23. P. 186-194.
Morrill L.C., Loeblich A.R. III. 1981. A survey for body scales in di-
noflagellates and a revision of Cachonina and Heterocapsa (Pyrrhophyta) H
J. Plankton Res. Vol. 3. P. 53-65.
Morrill L.C., Loeblich A.R. III. 1983a. Ultrastructure of the dinofla-
gellate amphiesma // Intern. Rev. CytoL Vol. 82. P. 151-180.
Morrill L.C., Loeblich A.R. III. 1983b. Formation and release of body
scales in the dinoflagellate genus Heterocapsa // J. Mar. Biol. Assoc. UK.
Vol. 63. P. 905-913.
Miiller O.F. 1773. Vemicum terrestrium et fluviatilum seu animalium
infusorum, helminthicorum et testaceorum, non marinorum secincta histo-
ria // Havniae et Lipsiae. Vol. 1. P. 1-135.
Murray S., Flo Jorgensen M., Ho S.Y.W., Patterson D.J., Jermiin
L.S. 2005. Improving the analysis of dinoflagellate phylogeny based on
rDNA// Protist. Vol. 156. P. 269-286.
Murray S., Patterson D.J. 2004. Cabra matta, gen. nov., sp. nov., a new
benthic, heterotrophic dinoflagellate // Eur. J. Phycol. Vol. 39. P. 229-234.
Murray S., Hoppenrath M., Larsen J., Patterson D.J. 2006. Bysma-
trum teres sp. nov., a new sand-dwelling dinoflagellate from north-western
Australia // Phycologia. Vol. 45. No. 2. P. 161-167.
Netzel H., Diirr G. 1984. Dinoflagellate cell cortex // D.L. Spector
(ed.). Dinoflagellates. Orlando et al.: Academic Press, Inc. P. 43-105.
Nezan E., Chomerat N. 2011. Vulcanodinium rugosum gen. et sp. nov.
(Dinophyceae), un nouveau dinoflagelle marin de la cote mediterraneenne
fran^aise // Cryptogamie: Algologie. Vol. 32. No. 1. P. 3-18.
Nishitani L., Erickson G., Chew K.K. 1985. Role of the parasitic di-
noflagellate Amoebophrya ceratii in control of Gonyaulax catenella popula-
tions // D.M. Anderson, A.W. White, D.G. Baden (eds). Toxic dinoflagellates.
N.Y.: Elsevier Science Publ. P. 225-230.
Norris D.R. 1967. Algal consortisms in marine plankton И V. Krish-
namurthy (ed.). Proceedings of a Seminar on Sea, Salts and Plants, 1965.
Bhavnagar, India: Central Salt Mar. Chem. Res. Ind. P. 178-189.
Ohtsuka S., Nagasawa K., Gejima K. 2000. Review of parasites of
marine zooplankton // Bull. Plankton Soc. Japan. Vol. 47. No. 1. P. 1-16.
Okolodkov Y.B. 1993. Algae in the annual sea ice at Hooker Island,
Franz Josef Land, in August 1991 // Polish Polar Res. Vol. 14. No. 1. P. 25-
32.
Okolodkov Y.B. 1998. A checklist of dinoflagellates recorded from the
Russian Arctic seas // Sarsia. Vol. 83. No. 4. P. 267-292.
Okolodkov Y.B. 1999. An ice-bound planktonic dinoflagellate Peridi-
niella catenata (Levander) Balech: morphology, ecology and distribution //
Botanica Marina. Vol. 42. P. 333-341.
Okolodkov Y.B., Campos-Bautista G., Garate-Lizarraga I., Gonza-
lez-Gonzalez J.A.G., Hoppenrath M., Arenas V. 2007. Seasonal changes
of benthic and epiphytic dinoflagellates in the Veracruz reef zone, Gulf of
Mexico //Aquat. Microb. Ecol. Vol. 47. No. 3. P. 223-237.
Okolodkov Y.B., Garate-Lizarraga I. 2006. An annotated checklist of
dinoflagellates (Dinophyceae) from the Mexican Pacific // Acta Bot. Mex.
Vol. 72. P. 1-154.
Orlova T.Y., Konovalova G.V., Stonik I.V., Morozova T.V., Shevchen-
ko O.G. 2002. Harmful algal blooms on the eastern coast of Russia // F.J.R.
Taylor, VL. Trainer (eds). Harmful algal blooms in the PICES region of the
North Pacific. PICES Scientific Report No. 23. Secretariat/Publisher, North
Pacific Marine Science Organization (PICES). P. 47-73.
Park M.G., Yih W., Coats W. 2004. Parasites and phytoplankton, with
special emphasis on dinoflagellate infections. J. Eukaryot. Microbiol. Vol. 51.
No. 2. P. 145-155.
Pascher A. 1914. Uber Flagellaten and Algen // Ber. Dt. Bot. Ges. Bd
32. No. 2. S. 136-160.
Pascher A. 1927. Die braume Algenreihe aus der Verwandtschaft der
Dinoflagellaten (Dinophyceen) //Arch. Protistenk. Bd 58. No. 1. S. 1-54.
Pascher A. 1931. Systematisch Ubersicht fiber die mit Flagellaten in
Zusammenhang stehenden Algenreihen und Versuch einer Einreihung dieser
Algenstamme in die Stamme des Pflanzenreiches // Beih. Bot. Zentralblatt.
Bd 48-11. No. 2. S. 317-332.
Pechlaner R. 1971. Factors that control the production rate and biomass
of phytoplankton in high-mountain lakes // Mitt. Intemat. Verein. Limnol.
Bd 19. S. 125-145.
Pennick N.C., Clarke K.J. 1977. The occurrence of scales in the peri-
dinian dinoflagellate Heterocapsa triquetra (Ehrenb.) Stein // Br. Phycol.
Vol. 12. P. 63-66.
Peters N. 1930. Peridinea // Die Tierwelt der Nord- und Ostsee. Teil 2.
Leipzig. S. 13-84.
Pfiester L.A., Lynch R.A. 1980. Amoeboid stages and sexual reproduc-
tion of Cystodinium batavense and its similarity to Dinococcus (Dinophy-
ceae) // Phycologia. Vol. 19. P. 178-183.
Pfiester L.A., Popovsky J. 1979. Parasitic, amoeboid dinoflagellates //
Nature. Vol. 279. P. 421-424.
Philippe H., Adoutte A. 1998. The molecular phylogeny of Eukaryota:
solid facts and uncertainties // G.H. Coombs, K. Vickerman, M.A. Sleigh,
A. Warren (eds). 1998. Evolutionary relationships among protozoa. London:
Chapman & Hall. P. 25-56.
Pollingher U. 1987. Ecology of dinoflagellates. B. Freshwater ecosys-
tems // F.J.R. Taylor (ed.). The biology of dinoflagellates. Botanical Mono-
graphs 21. Oxford et al.: Blackwell Sci. Publ. Oxford et al. P. 502-529.
Pollungher U. 1988. Freshwater armored dinoflagellates: growth, re-
production strategies, and population dynamics // C.D. Sandgreen (ed.).
Growth and reproduction strategies of freshwater phytoplankton. Cambridge:
Cambridge Univ. Press. P. 134-174.
Popovsky J., Pfiester L.A. 1982. The life-histories of Stylodinium
sphaera Pascher and Cystodinedria inermis (Geitler) Pascher (Dinophyceae),
two freshwater facultative predator-autotrophs //Arch. Protistenk. Vol. 125.
P. 115-127.
Popovsky J., Pfiester L.A. 1990. Dinophyceae (Dinoflagellida). Jena,
Stuttgart: Gustav Fischer Verlag, 272 p.
Prezelin B.B. 1987. Photosynthetic physiology of dinoflagellates 11
F.J.R. Taylor (ed.). The biology of dinoflagellates. Botanical Monographs 21.
Oxford et al. Blackwell Sci. Publ. P. 174-223.
Raikov LB. 1994. The diversity of forms of mitosis in Protozoa: a com-
parative review // Europ. J. Protistol. Vol. 30. P. 253-269.
Raikov I.B. 1995. The dinoflagellate nucleus and chromosomes: meso-
karyote concept reconsidered // Acta Protozool. Vol. 34. P. 239-247.
Rampi L., Bernhard M. 1980. Chiave per la determinazione delle Peri-
dinee pelagiche mediterranee. Roma: Comitato Nazionale Energia Nucleare
RT/BIO (80), 8. 193 p.
Rasmussen B. 2005. Evidence for pervasive petroleum generation and
migration in 3.2 and 2.63 billion-year old shales // Geology. Vol. 33. P. 497-
500.
Raven J.A., Richardson K. 1984. Dinophyte flagella: A cost-benefit
analysis H New Phycol. Vol. 98. P. 259-276.
Reaser J.K., Pomerance R., Thomas P.O. 2000. Coral bleaching and
global climate change: scientific findings and policy recommendations // Con-
serv. Biol. Vol. 14. No. 5. P. 1500-1511.
Reguera B. 2002. Small cells in Dinophysis spp.: a life cycle strategy
for phytoplankters with a holoplanktonic way of living? // E. Garces, A. Zin-
gone, M. Montresor, B. Reguera, B. Dale (eds). Report of the Workshop on:
LIFEHAB: Life histories of microalgal species causing harmful blooms. Re-
search in Enclosed Seas series 12. Brussels: European Commission. P. 60-63.
Rengefors K. 2001. Freshwater dinoflagellates — life history and HAB
potential // E. Garces, A. Zingone, M. Montresor, B. Reguera, B. Dale (eds).
Report of the Workshop on: LIFEHAB: Life histories of microalgal species
causing harmful blooms. Research in Enclosed Seas series 12. Brussels: Eu-
ropean Commission. P. 64-66.
Rengefors K., Laybourne-Parry J., Logares R., Marshall W.A.,
Hansen G. 2008. Marine-derived dinoflagellates in Antarctic saline lakes:
community composition and annual dynamics // J. Phycol. Vol. 44. P. 592-
604.
Rengefors K., Legrand C. 2001. Toxicity in Peridinium aciculife-
rum — an adaptive strategy to overcome other winter phytoplankton // Lim-
nol. Oceanogr. Vol. 46. P. 1990-1997.
Ris H., Kubai D.F. 1974. An unusual mitotic mechanism in the parasitic
protozoan Syndinium sp. H J. Cell. Biol. Vol. 60. P. 702-720.
Rizzo P.J. 1991. The enigma of the dinoflagellate chromosome // J. Pro-
tozool. Vol. 38. No. 3. P. 246-252.
Rizzo P.J. 2003. Those amazing dinoflagellate chromosomes // Cell
Res. Vol. 13. P. 215-217.
Roberts K.R., Heimann K., Wetherbee R. 1995. The flagellar appara-
tus and canal structure in Prorocentrum micans (Dinophyceae) // Phycologia.
Vol. 34. P. 313-322.
Robinson N., Eglinton G., Brassell S.C., Cranwell P.A. 1984. Dino-
flagellate origin for sedimentary 4-methylsteroids and 5(//)-stanols // Nature.
Vol. 308. P. 439-442.
Rochon A., de Vernal A., Turon J., Matthiessen J., Head M. 1999.
Distribution of recent dinoflagellate cysts in surface sediments from the North
92
DINOFLAGELLATA
Atlantic Ocean and adjacent seas in relation to sea-surface parameters //
AASP Foundation Contributions Series. N35. 150 p., 14 pl.
Roenneberg T., Deng T.S. 1997. Photobiology of the Gonyaulax cir-
cadian system. I. Different phase response for red and blue light // Planta.
Vol. 202. P. 494-501.
Rose M., Cachon J. 1951. Diplomorpha paradoxa, n. g., n. sp. Pro-
tiste de 1’ectoderme des Siphonophores // C. R. Acad. Sci., Paris. Vol. 233.
P. 451-452.
Saburova M., Al-Yamani E, Polikarpov I. 2009. Biodiversity of free-
living flagellates in Kuwait’s intertidal sediments // BioRisk. Vol. 3. P. 97-110.
Saldarriaga J.F., Leander B.S., Taylor EJ.R., Keeling P.J. 2003. Les-
sardia elongata gen. et sp. nov. (Dinoflagellata, Peridiniales, Podolampada-
ceae) and the taxonomic position of the genus Roscoffia II J. Phycol. Vol. 39.
P. 368-378.
Saldarriaga J.E, Taylor EJ.R., Cavalier-Smith T., Menden-Deuer
S., Keeling P.J. 2004. Molecular data and the evolutionary history of dinofla-
gellates // Europ. J. Protistol. Vol. 40. P. 85-111.
Sampedro N., Fraga S., Penna A., Casabianca S., Zapata M., Fuen-
tes Grunewald C., Riobo P., Camp J. 2011. Barrufeta bravensis gen. nov.
sp. nov. (Dinophyceae): a new bloom-forming species from the northwest
Mediterranean Sea // J. Phycol. Vol. 47. No. 2. P. 375-392.
Sarjeant W.A.S., Downie C. 1966. The classification of dinoflagellate
cysts above generic level // Grana Palynologica. Vol. 6. P. 503-527.
Saunders G.W., Hill D.R.A., Sexton J.P., Andersen R.A. 1997.
Small-subunit ribosomal RNA sequences from selected dinoflagellates: test-
ing classical evolutionary hypotheses with molecular systematic methods //
D. Bhattacharya (ed.). Origins of algae and their plastids. Wien, N.Y.: Spring-
er-Verlag. P. 237-259.
Saville-Kent W. 1880-1882. A manual of the Infusoria: including a de-
scription of all known flagellate, ciliate and tentaculiferous Protozoa, British
and foreign, and an account of the organization and affinities of the sponges.
London, x + 913 p.
Scalera-Liaci L., Sciscioli M., Lepore E., Gaino E. 1999. Symbiotic
zooxanthellae in Cinachyra tarentina, a non-boring demosponge // Endocyt
Cell Res. Vol. 13 P. 105-114.
Schlegel M. 1991. Protist evolution and phylogeny as discerned from
small subunit ribosomal RNA sequence comparisons // Europ. J. Protistol.
Vol. 27. P. 207-219.
Shields J.D. 1994. The parasitic dinoflagellates of marine crustaceans //
Annu. Rev. Fish Dis. Vol. 4. P. 241-271.
Schiller J. 1933. Dinoflagellatae (Peridineae). Teil 1. Leipzig. 617 S.
Schiller J. 1937. Dinoflagellatae (Peridineae). Teil 2. Leipzig. 590 S.
Schnepf E. 1993. From prey via endosymbiont to plastid // R.A. Lewin
(ed.). Origins of plastids. N.Y., London: Chapman & Hall. P. 53-76.
Schnepf E., Elbrachter M. 1988. Cryptophycean-like double mem-
brane-bound chloroplast in the dinoflagellate, Dinophysis Ehrenb.: evolution-
ary, phylogenetic and toxicological implications // Botanica Acta. Vol. 101.
P. 196-203.
Schnepf E., Elbrachter M. 1992. Nutritional strategies in dinoflagel-
lates: a review with emphasis on cell biological aspects // Europ. J. Protistol.
Vol. 28. P. 3-24.
Schnepf E., Elbrachter M. 1999. Dinophyte chloroplasts and phylo-
geny — A review // Grana. Vol. 38. P. 81-97.
Scholin C.A., Anderson D.M. 1994. Identification of group- and strain-
specific genetic markers for globally distributed Alexandrium (Dinophyceae).
I. RFLP analysis of SSU rRNA genes // J. Phycol. Vol. 30. P. 744-754.
Scholin C.A., Hallegraeff G.M., Anderson D.M. 1995. Molecular evo-
lution of the Alexandrium tamarense ‘species complex’ (Dinophyceae): dis-
persal in the North American and West Pacific regions // Phycologia. Vol. 34.
No. 6. P. 472-485.
Scholin C.A., Herzog M., Sogin M., Anderson D.M. 1994. Identifi-
cation of group- and strain-specific genetic markers for globally distributed
Alexandrium (Dinophyceae). II. Sequence analysis of a fragment of the LSU
rRNA gene // J. Phycol. Vol. 34. P. 472-485.
Scholin C.A., Sogin M.L. 1993. Two distinct small-subunit ribosomal
RNA genes in the North American toxic dinoflagellate Alexandrium fundy-
ense (Dinophyceae) // J. Phycol. Vol. 29. P. 209-216.
Schuttenberg H.Z. (ed.). 2001. Coral bleaching: causes, consequences
and response. Selected Papers presented at the 9th International Coral Reef
Symposium on «Coral Bleaching: Assessing and Linging Ecological and So-
cioeconomic Impacts, Future Trends and Mitigation Planning». Coastal Man-
agement Report N2230. Narragansett, RI: Coastal Resources Center, Univ, of
Rhode Island. 101 p.
Schiitt F. 1896. Peridiniales (Peridineae, Dinoflagellata, Cilioflagellata,
arthrodele Flagellaten) // A. Engler, K. Prantl (eds). Die naturlichen Pflan-
zenfamilien nebst ihren Gattungen und wichtigeren Arten insbesondere den
Nutzpflanzen unter Mitwirkung zahlreicher hervorragender Fachgelehrten,
Teil 1, Abt. lb. Leipzig: Engelmann. S. 1-30.
Sekida S., Okuda K., Katsumata K., Horiguchi T. 2003. A novel type
of body scale found in two strains of Amphidinium species (Dinophyceae) //
Phycologia. Vol. 42. P. 661-666.
Sewell R.B.S. 1951. The epibionts and parasites of the planktonic Co-
pepoda of the Arabian Sea // John Murray Expedition 1933-34, Sci. Rep. Br.
Mus. (Nat. Hist.) Vol. 9. P. 255-394.
Sgrosso S., Esposito E, Montresor M. 2001. Temperature and day-
length regulate encystment in calcareous cyst-forming dinoflagellates // Mar.
Ecol. Progr. Ser. Vol. 211. P. 77-87.
Shalchian-Tabrizi K., Klaveness D., Rudi K., Delwiche C.F., Jako-
bsen K.S. 2000. Phylogenetic analyses indicate that the 19'hexanoyloxy-
fucoxanthin-containing dinoflagellates have tertiary plastids of haptophyte
origin // Molecular Biol. Evol. Vol. 17. P. 718-729.
Shimizu Y. 1987. Dinoflagellate toxins // F.J.R. Taylor (ed.). The bio-
logy of dinoflagellates. Botanical Monographs 21. Oxford et al.: Blackwell
Sci. Publ.P. 282-315.
Shumway W. 1924. The genus Haplozoon, Dogiel. Observations on the
life history and systematic position // J. Parasitol. Vol. 11. P. 59-74.
Siano R., Kooistra W.H.C.F., Montresor M., Zingone A. 2009. Un-
armoured and thin-walled dinoflagellates from the Gulf of Naples, with the
description of Woloszynskia cincta sp. nov. (Dinophyceae, Suessiales) // Phy-
cologia. Vol. 48. P. 44-65.
Siano R., Montresor M., Probert J., Not E, de Vargas C. 2010. Pela-
godinium gen. nov. and P beii comb, nov., a dinoflagellate symbiont of plank-
tonic foraminifera // Protist. Vol. 161. No. 3. P. 385-399.
Siebert A.E. Jr. 1973. A description of Haplozoon axiothellae n. sp., an
endosymbiont of the polychaete Axiothella rubrocincta 11 J. Phycol. Vol. 9.
P. 185-190.
Sigee D.C. 1984. Some observations on the structure, cation content and
possible evolutionary status of dinoflagellate chromosomes // Bot. J. Linn.
Soc. Vol. 88. P. 127-147.
Sigee D.C. 1986. The dinoflagellate chromosome // Adv. Bot. Res.
Vol. 12. P. 205-264.
Skovgaard A., Massana R., Balague V., Saiz E. 2005. Phylogenetic
position of the copepod-infesting parasite Syndinium turbo (Dinoflagellata,
Syndinea) // Protist. Vol. 156. P. 413-423.
Skovgaard A., Massana R., Saiz E. 2007. Parasitic species of the genus
Blastodinium (Blastodiniphyceae) are peridinioid dinoflagellates // J. Phycol.
Vol. 43. P. 553-560.
Skovgaard A., Meyer S., Overton J.L., Stottrup J., Buchmann K.
2010. Ribosomal RNA gene sequences confirm that protistan endoparasite
of larval cod Gadus morhua is Ichthyodinium sp. // Dis. Aquat. Org. Vol. 88.
P. 161-167.
Skovgaard A., Saiz E. 2006. Seasonal occurrence and role of protis-
tan parasites in coastal marine zooplankton // Mar. Ecol. Prog. Ser. Vol. 327.
P. 37-49.
Skovgaard A., Salomonsen X.M. 2009. Blastodinium galatheanum sp.
nov. (Dinophyceae) a parasite of the planktonic copepod Acartia negligens
(Crustacea, Calanoida) in the central Atlantic Ocean // Eur. J. Phycol. Vol. 44.
No. 3. P. 425-438.
Skvortzov B.V. 1969. The list of new genera and type species of flag-
ellates and algae published in 1959-1961. Part II // Hidrobiologia. Vol. 34.
No. 3-4. P. 343-347.
Skvortzov B.V. 1972a. The list of new genera and type species of flag-
ellates and algae published in 1966-1968. Part IV // Hidrobiologia. Vol. 39.
No. l.P. 1-7.
Skvortzov B.V. 1972b. The list of new genera and type species of flag-
ellates and algae published in 1969. Part V // Hidrobiologia. Vol. 39. No. 2.
P. 241-245.
Sogin M.L. 1989. Evolution of eukaryotic microorganisms and their
small subunit ribosomal RNAs //Amer. Zool. Vol. 29. P. 472-485.
Sournia A. 1968. Le genre Ceratium (peridinien planctonique) dans le
canal de Mozambique. Contribution a une revision mondiale // Vie et Milieu.
Vol. 18. P. 375-499.
Sournia A. 1973. Catalogue des especes et taxons intraspecifiques de
Dinoflagelles marins actuels publies depuis la revision de J. Schiller. I. Dino-
flagelles libres // Beih. Nova Hedw. Hf. 48. P. i-xii, 1-92.
Sournia A. 1978. Catalogue des especes et taxons intraspecifiques de
Dinoflagelles marins actuels publies depuis la revision de J. Schiller. (Com-
plement) // Rev. Algol., N. S. Vol. 13. No. 1. P. 3-40.
Sournia A. 1974. Circadian periodicities in natural populations of ma-
rine phytoplankton //Adv. Mar. Biol. Vol. 12. P. 325-389.
Sournia A. 1982a. Form and function in marine phytoplankton // Biol.
Rev. Vol. 57. P. 347-394.
DINOFLAGELLATA
93
Sournia A. 1982b. Is there a shade flora in the marine plankton? // J.
Plankton Res. Vol. 4. No. 2. P. 391-399.
Sournia A. 1984. Classification et nomenclature de divers dinoflagelles
marins (Dinophyceae) // Phycologia. Vol. 23. No. 3. P. 345-355.
Sournia A. 1986. Atlas du phytoplancton marin. Vol. I. Introduction,
Cyanophycees, Dictyochophycees, Dinophycees et Raphidophycees. Paris:
Editions du Centre National de la Recherche Scientifique. 219 p.
Sournia A. 1990. Catalogue des especes et taxons infraspecifiques de
dinoflagelles marins actuels publies depuis la revision de J. Schiller. V. (Com-
plement) //Acta Protozool. Vol. 29. P. 321-346.
Sournia A. 1993. Catalogue des especes et taxons infraspecifiques
de dinoflagelles marins actuels publies depuis la revision de J. Schiller. VI.
(Complement) // Cryptogamie, Algol. Vol. 14. P. 133-144.
Sournia A., Cachon J., Cachon M. 1975. Catalogue des especes et
taxons infraspecifiques de dinoflagelles marins actuels publies depuis la revi-
sion de J. Schiller. II — Dinoflagelles parasites ou symbiotique // Arch. Pro-
tistenk. Bdll7. S. 1-19.
Sournia A., Chretiennot-Dinet M.-J., Ricard M. 1991. Marine phyto-
plankton: how many species in the world ocean? // J. Plankton Res. Vol. 13.
No. 5. P. 1093-1099.
Spalter R.A., Walsh D., Reeves R.A., Saul D.J., Gray R.D., Bergquist
P.L., McKenzie L., Bergquist P.R. 1997. Sequence heterogeneity of the ri-
bosomal RNA intergenic region Alexandrium species // Biochem. Syst. Ecol.
Vol. 25. P. 231-239.
Sparmann S.F., Leander B.S., Hoppenrath M. 2008. Comparative
morphology and molecular phylogeny of Apicoporus n. gen.: a new genus
of marine benthic dinoflagellates formerly classified within Amphidinium //
Protist. Vol. 159. P. 383-399.
Spector D.L. 1984. Dinoflagellates: an introduction // D.L. Spector
(ed.). Dinoflagellates. Orlando et al.: Academic Press, Inc. P. 1-15.
Spero H.J. 1987. Symbiosis in the planktonic foraminifer, Orbulina
universa, and the isolation of its symbiotic dinoflagellate Gymnodinium beii
sp. nov. // J. Phycol. Vol. 23. P. 307-317.
Spindler M., Hemleben C.I.E. 1980. Symbionts in planktonic foramin-
ifera (Protozoa) // W. Schwemmler, H.E.A. Schenk (eds). Endosymbiosis and
cell biology. Berlin, N.Y.: Walter de Guyter & Co. P. 133-140.
Staker R.D., Bruno S.F. 1980. Diurnal vertical migration in marine
phytoplankton // Botanica Marina. Vol. 23. P. 167-172.
Starmach K. 1974. Flora slodkowodna Polski. T. 4. Cryptophyceae, Di-
nophyceae, Raphidophyceae. Warszawa, Krakow: Panstwowe wydawnictwo
naukowe. S. 115-462.
Steencamp E.T., Wright J., Baldauf S.L. 2006. The protistan origins
of animals and fungi // Mol. Biol. Evol. Vol. 23. P. 93-106.
Steidinger K.A., Davis J.T., Williams J. 1967. A key to the marine
dinoflagellate genera of the west coast of Florida. St. Petersburg, FL: Florida
Board of Conservation Marine Laboratory, vi + 45 p., pl. I-IX.
Steidinger K.A., Burkholder J.M., Glasgow Jr. H.B., Hobbs C.W.,
Garrett J.K., Truby E.W., Noga E.J., Smith S.A. 1996. Pfiesteriapiscicida
gen. et sp. nov. (Pfiesteriaceae fam. nov.), a new toxic dinoflagellate with a
complex life cycle and behaviour // J. Phycol, Vol. 32. P. 157-164.
Steidinger K.A., Cox E.R. 1980. Free-living dinoflagellates // E.R. Cox
(ed.). Phytoflagellates. N.Y.: Elsevier/North Holland. P. 407-432.
Steidinger K.A., Tangen K. 1996. Dinoflagellates // C. Tomas (ed.).
Identifying marine phytoplankton. San Diego, CA: Academic Press, Inc.
P. 387-584.
Steidinger K.A., Tangen K. 1997. Dinoflagellates // Identifying mari-
ne phytoplankton / C. Tomas (ed.). San Diego, CA: Academic Press. P. 387-
584.
Steidinger K.A., Williams J. 1970. Dinoflagellates. Memoirs of the
Hourglass Cruises. Vol. 1. St. Petersburg, FL. 251 p.
Steidinger K.A., Landsberg J.H., Mason P.L., Vogelbein W.K., Tes-
ter P.A., Litaker R.W. et al. 2006. Cryptoperidiniopsis brodyi gen. et sp. nov.
(Dinophyceae), a small lightly armored dinoflagellate in the Pfiesteriaceae //
J. Phycol. Vol. 42. P. 951-961.
Steidinger K.A., Wolny J.L., Haywood A.J. 2008. Identification
of Kareniaceae (Dinophyceae) in the Gulf of Mexico // Beih. Nova Hedw.
Vol. 133. P. 269-284.
Stein F.R. 1883. Der Organismus der Infusionsthiere nach eigenen Forsc-
hungen in systematischer Reihenfolge bearbeitet. Ill Abteilung. II. Halfte. Die
Naturgeschichte der arthrodelen Flagellaten. Leipzig. 30 S., 25 Taf.
Stentiford G.D., Shields J.D. 2005. A review of the parasitic dinofla-
gellates Hematodinium species and Hematodinium-Wks species in marine
crustaceans // Dis. Aquat. Org. Vol. 66. P. 47-70.
Steudler P.A., Schmitz F.J., Ciereszko L.S. 1977. Chemistry of coel-
enterates. Sterol composition of some predatory-prey pairs on coral reefs //
Comp. Biochem. Physiol. Vol. 56 В. P. 385-392.
Stewart J.M., Beck J.S. 1967. Distribution of the DNA and the
DNA-histone antigens in the nuclei of free-living and parasitic Sarcomasti-
gophora // J. Protozool. Vol. 14. P. 225-231.
Stoecker D.E., Buck K.R., Putt M. 1992. Changes in the sea-ice brine
community during the spring-summer transition, McMurdo Sound, Antarc-
tica. I. Photosynthetic protists // Mar. Ecol. Prog. Ser. Vol. 84. P. 265-278.
Stoecker D.E., Gustafson D.E., Merrell J.R., Black M.M.D., Baier
C.T. 1997. Excystment and growth of chrysophytes and dinoflagellates at
low temperatures and high salinities in Antarctic sea-ice // J. Phycol. Vol. 33.
P. 585-595.
Stoecker D.E., Gustafson D.E., Black M.M.D., Baier C.T. 1998. Pop-
ulation dynamics of microalgae in the upper land-fast sea ice at a snow-free
location // J. Phycol. Vol. 34. P. 60-69.
Stoecker D.K., Johnson M.D., de Vargas C., Not F. 2009. Acquired
phototrophy in aquatic protists //Aquat. Microb. Ecol. Vol. 57. P. 279-310.
Subrahmanyan R. 1968. The Dinophyceae of the Indian seas. I. Genus
Ceratium Schrank. Mar. Biol. Assoc. India, Mem. 2. 129 p., incl. 9 pl.
Subrahmanyan R. 1971. The Dinophyceae of the Indian seas. II. Fam-
ily Peridiniaceae Schutt emend. Lindemann. Mar. Biol. Assoc. India, Mem.
2. 334 p., incl. 79 pl.
Sweeney B.M. 1976. Pedinomonas noctilucae (Prasinophyceae), the
flagellate symbiotic in Noctiluca (Dinophyceae) in Southeast Asia // J. Phy-
col. Vol. 12. P. 460-464.
Sweeney B.M. 1980. Intracellular source of bioluminescence // Intern.
Rev. Cytol. Vol. 68. P. 173-193.
Sweeney B.M. 1987. Bioluminescence and circadian rhythms // F.J.R.
Taylor (ed.). The biology of dinoflagellates. Botanical Monographs 21. Ox-
ford et al.: Blackwell Sci. Publ. P. 269-281.
Tamura M., Horiguchi T. 2005. Pileidinium ciceropse gen. et sp. nov.
(Dinophyceae), a sand-dwelling dinoflagellate from Palau // Eur. J. Phycol.
Vol. 40. P. 281-291.
Tamura M., Shimada S., Horiguchi T. 2005. Galeidinium rugatum
gen. et sp. nov. (Dinophyceae), a new coccoid dinoflagellate with a diatom
endosymbiont // J. Phycol. Vol. 41. P. 658-671.
Tappan H. 1980. The paleobiology of plant protists. San Francisco, CA:
W.H. Freeman & Co. 1028 p.
Taylor F.J.R. 1976a. Flagellate phylogeny: a study in conflicts // J. Pro-
tozool. Vol. 23. P. 28-40.
Taylor F.J.R. 1976b. Dinoflagellates from the International Indian
Ocean Expedition. A report on material collected by the R. V «Anton Bruun»
1963-1964 // Bibliotheca Botanica. Hf. 132. 234 p , pl. 1-46.
Taylor F.J.R. 1980. On dinoflagellate evolution // BioSystems. Vol. 13.
No. 1-2. P. 65-108.
Taylor F.J.R. 1982. Symbiosis in marine microplankton // Ann. Inst.
Oceanogr. Paris (Nouv. Ser.). Vol. 58 (Suppl.). P. 61-90.
Taylor F.J.R. (ed.). 1987. The biology of dinoflagellates / Oxford et al.:
Blackwell Scientific Publications, xii + 786 p.
Taylor F.J.R. 1999. Morphology (tabulation) and molecular evidence
for dinoflagellate phylogeny reinforce each other // J. Phycol. Vol. 35.
P. 1-3.
Taylor F.J.R. 2004. Illumination or confusion? Dinoflagellate molecu-
lar phylogenetic data viewed from a primarily morphological standpoint //
Phycol. Res. Vol. 52. P. 308-324.
Taylor F.J.R., Hoppenrath M., Saldarriaga J.F. 2008. Dinoflagellate
diversity and distribution // Biodiv. Conserv. Vol. 17. P. 407-418.
Tenenbaum D.R., Villac M.C., Viana S.C., Matos M., Hatherly M.,
Lima I.V., Menezes M. 2004. Phytoplankton atlas of Sepetiba Bay, Rio de
Janeiro, Brazil // GloBallast Monograph Series N16. London: International
Maritime Organization. 132 p.
Tengs T., Dahlberg O.J., Shalchian-Tabrizi K., KI aven ess D.,
Rudi K., Delwiche C.F., Jakobsen K.S. 2000. Phylogenetic analyses indi-
cate that the 19’ hexanoyloxy-fucoxanthin-containing dinoflagellates have
tertiary plastids of haptophyte origin // Mol. Biol. Evol. Vol. 17. P. 718—
729.
Throndsen J. 1973. Motility in some marine nanoplankton flagellates //
Norwegian J. Zool. Vol. 21. P. 193-200.
Throndsen J., Hasle G.R., Tangen K. 2003. Norsk kystplanktonflora.
Oslo: Almater Forlag AS. 341 p.
Throndsen J., Hasle G.R., Tangen K. 2007. Phytoplankton of Norwe-
gian coastal waters. Oslo: Almater Forlag AS. 341 p.
Tillmann U., Elbrachter M., Krock B., John U., Cembella A. 2009.
Azadinium spinosum gen. et sp. nov. (Dinophyceae) identified as a primary
producer of azaspiracid toxins // Eur. J. Phycol. Vol. 44. No. 1. P. 63-79.
Tomas R.N., Cox E.R. 1973. Observations on the symbiosis of Peri-
dinium balticum and its intracellular alga. I. Ultrastructure // J. Phycol. Vol. 9.
P. 304-323.
94
DINOFLAGELLATA
Trench R.K. 1987. Dinoflagellates in non-parasitic symbioses // F.J.R.
Taylor (ed.). The biology of dinoflagellates. Botanical Monographs 21. Ox-
ford et al.: Blackwell Sci. Publ. P. 530-570.
Trench R.K. 1993. Microalgal-invertebrate symbioses — a review //
Endocyt. Cell Res. Vol. 9. P. 135-175.
Trench R.K., Blank R.J. 1987. Symbiodinium microadriaticum Freu-
denthal, S. goreauii sp. nov., S. kawagutii sp. nov. and S', pilosum sp. nov.:
gymnodinioid dinoflagellate symbionts of marine invertebrates // J. Phycol.
Vol. 23. P. 469-481.
Trench R.K., Wethey D.S., Porter J.W. 1981. Observations on the
symbiosis with zooxanthellae among Tridacnidae (Mollusca, Bivalvia) //
Biol. Bull. Vol. 161. P. 180-198.
Trick C.G., Andersen R.J., Harrison P.J. 1984. Environmental fac-
tors influencing the production of an antibacterial metabolite from a marine
dinoflagellate Prorocentrum minimum // Can. J. Fish. Aquat. Sci. Vol. 41.
P. 423-432.
Turquet J., Quad J.P., Coute A., Faust M.A. 1998. Assemblage of
benthic dinoflagellates and monitoring of harmful species in Reunion Island,
SW Indian Ocean, 1993-1996 // B. Reguera, J. Blanco, M.L. Fernandez,
T. Wyatt (eds). Harmful algae. Xunta de Galicia, Intergovernmental Oceano-
graphic Commission of UNESCO, Spain. P. 44-47.
Ushida T. 1981. The relationships between Prorocentrum micans-
growth and its ecological environment. Sci. Pap. Inst. Algol. Res. Fac. Sci.
Hokkaido Univ. Vol. 7. No. 1. P. 1-17.
von Oppen Mieog J.C., Sanchez C.A., Fabricius K.E. 2005.
Diversity of algal endosymbionts (zooxanthellae) in octocorals: the roles of
geography and host relationships // Mol. Ecol. Vol. 14. P. 2403-2417.
Wall D., Dale B. 1968. Modem dinoflagellate cysts and evolution of the
Peridiniales // Micropaleontology. Vol. 14. P. 265-304.
Wang J.T., Douglas A.E. 1997. Nutrient signals and photosynthetic re-
lease by symbiotic algae // Plant Physiol. Vol. 114. P. 631-636.
Warming E. 1875. Om nogle ved Denmafks Xyster levende Bakterier H
Vidensk. Medd. Dan. Naturhist. Foren. Kjobenhavn. Vol. 20-28. P. 305-420.
Warming E. 1890. Handbuch der systematischen Botanik. Berlin:
Deutsche Ausgabe. xii + 468 S.
Watanabe M., Suda S., Inouye I., Sawaguchi T., Chihara M. 1990.
Lepidodinium viride gen. et sp. nov. (Gymnodiniales, Dinophyta), a green di-
noflagellate with a chlorophyll a- and /^-containing endosymbiont // J. Phycol.
Vol. 26. P. 741-751.
Wells J.W. 1956. Scleractinia // R.C. Moore (ed.). Treatise on inverte-
brate paleontology. Lawrence, Kansas: Univ, of Kansas Press. P. F328-F444.
Wiktor J., Okolodkov Y.B. 1995. Phytoplankton // R.Z. Klekowski.
J.M. W^slawski (eds). Atlas of the marine flora of southern Spitsbergen.
Gdansk: Institute of Oceanology, Polish Academy of Sciences. P. 1-295.
Williams E.H., Bunkley-Williams L. 1990. The world-wide coral
bleaching cycle and related sources of coral mortality // Atoll Res. Bull.
Vol. 335. P. 1-71.
Williams G.L., Lentin J.K., Fensome R.A. 1998. The Lentin and Wil-
liams index of fossil dinoflagellates 1998 edition. American Association of
Stratigraphic Palynologists, Contribution Series, 34. 817 p.
Withers N.W. 1982. Ciguatera fish poisoning // Ann. Rev. Med. Vol. 33.
P. 97-111.
Withers N.W. 1987. Dinoflagellate sterols // F.J.R. Taylor (ed.). The
biology of dinoflagellates. Botanical Monographs 21. Oxford et al.: Blackwell
Sci. Publ. P. 316-359.
Wolters J. 1991. The troublesome parasites — molecular and morpho-
logical evidence that Apicomplexa belong to the dinoflagellate-ciliate clade //
BioSystems. Vol. 25. P. 75-83.
Wood E.J.F. 1954. Dinoflagellates in the Australian region // Austr. J.
Mar. Freshw. Res. Vol. 5. No. 2. P. 171-351.
Wood E.J.F. 1968. Dinoflagellates of the Caribbean Sea and adjacent
areas. Coral Gables, FL: Univ, of Miami Press. 142 p.
Yongshui L. 2009. Flora algarum marinarum sinicarum. T. 6. Pyrrophy-
ta. No. 1. Dinophyceae Ceratiaceae. Beijing: Science Press. 93 p., 18 pl.
Yoon H.S., Grant J., Tekle Y.I., Wu M., Chaon B.C., Cole J.C.,
Longson Jr. J.M., Patterson D.J., Bhattacharya D., Katz L.A. 2008.
Broadly sampled multigene trees of eukaryotes // BMC Evol. Biol. 8: 14.
doi:10.1186/1471-2148-8-14.
Yoon H.S., Hackett J.D., Bhattacharya D. 2002. A single origin of the
peridinin- and fucoxanthin-containing plastids in dinoflagellates through ter-
tiary endosymbiosis // Proc. Natl. Acad. Sci. U.S.A. Vol. 99. P. 11724-11729.
Zardoya R., Costas E., Lopez-Rodas V., Garrido-Pertierra A., Bau-
tista J.M. 1995. Revised dinoflagellate phylogeny inferred from molecular
analysis of large-subunit ribosomal RNA gene sequences // J. Mol. Evol.
Vol. 41. P. 637-645.
Zingone A., Wyatt T. 2005. Harmful algal blooms: keys to the under-
standing of the phytoplankton ecology // A.R. Robinson, K.H. Brink (eds).
The sea, vol. 13. The global coastal ocean: multiscale interdisciplinary pro-
cesses. Harvard: Harvard Univ. Press. P. 867-926.
Zonneveld K.A.F. 1997. New species of organic walled dinoflagellate
cysts from modem sediments of the Arabian Sea (Indian Ocean) // Rev. Palae-
bot. Palynol. Vol. 97. P. 319-337.
ACANTHARIA Muller 1855
Гетеротрофные протисты с аксоподиями, представите-
ли морского планктона. Клетка радиально симметрична. Все
представители обладают внутриклеточным минеральным ске-
летом из сульфата стронция. Скелет включает 20 радиальных
элементов, взаиморасположение которых строго упорядоче-
но и описывается так называемым законом Мюллера. На дис-
тальных концах спикул скелета растянут внеклеточный покров
из переплетенных между собой эластичных волокон. Покров
прикреплен к спикулам через сократимые фибриллы — мио-
фриски. Центральная капсула внеклеточная. Акантарии обита-
ют преимущественно в эпипелагиали тропических зон океанов.
У большинства видов имеются внутриклеточные симбиотиче-
ские микроводоросли.
История изучения
Акантарии, населяющие пелагиаль океана — это
крупные (до миллиметра и более) клетки с ярко окра-
шенной центральной зоной цитоплазмы и со свето-
преломляющими иглами. Они хорошо различимы в
планктонных ловах при малых увеличениях оптики
или даже невооруженным глазом. Поэтому акантарии
стали известны еще на заре изучения морского микро-
планктона. Представителя акантарий (Acanthometra)
впервые упомянул Мюллер (Muller, 1855).
Для Эрнеста Геккеля радиолярии (в том числе акан-
тарии) были излюбленным объектом.' Его изящные и
порой преувеличенно художественные иллюстрации,
представленные в частности в специальной моногра-
фии Die Radiolarien (Haeckel, 1862) и в знаменитых
сборниках таблиц Kunstformen der Natur (Геккель,
2009), сделали радиолярий известными широкой пуб-
лике (рис. 40).
Санкт-Петербургский зоолог В.Т. Шевяков, работая
на Неаполитанской морской биологической станции,
детально изучил фауну средиземноморских акантарий.
В отличие от предшественников, в частности Геккеля,
которые классифицировали акантарий исключитель-
но по строению минерального скелета, Шевяков ввел
в систематику акантарий цитологические признаки, и
эта традиция сохранилась до наших дней. Публикации
профессора Шевякова (Schewiakoff, 1902, 1926), иллю-
стрированные совершенными зоологическими рисун-
ками (рис. 41), и ныне, через столетие не утратили сво-
Рис. 40. Lychnaspis polyancistra (отр. Arthracanthida).
Рисунок (как Dorataspis polyancistra) Э. Геккеля (Haeckel, 1862).
его научного значения, оставаясь самым масштабным
исследованием, посвященным биологии и классифика-
ции акантарий.
Во второй половине XX века радиолярии вызывали
научный интерес в первую очередь как объект палеон-
тологических исследований. Поскольку скелет аканта-
рий не сохраняется в ископаемом состоянии, основное
внимание уделялось полицистинам, а интерес к аканта-
риям был незначителен. В этот период публикации по
акантариям немногочисленны, тем не менее, выяснены
детали организации скелета и изучена ультраструкту-
ра клетки. Крупный вклад внесли ученица В.А. Догеля
В.В. Решетняк и группа французских исследователей,
в первую очередь, Ж. и М. Кашоны и Ж. Февр (Решет-
няк, 1981; Cachon, Cachon, 1964; Febvre, 1990).
В начале XXI века акантарии вновь привлекли к
себе внимание биологов в связи с попытками прояс-
96
ACANTHARIA
Рис. 41. Phyllostaurus cuspidatus (отр. Arthracanthida).
ко — кортекс под натяжением; кш — кортикальный шов; м — миофри-
ски; о — отверстие, через которое выходит аксоподия; эвр — эластич-
ные волокна радиальные; эк — эктоплазма; цк — центральная капсула с
многочисленными ядрами внутри. Увел.: 200*. (По: Schewiakoff, 1926).
нить с помощью молекулярных методов филогенетиче-
ские связи амебоидных протистов (Nikolaev et al., 2004;
Kunitomo et al., 2006; Pawlowski, Burki, 2009; Gilg et al.,
2010).
Классификация
Система акантарий, созданная В.Т. Шевяковым
(Schewiakoff, 1926), никогда не вызывала серьезных
возражений и, с учетом небольших таксономических
уточнений, остается общепринятой в мире по сегод-
няшний день. В состав акантарий входят четыре груп-
пировки, традиционно рассматриваемые в ранге отря-
да. Основа классификации — характер сочленения игл
в центре клетки.
1. Отряд Holacanthida — спикулы диаметральные в количе-
стве 10.
2. Отряд Symphyacanthida — 20 спикул; основания всех спикул
сливаются в единый конгломерат.
3. Отряд Chaunacanthida — 20 спикул, которые сочленены
подвижно.
4. Отряд Arthracanthida — 20 спикул; основания игл пирами-
дальной формы, тесно прилежат друг к другу; спикулы соч-
ленены неподвижно. Стенка центральной капсулы толстая,
ясноразличимая.
Строение клетки
Все акантарий — одноклеточные организмы; ко-
лоний не образуют. Контур клетки центросимметри-
чен; он задается минеральным скелетом, состоящим из
спикул. Количество радиальных элементов — всегда
двадцать. Эти спикулы радиально расходятся из геоме-
трического центра клетки, а их взаимно расположение
строго упорядочено и описывается так называемым
законом Мюллера. Закон этот сформулировал Геккель
(Haeckel, 1862) и назвал в честь исследователя, впер-
вые охарактеризовавшего взаиморасположение скелет-
ных элементов у акантарий (Muller, 1859). Легче всего
представить стереометрическое расположение спикул,
мысленно вписав скелет акантарий в глобус с сеткой
параллелей и меридианов. На рисунке 42, А показана
схема скелета, состоящего из 20 игл. Иглы организова-
ны в пять квартетов; все иглы расходятся от геометри-
ческого центра скелета. Если совместить центр клетки
с центром воображаемого глобуса, то четыре спикулы
так называемого экваториального квартета располо-
жатся в экваториальной плоскости под прямыми угла-
ми друг к другу (в виде греческого креста). Дистальные
концы еще четырех игл пронижут поверхность вооб-
ражаемого глобуса на уровне 28,8° северной широты
(Wilcock et al., 1988). По долготе эти иглы смещены на
45° относительно экваториальных. Этот квартет носит
название северного тропического. Спикулы северного
полярного квартета также берут начало от центра сфе-
ры, а их дистальные концы поднимаются к 57,6° север-
ной широты. Этот квартет вновь повернут на 45° по
Рис. 42. Схема взаимного расположение спикул в скелете акан-
тарии (иллюстрация закона Мюллера).
А — всего имеется 20 радиальных спикул (или 10 диаметральных); эти
20 спикул составляют пять квартетов: один «экваториальный» (э), два
«тропических» (т) и два «полярных» (п); Б — при взгляде с полюса,
спикулы каждого квартета образуют правильный крест и каждый такой
крест по долготе повернут относительно соседнего на 45°.
ACANTHARIA
97
долготе, и, соответственно, иглы расположены строго
над экваториальными (рис. 42, Б). Южная полусфера
зеркально симметрична северной; составляющие ее
квартеты называются южный тропический и южный
полярный. У одного отряда акантарий скелет состоит
не из двадцати радиальных спикул, а из десяти диаме-
тральных. Стереометрия скелета при этом полностью
сохраняется: каждая пара супротивных радиальных игл
замещена одной диаметральной иглой.
Спикулы равновелики или почти равновелики у
многих представителей Acantharia, и тогда клетка име-
ет форму многогранника (рис. 41). Нередко, однако,
определенные спикулы значительно длиннее и толще
остальных. В этом случае более мощные иглы называ-
ют главными, а остальные побочными. Главных спикул
бывает 2,4 или 6. Если имеется одна пара главных спи-
кул, то они лежат супротивно в составе экваториально-
го квартета; клетка при этом веретеновидная (рис. 43;
рис. 61, Л, Д вкл.). Если скелет включает четыре глав-
ных спикулы, то они составляют экваториальный квар-
тет, а клетка имеет форму квадратной или ромбической
пластины (рис. 67, В. вкл.). Наконец, шесть главных
спикул — это две противолежащие экваториальные
и расположенные на том же меридиане полярные
Рис. 43. В веретеновидном скелете Diploconus (отр. Arthracan-
thida) доминируют две супротивные эваториальные спикулы.
(По: Haeckel, 1887).
Отмечены спикулы тропических (т) и экваториального (э) квартетов.
Рис. 44. В шестиугольном скелете Hexaconus (отр. Arthracanthida)
мощно развиты две супротивные спикулы экваториального
квартета и расположенные на том же меридиане две пары по-
лярных спикул.
Обозначены спикулы: юп — южные полярные; ют — южные тропиче-
ские; э — экваториальные; ст — северные тропические; сп — северные
полярные. (По: Haeckel, 1887).
(рис. 42, 27); клетка тогда приобретает форму шести-
угольной пластины (рис. 44).
Апофизы — боковые отростки на спикулах; име-
ются у ряда представителей Symphyacanthida и Arthra-
canthida. Если отростки ветвятся, то только в плоскости
перпендикулярной оси спикулы. Разросшиеся апофизы
соседних спикул могут сливаться, формируя ажурную
сферу, которую называют раковиной (рис. 40). Скелет
акантарий может включать лишь одну такую сферу, и
в виде исключения две — наружную и внутреннюю —
у представителей рода Phractopelta. У взрослых осо-
бей ряда видов от тангентальных апофизов отрастают
гарпуновидные или иглоподобные радиальные шипы
(рис. 40). Последние служат, скорее всего, для раскре-
пления сети лишенных аксонемы псевдоподий.
Скелет у акантарий, также как у полицистин и фео-
дарий, полностью внутриклеточный. Основной мине-
ральный компонент спикул весьма необычен: это целе-
стин (сульфат стронция). Каждая спикула организована
как монокристалл (Wilcock et al., 1988). Эти кристаллы
по форме отличаются от известных кристаллов целести-
на, образующихся в результате хемогенного осаждения.
Целестин откладывается в матрикс спикулогенной ваку-
оли; в деталях процесс биоминерализации у акантарий
не изучен. Скелет обтянут мембраной единой периспи-
кульной (англ, perispicular) вакуоли. Кристаллическая
решетка целестина накладывает ограничения на форму
скелета акантарий (рис. 45). Размер скелета взрослых
особей от 0,15 до 1,6 мм, чаще от 0,2 до 0,7 мм.
98
ACANTHARIA
Рис. 45. Грани основания спикулы взаиморасположены под углами, допустимыми кристаллической решеткой целестина. Сочленение
оснований спикул в центре клетке задает углы расхождения спикул по закону Мюллера.
А — отдельные спикулы и фрагменты скелета Acanthometra pellucida, Phyllostaurus siculus и Acanthometra terracopa (отр. Arthracanthida), обработан-
ные в течение 15-30 секунд серной кислотой; Б — основание спикулы Acanthostaurus purpurascens (отр. Arthracanthida), масштабная линейка 5 мкм.
(А — по: Schewiakoff, 1902; Б— по: Febvre et al., 2000).
Рис. 46. Схема организации клетки акантарии.
ан — аксонема аксоподии, эс — экструсома, рп — ризоподии, м — миофриски; пл — плазмалемма; сп — спикула; цк — центральная капсула, ко —
кортекс, кош — кортикальный шов, эк — эктоплазма, эн — эндоплазма; фс — фотосимбионт, пг — пигментные тельца, мх — митохондрия, я — ядро,
ЭПр — эндоплазматический ретикулум, АГ — диктиосома аппарата Гольджи, ЦОМТ — центр организации микротрубочек (по разным авторам).
Кортекс (англ, periplasmic cortex) — внеклеточ-
ный эластичный покров1, сплетенный из волокон неиз-
1 Термин в данном случае неудачен, поскольку кортекс по опре-
делению является структурой или зоной, прилежащей изнутри к кле-
точной мембране (например, кортекс инфузорий). Было бы правильнее
именовать это образование кутикулой. Однако мы будем использовать
устоявшееся название, чтобы не усугублять терминологическую пута-
ницу. — Прим. авт.
вестного состава (рис. 46, 47, Л). У почти всех видов
акантарий кортекс имеет значительную толщину (не-
сколько микрон) и четко различим на светооптическом
уровне. Этот покров, вероятнее всего, проницаем для
воды, но задерживает взвешенные частицы субмикрон-
ного размера (экспериментально не подтверждено).
Кортекс натянут на кончики спикул и совместно со ске-
ACANTHARIA
99
Рис. 47. Ультратонкое строение кортекса и центральной капсулы акантарий отряда Symphyacanthida (трансмиссионная электронная
микроскопия): тангентальный срез через кортекс Haliommatidium muelleri (А); поперечный и тангентальный срезы через стенку цент-
ральной капсулы Heteracon muelleri (Б) и Haliommatidium muelleri (В).
Масштабная линейка 0,5 мкм. (По: Febvre et al., 2000).
летом определяет форму клетки акантарий (рис. 41). Он
подразделен на 20 полигональных (как правило пента-
и гексагональных) пластин. В центре каждой пласти-
ны имеется крупное отверстие, через которое проходит
спикула. Между собой пластины кортекса соединены
специальным швом. Шов растяжим в поперечном на-
правлении и увеличивает эластичность кортекса. Этот
шов по конструкции напоминает застежку-липуч-
ку (рис. 48). Он способен размыкаться и замыкаться
(рис. 49), но неизвестно задействуют ли живые акан-
тарии это свойство. В русскоязычной литературе от-
сутствует устоявшееся наименование этой структу-
ры (англ, elastic junction). Будем использовать термин
«кортикальный шов». Каждая пластина кортекса несет
несколько десятков регулярно рассеянных по ее пло-
щади тонких отверстий для выхода аксоподий. Если
аксоподий мало, то они все выходят на границе между
пластинами — в зоне кортикального шва (рис. 49).
Миофриски (англ, myonemes) — сократимые
тяжи или ленты, имеющие поперечную исчерчен-
ность — подвешивают пластину кортекса к пронизы-
вающей ее спикуле (рис. 41, 46, 49). Количество миоф-
рисков, присоединенных к одной игле всегда четное, у
разных видов составляет от 2 до 60. Миофриски состо-
ят из свитых попарно нитей белка, принадлежащего к
гетерогенному семейству тонких филаментов (<5 нм,
то есть тоньше, чем актиновый микрофиламент). Со-
кращение миофрисков АТФ-независимое и запускается
изменением концентрации Са2+. Таким образом, у акан-
тарий имеется оригинальная контрактильная система,
неродственная широко представленным у эукариот
актин-миозиновой и тубулин-динеиновой системам.
Контрактильные системы, главным компонентом кото-
рых выступают сократимые белки из семейства тонких
филаментов, обнаружены в разных группах протистов,
в частности у Sticholonche (см. главу Taxopodida в этом
томе). В наибольшей степени изучены такие системы у
инфузорий: представители разноресничных инфузорий
(например, Stentor и Spirostomum) способны момен-
тально сжиматься, используя сеть тонких филаментов,
Рис. 48. Кортикальный шов.
А — тангентальный срез кортикального шва Gigartacon muelleri, отр. Chaunacanthida; Б — схема устройства шва между двумя пластинами кортекса.
(А — по Febvre, 1990 с изменениями, масштабная линейка 0,1 мкм; Б — по Febvre, 1973).
100
ACANTHARIA
Рис. 49. Детали строения Amphilithium clavarium (отр. Symphy-
acanthida).
ко — кортекс под натяжением; кш — кортикальный шов; м — миофри-
ски; о — отверстие, через которое проходит аксоподия; эвр — эластичные
волокна радиальные; экс — эктоплазматическая сеть; т — тарелкообраз-
ное расширение периспикульной цитоплазмы под миофрисками; цк —
центральная капсула, оборванная вокруг спикулы. В левой части рисунка
кортикальный шов разъединен. Увел.: 560х. (По: Schewiakoff, 1926).
вшитых в кортекс; белок спазмин обеспечивает мгно-
венное сокращение стебелька сидячих перитрих (Vor-
ticella).
Центральная капсула (англ. capsule/-um,
central capsule/-um, capsular wall) представляет собой
внеклеточный волокнистый слой, по ультратонкому
строению сходный с кортексом (рис. 47). Аксоподии и
цитоплазматические тяжи проходят сквозь временные
отверстия в центральной капсуле (рис. 46). Матери-
ал центральной капсулы как рукавом одевает каждую
спикулу и, поднимаясь вдоль спикулы, подсоединятся
к кортексу. Этот элемент конструкции называют «пери-
спикульным конусом» (англ, perispicular cone). В.Т. Ше-
вяков (Schewiakoff, 1926) и вслед за ним В.В. Решетняк
(1981) считали, что центральная капсула первично от-
сутствует у примитивных акантарий и возникает в пре-
делах группы как апоморфный признак. Позже, однако,
выяснилось, что на ультрастуктурном уровне централь-
ная капсула обнаруживается у всех изученных видов,
в том числе у представителей семейства Acanthochi-
asmidae, считающегося самым архаичным. В послед-
нем случае центральная капсула имеет вид ажурной
сеточки (Febvre et al., 2000). У многих Arthracanthida
имеется раковина, нередко в виде массивного панциря
(рис. 63, вкл.; рис. 64, вкл.). Учитывая, что раковина —
структура внутриклеточная, а центральная капсула —
внеклеточная, непонятно, какова топология клеточной
мембраны. Также невыяснено, облекает ли периспи-
кульный конус апофизы и раковину у Arthracanthida.
Функции центральной капсулы акантарий неочевид-
ны. Акантария при раздражении втягивает под покров
центральной капсулы почти всю внекапсулярную ци-
топлазму; толстостенная центральная капсула Arthra-
canthida, видимо, раскрепляет спикулы, препятствуя их
угловому смещению (Решетняк, 1981), а также служит
цистоподобной оболочкой в ходе множественного раз-
множения (Febvre, 1990). На заре изучения радиолярий
наличие плотного кожуха — центральной капсулы, —
разделяющего внутреннюю и внешнюю зоны цито-
плазмы, считалось синапоморфией таксона Radiolaria
(Haeckel, 1862). Однако еще В.Т. Шевяков (Schewia-
koff, 1926) подметил своеобразие центральной капсулы
Acantharia и отличие ее от прочных, сложноорганизо-
ванных центральных капсул феодарий и полицистин.
Авторитетные специалисты по современным радиоля-
риям, в частности, Андерсон (Anderson, 1983), не еди-
ножды подчеркивали, что применение по отношению
к акантариям термина «центральная капсула» создает
ложное впечатление о гомологии структур. Отметим,
что центральная капсула у акантарий — образование
внеклеточное, а у феодарий и полицистин — насколько
это известно, внутриклеточное. Последние две группы
согласно современным филогенетическим представ-
лениям, базирующимся на молекулярных данных, не
являются сестринскими (Pawlowski, Burki, 2009 и др.).
Таким образом, центральные капсулы у представите-
лей всех трех групп — образования негомологичные.
В ходе этой ставшей достоянием прошлого дискуссии
не было предложено иного приемлемого термина для
обозначения волокнистого слоя, разделяющего слои
цитоплазмы акантарий. Мы продолжим использовать
термин «центральная капсула», помня о том, что речь
идет о негомологичных структурах у Acantharia, Phaeo-
daria и Polycystina.
Псевдоподии акантарий — двух типов. Легкораз-
личимы прямые, упругие, неанастомозирующие ак-
соподии. Они имеются у всех акантарий; длина их
составляет 100-300% радиуса цитоплазматического
тела, а толщина несколько микрон. Упругость аксопо-
дии обеспечивает аксонема — пучок микротрубочек,
собранных в квазикристаллическую конструкцию.
Микротрубочки аксонемы, как это характерно для ак-
тинопод (радиолярий и солнечников), связаны между
собой несократимыми мостиками; взаимное скольже-
ние микротрубочек невозможно. Так называемая ва-
лентность микротрубочек — это количество мостиков,
выявляемых на поперечном срезе аксонемы у одной
микротрубочки. В аксонемах акантарий валентность
микротрубочек составляет 2 или 3 (рис. 50). ЦОМТы
аксонем закреплены на базальных участках скелет-
ных игл. Аксонемы радиально расходятся из центра
клетки, пронизывают внутрикапсулярную цитоплаз-
му и, обтянутые плазмалеммой, продолжаются в виде
аксоподий (рис. 46). Количество аксонем и место, где
каждая выходит за пределы цитоплазматического тела,
у большинства форм характеризуются постоянством;
отверстия для выхода аксоподий распределены по пло-
ACANTHARIA
101
Рис. 50. Схема упаковки микротрубочек на поперечном срезе ак-
сонемы аксоподии. У акантарий известны два основных паттерна.
А — шесть трехвалентных микротрубочек составляют гексагональный
мотив (отр. Chaunacanthida, Arthracanthida), Б — десять трех- и двухва-
лентных микротрубочек составляют додекагональный мотив (отр. Hola-
canthida). У отряда Symphyacanthida паттерн нерегулярный, включает
мотив из спаренных шестиугольников (не показан).
щади кортекса регулярно. Деполимеризация микротру-
бочек и втягивание аксоподий осуществляется очень
быстро, за секунду. Расправление ореола аксоподий —
гораздо более длительный процесс, занимающий не-
сколько минут. При росте аксоподии происходит по-
лимеризация микротрубочек аксонемы. По аксонемам
перемещаются различные везикулы и органоиды, в
частности, митохондрии и экструсомы. Механизм
транспорта неизвестен; рваный ритм движения частиц
(Febvre et al., 2000), возможно, указывает на то, что за-
действованы динеин-подобные моторные белки.
Псевдоподии второго типа не содержат аксонему.
Эти нитевидные выросты клеточной поверхности вет-
вятся и анастомозируют, поэтому формально их следо-
вало бы именовать ретикулоподиями. Однако совре-
менное звучание термина подразумевает, что основу
цитоскелета составляют микротрубочки, а в данном
случае об устройстве цитоскета ничего неизвестно.
Поэтому будем использовать более широкий термин
«ризоподии», тем самым подчеркивая, что эти
выросты морфологически отличны от аксоподий, но
пока непонятно к какому типу псевдоподий принадле-
жат (название «ризоподии» восходит к имени таксона
Rhizopoda, который в системе Бючли объединял сарко-
довых с лобо-, фило- и ретикулоподиями). Ризоподии
акантарий занимают три различные позиции и, воз-
можно, имеют различное строение. 1. От концов спи-
кул центробежно отходит кисточка ризоподий (рис. 54,
вкл.). Такие терминальные ризоподии обильно развиты
на главных спикулах (рис. 63, Б, В, вкл.). Не установле-
но, имеются ли они у всех акантарий и какова их функ-
ция. 2. Под кортексом у всех акантарий находятся ана-
стомозирующие тяжи цитоплазмы. Одна функция этих
субкортикальных ризоподий очевидна — они участву-
ют в питании (рис. 55, вкл.). 3. Решетняк (1981) и Пет-
рушевская (1986) приводят схему организации клетки
акантарии, на которой изображены «филоподии» —
тонкие анастомозирующие псевдоподии, составляю-
щие ворсистый слой над поверхностью кортекса. Эта
схема, по-видимому, адаптирована из работы Дельри и
Меринфельда (Delrie, Merinfeld, 1965); первоисточник
мне недоступен. Февр с соавторами (Febvre et al., 2000)
описывают, видимо, ту же структуру («reticulopodial
network», с. 785) как анастомозирующие тяжи цито-
плазмы, которые выходят сквозь кортекс и служат для
улавливания добычи; однако авторы не дают ссылок и
не приводят иллюстраций. Подтверждающих микро-
фотографий мне не удалось найти в литературе: суще-
ствует ли гало надкортикальных ризоподий — вопрос
заслуживающий доисследования.
Цитоплазма акантарий подразделена на концентри-
ческие зоны (например, рис. 57, Г). Термины для обо-
значения зон восходят к протозоологической концепции
XIX века (Haeckel, 1862, 1887; Butschli, 1880-1889), со-
гласно которой клетка простейших разделена на студе-
нистую эктоплазму и разжиженную эндоплазму, при-
чем у представителей таксона Radiolaria (куда входили
акантарии, феодарии и отряды нынешних полицистин)
толстая эктоплазма отграничена центральной капсулой
от эндоплазмы и включает три концентрических слоя:
саркоматрикс (облекающий центральную капсулу тон-
кий уплотненный слой, где берут начало анастомози-
рующие псевдоподии), калимму (толстый срединный
прозрачный или пенистый слой) и саркодиктиум (на-
ружный тонкий уплотненный слой, где синтезируется
скелет). Стратификация цитоплазмы акантарий совсем
не укладывается в означенную схему; ведь сегодня по-
нятно, что планктонные актиноподы составляют по-
лифилетическую группировку, и «радиолярный» план
строения клетки (аксоподии, внутриклеточный мине-
ральный скелет, центральная капсула, калимма) при-
обретен ими конвергентно. В простейшем случае у
акантарий различимы (при малом увеличении) только
две зоны (например, рис. 57, В). Тогда их именуют эк-
топлазмой и эндоплазмой. Разумеется, это лишь при-
вычные термины; подразделение цитоплазмы на эн-
доплазму и эктоплазму у акантарий не гомологично
таковому у других амебоидных протистов (в частности
у голых амеб). У большинства видов акантарий в цито-
плазме отчетливо различимы как минимум три зоны:
1) внутренняя интенсивно окрашенная; 2) промежуточ-
ная гранулярная и 3) внешняя прозрачная или пенистая
(рис. 56, вкл.). Во внутренней зоне цитоплазмы раз-
мещаются ядра, а также зерна пигмента, придающие
ей желтый, красный, коричневый или почти черный
цвет. Промежуточная зона лишена пигментных зерен;
сюда проникают лакуны, заполненные морской водой.
Центральная капсула, когда она выявлена, охватывает
цитоплазму промежуточной зоны. Внешняя зона —
традиционно ее называют «калиммой» — почти
лишена органоидов; здесь встречаются пищеваритель-
ные вакуоли. На ультраструктурном уровне калимма
представляет собой рыхлое губчатое тело, состоящее
из анастомозирующих тяжей цитоплазмы, перемежаю-
щихся с цистернами (рис. 46). По крайней мере часть
этих цистерн открыты во внешнюю среду и заполне-
ны морской водой. Среди цистерн, вероятно, имеются
вакуоли, обеспечивающие плавучесть. Архитектура
взаиморасположения цитоплазматических тяжей, ин-
вагинаций и вакуолей не реконструирована. Февр с со-
авторами (Febvre et al. 2000) вслед за Геккелем называ-
102
ACANTHARIA
ют всю внутрикапсулярную цитоплазму эндоплазмой, а
всю экстракапсулярную (т.е. калимму) — эктоплазмой.
В этой трактовке эндоплазма оказывается поделенной
на ядросодержащую окрашенную и безъядерную не-
окрашенную зоны. В.Т. Шевяков (Schewiakoff, 1926)
и вслед за ним В.В. Решетняк (1981) называют эндо-
плазмой только внутреннюю пигментированную зону,
а остальные две зоны относят к эктоплазме и называют
их «собственно эктоплазмой» и калиммой. Эти авто-
ры приводят ряд аргументов в пользу такого варианта
разграничения; в частности, они указывают, что тяжи
цитоплазмы в составе калиммы и аксоподий выходят
сквозь отверстия во внеклеточной центральной капсу-
ле и при раздражении втягиваются под нее, сливаясь
с цитоплазмой промежуточной зоны. Раковина служит
дополнительной разграничительной поверхностью, и у
видов с раковиной нередко различимы четыре зоны ци-
топлазмы. Так, у Haliommatidium (рис. 58, Б, Г, вкл.) име-
ются зоны: пигментированная, внутрираковинная гра-
нулярная, внераковинная гранулярная и калимма. Февр
(Febvre, 1990) именует эндоплазмой Haliommatidium
всю внутрираковинную цитоплазму, то есть использует
схему разделения, отличную от двух предыдущих. Та-
ким образом, термины «внутрикапсулярная цитоплаз-
ма» и «внекапсулярная цитоплазма» четко определены,
поскольку позиция центральной капсулы почти всегда
известна; границы калиммы воспринимаются одинако-
во всеми авторами; относительно границы между эндо-
и эктоплазмой имеются разночтения, и положение этой
границы должно быть оговорено в каждом конкретном
случае. Во всех иллюстрациях к этой главе эндоплазма
и эктоплазма разграничены согласно Шевякову. За тер-
мином «калимма» мы предлагаем оставить лишь его
описательный смысл, отняв какую-либо таксономиче-
скую привязку: светлый пенистый слой цитоплазмы,
облекающий клетку крупных пелагических амебоид-
ных протестов (радиолярий в широком смысле и фора-
минифер) или крупных солнечников. Помимо концент-
рических компартментов существует и радиальный:
между спикулой и одевающей ее рукавом материала
центральной капсулы залегает цитоплазма, которая ха-
рактеризуется отсутствием ядер и пигмента, прозрач-
ностью, высокой интенсивностью цитоплазматических
токов. В русскоязычной литературе нет термина для
обозначения этой зоны; будем использовать кальку анг-
лийского названия — «периспикульная цитоплазма»
(perispicular cytoplasm). Саркоматрикса и саркодиктиу-
ма в понимании ранних авторов у акантарий нет. На-
ружным уплотненным слоем — саркодиктиумом — на-
зывали кортекс, исходя из ошибочного допущения, что
он является структурой внутриклеточной. Этот термин
(саркодиктиум), чтобы не создавать нового, можно ис-
пользовать для обозначения цитоплазмы, которая обво-
лакивает спикулы и отростки спикул.
Органоиды акантарий — обычные для эукариотной
клетки, в том числе имеются многочисленные мелкие
митохондрии с трубчатыми кристами. Липидные гло-
булы обильны во внутрикапсулярной цитоплазме.
Литосомы — овальные пластинки с двойным
лучепреломлением, по всей вероятности, с сернокис-
лым стронцием в качестве минерального компонента.
Они синтезируются в аппарате Гольджи и накаплива-
ются во внутрикапсулярной цитоплазме перед инци-
стированием у Holacanthida, Symphyacanthida и Chaun-
acanthida. Позже они транспортируются к плазмалемме
и встраиваются в цистную оболочку. Обозначенные на
рисунках Шевякова кристаллоиды, видимо, являются
литосомами (рис. 57, Г). Иной природы кристалличе-
ские тела в мембранной упаковке — светопреломляю-
щие, но без двойного лучепреломления — известны у
молодых особой Holacanthida (Febvre, 1990; рис. 53, А).
Экструсомы акантарий в состоянии покоя
имеют электронноплотный аксиальный элемент (Feb-
vre, 1990), и, таким образом, морфологически сходны
к кинетоцистами, которые изучены у центрохелидных
солнечников (Acanthocystis, Raphidiophrys) и десмото-
рацидных солнечников (Clathrulina') (Sakaguchi et al.,
2002). Синтез предшественников идет в комплексе
Гольджи во внутрикапсуллярной цитоплазме. Зрелые
экстру сомы, располагаются не только на аксоподиях,
но и в тяжах эктоплазмы. Очевидно, экструсомы за-
действованы в улавливании и иммобилизации добычи.
Механизм экструзии не известен.
Ядра у взрослых трофонтов множественные, при-
сутствуют в эндоплазме в количестве десятков штук.
Исключение составляют представители рода Haliom-
matidium (отряд Symphyacanthida), чьи зрелые трофон-
ты обладают единственным крупным, полиплоидным
ядром (Febvre, 1990). С. Февр с соавторами (Febvre et
al., 2000) сообщают, что и другие представители се-
мейства Pseudolithidae имеют единственное полипло-
идное ядро, однако, Шевяков иллюстрирует множе-
ственные ядра для Dicranophora (рис. 57, Г); мне не
удалось понять, в чем причина разночтений. Оболочка
крупного одиночного ядра Haliommatidium подостлана
ламиной — матом переплетенных фибрилл. У много-
ядерных акантарий ядра изоморфные, мелкие (порядка
10 мкм в диаметре), округлые. Плоидность их не уста-
новлена. У других одноклеточных организмов с мно-
жественными мелкими ядрами, такие ядра имеет пло-
идность 1 или 2; диплоидны, в частности, ядра опалин
(Райков, 1978). Деление ядер акантарий протекает по
типу закрытого плевромитоза с внутриядерным вере-
теном. ЦОМТы полуверетен встроены в поры ядерной
оболочки. В цитозоле вблизи каждого ЦОМТа проис-
ходит сборка пары центриолей (Febvre, 1990). Мейоз
неизвестен, синаптонемальные комплексы не описаны.
Фотосимбионты имеются почти у всех акантарий.
Для большинства видов фотосимбионтами выступа-
ют гаптофиты. Известны две морфы: безжгутиковая и
трехжгутиковая; обе морфы могут присутствовать од-
новременно в клетке хозяина. Ряд видов отряда Chaun-
acanthida состоит в сожительстве с динофлагеллатами
(Febvre, 1990). Оба типа окрашенных симбионтов при-
надлежат к филетической линии Chromista; таких при-
нято называть зооксантеллами. Зооксантеллы ло-
кализуются во внутренних зонах цитоплазмы и очень
редко в калимме. Клетки фотосимбионтов нередко
становятся основным по объему компонентом содер-
жимого центральной капсулы (рис. 67, Б, вкл.). Перед
ACANTHARIA
103
инцистированием или размножением хозяин перевари-
вает или выбрасывает зооксантелл. Ювенильные особи
лишены фотосимбионтов и получают их из внешней
среды. По мере роста трофонта концентрация зооксан-
телл в эндоплазме нарастает. Не выяснено, насколько
специфичны отношения фотосимбионта и хозяина.
Физиология и питание
Флотирование акантарий охарактеризовано на фе-
номенологическом уровне. В.Т. Шевяков (Schewiakoff,
1926) отмечал, что у экземпляров, всплывающих к са-
мой поверхности воды после дней затишья, кортекс
полностью вздут (Решетняк, 1981). Клетка акантарий
может незначительно изменять свою форму за счет
работы миофрисков. Каждый миофриск обладает спо-
собностью сокращаться независимо от других, но чаще
происходит координированное сокращение всего ан-
самбля (Febvre, 1990). У недавно пойманных живых эк-
земпляров, временно содержащихся в аквариуме, рез-
кое сокращение всех миофрисков наблюдается каждые
10-20 минут, причем эта активность как-то сопряжена
со способностью акантарий удерживать плавучесть
близкую к нулевой (Febvre et al., 2000). В результате со-
кращения миофрисков каждая пластина кортекса ока-
зывается подтянутой к вершине спикулы, весь кортекс
натягивается на окончаниях спикул, эластичный корти-
кальный шов претерпевает поперечное растяжение.
Устройство гидростатического аппарата акантарий
и механизм его работы, как ни странно, не охарактери-
зованы; имеющиеся в литературе версии не учитывают
действия простых физических законов. Рассуждения
об ажурности раковины (Петрушевская, 1986 и др.) ни-
как не проясняют вопрос, почему клетка остается на-
плаву: ведь минеральный скелет — неважно ажурный
или массивный — будет иметь плотность как минимум
в два раза превышающую плотность воды, и должен
существовать компенсаторный механизм. Корона ак-
соподий обеспечивает сопротивление формы и, раз-
умеется, замедляет опускание по закону Стокса, но не
может остановить это опускание1. Считается, что при
сокращении миофрисков пространство под кортексом
увеличивается, в лакуны калиммы насасывается допол-
нительный объем морской воды, и клетка всплывает
(Решетняк, 1981). Это объяснение тоже нереалистично:
переменный объем морской воды в лакунах калиммы
не изменит знак плавучести клетки (представьте дыря-
вый волейбольный мяч, заполненный водой; его пла-
вучесть не будет сколько-нибудь заметно зависеть от
того, расправлен ли он или слегка сжат). Для того что-
бы клетка — особенно клетка с тяжелым скелетом —
сохраняла нейтральную плавучесть, она должна обла-
дать отделами с содержимым меньшей плотности, чем
морская вода. Таким поплавком, вероятно, выступают
липидные глобулы, в обилии содержащиеся у всех
акантарий во внутрикапсулярной цитоплазме. Однако,
согласно натурным наблюдениям, акантарии способны
1 Скелеты радиолярий и планктонных фораминифер после отми-
рания организма опускаются со скоростью порядка 1 км в день (Honjo et
al.. 2008; Martin et al., 2010). — Прим. авт.
быстро уходить на глубину. Оперативно уменьшить
подъемную силу жирового поплавка вряд ли возможно:
сжигание жира — долговременный процесс; альтерна-
тивно, клетка могла бы извергнуть липидные включе-
ния, но подобный процесс, по-видимому, не описан ни
для каких протистов. Следовательно, акантарии допол-
нительно обладают водным поплавком — вакуолями с
водой, где тяжелые ионы частично замещены легкими
(см. раздел Плавучесть в главе Phaeodaria в этом томе).
Для того чтобы вода осмотически нагнеталась в ваку-
оли, они должны быть отграничены от внешней среды
слоем цитоплазмы минимальной толщины, и, значит,
эти вакуоли располагаются, скорее всего, в калимме.
Косвенным подтверждением тому служит название
самой длинной спикулы у Amphilithium. Помимо «зад-
ней» ее еще называют «нижней» (Решетняк, 1981). То
есть ранние авторы, ведя прижизненные наблюдения,
отметили, что эта спикула вместе с надетым на нее
массивом эндоплазмы обращена вниз. Следовательно,
поплавок расположен в противолежащем компартмен-
те — калимме (рис. 57, В). Поведенческие реакции,
описанные в начале раздела, можно интерпретировать
следующим образом. У клеток, всплывших к поверх-
ности океана, кортекс вздут под воздействием набух-
ших вакуолей калиммы (рис. 67, Д, вкл.). Сокращение
миофрисков опосредованное радиальным смещением
кортекса нагнетает в лакуны калиммы свежую порцию
морской воды, которая замещает рассол, отжатый при
осмотическом транспорте Н2О в вакуоли. В ответ на
любое раздражение клетка отвечает неспецифической
реакцией бегства: вакуоли схлопываются (кортекс по-
этому опадает, рис. 67, Б, вкл.), и акантария погружа-
ется.
Акантарии обитают у самой поверхности океана
(см. раздел Экология) и, видимо, обладают самым со-
вершенным гидростатическим аппаратом среди всех
планктонных протистов (Решетняк, 1981). Примеча-
тельно, что акантарии — эти совершенные плактеры —
имеют минеральный скелет большей плотности (целе-
стин 4,0 г см-3), нежели любые другие организмы, в том
числе бентосные и наземные2. Надо полагать, наличие
минерального скелета у всех планктонных амебоидных
протистов — это конвергентно возникшая адаптация к
планктонному образу жизни. Тяжелый балласт в соста-
ве гидростатического аппарата позволяет за счет схло-
пывания вакуолей калиммы быстро погружаться, уходя
от опасности.
Пищевой спектр акантарий широк. Микроскопиро-
вание пищевых вакуолей показало, что в состав жертв
из микропланктона входят тинтинниды и другие инфу-
зории, диатомовые, динофлагеллаты, веслоногие рачки
от науплиуса до взрослых, а также пелагические мол-
люски и пелагические саркодовые (Caron, Swanberg,
1990). Применение эпифлюоресцентной микроскопии
показало наличие в пищевых вакуолях окрашенно-
го наннопланктона и даже мелких (пикопланктонных,
<2 мкм) цианобактерий; кроме того обнаружены и ге-
2 Более тяжелый минерал барит 4,5 г см 3 в форме кристаллов, а
не скелета, имеется у харовых, планктонных десмид и глубоководных
бентосных протистов ксенофиофор. — Прим. авт.
104
ACANTHARIA
теротрофные бактерии (Febvre et al., 2000). Неясно,
захватывают ли акантарий мелкую пищу целенаправ-
ленно или попутно с более крупными объектами. Коли-
чественные оценки питания отсутствуют; упоминаются
наблюдения, что перевариваемые организмы в пище-
вых вакуолях наблюдаются весьма редко (Febvre, 1990).
Последовательность событий при захвате пищевых
объектов, в том числе крупных, прослежена не полно-
стью. На аксоподиях имеются экструсомы; нет наблю-
дений, свидетельствующих, что эти экструсомы заяко-
ривают или обездвиживают добычу. Альтернативный
или дополнительный аппарат пищедобычи — это гало
ризоподий, выставленных сквозь кортекс (Febvre et al.,
2000), однако само существование этого гало сомни-
тельно (см. раздел Строение клетки). Каким образом
жертва транспортируется под кортекс неизвестно; ги-
потетически, может размыкаться кортикальный шов, но
свидетельства тому отсутствуют. Часть экструсом рас-
полагается в тяжах цитоплазмы под кортексом (Febv-
re, 1990), где они, очевидно, задействованы в процессе
пищедобычи (рис. 55, вкл.). Пищеварительные вакуо-
ли размещены только во внекапсулярной цитоплазме,
здесь же отмечены лизосомы (Febvre, 1990). Дефекаци-
онные вакуоли смещаются к периферии калиммы и за-
тем как-то выводятся за пределы кортекса (Schewiakoff,
1926, цит. по: Решетняк, 1981). Пигментные гранулы,
возможно, представляют собой накапливаемые непере-
варенные остатки.
Зооксантеллы обнаружены почти у всех видов
акантарий, причем имеются в большом количестве у
взрослых трофонтов. Соответственно, предполагает-
ся, что фотосимбионты играют важную роль в трофике
акантарий, но измерения потоков азота, фосфора и са-
харов между симбионтом и хозяином не выполнялись.
Темп размножения зооксантелл низок по сравнению с
расчетным; это позволяет предполагать, что акантария
забирает значительную долю продукции фотосимбион-
тов (Febvre et al., 2000).
Размножение
и жизненные циклы
Акантарий не удается поддерживать в культуре. Эк-
земпляры, собранные в море, выживают в лаборатории
лишь в течение нескольких часов, максимум двух не-
дель, при этом удерживая себя во взвешенном состоя-
нии. Затем клетки оседают на дно и лизируются; иногда
перед гибелью они высвобождают сотни или тысячи
подвижных жгутиконосцев, которые осаждаются на
дно аквариума и погибают (Febvre, 1990; Febvre et al.,
2000). Итак, непонятно даже являются ли жгутиковые
клетки зооспорами или гаметами. Правда, В.Т. Шевя-
ков (Schewiakoff, 1926) описывал слияние жгутиковых
клеток (рис. 67, Г, £, вкл.) и формирование амебоид-
ных зигот, ползающих по дну аквариума. Последовате-
лям не удалось воспроизвести этот результат. Другим
источником информации служат планктонные сборы,
где обнаруживаются различные возрастные стадии
акантарий. Понятно, что информация недостаточна, и
представления о жизненном цикле акантарий фрагмен-
тарны.
Примитивные акантарий Acanthachiasmidae спо-
собны делиться бинарно; судьба кортекса и миофри-
сков (тонких и малозаметных) не прослежена; скелет
потомки наследуют пополам и недостающие иглы до-
страивают (Решетняк, 1981; Febvre, 1990; Febvre et al.,
2000). Подавляющее большинство акантарий неспо-
собно к бинарному делению. Видимо, сложная архи-
тектура клетки делает неоправданными частые мас-
штабные перестройки в ходе каждого из следующих
один за другим клеточных циклов. Акантарий реализу-
ют альтернативную стратегию: клетка в ходе длитель-
ного периода роста накапливает пластический матери-
ал, а потом претерпевает множественное деление.
Ювенильная особь одноядерна. В.Т. Шевяков
(Schewiakoff, 1926, цит. по: Решетняк, 1981) описыва-
ет зачаток целестинового скелета как звездообразное
20-лучевое образование в центре ядра; затем спикулы
растут, и единственное пока ядро сохраняет централь-
ную позицию и оказывается надетым на спикулы.
Крупное одиночное ядро у зрелых трофонтов актино-
под, действительно, зачастую пронизано каналами, че-
рез которые проходят балки скелета и аксонемы; тако-
вы, например, полиплоидные ядра многих Spumellaria
(Anderson, 1983). Ситуация же, когда молодое мелкого
размера гаплоидное или диплоидное ядро пронизано
каналами, экстраординарна. Авторы более поздних
сводок не упоминают это наблюдение Шевякова, по-
видимому, потому, что оно кажется сомнительным (Fe-
bvre, 1990; Febvre et al., 2000 и др.). Тем не менее, в
отличие от Геккеля, Шевяков изображал только то, что
видел, и хотя сегодня мы не можем объяснить, какова
конфигурация ядерной оболочки ювенильной особи,
надо считать, что картина, описываемая Шевяковым на
светооптическом уровне, реально существует.
По мере увеличения объема клетки количество
ядер нарастает (их плоидность неизвестна). Формиру-
ется многоядерный трофонт (рис. 51). На определен-
ной стадии онтогенеза формируется специфичная для
акантарий картина: ядра выстраиваются в концентри-
ческий монослой.
После периода питания и роста особь готовится к
размножению. Эту стадию называют гамонтом, следуя
терминологии Шевякова, который считал последую-
щий процесс гаметогенезом. Гамонт разбирает кортекс,
отбрасывает миофриски, выталкивает зерна пигмента
и литосомы, освобождается от пищеварительных ва-
куолей, переваривает либо изгоняет фотосимбионтов.
Эндоплазма становится прозрачной и объем ее увели-
чивается. Темп кариокинезов резко возрастает: ядра
делятся непрерывно, их количество достигает несколь-
ких сотен или тысяч. Происходит цитокинез: вокруг
каждого ядра обособляется довольно крупный участок
цитоплазмы. От центриолей отрастают два жгутика
(детали строения жгутикового аппарата неизвестны).
Сформировавшиеся жгутиконосцы роятся в полости
центральной капсулы; о наличии или отсутствии оста-
точного тела нет информации. Жгутиконосные клетки
всегда содержат липидные капли и, по наблюдениям
ACANTHARIA
105
Рис. 51. Жизненный цикл акантарий отряда Arthracanthida
1 — ювенильный одноядерный трофонт, 2, 3 — многоядерный трофонт, 4 — гамонт, 5 — двужгутиковые клетки. (По: Febvre, 1990 с изменениями).
В.Т. Шевякова (Schewiakoff, 1926), редко некоторые из
них несут «споры зооксантелл» (рис. 55, £, вкл.). Как
уже сказано, судьба жгутиконосных клеток не просле-
жена и непонятно, являются ли они зооспорами или
гаметами. И, соответственно, неясно является ли весь
процесс формирования жгутиковых клеток гаметогене-
зом или множественным бесполым размножением.
Принципиальный смысловой компонент в схеме
жизненного цикла акантарий, составленной Жаном
Февром (Febvre, 1990) — это вопросительный знак
(рис. 51). Если придерживаться трактовки стадий по
В.Т. Шевякову и при этом замкнуть схему цикла без
знака вопроса, как это сделано в рамках последней
масштабной попытки дать полную классификацию
протистов (Adi et al., 2005), то придется утверждать,
что акантарий размножаются исключительно половым
путем. Сейчас известна единственная группа эукариот
с нетканевой организацией, у которой жизненный цикл
протекает без фазы агамного размножения — это спо-
ровики Eugregarinida.
Описанным путем происходит гаметогенез у Ar-
thracanthida, которые обладают толстостенной цен-
тральной капсулой и используют ее в качестве цист-
ной оболочки. Реализация цикла у представителей
остальных отрядов отлична тем, что гамонт разбирает
свою нежную центральную капсулу и строит цистную
оболочку de novo из предварительно синтезированных
литосом. В ходе инцистирования происходит частич-
ная или полная разборка скелета. Соединение спикул
в центре клетки разрушается, и они начинают мед-
ленно менять свою ориентацию. У’ формирующихся
цист Chaunacanthida совокупность радиальных спи-
кул складывается зонтиком; эту характерную стадию
называют litholophus. Э. Геккель (Haeckel, 1887) опи-
сал род Litholophus с коническим пучком спикул, но
позднее выяснилось, что это стадия инцистирования
разных родов Chaunacanthida (рис. 52, А). Спикулы
растворяются в определенных участках и разламыва-
ются на балки, которые при участии аксоподий транс-
портируются центростремительно; эти балки, иногда
компактно уложенные параллельно друг другу, сохра-
няются внутри цисты (рис. 52, Б). В цисте происходит
множественное деление ядер. По завершении послед-
него деления происходит цитокинез, от центриолей
отрастают ундулиподии, и формируются жгутиковые
клетки.
Своеобразно протекает инцистирование у Haliom-
matidium (отряд Symphyacanthida). Представители это-
го рода обладают решетчатой раковиной (рис. 58, В,
Д, вкл.), которая в отличие от раковин Arthracanthida
(рис. 64, вкл.) расположена внутри центральной кап-
сулы. При инцистировании разбираются центральная
капсула и спикулы, а решетчатые пластины, из которых
состоит раковина, становятся стенкой цисты. В един-
ственном ядре наблюдаются многочисленные веретена
эндомитозов. Ядро быстро разбирается на многочис-
ленные мелкие ядра. Цитоплазма фрагментируется, и
после серии преобразований формируются двужгути-
ковые клетки. Последние оседали на дно контейнера и
в течение нескольких минут погибали (Febvre, 1990).
Неизвестно, существует ли стадия покоя, то есть
неясно, являются ли цисты акантарий лишь цистами
размножения, или они также обеспечивают и пере-
живание неблагоприятных периодов (то есть высту-
пают и как цисты покоя). Цисты акантарий обладают
Рис. 52. Цисты акантарий.
А — стадия litholophus формирующейся цисты Heteracon biformis (отр.
Chaunacanthida); Б — две цисты Holacanthida с остатками скелетных
спикул в цитоплазме. (По: Febvre, 1990).
106
ACANTHARIA
довольно большим удельным весом и быстро тонут
(-0,5 км день1; Martin et al., 2010). Приспособительное
значение этого неочевидно, учитывая, что акантарии в
большинстве своем населяют удаленные от побережий
поверхностные воды над океаническими впадинами.
Согласно одной из гипотез, продукция цист в момент
цветения фитопланктона и погружение их в батипела-
гиаль обеспечивает ювенилям обильный пищевой ре-
сурс в виде фитодетрита, оседающего после цветения
(Martin et al., 2010). С другой стороны, возможно, акан-
тарии (как и все радиолярии и планктонные форамини-
феры) высвобождают жгутиконосную стадию цикла на
глубине не менее 200 м, потому что ювенильные особи,
как и все микронного размера планктонные организмы,
не способны противостоять турбулентному перемеши-
ванию водной толщи и легко могут быть вынесены в
поверхностные воды, где повреждены штормовым
волнением и слишком ярким солнцем. По мере роста
и увеличения способности контролировать плавучесть
(и при необходимости уходить на глубину), они подни-
маются ближе к поверхности океана.
Филогения
Радиолярии — морские пелагические амебоидные
протесты с аксоподиями и внутриклеточным минераль-
ным скелетом. Приблизительно до середины XX сто-
летия Radiolaria воспринимались как таксон. В него
включали акантарий, феодарий и отряды полицистин,
а также иногда Taxopodida. Однако еще В.Т. Шевяков
отмечал своеобразие акантарий: 1) скелет, построен-
ный из целестина и состоящий из радиальных, а не
концентрических элементов, 2) отсутствие типичной
центральной капсулы, 3) многоядерность, 4) кортекс и
миофриски. Так что со временем акантарий стали выво-
дить за пределы Radiolaria и рассматривать в качестве
сестринского таксона равного ранга. Этой концепции,
в частности, придерживались P.O. Андерсон (Ander-
son, 1983) и В.В. Решетняк (1981). Примечательно, что
полицистины, приступая к множественному делению,
синтезируют кристаллы сернокислого стронция, кото-
рые в итоге окажутся в цитоплазме жгутиковых клеток.
Андерсон считал, что наличие SrSO4 у акантарий и по-
лицистин говорит о древней филогенетической связи
между Acantharia и Euradiolaria (Anderson, 1983), а для
В.А. Догеля (1950) этот факт служил указанием на пря-
мое родство Acantharia и Polycystina.
Изучение ультраструктуры аксоподий солнечников
и радиолярий выявило поразительно единообразную
картину квазикристаллической упаковки микротрубо-
чек в аксонеме (Cachon, Cachon, 1982). На основании
этого сходства было предложено объединить всех аме-
боидных протистов с аксоподиями в таксон Actinopoda.
Сюда вошли Spumellaria, Nassellaria, Phaeodaria, Acan-
tharia, Taxopodida и все солнечники единым классом
Heliozoa1. К концу XX века в концепциях царств эука-
1 Солнечники, в отличие от радиолярий, это преимущественно
бентосные пресноводные организмы; лишены центральной капсулы;
минеральный скелет, если имеют, то только внеклеточный силикат-
ный. — Прим. авт.
риот возобладала тенденция к дроблению макротаксо-
нов протистов и повышению их рангов. И Actinopoda,
и Radiolaria, и Heliozoa воспринимались как полифи-
летические группы, представители которых занимают
сходные экологические ниши и конвергентно приоб-
рели сходные черты строения, в том числе аксоподии
(Febvre et al., 2000 и др.).
Впрочем, в последние годы эта полемика сошла
на нет в виду решительных успехов, достигнутых мо-
лекулярными биологами. Позиция акантарий и дру-
гих групп актинопод на филогенетических деревьях
принципиально не меняется уже 5-6 лет (Nikolaev et
al. 2004; Kunitomo et al. 2006; Pawlowski, Burki 2009;
Gilg et al. 2010) и поэтому вряд ли в обозримом буду-
щем стоит ожидать кардинального пересмотра этих
воззрений. Хотя, конечно, будут еще производиться
уточнения, ведь накопление данных, в первую очередь
данных по нуклеотидным последовательностям гена
малой субъединицы рибосомальной РНК, идет гран-
диозными темпами. Итак, вырисовывается следующая
картина филогенетических связей радиолярий. Все от-
ряды полицистин действительно родственны. Acanthar-
ia и Taxopodida происходят от Polycystina; и сами поли-
цистины, таким образом, парафилетичны (см. рис. 79
в главе Phaeodaria). Феодарии же, хоть и принадлежат
тому же кластеру Rhizaria, не являются сестринской
группой по отношению к полицистинам и акантариям,
а входят в центральную группировку ризарий — Сег-
cozoa (если надо обозначить ранги, то Rhizaria можно
назвать царством, a Cercozoa подцарством). Эта схема,
с одной стороны, не подтверждает ни одну из ранее
существовавших концепций филогении радиолярий, а
с другой неожиданно показывает, что группы радио-
лярий не так далеки друг от друга, как еще недавно
казалось. Феодарии, которые во всех системах пози-
ционировались как близкие родственники полицистин,
таковыми не оказались, а вот акантарии, которым, ис-
ходя из перечисленных выше морфологических сооб-
ражений, в родстве с полицистинами в последние годы
было категорически отказано, все-таки оказались их
ближайшими родственниками.
Хотя акантарии в воде порой многочисленны, коли-
чество видов акантарий невелико (около 150), причем
во многих родах насчитывается 1-5 видов (Решетняк,
1981). Такая ситуация, вероятно, говорит в пользу того,
что таксон давно не испытывал вспышек адаптивной
радиации.
Морская вода сильно недонасыщена по сульфату
стронция, поэтому скелеты отмерших акантарий рас-
творяются по большей части еще не достигнув дна,
хотя тонут они весьма быстро (Martin et al., 2010). Со-
ответственно, палеонтологическая летопись акантарий
отсутствует.
Экология
Акантарии — обитатели океанической пелагиали;
существуют ли неретические виды неизвестно. В на-
чале XX века был описан один бентосный вид с целе-
ACANTHARIA
107
становыми спикулами (Podactinelius sessilis Schroder
1907), принадлежность которого к Acantharia остается
недоказанной (Решетняк, 1981). Акантарий распро-
странены циркумтропически, в высокие широты про-
никают лишь единичные виды, не встречаются в рас-
пресненных районах, избегают вод с обильной взвесью
(Решетняк, 1981; Caron, Swanberg, 1990; Febvre et al.,
2000). Максимальную численность и видовое разно-
образие акантарий отмечают в самом поверхностном
слое пелагиали — менее 100 м.
Удаленные от побережий воды субтропических
круговоротов всех океанов на подавляющей части сво-
ей акватории олиготрофны. Конкуренция за ресурсы
чрезвычайно напряженна и многие виды акантарий,
подобно другим пелагическим протистам и разным
многоклеточным планктонным и бентосным живот-
ным, вступают в симбиотические отношения с микро-
водорослями.
Зооксантеллы локализованы ближе к центру клет-
ки, что отличает акантарий от остальных пелагических
симбионтсодержащих амебоидных протистов (полици-
стин и фораминифер), которые широко распределяют
своих фотосимбионтов по внешнему вакуолизирован-
ному слою цитоплазмы, по выступающим шипам скеле-
та и по расправленным псевдоподиям. Эта особенность
акантарий, вероятно, обусловлена тем, что они обитают
у самой поверхности, где свет обилен и нет необходи-
мости распределять симбионтов так, чтобы создать им
оптимальные условия освещения. Косвенное подтверж-
дение такого объяснения дают те немногие виды акан-
тарий, которые населяют подповерхностные горизонты
с малой освещенностью. У этих форм зооксантеллы
рассеяны в калимме (Решетняк, 1981). Первичная про-
дукция зооксантелл в расчете на особь хозяина у акан-
тарий мала в сравнении с полицистинами и планктон-
ными фораминиферами (Caron et al., 1995). Возможно,
низкая продуктивность зооксантелл акантарий — это
эффект их компактной упаковки в ограниченном объ-
еме внутрикапсуллярной цитоплазмы.
Насыщающая плотность потока излучения для фо-
тосимбионтов акантарий исключительно высока, и они
продолжают фиксировать углерод даже в полдень у по-
верхности (Caron et al., 1995). В этом контексте, воз-
можно, стоит вспомнить о наличии многочисленных
пигментных гранул в эндоплазме акантарий и провести
аналогию с протистами, живущими при избыточном
освещении, такими как Chlamydomonas nivalis (Chlo-
rophyta), у которого обильные каротиноиды защищают
фотосистему, исполняя функцию и экрана, и антиокси-
данта.
Повреждающим фактором для организма, обитаю-
щего у поверхности воды, является и штормовая тур-
буленция. Считается, что акантарий обладают самым
совершенным гидростатическим аппаратом среди всех
пелагических саркодовых, который позволяет им кон-
центрироваться у поверхности, но быстро уходить на
глубину в преддверии надвигающегося шторма (по-
гружение осуществляется гораздо быстрее, чем всплы-
тие). Через несколько дней, как заштилеет, взрослые
трофонты вновь скапливаются у самой поверхности.
Готовящиеся к размножению экземпляры переста-
ют питаться и уходят на глубину 100-200 и более мет-
ров. Здесь же происходит и цистообразование. Цисты
продолжают опускаться. Ювенильные особи появля-
ются в глубинных горизонтах. С ростом они поднима-
ются в эпипелагиаль.
По сезонной динамике акантарий данные отрывочны.
Эксперименты с седиментационными ловушка-
ми, установленными в океане, дали весьма неожидан-
ные результаты. Оказалось, что в батипелагиали на
долю цист и мертвых клеток акантарий приходится
до 5-10% потока органического вещества — это очень
существенная доля, учитывая, что биомасса акантарий
в поверхностных водах редко достигает 1% суммарно-
го обилия автотрофных и гетеротрофных планктеров.
Интенсивная продукция цист, а также большой удель-
ный вес цист и скелетов акантарий за счет целестина
и, как следствие, высокая скорость их оседания, по-
видимому, обуславливают этот дисбаланс (Michaels et
al., 1995; Martin et al., 2010). Секвенирование ДНК из
проб морской воды с глубины несколько километров
выявило разнообразные последовательности, принад-
лежащие акантариям (или неизвестным родственни-
кам акантарий) (Not et al., 2007; Alexander et al., 2009).
Таким образом, акантарий вносят существенный, не
вполне еще оцененный вклад в поток органических и
минеральных частиц на дно океана.
Стронций служит индикатором определенных со-
бытий, происходивших в океане в прошлом. Палеоо-
кеанологи изучили современное распределение Sr в
океанах, и оказалось, что верхний стометровый слой
водного столба обеднен стронцием по сравнению с
нижезалегающей толщей. Планктонологические ис-
следования показали, что именно поток тонущих цист
и скелетов акантарий выносит сернокислый стронций
из эпипелагиали (De Deckker, 2004; Martin et al., 2010).
Загадкой долго оставалось происхождение обильных
микрочастиц барита, взвешенных в толще вод оке-
ана, пока не обнаружили, что растворение целести-
на в морской воде сопряжено с выпадением в осадок
BaSO4 (Bernstein, Byrne, 2004). Помимо того, барий в
заметных количествах присутствует в качестве при-
меси в целестине акантарий и, также как стронций,
транспортируется в глубинные воды потоком их цист
и скелетов. Таким образом, цикл Sr и Ва в океане в
значительной мере находится под контролем проти-
стов акантарий.
Питание, метаболизм, клеточные компартменты,
ядерные фазы, жизненный цикл, поведение, адаптации
акантарий совсем или почти совсем не изучены. Эти
изящные морские протесты безусловно заслуживают
более пристального внимания.
Систематический обзор
На сегодняшний день описано около 150 видов
акантарий, которые распределены по 20 семействам и
50 родам. Классификация дана по В.В. Решетняк (1981)
с уточнениями Февр с соавторами (Febvre et al. 2000).
108
ACANTHARIA
Рис. 53. Представители отряда Holacanthida.
А — организация клетки Acanthochiasma rubescens\ скелет {Б) и центральный участок диаметральной спикулы (В) Acanthocyrta haeckeli', центральный
участок диаметральной спикулы Acanthospira spiralis (Г); интактный (Д) и частично дезинтегрированный (Е) скелет Acanthocolla cruciata. ж — жиро-
вая капля; кр — кристаллоид; пг — пигментное тельце; рп — ризоподии. (По: Schewiakoff, 1926).
Изначально эта система была разработана В.Т. Ше-
вяковым (Schewiakoff, 1926), который был убежден в
существовании полового процесса у акантарий и по-
этому использовал термины «гамонт», «гаметогенез»,
«гаметы». В дань уважения профессора Шевякова мы
сохраним эти термины в диагнозах таксонов, но бу-
дем помнить о том, что наличие полового процесса у
акантарий до сих пор не доказано, и соответствующие
стадии, возможно, относятся к процессу множествен-
ного бесполого размножения. Приводим диагнозы всех
отрядов, семейств и родов. Дополнительную таксоно-
мическую информацию читатель сможет почерпнуть
из монографии В.В. Решетняк (1981). Если в диагнозах
упомянуты эндоплазма и эктоплазма, то они разграни-
чены по Шевякову (см. раздел Строение клетки). Цвет
эндоплазмы указан согласно «Иллюстрированному
атласу простейших» (Febvre et al., 2000); на рисунках
Шевякова цвет эндоплазмы часто отличен, что говорит
о лабильности этой характеристики. Помимо иллю-
страций, приведенных в этой главе, изображения пред-
ставителей большинства семейств акантарий обще-
доступны в сети Интернет, в частности на страницах
microscope.mbl.edu и wikipedia.org.
Отряд Holacanthida Schewiakoff 1926
Десять диаметральных спикул равной или нерав-
ной длины, соприкасаются или сплетаются в центре
клетки. Скелет, обработанный серной кислотой, распа-
дается на отдельные спикулы. Эндоплазма с пигментом
и многочисленными ядрами. Собственно эктоплазма
более прозрачная и менее гранулярная, чем эндоплаз-
ма, выглядит как студенистая оболочка. Граница меж-
ду эндоплазмой и эктоплазмой неявная. Центральная
капсула располагается близко к кортексу и плохо раз-
личима на светооптическом уровне. Поверхность клет-
ки неупорядоченно неровная или ограничена тонким
кортексом. Цитоплазму пронизывают многочисленные
тонкие аксонемы. Миофриски плоские. Гаметогенез в
цисте (рис. 52, Б).
Сем. Acanthochiasmidae Haeckel 1862
(рис. 53, А)
Длинные прямые спикулы равной длины только
соприкасаются в центре клетки. Спикулы более или
ACANTHARIA
109
менее цилиндрические, гладкие. Калимма вакуолизи-
рована. Кортекс различим, когда калимма полностью
вздута после длительного штиля. Миофриски чрез-
вычайно тонкие, видны при посредстве электронного
микроскопа как узкие плоские ленты. Гаметогенез в
сферической или удлиненной цисте. Единственный род
Acanthochiasma Haeckel 1862 с шестью видами: А. ги-
bescens, A. fusiforme, A. serrulata, A. planum, A. quadran-
gulatum и A. hertwigi. Среди этих видов только первые
два обычны. Распространение: Атлантика (Саргассово
море, Южное Пассатное течение), Индийский океан,
Средиземное море, западная Пацифика.
Сем. Acanthoplegmidae Schewiakoff 1926
(рис. 54, вкл.; рис. 55, А, вкл.)
Спикулы образуют в центре рыхлое сплетение.
Они длинные, равновеликие, цилиндрические, пря-
мые и очень тонкие. Эндоплазма содержит коричневые
или желтоватые включения и многочисленные ядра.
Эктоплазма более прозрачна. Центральная капсула в
виде ажурной сеточки. Кортекс — эластичная сеть с
гексагональной ячеей. Два крупных плоских миофри-
ска целиком укрыты кортексом. Непосредственно под
кортексом вокруг каждой спикулы имеется окаймле-
ние из крупных сферических гранул (их В.Т. Шевяков
ошибочно счел зооксантеллами [Febvre et al., 2000]).
Гаметогенез в удлиненной цисте. Единственный род —
Acanthoplegma Schewiakoff 1926 с единственным ви-
дом — A. krohni (Haeckel 1860). Обитает во всех океа-
нах, но не обилен.
Сем. Acanthocollidae Schewiakoff 1926
Спикулы цилиндрические, равной или неравной
длины. Спикулы перекручены между собой в центре
тела, составляя компактное сплетение; иногда сцемен-
тированы. Эндоплазма включает зерна пигмента ко-
ричневатого цвета и небольшое количество ядер. Эк-
топлазма прозрачная, калимма с анастомозирующими
тяжами. Стенка центральной капсулы волнистая. За
пределы кортекса выходят малочисленные аксоподий.
Миофриски треугольные и очень короткие, по 2-6 на
вершину. Гаметогенез в удлиненной цисте. Три рода.
Род Acanthospira Schewiakoff 1926
(рис. 53, Г, вкл.; рис. 56, А)
Спикулы одинакового строения и равной длины.
Центральное сплетение спикул неплотное. Миофри-
сков 2. Циста длинная цилиндрическая.
Род Acanthocyrta Schewiakoff 1926
(рис. 53, Б, В; рис. 56, В, вкл.)
Спикулы одинакового строения и почти равной
длины. Поверхность центральных участков спикул
неровная, они плотно подогнаны друг к другу и ком-
пактно сплетены. Миофрисков 6. Циста двуконусной
формы.
Род Acanthocolla Schewiakoff 1926
(рис. 53, Д, Е; рис. 56, Б, вкл.)
Две экваториальные спикулы гораздо толще и
длиннее, чем остальные восемь. Центральные участки
спикул сцементированы в базальное зерно. Цитоплаз-
матическое тело в форме квадратной или прямоуголь-
ной пластины. Миофрисков 4. Циста цилиндрическая
с приостренными полюсами, по ее оси различимы две
бывшие экваториальные спикулы.
Отряд Symphyacanthida Schewiakoff
1926
Скелет из 20 радиальных спикул. Проксимальные
концы спикул спаяны в маленький гомогенный шар
(расширение) или игольчатое звездообразное обра-
зование в центре клетки. Иглы не разъединяются при
обработке скелета серной кислотой. Эндоплазма с
ядрами, зернами коричневого, желтого или красновато-
го пигмента. Собственно эктоплазма с анастомозиру-
ющими цитоплазматическими тяжами и аксонемами.
Центральная капсула различима в световой микроскоп,
представляет собой переплетение тонких нитей при
наблюдении посредством электронного микроскопа.
Калимма прозрачна. Кортекс ясно различим при на-
блюдении в световой микроскоп, представляет собой
эластичную сетку с многочисленными порами, через
которые выходят аксоподий. Миофриски плоские. Га-
метогенез в цисте.
Сем. Amphilithidae Haeckel 1887,
emend. Schewiakoff 1926
Две экваториальные спикулы толще и длиннее
остальных. Тело клетки цилиндрическое или веретено-
видное. В эндоплазме многочисленные ядра и зооксан-
теллы. Миофрисков 6-24 на спикулу. Два рода.
Pop,Amphilithium Schewiakoff 1926
(рис. 49; 57, Б; рис. 58, А, вкл.)
Две главные экваториальные спикулы разной дли-
ны; более длинную называют задней. Остальные 18
спикул в 5-20 раз короче, чем задняя главная. Миофри-
сков 12, 16 или 24.
PoRAmphibelone Schewiakoff 1926
(рис. 58, Б, вкл.; рис. 59, Б, вкл.)
Две главные экваториальные спикулы одинаковой
или почти одинаковой длины, но отличны по строению.
Остальные 18 спикул в 1,5-2 раза короче, чем главные
экваториальные. Миофрисков 6-16.
110
ACANTHARIA
ACANTHARIA
111
Сем. Astrolithidae Haeckel 1887,
emend. Schewiakoff 1926
Спикулы равной или почти равной длины и одинако-
вой формы. Эндоплазма шаровидная. Стенка централь-
ной капсулы очень тонкая. Кортекс из эластичных тя-
жей, меж которыми остаются узкие щели. Миофрисков
6-12 лентовидных или 24-32 нитевидных. Четыре рода.
Род Heliolithium Schewiakoff 1926
(рис. 54, Б, вкл.; рис. 59, Д, вкл.)
Спикулы цилиндрические, идентичны по длине и
толщине; у некоторых экземпляров две супротивные
экваториальные спикулы заметно длиннее, а иногда
и толще остальных. Проксимальные концы спикул
утолщены. Они сливаются и формируют шарообраз-
ную структуру. Дистальные концы спикул заострены.
Мембрана периспикульной вакуоли тесно прижата к
скелету. Эндоплазма золотисто-желтая, содержит мно-
гочисленные мелкие ядра и жировые включения. Соб-
ственно эктоплазма слабо гранулированная, содержит
крупные экструсомы (кинетоцисты). Калимма прозрач-
ная, ячеистая, с аксонемами и цитоплазматическими
тяжами. Центральная капсула лежит близко к перифе-
рии, стенка ее организована как шерстистое сплетение
фибрилл. Кортекс — сеть из многих слоев эластичных
тяжей. Аксоподий выходят через отчетливые отверстия
в кортексе, которые расположены посередине между
соседствующими спикулами. Миофрисков 24-32.
Единственный вид — Н. aureum Schewiakoff 1926: тро-
пическая зона Индийского океана, Средиземное море.
РодAcantholithium (Haeckel 1887)
(рис. 60, А, вкл.)
Спикулы ромбические в сечении. Миофриски па-
лицеобразные, 8-12.
Род Astrolithium Haeckel 1860
(рис. 60, Б, Г, вкл.)
Спикулы цилиндрические, сильно расширенные у
основания. Миофриски широкие, 6-8.
Род Astrolonche Haeckel 1882
(рис. 60, 6, вкл.)
Спикулы цилиндрические с 2-6 продольными ря-
дами острых выступов (апофизов) в проксимальной
части.
Сем. Pseudolithidae Schewiakoff 1926
Спикулы очень тонкие, одинаковые по форме и в
большинстве случаев одинаковые по длине. Базальные
концы спикул имеют вид пирамид. Эндоплазма не-
больших размеров, шаровидной или эллипсоидальной
формы, желтовато-коричневая, содержит единственное
ядро и литосомы (Febvre et al., 2000). Калимма совер-
шенно прозрачная, с тонкими цитоплазматическими
тяжами, составляющими редкоячеистую сеть. Мио-
фрисков 16 на спикулу. Три рода.
Род Pseudolithium Schewiakoff 1926
(рис. 58, Г, вкл.)
Спикулы одинаковой длины; либо цилиндрические
по всей длине, либо в проксимальной части имеют
овальное или ромбическое поперечное сечение. Апо-
физов нет.
Род Dicranophora Schewiakoff 1926
(рис. 57, Г)
Спикулы одинаковой длины; цилиндрические в
дистальном участке и четырехгранные сжатые в прок-
симальном участке. Два противолежащих раздвоен-
ных апофиза отходят от спикулы в пределах V3 длины
от ее основания. Единственный вид — D. buetschlii
Schewiakoff 1926: Средиземное море.
Род Haliommatidium Mueller 1858
(рис. 47; рис. 58, 6, Д, вкл.)
Спикулы четырехгранные. Апофизы первого по-
рядка отходят мутовкой в пределах 73 длины от осно-
вания спикулы; апофизы второго и третьего порядка
отрастают под прямым углом в плоскости, перпенди-
кулярной оси спикулы. Апофизы совокупно образуют
решетчатую пластину с ромбическим контуром, изо-
гнутую по сфере. Пластины всех спикул могут смы-
каться, формируя решетчатую раковину сферической
формы.
Отряд Chaunacanthida Schewiakoff
1926
Скелет из 20 радиальных спикул. Спикулы погру-
жены основаниями в расположенный в центре фибрил-
лярный сократимый матрикс и могут испытывать угло-
вое смещение. Основания спикул заострены и имеют
Рис. 57. Представители отрядов Chaunacanthida (А, Б) и Symphyacanthida (В, Г).
А — инцистирование (стадия litholophus) Heteracon biformis', Б — организация клетки Heteracon biformis', В — Amphilithium clavariuirr, Г— организа-
ция клетки Dicranophora buetschlii. ап — аксоподия; ж — жировая капля; з — зооксантелла; ко — кортекс; кош — кортикальный шов; кр — кристал-
лоид; м — миофриски; рп — ризоподии; ск — дисковидный скелетный элемент; цк — центральная капсула; эвр — эластичные волокна радиальные;
эк — эктоплазма; экс — эктоплазматическая сеть; эн — эндоплазма; я — ядро. (По: Schewiakoff, 1926).
112
ACANTHARIA
огранку (как заточенный ножом карандаш). Спикулы
крестообразные в поперечном сечении; обычно два
противолежащих киля имеют пильчатый край, а два
другие гладкий. Внутрикапсулярная цитоплазма почти
всегда черная или красноватая. Центральная капсула
хорошо различима у представителей некоторых родов.
Калимма прозрачная. У многих видов кортекс несет хо-
рошо заметный рисунок широких кортикальных швов.
Миофриски по 4-16 у каждой спикулы, лентовидные,
очень длинные, сокращаются с большой амплитудой
и развивают большое усилие. Фотосимбионты из Di-
noflagellata обнаружены у представителей некоторых
родов. Инцистирование идет через стадию litholophus
(рис. 52, А). Циста продолговатая, вся поверхность вы-
стлана мелкими полигональными пластинками, име-
ются мелкие поры по углам пластинок и апертура на
одном полюсе.
Сем. Stauroconidae Schewiakoff 1926
Одна, две или четыре спикулы длиннее, чем осталь-
ные. Эндоплазма красная или черная. Собственно экто-
плазма и калимма бесцветные. Хорошо видны корти-
кальные швы. Миофрисков 6-12 на спикулу. Три рода.
Род Heteracon Schewiakoff 1926
(рис. 57, Д, Б)
Одна спикула длиннее остальных и имеет форму
шпателя. Остальные спикулы имеют крестовидное по-
перечное сечение; два противолежащих киля с ровным
гребнем, два других несут тонкие зубчики. Единствен-
ный вид — Н. biformis (Popofsky 1904): тропическая
Атлантика и Средиземное море.
Род Amphiacon Schewiakoff 1926
(рис. 61, Д, вкл.)
Две главные спикулы втрое длиннее и вдвое шире
остальных. Побочные спикулы имеют крестовидное
поперечное сечение; два противолежащих киля острые
с зубчиками, два другие гладкие. Цитоплазма корич-
невая или красноватая, гранулярная. Миофрисков 6-8.
Единственный вид — A. denticulatus (Haeckel 1860):
Средиземное море.
Род Stauracon Schewiakoff 1926
(рис. 54, В, вкл.)
Четыре экваториальные спикулы (с тонкими зуб-
чиками) в 3-4 раза длиннее, чем остальные спикулы
(гладкие). Эндоплазма ромбической формы в эквато-
риальной проекции, черная. Центральная капсула хо-
рошо различима. Миофриски либо медленно ундули-
руют, либо сокращаются быстро и мощно. У стадии
инцистирования litholophus спикулы в коническом пуч-
ке широко разведены (в отличие от Heteracon). Един-
ственный вид — S. pallidus (Claparede 1855): Северная
Атлантика, нотальная зона Индийского океана, Среди-
земное море.
Сем. Conaconidae Schewiakoff 1926
(рис. 61, Б, вкл.)
Спикулы равной длины (0,1-0,2 мм); два проти-
волежащих киля с пильчатым краем, а два другие с
гладким. Эндоплазма светлая, шаровидной формы.
В собственно эктоплазме заключены немногочислен-
ные зооксантеллы (динофлагеллаты); здесь же непо-
средственно перед инцистированием формируются
мелкие полигональные пластинки, характеризующиеся
двойным лучепреломлением. Стенка центральной кап-
сулы очень тонкая. Калимма гомогенная, светлая. Кор-
тикальные швы отсутствуют. Миофрисков 4-6 на спи-
кулу. Единственный род — Сопасоп Schewiakoff 1926
с единственным видом — С. foliaceus (Haeckel 1887);
обычен.
Сем. Gigartaconidae Schewiakoff 1926
(рис. 48, Д; рис. 59, Ж, вкл.;
рис. 61, В, вкл.)
Спикулы длинные (1-2 мм), одинаковые по форме
и размеру. У некоторых видов одна или две спикулы
несколько длиннее, чем остальные. Два противолежа-
щих киля спикулы имеют пильчатый край, а два дру-
гие — гладкий. Калимма гранулярна. Кортикальные
швы хорошо заметны. Миофрисков 6-8 на спикулу.
Единственный род — Gigartacon Schewiakoff 1926 с
шестью видами: G. fragilis, G. denticulatus, G. muelleri,
G. abcisus, G. cordiformis, G. bifidus.
Отряд Arthracanthida Schewiakoff 1926
Скелет из 20 радиальных спикул. Основания спикул
пирамидально-заостренные, слиты в единую централь-
ную массу, разъединяются после длительной обработ-
ки серной кислотой. Спикулы могут нести латеральные
выросты (апофизы), которые, если сливаются, фор-
мируют решетчатую раковину. Эндоплазма с много-
численными ядрами, зернами пигмента и включения-
ми. Зооксантеллы Haptophyta. Центральная капсула и
кортекс ясно различимы. Миофриски цилиндрические
или нитевидные, с невыразительной контрактильной
активностью. Аксонемы малочисленные. Гаметогенез
в гамонте, который морфологически мало отличен от
трофонта. Два подотряда диагностируются характером
сочленения радиальных спикул в центре клетки.
Подотряд Sphaenacantha Schewiakoff
1926
Проксимальные концы спикул выглядят как 5- или
6-гранные пирамиды (рис. 45, А). Скелет может быть
ACANTHARIA
113
представлен раковиной. Миофриски немногочислен-
ные, в количестве 6-16, реже 24-40 на спикулу.
Сем. Acanthometridae Haeckel 1887,
emend. Schewiakoff 1926
Спикулы равной или неравной длины, без апофи-
зов. Стенка центральной капсулы тонкая. Кортекс не-
сет кортикальные швы. Миофрисков 16-40 на спикулу.
Три рода.
Род Acanthometra МйНег 1856
(рис. 45, Д; рис. 54, Г, Д, вкл.; рис. 55, Е, вкл.)
Спикулы одинакового строения и одинаковой или
почти одинаковой длины. Внутрикапсулярная цито-
плазма желто-зеленая с многочисленными ядрами и
зооксантеллами. Центральная капсула в форме много-
гранника. Калимма прозрачная с тонкими цитоплаз-
матическими тяжами. Четкие кортикальные швы раз-
граничивают 20 полигональных пластин кортекса.
Миофрисков 24-40. Семь видов. Распространены всес-
ветно. Типовой вид — A. pellucida Muller 1856 — один
из самых многочисленных и широко распространен-
ных видов акантарий.
Po^Amphilonche Haeckel 1860
(рис. 59, Г, вкл.; рис. 61, Г, вкл.)
Две супротивные экваториальные иглы длиннее,
толще и устроены иначе, нежели остальные. Миофри-
сков 16—24. Два вида.
Род Tetralonche Schewiakoff 1926
Среди четырех главных спикул, одна пара может
быть несколько длиннее, чем другая. Побочные спику-
лы короче главных и могут подразделяться на несколь-
ко разновидностей. Четыре вида.
Сем. Lithopteridae Haeckel 1887,
emend. Popofsky 1904 (рис. 62, А, Б)
Четыре экваториальные спикулы крупнее осталь-
ных, они одинаковы по форме и размеру, называются
главными. Каждая главная спикула в дистальной трети
снабжена решетчатой лопастью треугольной формы;
лопасть лежит в экваториальной плоскости. Побочные
спикулы несколько различаются по длине, некоторые
могут нести тонкие перекладины в своей дистальной
части. Внутрикапсулярная цитоплазма крестообразной
или четырехлопастной формы, сжата в экваториальной
плоскости, содержит мелкие ядра и многочисленных
зооксантелл, охвачена сетью толстых фибрилл, сквозь
которую выходят аксоподий. Мелкие экструсомы ак-
тивно перемещаются вдоль аксоподий. Единственный
род — Lithoptera Muller 1858 включает два редких
вида.
Сем. Phractopeltidae Haeckel 1887
(рис. 63, А, вкл.)
Скелет включает две сферические раковины —
внутреннюю и наружную — сформированные из 5- и
6-сторонних пористых пластин. В центре каждой пла-
стины проходит спикула; соответственно, от каждой
спикулы в ее проксимальной трети отрастают на раз-
ных уровнях две пористые пластины. На поверхности
раковины видны швы, по которым соединены пори-
стые пластины. Все или некоторые спикулы в своей
дистальной части снабжены двумя противолежащими
апофизами. Апофизы у ряда видов ветвятся, и свобод-
ные концы, пересекаясь, формируют решетчатые пла-
стины, но последние никогда не образуют третью рако-
вину. Центральная капсула расположена между двумя
раковинами. Кортекс натянут над апофизами. Миофри-
сков 6-8 на спикулу. Единственный род — Phractopelta
Haeckel 1882 с пятью видами.
Сем. Dorataspidae Haeckel 1887
Спикулы одинаковы по форме и одинаковы или поч-
ти одинаковы по длине. Каждая спикула в своей прок-
симальной трети несет отростки (апофизы). Апофизов
либо 2 и они отходят супротивно, либо 4 — одной му-
товкой крестовидно. Апофизы дихотомически ветвятся
1-3 раза в плоскости перпендикулярной к оси спикулы.
Если ветви анастомозируют, то получается решетчатая
пластина (спикула пронизывает ее по центру). Пласти-
ны и ветвящиеся апофизы загнуты по сфере. Смыкаясь,
они образуют решетчатую раковину шаровидной или
чечевицеобразной формы. Зоны смыкания, или швы,
ясно различимы на многих раковинах. Швы очерчи-
вают пяти- или шестистороннюю зону вокруг каждой
спикулы. Между балками решетки расположены поры.
Их подразделяют на три категории. Аспинальные поры
примыкают к спикуле. Корональные поры образова-
ны срастанием ветвей 2-го и 3-го порядков, они рас-
положены вокруг спикулы концентрически в один
или несколько циклов. Шовные поры расположены в
зоне смыкания отростков соседних спикул. Эндоплаз-
ма желтого или красного цвета. Зооксантеллы много-
численны, содержатся во внекапсулярной цитоплазме.
Миофрисков 6-16 на спикулу. Одиннадцать родов, 35
видов. Существование родов Coscinaspis. Craniaspis.
Aconthaspis и Siphonaspis сомнительно, так как кроме
Геккеля, их представителей никто не отмечал (Решет-
няк, 1981). Пять родов космополитны, остальные оби-
тают в Тихом океане.
Род Pleuraspis (Haeckel 1862)
(рис. 64, Д, вкл.; рис. 65, Г)
Спикулы одинаковые по длине, цилиндрические.
Апофизы отходят на расстоянии ~’/3 длины спикулы от
ее основания. Апофизов два, они дают 1-2 ветвления.
Терминальные ветви апофизов одной спикулы между
собой не соединяются. Раковина решетчатая крупноя-
114
ACANTHARIA
ACANTHARIA
115
чеистая. От каждого участка смыкания апофизов сосед-
них спикул центробежно отходят 1-2 тонких гарпуно-
образных шипа. Эндоплазма желтоватая. Миофрисков
8. Три вида.
Род Stauraspis Haeckel 1882 (рис. 65, Е)
Спикулы одинаковые по длине, цилиндрические.
Апофизы отходят на расстоянии ~’/3 длины спикулы
от ее основания. Терминальные ветви апофизов одной
спикулы между собой не соединяются. Апофизов 4,
они дают 1-2 ветвления; всего получается 12-16 тер-
минальных ветвей. Раковина шаровидная решетчатая
мелкоячеистая. Миофрисков 8. Два вида.
Род Lychnaspis Haeckel 1882
(рис. 40; рис. 59, Б, вкл.; рис. 64, Б, вкл.)
Спикулы одинаковые по длине. Раковина шаровид-
ная, состоит из решетчатых пластин. Каждая пластина
имеет 4 аспинальные поры и окружена 8-12 шовными
порами. Рядом со швом берут начало тонкие гарпуноо-
бразные шипы, направленные центробежно. Эндоплаз-
ма желтоватая. Миофрисков 8-16. Девять видов.
Род Icosaspis Haeckel 1882 (рис. 65, Д)
Спикулы одинаковые по длине. Раковина шаровид-
ная, состоит из пористых пластин. Каждая пластина
имеет 8 крупных аспинальных пор и 1-2 цикла мелких
корональных пор. В швах в один ряд расположены мел-
кие шовные поры. Центральная капсула обычно розо-
вая. Миофрисков 12-16. Три вида.
Род Dorataspis Haeckel 1860
(рис. 64, 6, вкл.; рис. 65, Д, Б)
Спикулы одинаковые или почти одинаковые по
длине. Раковина шаровидная или чечевицеобразная,
представляет собой массивный панцирь. Внешняя
поверхность панциря гладкая; ясно различимы швы
между пяти- и шестиугольными пластинами. Каждая
пластина имеет 2 аспинальные поры. Каждый шов
содержит от 1 до 4 более мелких шовных пор. Соот-
ветственно, каждая пластина панциря очерчена 5-20
шовными порами. Эндоплазма бесцветна. Миофрисков
6-12. Шесть видов.
Род Coscinaspis Haeckel 1887
Спикулы равновеликие. Раковина шаровидная в
виде массивного панциря. Его внешняя поверхность
гладкая или несет тонкие шипы. Швы ясно различимы
между пластинами. Каждая пластина имеет 2 аспи-
нальные поры и 4-12 корональных пор. Каждый шов
снабжен одной шовной порой. Два вида.
Род Craniaspis (Haeckel 1887)
Спикулы равновеликие. Раковина шаровидная в
виде массивного панциря с гладкой внешней поверхно-
стью. Пластины панциря 5- и 6-сторонние. Швы ясно
различимые, волнистые. Шовных пор нет. Каждая пла-
стина имеет 2 аспинальные поры и много корональных
пор. Единственный вид: С. parmipora (Haeckel 1887),
тропическая Атлантика.
Род Hystrichaspis Haeckel 1887
(рис. 65, 6)
Раковина — шаровидный панцирь без швов. Внеш-
няя поверхность панциря — это сочетание многочис-
ленных воронкообразных ямок и гребней между ними;
по лезвию гребня отходят радиальные шипы. Спикулы
равновелики, каждая пронизывает дно ямки; примыкая
к спикуле, расположены две аспинальные поры, про-
бодающие дно ямки. Остальные ямки меньше по раз-
меру, они лежат в шовной зоне панциря и их называют
шовными. Аспинальную ямку окружают 10-12 шов-
ных ямок. Шовные ямки, прободенные порой и слепые
(без пор), закономерно чередуются. Эндоплазма темно-
красная. Миофрисков 8. Четыре вида.
Род Dictyaspis Haeckel 1887
(рис. 62, 6)
У всех шовных ямок дно прободено порой. Эндо-
плазма бесцветная, сферической или сфероидальной
формы. Миофрисков 8. Два вида.
Род Aconthaspis Haeckel 1887
Имеются корональные ямки. Дно каждой корональ-
ной и шовной ямки прободено одной порой. Три вида.
Род Siphonaspis (Haeckel 1887)
emend. Schewiakoff 1926
Раковина — чечевицеобразный панцирь без швов.
Внешняя поверхность панциря — это сочетание мно-
гочисленных воронкообразных ямок и гребней между
ними; по лезвию гребня отходят радиальные шипы.
Спикулы подразделяются на главные и побочные.
Главные более мощные, их шесть: две экваториальные
Рис. 62. Представители отряда Arthracanthida.
Ч. Б — Lithoptera muelleri\ В — Dictyaspis solidissima', Г— Hexaconus ciliatus\H— Coleaspis vaginata; E — Stauracantha orthostaura. an — аксоподия;
ж — жировая капля; з — зооксантелла; ко — кортекс; кош — кортикальный шов; м — миофриски; о — отверстие в кортексе для аксоподии; пщ —
пищевой объект; поа — пора аспинальная; пош — пора шовная; рп — ризоподии; ш — шип; эвр — эластичные волокна радиальные; экс — эктоплаз-
матическая сеть; я — ядро; яа — ямка аспинальная; яш — ямка шовная. (По: Schewiakoff, 1926).
116
ACANTHARIA
Рис. 65. Скелет представителей семейства Dorataspidae.
А, Б — Dorataspis loricata: взрослый экземпляр (А) и ювенильный экземпляр без зубчатой каймы вокруг пор и без шипов (Л); В — Hystrichaspis dor-
sata; Г— Pleuraspis costatcr^— Icosaspis ornata’, E — Stauraspis staurantha. noa — пора аспинальная; пок — пора корональная; пош — пора шовная;
р — пластина раковины; ш — шип; яа — ямка аспинальная; яш — ямка шовная. (По: Schewiakoff, 1926).
Рис. 66. Спикулы и апофизы представителей подотряда Phyllacantha.
А — Acanthostaurus purpurascens', Б — Stauracantha orthostaura', В — Phatnacantha icosaspis’, Г — Phyllostaurus cuspidatus’, Д — Pristacantha multi-
dentata\ E — Pristacantha octodon', Ж — Xiphacantha quadridentata', 3 — Dictyacantha tabulator И— Phatnacantha icosaspis. (По: Schewiakoff, 1926).
ACANTHARIA
117
118
ACANTHARIA
спикулы и все полярные на том же меридиане. Аспи-
нальные ямки, через которые выходят главные спи-
кулы, — самые крупные; их дно прободено шестью
аспинальными порами. Аспинальные ямки побочных
спикул меньше по размеру и прободены двумя аспи-
нальными порами. Каждую аспинальную ямку окру-
жают 10-12 маленьких шовных ямок; последние все
имеют одну тонкую пору. Единственный вид: S. cristata
(Haeckel 1887): Тихий океан.
Сем. Hexalaspidae Haeckel 1887
Главных спикул две или шесть, они много мощ-
нее побочных и отличаются от них по форме. Поверх-
ность толстостенной раковины покрыта многочис-
ленными, чаще в виде воронок, ямками, дно которых
прободено порами. Кромки ямок оторочены зубчатой
каймой. Последняя приподнята по краю ямок, про-
низанных спикулами. Вокруг главных спикул кайма
особенно мощно развита и образует манжету. Ямка,
через дно которой проходит спикула, называется аспи-
нальной. К каждой спикуле примыкают две аспиналь-
ные поры, расположенные на дне аспинальной ямки.
К аспинальной ямке примыкают, составляя окруж-
ность, 8-12 более мелких шовных ямок, каждая с од-
ной маленькой шовной порой. Центральная капсула
заключена внутри раковины. На каждой спикуле 8-12
миофрисков. Три рода.
Род Coleaspis Haeckel 1882
(рис. 62,Д)
Главных спикул две: экваториальные противолежа-
щие. Раковина чечевицеобразная. Манжеты есть у всех
игл, они низкие (<V3 высоты выступающего над рако-
виной участка спикулы). Три редких вида.
Род Hexalaspis Haeckel 1882
(рис. 63, Б, вкл.)
Главных спикул шесть: две экваториальные и на
том же меридиане все полярные. Манжеты вокруг спи-
кул отсутствуют. Раковина шаровидная или линзовид-
ная. Два редких вида.
Род Hexaconus Haeckel 1887
(рис. 44; 62, Г)
Главных спикул шесть: две экваториальные и на
том же меридиане все полярные. Манжеты имеются,
по крайней мере, вокруг главных спикул. Раковина ша-
ровидная или чечевицеобразная. Шесть редких видов.
Сем. Diploconidae Haeckel 1887
(рис. 43; рис. 59, В, вкл.; рис. 63, 3, вкл.)
Спикулы различны по размеру и форме. Две эква-
ториальные спикулы — самые длинные и толстые; их
называют главными. Все спикулы пронзают толсто-
стенную эллипсоидальную раковину. Каждая из двух
главных спикул оторочена манжетой в форме раструба.
Манжета несет продольные бороздки и имеет пильча-
тый край. Раковина прободена порами. Около каждой
спикулы имеются две аспинальные поры и на удалении
от нее по окружности расположены 5-6 шовных пор.
Центральная капсула заключена внутри раковины и
содержит ядра и липидные капли. Аксоподий выходят
через шовные поры. Калимма расположена вне ракови-
ны. Кортекс подвешен на окончаниях побочных спикул
при участии 6-12 миофрисков. Единственный род Dip-
loconus Haeckel 1860 включает пять редких видов.
Подотряд Phyllacantha Schewiakoff 1926
Проксимальный конец каждой спикулы несет 4—6
продольных гребней в форме лезвия (рис. 66, Б). Ос-
нования спикул собраны в округлую звездчатую массу,
между ними остаются пирамидальные полости. Спи-
кулы гладкие или снабжены апофизами. Стенка цен-
тральной капсулы толстая. Миофриски многочислен-
ные, в количестве 16-60 на спикулу.
Сем. Phyllostauridae Schewiakoff 1926
Спикулы без апофизов. Пять родов.
Род Phyllostaurus (Haeckel 1862)
(рис. 41; 66, Г)
Все спикулы одинакового строения и одинаковой
длины, реже одна или две экваториальные спикулы
длиннее остальных. Четыре вида.
PonAmphistaurus Schewiakoff 1926
(рис. 59, Б, вкл.; рис. 67, А, вкл.)
Две противолежащие экваториальные спикулы
длиннее, толще и иного строения, чем остальные. Цен-
тральная капсула удлиненная. Миофрисков 16-20. Че-
тыре вида.
Род Acanthostaurus Haeckel 1862
(рис. 45, Б; рис. 59, А, вкл.; рис. 66, А;
рис. 67, Б, Г-Е, вкл.)
Главных спикул четыре, они одинаковы по разме-
ру и строению, расположены крестообразно. Побоч-
ные спикулы несколько различаются между собой по
размеру и форме. Центральная капсула в форме ква-
дратной подушки. Эндоплазма красная. Миофрисков
16-30. Четыре вида.
Род Lonchostaurus (Haeckel 1862)
(рис. 67, 6, вкл.)
Экваториальные спикулы — главные. Одна пара
противолежащих главных спикул отличается от дру-
ACANTHARIA
119
гой пары. Побочные спикулы мельче и иного строения.
Проекция центральной капсулы от удлиненной до ром-
бической. Миофрисков 16. Два вида.
Род Zygostaurus Haeckel 1887
Все спикулы экваториального квартета — главные.
Главные спикулы, составляющие короткую пару, иден-
тичны, а составляющие длинную пару, различаются по
форме и длине. Побочные спикулы мельче и иного стро-
ения; тропические спикулы отличаются от полярных.
Контур центральной капсулы ромбический. Три вида.
Сем. Stauracanthidae Schewiakoff 1926
Все спикулы равновелики и чаще одинаковой
формы, четырехгранные; поперечное сечение кресто-
видное. Перпендикулярно к оси спикулы от ее ребер
отходят апофизы, которые имеют вид шипа, иглы или
продольно ориентированной пластины. Игловидные
апофизы могут ветвиться: апофизы второго и третье-
го порядка отходят под прямым углом в плоскости,
перпендикулярной оси спикулы. Апофизы соседних
спикул не соединяются. Основание спикулы оперено
четырьмя продольными выростами в форме лезвия.
Центральная капсула толстостенная. Миофрисков 40-
60 на спикулу. Четыре рода.
Род Pristacantha Haeckel 1887
(рис. 66, Д, Е; рис. 68, Б, вкл.)
Апофизы имеют вид шипа, не ветвятся. Их не ме-
нее восьми; отрастают на разных уровнях спикулы. Че-
тыре вида.
PoftXiphacantha Haeckel 1862
(рис. 66, Ж; рис.68, А, вкл.)
Апофизов четыре, они не ветвятся, имеют форму
шипа, пенька или продольно ориентированной пла-
стины; отрастают одной крестовидной мутовкой. Три
вида.
В монографии Шевякова изображение Pristacantha
octodon (Schewiakoff, 1926, table 43, fig. 1) ошибочно
маркировано Xiphacantha quadridentata. В монографии
Решетняк (1981) диагнозы родов Pristacantha и Xipha-
cantha содержат ошибки.
Род Stauracantha Haeckel 1882
(рис. 62, Е; 66, Б)
Апофизы игловидные, ветвящиеся. Первичных
апофизов четыре, отходящих крестовидной мутовкой.
Вторичные и третичные апофизы отрастают под пря-
мым углом в плоскости перпендикулярной оси спику-
лы, могут перекрещиваться между собой, но не сраста-
ются в решетку. Два вида.
Род Phatnacantha Haeckel 1882
(рис. 66, 6, И; рис. 68, 6, вкл.)
Спикула несет перпендикулярную ей решетчатую
пластину, которая состоит из сросшихся апофизов,
перекрещенных под прямым углом. Единственный
вид Ph. icosaspis Haeckel 1887: тропическая Пацифика,
Средиземное море.
Сем. Dictyacanthidae Schewiakoff 1926
(рис. 66, 3; рис. 68, Г, вкл.)
Спикулы одинаковые по форме и размеру, четы-
рехгранные. Каждая спикула продета через центр пла-
стины, которая имеет вид ортогональной решетки, вы-
гнутой по сфере. Пластины всех спикул составляют
сферическую решетчатую однослойную раковину.
В эндоплазме видны несколько ядер, зерна пигмен-
та и зооксантеллы. Кортекс толстый, с радиальными и
концентрическими кортикальными швами. Единствен-
ный род Dictyacantha Schewiakoff 1926 с двумя редки-
ми видами.
SUMMARY
The Acantharia аге marine planktonic heterotrophic sar-
codines with axopodia. The cell is radially symmetrical. All spe-
cies have intracellular skeleton of strontium sulfate. The skeleton
includes 20 radial spines, the arrangement of which is precise and
is described by the «Mullerian law». The termini of the radial
spines stenter an extracellular sheath of interlaced elastic fibrils.
This fibrous cortex is joined to the termini of the spines by con-
tractile myonemes. Acantharia dwell predominantly in the surface
tropical waters. Nearly all species harbor intracellular photosym-
bionts.
ЛИТЕРАТУРА
Геккель Э. 2009. Красота форм в морских глубинах (атлас радио-
лярий 1862 года). С.-Петербург: Изд-во Вернера Регена.
Догель В.А. 1950. Новые данные по филогении радиолярий // Зоол.
журн. Т. 29. № 6. С. 562-565.
Петрушевская М.Г. 1986. Радиоляриевый анализ. Л.: Наука. 200 с.
Райков И.Б. 1978. Ядро простейших. Морфология и эволюция. Л.:
Наука. 327 с.
Решетняк В.В. 1981. Акантарий (Acantharia, Protozoa) Мирового
океана// Фауна СССР. Нов. Сер. Л.: Наука. С. 3-210.
Adi S.M., Simpson A.G.B., Farmer М.А., Andersen R.A. et al. 2005.
The new higher level classification of eukaryotes with emphasis on the taxo-
nomy of protists // J. Euk. Microbiol. Vol. 52. No. 5. P. 399^451.
Alexander E., Stock A., Breiner H.W., Behnke A., Bunge J., Yaki-
mov M.M., Stoeck T. 2009. Microbial eukaryotes in the hypersaline anoxic
L’Atalante deep-sea basin // Environ. Microbiol. Vol. 11. P. 360-381.
Anderson R.O. 1983. Radiolaria. New York: Springer-Verlag. 355 p.
Bernstein R.E., Byrne R.H. 2004. Acantharians and marine barite //
Mar. Chemistry, Vol. 86. P. 45-50.
120
ACANTHARIA
Butschli О. 1880-1889. Protozoa. Abt. I (1880-1882) Sarkodina und
Sporozoa. Abt. II (1883-1887) Mastigophora. Abt. Ill (1887-1889) Infuso-
ria und System der Radiolaria // Bronn, H. G. (ed.), Klassen und Ordnung
des Thier-Reichs. Bd 1. C. F. Winter, Leipzig. P. 1-616, 617-1097, 1098—
2035.
Cachon J., Cachon M. 1964. Les mouvements de cyclose dans les axo-
podes d’Acanthaires. Les role rols de la nutrition et de la locomotion // Bull.
Inst. Oceanogr. Monaco Vol. 61. No. 1286. P. 1-8.
Cachon J., Cachon M. 1982. Actinopods // S.Parker (ed.). Synopsis
and classification of living organisms. NY: MacGraw-Hill. Vol. 1. P. 553-568.
Caron D.A, Swanberg N.R. 1990. The ecology of planktonic sarco-
dines. Rev. Aquat. Sci. Vol. 3. P. 147-180.
Caron D.A, Michaels A.F, Swanberg N.R., Howse F.A. 1995. Primary
productivity by symbiont-bearing planktonic sarcodines (Acantharia, Radio-
laria and Foraminifera) in surface waters near Bermuda // J Plankton Res.
Vol. 17. No. l.P. 103-129.
De Deckker P. 2004. On the celestite-secreting Acantharia and their
effect on seawater strontium to calcium ratios // Hydrobiologia. Vol. 517.
P. 1-13.
Delrie G., Merinfeld G. 1965. Etude de 1’absorption selective du stron-
tium par les Acanthaires // Euratom publ. 2475. Bruxelles. P. 1-53.
Febvre C., Febvre J., Michaels A. 2000. Acantharia // J.J. Lee,
G.F. Leedale & P. Bradbury (eds). An illustrated guide to the protozoa: organ-
isms traditionally referred to as protozoa, or newly discovered groups. 2nd ed.
Vol. 2. P. 783-803.
Febvre J. 1973. Le cortex des Acanthaires. II. Ultrastucture des zones
de jonction entre les pieces corticales // Protistologica. Vol. 9. No. 1. P. 87-
94.
Febvre J. 1990. Phylum Actinopoda, Class Acantharia. // Margulis L.
et al. (eds). Handbook of Protoctista. Boston: Jones and Bartlett Publishers.
P. 363-379.
Gilg I.C., Amaral-Zettler L.A., Countway P.D., Moorthi S., Sch-
netzer A., Caron D.A. 2010. Phylogenetic affiliations of mesopelagic Acan-
tharia and acantharian-like environmental 18S rRNA genes off the southern
California coast // Protist. Vol. 161. P. 197-211.
Haeckel E. 1862. Die Radiolarien (Rhizopoda Radiaria). Eine Monogr.
Berlin. 572 S.
Haeckel E. 1887. Report on Radiolaria collected by H.M.S. Chal-
lenger during the years 1873-1876 // Murray CWT aJ (ed.). The Voyage of
the H.M.S. Challenger. Vol. 18. London, Her Majesty’s Stationary Office.
1760 p.
Honjo S., Manganini S.J., Krishfield R.A., Francois R. 2008. Par-
ticulate organic carbon fluxes to the ocean interior and factors controlling the
biological pump: a synthesis of global sediment trap programs since 1983 //
Progress in Oceanography Vol. 76. P. 217-285.
Kunitomo Y, Sarashina I., lijima M, Endo K., Sashida K. 2006.
Molecular phylogeny of acantharian and polycystine radiolarians based on
ribosomal DNA sequences, and some comparisons with data from the fossil
record // Eur. J. Protistol. Vol. 42. P. 143-153.
Martin P., Allen J.T., Cooper M.J., Johns D.G., Lampitt R.S., Sand-
ers R., Teagle D.A.H. 2010. Sedimentation of acantharian cysts in the Iceland
Basin: Strontium as a ballast for deep ocean particle flux, and implications
for acantharian reproductive strategies // Limnol. Oceanogr. Vol. 55. No. 2.
P. 604-614.
Michaels A.F., Caron D.A., Swanberg N.R., Howse F.A., Michaels
C.M. 1995. Planktonic sarcodines (Acantharia, Radiolaria and Foraminifera)
in surface waters near Bermuda: abundance, biomass and vertical flux // J.
Plankton Res. Vol. 17. No. 1. P. 131-163.
Muller J. 1855. Uber die im Hafen von Messina beobachteten Polycysti-
nen // Monastber. Kgl. Preuss. Akcad. Wiss. Berlin, Jahrg. S. 1-253.
Muller J. 1859. Uber die Thalassicollen, Polycistinen und Acanthome-
tren des Mittelmeeres // Monastber. Kgl. Preuss. Akcad. Wiss. Berlin, Jahrg.
S. 1-59.
Nikolaev S.L, Berney C, Fahrni J.F., Bolivar L, Polet S., Myl’nikov
A.P., Aleshin V.V., Petrov N.B., Pawlowski J. 2004. The twilight of Helio-
zoa and rise of Rhizaria, an emerging supergroup of amoeboid eukaryotes //
Proc. Natl. Acad. Sci. USA. Vol. 101. P. 8066-8071.
Not F, Gausling R., Azam E, Heidelberg J.E, Worden A.Z. 2007.
Vertical distribution of picoeukaryotic diversity in the Sargasso Sea // Envi-
ron. Microbiol. Vol. 9. P. 1233-1252.
Pawlowski J., Burki E 2009. Untangling the phylogeny of amoeboid
protists // J. Euk. Microbiol. Vol. 56. P. 16-25.
Sakaguchi M., Suzaki T., Khan S.M.M.K., Hausmann K. 2002. Food
capture by kinetocysts in the heliozoon Raphidiophrys contractilis // Eur. J.
Protistol. Vol. 37. P. 453—458.
Schewiakoff W. 1902. Radiolaria-Acanthometrea // Memoires de 1’aca-
demie ipmeriale des sciences de St.-Petersbourg. Ser. 8. Vol. 12. No. 10.
Schewiakoff W. 1926. Die Acantharia // Fauna e flora del Golfo di Na-
poli. Vol. 37. P. 1-755.
Schroder O. 1907. Eine gestielte Acanthometridae (Podactinelius ses-
silis n. gen. n. sp.) // Deutsche Siidpolar-Expedition 1901-1903. Berlin. Bd 9
(Zool, Bd 1). Hf. 4. S. 225-236.
Wilcock J.R, Perry C.C, Williams R.J.P., Mantoura R.EC. 1988.
Crystallographic and morphological studies of the celestite skeleton of the
acantharian species Phyllostaurus siculus I I Proc. R. Soc. Lond. Vol. В 233.
P. 393-405.
PHAEODARIA Haeckel 1879
Феодарии — морские планктонные саркодовые. Эту группу,
насчитывающую более 600 видов, включают в нетаксономиче-
скую группировку Radiolaria. Ядро с участком цитоплазмы за-
ключено в толстостенную центральную капсулу. Сообщение с
внекапсулярной цитоплазмой осуществляется через три отвер-
стия. Снаружи от главного отверстия располагается специфич-
ное тело зелено-коричневого цвета — феодиум. Это скопление
гранул запасных питательных веществ, пищеварительных ваку-
олей и зерен непереваренного пигмента. Феодиум осуществля-
ет ассимиляцию пищи и кремнезема. Скелет внутриклеточный,
построен из радиальных и тангентальных чаще полых силикат-
ных спикул. У представителей большинства семейств спикулы
соединены в раковину. Скелет после смерти организма быстро
дезинтегрируется, поэтому палеонтологическая летопись фраг-
ментарна. Конфигурация органоидов и раковина у ряда семейств
билатерально симметричны. Клетки крупные и очень крупные
(разнос выростов раковины — до нескольких сантиметров). Фе-
одарии населяют всю толщу океанической пелагиали, избегают
опресненных акваторий. У феодарий не известны фотосимби-
онты.
История изучения
Феодарии — одна из самых странных, загадоч-
ных и почти неизученных групп протистов. Радиоля-
рии впервые были описаны Мейеном (Меуеп, 1834), а
собственно феодарий впервые отметил Бейли (Bailey,
1856) из морских отложений. Монографии Геккеля и
Геккера (Haeckel, 1862, 1887; Haecker, 1908), основан-
ные на материалах легендарных походов «Challenger»
и «Valdivia», по сегодняшний день являются главным
источником сведений о морфологии живых феодарий.
Все представления о строении центральной капсулы
феодарий базируются на исследовании Гертвига (Her-
twig, 1879).
Со времен основоположников самый масштабный
вклад в изучение феодарий внесла В.В. Решетняк. Она
преимущественно использовала материалы, собран-
ные ею в ходе рейсов «Витязя» в северную Пацифику.
В.В. Решетняк выполнила цитологическое исследо-
вание феодарий, охарактеризовала их вертикальное и
зональное распределение, составила определитель се-
мейств и, адаптировав воззрения предшественников,
создала систему феодарий (Решетняк, 1966), которая
воспроизведена в настоящем руководстве. Цикл цито-
логических работ Ж. и М. Кашонов, выполненный в
1960-70-е годы и подытоженный в публикации Cachon
et al. (1990), в условиях отсутствия более поздних ис-
следований, остается базисом представлений об орга-
низации клетки феодарий.
Планктонологические исследования, осуществлен-
ные в последней четверти XX века, существенно по-
полнили представления о широтном и вертикальном
распределении феодарий, об их питании и роли в
трофических цепях (Kling, 1976; Takahashi, Honjo,
1981; Gowing, Silver, 1983; Gowing, 1986, 1989; Kling,
Boltovskoy, 1999; Yamashita et al., 2002). Сбор материа-
ла для этих исследований выполняли главным образом
замыкающимися планктонными сетками. Использова-
ние седиментационных ловушек позволило оценить
вклад опускающихся скелетов феодарий в поток сили-
ката на дно (Takahashi, Honjo, 1983; Takahashi, 1997).
В одной экспедиции живой материал собирали с помо-
щью обитаемого подводного аппарата; были получены
уникальные данные о поведении феодарий (Swanberg
et al., 1986).
В последние годы регулярно публикуются статьи,
где феодарии учтены в молекулярно-филогенетиче-
ских построениях (Yuasa et al., 2006 и др.). Работы же,
посвященные морфологии, единичны (Paterson et al.,
2007).
На раннем этапе изучения радиолярий (и феода-
рий в частности) — в последней трети XIX и начале
XX столетия — крупный размер и эстетическая при-
влекательность этих морских саркодовых1 обеспечили
им интерес со стороны выдающихся протозоологов.
Затем, однако, лишь единичные исследователи всерьез
занимались феодариями. Палеонтологи оставляли без
внимания эту группу, так как скелет Phaeodaria редко
переходит в ископаемое состояние. Отсутствие интере-
са со стороны палеонтологов не стимулировало и из-
учение феодарий в рамках биологических дисциплин.
Собственная же мотивация биологов оказалась недо-
статочной для того, чтобы преодолевать очевидные
трудности, делающие феодарий неудобным объектом.
1 Саркодовые — морфологическая характеристика, давно утра-
тившая таксономическое звучание. Это протесты, клетки которых несут
временные выросты — псевдоподии. — Прим. авт.
122
PHAEODARIA
Во-первых, не удавалось поддерживать постоянную
лабораторную культуру. Во-вторых, обитают эти про-
тисты в океане и большей частью в подповерхностных
и глубинных водах; отсюда сложности с получени-
ем свежего материала. В-третьих, силикатный скелет
сильно затрудняет процедуру приготовления срезов
для микроскопии. Сведения о структурной организа-
ции и о физиологии клетки, в том числе сомнительные
и устаревшие, кочуют из сводки в сводку. Одна из са-
мых интригующих групп протистов заслуживает пере-
исследования на современном уровне.
Классификация
До 1970-х годов зоологи, придерживаясь системы
Отто Бючли (Butschli, 1880-1889), всех одноклеточных
протистов сводили в единственный тип Protozoa; и в
этих самых ранних классификациях существовал от-
носящийся к классу Sarcodina надотряд (либо отряд)
Phaeodaria. В последней четверти XX столетия, по мере
того как концепция филогенетической гетерогенности
протистов завоевывала позиции, таксономический ранг
феодарий неуклонно повышался, и они, как правило,
позиционировались как класс в составе типа Actinop-
oda (см. рис. 79). Молекулярные данные, полученные
в первом десятилетии XIX столетия, позволили убеди-
тельно показать, что феодарии принадлежат к филоге-
нетической ветви Cercozoa и не являются сестринской
группой других радиолярий (см. раздел Филогения).
В настоящем руководстве группе придан ранг типа, ис-
ходя из двух соображений. 1. Радиолярный план строе-
ния клетки (аксоподий, центральная капсула, калимма,
внутриклеточный минеральный скелет) не встречается
у филогенетически родственных групп. 2. Таксон до-
статочно солиден по объему, насчитывает около 600
видов.
В ходе таксономических пертурбаций возникло
написание Phaeodarea с окончанием -еа, подчеркиваю-
щим, что группа ранжируется как класс. В современ-
ной протистологии таксономический ранг — мало-
существенная характеристика (Adi et al., 2005; и др.).
Здесь мы сохраняем исходное написание Phaeodaria,
которым обозначаем группу безотносительно ее ранга
в классификации.
Сведения по цитологии феодарий отрывочны, по-
этому классификационными признаками служат толь-
ко особенности строения скелета. В состав Phaeodaria
входит шесть таксонов в ранге отряда (Cachon, Cachon,
1985; Cachon et al., 1990; Takahashi, Anderson, 2000).
Тип Phaeodaria Haeckel 1879
1. Отряд Phaeocystida: скелет представлен изолированными
спикулами.
1.1. Сем. Aulacanthidae
1.2. Сем. Astracanthidae
2. Отряд Phaeosphaerida: скелет - решетка из ячей треуголь-
ной, четырехугольной или полигональной формы; перекладины
решетки полые.
2.1. Сем. Aulosphaeridae
2.2. Сем. Sagosphaeridae
2.3. Сем. Cannosphaeridae
3. Отряд Phaeocalpida: пористая сферическая раковина с ра-
диально отходящими шипами обладает единственным крупным
отверстием (пиломом) и потому характеризуется радиальной
симметрией бесконечного порядка.
3.1. Сем. Castanellidae
3.2. Сем. Circoporidae
3.3. Сем. Polypyramidae
3.4. Сем. Porospathidae
3.5. Сем. Tuscaroridae
4. Отряд Phaeogromida: билатерально-симметричная или ра-
диально-симметричная мелкопористая раковина с одним круп-
ным отверстием (пиломом) и с малочисленными радиальными
шипами, отходящими только в определенных местах.
4.1. Сем. Lirellidae
4.2. Сем. Challengeridae
4.3. Сем. Medusettidae
5. Отряд Phaeogymnocellida: скелет отсутствует или развит
только около астропиле.
5.1. Сем. Atlanticellidae
5.2. Сем. Phaeodinidae
5.3. Сем. Phaeosphaeridae
6. Отряд Phaeoconchida: имеется двустворчатая раковина.
6.1. Сем. Concharidae
6.2. Сем. Coelodendridae
Строение клетки
Цитоплазма феодарий разграничена центральной
капсулой на эндо- и эктоплазму. В эндоплазме распо-
лагается ядро. В эктоплазме находятся скелет, феодиум
и цистерны, составляющие калимму (рис. 69). Клеточ-
ные органоиды и компартменты феодарий не исследо-
ваны с применением современных методик. Все мор-
фологические сведения получены более 30 лет назад
(см. История изучения), а обобщения с разной степе-
нью детализации выполнены в опубликованных за по-
следние десятилетия сводках по протистам вообще и
радиоляриям в частности (Решетняк, 1966; Grell, 1973;
Райков, 1978; Anderson, 1983; Cachon, Cachon, 1985;
Петрушевская, 1986; Cachon et al., 1990; Takahashi, An-
derson, 2000). Приводимые морфологические данные
почерпнуты из перечисленных сводок, если не дана яв-
ная ссылка на иной источник.
Центральная капсула (англ, capsule/capsu-
lum, central capsule/capsulum, capsular wall) внутрикле-
точная, имеется у всех видов. Стенка капсулы плотная,
толстая — порядка 10 мкм; неизвестен ее состав и не-
известно для каких веществ она проницаема. Эндо-
плазма и эктоплазма сообщаются через три отверстия
в стенке центральной капсулы. Одно, более крупное
отверстие, называется астропиле; место его локали-
зации именуется оральным полюсом. Два других от-
верстия — парапиле — как правило, расположены
латерально рядом с аборальным полюсом централь-
ной капсулы. Стенка капсулы не рассечена тонкими
сквозными щелями на блоки, как это имеет место у
Polycystina. По форме центральная капсула близка к
сфероиду: она чуть сплюснута по орально-абораль-
ной оси. Объем центральной капсулы и объем клетки
пропорциональны у особей разного размера, при этом
процессы подобные линьке не отмечены. То есть орга-
низм по мере своего роста добавляет материал в стен-
PHAEODARIA
123
Рис. 69. Организация клетки Phaeodaria.
ап — аксоподий, рп — ризоподии, км — клеточная мембрана, ск — тангентальные и радиальные скелетные спикулы, ка — цистерны калиммы,
мт — пучки микротрубочек, пар — парапиле, ЦОМТ — центр организации микротрубочек, я — ядро с хроматином, оц — околоядерная цистерна,
цк — центральная капсула, аст — астропиле, фе — феодиум, пс — перистом; пи — пилом. Вверху справа (врезка) схема упаковки микротрубочек в
аксонеме. (По разным авторам).
ку центральной капсулы, и та постепенно увеличива-
ется в размере.
Ядро имеет сферическую или субсферическую
форму и занимает значительную долю пространства
внутри центральной капсулы. Оно одиночное, и лишь
у некоторых представителей отрядов Phaeocystida и
Phaeocalpida в центральной капсуле находятся два
интерфазных ядра. Ядра феодарий очень крупные —
100-200 мкм в поперечнике, а у представителей се-
мейства Tuscaroridae достигают 650 мкм (Решетняк,
1966); это максимальный размер ядра, известный у
эукариот. У столь крупных ядер отношение поверхно-
сти к объему мало, но феодарии «не делают попыток»
увеличить его за счет инвагинаций ядерной оболочки;
такое конструктивное решение реализовано, например,
полицистинами, ядра которых тоже весьма крупные
(Anderson, 1983). В интерфазном ядре феодарий при-
сутствует большое количество гетерохроматина. Он,
как правило, образует центрально расположенное ско-
пление радиально лучистой формы. Зрелые трофонты
полиплоидны, >100 п (см. раздел Размножение и жиз-
ненный цикл). У наиболее изученного вида феодарий
Aulacantha scolymantha (отряд Phaeocystida) ядрышко
не выявлено. У некоторых других видов ядрышковый
материал обнаружен. По несколько фрагментов ядрыш-
ка отмечены на срезах (Решетняк, 1966). При этом
трехмерные реконструкции не выполнялись — не вы-
яснено, множественное оно или лопастное. Неизвестно
также, деградирует ли ядрышко при делении ядра.
Эндоплазма (= внутрикапсулярная цитоплазма) со-
держит протяженные цистерны толщиной 2-3 мкм, ко-
торые как чехлом укрывают ядро. Этот чехол прерван
напротив астропиле и парапиле (рис. 69). Предназна-
чение чехла непонятно. Центральная зона эндоплазмы,
прилегающая к ядру, сильно вакуолизирована. В пери-
ферической зоне эндоплазмы обнаружены палочковид-
ные образования толщиной 200 нм (англ, rodlets), т.е. в
8 раз толще микротрубочки; есть предположение, что
это созревающие экструсомы (Cachon, Cachon, 1973;
Swanberg et al., 1986).
Астропиле (лат. astropylae) — «звездчатое
отверстие»1. Оно растяжимо, имеет форму воронки,
обращенной наружу узким концом. Оттянутый кончик
называют хоботком (пробосцисом). Внутренняя по-
верхность выстлана цистерной эндоплазматического
ретикулума и собрана в продольные складки, которые
армированы продольными лентами микротрубочек
(рис. 70). Консолидированные ЦОМТы не описаны;
количество микротрубочек нарастает центробежно.
По результатам единственного ультраструктурного
исследования в просвете астропиле выявлены много-
1 Латинское существительное женского рода множественного
числа pylae означает теснины, врата; оно общеизвестно в составе грече-
ского топонима Фермопилы (греч. ©срротгиАш, лат. Thermopylae). В на-
учных публикациях существуют версии единственного числа — pyle и
руhim. Тот же корень задействован в слове pylom (вход). В русскоязыч-
ной литературе по биологии этот корень присутствует в сложносостав-
ных терминах (таких как нейропиль), которые звучат как слова мужского
рода (-пиль) или среднего рода (-пиле). — Прим. авт.
124
PHAEODARIA
Рис. 70. Схема строения астропиле феодарий.
Объемная реконструкция (I), где стрелкой указано положение попереч-
ного среза (II) с митохондриями и экструсомами в осевой зоне и лента-
ми микротрубочек, выстилающих складки стенки. (По: Cachon, Cachon,
1973).
Рис. 71. Схема строения парапиле феодарий.
мт — ствол микротрубочек, мх — митохондрии, па — палочковидные
структуры, цк — центральная капсула, ЦОМТ — центр организации
микротрубочек, экт — эктоплазма, энд — эндоплазма, эр — эндоплазма-
тический ретикулум. (По: Cachon, Cachon, 1973).
численные митохондрии и мелкие пузырьки, а также
электронноплотные тельца, интерпретируемые как
перерезанные поперек палочковидные экструсомы
(Cachon, Cachon, 1973). Астропиле называют цитофа-
рингсом. Действительно, астропиле по конструкции
(растяжимость, параллельные пластины микротрубо-
чек) напоминает сложноорганизованную клеточную
глотку («палочковый аппарат», «корзинку») хищных
эвгленовых и некоторых хищных инфузорий, которая
продвигает крупную пищевую вакуоль внутрь клетки
(Протесты 1, 2000; Протесты 2, 2007). Астропиле, не-
сомненно, выступает главным транспортным коридо-
ром, связывающим эндо- и эктоплазму. В частности,
обнаруженные здесь плотные тела, подобные экстру-
сомам, синтезируются поблизости от ядра и затем на-
правляются в эктоплазму. Что касается многочислен-
ных митохондрий, то непонятно, находятся ли они тут
транзитом или располагаются постоянно для обслу-
живания моторных белков. У ряда бесскелетных форм
пищевые вакуоли (и феодиум) сосредоточены внутри
центральной капсулы (Cachon-Enjumet, 1961а). Однако
у большинства феодарий захват и расчленение добы-
чи происходят в эктоплазме, в феодиуме; в эндоплазму
же, если и попадают, то немногочисленные пищева-
рительные вакуоли (Swanberg et al., 1986). Таким об-
разом, функциональная трактовка астропиле как кле-
точной глотки вряд ли правомерна. Отметим попутно,
что астропиле феодарий напоминает «лепестковый»
аппарат, замыкающий устье лорики у филозных про-
тистов Gromiida (Протесты 1, 2000), которые, кстати,
являются родственниками феодарий (рис. 79). Кроется
ли за этим сходством какое-то единство происхождения
или единство функции сейчас нельзя сказать: данных
мало, и получены они десятки лет назад.
Парапиле (ед. ч. parapyle, мн.ч. -ае) — простое
цилиндрическое отверстие в стенке центральной кап-
сулы. Мощный ствол микротрубочек, берущий начало
от крупного ЦОМТа, расположенного со стороны эндо-
плазмы, уходит сквозь парапиле в эктоплазму (рис. 71).
Неизвестно, осуществляется ли транспорт веществ
через это отверстие. Оба парапиле чаще расположены
вблизи аборального полюса центральной капсулы, реже
разнесены на значительное расстояние от него. Также
существуют виды, в частности многие представители
семейства Tuscaroridae, у которых парапиле локализо-
ваны в пределах оральной полусферы; их количество
иногда составляет 3^1.
Эктоплазма (= внекапсулярная цитоплазма) пред-
ставляет собой совокупность цитоплазматических тя-
жей, меж которыми заходят лакуны с морской водой.
Эктоплазма значительно превосходит эндоплазму по
объему. Геккель и другие ранние авторы подразделяли
эктоплазму Radiolaria на три концентрические зоны:
1) внутреннюю, саркоматрикс — название означает
слой, где зарождаются псевдоподии; 2) среднюю ва-
куолизированную — калимму; и 3) наружную, где
зарождается скелет, — саркодиктиум. Эта классифи-
кация воспроизведена в монографиях В.В. Решетняк
PHAEODARIA
125
(1966) и М.Г. Петрушевской (1986). Саркоматрикс и
саркодиктиум на микрофотографиях четко не отграни-
чиваются. Нет и подтверждений, приписываемой этим
слоям функциональной нагрузки. Поэтому эти терми-
ны вышли из употребления. Мощный слой калиммы
отчетливо виден у большинства феодарий. Этот термин
сохранился.
Калимма — это совокупность обширных ци-
стерн в эктоплазме. Калимма феодарий, предполо-
жительно, помогает клетке поддерживать плавучесть
близкую нулевой. Вероятно, цистерны замкнуты и
перемежаются с впячиваниями плазмалеммы, запол-
ненными морской водой (как у Polycystina; Anderson
1983); иначе, трудно представить, как эта система фи-
зически может исполнять роль поплавка (см. раздел
Плавучесть).
Ф е о д и у м (от лат. phaeo — бурый) — сплетение
цитоплазматических тяжей, внутри и вне которых, то
есть внутри- и внеклеточно, расположены тельца (Gow-
ing, 1986). Они представляют собой пищеварительные
вакуоли и запасные питательные вещества, в том числе
зерна гликогена, капли жира и гранулы белка, а также
отходы в виде непереваренных остатков и зерен пиг-
мента, причем последние чрезвычайно обильны. Со-
вокупность телец окрашена в зелено-коричневый и
иногда желтый цвет. За редкими исключениями (в со-
ставе отряда Phaeogymnocellida) феодиум имеется у
всех Phaeodaria, отчего группа получила свое название.
Он размещается в эктоплазме и у большинства видов
лежит около астропиле, но иногда охватывает всю
центральную капсулу. У некоторых представителей
Phaeogymnocellida феодиум также занимает часть вну-
трикапсулярного пространства. Из астропиле выходит
плотный цитоплазматический тяж, который ветвится в
феодиуме. Структура тяжа не исследована; возможно,
он армирован микротрубочками, продолжающимися из
астропиле. Феодиум представляет собой компартмент
клетки, где осуществляется переваривание пищи, на-
капливание отходов и аккумуляция запасных питатель-
ных веществ. Предполагается, что здесь также проис-
ходит ассимиляция и депонирование кремнезема.
Скелет феодарий внутриклеточный, целиком рас-
положен в эктоплазме. Конструктивно скелет состоит
из радиальных и тангентальных спикул. Если танген-
тальные спикулы сомкнуты, и меж ними остаются
лишь тонкие поры, что характерно для многих пред-
ставителей отрядов Phaeocalpida и Phaeogromida (см.
рис. 81, III, вкл.; рис. 90, I, вкл.), то такая раковина
обязательно имеет большое округлое отверстие —
пил ом, — через которое добыча транспортируется
в феодиум. Пилом располагается на том же радиусе,
что и феодиум и, соответственно, маркирует оральный
полюс раковины. Скелетный материал вокруг пилома
часто оттянут наружу, формируя короткую или длин-
ную трубку — перистом (рис. 69). Перистом не-
редко снабжен направленными наружу шиповидными
выростами (см. рис. 89, III, вкл.). У представителей
Challengeridae (отряд Phaeogromida) имеется так назы-
ваемая глотка (= фарингс) — трубка, берущая начало
от пилома и ввернутая в полость раковины. И глотка,
и перистом с шипами, вероятно, служат направляющи-
ми для транспортируемой в феодиум добычи и местом
крепления тянущих псевдоподий.
Материалом спикул служит обводненный SiO2 (т.е.
опал) в комбинации с органическим веществом неиз-
вестного состава. Созревание спикул описал Геккер
(Haecker, 1908), и за столетие объем знаний не увели-
чился (Афанасьева, 2006). На первом этапе заклады-
вается вакуоль с аморфным содержимым (рис. 72, I).
Еще до начала минерализации вакуоль может расти и
ветвится, и тогда в дальнейшем будет сформирована
игла сложной формы (рис. 72, II). Кремнеземсодер-
жащий матрикс откладывается в пристеночном слое
вакуоли, и, таким образом, в теле спикулы формиру-
ется осевая зона, не заполненная силикатом (рис. 72,
III). Иглы с аксиальной полостью — это характерная
особенность скелета феодарий. Отметим, что осе-
вого просвета не остается в тонких спикулах — они
сплошные. В.В. Решетняк (1966) описывает примеча-
тельный феномен: у представителей рода Aulokleptes
в просвете спикулы нередко заключен скелетный ком-
понент жертвы — игла феодарии (например, Aulacan-
tha), палочковидный панцирь пеннатной диатомеи
(рис. 72) или скелет силикофлагеллаты. Надо полагать,
мембрана дефекационной вакуоли каким-то обра-
зом меняет свою компетенцию, и вакуоль становится
спикулогенной. Концентрация силиката в океаниче-
ской воде повсеместно ниже насыщения, поэтому все
кремнеземные скелеты отмершего морского планктона
подвержены растворению. Скелеты феодарий раство-
ряются гораздо быстрее остальных, часто даже не до-
стигают дна (Takahashi, Honjo, 1983), а если достига-
ют, то большей частью в виде неидентифицируемых
обломков; из-за этого палеонтологическая летопись
Phaeodaria скудна. Наличием полостей в спикулах
лишь отчасти можно объяснить малую устойчивость
скелетов феодарий к растворению. К тому же далеко
не все спикулы феодарий имеют аксиальный просвет.
Более существенно то, что скелетный материал богат
II III IV
Рис. 72. Созревание скелетной спикулы Phaeodaria (схема пре-
образований).
I — спикулогенная вакуоль, содержащая диатомовую фрустулу. II —
почкование боковых ответвлений вакуоли. III — пристеночное отложе-
ние кремнеземсодержащего матрикса; в толстых участках вакуоли оста-
ется аксиальный просвет. IV — затвердевание кремнеземсодержащего
матрикса и резорбция мембраны вакуоли.
126
PHAEODARIA
органическим веществом; особенно велика доля ор-
ганики в стыках скелетных конструкций (за счет это-
го скелет в целом и его сочленения эластичны). После
смерти организма бактерии разрушают органический
матрикс, и скелет распадается.
Скелеты представителей высших семейств феода-
рий сочетают до десятка разных конструктивных эле-
ментов и обладают несвойственной протистам билате-
ральной симметрией (см. рис. 90, вкл.; рис. 91, вкл.).
С этой точки зрения скелет у феодарий организован
сложнее, чем у всех остальных одноклеточных существ.
Функции скелета планктонных саркодовых вооб-
ще и феодарий в частности — область догадок. Хотя
прямые подтверждения пока единичны (Swanberg et
al., 1986), разные авторы логично полагают, что очень
важной функцией скелета феодарий является под-
держка короны псевдоподий (см. раздел Питание).
Кочующее из сводки в сводку рассуждение о том, что
ажурное строение скелета радиолярий делает его лег-
ким, служа адаптацией к планктонному образу жизни
(Петрушевская, 1986 и др.), звучит неубедительно.
Все группы крупных планктонных саркодовых име-
ют скелет. Редукция скелета происходит редко: из-
вестна для немногих Phaeodaria и Polycystina и неиз-
вестна для Acantharia и планкто'нных фораминифер.
Материал скелета отнюдь не легкий. Более того, одна
из перечисленных групп — Acantharia — использует
скелетный материал с самым большим из известных
удельным весом (Raven, Giordano, 2009). Похоже, для
планктонных саркодовых важно, чтобы скелет был не
легким, а наоборот тяжелым. Это оправданно, если
скелет служит балластом в составе гидростатическо-
го аппарата. Чем тяжелее балласт, тем большей вер-
тикальной маневренностью обладает планктер, тем
быстрее он может уходить на глубину от шквала или
иной опасности. Возможно, неслучайно именно акан-
тарии с их тяжелым скелетом успешнее других план-
ктонных саркодовых освоили самый поверхностный
слой океана (см. главу Acantharia в этом томе). До-
полнительными функциями скелета могут быть уве-
личение эффективной поверхности парящей клетки и
уменьшение пищевой привлекательности организма.
Что касается механической защиты, то нелегко пред-
ставить себе хищника, от нападения которого феода-
рию убережет ее скелет.
Скелет отсутствует у большинства представителей
отряда Phaeogymnocellida. Неизвестно, существуют ли
первично бесскелетные виды (см. Систематический
обзор). Феодарии, лишенные скелета, зачастую аг-
глютинируют скелетные элементы жертв (силикофла-
геллат, диатомовых, Sticholonche и др.; рис. 96). Этот
минеральный материал, видимо, служит балластом в
составе гидростатического аппарата взамен собствен-
ного минерального скелета.
Псевдоподии феодарий двух типов. Аксоподии —
тонкие, прямые, эластичные, неанастомозирующие, с
аксонемой. Аксонема феодарий типична в том смысле,
что состоит из пучка упорядоченно упакованных па-
раллельных микротрубочек (рис. 69, врезка). Однако
в отличие от подавляющего большинства радиолярий
и солнечников у феодарий не выявляются электрон-
ноплотные связки между микротрубочками, составля-
ющими аксонему. Ствол микротрубочек по выходе из
парапиле расщепляется на пучки, которые радиально
пронизывают эктоплазму. Эти пучки и служат аксоне-
мами (рис. 69). Трудно представить стереометрически,
каким образом два ЦОМТа (расположенные в парапи-
ле) дают начало всем аксонемам аксоподий, составля-
ющих сферический ореол вокруг клетки, как например
у Aulacantha\ непонятно, существуют ли дополнитель-
ные аксоподиальные ЦОМТы на внешней поверхности
центральной капсулы.
Ситуация с псевдоподиями второго типа запу-
танная, и потребуется отступление в терминологию.
Согласно концепции, выдержанной в 1-м томе насто-
ящей серии, у саркодовых различают четыре основ-
ных класса псевдоподий: 1) лобоподии — массивные
с актиновым цитоскелетом (общеизвестны у Amoeba
proteus и других л обозных амеб); 2) филоподии —
тонкие неанастомозирующие с актиновым цитоске-
летом (у филозных амеб); 3) ретикулоподии, или гра-
нулоретикулоподии — тонкие обильно ветвящиеся и
анастомозирующие с цитоскелетом из подвижно соч-
лененных микротрубочек, характеризующиеся двуна-
правленным перемещением гранул (у фораминифер) и
4) уже упомянутые аксоподии (у радиолярий и солнеч-
ников). Помимо перечисленных основных известны
классы псевдоподий, специфичные для узкого круга
объектов. Таковы, к примеру, эпиподии раковинных
амеб, с помощью которых они крепятся в полости до-
мика, или ламеллиподия на лидирующем крае пере-
мещающегося фибробласта позвоночных. Помимо
этих четко очерченных терминов, существуют и более
размытые категории. Термин «филоподии» в публи-
кациях американских и европейских авторов неред-
ко имеет расширительное толкование: так называют
любые нитевидные неанастомозирующие и анасто-
мозирующие псевдоподии, в том числе неизвестного
устройства, т.е. в эту категорию попадают и филопо-
дии в узком смысле, и ретикулоподии. Например, в
классификации протистов Адля с соавторами (Adi et
al., 2005) термин «филоподии» в широком значении
задействован в диагнозах ряда филетических линий, в
том числе Rhizaria и Foraminifera. Термином «ризопо-
дии» совокупно обозначают псевдоподии первых трех
основных классов (лобо-, фило- и ретикулоподии), а
также все псевдоподии невыясненного строения. Тер-
мин восходит к названию подкласса Rhizopoda (кор-
неножки), который по системе Бючли объединял го-
лых амеб, раковинных амеб и фораминифер (Butschli,
1880-1889).
У феодарий псевдоподии второго типа берут нача-
ло во внешнем слое эктоплазмы. Они тонкие и способ-
ны давать немногочисленные ветвления и анастомозы.
Сванберг с соавторами (Swanberg et al., 1986) наблюда-
ли движение гранул в псевдоподиях, но не сообщают,
являлось ли оно двунаправленным. Вполне очевидно,
что морфологически эти псевдоподии не вписываются
ни в один из четырех основных классов, а если и имеют
сходство, то только с ретикулоподиями. Ультраструк-
PHAEODARIA
127
тура их не охарактеризована; ничего неизвестно о кон-
трактильной системе. Их называли филоподиями и ри-
зоподиями. Поскольку организация этих псевдоподий
не изучена, будем использовать термин «ризоподии»,
как самый индифферентный и не нарушающий логику,
изложенную абзацем выше.
Митохондрии — с трубчатыми кристами; обнару-
жены в эндоплазме, в астропиле и в феодиуме. Об эн-
доплазматическом ретикулуме лишь известно, что он
есть. Диктиосомы располагаются в околоядерной зоне
эндоплазмы (Cachon et al., 1990), но для Coelographis
sp. (сем. Coelodendridae), у которого вышеупомянутая
околоядерная цистерна прижата к ядерной оболочке,
диктиосомы отмечены в периферической эндоплазме
(Swanberg et al., 1986). Относительно лизосом сведения
отсутствуют.
Экструсомы у феодарий достоверно не иденти-
фицированы. Помимо уже упомянутых структур в
эндоплазме и астропиле, трактуемых как экструсомы
(Swanberg et al., 1986), тельца, напоминающие кине-
тоцисты Polycystina, обнаружены в феодиуме (Cachon,
Cachon, 1973; Cachon et al., 1990), но они почему-то
не отмечены под плазмалеммой псевдоподий (Ca-
chon, Cachon, 1976). Заслуживает внимания их мор-
фологическое сходство с ранними стадиями развития
фибриллярных тел, имеющихся у всех планктонных
фораминифер. Зрелые фибриллярные тела, предполо-
жительно, помогают фораминиферам поддерживать
нулевую плавучесть (Hemleben et al., 1989). Прикосно-
вение псевдоподий живых феодарий быстро обездви-
живает жертву (Решетняк, 1966), что косвенно говорит
о наличии в псевдоподиях экструсом парализующего
действия. Сванберг с соавторами (Swanberg et al., 1986)
характеризуют феодарий сем. Coelodendridae как са-
мых липучих планктеров, что может указывать на на-
личие мукоцист. Скорее всего, эктоплазма феодарий
несет вооружение, но сколько типов экструсом имеется
и какова их дефинитивная позиция еще предстоит вы-
яснить.
Внешняя морфология,
симметрия
Клетки феодарий крупные и очень крупные — доли
миллиметра и миллиметры в диаметре, а в исключи-
тельных случаях выросты разнесены на расстояние до
10 см. Форма клетки и конструкция скелета чрезвычай-
но вариабельны. Феодарии из разных отрядов зачастую
совсем несходны, разве только наличие феодиума ука-
зывает на их родство.
Примечательно, что скелет многих представителей
продвинутых отрядов (Phaeogromida и Phaeoconchida)
обладает билатеральной симметрией (см. рис. 91, вкл.),
которая столь несвойственна протистам (редкие при-
меры Diplomonada, Taxopodida). Билатеральная симме-
тричность дипломонад (Lamblia) не должна считаться
чем-то совсем необычным; жгутиконосец с удвоенным
набором органоидов обитает на границе раздела сред:
предпосылки для возникновения билатеральности,
безусловно, есть. А вот для планктонных саркодовых,
таких как феодарии, среда изотропна, что предполага-
ет развитие у одноклеточного организма сферической
симметрии (или аксиальной симметрии, если пище-
добывающий аппарат расположен по одному радиусу,
или если гидростатический аппарат крупной клет-
ки смещен от ее геометрического центра). Во всяком
случае, пространство обитания феодарий не создает
предпосылок для развития билатеральности у план-
ктонного протиста. Значит, билатеральность феодарий
продиктована каким-то необычным распределением
компартментов клетки. Если сконструировать архетип
феодарии, то окажется, что его цитоплазматическое
тело уже будет характеризоваться не сферической сим-
Рис. 73. Симметрия клетки Phaeodaria. Схематическое изображение конструктивных компонентов.
цк — центральная капсула, аст — астропиле, пар — парапиле, фе — феодиум, ск — скелет, ан — аксонема; вид с аборального полюса.
I — набор основных органоидов в клетке представителей примитивных отрядов осесимметричен, а наличие двух диаметрально расположенных па-
рапиле делают эту радиальную симметрию двулучевой (конструкция совмещается сама с собой при повороте вокруг оси симметрии на угол кратный
180°). II — нарушение осесимметричности, каковое часто наблюдается у представителей продвинутых отрядов, делает клетку двустороннесиммет-
ричной (имеется единственная плоскость симметрии; конструкцию невозможно совместить саму с собой при вращении на любой угол, отличный от
360°). Дальнейшие пояснения в тексте.
128
PHAEODARIA
метрией и не радиальной симметрией неопределенного
порядка, а более продвинутой — двулучевой (рис. 73,1)
(такой тип симметрии присущ пеннатным диатомовым,
десмидиевым водорослям, спорам миксоспоридий,
гребневикам, шестилучевым кораллам). При этом по-
верхность клетки (и расположенный по этому конту-
ру скелет) обладает сферической симметрией. Любое
усложнение конструкции, не нарушающее плоскость
симметрии, проходящую между двумя парапиле, на-
пример, неравномерное развитие зубцов вокруг пилома
(см. рис. 91, вкл.), или зеркально симметричный разво-
рот двух вееров аксонем, вслед за которым обязатель-
но изменится конфигурации скелета (рис. 73, II), не-
избежно сделает скелет билатерально симметричным.
Таким образом, в целом понятно каким образом скелет
высших феодарий приобретает билатеральную симме-
трию. Более интересен вопрос, каковы те закономерно-
сти компартментализации, подчиняясь которым в этой
крупной клетке с единственным крупным ядром возни-
кают приоритетные радиусы, маркируемые отверстия-
ми центральной капсулы. Однако подступиться к этому
вопросу нет возможности, ввиду скудости знаний об
организации клетки феодарий.
Питание
Все феодарии — гетеротрофы. Считается, что фо-
тосимбионтов нет ни у одного вида. Правда, P.O. Ан-
дерсон (Anderson, 1983) вскользь говорит об эндо-
симбиотических микроводорослях у Phaeodaria, но не
ссылается на источник сведений.
Диету Phaeodaria изучают посредством морфоло-
гического анализа срезов пищеварительных и дефека-
ционных вакуолей; ведут прижизненные наблюдения
за недавно выловленными экземплярами, в том числе
предлагая различные пищевые объекты; просматри-
вают инородные частицы, накопленные в феодиуме.
Хорошо документировано захватывание относитель-
но крупной добычи: веслоногих рачков, в основном
ювенильных, диатомовых водорослей, динофлагеллат,
полицистин, феодарий и даже организмов сантимет-
рового размера — сальп; прослежена и способность
улавливать мелких жгутиконосцев, в том числе из
Chlorophyta и Chrysophyta (Gowing, 1986; Swanberg et
al., 1986 и др.). Феодарии в большом количестве по-
требляют бактерий и взвешенный детрит; а судя по
наличию в пищеварительных вакуолях поперечно ис-
черченных экструсом, поедают и инфузорий (Gowing,
1989; Nothig, Gowing, 1991). Способны ли Phaeodaria
поглощать макромолекулы остается неизвестным. Та-
ким образом, спектр питания феодарий широк; в него
входят обычные пищевые объекты.
Захват добычи осуществляет корона псевдоподий
(Swanberg et al., 1986), при этом участие ризоподий,
составляющих сеть, кажется очевидным, но нет све-
дений, задействованы ли аксоподий в этом процессе.
У видов, обладающих цельной или двустворчатой ра-
ковиной (см. рис. 81, I, вкл.), ризоподии выходят на-
ружу через поры в стенке. У Coelodendridae ловчая
сеть псевдоподий «растянута» на многочисленных
отростках скелета (Swanberg et al., 1986). Контакт с
сетью псевдоподий обездвиживает добычу (Решет-
няк, 1966), и затем псевдоподии втягивают ее в фе-
одиум. Если поры в стенке раковины узкие, то на ее
оральном полюсе имеется крупное одиночное отвер-
стие (пилом), через которое пищевые объекты попада-
ют внутрь раковины (см. рис. 81, III, вкл.; рис. 89, I,
вкл.). Феодарии с усложненной раковиной, например,
снабженной пиломом, должны обладать соответству-
ющим аппаратом псевдоподий (рис. 69), обеспечиваю-
щим транспортировку жертвы по специфичному пути.
Как организован этот аппарат, связан ли он с астро-
пиле, остается неизвестным. В.В. Решетняк (1966) и
М.Г. Петрушевская (1986), цитируя Геккера (Haecker,
1908), говорят, что расчленение добычи осуществляет-
ся в феодиуме. Пока не выяснено, где происходит эн-
доцитоз — в короне ризоподий или в цитоплазматиче-
ских тяжах, пронизывающих феодиум. Неясно и каков
механизм фрагментации крупной добычи. Считается,
что переваривание происходит в феодиуме. Электрон-
ная микроскопия подтверждает существование здесь
многочисленных пищеварительных вакуолей (Gow-
ing 1986, 1989; Nothig, Gowing 1991; Gowing, Wishner,
1992). Отдельные фагосомы обнаружены и в эндо-
плазме (Swanberg et al., 1986); видимо, усвоение части
пищи может идти внутри центральной капсулы. О фи-
зиологии питания ничего не известно. В.В. Решет-
няк (1966) окрашивала срезы на гликоген и липиды и
продемонстрировала наличие этих запасных веществ
в феодиуме, но не в центральной капсуле. Напротив,
Кашон с соавторами (Cachon et al., 1990) утверждают,
что жировые капли аккумулируются вблизи ядра.
Вакуоли с непереваренными остатками во множе-
стве обнаруживаются в феодиуме (Gowing 1986, 1989;
Gowing, Wishner, 1992). Опорожняются ли они, и где
это происходит — не прослежено, однако внутри фе-
одиума найдены фрагменты кутикулы членистоногих,
лежащие свободно без мембранной обкладки между
тяжами цитоплазмы, то есть расположенные внекле-
точно (Gowing, 1986). Видимо, высвобождение содер-
жимого дефекационных вакуолей происходит здесь же.
Плавучесть
Как представители планктона, феодарии должны
быть способны поддерживать плавучесть близкую к
нулевой и делать ее положительной или отрицательной
для совершения вертикальных миграций. Наблюдений
за работой гидростатического аппарата феодарий со-
всем мало. Крупных феодарий, выловленных на глу-
бине 600-700 м, в течение нескольких дней содержали
в контейнерах с охлажденной морской водой на борту
судна, и почти все экземпляры висели в центре контей-
нера, демонстрируя способность эффективно удержи-
вать нейтральную плавучесть (Swanberg et al., 1986).
Как это ни странно, даже для Polycystina, которые из-
учены наиболее полно среди всех радиолярий (Ander-
son, 1983), нет детального описания работы механизма
PHAEODARIA
129
флотирования. Ниже сделана попытка суммировать
представления о флотировании радиолярий.
Организмы пикопланктона (<5 мкм; бактерии и са-
мые мелкие эукариоты), как и минеральные частицы
той же размерности, по закону Стокса оседают чрез-
вычайно медленно. Естественная турбуленция океани-
ческой пелагиали будет бесконечно долго удерживать
их в суспензии. Более же крупные организмы должны
иметь плавучесть близкую к нейтральной, чтобы оста-
ваться в планктоне. Удельный вес биогенного силика-
та ~2,0 г см-3 (Takahashi, Honjo, 1983) в два раза выше
удельного веса морской воды ~ 1,028 г см 3. Цитоплаз-
ма живых клеток, как правило, чуть тяжелее морской
воды, 1,025-1,050 г см 3, и сама по себе не может обе-
спечить подъемную силу. Следовательно, все феода-
рии, обладающие скелетом, должны иметь «поплавок».
Поплавок у живых организмов физически может быть
трех типов: 1) газ, 2) липиды и 3) водный раствор с по-
ниженной плотностью.
Газ сжимаем, и газовый пузырь в эластичной обо-
лочке живого тела меняет свою подъемную силу в за-
висимости от давления (т.е. глубины): при любом на-
чальном смещении по глубине, например, вверх, газ
расширяется, увеличивает свою подъемную силу, что
ведет к дальнейшему, все более быстрому всплытию,
и наоборот, начальное смещение вниз ведет к некон-
тролируемому погружению. Т.е. система обладает
положительной обратной связью (при выведении из
состояния неустойчивого равновесия идет вразнос)
и контролировать ее трудно; к этому способны орга-
низмы с продвинутой нервной системой — Nautilus,
рыбы с плавательным пузырем, аквалангист с компен-
сатором плавучести. Видимо, не существует ни одного
планктонного протиста, который бы обладал газовыми
пузырями, задействованными в регуляции плавучести.
Изъяна, присущего газовому поплавку, лишены жир и
вода: они практически несжимаемы, и величина подъ-
емной силы не зависит от давления.
Жир обладает заметно меньшим, чем вода, удель-
ным весом. Триглицериды ненасыщенных жирных
кислот имеют плотность близкую к 0,9 г см-3. Для ли-
пидов морских ракообразных и рыб известны величи-
ны 0,78-0,92 г см-3 (Herring, 2002). Можно полагать, что
феодарии, подобно многим пелагическим консументам
(в том числе ракообразным и рыбам), получают жир по
трофической цепи от фитопланктона и имеют липиды
с плотностью в пределах упомянутого диапазона. У фе-
одарий липидные глобулы рассредоточены в феодиуме
и эндоплазме. Относительно крупные жировые капли
диаметром несколько микрон, подобные тем, которые
имеются у ряда представителей Polycystina (Anderson,
1983, Fig. 2-13), у феодарий не обнаружены. Жир, со-
держащийся в клетках феодарий, несомненно, сооб-
щает им подъемную силу, но какова ее величина не-
известно. Считается, что в морских экосистемах, жир,
произведенный микроводорослями, большей частью
передается по трофической цепи как есть — без рас-
щепления на составляющие и последующего синтеза.
Если феодарии получают жир также, то их энергетиче-
ские траты на создание липидного поплавка невелики.
Еще одно существенное достоинство жира в качестве
материала, обеспечивающего плавучесть, состоит в
том, что он осмотически пассивен. Жировой поплавок
всем хорош, но оперативно изменять его подъемную
силу клетка не может. Значит, все протесты, которые
совершают достаточно быстрые вертикальные мигра-
ции, обладают также поплавком третьего типа.
Третий тип поплавка — емкость, заполненная во-
дным раствором с малой плотностью. Этот принцип за-
действуют многие Cephalopoda и глубоководные рыбы,
а также некоторые морские ракообразные (Schmidt-
Nielsen, 1997). Происходит замена тяжелых катионов
на легкие (Na+ на NH4+ с молярной массой 23 против
18) или тяжелых анионов на легкие (96SO42' на 2 36С1).
В отличие от жирового поплавка, эта система (которую
для краткости можно назвать «водным поплавком») ла-
бильна и позволяет тонко настроить гидростатический
аппарат. Однако она обладает и очевидными недостат-
ками. Плотность поплавковой жидкости, рассчитанная
для некоторых ракообразных, составила ~ 1,010 г см-3
(Sanders, Childress, 1988). Даже дистиллированная вода
(которая, как известно, имеет плотность около 1,0 г см 3)
лишь немного легче морской воды (1,028 г см 3). Из-за
того, что разница в плотности столь мала, для создания
достаточной подъемной силы водный поплавок должен
иметь очень большой объем. У радиолярий, очевидно,
в качестве водного поплавка функционирует широкая
зона цитоплазмы с прозрачными вакуолями — калимма
(рис. 89, II, вкл.). Поддержание неравновесной концен-
трации ионов требует постоянной работы ионных на-
сосов. Клетка, обладающая ионным поплавком, види-
мо, сталкивается и с физиологическими проблемами:
1) все эти ионы малого диаметра осмотически активны,
2) перераспределение ионов влияет на величину мем-
бранного потенциала, 3) концентрации задействован-
ных ионов, в частности Са2+, регулируют важнейшие
клеточные процессы. Видимо, для того, чтобы сгла-
дить негативные физиологические эффекты, некото-
рые животные используют «щадящую» модификацию
водного поплавка: Na+ замещают триметиламмонием
(CH3)3NH+ (Sanders, Childress, 1988). Этот катион тяже-
лее натрия (60 против 23 г моль1) и, казалось бы, рас-
твор должен стать плотнее. Однако расстояние между
поверхностными зарядами триметиламмония таково,
что притянутые к ним молекулы воды разведены меж-
ду собой на расстояние больше нормального. Вокруг
иона возникает зона с разрыхленной структурой воды и
плотность раствора снижается. Растворы сахаров тяже-
лее морской воды и не могут служить для поддержания
плавучести. Растворы пептидов теоретически, если
обладают свойством как ион триметиламмония разре-
живать упаковку молекул воды, могут исполнять роль
поплавка, но данных таких нет.
Водный поплавок, функционирующий за счет
перераспределения ионов, описан для морских план-
ктонных протистов — диатомовых и динофлагеллат
(Gross, Zeuthen, 1948; Schmidt-Nielsen, 1997). Пред-
положительно, калимму феодарий и других пелагиче-
ских саркодовых составляют вакуоли с раствором ма-
лой плотности. Состав раствора пока не определяли.
130
PHAEODARIA
Цистерны калиммы имеют сферическую форму (см.
рис. 83; рис. 89, II, вкл.), т.е. они замкнутые и обладают
избыточным внутренним давлением, которое создается
осмотически. Вероятно, ризоподии, создающие калим-
му, накачивают в зачаточную вакуоль какие-то легкие
ионы и следом из внешней среды осмотически посту-
пают молекулы воды (рис. 74,1). Для облегчения транс-
порта, вакуоли должны быть изолированы от внешней
среды лишь тонким слоем цитоплазмы (рис. 74, II).
Именно так на ультраструктурном уровне организова-
на калимма наиболее хорошо изученных радиолярий —
полицистин (Anderson, 1983, Fig. 2-12; Anderson et al.,
1986): электронно-прозрачные цистерны отграничены
двумя сближенными мембранами (мембраной вакуоли
и плазмалеммой) от лакун, открытых во внешнюю сре-
ду. Две мембраны местами расходятся, чтобы вместить
митохондрии, основное предназначение которых, ви-
димо, — энергетическое обеспечение ионных насосов.
Калимма отсутствует у ряда феодарий, в частно-
сти у Atlanticellidae и Coelodendridae. У первых цен-
тральная капсула преобразована в поплавковую камеру
Рис. 74. Гипотетическая схема организации калиммы радиоля-
рий. Клетка накачивает легкие ионы в растущую вакуоль, сле-
дом поступает осмотическая вода, получается раствор малой
плотности (I). Большая удельная поверхность обеспечивает этот
транспорт (II).
1 — ризоподия; 2 — митохондрия; 3 — морская вода; 4 — лакуны; 5 —
вакуоль калиммы.
(Fowler, 1903; Cachon-Enjumet, 1961а). У вторых име-
ется обширная поплавковая емкость, залегающая под
покровом решетчатого скелета и охватывающая цен-
тральную капсулу (см. рис. 98). Исходя из того, что по-
плавок должен компенсировать вес скелета, расчетная
плотность поплавковой жидкости Coelographis sp. со-
ставляет 1,022 г см-3 (Swanberg et aL, 1986). Эта расчет-
ная величина находится внутри реалистичного диапа-
зона — от 1,00 для пресной воды до 1,028 для морской
воды. В отличие от калиммы (рис. 74, II), поплавковая
камера имеет малую удельная поверхность, и интен-
сивный обмен ионами с внешней средой невозможен.
Значит, здесь задействован какой-то иной механизм
снижения плотности раствора — возможно, структури-
рование воды, подобно эффекту триметиламмония (см.
выше).
Планктонные организмы, питающиеся у поверх-
ности моря, как правило, способны быстро уходить на
глубину в преддверии надвигающегося шторма. В от-
личие от Acantharia, которые почти все обитают в верх-
нем слое океанической воды, и от Polycystina, которые
в меньшей степени, но тоже тяготеют к эпипелагиали,
Phaeodaria рассредоточены по всему водному столбу
(см. раздел Экология). Такая закономерность распре-
деления может косвенно свидетельствовать о том, что
гидростатический аппарат феодарий менее эффекти-
вен, чем других радиолярий.
Для придания клетке нулевой плавучести, в том
числе для компенсации веса кремнеземного скелета,
могут быть задействованы как липидные, так и водные
поплавки. Первые просто устроены и, видимо, энерго-
эффективны, обладание вторыми создает для клетки
трудности физиологического плана, но позволяет ей
тонко регулировать свою плавучесть.
Размножение и жизненный цикл
Два варианта размножения известны у Phaeodaria.
В одном — образуется небольшое количество (2, 4, 8,
12, 16) потомков, морфологически организованных как
родительская клетка (рис. 75, верхняя петля). Во втором
варианте, в результате множественного деления фор-
мируются тысячи жгутиковых клеток (рис. 75, нижняя
петля). Часть жизненного цикла, изображенную верх-
ней петлей на рисунке 75, будем для краткости имено-
вать фазой бинарного деления, помня, однако, о том,
что нередко формируется более двух дочерних особей.
Нижнюю петлю назовем фазой множественного деле-
ния. Не до конца понятно, как организован геном, и
какие преобразования он претерпевает в ходе размно-
жения. Продолжительность цикла неизвестна.
У особи, приступившей к бинарному делению,
происходит удвоение ядра (рис. 75, II). Ядерная обо-
лочка растворяется, веретено не выявлено, центриоли
отсутствуют (Cachon-Enjumet, 1961а, Ь; Райков, 1978).
В делящемся ядре феодарий обособляется до 1000 и
более хромосом; у Aulacantha их количество достига-
ет 2700 (Borgert, 1909; Haecker, 1908). Вся масса хро-
мосом выстраивается в диск. В отличие от ортомитоза
PHAEODARIA
131
Рис. 75. Схема жизненного цикла Phaeodaria.
I — зрелый трофонт (я — ядро, цк — центральная капсула, фе — феодиум, ск — радиальные и тангентальные спикулы скелета). II—IV — деле-
ние полиплоидного ядра и сопутствующая перешнуровка центральной капсулы (пояснения в тексте). V — скелетные элементы родительской осо-
би распределяются между потомками. VI — резорбция феодиума; многополюсная сегрегация геномов в полиплоидном ядре. VII — формирование
многочисленных ядер; резорбция центральной капсулы; схлопывание вакуолей калиммы (не показано); фрагментация клетки на сферические
плазмодии. VIII — эндомитозы, многополюсная сегрегация геномов (пм — плазматическая мембрана). IX — сферический плазмодий распадается
на амебоидные плазмодии (у Coelodendrumy, идут обычные кариокинезы с двухполюсным веретеном. X — амебоидный плазмодий распадается на
одноядерные «преспоры», которые делятся еще раз и дают двужгутиковые «зооспоры» с кристаллом (кр) в цитоплазме. (По разным авторам).
многоклеточных, здесь хромосомы ориентированы не
перпендикулярно оси деления, а параллельно ей. Диск,
состоящий из хромосом, разделяется на два параллель-
ных, расходящихся к полюсам веретена (рис. 76). По
мере продвижения к полюсу веретена каждый из до-
черних дисков становится выпукло-вогнутым — при-
нимает форму миски, обращенной вогнутой стороной
к полюсу (Grell, 1953; Cachon-Enjumet, 1961b).
Грель считал, что ядро феодарий полиплоидно, а
при кариокинезе к полюсам расходятся целые гено-
мы — так называемые «сборные хромосомы», в со-
ставе которых истинные хромосомы (в числе 8-12)
соединены последовательно (Grell, 1953, 1973). Соот-
ветственно, расщепление «сборных хромосом» — это
эндомитоз, который обеспечивает поддержание уровня
плоидности. Отсюда и необычная продольная ориен-
тация хромосом в составе метафазного диска. Однако
Кашон-Анжуме (Cachon-Enjumet, 1961b), выполнив
ультраструктурные исследования на десятке видов, на-
стаивала на том, что хромосомы в составе метафазного
диска морфологически различны, картина митоза со-
ответствует классической, и ядра феодарий диплоид-
132
PHAEODARIA
Рис. 76. Деление ядра Aulacantha scolymantha.
1 — центральная капсула; 2 — астропиле. (По: Cachon-Enjumet, 1961а).
ны (рис. 77). Однако Грель и Рутман (Grell, Ruthmann,
1964) приводили свои электронно-микроскопические
наблюдения в поддержку утверждения, что огромные
ядра феодарий полиплоидны. Тогда же Кашон-Анжуме
признала правоту оппонентов, обнаружив, что жгути-
коносцы, формирующиеся в результате множественно-
го деления клеток феодарий (см. ниже), имеют всего
восемь хромосом (Cachon-Enjumet, 1964). Авторы всех
более поздних обобщений согласны в том, что ядро это
полиплоидно (Райков, 1978; Cachon et al., 1990; Parfrey
et al., 2008). В остальном остается совершенно непо-
нятным, какие преобразования генома здесь происхо-
дят и каков их биологический смысл. Интригу привно-
сит и сообщение о том, что в делящемся полиплоидном
ядре присутствуют синаптонемальные комплексы, и,
значит, это деление является редукционным (Cachon et
al., 1973, цит. по Райков, 1978). Современные данные
отсутствуют.
Ядро претерпевает одно деление у феодарий с
двустороннесимметричным скелетом (отряды Phaeo-
gromida и Phaeoconchida). У Aulacantha и других Pha-
eocystida с их конструктивно простым скелетом, ядро
нередко претерпевает 2-А быстро следующих одно за
другим деления (рис. 75, III—IV). Центральная капсу-
ла перешнуровывается после завершения кариокинеза
(Решетняк, 1966) или разбирается перед кариокине-
зом и затем собирается вокруг каждого дочернего ядра
(Anderson, 1983). Разделение потомков осуществляется
только по завершении всех кариокинезов (рис. 75, V).
Такая последовательность событий присуща моноци-
стидным видам — имеющим единственную централь-
ную капсулу. У некоторых Aulacanthidae и Tuscaroridae,
обладающих двумя центральными капсулами (дици-
стидных форм), наоборот, сначала идет цитокинез, а
затем делятся ядра и центральные капсулы, тем самым
восстанавливается дицистидная организация клетки
(Cachon et al., 1990).
В ходе цитокинеза происходит распределение ске-
летных элементов между потомками, причем прави-
ла наследования зависят от конструкции скелета. Все
Phaeocystida, вероятно все Phaeosphaerida и часть Pha-
eocalpida (семейство Tuscaroridae) передают каждой
дочерней клетке примерно равную порцию скелет-
ных элементов, как радиальных, так и тангентальных
(рис. 75, V). У остальных Phaeocalpida и всех Phaeo-
gromida в полости их плотной цельной субсфериче-
ской раковины происходит бинарное деление; одна из
дочерних клеток, протиснувшись через пилом, покида-
ет родительскую раковину и строит себе новую. И, на-
конец, у феодарий с двустворчатым панцирем (отряд
Phaeoconchida), каждый из двух потомков наследует
одну створку и достраивает недостающую половинку
раковины.
Колониальная организация нехарактерна для фе-
одарий. Известны конструкции, состоящие максимум
из 16-ти центральных капсул, заключенных внутри
общего эктоплазматического тела; формируются они
в результате задержки цитокинеза. Примечательны по-
ликлеточные агрегаты, известные для представителей
двух родов из Tuscaroridae (Решетняк, 1966; Ling, Had-
dock, 1997). Десять-двадцать особей одного вида со-
вместно строят силикатную решетчатую сферу. Сфера
набрана из соединенных в торец полых перекладин, она
двухслойная, с треугольной ячеей, и, соответственно,
обладает геометрической жесткостью. Эта сфера внеш-
не очень похожа на решетчатые раковины Sagosphaeri-
dae, но является макроскопическим объектом с диаме-
тром ~1 см. У Tuscaridium оральные, а у Tuscaretta и
оральные, и соматические выросты встроены в решет-
чатую сферу. Эти выросты несут многочисленные от-
ростки в виде загнутых шипов (см. рис. 89, III, IV, вкл.).
У Tuscaretta globosa раковины модулей расположены на
внутренней поверхности сферы и ориентированы пило-
мом наружу. У Tuscaretta belknapi (см. рис. 89,1, вкл.),
Т tabulosa и Tuscaridium cygneum напротив, раковины
расположены на внешней поверхности сферы и ориен-
тированы пиломом внутрь. У последнего вида ось не-
которых раковин может быть ориентирована к поверх-
ности сферы под острым углом или даже тангентально
(Ling, Haddock, 1997). Раковины распределены по сфе-
ре, как правило, регулярно. Нет прямых подтвержде-
ний того, что модули соединены цитоплазматическими
мостиками (как в колонии Volvox). Скелет у феодарий
внутриклеточный, и поэтому наличие общей скелетной
конструкции предполагает существование цитоплазма-
тических мостиков. Описанную ассоциацию называют
PHAEODARIA
133
Рис. 77. Схема ядерных преобразований у феодарий в ходе бинарного деления. (По: Cachon-Enjumet, 1961а).
колонией (Решетняк, 1966; Anderson, 1983), но как она
возникает не выяснено. Вполне возможно, эта ассоци-
ация не является колонией в строгом смысле (продук-
том недоведенного до конца агамного деления), а осо-
би объединяются в плазмодий. Для чего объединяются
тускарориды, остается лишь догадываться. Ни одна из
догадок, к сожалению, пока не подкреплена свидетель-
ствами. 1) Решетчатая сфера служит опорой для со-
вместной сети ловчих ризоподий. 2) Особи совместно
регулируют плавучесть. 3) Объединение гарантирует
встречу гамет. 4) Мезо- и батипелагические предста-
вители Tuscaroridae, в том числе Tuscaridium cygneum
и несколько видов Tuscaretta, светятся (для чего они
используют свою способность к биолюминесценции
неизвестно). Объединение усиливает световой сигнал.
Наступление фазы множественного деления
(рис. 75, нижняя петля) маркируется деградацией фе-
одиума. Затем в ядре хроматиновый материал разби-
вается на сотни или тысячи отдельностей, каждая из
которых представляет собой гроздь хромосом, закре-
пленную в выпячивании ядерной оболочки (рис. 75, VI;
Cachon-Enjumet, 1961b). Эти грозди, возможно, пред-
ставляют собой гаплоидные наборы хромосом (Рай-
ков, 1978). Схлопываются вакуоли калиммы; исчезает
центральная капсула; цитоплазма, которая теперь не
подразделена на внутри- и внекапсулярную, фрагмен-
тируется на относительно крупные многоядерные об-
разования — сферические плазмодии (рис. 75, VII).
В ядрах сферических плазмодиев обнаруживаются
многополюсные фигуры деления (рис. 75, VIII), обра-
зованные такими же гроздьями хромосом, как наблю-
дались ранее на стадии подготовки к множественному
делению (рис. 75, VI). Каждый сферический плазмодий
делится на амебоидные плазмодии; в них уже идут ти-
пичные митозы закрытого типа (рис. 75, IX) с восемью
метафазными хромосомами (Cachon-Enjumet, 1964).
В ходе серии цитокинезов формируются двужгутико-
вые одноядерные клетки с двумя кристаллами, и за-
ключительное бинарное деление дает двужгутиковую
бродяжку с одним кристаллом (рис. 75, IX). Жгутики
разнонаправленны; детали строения жгутикового ап-
парата неизвестны. Бродяжки оседали на дно экспери-
ментального сосуда и погибали. Остается непонятным,
являются ли они гаметами или зооспорами.
Кристаллы неизвестного химического состава при-
сутствуют в жгутиковых клетках Phaeodaria (у трофон-
134
PHAEODARIA
тов они не обнаружены). В жизненном цикле Polycystina
тоже имеется фаза множественного деления, заверша-
ющаяся формированием жгутиковых клеток. Каждый
жгутиконосец Polycystina несет в цитоплазме кристалл
сернокислого стронция, обтянутый мембраной (Ander-
son, 1983; Anderson et al., 1990). He было эксперимен-
тальных работ, посвященных выявлению функции кри-
сталлов в жгутиковых клетках радиолярий. Кристалл
может служить статолитом, который, располагаясь на
удалении от центра тяжести, своим весом разворачи-
вает движущуюся клетку относительно вектора грави-
тации (Anderson, 1983; Anderson et al., 1990). Такой ме-
ханизм показан для инфузорий (Хаусман и др., 2010).
Жгутиковая клетка снабжена липидной глобулой. Эта
капля (помимо того, что жир, вероятно, задействован
как энергетический ресурс), располагаясь диаметраль-
но по отношению к кристаллу, тоже может способство-
вать позиционированию клетки относительно вектора
силы тяжести. Перечисленные приспособления имеют
смысл, только если бродяжка — это гамета. У многих
многоклеточных животных с внешним оплодотворени-
ем (Polychaeta, Bivalvia и др.) встреча гамет происходит
у поверхности воды. Все радиолярии, как и планктон-
ные фораминиферы, готовясь к множественному деле-
нию, уходят на глубину (Anderson, 1983; Hemleben et
al., 1989). Трудно представить, что гаметы радиолярий
блуждают в толще океана. Более вероятно то, что они
распространяются по естественным граничным по-
верхностям, таким как скачки плотности. Возможно,
опускающаяся радиолярия высвобождает жгутиконос-
цев при прохождении пикноклина, и затем жгутиковая
клетка за счет латерального расположения кристалла и
жировой капли перемещается по горизонтали, остава-
ясь в слое скачка. В такой ситуации встреча комплемен-
тарных клеток становится более вероятной.
Таким образом, в жизненном цикле феодарий
имеются стадии трофонта и жгутиковой клетки. Ка-
кие-либо покоящиеся стадии не обнаружены. Цикл,
по-видимому, у всех видов реализуется целиком в пе-
лагиали, вне связи с дном. Не выявлен диморфизм или
полиморфизм трофонтов.
Фаза жизненного цикла, ведущая к формированию
жгутиковых клеток (рис. 75, VI-X) относительно легко
поддается интерпретации: происходит деполиплоиди-
зация (Райков, 1978). Результирующий набор по раз-
ным оценкам содержит 8, 10 или 12 хромосом. Почти
наверняка это гаплоидный, а не диплоидный набор
хромосом: если в жизненном цикле происходит депо-
липлоидизация, сопровождающаяся множественным
делением родительской клетки с высокополиплоидным
ядром, то дочерние клетки, способные продолжить
цикл, бывают только гаплоидными (Parfrey at al., 2008).
Биологический смысл фазы бинарного деления не-
очевиден. Если жгутиковая клетка представляет собой
зооспору, то она напрямую вырастает в полиплоидно-
го трофонта (рис. 75, I), который может приступать к
множественному делению. Альтернативное агамное
деление неоправданно: оно бинарное, требует энерге-
тически затратных перестроек сложно дифференциро-
ванных цитоплазмы и минерального скелета, но дает
малое количество потомков. Если жгутиковая клет-
ка — гамета, то интерпретировать цикл еще сложнее:
нет очевидной стадии мейоза; бинарное агамное де-
ление остается неоправданным. Интерпретация цикла
станет логичной, если принять точку зрения Кашона с
соавторами (Cachon et al., 1973, цит. по Райков, 1978),
согласно которой синаптонемальные комплексы, об-
наруженные в делящихся полиплоидных ядрах феода-
рий, характеризуют процесс соматической редукции, а
высокий уровень плоидности поддерживается за счет
эндомитозов. Сходная картина соматической редукции
описана, видимо, лишь для полиплоидного ядра окси-
монад Pyrsonympha — эндобионтов кишечника тер-
митов (Райков, 1978). Отметим, что самый известный
пример соматического мейоза — в клетках таллома
PHAEODARIA
135
ряда красных и зеленых водорослей — существенно
отличен: там идет редукция 2п до п, а не деполиплои-
дизация (Саут, Уиттик, 1990).
Если у феодарий имеется соматическая редукция,
то это придает биологическую осмысленность жизнен-
ному циклу: фаза множественного деления обеспечива-
ет пролиферацию, а фаза бинарного деления служит в
основном для накопления генетической изменчивости.
Примечательно, что при такой трактовке цикла жгути-
ковая клетка может быть гаметой и зооспорой одно-
временно (как это нередко реализуется в жизненных
циклах водорослей, в частности Ulva [Саут, Уиттик,
1990]). Жгутиковая клетка, обладающая энергетиче-
ским запасом для длительного плавания, отправляется
на поиски комплементарной гаметы. Если находит, то
формирует с ней зиготу, а если не находит, то развива-
ется в гаплоидную ювениль. В таком цикле может от-
сутствовать редукционное деление зиготы, поскольку
последующие эндомитозы нивелируют разницу в пло-
идности между исходно гаплоидными и исходно ди-
плоидными клетками (рис. 78).
Экология
Все Phaeodaria — морские планктонные организ-
мы. Трофонты имеют размер от 50 мкм до нескольких
сантиметров, то есть эти организмы попадают в раз-
мерные классы микро- и мезопланктона, а самые круп-
ные принадлежат макропланктону. Феодарии населяют
все широтные зоны, но не проникают в опресненные
краевые моря (<32%о). Живут они на всех глубинах —
от эпипелагиали до ультраабиссали. Таксономическое
разнообразие феодарий максимально, как правило,
в батипелагиали (700-2000 м). Если в верхней части
водного столба обнаруживаются в основном мелко-
размерные виды, и они не бросаются в глаза на фоне
обилия обитающих здесь организмов, то глубже не-
скольких сотен метров, где количество живых особей
других планктонных протистов резко сокращается,
Phaeodaria во многих районах океана являются доми-
нирующей по биомассе группой протозойного план-
ктона (Решетняк, 1966; Anderson, 1983; Gowing, 1986;
Klaas, 2001; Yamashita et al., 2002; Gowing et al., 2003;
Zasko, Rusanov, 2005; Ishitani, Takahashi, 2007; и др.).
Трофические предпочтения исследуют, сопостав-
ляя набор заглоченных жертв с набором доступных
пищевых объектов (см. также раздел Питание). В пе-
риод весеннего цветения диатомовых, их интенсивно
поедают феодарии, населяющие верхние сотни метров
водного столба; при этом Phaeodaria становятся доми-
нирующей группой радиолярий (Nimmergut, Abelmann,
2002). Зимой же, когда пища в дефиците, феодарии не
проявляют пищевых предпочтений (Gowing, 1989).
Оказалось, что глубоководные феодарии — трофиче-
ские генералисты, поедающие наиболее доступную
пищу (Nothig, Gowing, 1991). Пока не выяснено, ловят
ли феодарии жертв в агрегатах взвешенного детрита
(«морском снеге») или выцеживают непосредственно
из воды, так как состав населения этих двух стаций
очень сходен. Неожиданным стало лишь то, что раци-
оны глубоководных ракообразных (копепод и мизид)
и феодарий почти одинаковы, хотя пищедобывающие
аппараты этих двух групп кардинально различны; ви-
димо, общий дефицит пищи на больших глубинах не
оставляет выбора (Gowing, Wishner, 1992). Определен-
ная избирательность по отношению к жертвам все-таки
проявилась: феодарии игнорировали сине-зеленых и
некоторых гетеротрофных бактерий, изобилующих в
ценозе (Gowing, 1986). В целом, складывается следу-
ющая картина. Феодарии, выловленные у поверхно-
сти океана, где пища, как правило, обильна, проявля-
ют пищевые предпочтения. Феодарии же населяющие
глубинные зоны пелагиали, где трофические ресурсы
бедны, поглощают весь спектр доступных по размеру
пищевых объектов; когда же происходит кратковре-
менное и малопредсказуемое увеличение притока ор-
ганики сверху, то эти обитатели глубин получают воз-
можность проявить избирательность. Количественно
оценить рацион феодарий пока не удается.
Хищники, специализирующиеся на питании фео-
дариями, неизвестны, что неудивительно, поскольку на
больших глубинах, где преимущественно обитают фе-
одарии, пища дефицитна, и все хищники вынужденно
являются эврифагами. Однако в поверхностных водах
субантарктики (0-200 м) развивающиеся в огромном
количестве Challengeridae становятся доминирующим
компонентом пищевого комка сальп. В батипелагиали
феодарии являются важным трофическим ресурсом,
особенно зимой, когда поток органики сверху иссякает.
Соответственно, предполагается, что в батипелагиали
через феодарий проходит значительная часть потока
энергии от нано- и пикопланктона к макропланктону
(Gowing, 1989).
Скелеты морских протистов (кокколитофорид,
фораминифер, радиолярий, диатомовых, силикофла-
геллат и др.) играют важнейшую роль в организации
направленного вниз транспорта органического ве-
щества из эуфотической зоны. Удельный вес органи-
ческого детрита (1,1-1,3 г см-3), производимого со-
обществом эпипелагиали, лишь ненамного превышает
удельный вес морской воды (1,028 г см-3) и сам по
себе детрит, даже оформленный в пеллеты, тонет мед-
ленно и успевает подвергнуться реминерализации, не
достигнув глубинных зон океана. Удельный вес ми-
нерального вещества скелетов много выше — опал
-2,0 г см’3, кальцит 2,7, целестин 4,0. Фекальные пел-
леты зоопланктона, нагруженные минеральными ске-
летами саркодовых, тонут быстро. Органическое ве-
щество в их составе не успевает окислиться до того,
как опустится в батиаль и абиссаль. Оказалось, что
вклад феодарий в работу этого биологического насоса
невелик, потому что их скелеты быстро фрагментиру-
ются и растворяются, успевая опуститься лишь на не-
сколько сотен метров (Takahashi, Honjo, 1981; Honjo et
al., 2008 и др.).
Внутриклеточные паразиты/симбионты часто за-
селяют цитоплазму и ядро феодарий (Решетняк, 1966).
Все идентифицированные симбионты — это Dinoflagel-
lata или, по крайней мере, принадлежат к филе Alveola-
136
PHAEODARIA
ta (Dolven et al., 2007). Неоднократно наблюдали выход
из феодарий расселительных жгутиковых клеток пред-
положительно гетеротрофных динофлагеллат (Cachon
et al., 1990). Получают ли феодарии какую-то отдачу от
этих симбионтов неизвестно. Способность многих сво-
бодноживущих динофлагеллат массово продуцировать
нейротоксины хорошо документирована. Для радио-
лярий Polycystina имеются наблюдения, указывающие,
что симбиотические динофлагеллаты снабжают хозяи-
на репеллентами, которые позволяют держать хищника
на расстоянии (Anderson, 1983). Возможно, подобные
взаимоотношения существуют в симбиозе феодарий и
гетеротрофных динофлагеллат.
Биолюминисценция зарегистрирована, в частно-
сти, для Tuscarantha luciae. Механизм — люциферин-
люцеферазная реакция. Биологический смысл свече-
ния непонятен (Daunert, Deo, 2006).
Секвенирование всего пула 18S рДНК пикоэука-
риот (<2 или <3 мкм) показало, что на всех глубинах
океана чрезвычайно обильны нуклеотидные последо-
вательности, кластеризующиеся в пределах Polycystina
и Acantharia, в то время как доля последовательностей,
относящихся к Phaeodaria и Foraminifera, исчезающее
мала (Not et al., 2007 и др.). Есть предположение, что
преобладающая часть последовательностей сарко-
довых принадлежит бродяжкам (Kimoto et al., 2010).
Тогда неясно, почему последовательности феодарий
столь малочисленны. Их бродяжки достаточно малы —
2 мкм (Cachon-Enjumet, 1964) или 4 мкм (Swanberg et
al., 1986) — чтобы фильтроваться во фракцию пико-
планктона.
Филогенетическое положение
Phaeodaria
Эрнст Геккель в составе радиолярий выделял че-
тыре монофилетических таксона (рис. 79, I), которые
группировал попарно, используя в качестве разграни-
чивающего критерия характер распределения отвер-
стий, пронизывающих стенку центральной капсулы:
Porulosa с множественными мелкими рассеянными
отверстиями и Osculosa с малочисленными крупны-
ми отверстиями, сосредоточенными в определенном
участке капсулы. Классификация радиолярий по Гек-
келю в полном объеме была включена в систему типа
Protozoa Отто Бючли (рис. 79,1), которую зоологи вос-
производили с определенными модификациями вплоть
до 1970-х годов. Системы радиолярий, сложившиеся
в 1970-1980-е годы (рис. 79, II—IV), вобрали три кон-
цепции. 1) Восстановлен таксон Polycystina1 Ehrenberg
1838, emend. Riedel 1967, объединяющий Spumellaria
и Nassellaria. 2) Акантариям, как правило, придава-
ли ранг более высокий, нежели остальным группам
радиолярий на том основании, что их скелет отличен
по химическому составу. 3) Накопление данных по уль-
траструктуре подвигло к установлению группировки
Actinopoda, куда были включены все аксоподиальные
1 Название означает, что скелет представителей включает серию
сферических конструкций. — Прим. авт.
протесты — радиолярии и солнечники. Сначала Acti-
nopoda рассматривались как монофилетическая груп-
пировка ранга типа (Levine et al., 1980; и др.). К концу
XX столетия возобладало воззрение, согласно которому
Actinopoda — это конструктивный принцип организа-
ции, независимо реализуемый в разных филетических
линиях (Takahashi, Anderson, 2000; и др.). Согласно со-
временным молекулярно-филогенетическим построе-
ниям (примерно с 2003 года), Phaeodaria не являются
прямыми родственниками других радиолярий, а на-
ряду с некоторыми солнечниками, жгутиконосцами и
филозными амебоидными протестами входят в состав
морфологически неоднородной группировки Cercozoa
(рис. 79, V).
Систематический обзор
Всего феодарий описано примерно 100 родов и
600 видов (Решетняк, 1966). Ниже приведена система
Геккера (Haecker, 1908), которую усовершенствовала
В.В. Решетняк (1966). В эту систему мы внесли сле-
дующие изменения. Всем подразделениям Phaeodaria
высшего уровня придан ранг отряда, также как это
сделано в Handbook of Protoctista и обоих изданиях The
illustrated guide to the Protozoa (Cachon, Cachon, 1985;
Cachon et al., 1990; Takahashi, Anderson, 2000). Следуя
этим же сводкам, все бесскелетные формы выведены из
1. Phaeocystida и 4. Phaeogromida в новый отряд 5. Pha-
eogymnocellida. Новое семейство 4.1. Lirellidae выделе-
но из состава 4.2. Challengeridae (Takahashi, Anderson,
2000). Семейства 6.1. Concharidae и 6.2. Coelodendridae
давно принято выделять в самостоятельные отряды.
Из соображений удобства классификации, избавляясь
от монотипических таксонов, мы возвращаем ранее
существовавшее объединение этих семейств в составе
6. Phaeoconchida.
Отряд 1. Phaeocystida Haeckel
1887
Скелет представлен изолированными спикулами.
В системе Решетняк отряд включал также бесске-
летные формы и имел в своем составе четыре семей-
ства: 1) Caementellidae Borgert без собственных ске-
летных элементов; 2) Cannorrhaphidae Haeckel только
с тангентальными спикулами; 3) Aulacanthidae Haeckel
с тангентальными и радиальными спикулами и 4) As-
tracanthidae Haecker с радиальными спикулами, но без
тангентальных. Причем, В.В. Решетняк считала эту
последовательность эволюционной: первичное отсут-
ствие скелета, приобретение сначала тангентальных и
затем радиальных скелетных спикул, и, наконец, утрата
тангентальных спикул.
Кашон-Анжуме (Cachon-Enjumet, 1961а) упразд-
нила первые два семейства. Она разделила Caemen-
tellidae на выделенное еще Геккелем Phaeodinidae и
новое семейство Phaeosphaeridae и позже вывела оба
таксона из отряда Phaeocystida (Cachon, Cachon, 1985).
PHAEODARIA
137
I
[Butschli 1880-1889]
[Haeckel 1887]
Rhizopoda Poru|osa Acantharia
Protozoa / Sarcodina/-RadiolariaZ Spumellaria
\ \ \ n i , Nassellaria
\ x Heliozoa Osculosa <"
Phaeodaria
II
[Петрушевская 1986]
/ Acantharia / Collodaria
Radiolaria/ . Polycystina/" д^Тн'1303
/ \ / ’ 1 Albaillellana
Actinopoda/ \ Euradiolaria / \ Nassellaria
\ z \ Phaeodaria
4 Heliozoa
Taxopodida
III
[Levine et al. 1980; Handbook of Protoctista 1990]
z Acantharia
/ „/ Spumellaria
/ x Polycystina <.< ...
Actinopoda Nassellaria
\z Phaeodaria
Heliozoa
IV
[Anderson 1983]
/Acantharia „ , „ Spumellaria
» .« u / „ .. , . „ Polycystina < .. „ .
Actinopoda 4_ Radiolana< Nassellaria
\ Phaeodaria
/ Heliozoa
Taxopodida
V
[Nikolaev et al. 2004; Polet et al. 2004; Takahashi et al. 2004; Adi et al. 2005;
Kunitomo et al. 2006; Yuasa et al. 2006; Not et al. 2007; Pawlowski 8l Burki 2009]
„^Acantharia
. Polycystina
/ Taxopodida phaeodaria
Desmothoracida (солнечники)
Gymnosphaerida (солнечники)
Euglyphida
x Foraminifera Gromiida
Rhizarla/
Vх- Cercozoa
Рис. 79. Представления о филогенетической позиции радиолярий (Phaeodaria, Polycystina и Acantharia) и Taxopodida, в том числе
ранние классификации (I—IV) и современная молекулярная филогения (V). Таксономические ранги опущены. Имена таксонов даны в
исходной форме; модификации окончаний игнорированы.
Феодарий с исключительно тангентальными спикула-
ми (что соответствует диагнозу сем. Cannorrhaphidae),
по-видимому, вообще не существует. Бесскелетные
феодарии часто аккумулируют вокруг клетки скелеты
пищевых организмов. Иногда так накапливаются спи-
кулы съеденных феодарий Aulacanthidae, и тогда эти
чужеродные спикулы располагаются на поверхности
клетки хищника тангентально (рис. 83, I). Во време-
на Геккеля еще не были известны силикофлагеллаты.
Скелеты съеденных силикофлагеллат, накопленные на
поверхности клеток голых феодарий, Геккель считал
тангентальными спикулами последних (см. рис. 95,
IX). Форму этих «спикул» он использовал как основ-
ной таксономический признак видового уровня. Ка-
шон-Анжуме (Cachon-Enjumet, 1961а) показала, что
формы, относимые Геккелем к Cannorrhaphidae, явля-
ются бесскелетными. После выполненной ею ревизии
в составе отряда сохранилось два семейства скелето-
образующих феодарий: Aulacanthidae и Astracanthidae.
1.1. Сем. Aulacanthidae Haeckel 1887
Спикулы двух сортов. Тангентальные спикулы
игловидные без боковых выростов, пустотелые, рас-
положены в периферическом слое эктоплазмы. Ради-
альные спикулы более длинные, толстые, с осевой по-
лостью, часто снабжены отростками; проксимальные
концы спикул покоятся внутри феодиума, который рас-
положен в центре клетки или слегка смещен от него;
дистальные концы их выходят за пределы слоя танген-
тальных спикул.
Строение дистального конца радиальной спику-
лы — основный диагностический признак родово-
138
PHAEODARIA
Aulacantha
Aulographis
Auloceros
Aulokleptes
Aulographonium
Aulospathis
Aulodendron
Рис. 80. Схема строения дистального конца радиальной спикулы
у представителей разных родов сем. Aulacanthidae.
го уровня (рис. 80). Спикула бывает заостренной или
оканчивается булавовидным утолщением, может нести
разное количество концевых и боковых веточек. Конце-
вые веточки иногда ветвятся или снабжены зубчиками.
Боковые веточки отходят мутовками или неупорядо-
ченно.
Род Aulacantha Haeckel 1860
Радиальные спикулы без концевых и боковых вето-
чек. Дистальный отдел радиальной спикулы либо глад-
кий, либо несет многочисленные мелкие зубчики.
К роду Aulacantha принадлежит хрестоматий-
ный представитель феодарий A. scolymantha Haeckel
1860 — радиальные спикулы цилиндрические; их дис-
тальные концы снабжены многочисленными мелкими
зубчиками. Изображения не приводим — их много в
сети Интернет.
РодAulographis Haeckel 1860 (рис. 81,1, вкл.)
Радиальные спикулы с концевыми веточками, но
без боковых. Концевые веточки неразветвленные, без
осевой полости, без боковых зубчиков.
Род Auloceros (рис. 82,1)
Радиальные спикулы с разветвленными концевыми
веточками, без боковых веточек.
ные скелетные элементы из опала (спикулы других ро-
дов феодарий, фрустулы пеннатных диатомовых). Ра-
диальные спикулы толстые, со слоистой стенкой.
Род Aulographonium (рис. 82, III)
Дистальный конец радиальных спикул вздут и не-
сет многочисленные (до 30) концевые веточки. Боко-
вых веточек нет.
Род Aulospathis Haeckel 1887 (рис. 82, IV)
Радиальные спикулы с боковыми и концевыми ве-
точками. Боковые веточки либо расположены мутовкой,
либо нерегулярно разбросаны по всей длине спикулы.
Каждая боковая и концевая веточка заканчивается спа-
тиллой (зазубренной чечевицеобразной бляшкой).
Род Aulodendron (рис. 82, V)
Дистальные участки радиальных спикул снабжены
неразветвленными концевыми веточками и несут мно-
гочисленные боковые веточки. Последние не собраны
в мутовки. Осевая полость радиальных спикул часто
заключает инородные скелетные остатки силикатной
природы.
1.2. Сем. Astracanthidae Haeckel 1887
(рис. 83, II)
Спикулы пустотелые, только радиальные; танген-
тальные отсутствуют. Две центральные капсулы. Един-
ственный род Astracantha Haecker 1908.
Отряд 2. Phaeosphaerida Haeckel 1887
Скелет в виде решетчатой сети. Сеть имеет шаро-
видную, яйцевидную, грушевидную или веретеновид-
ную форму. Решетку составляют полые перекладины,
которые сочленены торцами. Места сочленения назы-
вают узловыми точками. В узловую точку чаще схо-
дится шесть перекладин. Ячея решетки треугольная,
четырехугольная или полигональная. От решетчатой
сети центробежно отрастают радиальные спикулы. Ра-
диальные спикулы отходят либо непосредственно от
узловых точек, либо от специальных пирамидальных
постаментов над узловыми точками. Постаменты по-
строены из перекладин, сочлененных в геометрически
жесткий каркас — все ячейки треугольные.
Три семейства: Aulosphaeridae, Sagosphaeridae,
Cannosphaeridae.
Род Aulokleptes (рис. 82, II)
Радиальные спикулы с разветвленными или нераз-
ветвленными концевыми веточками, которые несут бо-
ковые зубчики. Боковые веточки отсутствуют. Осевая
полость радиальных спикул часто заключает чужерод-
2.1. Сем. Aulosphaeridae Haeckel 1862
Сочленение перекладин в узловых точках эластич-
ное. Решетчатая сеть одинарная. Радиальные спикулы
отходят от узловых точек сети, но у одного рода (Aulo-
scena) располагаются на пирамидальных постаментах.
PHAEODARIA
139
Рис. 82. Семейство Aulacanthidae.
I —Auloceros arborescens. II —Aulokleptes ramosus. Ill — дистальный конец радиальных спикул Aulographonium spp. IV — Aulospathis variabilis. По-
казаны радиальные спикулы с концевыми и боковыми веточками, тангентальные спикулы, феодиум и центральная капсула с ядром. V — дистальный
конец радиальных спикул Aulodendron spp. Масштабная линейка 0,1 мм. (По: Решетняк, 1966).
140
PHAEODARIA
Рис. 83.1 — Cannorrhaphis spinulosa. II — Astracantha (Aulactinium) actinastra. (По: Haeckel, 1887).
Род Aulastrum Haeckel 1887
(рис. 84,1)
Ячея решетчатой сети крупная, полигональная,
чаще пяти- и шестиугольная. Решетчатая сеть шаро-
видной формы. Радиальные спикулы отходят от узло-
вых точек сети.
Род Aulatractus Haeckel 1887 (рис. 84, II)
Решетчатая сеть веретенообразной формы, разно-
полюсная: один полюс тупой, другой приострен. Ради-
альные спикулы отходят от узловых точек сети. Ячея
решетчатой сети треугольная, реже четырехугольная
или полигональная.
Род Aulosphaera Haeckel 1887
(рис. 84, III)
Ячея решетчатой сети треугольная, реже четыреху-
гольная. Решетчатая сеть шаровидной, эллипсоидаль-
ной или грушевидной формы. Радиальные спикулы от-
ходят от узловых точек сети.
Род Aularia Haeckel 1887
Решетчатая сеть шаровидной, эллипсоидальной
или грушевидной формы. Радиальных спикул нет.
Возможно, представляет собой стадию развития
Aulosphaera.
Род Auloscena Haeckel 1887 (рис. 84, VI)
Радиальные спикулы отходят от пирамидальных
постаментов. Ячея сети треугольная, крупная.
2.2. Сем. Sagosphaeridae Haeckel 1887
Сочленение перекладин в узловых точках неэла-
стичное. Радиальные спикулы отходят от пирамидаль-
ных постаментов. Постаменты обладают геометриче-
ской жесткостью — перекладины, их составляющие,
соединены в треугольники. У ряда представителей
между вершинами пирамидальных постаментов пере-
брошены тангентальные перекладины, которые прида-
Рис. 84. Отряд Phaeosphaerida.
I — Aulastrum spinosum. II — Aulatractus fusiformis. Ill — Aulosphaera dendrophora. IV — Sagenoscena irmingeriana. V — Sagoscena elegans. VI —
Auloscena verticillus. VII — Sagenoarium chuni. VIII — Coelacantha dogieli. Внутренняя раковинка пористая с широко раскрытым пиломом. От нее
центробежно отходят радиальные спицы. Дистальный конец каждой радиальной спицы прикреплен к тангентальной перекладине посередине послед-
ней. Тангентальные перекладины составляют наружную решетчатую сеть. Масштабная линейка 0,1 мм. (III — по: Haeckel, 1887; остальные — по:
Решетняк, 1966).
PHAEODARIA
141
142
PHAEODARIA
ют конструкции жесткость. Если перекладины, соеди-
няющие вершины постаментов, многочисленны, они
составляют вторую (внешнюю) решетчатую сеть.
Род Sagoscena Haeckel 1887 (рис. 84, V)
Решетчатая сеть одинарная, шаровидной формы.
Пирамидальные постаменты без осевой балки.
Род Sagenoscena Haeckel 1887
(рис. 84, IV)
Решетчатая сеть одинарная, шаровидной или гру-
шевидной формы. Пирамидальные постаменты с осе-
вой балкой. Встречаются отдельные перекладины, пе-
рекинутые между вершинами постаментов, но они не
составляют вторую (внешнюю) решетчатую сеть.
Род Sagenoarium Borgert 1891
(рис. 84, VII)
Решетчатая сеть двуслойная, различной формы.
Пирамидальные постаменты без осевой балки.
Castanidium
Castanissa
Castanura
Castanella
Circocastanea
Castanarium
Рис. 85. Основные диагностические признаки родов Castanellidae.
1 — главные шипы; 2 — побочные шипы; 3 — зубцы.
2.3. Сем. Cannosphaeridae Haeckel 1887
(рис. 84, VIII)
Скелет включает внешнюю решетчатую сеть и
внутреннюю сферическую раковину. Решетчатая сеть
однослойная, с ячеей полигональной формы. От узло-
вых точек центробежно отходят радиальные спикулы.
Внутренняя раковина имеет очень крупный пилом и
заключает внутри себя феодиум. Стенка внутренней
раковины пронизана многочисленными беспорядочно
расположенными порами. Решетчатую сеть и ракови-
ну соединяют радиальные спицы без осевого просвета.
Спицы подсоединяются к решетчатой сети посередине
тангентальных перекладин.
Единственный род Coelocantha Hertwig 1879. Типо-
вой род Cannosphaera Haeckel 1887 Кашон с соавторами
(Cachon et al., 1990) синонимизировали с Coelocantha.
Отряд 3. Phaeocalpida Haecker 1908
Скелет представлен пористой раковиной, которая
снабжена радиальными выростами. Раковина сфериче-
ской или субсферической формы. Имеется пилом (кро-
ме семейства Polypyramidae). Наличие пил ома придает
радиальную симметрию скелету.
Пять семейств: Castanellidae, Circoporidae, Polypy-
ramidae, Porospathidae, Tuscaroridae.
3.1. Сем. Castanellidae Haeckel 1887
Раковина шаровидная. Стенка толстая, прочная.
Поры крупные, круглые или многоугольные, много-
численные, расположены по всей поверхности ракови-
ны. От межпоровых перегородок центробежно отходят
радиальные шипы, которые подразделяются на глав-
ные и побочные. Главные шипы — пустотелые, длин-
ные, относительно толстые, заостренные. Они доволь-
но равномерно разбросаны по поверхности сферы
(Геккель дал название семейству за сходство раковины
с незрелым плодом каштана). Главные шипы иногда
ветвятся дистально, но чаще остаются неразветвлен-
ными. Побочные шипы тонкие, короткие, без осевой
полости, не ветвятся. Побочные шипы имеются у всех
представителей семейства, а главные шипы у ряда
родов отсутствуют. Отверстие пилома, как правило,
оторочено воротничком из шипов или зубцов. Зубцы
отличаются от шипов значительной толщиной и кони-
ческой формой.
Семь родов (рис. 85).
Подсем. Eucastanellinae Haecker 1908
У основания радиальных шипов нет выемок.
Род Castanidium Haeckel 1879
(рис. 81, III, IV, вкл.)
Главные шипы имеются; неразветвленные. Пилом
оторочен главными шипами. Зубцы отсутствуют.
Род Castanissa Haeckel 1879
(рис. 86,1)
Главные шипы имеются; неразветвленные. Пилом
оторочен зубцами. Помимо зубцов край пилома неред-
ко вооружен 1-2 главными шипами.
PHAEODARIA
143
Рис. 86. Отряд Phaeocalpida.
I — Castanissa me gas tomato. II — Castanarium antarcticum. Ill — Castanarium favosum. IV — Castanura primitiva. V — Castanea henseni. VI — Haecke-
liana irregularis. Масштабная линейка 0,1 мм. (По: Решетняк, 1966).
Род Castanura Haeckel 1879 (рис. 86, IV)
Главные шипы имеются. Они разветвлены дисталь-
но. Пилом оторочен зубцами. Помимо зубцов край пи-
лома нередко вооружен 1-2 главными шипами.
Род Castanea Haecker 1908 (рис. 86, V)
Главные шипы имеются; неразветвленные. Пилом
окружен либо низкими бугорками, либо кратерообраз-
ным возвышением, либо гладким валиком. В послед-
нем случае около пилома может располагаться один
главный шип.
Род Castanella Haeckel 1879
(рис. 81, V, вкл.)
Главные шипы отсутствуют. Пилом оторочен зуб-
цами.
144
PHAEODARIA
Род Castanarium Haeckel 1879
(рис. 86, II, III)
Главные шипы отсутствуют. Зубцов нет. Пилом
либо невооруженный, либо оторочен побочными ши-
пами, которые ничем не отличаются от остальных ши-
пов на раковине.
Подсем. Circocastanellinae Haecker 1908
У основания каждого радиального шипа по кругу в
один ряд расположены 4-7 выемок.
Род Circocastanea Haecker 1908
(рис. 81, VI, вкл.)
Главные шипы отсутствуют. Пилом оторочен зуб-
цами.
3.2. Сем. Circoporidae Haeckel 1887
Раковина шаровидная или многогранная (обладаю-
щая полиаксонной симметрией), несет полые радиаль-
ные выросты. Поры располагаются у основания ради-
альных выростов по кругу в один ряд.
Подсем. Haeckelianinae Haeckel 1887
Радиальные выросты имеются в неопределенном
числе, не несут боковых отростков. Один род.
Род Haeckeliana' Haeckel 1887 (рис. 86, VI)
Поры расположены на теле раковины, а не подняты
на основания выростов. Раковина шаровидная, ее по-
верхность усеяна выемками или покрыта сетью мелких
гребней.
Подсем. Circogoninae Haeckel 1887
Радиальные выросты имеются в определенном чис-
ле, распределены по поверхности раковины в опреде-
ленном порядке. Выросты дистально разветвляются, а
по бокам снабжены длинными шипами. Поры прони-
зывают конические основания радиальных выростов.
Геккель описал пять родов. Более поздние авторы
встречали только представителей рода Circospathis.
Род Circospathis Haeckel 1879
(рис. 81, II, вкл.)
Выемки, покрывающие всю поверхность ракови-
ны, и разграничивающие их ребра составляют гексаго-
нальный рисунок. Пилом лучистый.
1 Марри (J. Murray) в своей коллекции материалов из экспедиции
на «Challenger» определенные экземпляры этикетировал НаескеНапа.
Геккель разбирал эту коллекцию и опубликовал диагноз рода, поэтому
автором описания считается он. — Прим. авт.
3.3. Сем. Polypyramidae Reschetnjak 1966
(рис. 87, II)
Радиальные выросты имеются в неопределенном
числе, разбросаны по всей поверхности раковины. Они
дистально разветвляются. Поры пронизывают пирами-
дальные постаменты, на которых расположены ради-
альные выросты, и поверхность раковины между по-
стаментами. Пилом отсутствует.
Единственный род—Polypyramis Reschetnjak 1952.
Наличие пилома — один из диагностических при-
знаков отряда Phaeocalpida, а у Polypyramis пилом от-
сутствует. По остальным признакам, в том числе по
строению стенки раковины, Polypyramis ближе всего
к Phaeocalpida, и В.В. Решетняк (1966) отнесла опи-
санный ею род к этому отряду. Раковина у Polypyramis
решетчатая, с порами более крупными, чем у осталь-
ных представителей Phaeocalpida. Видимо, при нали-
чии столь крупных пор, пилом — как специальное от-
верстие для транспортировки добычи в феодиум — не
нужен. Вслед за Решетняк мы сохраняем в диагнозе
отряда признак «наличие пилома», иначе этот диагноз
становится совершенно аморфным, как, например, в
Иллюстрированном атласе простейших (Takahashi, An-
derson, 2000).
3.4. Сем. Porospathidae Borgert 1901
(рис. 87,1)
Форма раковины от шаровидной до яйцевидной.
Микрорельеф поверхности раковины бугорчатый. Пи-
лом снабжен длинным цилиндрическим перистомом.
Радиальные выросты имеются в неопределенном чис-
ле, разбросаны по всей поверхности раковины. Они
не ветвятся, утончаются дистально, имеют осевую по-
лость. Радиальные выросты оральной полусферы длин-
ные, аборальной — короткие. Раковины очень мелкие
для феодарий — около 0,1 мм в диаметре.
Единственный род — Porospathis Haeckel 1879.
3.5. Сем. Tuscaroridae Haeckel 1887
Форма раковины разнообразна: грушевидная, сфе-
рическая, пирамидальная, веретеновидная. Пилом
снабжен перистомом. Радиальные выросты малочис-
ленные, расположены на раковине радиально симме-
трично, подразделяются на оральные (ротовые), кото-
рые отходят от края пилома, и соматические, основания
которых расположены в другом участке раковины. Ра-
диальные выросты трубчатые, утончаются дистально,
не ветвятся, но несут отростки в виде шипов. Стенка
раковины фарфоровидная, толстая, из мелких, танген-
тально-расположенных спикул, пронизана многочис-
ленными тонкими порами. Порами большого диаметра
прободены основания радиальных выростов. Поверх-
ность раковины гладкая — лишена микрорельефа. Ха-
рактерно наличие двух центральных капсул.
Пять родов. Четыре рода различимы по форме пе-
ристома, а для Tuscaretta основным диагностическим
PHAEODARIA
145
Рис. 87. Отряд Phaeocalpida.
I — Porospathis holostoma. II — Polypyramis fenestrata. Ill — Tuscarora bisternaria, 3-4 оральных выроста по краю кольцевидного перистома, 3-4 со-
матических выроста в экваториальной позиции (дистальные участки не показаны), феодиум, окруженная пенистой калиммой центральная капсула.
IV — Tuscarantha luciae. V — Tuscarilla scutellum. VI — Tuscarilla ampula. Масштабная линейка I-II — 0,1 мм, III—VI — 1 мм. (По: Решетняк, 1966).
146
PHAEODARIA
Tuscarora
Tuscarantha
Рис. 88. Основные диагностические признаки родов Tuscaroridae.
признаком служит наличие соматических выростов в
оральной полусфере раковины (рис. 88).
Род Tuscarora Murray 1876 (рис. 87, III)
Перистом в виде невысокого, сильно утолщенного
кольца (кольцевидный). Оральных выростов 3-4. Поры,
пронизывающие их основания, овальной формы. Сома-
тических выростов 3-4. Они отходят циркумаборально
или на экваторе. Раковина по форме шаровидная или
грушевидная.
Род Tuscarantha Haeckel 1887 (рис. 87, IV)
Перистом представляет собой короткую и широ-
кую трубку, в стенку которой встроены сильно взду-
тые, пронизанные крупными треугольными порами ос-
нования оральных выростов (перистом корзинчатый).
Оральных выростов 3. Они параллельны друг другу
или расходятся. Соматических выростов 1 или 3. Если
вырост один, то он занимает аборальное положение, и
раковина имеет веретенообразный вид. Если выростов
три, то они отходят циркумаборально, и раковина име-
ет форму трехгранной пирамиды.
Род Tuscarilla Haeckel 1887
(рис. 87, V, VI)
Перистом удлиненный, расширяется дистально, в
стенку раструба встроены пронизанные небольшими
овальными порами основания оральных выростов (пе-
ристом лучистый). Оральных выростов от 3 до 6. Они
расходятся. Соматических выростов 1-7. Если вырост
один, то он занимает аборальную позицию, и раковина
имеет веретенообразный вид. Если выростов несколь-
ко, то они отходят циркумаборально.
Род Tuscaridium Haeckel 1887
Перистом — удлиненная, сильно загнутая трубка,
заканчивающаяся клиновидной губой (перистом шле-
мовидный). Оральных выростов 4. Они отходят попар-
но от латеральных поверхностей перистома и направ-
лены горизонтально. В полярной проекции оральные
выросты составляют Андреевский крест. Соматиче-
ских выростов 1 или 5-7. Если вырост один, то он за-
нимает аборальное положение, и раковина имеет вере-
тенообразный вид. Если выростов 5-7, то они отходят
циркумаборально, и раковина имеет форму многогран-
ной пирамиды.
Tuscaridium cygneum формирует сферические коло-
нии (много фотографий есть в сети Интернет).
Род Tuscaretta Haeckel 1887
(рис. 89, вкл.)
Основания соматических выростов расположены
циркуморально. Раковина шаровидная или грушевид-
ная. Перистом различной формы.
Отряд 4. Phaeogromida Haeckel 1887
Раковина цельная, обладает радиальной или дву-
сторонней симметрией, снабжена пиломом.
Для Phaeogromida характерно усиленное развитие
ротовых структур на одной стороне пилома. Вероят-
но, здесь сосредоточены псевдоподии обеспечиваю-
щие транспорт добычи внутрь раковины, а усиленные
скелетные образования служат им опорой. Комплекс
ротовых структур билатерально симметричен, а соб-
ственно раковина всегда обладает радиальной сим-
метрией (аналогию дают восьмилучевые кораллы, в
строении тела которых прослеживается билатеральная
симметрия и радиальная симметрия). Билатеральность
орального скелета отчетливо выражена у большинства
представителей, но слабо проявляется у Medusetta и не-
которых Lirella.
PHAEODARIA
147
Три семейства: Lirellidae, Challengeridae, Meduset-
tidae. Многочисленные иллюстрации Phaeogromida
представлены на сайте radiolaria.org в разделе Archives/
Takahashi.
4.1. Сем. Lirellidae Loeblich et Tappan 1961
Раковина маленькая, яйцевидная или чечевицео-
бразная, и, как правило, несет продольную исчерчен-
ность. Перистом кольцевидный, его ось отклонена на
острый угол от оси раковины. На аборальном полюсе
раковины расположен заостренный выступ или полый
аборальный шип.
Все эти виды Решетняк (1966) относила к роду
Cadium в составе семейства Challengeridae. Следуем
системе, принятой во втором издании «Иллюстри-
рованного атласа простейших» (Takahashi, Anderson,
2000), согласно которой родовое название Cadium бо-
лее не используется. Соответствующие виды выведены
в новое семейство Lirellidae. Их теперь относят к родам
Borgertella или Lirella в зависимости от того, наличе-
ствует или отсутствует диафрагма, которой затянуто
отверстие пилома (Dumitrica, 1973).
Род Borgertella Dumitrica 1973
Яйцевидная раковина несет полый аборальный
шип. Перистом в форме раструба, изогнутый, объем
его сопоставим с объемом собственно раковины. Поло-
сти раковины и перистома разделены диафрагмой и со-
общаются посредством тонкой трубки, расположенной
на диафрагме ацентрично и направленной в полость
перистома. Аборальный шип в несколько раз длиннее,
чем высота раковины, и загибается по элиптической
кривой к перистому в той же плоскости, в которой изо-
гнут перистом. Навстречу ему от перистома может от-
ходить оральный шип.
Род Lirella Ehrenberg 1872
Стенка раковины покрыта продольными гребня-
ми или бороздами. Отсутствуют диафрагма в пил оме,
длинный аборальный шип и оральный шип.
4.2. Сем. Challengeridae Murray 1885
Раковина линзовидная или яйцевидная. Имеется
пилом с перистомом. Перистом продолжается зубцами,
одним зубцом или (редко) губой. Комплекс оральных
структур всегда билатерально симметричен, что прида-
ет билатеральную симметричность всему скелету. Если
раковина имеет линзовидную форму, то плоскость ее
большого сечения совпадает с мидсагиттальной пло-
скостью ротового аппарата. Стенка раковины состоит
из многочисленных силикатных ампул субсфериче-
ской формы. Пространство между соприкасающимися
ампулами заполнено рыхлым силикатным цементом.
Диаметр ампул приблизительно равен толщине стенки.
Отверстия ампул обращены в полость раковины.
Следующие структуры имеются у представителей
некоторых родов. Энтосолениевая трубка, или фарингс
(глотка) представляет собой ввернутую в полость рако-
вины прямую трубку. Соматические шипы либо идут
в один ряд по килю линзовидной раковины (тогда их
называют краевыми), либо один аборальный шип рас-
положен на аборальном полюсе яйцевидной раковины.
Гексагонально упорядоченные лунки могут покрывать
поверхность раковины целиком или частично.
Во всех сводках по феодариям, подготовленных в
последней четверти XX века, указан диагностический
признак семейства Challengeridae — наличие глотки,
или фарингса, то есть трубки, отходящей от пилома в
полость раковины (Cachon, Cachon, 1985; Cachon et.al.,
1990; Takahashi, Anderson, 2000). У многих Challengeri-
dae фарингс отсутствует (Takahashi, 1991; рис. 90,1, II,
вкл.). Очевидно, один раз вкравшаяся в текст опечатка
кочевала из сводки в сводку.
Род Protocystis Wallich 1869 (рис. 90,1—IV, вкл.)
Соматические шипы отсутствуют. Раковина линзо-
видная или яйцевидная. Поверхность раковины глад-
кая, без лунок. Оральные зубцы имеются или отсут-
ствуют. Фарингса нет.
Род Challengeron Haeckel 1887
Соматические шипы имеются; у мелких экземпля-
ров могут быть слабо выражены. Раковина линзовид-
ная или яйцевидная. Поверхность раковины гладкая,
без лунок. Перистом снабжен 1-4 зубцами или губой.
Фарингса нет.
Экземпляры, у которых не развились соматические
шипы, по ключу неотличимы от Protocystis.
Род Challengerosium Haeckel 1887
Имеется поле гексагонально упорядоченных лунок,
остальная поверхность раковины гладкая. Раковина
линзовидной формы. Зубцы на перистоме и краевые
шипы присутствуют. Фарингса нет.
Род Entocannula Haeckel 1879
Challengeridae с фарингсом, без оральных зубцов и
без соматических шипов. Перистом низкий, слабовы-
раженный.
Род Pharyngella Haeckel 1887
Challengeridae с фарингсом, с одним или несколь-
кими оральными зубцами, но без соматических шипов.
Перистом низкий, слабовыраженный.
Род Challengeranium Haecker 1908
Раковина яйцевидной формы. Перистом прободен
двумя крупными порами. Имеются два оральных зубца
148
PHAEODARIA
и апикальный шип. Вокруг основания апикального шипа
часто располагаются короткие шипики. Фарингса нет.
По ряду морфологических признаков Ch. diodon
(Haeckel) занимает промежуточное положение между
Challengeridae и Medusettidae (Takahashi, 1991).
4.3. Сем. Medusettidae Haeckel 1887,
emend. Borgert
В толще стенки раковины содержатся многочислен-
ные мелкие пустоты — альвеолы. Толстые радиальные
выросты также имеют альвеолярное строение: осевая
полость поделена перегородками на отсеки. Оральные
выросты почти всегда ветвятся. Может присутствовать
аборальный шип. Форма раковины от полусфериче-
ской до яйцевидной.
Рис. 91. Семейство Medusettidae. I — Euphysetta staurocodon. II — РОД MedUSettcl НавСкв! 1 887
Euphysetta amphicodon.
По: Haeckel, 1887. Раковина колпачковидной формы. Оральные вы-
росты почти одинаковой длины, в количестве четырех,
Рис. 92. Семейство Medusettidae: Gazelletta (I). Семейство Atlanticellidae: Nationaletta fragilis (II) и Planktonetta parthenopaea Cachon-
Enjumet (Planktonetta s.l., морфа переходная между Nationaletta и Atlanticella) (III).
1 — парапиле, 2 — центральная капсула, 3 — ядро, 4 — перистом, 5 — астропиле, 6 — феодиум, 7 — вторичная раковина. (По: Cachon-Enjumet, 1961а).
PHAEODARIA
149
терминально ветвятся. Аборальный шип почти всегда
присутствует.
Представители рода Medusetta обликом напомина-
ют гидроидных медузок: колпачковидная раковина с
широким пиломом, отороченным четырьмя шипами.
Отсюда название рода и семейства.
Род Euphysetta Haeckel 1887 (рис. 91)
Один оральный вырост значительно длиннее и тол-
ще, чем остальные три. Аборальный шип имеется.
Род Gazelletta Murray 1876 (рис. 92,1)
Раковина полусферическая. Шесть равноразмер-
ных оральных выростов подобно лучам расходятся от
пилома, длинные. Аборальный шип отсутствует.
Отряд 5. Phaeogymnocellida Cachon
et Cachon 1985
Скелет отсутствует у большинства представителей,
а если имеется, то частично редуцирован и расположен
около астропиле.
Три семейства: Atlanticellidae, Phaeodinidae и Pha-
eosphaeridae.
Боргерт включил в состав описанного им семей-
ства Atlanticellidae формы с рудиментарным скелетом
(Planktonetta, Nationaletta, Atlanticella) и бесскелетные
формы (Halocella, Lobocella, Cornucella, Globicella, Mi-
race I la).
Рудиментарный скелет Atlanticellidae имеет такое
же альвеолярное строение, как скелеты медузеттид.
Более того, некоторые Planktonetta из Atlanticellidae
малоотличимы от Gazelletta из Medusettidae (Fowler,
1904). Основными преобразованиями на пути от Me-
dusettidae к Atlanticellidae были: 1) многократное уве-
личение размера клетки, 2) превращение центральной
капсулы в поплавковую камеру и 3) частичная или пол-
ная редукция скелета. Решетняк (1966) вслед за Гекке-
ром (Haecker, 1908) рассматривала Atlanticellidae в ка-
честве прямых потомков С(72в//в/^-подобного предка
и не вычленяла их из состава семейства Medusettidae.
Всех бесскелетных Atlanticellidae по Боргерту (Halo-
cella, Lobocella, Cornucella, Globicella, Miracella) она
синонимизировала c Atlanticella. Таким образом, в ее
системе Planktonetta, Nationaletta и Atlanticella рассма-
тривались в качестве продвинутых Medusettidae.
Кашон-Анжуме (Cachon-Enjumet, 1961а) описа-
ла несколько новых видов бесскелетных феодарий
и восстановила семейство Atlanticellidae, выполнив
детальную его ревизию. В частности, она не обнару-
жила четких границ между представителями родов с
рудиментарным скелетом (Planktonetta, Nationaletta и
Atlanticella) и синонимизировала эти родовые назва-
ния (старший синоним Planktonetta). Таким образом, в
ее трактовке семейство Atlanticellidae состояло из не-
скольких бесскелетных родов (перечисленных в систе-
ме ниже) и Planktonetta sensu lato. Эта концепция при-
нята во всех последних сводках по феодариям (Cachon,
Cachon, 1985; Cachon et.al., 1990; Takahashi, Anderson,
2000). Кашон-Анжуме, вероятно, совершенно права в
том, что между Planktonetta, Nationaletta и Atlanticella
нет морфологических хиатусов, которые бы оправды-
вали существование самостоятельных родовых на-
званий. Однако сборный род Planktonetta s.l. (с диа-
гнозом «Рудиментарный скелет имеется») оказался
морфологически гетерогенным, и концепция не стала
общепринятой. В интернет-ресурсах чаще фигурируют
старые родовые названия sensu stricto (Planktonetta, Na-
tionaletta и Atlanticella). Чтобы читатель мог получить
представление, о каких морфах идет речь, мы приво-
дим диагнозы старых таксонов вместо Planktonetta s.l.
Кашон-Анжуме (Cachon-Enjumet, 1961а) также про-
вела тщательную ревизию бесскелетных форм, ранее
относимых к отряду Phaeocystida (см. выше), и раздели-
ла их на семейства Phaeodinidae и Phaeosphaeridae. Поз-
же она объединила все три семейства бесскелетных фе-
одарий (Atlanticellidae, Phaeodinidae и Phaeosphaeridae)
в новый отряд Phaeogymnocellida. Таксономическая
коллизия состоит в том, что аргументация в пользу соз-
дания нового отряда не была опубликована. Название
отряда и краткий его диагноз впервые появляются в Ил-
люстрированном атласе простейших (Cachon, Cachon,
1985) и дана ссылка на несуществующую статью Ка-
шон-Анжуме 1982 года. Последующие сводки воспро-
изводят тот же диагноз без анализа и комментариев
(Cachon et al., 1990; Takahashi, Anderson, 2000). Таксо-
номическая ситуация запутанная и требует ревизии.
Утрата скелета в пределах Atlanticellidae вторич-
на. Представителей же Phaeodinidae и Phaeosphaeridae
Кашон-Анжуме рассматривала как самых примитив-
ных феодарий, у которых скелет отсутствует первично
(Cachon-Enjumet, 1961а). Эта ее позиция воспроизве-
дена в поздних сводках (Cachon, Cachon, 1985; Cachon
et al., 1990; Takahashi, Anderson, 2000). Аргументы в
пользу того, что Phaeodinidae и Phaeosphaeridae не име-
ют скелета первично, никогда не обсуждались. Это,
скорее, традиционное воззрение, идущее от Геккеля,
который считал бесскелетных феодарий самыми при-
митивными. С равной вероятностью Phaeodinidae и
Phaeosphaeridae могут оказаться потомками каких-то
типичных скелетобразующих феодарий.
Отряд Phaeogymnocellida — вполне возможно ис-
кусственная группировка, но мы принимаем изложен-
ную концепцию Кашон-Анжуме из соображений удоб-
ства классификации. После того, как все бесскелетные
феодарии выведены за пределы Phaeocystida и Phaeo-
gromida и объединены между собой, отрядам удается
дать сколько-нибудь внятные диагнозы.
5.1. Сем. Atlanticellidae Borgert 1905,
emend. Cachon-Enjumet 1961
Центральная капсула крупная шаровидная. Ядро
занимает малую ее часть, остальной объем заполнен
150
PHAEODARIA
Рис. 93. Семейство Atlanticellidae. I — Planktonetta atlantica. II — скелет Atlanticella bicorn is.
1 — центральная капсула; 2 — перистом первичной раковины; 3 — проксимальные участки оральных выростов альвеолярного строения; 4 — вторич-
ная раковина, объемлющая феодиум; 5 — плавательный пузырь. В прижизненном положении особи Planktonetta (I), видимо, развернуты плаватель-
ным пузырем вверх (Fowler, 1903). Масштабная линейка 0,1 мм. (По: Решетняк, 1966).
прозрачной жидкостью. Скелет, если имеется, то рас-
положен только у астропиле. Последних может быть
более одного. Феодиум расположен вне центральной
капсулы рядом с астропиле и может отсутствовать.
У Planktonetta. Nationaletta и Atlanticella первичная
раковина редуцирована частично. От нее остается коль-
цевидный перистом (имеет форму ошейника). От пери-
стома радиально расходятся очень длинные оральные
выросты в количестве около десяти. Осевая полость
выроста поделена перегородками на отсеки. Оральные
выросты по всей длине дают короткие боковые отрост-
ки, которые терминально ветвятся (рис. 93, I; см. так-
же WoRMS, www.marinespecies.org, раздел PhaeodarEa/
Planktonetta). Каждая веточка заканчивается спатиллой
(зубчатой бляшкой). Оральные выросты скелета, оче-
видно, предназначены для растягивания ловчей сети
псевдоподий. С одной стороны от плоскости перистома
расположена центральная капсула с ядром, с другой —
внекапсулярная цитоплазма с феодиумом. Сообщение
между этими компартментами осуществляется через
дырочки в диафрагме — кожистой перепонке, которой
затянуто отверстие перистома. От перистома в толщу
феодиума идут тонкие, обильно ветвящиеся скелетные
выросты. Совокупно они образуют нерегулярно ячеи-
стую структуру — так называемый интрафеодиальный
скелет — который, вероятно, механически поддержи-
вает феодиум. На основе интрафеодиального скелета
возникают новообразования: плавательный пузырь
Planktonetta и вторичная раковина Nationaletta и Atlan-
ticella. заключающая феодиум.
Род Planktonetta Borgert 1901 (рис. 93,1)
Первичная раковина имеется. Она шаровидной
формы, с мягкой стенкой, облекает центральную капсу-
лу. Жестким остается лишь перистом. Ядро с участком
плотной цитоплазмы оттеснено к перистому. Диафраг-
ма прободена одним ацентрически расположенным от-
верстием, которое служит в качестве астропиле и па-
рапиле. Оральных выростов 8-10. Феодиум частично
находится в просвете перистома, частично выдается в
сторону противоположную центральной капсуле. Пла-
вательный пузырь — эластичное образование с проч-
ной двуслойной стенкой. Интрафеодиальный скелет
пронизывает весь феодиум и крепит плавательный пу-
зырь к перистому.
Род Nationaletta Borgert 1905 (рис. 92, II; 94)
От первичной раковины сохраняется только пери-
стом. На перистоме 10-13 оральных выростов. Цен-
тральная капсула похожа на пузырь, функционирует в
качестве поплавка. Отверстия в диафрагме многочис-
ленные, расположены в один ряд по кругу. Феодиум
погружен во вторичную раковину, которая имеет чаше-
видную форму.
Род Atlanticella Borgert 1905 (рис. 92, III; 93, II)
От первичной раковины сохраняется только пери-
стом. Центральная капсула очень крупная, похожа на
PHAEODARIA
151
Рис. 94. Семейство Atlanticellidae. Схема строения Nationaletta.
1 — центральная капсула, функционирующая как поплавок; 2 — пе-
ристом утраченной первичной раковины; 3 — проксимальные участки
оральных выростов (ветви не показаны); 4 — вторичная раковина, объ-
емлющая феодиум.
пузырь, который подразделен продольными бороздами
на доли, и функционирует в качестве поплавка. Фео-
диум погружен во вторичную раковину, которая имеет
удлиненную грушевидную форму.
Род Gymnocella Cachon-Enjumet 1961
(рис. 95,1)
Скелет и феодиум отсутствуют. Центральная кап-
сула субсферической формы. Астропиле единственное.
Парапиле в числе двух расположены у аборального
полюса центральной капсулы. В полости центральной
капсулы расположена обширная шаровидная вакуоль с
прозрачным содержимым. Ядро в форме мениска при-
жато к астропиле.
Род Halocella Borgert 1907 (рис. 95, II-V)
Центральная капсула сферической формы или слег-
ка продолговатая. Почти весь ее объем занят вакуолью
с прозрачным содержимым. Ядро прижато к астропи-
ле. Парапиле располагаются на диаметрально противо-
положной стороне центральной капсулы. От ядра к
противоположной стенке центральной капсулы тянется
цитоплазматическая структура. Она имеет форму либо
тяжа, либо полого конуса. Овальное основание конуса
опирается на тот участок стенки центральной капсулы,
где открываются парапиле. У некоторых экземпляров
имеется скелет. Он состоит из бокала, охватывающего
хоботок астропиле, и двух лепестков губчатого стро-
ения, подпирающих центральную капсулу. Феодиум
есть у некоторых особей; расположен рядом с астро-
пиле. У ювенилей также встречаются чужеродные ске-
летные остатки, перемешанные с глобулами феодиума.
Род Lobocella Borgert 1907 (= Cornucella
Borgert 1907) (рис. 95, VI-VIII)
Скелет и феодиум отсутствуют. Центральная кап-
сула сферической, лопастной или продолговатой фор-
мы. Ядро подвешено в центре центральной капсулы,
основной объем которой занят вакуолью с прозрач-
ным содержимым. Имеется толстый цитоплазматиче-
ский канатик, тянущийся радиально от ядра к стенке
центральной капсулы. Парапиле расположены рядом с
астропиле.
Род Miracella Borgert 1911 (рис. 95, IX)
Скелет отсутствует. Феодиум и чужеродные ске-
летные элементы из опала распределены вокруг цен-
тральной капсулы. Центральная капсула сферической,
яйцевидной или слаболопастной формы. Астропиле
единственное. Парапиле в числе двух расположены у
аборального полюса центральной капсулы. Ядро под-
вешено в центре центральной капсулы на радиаль-
ной расходящихся цитоплазматических тяжах, самые
толстые из которых тянутся к астропиле и парапиле.
Вакуоль с прозрачным содержимым охватывает ядро
и подвешивающие его тяжи и заполняет собой весь
остальной объем центральной капсулы.
5.2. Сем. Phaeodinidae Haeckel 1883,
emend. Cachon-Enjumet 1961
Скелет отсутствует. Внекапсулярная цитоплазма
содержит многочисленные глобулы феодиума и сили-
катные скелетные остатки силикофлагеллат, диатомо-
вых, феодарий и других протистов. Феодиум целиком
расположен вне центральной капсулы.
Род Phaeodina Haeckel 1888,
emend. Cachon-Enjumet 1961 (рис. 96, l-lll)
С признаками семейства. Клетка, как правило, ди-
цистидная — содержит две центральные капсулы.
5.3. Сем. Phaeosphaeridae Cachon-Enjumet
1961
Скелет отсутствует. Внекапсулярная цитоплазма
содержит многочисленные глобулы феодиума и сили-
катные скелетные остатки силикофлагеллат, диатомо-
вых, феодарий и других протистов. Феодиум частично
расположен внутри центральной капсулы.
Род Phaeosphaera' Cachon-Enjumet 1961
(рис. 96, IV-V)
Астропиле — узкое округлое отверстие с воротнич-
ком.
Род Phaeopyla Cachon-Enjumet 1961
(рис. 96, VI)
Астропиле — широкое округлое отверстие с ворот-
ничком.
1 Назвав так новые род и семейство, Кашон-Анжуме создала опре-
деленную путаницу Получилось, что семейство Phaeosphaeridae с родом
Phueosphuera не входит в состав отряда Phaeosphaerida. — Прим. авт.
152
PHAEODARIA
Рис. 95. Семейство Atlanticellidae.
I — Gymnocella tregouboffi', II—III — Halocella inermis', IV-V — Halocella borgertv, VI — Lobocella tenellcr, VII — Lobocella proteus', VIII — Lobocella
tenellcr, IX — Miracella ovulum. 1 — парапиле, 2 — ядро, 3 — астропиле. (По: Cachon-Enjumet, 1961а).
PHAEODARIA
153
Рис. 96. Семейство Phaeodinidae: I—II — Phaeodina valdiviae\ III — Phaeodina pelagica. Семейство Phaeosphaeridae: IV — Phaeos-
phaera nucleoelongatcr, V — Phaeosphaerapigmaecr, VI — Phaeopyla sphaerica. (По: Cachon-Enjumet, 1961a).
154
PHAEODARIA
Рис. 97. Семейство Phaeosphaeridae: I — Phaeodactylis hollander, II — Phaeodactylis radiata', III — Phaeodactylis fagei.
(По: Cachon-Enjumet, 1961a).
Род Phaeodactylis Cachon-Enjumet 1961
(рис. 97)
Астропиле оторочено придатками различной формы.
Отряд 6. Phaeoconchida Haeckel 1879
Имеется двустворчатая раковина. Раковина обла-
дает двулучевой или слабовыраженной двусторонней
симметрией. Стенка раковины пронизана крупными
порами. Основное морфологическое различие предста-
вителей двух семейств: отсутствие или наличие ветвя-
щихся выростов на раковине.
6.1. Сем. Concharidae Haeckel 1879
Раковина состоит из двух створок. Ветвящихся вы-
ростов нет. Могут присутствовать 1-2 шипа на створку.
По форме раковина либо субсферическая, либо сплю-
щенная перпендикулярно шовной плоскости. В по-
следнем случае створка несет киль, тянущийся по ее
медианной линии. Стенка толстая, прободена много-
численными крупными упорядоченно расположенны-
ми порами. Створки неподвижны одна относительно
другой и расходятся в процессе бинарного деления.
Два парапиле центральной капсулы расположены в
плоскости шва. Створки могут быть сочленены двумя
изодонтными замками из многих зубчиков. Раковина
бирадиально симметрична, но в случае, если шипы
на одной сворке отличны от шипов на другой (как у
Conchonia), раковина приобретает слабовыраженную
билатеральную симметрию. При этом мидсагиттальная
плоскость проходит через медианные линии створок.
Основные диагностические признаки родов Con-
charidae сведены в таблицу 3. Для одного рода приво-
дим развернутый диагноз.
Род Conchopsis Haeckel 1879 (рис. 90, V, вкл.)
Раковина по форме линзовидная: каждая створка
в форме ладьи обладает выраженным килем, во фрон-
тальной проекции раковина имеет почти округлое
очертание. От края створки, где расположены зубчики
Таблица 3
Диагностические признаки родов семейства Concharidae (по Takahashi, 1991 с изменениями)
Створки Шипы Родовое название
Подсемейство Conchariinae. Соприкасающиеся края створок гладкие, лишены зубчатого замка. Створки без киля, по форме почти полусферические или слегка сжатые. Без шипов Concharium Haeckel 1879
Один шип на створку Conchasma Haeckel 1887
Подсемейство Conchidiinae. Соприкасающиеся края створок зубчатые. Створки без киля, по форме почти полусферические или слегка сжатые. Без шипов Conchellium Haeckel 1887
Один шип на створку Conchidium Haeckel 1879
Два шипа на створку, расположены по медианной линии Conchonia Haeckel 1887
Подсемейство Conchopsidinae. Соприкасающиеся края створок зубчатые. Створки сжатые, в форме ладьи с килем. Без шипов Conchopsis Haeckel 1879
Один шип на створку Conchasma Haeckel 1887
PHAEODARIA
155
замка, в полость раковины отрастает пластина — «па-
рус».
6.2. Сем. Coelodendridae Haeckel 1887
Раковина из двух полусферических створок. Створ-
ки у некоторых видов сочленены изодонтным замком,
как у Concharidae. Створки тонкостенные, либо про-
низанные многочисленными порами, либо имеют вид
решетчатой сеточки. Пространство внутри раковины
занято центральной капсулой. Каждая створка снаб-
жена специфичным выростом — шлемом. Вырост по
форме напоминает наковальню или античный шлем,
состоящий из каски и гребня. Проксимальная часть, со-
ответствующая каске шлема и называемая rhinocanna,
«надета» на вершину створки раковины. Дистально
расположен гребень шлема (galea). Между риноканной
и нависающим гребнем есть перемычка — frenulum
(рис. 98). Стенка шлема пронизана многочисленными
порами. Кроме того, в стенке риноканны имеется круп-
ное отверстие, обращенное к астропиле. Центральная
часть феодиума расположена у астропиле, а латераль-
ные части феодиума заполняют собой полость обоих
шлемов. От шлема отрастают все радиальные шипы.
Радиальные шипы полые, дихотомически ветвятся; их
подразделяют на две категории: дендриты и контурные
шипы (грифели). Совокупность радиальных шипов
обладает двулучевой или слабовыраженной двусто-
ронней симметрией. Дендриты относительно корот-
ки и обильно ветвятся. Окончания дендритов у мно-
гих видов сплетаются в решетчатую мантию. Мантия
разъединена на зеркальные половины; граница лежит
в мидсагиттальной плоскости. Контурные шипы уме-
ренно ветвятся, они более длинные, чем дендриты, вы-
ступают за пределы решетчатой мантии, если таковая
имеется, и задают контур скелета. Различают главные
и боковые контурные шипы. Главных контурных ши-
пов два. Они самые длинные, направлены параллель-
но астропиле, прижизненно отвешиваются вниз. Бо-
лее короткие контурные шипы называют боковыми.
И дендриты, и контурные шипы несут многочисленные
«якорные нити» — тонкие отростки, заканчивающиеся
спатиллой.
В.В. Решетняк на своей схеме показала мощный
слой эктоплазмы, в который погружен весь скелет
(внешняя контурная линия на рис. 98). Однако Сван-
берг с соавторами показывают, что такого слоя экто-
плазмы не существует у Coelographis и, видимо, всех
остальных целодендрид: скелет, и в первую очередь
якорные нити, служат каркасом для сети псевдоподий
(Swanberg et al., 1986). У Coelodendridae нет калиммы;
плавучесть же клетке придает крупная поплавковая ка-
мера. В.В. Решетняк, видимо, регулярно находила по-
плавковую камеру у целодендрид из своих сборов, т.к.
даже изобразила ее на своей обобщенной схеме (заточ-
кованная область на рис. 98), но никак не обозначила на
рисунке и не прокомментировала в тексте, возможно,
потому, что классики не описывали эту структуру. На
иллюстрациях Геккеля структура, подобная поплавко-
Рис. 98. Схема строения скелета феодарий семейства Coeloden-
dridae.
1 — центральная капсула; 2 — двустворчатая раковина; 3 — rhinocanna;
4 — отверстие риноканны; 5 — galea; 6 — frenulum; 7 — передний ден-
дрит; 8 — боковой дендрит; 9 — контурный шип; 10 — якорные нити.
Дальнейшие пояснения в тексте. (По: Решетняк, 1966).
вой камере, изображена у большинства целодендрид
(Haeckel, 1887).
Имея в виду разнообразие конструктивных элемен-
тов скелета и их билатеральную упорядоченность, ве-
роятно, можно говорить, что целодендриды обладают
самым сложноорганизованным скелетом среди всех
протистов.
Таблица 4
Диагностические признаки подсемейств в составе
Coelodendridae: наличие (+) или отсутствие (-) атрибута
Решетчатая мантия Контурные шипы Главные контурные шипы Подсемейство
- + + Coelodorinae
- + - Coelotholinae
+ - Coelodryminae
+ + - Coelothyrsinae
+ + + Coeloplegminae
156
PHAEODARIA
Рис. 99. Семейство Coelodendridae.
I — Coelodendrum ramosissimum', II — C. ramosissimunr. раковина, галеа и основания четырех радиальных шипов. III — Coelotetraceras xanthacanthum\
IV — Coeloplegma murrayana. Масштабная линейка 0,1 мм. I, III, IV — по:Решетняк, 1966; II — по: Haeckel, 1862.
PHAEODARIA
157
Рис. 100. Семейство Coelodendridae.
I — Coelographis antarcticum, вид сбоку; II — Coelothyrsus cypripedium (дистальные отделы контурных шипов не показаны); III — Coelantheum
auloceroides. Масштабная линейка 0,1 мм. (По: Решетняк, 1966).
158
PHAEODARIA
В составе семейства описано >20 родов. В класси-
фикации целодендрид в первую очередь учитывают-
ся количество и форма контурных шипов. Сванберг с
соавторами показывают, что вариабельность набора
контурных шипов у Coelographis sp. перекрывает диа-
гнозы нескольких родов (Swanberg et al., 1986). Авторы
приводят доводы в пользу того, что вся система Coelo-
dendridae искусственна, и прогнозируют, что изучение
внутривидовой морфологической изменчивости по-
зволит многие родовые названия свести в синонимы.
Признаки, по которым В.В. Решетняк (1966) разграни-
чивает подсемейства, сведены в таблицу 4. Также даем
диагнозы некоторых характерных родов.
Подсем. Coelodorinae Haeckel 1887
Род Coelodendrum Haeckel 1860 (рис. 99,1, II)
Риноканна отсутствует. От галеи отходит 4 ради-
альных шипа.
Подсем. Coelotholinae Haeckel 1887
Род Coelotetraceras Haecker 1907 (рис. 99, III)
Риноканна отсутствует. От галеи отходит 3 радиаль-
ных шипа: 2 боковых контурных и 1 (передний) денд-
рит.
Подсем. Coelodryminae Haeckel 1887
Род Coelodrymus Haeckel 1879
С признаками подсемейства.
Подсем. Coelothyrsinae Haecker 1907
Род Coelothyrsus Haecker 1907 (рис. 100, II)
С признаками подсемейства.
Подсем. Coeloplegminae Haeckel 1887
Род Coelographis Haeckel 1887 (рис. 100,1)
Контурных шипов 6.
Род Coeloplegma Haeckel 1887
(рис. 99, IV)
Контурных шипов 14.
Род Coelantheum Haecker 1907
(рис. 100, III)
Контурных шипов 28.
Коллекции изображений феодарий имеются в сети Интернет, в частности:
1) Рисунки Геккеля по материалам экспедиции на «Challenger» (Haeckel, 1887), caliban.mpiz-koeln.mpg.de/haeckel/challenger/, раз-
дел Phaeodaria.
2) Сканограммы и микрофотографии проф. Такахаши, www.radiolaria.org, раздел Archive/Takahashi, plates 47-63.
SUMMARY
Marine planktonic sarcodines with arguably the most complex mineral skeleton in protists, with the largest nucleus known in eukaryotes,
and virtually unstudied.
ЛИТЕРАТУРА
Афанасьева M.C. 2006. Скелет радиолярий: формирование и мор-
фология оболочек скелета // Палеонтол. журн. № 5. С. 13-24.
Петрушевская М.Г. 1986. Радиоляриевый анализ. Л.: Наука. 200 с.
Протисты: Руководство по зоологии. Часть 1. Ред. А.Ф. Алимов.
СПб.: Наука. 2000. 679 с.
Протисты: Руководство по зоологии. Часть 2. Ред. А.Ф. Алимов.
СПб.: Наука. 2007. 1144 с.
Райков И.Б. 1978. Ядро простейших. Морфология и эволюция. Л.:
Наука. 327 с.
Решетняк В.В. 1966. Глубоководные радиолярии Phaeodaria се-
веро-западной части Тихого океана. Фауна СССР. Радиолярии. М.; Л.:
Наука. 208 с.
Саут Т., Уиттик А. 1990. Основы альгологии. М.: Мир. 597 с.
Хаусман К., Хюльсман Н., Радек Р. 2010. Протистология: Руко-
водство. М.: Т-во научных изданий КМК. 495 с.
Adi S.M., Simpson A.G.B., Farmer М.А., Andersen R.A. et al. 2005.
The new higher level classifi cation of eukaryotes with emphasis on the taxo-
nomy of protists // J. Euk. Microbiol. Vol. 52. No. 5. P. 399^151.
Anderson O.R. 1983. Radiolaria. New York, Berlin, Heidelberg, To-
kyo: Springer-Verlag, 355 p.
Anderson O.R., Perry C.C., Hughes N.P. 1990. Transmission and
scanning electron microscopic evidence for cytoplasmic deposition of stron-
tium sulphate crystals in colonial radiolarian // Philosophical Transactions:
Biological Sciences. Vol. 329. No. 1252. P. 81-86.
Anderson O.R., Swanberg N.R., Lindsey J.L., Bennett P. 1986. Func-
tional morphology and species characteristics of a large, solitary radiolarian
Physematium muelleri // The Biological Bulletin. Vol. 171. P. 175-187.
Bailey J.W. 1856. Notice of microscopic forms found in the soundings
of the Sea of Kamtschatka // The American Journal of Science and Arts (Sec-
ond Series). Vol. 22. No. 64. P. 1-6.
Borgert A. 1909. Untersuchungen uber die Fortpflanzung der tripyle-
en Radiolarien, speziell von Aulacantha scolymantha // II Teil. Arch. Proti-
stenkunde. Bd 14. S. 134-263.
Butschli O. 1880-1889. Protozoa. Abt. I (1880-1882) Sarkodina und
Sporozoa. Abt. II (1883-1887) Mastigophora. Abt. Ill (1887-1889) Infusoria
und System der Radiolaria // Bronn H.G. (ed.) Die Klassen und Ordnungen
des Thierreichs. C.F. Winter, Leipzig. S. 1-616, 617-1097, 1098-2035.
Cachon J., Cachon M. 1973. Systemes microtubulaires de 1’astropyle
et des poarapyles de Phaeodaries // Arch. Protistenkd. Bd 115. S. 324-355.
Cachon J., Cachon M. 1976. Les axopodes de Radiolaires dans leur
partie libre ectoplasmique //Arch. Protistenkd. Bd 118. S. 310-320.
Cachon J., Cachon M. 1985. III. Class Phaeodarea // Lee J.J., Hutner
S.H., Bovee E.C. (eds). An illustrated guide to the Protozoa. Lawrence, KS:
Society of Protozoologists. P. 295-302.
PHAEODARIA
159
Cachon J., Cachon M., Estep K.W. 1990. Phylum Actinopoda: Classes
Polycystina (= Radiolaria) and Phaeodaria // L. Margulis et al. (eds) Hand-
book of Protoctista... Jones & Bartlett Publ. P. 334-346.
Cachon J., Cachon M., Lecher P. 1973. Nouvelle interpretation de la
division nucl6aire de Phaeodari6s // Comptes Rendus. Academie de Sciences.
Vol. 276. P. 3311-3314.
Cachon-Enjumet M. 1961a. Contribution a l’6tude des Radiolaires
Phaeodari6s // Archives de Zoologie Exp6rimentale et Gen6rale. Vol. 100.
P. 152-273.
Cachon-Enjumet M. 1961b. La m6canique caryocin6tique chez les
Phaeodaries // Bulletin of the Institute Oceanographic Monaco. No. 1214.
Cachon-Enjumet M. 1964. L’Evolution sporog6netique des Phaeoda-
ries // Comptes Rendus. Academie de Sciences. Vol. 259. P. 2677-2678.
Daunert S., Deo S. 2006. Photoproteins in bioanalysis. Weinheim, Ger-
many: Wiley-VCH. 240 p.
Dolven J.K., Lindqvist C., Albert V.A., Bjerklund K.R., Yuasa T.,
Takahashi O., Mayama S. 2007. Molecular diversity of alveolates associ-
ated with neritic North Atlantic radiolarians // Protist. Vol. 158. P. 65-76.
Dumitrica P. 1973. Cretaceous and Quaternary Radiolaria in deep-sea
sediments from the nothwest Atlantic Ocean and Mediterranean Sea. // Ryan,
W.B.F. et al. (eds) Initial Reports of the Deep Sea Drilling Project. Vol. 13.
U.S. Gov. Print. Off.; Washington. P. 829-901.
Fowler O.H. 1903. On Planktonetta atlantica Borgert // Quart. J. Mi-
crosc. Sci. N.S. Vol. 47. P. 133-143.
Fowler O.H. 1904. Notes on the Anatomy of Gazelletta // Quart. J. Mi-
crosc. Sci. N.S. Vol. 48. P. 483-488.
Gowing M.M. 1986. Trophic biology of phaeodarian radiolarians and
flux of living radiolarians in the upper 200m of the North Pacific central
gyre // Deep Sea Research. Vol. 33. P. 655-674.
Gowing M.M. 1989. Abundance and feeding ecology of Antarctic phae-
odarian radiolarians // Mar. Biol. Vol. 103. P. 107-118.
Gowing M.M., Silver M.W. 1983. Origins and microenvironments of
bacteria mediating faecal pellet decomposition in the sea // Mar. Biol. Vol. 73.
P. 7-16.
Gowing M.M., Wishner K.F. 1992. Feeding ecology of benthopelagic
zooplankton on an eastern tropical Pacific seamount // Mar. Biol. Vol. 112.
P. 451-467.
Gowing M.M., Garrison D.L., Wishner K.F., Gelfman C. 2003. Me-
sopelagic microplankton of the Arabian Sea // Deep Sea Research I. Vol. 50.
P. 1205-1234.
Grell K.G. 1953. Die Chromosomen von Aulacantha scolymantha II
Archiv fur Protistenkunde Bd 99. S. 1-54.
Grell K.G. 1973. Protozoology. Berlin: Springer-Verlag. 554 S.
Grell K.G., Ruthmann A. 1964. Uber die Karyologie des Radiolars
Aulacantha scolymantha und die Feinstruktur seiner Chromosomen // Chro-
mosoma. Bd 15. S. 158-211.
Gross E, Zeuthen E. 1948. The buoyancy of plankton diatoms: a
problem of cell physiology // Proc. R. Soc. London, ser. B. Vol. 135. P. 382-
389.
Haeckel E. 1862. Die Radiolarien. (Rhizopoda Radialaria.) Eine Mono-
graphic. Berlin: Druck und Verlag von Georg Reimer. 586 S.
Haeckel E. 1887. Report on Radiolaria collected by H.M.S.Challenger
during the years 1873-1876 // Thompson C.W., Murray, J. (eds) The Voy-
age of H.M.S. Challenger. Her Majesty’s Stationary Office, London. Vol. 18.
1760 p.
Haecker V. 1908. Tiefsee-Radiolarien // Wissenschaftliche ergebnisse
der Deutschen Tiefsee-Expedition. Bd 14. S. 1-706.
Hemleben C., Spindler M., Anderson O.R. 1989. Planktonic Forami-
nifera. New York: Springer. 363 p.
Herring P.J. 2002. The biology of the deep ocean. Oxford, New York:
Oxford University Press, 314 p.
Hertwig P.J. 1879. Der Organismus der Radiolarien // Jenaische Denk-
schriften. Bd2. S. 129-277.
Honjo S., Manganini S.J., Krishfield R.A., Francois R. 2008. Par-
ticulate organic carbon fluxes to the ocean interior and factors controlling the
biological pump: a synthesis of global sediment trap programs since 1983 //
Progress in Oceanography. Vol. 76. P. 217-285.
Ishitani Y., Takahashi K. 2007. The vertical distribution of Radiolaria
in the waters surrounding Japan // Mar. Micropal. Vol. 65. P. 113-136.
Kimoto K., Yuasa T., Takahashi O. 2010. Molecular identification of
reproductive cells released from Cypassis irregularis Nigrini (Radiolaria) //
Environmental Microbiology Reports, doi: 10.1111/j. 1758-2229.2010.00191.x
Klaas Ch. 2001. Spring distribution of larger (>64 um) protozoans in
the Atlantic sector of the Southern Ocean // Deep Sea Research I. Vol. 48.
P. 1627-1649.
Kling S. 1976. Relation of radiolarian distributions to subsurface hy-
drography in the North Pacific // Deep Sea Research and Oceanographic Ab-
stracts. Vol. 23. No. 11. P. 1043-1058
Kling S., Boltovskoy D. 1999. Radiolaria Phaeodaria // Boltovskoy D.
(ed.) South Atlantic Zooplankton. Vol. 1. Leiden: Backhuys Publishers.
P. 231-264.
Levine N. D., Corliss J. O., Cox F.E.G., Deroux G., Grain J., Ho-
nigberg B.M., Leedale G.F., Loeblich A.R., Lom J., Lynn D.H., Merin-
feld D., Page F.C., Poljansky G., Sprague V., Vavra J. & Wallace F.G.
1980. A newly revised classification of the Protozoa // J. Protozool. Vol. 27.
P. 37-58.
Ling H-Y., Haddock S.H.D. 1997. The enclosing latticed sphere of Tus-
caridium cygneum (Murray), a eurybathyal phaeodarian Radiolaria, from the
North Pacific // Paleontol. Res. Vol. 1. P. 144-149.
Meyen F. 1834. Uber das Leuchten des Meeres und Beschreibung eini-
ger Polypen und niederer Thiere // Verh. Kais. Leopolddinisch-Carolinischen
deutschen Akademiya National Forsch. Bd 16. S. 125-216.
Nimmergut A., Abelmann A. 2002. Spatial and seasonal changes of
radiolarian standing stocks in the Sea of Okhotsk // Deep Sea Research I:
Oceanographic Research Papers. Vol. 49. No. 3. P. 463^193.
Not E, Gausling R., Azam E, Heidelberg J.F., Worden A.Z. 2007.
Vertical distribution of picoeukaryotic diversity in the Sargasso Sea // Envi-
ron. Microbiol. Vol. 9. P. 1233-1252.
Nothig E.-M., Gowing M.M. 1991. Late winter abundance and distri-
bution of phaeodarian radiolarians, other large protozooplankton and copepod
nauplii in the Weddell Sea, Antarctica// Mar. Biol. Vol. 111. P. 473^184.
Parfrey L.W., Lahr D.J.G., Katz L.A. 2008. The dynamic nature of
eukaryotic genomes // Molecular Biology and Evolution, Vol. 25. P. 787-794.
Paterson H., Pesant S., Clode P., Knott B., Waite A. 2007. System-
atics of a rare radiolarian — Coelodiceras spinosum Haecker (Sarcodina:
Actinopoda: Phaeodaria: Coelodendridae) // Deep Sea Research II: Topical
Studies in Oceanography. Vol. 54. No. 8-10. P. 1094-1102.
Raven J.A., Giordano M. 2009. Biomineralization by photosynthetic
organisms: Evidence of coevolution of the organisms and their environ-
ment? // Geobiology. Vol. 7. P. 140-154.
Sanders N.K., Childress J.J. 1988. Ion replacement as a buoyancy
mechanism in a pelagic deep-sea crustacean // J. Exp. Biol. Vol. 138. P. 333-
343.
Schmidt-Nielsen K. 1997. Animal physiology: adaptation and environ-
ment, 5th ed. Cambridge Univ. Press. 607 p.
Swanberg N., Bennett P., Lindsay J.L., Anderson O.R. 1986. The bi-
ology of a coelodendrid: a mesopelagic phaeodarian radiolarian // Deep Sea
Research I. Vol. 33. No. 1. P. 15-25.
Takahashi K. 1991. Radiolaria: flux, ecology, and taxonomy in the Pa-
cific and Atlantic // Honjo S. (ed.) Ocean Biocoenosis, Series No. 3. Woods
Hole Oceanographic Institution Press. 303 p.
Takahashi K. 1997. Siliceous Microplankton Fluxes in the Eastern Sub-
arctic Pacific, 1982-1986 // J. Oceanogr. Vol. 53. P. 455^166.
Takahashi K., Anderson O.R. 2000. Class Phaeodarea // J.J. Lee,
G.F. Leedale & P. Bradbury (eds). The illustrated guide to the protozoa. 2nd ed.
Organisms traditionally referred to as protozoa, or newly discovered groups.
Vol. 2. P. 981-994.
Takahashi K., Honjo S. 1981. Vertical flux of Radiolaria: a taxon-quan-
titative sediment trap study from the western tropical Atlantic // Micropaleon-
tol. Vol. 27. No. 2. P. 140-190.
Takahashi K., Honjo S. 1983. Radiolarian skeletons: Size, weight,
sinking speed, and residence time in tropical pelagic oceans // Deep Sea Re-
search I. Vol. 30. P. 543-568.
Yamashita H., Takahashi K., Fujitani N. 2002. Zonal and vertical dis-
tribution of radiolarians in the western and central Equatorial Pacific in Janu-
ary 1999 // Deep Sea Research II: Topical Studies in Oceanography. Vol. 49.
No. 13-14. P. 2823-2862.
Yuasa T., Takahashi O., Dolven J. K., Mayama S., Matsuoka A.,
Honda D., Bjerklund K.R. 2006. Phylogenetic position of the small solitary
phaeodarians (Radiolaria) based on 18S rDNA sequences by single cell PCR
analysis // Mar. Micropal. Vol. 59. P. 104-114.
Zasko D.N., Rusanov LI. 2005. Vertical distribution of radiolarians and
their role in epipelagic communities of the east Pacific rise and the Gulf of
California// Biology Bulletin. Vol. 32. No. 3. P. 279-287.
TAXOPODIDA Fol 1883
К Taxopodida относится один описанный вид — Sticholonche
zanclea. Это амебоидный протист, обитающий в морской пелаги-
али. Клетка двусторонне симметричная, бобовидная, дорсовен-
трально уплощенная в передней части. Типичный размер особей
составляет 200 мкм. Скелетные элементы представлены ради-
альными и тангентальными силикатными спикулами. Стихолон-
ха обладает уникальным типом локомоции — она продвигается
сквозь воду толчками, совершая взмахи аксоподиями, как весла-
ми. Основания аксоподий подвижно сочленены с ядром. Зрелая
особь целиком делится на большое количество жгутиковых кле-
ток. У Sticholonche нет фотосимбионтов. Этот протист — массо-
вый представитель океанического планктона в низких и умерен-
ных широтах.
История изучения
Обладающий своеобразным способом локомоции
планктонный организм привлекал к себе внимание
ранних протозоологов; организация Sticholonche zan-
clea была охарактеризована на светооптическом уровне
(Hertwig, 1877; Fol, 1883; и др.). Детальные исследова-
ния морфологии и контрактильной активности выпол-
нили французские ученые в 1950-70-х годах (Hollande,
Enjumet, 1954; Hollande et al., 1967; Cachon, Cachon,
1969, 1978; Cachon et al., 1977). Планктонологические
исследования, проведенные в конце XX века, выяви-
ли роль Sticholonche в трофических цепях и в рецир-
куляции силиката (Takahashi, Ling, 1980). Уже в теку-
щем столетии филогенетическую позицию Taxopodida
выясняли с использованием молекулярных методов
(Nikolaev et al., 2004; Not et al., 2007; и др.).
Морфология
Приведенные морфологические характеристики
взяты из публикаций Hollande et al. (1967), Cachon et al.
(1977), Cachon, Cachon (1978), если не дана иная ссыл-
ка. Клетка стихолонхи весьма изменчива по форме, дву-
сторонне симметрична; дорзальная поверхность более
выпуклая, чем вентральная; передний полюс несколько
расширен и уплощен, поэтому фронтальная проекция
клетки сердцевидна. Размер тела вариабелен: в некото-
рых популяциях составляет около 50 мкм (Takahashi,
Ling, 1980), в других — 200 мкм (Cachon et al., 1977) и
иногда достигает 750 мкм.
Скелет внеклеточный, представлен двумя разно-
видностями силикатных спикул. Мелкие искривлен-
ные спикулы расположены тангентально и погружены
в эластичный волокнистый матрикс, облекающий клет-
ку. Неизвестно являются ли они полыми или сплош-
ными. Крупные прямые радиальные спикулы — полые
и собраны в 14 четко обособленных пучков (розеток),
которые отходят от поверхности клетки в определен-
ных точках (Hollande, Enjumet, 1954). По одному пучку
расположено на переднем полюсе, заднем полюсе, дор-
сальной поверхности и вентральной поверхности. Вен-
чик из пяти пучков охватывает передний полюс клет-
ки, и венчик из пяти пучков охватывает задний полюс
(рис. 101). Основания радиальных спикул заякорены
во внеклеточном матриксе. Организм легко сбрасывает
спикулы и затем синтезирует новые. В естественных
условиях, видимо, постоянно происходит их обновле-
ние. Процесс синтеза спикул не прослежен. Материал
скелета представлен обводненным кремнеземом (опа-
лом). Примесь органического вещества мала, и в этом
отношении Sticholonche сходна с Polycystina и отлична
от Phaeodaria, в скелетном материале которых велика
доля органики.
Цитоплазма выглядит в определенной степени
вакуолизированной, но многие полости оказывают-
ся впячиваниями плазмалеммы, которые заполнены
морской водой (Febvre-Chevalier, 1985). Эти инвагина-
ции щелевидны (будем называть их далее лакунами),
вытянуты большей частью радиально и достигают
ядерной оболочки. Цитоплазматические мостики, со-
единяющие доли цитоплазмы, переброшены на раз-
ном удалении от ядра. На тангентальном срезе клетки
вблизи ядра щелевидные лакуны формируют гекса-
гональный паттерн, в каждой ячейке которого распо-
ложена аксонема. Эти две структуры — аксонемы и
лакуны — практически не оставляют здесь места для
цитозоля и органоидов. Почти весь цитозоль вытеснен
в периферическую вентральную зону клетки, где рас-
стояние между радиально расходящимися аксонема-
ми достаточно велико. В периферической цитоплазме
расположены диктиосомы. Митохондрии Sticholonche
TAXOPODIDA
161
многочисленные мелкие с кристами трубчатой формы.
Экструсомы отсутствуют.
Ядро одиночное, расположено ближе к дорзальной
поверхности клетки. Оно бобовидное, вытянуто вдоль
передне-задней оси, выгнуто кверху, несколько вогнуто
снизу (рис. 101). Длина его 60-80 мкм, ширина и высота
около 25 мкм. Реакция Фёльгена очень слабая (Cachon,
Cachon, 1969; см. также раздел Размножение и жизнен-
ный цикл). Ядрышко одиночное, занимает центральное
положение. Имеется толстая перинуклеарная капсула,
в состав которой входит ядерная оболочка нормального
Рис. 101. Внешний вид Sticholonche zanclea. Показаны перину-
клеарная капсула и розетки радиальных спикул.
А — вид сверху; Б— вид сбоку, дорсальная поверхность обращена вправо.
(По: Hollande, Enjumet, 1954).
строения с ядерными порами и подстилающий ее со-
товый слой, напоминающий таковой Amoeba proteus.
Многочисленные аксонемы, имеющиеся у Sticholonche
(см. ниже), все крепятся к ядру, и ламина (сотовый
слой), совершенно очевидно, выполняет опорную
функцию. В точках крепления аксоподий перинукле-
арная капсула прогнута. Эти впячивания сближены и
организованы в продольные ряды, поэтому поверх-
ность ядра выглядит рифленой. Прогибы наибольшего
радиуса расположены на переднем полюсе ядра. Точек
крепления аксонем нет на постерио-вентральной по-
верхности ядра. Перинуклеарная капсула здесь ровная,
без прогибов, а сотовый слой ее истончен.
Псевдоподии Sticholonche представлены исключи-
тельно аксоподиями. Длина их в среднем 150 мкм, ор-
ганизованы они в продольные ряды (рис. 102). Имеются
два поля аксоподий: дорзальное и вентролатеральное.
Дорзальное поле включает 6 рядов по -55 аксоподий
в каждом — три ряда слева и три справа от мидсагит-
тальной плоскости. Эти аксоподий неподвижны. Вен-
тролатеральное поле состоит из -50 рядов подвижных
аксоподий по 25-30 в ряду (рис. 103). Передние аксопо-
дии длиннее и толще, чем задние.
Микротрубочки в аксонеме аксоподий все трехва-
лентны и, соответственно, упакованы так, что на по-
перечном срезе образуют гексагональный паттерн. Ди-
аметр микротрубочек 22 нм, расстояние между ними
около 20 нм, мостики вдоль микротрубочки распреде-
лены с шагом 32 нм. Гексагональная упаковка микро-
трубочек в аксонеме проявляется и в ее форме — на
срезе аксонемы представляют собой шестиугольники,
как правило, с неравными сторонами (рис. 104, А).
Основанием аксонемы служит электронно-плот-
ное тело. Оно состоит из пластины, которая плоско-
стью примыкает к торцу аксонемы, и полукруглой го-
ловки, которая обращена к ядру. Пластина состоит из
4-5 слоев. По центру пластины имеется углубление,
из которого берет начало секстет микротрубочек, рас-
положенных в сердцевине аксонемы (вероятно, сборка
аксонемы начинается с полимеризации этих шести ми-
кротрубочек). Головка подвижно закреплена в мениске
электронно-плотного материала, которым выполнен
прогиб перинуклеарной капсулы. Шарнирное сочле-
нение головки и мениска напоминает тазобедренный
Рис. 102. Схема расположения аксонем на ядре Sticholonche zan-
clea. Аксонемы обрезаны на уровне колонн Фола. Передний по-
люс слева. (По: Hollande et al., 1967).
162
TAXOPODIDA
Рис. 103. Схема иллюстрирует подвижность аксоподий Stichol-
onche zanclea. Срезана передняя половина клетки. Все аксопо-
дии (изображены только находящиеся в плоскости среза) кре-
пятся к ядру. Аксоподии подразделяются на дорсальные (д),
дорсолатеральные (дл), латеральные (л) и вентральные (в). Тон-
кими стрелками показана траектория движения аксоподий: ра-
бочий удар (сплошная линия) и возвратное движение (пунктир).
Толстые стрелки на дорсальной поверхности клетки показывают
смыкание и размыкание дорсальных борозд при движении аксо-
подий. (По: Cachon et al., 1977).
сустав. От края пластины, на которой стоит аксонема,
к кромке мениска перекинуты сократимые фибриллы
(см. раздел Локомоция).
Цистерны гладкого ЭПР, расположенные на уровне
сократимых фибрилл, прилегают к плазмалемме, вы-
стилающей внеклеточные карманы. И плазмалемма в
этом участке, и обращенная к ней мембрана цистерны
армированы электронно-плотным матриксом и соеди-
нены между собой (рис. 105).
Проксимальные отделы соседних аксонем связаны
между собой эластичными фибриллами. Эти фибрил-
лы пересекают лакуны с морской водой и, таким об-
разом, являются внеклеточными (рис. 105).
Колонны Фола — плотные стержни около 1 мкм
в поперечнике, расположенные рядом с проксималь-
ными участками аксонем параллельно им. Названы в
честь описавшего их автора (Fol, 1883). На электроно-
граммах видно, что базальный участок каждой аксоне-
мы одет сплошным тонким чехлом электронно-плот-
ного материала, снаружи к чехлу прилежат монослоем
несколько десятков колонн Фола, а поверх этого корсе-
та расположена плазмалемма (рис. 104). Колонна Фола
представляет собой полудесмосому. Она связана сквозь
клеточную мембрану с эластичными фибриллами, тя-
нущимися через лакуну к соседней аксоподии.
Рис. 104. Колонны Фола.
А — схема поперечного среза аксоподии Sticholonche на уровне колонн
Фола; Б — схема поперечного среза колонн Фола; В — трехмерная ре-
конструкция. ан — аксонема, пл — плазмолемма, фи — внеклеточные
фибриллы. (По: Hollande et al., 1967 —A; Cachon, Cachon, 1978 —Б, В).
Локомоция
Перемещается Sticholonche толчками, за счет взма-
хов аксоподий вентро-латерального поля. Каждый гре-
бок всей совокупности аксоподий четко отграничен
от следующего, поэтому движущаяся стихолонха на-
поминает многовесельный корабль. Гребцы на задних
веслах (аксоподии, расположенные позади) чуть запаз-
дывают по фазе, поэтому картина гребка получается
метахрональная.
Ритм биения при постоянной температуре не меня-
ется у конкретной особи, но заметно варьирует у раз-
TAXOPODIDA
163
мх ла
мт
Рис. 105. Схема сочленения между основанием аксонемы и пе-
ринуклеарной капсулой Sticholonche.
ка — кариоплазма; кФ — колонны Фола; ла — лакуны; мт — микро-
трубочки; мх — митохондрии; пк — перинуклеарная капсула; тф — тон-
кие филаменты; фи — внеклеточные фибриллы; эр — цистерна ЭПР;
яо — ядерная оболочка. (По: Cachon et al., 1977 и Cachon, Cachon, 1978
с изменениями).
ных экземпляров. Если состояние организма ухудша-
ется, то частота взмахов возрастает. В норме организм
совершает взмахи с периодом ~0,7 с. Цикл гребных
движений аксоподии включает четыре фазы: рабочий
удар, пауза, возвратное движение, пауза. Рабочий удар
длится <0,1 с; остальные фазы более продолжитель-
ные — около 0,2 с каждая (Cachon et al., 1977).
Аксоподия, совершающая гребок, наклоняется как
единое целое, т.к. ее основание подвижно сочленено с
перинуклеарной капсулой (рис. 105). Амплитуда коле-
баний составляет -120°. Траектория взмаха различна
у вентральных и латеральных аксоподий. Вентраль-
ные — колеблются в продольной плоскости. Латераль-
ные аксоподии выполняют рабочий удар по прямой
спереди назад, а возвращаются, отклоняясь вбок по
дуге. Чем дальше от вентральной линии клетки распо-
ложена аксоподия, тем сильнее выгнута дуга (рис. 103).
Неизвестно, каково функциональное предназначение
более длинной возвратной траектории.
Траектория биения аксоподии задается формой
суставной головки. У латеральных аксоподий головка
более или менее шаровидная, что допускает ход в двух
плоскостях, как в тазобедренном суставе человека.
У вентральных аксоподий сочленение головки и мени-
ска — это плоский шарнир — как в коленном суста-
ве. Такие аксоподии наклоняются в одной плоскости.
У дорзальных аксоподий головка и мениск стыкуются
уплощенными поверхностями. Такое сочленение —
подобное межпозвонковому — не допускает сколько-
нибудь заметного наклона аксоподии.
Внеклеточные фибриллы, закрепленные на колон-
нах Фола, эластичны — они сильно растягиваются,
когда аксоподия отклонена от соседней. Сократимых
внеклеточных белков не существует; значит, эти фи-
бриллы не могут создавать усилие. Роль этих связок
неочевидна. Предположительно, они лишь удерживают
аксоподии в суставах (Cachon et al., 1977).
Контрактильной активностью обладают фибриллы,
связывающие основание аксоподии с мениском (Ca-
chon, Cachon, 1981). Эти фибриллы сплетены из тон-
ких филаментов (2-3 нм), сокращение которых АТФ-
независимо. При сокращении филаменты свиваются
между собой и укорачиваются в 9-10 раз. Чем толще
пучок филаментов, тем быстрее он сокращается. Во-
круг чаши мениска эти фибриллы распределены не-
равномерно. Наибольшее количество волокон сосре-
доточено на стороне, где их сокращение генерирует
усилие рабочего удара (Cachon et al., 1977). Во всех
изученных контрактильных системах на основе белков
из семейства тонких филаментов регуляция осущест-
вляется через изменение концентрации Са2+ (Хаусман
и др., 2010). Для данной системы регуляторную роль
иона кальция доказать не удалось (Cachon et al., 1977).
Инвагинации плазмалеммы пронизывают всю
толщу цитоплазмы и в частности подходят близко к
сократимым фибриллам (рис. 105). Роль этих лакун
в локомоции неочевидна. Она может быть двоякой.
1) Мембранный потенциал на плазмалемме регулирует
работу жгутика (и реснички) и, видимо, других систем
клеточной локомоции, в том числе тех, где задейство-
ваны тонкие филаменты, например, стебелек сувойки
(Хаусман и др., 2010). Возможно, у Sticholonche скачок
потенциала на плазмалемме запускает сокращение фи-
брилл. Кашон с соавторами (Cachon et al., 1977) дела-
ют предположение, что в регуляции также участвует
армированная цистерна ЭПР, прикрепленная здесь к
плазмалемме. 2) За счет того, что цитоплазма лакунами
разрезана на доли, маятниковые движения аксонем не
перемешивают цитоплазму.
Все протесты, которые перемещаются в толще
жидкости (вне связи с твердым субстратом), использу-
ют жгутик в качестве движителя. Единственное исклю-
чение — Sticholonche с ее гребными аксоподиями1. Для
других аксоподиальных протистов описаны отдаленно
похожие формы движения. Полицистины периодиче-
ски сокращают корону псевдоподий; вероятно для того,
чтобы освежить воду между псевдоподиями (Anderson,
1983). Механизм неизвестен; возможно, это частичная
1 Многие планктонные протисты, в частности радиолярии, изме-
няя свою плавучесть, совершают вертикальные миграции. Структуры,
которые бы мы воспринимали как движитель, отсутствуют, но переме-
щение это является активным и, значит, формально подпадает под опре-
деление локомоции. — Прим. авт.
164
TAXOPODIDA
деполимеризация микротрубочек аксонемы. У аканта-
рий Acanthocyrta В.Т. Шевяков (Schewiakoff, 1926) на-
блюдал бичевидные псевдоподии, которые совершают
плавные взмахи. Механизм движения неизвестен.
Ресничная локомоция характерна для инфузорий
и планктонных личинок многоклеточных животных
(Cnidaria, Polychaeta и многих других). Ресничка в фазе
возвратного движения складывается, уменьшая сопро-
тивление среды (Хаусман и др., 2010). Устройство же
аксоподий не позволяет ей быстро менять конформа-
цию; форма аксоподий одинакова при рабочем ударе
и возвратном движении. Эффективность локомоции
Sticholonche, естественно, невелика: при возвратном
движении аксоподий протист сдает от 2/3 до 3/4 пути,
пройденного в фазу рабочего удара (Cachon et al., 1977).
В подобной ситуации оказался бы человек на весель-
ной лодке, который пытается грести, не вынимая лопа-
сти из воды и не разворачивая их, а лишь протаскивая
с разной скоростью при рабочем гребке и возвратном
движении.
Радиальные спикулы воспроизводят траекторию
движения аксоподий, но пассивно. Каково их участие
в локомоции — не выяснено (Cachon et al., 1977). Воз-
можно, пучки спикул, соударяясь позади клетки, вы-
талкивают струю воды и создают реактивный толчок.
Плавание мелких организмов характеризуется ма-
лыми числами Рейнольдса, т.е. водная среда для них
вязкая, и эти организмы не полагаются на инерцию.
Sticholonche — редчайший пример протеста, который
перемещается толчками, т.е. использует инерцию.
Локомоция Sticholonche малоэффективна. Поэтому
вряд ли главное предназначение взмахов аксоподий —
это перемещение организма из точки А в точку Б.
Плавучесть
Когда особь Sticholonche прекращает взмахивать
аксоподиями, она оседает на дно микроаквариума (Ca-
chon et al., 1977), т.е. клетка сама по себе заметно тя-
желее воды. Возникает вопрос, одна лишь локомотор-
ная активность удерживает стихолонху в толще воды,
или имеется также поплавковый механизм. Если у
Sticholonche есть компартмент, функционирующий как
поплавок, то он, очевидно, расположен вверху. Дор-
сально в клетке стихолонхи расположено ядро. Ядра
никаких организмов не содержат вакуолей и липид-
ных включений. Ядро Sticholonche — не исключение
(Cachon, Cachon, 1969), а значит, не может служить по-
плавковым компартментом (см. раздел Плавучесть в
главе Phaeodaria). Получается, что Sticholonche удержи-
вается наплаву лишь биением аксоподий. Этот способ
поддержания плавучести представляется затратным,
особенно учитывая малую эффективность гребных
взмахов (см. выше).
Питание
Sticholonche не имеет автотрофных симбионтов и,
значит, получает всю пищу из окружающей воды. В ли-
тературе нет никаких сведений о том, как стихолонха
добывает пищу.
О пищеварительных вакуолях информации хоть
и немного, но все-таки она имеется. Гауинг (Gowing,
1989) получила электронограммы срезов цитоплазмы
нескольких особей из вод Субантарктики. В пищева-
рительных вакуолях обнаружены бактерии, Chlorella-
подобные клетки и чешуйки празинофитовых. В этих
вакуолях также присутствовали трихоцисты; вероятно,
Sticholonche способны захватывать более крупную и
активную добычу — инфузорий или динофлагеллат.
Таким образом, пищу Sticholonche составляют мелкие
организмы, обычные в эпипелагиали.
Аксоподий Sticholonche лишены экструсом и не
могут служить ловчим аппаратом. Псевдоподии других
типов у этого протиста отсутствуют. Ресничных струк-
тур у трофонта нет. Цитостом или что-либо похожее на
цитостом отсутствует.
Остается предполагать, что уловителем пищевых
частиц служит система лакун, пронизывающих всю
цитоплазму. Тогда маятниковые движения аксоподий
предназначены для прокачивания воды через этот
фильтрующий аппарат. Попутно аксоподий обеспечи-
вают локомоцию.
Размножение
и жизненный цикл
Бинарное деление Sticholonche упомянуто лишь
однажды (Hollande, Enjumet, 1954); другим авторам не
удалось наблюдать этот процесс. Множественное деле-
ние наблюдалось многократно. Иные формы пролифе-
рации и покоящиеся стадии у Sticholonche неизвестны.
Нет информации о продолжительности цикла.
Множественное деление Sticholonche и сопутству-
ющие ядерные преобразования Кантоны детально про-
следили на светооптическом уровне (Cachon, Cachon,
1969). При подготовке к делению в ядре появляются
нитевидные хромосомы, ядрышко распадается. Пери-
нуклеарная капсула прорывается в наиболее тонком
участке — на постерио-вентральной поверхности. Из
разрыва высовывается «ядерный язык»; покров его
тонкий и, видимо, представляет собой нормальную
ядерную оболочку. В вершине языка образуется встро-
енная в ядерную оболочку центросома, к которой при-
соединены все хромосомы; центриоли отсутствуют. Ко-
личество хромосом неопределенное, >10 (рис. 106, А).
Происходит эндомитоз: центросома удваивается, и
дочерние центросомы расходятся, растаскивая прок-
симальные участки хромосом. Дочерняя центросома
немедленно удваивается и начинается следующий эн-
домитоз. И так многократно. Выступ ядра становится
многовершинным. Плечи же хромосом пока остаются
вытянутыми, и их массив заполняет собой весь объ-
ем ядерного языка (рис. 106, Б). По завершении серии
эндомитозов плечи хромосом разъединяются, укора-
чиваются и стягиваются к своей центросоме, и каждая
гроздь хромосом обособляется в составе сферическо-
го ядра мелкого размера. Эти ядра еще несколько раз
TAXOPODIDA
165
Рис. 106. Преобразования ядра у особи Sticholonche zanclea, приступившей к множественному делению.
А — ядерный язык выдвигается из разрыва перинуклеарной капсулы; к его вершине стянуты хромосомы; показаны основания аксоподий (вид сбоку).
Б — после серии эндомитозов ядерный язык становится многовершинным (вид сзади). (По: Cachon, Cachon, 1969).
делятся митотически. Плечи хромосом на этой стадии
сильно конденсированы. К каждому митотическому
центру сходятся 8 хромосом (или 4 метацентрические
хромосомы?). В какой-то момент образуются кинетосо-
мы и кристаллы (неизвестного состава). Вокруг каждо-
го ядра обособляется участок цитоплазмы, и формиру-
ются бродяжки (4 мкм длиной и 1 мкм в поперечнике)
с двумя жгутиками неравной длины и с кристаллом
(2 мкм длиной). От материнской клетки остается внеш-
ний эластичный покров с закрепленными в нем спику-
лами, а также перинуклеарная капсула. Бродяжки при-
обретают подвижность и уплывают; их дальнейшую
судьбу проследить не удалось. Следующая известная
стадия цикла — это мелкие особи (<50 мкм), которые
появляются в планктоне и проявляют такую же локомо-
торную активность, как крупные особи.
Жизненный цикл прослежен не полностью: как и
для всех радиолярий неизвестно, является ли множе-
ственное деление гаметогенезом или спорогенезом.
Планктонные фораминиферы также продуцируют жгу-
тиковые клетки, и зигот также никому не удалось по-
лучить (Hemleben et al., 1989). Однако у планктонных
фораминифер созревание когорт всегда синхронизиро-
вано по лунному циклу, и это служит весомым аргу-
ментом в пользу того, что бродяжки — это гаметы. Для
Sticholonche нет информации о какой-либо синхрониза-
ции созревания особей в популяции.
Второй непроясненный вопрос — это плоидность
ядра трофонта. Выдвигая в качестве аргумента невос-
приимчивость ядра трофонта к реакции Фёльгена, Ка-
шоны сделали вывод, что это крупное ядро гаплоид-
но (Cachon, Cachon, 1969). И.Б. Райков (1978) считал
этот довод недостаточно убедительным и отмечал, что
крупные полиплоидные ядра полицистин тоже фёль-
ген-отрицательны, что обусловлено, видимо, особой
упаковкой хроматина. Окраска DAPI продемонстриро-
вала очень слабое свечение ядра Sticholonche (Suzuki
at el., 2009). Однако авторы статьи не считают это ядро
гаплоидным, предполагая, что проникновению кра-
сителя могла препятствовать толстая перинуклеарная
капсула. Ядра всех полицистин (за исключением Со1-
lodaria) также давали слабое свечение, и авторы статьи
полагают, что происходило это именно из-за наличия
плотной центральной капсулы, не пропускавшей кра-
ситель внутрь. Исходя из современных представле-
ний о транскрипции, трудно представить, что столь
крупная клетка как Sticholonche (>200 мкм) обходится
единственной матрицей (единственной копией гено-
ма). Скорее, здесь реализуется стратегия, которую, как
предполагается, задействуют многие крупные про-
тисты с одиночным ядром (Parfrey et al., 2008). Ядро
трофонта полиплоидно, но геномы в нем разнокаче-
ственны. Одна копия гаплоидного генома маркирована
эпигенетически (например, метилированием) как гене-
ративная. Эта копия не задействована в транскрипции,
что снижает риск повреждений, и впоследствии много-
кратно дуплицируется в ходе эндомитозов. Многочис-
ленные же соматические (вегетативные) копии генома
клетка разбирает при подготовке к множественному де-
лению и использует мононуклеотиды для построения
копий генеративного генома, которые пойдут в ядра
жгутиковых клеток. В любой версии необъясненным
166
TAXOPODIDA
остается, почему у Sticholonche набор, вступающий в
серию эндомитозов, по числу хромосом явно превос-
ходит набор, участвующий в заключительных митозах
мелких ядер.
Экология
Sticholonche населяет тропические и умеренные
зоны океанов, предпочитает глубины 100-500 м, встре-
чается в основном в продуктивных районах (Ander-
son, 1983), что, видимо, обусловлено высокой энер-
гозатратностью способа локомоции. На пикноклине
отмечены максимальные численности порядка 25 л1
(Takahashi, Ling, 1980). В продуктивных водах числен-
ность этого протиста нередко сопоставима с численно-
стью всех радиолярий вместе взятых (Takahashi, Ling,
1980; Anderson, 1983; Gowing, 1989). В силу своего
обилия Sticholonche служит пищевым ресурсом для
фаготрофных планктеров (Takahashi, Ling, 1980). Ра-
диальные спикулы Sticholonche легко опознаваемы по
характерной форме ланцетовидно-расширенных ос-
нований (рис. 101). Раздробленные спикулы найдены
в пеллетах мезо- и макропланктонных ракообразных
(Gowing, 1989; Eskinazi-Sant’Anna, 2006). Целые спи-
кулы накапливаются в массиве непереваренных остат-
ков у разных видов феодарий (Gowing, 1989). В клетке
Sticholonche поселяются гетеротрофные динофлагел-
латы (Cachon, Cachon, 1969). Симбионты отмечены
внутри ядра (Cachon, Cachon, 1969) и в вентральной
цитоплазме (Suzuki et al., 2009). Симбионт, приступив
к размножению, утилизирует все содержимое клетки
хозяина (Cachon, Cachon, 1969). В остальном характер
взаимоотношений симбионта и хозяина неизвестен.
Спикулы Sticholonche полые тонкостенные. Они,
хотя и состоят из опала, как скелеты полицистин, но
гораздо менее устойчивы к растворению. Спикулы
Sticholonche успевают опуститься лишь на несколько
сотен метров, до того как они растворятся, высвобождая
силикат. Учитывая высокую численность Sticholonche,
скелет этого протиста — существенный компонент
цикла кремния в океане (Takahashi, Ling, 1980).
Филогения, классификация
Sticholonche имеет аксоподий и по этому призна-
ку относится к морфологической группировке Acti-
nopoda, которая подразделяется на морфологические
группировки Radiolaria и Heliozoa. Стихолонха — мор-
ской планктонный организм; таковы все радиолярии
и очень немногие солнечники. Билатеральная симме-
трия, присущая Sticholonche, известна для некоторых
радиолярий Phaeodaria, но ни для одного солнечника.
С другой стороны, внеклеточный минеральный скелет
отсутствует у всех радиолярий, но имеется у многих
солнечников. Отсутствие центральной капсулы — так-
же черта организации солнечников. Перемещаться при
помощи аксоподий способны некоторые солнечники —
они перекатываются в чашке Петри (хотя в этом случае,
видимо, задействован иной принцип работы, нежели у
Sticholonche', см. главу Солнечники в этом томе). Таким
образом, Sticholonche сочетает черты организации ра-
диолярии и солнечника.
Гертвиг (Hertwig, 1877) охарактеризовал S. zanclea
как амебоидный организм с признаками Radiolaria и He-
liozoa. Фол (Fol, 1883) также полагал, что Sticholonche
занимает промежуточное положение между Radiolaria
и Heliozoa и создал для этого вида отдельный отряд
Taxopodida; название указывает, на то, что псевдоподии
организованы в ряды (лат. taxos — ряды). В первой
половине XX века Sticholonche относили к Radiolaria
(Hollande, Enjumet, 1954). При этом толстостенную
внутриклеточную структуру считали центральной кап-
сулой, пока Холланд с соавторами (Hollande et al., 1967)
не показали, что это ядерная оболочка. Затем Taxopo-
dida чаще включали в состав Heliozoa (Cachon, Cachon,
1978; Febvre-Chevalier, 1985). Выполненные уже в ны-
нешнем столетии молекулярно-филогенетические ис-
следования устойчиво позиционируют 5. zanclea вну-
три клады Polycystina (см. рис. 79 в главе Phaeodaria).
Формально описан единственный вид — S. zan-
clea Hertwig 1877. Такахаши и Линг (Takahashi, Ling,
1980) привели диагнозы двух видов, определенных
в открытой номенклатуре (sp. A, sp. В). Упоминание
«пресноводного протиста Sticholonche ankle» (Lovejoy
et al., 2006) — безграмотное цитирование публикации,
в которой говорится о морском протисте Sticholonche
zanclea. При секвенировании проб морского пикоплан-
ктона выявляют неидентифицированные 18S последо-
вательности, кластеризующиеся с последовательностя-
ми S. zanclea (Not et al., 2007). Вероятнее всего в пробы
попадают жгутиковые клетки, формирующиеся в ре-
зультате множественного деления. Непонятно пока,
принадлежат ли они расам S. zanclea или неописанным
видам Taxopodida.
Отряд Taxopodida Fol 1883
Род Sticholonche Hertwig 1877
(рис. 107, вкл.)
Крупный морской планктонный протает с 50-60
продольными рядами подвижных, работающих как
весла, аксоподий. Тело клетки сердцевидное расши-
ренное кпереди, дорсовентрально уплощенное, би-
латерально симметричное. Ядро одиночное крупное
бобовидное, вогнутое вентрально. Основание каждой
аксоподий закреплено в полусферическом прогибе
ядерной оболочки; прогибы расположены рядами.
Микротрубочки в составе аксонемы формируют гек-
сагональный паттерн. Минеральный скелет внекле-
точный, из силикатных спикул. Мелкие тангентальные
спикулы скреплены эластичным матриксом, облекаю-
щим тело клетки. Радиальные спикулы крупные, пу-
стотелые, их основания закреплены во внеклеточном
матриксе, собраны в 14 пучков. Единственный вид —
S. zanclea Hertwig, 1877.
TAXOPODIDA
167
SUMMARY
Sticholonche is a unique protist that ignores the Reynolds number. Food gathering generates thrust.
ЛИТЕРАТУРА
Райков И.Б. 1978. Ядро простейших. Морфология и эволюция. Л.:
Наука. 327 с.
Хаусман К., Хюльсман Н., Радек Р. 2010. Протистология: Руко-
водство. М.: Товарищество научных изданий КМК. 495 с.
Anderson R.O. 1983. Radiolaria. New York, Berlin, Heidelberg, To-
kyo: Springer-Verlag, 355 p.
Cachon J., Cachon M. 1969. Les processus sporogenetiques du Radio-
laire Sticholonche zanclea Hertwig // Arch. Protistenkd. Vol. 111. P. 87-99.
Cachon J., Cachon M. 1978. Sticholonche zanclea Hertwig. A rein-
terpretation of its phylogenetic position based upon new observations on its
ultrastructure//Arch. Protistenkd. Vol. 120. No. 1-2. P. 148-168.
Cachon J., Cachon M. 1981. Movement by non-actin filament mecha-
nisms П BioSystems. Vol. 14. P. 313-326.
Cachon J., Cachon M., Tilney L.G., Tilney M.S. 1977. Movement
generated by interactions between the dense material at the ends of microtu-
bules and non-actin-containing microfilaments in Sticholonche zanclea II J.
Cell Biol. Vol. 72. No. 2.P. 314.
Eskinazi-Sant’ Anna E. M. 2006. Sticholonche zanclea (Protozoa, Ac-
tinopoda) in fecal pellets of copepods and Euphausia sp. in Brazilian coastal
waters П Braz. J. Biol. Vol. 66. No. 3. P. 839-847.
Febvre-Chevalier C. 1985. IV Class Heliozoea Haeckel 1866 I I
Lee J.J., Hutner S.H., Bovee E.C. (eds). An illustrated guide to the Protozoa.
Lawrence, Kansas: Society of Protozoologists. P. 302-317.
Fol H. 1883. Sur le Sticholonche zanclea et un nouvel ordre de Rhizo-
podes I I Memoires de 1’Institut National Genevois. Vol. 15. P. 1-35.
Gowing M.M. 1989. Abundance and feeding ecology of Antarctic phae-
odarian radiolarians И Mar. Biol. Vol. 103. P. 107-118.
Hemleben C., Spindler M., Anderson O.R. 1989. Planktonic Forami-
nifera. New York: Springer. 363 p.
Hertwig R. 1877. Studien uber Rhizopoden. Jen. Zeitschr. f. Naturw.
Bd I. S. 324-348.
Hollande A., Enjumet M. 1954. Morphologic et affinites due Radio-
laire Sticholonche zanclea Hertwig // Annales Scientifique Nationale (Zool.)
lie serie. Vol. 16. P. 337-342.
Hollande A., Cachon J., Valentin M. 1967. Infrastructure des axo-
podes et organisation generale de Sticholonche zancles Hertwig (Radiolaire
Sticholonichidea) 11 Protisologica. Vol. 3. P. 155-164.
Lovejoy C., Massana R., Pedros-Alio C. 2006. Diversity and dis-
tribution of marine microbial eukaryotes in the Arctic Ocean and adjacent
seas И Applied and Environmental Microbiology. Vol. 72, No. 5. P. 3085-
3095.
Nikolaev S.L, C. Berney, J.F. Fahrni, I. Bolivar, S. Polet et al. 2004.
The twilight of Heliozoa and rise of Rhizaria, an emerging supergroup of
amoeboid eukaryotes И Proc. Natl. Acad. Sci. USA. Vol. 101. No. 21.
P. 8066-8071.
Not F., Gausling R., Azam E, Heidelberg J.F., Worden A.Z. 2007.
Vertical distribution of picoeukaryotic diversity in the Sargasso Sea II Envi-
ron. Microbiol. Vol. 9. P. 1233-1252.
Parfrey L.W., Lahr D.J.G., Katz L.A. 2008. The dynamic nature of
eukaryotic genomes 11 Molecular Biology and Evolution. Vol. 25. P. 787-794.
Schewiakoff W. 1926. Die Acantharia П Fauna e flora del Golfo di Na-
poli. Vol. 37. P. 1-755.
Suzuki N., Ogane K., Aita Y., Kato M., Sakai S. et al. 2009. Distri-
bution patterns of the radiolarian nuclei and symbionts using DAPI-fluores-
cence П Bull. Natl. Mus. Nat. Sci., Ser. B. Vol. 35. No. 4. P. 169-182.
Takahashi K., Ling H.Y. 1980. Distribution of Sticholonche (Radiola-
ria) in the upper 800 m of the waters in the Equatorial Pacific // Mar. Micropal.
Vol. 5. P. 311-319.
POLYCYSTINA Ehrenberg 1838
Полицистины — пелагические простейшие, с внутренним
кремневым скелетом, который состоит из отдельных игл или
имеет сложную конструкцию. Цитоплазма отчетливо разделе-
на на эндо- и эктоплазму. Эндоплазма заключена в централь-
ную капсулу. Характерной чертой всех полицистин является
наличие аксоподий. Гетеротрофы питаются преимущественно
простейшими и фитопланктоном. Все полицистины содержат в
эктоплазме симбионтов — одноклеточные водоросли, которые
способствуют процессу ассимиляции, а при неблагоприятных
условиях служат дополнительным источником питания. Разме-
ры одиночных форм полицистин колеблются от десятков микрон
до 1-3 мм. Колониальные полицистины (Spumellaria) достигают
4-6 см в диаметре, а некоторые виды рода Collozoum даже до
3 м в длину (Swanberg, 1979). Современные полицистины насе-
ляют все океаны и моря с океанической соленостью (32-35%о).
Распространены полицистины во всех климатических зонах от
Арктики до Антарктики, встречаются во всей толще вод от по-
верхности до абиссальных глубин. Известны с кембрия (lams,
Stevens, 1988), а массовые находки — с ордовикского периода.
Часто являются породообразующими организмами (кремнистые
породы, радиоляриевые илы).
История изучения
Исследование радиолярий начинается с первого со-
общения об одноклеточных организмах с кремневым
скелетом в планктоне современных океанов, сделан-
ного в 1809 г. В.Г. Тилезиусом — участником кругос-
ветного плавания русских моряков под руководством
И.Ф. Крузенштерна и Ю.Ф. Лисянского. К сожалению,
это первое упоминание о радиоляриях (так они были
названы только спустя полвека) осталось незамечен-
ным среди массы описаний другого биологического
материала.
Одно из ранних изображений ископаемых остатков
радиолярий было дано в 1834 г. Г. Мейером в фунда-
ментальном труде об ископаемых организмах Герма-
нии. В том же году по результатам кругосветного пу-
тешествия были опубликованы сведения о находках
ныне живущих радиолярий (Меуеп, 1834). Интересно
отметить, что Ф. Мейен первым установил и описал
крупные колониальные формы, бесскелетные или со
скелетом в виде отдельных игл.
Глубокое и всестороннее исследование ископаемых
и современных радиолярий было начато Х.Г. Эренбер-
гом. В цикле работ, опубликованных в 1838-1875 гг., он
осветил особенности строения скелета ископаемых и
современных радиолярий, создал их первую классифи-
кацию (Ehrenberg, 1838, 1847а, Ь, 1875). Новой группе
микроорганизмов Эренберг присвоил названце Arcel-
lina composita или Polycystina, т.е. многопузырчатые.
В имени Polycystina он отразил главную, по его мне-
нию, черту, свойственную всем радиоляриям — пори-
стое и сетчатое строение скелета.
Следующий решающий шаг в сравнительно-анато-
мическом изучении радиолярий был сделан Й.Г. Мюл-
лером, который впервые описал в Средиземном море
представителей семейства Acanthometra, характеризу-
ющихся особым числом и порядком расположения игл
скелета, состоящего из сернокислого стронция (целе-
стина) — SrSO4 (Muller, 1857, 1858). Мюллер опреде-
лил сходство радиального устройства тела и установил
тесную родственную связь нового семейства Acantho-
metra с семейством Polycystina Эренберга (Ehrenberg,
1838), отличающимся развитием кремневого скелета,
и объединил их в один новый отряд, который назвал
Radiolaria — лучевики или лучистые (Muller, 1858).
Выбор названия основывался на повсеместном присут-
ствии у живых форм многочисленных, довольно равно-
мерно распределенных радиальных псевдоподий. На-
звание Radiolaria сразу завоевало популярность и с тех
пор стало общепринятым.
Э. Геккель продолжил развивать идеи Мюллера в
исследовании радиолярий. В 1962 году Геккель опу-
бликовал монографию, в которой привел разделение
радиолярий на две группы (Polyzoa и Monozoa) и опи-
сание всех известных к тому времени 169 видов со-
временных радиолярий, отнесенных к 113 родам и 15
семействам (Haeckel, 1962). Результатом исследований
радиолярий, собранных экспедицией «Челленджер», в
основном в Тихом океане, было выделение новой груп-
пы радиолярий Phaeodaria (Haeckel, 1862).
Известность радиоляриям принесла ставшая за-
тем классической, прекрасно иллюстрированная мо-
нография Э. Геккеля (Haeckel, 1887) «Report on the
Radiolaria». Геккель обобщил все, что было известно
о современных и древних радиоляриях. Монография
состоит из двух томов: текста и атласа (144 таблицы).
POLYCYSTINA
169
В монографии дана классификация радиолярий, кото-
рая до сих пор используется многими специалистами
при изучении современных радиолярий, сделано опи-
сание строения мягкого тела и скелета радиолярий,
рассмотрены онтогенез и филогения радиолярий, при-
ведено их географическое и геологическое распро-
странение.
В систематической части Э. Геккель делит класс
радиолярий на два подкласса: Porulosa и Osculosa и
четыре легиона: Spumellaria и Acantharia, Nassellaria
и Phaeodaria. В основу деления на легионы положены
следующие признаки: симметрия, строение централь-
ной капсулы и положение в ней ядра, химический со-
став скелета, расположение скелета по отношению к
центральной капсуле и направление его роста (центро-
бежный или центростремительный). Деление на по-
дотряды среди Spumellaria идет по таким признакам,
как «отдельные клетки» или «колониальные формы»,
а также по первичной симметрии центральной капсу-
лы и скелета. Подразделение на подотряды в пределах
легиона Nassellaria строится на различных комбинаци-
ях таких элементов скелета, как «головной отдел, или
цефалис», «базальный треножник» и «сагиттальное
кольцо».
При внешней кажущейся стройности, наиболее
существенным недостатком этой системы является то,
что в ней не учитываются возрастные различия в стро-
ении скелета радиолярий (Геккель принимал все встре-
чающиеся формы радиолярий за взрослые организмы,
развитие которых завершено). В силу этого различные
стадии одного и того же вида могут быть отнесены к
различным таксонам высокого ранга. Сам Геккель не
считал свою систему полностью завершенной.
Среди наиболее значительных достижений в обла-
сти разработки классификации радиолярий после ра-
бот Геккеля необходимо отметить следующие работы.
К. Брандт (Brandt, 1905) заложил основы класси-
фикации колониальных радиолярий, развитые позднее
А.А. Стрелковым и В.В. Решетняк (1971). Е. Йорген-
сен (Jorgensen, 1905) обратил внимание на внутренний
игольчатый скелет насселлярий и предложил гомологи-
зировать иглы, дав им буквенные обозначения. В. Гек-
кер (Haecker, 1908), опираясь на данные изучения ске-
лета современных радиолярий, несколько упростил
и рационализировал систему Геккеля. А. Поповский
(Popofsky, 1908, 1912) развил принципы классифика-
ции насселлярий Йоргенсена по иглам и предложил
новую систему таксонов Nassellaria, впрочем, не полу-
чившую признание.
В середине XX в. практически одновременно вы-
ходят в свет основы палеонтологии: французская (De-
flandre, 1952, 1953), американская (Campbell, 1954) и
русская (Стрелков и др., 1959). Каждая из этих книг
отличается от других по своей направленности, охвату
материала и плану изложения. В этих трудах система
Геккеля, с одной стороны, канонизируется и предлага-
ется к обязательному использованию, а с другой сто-
роны — в нее вносятся изменения, дополнения и уточ-
нения, не затрагивающие основных идей и принципов,
заложенных Геккелем.
Особый, по сравнению с геккелевским, принцип
для систематики Spumellaria предлагают А. Голланд и
М. Анжуме (Hollande, Enjument, 1960), которые изуча-
ли живой планктонный материал. Они исходят из двух
основных критериев: онтогенетического роста скеле-
та и цитологических комплексов (строение ядра, цен-
тральной капсулы, псевдоподий, аксопластического
аппарата и др.). А. Голланд и М. Анжуме пересматри-
вают геккелевскую систему сфероидей (Spumellaria),
описывают новые надсемейства, семейства и роды.
Однако полной разработанной системы этой группы
пока нет.
Еще один принцип построения системы отряда
Spumellaria предложен А. Жамойдой (Жамойда, 1969).
Центробежный рост скелетов спумеллярий наводит на
мысль о сходном характере роста скелетов спумелля-
рий и кристаллов минералов. К построению системы
Spumellaria, по мнению А. Жамойды, можно приме-
нять те же законы симметрии, что и в кристаллогра-
фии. Однако центробежный рост спумеллярий часто
является артефактом, связанным с процессом раство-
рения раковинок.
Особую систему радиолярий опубликовал В. Рид ел
(Riedel, 1967). Следуя правилу приоритета, он вернулся
к названию Polycystina, впервые предложенному Эрен-
бергом (Ehrenberg, 1838), при этом отнес к собственно
радиоляриям только формы с кремневым скелетом и
рассматривал Spumellaria и Nassellaria в качестве по-
дотрядов отряда Polycystina. В своей классификации
Ридел использует принципы филогенетических взаи-
моотношений таксонов, общей геометрии и симметрии
скелетов, а также данные о стратиграфическом распро-
странении радиолярий.
В классификационных схемах, появившихся на ру-
беже XX и XXI вв., принцип классификации скелетов
радиолярий на основе симметрии не утрачивает своего
значения. Однако это уже не та симметрия, в смысле
проморфологии, которой пользовался Геккель. Скорее,
это общая геометрия скелета, хотя и называемая сим-
метрией. При этом с одной стороны, значение и роль
симметрии существенно преуменьшаются в класси-
фикационных построениях П. Де Вевера и И. Ориглия
(1982), П. Думитрики (1984) и Э.О. Амона (1999, 2000
a-в), с другой стороны, тип симметрии нередко стано-
вится основанием для выделения таксонов высоких си-
стематических уровней в классификациях, предложен-
ных М.Г. Петрушевской (1971, 1979, 1981, 1984, 1986),
Б.Б. Назаровым (1974а, б, 1975, 1981, 1988), С.В. Точи-
линой (Tochilina, 1996), П. Де Вевер с соавторами (De
Wever et al., 2001), M.C. Афанасьевой и Э.О. Амоном
(Афанасьева, Амон, 2003; Afanasieva et al., 2005).
Серьезную реформу системы радиолярий высших
таксономических уровней произвела М.Г. Петрушев-
ская (1971, 1979, 1981, 1984, 1986). Она попыталась
объединить представления исследователей XIX века и
данные, полученные цитологами во второй половине
XX века. Система высших таксонов радиолярий Петру-
шевской более точно и адекватно отражает многообра-
зие морфотипов и филетических связей радиолярий,
чем система Геккеля, и, в то же время, совершеннее
170
POLYCYSTINA
систем зарубежных ученых. Вместе с тем, радиолярии
продолжают рассматриваться в ранге класса с двумя
подклассами Euradiolaria и Acantharia. Стройная си-
стема Петрушевской охватывает все известные в то
время группы ископаемых и современных радиолярий,
учитывает новые данные цитологии, определяет таксо-
номический статус всех морфологических признаков
скелета.
Разграничение таксонов высокого ранга у радио-
лярий основано на особенностях строения нуклеоак-
соподиального комплекса, влияющих на морфологию
центральной капсулы и минерального скелета, а также
на положение его в клетке. На уровне семейств, родов
и видов у полицистин могут быть использованы только
детали строения скелета. Однако формальное приме-
нение признаков высоких таксонов при классификации
ископаемых радиолярий сталкивается с невозможно-
стью установить у вымерших организмов ядерные или
цитоплазматические структуры. В этом случае важ-
нейшее значение для фоссилий приобретает признак
симметрии клетки и преобладающая геометрическая
форма скелета, т.е. морфология скелета.
Д. Болтовской (Boltovskoy, 1998) в своей работе по
классификации и распределению современных радио-
лярий в Южной Атлантике придает большое значение
морфологии и физиологии радиолярий, рассматривая
морфологические особенности скелета, как классифи-
кационную базу. Проанализировав линии филогенезов
современных радиолярий, Болтовской приходит к за-
ключению, что наиболее важные скелетные признаки,
используемые Геккелем для построения системы, прак-
тически не работают на надвидовом уровне. В то же
время признаки, традиционно считавшиеся как мало-
значимые, показывают эволюционные тренды и, соот-
ветственно, вполне приемлемы для выделения таксо-
нов высокого ранга.
Система радиолярий Болтовского, ограниченная
только рамками голоцена, содержит описание 164 ви-
дов радиолярий и исчерпывающие диагнозы всех так-
сонов высокого ранга. Хотя сам Болтовской полагает,
что его классификация является компромиссной и вре-
менной, поскольку создание полной и всеобъемлющей
системы радиолярий станет возможным только после
инвентаризации всех без исключения радиолярий, со-
временные исследователи признают, что она является
лучшей из предложенных в последние десятилетия
(Афанасьева, Амон, 2006).
Все данные о распределение полицистин в толще
воды и в поверхностном слое донных осадков пред-
ставлены в атласе распределения современных поли-
цистин (Boltovskoy et al., 2010).
Классификация
Некоторые исследователи считают, что Polycystina
следует рассматривать в качестве подтипа (класса,
надкласса, надотряда, отряда) в типе (классе, под-
классе) Radiolaria (Riedel, 1967; Петрушевская, 1986;
Boltovskoy, 1998; De Wever et al., 2001; Афанасьева,
Амон, 2002, 2003, 2006; Карпов, 2004; Adi et al., 2005;
Малахов, 2006).
В настоящем руководстве принимается ранг типа
Polycystina, который представлен одним классом
Polycystinea Ehrenberg 1838.
Общепринятой классификации полицистин не су-
ществует. В ходе дальнейшего изложения мы будем
придерживаться классификации полицистин, предло-
вакуоли
центральная капсула
эндоплазма
ядро
аксопласт
раковина
зооксантеллы
филоподии
цитоплазма, окружающая
иглы и аксоподий .
игла
аксоподия
раковина
эктоплазма
Рис. 108. Схема организации сферических полицистин. (По: De Wever et al., 2001).
POLYCYSTINA
171
женной Д. Болтовским (Boltovskoy, 1998, 1999) для со-
временных радиолярий.
Тип Polycystina Ehrenberg 1838
Отряд Collodaria Haeckel 1881
Сем. Thalassicollida Haeckel 1862
Сем. Collozoida Haeckel 1862
Сем. Thalassosphaerida Haeckel 1862
Сем. Sphaerozoida Haeckel 1862
Отряд Spumellaria Ehrenberg 1875
Сем. Collosphaeridae (MUller) Strelkov & Reshetnjak 1971
Сем. Actinommidae (Haeckel) Sanfilippo & Riedel 1980
Сем. Coccodiscidae (Haeckel) Sanfilippo & Riedel 1980
Сем. Phacodiscidae Haeckel 1881
Сем. Spongodiscidae (Haeckel) Riedel 1967
Сем. Litheliidae Haeckel 1862
Сем. Pyloniidae Haeckel 1881
Сем. Tholoniidae Haeckel 1862
Отряд Nassellaria Ehrenberg 1875
Сем. Spyridae (= Trissocyclidae, Acanthodesmiidae) (Ehren-
berg) Petrushevskaya 1971
Сем. Plagoniidae (Haeckel) Riedel 1967
Сем. Theoperidae (Haeckel) Riedel 1967
Сем. Carpocaniidae (Haeckel) Riedel 1967
Сем. Pterocorythidae (Haeckel) Riedel 1967
Сем. Artostrobiidae (Riedel) Foreman 1973
Сем. Cannobotryidae (Haeckel) Riedel 1967
Морфология
Цитоплазматические образования. Цитоплазма
всех полицистин отчетливо разделена центральной
капсулой на эндо- и эктоплазму (рис. 108, 109). Андер-
сон (Anderson, 1983) придает этой дифференцировке
цитоплазмы полицистин большое значение, считая ее
особой ступенью специализации простейших.
В эндоплазме находятся: ядро, рибосомы,
митохондрии, аппарат Гольджи и эндоплазматиче-
ский ретикулум. Так же в эндоплазме обычны пище-
варительные вакуоли, вакуоли с запасными жировыми
включениями, кристаллы (Anderson, 1983) (рис. 109).
Эндоплазматический ретикулум хорошо развит, обра-
зует медиальные каналы, которые представляют собой
выстланные мембранами трубки сравнительно большо-
го диаметра (до 5 мкм), где возникают зоны активного
метаболизма. Митохондрии с трубчатыми кристами.
Жировые включения имеют вид шарообразных ка-
пель величиной 3-^4 мкм, в редких случаях до 70 мкм.
1-3 мелкие жировые капли или большее число мелких
капель жира заключены внутри центральной капсулы.
Они возникают на ранних стадиях развития и накапли-
ваются (Петрушевская, 1986). Считается, что жировые
капсулы — это не просто продукты обмена, резервный
источник питательных веществ, но и приспособление,
облегчающее парение в воде. Более того, не исклю-
чено, что объем жировых капель может меняться, об-
легчая подъем и опускание радиолярий в толще воды
(Haeckel, 1862).
Кристаллы изоморфной природы, состоящие из
сернокислых солей стронция или бария, обнаружены
почти у всех колониальных форм Collodaria (Huxley,
1851; Muller, 1858; Haeckel, 1862). Крупные кристаллы
достигают у вегетативных особей 35-50 мкм в длину и
Рис. 109. Разрез центральной капсулы и прилегающих участков
цитоплазмы. (По: De Wever et al., 2001).
12-22 мкм в ширину. У одной особи бывает по 10-50
крупных кристаллов или несколько сотен мелких.
Эктоплазма уплотнена и лишена многих ор-
ганелл и включений, типичных для эндоплазмы. Эк-
топлазма насыщена вакуолями, преимущественно
пищеварительными, содержит симбиотические водо-
росли — зооксантеллы (см. ниже), образует псевдо-
подии, сквозь нее проходят выходящие из эндоплазмы
аксонемы аксоподий (Кашон, Кашон 1984).
Долгое время считалось (Hertwig, 1879; Haeckel,
1887; Borgert, 1901; Стрелков и др., 1959), что экто-
плазма радиолярий состоит из саркоматрикса — слоя,
где зарождаются основные псевдоподии, вакуолизиро-
ванного слоя (калиммы) и саркодиктиума — наружного
уплотненного слоя, от которого отходят тонкие внека-
лиммарные псевдоподии. Эти представления подтвер-
дились (Cachon, Cachon, 1976а) только в отношении
рода Thalassicolla (Collodaria), которым свойственна
экзоаксопластия (см. ниже), поскольку аксонемы фор-
172
POLYCYSTINA
эндоплазматический
ретикулум
фузула
митохондрия
диктиосома
эндоплазма
аксопласт
клеточная
мембрана'^^
центральная
капсула
эндоплазматический
ретикулум
аксоподия
Рис. 110. Разрез через аксоподию и стенку центральной капсулы
полицистин. (По: Cachon, Cachon, 19766).
мируются у них на наружной поверхности центральной
капсулы. Именно утолщение основания этих аксоподий
и было описано как саркоматрикс. У других полици-
стин, у которых аксонемы идут из эндоплазмы, сарко-
матрикс не выражен. У Thalassicolla сильно развита ка-
лимма. Однако у многих полицистин калимма развита
слабо, при этом она бывает частично заключена внутри
скелетной раковины. По мнению французских авторов
(Hollande et al., 1970; Cachon, Cachon, 1978), калимма
в значительной степени представляет собой продукты
экскреции клеток. Снаружи от калиммы у полицистин
часто развиваются особый саркодиктиум и пелликула,
одевающая клетку как оболочка (Петрушевская, 1981).
Эндоплазма заключена в тончайшую оболочку —
центральную капсулу (рис. 109). Стенка цен-
тральной капсулы имеет толщину 60-80 нм и строится
из полигональных пластинок, разделенных небольши-
ми щелями, которые с обеих сторон выстланы мембра-
нами. На самих пластинах имеются округлые субми-
кроскопические поры разного размера. Количество и
форма пластинок варьируют в зависимости от стадии
жизненного цикла не только от вида к виду и от рода
к роду, но и у экземпляров одного вида. Гликопроте-
иновые пластинки, из которых составлена централь-
ная капсула, весьма нежные и они легко разрушаются
при воздействии даже слабых реагентов. Центральная
капсула разрушается после гибели полицистины уже
в верхних слоях воды, поэтому сообщения о находках
планктонных радиолярий с сохранившимися централь-
ными капсулами в древних отложениях (Schwarz, 1931;
Deflandre, 1953), видимо, ошибочны.
Там, где осевые нити аксоподий проходят через
оболочку центральной капсулы, она выпячивается в
виде сосочков — фузул. Вместе с плазмалеммой заги-
баются и гликопротеиновый слой, и мешки ретикулу-
ма. Отверстие сосочка закрыто особой мембраной, или
аксонема
Рис. 111. Схема организации аксоподий полицистин. (По: Cachon, Cachon, 19766).
POLYCYSTINA
173
Рис. 112. Типы нуклеаксоподиальных комплексов полицистин.
А — экзоаксопластия; Б-Ж— эндоаксопластия: Б — криптоаксопластия (анаксопластия), В — центраксопластия, Г— периаксопластия, Д, Е — апо-
аксопластия, Ж— проаксопластия. с — скелет, сп — спикула, сб — срединная балка, эндо-эндоплазма центральной капсулы, я — ядро, а — аксо-
пласт и аксоподии, жк — жировая капля, з — зооксантеллы, к — кристаллы целестина (SrSO4). (По: Афанасьева, 2006).
174
POLYCYSTINA
диафрагмой. Последняя, сравнительно тонкая, — при
ценраксопластии, а при периаксопластии имеется боль-
шая лакуна, как бы увеличивающая фузулу. Диафрагмы
и лакуны пронизаны отверстиями или каналами, кото-
рые бывают двух типов. Одни более узкие, в каждом из
них проходит по одной микротрубочке. Другие, более
широкие, служат для прохода жидкой цитоплазмы (ре-
оплазмы) (Hollande et al., 1970; Петрушевская, 1986).
Характерной чертой всех радиолярий являются
псевдоподии — аксоподий. Поскольку радиолярий
не удается культивировать, а в лабораторных условиях
они могут жить лишь в течение недели — месяца, то
физиология их изучена слабо. Но деятельность аксопо-
дий удалось наблюдать, и было обнаружено, что они
мультифункциональны. Аксоподий поддерживают ор-
ганизм в морской воде во взвешенном состоянии, при-
нимают участие в поимке добычи, играют важную роль
в метаболизме кремния, перенося его частицы для по-
строения раковин, осуществляют транспорт вакуолей и
мембран (Кашон, Кашон 1984) (рис. ПО).
Сами аксоподий прямо не участвуют в пищеваре-
нии. Они быстро освобождаются от пойманной добы-
чи, в них не бывает пищеварительных вакуолей. Эти
вакуоли локализуются в эктоплазме.
Аксоподий состоят из аксонемы (стереоплазма) и
окружающей цитоплазмы (реоплазма) (рис. 111). Аксо-
нема образована упорядоченно расположенными ми-
кротрубочками, которые соединены между собой при
помощи поперечных мостиков. Число мостиков, отхо-
дящих от одной микротрубочки, называют валентно-
стью. Считается, что микротрубочки могут проявлять
2 или 3 валентности, т.е. давать 2 или 3 мостика. Сое-
диненные микротрубочки составляют так называемую
стереоплазматическую решетку (рис. 111). Несмотря
на сложность и стабильность устройства, стереоплаз-
матическая решетка может мгновенно разбираться при
укорачивании аксоподий. Дезинтеграция микротрубо-
чек происходит и при воздействии химических реаген-
тов, и при резких изменениях температуры. Цитоплазма
аксоподий содержит мелкие митохондрии, служащие
энергетическим ресурсом деятельности аксоподий, и
осмофильные тельца. Отмечено движение цитоплазмы
в аксоподиях: внутри стереоплазматической решет-
ки — центростремительное, на периферии — центро-
бежное. Аксоподий быстро восстанавливаются за счет
самосборки микротрубочек. Аксонемы отходят от ак-
сопластов, расположенных у большинства полицистин
вблизи ядра. Аксопласт представлен электронно-плот-
ной аморфной массой, от которой расходятся микро-
трубочки аксонем.
Типы нуклеаксоподиальных комплексов одиноч-
ных полицистин выделены по расположению аксо-
пласта относительно ядра (Hollande, Enjumet, 1960;
Cachon, Cachon, 1971, 1976a; Петрушевская, 1986)
(рис. 112).
1. Экзоаксопластия (Collodaria): аксонемы не захо-
дят глубоко в эндоплазму. Аксопласт находится вблизи
центральной капсулы (рис. 112, А).
2. Эндоаксопластия (практически все полицисти-
ны): аксонемы заходят в эндоплазму, а часто и в ядро;
в этом случае выделяют пять нуклеоаксоподиальных
комплексов (рис. 112, Б-Ж)\
• криптоаксопластия (анаксопластия) — едино-
го аксопласта нет, каждая аксонема заякорена на
поверхности ядра (спумеллярии Actinommidae)
(рис. 112,27);
• центраксопластия — единый аксопласт находится в
цитоплазме в центре ядра, аксонемы пронизывают
ядро, проходя в цитоплазматических каналах; при
этом аксоподиальный аппарат, ядро, центральная
капсула, скелет являются радиально-симметричны-
ми (многие Spumellaria) (рис. 112, В);
• периаксопластия — единый аксопласт находится
в чашевидном углублении ядра, аксонемы отходят
плотным пучком в одну сторону, а по остальным
радиусам расходятся единичные аксоподий; аксо-
подиальный аппарат, ядро, центральная капсула,
скелет расположены гетерополярно (спумеллярии
Haxastylioidea) (рис. 112, Г);
• апоаксопластия — единый аксопласт находится от-
дельно или рядом с ядром, иногда даже в углубле-
нии, но тесного контакта между этими структурами
нет; расположение аксонем, взаимное положение
ядра и аксопласта, центральная капсула и скелет
отличаются гетерополярностью с элементами би-
латеральной симметрии (насселлярии Spyridae и
Plagoniidae) (рис. 112, Д, Е);
• проаксопластия — аксопласт находится в тесном
контакте с ядром и расположен между его лопа-
стями; аксоподиальный аппарат, ядро, централь-
ная капсула и скелет являются отчетливо гетеро-
полярными, иногда с элементами трилучевой и/
или билатеральной симметрии (многие Nassellaria)
(рис. 112, Ж).
Кроме аксоподий у полицистин есть филоподии —
тонкие, длинные, иногда ветвящиеся псевдоподии.
Они используются для ловли, добычи и формирования
крупных пищевых вакуолей.
Скелет полицистин. Скелет у радиолярий ис-
ключительно внутренний. Он не находится в непо-
средственном контакте с морской водой и поэтому не
подвергается растворению в течение жизни клетки.
Ультрамикроскопическими исследованиями было по-
казано, что даже выступающие наружу части скелета,
главным образом радиальные лучи и лопасти, покрыты
снаружи непрерывающимся слоем эктоплазмы, спо-
собной регенерировать поврежденные, травмирован-
ные участки скелета (Anderson, 1983; Петрушевская,
1986). Вот как описывает М.Г. Петрушевская (1986,
с. 49) парящие в воде полицистины: «как бы ни отлича-
лась одна форма скелета радиолярий от другой, в воде
парит лишь шаровидный, эллипсовидный или слегка
сплющенный комочек цитоплазмы со своими много-
численными волосовидными аксоподиями».
Основные функции скелета радиолярий — опорная
и, возможно, разделительная для определенных частей
и элементов цитоплазматических образований. Несмо-
тря на то, что радиолярии имеют внутренний скелет,
а цитоплазма, в которую он погружен, несет много-
численные псевдоподии, меняющие свои очертания,
POLYCYSTINA
175
цитоплазма в целом повторяет общую форму скелета
(Жамойда, 1999; Matsuoka, 1999).
Химический состав. Все полицистины имеют ау-
тогенный скелет, состоящий из аморфного кремнезема
(98% SiO2) (Hurd, Takahasi, 1981; Петрушевская, 1981;
Takahasi, Honjo, 1981). В состав скелета также входят
магний, кальций, натрий, алюминий и восемь амино-
кислот (Anderson, 1983).
Формирование скелета. У полицистин обнаруже-
ны мелкие от 0,2 нм до нескольких нанометров вакуоли
с оболочкой из нескольких мембран, между которыми
находится кремнезем (Cachon, Cachon, 1971). По пери-
ферии эти вакуоли выстланы плазмалеммой, а внутрен-
няя часть, содержащая скелет, окружена оболочкой, на-
поминающей силикалемму диатомей (Anderson, 1977,
1980, 1983; Anderson, Swanberg, 1981) (рис. 113). Пред-
Рис. 113. Формирование скелета.
А — скелет (ск), окруженный скелетообразующей вакуолью (в), Б —
пространственное соотношение между скелетообразующими вакуолями
(в) и скелетом (ск), образованным внутри этих вакуолей. (По: Anderson,
1983).
полагается, что на мембранах этих вакуолей формиру-
ется скелет. Сначала на силикалеммах выделяются от-
дельные гранулы кремнезема размером 0,01-0,05 мкм,
затем эти гранулы сливаются друг с другом.
Различают два способа образования скелета у со-
временных полицистин. Один способ — это «способ
ободка» (rim-growth); сначала образуется органическая
матрица будущего скелета, которая быстро окремнева-
ет, оставляя немногочисленные округлые поры, кото-
рые сужаются за счет дальнейшего утолщения стенки
скелета (Anderson, 1980). Другой — «способ мостика»
(bridge-growth); сначала формируются прямые пере-
кладины, которые, соединяясь мостиками и разрас-
таясь, создают раковинку с многочисленными порами
разного диаметра и формы (Anderson, 1980). Если при
первом способе преобладают округлые поры, то при
втором — полигональные. Различные части скелета,
даже у особей одного вида могут строиться разными
способами (Петрушевская, 1962, 1986).
У полицистин в онтогенезе сначала возникают
центральные части скелета, а затем — иногда сразу, а
иногда после некоторого перерыва — периферические.
Последние бывают более вариабельными и считаются
менее надежными для таксономии.
Морфология скелета полицистин очень разно-
образна. Форма скелета далеко не всегда поддается
описанию с помощью простых геометрических фигур.
Это могут быть губчатые или решетчатые сферы, часто
вставленные одна в другую; другие — внешне похожи
на гантели, цилиндры, башенки, пропеллеры, конусы,
шлемы, короны и т.д.
Скелеты спумеллярий могут состоять из сфериче-
ских отдельных или вставленных друг в друга решетча-
тых или губчатых раковин (рис. 114). Концентрические
сферы соединяются радиальными лучами, которые
часто иглами выступают наружу. Это первичные иглы,
они крупные и их число, как правило, фиксировано (2,
4 или 6), и расположены они упорядочено. Более мел-
кие иглы (щетинкообразной или шипообразной формы)
называются вторичными, как правило, они равномерно
разбросаны по всей поверхности раковины. Наружная
раковина называется кортикальной, раковины, находя-
щиеся внутри, — медуллярными (рис. 114, Л, Б).
Очень разнообразны по форме спумеллярии с губ-
чатым скелетом. Это могут быть сферы с длинными
иглами (рис. 114, В), плоские диски, квадраты и треу-
гольники (рис. 115, А-Д).
Встречаются двояковыпуклые диски, внутри кото-
рых расположена сферическая медуллярная раковина
(рис. 115, Е, Ж). Скелеты могут иметь полярные чашеч-
ки или быть богато украшены другими губчатыми или
решетчатыми структурами (рис. 116). У ряда полици-
стин скелет состоит из лежащих в разных плоскостях
решетчатых спиральных лент, которые частично или
полностью окружены не спиральными решетчатыми
структурами (рис. 117). У некоторых спумеллярий есть
пиломы в виде вытянутых трубок на границе решетча-
тых дисков (рис. 115, Е).
У насселлярий скелет гетерополярный. Радиаль-
ные иглы, число и положение которых постоянно об-
176
POLYCYSTINA
Рис. 114. Сферические раковины.
Рис. 115. Губчатые раковины.
А-Д — губчатые раковины; Е-Ж — двояко-
выпуклые раковины.
POLYCYSTINA
177
Рис. 116. Эллипсоидная раковина.
разуют первичную (центральную) спикулу. Иглы А
(апикальная игла), D (дорзальная игла), 21 (боковая до-
полнительная игла) отходят от одного конца срединной
балки (МВ); иглы Vert (вертикальная игла), 2L (боковая
главная игла), Ах (аксобласт) отходят от другого конца
(рис. 118, А). От основных игл обычно отходят пере-
кладины и отростки. Их расположение повторяется с
небольшими модификациями у большинства насселля-
рий.
Кроме прямых перекладин имеется система дуго-
образно изогнутых скелетных элементов (рис. 118, Б,
В). Дуги называются двумя буквами — по отросткам,
которые они соединяют (табл. 5).
Все иглы и дуги в сочетании с более или менее
развитыми пористыми стенками составляют цефалис
(I отдел скелета) (Петрушевская, 1971).
В цефалисе различают несколько частей: цефали-
ческая камера, боковые доли, антецефалическая ка-
мера, постцефалическая камера (рис. 119). У некото-
рых насселлярий хорошо развиты все части цефалиса
(мультилопастной цефалис); у других в большей или
меньшей степени развита одна (простой цефалис) или
несколько его частей (трехлопастной и двухлопастный
цефалис). Постцефалическая часть цефалиса бывает
Рис. 117. Спиральные раковины.
Таблица 5
Обозначение скелетных элементов
А - апикальная игла
а - передние отростки апикальной иглы А
Ante - антецефалическая доля цефалиса
Ах - аксобат
с - цервикальные отростки иглы D
D - дорзальная игла
d - отростки иглы £, следующие за пекторальными
отростками
Еис - эуцефалическая доля цефалиса
g - галерные отростки иглы А
f ~ фуркальные отростки иглы Vert
j - югальные отростки иглы Vert
L hLj - правая и левая главные боковые иглы
/и - правая и левая дополнительные боковые иглы
МВ - срединная балка
т - митральные отростки иглы А
р - пекторальные отростки иглы L
Pstc - постцефалическая доля цефалиса
q - отростки сагиттального кольца
t - тергальные отростки иглы I
Vert - вертикальная игла
z - отростки сагиттального кольца
Рис. 118. Схема организации скелетов Nassellaria.
А — первичная спикула, Б, В — основные дуги (вид сбоку и сверху).
(По: Петрушевская, 1981).
178
POLYCYSTINA
Рис. 119. Типы цефалиса.
А, Б — мультилопастной цефалис; В, Г— простой цефалис; Д Е — трехлопастной цефалис; Ж, 3 — цефалис с отшнурованным шейным отделом. (По:
Петрушевская, 1981 —Б, Е, 3; Петрушевская, 1971 —А, В, Г, Д\ Nigrini, 1967 —Ж). Сер — цефалическая камера, Ante — антецефалическая камера,
Pstc — постцефалическая камера, Later — боковые доли.
Рис. 120. Галея.
не ограничена от торакса и часто бывает преобразована
в тубус (рис. 119, Б). У некоторых форм, обладающих
сагиттальным кольцом, над цефалисом развивается так
называемая галеарная часть (галея) (рис. 120) (Петру-
шевская, 1971, 1981; Boltovskoy, 1998).
Раковина насселлярий может состоять только
из центральной спикулы или из центральной спику-
лы и дуг различного радиуса (сагиттального кольца),
из одного сегмента — цефалиса или из двух и более
сегментов, расположенных один за другим. Сегменты
называются: торакс, абдомен, постабдомен. Послед-
ний, в свою очередь, может быть разделен на 2-15 и
более сегментов (рис. 121). Стенка цефалиса и торакса
отдельных видов может иметь сходное строение (тол-
щину, расположение пор) или несколько отличаться.
У трехсегментных форм абдомен часто имеет более
мелкие, чем торакс поры, но может иметь и такую же,
как торакс стенку. У многосегментных насселлярий
следующие за абдоменом сегменты обычно повторяют
его строение, несколько отличаясь от него размерами.
Устье раковинки может быть или широко откры-
тым, или слегка суженным, иногда даже вытянутым
в трубку, или скелет заканчивается мешкообразно
(рис. 122, А, Б). Замыкается устье в конце роста ске-
лета. Иногда имеется пористая пластина, закрывающая
устье скелета, как крышечка. У некоторых насселля-
рий, например, у Carpocanium, имеется перистом. По-
POLYCYSTINA
179
Рис. 121. Схема раковины Nassellaria.
Постабд — постабдоминальный сегмент, перист — перистом. (По: Пе-
трушевская, 1981).
следний отдел раковинки (торакс или абдомен) не раз-
вивается в нормальный сегмент с пористыми стенками,
а бывает представлен лишь широкой, но короткой, ли-
шенной пор трубкой. Эта трубка и есть перистом. Край
перистома фестончатый или зубчатый (рис. 122, В).
Стенка раковины часто пронизана порами. Рас-
стояние между порами — ширина перекладин между
ними — примерно соответствует толщине стенки. Как
правило, расстояния между порами превышают тол-
щину стенки. Поэтому толстостенные раковины имеют
сравнительно немного удаленных друг от друга пор.
Если же поры в толстостенных раковинах расположе-
ны сравнительно густо, то оказывается, что переклади-
ны между ними утолщены посередине и более тонкие
у края пор. Это создает впечатление, что поры окайм-
лены или обрамлены. Тонкостенные раковины обычно
пронизаны густо расположенными порами, которые
располагаются в шахматном порядке, или, в редких
случаях, образуют продольные и поперечные ряды
(рис. 123).
Наружные придатки раковин: 1) апикальный рог,
возникающий на цефалисе как продолжение иглы А,
направлен вертикально вверх или несколько накло-
нен вперед (рис. 124, А, Б); 2) затылочный рог — про-
изводное иглы Vert (рис. 124, А); 3) так называемые
«ноги» — наружные продолжения игл D, L. и Ц; по-
следние обычно выходят наружу в верхней части или
Рис. 123. Расположение пор.
А — редкие поры; Б — продольные поры; В — поперечные ряды пор;
Г— поры в шахматном порядке.
по бокам торакса и называются латеральные «ноги»
(рис. 124, Л).
Они, так же как апикальный и затылочный рога,
представляют собой более или менее длинные иглы,
часто граненые. Придатки раковины, особенно ее
«ноги», иногда соединяются с наружной стенкой до-
полнительными перекладинами — распорками, соз-
дающими пирамиду, укрепляющую основание иглы.
Соединение придатков со стенкой на значительном
протяжении приводит к возникновению так называе-
180
POLYCYSTINA
Рис. 124. Наружные придатки.
мых крыльев (рис. 124, Г), а соединение не только со
стенкой, но также между собой и с иглой А формирует
особые пористые пластины (рис. 124, В). Иногда на-
блюдается смещение точки отхождения «ног» к нижне-
му краю торакса, такие «ноги» называются терминаль-
ными (рис. 124, Б).
Физиология
Движение. Механизм движения полицистин и их
ориентировка в пространстве до сих пор изучены очень
слабо. В связи с этим термины верхний — нижний и
передний — задний можно употреблять по отношению
к полицистинам только условно. Для полицистин из-
вестны вертикальные миграции и уход на глубину при
неблагоприятных условиях. Так, представители рода
Thalassicolla (Collodaria) способны подниматься и опу-
скаться благодаря наличию альвеол (пузырьки возду-
ха). Альвеолы могут исчезать — тогда удельная масса
клетки увеличивается и полицистины опускаются. Ког-
да альвеолы восстанавливаются, клетка поднимается в
верхние слои воды.
Питание. Публикаций о питании и захвате пищи
у полицистин очень мало по той простой причине, что
их не удается культивировать. Многие из них живут на
больших глубинах, и при отборе проб они оказываются
сильно поврежденными. Только поверхностные орга-
низмы, такие как Thalassicolla, Thalassophysa, Thalas-
solampe, Collozoum, удается содержать в лабораторных
условиях в течение нескольких недель, и то только в
тех случаях, если при отборе соблюдались большие
предосторожности.
Пищей полицистин служат мелкие организмы (зе-
леные жгутиконосцы, диатомеи, тинтинниды, различ-
ные споры), но иногда в их эктоплазме можно наблю-
дать и крупную добычу — копепод, сагитт, личинок
аннелид (Anderson, 1980; Gowing, 1998; Nothig, Gow-
ing, 1991). Добыча захватывается аксоподиями, и то-
ками цитоплазмы переносится поближе к центральной
капсуле в большие пищеварительные вакуоли (Cachon,
Cachon, 1976b; Кашон, Кашон, 1984). Изучая питание
колониальных радиолярий, Сванберг (Swanberg, 1979)
неоднократно наблюдал, что пища затягивается внутрь
колонии, где постепенно переваривается. Обычны пи-
щевые объекты размером менее 1 см. Пищевой спектр
колониальных радиолярий шире чем у одиночных:
фитопланктон, копеподы, аппендикулярии, личинки
моллюсков, одиночные радиолярии, акантарии, мелкие
гидромедузки, сифонофоры и мелкие сальпы.
На основании данных по колониальным радиоля-
риям сейчас твердо установлено, что радиолярии мо-
гут использовать продукты фотосинтеза своих симби-
онтов. Андерсон (Anderson, 1983) доказал, что колония
(Collozoum inerme) съедает и переваривает симбиоти-
ческие водоросли, если она помещена в стрессовые
условия, а при более мягких условиях имеет место
транслокация продуктов фотосинтеза от симбионта к
хозяину — Collosphaera globularis. Какую роль играет
активно пойманная пища, а какую — питание за счет
симбионтов — еще не известно. Есть данные, которые
показывают, что потребности метаболизма (дыхания)
полицистины могут удовлетворять за счет фотосинте-
за. Это указывает на то, что затраты на рост колонии и
размножение должны покрываться за счет гетеротроф-
ного питания (Сванберг, 1984).
POLYCYSTINA
181
Симбионты и паразиты. В эктоплазме многих
полицистин встречаются одноклеточные водоросли
динофитовых и криптомонад. На одну клетку одиноч-
ных полицистин приходится до 20-50 симбиотических
клеток. Наиболее изучены симбиотические водоросли
колониальных полицистин. Диаметр каждой колонии
равен в среднем 3-4 см. Каждая колония состоит при-
близительно из 100 центральных капсул диаметром
0,18 мм. Каждую центральную капсулу окружает 80-
100 зооксантелл. Доказано, что радиолярии не только
получают от симбионтов дополнительный кислород и
метаболиты, но могут переваривать их клетки при де-
фиците пищи. На свету зооксантеллы мигрируют от
центральных капсул и друг от друга, а в темноте все
симбионты собираются вокруг центральных капсул
радиолярий, возможно, там они получают продукты
жизнедеятельности радиолярий (Swanberg, 1979; An-
derson, 1983).
Одним из важных вопросов в изучении симбион-
тосодержащих полицистин в верхних слоях пелагиали
является оценка вклада зооксантелл в общую первич-
ную продукцию. В литературе имеются данные о том,
что в Красном море и Аденском заливе продукция зо-
оксантелл радиолярий (полицистин и акантарий) в 2-3
раза превышает продукцию фитопланктона (Хмелева,
1967). Другие исследователи, оценивая вклад в первич-
ную продукцию, отводят радиоляриям более скромную
роль (Swanberg, 1979, 1983). По нашим данным, полу-
ченным в малопродуктивных районах Тихого океана,
величина продукции колоний Collozoum inerme, коле-
блется в пределах от 0,01 до 0,12 мкг С/кол./ч. В связи
с низкой численностью этих колоний (1-10 экз./м3) в
верхнем слое воды вклад их зооксантелл составляет
всего 0,1-1,2 % от общей первичной продукции, не
превышающей в этих водах 2 мг С/м3/день (Засько, Ру-
санов, 2005).
Предполагается, что водоросли могут выделять
вещества, ядовитые для многих планктонных организ-
мов, но не для самих радиолярий. Этим объясняется
узость круга паразитов и комменсалов колониальных
радиолярий. Частыми, а иногда и многочисленными
паразитами колоний оказались амфиподы — гипери-
иды. Пять известных видов рода Hyperietta связаны
с колониями радиолярий, и эта связь облигатна, по
крайней мере, для ювенильных стадий, неспособных
к плаванию. Взрослые гиперииды способны поедать
центральные капсулы хозяина-радиолярии. На поверх-
ности колонии были обнаружены турбеллярии, кото-
рые поедали радиолярий (Сванберг, 1984).
Ядро и жизненный цикл
У Collodaria ядро вегетативной особи часто бывает
гигантским — до 200-300 мкм в диаметре. Первичное
ядро сферической, неправильной или лопастной фор-
мы лежит в середине центральной капсулы. Внутри
ядра находятся многочисленные нитевидные, сильно
деспирализованные хромосомы и несколько ядрышек
разнообразной формы. У Thalassophysa ядрышки ло-
кализированы в отчетливо выраженных выпячиваниях
ядра. В результате нескольких последовательных эн-
домитозов ядро становится полиплоидным. Степень
полиплоидности определяется в 40-60 п, где п — это
гаплоидный набор хромосом (Hollande et al., 1969)
(рис. 125).
У Spumellaria и Nassellaria ядра значительно мель-
че, чем у Collodaria, диаметр около 50-70 мкм. Стро-
ение ядра теснейшим образом связано с устройством
аксоподиального аппарата (см. раздел Цитоплазмати-
ческие образования).
Бинарное деление вегетативных особей наблю-
дается очень редко. Оно описано только у Collodaria:
Thalassicolla (Brandt, 1902) и Thalassophysa (Hollande,
Enjumet, 1953).
Процесс спорогенеза хорошо известен для многих
видов полицистин. Он начинается с образования в цен-
тре крупного вегетативного ядра — так называемого
кинетического центра, хромосомы располагаются ра-
диально от него. Внезапно центральная фигура исчеза-
ет, а появляются многочисленные мелкие кинетические
центры на периферии ядерной сферы — деполиплои-
дизация. Число хромосом прогрессивно уменьшается
с каждым делением, пока не образуются споры, в кото-
рых имеется всего несколько хромосом.
Спорогенез у Collodaria бывает прямым и запаз-
дывающим. При прямом спорогенезе первичное ядро
распадается на сравнительно крупные фрагменты, ко-
торые продолжают делиться и образуют вторичные
ядра. Эти ядра в результате еще нескольких делений
дают ядра зооспор. В этот момент распадается и ци-
топлазма материнской особи. Стадия многочисленных
центриоли
Рис. 125. Стадии деления ядра Thalassophysa (Collodaria). (По: Hollande et al., 1969).
182
POLYCYSTINA
вторичных ядер, лежащих в общей цитоплазме, кратко-
временна (Thalassicolla, Thalassophysa, все Spumellaria
и Nassellaria).
При запаздывающем спорогенезе стадия вторич-
ных ядер длится долго. Центральная капсула фрагмен-
тируется на вторичные центральные капсулы, каждая
из которых может содержать несколько вторичных
ядер. Масса внекапсулярной цитоплазмы увеличива-
ется, и получаются временные многоядерные и много-
капсулярные колонии («полициттарная» стадия), до-
стигающие нескольких сантиметров.
Механизм деления ядра изучен у Thalassophysa
(Collodaria) (Hollande et al., 1969). Спорогенез здесь
носит запаздывающий характер, возникает «полицит-
тарная» стадия, которая существует довольно долго.
Центральные капсулы продолжают делиться и возни-
кают дочерние колонии. Через несколько недель на-
ступают конечные стадии спорогенеза. Ритм ядерных
делений при этом ускоряется, ядра становятся мельче и
относительно богаче хроматином. В интракапсулярной
цитоплазме появляются характерные кристаллы. Затем
обосабливаются двужгутиковые споры. Через разрыв
центральной капсулы они уплывают в морскую воду.
Детали кариокинеза французские авторы наблюда-
ли на «полициттарной» стадии. На одном из полюсов
ядра имеется ямочка, на дне которой находится черве-
образное образование, прилегающее к ядерной оболоч-
ке, — атрактофор. Под ним лежат палочковидные цен-
триоли. Выявлены тянущие нити, которые связывают
центриоли с центромерами хромосом.
Хромосомы в ядрах «полициттарной» стадии —
метацентрические, неодинаковой длины, несколько
спирализованные. Центромеры имеют форму малень-
ких цилиндров. Они составлены из двух электронно-
плотных дисков, разделенных светлой полосой, кото-
рая пронизана фибриллами. В прометафазе, рядом с
парой центриолей исходного атрактофора возникает
пара дочерних центриолей (рис. 125). Два атрактофора
начинают расходиться и устанавливаются на противо-
положных полюсах ядра. Движение их становится воз-
можным благодаря удлинению нитей веретена. Ядер-
ная оболочка все время сохраняется. В дальнейшем
происходит сокращение нитей веретена, хромосомы
ориентируются и расходятся к его полюсам.
Наблюдаемый кариокинез Андре Голланд и Жан и
Моника Кашон трактуют как плеуро- или парамитоз,
при котором сохраняется ядерная оболочка (Hollande et
al., 1969).
Хромосомный цикл радиолярий пока неясен. Неиз-
вестно, имеет ли место редукционное деление и, если
да, то в какой именно момент жизненного цикла. По-
скольку судьба изоспор строго не прослежена, то во-
прос о том, происходит ли половой процесс, остается
открытым. Не исключено, что многие поколения ради-
олярий могут размножаться бесполым путем (Петру-
шевская, 1986).
Место полицистин в системе
протистов и филогения
Полицистины относятся к группе Radiolaria (Ra-
diozoa по Cavalier-Smith, 1987; Moreira et. al., 2007) су-
пергруппы Rhizaria (Cavalier-Smith, 2002; Pawlowski,
Burki, 2009). Эта группа состоит из Polycystinea (Spu-
mellarida, Nassellarida, Collodaria), Acantharea и Taxopo-
dida. Филогенетические исследования Radiolaria осно-
ваны на сравнении последовательностей нуклеотидов
генов 18S рРНК (Amaral Zettler et al., 1997, 1999; Ama-
ral Zettler, Caron, 2000; Lopez-Garcia et al., 2002; Polet
et al., 2004; Takahashi et al., 2004; Kunitomo et al., 2006;
Yuasa et al., 2006) и последовательностей ДНК, коди-
рующих белки (актин, полиубиквитин) (Nikolaev et al.,
2004; Bass et al., 2005) (рис. 126).
Отношения между акантариями и полицистинами
остаются неопределенными. Полученные данные сви-
детельствуют в пользу того, что акантарий и полици-
стины филогенетически далеки друг от друга, и, если
последняя группа ответвилась от общего ствола проти-
стов на самой заре радиации одноклеточных организ-
мов, то акантарий сделали это позднее (Amaral Zettler
et al., 1997; Lopez-Garcia et al., 2002; Nikolaev et al.,
2004; Takahashi et al., 2004). Предполагается, что акан-
тарий и полицистины произошли от общего предка с
кремнистым скелетом (Kunitomo et al., 2006). В ранних
гипотезах о происхождении полицистин предками этой
группы считали сидячих бентосных саркодовых, соби-
рающих пищу при помощи расходящихся от тела фило-
OUTGROUP (9 spp.)
1/100
1/100
.40/47
... Polycystine-like clone HA2----
Sticholonche-like clone KW16 -----
Trochammina sp.--------------------ГТ7----1
— Rotaliid foram [composite] roraminireral
---------------Ammonia sp. [composite] —I
(1/6)-
Radiozoa Retaria
1/96
.96/84
1/86
-* 0.1
1/1001—
48/64
— Gromia oviformis —'
Bigelowiella natans
Dimorpha-like sp. ATCC 50522
Paracercomonas marina ATCC 50344
— Thaumatomastix sp. ANCC 50250
Cercomonas sp. strain C-59 -------
Cercozoa
Рис. 126. Филогенетическое дерево Rhizaria. (По: Moreira et al., 2007).
POLYCYSTINA
183
1.0/71
1.0/100
1.0/76
1.0/98|
1.0/1001 I
0.81
/52
1.0/1001----Acrosphaera sp. CR6A
1.0/1001 I—Collosphaera globularis-huxleyi
I-------Siphonosphaera cyathina
-AT8_54
Collozoum serpentinum
l°-6%—A2.E002
------Raphidozoum acuferum
-Collozoum pelagicum
•Collozoum inerme
------Sphaerozoum punctatum
1.0/100 r-Thalassicolla pellucida
*—Thalassicol!a nucleata
L— DH145-HA2
—Pterocorys zancleus I Polycysti nea
-Eucyrtidium hexagonatum | Nassellarida
—DH145-KW16
-CS_E043
•Sticholonche zanclea
------CS-E020
(Heliozoa
i .o/97|Chaunacanthid sp. 218
Chaunacanthid 217
COLLOSPHAERIDAE
Polycystinea
Spumellarida
SPHAEROZOIDA
THALASSICOLLIDA
PTEROCORYTHIDAE
THEOPERIDAE
1.0/100
1.0/89
C3-E010
Symphyacanthid 211
C3-E029
4 л СЗ E013
1.0 ~
n&Acanthometra sp.
^Haliommatidium sp.
JrOLI11016
VOOLI11015
vXrthracanthid 206
1—DH147-EKD17
1.0/1001-OLI11032
Dictyocoryne truncatum
Euchitonia elegans
Triastrum aunvillii
Dicranastrum furcatum
Dictyocoryne profunda
Spongaster tetras
C1.E045
AT4.94
1.0/95 Achlya bisexualis
—Ciliophrys infusionum
—Blepharisma americanum
Oxytricha nova
0.96/76]
1.0
/100
1.0/100
1.0/100
1.0/100
1.0/100
Acantharea
Polycystinea
Spumellarida
Outgroup
SPONGODISCIDAE
— 0.01 substitution / site
Рис. 127. Филогенетическое дерево полицистин, построенное на основе анализа нуклеотидов генов 18S рРНК (алгоритм построения
наибольшего правдоподобия (ML)). (По: Yuasa et. al., 2005).
Заглавными буквами даны названия семейств используемые в настоящей главе.
подий (Микрюков, 2000), например, бентосных рако-
винных амеб (Алешин и др., 2005). Веским аргументом
в пользу этих гипотез является гетерополярность ске-
лета палеозойских, да и многих современных полици-
стин, обладающих скелетом (Петрушевская, 1986).
Филогенетические деревья полицистин, построен-
ные разными исследователями, различаются располо-
жением основных групп (отрядов и семейств) относи-
тельно друг друга и других групп супергруппы Rhizaria
(Amaral Zettler et al., 1999; Lopez-Garcia et al., 2002;
Takahashi et al., 2004; Yuasa et al., 2005, 2006; Kunitomo
et al., 2006; Pawlowski, Burki, 2009). Но на всех деревьях
видно, что Sphaerozoida, Thalassicollida (Collodaria),
Collosphaeridae (Spumellaria) и Pterocorycidae (Nassel-
laria) образуют монофилетическую группу, в которую
не входят Spongodiscidae (Spumellaria) (рис. 127). Этот
вывод не согласуется с принятой таксономией полици-
стин и заставляет нас считать, что Sphaerozoida, Thalas-
sicollida (Collodaria), Collosphaeridae (Spumellaria) и
Pterocorycidae (Nassellaria), возможно, произошли от
предков с разветвленной трехосной спикулой (Yuasa et
al., 2005).
Экология и биогеография
Распределение полицистин в толще воды. По-
лицистины связаны с водоемами с нормальной океани-
ческой соленостью. Современные полицистины редко
встречаются при солености ниже 32%о (Kling, 1978;
Anderson, 1983; Caron, Swanberg, 1990; Anderson et al.,
2000). Известен только один новый вид насселлярий
(Lophophaena rioplatensis}, который был обнаружен в
эстуарии реки La Plata (атлантическое побережье Юж-
184
POLYCYSTINA
ной Америки) при солености 15,4%о (Boltovskoy et al.,
2003).
И численность, и разнообразие полицистин мак-
симальны в экваториальной зоне океанов (100-200
видов) и убывают к югу и северу (50-60 видов). Од-
нако численность полицистин связана с зонами про-
дуктивности и бывает высокой во всех продуктивных
районах океана — зонах апвеллингов и дивергенций
(Кругликова, 1995; Boltovskoy et al., 1996). Вблизи ап-
веллингов численность полицистин бывает близкой к
той, что отмечается в радиоляриевых илах на экваторе
(по данным из поверхностного слоя донных осадков), а
разнообразие существенно меньше (Кругликова, 1995).
В морях разнообразие полицистин невелико и близ-
ко к типичному для холодноводных пелагических рай-
онов океанов (70-95 видов). Число видов полицистин в
тропических морях не сильно превышает число видов
в холодноводных морях, но численность радиолярий в
тропических районах значительно выше (Кругликова,
1995).
Вертикальное распределение. Большая часть по-
пуляции полицистин в тропических и субтропических
водах встречается в верхнем 50-100-метровом слое
воды (Петрушевская, 1971; Renz, 1976; Dworetzky,
Morley, 1987; Kling, 1979; Kling, Boltovskoy, 1995). До-
вольно часто можно увидеть два пика численности:
один — на или около поверхности, второй — между
глубинами 50-100 м (Петрушевская, 1971; Kling,
Boltovskoy, 1995). В холодноводных районах макси-
мальная численность полицистин встречается в более
глубоких слоях. Например, как в Антарктике, так и в
Арктике пик численности полицистин расположен на
глубинах 200-400 м и связан с теплой глубинной водой
(Петрушевская, 1967; Tibbs, 1967; Boltovskoy, Alder,
1992).
Многие виды радиолярий занимают определенные
глубинные интервалы. По сведениям о вертикальном
распределении радиолярий в толще воды разными ав-
торами в различных районах Мирового океана были
сделаны схемы вертикального деления океанических
вод.
В своей монументальной монографии, которая со-
ставлена по материалам кругосветной экспедиции на
судне «Челленджер», Геккель выделил 3 основных фа-
уны в зависимости от глубин океана, на которых обита-
ют радиолярии: пелагическая (0-37-55 м), абиссальная
и промежуточная фауна (46-5484 м) (Haeckel, 1887).
Последняя делится на 3 подзоны: светлая (46-274 м),
темная (274-3656 м), кремнеземная (3656-5484 м). По
Геккелю, спумеллярий и акантарии предпочитают свет-
лую зону, насселлярии и феодарии здесь немногочис-
ленны. В абиссальной зоне живет большинство видов
феодарий и значительная часть насселлярий.
Клинг и Болтовской (Kling, Boltovskoy, 1995) по
сетным ловам планктона в восточной части субтропи-
ческой Пацифики выделили четыре водных слоя: 1) по-
верхностный (с максимумом полицистин на 0 м, 25 м,
0 и 50 м, 50 м или 0 и 100 м), 2) подповерхностный
(максимум на 100 м), 3) глубинный (максимум на 200
м, 200 м и 300 м или 300 м) и 4) слой с видами, пре-
обладающими глубже 300 м. Приблизительно схожие
слои были выделены и другими авторами (Renz, 1976;
Dworetzky, Morley, 1987; Kling, 1979).
Петрушевская (1986) установила три видовых
группировки для полицистин в центральной части
Тихого океана. Число особей полицистин поверхност-
но — тепловодной группы, в большинстве сфероидной
и дискоидной формы, обитающих до глубин 75—150 м,
достигает тысяч экземпляров в 1 м3. Умеренно холод-
новодная группа, в которой преобладают циртоидные
формы (десятки экземпляров в 1 м3), обитают глубже
термоклина: ниже 75-100 м при температуре 7-13 °C, а
также населяют и поверхностные воды арктических и
антарктических морей и северо-западную часть Тихого
океана. Единичные особи, составляющие своеобраз-
ную комбинацию из циртоидных и сфероидных форм,
встречены на значительных глубинах, вплоть до абис-
сали.
Болтовской (Boltovskoy, 1994) также выделял хо-
лодноводные виды, обитающие в верхних слоях воды
в высоких широтах, которые встречаются в более глу-
боких слоях в средних и низких широтах. Например,
Lithomitra arachnea в арктическом и субарктическом
районах Тихого океана встречается в поверхностных
слоях воды, в центральной части Тихого океана этот
вид преобладает на глубинах 100-300 м, а в субтропи-
ческой части Тихого океана — на глубинах 300-1000 м.
Поскольку распределение видов радиолярий свя-
зано с движением водных масс, то нет возможности
создать общую схему вертикального распределения
радиолярий, применимую ко всему Мировому океану.
Опубликованная Кэси (Casey, 1971) и воспроизведен-
ная Андерсон (Anderson, 1983) схема вертикального
распространения полицистин в Мировом океане про-
тиворечит данным других авторов.
Географическое распространение. На распро-
странении полицистин, как и всего микропланктона,
сказывается климатическая зональность океана. Среди
полицистин выделяются группы видов, связанные в
своем распространении с водами определенных биоге-
ографических областей, либо широко распространен-
ные в водах всего Мирового океана. Такая закономер-
ность характерна только для полицистин, населяющих
поверхностные слои океана. В распределении полици-
стин, обитающих на больших глубинах, грани между
зоогеографическими областями Мирового океана сти-
раются (Стрелков, 1959).
На основе анализа материалов различных авторов,
М.Г. Петрушевская (1986) выделила океанические и
неретические виды.
Для океанических видов были установлены следу-
ющие ареалы ныне живущих видов полицистин.
1. Циркумтропические виды. В этой группе раз-
личают собственно тропические виды (в Тихом океане
между 40° северной и южной широт), некоторые из них
обнаружены в Средиземном море; экваториальные и
тропическо-бореальные (нотальные). В тропиках пред-
ставлены все семейства и почти все роды полицистин.
2. Виды умеренных областей (биполярные, ноталь-
ные и бореальные) населяют северную Атлантику и
POLYCYSTINA
185
Норвежское море, нотальную часть Индийского океана
и заходят в Антарктику. В Тихом океане они найдены
не только на севере и на юге, но и в тропиках (правда,
субповерхностно).
3. Космополитные виды в Арктике и Антарктике
обитают на глубинах 200-800 м при температуре от -2°
до +5°С, а в тропиках встречаются на больших глуби-
нах.
Существование неритической и дальненеритиче-
ской фауны радиолярий подтверждается тем, что срав-
нительно немногочисленные виды полицистин, отсут-
ствующие в океанических сообществах, обнаружены
в норвежских фьордах, в прибрежных водах вблизи
острова Куба и о. Хайнань, в Охотском море (Bjorklund,
1974; Swanberg, Bjorklund, 1984; Стрелков, Решетняк,
1971; Кругликова, 1975). Среди полицистин явно пре-
обладают океанические виды.
Границами распространения определенных фаун
в толще вод являются фронтальные зоны (Hays, 1965;
Петрушевская, 1967; Goll, Bjorklund, 1971; Boltovskoy,
1979; Abelmann, Gowing, 1997). Наиболее хорошо изу-
чена зона Арктической конвергенции, которая является
границей для Антарктического комплекса полицистин.
Хейс (Hays, 1965) считает, что зона конвергенции явля-
ется и количественной, и качественной границей.
Распространение многих видов полицистин опреде-
ляется системой течений (Бернштейн, 1934; Ridel, 1967;
Стрелков, 1959; Kling, Boltovskoy, 1995). Берштейн, из-
учавшая планктон Карского моря, в том числе и радио-
лярий, считает, что часть видов радиолярий полицистин
истинно карскоморские, другая часть видов принесена
течениями из Баренцева моря и из Атлантики.
Значение Polycystina
для биогеосферы
Оценивая значение полицистин в передаче энергии
в планктонных биоценозах, нужно признать, что поли-
цистины, как и планктонные фораминиферы, служат
промежуточным звеном в пищевой цепи между бакте-
риопланктоном и более крупными организмами — ра-
кообразными, личинками рыб и прочим. Правда, сре-
ди полицистин основную роль играют колониальные
формы, биомасса которых, по-видимому, бывает очень
высокой. Одиночные полицистины большой роли в пи-
щевых цепях не играют. Все же значение их для биоге-
осферы огромно. Они улавливают имеющуюся в водах
океана кремниевую кислоту и строят за счет нее свои
скелеты. После их гибели кремниевая кислота оказы-
вается уже связанной в виде мельчайших взвешенных
в воде скелетных частиц. Значительная часть скелетов
полицистин попадает в донные осадки и составляет
важнейший компонент осадочных пород (Петрушев-
ская, 1981).
Осадкообразующее значение полицистин. Ске-
леты мертвых полицистин, оставшиеся без цитоплаз-
матических образований, не удерживаются во взве-
шенном состоянии и начинают опускаться. В единице
объема морской воды их всегда меньше, чем живых
особей. Часто полицистины бывают съедены более
крупными организмами. Скелеты не перевариваются,
а выбрасываются наружу, часто склеенные вместе с
другими непереваренными остатками. Такие комочки
(пеллеты) опускаются быстрее, чем отдельные скеле-
ты. По пути на дно через многокилометровую толщу
воды многие скелеты полицистин растворяются. Осо-
бенно быстро растворение идет в верхних слоях воды,
сильно недонасыщенных кремневой кислотой. Мно-
гие скелеты полицистин, наиболее прочные и сильно
окремненные, достигают дна. Этому способствует низ-
кая температура воды и низкая кислотность. Скелеты
могут растворяться и в осадке, особенно если они на-
капливаются медленно или частично перемешиваются
придонным течением. Сохранению скелетов в осадке
способствует и быстрое захоронение, насыщение осад-
ка кремнекислотой. Только целые раковинки полици-
стин (не считая фрагментов) составляют до 30% неко-
торых донных осадков. В одном грамме таких осадков
бывают заключены сотни тысяч скелетов полицистин
и примерно половину из них составляют насселлярий.
Изучение этих скелетов составляет предмет радиоля-
риевого анализа (Петрушевская, 1981, 1986).
В современном кремненакоплении радиолярии
стоят на втором месте после диатомовых водорослей.
Радиоляриевые осадки распространены в зоне карбо-
натных илов на глубинах больше критических (обычно
ниже 4600-4900 м). На меньших глубинах скорость по-
ступления карбонатного материала намного выше, чем
кремнистого, и полицистины образуют лишь незначи-
тельную примесь в карбонатных осадках. Ниже «крити-
ческой глубины» физико-химические условия в водной
толще таковы, что карбонатные раковинки форамини-
фер почти полностью растворяются, и на больших глу-
бинах накапливаются бескарбонатные глубоководные
океанические отложения — красные глубоководные
глины или радиоляриевые осадки. Таким образом, рас-
пространение радиоляриевых осадков находится как
под климатическим контролем, определяющим их при-
жизненное распределение, так и под батиметрическим,
который как бы ограждает радиоляриевый материал от
разбавления планктонными фораминиферами (Кругли-
кова, 1966, 1969, 1981; Лисицын, 1966).
Осадки, состоящие, по крайней мере, на 30% из
скелетных остатков радиолярий, называются радио-
ляриевыми илами (Кеннетт, 1987). Особенно распро-
странены радиоляриевые илы в Индийском океане и в
меньшей степени — в Тихом океане, в Атлантическом
океане они вообще не встречаются. Области распро-
странения радиоляриевых илов приурочены к зоне эк-
ваториальной дивергенции, а также к северной и юж-
ной дивергенциям. Отсутствие радиоляриевых илов в
Атлантическом океане объясняется низким содержани-
ем аморфного кремнезема в донных осадках.
Растворение раковинок полицистин. Известно,
что лишь небольшая часть (менее 4%) кремнезема, за-
ключенного в опаловых скелетных элементах в под-
поверхностых водах океанов, достигает морского дна;
основная часть возвращается в водную толщу в виде
растворенного H4SiO4. Растворение кремнезема про-
исходит, главным образом, в сильно недонасыщенном
186
POLYCYSTINA
им верхнем 1000 метровом слое воды. Раковинки по-
лицистин являются наиболее устойчивыми к растворе-
нию среди силикофлагеллат и диатомей.
Сохранность радиолярий сильно варьирует и мо-
жет быть связана с несколькими факторами, в том
числе с биопродуктивностью в поверхностных водах.
Увеличение продуктивности микрофоссилий с крем-
невым скелетом, по-видимому, приводит к улучшению
их сохранности в поверхностных осадках (Кругликова,
1966, 1969, 1981). Другими факторами, влияющими на
сохранность раковинок, являются температурный гра-
диент, концентрация растворенного кремния, а также
скорость их оседания (Кеннетт, 1987). Естественно,
в осадке концентрируются преимущественно толсто-
стенные формы, и они же более характерны для глубо-
ких слоев водной толщи. Большинство представителей
отряда Spumellaria довольно устойчивы к растворению,
а у представителей Nassellaria установлена различная
степень чувствительности к растворению (Johnson,
1974). Растворение раковинок полицистин создает
большие различия между наборами видов в планктоне
и поверхностных осадках того же района.
Значение полицистин
для биостратиграфии
Геологическое прошлое полицистин намного бо-
гаче их современного состояния. Это видно на при-
мере распространения полицистин каменноугольной и
раннепермской эпох в акваториях рифов и рифообра-
зования, или на примере разных условий образования
радиоляриевых илов в палеозое, в кайнозое и в совре-
менных океанах.
Исследования последних десятилетий показали,
что ископаемые полицистины все шире и чаще вовле-
каются в практику биостратиграфических, геологиче-
ских, палеонтологических и палеоэкологических ис-
следований. Сложилось новое научное направление,
новая дисциплина в палеонтологии и биостратигра-
фии — радиоляриевый анализ (Петрушевская, 1986)
или радиоляриология (Amon, 1998). Новые методики и
подходы, новые концепции и теории, новая классифи-
кация открыли новые горизонты и возможности радио-
ляриевого анализа.
Значение радиоляриевого анализа трудно переоце-
нить особенно в районах, подверженных интенсивной
тектонике и метаморфизму, породы которых содержат
ограниченный набор фоссилий, способных дать да-
тировки геологического возраста (Афанасьева, Амон,
2006).
Во-первых, скелеты полицистин были обнаружены
во всех разновидностях пород: разнообразных осадоч-
ных или вулканогенно-осадочных толщ, свит и серий
на всех континентах и в донных осадках всех океанов.
Это делает их практически незаменимыми при работе с
«немыми», преимущественно кремнистыми породами,
нередко не содержащими никакой ископаемой фауны
или флоры, кроме радиолярий.
Во-вторых, полицистины являются эффективным
инструментом для биостратиграфии всего фанерозоя,
без пропусков и перерывов; они были встречены в по-
родах самого разнообразного геологического возраста:
от раннего — среднего кембрия и вплоть до современ-
ных осадков.
Полицистины имеют большое значение для расчле-
нения и корреляции осадочных, вулканогенно-осадоч-
ных и слабо метаморфизированных толщ; создания и
разработки местных, региональных и межрегиональ-
ных стратиграфических шкал; реконструкции палеоге-
ографических обстановок отдаленного геологического
прошлого.
Сбор материала
и методика изучения
Большинство данных, опубликованных о полици-
стинах, получены на основе изучения их из донного
осадка. Это связано с тем, что полицистины (кроме
колониальных) часто выпадают из поля зрения обыч-
ных планктонологических исследований, поскольку
это мелкие одиночные простейшие, которые не дают
значительных скоплений. Но если при сборе планкто-
на обращать специальное внимание на полицистин, то
можно собрать обильный материал по этой группе про-
стейших.
Для сбора полицистин используют конические
планктонные сети с фильтрующим конусом из капро-
нового сита с ячеями 100-300 мкм, заканчивающимся
стаканом, затянутым газом 50-150 мкм. Для вертикаль-
ных ловов с определенных глубин используют сеть
замыкающуюся. Горизонтальные ловы с поверхности
делают с лодки, волоча за лодкой коническую сеть в
течение 20 минут или плейстонной сеткой, собирая,
главным образом, колонии с глубины 0,2-0,7 м.
Для количественного учета полицистин использу-
ют батометрические пробы. Для получения репрезен-
тативных данных объем обследованной воды должен
быть довольно большим, более 25 л. Из батометров
планктон извлекают путем отстаивания, центрифуги-
рования или фильтрации в особой установке через спе-
циальные мембранные фильтры или через сито с ячеей
около 70 мкм.
Богатый и разнообразный материал по полицисти-
нам получают из сборов седиментационных ловушек,
которые состоят из одного или нескольких фильтру-
ющих конусов или труб, постепенно сужающихся к
накопительным стаканам. Ловушка может быть заяко-
рена ко дну или дрейфовать с течением, подвешенная
к бую на поверхности. Время, на которое устанав-
ливают ловушки, различное — от нескольких месяцев
до года и более (Honjo, Doherty, 1988; Lange, Boltovs-
koy, 1995). Полученные таким способом данные по-
зволяют не только определить видовой состав и чис-
ленность полицистин в исследованном районе, но и
проследить сезонную изменчивость и связь с водными
массами.
Собранные планктонные пробы, окрашивают кра-
сителем «нейтральный красный» (для разделения жи-
вых и мертвых организмов) и фиксируют 4% нейтраль-
POLYCYSTINA
187
ным формалином. Часто для сохранения колоний для
фиксации используют формалин с добавлением пикри-
новой кислоты.
Все пробы тотально просматриваются при увели-
чении х40-100. Встреченные радиолярии выбираются,
и из них делают постоянные препараты. Постоянные
препараты готовят так же, как и для других мелких
объектов. Для световой микроскопии полицистины в
течение двух часов промываются в дистиллированной
воде. Затем 3^4 минуты их красят борным кармином
и обезвоживают в спиртах восходящей крепости: 70°,
96° и 100 ° по две минуты. Перед заключением в баль-
зам полицистины на 1-2 минуты помещают в ксилол
(Роскин, Левинсон, 1957; Валовая, Кавтарадзе, 1993).
Для электронной микроскопии полицистин рекомен-
дуется следующая методика (Cachon, Cachon, 1978).
Полицистины фиксируются в течение нескольких ча-
сов в 1,25% растворе глутаральдегида с 2% раствором
параформальдегида в фосфатном буфере 0,4 М, к этому
фиксатору добавляют одну часть 8% раствора таннино-
вой кислоты и 1 часть очистителя — 1% раствора ди-
гитонина. После короткой промывки в буфере — пост-
фиксация в 1% растворе осмиевой кислоте в течение 1
часа, проводится быстрая дегидратация и заключение в
эпон. Препараты рассматривают при увеличении хЗООО
и более.
Для культивирования живых полицистин ловят под
водой в стеклянные банки объемом 0,25-0,5 л. В ла-
боратории полицистин держат в аквариумах с разной
температурой (+13...-25°) и освещенностью. В куль-
туру добавляют зеленую одноклеточную водоросль
Dunalialla salina или бесцветных жгутиконосцев. В ла-
бораторных условиях радиолярии живут по нескольку
недель. Это дает возможность наблюдать рост и деле-
ние клеток, ставить эксперименты по питанию и дыха-
нию полицистин.
Систематический обзор
Тип POLYCYSTINA Ehrenberg 1838
Класс POLYCYSTINEA Ehrenberg 1838
Отряд Collodaria Haeckel 1881
Крупные (400-800 мкм и более) одиночные и ко-
лониальные полицистины. Клетка коллодарий многоя-
дерная. Кроме ядер в эндоплазме находится капля жира
и несколько кристаллов целестина (SrSO4). У одиноч-
ных коллодарий хорошо развиты альвеолы (пузырьки
воздуха), расположенные как в эндоплазме, так и в
эктоплазме. Коллодарий характеризуются развити-
ем экзоаксопластического типа нуклеаксоподиально-
го комплекса. В эктоплазме формируется кремневый,
опаловый (SiO2-nH2O) скелет, который представлен
простой или многолучевой спикулой, иногда спикул
много. Встречаются виды, у которых скелет полностью
редуцирован. Коллодарий обитают в поверхностных
слоях открытого океана с нормальной соленостью, из-
редка встречаясь на глубинах до 30-50 м. При неблаго-
приятных условиях коллодарий погружаются в более
стабильную водную толщу. Представители этой груп-
пы плохо сохраняются в планктонных пробах, в осад-
ках они не сохраняются вообще или только их спикулы,
из-за этого плохо разработана систематика и распреде-
ление представителей отряда Collodaria. Детальные об-
зоры колониальных радиолярий, включая нескольких
Collodaria, были сделаны Hollande and Enjumet (1953),
Стрелковым и Решетняк (1971) и Swanberg (1979). Со-
гласно Haeckel (1887), эта группа включает четыре се-
мейства.
Сем. Thalassicollida Haeckel 1862
(рис. 128,Д)
Одиночные Collodaria, скелетные элементы отсут-
ствуют.
Роды: Actissa, Thalassocampe, Thalassopila, Thalas-
sicolla и Thalassophysa.
Род Thalassicolla Huxley 1851
(рис. 128, A)
Ядро сферическое. Многочисленные альвеолы рас-
положены в эктоплазме. Стенка центральной капсулы
толстая, студенистая.
Сем. Collozoida Haeckel 1862
(рис. 128, Б-В)
Колониальные Collodaria, скелетные элементы от-
сутствуют.
Род Collozoum.
Род Collozoum Haeckel 1862
(рис. 128, Б-В)
Каждая особь колонии представлена центральной
капсулой, лишенной игольчатых скелетных элементов.
Форма центральной капсулы различна: сферическая,
цилиндрическая, эллипсоидная, овальная, дисковид-
ная, полигональная с пальцевидными отростками.
Сем. Thalassosphaerida Haeckel 1862
(рис. 128, Г-Е)
Одиночные Collodaria с кремневыми спикулами.
Роды: Thalassosphaera, Thalassoxanthium, Physema-
tium, Thalassoplancta, Lampoxanthium.
Род Thafassoxanthium Haeckel 1887
(рис. 128, Г)
Альвеолы отсутствуют. Ветвящиеся спикулы рас-
положены в эктоплазме.
188
POLYCYSTINA
Рис. 128. Представители отряда Collodaria.
А — семейство Thalassicollida: Thalassicolla zanclea; Б-В — семейство Collozoida: Collozoum inerme\ Б — общий вид колонии, В — центральная кап-
сула с зооксантеллами; Г-Е — семейство Thalassosphaerida: Г— Thalassoxanthium medusium, Д— Physematium mulleri, Е — Lampoxanthium pandora,
Ж-И — семейство Sphaerozoida: Ж— Sphaeorozoum geminatum, 3 —Raphidozoum sp. (общий вид колонии), И—Raphidozoum neapolitanum (централь-
ная капсула) (По: Haeckel, 1887 —А, Г-Ж, Стрелков, Решетняк, 1971 — Б-В, Я; Swanberg, 1979 — 3).
Род Physematium Меуеп 1834 (рис. 128, Д)
Ядро сферическое. Многочисленные альвеолы рас-
положены в эндоплазме. Стенка центральной капсулы
очень тонкая. Спикулы гладкие и веретенообразные.
Род Lampoxanthium Haeckel 1887
(рис. 128, Е)
Многочисленные крупные альвеолы расположены
в эктоплазме. Спикулы ветвятся.
Сем. Sphaerozoida Haeckel 1862
(рис. 128, Ж-И)
Колониальные Collodaria, с кремневыми спику-
лами.
Роды: Belonozoum, Sphaeorozoum, Raphidozoum.
Род Sphaeorozoum Меуеп 1834 (рис. 128, Ж)
Скелетные элементы имеют двойные иглы — ди-
плотриэны, состоящие из главной оси, на концах кото-
рой расположены 2, 3, 4 и более боковых ветвей. Ветви
могут быть простыми и, чаще всего, гладкими или раз-
ветвленными и покрытые шипиками.
Род Raphidozoum Haeckel 1862 (128, 3-И)
Скелетные элементы представлены простыми и лу-
чистыми иглами (чаще всего с четырьмя, реже тремя,
пятью или шестью лучами).
Отряд Spumellaria Ehrenberg 1875
Одиночные (180-350 мкм) или колониальные поли-
цистины, характеризующиеся шаровидной формой ре-
POLYCYSTINA
189
Рис. 129. Представители семейства Collosphaeridae (отряд Spumellaria).
А —Acrosphaera cyrtodon, Б — Acrosphaera spinosa, В — Buccinosphaera invaginata, Г— Collosphaera tuberosa, общий вид колонии, Д— Collosphaera
huxleyi, E — Collosphaera polygona, Ж — Siphonosphaera socialis, 3 — Siphonosphaera tubulosa, И — Solenosphaera collina, К — Solenosphaera inflata,
Л — Solenosphaera zanguebaric. (По: Andrson, 1983 —А, Б, Д-3\ Стрелков, Решетняк, 1971 —В, Г, И-Л).
190
POLYCYSTINA
шетчатого, сетчатого или губчатого скелета и внутрен-
ним каркасом в виде спикулы или микросферы. Для
спумеллярий описан только эндоаксопластический тип
нуклеаксоподиального комплекса, при котором аксоне-
мы имеют аксопласт, расположенный внутри централь-
ной капсулы.
Сем. Collosphaeridae МйНег 1858, emend.
Strelkov et Reshetnjak 1971 (рис. 129)
Колониальные полицистины. Каждая особь, име-
ющая центральную капсулу, окружена пористой ра-
ковиной. Концентрические оболочки неизвестны. На-
стоящих радиальных игл нет, но обычны выпячивания
стенки — трубочки, направленные как наружу, так и
вовнутрь. Диаметр скелета одной особи обычно не бо-
лее 100-150 мкм. Отдельные особи (сотни-тысячи) по-
гружены в студенистую массу, образуя колонии. Форма
колонии не является видовым признаком и может быть
очень разнообразна: сферическая, эллипсоидальная,
цилиндрическая, имеющая форму ленты и т.д. Размеры
колоний до 3-5 см.
Роды: Acrosphaera, Buccinosphaera, Collosphaera,
Siphonosphaera, Solenosphaera, Tribonosphaera.
Род Acrosphaera Haeckel 1881 (рис. 129, А, Б)
Отдельные особи колонии отстоят далеко друг от
друга, каждая окружена решетчатой раковиной, наруж-
ная поверхность которой снабжена иглами. Последние
представлены либо короткими сплошными шипами,
либо коническими иглами, расположенными между по-
рами. Поры могут быть простыми, с гладкими краями
без какого-либо обрамления, либо края всех или толь-
ко крупных пор снабжены одной иглой или окружены
венчиком игл.
Род Buccinosphaera Haeckel 1887 (рис. 129, В)
Пористые раковины имеют вид помятых сфер с не-
глубокими вдавлениями и снабжены на внутренней
стороне радиальными, прободенными порами трубоч-
ками, направленными вовнутрь раковинки. Поры ра-
ковины и трубочек мелкие, округлые, неодинакового
размера.
Род Collosphaera Muller 1855 (рис. 129, Г-Е)
Крупные, отдаленные друг от друга на значитель-
ное расстояние особи с гладкой решетчатой раковиной.
Взрослые экземпляры с очень большими кристаллами
и голубым пигментом. Форма и величина решетчатых
раковин колоний очень разнообразна — от шаровидной
(С. huxleyi) j\q сильно помятых сфер с ясно выраженны-
ми вмятинами (С. tuberosa). Поры раковин часто окру-
глые (С. huxleyi), многоугольные (С. тасгорога), либо
они в виде тонкой сети из крупных и мелких много-
угольных ячей (С. polygond).
Род Siphonosphaera Muller 1858
(рис. 129, Ж, 3)
Решетчатые раковины колоний чаще всего шаро-
видной формы. Все или только часть округлых, неоди-
наковой величины пор вытянуты в наружные трубочки
со сплошными, не прободенными порами стенками.
Род Solenosphaera Haeckel 1887
(рис. 129, И-Л)
Особи колоний лежат плотно друг к другу. Поверх-
ность раковинок покрыта пронизанными порами тру-
бочками или заострениями, свободные концы которых
заканчиваются крупным отверстием. Край отверстия
может быть гладким, либо снабжен одной, реже не-
сколькими, иглами (зубцами).
Род Tribonosphaera Haeckel 1887
Простые решетчатые раковины, снабженные на
внутренней стороне радиальными, центрипетально
направленными игольчатыми отростками, свободно
оканчивающимися недалеко от центра раковины. Поры
крупные неодинаковых размеров. Монотипный род.
Семейство Actinommidae Haeckel 1862,
emend. Sanfilippo et Riedel 1980 (рис. 130)
Одиночные особи с решетчатым или губчатым
сферическим или эллипсоидальным скелетом. У гро-
мадного большинства форм скелет состоит из несколь-
ких концентрических раковин (сфер). Радиальных игл
6 и более. Иногда 2 или 4 иглы развиты лучше прочих.
Огромное разнообразие форм в этом семействе было
описано Геккелем (Haeckel 1887).
Роды: Acanthosphaera, Actinomma, Arachnosphaera,
Astrosphaera, Carposphaera, Cenosphaera, Centrocubus,
Cladococcus, Cromyechinus, Cromyomma, Druppatractus,
Heliaster, Heliosoma, Hexacontium, Octodendron, Pleg-
mosphaera, Saturnalis, Spongodictyon, Spongoplegma,
Spongosphaera, Stylatractus, Stylosphaera, Styptosphaera,
Thecosphaera.
Род Acanthosphaera Haeckel 1862 (рис. 130, A)
Сферическая решетчатая раковина с одинаковы-
ми полигональными ячейками из тонких перекладин.
Крупные радиальные иглы отсутствуют. В узлах ре-
шетки короткие, тонкие иглы.
Род Actinomma Haeckel 1860 (рис. 130, Б)
Скелет состоит из трех концентрических сфер. Кор-
тикальная раковина сетчатая с неправильными ячейка-
ми. Вторая раковина крупная, неправильной формы,
губчатая. Медуллярная раковина маленькая, круглая.
Радиальные иглы есть.
POLYCYSTINA
191
Рис. 130. Представители семейства Actinommidae (отряд Spumellaria).
А —Acanthosphaera actinota, Б — Actinomma leptodermum, В — Centrocubus cladostylus, Г— Cladococcus cervicornis, Д — Heliosoma echinaster, E —
Hexacontium armatum, Ж—Plegmosphaera entodictyon, 3 — Spongosphaera streptacantha, И— Satumalis circularis, К — Stylatractus spp. grup, Л—Stylo-
sphaera melpomene, M— Thecosphaera inermis. (По: Boltovskoy, 1999 —А, Б, Д, E, 3-M\ Boltovskoy, Riedel, 1987 — Hollande, Enjumet, 1960 — Г, Ж).
192
POLYCYSTINA
Род Centrocubus Haeckel 1862 (рис. 130, В)
Медуллярная раковина состоит из перекладин, со-
ставляющих маленький куб. Кортикальная раковина
губчатая и образуется непосредственно из медулляр-
ной. Крупные трехгранные иглы проходят через губча-
тое образование кортикальной раковины.
Род Cladococcus Haeckel 1862 (рис. 130, Г)
Сферическая раковина с хаотично расположенны-
ми порами. Много длинных цилиндрических игл, вет-
вящихся на концах.
Род Heliosoma Haeckel 1862 (рис. 130, Д)
Скелет состоит из двух концентрических сфер.
Медуллярная раковина сетчатая с тонкими перекла-
динами. Кортикальная раковина с правильно располо-
женными полигональными порами. Иглы длинные, их
более 6.
Род. Hexacontium Haeckel 1881 (рис. 130, Е)
Скелет состоит из трех концентрических сфер.
Кортикальная раковина с порами средних размеров,
округлой формы и расположенных упорядоченно или
хаотично. Поверхность этой раковины покрыта ши-
пами. Обычно 6 игл, расположенных парами по трем,
перпендикулярным друг другу, диаметрам.
Род Plegmosphaera Haeckel 1887 (рис. 130, Ж)
Скелет состоит из губчатой массы, в центре кото-
рой находится полость, окруженная более плотной губ-
чатой тканью.
Род Saturnalis Haeckel 1881 (рис. 130, И)
Скелет состоит из двух решетчатых сфер. Корти-
кальная раковина с округлыми порами и неровной по-
верхностью. Две радиальные иглы образуют отдален-
ное от раковины кольцо.
Род Spongosphaera Haeckel 1861 (рис. 130, 3)
Скелет состоит из трех частей: внутри две кон-
центрические, сферические, решетчатые раковины и
снаружи — одна губчатая раковина. Иглы, крупные,
трехгранные, с зазубренными краями, берут начало от
второй решетчатой раковины, проходят через губчатую
раковину и выходят наружу.
Род Stylatractus Haeckel 1887 (рис. 130, К)
Скелет обычно состоит из двух решетчатых рако-
вин. Кортикальная раковина овальная, часто толсто-
стенная, с неправильными порами. Медуллярная ра-
ковина сферическая. Две полярные иглы, одинакового
или разного размера.
Род Stylosphaera Ehrenberg 1854
(рис. 130, Л)
Скелет обычно состоит из двух решетчатых рако-
вин. Кортикальная раковина имеет почти квадратную
форму, толстостенная с зазубринами и порами, не име-
ющими определенной формы. Медуллярная раковина
сферическая. Шесть крепких лучей соединяют две
раковины. Обычно два из них выходят наружу, как ко-
роткие, трехгранные, полярные иглы. Две другие пары
лучей тоже могут выходить за кортикальную раковину,
но незначительно.
Род Thecosphaera Haeckel 1862 (рис. 130, М)
Раковина состоит из трех решетчатых сфер. Поры
на кортикальной раковине относительно мелкие, окру-
глые, правильно расположенные. Кортикальная рако-
вина обычно гладкая, без игл.
Сем. Coccodiscidae (Haeckel) Sanfilippo
et Riedel 1980 (рис. 131, А-Б)
Скелет состоит из двух или трех раковин. Решетча-
тая дискоидальная, линзовидная или эллипсоидальная
раковина окружает одну или две центральные сфериче-
ские раковины.
Роды: Didymocyrtis (= Ommatartus, Panartus), Spon-
goliva.
Род Didymocyrtis Haeckel 1881 (= Ommatartus,
Panartus) (рис. 131, A)
Скелет состоит из трех раковин. Кортикальная
раковина цилиндрическая или эллипсоидальная с за-
метной экваториальной перетяжкой. Две медуллярных
раковины (наружная — незначительно сжатая, вну-
тренняя — сферическая) соединяются с кортикальной
несколькими радиальными перекладинами. Могут
быть полярные чашки или иглы, возможен перифери-
ческий рост.
Род Spongoliva Popofsky 1912 (рис. 131,6)
В целом схож с родом Didymocyrtis, за исключением
кортикальной раковины, которая сильно редуцирована
и имеет неправильную ячеистую структуру. Взрослый
экземпляр обычно имеет хорошо развитую мантию.
Сем. Phacodiscidae Haeckel 1881
(рис. 131, В-Г)
Скелет состоит из двух или трех раковин. Двояко-
выпуклая, решетчатая наружная раковина не окруже-
на губчатыми структурами, может иметь радиальные
POLYCYSTINA
193
Рис. 131. Представители отряда Spumellaria.
А-Б— семейство Coccodiscidae: А — Ommatartus tetrathalamus, Б— Spongoliva ellipsoides', В-Г— семейство Phacodiscidae: В — Heliodiscus asteriscus,
Г— Sethodiscus macrococcus; Д-М— семейство Spongodiscidae: Д — Dictyocoryne truncatum, E — Euchitonia elegans, Ж — Spongaster tetras tetras,
3 — Stylodictya aculeata, И — Spongurus pylomaticus, К — Spongodiscus resurgens, Л — Spongocore cylindrica, M — Stylochlamydium venustum. (По:
Popofsky, 1913 —J; Boltovskoy, 1999 — Б-М}.
194
POLYCYSTINA
иглы. Внутри расположены одна или две центральные
сферические раковины.
Роды: Heliodiscus, Sethodiscus.
Род Heliodiscus Haeckel 1862 (рис. 131, В)
Кортикальная раковина двояковыпуклая, с пра-
вильно расположенными округлыми порами и 8-15
радиальными иглами в экваториальной плоскости. Ме-
дуллярная раковина сферическая.
Род Sethodiscus Haeckel 1887 (рис. 131,/”)
Очень схож с родом Heliodiscus, но без радиальных
игл.
Сем. Spongodiscidae (Haeckel) Riedel 1967
(рис. 131,Д-М)
Дискоидальный губчатый скелет, центральная
часть диска бывает более плотная, периферическая —
более рыхлая. Скелет обычно разделен на 3-4, редко
большее число «рук» из более упорядоченной плотной
скелетной ткани, между которой находится патагиум из
более рыхлой ткани. В стенке раковины часто имеется
пилом. Скелетные элементы пронизывают и централь-
ную капсулу и, возможно, ядро.
Роды: Amphirhopalum, Dictyocoryne, Euchitonia,
Spongaster, Spongocore, Spongodiscus, Spongopyle, Spon-
gotrochus, Spongurus, Stylochlamydium, Stylodictya.
Род Dictyocoryne Ehrenberg 1861
(рис. 131,4)
Скелет разделен на три «руки», которые расходят-
ся почти под равными углами от центрального диска.
Между руками может находиться патагиум.
Род, Euchitonia Ehrenberg 1860
(рис. 131,5)
Скелет разделен на три длинных и узких «руки»,
которые расходятся под разными углами (два тупых и
один острый) от центрального диска. Патагиум есть.
Род Spongaster Ehrenberg 1860
(рис. 131, Ж)
Раковина прямоугольная с закругленными углами.
От центрального диска к углам отходят 4 грушевидные
«руки».
Род Spongodiscus Ehrenberg 1854 (рис. 131, К)
Двояковыпуклый диск без видимых различий в
структуре, без игл по краям и на поверхности.
Род Spongurus Ehrenberg 1873 (рис. 131, И)
Раковина цилиндрическая или продолговато-эл-
липсоидальная. Внутренняя часть раковины состоит из
более плотной скелетной ткани, поверхность покрыта
щетинообразными иглами, на одном из полюсов есть
пилом.
Род Stylochlamydium Haeckel 1887
(рис. 131, М)
Двояковыпуклый диск, четко разделенный на каме-
ры, расположенные по спирали или по кругу. Диск окру-
жен патагиумом. Имеются иглы. Иногда есть пилом.
Род Stylodictya Ehrenberg 1873 (рис. 131,3)
Плоский диск с ясно выраженными концентриче-
скими кольцами, с краевыми иглами или без них.
Сем. Litheliidae Haeckel 1862
(рис. 132, А-Д)
Сферические или эллипсоидальные раковины без
полярных игл. Губчатая ткань расположена концентри-
ческими слоями или спирально.
Роды: Larcopyle, Larcospira, Lithelius, Pylospira,
Tholospira.
Род Larcopyle Dreyer 1889 (рис. 132, A)
Наружная раковина эллипсоидальная с неправиль-
ными порами, поверхность часто колючая или покрыта
шипами. Внутренняя раковина спиральная. На одном
из полюсов расположен пилом, окруженный крупными
иглами.
Род Larcospira Haeckel 1887 (рис. 132, Б)
Раковина состоит из двух спиралей, берущих на-
чало в общей точке.
Род Lithelius Haeckel 1880 (рис. 132, В)
Общая форма раковины круглая или овальная. Ме-
дуллярная раковина окружена сложной спиралью из
3-5 слоев, поверхность спирали покрыта иглами.
Род Spongocore Haeckel 1887
(рис. 131,77)
Раковина цилиндрическая, с иглами или без них,
с мантией и двумя небольшими сжатиями.
Род Pylospira Haeckel 1887 (рис. 132, Г)
Общая форма раковины овальная. Раковина состо-
ит из серий спирально расположенных камер. Поверх-
ность раковины покрыта иглами.
POLYCYSTINA
195
Род Tholospira Haeckel 1887 (рис. 132, Д)
Наружная раковина имеет сетчатую структуру с по-
рами разных размеров. Поверхность раковины покры-
та шипами.
кольцо опоясывает с боков по самому длинному диме-
тру — главной оси (латерально); второе — по попереч-
ной оси меньшей длины (экваториально); третье — по
передне-задней самой короткой оси (сагиттально).
Роды: Dipylissa, Octopyle, Phorticium, Pylolena.
Сем. Pyloniidae Haeckel 1881
(рис. 132, E-3)
Скелет состоит из двух или трех лентовидных вза-
имно перпендикулярных, сплющенных колец. Первое
Род Octopyle Haeckel 1881 (= Tetrapyle)
(рис. 132, Е)
Раковина состоит из двух сетчатых колец. Наруж-
ное кольцо имеет большие отверстия.
Рис. 132. Представители отряда Spumellaria.
А-Д — семейство Litheliidae: А — Larcopyle butschlii, Б — Larcospira quadrangula, В — Lithelius nautiloides, Г — Pylospira octopyle, Д - Tholospira
cervicornis; E-3 — семейство Pyloniidae: E— Octopyle stenozona, Ж—Phorticium clevei, 3 — Pylolena armata; И— семейство Tholoniidae: И— Cubot-
holus spp. (По: Boltovskoy, 1999 — A-В, Д E, 3, И; Paverd, 1995 —Г; Boltovskoy, Riedel, 1987 — Ж).
196
POLYCYSTINA
Род Phorticium Jorgensen 1887
(рис. 132, Ж)
В целом схож с родом Octopyle, за исключением
того, что центральная часть — крупная структура, об-
разованная сериями спирально расположенных камер.
Род Pylolena Haeckel 1887
(рис. 132,3)
Центральная раковина окружена тремя центробеж-
но расходящимися лентами, концы которых образуют
треугольную фигуру. Вокруг этой структуры может
формироваться решетчатая сфера.
Сем. Tholoniidae Haeckel 1862
(рис. 132, И)
Полностью решетчатая раковина, целиком закры-
тая и имеет сжатия, которые определяют выпуклости.
Род: Cubotholus.
Род Cubotholus Haeckel 1862 (= Tholonium)
(рис. 132, И)
Кортикальная раковина состоит из 6 полусфериче-
ских сводов, расположенных попарно по трем взаимно
перпендикулярным осям. Маленькая медуллярная ра-
ковина внутри центральной камеры представлена не
всегда.
Отряд Nassellaria Ehrenberg 1875
Сравнительно мелкие (диаметр скелета 100-200
мкм, редко более) одиночные полицистины. Скелет со-
стоит из центральной спикулы и сегментов развитых в
разной степени у разных групп. Спикула и ее элемен-
ты могут глубоко врезаться в центральную капсулу и
ядро, влияя на их форму, но скелет, по-видимому, оста-
ется внекапсулярным. Эндоаксопластия: аксопласт на-
ходится внутри центральной капсулы, с той стороны
ядра, которая ближе к срединной балке скелета.
Сем. Spyridae (= Trissocyclidae,
Acanthodesmiidae) (Ehrenberg)
Petrushevskaya 1971
(рис. 133, А-Д)
Скелет, в котором дифференцировка в направле-
нии основной гетерополярной оси выражена не всегда.
Среди игл хорошо развиты А и Vert, соединенные дугой
в Avert — четко выраженное D-образное сагиттальное
кольцо. Примерно одинаково развиты иглы D, 2L, 21,
практически не развита Ах. Скелет иногда редуциро-
ван до сагиттального кольца.
Роды: Acanthodesmia, Amphispyris, Cephalospyris,
Lophospyris, Nephrospyris, Phormospyris, Tholospyris,
Triceraspyris, Zygocircus.
Род Acanthodesmia МйПег 1856 (рис. 133, A)
Скелет состоит из сагиттального, фронтального и
базального колец.
Род Amphispyris Haeckel 1881 (рис. 133, Б)
Скелет представлен увеличенным в передне-заднем
направлении цефалисом. Имеется шесть пар перекла-
дин, отходящих от сагиттального кольца, которые вет-
вятся и соединяются, образуя решетчатые латеральные
стенки раковины.
Род Phormospyris Haeckel 1887 (рис. 133, В)
Двулопастная, сжатая в сагиттальной плоскости
тонкостенная раковина с тремя терминальными «но-
гами».
Род Tholospyris Haeckel 1881 (рис. 133, Г)
Грушевидная или овальная, сжатая в сагиттальной
плоскости раковина с тремя терминальными «ногами».
Род Zygocircus BUtschli 1882 (рис. 133, Д)
Скелет представлен одним сагиттальным кольцом,
состоящим из трехгранных перекладин. От граней от-
ходят зубчатые выросты в виде шипов.
Сем. Plagoniidae (Haeckel) Riedel 1967
(рис. 133, Е-И)
Форма скелета пирамидальная, в виде короткого
конуса, приближающегося к зонтику, иногда сходная
с матрешкой. Стенка раковинки или целостная, прони-
занная отдельными, далеко отстоящими друг от друга
порами, или сетчатая, с тесно расположенными поли-
гональными порами, или даже состоящая из отдельных
редких перекладин. Цефалис составляет значительную
часть раковины и обычно служит основным вместили-
щем центральной капсулы. Иногда весь скелет сводит-
ся к цефалису или даже — к одной цефалической каме-
ре, а остальные части скелета развиты слабо. Иглы А,
D, 2L, Vert, Ах и перекладины спикулы крупные. Игла
А дает апикальный рог. Иглы D и 2L часто образуют
«ноги», направленные вниз в стороны.
Роды: Antarctissa, Arachnocorys, Callimitra, Clathro-
canium, Clathrocorys, Helotholus, Lampromitra, Lopho-
phaena, Neosemantis, Peromelissa (= Lithomelissd),
Phormacantha, Pseudocubus, Sethophormis, Tetraplecta,
Trisulcus.
РодСаШтИга Haeckel 1881 (рис. 133, E)
Скелет гомологичен двум сегментам и состоит из
цефалиса и 6 пластин. Цефалис с крупным трехгран-
ным апикальным рогом, который может ветвиться.
POLYCYSTINA
197
Рис. 133. Представители отряда Nassellaria.
А-Д— семейство Spyridae: А —Acanthodesmia viniculata, Б — Amphispyris reticulata, В — Phormospyris stabilis scaphipes, Г— Tholospyris spp. group,
Д — Zygocircus productus; Е-И — семейство Plagoniidae: E — Callimitra carolotae, Ж — Clathrocorys teuscheri, 3 — Lophophaena hispida, И— Setho-
phormis aurelia. (По: Петрушевская, 1971 —A; Boltovskoy, 1999 — Б, Е-И\ Goll, 1976 — B; Haeckel, 1887 — Г; Boltovskoy, Riedel, 1987—Д).
198
POLYCYSTINA
Дорсальная (D) и две латеральных (2L) иглы направ-
лены вниз и в стороны, образуют узкие сетчатые пла-
стины, которые формируют торакс. Абдомен не разви-
вается.
Род Clathrocorys Haeckel 1881 (рис. 133, Ж)
Как и у рода Callimitra, весь скелет состоит из 6
сетчатых или пористых пластин, прилегающих к цефа-
лису. В этих пластинах лучше развита периферическая
часть, а центральная обычно имеет большие просветы.
Род Lophophaena Ehrenberg 1847 (рис. 133, 3)
Скелет высокий, почти цилиндрический, или слег-
ка расширенный кверху цефалисом. Цефалис с длин-
ными многочисленными нитевидными дополнитель-
ными иглами и крупными порами. Дорсальная (D) и
латеральные (2L) иглы могут давать небольшие боко-
вые придатки в виде крыльев или быть направлены
вниз, проходить в стенках торакса до его конца и про-
должаться дальше, как терминальные «ноги». Торакс
конический. Поры округлые, расположены неупорядо-
ченно.
Род Sethophormis Haeckel 1881 (рис. 133, И)
Скелет тонкостенный, напоминающий зонтик.
Куполообразный цефалис образован нитевидными,
дугообразно изогнутыми, пересекающимися перекла-
динами. Торакс развивается в стороны вниз от дуг, за-
канчивающих цефалис. Стенка торакса представлена
тонкой сетчатой структурой, через которую проходят
многочисленные радиальные ребра.
Сем. Theoperidae (Haeckel) Riedel 1967
(рис. 134, Д-З)
Раковина с тремя-четырьмя, редко более сегмента-
ми. Цефалис сферический и относительно маленький,
отделенный от торакса, со значительным апикальным
рогом. Торакс куполовидный. Абдомен в виде воронки.
Торакс и абдомен пронизаны округлыми, упорядоче-
но расположенными порами. Иглы D и 2L проходят в
стенках и торакса, и абдомена, как сравнительно высо-
кие ребра. Их свободные концы образуют «ноги», на-
правленные вниз и немного в стороны.
Роды: Artostrobus, Clathrocyclas, Cornutella, Coroc-
alyptra, Cycladophora, Cyrtopera, Dictyophimus (= Pseu-
dodictyophimus), Eucyrtidium, Lipmanella, Litharach-
nium, Lithopera, Pterocanium.
Род Artostrobus Haeckel 1887 (рис. 134, A)
Цефалис плохо развит и лишен пор. Хорошо раз-
вит апикальный (А) и затылочный (Vert) рога. Торакс
цилиндрический с крупными округлыми порами, рас-
положенными рядами.
Род Cornutella Ehrenberg 1838 (рис. 134, Б)
Узкая коническая раковина. Почти круглый цефа-
лис лишен пор и имеет апикальный рог (А). Поры на
тораксе круглые и увеличиваются к основанию.
Род Corocalyptra Haeckel 1887 (рис. 134, Б)
Цефалис с крупным апикальным рогом. Торакс ку-
полообразный, с крупными многоугольными порами
и тремя маленькими иглами (крыльями). Абдомен ци-
линдрический.
Род, Cycladophora Ehrenberg 1847
(рис. 134, Г)
Раковина от конической до колоколообразной.
Цефалис полукруглый с редкими порами и обычно с
двумя рогами. Торакс цилиндрической формы с окру-
глыми порами, расположенными рядами, которые уве-
личиваются к абдомену. Абдомен конический или во-
ронковидный с порами разной величины и формы.
Род Dictyophimus Bailey 1856
(= Pseudodictyophimus Petrushevskaya 1971)
(рис. 134, E)
Цефалис небольшой и частично погружен в то-
ракс. Имеются большой апикальный рог (А), неболь-
шой затылочный рог (Vert). Торакс пирамидальный или
конический, устье закрыто или открыто и имеется три
«ноги» (D и 2L). Поры разного размера, расположены
беспорядочно.
Род Eucyrtidium Ehrenberg 1847
(рис. 134, Ж)
Скелет состоит из 6-10 сегментов. В верхней ча-
сти он конический, ниже цилиндрический или обрат-
ноконический. Цефалис небольшой, тонкостенный
с апикальным рогом (А). Торакс больше цефалиса и
примерно равен абдомену и последующим сегментам.
Поры округлые или гексагональные, расположены про-
дольными рядами, переходящие с сегмента на сегмент.
Род Lithopera Ehrenberg 1847 (рис. 134, 3)
Цефалис толстостенный, почти лишенный пор
шар, погруженный в торакс. Апикальный рог тонкий и
короткий. Торакс овальный, с закрытым устьем. Поры
одинаковые и расположены гексагонально.
Род Pterocanium Ehrenberg 1847 (рис. 134, Д)
Маленький цефалис с одним или двумя рогами. То-
ракс тонкостенный, с тремя ребрами, заканчивающи-
мися «ногами». «Ноги» почти параллельны друг другу.
Абдомен развит только у взрослых форм.
POLYCYSTINA
199
Сем. Carpocaniidae (Haeckel) Riedel 1967
(рис. 134, И)
Скелет двухсегментный, форма его эллипсоидаль-
ная или бочонковидная. Маленький цефалис снаружи
не отделен от торокса, стенки его непосредственно
переходят в стенки торакса без резкого пережима. Аб-
домен отсутствует.
Род: Carpocanium.
Род Carpocanium Ehrenberg 1847
(рис. 134, И)
Скелет эллипсоидальный. Цефалис не отделен от
торакса и заключен в верхней его части. Поры окру-
глые и расположены в шахматном порядке. Торакс
сужается книзу и переходит в перистом. Перистом в
виде гладкого валика или трубки, край его может быть
зубчатым.
Сем. Pterocorythidae (Haeckel), Riedel 1967
(рис. 135, А-Г)
Раковина с одним-тремя сегментами, коническая
или веретеновидная. Цефалис большой, с шейкой, бо-
ковыми долями и апикальным рогом. Цефалис и торакс
образуют цефалоторакс. Торакс заканчивается внутрен-
ним валиком. Если есть абдомен, то он имеет вид более
или менее высокого бочонка. Абдомен часто снабжен
приустьевыми шипами. Поры на тораксе и иногда на
абдомене расположены в шахматном порядке, при этом
вырисовываются продольные ряды.
Роды: Anthocyrtidium, Lamprocyclas, Lamprocyrtis,
Pterocorys, (= Theoconus), Pteroscenium, Stichopilium,
Theocorythium.
Род Anthocyrtidium Haeckel 1881 (рис. 135, A)
Цефалис удлиненный, с большим трехгранным
апикальным рогом (А). Торакс конусовидный, с окру-
Рис. 134. Представители отряда Nassellaria.
А-3 — семейство Theoperidae: А — Artostrobus annulatus, Б— Comutella profunda, В — Corocalyptra columba, Г— Cycladophora davisiana, Д — Ptero-
canium praetaxum, E — Pseudodictyophimus gracilipes, Ж— Eucyrtidium hexastichum, 3 — Lithopera bacca; И— семейство Carpocaniidae: И— Carpoca-
nium spp. (По: Boltovskoy, 1999 — А-3; Петрушевская, 1971 —И).
200
POLYCYSTINA
Рис. 135. Представители отряда Nassellaria.
А-Г — семейство Pterocorythidae: А — Anthocyrtidium zanguebaricum, Б — Lamprocyclas maritalis, В — Pterocorys minythorax, Г — Theocorythium
trachelium\ Д-З — семейство Artostrobiidae: Д— Botryostrobus auritus/australis, E — Phormostichoartus corbula, Ж — Lithomitra arachnea, 3 — Spiro-
cyrtis seal ar is\ И-М— семейство Cannobotryidae: И — Acrobotrys spp., К— Botryocephalina armata, Л— Botryopyle dictyocephalus, M— Saccospyris
antarctica. (По: Boltovskoy, 1999 — A-И, Л-M', Boltovskoy, Riedel, 1987 — K).
глыми порами, расположенными гексагонально. Устье
сжато, оформлено валиком, который может быть глад-
ким или с зубчиками.
Род Lamprocyclas Haeckel 1881 (рис. 135, Б)
Скелет массивный. Цефалис овальный, с большим
апикальным рогом (А). Торакс куполообразный, с чет-
кими продольными рядами пор. Абдомен более широ-
кий чем торакс. Стенки абдомена часто образуют утол-
щения в виде абдоминальных приустьевых зубов.
Род Pterocorys Haeckel 1881 (рис. 135, В)
Скелет тонкостенный. Цефалис овальный, с апи-
кальным рогом (А). Торакс и абдомен конусовидные,
с большим количеством мелких, густо расположенных
пор. Край абдомена лишен перистома и остается не-
оформленным.
Род Theocorythium Haeckel 1887 (рис. 135, Г)
Цефалис сферический, с апикальным рогом (А).
Между цефалисом и тораксом есть переход (шейка).
Абдомен цилиндрический, уже торакса, его нижний
край, в виде перистомного валика, вооружен зубцами.
Поры расположены четкими продольными рядами.
Сем. Artostrobiidae (Riedel) Foreman 1973
(рис. 135, Д-З)
Удлиненная раковина, подразделенная на цефалис,
торакс, абдомен и постабдоминальные сегменты. По-
стабдоминальные сегменты могут объединяться между
собой и с абдоменом в единое целое. Цефалис и торакс
обычно тесно слиты друг с другом. Общая форма рако-
вины приближается к конусу, сигаре или к цилиндру.
Поры на тораксе, абдомене и постабдоминальной части
расположены поперечными рядами.
Роды: Botryostrobus (= Lithocampe), Phormosticho-
artus, Siphocampe (= Lithomitra), Spirocyrtis, Tricolo-
campe (= Siphocampium).
Род Botryostrobus Ehrenberg 1844
(= Lithocampe) Petrushevskaya 1967
(рис. 135, Д)
Цилиндрическая раковина с 5-8 сегментами. Це-
фалис полусферический, с апикальным рогом (А). Все
постторакальные сегменты примерно такой же длины.
Рис. 8. Представители различных родов Gymnodiniales из Европейской Арктики (Гренландское море).
А — Gymnodinium abbreviatum Kofoid et Swezy; Б — Amphidinium sphenoides Wulff; В — Gyrodinium cf. spirale (Bergh) Kofoid et Swezy; Г—Katodinium
glaucum (Lebour) Loeblich III; Д— Torodinium teredo (Pouchet) Kofoid et Swezy; E — кремниевый элемент внутреннего скелета Actiniscus pentasterias
(Ehrenberg) Ehrenberg. Все виды планктонные; рис. А-Д — сем. Gymnodiniaceae, рис. Е — сем. Actiniscaceae. На рис. А-Д передняя часть клетки рас-
положена слева; на рис. Б-Д клетки изображены в зеркальном отражении.
Рис. 9. Представители различных родов Gymnodiniales и (предположительно) Suessiales из Европейской Арктики (Гренландское
море).
А и Б— Gymnodiniales gen. sp., типично гимнодиниоидные клетки, объединенные в шаровидную колонию или ценобий (также, возможно, планктон-
ная вторичная циста динофлагеллаты Schizochytriodinium calani Elbrachter, паразитирующей на каляноидных копеподах, во время образования дино-
спор посредством палинтомии; см. Elbrachter, 1988); представители сем. Wamowiaceae: В — Warnowia sp., Г— hematodinium sp., Д — Proterythropsis
sp., E — (?) цисты Polarella glacialis Montresor, G. Procaccini et D.K. Stoecker (4 клетки, окруженные общей слизистой оболочкой; можно различить
желтые хлоропласты, поясок и шипики, покрывающие клетку). Все виды найдены в планктонных пробах. На рис. В-Д передняя часть клетки распо-
ложена справа; у всех клеток можно различить ядро в передней части клетки, оцеллюс в задней части клетки и палочковидные нематоцисты. Клетки
изображены в зеркальном отражении.
Рис. 11. Представители Prorocentrales, виды рода Prorocentrum, из Мексиканского залива.
А — планктонный Р. gracile Schiitt (тератологическая форма с вздутием теки), Б — планктонный Р. compression (Bailey) Т.Н. Abe, В — эпифитный Р
rhathymum Loeblich III, Sherley et Schmidt, Г— эпифитный P lima (Ehrenberg) Stein, Д— эпифитный P sculptile M.A. Faust, E— эпифитный P cf. con-
cavum Fukuyo. Апикальные пластинки у всех видов расположены справа; на рис. Г и Е заметен центральный пиреноид в виде кольца. Тека окрашена
трипановым синим.
Рис. 12. Представители Dinophysiales из Мексиканского залива.
А — Dinophysis caudata Saville-Kent, Б — Dinophysis doryphora (Stein) Т.Н. Abe, В — Dinophysis apicata (Kofoid et Skogsberg) Abe vel Balech, Г—Am-
phisolenia bidentata Schroder, Д — Ornithocercus magnificus Stein, E — Sinophysis stenosoma Hoppenrath. Рис. А-Д — планктонные виды, Е — эпифит-
ный вид. Передняя часть клеток (эпитека) расположена слева. Тека окрашена трипановым синим.
Рис. 14. Представители Gonyaulacales из Мексиканского залива.
А — Amphidoma caudata Halldal, Б — Palaeophalacroma unicinctum J. Schiller. В — Gonyaulax spinifera (Claparede et Lachmann) Diesing, Г— Lingulodin-
ium polyedra (Stein) Dodge, Д — Protoeeratiuni cf. globosum Kofoid et Michener. E — Acanthogonyaulax spinifera (Murray et Whitting) Graham. Передняя
часть клеток (эпитека) расположена справа. Тека окрашена трипановым синим.
Рис. 15. Предс'гавшели Gonyaulacales из Мексиканского залива.
.4 — ieratium candelabrum Ehrenberg, Б— Goniodoma potyedricum (Pouchet) Jorgensen, В - колония Alexandrium cf. caienella (Whedon el Kofoid)
Balech, Г - Pyrophacus steinii (J. Schiller) Wall et B. Dale;/? — Pyrocysth robusta Kofoid, E - Heterodinium milnerii Kofoid. Все виды планкюнные. На
рис. I В и Е передняя чаечь клеток (эиигека) расположена справа. Тека окрашена 1рипаиовым синим иа рис. .4 -Д.
Рис. 17. Представители Peridiniales из Мексиканского залива.
А — Peridinium quinquecorne Т.Н. Abe, Б — Protoperidinium sphaericum (J Murray et Whitting) Balech, В — Diplop\alop.\i.\ bomba (Stein) Dodge et Toriumi
(замегны зоны роста), Г— Podolampas reticulata Kofoid, Д — Blepharoc v\ta splendor-maris (Ehrenberg) Ehrenberg (хорошо замспны сиирализованпые
хромосомы в ядре, занимающем переднюю и центральную части khcikh). Е — Oxytoxum scolopax Stein. Все виды планктонные. На рис. А и /- Е апекс
расположен справа, на рис. Бп В наверху. Тека окрашена трипановым синим.
Рис. 22. Продольный жгутик морского планктонною вида Cercitium circticum Ehrcnbcrg»B движении (вид клегки с вентральной стороны).
А — клетка с полностью расправленным жт\ тиком. совершающим частые волнообразные движения; В тело кленки с почти полностью сложенным
жгутиком; В и Г— часть клетки с расправляющимся жт) тиком. Вее клетки изображены в зеркальном отражении.
Рис. 31. Бесполое размножение (деление надвое) у видов пор. Gymnodiniales.
.4 — конец деления клетки Gymnodinium abbreviatum Kofoid et Swezy; Б — разделившиеся клетки Gymnodinium endofasciculum Campbell; В и Г— на-
чало деления клетки Gyrodinium cf. spirale (Bergh) Kofoid et Swezy (на рис. Г заметно еще не разделившееся ядро, занимающее центральную часть
клетки); Д— начало деления клетки Wamowiaceae gen. sp. (в центральной части еще не разделившейся клетки хорошо заметно почти разделившееся
ядро со спирализованными хромосомами); Е — конец деления клетки (?) Nematodinium sp. (заметны два ядра, два оцеллюса и два нематоциста в еще
не разделившейся до конца клетки; в отличие от сем. Gymnodiniaceae на рис. А-Г, у видов сем. Wamowiaceae деление происходит в поперечной пло-
скости клетки, как изображено на рис. Ди Е). Все клетки представлены в зеркальном отражении.
Рис. 33. Бесполое размножение у видов пор. Dinophysiales и Gonyaulacales.
А-В — деление на две равных клетки у морского планктонного вида Dinophysis rotunclata Claparede et Lachmann (каждая и з вновь обра ковавшихся кле-
ток достраивает своп половины эпитеки и гипотеки): Г-Е— десмошизис у морских планкюнных видов рода Ceratium'. / - Ceratium tripos O.F. Miiller
(на теке, окрашенной трипановым синим, виден результат косого деления); Ди Е— Ceratium arcticum Ehrenberg (wicikh изображены в зеркальном
отражении), дочерние клетки после деления, каждая из коюрых унаследовала половину теки от магеринской клетки (пнютеку на рис. Д и зншеку на
рис. Е) и регенерирует недостающую половину (эпшеку на рис. Ди пню теку на рис. Е).
Рис. 37. Цисты современных динофлагеллат.
4 временная циста Cochlodinium sp., Б— покоящаяся циста Ро1укпко\ sp.. В временная micia (?) Hdrnowia sp.. /’ покоящаяся цисча Protoperi-
dimum oblongum (J. Schiller) F.J.R. Taylor, Д— покоящаяся циста Proiopendimum sp., E — (?) покоящаяся цисга пспзвеспюй 1аксономической прпнад-
ежносш. описанной как Echinum majus Meunier. На рис. J и В шмеша капсула. окружающая кле1ку. характерная для временных цист Gymnodiniales.
рис. Д циста окрашена трипановым синим.
Рис. 54. Представители отрядов акантарий.
А — отр. Holacanthida, Acanthoplegma krohnv, Б — отр. Symphyacanthida, Heliolithium aureutrr, В — отр. Chaunacanthida, Stauracon pallidus\ Г, Д— отр.
Arthracanthida, Acanthometrapellucida. an — аксоподия; ж — жировая капля; з — зооксантеллы; ко — кортекс; м — миофриски; пщ — остатки пище-
вого объекта; рп — ризоподии; слс — слизистый слой; цк — центральная капсула; эвр — эластичные волокна радиальные; эк — эктоплазма; экс —
эктоплазматическая сеть; эн — эндоплазма. Увел.: А — 120х, Б — 200х, В — 80х, Г— 120х, Д— 900х. Рисунки В.Т. Шевякова (Schewiakoff, 1926).
Рис. 55. Питание Acanthoplegma krohni (А, Б, В, Г, Д) и жгутиковые клетки Acanthometrapellucida (£).
ап — аксоподия; ж — жировая капля; з — спора зооксантеллы; ко — кортекс; м — миофриски; пг — пигментные гранулы; пщ — остатки пищевого
объекта; эк — эктоплазма; эн — эндоплазма; я — ядро. Е — увел.: 1800*. Рисунки В.Т. Шевякова (Schewiakoff, 1926).
Рис. 56. Представители семейства Acanthocollidae.
А — Acanthospira spiralis-, Б — Acanthocolla cruciate; В — Acanthocyrta haeckeli. ап — аксоподия; ко — кортекс; м — миофриски; ппб — псевдоподия
бичевидная; рп — ризоподии; сл — слизь; эк — эктоплазма; эн — эндоплазма; я — ядро. Рисунки В.Т. Шевякова (Schewiakoff, 1926).
Рис. 58. Представители отряд Symphyacanthida.
-! — Amphilithium concretum: Б — Amphibelone hydrotomica; В, Д — Haliommatidium muelleri:, Г— Pseudolithium bifidum. an — аксоподия; з — зоок-
1Д--:телла: ко — кортекс; кр — кристаллоид; м - миофриски; пг — зерно пигмента; рп — ризоподии; цк — центральная капсула; эк — эктоплазма;
« — ядро. Рисунки В.Т. Шевякова (Schewiakoff, 1926).
Рис. 59. Фотографии акайiарий.
J —Accinthostaurus sp. (смрелкамп отечсиы фоюсимбиои! и аксоподия с жеiр\сомами): Б — Lvc hna^pis sp. (смрелкой oimchcii радиальный шип па
раковине); 2? — 'lAmphibelone sp.; Г Amphilonchc clonpaur. ,1 "Пleliohihumi auivimr. Е - Amphhiспич/s sp. (ciредка \ка бываем на исрисиикудьпый
конус с ИЗВИ1ЫМИ миофрпсками); Ж ?Gipariaeon sp.: ? Diploconus Д/sees (ciредкой ошечеиы псевдоподии. выходящие ib маижем тайных спи-
кул). Экваториальная Атлаишка; инвер!ированиый микроскоп Carl Zeiss \\io\ert: июбражеиия .иобеию предоставили К. Хаусман и А. Кудрявцев.
Рис. 60. Представители семейства Astrolithidae.
А — Acantholithium stellatunr, Б — Astrolithium bulbiferunr, В — Astrolonche serrate', Г— организация клетки Astrolithium bulbiferum. ап — аксоподия;
ж — жировая капля; з — зооксантелла; ко — кортекс; м — миофриски; оч — окрашенная частица; пг — пигментное тельце; рп — ризоподии; цк —
центральная капсула; эк — эктоплазма; экс — эктоплазматическая сеть; я — ядро. Рисунки В.Т. Шевякова (Schewiakoff, 1926).
Рис. 61. Представители отрядов Chaunacanthida (А, Б, В) и Arthracanthida (Г).
А —Amphiacon denticulatus', Б— Сопасоп foliaceus\ В — Gigartacon fragilis\ Г—Amphilonche elongata. ап — аксоподия; ж — жировая капля; з — зоок-
сантелла; ко — кортекс; м — миофриски; пг — пигментированное тело; рп — ризоподии; слс — слизистый слой; цк — центральная капсула; я — ядро.
Рисунки В.Т. Шевякова (Schewiakoff, 1926).
A
Рис. 63. Представители отряда Arthracanthida.
А — Phractopelta dorataspis', Б — Hexalaspis heliodiscus\ В — Diploconus fasces, an — аксоподия; ж — жировая капля; з — зооксантелла; ко — кортекс;
м — миофриски; поа — пора аспинальная; пок — пора корональная; пош — пора шовная; р — раковина; рп — ризоподии; цк — центральная капсула;
эк — эктоплазма; я — ядро. Рисунки В.Т. Шевякова (Schewiakoff, 1926).
A
рп
ап
Рис. 64. Представители семейства Dorataspidae.
А — Pleuraspis costata; Б — Lychnaspis giltschr, В — Dorataspis loricata. ап — аксоподия; ж — жировая капля; з — зооксантелла; ко — кортекс; м — ми-
офриски; рп — ризоподии; цк — центральная капсула; ш — шип; эк — эктоплазма; эн — эндоплазма; я — ядро. Рисунки В.Т. Шевякова (Schewiakoff,
1926).
Рис. 67. Представители подотряда Phyllacantha.
4 — Amphistaurus complanatus', Б, Г, Д, Е — Acanthostaurus purpurascens". миофриски расслаблены (Б), миофриски сокращены (Д), гаметы (Г), зиго-
ты (Е); В — Lonchostaurus rhombicus. ап — аксоподия; ж — жировая капля; з — зооксантелла; ко — кортекс; кош — кортикальный шов; м — мио-
ттиски; рп — ризоподии; цк — центральная капсула; эвр — эластичные волокна радиальные; эк — эктоплазма; я — ядро. Рисунки В.Т. Шевякова
S^e^akofT 1926).
Рис. 68. Представители подотряда Phyllacantha.
А —Xiphacantha alata\ Б — Pristacantha multidentata', В — Phatnacantha icosaspis', Г—Dictyacantha tabulata. an — аксоподия; з — зооксантелла; ко —
кортекс; м — миофриски; слс — слизистый слой; цк — центральная капсула; эк — эктоплазма; экс — эктоплазматическая сеть. Рисунки В.Т. Шевякова
(Schewiakoff, 1926).
Рис. 81. Семейства Aulacanthidae (I), Circoporidae (II) и Castanellidae (III—VI).
I — дицистидный (с двумя центральными капсулами) вид Aulographis furcula', интенсивно окрашены феодиум и две центральные капсулы кверху
от него; имеются малочисленные радиальные спикулы с простыми концевыми веточками (рс) и многочисленные тангентальные спикулы (тс). II —
Circospathis sexfurca. Ill — Castanidium variabile. IV — Castanidium podacontiunr, основания радиальных игл на пирамидальных постаментах. V —
Castanella sloggetti. VI — Circocastanea margarita. Фото: все экземпляры из Берингова моря; I — фиксированный спиртом подкрашенный кармином
экземпляр, инвертированный микроскоп Nikon TS100, выполнил В. Златогурский; II—VI — высушенные экземпляры, бинокуляр Leica М205 С, на-
ложение оптических срезов в программе Helicon Focus, выполнил И. Кузнецов. Масштабная линейка: I — 1 мм, II—VI — 0,1 мм.
Рис. 89. Семейство Tuscaroridac, Tusccirellci belknapi. I — экземпляр с четырьмя оральными выростами и четырьмя соматическими
(один отломан). II — раковина содержит феодиум (длинная стрелка) и две калиммы (короз кие стрелки) вокруг двух центральных кап-
сул. III — из перистома в осевую полость оральных вырос юв входят цитоплазматические 1яжи. IV — оральные выросты и прокси-
мальные участки соматических выростов вооружены шипами; основания соматических выростов прободены крупными отверстиями.
Экземпляры из Берингова моря, фиксированы спиртом, не окрашены, просветлены глицерином, бинокуляр Leica М205 С, наложение оптических
срезов в программе Helicon Focus, выполнил И. Кузнецов. Машшабиая линейка: I — 1 мм. II—IV — 0.1 мм.
Рис. 90. I — семейство Challengeridae, Protocystis sp. II—IV — семейство Challengeridae, Protocystis naresr. II — в падающем и про-
ходящем свете, вид сбоку, отсутствует фарингс (впячивающаяся трубка), просвечивает высохший феодиум; III — гексагональное
расположение пор; IV — в падающем свете, косая ориентация, виден пилом. V — семейство Concharidae, Conchopsis barccr. видны
зубчики замка внутри шва; поры крупные, ближе к килю они щелевидны, ближе к замку имеют округлые очертания; просвечивает
высохший феодиум.
Берингово море, высушенные экземпляры, бинокуляр Leica М205 С. наложение оптических срезов в программе Helicon Focus, выполнил И. Кузнецов.
Масштабная линейка 0,1 мм.
Рис. 107. Светооптические изображения Sticholonche.
А, Б, В, Г, Д\ живые экземпляры. 1 — аксоподии; 2 — внеклеточная эластичная оболочка, в которой закреплены спикулы; 3 — перинуклеарная капсула;
4 — радиальные спикулы, организованные в розетты. Е, Ж — пустые оболочки с закрепленными спикулами. На рис. Ж на 11 ч расположена аканта-
рия. Размер тела Sticholonche на всех изображениях — около 50 мкм. А, Б, В, Г, Д— Средиземное море, Виллафранка; инвертированный микроскоп
Carl Zeiss Axiovert; изображения любезно предоставил А. Кудрявцев. Е, Ж — Экваториальная Атлантика; инвертированный микроскоп Carl Zeiss
Axiovert; изображения любезно предоставили К. Хаусман и А. Кудрявцев.
POLYCYSTINA
201
как и торакс. Поры на всех сегментах расположены по-
перечными рядами. Устье суженное, неоформленное.
Род Phormostichoartus Campbell 1951
(рис. 135, Е)
Скелет состоит из четырех сегментов. Цефалис
вдавлен в торакс. Абдомен цилиндрический, короткий.
Последний сегмент в три-четыре раза длиннее, чем
предыдущие. Поры на всех сегментах расположены
поперечными рядами. Устье открытое, неоформленное,
иногда суженное в виде трубки.
Род Siphocampe Ehrenberg 1838
(= Lithomitra) Haeckel 1887 (рис. 135, Ж)
Скелет состоит из 5-6 и более сегментов. Апикаль-
ный рог почти не развит. Постторакальная часть имеет
цилиндрическую форму и суженное, но не оформлен-
ное устье. На каждом постторакальном сегменте рас-
положено не более двух поперечных рядов пор. Про-
дольные ряды практически не выражены.
Род Spirocyrtis Haeckel 1887 (рис. 135, 3)
Треугольная раковина с 6-8 сегментами и густо
расположенными порами. На цефалисе и тораксе поры
округлые, на остальных — почти квадратные. Замет-
ный апикальный рог (А). Большой широкий тубус
(Vert) направлен косо вверх.
Сем. Cannobotryidae (Haeckel) Riedel 1967
(рис. 135, И-М)
Скелет состоит из 2-3 сегментов. Цефалис специ-
ализированный, многолопастной, разделен на доли.
Благодаря этому, раковина — билатерально-симме-
тричная. Цефалис составляет V3-V2 всей раковины.
Вместе с тораксом цефалис часто создает цефалото-
ракс, который составляет практически всю раковину.
«Ног» нет, но обычны трубки, связанные с иглами А,
Vert, D, L. Стенки пористые, гиалиновые или много-
слойные губчатые, расположение пор беспорядочное
или в поперечных рядах.
Роды: Acrobotrys, Botryocephalina, Botryocyrtis,
Botryopyle, Centrobotrys, Saccospyris.
Род Acrobotrys Haeckel 1881 (рис. 135, И)
Сильно развита антецефалическая камера, охваты-
вающая цефалическую. Анте-постцефалические каме-
ры вытянуты в трубки.
Род Botryocephalina Petrushevskaya 1965
(рис. 135, К)
Цефалис, главным образом, представлен полусфе-
рическими антецефалической и цефалической камера-
ми почти одинакового размера, с длинными апикаль-
ными иглами. Торакс цилиндрический.
Род Botryopyle Haeckel 1881 (рис. 135, Л)
Крупный цефалис представлен большой яйцевид-
ной, тонкостенной антецефалической камерой и ма-
ленькой сферической, толстостенной цефалической
камерой. Торакс цилиндрический.
Род Saccospyris Haecker 1908 (рис. 135, М)
Цефалис состоит из трех лопастей. Антецефали-
ческая и цефалическая камеры намного крупнее пост-
цефалической. Торакс цилиндрический, с закрытым
устьем.
БЛАГОДАРНОСТИ
Автор приносит искреннюю благодарность С.Б. Кругликовой, В.С. Вишневской и Т.Н. Палечек за помощь и ряд ценных советов
при подготовке рукописи; И.И. Русанову, Э.И. Мусаевой и Л.Л. Анохиной за неоценимую помощь при подготовке работы к печати.
SUMMARY
A review comprises information on the basic aspects of
morphology, physiology, phylogeny and ecology of representatives
of the phylum Polycystina.
The data on different groups of polycystine were summarized
from published articles and monographs, as well as from the recent
reviews devoted to polyclystine (Anderson, 1993; Petrushevskaya,
SS6: Boltovskoy, 1999; Anderson et al., 2000; De Wever et
2.'.. 2001). In taxonomic part we followed the classification of
the polycystine given in «South Atlantic Zooplankton», section
Radiolaria Polycystina (Boltovskoy, 1999).
The review includes a general characteristic of Polycystina, a
brief history of polycystine studies from early XIXth to late XXth
century with special emphasis on personal contributions of different
scientists into study of polycystine.
In next section «Morphology» cellular structure of polycystine
is described: endoplasm, ectoplasm, central capsule, axopodia and
skeleton.
In section «Physiology» the movements of polycystine, their
nutrition, symbiosis and process of reproduction are discussed.
Geographic distribution of polycyctine in water column and
radiolarian sedimentation are discribed in the section «Ecology and
biogeography».
The position of Polycystina in the system of Protozoa is
discussed based on recent data of rRNA structure in representatives
of the main order of the phylum.
The conclusion section contains descriptions of orders, families,
genera.
202
POLYCYSTINA
ЛИТЕРАТУРА
Алешин В.В., Мыльников А.П., Петров Н.Б. 2005. Дерево корне-
ножек // Природа. № 9. С. 40-46.
Амон Э.О. 1999. Систематика сфереллярий (радиолярии) палеозоя
Урала // Матер, по стратиграфии и палеонтологии Урала. Вып. 2. Екате-
ринбург: УрО РАН. С. 187-196.
Амон Э.О. 2000а. Материалы к ревизии семейства иглистых ра-
диолярий палеосценид из палеозойских отложений Урала // Матер, по
стратиграфии и палеонтологии Урала. Вып. 4. Екатеринбург: УрО РАН.
С. 50-86.
Амон Э.О. 20006. Система высших таксонов ставраксонных радио-
лярий палеозоя // Ежегодник-1999 Ин-та геологии и геохимии УрО РАН.
Екатеринбург: УрО РАН. С. 3-11.
Амон Э.О. 2000в. Верхнемеловые радиолярии Урала // Матер, по
стратиграфии и палеонтологии Урала. Вып. 5. Екатеринбург: Ин-т гео-
логии и геохимии УрО РАН. 209 с.
Афанасьева М.С., Амон Э.О. 2002. Новый подход к проблеме
классификации радиолярий: иглистые и губчатые радиолярии // Всеросс.
научн. конф. «Геология, Геохимия и Геофизика на рубеже XX и XXI ве-
ков». Т. 1. Тектоника, стратиграфия, литология. М.: РФФИ. С. 122-124.
Афанасьева М.С., Амон Э.О. 2003. Новая классификация радио-
лярий // Палеонтол. журн. № 6. С. 72-86.
Афанасьева М.С., Амон Э.О. 2006. Радиолярии. М.: ПИН РАН.
320 с.
Берштейн Т.П. 1934. Зоопланктон Карского моря по материалам
экспедиции Арктического института на «Седове» 1930 года и «Ломоно-
сове» 1931 года // Тр. Аркт. ин-та. Вып. 9. С. 3-58.
Валовая М.А., Кавтарадзе Д.Н. 1993. Микротехника. Правила.
Приемы. Искусство. Эксперимент. М.: Изд-во МГУ. 240 с.
Де Вевер П., Ориглия И. 1982. Классификация сатурналид на ос-
нове их симметрии // Морфология, экология и эволюция радиолярий. Л.:
Наука. С. 103-113.
Думитрика П. 1984. Систематика радиолярий Sphaerellaria // Мор-
фология, экология и эволюция радиолярий. Л.: Наука. С. 91-102.
Жамойда А.И. 1969. Обзор исследований радиолярий (1950-1966) //
Стратиграфия, палеонтология // Итоги науки (ВИНИТИ). М. С. 17-24.
Жамойда А.И. 1999. Практическое руководство по микрофауне.
Радиолярии мезозоя. Т. 6. ВСЕГЕИ. СПб. 266 с.
Засько Д.Н., Русанов И.И. 2005. Вертикальное распределение ра-
диолярий и их роль в эпипелагиали Восточно-Тихоокеанского поднятия
и Калифорнийского залива // Изв. РАН. Сер. Биол. № 3. С. 339-348.
Карпов С.А. 2004. Современная система протистов, разработанная
С. А. Карповым. ZooDiv Всероссийская информационная система (http://
www.zin.ru/ZooDiv/Protista.htm).
Кашон Ж., Кашон М. 1984. Цитология Полицистин (Polycystina
Ehrenberg, 1839) // Морфология, экология и эволюция радиолярий /
Матер. IV симпоз. европейских радиоляристов EuroRad-IV Л.: Наука.
С. 5-21.
Кеннетт Дж.П. 1987. Морская геология. Т. 2. М.: Мир. 383 с.
Кругликова С.Б. 1966. Количественное распределение радиоля-
рий в поверхностном слое донных осадков северной половины Тихого
океана// Геохимия кремнезема. М.: Наука. С. 246-261.
Кругликова С.Б. 1969. Радиолярии в поверхностном слое осадков
в северной половине Тихого океана // Тихий океан. Биология. Микро-
флора и микрофауна в осадках Тихого океана. М.: Наука. С. 48-72.
Кругликова С.Б. 1975. Радиолярии в поверхностном слое осадков
Охотского моря // Океанология. Т. 15. Вып. 1. С. 116-123.
Кругликова С.Б. 1981. Некоторые черты экологии и распростране-
ние современных и кайнозойских радиолярий // Систематика, эволюция
и стратиграфическое значение радиолярий. М.: Наука. С. 118-139.
Кругликова С.Б. 1995. Структура ассоциаций радиолярий-полици-
стин на видовом и надвидовом уровне и палеосреда // Современный и
ископаемый микропланктон Мирового океана. М.: Наука. С. 76-89.
Лисицин А.П. 1966. Основные закономерности распределения со-
временных кремнистых осадков и их связь с климатической зонально-
стью // Геохимия кремнезема. М.: Наука. С. 90-191.
Малахов В.В. 2006. Современная система протистов, разработан-
ная. В.В Малаховым. ZooDiv Всероссийская информационная система
(http://www.zin.ru/ZooDiv/Protista.htm).
Микрюков К.А. 2000. Солнечники, как существенный компонент
микробентоса // Радиоляриология на рубеже тысячелетий: итоги и пер-
спективы. Мат. 11 Семинара по радиоляриям. СПб.; М. С. 47^49.
Назаров Б.Б. 1974а. К систематике палеозойских сфероидей // Си-
стематика и стратиграфическое значение радиолярий. Тр. ВСЕГЕИ. Нов.
сер. Т. 226. С. 35-40.
Назаров Б.Б. 19746. Albaillellidae и Paleoscenidiidae из верхнеде-
вонских отложений Южного Урала // Систематика и стратиграфическое
значение радиолярий. Тр. ВСЕГЕИ. Нов. сер. Т. 226. С. 41^47.
Назаров Б.Б. 1975. Радиолярии нижнего-среднего палеозоя Казах-
стана (методы исслед., систематика, стратигр. знач.) // Тр. Геол, ин-та АН
СССР. Вып. 275. М.: Наука. 202 с.
Назаров Б.Б. 1981. Эволюция радиолярий в палеозое и вопросы
их систематики // Систематика, эволюция и стратиграфическое значение
радиолярий. М.: Наука. С. 22-37.
Назаров Б.Б. 1988. Радиолярии палеозоя. Практическое руковод-
ство по микрофауне СССР. Т. 2. Л.: Недра. 232 с.
Петрушевская М.Г. 1962. Значение роста скелета радиолярий для
их систематики // Зоол. журн. Т. 41. Вып. 3. С. 331-341.
Петрушевская М.Г. 1967. Радиолярии отрядов Spumellaria и
Nassellaria Антарктической области (По материалам Советской Аркти-
ческой экспедиции) // Исследование морей. Экспедиции 1955-1958 гг.
Т. 4(12). Вып. 3. С. 5-186.
Петрушевская М.Г. 1971. Радиолярии Nassellaria в планктоне Ми-
рового океана. (Радиолярии Мирового океана по материалам Советских
экспедиций). Л.: Наука. С. 5-294.
Петрушевская М.Г. 1979. Новый вариант системы Polycystina //
Ископаемые и современные радиолярии. Л.: Наука. С. 101-118.
Петрушевская М.Г. 1981. Радиолярии отряда Nassellaria Мирового
океана. Л.: Наука. 406 с.
Петрушевская М.Г. 1984. О классификации радиолярий Polycys-
tina // Морфология, экология и эволюция радиолярий. Л.: Наука. С. 124—
148.
Петрушевская М.Г. 1986. Радиоляриевый анализ. Л.: Наука. 200 с.
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. М.:
Советская Наука. 467 с.
Сванберг Н. 1984. Биология колониальных радиолярий. Морфоло-
гия, экология и эволюция радиолярий // Матер. IV симпозиума европей-
ских радиоляристов EuroRad-IV Л.: Наука. С. 35-40.
Стрелков А.А. 1959. Экология современных радиолярий и их гео-
графическое распространение^/ Основы палеонтологии. М.: АН СССР.
С. 410-417. \
Стрелков А.А., Решетняк В.В. 1971. Колониальные радиолярии
Spumellaria Мирового океана // Исследование фауны морей. Вып. 9(17).
С. 295-373.
Стрелков А.А., Хабаков А.В., Липман Р.Х. 1959. Подкласс
Radiolaria // Основы палеонтологии. Простейшие. Т. 1. М.: АН СССР.
С.369-482.
Хмелева Н.Н. 1967. Роль радиолярий при оценке первичной про-
дукции в Красном море и Аденском заливе // Докл. АН СССР. Т. 172.
№ 6. С. 1430-1433.
Abelmann A., Gowing M.M. 1997. Spatial distribution of living poly-
cystine radiolarian taxa — baseline study for paleoenvironmental reconstruc-
tion in the Southern Ocean (Atlantic sector) // Mar. Micropal. No. 30. P. 3-28.
Adi S.M., Farmer M.A., Karpov S., Lynn D.H., Simpson A.G.B.,
Smirnov A.V. et al. 2005. The new higher level classification of Eukaryotes
with emphasis on the taxonomy of protists // J. Euk. Microbiol. Vol. 52(5).
P. 399-451.
Afanasieva M.S., Amon E.O. Agarcov Yu. V. Boltovskoy D.S. 2005.
Radiolarians in the geological Record // Paleontol. J. Vol. 39. Suppl. 3.
P. 135-392.
Amaral Zettler L.A., Anderson O.R., Caron D.A. 1999. Towards a
molecular phylogeny of colonial spumellarian Radiolaria // Mar. Micropal.
Vol. 36. P. 67-79.
Amaral Zettler L.A., Caron D.A. 2000. New insights into the phylog-
eny of the Acantharea based on SSU rRNA gene sequencing // Eur. J. Protis-
tol. Vol. 36. P. 34-39.
Amaral Zettler L.A., Sogin M.L., Caron D.A. 1997. Phylogenetic
relationships between the Acantharea and the Polycystinea: A molecular
perspective on Haeckel’s Radiolaria // Proc. Natl. Acad. Sci. U.S.A. Vol. 94.
P. 11411-11416.
Amon E.O. 1998. Radiolariology: a new scientific displine in paleontol-
ogy // 6th Zoonenshain Conference on Plate Tectonics. Programme and Ab-
stracts. Moscow. Institute of Oceanology RAS. GEOMAR. P. 151.
Anderson O.R. 1977. Cytoplasmatic fine structure of Nassellarian Ra-
diolaria // Mar. Micropal. Vol. 2. No. 3. P. 251-230.
Anderson O.R. 1980. Radiolaria // Biochemistry and Physiology of
Protozoa. N.Y. Vol. 3. P. 1^12.
Anderson O.R. 1983. Radiolaria. Springer-Verlag. N.Y., Berlin, Hei-
delberg, Tokyo. 450 p.
POLYCYSTINA
203
Anderson O.R., Nigrini N., Boltovskoy D., Takahashi K., Swanberg
N. 2000. Class Polycystinea // An illustrated guide to the Protozoa. Society of
Protozoologists. J. Lee (ed.). Lawerence. Kansas, USA. P. 994-1022.
Anderson O.R., Swanberg N.R. 1981. Skeletal morphogenesis in some
living collosphaerid radiolarian // Mar. Micropal. Vol. 6. P. 385-396.
Bass D., Moreira D., Lopez-Garcia P., Polet S., Chao E.E., Herden
S., Pawlowski J., Cavalier-Smith T. 2005. Polyubiquitin insertions and the
phylogeny of Cercozoa and Rhizaria // Protistology. Vol. 156. P. 49-161.
Bjorklund K. 1974. The seasonal occurrence and depth zonation of ra-
diolarians in Korsfjorden, Western Norway // Sarsia. Vol. 56 P. 13^42.
Boltovskoy D. 1979. Zooplankton of the south-western Atlantic // S.
Afr. J. Sci. Vol. 75. P. 541-544.
Boltovskoy D. 1994. The sedimentary record of pelagic biogeography //
Progr. Oceanogr. Vol. 4. P. 35-160.
Boltovskoy D. 1998. Classification and distribution of South Atlantic
recent Polycystine Radiolaria // Paleontologica Electronica. Vol. 1. Issue 2.
116 p. (http://palaeo-electronica.org/1998_2/boltovskoy/issue2.htm).
Boltovskoy D. 1999. Radiolaria Polycystina // South Atlantic Zooplank-
ton. D. Boltovskoy. (ed.). Vol. 1. Backhuys Publishers, Leiden. P. 149-212.
Boltovskoy D., Alder V.A. 1992. Paleoecological implications of ra-
diolarian distribution and standing stocks versus accumulation rates in the
Weddell Sea // The Antarctic environment: a perspective on global change.
Ant. Res. Ser. Amer. Geophys. Union. Vol. 56. P. 377-384.
Boltovskoy D., Kogan M., Alder V.A., Mianzan H. 2003. First re-
cord of a brackish radiolarian (Polycystina): Lophophaena rioplatensis n. sp.
in the Rio de la Plata estuary // J. of Plankton Research. Vol. 25. No. 12.
P. 1551-1559.
Boltovskoy D., Uliana E., Wefer G. 1996. Seasonal variation in the
flux of microplankton and radiolarian assemblage compositions in the north-
eastern tropical Atlantic at 2195 m // Limnol. Oceanogr. Vol. 41. No. 4.
P. 615-635.
Boltovskoy D., Kling S., Takahashi K., Bjorklund R. 2010. World atlas
of distribution of recent Polycystina (Radiolaria) // Palaeontologia Electron-
ica. Vol. 13, Issue 3; 18A. 230 p. (http://palaeo-electronica.org/2010 3/215/
index.html)
Borgert A. 1901. Die nordischen Tripyleen-Arten // Nordisches Plank-
ton. Abh. 15. S. 1-52.
Brandt K. 1902. Beitrage zur Kenntnis der Colliden // Arch. Protisten-
kd. Bdl.No. l.S. 59-88.
Brandt K. 1905. Zur Systematik der koloniebildenden Radiolarien //
Zool. Jahrb. Suppl. 8. S. 311-352.
Cachon J., Cachon M. 1971. Recherches sur le metabolosme de la si-
lice chez les Radiolaires. Absorption et excretion // C. R. Acad. Sci. Paris.
Vol. D. No. 272. P. 1652-1654.
Cachon J., Cachon M. 1976a. Le Systeme axopodail des Collodaires
(Radiolaires Polycystines). 1. Les Exo-axopodiata // Arch. Protistenkd.
Vol. 118. P. 227-234.
Cachon J., Cachon M. 1976b. Les axopodes de Radiolaires dans
leur partie libre et ectoplasmique: structure et function // Arch. Protistenkd.
Vol. 118. P. 310-320.
Cachon J., Cachon M. 1978. Constitution infrastructurale des micro-
tubules du systeme axopodial des Radiolaires // Arch. Protistenkd. Vol. 120.
P. 229-231.
Campbell A.S. 1954. Radiolaria // Treatise on Invertebrate Paleontol-
ogy. R.C. Moore (ed.). Univ. Kanzas Press and Geol. Soc. Amer. pt. D. Pro-
tista. No. 3P. 11-163.
Caron D.A., Swanberg N.O. 1990. The Ecology of Planktonic Sarco-
dines //Aquatic Science. Vol. 3. P. 147-180.
Casey R. 1971. Distribution of polycystine radiolaria in the Ocean in re-
lation to physical and chemical conditions // Micropaleontology of the Ocean.
Cambridge.?. 151-159.
Cavalier-Smith T. 1987. The origin of eukaryote and archaebacterial
cells // N. Y. Acad. Sci. Vol. 503. P 17-54.
Cavalier-Smith T. 2002. The phagotrophic origin of eukaryotes and
phylogenetic classification of Protozoa// Int. J. Syst. Evol. Microbiol. Vol. 52.
P. 297-354.
De Wever P., Dumitrica P., Caulet J.P., Nigrini C., Caridroit M.
2001. Radiolarians in the Sedimentary record // Gordon and Breach Science
Publishers. 533 p.
Deflandre G. 1952. Classe de Radiolaires // Piveteau J. (ed.) Traite de
Paleontologie. Paris: Masson et Gie. Vol. 1. S. 303-313.
Deflandre G. 1953. Radiolaires fossiles // Grasse P. (ed.) Traite de Zo-
ologie. Vol. 1. Part 2. Paris: Masson et Gie. S. 389-436.
Dworetzky B.A., Morley J.J. 1987. Vertical distribution of radiolaria
in the eastern equatorial Atlantic: analysis of multiple series of closely-spaced
plankton tow // Mar. Micropal. Vol. 12. P 1-19.
Ehrenberg Ch.G. 1838. Uber die Bildung der Kreidefelsen und des
Kreidemergels durch unsichtbare Organismen // Abh. Preuss. Berliner Akad.
Wiss. Berlin. S. 59-147.
Ehrenberg Ch.G. 1847a. Beobachtungen uber die microskopischen
kieselschaligen Polycystinen als machtige Gebirgsmasse von Barbados und
uber das Verhaltnis der aus mehr als 300 neuen Arten bestehenden ganz ei-
gentiimlichen Formengruppe jener Felsmasse zur den lebenden Thieren und
zur Kreidebildung // Monatsber. Kgl. Preuss. Akad. Wiss. Berlin. S. 40-60.
Ehrenberg Ch.G. 18476. Uber eine halibiolithische, von Herm
R.Schomburgk entdeckte, vorherrschend aus microskopischen Polycystinen
gebildete, Gebirgsmasse von Barbados // Monatsber. Kgl. Preuss. Akad. Wiss.
Berlin. S. 236-250.
Ehrenberg Ch.G. 1875. Fortsetzung der mikrogeologischen Studien als
Gesammt-Uebersicht der mikroskopischen Palaeontologie gleichartig analy-
sirter Gebirgsarten der Erde, mit specieller Rucksicht auf den Polycystinen
Mergel von Barbados // Abh. Kgl. Preuss. Akad. Wiss. Berlin. 226 S.
Goll R.M., Bjorklund K.R. 1971. Radiolaria in surface sediments of
the North Atlantic Ocean // Micropaleontology. Vol. 17. No. 4. P. 434-454.
Gowing M.M. 1998. Abundance and feeding ecology of Antarctic phae-
odarian radiolarians // Mar. Biol. No. 103. P 107-118.
Haeckel E. 1862. Die Radiolarien (Rhizopoda Radiata). Eine Monog-
raphic. Berlin. 572 S.
Haeckel E. 1887. Reports on the Radiolaria collected by H.M.S. «Chal-
lenger» during the years 1873-1876 // Challendger Exped. Repts. Zool.
Vol. 18. Pt. 1-2. S. 1-1803.
Haecker V. 1908. Tiefsee-Radiolarien // Ergeb. Dt. Tiefsee-Exped.
Dampfer «Valdivia» 1898-1899. Jena. Bd 14. 706 S.
Hays J.D. 1965. Radiolaria and late Tertiary and Quaternary history of
Antarctic Sea // Biol. Antarctic Seas. Vol. 2. Antarctic Research. Ser. 5. Amer.
Geophys. Union. P 125-184.
Hertwig R. 1879. Der Organismus der Radiolarien. Jena. 149 S.
Hollande A., Cachon J., Cachon M. 1969. La Dinomitose atratopho-
rienne a fuseau endonucleaire chez les Radiolaires Thalassopkysidae // C. R.
Acad. Sci. Paris. Vol. D. No. 269. P. 179-182.
Hollande A., Cachon J., Cachon M. 1970. La signification de la mem-
brane capsulaire des Radiolaires et ses rapports avec le plasmalemme ett les
membranes du reticulum endoplasmique. Affinities entre Radiolares, Helio-
zoaires et Peridiniens // Protistologica. T. 6. Fasc. 3. P. 311-318.
Hollande A., Enjumet M. 1953. Contribution a 1’etude biologique des
Sphaerocollides (Radiolaires Collodares et Radiolaires Polycyttares) et de
leures parasites. I. Thalassicollidae, Physematidae, Thalassophysidae // Ann.
Sci. Nat. Zool. Biolog. Animal. T. 15. No. 1. P. 99-183.
Hollande A., Enjumet M. 1960. Cytologic, evolution et systematique des
Sphaeroides (Radiolaries) // Mus. Natl. Hist. Nat. Arch. Ser. 7. Vol. 7. P 1-134.
Honjo S., Doherty K.W. 1988. Large-aperture time-series sediment
traps; design objectives, construction and application // Deep Sea Research.
Vol. 35. R 133-149.
Hurd D.C., Takahashi K. 1981. On the estimation of minimum me-
chanical lost during an in situ biogenic silica dissolution experiment // Mar.
Micropal. No. 6. P 169-182.
Huxley Т.Н. 1851. Zoological notes and observations made on board
H.M.S. Rattlesnake. III. Upon Thalassicolla, a new zoophyte // Annals and
Magazine of Natural History. Ser. 2. T. 8 (48). P. 433^442.
lams W., Stevens R. 1988. Radiolaria and other Siliceous Microfossils
of the Cow Head Group (Upper Cambrian — Middle Ordovician) of Western
Newfoundland //Abstr. 1st Intern. Conf. Radiolaria (EURORAD V) Marburg.
P. 19-20.
Johnson Т.Н. 1974. The Dissolution of Siliceous Microfossils in Sur-
face Sediments of the Eastern Tropical Pacific // Deep Sea Research. Vol. 21.
P. 851-864.
Jorgensen E. 1905. The protist Plankton and the diatoms in bottom
samples // Bergen Mus. Skrifter. Vol. 7. P. 114-151.
Kling S.A. 1978. Radiolaria // B.U. Haq, A. Boersma. (eds). Introduc-
tion to Marine Micropaleontology. Elsevier. Amsterdam. P. 203-244.
Kling S.A. 1979. Vertical distribution of polycystine radiolarians in the
central North Pacific // Mar. Micropal. Vol. 4. P. 295-318.
Kling S.A., Boltovskoy D. 1995. Radiolarian vertical distribution pat-
terns across the southern California Current // Deep Sea Research. Vol. 42.
P. 191-231.
Kunitomo Y., Sarashina L, lijima M., Endo K., Sashida K. 2006.
Molecular phylogeny of acantharian and polycystine radiolarians based on
ribosomal DNA sequences, and some comparisons with data from the fossil
record // Eur. J. Protistol. Vol. 42. P. 143-153.
Lange C.B., Boltovskoy D. 1995. Trampas de sedimento // Manual de
metodos ficologicos. Alveal K., Ferrario M.E., Oliveira E.C., Zar E. (eds)
Universidad de Concepcion, Chile. P. 93-118.
204
POLYCYSTINA
Lopez-Garcia P., Rodriguez-Valera F., Moreira D. 2002. Toward the
monophyly of Haeckel’s Radiolaria: 18S rRNA environmental data support
the sisterhood of Polycystinea and Acantharea H Mol. Biol. & Evol. Vol. 19.
P. 118-121.
Matsuoka A. 1999. Current activities of Radiolarian research // Forma.
Vol. 14. P. 199-204.
Meyen, F.J.F. 1834. Beitrage zur Zoologie Gesammelt auf einer Reise
um die Erde // Verhandlungen der kaiserlichen leopoldinisch-carolinischen
Akademie der Naturforscher. Achten Bandes т. XVI. Supplement.
Moreira D., von der Heyden S., Bass D., Lopez-Garcia P., Chao, E.,
Cavalier-Smith T. 2007. Global eukaryote phylogeny: combined small and
large-subunit ribosomal DNA support monophyly of Rhizaria, Retaria and
Excavata // Molecular. Phylogenet. Evol. Vol. 44. P. 255-266.
Muller J. 1858. Uber die Thalassicollen, Polycystinen and Acanthome-
tren des Mittelmeeres // Monatsber. Kgl. Preuss. Akad. Wiss. Berlin. S. 474-
503.
Nikolaev S.I., Berney C., Fahrni J.F., Bolivar L, Polet S., Mylnikov
A.P., Aleshin V.V., Petrov N.B., Pawlowski J. 2004. The twilight of Helio-
zoa and rise of Rhizaria, an emerging supergroup of amoeboid eukaryotes //
Proc. Nat. Acad. Sci. (USA). Vol. 101. P. 8066-8071.
Nothig E.-M., Gowing M.M. 1991. Late winter abundance and distri-
bution of phaeodarian radiolarians, other large protozooplankton and cope-
pod nauplii in the Weddell Sea, Antarctica // Mar. Biology. No. 111. P. 473-
484.
Pawlowski J., Burki F. 2009. Untangling the phylogeny of amoeboid
protests // J. Euk. Microbiol. Vol. 56(1). P. 16-25.
Polet S., Berney C., Fahrni J., Pawlowski J. 2004. Small-subunit ri-
bosomal RNA gene sequences of Phaeodarea challenge the monophyly of
Haeckel’s Radiolaria. // Protist. Vol. 155. P. 53-63.
Popofsky A. 1908. Die Radiolarien der Antarktis // Deutsche Sudpolar-
Expedition (1901-1903). Bd 10. Zoologie. Bd 3. Berlin. S. 185-305.
Popofsky A. 1912. Die Sphaerellarien des Warmwassergebietes //
Deutsche Sudpolar-Expedition (1901-1903). Bd 13. Zoologie. Bd 5. Berlin.
S. 75-159.
Renz G.W. 1976. The distribution and ecology of Radiolaria in central
Pacific: plankton and surface sediments // Bull. Scr. Inst. Oceanogr. Vol. 22.
P. 1-276.
Riedel W.R. 1967. Class Actinopoda. Protozoa // The Fossil record.
London. P. 291-298.
Schwarz A. 1931. Uber den Kurperbau der Radiolarien // Abh. Senck-
enb. Naturforsch. Ges. Bd 43. Lfg. 1. S. 3-17.
Swanberg N.R. 1979. The ecology of colonial radiolarians // Doct. dis-
sertation Woods Holl. Oceanographic institution Massachusetts institute of
technology Woods Holl.
Swanberg N.R. 1983. The trophic role of colonial Radiolaria in the oli-
gotrophic oceanic environments // Limnol. Oceanogr. Vol. 28. P. 202-239.
Swanberg, N.R., Bjorklund, K.R. 1984. Faunal studies of radiolaria in
plankton and sediments of Norwegian Fjords. // Eurorad (Radiolaria). No. 9.
P.99.
Takahashi K., Honjo S. 1981. Vertical flux of Radiolaria: A taxon-
quantitative sediment trap study from the western tropical Atlantic // Micro-
pal. Vol. 27. No. 2. P. 140-190.
Takahashi O., Yuasa T., Honda D., Mayama S. 2004. Molecular phy-
logeny of solitary shell-bearing Polycystinea (Radiolaria) // Rev. Micropal.
Vol. 47. P. 111-118.
Tibbs A.I. 1967. On some planktonic protozoa taken from the track
of Drift Station Arlis I, 1960-1961 // Arct. Inst. N. Amer. Vol. 20. No. 4.
P. 247-254.
Tochilina S.V. 1996. On the problems of the systematics of Nassellaria
(Radiolaria) // Biochemical peculiarities. Evolution. Vladivostok: Far Eastern
Branch of RAS. 51 p.
Yuasa T., Takahashi O., Dolven J. K., Mayama S., Matsuoka A.,
Honda D., Bjorklund K. R. 2006. Phylogenetic position of the small solitary
phaeodarians (Radiolaria) based on 18S rDNA sequences by single cell PCR
analysis // Mar. Micropal. Vol. 59 P. 104-114.
Yuasa T., Takahashi O., Honda D., Mayama S. 2005. Phylogenetic
analyses of the polycystine Radiolaria based on the 18S rDNA sequences of
the Spumellarida and the Nassellarida // Eur. J. Protistol. Vol. 41. P. 287-298.
/
СОЛНЕЧНИКИ
Солнечники — это полифилетическая группа протистов, об-
ладающих тонкими, длинными псевдоподиями, чаще всего ак-
соподиями, радиально расходящимися от округлого тела клетки.
На аксоподиях находятся экструсомы, обеспечивающие захват
и удержание добычи. У солнечников нет внутреннего скелета,
но у многих представителей клетку покрывает слой чешуек, а
у большинства десмоторацидных солнечников все тело клетки
заключено в перфорированную органическую капсулу. Многие
солнечники ведут прикреплённый образ жизни или держатся у
поверхности донного осадка, т.е. являются бентосными орга-
низмами, однако известны находки солнечников в планктоне.
Встречаются как формы полностью лишённые жгутиков, так и
развивающие жгутики на определённой стадии жизненного цик-
ла, а у некоторых солнечников жгутиковый аппарат присутству-
ет постоянно. Среди солнечников известны только свободножи-
вущие организмы. Большинство солнечников — гетеротрофы,
но есть также несколько представителей с миксотрофным или
автотрофным типом питания.
В составе солнечников мы рассмотрим отряды Центрохе-
лидные солнечники (Centrohelida Kuhn 1926); Актинофриидные
солнечники (Actinophryida Hartmann 1913); Десмоторацидные
солнечники (Desmothoracida Hertwig et Lesser 1874); Гимносфе-
ридные солнечники (Gymnosphaerida Poche 1913); Диморфиды
(Dimorphida Siemensma 1991); Пединеллиды (Pedinellida Zim-
mermann, Moestrup et Hallfors 1984); Ротосфериды (Rotosphaeri-
da Rainer 1968).
История изучения
Понятию «солнечники» тождественны латини-
зированное название «Heliozoa», с момента первого
употребления (Haeckel, 1866) использовавшееся в так-
сономическом смысле, а также английское название
«sun-animalcules» или в буквальном переводе — сол-
нечные зверушки. Первое, не подвергающееся сомне-
нию, описание солнечника принадлежит Жобло (Joblot,
1718). На основании рисунка, приведённого в работе
сложно предположить к какой систематической группе
«солнечников» отнести эту находку. В конце XIX века
наблюдался значительный интерес к этим необычным
организмам. Уильям Арчер (William Archer) и Ричард
Грэф (Richard Greeff) один за другим описывали новые
роды и виды (Archer, 1867, 1869; Greeff, 1869, 1873 и
др.). В этот период к солнечникам относили всех сфе-
рически симметричных простейших с лучевидными
псевдоподиями, кроме радиолярий. Последние отлича-
ются от солнечников наличием центральной капсулы и
внутреннего скелета. Кроме того, в отличие от исклю-
чительно морских радиолярий солнечников обнаружи-
вали как в солоноводных, так и в пресноводных место-
обитаниях. Ниже мы увидим, что понимание термина
«солнечники» по мере появления новых исследований
станет углубляться и расширяться.
В ходе накопления данных появились и первые
попытки обобщить и систематизировать разнообра-
зие солнечников. В качестве примера можно привести
систему Шаудина (Schaudinn, 1896), который выделял
следующие группы солнечников:
1) Aphrothoraca. Солнечники, поверхность клетки
которых не несёт каких-либо покровных структур (Ас-
tinophrys, Actinosphaerium, Gymnosphaera и др.);
2) Chlamydophora. Солнечники с аморфными по-
кровными структурами (Chlamydaster (под названием
Astrodisculus). Sphaerastrum. Heterophrys, Lithocolla)\
3) Chalarothoraca. Солнечники с кремнезёмными
чешуйками (Raphidiophrys, Acanthocystis, Pompho-
lyxophrys, Pinaciophora и др.);
4) Desmothoraca. Солнечники с перфорированной
капсулой (Hedriocystis, Clathrulina, Orbulinelld).
Эта система игнорирует устройство клетки солнеч-
ника, и акцент делается только на строении покровов.
Но одна из группировок этой системы (Desmothoraca)
оказалась удачной и сохранилась до сих пор (десмото-
рацидные солнечники).
Большой вклад в изучение солнечников был внесён
знаменитым естествоиспытателем Львом Семёнови-
чем Ценковским. Достаточно упомянуть, что он пер-
вым описал представителей двух отрядов солнечников.
Ему принадлежит первое описание десмоторацидного
солнечника — Clathrulina elegans (Cienkowski, 1867) и
первое описание солнечника со жгутиком — Cilioph-
rys infusionum (Cienkowski, 1876). Последнее открытие
явилось особенно важным, т.к. оно повлекло за со-
бой расширение понятия «солнечники». Теперь в эту
группу стали включать и жгутиконосцев, если они об-
ладают лучевидными псевдоподиями. Позднее были
обнаружены также солнечники с двумя жгутиками
(Heliomorpha, Acinetactis) и с четырьмя жгутиками (Те-
tradimorpha) (Gruber, 1881; Stokes, 1886; Hsiung, 1927).
206
СОЛНЕЧНИКИ
Все эти представители получили название хелиофла-
геллат — отряд Helioflagellida (Hall 1953).
В первой системе простейших, предложенной
Бючли (Butschli, 1880-1882), солнечники (Heliozoa)
наравне с радиоляриями (Radiolaria) и корненожками
(Rhizopoda) входят в состав Sarcodina. В более поздних
системах (Calkins, 1909) появляется таксон Actinopoda,
объединяющий солнечников и радиолярий.
Начало XX века было ознаменовано публикациями
больших сводок по солнечникам Швейцарии (Penard,
1904) и Великобритании (Wailes, 1921).
В работах Пенара прослеживается идея о двух ти-
пах организации клетки солнечника. Кюн (Kuhn, 1926)
реализует эту идею, разделяя солнечников на две груп-
пы:
1) Actinophryida. Солнечники, аксонемы аксоподий
которых сходятся к ядру;
2) Centrohelida. Солнечники, аксонемы аксоподий
которых соединяются в центре клетки.
Эти названия используются до сих пор, хотя состав
соответствующих таксонов сильно изменился.
С изобретением электронного микроскопа нача-
лись и ультраструктурные исследования солнечников.
В 1954 году были опубликованы первые электроно-
граммы. Были исследованы актинофриидный солнеч-
ник Actinophrys sol и центрохелидный солнечник Hete-
rophrys marina (Wohlfarth-Bottermann, Kruger, 1954).
С этого времени актинофриидных солнечников актив-
но изучали с помощью просвечивающей электронной
микроскопии. Они стали моделью для исследования
ультраструктуры микротрубочкового цитоскелета
клетки. Многие работы по этой теме были выполнены
в университете Хиросимы (Япония).
Центрохелидных солнечников интенсивно изучают
как с помощью просвечивающей, так и с помощью ска-
нирующей электронной микроскопии. Для большин-
ства этих организмов электронно-микроскопическое
исследование стало необходимым условием видовой
идентификации.
В 1968 вышла в свет монография Хенрика Райне-
ра (Heinrich Rainer), посвящённая солнечникам (Rainer,
1968). Его система всё ещё базируется только на све-
томикроскопических данных, но при этом уже хорошо
отграничены основные группы солнечников — Acti-
nophryida, Desmothoracida, Rotosphaerida. Гимносфе-
ридные солнечники в этой системе входят в состав
Centrohelida, т.к. на светомикроскопическом уровне их
ЦОМТы очень сходны.
Далее было опубликовано немало работ, по-
свящённых систематике и биологии солнечников.
Стоит отметить самых активных исследователей из
Германии (Christian F. Bardele, Klaus Hausmann, Mon-
ika Durrschmidt), Франции (Colette Febvre-Chevalier,
Jean-Pierre Mignot, Guy Brugerolle), Голландии (Rudi
M.M. Roijackers, Ferry J. Siemensma), Австралии (Roger
Croome, David J. Patterson), Канады (Kenneth H. Nich-
olls) и США (Lloyd A. Davidson, Daniel E. Wujek).
Ультраструктурные исследования актинофриид-
ных, центрохелидных и гимносферидных солнечников
(Febvre-Chevalier, 1973, 1980; Febvre-Chevalier, Febvre,
1984; Bardele, 1975, 1977a, b; Jones, 1976; Patterson,
1979; Durrschmidt, Patterson, 1987a, b) формируют и
новое понимание термина «солнечники». Ключевым
признаком солнечников становится наличие аксопо-
дий — особого типа псевдоподий. Согласно опреде-
лениям, содержащимся в современных руководствах
(Карпов, 2001; Hausmann et al., 2003) аксоподий пред-
ставляют собой неветвящиеся узкоконические или
нитевидные псевдоподии внутри которых находится
аксиальный микротрубочковый цитоскелет. Микро-
трубочки в нем связаны между собой и организованы
в виде тонкого тяжа — аксонемы. Аксоподий есть и
у радиолярий, но у них они лишены экструсом —
стрекательных органелл.
Но постепенно накапливались и данные, плохо
укладывающиеся в эту концепцию. Так, исследова-
ния Барделе и Бружеролля (Bardele, 1972; Brugerolle,
1985) показали, что у десмотрацидных солнечников
микротрубочки в аксонемах не образуют упорядочен-
ной структуры, а сами псевдоподии могут ветвиться и
анастамозировать. Формально такие псевдоподии сле-
довало бы назвать ретикулоподиями (ретикулопо-
д и и — нитевидные ветвящиеся и анастомозирующие
псевдоподии, которые обычно содержат микротрубоч-
ки) (Карпов, 2004; Hausmann et al., 2003). Тем не менее,
ветвление и анастомозы встречаются достаточно ред-
ко, и этим явлением можно пренебречь. Таким образом,
можно всё-таки употреблять термин аксоподий, как и
поступают многие авторы (Brugerolle, 1985; Young et
al., 1995). А вот термин филоподии, употребляемый в
некоторых работах (Bardele, 1972; Mayer, 1997; Mikrju-
kov, 2000a) на наш взгляд неприменим по отношению к
псевдоподиям десмоторацидных солнечников (фило-
подии — это нитевидные, часто ветвящиеся, ино-
гда анастомозирующие псевдоподии, внутри которых
проходит поддерживающий пучок микрофиламентов
или, по крайней мере, отсутствуют микротрубочковые
структуры) (Карпов, 2001; Hausmann et al., 2003). Но
нашлись и солнечники с псевдоподиями, целиком от-
вечающими последнему определению.
Изучение Паттерсоном тонкого строения ещё од-
них «традиционных» солнечников — ротосферид
(Patterson, 1985), показало, что, несмотря на чрезвы-
чайное внешнее сходство с центрохелидными солнеч-
никами (лучистые псевдоподии, эксцентричное поло-
жение ядра, кремнезёмные чешуйки), цитологически
эти организмы скорее близки к филозным амёбам.
А микротрубочковый скелет в псевдоподиях этих про-
тистов вообще отсутствует. Это означает, что они явля-
ются филоподиями, а не аксоподиями, характерными
для других солнечников. Экструсомы в псевдоподиях
ротосферид также отсутствуют. В связи с этим, мно-
гие авторы (Page, 1987; Roijackers, Siemensma, 1988;
Siemensma, 1991; Mikrjukov, 1999; Esteban et al., 2007)
не относят этих протистов к солнечникам и рассма-
тривают ротосферид вместе с филозными амёбами.
На наш взгляд, уместно всё же рассматривать их в со-
ставе не таксономической группы «солнечники», что и
делают многие авторы (Rainer, 1968; Croome, 1987а, b;
Croome et al., 1987). Принимая последнюю точку зре-
СОЛНЕЧНИКИ
207
ния, нужно признать, что главный признак, объединяв-
ший солнечников — аксоподии, несущие экструсомы
также выполняется не всегда.
Весьма неожиданными оказались и результаты
ультраструктурных исследований так называемых хе-
лиофлагеллат. Эти организмы чётко подразделились на
две явно неродственные друг другу группы. В одну из
них вошли представители таких родов как Dimorpha и
Tetradimorpha (отряд Dimorphida Siemensma 1991). Эти
организмы обладают весьма характерным и во многом
уникальным набором ультраструктурных признаков
(Brugerolle, Mignot, 1983; 1984а, b). А вот тонкое стро-
ение представителей других родов бывших хелиофла-
геллат — Ciliophrys, Actinomonas, Pteridomonas оказа-
лось чрезвычайно сходным с таковым своеобразных
фото- и миксотрофных протистов — представителей
родов Pedinella, Pseudopedinella и др. На основании
этого сходства Циммерман с соавторами (Zimmermann
et al., 1984) объединили их в один порядок, которому
они в соответствии с правилами ботанической номен-
клатуры дали название Pedinellales, а мы в рамках это-
го зоологического издания будем рассматривать его как
отряд Pedinellida. Так в состав солнечников вошли уже
не сферически симметричные, а радиально симметрич-
ные протесты, включая автотрофные формы. Это вновь
расширило термин «солнечники», и сделало ещё более
сложной задачу общей характеристики этой гетероген-
ной группы. Тем не менее, гетеротрофные пединнели-
ды, в особенности представители рода Ciliophrys явно
отвечают понятию «солнечник», а ультраструктурное
сходство заставляет рассматривать вместе с ними и их
ближайших автотрофных родственников.
Итогом электронно-микроскопических исследова-
ний можно назвать систему солнечников, предложен-
ную супругами Февр (Febvre-Chevalier, Febvre, 1984).
Она в первую очередь основана на строении ЦОМТов,
и в ней солнечники подразделены на следующие груп-
пы:
1) Cryptaxohelida. Солнечники, аксопласт которых
ассоциирован с ядерной оболочкой (Desmothoracida,
Actinophryida, Pedinellida; Taxopodida);
2) Phaneraxohelida
— Axoplasthelida — солнечники с центральным ак-
сопластом и гексагональной укладкой микротрубочек
аксонем (Gymnosphaerida);
— Centroplasthelida — солнечники обладающие
центропластом (Centrohelida);
— Nucleoplasthelida — солнечники аксопласт, кото-
рых окружён ядром или имеет линзовидную форму и
располагается вблизи ядра (Dimorphida).
Мы видим, что в составе Cryptaxohelida супруги
Февр рассматривают еще один отряд — Taxopodida
Fol 1882. Этот монотипный таксон включает в себя
только один вид — Sticholonche zanclea Hertwig 1899.
Представители этого вида — облигатные океаниче-
ские планктёры. Аксоподии не служат им для питания,
а лишь участвуют в локомоции — они работают как
миниатюрные вёсла. Но наличие внешнего скелета —
кремнезёмных веретеновидных чешуек в сочетании с
отсутствием центральной капсулы сближает таксопо-
дид с солнечниками. Таким образом, мы вновь сталки-
ваемся с расширением этого понятия.
Многие авторы, основываясь на глубоких ультра-
структурных различиях, стали относить солнечников
к разным группам протистов, сформировалась концеп-
ция полифилетичности Heliozoa (Davidson, 1982; Bru-
gerolle, Mignot, 1984b; Smith, Patterson, 1986 и др.).
Эту идею горячо поддержал и другой исследова-
тель солнечников — Кирилл Александрович Микрю-
ков. Он опубликовал серию работ (Микрюков, 1998,
2000; Mikrjukov, 1999, 2000а, b; Mikrjukov, Patterson,
2001), завершившуюся монографией по центрохелид-
ным солнечникам (Микрюков, 2002), в которых, в част-
ности, выдвинул гипотезы происхождения и эволюции
различных групп этих протистов.
В XXI веке солнечники стали объектом молекуляр-
но-генетических исследований (Nikolaev et al., 2004;
Cavalier-Smith, von der Heyden, 2007). Работы этих авто-
ров поддержали гипотезу о полифилетичности группы,
но пролить свет на положение многих таксонов солнеч-
ников в системе протистов по-прежнему не удалось.
Таким образом, современные исследования показа-
ли, что большинство солнечников имеют только внеш-
нее сходство и не связаны друг с другом филогенетиче-
ски. Тем не менее, удобно по прежнему рассматривать
солнечников как единую группу, не придавая этому объ-
единению таксономического смысла. Как было показа-
но выше, некоторые необычные таксоны удобно всё же
включать в состав этой сборной группы в силу разных
причин. Ротосферид — из-за сходства чешуек, димор-
фид — из-за сходной клеточной организации (ЦОМТ,
аксоподиальная система), фото- и миксотрофных пе-
динеллид — из-за их ультраструктурного сходства с
фаготрофными Pteridomonas, Actinomonas и Ciliophrys.
Большую роль также играет исторически сложившиеся
традиции и общие подходы к изучению солнечников.
Лишь в отношении отряда Taxopodida мы склонны со-
гласиться с точкой зрения К. Микрюкова (Микрюков,
1998) о том, что их стоит относить к другой нетаксоно-
мической группе — радиолярии в силу того, что они не
используют аксоподии для захвата добычи и всю жизнь
проводят в планктоне. Здесь соображения, основанные
на морфологии, не вступают в противоречие с совре-
менными представлениями о филогении — согласно
исследованию таких молекулярных маркеров как 18S
рДНК и ген актина таксоподиды вместе с акантариями
образуют группу сестринскую полицистинам (Nikolaev
et al., 2004).
Строение клетки солнечников
Покровы. Клетка солнечника покрыта плазмалем-
мой. У некоторых представителей группы (Actinophrys,
Actinosphaerium, Oxnerella maritima, Gymnosphaera
albida и др.) плазмалемма не несёт никаких специ-
альных образований (рис. 136, A) (Dobell, 1917; Jones,
1976; Patterson, 1979), в то время как у большинства
солнечников клетку покрывают чешуйки или окружает
органическая капсула.
208
СОЛНЕЧНИКИ
Рис. 136. Типы организации покровов.
А — клетка, окружённая только плазмалеммой; Б — клетка, окружённая мукополисахаридной капсулой; В — клетка заключена в перфорированную
капсулу; Г — клетка окружена органическими чешуйками (спикулами), погружёнными в мукополисахаридную капсулу; Д — клетка покрыта крем-
незёмными чешуйками.
У солнечников можно выделить следующие типы
внеклеточных покровных структур:
1) Мукополисахаридная капсула (рис. 136, Б).
Встречается у десмоторацидных и центрохелидных
солнечников (Durrschmidt, Patterson, 1987а; Mayer,
Kreutz, 1998).
2) Органическая перфорированная капсула, не при-
легающая к поверхности клетки. Встречается у многих
десмоторацидных солнечников (рис. 136, В) (Bardele,
1972; Brugerolle, 1985).
3) Слой органических чешуек, погружённых в
мукополисахаридный матрикс. Встречается у неко-
торых центрохелидных солнечников и пединеллид
(рис. 136, Г) (Bardele, 1975; Febvre-Chevalier, Febvre,
1984; Koutoulis et al., 1993).
4) Слой кремнезёмных чешуек, погружённых в
мукополисахаридный матрикс. Встречается у боль-
шинства центрохелидных солнечников и ротосферид,
а возможно также у гимносферидных солнечников
(рис. 136, Д) (Febvre-Chevalier, 1973; Rees et al., 1981;
Kinoshita et al., 1995).
Псевдоподии. Солнечники используют аксоподий
для питания и локомоции. Аксиальный тяж микротру-
бочек в аксоподиях может весьма быстро разбираться.
Так, потревоженный солнечник очень быстро втягива-
ет аксоподий, причем нередко это происходит за доли
секунды (Davidson, 1975).
Аксоподий играют роль при захвате и удержании
добычи. С их помощью добыча может подтягиваться к
телу клетки. Однако для фагоцитоза солнечники обра-
зуют короткие массивные воронковидные псев-
доподии, подобные лобоподиям голых амёб.
Микротрубочки аксонемы соединяются между со-
бой с помощью белковых мостиков, число которых
в литературе получило название валентности ми-
кротрубочки. Благодаря мостикам микротрубочки
аксонем, как правило, имеют характерный паттерн
укладки, который хорошо виден на поперечном срезе
аксоподий. Можно выделить следующие паттерны:
1) Четырёхвалентные микротрубочки, образующие
орнамент из чередующихся шестиугольников и равно-
сторонних треугольников (большинство Centrohelida)
(рис. 137, Л) (Bardele, 1977а, b);
2) Поливалентные микротрубочки, сгруппирован-
ные в две вложенные друг в друга спирали (Actinophry-
ida) (рис. 137, Б) (Jones, Tucker, 1981);
3) Трёхвалентные микротрубочки, сгруппирован-
ные в гексагональный орнамент (Gymnosphaerida)
(рис. 137, Д) (Febvre-Chevalier, 1973, 1980; Jones, 1975);
4) Четырёхвалентные микротрубочки, чередую-
щиеся в шахматном порядке (некоторые Dimorphida)
(рис. 137, 3) (Brugerolle, Mignot, 1984b);
5) Двухвалентные микротрубочки, образую-
щие один равносторонний треугольник (Pedinellida)
(рис. 137, Е) (Larsen, 1985; Daugbjerg, 1996а);
6) Микротрубочки различной валентности, лежа-
щие неупорядоченно (Desmothoracida, некоторые Di-
morphida) (рис. 137, Г, Ж) (Bardele, 1972; Brugerolle,
1985).
Центры организации микротрубочек (ЦОМТы).
У солнечников выделяют два основных типа цитоплаз-
матических ЦОМТов — центропласты (рис. 138, Л) и
аксопласты (рис. 138,Б).
Центропласт, как и следует из названия, распо-
лагается в центре клетки солнечника. Эта органелла
представляет собой трёхслойный электронно-плотный
диск, окружённый двумя менее плотными полусфера-
ми (Dobell, 1917; Kormos, 1971; Bardele, 1975; Febvre-
СОЛНЕЧНИКИ
209
Рис. 137. Схемы организации аксонем аксоподий.
А — Centrohelida (Polyplacocystis ambigua}\E— Actinophryida (Actinosphaerium eichhorniip В — Actinophryida, типы микротрубочек; Г— Desmotho-
racida (Clathrulina elegans); Д — Gymnosphaerida (Actinocoryne contractilis}; E — Pedinellida (Pteridomonas danica)\ Ж — Dimorphida (Tetradimorpha
radiatd)\ 3 — Dimorphida (Heliomorpha mucosa}. (По: Bardele, 1977 —Л; Mikijukov, Patterson, 2001 — E\ Cachon et al., 1973 — B\ Bardele, 1972 —Г;
Febvre-Chevalier, 1980 —Д; Patterson, Fenchel, 1985 —£; Brugerolle, Mignot, 1984 —Ж, 3}.
Chevalier, Febvre, 1984). Всю эту структуру окружает
зона, в которой находятся белковые филаменты (Rieder,
1979) и где берут начало проксимальные концы аксо-
нем. Центропласт характерен для центрохелидных сол-
нечников.
Аксопласты — ЦОМТы, представляющие собой
сгустки электронно-плотного, фибриллярного или
гранулярного материала (Jones, 1976; Patterson, 1979;
Febvre-Chevalier, 1980; Febvre-Chevalier, Febvre, 1984;
Brugerolle, Mignot, 1984b; Brugerolle, 1985; Daugbjerg,
1996a). Локализация аксопластов может быть различ-
ной. Очень часто они связаны с ядерной оболочкой
(Actinophryida, Pedinellida, Desmothoracida). Также ак-
сопласт может располагаться в центре клетки (Gymno-
sphaerida). У некоторых диморфид его облегает чаше-
видное ядро.
Экструсомы. Псевдоподии большинства солнеч-
ников несут экструсомы, на светомикроскопическом
уровне имеющие вид гранул. Они способны переме-
щаться вдоль псевдоподии (Troyer, 1975; Bardele, 1976;
210
СОЛНЕЧНИКИ
Рис. 138. ЦОМТы. "
А — центропласт Centrohelida (HeterophrysY Б— аксопласт Actinophryida (Actinosphaerium). (Flo^ardele, 1977 — А\ Jones, Tucker, 1981 —Б).
Рис. 139. Экструсомы.
А — мукоциста Actinophryida (Actinophrys taurianini)\ Б — экструсома с фибриллярным содержимым Actinophryida (Actinophrys taurianini)\ В — экс-
трусома с гранулярным содержимым Actinophryida (Actinophrys taurianini)', Г— кинетоциста Centrohelida (Chlamydaster laciniatus}. аэ — аксиальный
элемент, к — конусовидный наконечник, кк — кожух кинетоцисты; с — связка с плазмалеммой; ш — шаровидное основание. (По: Микрюков, 1996 —
A-В; Diirrschmidt, Patterson, 1987 — Г).
Suzaki et al., 2003). Такие же экструсомы расположе-
ны и в кортикальной зоне клетки. Эти субмембранные
органеллы способны выбрасывать своё содержимое в
ответ на механические, химические или электрические
стимулы (Hausmann, 1978). Экструсомы окружены
мембраной; своим апикальным концом каждая экстру-
сома контактирует с плазмалеммой клетки (Davidson,
1976). При «срабатывании» экструсомы, её мембра-
на встраивается в плазмалемму клетки, а содержимое
высвобождается наружу (Patterson, Hausmann, 1981;
Sakaguchi et al., 2002).
Наиболее простым типом экструсом являются
мукоцисты (рис. 139, А). Они содержат электрон-
но-плотный мукополисахаридный секрет, способству-
СОЛНЕЧНИКИ
211
ющий повышению адгезивных свойств псевдоподии.
Такой тип экструсом встречается у актинофриидных
и гимносферидных солнечников, диморфид, а также
у пединеллид (Anderson, Beams, 1960; Jones, 1976; Fe-
bvre-Chevalier, 1980; Larsen, 1985; Mikrjukov, 2000b).
У актинофриидных солнечников, помимо мукоцист
встречаются мукоцистоподобные экструсомы с во-
локнистым (рис. 139, Б) или гранулярным (рис. 139,
В) материалом (Patterson, 1979; Mikrjukov, Patterson,
2001).
Более сложный тип экструсом — кинетоцисты
(рис. 139, Г). Эти органеллы получили свое название,
благодаря способности перемещаться вдоль аксопо-
дий. Тем не менее, к перемещению способны и муко-
цисты. Характерной же чертой кинетоцист является их
сложная организация. Внутри каждой экструсомы это-
го типа располагается аксиальный элемент, ко-
торый окружён специальным кожухом. Эти органеллы,
как и мукоцисты, позволяют аксоподиям удерживать те
или иные объекты. Наличие кинетоцист характерно для
центрохелидных, десмоторацидных и гимносферид-
ных солнечников, а также для диморфид (Bardele, 1972;
Davidson, 1973; Febvre-Chevalier, 1980; Brugerolle, Mi-
gnot, 1984b; Durrschmidt, Patterson, 1987a, b).
У ротосферид экструсомы не обнаружены (Patter-
son, 1985).
Вакуолизация и компартментализация цито-
плазмы клетки. У некоторых представителей сол-
нечников (Actinophryida, Gymnosphaerida) цитоплазма
клетки достаточно отчетливо разделена наэктоплаз-
м у, содержащую крупные и многочисленные вакуоли и
эндоплазму, вакуолей в которой гораздо меньше и
сами они гораздо мельче (Febvre-Chevalier, 1973; Jones,
1976; Suzaki et al., 1980; Patterson, Hausmann, 1981;
Sakaguchi et al., 1998). Функциональное значение тако-
го разделения цитоплазмы пока не ясно.
Иногда на периферии клетки солнечников (цен-
трохелидные солнечники Raphidiophrys, Raphidocystis,
Acanthocystis, гимносферидный солнечник Gymnos-
phaera albida) располагается система лакун (lacu-
nar system), представляющих собой глубокие впячива-
ния плазмалеммы (Jones, 1976; Durrschmidt, Patterson,
1987b).
Пищеварительные вакуоли у солнечников могут
располагаться как в центральной части (некоторые Ac-
tinophryida), так и на периферии клетки (Gymnosphaeri-
da, Centrohelida, Desmothoracida, Pedinellida, Dimorphi-
da) (Bardele, 1972; Febvre-Chevalier, 1980; Brugerolle,
Mignot, 1984b; Larsen, 1985; Daugbjerg, 1996a). Также
описано переваривание крупных пищевых объектов в
особых «гигантских» периферических вакуолях, силь-
но выступающих на поверхности клетки (рис. 140)
(Actinophryida) (Suzaki et al., 2003).
В клетках пресноводных солнечников, как правило,
имеется одна или несколько сократительных вакуолей.
Ядро. Ядро может располагаться в центре клетки
(акгинофриидный солнечник Actinophrys, часть Des-
mothoracida, Pedinellida, Dimorphida) или на ее пери-
ферии (Centrohelida, некоторые Desmothoracida, Roto-
sphaerida, гимносферидный солнечник Hedraiophrys
Рис. 140. Образование периферической вакуоли у Actinophrys sol.
В правом нижнем углу — время, прошедшее с момента захвата пищево-
го объекта (в минутах). (По: Linnenbach, Hausmann, 1985).
hovassel). Многочисленные ядра гимносферидного сол-
нечника Actinocoryne contractilis находятся в его распла-
станном по субстрату амебоидном основании. У много-
ядерных солнечников Actinosphaerium (Actinophryida)
и Gymnosphaera albida (Gymnosphaerida) ядра хаотич-
но разбросаны в цитоплазме.
Ядрышковый материал в ядрах клеток солнечников
может иметь различную локализацию. Встречаются
везикулярные ядра с одним крупным ядрышком (Cen-
trohelida, актинофриидный солнечник Actinosphaerium
eichhornii, Desmothoracida, гимносферидный солнеч-
ник Actinocoryne contractilis', Dimorphida, большинство
Pedinellida) (Barrett, 1958; Swale, 1969; Bardele, 1972;
Brugerolle, Mignot, 1984b; Febvre-Chevalier, Febvre,
1984; Larsen, 1985). Ядрышковый материал может об-
разовывать кайму на периферии ядра (Actinophrys
sol, A. salsuginosa, Actinosphaerium nucleofilum) (Bar-
rett, 1958; Patterson, 1979; Mikrjukov, Patterson, 2001).
По предположению Микрюкова и Паттерсона у пе-
динеллиды Ciliophrys azurina имеется и центральное
ядрышко, и кайма ядрышкового материала под ядерной
оболочкой (Mikrjukov, Patterson, 2001). У актинофриид-
ного солнечника Actinophrys taurianini и гимносферид-
ных солнечников Gymnosphaera albida и Hedraiophrys
hovassei на периферии ядра располагаются немного-
численные шаровидные ядрышки (Febvre-Chevalier,
1973; Jones, 1976; Mikrjukov, Patterson, 2001). Ядерная
ламина может быть выражена в различной степени.
Так, даже в пределах сравнительно компактной группы
гимносферидных солнечников у Hedraiophrys hovassei
она развита хорошо, а у Actinocoryne contractilis не вы-
ражена вовсе (Febvre-Chevalier, 1980).
212
СОЛНЕЧНИКИ
А
г
Рис. 141. Митохондрии.
А — Centrohelida (Acanthocystis); Б — Rotosphaerida (Pompholyxophrys}; В — Actinophryida (Actinophrys salsuginosa); Г— Desmothoracida (Hedriocystis
pellucida); Д— Heliomonadida (Tetradimorpha); E — Gymnosphaerida (Actinocoryne contractilisy Ж — Pedinellida (Pedinella). (По: Микрюков, 2002 —
Л, Б, Г-Ж; Mikijukov, Patterson, 2001 — В).
Деление ядер солнечников в изученных группах
происходит по типу открытого (Dimorphida) или
полузакрытого (Centrohelida, Pedinellida, Acti-
nophryida) ортомитоза (Raikov, 1994). У гимнос-
феридных и десмоторацидных солнечников, а также у
ротосферид тип митоза пока не установлен.
Митохондрии. Среди различных групп солнечни-
ков встречаются кристы митохондрий всех трёх типов,
выделенных Л.Н. Серавиным (Серавин, 1993): ла-
меллярные (lamellar), везикулярные (vesicu-
lar) и тубулярные (tubular)(Febvre-Chevalier,Febv-
re, 1984; Siemensma, 1991).
Ламеллярные кристы у центрохелидных солнечни-
ков встречаются в форме лентовидных (ribbon-
like) крист (рис. 141, Л), а у ротосферид (рис. 141,5) —
в форме дисковидных (disc-like).
СОЛНЕЧНИКИ
213
Кристы везикулярного типа характерны для акти-
нофриидных солнечников, у которых они встречают-
ся в форме пузырьковидных (bleb-like) крист
(рис. 141, В). Везикулярные кристы десмоторацидных
солнечников имеют ампуловидную (ampula-like)
форму (рис. 141, Г)-
Тубулярные кристы характерны для митохондрий
гимносферидных солнечников, пединеллид и димор-
фид(рис. 141, Д-Ж).
Стебельки. Многие виды солнечников ведут си-
дячий образ жизни и образуют стебельки для при-
крепления к субстрату. В наибольшей степени это
характерно для десмоторацидных солнечников (Clath-
rulina, Hedriocystis, Penardiophrys, Cienkowskya, Acti-
nosphaeridiuni). У них стебелёк является внеклеточной
структурой и представляет собой полую трубку из во-
локнистого материала, который обычно (за исключени-
ем A ctinosphaeridium) представляет собой единое целое
с капсулой, покрывающей клетку (Bardele, 1972; Bru-
gerolle, 1985). Полый стебелёк характерен и для цен-
трохелидного солнечника Heterophrys minutus (Febvre-
Chevalier, Febvre, 1984). Центрохелидный солнечник
Polyplacocystis arborescens, прикрепляется к субстрату
мукополисахаридным стебельком, покрытым кремне-
зёмными чешуйками.
У гимносферидного солнечника Actinocoryne
contractilis имеется цитоплазматический стебелёк, об-
ладающий сократимостью и представляющий собой
часть цитоплазматического тела клетки (Febvre-Cheva-
lier, 1980). Для некоторых пединеллид (Pteridomonas,
Actinomonas, Pedinelld) характерны стебельки, пред-
ставляющие собой специализированные аксоподий.
Как и аксоподия, стебелёк поддерживается аксонемой
из трёх микротрубочек и способен сокращаться (Lars-
en, 1985; Patterson, Fenchel, 1985).
Питание
Подавляющее большинство солнечников являются
гетеротрофными организмами. Только некоторые педи-
неллиды питаются миксотрофно или автотрофно, так
как у них имеются хлоропласты. Пищей солнечников
могут стать мелкие живые организмы: бактерии, водо-
росли, жгутиконосцы, коловратки, нематоды, гастро-
трихи, личинки различных многоклеточных животных,
зооспоры грибов, а также другие солнечники (рис. 142)
(Bovee, Cordell, 1971; Batko, Hassan, 1988; Siemensma,
1991). Некоторые мелкие солнечники могут существо-
вать, питаясь только бактериями (Brugerolle, 1985).
Коснувшись кончика аксоподий центрохелидного
солнечника, подвижный микроорганизм моментально
оказывается обездвижен. В случае актинофриидно-
го солнечника, жертва остаётся живой и подвижной
до момента собственно фагоцитоза и переваривания
(рис. 143).
Удержанию пищи способствуют расположенные
на поверхности аксоподий экструсомы, выделяющие
клейкие вещества и заякоривающие пищевой объект
(Sakaguchi et al., 2002). Постепенно солнечник форми-
Рис. 142. Raphidiophrys elegans поедает Chlamydaster sterni.
А — образование воронковидной псевдоподии: Re — Raphidiophrys ele-
gans, Chs — Chlamydaster sterni', Б — образование пищеварительной ва-
куоли. (По: Siemensma, 1991).
Рис. 143. Схема питания Actinosphaerium eichhornii.
А — добыча контактирует с аксоподиями; Б — добыча подтягивается
к внешнему слою цитоплазмы; В — образование воронковидной псев-
доподии; Г — образование пищеварительной вакуоли; Д — пищевари-
тельная вакуоль транспортируется в эндоплазму. (По: Siemensma, 1991).
рует или подтягивает другие аксоподий, и перемещает
захваченный пищевой объект к внешнему слою цито-
плазмы. Там добыча либо фагоцитируется при помощи
лишенной микротрубочкового цитоскелета короткой
воронковидной псевдоподии, либо же пищеваритель-
ная вакуоль образуется путем впячивания клеточной
мембраны (Nicholls, 1983). После завершения пище-
варения не переваренные остатки выбрасываются на-
ружу.
Жизненный цикл
Жизненный цикл многих солнечников начинается
и оканчивается бинарным делением клетки. При не-
благоприятных условиях образуются цисты покоя. Для
214
СОЛНЕЧНИКИ
Рис. 144. Жизненный цикл Desmothoracida (Clathrulina elegans).
А — питающаяся особь; Б — деление клетки; В — развитие жгутиков у одной из дочерних клеток; Г — зооспора; Д — оседание зооспоры; Е — раз-
витие псевдоподий; Ж— разборка жгутиков; 3 — секреция стебелька и капсулы. (По разным авторам).
некоторых представителей характерно множественное
деление (плазмотомия) (Actinosphaerium^ Actinoco-
ryne contractilis) (Barrett, 1958; Febvre-Chevalier, 1980).
Более сложен жизненный цикл десмоторацидных сол-
нечников (рис. 144) (Bardele, 1972). В нём присутствует
расселительная стадия в виде зооспоры. В некоторых
группах описан половой процесс, а также агамные сли-
яния клеток (Belaf, 1923; Peters, 1966; Sakaguchi et al.,
2001).
Половой процесс подробно описан у актинофри-
идных солнечников (Peters, 1966; Mignot, 1979, 1980,
1981). Он представляет собой педогамию в цисте, с
образованием амебоидных гамет. Существуют также
фрагментарные данные о половом процессе у гимно-
сферидных солнечников, при котором происходит
образование и слияние двужгутиковых гамет (Jones,
1976).
Образование покоящихся цист описано у акти-
нофриидных, центрохелидных, десмоторацидных
солнечников и у пединеллид (Bardele, 1972; Patterson,
Thompson, 1981; Durrschmidt, Patterson, 1987b; Thom-
sen, 1988; Newman, Patterson, 1993). Покровные струк-
туры клетки (чешуйки, капсула) часто служат внешней
оболочкой цисты. Также, как правило, образуется один
или несколько дополнительных защитных слоёв. Акти-
нофриидные солнечники, поверхность клетки которых
на трофической стадии не несёт каких либо покровных
структур строят многослойную оболочку, включающую
слой кремнезёмных чешуек (Patterson, Thompson, 1981;
Mikrjukov, Patterson, 2001). У центрохелидных солнеч-
ников чешуйки есть и на трофической стадии, но при
инцистировании, формируется дополнительный слой
морфологически отличающихся чешуек (Durrschmidt,
Patterson, 1987b). Десмоторацидные солнечники обра-
СОЛНЕЧНИКИ
215
Рис. 145. Агамные слияния.
А — псевдокопуляция; Б — псевдоконьюгация. пв — пищеварительная
вакуоль.
зуют цисту внутри перфорированной капсулы. Неред-
ко, инцистированию у этих солнечников предшествует
одно или несколько бинарных делений и в капсуле ока-
зывается несколько цист (Bardele, 1972).
Агамные слияния. Агамные слияния по типу
временной псевдокопуляции — полного
слияния клеток (рис. 145, А) (Серавин, Гудков, 1984),
весьма характерны для актинофриидных солнечников,
а также периодически отмечаются у центрохелидных
солнечников и пединеллид (Pteridomonas, Ciliophrys)
(Shigenaka, Kaneda, 1979; Patterson, Fenchel, 1985; Sak-
aguchi et al. 2002; Looper, 2005). Нередко эти слияния
имеют место при совместном питании нескольких сол-
нечников. Псевдокопуляция может быть как бинарной,
так и множественной. Цитоплазма сливается, и солнеч-
ники на время образуют единый организм. Аксоподий
при этом не теряют своей формы. В центре образуется
крупная пищеварительная вакуоль, в которой перева-
ривается пища. По окончании переваривания солнеч-
ники вновь расходятся, превращаясь в самостоятель-
ные организмы.
Другой тип слияний — временная псевдо-
коньюгация. При псевдоконьюгации слияние осу-
ществляется за счёт образования цитоплазматического
мостика между клетками (рис. 145, Б). Этот тип агам-
ных слияний встречается у актинофриидных солнеч-
ников.
Колонии. Центрохелидные солнечники (некоторые
Heterophrys, Sphaerastrum, некоторые Raphidiophrys)
образуют колонии из одноядерных особей, связанных
между собой цитоплазматическими мостиками (Walz,
2006).
Десмоторацидные солнечники могут существовать
в виде древовидных колоний. Их образования является
результатом метаморфоза дочерней особи на материн-
ской капсуле (Bardele, 1972). Похожие колонии могут
образовывать и пединеллиды, но здесь это результат
недоведённого до конца деления клетки (Высоцкий,
1887).
Движение
В целом, солнечники малоподвижны и способны
лишь пассивно флотировать в толще воды. Известна
способность этих протистов перекатываться по суб-
страту за счёт укорачивания одних псевдоподий и удли-
нения других. Скорость такого движения у актинофри-
идных солнечников может достигать 100 мкм в минуту,
что вполне сравнимо со скоростью амебоидного дви-
жения (Rainer, 1968; Watters, 1968).
Многие из этих протистов (диморфиды и пединел-
лиды, зооспоры десмоторацидных и гимносферидных
солнечников) передвигаются при помощи жгутиков.
Распространение
Среди солнечников встречаются как пресноводные,
так и морские виды, однако последних описано значи-
тельно меньше. Несколько видов обнаружено в почве,
где они достигают иногда большой численности (Ни-
колюк, Гельцер, 1972). Богатым солнечниками является
биотоп сфагнового болота. Они преимущественно за-
селяют прибрежные зоны водоёмов и нередко встре-
чаются в зарослях нитчатых водорослей (Siemensma,
1991).
В литературе существует две точки зрения на образ
жизни этих протистов. Некоторые авторы считают их
планктонными организмами, отмечая их присутствие в
пелагиали (Canter, 1966; Arndt, 1993; Stensdotter-Blom-
berg, 1998). Целый ряд авторов (Durrschmidt, 1985; Sie-
mensma, Roijackers, 1988a, b; Mikijukov, 1993; и др.)
считают выход в планктон факультативным явлением,
способствующим расселению, и предполагают, что
большую часть жизни солнечники проводят как бен-
тосные организмы. Вторая точка зрения кажется нам
более обоснованной, учитывая обилие прикреплённых
к субстрату форм среди солнечников. Однако, прини-
мая во внимание гетерогенность этой группы проти-
стов и регулярные находки солнечников в планктонных
пробах, следует предположить, что некоторые солнеч-
ники всё же ведут пелагический образ жизни.
216
СОЛНЕЧНИКИ. CENTROHELIDA
Отряд Centrohelida KQhn 1926
ЦОМТ центрохелидных солнечников представ-
лен центропластом. Микротрубочки аксонем образу-
ют паттерн в форме шестиугольника. В более сложно
организованных аксонемах наблюдается чередование
шестиугольников и равнобедренных треугольников из
микротрубочек. В редких случаях в состав паттерна
входят многоугольники с другим количеством микро-
трубочек. Экструсомы относятся к типу кинетоцист.
Аксиальный элемент кинетоцисты имеет сферическое
основание и коническую вершину. Ядро располага-
ется на периферии клетки. В середине ядра находит-
ся единственное ядрышко. Внеклеточные покровные
структуры отсутствуют (род Oxnerella), представлены
мукополисахаридной капсулой (род Chlamydaster) или
слоем внеклеточных чешуек, которые могут быть как
полностью органическими, так и кремнифицирован-
ными. Описано инцистирование. Кристы митохондрий
ламеллярные, лентовидной формы. Пресноводные и
морские организмы. Распространены всесветно. В со-
ставе отряда выделяют 3 семейства: Heterophryidae,
Raphidiophryidae и Acanthocystidae1.
Классификация
Отряд Centrohelida Kuhn 1926
Сем. Heterophryidae Poche 1913
Род Oxnerella Dobell 1917
Род Chlamydaster Rainer 1968
Род Sphaerastrum Greeff 1873
Род Heterophrys Archer 1869
Сем. Raphidiophryidae Mikrjukov 1996
VQjxParasphaerastrum Mikrjukov 1996
Род Polyplacocystis Mikrjukov 1996
Род Raphidiophrys Archer 1867
Род Raphidocystis Penard 1904
Сем. Acanthocystidae Claus 1874
Род Heteroraphidiophrys Mikrjukov et Patterson 2002
Род Pseudoraphidocystis Mikrjukov 1997
Род Pseudoraphidiophrys Mikrjukov 1997
Род Pterocystis Siemensma et Roijackers 1988
Род Raineriophrys (Mikrjukov 2001) Mikrjukov 2002
Род Choanocystis Penard 1904
Род Acanthocystis Carter 1863
Морфология и биология
Покровы. За исключением плохо исследованного
солнечника Oxnerella maritima, у всех центрохелидных
солнечников есть те или иные внеклеточные покровные
структуры (Микрюков, 2002; Siemensma, 1991). Они
1 При подготовке этой главы мы отдали предпочтение более
старой классификации Микрюкова (2002), которая основана на морфо-
логических данных. Классификация, предложенная Кавалье-Смитом и
фон дер Хейден (Cavalier-Smith, von der Heyden, 2007), основана как
на морфологических, так и на молекулярно-генетических данных. Воз-
можно, она лучше отражает филогенетические связи между различными
представителями этой группы, но для ознакомления читателя с разноо-
бразием центрохелидных солнечников мы предпочли более удобный для
восприятия вариант, основанный на морфологии. Новая классификация
будет рассмотрена в разделе «Систематика и филогения». — Прим. авт.
могут быть представлены мукополисахаридной кап-
сулой (Chlamydaster). У других представителей {Hete-
rophrys, Sphaerastrum) в покрывающем клетку мукопо-
лисахаридном слое находятся органические чешуйки
(спикулы). Спикулами у центрохелид принято на-
зывать простые органические чешуйки, имеющие вы-
тянутую форму. Они могут>быть ориентированы как
тангентально (рис. 146,^4^ так и радиально (рис. 146,
Б) (Bardele, 1975; Febvre-Chevalier, Febvre, 1984).
У большинства центрохелидных солнечников клет-
ку покрывают чешуйки, состоящие из кремнезёма.
У Parasphaerastrum клетку покрывают вытянутые че-
шуйки, напоминающие спикулы Sphaerastrum и Hete-
rophrys, но тоже кремнефицированные. В остальных
случаях, всегда присутствует слой пластинчатых крем-
незёмных чешуек (plate-scales), большей частью ориен-
тированных тангентально по отношению к поверхности
клетки. Кроме того, у ряда видов присутствуют ради-
альные кремнезёмные чешуйки (spine-scales) одного
или нескольких типов, ориентированные параллельно
аксоподиям. Наконец, один из представителей центро-
хелидных солнечников—Raphidiophrys heterophryoidea
обладает как спикулами, так и тангентальными, крем-
незёмными чешуйками (Zlatogursky, 2011).
Пластинчатые чешуйки нередко несут по краю
полую маргинальную кайму (рис. 146, В), хотя могут
ее и не иметь (рис. 146, Г). Иногда встречаются во-
ронковидные и трубковидные чешуйки (рис. 146, Д,
Е). Радиальные чешуйки, как правило, имеют упло-
щённое основание, обращённое к поверхности клетки
(рис. 146, Ж).
Аксоподии. Аксоподии центрохелидных солнеч-
ников очень тонкие. На всём протяжении аксоподии её
толщина практически неизменна.
Паттерн упаковки микротрубочек в аксонеме до-
статочно сложен и варьирует у различных представи-
телей центрохелидных солнечников. В наиболее про-
стом случае аксонема представлена только шестью
микротрубочками, образующими равносторонний ше-
стиугольник. Такой паттерн можно наблюдать в аксо-
подиях представителей рода Chlamydaster (рис. 147, А)
(Durrschmidt, Patterson, 1987а). Также организованы
аксоподии у представителей некоторых штаммов Het-
erophrys marina. У других штаммов этого вида есть
ещё шесть микротрубочек, образующих со сторона-
ми шестиугольника равносторонние треугольники
(рис. 147, Б) (Bardele, 1975, 1977b). У Н. magna за счёт
дополнительных микротрубочек образуется ещё три
пары пятиугольников (рис. 147, В) (Bardele, 1977b).
У Н. elati вокруг центрального шестиугольника микро-
трубочек лежат многочисленные неупорядоченные
микротрубочки не связанные друг с другом мостиками
(рис. 147, Г) (Bardele, 1975, 1977b). У Н. minutus во-
круг центрального шестиугольника можно наблюдать
многоугольники из четырёх, семи, девяти и даже один-
надцати микротрубочек (рис. 147, Д) (Febvre-Chevalier,
Febvre, 1984). У представителей родов Polyplacocystis,
СОЛНЕЧНИКИ. CENTROHELIDA
217
Рис. 146. Типы чешуек.
А — тангентальные спикулы (Sphaerastrum fockii); Б — радиальные спикулы (Heterophrys marina); В — тангентальная кремнезёмная чешуйка с по-
лой маргинальной каймой (Raphidocystis tubifera); Г—тангентальная кремнезёмная чешуйка без полой маргинальной каймы (Choanocystis rhytidos);
Д,Е — воронковидные кремнезёмные чешуйки (Raphidocystis glabra); Ж—радиальная кремнезёмная чешуйка (Raineriophrys echinata). (По: Микрю-
ков, 2002 —А, Б; Siemensma, 1991 —В-Ж).
Рис. 147. Схемы расположения аксонемных микротрубочек.
А — Chlamydaster, некоторые штаммы Heterophrys marina; Б — некоторые штаммы Heterophrys marina; В — Heterophrys magna; Г — Heterophrys
е1ай;Д—Heterophrys minutus; E — Acanthocystis pectinata. Такой же паттерн характерен и для остальных центрохелидных солнечников. (По: Bardele,
1977 — А-Г, Е; Febvre-Chevalier, Febvre, 1984 — Д).
218
СОЛНЕЧНИКИ. CENTROHELIDA
Рис. 148. Гипотетическая схема сборки аксонемы.
1-6 — последовательные стадии присоединения микротрубочек. (По:
Bardele, 1977b).
Рис. 149. Строение аксонемы на различных уровнях.
А-Д — срезы цитоплазматической части аксонемы Heterophrys magna:
А — на уровне центропласта, Б-Г — на промежуточных уровнях, Д —
на расстоянии ~ 0,5 мкм от центропласта. 1-6 — срезы аксонемы ак-
соподии Heterophrys marina: 1 — в проксимальной части; 2-5 — на
промежуточных уровнях; 6 — в самой дистальной части. (По: Bardele,
1977b -Л-Д; Bardele, 1975 — 1-6).
Raphidiophrys, Acanthocystis, Choanocystis и др. в цен-
тре аксонемы располагается, не шестиугольник, а два
равносторонних треугольника (рис. 147, Е). В связи с
этим, Барделе (Bardele, 1977b) предположил, что сбор-
ка таких аксонем начинается с триады микротрубочек
(рис. 148).
Степень развития аксонемы зависит не только от
видовой принадлежности солнечшцс^ но и от того,
на каком уровне была перерезана решётка аксонемы.
Так, у Heterophrys magna в самой проксимальной части
находится только центральный шестиугольник микро-
трубочек. По мере продвижения от центропласта к дис-
тальной части аксонемы к паттерну добавляются до-
полнительные микротрубочки, и он становится более
сложным (рис. 149, А-Д). Внутри аксоподий тенденция
может быть обратной. Так, у Heterophrys marina шести-
угольник аксонемы в дистальной части аксоподий де-
градирует, а на самой вершине аксонему поддерживает
только одна микротрубочка (рис. 149).
В базальной части аксонемы внутри каждого
шестиугольника находится трёх- или четырёхжиль-
ный белковый тяж диаметром 20 нм (Rieder, 1979;
Durrschmidt, Patterson, 1987а).
Экструсомы. Экструсомы центрохелидных солнеч-
ников представлены кинетоцистами (рис. 139, Г; 150).
Во всех случаях выявлена одна и та же характерная
форма аксиального элемента кинетоцисты. У всех из-
ученных видов аксиальный элемент имеет шаровидное
основание и конический наконечник. Вся эта структура
окружена кожухом из умеренно электронно-плотного
материала. На продольном срезе кожух обычно облада-
ет исчерченностью. По-видимому, он состоит из стоп-
ки дисковидных структур, окружающих аксиальный
элемент. Его вместе с кожухом покрывает особая ча-
шевидная структура. Её уплощённые края контактиру-
ют с мембраной кинетоцисты. Место, где кинетоциста
крепится к плазмалемме, как правило, несёт нитевид-
ные выросты («антенны»). Вершина аксиального эле-
мента соединяется с нитевидными выростами особы-
ми трансмембранными частицами (Bardele, 1969, 1975;
Davidson, 1976; Sakaguchi et al., 2002).
Рис. 150. Кинетоциста Polyplacocystis coerulea.
a — нитевидные выросты («антенны»); д — дисковидные структуры,
образующие кожух кинетоцисты; к — конусовидная часть аксиального
элемента; п — плазмалемма; ч — чашевидная структура; ш — шаровид-
ная часть аксиального элемента. (По: Sakaguchi et al., 2002).
СОЛНЕЧНИКИ. CENTROHELIDA
219
Рис. 151. Схема тонкого строения Polyplacocystis amhigua.
а — аксонема, д — диктиосома, к — кинетоциста, кдв — кремний-депонирующая везикула, лк — липидная капля, м — митохондрия, пв — пищева-
рительная вакуоль, пк — прекинетоциста, св — сократительная вакуоль, сл — система лакун, ц — центропласт, ч — чешуйка, эпр — эндоплазмати-
ческий ретикулум, я — ядро, яд — ядрышко, зи — зона исключения. (По: Durrschmidt, Patterson, 1987b).
Кинетоцисты формируются в диктиосомах аппа-
рата Гольджи. От диктиосом отшнуровываются вези-
кулы неправильной формы — прекинетоцисты
(рис. 151). На более поздних стадиях в них становятся
различимы скопления электронно-плотного материала.
По мере развития эти уплотнения окружаются мембра-
ноподобным слоем. На финальных стадиях различимы
шаровидное основание и конусовидный наконечник
аксиального элемента кинетоцисты (Bardele, 1975;
Durrschmidt, Patterson, 1987а).
Цитоплазма. Цитоплазма клетки довольно чётко
подразделяется на несколько сферических слоёв: Пере-
числим их, двигаясь от периферии клетки к её центру:
1) кортикальная зона вакуолизованной цитоплазмы (не-
редко пронизана системой лакун); ее в какой-то степени
можно рассматривать как эктоплазму; 2) зона цитоплаз-
220
СОЛНЕЧНИКИ. CENTROHELIDA
Рис. 152. Формирующая спикулу органелла Heterophrys marina.
А — вид сбоку; Б — поперечный срез, в — вакуоль, п — плазмалемма, с — спикула. (По: Bardele, 1975).
мы, содержащей органеллы; 3) цитоплазма, лишённая
органелл — зона исключения (exclusion zone)
(рис. 151) (Febvre-Chevalier, Febvre, 1984; Durrschmidt,
Patterson, 1987a). В центре третьей, самой внутренней
зоны располагается центропласт (рис. 138, А; 151).
К нему, пронизывая все слои цитоплазмы, сходятся ак-
сонемы аксоподий. Сферическую симметрию нарушает
крупное ядро, которое жёстко закреплено на периферии
клетки, одновременно располагаясь в зонах (1) и (2).
У представителей пресноводных видов присут-
ствует несколько сократительных вакуолей. Число их
варьирует и по некоторым данным может достигать 20
на одну клетку (Schulze, 1874). В периферическом слое
цитоплазмы клетки расположены многочисленные пи-
щеварительные вакуоли.
Для представителей Heterophrys. клетки которых
несут спикулы, описаны так называемые форми-
рующие спикулы органеллы (spicule-form-
ing organelles). Они представляют собой инвагинации
плазмалеммы, по форме повторяющие очертания спи-
кулы (Bardele, 1975; Febvre-Chevalier, Febvre, 1984)
(рис. 152). В случае центрохелидных солнечников с
кремнезёмными чешуйками, как и в случае других
протистов, с кремнифицированными структурами (ра-
ковинные амёбы, ротосфериды), образуются крем-
ний-депонирующие везикулы (silica deposi-
tion vesicles) (Anderson, 1994). Процесс формирования
чешуек был изучен Паттерсоном и Дюршмит (Patter-
son, Durrschmidt, 1988) у Polyplacocystis ambigua. Они
культивировали солнечников в среде обеднённой крем-
нием. В таких условиях большинство клеток утрачи-
вали чешуйки. При добавлении в среду кремния через
4-6 часов чешуйки вновь появлялись на поверхности
клеток. На ранних этапах созревания кремнезём на-
капливается в везикуле в виде губчатого материала.
Предполагают, что ионы кремния осаждаются на орга-
ническую матрицу, так как часть содержимого вакуоли
устойчива к действию плавиковой кислоты (Patterson,
Durrschmidt, 1988).
Под вакуолизованной цитоплазмой залегает слой,
содержащий основные клеточные органеллы и включе-
ния: митохондрии, диктиосомы аппарата Гольджи, пре-
кинетоцисты, ЭПР, липидные капли. Непосредственно
под лакунарной системой располагается слой митохон-
дрий. Митохондрии имеют вытянутую форму. Вдоль
длинной оси органеллы тянутся ламеллярные ленто-
видные кристы, почти достигающие противоположно-
го конца митохондрии (рис. 141, Л; 151) (Durrschmidt,
Patterson, 1987b). Глубже расположены цистерны ЭПР.
Наиболее близко к зоне исключения находятся диктио-
сомы аппарата Гольджи. У Chlamydaster laciniatus аппа-
рат Гольджи проникает и в кортикальную часть клетки,
что может быть обусловлено его участием в формиро-
вании мукополисахаридной капсулы (Durrschmidt, Pat-
terson, 1987а).
Центропласт. Впервые эта органелла была описана
на светомикроскопическом уровне Добеллом (Dobell,
1917) у солнечника Oxnerella maritima. С тех пор были
опубликованы многочисленные работы, посвящённые
строению центропласта (Bardele, 1970, 1975, 1977 а, Ь;
Kormos, 1971; Tilney, 1971; Davidson, 1972; Rieder,
1979; Febvre-Chevalier, Febvre, 1984; Durrschmidt, Pat-
terson, 1987a, b; Kinoshita et al., 1995).
Согласно терминологии Ридера (Rieder, 1979) цен-
тропласт состоит из трёх компонентов: трёхслойный
диск, полусферы и оболочка центропласта. На по-
перечном срезе диска видны три электронно-плотные
полосы, разделённые просветами. С двух сторон диск
окружают полусферы, которые, в свою очередь, окру-
жены оболочкой, умеренной плотности (рис. 138, Л;
СОЛНЕЧНИКИ. CENTROHELIDA
221
Рис. 153. Центрохелидные солнечники семейства Acanthocystidae.
А — Acanthocystis nichollsi'. высушенный препарат чешуек (фазовый контраст); Б — Choanocystis sp.: общий вид клетки (контраст Номарского); В —
Pterocystis striata', высушенный препарат чешуек (СЭМ); Г— Acanthocystis bicornis'. высушенный препарат чешуек (СЭМ); Д — Choanocystis sp.:
высушенный препарат чешуек (СЭМ); Е — Raineriophrys erinaceoides'. цистная чешуйка и чешуйки трофической стадии (СЭМ); Ж — Acanthocystis
nichollsi'. высушенный препарат чешуек (СЭМ), а — аксоподия; к — кинетоцисты; св — сократительная вакуоль; тч - чешуйки трофической стадии;
ч — чешуйки; ц — центропласт; цч — цистная чешуйка. Масштабные линейки: А,Б,Д— 10 мкм; В,Г,Е — 1 мкм; Ж — 5 мкм.
222
СОЛНЕЧНИКИ. CENTROHELIDA
Рис. 154. Центрохелидные солнечники семейства Raphidiophryidae.
А-Г— Polyplacocystis ambigua: А — общий вид клетки (фазовый контраст); Б — кинетоцисты в периферическом слое цитоплазмы (контраст Номар-
ского); В — высушенный препарат чешуек (контраст Номарского). Г— общий вид клетки (фазовый контраст); Д— Raphidiophrys intermedia, общий
вид клетки (фазовый контраст); Е — Raphidiophrys capitata: центральная часть клетки (фазовый контраст); Ж—Polyplacocystis ambigua: высушенный
препарат чешуек (СЭМ); 3 — Polyplacocystis symmetrica: высушенный препарат чешуек (СЭМ); И — Raphidiophrys capitata: высушенный препарат
чешуек (СЭМ); К — Raphidiophrys heterophryoidea: высушенный препарат цистных чешуек (СЭМ), а — аксоподия; ак — аксоподиальные кинетоци-
сты; к — кинетоцисты; пк — периферические кинетоцисты; св — сократительная вакуоль; ц — центропласт; ч — чешуйки; я — ядро. Масштабные
линейки: А-Д — 20 мкм; Е, 3 — 5 мкм; Ж— 10 мкм; И— 2 мкм; К— 1 мкм.
СОЛНЕЧНИКИ. CENTROHELIDA
223
151). Совокупность зоны исключения и центропласта
называется центросферой. У Chlamydaster lacini-
atus, Heterophrys marina, H. minutus и Raphidiophrys ele-
gans между центропластом и зоной исключения распо-
лагается небольшой электронно-светлый слой (Bardele,
1975; Febvre-Chevalier, Febvre, 1984; Brugerolle, Mignot,
1984b; Durrschmidt, Patterson, 1987b). В этом слое берут
начало проксимальные концы микротрубочек аксонем.
Непосредственное участие центропласта в стабилиза-
ции аксонемных микротрубочек было доказано Тильни
(Tilney, 1971).
У центрохелидных солнечников, обладающих
сложными аксонемами (Raphidiophrys, Polyplacocystis,
Acanthocystis и др.) по мере погружения аксонем в обо-
лочку центропласта число микротрубочек уменьшается
(Rieder, 1979). Наиболее глубоко заходит центральный
шестиугольник микротрубочек. В пределах оболочки
центропласта микротрубочки располагаются под углом
друг к другу (Durrschmidt, Patterson, 1987b).
Ядро и деление клетки. Ядро у центрохелид-
ных солнечников располагается на периферии клет-
ки (рис. 151). В центре ядра находится одно крупное
ядрышко. Сквозь инвагинации ядерной оболочки про-
ходят аксонемы некоторых аксоподий, благодаря чему
ядро всегда занимает фиксированное положение в
клетке.
Деление особей на светомикроскопическом уров-
не изучалось у трёх представителей: Choanocystis sp.
(Schaudinn, 1896), Oxnerella maritima (Dobell, 1917),
Polyplacocystis arborescens (Villenueve, 1937). Согласно
описанию Добелла, при делении солнечника первым
делится центропласт. Ядро в этот момент увеличивает-
ся в размере. Постепенно, тело солнечника удлиняется,
ядро мигрирует в центр клетки и занимает положение
между двумя дочерними центропластами, которые ста-
новятся ЦОМТами митотического веретена. Ядрышко
исчезает, хромосомы спирализуются и наблюдаются
картины митоза, характерные и для других эукариот.
Оболочка ядра резорбируется лишь частично. Цен-
тропласты в процессе деления увеличиваются, стано-
вятся подкововидными, а позднее — кольцевидными.
По данным Добелла, аксоподии втягиваются в начале
деления и развиваются вновь только при цитокинезе,
обеспечивая расхождение поделившихся клеток. Таким
образом, деление клетки проходит по типу полузакры-
того ортомитоза (Raikov, 1994).
Инцистирование. У некоторых центрохелидных
солнечников описано образование цист покоя (Penard,
1904; Rainer, 1968; Durrschmidt, Patterson, 1987a). Ha
ультраструктурном уровне процесс инцистирования
описан Паттерсоном и Дюршмит у Polyplacocystis ат-
bigua (Durrschmidt, Patterson, 1987а). В начале этого
Рис. 155. Питание Acanthocystis penardi.
1-7 — стадии фагоцитоза (пояснения в тексте), а — аксоподия, вп — воронковидная псевдоподия, г — гранулы, по — пищевой объект, р — радиаль-
ные чешуйки, т — тангентальные чешуйки. (По: Nicholls, 1983).
224
СОЛНЕЧНИКИ. CENTROHELIDA
процесса на поверхности клетки появляется допол-
нительный слой более широких и массивных чешуек.
Диктиосомы мигрируют к периферии клетки, и клет-
ка продуцирует органический материал стенки цисты.
В цитоплазме появляются многочисленные автолизо-
сомы, а также везикулы с гранулярным содержимым.
Затем пищеварительные вакуоли исчезают, лакунарная
система превращается в «стопки мембран» на пери-
ферии клетки. В цитоплазме начинают преобладать
липидные капли, ассоциированные с митохондриями
и цистернами ЭПР. Кристы в митохондриях дегради-
руют.
В зрелой цисте посередине клетки располагается
ядро, окруженное диктиосомами. Не наблюдается ни
кинетоцист, ни аксонем, ни центропласта. Стенку зре-
лой цисты составляют шесть слоёв. Снаружи находят-
ся чешуйки трофической стадии, глубже — слой цист-
ных чешуек, а к плазмалемме прилегают четыре слоя
органического материала.
Особые цистные чешуйки, отличные по строе-
нию от чешуек трофической стадии характерны и для
Raineriophrys erinaceoides (рис. 153, Е). Но наиболее
интересен в этом отношении недавно описанный (Zla-
togursky, 2011) солнечник Raphidiophrys heterophry-
oidea. При инцистировании он формирует чешуйки,
снабжённые специальными зубцами, которые плотно
прилегют к зубцам соседних чешуек. Стенка цисты,
состоит из множества чешуек, сложенных наподобие
мозаики (рис. 154, К).
Питание. Центрохелидные солнечники питаются
различными жгутиконосцами (рис. 155), инфузориями,
диатомовыми водорослями и другими мелкими орга-
низмами. Описаны случаи питания одних центрохе-
лидных солнечников (Raphidiophrys elegans) другими
(Chlamydaster sterni) (рис. 142) (Siemensma, 1991).
Во время питания мембрана кинетоцисты встраи-
вается в плазмалемму аксоподии, а её аксиальный эле-
мент закрепляется на поверхности пищевого объекта.
Питание может сопровождаться псевдокопуляцией не-
скольких особей (Sakaguchi et al., 2002).
Хлоропласты пищевых объектов, если они имеют-
ся, могут долго оставаться не переваренными и функ-
ционально интактными внутри пищеварительной ва-
куоли. Встречаются и хлоропласты, оставшиеся после
переваривания пищи, не окружённые дополнительной
мембраной. Предполагается, что солнечник при этом
использует их, как фотосинтезирующих симбионтов —
явление клептопластии (Patterson, Durrschmidt,
1987).
Экология и условия обитания
Центрохелидные солнечники широко распростра-
нены в пресноводных водоёмах. Находки их в солонова-
товодных и морских водоёмах более редки (Siemensma,
1991). Имеется несколько видов центрохелидных сол-
нечников, которые известны как в морских, так и в
пресноводных биотопах (Микрюков, 1999). Микрюков
предполагал, что морские биотопы не являются пре-
градой для распространения солнечников. Однако дан-
ные Кавалье-Смита и фон дер Хейден (Cavalier-Smith,
von der Heyden, 2007) по секвенированию природных
проб с использованием специфичных ПЦР-праймеров,
напротив, показали наличие строго пресноводных и
строго морских эволюционных линий центрохелидных
солнечников. Общий предок центрохелидных солнеч-
ников, согласно этим данным был пресноводным, а
затем имели место многократные переходы в морские
местообитания. Не исключена и вторичная адаптация
некоторых групп к пресноводным биотопам. Велико
разнообразие этих организмов на сфагновых болотах
и в водоёмах с большим количеством нитчатых водо-
рослей (Biyu, 2000; Микрюков, 2002).
Согласно данным секвенирования природных проб
центрохелидные солнечники присутствуют в анаэроб-
ных местообитаниях (Slapeta et al., 2005). К сожале-
нию, мы ничего не знаем о физиологическом состоянии
солнечников упомянутых в этой работе. В анаэробном
биотопе они могли находиться в виде цист.
Систематика и филогения
В эпоху светомикроскопических исследований по-
нимание таксона Centrohelida было достаточно широ-
ким. Из-за наличия очень схожих кремнезёмных че-
шуек в него включали представителей Rotosphaerida.
Кроме того, аксопласт, располагающийся в центре
клетки, на светомикроскопическом уровне очень труд-
но отличить от центропласта. Это послужило причи-
ной того, что в эту же группу стали включать гимнос-
феридных солнечников и диморфид.
В эпоху электронно-микроскопических исследова-
ний эта точка зрения была отвергнута. В системе супру-
гов Фебр (Febvre-Chevalier, Febvre, 1984) все центро-
хелидные солнечники помещены в отдельную группу
Phaneraxohelida. Паттерсон и Дюршмит предлагают
для этой группы название Centroheliozoa (Durrschmidt,
Patterson, 1987а).
Внутреннее деление группы традиционно осущест-
влялось на основании строения чешуек. Долгое время
центрохелидных солнечников разделяли только на два
семейства:
1) Heterophryidae Poche 1913. Центрохелидные сол-
нечники без кремнезёмных чешуек.
2) Acanthocystidae Claus 1874. Центрохелидные
солнечники с кремнезёмными чешуйками.
Микрюков (Mikijukov, 1996) сохраняет Heterophry-
idae в прежнем составе, пересматривает диагноз Acan-
thocystidae и выделяет ещё одно семейство — Raphid-
iophryidae. По Микрюкову Acanthocystidae объединяет
солнечников с двумя слоями разнокачественных че-
шуек, а в Raphidiophryidae входят солнечники с одним
слоем тангентальных чешуек, прилегающим к поверх-
ности клетки. Так возникает система центрохелидных
солнечников, которой мы придерживались в этой ра-
боте.
Микрюков (2002) предполагал, что эволюция сол-
нечников шла в сторону усложнения внешнего скеле-
СОЛНЕЧНИКИ. CENTROHELIDA
225
та. Он выстраивал морфологический ряд, в котором за
формами лишёнными каких-либо покровных структур
(Oxnerella) следуют представители, окружённые толь-
ко слизистой капсулой (Chiату das ter). Вслед за этим
центрохелидные солнечники приобрели спикулы, кото-
рые затем подверглись биоминерализации и преврати-
лись в кремнезёмные чешуйки. Далее предполагаемая
эволюция шла по пути дифференцировки чешуек на
тангентальные и радиальные.
Кавалье-Смит и фон дер Хейден (Cavalier-Smith,
von der Heyden, 2007) исследовали 18S рДНК из 35
штаммов центрохелидных солнечников, а также полу-
чили 71 сиквенс из природных проб с использованием
ПЦР со специфическими для центрохелидных солнеч-
ников праймерами. Часть сиквенсов были дополнены
данными световой и электронной микроскопии.
На основании полученных сиквенсов были по-
строены филогенетические деревья. При построении
деревьев различными методами солнечники устойчиво
делились на две клады. В первую (будущий подотряд
Pterocystina) попадали все представители с чешуйками
типа Raineriophrys/Pterocystis/Choanocystis, а во вто-
рую (будущий подотряд Acanthocystina) — солнечники
с чешуйками типа Acanthocystis/Raphidiophrys/Polypla-
cocystis. Солнечники без кремнезёмных чешуек раз-
розненно группировались с другими представителями
на разных ветках обоих клад. Представители Chlamy-
daster, Heterophrys myriopoda, Sphaerastrum оказались
в Pterocystina. Сиквенс Heterophrys marina оказался
очень необычным за счёт наличия семи вставочных
регионов, отсутствующих у других центрохелидных
солнечников. Авторы перенесли его в новое семейство
Marophryidae с единственным монотипическим родом
Marophrys и типовым видом М. marina. В отличие от
других солнечников, лишённых кремнезёмных чешуек
он попадал в подотряд Acanthocystina. С учётом этих
данных, семейство Heterophryidae следует считать по-
лифилетическим, а утрату кремнезёмных чешуек —
вторичным многократно имевшим место явлением. Се-
мейство Acanthocystidae оказалось парафилетическим.
На основании полученных данных центрохелид-
ных солнечников разделили на два подотряда и шесть
семейств:
I. Подотряд Pterocystina Cavalier-Smith, von der Hey-
den 2007. Центрохелидные солнечники с укороченным
18S геном, без вставочных сегментов, характерных для
Acanthocystidae. Исходно — солнечники с тангенталь-
ными чешуйками без полой маргинальной каймы и ра-
диальными билатерально симметричными чешуйками.
Кремнезёмные чешуйки утрачивались дважды (Chla-
ту das ter, Heterophrys).
1. Сем. Heterophryidae Poche 1913. Солнечники
с веретеновидными спикулами. 18S ген лишён семи
вставочных сегментов, характерных для Marophryidae.
Представители: Heterophrys, Sphaerastrum.
2. Сем. Pterocystidae Cavalier-Smith et von der Hey-
den 2007. Солнечники с тангентальными и билате-
рально симметричными радиальными чешуйками, в
которых можно выделить ствол и крыловидные расши-
рения. Иногда кремнезёмные чешуйки утрачиваются
(Chiату das ter). Представители: Pterocystis', Rainerioph-
rys', Chlamydaster.
3. Сем. Choanocystidae Cavalier-Smith et von der
Heyden 2007. Солнечники с тангентальными и ради-
альными чешуйками. Радиальные чешуйки с сердце-
видным основанием и стволом.
Представители: Choanocystis.
II. Подотряд Acanthocystina Cavalier-Smith, von
der Heyden 2007. Центрохелидные солнечники, 18S
ген которых содержит 7-13 характерных вставочных
регионов. Исходно — солнечники с овальными тан-
гентальными чешуйками, нередко — с полой марги-
нальной каймой и радиальными чешуйками с круглым
основанием. Кремнезёмные чешуйки утрачены у Ma-
rophrys.
4. Сем. Marophryidae Cavalier-Smith et von der Hey-
den 2007. Солнечники с веретеновидными спикулами.
18S ген содержит 7 характерных вставочных сегмен-
тов. Представители: Marophrys.
5. Сем. Acanthocystidae Claus 1874. Солнечники с
двумя или тремя типами чешуек. Тангентальные че-
шуйки овальные. Чешуйки внешнего слоя представле-
ны воронковидными и (или) удлинёнными чешуйками
с круглым основанием. Представители: Acanthocystis,
Raphidocystis, Pseudoraphidocystis.
6. Сем. Raphidiophryidae Mikrjukov 1996. Солнеч-
ники с одним слоем тангентальных чешуек с полой
маргинальной каймой. Представители: Raphidiophrys,
Polyplacocystis, Heteroraphidiophrys, Pseudoraphidioph-
rys.
После того, как таксоны Actinopoda и Heliozoa при-
знали полифилетическими, встал вопрос о том, где сле-
дует укоренить таксон Centrohelida на эволюционном
древе эукариот.
Микрюков (2002) сближал центрохелидных солнеч-
ников с амёбофлагеллатами из рода Limnophila. В со-
авторстве с А. П. Мыльниковым (Mikrjukov, Mylnikov,
1998) он детально изучил штамм Limnophila borokensis
(= Gymnophrys cometa), выявив наличие ламеллярных
лентовидных крист в митохондриях, а также кинето-
цист. На настоящий момент установлено, что эти ор-
ганизмы относятся к отряду Proteomyxidea (Cercozoa,
Rhizaria) (Bass et al., 2009).
Согласно молекулярно-генетическим данным цент-
рохелидные солнечники относятся к биконтам, так как
у них отмечено специфическое слияние генов дигид-
рофолатредуктазы и тимидилатсинтазы (DHFR-TS)
(Stechmann, Cavalier-Smith, 2002).
На молекулярно-филогенетических схемах, осно-
ванных на анализе гена 18S рРНК, центрохелидные
солнечники оказываются сестринской группой гапто-
фитовых (Cavalier-Smith, Chao, 2003; Nikolaev et al.,
2006; Moreira et al., 2007). Недалеко от гаптофитовых
центрохелидные солнечники размещаются и на древах,
основанных на анализе 28S гена (Cavalier-Smith, 2006;
Moreira et al., 2007).
Реже Centrohelida группируются с анциромонада-
ми или красными водорослями (Cavalier-Smith, Chao,
226
СОЛНЕЧНИКИ. CENTROHELIDA
2003). На некоторых древах центрохелидные солнечни-
ки оказываются сестринской группой к глаукофитовым
и криптофитовым (Nikolaev et al., 2004; Sakaguchi et al.,
2005).
Был выполнен комбинированный анализ пар генов:
188/актин (Nikolaev et al., 2004) и тубулин/актин (Saka-
guchi et al., 2005; Takishita et al., 2005). В первом случае
центрохелидные солнечники группировались с вет-
кой глаукофитовых и криптофитовых, а во втором —
с красными водорослями.
Сакагучи с соавторами (Sakaguchi et al., 2007) ис-
пользовали Polyplacocystis coerulea (= Raphidiophrys
contractilis) в качестве модельного объекта для моле-
кулярно-генетических исследований. Они получили
сиквенсы генов, кодирующих белки теплового шока
HSP70 и HSP90, а также гена фактора элонгации EF-2.
Прибавив информацию об уже известных генах (18S,
актин, альфа и бета тубулины) они провели мультиген-
ный филогенетический анализ. Тем не менее, разре-
шить место отхождения центрохелидных солнечников
от общего филогенетического древа эукариот так и не
удалось. Центрохелидные солнечники при различных
способах анализа либо занимали базальную позицию
между Opisthokonta и Amoebozoa, либо кластеризова-
лись с кладами Alveolata + Stramenopiles, Rhodophyta
и Viridiplantae во всех случаях с очень маленькой под-
держкой.
Ещё одна попытка установить родственные связи
центрохелидных солнечников недавно была предпри-
нята коллективом авторов (Burki et al., 2009), на этот
раз с использованием 454-сиквенирования 127 генов.
В результате солнечники оказались сестринской груп-
пой жгутиконосцев-телонемид. Ветвь телонемиды +
центрохелидцые солнечники кластеризовалась с кла-
дой гаптофитовых и криптофитовых, но поддержка и в
этом случае не превысила 70%.
Систематический обзор
Сем. Heterophryidae Poche 1913
(рис. 156, 157)
Поверхность клетки не несёт никаких покров-
ных структур (Oxnerella) или окружена мукополи-
сахаридной капсулой (Chlamydaster, Heterophrys,
Sphaerastrum). В мукополисахаридную капсулу погру-
жены спикулы (Heterophrys, Sphaerastrum), либо спи-
кулы отсутствуют (Chlamydaster).
Род Oxnerella Dobell 1917
(рис. 156, А)
Монотипный род с единственным представите-
лем Oxnerella maritima Dobell 1917. Поверхность
клетки не несёт никаких покровных структур. Из-
вестны находки подобных организмов как в морских,
так и в пресноводных местообитаниях. Все они до-
статочно плохо документированы. Явно требуется ре-
изоляция и более подробное исследование этого сол-
нечника.
Род Chlamydaster Rainer 1968
(рис. 156, Б; 157, А, Б)
Клетка окружена мукополисахаридной капсулой.
Чешуйки отсутствуют.
Типовой вид: С. sterni Rainer 1968.
Род Heterophrys Archer 1869
(рис. 156, В; 157, В, Д)
Имеются радиально ориентированные спикулы,
погружённые в мукополисахаридную капсулу.
Типовой вид://. myriopodaArcher 1869.
Род Sphaerastrum Greeff 1873
(рис. 156, Г; 157, Г, Е)
Монотипный род с единственным представителем
S.fockii (Archer 1869) West 1901. Имеются тангенталь-
но ориентированные спикулы, погружённые в мукопо-
лисахаридную капсулу.
Сем. Raphidiophryidae Mikrjukov 1996
(рис. 154, 158)
Клетка покрыта кремнезёмными чешуйками, по-
гружёнными в мукополисахаридный матрикс. Чешуй-
ки чаще ориентированы тангентально. Форма чешуек
стержневидная (Parasphaerastrum) или чешуйки упло-
щённые. В последнем случае чешуйки окружены по-
лой маргинальной каймой. Наряду с тангентальными,
у некоторых представителей (Raphidocystis) присут-
ствуют радиально ориентированные трубковидные и
воронковидные чешуйки.
Род Parasphaerastrum Mikrjukov 1996
(рис. 158, А, Б)
Монотипный род с единственным представителем
Р. marina (Ostenfeld 1904) Mikrjukov 1996. Клетка по-
крыта тангентально ориентированными стержневид-
ными чешуйками одного типа.
Род Raphidocystis Penard 1904
(рис. 158, В, Г)
Клетка покрыта чешуйками трёх типов. К поверх-
ности клетки прилегают тангентально ориентирован-
ные пластинчатые чешуйки. Они окружены полой
маргинальной каймой, могут быть гладкими или яче-
истыми. Также имеются радиально ориентированные
воронковидные и трубковидные чешуйки.
Типовой вид:/?, lemani(Penard 1891)Penard 1904.
СОЛНЕЧНИКИ. CENTROHELIDA
227
Рис. 156. Центрохелидные солнечники семейства Heterophryidae.
А — Oxnerella maritimci, общий вид; Б — Chlamydaster sterni, общий вид; В — Heterophrys myriopoda, общий вид; Г— Sphaerastrum fockii, общий вид.
(По: Dobell, 1917 —Л; Rainer, 1968 — Б, В; Archer, 1869 — Г).
228
СОЛНЕЧНИКИ. CENTROHELIDA
Рис. 157. Центрохелидные солнечники семейства Heterophryidae.
А — Chlamydaster sterni’. общий вид клетки (фазовый контраст); Б — Chlamydaster sp.: общий вид клетки (фазовый контраст); В — Heterophrys
myriopoda’. общий вид клетки (фазовый контраст); Г — Sphaerastrum fockii'. общий вид клетки (контраст Номарского); Д — Heterophrys sp.: вы-
сушенный препарат спикул (фазовый контраст); Е — Sphaerastrum fockii'. высушенный препарат спикул (СЭМ), а — аксоподий; к — кинетоцисты;
мк — мукополисахаридная капсула; с — спикулы; ц — центропласт; я — ядро. Масштабные линейки: А, Б, Г— 20 мкм; В — 25 мкм; Д, Е — 5 мкм.
СОЛНЕЧНИКИ. CENTROHELIDA
229
Род Polyplacocystis Mikrjukov 1996
(рис. 154, А-Г, Ж, 3; 158, Д, Е)
Клетка покрыта более или менее однотипными
чешуйками, ориентированными тангентально. Чешуй-
ки окружены полой маргинальной каймой. Полости,
разделённые септами в толще чешуйки, отсутствуют.
Фактура поверхности чешуек гладкая или ячеистая.
Типовой вид:/! symmetrica (Penard 1904) Mi-
krjukov 1996.
Род Raphidiophrys Archer 1867
(рис. 154, Д, Е, И, К\ 158, Ж, 3)
Клетка покрыта более или менее однотипными че-
шуйками, ориентированными тангентально. Чешуйки
окружены полой маргинальной каймой. Внутри че-
шуйки имеются радиальные септы, между которы-
ми находятся полости. У одного из представителей
(Raphidiophrys heterophryoidea) имеются спикулы.
Типовой вид:/?, viridis Archer 1867.
Сем. Acanthocystidae Claus 1874
(рис. 153, 159, 160)
Клетка покрыта кремнезёмными чешуйками, по-
гружёнными в мукополисахаридный матрикс. Чешуй-
ки всегда подразделяются минимум на два морфологи-
ческих класса. К поверхности клетки всегда прилегают
пластинчатые чешуйки без полой маргинальной кай-
мы. Наружные чешуйки могут быть ориентированы
как тангентально, так и радиально. В последнем случае
чешуйки имеют стержневидную или воронковидную
форму.
Род Heteroraphidiophrys Mikrjukov et Patterson
2002 (рис. 159,Д, Е)
Монотипный род с единственным представителем
Н. australis Mikrjukov et Patterson 2002. Клетка покры-
та чешуйками двух типов. К поверхности клетки при-
легают вытянутые чешуйки, их полая маргинальная
кайма выражена не очень сильно, имеется централь-
ное ребро. Снаружи располагаются более широкие
чешуйки с хорошо развитой полой маргинальной кай-
мой.
Род Pseudoraphidocystis Mikrjukov 1997
(рис. 159, А-В)
К поверхности клетки прилегают овальные пла-
стинчатые чешуйки. Снаружи располагаются воронко-
видные чешуйки.
Типовой вид:/ glutinosa (Penard 1904) Mikrju-
kov 1997.
Род Pseudoraphidiophrys Mikrjukov 1997
(рис. 159, Г)
К поверхности клетки прилегают овальные пла-
стинчатые чешуйки. Чешуйки внешнего слоя тоже пла-
стинчатые. Они имеют радиальные рёбра и одно цен-
тральное ребро.
Типовой вид: Р. formosa (Durrschmidt 1985)
Mikrjukov 1997.
Род Pterocystis Siemensma et Roijackers 1988
(рис. 153, В; 160, A-В)
К поверхности клетки прилегают овальные пла-
стинчатые чешуйки. Чешуйки наружного слоя ориен-
тированы более или менее радиально. Каждая чешуйка
состоит из ствола, с двух сторон от которого отходят
уплощённые расширения (lateral wings). Смыкаясь в
проксимальной части чешуйки, они образуют воронко-
видное углубление.
Типовой вид: Р pteracantha (Siemensma 1981)
Siemensma et Roijackers 1988.
Род Raineriophrys (Mikrjukov 2001) Mikrjukov
2002 (рис. 153, Е;160,Г-Е)
К поверхности клетки прилегают овальные пла-
стинчатые чешуйки. Чешуйки наружного слоя ориен-
тированы более или менее радиально. Каждая чешуйка
имеет ствол. С двух сторон от ствола отходят упло-
щённые расширения. В проксимальной части чешуй-
ки имеется также базальное расширение (basal wing),
которое хорошо отделимо от латеральных и ориенти-
ровано перпендикулярно по отношению к последним.
Вместе латеральные и базальное расширения образуют
углубление треугольной формы. У некоторых предста-
вителей это углубление отсутствует.
Типовой вид:/?, erinaceoides (Petersen et Hansen
1960) Mikrjukov 2001.
Род Acanthocystis Carter 1863
(рис. 153, А, Г, Ж; 160,Ж-И)
К поверхности клетки прилегают овальные пластин-
чатые чешуйки. Наружный слой представлен чешуйка-
ми с круглым основанием. Полый трубковидный ствол
чешуйки берёт начало в центре круглого основания.
Типовой вид: A. turfacea Carter 1863.
Род Choanocystis Penard 1904
(рис. 153, Б, Д; 160, К-М)
К поверхности клетки прилегают овальные пластин-
чатые чешуйки. Наружный слой представлен чешуйками
с сердцевидным основанием. В выемке сердцевидной
пластинки берёт начало полый трубковидный ствол ра-
диальной чешуйки.
Типовой вид: С. lepidula Penard 1904.
230
СОЛНЕЧНИКИ. CENTROHELIDA
Рис. 158. Центрохелидные солнечники семейства Raphidiophryidae.
А, Б — Parasphaerastrum marina'. А — общий вид, Б — чешуйка; В, Г— Raphidocystis lemani'. В — общий вид, Г— чешуйки; Д, Е — Polyplacocystis
ambigua'. Д— общий вид, Е — чешуйка; Ж, 3 — Raphidiophrys elegans'. Ж — общий вид, 3 — чешуйка. (По: Mikrjukov, 1996 — Л, Б; Siemensma,
1991 — В, Г, 3; Penard, 1904 —Д; Patterson, Durrschmidt, 1988 — Е; Rainer, 1968 —Ж).
СОЛНЕЧНИКИ. CENTROHELIDA
231
Рис. 159. Центрохелидные солнечники семейства Acanthocystidae.
А-В — Pseudoraphidocystis glutinosa: А — общий вид, Б — тангентальная чешуйка, В — воронковидная чешуйка; Г— Pseudoraphidiophrys formosa,
общий вид; Д>Е — Heteroraphidiophrys australis: Д— общий вид, Е — чешуйки. (По: Siemensma, 1991 — А-В\ Durrschmidt, 1985 — Г; Микрюков,
2002 —Д, Е).
232
СОЛНЕЧНИКИ. CENTROHELIDA
Рис. 160. Центрохелидные солнечники семейства Acanthocystidae.
А-В — Pterocystis pterocantha: А — общий вид, Б — тангентальная чешуйка, В — радиальная чешуйка; Г-Е — Raineriophrys erinaceoides: Г— общий
вид, Д — тангентальная чешуйка, Е — радиальная чешуйка; Ж-И — Acanthocystis turfacea\ Ж — общий вид, 3 — тангентальная чешуйка, И — ра-
диальная чешуйка; К-М— Choanocystis lepidula’. К — общий вид, Л — тангентальная чешуйка, М— радиальная чешуйка. (По: Siemensma, 1991).
СОЛНЕЧНИКИ. ACTINOPHRYIDA
233
Отряд Actinophryida Hartmann 1913
Аксонемные микротрубочки актинофриидных
солнечников отходят от электронно-плотного ЦОМТа
(аксопласта), так или иначе связанного с ядерной обо-
лочкой. Микротрубочки в аксонемах аксоподий образу-
ют паттерн в виде вложенных одна в другую спиралей.
Экструсомы представлены мукоцистами, присутству-
ют также экструсомы с зернистым и фибриллярным
содержимым. Есть как одно-, так и многоядерные
представители. Встречаются как везикулярные ядра с
одним центральным ядрышком, так и ядра с тем или
иным количеством периферических ядрышек. При
инцистировании на поверхности клетки формируется
слой сферических или пластинчатых кремнезёмных
чешуек. Инцистирование сопровождается половым
процессом (педогамией) с участием амебоидных гамет.
Кристы митохондрий везикулярного типа, имеют пу-
зырьковидную форму. Пресноводные и морские орга-
низмы. Распространены всесветно.
Классификация
Отряд Actinophryida Hartmann 1913
Сем. Actinophryidae Dujardin 1841
Род Actinophrys Ehrenberg 1830
Род Actinosphaerium Stein 1875
Морфология и биология
Аксоподии. Аксоподии актинофриидных солнеч-
ников заметно сужаются по направлению к вершинам,
то есть имеют форму сильно вытянутых конусов.
Функции ЦОМТов у актинофриидных солнечни-
ков выполняют аксопласты. У Actinophrys аксопласт
представлен скоплениями электронно-плотного ма-
териала, находящимися на поверхности ядерной обо-
лочки у основания аксонем (Jones, Tucker, 1981).
У Actinosphaerium аксопласт может как располагаться
на ядерной оболочке (рис. 138, Б), так и находиться в
цитоплазме вблизи ядра (Anderson, Beams, 1960).
У актинофриидных солнечников аксонемы аксопо-
дий на срезе дают паттерн, в виде вложенных одна в
другую спиралей (рис. 137, Б). При этом микротрубоч-
ки имеют мостики двух типов — короткие и длинные
(рис. 137, В). Более короткие мостики состоят не из
одного, а из пары белковых тяжей. В центре паттерна
находятся две восьмивалентные микротрубочки, при
этом семь мостиков длинные и один короткий. Далее
к ним присоединяются четырёх- и пятивалентные ми-
кротрубочки (Cachon et al., 1973).
У Actinophrys sol, Actinophrys taurianini, а также
у Actinosphaerium nucleofilum отмечены более мелкие
аксонемы, не участвующие в образовании аксоподий
(Jones, Tucker, 1981).
Экструсомы. У актинофриидных солнечников
описано три типа экструсом: гранулы с электронно-
плотным (мукоцисты) (рис. 139, А), волокнистым (рис.
139, Б) или зернистым (рис. 139, В) содержимым (An-
derson, Beams, 1960; Patterson, 1979; Mikrjukov, Patter-
son, 2001). Экструсомы первых двух типов встречают-
ся у всех актинофриидных солнечников, в то время как
последний тип описан только у Actinophrys taurianini
(Микрюков, 1996).
Цитоплазма. У актинофриидных солнечников хо-
рошо выражено разделение цитоплазмы на эктоплазму
и эндоплазму. Наиболее ярко это можно наблюдать у
представителей рода Actinosphaerium (рис. 161, £), но
в некоторых случаях, напротив, разделение почти неза-
метно (Actinophrys taurianini) (Tilney, Porter, 1965; Pat-
terson, 1979; Микрюков, 1996).
У Actinophrys (рис. 162) в эктоплазме располагают-
ся многочисленные пищеварительные вакуоли и мито-
хондрии с везикулярными пузырьковидными кристами.
В этой же зоне располагаются цистерны шероховатого
или гладкого ЭПР. Во внешнем слое цитоплазмы при-
сутствуют липидные капли.
В эндоплазме находятся цистерны ЭПР, митохон-
дрии в ней менее многочисленны. В наиболее глубокой
зоне эндоплазмы располагается слой многочисленных
диктиосом аппарата Гольджи. В центре клетки рас-
полагается ядро (Patterson, 1979; Mikrjukov, Patterson,
2001).
У Actinosphaerium расположение органелл в цито-
плазме несколько иное. В эктоплазме органеллы отсут-
ствуют. Она заполнена крупными вакуолями без како-
го-либо оформленного содержимого (Anderson, Beams,
1960). В наружном слое эндоплазмы находятся ядра,
митохондрии, диктиосомы аппарата Гольджи. Пищева-
рительные вакуоли, как правило, находятся в централь-
ной зоне клетки (Barrett, 1953, 1958; Anderson, Beams,
1960; Tilney, Porter, 1965).
Ядро и деление клетки. У представителей рода
Actinophrys в центре клетки располагается одно круп-
ное ядро (рис. 161, Б, В), в то время как у актинофри-
идных солнечников рода Actinosphaerium в эндоплазме
находятся многочисленные ядра (рис. 161, Г).
Локализация ядрышкового материала может
быть различной. Встречаются ядра с одним крупным
ядрышком в центре (рис. 163, В) (Actinosphaerium
eichhornii) или ядра с тонким слоем ядрышкового мате-
риала, подстилающим ядерную оболочку (рис. 163, Б)
(Actinophrys sol, A. salsuginosa и Actinosphaerium
nucleofilum) (Barrett, 1958; Tilney, Porter, 1965; Patterson,
1979). У Actinophrys taurianini под ядерной оболочкой
находятся многочисленные ядрышки (рис. 163, A) (Mi-
kqukov, Patterson, 2001).
В интерфазном ядре Actinophrys sol 44 хромосомы
(Belaf, 1923).
Митотическое деление ядра изучено у Actinophrys
sol (Belaf, 1923, Mignot, 1984). При митозе хорошо вы-
ражена метафазная пластинка. Ядерная оболочка на
стадии метафазы перфорируется на полюсах, но сохра-
няется. Микротрубочки веретена деления параллельны
друг другу и не сходятся на полюсах ядра. От внутрен-
234
СОЛНЕЧНИКИ. ACTINOPHRYIDA
Рис. 161. Актинофриидные солнечники (Actinophryida).
А —Actinophrys sp.: общий вид клетки (фазовый контраст); £ — Actinophrys taurianini'. общий вид клетки (контраст Номарского); В —Actinophrys sp.:
фрагмент клетки (фазовый контраст); Г—Actinosphaerium eichhornii'. фрагмент клетки с ядрами (фазовый контраст); Д — Actinosphaerium eichhornii:
мукоцисты в периферическом слое цитоплазмы (контраст Номарского), Е — Actinosphaerium eichhornii'. общий вид клетки (фазовый контраст), а —
аксоподия; г — граница экто- и эндоплазмы; м — мукоцисты; пв — пищеварительная вакуоль; св — сократительная вакуоль; я — ядро. Масштабные
линейки: А — 60 мкм; Б,В,Д — 20 мкм; Г— 10 мкм; Е — 100 мкм.
СОЛНЕЧНИКИ. ACTINOPHRYIDA
235
Рис. 162. Схема тонкого строения Actinophrys sol.
а — аксоподия; ак — аксонема; д — диктиосома; л — липидная капля; м — митохондрия; пв — пищеварительная вакуоль; св — сократительная ваку-
оль; э — экструсома; эпр — эндоплазматический ретикулум; я — ядро; яд — ядрышко. (По: Patterson, 1986).
236
СОЛНЕЧНИКИ. ACTINOPHRYIDA
Рис. 163. Типы ядер актинофриидных солнечников.
А — ядро с немногочисленными крупными ядрышками на периферии
(Actinophrys taurianini); Б — ядро с многочисленными мелкими ядрыш-
ками на периферии (Actinophrys sol); В — ядро с одним ядрышком в цен-
тре (Actinosphaerium eichhornii). (По: Микрюков, 1996 — А).
ней поверхности ядерной оболочки отшнуровывают-
ся мембранные пузырьки. На полюсах располагаются
плотные тельца — так называемые «полярные шапоч-
ки». На ультраструктурном уровне показано, что они
состоят из остатков ядерной оболочки, мембранных
пузырьков и разрушенных микротрубочек. На стадии
анафазы мембранные пузырьки встраиваются в ядер-
ную оболочку, обеспечивая её удлинение. Таким об-
разом, для актинофриидных солнечников характерен
полузакрытый ортомитоз, согласно классификации
Райкова (Raikov, 1994).
Цитокинез происходит при участии аксоподий.
В случае, если деление клетки происходит на поверх-
ности субстрата используется тот же механизм, что и
при передвижении одиночной клетки солнечника. Так-
же деление возможно и в толще воды, где, отталкиваю-
щая сила, разделяющая клетки передаётся с помощью
аксоподий. Доказательством этого служит то, что об-
работка колхицином ингибирует этот процесс. Это го-
ворит о том, что присутствие микротрубочек, которые
находятся в аксоподиях, критично для завершения ци-
токинеза (Ockleford, 1974; Suzaki et al., 1978).
Для Actinosphaerium при попадании в неблагопри-
ятные условия иногда характерно деление на множе-
ство одноядерных клеток (Barrett, 1958), дальнейшая
судьба которых не была прослежена.
Цисты и половой процесс» Цисты актинофриид-
ных солнечников (Actinosphaerium, Actinophrys sol,
A. salsuginosa) покрыты многослойной оболочкой
(рис. 164). Электронно-микроскопические исследо-
вания позволяют различить в оболочке цисты 7 или 8
слоёв (рис. 164, В). Снаружи цисту покрывает мукопо-
Рис. 164. Цисты актинофриидных солнечников.
А — внешний слой цисты у Actinophrys sol; Б — внешний слой цисты у Actinosphaerium nucleofilum; В — поперечный разрез цисты Actinosphaerium
nucleofilum. 1 — место расположения полисахаридного слоя (на рисунке он не показан); 2 — слой кремнезёмных чешуек; 3 — электронно-плотный
слой I; 4 — слой диффузного материала; 5 — электронно-плотный слой II; 6 — фибриллярный слой; 7 — зернистые слои; 8 — плазмалемма солнеч-
ника. (По: Newman, Patterson, 1993 —A; Patterson, Thompson, 1981 — Б, В).
СОЛНЕЧНИКИ. ACTINOPHRYIDA
237
Рис. 165. Педогамия у Actinophrys sol.
А — трофозоит; Б — аксоподии втягиваются, начинают формироваться чешуйки; В — метафаза митоза; Г— анафаза митоза; Д— профаза мейоза I;
Е — анафаза мейоза I; Ж— профаза мейоза II; 3 — анафаза-телофаза мейоза II; И— копуляция гамет; К— сближение ядер; Л— кариогамия; М —
зрелая циста. (По: Mignot, 1979).
И
лисахаридный слой. Непосредственно под ним зале-
гает слой пластинчатых (Actinophrys sol) (рис. 164, А)
или сферических (Actinosphaerium nucleofilum, Acti-
nophrys salsuginosa) (рис. 164, Б) кремнезёмных че-
шуек. Далее располагаются два слоя, представленные
электронно-плотным материалом, между которыми
находится слой диффузного вещества. Следующий
слой содержит многочисленные нитевидные струк-
туры и отдельные электронно-плотные включения.
Этот слой отделяют от плазмалеммы один или два гра-
нулярных слоя (Patterson, 1979; Patterson, Thompson,
1981).
Инцистирование клетки актинофриидных солнеч-
ников сопровождается половым процессом с участием
амебоидных гамет — педогамией (Peters, 1966; Patter-
son, 1986) (рис. 165).
Подробно этот процесс прослежен у Actinophrys
(Belaf, 1923; Mignot, 1979, 1980, 1981). При переходе
к инцистированию солнечник втягивает аксоподии.
В цитоплазме во множестве появляются плотные гра-
нулы. Формируются вакуоли с цистными чешуйками,
которые затем выводятся на поверхность клетки путём
экзоцитоза. Ядро в это время делится митотически. За
митозом следует цитокинез. Ядро каждой из дочерних
клеток претерпевает мейоз.
Для актинофриидных солнечников характерен ти-
пичный двухступенчатый мейоз, сходный с таковым
у многоклеточных животных. На протяжении первого
деления мейоза ядерная оболочка подвергается лишь
частичной разборке на полюсах. При этом частичная
деградация ядерной оболочки выражена сильнее, чем
при митозе. Новая ядерная оболочка в телофазе фор-
мируется под покровом старой. На стадии профазы
мейоза I хорошо читается зиготенная стадия (стадия
букета). Можно наблюдать биваленты. Гомологичные
хромосомы контактируют в нескольких местах. На
стадии диакинеза биваленты становятся более корот-
кими. В поздней профазе начинается синтез мембран
будущей ядерной оболочки. Этот процесс носит нерав-
номерный характер. В метафазе мейоза I 22 бивалент-
ных хромосомы выстраиваются на экваторе веретена
деления. Веретено превышает по длине митотическое.
Центриоли отсутствуют. На полюсах веретена вместо
них располагаются многочисленные везикулы, от кото-
рых отходят микротрубочки веретена. Бивалентность
становится хорошо заметной в анафазе. Между двумя
мейотическими делениями хромосомы имеют крестоо-
бразную форму (две гомологичных хромосомы, соеди-
нённые общей центромерой). Одно из дочерних ядер
деградирует, образуя направительное тельце, в то вре-
238
СОЛНЕЧНИКИ. ACTINOPHRYIDA
мя как оставшееся ядро претерпевает второе деление
мейоза.
Вновь одно из дочерних гаплоидных ядер дегради-
рует и образуется пара гамет. Одна из гамет, которая
считается мужской, образует псевдоподию, по которой
пронуклеус мигрирует в женскую гамету. В цитоплазме
последней находятся многочисленные микротрубочки,
видимо также способствующие встрече гаплоидных
ядер. Образовавшаяся диплоидная клетка переживает
период покоя в цисте.
Питание и агамные слияния» Актинофриидные
солнечники питаются бактериями, водорослями, жгу-
тиконосцами, инфузориями, коловратками, гастро-
трихами, а также личинками других многоклеточных
животных (Bovee, Cordell, 1971; Patterson, 1979; Batko,
Hassan, 1988; Siemensma, 1991).
Актинофриидные солнечники, в отличие от цен-
трохелидных не парализуют пищевые объекты, и не-
редко последние продолжают двигаться даже в пище-
варительной вакуоли (Patterson, Hausmann, 1981).
В опытах с кормлением солнечников инфузориями
и жгутиконосцами и те и другие концентрируются во-
круг клеток солнечников (Gr^becki, Hausmann, 1993).
На основании данных видеомикроскопии высказыва-
лись предположения о том, что химические агенты,
выделяемые солнечником, могут вызывать инверсию
биения цилиатуры инфузорий, заставляя их вновь и
вновь проплывать мимо аксоподий, образуя большие
скопления вокруг клеток солнечника (Gr^becki, Haus-
mann, 1993).
Благодаря серии экспериментальных работ (Gr^be-
cki, Hausmann, 1993; Sakaguchi et al., 1998, 2001) было
показано, что в экструсомах актинофриидных сол-
нечников содержится особый многофункциональный
агент — гликопротеин весом 40 кДа, известный под
названием gp40. Этот агент вызывает выстреливание
других экструсом, благодаря чему даже слабый контакт
пищи с аксоподией солнечника вызывает выстрелива-
ние большого числа экструсом. Гликопротеин имеет
сродство к мембранным рецепторам пищевых объек-
тов. В связанной форме он также обладает способно-
стью индуцировать фагоцитоз у солнечника и обеспе-
чивает адгезию клеток солнечника и пищевого объекта
друг к другу.
Лавинообразное выстреливание множества экстру-
сом сильно увеличивает площадь плазматической мем-
браны солнечника (Hausmann, Patterson, 1982). Экс-
трусомы могут также сливаться друг с другом, образуя
более крупные везикулы, которые затем встраиваются в
мембрану (Mulisch, Hausmann, 1991). Благодаря этому
при захвате крупной пищи солнечник быстро формиру-
ет огромную псевдоподию, заключая клетку в гигант-
скую периферическую вакуоль (рис. 140) (Suzaki et al.,
2003). В ней пища подвергается постепенному перева-
риванию и по частям транспортируется в эндоплазму в
более мелких пищеварительных вакуолях (Hausmann,
Patterson, 1982).
При совместном питании очень часто можно наблю-
дать явление псевдокопуляции. Это явление описано у
Actinophrys sol (Patterson, 1979; Hausmann, Patterson,
1982; Looper, 2005), Actinophrys salsuginosa (Mikijukov,
Patterson, 2001), Actinosphaerium nucleofilum и Actinos-
phaerium eichhornii (Barrett, 1958). He отмечали подоб-
ных слияний лишь у Actinophrys taurianini, несмотря на
то, что представителей этого вида удавалось некоторое
время поддерживать в культуре (Микрюков, 1996).
Слияния могут быть вызваны контактом перифе-
рических вакуолей или соприкосновением аксоподий
двух солнечников (Shigenaka, Kaneda, 1979; Nishi et al.,
1988). Как оказалось, индуктором агамных слияний
у актинофриидных солнечников также является gp40
(Sakaguchi et al., 2001).
Экология и условия обитания
Актинофриидные солнечники весьма обычны и
широко представлены в самых разных биотопах. По-
мимо находок их в болотах, озёрах, реках и просто не-
больших лужах, есть указания на то, что они обитают
и в почве. Николюк и Гельцер (1972) сообщают, что в
одном грамме почвы из ризосферы кукурузы ими было
найдено 250 клеток Actinophrys. Фон ден Веркен (van
den Werken, 1978) обнаружил Actinophrys в заполнен-
ном дождевой водой углублении между черепицами
своей террасы. Также этот солнечник был отмечен в
покрытых льдом водоёмах при температуре около 3 °C
(Mikrjukov, Croome, 1998). Актинофриидных солнеч-
ников находят не только в пресных, но и в солонова-
товодных биотопах. Actinophrys taurianini является
морским организмом и нормально развивается при со-
лёности 35%о (Микрюков, 1996).
Вполне вероятно, что актинофриидные солнечники
являются космополитами, т.к. они обнаружены в пре-
сных водах по всему миру. Более редкие в процентном
отношении находки в солоноватоводных и морских
биотопах, вероятно, являются следствием неполноты
исследований.
Систематика и филогения
В 1830 году Эренберг описал первую находку акти-
нофриидного солнечника — Actinophrys sol (Ehrenberg,
1830). Им же через десять лет был описан и представи-
тель другого рода — Actinosphaerium eichhornii (Ehren-
berg, 1840). Дюжарден (Dujardin, 1841) рассматривает
этих солнечников в составе единой группы, которую
он обозначает как «family Actinophryens». Позднее это
название было латинизировано (Claparede, Lachmann,
1858). Начиная с Хартмана (Hartmann, 1913) его часто
употребляют в ранге отряда.
Помимо двух указанных родов, в составе группы
рассматривались некоторые десмоторацидные сол-
нечники — Clathrulina (Cienkowski, 1867), филозные
амёбы — Vampyrellidium (Treguboff, 1953), пединелли-
ды — Ciliophrys (Levine et al., 1980). Выделяли также
роды Camptonema Schaudinn 1894 и Echinosphaerium
Hovasse 1968, которые в настоящее время рассматри-
ваются, как синонимы Actinosphaerium (Mikrjukov, Pat-
terson, 2001).
СОЛНЕЧНИКИ. DESMOTHORACIDA
239
Как и других солнечников, Actinophryida долго рас-
сматривали в составе класса Heliozoa (надкласс Acti-
nopoda) (Levine et al., 1980). Так как сейчас эту группу
признали полифилетической, актуален вопрос о проис-
хождении актинофриидных солнечников.
Трегубов предполагал, что актинофриидные сол-
нечники произошли от филозных амёб (Treguboff,
1953). Дэвидсон (Davidson, 1982) выдвинул гипотезу о
происхождении актинофриидных солнечников от педи-
неллид. В дальнейшем она была развита Паттерсоном
и позднее Микрюковым (Patterson, 1986; Mikrjukov,
Patterson, 2001; см. также раздел «Пединеллиды»).
Согласно данным молекулярно-филогенетическо-
го анализа, основанного на комбинированном анализе
сиквенсов двух генов: 18S и актина актинофриидные
солнечники относятся к таксону Stramenopiles — тому
же макротаксону, что и пединеллиды (Nikolaev et al.,
2004). Более точно «разрешить» место ветвления акти-
нофриидных солнечников не удалось.
Систематический обзор
Род Actinophrys Ehrenberg 1830
(рис. 161, А-В; 166, А)
В центре клетки располагается одно ядро. Стаби-
лизация микротрубочек осуществляется электронно-
плотным аксопластом, располагающимся на поверх-
ности ядерной оболочки. Разделение цитоплазмы на
экто- и эндоплазму не явственное.
Рис. 166. Актинофриидные солнечники.
А — Actinophrys sol, общий вид; Б — Actinosphaerium eichhornii, общий
вид. (По: Siemensma, 1991).
Типовой вид: Actinophrys sol (Muller 1773) Eh-
renberg 1840.
Род Actinosphaerium Stein 1857
(рис. 161, Г-Е; 166,5)
В цитоплазме располагаются многочисленные
ядра. ЦОМТы находятся на поверхности ядерной обо-
лочки или в околоядерной цитоплазме. Слой крупных
вакуолей эктоплазмы явственно отграничен от мелко-
вакуолизованной эндоплазмы.
Типовой вид: Actinosphaerium eichhornii (Eh-
renberg 1840) Stein 1857.
Отряд Desmothoracida Hertwig et Lesser 1874
ЦОМТ десмоторацидных солнечников представлен
электронно-плотным аксопластом, связанным с ядер-
ной оболочкой. Микротрубочки в аксонемах аксоподий
неупорядочены. Экструсомы представлены кинетоци-
стами, содержащими конический аксиальный элемент,
который окружён кольцевидным кожухом. Ядро всегда
одно, с одним центральным ядрышком. У большинства
представителей присутствует перфорированная капсу-
ла и стебелёк, состоящие из органического материала.
Возможно инцистирование клетки солнечника внутри
капсулы. У некоторых представителей описан сложный
жизненный цикл, включающий трофическую стадию,
амебоидную стадию и стадию одно- или двужгутико-
вой зооспоры. На стадии зооспоры кинетосомы ориен-
тированы перпендикулярно друг к другу и связаны с
ядерной оболочкой с помощью ризопласта или пучка
микрофибрилл. Кристы митохондрий везикулярного
типа, ампуловидной формы.
Классификация
Отряд Desmothoracida Hertwig et Lesser 1874
Сем. Clathrulinidae Claus 1874
Род Actinosphaeridium Zacharias 1893
Род Clathrulina Cienkowski 1867
Род Orbulinella Entz 1877
Род Hedriocystis Hertwig et Lesser, 1874
Род Penardiophrys Mikrjukov 2000
Род Cienkowskya Schaudinn 1896
Морфология и биология
Покровы. У большинства десмоторацидных сол-
нечников клетку окружает неплотно прилегающая к
клеточной поверхности перфорированная органиче-
ская капсула (рис. 167; 168, Б-И), через отверстия ко-
торой проходят аксоподий солнечника. Только у пред-
ставителей рода Actinosphaeridium клетка окружена
мукополисахаридной капсулой (рис. 168, Л; 169, А).
Ультраструктурные исследования (Bardele, 1972;
Brugerolle, 1985) выявили в составе капсулы волокни-
стые структуры, свидетельствующие о том, что она, по
крайней мере отчасти, состоит из органического ма-
териала. Капсулы молодых солнечников прозрачные.
На более поздних стадиях развития капсула темнеет
и приобретает коричневый цвет. Потемнение капсулы
240
СОЛНЕЧНИКИ. DESMOTHORACIDA
Барделе (Bardele, 1972) объясняет «задубливанием»
солями железа, а возможно и инкрустацией кремне-
зёмом.
Стебелёк. У большинства видов десмоторацидных
солнечников есть полый внеклеточный стебелёк, пред-
ставляющий собой продукт секреции клетки (рис. 167;
168). У некоторых видов (Clathrulina elegans, Penar-
diophrys reticulata) описаны и флотирующие формы без
стебелька, а у видов Penardiophrys spinifera и Orbuli-
nella smaragdea известны только бесстебельковые осо-
би (Entz, 1877; Brown, 1918; Siemensma, 1991; Young et
al., 1995). Основание стебелька расширено, от него от-
ходят корневидные (root-like) выросты, служащие для
прикрепления к субстрату. В своей апикальной части
Рис. 167. Схема тонкого строения Clathrulina elegans.
А — общая организация; справа капсула удалена; Б-Г— ультраструктурная организация: Б — продольный срез через аксоподию в месте раздвоения;
В — периферическая часть цитоплазмы; Г— поперечный срез через аксоподию. а — аксоподия; б — бифуркация; г1 — гранулы 1-го типа; г2 — гра-
нулы 2-го типа; зм — запас плазматической мембраны; к — кинетоциста; м — митохондрия; мт —микротрубочки; пв — пищеварительная вакуоль.
(По: Bardele, 1972 — Б-Г).
СОЛНЕЧНИКИ. DESMOTHORACIDA
241
Рис. 168. Десмоторацидные солнечники (Desmothoracida).
А — Actinosphaeridium pedatus’. общий вид клетки (фазовый контраст); Б — Hedriocystis pellucidcr. общий вид клетки (контраст Номарского); В —
Clathrulina elegans’. цисты в перфорированной капсуле (фазовый контраст); Г— Clathrulina sp. общий вид клетки (контраст Номарского); Д— Clath-
rulina sp.: перфорированная капсула (контраст Номарского); Е, Ж — Hedriocystispellucidcr. выход зооспоры из материнской капсулы, две последова-
тельные стадии (контраст Номарского); 3—Penardiophrys spinifera’. общий вид клетки (контраст Номарского); И—Hedriocystis sp.: общий вид клетки
(фазовый контраст), а — аксоподия; з — зооспора; к — капсула; мк — мукополисахаридная капсула; о — отверстия капсулы; с — стебелёк; ц — циста;
ш — шип капсулы; я — ядро. Масштабные линейки: 10 мкм.
242
СОЛНЕЧНИКИ. DESMOTHORACIDA
Ж
Рис. 169. Десмоторацидные солнечники.
А —Actinosphaeridium pedatus, общий вид; Б— Clathrulina elegans, общий вид; В, Г— Orbulinella smaragdea'. В — сектор клетки с ядром, Г— капсу-
ла; Д-Ж—Hedriocystis pellucida\ Д— общий вид, Е — капсула, Ж— зооспора; 3 — Penardiophrys reticulata, общий вид; И, К— Cienkowskya brachyp-
ous: И— общий вид, К— зооспора. (По: Siemensma, 1991 —А, Б,Д-К\ Rainer, 1968 —В, Г).
СОЛНЕЧНИКИ. DESMOTHORACIDA
243
стебелёк сужается, сливаясь с капсулой. В этом месте
капсула относительно легко отрывается от стебелька,
что может способствовать расселению солнечников
(Penard, 1904).
Аксоподий. Аксоподий отходят от конических вы-
ростов клетки (рис. 167). Один такой вырост может не-
сти от одной до трёх аксоподий (Penard, 1904; Bardele,
1972). Внутри аксоподий проходит пучок из 10-20 ми-
кротрубочек (рис. 137, Д 167, Г). В дистальном конце
аксоподий число микротрубочек сокращается. В цито-
плазме клетки наблюдали только отдельные микротру-
бочки, соединяющие аксонемы с ядерной оболочкой.
Микротрубочки аксоподий не объединены между со-
бой в геометрически упорядоченные структуры, хотя
иногда на срезах можно наблюдать паттерн в виде де-
формированного шестиугольника.
Аксоподий могут ветвиться и анастомозировать.
ЦОМТы десмоторацидных солнечников представ-
ляют собой электронно-плотные аксопласты и рас-
полагаются на поверхности ядерной оболочки (Bru-
gerolle, 1985).
Экструсомы. Кинетоцисты имеют характерное
строение (рис. 170). Чуть дистальнее середины кине-
тоцисты располагается крупное кольцевидное обра-
зование. Внутрь этой структуры вдается аксиальный
элемент в форме усечённого конуса. Внутри аксиаль-
ного элемента находится ещё одна структура кониче-
ской формы. В ней проходит канал, в котором можно
различить игловидное образование (Bardele, 1972; Bru-
gerolle, 1985).
Цитоплазма. В цитоплазме Clathrulina elegans от-
мечено наличие двух типов гранул, предположительно
содержащих запасные вещества (Bardele, 1972). Около
основания аксоподий и под мембраной, покрывающей
кортикальную цитоплазму, располагаются скопления
уплощённых мембранных цистерн (рис. 167). Эти обра-
зования наиболее многочисленны у особей, аксоподий
которых втянуты. Барделе (Bardele, 1972) предполага-
ет, что они представляют собой «запас» плазматиче-
ской мембраны солнечника.
Ядро окружают диктиосомы аппарата Гольджи.
Митохондрии с везикулярными ампуловидными кри-
Рис. 170. Кинетоциста Clathrulina elegans.
аэ — аксиальный элемент; кэ — кольцевидный элемент; им — плазма-
лемма. (По: Bardele, 1972).
стами располагаются в цитоплазме клетки, в том числе
заходят в основания аксоподий (рис. 141, Г; 167).
Ядро. У большинства представителей единствен-
ное ядро располагается в центре клетки, но у Hedrio-
cystis minor и Penardiophrys spinifera оно смещено к пе-
риферии клетки (Siemensma, 1991). В ядре находится
одно крупное ядрышко. В активно растущих культурах
Clathrulina elegans наблюдали особи с несколькими
ядрами (Bardele, 1972).
Жизненный цикл. Жизненный цикл десмотора-
цидных солнечников состоит из нескольких стадий
(рис. 144). На трофической стадии у солнечника хоро-
шо развиты аксоподий, капсула и стебелёк. Солнечник
питается, растёт, а затем приступает к бинарному деле-
нию. После того как клетка поделилась, события могут
развиваться по-разному. При неблагоприятных услови-
ях клетки, образовавшиеся в результате деления, могут
инцистироваться. Перед этим возможны дополнитель-
ные деления. Если условия более благоприятные, то
одна из поделившихся клеток покидает материнскую
капсулу и, принимая амебоидную форму, строит новый
стебелёк и новую капсулу прямо на поверхности мате-
ринской. Это приводит к образованию колоний. В дру-
гих случаях дочерняя клетка покидает материнскую
капсулу в виде зооспоры (168, Е, Ж). Зооспора некото-
рое время перемещается с помощью жгутиков, а потом
оседает на субстрат и строит новые стебелёк и капсулу.
Превращение зооспоры в трофическую стадию
прослежено на примере Clathrulina elegans (Cien-
kowski, 1867; Valkanov, 1928; Bardele, 1971, 1972;
Siemensma, 1991), в то время как у Hedriocystis pellu-
cida и Cienkowskya brachypous наблюдали только об-
разование зооспор (Hoogenraad, 1927; Brugerolle,
1985; Siemensma, 1991). У Actinosphaeridium pedatus,
Cienkowskya meres chkowskii и Penardiophrys spinifera
наблюдали только трофическую стадию и цисты.
В случае Orbulinella smaragdea, Hedriocystis minor,
H. zhadani, Penardiophrys reticulata известны только
трофические стадии.
Зооспоры. У Cienkowskya brachypous описано
формирование одножгутиковых зооспор (de Saedeleer,
1930). Двужгутиковые зооспоры описаны у Clathrulina
elegans, Hedriocystispellucida и у Actinosphaeridiumped-
atus (рис. 168, £, Ж; 171; ) (Hoogenraad, 1927; Bardele,
1972; Siemensma, 1991). Парные жгутики берут своё на-
чало от кинетосом, ориентированных перпендикулярно
друг по отношению к другу (Brugerolle, 1985). Кинето-
сомы связаны с мембраной ядра, которое располагается
на переднем конце клетки. В случае Clathrulina связую-
щим звеном является короткий ризопласт с нерегуляр-
ной исчерченностью (Bardele, 1972). У Hedriocystis ки-
нетосомы соединяются с мембраной ядра с помощью
пучка микрофибрилл (Brugerolle, 1985). Кинетосомы
наблюдали также и у клетки, которая после деления
остаётся в материнской капсуле, и не превращается в
зооспору. Зооспора движется по спиральной траекто-
рии, при этом её жгутики направлены вперёд. На за-
днем конце клетки можно различить сократительные
вакуоли и так называемые «гранулярные включения».
Под мембраной зооспоры содержатся многочисленные
244
СОЛНЕЧНИКИ. DESMOTHORACIDA
мембранные цистерны, на поверхности которых нахо-
дятся кинетоцисты. Судя по всему, эти структуры пред-
ставляют собой «запас» плазматической мембраны. В
цитоплазме зооспоры наблюдаются только отдельные
немногочисленные микротрубочки. Цитоплазма богата
свободными рибосомами. Многочисленные везикулы
диктиосом аппарата Гольджи заполнены волокнистым
и гранулярным содержимым (Bardele, 1972).
Образование стебелька и капсулы. Процесс пре-
вращения зооспоры в трофическую стадию на ультра-
структурном уровне был описан у Clathrulina elegans
Кристианом Барделе (Bardele, 1971; 1972), данные
которого согласуются со светомикроскопическими на-
блюдениями Валканова (Valkanov, 1928). На первом
этапе происходит разборка жгутиков и образование не-
больших псевдоподий. На дистальных частях жгутиков
появляются характерные утолщения, и жгутики одно-
временно укорачиваются. Клетка принимает сфериче-
скую форму. Формируются псевдоподии с широким
закруглённым основанием, которое резко переходит
в тонкую дистальную часть. Наконец, клетка оконча-
тельно принимает сферическую форму, ядро занимает
центральное положение, и псевдоподии становятся бо-
лее оформленными. Время, за которое клетка проходит
эти стадии, составляет около трёх минут.
Далее осуществляется секреция стебелька и капсу-
лы. Одна из псевдоподий развивающегося солнечника
прикрепляется к какому-либо субстрату (им может слу-
жить и плёнка поверхностного натяжения воды). Её ди-
аметр и длина увеличиваются по сравнению с другими
аксоподиями. Эта аксоподия в литературе получила на-
звание стебелёк-формирующей псевдопо-
дии (stalk-moulding pseudopod). Ее скелет составляет
аксонема из тысячи и более микротрубочек, отходящих
от ядерной оболочки. Основание стебелёк-формирую-
щей псевдоподии лежит в небольшом углублении на
поверхности клетки и окружено со всех сторон цито-
плазмой. В просвет между стебелёк-формирующей
псевдоподией и окружающей цитоплазмой и секрети-
руется материал стебелька. Секреция осуществляется
окружающей цитоплазмой, а стебелёк-формирующая
псевдоподия выполняет функцию «модели» стебелька.
Постепенно псевдоподия вытягивается, окружающая
цитоплазма передвигается выше, продолжая секрети-
ровать стебелёк. Когда стебелёк уже достиг максималь-
ной длины, некоторое время внутри него ещё сохраня-
Рис. 171. Зооспора десмоторацидного солнечника.
А — общая организация; Б — ядро и жгутиковый аппарат; В — цитоплазма на периферии клетки; г1 — гранулы 1-го типа; г2 — гранулы 2-го типа;
д — диктиосома; ж — жгутик; к — кинетосома; кц — кинетоциста; м — митохондрия; мф — микрофибриллярный тяж; пв — пустая вакуоль; я —<
ядро; яд — ядрышко. (По: Bardele, 1972 —А, В; Mikrjukov, 2000 — Б).
СОЛНЕЧНИКИ. DESMOTHORACIDA
245
Рис. 172. Гипотетическая схема морфогенеза перфорированной капсулы Clathrulina elegans.
акс — аксоподия; цб — цитоплазматический бугорок. Пояснения в тексте. (По: Bardele, 1972).
ется псевдоподия, но вскоре она втягивается и стебелёк
становится полым.
Одновременно с секрецией стебелька происходит
формирование решётчатой капсулы. Перед началом
этого процесса в теле солнечника формируется много
вакуолей и за счёт этого клетка увеличивается до раз-
меров будущей капсулы. Согласно гипотезе Барделе
(Bardele, 1972) в этот момент клетка формирует цито-
плазматические бугорки, которые по размерам соот-
ветствуют отверстиям капсулы (рис. 172). В ложбинки
между ними секретируется материал капсулы. Ког-
да формирование капсулы заканчивается, солнечник
вновь уменьшается в размерах за счет исчезновения
части вакуолей. При формировании капсулы каждо-
му цитоплазматическому бугорку соответствует одна
аксоподия. После втягивания бугорков через каждое
отверстие капсулы выходит одна псевдоподия. Это
соотношение сохраняется до первого деления. После
деления солнечник заполняет новыми аксоподиями
освободившиеся отверстия и здесь могут возникать
«ошибки». В одно отверстие могут попасть сразу две
или более аксоподий. Как правило, в подобном случае
происходит частичное или полное их слияние.
Также формирование капсулы наблюдали у бес-
стебельковых планктонных форм Clathrulina elegans.
Несмотря на то, что стебелёк не формируется, превра-
щение зооспоры в трофическую стадию проходит на
поверхности субстрата (Young et al., 1995).
Бружероль (Brugerolle, 1985) предполагает, что у
Hedriocystis pellucida капсула формируется по анало-
гичному принципу.
Инцистирование. При неблагоприятных услови-
ях десмоторацидные солнечники инцистируются
(рис. 168, В). Инцистированию обычно предшествуют
одно или несколько митотических делений, а затем каж-
дая из образовавшихся клеток одевается плотной обо-
лочкой, оставаясь при этом в материнской капсуле.
Барделе (Bardele, 1972) отмечает, что цисты Clath-
rulina elegans покрыты мельчайшими иглами (spins).
У представителей этого вида удавалось наблюдать до
восьми цист в одной капсуле. Ценковский (Cienkowski,
1867) наблюдал эксцистирование Clathrulina elegans и
отмечал, что из каждой цисты выходит зооспора. Это-
му автору не удалось наблюдать жгутики непосред-
ственно, и он заключил об их наличии по характеру
движения эксцистировавшихся клеток.
Также цисты описаны у Hedriocystis pellucida
(Hoogenraad, 1927), Cienkowskya mereschkowskii (Цен-
ковский, 1881), Actinosphaeridium pedatus (Zacharias,
1893; Mayer, Kreutz, 1998) и Penardiophrys spinifera
(Mayer, 1997).
Питание. Пищу десмоторацидных солнечников
составляют бактерии, мелкие жгутиконосцы, и ин-
фузории. Захваченная аксоподиями пища либо сразу
втягивается внутрь капсулы через одно из отверстий,
либо пищеварительная вакуоль формируется снаружи,
и начальные стадии пищеварения проходят вне капсу-
лы (Cienkowski, 1867; Hoogenraad, 1927; Bardele, 1972).
Экология и условия обитания
Десмоторацидных солнечников можно встретить в
прибрежной зоне мелких водоёмов, во влажном мху, на
поверхности нитчатых водорослей.
Большинство исследователей описывают находки
десмоторацидных солнечников в пресной воде. Но два
вида Hedriocystis zhadani и Cienkowskya mereschkowskii
описаны только в водах Белого моря (Ценковский,
1881; Mikrjukov, 2000а). Известна одна находка Orbu-
linella smaragdea (Labbe, 1924) в солоноватоводном
водоёме. Сам факт этих находок указывает на то, что
кажущееся преобладание среди десмоторацидных сол-
нечников пресноводных форм — следствие недоста-
точной изученности морской фауны этих организмов.
Систематика и филогения
Первое несомненное описание десмоторацидного
солнечника принадлежит Ценковскому (Cienkowski,
1867), который описал Clathrulina elegans. Таксон Des-
mothoracida впервые упоминается в работе Гертвига и
Лессера (Hertwig, Lesser, 1874). Некоторые авторы (Pe-
nard, 1904; Rainer, 1968; Bardele, 1972) рассматривали
десмоторацидных солнечников и некоторые другие ор-
ганизмы в составе группы «Pseudoheliozoa». Во многих
системах десмоторацидных солнечников объединяли
с другими солнечниками, аксопласт которых связан с
ядерной оболочкой — Actinophryida, Pedinellida (Куса-
кин, Дроздов, 1998; Карпов, 2000, 2001; Febvre-Cheva-
lier, Febvre, 1984; Cavalier-Smith, 1993).
246
СОЛНЕЧНИКИ. GYMNOSPHAERIDA
Смит и Паттерсон (Smith, Patterson, 1986) предпо-
лагали родство десмоторацидных солнечников с ди-
морфидами. Микрюков (Микрюков, 2000; Mikrjukov,
2000а) развивает эту идею и высказывает «церкомонад-
ную» гипотезу о происхождении ряда групп солнечни-
ков, включая десмоторацидных.
Согласно этой гипотезе, предками десмоторацидных
солнечников и диморфид являются амебоидные жгу-
тиконосцы — церкомонады. Представители рода Сег-
comonas на некоторых стадиях жизненного цикла имеют
сферическую форму тела и тонкие радиально расходя-
щиеся псевдоподии. Для церкомонад также характерны
быстрые переходы от радиально-симметричной формы с
неактивными жгутиками в подвижную жгутиковую фор-
му, что мы наблюдаем и у Desmothoracida (Bardele, 1972).
Анализ сиквенсов гена, кодирующего 18S рРНК,
а также сиквенсов актин-кодирующего гена (Nikolaev
et al., 2004), в целом подтвердил гипотезу Микрюкова.
Исследованы два вида: Clathrulina elegans и Hedrio-
cystis cf. spinifera. На кладограмме десмотораццдные
солнечники заняли положение между амебоидными
жгутиконосцами Massisteria marina и Lymnophyla boro-
kensis в составе макротаксона Rhizaria, куда входят
и церкомонады. Этих же взглядов придерживаются
Басс с соавторами (Bass et al., 2009). Они рассматри-
вают десмоторацидных солнечников в составе класса
Granofilosea (Cercozoa, Rhizaria), куда также включают
диморфид, и других фило- и аксоподиальных амебоид-
ных жгутиконосцев.
Систематический обзор
Род Actinosphaeridium Zacharias 1893
(рис. 168, Д; 169, А)
Монотипный род с единственным видом Actino-
sphaeridium pedatus Zacharias 1893. Клетка окружена
мукополисахаридной капсулой. Твёрдая органическая
капсула отсутствует. Клетки располагаются на вершине
полого стебелька.
Род Clathrulina Cienkowski 1867
(рис. 168, В-Д] 169, Б)
Монотипный род с единственным видом Clathruli-
na elegans Cienkowski 1867. Его представители — сол-
нечники с решетчатой капсулой, отверстия в которой
достаточно крупные. Переход между капсулой и сте-
бельком резкий, хорошо заметный. Иногда стебелёк
может отсутствовать.
Род Orbulinella Entz 1877
(рис. 169, В, Г)
Монотипный род с единственным видом Orbulinel-
la smaragdea Entz 1877. Отверстия капсулы мелкие и
располагаются на дне воронковидных углублений. Сте-
белёк отсутствует. Аксоподии без гранул, расширяются
к дистальному концу.
Род Hedriocystis Hertwig et Lesser 1874
(рис. 168, Б, Б, Ж, И; 169, Д-Ж)
Отверстия капсулы небольшие, скорее напоминают
поры. У всех описанных представителей имеется сте-
белёк. Переход между капсулой и стебельком резкий,
хорошо заметный.
Типовой вид: Hedriocystis pellucida Hertwig et
Lesser, 1874.
Род Penardiophrys Mikrjukov 2000
(рис. 168,3; 169,3)
Капсулы с крупными отверстиями, каждое из ко-
торых затянуто тонкой мембраной. В центре каждой
мембраны имеется пора, через которую выходит аксо-
подия. Переход между капсулой и стебельком резкий.
Описаны бесстебельковые формы.
Типовой вид: Penardiophrys reticulata (Penard
1904) Mikrjukov 2000.
Род Cienkowskya Schaudinn 1896
(рис. 169, И, К)
Капсула с мелкими порами, плавно переходит в
широкий короткий стебелёк.
Типовой вид: Cienkowskya mereschkowskii
(Cienkowski 1881) Schaudinn 1896.
Отряд Gymnosphaerida Poche 1913
Аксопласт имеет зернистую или фибриллярную
структуру. Для аксонем аксоподий характерен гекса-
гональный паттерн укладки микротрубочек. Имеются
два типа экструсом: мукоцисты с гомогенным содер-
жимым и кинетоцисты со стреловидным аксиальным
элементом. Встречаются как одноядерные, так и много-
ядерные виды. Иногда на поверхности клетки распо-
лагаются чешуйки. Нередко часть клетки распластана
по субстрату. Кристы митохондрий тубулярные. Очень
небольшая группа; включает в свой состав три моно-
типных рода.
Классификация
Отряд Gymnosphaerida Poche 1913
Сем. Gymnosphaeridae Poche 1913
Род Gymnosphaera Sassaki 1894
Род Actinocoryne Febvre-Chevalier 1980
Род Hedraiophrys Febvre-Chevalier 1973
СОЛНЕЧНИКИ. GYMNOSPHAERIDA
247
Морфология и биология
Покровы. Покровы гимносферидных солнечни-
ков могут иметь различное строение. Представители
Actinocoryne contractilis лишены каких-либо специаль-
ных покровных образований (Febvre-Chevalier, 1980).
У Gymnosphaera albida клетку покрывает слой волок-
нистого материала (Jones, 1976). У Hedraiophrys hovas-
sei клетку покрывают немногочисленные крупные тан-
гентально ориентированные веретеновидные чешуйки
(Febvre-Chevalier, 1973).
Аксоподий. Аксоподий гимносферидных солнеч-
ников обычно прямые, не сливающиеся друг с другом
и не ветвящиеся, но у Gymnosphaera albida основания
аксоподий образуют трёхмерную сеть (рис. 173). Ми-
кротрубочки аксонем формируют паттерн из шестиу-
гольников, напоминающий соты (рис. 137, Д) (Jones,
1975; Febvre-Chevalier, 1980). Проксимальные концы
аксонем окружены слоем нитевидных структур. Вме-
сте эти структуры формируют фибриллярно-грануляр-
ную массу аксопласта (рис. 173) (Jones, 1976).
Экструсомы. Экструсомы Gymnosphaera albida
и Hedraiophrys hovassei представляют собой мукоци-
сты с гомогенным электронно-плотным содержимым
(рис. 173, 174, A) (Febvre-Chevalier, 1973; Jones, 1976).
Такие же мукоцисты встречаются у Actinocoryne con-
tractilis, но у этих солнечников есть и кинетоцисты со
стреловидным аксиальным элементом (рис. 174, Б).
Последние располагаются в распластанной по суб-
страту части клетки солнечника (Febvre-Chevalier,
1980).
Цитоплазма. Цитоплазма G. albida подразделя-
ется на эктоплазму, содержащую основной набор ор-
ганелл и эндоплазму, в которой присутствуют только
мелкие вакуоли (Rainer, 1968). Как эктоплазма, так и
эндоплазма пронизаны глубокими впячиваниями плаз-
малеммы — системой лакун. В эктоплазме находятся
ядра, аппарат Гольджи, рибосомы, экструсомы, мито-
хондрии, липидные капли (рис. 173). Кристы митохон-
дрий тубулярные (рис. 141, Е). Некоторые из вакуолей
эктоплазмы содержат органические кристаллы (рис.
173) (Jones, 1976).
Рис. 173. Схема тонкого строения Gymnosphaera albida.
а — аксоподия; ак — аксонема; ап — аксопласт; вс — волокнистый слой; д — диктиосома; л — липидная капля; м — митохондрия; ок — органический
кристалл; пв — пищеварительная вакуоль; тса — трёхмерная сеть аксоподий; э — экструсома; эпр — эндоплазматический ретикулум; я — ядро. (По:
Jones, 1976).
248
СОЛНЕЧНИКИ. GYMNOSPHAERIDA
Рис. 174. Экструсомы Actinocoryne contractilis.
А — мукоциста, Б — кинетоциста. (По: Микрюков, 2002).
Тело A. contractilis подразделено на три зоны: рас-
пластанное по субстрату амебоидное основание (ame-
boid base), сократимый стебелёк и головка (head), да-
ющая начало аксоподиям. Диктиосомы и шероховатый
ЭПР находится в амебоидном основании. Митохон-
дрии локализованы главным образом в стебельке и го-
ловке (Febvre-Chevalier, 1980).
Клетка Н. hovassei также имеет распластанную по
субстрату часть, но стебелёк у этого солнечника от-
сутствует. У этих организмов хорошо выражено раз-
деление цитоплазмы на сильно вакуолизованную эк-
топлазму и содержащую мелкие гранулы эндоплазму.
В цитоплазме отмечены зоохлореллы (Febvre-Cheva-
lier, 1973).
Ядро. Встречаются как одноядерные (Я. hovassei),
так и многоядерные (A. contractilis, G. albida) пред-
ставители гимносферидных солнечников. Ядро Я. ho-
vassei располагается на периферии клетки. У G. al-
bida многочисленные ядра лежат в эктоплазме. Ядра
A. contractilis располагаются в амебоидном основании
клетки солнечника. В ядрах G. albida, Н. hovassei, как
правило, имеется несколько периферических ядры-
шек. Для ядер A. contractilis характерно одно эксцен-
тричное ядрышко. У Я. hovassei хорошо представлена
ядерная ламина, в то время как в ядрах других гим-
носферидных солнечников она не выражена (Febvre-
Chevalier, 1980).
Жизненный цикл. У G. albida описаны только би-
нарные деления и образование двужгутиковых гамет,
которые затем сливаются между собой (Jones, 1976).
Рис. 175. Гимносферидные солнечники.
А — Gymnosphaera albida, общий вид; Б—Actinocoryne contractilis, общий вид; В — Hedraiophrys hovassei, общий вид. (По: Rainer, 1968 —A; Febvre-
Chevalier, 1980 — Б; Febvre-Chevalier, 1973 —В).
СОЛНЕЧНИКИ. DIMORPHIDA
249
Размножение A. contractilis может идти различны-
ми путями. Так же, как у G. albida у этого солнечника
описано продуцирование двужгутиковых клеток. До-
черние особи могут отпочковываться головкой. В этом
случае ядро должно мигрировать по стебельку из аме-
боидного основания. К сожалению, подробности это-
го явления не были изучены. Также солнечник может
сгруппироваться и множественно поделиться (разделе-
ние на головку, стебелёк и основание при этом исчеза-
ет). В двух последних случаях образовавшиеся мелкие
одноядерные солнечники флотируют, а затем прикре-
пляются к субстрату и дают начало новому организму
(Febvre-Chevalier, 1980).
Множественное деление описано и у Я. hovassei
(Febvre-Chevalier, 1973).
Питание. Пищей гимносферидным солнечникам
могут служить диатомеи, инфузории, радиолярии, ко-
ловратки, нематоды, личинки копепод (Jones, 1976;
Febvre-Chevalier, 1980).
Actinocoryne contractilis захватывает пищу аксо-
подиями, и в области головки формируются крупные
пищеварительные вакуоли. Затем в более мелких ваку-
олях пища по стебельку попадает в амебоидное осно-
вание, где происходят конечные этапы переваривания и
выброс не переваренных остатков.
Экология и условия обитания
Все гимносферидные солнечники являются мор-
скими организмами, в той или иной степени ассоции-
рованными с субстратом. Им могут служить как неор-
ганические частицы, так и живые организмы, например
губки (Jones, 1976; Febvre-Chevalier, 1980).
Систематика и филогения
Первое описание гимносферидного солнечника
принадлежит Сасаки (Sassaki, 1894), который описал
Gymnosphaera albida.
Как уже упоминалось, долгое время их объединя-
ли с центрохелидными солнечниками, из-за того, что
на светомикроскопическом уровне их ЦОМТы очень
сходны.
Согласно гипотезам, выдвигающимся современны-
ми авторами, гимносферидные солнечники произошли
от амебоидных жгутиконосцев церкомонад (Mikrjukov,
2000а). На это указывает наличие в жизненном цикле
жгутиковых стадий, морфологически сходных с церко-
монадами.
Молекулярно-филогенетические данные по этой
группе пока отсутствуют.
Систематический обзор
Род Gymnosphaera Sassaki 1894 (рис. 175, А)
Монотипный род с единственным видом Gymnos-
phaera albida Sassaki 1894. Многоядерные свободно-
плавающие солнечники. Поверхность клетки покрыта
тонкой волокнистой оболочкой.
Pop, Actinocoryne Febvre-Chevalier 1980
(рис. 175, Б)
Монотипный род с единственным видом Actinoco-
ryne contractilis Febvre-Chevalier 1980. Многоядерные
прикреплённые солнечники. Стебелёк обладает сокра-
тимостью.
Род Hedraiophrys Febvre-Chevalier 1973
(рис. 175, В)
Монотипный род с единственным видом Hedraioph-
rys hovassei Febvre-Chevalier 1973. Одноядерные при-
креплённые солнечники. Стебелёк не выражен. Клетка
покрыта тангентальными веретеновидными чешуй-
ками.
Отряд Dimorphida Siemensma 1991
Клетка диморфид может существовать в двух раз-
личных формах — как амебоидный жгутиконосец или
как солнечник, имеющий помимо аксоподий два или
четыре жгутика. Амебоидный жгутиконосец может
быстро развивать аксоподии, превращаясь в солнеч-
ника. Жгутики при этом сохраняются. Может происхо-
дить и обратная трансформация.
Корешковый аппарат жгутиков имеет связь с
ЦОМТом, который представляет собой аксопласт.
Структура аксопласта фибриллярно-гранулярная. Ки-
нетосомы удлинённые. Микротрубочки в аксонемах
аксоподий расположены в шахматном порядке или
лежат неупорядоченно. Экструсомы представлены
кинетоцистами или мукоцистами. Известны только
одноядерные формы. Аксопласт может находиться во
впячивании ядра, которое облегает его со всех сторон.
Кристы митохондрий тубулярного типа.
Классификация
Отряд Dimorphida Siemensma 1991
Сем. Heliomorphidae Cavalier-Smith et Bass 2009
Род Heliomorpha Cavalier-Smith et Bass 2009
Сем. Acinetactidae Stokes 1886
Род Acinetactis Stokes 1886
Сем. Tetradimorphidae Cavalier-Smith et Bass 2009
Род Tetradimorpha Hsiung 1927
250
СОЛНЕЧНИКИ. DIMORPHIDA
Морфология и биология
Покровы. У диморфид не описано каких-либо вне-
клеточных покровных структур. Микрюков (Mikijukov,
2000b) указывает на наличие у Tetradimorpha pterbica
небольшого слоя мукополисахаридного материала,
подстилающего плазмалемму по типу псевдопеллику-
лы (Карпов, 1986).
Аксоподий. Аксоподий отходят от всей поверхно-
сти клетки или собраны в два пучка: вокруг жгутиков и
на противоположном полюсе клетки. Так, у некоторых
представителей Tetradimorpha жгутики окружены че-
тырьмя аксоподиями, направленными вперёд, а восемь
аксоподий отходят назад (Brugerolle, Mignot, 1983).
Аксонемные микротрубочки диморфид из рода
Tetradimorpha не образуют упорядоченного паттерна
(рис. 137, Ж). Валентность микротрубочек колеблется
от одного до шести.
У представителей рода Heliomorpha микротру-
бочки аксонем расположены в шахматном порядке
(рис. 137, 3). Внутренние микротрубочки аксонемы
четырёхвалентны. Пересекаясь между собой, мостики
образуют крестообразную структуру.
Стабилизация микротрубочек осуществляется
фибриллярно-гранулярным аксопластом. Он распола-
гается между ядром и кинетосомами жгутиков (или в
углублении ядра) и может иметь как шаровидную, так
и линзовидную форму (рис. 176) (Brugerolle, Mignot,
1984а).
У Tetradimorpha аксопласт окружён волокнистым
материалом, в котором заякориваются кинетосомы и
основания аксоподий (Brugerolle, Mignot, 1983).
Жгутиковый аппарат. Жгутики гладкие, гетеро-
динамные. Их может быть два (род Heliomorpha) или
четыре (род Tetradimorpha).
У представителей рода Heliomorpha один из жгу-
тиков направлен вперёд (рис. 176). У Н mucosa его
окружает мукополисахаридный слой. Другой жгутик
обращён вбок или назад. В переходной зоне жгутика
имеется дополнительная поперечная пластинка с аксо-
Рис. 176. Схема тонкого строения Heliomorpha mucosa (= Dimorpha mutans).
a — аксоподия; aa — аксонема аксоподий; ап — аксопласт; д — диктиосома; ж1 — передний жгутик; ж2 — задний жгутик; л — липидная капля;
м — митохондрия; мк1 — микротрубочковый корешок 1; мк2 — микротрубочковый корешок 2; мт — микротрубочки, мф — микрофибриллы; пв —
пищеварительная вакуоль; пк — прекинетоцисты; рп — ризопласт; со — слизистая оболочка жгутика; фк — фибриллярный корешок; э — экструсома;
эпр — эндоплазматический ретикулум; я — ядро. (По: Brugerolle, Mignot, 1984).
СОЛНЕЧНИКИ. DIMORPHIDA
251
сомой и плотный цилиндр. Описан хорошо развитый
корешковый аппарат жгутиков Heliomorpha. От дис-
тальной части кинетосомы активного жгутика отхо-
дит ряд из многочисленных микротрубочек. Имеется
поперечно исчерченный ризопласт, а также исчерчен-
ные фибриллы, соединяющие кинетосому с аксопла-
стом (рис. 176). Кроме этого, от основания каждой
кинетосомы отходят пучки микротрубочек, связанных
электронно-плотным материалом. Они ориентированы
параллельно цитоплазматическим частям апикальных
аксонем (Brugerolle, Mignot, 1984b; Mignot, Brugerolle,
1991).
У представителей Tetradimorpha корешковая систе-
ма жгутиков организована значительно проще. И ки-
нетосомы четырёх жгутиков, и аксонемы аксоподий
соединены волокнистым материалом с линзовидным
аксопластом (Brugerolle, Mignot, 1983).
Экструсомы. Экструсомы представлены кине-
тоцистами с заострённым (Tetradimorpha radia-
ta) (рис. 177, А) или тупоконечным (Heliomorpha)
(рис. 177, Б) цилиндрическим аксиальным элементом.
Аксиальный элемент имеет многослойную структуру
(Brugerolle, Mignot, 1984а). У Tetradimorpha pterbica
экструсомы представлены мукоцистами (Mikijukov,
2000b).
Рис. 177. Кинетоцисты диморфид.
А — Tetradimorpha-, Б — Heliomorpha. (По: Mikrjukov, 2000).
Цитоплазма. Органеллы распределены в цито-
плазме достаточно равномерно; заметного разделения
на экто- и эндоплазму нет. Имеется одна, две или не-
сколько сократительных вакуолей. В цитоплазме также
находятся пищеварительные вакуоли, прекинетоцисты,
митохондрии, липидные капли (рис. 176). Кристы ми-
тохондрий тубулярные (рис. 141, Д). Ядро окружают
диктиосомы (рис. 176) (Brugerolle, Mignot, 1984а).
Ядро и деление клетки. Диморфиды являются
одноядерными организмами. Ядро может занимать в
клетке различное положение. Оно может располагаться
на противоположном жгутикам полюсе клетки, быть
приближенным к аксопласту или облегать аксопласт со
всех сторон. Как правило, единственное ядрышко рас-
полагается в центре ядра.
Деление ядра изучено у Heliomorpha (Mignot, Bru-
gerolle, 1991). В ходе митотического деления первыми
начинают удваиваться кинетосомы. Затем, аксопласт
делится, после чего, имеет место полная разборка обо-
их аксопластов. Происходит конденсация хроматина.
В метафазе ядерная оболочка полностью резорбиру-
ется. Просматривается хорошо развитое веретено де-
ления. Кинетосомы занимают положение на полюсах
веретена. Веретено и кинетосомы связывают друг с
другом короткие исчерченные нити. В составе хромо-
сом не наблюдали дифференцированных кинетохоров.
В анафазе происходит деконденсация хромосом. В те-
лофазе ядерная оболочка восстанавливается. Кана-
лы в ядре образуются благодаря присутствию между
хромосомами пучков микротрубочек. Одновременно
с этим в клетке вновь начинается сборка аксонемных
микротрубочек и вновь появляется ЦОМТ. Таким об-
разом, у этих организмов наблюдается открытый ор-
томитоз, согласно классификации Райкова (Raikov,
1994).
Питание. Диморфиды улавливают различные мел-
кие пищевые организмы при помощи аксоподий (Hsi-
ung, 1927; Brugerolle, Mignot, 1984b). Биение жгутиков
способствуют попаданию пищи к аксоподиям (Mikiju-
kov, 2000b).
Экология и условия обитания
Известны только пресноводные находки димор-
фид. Указания на их присутствие в морских биотопах,
видимо, являются ошибочными. Согласно имеющимся
данным, эти организмы являются придонными обита-
телями (Mikijukov, 2000b).
Систематика и филогения
В 1881 году Грубером (Gruber, 1881) был описан
необычный жгутиконосец. Он обладал одновременно и
двумя жгутиками и аксоподиями, которые отходили от
всей поверхности клетки. Клетка могла быстро втяги-
вать аксоподий и перемещаться с помощью жгутиков.
Ему было присвоено название Dimorpha mutans. Опи-
сание, данное Грубером, чрезвычайно краткое, отсут-
ствует информация о положении ядра, аксопласта. Это
сильно затрудняет сопоставление с более поздними на-
ходками, также идентифицированными, как Dimorpha
mutans. Блокман (Blochmann, 1894) описал под этим
названием ещё один организм неясной видовой при-
надлежности.
В 1907 году Шутенден (Schoutenden, 1907) описал
ещё один «вариант» D. mutans. Его подробное описа-
ние хорошо сопоставимо с более поздними находками
Dimorpha. Это связано с тем, что описание Шутендена
содержит информацию о взаимном расположении ак-
сопласта и ядра у этих организмов. На переднем полю-
се ядра имеется инвагинация, в которой располагается
аксопласт. Аксонемы проходят через каналы пронизы-
вающие ядро.
В серии работ Миньо и Бружеролля (Brugerolle,
Mignot, 1984а, b; Mignot, Brugerolle, 1991) подробно
исследовали на электронно-микроскопическом уровне
ещё один изолят Dimorpha mutans. Судя по всему, их
организм относится к тому же роду, что и диморфида
Шутендена, хотя имеются небольшие различия в рас-
пределении сократительных вакуолей. Также D. mutans
Миньо и Бружеролля отличается мукополисахаридной
оболочкой вокруг переднего жгутика.
252
СОЛНЕЧНИКИ. DIMORPHIDA
Басс и Кавалье-Смит (Bass et al., 2009) вводят новое
родовое название Heliomorpha вместо преоккупирован-
ного Dimorpha. В качестве типового вида они указыва-
ют изолят Миньо и Бружеролля, присваивая ему новое
название Heliomorpha mucosa. Изолят Шутендена на
основании имеющихся различий они переописывают
как второй вид рода — Heliomorpha depressa.
Положение диморфид в системе протистов до сих
пор остаётся дискуссионным вопросом. Первоначаль-
но Холл поместил их в отряд Helioflagellida (Hall, 1953)
вместе с пединеллидами рода Ciliophrys} в системе
Кудо диморфиды составляли отдельное семейство вну-
три отряда Heliozoa (Kudo, 1971). Во многих системах
диморфиды рассматривались с другими амебоидны-
ми жгутиконосцами в составе отряда Rhizomastigida
(Doflein, 1909). Позднее диморфид стали сближать с
центрохелидными солнечниками (Davidson, 1982; Bru-
gerolle, Mignot, 1984b; Febvre-Chevalier, Febvre, 1984).
Существует гипотеза о том, что диморфиды произошли
от амебоидных жгутиконосцев подобных Cercomonas
(Smith, Patterson, 1986; Mikrjukov, 2000b). Басс с соав-
торами (Bass et al., 2009) рассматривают диморфид в
составе класса Granofilosea (Cercozoa, Rhizaria).
Молекулярные данные по этой группе пока отсут-
ствуют.
Систематический обзор
Род Heliomorpha Cavalier-Smith et Bass 2009
(рис. 178, A)
Диморфиды, имеющие два жгутика. Аксопласт рас-
полагается во впячивании ядра. Микротрубочки в аксо-
подиях расположены в шахматном порядке.
Типовой вид: Heliomorpha mucosa Cavalier-
Smith et Bass 2009.
Рис. 178. Диморфиды.
A — Tetradimorpha tetramastix, общий вид; Б — Heliomorpha depressa, общий вид; В — Acinetactis elegans, общий вид. (По: Siemensma, 1991 —
Л; Shoutenden, 1907 — Б', Valkanov, 1928 — В).
СОЛНЕЧНИКИ. PEDINELLIDA
253
Род Tetradimorpha Hsiung 1927 Род Acinetactis Stokes 1886 (рис. 178, В)
(рис. 178, Б)
Диморфиды с двумя жгутиками, аксопласт которых
Диморфиды с четырьмя жгутиками. Микротрубоч- располагается в центре клетки. Он связан с ядром но не
ки в аксоподиях лежат неупорядочено. находится во впячивании ядерной оболочки.
Типовой вид: TetradimorpharadiataHsiung 1927. Типовой вид: Acinetactis mirabilis Stokes 1886.
Отряд Pedinellida Zimmermann, Moestrup et Hallfors 1984
И жгутик, и аксоподий у пединеллид присутству-
ют одновременно. Единственный жгутик покрыт трёх-
частными трубчатыми мастигонемами. Имеется две
кинетосомы, одна из которых не имеет жгутика. ЦОМТ
представлен электронно-плотным аксопластом, связан-
ным с ядерной оболочкой. Аксонема каждой аксоподий
состоит из трёх микротрубочек, расположенных в виде
равностороннего треугольника. Экструсомы представ-
лены мукоцистами. Известны только одноядерные
формы. Поверхность клетки у некоторых видов несёт
органические чешуйки. Часть представителей имеют
стебельки. Описано инцистирование с образованием
трёхслойной оболочки. У части представителей в клет-
ках присутствуют хлоропласты. Известны автотроф-
ные, гетеротрофные и миксотрофные представители.
Кристы митохондрий тубулярного типа.
Классификация
Отряд Pedinellida Zimmermann, Moestrup et Hallfors 1984
Род Apedinella Throndsen 1971
Род Mesopedinella Daugbjerg 1996
^Qj\Helicopedinella (Roukhiyajnen 1966) Sekiguchi et al. 2003
Род Pseudopedinella^. Carter 1937
Род Pedinella Vysotskii 1888
Род Pteridomonas Penard 1890
Род Actinomonas Kent 1880
Род Parapedinella Pedersen, Beech et Thomsen 1986
Род Ciliophrys Cienkowski 1876
Морфология и биология
Покровы. Среди пединеллид встречаются как ор-
ганизмы без каких-либо специальных покровных об-
разований (некоторые Pedinella, Actinomonas, Pterido-
monas, Pseudopedinella, Ciliophrys), так и организмы,
клеточная поверхность которых несёт чешуйки (Pe-
dinella squamata, Apedinella, Mesopedinella, Parapedi-
nella). У Pedinella squamata, Parapedinella и Mesopedi-
nella имеются только пластинчатые чешуйки. Каждая
чешуйка состоит из утолщенной каймы и более тон-
кой центральной части, представленной сетью воло-
кон (рис. 179, Д, Ж, И). У Apedinella помимо чешуек,
организованных по описанному выше типу имеются
сильно удлинённые радиальные чешуйки (рис. 179,
Е) (Throndsen, 1971; Pedersen et al., 1986; Daugbjerg,
1996a). Волокна, входящие в состав мембраны пла-
стинчатых чешуек Pedinella squamata, Mesopedinella и
Apedinella расположены хаотично (рис. 179, Д, Ж), в то
время как в случае Parapedinella они образуют упоря-
доченную ячеистую структуру (рис. 179, И).
Чешуйки образуются в вакуолях, синтезирующих-
ся в аппарате Гольджи (Daugbjerg, 1996а). Природа ма-
териала, из которого состоят чешуйки, пока неизвест-
на. Данные энерго-дисперсионного анализа чешуек
Parapedinella показали отсутствие в них кремнезёма
(Pedersen etal., 1986).
Аксоподий. У представителей родов Parapedi-
nella и Ciliophrys аксоподий могут образовываться в
любом месте клеточной поверхности. У Pteridomonas,
Actinomonas и Pedinella аксоподий сгруппированы
венчиком вокруг апикально расположенного жгутика.
Обычно они образуют два хорошо выраженных кольца
вокруг жгутика. У Pteridomonas во внешнем круге две-
надцать, а во внутреннем — шесть аксоподий. Такие
же два круга аксоподий имеются и у Actinomonas но,
помимо этого аксоподий часто образуются и в других
областях клетки. У Pseudopedinella elastica аксопо-
дии могут образовывать два венчика: верхний (вокруг
жгутика) и нижний (вокруг стебелька) (Zimmermann
et al., 1984). У Mesopedinella, Pseudopedinella pyrifor-
mis и P thomsenii образование аксоподий не описано
(Throndsen, 1971; Ostroff, Valkenburg, 1978; Thomsen,
1988; Daugbjerg, 1996a).
У многих пединеллид в апикальной части клетки
находится трёхмерная электронно-плотная сеть, объ-
единяющая аксонемы (рис. 180) — апикальный цито-
скелет. Эта структура описана у представителей родов
Pteridomonas, Actinomonas, Mesopedinella, Pseudo-
pedinella (Throndsen, 1971; Ostroff, Valkenburg, 1978;
Larsen, 1985, Patterson, Fenchel, 1985; Thomsen, 1988;
Daugbjerg, 1996a). Существует также тщательное ис-
следование апикального цитоскелета Apedinella кото-
рый реконструировали Котолис с соавторами (Koutoulis
et al., 1988). На основании электронно-микроскопиче-
ских исследований, а также с помощью иммуно-флю-
оресцентных методик была предложена модель цито-
скелета Apedinella. Радиальные чешуйки связывают с
плазмалеммой так называемые микролигаменты — ис-
черченные связки (рис. 181). Микролигаменты соеди-
няются с электронно-плотными пластинками мембра-
ны. Пластинки соединяются между собой через одну
мощными пучками центрина и актина. Таким образом,
при виде сверху можно наблюдать фигуру в виде двух
налагающихся равнобедренных треугольников или ше-
стиконечной звезды (рис. 182). Своеобразную структу-
ру имеют аксоподиальные аксонемы, представленные
триадами микротрубочек (рис. 181). Три аксонемы
254
СОЛНЕЧНИКИ. PEDINELLIDA
каждого сектора клетки не продолжаются за пределы
клетки, они копированы цилиндрическими структура-
ми. Ещё две аксонемы дают начало паре аксоподий,
одна из которых связана с микролигаментом, а дру-
гая — с основанием радиальной чешуйки. Ещё одна
кэпированная аксонема проходит под поверхностью
клетки до места отхождения стебелька. Одна аксонема
заходит в стебелёк.
Как уже было сказано, каждая аксоподия поддер-
живается триадой микротрубочек. На тангентальном
срезе микротрубочки располагаются в форме равнобе-
дренного треугольника (рис. 137, Е). Аксонемные ми-
кротрубочки отходят от аксопластов, расположенных
на поверхности ядерной оболочки. У представителей
родов Actinomonas и Pteridomonas в этой области име-
ются структуры, напоминающие подпорки (рис. 183).
Рис. 179. Пединеллиды.
А — Pedinella hexacostata, общий вид колонии; Б — Pseudopedinella elastica, общий вид; В — Helicopedinella tricostata, общий вид; Г-Е — Apedinella
radians'. Г— общий вид, Д—тангентальная чешуйка, Е — радиальная чешуйка; Ж, 3 — Mesopedinella arctica'. Ж — чешуйка, 3 — общий вид; И, К—
Parapedinella reticulata’. И— чешуйка; К— общий вид; Л — Pteridomonas danica, общий вид; М— Actinomonas pusilia, общий вид; Н— Ciliophrys
infusionum, общий вид. (По: Lee, 1980 — Л; Zimmerman et al., 1984 — Б; Sekiguchi et al., 2003 — В, Г, 3, К; Koutoulis et al., 1988 —Д, E; Daugbjerg,
1996a — Ж', Pedersen et al., 1986 — И; Siemensma, 1991 —Л-Н).
СОЛНЕЧНИКИ. PEDINELLIDA
255
Рис. 180. Апикальный цитоскелет Actinomonas.
У Ciliophrys аксопласты на срезе имеют вид трёхло-
пастных электронно-плотных пятен (Davidson, 1982).
Места выхода аксонем за границу клеточной поверх-
ности армированы волокнистым материалом (рис. 183)
(Larsen, 1985; Patterson, Fenchel, 1985).
Движение. Среди пединеллид есть как подвиж-
ные активно плавающие представители (Pseudopedi-
nella, Apedinella, Mesopedinella, Helicopedinella, Para-
pedinella), так и пассивные организмы, переходящие
к жгутиковой локомоции только изредка (Ciliophrys).
Наконец, представители родов Pedinella, Actinomonas и
Pteridomonas прикрепляются к субстрату стебельком и
перемещаются с помощью жгутика только в целях рас-
селения, сохраняя при этом стебелек.
При различных стрессовых воздействиях аксопо-
дии Ciliophrys infusionum могут втягиваться. Согласно
наблюдениям Дэвидсона (Davidson, 1982), этот про-
цесс осуществляется двумя путями.
В ответ на механический стимул (например — при-
косновение стеклянным капилляром) аксоподии втяги-
ваются практически моментально (процесс занимает
менее 20 мс). Последующее восстановление аксоподий
занимает 2-3 минуты. В первые 30-40 секунд новые
стимулы не вызывают сокращения (фаза рефрактерно-
сти). Моментальное втягивание аксоподий характерно
также для Pedinella и других пединеллид.
аа — аксонема аксоподии; аж — аксонема жгутика; ак — аксоподия;
ж — жгутик; пт — параксиальный тяж; эпм — электронно-плотный ма-
териал. (По: Larsen, 1985).
Рис. 181. Движение радиальных чешуек Apedinella.
А — радиальные чешуйки направлены назад; Б — радиальные чешуйки направлены вбок; 1-6 — номера аксонем (пояснения в тексте), а — аксонема;
ак — аксоподия; ж — жгутик; к — цилиндрический кэп; мл — микролигамент; пл — электронно-плотная пластинка; рч — радиальная чешуйка; ц —
пучок центрина; я — ядро. (По: Koutoulis et al., 1988).
256
СОЛНЕЧНИКИ. PEDINELLIDA
Рис. 182. Апикальный цитоскелет Apedinella.
ак — аксоподия; ж — жгутик; мл — микролигамент; пи — пиреноид;
пл — электронно-плотная пластинка; рч — радиальная чешуйка; ч —
пластинчатая чешуйка. (По: Koutoulis et al., 1988).
При опосредованной стимуляции Ciliophrys, такой,
например, как сотрясение емкости, в которой находят-
ся клетки, аксоподий втягиваются медленнее и клетка
переходите жгутиковую стад и ю. Остатки аксо-
подий концентрируются в задней части клетки, фор-
мируя подобие хвоста. Процесс трансформации может
занимать около 30 секунд.
Для свободноплавающих клеток Apedinella, покры-
тых пластинчатыми чешуйками, а также несущих пояс
из шести радиальных чешуек, характерен ещё один ин-
тересный вариант подвижности. Когда клетка движет-
ся вперёд, чешуйки направлены назад, образуя конус
на конце клетки (рис. 181, А). Но когда клетка оста-
навливается, чтобы изменить направление движения
радиальные чешуйки отгибаются вперёд, и становятся
перпендикулярными поверхности клетки (рис. 181, Б).
Оказалось, что это явление обеспечивается работой
сложной системы апикального цитоскелета (Koutoulis
etal., 1988).
Жгутиковый аппарат. У пединеллид имеется один
апикальный жгутик. У представителей рода Ciliophrys
на стадии солнечника, в состоянии покоя или медлен-
ного биения жгутик, как правило, имеет форму вось-
мёрки (Ciliophrys infusionum) (рис. 184, А) или двойной
восьмёрки (Ciliophrys azurina) (Cienkowski, 1876; Mi-
krjukov, Patterson, 2001). По данным Дэвидсона (David-
son, 1982) жгутик сохраняет свою характерную форму
даже будучи отделённым от клетки, хотя и перестаёт
двигаться. Клетка через некоторое время развивает но-
вый жгутик. На подвижной стадии жгутик утрачивает
форму восьмёрки и волнообразно ундулирует.
По всей длине жгутик несёт гребень, внутри кото-
рого находится в той или иной степени развитый парак-
сиальный тяж (Larsen, 1985; Pedersen et al., 1986). Лишь
у Pteridomonas параксиальный тяж почти отсутствует
(Patterson, Fenchel, 1985).
Жгутик покрывают один (Pedinella', Pseudopedinel-
la, Apedinella) или два (Ciliophrys, Pteridomonas, Acti-
nomonas, Parapedinella, Mesopedinella) ряда трёхчаст-
ных трубчатых мастигонем (рис. 183). Мастигонемы
несут на вершине один (Ciliophrys) или три терминаль-
ных филамента, имеют трубчатый стержень и неболь-
шую базальную часть (Davidson, 1982; Pedersen et al.,
1986). Формирующиеся мастигонемы могут находить-
ся как в цистернах ЭПР, так и в диктиосомах аппара-
та Гольджи (Zimmermann et al., 1984). У Actinomonas,
Pteridomonas, Parapedinella также могут присутство-
вать жгутиковые чешуйки, окружённые зернистой
электронно-плотной каймой (Larsen, 1985; Patterson,
Fenchel, 1985; Petersen et al., 1986).
В переходной зоне жгутика находится поперечная
пластинка, располагающаяся чуть выше поверхности
клетки (Throndsen, 1971; Hibberd, 1979; Zimmermann et
al., 1984; Larsen, 1985; Patterson, Fenchel, 1985). У Cili-
ophrys, Apedinella и Pteridomonas проксимальнее по-
перечной пластинки располагается структура в виде
двух колец или спирали с двумя завитками (рис. 183).
У Actinomonas в этой зоне располагается тонкая пла-
стинка электронно-плотного материала (Larsen, 1985).
Микротрубочки центрального дублета аксонемы жгу-
тика могут быть соединены с поперечной пластинкой
с помощью нитевидных связок (Koutoulis et al., 1988;
Daugbjerg, 1996a).
Две кинетосомы связаны друг с другом, а также с
ядерной оболочкой электронно-плотным материалом
(рис. 183) (Swale, 1969; Throndsen, 1971; Davidson,
1982; Zimmermann et al., 1984; Larsen, 1985; Patterson,
Fenchel, 1985; Daugbjerg, 1996a). У Pteridomonas, Ac-
tinomonas, Pedinella, Apedinella и Mesopedinella между
ядерной оболочкой и основанием жгутиковой кинето-
сомы располагаются две электронно-плотных струк-
туры, по форме напоминающие полумесяцы (рис. 183)
(Larsen, 1985; Patterson, Fenchel, 1985; Daugbjerg,
1996a, b). Внутри кинетосом находится электронно-
плотный материал.
Стебелёк. Как уже было сказано выше, у всех
представителей пединеллид кроме Ciliophrys и Para-
pedinella имеется цитоплазматический стебелёк, яв-
ляющийся выростом клетки (Zimmermann et al., 1984;
Larsen, 1985; Patterson, Fenchel, 1985; Daugbjerg,
1996a). У представителей родов Pedinella, Actinomonas
и Pteridomonas стебелёк тонкий, служит для при-
крепления клетки к субстрату и может быстро сокра-
щаться (Sekiguchi et al., 2003). Pseudopedinella и Meso-
pedinella имеют более толстый стебелёк и никогда не
используют его для прикрепления. У Pseudopedinella
thomsenii стебелёк может сокращаться, но этот про-
цесс значительно медленнее, чем у прикреплённых
пединеллид (Thomsen, 1988). У Apedinella стебе-
лёк маленький и также не служит для прикрепления.
У Mesopedinella и Apedinella стебелёк присутствует не
СОЛНЕЧНИКИ. PEDINELLIDA
257
постоянно (Zimmermann et al., 1984; Daugbjerg, 1996a).
У Helicopedinella стебелёк спирально закручен и не
прикрепляется к субстрату.
У прикреплённых форм внутри стебелька распо-
лагается аксонема, микротрубочки которой отходят
от ядерной оболочки (Larsen, 1985; Patterson, Fenchel,
1985). Таким образом, у этих представителей стебелёк
представляет собой специализированную аксоподию.
У Pseudopedinella и Mesopedinella микротрубочки в
стебельке не обнаружены (Ostroff, Valkenburg, 1978;
Daugbjerg, 1996а).
У Actinomonas, Pteridomonas, Pseudopedinella, Ape-
dinella в стебелёк заходит окружённая мембраной орга-
нелла, внутри которой находятся многочисленные ве-
зикулы — везикулярная система стебелька (рис. 183).
Её окружают диктиосомы (Larsen, 1985; Patterson,
Fenchel, 1985; Thomsen, 1988). В области перехода этой
органеллы из клетки в стебелёк имеется электронно-
плотное кольцо, напоминающее сфинктер (рис. 183)
(Larsen, 1985). У Mesopedinella, Pedinella везикулярная
система стебелька слабо развита и не окружена дикти-
осомами (Swale, 1969; Daugbjerg, 1996а).
Рис. 183. Схема тонкого строения Pteridomonas danica.
а — аксоподия; б — бактерия; д — диктиосома; к1 — кинетосома 1; к2 — кинетосома 2; л — липидная капля; м — митохондрия; мгн — мастиго-
немы; вес — везикулярная система стебелька; пв — пищеварительная вакуоль; пм — электронно-плотные структуры; напоминающие полумесяцы;
пс — переходная спираль; с — стебелёк; сф — структура, напоминающая сфинктер; э — экструсома; эпм — электронно-плотный материал в местах
отхождения аксоподий; эпр — эндоплазматический ретикулум; я — ядро; яд — ядрышко. (По: Patterson, Fenchel, 1985).
258
СОЛНЕЧНИКИ. PEDINELLIDA
Рис. 184. Пединеллиды (Pedinellida) (А, Б) и Ротосфериды (Rotosphaerida) (В-Ж).
А — Ciliophrys infusionum: общий вид клетки (фазовый контраст); Б — Ciliophrys infusionum: общий вид клетки (контраст Номарского); В — Рот-
pholyxophrys exigua: общий вид клетки (фазовый контраст); Г— Pompholyxophrys exigua: общий вид клетки (контраст Номарского); Д, Е — Pompho-
lyxophrys exigua. сферические скелетные элементы (СЭМ); Ж— Pompholyxophrys exigua: сферические скелетные элементы (контраст Номарского),
а — аксоподия; б — бактерии; ж — жгутик; ф — филоподия; ч — чешуйки; э — экструсомы; я — ядро. Масштабные линейки: 10 мкм.
Нередко стебелёк ветвится. У Pedinella hexa-
costata это приводит к образованию колоний, а у Pseu-
dopedinella к появлению корневидных выростов на кон-
це стебелька (Высоцкий, 1887; Zimmermann et al., 1984).
Экструсомы. Экструсомы пединеллид представля-
ют собой мукоцисты (рис. 183). У Ciliophrys infusionum
они располагаются приблизительно на одинаковом рас-
стоянии друг от друга и их способность к двунаправ-
СОЛНЕЧНИКИ. PEDINELLIDA
259
ленному перемещению вдоль аксоподий сильно огра-
ничена.
По данным исследований методом замораживания-
скалывания (Davidson, 1976) прикрепление мукоцист к
плазмалемме у Ciliophrys осуществляется с помощью
специальных частиц, число которых варьирует от 6 до
100 на одну экструсому.
Мукоцисты пединеллид образуются в аппарате
Гольджи. У Ciliophrys на ранних этапах развития в экс-
трусомах видны многочисленные пузырьки с электрон-
но-плотным содержимым. На более зрелых стадиях
пузырьки сливаются, и образуется система трубочек,
также заполненных электронно-плотным материалом.
Наконец, в зрелой мукоцисте всё содержимое осмио-
фильно (Davidson, 1976).
Также экструсомы описаны у Pedinella, Apedinella,
Actinomonas, Pteridomonas, Parapedinella (Swale, 1969;
Throndsen, 1971; Larsen, 1985; Patterson, Fenchel, 1985;
Pedersen et al., 1986).
Цитоплазма. У Ciliophrys в кортикальном слое
цитоплазмы располагаются митохондрии, пищевари-
тельные вакуоли, шероховатый ЭПР. Вокруг ядра на
небольшом расстоянии располагаются диктиосомы.
Вокруг оболочки ядра находится свободная зона, в ко-
торой наблюдаются только рибосомы (Davidson, 1976;
1982).
У прикреплённых представителей в апикальной
части располагаются пищеварительные вакуоли и ми-
тохондрии, а в базальной части клетки находятся одна
или несколько диктиосом (рис. 183) (Larsen, 1985; Pat-
terson, Fenchel, 1985; Daugbjerg, 1996a).
У всех представителей в центре клетки располага-
ется крупное сферическое ядро (рис. 183).
Для митохондрий пединеллид характерны корот-
кие тубулярные кристы (рис. 141, Ж). Внутри крист
могут наблюдаться электронно-плотные включения
(Swale, 1969; Throndsen, 1971; Davidson, 1982; Zimmer-
mann et al., 1984; Larsen, 1985; Patterson, Fenchel, 1985).
У фототрофных представителей (Apedinella, Mesope-
dinella, Pseudopedinella) митохондрии располагаются
между хлоропластами и ядром и соединяются между
собой в общую сеть (Koutoulis et al., 1988; Thomsen,
1988; Daugbjerg, 1996a). С митохондриями могут быть
связаны микротельца (Zimmermann, et al., 1984; Daug-
bjerg, 1996a).
Хлоропласты. У части представителей пединел-
лид (Apedinella, Pseudopedinella, Mesopedinella, Pedi-
nella, Helicopedinella) описаны активные хлоропласты.
В большинстве случаев вокруг ядра располагаются
шесть хлоропластов. Исключением являются предста-
вители Pseudopedinella thomsenii и Helicopedinella, у
которых их только три (Thomsen, 1988).
Сложные хлоропласты пединеллид окружены тре-
мя мембранами и больше всего напоминают хлоропла-
сты охрофитов. Как и в случае последних, считается,
что они произошли от красных водорослей (Cavalier-
Smith, 2006).
В составе хлоропластов Apedinella, Pseudopedi-
nella, Helicopedinella и Pedinella squamata отмечено
наличие пиреноидов. Чаще всего пиреноид образует
бугорок на поверхности хлоропласта. При этом его
пронизывают трубчатые впячивания хлоропластной
мембраны. У Pedinella squamata эти инвагинации
имеют не трубчатую, а щелевидную форму (Sekiguchi
et al., 2003). У Pseudopedinella thomsenii пиреноид не
образует бугорка на поверхности хлоропласта (Thom-
sen, 1988), но трубковидные впячивания мембраны вы-
ражены. Наконец, у Helicopedinella отсутствуют как
бугорок, так и впячивания. У Pedinella swalei и Me-
sopedinella отсутствуют пиреноиды как таковые. Как
правило, хлоропласты находятся в перинуклеарном
пространстве. У Pedinella squamata хлоропласты не
связаны с ядром непосредственно. Их соединяет слой
цистерн ЭПР (Sekiguchi et al., 2003). Предполагают, что
это связано с тем, что эти организмы миксотрофны, и
транспорт пищеварительных вакуолей в заднюю часть
клетки осуществляется между хлоропластами и ядром.
В хлоропластах хорошо выражена опоясывающая ла-
мелла. Тилакоиды ассоциированы в группы по три, при
этом одиночные тилакоиды связывают стопки между
собой (Daugbjerg, 1996а).
У Pteridomonas в цитоплазме обнаружены руди-
ментарные неактивные хлоропласты — лейкопласты.
Кроме того, показано наличие у Pteridomonas хлоро-
пластного гена rbcL (Sekiguchi et al., 2002). В этой же
работе были выполнены аналогичные исследования на
Ciliophrys. У этих организмов лейкопласты не были об-
наружены. Тем не менее, ген rbcL был выявлен и в этом
случае.
Ядро и деление клетки. Для пединеллид характер-
но наличие одного ядра с одним крупным ядрышком
в центре (рис. 184, А). Ядро всегда занимает в клетке
центральное положение (Davidson, 1982; Larsen, 1985).
У Ciliophrys azurina помимо центрального ядрышка
имеется периферический слой ядрышкового материала
(Mikrjukov, Patterson, 2001).
Процесс деления детально изучен на примере Ape-
dinella radians (Koutoulis, Wetherbee, 1993a-c).
При подготовке к делению удваивается число хло-
ропластов, радиальных чешуек и кинетосом. По обе
стороны от материнской диктиосомы образуются две
дочерних. В профазе на полюсах ядра накапливается
центрин, от которого позднее начинают отходить ми-
кротрубочки веретена деления.
На стадии метафазы по бокам от материнского
жгутика формируются два дочерних. При этом мате-
ринский жгутик укорачивается до тех пор, пока не ис-
чезнет вовсе. Дочерние жгутики в это время, напротив,
увеличиваются и затем расходятся между двумя особя-
ми (рис. 185) (Patterson, Fenchel, 1985; Heimann et al.,
1989; Daugbjerg, 1996a). Ядерная оболочка перфори-
руется на полюсах. Микротрубочки внутриядерного
веретена деления подходят к метафазной пластинке.
Кинетохоры на хромосомах не выражены. В конце ме-
тафазы начинается расхождение кинетосом.
В ходе анафазы веретено деления удлиняется. Ма-
теринский жгутик к этому времени полностью исчезает.
На стадии телофазы хлоропласты расходятся в
тесной связи с ядрами по три в каждую дочернюю
клетку. Начинает образовываться борозда деления.
260
СОЛНЕЧНИКИ. PEDINELLIDA
Рис. 185. Схема деления Pteridomonas danica.
1 — интерфазная клетка; 2 — по бокам образуются два дочерних жгути-
ка; 3,4 — материнский жгутик укорачивается, дочерние — удлиняются;
5 — клетка с двумя дочерними жгутиками; материнский жгутик полно-
стью отсутствует. (По: Patterson, Fenchel, 1985).
Рис. 186. Схема питания Pteridomonas danica.
Стрелками показано направление фильтрующих токов. (По: Christensen-
Dalsgaard, Fenchel, 2003).
Происходит деление хлоропластов в меридиональной
относительно веретена плоскости (Zimmermann et al.,
1984; Koutoulis, Wetherbee, 1993b, с). Верхние дочер-
ние хлоропласты смещаются относительно нижних, и
восстанавливается интерфазное состояние с кольцом
из шести хлоропластов вокруг ядра. Видимо, борозда
деления провоцирует и деление митохондриальной
сети. Также происходит деление апикального цитоске-
лета. Образуется два равнобедренных треугольника,
которые у дочерних клеток потом достраиваются до
полной шестиконечной звезды. Предполагается, что
перестройка апикального цитоскелета тесно связана с
делением и смещением хлоропластов (Koutoulis, Weth-
erbee, 1993b, с).
Таким образом, у этих организмов наблюдается по-
лузакрытый ортомитоз, согласно классификации Рай-
кова (Raikov, 1994).
Инцистирование. Инцистирование описано у
Mesopedinella, Pseudopedinella и Apedinella (Thomsen,
1988; Daugbjerg, 1996a). У Pseudopedinella thomsenii
циста окружена трёхслойной оболочкой. Внешний
электронно-плотный и волокнистый слой имеет неров-
ный контур. Рентгеновский анализ показал, что этот
слой оболочки цисты содержит железо. Цитоплазма
цисты электронно-плотная. Число хлоропластов в ци-
сте варьирует от двух до шести. (Thomsen, 1988). В ци-
стах Apedinella отмечено наличие цистной пробки. Со-
матические чешуйки, если они есть, покрывают цисту
снаружи (Daugbjerg, 1996а).
Питание. Среди пединеллид встречаются фото-
трофные (Apedinella, Mesopedinella, Helicopedinelld),
миксотрофные (Pedinella и возможно Pseudopedinella)
и гетеротрофные формы (Ciliophrys, Actinomonas,
Pteridomonas, Parapedinelld).
С помощью жгутика прикреплённые пединеллиды
создают ток воды через систему аксоподий (рис. 186).
Мелкие пищевые объекты, которыми для большинства
представителей служат бактерии, прилипают к аксопо-
диям (Patterson, Fenchel, 1985). Пища фагоцитируется
на переднем конце клетки. Переваривание осуществля-
ется в крупных вакуолях на заднем конце.
По некоторым неподтверждённым данным Pseudo-
pedinella (Р rhizopodiaca, Р elastica и Р erkensis) могут
фагоцитировать пищу, используя для этого стебелёк
(Skuja, 1948; Schiller, 1952).
Для Ciliophrys характерно питание более крупны-
ми организмами, например — диатомовыми водорос-
лями (Mikrjukov, Patterson, 2001).
Агамные слияния. У Ciliophrys и Pteridomonas не-
редко можно наблюдать псевдокопуляцию (Cienkowski,
1876; Davidson, 1982; Patterson, Fenchel, 1985). У Cili-
ophrys это явление может иметь место, как при нор-
мальных условиях, так и при искусственном контакте
клеток в результате центрифугирования. Нередко одна
из клеток синцития переходит в жгутиковую стадию
и тянет за собой всю остальную цитоплазматическую
массу.
Экология и условия обитания
Пединеллиды представлены, в основном, морски-
ми организмами. Представители Pseudopedinella могут
встречаться как в морских (Р pyriformis, Р thomsenii),
так и в солоноватоводных (Р elastica) водоёмах (Daug-
bjerg, 1996а).
Ciliophrys infusionum считается эвригалинным ви-
дом. Представители этого вида нередко населяют за-
грязнённые водоёмы с сильно заиленным дном (Sie-
mensma, 1991). С. azurina описан только из морского
биотопа (Mikrjukov, Patterson, 2001).
Некоторые представители Pedinella являются эври-
галинными, известны их находки в морских, пресных
и солоноватоводных биотопах (Swale, 1969). Pseudo-
pedinella thomsenii и Mesopedinella arctica являются
криофильными организмами и живут при температуре
близкой к 0 °C (Daugbjerg, 1996а).
Систематика и филогения
Среди пединеллид есть как представители с хло-
ропластами, так и бесцветные организмы. Это стало
причиной того, что первые были предметом изучения
альгологов, а вторыми занимались протозоологи.
Зоологи включали гетеротрофных представителей
этой группы в состав Rhizomastigida (Doflein, 1909 и др.),
Heliozoa (Levine et al., 1980 и др.) и других отрядов (см.
также аналогичный раздел по Dimorphida). Сходство
венчика аксоподий Pteridomonas с воротничком хоаноф-
лагеллат, заставляло исследователей ошибочно сбли-
СОЛНЕЧНИКИ. PEDINELLIDA
261
жать этот род с воротничковыми жгутиконосцами (см.,
например, Davidson, 1982). Окрашенные представители
рассматривались альгологами в составе золотистых во-
дорослей Chrysophyta (Pascher, 1910; Zimmermann et al.,
1984; Cavalier-Smith, 1986; Moestrup, 1995).
Более современные морфологические исследо-
вания указывают на то, что это единая группа. Уль-
траструктурные особенности всех пединеллид чрез-
вычайно схожи, и отличие между бесцветными и
окрашенными формами состоит только в отсутствии
или наличии хлоропластов. Эта граница стала ещё бо-
лее размытой после открытия у Pteridomonas лейкопла-
стов и хлоропластного гена rbcL, а также находки этого
же гена у Ciliophrys (Sekiguchi.et al., 2002).
Паттерсоном высказывалась радикальная точка
зрения, согласно которой гетеротрофные представите-
ли пединеллид являются предковой формой всех гете-
роконтных водорослей (Patterson, 1986). Но согласно
данным молекулярно-филогенетического анализа пе-
динеллиды занимают место самостоятельной группы
в пределах таксона Stramenopiles (Cavalier-Smith et al.,
1995; Cavalier-Smith, Chao, 1996; Adi et al., 2005). В та-
ком случае наиболее древними следует считать авто-
трофных Pedinellida, а переход к фаготрофии и утрата
хлоропластов представляются вторичными явлениями.
На основании как морфологических, так и моле-
кулярно-генетических данных, представители рода
Ciliophrys сильно отличаются от других пединел-
лид и близки к представителям своеобразного рода
Rhizochromulina. Существование монофилетической
клады, объединяющей эти два рода, подтверждается
кладистическим анализом на основании морфологи-
ческих признаков (Sekiguchi et al., 2003). Эта же клада
присутствует на деревьях, основанных на сравнении
последовательностей генов 18S рДНК и rbcL, в том чис-
ле при комбинированном анализе по двум этим генам
(Cavalier-Smith et al., 1995; Cavalier-Smith, Chao, 1996;
Sekiguchi et al., 2003). Таким образом, утрата хлоропла-
стов у Ciliophrys и других гетеротрофных пединеллид
{Actinomonas, Pteridomonas, Parapedinella} происходила
независимо. Эти данные свидетельствуют о полифиле-
тичности таксона Pedinellida и необходимости вывода
Ciliophrys из состава этой группы. Согласно правилам
кладизма, следовало бы рассматривать Ciliophrys в со-
ставе отдельной группы вместе с Rhizochromulina. Но,
как будет показано ниже, этот таксон, в свою очередь
может оказаться парафилетическим.
Широкое распространение получила гипотеза, со-
гласно которой Ciliophrys — предковая форма, давшая
начало отряду Actinophryida (Davidson, 1982; Patterson,
1986; Mikrjukov, Patterson, 2001). Среди сходств ак-
тинофриидных солнечников и Ciliophrys можно упо-
мянуть строение ЦОМТа, ядра, экструсом. Согласно
предположению Паттерсона утрата представителями
Ciliophrys жгутикового аппарата и усложнение аксо-
немной решётки могли привести к возникновению Ac-
tinophrys. Этот морфологический ряд дополняет сход-
ство в строении аксоподий и локализации ядрышкового
материала у Ciliophrys azurina и Actinophrys (Mikrju-
kov, Patterson, 2001). Как уже было упомянуто выше,
данные молекулярно-филогенетического анализа не
противоречат этой точке зрения, но и не подтвержда-
ют её полностью, так как разрешить место ответвления
актинофриидных солнечников на древе страменопилов
пока не удалось (Nikolaev et al., 2004).
Таким образом, для построения естественной си-
стемы солнечникоподобных страменопилов необходи-
мы дополнительные исследования. Именно поэтому,
мы пока рассматриваем род Ciliophrys в составе педи-
неллид.
Систематический обзор
Род Apedinella Throndsen 1971 (рис. 179, Г-Е)
Одиночные свободноплавающие организмы с ше-
стью хлоропластами. В покровах присутствуют пла-
стинчатые чешуйки с мелкоячеистой структурой и
шесть радиальных чешуек. По две короткие аксоподий
поддерживают каждую из радиальных чешуек. Пита-
ние автотрофное.
Типовой вид:ApedinellaspiniferaThrondsen 1971.
Род Mesopedinella Daugbjerg 1996
(рис. 179, Ж, 3)
Монотипный род с единственным видом — Meso-
pedinella arctica Daugbjerg 1996. Одиночные свобод-
ноплавающие организмы. Клетка покрыта овальными
чешуйками с мелкоячеистой структурой. Имеется сте-
белёк, но он не служит для прикрепления к субстрату.
Аксоподий отсутствуют. Питание автотрофное.
Род Helicopedinella (Roukhiyajnen 1966)
Sekiguchi et al. 2003 (рис. 179, В)
Монотипный род с единственным видом — Heli-
copedinella tricostata (Roukhiyajnen 1966) Sekiguchi et
al. 2003. Одиночные свободноплавающие организмы с
тремя хлоропластами. Стебелёк спирально закручен,
не служит для прикрепления к субстрату. Имеются ак-
соподии вокруг жгутика. Питание автотрофное.
Род Pseudopedinella Carter 1937 (рис. 179, Б)
Одиночные свободноплавающие организмы. Число
хлоропластов три или шесть. Имеется стебелёк, но он
не служит для прикрепления к субстрату. Аксоподий
отсутствуют. Питание автотрофное.
Типовой вид: Pseudopedinella pyriformis Carter
1937.
Род Pedinella Vysotskii 1888 (рис. 179, A)
Типовой вид: Pedinella hexacostata Vysotskii
1888.
Одиночные или колониальные, прикреплённые
организмы. Иногда присутствуют чешуйки. Стебелёк
262
СОЛНЕЧНИКИ. ROTOSPHAERIDA
нередко разветвлённый, служит для прикрепления к
субстрату. Аксоподий располагаются венчиком вокруг
жгутика. Возможно как питание с помощью аксоподий,
так и фотосинтез.
Род Pteridomonas Penard 1890 (рис. 179, Л)
Одиночные прикреплённые организмы. Описан
лейкопласт. Чешуйки отсутствуют. Аксоподий образу-
ют венчик вокруг жгутика, гранулы хорошо выражены.
Питание гетеротрофное.
Типовой вид: Pteridomonaspulex Penard 1890.
For ActinomonasS. Kent 1880 (рис. 179, M)
Одиночные прикреплённые организмы. Хлоро-
пласты и чешуйки отсутствуют. Аксоподий с хорошо
выраженными гранулами отходят от всей поверхности
клетки. Питание гетеротрофное.
Типовой вид: Actinomonas mirabilis S. Kent 1880.
Род Parapedinella Pedersen, Beech et Thomsen
1986 (рис. 179, И, К)
Монотипный род с единственным видом Parapedi-
nella reticulata Pedersen, Beech et Thomsen 1986. Оди-
ночные свободноплавающие организмы. Хлоропласты
отсутствуют. Клетку окружают тангентальные чешуй-
ки с крупноячеистой структурой. Стебелёк отсутствует.
Аксоподий отходят от всей поверхности клетки, хоро-
шо выражены гранулы. Питание гетеротрофное.
Род Ciliophrys Cienkowski 1876
(рис. 184, А, Б; 179, Н)
Одиночные малоподвижные организмы. Хлоро-
пласты и чешуйки отсутствуют. Аксоподий с хорошо
выраженными гранулами отходят от всей поверхности
клетки. Питание гетеротрофное.
Типовой вид: Ciliophrys infusionum Cienkowski
1876.
Отряд Rotosphaerida Rainer 1968 — Ротосфериды
Псевдоподии ротосферид представляют собой фи-
лоподии. Ядро всегда единственное и располагается на
периферии клетки. Клетку покрывают кремнезёмные
чешуйки. Кристы митохондрий ламеллярные, диско-
видной формы. Пресноводные и морские организмы.
Распространены всесветно.
Морфология и биология
Клетку всех представителей покрывает слой крем-
незёмных чешуек. Вокруг поверхности клетки может
располагаться как слой полых сферических или оваль-
ных чешуек (рис. 184, В-Ж\ 187; 188, 3), так и множе-
ство плоских чешуек. В последнем случае чешуйки
состоят из двух пластинок, между которыми находится
электронно-плотный материал. Пластинка чешуйки,
лежащая кнаружи от клетки, пронизана порами, ко-
личество и расположение которых видоспецифично
(рис. 188, Б, Г). У некоторых представителей имеет-
ся также слой радиально ориентированных чешуек
(рис. 188, Д) (Siemensma, 1991; Mikijukov, 1999).
В составе покровов встречаются бактерии, адгези-
рованные к поверхности чешуек (рис. 187) (Patterson,
1985).
Тонкие и прямые филоподии монотонной толщи-
ны отходят от всей поверхности клетки ротосферид
(рис. 187). В них не обнаружено ни микротрубочек, ни
экструсом (Patterson, 1985).
Тонкое строение ротосферид (рис. 187) изучено на
примере Pompholyxophryspunicea (Patterson, 1994). Ци-
топлазма часто пигментирована и может иметь красно-
ватый оттенок. Ядро располагается эксцентрично. Его
плотно окружают диктиосомы аппарата Гольджи. В ци-
топлазме беспорядочно распределены пищеваритель-
ные вакуоли и митохондрии с ламеллярными кристами
дисковидной формы (рис. 141, Б). Встречаются липид-
ные капли, связанные с мембранными пузырьками не-
правильной формы. Внешний слой цитоплазмы лишён
каких-либо органелл. В нём просматриваются тонкие
волокна неизвестной природы (Patterson, 1985).
Ядро смещено к периферии клетки. Одно крупное
ядрышко (рис. 187) располагается в центре ядра (Rain-
er, 1968, Patterson, 1985).
О питании ротосферид известно не много. В пи-
щеварительных вакуолях Pompholyxophrys описа-
ны остатки диатомовых водорослей (Patterson, 1985;
Siemensma, 1991).
Ротосфериды встречаются как в бентосных, так
и в планктонных пробах. Представители родов Pina-
ciophora и Rabdiophrys встречаются как в морских,
так и в пресноводных местообитаниях. Представи-
тели рода Pompholyxophrys предпочитают пресные
воды. Также известна находка Р ovuligera в солонова-
товодном водоёме (Jones, 1974). Ротосфериды могут
обитать при достаточно низких температурах. Опи-
саны находки Pinaciophora в пробах из Антарктиды
(Croome et al., 1987).
Систематика и филогения
В эпоху светомикроскопических исследований ро-
тосферид на основании внешнего сходства рассматри-
вали в составе Heliozoa, при этом сближая их с центро-
хелидными солнечниками (Treguboff, 1853; Schaudinn,
СОЛНЕЧНИКИ. ROTOSPHAERIDA
263
Рис. 187. Схема тонкого строения Pompholyxophrys punicea.
б — бактерия; д — диктиосома; ф — филоподия; кдв — кремний-депонирующая везикула; л — липидная капля; м — митохондрия; пв — пищевари-
тельная вакуоль; сэ — скелетный элемент; эпр — эндоплазматический ретикулум; я — ядро; яд — ядрышко. (По: Patterson, 1985).
1896; Hartmann, 1913; Poche, 1913). Само название
Rotosphaerida было предложено Райнером (Rainer,
1968), который обратил внимание на многие черты,
отделяющие ротосферид от других солнечников. Рай-
нер рассматривал в составе ротосферид своеобразную
филозную амёбу Lithocolla. покровы которой пред-
ставлены не чешуйками, а экзогенными элементами —
песчинками. Паттерсон (Patterson, 1994) предложил
рассматривать этот организм incertae sedis, так как он
сильно выделяется из Rotosphaerida, и отсутствуют
данные по его общей ультраструктуре. Ещё один
организм, который Райнер включал в ротосферид —
Elaeorhanis. В его покровах также присутствуют
экзогенные элементы (песчинки, панцири диатомовых
водорослей). Микрюков и Крум (Mikrjukov, Croome,
1998) рассматривают его в составе филозных амёб-
нуклеариид.
Строение нуклеариидных амёб и ротосферид на
ультраструктурном уровне очень сходно (Patterson et
al., 1987). Это заставляет предполагать, что эти группы
родственны друг другу.
Молекулярно-биологические исследования ротос-
ферид до сих пор не проводились. Об их положении в
современной системе можно судить только по данным
о близких к ротосферидам нуклеариидах. Последние
на кладограммах, основанных на анализе 18S гена ока-
зываются около точки расхождения грибов и многокле-
точных животных (Zettler et al., 2001).
Ультраструктурное сходство ротосферид и нуклеа-
риид привело учёных к мысли о том, что эти группы
следует рассматривать в составе одного таксона. На-
звание для этой группы было предложено Пейджем —
Cristidiscoidida Page 1987. В этот таксон, имеющий
ранг отряда вошли семейства Nucleariidae Cann et Page
264
СОЛНЕЧНИКИ. ROTOSPHAERIDA
Рис. 188. Ротосфериды.
А, Б — Pinaciophorafluviatilis. А — общий вид, Б — чешуйка; В-Д — Rabdiophrys anulifera: В — общий вид, Г— тангентальная чешуйка, Д— ради-
альная чешуйка; Е — Rabdiaster ludibunda, общий вид (справа — чешуйки); Ж, 3 — Pompholyxophtys punicea: Ж — общий вид, 3 — чешуйка. (По:
Siemensma, 1991 —А-Д, Ж, 3; Mikijukov, 1999 — Е).
СОЛНЕЧНИКИ. ROTOSPHAERIDA
265
1979 и Pompholyxophryidae Page, 1987. Этот вариант
системы уже упоминался на страницах первого тома
настоящего издания, в разделе о голых амёбах. Ми-
крюков (Mikrjukov, 1999) справедливо отмечает, что
при создании своей системы Пейдж проигнорировал
название Rotosphaerida Rainer 1968 и ввёл название
Pompholyxophryidae Page 1987 для таксона того же
объёма. Логично было бы считать последнее название
младшим синонимом первого. Тем не менее, Микрю-
ков сохраняет название Pompholyxophryidae, а назва-
ние Rotosphaerida применяет для таксона совпадаю-
щего по объёму с Cristidiscoidida Page 1987. Последнее
название он рассматривает как младший синоним
Rotosphaerida Rainer 1968. Это решение кажется нам
непоследовательным, так как название Rotosphaerida
было предложено Райнером именно для филозных
амёб обладающих чешуйками. В рамках этого издания
мы продолжаем использовать название Rotosphaerida в
его первоначальном смысле.
Вопрос о филогенетических и систематических
взаимоотношениях внутри Cristidiscoidida требует
дальнейшей разработки. Семейство Nucleariidae мо-
жет оказаться парафилетическим, так как логично
предположить, что ротосфериды когда-то произошли
от голых амёб, не имеющих чешуек. В то же время,
парафилия возможна и для самих ротосферид, если
предположить возможность вторичной утраты чешу-
ек, наподобие того, как это недавно было показано для
центрохелидных солнечников. В таком случае потребу-
ется полный пересмотр системы, так как Nucleariidae и
Rotosphaerida (= Pompholyxophryidae) окажутся поли-
и парафилетичными соответственно.
Систематический обзор
Род Pinaciophora Greeff 1869 (рис. 188, А, Б)
Клетку окружает слой плоских тангентально ори-
ентированных чешуек. Лежащая кнаружи от клетки
поверхность чешуйки перфорирована несколькими от-
верстиями. Могут также присутствовать радиальные
чешуйки.
Типовой в и д: Р fluviatilis Greff 1869.
Род Rabdiophrys Rainer 1968 (рис. 188, В-Д)
Клетку окружают тангентальные пластинчатые че-
шуйки с отверстием в центре. Также имеется слой ра-
диальных чешуек.
Типовой вид: R. anulifera Rainer 1968.
Род Rabdiaster Mikrjukov 1999 (рис. 188, Е)
Клетку окружают тангентальные чешуйки. По-
верхность чешуек, лежащая кнаружи от клетки пер-
форирована только мелкими порами. Имеются также
радиальные чешуйки.
Типовой вид:/?, pertzovi (Mikijukov 1994) Mi-
krjukov 1999.
Род Pompholyxophrys Archer 1869
(184, В-Ж] рис. 188, Ж, 3)
Все чешуйки одного типа, перфорированы мелки-
ми порами и могут иметь сферическую, яйцевидную
или дисковидную форму.
Типовой ви д: Р punicea Archer 1869.
SUMMARY
Heliozoans are a polyphyletic assemblage of protists possessing
long and thin pseudopodia, most often — axopodia, radiating from
the spherical cell body. The axopodia bear extrusomes that serve for
trapping and holding of prey. Heliozoans have no internal skeleton,
but their cells are often covered with a layer of scales or with a per-
forated capsule. Since many forms of these organisms are attached
or substratum-associated, the group is considered to be benthic. But
planktonic findings of heliozoans are also known. Some of heliozo-
ans have a flagellum (flagella) on some stages of the life-cycle or
even permanently. There are only free-living representatives. These
organisms are mostly heterotrophic, but there are some mixotrophic
or even autotrophic species.
We will consider seven orders of heliozoans: Centrohelid he-
liozoans (Centrohelida Kuhn 1926); Actinophryid heliozoans (Ac-
tinophryida Hartmann 1913); Desmothoracid heliozoans (Des-
mothoracida Hertwig et Lesser 1874); Gymosphaerid heliozoans
(Gymnosphaerida Poche 1913); Dimorphids (Dimorphida Sie-
mensma 1991); Pedinellids (Pedinellida Zimmermann, Moestrup et
Hallfors 1984) and Rotosphaerids (Rotosphaerida Rainer 1968).
Centrohelid heliozoans form the vast majority of heliozoan
species diversity. Many representatives have siliceous scales with a
complex species-specific structure. A unique organelle of centrohelid
heliozoans is the centroplast, a special kind of MTOC. Microtubules
in the axopodia have a hexagonal-related pattern of arrangement. The
extrusomes are kinetocysts with a characteristic ball-and-cone struc-
ture of the axial element. The nucleus is peripheral, with a single nu-
cleolus. The mitochondrial cristae are lamellar, ribbon-shaped. Cyst
formation has been described. Centrohelid heliozoans are known
from both freshwater and marine habitats.
Actionophryid heliozoans comprise only five species. The
MTOC of these organisms is a nucleus-associated axoplast. The
axonemal microtubules are arranged in a double-spiral pattern. The
extrusomes of actinophryid heliozoans are electron-dense mucocysts
or granules with granular or fibrillar content. The nucleus is single or
there are several nuclei. There are three types of nuclei in actinophry-
ids: with a single central nucleolus, with several large peripheral nu-
cleoli and with numerous small peripheral nucleoli. In the process of
encystment the cell forms a layer of spherical or flat siliceous scales.
The sexual process in the form of paedogamy takes place within the
cyst. The mitochondria have vesicular bleb-like cristae. Actinophryid
heliozoans are marine and freshwater organisms with a world-wide
distribution.
Desmothoracid heliozoans is also a small group with about ten
species. Their MTOC, as in the previous case, is a nucleus-associ-
ated axoplast. The axonemal microtubules of desmothoracids have
no geometrical arrangement. The extrusomes are kinetocysts with a
cone-like axial element surrounded with a ring-like structure. The
nucleus is always single, with one central nucleolus. The majority of
desmothoracid heliozoans have a perphorated organic capsule and a
stalk. Encystment inside the capsule is possible. A complex life cycle
including a trophic stage, an ameboid stage and a stage of mono- or
biflagellated zoospore has been described for some of these organ-
isms. On the zoospore stage kinetosomes are oriented perpendicu-
larly to each other and connected to the nuclear membrane with a
rhizoplast or a microfibrillar bundle. The mitochondria have vesicu-
lar ampula-like cristae.
Gymnosphaerid heliozoans order contains only three monotypic
genera. The axoplast of these organisms has a granular or fibrillar
266
СОЛНЕЧНИКИ
structure. Their axonemal microtubules have a hexagonal arrange-
ment. All the representatives have mucocysts, and in one genus ki-
netocysts with an arrow-like axial element have been described. Both
uninucleate and multinucleate organisms are known in the group.
The cell surface sometimes bears scales. Some of the cells are often
spread on the substratum. The mitochondria have tubular cristae.
Dimorphids are organisms whose cells can have two different
forms: an ameboid flagellate with two or four flagella and a heliozoan.
The ameboid flagellate can quickly develop axopodia and transform
itself into a heliozoan still possessing flagella. The reverse transforma-
tion is also possible. The flagellar root system is connected to the axo-
plast. The structure of axoplast is fibrillar-granular. The kinetosomes
are elongated. The axonemal microtubules are in a staggered order
or have no geometrical arrangement. The extrusomes are kinetocysts
or mucocysts. Only uninucleate forms of dimorphids are known. The
axoplast can be either located inside the nucleus or lie free in the cyto-
plasm. The mitochondrial cristae of these organisms are tubular.
The order Pedinellida unifies heterotrophic, autotrophic and
mixotrophic organisms. These protists have both axopodia and a fla-
gellum. There are tripartite tubular mastigonemes on the flagellum.
Only one of the two kinetosomes produces a flagellum. MTOC of pe-
dinellids is a nucleus-associated axoplast. Each axopodial axoneme
is composed of only three microtubules arranged in a equilateral
triangle-like pattern. The extrusomes (if present) are mucocysts. All
the representatives are uninucleate. Some pedinellids have a stalk.
Encystment with the formation of three-layered sheaths has been de-
scribed. The mitochondrial cristae are tubular.
Rotosphaerids are close relatives of nucleariid amoebas, but
have a very characteristic heliozoan-like appearance. Their pseudo-
podia are not axopodia but filopodia. The nucleus of rotosphaerids
is always single. The cell is covered with siliceous scales. The mi-
tochondria of those organisms have lamellar disc-like cristae. Roto-
sphaerids are both marine and freshwater organisms with a world-
wide distribution.
ЛИТЕРАТУРА
Высоцкий A.B. 1887. Mastigophora и Rhizopoda, найденные в Вей-
совом и Репном озёрах. Отчёт об экскурсии для исследования Славян-
ских озёр Харьковской губернии в ботаническом отношении // Тр. общ.
исп. природы Харьк. имп. Ун-та. Т. 21. С. 119-140.
Карпов С.А. 1986. Строение покровов жгутиконосцев // Цитоло-
гия. Т. 28. С.129-150.
Карпов С.А. 2000. Система протистов. СПб.;Омск: изд-во ОмГПУ
215 с.
Карпов С.А. 2001. Строение клетки протистов. СПб.: Тесса. 384 с.
Кусакин О.Г., Дроздов А.Л. 1998. Филема органического мира.
Ч. 2. Prokaryota, Eukaryota: Microsporobiontes, Archemonadobiontes,
Euglenobiontes, Myxobiontes, Rhodobiontes, Alveolates, Heterokontes.
СПб.: Наука. 359 с.
Микрюков К.А. 1996. Тонкое строение нового вида морского акти-
нофриидного солнечника Actinophrys marina (Actinophryida, Sarcodina)
из Белого моря // Зоол. журн. Т. 75. С. 1443-1451.
Микрюков К.А. 1998. К биологии солнечников: феномен образования
лучистых форм у бентосных саркодовых // Зоол. журн. Т. 77. С. 147-157.
Микрюков К.А. 1999. Интересные находки солнечников (Protista)
в Чёрном море и Крыму: к вопросу о единстве морской и пресноводной
фауны этих организмов // Зоол. журн. Т. 78. С. 517-527.
Микрюков К.А. 2000. Система и филогения солнечников (Heliozoa
Haeckel, 1866): реально ли существование этого таксона? // Зоол. журн.
Т. 79. С. 883-897.
Микрюков К.А. 2002. Центрохелидные солнечники (Centrohelio-
zoa). М.: Т-во научных изданий КМК. 136 с.
Николюк В.Ф., Гельцер Ю.Г. 1972. Почвенные простейшие
СССР. Ташкент: ФАН. 312 с.
Серавин Л.Н. 1993. Основные типы и формы тонкого строения
крист митохондрий; степень их эволюционной стабильности (способ-
ность к морфологическим трансформациям) // Цитология. Т. 35. С. 3-33.
Серавин Л.Н., Гудков А.В. 1984. Основные типы и формы агам-
ных слияний клеток у простейших // Цитология. Т. 26. С. 123-131.
Ценковский Л. 1881. Отчёт о Беломорской экскурсии 1880 года //
Тр. Санкт-Петербургского об-ва естествоисп. Т. 12. С. 130-171.
Adi S.M., Simpson A.G.B., Farmer М.А., Andersen R.A., Ander-
son R.A., Barta J., Bowser S.S., Brugerolle G., Fensome R., Fredericq S.,
James T.Y., Karpov S.A., Kugrens P., Krug J., Lane C., Lewis L.A., Lodge
J., Lynn D.H., Mann D., McCourt R.M., Mendoza L., Moestrup 0., Moze-
ley-Standridge S.E., Nerad T.A., Shearer C., Smirnov A.V., Spiegel F. and
Taylor F.J.R. 2005. The new higher level classification of eucaryotes with
emphasis on the taxonomy of protists // J. Euk. Microbiol. Vol. 52. P. 399-451.
Anderson O.R. 1994. Cytoplasmic origin and surface deposition of sili-
ceous structures in Sarcodina// Protoplasma. Vol. 181. P. 61-66.
Anderson E., Beams H.W. 1960. The fine structure of the heliozoan
Actinosphaerium nucleofilum I I J. Protozool. Vol. 7. P. 190-199.
Archer W. 1867. On some freshwater Rhizopoda, new or little-known //
Quart. J. Microsc. Sci. Vol. 9. P. 250-271.
Archer W. 1869. On some freshwater rhizopoda, new or little-known //
Quart. J. Microsc. Sci. Vol. 9. P. 386-397.
Arndt H. 1993. A critical review of the importance of rhizopods (naked
and testate amoebae) and actinopods (heliozoa) in lake plankton // Mar. Mik-
robial Food Webs. Vol. 7. P. 3-29.
Bardele C.F. 1969. Ultrastructur der “komchen” auf den axopodien
von Raphidiophrys (Centrohelida, Heliozoa) // Z. Naturforsch. B. Bd 24.
S. 362.
Bardele C.E 1970. Comparative ultrastructural studies on Centrohe-
lida// J. Protozool. Vol. 17. P. 10-11.
Bardele C.E 1971. On the morphogenetic role of microtubules dur-
ing stalk formation in Clathrulina elegans (Desmothoraca) // J. Protozool.
Vol. 18. P. 18.
Bardele C.E 1972. Cell cycle, morphogenesis, and ultrastructure in the
pseudoheliozoan Clathrulina elegans IIZ. Zellforsch. Vol. 130. P. 219-242.
Bardele C.E 1975. The fine structure of the centrohelidian heliozoan
Heterophrys marina H Cell and Tissue Research. Vol. 161. P. 85-102.
Bardele C.E 1976. Particle movement in heliozoan axopods associated
with lateral displacement of highly ordered membrane domains 11 Z. Natur-
forsch. Vol. 31. P. 190.
Bardele C.F. 1977a. Organization and control of microtubule pattern in
centrohelidian Heliozoa // J. Protozool. Vol. 24. P. 9-14.
Bardele C.E 1977b. Comparative study of axopodial microtubule patterns
and possible mechanisms of pattern control in the centrohelidian Heliozoa Acan-
thocystis, Raphidiophrys and Heterophrys H J. Cell Sci. Vol. 25. P. 205-232.
Barrett J.M. 1953. The mechanism of food capture in Actinosphaerium
eichhornii П J. Protozool. Vol. 1. P. 19.
Barrett J.M. 1958. Some observations on Actinosphaerium nucleofilum
n. sp., a new fresh water actinophryid // J. Protozool. Vol. 5. P. 205-209.
Bass D., Chao E., Nikolaev S., Yabuki A., Ishida K., Berney C., Pak-
zad U., Wylezich C., Cavalier-Smith T. 2009. Phylogeny of novel naked
filose and reticulose Cercozoa: Granofilosea cl. n. and Proteomyxidea re-
vised // Protist. Vol. 160. P. 75-109.
Batko A., Hassan S.K.M. 1988. A heliozoan devouring motile chytrid
zoospores // Acta Mycologica. Vol. 23. P. 105-106.
Belar K. 1923. Untersuchungen an Actinophrys sol Ehrenberg I. Die
Morphologic des Formwechsels //Arch. Protistenkd. Bd 46. S. 371—435.
Biyu S. 2000. Planktonic protozooplankton (ciliates, heliozoans and
testaceans) in two shallow mesotrophic lakes in China — a comparative
study between a macrophyte-dominated lake (Biandantang) and an algal lake
(Houhu) // Hydrobiologia. Vol. 434. P. 151-163.
Blochmann F. 1894. Uber Dimorpha mutans 11 Biol. Zentralbl. Bd 14.
S. 197-199.
Bovee E.C., Cordell D.L. 1971. Feeding on gastrotrichs by the helio-
zoon Actinophrys sol И Transactions of the American Microscopical Society.
Vol. 90. P. 365-369.
Brown J.M. 1918. On Pyxidicula invisitata, a rhizopod new to Britain,
and Hedriocystis spinifera, a new heliozoon // J. Roy. Microsc. Soc. Vol. 2.
P. 170-172.
Brugerolle G. 1985. Ultrastructure &Hedriocystis pellucida (Heliozoa,
Desmothoracida) et de sa forme migratice flagelle I I Protistologica. Vol. 21.
P. 259-265.
Brugerolle G., Mignot J.P. 1983. Caracteristiques ultrastructurales de
1’helioflagelle Tetradimorpha (Hsiung) et leur interet pour 1’etude phyletique
des heliozoaires // J. Protozool. Vol. 30. P. 473-480.
Brugerolle G., Mignot J.P. 1984a. La caracteristiques ultrastructurales
de 1’helioflagelle Dimorpha mutans Gruber (Sarcodina-Actinopoda) et leur
interet phyletique // Protistologica. Vol. 20. P. 97-112.
СОЛНЕЧНИКИ
267
Brugerolle G., Mignot J.P. 1984b. The cell characters of two heliofla-
gellates related to the centrohelidian lineage: Dimorpha and Tetradimorpha 11
Origins of Life. Vol. 13. P. 305-314.
Burki F., Inagaki Y., Brate J., Archibald J.M., Keeling P.J., Cavalier-
Smith T., Sakaguchi M., Hashimoto T., Horak A., Kumar S., Klaveness
D., Jakobsen K.S., Pawlowski J., Shalchian-Tabrizi K. 2009. Large-scale
phylogenomic analyses reveal that two enigmatic protist lineages, Telonemia
and Centroheliozoa, are related to photosynthetic chromalveolates // Genome
Biology and Evolution. Vol. 1. P. 231-238.
Butschli O. 1880-1882. Protozoa. Mit einem Beitrag: Palaeontologi-
sche Entwicklung der Rhizopoda, von C. Schwager // Bronn H.G. (ed.) Die
Klassen und Ordnungen des Thierreichs, wissenschaftlich dargestellt in Wort
und Bild: Winter’sche Verlagshandlung (Leipzig), 3 Abt.: Abt. 1 Sarkodina
und Sporozoa. 616 S.
Cachon J., Cachon M., Febvre-Chevalier C., Febvre J. 1973. De-
terminisme de 1’edification des systemes microtubulaires stereoplasmiques
d’Actinopodes // Arch. Protistenkd. Vol. 115. P. 137-153.
Calkins G.N. 1909. Protozoology. New York: Lea & Febiger. 349 p.
Canter H.M. 1966. Chytriomyces heliozoicola sp. nov., a parasite of
Heliozoa in the plankton // Trans. Brit. Mycol. Soc. Vol. 49. P. 633-638.
Cavalier-Smith T. 1986. The kingdom Chromista: origin and system-
atics // Round F.E.,Chapman D.J. (eds) Progress in phycological research.
Bristol: Biopress Ltd. P. 105-184.
Cavalier-Smith T. 1993. Kingdom Protozoa and its 18 phyla // Micro-
biological Reviews. Vol. 57. P. 953-994.
Cavalier-Smith T. 2006. Cell evolution and Earth history: stasis and
revolution // Philos. Trans. R. Soc. Lond. Ser. В Biol. Sci. Vol. 361. P. 969-
1006.
Cavalier-Smith T., Chao E.E., Allsopp M.T.E.P. 1995. Ribosomal
RNA evidence for chloroplast loss within Heterokonta: pedinellid relation-
ships and a revised classification of ochristan algae // Arch. Protistenkd.
Vol. 145. P. 209-220.
Cavalier-Smith T., Chao E.E. 1996. 18S rRNA sequence of Hetero-
sigma carterae (Raphidophyceae), and the phylogeny of heterokont algae
(Ochrophyta) // Phycologia. Vol. 35. P. 500-510.
Cavalier-Smith T., Chao E. 2003. Molecular phylogeny of centrohelid
heliozoa, a novel lineage of bikont eukaryotes that arose by ciliary loss // J.
Mol. Evol. Vol. 56. P. 387-396.
Cavalier-Smith T., von der Heyden S. 2007. Molecular phylogeny,
scale evolution and taxonomy of centrohelid heliozoa // Molecular Phyloge-
netics and Evolution. Vol. 44. P. 1186-1203.
Cienkowski L. 1867. Uber Clathrulina, eine neue Actinophryengat-
tung // Arch. Mikr. Anat. Bd 3. S. 311-316.
Cienkowski L. 1876. Uber einige Rhizopoden und verwandte Organis-
men//Arch. Mikr. Anat. Bd 12. S. 15-50.
Claparede E., Lachmann J. 1858. Etudes sur les infusoires et les Rhi-
zopodes. // Mem. Inst. Nat. Genevois. Vol. 4. P. 431-457.
Christensen-Dalsgaard K.K. and Fenchel T. 2003. Increased filtra-
tion efficiency of attached as compared to free-swimming flagellates // Aquat.
Microbiol. Ecol. Vol. 3. P. 77-86.
Croome R.L. 1987a. Pinaciophora columna n. sp., P tasmanica n. sp.
and P apora n. sp., new heliozoeans from Australia, and a report of P fluvia-
tilis Greeff from Antarctica // Arch. Protistenkd. Vol. 133. P. 15-20.
Croome R. L. 1987b. Pinaciophora ovalis (Rotosphaerida, Heliozoea),
a new species from Australia // Arch. Protistenkd. Vol. 134. P. 343-346.
Croome R.L., van den Hoff J., Burton H.R. 1987. Observations of
the heliozoean genera Pinaciophora and Acanthocystis (Heliozoea, Sarco-
dina, Protozoa) from Ellis Fjord, Antarctica // Polar Biology. Vol. 8. P. 23-
28.
Daugbjerg N. 1996a. Mesopedinella arctica gen. et sp. nov. (Pedinel-
lales, Dictyochophyceae). I. Fine structure of a new marine phytoflagellate
from Arctic Canada // Phycologia. Vol. 35. P. 435-445.
Daugbjerg N. 1996b. Mesopedinella arctica (Pedinellales). II. Phylog-
eny of Mesopedinella, including a cladistic analysis of Dictyochophyceae //
Phycologia. Vol. 35. P. 563-568.
Davidson L.A. 1972. Ultrastructure of heliozoon Heterophrys marina
and of helioflagellate Ciliophrys marina // J. Ultrast. Res. Vol. 38. P. 219.
Davidson L.A. 1973. Contractile axopodia of the centrohelidian Het-
erophrys marina II J. Cell Biol. Vol. 59. P. 71.
Davidson L.A. 1975. Studies of actinopods Heterophrys marina and
Ciliophrys marina', energetics and structural analysis of their contractile axo-
podia. General ultrastructure and phylogenetic relationships. University of
Berkeley. Ph. D. Thesis.
Davidson L.A. 1976. Ultrastructure of the membrane attachment sites
of the extrusomes of Ciliophrys marina and Heterophrys marina (Actinopo-
da) // Cell and Tissue Research. Vol. 170. P. 353-365.
Davidson L.A. 1982. Ultrastructure, behavior, and algal flagellate affini-
ties of the helioflagellate Ciliophrys marina, and the classification of the helio-
flagellates (Protista, Actinopoda, Heliozoea) // J. Protozool. Vol. 29. P. 19-29.
Dobell C. 1917. On Oxnerella maritima, nov. gen., nov. spec, a new
heliozoon, and its method of division; with some remarks on the centroplast
of the Heliozoa // Quart. J. Microsc. Sci. Vol. 62. P. 515-538.
Doflein F. 1909. Lehrbuch der Protozoenunde. Jena: Verlag von Gustav
Fisher. 914 p.
Dujardin F. 1841. Histoire naturelle des zoophytes. Infusoires, com-
prenant la physiologic et la classificatin de ces animaux, et la maniere de les
etudier a Г aide du microscope. Paris, Roret. 684 p.
Durrschmidt M. 1985. Electron microscopic observations on scales of
species of the genus Acanthocystis (Centrohelidia, Heliozoa) from Chile, I //
Arch. Protistenkd. Vol. 129. P. 55-87.
Durrschmidt M., Patterson D.J. 1987a. A light and electron micro-
scopic study of a new species of centroheliozoon Chlamydaster fimbriatus //
Tissue & Cell. Vol. 19. P. 365-376.
Durrschmidt M., Patterson D.J. 1987b. On the organization of the He-
liozoa Raphidiophrys ambigua Penard and R. pallida Schulze //Ann. Sci. Nat.
Zool. Biolog. Animal. Vol. 8. P. 135-155.
Ehrenberg G. 1830. Actinophrys sol // Beitrage zur Kenntnis der Orga-
nisation der Infusorien und ihrer geographischen Verbreitung. Abhandlung d.
Konigl. Acad. d. Wiss. zu Berlin. S. 1-88.
Ehrenberg G. 1840. Actinophrys eichhornii I I Berichte der Berliner
Akademie. S. 197.
Entz G. 1877. Orbulinella smaragdea. A szamosfalvi sostoban elo gyo-
klabukrol//Termeszetr. Fuz. Vol. 1. P. 164-165.
Esteban G.L., Gooday A., Clarke K. 2007. Siliceous scales of filose-
amoebae (Pompholyxophryidae, Rotosphaerida) from deep Southern Ocean
sediments, including first records for the Southern Hemisphere // Polar Biol-
ogy. Vol. 30. P. 945-950.
Febvre-Chevalier C. 1973. Hedraiophrys hovassei, morphologic, bio-
logic et cytologie // Protistologica. Vol. 9. P. 503-520.
Febvre-Chevalier C. 1980. Behavior and cytology of Actinocoryne
contractilis, nov. gen., nov. sp., a new stalked heliozoan (Centrohelidia):
comparison with the other related genera. // J. Mar. Biol. Ass. U.K. Vol. 60.
P. 909-928.
Febvre-Chevalier C., Febvre J. 1984. Axonemal microtubule pattern
of Cienkowskya mereschkowski and a revision of heliozoan taxonomy // Ori-
gins of Life. Vol. 13. P. 315-338.
Gr^becki A., Hausmann K. 1993. Motor behavior of prey during first
steps of food capture by Actinophrys sol // Acta Protozool. Vol. 32. P. 157-164.
Greeff R. 1869. Uber Radiolarien und Radiolarienartige Rhizopoden
des sussen Wassers //Arch. Mikr. Anat. Bd 5. S. 404-505.
Greeff R. 1873. Uber Radiolarien und radiolarienartige Rhizopoden des
sussen Wassers // Sitzungsber. Ges. Beford. Naturw., Marburg. S. 47-64.
Gruber A. 1881. Dimorpha mutans'. eine Mischform von Flagellaten
und Heliozoen // Z. Wiss. Zool. Bd 36. S. 445—458.
Haeckel E. 1866. Generelle Morphologic der Organismen. Berlin:
G. Reimer.
Hall R.P. 1953. Protozoology. New York: Prentice-Hall.
Hartmann M. 1913. Rhizopoda // Handworterbuch der Naturwissen-
schaften. Jena: Gustav Fischer Verlag. S. 422-446.
Hausmann K. 1978. Extrusive organelles in Protists // Int. Rev. Cytol.
Vol. 52. P. 197-276.
Hausmann K., Hiilsmann N., Radek R. 2003. Protozoology. Berlin,
Stuttgart: Schweizerbart’sche Verlagsbuchhandlung.
Hausmann K., Patterson D.J. 1982. Pseudopod formation and mem-
brane production during prey capture by a heliozoon. (Feeding by Actinoph-
rys II) // Cell Motility. Vol. 2. P. 9-24.
Heimann K., Benting J., Timmermann S., Melkonian M. 1989. The
flagellar development cycle in algae. Two types of flagellar development in
uniflagellated algae // Protoplasma. Vol. 153. P. 14-23.
Hertwig R., Lesser E. 1874. Uber Rhizopoden und denselben naheste-
hende Organismen. 3. Teil Heliozoa//Arch. Mikr. Anat. Bd 10. S. 147-236.
Hibberd D.J. 1979. The structure and phylogenetic significance of the
flagellar transition region in the chlorophyll-c containing algae // Biosystems.
Vol. 11. P. 243-262.
Hoogenraad H.R. 1927. Beobachtungen fiber den bau, die lebensweise
und die entiwicklung von Hedriocystis pellucida // Arch. Protistenkd. Bd 58.
S. 321-343.
Hsiung T. S. 1927. Tetradimorpha radiata sp. nov. et gen. nov. a flagellate
of the family Rhizomastigidae // Trans. Am. Microsc. Soc. Vol. 46. P. 208-211.
Joblot L. 1718. Descriptions et usages de plusiers nouveaux micros-
copes: tant simples que composez; avec de nouvelles observations faites sur
de multitude innombrable d’insectes, & d’autres animaux de di verses especes,
268
СОЛНЕЧНИКИ
qui naissent dans des liqueurs pre’pare’es, & dans celles qui ne le sont point.
Paris: Chez J. Collombat, imprimeur. 96 p.
Jones E.E. 1974. The Protozoa of Mobile Bay, Alabama // University
of South Alabama Monograph, Vol. 1. Mobile: University of South Alabama
Press.
Jones W.S. 1975. The pattern of microtubules in the axonemes of
Gymnosphaera albida Sassaki: evidence for 13 protofilaments // J. Cell Sci.
Vol. 18. P. 135-155.
Jones W.S. 1976. The ultrastructure of Gymnosphaera albida Sassaki,
a marine axopodiate protozoon // Phil. Trans. Roy. Soc. Vol. 275. P. 349-384.
Jones J.C.R., Tucker J.B. 1981. Microtubule-organizing centers and
assembly of the double-spiral microtubule pattern in certain heliozoan axo-
nemes // J. Cell Sci. Vol. 50. P. 259-280.
Kinoshita E., Suzaki T., Shigenaka Y., Sugiyama M. 1995. Ultrastruc-
ture and rapid axopodial contraction of a Heliozoa, Raphidiophrys contracti-
lis sp. nov. // J. Euk. Microbiol. Vol. 42. P. 283-288.
Kormos J. 1971. On the structure of centroplast // Acta Biol. Acad. Sci.
Hung. Vol. 22. P. 81-83.
Koutoulis A., McFadden G.L, Wetherbee R. 1988. Spine-scale reori-
entation in Apedinella radians (Pedinellales, Chrysophyceae): the microar-
chitecture and immunocytochemistry of the associated cytoskeleton // Proto-
plasma. Vol. 147. P. 25-41.
Koutoulis A., Ludwig M., Wetherbee R. 1993. A scale associated pro-
tein of Apedinella radians (Pedinellophyceae) and its possible role in the ad-
hesion of surface components // J. Cell Sci. Vol. 104. P. 391-398.
Koutoulis A., Wetherbee R. 1993a. Cytoskeletal dynamics of Apedi-
nella radians (Pedinellophyceae) I. Pre-division development and the forma-
tion of spine-scales and body scales // Protoplasma. Vol. 175. P. 17-28.
Koutoulis A., Wetherbee R. 1993b. Cytoskeletal dynamics of Apedi-
nella radians (Pedinellophyceae) II. Cell division and maintenance of cell
polarity and symmetry // Protoplasma. Vol. 175. P. 39-42.
Koutoulis A., Wetherbee R. 1993c. Cytoskeletal dynamics of Ape-
dinella radians (Pedinellophyceae) III. Post-division development, main-
tenance of cell symmetry and re-establishment of interphase morphology //
Protoplasma. Vol. 175. P. 43-57.
Kudo R.R. 1971. Protozoology. 5th ed. Springfield, Illinois: Thomas.
1178 p.
Kiihn A. 1926. Rhizopoden // Morphologie der Tierre in Bildem. Proto-
zoen. Berlin: Gebriider Bomtraeger. S. 107-272.
Labbe A. 1924. Introduction a 1’etude des milieux marins hyperalsa-
lins // Arch. Zool. Exper. Vol. 62. P. 401-568.
Larsen J. 1985. Ultrastructure and taxonomy of Actinomonas pusilia,
a heterotrophic member of Pedinellales (Chrysophyceae) // Br. Phycol. J.
Vol. 20. P. 341-355.
Levine N.D., Corliss J.O., Cox F.E.G., Deroux G., Grain J., Honig-
berg B.M., Leedale G.E, Loeblich A.R., Lom J., Lynn D.H., Merinfeld
D., Page EC., Poljansky G., Sprague V., Vavra J., Wallace EG. 1980. A
newly revised classification of the Protozoa// J. Protozool. Vol. 27. P. 37-58.
Looper J.B. 2005. Cytoplasmic fusion in Actinophrys sol, with special
reference to the karyoplasmic ratio // J. Exp. Zool. Vol. 50. P. 31-49.
Mayer P. 1997. Hedriocystis spinifera, nach 77 Jahren wiederentdeckt //
Mikrokosmos. Bd 86. S. 65-68.
Mayer P., Kreutz M. 1998. Nuclearia caulescens, eine noch wenig er-
forshte amobenart // Mikrokosmos. Bd 87. S. 307-310.
Mignot J.P. 1979. Etude ultrastructurale de la pedogamie chez Acti-
nophrys sol (heliozoaire). I. La division programique // Protistologica.
Vol. 15. P. 387-406.
Mignot J.P. 1980. Etude ultrastructurale de la pedogamie chez Acti-
nophrys sol (heliozoaire). II. Les divisions de maturation // Protistologica.
Vol. 16. P. 205-225.
Mignot J.P. 1981. Etude ultrastructurale de la pedogamie chez Ach-
nophrys sol (heliozoaire). III. Gametogenese, fecondation, enkystment // Pro-
tistologica. Vol. 26. P. 533-547.
Mignot J.P. 1984. Etude ultrastructurale de la mitose vegetative chez
1’heliozoaire Actinophrys sol II Protistologica. Vol. 20. P. 247-263.
Mignot J.P., Brugerolle G. 1991. Cell division in the heliozoan Dimor-
pha mutans and evolution of centrosomal organization during the cell cycle //
Biol. Cell. Vol. 72. P. 51-50.
Mikrjukov K.A. 1993. Observations on Centroheliozoa (Sarcodina,
Protozoa) of the Volga basin // Zoosystematica Rossica. Vol. 2. P. 201-209.
Mikrjukov K.A. 1996. Revision of the genera and species composition
of lower Centroheliozoa. I. Family Heterophryidae Poche // Arch. Protisten-
kd. Vol. 147. P. 107-113.
Mikrjukov K.A. 1999. Taxonomic revision of scale-bearing heliozo-
on-like amoebae (Pompholyxophryidae, Rotosphaerida) // Acta Protozool.
Vol. 38. P. 119-131.
Mikrjukov K.A. 2000a. Taxonomy and phylogeny of Heliozoa. I. The
order Desmothoracida Hertwig et Lesser, 1874 // Acta Protozool. Vol. 39.
P. 81-97.
Mikrjukov K.A. 2000b. Taxonomy and phylogeny of Heliozoa. II. The
orderDimorphida Siemensma, 1991 //Acta Protozool. Vol. 39. P. 99-115.
Mikrjukov K.A., Croome R.L. 1998. Observations of heliozoans in
ice-covered pounds on mount Buffalo // The Victorian Naturalist. Vol. 115.
P. 239-241.
Mikrjukov K. A., Mylnikov A. P. 1998. A study of the structure and the
life cycle of Gymnophrys cometa Cienkowski, 1876 (Gymnophrea classis n.)
with remarks on the taxonomy of the amoebo-flagellated genera Gymnophrys
and Borkovia // Acta Protozool. Vol. 37. P. 179-189.
Mikrjukov K.A., Patterson D.J. 2001. Taxonomy and phylogeny of
heliozoa. III. Actinophryids // Acta Protozool. Vol. 40. P 3-25.
Moestrup 0.1995. Current status of chrysophyte ‘splinter groups’: syn-
urophytes, pedinellids, silicoflagellates // Proc. 3rd Int. Chrysophyte Symp. I
Sandgren C.D., Smol J.P, Kristiansen J. (eds) Cambridge: Cambridge Univ.
Press. P. 75-91.
Moreira D., von der Heyden S., Bass D., Lopez-Garcia P., Chao E.,
Cavalier-Smith T. 2007. Global eukaryote phylogeny: Combined small- and
large-subunit ribosomal DNA trees support monophyly of Rhizaria, Retaria
and Excavata// Mol. Phylogenet. Evol. Vol. 44. P. 255-266.
Mulish M., Hausmann K. 1991. Rapid lipid intussusception into the
plasma membrane of the heliozoon Actinophrys sol during phagocytosis 11
Naturwissenschaften. Bd 78. S. 232-233.
Newman P.J., Patterson D.J. 1993. The role of an organic matrix dur-
ing the formation of siliceous scales in the heliozoon Actinophrys sol (Acti-
nophryida, Protista) // Eur. J. Protistol. Vol. 29. P. 334-343.
Nicholls K.H. 1983. Little-known and new heliozoeans: the centrohe-
lid genus Acanthocystis including descriptions of nine new species // Can. J.
Zool. Vol. 61. P. 1369-1386.
Nikolaev S.L, Berney C., Fahrni J.E, Bolivar J., Polet S., Mylnikov
A. P., Aleshin V.V., Petrov N.V., Pawlowski J. 2004. The twilight of Helio-
zoa and rise of Rhizaria an emerging supergroup of amoeboid eukaryotes H
PNAS. Vol. 101. P 8066-8071.
Nikolaev S. L, Berney C., Petrov N. B., Mylnikov A. P., Fahrni J. E,
Pawlowski J. Phylogenetic position of Multicilia marina and the evolution
of Amoebozoa// Int. J. Syst. Evol. Microbiol. 2006. Vol. 56. P. 1449-1458.
Nishi T., Kobayashi M., Isomura M., Ishida H., Shigenaka Y. 1988.
Direct evidence for axopodial fusion preceding cell-to-cell contact in a helio-
zoan Echinosphaerium 11 Zool. Sci. Vol. 5. P. 179-182.
Ockleford C.D. 1974. Cytokinesis in the heliozoan Actinophrys sol I I J.
Cell Sci. Vol. 16. P. 499-517.
Ostroff C.R., van Valkenburg S.D. 1978. The fine structure of Pseudo-
pedinella pyriforme Carter (Chrysophyceae) // Br. Phycol. J. Vol. 13. P. 35-49.
Page EC. 1987. The classification of «naked» amoebae (phylum Rhi-
zopoda) // Arch. Protistenkd. Vol. 133. P. 199-217.
Pascher A. 1910. Chrysomonaden aus dem Hirschberger Grossteiche 11
Abh. Int. Rev. Ges. Hydrobiol. Hydrograph. Bd 1. S. 1-66.
Patterson D.J. 1979. On organization and classification of the proto-
zoon Actinophrys sol Ehrenberg, 1830 // Microbios. Vol. 26. P. 165-208.
Patterson D.J. 1985. On the organization and affinities of the amoeba,
Pompholyxophrys punicea Archer, based on ultrastructural examination of in-
dividual cells from wild material // J. Protozool. Vol. 32. P. 241-246.
Patterson D.J. 1986. The actinophryid heliozoa (Sarcodina, Actinopo-
da) as chromophytes // Chrysophytes: Aspects and Problems / Kristiansen J.,
Anderson. R.A. (eds) Cambridge & New York: Cambridge University Press.
P. 49-67.
Patterson D.J. 1994. Protozoa, evolution and classification 11 Progress
in Protozoology. Proc, of the IX Intemat. Congress of Protozoology. Stuttgart:
Fischer Verlag. P. 1-14.
Patterson D.J., Fenchel T. 1985. Insights into the evolution of Heliozoa
(Protozoa, Sarcodina) as provided by ultrastructural studies on a new spe-
cies of flagellate from the genus Pteridomonas // Biol. J. Linn. Soc. Vol. 24.
P. 381-403.
Patterson D.J., Durrschmidt M. 1987. Selective retention of chloro-
plasts by algivorous heliozoa: fortuitous chloroplast symbiosis? // Eur. J. Pro-
tistol. Vol. 23. P. 51-55.
Patterson D.J., Durrschmidt M. 1988. The formation of siliceous
scales by Raphidiophrys ambigua (Protista, Centroheliozoa) // J. Cell Sci.
Vol. 91. P. 33-39.
Patterson D.J., Hausmann K. 1981. Feeding by Actinophrys sol (Pro-
tista, Heliozoa): I. Light microscopy // Microbios. Vol. 31. P. 39-55.
Patterson D.J., Thompson D.W. 1981. Structure and elemental com-
position of the cyst wall of Echinosphaerium nucleofilum Barrett (Heliozoa,
Actinophryida) // J. Protozool. Vol. 28. P. 188-192.
СОЛНЕЧНИКИ
269
Patterson D.J., Surek В., Melkonian M. 1987. The ultrastructure of
Vampyrellidium perforans Surek & Melkonian and its taxonomic position
among the naked filose amoebae // J. Protozool. Vol. 34. P. 63-67.
Pedersen S.M., Beech P.L., Thomsen H.A. 1986. Parapedinella re-
ticulata gen. et sp. nov. (Chrysophyceae) from Danish waters // Nord. J. Bot.
Vol. 6. P. 507-513.
Penard E. 1904. Les Heliozaires d’eau douce. Geneve: Kundig. 341 p.
Peters W. 1966. Die paedogamie von Actinosphaerium nucleofilum
Barrett (Heliozoa) //Arch. Protistenkd. Bd 109. S. 278-288.
Poche F. 1913. Das System der Protozoen //Arch. Protistenkd. Bd 30.
S. 125-321.
Raikov LB. 1994. The diversity of forms of mitosis in Protozoa: a com-
parative review // Eur. J. Protistol. Vol. 30. P. 253-269.
Rainer H. 1968. Urtiere, Protozoa; Wurzelfubler, Rhizopoda; Sonnen-
tierchen, Heliozoa. Jena: Gustav Fischer Verlag. 176 p.
Rees A. J. J., Donaldson D.A., Leedale G.F. 1981. Morphology of the
scales of the freshwater heliozoan Raphidocystis tubifera (Heliozoa, Centro-
helidia) and organization of the intact scale layer // Protistologica. Vol. 26.
P. 565-570.
Rieder C.L. 1979. High-voltage electron microscopy reveals new com-
ponents in the axonemes and centroplast of the centrohelidian Raphidiophrys
ambigua II J. Cell Sci. Vol. 40. P. 215-234.
Roijackers R.M.M., Siemensma F.J. 1988. A study of cristidiscoidid
amoebae (Rhizopoda, Filosea), with descriptions of new species and keys to
genera and species //Arch. Protistenkd. Vol. 135. P. 237-253.
Saedeleer H., de. 1930. Structure, nutrition, reproduction de Monomas-
tigocystis brachypous n. g., n. sp. //Ann. Protistologie. Vol. 1. P. 1-11.
Sakaguchi M., Hausmann K., Suzaki T. 1998. Food capture and adhe-
sion by the heliozoan Actinophrys sol И Protoplasma. Vol. 203. P. 130-137.
Sakaguchi M., Murakami H., Suzaki T. 2001. Involvement of a 40-
kDa glycoprotein in food recognition, prey capture, and induction of phago-
cytosis in the Protozoon Actinophrys sol 11 Protist. Vol. 152. P. 33-41.
Sakaguchi M., Suzaki T., Khan S.M.M.K., Hausmann K. 2002. Food
capture by kinetocysts in the heliozoon Raphidiophrys contractilis H Eur. J.
Protistol. Vol. 37. P. 453-458.
Sakaguchi M., Nakayama T., Hashimoto T., Inouye I. 2005. Phylog-
eny of the centrohelida inferred from SSU rRNA, tubulins, and actin genes //
J. Mol. Evol. Vol. 61. P. 765-775.
Sakaguchi M., Inagaki Y., Hashimoto T. 2007. Centrohelida is still
searching for a phylogenetic home: Analyses of seven Raphidiophrys con-
tractilis genes // Gene. Vol. 405. P. 47-54.
Sassaki С. 1894. Untersuchngen uber Gymnosphaera albida, eine neue
marine Heliozoen // Jena. Z. Nature. Bd 28. S. 45-52.
Schaudinn F. 1896. Heliozoa // Das Thierreich. Berlin: Friedlander und
Sohn. 24 p.
Schiller J. 1952. Neue Microphyton aus dem Neusiedler See und bena-
chbarter Gebiete 11 Osterreichische Botanische Zeitschrift. Bd 99. S. 100-117.
Schoutenden H. 1907. Notes sur quelques flagelles //Arch. Protistenkd.
Vol. 9.P. 108-133.
Schulze EE. 1874. Rhizopodenstudien. II 11 Arch. Mikr. Anat. Bd 10.
S. 377—400.
Sekiguchi H., Moriya M., Nakayama T. and Inouye 1.2002. Vestigial
chloroplasts in heterotrophic stramenopiles Pteridomonas danica and Cili-
ophrys infusionum (Dictyochophyceae) // Protist. Vol. 153. P. 157-167.
Sekiguchi H., Kawachi M., Nakayama T., Inouye I. 2003. A taxo-
nomic re-evaluation of the Pedinellales (Dictyochophyceae), based on mor-
phological, behavioral and molecular data // Phycologia. Vol. 42. P. 165-182.
Shigenaka Y., Kaneda M. 1979. Studies on the cell fusion of Heliozo-
ans. IV. An electron microscopical study on the fusion process accompained
with axopodial degradation // Ann. Zool. Japonenses. Vol. 52. P. 28-39.
Siemensma F.J. 1991. Klasse Heliozoa Haeckel, 1866//Nackte Rhizop-
oda und Heliozoea. Stuttgart, New York: Gustav Fischer Verlag. P. 171-297.
Siemensma F.J., Roijackers R.M.M. 1988a. The genus Raphidiophrys
(Actinopoda, Heliozoea): scale morphology and species distinctions // Arch.
Protistenkd. Vol. 136. P. 237-248.
Siemensma F.J., Roijackers R.M.M. 1988b. A study of new and
little-known acanthocystid heliozoeans, and a proposed division of the ge-
nus Acanthocystis (Actinopoda, Heliozoea) // Arch. Protistenkd. Vol. 135.
P. 197-212.
Skuja H. 1948. Taxonomie des Phytoplanktons einiger Seen in Up-
pland, Schweden // Symbolae Botanicae Upsalienses. Vol. 10. S. 1-399.
Slapeta J., Moreira D., Lopez-Garcia P. 2005. The extent of protist
diversity: insights from molecular ecology of freshwater eukaryotes // Proc.
R. Soc. Ser. B. Vol. 272. P. 2073-2081.
Smith R. McK., Patterson D.J. 1986. Analyses of heliozoan interrela-
tionships: an example of the potentials and limitations of ultrastructural ap-
proaches to the study of protistan phylogeny // Proc. R. Soc. Lond. Vol. 227.
P. 325-366.
Stechmann A., Cavalier-Smith T. 2002. Rooting the eukaryote tree by
using a derived gene fusion // Science. Vol. 297. P. 89-91.
Stensdotter-Blomberg U. 1998. Factors controlling pelagic popula-
tions of ciliates and heliozoans — late summer investigations in an acidic lake
before and after liming // J. Plankton Research. Vol. 20. P. 423-442.
Stokes A.C. 1886. Noticesofhewfresh-waterinftisoria // Proc. Am. Phi-
los. Soc. Vol. 23. P. 562-568.
Suzaki T., Shigenaka Y., Takeda Y. 1978. Studies on the cell division
of heliozoans. II. Active role of axopodia on division process and transforma-
tion of remnants of cytoplasmic connecting bridge to new axopodia // Cell
Structure and Function. Vol. 3. P. 209-218.
Suzaki T., Shigenaka Y., Watanabe S., Toyohara A. 1980. Food cap-
ture and ingestion in the large heliozoan, Echinosphaerium nucleofilum // J.
Cell. Sci. Vol. 42. P. 61-79.
Suzaki T., Arikawa M., Saito A., Omura G., Khan M. K., Sakaguchi
M., Hausmann K. 2003. Organelle movement in Actinophrys sol and its in-
hibition by cytochalasin В // Acta Protozool. Vol. 42. P. 7-10.
Swale E.M.F. 1969. A study of the nannoplankton flagellate Pedinella
hexacostata Vysotskii by light and electron microscopy // Brit. Phycol. J.
Vol. 4. P. 65-86.
Takishita K., Inagakib Y., Tsuchiya M., Sakaguchi M., Maruyama
T. 2005. A close relationship between Cercozoa and Foraminifera supported
by phylogenetic analyses based on combined amino acid sequences of three
cytoskeletal proteins (actin, alpha-tubulin, and beta-tubulin) // Gene. Vol. 362.
P. 153-160.
Thomsen H.A. 1988. Ultrastructural studies of the flagellate and cyst
stages of Pseudopedinella tricostata (Pedinellales, Chrysophyceae) // Br.
Phycol. J. Vol. 23. P. 1-16.
Throndsen J. 1971. Apedinella gen. nov. and the fine structure of A. spi-
nifera (Throndsen) comb. nov. // Norw. J. Bot. Vol. 18. P. 47-64.
Tilney L.G., Porter K.R. 1965. Studies on microtubules in Heliozoa I.
The fine structure of Actinosphaerium nucleofilum (Barrett), with particular
reference to the axial rod structure // Protoplasma. Vol. 60. P. 317-344.
Tilney L.G. 1971. How microtubule patterns are generated. The relative
importance of nucleation and bridging of microtubules in the formation of the
axoneme of Raphidiophrys // J. Cell Biol. Vol. 51. P. 837-854.
Treguboff G. 1953. Classe de Heliozoaires // Traite de Zoologie /
P.-P. Grasse (ed.). Paris: Masson et Cie. P. 437-489.
Troyer D. 1975. Possible involvement of the plasma membrane in sal-
tatory particle movement in heliozoan axopods // Nature. Vol. 254. P. 696-
698.
Valkanov A. 1928. Die Stielbildung bei Desmothoraken nebst einigen
Worten tiber die Stellung dieser Gruppen im System // Arch. Protistenkd.
Bd 64. S. 446-456.
Villenueve F. 1937. Sur la structure de Cienkowskya mereschkowskyi
Cienk. et d’Actinolophus pedunculatus Schulze, Heliozoaires des eaux sau-
matres de Sete //Arch. Zool. Exper. et Gene. Vol. 78. P. 243-250.
Wailes G.H. 1921. Heliozoa // British freshwater rhizopoda and helio-
zoa / Cash J.,Wailes G. H. (eds) London. P. 1-72.
Walz B. 2006. Raphidiophrys elegans a colony-forming heliozoa // Mi-
krokosmos. Vol. 95. P. 173-175.
Watters C. 1968. Studies on the motility of the heliozoa. I. The locomo-
tion of Actinosphaerium eichhornii and Actinophrys sp. // J. Cell Sci. Vol. 3.
P. 231-244.
Werken H., van den. 1978. Verborgen wereld op het balkon // Artis.
Vol. 26. P. 204-214.
Wohlfarth-Bottermann K.E., Kruger F. 1954. Die Feinstruktur der
Axopodien und der Skelettnadeln von Heliozoen // Protoplasma. Bd 44.
S. 177-191.
Young J., Laybourn P.J., Jones R.I, Walton M. 1995. A stalkless sub-
species of Clathrulina elegans Cienkowski (1867) from the plankton of Loch
Ness, Scotland // Eur. J. Protistol. Vol. 31. P. 54-57.
Zacharias O. 1893. Faunistische und biologische beobachtungen am
Gr. Ploner See // Forschungsber. Biol. Station. Pion. Bd 1. S. 1-52.
Zimmerman B., Moestrup 0., Hallfors G. 1984. Chrysophyte or he-
liozoon: ultrastructural studies on a cultured species of Pseudopedinella (Pe-
dinellales ord. nov.) with comments on species taxonomy // Protistologica.
Vol. 20. P. 591-612.
Zettler L.A.A., Nerad T.A., O’Kelly C.J., Sogin M.L. 2001. The
nucleariid amoebae: more protists at the animal-fungal boundary I I J. Euk.
Microbiol. Vol. 48. P. 293-297.
Zlatogursky V.V. 2011. Raphidiophrys heterophryoidea sp. nov. (Cen-
trohelida: Raphidiophryidae), the first heliozoan species with a combination
of siliceous and organic skeletal elements // Eur. J. Protistol. (in press).
PELOBIONTIDA (Page 1976) Griffin 1988
В основном свободноживущие, микро- и анаэробные, ами-
тохондриальные, амебоидные протисты, обладающие одним
или несколькими жгутиками (моноконты). Представители от-
ряда обитают в пресных и морских водах, известны находки
пелобионтов в почве, единичные виды эндокоменсалы по-
звоночных животных. Пелобионты обладают совокупностью
сходных и весьма необычных черт клеточной организации: их
клетки лишены митохондрий и диктиосом аппарата Гольджи,
морфофункциональная организация цитоскелета предполагает
возможность реализации двух типов клеточного движения -
амебоидного и жгутикового. Запасные питательные вещества
накапливаются в виде липидных капель и зерен гликогена. Для
многих пелобионтов характерно присутствие в цитоплазме про-
кариотных эндобионтов. Отряд Pelobiontida (Page 1976) Griffin
1988, включает два семейства: Mastigamoebidae Kudo 1939 и
Pelomyxidae Schulze 1877. В настоящее время известно 5 родов
и около 25 видов пелобионтид.
История изучения
Отряд Pelobiontida (Page 1976) Griffin 1988 можно
отнести к числу относительно новых таксонов про-
тистов, появившихся в системе эукариот на волне ин-
тенсивных ультраструктурных исследований во второй
половине прошлого века (Гудков и др., 2004).
Исходно отряд Pelobiontida Page 1976 включал в
себя единственный род Pelomyxa и входил в состав
подкласса Gymnamoebae (Lobosea) (Page, 1976). Пред-
лагая этот таксон, Пейдж преследовал единственную
цель: подчеркнуть исключительность гигантского
многоядерного, амебоидного организма Pelomyxa ра-
lustris.
По общей морфологии и способу движения пело-
миксы во многом напоминают представителей лобоз-
ных амеб (Rhizopoda, Lobosea), на основании чего их
традиционно относили к числу представителей этого
таксона, нередко из-за размеров именуя их «гигантски-
ми амебами» (Penard, 1902; Kudo, 1957; Page, 1976).
В макросистеме протистов, предложенной Между-
народным комитетом по систематике и эволюции
Общества протозоологов, опубликованной в 1980 г.,
Р palustris. в рамках отряда Pelobiontida Page 1976,
выделяемого по монотипии, входила в состав класса
Lobosea, надкласса Rhizopoda (Levine et al., 1980).
В то же время, представители родов Mastigamoeba
Schulze 1875, Mastigella Frenzel 1897 и Mastigina Fren-
zel 1897, а также Dinamoeba Leidy 1874 в прежних си-
стемах протистов, как правило, объединялись в одно
семейство Mastigamoebidae Kudo 1939. Их рассматри-
вали в составе отряда Rhizomastigina Doflein 1916 в
числе прочих таксонов гетеротрофных жгутиконосцев
(Doflein, Reichenow, 1928; Honigberg et al., 1964). Од-
нако в упомянутой выше макросистеме, предложенной
Международным комитетом по систематике и эволю-
ции Общества протозоологов (Levine et al., 1980), ма-
стигамебы неожиданно «выпали» из поля зрения авто-
ров и не фигурировали ни среди зоофлагеллат, ни среди
ризопод.
Свой современный облик отряд Pelobiontida при-
нял благодаря результатам исследований ультраструк-
туры двух организмов Tricholimax {Mastigina) hylae
и Pelomyxa palustris (Brugerolle, 1982; Griffin, 1988).
Наличие жгутиков (неподвижных или слабо подвиж-
ных) с нетипичным строением аксонемы и одиночной
кинетосомой, присутствие конуса микротрубочек, от-
ходящего от основания базального тела и, видимо, свя-
занного с ядерной оболочкой, а также ряд других при-
знаков (таких, как отсутствие митохондрий, диктиосом
аппарата Гольджи и т.д.) послужили Гриффину (Griffin,
1988) основанием для сближения Р palustris и Т hylae.
Одновременно и в значительной степени интуитив-
но он указал на сходство Tricholimax hylae и мастига-
мёб. Основываясь на этих гипотезах, Гриффин поме-
стил мастигамебид (т.е. роды Mastigamoeba. Mastigina.
Mastigella. а также относящийся, по его мнению, к
этой группе род Dinamoeba) в отряд Pelobiontida (Page
1976) Griffin 1988, ранее включавший единственный
вид Р palustris. и вывел этот отряд из состава голых
лобозных амеб и вообще ризопод. В дальнейшем орга-
низмы, включаемые в отряд Pelobiontida sensu Griffin
1988, стали неформально именовать «пелобионта-
ми» (Brugerolle, 1991а, Ь, 1993; Patterson, 1994, 1999;
Brugerolle, Muller, 2000; Brugerolle, Patterson, 2000).
Таким образом, ретроспективный взгляд на исто-
рию изучения пелобионтов складывается из двух эта-
пов. Первый — до 1988 г., связан с независимым из-
учением представителей двух групп — пеломикс и
PELOBIONTIDA
271
мастигамеб, в то время как второй представляет со-
бой период изучения пелобионтов в контексте фило-
генетической и таксономической целостности отряда
Pelobiontida.
Типовой вид рода Pelomyxa — Р. palustris был
описан Греффом в 1874 году как гигантский (дости-
гающий в диаметре 5 мм) многоядерный амебоидный
организм, обитающий в толще иловых осадков (Greeff,
1874). Согласно описанию Греффа, форма клеток пере-
двигающихся пеломикс преимущественно моноподи-
альная, на заднем конце хорошо заметен бульбовидный
уроид. На его поверхности иногда обнаруживаются
прозрачные выросты различной формы — так назы-
ваемые билли. Практически всю цитоплазму пеломик-
сы занимают оптически прозрачные вакуоли, между
которыми наблюдаются узкие мостики цитоплазмы.
В качестве одного из ключевых признаков Р palustris
Грефф рассматривал организацию ядерного аппарата.
Количество ядер в клетках пеломикс может достигать
100 и более. Ядра гранулярные, многочисленные мел-
кие ядрышки располагаются по их периферии, иногда
образуя сплошную кайму непосредственно под ядер-
ной оболочкой. В описании Греффа, в принятой на тот
период времени терминологии, сообщается о большом
количестве «блестящих тел» заполняющих цитоплаз-
му пеломиксы. Они могут иметь различную форму —
округлую, овальную, гантелевидную, и часто окруже-
ны «палочковидными структурами». По современным
представлениям, описанные Греффом «палочковидные
структуры» в цитоплазме Р palustris — это бактери-
альные эндобионты, а «блестящие тела» представляют
собой зерна гликогена (Fortner, 1934; Leiner et al., 1954;
Kudo, 1957)
Впоследствии разными авторами в состав рода
Pelomyxa было включено более 20 видов амебоидных
организмов. Большинство из них было описано на ру-
беже XIX-XX веков (Leidy, 1879; Bourne, 1891; Bloch-
mann, 1894; Penard, 1902 и др.). Нужно отметить, что
многие «новые» виды пеломикс, при этом, практиче-
ски не отличались от Р. palustris (Leidy, 1879; Bourne,
1891; Kudo, 1957; Whatley, Chapmen-Andresen, 1990).
Так, например, единственным признаком дифференци-
ального диагноза Р viridis Bourne 1891 являлся цвет ци-
топлазмы пеломикс, который у Р palustris существенно
варьирует в зависимости от состава пищевых включе-
ний (Okada, 1930; Hollande, 1945; Kudo, 1957). Окраска
цитоплазмы служила и главным отличительным при-
знаком вида Р greeffi, который был описан Блохманном
(Blochmann, 1894). Р villosa Leidy 1879 была описана
на основании отсутствия в клетках «блестящих тел», а
также наличия в зоне уроида гиалиновых билли харак-
терной формы (Leidy, 1879), что не исключало возмож-
ности отнесения ее к виду Р. palustris.
Следует учитывать, что многие описания новых
видов пеломикс этого периода основывались на наблю-
дении их единичных особей и носили в значительной
степени эмоциональный и малоинформативный ха-
рактер. Это затрудняло, а подчас делало невозможным
последующую реизоляцию многих описанных видов
рода Pelomyxa, на что некоторые исследователи указы-
вали еще на рубеже XIX-XX веков (Gruber, 1884; Pe-
nard, 1902).
Однако наряду с этим в литературе постепенно
накапливались и гораздо более аргументированные
описания новых видов пеломикс, которые содержа-
ли достаточно полную информацию о морфологии их
клеток, структуре и характере движения цитоплазмы,
наличии цитоплазматических включений, строении и
размерах ядер, данные об их жизненных циклах. В пер-
вую очередь это относится к работам Грубера и Пенара
(Gruber, 1884; Penard, 1902, 1904). Эти исследователи
уделяли большое внимание точному описанию мор-
фологических признаков. В качестве примера доста-
точно обратиться к одному из «груберовских» диагно-
зов. Так, например, диагноз Amoeba prima Gruber 1884
(Грубер относил исследованные им организмы к роду
Amoeba, однако впоследствии Пенар (Penard, 1902) пе-
ревел их в род Pelomyxa') звучал следующим образом:
«Диаметр амёб в среднем составляет 0,3 мм. Прото-
плазма гиалиновая, вязкая, с небольшим количеством
зернышек. В значительной степени все компоненты
клетки вытесняются множеством наполненных жид-
костью вакуолей, примерно одинаковых по размеру.
Многочисленные ядра сферической формы, с большим
центральным ядрышком, которое может распадаться
на несколько частей. Клетки передвигаются с образо-
ванием одной широкой ведущей псевдоподии. Фор-
мирование заостренных псевдоподий несвойственно.
В задней части клетки часто выделяется зона покрытая
многочисленными прозрачными ворсинками» (цит. по:
Gruber, 1884, с. 193). Недавние исследования показали,
что перечисленные признаки действительно позволя-
ют дифференцировать Pelomyxa prima (Gruber, 1884)
в природных популяциях и доказали, что по крайней
мере часть ранее описанных видов рода Pelomyxa опре-
деленно подлежит реизоляции на основании их перво-
описаний (Фролов и др., 2005; Frolov et al., 2006).
Трудности при описании отдельных видов пело-
микс в значительной степени были связаны с отсут-
ствием четкого диагноза рода Pelomyxa. Исследовате-
ли зачастую пытались опереться на какой-либо один,
наиболее значимый с их точки зрения признак. Из наи-
более очевидных признаков, типичных для пеломикс,
обычно выделялись два: их размеры и многоядерность.
В середине XX века, как отмечал Пейдж, сложилась
тенденция, чуть ли не всех крупных лобозных много-
ядерных амеб считать принадлежащими к роду Pelo-
myxa (Page, 1976). Грефф, Лейди, Вильсон и многие
другие исследователи использовали многоядерность
в качестве основного признака рода Pelomyxa в сво-
их таксономических построениях (Greff, 1874; Leidy,
1879; Wilson, 1900). При этом в состав рода Pelomyxa
включались амебоидные организмы, которые по всем
остальным признакам существенно отличались от ти-
пового вида Р. palustris (Schaeffer, 1926; Andresen et al.,
1968). В связи с этим в литературе широко обсуждал-
ся вопрос о том, может ли количество ядер считаться
основным определяющим признаком при описании ви-
дов лобозных амеб и пеломикс в частности (Rice, 1945;
Kudo, 1952, 1959; Andresen etal., 1968; Daniels, 1973).
272
PELOBIONTIDA
Для решения этой проблемы были предприняты
специальные сравнительные исследования, в том числе
и тонкого строения Р palustris, Р. carolinensis, Р поЫ-
lis и Р illinoisensis (Kudo, 1946, 1951; Andresen, 1956,
1973; Andresen et al., 1968). В конечном итоге было при-
знано, что многоядерность не может являться ни един-
ственным, ни ключевым признаком, определяющим
принадлежность амебоидного организма к конкретно-
му роду лобозных амеб (Bovee, 1985; Page, 1987). В ре-
зультате этих исследований Р carolinensis, Р nobilis и
Р illinoisensis, по совокупности признаков были выде-
лены в отдельный род Chaos (Euamoebida, Amoebidae)
(Schaeffer, 1926; Bovee, 1985; Page, 1987).
Надо отметить, что к середине XX в. число видов
пеломикс, упоминавшихся в различного рода сводках
и руководствах стало стремительно сокращаться. За
этим фактом не стояло никаких обоснованных таксо-
номических акций. Так, в своей монографии 1976 года,
посвященной ревизии лобозных амёб, Пейдж без по-
яснений рассматривал уже только три валидных, с его
точки зрения, вида пеломикс — Р palustris, Р belevskii
и Р schiedti (Page, 1976).
Первые электронно-микроскопические исследова-
ния представителей рода Pelomyxa, по мнению их ав-
торов, были выполнены на особях одного вида Р palus-
tris. Результаты показали, что у изученных организмов
существенно варьировали такие признаки, как строе-
ние ядер, состав бактериальных эндобионтов, струк-
турная организация цитоплазмы (Daniels et al., 1966;
Daniels, Breyer, 1967). В 1978 году было опубликова-
но краткое сообщение Чапмен-Андресен, в котором
один из надёжных «груберовских» видов пеломикс
Р binucleata был признан стадией жизненного цикла
Р palustris (Chapmen-Andresen, 1978, 1982). Пэйдж в
1981 году (Page, 1981) предпринял попытку переис-
следования ряда видов пеломикс — Р. fragilis Penard
1904, Р vivipara Penard 1902, Р belevskii Penard 1893 и
P binucleata (Gruber 1884). В работе были использова-
ны тотальные препараты из коллекции Пенара. Пейдж
отмечал, что представленные на препаратах организмы
отличались по количеству и структуре ядер, наличию
и форме псевдоподий, форме клеток, пищевым пред-
почтениям, наличию и локализации в клетке бактери-
альных эндобионтов (Page, 1981). Однако, ссылаясь
на работы Дэниелса с соавторами (Daniels et al., 1966;
Daniels, Breyer, 1967) и Чапмен-Андресен (Chapmen-
Andresen, 1978, 1982), Пейдж пришел к выводу, что все
изученные организмы представляют собой не что иное,
как жизненные формы (стадии развития) Р palustris.
Попытки сведения ряда видов рода Pelomyxa в си-
нонимы Р palustris, предпринимались неоднократно и
другими авторами, в том числе и путем соотнесения
их со стадиями жизненного цикла Р palustris (см., на-
пример, Kudo, 1957; Page, 1976, 1981). Родоначальни-
ком гипотезы монотипии рода Pelomyxa можно считать
Шаффера (Schaeffer, 1926), который первым предло-
жил считать Р palustris единственным валидным видом
рода Pelomyxa. Научное обоснование концепции моно-
типии рода Pelomyxa было дано в поздних работах Ват-
лей и Чапмен-Андресен (Whatley, Chapmen-Andresen,
1990). В 1990 году ими были обобщены результаты
исследований жизненного цикла Р palustris (Whatley,
Chapmen-Andresen, 1990; Chapmen-Andresen, 1978,
1982). Эти данные послужили основой для пересмотра
существующих представлений обо всех организмах,
ранее входивших в состав рода Pelomyxa. В своих ра-
ботах Чапмен-Андресен сообщала о том, что в приро-
де ею были обнаружены различные формы Р palustris
(Chapmen-Andresen, 1978, 1982; Whatley, Chapmen-An-
dresen, 1990), процентное соотношение которых в во-
доемах отличалось в зависимости от времени года. Эти
«формы» различались по целому комплексу признаков.
В том числе по окраске и размеру клеток, количеству
и структуре ядер, скорости поглощения кислорода, ко-
личественному соотношению разных видов бактери-
альных эндобионтов и также характеру локализации
последних в клетках пеломикс (Chapmen-Andresen,
Hamburger, 1981; Whatley, Chapmen-Andresen, 1990).
Исследователи также утверждали, что им удава-
лось наблюдать процесс трансформации одной формы
Р palustris в другую в лабораторных условиях. Осно-
вываясь на вышеизложенных фактах, Ватлей и Чап-
мен-Андресен сделали следующие выводы. 1. Р pa-
lustris обладает сложным и полиморфным жизненным
циклом. По ходу жизненного цикла особенности стро-
ения пеломикс варьируют в значительной степени.
2. Все ранее описанные виды рода Pelomyxa на самом
деле являются стадиями жизненного цикла Р palustris.
Таким образом, фактически была проведена ревизия
рода Pelomyxa, в результате которой в его составе был
оставлен единственный типовой вид Р palustris.
Первый представитель будущего семейства Masti-
gamoebidae Kudo 1939 был описан одновременно с
Р palustris в 1874 году. В водоемах Северной Америки
Лейди обнаружил крупных амеб, формирующих мно-
гочисленные конические псевдоподии, поверхность ко-
торых была покрыта множеством мелких палочковид-
ных частиц (Leidy, 1874). Он назвал новый организм
Dinamoeba mirabilis.
Первый представитель собственно мастигамеб
Mastigamoeba aspera Schulze 1875, был описан через
год. Интересно, что в публикации Шульца (Schulze,
1875) в первый и единственный раз, вплоть до иссле-
дований Гриффина (Griffin, 1988), в литературе возник
вопрос о возможном родстве мастигамеб и пеломикс.
Среди морфологических признаков, включенных в
диагноз нового рода Mastigamoeba, были: наличие
псевдоподий и жгутика, перманентная связь жгутика
с ядром, наличие выраженной гиалоплазмы. Поверх-
ность М. aspera подобно D. mirabilis была покрыта па-
лочковидными частицами. Различия между этими дву-
мя организмами заключались в том, что у первой был
описан жгутик, а у второй нет.
Спустя два десятилетия Френзель, изучая фауну
амеб и солнечников на территории Аргентины, опи-
сал четыре новых рода мастигамебоподобных орга-
низмов Mastigella Frenzel 1897, Limulina Frenzel 1897,
Mastigina Frenzel 1897 и Tricholimax Frenzel 1897.
Представители первых двух родов отличались от Mas-
tigamoeba aspera отсутствием перманентной связи
PELOBIONTIDA
273
между ядром и жгутиком. При этом сравнение их типо-
вых видов Mastigella polymastix Frenzel 1897 и Limulina
unica Frenzel 1897 не было произведено, а какие-либо
существенные различия в их описаниях отсутствовали.
Это позволило Гольдшмидту (Goldschmidt, 1907), пере-
исследовавшему М. polymastix десятью годами позже,
усомниться в целесообразности сохранения самостоя-
тельного рода Limulina и, в конце концов, отказаться от
него, переведя L. unica в род Mastigella. Организм, опи-
санный Френзелем как Mastigina chlamys, обладал жгу-
тиком, основание которого было связано с ядром, был
лишен псевдоподий, при этом вся поверхность клетки
была покрыта тонкими, длинными, игловидными вы-
ростами (Frenzel, 1897).
И, наконец, Tricholimax hylae Frenzel 1897 был
обнаружен Френзелем в кишечнике амфибий. Этот
организм характеризовался направленным вперед не-
подвижным, коротким жгутиком, связанным с ядром,
фонтанирующим током цитоплазмы, наличием от 1 до
6 ядер в одножгутиковых клетках и отсутствием псев-
доподий. Родовое название Tricholimax Frenzel 1897 не
нашло поддержки у большинства исследователей того
времени. В 1907 году Гольдшмидт (Goldschmidt, 1907)
перевел Т. hylae Frenzel 1897 в род Mastigina Frenzel
1897, основываясь главным образом на фонтанирую-
щих токах цитоплазмы, аналогичных описанным им у
Mastigina chlamys и отсутствию псевдоподий. Позднее
Леммерманн (Lemmermann, 1914) предложил рассма-
тривать Tricholimax hylae в рамках рода Mastigamoeba
Schulze 1875, однако эта идея не нашла поддержки
среди протозоологов и в большинстве последующих
сводок, вплоть до наших дней этот организм фигу-
рировал под названием Mastigina hylae (Frenzel 1897)
Goldschmidt 1907.
Таким образом, к началу XX в. в протозоологиче-
ской литературе имелись описания 6 родов амебо-жгу-
тиконосцев, характеризующихся известной степенью
сходства. Первая попытка их объединения была пред-
принята Гольдшмидтом (Goldschmidt, 1907). Однако,
как это часто случалось в ранних работах по систе-
матике протистов, Гольдшмидт ввел не название так-
сона, а обозначил неформальную группу, родствен-
ных, по мнению автора, организмов, в данном случае
«mastigamoben». В ее состав включались 3 рода масти-
гамебид Mastigamoeba Schulze 1875, Mastigella Frenzel
1897 и Mastigina Frenzel 1897. Роды Limulina Frenzel
1897 и Tricholimax Frenzel 1897 не были включены в
группу «mastigamoben», а организмы, послужившие
основанием для их создания, были отнесены к родам
Mastigella Frenzel 1897 и Mastigina Frenzel 1897. Din-
amoeba mirabilis Leidy 1874, в виду отсутствия в ее
описании жгутика, не попала в группу «mastigamoben».
Однако ее сходство с М. aspera было предметом посто-
янных дискуссий о возможной идентичности обоих
организмов, путаница усугубилась тем, что со време-
нем в литературе появились описания D. mirabilis, об-
ладающих жгутиками и безжгутиковых форм М. aspera
(Leidy 1874, 1879; Penard 1902, 1909, 1936; de Groot,
1936). Так или иначе, род Dinamoeba Leidy 1874 про-
существовал в системе протистов до наших дней, в
большинстве сводок он помещался в список родов аме-
боидных организмов с неясным систематическим по-
ложением.
В 1939 году Кудо оформил формальный статус
группы «mastigamoben» sensu Goldschmidt 1907, по-
местив Mastigamoeba Schulze 1875 и Mastigella Frenzel
1897 в семейство Mastigamoebidae Kudo 1939. Ком-
позиция семейства Mastigamoebidae в дальнейшем не
претерпевала существенных изменений. Лишь в 1986
году Чавез с коллегами (Chavez et al., 1986) описали но-
вый мастигамебоподобный организм, предложив для
него новое родовое название Phreatamoeba balamuthi
Chavez et al. 1986. Основанием для этого послужи-
ло описание довольно сложного жизненного цикла
Р balamuthi, включавшего стадии многоядерных амеб,
одноядерных жгутиконосцев и цисты. Однако все эти
стадии имеются и в жизненных циклах представителей
рода Mastigamoeba, поэтому вскоре Симпсон с колле-
гами перевели Р balamuthi в род Mastigamoeba, а род
Phreatamoeba Chavez et al. 1986, описанный по моно-
типии был закрыт (Simpson et al., 1997).
С момента установления формального статуса се-
мейства Mastigamoebidae и до выхода в свет работы
Гриффина практически никаких значительных собы-
тий в изучении мастигамебид не происходило. Появ-
лявшиеся в литературе редкие описания новых видов
позволяли лишь судить о всесветном распространении
этих организмов и изредка содержали отрывочные све-
дения об их жизненных циклах. Из работ этого пери-
ода следует, однако выделить, сводку Сквортцкого и
Нода, вышедшую в 1976 году (Skvortzkov, Noda, 1976).
С точки зрения систематики мастигамебид эта работа
имела почти катастрофические последствия. Авторами
были приведены краткие описания 130(!) видов орга-
низмов отнесенных ими к роду Mastigella. В основном
это были мелкие 8-10 мкм жгутиконосцы, принцип и
характер описания которых, в большинстве случаев не
предполагали их безусловную принадлежность к како-
му-либо определенному таксону протистов и мастига-
мебидам в частности.
В 1982 году Бружероллем было выполнено первое
исследование ультраструктуры представителя масти-
гамебид — Tricholimax (Mastigina} hylae (Brugerolle
1982). Оказалось, что этот амебоидный организм не
имеет ни митохондрий, ни диктиосом аппарата Голь-
джи, но обладает сложно организованным жгутиковым
аппаратом. В основании жгутика Т. hylae расположена
единственная кинетосома, микротрубочковые дерива-
ты которой формируют устойчивую связь с оболочкой
ядра (Brugerolle, 1982).
Эта работа имела исключительное значение. С од-
ной стороны она позволила провести четкую границу
между мастигамебидами и целым рядом организмов,
также сочетающих в себе признаки амеб и жгутико-
носцев (церкомонады, гиперамебы и т.п.). С другой
стороны, она создала предпосылки для сравнительных
исследований морфофункциональной организации ма-
стигамебид и пеломикс, доводы о филогенетической
связи которых носили в это время чисто интуитивный
характер (Cavalier-Smith, 1983). И вскоре такое ис-
274
PELOBIONTIDA
следование было выполнено. Гриффин, изучая тонкое
строение Р palustris, показал наличие у этого протиста
многочисленных жгутиков с непарными кинетосомами
(Griffin, 1988). Более того, полученные им факты обна-
ружили и целый ряд других очевидных черт сходства
в организации Р palustris и Tricholimax (Mastigina)
hylae (Brugerolle, 1982; Griffin, 1988). Основываясь на
полученных данных, Гриффин поместил род Pelomyxa
Greeff 1874 вместе с родами Mastigina Frenzel 1897,
Dinamoeba Leidy 1874, Mastigella Frenzel 1897 и Masti-
gamoeba Schulze 1875 в отряд Pelobiontida (Page) Grif-
fin 1988, при этом первые два рода вошли в состав сем.
Pelomyxidae, а остальные в сем. Mastigamoebidae.
Последовавшие затем исследования нового и
очень своеобразного вида мастигамебид Mastigamoeba
schizophrenia (Simpson et al., 1997), и целого ряда других
представителей этой группы, таких как М. punctachora,
М. simplex и Mastigella commutans (Walker et al., 2001),
подтвердили справедливость гипотезы Гриффина, по-
казав принципиальное единообразие организации жгу-
тикового аппарата мастигамебид и пеломиксид. Кроме
того, было установлено, что многие виды мастигамебид
обладают выраженным внутривидовым полиморфиз-
мом и могут, в частности, формировать многоядерные
амебоидные формы со значительно редуцированным
жгутиковым аппаратом или вообще лишенные жгути-
ков (Simpson et al., 1997; Bernard et al., 2000; Walker et
al., 2001).
В недавнем прошлом была поставлена точка и в
дискуссии по поводу вероятной монотипии рода Pelo-
myxa Greeff 1874. Исследование пеломиксоподобных
организмов в водоемах Северо-Запада России вы-
явило наличие достаточно разнообразной фауны этих
организмов. За короткий промежуток времени было
обнаружено более 10 видов пеломикс, из которых 5
оказались новыми для науки, а остальные были впер-
вые реизолированы и изучены после их первоописа-
ний (Frolov et al., 2004, 2005, 2006; Фролов и др., 2005,
2010; Чистякова и др., 2010).
Молекулярно-филогенетические исследования по-
следнего десятилетия, кардинально изменившие пред-
ставления об эволюции многих групп эукариот, и суще-
ственно изменившие систему амебоидных протистов в
частности (см., например, Smirnov et al., 2005; Nikolaev
et al., 2006; Pawlowski, 2008; Pawlowski, Burki, 2009), в
отношении композиции собственно отряда Pelobiontida
пока не дали сколько-нибудь значимых результатов.
Возможные причины этого и те немногочисленные
факты, которыми все же располагает современная на-
ука, мы рассмотрим в разделе «Филогения».
Классификация
Поскольку представления о филогении организмов,
ныне объединяемых в отряд Pelobiontida, менялись не-
однократно и, зачастую кардинально, то и классифика-
ция этих организмов, подверженная стремлению отра-
жать ее новейшие веяния, претерпевала неоднократные
и существенные изменения. В литературе можно встре-
тить множество тому примеров, большинство из кото-
рых сейчас уже представляют лишь исторический ин-
терес. Здесь мы упомянем наиболее значимые из них
(табл. 6).
В каждом из таких вариантов, помимо субъектив-
ных точек зрения их авторов, в той или иной мере были
отражены и новейшие достижения соответствующего
периода. В своей работе мы вынуждены поступить
аналогичным образом. Необходимые пояснения и ар-
гументацию изменения прежних систем, принятые в
этом издании, читатель найдет в последующих главах.
Отряд Pelobiontida (Page) Griffin 1988
Сем. Mastigamoebidae Kudo 1939
Род Mastigamoeba Schulze 1875
Род Mastigella Frenzel 1897
Род Mastigina (Frenzel 1897)
Род Tricholimax Frenzel 1897
Сем. Pelomyxidae Schulze 1877
Род Pelomyxa Greeff 1874
Таблица 6
История формирования взглядов на систему пелобионтид
Автор Отряд Семейство Род
Kudo, 1939 Amoebina Rhizomastigina Amoebidae Mastigamoebidae Pelomyxa Dinamoeba Mastigamoeba Mastigella
Doflein, Reichenow, 1952 Amoebina Rhizomastigina Chaoidae Cercomonadidae Pelomyxa Mastigamoeba Mastigella Mastigina
Griffin, 1988 Pelobiontida Pelomyxidae Mastigamoebidae Pelomyxa Mastigina Mastigamoeba Mastigella Dinamoeba
Walker et al., 2001 группа “Pelobionts” Pelomyxidae Mastigamoebidae Pelomyxa Mastigina Mastigamoeba Mastigella
PELOBIONTIDA
275
Морфофункциональная
организация
Традиционно морфологические описания проти-
стов многие авторы начинают с характеристики фор-
мы тела их клеток. Это и не удивительно, поскольку
во многих случаях характерная форма тела того или
иного организма позволяет исследователям идентифи-
цировать необходимый объект уже на этапе тривиаль-
ных светооптических наблюдений. Для пелобионтов,
как и для большинства других организмов, использую-
щих амебоидное движение, понятие «форма клетки», в
прямом смысле, по понятным причинам неприемлемо.
И все же многие амебоидные организмы вполне узна-
ваемы при просмотре в световой микроскоп. Это связа-
но с тем, что изменения формы их клеток, как правило,
сопровождаются проявлением характерных, иногда
уникальных вторичных признаков. Это могут быть, на-
пример, особая форма ведущей псевдоподии или фор-
мирование специфических латеральных псевдоподий
и т.п. В число таких признаков вторично включается
и «форма тела». Дело в том, что клетки многих аме-
боидных организмов, находясь в процессе однонапр-
вленного движения, и до момента изменения вектора
движения, часто обладают относительно постоянной и
нередко характерной формой.
Для описания комплекса признаков, характеризую-
щего амеб, находящихся в процессе активной локомо-
ции, сравнительно недавно было предложено понятие
морфотипа (Smirnov, Goodkov, 1999; Smirnov, Brown,
2004). За последние годы использование морфотипов
вошло в практику описания голых лобозных амеб и
целого ряда других амебоидных организмов. Подоб-
ный принцип мы пытаемся использовать и при описа-
нии морфологии представителей отряда Pelobiontida.
На данном этапе в этой группе, на наш взгляд, можно
выделить два основных морфотипа клеток, что отчасти
поддерживает и идею разделения отряда на 2 семейства
(рис. 189). Для большинства представителей сем. Mas-
tigamoebidae, находящихся на стадии одноядерных тро-
фозоитов, характерен «цилиндрический» морфотип, их
единственный жгутик отходит от апикального конца
клетки (рис. 189, А). Для организмов, объединяемых в
семейство Pelomyxidae, характерны «сигаровидный» и
Рис. 189. Морфотипы пелобионтид.
А — мастигамебоидный, Б— пеломиксоидный морфотипы Pelobiontida.
«каплевидный» морфотипы. Передний конец пеломикс
обычно дифференцирован в выраженную лобоподию,
задний — в оформенный уроид, а многочисленные
жгутики располагаются по всей поверхности за исклю-
чением фронтальной области клетки (рис. 189, Б).
Не стоит, однако, абсолютизировать возможность
использования характеристики морфотипов при опи-
саниях пелобионтид. Так, например, за чертой двух
основных, приведенных выше морфотипов, остается
значительная группа организмов ведущих малопод-
вижный образ жизни, обычно постоянно обитающих
внутри комков детрита, а большинство мастигелл (род
Mastigella) при перемещении по субстрату избега-
ют однонаправленного движения. При этом попытки
описания большего числа уникальных морфотипов, за
счет включения более частных признаков, неминуемо
приводят к путанице, проявляющейся в последующем
обнаружении одинаковых морфотипов у представите-
лей разных таксонов пелобионтид. Это, безусловно,
снижает прогностическую ценность самого понятия
морфотип. Таким образом, при описании таксонов пе-
лобионтид рангом ниже семейства или в описаниях
морфологии отдельных организмов, к понятию морфо-
тип, по нашему мнению, пока не следует прибегать.
Клетки большинства пелобионтид моноподиаль-
ны, т.е. в процессе движения формируют одну веду-
щую, обычно широкую псевдоподию. На поверхно-
сти клетки, кроме того, могут формироваться и так
называемые латеральные гиалиновые псевдоподии
различной формы. Они могут быть конические, широ-
кие уплощенные или пальцевидные, а также длинные
тонкие, напоминающие филоподии. Часто организ-
мы, демонстрирующие способность к формированию
латеральных псевдоподий, обладают несколькими
или всеми перечисленными выше их типами. Однако
у представителей семейства Pelomyxidae никогда не
встречаются длинные тонкие псевдоподии. На перед-
нем конце клеток мастигамебид (сем. Mastigamoebidae)
часто наблюдается эруптивное движение цитоплазмы
(Goldschmidt, 1907; Becker, 1924, 1928), а для многих
пеломикс характерен так называемый фонтанирующий
ток цитоплазмы в передней части клетки (Mast, 1934),
который, однако, описан и у крупных мастигамеб, на-
пример, у Mastigamoeba aspera.
По характеру возникновения и расположению
псевдоподий у активно передвигающихся особей пе-
лобионтид можно выделить ряд наиболее распростра-
ненных форм. 1) Латеральные псевдоподии у локомо-
торных форм практически отсутствуют. Этот вариант
организации характерен для некоторых мастигамеб
(М trichophora, М. chlamys), а также наиболее крупных
представителей рода Pelomyxa. 2) Псевдоподии форми-
руются преимущественно в задней части клетки, спе-
реди образуется широкая ведущая псевдоподия. Такая
форма клеток встречается у многих мастигамеб и пело-
микс. 3) Субпсевдоподии формируются на всей поверх-
ности клеток, как, например, у Р. gruberi и М. aspera.
Оформленный уроид в задней части клетки характерен
для представителей рода Pelomyxa, однако встречается
и у некоторых мастигамебид, например, у М. aspera и
276
PELOBIONTIDA
П1П1.Ш
A
Рис. 190. Схема организации покровов у различных представителей отряда Pelobiontida.
А — аморфный гликокаликс; Б, В — филаментозный гликокаликс; Г— гликостили; Д— чешуйки и спикулы.
Д
М. trichophora. Уроид, как правило, бульбовидный, по-
крытый многочисленными гиалиновыми билли. В не-
которых случаях уроид, как таковой, отсутствует, и в
задней части клетки наблюдаются бахрома из много-
численных гиалиновых, иногда ветвящихся выростов.
Покровы пелобионтид сформированы плазмалем-
мой, покрывающей клетку и переходящей на унду-
липодии их жгутиков. Усложнение организации по-
кровов в этой группе связано с развитием различных
типов надмембранных структур. На поверхности кле-
ток большинства представителей пелобионтид посто-
янно присутствует тонкий слой аморфного гликока-
ликса, толщина которого обычно не превышает 50 нм
(рис. 190, А; 191, А). Такие покровы характерны, в
частности, для мастигамебид (Brugerolle, 1982; Chavez
et al., 1986; Simpson, et al., 1997; Walker et al., 2001), при
этом гликокаликс часто распределяется на поверхности
их клеток неравномерно в виде обособленных пятен.
Среди пеломикс покровы с в той или иной степени раз-
витым, аморфным гликокаликсом отмечены у Р stag-
na/is, Р binucleata и Р tertia (рис. 191, Л). Наибольшей
толщины он достигает в зоне уроида, в то время как на
фронтальной поверхности клеток пеломикс значитель-
но тоньше или отсутствует.
Другой тип гликокаликса — филаментозный
(рис. 190, Б, В). Для него характерно наличие боль-
шого количества филаментов, погруженных в бес-
структурный матрикс низкой электронной плотности.
Такие филаменты могут располагаться перпендику-
лярно к поверхности клетки (рис. 190, Б) как, напри-
мер, у Р palustris и Р gruberi или более или менее
параллельно плазмалемме, как у Р flava и М. aspera
(рис. 191, В, Г). Надмембранные комплексы у послед-
них двух видов характеризуются гипертрофированным
развитием, покрывая клетки слизистым чехлом, дости-
гающим у обоих видов толщины 1 мкм и более. В све-
товой микроскоп видно, что у Mastigamoeba aspera вся
поверхность клеток покрыта, кроме того, разноорен-
тированными, короткими палочковидными структура-
ми, природа которых ранее неоднократно обсуждалась
в литературе (Schulze, 1875; Penard, 1902, 1909, 1936;
Goldschmidt, 1907; Lemmermann 1914; Kudo, 1950;
Page, 1970; Siemensma, 1987). Недавние электронно-
микроскопические исследования показали, что в ги-
пертрофированном слое филоментозного гликокаликса
этих мастигамебид обитают видоспецифичные прока-
риотные эктобионты (рис. 191, Г). Для пеломикс Р pri-
ma и Р. corona, а также для Mastigella nitens характерно
присутствие на поверхности их клеток комплексного
гликокаликса (рис. 190, Г). В матриксе средней элек-
тронной плотности, перпендикулярно плазмалемме у
этих организмов располагаются структуры, морфоло-
гически сходные с гликостилями голых лобозных амеб
(Smirnov, Brown, 2004).
Однако наиболее сложно организованный и не-
обычный для пелобионтид в целом тип покровов об-
наружен у представителей рода Mastigina (рис. 190, Д).
Многие исследователи, изучавшие этих необычных ма-
стигамебид, указывали на то, что поверхность их кле-
ток покрыта видимыми в световой микроскоп много-
численными волосками или иголочками, длина которых
может достигать 10 мкм. Природа этих образований
долгое время оставалась загадкой для исследователей:
одни полагали, что это могут быть прокариотные экто-
бионты, другие рассматривали их как видоизмененные
жгутики, третьи приписывали им функции элементов
наружного скелета (Frenzel, 1897; Lauterbom, 1901;
Goldschmidt, 1907; Lemmermann, 1914; Lackey, 1932).
Изучение тонкого строения Mastigina trichophora по-
казало, что организация покровов этого организма ха-
рактеризуется высокой степенью сложности и отлича-
ется от таковой всех изученных до настоящего времени
пелобионтид (рис. 191, Д, Е). С поверхностной мем-
браной М. trichophora связан аморфный слой гликока-
ликса толщиной около 0,5 мкм. В этот слой погружены
плотно прилегающие друг к другу чешуйки, имеющие
в сечении форму лодочки. Внутри чешуек у полюсов
каждой «лодочки», в свою очередь, берут начало длин-
PELOBIONTIDA
277
Рис. 191. Ультраструктура покровов пелобионтов.
А — аморфный гликокаликс на поверхности клетки Pelomyxa binucleata', Б — гликостили на поверхности Mastigella nitens’, В — филаментозный гли-
кокаликс на поверхности Pelomyxa flava', Г — филаментозный гликокаликс на поверхности клетки Mastigamoeba aspera, с обитающими в его толще
симбиотическими бактериями; Д, Е — чешуйки и спикулы на поверхности клеток Mastigina trichophora. гл — гликокаликс; сб — бактериальные
эктобионты; сп — спикулы; цп — цитоплазма, ч — чешуйки. Масштабные линейки: А, Б — 0,1 мкм; В, Г— 0,2 мкм; Д— 1мкм; Е — 2 мкм.
278
PELOBIONTIDA
Рис. 192. Организация цист покоя пелобионтов.
А — зрелая циста Pelomyxa palustris in vivo; Б — ультраструктура трехслойной оболочки цисты Р. palustris; В — ультраструктура цисты покоя Masti-
gamoeba schizophrenia. (По: Simpson et al., 1997). в — центральная вакуоль; жг — жгутик; зя — заднее ядро; кс — кинетосома; оц — оболочка цисты;
пя — переднее ядро; цп — цитоплазма; эр — каналы эндоплазматического ретикулума. Масштабные линейки: А — 200 мкм; Б — 1 мкм; В — 0,5 мкм.
PELOBIONTIDA
279
ные полые иглы или спикулы, почти под прямым углом
отходящие от поверхности клетки. Вероятнее всего и
чешуйки и спикулы имеют органическую природу.
Отдельного упоминания заслуживает организация
покровов у покоящихся стадий пелобионтид. Как уже
отмечалось, цисты покоя обнаружены у небольшого
числа их представителей, а их ультратонкая органи-
зация изучена всего у 3-х видов (Chavez et al., 1986;
Simpson, et al., 1997; Фролов и др., 2007). Pelomyxa
palustris — единственный вид пеломикс, в жизненном
цикле которого присутствует стадия цисты. Цисты
покоя Р palustris имеют уникальную организацию.
Практически весь объем инцистированной клетки за-
нимает гигантская центральная вакуоль (рис. 192, А),
в которой локализованы все прокариотные эндоци-
тобионты. Прозрачная цитоплазма содержит 4 ядра,
трубчатые каналы эндоплазматического ретикулума —
производные наружной мембраны ядерной оболочки,
и рибосомы. Клетка покрыта плазмелеммой, кнаружи
от которой формируется массивная наружная оболоч-
ка, достигающая толщины 1,5-2 мкм. Стенка цисты
Р palustris построена по типу кутикулы и содержит
три концентрических, переходящих друг в друга слоя
различной структуры и разной электронной плотности
(рис. 192, Б).
Цисты мастигамебид организованы по совершен-
но иному принципу (Chavez et aL, 1986; Simpson et al.,
1997). И у Mastigamoeba longifilum, и у Mastigamoeba
schizophrenia морфология инцистированных особей
не претерпевает сколько-нибудь заметных отличий от
морфологии трофозоитов. В том числе, например, они
сохраняют подвижный жгутик. Оболочка цисты тонкая
(менее 100 нм), эластичная, ее основу составляет мел-
козернистый матрикс средней электронной плотности
(рис. 192, В). Степень различия организации покровов
стадий покоя у Р palustris и мастигамеб столь велика,
что позволяет говорить о независимом происхождении
стадии цисты в жизненных циклах представителей
обоих семейств пелобионтид.
Вместе с тем, сравнительный анализ типов покро-
вов, характерных для различных пелобионтид, пока-
зывает, что в этой группе протистов сходная организа-
ция поверхностных структур зачастую проявляется у
представителей, как разных семейств, так и их родов.
Исключением в данном случае являются мастигины
(род Mastigina}, покровные элементы которых — че-
шуйки и спикулы, служат надежным диагностическим
признаком родового ранга. Также, вероятно, следует
подчеркнуть, что по разнообразию типов покровов
относительно немногочисленные представители отр.
Pelobiontida, оказываются сравнимы с такой большой
группой протистов, как голые лобозные амебы (Gym-
namoebia, Lobosea) (Page, 1987; Smirnov, Brown, 2004).
Организация цитоплазмы пелобионтид выглядит
крайне своеобразно. Как уже неоднократно подчерки-
валось, клетки пелобионтид лишены митохондрий и
диктиосом аппарата Гольджи (Brugerolle, 1982; Chavez
et al., 1986; Серавин, 1992; Simpson, et al., 1997; Walker
et al., 2001; Гудков и др., 2004). В настоящее время мы
разделяем точку зрения Волкер с коллегами, полагаю-
щими, что периодически появляющиеся в литературе
описания аппарата Гольджи у пеломикс (см. например:
Серавин, Гудков, 1987г; Frolov et al., 2004), связаны,
вероятнее всего, с ошибочной трактовкой похожих на
диктиосомы структур, производных сложно организо-
ванной системы каналов эндоплазматического ретику-
лума (Walker et al., 2001).
Пока остается открытым вопрос о наличии в ци-
топлазме пелобионтид микротелец (Finlay, Fenchel,
1989). Описания подобных им органелл носят слу-
чайный характер и, несомненно, требуют подтвержде-
ния (Серавин, Гудков, 19876; Walker et al., 2001). Для
большинства представителей рода Pelomyxa, а также
некоторых мастигамебид, например, Mastigella nitens
характерно наличие в цитоплазме так называемых
структурных вакуолей (Гудков, Серавин, 19916). Это
оптически пустые, как правило, сферические вакуоли
разного диаметра, которые вероятнее всего являются
производными эндоплазматического ретикулума. Си-
стема структурных вакуолей у некоторых видов может
быть очень сильно развита. Например, у зрелых тро-
фозоитов Р palustris и Р prima они заполняют до 75%
от объема клетки. Функциональное значение структур-
ных вакуолей пока неизвестно.
Цитоплазма пелобионтид может служить средой
обитания для ряда организмов, среди которых особое
место, безусловно, занимают облигатные прокари-
отные цитобионты (рис. 193). Наибольшее разноо-
бразие бактериальных эндоцитобионтов обнаружено
у представителей рода Pelomyxa (Frolov et al., 2004;
2005; 2006; Фролов и др., 2005). Чаще всего у пело-
микс встречаются следующие симбиотические бакте-
рии. 1) Так называемые «large-type» симбионты (рис.
193, А). Крупные палочковидные бактерии, длина ко-
торых может превышать 3 мкм при диаметре клетки
0,7-0,8 мкм. Характерной особенностью их строения
является наличие продольной бороздки, часто дости-
гающей середины клетки бактерии. 2) Грамположи-
тельные метаногенные бактерии с электронно-плотной
бактериоплазмой (рис. 193, Б), длина которых обычно
не превышает 2,5 мкм, при диаметре 0,2 мкм. На при-
мере эндобионтов Р palustris было показано, что эти
бактерии относятся к виду Metanobacterium formicicum
(van Bruggen et al., 1988). В цитоплазме P palustris так-
же обитают грамотрицательные бактерии (рис. 193, В),
сходные с М. formicicum, но имеющие более закруглен-
ные концы. Видоспецифичные прокариотные эндоби-
онты обнаружены, кроме того, у Р stagnalis и Р flava
(рис. 193, Г), а у Р binucleata симбиотические бакте-
рии морфологически сходны с large-type симбионтами
и метаногенами М. formicicum, однако имеют гораздо
большие размеры.
У представителей сем. Mastigamoebidae бактери-
альные эндоцитобионты встречаются гораздо реже
(van Bruggen et al., 1985; Walker et al., 2001). У Masti-
gella commutans в цитоплазме обитают бактерии, сход-
ные с М. formicicum (Walker et al., 2001). У Mastigella
sp. также был обнаружен предположительно этот вид
бактерий и, кроме того, «large-type» симбионты (van
Bruggen et al., 1985). M. nitens — третий вид мастигелл,
280
PELOBIONTIDA
Рис. 193. Прокариотные цитобионты из цитоплазмы некоторых пелобионтов.
А — «large-type» бактерии с характерным продольным, щелевидным впячиванием клеточной стенки (cleaft), из цитоплазмы Pelomyxa palustris} Б —
метаногенные грамположительные бактерии Metanobacterium formicicum из цитоплазмы Р palustris} В — метаногенные грамотрицательные бактерии
из цитоплазмы Р palustris} Г — цитобионтные бактерии из цитоплазмы Р flava} Д — цитобионтные бактерии из цитоплазмы Mastigina trichophora}
Е — цитобионтные бактерии из цитоплазмы Mastigella nitens} Ж — цитобионтные бактерии из цитоплазмы Mastigamoeba aspera. Масштабные ли-
нейки: А — 0,7 мкм; Б-Ж— 0,4 мкм.
PELOBIONTIDA
281
достоверно содержащий в цитоплазме симбиотических
бактерий. Один из них — это классические «large-type»
симбионты, а другой — палочковидные бактерии сред-
ней величины (рис. 193, Е). У двух видов рода Masti-
gella. таким образом, в цитоплазме обитают эндоцито-
бионты, свойственные большинству представителей
рода Pelomyxa. Видоспецифичные прокариотные цито-
бионты также обнаружены у крупных видов мастига-
мебид Mastigamoeba aspera (рис. 193, Ж) и Mastigina
trichophora (рис. 193, Д).
Роль цитобионтных бактерий в формирующихся
при их участии симбиотических системах пока неоче-
видна. В значительной степени интуитивно им при-
писывают определенную роль в метаболизме хозяев
(см., например, Whatley, 1976; Whatley, Whatley, 1980),
основываясь, в частности, на том факте, что М. formi-
cicum — симбионт, распространенный в самых различ-
ных группах именно анаэробных протистов (Fenchel et.
al., 1977; van Bruggen et al., 1983; Vogels et al., 1984;
Fenchel, Finlay, 1991, 1992). Нельзя не отметить высо-
кую степень интегрированности эндоцитобионтов пе-
лобионтид в клеточные циклы их хозяев. Так, на ста-
диях предшествующих делению клеток, происходит
синхронное перемещение всех цитоплазматических
бактерий к поверхности ядер, вокруг которых вре-
менно формируются мощные многослойные бактери-
альные конгломераты. Несомненно, это способствует
более упорядоченному распределению симбионтов
между дочерними клетками в процессе деления, ко-
торое у пеломикс часто носит характер анархической
плазмотомии.
В цитоплазме большинства видов пеломикс по
мере роста клеток происходит накопление запасных
веществ в виде гликогеновых зерен и/или липидных ка-
пель. У разных видов пелобионтид гликогеновые зерна
различаются по форме, размеру и фактуре поверхно-
сти. Можно выделить ряд закономерностей, связанных
с накоплением запасных веществ клетками различных
представителей отряда, которые, однако, не носят аб-
солютного характера. Так, для ряда организмов, цито-
плазма которых отличается развитой системой струк-
турных вакуолей, таких, как Р. palustris, Р. corona или
Р. prima, характерно накопление огромного количества
гликогена в виде зерен, окруженных мембранами ре-
тикулума. На поздних стадиях развития у этих видов
исчезают пищеварительные вакуоли, сокращается
количество структурных вакуолей, а вся цитоплазма
оказывается заполненной зернами гликогена. Для ор-
ганизмов, не обладающих развитой системой струк-
турных вакуолей подобных Р. binucleata или Р. flava.
напротив, характерно наличие в цитоплазме большого
количества свободных липидных капель. Гликогеновые
зерна формируются у них в относительно небольшом
количестве, а иногда могут отсутствовать вовсе, что
особенно характерно для Р. flava. Наконец, у Р. gruberi,
в цитоплазме которой отсутствуют структурные вакуо-
ли, отсутствуют и оба типа запасных веществ (Frolov et
al., 2004, 2005,2006; Фролов и др., 2005). Аналогичные
примеры можно обнаружить и среди мастигамебид,
для большинства которых не характерно ни наличие в
цитоплазме структурных вакуолей, ни каких-либо за-
пасных веществ. Однако у М. setosa. в цитоплазме при-
сутствуют немногочисленные структурные вакуоли и
липидные капли, а М. nitens демонстрирует наличие
как относительно развитой системы структурных ваку-
олей, так и присутствие гликогеновых зерен, окружен-
ных мембранами ретикулума.
Количество ядер в клетках пелобионтид варьиру-
ет в широких пределах. От 1-2 у мастигамебид и не-
которых пеломикс, до нескольких десятков (у много-
ядерных стадий мастигамеб и большинства пеломикс)
и даже сотен (у крупных пеломикс), а иногда и тысяч
у Р. palustris. Организация ядер относительно консер-
вативна. Обычно у пелобионтид выделяют два основ-
ных их типа (рис. 194, 195). Ядра гранулярного типа
(рис. 194, А) характеризуются большим количеством
ядрышек, занимающих периферическое положение.
Другой тип — пузырьковидные ядра, отличаются при-
сутствием в ядре единственного крупного ядрышка,
располагающегося в центре или слегка эксцентрично
(рис. 194, Б). Ядра окружены ядерной оболочкой состо-
ящей из двух мембран, разделенных перинуклеарным
пространством, и переходящих друг в друга при фор-
мировании ядерных пор. Наружный диаметр послед-
них составляет около 110 нм, а внутренний около 70 нм.
Количество пор варьирует у разных видов на разных
стадиях ядерного цикла от нескольких до 50-70 штук
на 1 мкм2 ядерной поверхности. В ряде случаев мож-
но наблюдать усложнение строения ядерной оболочки
за счет формирования внешних слоев — производных
каналов и пузырьков эндоплазматического ретикулума.
При этом следует заметить, что если пузырьковидные
ядра всегда окружены простой оболочкой, то оболочка
гранулярных ядер обязательно несет на своей наруж-
ной поверхности дополнительные структурные эле-
менты (рис. 194,196). Кроме уже упомянутых произво-
дных эндоплазматического ретикулума, это могут быть
короткие микротрубочки (рис. 196, В), закладывающи-
еся в околоядерной зоне или везикулы с электронно-
плотным содержимым (рис. 196, Г). Структура и раз-
мер ядер в одной клетке, как правило, одинаковы, за
исключением клеток находящихся на стадии ядерной
пролиферации. Имеющиеся в литературе сообщения о
том, что Р. palustris может обладать двумя различными
типами ядер (Andresen et al., 1968), вероятно, следует
Рис. 194. Схема организации основных типов ядер пелобионтов.
А — гранулярные ядра, Б — пузырьковидные или визикулярные ядра.
282
PELOBIONTIDA
Рис. 195. Ультраструктурная организация ядер пелобионтов.
А — Pelomyxa binucleata', Б — Pelomyxa prima', В — Pelomyxa palustris’, Г — Mastigamoeba aspera', Д — Mastigina trichophora', E — Mastigella nitens.
я — ядро; яо — ядерная оболочка; яд — ядрышки. Масштабные линейки: А-Е — 1 мкм.
отнести к числу казусов, представляющих в настоящее
время лишь исторический интерес. Эти авторы после-
довательно рассматривали все виды пеломикс в каче-
стве «жизненных форм» единственного вида Р palus-
tris и, соответственно, ядра разных видов описывали в
контексте внутривидового полиморфизма Р palustris.
Для многих мастигамебид, за редкими исключе-
ниями, о которых будет сказано ниже, характерны
пузырьковидные ядра (Brugerolle, 1982; Chavez et al.,
1986; Simpson et al., 1997; Walker et al., 2001). Их от-
личают хорошо оформленное, крупное ядрышко, лежа-
щее в центре ядра, высокая плотность ядерных пор и
отсутствие дополнительных слоев в ядерной оболоч-
ке (рис. 195, Г). К поверхности апикального полюса
ядра мастигамебид подходят микротрубочки ядерного
конуса, являющиеся дериватами кинетосомы (см. да-
лее). Исключением служат представители рода Masti-
gella. у представителей которого кариомастигонты не
формируются. Среди изученных видов пеломикс пу-
зырьковидными ядрами обладают Р gruberi и Р prima
(рис. 195, Б; 196, А). В околоядерной зоне у особей этих
видов, как и у мастигамеб, обнаруживается множество
микротрубочек. Из глубины цитоплазмы к поверхности
ядер подходят как отдельные микротрубочки, так и их
PELOBIONTIDA
283
группы. Их число сравнимо с числом микротрубочек
в ядерных конусах мастигамебид, а характер взаимо-
действия с ядерной оболочкой очень похож на тот, что
описал Бружероль у Tricholimax hylae (Brugerolle, 1982,
Fig. 10, p. 232). Есть, однако, и одно существенное от-
личие. Конус микротрубочек мастигамебид взаимодей-
ствует только с одним ядерным полюсом, тогда как у
Рис. 196. Ультраструктурная организация ядерных оболочек у
пелобионтид.
А — Pelomyxa gruberi', Б— Mastigella nitens', В — Pelomyxa flava', Г—Pe-
lomyxa stagnalis. 6 — цитобионты; мт — околоядерные микротрубочки;
я — ядро; яо — ядерная оболочка. Масштабные линейки: А-Г — 1 мкм.
ядер Р gruberi, например, микротрубочки подходят к
поверхности ядер со всех сторон. Вполне вероятно,
что ядерный конус мастигамебид и базальные кинето-
сомальные пучки Р gruberi являются гомологичными
структурами (Frolov et al., 2005, 2006). Учитывая, что
пучки микротрубочек подходят к ядерной оболочке
Р gruberi с разных сторон, велика вероятность того,
что они могут являться производными разных жгу-
тиков. В тоже время, поскольку кинетосома каждого
жгутика формирует 2 таких пучка (см. далее), расходя-
щихся от ее основания под значительным углом друг к
другу, нельзя исключать возможность взаимодействия
этих пучков микротрубочек с разными ядрами.
Для большинства пеломикс присущи ядра грану-
лярного типа (рис. 195, Л, В). Ядрышковый материал
в них располагается по периферии, в ядрах некоторых
видов он плотно прилегает к внутренней поверхности
ядерной оболочки, у других локализуется на некото-
ром расстоянии от нее. Среди мастигамебид ядра, ко-
торые могут быть отнесены к типу гранулярных, об-
наружены у Mastigina trichophora и Mastigella nitens
(рис. 195, Д, £). Ядрышковый материал в них фрагмен-
тирован и располагается по периферии, прилегая к вну-
тренней поверхности ядерной оболочки.
Безусловно, одной из самых ярких черт в организа-
ции пелобионтид является наличие в их клетках двух
морфофункциональных систем, обеспечивающих два
различных типа клеточного движения: амебоидного и
жгутикового (Серавин, 1967). Основу первой из них
составляют микрофиламентозные элементы корти-
кального цитоскелета, второй — микротрубочковые
ассоциаты жгутикового аппарата. Оба типа движения
реализуются с разной степенью эффективности в раз-
ных группах пелобионтид, а в ряде случаев и у разных
стадий развития одного вида.
Для мелких видов мастигамебид характерно ис-
пользование обоих типов движения. При контакте с
субстратом они передвигаются как истинные амебы,
однако, утратив связь с субстратом, быстро перемеща-
ются в толще воды уже как настоящие жгутиконосцы.
Крупные представители мастигамебид, подобные М. ni-
tens, хотя и обладают длинным, подвижным жгутиком,
при перемещении по субстрату используют исключи-
тельно амебоидный способ движения. Аналогично, все
известные многоядерные стадии мастигамебид исполь-
зуют также только амебоидное движение. Представи-
тели рода Pelomyxa, обладают многочисленными, но,
как правило, неподвижными жгутиками, неспособны-
ми генерировать движение. Все пеломиксы на всех ста-
диях развития используют исключительно амебоидное
движение. Число жгутиков у пеломикс непостоянно и,
по-видимому, связано с размерами клеток.
По данным Гриффина, на поверхности различных
клеток пеломикс отмечалось от 64 жгутиков у самых
мелких форм, до приблизительно 700 у наиболее круп-
ных особей Р palustris (Griffin, 1988). Жгутики, как
правило, неподвижные и короткие, их длина не превы-
шает 10-20 мкм у большинства исследованных видов.
Единственный вид пеломикс, у которого на данный
момент обнаружены подвижные жгутики — Р binucle-
284
PELOBIONTIDA
ata. У этой пеломиксы ундулиподии способны совер-
шать маятникоподобные колебания или вращательные
движения, при этом зона активности находится непо-
средственно у основания жгутика. В ряде случаев, у
одноядерных особей Р binucleata, отмечены настоящие
волнообразные колебания жгутиков. Однако движение
отдельных жгутиков на поверхности одной и той же
клетки нескоординировано, даже если они находятся
в непосредственной близости друг от друга. В любом
случае, эти жгутики не осуществляют двигательную
функцию. Жгутики у пеломикс могут располагаться
как непосредственно на поверхности клетки, так и на
концах небольших гиалиновых псевдоподий, образу-
ющихся на боковых поверхностях клетки, как, напри-
мер, у Р. flava, или сосредоточенных в зоне уроида, как
например, у Р palustris и Р stagnalis. У большинства
мастигамебид единственный направленный вперед
жгутик располагается на терминальной поверхности
лобоподии. Эруптивное движение цитоплазмы на пе-
реднем конце клеток, несущих жгутики, отмеченное у
некоторых мастигамеб (Walker et al., 2001), может при-
водить к кратковременному формированию нескольких
псевдоподий. Однако и в этом случае жгутик сохраня-
ется на ведущей лобоподии. Единственным исключе-
нием в этой группе является Mastigella nitens. Поверх-
ность этой мастигеллы сплошь покрыта массивными
гиалиновыми псевдоподиями, на одной из которых и
располагается жгутик.
Интересно отметить, что у большинства амебо-
идных протистов, обладающих жгутиками, в месте
локализации последних вообще не происходит фор-
мирования псевдоподий (см., например, Ширкина, Се-
ливанова, 1982; Карпов, Мыльников, 1989; Мыльников,
1989). На поверхности клеток пеломикс жгутики в от-
личие от мастигамебид никогда не занимают постоян-
ного положения. Еще Блохманн отмечал перемещение
«нитевидных придатков» на поверхности клеток пело-
микс по направлению к их переднему концу, т.е. переме-
щение их вместе с поверхностной мембраной относи-
тельно периферической зоны цитоплазмы (Blochmann,
1894). Гриффин в своих исследованиях при помощи
сканирующего микроскопа показал, что отдельные
клетки Р palustris отличаются по характеру располо-
жения жгутиков на поверхности клетки (Griffin, 1988).
В некоторых случаях они были достаточно равномерно
распределены по клеточной поверхности, тогда как в
других образовывали отдельные плотные скопления.
Единственным местом, где у пеломикс отсутствуют
жгутики, является фронтальная поверхность лобопо-
дии. Возможно, эта закономерность каким-то образом
связана с преобразованиями плазмалеммы в процессе
локомоции клетки. Так, существует гипотеза, что на
переднем конце клетки у движущихся особей Р palus-
tris постоянно происходит обновление плазматической
мембраны за счет встраивания в нее мембран структур-
ных вакуолей (Гудков, Серавин, 19916). В то же время
в зоне уроида происходит постоянная интернализация
мембраны за счет пиноцитоза, а также фагоцитоза, ко-
торые у Р palustris на заднем конце клетки осущест-
вляются практически непрерывно (Kudo, 1957). В этой
зоне отмечается выраженная складчатость мембраны
(см., например, Andresen et al., 1968; Griffin, 1988).
Гриффин обнаружил здесь жгутики, лежащие в вакуо-
лях внутри цитоплазмы (Griffin, 1988). Правда, Гудков
описывает погруженные жгутики и вне уроидальной
зоны клеток Р palustris (Гудков, 1989). Электронно-
микроскопические исследования показывают, что по-
верхностная мембрана жгутиков пелобионтид не несет
каких-либо надмембранных структур, за исключением
Р prima, жгутики которой покрыты тонким (толщиной
около 7 нм) слоем аморфного гликокаликса.
Ундулиподии жгутиков пеломикс армированы
микротрубочками, аранжировка которых вариабельна
даже у жгутиков в пределах одной особи. Формула их
аксонемы всегда отличается от 9x2+2, которая харак-
терна для функционирующих ундулиподий подавля-
ющего большинства эукариот. На поперечных срезах
жгутиков у разных видов обнаружены разнообразные
варианты расположения микротрубочек аксонемы, как,
например, 8+2+1, 7+2+1+1+2, 9+2+0, 10+2+1 и другие.
Более того, на разных уровнях одной ундулиподии рас-
положение микротрубочек также может отличаться.
Как уже отмечалось выше, мастигамебиды обладают
единственным, локомоторным жгутиком. Их ундули-
подии имеют типичное строение и аранжировка ми-
кротрубочек аксонемы жгутика, по крайней мере, у из-
ученных видов, отвечает стандартной формуле 9x2+2.
Единственным исключением является обитающая
в кишечнике некоторых амфибий Tricholimax hylae.
Для этой крупной амебы характерен преимуществен-
но амебоидный способ локомоции. Ее единственный
короткий жгутик при движении направлен вперед, но
практически неподвижен. В аксонеме жгутика Т. hylae,
подобно пеломиксам, отмечено нарушение стандарт-
ной аранжировки микротрубочек (Brugerolle, 1982).
По сути, аксонема Т. hylae представлена пучком не-
упорядоченных микротрубочек, отдельные синглеты и
дуплеты которых располагаются хаотично. В дуплетах
периферических микротрубочек аксонемы М. schizo-
phrenia отсутствуют внешние динеиновые ручки. Это,
однако, не влечет за собой нарушений в классической
аранжировке микротрубочек их аксонемы (9x2+2) и
не оказывает видимого влияния на функционирование
жгутика (Simpson et al., 1997).
Известно, что способность жгутика к ундулирую-
щему движению не зависит напрямую от аранжиров-
ки микротрубочек в аксонеме. Одним из характерных
примеров являются гаметы некоторых споровиков
(тип Sporozoa), строение аксонем жгутиков которых —
6x2+0 или даже 3x2+0 (цит. по: Серавин, 1985) — от-
нюдь не препятствует генерации активного движения.
Нужно отметить, однако, что в отличие от пеломикс
аранжировка микротрубочек в аксонемах жгутиков га-
мет споровиков стабильна в пределах каждого отдель-
ного вида этих протистов, и что их периферические
микротрубочки всегда объединены в дуплеты. Таким
образом, жгутики, строение аксонемы которых до-
статочно сильно отличается от 9x2+2, в ряде случаев
все же сохраняют способность совершать те или иные
виды движений. У пелобионтид подобную картину мы
PELOBIONTIDA
285
Рис. 197. Схемы организации основных типов жгутикового аппарата пелобионтид.
А — жгутиковый аппарат Pelomyxa prima', Б — Р. binucleata', В — Mastigamoeba punctachora. (По: Walker et al., 2001). a — аксонема жгутика; бмт —
группа базальных микротрубочек; кс — кинетосома; лк — латеральный корешок; пз — переходная зона; рмт — группа радиальных микротрубочек;
цо — ЦОМТ латерального корешка; як — ядерный конус микротрубочек.
наблюдаем у Р binucleata и Tricholimax hylae. Согласно
регуляторной гипотезе Серавина, нарушения в аран-
жировке микротрубочек аксонемы в первую очередь
влияют не на способность жгутиков к ундулирующему
движению, а на способность протистов, а также клеток
многоклеточных совершать направленные перемеще-
ния, а также регулировать биение жгутика (Серавин,
1985).
Базальная часть жгутикового аппарата пелобион-
тид традиционно может быть подразделена на пере-
ходную зону и кинетосому. В основании жгутиков пе-
лобионтид всегда расположена одиночная кинетосома.
Наличие непарных кинетосом, явление среди проти-
стов неординарное, которое, безусловно, следует рас-
сматривать в качестве серьезного филогенетического
маркера. Строение базальной части жгутика и связан-
ных с ней корешков значительно варьирует в пределах
группы (рис. 197). У пеломикс, относящихся к видам
Р gruberi, Р prima, Р flava, Р tertia длина базально-
го тела значительна и составляет в среднем 0,7 мкм,
хотя у Р gruberi может достигать 1,2 мкм (рис. 198,
A-В). У Р gruberi и Р prima базальное тело жгутика
окружено муфтой электронно-плотного материала
(рис. 198, Б, Ж). У Р binucleata и Р stagnalis кинетосо-
мы короткие (рис. 199, А-Г), их длина составляет при-
близительно 200 нм, муфта электронно-плотного мате-
риала отсутствует. У Р palustris в основании жгутиков
не всегда обнаруживается оформленная кинетосома,
если же она дифференцируется, то сходна по морфо-
логии с кинетосомой Р binucleata. У Р. prima в средней
и базальной части кинетосомы ее стенка образована не
триплетами, а дуплетами и даже синглетами микротру-
бочек. Поперечный профиль данной структуры пред-
ставлен в этом случае ломаной линией.
С кинетосомой жгутика у представителей рода
Pelomyxa связано несколько групп микротрубочек
(рис. 197, А, Б), количество и состав которых варьирует
в зависимости от видовой принадлежности амеб. В то
же время набор микротрубочковых дериватов, связан-
ных с кинетосомой, стабилен в пределах вида. Груп-
пы микротрубочек, ЦОМТы которых морфологически
связаны с кинетосомами пеломикс, обозначают сле-
дующим образом: 1) Латеральный корешок, это лента
из примерно 10-20 микротрубочек, связанная в своем
основании с выраженным ЦОМТом расположенном на
латеральной поверхности кинетосомы. 2) Радиальные
микротрубочки. Их основания обычно погружены в
электронно-плотный материал на поверхности кинето-
сомы. Радиальные микротрубочки располагаются в не-
сколько рядов и отходят от кинетосомы в цитоплазму
под значительным углом. 3) Базальные микротрубочки
отходят вглубь цитоплазмы от основания кинетосомы.
У Р. prima имеются все три группы микротрубочек.
Латеральный корешок отходит от скопления электрон-
но-плотного материала, который локализован в ниж-
ней части кинетосомы. Его микротрубочки в форме
компактного пучка проходят параллельно поверхно-
сти клетки. Основания радиальных микротрубочек
погружены в муфту электронно-плотного материа-
ла, который окружает кинетосому и, вероятно, играет
роль ЦОМТа. Базальные микротрубочки, в количестве
30^40 штук, отходят от нижней границы кинетосомы, в
зоне, где отсутствует электронно-плотный материал, и
формируют достаточно компактный пучок, направлен-
ный вглубь клетки перпендикулярно ее поверхности.
У Р. gruberi (рис. 198), отсутствует латеральная лента
микротрубочек, однако от нижней части кинетосомы
отходят не один, как у Р. prima, а два пучка базальных
микротрубочек, каждый из которых образован 20-30
микротрубочками. Эти пучки направлены также вглубь
клетки. Кроме того, для Р. gruberi характерно наличие
большего числа радиальных микротрубочек (рис. 198),
которое сочетается с необычно длинной кинетосомой.
Для Р. flava характерно наличие грех микротрубочко-
286
PELOBIONTIDA
Рис. 198. Ультраструктура жгутикового аппарата Pelomyxa gruberi.
а — аксонема; кс — кинетосома; лк — латеральный корешок; рмт — радиальные микротрубочки; пз — переходная зона. Масштабные линейки: А-Д.
Ж,3 — 0,4 мкм; Е — 0,2 мкм; И— 0,1 мкм.
PELOBIONTIDA
287
Рис. 199. Ультраструктура жгутикового аппарата Pelomyxa binucleata.
а — аксонема; кс — кинетосома; рмт — радиальные микротрубочки. Масштабные линейки: А, В — 0,4 мкм; Б, Г, Е-И— 0,2 мкм; Д— 0,1 мкм.
288
PELOBIONTIDA
вых дериватов, связанных с базальным телом жгутика
(Фролов и др., 2010). В дистальной части кинетосомы
к ней прилегает компактный участок электронно-плот-
ного материала, от которого берет начало латеральный
корешок, образованный лентой из 10-11 плотно при-
легающих друг к другу микротрубочек. Этот корешок
располагается вдоль поверхности клетки.
Практически по всей длине кинетосомы, за исклю-
чением зоны, связанной с латеральным корешком, от-
ходят радиальные микротрубочки. Они формируют до
10 концентрических рядов, а общее их количество мо-
жет достигать 120 и более штук. Угол наклона этих ми-
кротрубочек относительно поверхности клетки может
быть различным. Иногда, если жгутик располагается
на конце небольшой конической псевдоподии, ради-
альные микротрубочки организованы в форме массив-
ного компактного пучка. От основания кинетосомы Р.
flava отходит небольшое количество базальных микро-
трубочек, формирующих рыхлый пучок. Вглубь клетки
у Р. flava ни одна из групп микротрубочек, связанных с
кинетосомой, не проникает. У Р tertia с кинетосомой
связаны радиальные микротрубочки, которые, однако,
окружают кинетосому не по всему периметру, а отхо-
дят лишь от одной из ее боковых сторон и в виде до-
статочно плотного пучка располагаются вдоль поверх-
ности клетки.
Кроме того, в верхней части кинетосомы в связи с
ней обнаруживается небольшое скопление электрон-
но-плотного материала, возможно, аналогичное тому,
которое связано с латеральным корешком у Р flava и
Р prima. У Р binucleata от кинетосомы отходит груп-
па радиальных микротрубочек, количество которых
составляет 35-40 (рис. 199). Эти микротрубочки на-
правлены перпендикулярно поверхности клетки, одна-
ко практически сразу изгибаются под прямым углом и
формируют рыхлый пучок, подстилающий плазмати-
ческую мембрану. На поперечных срезах можно ви-
деть, что непосредственно под кинетосомой радиаль-
ные микротрубочки располагаются в 2-3 спирально
закрученных ряда, формируя полый цилиндр. Таким
образом, базальные микротрубочки, отходящие от
основания кинетосомы, у Р binucleata отсутствуют.
Сходным образом организована и базальная зона жгу-
тика у Р stagnalis (Чистякова, Фролов, 2010). У этой
пеломиксы также обнаруживаются связанные с кине-
тосомой радиальные микротрубочки, однако их коли-
чество меньше, чем у Р binucleata. Эти микротрубочки
также формируют спираль, видимую на поперечных
срезах. Однако от кинетосомы они отходят сразу под
углом, располагаясь в поверхностных слоях цитоплаз-
мы. Таким же образом организованы и микротрубочки,
связанные с основанием жгутика, и у Р. palustris. В то
же время мы не можем с уверенностью говорить о на-
личии выраженной кинетосомы в основании жгутиков
у этого вида пеломикс.
Гудков сообщает о том, что кинетосомоподобная
структура, являющаяся центром организации микро-
трубочек, обнаруживается лишь в основании вновь
формирующихся жгутиков, и электронно-плотный ма-
териал, входящий в ее состав, практически полностью
расходуется на образование аксонемы ундулиподии
(Гудков, 1989). По его данным у Р. palustris проис-
ходит постоянное обновление «популяции» жгутиков
(Гудков, 1989). При электронно-микроскопических ис-
следованиях у Р. palustris могут быть обнаружены так
называемые жгутиковые почки (жгутики, закладыва-
ющиеся de novo), обладающие выраженной кинетосо-
мой, а также «зрелые» жгутики на разных стадиях ее
редукции. Эти данные отчасти подтверждаются наблю-
дениями за другим видом пеломикс — Р. gruberi. В ци-
топлазме этой пеломиксы регулярно обнаруживаются
свободные (лишенные ундулиподий) кинетосомы с ти-
пичным для данного вида набором микротрубочковых
дериватов (Frolov et al., 2006). У этого вида обнаруже-
ны и структуры, напоминающие «жгутиковые почки».
Они представляют собой короткие выросты поверхно-
сти клетки, погруженные в небольшой карман. В ос-
новании таких выростов в цитоплазме располагается
кинетосома типичного строения, связанная с радиаль-
ными и базальными микротрубочками. Сам вырост
заполнен при этом электронно-плотным материалом
(Frolov et al., 2006). По всей видимости, эти структуры
также представляют собой жгутики, формирующиеся у
пеломикс de novo.
По сообщению Гудкова и Серавина, в цитоплазме
Р. palustris были, кроме того, обнаружены электронно-
плотные тела, имеющие неотчетливую 9-лучевую сим-
метрию. По мнению авторов, эти тела представляют со-
бой ЦОМТы, являющиеся организующим центром при
формировании жгутиков (Серавин, Гудков, 1987а, в;
Гудков, 1989). Процесс разборки жгутиков был про-
демонстрирован этими авторами у Р. palustris. По их
данным жгутик, подлежащий резорбции, укладывается
на поверхность клетки и фагоцитируется клеткой. На
электронограммах были отмечены жгутики, еще сохра-
няющие свою организацию, окруженные мембраной
вакуоли. Впоследствии, по всей видимости, происхо-
дит разборка микротрубочек аксонемы. Подобное яв-
ление у Р. palustris было отмечено также Гриффином
(Griffin, 1988). Правда, автор трактует это образование,
напротив, как одну из стадии формирования нового
жгутика. По всей вероятности, в уроидальной зоне по-
гружение жгутиков в цитоплазму и последующая раз-
борка аксонемы может происходить у большинства
пеломикс. С сожалением приходится констатировать,
что в настоящее время неизвестно, каким образом на
самом деле происходит увеличение числа кинетосом
у пеломикс. По-видимому, процессы закладки новых
жгутиков протекают с очень высокой скоростью. Так, в
зрелых цистах Р. palustris. а также у многоядерных мо-
лодых особей еще не покинувших цисту, ни жгутики,
ни отдельные ЦОМТы в цитоплазме не обнаруживают-
ся. В то же время, молодые особи пеломикс, практиче-
ски сразу после эксцистирования уже имеют многочис-
ленные жгутики, типичного для этого вида строения.
Подобно пеломиксам в основании жгутика у всех
исследованных представителей мастигамебид лежит
одиночная кинетосома (рис. 197, В; 200, Б, В). В боль-
шинстве случаев полые кинетосомы формируются де-
вятью триплетами микротрубочек, однако у М. schizo-
PELOBIONTIDA
289
Рис. 200. Ультраструктура жгутикового аппарата Mastigamoeba aspera.
кс — кинетосома; лк — латеральный корешок; цок — ЦОМТ микротрубочек ядерного конуса; як — микротрубочки ядерного конуса; ят — ядерное
тельце. Масштабные линейки: А-Е — 0,2 мкм.
phrenia стенка кинетосомы образована не триплетами,
а дуплетами микротрубочек (Simpson et al., 1997). С ки-
нетосомами жгутиков мастигамебид связаны три груп-
пы микротрубочек (рис. 197,5): латеральный корешок,
конус микротрубочек и радиальные микротрубочки.
Латеральный корешок обнаружен у всех представи-
телей семейства Mastigamoebidae. Он берет начало от
хорошо выраженного ЦОМТа, который локализован на
латеральной поверхности кинетосомы, и представля-
ет собой ленту из плотно прилегающих друг к другу
микротрубочек. Число микротрубочек в латеральном
корешке, по всей вероятности, видоспецифично и ва-
рьирует у разных представителей мастигамебид от 10
до 30, редко более. У Т. hylae описан так называемый
ризостиль, в состав которого, кроме латерального ко-
решка, входят еще несколько пучков микротрубочек,
происхождение которых пока остается неясным. Ра-
диальные микротрубочки берут начало в электронно-
плотном материале, расположенном на латеральной
поверхности кинетосомы, и под значительным углом
к ней отходят в цитоплазму. Комплекс радиальных
микротрубочек не обнаружен лишь у самого мелкого
из исследованных представителей мастигамебид —
М. simplex (Walker et al., 2001).
Однако самой характерной чертой в организации
базальной части жгутикового аппарата мастигамебид
является наличие конуса микротрубочек (рис. 197, В;
200). Его часто называют также ядерным конусом, по-
скольку у большинства представителей семейства он
принимает участие в формировании кариомастигон-
та. Надо заметить, однако, что в большинстве случаев
провести четкую границу между радиальными микро-
трубочками и микротрубочками ядерного конуса прак-
тически невозможно. В базальной части кинетосо-
мы на одном уровне обнаруживаются как основания
микротрубочек, отходящих в цитоплазму почти пер-
пендикулярно ее продольной оси (радиальные), так и
микротрубочки, направляющиеся вдоль этой оси непо-
290
PELOBIONTIDA
средственно к ядру (микротрубочки конуса). У Т. hylae
конус микротрубочек вообще не дифференцируется, а
в формировании кариомастигонта принимают участие,
вероятно, все многочисленные радиальные микротру-
бочки (Brugerolle, 1982). Несколько необычно в этом
смысле выглядит ядерный конус М. aspera, микротру-
бочки которого берут начало от массивного обособлен-
ного ЦОМТа, расположенного под основанием кинето-
сомы (рис. 200, Д).
Структура переходной зоны жгутика изучена не у
всех описанных к настоящему времени видов пеломикс.
В целом, анализ имеющихся в нашем распоряжении
данных показывает, что если в переходной зоне жгу-
тика этих пелобионтид и обнаруживается какая-либо
морфологически оформленная дополнительная струк-
тура, то это — переходный цилиндр, свойственный в
частности переходным зонам жгутиков Р binucleata и
Р gruberi. Длина такого цилиндра составляет в сред-
нем 100 нм, диаметр — 80 нм. У Р prima центральная
часть переходной зоны заполнена электронно-плотным
материалом, который возможно, маскирует какие-либо
структуры, имеющиеся в ней. У этого вида переходная
зона жгутиков выступает над поверхностью клетки на
0,18-0,20 мкм. Непосредственно от верхней границы
электронно-плотного материала берут начало централь-
ные микротрубочки аксонемы. У Р. palustris весь жгу-
тиковый аппарат редуцирован в значительной степени.
У этого вида в основании сформированных жгутиков
не всегда удается даже дифференцировать переходную
зону жгутика, как таковую. Для всех изученных Mastig-
amoebidae характерно наличие в базальной части пере-
ходной зоны жгутика, тонкостенного цилиндра. Кроме
того, у ряда видов мастигамебид большая часть пере-
ходной зоны бывает заполнена электронно-плотным
материалом (Simpson et al., 1997; Walker et al., 2001).
Сравнительный анализ организации жгутикового
аппарата пелобионтид позволяет выделить ряд оче-
видных на наш взгляд эволюционных тенденций, ре-
ализующихся у этой аберрантной группы протистов.
Вероятно, за исходный тип для всех представителей
группы следует принять жгутиковый аппарат Mastig-
amoeba, включающий непарную кинетосому, с которой
ассоциированы три группы микротрубочек (латераль-
ный корешок, радиальные микротрубочки и ядерный
конус), переходную зону с переходным цилиндром и
ундулиподию с классической аранжировкой микротру-
бочек аксонемы. В наиболее общем случае жгутиковый
аппарат такого строения участвует в формировании
кариомастигонта. Изменения этой модели происходят
во всех группах мастигамебид и, вероятно, в значи-
тельной степени независимо. Уже среди представите-
лей собственно мастигамеб обнаруживаются различ-
ные примеры нарушения данной схемы: утрата одной
из групп кинетосомальных микротрубочек, наличие
аберрантных кинетосом и формирование автономного
ЦОМТа микротрубочек ядерного конуса (Simpson et
al., 1997; Walker et al., 2001). Для рода Mastigella харак-
терно отсутствие в клетках кариомастигонтов. Един-
ственный представитель рода Tricholimax — Т. hylae,
демонстрирует более существенные изменения в стро-
ении жгутикового аппарата, которые затрагивают как
его базальную часть (сложный ядерный конус, форми-
рование ризостиля), так и ундулиподию, аранжировка
микротрубочек аксонемы которой отлична от формулы
9x2+2 (Brugerolle, 1982).
Таким образом, уже среди Mastigamoebidae обна-
руживаются все те изменения организации жгутиково-
го аппарата, которые до недавнего времени считались
характерной чертой организации представителей сем.
Pelomyxidae. У пеломикс, как мы уже подчеркивали,
выделяются две группы организмов, принципиально
различающиеся строением базальной части жгутико-
вого аппарата. При этом наблюдается очень интересная
параллель между организацией жгутикового и ядерно-
го аппаратов в обеих их группах. У видов, обладающих
пузырьковидными ядрами «мастигамебного» типа,
кинетосомы жгутиков ассоциированы с 2-3 группами
микротрубочек. И если пучки базальных микротрубо-
чек пока только гипотетически можно отождествлять с
ядерным конусом, то латеральный корешок и радиаль-
ные микротрубочки этих пеломикс несомненно гомо-
логичны таковым мастигамебид. В другой группе пе-
ломикс, обладающих характерным типом гранулярных
ядер, латеральный корешок и базальные микротрубоч-
ки отсутствуют, а число радиальных микротрубочек
сильно редуцировано. Представители обеих групп пе-
ломикс, кроме того, демонстрируют и все те отклоне-
ния от исходной схемы строения жгутикового аппарата,
которые мы отмечали в качестве единичных примеров
у мастигамебид. Это — аберрантная организация аксо-
немы, отсутствие в переходной зоне переходного ци-
линдра, наличие в переходной зоне электрнноплотного
материала, нарушения в организации периферических
микротрубочек в кинетосоме и переходной зоне.
Жизненные циклы
Для многих пелобионтов характерен полиморфизм,
который проявляется в различиях между особями од-
ного вида по размерам, количеству ядер, локализации
в их клетках эндобионтов, особенностях организации
цитоплазмы и т.п. Предположения о том, что эти явле-
ния так или иначе связаны со сменой стадий жизнен-
ного цикла данных протистов, высказывались в лите-
ратуре неоднократно. Впервые жизненный цикл был
изучен у Р, palustris, его схема была предложена Ват-
лей и Чапмен-Андресен (Whatley, Chapmen-Andresen,
1990). Нужно отметить, однако, что эта схема, отчасти
справедливо демонстрирующая порядок чередования
стадий развития Р palustris, вместе с тем, не позволя-
ет судить о большинстве процессов, сопровождающих
переход от одной стадии пеломикс к другой. Так, до
сих пор остаются неизученными ни способ размноже-
ния Р palustris, ни типы деления ядер этих организ-
мов. Анализ литературы показывает, что большинство
работ, посвященных исследованию особенностей раз-
множения представителей рода Pelomyxa, в первую
очередь Р palustris, содержат описания необычных
способов делений ядер, которым их авторы зачастую
PELOBIONTIDA
291
дают не менее необычные названия: ядерное почкова-
ние, ядерная споруляция и т.п.
Первые упоминания об аберрантных делениях ядер
пеломикс содержатся уже в ранних работах Греффа
(Greeff, 1874) и Пенара (Penard, 1902), которым, по их
словам, удавалось наблюдать, как «из ядра в цитоплаз-
му выходят маленькие тельца, которые, вероятно, впо-
следствии могут стать нормальными ядрами» (Greeff,
1874). Это описание очень напоминает картину «лопа-
ющихся ядер», обычно сопровождающую разрушение
клетки пеломиксы. Вероятно, этим объяснением впол-
не можно было бы удовлетвориться, если бы не автори-
тет авторов подобных наблюдений. Более того, много
позднее Дэниелс с соавторами, пришли к выводу о том,
что у Р palustris может встречаться как митотическое
деление ядер, так и ядерное почкование. Характер-
ными чертами последнего процесса они полагали со-
хранение ядерной оболочки и формирование тем или
иным способом очень мелких, диаметром менее 5 мкм,
«ядерных спор» (Daniels, Pappas, 1986, 1994). Нужно,
однако, отметить, что эти наблюдения, впрочем, как
и все остальные аналогичные наблюдения, ни разу не
были подтверждены сколько-нибудь информативным
иллюстративным материалом, позволяющим судить
о достоверности столь неординарных явлений. Про-
цесс деления клеток у Р palustris также не исследован.
По данным разных авторов, у Р palustris может иметь
место как неравная (анархичная) плазмотомия так и
бинарные деление клеток, впрочем, обычно тоже не-
равные (Schulze, 1875; Veley, 1905; Leiner et al., 1954;
Whatley, Chapmen-Andresen, 1990).
Чередование стадий жизненного цикла Р palustris
(рис. 201, А) по данным Чапмен-Андресен (Whatley,
Chapmen-Andresen, 1990) носит выраженный сезон-
ный характер. Весной из цист (рис. 201, А г) выходят
молодые пеломиксы (рис. 201, А 61). Исследователь-
ница сообщает о том, что это двуядерные амебки.
По нашим наблюдениям (Фролов и др., 2007) цисты
Р palustris 4-ядерные и, более того, до выхода моло-
дых особей из цист, эти ядра претерпевают минимум
2 деления. У молодых пеломикс не развита система
структурных вакуолей, отсутствуют гликогеновые
тела и минеральные гранулы, эндобионты равномер-
но распределены по цитоплазме. Затем следует ста-
дия роста (рис. 201, А 62-63). Пеломиксы активно
питаются, количество ядер увеличивается до 30-60.
В цитоплазме появляются гликогеновые тела, вокруг
которых концентрируются симбиотические бактерии.
На стадии роста Р palustris активно передвигаются,
имеют овальную или сигаровидную форму с хорошо
выраженным бульбовидным уроидом на заднем кон-
це клетки. В конце лета — начале осени на следую-
щей, так называемой стационарной стадии (рис. 201,
А 64), пеломиксы приобретают сферическую форму,
уроид исчезает. Клетки малоподвижны при постоян-
ной внутриклеточной циркуляции цитоплазмы. Ко-
личество ядер в них может достигать тысячи и более.
Симбиотические бактерии на этой стадии концентри-
руются вокруг ядер. Гигантские многоядерные клетки
Р palustris в конце осени — начале зимы начинают
делиться путем плазмотомии (рис. 201, А в). В даль-
нейшем, по мнению Чапмен-Андресен, возможны два
варианта развития продуктов плазмотомии Р palus-
tris. Пеломиксы либо возвращаются на стадию роста,
либо, образуют цисты. Жизненный цикл отдельных
особей не синхронизирован, хотя обычно связан со
сменой времен года и имеет годовую периодичность.
В схеме жизненного цикла Р palustris, предложен-
ной Ватлей и Чапмен-Андресен (Whatley, Chapmen-
Andresen, 1990), есть много неясных мест, которые
главным образом приурочены к процессам, сопрово-
ждающим смену стадий развития. Их описание носит в
значительной степени спекулятивный характер и, хотя
авторы в ряде случаев ссылаются на некие эксперимен-
тальные данные, документированные подтверждения
их выводов в литературе отсутствуют. По нашим дан-
ным к числу заслуживающих доверия фактов, которые
подтверждаются прямыми наблюдениями в природе,
относятся следующие: появление в природных попу-
ляциях Р palustris множества мелких особей содержа-
щих около 20 ядер в результате их эксцистирования в
первые весенние месяцы; формирование гигантских
многоядерных особей в летне-осенний период; исчез-
новение гигантских пеломикс и появление большого
количества 4-ядерных цист в конце осени — начале
зимы (Фролов и др., 2007).
Рис. 201. Схемы циклов развития различных представителей семейства Pelomyxidae.
А — Pelomyxapalustris Greeff 1874; Б — Pelomyxa binucleata Gruber 1884; В — Pelomyxa gruberi Frolov et al. 2006. a — одноядерные трофозоиты, б —
многоядерные трофозоиты, в — стадия плазмотомии, г — циста.
292
PELOBIONTIDA
P palustris — единственный представитель пело-
микс, в жизненном цикле которого обнаружена ста-
дия цисты, жизненные циклы остальных представи-
телей семейства протекают по упрощенным и более
очевидным схемам (рис. 201, Б, В). Так у Р binucleata
(рис. 201, Б) в жизненном цикле чередуются две хорошо
дифференцируемые стадии — одноядерные (рис. 201,
Б al, а2) и взрослые двуядерные (рис. 201, Б б). Взрос-
лые особи встречаются в водоемах Северо-Запада Рос-
сии, начиная с конца сентября и до середины августа
следующего года. Соответственно, пик численности
молодых одноядерных Р binucleata приходится на вто-
рую половину августа, сентябрь. Обе стадии помимо
количества ядер отличаются друг от друга по целому
комплексу морфологических признаков. У одноядер-
ных форм более выражена широкая гиалиновая кайма
по периферии клетки, оформленный уроид у этих пе-
ломикс отсутствует, вместо него в задней части клетки
наблюдается зона, покрытая многочисленными гиали-
новыми билли. Двуядерные клетки, как правило, име-
ют выраженный бульбовидный уроид. Их бактериаль-
ные эндобионты распределены по всей цитоплазме.
Перед делением материнской особи все эндобионты
концентрируются вокруг обоих ядер, формируя по-
добие многослойных чехлов окружающих каждое из
них. Эта сложная ассоциация эндобионтов, сохраняет-
ся и после деления материнской клетки Р binucleata.
Ядра, окруженные эндобионтами, занимают до 2/3 объ-
ема дочерних клеток. Продукты деления — молодые
пеломиксы (рис. 201, Б al) очень подвижны, они ин-
тенсивно питаются, поглощая, главным образом, одно-
клеточные зеленые водоросли и колонии прокариот.
Процессы пищеварения идут, вероятно, очень медлен-
но, поскольку организмы в пищеварительных вакуолях
сохраняют свою естественную пигментацию в течение
недель и даже месяцев. Перед делением ядра ассоциат
эндобионтов распадается на отдельности, освобождая
поверхность ядерной оболочки. Далее следует деление
ядра, тип которого пока неизвестен. Конечные процес-
сы протекают, вероятно, очень быстро. Нам довелось
наблюдать более 2000 одноядерных особей Р binucle-
ata в период активного появления двуядерных стадий,
при этом только дважды нами были встречены одно-
ядерные клетки с «голыми» ядрами и одна клетка со-
держала два только что разошедшихся ядра.
Еще у одного представителя рода Pelomyxa. Р gru-
beri основные этапы развития осуществляются на
одноядерной стадии (Frolov et al., 2006). В результате
плазмотомии (рис. 201, В в) из крупных многоядерных,
содержащих от 16 до 32 ядер, особей (рис. 201, В 64)
образуются мелкие одноядерные клетки (рис. 201, В а).
Основная масса эндобионтов в этих клетках локали-
зована вокруг ядра. Следующая за этим стадия роста,
в ходе которой как клетка, так и ее ядро существенно
увеличиваются в размерах, растянута у Р gruberi на 6-7
месяцев. По завершении фазы роста, клетки Р gruberi
вступают в фазу ядерных делений (рис. 201, В 61-64).
Единственное ядро, достигшее к этому времени гигант-
ских размеров (его диаметр превышает 50 мкм), начи-
нает делиться, в результате чего и формируются много-
ядерные пеломиксы. Максимальное количество ядер в
клетках Р gruberi варьирует от 16 (в северных популя-
циях) до 32 (в южных). Промежутки между делениями
ядер достигают по времени нескольких недель, хотя
сами деления происходят очень быстро. На этой стадии
рост клеток прекращается. По достижении максималь-
ного количества ядер организмы начинают делиться
путем плазмотомии. У Р gruberi отмечены оба ее типа:
анархичная плазмотомия, продуктами которой являют-
ся клетки со случайным набором ядер, и плазмотомия
происходящая путем формирования симметричных
розеток дочерних особей, содержащих равные наборы
ядер. В обоих случаях конечными продуктами делений
являются одноядерные особи, незамедлительно (минуя
стадию покоя), вступающие в фазу роста (Frolov et al.,
2006). Строгая сезонная приуроченность для жизнен-
ного цикла Р gruberi нехарактерна. Хотя полный цикл
развития и повторяется с практически годовой перио-
дичностью, и клетки внутри различных микропопуля-
ций Р gruberi относительно синхронизированы в раз-
витии, различия между состоянием микропопуляций,
даже в пределах одного водоема, могут быть весьма су-
щественными. При этом в одно и тоже время, в одной
из стаций Р gruberi могут быть представлены мелкими
одноядерными особями, находящимися на начальных
этапах фазы роста, а в соседней — крупными клет-
ками, пребывающими в состоянии активной ядерной
пролиферации.
У остальных пеломикс жизненные циклы пока не
изучены. Приведенные примеры позволяют, однако,
предполагать наличие минимум двух основных тенден-
ций, определяющих структуру их жизненных циклов.
Главное различие между ними заключается в наличии
или отсутствии в жизненном цикле выраженной одно-
ядерной стадии. Здесь следует, несколько забегая впе-
ред, сказать, что одноядерные стадии являются обяза-
тельным атрибутом жизненных циклов мастигамебид
и, вполне вероятно, что одноядерность пелобионтов
может рассматриваться как плезиоморфный признак
присущий данной группе протистов в целом.
Жизненные циклы представителей семейства Mas-
tigamoebidae изучены очень фрагментарно. Отдельные
описания включают, в лучшем случае, перечень ста-
дий, обнаруженных в культуре (Chavez et al., 1986) или
в насыщенных пробах (Simpson et al., 1997) тех или
иных видов мастигамебид. Так, Чавез с коллегами при
описании Mastigamoeba (Phreatamoeba) balamuthi об-
наружил, что в культуре эти организмы представлены
тремя стадиями: жгутиковой — мастигамебы имеют
от l-ro до 4-х ядер, каждое из которых связано с осно-
ванием своего жгутика; амебоидной — амебы имеют
множество ядер, жгутики отсутствуют; цистой. В пере-
живающей пробе морские мастигамебы Mastigamoeba
schizophrenia (Simpson et al., 1997) формируют анало-
гичные стадии развития (рис. 202). Различия носят бо-
лее или менее частный характер и связаны главным об-
разом с тем, что М. schizophrenia на протяжении всего
цикла развития обладает парными ядрами. Обитающая
в кишечнике амфибий Tricholimax hylae — еще один
представитель мастигамебид, у которого в природных
PELOBIONTIDA
293
Рис. 202. Стадии жизненного цикла Mastigamoeba schizophrenia.
Объяснение см. в тексте. (По: Simpson et al., 1997).
популяциях обнаружены все три перечисленные выше
стадии развития (Frenzel, 1897; Goldschmidt, 1907).
Индивидуальной особенностью данного вида являет-
ся организация многоядерных стадий. У Т. hylae это
не безжгутиковые амебы, а одножгутиковые клетки, в
цитоплазме которых, кроме того, формируются множе-
ственные кариомастигонты, лишенные ундулиподий.
У некоторых представителей рода Mastigella также
описан полиморфизм стадий развития. Так у М. vitrea в
жизненном цикле имеются клетки, несущие от 1-го до
4-х подвижных жгутиков, полностью лишенные жгу-
тиков амебы и цисты (van Bruggen et al., 1985). Ана-
логичные стадии описаны у М. nitens и М. polymastix.
Вероятнее всего 4-ядерные и 4-жгутиковые стадии, об-
наруженные у некоторых из эих видов, являются пред-
шественниками процесса плазмотомии.
На основании приведенных выше описаний можно
предложить гипотетическую, обобщенную схему жиз-
ненного цикла, свойственного, вероятно, большинству
представителей семейства Mastigamoebidae. Согласно
этой схеме в цикле развития мастигамебид имеются три
основных стадии: жгутиконосцы, многоядерные амебы
и цисты. Одножгутиковых, одноядерных мастигамеб,
следует считать трофозоитами. Эта стадия присутству-
ет в жизненных циклах всех известных мастигамебид и
является основной формой при идентификации. Судьба
трофозоитов двояка: в определенных условиях они мо-
гут трансформироваться в амеб и в процессе активной
ядерной пролиферации формировать крупные много-
ядерные клетки, продуктами делений которых является
следующая генерация трофозоитов. В иных условиях
развития трофозоиты способны инцистироваться для
переживания неблагоприятных условий. После эксци-
стирования трофозоиты вновь включаются в цикл раз-
вития. Помимо формирования многоядерных клеток и
последующей плазмотомии трофозоиты, по крайней
мере ряда видов, способны размножаться и путем би-
нарных делений. В рамках семейства Mastigamoebidae
разнообразие циклов развития связано, таким образом,
с различной степенью выраженности у разных видов
тех или иных фаз базовой модели цикла, вплоть до пол-
ного исключения некоторых из них. Так, у Т. hylae в
жизненном цикле отсутствует фаза бинарных делений
одноядерных клеток. Напротив, этот способ размноже-
ния, вероятно, является единственным в циклах разви-
тия представителей рода Mastigina и ряда мастигамеб,
у которых неизвестны многоядерные формы. Стадия
цисты, также может выпадать из жизненного цикла
многих мастигамебид.
Сравнивая схемы жизненных циклов Mastigamoe-
bidae и Pelomyxidae, нельзя не обратить внимания на
принципиальное сходство в организации задейство-
ванных в них стадий развития. Важно еще раз под-
черкнуть, что и одноядерные и многоядерные стадии
встречаются в циклах развития представителей обоих
семейств пелобионтид. Пожалуй, только различия в
организации многоядерных амеб отчасти позволяют
провести черту между жизненными циклами обеих
групп пелобионтид. У пеломиксид многоядерные аме-
бы обычно обладают многочисленными жгутиками, а у
294
PELOBIONTIDA
мастигамебид мультинуклеарные клетки, как правило,
лишены жгутиков. Однако есть целый ряд примеров
размывающих четкость и этой границы. Так много-
ядерные клетки Т. hylae сохраняют свой единственный
неподвижный жгутик, а их ядра ассоциированы с кине-
тосомами, погруженными в цитоплазму. В то же время
у представителя пеломиксид Р gruberi молодые одно-
ядерные стадии не имеют жгутиков, а их кинетосомы
погружены вглубь клетки. И, наконец, многие масти-
гамебы и мастигеллы могут формировать клетки с 2-4
ядрами и соответствующим числом жгутиков. Это,
однако, не мешает предполагать наличие общей, базо-
вой модели цикла развития, присущего пелобионтам в
целом. Такой цикл, в наиболее полном виде, вероятно,
заключается в чередовании одноядерных и многоядер-
ных стадий, сопровождаемых двумя формами клеточ-
ных делений: плазмотомией многоядерных клеток и
бинарными делениями одноядерных. Смещение вре-
менных акцентов на ту или иную стадию приводит к
формированию двух типов циклов, которые хотя и с
некоторыми отличиями, но реализуются у представи-
телей обоих семейств пелобионтид. Стадия цисты, по
всей вероятности, возникала в жизненных циклах пе-
лобионтид у ряда их представителей независимо и не-
однократно на более поздних этапах эволюции, о чем
свидетельствуют сравнительно-морфологические дан-
ные, рассмотренные нами выше.
Филогения
Представления о филогении пелобионтид до недав-
него времени основывались исключительно на данных
сравнительно-морфологических исследований. Ре-
зультатом этих работ было появление в зоологической
литературе второй половины XX в. ряда гипотез, так
или иначе связанных с попыткой решения одной из на-
сущных фундаментальных задач того периода — вы-
яснению вероятного происхождения и роли в эволюции
эукариот различных групп амитохондриальных про-
стейших. Уже на рубеже столетий часть этих гипотез
отошла в историю не найдя подтверждения в новейших
молекулярно-филогенетических исследованиях проти-
стов, другие, напротив, в настоящее время завоевыва-
ют все большее признание, органично сочетая в себе
данные морфологических и молекулярных филогений.
Ниже мы остановимся подробнее на наиболее интерес-
ных с нашей точки зрения филогенетических концеп-
циях, заметное место в которых отводилось пелобион-
тидам.
Концепции Caryoblastea Margulis 1974 и Pelofla-
gellatea Goodkov et Seravin 1991a. Ряд протозоологов,
основываясь уже на ранних данных по ультраструктуре
пелобионтид, подчеркивая уникальность организации
Р. palustris. выделяли род Pelomyxa в отдельную таксо-
номическую единицу высокого ранга (Margulis, 1974,
1981; Goodkov, Seravin, 1995). Как уже было отмечено,
первые электронно-микросопические исследования
Р palustris показали, что у этого организма отсутствует
большинство органелл эукариотной клетки, как то: ми-
тохондрии, диктиосомы аппарата Гольджи, центриоли,
комплекс сократительной вакуоли и другие.
Эти данные послужили основой для выдвижения
гипотезы о том, что Р palustris может представлять со-
бой своего рода живой реликт, сохранившуюся до на-
стоящего времени предковую форму эукариотного ор-
ганизма, исходно обитавшего в анаэробных условиях
(Margulis, 1974; Whatley, Whatley, 1980, 1983; Марге-
лис, 1983; Corliss, 1984; и др.). Сторонники этой гипо-
тезы полагали, что все перечисленные выше органеллы
отсутствуют у пеломиксы первично. Было выдвинуто
даже предположение о том, что один из прокариотных
эндобионтов пеломикс (large-type бактерии) может яв-
ляться предшественником митохондрий эукариот. Осо-
бенную поддержку данная гипотеза находила у сторон-
ников теории происхождения эукариотной клетки путем
серийного симбиогенеза (Маргелис, 1983). Признание
исключительной роли Р palustris в эволюции эукари-
отных организмов послужило основанием для выделе-
ния этого вида в отдельный тип Karyoblastea (Margulis,
1974, 1981; Whatley, Chapman-Andresen, 1990). Такой
высокий ранг таксона должен был, по мнению авторов,
отражать уникальность пеломикс как проэукариотных
организмов, возможно, непосредственно связанных с
предками всех эукариот. В контексте общей логики те-
ории серийного симбиогенеза, концепция Karyoblastea
выглядела весьма привлекательной. Однако она была
практически полностью лишена доказательной базы,
ибо вопрос о том первично или вторично отсутствие в
клетках пеломиксы ряда органелл, в то время не имел
однозначного ответа (Гудков, Серавин, 1991а).
Безусловно, важнейшим моментом в развитии со-
времнных представлений о природе пелобионтид в
целом и пеломиксы в частности, стало обнаружение у
Р palustris настоящих жгутиков (Griffin, 1988; Гудков,
1989). Опубликованные практически одновременно,
исследования Гудкова и Гриффина существенно отли-
чались интерпретацией полученных фактов и легли в
основу двух независимых концепций филогении пело-
бионтид.
По данным Гудкова и Серавина, в основании ун-
дулиподии Р palustris отсутствовала оформленная
кинетосома (Гудков, 1989; Гудков, Серавин, 1991а).
Микротрубочки аксонемы, брали начало в «облаке»
осмиофильного материала, которому авторы отводи-
ли роль автономного ЦОМТа. Согласно предложенной
ими гипотезе жгутиковый аппарат пеломиксы нахо-
дится в сильно редуцированном состоянии, на одной
из стадий, соответствующей переходу от жгутиково-
го способа локомоции к амебоидному. Известно, что
виды, способные к амебоидному движению, встре-
чаются в разных таксонах протистов, использующих
в качестве основного способа движения жгутиковое.
У таких протистов часто наблюдается в той или иной
степени выраженная редукция жгутикового аппара-
та, что, вероятно, связано с утратой жгутиком его ло-
комоторной функции. Гудков и Серавин поместили
Р. palustris в отдельный класс Peloflagellatea (Гудков,
Серавин, 1991а, 2000), включавший один отряд с диа-
гнозом класса, одно семейство и один род с единствен-
PELOBIONTIDA
295
ным видом Р palustris, подчеркивая таким образом
уникальность ее строения. Однако они специально от-
мечали, что, по их мнению, Р. palustris, скорее всего, в
своем происхождении связана с группой эукариотных
организмов, вторично утративших ряд клеточных ор-
ганелл в результате приспособления к специфическим
условиям существования в анаэробных средах. Авторы
полагали, что ни один из существовавших на тот мо-
мент вариантов системы не отражает действительно-
го положения Р. palustris среди других протистов. По
мнению Серавина и Гудкова Р. palustris не следовало
помещать ни среди голых лобозных амеб (Lobosea) ни
относить к таксону, включающему примитивных про-
тистов, первично не имеющих митохондрий, например,
типу Karyoblastea. При этом они не видели достаточ-
ных оснований и для сближения Р palustris с какими-
либо другими группами протистов. Так, например, об-
суждая возможность объединения в пределах одного
таксона пеломикс и мастигамеб, авторы подчеркивали,
что делать какие-либо заключения относительно их
филогенетической близости невозможно, без получе-
ния дополнительных данных об ультраструктуре дру-
гих представителей группы (Гудков, Серавин, 1991а,
2000). Наличие некоторых общих черт в строении кле-
ток Tricholimax hylae, Mastigella и Pelomyxa, как, на-
пример, отсутствие митохондрий и наличие в клетках
симбиотических бактерий, могло быть обусловлено, по
их мнению, сходством среды обитания этих организ-
мов. Видоизмененное строение жгутикового аппарата,
в свою очередь, могло быть связано с утратой жгути-
ком его функционального значения в связи с переходом
организмов к амебоидному способу локомоции, кото-
рый мог осуществляться независимо у пеломикс и ма-
стигамеб (Гудков, Серавин, 1991а).
Концепция Pelobiontida Гриффина (Griffin, 1988)
в значительной степени была основана на сравнитель-
ном анализе строения жгутикового аппарата Р palus-
tris и Tricholimax {Mastigina) hylae. В отличие от ав-
торов концепции Peloflagellatea, Гриффин не обошел
вниманием такой важный факт как наличие непарных
кинетосом в основании жгутиков обоих организмов —
признак, исключительность которого специально под-
черкивал Бружеролль, изучивший тонкое строение жгу-
тикового аппарата Т hylae (Brugerolle, 1982). Именно
очевидное сходство в строении жгутикового аппарата
послужило основанием для сближения родов Pelomyxa
и Tricholimax, и их последущего включения вместе с
родами Mastigamoeba Schulze 1875; Mastigella Frenzel
1897 и Mastigina Frenzel 1897, а также Dinamoeba Leidy
1874 в отряд Pelobiontida (Page) Griffin 1988.
Как уже отмечалось в предыдущих разделах, отряд
Pelobiontida первоначально включал в себя единствен-
ный род Pelomyxa и входил в состав подкласса Gym-
namoebae (Lobosea). В качестве признаков, характери-
зующих представителей отряда Pelobiontida, Гриффин
привел нижеследующие: 1) пелобионтиды — это аме-
боидные протисты, обладающие жгутиками; 2) в осно-
вании жгутиков пелобионтид расположены непарные
кинетосомы; 3) микротрубочки в аксонеме могут быть
аранжированы необычным образом; 4) с базальным
телом жгутика связаны радиальные микротрубоч-
ки; 5) микротрубочки обнаруживаются также в связи
с ядром; 6) цитоплазма сильно вакуолизирована; 7) в
клетках обитают специфичные бактериальные эндо-
бионты; 8) митохондрии отсутствуют; 9) многие виды
многоядерны; 10) обитают в анаэробных или микроаэ-
робных условиях. Здесь нужно отметить, что к момен-
ту опубликования Гриффином своей работы (Griffin,
1988), на электронно-микроскопическом уровне была
исследована морфология только одного представи-
теля группы мастигамебид — Tricholimax {Mastigina)
hylae (Brugerolle, 1982). При этом сам Гриффин поме-
щал Т hylae в одно семейство с Р palustris, дистанци-
руя их, таким образом, от остальных Mastigamoebidae
(Griffin, 1988). Следовательно, включая в отряд Pelobi-
ontida мастигамебид, Гриффин мог руководствоваться
лишь интуитивными соображениями, основанными
исключительно на данных светооптических наблю-
дений.
Исследования особенностей тонкого строения
других представителей семейства Mastigamoebidae,
таких как Mastigamoeba schizophrenia, М. balamuthi,
М. simplex, Mastigella punctachora и др., выполненные
десятилетие спустя (Simpson et al., 1997; Walker et al.,
2001), тем не менее, доказали безусловную правоту ги-
потезы Гриффина. В частности было показано, что в
основании жгутика у всех мастигамебид, расположена
одиночная кинетосома, с которой связаны три группы
микротрубочек: латеральный корешок, конус микро-
трубочек и группа радиальных микротрубочек. Некото-
рые мастигамебиды оказались способны к формирова-
нию амебоидной безжгутиковой стадии, в ряде случаев
доминировавшей в их жизненном цикле (например,
у М. balamuthi). Для некоторых видов была отмечена
способность к слиянию нескольких особей и образова-
нию небольших плазмодиев. То есть нашло подтверж-
дение и предположение о распространенности много-
ядерных стадий у мастигамебид. Основным признаком
семейства Pelomyxidae, отличающим его представите-
лей от Mastigamoebidae Гриффин считал нестабильный
состав микротрубочек в аксонеме жгутиков, что и по-
зволяло ему сближать рода Tricholimax {Mastigina) и
Pelomyxa. Положение отряда Pelobiontida среди других
протистов Грифин не определял. Анализ имеющихся в
настоящее время морфологических данных показывает
(Гудков и др., 2004), что отряд Pelobiontida sensu Grif-
fin 1988 представляет собой группировку несомненно
родственных организмов. Это, хотя и с некоторыми
оговорками, подтверждают и молекулярно-филогене-
тические исследования последних лет (Morin, Mignot
1995; Bapteste et al., 2002; Smirnov et al., 2005; Nikolaev
et al., 2006; Pawlowski, Burki, 2009).
Концепция Archamoebae (от царства Archezoa к
подтипу Conosea). В одной из ранних редакций много-
царственной системы протистов, предложенной Ка-
валье-Смитом (Cavalier-Smith, 1983), род Pelomyxa и
мастигамебиды, рассматривались как одни из наиболее
примитивных групп протистов. Для таких организмов
Кавалье-Смит выделил в царстве Protozoa особое под-
царство Archezoa, позднее подняв его ранг до царства
296
PELOBIONTIDA
Saccharomyces cereviae
“ Monosiga brevicollis
.......... Trichoplax adhaerens
0.95
1.0
1.0
1.0
1.0
1.0|
0.95I
Opisthokonta
..........(внешняя группа)
..........Heleospera sphagni
“ Saccamoeba Umax
Hartmanella cantabriglensis
" — Glaeseria mira
—Amoeba leningradensis
Amoeba proteus
Chaos carolinensis
1.0
1.0
Leptomyxa reticulata
Paraflabellula reniformis
‘l«0 Rhizamoeba saxonica
—Hartmanella verm (formis
............. Echinamoeba thermarum
1.0 l—.... Echinamoeba exundans
Baiamuthia mandrillaris
Acanthamoeba tubiashi
Acanthamoeba lenticuiata
—— Platyamoeba stenopodia
— Dermamoeba algensis
Vexillifera armata
Neoparamoeba pemaquidensis
Neoparamoeba branchiphila
— Korotnevella Stella
0.99I
0.9|
0.97|
Vexillifera minutissima
— Clydonella sp. ATCC 50884
0.53
0.68
0.95
0.89
1.0
Lingu (amoeba ieei
1.0
1 Vannella miroides
Platyamoeba plurinucleolus
Vanneiia anglica
________ 1.01----------1
0.98
0.97
0.67
1.0
1.0
1.0
1.0
0.95
0.01
Pelomyxa palustris (sensu Milyutina et al, 2001)"]
-------Pelomyxa palustris (from cysts) J Pelobiontida
———— Entamoeba coii
-// Entamoeba ranarum
— Entamoeba histolytica
Entamoeba gingivalis
....Entamoeba polecki
□ Pelobiontida
1.0
Mastigamoeba simplex
Endolimax папа
Ф
Ф
E
co
CH
Ф
(/)
1.0
.0
Multicilia marina
Mastigamoeba sp.
“ Phreatamoeba balamuthi*
Mastigella commutans
““ Polysphondylium pallidum
Dictiostelium discoideum
Pelobiontida
1.0
1.0
........... Arcyria denudata
————— Trichia persimilis
———— Protophysarum phloiogenum
Physarum polycephalum
' 1 Stemonitis flavogenita
Symphytocarpus impexus
—— Filamoeba nolandi
Gephyramoeba sp. ATCC50654
Phalansterium solitarium
Рис. 203. Филогения Amoebozoa реконструированная по последовательностям гена 18S рРНК по методу Байеса с использованием
модели GTR+G+I.
Числа в узлах соответствуют апостериорным вероятностям. Длины ветвей даны в пропорции к предполагаемому числу замен. Исключение составля-
ют семь ветвей, перечеркнутых посередине двумя косыми чертами, которые уменьшены вдвое от исходной длины. Шкала соответствует количеству
замен на сайт. Оригинал А.Ю. Костыгова.
* См. Систематический обзор: Mastigamoeba longifilum. — Прим. авт.
PELOBIONTIDA
297
и даже суперцарства (Cavalier-Smith, 1983, 1991, 1993).
Характерными чертами представителей этой супер-
группировки протистов признавались первичное от-
сутствие митохондрий, пероксисом, и дикгиосом аппа-
рата Гольджи, а также наличие рибосом с константой
седиментации 70S, как у прокариот. В состав Arche-
zoa исходно были включены четыре типа протистов
Metamonada, Microsporidia, Parabasalia, Archamoebae.
Тип Archamoebae включал мастигамебид и Р palustris
в качестве самостоятельных классов Mastigamoebea
Cavalier-Smith 1987 и Pelobiontea Cavalier-Smith 1987,
позднее объединенных в один класс Pelobiontea Cava-
lier-Smith 1991. В состав последнего на основании на-
копившихся молекулярно филогенетических данных
были включены также энтамебы (Entamoebida), эндо-
паразитические амебоидные простейшие, обитающие
в кишечнике позвоночных животных.
Супертаксон Archezoa как группировка, предполо-
жительно объединяющая примитивных, первично ами-
тохондриальных протистов просуществовал недолго.
Необходимость в нем отпала после того как из его со-
става были исключены младшие таксоны, в отношении
представителей которых был доказан вторичный ха-
рактер утраты митохондрий (Hinkle et al., 1994; Clark,
Roger, 1995; Morin & Mignot, 1995; Cavalier-Smith,
1998). В результате проведенных таксономических
перестроек Archamoebae были помещены во вновь
созданный тип Amoebozoa, подтип Conosa (Cavalier-
Smith, 1998), который объединил в рангах инфратипов
две на первый взгляд очень разные группы протистов
Archamoebae и Mycetozoa. Однако когда архамеб и
миксомицетов стали рассматривать в контексте их ве-
роятной филогенетической общности, выяснилось, что
помимо очевидных различий они имеют немало точек
соприкосновения и не только на схемах современных
молекулярных филогений (рис. 203), но и в особенно-
стях морфофункциональной организации их клеток.
Так, представители подтипа Conosa в редких случаях
характеризуются наличием в основании жгутика оди-
ночной кинетосомы, с которой связан, во-первых, ко-
нус микротрубочек, часто ассоциированный с ядром, и,
во-вторых, латеральный микротрубочковый корешок,
прилегающий к клеточной поверхности.
Гомологичность ядерных конусов микротубочек у
Archamoebae и Mycetozoa до недавнего времени под-
вергалась сомнениям, главным образом потому, что у
миксомицетов конус микротрубочек не отходит непо-
средственно от кинетосомы, а связан с отдельным цен-
тром организации микротрубочек, который располага-
ется в основании кинетосомы. Однако новые данные
о формировании базальных кинетосомальных пучков
микротрубочек у ряда пеломикс и обнаружение на-
стоящего базального ЦОМТа микротубочек конуса у
М. aspera (рис. 200), говорят, на наш взгляд, о необо-
снованности таких сомнений.
В настоящее время монофилия группы Conosa под-
держивается результатами многочисленных молеку-
лярно-филогенетических исследований (Nikolaev et al.,
2006; Pawlowski, 2008; Pawlowski, Burki, 2009) и вы-
глядит достаточно убедительно. Также относительно
устойчивой кажется группировка Archamoebae, регу-
лярно формирующая компактный кластер на филоге-
нетических схемах Amoebozoa, реконструированных
по последовательностям различных генов (Milyutina
et al., 2001; Bapteste et al., 2002; Edgcomb et al., 2002;
Nikolaev et al., 2006; Pawlowski, 2008; Pawlowski, Burki,
2009). Однако ситуация, складывающаяся внутри груп-
пировки собственно Archamoebae, выглядит крайне
неоднозначной (рис. 203). После включения в моле-
кулярно филогенетические исследования паразитиче-
ских организмов, представителей отряда Entamoebida и
Endolimax папа, отряд Pelobiontida (Page, 1976) Griffin,
1988, представлявший, казалось, незыблемое ядро Ar-
chamoebae, оказывается парафилетической группой!
При этом общие клады формируют Mastigamoebidae и
Endolimax папа, с одной стороны, и Pelomyxidae и Ent-
amoebida — с другой.
До сего времени, монофилия пелобионтид, хорошо
поддерживалась ранними молекулярно филогенетиче-
скими исследованиями, и опиралась на целый ряд мор-
фологических признаков высокого филогенетического
уровня, характерных для пелобионтид в целом. Напро-
тив новые группировки Mastigamoebidae + Endolimax
папа и Pelomyxidae + Entamoebida — вообще лишены
поддержки с точки зрения морфологии, поскольку и
Endolimax и Entamoeba не имеют жгутиков и демон-
стрируют отличную от пелобионтид организацию
ядерного аппарата.
Таким образом, на повестку дня неожиданно
встает вопрос: существует ли такой таксон — отряд
Pelobiontida? А если существует, то каков его состав, и
какое место он занимает в Archamoebae? Еще со времен
ранних молекулярно филогенетических исследований
хорошо известны примеры того, что включение в чис-
ло объектов таких исследований новых организмов или
их групп, в ряде случаев, способно вызывать не только
модификации отдельных клад, но и влиять на архитек-
тонику филогенетической модели в целом. Поэтому
можно предположить, что современные представления
о филогенетических отношениях внутри группы Arch-
amoebae носят этапный характер, в большей степени
отражающий слабую изученность архамеб в целом,
нежели реально существующие проблемы. Вероятно,
этим замечанием можно было бы ограничиться, пред-
положив, что включение новых представителей арха-
меб в филогенетические исследования в дальнейшем
прояснит сложившуюся ситуацию. Однако это предпо-
ложение вряд ли удовлетворит читателей и совершенно
неприемлемо для автора, поскольку парафилия пело-
бионтид — это на сегодняшний день факт очевидный
(Milyutina et al., 2001; Edgcomb et al., 2002; Nikolaev et
al., 2006; Pawlowski, 2008), а в заглавие этой главы вы-
несено название таксона — отряд Pelobiontida (Page)
Griffin 1988.
Для решения этой проблемы мы хотим предло-
жить рабочую гипотезу, позволяющую с нашей точки
зрения, сохранить на данном временном отрезке за
отрядом Pelobiontida его таксономический статус, из-
бежав при этом конфликта с результатами новейших
молекулярно филогенетических исследований. Отряд
298
PELOBIONTIDA
Pelobiontida в его традиционной трактовке включает
два семейства свободноживущих амебоидных орга-
низмов Pelomyxidae и Mastigamoebidae, обитающих в
сапропелевых илах различных водоемов. Сейчас уже
нет оснований сомневаться, что пелобионтиды про-
изошли от организмов, некогда обладавших полным
набором клеточных органелл (Clark, 1999). Однако
в литературе за пелобионтидами не случайно закре-
пился статус «дегенерирующей группы протистов»
(Edgcomb et al., 2002). Регрессивный характер эво-
люции этих протистов отчетливо прослеживается в
результатах как морфологических, так и молекуляр-
но генетических исследований (Edgcomb et al., 2002).
По-видимому, предки пелобионтид утратили митохон-
дрии и диктиосомы аппарата Гольджи в процессе ос-
воения новой для них среды обитания — толщи ило-
вых отложений, в ходе адаптаций к существованию в
анаэробных условиях. Аналогичные примеры можно
без труда найти во многих группах протистов (Карпов,
2001). В общие процессы клеточного регресса ока-
зался вовлечен и их жгутиковый аппарат, тенденция к
утрате которым двигательной функции и его морфо-
логическая деструкция отчетливо прослеживаются в
связи с увеличением размеров клетки и гипертрофией
ядерного аппарата.
Возможный переход к паразитическому образу
жизни, таким образом, вполне мог осуществляться у
организмов с уже редуцированным набором клеточ-
ных органелл и в уже дивергировавших к этому вре-
мени основных ветвях пелобионтид: Pelomyxidae и
Mastigamoebidae — независимо. Если принять эти
рассуждения, то мы вполне можем рассматривать Ent-
amoebida и Endolimax папа в качестве пелобионтид, у
которых регрессивный характер эволюции клеточных
органелл оказался реализован в наиболее крайней сте-
пени, приведя, в том числе, к полной утрате жгутико-
вого аппарата. Вполне вероятно, что переход к парази-
тизму и адаптация к новой среде обитания ускорили
эти процессы. Для иллюстрации некоторого промежу-
точного состояния здесь можно привести в качестве
примера Tricholimax hylae — комменсала головастиков
ряда земноводных. Это пока единственный известный
представитель мастигамебид, у которого наблюдается
существенная редукция жгутикового аппарата, сопря-
женная с утратой жгутиком его двигательной функ-
ции.
Не сложно заметить, что предлагаемая нами гипо-
теза ставит под сомнение целесообразность использо-
вания в дальнейшем термина Archamoebae, поскольку,
по сути, он оказывается младшим синонимом названия
отряда Pelobiontida (Page 1976) Griffin 1988. Проверка
данной гипотезы связана с привлечением в качестве
объектов будущих молекулярно-филогенетических и
морфологических исследований организмов, очевидно
перспективных для понимания природы и эволюции
пелобионтид. Речь идет, в первую очередь о предста-
вителях рода Pelomyxa, обладающих полным набо-
ром микротрубочковых кинетосомальных дериватов и
аберрантных мастигамебидах, таких как: Tricholimax
hylae и Mastigina trichophora.
Систематический обзор
Отряд Pelobiontida (Раде 1976) Griffin
1988
В составе отряда выделяются два семейства: Masti-
gamoebidae Kudo 1939 и Pelomyxidae Schulze 1877. Все
Mastigamoebidae на одноядерной стадии имеют один
локомоторный жгутик, а их многоядерные стадии, как
правило, лишены жгутиков. Одноядерные стадии Pelo-
myxidae либо не имеют жгутиков, либо обладают мно-
гочисленными неподвижными жгутиками. Многоядер-
ные стадии развития пеломикс несут многочисленные
неподвижные или мало подвижные жгутики, не прини-
мающие участия в локомоции клетки.
Сем. Mastigamoebidae Kudo 1939
Мелкие, реже средней величины пелобионты, жиз-
ненный цикл которых обычно протекает с чередова-
нием одноядерных одножгутиковых и многоядерных
безжгутиковых амебоидных стадий и цист (рис. 204).
Большинство мастигамебид имеют размеры тела менее
50 мкм, жгутик при этом может достигать длины 100 и
более мкм. В основном свободноживущие гетеротро-
фы, один род представлен комменсалами, обитающими
в кишечнике амфибий, ряд видов имеют прокариотных
и/или хлорофилл содержащих эукариотных симбион-
тов.
В состав семейства входят четыре рода: Mastig-
amoeba Schulze 1875 (типовой); Mastigella Frenzel 1897;
Mastigina (Frenzel 1897) и Tricholimax Frenzel 1897.
Род Mastigamoeba Schulze 1875
S у n.: Dinamoeba Leidy 1874.
Свободноживущие мастигамебиды, трофические
стадии обладают единственным подвижным жгутиком,
основание которого перманентно соединено с поверх-
ностью ядерной оболочки за счет конуса кинетосо-
мальных микротрубочек. Полиморфный род, включа-
ющий 8 валидных видов.
Типовой вид:MastigamoebaasperaSchulze 1875.
Mastigamoeba aspera Schulze 1875
S у n.: Dinamoeba mirabilis Leidy 1874; Mastigamoe-
ba cestriensis Cash 1905; Mastigamoeba schulzei Frenzel
1897.
M. aspera — крупные мастигамебы, способные
по некоторым данным достигать в длину 600 мкм и
более. Описаны из пресных, морских водоемов и по-
чвы. Клетки часто формируют множество длинных
пальцевидных псевдоподий. Характерная черта этого
вида, наличие на поверхности клетки мощного слоя
гликокаликса, в котором обитают многочисленные па-
лочковидные симбиотические бактерии (рис. 191, Г).
Многоядерные взрослые особи, как правило, лишены
жгутика. Цисты не описаны (рис. 204, А).
PELOBIONTIDA
299
Рис. 204. Представители семейства Mastigamoebidae.
А — Mastigamoeba aspera’, Б — Mastigamoebaflexuosa’, В — Mastigamoeba longifilum', Г— Mastigamoebapunctachora; Д— Mastigamoeba simplex’, E —
Mastigamoeba schizophrenia', Ж— Mastigamoeba viridis’, 3 — Mastigina chlamys’, И— Mastigina trichophora’, К — Mastigella polymastix’, Л— Mastigella
nitens’, M— Mastigella vitrea; H— Tricholimax hylae. A — no: Schulze, 1875b; Б — no: Stokes, 1888; В— no: Stokes, 1886; Г— no: Bernard et al., 2000;
Д—no: Kent, 1880; E — no: Simpson et al., 1997; Ж—no: Skuja, 1956; 3—no: Frenzel, 1897; И—no: Lauterbom, 1901; A"—no: Frenzel, 1897;J7—no:
Penard, 1909; M— no: Goldschmidt, 1907a; H— no: Frenzel, 1897.
300
PELOBIONTIDA
Mastigamoeba flexuosa Stokes 1888
Длина клеток может достигать 160 мкм. Ядро ло-
кализовано в переднем конце и связано с основанием
жгутика. На поверхности присутствуют пальцевидные
псевдоподии. Обитает в пресных водоемах, вид изве-
стен только по первоописанию (рис. 204, Б).
Mastigamoeba longifilum Stokes 1886
Syn.: Mastigamoeba balamuthi (Chavez et al. 1986)
Simpson et al. 1997; bas.: Phreatamoeba balamuthi} Mas-
tigamoeba buetschlii Klebs 1892; Mastigamoeba eugle-
noides Skuja 1939; Mastigamoeba invertens Klebs 1892;
Mastigamoeba lacustris (Penard 1909) Lemmermann
1914; bas.: Mastigina lacustris Penard 1909; Mastigamoe-
ba lobata (Dujardin 1841) Butschli 1884; Mastigamoeba
psammobia Larsen et Patterson 1990; Mastigamoeba
pachyderma Skuja 1948; Mastigamoebaparamylon (Fren-
zel 1897) Lemmermann 1914; Mastigamoeba ramulosa
Kent 1880; Mastigamoeba reptans Stokes 1890; Mastig-
amoeba skujae Larsen et Patterson 1990; Mastigamoeba
torulosa Skuja 1956; Mastigamoeba volutans Lackey
1923; Mastiginaparamylon Frenzel 1897.
Длина клеток этого вида широко варьирует в пре-
делах от 6 до 100 мкм. Обитает в различных типах
пресных водоемов. Поверхность тела всегда покры-
та многочисленными полиморфными псевдоподия-
ми. Описаны безжгутиковые многоядерные стадии и
цисты. Ядра пузырьковидные. Жгутик обычно очень
длинный, может превышать длину тела в 5 и более раз.
Основание кинетосомы тесно прилегает к поверхности
ядра (рис. 204, В).
Mastigamoeba punctachora Bernard,
Simpson et Patterson 2000
Клетки длиной от 5 до 90 мкм. Характерный при-
знак наличие внутри ядра оптически плотной гранулы,
прилегающей к ядрышку со стороны, обращенной к
заднему концу клетки. Длина жгутика примерно рав-
на длине тела. Безжгутиковые стадии имеют до 8 ядер.
Обитают в илах пресных водоемов (рис. 204, Г).
Mastigamoeba schizophrenia Simpson, Bernard,
Fenchel et Patterson 1997
Эти мастигамебы обладают жизненным циклом,
в котором представлены жгутиковые формы, безжгу-
тиковые многоядерные амебы и цисты. Характерный
признак М. schizophrenia наличие спаренных ядер на
всех стадиях развития. Мелкие мастигамебы с длиной
тела не превышающей 25 мкм, жгутик в 3 и более раз
превосходит длину тела. Многоядерные формы имеют
до 5 пар ядер. Цисты 10 мкм в диаметре. Обитают в
морских илах (рис. 204, Е).
Mastigamoeba simplex Kent 1880
Syn.: Mastigamoeba auriculata Penard 1909; Masti-
gella penardii Lemmermann 1914; Mastigamoeba scholaia
Klug 1936; Mastigamoeba steinii Klug 1936.
Среднего размера мастигамебы, достигающие в
длину 40 мкм. Свободная часть жгутика вдвое превы-
шает длину тела. Имеется сократительная вакуоль. По-
верхность гладкая, изредка формирует тонкие псевдо-
подии. Передняя часть ядра вытянута по направлению
к основанию жгутика. В цитоплазме имеются плотные
окруженные двумя мембранами микротельца. Обитают
в илах пресных водоемов (рис. 204, Д).
Mastigamoeba viridis Prowazek 1900
Syn.: Mastigamoeba retrograda Skuja 1956; Mastig-
amoeba chlorelligera Calaway et Lackey 1962.
Мастигамебы средней величины, длина локомо-
торных форм достигает 30-50 мкм. Поверхность часто
формирует тонкие псевдоподии. В цитоплазме обита-
ют зоохлореллы, вследствие чего амебы окрашены в
зеленый или золотисто-зеленый цвет (рис. 204, Ж).
Род Mastigina (Frenzel 1897) emend. Frolov
Мастигамебиды, поверхность которых покрыта ор-
ганическими чешуйками и спикулами. Ядро подобно
представителям рода Mastigamoeba перманентно свя-
зано с конусом кинетосомальных микротрубочек.
Типовой вид Mastigina chlamys Frenzel 1897.
Mastigina chlamys Frenzel 1897
Syn.: Mastigamoeba chlamys (Frenzel 1897) Lemmer-
mann 1914.
Мастигамебиды среднего размера от 15 до 75 мкм.
Цисты, многоядерные и безжгутиковые стадии не-
известны. Сократительная вакуоль имеется. Жгутик
примерно вдвое короче длины тела. Поверхность по-
крыта плотной щетиной из коротких спикул. Известны
из пресных водоемов. Ультраструктура не исследована
(рис. 204, 3).
Mastigina trichophora (Lauterborn 1901) comb. n.
Syn.: Mastigamoeba trichophora Lauterborn 1901;
Mastigamoeba pilosa (Cash 1905); Amoeba pilosa Cash
1905; Mastigella radiosa Lackey 1932; Mastigamoeba se-
tosa (Goldschmidt 1907), Lemmermann 1914; Mastigina
setosa Goldschmidt 1907; Mastigella andiras Skvortzkov
et Noda 1976; Mastigella sudzuki Skvortzkov et Noda
1976.
Крупные мастигамебиды, достигающие в длину
200 мкм, обладающие жгутиком, равным или превы-
шающим длину тела клетки (рис. 204, И). Поверхность
несет длинные спикулы, основания которых лежат в
ладьевидных чешуйках покрывающих плазмалемму
клеток (рис. 191, Д Е). При движении характерны фон-
танирующие токи цитоплазмы и эруптивный тип фор-
мирования псевдоподий.
Род Mastigella Frenzel 1897
Syn.: Limulina Frenzel 1897; Mastigamoebula Fan-
tham 1919; Micromastix Frenzel 1897.
PELOBIONTIDA
301
Мастигамебиды, на трофической стадии жизнен-
ного цикла обладающие единственным подвижным
жгутиком. Конус кинетосомальных микротрубочек не
связан с поверхностью ядерной оболочки. В цитоплаз-
ме ряда видов обнаружены прокариотные цитобионты.
Типовой вид:MastigellapolymastixFrenzel 1897.
Mastigella polymastix Frenzel 1897
Syn.: Limulina unica Frenzel 1897; Mastigella unica
(Frenzel 1897) Goldschmidt 1907; Mastigamoeba com-
mutans Meyer 1897; Mastigella commutans (Meyer 1897)
Goldschmidt 1907; Mastigamoebula africana Fantham
1919; Mastigella januarii (Frenzel 1897) Lemmermann
1914; Micromastix januarii Frenzel 1897.
Локомоторные формы могут достигать в длину
80 мкм. Жгутик обычно вдвое длиннее тела клетки. Ха-
рактерно наличие множества полиморфных псевдопо-
дий. В цитоплазме присутствуют метаногенные бакте-
рии. Описаны из илов пресных водоемов (рис. 204, К).
Mastigella nitens Penard 1909
Syn.: Mastigamoeba giganthea Prowazek 1913; Mas-
tigamoeba gigantea Klug 1936; Mastigamoeba gigantoi-
dea Lepsi 1965.
Крупные мастигеллы округлой формы, диаметр
клеток может достигать 200 мкм, жгутик 100-200 мкм.
Потревоженные клетки легко утрачивают жгутик. По-
верхность формирует «корону» из массивных гиали-
новых псевдоподий. Ядро с многочисленными ядрыш-
ками, расположенными по периферии. В цитоплазме
присутствуют эндосимбиотические бактерии двух ви-
дов: крупные с продольным впячиванием клеточной
стенки и мелкие палочковидные метаногены. Описаны
цисты. Обитают в различных типах пресных водоемов
(рис. 204, Л).
Mastigella vitrea Goldschmidt 1907
Крупные мастигеллы, длина клеток достигает
120 мкм, жгутик в два раза короче. В цитоплазме оби-
тают палочковидные метаногенные бактерии. Склон-
ны к формированию полиморфных псевдоподий
(рис. 204, М).
Род Tricholimax Frenzel 1897
Пелобионты с одним неподвижным коротким жгу-
тиком. Кинетосома соединена с ядерной оболочкой ко-
нусом микротрубочек. Известны многоядерные стадии
и цисты. Коменсалы кишечника амфибий. Единствен-
ный вид Tricholimax hylae Frenzel 1897.
Tricholimax hylae Frenzel 1897
Syn.: Mastigina hylae Goldschmidt 1907; Mastig-
amoeba hylae Lemmermann 1914.
Крупные до 150 мкм в длину амебы, обитающие
в кишечнике ряда амфибий. Формируют 4-ядерные
цисты. В цитоплазме зрелых трофозоитов могут при-
сутствовать до 6 ядер, каждое из которых соединено со
своей дочерней кинетосомой. Однако только один ка-
риомастигонт обладает жгутиком, выходящим за пре-
делы клетки. Аксонема жгутика имеет нестабильный
набор микротрубочек (рис. 204, Н).
Примечание. В 2006 году Волкер с коллегами (Walker
et al., 2006) использовали забытое видовое название Tricholi-
max hylae Frenzel 1897 вместо широко употребимого названия
Mastigina hylae Goldschmidt 1907, ссылаясь на неопределенный
диагноз рода Mastigina Frenzel 1897, который не позволяет
различать представителей родов Mastigina и Mastigamoeba.
Гольдшмидт, переведя Т. hylae в род Mastigina и упразднив
род Tricholimax Frenzel 1897, в качестве ключевого признака
рода Mastigina рассматривал наличие фонтанирующих токов
цитоплазмы на переднем конце клетки и отсутствие псевдоподий
у этих мастигамебид (Goldschmidt, 1907). Однако эти признаки
не фигурировали в оригинальном описании Френзеля (Fren-
zel, 1897), в котором автор делал основной упор на необычное
строение покровов у типового вида Mastigina chlamys Frenzel
1897. В данной работе мы уточняем диагноз рода Mastigina
(Frenzel, 1897), оставляя в его составе только тех мастигамебид,
покровы которых подобно М. chlamys Frenzel 1897 включают
элементы наружного скелета — чешуйки и спикулы. При этом
мы разделяем точку зрения Волкер с коллегами о необходимости
возврата прежнего родового названия организму Tricholimax hy-
lae Frenzel 1897.
Сем. Pelomyxidae Schulze 1877
В это семейство включены пелобионты, много-
ядерные стадии которых характеризуются наличием
многочисленных неподвижных или малоподвижных
жгутиков. Аксонемы жгутиков пеломикс имеют не-
стабильное число микротрубочек всегда отличное от
9x2+2. Для пеломиксид, типично чередование в жиз-
ненном цикле одноядерных (или стадий с небольшим
количеством ядер) и многоядерных стадий. Стадия ци-
сты найдена только у одного вида — Р palustris. Типо-
вой род — Pelomyxa Greeff 1874.
Род Pelomyxa Greeff 1874
Syn.: Pelobius Greeff 1870.
Крупные и средней величины моноподиальные
амебы, обладающие многочисленными малоподвижны-
ми или неподвижными жгутиками. Для большинства
видов характерно наличие в цитоплазме структурных
вакуолей, гликогеновых зерен и прокариотных цитоби-
онтов. Видовое разнообразие изучено недостаточно.
Типовой вид: Pelomyxapalustris Greeff 1874.
Pelomyxa palustris Greeff 1874
Syn.: Amoeba lucida Gruber 1884; Amoeba spinosa
Hollande 1945; Pelomyxa caulleryi Hollande et Guilcher
1945; Pelomyxa fragilis Penard 1904; Pelomyxa greeffi
Blochmann 1894; Pelomyxa lucida Penard 1902; Pelo-
myxa parvialveolata Korotnneff 1879; Pelomyxa villosa
Leidy 1879; Pelomyxa viridis Bourne 1891; Pelomyxa vi-
vipara Penard 1902.
P. palustris (рис. 205, A) — гигантская, достигающая
в длину 5мм, многоядерная амеба. Цитоплазма обычно
серая, пенистая, пространство между структурными и
302
PELOBIONTIDA
пищеварительными вакуолями заполнено многочис-
ленными ядрами, прокариотными цитобионтами, зер-
нами гликогена Прокариотные цитобионты — палоч-
ковидные бактерии трех видов: крупные с продольной
бороздкой (англ, cleaft), иногда достигающей уровня
середины клетки, и более мелкие грамположительные
и грамотрицательные бактерии. По крайней мере, два
из трех видов прокариотных эндобионтов, обнаружен-
ных у Р palustris. представляют собой метаногены.
Пищевая специализация у Р palustris не выражена, пи-
щеварительные вакуоли всегда содержат значительное
количество минеральных частиц. Ядра гранулярного
типа, их количество у зрелых трофозоитов достигает
100 и более штук на клетку. Многочисленные жгути-
ки неподвижны. Базальный аппарат жгутика сильно
редуцирован. Жизненный цикл характеризуется выра-
женной сезонной синхронизацией и наличием стадии
четырехядерной цисты. Обитают в постоянных, слабо-
проточных и стоячих водоемах, в илах на глубине до
1,5 м.
Pelomyxa belevskii Penard 1893
Клетки малоподвижные, как правило, овальной
формы, достигают в длину 500 мкм и более. Гиалоплаз-
ма хорошо выражена, поверхность покрыта множе-
ством коротких псевдоподий. Цитоплазма прозрачная.
В ней всегда обнаруживаются крупные (обычно 2-3)
фрагменты останков сосудистых растений, лежащие
в гипертрофированных пищеварительных вакуолях,
диаметр которых может достигать 2/3 диаметра клетки.
Молодые клетки содержат 2-8 ядер. Зрелые особи со-
держат более 60 ядер, их цитоплазма, заполненная мел-
кими гранулами гликогена, утрачивает прозрачность.
Эндосимбионты представлены видами: крупными и
мелкими палочковидными бактериями. Перед плазмо-
томией содержимое пищеварительных вакуолей вы-
водится наружу. Обитают в водоемах бедных водной
растительностью на небольшой глубине, обычны в бе-
реговой зоне озер. Ультраструктура неизучена.
Pelomyxa binucleata (GrCiber 1884) Penard 1893
S у n.: Amoeba binucleata Gruber 1884.
Подвижные клетки достигают в длину 400-450 мкм.
На переднем конце тела в процессе движения формиру-
ется лишь узкая зона гиалоплазмы. Латеральные псев-
доподии отсутствуют. Уроид небольшой, при движении
часто обращен к субстрату. Жгутики многочисленные,
слабо подвижны. Цитоплазма прозрачная, окрашена в
зеленый цвет благодаря наличию в пищеварительных
вакуолях многочисленных хлорофилл содержащих
организмов. Количество структурных вакуолей незна-
чительно. У взрослых особей Р binucleata цитоплазма
содержит относительно небольшое количество глико-
геновых телец, имеющих правильную сферическую
форму, гладкую поверхность и достигающих в диаме-
тре 10—15 мкм. В цитоплазме многочисленны крупные
липидные капли.
Эктоплазма четко выражена, содержит сеть тонких
фибрилл и отделена от эндоплазмы пограничным сло-
ем цистерн и каналов ретикулума. Симбионты — па-
лочковидные бактерии двух видов, крупные с продоль-
ной бороздкой и тонкие грамположительные бактерии.
Длина тех и других может достигать 30 мкм и более.
Ядерная оболочка несет на наружной поверхности
мультиламеллярный слой. Ядрышко фрагментировано
и располагается в центре ядра. В жизненном цикле про-
исходит чередование одноядерных и двуядерных ста-
дий. В водоемах Северо-Запада России первые обычно
встречаются с сентября по март, вторые с февраля по
август. Р binucleata (рис. 205, Б) обитают практически
в любых типах стоячих и слабо проточных водоемов с
достаточным уровнем прибрежных иловых отложений.
Особенно многочисленны эти амебы в местах богатых
водной растительностью, на небольших глубинах от 10
до 60 см.
Pelomyxa corona Frolov, Goodkov et Chystjakova 2004
Пеломиксы среднего и крупного размера. В жиз-
ненном цикле известны только крупные многоядерные
стадии и мелкие амебки со случайным набором неболь-
шого числа ядер. Диаметр молодых особей 50-70 мкм,
крупные пеломиксы достигают в длину 300-500 мкм.
Малоподвижные, обычно сферической формы с хоро-
шо выраженной гиалоплазмой (рис. 205, В). Радиаль-
но расходящиеся гиалиновые псевдоподии различной
формы обычно уплощенные, часто раздвоенные на
конце. При движении формируют мощную гиалинову
лобоподию, уроид представлен множеством гиали-
новых билли. В эндоплазме в большом количестве и
примерно в равном соотношении представлены 3 вида
эндосимбиотических бактерий. Два из них, крупные
бактерии с выраженной продольной бороздкой и более
мелкие палочковидные бактерии, лежат в индивиду-
альных вакуолях, мембраны которых довольно тесно
прилегают к их поверхности. Третий вид — овальные,
крупные бактерии свободно располагаются в больших
вакуолях по 2, 3 особи в каждой. Гликогеновые тела,
достигающие в диаметре 1 мкм, имеют неправильную
форму, складчатую поверхность и окружены многочис-
ленными каналами эндоплазматического ретикулума.
Ядра гранулярного типа, до 100 и более у зрелых тро-
фозоитов. Жгутики не обнаружены, хотя в цитоплазме
встречаются отдельные пучки микротрубочек. Обитает
в илах, в небольших водоемах заросших растительно-
стью, в сфагновых болотах.
Pelomyxa flava Frolov, Malysheva et
Chystjakova 2010
Подвижные пеломиксы с цилиндрической фор-
мой тела. Цитоплазма прозрачная, за счет включений
окрашена в интенсивно желтый или желто-зеленый
цвет. Система структурных вакуолей не развита. В ци-
топлазме преобладают липидные капли, единичные
гликогеновые зерна имеют неправильную форму. Раз-
мер клеток от 100 (молодые особи) до 300 мкм (взрос-
лые локомоторные формы). Гиалоплазма не выражена.
В жизненном цикле преобладает двуядерная стадия,
плазмотомия происходит на четырехядерной стадии.
PELOBIONTIDA
303
A
Д
Рис. 205. Представители семейства Pelomyxidae.
А — Pelomyxa palustris; Б — Pelomyxa binucleata; В — Pelomyxa corona; Г— Pelomyxa gruberi; Д — Pelomyxa prima; E — Pelomyxa tertia. A — no:
Greeff, 1874; Б— no: Gruber, 1884; В — no: Frolov et al., 2004; Г— no: Frolov et aL, 2006; Д— no: Gruber, 1884; E — no: Gruber, 1884.
304
PELOBIONTIDA
Ядра гранулярного типа, фрагментированный матери-
ал ядрышка располагается по периферии ядра. На всех
стадиях цикла оболочка ядра окружена микротрубоч-
ками, расположенными в 1 ряд. Жгутики неподвиж-
ные. В основании жгутика находится длинная полая
кинетосома с выраженным центральным филаментом.
Ее длина может достигать 0,9 мкм. Эндоцитобионты
представлены крупными палочковидными бактериями
с выраженной продольной бороздкой и двумя видами
более мелких палочковидных бактерий. Р flava обита-
ют в заболачиваемых стоячих и слабо проточных, пре-
сных водоемах на глубине 20-50 см. Питаются главным
образом одноклеточными водорослями. В пищевари-
тельных вакуолях особенно многочисленны представи-
тели хлорофитовых и ксантофитовых.
Pelomyxa gruberi Frolov, Goodkov, Chystjakova et
Skarlato 2006
Пеломиксы с округлой (питающиеся стадии) или
цилиндрической (локомоторные стадии) формой тела.
При движении формируют выраженную гиалино-
вую лобоподию с пальцевидными субпсевдоподиями
(рис. 205, Г). Размер клеток от 80 (молодые одноядер-
ные особи) до 350 мкм (многоядерные локомоторные
формы). В жизненном цикле чередуются фаза роста
одноядерных амеб, фаза формирования многоядер-
ных амеб и фаза плазмотомии. По продолжительности
преобладающей является стадия одноядерных амеб.
Цитоплазма четко дифференцируется на экто- и эндо-
плазму. Структурные вакуоли отсутствуют или край-
не немногочисленны, гликогеновые зерна и липидные
капли отсутствуют. Ядра от 1 до 32, пузырьковидные
с одним центральным ядрышком; на всех стадиях цик-
ла оболочка ядра окружена микротрубочками. Жгути-
ки неподвижные. В переходной зоне жгутика имеется
переходный цилиндр. Кинетосома длинная, может до-
стигать 1 мкм и более. Эндосимбиоты представлены
крупными палочковидными бактериями с выраженной
продольной бороздкой и более мелкими палочковид-
ными метаногенами. Обитают в илах прибрежной зоны
стоячих и слабо проточных пресных водоемов на глу-
бине 5-70 см. Питаются мелкими частицами детрита в
основном растительного происхождения, минеральные
включения в цитоплазме встречаются нерегулярно.
Окраска цитоплазмы в зависимости от преобладающих
пищевых включений от светло-бежевой до темно ко-
ричневой.
Pelomyxa stagnalis Chystjakova, Frolov 2010
Крупные многоядерные пеломиксы, длина локомо-
торных форм может превышать 800 мкм. Форма клет-
ки овальная или грушевидная, уроид, если он выра-
жен, имеет бульбовидную форму. При движении токи
цитоплазмы равномерные, фонтанирующее движение
цитоплазмы на переднем конце клетки не выражено.
Преимущественная окраска цитоплазмы зеленовато-
коричневая. Цитоплазма сильно вакуолизирована. Гли-
когеновые тельца округлой формы имеют мелкозерни-
стую структуру. Количество ядер в клетке 30-50. Ядра
округлые, размер ядер 25-30 мкм, часто окружены
оптически плотными гранулами. Ядрышко централь-
ное, чаще цельное, округлое, иногда, состоящее из 2-3
долей неправильной формы. В цитоплазме встречается
два вида палочковидных бактериальных эндобионтов.
Кинетосома короткая. Жгутики локализованы преиму-
щественно в уроидальной зоне. Обитают в илах при-
брежной зоны стоячих и слабо проточных, пресных
водоемов и в сфагновых болотах. Питаются мелкими
частицами детрита в основном растительного про-
исхождения, минеральные включения в цитоплазме
встречаются нерегулярно.
Pelomyxa prima (Gruber 1884) Penard 1902
S у n.: Amoebaprima Gruber 1884.
Клетки P prima имеют характерную каплевидную
форму тела и достигают длины 550 мкм. Цитоплазма
заполнена множеством структурных вакуолей, выгля-
дит «пенистой», что является характерной чертой этого
вида. В клетках Р prima постоянно присутствуют два
вида прокариотных эндоцитобионтов: мелкие палоч-
ковидные бактерии и крупные, с глубоким щелевид-
ным впячиванием оболочки. Ядра пузырьковидные, их
количество в крупных клетках исчисляется сотнями.
Жгутики неподвижные, выявляются по всей поверх-
ности клетки, но наиболее многочисленны на заднем
ее конце в уроидальной зоне. Основания жгутиков глу-
боко погружены в цитоплазму. Длина кинетосом до-
стигает 0,7 мкм. Пищевая специализация не выявлена,
в цитоплазме обнаруживается довольно характерный,
в частности, для Pelomyxa palustris набор из домиков
диатомей и тестаций, спор хвойных растений и мине-
ральных включений. Обитают в илах стоячих водоемов
с твердым песчаным дном (рис. 205, Д).
Pelomyxa tertia (Gruber 1884) Penard 1902
S у n.: Amoeba tertia Gruber 1884.
Известны только многоядерные стадии жизненно-
го цикла Р tertia. В малоподвижном состоянии клет-
ки Р tertia имеют округлую или грушевидную фор-
му и обычно не превышают в диаметре 120-150 мкм
(рис. 205, Е). При направленном движении вытяги-
ваются, достигая в длину 200-220 мкм. Гиалоплаз-
ма в клетках Р tertia не выражена. Многочисленные
жгутики неподвижны. Бульбовидный уроид, несущий
короткие гиалиновые билли, характерен для клеток,
осуществляющих направленное движение. Для кле-
ток пребывающих в состоянии относительного покоя
типичным является его отсутствие и формирование в
уроидальной зоне плотной щетки из длинных тонких
билли. Цитоплазма Р tertia окрашена в темный желто-
коричневый цвет, она содержит множество светопре-
ломляющих гранул, структурных и пищеварительных
вакуолей. В последних преобладают одноклеточные
водоросли и мелкие минеральные включения. Ядра
диаметром 17-19 мкм, в количестве от 2 до 12, свобод-
но перемещаются с токами цитоплазмы. Уникальной
чертой организации ядер Р tertia является отсутствие
выраженных компактных ядрышек и локализация мел-
PELOBIONTIDA
305
козернистого материала у внутренней поверхности
ядерной оболочки в виде своеобразных валиков. Жгу-
тики Р tertia неподвижны, особенно многочисленны
в уроидальной зоне, где часто локализуются между
гиалиновыми билли. Кинетосома достигает в длину
0,6 мкм. Р tertia наиболее многочисленны в сильно за-
росших водоемах с песчаным дном, где встречаются на
глубине до 1,5-2 м.
SUMMARY
The representatives of Pelobiontida order (Page 1976) Griffin
1988 are mostly free-living micro-and anaerobic amoeboid protists
possessing flagella. Pelobionts live in fresh and marine waters, a
number of species are known to be discovered in the soil, and a few
species are endocommensal of vertebrates. Pelobionts have a set of
similar and highly unusual features in their cellular organization:
their cells are devoid of mitochondria and Golgi dictyosomes, their
flagella have a single unpaired kinetosome, and nutrient supplies are
accumulated in the form of lipid droplets and glycogen granules.
The presence of prokaryotic endobionts in the cytoplasm is common
for many pelobionts. Pelobiontida order (Page 1976) Griffin 1988,
includes two families: Mastigamoebidae Kudo 1939 and Pelomyxidae
Schulze 1877. Presently, there are 5 genera and about 25 species of
pelobionts are known. The chapter examines in detail the current
data on the morphology and life cycles of pelobionts; taxonomy and
phylogeny issues of the representatives of the order are considered.
ЛИТЕРАТУРА
Гудков A.B. 1989. Ультраструктура гигантской амебы Pelomyxa
palustris. I. Цитоплазматические микротрубочки, субцентриоли и жгути-
ки. Сравнительно-морфологический анализ организации И Цитология.
T. 31.С. 371-379.
Гудков А.В., Серавин Л.Н. 1991а. Новое представление о приро-
де «гигантской амебы» Pelomyxa palustris', положение этого организма
в системе низших эукариот (Peloflagellata classis n.) // Зоол. журн. T. 70.
С. 5-16.
Гудков А.В., Серавин Л.Н. 19916. Ультраструктура гигантской
амебы Pelomyxa palustris. III. Вакуолярная система: ее природа, органи-
зация и функциональное значение // Цитология. Т. 33. С. 17-25.
Гудков А.В., Серавин Л.Н. 2000. Класс Peloflagellatea И А.Ф. Али-
мов (ред.). Протисты. 4. 1. (Руководство по зоологии). СПб.: Наука.
С. 508-516.
Гудков А.В., Чистякова Л.В., Серавин Л.Н., Фролов А.О. 2004.
Краткая история и современное состояние концепции пелобионтов
(Класс Peloflagellatea) // Зоол. журн. Т. 83. С. 643-654.
Карпов С.А. 2001. Строение клетки протистов. СПб.: ТЕССА. 384 с.
Карпов С.А., Мыльников А.П. 1989. Биология и ультраструктура
бесцветных жгутиконосцев Apusomonadida ord. n. И Зоол. журн. Т. 68.
С. 5-17.
Маргелис Л. 1983. Роль симбиоза в эволюции клетки. М.: Мир.
352 с.
Мыльников А.П. 1989. Корешковая система жгутиконосцев цер-
комонадид // Информ, бюлл. Ин-та биологии внутренних вод. Л.: Наука.
С.52-54.
Серавин Л.Н. 1967. Двигательные системы простейших. Л.: Нау-
ка. 332 с.
Серавин Л.Н. 1985. Вариации в строении аксонемы жгутика и про-
исхождение этой органеллы // Цитология. Т. 9. С. 971-985.
Серавин Л.Н. 1992. Эукариоты, лишенные важнейших клеточных
органелл (жгутиков, аппарата Гольджи, митохондрий), и главная задача
органеллологии // Цитология. Т. 35. С. 3-33.
Серавин Л.Н., Гудков А.В. 1987а. Жгутики пресноводной амебы
Pelomyxa palustris И Цитология. Т. 29. С. 721-724.
Серавин Л.Н., Гудков А.В. 19876. Цитоплазматические гранулы,
подобные микротельцам, у амебы Pelomyxa palustris И Цитология. Т. 29.
С. 600-603.
Серавин Л.Н., Гудков А.В. 1987в. Особенности организации цито-
скелета у амебы Pelomyxapalustris // Цитология. Т. 29. С. 835-837.
Серавин Л.Н., Гудков А.В. 1987г. Аппарат Гольджи у амебы
Pelomyxapalustris // Докл. АН СССР. Т. 296. С. 249-250.
Фролов А.О., Гудков А.В., Чистякова Л.В., Малышева М.Н.
2005. Свето- и электронно-микроскопическое исследования Pelomyxa
prima Gruber, 1884 (Pelobiontida) // Цитология. T. 47. С. 89-99.
Фролов А.О., Чистякова Л.В., Малышева М.Н., Гудков А.В.
2007. Морфологическое исследование цист Pelomyxa palustris И Цито-
логия. Т. 49. С. 642-651.
Фролов А., Чистякова Л., Малышева М. 2010. Свето- и электрон-
но-микроскопическое исследования Pelomyxa flava sp. n. (Archamoebae,
Pelobiontida) И Цитология. T. 52. C. 776-784.
Чистякова Л., Фролов A. 2010. Свето- и электронно-микроскопи-
ческое исследования Pelomyxa stagnalis sp. n. (Archamoebae, Pelobion-
tida)// Цитология. T. 52. C. 451-458.
Ширкина Н.И., Селиванова Г.В. 1982. Особенности жизненно-
го цикла бесцветного жгутиконосца Thaumatomonas lauterborni (Kine-
toplastida, Thaumatomonadidae) 11 Зоол. журн. T. 61. С. 929-933.
Andresen N. 1956. Cytological investigations of the giant amoeba Cha-
os chaos H L. Comp. Rend. Trav. Lab. Carlsberg. Vol. 29. P. 435-555.
Andresen N. 1973. General morphology // K.W. Jeon (ed.). The Biol-
ogy of Amoeba. New York, London: Academic Press. P. 99-123.
Andresen N., Chapman-Andresen C., Nilsson J.R. 1968. The fine
structure of Pelomyxa palustris 11 Compt. Rend. Trav. Labor. Carlsberg, Ser.
chim. Vol. 36. P. 285-320.
Bapteste E., Brinkmann H., Lee J.A., Moore D.V., Sensen C.W.,
Gordon P. 2002. The analysis of 100 genes supports the grouping of three
highly divergent amoebae: Dictyostelium, Entamoeba and Mastigamoeba H
PNAS. Vol. 99. P. 1414-1419.
Becker E.R. 1924. The morphology of Mastigina hylae (Frenzel) from
the intestine of the tedpole // J. Parasitol. Vol. 10. P. 213-216.
Becker E.R. 1928. Streaming and polarity in Mastigina hylae (Fren-
zel)//Biol. Bui. Vol. 54. P. 109-116.
Bernard C., Simpson A.G.B., Patterson D.J. 2000. Some free-li-
ving flagellates (Protista) from axonic habitats // Ophelia. Vol. 52. P. ИЗ-
142.
Blochmann F. 1894. Kleine Mitteilungen uber Protczoen // Biol.
Zentralbl. Bd 14. S. 82-91.
Bourne A.G. 1891. On Pelomyxa viridis sp. n. and on the vesicular na-
ture of protoplasm H Quart. J. Microsc. Sci. Vol. 32. P. 257-374.
Bovee E.C. 1985. Class Lobosea Carpenter, 1861 11 J. J. Lee, S.H. Hut-
ner, E.C. Bovee (eds). An illustrated guide to the Protozoa. Lawrence: Allen
Press. P. 158-211.
Brugerolle G. 1982. Caracteres ultrastructuraux d’une mastigamibe:
Mastigina hylae (Frenzel) // Protistologica. Vol. 18. P. 227-235.
Brugerolle G. 1991a. Flagella and cytoskeletal systems in amitochon-
drial flagellates: Archamoeba, Metamonada and Parabasalia // Protoplasma.
Vol. 164. P. 70-90.
Brugerolle G. 1991b. Cell organization in free-living amitochondriate
heterotrophic flagellates // D. J. Patterson, J. Larsen (eds). The biology of free-
living heterotrophic flagellates. Oxford: Clarendon Press. P. 133-148.
Brugerolle G. 1993. Evolution and diversity of amitochondrial zoofla-
gellates H J. Euk. Microbiol. Vol. 40. P. 616-618.
Brugerolle G., Muller M. 2000. Amitochondriate flagellates // B.S.C.
Leadbeater, J.C. Green (eds). The flagellates. Unity, diversity and evolution.
The Systematics Association special volume series 59. London, New York:
Taylor and Francis Publ. P. 166-189.
Brugerolle G., Patterson D. 2000. Order Pelobiontida Page, 1976 H J.J.
Lee, G.F. Leedale and P. Bradbury (eds). An Illustrated Guide to the Protozoa.
V II. Lawrence: Allen Press. P. 1097-1103.
Biitschli O. 1884. Protozoa. Erster Band. Zweiter Abtheilung: Masti-
gophora // H.G. Bronn (ed.). Die Klassen und Ordnungen des Thier-Reichs,
wissenschaftlich dargestellt in Wort und Bild. S. 617-872.
306
PELOBIONTIDA
Calaway W.T., and Lackey J.B. 1962. Waste treatment protozoa. Flag-
ellata // Florida Engineering. Series No. 3. College of Engineering, University
of Florida, Gainesville. P. 1-140.
Cash J. 1905. The British Freshwater Rhizopoda and Heliozoa. Ray
Society, London. Vol. 1. P. 1-150.
Cavalier-Smith T. 1983. A 6-kingdom classification and a unified phy-
logeny 11W. Schwemmler, H.E.A. Schenk (eds). Endocytobiology II. Berlin:
W. de Gruyter. P. 1027-1034.
Cavalier-Smith T. 1987. The origin of cells: a symbiosis between
genes, catalysis, and membranes // Cold Spring Harbor Symp. Quant. Biol.
Vol. 52. P. 805-824.
Cavalier-Smith T. 1991. Archamoebae: the ancestral eukaryotes? //
BioSystems. Vol. 25. P. 25-38.
Cavalier-Smith T. 1993. Kingdom Protozoa and its 18 phyla // Micro-
biol. Rev. Vol. 57. P. 953-994.
Cavalier-Smith T. 1998. A revised six-kingdom system of life // Biol.
Rev. Vol. 73. P. 203-266.
Chapman-Andresen C. 1978. The life cycle of Pelomyxapalustris // J.
Protozool. Vol. 25. P. 42A.
Chapman-Andresen C. 1982. Identification of Pelomyxa binucleata as
a stage in the life cycle of P palustris 11 J. Protozool. Vol. 9. P. 99-500.
Chapman-Andresen C., Hamburger K. 1981. Respiratory studies of
the giant amoeba Pelomyxa palustris 11 J. Protozool. Vol. 8. P. 33-440.
Chavez L.A., Balamuth W., Gong T. 1986. A light and electron mi-
croscopical study of a new, polymorphic free-living amoeba, Phreatamoeba
balamuthi n. g., n. sp. // J. Protozool. Vol. 3. P. 97-404.
Clark C.G. 1999. The effect of secondary loss on our views of eukary-
otic evolution H Biol. Bui. Vol. 96. P. 85-388.
Clark C.G., Roger A.G. 1995. Direct evidence for secondary loss of
mitochondria in Entamoeba histolytica // Proc. Natl. Acad. Sci. USA. Vol. 2.
P. 518-6521.
Corliss J.O. 1984. The kingdom Protista and its 45 phyla // BioSystems.
Vol. 7. P. 7-126.
Daniels E.W. 1973. Ultrastructure // K.W. Jeon (ed.). The biology of
Amoeba. New York, London: Academic Press. P. 125-169.
Daniels E.W., Breyer E.P. 1967. Ultrastructure of the giant amoeba
Pelomyxa palustris 11 J. Protozool. Vol. 14. P. 167-179.
Daniels E.W., Breyer E.P., Kudo R.R. 1966. Pelomyxa palustris
Greeff. 2. Its ultrastructure // Z. Zellforsch. Vol. 73. P. 367-383.
Daniels E.W., Pappas G.D. 1986. Reproduction in the giant amoeba,
Pelomyxa palustris 11 Cell Biol. Int. Rep. Vol. 10. P. 221.
Daniels E.W., Pappas G.D. 1994. Reproduction of nuclei in Pelomyxa
palustris 11 Cell Biol. Int. Rep. Vol. 18. P. 805-812.
de Groot A.A. 1936. Einige Beobachtungen an Dinamoeba mirabilis
Leidy //Arch. Protistenk. Bd 87. S. 427-436.
Doflein F., Reichenow E. 1928. Lehrbuch der Protozoenkunde. (1)
Mastigophoren und Rhizopoden. Jena: Verlag von Gustav Fisher. S. 437-
864.
Doflein E, Reichenow E. 1952. Lehrbuch der Protozoenkunde. Eine
Darstellung der Naturgeschichte der Protozoen mit besonderer Berficksich-
tigung der parasitischen und pathogenen Formen. Zweiter Teil: Spezielle
Naturgeschichte der Protozoen. 1. Halfte: Mastigophoren und Rhizopoden.
Sechste Auflage. Jena (Gustav Fischer), IV, 1 BL, S. 411-776.
Dujardin F. 1841. Histoire naturelle des Zoophytes. Paris: Librairie en-
cyclopedique de Roret. P. 1-684.
Edgcomb V.P., Simpson A.G.B., Zettler L.A., Nerad T.A., Patterson
D.J., Holder M.E. 2002. Pelobionts are degenerate protists: insights from
molecules and morphology И Mol. Biol. Evol. Vol. 19. P. 978-982.
Fantham H.B. 1919. Some parasitic protozoa found in South Africa 11
South African J. Sci. Vol. 16. P. 185-191.
Fenchel T., Finlay B.J. 1991. The biology of free-living anaerobic cili-
ates // Eur. J. ProtistoL Vol. 26. P. 201-215.
Fenchel T., Finlay B.J. 1992. Production of methane and hydrogen by
anaerobic ciliates containing symbiotic methanogenes H Arch. Microbiol.
Vol. 157. P. 475-480.
Fenchel T., Perry T., Thane A. 1977. Anaerobiosis and symbiosis with
bacteria in free-living ciliates // J. Protozool. Vol. 24. P. 154-163.
Finlay B.J., Fenchel T. 1989. Hydrogenosomes in some anaerobic
protozoa resemble mitochondria // FEMS Microbiol. Lett. Vol. 65. P. 311—
314.
Fortner H. 1934. Untersuchungen an Pelomyxa palustris Greeff. Stu-
dien zur Biologie und Physiologie des Tieres. 1. Teil // Arch. Protistenk. Bd
83. S. 381-464.
Frenzel J. 1897. Untersuchungen fiber die mikroskopische Fauna Ar-
gentiniens. Erster Teil: Die Protozoen. I und II. Abteilung: Die Rhizopoden
und Helioamoben. Stuttgart: Verlag von Erwin Nagele. 161 S.
Frolov A., Chystjakova L., Goodkov A. 2004. A new pelobiont pro-
tist Pelomyxa corona sp. n. (Peloflagellatea, Pelobiontida) // J. Protistology.
Vol. 3.P. 233-241.
Frolov A., Chystjakova L., Goodkov A. 2005. A light- and electron-
microscopical study of Pelomyxa binucleata (Grfiber, 1884) (Peloflagellatea,
Pelobiontida) 11 J. Protistology. Vol. 4. P. 57-73.
Frolov A., Goodkov A., Chystjakova L., Skarlato S. 2006. Morphol-
ogy and development of Pelomyxa gruberi sp. n. (Peloflagellatea, Pelobion-
tida) 11 J. Protistology. Vol. 4. P. 227-244.
Goldschmidt R. 1907. Lebensgeschichte der Mastigamoben Masti-
gella vitrea n. sp. und Mastigina setosa n. sp. // Arch. Protistenk. SuppL I.
S. 83-168.
Goodkov A.V., Seravin L.N. 1995. Pelomyxa palustris'. amoeba,
caryoblastean, archezoan, or peloflagellatan? // Cytology (Russia). Vol. 37.
P. 1053-1063.
Greeff R. 1874. Pelomyxa palustris (Pelobius), ein amoebenartiger Or-
ganismus des sussen Wassers 11 Arch. Microscop. Anat. Bd 10. S. 53-73.
Griffin J.L. 1988. Fine structure and taxonomic position of the giant
amoeboid flagellate Pelomyxapalustris // J. Protozool. Vol. 35. P. 300-315.
Gruber A. 1884. Studien fiber Amoben 11 Zeitschr. Wissenschaft. Zool.
Bd41. S. 186-225.
Hinkle G., Leipe D.D., Nerad T.A., Sogin M.L. 1994. The unusually
long small subunit ribosomal RNA of Phreatamoeba balamuthi // Nucl. Acids
Res. Vol. 22. P. 465-469.
Hollande A. 1945. Biologie et reproduction des rhizopodes des genres
Pelomyxa et Amoeba et cycle evolutif de I’Amoeboiphilus destructor nov.
gen., nov. spec., Chytridinee (?) parasite de Pelomyxa palustris Greeff // Bui.
Biol. France et Belg. Vol. 79. P. 31—66.
Hollande A., Guilcher Y. 1945. Les amibes du genre Pelomyxa // Bull.
Soc. Zool. France. T. 70. P. 53-56.
Honigberg B.M., Balamuth W., Bovee E.C., Corliss J.O. et al. 1964. A
revised classification of the phylum Protozoa // J. Protozool. Vol. 11. P. 7-20.
Kent W.S. 1880. A Manual of the Infusoria. London: David Bogue.
472 p.
Klebs G. 1892. Flagellatenstudien, Theil 1 // Z. Wiss. Zool. Bd 55. S.
265-445.
Klug G. 1936. Neue oder wenig bekannte Arten des Gattungen Mas-
tigamoeba, Mastigella, Cercobodo, Tetramitus und Trigonomonas // Arch.
Protistenk. Bd 87. S. 97-116.
Korotneff A. 1879. Etudes sur les Rhizopodes 11 Arch. Zool. Exp. et
Gen. Vol. 8. P. 467-482.
Kudo R.R. 1939. Protozoology. London: Bailliere, Tindall and Cox.
689 p.
Kudo R.R. 1946. Pelomyxa carolinensis Wilson. I. General observation
on the Illinois stock 11 J. Morphol. Vol. 78. P. 317-351.
Kudo R.R. 1950. A species of Pelomyxa from Illinois // Trans. Amer.
Microsc. Soc. Vol. 69. P. 368-370.
Kudo R.R. 1951. Observations on Pelomyxa illinoisensis // J. Morphol.
Vol. 88. P. 145-184.
Kudo R.R. 1952. The genus Pelomyxa 11 Trans. Amer. Microsc. Soc.
Vol. 71. P. 108-113.
Kudo R.R. 1957. Pelomyxa palustris Greeff. I. Cultivation and general
observations // J. Protozool. Vol. 4. P. 154-164.
Kudo R.R. 1959. Pelomyxa and related organisms // Ann. N.Y. Acad.
Sci. Vol. 78. P. 474—486.
Lackey J.B. 1923. The fauna of Imhoff tanks // New Jersey Agricultural
Experiment Stations Bulletin. Vol. 417. P. 3-39.
Lackey J.B. 1932. Oxygen deficiency and sewage protozoa: with de-
scriptions of some new species // Biol. Bull. Vol. 63. P. 287-295.
Larsen J., Patterson D.J. 1990. Some flagellates (Protista) from tropi-
cal marine sediments // J. Nat. Hist. Vol. 24. P. 801-937.
Lauterborn R. 1901. Die sapropelische Lebewelt 11 Zool. Anzeiger.
Bd 24. S. 50-55.
Leidy J. 1874. Notice of a remarkable amoeba // Proc. Acad. Nat. Sci.
Philadelphia. P. 142-143.
Leidy J. 1879. Freshwater rhizopods of North America // Rept. U.S.
Geol. Surv. Territ. Vol. 12. 324 p.
Leiner M., Wohlfeil M., Schmidt D. 1954. Pelomyxapalustris Greeff /
Ann. Sci. Natur. (Zool.). Ser. 11. Vol. 16. P. 537-594.
Lemmermann E. 1914. Flagellatae, 1 // A. Pascher (ed.). Die Sfisswas-
ser-flora Deutschlands, Osterreichs und der Schweiz. Jena: Gustav Fischer.
S. 1-138.
Lepsi I. 1965. Protozoologie. Romania: Acad. Rep. Soc. 999 p.
Levine N.D., Corliss J.O., Cox F.E.G., Deroux G., Grain J., Hon-
igberg B.M. et al. 1980. A newly revised classification of the Protozoa // J.
Protozool. Vol. 27. P. 37-58.
PELOBIONTIDA
307
Margulis L. 1974. Five-kingdom classification and the origin and evolu-
tion of cells H Evol. Biol. Vol. 7. New York, London: Plenum Press. P. 45-78.
Margulis L. 1981. Symbiosis in cell evolution. Life and its environment
on the early Earth. San Francosco: W. H. Freeman. 399 p.
Mast S.O. 1934. A amoeboid movement in Pelomyxa palustris
(Greeff) 11 Physiol. Zool. Vol. 7. P. 470-478.
Meyer H. 1897. Untersuchungen fiber einige Flagellaten // Revue Su-
isse Zool. Bd 5. S. 43-89.
Milyutina LA., Aleshin V.V., Mikrjukov K.A., Kedrova O.S., Petrov
N.B. 2001. The unusually long small subunit ribosomal RNA gene found in
amitochondriate amoeboflagellate Pelomyxa palustris'. its rRNA predicted
secondary structure and phylogenetic implication 11 Gene. Vol. 272. P. 131—
139.
Morin L. and Mignot J.-P. 1995. Are archamoebae true archezoa? The
phlyogenetic position of Pelomyxa sp., as inferred from large subunit ribo-
somal RNA sequencing И Eur. J. Protistol. Vol. 31. P. 160A.
Nikolaev S.L, Berney C., Petrov N.B., Mylnikov A.P., Fahrni J.F.
and Pawlowski J. 2006. Phylogenetic position of Multicilia marina and evo-
lution of Amoebozoa H Int. J. Syst. Evol. Microbiol. Vol. 56. P. 1449-1458.
Okada Y.K. 1930. Uber den Bau und die Bewegungsweise von Pelo-
myxa//Arch. Protistenk. Bd 70. S. 131-154.
Page EC. 1970. Mastigamoeba aspera from estuarine tidal pools in
Maine H Trans. Amer. Microsc. Soc. Vol. 89. P. 197-200.
Page EC. 1976. A revised classification of the Gymnamoebia (Protozoa:
Sarcodina) H Zool. J. Linn. Soc. Vol. 58. P. 61-77.
Page EC. 1981. Eugene Penard’s slides of Gymnamoebia: re-examina-
tion and taxonomic evaluation // Bui. Brit. Mus. Nat. Hist. (Zool.). Vol. 40.
P. 1-32.
Page EC. 1983. Marine Gymnamoebia. Cambridge: Inst. Terrestr. Ecol.
Publ. 54 p.
Page EC. 1987. The classification of “naked” amoebae (phylum
Rhyzopoda) // Arch. Protistenk. Bd 133. S. 199-217.
Patterson D.J. 1994. Protozoa: evolution and systematics 11 Haussman
K. and Huisman N. (eds) Progress in Protozoology. Stuttgart, Jena, New York:
Gustav Fisher Verlag. P. 1-14.
Patterson D.J. 1999. The diversity of eukaryotes // Amer. Natur.
Vol. 69. P. 96-124.
Pawlowski J. 2008. The twilight of Sarcodina: a molecular perspec-
tive on the polyphyletic origin of amoeboid protests 11 Protistology. Vol. 5.
P. 281-302.
Pawlowski J., Burki F. 2009. Untangling the Phylogeny of Amoeboid
Protists // J. Euk. Microbiol. Vol. 56. P. 16-25.
Penard E. 1893. Pelomyxa palustris et quelques autres organisms in-
terieurs 11 Arch. Sci. Phys. Nat. Vol. 29. P. 165-184.
Penard E. 1902. Faune rhizopodique du Bassin du Leman. Geneva:
W. Kundig et Fils. 712 s.
Penard E. 1904. Quelques nouveaux Phizopodes d’ean douce // Arch.
Protistenk. Bd 3. S. 391-422.
Penard E. 1909. Sur quelques mastigamibes des environs de Geneve //
Rev. Suisse Zool. Vol. 17. P. 405-439.
Penard E. 1936. Rhizopode ou flagellate? Quelques reflexions a propos
de la Dinamoeba mirabilis // Bull. Soc. Fran^aise de Microbiologie de Paris.
T. 5. P. 54-163.
Prowazek S. 1913. Aus dem Nachlass von Fritz Schaudinn // Arch. Pro-
tistenk. Bd31 S. 72-76.
Rice N.E. 1945. Pelomyxa carolinensis (Wilson) or Chaos chaos (Lin-
neaus)? // Biol. Bull. Vol. 88. P. 139-143.
Schaeffer A.A. 1926. Taxonomy of the amebas // Pap. Dep. Mar. Biol.
Carnegie Inst. Wash. Vol. 24. P. 1-116.
Shulze EE. 1875. Rhizopodienstudien 11 Arch. Mikr. Anat. Bd 11.
S. 583-596.
Siemensma EJ. 1987. De Nederlandse Naaktamoeben (Rhizopoda,
Gymnamoebia) // Wetenschappelijke mededelingen Koninklijke Nederlandse
Natuurhistorische Vereniging. Vol. 181. P. 1-136.
Simpson A.G.B., Bernard C., Fenchel T., Patterson D.J. 1997. The
organisation of Mastigamoeba schizophrenia n. sp.: more evidence of ultra-
structural idiosyncrasy and simplicity in pelobiont protists // Eur. J. Protistol.
Vol. 33. P. 87-98.
Skuja H. 1939. Beitrag zur Algenflora Lettlands II // Acta Horti botanici
Universitatis latviensis. Vol. 11-12. P. 41-169.
Skuja H. 1948. Taxonomie des Phytoplanktons einiger Seen in Up-
pland, Schweden // Symbolae botanicae Uppsalienses. Vol. 9. S. 1-399.
Skuja H. 1956. Taxonomische und Biologische Studien das Phyto-
plankton Schwedischer Binnengewasser // Nova Acta Regiae Societatis Sci-
entiarum Uppsaliensis, 4th series. Vol. 16. S. 1-403.
Skvortzkov B.V., Noda M. 1976. Flagellates of clean and polluted
waters .V. A short description of colourless flagellates with one swimming
flagellum -genus Mastigella (Frenzel) nob. (Rhizomastigaceae) reported dur-
ing 1962-1975 in many parts of the world and especially from subtropics of
Brasil, South America. Prof Mitsuko Noda Commemorative Publication on
his retirement from the Faculty of Science, Niigata University. Laboratory of
Phytotaxo-Morphology, Faculty of Science, Niigata University.
Smirnov A.V., Brown S. 2004. Guide to the methods of study and iden-
tification of soil gymnamoebae // J. Protistology. Vol. 3. P. 148-190.
Smirnov A.V. and Goodkov A.V. 1999. An illustrated list of the ba-
sic morphotypes of Gymnamoebia (Rhizopoda, Lobosea) // J. Protistology.
Vol. 1. P. 20-29.
Smirnov A.V., Nassonova E.S, Berney C., Fahrni J., Bolivar L, Paw-
lowski J. 2005. Molecular phylogeny and classification of the lobose amoe-
bae // Protist. Vol. 156. P. 129-142.
Stokes A.C. 1886. Notices of new fresh-water Infusoria // Proc. Ameri-
can Philosophical Soc. Vol. 23. P. 562-568.
Stokes A.C. 1888. A preliminary contribution toward a history of the
fresh-water infusoria of the United States 11 J. Trenton Nat. Hist. Soc. Vol. 1.
P. 73-319.
van Bruggen J.J.A., Stumm C.K., Vogels G.D. 1983. Symbiosis of
methanogenic bacteria and sapropelic protozoa 11 Arch. Microbiol. Vol. 136.
P. 89-96.
van Bruggen J.J.A., Stumm C.K., Zwart K.B., Vogels G.D. 1985.
Endosymbiotic methanogenic bacteria of the sapropelic amoeba Mastigella 11
FEMS Microbiol. Ecology. Vol. 31. P. 187-192.
van Bruggen J.J.A., van Rens G.L.M., Geertman E.J.M., Zwart
K.B., Stumm C.K., Vogels G.D. 1988. Isolation of methanogenic endosym-
biont of the sapropelic amoeba Pelomyxa palustris Greeff // J. Protozool.
Vol. 35. P. 20-23.
Veley L.J. 1905. A further contribution to the study of Pelomyxa palus-
tris (Greeff) // J. Linn. Soc. (Zool.). Vol. 29. P. 374-395.
Vogels G.D., van der Drift C., Stumm C.K., Keltjens J.T.M., Zwart
K.B. 1984. Methanogenesis: surprising molecules, microorganisms and sys-
tems //Antonie Van Leeuwenhoch. Vol. 50. P. 557-567.
Walker G., Simpson A.G.B., Edgcomb V., Sogin M.L., Patter-
son D.J. 2001. Ultrastructural identities of Mastigamoeba punctachora,
Mastigamoeba simplex and Mastigella commutans and assessment of
hypotheses of relatedness of the pelobionts (Protista) // Eur. J. Protistol.
Vol. 37. P. 15-25.
Walker G., Dacks J. B., Embley T. M. 2006. Ultrastructural descrip-
tion of Breviata anathema, n. gen., n. sp., the organism previously studied as
“Mastigamoeba invertens” 11 J. Euk. Microbiol. Vol. 53, P. 65-78.
Whatley J.M. 1976. Bacteria and nuclei in Pelomyxa palustris'. com-
ments on the theory of serial endosymbiosis // New Phytol. Vol. 76. P. 111-
120.
Whatley J.M., Chapman-Andresen C. 1990. Phylum Karyoblastea //
Margulis L., Corlis J.O., Melkonian M., Chapman D.J. (eds) Handbook of
Protoctista. Boston: Jones and Burlett Publ. P. 167-185.
Whatley F.R., Whatley J.M. 1980. The establishment of organelles H
Schenk H.E.A., Schwemmler W. (eds) Endocytobiology. I. Berlin, New York:
Walter de Gruyter. P. 849-865.
Whatley F.R., Whatley J.M. 1983. Pelomyxa palustris 11 Schenk
H.E.A., Schwemmler W. (eds) Endocytobiology. II. Berlin, New York: Walter
de Gruyter. P. 413-426.
Wilson H.V. 1900. Notes on a species of Pelomyxa 11 Amer. Natur.
Vol. 34. P. 535-550.
APUSOZOA (Cavalier-Smith 2002) Cavalier-Smith 2010
Этот тип является парафилетическим (Cavalier-
Smith et al., 2008), поэтому далеко не все его признают
(Atkins et al., 2000; Yoon et al., 2008; Roger, Simpson,
2009). Каждая из входящих в него групп имеет глубо-
кое ветвление на молекулярно-филогенетических схе-
мах эукариот, не попадая ни в один из шести супер-
кластеров (Adi et al., 2005). Т. Кавалье-Смит относит
к этому типу отряд Apusomonadida Karpov et Mylnikov
1989, жгутиконосцев рода Ancyromonas Kent 1882 и
филозных амеб рода Micronuclearia Mikrjukov et Myl-
nikov 2001 (Cavalier-Smith, Chao, 2010). Для всех этих
организмов характерно наличие тонкого плотного слоя
эпиплазмы под плазмалеммой и вентральной борозд-
ки, из которой формируются псевдоподии. Сиквенсы
генов каждого из представителей этих таксонов рас-
полагаются на молекулярно-филогенетических схемах
в основании опистоконтов или Amoebozoa, и довольно
слабо группируются друг с другом (рис. 206).
1/0.99/88
1/0.99-85
l.'0 99.93r- Podomonas cacens/sAY050'82 Ar>. lenmnnqrlirlq
1/0 99-97П-Podomonas magnaCCAP1901/4 AY268039 MpUSOmOnaaiua
’—- marine sediment DNACYSGM-24 Sagami Bay, Japan AB275107
1/0 ^PApusomonas proboscidea CCAP 1905/1 soil, Scotland, UK L37037
> \J| ^^somonas proboscides HFCC47 dystrophic pond, Borok, Russia DQ7207567 I
x xjrApuscmcnas prabcscidea HFCC336 18m deep groundwater, Germany DQ207568|0-66/0.96'69
T— soil DNA clone Amb_18S_480 misannotated as Acanthamoeba EF023187 |
---Manchomomonas bermudensis ATCC50234 AY050178
0.23/-/-
0.39-.-
1/1/98
0.294- fMtimonas media Millport strain AY050181
• Multimonas media 6B Wembury Bay. Devon, UK CCAP1901/3 EU542598 I
— 0.52/-/- Multimonas media 7c Milton Sands. Devon, UK EU542597 I
-------------------rrid-Atlantic Ocean ridge sediment DNA AT-50 AF530544 0.43/0.42/87
—Thecamonas oxoniensis CCAP1901/2 EU542598
0.93/0.J5/30
0.95/0.73/39
Thecamonas sp. from CCAP cryptomonad cultureAY050179
------------------mW-Atlantic Ocean ridge sediment DNA AT-41AF530528
Thecamonas trahens ATCC50062 AY050180
....... Thecamonas aff. trahens I-FCC48 AY827841
—....'.... Thecamonas aff. trahens HFCC49AY827842
e Thecamonas aff. trahens CCAP 1901 /1 (A-1 a) EU542595
Thecamonas aff. trahens Thai EU542599
Thecamonas sp. Bamfield
i/o.af9i
Planomonas m/craATCC50267 AF053088
IRanomonas mylnikovi CCAP1958/3 EU349231 n.
Ranomonassp. HFCC60 AY827843 I Г 1аПО1Т1ОПаС11иа
Ranomcnas sp. HFCC62 AY827844 I
Ranomonas marine DNA pl 5SBG2 AY882531 I
--------------Mtcronuclearia podoventralis 1 Micronucleariida
EU542594
0.2
Рис. 206. Состав типа Apusozoa и родственные связи трех составляющих его групп (Apusomonadida, Ancyromonas (= Planomonas) и
Micronuclearia) на филогенетической схеме, построенной по гену 18S рРНК.
Черные кружки означают 100% поддержку по всем трем методам построения схемы (MrBayes, PhyloBayes, RAxML). Жирным выделены сиквенсы,
впервые приведенные в этой статье. (По: Cavalier-Smith, Chao, 2010).
APUSOZOA. ОТРЯД APUSOMONADIDA
309
Тип Apusozoa первоначально включал только от-
ряд Apusomonadida и род Ancyromonas (Cavalier-Smith,
2002), а после описания Micronuclearia podoventralis
(Mikrjukov, Mylnikov, 2001) и последующего секвени-
рования erol8S рРНК гена Т. Кавалье-Смит объединяет
Micronuclearia с Ancyromonas (= Planomonas) в новый
класс Hilomonadea, а отряд Apusomonadida оставляет в
классе Thecomonadea (Cavalier-Smith, Chao, 2010). Та-
ким образом, тип Apusozoa включает класс Thecomon-
adea (Cavalier-Smith 1993) Cavalier-Smith 2010 с одним
отрядом Apusomonadida и класс Hilomonadea Cavalier-
Smith 2010 с двумя родами Micronuclearia и Ancyromo-
nas.
Учитывая слабые родственные связи между этими
тремя таксонами на молекулярно-филогенетических
схемах и лишь немногие общие морфологические при-
знаки, объединение их в один тип действительно вы-
глядит малообоснованным. Тем не менее, независимо
от взглядов на родство этих ключевых для филогении
эукариот групп между собой, они последовательно рас-
смотрены в настоящей главе в рамках типа Apusozoa
исключительно ради удобства изложения.
Отряд Apusomonadida Karpov et Mylnikov 1989
Гетероконтные бесцветные преимущественно ползающие
жгутиконосцы часто с хоботком на переднем конце. На ниж-
ней (вентральной) поверхности клетки проходит бороздка (же-
лоб), ограниченная боковыми складками покровов. Покровы
образованы плазмалеммой с подстилающим ее плотным слоем
эпиплазмы. Жгутики гладкие с акронемой. Передний жгутик
короткий, проходит внутри муфты из боковых складок, всегда
обращен вперед и влево и «машет» влево. Задний жгутик про-
ходит под клеткой по левой стороне вентральной бороздки. От
кинетосом вглубь клетки отходят 2-3 микротрубочковых кореш-
ка. Наиболее широкий из них представлен ризостилем, который
направлен к ядру и вместе с диктиосомой и электронно-плотной
структурой образует специфический комплекс органелл в перед-
ней части клетки. Митохондрии с трубчатыми или мешковидны-
ми кристами. Цисты обнаружены только у одного вида, но все
способны переносить высыхание. Для некоторых видов харак-
терны плазмодии. Свободноживущие. Пресноводные и морские.
Обитают на литорали, в очистных сооружениях, стоячих водо-
емах, почве; как правило, не достигая высокой численности.
Жгутиконосцы передвигаются, медленно скользя по субстрату.
Вентральная бороздка служит для образования псевдоподий и
заглатывания пищи (преимущественно бактерий).
Бесполое размножение осуществляется делением клетки
надвое. Половое размножение не обнаружено.
История изучения
Первый вид апузомонад был неверно описан как
бодонида Rhynchomonas mutabilis (Griessmann, 1913),
который позднее был отнесен к роду Thecamonas
(Larsen, Patterson, 1990).
Первоописание же рода Amastigomonas и его ти-
пового вида Amastigomonas debruynei впервые было
сделано де Седелером (Saedeleer, 1931). Он обнаружил
в почвах Голландии метаболирующих простейших с
хоботком, но без жгутиков, что и отражено в названии
рода.
Род Apusomonas и его единственный вид Ар. рго-
boscidea был описан Алексеевым из фекалий лошади
(Alexeieff, 1924).
Дальнейшее изучение этих жгутиконосцев приоста-
новилось. По-видимому, главная причина заключалась
в том, что они не дают заметной численности в водо-
емах и почвенных пробах, поэтому, несмотря на харак-
терные признаки, часто оставались незамеченными.
Лишь спустя полвека были описаны другие пред-
ставители рода Amastigomonas'. Am. caudata — более
крупный пресноводный амастигомонас с хвостовой
псевдоподией из Рыбинского водохранилища (Жуков,
1975) и Am. borokensis из рыборазводного пруда в Вен-
грии (Hamar, 1979). Оба организма имели сократитель-
ные вакуоли. Типовой вид Am. debruynei затем был не-
однократно обнаружен в самых разных пресноводных
и почвенных биотопах (рис. 207). Однако в более позд-
них работах был обнаружен передний жгутик, отходя-
щий от хоботка, а затем и задний, или рекуррентный.
По-видимому, жгутики не были замечены де Седеле-
ром и поэтому не указаны в описании. По общему со-
гласию между протозоологами название рода и автор-
ство были сохранены. В дальнейшем амастигомонасы
были найдены и в морских биотопах: А.П. Мыльников
обнаружил Am. caudata в Белом море (Мыльников,
1989), затем американские авторы описали новый вид
Рис. 207. Внешний вид Amastigomonas debruynei с дорсальной
стороны.
ж — передний жгутик, мх — муфта хоботка. Масштабная линейка —
5 мкм. (По: D.J. Patterson, L. Amaral-Zettler, М. Peglar and T. Nerad, по
лицензии MBL (micro*scope)).
310
APUSOZOA. ОТРЯД APUSOMONADIDA
Am. bermudensis из биотопа с океанической соленостью
и провели ревизию рода (Molina, Nerad, 1991).
Первые ультраструктурные исследования в 1974
году дали возможность увидеть в сканирующий ми-
кроскоп внешнюю форму Apusomonas proboscidea
(Vickerman et al., 1974). В этой же работе авторы опи-
сали поведение жгутиконосца в культуре и процесс
деления клетки под световым микроскопом. В кон-
це 70-х в группе исследователей под руководством
Б.Ф. Жукова (ИБВВ РАН в п. Борок, Ярославской
обл.) под пристальным вниманием оказались многие
группы бесцветных жгутиконосцев по разным причи-
нам пренебрегаемые протозоологами, а в настоящее
время играющие ключевую роль в мегасистематике
и филогении эукариот. В их числе оказались и апу-
зомонады. Первые светооптические, а затем ультра-
структурные исследования показали уникальность
этих жгутиконосцев. В 1980 году Ар. proboscidea был
ошибочно описан как новый род и вид Rostromonas
applanata (Карпов, Жуков, 1980), а в 1981 году С.А.
Карпов предложил на основании собственных уль-
траструктурных исследований выделить род Apu-
somonas в самостоятельный отряд Apusomonadida.
Хотя эта идея, доложенная на протозоологической
конференции в Ленинграде в 1981 году, была под-
держана протозоологами, она не была реализована
в то время. Электронно-микроскопические исследо-
вания Ар. proboscidea (Карпов, Жуков, 1984; Karpoff,
Zhukov, 1986) продемонстрировали уникальность
строения покровов, цитоскелета и особенности пита-
ния этого жгутиконосца. В 1989 году были получены
первые ультраструктурные данные по представите-
лю другого рода — Amastigomonas caudata (Мыль-
ников, 1989), которые показали большое сходство
этих видов друг с другом. Это позволило с большей
уверенностью объединить их в самостоятельное се-
мейство Apusomonadea и отряд Apusomonadida (Кар-
пов, Мыльников, 1989), в который вошли 2 вида из
рода Amastigomonas и один вид Apusomonas. В даль-
нейшем, благодаря работам отечественных (Мыль-
ников, 1999) и зарубежных (Molina, Nerad, 1991) про-
тозоологов число видов Amastigomonas увеличилось
до 9, а для Apusomonas был описан еще один вид из
Австралии (Ekelund, Patterson, 1997). Общий список
видов представлен в следующем разделе этой главы.
Ларсен и Паттерсон установили новый род Thecamo-
nas для Rhynchomonas mutabilis и описали три вида:
Т. mutabilis, Т. trahens и Т. filosa (Larsen, Patterson,
1990). Молина и Нерад отнесли эти виды к роду
Amastigomonas (Molina, Nerad, 1991), основываясь на
исследовании Мыльниковым близкого к ним по уль-
траструктуре Am. caudata (Мыльников, 1989). Эта по-
зиция была принята большинством современных про-
тистологов, включая Ларсена и Паттерсона, а название
рода Thecamonas стали считать младшим синонимом
Amastigomonas.
Здесь опять следует остановиться на признаках
рода Amastigomonas. В его первоописании сказано,
что он не имеет жгутиков, или только передний. Жу-
ков описал Am. caudata, у которого также не видны
жгутики (Жуков, 1975). В дальнейшем наличие двух
жгутиков было подтверждено электронно-микроско-
пическими и более детальными светооптическими
исследованиями, поэтому считается, что амастигомо-
нас имеет два жгутика, которые де Седелер и Жуков
не заметили. В целом эта точка зрения принята боль-
шинством современных авторов, а довольно четкие
признаки амастигомонаса не позволяют сомневаться в
диагностике рода.
Между тем, Кавалье-Смит и Чао (Cavalier-Smith,
Chao, 2010) подошли к этому формально и заяви-
ли, что имя рода Amastigomonas не должно быть ис-
пользовано в отношении всех видов апузомонад со
жгутиками. Они подчеркнули, что после де Седелера
никто этого амастигомонаса не видел, поэтому все
его «представители» должны быть отнесены к дру-
гим родам. По меньшей мере, пресноводные должны
быть отделены от морских, поскольку не было пока-
зано, что генетически однородные популяции могут
обитать и в морской и в пресной воде (Cavalier-Smith,
Chao, 2010). Свои утверждения авторы подкрепля-
ют молекулярно-филогенетическими построениями,
основанными на данных по секвенированию гена
18S рРНК из 21 клона апузомонад. По их мнению,
помимо рода Apusomonas к апузомонадам относят-
ся 4 новых рода: Multimonas, Folimonas, Podomonas
и Manchomonas, — и один прежний — Thecamonas
Larsen et Patterson 1990. Все они объединяют извест-
ные виды рода Amastigomonas. Другими словами, пока
амастигомонас без жгутиков, соответствующий опи-
санию де Седелера не будет выделен и исследован в
электронный микроскоп, остается вероятность того,
что Amastigomonas debruynei вообще не связан с апу-
зомонадами (Cavalier-Smith, Chao, 2010). В то же вре-
мя, пресноводные амастигомонасы очень похожи на
других апузомонад с малозаметным передним жгути-
ком, окруженным муфтой, поэтому они, скорее всего,
апузомонады (Cavalier-Smith, Chao, 2010). Таким об-
разом, эти авторы склонны относить к амастигомона-
су лишь 3 пресноводных вида, а морские — распреде-
лить между 5 родами в соответствии с молекулярной
филогенией и некоторыми нечеткими морфологиче-
скими отличиями.
Обособленность апузомонад среди эукариот была
продемонстрирована, практически, всеми молекуляр-
но-биологическими исследованиями. Данные по сек-
венированию генов 18S рРНК (Cavalier-Smith, Chao,
1995) показали, что они действительно представляют
собой уникальную группу эукариот, вероятно ближай-
шую к предковой форме, от которой произошли жи-
вотные, грибы и воротничковые жгутиконосцы. Более
поздние данные по другим генам нескольких видов
апузомонад также подтвердили их обособленность сре-
ди не только протистов, но и всех эукариот (Kim et al.,
2006; Scheckenbach et al., 2006).
В 2003 году на основании молекулярно-филогене-
тических построений и анализа особенностей строения
покровов апузомонады объединяются с Ancyromonas в
класс Thecamonadea в типе Apusozoa (Cavalier-Smith,
Chao, 2003, 2010).
APUSOZOA. ОТРЯД APUSOMONADIDA
311
Классификация1
Типовое семейство Apusomonadidae Karpov et
Mylnikov 1989 с диагнозом отряда.
Типовой род Apusomonas Alexeieff 1924 с типовым
видом Ар. proboscidea Alexeieff 1924. Второй род —
Amastigomonas de Saedeleer 1931 с типовым видом Ат.
debruynei de Saedeleer 1931.
Различия между родами в пределах отряда связаны,
прежде всего, с размерами клеток и строением хобот-
ка. У Apusomonas хоботок длиннее, а ядро прилегает к
заднему концу клетки, у Amastigomonas хоботок, если
имеется, короткий, ядро находится в средней или пе-
редней части клетки. Amastigomonas также способен
формировать заметные псевдоподии и плазмодии.
Род Amastigomonas de Saedeleer 1931
Am. debruynei de Saedeleer 1931
Am. bermudensis Molina et Nerad 1992
Am. caudata Zhukov 1975 (= Am. borokiensis Hamar 1979)
Am.filosa (Larsen and Patterson) Molina et Nerad 1991
Am. gigantea Mylnikov 1999
Am. griebenis Mylnikov 1999
Am. klosteris Arndt et Mylnikov 1999 (in Mylnikov 1999)
Am. marina (Mylnikov) Mylnikov 1999
Am. muscula Mylnikov 1999
Am. mutabilis (Griessmann) Molina et Nerad 1991
Род Apusomonas Alexeieff 1924
Ap. proboscidea Alexeieff 1924
Ap. australiensis Ekelund et Patterson 1997
Морфология
Строение жгутиковых стадий
Апузомонады — это ползающие гетероконтные
жгутиконосцы. Они имеют уплощенную форму тела
и в разной степени выраженный хоботок на переднем
конце клетки (рис. 207). На нижней (вентральной) по-
верхности клетки и хоботка проходит бороздка, или
вентральный желоб, в котором располагается задний
жгутик (рис. 208, 209).
Хоботок Apusomonas образован проксимальным
мастигофором и дистальной муфтой с передним жгу-
тиком (рис. 208, 209). Мастигофор представляет собой
довольно толстый подвижный цитоплазматический
вырост. По его вентральной стороне так же, как и по
телу клетки, проходит вентральная бороздка, в которой
лежит задний жгутик. Складки покровов, ограничива-
ющие вентральную бороздку, продолжаются и в дис-
тальную часть хоботка, формируя муфту вокруг перед-
него жгутика.
У Amastigomonas мастигофор отсутствует, хоботок
представлен только муфтой с проходящим в ней перед-
ним жгутиком, а кинетосомы жгутиков находятся в ос-
новании хоботка (рис. 210).
Покровы. Одной из наиболее ярких отличитель-
ных особенностей этих простейших являются покровы.
1 В этой главе принята традиционная классификация апузомонад
без учета последней статьи Кавалье-Смита и Чао (Cavalier-Smith, Chao,
2010), в которой имеются логические противоречия и слабо обоснован-
ные заключения. — Прим. авт.
Рис. 208. Схема строения Apusomonas proboscidea.
А — вид с дорсальной стороны при малом увеличении; Б — вид с вент-
ральной стороны при большем увеличении; В — вид в профиль, зж —
задний жгутик, мф — мастигофор, пж — передний жгутик, св — со-
кратительная вакуоль, я — ядро. Масштабная линейка — 7 мкм. (По:
Карпов, Жуков, 1980).
Большая часть поверхности клетки покрыта плазма-
леммой с подстилающим ее плотным слоем эпиплазмы
(рис. 209, 211). Ранее (Карпов, Жуков, 1984; Карпов,
Мыльников, 1989) предполагалось, что покровы об-
разованы двойной мембраной. Действительно, на сре-
зах Ар. proboscidea хорошо видно (рис. 209, Б; 211, В),
что оболочка клетки состоит из пяти слоев; толщина
ее примерно в 2 раза больше плазмалеммы, а покровы
Am. caudata и Am. sp. можно интерпретировать как две
прилегающие друг к другу мембраны (Карпов, Мыль-
ников, 1989). Однако специальных исследований по
изучению покровов (например, путем замораживания-
скалывания) не проводили. Кроме того, после публи-
кации материала по Hemimastix (Foissner et al., 1988),
имеющего похожие покровы, Карпов стал интерпрети-
ровать их иначе, и в дальнейшем более осторожно опи-
сывал электронно-плотный слой «второй мембраны»
как эпиплазму (Карпов, 2001: Karpov, 2007). Вентраль-
ный желоб клетки и собственно жгутики выстланы од-
ной плазмалеммой.
Необычные образования обнаружены на поверх-
ности клеток Am. caudata. От поверхности клеток от-
ходят трубчатые нити диаметром 60-70 нм и длиной
от 0,6 до 3 мкм со спирально исчерченной стенкой.
Каждая нить опирается на осмиофильное утолщение
312
APUSOZOA. ОТРЯД APUSOMONADIDA
Рис. 209. Ультраструктура Apusomonas proboscidea.
A — сагиттальный срез клетки и хоботка; Б — строение боковой складки вентральной бороздки и акронемы заднего жгутика (стрелка указывает на
покровы для сравнения с плазмалеммой, отмеченной наконечником); В — поперечный срез тонкой части хоботка; Г— поперечный срез мастигофора
(вид из клетки); Д— продольный срез кинетосомы (стрелки указывают стенки цилиндра); Е-3 — подборка из серии продольных срезов мастигофора;
И— схема строения корешковой системы жгутиков. Дистальный кончик хоботка на находится слева, аг — аппарат Гольджи, азж — акронема за-
днего жгутика, вб — вентральная бороздка, зж — задний жгутик, кв — края вентральной бороздки, кз — кинетосома заднего жгутика, кп — кинетосо-
ма переднего жгутика, лд — левый дорсальный корешок, лк — левый корешок, м — митохондрия, мф — муфта, мфс — многослойная фибриллярная
структура, пв — пищеварительная вакуоль, пж — передний жгутик, пик — поперечно-исчерченный фибриллярный корешок, пк — правый корешок,
р — ризостиль, фм — фибриллярный мостик между кинетосомами, эр — эндоплазматический ретикулум, я — ядро; Масштабная линейка (мкм): А —
2,5; Б— 0,3; В, Д— 0,8; Г— 0,5; Е-3 — 1 (По: Карпов, Мыльников, 1989 — А, Б; Karpov, 2007 — В-И).
APUSOZOA. ОТРЯД APUSOMONADIDA
313
Рис. 210. Схема строения Amastigomonas bermudensis.
а — акронема переднего жгутика, зж — задний жгутик, кв — края вен-
тральной бороздки, мх — муфта хоботка, пж — передний жгутик, р —
ризостиль, я — ядро. (По: Molina, Nerad, 1991).
оболочки (Карпов, Мыльников, 1989). Происхождение
и функции нитей неясны, возможно, они служат для
прикрепления к субстрату при переходе к покоящейся
стадии.
Жгутиковый аппарат у всех изученных видов
устроен однотипно. Оба жгутика отходят от основания
хоботка у Amastigomonas, или от вершины мастиго-
фора у Apusomonas. Передний (двигательный) жгутик
короткий, направлен вперед и влево; задний (рулевой,
или рекуррентный) много длиннее, направлен назад и
проходит в вентральном желобе, или бороздке. При на-
блюдении с дорсальной стороны клетки задний жгутик
очень трудно заметить, он бывает виден только при
резких поворотах особи, или откреплении клетки от
субстрата.
Оба жгутика гладкие, т.е. лишены мастигонем и
чешуек. На поверхности муфты, окружающей перед-
ний жгутик Amastigomonas bermudensis (Molina, Nerad,
1991) отмечены необычные вздутия в виде небольших
выпячиваний (рис. 210). Задний жгутик с хорошо вы-
раженной акронемой. Акронема переднего жгутика
характерна для Ар. proboscidea (Карпов, Жуков, 1984)
и Am. bermudensis (Molina, Nerad, 1991). Аксонема со-
держит обычный набор микротрубочек, соответствую-
щий формуле 9+2. Никаких параксиальных элементов
в жгутике или дополнительных структур в его переход-
ной зоне не обнаружено (Karpoff, Zhukov, 1986; Karpov,
2007). Переходная зона устроена довольно просто: по-
перечная пластинка расположена на уровне плазмалем-
мы, в нее упираются две центральные трубочки аксоне-
мы. Кинетосомы обоих жгутиков и корешковая система
апузомонад детально изучена только у Ар. proboscidea
(Karpov 2007) (рис. 209).
Кинетосомы лежат почти параллельно друг дру-
гу, но направлены в противоположные стороны. Угол
наклона одной кинетосомы по отношению к другой
немного меняется у разных особей. Иногда они рас-
полагаются практически антипараллельно (рис. 209).
Проксимальный конец кинетосом обычно косо срезан
(рис. 209). В дистальной части кинетосомы находится
полый тонкостенный цилиндр, который на поперечных
срезах выглядит как тонкая нить, связывающая ко-
роткие мостики, отходящие от А-трубочек (рис. 209).
Цилиндр не заходит в переходную зону, упираясь в по-
перечную пластинку. Проксимальная часть каждой ки-
нетосомы содержит хорошо заметную колесовидную
структуру (рис. 209).
Поскольку значительных отличий между кинетосо-
мами не обнаружено, а данные по репликации кинето-
сом отсутствуют, нельзя сказать какая из них старше,
и, следовательно, невозможно пронумеровать. Поэтому
правильнее называть их по принадлежности к тому или
иному жгутику: кинетосома переднего (КП) и кинето-
сома заднего (КЗ) жгутика соответственно. КЗ лежит
вентральнее КП и обращена дистальным концом чуть
влево и дорсально, а КП расположена почти параллель-
но продольной оси хоботка.
Обе кинетосомы связаны друг с другом фибрилляр-
ными мостиками. Наиболее заметным из них является
многослойная фибриллярная структура (МФС). Дру-
гая связка представляет собой широкий мостик между
кинетосомами с электронно-плотной палочковидной
структурой в середине.
Практически все корешки отходят от кинетосом на-
зад, поддерживая мастигофор, в котором отсутствуют
какие-либо органеллы. Три главных корешка в виде от-
дельных лент микротрубочек обычно хорошо заметны
на поперечном срезе (рис. 209, Г). Самый крупный из
них — ризостиль — проходит вдоль продольной оси
хоботка, продолжается вглубь клетки, достигая ядра.
Эта широкая лента микротрубочек на поперечных сре-
зах выглядит S-образно, микротрубочки в ленте слегка
раздвинуты и связаны между собой мостиками. Каж-
дая микротрубочка несет продольные гребни с вен-
тральной и дорсальной стороны, которые на выпуклой
дорсальной стороне ризостиля объединяются общей
пластинкой (рис. 209, Г, Е, И). В средней части корешка
от пластинки отходят длинные дорсальные нити. Ризо-
стиль начинается между кинетосомами, по-видимому,
от МФС и насчитывает от 9 в основании до 12 микро-
трубочек в самой широкой части. Ближайшая к КЗ пара
микротрубочек ризостиля ответвляется от остальных
у самого основания и формирует вентральную часть
заднего левого корешка (ЛК), который сопровождает
задний жгутик (рис. 209, Е, Е, Ж). Параллельно этой
паре микротрубочек идут две одиночные микротрубоч-
ки, которые отходят от КЗ (рис. 209, И), также сопро-
вождают задний жгутик, формируя дорсальную часть
левого корешка.
314
APUSOZOA. ОТРЯД APUSOMONADIDA
Правый корешок из микротрубочек (ПК) в виде
широкой ленты отходит от КП и непосредственно
связан с МФС; он залегает под плазматической мем-
браной правой стороны клетки (рис. 209, Г, 3, И).
В проксимальной части ПК насчитывает 11 микротру-
бочек, которые охватывают КП справа и с дорсальной
стороны. По мере приближения к основанию хоботка
количество микротрубочек в этой правой ленте посте-
пенно уменьшается до 5. С ПК связан фибриллярный
исчерченный корешок, который начинается примерно
от середины КП с правой ее стороны и продолжает-
ся по внутренней стороне правого корешка. На уров-
не кинетосомы он достигает в толщину до 90 нм, а в
задней части постепенно истончается (рис. 209, Ж).
Период исчерченности корешка составляет примерно
50 нм.
Рис. 211. Ультраструктура Amastigomonas caudate.
А — сагиттальный срез клетки и хоботка; Б — поперечный срез клетки; В — строение боковой складки вентральной бороздки (стрелка указывает на
эпиплазму под плазмалеммой, наконечник — плазмалемму вентральной бороздки); Г— срез через основания жгутиков и псевдоподию; Д— строение
хоботка и апикальной части клетки; Е — фибриллярные связки между кинетосомами; Ж — структура митохондрии, аг — аппарат Гольджи, вб —
вентральная бороздка, зж — задний жгутик, лк — левый корешок, м — митохондрия, мф — муфта, пв — пищеварительная вакуоль, пж — передний
жгутик, пк — правый корешок, пс — псевдоподия, р — ризостиль, фм — фибриллярный мостик между кинетосомами, эр — эндоплазматический
ретикулум, эт — электронно-плотное тело, связанное с ризостилем, я — ядро. Масштабная линейка (мкм): А, Д— 1, Б, Г— 0,5, В, Ж — 0,2, Е — 0,8
(ориг. А.П. Мыльникова — А, Б, Г-Ж', по: Карпов, Мыльников, 1989 — В).
APUSOZOA. ОТРЯД APUSOMONADIDA
315
Рис. 212. Схема строения клетки Amastigomonas.
а — акронема переднего жгутика, аг — аппарат Гольджи, вб — вентраль-
ная бороздка, зж — задний жгутик, кв — край вентральной бороздки,
кн — кинетосомы, м — митохондрия, р — ризостиль, х — хоботок,
эр — эндоплазматический ретикулум, эт — электронно-плотное тело,
связанное с ризостилем и диктиосомой, я — ядро. (По: Мыльников, 1989
с изменениями).
Еще один корешок из двух микротрубочек, левый
дорсальный (ЛД), начинается недалеко от КП букваль-
но между передними окончаниями ПК и фибриллярно-
го исчерченного корешка (рис. 209, И). Левый дорсаль-
ный корешок направлен дорсально и перпендикулярно
ПК, а затем поворачивает влево, образуя арку, поддер-
живающую передний конец мастигофора с дорсальной
стороны.
В самом кончике мастигофора с дорсальной сторо-
ны хорошо заметна широкая многослойная фибрилляр-
ная структура (МФС), которая, по-видимому, представ-
ляет здесь основное скелетное образование (рис. 209,
Е, И). Эта МФС дает два выроста вправо и влево, кото-
рые укрепляют переднюю часть мастигофора. В сред-
ней части МФС связана с КЗ, а правый вырост ассоции-
рован с дистальной частью КП. МФС дает начало двум
основным корешкам апузомонаса: ризостилю и ПК.
Таким образом, КП связана с двумя микротрубоч-
ковыми корешками (ПК и ЛД), а также с исчерченным
фибриллярным корешком (ПИК); КЗ связана с ризости-
лем, от которого затем ответвляются 2 микротрубочки
в левую ленту (рис. 209, И).
Отрывочные данные по другим видам апузомонад,
позволяют предположить, что их корешковая система
весьма консервативна. У всех изученных в этом от-
ношении видов от кинетосом отходят вглубь клетки 3
ленты микротрубочек, формируя ее скелет (рис. 211,
212). Поскольку корешки различаются по количеству
микротрубочек, их можно описать в виде формул, как
это принято для некоторых групп жгутиконосцев (Кар-
пов, 1988). Так, у Ар. proboscidea количество микротру-
бочек в корешках распределяется следующим образом:
4 левый — (9-12 ризостиль) — (5-9 правый) (Karpov,
Рис. 213. Участок плазмодия Amastigomonas caudata. Видны отдельные особи в центре и общие участки цитоплазмы по периферии
плазмодия.
ж — жгутики, кв — край вентральной бороздки, м — митохондрия, пв — пищеварительная вакуоль, пс — псевдоподия, я — ядро. Масштабная ли-
нейка — 3 мкм (ориг. А.П. Мыльникова).
316
APUSOZOA. ОТРЯД APUSOMONADIDA
2007). У Am. caudata, соответственно, (3—5)—(8—10)—5
(Мыльников, 1989); у Am. bermudensis'. 4—(12—16)—
(10-12) (Molina, Nerad, 1991). Жгутики Am. sp. имеют
всего два микротрубочковых корешка: 3-(7-9) (Карпов,
Мыльников, 1989). Вероятно, третий корешок редуци-
ровался в связи с небольшими размерами переднего
жгутика.
Наиболее характерной чертой корешковой системы
этих трех видов следует считать ризостиль, проходя-
щий вдоль продольной оси клетки, составляя ее осе-
вой скелет (рис. 212). Количество микротрубочек в нем
примерно одинаково у всех видов, микротрубочки свя-
заны между собой мостиками, а у Ар. proboscidea этот
корешок несет боковые фибриллярные гребни. Ризо-
стиль всех изученных видов связан с электронно-плот-
ным телом в основании хоботка (рис. 211, Д), которое,
возможно, является дериватом ризостиля.
Ядро и цитоплазматические органеллы. Важ-
ным признаком этих жгутиконосцев является и распо-
ложение единственной диктиосомы аппарата Гольджи.
Она всегда находится у основания хоботка и связана с
ризостилем (рис. 209, 211).
Митохондрии у всех видов имеют трубчатые кри-
сты (рис. 209, 211). Довольно необычные электронно-
прозрачные пузырьки в матриксе митохондрий обна-
ружены у Ар. proboscidea, но у Am. bermudensis, Ат.
caudata и Am. sp. они отсутствуют, а кристы типично
трубчатые (рис. 211, Ж). Возможно, эти отличия связа-
ны с особенностями фиксации и не имеют существен-
ного значения.
Ядро пузырьковидное с хорошо выраженным ге-
терохроматином и крупным ядрышком (рис. 209, 211).
У Ар. proboscidea оно занимает крайне заднее положе-
ние, а у видов амастигомонаса находится в передней
половине клетки.
Каналы шероховатого эндоплазматического рети-
кулума располагаются преимущественно по перифе-
рии клетки параллельно ее покровам. В результате вся
цитоплазма клетки разделяется на относительно тон-
кий слой эктоплазмы, практически лишенный каких-
либо органелл или включений, и эндоплазму, в которой
расположены митохондрии, пищеварительные вакуоли
и запасные питательные вещества в виде липидных ка-
пель. У некоторых видов отмечены в цитоплазме ми-
кротельца (Molina, Nerad, 1991).
Сократительная вакуоль найдена только у пресно-
водных видов апузомонаса, где она занимает строго
определенное положение слева от ядра (рис. 207), и
у почвенных амастигомонасов (обычно лежит в зад-
ней части клетки). Морские и солоноватоводные виды
Amastigomonas сократительной вакуоли лишены.
Необычные структуры обнаружены в цитоплазме
Am. bermudensis (Molina, Nerad, 1991). Авторы отмети-
ли толстые рыхлые пучки фибриллярных нитей, кото-
рые встречались в эндоплазме и под покровами клет-
ки. Нечто похожее отмечалось и для Ар. proboscidea
(Karpoff, Zhukov, 1986), но не в виде пучков, а в форме
сети. По толщине эти нити больше напоминают про-
межуточные, а не актиновые филаменты, но их состав
неизвестен.
Наличие одной лишь плазмалеммы в вентральной
бороздке позволяет клетке формировать псевдоподи-
альные выросты для заглатывания бактерий. Апузо-
монады способны формировать как длинные и тонкие
филоподии (характерны для Am.filosa), так и широкие
плоские ламеллиподии (у многих апузомонад). Осно-
ву тех и других составляет цитоплазма, пронизанная
сеточкой микрофиламентов (рис. 211, Г), какие-либо
органеллы здесь не встречаются, отсутствуют и микро-
трубочки.
Строение плазмодия. Плазмодии регулярно встре-
чаются в культурах Ат. caudata и Am. sp. Они образуют-
ся в результате слияния нескольких особей (рис. 213).
Возможно, небольшие плазмодии образуются при со-
вместном захвате и переваривании крупной добычи.
В центре такого плазмодия иногда видна крупная пи-
щеварительная вакуоль (Карпов, Мыльников, 1989).
При этом особи сохраняют свое ядро и набор органелл:
митохондрии, диктиосому, сократительную вакуоль
и жгутиковый аппарат. Такие картины описаны и для
апузомонаса. Таким образом, плазмодий представляет
собой несколько (иногда десятки) слившихся вентраль-
ными участками или псевдоподиями особей, сохраня-
ющих свою индивидуальность (рис. 213). В крупных
плазмодиях отдельные особи неразличимы, а жгутики
незаметны, но по периферии клетки формируются ши-
рокие ламеллиподии. Через 3-4 суток такие плазмодии
погибают. У других плазмодиев, которые снабжены
функционирующими жгутиками, возможно, проис-
ходит фрагментация. Однако полностью этот процесс
проследить не удалось. Образование плазмодиев мож-
но стимулировать повышением концентрации клеток
при помощи центрифугирования.
Стадии покоя. По некоторым данным (Vickerman
et al., 1974) Ар. proboscidea при подсыхании образует
овальные неподвижные клетки. При этом хоботок втя-
нут, а сократительная вакуоль не функционирует. Одна-
ко стенка цисты не образуется. Если такую высохшую
культуру залить средой, появляются подвижные особи.
Такие же результаты были получены на культурах
Am. caudata и Am. sp. После высыхания среды они со-
храняют жизнеспособность в течение двух недель.
Плазмодии при этом погибают, но настоящие цисты
так и не образуются. По-видимому, особи плотно при-
легают вентральной поверхностью к дну чашки Петри,
а оболочка дорсальной стороны тела оказывается до-
статочной защитой от высыхания (Карпов, Мыльников,
1989). До недавнего времени отсутствие цист у апузо-
монад считалось признаком всего отряда. Однако у од-
ного из морских клонов амастигомонаса были обнару-
жены цисты (Cavalier-Smith, Chao, 2010).
Питание
Все апузомонады активные фаготрофы. Они по-
глощают бактерии при помощи псевдоподиальных
выростов, которые образуются из вентральной борозд-
ки. Образованная плазмалеммой, ее поверхность до-
вольно подвижна. У Ар. proboscidea легко образуются
APUSOZOA. ОТРЯД APUSOMONADIDA
317
небольшие выпячивания, а также инвагинации цито-
плазмы. При передвижении жгутиконосца ползком в
желоб хоботка попадают пищевые частицы. При по-
мощи ундулирующих движений боковых складок они
проталкиваются в заднюю часть желоба, где располо-
жен вентральный карман (рис. 209, 210). В нем обра-
зуются впячивания плазмалеммы, куда попадают бак-
терии. В дальнейшем формируется пищеварительная
вакуоль.
Представители амастигомонаса обладают большей
способностью к метаболии и могут формировать срав-
нительно крупные псевдоподии (рис. 211), которые
захватывают бактерий за пределами вентральной бо-
роздки. Затем пища втягивается в эндоплазму и пере-
варивается.
Размножение
Особенности бесполого размножения изучены
только у Ар. proboscidea, который размножается бинар-
ным делением. Этот процесс исследован на светоопти-
ческом уровне (Vickerman et al., 1974) и неоднократно
наблюдался автором этой статьи.
Делятся обычно сравнительно крупные особи. Они
останавливаются, втягивают хоботок, оба жгутика и
округляются. Ядро принимает шаровидную форму, раз-
бухает и мигрирует в центр клетки. В ранней профазе
удваиваются кинетосомы жгутиков и перемещаются к
противоположным полюсам клетки. Постепенно грани-
цы ядра и ядрышко исчезают, проявляются 20-25 хро-
мосом, формирующих четкую метафазную пластинку.
К моменту расхождения хромосом становятся заметны
два подвижных жгутика, которые направлены в проти-
воположные стороны. По мере расхождения хромосом
и их последующей деспирализации формируются за-
чатки хоботков и появляются границы дочерних ядер
(Vickerman et al., 1974). Вслед за этими преобразова-
ниями начинается цитокинез. Создается впечатление,
что вытягивание шаровидной клетки в овальную с
последующим образованием перетяжки при цитоки-
незе происходит благодаря активной работе передних
жгутиков, направленных в противоположные стороны.
Задние жгутики при этом не видны. Вновь образовав-
шееся ядро расположено с правой стороны дочерней
клетки, а сократительная вакуоль слева. Хоботки до-
черних клеток становятся все заметнее, появляется
экваториальная перетяжка. Вскоре две небольшие осо-
би разрывают связывающий их цитоплазматический
мостик и становятся самостоятельными трофонтами.
Ядро перемещается к заднему полюсу клетки. Таким
образом, судя по светооптическим описаниям, деление
ядра можно назвать открытым ортомитозом. Скорость
размножения жгутиконосцев невелика. Удвоение чис-
ленности происходит за 1-2 суток.
Наличие плазмодиев в жизненном цикле морских
видов позволяет предположить, что у них возможны
парасексуальные процессы (Серавин, Гудков, 1984).
Настоящий половой процесс у этих жгутиконосцев не
обнаружен.
Экология
Апузомонады регулярно встречаются в пробах
из пресных водоемов европейской части России. Ар.
proboscidea довольно обычен в очистных сооружениях,
в частности, в аэрофильтрах, сточных канавах и пру-
дах, в том числе в мелких водоемах Каневского запо-
ведника, в озерах окрестностей пос. Дальние Зеленцы
Мурманской обл. и пос. Борок Ярославской обл. Од-
нако во всех случаях они малочисленны, поэтому их
трудно обнаружить без концентрирования пробы. Ис-
ключение составляют почвенные вытяжки, например,
из оранжерейной почвы, где численность этих жгути-
коносцев велика. Следует отметить, что морфологи-
чески почвенные и пресноводные клоны этого вида не
отличаются друг от друга.
Самая богатая фауна рода Amastigomonas харак-
терна для морских вод с пониженной соленостью
(10-20%о). Эти жгутиконосцы часто встречаются на
погруженных в морскую воду стеклах обрастаний.
Исследование проб с литорали Баренцева моря с оке-
анической соленостью 25-35%о (Мыльников, Жгарев,
1984), как и других бентосных проб в разных точках
мирового океана (Patterson et al., 1993; Ekebom et al.,
1995/1996) не выявило представителей рода Amastigo-
monas.
Таким образом, в почвенных, пресноводных и со-
лоноватоводных экосистемах, особенно, в бентосе,
апузомонады формируют экологически значимый ком-
понент фауны гетеротрофных жгутиконосцев (Arndt et
al., 2000). Среди наиболее часто встречающихся в про-
бах 20 видов гетеротрофных жгутиконосцев отмечены
три морфологических вида апузомонад (Lee, Patterson,
2000).
В лаборатории амастигомонасы хорошо развива-
ются на искусственной морской среде с добавлением
бактерий. Они плотно прилегают к твердому субстра-
ту (агару или дну чашки Петри), что легко обнаружить
при попытке смыть их струей жидкости из пипетки
(Vickerman et al., 1974, Карпов, Мыльников, 1989). По-
этому при пересеве сначала необходимо соскоблить
клетки с поверхности сосуда. Оторванные от субстрата
особи, несмотря на активную работу жгутиков, быстро
оседают на дно.
Систематика и филогения
В соответствии с современными представлениями
об эволюционном консерватизме клеточных структур
и, особенно, жгутикового аппарата, морфологические
особенности клетки считаются важными таксономи-
ческими признаками (Moestrup, 1982; Melkonian, 1984;
Карпов, 1988). В то же время хорошо известно, что
такие признаки, как гетероконтность, способность об-
разовывать плазмодии слиянием клеток встречаются в
совершенно разных неродственных группах организ-
мов, т.е. сходство по этим признакам носит характер
параллелизмов или конвергенции (Карпов, 2001; Хаус-
ман и др., 2010).
318
APUSOZOA. ОТРЯД APUSOMONADIDA
Archamoebae
Phalansterium
Plantae
Cryptophyta +
Haptophyta
Heterokonta
Apusomonadida
Amoebozoa
слизевики
.e
Opisthokonta
Multicilia
лобозные
амебы
Alveolata
Rhizaria
Excavata
Прокариоты
Eubacteria
Archaebacteria
Рис. 214. Упрощенное филогенетическое древо со всеми супергруппировками эукариот.
Показано глубокое ветвление апузомонад с неясными филогенетическими связями (отмечено пунктиром). Цифры обозначают количество кинетосом
в анцестральной кинетиде. (По: Roger, Simpson, 2009 с изменениями).
Эукариоты
С другой стороны, особенности цитоскелета проти-
ста до сих пор считаются важными таксономическими
и филогенетическими маркерами и позволяют, наряду с
молекулярной филогенией, аргументировано обсуждать
его положение в системе эукариот. Организация цито-
скелета детально описана только у одного вида апузо-
монад — Apusomonas proboscidea (Karpov 2007). Одна-
ко фрагментарные сведения по другим жгутиконосцам
позволяют предположить, что и другие апузомонады
в этом отношении устроены примерно так же. Кореш-
ковая система жгутиков, как и организация покровов,
весьма своеобразны в этой группе жгутиконосцев. По
совокупности признаков этих структур апузомонады
не похожи на других протистов. С одной стороны, они
имеют такие же покровы, как у Hemimastigophora (см.
главу Hemimastigophora), а ризостиль, как у крипто-
монад, с другой, организация цитоскелета обнаружи-
вает значительное сходство с таковой миксомицетов
(Amoebozoa) (Karpov, 2007). Эти морфологические
данные подтверждаются и молекулярно-филогенетиче-
скими схемами (Cavalier-Smith, Chao, 1995, 2003, 2010;
Kim et al., 2006; Scheckenbach et al., 2006). Ветвь апузо-
монаса лежит между двумя крупнейшими кластерами:
Amoebozoa и Opisthokonta (Roger, Simpson, 2009) (рис.
214). По наиболее представительной выборке апузомо-
нады ближе к опистоконтам, хотя эта связь считается
очень слабой (Cavalier-Smith, Chao, 2010).
Систематический обзор
Род,Apusomonas Alexeiff 1924 (рис. 208, 215, А)
Хоботок хорошо развит, состоит из мастигофора и
тонкой дистальной части. Кинетосомы жгутиков рас-
положены на дистальном конце мастигофора. Пресно-
водные и почвенные апузомонады.
Типовой вид Apusomonas proboscidea Alexeiff
1924.
Ар. proboscidea Alexeiff 1924
Syn.: Rostromonas applanata Karpoff et Zhukov
1980 (рис. 208).
Клетки сплющены дорсовентрально, причем
дорсальная сторона немного выпуклая, а вентраль-
ная слегка вогнута в передней части клетки. Особи
овальной формы, длина тела клетки 9-14 мкм, ши-
рина 6-11 мкм. Покровы ригидные на дорсальной и
частично вентральной стороне. Подвижный хоботок
примерно равен длине клетки. Передний жгутик от-
ходит от дистального конца мастигофора, его прок-
симальная часть примерно на 3Л окружена муфтой,
снаружи видна только акронема. Ядро бобовидной
формы находится сзади, а сократительная вакуоль
прилегает к ядру слева. Особи скользят по субстрату
довольно медленно, хоботок при этом вытянут впе-
ред, наиболее подвижная дистальная часть хоботка с
передним жгутиком совершает быстрые колебатель-
ные движения влево.
Ар. australiensis Ekelund et Patterson 1997
(рис. 215, A)
Apusomonas с очень подвижным хоботком и за-
метно выступающим вперед левым «плечом», так что
образует как бы воротничок вокруг основания хобот-
ка. Клетки сплющены дорсовентрально, форма особей
в виде неправильного овала, асимметрична, правая
APUSOZOA. ОТРЯД APUSOMONADIDA
319
Рис. 215. Внешний вид представителей родов Apusomonas и Amastigomonas.
А — Ар. aus traliensis, Б — Am. caudata, В — Am. mutabilis. Оптика Номарского, прижизненный препарат. Вид с дорсальной стороны. Г-Д — Am. fi-
losa. Схематический рисунок слева и прижизненная фотография (фазовый контраст) справа. Масштабная линейка (мкм): А, Б, Г, Д — 3, В — 5.
(По: Ekelund, Patterson, 1997 — А-, Жуков, 1975 — Б\ ориг. Won Je Lee, по лицензии MBL (micro*scope) — В; ориг. D.J. Patterson, по лицензии MBL
(micro* scope) — Г-Д).
сторона более закруглена, чем левая, передний конец
немного скошен. Длина клетки 6-10 мкм, ширина
5-7 мкм. Покровы ригидные на дорсальной и частич-
но вентральной стороне. Мастигофор примерно равен
длине клетки. Передний жгутик отходит от дисталь-
ного конца мастигофора, его проксимальная часть на
2/3 или 3/4 окружена муфтой. Ядро находится сзади, а
сократительная вакуоль примерно на уровне середины
клетки с левой стороны.
Обнаружен в садовых почвах университета Сид-
нея (Австралия) где встречается чаще, чем Ар. probos-
cidea.
Род, Amastigomonas de Saedeleer 1931
(рис. 215,216)
Хоботок лишен мастигофора, кинетосомы лежат в
основании хоботка на переднем конце клетки.
Пресноводные и морские.
Типовой вид Amastigomonas debruynei de
Saedeleer 1931.
Am. debruynei de Saedeleer 1931
Syn.: Thecamonas trahens Larsen et Patterson 1990;
Amastigomonas trahens Molina et Nerad 1991) (рис. 207).
Длина клетки от 5 до 8 мкм, ширина 3 мкм. Клет-
ки сплющены дорсовентрально, метаболируют, но не
проявляют амебоидного движения. Жгутики плохо за-
метны. Крючковидный хоботок длиной около 2 мкм об-
ращен влево, из него наружу выходит акронема перед-
него жгутика. Задний жгутик немного длиннее клетки,
поэтому его дистальный конец бывает заметен. Иногда
формирует хвостовые псевдоподии. Ядро расположено
в передней левой части клетки, сократительная ваку-
оль в задней части клетки. Пресноводные и почвенные
организмы.
Am. caudata Zhukov 1975 (рис. 215, Б)
Тело жгутиконосца более или менее овальное. Дли-
на особей 6-8 мкм, ширина до 3-3,5 мкм. Сзади клетки
обычно видна небольшая псевдоподия. Длина хоботка
составляет 0,8-1 мкм. На тотальных препаратах в про-
свечивающем электронном микроскопе хорошо замет-
ны небольшой хоботок, два жгутика и нитевидные об-
разования, более или менее равномерно покрывающие
тело жгутиконосца. Несмотря на интенсивную работу
хоботка, эти организмы передвигаются по субстрату
крайне медленно. По мере старения культуры в чаш-
ке появляются небольшие, до 10-30 мкм в диаметре,
плазмодии, которые в дальнейшем погибают. Обитают
в пресных, солоноватых и морских водах (Larsen, Pat-
terson, 1990; Vors, 1992; Жуков, 1993).
Am. bermudensis Molina et Nerad 1991 (рис. 210)
Особи овальной, иногда веретеновидной формы,
длина клетки 8-11,5 мкм, ширина 3-5,5 мкм; длина
хоботка — 3,5^4,5 мкм. Жгутики гладкие без акронем.
Передний жгутик бьет влево вперед изгибаясь в форме
крутой арки.
Am. mutabilis (Griessmann) Molina et Nerad 1991
(рис. 215, В)
Клетки имеют форму эллипса длиной 9-16 мкм и
шириной 4 мкм, сплющены дорсовентрально, способ-
ны метаболировать. Передний жгутик длиной около
половины клетки окружен муфтой 2,5 мкм в длину.
Задний жгутик немного длиннее клетки, несколько вы-
ступает за ее пределы. Ядро расположено субапикаль-
но ближе к правому краю клетки. Особи часто имеют
гранулы с вентральной стороны, сопровождающие за-
дний жгутик. Морские. Обнаружены в водах Австра-
лии, Бразилии, Дании, Англии, Франции, Гренландии
и в Северной Атлантике (Lee, Patterson, 2000).
320
APUSOZOA. ОТРЯД APUSOMONADIDA
Am. filosa Larsen et Patterson 1990 (рис. 215, Г, Д)
Клетки пластичны, имеют различную форму от об-
ратнояйцевидной до эллиптической, длина клетки 5,5-
7 мкм, хоботок примерно 2 мкм, из хоботка выступает
жгутик с акронемой, общая длина жгутика 5 мкм. За-
дний жгутик не выступает за пределы клетки и бывает
заметен только при резких поворотах особи. При дви-
жении клетки заметны выступающие в обе стороны ни-
тевидные псевдоподии, которые по мере продвижения
клетки вперед смещаются назад. Обнаружены только
однажды в морском бентосе тропиков.
Am. klosteris Arndt et Mylnikov 1999
(рис. 216, А, Б)
Особи уплощенные бобовидные или эллипсоид-
ные с передним и задним хоботком. Длина клетки
12-20 мкм (чаще 16-17), ширина 10-12 мкм; перед-
ний хоботок 2-3 мкм, задний — 4-5 мкм. Передний
жгутик просматривается внутри прозрачного хоботка
и достигает 4-6 мкм. Рулевой жгутик с акронемой ча-
стично проходит внутри заднего хоботка и равен 22-
32 мкм. Ядро располагается в передней части клетки.
На вентральной поверхности клетки заметны жгутико-
вый карман и вентральная бороздка. Движение особи
скользящее. Передний жгутик совершает гребные дви-
жения. Во время остановки образует тонкие псевдопо-
дии, отходящие из вентральной бороздки.
Am. klosteris отличается от остальных видов рода
Amastigomonas наличием второго заднего хоботка, эл-
липсовидной формой тела и большими. По характеру
движения напоминает A mastigomonas mutabilis (Larsen,
Patterson, 1990), а метаболией — клетки Apusomonas
proboscidea (Жуков, Мыльников, 1987). Солоновато-
водный (8-9%о). Впервые обнаружен в бентосной про-
бе на глубине 0,4 м на литорали Балтийского моря,
вблизи г. Клостер, о-в Хиддензее (ФРГ).
Am. gigantea Mylnikov 1999 (рис. 216, В, Г)
Клетки овальные, уплощенные, метаболирующие,
с заостренным передним и задним концами. Длина
тела клетки равна 23-25, ширина 10-18 мкм. Перед-
ний жгутик длиной 18-20 мкм проксимально прохо-
дит внутри небольшого хоботка и далее свободно. Он
совершает частые взмахи. Хоботок равен 2,0^4,5 мкм.
Задний жгутик длиной 45-50 мкм своей проксималь-
ной частью проходит внутри хорошо заметной вен-
тральной продольной бороздки и за пределами клетки
постепенно дистально утончается, образуя акронему.
На поверхности клетки располагаются слева три и
справа один ряд мелких гранул, а в центре два круп-
ных пятна. Ядро находится около основания хоботка.
Во время метаболии клетка изменяет свою форму, не
образуя латеральных псевдоподий. Единственная узкая
псевдоподия отходит сзади. Иногда она настолько тон-
кая, что ее можно ошибочно принять за второй задний
жгутик. Движение быстрое, скользящее, с частыми по-
воротами. Отличается от других известных видов рода
Amastigomonas наиболее крупными размерами, на-
личием очень длинных жгутиков и рядов мелких гра-
нул. Сходен с Am. mutabilis формой клетки и хорошо
заметной вентральной бороздкой (Griessmann, 1913;
Ruinen, 1938; Larsen, Patterson, 1990). Солоноватовод-
ный (8-9%o). Впервые обнаружен в бентосной пробе на
глубине 0,4 м на литорали Балтийского моря, вблизи
г. Клостер, о-в Хиддензее (ФРГ).
Am. griebenis Mylnikov 1999 (рис. 216, Д-З)
Особи овальные уплощенные, длиной 5-7, шири-
ной 2-3 мкм. На переднем конце клетки находится не-
большой хоботок, внутри которого проходит передний
жгутик. У некоторых особей хоботок не виден. Ядро
находится вблизи основания хоботка. Сократительная
вакуоль отсутствует. В цитоплазме расположено не-
сколько темных гранул. Метаболия тела заметна при из-
менении движения клетки. Покровы ригидные. Длина
переднего жгутика равна 1,6-2,5, длина заднего, имею-
щего акронему, равна 9-14 мкм. Хоботок равен 0,5-0,7
мкм. Задняя псевдоподия обычно нитевидная, реже
широкая. Задний жгутик соединен с вентральной по-
верхностью клетки, что заметно при поворотах клетки.
Псевдоподии формируются из вентральной бороздки.
Этот вид, как и два вида Amastigomonas caudata и
A. debruynei (Жуков, 1971; Hamar, 1979), имеют сход-
ные размеры и форму клеток. В отличие от последних
двух, рассматриваемый вид A. griebenis отличается бо-
лее длинными жгутиками, малозаметным хоботком и
отсутствием латеральных псевдоподий.
Солоноватоводный (8-9%о). Впервые обнаружен в
бентосной пробе на глубине 0,5 м на литорали Балтий-
ского моря, вблизи г. Грибен, о-в Хиддензее (ФРГ).
Am. muscula Mylnikov 1999 (рис. 216, И-Л)
Клетка удлиненно-овальная и покрыта уплотнен-
ными покровами. Задний конец тела заострен. Длина
тела клетки 7-8, ширина — 2,8-3,5 мкм. Небольшой
подвижный хоботок, длиной 0,7-1 мкм располагает-
ся субапикально. Передняя треть клетки отделена от
задней части перетяжкой. Передний жгутик не выхо-
дит за пределы хоботка, задний жгутик без акронемы,
длиной 12-13 мкм. Небольшая узкая псевдоподия, ох-
ватывающая задний жгутик, отходит сзади. Движение
быстрое скользящее с частыми поворотами и редкими
остановками. Во время движения клетки заметно, что
тело клетки покрыто упругой плотной оболочкой, раз-
деленной поперечной гибкой перетяжкой на две не-
равные части. Внутри клетки заметны мелкие гранулы.
Пищеварительные вакуоли не видны, возможно, из-за
плотной оболочки клетки. Цитостом и сократительная
вакуоль не найдены.
Отличается от других представителей рода Amasti-
gomonas плотными покровами, разделенными попереч-
ной перетяжкой. Такая перетяжка неизвестна у других
Amastigomonas. Этот вид напоминает Amastigomonas
marina формой и размерами тела (Мыльников, 1989;
Карпов, Мыльников, 1989), но в отличие от него не об-
разует латеральных псевдоподий и не имеет длинного
переднего жгутика, выходящего за пределы хоботка.
APUSOZOA. ОТРЯД APUSOMONADIDA
321
Солоноватоводный (8-9%o). Впервые обнаружен в
бентосной пробе на глубине 0,5 м на литорали Балтий-
ского моря, вблизи г. Грибен, о-в Хиддензее (ФРГ). От-
носится к редким видам.
Am. marina Mylnikov 1999 (рис. 216, М-О)
Syn.: Cercomonas marina Mylnikov 1989.
Клетки сильно метаболирующие, амебоидные,
овальные или удлиненно-овальные. Длина тела клет-
ки 5-8, ширина 2-4 мкм. Передний жгутик длиной
3-5 мкм проходит внутри хоботка, задний жгутик дли-
ной 8-16 мкм частично проходит внутри вентральной
бороздки. Образует плазмодии.
Отличается от известных видов Amastigomonas
длинным передним жгутиком и способностью в ре-
зультате слияния клеток образовывать плазмодии.
Ранее был описан как представитель рода Cercom-
onas (Мыльников 1989). Однако изучение его ультра-
структуры показало, что этот организм имеет характер-
ные для представителей рода Amastigomonas покровы,
вентральную бороздку с боковыми складками и хобо-
ток (Мыльников, 1990).
Отмечен на литорали Баренцева, Черного и Бал-
тийского морей при солености 7-22%о (Мыльников,
1999).
Рис. 216. Внешний вид представителей рода Amastigomonas.
А-Б — A. klosteris-, В, Г—A. gigantea, Д-З — A. griebenis, И-Л — A. muscula, М-0 — A. marina, вб — вентральная бороздка, гр — гранулы, зж — за-
дний жгутик, пж — передний жгутик, пс — псевдоподия, пт — перетяжка, х — хоботок, я — ядро. Масштабная линейка (мкм): А-3 — 10; И-0 — 5.
(По: Мыльников, 1999, с изменениями).
322
APUSOZOA. ОТРЯД ANCYROMONADIDA
Отряд Ancyromonadida Cavalier-Smith 1997
Гетеротрофные гетероконтные жгутиконосцы с малоза-
метным передним и относительно длинным задним жгутика-
ми, каждый из которых выходит из отдельного кармана, а не
из общего, как у большинства жгутиконосцев. Размеры особи
обычно не превышают 10 мкм. Карман заднего жгутика перехо-
дит в желобок на вентральной поверхности. Перегородка между
карманами продолжается дорсально в форме рострума, в кото-
ром находятся экструсомы. Плазмалемма подостлана тонким
плотным слоем эпиплазмы. Митохондрии с пластинчатыми кри-
стами. Передвигаются эти бактериотрофы, скользя по субстрату.
Обитают в морских и солоноватых водах, а также гиперсоленых
биотопах.
История изучения
и классификация
Ancyromonas sigmoides был описан Сэвилом Кен-
том (Kent, 1880), а современное понимание рода Ancy-
romonas было дано Ханелем (Hanel, 1979). С тех пор
его представители были обнаружены повсеместно,
поскольку являются обычными обитателями самых
различных экотопов. Особый интерес вызывает изо-
лированное положение сиквенсов рРНК этого рода на
филогенетических схемах (рис. 206).
Ультратонкое строение клетки впервые было из-
учено у A. sigmoides (правда, под другим названи-
ем — Heteromita sp.) А.П. Мыльниковым (Мыльников,
1990).
Т. Кавалье-Смит с соавторами (Cavalier-Smith et
al., 2008) существенно расширил видовой состав рода,
опубликовал данные по ультраструктуре еще одного
вида A. micra и провел таксономическую ревизию ан-
циромонад. В результате он пришел к выводу, что все
современные описания Ancyromonas были, на самом
деле, описаниями совершенно других организмов, от-
личных от анциромонаса Кента, поскольку Кент опи-
сал прикрепленный организм, а во всех современных
работах изучались подвижно-скользящие формы, кото-
рые, к тому же, отличаются морфологически от анци-
ромонаса Кента. Поэтому Т. Кавалье-Смит объединил
все современные виды в новый род Planomonas, кото-
рый включает несколько видов. Спустя два года после-
довал детальный разбор этой статьи (Heiss et al., 2010),
в котором авторы показали, что представления об анци-
ромонасе как только о неподвижно прикрепленном ор-
ганизме, а планомонасе, как только о подвижно сколь-
зящем, неверны, т.к. в первоописании анциромонаса
указано, что он способен и прикрепляться к субстрату,
и передвигаться. Кроме того, отличия формы тела и
размеров оказались несущественны. Поэтому авторы
статьи считают имя Planomonas младшим синонимом
Ancyromonas, a Planomonas mylnikovi младшим синони-
мом Ancyromonas sigmoides. В результате, по послед-
ней ревизии род Ancyromonas включает: A. sigmoides,
A. cephalopora, A. melba, A. sinistra, A. micra, A. howeae
и A. limna (Heiss et al., 2010).
В настоящей главе принята эта последняя класси-
фикация, а отряд Planomonadida, семейство Planomona-
didae и род Planomonas признаются, вслед за авторами
статьи, недействительными.
Морфология и биологические
особенности
Строение клетки изучено только у типового вида
Ancyromonas sigmoides (Мыльников, 1990; Heiss et al.,
2010) (рис. 217).
Покровы жгутиконосца очень похожи на таковые
апузомонад и гемимастигин: под плазматической мем-
браной расположен плотный и тонкий слой эпиплазмы,
а снаружи мембраны лежит толстый слой гликокаликса
(рис. 217). На апикальном конце клетки имеется ро-
струм, в котором находится батарея экструсом — ки-
нетоцист (рис. 217, 218). Ядро расположено ближе к
спинной стороне клетки и занимает ее большую часть.
Диктиосома аппарата Гольджи лежит вентрально от
ядра. Митохондрии имеют пластинчатые кристы, что
существенно отличает их от апузомонад. У анциро-
монаса отсутствует и характерный для апузомонад
хоботок. По строению цитоскелета, который детально
изучен у Ancyromonas sigmoides (Heiss et al. 2010), у
них также мало общего: у анциромонаса отсутствуют
наиболее характерные черты апузомонаса (ризостиль и
многослойная фибриллярная структура), а корешковая
система более напоминает таковую церкомонад. Авто-
ры статьи обнаруживают гомологию некоторых жгу-
тиковых корешков этого вида с корешками типичных
экскават (Heiss et al., 2010).
Таким образом, эти две группы жгутиконосцев объ-
единяет только один неоспоримый морфологический
признак — своеобразные покровы.
Питаются жгутиконосцы фаготрофно. Детали этого
процесса не прослежены, но показано, что захват пищи
осуществляется в районе вентрального углубления, в
которое переходит карман заднего жгутика. В этой зоне
отсутствует эпиплазма, и клетка способна формировать
короткие псевдоподии для захвата бактерий. В цито-
плазме обычно обнаруживаются пищеварительные ва-
куоли с бактериями на разных стадиях переваривания.
Особенности размножения жгутиконосцев не изучены.
Систематический обзор
Отряд Ancyromonadida Cavalier-Smith
1997
Сем. Ancyromonadidae Cavalier-Smith 1993
Род Ancyromonas (Saville Kent) Heiss,
Walker et Simpson 2010
Клетки мелкие до 10 мкм длиной, овальной или
бобовидной формы сплющены дорсовентрально. На
APUSOZOA. ОТРЯД ANCYROMONADIDA
323
Рис. 217. Ультратструктура и схематические изображения Ancyromonas sigmoides.
А — продольный срез клетки; Б— строение ядра, митохондрии и кинетосом жгутиков; В — продольный срез кинетоцист рострума; Г— структура
покровов (стрелкой показан плотный слой эпиплазмы под плазматической мембраной); Д— поперечный срез жгутика внутри жгутикового кармана;
Е — схема строения клетки; Ж— строение корешковой системы жгутиконосца, аг — аппарат Гольджи, апж — акронема переднего жгутика, зж — за-
дний жгутик, зк1-зкЗ — задние корешки 1-3, зс — задний синглет, кз — кинетосома заднего жгутика, кн — кинетосомы, кп — кинетосома переднего
жгутика, м — митохондрия, мт — микротельце, пв — пищеварительная вакуоль, пж — передний жгутик, пк — передний корешок, пс — передний
синглет, р — рострум с кинетоцистами, сс — серповидная структура, от которой отходят три синглета микротрубочек и зк2, я — ядро. Масштабная
линейка: А, Б— 1 мкм, В — 200 нм, Г— 100 нм, Д— 400 нм. (По: Мыльников, 1990 —Л, Е; ориг. A. Heiss — Б-Д, Ж).
324
APUSOZOA. ОТРЯД ANCYROMONADIDA
Рис. 218. Внешний вид представителей рода Ancyromonas.
А — A. sigmoides^ Б — A. micra; В — A. howeae; Г— A. sinistra'^— A. cephalopora; Е — A. melba. А-В — оптика Номарского. Угадывается передний
жгутик (акронема). Масштабная линейка — 5 мкм. (По: Heiss et al., 2010 — Л; Cavalier-Smith et al., 2008 — Б-B; Al-Qassab et al., 2002 — Г; Larsen,
Patterson, 1990 —Д; Tong et al., 1998 — E).
переднем конце находится рострум, который резко за-
гибается латерально или назад, с двумя рядами экстру-
сом. Каждый из двух жгутиков выходит из собственного
углубления или кармана, которые лежат по обе стороны
рострума. Передний жгутик короткий, часто малозаме-
тен, т.к. полностью или частично представлен только
акронемой. Задний жгутик обычно в полтора-два с по-
ловиной раза длиннее клетки, его проксимальная часть
проходит в узкой неглубокой бороздке на поверхности
клетки, а дистальная часть свободна. Особи передвига-
ются плавно скользя на прилегающем к субстрату за-
днем жгутике. Покровы усилены слоем плотного мате-
риала подстилающего большую часть поверхностной
мембраны. В составе рода насчитывается семь видов.
Типовой вид: Ancyromonas sigmoides (Saville Kent)
Heiss, Walker et Simpson, 2010.
A. sigmoides (Saville Kent) Heiss,
Walker et Simpson 2010 (рис. 218,4)
Syn.: Planomonas mylnikovi Cavalier-Smith 2008.
Особи бобовидной формы длиной 4-5 мкм, ши-
риной 3-4 мкм, сплющены дорсовентрально. Рострум
узкий с эктрусомами. Передний жгутик почти весь
представлен акронемой, за пределы клетки выступает
в виде тонкого прямого еле заметного волоска длиной
менее микрона. Задний жгутик примерно в два раза
длиннее тела, иногда до половины его длины занимает
акронема. Обитает в морских и солоноватых водах. От-
мечен только в северном полушарии.
A. cephalopora (Larsen et Patterson) Heiss,
Walker et Simpson 2010 (рис. 218, Д)
Bas.: Bodo cephalopora Larsen et Patterson 1990.
Syn.: Planomonas cephalopora (Larsen et Patterson)
Cavalier-Smith 2008.
Диаметр почти шаровидной клетки 7-8 мкм ро-
струм широкий с 6-8 экструсомами, расположенными
в два ряда, задний жгутик длиной 15-20 мкм, всегда
с акронемой, которая составляет четверть его длины.
Передний жгутик равен длине тела, но значительно
APUSOZOA. ОТРЯД ANCYROMONADIDA
325
тоньше заднего. Основание заднего жгутика лежит в
поперечной бороздке, а сам жгутик плавно изгибает-
ся и во время движения направлен назад. Вентральная
поверхность клетки за пределами жгутикового кармана
выпуклая.
Обитает в морских осадках.
A. melba Patterson et Simpson 1996
(рис. 218, E)
Syn.: Ancyromonas magna (Tong et al.); Planomonas
melba (Patterson et Simpson) Cavalier-Smith 2008.
Овальные особи длиной 4-7 мкм, оба жгутика оди-
наковой толщины, акронема переднего короткая, задне-
го варьирует от довольно заметной до полного исчезно-
вения. Длина заднего жгутика составляет 1,5-2 длины
тела. Обнаружен в очень соленой среде (60-150%о).
A. sinistra Al-Qassab et al. 2002
(рис. 218, Г)
Syn.: Planomonas sinistra (Al-Qassab et al.) Cava-
lier-Smith 2008.
Особи круглые, сплющены дорсовентрально без
заметного рострума, диаметром 5-6 мкм, передний
жгутик очень тонкий (по-видимому, видна только акро-
нема) длиной 7 мкм, задний в 2-2,5 раза превышает
длину клетки, с акронемой. Левый передний край клет-
ки складчатый. Обитают в морской и гиперсоленой
(67%о) среде.
A. micra (Cavalier-Smith) Heiss,
Walker et Simpson 2010 (рис. 218, Б)
Bas.: Planomonas micra Cavalier-Smith 2008.
Длина клетки почти равна ширине, примерно
4 мкм, рострум широкий с хорошо заметными экс-
трусомами, расположенными двумя рядами по три.
Задний жгутик длиной 10 мкм, обычно с акронемой,
при движении клетки отходит почти перпендикулярно
и отгибается назад примерно под 45° к заднему концу
тела с правой его стороны. Дорсальная сторона карма-
на заднего жгутика заметно выступает в виде широ-
кого конического выроста. Вентральная поверхность
позади жгутикового кармана немного вогнута, сокра-
тительная вакуоль отсутствует. Цисты не образует.
Морские.
A. howeae (Cavalier-Smith) Heiss,
Walker et Simpson 2010 (рис. 218, В)
Bas.: Planomonas howeae Cavalier-Smith 2008.
Тело бобовидной формы 4-5 мкм в длину и 3-4 мкм
в ширину, рострум узкий с экструсомами, задний жгу-
тик длиной 7 мкм с небольшой акронемой или без нее,
передний длиной 1,7-2,8 мкм очень тонкий трудно раз-
личимый в световой микроскоп. Сократительная ваку-
оль рядом с кинетосомами. Пресноводный. Клетки во
время движения часто останавливаются, «клюя носом»
за счет резкого изгиба заднего жгутика в проксималь-
ной части.
А. Птпа (Cavalier-Smith) Heiss,
Walker et Simpson 2010
Bas.: Planomonas limna Cavalier-Smith 2008.
Этот вид очень похож на предыдущий по морфо-
логии и обитанию, а отличие гена малой субъединицы
рРНК от Ancyromonas howeae составляет всего один
нуклеотид. Возможно, эти виды конспецифичны, но
чтобы это утверждать, необходимо проверить сиквен-
сы других генов.
Ancyromonas contorta (Klebs) Lemmerman 1913
является младшим синонимом Phyllomonas contorta
Klebs 1892, поэтому исключен из состава рода Ancy-
romonas до новых исследований (Cavalier-Smith et al.,
2008; Heiss et al., 2010)
Отряд Micronucleariida Cavalier-Smith 2008
Эти очень мелкие амебоидные организмы впервые
были обнаружены в очистных сооружениях п. Борок
Ярославской области, изучены и описаны сравнитель-
но недавно (Mikrjukov, Mylnikov, 2001). В дальнейшем
оказалось, что эти амебы широко представлены в засолен-
ных почвах Австралии, и, по-видимому, являются обыч-
ными обитателями почвы. По внешнему виду и пластин-
чатым кристам митохондрий авторы отнесли их к отряду
Rotosphaerida Rainer, 1968.
Морфология и физиология
Ультраструктура М. podoventralis изучена в той же
единственной работе (Mikrjukov, Mylnikov, 2001). По-
верхность клетки покрыта рыхлым слоем гликокаликса
толщиной около 50-70 нм, который авторы называют
гликостилями, хотя четких упорядоченных структур
гликокаликс не образует. Плазмалемму подстилает тон-
кий слой эпиплазмы (4-5 нм), расположенный на глу-
бине примерно 10 нм.
Ядро пузырьковидное с центральным ядрышком
смещено к дорсальной стороне, место выхода филопо-
дий и вакуоль лежат, таким образом, вентрально.
Цитоплазма содержит мелкие и крупные вакуо-
ли преимущественно на вентральной стороне клетки.
Единственная довольно крупная диктиосома аппарата
Гольджи прилегает к ядру. Несколько митохондрий с
пластинчатыми кристами распределены по периферии
клетки.
Поскольку сократительной вакуоли авторы не об-
наружили, то предположили, что ее функции выполня-
326
APUSOZOA. ОТРЯД MICRONUCLEARIIDA
Рис. 219. Внешний вид и схема внутреннего строения Micronuclearia podoventrails. А — флотирующая форма; Б— ползающая форма;
В — схема строения клетки, аг — диктиосома, бв — базальная вакуоль, бс — боковая складка, м — митохондрия, ф — филоподия, эп —
эпиплазма, я — ядро. (По: Mikijukov, Mylnikov, 2001).
ет крупная вентральная вакуоль, к которой прилегают,
иногда сливаясь с ней мелкие везикулы. Таким образом,
формируется, по-видимому, спонгиом. Содержимое ва-
куоли должно изливаться в неглубокое углубление на
вентральной стороне. Если это так, то здесь должна
быть специальная пора, т.к. плазмалемма подстилается
эпиплазмой, которая должна препятствовать слиянию
вакуоли с плазматической мембраной. Экструсомы от-
сутствуют. В пищеварительных вакуолях видны бакте-
рии на разных стадиях деградации. Филоподии, одна
или несколько, обычно ветвятся. Авторы показали, что
бактерии захватываются в основании филоподий. Осо-
бенности внутреннего строения филоподий авторы не
обсуждали, однако, судя по электронограммам, в них
заметны профили микротрубочек (Mikrjukov, Mylnikov,
2001, fig. 2 С-Е).
Размножение
М. podoventralis размножается бинарным делени-
ем, причем, авторам удалось показать две стадии ми-
тоза: профазу и метафазу. В профазе диктиосома удва-
ивается, и они расходятся к полюсам ядра. Ядрышко в
профазе исчезает, а внутри ядра видны микротрубочки
веретена. В метафазе хромосомы конденсируются и
образуют нормальную метафазную пластинку, а обо-
лочка ядра распадается на мелкие везикулы. Таким
образом, деление ядра идет по типу открытого орто-
митоза. Строение ЦОМТа веретена не изучено. Хотя
авторы описывают фибриллярную структуру, которая
ассоциирована с диктиосомой, но приведенная в рабо-
те электронограмма полного представления о ЦОМТе
не дает.
Половой процесс, а также цисты не обнаружены.
Филогения и систематика
Micronuclearia отнесена авторами к отряду Rotos-
phaerida на том основании, что она имеет ветвящиеся
филоподии и пластинчатые кристы в митохондриях.
Это мнение кажется малообоснованным, поскольку
ротосфериды включают филозных амеб с кремнезем-
ными чешуйками на поверхности клетки (см. главу
Солнечники наст, издания). Кроме того, Micronuclearia
отличается по типу митоза от входящих в состав отряда
нуклеариид, имеющих закрытый ортомитоз.
Вместе с тем, микронуклеария по ряду признаков
похожа на анциромонас: пластинчатые кристы в ми-
тохондриях, подстилающий плазмалемму слой эпи-
плазмы, наличие вентральной бороздки, где идет фа-
APUSOZOA. ОТРЯД MICRONUCLEARIIDA
327
гоцитоз. На молекулярно-филогенетических схемах
микронуклеария не группируется с нуклеариидами,
но иногда сиквенсы ее генов формируют сестринскую
группу сиквенсам анциромонаса (рис. 206).
Таким образом, до проведения новых исследова-
ний этой амебы разумно оставить ее в составе типа
Apusozoa.
Систематический обзор
Отряд Micronucleariida Cavalier-Smith
2008
Безжгутиковые фаготрофные простейшие с пла-
стинчатыми кристами в митохондриях и однослойной
пластинкой (слоем эпиплазмы) под плазмалеммой, по-
крывающей сильно выпуклую поверхность клетки за
исключением вентральной бороздки1, из которой фор-
мируются ветвящиеся псевдоподии для прикрепления
клетки к субстрату. Центриоли отсутствуют.
1 Здесь допущена неточность: вентральная бороздка микронукле-
арии так же, как и вся поверхность клетки, усилена этим слоем эпиплаз-
мы (см. Mikrjukov, Mylnikov, 2001). — Прим. авт.
Сем. Micronucleariidae Cavalier-Smith 2008
Диагноз как у отряда.
Род Micronuclearia Mikrjukov et Mylnikov 2001
Нуклеариидная амеба с ветвящимися нитевидны-
ми псевдоподиями, которые выходят из одной опре-
деленной зоны на поверхности клетки. Типовой вид:
М. podoventralis Mikrjukov et Mylnikov 2001.
M. podoventralis Mikrjukov et Mylnikov 2001 (рис. 219)
Шаровидная амеба диаметром 4,2-5,5 мкм, прак-
тически не меняет свою форму и чаще всего образу-
ет одну ветвящуюся филоподию длиной в 3-4 раза
превышающую размер клетки. Место выхода фило-
подии слегка вогнуто и более ригидно по сравнению
с остальной поверхностью клетки. В этой части ци-
топлазмы всегда присутствует крупная вакуоль. Ядро
расположено дорсально. Сократительная вакуоль не
обнаружена. Филоподии флотирующих форм обра-
щены к субстрату, а у ползающих направлены вперед.
Филоподии служат для захвата бактерий, которыми
питаются амебы.
SUMMARY
The morphology, physiology, history of study, ecology, phy-
logeny and taxonomic overview of species of the order Apuso-
monadida Karpov et Mylnikov 1989, genera Ancyromonas Kent
1882 and Micronuclearia Mikrjukov et Mylnikov 2001 have been
described in the frame of paraphyletic phylum Apusozoa. They
have a thin layer of epiplasm under the plasma membrane and the
ventral furrow producing pseudopodia for feeding. No other com-
mon morphological characters were found. Sequences of these taxa
weekly group together, having deep branches between Amoebozoa
and Opisthokonta. Apusomonadida includes two genera Apusomo-
nas and Amastigomonas. Division of the latter genus in 5 separate
genera (Multimonas, Folimonas, Thecamonas, Podomonas, Man-
chomonas} according to Cavalier-Smith and Chao (2010) was not
accepted here.
ЛИТЕРАТУРА
Жуков Б.Ф. 1971. Определитель бесцветных свободноживущих
жгутиконосцев подотряда Bodonida Hollande // Биология и продуктив-
ность пресноводных организмов. Л.: Наука. С. 241-284.
Жуков Б.Ф. 1975. Amastigomonas caudata sp. п. (подотряд Bodonina
Holl., отряд Kinetoplastia Honigberg, класс Zoomastigophorea Calkins, Pro-
tozoa) // Биол. внутр, вод. Информ, бюл. №19. С. 25-26.
Жуков Б.Ф. 1993. Атлас пресноводных гетеротрофных жгутико-
носцев (биология, экология и систематика). Рыбинск: Ин-т биологии
внутр, вод РАН.
Жуков Б.Ф., Мыльников А.П. 1987. Новые и редкие виды бесц-
ветных жгутиконосцев в фауне Европейской части СССР // Фауна и био-
логия пресноводных организмов. Л.: Наука. С. 70-86.
Карпов С.А. 1988. Строение жгутиковых корешков у подвижных
клеток водорослей, грибов и бесцветных жгутиконосцев // Цитология.
Т. 30. №4. С. 371-389.
Карпов С.А. 2001. Строение клетки протистов. СПб.: Тесса.
Карпов С.А., Жуков Б.Ф. 1980. Новый представитель пресновод-
ной фауны бесцветный жгутиконосец Rostromonas applanata gen. et sp. n.
(Zoomastigophorea, Protozoa) // Зоол. журн. T. 59. № 11. С. 1733-1734.
Карпов С.А., Жуков Б.Ф. 1984. Ультратонкое строение бесцвет-
ного жгутиконосца Apusomonas proboscidea II Цитология. Т. 26. № 8.
С. 886-890.
Карпов С.А., Мыльников А.П. 1989. Биология и ультраструктура
бесцветных жгутиконосцев Apusomonadida ord. n. // Зоол. журн. Т. 68.
№8. С. 5-17.
Мыльников А.П. 1989. Ультратонкое строение жгутиконосца
Amastigomonas caudata II Цитология. Т. 31. № 4. С. 489-491.
Мыльников А.П. 1990. Строение клеток жгутиконосца Сегсото-
nas marina И Биол. внутр, вод. Информ.бюл. № 85. С. 37-41.
Мыльников А.П. 1999. Новые солоноватоводные амебоидные
жгутиконосцы рода Amastigomonas (Apusomonadida, Protozoa) // Зоол.
журн. Т. 78. № 7. С. 771-777.
Мыльников А.П., Жгарев Н.А. 1984. Жгутиконосцы литорали
Баренцева моря и пресноводных водоемов // Биол. внутр, вод. Информ,
бюл. № 63. С. 54-57.
Серавин Л.Н., Гудков А.В. 1984. Возможные формы агамных ге-
нетических взаимоотношений у протистов и пути становления полового
процесса // Цитология. Т. 26. № 11. С. 1224-1236.
Хаусман К., Хюльсман Н., Радек Р. 2010. Протистология: Руко-
водство. М.: Т-во научных изданий КМК. 495 с.
Adi S.M., Simpson A.G.B., Farmer М.А., Andersen R.A., Ander-
son O.R., Barta J., Bowser S., Brugerolle G., Fensome R., Fredericq S.,
James T.Y., Karpov S.A., Kugrens P., Krug J., Lane C., Lewis L.A.,
Lodge J., Lynn D.H., Mann D., McCourt R.M., Mendoza L., Moe-
strup 0., Mozley-Standridge S.E., Nerad T.A., Shearer C., Smirnov A.V.,
Spiegel F., Taylor F.J.R. 2005. The New Higher Level Classification of Eu-
karyotes with Emphasis on the Taxonomy of Protists // J. Euk. Microbiol.
Vol. 52. No. 5. P. 399-432.
Alexeieff A. 1924. Notes sur quelques protistes coprocoles // Arch. Pro-
tistenkd. Bd 50. S. 27-49.
328
APUSOZOA
Al-Qassab S., Lee W.J., Murray S., Simpson A.G.B., Patterson D.J.
2002. Flagellates from stromatolites and surrounding sediments in Shark Bay,
Western Australia // Acta Protozool. Vol. 41. P. 91-44.
Arndt H., Dietrich D., Auer B., Cieven E.J., Grafenhan T., Wei-
tere M. 2000. Functional diversity of heterotrophic flagellates in aquatic eco-
systems // B.S.C. Leadbeater, J. Green (eds). The flagellates. N.Y.: Taylor and
Francis. P. 240-268.
Atkins M.S., McArthur A.G., Teske A.P. 2000. Ancyromonadida: a
new phylogenetic lineage among the protozoa closely related to the common
ancestor of metazoans, fungi and choanoflagellates (Opisthokonta) // J. Mol.
Evol. Vol. 51. P. 278-285.
Cavalier-Smith T. 1993. The protozoan phylum Opalozoa // J. Euk. Mi-
crobiol. Vol. 40. P. 609-615.
Cavalier-Smith T. 2002. The phagotrophic origin of eukaryotes and
phylogenetic classification of Protozoa // IJSEM. Vol. 52. P. 297-354.
Cavalier-Smith T., Chao E.E. 1995. The opalozoan Apusomonas is re-
lated to the common ancestor of animals, fungi, and choanoflagellates // Proc.
R. Soc. bond. В Biol. Sci. Vol. 261. P. 1-6.
Cavalier-Smith T., Chao E.E. 2003. Phylogeny of Choanozoa, Apuso-
zoa, and other Protozoa and early eukaryote megaevolution // J. Mol. Evol.
Vol. 56. P. 540-563.
Cavalier-Smith T., Chao E.E. 2010. Phylogeny and evolution of
Apusomonadida (Protozoa: Apusozoa): new genera and species // Protist.
Vol. 161. P. 549-576.
Cavalier-Smith T., Chao E.E.-Y., Stechmann A., Oates B., Nikolaev
S. 2008. Planomonadida ord. nov. (Apusozoa): ultrastructural affinity with
Micronuclearia podoventralis and deep divergences within Planomonas gen.
nov. // Protist. Vol. 159. P. 535-562.
Ekebom J.E., Patterson D.J., Vors N. 1995/96. Heterotrophic flagel-
lates from coral reef sediments (Great Barrier Reef. Australia) // Arch. Pro-
tistenkd. Bd 146. S. 251-272.
Ekelund F., Patterson D.J. 1997. Some heterotrophic flagellates from
a cultivated garden soil in Australia //Arch. Protistenkd. Bd 148. S. 461-478.
Foissner W., Blatterer H., Foissner I. 1988. The Hemimastigophora
(Hemimastix amphikineta nov. gen., nov. spec.), a new protistan phylum from
Gondwanian soils // Eur. J. Protistol. Vol. 23. P. 361-383.
Griessmann K. 1913. Uber marine Flagellaten // Arch. Protistenkd.
Bd 32 (year 1914). S. 1-78.
Hamar J. 1979. Some new zooflagellates from Hungary // Tiscia.
Vol. 14. P. 147-162.
Hanel K. 1979. Systematik und Okologie der farblosen Flagellaten des
Abwassers//Arch. Protistenkd. Bd 121. S. 73-137.
Heiss A.A., Walker G., Simpson A.G.B. 2010. Clarifying the taxonom-
ic identity of a phylogenetically important eukaryotes: Planomonas is a junior
synonym of Ancyromonas 11 J. Euk. Microbiol. Vol. 57. No. 3. P. 285-293.
Karpoff S.A., Zhukov B.F. 1986. Ultrastructure and taxonomic posi-
tion of Apusomonas proboscidea Alexeieff // Arch. Protistenkd. Bd 131.
No. 1-2. S. 13-26.
Karpov S.A. 2007/8. The flagellar apparatus structure of Apusomonas
proboscidea and apusomonad relationships // Protistology. Vol. 5 No. 2/3.
P. 146-155.
Kim E., Simpson A.G.B., Graham L.E. 2006. Evolutionary relation-
ships of apusomonads inferred from taxon-rich analyses of six nuclear-encod-
ed genes // Mol. Biol. Evol. Vol. 23. P. 2455-2466.
Larsen J., Patterson D.J. 1990. Some flagellates (Protista) from tropi-
cal marine sediments // J. Nat. Hist. Vol. 24. P. 801-937.
Lee W.J., Patterson D.J. 2000. Heterotrophic flagellates (Protista) from
marine sediments of Botany Bay, Australia // J. Nat. Hist. Vol. 34. P. 483-562.
Melkonian M. 1984. Flagellar apparatus ultrastructure in relation to
green algae classification // Systematics of the green algae. Orlando: Acad.
Press. Vol. 7. P. 3-120.
Mikrjukov K.A., Mylnikov A.P. 2001. A study of the fine structure
and mitosis of a lamellicristate amoeba, Micronuclearia podoventralis gen.
et sp. nov. (Nucleariidae, Rotosphaerida) // Eur. J. Protistol. Vol. 37. P. 15-24.
Moestrup 0. 1982. Flagellar structure in algae: a review with new ob-
servations particularly on the Chrysophyceae, Phaeophyceae (Fucophyceae),
Euglenophyceae and Reckertia H Phycologia. Vol. 21. P. 427-528.
Molina F.L, Nerad T.A. 1991. Ultrastructure of Amastigomonas ber-
mudensis ATCC 50234 sp. nov. —a new heterotrophic marine flagellate //
Eur. J. Protistol. Vol. 27. P. 386-396.
Patterson D.J., Nygaard K., Steinberg G., Turley C.M. 1993. Hetero-
trophic flagellates and other protists associated with oceanic detritus through-
out the water column in the Mid North Atlantic /7 J. Mar. Biol. Assoc. U.K.
Vol. 73. P. 67-95.
Patterson D.J., Simpson A.G.B. 1996. Heterotrophic flagellates from
coastal marine and hypersaline sediments in Western Australia // Eur. J. Pro-
tistol. Vol. 32. P. 423-448.
Roger A.J., Simpson A.G.B. 2009. Evolution: Revisiting the Root of
the Eukaryote Tree // Current Biology. DOI: 10.1016/j.cub.2008.12.032.
Ruinen J. 1938. Notizen uber Salzflagellaten. II. Uber die Verbreitung
der Salzflagellaten. Arch.Protistenk. Bd. 90. S. 210-258.
Saedeleer H., de. 1931. Niewe of weinig bekende Flagellaten // Natuur-
wetenschappelijk Tijd. Bd 13. S. 89-97.
Saville Kent W. 1880-1882. A Manual of the Infusoria // Bogue, Lon-
don.
Scheckenbach F., Wylezich C., Mylnikov A.P., Weitere M., Arndt H.
2006. Molecular comparisons of freshwater and marine isolates of the same
morphospecies of heterotrophic flagellates //Appl. Envir. Microbiol. Vol. 72.
No. 10. P. 6638-6643.
Tong S.M., Nygaard K., Bernard C., Vors N., Patterson D.J. 1998.
Heterotrophic flagellates from the water column in Port Jackson, Sydney,
Australia // Eur. J. Protistol. Vol. 34. P. 162-194.
Vickerman K., Darbyshire I.F., Ogden C.G. 1974. Apusomonas pro-
boscidea Alexeieff, 1924 — an unusual phagotrophic flagellate from soil //
Arch. Protistenkd. Bd 116. No. 3-4. S. 254-269.
Vors N. 1992. Heterotrophic amoebae, flagellates and Heliozoa
from the Tvarminne area, gulf of Finland, in 1988-1990 // Ophelia. V. 36.
P. 1-109.
Yoon H. S., Grant J., Tekle Y.L, Wu M., Chaon B.C., Cole J.C., Logs-
don J.M.Jr., Patterson D.J., Bhattacharya D., Katz L.A. 2008. Broadly
sampled multigene trees of eukaryotes // BMC Evol. Biol. Vol. 8. P. 14. DOI:
10.1186/1471-2148-8-14.
HEMIMASTIGOPHORA FoissnerW., Blattereret Foissner I. 1988
Гетеротрофные свободноживущие протисты веретеновид-
ной формы длиной от 5 до 60 мкм с несколькими жгутиками,
которые организованы в две кинеты. Жгутики выходят из бо-
ковых бороздок, расположенных по слабо выраженной спира-
ли. Бороздки тянутся по всей длине тела или занимают только
переднюю его часть. Кинетосомы одиночные с двумя латераль-
ными корешками из микротрубочек. Девять сильно развитых
переходных фибрилл формируют четко выраженную корзинку
вокруг кинетосомы. В основании жгутика находится парасо-
мальный мешочек. Покровы ригидные с подстилающим плазма-
лемму плотным слоем эпиплазмы, образующей две продольные
пластинки. Ядро одно с хорошо заметным ядрышком, которое
сохраняется при митозе. Сократительная вакуоль расположена
в задней части тела. Кристы митохондрий трубчатые или меш-
ковидные, в передней части клетки расположены крупные ампу-
ловидные экструсомы. Питаются голозойно, поглощая пищу на
переднем конце тела. Бесполое размножение бинарным делени-
ем: особи делятся продольно в свободноплавающем состоянии.
Пресноводные и почвенные организмы, обитают в эвтрофиро-
ванных биотопах.
История изучения
Семейство Spironemidae было установлено До-
флейном (Doflein, 1916) для уникального пресновод-
ного организма с множеством жгутиков Spironema
multiciliatum Klebs 1893. Сравнительно недавно, по-
сле изучения ультраструктуры и биологических осо-
бенностей почвенного жгутиконосца Hemimastix
amphikineta Foissner W., Blatterer et Foissner I. 1988
(Foissner et al., 1988) этот вид был включен в семей-
ство Spironemidae. Морфология клетки и цитоскелет
оказались совершенно необычными для протистов,
поэтому авторы не смогли отнести эти организмы к
какому-либо известному крупному таксону. В резуль-
тате ранг группы сразу был повышен до типа Hemi-
mastigophora Foissner W., Blatterer et Foissner I. 1988.
Позднее была исследована ультраструктура других
похожих на Hemimastix простейших: Spironema и
Stereonema (Foissner, Foissner, 1993). В результате все
три рода были объединены в семейство Spironemidae
Foissner et Foissner 1993 (Foissner, Foissner, 2000).
Внешне похожий, но не изученный Paramastix также
было предложено относить к типу Hemimastigophora
(Zoelffel, Skibbe, 1997).
Поиски родственных группировок протистов ни к
чему не привели. Одни авторы склонны сближать их
с эвгленовыми (Foissner et al., 1988; Foissner, Foissner,
1993), другие считают, что по некоторым признакам
эти организмы сходны с апузомонадами (Карпов, 1990;
Karpov, 2007). Возможно, секвенирование генов прольет
свет на положение гемимастигин в системе эукариот.
Классификация
Тип Hemimastigophora Foissner W., Blatterer et Foiss-
ner I. 1988 включает один класс Hemimastigea Foiss-
ner W., Blatterer et Foissner I. 1988 с одним отрядом
Hemimastigida Foissner W., Blatterer et Foissner I. 1988.
Традиционно в отряде одно семейство Spironemidae
Doflein 1916, объединяющее три рода со следующими
видами: Hemimastix amphikineta} Spironema multicilia-
tum, S. terricola, S. goodeyi; Stereonema geiseri. Род
Paramastix (P con if er a, P truncata, P lata. P minuta)
выделяется здесь в отдельное семейство Paramastigidae
fam. nov.
Морфология
Гемимастигины представлены веретеновидными
или овальными уплощенными клетками с двумя ряда-
ми жгутиков (кинет) по обе стороны. Размеры кинет
варьирует от коротких на переднем конце тела, как у
Paramastix, до длинных, идущих вдоль всей клетки
(Hemimastix}. Апикальная часть клетки часто обосо-
блена неглубокой перетяжкой и называется капитулум.
На заднем конце тела у некоторых спиронемид имеется
хвостовой вырост.
Строение клетки детально изучено у трех предста-
вителей: Hemimastix amphikineta (Foissner et al., 1988),
Spironema terricola и Stereonema geiseri (Foissner, Foiss-
ner, 1993).
Ультраструктура всех трех видов, относящихся к
трем родам, имеет много общих черт, поэтому далее
дано обобщенное описание всех систем и органоидов
клетки гемимастигин с указанием отличий того или
иного вида.
330
HEMIMASTIGOPHORA
Покровы. Плазматическая мембрана покрыта
снаружи слабо выраженным слоем гликокаликса. Под
плазмалеммой находится плотная эпиплазма (рис. 220,
221), состоящая из двух слоев: тонкого осмиофильного
и расположенного под ним более толстого и рыхлого
(рис. 222, 223). Эпиплазма подстилает большую часть
поверхности клетки Hemimastix. разрывы в этом слое
есть только в боковых бороздках с одной стороны от
основания жгутиков (рис. 220-222). Под плазмалеммой
и под эпиплазмой лежат идущие вдоль клетки микро-
трубочки.
Авторы (Foissner et al., 1988) выделяют у Hemimas-
tix три группы микротрубочек: Ml — широкая лента
микротрубочек подстилает плазмалемму (без эпиплаз-
мы) между кинетой и краем кортикальной пластинки,
М2 — узкая лента микротрубочек укрепляет край кор-
тикальной пластинки, и М3, которая состоит из многих
одиночных микротрубочек, идущих под кортикальной
пластинкой (рис. 220, 222). Причем, микротрубочки в
Ml и М2 отстоят друг от друга примерно на диаметр
микротрубочки и соединяются друг с другом, а иногда
и с плазмалеммой мостиками (рис. 222-224). Проис-
хождение кортикальных микротрубочек неясно. Пред-
полагается, что они переходят с одной стороны клет-
ки через капитулум, где их количество увеличено, на
Рис. 220. Внешний вид (Л), схема расположения пластинок кор-
текса на поперечном срезе (Б) и схема строения кортекса (В) у
Hemimastix amphikineta.
б — боковая бороздка, дк — длинный корешок из микротрубочек, ж —
жгутики, к — капитулум, кк — короткий корешок из микротрубочек,
м — митохондрия, мт1 — микротрубочки бороздки без эпиплазмы,
мт2 — микротрубочки гребня бороздки с эпиплазмой, мтЗ — одиночные
микротрубочки под пластинками 1 и 2 эпиплазмы, пв — пищеваритель-
ная вакуоль, пм — плазматическая мембрана, пф — переходные фибрил-
лы, образующие «корзинку», св — сократительная вакуоль, эп — эпи-
плазма, я — ядро с ядрышком. (По: Foissner et al., 1988 с изменениями).
другую, а по мере приближения к заднему концу число
микротрубочек заметно уменьшается.
Таким образом, можно выделить на поверхности
Hemimastix как бы две ригидные пластинки, которые
разделены в области боковых бороздок (рис. 220, 221).
По мнению авторов, такие покровы напоминают по-
кровы многих эвгленовых, также состоящие из про-
дольных белковых полосок, укрепленных микротру-
бочками.
У Spironema покровы не такие упругие как у геми-
мастикса, клетка способна к метаболическому движе-
нию. Тем не менее, поверхность образует небольшие
складки, а под плазмалеммой обнаружена эпиплазма
из наружного плотного и внутреннего рыхлого слоев
(рис. 223). Правда, эпиплазма выстилает только капи-
тулум, а по мере приближения к заднему концу кинет
покрывает все меньшую площадь поверхности, прак-
тически, исчезая на уровне середины клетки. Таким
образом, вся остальная поверхность Spironema не име-
ет эпиплазмы, а укреплена только микротрубочками,
которые, предположительно начинаются в хвостовом
отростке, идут к переднему концу и, пройдя под покро-
вами капитулума, по другой стороне клетки возвраща-
ются в хвостовой вырост.
Поверхность Stereonema geiseri тоже слегка складча-
тая как у Spironema terricola, и кортикальные пластинки
сходной формы. Правда, эпиплазма без осмиофильно-
го слоя, а между микротрубочками и эпиплазмой часто
видны нитевидные мостики (рис. 224).
Таким образом, покровы Stereonema и Spironema
менее упруги, чем у Hemimastix и позволяют изменять
форму тела. Однако метаболическое движение было
показано только для представителей рода Spironema
(Foissner, Foissner, 1993).
Экструсомы. Под покровами клетки находятся
крупные экструсомы длиной 4 и диаметром 0,23 мкм,
которые видны в световой микроскоп. Они располага-
ются вдоль кинет и в капитулуме (рис. 221, 223, 224).
Экструсомы имеют довольно сложное строение, отча-
сти напоминая трихоцисты инфузорий (рис. 222-225).
У Hemimastix они представляют собой вакуоль ампу-
ловидной формы с длинным горлышком. Передний ко-
нец горлышка закреплен в слое эпиплазмы при помо-
щи специальных эпиплазматических усиков, а задний
конусовидно расширяется переходя в ампулу, запол-
ненную аморфным материалом. Горлышко ампулы со-
держит игловидный стержень, задний конец которого
имеет 2 вздутия, погруженных в материал ампулы. Оба
эти вздутия имеют дисковидные расширения, или вы-
росты (рис. 222, 225). У изученных видов спиронемид
экструсомы примерно одинаковы по размеру и форме,
различаясь лишь в деталях (рис. 222-224). Наиболее
просто они устроены у Stereonema (Foissner, Foissner,
1993). У Paramastix, если и есть экструсомы, то мел-
кие, т.к. не видны в световой микроскоп.
Кинеты содержат разное число жгутиков от 4 до
15. Они лежат в бороздках, которые хорошо выражены
только у гемимастикса. Бороздки спиронемы и стере-
онемы малозаметны, их жгутики находятся в индиви-
дуальных ямках. Впрочем, эти ямки сохраняются и у
HEMIMASTIGOPHORA
331
гемимастикса в виде ограничивающего валика вокруг
основания каждого жгутика. На дне каждой ямки, поза-
ди кинетосомы, находится небольшое впячивание плаз-
малеммы в виде обращенного к заднему концу клетки
мешочка (рис. 223). Авторы показали, что от дна этого
углубления, отшнуровываются мелкие пузырьки, что
указывает на его пиноцитозную активность.
Рис. 221. Продольный срез клетки Hemimastix amphikineta.
аг — диктиосома, ж — жгутик, л — лизосома (осмиофильная глобула),
м — митохондрия, мб — микротрубочки, выстилающие бороздку, пв —
пищеварительная вакуоль, св — сократительная вакуоль, эр — шерохо-
ватый ЭР, я — ядро. Масштабная линейка — 5 мкм. (По: Foissner et al.,
1988).
Жгутиковый аппарат устроен у всех изученных
видов однотипно (рис. 220, 222-224). Каждый жгутик
имеет одну довольно короткую кинетосому, от которой
отходят в направлении заднего конца клетки два лате-
ральных корешка из микротрубочек.
Оба корешка начинаются от аморфного материа-
ла, окружающего проксимальный конец кинетосомы.
Один корешок короткий, обычно ассоциирован с тон-
когранулярным материалом, а другой довольно длин-
ный, достигает другой кинетосомы и даже продол-
жается за нее, перекрываясь с ее коротким корешком
(рис. 220, В; 222, 223, 225). От основания кинетосомы
к плазматической мембране отходят 9 переходных фи-
брилл, формирующих так называемую корзинку. Они,
скорее, напоминают гребни, а не отдельные филамен-
ты, как у других протистов (рис. 220, В; 222, 224).
Поперечная пластинка переходной зоны жгутика
без аксосомы, вогнута в сторону кинетосомы и распо-
ложена чуть выше поверхности клетки. Дистальнее нее
находится невысокий переходный цилиндр, связанный
с А-трубочками аксонемы (рис. 222, 224).
Аксонема содержит обычный набор микротру-
бочек, параксиальный тяж или иные параксиальные
структуры отсутствуют. Не обнаружены и мастигоне-
мы на поверхности жгутиков, что естественно для мно-
гожгутиковых форм (Карпов, 1990).
Ядро и цитоплазматические органеллы. В клет-
ке только одно крупное ядро, обычно пузырьковидного
типа с хорошо заметным ядрышком. Оно располагается
в задней половине клетки у спиронемид и в передней
у парамастикса. Никаких особенных структур в стро-
ении ядерной оболочки и внутри ядра не обнаружено.
Митохондрии с трубчатыми, слегка сжатыми с
боков, или мешковидными кристами (рис. 222). В ма-
триксе митохондрий Hemimastix часто обнаруживают-
ся довольно крупные электронно-прозрачные, огра-
ниченные мембраной вакуоли (Foissner et al., 1988).
По-видимому, это вздутия крист. Похожие вздутия от-
мечены также в митохондриях Apusomonas proboscidea
(см. главу Apusozoa).
В передней части клетки Hemimastix обнаружено
до 10 хорошо выраженных диктиосом АГ, каждая из
которых состоит из 5-9 цистерн. В качестве необыч-
ной особенности авторы отмечают ветвящиеся ци-
стерны диктиосомы у Hemimastix (Foissner et al., 1988)
(рис. 222).
Цистерны ШЭР лежат как внутри клетки, так и по
периферии, подстилая эпиплазму (рис. 221). Похожее
расположение ШЭР под покровами отмечено и у апу-
зомонад (см. главу Apusozoa).
Крупные (до 5 мкм в диаметре) и мелкие пищева-
рительные вакуоли с остатками непереваренной пищи
лежат в глубоких слоях цитоплазмы (рис. 221). Кроме
того, обнаружены осмиофильные глобулы диаметром
100-300 нм окруженные мембраной. По-видимому,
они представляют собой лизосомы.
Сократительная вакуоль у всех видов находится
на заднем конце клетки. На ультратонких срезах вид-
ны окружающие ее характерные пузырьки или каналы
(рис. 221).
332
HEMIMASTIGOPHORA
Рис. 222. Особенности ультраструктуры Hemimastix amphikineta.
А — продольный срез кинетиды и строение покровов в боковой бороздке; Б — поперечный срез переходной зоны жгутика. Стрелками на А и Б по-
казан цилиндр в переходной зоне жгутика. В — диктиосома с ветвящейся цистерной (стрелка); Г— строение митохондрии; Д— выстреливающая
экструсома; Е — интактная экструсома. ам — аморфное содержимое в задней части ампулы, д — дисковидные выросты гранулы, дк — длинный ко-
решок из микротрубочек, дк’ — длинный корешок соседней (передней) кинетосомы, ис — игловидный стержень, ка — конус ампулы, кк — короткий
корешок из микротрубочек, мт1 — микротрубочки бороздки без эпиплазмы, мт2 — микротрубочки гребня бороздки с эпиплазмой, мтЗ — одиночные
микротрубочки под пластинками 1 и 2 эпиплазмы, пп — поперечная пластинка, пф — переходные фибриллы, образующие «корзинку», эп — эпи-
плазма, состоящая из плотного и рыхлого слоев, эр — шероховатый ЭР. Масштабные линейки: А — 500 нм; В, Г— 300 нм; Д— 1 мкм; Е — 200 нм.
(По: Foissner et al., 1988, с изменениями).
Рис. 223. Особенности ультраструктуры Spironema terricola.
А — строение покровов на поперечном срезе; Б — структура кинеты на продольном срезе боковой бороздки (передний конец клетки вверху); В —
строение капитулума (на врезке этот участок клетки показан стрелкой); Г— поперечный срез клетки в области ядра; Д— продольный срез хвостового
отростка; Е — продольный срез экструсомы. ам — аморфное содержимое в задней части ампулы, гр — гранулярный материал ассоциированный с
коротким корешком, дк — длинный корешок из микротрубочек, ж — жгутики, ис — игловидный стержень, ка — конус ампулы, кк — короткий коре-
шок из микротрубочек, кн — кинетосома, мт — микротрубочки под эпиплазмой, ос — основание игловидного стержня, пф — переходные фибриллы,
пэп — плотный слой эпиплазмы, пя — парасомальная ямка (мешочек), рэп — рыхлый слой эпиплазмы, смт — субмембранные микротрубочки,
эк — экструсома, эп — эпиплазма, эр — шероховатый ЭР, я — ядро с ядрышком. Масштабные линейки: А — 125 нм; Б, В — 1мкм; Г, Е — 500 нм;
Д— 750 нм. (По: Foissner, Foissner, 1993, с изменениями).
HEMIMASTIGOPHORA
333
fe-А'Л- N
par*
пэп
S-, ис
мтх
кг
вР
vc\<-T. • u .;z^r-.'v'-
пДКу
£ -
334
HEMIMASTIGOPHORA
Рис. 224. Особенности ультраструктуры Stereonema geiseri.
А — поперечный срез передней части клетки (капитулума); Б — поперечный срез клетки на уровне ядра (на врезке поперечный срез хвостового от-
ростка). Стрелки указывают границы эпиплазмы. В — строение кинетиды на продольном срезе. Стрелка показывает стенку переходного цилиндра,
наконечник — поперечную пластинку. Г— строение покровов (стрелка указывает мостики между микротрубочками и эпиплазмой); Д— передний
кончик экструсомы (стрелками показаны эпиплазматические усики); Е — задний отдел экструсомы (стрелкой показано основание игловидного стерж-
ня). ам — аморфное содержимое в задней части ампулы, б — боковая бороздка, гх — гетерохроматин, дк — длинный корешок из микротрубочек,
ж — жгутики, ис — игловидный стержень, кк — короткий корешок из микротрубочек, м — митохондрия, мт — микротрубочки под эпиплазмой,
пв — пищеварительная вакуоль, пп — поперечная пластинка, пф — переходные фибриллы, образующие «корзинку», смт — субмембранные микро-
трубочки, эк — экструсома, эп — эпиплазма, я — ядро с ядрышком. Масштабные линейки: А — 1 мкм; Б — 2 мкм; В,Д,Е — 500 нм; Г— 250 нм.
(По: Foissner, Foissner, 1993, с изменениями).
HEMIMASTIGOPHORA
335
Рис. 225. Схема строения покровов и кинетиды у Spironema (Л-В), Stereonema (Г) и строение экструсомы у Hemimastix (Д).
А — на уровне капитулума; Б, Г— на уровне заднего конца кинеты; В — хвостовой отросток, ам — аморфное содержимое в задней части ампулы, д —
дисковидные выросты гранул в основании игловидного стержня, дк — длинный корешок из микротрубочек, дк’ — длинный корешок соседней (перед-
ней) кинетосомы, ж — жгутик, ис — игловидный стержень, ка — конус ампулы, кк — короткий корешок из микротрубочек, ма — мембрана ампулы,
мт — микротрубочки под эпиплазмой, пв — пищеварительная вакуоль, пм — плазматическая мембрана, ф — усики эпиплазмы, эк — экструсома,
эп — эпиплазма, эп1 — пластинка эпиплазмы 1, эп2 — пластинка эпиплазмы 2, я — ядро с ядрышком. (По: Foissner, Foissner, 1993, с изменениями).
Питание
Гемимастигины питаются бактериями и жгутико-
носцами. Установлено, что заглатывание пищи проис-
ходит на переднем конце (Klebs, 1893; Foissner et al.,
1988; Zoelffel, Skibbe, 1997), однако точная локализа-
ция места захвата пищи неизвестна (рис. 226, 227). По-
скольку какие-либо специальные ротовые структуры
отсутствуют, можно предположить, что фагоцитоз идет
в жгутиковой бороздке капитулума, а не на апикальном
конце, где покровы укреплены дополнительным слоем
эпиплазмы с подстилающими микротрубочками. Дик-
тиосомы всегда находятся в передней половине клетки
и обеспечивают формирование мембраны пищевари-
тельной вакуоли (Foissner, Foissner, 1993).
Питание парамастикса было изучено на светооп-
тическом уровне (Zoelffel, Skibbe, 1997). Правда, ав-
торы не наблюдали питание живого парамастикса, в
результате на рисунке 227 представлена предполагае-
мая последовательность этапов захвата жгутиконосца
по фиксированным препаратам. Заглатывание объекта
происходит на переднем конце клетки. При этом об-
ращает на себя внимание подвижность папиллы: она
способна вытягиваться, формировать что-то вроде при-
336
HEMIMASTIGOPHORA
Рис. 226. Схема захвата и заглатывания пищевого объекта у
Hemimastix.
Стрелки показывают направление процесса и альтернативные пути (за-
глатывание объекта целиком или частично). (По: Foissner et al., 1988).
Рис. 227. Схема захвата и заглатывания пищевого объекта у
Paramastix. (По: Zoelffel, Skibbe, 1997).
соски при контакте с жертвой и затем практически ис-
чезать, трансформируясь в пищевую ямку, которая за-
мыкается в пищевую вакуоль.
Размножение
В литературе описано только бесполое размноже-
ние гемимастигин. Клетки делятся продольно в сво-
бодноплавающем состоянии. Оно изучено только у
Hemimastix amphikineta на светооптическом уровне: ав-
торы наблюдали бинарное деление на живых клетках в
культуре и на фиксированных окрашенных препаратах
(Foissner et al., 1988). Деление начинается с удвоения
кинет, поэтому на ранних стадиях у особи по 2 кинеты
с каждой стороны (рис. 228). Затем наступает митоз,
причем, ядрышко сохраняется на всех стадиях деления
ядра. Очертания ядра хорошо видны, поэтому можно
предположить, что ядерная оболочка не разрушается,
и митоз закрытого типа. Борозда продольного деления
формируется на переднем конце клетки, продвигается
Рис. 228. Бинарное деление Hemimastix amphikineta.
А — удвоение кинет; Б — анафаза—телофаза; В — углубление борозды
деления; Г— дочерние клетки соединены задними концами на заверша-
ющей фазе цитокинеза. (По: Foissner et al., 1988, с изменениями).
назад и достигает заднего конца. На поздних стадиях
цитокинеза особи развернуты передними концами в
противоположные стороны (рис. 228, Г).
Экология
Интересны сведения о географическом распростра-
нении гемимастигин. Фойснер с соавторами (Foissner
et al., 1988; Foissner, Foissner, 1993) находили Hemimas-
tix только в пробах из южного полушария (Австралия,
Чили), причем, довольно редко — примерно в 10%
проб. Однако М. Цолфель (Zoelffel — личное сообще-
ние) утверждает, что наблюдал этот организм в пробах
из Германии. Кроме того, другие спиронемиды были
описаны из почв Англии и пресных вод Германии (цит.
по: Foissner et al., 1988; Kreutz, Hippe, 1998). Возмож-
но, эти организмы распространены всесветно, но не
дают высокую численность, и поэтому редки в пробах.
Между тем, некоторые гемимастигины, например, Spi-
ronema multiciliatum Klebs 1893 и Paramastix conifera
Skuja 1948 — частые обитатели почв и пресных водое-
мов (Goodey, 1916; Zoelffel, Skibbe, 1997; Kreutz, Hippe,
1998).
Длинное червеобразное тело и сократимость Spi-
ronema goodeyi и S. terricola возможно, являются адап-
тацией к обитанию в почве. Hemimastix, по-видимому,
произошел от спиронема-подобного организма в ре-
зультате утраты хвостового отростка, что привело к
удлинению кинет. Небольшие размеры гемимастикса
избавили его от необходимости переходить к мета-
болическому движению, протискиваясь между ча-
стицами почвы (Foissner, Foissner, 1993). Похожие
тенденции утраты метаболического сокращения на-
блюдаются при уменьшении размеров почвенных ин-
фузорий (Foissner, 1987). Помимо уменьшения раз-
HEMIMASTIGOPHORA
337
меров и утраты сократимости гемимастикс приобрел
складчатость кортекса.
Цисты у представителей этого типа не наблюдали,
однако спиронемиды появляются в пробе при увлажне-
нии совершенно сухих образцов почвы. По-видимому,
какие-то покоящиеся стадии у них все же имеются
(Foissner, Foissner, 1993), что естественно для почвен-
ных организмов.
Систематика и филогения
Молекулярная филогения для гемимастигин неиз-
вестна, поэтому все изложенные ниже рассуждения
основаны на сравнительно-морфологических данных.
Исследование ультратонкого строения Spironema и
Stereonema показало, что эти два рода морфологиче-
ски очень близки к Hemimastix, поэтому объединение
трех родов в одно семейство не вызывает сомнений.
Светооптические исследования представителей рода
Paramastix продемонстрировали как сходство, так и
отличия от спиронемид. Включение его в состав от-
ряда Hemimastigea, по-видимому, оправдано (Zoelffel,
Skibbe, 1997). На переднем конце клетки парамастик-
са имеются две радиально симметричные бороздки, в
которых лежат кинеты, содержащие по нескольку жгу-
тиков (точное число их неизвестно). Биение жгутиков,
как и у спиронемид, не метахрональное, а беспорядоч-
ное. Парамастикс, как и спиронемиды, захватывает
пищу на переднем конце тела. Его упругие покровы
напоминают таковые гемимастикса, сократительная
вакуоль также находится на заднем полюсе клетки. Од-
нако есть и существенные отличия: у парамастикса нет
таких крупных экструсом, которые видны в световой
микроскоп у спиронемид, а его покровы не образуют
складок. Кроме того, капитулум в форме папиллы,
или рострума, не отмечен у спиронемид, а ядро пара-
мастикса лежит в передней части клетки. Поскольку
кинеты находятся только на апикальном конце клетки,
то эпиплазматические пластинки, вероятно, отсутству-
ютпочти по всей поверхности клетки. В то же время,
авторы (Zoelffel, Skibbe, 1997) отмечают упругость по-
кровов и неспособность этих организмов к метаболии.
Возможно, покровы парамастикса устроены иначе, чем
у спиронемид.
На основании таких данных разумно выделить
Paramastix в отдельное семейство Paramastigidae fam.
nov. (см. раздел Систематический обзор).
В целом, гемимастигины обладают весьма свое-
образным сочетанием признаков, какие не обнаружи-
ваются в других типах и супергруппах протистов. По
строению кинет их можно сравнить с инфузориями:
они напоминают инфрацилиатуру с микротрубочковы-
ми корешками, — а еще со Stephanopogon, также име-
ющего одиночные короткие кинетосомы, но связанные
друг с другом фибриллярными корешками. Однако по
другим признакам (покровы, кристы митохондрий) эти
три группы сильно отличаются друг от друга.
В. Фойснер с соавторами (Foissner et al., 1988; Foiss-
ner, Foissner, 1993, 2000; 2011 — личное сообщение)
разрабатывает идею родства гемимастигин с эвглено-
выми на основании сходства покровов. Действитель-
но, и те и другие имеют своеобразную вращательную
симметрию расположения белковых полосок, или
эпиплазматических пластинок, укрепленных микро-
трубочками. Происхождение покровов гемимастигин
от кутикулы эвгленовых авторы представляют в виде
редукции количества пластинок до двух и увеличения
их размеров. Эту гипотезу подтверждают наблюдения
за поведением видов Spironema, обладающих типич-
но эвгленоидным движением. Правда, механизм этого
движения у спиронемы неизвестен, и он может быть
совершенно иным, поскольку при эвгленоидном дви-
жении (метаболии) задействовано несколько полосок,
скользящих относительно друг друга, а у Spironema
их только две и они занимают лишь переднюю часть
клетки. Кроме того, эвгленоидное движение предпо-
лагает перекрывание пластинок, чтобы обеспечить их
скольжение относительно друг друга, а у спиронемид
пластинки не перекрываются.
Определенное, далеко не полное, сходство отме-
чается в строении экструсом спиронемид и некоторых
Euglenozoa.
Однако по многим другим признакам эвглениды
и кинетопластиды отличаются от гемимастигин: пла-
стинчатые кристы митохондрий, всего 1-2 жгутика,
глубокий жгутиковый резервуар, запасное вещество в
форме парамилона, параксиальный тяж, длинная пере-
ходная зона жгутика, мастигонемы на жгутиках, хлоро-
пласты, как плезиоморфный признак для всей группы
Euglenozoa.
В то же время, покровы Apusozoa (см. предыдущую
главу) очень похожи на таковые гемимастигин, а рас-
положение микротрубочек, выстилающих плазмалем-
му (микротрубочки разделены равными промежутка-
ми и связаны с плазмалеммой) напоминает правый и
левый корешки апузомонад. Сходно устроены их ми-
тохондрии (отмечаются вздутия крист — редкое явле-
ние среди протистов), а под покровами располагаются
цистерны ЭПР. Однако по строению кинетиды эти две
группы протистов существенно отличаются друг от
друга. По-видимому, дальнейшее обоснованное обсуж-
дение филогенетических связей этой группы возможно
только после включения сиквенсов ее представителей в
общую МФС эукариот.
Систематический обзор
Тип Hemimastigophora Foissner W.,
Blatterer et Foissner 1.1988
(Класс Hemimastigea Foissner W., Blatterer et Foiss-
ner I. 1988 и отряд Hemimastigida Foissner W., Blat-
terer et Foissner I. 1988 с тем же диагнозом)
Жгутики организованы в кинеты, расположенные
по слабой спирали. Кинеты равны длине тела или коро-
че. Кинетосомы одиночные со сложной системой ми-
кротрубочковых корешков и парасомальным мешочком
338
HEMIMASTIGOPHORA
в основании жгутика. Кортекс образован продольно
идущими по пологой спирали симметрично располо-
женными пластинками эпиплазмы и подстилающими
их одиночными микротрубочками, или их лентами.
Кристы митохондрий трубчатые или мешковидные.
Для многих характерны крупные экструсомы. Размно-
жаются в свободноплавающем состоянии, продольным
делением клетки на две.
Замечания. Из-за характерной вращательной
симметрии кортикальных пластинок правая и левая
стороны неразличимы. Плотный субмембранный слой
назван эпиплазмой по сходству с таковой инфузорий
и эвгленид. Пластиды, мастигонемы и параксиальные
структуры отсутствуют. В митохондриях встречаются
полости (вздутия крист), что отмечено для ряда пред-
ставителей и не является артефактом.
Сем. Spironemidae Doflein 1916
Мелкие до средних размеров (10-60 мкм) от чер-
веобразной и веретеновидной до почти шаровидной
формы, часто уплощенные гемимастигиды с более или
менее отчетливо выраженной перетяжкой на переднем
конце тела, отделяющей капитулум. Две кинеты распо-
ложены в продольных бороздках по обе стороны клет-
ки. Кинетосомы жгутиков одиночные короткие (длина
примерно равна диаметру), несут по два латеральных
корешка из микротрубочек (короткий и длинный), ко-
торые тянутся параллельно друг другу в сторону со-
седней кинетосомы. Переходные фибриллы отходят от
проксимального конца кинетосомы, образуя вокруг нее
«корзинку»; поперечная пластинка в переходной зоне
жгутика толстая и вогнутая, переходный цилиндр на-
ходится над поперечной пластинкой. Ядро пузырько-
видное с крупным ядрышком лежит в задней половине
клетки. Ядрышко сохраняется при митозе. Сократи-
тельная вакуоль в задней части клетки. Экструсомы ам-
пуловидные содержат длинный игловидный стержень,
погруженный в аморфный материал ампулы. Погло-
щение пищи на переднем конце клетки, но оральные
структуры не отмечены. Особи передвигаются скользя
по субстрату при помощи жгутиков.
Типовой род Spironema Klebs 1893.
Род Spironema Klebs 1893
Особи мелкие или среднего размера (15-50 мкм) с
кинетами, лежащими в слабо выраженных бороздках,
доходящих до середины тела. Задний конец с отчетли-
вым хвостовым отростком. Кортекс мягкий эластичный
слегка складчатый. Обладают сильной сократимостью,
внешне напоминая метаболическое движение эвглено-
вых. Встречаются в пресных водах и почве.
Типовой вид 5. multiciliatum Klebs 1983.
Замечания. Отличаются от Stereonema и Hemi-
mastix способностью метаболировать. У эвгленовых
эта особенность служит признаком рода. Из описания
Клебса (Klebs, 1893) неясно, доходят бороздки до ос-
нования хвостового отростка или до середины тела, но
у других видов — до середины тела, поэтому признак
указан для всего рода.
S. multiciliatum Klebs 1983 (рис. 229)
Клетки ланцетовидные размером 14-18x2-3 мкм с
хвостовым отростком до ’/ длины тела. Капитулум ма-
лозаметен. Кинеты содержат по 6-13 жгутиков. Сокра-
тительная вакуоль в основании хвостового отростка.
Замечания. Отличается от других видов по раз-
мерам и форме тела, а также слабо выраженному капи-
тулуму.
Рис. 229. Внешний вид Spironema multiciliatum.
А, Б — две разные клетки показаны с узкой (А) и широкой (Б) сторо-
ны; В — экземпляр со жгутиками, доходящими до заднего конца клетки,
св — сократительная вакуоль. (По: Klebs, 1893).
S. terricola Foissner et Foissner 1993 (рис. 230)
Червеобразное тело клетки длиной 30-50 мкм с
длинным (до половины длины тела) и очень тонким
хвостовым отростком. Капитулум хорошо заметен,
кинеты занимают переднюю V часть клетки, каждая
содержит 8 жгутиков. Ядро округлое. Описана из по-
чвенной пробы.
S. goodeyi Foissner et Foissner 1993
(рис.231)
Червеобразное тело клетки размерами 20-50x4 мкм
с коротким (до V длины тела) хвостовым отростком.
Капитулум заметен, кинеты занимают переднюю V8
часть клетки, каждая содержит 3-9 жгутиков. Ядро вы-
тянутое. Описана из почвенной пробы.
Род Stereonema Foissner et Foissner 1993
Спиронемиды средних размеров (20-30 мкм) вере-
теновидные или эллипсоидной формы с эластичными
покровами. Кинеты в слабо заметных бороздках, кото-
рые оканчиваются на середине тела клетки. Особи не
способны сокращаться.
Замечания. Отличается от Spironema неспособ-
ностью к эвгленоидному движению (метаболии), а от
HEMIMASTIGOPHORA
339
Рис. 230. Внешний вид Spironema terricola.
А — прикрепленная особь; Б — изогнутая, немного сократившаяся клет-
ка; В — очертания сильно сокращенной особи, пв — пищеварительная
вакуоль, св — сократительная вакуоль, э — экструсома, я — ядро. (По:
Foissner, Foissner, 1993).
Hemimastix более короткими кинетами, редуцирован-
ной эпиплазмой и упрощенной организацией жгутико-
вых бороздок.
Род монотипический с видом Stereonema geiseri
Foissner et Foissner 1993.
S. geiseri Foissner et Foissner 1993 (рис. 232)
Особи ланцетовидной формы размером 20-30*5-
8 мкм с хвостовым отростком примерно V длины тела.
Капитулум малозаметен. Кинеты по 12 жгутиков. Ядро
округлое. Перемещаются скользя по субстрату, плава-
ющие особи не обнаружены. Найдены в перифитоне
мезосапробных рек Германии и Австрии.
Род Hemimastix Foissner W.,
Blatterer et Foissner 1. 1988
Мелкие (менее 20 мкм) сильно уплощенные спиро-
немиды с кинетами в хорошо выраженных бороздках,
Рис. 231. Внешний вид Spironema goodeyi (окраска железным
гематоксилином).
А, Б — расправленные особи; В — сократившаяся клетка, к — капиту-
лум, св — сократительная вакуоль, я — ядро. (По: Goodey, 1916).
идущих от переднего до заднего конца клетки. Покро-
вы ригидные, складчатые с четким воротничком вокруг
основания каждого жгутика. Клетки не метаболируют
и не сокращаются. Обитают в почве.
Замечания. Отличаются от Stereonema и Spi-
ronema сильно складчатым ригидным кортексом, хоро-
шо заметными бороздками и воротничком вокруг осно-
вания жгутика.
Н. amphikineta Foissner W.,
Blatterer et Foissner I. 1988 (рис. 220, A)
Особи эллипсоидной формы размерами 14-20*7-
10 мкм, соотношение ширины к толщине примерно
2:1. Капитулум хорошо заметен. Кинеты насчитыва-
ют по 12 жгутиков. Ядро округлое.
Paramastigidae fam. nov.
Особи яйцевидной формы, капитулум в форме ро-
струма, или папиллы. Короткие кинеты сосредоточе-
ны на апикальном конце клетки в основании папиллы.
Экструсомы не видны в световой микроскоп, возмож-
но, отсутствуют. Покровы ригидные, клетки не способ-
ны метаболировать. Ядро находится в передней части
клетки. Особи не прикрепляются к субстрату, свобод-
ноплавающие.
340
HEMIMASTIGOPHORA
Рис. 232. Внешний вид Stereonema geiseri с широкой (А) и узкой
(Б) стороны.
пв — пищеварительная вакуоль, св — сократительная вакуоль, э — экс-
трусома, я — ядро. (По: Foissner, Foissner, 1993).
Рис. 233. Внешний вид Paramastix conifera.
Вверху вид с переднего конца клетки (стрелками показаны кинеты).
пв — пищеварительная вакуоль, св — сократительная вакуоль, я — ядро.
(По: Zoelffel, Skibbe, 1997).
Таблица 7
Сравнительная характеристика видов рода Paramastix (по: Zoelffel, Skibbe, 1997)
Вид Размеры клетки (мкм) Общее количество жгутиков Особенности строения
Р conifera Skuja 1948 10-18x9-12 16-20 Папилла хорошо выражена, тело обратнояйцевид- ное, удлиненное с закругленным задним концом
Р truncata Skuja 1948 14-20x11-14 20-24 Папилла малозаметна, задний конец не закруглен
Р lata Skuja 1956 13-21x11-16 10-12 Папилла небольшая округлая, форма тела от окру- глой до прямоугольной
P minuta Skuja 1964 8-11 8 Папилла широкая и уплощенная, тело почти шаро- видное
Род Paramastix Skuja 1948
Диагноз как у семейства.
Типовой вид Paramastix conifera Skuja 1948.
Р. conifera Skuja 1948 (рис. 233)
Особи яйцевидные размером 10-18x9-12 мкм, с
большой передней папиллой, в основании которой
располагаются спирально 2 кинеты по 8-12 жгути-
ков в каждой. Жгутики примерно равны длине тела.
Питание голозойное, преимущественно мелкими
жгутиконосцами, образование псевдоподий или пи-
тание с их помощью убедительно не описано. Круп-
ное ядро находится в передней части клетки, сокра-
тительная вакуоль расположена сзади. Пресноводные
хищники.
Всего описано 4 вида, но различия между ними не-
велики. Кроме того, исследование культуры Р conifera
показало существенный разброс в размерах клетки, а
также вариации ее формы, которые перекрываются с
этими параметрами у других видов. Поэтому было вы-
сказано сомнение в валидности трех позднее описан-
ных видов (Zoelffel, Skibbe, 1997), краткие сведения о
которых приведены в таблице 7.
HEMIMASTIGOPHORA
341
SUMMARY
This small group of heterotrophic protists with many flagella
still not studied with molecular phylogeny, so we do not know their
relationships. General morphology and ultrastructure were investi-
gated well (Foissner et al., 1988, 1993, 2000), and distinct peculiari-
ties of hemimastigids were shown. The hemimastigids have small
to medium size vermiform to ovoid with so called capitulum at the
anterior end equipped with extrusomes visible through the light mi-
croscope. Flagella arise from two slightly spiraled lateral furrows.
Single kinetosome produces two microtubular roots directed poste-
rior. There are parasomal sac and peculiar fibrillar basket formed by
transitional fibers. The layer of dense epiplasm underlines the plasma
membrane. The epiplasm is interrupted at the lateral furrows, thus
two distinct plates supported by longitudinal microtubules form a
cortex. Some species enable to metabolic movement, but the mecha-
nism is obviously different from euglenoid metaboly. One vesicular
nucleus seems to divide by close mitosis with persisting nucleolus.
Mitochondrial cristae tubular to succular. Feed phagotrophically, fis-
sion in free-swimming condition. Freshwater and soil. Genus Para-
mastix differ essentially from spironemids by rostrum-like capitulum,
very short anteriorly located kineties, anterior location of the nucleus
and invisible (or absent) extrusomes. The new family Paramastigidae
was established for this genus.
ЛИТЕРАТУРА
Карпов С.А. 1990. Система протистов. Омск: Межвузовская тип.
ОмПИ. 195 с.
Doflein F. 1916. Lehrbuch der Protozoenkunde. 4. Aufl. Fischer:
lena.
Foissner W. 1987. Soil protozoa: fundamental problems, ecological sig-
nificance, adaptations in ciliates and testaceans, bioindicators, and guide to
the literature П Progr. Protistol. Vol. 2. P. 69-212.
Foissner W., Blatterer H., Foissner I. 1988. The Hemimastigophora
(Hemimastix amphikineta nov. gen., nov. spec.), a new protistan phylum from
Gondwanian soils // Eur. J. Protistol. Vol. 23. P. 361-383.
Foissner W., Foissner I. 1993. Revision of the family Spironemidae
Doflein (Protista, Hemimastigophora), with description of two new species,
Spironema terricola n. sp., and Stereonema geiseri n. gen., n. sp. H J. Euk.
Microbiol. Vol. 40. P. 422^138.
Foissner W., Foissner I. 2000. Hemimastigophora // J.J. Lee, G.F. Lee-
dale, Ph. Bradbury (eds). The illustrated guide to the Protozoa. Vol. 2. Allen
Press Inc.: Lawrence. P. 1185-1186.
Goodey T. 1916. Observations on the cytology of flagellates and amoe-
bae obtained from old stored soil П Proc. Zool. Soc. Lond. P. 309-330.
Karpov S.A. 2007/8. The flagellar apparatus structure of Apusomonas
proboscidea and apusomonad relationships П Protistology. Vol. 5. No. 2/3.
P. 146-155.
Klebs G. 1893. Flagellatenstudien. Teil I // Z. Wiss. Zool. Bd 55. S. 265-351.
Kreutz M., Hippe E. 1998. Stereonema geiseri im Palmengarten П Mi-
krokosmos. Bd 87. S. 367-368.
Zoelffel M., Skibbe O. 1997. Rediscovery of the multiflagellated protist
Paramastix conifera Skuja 1948 (Protista incertae sedis) П Nova Hedwigia.
Vol. 65 No. 1^1. P. 443-452.
ICHTHYOSPOREA Cavalier-Smith 1998
Тканевые, редко, внутриклеточные, паразиты кишечни-
ка рыб, амфибий и ракообразных. Они обладают достаточно
сложным жизненным циклом и осмотрофным типом питания.
Трофическая стадия представлена многоядерной толстостенной
клеткой нередко с центральной вакуолью или включением. Раз-
множение бесполое бинарным делением или фрагментацией
плазмодия, приводит в конечном итоге к формированию одно-
ядерных клеток (амеб, жгутиконосцев или неподвижных эндо-
спор), которые служат расселительными и инвазионными ста-
диями. Кристы митохондрий пластинчатые, но встречаются и
трубчатые. У некоторых видов отмечены септальные гифы.
Класс подразделяется на два отряда: Ichthyophonida и
Dermocystida. Ихтиофониды паразитируют на рыбах, амфибиях
и беспозвоночных животных, проводя большую часть жизнен-
ного цикла в их кишечнике. Расселительные стадии: неподвиж-
ные эндоспоры или амебы. Дермоцистиды паразитируют в ры-
бах, образуя в эпителиях хозяина внутриклеточные и тканевые
стадии, плазмодии и цисты, а также продуцируют неподвижные
споры или зооспоры с одним задним жгутиком; амебы в их жиз-
ненном цикле не отмечены.
Наиболее важны в практическом отношении: Ichthyophonus
hoferi, который вызывает поражения различных органов при-
мерно у 80 видов морских и пресноводных рыб, приводящие к
смертельному исходу и, соответственно, к значительному эко-
номическому ущербу; Psorospermium haeckeli — паразит соеди-
нительной ткани пресноводных раков, которого связывают со
значительными коммерческими потерями их запасов; и Rhino-
sporidium seeberi — паразит млекопитающих, включая человека.
История изучения
Первые описания этих паразитов относятся к се-
редине XIX века, когда в кишечнике многоножки был
обнаружен Enterobryus elegans (Leidy, 1849). Затем
Лейди обнаружил их и в других артроподах, считая
растениями. Немного позднее в членистоногих были
описаны Psorospermium haeckeli и Amoebidium parasiti-
сит (Haeckel, 1857; Cienkowski, 1861). В рыбах первая
ихтиоспорида Ichthyophonus hoferi была обнаружена
также еще в XIX веке (Hofer, 1893), а затем был опи-
сан и паразит человека Rhinosporidium seeberi (Seeber,
1900). Число новых родов, отнесенных в дальнейшем
к ихтиоспоридам, увеличивалось медленно, а таксоно-
мическое положение этих организмов было неясным
и они часто сопровождались эпитетом «загадочные».
Определенность в этом отношении внесли только мо-
лекулярно-биологические исследования. При изучении
проблемы происхождения многоклеточных животных
было установлено, что паразиты рыб Ichthyophonus и
так называемый rosette agent располагаются на моле-
кулярно-филогенетическом древе вблизи разветвле-
ния животных и грибов (Kerk et al., 1995; Spanggaard
et al., 1996). Несколько позднее существование такой
клады подтвердил Рейган с соавторами (Ragan et al.,
1996) при исследовании двух других паразитов рыб.
Эти авторы сформировали неформальную группу из
четырех родов, назвав ее по начальным буквам их на-
званий (Dermocystidium, rosette agent, Ichthyophonus,
Psorospermium) — DRIP (рис. 234). В 1998 году
T. Кавалье-Смит выделил их в класс Ichthyosporea
(Cavalier-Smith, 1998), поскольку все они являются па-
разитами рыб, а их клеточная стенка не содержит хити-
на. Однако отсутствие хитина подвергалось сомнению.
Еще ранее было показано наличие хитина в клеточной
стенке Ichthyophonus hoferi (Spanggaard et al., 1995),
что, правда, затем не подтвердилось (см. главу Морфо-
логия), а у Rhinosporidium seeberi найден, по меньшей
мере, один ген хитин синтазы (Herr et al., 1999).
После формирования четкой монофилетической
группировки на древе опистоконтов, названной подти-
пом Mesomycetozoa (Mendoza et al., 2002), исследова-
ния последних лет привели к описанию 6 новых родов
ихтиоспорид: Sphaeroforma, Creolimax, Amphibiocystid-
ium, Amphibiothecum, Pirum nAbeoforma (Jostensen et al.,
2002; Pascolini et al., 2003; Feldman et al., 2005; Pereira
et al., 2005; Marshall et al., 2008; Marshall, Berbee, 2011).
Интересно, что уже в 2000 году была опубликована
работа, в которой впервые было показано, что трихо-
мицет Amoebidium parasiticum из порядка Amoebidiales
также относится к DRIP-кладе (Ustinova et al., 2000).
Однако наибольший вклад в увеличение разнообразия
этой группы внес Кафаро (Cafaro, 2005), который по-
казал, что Enterobryus и 16 других родов трихомицетов
порядка Eccrinales по молекулярной филогении входят
в состав ихтиоспорид (рис. 235). Сходство предста-
вителей Amoebidiales и Eccrinales отмечалось и ранее
(Duboscq et al., 1948), а их обособленность от осталь-
ных трихомицетов (пор. Harpellales и Asellariales) была
показана ультраструктурными исследованиями (Moss,
ICHTHYOSPOREA
343
99
100
60-79
76-99
70-80
68-90
61-78
48-68
87-97
Xenopus laevis
—— Asterias amurensis
— Brachionus plicatilis
Acanthopleura japonica
Mytilus edulis
— Lineussp.
--------------------------------Eisenia fetida
—— Artemia salina
Eurypelma californica
I—— Tripedalia cystophora
|— Mnemiopsis leidyi
I— Beroe cucumis
Microciona prolifera
1001 Acanthocoepsis unguiculata
Diaphanoeca grandis .
— Psorospermium haeckelii
Ichthyophonus hoferi
rosette agent
Dermocystidium sp.
Dermocystidium salmonis .
Neocallimastix sp.
Spizeliomyces acuminatus
1 Chytridium confervae
—...... Aspergillus fumagatus
I Ustilago maydis
......... Mucor racemosus -
----Apusomonas proboscidea
t Acanthamoeba palestinensis 30870
। Acanthamoeba castellanii 50374
Cyanophora paradoxa =
Zamia pumila
• Chlorella fusca =
........—........... Palmaria palmata
— Porphyra spiralis var. amplifolia .
Lagenidium giganteum
- Rhizosolenia setigera
Synura spinosa
Tribonema aequale
Labyrinthuloides minuta
— Labyrinthuloides haliotidis -
76-83
71-100
37-38
38-53
83-94/1
89-98
100
100
96-99
100
97-99
99-100
- Theileria buffeli
Sarcocystis muris
Perkinsus sp.
Perkinsus marinus
100
100
животные
DRIP
грибы
протисты
хлоро-
бионты
багрянки
гетеро-
КОНТЫ
Apicom-
plexa
Рис. 234. Положение представителей Ichthyosporea (DRIP-клада) на древе эукариот. Древо построено на основе анализа гена 18S
рРНК по методу максимального правдоподобия (maximum-likelihood). (По: Ragan et al., 1996; с изменениями).
344
ICHTHYOSPOREA
55
59|
Palavascia patagonica ARGD1C15
Alacrinella limnoriae MA8W4
Astreptonema gammari MN3W6
- Enteropogon sexuale WAIC5
Taeniella carcini WA1C37
77
97
51
52
100
60
99
55
86
66
69
---Astreptonema sp. WA3C3
---- Taeniellopsis sp. MA5C17
Enterobryus oxidi KS79W2
68 [ Enterobryus sp. SPA10C6
।— Ente robryus sp. MAll Cl
100|--Eccrinidus flexilis SPA10C2
c L Eccrinidus flexilis SPA 11C45
100Paramoebidium sp. KS61W6
Amoebidium parasiticum
- Ichthyophonus hoferi
Anurofeca richardsi
Sphaeroforma arctica
• Dermocystidium salmonis
Rhinosporidium seeberi
L— Sphaerothecum destruens
----Diaphanoeca grandis
----Monosiga brevicollis
Mnemiopsis leidyi
Beroe cucumis
100
ECC
89
58
100
100
100
— Microciona prolifera
Xylaria carpophila
Tricholoma matsutake
-----Gigaspora gigantea
----Chytriomyces hyalinus
- Capniomyces stellatus
Smittium culisetae
----Kickxella alabastrina
ICH
AMO
DER
CHO
P
A
F
Achlya bisexualis
Рис. 235. Положение трихомицетов (nop. Eccrinales и Amoebidiales) на филограмме опистоконтов, построенной на основе анализа 18S
рДНК по методу максимальной экономии (maximum parsimony) с указанием бутстрэпов в узлах ветвлений. Шкала: скорость замены
50 нуклеотидов.
А — животные, АМО—Amoebidiales, СНО — хоанофлагеллаты, DER — дермоцистиды, ЕСС — Eccrinida, F — грибы, ICH — ихтиофониды, Р — про-
тесты, S — гетероконты. (По: Cafaro, 2005).
ICHTHYOSPOREA
345
1999). У этих трихомицетов в отличие от настоящих
грибов не обнаружен хитин в клеточной стенке, аппа-
рат Гольджи представлен диктиосомами, а септы обра-
зуются только при формировании спорангия, тогда как
многоядерный трофонт не имеет перегородок. Таким
образом, молекулярная филогения подтвердила, что
порядки Amoebidiales и Eccrinales филогенетически
связаны друг с другом и не являются грибами. В то же
время удалось показать, что представители этих поряд-
ков относятся к отряду Ichthyophonida (Cafaro, 2005).
Классификация
Герр и соавторы (Herr et al., 1999) не приняли
классификацию Кавалье-Смита и описали для этих
организмов неформальную ветвь «мезомицетозоев»
(лежащую между животными и грибами). Формально
новый класс Mesomycetozoea и подтип Mesomycetozoa
был предложен чуть позже (Mendoza et al., 2001, 2002).
Основой для замены Ichthyosporea на Mesomycetozoea
стало то, что в эту группу вошли организмы, которые
не являются паразитами рыб. По-видимому, изменение
объема таксона не является достаточным аргументом
для изменения его названия, поэтому вслед за другими
авторами (Adi et al., 2005; Marshall et al., 2008; Mikhailov
et al., 2009) будем придерживаться оригинального и бо-
лее благозвучного названия класса Ichthyosporea.
К. Михайлов с соавторами (Mikhailov et al., 2009)
установили монофилетичность группы, объединяю-
щей Ichthyosporea, Filasteria (Capsaspora + Ministerid)
и Corallochytrium и также назвали ее Mesomycetozoea,
не придавая рангов этим таксонам. В настоящее время
нет причин сомневаться в том, что ихтиоспориды пред-
ставляют группу ранга класса, поэтому вся эта моно-
филетическая ветвь должна, вероятно, объединяться в
таксон более высокого ранга. Однако решение проблем
мегатаксономии не входит в задачи настоящей работы,
поэтому здесь, вслед за указанными авторами, сохра-
ним безранговую классификацию.
В этой главе рассмотрен только класс Ichthyosporea,
который значительно увеличился за последнее время и
насчитывает до 30 родов. После введения в него двух
дополнительных порядков Eccrinales и Amoebidiales,
таксономия класса должна бы сильно измениться, т.к.
вместо двух в нем оказалось 4 таксона ранга отряда.
Однако группировка сиквенсов на молекулярно-фило-
генетических схемах не вполне соответствует этим тра-
диционным отрядам, и систематика класса в настоящее
время еще не устоялась. Поэтому представляется раз-
умным не сохранять деление бывших трихомицетов на
2 порядка, а включить их в отряд Ichthyophonida.
Класс Ichthyosporea Cavalier-Smith 1998
Отряд Ichthyophonida Cavalier-Smith 1998 (24 рода)
Отряд Dermocystida Cavalier-Smith 1998 (5 родов)
Общая морфология стадий
в ходе жизненного цикла
Все, что мы знаем о жизненном цикле Ichthyo-
phonida, основано на изучении отдельных паразити-
ческих стадий, найденных в том или ином хозяине, а
также изолированных клонов на искусственной среде.
В лабораторных условиях удается получить рассели-
тельные стадии в виде амебоидных клеток и эндоспор
Dermocystida
Ichthyophonida
Рис. 236. Схема предположительного жизненного цикла у представителей отрядов Dermocystida и Ichthyophonida.
Стадии слева от вертикальной черты обнаружены в хозяине, справа — in vitro. (По: Mendoza et al., 2002; с изменениями).
Дермоцистиды формируют шаровидные клетки с эндоспорами (1). In vitro вышедшие эндоспоры (2) превращаются в одножгутиковые зооспоры (3),
которые являются инфекционным началом. Они заражают хозяина и инцистируются (4). Затем цисты увеличиваются в размерах (5) и подвергаются
делению с образованием эндоспор (1). Высвобождение эндоспор случается и внутри хозяина, тогда они заражают другие ткани и цикл повторяется
(1,4, 5,1).
Ихтиофониды формируют в тканях хозяина шаровидные или овоидные клетки (1). In vitro рецептакулы со спорами вылупляются из овоидных клеток
(2). Рецептакулы (3) прорываются, высвобождая эндоспоры (4), которые трансформируются в амебоидные клетки, способные к инвазии (5). Попадая
в хозяина амебы развиваются в небольшие рецептакулы (6), которые в дальнейшем образуют на поверхности клеточную стенку, а внутри них разви-
ваются эндоспоры (7, 1). Эндоспоры также могут высвобождаться внутри хозяина, повторяя цикл (1, 6, 7, 1).
346
ICHTHYOSPOREA
у некоторых видов Amoebidium, Abeoforma, Pirum,
Sphaeroforma, Pseudoperkinsus, Creolimax, Ichthyopho-
nus и Psorospermium (Marshall, 2009). Следовательно,
можно предположить, что эти одноядерные стадии яв-
ляются инфицирующим началом и в природе (рис. 236).
Но до сих пор in vivo жизненный цикл не прослежен
ни у одного вида. Такая же ситуация складывается и с
представителями дермоцистид (Dermocystidium): пред-
полагается, что новое заражение рыб вызывают одно-
жгутиковые зооспоры.
Дермоцистиды формируют шаровидные клетки с
эндоспорами (рис. 236). In vitro вышедшие эндоспоры
превращаются в одножгутиковые зооспоры, которые
являются инфекционным началом. Они заражают хо-
зяина и инцистируются. Затем цисты увеличиваются в
размерах и подвергаются делению с образованием эн-
доспор. Высвобождение эндоспор случается и внутри
хозяина, тогда они заражают другие ткани и цикл по-
вторяется.
Ихтиофониды формируют в тканях хозяина шаро-
видные (Ichthyophonus) или овоидные клетки (Psoro-
spermium haeckeli), или клетки крепятся на поверхно-
сти кутикулы (Amoebidium parasiticum). In vitro (рис.
236) рецептакулы со спорами вылупляются из овоид-
ных клеток. Рецептакулы прорываются, высвобождая
эндоспоры, которые трансформируются в амебоидные
клетки, способные к инвазии. Попадая в хозяина, амебы
развиваются в небольшие рецептакулы, которые в даль-
нейшем образуют на поверхности клеточную стенку, а
внутри них развиваются эндоспоры. Эндоспоры также
могут высвобождаться внутри хозяина, повторяя цикл.
Исследование морфологии на светооптическом
уровне дает возможность для обнаружения паразитов
в ткани или на поверхности кишечного тракта хозяина,
и здесь главными признаками являются форма споран-
гия, его размеры, а также особенности расселительных
стадий (детальнее см. раздел Систематический обзор).
Особенности строения самих клеток удается рассмо-
треть только на ультратонких срезах в ТЭМ.
Бывшие трихомицеты порядков Eccrinales (экрини-
ды) и Amoebidiales (амебиды) являются комменсалами
многих членистоногих, обитая преимущественно в за-
днем отделе кишечника. Экриниды характеризуются
неветвящимся несептированным многоядерным тро-
фонтом (талломом) и субапикальным ростом. Бесполое
размножение осуществляется спорами, образующими-
ся в терминальных спорангиях. Выделяют несколько
морфотипов спор, которые, в свою очередь, группи-
руют в 2 морфо-функциональные категории: споран-
гиоспоры первичного заражения (primary infestation
sporangiospores) и спорангиоспоры вторичного зара-
жения (secondary infestation sporangiospores) ’. Первич-
ные спорангиоспоры (обычно одноядерные с толстой
стенкой) выделяются во внешнюю среду и заражают
других хозяев, а вторичные (обычно многоядерные с
тонкой стенкой) — распространяют инфекцию в том
же хозяине. Для первичных спорангиоспор некото-
1 Для удобства изложения будем использовать сокращенные, хотя
и неточные названия: первичные и вторичные спорангиоспоры, соответ-
ственно. — Прим. авт.
рых экринид характерны придатки в виде одного-двух
усиков на каждом полюсе, которые образованы за счет
наружного слоя клеточной стенки спорангиоспоры
(Moss, 1999). Из спорангиоспоры выходит одна или не-
сколько неподвижных эндоспор или подвижных амеб,
которые служат для расселения и заражения новых хо-
зяев. Амебоидные клетки, попадая во внешнюю среду
обычно инцистируются.
Исследование экринид затруднено тем, что их не
удается культивировать, и, хотя они широко распро-
странены в природе, мы очень мало знаем об их пита-
нии, физиологии и экологии.
Ультраструктура клетки Ichthyosporea
Ультраструктурные исследования проведены как
на зараженных тканях, где были обнаружены различ-
ные стадии развития паразитов, так и на выделенных
в культуру паразитах. Следует учесть, что толстая обо-
лочка из полисахаридов препятствует проникновению
фиксаторов внутрь клетки, поэтому при традиционном
(химическом) методе фиксации электронограммы не
всегда высокого качества. Например, трудно бывает
определить форму крист в митохондриях, или «прочи-
тать» количество мембран, окружающих ту или иную
структуру. Эту проблему удается решить, используя
метод криоэлектронной микроскопии, при котором
фиксируются замороженные объекты (Marshall et aL,
2008). При этом лучше сохраняется цитоплазма и вы-
являются неотмеченные ранее структуры, например,
трубчатые выросты и впячивания плазматической мем-
браны трофонта, правда, внутренние мембраны клетки
часто не видны (Marshall et al., 2008; Marshall, Berbee,
2011) (рис. 237).
Структура и состав клеточной стенки исключи-
тельно важны для определения таксономического поло-
жения организма, поэтому были изучены в нескольких
работах. Все трофические и многие расселительные
стадии ихтиоспорид имеют толстую клеточную стенку,
что считается одним из главных признаков класса. Её
строение показано во всех работах по ультраструктуре.
Отмечается значительная толщина стенки (от 100 нм
до нескольких микрон), ее гомогенность или гетеро-
генность (2-4 слоя). Различия в строении стенки могут
быть также связаны с методом фиксации материала.
Окрашивание клеточной стенки у паразита раков
Psorospermium haeckeli дает реакцию на коллаген и
эластиноподобные белки, гликопротеины и мукопо-
лисахариды (Vogt, Rug, 1995), а биохимический ана-
лиз четко показывает, что клеточная стенка паразитов
рыб Dermocystidium sp. и Ichthyophonus hoferi состоит
преимущественно из углеводов (Hedrick et al., 1989;
Rand, 1994; Dykova, Lom, 1992). Более того, в одной
работе авторы утверждали, что мономеры клеточной
стенки I. hoferi представлены N-ацетил-глюкозамином,
т.е. мономером хитина (Spanggaard et al., 1996). Наи-
более детально состав клеточной стенки был изучен у
Sphaeroforma arctica (Jostensen et al., 2002), обитающей
в кишечнике амфипод. Она практически полностью со-
стоит из углеводов, жиры отсутствуют, а белки в еле-
ICHTHYOSPOREA
347
Рис. 237. Ультраструктура клеток Sphaeroforma при химической фиксации (А) и криофиксации (Б). Дочерние клетки лежат внутри
материнской, от которой при первом способе сохраняется лишь оболочка (А).
аг — аппарат Гольджи, в — везикулы, кс — клеточная стенка, м — митохондрии, я — ядро. Масштабная линейка — 2 мкм. (По: Mendoza et al.,
2002 — A; Marshall, 2009 — Б).
довом количестве. Основным компонентом углеводов
является N-ацетил-галактозамин. Он составляет до
70% всего сухого веса клетки. Иостенсен с соавторами
(Jostensen et al., 2002) подвергают сомнению данные
по наличию хитина в клеточной стенке на том основа-
нии, что чувствительность метода в работе Спангаарда
с коллегами (Spanggaard et al., 1996) была недостаточ-
но высока для такого заключения. Если учесть, что у
других представителей класса Ichthyosporea хитин не
обнаружен, то можно считать, что по этому признаку
все они кардинально отличаются от грибов.
Особенности ультраструктуры Dermocystida
Ультратонкое строение отдельных стадий жиз-
ненного цикла дермоцистид показано в нескольких
работах. Так, изучено формирование одножгутико-
вых зооспор в спорах Dermocystidium salmonis Davis
1947 (Olson et al., 1991), и ультраструктура D. cyprini
Cervinka et Lom 1974 (Lotman et al., 2000). Однако наи-
более полно исследованы D. регсае и D. fennicum (Pe-
kkarinen et al., 2003), поэтому последующее описание
основано преимущественно на этих данных.
Первыми после заражения в тканях рыбы обнару-
живаются внутриклеточные стадии Dermocystidium.
Это мелкие (до 2,5 мкм в диаметре) шаровидные клет-
ки, которые содержат крупное ядро с ядрышком, ваку-
олизированную цитоплазму с множеством рибосом.
Клетка покрыта трехслойной оболочкой толщиной
около 20 нм, снаружи которой расположен толстый (до
80 нм) войлокоподобный слой. По мере роста паразита
трехслойность исчезает, толщина оболочки увеличива-
ется и, у клеток размером примерно 5 мкм, превышает
200 нм. При этом она становится плотной и гомогенной
по составу. Клетка паразита отделена от цитоплазмы
хозяина электронно-прозрачной зоной (рис. 238).
На стадии небольшого плазмодия (около 15 мкм)
толщина оболочки достигает 0,5-1 мкм, кроме того,
она образует множественные тонкие наружные вы-
росты (рис. 238). По мере роста плазмодий разрушает
клетку хозяина и становится из внутриклеточного тка-
невым паразитом.
На этой стадии клеточная стенка дифференциру-
ется на плотный наружный слой и более толстый и
рыхлый внутренний слой (рис. 238). По мере развития
плазмодия ядро увеличивается в размерах, ядрышко
также становится крупнее и приобретает гетероген-
ность. В цитоплазме появляются мелкие липидные ва-
куоли и вакуоли с плотными гранулами.
На последующих стадиях развития, которые мож-
но считать близкими к зрелому состоянию плазмодия,
его клеточная оболочка становится более однородной
и толстой, достигая в толщину от 1,5 мкм до 4 и, в от-
дельных случаях, даже 6 мкм (рис. 238). Несколько
отличается по плотности самый наружный слой око-
ло 30 нм толщиной. Он покрывает всю поверхность
клетки и даже тонкие нитевидные наружные выросты
(билли) длиной до 2,5 мкм, которые погружены в цито-
плазму клетки хозяина.
Интересно, что у D. регсае и D. fennicum ядра внутри
плазмодия можно наблюдать только на ранних стадиях
развития. Затем, вплоть до стадии споробласта они не
348
ICHTHYOSPOREA
Рис. 238. Ультраструктура стадий жизненного цикла Dermocystidium регсае.
А — ранняя внутриклеточная стадия (стрелка показывает тонкую клеточную стенку); Б — молодой плазмодий (стрелками показаны тонкие выросты
клеточной стенки); В — выросты клеточной стенки плазмодия (стрелки показывают наружный слой клеточной стенки); Г— фибриллы (ф) в цитоплаз-
ме (на врезке структура митохондрий); Д — молодые споры и одна зрелая спора (справа вверху); Е — первая фаза зооспорогенеза: ядро увеличено,
включение уменьшено, в цитоплазме появляются плотные глобулы, вк — центральное включение, кс — стенка плазмодия, л — липидная глобула,
цх — цитоплазма клетки хозяина, я — ядро. Масштабные линейки: А, В, Г— 1 мкм; Б,Д,Е — 2 мкм. (По: Pekkarinen et al., 2003; с изменениями).
ICHTHYOSPOREA
349
обнаруживаются на срезах, а множество мелких ядер
появляется вновь только на предспоробластической
стадии (Pekkarinen et al., 2003). Это исчезновение ядер
выглядит крайне необычно1. У других дермоцистид в
этот период крупное ядро обычно фрагментируется на
несколько мелких ядер, которые, в свою очередь, под-
вергаются делению. Во всяком случае, у D. cyprini (Lot-
man et al., 2000) дробление крупного ядра на мелкие
идет без таких скачкообразных событий. Плазмодий
D. cyprini содержит нормальные ядра на всем протяже-
нии развития, а цитоплазма лишена вакуолей с плот-
ными гранулами. Вероятно, ядерные преобразования
у D. регсае и D. fennicum имеют свои особенности и
требуют отдельного исследования.
Внутри развивающегося плазмодия есть все обыч-
ные для эукариотных клеток органеллы: митохондрии
с пластинчатыми кристами, диктиосомы аппарата
Гольджи, каналы ЭПР, различного размера вакуоли с
гранулами, липидные капли и гранулы гликогена обыч-
но собранные в розетки (рис. 238). Изредка в цитоплаз-
ме обнаруживаются пучки фибрилл и кристаллоиды
(рис. 238).
Перед началом спорогенеза в цитоплазме содержат-
ся крупные липидные глобулы (до 4 мкм в диаметре) и
намечаются борозды будущей плазмотомии. К этому
времени размеры плазмодия достигают 1-2 мм.
Спорогенез. Перед спорогенезом оболочка плазмо-
дия дифференцируется на два четких слоя: наружный
электронно-прозрачный и внутренний более плотный
и гетерогенный, образованный как бы чередующимися
запятыми. Затем начинается фрагментация плазмодия.
Появившиеся перед спорогенезом ядра (ядра спорон-
тов) делятся и дают ядра споробластов. Вокруг каждо-
го ядра, имеющего на этой стадии деспирализованный
хроматин и маленькое ядрышко, обособляется неболь-
шой участок цитоплазмы, в котором расположены мел-
кие осмиофильные глобулы. Эти глобулы появляют-
ся в результате дробления крупных липидных капель
плазмодия. Рядом с ядром располагается чашевидная
диктиосома аппарата Гольджи и центриолярный аппа-
рат с расходящимися от центриолей микротрубочками.
Споробласты отделены друг от друга губчатым слоем.
В цитоплазме появляется включение в виде округлого
тела, которое увеличивается в размерах и по мере пре-
вращения споробласта в спору становится все более
плотным и занимает центр клетки (рис. 238).
Спора размером 6-8 мкм содержит ядро, плотное
центральное включение, митохондрии, цистерны мем-
бран, липидные глобулы и гранулы гликогена. Стенка
споры толщиной около 40 нм состоит из фибрилляр-
ных и пластинчатых структур (рис. 238).
Зооспорогенез. При инкубировании спор дермоци-
стидиума в воде они начинают делиться и формируют
1 На стадии «отсутствия ядер» у D. регсае и D. fennicum в цито-
плазме обнаруживаются причудливо изогнутые мембраны, часто обра-
зующие складки, видны пузырьки с одной мембраной, в которых содер-
жится хроматиноподобный материал. В расширениях таких пузырьков
накапливается электронно-плотный материал, в котором иногда видны
микротрубочки диаметром 30-40 нм. Эти данные можно интерпретиро-
вать как необычные преобразования хроматина, которые не описаны у
других эукариот. — Прим. авт.
Рис. 239. Схема строения зооспоры Dermocystidium регсае.
вк — включение, г — гранулы гликогена, ж — жгутик, к — кинетосо-
ма жгутика, л — липидные капли, м — митохондрия, р — рибосомы,
ри — поперечно-исчерченный фибриллярный корешок, ру — румпо-
сомо-подобная структура, ц — безжгутиковая кинетосома, я — ядро.
(По: Pekkarinen et al., 2003).
зооспоры. Сначала увеличивается в размерах ядро, а
центральное включение становится менее плотным
и уменьшается в размерах (рис. 238). Ядро переме-
щается в центр клетки, цитоплазма слегка отстает от
клеточной стенки, и начинается деление, идущее, по-
видимому, синхронно: две дочерние клетки споры
дают 4, те — 8 и т.д., пока внутри общей оболочки не
сформируется несколько клеток — зооспор (рис. 238).
Зрелая зооспора содержит одно ядро, к которому при-
легает митохондрия с пластинчатыми кристами; вклю-
чение также образуется вновь, но уже не такое плотное,
как внутри споры (рис. 239). По периферии клетки со
стороны включения находится структура, похожая на
пронизанную отверстиями цистерну ЭПР (румпосому)
хитридиомицетов. Имеются липидные глобулы и зёр-
на гликогена. Рибосомы локализованы в прилегающем
к ядру участке цитоплазмы, что также характерно для
многих хитридиомицетов (Barr, 1992). Жгутик вырас-
тает из прилегающей к включению кинетосомы непо-
средственно перед выходом зооспоры из общей обо-
лочки споры. От кинетосомы жгутика отходит вдоль
поверхности включения довольно широкий поперечно-
исчерченный корешок, охватывающий расположенную
перпендикулярно к ней короткую безжгутиковую кине-
тосому. По меньшей мере, одна микротрубочка идет от
кинетосомы вглубь клетки.
Особенности ультраструктуры
Ichthyophonida
Ультраструктура ихтиофонид известна для несколь-
ких видов. Приведем здесь обобщенные сведения на ос-
350
ICHTHYOSPOREA
новании работ по Sphaeroforma arctica (Jostensen et al.,
2002), Pirum gemmata и Abeoforma whisleri (Marshall,
Berbee, 2011). Эти виды обитают в просвете кишечника
амфипод и других морских беспозвоночных.
Мелкие одноядерные клетки Sphaeroforma arctica
диаметром 6 мкм имеют однородную по составу кле-
точную стенку толщиной 100 нм, которая пронизана
регулярно расположенными порами (рис. 240). Внутри
клетки находится ядро с крупным ядрышком и митохон-
дрии с плотно упакованными пластинчатыми кристами.
Крупные клетки диаметром 17 мкм окружены такой же
клеточной стенкой. В результате нескольких делений
крупной особи образуется 15-25 мелких дочерних кле-
ток диаметром около 5 мкм (рис. 237). Судя по всему,
деление идет до тех пор, пока клетки не разорвут мате-
ринскую клеточную стенку и не выйдут наружу.
Одноядерные клетки сначала растут, при этом их
ядро увеличивается в размерах примерно в 2 раза. За-
тем ядро делится на два, а дочерние ядра делятся син-
хронно, формируя, соответственно, 4, 8, 16 и т.д. чис-
ло ядер. Стенка материнской клетки состоит из двух
слоев: наружного плотного и внутреннего рыхлого. В
целом клеточная стенка тоньше, чем у дермоцистид.
Криоэлектронная микроскопия также выявляет у не-
которых видов каналы, или поры, в клеточной стен-
ке. Интересно, что плазматическая мембрана местами
образует трубчатые инвагинации внутрь цитоплазмы
(рис. 241), или наружные трубчатые выросты, лежащие
под клеточной стенкой. Цитоплазма и ее органеллы, в
общем мало отличаются от описанных структур дер-
моцистид: митохондрии с пластинчатыми кристами, за
исключением Ichthyophonus hoferi, есть гликогеновые
розетки и липидные капли. У ихтиофонид, как и у дер-
моцистид, имеется крупная центральная вакуоль.
Рис. 240. Строение одноядерной клетки Sphaeroforma arctica.
в — везикула, л — предположительно лизосома, м — митохондрии, п —
поры в клеточной стенке, я — ядро. Масштабная линейка — 1 мкм. (По:
Jostensen et al., 2002).
Центросома Ichthyophonida не содержит центрио-
лей, а митотические микротрубочки отходят от элек-
тронно-плотной пластинки, которую Маршал с соав-
торами (Marshall et al., 2008; Marshall, Berbee, 2011)
назвал SPB1 (spindle pole body). Эта пластинка у Pirum
и Abeoforma имеет серповидную форму, или незам-
кнутое кольцо диаметром примерно 200 нм. Вокруг
серповидного ЦОМТа располагаются цистерны глад-
кого ЭПР, напоминающие аппарат Гольджи, однако на-
стоящие диктиосомы у представителей этих родов не
обнаружены. Тип митоза не известен, но, основываясь
на данных по делению ядер в плазмодиях (например, у
миксомицетов) можно предположить, что он относит-
ся к закрытому типу При этом ядра становятся мель-
че. Перед делением в процессе образования эндоспор,
клетки становятся многоядерными. Плазмодий почти
одновременно дробится на мелкие одноядерные эндо-
споры, на первых порах покрытые только унитарной
мембраной.
У плазмодиев Ichthyophonus hoferi цитоплазма ва-
куолизирована, и перед спорогенезом в них насчиты-
ваются сотни ядер. При спорогенезе у этого вида также
идет фрагментация плазмодия, но иногда обособляют-
ся группы из нескольких ядер.
Питание
Очень мало известно о способе питания. Фаготро-
фия не отмечена ни для одной стадии ихтиоспорид.
Считается, что они поглощают питательные вещества
из хозяина осмотрофно, через поры в клеточной стенке
(Mendoza et al., 2002; Marshall, Berbee, 2011).
Размножение
До последнего времени считалось, что ихтиоспо-
риды размножаются только бесполым путем (Mendoza
et al., 2002). Этот процесс освещен в предыдущих
разделах. Следует добавить, что при развитии в куль-
туре многоядерные клетки (плазмодии) помимо вы-
свобождения эндоспор или амеб могут размножаться
почкованием. При этом отделяющаяся почка содер-
жит несколько ядер. Амебоидные клетки ихтиофонид
способны отползать от спорангия, демонстрируя рас-
селительную фунцию. У разных видов амебы могут
формировать различные псевдоподии: лобоподии, суб-
псевдоподии (пальцевидные филоподии) и ветвящиеся
длинные филоподии.
После включения экринид в состав ихтиоспорей
мы могли бы утверждать, что половой процесс име-
ет место при лестничной конъюгации Enteropogon
sexuale (Hibbits, 1978) (рис. 242). Однако клетки по-
сле слияния не росли и не делились, поэтому нельзя
с уверенностью говорить о наличии полового процес-
1 Для таких структур существуют общеизвестные названия:
NAO — nuclear associated organelle, и ЦОМТ - центр организации ми-
кротрубочек (Райков, 1978), который в разных группах эукариот имеет
разное строение. Отдадим здесь предпочтение термину ЦОМТ (в англо-
язычных работах — МТОС) как общепринятому в отечественной лите-
ратуре. — Прим. авт.
ICHTHYOSPOREA
351
Рис. 241. Ультраструктура Pirum gemmata (А-Д) и Abeoforma whisleri (E).
A — вегетативный плазмодий с центральной вакуолью (цв), Б — зрелая клетка с эндоспорами, В — клеточные стенки двух прилегающих друг к другу
клеток, Г — инвагинация плазмалеммы с мембранными трубочками, Д — центросома, Е — вегетативный плазмодий (стрелки указывают внешние
границы плазмодия), в — вакуоль, вм — внеклеточный материал, г — гликоген, кс — клеточная стенка, м — мембрана, мт — микротрубочки, п — по-
лость, образованная впячиванием плазматической мембраны, в которой лежат трубочки, т — трубочки, образованные плазматической мембраной, я —
ядро, яп — ядерные поры. Масштабные линейки: А — 10 мкм, Б, Е — 2 мкм, В, Г— 500 нм, Д— 500 нм. (По: Marshall, Berbee, 2011; с изменениями).
са, который включает, как известно, не отмеченный
в упомянутой работе мейоз. С другой стороны, автор
проводил наблюдения в течение короткого времени,
следовательно, нельзя исключить слияние ядер и по-
следующий мейоз на более поздних стадиях жизнен-
ного цикла.
Для решения этой проблемы Маршал (Marshall,
2009) предпринял попытку генетического анализа
клонов. Он сравнил гены EFL и HSP70 у двух разных
клонов Sphaeroforma (Pseudoperkinsus) sp., и показал,
что эти гены в каждом клоне имеют разную историю
и отличаются настолько, что нельзя исключить генети-
ческую рекомбинацию. Автор делает заключение, что
в гаплоидном жизненном цикле Sphaeroforma (Pseu-
doperkinsus) sp. имеет место половой процесс. По-
видимому, он факультативен и приводит к периодиче-
352
ICHTHYOSPOREA
Рис. 242. Внешний вид Enteropogon sexuale.
Слева таллом с многоядерными спорангиоспорами, справа — лестничная конъюгация двух талломов. (По: Misra, Lichtwardt, 2000).
скому появлению кратковременной диплоидной фазы
в жизненном цикле этого вида. Вероятно, именно фа-
культативность полового процесса не позволяет обна-
ружить конъюгацию клеток при исследовании культур
Sphaeroforma (Pseudoperkinsus) sp.
По-видимому, эти данные требуют более весомого
подтверждения. Здесь отметим лишь, что генетический
анализ популяций и клонов оказывается более эффек-
тивным и коротким путем для обнаружения полового
процесса у протистов, чем прямые наблюдения за их
поведением в культуре.
Экология
Все описанные виды были выделены из животных
хозяев и считаются паразитами или симбионтами. Они
попадают в организм преимущественно через ротовое
отверстие и заселяют кишечник (Jones, Dawe, 2002;
Cafaro, 2005). В редких случаях (Amoebidium) паразиты
прикрепляются к хозяину снаружи, становясь эпибион-
тами. Разнообразие ихтиоспорид далеко не исчерпано
известными видами. Об этом свидетельствуют много-
численные природные сиквенсы, явно не относящиеся
ни к одному из известных таксонов, но расположенные
в пределах ветви ихтиоспорид (рис. 243).
Для отряда Ichthyophonida видовая специфичность
паразита к хозяину не показана. Более того, у изоля-
тов Creolimax fragrantissima. выделенных из четырех
различных хозяев, локусы ITS и EFL оказались иден-
тичны (Marshall et al., 2008), a Ichthyophonus hoferi
способен заражать новых хозяев, проходя по пищевой
цепочке хищников (Jones, Dawe, 2002). Конечно, нель-
зя исключить, что существуют неизвестные еще виды
с высокой специфичностью к хозяину, или у тех же
изолятов будут отличия по другим локусам ДНК, но
пока таких данных нет и, в общем, это маловероятно.
К настоящему времени уже около 10 видов ихтиофо-
нид культивируются на искусственной среде независи-
мо от хозяина, и это не представляет большой слож-
ности. Представители родов Creolimax. Sphaeroforma.
Pirum. Abeoforma обитают в просвете кишечника, по-
этому обладают осмотрофным типом питания. Следо-
вательно, можно предположить, что эти опистоконты
сравнительно недавно эволюционировали от свобод-
ноживущего предка и еще не приобрели специфич-
ность к хозяину.
Наоборот, дермоцистиды являются облигатными
паразитами и, по-видимому, могли коэволюциониро-
вать со своими позвоночными хозяевами. Это можно
предположить на основе изучения штаммов одного фи-
лотипа Rhinosporidium seeberi. у которых локусы ITS
отличались в зависимости от вида хозяина и его гео-
графического положения (Silva et al., 2005).
Обобщенные сведения по некоторым особенно-
стям жизненных циклов Ichthyosporea и их хозяевам
приведены в таблице 8.
Способность к повторному заселению того же хо-
зяина исключительно важна для экринид. Они прикре-
пляются к кутикуле задней кишки и желудка многих
морских ракообразных, но не обнаружены в средней
кишке и гепатопанкреасе, не имеющих хитиновой
выстилки. Поэтому, сбрасывая кутикулу при линьке,
хозяин полностью освобождается от этих паразитов.
В результате паразит оказывается во внешней среде и
вынужден заселять хозяина вновь. У экринид есть для
этого определенная согласованность стадий жизнен-
ного цикла. Так, расселение внутри хозяина (вторич-
ное заражение) осуществляется путем фрагментации
многоядерного трофонта на клетки различного размера
с тонкими покровами и сравнительно небольшим, но
неопределенным числом ядер. Перед линькой хозя-
ICHTHYOSPOREA
353
1. Abeoforma
Pirum
2. Eccrinales
Amoebidiales
Ichthyophonus
^—^Ichthyophonus
3. Psorospermium
haeckeli
Dermocystida
______________________ Capsaspora owczarzaki
0.1
Рис. 243. Молекулярная филогения Ichthyosporea по гену 18S рРНК с включением природных сиквенсов.
Использованы методы максимального правдоподобия, максимальной экономии и байесов метод. Площадь треугольника пропорциональна количеству
сиквенсов. Жирные линии означают поддержку 90% и выше по всем трем методам. (По: Marshall, 2009; с изменениями).
ина паразит формирует первичные спорангиоспоры,
Имеющие толстую клеточную стенку и 1^4 ядра, т.е.
приспособленные для переживания во внешней среде
и заражения новых хозяев. Не исключено, что при об-
разовании спор идет мейоз, и гаплоидное поколение
подвергается воздействию внешних факторов перед
последующей гаметогамией в хозяине. Образование
расселительных амебоидных стадий происходит при
линьке хозяев и у других ихтиофонид (Whisler, 1965).
Другим приспособлением экринид из морских и про-
точных пресных вод является формирование придатков
на поверхности спорангиоспор, которые предположи-
тельно замедляют их оседание в толще воды и увели-
чивают вероятность встречи с новым хозяином.
Систематика и филогения
Молекулярно-филогенетические схемы по несколь-
ким генам постоянно показывают, что ихтиоспориды и
хоанофлагеллаты являются сестринскими многокле-
точным животным (Lang et al., 2002; Ruiz-Trillo et al.,
2006; Steenkamp et al., 2006). Порядок ветвления этих
кластеров неразрешим, но чаще всего ветвь ихтио-
спорид отходит стразу после разветвления опистокон-
тов на Holomycota (грибы и близкие к ним организ-
мы, включая микроспоридий) и Holozoa (Capsaspora,
Corallochytrium, Minis ter ia, Ichthyosporea, Choanofla-
gellata, Metazoa). Ихтиоспориды — вторая по разно-
образию после воротничковых жгутиконосцев ветвь
354
ICHTHYOSPOREA
Таблица 8
Характерные черты наиболее изученных таксонов Ichthyosporea (по: Mendoza et al., 2002; Marshall, 2009)
Таксон Тип крист в митохондриях Стадии жизненного цикла Хозяева
Отряд Dermocystida
Dermocystidium spp. пластинчатые удлиненный спорангий, эндоспоры, одножгу- тиковые зооспоры рыбы
Sphaerotecum destruens пластинчатые? шаровидный спорангий, эндоспоры, одножгутиковые зооспоры рыбы
Rhinosporidium seeberi пластинчатые шаровидный спорангий, эндоспоры, одножгутиковые зооспоры ? млекопитающие, птицы
Отряд Ichthyophonida
Amoebidium parasiticum пластинчатые спорангий, эндоспоры, амебоидная стадия насекомые и ракообразные
Ichthyophonus hoferi трубчатые гифы, плазмодий, споры, амебоидная стадия рыбы
Psorospermium haeckeli пластинчатые овоидные споры с раковинкой, амебоидная стадия раки
Anurofeca richardsi пластинчатые? шаровидный спорангий, эндоспоры личинки бесхвостых амфибий
Creolimax fragrantissima пластинчатые шаровидный спорангий, эндоспоры различные морские беспозвоночные, особенно, сипункулиды
Sphaeroforma arctica, S. nootkatensis, S. tapetis (= Pseudoperkinsus tapetis) пластинчатые шаровидный спорангий, эндоспоры, плазмо- дии, амебы амфиподы, различные морские беспоз- воночные, особенно, двухстворчатые моллюски
Paramoebidium пластинчатые? удлиненный изогнутый спорангий, эндоспоры задний отдел кишечника личинок во- дных насекомых
Pirum gemmata пластинчатые грушевидный спорангий, эндоспоры сипункулиды
Abeoforma whisleri пластинчатые шаровидный спорангий, эндоспоры, плазмо- дии, амебы мидии
Enteropogon sexuale ? неветвящийся сильно вытянутый плазмодий, эндоспоры. Кариогамия задний отдел кишечника раков-кротов
Enterobryus sp. ? сильно вытянутый плазмодий редко с бифур- кациями в основании, эндоспоры членистоногие, диплоподы, нематоды
Astreptonema gammari ? сильно вытянутый плазмодий, эндоспоры амфиподы
Palavascia sp. ? сильно вытянутый плазмодий, эндоспоры изоподы
одноклеточных Holozoa, включающая почти 30 родов
(Marshall, 2009).
После работ Устиновой с соавторами (Ustynova et
al., 2000) и Кафаро (Cafaro, 2005) разнообразные в мор-
фологическом отношении экриниды и амебиды заняли
свое место в классе Ichthyosporea. При этом обе груп-
пы формируют четкую монофилетическую группиров-
ку в составе Ichthyophonida (Marshall, Berbee, 2011)
(рис. 235, 243).
Ближайший сосед экринид и амебид Ichthyophonus
hoferi способен формировать гифоподобные струк-
туры при понижении pH среды. При повышенной pH
он образует амеб (Okamoto et al., 1985). Судя по всему,
Ichthyophonus вместе с амебидами и экринидами фор-
мирует одну монофилетическую ветвь (Cafaro, 2005).
Эту идею поддерживает и Маршалл (Marshall, 2009),
который на большей выборке сиквенсов 18S рДНК по-
казывает, что отряд ихтиофонид формирует 4 ветви,
образованные как сиквенсами известных видов, так и
природными (рис. 243). Одна ветвь содержит сиквен-
сы двух недавно описанных родов Abeoforma и Pirum,
которые характеризуются нецентриолярным ЦОМТом,
трубчатыми выростами плазматической мембраны, на-
личием плазмодиев и амеб, а также бинарным делени-
ем. Вторая линия ихтиофонид включает ветвь экринид
с амебидами и Ichthyophonus. Для нее описаны плаз-
модии и амебы, поры в клеточной стенке и прикрепи-
тельная органелла, или присоска, которая служит для
закрепления трофонта экриниды на поверхности кути-
кулы. Третья филогенетическая ветвь содержит только
один вид Psorospermium haeckeli, который способен
формировать амеб. Четвертая ветвь объединяет при-
родные сиквенсы, группирующиеся вокруг Sphaero-
forma и Creolimax с шаровидным талломом. Для этой
группы характерны нецентриолярный ЦОМТ, трубча-
тые выросты плазматической мембраны, плазмодии и
амебы, бинарное деление, поры в клеточной стенке и
прикрепительная органелла. Таким образом, морфоло-
гические особенности всех группировок сильно пере-
крываются, а «недостающие признаки» у экринид и
амебид могут быть обнаружены позднее при более де-
тальных ультраструктурных исследованиях. Вероятно,
поэтому Маршалл (Marshall, 2009) считает эти филоге-
нетические линии предварительными и пока не делает
таксономических выводов.
Группа дермоцистид всегда четко отделяется от их-
тиофонид и является базальной ветвью Ichthyosporea,
т.е. ближе других к предку всех ихтиоспорид. Однако
их биологические особенности свидетельствуют об об-
ратном. Один из ближайших к ихтиоспоридам видов
ICHTHYOSPOREA
355
амебоидных Mesomycetozoa — Ministeria vibrans —
представлен свободноживущими формами, у которых
в редких случаях отмечается зачаточный жгутик, а
дермоцистиды — высокоспециализированные пара-
зиты с обязательной жгутиковой стадией в жизнен-
ном цикле и полным отсутствием амебоидных форм.
По этим признакам ихтиофониды, среди которых нет
специфичности к хозяину, есть сапрофиты и амебоид-
ные формы в жизненном цикле, но нет жгутиков, мно-
го ближе к свободноживущим представителям подтипа
Mesomycetozoa. По-видимому, это противоречие будет
предметом дальнейших исследований всей группы
Mesomycetozoa.
Систематический обзор
Описания некоторых родов даны детальнее, чем
это обычно принято, чтобы, во-первых, полнее отраз-
ить интересную историю изучения некоторых видов,
во-вторых, современные диагнозы некоторых видов
и родов включают практически всю информацию по
светооптическим и ультраструктурным особенностям,
что свидетельствует об отсутствии четких таксоно-
мических критериев в классе Ichthyosporea. В связи
с последним обстоятельством, группировка родов по
семействам представляется преждевременной (см. так-
же раздел Классификация), поэтому приведены только
описания родов, распределенных по двум отрядам.
Подтип Mesomycetozoa Mendoza et al.
2002
Класс Ichthyosporea Cavalier-Smith
1998
Отряд Ichthyophonida Cavalier-Smith 1998
Род Amoebidium Cienkowski 1861 (рис. 244)
Трофонты прикрепляются к кутикуле хозяина сна-
ружи, редко поселяются в ректуме. Они продуцируют
одноядерные спорангиоспоры или амебоидные клетки.
Амебы инцистируются и затем трансформируются в
удлиненные цистоспоры.
Типовой вид: Л. parasiticum Cienkowski 1861.
Хозяева: ракообразные и личинки водных насе-
комых.
Локализация: поверхность экзокутикулы.
Этот род включает 4 вида: A. australiense, A. collu-
viei, A. parasiticum и A. recticola. Один из наиболее изу-
ченных — A. parasiticum Cienkowski 1861, — который
является эпибионтом многих пресноводных раков и на-
секомых, или поселяется в задней кишке. Первоначаль-
но этот, очевидно, непатогенный организм, относили к
грибам на том основании, что он подобно грибам фор-
мирует одноклеточный таллом — спорангий удлинен-
ной формы, прикрепленный к хозяину снаружи спе-
циальной ножкой. В отличие от других ихтиофонид с
шаровидным спорангиоспорами A. parasiticum образу-
ет внутри спорангия сигаровидные спораногиоспоры.
Рис. 244. Сигаровидные спорангиоспоры Amoebidium parasiti-
cum (А), отделенный от тела хозяина спорангий (5) и рассели-
тельная стадия в виде моноподиальной амебы (5).
Масштабная линейка: А — 15 мкм, Б, В — 3 мкм. (По: Mendoza et al.,
2002; с изменениями).
Их форма и размеры являются видовыми признаками.
Они выходят из спорангия и могут, прикрепляться к
новому хозяину. Иногда из спорангия выходят подвиж-
ные моноподиальные амебы размером чуть меньше
10 мкм. Амебы в дальнейшем инцистируются, цисты
растут, становясь многоядерными, и затем формируют
удлиненные цистоспоры, очень похожие на споранги-
оспоры.
Ценковский отнес этот вид к хитридиомицетам
(Cienkowski, 1861), другие авторы помещали его среди
простейших, относя то к споровикам, то к Мухотусо-
phyta (Whisler, 1962). Позднее этот организм отнесли к
трихомицетам (Misra, Lichtwardt, 2000), а после деталь-
ного изучения культуры типового вида Amoebidiumpar-
asiticum, весь род был включен в состав Ichthyosporea
(Ustinova et al., 2000).
Мендоза с соавторами (Mendoza et al., 2002) под-
твердил, что A. parasiticum является сестринской груп-
пой Ichthyophonus hoferi и I. irregularis и относится к
отряду Ichthyophonida. Другие представители рода
Amoebidium не исследованы.
Род Paramoebidium Leger et Duboscq 1929
(рис. 245)
Таллом неветвящийся, различной формы (пря-
мой, изогнутый, крючковидный), прикрепляется к
356
ICHTHYOSPOREA
Рис. 245. Внешний вид Paramoebidium.
А — таллом, Б — амебоидные зооспоры, В — циста с двумя цистоспорами. Масштабные линейки: А — 3 мкм, Б, В — 5 мкм. (По: Misra, Lichtwardt,
2000; с изменениями).
поверхности кутикулы задней кишки при помощи се-
кретируемой присоски. Амебы выходят из спорангия
без предварительного формирования спорангиоспор
(одноядерных клеток, покрытых клеточной стенкой).
Амебоидные зооспоры инцистируются, цисты фор-
мируют от двух до нескольких цистоспор. Отличается
от Amoebidium большими размерами, локализацией —
обычно в задней кишке — и отсутствием спорангио-
спор.
Типовой вид: Р inflexum Leger et Duboscq
1929.
Хозяева: нимфы насекомых Ephemeroptera, Ple-
coptera, личинки Simuliidae.
Локализация: задний отдел кишечника.
Род Alacrinella Manier et Ormieres ex Manier
1968 (рис. 246)
Таллом гетероморфный. Макроталлом в основании
лопастный или уплощенный. Спорангиоспоры пер-
вичного заражения овальные, с четырьмя ядрами, тол-
стостенные. Спорангиоспоры вторичного заражения
многоядерные. Материнская клетка споры сохраняется
на апексе. Микроталлом распадается на серию мелких
клеток.
Типовой вид: Л. limnoriae Manier et Ormieres ex
Manier 1968.
Хозяева: равноногие рачки сем. Limnoidae.
Локализация: задний отдел кишечника.
Рис. 246. Внешний вид Alacrinella.
А — присоска в основании таллома, Б — таллом со спорангиоспорами. (По: Misra, Lichtwardt, 2000; с изменениями).
ICHTHYOSPOREA
357
Рис. 247. Внешний вид таллома Arundinula. На врезке спора с
придатками. (По: Misra, Lichtwardt, 2000; с изменениями).
PoRArundinula Leger et Duboscq 1906
(рис. 247)
У хозяев, десятиногих раков, таллом паразита при-
крепляется как в передней кишке, так и в задней. Ма-
теринская клетка споры сохраняется на апикальном
полюсе. Спорангиоспоры первичного заражения часто
плоские, дисковидные, а вторичного заражения — поч-
ти овальные, иногда вытянутые. Некоторые виды про-
дуцируют споры с нитевидными выростами.
Типовой вид: Л. capitata Leger et Duboscq 1906.
Хозяева: раки-отшельники и другие аномуриды.
Локализация: передний и задний отделы ки-
шечника.
Рис. 248. Внешний вид спорангиоспор Astreptonema с тонкими
придатками (по: Misra, Lichtwardt, 2000; с изменениями).
Рис. 249. Внешний вид таллома Eccrinidus.
На врезке двудольчатая спорангиоспора. (По: Misra, Lichtwardt, 2000;
с изменениями).
Род Astreptonema Hauptfleisch 1895
(рис. 248)
Таллом диморфный, материнская клетка споры со-
храняется на апикальном полюсе. Макроталлом обыч-
но изогнут в основании, продуцирует толстостенные
овальные обычно с четырьмя ядрами спорангиоспо-
ры первичного заражения, некоторые с нитевидным
выростом на каждом полюсе, или дает многоядерные
спорангиоспоры вторичного заражения. Микроталлом
распадается на серию мелких клеток.
Типовой вид: Л. longispora Hauptfleisch 1895.
Хозяева: креветки и пресноводные рачки (Аш-
phipoda).
Локализация: задний отдел кишечника.
Род Eccrinidus Manier 1970 (рис. 249)
Спорангиоспоры первичного заражения цистовид-
ные двудольчатые, редко, однодольчатые. Из каждой
доли высвобождается одна четырехядерная клетка.
Имеются также многоядерные спорангиоспоры вто-
ричного заражения.
Типовой в и д: £ flexilis Manier 1970.
Хозяева: многоножки (Diplopoda: Glomeridae).
Локализация: задний отдел кишечника.
Род Eccrinoides Leger et Duboscq 1929
(рис. 250)
Спорангиоспоры первичного заражения овальные
четырехядерные толстостенные обычно имеют по од-
ной поре на каждом полюсе. Спорангиоспоры вторич-
ного заражения тонкостенные с 4-8 ядрами.
Типовой вид: £. henneguyi Leger et Duboscq
1929.
Хозяева: многоножки (Diplopoda: Glomeridae) и
изоподы (Tylidae, Porcellionidae).
Локализация: задний отдел кишечника.
358
ICHTHYOSPOREA
Рис. 250. Внешний вид Eccrinoides.
Таллом внизу, слева увеличен его дистальный конец со зрелыми спорангиоспорами, справа — первичные спорангиоспоры с порами на полюсах
(стрелка). (По: Misra, Lichtwardt, 2000; с изменениями).
Род Enterobryus Leidy 1849 (рис. 251)
Таллом неветвящийся ценотический с хорошо за-
метной присоской. Спорангиоспоры первичного зара-
жения тонкостенные одноядерные, вторичного зара-
жения — цилиндрические, содержат 4-8 ядер. Иногда
продуцируют и другие типы клеток.
Типовой в и д: £. elegans Leidy 1849.
Хозяева: многоножки (многие семейства дипло-
под) и жуки, преимущественно сем. Hydrophilidae.
Локализация: задний отдел кишечника.
Род Enteromyces Lichtwardt 1961 (рис. 252)
Таллом диморфный обычно растет пучками, при-
крепляясь к кутикуле передней кишки множеством
присосок. Спорангий продуцирует толстостенные од-
ноядерные или многоядерные спорангиоспоры. Мате-
ринская клетка споры сохраняется.
Типовой в и д: Е callianassae Lichtwardt 1961.
Хозяева: бокоплавы, креветки и настоящие кра-
бы (Brachyura).
Локализация: передний отдел кишечника.
Рис. 251. Таллом Enterobryus (слева) и присоска в основании
таллома (справа). (По: Misra, Lichtwardt, 2000; с изменениями).
Род Enteropogon Hibbits 1978 (рис. 241)
Имеется 4 типа таллома, каждый из которых про-
дуцирует тонкостенные одноядерные и многоядерные
клетки. Для одного типа таллома характерно лестнич-
ное слияние.
Типовой в и д: £. sexuale Hibbits 1978.
Хозяева: раки-кроты (Callianassidae).
Локализация: задний отдел кишечника.
Род LajasiellaTuset et Manier 1950 (рис. 253)
Таллом короткий, материнская клетка споры сохра-
няется. Продуцирует один крупный спорангий с мно-
жеством спорангиоспор первичного заражения, или
серию терминальных одноядерных клеток.
Типовой в и д: L. aphodii Tuset et Manier 1950.
Хозяева: личинки пластинчатоусых жуков (Scar-
abaeidae).
Локализация: задний отдел кишечника.
Род Leidyomyces Lichtwardt, White,
Cafaro et Misra 1999 (рис. 254)
Обычно растет пучком отдельных нитей, которые
прикрепляются общей присоской в основании. Реже
встречаются одиночные нити таллома. Таллом дает
спорангии с одноядерными или вытянутыми много-
ядерными спорангиоспорами.
ICHTHYOSPOREA
359
Рис. 252. Внешний вид Enteromyces.
А — множественная присоска в основании многочисленных нитей таллома, Б — макроталлом
(слева) со зрелыми толстостенными сорангиоспорами и микроталлом. (По: Misra, Lichtwardt, 2000;
с изменениями).
Рис. 253. Внешний вид таллома Lajasiel-
la (по: Misra, Lichtwardt, 2000; с измене-
ниями).
Рис. 254. Внешний вид Leidyomyces.
А — клубок неветвящихся нитей таллома (на врезке множественная присоска в основании),
Б — одноядерные спорангиоспоры. (По: Misra, Lichtwardt, 2000; с изменениями).
Рис. 255. Внешний вид Palavascia. (По:
Misra, Lichtwardt, 2000; с изменениями).
360
ICHTHYOSPOREA
Типовой вид: I. attenuatus Lichtwardt, White,
Cafaro et Misra 1999.
Хозяева: сахарные жуки (сем. Passalidae).
Локализация: задний отдел кишечника.
Род Palavascia Тuset et Manier 1947
(рис. 255)
Спорангии образуются на кончиках таллома и дают
овальные или эллипсоидные толстостенные одно- или
иногда многоядерные спорангиоспоры первичного за-
ражения. Материнская клетка споры сохраняется.
Типовой в и д: РphiloscidaeTusetetManier 1947.
Хозяева: морские изоподы (Oniscidae, Sphaero-
matidae).
Локализация: задний отдел кишечника.
Род Paramacrinella Manier et Grizel 1971
(рис. 256)
Таллом диморфный. Макроталлом неветвящийся,
продуцирует спорангиоспоры первичного и вторично-
го заражения. Материнская клетка споры сохраняется в
основании зрелого таллома. Микроталлом распадается
на серию одноядерных клеток.
Типовой вид: Р microdeutopi Manier et Grizel
1971.
Хозяин: амфипода Microdeutopus anomalus.
Локализация: задний отдел кишечника.
Рис. 256. Внешний вид Paramacrinella. (По: Misra, Lichtwardt,
2000; с изменениями).
Род Passalomyces Lichtwardt, White,
Cafaro et Misra 1999 (рис. 257)
Таллом с толстыми стенками формирует терми-
нально серию толстостенных уплощенных спорангиев,
каждый из которых содержит тонкостенную одно- или
многоядерную спорангиоспору.
Типовой в и д: Р compressus Lichtwardt, White,
Cafaro et Misra 1999.
Хозяева: сахарные жуки (сем. Passalidae).
Локализация: задний отдел кишечника.
Рис. 257. Внешний вид Passalomyces. (По: Misra, Lichtwardt,
2000; с изменениями).
Род Ramacrinella Manier et Ormieres ex Manier
1961 (рис. 258)
Таллом диморфный. Макроталлом ветвится в осно-
вании, продуцирует на дистальных кончиках споран-
гиоспоры первичного и вторичного заражения. Мате-
ринская клетка споры сохраняется в основании зрелого
таллома. Микроталлом неветвящийся, распадается на
серию мелких одноядерных клеток.
Типовой вид: Я. raibauti Manier et Ormieres ex
Manier 1961.
Хозяин: амфипода Microdeutopus anomalus.
Локализация: задний отдел кишечника.
ICHTHYOSPOREA
361
Рис. 258. Внешний вид Ramacrinella. (По: Misra, Lichtwardt,
2000; с изменениями).
Род Taeniella Leger et Duboscq 1911 (рис. 259)
Таллом продуцирует толстостенные, устойчивые к
внешним воздействиям спорангиоспоры с двумя при-
датками на каждом полюсе, а также тонкостенные спо-
рангиоспоры первичного и вторичного заражения.
Типовой в и д: Z carcini Leger et Duboscq 1911.
Хозяева: раки-кроты и настоящие крабы (Вга-
chyura).
Локализация: задний отдел кишечника.
Рис. 259. Внешний вид Taeniella. Справа толстостенная споран-
гиоспора с придатками. (По: Misra, Lichtwardt, 2000; с измене-
ниями).
Рис. 260. Внешний вид Taeniellopsis. Талломы с многоядерными (слева) и одноядерными (справа) спорангиоспорами. В центре одно-
ядерные спорангиоспоры. (По: Misra, Lichtwardt, 2000; с изменениями).
362
ICHTHYOSPOREA
Род Taeniellopsis Poisson 1927 (рис. 260)
Таллом мономорфный продуцирует тонкостенные
одноядерные спорангиоспоры первичного заражения и
многоядерные спорангиоспоры вторичного заражения.
При линьке хозяина образует толстостенные овальные
одноядерные спорангиоспоры.
Типовой вид: Т. orchestiae Poisson 1927.
Хозяева: скакуны или морские блохи (Amphipo-
da: Talitridae, Orchestiidae).
Локализация: задний отдел кишечника.
Род Anurofeca Baker, Beebee et Ragan 1999
(рис. 261)
Представители этого рода считались водорослями
и были описаны как Prototheca richardsi (Beebee, Wong,
1993; Wong, Beebee, 1994). Поскольку они были обна-
ружены в экскрементах головастика лягушки (Richards,
1958), то предполагалось, что паразитируют в кишеч-
нике личинок бесхвостых амфибий. Они действитель-
но обитают в кишечнике, однако их патогенез до сих
пор не показан.
Род Anurofeca был описан Бейкером с соавторами
на основании молекулярной филогении по гену 18S
рРНК (Baker et al., 1999). A. richardsi образует сфери-
ческие сильно вакуолизированные неподвижные клет-
ки диаметром 3—10 мкм. Зрелые особи от 7 до 10 мкм
диаметром, окружены клеточной стенкой до 1 мкм тол-
щиной. Вакуоли занимают до половины объема клет-
ки, поэтому ядро расположено на периферии. Мито-
хондрии имеются, но плохо различимы в электронный
микроскоп. В результате деления клеток формируются
многоклеточные конгломераты, насчитывающие от 2
до 8 клеток. Дочерние особи мельче, но морфологиче-
ски неотличимы от материнских. Другие стадии жиз-
ненного цикла не обнаружены.
Морфологически анурофека напоминает клетки
Prototheca, но плохо растет на их культуральной среде
и практически не дает реакции на антитела Prototheca.
После молекулярно-биологических исследований
(Baker et al., 1999) стало ясно, что этот вид относит-
ся к Mesomycetozoa и наиболее близок Psorospermium
haeckeli, образуя вместе с ним сестринскую ветвь
Ichthyophonus hoferi.
Типовой вид: Л. richardsi Baker, Beebee et Ra-
gan 1999.
Хозяева: личинки бесхвостых амфибий.
Локализация: кишечник.
Род Ichthyophonus Plehn et Mulsow 1911
(рис. 262)
С начала XX столетия было опубликовано множе-
ство сообщений о болезнях рыб, вызванных I. hoferi.
Во всем мире было зафиксировано 14 морских и 6 пре-
Рис. 261. Anurofeca richardsi в сканирующем (А) и просвечивающем (Б) электронном микроскопе.
А — шаровидные клетки с налипшими бактериями и частичками органики; Б — на срезе клетки видны многочисленные везикулы в цитоплазме.
Масштабная линейка — 1 мкм. (По: Mendoza et al., 2002).
Рис. 262. «Микроспоры» Ichthyophonus hoferi вышедшие из кончиков их гифов (Л) и гистологический препарат мышечной ткани
сельди, инфицированной I. hoferi (Б).
м — мускулатура, с — споры I. hoferi, э — эпидермис. Масштабная линейка — 50 мкм. (По: Mendoza et al., 2002).
ICHTHYOSPOREA
363
сноводных видов рыб, страдающих от этого паразита,
который часто поражает внутренние органы: сердце,
печень, мышцы и селезенку. Он встречается в пора-
женных тканях в виде округлых толстостенных много-
ядерных клеток, называемых цистами, спорами или по-
коящимися спорами (рис. 262). I. hoferi легко выделить
в культуру из пораженных тканей.
До последнего времени Ichthyophonus hoferi счи-
тался видом неопределенного систематического поло-
жения: то ли грибом, то ли простейшим (Mendoza et al.,
2002). Долгое время род Ichthyophonus был монотипи-
ческим. Позднее было описано еще 3 вида Ichthyopho-
nus'. I. gastrophilum, I. intestinalis и I lotae. Оказалось,
однако, что I. gastrophilum является младшим синони-
мом I. hoferi, а два других вида относятся к настоящим
грибам из отряда Enthomophthorales (Neish, Hughes,
1980).
Однако в камбале был обнаружен еще один похо-
жий на него представитель Ichthyophonus, отличаю-
щийся по сиквенсу 18S рДНК. Он был описан как но-
вый вид I. irregularis (Rand et al., 2000).
Свое нынешнее таксономическое положение I. ho-
feri тоже получил не сразу: сначала его сближали с во-
ротничковыми жгутиконосцами, но затем было показа-
но, что этот вид относится к DRIP (Ragan et al., 1996).
Поскольку этот вид легко культивируется, он достаточ-
но хорошо изучен. Строение клетки в целом такое же,
как у других ихтиофонид, но кристы в митохондриях
трубчатые, а не пластинчатые. При пониженной pH он
дает гифы, а при повышении pH до 7-9 развивает под-
вижные амебоидные формы. Последняя особенность
обнаружена и у других представителей Ichthyophonida,
но отсутствует у Dermocystida.
Типовой вид: I. hoferi Plehn et Mulsow 1911.
Хозяева: костные рыбы.
Локализация: сердце, печень, мышцы, селезенка.
Род Psorospermium Hilgendorf 1883
(рис. 263)
Psorospermium haeckeli впервые был описан Гек-
келем в 1857 году как паразит речного рака (Haeckel,
1857), но не был назван. Позднее, в 1883 году, Хильген-
дорф (Hilgendorf, 1883) назвал его в честь Геккеля. Этот
вид поражает, в основном, раков и был найден в Север-
ной и Южной Америке, в большинстве европейских
стран, а также в Сибири. В разное время его относили
и к грибам, и к простейшим, и к водорослям, основы-
ваясь на морфологических описаниях разных стадий
жизненного цикла (Nylund et al., 1983). Из-за этой не-
определенности его называли загадочным паразитом
пресноводных раков. Помимо Р haeckeli были описаны
еще 2 вида: Psorospermium orconectis (de la Herran et
al., 2000) и Psorospermium sp. (Воронин, 1975), — пер-
вый из которых, судя по морфологическим признакам,
является младшим синонимом Psorospermium haeckeli.
В то же время, по размерам, морфологии и гистологии
можно выделить, по меньшей мере, 6 морфотипов,
каждый из которых представляет собой самостоятель-
ный вид (Vogt, 1999).
Р. haeckeli поражает преимущественно соедини-
тельную ткань вокруг кишечника, хотя описаны случаи
поражения мышечной и других тканей. В пораженных
тканях этот паразит встречается в виде овальных и
вытянутых спор размером 45><90 мкм, одетых свето-
преломляющей оболочкой. Внутри них в цитоплазме
также обнаруживаются светопреломляющие гранулы
разного размера (рис. 263). По этим овальным спорам
Р. haeckeli четко отличается от всех других представи-
телей класса, имеющих споры сферической формы.
Обнаружена в их жизненном цикле и двуядерная аме-
боидная стадия.
Вопрос о филогении Р. haeckeli был решен, когда
Рэйган с соавторами амплифицировали и секвениро-
вали ген его 18S рРНК (Ragan et al., 1996). Было по-
казано, что это не гриб, а представитель группы DRIP.
Позднее многие авторы подтвердили, что Р. haeckeli
группируется с I. hoferi, или располагается в основа-
нии отряда Ichthyophonida (Herr et al., 1999; Mendoza
et al., 2002). Оба вида имеют амебоидные стадии и
патогенны для морских животных. Вместе с тем, они
отличаются по форме крист в митохондриях: I. hoferi
имеет трубчатые, а для Р. haeckeli характерны пла-
стинчатые кристы. Форма крист считалась ключевым
признаком до появления молекулярно-филогенетиче-
ских исследований. Сейчас принято думать, что в не-
которых таксонах эти морфологические признаки не
столь стабильны.
Типовой вид:/! haeckeli Hilgendorf 1883.
Хозяева: пресноводные раки.
Локализация: соединительная ткань кишечни-
ка, мышцы.
Рис. 263. Препарат соединительной ткани речного рака, заражен-
ного Psorospermiun haeckeli (А) и удлиненные споры Р haeckeli
(Б). В цитоплазме клеток видны светопреломляющие гранулы.
Масштабная линейка: А — 50 мкм, Б — 20 мкм. (По: Mendoza et al.,
2002).
364
ICHTHYOSPOREA
Род Sphaeroforma' (Jostensen et al.) Marshall
2009 (рис. 237)
С и н.: Pseudoperkinsus Figueras et al. 2000.
Шаровидные многоядерные клетки с гладкой кле-
точной стенкой. Деление ядер синхронное, практи-
чески, одновременное. Бесполое размножение пре-
имущественно посредством полной трансформации
родительской клетки в многочисленные эндоспоры.
Жгутиковые стадии отсутствуют. У некоторых видов
отмечены короткоживущие плазмодии и амебоидные
стадии. Клетки способны прикрепляться к хозяину, но
специальные прикрепительные органеллы отсутству-
ют. Митохондрии с пластинчатыми кристами и ядра с
множественными периферическими ядрышками. Ап-
парат Гольджи в виде диктиосом, ЦОМТ лежит между
ядром и диктиосомой. Клеточная стенка обычно двус-
лойная (наружный плотный, внутренний электронно-
прозрачный), пронизана порами и покрыта прозрачным
гликокаликсом. Внутренний слой стенки импрегниро-
ван трубчатыми выростами плазматической мембраны.
Обитают в кишечнике морских беспозвоночных.
Sphaeroforma отличается от ближайшего на моле-
кулярно-филогенетическом древе Creolimax наличием
неподвижных колоний, периферических ядрышек, от-
сутствием долгоживущей амебоидной стадии и цен-
тральной вакуоли.
Типовой вид — Sphaeroforma arctica2 Jostensen et al.
2002 — шаровидный эукариотный организм, который
был выделен из амфиподы Gammarus setosus во время
экспедиции в высокие арктические широты (Jostensen
et al., 2002). Поскольку хозяин не проявлял признаков
заболевания, было неясно, является ли S. arctica пара-
зитом, безвредным комменсалом или просто пищевым
объектом.
При дальнейшем изучении культур этого вида не
отмечено почкования, гифального роста, амебоидных,
споровых или жгутиковых стадий. Особи размером
5-7 мкм развиваются внутри шаровидной материнской
клетки, которая со временем деградирует до клеточной
стенки. Зрелая материнская клетка, достигнув диаме-
тра 30-35 мкм, разрушается, из нее выходят от 120 до
150 мелких эндоспор.
Морские холодолюбивые.
Попытки заразить ими амфипод оказались без-
успешными.
Более детальные генетические и морфологические
исследования показали, что этот род насчитывает 4
вида: S. arctica Jostensen et al. 2002, S. nootkatensis Mar-
1 Маршал указывает, что Pseudoperkinsus и его единственный вид
Р tapetis (Figueras et al., 2000) формально неописаны, а изученная эти-
ми авторами культура была заражена дермоцистидой, поэтому в работе
были отмечены жгутиковые формы, и она была генетически неоднород-
на (Marshall, 2009). Поэтому род Pseudoperkinsus не валиден. — Прим,
авт. 2 ~
Иостенсен с соавторами поместили частичный сиквенс гена
18S рРНК этого вида в GenBank под именем Sphaerosoma arcticus еще
в 1999 году, и под этим именем (иногда Sphaerosoma arcticum) этот сик-
венс использовали другие авторы (Baker et al., 1999; Ustinova et al., 2000;
Mendoza et al., 2002; Pekkarinen et al., 2003). Однако публикация с описа-
нием нового вида и рода Sphaeroforma arctica вышла только в 2002 году
(Jostensen et al., 2002). — Прим. авт.
shall 2009, S. gastrica Marshall 2009 и S. tapetis Marshall
2009.
Типовой вид: S. arctica Jostensen et al. 2002.
Хозяева: амфиподы и другие морские беспозво-
ночные.
Локализация: полость кишечника.
Род Creolimax Marshall, Celio, McLaughlin et
Berbee 2008 (рис. 264, А, Б)
Вегетативные особи шаровидной формы, много-
ядерные, покрыты гладкой клеточной стенкой, содер-
жат одну крупную центральную вакуоль. Колонии в
культуре белого цвета, шероховатые в форме наростов
неправильной формы. В условиях культуры продуци-
рует мелких моноподиальных амеб, иногда наблюдает-
ся агрегация клеток. Питание осмотрофное, на стадии
амеб фагоцитоз не обнаружен. Распространение при по-
мощи эндоспор или амеб, которые выходят из материн-
ской клетки через поры или разрывы клеточной стенки.
Ультраструктура: клеточная стенка примерно 80 нм
толщиной, состоит из наружного гомогенного элек-
тронно-плотного слоя и внутреннего прозрачного, в ко-
торый погружены трубчатые выросты плазматической
мембраны. Митохондрии с пластинчатыми кристами,
ЦОМТ митотического веретена без центриолей, ассо-
циирован с ядром и аппаратом Гольджи.
Род помещен в отряд Ichthyophonida, поскольку от-
носится к этой ветви на молекулярно-филогенетичекой
схеме. От ближайшего рода Sphaeroforma отличается
формированием колоний и амеб в качестве расселитель-
ных стадий, а также по способу выхода эндоспор: через
поры и мелкие множественные разрывы, а не в резуль-
тате полного разрушения оболочки материнской клетки.
Типовой вид: С. fragrantissima Marshall, Celio,
McLaughlin et Berbee 2008.
Хозяин: оболочник Corella sp.
Локализация: пищеварительный тракт.
Род Pirum Marshall et Berbee 2011
(рис. 264, В)
Вегетативные особи яйцевидной формы, много-
ядерные, покрыты гладкой клеточной стенкой, содер-
жат одну крупную или несколько вакуолей. Питание
осмотрофное, фаготрофно питающихся стадий нет.
Бесполое размножение и распространение при помощи
слабо метаболирующих неподвижных эндоспор без
клеточной стенки, которые резко выбрасываются через
разрывы в стенке материнской клетки. Редко эндоспо-
ры при высвобождении образуют цепочку клеток. Спо-
рогенез идет путем фрагментации цитоплазмы плаз-
модия на одноядерные эндоспоры. Многоклеточные
агрегаты, гифы, жгутиковые или подвижные амебоид-
ные стадии не отмечены.
Ультраструктура: клеточная стенка состоит из двух
слоев: наружный из переплетающихся фибрилл, ле-
жащих параллельно плазматической мембране; внут-
ренний электронно-прозрачный слой варьирует по
ICHTHYOSPOREA
365
Рис. 264. Внешний вид Creolimax: fragrantissima (А, Б), Pirum gemmata (В) и Abeoforma whisleri (Г-Е) в световой микроскоп.
Л, Б — клетки с разным числом вакуолей, В — различные формы таллома с центральной вакуолью (цв), Г — шаровидные клетки, Д — переходная
форма к плазмодию, Е — плазмодий. Масштабные линейки — 20 мкм. (По: Marshall et al., 2008 — А, Б; Marshall, Berbee, 2011 — В-Е).
толщине, в него проникают трубчатые выросты мем-
браны, которые отмечены также и в эктоплазме клетки.
Митохондрии с трубчатыми кристами, ядро с крупным
ядрышком, центросома в форме серповидной пластин-
ки с расходящимися микротрубочками.
На основании молекулярно-филогенетического ана-
лиза гена 18S рРНК род отнесен авторами к ветви Ich-
thyophonida. Сестринская ветвь представлена сиквенсом
рРНК рода Abeoforma. Отличается от Abeoforma отсут-
ствием расселительных стадий в виде подвижных амеб
и плазмодиев, структурой внутреннего слоя клеточной
стенки и организацией трубчатых выростов мембраны.
Типовой вид: Р gemmata Marshall et Berbee
2011.
Хозяин: почвенная олигохета Phascolosoma
agassizii.
Локализация: пищеварительный тракт.
Род Abeoforma Marshall et Berbee 2011
(рис. 264, Г-Е)
Вегетативные особи многоядерные шаровидные
с одной или несколькими вакуолями, занимающими
большую часть клетки. Сложный и недерминирован-
ный клеточный цикл из нескольких стадий включа-
ет расселительные подвижные амебы и плазмодии.
Многоядерные плазмодии неправильной формы, раз-
личных размеров, обычно покрыты клеточной стен-
кой. Одноядерные амебы без клеточной стенки, часто
моноподиальные. Питание осмотрофное, фагоцитоз
не отмечен. Четыре варианта бесполого размножения:
1) родительская клетка полностью или частично транс-
формируется в амебоидные эндоспоры, 2) частые и по-
вторные бинарные деления амеб и эндоспор, 3) почко-
вание плазмодиев, 4) редко происходит высвобождение
366
ICHTHYOSPOREA
множества неподвижных эндоспор через разрывы в
родительской клеточной стенке.
Ультраструктура: клеточная стенка из одного или
двух слоев, внутренний (или единственный) из которых
образован матриксом средней электронной плотности,
заключающим тубулярные выросты плазматической
мембраны и каналы. Внешний слой, если присутствует,
состоит из сеточки фибрилл. Митохондрии с пластин-
чатыми кристами, ядро с заметным ядрышком и приле-
гающей центросомой с отходящими микротрубочками.
В соответствии с молекулярно-филогенетической схе-
мой относится к ихтиофонидам с ближайшим соседом
Pirum.
Типовой вид:Л. whisleriMarshalletBerbee2011.
Хозяин: двухстворчатый моллюск Mytilus sp.
Локализация: желудок, тонкий кишечник, гепа-
топанкреас.
Отряд Dermocystida Cavalier-Smith 1998
Род Dermocystidium Perez 1908
(рис. 265)
Dermocystidium характеризуется сферическими
спорангиями (цистами), внутри которых развиваются
эндоспоры (рис. 265). Такие признаки мы встречаем и
у других представителей Dermocystida, что объясняет
повышенное внимание первых исследователей к мор-
фологическому сходству Dermocystidium и Rhinospo-
ridium seeberi. На основании морфологических при-
знаков виды рода Dermocystidium относили сначала к
гаплоспоридиям, грибам или к Apicomplexa (Mendoza
et al., 2002).
Предполагается, что рыбы заражаются при контак-
те с эндоспорами, вышедшими из инфицированных
рыб. Шаровидные спорангии Dermocystidium диаме-
тром 200-400 мкм содержат сотни эндоспор. Споран-
гии можно легко обнаружить на жабрах, где их массо-
вое развитие препятствует поглощению кислорода и в
конечном итоге приводит к гибели рыбы.
Типовой вид: D. pusula Perez 1908.
Хозяева: костные рыбы.
Локализация: кожный эпителий.
Рис. 265. Гистологический препарат жабр рыбы, инфицирован-
ной Dermocystidium salmonis.
А — спорангий с многочисленными эндоспорами, Б — спорангий при
большем увеличении. Масштабные линейки: А — 50 мкм, Б — 20 мкм.
(По: Mendoza et al., 2002).
Род Amphibiocystidium Pascolini et al. 2003
(рис. 266)
Этот паразит, вызывающий поражения кожи у ля-
гушек, после детального исследования строения и
молекулярной филогении был переведен из рода Der-
mocystidium в новый род Amphibiocystidium (Pascolini
et al., 2003; Pereira et al., 2005). По данным молекуляр-
ной филогении А. гапае является сестринским роду
Dermocystidium и располагается недалеко от Rhinospo-
ridium seeberi. Спорангий диаметром до 400 мкм имеет
двухслойную клеточную стенку (тонкий наружный и
толстый внутренний слой) и формирует сотни эндо-
спор размером от 2 до 7 мкм. Эндоспоры окружены
толстой похожей на капсулу оболочкой, внутри обнару-
живаются электронно-плотные гранулы и ядро.
В отличие от представителей Dermocystidium,
А. гапае, как и R. seeberi, не формируют жгутико-
вых зооспор (Pereira et al., 2005). Таким образом, род
Amphibiocystidium имеет черты сходства как с Dermo-
cystidium, так и с Rhinosporidium.
Рис 266. Гистологический срез кожи лягушки Rana esculenta, зараженной Amphibiocystidium гапае. Видны зрелые спорангиоспоры
со спорами. (По: Pereira et al., 2005).
ICHTHYOSPOREA
367
В настоящее время и другие виды дермоци-
стид, обитающие в лягушках (D. pusula, D. ranae,
Dermosporidium spp. и Dermomycoides spp.) считаются
синонимами Amphibiocystidium ranae (Pascolini et al.,
2003; Pereira et al., 2005). Таким образом, паразиты ам-
фибий {Amphibiocystidium) обособляются от паразитов
рыб {Dermocystidium).
Типовой вид: Л. ranae Pascolini et al. 2003.
Хозяева: амфибии.
Локализация: кожный эпителий.
Род Amphibiothecum Feldman, Wimsatt et
Green 2005
Паразит жаб Dermocystidium penneri на молекуляр-
ных филограммах близок Sphaerotecum destruens, но в
то же время, его цисты значительно мельче, а споры,
наоборот, в 2-5 раз крупнее. Кроме того, Sphaerotecum
destruens паразитирует в лососевых. Поэтому авторы
исследования (Feldman et al., 2005) переименовали вид
Dermocystidium penneri в Amphibiothecum penneri, уста-
новив, таким образом, новый род Amphibiothecum. По-
видимому, было бы логично описать этот вид как еще
одного представителя рода Amphibiocystidium, к кото-
рому отнесены паразиты земноводных, но на фило-
грамме виды Amphibiocystidium локализуются в ином
месте.
Типовой вид: Л. penneri Feldman, Wimsatt et
Green 2005.
Хозяин: жаба.
Локализация: кожный эпителий.
Род Rhinosporidium Seeber 1900 (рис. 267)
Rhinosporidium seeberi вызывает заболевание в
форме грануломатоза у человека и животных, так на-
зываемый риноспоридиоз, который встречается пре-
имущественно в тропиках. Болезнь характеризуется
развитием полипов в ноздрях и на глазной конъюнкти-
ве. Известна только одна стадия развития этого пато-
гена — спорангии диаметром 60-450 мкм на разных
стадиях развития, внутри которых формируются эндо-
споры в огромном количестве — до 12 000 штук раз-
мером от 7 до 15 мкм. Эндоспоры выбрасываются из
Рис. 267. Гистологический препарат полипоидной ткани человека, зараженного Rhinosporidium seeberi.
А — незрелый спорангий и клетки воспаленной ткани; Б — зрелый спорангий с огромным количеством эндоспор. Масштабная ли-
нейка: А — 50 мкм, Б — 25 мкм. (По: Mendoza et al., 2002).
Рис. 268. Ультраструктура Sphaerotecum destruens.
А — трофонт в интерстициальных клетках почки зараженной горбуши, Б — ультраструктура делящейся особи, В — строение покровов и митохон-
дрий. Масштабные линейки: А — 0,7 мкм, Б — 0,8 мкм, В — 0,3 мкм. (По: Mendoza et al., 2002).
368
ICHTHYOSPOREA
спорангия через специальную пору и заражают окру-
жающие ткани. В культуре не поддерживается, поэто-
му экспериментальные заражения животных не прово-
дились.
Таксономическое положение этого организма было
не определено до последнего времени. Первое опи-
сание риноспоридиоза принадлежит Сиберу (Seeber,
1900), который отнес инфицирующее начало к споро-
викам. Позднее (Ashworth, 1923) этот вид был вклю-
чен в состав хитридиомицетов, а Додж (Dodge, 1935)
принял спорангий за многоспоровую сумку и клас-
сифицировал R. seeberi как сумчатый гриб. Совсем
экзотическими выглядят интерпретации этого вида
как цианобактерии (Ahluwalia et al., 1997) или просто
как скопление ненужных углеводов (Ahluwalia, 1992).
Были и попытки сравнивать его с патогенами рыб
Ichthyophonus (Laveran, Pettit, 1910) и Dermocystidium
(Dunkerly, 1914; Carmi, 1940), но в то время не было
достаточных оснований для объединения этих родов.
Впервые этот вид был помещен среди Mesomycetozoea
сравнительно недавно на основании ультраструктур-
ных и молекулярно-биологических исследований (Herr
et al., 1999). Митохондрии с пластинчатыми кристами
удалось обнаружить только на промежуточных стадиях
созревания спорангия, в котором видны многочислен-
ные ядра и пластинчатые тела.
Rhinosporidium объединяет примерно 20 видов,
каждый из которых вызывает заражение с летальным
исходом рыб и морских животных.
Типовой вид: R. seeberi Seeber 1900.
Хозяева: птицы и млекопитающие.
Локализация: носоглотка, глаза.
Род Sphaerotecum Arkush et al. 2003
(рис. 268)
Вызывает заболевание лососевых рыб с последую-
щим летальным исходом. Споры развиваются внутри-
клеточно, вызывая гранулез почек и селезенки. Зрелая
спора дает множество жгутиковых зооспор. По сово-
купности этих признаков Sphaerotecum отличается от
Dermocystidium и Rhinosporidium. Наличие в жизнен-
ном цикле одножгутиковых зооспор позволяет предпо-
лагать, что они также могут служить инфицирующим
началом. Сначала считали, что rosette agent имеет труб-
чатые кристы в митохондриях (Arkush et al., 1998), од-
нако позднее было показано, что у него пластинчатые
кристы (Mendoza et al., 2002).
Типовой вид: 5. destruens Arkush et al. 2003
(= rosette agent).
Хозяин: лососевые рыбы.
Локализация: почки, селезенка.
SUM
The general characteristics, brief history, classification, mor-
phology, ecology, practical importance, phylogeny and the de-
scription of genera have been reviewed. Basic reviews by Mis-
ra, Lichtwardt (2000), Mendoza et al. (2002), Pekkarinen et al.
(2003), Cafaro (2005), Marshall (2009), along with other papers
ARY
have been used for this chapter. The class Ichthyosporea be-
longs to the subphylum Mesomycetozoa and contains two orders:
Ichthyophonida with 24 genera, and Dermocystida (5 genera)
without division onto the families because of poor taxonomic cri-
teria.
ЛИТЕРАТУРА
Воронин B.H. 1975. О находках Psorospermium lacustris И Известия
ГосНИИОРХ. Т. 93. С. 125-26.
Райков И.Б. 1978. Ядро простейших. Л.: Наука. 328 с.
Adi S.M., Simpson A.G.B., Farmer М.А., Andersen R.A., Ander-
son R.A., Barta J., Bowser S., Brugerolle G., Fensome R., Fredericq S.,
JamesT.Y., Karpov S.A., Kugrens P., Krug J., Lane C., Lewis L.A., Lodge
J., Lynn D.H., Mann D., McCourt R.M., Mendoza L., Moestrup 0., Mo-
zley-Standridge S.E., Nerad T.A., Shearer C., Smirnov A.V., Spiegel F.
and Taylor F.J.R. 2005. The New Higher Level Classification of Eukaryotes
with Emphasis on the Taxonomy of Protists // J. Euk. Microbiol. Vol. 52.
P. 399-432.
Ahluwalia K.B. 1992. New interpretations in rhinosporidiosis, enig-
matic disease of the last nine decades // J. Submicrosc. Cytol. Pathol. Vol. 24.
P. 109-114.
Ahluwalia K.B., Maheshwari N., Deka R.C. 1997. Rhinosporidi-
osis: a study that resolves etiologic controversies //Am. J. Rhinol. Vol. 11.
P. 479-483.
Arkush K.D., Frasca S.Jr., Hedrick R.P. 1998. Pathology associated
with the rosette agent, a systemic protist infecting salmonid fishes // J. Aquat.
Anim. Health. Vol. 10. P. 1-11.
Ashworth J.H. 1923. On Rhinosporidium seeberi (Wemecki, 1903)
with special reference to its sporulation and affinities // Trans. R. Soc. London
Edinb. Vol. 53. P. 301-342.
Baker G.C., Beebee T.J.C., Ragan M.A. 1999. Prototheca richardsi, a
pathogen of anuran larvae, is related to a clade of protistan parasites near the
animal-fungal divergence//Microbiology. Vol. 145. P. 1777-1784.
Barr D.J.S. 1992. Evolution and Kingdoms of organisms from the per-
spective of a mycologist // Mycologia. Vol. 84. P. 1-11.
Beebee TJ.C., Wong A.L.C. 1993. Stimulation of cell division and
DNA explication in Prototheca richardsi by passage through larval amphib-
ian guts // Parasitology. Vol. 107. P. 119-124.
Cafaro M.J. 2005. Eccrinales (Trichomycetes) are not fungi, but a clade
of protists at the early divergence of animals and fungi // Molecular Phyloge-
netics and Evolution. Vbl._35. P. 21-34.
Carini A. 1940. Sobre um pasasito semelhante ao “Rhino sporidium”
encontrado em quistos da pele de uma “hyla” // Arq. Inst. Biol. San Paulo.
Vol. 11. P. 93-96.
Cavalier-Smith T. 1998. Neomonada and the origin of animal and
fungi // Evolutionary Relationships Among Protozoa. Eds. Coombs G.H.,
Vickerman K., Sleigh M.A., Warren A. Vol. 56. Dordrecht, The Netherlands:
Kluwer. P. 375-407.
Cienkowski L. 1861. Uber parasitische Schlauche auf Crustaceen und
einigen Insektenlarven (Amoebidium parasiticum) I I Bot. Ztg. Bd 19. S. 169—
174.
de la Herran R., Garrido M.A., Navas R.J., Rejon C.R., Rejon M.R.
2000. Molecular characterization of the ribosomal RNA gene region of Per-
kinsus atlanticus\ its use in phylogenetic analysis and as a target for a molecu-
lar diagnosis // Parasitology. Vol. 120. P. 345-53.
Dodge C.W. 1935. Medical mycology, fungous diseases of men and
other mammals. C.V Mosby Co., St. Louis, MO. P. 151-152.
Duboscq O., Leger L., Tuzet O. 1948. Contribution a la connaissance
des Eccrinides: les Trichomycetes // Arch. Zool. Exp. Gen. Vol. 86. P. 29-144.
ICHTHYOSPOREA
369
Dukerly J.S. 1914. Dermocystidium pusula Perez, parasitic on trutta
fario // Zool. Anz. Vol. 44. P. 179-182.
Dykova L., Lom J. 1992. New evidence of fungal nature of Dermocys-
tidium koi Hoshina and Sahara, 1950 // J. Appl. Ichthyol. Vol. 8. P. 180-185.
Feldman S.H., Wimsatt J.H., Green D.E. 2005. Phylogenetic classifi-
cation of the frog pathogen Amphibiothecum (Dermocystidium) penneri based
on small ribosomal subunit sequencing // J. Wild Dis. Vol. 41. P. 701-706.
Figueras A., Lorenzo G., Ordas M.C., Gouy M., Novoa B. 2000. Se-
quence of the small subunit ribosomal RNAgene of Perkinsus atlanticus-\\ke,
isolated from carpet shell clam in Galicia, Spain // Mar. Biotechnol. Vol. 2.
P. 419-428.
Haeckel E. 1857. Uber die gewebe des flusskrebses // Arch. Anat.
Physiol. Wiss. Med. Bd 24. S. 469-568.
Hedrick R.P., Friedman C.S., Modin J. 1989. Systemic infection
in Atlantic salmon Salmo salar with a Dermocystidium-Wke species // Dis.
Aquat. Org. Vol. 7. P. 171-177.
Herr R.A., Ajello L., Taylor J.W., Arseculeratne S.N., Mendoza L.
1999. Phylogenetic analysis of Rhinosporidium seeberi's 18S small-subunit
ribosomal DNA groups this pathogen among members of the protoctistant
Mesomycetozoa clade // J. Clin. Microbiol. Vol. 37. P. 2750-2754.
Hibbits J. 1978. Marine Eccrinales (Trichomycetes) found in crusta-
ceans of the San Juan Archipelago, Washington // Syesis. Vol. 11. P. 213-261.
Hilgendorf E 1883. Bemerkungen uber die sogenanntekrebspest, ins-
besondere fiber Psorospermium haeckeli spec, nova // Sitz. Gess. Nat. Freun.
Berlin. Bd9. S. 179-183.
Hofer B. 1893. Eine Salmonidenerkrankung // Allg. Fisch Ztg. Bd 18.
S. 168-171.
Jostensen J.-P., Sperstad S., Johansen S., Landfald B. 2002. Mo-
lecular-phylogenetic, structural and biochemical features of a cold-adapted,
marine ichthyosporean near the animal-fungal divergence, described from in
vitro cultures // Eur. J. Protistol. Vol. 38. P. 93-104.
Jones S.R.M., Dawe S.C. 2002. Ichthyophonus hoferi (Plehn & Mul-
sow) in British Columbia stocks of Pacific herring, Clupea pallasi (Valen-
ciennes), and its infectivity to Chinook salmon, Oncorhynchus tshawytscha
(Walbaum) // J. Fish Dis. Vol. 25. P. 415-421.
Kerk D., Gee A., Standish M., Wainwright P.O., Drum A.S., Elston
R.A., Sogin M.L. 1995. The rosette agent of Chinook salmon (Oncorhynchus
tshawytscha) is closely related to choanoflagellates, as determined by Phylo-
gepetic analyses of its small ribosomal subunit RNA // Mar. Biol. Vol. 122.
P. 187-92.
Lang B.F., O’Kelly C.O., Nerad T.A., Gray M.W., Burger G. 2002.
The closest unicellular relatives of animals // Curr. Biol. Vol. 12. P. 1773-1778.
Laveran A., Pettit A. 1910. Sur une epizootie des truites // C. R. Acad.
Sci. Vol. 151. P. 421-423.
Leidy J. 1849. Enterobryus, a new genus of confervaceae // Proc. Natl.
Acad. Sci. Phil. Vol. 4. P. 225-233.
Lotman K., Pekkarinen M., Kasesalu J. 2000. Morphological obser-
vations on the life cycle of Dermocystidium cyprini Cervinka et Lom, 1974,
parasitic in carps (Cyprinus carpid) // Acta Protozool. Vol. 39. P. 125-134.
Marshall W.L. 2009. New ichthyosporean protists and their biology as
inferred from molecular genetic and light and electron microscopic study //
PhD thesis. University of British Columbia.
Marshall W.L., Berbee M.L. 2011. Facing Unknowns: Living Cultures
(Pirum gemmata gen. nov., sp. nov., and Abeoforma whisleri, gen. nov., sp.
nov.) from Invertebrate Digestive Tracts Represent an Undescribed Clade
within the Unicellular Opisthokont Lineage Ichthyosporea (Mesomyceto-
zoea) // Protist. Vol. 162. P. 33-57.
Marshall W.L., Celio G., McLaughlin D.J., Berbee M.L. 2008. Mul-
tiple isolations of a culturable, motile Ichthyosporean (Mesomycetozoa, Opis-
thokonta), Creolimax fragrantissima n. gen., n. sp., from marine invertebrate
digestive tracts // Protist. Vol. 159. P. 415-433.
Mendoza L., Ajello L., Taylor J.W. 2001. The taxonomic status of
Lacazia loboi and Rhinosporidium seeberi has been finally resolved with the
use of molecular tools // Rev. Iberoam. Micol. Vol. 18. P. 95-98.
Mendoza L., Taylor J.W., Ajello L. 2002. The class Mesomycetozoea:
a heterogeneous group of microorganisms at the animal-fungal boundary //
Annu. Rev. Microbiol. Vol. 56. P. 315-344.
Mikhailov K.V., Konstantinova A.V., Nikitin M.A., Troshin P.V.,
Rusin L.Yu., Lyubetsky V.A., Panchin Yu.V., Mylnikov A.P., Moroz L.L.,
Kumar S., Aleoshin V.V. 2009. The origin of Metazoa: a transition from tem-
poral to spatial cell differentiation // BioEssays. Vol. 31. Iss. 7. P. 758-768.
Misra J.K., Lichtwardt R.W. 2000. Illustrated genera of Trichomyce-
tes fungal symbionts of insects and other arthropods // Oxford & IBH publish-
ing Co. Pvt. Ltd. New Delhi, Calcutta.
Moss S.T. 1999. Astreptonema gammari’. An Eccrinid with Appendaged
Spores // Kew Bulletin. V. 54. No. 3. P. 637-650.
Neish G.A., Hughes G.C. 1980. Fungal diseases of fishes, Book 6 //
S.F. Snieszco, H.R. Axelrod (eds). Diseases of Fishes. P. 61-100. USA/New
Jersey/Gt. Britain/Surrey: TFH.
Nylund V., Westman K., Laintmaa K. 1983. Ultrastructure and tax-
onomic position of the crayfish parasite Psorospermium haeckeli Heilgen-
dorf // Freshw. Crayfish Vol. 5. P. 307-14.
Okamoto N., Nakase K., Suzuki H., Nakai Y., Fujii K., Sano T. 1985.
Life history and morphology of Ichthyophonus hoferi in vitro // Fish Pathol.
Vol. 20. P. 273-286.
Olson R.E., Dungan C.F., Holt R.A. 1991. Water-borne transmission
of Dermocystidium salmonis in the laboratory // Dis. Aquat. Org. Vol. 12.
P. 41—48.
Pascolini R., Daszak P., Cunningham A., Fagotti A., Tei S., Vagnet-
ti D., Bucci S., Di Rosa I. 2003. Parasitism by Dermocystidium ranae in a
population of Rana esculenta complex in Central Italy and description of of
Amphibiocystidium n. gen. // Dis. Aquat. Org. Vol. 56. P. 65-74.
Pekkarinen M., Lom J., Murphy C.A., Ragan M.A., Dykova 1.2003.
Phylogenetic position and ultrastructure of two Dermocystidium species (Ich-
thyosporea) from the common perch (Perea fluviatilis) // Acta Protozool.
Vol. 42. P. 287-307.
Pereira C.N., Di Rosa I., Fagotti A., Simoncelli E, Pascolini R., Men-
doza L. 2005. The pathogen of frogs Amphibiocystidium ranae is a member
of the order Dermocystida in the class Mesomycetozoea // J. Clin. Microbiol.
Vol. 43. P. 192-198.
Ragan M.A., Goggin C.L., Cawthorn R.J., Cerenius L., Jamienson
A.V.C., Plourdes S.M., Tand T.G., Soderhall K., Gutell R.R. 1996. A novel
clade of protistes near the animal-fimgal divergence // Proc. Natl. Acad. Sci.
USA. Vol. 93. P. 11907-11912.
Rand T.G. 1994. An unusual form of Ichthyophonus hoferi (Icthyopho-
nales: Ichthyophonaceae) from yellowtail flounder Limanda ferruginea from
the Nova Scotia shelf // Dis. Aquat. Org. Vol. 18. P. 21-28.
Rand T.G., White K., Cannone J.J., Gutell R.R., Murphy C.A.,
Ragan M.A. 2000. Ichthyophonus irregularis sp. nov. from the yellowtail
flounder Limanda ferruginea from the Nova Scotia shelf // Dis. Aquat. Organ.
Vol. 41. P. 31-36.
Richards C.M. 1958. The inhibition of growth in crowded Rana pipiens
tadpoles // Physiol. Zool. Vol. 31. P. 138-151.
Ruiz-Trillo L, Lane C.E., Archibald J.M., Roger A. J. 2006. Insights
into the evolutionary origin and genome architecture of the unicellular opis-
thokonts Capsaspora owczarzaki and Sphaeroforma arctica I I J. Euk. Micro-
biol. Vol. 53. P. 1-6.
Seeber G.R. 1900. Un nuevo sporozuario parasite del hombre. Dos ca-
sos encontrados en polypos nasals. MD thesis. Univ. Nacional Buenos Aires.
Imprenta Libreria “Boullosa”.
Silva V., Pereira C.N., Ajello L., Mendoza L. 2005. Molecular evi-
dence for multiple host-specific strains in the genus Rhinosporidium II J. Clin.
Microbiol. Vol. 43. P. 1865-1868.
Spanggaard B., Huss H.H., Brescianni J. 1995. Morphology of Ich-
thyophonus hoferi assessed by light and scanning electron microscopy // J.
Fish Dis. Vol. 18. P. 567-577.
Spanggaard B., Skouboe P., Rossen L., Taylor J.W. 1996. Phyloge-
netic relationships of the intercellular fish pathogen Ichthyophonus hoferi, and
fungi, choanoflagellates and the rosette agent // Mar. Biol. Vol. 126. P. 109-15.
Steenkamp E.T., Wright J., Baldauf S.L. 2006. The protistan origins
of animals and firngi // Mol. Biol. Evol. Vol. 23. P. 93-106.
Ustinova L, Kienitz L., Huss V.A.R. 2000. Hyaloraphidium curvatum
is not a green alga, but a lower fungus; Amoebidium parasiticum is not a fun-
gus, but a member of the DRIPs // Protist. Vol. 151. P. 253-262.
Vogt G. 1999. In vitro induction of further development of sporocysts
of the crayfish parasite Psorospermium haeckeli I I Freshw. Crayfish. Vol. 12.
P. 319-334.
Vogt G., Rug M. 1995. Microscopic anatomy and histochemistry of
the crayfish parasite Psorospermium haeckeli 11 Dis. Aquat. Org. Vol. 21.
P. 79-90.
Whisler H.C. 1962. Culture and nutrition of Amoebidium parasiticum 11
Am. J. Bot. Vol. 29. P. 193-199.
Whisler H.C. 1965. Host-integrated development in Amoebidiales // J.
Protozool. Vol. 13. P. 183-188.
Wong A., Beebee T. 1994. Identification of a unicellular, non-pigment-
ed alga that mediates growth inhibition in anuran tadpoles: a new species
of the genus Prototheca (Chlorophyceae: Chlorococcales) // Hydrobiologia.
Vol. 277. P. 85-96.
KATHABLEPHARIDA Okamoto et Inouye 2005
Морские и пресноводные гетеротрофные жгутиконосцы
эллипсоидной или яйцевидной формы с двумя толстыми нерав-
ными жгутиками. Один жгутик направлен вперед и латерально,
второй назад, реже оба жгутика смотрят вперед. Клетка и жгути-
ки покрыты гликопротеиновым слоем пластинок, ряды которых
расположены спирально. Цитостомальный (ротовой) аппарат
представлен сложной системой цитофарингиальных вакуолей
и продольных пучков микротрубочек. Под плазмалеммой про-
ходят ленты микротрубочек. Пузырьковидное ядро лежит в цен-
тре клетки, реже сзади. Митохондрии с трубчатыми кристами.
Стрекательные органеллы представлены эжектосомами (= те-
ниоболоцистами) трех типов, состоящими из свернутой ленты.
Большинство катаблефарид — облигатные хищники, которые
обычно высасывают жертву, а некоторые заглатывают ее цели-
ком. Размножаются продольным делением надвое. Цисты и по-
ловой процесс неизвестны.
История изучения
Впервые в пресных водах представители рода Kath-
ablepharis найдены Скуйя (Skuja, 1939). В ряде публи-
каций он описал 5 видов этого рода (Skuja, 1939, 1948,
1964). Эти жгутиконосцы были помещены в семейство
Katablepharidacea Skuja 1939 — катаблефариды, куда
вошли бесцветные криптомонады, несущие продоль-
ную бороздку и два гетеродинамичных жгутика. Бо-
таники обычно использовали имя рода Katablepharis,
а зоологи — Kathablepharis*(yors, 1992а). В морских
водах обитает похожий на Kathablepharis жгутиконо-
сец, названный Bodo marina Braarud 1935, позже пере-
несенный в род криптомонад Chilomonas Ehrenberg
1832 из-за сходства расположения стрекательных орга-
нелл. В дальнейшем, для этого вида был выделен род
Leucocryptos и вид L. marina Butcher, 1967 на основа-
нии наличия бороздки (Butcher, 1967).
Подробное исследование морфологии клеток ката-
блефарид началось с работ Ли, Кюгренса и Ворс (Lee,
Kugrens, 1991; Vors, 1992а), впервые изучившими тон-
кое строение клеток этих организмов. Эти работы по-
казали, что катаблефариды существенно отличаются от
криптомонад формой крист митохондрий, строением
покровов и наличием крупного микротрубочкого ци-
тостомального аппарата. Дальнейшее исследование
тонкого строения подтвердило единство плана клеток
нескольких видов катаблефарид и позволило описать
новые виды (Lee et al., 1991, 1992; Clay, Kugrens, 1999a,
b; Vors, 1992a, b; Мыльников, 1992; Мыльников и др.,
1998; Okamoto, Inouye, 2005).
Катаблефариды традиционно рассматривались в
семействе Kathablepharidaceae (Skuja, 1939) внутри
класса Cryptophyceae. Исследование тонкого строения
катаблефарид показало, что эти организмы отлича-
ются от криптомонад. Кавалье-Смит (Cavalier-Smith,
1993) помещал катаблефарид в тип Opalozoa на осно-
вании наличие у них трубчатых крист митохондрий
и отсутствия дополнительной скрученной ленты в
эжектосомах. Позже он перенес катаблефарид в класс
Cyathobodonea и выделил их в отдельный отряд Katha-
blepharida. В дальнейшем этот отряд отнесен к группе
Neomonada (Cavalier-Smith, 1997). Во всех этих схемах
учитывалась ультраструктура только одного вида Kath-
ablepharis ovalis. В одной из последних макросистем
Кавалье-Смит (Cavalier-Smith, 2004) образовал подтип
Leucrypta для катаблефарид как равный подтипу Сгур-
tophyta. Недавнее исследование сиквенсов генов малой
субъединицы рибосомальной ДНК и бета-тубулина и
ультраструктуры двух видов позволили выделить но-
вый тип одноклеточных Kathablepharida Okamoto et In-
ouye (Okamoto, Inouye, 2005), который был соотнесен с
типом Cryptophyta как сестринской группой.
В 2006 г. описана необычная катаблефарида Hatena
arenicola Okamoto et Inouye 2006, содержащая симби-
отическую водоросль Nephroselmis sp. (Okamoto, In-
ouye, 2006). В настоящее время к катаблефаридам так-
же относят малозученный род Platychilomonas Larsen
et Patterson 1990, характеризующийся уплощенным
телом клетки, продольной бороздкой, двумя рядами
крупных эжектосом и разнонаправленными жгутиками
(Larsen, Patterson, 1990). Недавно на основании свето-
микроскопических и молекулярно-биологических дан-
ных описан род Roombia Okamoto et al. 2009, который
отнесен к катаблефаридам.
Морфология
Форма клеток катаблефарид обычно эллипсоид-
ная или цилиндрическая, реже с зауженным задним
KATHABLEPHARIDA
371
Рис. 269. Строение клетки Kathablepharis sp.
А — плавающая особь (световой микроскоп); Б — высушенная клетка с выстреленными эжектосомами; В — продольный срез клетки; Г— жгутик и
покровы клетки; Д— жгутик и эктопрокт; Е и Ж— поперечный и продольный срезы переднего конца клетки; 3 — поперечный срез жгутика; И-К —
эжектосомы; Л— выстреленные эжектосомы. аГ — аппарат Гольджи, вэ — выстреленная эжектосома, гпс — гликопротеиновый пластинчатый слой,
жг — жгутик, зж — задний жгутик, м — митохондрия, мк — микротрубочковый конус, от — осмиофильные тела, пв — пищеварительная вакуоль,
пж — передний жгутик, пм — пучки микротрубочек, см — субмембранные микротрубочки, ц — цитостом, цв — цитофарингиальные вакуоли, э —
эжектосома, эп — эктопрокт, я — ядро.
концом (у Leucocryptos marina). У Hatena arenicola и
Platychilomonas psammobia клетки сильно уплощены в
отличие от большинства катаблефарид.
У большинства катаблефарид два неравных жгути-
ка отходят субапикально из небольшого жгутикового
кармана или бороздки. В клетке заметны батареи эжек-
тосом (рис. 269, А; 270, А; 271, Е-3). На высушенных
препаратах видно, что клетка окружена выстрелен-
ными эжектосомами (рис. 269, Б). После применения
фиксирующих веществ на основе четырехокиси осмия
и сулемы тело жгутиконосца сжимается в 2-3 раза.
Ядро расположено ближе к центру клетки.
У Kathablepharis sp. поверхность тела клетки и
жгутиков по спирали покрыта слоем гликопротеино-
вых пластинок, напоминающим таковой у амеб Мауо-
rella, Hollandella, Hartmanella, и расположенный пер-
пендикулярно или под углом 70-80° к поверхности
(рис. 269, Г; 270, В). Они лежат рядами, направленны-
ми косо по отношению к продольной оси клетки. Под
пластинками располагаются два тонких слоя. Ниже
находится плазмалемма обычного трехслойного стро-
ения. Расстояние между пластинками равно 22-30 нм.
Под плазмалеммой лежат овальные и уплощенные пу-
зырьки, между ними проходят субмембранные микро-
трубочки в виде лент (рис. 269, Г; 270, Б).
Гликопротеиновый слой пластинок отсутствует
лишь в месте отхождения жгутиков и на стенке дна
жгутикового кармана. Аксонема жгутиков устроена
по формуле 9+2 (рис. 269, Г, 3). Спицы, соединяющие
центральные микротрубочки и периферические дупле-
372
KATHABLEPHARIDA
Рис. 270. Схема строения Kathablepharis sp.
А — общий вид; Б — жгутик, эктопрокт и покровы; В — поперечный срез микротрубочкого конуса; Г — зрелая эжектосома; Д — выстреленная
эжектосома. мл — микротрубочковая лента, м — перемычка, сп — спираль, ф — фибриллярный корешок. Остальные обозначения как на рис. 269.
ты, малозаметны. Кончик жгутика не содержит микро-
трубочек.
В переходной зоне жгутика заметна спираль, состо-
ящая из 4, реже 5 витков (рис. 270, Б). Высота спирали
равна 0,21-0,30 мкм. Ниже спирали лежит попереч-
ная пластинка, над которой находится небольшая цен-
тральная аксосома, под ней заметен темный цилиндр.
На уровне поверхности клетки можно увидеть вторую
тонкую поперечную пластинку. Длина кинетосом рав-
на 0,9-1,2 мкм, они лежат под острым углом друг к дру-
гу и соединены исчерченным мостиком.
Корешковая система жгутиков довольно своео-
бразна (Lee et al., 1992; Мыльников и др., 1998). Прок-
симальный конец кинетосомы жгутика соединен с
крупной митохондрией перемычками (рис. 270, Б).
В этом месте под кинетосомой поверхность митохон-
дрии вогнута. Кинетосомы окружены несколькими
аморфными сателлитами. Фибриллярный, вероятно,
треугольной формы, корешок отходит от кинетосомы
и соединяется с порошицей. Единственным микротру-
бочковым корешком является лента из 8-12 микротру-
бочек (рис. 270, Б).
Передний конец клетки жгутиконосца представля-
ет собой сложноустроенную микротрубочковую и ва-
куолярную систему (Lee et al., 1991; Мыльников и др.,
1998). На самом ее кончике находится небольшой ци-
тостом (ямка), не покрытая гликопротеиновым слоем
пластинок (рис. 269, Е; 270, А). Сзади ямки начинается
микротрубочковый конус (рис. 269, Е, Ж; 270, А-В).
В конусе видны два ряда микротрубочек. Чуть ниже эти
микротрубочки в результате перегруппировки органи-
зуются в пучки по 8-14. Всего обнаружено не менее 14
пучков (рис. 269, Г). У Hatena arenicola стенка конуса
состоит из одного слоя микротрубочек. Они доходят до
ядра, расширяясь на расстояние 3 мкм. К внутренней
стороне конуса Kathablepharis sp. прилегают 5-6 цито-
фарингиальных вакуолей (рис. 269, Е, Ж; 270, А, В), у
Hatena arenicola — более 10 таких вакуолей. Полость
конуса заполнена осмиофильными телами. Сзади кону-
са лежит аппарат Гольджи. Такой же аппарат находится
около порошицы.
В переднем конце клетки Kathablepharis sp. на-
чинаются субмембранные микротрубочковые ленты
(рис. 270, Б). Всего насчитывается примерно 20 лент, в
KATHABLEPHARIDA
373
Рис. 271. Пресноводные (Б-Е) и морские (А, Ж-К) катаблефариды.
А-Б — Kathablepharis ovalis, В — К. hyalurus, Г-Д — К. oblonga, Е — К. remigera, Ж — Leucocryptos marina, 3 — Platychilomonas psammobia, И
— Hatena arenicola, К — Roombia truncata. 6p — бороздка, пп — папилла, сб — симбионт, св — сократительная вакуоль, ст — стигма. Остальные
обозначения как на рис. 269. (По: Skuja, 1948 — А-Б; Skuja, 1939 — В; Skuja, 1964 — Г-Е; Vors, 19926 — Е-Ж; Larsen, Patterson, 1990 — 3; Okamoto,
Inouye, 2006 — И; Okamoto et al., 2009 — K).
каждой no 2-4 микротрубочки, что в сумме составляет
51-52 микротрубочки. Пищеварительная вакуоль часто
лежит прямо под конусом и около пузырьковидного
ядра. Митохондрии содержат трубчатые кристы. За-
пасные вещества представлены округлыми гранулами
диаметром 0,7-1,0 мкм.
Эктопрокт (порошица) имеет диаметр 0,8 мкм
(рис. 269, Д; 270, А, Б). Диаметр отверстия 0,25 мкм.
Внутри нее часто можно заметить остатки пищи. Стен-
ка порошицы состоит из унитарной мембраны. Часто
она окружена каналами шероховатого эндоплазматиче-
ского ретикулума.
Вокруг верхнего конца конуса лежат 5-6 малых
эжектосом и пустые вакуоли. Стрекательные орга-
неллы представлены эжектосомами (рис. 269, А. Б, Д\
270, Я, Г,Д). Обычно они лежат в поверхностном слое
цитоплазмы. Несколько этих органелл окружают пе-
редний конец клетки и жгутиковый карман. Чаще они
располагаются батареями по 3-5 штук в одном ряду,
причем большие и малые эжектосомы лежат рядом.
Эжектосома рассматриваемого типа представляет со-
бой цилиндрическое тело, у которого центральная
часть симметрично вдавлена (рис. 269, И, К; 270, Г).
Строение больших и малых эжектосом одинаково. От
их торцевой части отходит осмиофильное волокнистое
тело. Возможно, оно участвует в инициации выстрели-
вания органеллы. Диаметр большой эжектосомы до-
стигает 0,6-0,8 мкм, а длина — 0,75 мкм, тогда как ма-
лая имеет диаметр 0,18-0,21 мкм, а длину — 0,18 мкм.
Внутри эжектосомы находится спираль, представляю-
щая собой свернутую ленту, содержащую 20-23 витка.
Последний виток соединен с волокнистым телом. Ино-
гда заметно отслоение витков спирали друг от друга.
Выстреливание эжектосомы приводит к разверты-
ванию спирали. Ленты выстреленной органеллы ле-
жат рядом с клеткой. Эти ленты свернуты продольно
в трубку длиной 10-16 мкм (рис. 269, Б, Л\ 270, Г, Д).
Расчеты показывают, что при выстреливании не про-
исходит существенного изменения размеров ленты, а
меняется только способ ее свертывания.
У Hatena arenicola обнаружены клетки двух форм:
с симбионтом и без него. В последнем случае в клетке
развивается пищеварительный аппарат: конус микро-
трубочек и цитостом, способные к захвату клеток жерт-
вы. В клетках с симбионтом на месте конуса микротру-
бочек находится стигма симбионта.
374
KATHABLEPHARIDA
Особенности биологии
катаблефарид
Во время плавания хищник вращается вокруг своей
продольной оси, в этом случае задний жгутик служит
рулем, а передний обвивается вокруг клетки. У Hatena
arenicola обнаружен другой тип передвижения — пол-
зание.
В пробах хищные катаблефариды активно погло-
щают мелких бактериотрофных жгутиконосцев (бодо-
нид, хризофитовых) (Lee et al., 1991, 1992; Мыльников
и др., 1998). Процесс захвата напоминает таковой у
колподеллид и динофлагеллат. После контакта жертвы
и переднего конца тела хищника между ними образу-
ется цитоплазматический мостик. В течение 1-2 мин
содержимое жертвы переходит в клетку хищника. Та-
кой способ захвата пищи называется мизоцитозом. Для
некоторых видов катаблефарид отмечено заглатывание
жертвы целиком, как у хищных бодонид и Colponema.
В отличие от большинства катаблефарид у Roombia
truncata в бороздке образуется широкая псевдоподия,
захватывающая клетки жертвы (Okamoto et al., 2009).
По-видимому, у этого жгутиконосца отсутствует цито-
стомальный микротрубочковый конус и, как следствие,
меняется способ захвата пищи.
В культуре через 2-4 дня после инокуляции ката-
блефариды выедают все клетки жертвы, находившиеся
в чашке Петри, и оседают на дно, образуя скопления,
состоящие из 3-50 малоподвижных клеток. Цисты в
культуре не обнаружены.
У Kathablepharis sp. деление особи начинается с
переднего конца в подвижном состоянии (рис. 271, Д).
При плавании хищник вращается вокруг своей про-
дольной оси, в этом случае задний жгутик служит
рулем, а передний обвивается вокруг клетки как у ди-
нофлагеллат, но в отличие от них не прикрепляется к
поверхности клетки (рис. 271, А, В). Половой процесс
у катаблефарид не найден.
Экология
В морских и пресных водоемах наиболее часто
встречаются Leucocryptos marina, Kathablepharis remig-
era и К ovalis. Эти виды, являясь облигатными хищни-
ками, существенно снижают численность фито- и зоо-
микропланктона (мелких водорослей и гетеротрофных
жгутиконосцев, а также бактерий) (Lee, Kugrens, 1991;
Vors, 1992а, b; Clay, Kugrens, 1999а, b). Катаблефариды
как космополиты играют существенную роль в круго-
вороте органического вещества в водных экосистемах,
что необходимо учитывать при выяснении роли про-
стейших в природе (Weisse, 1997).
Филогения
Катаблефариды широко распространены в мор-
ских и пресноводных экосистемах и являются одной
из наиболее загадочных групп протистов (Clay, Kug-
rens, 1999а, b). Они составляют хорошо очерченный
таксон (Okamoto, Inoyue, 2005). Исходя из морфо-
логических данных, среди известных таксонов для
этих хищников трудно найти какую-либо сходную с
ними группу. Лишь по отдельным признакам их мож-
но сближать с празинофитовыми, кинетопластидами,
криптомонадами, диномонадами, инфузориями и сар-
кодовыми.
Идея Ли и Кюгренса (Lee, Kugrens, 1991) о том,
что Kathablepharis можно рассматривать как предка
группы зеленых водорослей по отдаленному сходству
покровов и стрекательных органелл сейчас устарела.
Слишком различны у этих организмов планы строения.
Одна из гипотез рассматривает сходство катаблефа-
рид с альвеолятами (динофлагеллатами, инфузориями и
колподеллидами) (Okamoto, Inoyue, 2005). Так, в част-
ности, структура их аппарата захвата пищи напоминает
апикальный комплекс или пучки микротрубочек щупа-
лец сукторий и стебелька диномонад. Периферические
расширения эндоплазматического ретикулума напоми-
нают поверхностные альвеолы у Apicomplexa. У этих
групп сходны кристы митохондрий и субмембранные
продольные микротрубочки, но стрекательные орга-
неллы значительно различаются. По способу питания
катаблефариды похожи на сосущих инфузорий, ди-
номонад и колподеллид. Сходство цитостомальных
структур Kathablepharis и колподеллид, возможно, объ-
ясняется одинаковым способом поглощения пищи (ми-
зоцитозом). Это в полной мере относится и к сосущим
инфузориям (Suctoria), щупальца которых содержат
ленты микротрубочек, организованные в виде трубки.
Жертва у сукторий высасывается через временный ка-
нал, окаймленный микротрубочками. Сам процесс пи-
тания напоминает таковой у Kathablepharis. Из других
групп простейших стоит отметить амеб, которые имеют
структурированный гликокаликс, похожий на пластин-
чатый слой Kathablepharis. Подобный слой обнаружен
недавно у хищных жгутиконосцев Cryothecomonas, ко-
торые относятся к Cercozoa.
Ранее предполагалось, что катаблефариды мор-
фологически сходны с криптомонадами. Это в пер-
вую очередь касается эжектосом (Kugrens, Lee, 1991;
Мыльников, 1992). Форма и размеры малых и боль-
ших эжектосом у криптомонад и Kathablepharis оди-
наковы. Отличие заключается в том, что эжектосомы
криптомонад состоят не из одной, а из двух свернутых
лент, поэтому после выстреливания эжектосомы лента
образует изгиб ее на две части: длинную и короткую.
Как видно, эжектосому Kathablepharis можно рассма-
тривать как редуцированную эжектосому криптофи-
товых. Стоит отметить, что эжектосомы встречаются
как у фототрофных, так и фаготрофных криптомонад.
Клетки некоторых криптомонад, как и пресноводного
Kathablepharis sp., покрыты гликопротеиновыми пла-
стинками. Важным отличием криптомонад является
наличие у них пластинчатых, а не трубчатых крист в
митохондриях.
Считается, что наиболее примитивным видов среди
катаблефарид является Kathablepharis hyalurus, у ко-
торого отсутствуют цитофарингиальные вакуоли, ци-
KATHABLEPHARIDA
375
0.05
0 96I
63
-------------Raphidiophrys contractilis
----Pavlova lutheri^^^^^^^^^^^
Isochrysis galbana
Emiliania huxleyi
Chrysochromulina sp NIES-1333
-------------Goniomonas truncate
Guillardia theta
_____________-r—Telonema subtile
•*— Telonema antarcticum
81
Centrohelids
Haptophytes
Cryptophytes
Telonemids
_a j- Leucocryptos marina
'-Leucocryptos marina
Roombia truncate gen. et sp. nov.
Griffithsia japonica
-------Guillardia theta (nucleomorph)
-----------------------Hemiselmis andersenii (nucleomorph)
-----------------------Cyanidioschyzon merolae
-----------------------Trimastix marina
---Glaucocystis nostochinearum
---Cyanophora paradox a
---Mesostigma vinde
Physcomitrella patens
---Capsicum chinense
---Arabidopsis thaliana
---Chlamydomonas reinhardtii
---Pterosperma cristatum
-Ostreococcus lucimarum
--------Blepharisma intermedium
--------Pseudourostyla cristate
--------Halteria grandmella
--------Tetrahymena thermophila
--------Toxoplasma gondii
--------Babesia bovis
--------Cryptosporidium parvum
-Crypthecodinium cohnii
—Kariodinium micrum
—Plectospira myriandra
Thraustotneca ciavata
Achlya ambisexualis
ytopnthora palmivora
--------Phaeodactylum tricomutum
--------Thalassiosira pseudonana
—Mallomonas rasilis
-Synura sphagnicola
--------Entamoeba histolytica
Physarum polycephalum
Dictyostelium discoideum
-----------------------Apis mellifera
-----------------------Spodoptera frugiperda
-----------------------Opistophthalmus carinatus
-----------------------Tetraodon nigroviridis
-----------------------Monosiga brevicolis
Blastocladiella emersonii
Zopnnus cinereus
-Laccaria bicolor S238N-H82
-----------------------Cryptococcus neoformans
Rhynchopus sp. ATCC50230
-----------------------e r-Leishmania infantum
J'-Leishmania major
1----------------------Trypanosoma cruzi
Rhynchobodo ATCC50359
Entosiphon sulcatum
—Euglena gracilis
------Redinomonas americana
------Andalucia godoy
Naegleria gruberi
------Breviata anathema
Kata blepha rids
099
я
Q
Archaeplastida
Alveolates
Stramenopiles
Opistokontes
Excavates
Рис. 272. Молекулярная филогения катаблефарид. Топология основана на методе максимального правдоподобия по сиквенсу гена
Hsp90 с использованием эволюционных моделей RTREV+GAMMA+F. (По: Okamoto et al., 2009).
376
KATHABLEPHARIDA
тостом и внутренние пучки микротрубочек. У К. ova-
lis всего две цитофарингиальные вакуоли, тогда как у
остальных катаблефарисов их более 6 (Okamoto, In-
ouye, 2005).
Проведенное молекулярно-биологическое иссле-
дование Kathablepharis japonica подтвердило род-
ственные связи катаблефарид с криптомонадами и не
подтвердило их сходство с альвеолатами (рис. 272)
(Okamoto, Inouye, 2005). Деревья сходства, построен-
ные на основании ДНК малой субъединицы рибосом
и бета-тубулина, показали одинаковые результаты. По-
добные данные получены для Hatena arenicola (Oka-
moto, Inouye, 2006) и Roombia truncata (Okamoto et al.,
2009), а также для неидентифицированных видов из
пресных и морских вод (Slapetaet al., 2006).
Таким образом, катаблефариды и криптомонады
являются сестринскими группами. Морфологические
отличия заключаются в форме крист митохондрий (кру-
глые у катаблефарид и пластинчатые у криптомонад), а
также строении покровов и цитостомального аппарата
(Okamoto, Inouye, 2005; Okamoto et al., 2009).
Систематическая часть
Семейство Kathablepharidaceae было введено Скуй-
ей (Skuja, 1939) для одного рода Kathablepharis и поме-
щено в класс Cryptophyceae. Затем Ворс (Vors, 1992а)
добавила в это семейство род Leucocryptos. Позже
добавлены роды Platychilomonas, Hatena и Roombia.
В природе, вероятно, существует значительно большее
видовое разнообразие катаблефарид, что следует из
молекулярно-биологического исследования пресновод-
ных и морских проб, которое выявило наличие в них не
менее десяти пока неидентифицированных видов ката-
блефарид (Slapetaet al., 2006).
Тип Kathablepharida Okamoto et Inouye
2005
Клетки эллипсоидные или эллипсоидно-цилиндри-
ческие с двумя толстыми жгутиками разной длины,
отходящими в субапикальном районе на вентральной
стороне. В большинстве случаев один жгутик направ-
лен вперед и другой назад. Хорошо заметные эжекто-
сомы трех типов лежат около жгутиков продольными
рядами. Пластиды отсутствуют.
Класс Kathablepharidea Okamoto et Inouye
2005
Диагноз соответствует диагнозу типа.
Отряд Kathablepharidida Okamoto et Inouye
2005 (non Kathablepharida Cavalier-Smith
1993)
Диагноз соответствует диагнозу класса.
Сем. Kathablepharididae (Vors 1992а)
emend. Clay et Kugrens 1999
(non Kathablepharidaceae Skuja 1939)
Свободноплавающие двужгутиковые простейшие.
Клетки несут два передненаправленных жгутика или
один жгутик направлен вперед, второй рекуллентный.
Митохондрии с трубчатыми кристами. Покровы допол-
нены двумя слоями пластинок, покрывающих клеточ-
ное тело и жгутики. Клетки с переднерасположенным
аппаратом Гольджи. Пищеварительная вакуоль может
располагаться спереди ядра у одних видов, либо позади
него у других. Большие и малые эжектосомы содержат
одну свернутую ленту.
Типовой род: Kathablepharis Skuja 1939.
Род Kathablepharis Skuja 1939
(= Katablepharis в: Skuja 1948, 1956 emend.
Clay et Kugrens 1999)
Форма клеток представителей рода обычно эллип-
соидная или цилиндрическая, реже с зауженным за-
дним концом. Клетки имеют пищеварительный аппа-
рат, состоящий из цитофарингиальных вакуолей и/или
цитостомальных и субцитостомальных вакуолей, или
они и цитостом отсутствуют. Эжектосомы III типа от-
сутствуют.
Виды отличаются друг от друга положением ядра,
пищеварительных вакуолей, числом и положением
эжектосом, размерами и формой тела. Обитают в мор-
ских и пресных водах, достигая большой численности.
Описано 9 видов.
Типовой вид: Kathablepharis ovalis Skuja 1948.
К. ovalis Skuja 1948 (рис. 271, А, Б)
Клетка эллипсоидная с несколько зауженным за-
дним концом тела. Длина клетки 7-13,5 мкм, ширина
3-7 мкм. Жгутики длиной 12 и 15 мкм отходят суба-
пикально из небольшого кармана. Ядро в центре, со-
кратительная вакуоль в переднем конце клетки. Перед-
ний жгутик иногда образует петли или закручивается.
Задний жгутик является рулевым. При плавании особи
вращаются вокруг продольной оси. Редко особи мед-
ленно плавают задним концом вперед, при этом оба
жгутика направлены в одну сторону. Отмечены две
цитофарингиальных вакуоли. Малоподвижные клетки
оседают на дно и образуют агрегаты по 20-100 особей.
В культуре питались Chrysochromulina parva (Lee, Ku-
grens, 1991). Распространен в пресных водах.
К. hyalurus Skuja 1939 (рис. 271, В)
Длина клетки 13-18 мкм, ширина 6-9 мкм. Форма
клетки вытянуто-эллипсоидная, и иногда клетка упло-
щена. Продольная неглубокая бороздка проходит на 3/4
длины тела. Внутри бороздки располагаются 1-2 ряда
эжектосом. Два толстых жгутика равные 1-1,5 длины
клетки отходят субапикально. У плавающих клеток
один жгутик направлен вперед, второй тянется назад.
KATHABLEPHARIDA
377
Ядро в центре клетки. Две или больше сократительных
вакуолей и многочисленные блестящие гранулы на-
ходятся в цитоплазме (Vors, 1992b). Распространен в
морских водах.
К. oblonga Skuja 1964 (рис. 271, Г, Д)
Клетка вытянуто-овальная или эллипсоидная, дли-
ной 13-20 мкм, шириной 3-6 мкм.
Два неравных жгутики отходят субапикально.
Ниже жгутиков располагается узкая продольная вы-
емка. Батареи эжектосом заметны в передней части
клетки. Перипласт тонкий зеленоватый. Один жгутик
направлен вперед, второй назад. Цитоплазма прозрач-
ная, содержит гранулы. 2-4 сократительные вакуоли
располагаются ниже ядра, которое занимает централь-
ное положение. Размножение в подвижном состоянии
путем продольного деления надвое. Распространен в
пресных водах.
К. remigera (Leucocryptos remigera Vors 1992)
Clay et Kugrens 1999 (рис. 271, E)
Клетки эллипсоидные. Жгутики отходят субапи-
кально из небольшого кармана. Передний жгутик в
1,5-2 раза длиннее тела, второй в 2-4 раза длиннее
дела. При плавании оба жгутика закручиваются вокруг
клетки. Передний жгутик совершает синусоидальные
колебания большой амплитуды. Задний жгутик мало-
активен и редко совершает взмахи. В клетке видны
1-2 ряда из 1-9 больших эжектосом и многочисленные
малые периферические эжектосомы. Ядро в центре.
Отмечено 6-10 цитофарингиальных вакуолей. Микро-
трубочковый конус содержит 10 пучков из 1-20 микро-
трубочек. Обычный вид, встречающийся круглый год в
морских и солоноватых водах.
Род Leucocryptos Butcher 1967
emend. Clay et Kugrens 1999
Клетки каплевидной формы. Отсутствуют цитофа-
рингиальные вакуоли. Цитостом присутствует. Эжек-
тосомы III типа.
Типовой вид: Leucocryptos marina Butcher
1967.
L. marina Butcher 1967
(Bodo marina Braarud 1935 = Chilomonas marina
Halldal 1953) (рис. 271, Ж)
Клетки ригидные, ассиметричные каплевидной
формы с заостренным задним концом. Длина клетки
7-30 мкм и шириной 3-10 мкм. 1-5 больших эжекто-
сом лежат на вентральной стороне. Ядро центральное.
Пищеварительные вакуоли с красноватым или желто-
коричневым содержимым находятся в задней части
клетки. Размножение продольным делением. Два тол-
стых жгутика отходят субапикально из небольшого
кармана и равны 1-1,5 длины тела клетки. При плава-
нии передний жгутик закручивается вокруг переднего
конца клетки. Другой жгутик направлен назад. Клетка
движется прямо, вращаясь вокруг продольной оси. При
остановках оба жгутика направлены вперед. Иногда
клетки медленно плавают назад (Vors, 1992а, Ь).
Обычный вид, встречающийся круглый год в мор-
ских и солоноватых водах.
Род Platychilomonas Larsen and Patterson 1990
Клетки эллипсоидные и уплощенные. Два ряда
эжектосом лежат вдоль передней части бороздки. Из
нее отходят 2 жгутика под тупым углом друг к другу.
Бороздка соединяется с вакуолью, расположенной око-
ло поверхности клетки. Хлоропласт отсутствует. Ядро
смещено к заднему концу клетки. Малые эжектосомы
располагаются под поверхностью клетки. У неподвиж-
ных особей один жгутик прижат к зауженному краю
клетки и образует кольцо.
Типовой вид: Platychilomonaspsammobia Lars-
en and Patterson 1990.
P. psammobia Larsen and Patterson 1990
(рис. 271,3)
Клетки эллипсоидные, уплощенные, 15-20 мкм
длины, 8-12 мкм ширины. Два ряда эжектосом лежат
вдоль передней части бороздки. Там же отходят 2 жгу-
тика под тупым углом друг к другу. Бороздка соединя-
ется с вакуолью, расположенной около поверхности
клетки. Ядро лежит сзади. Малые эжектосомы лежат
около поверхности клетки. У неподвижных особей
один жгутик прижат к зауженному краю клетки и обра-
зует кольцо, второй спирально свернут. Особи плавают
быстро.
Ультраструктура этого вида не изучена. Известен
из морских вод (Дания и Великобритания) (Larsen,
Patterson, 1990).
Род Hatena Okamoto et Inouye 2006
Клетки уплощенные и эллипсоидные. Короткий
и длинный жгутики отходят из небольшой бороздки.
В районе бороздки заметны 2 ряда эжектосом. Пери-
ферическую часть клетки занимает клетка симбионта,
стигма которого лежит субапикально. После деления
клетки надвое только одна дочерняя клетка остается с
симбионтом, другая его теряет и образует пищевари-
тельный аппарат (систему микротрубочек и цитофа-
рингиальных вакуолей) обычный для катаблефарид.
Типовой вид: Hatena arenicola Okamoto et In-
ouye 2006.
H. arenicola Okamoto et Inouye 2006
(рис. 271, И)
Клетки уплощенные, эллипсоидные. Длина клетки
30—40 мкм, ширина 15-20 мкм. В переднем конце клет-
ки лежит небольшая бороздка длиной 4 мкм и шириной
2 мкм. Из передней части бороздки отходят длинный
передний и короткий задний жгутики. В районе бо-
роздки заметны 2 ряда эжектосом. Периферическую
378
KATHABLEPHARIDA
часть клетки занимает клетка симбионта, стигма кото-
рого лежит субапикально. Обитает в морских водах.
Род Roombia Okamoto et al. 2009
Клетки эллипсоидные или усеченно эллипсоидные,
дорсовентрально сжатые, без хроматофора, с двумя
жгутиками, отходящими от небольшого выроста (па-
пиллы) в субапикальной части клетки. Ядро в центре
клетки. Питание микроводорослями и бактериями.
Типовой вид: Roombia truncata Okamoto et al.
2009.
R. truncata Okamoto et al. 2009 (рис. 271, К)
Клетки эллипсоидные или усеченно-эллипсоид-
ные, дорсовентрально сжатые, 12-17 мкм в длину,
9-14 мкм в ширину, без хроматофора, с двумя одинако-
вой длины жгутиками, отходящими от небольшого вы-
роста (папиллы). 5-10 рядов эжектосом располагаются
на вентральной стороне клетки. Передние эжектосомы
0,3 мкм в диаметре, задние — 0,7 мкм. Ядро в центре
клетки. Пищеварительная вакуоль на правой стороне
клетки. Питание диатомовыми Navicula sp. и бактерия-
ми. Обитает в морских водах.
SUMMARY
Kathablepharids аге marine and freshwater heterotrophic flagel-
lates of the oval or ovoid shape with two thick unequal rare equal
flagella. The first flagellum directs forward and lateral, the second di-
rects behind, rare the both direct ahead. The cell and flagella are cov-
ered by lamellar layer which supported by thin plate. The cytopharin-
geal (cytostomal) apparatus composed of complex system of circular
vacuoles and the bundles of longitudinal microtubules. The microtu-
bular bands lie beneath the plasmalemma. The vesicular nucleus lies
in the cell centre, rare behind. The mitochondria have tubular cristae.
The extrusive organelles — ejectisomes (= taeniobolocysts) of three
types and composed of coiled ribbon. The ejectisomes of I and II type
are similar in their shape and differ from each other by the sizes. The
ejectisomes of III type are the largest and have long central part. Most
of Kathablepharids are the obligate predators and feed by means of
mizocytotis (suction of the prey cytoplasm), rare capture the whole
cells. One species is bacteriotrophic and another species has the auto-
trophic symbiont (algae). The cell reproduction is by the longitudinal
binary fission. Cysts and sexual process are unknown.
ЛИТЕРАТУРА
Мыльников А.П. 1992. Строение стрекательных органелл хищно-
го жгутиконосца Katablepharis sp. // Биология внутренних вод. Информ,
бюл. № 95. С. 28-33.
Мыльников А.П., Мыльникова З.М., Цветков А.И. 1998. Осо-
бенности ультраструктуры хищного жгутиконосца Katablepharis sp. //
Цитология. Т. 40. № 7. С. 706-712.
Butcher R.W. 1967. An introductory account of the smaller algae of
British coastal waters. IV. Cryptophyceae // Fisheries Investigations. Series 4.
London. P. 1-54.
Cavalier-Smith T. 1993. The protozoan phylum Opalozoa // J. Euk. Mi-
crobiol. Vol. 40. P. 609-615.
Cavalier-Smith T. 1997. Amoeboflagellates and mitochondrial cristae
in eukaryote evolution: megasystematics of the new protozoan subkingdoms
Eozoa and Neozoa //Arch. Protistenkd. Vol. 147. P. 237-258.
Cavalier-Smith T. 2004. Only six kingdoms of life // Proc. R. Soc.
bond. В 271. P. 1251-1262.
Clay B., Kugrens P. 1999a. Systematics of the enigmatic kathablepha-
rids, including EM characterization of the type species, Kathablepharis phoe-
nikoston, and new observations on К remigera comb. nov. // Protist. Vol. 150.
P. 43-59.
Clay B.L., Kugrens P. 1999b. Description and ultrastructure of Kath-
ablepharis tenuis sp. nov. and К obesa sp. nov. — two new freshwater Kath-
ablepharis (Kathablepharididae) from Colorado and Wyoming // Eur. J. Pro-
tistol. Vol. 35. P. 435-447.
Larsen J., Patterson D.J. 1990. Some flagellates (Protista) from tropi-
cal marine sediments // J. Nat. Hist. Vol. 24. P. 801-937.
Lee R.E., Kugrens P. 1991. Katablepharis ovalis, a colourless flagel-
late with interesting cytological characteristics // J. Phycol. Vol. 27. P. 505-
513.
Lee R.E., Kugrens P., Mylnikov A.P. 1991. Feeding apparatus of the
colourless flagellate Katablepharis (Cryptophyceae) // J. Phycol. Vol. 27.
P. 725-733.
Lee R.E., Kugrens P., Mylnikov A.P. 1992. The structure of the flagel-
lar apparatus two strains of Katablepharis (Cryptophyceae) // Br. Phycol. J.
Vol. 27. P. 369-380.
Okamoto N., Inouye I. 2005. The katablepharids are a distant sister
group of the Cryptophyta: a proposal for Katablepharidophyta Divisio Nova /
Kathablepharida phylum novum based on SSU rDNA and Beta-tubulin phy-
logeny // Protist. Vol. 156. P. 163-179.
Okamoto N., Inouye I. 2006. Hatena arenicola gen. et sp. nov., a
katablepharid undergoing probable plastid acquisition // Protist. Vol. 157.
P. 401-419.
Okamoto N., Chantangsi C., Horak A., Leander B.S., Keeling P.J.
2009. Molecular phylogeny and description of the novel katablepharid Room-
bia truncata gen. et sp. nov., and establishment of the Hacrobia taxon nov. //
PlosOne. Vol. 4. P. e7080. doi: 10.1371.
Skuja H. 1939. Beitrag zurAlgenflora Lettlands II //Acta Horti botanici
Universitatis Latviensis // Bd 11/12. S. 41-169.
Skuja H. 1948. Taxonomie des Phytoplanktons einiger Seen in Up-
pland, Schweden // Symb. Bot. Upsal. Bd 9/3. S. 1-399.
Skuja H. 1964. Grundziige der Algenflora und Algenvegetation der
Fjeldgegenden um Abisko in Schwedish-Lappland // Nova Acta Regiae Soc.
Scient. Uppsaliensis, ser. IV. Bd 18. S. 1^65.
Slapeta J., Lopez-Garcia P., Moreira, D. 2006. Present status of the
molecular ecology of Kathablepharids // Protist. Vol. 157. P. 7-11.
Vors N. 1992a. Ultrastructure and autecology of the marine, heterotro-
phic flagellate Leucocryptos marina (Braarud) Butcher 1967 (Katablephari-
daceae/Kathablepharidae), with a discussion of the genera Leucocryptos and
Katablepharis!Kathablepharis II Eur. J. Protistol. Vol. 28. P. 369-389.
Vors N. 1992b. Heterotrophic amoebae, flagellates and Heliozoa
from the Tvarminne area, gulf of Finland, in 1988-1990 // Ophelia. Vol. 36.
P. 1-109.
Weisse T. 1997. Growth and production of heterotrophic nanoflagellates
in a meso-eutrophic lake // J. Plankton Res. Vol. 19. P. 703-722.
HAPLOSPOR1D1A Caulery et Mesnil 1899
Гаплоспоридии — это одноклеточные паразиты морских и
пресноводных беспозвоночных животных. Они развиваются в
гемоцитах, соединительной ткани или выстилке целома хозяи-
на. В ходе сложного жизненного цикла формируют плазмодий,
который содержит много ядер, обычно расположенных пара-
ми, митохондрии с трубчато-везикулярными кристами, а также
специфические органеллы гаплоспоросомы. Развитие в хозяи-
не завершается образованием мелких (2-12 мкм) одноядерных
спор с отверстием, которое прикрывает крышечка (оперкулум)
или язычок. Споры декорированы снаружи нитями или трубоч-
ками. Стенка споры формируется из безъядерной цитоплазмы,
которая окружает ядросодержащую часть клетки в процессе
формирования споры.
Распространены всесветно.
Известно около 50 видов из разных хозяев: трематод, нема-
тод, полихет, немертин, ракообразных, моллюсков, иглокожих
и асцидий. Особенно часто поражаются моллюски. Виды рода
Haplosporidium наносят значительный ущерб устричным хозяй-
ствам.
История изучения
Гаплоспоридии были открыты в конце XIX века
Ф. Менилом и его двоюродным братом М. Колери
(Caullery, Mesnil, 1899). Колери занимался морски-
ми полихетами и, по-видимому, во время обычного
вскрытия червя Scoloplos armiger, найденного в бух-
те Св. Мартина на побережье Нормандии, обнаружил
этих необычных паразитов, которых затем исследовал
и описал Менил. После вскрытия сотен червей они
нашли всего несколько экземпляров Haplosporidium
(= Aplosporidium) scolopli. Приведенные в их работах
рисунки настолько точны и детальны, что до сих пор
имеют не только историческую ценность.
Другой представитель гаплоспоридий Minchinia
chitonis (Lankester 1885) Labbe 1896 был найден в Бре-
тани. Позднее эти протисты были обнаружены в ат-
лантических прибрежных водах Северной Америки,
Карибских островов, вдоль Европейской береговой
линии, а также у берегов Японии, Кореи, Калифор-
нии, Австралии и на Средиземноморье (Perkins, 1990).
Гаплоспоридии не отмечены пока в Южной Америке
и Африке, но, вероятно, это дело времени (Burreson,
Ford, 2004).
Начиная, фактически, со времени первых описа-
ний гаплоспоридии доставляют немало хлопот систе-
матикам. Первые исследователи помещали род Haplo-
sporidium в отряд Haplosporida в классе Sporozoa типа
Protozoa (см. Burreson, Ford, 2004). Исторически сло-
жилось так, что в дальнейшем в этот отряд попадали
все паразитическое спорообразующие протисты, у ко-
торых отмечали многоядерные клетки (плазмодии) без
клеточной стенки, и которых невозможно было отнести
к другим таксонам (Sprague, 1979).
В 1979 году Спрэг суммировал кардинальные от-
личия гаплоспоридий от споровиков (Apicomplexa) по
ультраструктуре и жизненному циклу и вывел Haplo-
sporidia (а также Paramyxea) из Sporozoa, создав для
них новый тип Ascetospora (Sprague, 1979). В даль-
нейшем в пределах этого типа был сформирован класс
Stellatosporea с двумя отрядами Occlusosporida (сем.
Marteiliidae) и Balanosporida (сем. Haplosporidiidae и
Anurosporidiidae) (Sprague, 1982). Авторы опублико-
ванной годом позже классификации также сохраняют
этот тип, но выделяют в нем два класса: Haplosporea
и Paramyxea (отр. Paramyxida и отр. Marteiliida), чет-
ко отделив гаплоспоридий от парамиксид (Desportes,
Nashed, 1983).
Дальнейшие ультраструктурные исследования по-
казали, что морфологические отличия между пред-
ставителями парамиксид и гаплоспоридий настолько
существенны (см. также главу Парамиксиды), а своео-
бразие каждого из этих таксонов настолько велико, что
позднее тип Ascetospora был упразднен, а ранг Haplo-
sporidia и Paramyxea был повышен до типа (Desportes,
Perkins, 1990; Perkins, 1990, 1991, 2000; Cavalier-Smith,
1993). Тип Haplosporidia приняло большинство проти-
стологов, однако Корлис (Corliss, 1994) в своей системе
протистов воспроизвел тип Ascetospora в соответствии
с прежней классификацией (Desportes, Nashed, 1983).
Первая попытка определить филогенетическое по-
ложение гаплоспоридий при помощи секвенирования
рРНК малой субъединицы рибосом одного вида Hap-
losporidium nelsoni оказалась безуспешной (Fong et
al., 1993). Однако данные по тому же гену, но уже по
двум видам позволили предположить, что гаплоспо-
ридии имеют общего предка с альвеолатами (Siddall et
380
HAPLOSPORIDIA
al., 1995). Более детальный анализ молекулярно-фило-
генетического древа (также основанного на данных по
тому же гену 18S рРНК), в который были включены
уже пять видов, представлявшие три рода гаплоспо-
ридий, продемонстрировал их близость к инфузориям
(Flores et al., 1996). Таким образом, складывалось пред-
ставление, что гаплоспоридии близки к альвеолатам и
даже, конкретно, к инфузориям, причем, в ранге типа,
т.е. равны по статусу инфузориям, динофлагеллатам и
Apicomplexa (Cavalier-Smith, 1993; Siddall et al., 1995;
Flores et al., 1996).
Работы по молекулярной филогении, основанные
на более представительной выборке эукариот, позво-
лили установить родство гаплоспоридий с протистами
(Gromia, Plasmodiophora), входящими в тип Cercozoa
(Cavalier-Smith, Chao, 2003а, b). На этом основании ав-
торы указанных статей возродили класс Ascetosporea.
К этому времени морфологи обосновали диагноз га-
плоспоридий, имеющих в жизненном цикле стадию
многоядерного плазмодия и яйцевидной споры; кле-
точная стенка споры закладывается внутриклеточно,
а на одном полюсе споры есть отверстие, прикрытое
крышечкой (Perkins, 2000).
В результате синтеза морфологии и молекулярной
филогении гаплоспоридии представляются монофи-
летическим таксоном, который в ранге отряда Haplo-
sporida помещен в класс Ascetosporea, наряду с двумя
другими отрядами Paramyxida и Claustrosporida (Cava-
lier-Smith, Chao, 2003b). Последний отряд включает
род Claustrosporidium, представители которого содер-
жат гаплоспоросомы, но существенно отличаются от
гаплоспоридий (см. раздел Классификация).
Молекулярно-генетические исследования Вопат-
ia (паразита устриц) показали, что они входят в один
кластер с другими гаплоспоридиями (Haplosporidium,
Urosporidium и Minchinia) (Reece et al., 2004). Однако
долгое время у видов Bonamia не было показано спо-
рообразование, что сразу приводило к утрате главных
признаков всего отряда (наличия спор с крышечкой
и особого способа их формирования). В дальнейшем
споры были найдены у одного вида Bonamia (Carnegie
et al., 2006), поэтому прежний диагноз Haplosporidia
остается в силе.
Основная литература посвящена двум видам: Hap-
losporidium nelsoni и Н. costale — т.к. именно они вы-
зывают массовую гибель устриц, поражая гемоциты.
Классификация
Долгое время в отряде Haplosporidia насчитывали
только 3 рода, объединяющие 33 вида (Perkins, 2000).
В современных работах в состав гаплоспоридий обыч-
но включают четыре рода: Minchinia Labbe 1896, Hap-
losporidium Caullery et Mesnil 1899, Urosporidium Caul-
lery et Mesnil 1905 и Bonamia Pichot et al. 1979, которые
объединяют 45 видов. Среди них 5 видов не названы
(ниже их количество указано в скобках); кроме того, в
последнем обзоре авторы отмечают еще 11 неописан-
ных видов (Hine et al., 2009).
По особенностям строения споры гаплоспоридии
сгруппированы в 2 семейства.
Сем. Haplosporidiidae Caullery et Mesnil 1899
Haplosporidium Caullery et Mesnil 1899 — 23 вида (+ 3)
Bonamia Pichot et al. 1979 — 4 вида
Minchinia Labbe 1896 — 5 видов (+ 1)
Сем. Urosporidiidae Caullery et Mesnil 1905
Urosporidium Caullery et Mesnil 1905 — 8 видов (+ 1)
Относимый ранее к гаплоспоридиям род Апиго-
sporidium в настоящее время упразднен, поскольку его
типовой вид A. pelseneeri перенесен в род Haplosporidi-
um, а другие представители Anurosporidium не описаны
(Perkins, 1990).
Сравнительно недавно Ларсон (Larsson, 1987) уста-
новил род Claustrosporidium для двух видов С. gammari
и С. aselli, которые обитают в морских амфиподах и
пресноводных равноногих раках и относились ранее
к роду Haplosporidium. Новый род был выделен в от-
дельное семейство Claustrosporidiidae Larsson 1987 в
пределах отряда Haplosporida. Плазмодии, споробла-
сты и споры Claustrosporidium gammari действитель-
но содержит гаплоспоросомы, деление ядра закрытым
внутриядерным митозом, но споры не имеют отвер-
стия, сферулы в спороплазме нет, а само формирование
споры также идет иначе чем у остальных гаплоспори-
дий: стенка споры образуется на поверхности плаз-
малеммы, а не из эписпоровой цитоплазмы. В связи
с этим Прекинс не включает Claustrosporidium spp. в
Haplosporidia (Perkins, 2000). К сожалению, сиквенсы
ядерных генов для видов этого рода отсутствуют, по-
этому нельзя определенно сказать о его филогенетиче-
ских связях. Несмотря на это, на основании наличия
гаплоспоросом Кавалье-Смит и Чао (Cavalier-Smith,
Chao, 2003а) выделяют род Claustrosporidium в отдель-
ный отряд Claustrosporida в классе Ascetosporea наряду
с отрядами Haplosporida и Paramyxida.
Морфология
и жизненный цикл
Полный жизненный цикл не был изучен ни у од-
ного вида, поскольку гаплоспоридий не удается куль-
тивировать. Поэтому все данные получены только на
срезах зараженных тканей хозяина. Попытки зараже-
ний других хозяев того же вида обычно оканчивались
неудачей. Здесь приводится описание морфологии
различных стадий паразитов обобщенного жизненно-
го цикла представителей преимущественно двух ро-
дов: Haplosporidium и Minchinia (Perkins, 1990; 2000)
(рис. 273).
Каким образом паразит попадает в хозяина — не-
известно. Возможно, споры выделяются из хозяина с
фекалиями и захватываются следующим беспозвоноч-
ным хозяином вместе с пищей, или окончательный хо-
зяин получает их каким-то образом от промежуточно-
го. В кишечнике из спор выходят, по-видимому, мелкие
амебоидные зародыши, которые проникают в соедини-
тельную ткань или эпителий, или заглатываются гемо-
цитами, становясь на короткое время внутриклеточны-
HAPLOSPORIDIA
381
Рис. 273. Схема обобщенного жизненного цикла гаплоспори-
дий. Выход спороплазмы предположительно происходит в ки-
шечнике хозяина. (По: Perkins, 2000).
ми паразитами. Самая первая стадия Haplo sporidium,
которую удается обнаружить в хозяине, представлена
клетками, содержащими от двух (дикарион) до четырех
ядер. В дальнейшем число ядер увеличивается до не-
скольких десятков. Для Bonamia sp., которая развивает-
ся в гемоцитах (Hine, Wesney, 1994), и Minchinia occulta
(Bearham et al., 2008) характерны одноядерные стадии
(рис. 274), хотя для них описан и дикарион, и в редких
случаях обнаруживаются 4-5 ядер.
Строение плазмодия
Трофическая стадия в тканях хозяина представля-
ет собой одно-, двух- или многоядерную клетку без
специальной оболочки, т.е. покрытую только плазма-
леммой (рис. 275). Трофонт содержит пузырьковидное
ядро, митохондрии с трубчатыми или пузырьковидны-
ми кристами, цистерны гладкого и шероховатого эндо-
плазматического ретикулума и диктиосомы аппарата
Гольджи. Иногда в цитоплазме отмечают липидные
глобулы. Ядра плазмодия часто, но далеко не всегда
лежат парами, прилегая одной стороной друг к другу
(рис. 275). Контакт этот не плотный, между ядрами
диплокариона иногда обнаруживаются цистерны ЭПР
или микротрубочки.
Отличительная черта цитоплазмы плазмодия —
наличие гаплоспоросом1. Эти органеллы имеют вид
небольших, часто, уплощенных пузырьков, размером
70-250 нм, окруженных одной мембраной. Внутреннее
1 Подробнее о морфологическом разнообразии гаплоспоросом и
их встречаемости в других таксонах протистов см. главу Рагатухеа. —
Прим. авт.
Рис. 274. Ультраструктура гемоцита Ostrea edulis, содержащего в цитоплазме две клетки Bonamia ostreae. В клетке паразита видна
крупная митохондрия со светлым матриксом, липидная капля и плохо различимое на фоне плотной цитоплазмы ядро.
Масштабная линейка: 2 мкм. (По: Balseiro et al., 2006).
382
HAPLOSPORIDIA
Рис. 275. Плазмодий Haplosporidium nelsoni в соединительной ткани устрицы.
А — общий вид с диплокарионом, зоной формирования гаплоспоросом (фг), гаплоспоросомами (га) и митохондриями (м) (стрелками показаны микро-
трубочки в ядре); Б— внутриядерный ЦОМТ (стрелка) с микротрубочками митотического веретена; В — предшественник гаплоспоросомы; Г— зре-
лая гаплоспоросома. Масштабные линейки: А — 500 нм, Б, В — 200 нм, Г— 100 нм. (По: Perkins, 1990 с изменениями).
содержимое разделено на так называемую сердцеви-
ну бобовидной формы, содержащую гликопротеины
(Azevedo, Corral, 1985), и окружающий ее кортекс, от-
деленный от сердцевины узким просветом. Этот элек-
тронно-прозрачный просвет близок по толщине к мем-
бране, поэтому его называют внутренней мембраной
(Perkins, 1990; Hine et al., 2009) или мембраноподобной
структурой (Reece et al., 2004). На срезах она сильно
отличается от наружной мембраны гаплоспоросомы
(рис. 275), поэтому возникают сомнения в том, что это
настоящая внутренняя мембрана. Между тем, в ней
обнаружены липиды (Perkins, 1990), а отсутствие ха-
рактерной трехслойности можно объяснить неадекват-
ными методами фиксации. Последний аргумент ока-
зывается весьма убедительным, т.к. у гаплоспоросом
парамиксид, внутренняя мембрана в редких случаях
хорошо видна и по всем параметрам сходна с наружной
(см. главу Paramyxea).
HAPLOSPORIDIA
383
Функция гаплоспоросом до сих пор неизвестна.
Одни авторы считают, что они содержат гидролити-
ческие ферменты, которые могут разрушать клетку
хозяина, другие — что это вирусоподобные частицы,
третьи — что они участвуют в формировании оболоч-
ки споронта, выделяя свое содержимое на поверхность
плазматической мембраны (Perkins, 1990, 2000). По-
следнее предположение наиболее вероятно, поскольку
гаплоспоросомы обычно исчезают в процессе споро-
образования.
Гаплоспоросомы образуются в особой зоне форми-
рования гаплоспоросом, которая имеет неправильную
форму и ограничена мембраной (рис. 275). Внутри на-
ходятся электронно-плотные тельца. От этой зоны от-
почковываются так называемые предшественники га-
плоспоросомы (рис. 275, В). Они примерно в два раза
больше зрелой органеллы и содержат под мембраной
тонкую электронно-плотную полоску, отделенную от
пока еще рыхлой сердцевины довольно широким про-
светом (рис. 275, В). Зрелые гаплоспоросомы рассеяны
по всей цитоплазме клетки (рис. 275, Л, Г). Образова-
ние самой зоны формирования гаплоспоросом связы-
вают с диктиосомой.
Плазмодий формируется из одноядерной клетки в
результате ядерных делений. Деление ядра протекает
без разрушения ядерной оболочки, т.е. классифици-
руется как закрытый внутриядерный митоз. Микро-
трубочки веретена деления отходят от двух внутрия-
дерных ЦОМТов, которые не контактируют с ядерной
оболочкой (рис. 275). По этому признаку гаплоспори-
дий иногда сравнивают с микроспоридиями (Perkins,
1990), однако у последних ЦОМТы встроены в обо-
лочку ядра. Внутриядерное веретено из микротрубочек
сохраняется у гаплоспоридий и в интерфазных ядрах
(рис. 275).
Крупный плазмодий разделяется на фрагменты с
различным числом ядер; эти фрагменты расселяют-
ся по тканям хозяина, давая начало другим крупным
плазмодиям. Расселение паразита по тканям идет при
помощи гемоцитов, которые заглатывают такие мало-
ядерные фрагменты, или они пассивно разносятся ге-
молимфой. Осев в ткани, паразит опять растет и ста-
новится многоядерным плазмодием. Этот цикл может
повторяться неопределенно долго.
Формирование споробластов1
Споруляция была описана у всех спорообразую-
щих гаплоспоридий, т.к. особенности этого процес-
са являются таксономическими признаками (Perkins,
1990; 2000). В общем виде это выглядит следующим
образом.
Начало образования споронта определяется по по-
явлению тонкой (примерно 20 нм толщиной) оболочки
на поверхности плазмодия. При этом ткани хозяина во-
круг паразита существенно деградируют, подвергаясь
лизису. Число ядер внутри плазмодия увеличивается в
1 Термин споробласт здесь не точен, поскольку спора образует-
ся не непосредственно из него, а из зиготы, которая формируется после
слияния споробластов. — Прим. авт.
результате делений, которые включают и мейотические
деления ядер, что подтверждается наличием синапто-
немальных комплексов (Perkins, 1975). В дальнейшем
плазмодий делится на отдельные споробласты. При
этом в цитоплазме образуется множество уплощен-
ных пузырьков, которые сливаются друг с другом и
формируют плазматическую мембрану споробластов.
В результате вокруг каждого ядра обособляется уча-
сток цитоплазмы и после завершения процесса множе-
ственного деления внутри общей оболочки споронта
формируются одноядерные гаплоидные споробласты.
Споробласты группируются попарно и затем сливают-
ся друг с другом, образуя двуядерные клетки. Процесс
завершается кариогамией и формированием зиготы
(Desportes, Nashed, 1983; La Haye et al., 1984).
Таким образом, гаплофаза в жизненном цикле га-
плоспоридий ограничена существованием гамет (спо-
робластов). Гаплоспоросомы обычно исчезают из
споронта во время формирования споробластов и по-
являются вновь только в спороплазме споры, т.е. их на-
личие связано с диплоидной фазой.
В этой части цикла есть сомнения, т.к. были обнару-
жены споронты с двумя типами ядер, что предполагает
слияние некоторых ядер уже в споронте. Существуют
также предположения, что споры могут формироваться
непосредственно из споробластов, а не из зиготы, но
большинство исследователей не поддерживает эту точ-
ку зрения (см. Reece et al., 2004).
Формирование споры
При образовании споры зигота сначала принимает
удлиненную форму, а ядро мигрирует к одному полюсу
клетки. Затем в середине клетки образуется перетяжка,
и зигота принимает характерную форму песочных ча-
сов (рис. 273). После этого безъядерная часть зиготы
начинает охватывать ядросодержащую часть, или спо-
роплазму. Цитоплазматический мостик между двумя
частями клетки разрывается, а спороплазма почти пол-
ностью окружается (как бы заглатывается) безъядерной
частью клетки, называемой на этом этапе эписпоровой
цитоплазмой. Однако края эписпоровой цитоплазмы не
смыкаются полностью. На этом полюсе клетки оста-
ется отверстие, которое закрывается в дальнейшем
специальной апертурой. У видов Haplosporidium и
Minchinia формируется крышечка из плотного матери-
ала на шарнире, так что она может открываться. Она
располагается снаружи отверстия и лежит на фланце
споры, прикрепляясь к нему фибриллярным матери-
алом (рис. 276, 277). У видов Urosporidium край эпи-
плазмы во время роста становится язычком, который
закрывает отверстие изнутри (рис. 278).
Стенка споры (а также ее производные: крышечка
или язычок) образуется под мембраной эписпоровой
цитоплазмы, которая плотно прилегает к плазматиче-
ской мембране спороплазмы.
Эписпоровая цитоплазма в дальнейшем дегради-
рует. В ней по мере созревания споры формируются
фибриллы, которые оплетают ее снаружи. Таким об-
разом, наружная поверхность оболочки зрелой споры
384
HAPLOSPORIDIA
Рис. 276. Строение споры Haplosporidium.
А — зона отверстия еще не сформированной споры Н. louisiancr, Б— практически зрелая спора Н. lusitanicum. га — гаплоспоросомы, кр — крышечка,
о — формирующиеся нити орнаментации споры, сф — сферулосома, ф — фланец, ша — шарнир, эц — эписпоровая цитоплазма, в которой видны
нити орнамента (Ь), я — ядро. Масштабные линейки: А — 0,5 мкм, Б— 1 мкм. (По: Perkins, 1990).
HAPLOSPORIDIA
385
Рис. 277. Спора Haplosporidium louisiana на одной из последних
стадий созревания. Отверстие покрыто снаружи крышечкой на
шарнире слева и скреплено особыми связками справа,
га — гаплоспоросома, м — митохондрии, ос — осмиофильные нити, или
фибриллы в цитоплазме эписпоры, из которых формируется орнамен-
тация споры, сф — сферула, фг — зона формирования гаплоспоросом,
эц — эписпоровая цитоплазма, я — ядро. Масштабная линейка — 1 мкм.
(По: Perkins, 2000).
покрыта нитями разной толщины. Они, в свою очередь,
могут сливаться со стенкой споры, или располагаться
свободно. Так, у Minchinia нити образуют 2-4 торча-
щие в разные стороны «хвоста», которые видны в све-
товой микроскоп. У Haplosporidium эти нити тоньше,
многочисленнее и завиваются вокруг споры. Предпо-
лагается, что тонкая структура орнамента на поверхно-
сти споры видоспецифична (Perkins, 1990).
Внутри споры, в спороплазме, вновь обнаружи-
ваются гаплоспоросомы, которые исчезают во время
споруляции. У некоторых видов они существенно от-
личаются от сферических гаплоспоросом вегетатив-
ных стадий. Перкинс, например, описывает самые
разные формы гаплоспоросом: уплощенные, сабле-
видные, грушевидные, червеобразные (Perkins, 1990);
у Haplosporidium armoricanum обнаружены сердце-
видные гаплоспоросомы (Hine et al., 2007). Мито-
хондрии с трубчатыми кристами, многочисленные не
связанные с мембранами рибосомы, а также стопки
мембран, характерные для цитоплазмы трофонта, об-
наружены и в спороплазме (рис. 275, 276, 278). Су-
щественным отличием споры от других стадий жиз-
ненного цикла считается наличие клубка мембран
под апертурой, так называемой сферулосомы, или
сферулы, предположительно, производной аппара-
та Гольджи. Сферула набухает при эксцистировании.
Дальнейшая судьба ее не прослежена. Возможно, она
продуцирует вещества для растворения фибрилляр-
ного материала спор Haplosporidium и Minchinia (или
язычка у видов Uro sporidium), после чего крышечка
раскрывается, высвобождая спороплазму. Такие споры
с откинутой крышечкой и выходящей спороплазмой
были отмечены в редких случаях, но что за этим сле-
дует, неизвестно (Perkins, 1990). Можно также пред-
положить, что набухание сферулы просто выталкива-
ет спороплазму с ядром, которая имеет собственную
мембрану, из споры. Тогда следует признать, что сфе-
рула становится внеклеточным образованием.
Ядро споры не содержит микротрубочек, которые
сохраняются в интерфазных ядрах трофонта, а также в
ядрах клеток во время споруляции.
Разрушение тканей хозяина на этом этапе приво-
дит к его гибели, и споры, так или иначе, оказываются
во внешней среде (воде). Их дальнейшая судьба неиз-
вестна.
У большинства видов Bonamia стадия споры отсут-
ствует, возможно, она была утрачена в процессе эволю-
ции. Это предположение подтверждается эксперимен-
тальными данными по заражению. При совместном
содержании здоровых и зараженных Bonamia ostreae
моллюсков, иногда наблюдается распространение ин-
фекции (Elston et al., 1986). Кроме того, к заражению
моллюсков приводит и прямая инокуляция очищенных
внутригемоцитных стадий (Hervio et al., 1995). В то же
время, попытки прямого заражения спорообразующи-
ми гаплоспоридиями были безуспешными (Ford, Tripp,
1996). Потому общепринято представление о том, что
спорообразующим гаплоспоридиям необходим про-
межуточный хозяин для завершения жизненного цик-
ла (Andrews, 1984; Haskin, Andrews, 1988; Powell et al.,
1999).
Экология
Сведения по экологии гаплоспоридий скудны, по-
скольку основная литература посвящена таксономии
и морфологии. Здесь приведены немногие известные
данные по обзору Перкинса (Perkins, 1990).
Гаплоспоридий можно обнаружить как в умерен-
ных, так и в тропических широтах, практически, на
всех континентах. Они поражают беспозвоночных,
обитающих преимущественно на литорали и мелково-
дье. Лишь немногие виды гаплоспоридий выделены из
пресноводных хозяев. Проще всего их найти в беспоз-
воночных, сидящих на твердых субстратах (коралло-
вые рифы, камни, устричные банки), или на поверхно-
сти таких крупных беспозвоночных как крабы. Червей
и ракообразных собирают просеиванием донных осад-
ков. Для обнаружения паразитов готовят гистологиче-
ские срезы или давленные препараты.
Некоторые экологические характеристики извест-
ны для Haplosporidium nelsoni и Н costale — парази-
тов американских устриц. Лимитирующим фактором у
этих видов является соленость. Для Н. nelsoni оптимум
лежит в пределах от 15 до 30%о (Andrews, Frierman,
1974), а Н. costale развивается при солености выше
386
HAPLOSPORIDIA
Рис. 278. Строение споры Urosporidium spisuli.
А — вид споры со стороны отверстия, на которой виден язычок (яз) внутри ободка (об) и одна из оплетающих ее нитей (но); Б — спора на ультра-
тонком срезе: язычок (яз) закрывает отверстие споры изнутри, но его неплотно прилегающий край не попал на срез, га — гаплоспоросомы, м — ми-
тохондрия, эц — эписпоровая цитоплазма, я — ядро. Масштабные линейки: А — 5 мкм, Б— 0,5 мкм. (По: Perkins, 1990).
30%о (Andrews, Wood, 1967). В связи с этим в дождли-
вые годы плотность популяции Н. nelsoni резко снижа-
лась, поскольку этот вид приурочен к эстуариям, в то
время, как популяции Н. costale устойчивее, т.к. раз-
виваются в открытой части заливов, где распреснение
незначительно. Судя по неоднородному распростране-
нию обоих видов вдоль побережья США, температура
также является для них важным абиотическим факто-
ром. В летние месяцы смертность устриц увеличивает-
ся, а зимой значительно снижается и новых заражений
HAPLOSPORIDIA
387
не происходит, хотя пониженная температура не вызы-
вает гибели популяции паразита.
Пока не были обнаружены споры у Bonamia. было
высказано предположение, что виды этого рода, воз-
можно, представляют собой промежуточную стадию в
жизненном цикле какого-то другого вида. В этой связи
интересны недавно полученные данные по строению
Minchinia occulta Bearham et al. 2008, вызывающей
80% смертности устриц Saccostrea cuccullata аквакуль-
тур Северо-Западной Австралии (Bearham et al., 2008).
Оказалось, что трофические стадии необычны для рода
Minchinia’. они содержат только одно ядро и по стро-
ению напоминают виды Bonamia, однако у Minchinia
occulta имеются оперкулятные споры.
Отсутствие сведений о полном жизненном цикле
гаплоспоридий, не позволяет выявить пути распро-
странения и природные очаги инфекции. Возможность
заражения устриц через промежуточного хозяина так-
же необходимо учитывать при исследовании экологии
гаплоспоридий (Perkins, 1990).
Практическое значение
Гаплоспоридия Haplosporidium nelsoni хорошо из-
вестна как MSX (акроним от Multinucleated Sphere X —
многоядерный шар неизвестной принадлежности), вы-
зывающий широчайшие эпизоотии устриц Crassostrea
virginica. выращиваемых вдоль атлантического побере-
жья США (Andrews, 1968; Farley, 1975; Ford, Haskin,
1982, Haskin, Andrews, 1988).
Впервые паразит был обнаружен в 1957 году во
время беспрецедентной по размаху эпизоотии устриц
на Delaware Bay (Haskin et al., 1966). Позднее Н. nel-
soni поразил не меньшее количество устриц на Chesa-
peake Bay (Andrews, Wood, 1967). Суммарно в течение
двух лет погибло более 90% популяции устриц, выра-
щиваемых в этих зонах высокой солености (Andrews,
1979). Причины этих вспышек неизвестны до сих пор,
но больше заболевания устриц такого масштаба не по-
вторялись.
В 90-е годы паразит был обнаружен вдоль Атлан-
тического побережья США от штата Мен до Флориды,
причем в течение одного года максимальная заражен-
ность моллюсков Н. nelsoni составляла от 88 до 92%
(Burreson, 2006). Другие виды Haplosporidium: Н. tume-
facientis. поражающий Mytilus californianus (Taylor,
1966) и H. tapetis. обнаруженный в двухстворчатом
моллюске Tapes decussatus. а также Н. mytilovorum в
мышцах Mytilus edulis. по-видимому, не относятся к
коммерчески важным вредителям (Perkins, 1990).
Urosporidium crescens и U. spisuli распространены
на восточном побережье США. Они наносят непря-
мой экономический ущерб. Их коричневые или черные
споры хорошо заметны в мускулатуре крабов и моллю-
сков, поэтому портят их товарный вид (Perkins, 1990).
Представители рода Bonamia вызывают так назы-
ваемые бонамиозы — заболевания устриц, ведущие к
летальному исходу. При этом поражаются клетки ге-
молимфы — гемоциты. Гистологически паразит выяв-
Рис. 279. Bonamia angasi в гемоцитах устрицы на гистологиче-
ском срезе.
Окраска гематоксилин-эозином. Белыми стрелками показаны одноядер-
ные формы, черными — двуядерные. Масштабная линейка — 10 мкм.
(По: Corbeil et al., 2009).
ляется на срезах соединительной ткани жабр, мантии,
гонад и пищеварительной железы при окрашивании ге-
матоксилин-эозином. В гемоцитах они отмечаются как
мелкие шаровидные тельца диаметром 2-5 мкм, содер-
жащие одно или два ядра (рис. 279), но могут встре-
чаться и внеклеточно. Виды Bonamia ostreae и В. exi-
tiosa обнаружены в Европе (Abollo et al., 2008).
Для диагностики заболеваний рекомендуется ис-
пользовать как традиционные гистологические и элек-
тронно-микроскопические методы, так и более совре-
менные: FISH гибридизация, секвенирование гена 18S
рРНК, ПЦР при помощи специфичных праймеров и
некоторые другие.
Систематика и филогения
Строение апертуры споры в качестве система-
тического признака можно успешно использовать
лишь на уровне семейств. Так, у представителей сем.
Urosporidiidae язычок закрывает отверстие споры из-
нутри, а у Haplosporidiidae оно закрыто крышечкой
снаружи. Чтобы отличить Haplosporidium от Minchinia
используются другой признак — орнаментация по-
верхности споры, которая видна только в просвечиваю-
щий и сканирующий электронный микроскоп. К сожа-
лению, для типового вида Haplosporidium (Н. scolopli)
она неизвестна, поскольку после первоописания его
не находили. Такая неопределенность вынуждает при-
нять произвольное решение об отличительных при-
знаках Haplosporidium от Minchinia. Было предложено
считать, что у Minchinia нити на поверхности споры
формируются из эпиплазмы, а у Haplosporidium — из
материала клеточной стенки споры (Ormieres, 1980).
Многие авторы приняли это предложение (McGovern,
Burreson 1990; Hine, Thome, 1998, 2002; Azevedo et al.,
1999; Azevedo, 2001; Burreson, 2001), однако Перкинс
388
HAPLOSPORIDIA
96
73
100
100
100
' ' ' Chlorarachnion sp.
p— Massisteria marina
5 Cercomonas longicauda
Heteromita globosa
Unidentified cercozoan sp.
Euglypha rotunda
77l у Cercomonas sp. ATCC50317
io6l Cercomonas sp. ATCC50318
wop- Undescribed SPP- SSU clone16
L Undescribed SPP- SSU clone18
—— Undescribed NZAP
Urosporidium sp.
Urosporidium crescens
...... Haplosporidium iouisiana
— Haplosporidium nelsoni
100r— Haplosporidium costale
""I [..Haplosporidium pickfordi
ioo1— Haplosporidium lusitanicum
57 Ю0 Г Mikrocytos roughleyi
ГТ. Bonamia sp.
100
100
100
Ji ool Bonamia ostreae
75
Minchinia tapetis
p- Minchinia chitonis
100—|_ Undescribed CfP
ioqI— Minchinia teredinis
Рис. 280. Консенсусное древо, построенное по методу макси-
мальной экономии по гену 18S рРНК показывает взаимоотноше-
ния видов в пределах ran л о споридий. Jackknife-индекс показан
в основании ветвей. (По: Reece et al., 2004).
(Perkins, 2000) относит к Minchinia только те виды, у
которых нити видны в световой микроскоп, а к Haplo-
sporidium, соответственно, с неразличимой орнамента-
цией. В одной из последних работ Риса с соавторами
(Reece et al., 2004) методами молекулярной филогении
была показана важность признака происхождения по-
верхностных элементов споры для таксономии. По их
данным все виды рода Minchinia образуют монофиле-
тическую группу, для которой характерно формиро-
вание орнамента из эписпоровой цитоплазмы, а род
Haplosporidium оказывается парафилетичным. Следо-
вательно, можно предположить, что виды с оплеткой,
развивающейся из стенки споры, могут принадлежать
разным родам. Род Bonamia обычно кластеризуется с
Minchinia (Reece et al., 2004) (рис. 280).
Недавно была предпринята попытка соотнесения
морфологических признаков гаплоспоридий с молеку-
лярно-генетическими данными (Hine et al., 2009). Авто-
ры выделили 53 морфологических (преимущественно,
ультраструктурных) признака всех стадий жизненного
цикла и подвергли их кладистическому анализу. В ре-
зультате наиболее четкие ветви образуют все 5 изучен-
ных видов рода Minchinia и 3 вида Bonamia. Самосто-
ятельную ветвь дает один вид Urosporidium crescens,
а род Haplosporidium оказывается полифилетичным:
он группируется в 4 независимых кластера, насчиты-
вающих соответственно 3, 2, 2 и 1 вид. Эти данные в
целом соответствуют современным работам по моле-
кулярной филогении генов 18S рРНК и актина, которые
тоже свидетельствуют о парафилии Haplosporidium и
монофилии трех других родов (Burreson, Ford, 2004;
Burreson, Reece, 2006). Крупномасштабное древо по
гену актина (Burki et al., 2010) показывает еще боль-
шую гетерогенность гаплоспоридий, и даже их пара-
филию. Учитывая, что филогения по двум генам дает
более адекватное распределение видов, можно предпо-
ложить, что мультигенный анализ будет продуктивнее
и поможет разрешить родственные взаимоотношения
гаплоспоридий.
Филогенетические связи Haplosporidia с другими
протистами не ясны. С тех пор как установлен этот
таксон, к нему относили любое простейшее, которое не
похоже ни на амеб, ни на жгутиконосцев, ни на инфу-
зорий, при этом формирует споры без полярного фила-
мента и полярной капсулы; не имеет апикального ком-
плекса, и без внутреннего почкования, характерного
для парамиксид. По таким, преимущественно, негатив-
ным признакам в эту группу теоретически могли по-
падать совершенно неродственные спорообразующие
протисты. Можно было бы ожидать, что толстые стен-
ки спор будут найдены в ископаемых остатках, однако
пока таких данных нет.
Для определения филогенетических связей гапло-
споридий с другими протистами морфологических
признаков оказалось недостаточно. В 80-е годы на
основании сходства ядерных фаз в жизненном цикле
(дикарион), внутриядерного митоза и центров орга-
низации микротрубочек митотического веретена было
высказано предположение об их близости к микро-
споридиям (Desportes, Nashed, 1983). Однако эта идея
была отвергнута Перкинсом (Perkins, 1990), посколь-
ку у гаплоспоридий нет полярной трубки, но присут-
ствуют гаплоспоросомы и митохондрии, которых нет у
микроспоридий. Сейчас хорошо известно, что микро-
споридии относятся к грибам, где они выделены в са-
мостоятельный тип (Hibbett et al., 2007), хотя недавно
появились работы, о более глубоком ветвлении микро-
споридий среди Holomycota (Lara et al., 2010; Jones et
al., 2011). Наличие гаплоспоросом также не является
уникальным признаком гаплоспоридий. Такие орга-
неллы найдены также у парамиксид и миксоспоридий
(Perkins, 1990).
Комбинированные данные по генам актина и рРНК
(Reece et al., 2004) подтвердили монофилию Haplospo-
ridia и их связь с Cercozoa, которую впервые показа-
ли Кавалье-Смит и Чао (Cavalier-Smith, Chao, 2003b).
Последние авторы предпочитают включать гаплоспо-
ридий в Cercozoa, поскольку у них также есть «почти
уникальная» для Cercozoa делеция одного нуклеотида.
Кроме того, с одной стороны Кавалье-Смит и Чао ут-
верждают, что Haplosporida и Paramyxida это разные
отряды в типе Cercozoa, а с другой, помещают Marteilia
refringens (Paramyxea) среди гаплоспоридий, где она
является сестринской ветвью Haplosporidium costale
(Cavalier-Smith, Chao, 2003a).
Другие исследователи гаплоспоридий, опираясь на
собственный анализ молекулярной филогении, счита-
HAPLOSPORIDIA
389
ют, что Haplosporidia и Paramyxea не являются близко-
родственными группами (Berthe et al., 2000; Reece et al.,
2004). Кроме того, комбинированное молекулярно-фи-
логенетическое древо по генам рРНК и актина показы-
вает, что парамиксида Marteilia refringens не относится
к Haplosporidia (Reece et al., 2004). Анализ ризарий по
генам 18S и 28S рРНК показывает, что гаплоспоридии
являются сестринской группой раковинным амебам
рода Gromia (Bass et al., 2009). Таким образом, Haplo-
sporidia — морфологически и генетически четко очер-
ченный монофилетический таксон, филогенетические
связи которого пока не вполне ясны.
Систематический обзор
Класс Haplosporidia Caullery 1953
Отряд Haplosporida Caullery et Mesnil 1899
Сем. Haplosporidiidae Caullery et Mesnil
1899
Крышечка (оперкулум) закрывает отверстие споры
снаружи.
Паразиты морских олигохет, полихет, немертин,
моллюсков, декапод, иглокожих, асцидий и змей.
Род Haplosporidium Caullery et Mesnil 1899
(рис. 281)
Споры овальные приплюснутые на одном из по-
люсов, где расположено отверстие, прикрытое снару-
жи крышечкой. Спора обвита тонкими невидимыми в
световой микроскоп нитями, которые формируются из
эписпоровой цитоплазмы. Это определение охватывает
23 вида гаплоспоридий, обнаруженных в морских по-
лихетах, ракообразных, моллюсках, иглокожих, обо-
лочниках.
Типовой вид — Н. scolopli Caullery et Mesnil
1899, обнаружен в полихете Scoloplos mulleri. Cap de la
Hague, Франция. Ультраструктура неизвестна.
Род Minchinia Labbe 1896 (рис. 281)
Споры по форме похожи на таковые Haplospo-
ridium, но оплетающие спору нити видны в световой
микроскоп.
Типовой вид — М. chitonis (Lankester 1885)
Labbe 1896, обнаружен в хитонах Lepidochitona cine-
reus, обитающих в Ла-Манше у берегов Франции и Ан-
глии.
Описано 5 видов, паразитирующих в морских по-
лихетах и моллюсках.
Род Bonamia Pichot et al. 1979 (рис. 274, 279)
Паразиты устриц, поражают гемоциты. Клетки со-
держат гаплоспоросомы, но споры в жизненном цикле
были обнаружены сравнительно недавно и только у
одного вида В. perspora (Carnegie et al., 2006). Споры
оперкулятного типа, по данным молекулярной филоге-
нии Bonamia представляет собой сестринскую группу
Minchinia (рис. 280), поэтому род отнесен к сем. Ha-
plosporidiidae (Carnegie et al., 2000; Reece, Stokes, 2003;
Reece et al., 2004).
Типовой вид — В. ostreae Pichot et al. 1979, об-
наружен в устрицах Ostrea edulis в штатах Калифорния
и Мэн (США), а также в Европе.
Представитель другого рода, Mikrocytos roughleyi,
описанный из австралийской устрицы Saccostrea glom-
erata (Farley et al., 1988), как и Bonamia, развивается
внутри гемоцитов, имеет сходную ультраструктуру, на
Рис. 281. Споры паразита устриц Haplosporidium nelsoni (Л) и паразита полихет Minchinia teredinis (Б) в сканирующем электронном
микроскопе.
Масштабная линейка— 1 мкм. (По: Burreson, Reece, 2006 — Л; McGovern, Burreson, 1990 — Б).
390
HAPLOSPORIDIA
филогенетической схеме выявляется как ее сестринская
группа, поэтому переведен в род Bonamia (Cochennec-
Laureau et aL, 2003; Reece et al., 2004). Другой вид рода
Mikrocytos, M. mackini, поражающий клетки соедини-
тельной ткани Crassostrea gigas в Британской Колумбии
(Канада) (Farley et al., 1988) и штате Вашингтон (США),
по-видимому, не относится ни к Bonamia, ни даже к га-
плоспоридиям (Hine et al., 2001; Carnegie et al., 2003).
Сем. Urosporidiidae Caulleryet Mesnil 1905
Складка стенки споры (язычок) закрывает отвер-
стие изнутри, крышечка отсутствует. Преимуществен-
но гиперпаразиты ооцист и метацеркарий трематод, а
также нематод. Один вид найден в целоме полихеты.
Род Urosporidium Caullery et Mesnil 1905
(рис. 278)
Споры шаровидные или немного вытянутые с от-
верстием на одном из полюсов, которое прикрыто
язычком из материала стенки споры. Один или не-
сколько выростов эписпороплазмы укреплены лентами
цитоплазматического материала.
Типовой вид — U. fuliginosum Caullery et
Mesnil 1905. Обнаружен в полихете Syllis gracilis, оби-
тающей в Ла-Манше у берегов Франции. Ультраструк-
тура неизвестна.
Паразитируют в трематодах, нематодах и полихе-
тах (Burreson, Ford, 2004).
Один вид — Urosporidium cannoni Anderson et al.
1993 — был обнаружен в тканях турбеллярии (Poly-
cladida), обитающей на устричной ферме в Австралии.
Поверхность зрелой споры обвивают 11-13 нитей фор-
мирующихся из эписпоровой цитоплазмы и располо-
женных через неравные интервалы. Во время развития
споры хорошо заметна сферула, которая исчезает после
созревания споры. Последние находятся в цистах, кото-
рые содержат иногда до нескольких сотен спор. Зрелые
цисты обычно встречаются группами и заметны в виде
черных пятен на теле красно-коричневых турбеллярий
(Anderson et al., 1993).
SUMMARY
The general characteristics, brief history, classification, mor-
phology, ecology, practical importance, phylogeny and the descrip-
tion of genera have been reviewed. Basic reviews by Perkins (1990,
2000), Reece et al. (2004), Hine et al. (2009) along with other papers
have been used for this chapter. The Haplosporidia is regarded here
as a monophyletic taxon inside Cercozoa. Order Haplosporida Caul-
lery et Mesnil 1899 includes two families: Haplosporidiidae Caullery
et Mesnil 1899 (Haplosporidium, Minchinia, Bonamia) and Urospo-
ridiidae Caullery et Mesnil 1905 (Urosporidium).
ЛИТЕРАТУРА
Abollo E., Ramilo A., Casas S.M., Comesana P., Cao A., Carballal
M.J., Villalba A. 2008. First detection of the protozoan parasite Bonamia
exitiosa (Haplosporidia) infecting flat oyster Ostrea edulis grown in European
waters //Aquaculture. Vol. 274. P. 201-207.
Anderson T.J., Newman L.J., Lester R.J.G. 1993. Light and electron
microscope study of Urosporidium cannoni n. sp., a haplosporidian para-
site of the polyclad turbellarian Stylochus sp. // J. Euk. Microbiol. Vol. 40.
P. 162-168.
Andrews J.D. 1968. Oyster mortality studies in Virginia. VII. Review
of epizootiology and origin of Minchinia nelsoni 11 Proc. Nat. Shellfish Assoc.
Vol. 58. P. 23-36.
Andrews J.D. 1984. Epizootiology of diseases of oysters (Crassostrea
virginica), and parasites of associated organisms in eastern North America //
Helgol. Meer. Vol. 37. P. 149-166.
Andrews J.D., Frierman M. 1974. Epizootiology of Minchinia nelsoni
in susceptible wild oystes in Virginia, 1959 to 1971 // J. Invertebr. Pathol.
Vol. 24. P. 127-140.
Andrews J.D., Wood J.L. 1967. Oyster mortality studies in Virginia.
VI. History and distribution of Minchinia nelsoni, a pathogen of oysters, in
Virginia//Ches. Sci. Vol. 8. P. 1-13.
Andrews J.D. 1979. Oyster disease in Chesapeake Bay // Mar. Fish.
Rev. Vol. 41. P. 45-53.
Azevedo C. 2001. Ultrastructural description of the spore maturation
stages of the clam parasite Minchinia tapetis (Vilela 1951) (Haplosporida:
Haplosporidiidae) // Syst. Parasitol. Vol. 49. P. 189-194.
Azevedo C., Montes J., Corral L. 1999. A revised description of Hap-
losporidium armoricanum, parasite of Ostrea edulis L. from Galicia, north-
western Spain, with special reference to the sporewall filaments // Parasitol.
Res. Vol. 85. P. 977-983.
Azevedo C., Corral L. 1985. Cytochemical analysis of the haplosporo-
somes and vesicle-like droplets of Haplosporidium lusitanicum (Haplospo-
rida, Haplosporidiidae), parasite of Helcion pellucidus (Prosobranchia) // J.
Invertebr. Pathol. Vol. 46. P. 281-288.
Balseiro P., Conchas R.F., Montes J., Gomez-Leon J., Novoa B.,
Figueras A. 2006. Comparison of diagnosis techniques for the protozoan
parasite Bonamia ostreae in flat oyster Ostrea edulis // Aquaculture. Vol. 261.
P. 1135-1143.
Bass D., Chao E.E., Nikolaev S., Yabuki A., Ishida K., Pakzad U.,
Wylezich C., Cavalier-Smith T. 2009. Phylogeny of naked filose and re-
ticulose Cercozoa: Granofilosea cl. n. and Proteomyxidea revised // Protist.
Vol. 160. P. 75-109.
Bearham D., Spiers Z., Raidal S.R., Jones J.B., Nicholls P.K. 2008.
Spore ornamentation of Minchinia occulta n. sp. (Haplosporidia) in rock oys-
ters Saccostrea cuccullata (Bom, 1778) // Parasitology. Vol. 135 (issue 11)
P. 1271-1280.
Berthe F.C.J., Le Roux F., Peyretaillade E., Peyret P., Rodriguez D.,
Gouy M., Vivares C.P. 2000. Phylogenetic analysis of the small subunit ri-
bosomal RNA of Marteilia refringens validates the existence of phylum Para-
myxea (Desportes and Perkins, 1990) //J. Euk. Microbiol. Vol. 47. P. 288-293.
Burki F., Kudryavtsev A., Matz M.V., Aglyamova G.V., Bulman S.,
Fiers M., Keeling P.J., Pawlowski J. 2010. Evolution of Rhizaria: new in-
sights from phylogenomic analysis of uncultivated protists // BMC Evolution-
ary Biology. Vol. 10. P. 377.
Burreson E.M. 2001. Spore ornamentation of Haplosporidium pick-
fordi Barrow, 1961 (Haplosporidia), a parasite of freshwater snails in Michi-
gan, USA // J. Euk. Microbiol. Vol. 48. P. 622-626.
Burreson E.M. 2006. Infection with Haplosporidium nelsoni // Manual
of diagnostic tests for aquatic animals, 5th edition. World Organisation for
Animal Health, Paris.
Burreson E.M., Ford S.E. 2004. A review of recent information on
the Haplosporidia, with special reference to Haplosporidium nelsoni (MSX
disease) //Aquat. Living Resour. Vol. 17. P. 499-517.
HAPLOSPORIDIA
391
Burreson E.M., Reece K.S. 2006. Spore ornamentation of Haplospo-
ridium nelsoni and Haplosporidium costale (Haplosporidia), and incongru-
ence of molecular phylogeny and spore ornamentation in the Haplosporidia //
J. Parasitol. Vol. 92. P. 295-1301.
Carnegie R.G., Barber B.J., Culloty S.C., Figueras A.J., Distel D.L.
2000. Development of a PCR assay for detection of the oyster pathogen Bon-
amia ostreae and support for its inclusion in the Haplosporidia // Dis. Aquat.
Org. Vol. 42. P. 199-206.
Carnegie R. G., Burreson E.M., Hine P.M., Stokes N.A., Audemard
C., Bishop M.J., Peterson P.H. 2006. Bonamia perspora n. sp. (Haplospo-
ridia), a parasite of the oyster Ostreola equestris, is the first Bonamia species
known to produce spores // J. Euk. Microbiol. Vol. 53. P. 32-245.
Carnegie R.G., Meyer G.R., Blackbourn J., Cochennec-Laureau N.,
Berthe F.C.J., Bower S.M. 2003. Detection of the oyster parasite Mikrocytos
mackini by PCR and fluorescent in situ hybridization, and a preliminary phy-
logenetic analysis // Dis. Aquat. Org. Vol. 54. P. 219-227.
Caullery M., Mesnil F. 1899. Sur le genre Aplosporidium (nov) et
1’ordre nouveau des Aplosporidies // C. R. Soc. Biol. (Paris). Vol. 51. P. 789-
791.
Caullery M., Mesnil F. 1905. Sur quelques nouvelles haplosporidies
d’Annelide // C. R. Soc. Biol. (Paris). Vol. 58. P. 580-583.
Cavalier-Smith T. 1993. Kingdom Protozoa and its 18 phyla // Micro-
biol. Rev. Vol. 57. P. 953-994.
Cavalier-Smith T., Chao E.E.-Y. 2003a. Phylogeny of Choanozoa,
Apusozoa, and other Protozoa and early eukaryote megaevolution // J. Mol.
Evol. Vol. 56. P. 540-563.
Cavalier-Smith T., Chao E.E.-Y. 2003b. Phylogeny and classification
of phylum Cercozoa (Protozoa) // Protist. Vol. 154. P. 341-358.
Cochennec-Laureau N., Reece K.S., Berthe F.C.J., Hine P.M. 2003.
Mikrocytos roughleyi taxonomic affiliation leads to the genus Bonamia (Hap-
losporidia) // Dis. Aquat. Org. Vol. 54. P. 209-217.
Corbeil S., Handlinger J., Crane M.St.J. 2009. Bonamiasis in Austra-
lian Ostrea angasi 11 Australian and New Zealand standard diagnostic proce-
dure. January Issue. P. 1-22.
Corliss J.O. 1994. An interim utilitarian (“user-friendly”) hierarchi-
cal classification and characterization of the protists // Acta Protozoologica.
Vol. 33. P. 1-51.
Desportes L, Nashed N.N. 1983. Ultrastructure of sporulation in
Minchinia dentali (Arvy), an haplosporean parasite of Dentalium entale
(Scaphopoda, Mollusca); taxonomic implications // Protistologica. Vol. 19.
P. 335-460.
Desportes I. and Perkins F.0.1990. Phylum Paramyxea // L. Margulis,
J.O. Corliss, M. Melkonian and D.J. Chapman (eds). Handbook of Protoc-
tista. Jones and Bartlett Publ., Boston. P. 30-35.
Elston R.A., Farley C.A., Kent M.L. 1986. Occurrence and signifi-
cance of bonamiasis in European flat oysters Ostrea edulis in North Ameri-
ca // Dis. Aquat. Org. Vol. 2. P. 49-54.
Farley C.A. 1975. Epizootic and enzootic aspects of Minchinia nelsoni
(Haplosporida) disease in Maryland oysters // J. Protozool. Vol. 22. P. 418—
427.
Farley C.A., Wolf P.H., Elston R.A. 1988. A long-term study of “mi-
crocell” disease in oysters with a description of a new genus, Mikrocytos
(g. n.), and two new species, Mikrocytos mackini (sp. n.) and Mikrocytos
roughleyi (sp. n.) // Fish. Bull. Vol. 86. P. 581-593.
Flores B.S., Siddall M.E., Stokes N.A., Burreson E.M. 1996. Phy-
logeny of the Haplosporidia (Eukaryota: Alveolata) based on small subunit
ribosomal RNAgene sequence // J. Parasitol. Vol. 82. P. 616-623.
Fong D., Chan M.M.-Y., Rodriguez R., Chen C.-С., Liang Y., Little-
wood D.T.J., Ford S.E. 1993. Small subunit ribosomal RNA gene sequence
of the parasitic protozoan Haplosporidium nelsoni provides a molecular probe
for the oyster MSX disease // Mol. Biochem. Parasitol. Vol. 62. P. 139-143.
Ford S.E., Haskin H.H. 1982. History and epizootiology of Haplospo-
ridium nelsoni (MSX), an oyster pathogen, in Delaware Bay, 1957-1980 H J.
Invertebr. Pathol. Vol. 40. P. 118-141.
Ford S.E., Tripp M.R. 1996. Diseases and defense mechanisms // Ken-
nedy V.S., Newell R.I.E., Eble A.F. (eds). The eastern oyster Crassostrea vir-
ginica, Maryland Sea Grant, College Park, MD. P. 5814)60.
Haskin H.H., Andrews J.D. 1988. Uncertainties and speculations about
the life cycle of the eastern oyster pathogen Haplosporidium nelsoni (MSX) //
Fisher W.S. (ed.) Disease Processes in Marine Bivalve Molluscs. Am. Fish.
Soc. Spec. Publ. Vol. 18. P. 5-22.
Haskin H.H., Stauber L.A., Mackin J.A. 1966. Minchinia nelsoni n.
sp. (Haplosporida, Haplosporidiidae): causative agent of the Delaware Bay
oyster epizootic // Science. Vol. 153. P. 1414-1416.
Hervio D., Bachere E., Boulo V., Cochennec N., Vuillemin V., Le
Coguic Y., Cailletaux G., Mazurie J., Mialhe E. 1995. Establishment of
an experimental infection protocol for the flat oyster, Ostrea edulis, with the
intrahaemocytic protozoan parasite, Bonamia ostreae'. application in the se-
lection of parasite resistant oysters //Aquaculture. Vol. 132. P. 183-194.
Hibbett D.S., Binder M., Bischoff J.F., Blackwell M., Cannon P.F.,
Eriksson O.E., Huhndorf S., James T., Kirk P.M., Lucking R., Thorsten
Lumbsch H., Lutzoni F., Matheny P.B., McLaughlin D.J., Powell M.J.,
Redhead S., Schoch C.L., Spatafora J.W., Stalpers J.A., Vilgalys R.,
Aime M.C., Aptroot A., Bauer R., Begerow D., Benny G.L., Castle-
bury L.A., Crous P.W., Dai Y.-C., Gams W., Geiser D.M., Griffith G.W.,
Gueidan C., Hawksworth D.L., Hestmark G., Hosaka K., Humber R.A.,
Hyde K.D., Ironside J.E., Koljalg L., Kurtzman C.P., Larsson К.-H., Li-
chtwardt R., Longcore J., Miadlikowska J., Miller A., Moncalvo J.-M.,
Mozley-Standridge S., Oberwinkler F., Parmasto E., Reeb V., Rog-
ers J.D., Roux C., Ryvarden L., Sampaio J.P., Schussler A., Sugiyama J.,
Thorn R.G., Tibell L., Untereiner W.A., Walker C, Wang Z., Weir A.,
Weiss M., White M.M., Winka K., Yao Y.-J., Zhang N. 2007. A higher-
level phylogenetic classification of the Fungi // Mycol. Res. Vol. 111. No. 5.
P. 509-547.
Hine P.M., Carnegie R.B., Burreson E.M., Engelsma M.Y. 2009.
Inter-relationships of haplosporidians deduced from ultrastructural studies //
Dis. Aquat. Org. Vol. 83. P. 247-256.
Hine P.M., Bower S.M., Meyer G.R., Cochennec-Laureau N., Berthe
F.C.J. 2001. Ultrastructure of Mikrocytos mackini, the cause of Denman Is-
land disease in oysters Crassostrea spp. and Ostrea spp. in British Columbia,
Canada // Dis. Aquat. Org. Vol. 45. P. 215-227.
Hine P.M., Thorne T. 1998. Haplosporidium sp. (Haplosporidia) in
hatchery-reared pearl oysters, Pinctada maxima (Jameson, 1901), in north
western Australia // J. Invertebr. Pathol. Vol. 71. P. 48-52.
Hine P.M., Thorne T. 2002. Haplosporidium sp. (Alveolata: Haplospo-
ridia) associated with mortalities among rock oysters Saccostrea cuccullata in
north Western Australia // Dis. Aquat. Org. Vol. 51. P. 123-133.
Hine P.M., Wesney B. 1994. The functional cytology of Bonamia sp.
(Haplosporidia) infecting oysters (Tiostrea chilensis)'. an ultracytochemical
study // Dis. Aquat. Org. Vol. 20. P. 207-217.
Hine P.M., Engelsma M.Y., Wakefield St.J. 2007. Ultrastructure of
sporulation in Haplosporidium armoricanum // Dis. Aquat. Org. Vol. 77.
P. 225-233.
Jones M.D.M., Forn L, Gadelha C., Egan M.J., Bass D., Massana
R., Richards T.A. 2011. Discovery of novel intermediate forms redefines the
fungal tree of life // Nature. Vol. 474. P. 200.
La Haye C.A., Holland N.D., McLean N. 1984. Electron microscopic
study of Haplosporidium comatulae n. sp. (Phylum Ascetospora: Class Stel-
latosporea), a haplosporidian endoparasite of an Australian crinoid, Oligo-
metra serripinna (Phylum Echinodermata) // Protistologica. Vol. 20. P. 507-
515.
Lara E., Mitchell E.A., Moreira D., Lopez-Garcia P. 2010. The en-
vironmental clade LKM11 and Rozella form the deepest branching clade of
fungi//Protist. Vol. 161. P. 116-121.
Larsson R. 1987. On Haplosporidium gammari, a parasite of the am-
phipod Rivulogamarus pulex, and it relationships with the phylum Ascetos-
pora // J. Invertebr. Pathol. Vol. 49. P. 159-169.
McGovern E.R., Burreson E.M. 1990. Ultrastructure of Minchinia
sp. spores from shipworms (Teredo spp.) in the western North Atlantic, with
a discussion of taxonomy of the Haplosporidiidae // J. Protozool. Vol. 37.
P. 212-218.
Ormieres R. 1980. Haplosporidium parisi n. sp. haplosporidie parasite
de Serpula vermicularis L. etude ultrastructurale de la spore // Protistologica.
Vol. 16. P. 467^174.
Perkins F.O. 1975. Fine structure of Minchinia sp. (Haplosporida)
sporulation in the mud crab, Panopeus herbstii // Mar. Fish. Rev. Vol. 37.
P. 46-60.
Perkins F.O. 1990. Phylum Haplosporidia // Margulis L., Corliss J.O.,
Melkonian M., Chapman D.J. (eds). Handbook of Protoctista. Jones and Bart-
lett Publishing, Boston, MA. P. 19-29.
Perkins F.O. 1991. “Sporozoa”: Apicomplexa, Microsporidia, Haplos-
poridia, Paramyxea, Myxosporidia, and Actinosporidia // Harrison F. W., Cor-
liss J.O. (eds). Microscopic anatomy of Invertebrates. Vol. 1. Wiley-Liss, NY.
P. 261-331.
Perkins F.O. 2000. Phylum Haplosporidia Caullery & Mesnil, 1899 //
Lee J.J., Leedale G.F., Bradbury P. (eds). An illustrated guide to the proto-
zoa, 2nd edition. Vol. 2. Society of Protozoologists, Lawrence, KS. P. 1328—
1341.
Powell E.N., Klinck J.M., Ford S.E., Hofmann E.E., Jordan S.J.
1999. Modeling the MSX parasite in eastern oyster (Crassostrea virginica)
populations. III. Regional application and the problem of transmission // J.
Shellfish Res. Vol. 18. P. 517-537.
392
HAPLOSPORIDIA
Reece K.S., Siddall M.E., Stokes N.A., Burreson E.M. 2004. Molecu-
lar phylogeny of the Haplosporidia based on two independent gene sequen-
ces // J. Parasitol. Vol. 90. P.lll 1-1122.
Reece K.S., Stokes N.A. 2003. Molecular analysis of a haplosporidian
parasite from cultured New Zealand abalone Haliotis iris II Dis. Aquat. Org.
Vol. 53. P. 61-66.
Siddall M.E., Stokes N.A., Burreson E.M. 1995. Molecular phylo-
genetic evidence that the phylum Haplosporidia has an alveolate ancestry //
Mol. Biol. Evol. Vol. 12. P. 573-581.
Sprague V. 1979. Classification of the Haplosporidia // Mar. Fish. Rev.
Vol. 41. P. 40—44.
Sprague V. 1982. Ascetospora // Parker S.P. (ed.). Synopsis and
Classifcation of Living Organisns. Vol. 1. McGraw-Hill Book Co., N.Y.
P. 599-601.
Taylor R.L. 1966. Haplosporidium tumifacientis sp. n., the etiologic
agent of disease of the California sea mussel, Mytilus californianus Conad //
J. Invertebr. Pathol. Vol. 8. P. 109-121.
PARAMYXEA Chatton 1911
Паразитические гетеротрофные протисты обитающие в
органах пищеварения (кишечном эпителии, гепатопанкреасе)
морских беспозвоночных, где они питаются осмотрофно. Спо-
рогенез осуществляется путем внутреннего почкования и за-
вершается формированием многоклеточной споры. Митоз от-
крытого типа, центриоли состоят из синглетов микротрубочек.
Митохондрии с трубчатыми кристами.
История изучения
и классификация
Первая парамиксида Paramyxa paradoxa Chatton
1911 была описана из личинки пелагической полихе-
ты, найденной неподалеку от Banyuls-sur-Mer на Сре-
диземноморском побережье Франции (Chatton, 1911).
В дальнейшем, изучение и определение их видовой и
родовой принадлежности стало возможным только на
ультраструктурном уровне, поскольку главным при-
знаком этих организмов считается количество клеток
в споре. Изучение ультратонкого строения Paramyxa
paradoxa показало, что этот вид действительно отлича-
ется от всех других парамиксид и является единствен-
ным представителем рода (Desportes, 1981). Род Mar-
teilia — наиболее важный в практическом отношении
паразит устриц, поражающий их пищеварительную
железу, — был описан в 1974 году, но его отличие от
парамиксы было продемонстрировано тогда только на
светооптическом уровне (Grizel et al., 1974). Род Para-
marteilia был установлен при изучении парамиксид из
гонад амфиподы Orchestia gammarellus, на основе не-
скольких признаков (количество вторичных клеток,
особенности спор и таксономическое положение хозя-
ина), что позволило отделить его от двух других родов
(Ginsburger-Vogel, Dersportes, 1979). Позднее был опи-
сан род Marteilioides с типовым видом М. chungmuensis
Comps, Park et Desportes 1986, отличающийся наличи-
ем только одной трехклеточной споры во вторичной
клетке (Comps et al., 1986). И последний род Рагатух-
oides был установлен совсем недавно: его представи-
тели были выделены из полихеты, где он развивается
в клетках кишечного эпителия (Larsson, Koie, 2005).
Морфологически его представители очень похожи на
Paramyxa, но авторы указали на присутствие придат-
ков споры и гаплоспоросом в двух из четырех клеток
споры. Поскольку описание всех пяти родов приведе-
но по разным признакам, в 2009 году было предложе-
но унифицировать систему парамиксид, используя, как
и раньше, только признаки спор, и вернуться, таким
образом, к трем родам, объединяющим все 10 видов
парамиксид (Fiest et al., 2009) (рис. 282). В результа-
те Marteilioides chungmuensis Comps, Park et Desportes
1986 перенесен в род Marteilia', Marteilioides branchia-
lis Anderson et Lester 1992 отнесен к роду Paramarteilia',
Paramyxoides Larsson et Koie 2005 считается младшим
синонимом Paramyxa и его единственный вид Para-
myxoides nephtys Larsson et Koie 2005 перенесен в род
Paramyxa.
Роды и виды различаются по количеству спор и
споровых клеток в споронте, а также таксономическим
положением хозяина.
Представители Marteilia паразитируют в моллю-
сках. В состав рода Marteilia входят следующие виды:
М. refringens Grizel et al. 1974, M. sydneyi Perkins et Wolf
1976, M. lengehi Comps 1976, M. christenseni Comps
1985, M. chungmuensis Comps et al. 1986.
Виды Paramarteilia'. P. orchestiae Ginsburger-Vogel
et Desportes 1979, P. branchialis Anderson et Lester 1992,
P. canceri Fiest et al. 2009, — паразитируют в ракообраз-
ных.
Виды Paramyxa'. Р. paradoxa Chatton 1911, P. (= Pa-
ramyxoides) nephtys — в полихетах.
Paramyxa и Paramarteilia найдены в морских бес-
позвоночных у берегов Франции, Marteilia — Фран-
ции, Испании, Дании, России, США, Австралии, Кореи
и Японии.
Морфология основных стадий
жизненного цикла
Прежде изложения морфологии парамиксид, вкрат-
це приведем основные стадии их жизненного цикла,
особенно, спорогенеза, который представляет собой
один из способов размножения паразита.
394
PARAMYXEA
Paramarteilia Marteilia Paramyxa
Р. cancan Р. orchestias Р. branchialis М. chungmuensis М Sydney! М refringens Marteilia Р paradoxa Р nephfys
\® ) \ryQ/ 'Pq о/ \© у lQ ©Л /О (о© Д ©@J
©
Основной признак рода - количество клеток в споре, которая может быть
2-х, 3-х и 4-х клеточной. Первичная клетка Paramarteilia содержит до 12
вторичных клеток, каждая из которых заключает в себе одну или две
двухклеточные споры. У Marteilia от 3 до 16 вторичных клеток по 1 - 6
трехклеточных спор в каждой. У Рагатуха 2-4 вторичные клетки, в
каждой по 4 четырехклеточных споры.
Рис. 282. Ключевые признаки и классификация парамиксид. Ядра не показаны на основной схеме, а только в правой колонке с клю-
чевыми признаками.
пк — первичная клетка, вк — вторичная клетка, сп — спора, С1-С6 генерации клеток от первичной до спороплазмы с соответствующими ядрами
(я1-я6). (По: Fiest et al., 2009).
Размножение и жизненный цикл
Размножение осуществляется двумя путями: обыч-
ным бинарным делением родительской амебоидной
клетки, и путем внутреннего почкования при образо-
вании спор (спорогонии). Бинарное деление удавалось
наблюдать крайне редко, в частности, оно было показа-
но для Marteilia chungmuensis (Itoh et al., 2004). Споры
всех представителей, входящих в этот таксон, всегда
многоклеточны. Они возникают внутри родоначальной
амебоидной клетки путем эндогенного почкования. В
результате формируется несколько генераций клеток
(рис. 282).
Спорогония в общем виде идет следующим обра-
зом (рис. 282). Родоначальная амебоидная клетка (С1)1
развивается между клетками ткани хозяина, увеличи-
ваясь в размерах. Первое же деление ядра приводит к
формированию меньшего ядра вторичной клетки, т.е.
в результате митоза образуются 2 ядра неравного раз-
мера.
При митозе ядерная оболочка распадается на мел-
кие уплощенные везикулы, из которых потом собира-
ется оболочка обоих дочерних ядер. Центрами органи-
зации веретена деления являются пары ортогонально
1 По другой терминологии: плазмодий (Perkins, 1976), родона-
чальная клетка (Ginsburger-Vogel, Desportes 1979), первичная зародыше-
вая клетка (Desportes, 1984). — Прим. авт.
ориентированных друг к другу центриолей, образован-
ных синглетами микротрубочек. Впервые они были об-
наружены у Marteilia sp. (Desportes, Ginsburger-Vogel,
1977). Таким образом, деление ядра следует считать
открытым ортомитозом.
После кариокинеза меньшее ядро с довольно уз-
кой зоной цитоплазмы отделяется от цитоплазмы ро-
доначальной клетки цистернами эндоплазматического
ретикулума. Этот процесс приводит к образованию
внутриклеточной дочерней клетки (С2)2, которая нахо-
дится внутри вакуоли. Эта вторичная клетка сразу же
делится, давая две идентичные вторичные клетки, каж-
дая из которых находится в собственной вакуоли вну-
три родоначальной клетки. Деление вторичных клеток
может продолжаться, и в зависимости от вида форми-
руется разное, но вполне определенное число вторич-
ных клеток, каждая из которых находится внутри своей
вакуоли. Клетка-родоначальница при этом продолжает
расти, но больше не делится.
Затем внутри каждой вторичной клетки, которая
теперь уже считается споронтом, опять же путем вну-
треннего почкования развивается третичная клетка
(СЗ). Ее называют также наружной споровой клеткой,
или спорой. В случае Paramarteilia orchestiae третич-
2 Альтернативные термины: спорангии (Perkins, 1976), пан-
споробласты (Ginsburger-Vogel, Desportes 1979), споронты (Desportes,
1981). —Прим. авт.
PARAMYXEA
395
ная клетка делится на две одинаковые споровые клет-
ки. В каждой споровой клетке отделятся внутрь ее, сно-
ва в результате эндогенного почкования, дефинитивная
репродуктивная единица — внутренняя споровая клет-
ка (С4), или спороплазма. Таким образом, формируется
двуклеточная спора, характерная для представителей
рода Paramarteilia (рис. 282).
У других парамиксид процесс идет сложнее: спо-
ры могут быть трехклеточные (Marteilia), когда внутрь
клетки С4 отпочковывается С5, и четырехклеточные
(Рагатуха), когда появляется генерация С6. В этом
случае спороплазмой называют С5 и С6, соответствен-
но, т.е. клетку последней генерации. Кроме того, пред-
полагается, что у Рагатуха процесс формирования
споры может сочетаться с мейотическими делениями
(Desportes, 1984).
Сведения о завершающем этапе созревания споры,
практически, отсутствуют. Известно, что цитоплазма
споронта деградирует, так что вокруг наружной спо-
ровой клетки остается лишь его мембрана. Поверх-
ность споры гладкая, у некоторых видов, например, у
Рагатуха nephtys, имеются полярные придатки длиной
около 13 мкм (Larsson, Koie, 2005). Зрелые споры вы-
деляются в пространство кишечного тракта и выводят-
ся наружу с фекалиями. Их дальнейшая судьба неиз-
вестна. Поскольку эксперименты с заражением хозяина
спорами парамиксид не увенчались успехом, предпо-
лагается, что для завершения жизненного цикла необ-
ходим промежуточный хозяин, или имеют место сво-
бодноживущие стадии. Так, применение современных
методов исследований показало, что ДНК Marteilia
refringens всегда обнаруживается в копеподах Рагасаг-
tia (= Acartia) grani (Audemard et al., 2002). Более того,
сам паразит был обнаружен в яичниках рачка, а экспе-
риментальное заражение рачков от инфицированных
устриц прошло успешно. Таким образом, можно счи-
тать доказанным, что М. refringens имеет двух хозяев,
в которых предположительно происходит чередование
поколений.
Строение клетки парамиксид
Ультратонкое строение парамиксид известно для
каждого рода. Больше всего работ посвящено иссле-
дованию Marteilia (Grizel et al., 1974; Perkins, 1976;
Perkins, Wolf, 1976; Comps et al., 1986; Anderson, Les-
ter, 1992; Itoh et al., 2004). В меньшей степени изучены
представители двух других родов: Paramarteilia (Gins-
burger-Vogel, Desportes, 1979; Fiest et al., 2009) и Рага-
туха (Desportes, 1981; Larsson, Koie, 2005).
В целом ультраструктурные особенности всех па-
рамиксид довольно сходны, поэтому можно привести
общую характеристику строения клеток на разных ста-
диях жизненного цикла.
Рис. 283. Ультратонкий срез типичной многоклеточной стадии спорогенеза Paramarteilia canceri. Первичная клетка (С1) отделена от
окружающей ткани плазмалеммой (стрелки). В ней содержатся палочковидные гаплоспоросомы (сконцентрированы в левой части
клетки), и две вторичные клетки (С2) без гаплоспоросом. В одной из вторичных клеток видны две споры (СЗ), содержащие по споро-
плазме (С4) и заполненные длинными гаплоспоросомами со вздутием на одном конце.
я1, я2 — ядра первичной и вторичной клеток, соответственно. Масштабная линейка: 2 мкм. (По: Fiest et al., 2009; с изменениями).
396
PARAMYXEA
Трофические первичные клетки покрыты только
цитоплазматической мембраной без каких-либо допол-
нительных наружных и внутренних слоев (рис. 283).
Обычно они содержат крупные вакуоли с многочис-
ленными мелкими пузырьками, часть из которых за-
полнена электронно-плотным материалом (Perkins,
1976; Perkins, Wolf, 1976). Эти, так называемые муль-
тивезикулярные тела, предположительно являются
центрами гаплоспорогенеза. В цитоплазме первичных
клеток имеются гаплоспоросомы, обычно палочковид-
ной формы, различающиеся по размерам. Кристы в
митохондриях трубчато-везикулярные, слабо развиты.
Ядро одно, с хорошо заметным ядрышком и грануляр-
ным хроматином. В цитоплазме содержатся многочис-
ленные свободные рибосомы, а также цистерны ЭПР,
различные мелкие пузырьки и крупные электронно-
прозрачные вакуоли. У Marteilia refringens обнаруже-
ны исчерченные, по-видимому, белковые пластинки
длиной 1-5 мкм, которые формируются из электронно-
плотного материала, расположенного между мембра-
нами ЭПР (Grizel et al., 1974).
Строение вторичной клетки меняется в процессе
роста. Исходно это сравнительно небольшая клетка с
крупным ядром и неширокой зоной цитоплазмы вокруг
него. Ядро с большим количеством пор в оболочке де-
спирализованным хроматином и крупным ядрышком
свидетельствует о высокой пролиферативной активно-
сти клетки. В цитоплазме имеются рибосомы, ЭПР и
митохондрия с трубчатыми кристами. Гаплоспоросомы
во вторичных клетках отсутствуют (Fiest et al., 2009).
Когда вторичные клетки достигнут своих макси-
мальных размеров, увеличившись примерно в два раза,
они становятся споронтами, в которых образуются
третичные клетки, или споры. Ядро вторичной клетки
оттесняется при этом на периферию, оно принимает
характерную треугольную форму и содержит преиму-
щественно гетерохроматин (рис. 283).
Споровые клетки (СЗ) иногда образуют неболь-
шие псевдоподиальные выросты. Ядро шаровидное
с многочисленными порами, богато эухроматином.
В цитоплазме присутствуют свободные рибосомы и
каналы ЭПР, а митохондрии на этой стадии развития
паразита не обнаруживаются. Их цитоплазма содержит
большое количество таких же гаплоспоросом, как и в
первичных клетках, но кроме них у Paramarteilia сапс-
eri обнаружены длинные (до 3,5 мкм) гаплоспоросомы
весьма причудливой формы: к одному концу она посте-
пенно заостряется, а на другом образует вздутие (Fiest
et al., 2009) (рис. 3). Внутренняя мембрана так же от-
деляет кортекс от сердцевины, как и у палочковидных
гаплоспоросом, но сердцевина в колбовидном вздутии
гетерогенна и имеет внутреннюю электронно-плотную
субстанцию (рис. 284).
Клетка последней генерации, или спороплазма,
обычно шаровидной или яйцевидной формы содержит
одно бобовидное ядро с конденсированным хромати-
ном и ядрышком (рис. 283). В цитоплазме отмечены
свободные рибосомы и каналы ЭПР. Митохондрия со
слабо развитыми кристами лежит в чашевидном углу-
блении ядра. Гаплоспоросомы в спороплазме отсут-
ствуют. К поверхности ядра примыкают центриоли.
Интересно, что одна из ортогонально расположенных
центриолей «сидит» в небольшом углублении на на-
ружной мембране ядра, а под центриолью с внутрен-
ней стороны ядерной оболочки находится электронно-
плотная пластинка (рис. 284).
Г аплоспоросомы
Эти необычные органеллы заслуживают особого
внимания. В некоторых общебиологических работах
встречается заблуждение, что гаплоспоросомы —
это уникальная особенность гаплоспоридий. Однако
эти, практически, неизученные органеллы найдены
в трех таксонах эукариот: Haplosporidia (см. главу
Haplosporidia), Myxozoa (Kent et al., 2000) и Paramyxea.
Поскольку гаплоспоридии и парамиксиды по моле-
кулярным данным близкородственны, возможно, их
гаплоспоросомы гомологичны друг другу. Однако у
далеко отстоящих миксоспоридий эти органеллы при
внешнем сходстве могут отличаться биохимически и
выполнять различные функции.
Как ни парадоксально, наибольшее морфологиче-
ское разнообразие этих органелл наблюдается у пара-
миксид, а не у гаплоспоридий. Они обнаруживаются
в первичных и третичных клетках, а иногда и в спо-
роплазме. Вторичные клетки их лишены. Гаплоспо-
росомы отличаются морфологически даже на разных
стадиях одного вида. Так, в родоначальной клетке они
вытянуты и больше похожи на трубочки, а в спороплаз-
ме — более широкие и короткие. У представителей
родов Marteilia и Paramarteilia гаплоспоросомы обна-
ружены во внешней споровой клетке, у Paramyxa они,
причем разного размера, присутствуют в спороплазме.
В то же время, спороплазма Paramarteilia canceri их
лишена.
Типичные гаплоспоросомы парамиксид имеют
плотный поверхностный слой и более светлую серд-
цевину, которая ограничена плохо выраженной мем-
браной (рис. 284). Иногда гаплоспоросомы заполнены
однородным электронно-плотным материалом, кото-
рый полностью маскирует внутреннюю мембрану так,
что она не видна. Возможно, это связано с различи-
ями в методах фиксации материала. В большинстве
публикаций по Marteilia refringens внутренняя мем-
брана присутствует (Perkins 1976; Robledo, Figueras,
1995). В клетках М. chungmuensis и Paramyxa para-
doxa гаплоспоросомы заполнены электронно-плотным
материалом, внутренняя мембрана не видна (Comps
et al., 1986; Desportes, 1981), a у Paramarteilia orches-
tiae она четко выявляется (Ginsburger-Vogel, Desportes,
1979). В большинстве клеток Paramyxa nephtys га-
плоспоросомы плотные, только в спороплазме иногда
отмечается ограничивающий сердцевину мембрано-
подобный слой (Larsson, Koie, 2005). При этом сами
органеллы сильно различаются по форме: в первич-
ной клетке гаплоспоросомы трубчатые, диаметром
55-90 нм, в спороплазме они могут быть шаровидные,
80-300 нм, или в форме коротких трубочек, диамет-
ром 70-100 нм.
PARAMYXEA
397
Рис. 284. Ультраструктура гаплоспоросом Paramarteilia canceri (A-В) и строение центриоли (ц) на продольном срезе Marteilia refrin-
gens (Г). На врезке поперечный срез центриоли Marteilia sp. (стрелка указывает на втулку колесовидной структуры).
А — гаплоспоросомы в первичной клетке (стрелками показаны мультивезикулярные тела); Б — палочковидные гаплоспоросомы при большом уве-
личении: видна внутренняя (вм) и наружная мембрана (нм); В — гаплоспоросомы в третичной клетке (СЗ). га — гаплоспоросомы вблизи мультиве-
зикулярных тел, я — ядро; стрелками на рис. Г показана электронно-плотная пластинка под внутренней мембраной ядра. Масштабные линейки: А, В,
Г— 200 нм, Б— 60 нм. (По: Fiest et al., 2009 —A-В; Ginsburger-Vogel, Desportes, 1979 — Г).
398
PARAMYXEA
Наиболее детально строение гаплоспоросом из-
учено у Paramarteilia canceri (Fiest et al., 2009). В ци-
топлазме первичной клетки они довольно много-
численны; зрелые гаплоспоросомы цилиндрической
формы длиной до 280 нм толщиной около 50 нм
(рис. 283, 284). Они распределены по всей цитоплаз-
ме, но тяготеют к мультивезикулярным структурам,
по-видимому, центрам гаплоспорогенеза. На продоль-
ных срезах гаплоспоросом хорошо заметна внутрен-
няя мембрана, которая отделяет сердцевину от кортек-
са (рис. 284). Здесь видно, что внутренняя мембрана
имеет характерную трехслойность, а по толщине со-
ответствует наружной мембране. В третичных клет-
ках у этого вида отмечаются два типа гаплоспоросом:
короткие палочковидные и длинные колбовидные
(рис. 284). Авторы полагают, что морфологическое
разнообразие гаплоспоросом у парамиксид довольно
велико и не может служить таксономическим призна-
ком (Fiest et al., 2009).
Экология и практическое
значение
Все известные парамиксиды являются внутрикле-
точными или тканевыми паразитами морских беспоз-
воночных: полихет, ракообразных и коммерчески важ-
ных моллюсков (устриц). В принципе, они поражают
все ткани и органы, однако характерные стадии споро-
генеза найти проще, поэтому их описывают в первую
очередь. Многоклеточные споры чаще всего находят
в органах пищеварения, особенно, в пищеваритель-
ной железе у полихет и моллюсков, а у ракообразных
в эпителии гонад, где паразиты вызывают образование
хитиновых наростов. Начальные стадии заражения об-
наруживаются в эпителии пальп, жабр и кишечника.
Паразит оказывает заметное влияние на клетки хо-
зяина. Так, Рагатуха paradoxa, паразитируя в кишеч-
ном эпителии личинки полихеты вызывает гипертро-
фию митохондрий и ядер, при этом цитоплазма клетки
хозяина становится менее плотной. В течение послед-
них 30 лет виды Marteilia были основной причиной
гибели огромного числа культивируемых моллюсков в
Европе и Австралии. Например, у французского побе-
режья Атлантики часто поражается популяция устриц
(Ostrea edulis).
Наиболее значимы в практическом отношении
Marteilia refringens и М. sydneyi, вызывающие мартей-
лиоз — заболевание пищеварительной железы, которое
ведет к смерти моллюска. Так, М. refringens вызывает
массовую гибель плоских европейских устриц Ostrea
edulis, а М. sydneyi поражает австралийских устриц
Saccostrea glomerata. Начиная с 1968 года М. refringens
наносит серьезный ущерб Европейским хозяйствам по
выращиванию О. edulis. Инфекция вызывает истоще-
ние моллюска, обесцвечивание пищеварительной же-
лезы, остановку роста, некроз тканей и смерть.
Диагностика заболевания осуществляется самыми
различными методами: импринтинг (окраска мазков) с
разных тканей, гистология эпителия пищеварительно-
го тракта, просвечивающая электронная микроскопия,
использование моноклональных антител, специфич-
ных праймеров для ПЦР, FISH-гибридизация.
Естественным хозяином для Marteilia refringens
долгое время считался только один вид двухстворча-
тых моллюсков Ostrea edulis (Grizel et al., 1974). Другие
моллюски: Mytilus galloprovincialis и M. edulis, обитаю-
щие от Атлантического побережья Испании и Франции
до Средиземного и Адриатического морей, в Чёрном и
Белом морях, а также на Дальнем Востоке, инфициру-
ются представителями другого вида Marteilia maurini.
Сейчас известно, что вид М. maurini конспецифичен
М. refringens (Lopez-Flores et al., 2004, Novoa et al.,
2005), таким образом, природный резервуар для М. re-
fringens огромен.
М. sydneyi поражает, возможно, и Saccostrea echi-
nata. М. lengehi паразитирует в Saccostrea cucullata,
обитающей в Персидском заливе и у западного побе-
режья Австралии. М. christenseni обнаружена в Scro-
bicularia plana во Франции. М. chungmuensis также
наносит существенный урон, поражая репродуктив-
ную систему тихоокеанских устриц Crassostrea gigas.
Подобные мартейлии (не определенные до вида) пара-
зиты найдены в моллюсках, обитающих в самых уда-
ленных точках земного шара (США, Фиджи, Тайланд,
Австралия).
Из других видов парамиксид потенциальную опас-
ность для промысла крабов представляет недавно из-
ученный вид Paramarteilia canceri, обнаруженный в
европейском съедобном крабе Cancer pagurus (Fiest et
al., 2009).
Систематика и филогения
Систематическое положение Paramyxea было пред-
метом постоянных дискуссий. Их помещали в Chytrid-
iomycota, в Microsporidia, относили к низшим грибам,
Myxozoa и (вместе с Haplospora) в тип Ascetospora
(Sprague, 1982). В типе Ascetospora Sprague 1979 они
распределялись по двум классам: класс Stellatosporea
включал два рода — Marteilia и Paramarteilia, а род Ра-
гатуха относился к классу Paramyxea Levine et Sprague
1979. В дальнейшем, на основании единообразия уль-
тратонкого строения и спорогонии путем внутренне-
го почкования этих паразитов все-таки объединили в
классе Paramyxea (Desportes, 1981). Позднее, по пере-
численным морфологическим признакам было пред-
ложено выделить класс в отдельный тип (Desportes,
Perkins, 1990).
Первые филограммы, построенные по гену рРНК
малой субъединицы рибосом Marteilia refringens пока-
зали, что парамиксиды не связаны близко ни с одним
типом эукариот, включая Haplosporidia (Berthe et al.,
2000; Burresson, Ford, 2004), что подтверждало обосо-
бленность этой группы протистов.
Таким образом, первые молекулярные данные со-
гласуются с цитологическими характеристиками пара-
миксид, демонстрируя изолированность этой группы
и придание ей ранга типа (Berthe et al., 2000). В более
PARAMYXEA
399
общих работах по молекулярной филогении эукариот
(Cavalier-Smith, Chao, 2003) гаплоспоридий и парамик-
сиды попадают в кластер Cercozoa. Поэтому предлага-
ется объединить два отряда Haplosporida и Paramyxida
в одном классе Ascetosporea (см. обсуждение этого
вопроса в главе Haplosporidia). Других работ по моле-
кулярной филогении парамиксид нет, поэтому в более
поздних публикациях авторы принимают классифика-
цию Т. Кавалье-Смита и Э. Чао (Fiest et al., 2009). Одна-
ко парамиксиды дают слишком длинную ветвь в преде-
лах Ascetosporea, поэтому нельзя исключить известный
артефакт LBA, в соответствии с которым парамиксиды
могут располагаться в другом месте филогенетиче-
ского древа. Следует учесть, что морфологически их
объединяет наличие гаплоспоросом. Другие признаки
существенно отличаются. У парамиксид нет клеточной
стенки, способ формирования споры уникален среди
протистов, они имеют настоящие центриоли, которых
лишены гаплоспоридий. Поэтому в пределах этой гла-
вы созраняется класс Рагатухеа с неопределенными
филогенетическими связями.
Систематика парамиксид недавно претерпела пе-
риод отклонения от использования традиционных
признаков и введения новых. Буквально два года на-
зад было предложено упорядочить принципы класси-
фикации и провести ревизию двух родов парамиксид,
установленных по новым критериям (Fiest et al., 2009).
Здесь мы приведем основные предложения, выдвину-
тые авторами этой работы.
При описании Marteilioides и Paramyxoides авто-
ры использовали такие признаки, как количество вто-
ричных клеток и форму гаплоспоросом (Comps et al.,
1986; Larsson, Koie, 2005). Традиционно же разделение
на три рода Paramyxa, Marteilia, Paramarteilia произ-
водили по количеству клеток в споре. Поэтому было
предложено (Fiest et al., 2009) использовать в качестве
признаков рода количество клеток в споре: двуклеточ-
ные споры (Paramarteilia), трехклеточные (Marteilia) и
четырехклеточные (Paramyxa) (рис. 282). Деление на
виды внутри рода предлагается проводить по количе-
ству вторичных клеток внутри первичной, а также чис-
лу спор во вторичных клетках. Другими признаками
видов могут быть также морфология самих спор, нали-
чие придатков, ну и, конечно, молекулярная филогения,
которая позволяет оценить генетическое разнообразие
в пределах морфовидов.
В практическом отношении авторы предлагают
упразднить род Marteilioides и перенести его типовой
вид М. chungmuensis в род Marteilia, а вид Marteilioi-
des branchialis в род Paramarteilia. Сходным образом
упраздняется род Paramyxoides, поскольку описанные
в нем гаплоспоросомы отнюдь не уникальны, а по ко-
личеству клеток в споре, его типовой вид Paramyxoides
nephtys переносится в род Paramyxa.
По-видимому, позицию авторов следует при-
нять, — это не просто возврат к пройденному, а следо-
вание строгим критериям оценки признаков на уровне
родов и видов. Действительно, введение новых при-
знаков в этой группе неоправданно, оно лишь вносит
путаницу в проверенные временем принципы класси-
фикации и провоцирует исследователей к созданию не-
существенных таксономических критериев.
Поэтому в главе систематический обзор мы будем
основываться на традиционных признаках парамиксид,
которые были соотнесены с соответствующим рангом
таксона в цитируемой статье (Fiest et al., 2009).
Систематический обзор
Класс Рагатухеа Chatton 1911
Отряд Paramyxida Chatton 1911
Спорообразование идет путем внутреннего поч-
кования в исходной амебоидной клетке, которая раз-
вивается из споры в тканях морских беспозвоночных
животных, и характеризуется тем, что сформирован-
ные зародыши остаются внутри материнской клетки.
Споры состоят из нескольких вложенных друг в друга
клеток.
Род Paramyxa Chatton 1911
Споры четырехклеточные. Паразиты полихет.
Типовой ви д: Р. paradoxa Chatton 1911.
Р. paradoxa Chatton 1911
Родоначальная клетка дает 4 вторичные клетки, со-
держащие по 4 споры.
Хозяева: полихеты.
Локализация: кишечный эпителий.
Р. nephtys (Larsson et Koie) Fiest et al. 2009
(= Paramyxoides nephtys Larsson et Koie 2005)
Родоначальная клетка дает 2-4 вторичные клетки,
содержащие по 4 веретеновидные четырехклеточные
споры с гладкой клеточной стенкой. Каждая спора раз-
мером около 10 мкм находится в собственном мешке,
который формирует внешняя споровая клетка (СЗ);
спора с полярными придатками длиной до 13,3 мкм.
Гаплоспоросомы трех типов присутствуют в клетках 1,
4, и 5.
Хозяин: полихета Nephtys саеса.
Локализация: кишечный эпителий.
Род Marteilia Grizel, Comps, Bonami,
Cosserans, Duthoit et Le Pennec 1974
При спорогонии каждая вторичная клетка дает раз-
ное число третичных клеток (спор), которые всегда
трехклеточны. Паразиты моллюсков.
Типовой в и д: refringens Grizel, Comps, Bona-
mi, Cosserans, Duthoit et Le Pennec 1974.
M. refringens Grizel, Comps, Bonami, Cosserans,
Duthoit et Le Pennec 1974
Родоначальная клетка дает 8 вторичных клеток, со-
держащих по 4 споры.
400
PARAMYXEA
Хозяева: вызывает летальную инфекцию Ostrea
edulis. способна заражать Mytilus edulis и М. gallopro-
vincialis.
Локализация: преспоруляция (формирование
вторичных клеток) идет в эпителии пальп, желудка, ки-
шечного тракта и, возможно, жабр. Спорогенез в эпи-
телии пищеварительной железы.
М. sydneyi Perkins et Wolf 1976
Родоначальная клетка дает 16 вторичных клеток,
содержащих по 2 споры.
Хозяева: Saccostrea glomerata (= commercialis) и,
возможно, Saccostrea echinata.
Локализация: начальные стадии заражения в
эпителии пальп и жабр, преспоруляция в соединитель-
ной ткани кишечника, спорогенез в эпителии пищева-
рительной железы.
М. christenseni Comps 1983
Хозяин: двухстворчатый моллюск Scrobicularia
plana.
Локализация: пищеварительная железа.
М. lengehi Comps 1976
Хозяин: устрица Saccostrea cucullata.
Локализация: пищеварительная железа.
М. chungmuensis (Comps et al.) Fiest 2009
(= Marteilioides chungmuensis Comps et al. 1986)
Родоначальная клетка дает 3 вторичные клетки, со-
держащие по 1 споре.
Хозяин: тихоокеанская устрица Crassostrea gigas.
Локализация: яичники.
Род Paramarteilia Ginsburger-Vogel
et Desportes 1979
Споры двуклеточные. Паразиты ракообразных
Типовой вид:/! orchestiae Ginsburger-Vogel et
Desportes 1979.
P. orchestiae Ginsburger-Vogel et Desportes
1979
Родоначальная клетка дает до 10 вторичных клеток,
содержащих по 2 споры.
Хозяин: амфипода Orchestia gammarellus.
Локализация: семенники и яичники. Вызывает
хитиновые наросты под эпидермисом.
Р. branchialis (Andersen et Lester) Fiest et al. 2009
(= Marteilioides branchialis Andersen
et Lester 1992)
Родоначальная клетка дает 2-6 вторичных клеток,
содержащих по 1 споре.
Хозяин: Saccostrea glomerata.
Локализация: начальные этапы заражения об-
наружены в жабрах, спорогония идет в пищеваритель-
ной железе.
Р. canceri Fiest et al. 2009
Родоначальная клетка дает 3 вторичные клетки, со-
держащие по 2 споры.
Хозяин: краб Cancer pagurus.
Локализация: системное заражение; поража-
ются, практически, все органы и ткани — гепатопан-
креас, жабры, сердце, скелетная мускулатура, гонады,
гемоциты и т.д.
SUMMARY
The general characteristics, brief history of study, classifica-
tion, morphology, ecology, practical importance, phylogeny and the
description of 10 known species have been reviewed. Reviews by
Desportes and Perkins (1990), Berthe et al. (2000), Feist et al. (2009)
along with other papers have been used to compile this chapter. The
Paramyxea is regarded here as a monophyletic taxon with unclear af-
finities. There are three described genera: Рагатуха with 2 species,
Marteilia with 5 species and Paramarteilia with 3 species.
ЛИТЕРАТУРА
Anderson T., Lester R.J.G. 1992. Sporulation of Marteilioides bran-
chialis n. sp. (Paramyxea) in the Sydney rock oyster, Saccostrea commercia-
lis'. an electron microscope study // J. Protozool. Vol. 39. P. 502-508.
Audemard C., Le Roux F., Barnaud A., Collins C., Sautour B., Sau-
rian P.-G., De Montadouin X., Coustau C., Combes C., Berthe F. 2002.
Needle in a haystack. Involvement of the copepod Paracartia grani in the life
cycle of the oyster pathogen Marteilia refringens II Parasitology. Vol. 124.
P. 315-323.
Berthe F.C.J., Le Roux F., Peyretaillade E., Peyret P., Rodriguez D.,
Gouy M., Vivares C.P. 2000. Phylogenetic analysis of the small subunit
ribosomal RNA of Marteilia refringens validates the existence of phylum
Paramyxea (Desportes and Perkins, 1989) // J. Euk. Microbiol. Vol. 47.
P. 288-293.
Burreson E.M., Ford S.E. 2004. A review of recent information on
the Haplosporidia, with special reference to Haplosporidium nelsoni (MSX
disease) //Aquat. Living Resour. Vol. 17. P. 499-517.
Cavalier-Smith T., Chao E.E.-Y. 2003. Phylogeny and classification of
phylum Cercozoa (Protozoa) // Protist. Vol. 154. P. 341-358.
Chatton E. 1911. Sur une Cnidosporidie sans cnidoblaste (Рагатуха
paradoxa, n. g., n. sp.) // C. R. Acad. Sci. Paris. Vol. 152. P. 631-633.
Comps M., Park M.S., Desportes I. 1986. Etude ultrastructurale de
Marteilioides chungmuensis n. g., n. sp., parasite des ovocytes de 1’Huitre
Crassostrea gigas Th. 11 Protistologica. Vol. 22. P. 279-285.
Desportes I. 1981. Etude ultrastructurale de la sporulation de Рагатуха
paradoxa Chatton (Paramyxida) parasite de 1’Annelide Polychete Poecilo-
chaetus serpens 11 Protistologica. Vol. 17. P. 365-386.
Desportes I. 1984. The Paramyxea Levine, 1979: An original example
of evolution towards multicellularity // Orig. Life. Vol. 13. P. 343-352.
Desportes I., Perkins F. 1990. Phylum Paramyxea // Margulis L., Corl-
iss J.O., Melkonian M., Chapman D.J. (eds). Handbook of Protoctista. Jones
and Bartlett Publishers, Boston. P. 30-35.
Desportes L, Ginsburger-Vogel T. 1977. Ultrastructure du centriole de
Marteilia sp., protiste parasite d’Orchestia gammarellus (Pallus) (Crustacea,
Amphipod) // Protistologica. Vol. 13. P. 607-610.
Feist S.W., Hine P.M., Bateman K.S., Stentiford G.D., Longshaw M.
2009. Paramarteilia canceri sp. n. (Cercozoa) in the European edible crab
PARAMYXEA
401
(Cancer pagurus) with a proposal for the revision of the order Paramyxida
Chatton, 1911 // Folia Parasitologica. Vol. 56. P. 73-85.
Ginsburger-Vogel T., Desportes I. 1979. Etude ultrastructurale de la
sporulation de Paramarteilia orchestiae gen. n., sp. n., parasite de 1’Amphi-
pode Orchestia gammarellus (Pallas) // J. Protozool. Vol. 26. P. 390-403.
Grizel H., Comps M., Bonami J.R., Cousserans F., Duthoit J.L., Le
Pennec M.A. 1974. Recherche sur 1’agent de la maladie de la glande diges-
tive de Ostrea edulis Linne // Sci. Peche. Vol. 240. P. 7-30.
Itoh N., Komiyama H., Ueki N., Ogawa K. 2004. Early developmen-
tal stages of a protozoan parasite, Marteilioides chungmuensis (Рагатухеа),
the causative agent of the ovary enlargement disease in the Pacific oyster,
Crassostrea gigas 11 Int. J. Parasitol. Vol. 34. P. 1129-1135.
Kent M.L., Moser M., Marques A., Lorn J. 2000. Phylum Myxozoa //
Lee J.J., Leedale G.F., Bradbury P. (eds) The Illustrated Guide to the Proto-
zoa, Society of Protozoologists, Lawrence Kansas. P. 127-148.
Larsson J.I.R., Koie M. 2005. Ultrastructural study and description of
Paramyxoides nephtys gen. n., sp. n. a parasite of Nephtys caeca (Fabricius,
1780) (Polychaeta: Nephtyidae) H Acta Protozool. Vol. 44. P. 175-187.
Lopez-Flores L, de la Herran R., Garrido-Ramos M.A., Navas J.I.,
Ruiz-Rejon C., Ruiz-Rejon M. 2004. The molecular diagnosis of Marteilia
refringens and differentiation between Marteilia strains infecting oysters and
mussels based on the rDNA IGS sequence // Parasitology. Vol. 129. P. 411—
419.
Novoa B., Posada D., Figueras A. 2005. Polymorphins in the sequenc-
es of Marteilia internal transcribe spacer region of the ribosomal RNA genes
(ITS-1) in Spain: genetic types are not related with bivalve hosts // J. Fish Dis.
Vol. 28. P. 331-338.
Perkins F. 1976. Ultrastructure of sporulation in the European flat oys-
ter pathogen Marteilia refringens — taxonomic implications // J. Protozool.
Vol. 23. P. 64-74.
Perkins F., Wolf P.H. 1976. Fine structure of Marteilia sydneyi
sp. n. — haplosporidian pathogen of Australian oysters // J. Parasitol. Vol. 62.
P. 528-538.
Reece K.S., Siddall M.E., Stokes N.A., Burreson E.M. 2004. Molecu-
lar phylogeny of the Haplosporidia based on two independent gene sequen-
ces // J. Parasitol. Vol. 90. P. 1111-1122.
Robledo J.A.F., Figueras A. 1995. The effects of culture-site, depth,
season, and stock source on the prevalence of Marteilia refringens in cultured
mussels (Mytilus galloprovincialis Lmk.) from Galicia, Spain // J. Parasitol.
Vol. 81. P. 354-363.
Sprague V. 1982. Ascetospora // Parker S.P. (ed.) Synopsis and classifi-
cationof living organisms. Vol. 1. McGraw-Hill Book Co., N.Y. P. 599-601.
THAUMATOMONADIDA (Shirkina) Karpov 1990
Гетероконтные бесцветные жгутиконосцы размером
8-50 мкм, слегка уплощенные дорсовентрально, часто с борозд-
кой на вентральной поверхности клетки, из которой образуются
псевдоподии. Тело клетки покрыто мелкими кремнеземными че-
шуйками, которые синтезируются на поверхности митохондрий,
имеющих пузырьковидные кристы. Экструсомы представлены
кинетоцистами. Жгутики выходят из углубления на переднем
конце клетки; ядро прилегает к основанию жгутиков. Сократи-
тельные вакуоли обычно лежат по обе стороны от жгутикового
кармана. Передвигаются при помощи жгутиков, обычно ползая
по субстрату. Способны формировать плазмодии путем слияния
клеток. При неблагоприятных условиях образуют цисты.
Обитают в бентосе морских и пресных вод, а также в почве.
Широко распространены в природе.
История изучения
Отряд Thaumatomonadida был образован сравни-
тельно недавно (Ширкина, 1987) на основании изуче-
ния жизненного цикла и светооптических наблюдений
одного из представителей — Thaumatomonas lauterborni
(рис. 285). Однако отдельные виды и роды, объединен-
ные затем в отряд, известны с конца XIX — начала XX
века (Lauterborn, 1899; Sandon, 1927; Saedeleer, 1931).
В разное время к тауматомонадам относили различные
организмы. В зарубежной литературе тауматомонад
помещают в семейство Thaumatomastigidae (Patterson,
Zolffel, 1991), не принимая во внимание наличие дру-
гого названия семейства Thaumatomonadidae Hollande,
1952, которое обычно использовали зоологи (Жуков,
1971). Названия этих семейств определяются их ти-
повыми родами: представители рода Thaumatomonas
чаще с коротким передним жгутиком покрыты одним
слоем соматических чешуек, a Thaumatomastix обычно
с длинным передним жгутиком и с дополнительным
наружным слоем соматических чешуек с длинным ши-
пом. Такие чешуйки видны в световой микроскоп и на-
зываются спикулами. Исследования ультраструктуры
представителей рода Thaumatomonas (Карпов, Жуков,
1987; Карпов, 1987,1993; Vickerman, 1988; Vickermanet
al., 1991) привели к ревизии отряда Thaumatomonadida,
в результате которой был изменен его диагноз и опре-
делен объем (Карпов, 1990а). До молекулярно-генети-
ческих исследований филогенетические связи этого
Рис. 285. Трофическая форма Thaumatomonas lauterborni с вет-
вящимися псевдоподиями.
гр — гранулы по краям вентральной бороздки, зж — длинный задний
жгутик, пж — короткий передний жгутик, пс — псевдоподии, св — со-
кратительные вакуоли, я — ядро. (По: Saedeleer, 1931).
таксона были неясны. В настоящее время сиквенсы
гена 18S рРНК его представителей локализуются на
молекулярно-филогенетических схемах (МФС) среди
Cercozoa (Wylezich et al., 2007; Howe et al., 2011; Ota et
al., in press) (рис. 286).
Классификация
Примерно 20 лет назад отряд тауматомонад объ-
единял от трех до восьми родов: Bodopsis Lemmermann
1914, Gyromitus Skuja 1939, Hyaloselene Skuja 1956,
Protaspis Skuja 1939, Rhizaspis Skuja 1948, Synoikomo-
nas Skuja 1969, Thaumatomastix Lauterborn 1899 и Thau-
matomonas De Saedeleer 1931 (Карпов, 1990a; Patterson,
Zolffel, 1991), отличающихся друг от друга размерами и
THAUMATOMONADIDA
403
14/0.47
2/0.45
1 Paulinella chr
— ENV: marine sediment 7-1 4: AY620334 I KJnvp| г|яг1 л О /ОППД \
ENV: marine sediment 7-1.3:AY620333 I INOVel CiaOe О
------ENV: marine sediment 7-6.6; AJ620336
— Trachetocorythion pulchetlum AJ418789
Assullna muscorum AJ418791
— Euglypha filifera AJ418786
'Tnnema enchelys AJ418792
Euglyphida
ENV: freshwater/sediment 13-1.8 AJ620296
। Auranticordis quadnverberis EU484394 I
Pseudopirsonia mucosa AJ561116 I
— ENV: marine sediment 7-5.4: AY620332 I Marimonadlda
ENV: marine surf water 12-4.1: AJ620337 I ,V,C“ " ’
ENV: marine surf water 12-4.3: AY620359 I
—Clautnavia biflagellata FJ919772
__j ENV: marine surf water C1: AJ620329 I KI л vol
"1 ....... ................... ENV: manne surf water C5: AJ620331 I INOVOI
clade 2
(2004)
IMBRICATEA
2/0.29
55/.
0.43
52/
0.49
39/0.95
50/0.81
77/0.98
•NudtfUa products HQ121434
Thaumatomonas oxoniensis Hinksev HQ12142B
Thaumatomonas Vancouver! 3108W2 AF411264
Thaumatomonas sp. ATCC 50250 AF411261
Thaumatomonas seravini ATCC 50636 type strain T-2 AF411259
Thaumatomonas sp. SA2 AF411260
Thaumatomonas sp SA1AF411263
Alias aff. diplophysa ATCC 50365 AF411262
... ENV-marine sediment A15 AY620317
Reckertia filosa AY268040
..... Manne cercozoan 5b FJ410916
Peregrinia clavideferens OQ211593 <
— ENV-manne sediment 9-2.4 AY620311
—4.....'Spongomonas minima' UT1 AF411281 I
Ф ------------ Г*- Spongomonas solrtaria HQ121435 I SDOnOOmOnadlda
1----------Spongomonas sp. KV/DB AJ620252 I H a
..- ENV. marine sediment D6: AY620316
1 Dlscomonas retusa FJ824131
85/
10.50
Thaumato-
monadidae
Thaumato-
monadida
Peregriniidae
I Novel clade 4 (minus 9-2.2) (2004)
—— ENV: marine sediment 7-6.2: AY620348
ENV: marine sediment 9-1.4: AY620314
r—* Rhogostoma schuessleri HQ121430 .
r Rhogostoma minus CCAP1966/4 HQ121431 I
— _ Г1 ' Rhogostomaminus CCAP1966/3 AJ5148671
I—^Rhogostoma sp. DB-2002 HQ121437 I КПIZ3Spid 1036
4 ^Rhogostoma m/cra HQ121436 I
1 ENV: soil Amb-18S-1491: EF024013 I
Cryothecomonas aestivalis 1 AF290539
ENV- manne sediment 7-2.1: AY620354
Cryomonad ida
M
о
N
A
D
О
F
I
L
О
S
A
•Protaspa longipes AF290540
'•Protaspa grandis DQ303924
Protaspa obliqua FJ824121
ENV: marine sediment A14. AY620321
——"" ENV 0.5 m freshwater column F9: AY620281
Botuliforma benthlca FJ824126
ENV manne sediment 7-4.3: AY620356 ...
Ebna tripartita DQ303922 ЕЬПЮЭ . r-.
' ydifflugia ct. gracilis AJ418794 | SCtOTlIOSlda
Aulacantha scotymantha AY266294 I _., ,
^Aulosphaara trigonopa AY266292 Phaeodaria
......... I, «М . । Coelodendrum ramosissimum AY266294
y— Ventnfissura foliifbrmis FJ824128 zx2
“TA|———Venlrifissura artocarpotdea FJ824127 I x/ . . . r.‘ .
I .......... ENV manne sediment 7-5.5: AY620347 I VentriCleTtlOa
....... Verrucomonas longifila FJ824130 I
• — ENV: 0.5 m freshwater column F6: AY620288
...... ENV: 0.5 m freshwater column F5; AY620287
4 .................................... ENV: marine sediment 9-2.2; AY620308
* Allapsa vibrans AF411265
.... ENV: soil Amb-18S-949: EF023686
। Teretomonas rotunda AY620256
Neoheteromita tolerans HQ121433
- ENV- uncultured soil glissomonad AH4878118t19: EU709217
Neoheteromita globosa 042447
Sandona ubiquita ЕЦ709153
1 1 Proieptomonas faecrcoia AF411275
Bodomorpha minima AF411276
.......... ENV- soil HetChi9: EU709276
' ENV: leafy freshwater sediment PP1-14: AY620290
Aurigamonas soils DQ199661 I
I Agitatidae | Pansomonadida
। । ENV: marine sediment 7-3.4: AY620361
-/0.40
Protaspidae
Ebriida
| Ventricleftida
THECOFILOSEA
-/0.98
Glissomonadida
60/0.90
0.58
76/0.93
52/,
0.83
SARCO
38/
0.50
39/
0.95
39/
0.93
15/0.70
83/1.00
Г80]_
63/0.99 --------------- —---------
Cercomonas braziltensis FJ790702
Cercomonas longicauda FJ790068
Cavemomonas mica FJ790718
Cavemomonas stercoris FJ790717
Cercomonas radiate FJ790712
Paracercomonas virgana AY884340
Paracercomonas tenuis AF534712
i— Paracercomonas sp. Panama83 FJ790737
I— Paracercomonas baikallHQttUAO
Paracercomonas anaerobica AF411272 . . . ...
Metopuda
non aff. ftuens AF411278 ——————
-^ENVMrarinesurf vrater^XS: AY620358 | Novel clade 6 (2004)
wtexAY620255 1 Metromonadida
Cercomonadida
I । ENV. manne sediment nh 13: EU567296
I» ENV freshwater sediment 13-4.8- AY620301
L-ENV. marine sediment E13: EU567253
r ENV freshwater sediment: Ib28 EU567252
— Uncultured eukaryote HAVOmat-euk24 EF032802 I
...............ENV: freshwater sediment: Ib19 EU567207 |_
I........ Hedriocystis reticulata AY305010 I иеЗПТОТПОГаСЮа
w » — Clathrulina elegans AY305009 I
ENV. freshwater sedime Qp23 EU567215 I Novel clade Gran-4
ENV: brackish sediment 12-1 3: AY620364 I Novel clades Gran-2 & 3
j ........ ENV: marine sediment 7-1.5: AY620344 I Мл,,л| 4
1 ENV. marine sediment eb6: EU567231 I NOVBl 01306 СэГОП- I
------------— Nanofilidae
Mesoftlidae \
Novel clade
Gran-6
n Nanofila manna AF289081
ENV: anaerobic freshwater sediment DB-2703-11: EU567236 —
— Masofila limnetica AF411283 "
r— ENV: marine sediment. he2 EU567248
'—ENV: manne sediment fp23: EU567249
•Massisteria marina AF411286
........... ENV: marine sediment 7-2.6: AY620343
............. "u Minimassisteria diva EF405665
....... ENV: anoxic saline lake sediment NAMAKO-18 AB252758
— ENV: anaerobic freshwater sediment DB-2703-10: EU567238
Limnofila angllca EU567255
Limnofila oxoniensis EU567256
— Limnofila longa EO567254
40/0.59
81/0.98
MONADEA
I METROMONADEA
I includes Micrometopion nu
nutans
Novel clade 5 (2004); Gran-5 (2009a)
| Massisteridae, Leucodictyida
| Limnofilida
........................ ENV coastal marine water UEPACLp3: DQ369015
ENV: arctic marine water column NW617.36: DQ314819
Chtorarachnion reptans U03477
..—Mlcrometopion nutans HQ121441
^^B^tf&M?4S?^EW5672e7|Tremulida (Novel Clade 11; Bass et al. 2009)
ENV: freshwater sediment: IbB EO567286
ENV: anaerobic freshwater sediment DB-2703-19: EU567290
—— ENV: anaerobic freshwater sediment DB-2305-21; EU567288
ENV: anoxic saline lake sediment NAMAKO-20 AB252760
_— ENV- freshwater column LG21-O1: AY919754
। ................ ENV: uncultured freshwater picople ‘ '
— "" ENV: anaerobic freshwater sediment DB-2703
tumca EU567292
GRANOFILOSEA
|CHLORARACHNEA
| Novel Clade 12 (Bass et al. 2009)
)зазк¥и^б5728АзУ642739 1 Nove* Clade 10 (Bass et al. 2009)
i- — Arachnuia impatiens EU567294
>Spongospora subterranea f. sp. nasturtii AF310901
Phagomyxa odontettae AF310904
———— Filoreta marina AY268044
Gromia oviformis AJ457814
—— Gromia oviformis AJ457812
• — chaunacanthtd sp.218 AF018158
symphacanthid 211 AF063242
' Acanthometra sp AF063240
Sticholonche sp. AY268045
' .................... Spongaster tetras AB101542
ENDOMYXA
Radiozoan outgroup
Рис. 286. Место тауматомонад на молекулярно-филогенетическом древе Cercozoa, построенном по сиквенсам гена 18S рРНК.
(По: Howe et al., 2011).
404
THAUMATOMONADIDA
Рис. 287. Внешний вид представителей тауматомонад.
А — Thaumatomastix setifera, Б — Thaumatomastix tripus, В — Reckertia platyformis, Г— Thaumatomastix salina, Д — Reckertia thomseni, E — Gyromitus
disomatus,)K— Thaumatomonas godboldi, 3 — Reckertia sagittifera, И— Hyaloselene compressa. (По разным авторам).
THAUMATOMONADIDA
405
Таблица 9
Распределение чешуек на поверхности клетки и жгутиков у всех описанных видов Thaumatomastix
(по разным авторам)
Вид Соматические чешуйки Жгутиковые чешуйки Количество жгутиков
плоские спикулы
Т. dybsoeana + — + 1
Т. formosa + — + 2
Т. fragilis + — + 2
Т. fusiformis + — + 2
Т. groenlandica + — + 2?
Т. igloolika + — + 2
Т. nigeriensis + — ? 2
Т. punctata + — — ?
Т. spinosa + — + 2
Т. splendida + — + 2
Т. thomseni + — + 1
Т. bipartita + + — 1
Т. sagittifera + + + 2
Т. salina + + + 2
Т. setifera ? + ? 2
Т. tauryanini + + — 0
Т. tripus + + ? 2
Примечание. + — присутствуют,-----отсутствуют, ? — данные отсутствуют или сомнительны, 0-2 — число жгутиков. Полужирным шрифтом
выделены виды, перенесенные в род Reckertia в работе Howe et al. (2011).
формой тела клетки, длиной жгутиков (рис. 287), а так-
же структурой чешуек. Для Gyromitus и Thaumatomastix
характерны плавающие клетки, остальные представле-
ны ползающими организмами.
Позднее название рода Synoikomonas было призна-
но не валидным, а его виды включены в состав рода
Hyaloselene, поскольку представители Synoikomonas
отличались только по наличию пластид (которые, ско-
рее всего, принадлежали заглоченным пищевым объ-
ектам) и по неспособности формировать псевдоподии
(Patterson et al., 2001). Авторы указанной статьи пред-
положили, что Allas тоже близок тауматомонадам, и
это действительно было подтверждено данными моле-
кулярной филогении по гену 18S рРНК (Cavalier-Smith,
Chao, 2003).
Protaspis1 был переведен из тауматомонад в церко-
монады на том основании, что не имеет жгутикового
кармана, от кинетосом отходит характерный для цер-
комонад конус микротрубочек, и, по-видимому, лишен
чешуек (Mylnikov, Karpov, 2004). Исследования уль-
траструктуры Р grandis действительно показали от-
сутствие соматических чешуек, а на основании моле-
кулярной филогении было установлено, что он входит
в состав криомонад (Hoppenrath, Leander, 2006).
Типовой вид рода Bodopsis (Klebs 1892) Lemmer-
mann 1914 — В, alternans (Klebs) Lemmermann 1914
совсем не похож на тауматомонаду: это гетеротрофные
плавающие жгутиконосцы удлиненно-цилиндричекой
формы; жгутики в 2 раза длиннее тела, при этом руле-
1 Имя этого рода невалидно по зоологической номенклатуре, т.к.
ранее им была названа девонская рыба (Protaspis Bryant 1933). В свя-
зи с этим обстоятельством имя рода жгутиконосцев было изменено на
Protaspa Cavalier-Smith (Howe et al., 2011). — Прим. авт.
вой жгутик спирально закручивается вокруг клетки во
время ее движения; ядро расположено в задней части
клетки. Морские. Время от времени клетки формиру-
ют псевдоподии, выходящие из переднего углубления,
которое, в отличие от Thaumatomonas, не окружено гра-
нулами.
Позднее описанные виды В. godboldi Lackey 1933
и В. platyformis Lackey 1940 имеют ядро в передней
части клетки, что характерно для всех тауматомонад.
Поскольку у типового вида Bodopsis ядро не связано с
кинетосомами, то их клетки должны иметь совершенно
другой скелет. Кроме того, они не изучены в электрон-
ный микроскоп, поэтому неизвестно, покрыты ли клет-
ки чешуйками. Таким образом, кардинальные отличия
в строении клетки В. alternans от других тауматомонад
позволяют считать, что: 1) этот вид, и, следователь-
но, род Bodopsis Lemmermann не является тауматомо-
надой; 2) В. godboldi и В. platyformis не относятся к
роду Bodopsis по строению и особенностям движения.
В рамках этой главы вид В. godboldi предварительно
отнесен к роду Thaumatomonas, а В. platyformis — к
Reckertia.
Род Thaumatomonas отличали от Thaumatomastix
по нескольким, прямо скажем, нечетким признакам.
Считалось, что у представителей первого рода корот-
кий передний жгутик без чешуек, а у второго — оба
жгутика длинные, передний из которых покрыт чешуй-
ками. Однако многие виды рода Thaumatomastix так-
же обладают коротким передним жгутиком, который
не всегда покрыт чешуйками. Вторая группа призна-
ков связана с соматическими чешуйками. Тело клетки
Thaumatomastix в отличие от Thaumatomonas покры-
то игловидными чешуйками, или спикулами, которые
406
THAUMATOMONADIDA
Рис. 288. Схема строения клетки Gyromitus Птах.
Врезки: вверху слева — его соматические чешуйки; внизу справа — че-
шуйки G. disomatus. (По: Swale, Belcher, 1975).
видны в световой микроскоп (Beech, Moestrup, 1986).
Однако не все виды Thaumatomastix несут игловид-
ные чешуйки, или спикулы, и часто покрыты не дву-
мя, а одним слоем плоских чешуек, похожих по фор-
ме на таковые Thaumatomonas (Thomsen et al., 1995).
Виды Thaumatomonas известны из пресных вод, тогда
как представители Thaumatomastix обитают преиму-
щественно в солоноватоводных и морских бассейнах
(Thomsen, Ikavalko, 1997).
Ультраструктура жгутиконосца неопределенного
систематического положения Reckertia sagittifera была
изучена Мёструпом (Moestrup, 1982; Beech, Moestrup,
1986), и после детального сравнения с представите-
лями рода Thaumatomastix авторы признали, что их
организм следует включить в состав этого рода как
Thaumatomastix sagittifera, поскольку у него на перед-
нем жгутике есть чешуйки, а тело клетки покрыто
слоем плоских соматических чешуек (Beech, Moestrup,
1986). Внутреннее строение клетки также соответ-
ствует структуре клетки тауматомонад. Хов с соав-
торами (Howe et al., 2011) возродили название рода
Reckertia на том основании, что Reckertia sagittifera
не несет характерных для Thaumatomastix игловидных
чешуек и у нее не наблюдали образование псевдопо-
дий из вентральной бороздки. Кроме того, на МФС по
18S рРНК Reckertia filosa не группируется с предста-
вителем Thaumatomastix, несущим игловидные чешуй-
ки. Поэтому все виды Thaumatomastix без игловидных
чешуек были перенесены в род Reckertia (Howe et al.,
2011). В таблице 9 эти виды выделены полужирным
шрифтом. С нашей точки зрения, идея восстановления
рода Reckertia выглядит вполне логичной, посколь-
ку признак наличие/отсутствие игловидных чешуек
(спикул) вполне весомый признак рода. Кроме того, и
молекулярно-филогенетические схемы подтверждают
такое разделение. В связи с этим обстоятельством, к
роду Reckertia нужно отнести и два других вида Thau-
matomastix, не имеющих спикул: Т. punctata и Т. thom-
seni. От Thaumatomonas этот род отличается наличием
жгутиковых чешуек.
В то же время, трудно согласиться с выделением
нового рода Peregrinia. Хов с соавторами (Howe et al.,
2011) выделяют этот род на базе Gyromitus Umax, сома-
тические чешуйки которого существенно отличаются
по форме от таковых Gyromitus disomatus (рис. 288), а
его особи способны утрачивать жгутики и переходить
к метаболическому движению. Однако по вариациям
формы одного слоя соматических чешуек всегда раз-
личали виды, а не роды; метаболическое изменение
формы тела при утрате жгутиков характерно для обоих
видов Gyromitus (Swale, Belcher, 1974; 1975). На моле-
кулярно-филогенетических схемах представители рода
Gyromitus формировали базальную ветвь тауматомо-
над, сестринскую другим клонам отряда (Wilezych et
al., 2007; Howe et al., 2011), что, по мнению Хова с со-
авторами (Howe et al., 2011) тоже поддерживает идею
нового рода и даже семейства. С нашей точки зрения,
обособленность соответствующего сиквенса на МФС
лишь подтверждает родовой уровень Gyromitus. В свя-
зи с этими соображениями, название рода Peregrinia
считаем невалидным, а вид Р. clavideferens Howe, Arndt
et Cavalier-Smith, 2011 становится базовым для нового
вида Gyromitus — G. clavideferens comb. nov.
Описанный И.М. Балоновым вид хризофитовых
Chrysosphaerella triangulata (Балонов, 1980) был позд-
нее ошибочно отнесен к новому виду Thaumatomastix
triangulata Beech et Moestrup, 1986 (Beech, Moestrup,
1986), на что справедливо указывают Хов с соавторами
(Howe et al., 2011) и считают вид Thaumatomastix trian-
gulata невалидным.
К сожалению, из всех видов Thaumatomastix вы-
делены и изучены в чистых культурах лишь два кло-
на (Zolotarev1 et al., 2011; Ota et al., in press), поэтому
дальнейшие более масштабные исследования могут
привести к серьезной ревизии этого рода. Установле-
но, например, что у некоторых Thaumatomastix перед-
ний жгутик очень короткий или совсем не виден на то-
1 У изученного в этой работе клона отсутствуют спикулы, но есть
жгутиковые чешуйки, поэтому его следует относить к роду Reckertia. —
Прим. авт.
THAUMATOMONADIDA
407
тальных препаратах (Thomsen et al., 1993; Микрюков,
2002). Такие особи, вероятно, следует относить к роду
Thaumatomonas.
В последней ревизии отряда Thaumatomonadida
(Howe et al., 2011) авторы разделили отряд на 2 семей-
ства: Thaumatomonadidae Hollande, 1952 и Peregriniidae
Cavalier-Smith, 2011. Заметим, однако, что признаки се-
мейств сильно перекрываются, а отличия выглядят не-
существенными (см. обсуждение в разделе Системати-
ка и филогения), поэтому приведем здесь список всех
видов тауматомонад без деления на семейства.
Отряд Thaumatomonadida (Shirkina) Karpov 1990
Thaumatomonas de Saedeleer 1931
T. lauterbomi de Saedeleer 1931
T. seravini Mylnikov et Karpov 1993
T. coloniensis Wylezich, Mylnikov, Weitere et Arndt 2006
T. zhukovi Mylnikov 2003
T. godboldi comb. nov.
Reckertia Conrad 1920
R. sagittifera Conrad 1920
R. dybsoeana Cavalier-Smith 2011
R.filosa Howe, Scoble et Cavalier-Smith 2011
R. spinosa Cavalier-Smith 2011
R.formosa Cavalier-Smith 2011
R. fragilis Cavalier-Smith 2011
R.fusiformis Cavalier-Smith 2011
R. splendida Cavalier-Smith 2011
R. igloolika Cavalier-Smith 2011
R. groenlandica Cavalier-Smith 2011
R. nigeriensis Cavalier-Smith 2011
R. thomseni comb. nov.
R. punctata comb. nov.
R. platyformis comb. nov.
Thaumatomastix Lauterbom 1899
T. setifera (Lauterbom 1896) Lauterbom 1899
T bipartita Beech et Moestrup 1986
T. patelliformis (Takahashi et Hara) Beech et Moestrup 1986
T. salina (Birch-Andersen) Beech et Moestrup 1986
T. tripus (Takahashi et Hara) Beech et Moestrup 1986
T. tauryanini Mikijukov 2002
Gyromitus Skuja 1939
G. disomatus Skuja 1939
G. cordiformis Skuja 1948
G. Umax Swale et Belcher 1975
G. clavideferens comb. nov.
Hyaloselene Skuja 1956
H. compressa Skuja 1956
H. dubia Skuja 1964
Allas Sandon 1927
A. diplophysa Sandon 1927
Морфология
Строение подвижных жгутиковых особей рассмо-
трим на примере наиболее изученных представителей
рода Thaumatomonas (Ширкина, 1987; Карпов, Жуков,
1987; Карпов, 1987, 19906, 1993; Vickerman, 1988; Кар-
пов, Макаренкова, 1989; Vickerman et al., 1991; Мыль-
ников, Карпов, 1993; Karpov, 2010/11). Трофическая
стадия в жизненном цикле, по сути, также представле-
на гетероконтным жгутиконосцем с той разницей, что
он неподвижен и имеет псевдоподии (рис. 285).
Размеры особей у разных видов варьируют от 8 до
20 мкм. Жгутики обычно выходят из довольно глубо-
кого жгутикового кармана, расположенного субапи-
кально. Он представляет собой воронку, обращенную
устьем вперед и вентрально, переходя на вентральной
стороне в продольную бороздку. По обеим сторонам
жгутикового кармана располагаются две сократитель-
ные вакуоли, которые поочередно изливают в него свое
содержимое. Вентральная бороздка тянется вдоль всей
нижней поверхности тела жгутиконосца, практически
до заднего конца клетки. Соматические чешуйки по-
крывают почти всю поверхность клетки за исключе-
нием жгутикового кармана и вентральной бороздки.
Из бороздки формируются тонкие и длинные псевдо-
подии. Поскольку внутри псевдоподий не обнаружены
микротрубочки, их можно считать филоподиями, кото-
рые, однако, бывают довольно плоскими и широкими,
часто ветвятся, охватывая большое пространство во-
круг клетки. Филоподии захватывают бактерий иногда
при этом, сливаясь друг с другом, и транспортируют
их в пищевых вакуолях внутрь клетки для перевари-
вания. Ядро крупное с хорошо заметным центральным
ядрышком. Своим заостренным передним концом ядро
упирается в основания жгутиков.
Ультраструктура клетки изучена в нескольких
работах: Thaumatomastix (Ota et al., in press), Reckertia
(Moestrup, 1982; Zolotarev et al., 2011), Thaumatomo-
nas (Карпов, Жуков, 1987; Карпов, 1987, 1993; Karpov,
2010/11; Howe et al., 2011; Мыльников, Мыльникова,
в печати), Gyromitus (Swale, Belcher, 1974, 1975). Вну-
треннее строение клетки весьма однообразно, поэтому
здесь приведены обобщенные результаты исследова-
ний с обсуждением характерных для некоторых видов
особенностей. Поскольку наиболее детально иссле-
дованы виды Thaumatomonas seravini и Т lauterbomi,
будем опираться здесь преимущественно на наши дан-
ные, как опубликованные, так и оригинальные.
Тело клетки покрыто кремнеземными чешуйками,
которые у разных видов отличаются по форме и раз-
мерам. Они покрывают клетку в один слой, прикрепля-
ясь к плазматической мембране слоем гликокаликса
(рис. 289).
Ядро пузырьковидного типа смещено в переднюю
часть особи, имеет немного вытянутый передний ко-
нец, к которому прилегают кинетосомы жгутиков. Со
стороны кинетосом на поверхности ядра имеется не-
большое углубление. В околоядерной цитоплазме ле-
жат диктиосомы (на одном срезе клетки часто видны
2-3), а к жгутиковому карману примыкают две сокра-
тительные вакуоли (рис. 285, 289).
Чешуйки формируются на поверхности митохонд-
рий (рис. 290). Их сборка происходит внутри матрич-
ного пузырька, плотно прилегающего к наружной
мембране митохондрии. У представителей рода Thau-
matomonas в этом месте обе мембраны митохондрии
инвагинируют довольно глубоко (рис. 290), а про-
странство между наружной и внутренней мембранами
митохондрии заметно увеличивается. Происхождение
пузырька, возможно, связано с дикгиосомой. По мере
созревания чешуйки матричный пузырек приобретает
ее форму, а позднее в нем появляются контуры буду-
щей чешуйки (рис. 290). При этом плоское основание
408
THAUMATOMONADIDA
Рис. 289. Ультраструктура Thaumatomonas lauterbomi в сканирующем (А) и Thaumatomonas seravini в просвечивающем (Б) ЭМ.
аг — аппарат Гольджи, вб — вентральная бороздка, зж — задний жгутик, жк — жгутиковый карман, кц — кинетоциста, м — митохондрия, пж —
передний жгутик, сб — симбиотическая бактерия, св — сократительная вакуоль, ч — чешуйки, я — ядро, яд — ядрышко. Масштабные линейки:
А — 3 мкм, Б— 2 мкм. (Рис. А любезно предоставлен К. Викерманом).
THAUMATOMONADIDA
409
Рис. 290. Ультраструктура Thaumatomonas seravini.
A — ядро (я), диктиосома аппарата Гольджи (аг) и матричный пузырек чешуйки (ч) на поверхности митохондрии (м); Б — участок цитоплазмы с
микротельцем (мт) и симбиотической бактерией (сб). пм — плазматическая мембрана покрыта чешуйками. Масштабная линейка — 0,5 мкм.
410
THAUMATOMONADIDA
Рис. 291. Ультраструктура Thaumatomonas lauterborni.
A — поперечный срез клетки (на врезке продольный срез кинетоцисты); Б— псевдоподиальный вырост из вентральной бороздки; В — продольный
срез кинетосомы (заметен косо срезанный проксимальный конец) переднего жгутика; Г — продольный срез кинетосомы заднего жгутика. Стрелки
на В и Г— переходный цилиндр, аг — аппарат Гольджи, вз2 — вентральный задний корешок, дп — дорсальный передний корешок с вторичными
микротрубочками (вмт), квб — края вентральной бороздки, кц — кинетоцисты, м — митохондрии, мп — мелкие пузырьки в основании псевдоподии,
пв — пищевая вакуоль, пс — псевдоподия, ст — структурные вакуоли, фк — фибриллярный корешок, ч — чешуйки, я — ядро. Масштабные линейки:
А, Б— 1,5 мкм, В, Г— 0,5 мкм. (По: Карпов, Жуков, 1987 —Л; Карпов, 19906 — Б).
THAUMATOMONADIDA
411
Рис. 292. Ультраструктура Thaumatomonas.
А — продольный срез вентральной бороздки Т. seravini', Б, В — два из серии срезов ядра на стадии прометафазы Т. lauterbomi. жк — жгутиковый кар-
ман, ия — инвагинация оболочки ядра в области кинетосом (кн), м — митохондрия, мп — мелкие пузырьки в цитоплазме над вентральной бороздкой,
мт — микротельце, ст — структурные вакуоли по обе стороны вентральной бороздки (вб), хр — хромосомы, ч — чешуйки, яо — ядерная оболочка.
Масштабная линейка — 1 мкм.
412
THAUMATOMONADIDA
чешуйки обращено к цитозолю. После созревания че-
шуйки пузырек отделяется от митохондрии и выносит
свое содержимое наружу Размеры чешуек не превы-
шают 0,7 мкм. Подобным же образом формируются
чешуйки у Thaumatomastix (= Reckertia) sp. (Zolotarev
et al., 2011), Thaumatomastix salina (Ota et al., in press)
и у Reckertia sagittifera (Moestrup, 1982), а вот у Gy-
romitus матричный пузырек формируется не в углубле-
нии, а на выступе митохондрии (Swale, Belcher, 1974,
1975) (рис. 288).
Под плазмалеммой клетки находятся экструзив-
ные органеллы — кинетоцисты, сосредоточенные
преимущественно на дорсальной стороне и переднем
конце клетки (рис. 289, 291). Их оболочка образована
унитарной мембраной, под которой просматривается
рыхлый матрикс из тонкофибриллярного материала.
Тело кинетоцисты занимает центральную часть и со-
стоит из муфточки и центрального стержня (рис. 291).
Выстрелившие кинетоцисты не обнаружены, поэтому
их функция не известна. Кинетоцисты найдены у всех
изученных тауматомонад и могут считаться хорошим
морфологическим признаком этого отряда.
Митохондрии с пузырьковидными кристами
(рис. 289-291) распределены в цитоплазме неравно-
мерно. Чаще всего они встречаются в передней части
клетки и в дорсальной области, значительно реже —
в зоне вентральной бороздки и совсем отсутствуют в
филоподиальных выростах.
В каналах эндоплазматического ретикулума Thau-
matomonas seravini обнаружены симбиотические бак-
терии (рис. 290). Судя по сравнительно тонкой кле-
точной стенке, их можно предварительно отнести к
грамотрицательным бактериям. Одиночные бактерии
внутри вакуолей Т zhukovi также описаны как симбио-
тические (Мыльников, Мыльникова, в печати), однако
не исключено, что они лежат в пищеварительных ваку-
олях, т.к. среди них встречаются частично разрушен-
ные бактерии, а мембрана вакуоли находится на значи-
тельном расстоянии от поверхности бактерии, что не
характерно для симбионтофорных вакуолей.
Рис. 293. Схема строения клетки Thaumatomonas.
вб — вентральная бороздка со структурными вакуолями, зж — задний жгутик, кц — кинетоциста, м — митохондрия, мт — микротрубочки корешков,
выстилающие жгутиковый карман, пв — пищеварительная вакуоль, пж — передний жгутик, ч — чешуйки, я — ядро. (По: Карпов, 1990а).
В цитоплазме часто заметны профили микроте-
лец (рис. 290). Возможно, это одно сильно ветвящее-
ся микротельце с гомогенным электронно-плотным
содержимым. Вентральную часть клетки занимает
множество мелких пузырьков. По обе стороны вдоль
вентральной бороздки Thaumatomonas лежат ряды
вакуолей примерно одного размера с электронно-про-
зрачным содержимым (рис. 291; 292, Л; 293). Вероятно,
именно они имеют вид гранул по краю вентральной бо-
роздки, отмеченных при описании первого вида Thau-
matomonas (рис. 285).
Жгутиковый аппарат. Кинетосомы обоих жгу-
тиков расположены в непосредственной близости от
ядра и связаны с его поверхностью микротрубочками и
микрофиламентами. Кинетосома заднего жгутика (КЗ)
находится ближе к ядру, а переднего (КП) смещена впе-
ред и влево. Обе кинетосомы направлены дистальными
концами вентрально и немного вперед, располагаясь
почти параллельно друг другу (рис. 293). Проксималь-
ные концы кинетосом как бы косо срезаны (рис. 291).
Аксонема жгутиков имеет типичный набор микро-
трубочек 9+2. Переходная зона обоих жгутиков также
устроена одинаково (рис. 291). Поперечная пластинка
расположена выше уровня поверхности клетки. В цен-
тре пластинки находится довольно крупная аксосома,
от которой берут начало две центральные микротрубоч-
ки аксонемы. На уровне дистального края кинетосомы
имеется диафрагма с довольно широким отверстием.
На продольных срезах сверху и снизу поперечной пла-
стинки видны две тонкие линии, прилегающие изнутри
к периферическим дублетам (рис. 291), которые пред-
ставляют собой стенки переходного цилиндра.
Строение корешковой системы детально изучено и
реконструировано по серийным срезам только у Thau-
matomonas lauterborni и Т seravini (Karpov, 2010/11).
Предварительно можно заключить, что кинетида тау-
матомонаса очень похожа на кинетиду церкомонад
(Karpov et al., 2006; Cavalier-Smith, Karpov, 2011), по-
этому названия корешков такие же, как у церкомонад.
На рисунке 291 показан дорсальный передний коре-
кц
THAUMATOMONADIDA
413
ВИД соматические чешуйки жгутик, чешуйки вн. вид клетки
плоские спикулы
Т. sagittifera О © /П
Т. spinosa
Т. sp. <Л
Т. dybsoeana ©
Т. formosa 6"
Т. sp.
Т. triangulata доек (^3—~
Т. tripus фр—
Т. patelliformis
Т. sp. фДг-
Т. sp. (^kesssb"x^ "
Т. bipartita ( §ь>= —=<с.
Т. salina (i ^========—< 0
Рис. 294. Таблица соматических и жгутиковых чешуек у разных видов Thaumatomastix. (По: Thomsen et al., 1995).
414
THAUMATOMONADIDA
Рис. 295. Форма соматических и жгутиковых чешуек различных видов Thaumatomastix и Reckertia.
Стрелками показаны жгутиковые чешуйки. А — Thaumatomastix bipartita, Б — Reckertia dybsoeana, В — R. fusiformis, Г— R. formosa, Д— R. spinosa,
E — R.fragilis, Ж—R. igloolika, 3 — R. sagittifera, И— T. patelliformis, К—R. groenlandica, JI— T. tripus, M— R. splendida, H— T. salina, О — R. nige-
riensis, П—R. thomseni, P — T. tauryanini, C—R. punctata. Масштабные линейки: А, И, О — 1 мкм; Б, Г-Е, К,М,П— 100 нм; В, Д, Е, К, Л, Н— 0,5 мкм;
Ж, 3 — 200 нм; П, С — 0,4 мкм. (По разным авторам).
THAUMATOMONADIDA
415
Рис. 296. Тотальные препараты чешуек Thaumatomonas lauterborni (А), Т. seravini (Б), Т. coloniensis (В), Т. zhukovi (Г-Е).
Масштабная линейка — 0,5 мкм. (По: Мыльников, Карпов, 1993 —А, Б; Wylezich et al., 2007 — В; Мыльников, Мыльников, 2003 — Г-Е).
шок (ДП), который начинается от кинетосомы перед-
него жгутика и проходит под плазмалеммой по левой
передней стороне жгутикового кармана. В непосред-
ственной близости от кинетосомы этот корешок насчи-
тывает 3 микротрубочки, и связан с электронно-плот-
ным материалом, от которого отходят многочисленные
вторичные микротрубочки вдоль поверхности ядра
(рис. 291, В). В дистальной части ДП также окружен
электронно-плотным материалом, от которого вторич-
ные микротрубочки идут вправо и влево, укрепляя
устье жгутикового кармана. На рисунке 291, Г показан
один из двух вентральных корешков, который ассоци-
ирован с фибриллярной неисчерченной пластинкой,
сопровождающей его в проксимальной части, когда ко-
решок проходит вдоль поверхности ядра. Он отходит
от кинетосомы заднего жгутика и выстилает заднюю
стенку жгутикового кармана. Мощный фибриллярный
корешок отходит также от кинетосомы заднего жгутика
и идет вдоль поверхности ядра (рис. 291, Г). У Т. se-
ravini он длиннее, чем у Т lauterborni, имеет попереч-
ную исчерченность и прикрепляется к ядру в районе
небольшого углубления на его поверхности.
Соматические чешуйки. Исследование сомати-
ческих чешуек у представителей рода Thaumatomastix
привело к выделению почти 20 видов. Между тем, эти
виды близки по строению клетки и биологическим осо-
бенностям к видам Thaumatomonas, а также и по форме
чешуек внутреннего слоя, которые преимущественно
состоят из двух параллельных овальных или треуголь-
ных пластинок, соединенных между собой нескольки-
ми столбиками, или ножками (Beech, Moestrup, 1986;
Thomsen et al., 1993, 1995; Thomsen, Ikavalko, 1997;
Микрюков, 2002) (рис. 294, 295). Таким образом, по
форме соматических чешуек оба рода демонстрируют
сходные ряды изменчивости. Однако Thaumatomastix
теперь четко отличается от Thaumatomonas наличием
второго, наружного слоя чешуек в форме спикул (Howe
et al., 2011).
Ранее X. Томсен с соавторами (Thomsen et al., 1993)
пытался разделить род Thaumatomastix на 3-4 группы
(рис. 294). Клетки видов Reckertia (= Thaumatomastix}
sagittifera и R. spinosa покрыты одним слоем похожих
на корону чешуек. Остальные имеют, по меньшей мере,
один слой плоских двухслойных чешуек, образованных
треугольными (Reckertia (= Thaumatomastix) dybsoeana,
R. formosa, T tripus и T patelliformis) или овальными
(T. bipartita, T salina) пластинками. Спикулы образуют
наружный слой и часто видны в световой микроскоп.
Они имеют овальное или треугольное плоское осно-
вание, от которого отходят 3 столбика, подпирающие
обязательный воротничок (рис. 294,295). От воротнич-
ка отходит длинный прямой или изогнутый шип, окан-
чивающийся двумя или тремя зубцами. Интересно, что
все виды, у которых внутренний слой чешуек с оваль-
ными пластинками, имеют также и спикулы (Thomsen
et al., 1995). Поднимавшийся в литературе вопрос о де-
лении рода Thaumatomastix на 3 или 4 рода на основе
наборов чешуек (Thomsen et al., 1993) долгое время не
обсуждался, поскольку были необходимы данные по
молекулярной филогении. В настоящее время такие
416
THAUMATOMONADIDA
данные получены для немногих видов Thaumatomastix
и проведена ревизия рода (Howe et al., 2011) (см. об-
суждение в разделе Систематика и филогения).
Форма чешуек, очевидно, генетически детермини-
рована и как нельзя лучше подходит для видовой иден-
тификации «чешуйчатых» жгутиконосцев. Однако в
литературе периодически появляются сообщения о
нарушении правила: один вид характеризуется одно-
типными чешуйками. Так, у Paraphysomonas (Chryso-
phyceae) имеются уродливые и аберрантные чешуйки
(Thomsen et al., 1995). X. Томсен с соавторами (Thomsen
et al., 1993) приводит фотографии соматических чешу-
ек неизвестного вида Thaumatomastix как овальной,
так и треугольной формы. Такой феномен авторы объ-
ясняют следующим образом: после бинарного деления
дочерняя клетка наследует материнские чешуйки и
синтезирует свои собственные; если она попадает при
этом в микронишу с другим составом солей, то возмо-
жен синтез чешуек другой формы (Thomsen, Ikavalko,
1997). Возможно, по этой причине в старых культурах
могут появляться особи с нетипичными чешуйками
(рис. 296, Е).
Специальное исследование формы чешуек Т zhu-
kovi в просвечивающем и сканирующем ЭМ показало,
что клетки этого клона покрыты преимущественно
овальными чешуйками, среди которых встречается не-
большое количество треугольных (Мыльников, Мыль-
ников, 2003). Следовательно, особи Т zhukovi порыты
двумя типами соматических чешуек, расположенных в
один слой на поверхности клетки (рис. 296).
Возможно, накопление данных о переходных фор-
мах чешуек в дальнейшем приведет к пересмотру ви-
довых признаков у покрытых чешуйками протистов,
что, безусловно, должно быть подкреплено результата-
ми молекулярно-филогенетических исследований.
Питание
Процесс питания тауматомонад изучен недостаточ-
но. Внешне все выглядит просто: клетка останавлива-
ется, выпускает из вентральной бороздки псевдоподии
и приступает к питанию, захватывая бактерий из окру-
жающей среды как амебоидный организм. В то же вре-
мя, удивляет высокая скорость образования длинных и
тонких псевдоподий. Это занимает буквально секунды.
Между тем, длина отдельных филоподий иногда в 10
раз превышает длину клетки (личное наблюдение ав-
тора). Поэтому возникает вопрос, откуда берет клетка
то огромное по площади количество мембраны, по-
крывающей сеть филоподий. При анализе электроно-
грамм выясняется, что практически вся вентральная
цитоплазма заполнена мелкими пузырьками (рис. 291;
292, А). Эти везикулы занимают пространство от перед-
него до заднего конца вдоль всей вентральной борозд-
ки. По-видимому, именно эти пузырьки и представля-
ют собой депо мембран, необходимых для построения
псевдоподий. Действительно, в основании формирую-
щейся псевдоподии всегда можно обнаружить целые
кластеры таких пузырьков (рис. 291, Б).
Каким же образом клетка накапливает эти пузырь-
ки? Теоретически есть два пути их формирования: в ре-
зультате деятельности диктиосом и за счет эндоцитоз-
ной активности. В эксперименте с пероксидазой хрена,
связывающей гликокаликс, было показано, что она об-
наружена как на поверхности клетки, так и внутри этих
мелких пузырьков (Карпов, Макаренкова, 1989). Кроме
того, в жгутиковом кармане Т. lauterbomi отмечена по-
стоянная эндоцитозная активность по типу рецептор-
ного эндоцитоза (с образованием окаймленных ямок и
пузырьков). Эти факты убедительно свидетельствуют
о том, что основная масса мелких везикул на вентраль-
ной стороне клетки накапливается в результате ее эндо-
цитозной активности.
После захвата одной или нескольких бактерий фор-
мируется пищевая вакуоль, которая транспортируется
внутрь клетки. Здесь в результате слияния с лизосома-
ми она становится пищеварительной вакуолью, в кото-
рой происходит переваривание пищи.
Завершив питание, трофонт обычно втягивает псев-
доподии внутрь клетки. Однако, удавалось наблюдать и
другое явление: по неизвестной причине клетка вдруг
расправляла жгутики, переходила к движению и уда-
лялась, оставляя всю сеть псевдоподий на субстрате.
Возможно, это связано с возникновением какой-либо
критической ситуации в жизни особи.
Размножение
Для тауматомонад описано только бесполое раз-
множение. Слияния одноядерных особей в культуре ве-
дут к образованию плазмодия, но дальнейшее слияние
ядер, а также мейотические деления не наблюдались.
Бесполое размножение путем фрагментации плаз-
модиев описано в следующем разделе (Жизненный
цикл тауматомонад на примере Т. lauterbomi).
Бинарное деление клетки на светооптическом
уровне было показано для нескольких видов. Достаточ-
но детально описано деление клетки у Thaumatomonas
(= Bodopsis) godboldi (Lackey, 1933), во время которо-
го особь активно передвигается. Автор установил, что
оболочка ядра сохраняется на всем протяжении мито-
за (рис. 297). В профазе идет спирализация хромосом,
ядрышко деградирует. Материнские жгутики остаются
у одной дочерней особи, а у другой оба жгутика форми-
руются заново уже в профазе. На стадии метафазы хо-
рошо видны 24 мелкие шаровидные хромосомы. Вну-
триядерное веретено деления плохо заметно. В анафазе
ядро вытягивается гантелевидно, хромосомы расходят-
ся к полюсам веретена. В телофазе быстро происходит
деспирализация хромосом и формирование ядрышка.
Цитокинез начинается с переднего конца: борозда раз-
деляет сначала жгутиковый карман, затем, углубляясь,
достигает заднего конца клетки (рис. 297).
Трофонты Thaumatomonas lauterbomi делятся в не-
подвижном состоянии (Ширкина, 1987). При этом осо-
би останавливаются, редуцируют оба жгутика, и при-
ступают к продольному делению, которое протекает в
целом так же, как у Т godboldi. Когда борозда деления
THAUMATOMONADIDA
417
Рис. 297. Бинарное деление Thaumatomonas godboldi.
А — прометафаза, Б — метафаза, В — анафаза, Г — цитокинез. (По:
Lackey, 1933).
достигает заднего конца клетки, дочерние особи разъ-
единяются, формируют новые жгутики и переходят к
самостоятельному движению и питанию. Из этих на-
блюдений следует, что жгутики обеих дочерних особей
возникают заново.
Похожая форма деления описана и для трофонтов
Thaumatomastix salina, который также имеет короткий
передний и длинный задний жгутики (Beech, Moestrup,
1986). Правда, исчезновение жгутиков перед делением
ядра не всегда отмечается авторами.
Поведение ядерного аппарата на ультраструктур-
ном уровне не исследовано. Здесь приведены два
изображения из серии срезов делящегося ядра Thau-
matomonas lauterbomi (рис. 292, Б, В) на стадии про-
метафазы. Действительно, трансформация кинетиды
завершается уже в профазе, и к полюсам делящегося
ядра расходятся уже сформированные пары кинетосом.
На срезах внутри жгутикового кармана видны только
короткие задние жгутики, а кинетосомы передних еще
без жгутиков. Таким образом, можно предположить,
что передним жгутикам, формирование которых за-
паздывает, дадут начало дочерние (вновь сформиро-
ванные) кинетосомы. Следовательно, трансформацию
кинетосом у Thaumatomonas можно отнести к полукон-
сервативному типу, характерному для всех жгутиковых
протистов. Это противоречит приведенному выше опи-
санию Дж. Лэки (Lackey, 1933), поэтому необходимо
исследование ультраструктуры делящейся клетки у
Т godboldi.
Некоторые корешки (вероятнее всего, ризопла-
сты) врастают в углубления ядра, слабо выраженные в
Рис. 298. Схема жизненного цикла Thaumatomonas lauterbomi.
а — амебоидная форма, жг — жгутиковая форма, сж — слияние жгутиконосцев с последующим делением ядер, мп — молодой плазмодий, зп — зре-
лый плазмодий, фп — фрагментация плазмодия, ц — циста. (По: Ширкина, 1987, с изменениями).
418
THAUMATOMONADIDA
интерфазе, но значительные у делящегося ядра. Кон-
денсированные хромосомы прикрепляются к ядерной
оболочке при помощи микротрубочек, которые форми-
руются внутри ядра. Ядерная оболочка в целом на ста-
дии прометафазы остается интактной, что подтверж-
дает наблюдения Дж. Лэки (Lackey, 1933). Правда, в
районе кинетосом с обоих полюсов ядра можно видеть
небольшие разрывы в ядерной оболочке. Эти данные
позволяют предположить, что у Thaumatomonas идет
полузакрытый ортомитоз с участием ризопластов в ка-
честве ЦОМТов.
Жизненный цикл тауматомонад
на примере Т. lauterborni
Жизненный цикл у тауматомонад весьма сложен.
Помимо трофических и покоящихся стадий, характер-
ных для большинства свободноживущих протистов
у них есть стадии расселения и плазмодии. Наиболее
полно описан жизненный цикл при исследовании куль-
туры Т lauterborni (Ширкина, 1987).
На первой стадии одноядерные подвижные особи
чередуются с неподвижными питающимися клетками
Рис. 299. Ультраструктура плазмодия Thaumatomonas lauterborni.
Врезка: две особи Т. seravini с общей пищеварительной вакуолью, аг — аппарат Гольджи, ж — жгутик, м — митохондрия, пв — пищеварительная
вакуоль, пс — псевдоподия, св — сократительная вакуоль, я — ядро. Масштабные линейки: 2 мкм, врезка — 3 мкм. (По: Карпов, 19906).
THAUMATOMONADIDA
419
(рис. 298). По мере развития культуры в ней появляют-
ся более крупные клетки с тремя и более ядрами и не-
сколькими жгутиками. Обычно это мелкие (до 30 мкм)
подвижные трехлопастные особи с тремя длинными
жгутиками. Эти небольшие плазмодии образуются, по-
видимому, в результате эндомитозов без последующего
цитокинеза, хотя не исключено и слияние одноядерных
жгутиконосцев друг с другом. Так, на рисунке 299 по-
казаны две клетки, соединившиеся цитоплазматиче-
ским мостиком в области вентральной бороздки; они
имеют общую пищевую вакуоль.
Мелкие плазмодии также способны к активному
питанию. При этом особь останавливается, подвора-
чивает жгутики и образует широкие псевдоподии типа
ламеллиподий, от которых отходит множество тонких
субпсевдоподий, активно захватывающих пищевые
частицы. В таком состоянии организм проводит не-
сколько минут. Затем псевдоподии втягиваются, вновь
появляются жгутики, и плазмодий продолжает движе-
ние. Такое чередование двигательной и пищевой ак-
тивности характерно и для более крупных плазмодиев,
имеющих от 4 до 7 ядер и соответствующее количество
жгутиков.
Следующая стадия — агрегация клеток. Одно-
ядерные жгутиконосцы собираются вокруг небольших
плазмодиев, плотно к ним примыкая. Иногда в культу-
ре появляются довольно крупные агрегаты клеток, со-
стоящие только из одноядерных особей. Форма агрега-
тов различна. В одних случаях клетки располагаются
по кругу, оставляя в центре свободное пространство;
в других — образуют плотные гроздья вокруг мелких
амебоидных плазмодиев. Процесс объединения особей
может продолжаться от нескольких часов до полутора
суток. Затем они чаще всего сливаются в единый круп-
ный плазмодий, а в редких случаях агрегаты снова рас-
падаются на отдельные клетки. Крупные плазмодии
размером от 80 до 150 мкм представляют собой аме-
боидные клетки разнообразной формы, содержащие до
100 и более ядер (рис. 298, 299). Они практически не-
подвижны, но способны к активному питанию. Внутри
таких плазмодиев часто видна крупная пищеваритель-
ная вакуоль.
Следующая стадия — так называемая стадия фраг-
ментации. Обычно на 8-9-е сутки после пересева куль-
туры плазмодии начинают распадаться на отдельные
фрагменты. Фрагментация происходит двумя путями.
В одном случае плазмодии вытягиваются в цепочки,
с обоих концов которой поочередно отделяются одно-
ядерные особи, сразу формирующие жгутики. При
таком способе фрагментации плазмодий размером 60-
80 мкм за 30 мин способен давать до 20 и более особей.
В другом варианте одноядерные клетки поочередно от-
почковываются в любом участке тела плазмодия. Этот
процесс может прерываться. Тогда у плазмодия появля-
ются жгутики, и он некоторое время активно переме-
щается. Затем фрагментация возобновляется. Иногда
при фрагментации отшнуровываются не одноядерные,
а двуядерные особи. Кроме того, процесс фрагмен-
тации может идти не до конца. В результате остается
многоядерная клетка, которая округляется, покрывает-
ся оболочкой и существует в таком состоянии длитель-
ное время. Еще более редкое явление — внутреннее
почкование. При этом обособление участка цитоплаз-
мы с ядром происходит внутри плазмодия. Вновь сфор-
мированная одноядерная клетка находится в вакуоли.
Дальнейшая судьба ее не прослежена.
В большинстве случаев фрагментация плазмодиев
приводит к образованию одноядерных подвижных осо-
бей, и жизненный цикл Т lauterbomi замыкается.
Жгутиконосцы способны образовывать покоящие-
ся стадии — цисты. Однако в процессе культивирова-
ния и регулярного пересева эта стадия не наблюдается.
Инициировать формирование цист можно понижением
температуры до 3—5 °C в течение достаточно длитель-
ного времени (Ширкина, 1987). Цисты обычно окру-
глой формы диаметром 5-7 мкм. Вероятно, в природе
такие цисты необходимы для переживания неблагопри-
ятных условий, в частности, зимнего периода.
Экология
Тауматомонады — типичные консументы бен-
тосной нанофауны (Arndt et al., 2000; Deitrich, Arndt,
2000; Lee, Patterson, 2000). Они питаются обитающи-
ми в осадке бактериями. Тауматомонады отсутствуют
в широко известных определителях, поэтому их часто
не замечают при экологических исследованиях. Допол-
нительные трудности возникают из-за их сильной мор-
фологической пластичности: они могут менять форму
в течение нескольких секунд, обладая сложным жиз-
ненным циклом, встречаются в природе в форме раз-
личных непохожих друг на друга особей. Тем не менее,
современные исследования показали, что тауматомо-
нады — типичный компонент бентосных и почвенных
сообществ (Ekelund et al., 2004; Wylezich et al., 2007).
Причем, Thaumatomonas встречается преимуществен-
но в пресноводных биотопах. Однако немногие клоны
способны переносить небольшое повышение соле-
ности. Например, Т seravini выдерживает постепен-
ное повышение солености до 6%о (Arndt et al., 2000).
У Thaumatomastix. напротив, только один вид описан
из пресноводного местообитания (Thomsen, Ikavalko,
1997).
Помимо бентоса тауматомонады отмечаются в арк-
тических (Thomsen, Ikavalko, 1997) и в антарктиче-
ских льдах (Thomsen et al., 1995). Томсен с соавторами
(Thomsen et al., 1995; Thomsen, Ikavalko, 1997) отмечает,
что Thaumatomastix splendida особенно хорошо адапти-
рован к обитанию в микроканалах льда, заполненных
морским рассолом, соленость которого в 2-3 раза выше
океанической. Кроме того, тауматомонады населяют
пелагиаль, где они ассоциированы с взвешенными ча-
стицами (Wylezich et al., 2007). Их вклад в общую чис-
ленность мелких жгутиконосцев пелагиали невелик
(до 4%) по сравнению с бентосным сообществом гете-
ротрофных флагеллат (до 20%). В некоторых сезонных
исследованиях авторы отмечали обильное развитие та-
уматомонад в солоноватоводных (Dietrich, Arndt, 2000)
и пресноводных (Auer et al., 2003) экосистемах. При-
420
THAUMATOMONADIDA
чем, эти организмы представляли значительную долю
биомассы гетеротрофных жгутиконосцев, которая ино-
гда достигала 50%. Среднегодовое значение биомассы
тауматомонад по отношению ко всей биомассе наноф-
лагеллат в солоноватоводных системах составляло 14%
(Dietrich, Arndt, 2000). Эти организмы обнаружены и в
талых водах Антарктики, где их вклад в биомассу до-
стигал 8% (Dietrich, Arndt, 2000). Отмечены тауматомо-
нады и в грунтовых водах, что неудивительно, посколь-
ку они — обычный компонент почвенных экосистем.
Систематика и филогения
Филогенетические отношения внутри отряда стро-
ятся на основании сиквенсов гена рРНК малой субъе-
диницы рибосом (Cavalier-Smith, Chao, 2003; Wylezich
et al., 2007; Howe et al., 2011; Ota et al., in press). К на-
стоящему времени опубликованы сиквенсы этого гена
для 13 клонов рода Thaumatomonas, двух клонов Thau-
matomastix, одного клона Gyromitus и трех клонов Al-
las (Wylezich et al., 2007; Howe et al., 2011; Ota et al.,
in press). В целом, это неплохая выборка, по которой
можно судить о филогении этого небольшого по коли-
честву видов отряда. Судя по приведенному в послед-
ней работе мелкомасштабному древу, построенному по
18S рРНК (рис. 300), все клоны Thaumatomonas и Allas
распадаются на две сестринские ветви со стопроцент-
ной поддержкой (Howe et al., 2011). Отличия сиквенсов
Thaumatomonas друг от друга минимальны, меньшее
сходство с этими клонами проявляет Allas aff. diplo-
physa. но также довольно близок к ним. На некоторых
МФС Allas парафилетичен, кластеризуясь с видами
тауматомонаса (Wylezich et al., 2007). Учитывая мор-
фологическое сходство Allas и Thaumatomonas, можно
предполагать, что Allas, на самом деле, представляет
один из видов Thaumatomonas.
Значительно дальше от этого кластера отстоят
Reckertia filosa и Gyromitus (= Peregrinia) clavideferens
(Howe et al., 2011), демонстрируя обособленность на
уровне рода.
Род Rhizaspis по МФС группируется с другими кри-
омонадами (Rhogostoma\ где для него предлагается от-
дельное семейство (Howe et al., 2011). Данные молеку-
лярной филогении для Hyaloselene отсутствуют.
Таким образом, все МФС демонстрируют монофи-
летичность тауматомонад. Gyromitus образует наибо-
лее базальную ветвь, сестринскую другим тауматомо-
надам. Род Thaumatomonas распадается на две ветви,
одна из которых включает клон Т coloniensis. другая
Allas aff. diplophysa (Wylezich et al.,2007; Howe et al.,
2011). Возможно, использование сиквенсов других ге-
нов и увеличение количества исследуемых клонов даст
более ясную картину филогении тауматомонад.
Эти же данные позволяют судить и о связях тау-
матомонад с другими протистами. Очевидно, что они
представляют собой типичных Cercozoa, близких к цер-
комонадам. Предполагаемая ранее близость их к Eugly-
pha (Cavalier-Smith, Chao, 2003) оказалась ошибочной.
Более представительная выборка клонов тауматомонад
показала, что они являются самостоятельной ветвью
в переделах Cercozoa (Wylezich et al., 2007; Howe et
al., 2011). Эта более здравая позиция согласуется и с
морфологическими данными. Их близость к спонгомо-
надам, как следует из недавно опубликованных МФС
со слабой статистической поддержкой (Howe et al.,
2011) не подтверждается морфологическими данными
(Karpov, 2010/11). Напротив, по ультраструктурным
IThaumatomonas coloniensis HFCC59 DQ211591
Thaumatomonas coloniensis HFCC93 DQ211592
Thaumatomonas sp. (K. Vickerman) U42446
Thaumatomonas ?lauterborniTA ‘SCCAP TT AY496046
95
Thaumatomonas vancouveri 3108W2 AF411264
Thaumatomonas oxoniensis Hinksey HQ121429
'—Thaumatomonas sp. ‘SCCAP T-3’ AY496044
62
100
100
99
92
*— Thaumatomonas sp. ATCC 50250 AF411261
Thaumatomonas seravini ATCC 50636 type strain T-2 AF411259
-Thaumatomonas seravini ‘SCCAP T2’ AY496045
" - Thaumatomonas sp. TMT002 DQ980486
Thaumatomonas sp. SA1 AF411263
-Thaumatomonas sp. SA2AF411260
I- Allas aff. diplophysa ATCC 50365 AF411262
ENV-freshwater sediment 13-1.4 AY620305
rENV-soil Amb_18S„695 EF023367
'ENV-soil Elev_18S_7011 EF025032
-Reckertia filosa JJP-2003 AY268040
............-—ENV-marine sediment 9-2.6 AY620310
ENV-marine sediment A15 AY620317
II II И Illi I I..........................................ПИШИ , 0.1
Discomonas retusa FJ824131
------Gyromitus clavideferens HFCC94
Рис. 300. Взаимное расположение сиквенсов гена 18S рРНК тауматомонад на мелкомасштабной молекулярно-филогенетической схе-
ме. (По: Howe et al., 2011).
THAUMATOMONADIDA
421
особенностям (организация цитоскелета, строение
псевдоподий и экструсом, а также наличие микротель-
ца и трубчатых крист в митохондриях) они похожи на
церкомонад (Karpov, 2010/11). Кроме того, те и другие
способны формировать плазмодии в жизненном цикле
и ведут преимущественно ползающий образ жизни.
Переходя к систематическому обзору Thaumatomo-
nadida резюмируем, что этот отряд включает в настоя-
щее время 6 родов: Thaumatomonas De Saedeleer 1931;
Reckertia Conrad 1920; Thaumatomastix Lauterbom 1899;
Gyromitus Skuja 1939; Allas Sandon 1927 и Hyaloselene
Skuja 1956. Два рода Rhizaspis и Protaspa включены в
состав близкого отряда Cryomonadida (см. главу Сгуо-
monadida), а род Bodopsis, по-видимому, следует счи-
тать глиссомонадой.
Систематический обзор
Род Thaumatomonas de Saedeleer 1931
Подвижные особи представлены гетероконтными
жгутиконосцами с удлиненно-овальными очертания-
ми; немного уплощены дорсовентрально. Передний
жгутик значительно короче заднего. Мелкие сомати-
ческие чешуйки в один слой покрывают клетку. Две
сократительные вакуоли на переднем конце клетки
попеременно изливают свое содержимое в общий про-
ток, открывающийся наружу у основания жгутиков.
Ядро крупное с центральным ядрышком находится
в передней половине клетки у основания жгутиков.
В жизненном цикле имеются стадии филоподиальной
жгутиковой амебы, плазмодия и цисты. Пресноводные
и почвенные фаготрофы.
Типовой вид: Т lauterbomi de Saedeleer 1931.
Т. lauterbomi de Saedeleer 1931
(рис. 285; 296, A)
Длина жгутиконосца варьирует от 8,3 до 15 мкм
(средняя 11,2) и примерно вдвое превышает шири-
ну (5-8, средняя 6,8 мкм). Задний конец клетки часто
уже переднего. Передний жгутик короткий (3-^1 мкм),
задний в 1,5-2 раза превышает длину клетки, проходя
вдоль малозаметной вентральной бороздки. Движение
скользящее равномерное. Цитоплазма содержит много
крупных гранул.
Характерны овальные соматические чешуйки: пло-
ское основание (0,7x0,35 мкм) прилегает к плазмалем-
ме, наружная часть чешуйки похожа на коромысло,
которое соединяется концами с основанием тремя-че-
тырьмя столбиками на каждом конце. На обоих концах
коромысла имеется по отверстию. Цисты шаровидные
с гладкой сравнительно тонкой оболочкой.
Т. seravini Mylnikov et Karpov 1993 (рис. 296, Б)
Подвижные особи округлые или широкоовальные,
значительно уплощены дорсовентрально. Длина клет-
ки варьирует от 10 до 16,5 мкм (средняя 14), ширина от
6,6 до 11,6 мкм (средняя 8,65 мкм). Передний жгутик
короткий (4-5 мкм), задний — вдвое превышает дли-
ну клетки, направлен назад вдоль малозаметной вен-
тральной бороздки. На переднем конце часто заметна
небольшая ямка, маркирующая отверстие общего кана-
ла двух сократительных вакуолей. Основание чешуйки
плоское треугольной формы с длиной стороны около
0,7 мкм. Верхняя часть чешуйки также треугольной
формы перфорирована по краю. Основание чешуйки
соединяется с верхней частью тремя ножками на вер-
шинах треугольника. Цисты диаметром 8,3-11,6 мкм.
Цисты с толстой оболочкой без пробочки.
Т. coloniensis Wylezich, Mylnikov, Weitere et Arndt
2006 (рис. 296,8; 301)
Ползающие клетки овальные или с заостренным
задним концом; длина 9,9-14,9 мкм (в среднем 12,26),
ширина 3,0-5,8 mm (в среднем 4,74). Короткий перед-
ний жгутик длиной 1,0-1,5 мкм, задний жгутик гладкий
длиной 16-18 мкм не прилегает к телу клетки. Сомати-
ческие чешуйки овальные размером 0,50-0,65x0,35-
0,45 мкм. Они состоят из двух овальных пластинок, на
каждом конце их связывают друг с другом 3-5 столби-
ков. Наружная пластинка утолщена по краю и по обе
стороны от продольной центральной пластинки имеет
по 4-6 отверстий. Особи не образуют агрегатов кле-
ток или плазмодиев. В жизненном цикле присутству-
ют шаровидные цисты с гладкой стенкой, диаметром
8,3-11,6 мкм.
Пресноводные.
Рис. 301. Различные формы клеток Thaumatomonas coloniensis
в культуре.
а-д — подвижные особи, е — делящаяся клетка, ж-к — амебоидные
малоподвижные особи, л — циста. Масштабная линейка — 10 мкм.
Т. zhukovi Mylnikov 2003 (рис. 296, Г-Е; 302)
Ползающие уплощенные клетки овальной фор-
мы с заостренным задним концом тела, длиной 6,6-
11,6 мкм (9,39=1=0,15) и шириной 4,5-5,5 мкм. Два не-
равных жгутика выходят из небольшого углубления на
переднем конце тела. Короткий двигательный жгутик
длиной 1,0-1,5 мкм направлен вперед, задний длиной
15-18 мкм проходит под клеткой внутри вентральной
бороздки. Тело клетки покрыто одним слоем оваль-
422
THAUMATOMONADIDA
Рис. 302. Различные формы клеток Thaumatomonas zhukovi.
a-в — активно ползающие клетки (б — вид в профиль); г, д — амебо-
идные формы (трофонты); е — циста; ж — начало образования плазмо-
дия; з, и — плазмодии. Масштабные линейки: а-в — 5 мкм; г — 8 мкм;
д-и — 10 мкм.
ных чешуек с вкраплениями треугольных. Овальная
чешуйка 0,60-0,75x0,30-0,40 мкм с перфорированной
по краю 3-5 отверстиями верхней пластинкой. Верхняя
пластинка треугольной чешуйки, перфорированная 4-6
отверстиям, имеет основание с ребром 0,65-0,75 мкм.
Формируют многоядерные плазмодии диаметром
35-50 мкм. Цисты с гладкой поверхностью диаметром
8,3-10,0 мкм.
Замечания. Два типа чешуек являются, вероят-
но, родственными по происхождению. Так, нередко на
тотальных препаратах обнаруживались чешуйки с про-
межуточной структурой от овальной до треугольной
(рис. 296, Г-Е). В этом случае у овальной чешуйки по-
является третье ребро, в котором заметно одно или два
отверстия. Отмечено несколько аберрантных четыре-
хугольных чешуек с ребром нижней пластинки 0,5 мкм
(рис. 296, Е).
Т. godboldi comb. nov. (рис. 287, Ж; 297)
Баз.: Bodopsis godboldi Lackey 1933.
Особи имеют овальные очертания, слегка сплюще-
ны дорсовентрально, длина клетки 12 мкм, ширина 6, а
толщина 3-^1 мкм. На переднем конце имеется углубле-
ние, из которого выходят два жгутика: короткий перед-
ний составляет 1/4 длины клетки, а длинный рулевой
примерно равен длине клетки. Из этого же углубления
формируются при необходимости и псевдоподии. Ядро
имеет слегка вытянутый передний конец, прилегаю-
щий к основаниям жгутиков. Сократительная вакуоль
прилегает жгутиковому углублению, куда изливает со-
держимое при сокращении. Метаболия клетки не от-
мечена.
Два недавно описанных вида Т oxoniensis Bass et
Cavalier-Smith 2011 и T. vancouveri Cavalier-Smith et
Chao 2011 имеют идентичные гены 18S рРНК, найдены
отличия по 16 нуклеотидам в ITS2 (Howe et al., 2011).
Строение чешуек описано только у Т oxoniensis, но не
приведены фотографии. Авторы статьи утверждают, что
чешуйки очень похожи на таковые Т. coloniensis. Учиты-
вая большое сходство в строении чешуек Т. oxoniensis и
Т. coloniensis, а также минимальные различия в генах
18S рРНК, предлагаем считать эти виды конспецифич-
ными, а имя вида Т. oxoniensis невалидным, поскольку
оно является младшим синонимом Т. coloniensis.
Т. vancouveri описан только по изображениям фик-
сированных в парах осмия клеток и сиквенсам генов
рРНК. Приведенные в работе Хова с соавторами (Howe
et al., 2011) элекгронограммы срезов клетки демонстри-
руют наличие слоя соматических чешуек, но не позво-
ляют судить об их форме, которая является ключевым
признаком в описании вида тауматомонад. Поэтому
следует признать, что описание вида Т. vancouveri не
соответствует современным требованиям (отсутству-
ют сведения о форме чешуек, не показан внешний вид
и размеры живых особей, а также стадия трофонта с
псевдоподиями), а имя вида Т. vancouveri будем считать
невалидным.
Род Reckertia Conrad 1920
Особи покрыты одним слоем чешуек, имеющих
форму треугольника или корзинки, иногда неопреде-
ленной формы. Короткий передний жгутик, если име-
ется, обычно покрыт мелкими овальными чешуйками,
задний гладкий, длиннее тела. Преимущественно мор-
ские.
Типовой вид:/?, sagittifera Conrad 1920.
R. sagittifera Conrad 1920 (рис. 287, 3; 295, 3)
Передний жгутик покрыт овальными чешуйками
0,2x0,3 мкм с утолщенным краем и хорошо заметным
кольцевым валиком на некотором расстоянии от края.
Соматические чешуйки, имеют треугольное основа-
ние и скорее похожи на корону, а не двухслойные, как
у большинства других видов. Они показаны только на
срезах (Moestrup, 1982), поэтому о размерах судить
трудно.
R. dybsoeana Cavalier-Smith 2011 (рис. 295, Б)
Баз.: Thaumatomastix dybsoeana Thomsen et al.,
1993.
Тело жгутиконосца размером 6x15 мкм с одним
видимым жгутиком около 7 мкм длиной. Жгутик по-
крыт почти круглыми чешуйками диаметром 0,37-0,6
(среднее 0,49) мкм, в центре которых имеется неболь-
шой шишковидный выступ. Соматические чешуйки
плоские треугольные со стороной примерно 0,7 мкм,
состоят из двух почти одинаковых по размеру пласти-
нок, соединенных ножками на вершинах треугольни-
ков. Проксимальная пластинка плоская однородная, а
дистальная образована небольшим плотным треуголь-
ником в центре со стороной 0,24 мкм, от вершин кото-
рого отходят перекладины к окаймляющему ребру.
R. filosa Howe, Scoble et Cavalier-Smith 2011
(рис. 303, Г-Ж)
Особи овально-дисковидные размером 11-12,5 мкм,
задний жгутик длиной 17-20 мкм, или в 1,75-2 раза
THAUMATOMONADIDA
423
Рис. 303. Тотальные препараты чешуек Gyromitus clavideferens (A-В) и Reckertia filosa (Г-Ж). Е — жгутиковые чешуйки.
Стрелками показаны детали строения чешуек. Масштабная линейка — 200 нм. (По: Howe et al., 2011; с изменениями).
длиннее тела; короткий передний, постоянно бьющий
жгутик — 2-3,5 мкм. Филоподии длинные ветвящи-
еся, часто пластинчатые. Соматические чешуйки об-
разованы двумя треугольными пластинками разме-
ром 0,5-0,6 мкм. В вершинах наружной пластинки по
овальному отверстию, от краев которого идут к вну-
тренней пластинке три столбика, сливающиеся в точ-
ке крепления к внутренней пластинке. Задний жгутик
гладкий, передний покрыт овальными мелкими (0,33—
0,37x0,20-0,22 мкм) чешуйками с продольным утол-
щением. Отмечена многоядерная стадия в жизненном
цикле. Морские, с передней сократительной вакуолью.
Движение скользящее, бактериотрофы. Цисты не обна-
ружены.
424
THAUMATOMONADIDA
R. spinosa Cavalier-Smith 2011 (рис. 295, Д)
Баз.: Thaumatomastix Thomsen et al. 1993.
Одиночные жгутиконосцы размером 8x10 мкм с
длинным (23 мкм) гладким и коротким (6,5 мкм), по-
крытым чешуйками жгутиком. Оба жгутика без масти-
гонем. Жгутиковые чешуйки почти круглые диаметром
0,32-0,43 мкм (в среднем 0,37 мкм). Соматические че-
шуйки одного типа: плоское треугольное основание
(сторона треугольника 0,4-0,5 мкм) на котором имеет-
ся надстройка в виде сетчатой короны, иногда с пальце-
видным выступом в центре.
R. formosa Cavalier-Smith 2011 (рис. 295, Г)
Баз.: Thaumatomastix formosa Thomsen et al. 1993)
Тело жгутиконосца имеет форму эллипса разме-
ром 8x10 мкм с длинным (21 мкм) гладким и коротким
(3,5 мкм) покрытым чешуйками жгутиком. Оба жгути-
ка без мастигонем. Жгутиковые чешуйки дисковидные
диаметром 0,17-0,27 (в среднем 0,21) мкм. Плоские
соматические чешуйки полностью покрывают клетку,
имеют треугольные очертания со стороной треуголь-
ника 0,85-1,28 мкм. Состоят из двух примерно оди-
наковых пластинок, соединенных на вершинах тремя
полыми столбиками, напоминающими по форме бокал
для вина.
R. fragilis Cavalier-Smith 2011 (рис. 295, Е)
Баз.: Thaumatomastixfragilis Thomsen et al. 1995.
Клетки размером 6x4,6 мкм с двумя жгутика-
ми. Длинный (примерно 10 мкм) гладкий, а короткий
(6 мкм) покрыт мелкими овальными чешуйками раз-
мером 0,24x0,18 мкм с утолщенным краем. Однотип-
ные чешуйки покрывают все тело клетки. Они состоят
из плоской базальной пластинки в виде треугольника
с закругленными краями (длина стороны 0,45 мкм), с
которой соединяются симметрично расположенные
ветвящиеся палочки, оканчивающиеся крупным цен-
тральным шипом и короткими боковыми выступами.
R. fusiformis Cavalier-Smith 2011 (рис. 295, В)
Баз.: Thaumatomastixfusiformis Thomsen et al. 1995.
Клетки размером 11 x8 мкм с двумя жгутиками дли-
ной 12 и 4 мкм. Короткий жгутик покрыт похожими на
лодочку чешуйками размером 0,4-0,7x0,1-0,16 мкм с
загнутыми внутрь краями. Тело клетки покрыто одно-
типными чешуйками в форме короны: плотная базаль-
ная пластинка треугольная с закругленными краями и
стороной 0,65x0,75 мкм. Над плоскостью пластинки
возвышаются отростки, отходящие от каждого края
пластинки. Они образуют треугольные и пятиугольные
фигуры, а также прямоугольную перфорацию по краю
пластинки.
R. splendida Cavalier-Smith 2011 (рис. 295, М)
Баз.: Thaumatomastix Thomsen et al. 1995.
Шаровидные или немного вытянутые клетки раз-
мером 12-19x12-15 мкм, слегка сплющены дорсо-
вентрально. Длинный гладкий жгутик 15-20 мкм, по-
крытый чешуйками короткий жгутик около 8 мкм.
Овальные жгутиковые чешуйки варьируют в размерах
(0,29-0,55x0,22-0,34 мкм), представляют собой тонко
гранулярную пластинку с утолщенным краем и с не-
большим центральным выступом. Однотипные сома-
тические чешуйки имеют плоское основание в виде
треугольника с закругленными углами со стороной
0,79-0,98 мкм и заметным центральным выростом
длиной 1,19x1,98 мкм, который образуется в результа-
те слияния трех палочек, отходящих от середины пер-
форированного края пластинки. На дистальном конце
выроста эти палочки опять немного расходятся, а затем
соединяются в одной точке в виде небольшой шишечки.
R. igloolika Cavalier-Smith 2011 (рис. 295, Ж)
Баз.: Thaumatomastix igloolika Thomsen et Ikavalko
1997.
Шаровидные клетки диаметром около 7 мкм, ко-
роткий жгутик 4 мкм длиной покрыт мелкими (0,3—
0,4x0,125 мкм) удлиненными похожими на лодочку
чешуйками с утолщенным краем. Однотипные сома-
тические чешуйки состоят из плоского треугольного
основания со стороной 0,5-0,7 мкм и простым окайм-
ляющим ребром, поднятым над основанием на трех
угловых столбиках.
R. groenlandica Cavalier-Smith 2011 (рис. 295, К)
Баз.: Thaumatomastix groenlandica Thomsen et Ika-
valko 1997.
Покрытый чешуйками жгутик 4 мкм в длину, че-
шуйки овальные часто неправильной формы размером
0,3-0,35x0,15-0,2 мкм. Однотипные соматические че-
шуйки с плоским треугольным основанием со сторо-
ной 0,5-0,6 мкм, которое соединяется тремя столбика-
ми (0,15 мкм) в углах треугольника с опоясывающим
ребром. Ребро расположено параллельно основанию,
середины его сторон соединятся короткими балками с
центром дистальной части чешуйки.
R. nigeriensis Scoble et Cavalier-Smith 2011
(рис. 295, О)
Баз.: Thaumatomastix nigeriensis Wujek, Pershon et
Kadiri 2008.
Одиночные клетки размером 7x15 мкм с двумя
жгутиками. Длинный жгутик гладкий 12 мкм. Клетка
покрыта однотипными чешуйками. Чешуйка состоит
из треугольной пластинки с закругленными углами
(расстояние от вершины треугольника до противо-
положной стороны составляет 1,4-1,9 мкм); в центре
пластинки возвышается трехлопастной вертикальный
вырост (0,65-0,85 мкм); от каждой лопасти отходит к
центру перекладина, которая соединяется с двумя дру-
гими. Под этой конструкцией в центре пластинки на-
ходится отверстие, которое при взгляде сверху создает
иллюзию трех отверстий, поэтому авторы описывают
его как три поры между перекладинами.
Живые особи не наблюдали. Описание составлено
по тотальным препаратам.
THAUMATOMONADIDA
425
R. thomsenicomb. nov. (рис. 287, Д; 295, /7)
Баз.: Thaumatomastixjhomseni Twig 1997.
Овальные клетки 10-12,5x7-10 мкм, в световой
микроскоп виден только один жгутик, который в пол-
тора раза длиннее клетки. Узкая вентральная борозд-
ка простирается от жгутикового кармана примерно до
середины клетки. Жгутиковые чешуйки овальные 250-
310x165-195 нм с перфорированным краем. Соматиче-
ские чешуйки овальной формы 800-900x500-600 нм
состоят из двух пластинок, которые соединяются в
центре продольной полоской и овальными утолщени-
ями по краю.
R. punctata comb. nov. (рис. 295, С)
Баз.: Thaumatomastix punctata Thomsen (in Vors,
1992).
В этой работе приведены только фотографии сома-
тических чешуек. Жгутиковые чешуйки не наблюдали.
Описание самих представителей этого вида отсутст-
вует.
R. platyformis comb. nov. (рис. 287, В)
Баз.: Bodopsis platyformis Lackey 1940.
Особи размером 15-20 микрон в длину и 12-15 в
ширину, имеют овальные или округлые очертания, при
остановке слабо метаболируют. Небольшое углубление
спереди служит для образования коротких псевдопо-
дий. Отсюда же выходят жгутики. Передний — при-
мерно равен длине тела, рулевой — в 2,5 раза длиннее.
Крупное ядро с хорошо заметным ядрышком находится
в центре клетки. Вокруг ядра аккумулируются гранулы.
Временами обильны в морском бентосе.
Род Thaumatomastix Lauterbom 1899
Син.: Tentaculomonas Skvortzow et Noda 1969.
Фаготрофные тауматомонады. Два жгутика выхо-
дят субапикально и обращены на вентральную сторо-
ну; у некоторых видов редуцированы. Соматические
чешуйки в два слоя покрывают клетку, наружные че-
шуйки обычно представлены спикулами, которые
видны в световой микроскоп. Некоторые виды несут
очень мелкие чешуйки на поверхности переднего жгу-
тика (Thomsen et al., 1993, 1995; Thomsen, Ikavalko,
1997).
Диагнозы приведенных ниже валидных видов
сводятся, как правило, к описанию формы чешуек
(рис. 295).
Типовой вид: Т. setifera (Lauterbom 1896) Laut-
erbom 1899.
Т. setifera (Lauterbom 1896) Lauterbom 1899
(рис. 287, A)
Жгутиконосцы овальные немного уплощены дор-
совентрально, длиной 14-17 мкм. Клетки покрыты
слоем чешуек с длинными тонкими шипами. Вен-
тральная бороздка простирается от переднего углу-
бления, из которого выходят два жгутика, до заднего
конца. Передний жгутик немного меньше или равен
длине тела, задний — составляет 1,2-1,6 длины клет-
ки. Ядро лежит спереди. Особи перемещаются скользя
по субстрату. Этот вид не исследован в электронный
микроскоп, поэтому форма и точные размеры чешуек
неизвестны.
Т. bipartita Beech et Moestrup 1986
(рис. 295, A)
Клетки в форме эллипса размером 10x5 мкм с од-
ним видимым жгутиком длиной 10 мкм. Тело клетки
покрыто многочисленными чешуйками двух типов.
Спикулы (2,5-3,0 мкм) имеют округло-треугольную
пластинку в основании со стороной 0,5 мкм. От нее
отходят три коротких столбика, которые сливаются на
расстоянии 200 нм непосредственно перед располо-
женным дистальнее утолщением в форме воротничка
шириной 100 нм. Дистальная часть спикулы раздваива-
ется на расстоянии от половины до 74 его длины. При
этом обе ветви лежат под углом примерно 45° и стянуты
друг с другом тонкой пленкой. Плоские чешуйки состо-
ят из двух овальных пластинок размером 1,7-2,0x0,9-
1,1 мкм каждая. Наружная пластинка имеет углубление
в центральной части, где обе пластинки соединяются
поперечной балкой. В результате наружная пластинка
оказывается разделена на две полукруглые зоны.
Т. patelliformis (Takahashi et Hara) Beech
et Moestrup 1986 (рис. 295, И)
Баз.: Chrysosphaerella patelliformis Takahashi et
Hara 1984; син.: Spiniferomonas patelliformis (Taka-
hashi et Hara) Nicholls 1984.
Лишь несколько особей было изучено в электрон-
ный микроскоп, живых не наблюдали, поэтому особен-
ности жгутиков и формы клетки неизвестны. Особи
этого вида имеют большое сходство с представителями
Т. tripus (см. далее). Отличия касаются только размеров
чешуек. Плоские чешуйки со стороной 1,0-1,8 мкм.
Спикулы имеют плоское основание диаметром 0,5-
0,7 мкм, воротничок — 0,2-0,4 мкм, столбики между
ними длиной 0,3-0,4 мкм, а длина спикулы 3,4-6,6 мкм
(Beech, Moestrup, 1986).
Т. salina (Birch-Andersen) Beech et Moestrup 1986
(рис. 287, Г; 295, /7)
Син.: Chrysosphaerella salina Birch-Andersen 1973.
Клетки овальные размером 7-12x8-15 мкм слег-
ка уплощены дорсовентрально. Длинный жгутик ра-
вен 3/4—5/4 длины клетки, гладкий; короткий жгутик
едва заметен, покрыт мелкими овальными чешуйками
(0,6-0,75x0,2-0,3 мкм) с продольно расположенным
гребнем в центре. Вентральная бороздка тянется от
жгутиковой ямки примерно до середины тела клетки.
Обычно особи передвигаются скользя по субстрату с
волочащимся длинным жгутиком.
Клетка покрыта двумя типами соматических чешу-
ек. Наружные чешуйки представлены длинными спи-
426
THAUMATOMONADIDA
кулами, видны в световой микроскоп. Они значительно
варьируют в длину (2-10 мкм) и всегда оканчиваются
тремя зубцами. Основание чешуйки треугольное с за-
кругленными углами имеет утолщение по краю. От
углов пластинки основания возвышаются три столби-
ка, которые соединяются друг с другом над центром
основания чешуйки (на высоте примерно 0,2 мкм).
Непосредственно над местом их слияния находится
воротничок, который по форме похож на основание че-
шуйки (размером примерно на треть меньше) и распо-
ложен параллельно ему. Дистально от воротничка идет
собственно спикула, которая на поперечном срезе по-
хожа на трехтавровую балку.
Плоские овальные чешуйки внутреннего слоя со-
стоят из двух соединенных между собой примерно
одинаковых по размеру пластинок. Обращенная на-
ружу пластинка блюдцевидной формы с утолщенным
широким краем имеет углубление по малому диаметру,
сливаясь в этой зоне с проксимальной пластинкой. Обе
ее половинки пронизаны отверстиями.
Т. tripus (Takahashi et Hara) Beech et Moestrup 1986
(рис. 287,5; 295,77)
Баз.: Chrysosphaerella tripus Takahashi et Hara 1984;
син.: Spiniferomonas tripus (Takahashi et Hara) Nicholls
1984.
Клетки овальной формы размером 8-15x12-21 мкм
слегка сплющены дорсовентрально. Длинный жгутик
чуть длиннее клетки, короткий — лишь немного вы-
ступает за пределы жгутикового кармана. Короткий
жгутик не удалось наблюдать в электронный микро-
скоп, поэтому форма и размеры его чешуек неизвест-
ны (Beech, Moestrup, 1986). Спикулы 20-30 наружных
чешуек достигают длины 7-15 мкм и хорошо видны в
световой микроскоп. Оба типа соматических чешуек
имеют трехлучевую симметрию. Плоские чешуйки со-
стоят из двух параллельно расположенных треугольных
пластинок с закругленными углами, соединенных тре-
мя столбиками. Сторона плоской чешуйки 1,8-2,5 мкм.
Плоское основание спикулы диаметром 0,8-1,4 мкм со-
единяется с воротничком (0,3-0,6 мкм) тремя столбика-
ми длиной 0,6-0,8 мкм.
Т. tauryanini Mikrjukov 2002
(рис. 295, Р)
Одиночные клетки округлой формы диаметром
22-26 мкм. Жгутики не были обнаружены ни у одного
из трех найденных экземпляров ни под световым, ни
под электронным микроскопом. Чешуйки внутренне-
го слоя (размером 3,3-3,7 мкм) состоят из двух парал-
лельных пластинок треугольной формы, соединенных
в местах трех симметрично расположенных субпери-
ферических инвагинаций наружной пластины, кото-
рая окружена широкой, гладкой периферической кай-
мой около 0,8 мкм толщиной. Внутренняя пластина
плоская и бесфактурная. Спикулы 10-13 мкм длиной,
прямые или слегка изогнутые в проксимальной ча-
сти, с массивным, цилиндрическим, не сужающимся
стволом примерно 0,4 мкм толщиной. Базальная часть
спикул представлена характерной для рода пьедестало-
видной структурой, образованной округлой базальной
пластинкой, от которой берут начало ствол и три пло-
хо выраженные ручки-подпорки; последние образуют
округлый воротничок, опоясывающий ствол вместе их
схождения. Ствол оканчивается верхушкой, состоящей
из трех затупленных маргинальных зубцов.
Обнаружены в морских (соленость ~29%о) пробах
поверхностного слоя алевритового ила.
Род Gyromitus Skuja 1939
Обычно плавающие тауматомонады с двумя жгу-
тиками равной длины. Оседая на субстрат формируют
псевдоподии, переходя в амебоидную стадию. Сомати-
ческие чешуйки видны только в электронный микро-
скоп. Электронно-микроскопические исследования
G. disomatus продемонстрировали все основные черты
тауматомонад (Swale, Belcher, 1974, 1975).
Типовой вид: G. disomatus Skuja 1939 (рис.
287, Е).
G. disomatus Skuja 1939
Плавающие особи размером 15-22 микрона в дли-
ну с двумя равными жгутиками, с расширенным перед-
ним концом и слегка спирально закрученным задним,
так что клетка напоминает стилизованное изображение
сердца. Жгутики выходят из углубления на переднем
конце. Две сократительные вакуоли лежат по обе сто-
роны жгутикового кармана, плавающие клетки слегка
метаболируют, иногда имеют хвостовые псевдоподии.
На заднем конце имеется небольшая бороздка. У осев-
ших на субстрат клеток жгутики не видны, быстро фор-
мируются ветвящиеся псевдоподии. Иногда клетка не
формирует псевдоподии, но становится сильно мета-
болирующей, при этом жгутики медленно ундулируют.
Поверхность особи покрыта однотипными чешуйками
размером 0,5><0,3 мкм, которые представляют собой
открытую коробочку овальной формы с плоским ос-
нованием и перфорированной стенкой. Верхний край
коробочки утолщен.
Замечания. Строение чешуек и особенности био-
логии дополнены по работе Свэйл и Белчер (Swale,
Belcher, 1974), которые исследовали ультраструктуру
клетки. Изученные в этой работе особи отличались от
первоописания только по размерам (10-18 мкм).
G. cordiformis Skuja 1948
Отличается от G. disomatus главным образом тем,
что псевдоподии формируются не на заднем конце
клетки, а в ее средней части из вентральной бороздки.
Форма чешуек неизвестна.
G. Umax Swale et Belcher 1975
(рис. 288)
Ползающие клетки грушевидной формы слегка
уплощенные, длиной 18-26 микрон, с двумя гладкими
жгутиками одинаковой длины, выходящими из перед-
THAUMATOMONADIDA
427
него углубления. На заднем конце клетки имеется уз-
кая бороздка, из которой выходят тонкие псевдоподии.
Клетки покрыты одним слоем одинаковых чешуек раз-
мером 0,6x0,3x0,2 мкм, имеющих плоское овальное
основание, соединенное на каждом конце тремя стол-
биками с наружным ободком. Ободок вытянут вдоль
основания пластинки, на концах имеет круглое сече-
ние, а в средней части утолщен, имея сечение в форме
немного скругленного уголка.
Клетка подвержена медленным изменениям фор-
мы, часто становится полностью амебоидной. Плаваю-
щие формы не обнаружены.
G. clavideferens comb. nov.
(рис. 303, A-В)
Баз.: Peregrinia clavideferens Howe, Arndt and Cav-
alier-Smith 2011.
Особи сильно метаболирующие неопределенной
формы, уплощенные в виде диска, размеры сильно ва-
рьируют (14-40 мкм) в среднем 25,4 мкм. Жгутики не
видны. Пальцевидные и заостренные длинные ветвя-
щиеся псевдоподии формируются по всей поверхности
клетки. Клетки передвигаются скользя по субстрату,
часто формируют лидирующую ламеллиподию. По-
верхность клетки покрыта слоем однотипных чешу-
ек, похожих по форме и размерам на таковые G. Птах.
Отличаются наличием перфорированных пластинок в
средней части ободка. Клетки заполнены крупными и
мелкими вакуолями. Цисты вакуолизированы, шаро-
видные, диаметром 11-14 мкм. Два жгутика были за-
метны только при выделении культуры из природной
пробы.
Род Hyaloselene Skuja 1956
Ползающие латерально уплощенные тауматомона-
ды с двумя неравными жгутиками. Способны форми-
ровать псевдоподии, но переход к амебоидной стадии
наблюдается редко. Имеют экструсомы, чешуйки не
видны в световой микроскоп.
Типовой вид: Н. compressa Skuja 1956 (рис.
287, И). Скуя описал еще один вид Н. dubia Skuja 1964,
который позднее не отмечали. Представители рода не
изучены.
Род Allas Sandon 1927
Особи с округлым пластичным телом, немного упло-
щены дорсовентрально. Обладают коротким передним и
длинным задним жгутиками. Обнаружены в почве.
Единственный вид — A. diplophysa Sandon 1927
Описанный вид обладает большим сходством с
представителями рода Thaumatomonas. Морфологи-
ческое и генетическое сходство настолько велико, что
логично было бы объединить оба рода в один (Howe
et al., 2011). Однако, как справедливо отмечают авторы
указанной статьи, поскольку Allas описан раньше, то
нужно упразднять род Thaumatomonas и все его виды
перенести в Allas. Эта формальная операция сталки-
вается с одной серьезной проблемой — представите-
ли рода Thaumatomonas изучены лучше всех других
тауматомонад, в то время как Allas не изучен совсем.
Поэтому следует согласиться с идеей оставить такие
формальные перестановки до детального исследования
типового вида A lias diplophysa.
SUMMARY
The description of the taxonomy, morphology, behavior, life
cycle, feeding, reproduction, phylogeny and ecology of thaumato-
monads has been described including the most recent data (Howe
et al., 2011; Zolotarev et al., 2011; Ota et al., in press). A species
description for all thaumatomonad genera: Thaumatomonas, Reck-
ertia, Thaumatomastix, Gyromitus, Hyaloselene and Allas, which
are not united in the families, has been done. A family Peregriniidae
Cavalier-Smith 2011, and a genus Peregrinia were not accepted
here as the type species P clavideferens Howe, Arndt et Cavalier-
Smith 2011 is just a new species of Gyromitus — G. clavideferens
comb. nov.
Bodopsis (Klebs 1892) Lemmermann 1914 was removed from
Thaumatomonadida as type species B. alternans (Klebs) Lemmer-
mann 1914 is cardinally different from thaumatomonads. Bodopsis
godboldi Lackey 1933 and B. platyformis Lackey 1940 were trans-
ferred to Thaumatomonas godboldi comb. nov. and Thaumatomonas
platyformis.
Following the idea by Howe et al. (2011) to keep a genus Re-
ckertia for thaumatomonads without spicules, but with flagel-
lar scales, the species Thaumatomastix thomseni, T punctata and
T platyformis were transferred to Reckertia as R. thomseni comb,
nov., R. punctata comb. nov. and R. platyformis comb. nov. The
name Thaumatomonas oxoniensis Bass et Cavalier-Smith, 2011 is a
younger synonym of T. coloniensis Wylezich, Mylnikov, Weitere et
Arndt 2006 as both species have nearly identical 18S rRNA and ITS2
sequences, and very similar somatic scales. Thaumatomonas vancou-
veri Cavalier-Smith et Chao 2011 was regarded invalid, because the
scale description is incomplete.
ЛИТЕРАТУРА
Балонов И.М. 1980. О новом виде рода Chrysosphaerella (Chryso-
phyta) // Бот. журн. Т. 65. С. 1190-1191.
Жуков Б.Ф. 1971. Определитель бесцветных свободноживущих жгу-
тиконосцев подотряда Bodonina Hollande // Биология и продуктивность
пресноводных организмов. Л.: Наука. С. 241-284.
Карпов С.А. 1987. Строение жгутикового аппарата у бесцветно-
го жгутиконосца Thaumatomonas lauterborni и оценка концепции эволю-
ционного консерватизма клеточных структур // Цитология. Т. 29. № 12.
С.1349-1353.
Карпов С.А. 1990а. Анализ отрядов Phalansteriida, Spongomonadida,
Thaumatonadida (Mastigophora) // Зоол. журн. Т. 69. Вып. 3. С. 5-12.
Карпов С.А. 19906. Система протистов. Омск: Межвузовск. тип.
Омск. пед. ин-та. 195 с.
Карпов С.А. 1993. Ультратонкое строение бесцветного жгути-
коносца Thaumatomonas seravini И Цитология. Т. 35. Вып. 9. С. 8-
11.
Карпов С.А., Жуков Б.Ф. 1987. Особенности ультраструктуры бесц-
ветного жгутиконосца Thaumatomonas lauterborni И Цитология. Т. 29. № 10.
С. 1168-1171.
Карпов С.А., Макаренкова Е.П. 1989. Фагоцитоз и эндоцитоз у
бесцветного жгутиконосца Thaumatomonas lauterborni И Цитология.
Т. 31. №3. С. 347—349.
428
THAUMATOMONADIDA
Микрюков K.A. 2002. Thaumatomastix tauryanini sp. n. (Protista,
Sarcomonadea, Thaumatomonadida) — фаготрофный амебоидный жгу-
тиконосец из донного осадка Белого моря // Зоол. журн. Т.81. Вып. 2.
С. 261-265.
Мыльников A.IL, Карпов С.А. 1993. Новый представитель от-
ряда Thaumatomonadida — Thaumatomonas seravini И Зоол. журн. Т. 72.
Вып. 9. С. 5-10.
Мыльников А.П., Мыльников А.А. 2003. Новый амебоидный
жгутиконосец Thaumatomonas zhukovi (Thaumatomonadida, Protozoa) //
Зоол. журн. Т. 82. № 12. С. 1411-1417.
Мыльников А.П., Мыльникова З.М. 2011. Ультратонкое строе-
ние амебоидного жгутиконосца Thaumatomonas zhukovi (Thaumatomo-
nadida (Shirkina) Karpov, 1990) // Биология внутренних вод (в печати).
Ширкина Н.И. 1987. Морфология и жизненный цикл Thaumatomonas
lauterbomi De Saedeleer, 1931 (Mastigophora) // Фауна и биология пресно-
водных организмов. Л.: Наука. С. 87-101.
Auer В., Kiertucki Е., Arndt Н. 2003. Distribution of benthic hetero-
trophic flagellates in a mesotrophic lake //Arch. Hydrobiol. Vol. 158. P. 127—
144.
Arndt H., Dietrich D., Auer B., eleven E.-J. Grafenhan T., Weitere
M., Mylnikov A.P. 2000. Functional diversity of heterotrophic flagellates in
aquatic ecosystems // Leadbeater, B.S.C., Green, J.C. (eds) The Flagellates.
Taylor and Francis, London and New York. P. 140-268.
Beech P.L., Moestrup 0. 1986. Light and electron microscopic observa-
tions on the heterotrophic protists Thaumatomastix salina comb. nov. (syn. Chrys-
osphaerella salina) and its allies //Nord. J. Bot. Vol. 6. P 865-877.
Cavalier-Smith T., Chao E.E. 2003. Phylogeny and classification of
phylum Cercozoa (Protozoa) // Protist. Vol. 154. P. 341-358.
Cavalier-Smith T., Karpov S.A. 2011. Paracercomonas kinetid ultra-
structure, origins of the body plan of Cercomonadida, and cytoskeleton evolu-
tion in Cercozoa // Protist, doi: 10.1016/j.protis.2011.06.004
Dietrich D., Arndt H. 2000. Biomass partitioning of benthic microbes
in a Baltic inlet: relationship between bacteria, algae, heterotrophic flagellates
and ciliates // Mar. Biol. Vol. 136. P. 309-322.
Ekelund E, Daugbjerg N., Fredslund L. 2004. Phylogeny of Het-
eromita, Cercomonas and Thaumatomonas based on ssu rDNA sequences,
including the description of Neocercomonas jutlandica sp. nov., gen. nov. //
Eur. J. Protistol. Vol. 40. P. 119-135.
Hoppenrath M., Leander B.S. 2006. Dinoflagellate, Euglenid, or Cer-
comonad? The ultrastructure and molecular phylogenetic position of Protas-
pis grandis n. sp. // J. Euk. Microbiol. Vol. 53. P. 27-342.
Howe A.T., Bass D., Scoble J.M., Lewis R., Vickerman K., Arndt H.,
Cavalier-Smith T. 2011. Novel cultures protists identify deep-branching en-
vironmental DNA clades of Cercozoa: new genera Tremula, Micrometopion,
Minimassisteria, Nudifila, Peregrinia H Protist. Vol. 162. P. 332-372.
Karpov S.A. 2010/11. Flagellar apparatus structure of Thaumatomo-
nas (Thaumatomonadida) and thaumatomonad relationships // Protistology.
Vol. 6. No. 4. P. 326-344.
Karpov S.A., Bass D., Mylnikov A.P., Cavalier-Smith T. 2006. Mo-
lecular phylogeny of Cercomonadidae and kinetid patterns of Cercomonas
and Eocercomonas gen. nov. (Cercomonadida, Cercozoa) // Protist. Vol. 157.
P. 125-158.
Lee W.J., Patterson D.J. 2000. Heterotrophic flagellates (Protista) from
marine sediments of Botany Bay, Australia // J. Nat. Hist. Vol. 34. P. 483-
562.
Lackey J.B. 1933. The structure and division of Bodopsis godboldi,
spec. nov. // Biological Bulletin, Marine Biological Laboratory Wood’s Hole.
Vol. 65. P. 498-507.
Lackey J.B. 1940. Some new flagellates from the woods hole area //
American Midland Naturalist. Vol. 23. No. 2. P. 463-471.
Lauterbom R. 1899. Protozoen-Studien IV. Theil. Flagellaten aus dem
Gebiete des Oberrheins // Zeitschr wiss Zool. Bd 65. S. 369-391.
Lemmermann E. 1914. Heft 1, Flagellatae 1 // Gustav Fischer. Jena.
Moestrup 0. 1982. Flagellar structure in algae: a review, with obser-
vations particularly on the Chrysophyceae, Phaeophyceae (Fucophyceae),
Euglenophyceae and Reckertia H Phycologia. Vol. 27. P. 427-528.
Mylnikov A.P., Karpov S.A. 2004. Review of diversity and taxonomy
of cercomonads // Protistology. Vol. 3. P. 201-217.
Ota S., Eikrem W., Edvardsen B. Ultrastructure and molecular phylo-
geny of thaumatomonads (Cercozoa) with emphasis on Thaumatomastix sa-
lina from Oslofjorden, Norway // Protist (in press).
Patterson D.J., Vors N., Simpson A.G.B., O’Kelly C. 2001. Residual
heterotrophic flagellates // J.J. Lee, G.F. Leedale and P. Bradbury (eds). An
Illustrated guide to the protozoa. 2nd edition. Allen press, Society of Protozo-
ologists. P. 1302-1327.
Patterson DJ^ Zolffel M. 1991. Heterotrophic flagellates of uncertain
taxonomic position // Free-living heterotrophic flagellates. Oxford: Clarendon
Press. P. 427-476.
Saedeleer H. de. 1931. Notes de Protistologie IV. Thaumatomonas
Lauterbomi, n. g., n. sp., flagelle nouveau: cytologie, cycle biologique, posi-
tion systematique // Recueil L’Instit Zool Torley-Rousseau. Vol. 3. P. 89-103.
Sandon H. 1927. The Composition and Distribution of the Protozoan
Fauna of the Soil // Oliver and Boyd, Edinburgh.
Skuja H. 1939. Beitrag zur Algenflora Lettlands IIH Acta Horti botanici
Universitatis latviensis. Bd 11/12. S. 41-169.
Skuja H. 1948. Taxonomie des Phytoplanktons einiger Seen in Up-
pland, Schweden // Symbolae botanicae Upsaliensis. Bd 9. S. 1-399.
Skuja H. 1956. Taxonomische und biologische Studien das Phytoplank-
ton schwedischer Binnengewasser // Nova Acta Regiae Societatis Scien-
tiarum Uppsaliensis. 4th ser. Bd 16. S. 1-403.
Skuja H. 1964. Grundzuge der Algenflora und Algenvegetation der
Fjeld-gegenden um Abisko in Schwedish-Lappland // Nova Acta Regiae So-
cietatis Scientiarum Uppsaliensis. 4th ser. Bd 18. S. 1^165.
Swale E.M.E, Belcher J.H. 1974. Cyromitus disomatus Skuja — a free-
living colourless flagellate//Arch. Protistenkd. Vol. 116. P. 211-220.
Swale E.M.E, Belcher J.H. 1975. Gyromitus Umax nov. sp. — a free-
living colourless flagellate // Arch. Protistenkd. Vol. 117. P. 20-26.
Thomsen H.A., Ikavalko J. 1997. Species of Thaumatomastix (Thau-
matomastigidae, Protista incertae sedis) from the Arctic sea ice biota (North-
East Water Polynya, NE Greenland) // J. Mar. Sys. Vol. 10. P. 263-277.
Thomsen H.A., Hallfors G., Hallfors S., Ikavalko J. 1993. New obser-
vations on the heterotrophic protist genus Thaumatomastix (Thaumatomas-
tigaceae, Protista incertae sedis), with particular emphasis on material from
the Baltic Sea //Ann. Bot. Fennici. Vol. 30. P. 87-108.
Thomsen H.A., Kosman C., Ikavalko J. 1995. Three new species of
Thaumatomastix (Thaumatomastigidae, Protista incertae sedis), a ubiquitous
genus from the Antarctic ice biota // Eur. J. Protistol. Vol. 31. P. 174-181.
Vickerman K., Brugerolle G., Mignot J.-P. 1991. Mastigophora H
Microscopic anatomy of invertebrates. Vol. 1. Protozoa. New York etc.: Wi-
ley-Liss. P. 13-159.
Vickerman K. 1988. Thaumatomonas lauterbomi’. a scale-secreting
amoeboflagellate with a plasmodial phase in its life cycle // Abstr. 41st Ann.
Meet. Soc. Protozool. Bristol. England. P. 32.
Vors N. 1992. Heterotrophic amoebae, flagellates and heliozoa from the
Tvarminne area, Gulf of Finland, in 1988-1990 // Ophelia. Vol. 36. P. 1-109.
Wujek D.E., Pershon L.E., Kadiri M.O. 2008. Description of a new
freshwater species of Thaumatomastix (Thaumatomastigidae, Protista incer-
tae sedis) from Nigeria, West Africa // Tropical Freshwater Biology. Vol. 17.
No. 2. P. 13-20.
Wylezich C., Mylnikov A., Weitere M., Arndt H. 2007. Distribution
and phylogenetic relationships of freshwater thaumatomonads with a descrip-
tion of the new species Thaumatomonas coloniensis n. sp. // J. Euk. Micro-
biol. Vol. 54. No. 4. P. 347-357.
Zolotarev V.A., Myl’nikova Z.M. and Myl’nikov A.P. 2011. The ultra-
fine structure of amoeboid flagellate Thaumatomastix sp. (Thaumatomonadida
(Shirkina) Karpov, 1990) // Inland Water Biology. Vol. 4. No. 3. P. 287-292.
CRYOMONADIDA Cavalier-Smith 1993
Гетеротрофные жгутиконосцы и амебы, покрытые плотно
прилегающей тонкой однослойной или толстой многослойной
раковиной за исключением жгутиковых карманов и вентральной
бороздки. Два гладких (редко с простыми мастигонемами) гете-
родинамичных жгутика, отходящих раздельно, приблизительно
под прямым углом друг к другу; или жгутики отсутствуют. Ки-
нетосомы жгутиков связаны поперечно-исчерченным мостиком
и от них начинаются несколько микротрубочек, одна из которых
направлена к ядру. Переходная зона жгутиков может содержать
спираль или цилиндр над поперечной пластинкой. Митохондрии
с трубчатыми кристами. В цитоплазме, обычно присутствуют
цилиндрические экструсомы, микротельца, липидные капли и
слизистые тела. Питание с помощью псевдоподии, выходящей
из вентральной бороздки. Размножение продольным делением.
Митоз открытый с кинетосомами в качестве ЦОМТов. В гене
полиубиквитина одна вставка, кодирующая аминокислоту. Бак-
териотрофы, хищники и альготрофы. Пресноводные, морские и
почвенные.
История изучения
Представители рода Cryothecomonas описаны от-
носительно недавно как двужгутиковые хищные жгу-
тиконосцы, обитающие подо льдом морских водоемов
(Thomsen et al., 1991). Уникальное строение раковинки,
прилегающей к поверхности клетки, наличие вентраль-
ной бороздки и обитание в холодных водах выделяет
этих протистов среди других жгутиконосцев. Позже
были описаны виды Cryothecomonas из относительно
теплых летних биотопов Северного моря (Drebes et
al., 1996; Schnepf, Kuhn, 2000). Исследование ультра-
структуры подтвердило единство плана строения всех
известных видов рода (Thomsen et al., 1991; Drebes et
al., 1996; Schnepf, Kuhn, 2000).
В 1993 Кавалье-Смит (Cavalier-Smith, 1993) пред-
ложил выделить род Cryothecomonas в монотипный
отряд Cryomonadida. Увеличение объема этого отряда
началось с внедрением молекулярных методов в так-
сономии. Так, первые работы в этом направлении по-
казали, что штаммы Cryothecomonas aestivalis состав-
ляют хорошо очерченную кладу, а сиквенсы Potaspa
(Cryothecomonas) longipes образуют сестринскую ветвь
(Kuhn et al., 2000). Последующие работы показали, что
к отряду криомонад необходимо относить группы не-
которых двужгутиковых и безжгутиковых организмов
(Protaspa, Rhizaspis, Rhogostoma), которые заключены
в тонкостенную раковину (Nikolaev et al., 2003; Bass et
al., 2005; Hoppenrath, Leander, 2006; Howe et al., 2011).
Начиная с последнего десятилетия XX века, криомонад
находят регулярно в морских, реже, в пресных водах
и почве (Larsen, Paterson, 1990; Thomsen et al., 1991;
Ekelund, Patterson, 1997; Lee, Patterson, 2000; Lee et
al., 2005; Auer, Arndt, 2001). В течение этого времени
появились данные о тонком строении клеток 6 видов
Cryothecomonas, одного вида Protaspa и одного вида
Rhogostoma (Simitzis, Goff, 1981; Thomsen et al., 1991;
Drebes et al., 1996; Schnepf, Kuhn, 2000; Hoppenrath,
Leander, 2006). В настоящее время основным методом
при выяснении положения этих жгутиконосцев и амеб
в группе Cercozoa является молекулярно-филогенети-
ческий анализ.
Классификация
Состав таксона приведен в соответствии с послед-
ними изменениями в таксономии криомонад (Howe et
al., 2011).
Отряд Cryomonadida Cavalier-Smith 1993
Сем. Protaspidae (Skuja) Cavalier-Smith 1993
Cryothecomonas Tomsen et al. 1991
C. armigera Tomsen et al. 1991
C. aestivalis Drebes et al. 1996
C. inermis Tomsen et al. 1991
C. scybalophora Tomsen et al. 1991
C. vesiculata Tomsen et al. 1991
Protaspa (Skuja) Cavalier-Smith 2011
P gemmifera (Larsen et Patterson) Cavalier-Smith 2011
P. glans (Skuja) Cavalier-Smith 2011
P grandis (Hoppenrath et Leander) Cavalier-Smith 2011
P longipes (Schnepf et Kuhn) Cavalier-Smith 2011
P maior (Skuja) Cavalier-Smith 2011
P metarhiza (Skuja) Cavalier-Smith 2011
P obaniformis (Chantangsi et Leander) Cavalier-Smith 2011
P obliqua (Larsen et Patterson) Cavalier-Smith 2011
P obovata (Skuja) Cavalier-Smith 2011
P oviformis (Chantangsi et Leander) Cavalier-Smith 2011
P rotunda (Chantangsi et Leander) Cavalier-Smith 2011
P simplex (Vors) Cavalier-Smith 2011
P tanyopsis (Norris) Cavalier-Smith 2011
P tegere (Larsen et Patterson) Cavalier-Smith 2011
430
CRYOMONADIDA
P verrucosa (Larsen et Patterson) Cavalier-Smith 2011
Сем. Rhizaspididae (Skuja) Cavalier-Smith 2011
Rhizaspis Skuja 1948
R. granulata Skuja 1948
R. simplex Skuja 1948
Rhogostoma Belar 1921
R. minus Belar 1921
R. micra Cavalier-Smith et Scoble 2011
R. schuessleri Belar 1921
R. timida Cavalier-Smith 2011
Capsellina Penard 1909
C. bryorum Penard 1909
Морфология
Представителей семейства Protaspidae несут 2
жгутика. Клетка овальная, уплощенная с небольшой
папиллой или более крупным выростом на переднем
конце (рис. 304, А, Б, В; 305, А, Б; 306, А, Б, Д, К, Р)
(Thomsen et al., 1991; Drebes et al., 1996; Schnepf, Kuhn,
2000; Hoppenrath, Leander, 2006). Раковина, плотно при-
легающая к поверхности клетки, состоит из несколь-
ких слоев: под внешним гребенчатым лежит аморфный
слой, затем тонкий плотный, и к мембране прилегает
внутренний аморфный слой (рис. 304, Г, Д, И\ 305, В).
Поверхностные гребни идут почти параллельными
рядами (рис. 304, Ж). В месте отхождения жгутиков
раковина образует воронку с электронно-плотной стен-
кой, состоящей из трех слоев (рис. 304, Г,Д). Внешние
слои раковины имеют поры для выстреливания экстру-
сом (рис. 305, В). Раковина отсутствует на небольших
участках в районе жгутикового кармана и цитостома
(рис. 304, Г, Д, И). У питающихся и делящихся особей
С. aestivalis раковина частично или полностью реду-
цирована. Она образует плотный воротничок и муфту
вокруг проксимального конца жгутиков (рис. 304, Д;
306, А, Б).
Жгутики отходят от переднего конца клетки у осно-
вания папиллы из двух раздельных жгутиковых карма-
нов (рис. 304, А-Г). У большинства криомонад жгутики
гладкие; простые мастигонемы (6 нм толщиной и 700-
800 нм длиной) обнаружены у Protaspa longipes. Аксо-
нема устроена по формуле 9+2. Параксиальный тяж в
жгутиках отсутствует. В переходной зоне жгутика две
поперечные пластинки: одна (проксимальная) на уров-
не поверхности клетки, другая (дистальная) значитель-
но выше. Между ними находится электронно-плотная
структура, напоминающая катушку ниток (рис. 306, А).
Над дистальной поперечной пластинкой находится
спиральный филамент, образующий 6 витков высотой
175 нм (рис. 304, И\ 306, А). У С. aestivalis спираль в
переходной зоне жгутиков состоит из 2-7 плотных ко-
лец. У С. vesiculata эта структура напоминает цилиндр.
Кинетосомы относительно длинные (750-900 нм) с
колесовидной структурой, расположены друг к другу
под углом 70-100° (рис. 304, Г). От их периферических
триплетов отходят радиально расходящиеся сателлиты
и фибриллы (рис. 306, А, Г). Кинетосомы некоторых
видов соединены поперечно-исчерченным мостиком
(рис. 306, Б, В). Корешковая система жгутиков слабо
развита. Микротрубочки обычно группами по 3-^1 про-
ходят около кинетосом и ядра, а также заметны под
плазмалеммой в переднем конце клетки. Точное распо-
ложение этих корешков не установлено. У С. aestivalis
и Р longipes одна лента микротрубочек отходит от ки-
нетосом к поверхности клетки, другие микротрубочки
выстилают жгутиковые карманы (рис. 306, В).
Большое ядро с центральным ядрышком лока-
лизовано в переднем конце клетки, реже в заднем
(рис. 304, Л*; 305, Б; 307, А-Т). У С. aestivalis изредка
встречаются два ядрышка в ядре (Drebes et al., 1996).
Ядерные поры хорошо заметны. У Protaspa grandis
ядро содержит большое ядрышко и постоянно конден-
сированные хромосомы (рис. 305, Б), а на передней
стороне ядра заметно углубление. В световой микро-
скоп на передней стороне ядра заметны прилегающие
колпачки неясной природы (рис. 307, В, Q. Овальные
или продолговатые митохондрии имеют трубчатые
кристы (рис. 304, 3; 305, В, Д). В клетке обычно рас-
полагается несколько диктиосом аппарата Гольджи
(рис. 305, Г).
Для некоторых видов Cryothecomonas харак-
терны цилиндрические экструсомы одного размера
(рис. 304, Е). У Protaspa longipes клетка содержит экс-
трусомы трех размеров. У Protaspa grandis экструсо-
мы сгруппированы в батареи. Отдельная экструсома
окружена унитарной мембраной и состоит из палоч-
ковидной структуры длиной до 5 мкм и передней ча-
шечки (колпачка) (рис. 304, 77). Диаметр экструсомы
составляет 0,10-0,12 мкм. Внутри палочковидной
структуры проходит узкий канал. Сердцевина экстру-
сомы окружена цилиндром с плотной стенкой и ино-
гда исчерчена (расстояние между полосками равно
10 нм). В месте контакта дистального конца экстру-
сомы обнаружены небольшие инвагинации — поры
(рис. 305, В, Е). Экструсомы формируются в цистер-
нах аппарата Гольджи.
У непитающихся особей Cryothecomonas цитостом
в виде узкой щели расположен в вентральной бороздке
в задней части клетки; у Protaspa — в передней, сред-
ней или задней части клетки. Во время захвата пищево-
го объекта цитостом значительно расширяется. Из него
выходит псевдоподия, содержащая пучок микротрубо-
чек (рис. 304, М). Через цитостом также идет процесс
экзоцитоза. Около цитостома в цитоплазме скапливает-
Рис. 304. Строение клетки Cryothecomonas armigera (А-В,Д-Л) и С. scybalophora (Г, М).
А — общий вид клетки, световой микроскоп; Б, В — сканирующий микроскоп; Г— расположение жгутиков; Д — строение жгутика; Е — участок
цитоплазмы; Ж — покровы; 3 — митохондрия; И— строение переходной зоны жгутиков; К— ядро; Л— экструсома; М— псевдоподия, вр — во-
ронка, кл — колпачок на переднем конце экструсомы, кс — кинетосома, мг — маленькие гранулы, пв — пищеварительная вакуоль, пп — папилла,
пс — псевдоподия, рв — раковина, сп — спираль в переходной зоне жгутика, экс — экструсома, я — ядро, ям — ямка на поверхности клетки, стрел-
ка — поперечная пластинка в переходной зоне жгутика. Масштабные линейки: А — 5 мкм, Б, В, Е, К — 2 мкм, Г, Д, Ж-И, Л, М — 0,5 мкм. (По:
Thomsen et al., 1991).
CRYOMONADIDA
431
432
CRYOMONADIDA
Рис. 305. Строение клетки Protaspa grandis.
А — дорсальный и вентральный виды клетки в сканирующем микроскопе (двойная головка стрелки — папилла, стрелка — складка вентральной
бороздки); Б — сагиттальный срез клетки; В — покровы (стрелка — поры, через которые выстреливают экструсомы); Г— аппарат Гольджи; Д— ми-
тохондрия (стрелка); Е — экструсома. аГ — аппарат Гольджи, м — митохондрия, пз — прозрачные пузырьки, пк — покровы, пр — пора, экс — экс-
трусома, я — ядро, стрелка — поры в оболочке клетки. Масштабные линейки: А — 5 мкм, Б — 2 мкм, В — 0,15 мкм, Г-Е — 0,25 мкм. (По: Hoppenrath,
Leander, 2006).
CRYOMONADIDA
433
Рис. 306. Схема строения жгутикового аппарата криомонад.
А — Cryothecomonas armigera', Б, В — С. aestivalis', Г— Protaspa longipes. вр — воронка, жг — жгутик, кст — колесовидная структура, кш — катушка
(осмиофильная структура), лм — лента микротрубочек, мкт — микротрубочки, мф — муфта, пз — переходная зона жгутика, пм — поперечно-исчер-
ченный мостик, ск — сателлиты кинетосом, сп — спираль, ц — цилиндр, ф — фибрилла. (По: Thomsen et al., 1991, с изменениями — A; Drebes et al.,
1996, с изменениями — Б, В; Schnepf, Kuhn, 2000, с изменениями — Г).
ся множество пузырьков (депо мембран для быстрого
образования псевдоподий). Пищеварительные вакуоли
многочисленны (рис. 304, Е, К).
Небольшие ямки располагаются на поверхности
клетки (рис. 304, А). В цитоплазме видны плотно упа-
кованные рибосомы и гладкий эндоплазматический
ретикулум. В переднем конце клетки около кинето-
сом жгутиков рассеяны мелкие гранулы (рис. 304, Г).
У Cryothecomonas armigera и С. inermis в цитоплазме
располагается множество лизосом, микротелец и ли-
пидных капель. У Protaspa grandis передний конец
клетки наполнен множеством мелких электронно-про-
зрачных пузырьков (рис. 305, Б). Цитоплазма обычно
бесцветная и содержит пищеварительные вакуоли и
окрашенные частицы (желтые, оранжевые, красные и
коричневые), которые, вероятно, являются липидными
глобулами (рис. 305, Б).
У представителей семейства Rhizaspidae жгути-
ки отсутствуют на всех стадиях жизненного цикла.
В остальном, морфология их клеток напоминает тако-
вую у представителей семейства Protaspidae (Simitzis,
Goff, 1981). У Rhogostoma minus особи имеют овальную
форму, 8-10 мкм в длину, 5-8 мкм в ширину (рис. 305,
Л, Б). Клетки ригидные и покрытые тонкостенной рако-
виной, которая плотно прилегает к поверхности клетки
и малозаметна в световом микроскопе. После гибели и
автолиза содержимого клетки раковинка остается ин-
тактной. Часто клетки образуют агрегации из 4 и более
особей (рис. 306, Б). Эти амебы формируют уплощен-
ные или узкие разветвленные псевдоподии. Анастомо-
зирующие псевдоподии не найдены. Псевдоподии бы-
стро меняют размеры и форму во время передвижения
клетки. Внутри псевдоподий не заметно токов цито-
плазмы и частиц. Ядро лежит в верхней части клетки
(рис. 308, Л, Д). Псевдостом, который располагается в
нижней части клетки, малозаметен. Плавающие клет-
ки, цисты, многоядерные плазмодии или жгутиковые
зооспоры не найдены. Особи размножаются бинарным
делением клетки.
Клетки покрыты тонкостенной однослойной рако-
виной, плотно прилегающей к поверхности клетки и
повторяющей ее контуры (рис. 306, В, Г). Раковина не-
значительно отслаивается от поверхности клетки и сое-
диняется перемычкой с телом клетки в псевдостоме (рис.
308, В). Последний представляет собой щель в нижнем
конце клетки (рис. 308, Г). Между плазмалеммой клетки
и раковиной заметны малоконтрастные гранулы. В рай-
оне псевдостома образуются псевдоподии (рис. 308, Г).
Пузырьковидное ядро овальной формы размером
2x3 мкм прилегает к дорсальной поверхности клет-
ки (рис. 308, Г). Ядрышко также смещено дорсально.
Аппарат Гольджи размером 1,2-1,4x1,0—1,2 мкм пред-
ставлен стопкой уплощенных цистерн и лежит близ-
ко к поверхности клетки (рис. 308, Д). Жгутики или
их элементы не обнаружены. Митохондрии содержат
трубчатые кристы, имеют овальную форму и длину
0,8-1,0 мкм (рис. 308, Е, Ж). Микротельца длиной 0,4-
0,5 мкм с неровной поверхностью и мелкозернистым
матриксом располагаются в разных частях цитоплазмы
(рис. 306, Ж). В вентральной зоне клетки лежит боль-
шое количество круглых и уплощенных пузырьков, а
также скопления мембран (рис. 308, Г). Пищеваритель-
ные вакуоли содержат бактерии на различных стадиях
переваривания (рис. 308, Г, Ж). Симбиотические бакте-
рии круглой или овальной формы длиной 0,3-0,5 мкм
располагаются чаще в районе псевдостома (рис. 308,3).
Экструсомы отсутствуют. Цисты неизвестны.
Особенности биологии
Представители рода Cryothecomonas являются
планктонными организмами, которые питаются бак-
териями и крупными пеннатными водорослями. Аме-
боидные представители Protaspa являются ползаю-
434
CRYOMONADIDA
— пж—
Рис. 307. Представители отряда Cryomonadida.
А — Cryothecomonas armigera, Б — С. aestivalis, В — Protaspa gemmifera, Г— Р. glans, Д— Р. grandis, Е — Р longipes, Ж — Р maior, 3 — Р. metarhiza,
И—Р obaniformis,K—Р. obliqua,JI, М—Р obovata,H—Р oviformis, О — Р rotunda, П—Р simplex, Р — Р tanyopsis, С — Р tegere, Т—Р verrucosa,
У — Rhizaspis granulata, Ф — Rh. simplex, X — Rhogostoma minus, Ц — Rh. schuessleri, 4 — Rh. timida, Ш — Capsellina bryorum. вбр — вентраль-
ная бороздка, зд — задний жгутик, пж — передний жгутик, пс — псевдоподии, я — ядро, одиночная головка стрелки — папилла, двойная головка
стрелки — вырост клетки, стрелка — колпачок на ядре. (По: Hoppenrath, Leander, 2006 — А-3, К-М, П-Т; Chantangsi, Leander, 2010 — И,Н, О; Skuja,
1948 — У, Ф; Bartos, 1954 — Ц, Ч; Penard, 1909 — Ш; ориг. — X).
CRYOMONADIDA
435
Рис. 308. Строение клетки Rhogostoma minus.
А — одиночная клетка; Б— агрегация клеток; В — участок покровов; Е — митохондрии; Ж — пищеварительная вакуоль, митохондрия и микротельце;
3 — симбиотические бактерии. аГ — аппарат Гольджи, м — митохондрия, мт — микротельце, пв — пищеварительная вакуоль, пс — псевдоподия,
рв — раковина, сб — симбиотическая бактерия, уп — уплощенные пузырьки, цщ — цитостомальная щель, я — ядро, яд — ядрышко. Масштабные
линейки: А — 8 мкм, Б — 20 мкм, Г— 2 мкм, Д— 1 мкм, В, Е-3 — 0,5 мкм.
щими жгутиконосцами, но способны плавать (Larsen,
Patterson, 1990; Vors, 1992). К семейству Rhizaspidae
относятся амебы, отличающиеся малой подвижно-
стью. Жизненный цикл большинства видов криомонад
состоит из стадии активно питающейся подвижной
клетки (трофонта), которая при размножении делится
продольно и обычно производит две дочерние клетки.
У Protaspa во время митоза ядерная оболочка полно-
стью резорбируется в стадии метафазы.
У Cryothecomonas aestivalis жизненный цикл состо-
ит из 3-х стадий (Drebes et al., 1996). Первая стадия —
это плавающие клетки с длинными жгутиками. После
контакта с диатомовой водорослью Guinardia delicatula
(Cleve) Hasle клетка хищника пронзает фрустулу во-
доросли и через образовавшееся отверстие проникает
внутрь в течение 5-10 минут. Там клетка интенсивно
поглощает цитоплазму жертвы с помощью псевдопо-
дии (вторая стадия), сильно увеличиваясь в размерах
до 10x20 мкм и укорачивая жгутики. Затем, через 4 часа
после проникновения в клетку водоросли, клетка хищ-
ника делится несколько раз (третья стадия) продуцируя
8-32 мелкие дочерние клетки (зооспоры), которые по-
кидают фрустулу водоросли. Внутри фрустулы оста-
ются коричневатые остаточные тела. Зооспоры быстро
приобретают способность снова атаковать диатомовые
водоросли. Весь жизненный цикл занимает 18-20 ча-
сов. Цистоподобные клетки формируются внутри диа-
томовых фрустул.
436
CRYOMONADIDA
Экология
Большинство видов рода Cryothecomonas обитает в
холодных морских водах подо льдом (Thomsen et al.,
1991; Ikavalko, Gradinger, 1997) и лишь один вид в от-
носительно теплой воде в летний период (Drebes et al.,
1996). Оказалось, что эти хищники играют существен-
ную роль в морских экосистемах, потребляя других
простейших и водоросли, в том числе крупные пеннат-
ные диатомовые водоросли (Drebes et al., 1996; Stoecker
et al., 1993). Судя по молекулярно-биологическим дан-
ным обработки проб, Cryothecomonas имеют всесвет-
ное распространение (Massana et al., 2004).
Виды Protaspa первоначально описаны из соло-
новатых вод Балтийского моря (Skuja, 1939, 1948). В по-
следней четверти XX века установлено, что наибольшее
разнообразие Protaspa достигали в морях по всему миру,
в том числе в водах омывающих Австралию, Южную
Америку, Юго-Восточную Азию, а также в Белом море
(Norris 1961; Larsen, Patterson, 1990; Tong et al. 1998; Lee,
2002,2006; Lee, Patterson, 2000; Tikhonenkov et al., 2006).
Эти жгутиконосцы также найдены в пресных водах
(Auer, Arndt, 2001; Lee et al., 2005; Tikhonenkov, 2007/8).
Наиболее редко они встречаются в почве, не достигая
там большой численности (Ekelund, Patterson, 1997).
Представители семейства Rhizaspididae (Rhizaspis,
Rhogostoma, Capsellind) являются бактериотрофами и
очень редко отмечены в фаунистических списках. Они
характерны для почвенных биоценозов (Simitzis, Goff,
1981; Мазей, Цыганов, 2006).
Филогения
По гену 18S рРНК Cryothecomonas aestivalis и Pro-
taspa longipes (Kuhn et al., 2000; Cavalier-Smith, Chao,
2003) криомонады образуют монофилетическую груп-
пу внутри типа Cercozoa. Сестринской группой оказы-
ваются Heteromita, Thaumatomonas и Cercomonas, но
со слабой статистической поддержкой. Этих протистов
сближает наличие псевдоподий, участвующих в погло-
щении пищи. Псевдоподии у Thaumatomonas отходят
из вентральной бороздки (Карпов, Жуков, 1987) так же,
как у криомонад. Однако Thaumatomonas отличаются
наличием чешуек на поверхности клетки, другой ко-
решковой системой жгутиков и типом экструсом (мел-
кими овальными кинетоцистами).
Согласно молекулярно-биологическим данным
Protaspa grandis группируется с Cryothecomonas aes-
tivalis и Protaspa longipes в одну кладу (Hoppenrath,
Leander, 2006). Все криомонады являются сестринской
группой по отношению к тауматомонадам.
Небольшие раковинные амебы Rhogostoma (= Le-
cythium sp.) также относятся к кладе криомонад (Niko-
laev et al., 2003). В итоге в отряд Cryomonadida сей-
час входят роды Cryothecomonas, Protaspa, Rhizaspis,
Rhogostoma и Capsellina (Howe et al., 2011). Последу-
ющее исследование гена полиубиквитина показали,
что для криомонад характерна одна вставка, кодирую-
щая аминокислоту (Bass et al., 2005; Howe et al., 2011;
Chantangsi et al., 2010), в отличие от других церкозоев с
двумя вставками. Этот признак является таксономиче-
ски значимым для криомонад.
Систематический обзор
Первоначально отряд Cryomonadida помещали
в субкласс Thecomonadia Cavalier-Smith 1993 класса
Heteromitea Cavalier-Smith 1993 типа Opalozoa Cavalier-
Smith 1991. После получения данных по сиквенсам ри-
босомальной РНК малой субъединицы его поместили в
класс Thecofilosea Cavalier-Smith 2003 (Cavalier-Smith,
Chao, 2003) подтипа Filosa Cavalier-Smith 2003. В даль-
нейшем криомонады в качестве отряда вошли вместе с
Tectofilosida в класс Thecofilosea подтипа Monadofilosa
Cavalier-Smith 1997 типа Filosa Cavalier-Smith 2003.
В свою очередь, последний входит в группу Cercozoa
Cavalier-Smith 1998, которая относится к супергруппи-
ровке Rhizaria Cavalier-Smith 2002.
Отряд Cryomonadida Cavalier-Smith 1993
Сем. Protaspidae (Skuja) Cavalier-Smith 1993
Ригидные клетки с двумя гетеродинамичными
жгутиками. Жгутики примерно равной длины отходят
субапикально из отдельных карманов от вентральной
стороны тела. Клетки уплощены дорсовентрально, с
вентральной бороздкой, из которой отходят псевдопо-
дии, используемые для питания.
Включает в настоящее время два рода Cryothe-
comonas Thomsen et al. 1991 и Protaspa Cavalier-Smith
2011 (= Protaspis Skuja 1939). Роды и виды различают-
ся по положению и строению вентральной бороздки,
наличию или отсутствию колпачка на ядре, размерам
клетки, питанию и местообитанию.
Род Cryothecomonas Tomsen et al. 1991
Двужгутиковые гетеротрофные жгутиконосцы,
плавающие или ползающие. Один жгутик направлен
вперед, второй — назад. Клетка заключена в тонко-
стенную раковину, которая прерывается в месте отхож-
дения жгутиков и в районе цитостома. Раковина не вид-
на в световой микроскоп. Питание за счет образования
псевдоподий из вентральной бороздки. Митохондрии с
трубчатыми кристами. Кинетосомы жгутиков соедине-
ны поперечно-исчерченным мостиком, от них отходят
ленты микротрубочек, одна из которых соединяет ки-
нетосомы с ядром. В цитоплазме присутствуют дикти-
осомы и цилиндрические экструсомы. Клетки делятся
продольно, деление ядра — открытый ортомитоз. Мор-
ские. Питаются мелкими жгутиконосцами и диатомо-
выми водорослями.
Типовой вид: С. armigera.
С. armigera Tomsen etal. 1991 (рис. 307, А)
Клетки яйцевидной формы и дорсовентрально
уплощены, 12-32 мкм длины, 7-13 мкм ширины. Ци-
CRYOMONADIDA
437
тостом располагается в заднем конце клетки на дне
вентральной бороздки. Раковина многослойная с элек-
тронно-плотным внутренним слоем и внешним слоем,
в котором материал образует равномерные гребни. Экс-
трусомы распределены по всей клетке.
Обитают в Антарктике под морским льдом.
С. aestivalis Drebes et al. 1996 (рис. 307, Б)
Бесцветные подвижные жгутиконосцы, продолго-
ватой или овальной формы. 9-12 мкм длины и 4-5 мкм
ширины. Два жгутика отходят апикально. Передний
жгутик длиной 15 мкм, задний — до 25 мкм. Питают-
ся морскими планктонными диатомовыми Guinardia
delicatula. Трофонты пронзают фрустулу водоросли и
медленно фагоцитирует ее цитоплазму с помощью вы-
ходящей из раковины псевдоподии. Раковина тонкая
и состоит из двух слоев. Зрелые трофонты образуют
8-32 расселительных клеток (бродяжек).
Обнаружен на литорали Северного моря.
С. inermis Tomsen etal. 1991
Сходен с С. armigera и отличается от него мень-
шим дорсовентральным уплощением клетки. Клетки
длиной 10-15 мкм и шириной 7-10 мкм. Экструсомы
отсутствуют. Обнаружен под морским льдом у берегов
Дании.
С. scybalophora Tomsen et al. 1991
Клетки 9-14 мкм длиной, 4,5-9 мкм шириной. Ра-
ковина состоит из одного электронно-плотного слоя,
который поддерживается равномерными выростами
(протуберанцами). Раковина обычно покрыта детри-
том. Несколько больших экструсом лежат в переднем
конце клетки. Разветвленные псевдоподии выходят из
цитостома. Обнаружен под морским льдом у берегов
Дании.
С. vesiculata Tomsen et al. 1991
Клетки вытянуты: 9-14 мкм длины, 4,5-9 мкм ши-
рины. Раковина состоит из двух слоев. Слизистые тела
упакованы в группы гексагональной формы. Лизосомо-
подобные тела хорошо заметны. Обнаружен под мор-
ским льдом у берегов Дании.
Род Protaspa (Skuja) Cavalier-Smith 2011
Баз.: Protaspis Skuja 1939.
Гетеротрофные ползающие жгутиконосцы с двумя
равными или почти равными жгутиками, отходящими
субапикально с вентральной стороны клетки. Обычно
имеют бороздку на вентральной стороне клетки и кол-
пачок. (заметный в световой микроскоп) на передней
стороне ядра. Задний жгутик отходит слева от места
отхождения переднего жгутика. Питается посредством
образования псевдоподий, выходящих из бороздки
(Skuja, 1939, 1948; Larsen, Patterson, 1990). Фаготрофы.
Предполагается хищничество у одного вида (Protaspa
verrucosa), поедающего мелких бодонид и хризомонад.
Ранее этот род на основании наличия бороздки и упло-
щенности клетки был помещен в отряд Thaumatomo-
nadida (Patterson, Zolffel, 1991). Затем он был перенесен
в отряд Cercomonadida (Mylnikov, Karpov, 2004). После
исследования ультраструктуры и гена 18S рРНК Pro-
taspa glans это род перенесен в отряд криомонад (Howe
et al., 2011).
Предыдущее название рода Protaspis изменено на
Protaspa, так как оно было преоккупировано для девон-
ских рыб Protaspis Bryant 1933 (Howe et al., 2011).
Род содержит 14 видов. Типовой вид: Protaspa glans
(Skuja) Cavalier-Smith 2011.
P. gemmifera (Larsen et Patterson) Cavalier-Smith
2011(рис. 307, В)
Баз.: Protaspis gemmifera Larsen et Patterson 1990.
Клетка овальная закругленная, длиной 10-14 мкм,
шириной 8-12 мкм, уплощена. Вентральная бороздка
неглубокая и уменьшается к заднему концу клетки.
Передний жгутик равен длине клетки, задний — вдвое
длиннее. Задний жгутик отходит слева от переднего.
Ядро спереди с двумя пластинчатыми структурами
(колпачками) на его передней части. Запасной матери-
ал представлен овальными или палочковидными тела-
ми в задней части клетки.
Р. glans (Skuja) Cavalier-Smith 2011 (рис. 307, Г)
Баз.: Protaspis glans Skuja 1939.
Клетки овальные, длиной 14-19 мкм, шириной
9,5-14 мкм, толщиной 5-8 мкм. Передний жгутик ра-
вен длине клетки, задний — в 1,5-2 раза длиннее. Две
сократительные вакуоли находятся сзади. Клетка про-
зрачная и наполнена гранулами. Ядро лежит спереди
латерально.
Морское побережье. Гавайи.
Р. grandis (Hoppenrath et Leander) Cavalier-Smith
2011 (рис. 307,Д)
Баз.: Protaspis grandis Hoppenrath et Leander 2006.
Клетки овальные и вытянутые с параллельными
латеральными сторонами, дорсовентрально сжаты.
Длина 32,5-55 мкм, ширина 20-35 мкм. Два гетероди-
намичных жгутика отходят субапикально и разделе-
ны выступом. Вентральная бороздка располагается в
передней части клетки. Ядро в задней части клетки, с
ядрышком и постоянно конденсированными хромосо-
мами. Псевдоподии отходят из щели внутри вентраль-
ной бороздки. Утолщенная клеточная стенка состоит
из 7 слоев: базального слоя, промежуточного, пузыр-
чатого, внешней пластины, глубинного слоя, среднего
и внешнего слоев. Базальный слой и промежуточный
имеют поры для выстреливания экструсом.
Морской. Канада.
Р. longipes (Schnepf et Kuhn) Cavalier-Smith 2011
(рис. 307, E)
Баз.: Cryothecomonas longipes Schnepf et Kuhn
2000.
438
CRYOMONADIDA
Клетки овальные, дорсовентрально уплощены,
длиной 9-14 мкм, шириной 7-9 мкм. Передний жгу-
тик длиной 9-15 мкм, задний — 20-24 мкм и покрыт
тонкими волосками. Раковина состоит из нескольких
слоев и снаружи гребенчатая. Питается различными
диатомовыми водорослями, пронзая их створки и по-
глощая содержимое с помощью псевдоподии, остава-
ясь при этом снаружи. Экструсомы трех размеров.
Северное море. Планктон.
Р. maior (Skuja) Cavalier-Smith 2011 (рис. 307, Ж)
Баз.: Protaspis maior Skuja 1939.
Клетки овальные размером 24-40x16-30 мкм. Бо-
роздка проходит на вентральной стороне и немного
изогнута. Передний жгутик примерно равен длине
клетки, задний вдвое длиннее. Клетка наполнена мно-
жеством крупных гранул. Ядро находится спереди или
сбоку.
Балтийское море.
Р. metarhiza (Skuja) Cavalier-Smith 2011
(рис. 307, 3)
Баз.: Protaspis metarhiza Skuja 1939.
Клетки длиной 30-36 мкм, шириной 16-25 мкм,
толщиной 12-20 мкм. Во время ползания клетка вы-
тягивается и заостряется сзади, вентральная бороздка
малозаметна. Передний жгутик равен одной трети от
длины клетки, задний жгутик равен длине клетки или
чуть короче. Ядро находится на срединной линии спе-
реди. Постоянно образуют псевдоподии. Клетка мета-
боличная и при движении извивается. Сократительная
вакуоль незаметна.
Морское побережье. Балтийское море.
Р. obaniformis (Chantangsi et Leander)
Cavalier-Smith 2011 (рис. 307, И)
Баз.: Protaspis obaniformis Chantangsi et Leander
2010.
Клетки широкоэллиптические и дорсовентрально
уплощены, шириной 30-50 мкм и длиной 50-65 мкм.
Клеточная стенка толстая с гладкой поверхностью.
Жгутики отходят субапикально. Передний жгутик
составляет одну вторую или одну треть от длины
клетки. Ядро овальное 18x17 мкм. Хромосомы по-
стоянно конденсированы. Ядро лежит в центре клет-
ки, иногда смещено вперед. Цитоплазма содержит
многочисленные сферические коричневатые грану-
лы. Вертикальная вентральная щель лежит в задней
части клетки (Chantangsi, Leander, 2010). Отличается
от остальных видов задним расположением цитосто-
мальной щели.
Морской. Прибрежье. Канада.
Р. obliqua (Larsen et Patterson) Cavalier-Smith 2011
(рис. 307, К)
Баз.: Protaspis obliqua Larsen et Patterson 1990.
Клетка уплощена, овальной формы, длиной 14-
20 мкм, шириной 12-18 мкм, спереди с ямкой, лежа-
щей слева от срединной линии клетки. Вентральная
бороздка в задней части клетки. Передний жгутик от-
ходит субапикально, небольшой выступ отделяет его от
места отхождения заднего жгутика. Передний жгутик
составляет около 3/4 от длины клетки, задний жгутик
равен длине клетки или незначительно ее превышает.
Ядро в форме диска, 5-8 мкм в диаметре, лежит спере-
ди и не имеет ядерного колпачка.
Р. obovata (Skuja) Cavalier-Smith 2011
(рис. 307,77, М)
Баз.: Protaspis obovata Skuja 1948.
Клетка слабо метаболичная, яйцевидная или гру-
шевидная, дорсовентрально сжата, спереди закругле-
на, длиной 26^40 мкм, шириной 17-22 мкм. Бороздка
лежит вентрально. Перипласт прозрачный, тонкий.
Жгутики отходят субапикально и равны длине клетки.
В клетке много гранул. Сократительная вакуоль сзади.
Крупное ядро спереди. Деление клетки продольное и
происходит в подвижном состоянии.
Морской.
Р. oviformis (Chantangsi et Leander) Cavalier-Smith
2011(рис.307, H)
Баз.: Protaspis oviformis Chantangsi et Leander 2010.
Клетка шириной 25^40 мкм, длиной 30^45 мкм,
овальные или закругленные, дорсовентрально уплоще-
ны. Спереди выступ. Ядро диаметром 8 мкм лежит в
центре клетки. Хромосомы расположены по периферии
ядра. Цитоплазма содержит многочисленные коричне-
вые, серые и желтые гранулы. Продольная вентральная
бороздка проходит по середине клетки. Псевдоподии
пальцевидные. Движение скользящее. Обитают в мор-
ском прибрежном песке.
Морской. Канада.
Р. rotunda (Chantangsi et Leander) Cavalier-Smith
2011 (рис. 307, О)
Баз.: Protaspis rotunda Chantangsi et Leander 2010.
Клетки шириной 25-27 мкм, длиной 30-31 мкм,
дорсовентрально уплощены. Овальные и округлые.
С гладкой поверхностью. Два жгутика отходят суба-
пикально и отделены друг от друга выростом. Ядро
11x15 мкм. Ядро яйцевидное и лежит справа в перед-
ней части клетки. Цитоплазма гомогенная. Изогнутая
бороздка на вентральной стороне спереди.
Канада. Морской песок прибрежья.
Р. simplex (Vors) Cavalier-Smith 2011
(рис. 307, П)
Баз.: Protaspis simplex Vors 1992.
Ползающие клетки с овальным или яйцевидным
телом, уплощены. Размеры клетки 1x2-10x25 мкм. Два
неравных жгутика отходят субапикально. Вентральная
бороздка присутствует. Ядро лежит спереди или лате-
рально. Псевдоподии не отмечены. Передний жгутик
вдвое короче клетки. Он машет влево с небольшой ам-
плитудой. Задний жгутик в 1-3 раза длиннее клетки,
CRYOMONADIDA
439
при движении полностью прилегает к субстрату. Во
время скольжения задний конец клетки приподнят, и
она контактирует с субстратом передним концом. Тело
клетка раскачивается в унисон с биением переднего
жгутика.
Морская. Дания. Канада. Арктика.
Р. tanyopsis (Norris) Cavalier-Smith 2011
(рис. 307, Р)
Баз.: Protaspis tanyopsis Norris 1961.
Клетки вытянутые, длиной 28-30 мкм, шириной
9-11 мкм, слабо уплощенные на переднем конце. За-
дний конец тела широко закруглен, передний конец за-
круглен или усечен. Клетки метаболичные, псевдопо-
дии не обнаружены. Вентральная бороздка составляет
2/3 от длины клетки. Край бороздки спереди образует
небольшой вырост, ниже которого бороздка расширя-
ется. Клетки с двумя равными жгутиками. Жгутики
отходят ниже клеточного выроста. Один жгутик на-
правлен вперед, второй — назад и лежит в вентраль-
ной бороздке. Большое ядро находится в передней
трети клетки. Цитоплазма заполнена многочисленны-
ми крупными гранулами. Крупные пищеварительные
вакуоли лежат в задней части клетки. Сократительная
вакуоль отсутствует. Две небольших светопреломляю-
щих гранулы находятся в переднем конце клетки под
выростом.
Морской.
Р. tegere (Larsen et Patterson) Cavalier-Smith 2011
(рис. 307, С)
Баз.: Protaspis tegere Larsen et Patterson 1990.
Клетка продолговатая или яйцевидная, длиной 14-
20 мкм, шириной 9-13 мкм, уплощенная, с небольшой
передней выемкой. Жгутики отходят из субапикаль-
ного углубления. Передний жгутик равен длине клет-
ки, задний — вдвое длиннее. Вентральная бороздка
проходит от переднего до заднего конца клетки. Ядро
4-7 мкм в диаметре лежит спереди медиально. Перед-
ний конец ядра накрыт колпачком. Псевдоподии выхо-
дят из бороздки.
Морской. Гавайи.
Р. verrucosa (Larsen et Patterson) Cavalier-Smith
2011 (рис. 307,7)
Баз.: Protaspis verrucosa Larsen et Patterson 1990.
Клетка продолговатая закругленная, длиной 10-
18 мкм, шириной 9-16 мкм, уплощенная; покрыта
шишковидными выступами. Вентральная бороздка и
передний жгутик короче клетки, задний жгутик немно-
го длиннее. Жгутики отходят из углубления на перед-
нем конце бороздки, задний жгутик отходит позади
переднего жгутика. Вентральная бороздка проходит от
жгутикового кармана почти до заднего конца клетки.
Ядро дисковидной формы, 3-5 мкм в диаметре, лежит
спереди по средней линии клетки. Колпачки на ядре от-
сутствуют.
Морской.
Сем. Rhizaspididae (Skuja) Cavalier-Smith
2011
Амебы располагаются в тонкостенной раковине,
которая состоит из одного гладкого плотного слоя чуть
толще плазмалеммы. Раковина мягкая, латерально сжа-
тая, прилегает с небольшим зазором ко всей поверх-
ности клетки. Особи билатерально симметричны в от-
личие от радиально симметричных Chlamydophryidae
De Saedeleer, 1934. Из вентральной щели (цитостома)
раковины выходят филоподии, которые у одного вида
анастомизируют как ретикулоподии.
Типовой род: Rhizaspis Skuja 1948. Другие роды
Rhogostoma Belar 1921 и Capsellina Penard 1909. Тон-
кое строение Rhogostoma изучено в работе Зимициса и
Гоффа (Simitzis, Goff, 1981) и автором настоящей гла-
вы (А.П. Мыльников, личное сообщение). Ранее Скуйя
(Skuja, 1939, 1948) относил род Rhizaspis к эвгленовым,
которые не образуют филоподий и несут жгутики. Эти
признаки не отмечены для Rhizaspis, поэтому включе-
ние его в состав Euglenida некорректно.
Род Rhizaspis Skuja 1948
Клетки метаболичные, дорсовентрально сжаты,
овальные, яйцевидные, выпукло-вогнутые. Раковина
тонкая гибкая. В цитоплазме много гранул. Ядро круп-
ное дорсальное или в центре клетки. Сократительная
вакуоль присутствует.
Типовой вид: R. granulata Skuja 1948.
R. granulata Skuja 1948 (рис. 307, У)
Клетка слабо метаболичная. Сильно уплощена. Эл-
липсоидная или округло-овальная, спереди закруглена,
дорсально выпуклая, вентрально плоская или вогну-
тая, 43-67 мкм длины, 27-52 мкм ширины, 10-16 мкм
толщины. Псевдоподии достигают 90 мкм. Раковина
морщинистая, тонкая и прозрачная. Сократительные
вакуоли находятся у цитостома. Ядро в центре. Деле-
ние продольное в ризоподиальной стадии.
R. simplex Skuja 1948 (рис. 307, Ф)
Клетка слабо метаболичная, уплощена, овальная
или яйцевидная, длиной 46-62 мкм, шириной 22-
35 мкм, толщиной 13-24. Псевдоподии достигают 50-
100 мкм длины. Раковина прозрачная. Сократительные
вакуоли у цитостома. Ядро смещено дорсально.
Род Rhogostoma Belar 1921
Раковина в виде тонкой гибкой, прозрачной мем-
браны, полусферическая, сжатая, без прикрепленных
минеральных частиц. Щелевидное устье (цитостом) на
дне овального углубления раковины. Цитоплазма, со-
держащая одно пузырьковидное ядро, почти полностью
заполняет полость раковины. Деление продольное.
Типовой вид: Rhogostoma schuessleri Belar
1921.
440
CRYOMONADIDA
R. minus Belar, 1921 (рис. 30, X)
Син.: Lecythium sp. Nikolaev et al., 2003.
Мягкая гладкая раковина с отверстием, из которого
выходят ламеллярные и пальцевидные, не грануляр-
ные разветвленные псевдоподии. Клетка уплощена
имеет эллипсоидную форму. Клетки 8-10 мкм длины,
5-8 мкм ширины, в старых культурах до 10-12 мкм
длины. Клетка полностью заполняет раковину. Щеле-
видное углубление плохо заметно в световой микро-
скоп. Из вентральной щели отходят псевдоподии. Они
в несколько раз превышают длину клетки и медленно
двигают ее по субстрату. В цитоплазме заметны грану-
лы и пузырьки, крупная латеральная сократительная
вакуоль, ядро в центре клетки. Особи обычно форми-
руют скопления. Зрелые клетки делятся на две одина-
ковые дочерние клетки. Зооспоры, цисты или много-
ядерные плазмодии не найдены. Питание бактериями.
Пресноводные. Систематическое положение определе-
но на основе исследования гена 18S рРНК (Nikolaev et
al., 2003; Howe et al., 2011)
Стоячие пресные воды.
R. micra Cavalier-Smith et Scoble 2011
Клетка 6,5-10 мкм, морфологически очень похо-
жа на R. minus, отличаясь по сиквенсу гена 18S рРНК
(Howe et aL, 2011). Раковинка обычно покрыта детри-
том и бактериями. Псевдоподии сокращаются редко.
Форма клетки более изменчивая, чем у R. minus. Часто
образуются пальцевидные псевдоподии, ламеллярные
реже. Клетка иногда резко разворачивается в направле-
нии доминирующей псевдоподии и вытягивается.
Стоячие пресные воды.
R. schuessleri Belar 1921 (рис. 307, Ц)
Клетки длиной 5 мкм. Раковина в виде тонкой гиб-
кой, прозрачной мембраны, полусферическая, сжатая,
без прикрепленных минеральных частиц. Щелевид-
ное устье (цитостом) располагается на дне овального
углубления раковины. Цитоплазма, содержащая одно
пузырьковидное ядро, почти полностью заполняет по-
лость раковины. Деление продольное. Формирует ла-
меллиподии более широкие, чем клетка. На концах их
формируются филоподии. Почва.
R. timida Cavalier-Smith 2011
(рис. 307, Ч)
Син.: Capsellina timida Brown 1911.
Раковина прозрачная, овальная, эллипсовидная в
профиль, с множеством липидных гранул и пищева-
рительных вакуолей. Одна неветвящаяся филоподия.
Длина клетки 34 мкм, ширина 25 мкм, толщина 16-
17 мкм. Обитают во мху.
Род Capsellina Penard 1909
Раковина в плане овальная, сероватая, по форме на-
поминает таковую у Rhogostoma, и отличается от нее
наличием прикрепленных коричневатых экзогенных
частиц. Устье щелевидное, располагается в основании
глубокого углубления. Одно круглое ядро с нескольки-
ми ядрышками. Деление продольное.
Монотипный род.
С. bryorum Penard 1909
(рис. 307, Ш)
Раковина маленькая, яйцевидная, прозрачная эла-
стичная, бесцветная, гранулярная; много липидных гло-
бул, пищевых частиц. Ядро с центральным ядрышком
располагается сзади; сократительные вакуоли много-
численны. Образует одну филозную псевдоподию. Дли-
на клетки 34 мкм, ширина 25 мкм, толщина 16-17 мкм.
Мох.
SUMMARY
Heterotrophic flagellates and amoebae, which are tightly cov-
ered by thin single-layered or thick multi-layer test except flagellar
pockets and cytostomal groove. Two smooth (rare with simple mas-
tigonemes) heterodynamic flagella, which separately arise approxi-
mately at right angle to each other or the flagella are absent. The
kinetosomes are interconnected by the cross-banded bridge and give
rise of several microtubules, one of which passes towards the nucle-
us. The flagellar transition zone contains the spiral fiber or cylinder
above the transverse plate. Mitochondria have tubular cristae. Cylin-
drical extrusomes, microbodies, lipid globules and mucous bodies
are present in cytoplasm. Feeding by pseudopodia, which arise from
cytostomal groove. Reproduction appears by binary longitudinal
fission. Nuclear division appears by open orthomitosis with kineto-
somes acting as MTOCs. The polyubiquitin gene contains one in-
sertion coding amino acid. Bacteriotrophs, predators and algivorous.
Freshwater, marine and soil.
ЛИТЕРАТУРА
Карпов C.A., Жуков Б.Ф. 1987. Особенности ультраструктуры
бесцветного жгутиконосца Thaumatomonas lauterborni И Цитология. Vol.
29. С. 1168-1171.
Мазей Ю.А., Цыганов А.Н. 2006. Пресноводные раковинные аме-
бы. М.: Т-во научных изданий КМК. 300 с.
Auer В., Arndt Н. 2001. Taxonomic composition and biomass of het-
erotrophic flagellates in relation to lake trophy and season 11 Freshwater Biol.
Vol. 46. P. 959-972.
Bass D., Moreira D., Lopez-Garcia P., Polet S., Chao E.E., Hey-
den S. von der, Pawlowski J., Cavalier-Smith T. 2005. Polyubiquitin in-
sertions and the phylogeny of Cercozoa and Rhizaria П Protist. Vol. 156.
P. 149-161.
Bartos E. 1954. Korenonozce radu Testacea. Bratislava. Vyd. Slov.
Akad. Vied. 189 s.
Cavalier-Smith T. 1993. Kingdom Protozoa and ots 18 Phyla П Micro-
biol. Rev. Vol. 57. P. 953-994.
CRYOMONADIDA
441
Cavalier-Smith T., Chao E.E. 2003. Phylogeny and classification of
phylum Cercozoa (Protozoa) // Protist. Vol. 154. P. 341-358.
Chantangsi C., Hoppenrath M., Leander B.S. 2010. Evolutionary re-
lationships among marine cercozoans as inferred from combined SSU and
LSU rDNA sequences and polyubiquitin insertions // Molecular. Phylogenet.
Evol. Vol. 57. P. 518-527.
Chantangsi C., Leander B.S. 2010. An SSU rDNA barcoding approach
to the diversity of marine interstitial cercozoans, including descriptions of
four novel genera and nine novel species // Int. J. Syst. Evol. Mier. Vol. 60.
P. 1962-1977.
Drebes G., Kuhn S.F., Gmelch A., Schnepf E. 1996. Cryothecomonas
aestivalis sp. nov., a colourless nanoflagellate feeding on the marine centric
diatom Guinardia delicatula (Cleve) Hasle // Helgolander Meeresunters.
Vol. 50. P. 497-515.
Ekelund F., Patterson D.J. 1997. Some heterotrophic flagellates from
a cultivated garden soil in Australia // Arch. Protistenkd. Bd 148. S. 461—
478.
Hoppenrath M., Leander B.S. 2006. Dinoflagellate, Euglenid or Cer-
comonad? The ultrastructure and molecular phylogenetic position of Protas-
pis grandis n. sp. // J. Euk. Microbiol. Vol. 53. P. 327-342.
Howe A.T., Bass D., Scoble J.M., Lewis R., Vickerman K., Arndt H.,
Cavalier-Smith T. 2011. Novel cultures protists identify deep-branching en-
vironmental DNA clades of Cercozoa: new genera Tremula, Micrometopion,
Minimassisteria, Nudifila, Peregrinia // Protist. Vol. 162. P. 332-372.
Ikavalko J., Gradinger R. 1997. Flagellates and heliozoans in the
Greenland Sea ice studied alive using light microscope // Polar Biol. Vol. 17.
P. 473-481.
Kuhn S., Lange M., Medlin L.K. 2000. Phylogenetic position of Cryo-
thecomonas inferred from nuclear-encoded small subunit ribosomal RNA //
Protist. Vol. 151. P. 337-345.
Larsen J., Patterson D.J. 1990. Some flagellates (Protista) from tropi-
cal marine sediments // J. Nat. Hist. Vol. 24. P. 801-937.
Lee W.J. 2002. Some free-living heterotrophic flagellates from marine
sediments of Inchon and Ganghwa Island, Korea // Korean J. Biol. Sci. Vol. 6.
P. 125-143.
Lee W.J. 2006. Some free-living heterotrophic flagellates from marine
sediments of tropical Australia // OSJ. Vol. 41. P. 75-95.
Lee W.J., Patterson D.J. 2000. Heterotrophic flagellates (Protista) from
marine sediments of Botany Bay, Australia // J. Nat. Hist. Vol. 34. P. 483-562.
Lee W.J., Simpson A.G.B., Patterson D.J. 2005. Free-living heterotro-
phic flagellates from freshwater sites in Tasmania (Australia), a field survey //
Acta Protozool. Vol. 44. P. 321-350.
Massana R., Balague V., Guillou L., Pedros-Alio C. 2004. Picoeu-
karyotic diversity in an oligotrophic coastal site studied by molecular and
culturing approaches // FEMS Microbiology Ecology Vol. 50. P. 231-243.
Myl’nikov A.P., Karpov S.A. 2004. Review of diversity and taxonomy
of cercomonads // Protistology. Vol. 3. P. 201-217.
Nikolaev S.I., Berney C., Fahrni J., Mylnikov A.P., Aleshin V.V.,
Petrov N.B., J. Pawlowski. 2003. Gymnophrys cometa and Lecythium sp.
are core Cercozoa: Evolutionary Implications // Acta Protozool. Vol. 42.
P. 183-190.
Norris R.E. 1961. Observation on phytoplankton organisms collected on
the N.Z.O.I. Pacific cruise, September 1958 // N. Z. J. Sci. Vol. 4. P. 162-188.
Patterson D.J., Zolffel M. 1991. Heterotrophic flagellates of uncertain
taxonomic position // J.D. Patterson, J. Larsen (eds). The biology of free-
living heterotrophic flagellates. Oxford. Clarendon Press. P. 427-^476.
Penard E. 1909. Sur quelques rhizopodes des mousse //Arch. Protisten-
kd. Bd 17. S. 258-296.
Schnepf E., Kuhn S.F. 2000. Food uptake and fine structure of Cryo-
thecomonas longipes sp. nov., a marine nanoflagellate incertae sedis feeding
phagotrophically on large diatoms // Helgol. Mar. Res. Vol. 54. P. 18-32.
Simitzis A.M., Goff F. 1981. Observations on testate amoebae of the
group Capsellina Penard 1909 — Rhogostoma Belar 1921 (Gromiidae,
Gromiida, Filosea) // Protistologica. Vol. 17. P. 99-111.
Skuja H. 1939. Beitrag zurAlgenflora Lettlands II //Acta Horti botanici
Universitatis latviensis. Vol. 11/12. S. 41-169.
Skuja H. 1948. Taxonomie des Phytoplanktons einiger Seen in Up-
pland, Schweden // Symb. Bot. Upsal. Vol. 9/3. S. 1-399.
Stoecker D.K., Buck K.R., Putt M. 1993. Changes in the sea-ice brine
community during the spring-summer transition, McMurdo Sound, Antarc-
tica. II. Phagotrophic protists // Mar. Ecol. Prog. Ser. Vol. 95. P. 103-113.
Thomsen H.A., Buck K.R., Bolt P.A., Garrison D.L. 1991. Fine struc-
ture and biology of Cryothecomonas gen. nov. (Protista incertae sedis) from
the ice biota // Can. J. Zool. Vol. 69. P. 1048-1070.
Tikhonenkov D.V. 2007/8. Species diversity of heterotrophic flagellates
in Rdeisky reserve wetlands // Protistology. Vol. 5. P. 213-230.
Tikhonenkov D.V., Mazei Yu.A., Mylnikov A.P. 2006. Species diver-
sity of heterotrophic flagellates in White Sea littoral sites // Eur. J. Protistol.
Vol. 42. P. 191-200.
Tong S.M., Nygaard K., Bernard C., Vors N., Patterson D.J. 1998.
Heterotrophic flagellates from the water column in Port Jackson, Sydney,
Australia// Eur. J. Protistol. Vol. 34. P. 162-194.
Vors N. 1992. Heterotrophic amoebae, flagellates and Heliozoa from the
Tvarminne Area, Gulf of Finland, in 1988-1990 // Ophelia. Vol. 36. P. 1-109.
PANSOMONADIDA Vickerman, Appleton, Clarke et Moreira 2005
Пресноводные и почвенные гетеротрофные жгутиконос-
цы с двумя гетеродинамичными жгутиками, которые опушены
простыми мастигонемами. Задний жгутик длинный и актив-
ный. Другой жгутик сильно укорочен и неактивен. Клетка име-
ет радиальные выросты — гаптоподии, с осевым скелетом из
микрофиламентов. Гаптоподия оканчивается стрекательной ор-
ганеллой — гаптосомой. Пузырьковидное ядро лежит в центре
клетки; митохондрии с трубчатыми кристами; имеются одна-
две сократительные вакуоли. Особи способны формировать
филоподии или ламеллиподии для захвата жертвы. Хищники и
бактериотрофы. Помимо жгутиковой в жизненном цикле есть
амебоидная стадия и циста покоя. Размножаются продольным
делением надвое. Половой процесс неизвестен. Обитают в по-
чве и пресных водах.
История изучения
Впервые пансомонады (Pansomonadida Vickerman
et al. 2005) стали известны из работы К. Викермана с
соавторами (Vickerman et al., 2005), в которой установ-
лено, что эти организмы встречаются в сухих и влаж-
ных почвах из множества регионов мира. В этой же
работе приведено строение клеток Aurigamonas solis и
определено его место в системе организмов на осно-
вании изучения сиквенсов ДНК малой субъединицы
рибосом. Обособленное положение на молекулярно-
филогенетической схеме (МФС) и уникальные морфо-
логические особенности позволили выделить новый
отряд пансомонад. Позднее (Howe et al., 2011а) в этот
таксон на основании МФС были включены представи-
тели рода Agitata, которые по внешнему виду и образу
жизни сходны с церкомонадами (Cercomonadida Poche.
1913).
Морфология Aurigamonas solis
Тело Aurigamonas шаровидное или яйцевидное
со слегка уплощенным передним концом, от которого
отходят два жгутика (Vickerman et al., 2005). Диаметр
клетки (3-18 мкм) сильно варьирует в зависимости от
условий питания. Упругие радиально расходящиеся
гаптоподии равномерно распределены по поверхно-
сти подвижных клеток (рис. 309, A-В). Длинный жгу-
тик направлен назад, достигая 12-52 мкм в длину. Его
дистальный неподвижный конец изогнут в виде петли,
которая прикрепляется к субстрату. Короткий жгутик
длиной 6-8 мкм в форме крючка, на жгутиковой стадии
малозаметен (рис. 309, В). Он хорошо виден у сильно
уплощенных организмов, переходящих в амебоидную
стадию.
Длинный жгутик покрыт простыми мастигонема-
ми и несет на дистальном конце небольшую акронему
(рис. 310, Б). Мастигонемы длиной 690 нм относитель-
но упругие. Они отстоят друг от друга на расстоянии
70 нм. Второй короткий жгутик также покрыт масти-
гонемами (рис. 311). Аксонема обоих жгутиков имеет
обычный набор микротрубочек (9+2), параксиальные
элементы отсутствуют. Во время деления клетки ко-
роткий жгутик материнской особи трансформируется у
дочерней особи в длинный. Таким образом, у пансомо-
над полуконсервативный тип репликации кинетосом,
характерный для всех эукариот.
Переходная зона жгутика содержит поперечную
пластинку, лежащую выше поверхности клетки. Кине-
тосомы длиной около одного микрона с довольно длин-
ной колесовидной структурой лежат неподалеку от
ядра, но морфологически с ним не связаны (рис. 310, Д;
311). С проксимальным концом кинетосомы ассоци-
ирована электронно-плотная пластинка, которая слу-
жит центром образования микротрубочек, идущих под
плазмалеммой. Детали строения корешковой системы
не изучены.
Гаптоподии Aurigamonas, в отличие от аксоподий
солнечников, имеют одинаковую толщину (0,3 мкм) по
всей длине и оканчиваются шишковидными гаптосо-
мами (рис. 309, А-В', 310, Г). Число гаптоподий у одной
клетки варьирует от 15 до 50 при длине 5-7 мкм. Скелет
гаптоподии представляет собой полый цилиндр, стенка
которого состоит из плотно упакованных микрофила-
ментов толщиной 7 нм (рис. 310, В). Проксимальный
конец цилиндра лежит непосредственно в эктоплазме
клетки, не прикрепляясь к каким-либо структурам.
В основании гаптоподии эктоплазма клетки конусо-
образно выступает наружу, образуя папиллу размером
0,7*0,85 мкм (рис. 310, А, Д, 311). Капсула гаптосомы
содержит электронно-плотную сердцевину и окруже-
PANSOMONADIDA
443
Рис. 309. Внешняя форма клетки Aurigamonas solis.
А — клетка в стадии прикрепления и образовании псевдоподии (световой микроскоп); Б — высушенный препарат; В — общий вид клетки в сканиру-
ющем электронном микроскопе, бк — бактерия, пс — псевдоподия, гп — гаптоподия, гс — гаптосома, дж — длинный жгутик, лп — ламеллиподия,
фп — филоподия, я — ядро; большая стрелка — длинный жгутик, маленькая черная стрелка и короткая белая стрелка — короткий жгутик. Масштаб-
ные линейки: А — 10 мкм, Б, В — 5 мкм. (По: Vickerman et al., 2005).
на мембраной (рис. 310, Г). Гаптоподии отсутствуют у
амебоидных уплощенных клеток во время образования
разветвленных псевдоподий (рис. 312, Е) и прекраще-
ния работы жгутика.
Ядро диаметром 3-8 мкм с центральным ядрышком
лежит неподалеку от кинетосом (рис. 309, Я; 310, А,Д).
Две попеременно работающие сократительные вакуо-
ли расположены спереди от ядра, по обе стороны от ки-
нетосом (рис. 310, Д; 311). Митохондрии с трубчатыми
или ампуловидными кристами (рис. 310, Я, Ж). Дик-
тиосома аппарата Гольджи лежит в небольшом углу-
блении ядра (рис. 310, Я, £; 311). У голодных особей
в цитоплазме заметны спикуловидные тела, которые
находятся в вакуолях (рис. 310, А; 311). Предполагает-
ся, что они участвуют в образовании пищеварительных
вакуолей. Обычно в клетке присутствуют оранжевые
липидные глобулы и зрелые гаптосомы (рис. 310, А).
Некоторые цистерны эндоплазматического ретикулума
содержат зачатки мастигонем. В цитоплазме обнаружи-
ваются многочисленные уплощенные пузырьки с утол-
щенной мембраной (10 нм), вероятно, участвующие в
быстром образовании псевдоподий и пищеварительной
вакуоли (рис. 311). Одиночная разветвленная органел-
ла (микротельце, или парануклеарное тело) с тонкой
мембраной (6 нм) и трубчатыми структурами распола-
гается около ядра (рис. 310 А; 311).
444
PANSOMONADIDA
Рис. 310. Строение клетки Aurigamonas solis.
А — продольный срез клетки, Б — длинный жгутик, В — строение гаптоподии, Г— гаптоподия и гаптосома, Д и Е — срезы переднего конца клетки,
Ж— митохондрия. аГ — аппарат Гольджи, ан — акронема, бк — бактерия, гп — гаптоподия, гс — гаптосома, кс — кинетосома, лг — липидные гло-
булы, м — митохондрия, мн — мастигонемы, мт — микротельце, мф — микрофиламенты, пп — папилла, св — сократительная вакуоль, сп — спикулы,
уп — уплощенные пузырьки, эр — эндоплазматический ретикулум, я — ядро, большая стрелка — электронно-плотное тело (пластинка), маленькие
стрелки — микрофиламенты внутри гаптоподии. Масштабные линейки: А, Е — 1 мкм, В — 0,25 мкм,ГДЖ — 0,5 мкм. (По: Vickerman et al., 2005).
Шаровидная циста покрыта тонкой (0,1 мкм) обо-
лочкой без пор. В цитоплазме цисты находится ядро,
кинетосомы жгутиков, митохондрии, шероховатый
ЭПР, аппарат Гольджи и микротельце. Гаптоподии и
спикулы в ней не обнаружены.
Особенности биологии
Aurigamonas solis
Aurigamonas питается различными жгутиконосца-
ми и, возможно, бактериями (Vickerman et al., 2005).
В зависимости от размера жертвы обнаружено три
способа питания: 1) фагоцитоз — заглатывание клет-
ки эукариотной жертвы целиком (рис. 312, А, Б), или
2) захват прикрепленных к субстрату бактерий при
помощи крупной ламеллиподии (рис. 312, £); 3) ми-
зоцитоз — «высасывание» части цитоплазмы круп-
ной жертвы (рис. 312, В). В смешанной культуре этот
хищник поглощал целиком Spumella sp. (4-9 мкм),
Bodo saltans (5-9 мкм), Rhynchobodo sp. (12-
15 мкмк), Goniomonas truncata (8-12 мкм), Apusomo-
nas proboscidea (9-14 мкм) и Ploeotia sp. (15-21 мкм).
Aurigamonas поглощал только вегетативные формы и
игнорировал цисты. Он нападал также на амебоид-
ных жгутиконосцев Heteromita (4-8 мкм), Cercomonas
(12-21 мкм) и Thaumatomonas, но почему-то не за-
глатывал их, а после временного контакта отползал.
Почвенные инфузории, например, Colpoda cucullus
и амебы (Mayorella spp.) не подвергались нападе-
нию с его стороны. Наиболее подходящей жертвой
для Aurigamonas служили Bodo saltans и Ploeotia sp.
Клетки первого вида при случайном контакте прили-
пали к кончикам гаптоподий, затем в течение 2 минут
PANSOMONADIDA
445
Рис. 311. Схема строения клетки Aurigamonas solis.
аГ — аппарат Гольджи, гп — гаптоподия, гс — гаптосома, дж — длинный жгутик, кж — короткий жгутик, лг — липидные глобулы, м — митохондрия,
мкт — микротрубочки, мт — микротельце, мф — микрофиламенты, пп — папилла, св — сократительная вакуоль, сп — спикулы, уп — уплощенные
пузырьки, я — ядро. (По: Vickerman et al., 2005).
446
PANSOMONADIDA
хищник охватывал клетку жертвы большой псевдо-
подией и втягивал вакуоль внутрь при участии со-
кращающихся гаптоподий (рис. 312, А). В пищевари-
тельной вакуоли через некоторое время появлялись
светопреломляющие спикулы, поступающие туда из
цитоплазмы хищника. В редких случаях жертва успе-
вала открепиться от гаптоподий хищника и уплыть
до формирования псевдоподии. Полный цикл погло-
щения Ploeotia занимал 20 минут. Клетки Euglena
gracilis и Apusomonas proboscidea поглощались по-
средством мизоцитоза. В этом случае от жертвы
оставалась пустая оболочка (рис. 312, В). В резуль-
тате активного питания обычно происходит увеличе-
ние размера клеток Aurigamonas. Попытки перевести
культуру Aurigamonas на питание одними бактериями
оканчивались неудачей. Поэтому можно считать эту
пансомонаду облигатным хищником с широким спек-
тром питания.
Рис. 312. Питание и образование псевдоподий Aurigamonas solis.
A-В — питание различными видами жертв (А — Bodo saltans, Б — Ploeotia sp., В — Euglena gracilis), Г— начало амебоидной стадии, Д— образова-
ние ламеллиподии, Е — сокращение гаптоподий и образование разветвленных филоподий. Масштабная линейка: 10 мкм. (По: Vickerman et al., 2005).
PANSOMONADIDA
447
Культуры Aurigamonas хорошо росли с добавле-
нием в качестве пищи В. saltans и бактерий. Через
3 недели после посева численность клеток уменьша-
лась, и они переходили в цисты. Перед инцистирова-
нием особи теряли двигательную активность, умень-
шались в размерах до 3,7—4,8 мкм. После содержания
Aurigamonas при 4—8 °C в течение нескольких меся-
цев, последующего пересева на свежую среду, содер-
жащую В. saltans, они эксцистировались и приступа-
ли к размножению.
В дополнение к гаптоподиям жгутиконосец про-
дуцирует псевдоподии, причем, не только для захвата
пищи (рис. 312, Г). Их форма меняется от лобоподиаль-
ной до филоподиальной. Одна или более (до трех) псев-
доподий длиной до 18 мкм способны формироваться
на любом участке клетки (рис. 312, Г). Они служат для
прикрепления клетки к субстрату, а после открепления
от него преобразуются в одну длинную ламеллиподию
(рис. 312, Д), или в несколько сильно ветвящихся фило-
подий (рис. 312, £). У амебоидных форм жгутики не
функционируют, однако после втягивания псевдоподий
и переходе к активному движению биение жгутика воз-
обновляется.
Жгутиконосец скользит по субстрату по прямой со
скоростью 0,3-0,5 мм/мин, одновременно покачиваясь
из стороны в сторону на угол примерно 30° со скоро-
стью 150-200 колебаний в минуту. Такие особенности
движения клетки и наличие гаптоподий позволяют
легко определять этот организм в пробах. При откре-
плении от субстрата клетка хаотично раскачивается.
Движение длинного жгутика приводит к скоплению
бактерий на его кончике. У неподвижных особей длин-
ный жгутик отсутствует, вероятно, в результате автоно-
мии (Vickermen et al., 2005).
Экология
Aurigamonas solis обнаруживается сравнительно
редко: в 8 из 175 почвенных проб (Vickerman et al.,
2005). Однако встречаемость этого жгутиконосца в
пробах из нескольких географически удаленных рай-
онов предполагает широкое распространение этого
хищника в почвах. В России этот вид найден в забо-
лоченных водоемах (Leonov, 2007). Удивительно, что
ранее этот организм не отмечали в природе, хотя его
идентификация не вызывает затруднений. Возможно,
это объясняется способом обработки проб, в которых в
момент отбора мало клеток жертв. Клетки Aurigamonas
появляются в пробах на восьмой день после пересева,
когда размножаются клетки жертв, необходимые для их
питания.
Систематика и филогения
Редукция переднего жгутика — обычное явление
у представителей Cercozoa (например у глиссомонад,
Helkesimastix, Thaumatomonas), или этот жгутик от-
сутствует (Allantion) (Cavalier-Smith et al., 2009; Howe
et al., 2009; 2011b). Редуцированный жгутик обычно
сохраняет свою подвижность в отличие от коротко-
го жгутика Aurigamonas. Способ крепления к суб-
страту заднего жгутика Aurigamonas, а также маят-
никообразные покачивания клетки при движении, в
определенной мере сходны с таковыми морского хищ-
ника Metromonas (Larsen, Patterson, 1990). В отличие
от большинства других Cercozoa жгутики Aurigamonas
несут простые мастигонемы, такие же, как у эвглено-
вых, кинетопластид и динофлагеллят (Brooker, 1965;
Karpov, 2000).
Гаптоподий внешне напоминают аксоподий, от-
личаясь от них одинаковой толщиной и отсутствием
экструсом по всей своей длине. Они более ригидны и
не способны быстро сокращаться как у Actinophryida
и Centrohelida (Kinoshita et al., 2001; см. гл. Солнечни-
ки). Однако гаптоподий принципиально отличаются
от аксоподий наличием совершенно иного скелета (из
микрофиламентов, а не микротрубочек), который, к
тому же, не имеет морфологически выраженного цен-
тра организации. Судя по толщине, микрофиламенты
Aurigamonas построены из актина, однако окрашива-
ние на F-актин не проводили.
Гаптоподий гораздо ближе по строению к микро-
виллям воротничковых жгутиконосцев. По сути, это
вторая группа протистов, имеющая постоянные выро-
сты со скелетом из микрофиламентов. Правда, у хоа-
нофлагеллат микровилли тоньше (примерно 200 нм в
диаметре) и поддерживаются сплошным пучком ми-
крофиламентов (Karpov, Leadbeater, 1998), тогда как у
Aurigamonas микрофиламенты организованы в форме
полого цилиндра. По-видимому, такие структуры раз-
вивались в обеих группах независимо, т.к. по другим
морфологическим и генетическим (сиквенсы генов)
признакам эти таксоны далеко отстоят друг от друга:
Aurigamonas относится к Cercozoa, а хоанофлагеллаты
к опистоконтам.
Некоторые морфологические особенности Auriga-
monas (псевдоподии, гаптосомы, микротельца, от-
сутствие поверхностного цитоскелета или защитных
структур) сближает их с классом Sarcomonadea (Cava-
lier-Smith, Chao, 2003), в том числе с отрядом Сегсо-
monadida (Bass et al., 2009). Филогенетический ана-
лиз сиквенсов малой субъединицы рДНК показал, что
Aurigamonas находится внутри группы Cercozoa. Хотя
организация гаптоподий уникальна среди Cercozoa,
двужгутиковость и амебоидная природа Aurigamonas
подтверждает их родственные связи. С соответствии
с последними МФС A. solis ближе всех к новому роду
Agitata, и некоторым природным сиквенсам, в том чис-
ле к новой кладе 7 (Bass et al., 2009).
Дальнейшие исследования показали, что три вида
из рода Agitata сходны по сиквенсам генов 18S рРНК с
Aurigamonas solis, а полиубиквитин у этого вида и Agi-
tata tremulans содержит вставку аминокислоты (сери-
на) (Bass et al., 2005; 2009; Vickerman et al., 2005; Howe
et al., 2011a). Такая вставка имеется у представителей
Gromiidea, Chlorarachnea и Metopiida, тогда как другие
церкозои имеют две вставки аминокислоты (Bass et al.,
2009; Howe et al., 2011a). Это означает, что Aurigamonas
не является саркомонадой, а принадлежит к церкозоям,
448
PANSOMONADIDA
имеющим только одну вставку аминокислоты. Соглас-
но приведенной в работе МФС клада Aurigamonas +
Agitata + NC7 занимает апикальное положение и явля-
ется сестринской к Heteromitidae Kent, 1880 (ныне это
отряд Glissomonadida Howe et al., 2009) co слабой ста-
тистической поддержкой.
Виды рода Agitata существенно отличаются от
Aurigamonas по спектру питания, форме тела, жиз-
ненному циклу, отсутствию гаптоподий и поведению
(Bass et al., 2009). В соответствии с последней МФС
(Howe et al., 2011а) статистическая поддержка класте-
ра, объединяющего эти два рода, сравнительно низка, а
ультратонкое строение представителей рода Agitata не
изучено. Перечисленные причины позволяют считать
включение рода Agitata в отряд пансомонад преждев-
ременным. Поэтому в систематическом обзоре приве-
ден только один вид отряда Pansomonadida.
Систематический обзор
Исключив Agitata из пансомонад, мы получаем
таксон с уникальным сочетанием морфологических
признаков: два жгутика, гаптосомы и гаптоподии (по-
следние два не встречаются у других протистов). Обо-
собленность этой группы подтверждается молекулярно-
биологическими данными (Vickerman et al., 2005; Bass
et al., 2009; Howe et al., 2011). Ограничив состав отряда
одним родом, следовало бы изменить исходный диагноз
отряда, однако в данной работе такая задача не ставится.
SUM
The freshwater and soil heterotrophic flagellates with two het-
erodynamic flagella covered with simple mastigonemes. The pos-
terior flagellum is active and long, another flagellum is short and
non-active. The cell has unique radial projections — haptopodia.
Each haptopodium has an axial cylinder of microfilaments, ending
with an extrusive organelle — haptosoma. The vesicular nucleus
is located at the cell centre, mitochondria have tubular cristae, one
or two contractile vacuoles present. The cell can produce filopo-
dia or lamellipodia for prey (protists and bacteria) capture. The life
Отряд Pansomonadida Vickerman,
Appleton, Clarke et Moreira 2005
Гетеротрофные жгутиконосцы с двумя гетеродина-
мичными жгутиками. Подвижная жгутиковая стадия
чередуется с амебоидной сидячей. Между мономерами
убиквитина находится одна вставка аминокислоты.
Отряд включает 1 род: Aurigamonas.
Род Aurigamonas Vickerman 2005
Хищные жгутиконосцы с многочисленными гапто-
подиями и двумя жгутиками (одним длинным и подвиж-
ным, вторым загнутым и неподвижным). Пузырьковид-
ное ядро прилегает к кинетосомам. Две сократительные
вакуоли находятся у основания жгутиков. Каждая гап-
топодия отходит от папиллы и несет терминальную гап-
тосому, служащую для фиксации и удержания добычи.
Питание при помощи псевдоподий: голозойное или ми-
зоцитоз. Почвенные организмы. Род монотипный.
Aurigamonas solis Vickerman 2005 (рис. 309-311)
Слабоподвижные сферические или яйцевидные
жгутиконосцы, диаметром 3-18 мкм, покрытые 15-50
гаптоподиями, достигающими 6 мкм длины. Длинный
жгутик 9-52 мкм синусоидально изгибается от основа-
ния к дистальному концу и во время движения клетки
по субстрату вызывает ее маятникообразные движения.
Короткий жгутик длиной 4-8 мкм.
ARY
cycle consists of the flagellate and amoeboid stages and the rest
cysts. The reproduction appears by longitudinal binary fission.
Sexual process is unknown. Occur in soil and freshwater habitats.
Only genus Aurigamonas was included in the order. Three species
of another genus Agitata were excluded from the order, because
of low support on the recent molecular phylogenetic tree (Howe
et al., 2011a), essential morphological and behavior differences of
Agitata and Aurigamonas (Bass et al., 2009), and unknown ultra-
structure of Agitata.
ЛИТЕРАТУРА
Bass D., Moreira D., Lopez-Garcia P., Polet S., Chao E.E, von der
Heyden S., Pawlowski J., Cavalier-Smith T. 2005. Polyubiquitin insertions
and the phylogeny of Cercozoa and Rhizaria. // Protist. Vol. 156. P. 149-161.
Bass D., Howe A.T., Mylnikov A.P., Vickerman K., Chao E.E.,
Smallbone J.E., Snell J., Cabral Jr.C., and Cavalier-Smith T. 2009. Phy-
logeny and classification of Cercomonadidae: Cercomonas, Eocercomonas,
Paracercomonas, and Cavernomonas gen. n. // Protist. Vol. 160. P. 483-521.
Brooker B.E. 1965. Mastigonemes in a bodonid flagellate // Exp. Cell
Res. Vol. 37. P. 300-305.
Cavalier-Smith T., Chao E.-E. 2003. Phylogeny and classification of
Cercozoa (Protozoa) // Protist. Vol. 154. P. 341-358.
Cavalier-Smith T., Lewis R., Chao E.-E., Oates B., Bass D. 2009.
Helkesimastix marina n. sp. (Cercozoa: Sainouroidea superfam. n.) a gliding
zooflagellate of novel ultrastructure and unusual ciliary behaviour // Protist.
Vol. 160. P.452^79.
Howe A.T., Bass D., Scoble J.M., Lewis R., Vickerman K., Arndt H.,
Cavalier-Smith T. 2011a. Novel cultures protists identify deep-branching en-
vironmental DNA clades of Cercozoa: new genera Tremula, Micrometopion,
Minimassisteria, Nudifila, Peregrinia II Protist. Vol. 162. P. 332-372.
Howe A.T., Bass D., Chao E.E, Cavalier-Smith T. 2011b. New genera,
species, and improved phylogeny of Glissomonadida (Cercozoa) // Protist.
Vol. 162. P. 710-722.
Karpov S.A. 2000. Flagellate phylogeny: an ultrastructural approach //
B.S.C. Leadbeater, J.C. Green (eds). The flagellates. Unity, diversity and evo-
lution. Systematics Association Special Volume Series 59. London: Taylor
and Francis. P. 336-360.
Karpov S.A., Leadbeater B.S.C. 1998. Cytoskeleton structure and
composition in choanoflagellates // J. Euk. Microbiol. Vol. 45. P. 361—
367.
Kinoshita E., Shigenaka Y., Suzaki T. 2001. The ultrastructure of
contractile tubules in the heliozoan Actinophrys sol and their possible in-
volvement in rapid axopodial contraction // J. Euk. Microbiol. Vol. 48.
P. 519-526.
Larsen J., Patterson D.J. 1990. Some flagellates (Protista) from tropi-
cal marine sediments // J. Nat. Hist. Vol. 24. P. 801-937.
Leonov M.M. 2007. The biodiversity of heliozoans and hetero-
trophic flagellates of several bogs and small river // Abstracts of V Eu-
ropean Congress of Protistology and XI European Conference on Ciliate
Biology (Russia, St. Petersburg, July 23-27, 2007). Protistology. Vol. 5.
P. 50.
Vickerman K., Appleton P.L., Clarke K.J., Moreira D. 2005.
Aurigamonas solis n. gen., n. sp., a soil-dwelling predator with unusual helio-
flagellate organisation and belonging to a novel clade within the Cercozoa //
Protist. Vol. 156. P. 335-354.
Указатель латинских названий1
Abedinium 14, 79
— dasypus 80
Abeoforma 342, 346, 350, 352, 354, 365
— whisleri 350, 351, 354, 365, 366
Abratopdinium 12
Acanthachiasmidae 104
Acantharea 182
Acantharia 95, 97, 100, 106, 107, 126, 130, 136,137, 169, 170
Acanthaulax 10
Acanthochiasma 109
— fusiforme 109
— hertwigi 109
— planum 109
— quadrangulatum 109
— rubescens 108, 109
— serrulata 109
Acanthochiasmidae 100, 108
Acanthocolla 109
— cruciata 108, рис. 56 (вкл.)
Acanthocollidae 109, рис. 56 (вкл.)
Acanthocyrta 109, 164
— haeckeli 108, рис. 56 (вкл.)
Acanthocystidae 216, 221, 224, 225, 229, 231, 232
Acanthocystina 225
Acanthocystis 102, 205, 211, 212, 216, 218, 223, 225, 229
— bicornis 221
— nichollsi 221
— pectinata 217
— penardi 223
— turfacea 229, 232
Acanthodesmia 196
— viniculata 197
Acanthodesmiidae 171, 196
Acanthodinium 53
Acanthogonyaulax 11, 55
— spinifera 55, рис. 14 (вкл.)
Acantholithium 111
— stellatum рис. 60 (вкл.)
Acanthometra 168
AcanthometraVS, 113
— pellucida 113, 98, рис. 54 (вкл.), рис. 55 (вкл.)
— terracopa 98
Acanthometridae 113
Acanthoplegma 109
— krohni 109, рис. 54 (вкл.), рис. 55 (вкл.)
Acanthoplegmidae 109
Acanthosphaera 190
— actinota 191
Acanthospira 109
— spiralis 108, рис. 56 (вкл.)
Acanthostaurus 118, рис. 59 (вкл.)
— purpurascens 98,117, рис. 67 (вкл.)
Acartia grani 395
Achilleodinium 10
Achomosphaera 11, 54
Achradina 10, 50
— pulchra 50
Acinetactidae 249
Acinetactis 205, 249, 253
— elegans 252
— mirabilis 253
Aconthaspis 113, 115
Acritarcha 8
Acrobotrys 200, 201
Acrosphaera 190
— cyrtodon 189
— spinosa 189
Actiniscaceae 10, 48, рис. 8 (вкл.)
Actiniscineae 9, 48, 49
Actiniscus 10, 48
— pentasterias 17, 48, рис. 8 (вкл.)
Actinocoryne 246, 249
— contractilis 209, 211, 212, 213, 214, 247-249, 248,
Actinodinium 14, 78
— apsteinii 78
Actinomma 190
— leptodermum 191
Actinommidae 171, 174, 190,191
Actinomonas 207, 213, 253-257, 255, 259-262
— mirabilis 262
— pusilia 254
Actinophryida 205-209,209,210,211, 212,212,233, 239,245,261,
447
Actinophryidae 233
Actinophrys 73, 205, 207, 211, 233, 237-239, 261
— salsuginosa 211, 212, 233, 236-238
— sol 206, 211, 211, 233, 235, 236-239, 236, 237, 239
— taurianini 210, 211, 233, 236, 238
Actinopoda 106, 122, 136, 166, 206, 225, 239
Actinosphaeridium 213, 239, 246
Полужирным шрифтом выделены номера страниц с иллюстрациями в тексте и номера цветных рисунков вклейки.
450
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
— pedatus 241, 242, 243, 245, 246
Actinosphaerium 205, 207, 210, 211, 214, 233, 236, 238, 239
— eichhornii 209, 211, 213,233, 236, 238, 239, 239
— nucleofilum 211, 233, 236, 237, 238
Actinotheca 11
Actissa 187
Adenoides 13, 68
— eludens 68
Adinimonas 9, 13, 72
— oviforme 72
Adnatosphaeridium 11
Agitata 442, 447, 448
— tremulans 447
Agrosphaera 14, 80
— pellucida 80
Aiora 11
Aireiana 11
Akashiwo 9, 43, 82
— sanguinea 43
Alacrinella 356, 356
— limnoriae 356
Alasphaera 12
Aldorfia 10
Alexandrium 11, 27, 33, 56-58
— catenella рис. 15 (вкл.)
— minutum 57
— tamarense 29,32
Algidasphaeridium 9
Alisogymnium 10
Allantion 447
Allas 405, 407, 420, 421, 427
— diplophysa 407, 420, 427
Alterbidinium 12
Alveolata39, 135,226
Alveolates 40
Amastigomonas 309-311, 313, 315, 316, 317, 319-321, 319,321
— bermudensis 310, 311, 313, 313, 316, 319
— borokensis 309, 311
— caudata 309-311, 314,315, 316, 319, 319, 320
— debruynei 309-311, 309, 319, 320
— .filosa 311,316,319, 320
— gigantea 311, 320, 321
— griebenis 311, 320, 321
— klosteris 311, 320, 321
— marina 311, 320, 321, 321
— muscula 311, 320, 321
— mutabilis 311,319, 319, 320
— trahens 319
Ambonosphaera 10, 11
Amoeba 271
— binucleata 302
— lucida 301
— pilosa 300
— prima 271, 304
— proteus 126, 161
— spinosa 301
— tertia 304
Amoebidae 272, 274
Amoebidiales 342, 344, 345, 346
Amoebidium 346, 352, 355, 356
— australiense 355
— colluviei 355
— parasiticum 342, 346, 354, 355, 355
— recticola 355
Amoebina 274
Amoebophrya 14, 39, 82
— ceratii 82
Amoebophryaceae 14, 81
Amoebozoa 226, 296, 297, 308, 318
Amphiacon 112
— denticulatus 112, рис. 61 (вкл.)
Amphibelone 109, рис. 59 (вкл.)
— hydrotomica рис. 58 (вкл.)
Amphibiocystidium 342, 366, 367
— ranae 366, 366, 367
Amphibiothecum 342, 367
— penneri 367
Amphidiadema 12
Amphidiniella 9, 11, 59
— sedentaria 59
Amphidiniopsis 13, 66
— kofoidii 66
Amphidinium 9, 15, 22, 33, 37, 41, 43-45, 49, 58
— carterae 15
— operculatum 43
— sphenoides рис. 8 (вкл.)
Amphidoma 10, 53
— caudata рис. 14 (вкл.)
— nucula 53
Amphigymnium 10
Amphilithidae 109
Amphilithium 103, 109
— clavarium 100,110
— concretum рис. 58 (вкл.)
Amphilonche 113
— elongata рис. 59 (вкл.), рис. 61 (вкл.)
Amphilothus 50
Amphipoda 357, 362
Amphirhopalum 194
Amphisolenia 13, 22, 33, 42, 71
— bidentata рис. 12 (вкл.)
— globifera 71
— thrinax 15
Amphisoleniaceae 13, 42, 71
Amphispyris 196
— reticulata 197
Amphistaurus 118, рис. 59 (вкл.)
— complanatus рис. 67 (вкл.)
Amphitholaceae 10, 50
Amphitholus 10, 50
— elegans 50
Amphorosphaeridium 11
Amphorula 10
Amylax 11, 22, 54, 55
— lata 55
Amyloodinium 13, 39, 68
— ocellatum 39, 68
Ancyromonadida 322
Ancyromonadidae 322
Ancyromonas 308-310, 308, 322, 324, 325
— cephalopora 322, 324, 324
— contorta 325
— howeae 322, 324, 325
— limna 322, 325
— magna 325
— melba 322, 324, 325
— micra 322, 324, 325
— sigmoides 322, 323, 324, 324
— sinistra 322, 324, 325
Andalusiella 12
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
451
Andreedinium 12
Angustidinium 12
Antarctissa 196
Anthocyrtidium 199
— zanguebaricum 200
Anthozoa 37, 52
Anurofeca 362
Anurofeca richardsi 354, 362, 362
Anurosporidiidae 379
Anurosporidium 380
— pelseneeri 380
Apectodinium 12
Apedinella 253, 255-257, 255, 256, 259-261
— radians 254,259
— spinifera 261
Aphrothoraca 205
Apicomplexa 39,40, 366, 374, 379, 380
Apicoporus 9, 43
— glaber 33, 43
Apiculadinium 13
Aplosporidium scolopli 379
Apodiniaceae 14, 77
Apodinium 14, 39, 45, 77
— mycetoides 77
Aprobolocysta 10
Apsteinia 63
Aptea 11
Apteodinium 10
Apusomonadea 310
Apusomonadida 308-310, 308
Apusomonadidae 311
Apusomonas 309-311, 313, 318, 319
— australiensis 311, 318, 319
—proboscidea 309-311, 311,312, 313, 315-320, 331, 444, 446
Apusozoa 308-310,308, 327, 331, 337
Aquadulcum 13
Arachnocorys 196
Arachnodinium 11
Arachnosphaera 190
Araneosphaera 10
Arcellina composita 168
Archaeosphaerodiniopsis 13, 68
— verrucosum 68
Archaeperidinium 62
Archamoebae 295, 297, 298
Archeotectatum 11
Archezoa 295, 297
Areoligera 11
Areoligeraceae 11, 55
Areosphaeridium 10
— diktyoplokum 32
Arkellea 10
Arpyloraceae 14, 82
Arpylorus 14, 40, 82
Arthracanthida 95-98, 96, 97, 100, 101, 105, 105, 112, 115, рис. 54
(вкл.), рис. 61 (вкл.), рис. 63 (вкл.)
Artostrobiidae 171, 200, 200
Artostrobus 198
— annulatus 199
Arundinula 357
— capitata 357
Arvalidinium 12
Ascetospora 379, 398
Ascetosporea 380, 399
Ascodinium 12
Asellariales 342
Asterodinium 10, 50
— gracile 50
Astracantha 138
— actinastra 140
Astracanthidae 122, 136-138
Astreptonema 357, 357
— gammari 354
— longispora 357
Astrodisculus 205
Astrolithidae 111, рис. 60 (вкл.)
Astrolithium 111
— bulbiferum рис. 60 (вкл.)
Astrolonche 111
— serrate рис. 60 (вкл.)
Astrosphaera 190
Ataxiodinium 11, 54
Atelodinium 14, 82
— microsporum 82
Atlanticella 148, 149, 150
— bicornis 150
Atlanticellidae 122, 130,148, 149,150-152
Atlanticellodinium 14, 82
— tregouboffi 82
Atlantodinium 11
Atopodinium 11
Aulacantha 125, 126, 130, 132, 138
— scolymantha 123,132, 138
Aulacanthidae 122, 132, 136, 137,138, 139, рис. 81 (вкл.)
Aulactinium actinastra 140
Aularia 140
Aulastrum 140
— spinosum 141
Aulatractus 140
Aulatractus fusiformis 141
Auloceros 138
— arborescens 139
Aulodendron 138,139
Aulographis 138
— furcula рис. 81 (вкл.)
Aulographonium 138,139
Aulokleptes 125, 138
— ramosus 139
Auloscena 138, 140
— verticillus 141
Aulospathis 138
— variabilis 139
Aulosphaera 140
— dendrophora 141
Aulosphaeridae 122, 138
Aureodinium 43
Aurigamonas 442, 444, 446-448
— solis 442, 443-446,444, 447, 448
Australisphaera 11
Avellodinium 11
Axoplasthelida 207
Azadinium 9, 13, 68
— spinosum 68
Balcattia 11
Baldinia 9, 10, 25, 41, 52
— anauniensis 24, 52
Balechina 10, 43, 49, 56
— pachydermata 49
Balmula 11
452
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Balteocysta 11
Barbatacysta 11
Bargoniella 14, 77
— amylacea 11
Barrufeta 9, 43
— bravensis 43
Batiacasphaera 11
— micropapillata 32
Batioladinium 10
— longicornutum 32
Beaumontella 10
Bellatudinium 13
Belodinium 11
Belonozoum 188
Berghiella 10, 49
— perplexa 49
Bernardinium 9, 44, 47
— bernardinense 47
Beyrichodinium 10
Bicarinellum 12
Biecheleria 9, 10, 41, 51
— pseudopalustris 51
Biecheleriopsis 9, 10, 41, 51
— adriatica 51
Biorbifera 13
Bitectatodinium 11,54
Bivalvia 134
Blastodiniaceae 14, 39, 76
Blastodiniales 14, 40, 45, 76-78
Blastodiniphyceae 8, 14, 27, 29, 39,41, 76
Blastodinium 14, 39, 76
— pruvotii 76
Blepharocysta 13, 64, 65
— splendor-maris 15, 64, рис. 17 (вкл.)
Bodo cephalopora 324
— marina 370, 377
— saltans 444, 446,447
Bodopsis 402, 405, 421
— alternans 405
— godboldi 405, 416, 422
— platyformis 405, 425
Bohaidina 12
Bonamia 380, 381, 385, 387-390
— angasi 387
— exitiosa 387
— ostreae 381, 385, 387, 389
— perspora 389
Boreadinium 13, 63
— pisiforme 63
Boreocysta 11
Borgertella 147
Borghiella 9, 10, 41, 52
— dodgei 52
Borghiellaceae 9, 10, 52
Bosedinia 12
Botryocephalina 201
— armata 200
Botryocyrtis 201
Botryopyle 201
— dictyocephalus 200
Botryostrobus 200
— auritus/australis 200
Bourkidinium 11
Brachydiniaceae 10, 50
Brachydinium 10, 50
— capitatum 15, 50
Brachyura 358, 361
Bradleyella 11
Brigantedinium 13, 63
Broomea 10
Broomeoideae 10
Buccinosphaera 190
— invaginata 189
Bulbodinium 12
Bysmatrum 9, 12, 60
— caponii 21
— subsalsum 60
Balanosporida 379
Cabra 9, 13, 66
— matta 66
Cachonella 14, 77
— paradoxa 32, 77
Cachonellaceae 14, 77
Cachonina 12, 60
Cachonodinium 14, 80
— caudatum 80
Cadium 147
Caementellidae 136
Calcicarpinum 12
Calciodinelloideae 12
Calciodinellum 12, 61
Calcipterellum 12, 54
Caligodinium 11
Callaiosphaeridium 11
Callianassidae 358
Callimitra 196, 198
— carolotae 197
Camptonema 238
Cancer pagurus 398, 400
Canningia 11
Canninginopsis 11
Cannobotryidae 171, 200,201
Cannorrhaphidae 136, 137
Cannorrhaphis spinulosa 140
Cannosphaera 142
Cannosphaeridae 122, 138, 142
Cannosphaeropsis 11
Cantulodinium 10
Capillicysta 13
Capsaspora 345, 353
Capsellina 430, 436, 439, 440
— bryorum 430, 434,440
— timida 440
Carduifolia 10
Carinellum 12
Carnarvonodinium 11
Carpatella 10
Carpathodinium 10
Carpocaniidae 171, 199,199
Carpocanium 178, 199,199
Carpodinium 10
Carposphaera 190
Caryoblastea 294
Caryotoma 14, 77
— bernardi 11
Cassiculosphaeridia 11
Cassidium 11
Cassiopea 52
Castanarium 144
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
453
— antarcticum 143
— favosum 143
Castanea 143
— henseni 143
Castanella 143
— sloggetti рис. 81 (вкл.)
Castanellidae 122, 142,142, рис. 81 (вкл.)
Castanidium 142
— podacontium рис. 81 (вкл.)
— variabile рис. 81 (вкл.)
Castanissa 142
— megastomata 143
Castanura 143
— primitiva 143
Catastomocystis 11
Cauca 11
Cauveridinium 11
Cenosphaera 190
Centrobotrys 201
Centrocubus 190, 192
— cladostylus 191
Centrodiniaceae 9, 13, 67
Centrodinium 11, 13, 68
— elongatum 68
Centrohelida 205-208, 209,210,211, 212, 212,216, 224, 225, 447
Centroheliozoa 224
Centroplasthelida 207
Cepadinium 12
Cephalopoda 129
Cephalospyris 196
Cerataulina 45
Ceratiaceae 11, 56
Ceratiineae 11, 56
Ceratium 11, 23, 27, 33, 34, 56, 81, 82
— arcticum рис. 22 (вкл.), рис. 33 (вкл.)
— candelabrum 56, рис. 15 (вкл.)
— cornutum 15
— furca 56
— hirundinella 7, 31, 33
— horridum 30
— tetraceras 56
— tripos 24, рис. 33 (вкл.)
Ceratocoryaceae 11, 55
Ceratocorys 11, 55
— horrida 55
Ceratodinium 43
Ceratoperidinium 10, 49
— у eye 49
Cercaria 71
Cercomonadida 437,442, 447
Cercomonadidae 274
Cercomonas 246, 252, 321, 436, 444
— marina 321
Cercozoa 106, 122,136,225,246,252, 374,380,388,399,402,403,
420, 429, 436, 447
Cerebrocysta 11
Cernicysta 10
Cerodinium 12
Chaetoceros 45
Chalarothoraca 205
Challengeranium 147
— diodon 148
Challengeridae 122, 125, 135, 136, 148, рис. 90 (вкл.)
Challengeron 147
Challengerosium 147
Chalubinskia 13, 67
Chaoidae 274
Chaos 272
Charlesdowniea 12
Chatangiella 12
— verrucosa 32
Chaunacanthida96, 99,101, 102, 105,105,110, 111, рис. 54 (вкл.),
рис. 61 (вкл.)
Chichaouadinium 12
— vestitum 32
Chilodinium 43
Chilomonas 370
— marina 377
Chimonodinium 9, 13, 65
— lomnickii 65
Chiropteridium 11
Chlamydaster 205, 216, 217, 225, 226, 228
— laciniatus 210, 220, 223
— sterni 213, 224, 226, 227, 228
Chlamydomonas nivalis 107
Chlamydophora 205
Chlamydophorella 11
Chlamydophryidae 439
Chlorarachnea 447
Chlorella 164
Chlorophyta 107, 128
Choanocystidae 225
Choanocystis 216, 218, 221, 223, 225, 229
— lepidula 229, 232
— rhytidos 217
Choanoflagellata 353
Chromalveolata 39
Chromista 102
Chrysidella 76
Chrysochromulina parva 376
Chrysophyceae 416
Chrysophyta 128, 261
Chrysosphaerella patelliformis 425
— salina 425
— triangulata 406
— tripus 426
Chytridiomycota 398
Chytriodiniaceae 45
Chytriodinium 14, 45, 78
— roseum 78
Chytroeisphaeridia 11
Cienkowskya 213, 239, 246
— brachypous 242, 243
— mereschkowskii 243, 245, 246
Ciliophrys 207, 215, 238, 252, 253, 255, 256, 259-262
— azurina 211, 256, 259-261
— infusionum 205, 254, 255, 256, 258, 258, 260, 262
Cinctactiniscus 10
Circocastanea 144
— margarita рис. 81 (вкл.)
Circocastanellinae 144
Circogoninae 144
Circoporidae 122, 142, 144, рис. 81 (вкл.)
Circospathis 144
— sexfurca рис. 81 (вкл.)
Circulodinium 11
Cirrusphaera 11
Citharistes 13, 33, 34, 39, 69
— regius 69
Cladococcus 190, 192
454
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
— cervicornis 191 Collozoum 168, 180, 187
Cladopyxiaceae 10, 53 — inerme 76, 180, 181,188
Cladopyxidium 10 Colonsaydinium 12
Cladopyxiineae 53, 54 Colpoda cucullus 444
Cladopyxis 10, 53 Colpodella 40
— brachiolata 53 Colponema 374
— caryophyllum 15 Cometodinium 11
Clathrocanium 196 Comparodiniaceae 13, 67
Clathrocorys 196, 198 Compositosphaeridium 11
— teuscheri 197 Conacon 112
Clathroctenocystis 10 —foliaceus 112, рис. 61 (вкл.)
Clathrocyclas 198 Conaconidae 112, 122, 136, 154, 155
Clathrulina 102, 205, 213, 238, 239, 241, 243, 246 Concharidae рис. 90 (вкл.)
— elegans 205, 209, 214, 240, 240-243, 243-246, 245 Conchariinae 154
Clathrulinidae 239 Concharium 154
Claustrosporida 380 Conchasma 154
Claustrosporidiidae 380 Conchellium 154
Claustrosporidium 380 Conchidiinae 154
— aselli 380 Conchidium 154
— gammari 380 Conchonia 154
Cleistosphaeridium 11 Conchopsidinae 154
—placacanthum 32 Conchopsis 154
Clipeodinium 79 — barca рис. 90 (вкл.)
Cnidaria 52, 76, 164 Congruentidiaceae 13, 62
Cobricosphaeridium 14 Congruentidioideae 13
Coccodiscidae 171, 192,193 Congruentidium 13, 62
Cochlodinium 9,15, 32, 43, рис. 37 (вкл.) — compressum 62
—pirum 32 Conneximura 10
— strangulatum 44 Conosa 297
Cochlosyndinium 81 Conosea 295
Codoniella 11 Conosphaeridium 10
Coelacantha dogieli 141 Coolia 11,33,56, 57
Coelantheum 158 — monotis 57
— auloceroides 157 Corallochytrium 345, 353
Coelocantha 142 Corculodinium 12
Coelodendridae 122, 127, 128, 130, 136, 155,155-157, 158 Cordosphaeridium 10
Coelodendrum 131, 158 —funiculatum 32
— ramosissimum 156 Corella 364
Coelodorinae 155, 158 Cornucella 149, 151
Coelodryminae 155, 158 Cornudinium 10
Coelodrymus 158 Cornutella 198
Coelographis 127, 130, 155, 158 —profunda 199
— antarcticum 157 Corocalyptra 198
Coeloplegma 158 — columba 199
— murrayana 156 Coronifera 11
Coeloplegminae 155, 158 Corradinisphaeridium 11
Coelotetraceras 158 Corrudinium 11
— xanthacanthum 156 Corythodinium 67
Coelotholinae 155, 158 Coscinaspis 113, 115
Coelothyrsinae 155, 158 Cotylorhiza 52
Coelothyrsus 158 — tuberculata 76
— cypripedium 157 Craniaspis 113, 115
Coleaspis 118 —parmipora 115
— vaginata 115 Craspedodinium 12
Colinella 82 Craspedotella 14, 80
Collinella 82 —pileotus 80
Collodaria 165, 171, 174, 180-183,181, 187, 188,188 Crassostrea gigas 390, 398, 400
Collosphaera 190 — virginica 387
— globularis 180 Creolimax 342, 346, 352, 354, 364
— huxleyi 189, 190 —fragrantissima 352, 354, 364, 365
— macropora 190 Crepidoodinium 14, 39, 77
—polygona 189, 190 — cyprinodontum 77
— tuberosa 189, 190 Cribroperidinioideae 10
Collosphaeridae 171, 183,189, 190 Cribroperidinium 10
Collozoida 171, 187,188 Cristadinium 13
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
455
Cristidiscoidida 263, 265
Cromyechinus 190
Cromyomma 190
Cryomonadida 421,429, 434,436
Cryothecomonas 374, 429, 430, 433, 436
— aestivalis 429, 430, 433, 434,435^137
— armigera 429, 431, 433, 433,434, 436, 437
— inermis 429, 433, 437
— longipes 429, 437
— scybalophora 429, 431,437
— vesiculata 429, 430, 437
Cryptarchaeodinium 10
Cryptaxohelida 207
Crypthecodiniaceae 11, 58
Crypthecodinium 11, 58
— cohnii 58
— setense 58
Cryptomonadineae 74
Cryptoperidiniopsis 9, 13, 65
— brodyi 65
Cryptophyceae 370, 376
Cryptophyta 370
Ctenidodinium 10
Cubodinellum 12
Cubotholus 195, 196
Cyathobodonea 370
Cycladophora 198
— davisiana 199
Cyclonephelium 11
Cymbodinium 14, 80
— elegans 15, 80
Cymososphaeridium 10
Cyrtopera 198
Cystodinedria 14, 72, 73
— inermis 73
Cystodinium 14, 72, 73
— bataviense 73
— cornifax 15, 32
Damassadinium 10
Dapcodinium 10
Dapsilidinium 12
Deflagymnium 13
Deflandrea 12
Deflandreoideae 12
Dermocystida 342, 345, 345, 347, 354, 363, 366
Dermocystidium 342, 346, 347, 354, 366-368
— cyprini 347, 349
—fennicum 347, 349
—penneri 367
—регсае 347, 348, 349, 349
—pusula 366, 367
— ranae 367
— salmonis 347, 366
Dermomycoides 367
Dermosporidium 367
Desmocapsa 13, 72
— gelatinosa 72
Desmocapsaceae 13, 72
Desmocapsales 13, 72
Desmocysta 12
Desmomastix 13, 72
— globosa 72
Desmothoraca 205
Desmothoracida 205-209, 209, 211, 212, 214, 239, 241, 246
Diacanthum 10
Diacrocanthidium 14
Diaster 10, 48
— macrokaryon 48
Dichadogonyaulax 10
Diconodinium 12
Dicranophora 102, 111
— buetschlii 110, 111
Dicroerisma 10, 49
— psilonereiella 49
Dicroerismaceae 10, 49
Dictyacantha 119
— tabulata 117, рис. 68 (вкл.)
Dictyacanthidae 119
Dictyaspis 115
— solidissima 115
Dictyocoryne 194
— truncatum 193
Dictyophimus 198
Didymocyrtis 192
Dimorpha 207, 251, 252
— mutans 250, 251
Dimorphida 205, 207, 208, 209, 211, 212, 249
Dimorphosphaera 12
Dinalialla salina 187
Dinamoeba 73, 270, 273, 274, 295, 298
— mirabilis 272, 273, 298
Dinamoebidium 14, 73
— varians 73
Dinasteromonas 9
Dinastridium 14, 67, 73
— sexangulare 73
Dinaurelia 10
Dingodinium 12
Dinocapsis 61
Dinoceras 9
Dinocloniaceae 14, 74
Dinoclonium 14, 74
— paradoxa 74
Dinococcales 67
Dinococcus 73
Dinoflagellata 7, 9, 14,42, 74, 80, 82, 112, 135
Dinofurcula 13, 69
— ultima 70
Dinogymnioideae 10
Dinogymnium 10
Dinokaryota 9, 42
Dinophyceae 9, 13, 14, 29,41, 42, 72, 75
Dinophysiaceae 13, 42, 69
Dinophysiales 13, 41, 42, 58, 69, 71, рис. 12 (вкл.), рис. 33 (вкл.)
Dinophysiphycidae 13, 69
Dinophysis 13, 22, 27, 28, 34, 42, 69, 70
— acuta 69
— apicata рис. 12 (вкл.)
— caudata 19, рис. 12 (вкл.)
— doryphora рис. 12 (вкл.)
— rotundata рис. 33 (вкл.)
Dinopodiella 74
Dinoporella 12
Dinopyxis 71
Dinorbiculus 73
Dinosphaera 13, 68
— palustris 68
Dinothrix 14,15, 74
— conradii 74
456
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Dioxy а 12 Echinodinella 12
Diphasiosphaera 11 Echinosphaerium 238
Diphy es 10 Echinum majus 51, рис. 37 (вкл.)
Diploconidae 118 — minus 51
Diploconus 97, 118 Ectosphaeropsis 11
—fasces рис. 59 (вкл.), рис. 63 (вкл.) Egmontodinium 10
Diplodinium 58, 78 Elaeorhanis 263
Diplomonada 127 Ellipsodinium 12
Diplomorpha 77 Ellipsoidictyum 12
Diplopelta 13, 62, 63 Ellobiopsidae 40
— bomba 63 Ellobiopsis 40
Diplopeltopsis 64 Elytrocysta 12
Diplopoda 357 Emmetrocysta 10
Diplopsalioideae 13 Emslandia 11
Diplopsalis 13, 63, 64 Enciculifera 62
— lenticula 63 Endoceratium 11
Diplopsalopsis 13, 63 Endodinium 76
— bomba 21, рис. 17 (вкл.) — chattonii 76
— orbicularis 63 Endolimax 291
Dipylissa 195 — папа 297, 298
Discorsia 11 Endoscrinium 10
Discroerisma 49 Energlynia 10
Disphaerogena 11 Ensiculifera 12, 60
Dissiliodinium 11 — mexicana 61
Dissimulidinium 12 Entamoeba 297
Dissodinium 14, 33, 58, 77 Entamoebida 297, 298
—pseudolunula 77 Enterobryus 342, 354, 358, 358
Dissodium 13, 63 — elegans 342, 358
—parvum 63 Enteromyces 358, 359
Distatodinium 12 — callianassae 358
Dodekovia 13 Enteropogon 358
Dogelodinium 14, 82 — sexuale 350, 352, 354, 358
— ovoides 82 Enthomophthorales 363
Dolichodinium 12, 59 Entocannula 147
— lineatum 59 Entzia 63
Dollidiniaceae 13, 68 Eodinia 10
Dollidinium 13 Epelidosphaeridia 12
Dorataspidae 113,116, рис. 64 (вкл.) Ephemeroptera 356
Dorataspis 115 Epiperidinium 54
— loricata 116, рис. 64 (вкл.) Epiplosphaera 12
—polyancistra 95 Epitricysta 11
Dorocysta 12 Erythropsidinium 9, 47
Dracodinium 12 — agile 47
Druggidium 10, 32 Erythropsis M
Druppatractus 190 Escharisphaeridia 11
Duboscquella 14, 82 Esoptrodinium 9, 44, 47
— tintinnicola 82 — gemma 44
Duboscquellaceae 14, 82 Euamoebida 272
Duboscquodinium 14, 82 Eucampia 45
— collini 82 Eucastanellinae 142
Dubridinium 13, 63, 64 Euchitonia 194
Duosphaeridium 12 — elegans 193
Durinskia 12, 22, 61 Eucladinium 12, 198
— baltica 28, 61 — hexastichum 199
— capensis 21 Euglena gracilis 446, 446
Durotrigia 10 Euglenida 439
Euglenozoa 337
Eatonicysta 10 Euglypha 420
Eccrinales 342, 344, 345, 346 Eugregarinida 105
Eccrinida 344 Euphysetta 149
Eccrinidus 357, 357 — amphicodon 148
—flexilis 357 — staurocodon 148
Eccrinoides 357, 358 Euradiolaria 106, 170
— henneguyi 357 Eurydinium 12
Echinidium 9 Evansia 10
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
457
Evittodinium 12 Evittosphaerula 11 Exiguisphaera 11 Exochosphaeridium 12 Exuviaellali, 72 Glenodiniopsis 12, 60, 75 — steinii 60 Glenodinium 12, 49, 52, 57, 60-66, 68, 73 — acutum 63 — cinctum 60 Glissomonadida 448
Facetodinium 12 Fibradinium 10 Fibrocysta 11 Filasteria 345 Filisphaera 11 Filodinium 9, 44 — hovassei 44 Filosa 436 Fistulacysta 12 Flamingoia 12 Florentinia 11 Foliactiniscus 10 Folimonas 310 Foraminifera 76, 126, 136 Foucheria 11 Fragilidium 11, 57 — heterolobum 57 Freboldinium 10 Furzidinium 11 Fusiformacysta 12 Globicella 149 Glochidinium 9, 12, 61 —penardiforme 61 Gloeodiniaceae 14, 75 Gloeodinium 14, 37, 73, 75 — montanum 75 — viscum 75 Glomeridae 357 Glossodinium 11 Glyphanodinium 10 Gochteodinia 10 Godavariella 12 Gomesiamonadaceae 74 Gomesiamonas 74 — stagnalis 74 Gonellum 12 Gongylodinium 11 Goniaulax 54 Goniodinium 12 Goniodoma 11, 56, 57, 68 — acuminatum 56
Gaarderia 13, 64 — angusta 65 Gagiella 12 Galeacysta 11 Galeidinium 9, 12, 61 — rugatum 61 Gambierdiscoideae 11, 56 Gambierdiscus 11, 27, 33, 37, 56 — caribaeus 20 — toxicus 57 Gammarus setosus 364 Gardodinium 12 — trabeculosum 32 Gazelletta 148, 149 Geiselodinium 12 Gelatia 11 Geodinium 14, 80 — terrestre 80 Gerdiocysta 11 Gerlachidium 13 Gessnerium 57 Gigartacon 112, рис. 59 (вкл.) — abcisus 112 — bifidus 112 — cordiformis 112 — denticulatus 112 — fragilis 112, рис. 61 (вкл.) — muelleri 99, 112 Gigartaconidae 112 Gillnia 10 Ginginodinium 12 Gippslandia 12 Glaphyrocysta 11 Gleba 14, 80 Glenoaulax 14, 80 — inaequalis 80 Glenodiniaceae 12, 60 Glenodiniineae 12, 60 — polyedricum рис. 15 (вкл.) Goniodomaceae 11, 56 Goniodomineae 56 Goniodomoideae 11 Goniomonas truncata 444 Gonyaulacaceae 10 Gonyaulacaceae 11, 54, 69 Gonyaulacales 10, 11, 22, 41, 52-54, 58, рис. 14 (вкл.), рис. 15 (вкл.), рис. 33 (вкл.) Gonyaulacineae 10, 11, 54-59 Gonyaulacoideae 11 Gonyaulacysta 11 Gonyaulax 8, 11, 33, 54, 55, 57, 63, 68, 82 — apiculata 63 — pacifica 32 — polygramma 19 — spinifera 54, рис. 14 (вкл.) Gordiacysta 11 Gorkadinium 13 Gotoius 13, 63 — mutsuensis 63 Gramocysta 12 Granofilosea 246, 252 Gresslyodinium 9, 10,47 — cylindricum 47 Gromia 380 Gromiida 124 Gromiidea 447 Guinardia delicatula 435, 437 Guttula 74 — bacillariophaga 74 Gymnamoebae 270, 295 Gymnamoebia 279 Gymnaster 48 Gymnocella 151 — tregouboffi 152 Gymnocystodinium 73 Gymnodiniaceae 9, 41, 42, рис. 8 (вкл.), рис. 31 (вкл.)
458
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Gymnodiniales 9, 22, 40-42, 48, рис. 8 (вкл.), рис. 9 (вкл.), рис.
31 (вкл.), рис. 37 (вкл.)
Gymnodiniineae 9, 42, 46-48
Gymnodiniphycidae 9,42
Gymnodinium 9, 22, 25, 33, 37, 41, 43^9, 51, 58, 66, 73, 76-79, 82
— abbreviatum рис. 8 (вкл.), рис. 31 (вкл.)
— catenatum 43
— coeruleum 15
— endofasciculum рис. 31 (вкл.)
— fuscum 43
Gymnophrys cometa 225
Gymnosphaera 205, 246, 247, 249
— albida 207, 211, 247-249, 248, 247
Gymnosphaerida 205, 207-209, 209, 211, 212, 246
Gymnosphaeridae 246
Gynogonadinium 9, 48
— aequatoriale 48
Gyrodiniellum 9, 44
— shiwhaense 44
Gyrodinium 9, 22, 41, 44,46, 50, 72, 80, 81
— instriatum 32
— spirale 44, рис. 8 (вкл.), рис. 31 (вкл.)
Gyromitus 402, 405-407, 412, 420, 421, 426
— cavidiferens 420
— clavideferens 406, 407, 423, 427
— cordiformis 407, 426
— disomatus 404,406, 406, 407, 426
— Umax 406, 406, 407, 426, 427
Habibacysta 11
Haeckeliana 144
— irregularis 143
Haeckelianinae 144
Haematococcus 74
Haematodinium 80, 81
Haliommatidium 102, 105, 111
— muelleri 99, рис. 58 (вкл.)
Halocella 149, 151
— borgerti 152
— inermis 152
Halophilodinium 14, 80
— gessneri 80
Halostylodinium 9, 14, 73
— arenarium 73
Halteria arenicola 370-374
Haplodinium 13, 72
— anjoliense 72
Haplospora 398
Haplosporida 379, 380, 388, 389, 399
Haplosporidia 379, 380, 388, 389, 396, 398
Haplosporidiidae 379, 380, 387, 389
Haplosporidium 379-381, 383, 384, 385, 387-389
— armoricanum 385
— costaZe380, 385, 386, 388
— louisiana 384, 385
— lusitanicum 384
— mytilovorum 387
— nelsoni 379, 380, 382, 385-387, 389
— scoZopZz'379,387,389
— tapetis 387
— tumefacientis 387
Haplosporea 379
Haplozoaceae 14, 77
Haplozoon 14,15, 39, 78
— armatum 78
Hapsidaulax 12
Hapsocysta 11
Haptophyta 112
Harpellales 342
Hartmanella 371
Hatena 376, 377
— arenicola 373, 376, 377
Haxagonifera 12
Haxastylioidea 174
Hebecysta 13
Hedraiophrys 246, 249
— hovassei 211, 247-249, 248
Hedriocystis 205, 213, 239, 241, 243, 246
— minor 243
—pellucida 212, 241, 242, 243, 245, 246
— spinifera 246
— zhadani 243, 245
Heibergella 13
Helbydinium 11
Helgolandinioideae 11,56, 57
Helgolandinium 11, 57
Heliaster 190
Helicopedinella 253, 255, 257, 259-261
— tricostata 254, 261
Heliodiscus 194
— asteriscus 193
Helioflagellida 206, 252
Heliolithium 111
— aureum 111, рис. 54 (вкл.), рис. 59 (вкл.)
Heliomonadida 212
Heliomorpha 205, 249, 250-252, 251
— depressa 252, 252
— mucosa 209, 250, 250, 252
Heliomorphidae 249
Heliosoma 190, 192
— echinaster 191
Heliozoa 106, 166, 205-207, 225, 239, 252, 260, 262
Helkesimastix 447
Helotholus 196
Hematodinium 14, 81
— perezi 81
Hemicystodinium 57
Hemidinium 14, 47, 73, 75
— nasutum 73
Hemimastigea 329, 337
Hemimastigida 329, 337
Hemimastigophora 318, 329, 337
Hemimastix 311, 329-331, 336-339, 335,336
— amphikineta 329, 330-332, 336, 336, 339
Hemimastogophora 329
Hemiplacophora 11
Hemisphaeridium 11
Heptasphaera 12
Herdmania 13, 66
— litoralis 67
Herendeenia 10
Heslertonia 12
Heteracon 112
— biformis 105,110, 112
— muelleri 99
Heteraulacacysta 11
Heteraulacus 13, 56, 68
Heterobractum 13, 65
— striatum 65
Heterocapsa 12, 15, 17, 23, 33, 41, 60
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
459
— circularisquama 60
— niei 18
— triquetra 60
Heterocapsaceae 12, 59
Heterocapsineae 12, 59
Heterodiniaceae 11, 58
Heterodinium 11, 33, 54, 55, 58, 59
— extremum 15
— milnerii рис. 15 (вкл.)
— scrippsae 58
Heteromita 322, 436, 444
Heteromitea 436
Heteromitidae 448
Heterophryidae 216, 224-226, 227, 228
Heterophrys 205, 210, 215, 216, 220, 225, 226, 228
— elati 216, 217
— magna 216, 217, 218, 218
— marina 206, 216, 217, 218, 218, 220, 223, 225
— minutus 213, 216, 217, 223
— myriopoda 225, 226, 227, 228
Heteroraphidiophrys 216, 225, 229
— australis 229, 231
Heteroschisma 13, 70
— inaequale 70
Heterosigma akashiwo 66
Heterosphaeridium 12
Hexacontium 190, 192
— armatum 191
Hexaconus 97, 118
— ciliatus 115
Hexacorallia 37
Hexalaspidae 118
Hexalaspis 118
— heliodiscus рис. 63 (вкл.)
Hilomonadea 309
Histiocysta 10
Histioneis 13, 33, 34, 39, 42, 69, 70
— megalocopa 15
— remora 70
Histiophora 11
Histiophysis 13, 70
— rugosa 70
Holacanthida 96,101, 102,105,108, 108, рис. 54 (вкл.)
Hollandella 82, 371
Holmwoodinium 12
Holomycota 353, 388
Holozoa 353, 354
Horologinella 13
Hortobaggiomonas 74
— plicata 74
Huanghedinium 12
Hurlandsia 12
Hurunuia 11
Hyalosaccus 82
Hyaloselene 402, 405, 407, 420, 421, 427
— compressa 404,407, 427
— dubia 407, 427
Hydrophilidae 358
Hydrozoa 37, 52, 76
Hyperietta 181
Hypnodinium 14, 73
— sphaericum 73
Hystrichaspis 115
— dorsata 116
Hystrichodinium 11
Hystrichokolpoma 11
Hystrichosphaeridium 55
Hystrichosphaerina 11
Hystrichosphaeropsis 11
Hystrichostrogylon 11
Ichthyodinium 14, 81
— chabelardi 39, 81
Ichthyophonida 342, 345, 345, 349, 350, 352, 354, 355, 363-365
Ichthyophonus 342, 346, 354, 362, 363, 368
— gastrophilum 363
— hoferi 342, 346, 350, 352, 354, 355, 362, 362, 363
— intestinalis 363
— irregularis 355, 363
— lotae 363
Ichthyosporea 342, 343, 345-347, 352-355, 353
Icosaspis 115
— omata 116
Ifecysta 11
Imbatodinium 10, 11, 54
Impletosphaeridium 12
Indodinium 12
Indosphaera 12
Invertocysta 11
Isabelidinium 12
Isthmocystis 11
Jadwigia 9, 47
— applanata M
Jansonia 12
Jinhudinium 12
Jusella 12
Kaiwaradinium 11
Kallosphaeridium 11
Kalyptea 10
Kansodinium 12, 61
— ambiguum 61
Karenia 9, 22, 27, 46, 49
— brevis 46
Kareniaceae 9, 46
Karlodinium 9, 22, 46
— micrum 46
— veneficum 46
Karyoblastea 294, 295
Katablepharidacea 370
Katablepharis 370, 376
Kathablepharida 370, 376
Kathablepharidaceae 370, 376
Kathablepharidea 376
Kathablepharidida 376
Kathablepharididae 376
Kathablepharis 370-372, 371, 372, 374, 376
— hyalurus 373, 374, 376
— japonica 376
— oblonga 373, 377
— ovalisYlb, 373,374,376
— remigera 373, 374, 377
Katodinium 9,15, 44
— glaucum рис. 8 (вкл.)
— nieuportensis 44
Kenleyia 11
Keppenodinium 14, 82
— mycetoides 82
Keuppisphaera 12
460
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Kiokansium 11 — williamsii 32 Kisselovia 12 Kleithriasphaeridium 10 Kofoidiniaceae 14, 79 Kofoidinium 14, 79 — pavillardii 15 — velelloides 79 Kolkwitziella 13, 63, 64 — salebrosa 64 Komewuia 11 Korystocysta 11 Kryptoperidinium 12, 22, 33, 61 — foliaceum 28, 62 Leucrypta 370 Levisphaera 12 Liasidium 12 Liesbergia 11 Limbodinium 10 Limnoidae 356 Limnophila 225 — borokensis 225 Limulina 2T1, 273, 300 — unica 273, 301 Lingulodinium 11, 55 — machaeroporum 55 —polyedra рис. 14 (вкл.) Lipmanella 198 Lirella 146, 147
Labyrinthodinium 12 Laciniadinium 12 Lacrymodinium 10 Lacunodinium 12 Lagenadinium 13 Lagenorhytis 11 Lajasiella 358, 359 — aphodii 358 Lamblia 127 Lampoxanthium 187, 188 — pandora 188 Lamprocyclas 199, 200 — maritalis 200 Lamprocyrtis 199 Lampromitra 196 Lanterna 10 Lanternosphaeridium 11 Larcopyle 194 — butschlii 195 Larcospira 194 — quadrangula 195 Laticavodinium 12 Latifascia 13, 70 — inaequale 70 Leberidocysta 12 Lebouraia 13, 63, 64 — minuta 64 Lecythium 436, 440 Leidyomyces 358, 359 — attenuatus 360 Leipokatium 13, 63 Lejeunecysta 13, 63 Lentinia 12 Lepidochitona cinereus 389 Lepidodinium 9, 15, 22, 44 — viride 44 Leptodinioideae 10 Leptodinium 10, 80 Leptodiscaceae 14, 79 Leptodiscus 14,15, 79 — medusoides 79 Leptophyllus 79 Leptospathium 80 Lessardia 9, 13, 64 — elongata 64 Lessardiaceae 9, 13, 64 Leucocryptos 370, 376, 377 — marina 370, 371, 373, 374, 377 — remigera Leucopsis 47 Lirellidae 122, 136, 147 Lissaiella 10, 49 — obrae 49 Lissodinium 13, 65 — schilleri 65 Litharachnium 198 Litheliidae 171, 194,195 Lithelius 194 — nautiloides 195 Lithocampe 200 Lithocolla 205, 263 Lithodesmium 45 Lithodinia 10 Litholophus 105 Lithomelissa 196 Lithomitra 200, 201 — arachnea 184, 200 Lithopera 198 — bacca 199 Lithoperidinioideae 12 Lithoperidinium 12 Lithoptera 113 — muelleri 115 Lithopteridae 113 Litosphaeridium 10 Lobionella 13 Lobocella 149, 151 —proteus 152 — tenella 152 Lobosea 270, 279, 295 Lohmannia 82 Lonchostaurus 118 — rhombicus рис. 67 (вкл.) Lophocysta 10 Lophodinium 10, 49 — polylophum 50 Lophophaena 196, 198 — hispida 197 — rioplatensis 183 Lophospyris 196 Lotharingia 10 Lotharingiaceae 10, 54 Luciella 9, 13, 65 — masanensis 66 Luehndea 10 Luehndeoideae 10 Lunatadinium 13 Luxadinium 12 Lychnaspis 115, рис. 59 (вкл.) — giltschi рис. 64 (вкл.)
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
461
—polyancistra 95 Lymnophyla borokensis 246 — trichophora 275, 276, 282, 300 — viridis 299, 300 — volutans 300
Madreporaria 37 Maduradinium 12 Maghrebinia 11 Manchomonas 310 Manchudinium 14, 74 — sinicum 74 Mancodiniaceae 10, 53 Mancodinioideae 10 Mancodinium 10 Manumiella 12 Marophryidae 225 Marophrys 225 — marina 225 Marteilia 393-396, 397, 398, 399 — christenseni 393, 398, 400 — chungmuensis 393, 394, 396, 398, 400 — lengehi 393, 398, 400 — maurini 398 — refringence 388, 389, 393, 395, 396,397, 398, 399 — sydneyi 393, 398, 400 Marteiliida 379 Marteilioides 393, 399 — branchialis 393, 399, 400 — chungmuensis 393, 399, 400 Marteiliidae 379 Massartia 44 Massisteria marina 246 Mastigamoeba 270, 272-274, 290, 295, 298, 300, 301 — aspera 272, 273, 275, 276, 277, 280, 281, 282, 289, 290, 297, 298, 299 — auriculata 300 — balamuthi 292, 295, 300 — cestriensis 298 — chlamys 275, 300 — chlorelligera 300 — commutans 301 — euglenoides 300 —flexuosa 299, 300 — gigantea 301 — giganthea 301 — gigantoidea 301 — hylae 301 — invertens 300 — lacustris 300 — lobata 300 — longifilum 279, 296, 299, 300 —pachyderma 300 —paramylon 300 —pilosa 300 — psammobia 300 —punctachora 274, 285, 299, 300 — ramulosa 300 — reptans 300 — retrograda 300 — schizophrenia 274, 278, 279, 284, 288, 292, 293, 295, 299, 300 — scholaia 300 — schulzei 298 — setosa 300 — simplex 274, 289, 295, 299, 300 — skujae 300 — steinii 300 — torulosa 300 Mastigamoebea 297 Mastigamoebidae 270, 272-275, 279, 289, 290, 292, 293, 295, 297, 298, 299 Mastigamoebula 300 — africana 301 Mastigella 270, 272-275, 279, 281, 282, 290, 293, 295, 298, 300 — andiras 300 — commutans 274, 279, 301 —januarii 301 — nitens 276, 277,279, 280,281, 282,283, 283,284, 293, 299, 301 —penardii 300 —polymastix 273, 293, 299, 301 — punctachora 295 — radiosa 300 — setosa 281 — sudzuki 300 — unica 301 — vitrea 293, 299, 301 Mastigina 270, 272-274, 276, 279, 293, 295, 298, 300, 301 — chlamys 273, 300, 301 — hylae 270, 273, 274, 295, 301 — lacustris 300 — paramylon 300 — setosa 300 — trichophora 276, 277, 280,281, 283, 298, 299, 300 Maturodinium 10 Mayorella 371, 444 Medusetta 146, 148, 149 Medusettidae 122, 147-149,148 Meiourogonyaulax 10 Melanodinium 13, 68 — nigricans 69 Melitasphaeridium 11 Melodinium 43 Membranilarnacia 12 Membranilamax 12 Membranophoridium 11 Mendicodinium 12 Meristaulax 11 Merodinium 14, 81 — dolosum 81 Mesokaryota 29 Mesomycetozoa 342, 345, 355, 362, 368 Mesomycetozoea 345, 368 Mesopedinella 253, 255-257, 259-261 — arctica 254, 260, 261 Mesoporos 13, 72 — oblonga 72 — perforatus 72 Metadinophysis 13, 70 — sinensis 70 Metamonada 297 Metanobacterium formicicum 279, 280, 281 Metaphalacroma 13, 70 — skogsbergii 70 Metazoa 353 Metopiida 447 Metromonas 447 Micracanthodinium 10, 53 — setiferum 53 Microceratium 10, 50 — orstomii 50
462
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
Microdeutopus anomalus 360 Microdinium 10 Micromastix 300 —januarii 301 Micronuclearia 308, 308, 309, 325-327 —podoventralis 309, 325-327, 326 Micronucleariida 327 Micronucleariidae 327 Microsphaeridium 12 Microsporea 398 Microsporidia 297 Mikrocysta 10 Mikrocytos 390 — mackini 390 — roughleyi 389 Mikropithon 13 Millioudodinium 11 Minchinia 380, 383, 385, 387-389 — chitonis 379, 389 — occulta 381, 387 — teredinis 389 Ministeria 345, 353 — vibrans 355 Minuscula 62 Miracella 149, 151 — ovulum 152 Moesiodinium 12 Moestrupia 9, 72 Monadofilosa 436 Monaster 10, 50 — rete 50 Monozoa 168 Montanarocysta 12 Mooradinium 12 Morkallacysta 12 Mosaicodinium 11 Muderongia 11 Muiradinium 12 Muiriella 13 Multimonas 310 Multispinula 13, 63 Muraticysta 11 Muratodinium 11 Murracystis 58 Murrayella 53, 68 Mycetozoa 297 Mysticella 13, 65 — striata 65 Mytilus 366 — califomianus 387 — edulis 387, 398, 400 — galloprovincialis 398, 400 Myxodinium 14, 78 —pipiens 78 Myxomycophyta 355 Myxozoa 396, 398 Nautilus 129 Navicula 378 Nelchinopsis 11 Nelsoniella 12 Nematodinium 9, 25, 47, рис. 9 (вкл.), рис. 31 (вкл.) — partitum 48 Nematopsides 9, 47, 48 — vigilans 48 Nematosphaeropsis 11, 54 Neoceratium 56 Neodiacrodium 11 Neomonada 370 Neosemantis 196 Nephrodinella 12 Nephrodinium 9 Nephroselmis 370 Nephrospyris 196 Nephtys caeca 399 Netrelytron 10 Neuffenia 13 Nexosispinum 11 Noctiluca 7, 14, 30, 78 — miliaris 15, 79 — scintillans 39 Noctilucaceae 14, 78 Noctilucales 14, 78, 79 Noctiluciphyceae 14, 29, 30,41, 78 Noricysta 10 Nucleariidae 263, 265 Nucleoplasthelida 207 Nyktericysta 11 Oblea 13, 63, 64 — baculifera 64 Occisucysta 10 Occlusosporida 379 Ochetodinium 10 Octodendron 190 Octodinium 13 Octopyle 195, 196 — stenozona 195 Odontochitina 11 — porifera 32 Odontochitinopsis 11 Okerisphaeridium 11 Oligosphaeridium 10 Omanodinium 13, 63 Omatia 10 Omatidium 12 Ommatartus 192 — tetrathalamus 193 Oniscidae 360 Oodiniaceae 14, 76 Oodinioides 14, 78 — vastador 78 Oodinium 14, 39, 68, 76, 77 — pouchetii 77
Nannoceratopsiaceae 13, 69 Nannoceratopsiales 13, 69 Nannoceratopsis 13 Nassellaria 106, 136, 169, 171, 174, 177, 179, 181-183, 186, 196, 197,199, 200 Nassellarida 182 Nationaletta 148, 149, 150,151 —fragilis 148 Opaeopsomus 13 Opalozoa 370,436 Operculodinium 55 Opisthokonta 318, 226 Orbulina universa 51 Orbulinella 205, 239, 246 — smaragdea 240, 242, 243, 245, 246 Orchestia gammarellus 393, 400
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
463
Orchestiidae 362 Ornithocercus 13, 33, 34, 39, 42, 69, 70 — magnificus 70, рис. 12 (вкл.) Orobodinium 13 Orthocarinellum 12 Orthopithonella 12 Osculosa 136, 169 Ostrea edulis 381, 389, 398, 400 Ostreopsis 11, 27, 56, 57 — siamensis 57 Ouracoccus 74 Ovalicysta 12 Ovoidinioideae 12 Ovoidinium 12 Oxnerella 216, 225, 226 — maritima 207, 216, 220, 223, 226, 227 Oxyphysiaceae 13, 71 Oxyphysis 13, 71 — oxytoxoides 71 Oxyrrhis 40 Oxytoxaceae 13, 67 Oxytoxum 13, 42, 67 — scolopax 67, рис. 17 (вкл.) Oyemonas 74 — pulsulae 74 Paramastigidae 329, 337, 339 Paramastix 329, 330, 336, 337, 340 — conifera 329, 336, 340, 340 — lata 329, 340 — minuta 329, 340 — truncata 329, 340 Paramoebidium 354, 355, 356 — inflexion 356 Paramyxa 393, 395, 396, 398, 399 — nephtys 393, 395, 396, 399 —paradoxa 393, 396, 398, 399 Paramyxea 379, 388, 389, 393, 396, 398, 399 Paramyxida 379, 380, 388, 399 Paramyxoides 393, 399 — nephtys 393, 399 Paranetrelytron 10 Parapedinella 253, 255, 256, 259-262 — reticulata 254, 262 Paraperidinium 12 Paraphysomonas 416 Parapodinium 14, 80 — stylipes 80 Parascriniocassis 10 Parasphaerastrum 216, 226 — marina 226, 230 Pareodinia 10
Pachydinium 11, 49, 56 — mediterraneum 56 Palaeocystodinium 12 — golzowense 32 Palaeodinophysis 13, 40, 69 Palaeoglenodinium 13 Palaeohystrichodinium 13 Palaeohystrichophora 12 Palaeoperidinioideae 12 Palaeoperidinium 12 Palaeophalacroma 10, 54 — unicinctum рис. 14 (вкл.) — verrucosum 54 Palaeosphaerium 13 Palaeotetradinium 13 Palatinus 9, 12, 62 — apiculatus 62 Palavascia 354, 359, 360 — philoscidae 360 Palynodinium 11 Panartus 192 Pandadinium 11 Pannosiella 12 Pansomonadida 442, 448 Papuadinium 12 Parabasalia 297 Parabohaidina 12 Paracartia grani 395 Paraevansia 10 Paragonyaulacysta 10 Paragymnodinium 9, 44 — shiwhaense 45 Parahistioneis 70 Paramacrinella 360, 360 — microdeutopi 360 Paramarteilia 393, 395, 396, 398-400 — branchialis 393, 400 — canceri 393, 395, 396, 397, 398, 400 — orchestiae 393, 394, 396, 400 Pareodiniaceae 10, 54 Pareodinioideae 10 Parrocelia 64 Parvilucifera 40 Parvocavatus 12 Parvocysta 12 Parvulodinium 12 Passalidae 360 Passalomyces 360, 360 — compressus 360 Paucibucina 12 Paucisphaeridium 12 Paulsenella 9, 39, 45 — chaetoceratis 45 Pavillardia 9, 45 — tentaculifera 45 Pavillardinium 53, 68 Pedinella 207, 212, 213, 253, 255-257, 259-261 — hexacostata 254, 258, 261 — squamata 253, 259 — swalei 259 Pedinellales 207 Pedinellida 205, 207-209, 209,211, 212, 212,245, 253, 258,261 Pedinomonas 39 Pelagodinium 10, 25, 37, 51 — beii 51 Pelobiontea 297 Pelobiontida 270, 271,274, 275, 275, 276,279, 295, 297, 298 Pelobius 301 Peloflagellatea 294, 295 Pelomyxa 270-272, 274, 275, 279, 281, 283, 285, 290, 292, 294, 295, 298, 301 — belewskii 272, 302 — binucleata 272, 276, 277, 279, 281, 282, 283-285, 285, 287, 288, 290, 291,292, 302,303 — carolinensis 272 — caulleryi 301 — corona 276, 281,302, 303 —flava 276, 277, 279, 280, 281, 283,284, 285, 288, 302, 304
464
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
—fragilis 272, 301
— greeffi 271, 301
— gruberi 275, 276, 281-283, 283, 285, 286, 288, 290, 291, 292,
294, 303, 304
— illinoisensis 272
— lucida 301
— nobilis 272
— palustris 270, 271, 274, 276, 278, 279, 280, 281-285, 282, 288,
290-292, 291,294, 295, 297, 301, 302, 303, 304
— parvialveolata 301
—prima 271, 276, 279, 281, 282, 282,284, 285, 285,288, 290, 303,
304
— schiedti 272
— stagnalis 276, 279, 283, 284, 285, 288, 304
— tertia 276, 285, 288, 303, 304, 305
— villosa 271, 301
— viridis 271, 301
— vivipara 272, 301
Pelomyxidae 270, 274, 275, 290, 291,293, 295, 297, 298, 301, 303
Penardiophrys 213, 239, 246
— reticulata 240, 242,243, 246
— spinifera 240, 241, 243, 245
Pentadinium 11
Pentafidia 13
Pentapharsodinium 13, 61, 62
— dalei 62
Peregrinia 406
Peregrinia clavideferens 406, 420, 427
Peregriniidae 407
Peridictyocysta 12
Peridiniaceae 12, 60, 62
Peridiniales 12, 13, 22,41, 59, 60, 62, 64, 67, рис. 17 (вкл.)
Peridinieae 74
Peridiniella 10, 54
— catenata 33
— sphaeroidea 54
Peridiniineae 12, 13, 60, 66
Peridinioideae 12
Peridiniopsis 12, 33, 61-64, 67
— borgei 62
— polonicum 28, 62
Peridiniphycidae 10, 13, 41, 52, 59, 67, 68
Peridinium 7, 8, 12, 23, 33, 43, 58, 61-67, 69, 81
— cinctum 7, 61
— quinquecorne 62, рис. 17 (вкл.)
— sociale 60
— voltzii 31
Perisseiasphaeridium 10
Perkinsus 40
Peromelissa 196
Pervosphaeridium 11
Petalodinium 14, 80
— porcelio 80
Pfiesteria 9, 13, 34, 65, 66
— piscicida 65
Pfiesteriaceae 8, 9, 13, 34, 65, 66
Phacodiscidae 171, 192,193
Phaeocalpida 122, 123, 125, 132, 142,143, 144,145
Phaeoconchida 122, 127, 132, 136, 154
Phaeocystida 122, 123, 132, 136, 149
Phaeodactylis 154
— fagei 154
— hollandei 154
— radiata 154
Phaeodarea 122
Phaeodaria 100, 106, 121, 122, 123, 125, 125, 126, 127, 128, 130,
131, 133,134, 135, 136,137, 160, 166, 168, 169
Phaeodina 151
— pelagica 153
— valdiviae 153
Phaeodinidae 122, 136, 149, 151,153
Phaeogromida 122, 125, 127, 132, 136, 146, 147, 149
Phaeogymnocellida 122, 125, 136, 149
Phaeopyla 151
— sphaerica 153
Phaeosphaera 151, 154
— nucleoelongata 153
—pigmaea 153
Phaeosphaerida 122, 132, 138,141, 151, 154
Phaeosphaeridae 122, 136, 149, 151,153, 154,154
Phalacroma 42, 58, 69-71
Phallocysta 13
Phaneraxohelida 207, 224
Phanerodinium 12
Pharyngella 147
Phascolosoma agassizii 365
Phatnacantha 119
— icosaspis 117, 119, рис. 68 (вкл.)
Phelodinium 13
Pheopolykrikos 9, 45
— beauchampii 45
Philozoon 76
— medusarum 76
Phoberocysta 11
Phormacantha 196
Phormospyris 196
— stabilis scaphipes 197
Phormostichoartus 200, 201
— corbula 200
Phorticium 195, 196
— clevei 195
Phractopelta 97, 113
— dorataspis рис. 63 (вкл.)
Phractopeltidae 113
Phreatamoeba 273
— balamuthi 273, 292, 300
Phthanoperidinium 12
Phyllacantha 117, 118, рис. 67 (вкл.), рис. 68 (вкл.)
Phyllodinium 61
Phyllomonas contorta 325
Phyllostauridae 118
Phyllostaurus 118
— cuspidatus 96,117
— siculus 98
Physematium 187, 188
— mulleri 188
Phytodinedria 73
Phytodiniaceae 14, 72
Phytodiniales 8, 14, 39, 72, 74, 75
Phytodinium 14, 72
— simplex 72
Pierceites 12
Pileidinium 9, 14, 75
— ciceropse 75
Pilosidinium 11
Pinaciophora 205, 262, 265
— fluviatilis 264, 265
Pirum 342, 346, 350, 352, 354, 364, 366
— gemmata 350, 351, 354, 365, 365
Pirumella 12
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
465
Piscinoodinium 14, 77
—pillulare 39, 77
Pithonella 12
Plagiodinium 9, 11, 59
— belizeanum 59
Plagoniidae 171, 174, 196,197
Planktonetta 148, 149,150, 150
— atlantica 150
— parthenopaea 148
Planodinium 11, 59
— striatum 59
Planomonadida 322
Planomonadidae 322
Planomonas 308, 309, 322
— cephalopora 324
— howeae 325
— limna 325
— melba 325
— micra 325
— mylnikovi 322, 324
— sinistra 325
Planoperidinium 12
Plasmodiophora 380
Platychilomonas 370, 376, 377
—psammobia 371, 373, 377
Plecoptera 356
Plectoninium 44
Plegmosphaera 190, 192
— entodictyon 191
Pleromonas 13, 72
— erosa 72
Pleuraspis 113
— costata 116, рис. 64 (вкл.)
Ploeotia 444, 446, 446
Pluriarvalium 10
Podactinelius sessilis 107
Podolampaceae 13, 64
Podolampas 13, 64
— bipes 22, 64
— reticulata рис. 17 (вкл.)
Podomonas 310
Podoplea 78
Polarella<f 10, 25,41,51
— glacialis 33, 51, рис. 9 (вкл.)
Polychaeta 134, 164
Polycladida 390
Polycystina 100, 106, 122, 125-130, 134, 136, 137, 160, 166, 168-
171, 185, 187
Polycystinea 170, 182, 187
Polygonifera 12
Polykrikaceae 9,46
Polykrikos 9, 25, 45, 46, рис. 37 (вкл.)
— schwartzii 46
Polyplacocystis 216, 223, 225, 229
— ambigua 209, 219, 220, 222, 223, 230
— arborescens 213, 223
— coerulea 218, 226
— symmetrica 222, 229
Polypyramidae 122, 142, 144
Polypyramis 144
— fenestrata 145
Polysphaeridinium 57
Polysphaeridium 57
Polystephanephorus 11
Polyzoa 168
Pomatodinium 14, 79
— impatiens 79
Pompholyxophryidae 265
Pompholyxophrys 205, 212, 262, 265
— exigua 258
— ovuligera 262
— punicea 262, 263, 264, 265
Porcellionidae 357
Porella 72
Porospathidae 122, 142, 144
Porospathis 144
— holostoma 145
Porotheca 72
Porulosa 136, 169
Postprorocentrum 71
Potaspa longipes 429
Pouchetia 47, 48
Praecalcigonellum 12
Pratjetella 79
Praussia 10
Preperidinium 13, 63, 64
— meunierii 64
Prionodinium 11
Pristacantha 119
— multidentata 117, рис. 68 (вкл.)
— octodon 117, 119
Proaulax 14, 43, 81
— corpusculum 81
Prodinophysis 69
Productodinium 12
Proheteroschisma 70
Prolixosphaeridium 14
Prominangularia 12
Pronoctiluca rostrata 64
Properidinium 62
Prorocentraceae 13, 71
Prorocentrales 13, 22,41, 71, рис. 11 (вкл.)
Prorocentrophycidae 13, 71
Prorocentrum 13,15, 25, 27, 28, 33, 37, 41, 71, рис. 11 (вкл.)
— compressum рис. 11 (вкл.)
— concavum рис. 11 (вкл.)
— gracile рис. 11 (вкл.)
— lima 19, 28, 37, рис. 11 (вкл.)
— mexicanum 37
— micans 71
— rhathymum 19, рис. 11 (вкл.)
— sculptile рис. И (вкл.)
Prosoaulax 9, 45
— lacustris 45
Protapis glans 437
Protaspa 421, 429, 430, 433, 435-437
— gemmifera 429, 434,437
— glans 429, 434,437
— grandis 429, 430, 432,433, 434, 436, 437
— longipes 429, 430, 433, 434,436, 437
— maior 429, 434,438
— metarhiza 429, 434,438
— obaniformis 429, 434,438
— obliqua 429, 434, 438
— obovata 429, 434,438
— oviformis 429, 434,438
— rotunda 429, 434,438
— simplex 429, 434,438
— tanyopsis 429, 434,439
— tegere 429, 434, 439
466
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
— verrucosa 430, 434,437, 439
Protaspidae 429, 430, 433
Protaspis 402, 405, 436, 437
— gemmifera 437
— glans 437
— grandis 405, 437
— maior 438
— metarhiza 438
— obaniformis 438
— obliqua 438
— obovata 438
— oviformis 438
— rotunda 438
— simplex 438
— tanyopsis 439
— tegere 439
— verrucosa 439
Proteomyxidea 225
Proterythropsis 9, 47, 48, рис. 9 (вкл.)
— crassicaudata 48
Protobatioladinium 10
Protoceratium 11, 55, 69
— aceros 55
— globosum рис. 14 (вкл.)
Protocryptomonas 74
Protocystis 147, рис. 90 (вкл.)
— naresi рис. 90 (вкл.)
Protodinium 10, 41, 51, 76
— Simplicius 51
Protoellipsodinium 11
Protogonyaulax 57
Protoodiniaceae 14, 76
Protoodinium 14, 39, 76
— chattoni 15, 76
Protoperidinium 13,16, 27, 34, 62, 81, 82, рис. 37 (вкл.)
— concinnum 21
— crassipes 21
— depressum 15
— grande 17
— oblongum рис. 37 (вкл.)
— pellucidum 63
— sphaericum рис. 17 (вкл.)
Protopsis 9, 47, 48
— nigra 48
Prototheca 362
— richardsi 362
Protozoa 122, 136, 295, 379
Psaligonyaulax 11
Pseliodinium 14, 75
— vaubanii 75
Pseudoactiniscus 9
Pseudoalterbia 13
Pseudoceratium 11
Pseudocubus 196
Pseudodeflandrea 13
Pseudodictyophimus 198
— gracilipes 199
Pseudoheliozoa 245
Pseudokomewuia 13
Pseudolithidae 102, 111
Pseudolithium 111
— bifidum рис. 58 (вкл.)
Pseudo-nitzschia 28
Pseudopedinella 207, 253, 255-261
— elastica 253, 254,260
— erkensis 260
—pyriformis 253, 260, 261
— rhizopodiaca 260
— thomsenii 253, 256, 259, 260
Pseudoperkinsus 346, 351, 352, 364
— tapetis 354, 364
Pseudopfiesteria 9, 13, 34, 66
— shumwayae 66
Pseudophalacroma 13, 70
— nasutum 70
Pseudoraphidiophrys 216, 225, 229
— formosa 229, 231
Pseudoraphidocystis 216, 225, 229
— glutinosa 229, 231
Pseudostephodinium 13
Pseudothecadinium 9, 11, 59
— campbellii 59
Psorospermium 342, 346, 363
— haekeli 342, 346, 354, 362, 363, 363
— orconectis 363
Pteridomonas 207, 213, 215, 253-257, 259-262
— danica 209, 254, 257, 260
— pulex 262
Pterocanium 198
— praetaxum 199
Pterocorycidae 183
Pterocorys 199, 200
— minythorax 200
Pterocorythidae 171, 199, 200
Pterocystidae 225
Pterocystina 225
Pterocystis 14, 81, 216, 225, 229
— pteracantha 229, 232
— striata 221
— vanhoeffenii 81
Pterodinium 11
Pteroscenium 199
Pterosphaera 81
Ptychodiscaceae 10,49
Ptychodiscales 10, 49, 50
Ptychodiscoideae 10
Ptychodiscus 10, 46, 49
— noctiluca 49
Pylolena 195, 196
— armata 195
Pyloniidae 171, 195,195
Pylospira 194
— octopyle 195
Pyramidodinium 9, 14, 48
— atrofuscum 48
Pyrgidium 67
Pyrocystaceae 8, 11, 57
Pyrocystis 11, 33, 58, 77
— noctiluca 32, 58
— robusta рис. 15 (вкл.)
Pyrodinioideae 11, 57
Pyrodinium 11, 33, 57
— bahamense 57
--bahamense 15, 20
Pyrophacus 11
Pyrophacus 57
— horologium 57
— steinii рис. 15 (вкл.)
Pyrrhophyta 8
Pyrrophyta 8, 74
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
467
Pyrsonympha 134 Pyxidiella 12 Pyxidinopsis 11 Rhinodinium 9, 13, 67 — broomeense 67 Rhinosporidium 366-368 — seeberi 342, 352, 354, 366-368, 367
Quinquecuspis 13, 63 Rhiptocorys 10 Rhizaria 106, 126, 182,182, 183, 225, 246, 252,436
Rabdiaster 265 — ludibunda 264 —pertzovi 265 Rabdiophrys 262, 265 — anulifera 264, 265 Raciborskia 72 Radiolaria 76, 100, 101, 106, 121, 124, 166, 168, 170, 182, 206 Radiozoa 182 Radiozoum 14, 81 — lobatum 81 Raetiaedinium 12 Raineriophrys 216, 225, 229 — echinata 217 — erinaceoides 221, 224, 229, 232 Ramacrinella 360, 361 — raibauti 360 Rana esculenta 366 Raphidiophryidae 216, 222, 224-226, 230 Raphidiophrys 102, 205, 211, 215, 216, 218, 223, 225, 229 — contractilis 226 — elegans 213, 223, 224, 230 — heterophryoidea 216, 222, 224, 229 — intermedia 222 — viridis 229 Raphidocystis 211, 216, 225, 226 — capitata 222 — glabra 217 — lemani 226, 230 — tubifera 217 Raphidodinium 12 Raphidozoum 188,188 — neapolitanum 188 Reckertia 405-407, 412, 414,421, 422 — dybsoeana 407, 414,415, 422 —filosa 406, 407, 420, 422, 423 —formosa 407, 414,415, 424 —fragilis 407, 414,424 —fusiformis 407, 414,424 — groenlandica 407, 414,424 — igloolika 407, 414,424 — nigeriensis 407, 414,424 —platyformis 404,407, 425 —punctata 407, 414,425 — sagittifera 404, 406, 407, 412, 414,415, 422 — spinosa 407, 414,415, 424 — splendida 407, 414,424 — thomseni 404,407, 414,425 Refractocystis 74 — pluvialis 74 Refractodes 74 — brasiliana 74 Refractomonas 74 — brasiliana 74 Renidinium 11 Resticulasphaera 12 Reticulatosphaera 12 Reutlingia 12 Rhaetogonyaulacineae 10, 53 Rhaetogonyaulax 10 Rhizaspidae 433, 435 Rhizaspididae 430,436,439 Rhizaspis 402, 420, 421, 429, 430, 436, 439 — granulata 430, 434,439 Rhizaspis simplex 430, 434, 439 Rhizochromulina 261 Rhizodinium 14 Rhizomastigida 252,260 Rhizomastigina 270, 274 Rhizopoda 126, 206, 270 Rhodophyta 226 Rhogostoma 420, 429, 430, 436, 439, 440 — micra 430, 440 — minus 430, 433, 434, 435,440 — schuessleri 430, 434,439, 440 — timida 430, 434, 440 Rhombodinium 12 — porosum 32 Rhynchobodo 444 Rhynchodiniopsis 10 — cladophora 32 Rhynchomonas mutabilis 309, 310 Riculacysta 11 Rigaudella 10 Ripea 12 Romanodinium 12 Roombia 370, 376, 378 — truncata 373, 374, 376, 378 Roscoffia 13, 69 — capitata 69 Rosswangia 10 Rostromonas applanata 310,318 Rotosphaerida 205,206,211, 212,224, 258,262, 263, 265, 325, 326 Rotosphaeropsis 10 Rottnestia 11 Rufusiella 14, 39, 74 — insignis 75 Sabulodinium 13, 70 — undulatum 70 Saccospyris 201 — antarctica 200 Saccostrea commercialis 400 — cuccullata 387, 398, 400 — echinata 398, 400 — glomerata 389, 400 Saeptodinium 12 Sagenoarium 142 — chuni 141 Sagenoscena 142 — irmingeriana 141 Sagoscena 142 — elegans 141 Sagosphaeridae 122, 132, 138, 140 Sahulidinium 12 Samlandia 11 Sarcodina 122, 206 Sarcomonadea 447 Saturnalis 190, 192
468
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
— circularis 191 —fockii 217, 226, 227,228
Saturnodinium 11 Sphaeripara 14, 82
Satyrodinium 12 — carenata 82
Saxodinium 10 Sphaeriparaceae 14, 82
Scaphodinium 14, 80 Sphaerodinella 12
— mirabile 80 Sphaerodinium 60
Scarabaeidae 358 Sphaeroforma 342, 346, 347, 351, 352, 354, 364
Schematophora 11 — arctica 346, 350, 350, 354, 364
Schizochytriodinium 9, 45 — gastrica 364
— calani 45, рис. 9 (вкл.) — nootkatensis 354, 364
Schizodinium 14, 78 — tapetis 354, 364
— spar sum 78 Sphaeromatidae 360
Schizosphaerella 14 Sphaerosoma arcticum 364
Sclerodinium 10, 50 — arcticus 364
— calyptroglyphe 50 Sphaerotecum 368
Scoloplos armiger 379 — destruens 354, 367, 367, 368
— miilleri 389 Sphaerozoida 171, 183, 188,188
Scriniocassiaceae 10, 54 Spinidinium 12
Scriniocassis 10 Spiniferites 11, 54
Scriniodinium 11 — ellipsoideus 32
Scrippsiella 12, 37, 60, 61 Spiniferodinium 14, 74
— sweeneyae 61 — galeiforme 74
— trochoidea 33 Spiniferomonas patelliformis 425
Scrobicularia plana 398, 400 — tripus 426
Scyphozoa 37, 52, 76 Spiniferopsis 12
Selenopemphix 13, 63 Spiraulax 11, 55
Senegalinium 12 —jollifei 55
Senoniasphaera 11 Spiraulaxina 55
Sentusidinium 11 Spirocyrtis 200, 201
Sethodiscus 194 — scalaris 200
— micrococcus 193 Spirodinium 44
Sethophormis 196, 198 Spironema 329, 330, 335, 337-339
— aurelia 197 — goodeyi 329, 336, 338, 339
Shublikodiniaceae 10, 53 — multiciliatum 329, 336, 338, 338
Silicisphaera 11 — terricola 329, 330, 333, 336, 338, 339
Simuliidae 356 Spironemidae 329, 338
Sinodinium 54 Spirostomum 99
Sinophysis 13, 22, 70 Spongaster 194
— microcephala 19, 71 — tetras tetr as 193
— stenosoma рис. 12 (вкл.) Spongocore 194
Siphocampe 200, 201 — cylindrica 193
Siphocampium 200 Spongodictyon 190
Siphonaspis 113, 115 Spongodinium 11
— cristata 118 Spongodiscidae 171, 183,193, 194
Siphonosphaera 190 Spongodiscus 194
— socialis 189 — resurgens 193
— tubulosa 189 Spongoliva 192
Sirmiodiniopsis 11 — ellipsoids 193
Sirmiodinium 10 Spongoplegma 190
Sliteria 12 Spongopyle 194
Smolenskiella 12 Spongosphaera 190, 192
Soaniella 12 — streptacantha 191
Sokolovidinium 12 Spongotrochus 194
Solenodinium 14, 81 Spongurus 194
—fallax 81 —pylomaticus 193
Solenosphaera 190 Sporozoa 284, 379
— collina 189 Spumella 444
— inflata 189 Spumellaria 104, 106, 136, 168, 169, 171, 174, 181-183, 186, 188,
— zanguebaric 189 189,191,193,195
Spatulodinium 14, 79 Spumellarida 182
—pseudonoctiluca 79 Spyridae 171, 174, 196,197
Sphaenacantha 112 Staszicella 13, 62, 67
Sphaeorozoum 188 Stauracantha 119
— geminatum 188 — orthostaura 115,117
Sphaerastrum 205, 215, 216, 225, 226 Stauracanthidae 119
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
469
Stauracon 112
— pallidus 112, рис. 54 (вкл.)
Stauraspis 115
— staurantha 116
Stauroconidae 112
Steiniella 54
Stelladinium 13, 62, 63
Stellatosporea 379, 398
Stenopyxinium 13
Stentor 99
Stephanelytraceae 13, 68
Stephanelytron 13
Stephanopogon 337
Stephodinium 11
Stereonema 329, 330, 335, 337-339
— geiseri 329, 330, 334, 339, 340
Sticholonche 99, 126, 160-166,162,163, рис. 107 (вкл.)
— ankle 166
— zanclea 160,161, 162,165, 166, 207
Stichopilium 199
Stiphrosphaeridium 10
Stoeckeria 9, 13, 66
— algicida 66
Stoveracysta 11
Stramenopiles 226, 239, 261
Streptotheca 45
Stylatractus 190,191, 192
Stylochlamydium 194
— venustum 193
Stylodictya 194
— aculeata 193
Stylodinium 14, 62, 74
— globosum 74
Stylosphaera 190, 192
— melpomene 191
Styptosphaera 190
Subathua 11
Subtilidinium 10
Subtilisphaera 12
Suctoria 374
Suessia 10
Suessiaceae 10, 50
Suessiales 10,41, 50, 51, 52, рис. 9 (вкл.)
Suibindia 14
Sumatradinium 12
Surculosphaeridium 11
Susadinium 12
Svalbardella 12
Sverdrupiella 13
Syllis gracilis 390
Syltodinium 9, 45
— listii 45
Symbiodiniaceae 10,41, 52
Symbiodinium 10, 25, 26, 29, 37, 41, 51, 52, 76
— microadriaticum 52, 76
Symphyacanthida 96, 97, 99, 100, 101, 102, 105, 109, 110, рис. 54
(вкл.), рис. 58 (вкл.)
Syndinea 14, 27,41,81
Syndiniaceae 14, 81
Syndiniales 14, 39, 81, 82
Syndiniophyceae 14, 81
Syndinium 14, 81
— turbo 81
Synechococcus 39. 69
Synechocystis 39. 69
Synhemidinium 81
Synoikomonas 402, 405
Systematophora 10
Tabulodinium 10
Taeniella 361, 361
— carcini 361
Taeniellopsis 361, 362
— orchestiae 362
Taeniophora 11
Takayama 9, 46
— pulchella 46
Talimudinium 13
Talitridae 362
Tanyosphaeridium 12
Tapes decussatus 387
Taxopodida 106, 127,137, 160, 166, 182, 207
Tectatodinium 11, 54
Tectofilosida 436
Tehamadinium 10
Teneridinium 12
Tentaculomonas 425
Tenua 11
Ternia 13
Tetrachacysta 12
Tetradimorpha 205, 207, 212, 249-251, 251,253
—pterbica 250, 251
— radiata 209, 251, 253
— tetramastix 252
Tetradimorphidae 249
Tetradinium 14, 74
— javanicum 74
Tetralonche 113
Tetramerosphaera 12
Tetranguladinium 13
Tetraplecta 196
Tetrapyle 195
Tetratropis 12
Thafassoxanthium 187
Thalassicolla 171, 172, 180-182, 187
— zanclea 188
Thalassicollida 171, 183, 187,188
Thalassiphora 11
— patula 32
Thalassocampe 187
Thalassolampe 180
Thalassomyces 40
Thalassophysa 180-182,181, 187
Thalassopila 187
Thalassoplancta 187
Thalassosphaera 187
Thalassosphaerida 171, 187,188
Thalassoxanthium 187
— medusium 188
Thaumatodinium 13, 71
— molischii 71
Thaumatomastigidae 402
Thaumatomastix 402,405^107,412,413,414,415,416,419-421,425
— bipartita 405, 407, 414,415, 425
— dybsoeana 405, 415, 422
—formosa 405, 424
—fragilis 405, 424
—fusiformis 405, 424
— groenlandica 405, 424
— igloolika 405, 424
470
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
— nigeriensis 405, 424
—patelliformis 407, 415, 425
—punctata 405, 406, 425
— sagittifera 405, 406, 415
— salina 404,405, 407, 412, 415, 417, 425
— setifera 404,405, 407, 425
— spinosa 405, 424
— splendida 405, 419, 424
— tauryanini 405, 407, 426
— thomseni 405, 406, 425
— triangulata 406, 406
— tripus 404, 405, 407, 415,425, 426
Thaumatomonadida 402, 407,421, 437
Thaumatomonadidae 402,407
Thaumatomonas 402, 405-407, 411, 412, 412, 415, 417-421, 427,
436,444,447
— coloniensis 407, 415,420-422, 421
— godboldi 404,407, 416, 417, 417,422
— lauterborni 402,402,407,408,410,411,412,415-419,415,417,
418,421
— oxoniensis 422
— patelliformis 414
— salina 414
— seravini Ml, 408, 409, 411,412, 415, 415, 418,419, 421
— tauryanini 414
— tripus 414
— vancouveri 422
— zhukovi 407,412, 415,416,421, 422
Thaurilens 13, 67
— denticulata 67
Thecadiniaceae 11, 58
Thecadiniopsis 11, 59
— tasmanica 59
Thecadinium 11, 58, 59, 66, 70
— drageskoi 59
— kofoidii 59
Thecamonadea 310
Thecamonas 309, 310
— filosa 310
— mutabilis 310
— trahens 310, 319
Thecofilosea 436
Thecomonadea 309
Thecomonadia 436
Thecosphaera 190, 192
— inermis 191
Theoconus 199
Theocorythium 199, 200
— trachelium 200
Theoperidae 171, 198,199
Tholoniidae 171,195, 196
Tholonium 196
Tholospira 194, 195
— cervicornis 195
Tholospyris 196,197
Thompsodinium 13, 69
— intermedium 69
Thoracosphaera 14, 75
— heimii 75
Thoracosphaeraceae 8, 14, 75
Thoracosphaerales 14, 75
Tintinnophagus 9, 14, 75
— acutus 75
Tintinnopsis 75
Toggle britannica 45
Togula 9, 45
Torodinium 9, 45
— teredo 45, рис. 8 (вкл.)
Tovellia 9, 47
— coronata 47
Tovelliaceae 9,46
Trabeculidium 11
Triadinium 56, 68
Triblastula 11
— utinensis 32
Tribonosphaera 190
Triceraspyris 196
Trichocyanella 74
— spiralis 74
Trichodinium 11
Tricholimax 272-274, 290, 295, 298, 301
— hylae 270, 273, 274, 283-285, 289, 290, 292-295, 298, 299, 301
Tricolocampe 200
Tridacnidae 37
Trigonopyxidia 12
Trinovantedinium 13, 63
Triposolenia 22, 33, 42, 71
— truncata 71
Trissocyclidae 171, 196
Trisulcus 196
Trithyrodinium 32
Trivalvadinium 12
Truncatulina lobatula 76
Trypanodinium 14, 81
— ovicola 81
Tuberculodinium 57
Tubotuberella 11
Turbiosphaera 11
Tuscarantha 146
— luciae 136,145
Tuscaretta 132, 133, 144, 146
— belknapi 132, рис. 89 (вкл.)
— globosa 132
— tabulosa 132
Tuscaridium 132, 146
— cygneum 132, 133, 146
Tuscarilla 146
— ampula 145
— scutellum 145
Tuscarora 146
— bisternaria 145
Tuscaroridae 122-124, 132, 133, 142, 144,146, рис. 89 (вкл.)
Tylidae 357
Tyrannodinium 9, 13, 66
— berolinense 66
Ulva 135
Umbodinium 13
Unipontidinium 11
Urococcus 74, 75
Urosporidiidae 380, 387, 390
Urosporidium 380, 383, 385, 390
— cannoni 390
— crescens 387, 388
— fuliginosum 390
— spisuli 386, 387
Uvatodinium 12
Valensiella 12
Valvaeodinium 13
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
471
— lineatum 32
Vampyrella 73
Vampyrellidium 238
Vectensia 13
Vectidinium 12
Velella velella 76
Vesperopsis 11
Vexillocysta 11
Viridiplantae 226
Volvox 132
Vorticella 61, 100
Votadinium 13, 63
Vozzhennikovia 12
Vulcanodinium 9, 13, 67
— rugosum 67
Walvisia 10
Wanaea 10
Wanneria 10
Warnowia 9, 47, 48, рис. 9 (вкл.), рис. 37 (вкл.)
—fusus 47
Wamowiaceae 9, 24, 25,47, рис. 9 (вкл.), рис. 31 (вкл.)
Warrenia 12
Wervekodinium 10
Wetzeliella 12
Wetzelielloideae 12
Wigginsiella 11
Williamsidinium 12
Wilsonidium 12
Woloszynskia 9, 25, 37, 41, 46, 47, 51, 52
— reticulata 46
Xandarodinium 13, 63
Xenascus 11
Xenascus 32
Xenicodinium 11
Xenikoon 12
Xiphacantha 119
— alata рис. 68 (вкл.)
— quadridentata 119
Xiphophoridium 12
Xuidinium 12
Xylochoarion 14
Yalkalpodinium 11
Yolkinigymnium 10
Zhongyuandinium 13
Zoorhabdella 14, 76
— truncatulinae 76
Zooxanthella 14, 52, 76
— nutricula 76
Zygabikodinium 64
Zygocircus 196
—productus 197
Zygostaurus 119
Сведения об авторах
ЗАСЬКО Дарья Николаевна, Институт океаноло-
гии им. П.П. Ширшова РАН.
117997 Москва, Нахимовский проспект, д. 36.
E-mail: dasha_zas@mail.ru.
Научные интересы: биогеография радиолярий.
Избранные публикации:
Засько Д.Н., Ведерников В.И. 2003. Сравнитель-
ный анализ вертикального распределения радиоля-
рий, зоопланктона и хлорофилла в эпипелагиали раз-
личных районов Северной Атлантики (июнь-сентябрь
2001 г.) // Океанология. Т. 1. С. 71-83.
Засько Д.Н., Русанов И.И. 2005. Вертикальное рас-
пределение радиолярий и их роль в эпипелагиали Вос-
точно-Тихоокеанского поднятия и Калифорнийского
залива // Известия РАН. Серия Биологическая. № 3.
С. 339-348.
Кругликова С.Б., Бьерклунд К.Р., Засько Д.Н. 2007.
Распространение полицистин (Euradiolaria) в донных
отложениях и планктоне Северного океана и Аркти-
ческих окраинных морей // Доклады Академии наук.
Т.415.№2. С. 281-285.
ЗЛАГОГУРСКИЙ Василий Владимирович,
Санкт-Петербургский государственный университет.
199034 Санкт-Петербург, Университетская наб.,
Д. 7/9.
E-mail: v.zlatogursky@gmail.com.
Научные интересы: фауна, систематика, фило-
гения и строение солнечников «Heliozoa».
Избранные публикации:
Zlatogursky ИИ 2010. Three new freshwater species of
centrohelid heliozoans: Acanthocystis crescenta sp. nov.,
A. kirilli sp. nov., and Choanocystis minima sp. nov. // Eur.
J. Protistol. Vol. 46. P. 159-163.
Zlatogursky И И 2011. Raphidiophrys heterophryoi-
dea sp. nov. (Centrohelida: Raphidiophryidae), the first
heliozoan species with a combination of siliceous and
organic skeletal elements // Eur. J. Protistol. (in press).
doi:10.1016/j.ejop.2011.09.004.
КАРПОВ Сергей Алексеевич, Зоологический ин-
ститут РАН; Санкт-Петербургский государственный
университет.
199034 Санкт-Петербург, Университетская наб., д. 1.
199034 Санкт-Петербург, Университетская наб.,
д. 7/9.
E-mail: sakarpov4@gmail.com.
Научные интересы: фауна, систематика, фило-
гения и строение протистов.
Избранные публикации:
Карпов С.А. 2001. Строение клетки протистов.
СПб.: Тесса.
Karpov S.A. 2007/8. The flagellar apparatus structure
of Apusomonas proboscidea and apusomonad relation-
ships // Protistology. Vol. 5. No. 2/3. P. 146-155.
Karpov S.A. 2010/11. Flagellar apparatus structure of
Thaumatomonas (Thaumatomonadida) and thaumatomonad
relationships // Protistology. Vol. 6. No. 4. P. 326-344.
КОРСУН Сергей Анатольевич, Институт океано-
логии им. П.П. Ширшова РАН; Санкт-Петербургский
государственный университет.
117997 Москва, Нахимовский проспект, д. 36.
199034 Санкт-Петербург, Университетская наб.,
д. 7/9.
E-mail: s_korsun@ocean.ru.
Научные интересы: экология и палеоэкология
арктических фораминифер, морская биология, протисты.
Избранные публикации:
К. Хаусман, Н. Хюльсман, Р. Радек. 2010. Протисто-
логия: Руководство // Пер. с англ. С.А. Карпова под ред.
С.А. Корсуна. М.: Т-во научных изданий КМК. 495 с.
МЫЛЬНИКОВ Александр Петрович, Институт
биологии внутренних вод РАН.
152742 Ярославская область, Некоузский район,
пос. Борок.
E-mail: mylnikov@ibiw.yaroslavl.ru.
Научные интересы: фауна, систематика, фило-
гения и ультраструктура гетеротрофных жгутиконос-
цев и солнечников.
Избранные публикации:
Мыльников А.П., Мыльникова, З.М., Цветков А.И.
1998. Особенности ультраструктуры хищного жгу-
тиконосца Katablepharis sp. // Цитология. Т. 40, №. 7.
С. 706-712.
СВЕДЕНИЯ ОБ АВТОРАХ
473
Nikolaev S.L, Berney С., Fahrni J.F, Bolivar L, Po-
let S., Mylnikov A.P, Aleshin VV, Petrov N.B., Pawlows-
ki J. 2004. The twilight of Heliozoa and rise of Rhizaria,
an emerging supergroup of amoeboid eukaryotes // PNAS.
Vol. 101. N 21. P. 8066-8071.
Myl’nikov A.P, Karpov S.A. 2004. Review of diver-
sity and taxonomy of cercomonads // Protistology. Vol. 3.
P. 201-217.
ОКОЛОДКОВ Юрий Борисович, Institute de
Ciencias Marinas у Pesquerias, Universidad Veracruzana.
Calle Hidalgo 617, Col. Rio Jamapa, Boca del Rio,
Veracruz, C.P. 94290, Mexico.
E-mail: yuriokolodkov@yahoo.com.
Научные интересы: таксономия, экология и
биогеография морских динофлагеллат.
Избранные публикации:
Okolodkov Y.B., Dodge J.D. 1995. Redescription of
the planktonic dinoflagellate Peridiniella danica (Paulsen)
comb. nov. and its distribution in the N. E. Atlantic // Eur.
J. Phycol. Vol. 30. P. 299-306.
Okolodkov Y.B., Garate-Lizarraga I. 2006. An anno-
tated checklist of dinoflagellates (Dinophyceae) from the
Mexican Pacific И Acta Bot. Mex. Vol. 72. P. 1-154.
Okolodkov Y.B., Campos-Bautista G., Gdrate-Lizdr-
raga L, Gonzalez-Gonzalez J.A.G., Hoppenrath M., Are-
nas V. 2007. Seasonal changes of benthic and epiphytic
dinoflagellates in the Veracruz reef zone, Gulf of Mexico //
Aquat. Microb. Ecol. 2007. Vol. 47. No. 3. P. 223-237.
ФРОЛОВ Александр Олегович, Зоологический
институт РАН.
199034 Санкт-Петербург, Университетская наб., д. 1.
E-mail: frolal@yandex.ru.
Научные интересы: фауна, систематика, фило-
гения и строение архамеб; Archamoebae.
Избранные публикации:
Frolov A., Goodkov A., Chystjakova L., Skarlato S.
2006. Morphology and development of Pelomyxa gruberi
sp. n. (Peloflagellatea, Pelobiontida) // Protistology. Vol. 4.
No. 3. P. 227-244.
Фролов A.O., Чистякова Л.В., Малышева M.H.
2010. Свето- и электронно-микроскопическое иссле-
дования Pelomyxa flava sp. n. (Archamoebae, Pelobion-
tida) // Цитология. T. 52. № 9. C. 776-784.
Чистякова JL, Mumeea О., Фролов A. 2012. Морфо-
логия Mastigamoeba aspera Schulze, 1875 (Archamoebae,
Pelobiontida) // Цитология. T. 54. № 1. C. 58-65.
СОДЕРЖАНИЕ
Предисловие.............................................................................................5
Dinoflagellata (Ю.Б. Околодков).........................................................................7
Acantharia (С.А. Корсун)..............................................................................120
Phaeodaria (С.А. Корсун)..............................................................................121
Taxopodida (С.А. Корсун)..............................................................................161
Polycystina (Д.Н. Засъко).............................................................................168
Солнечники (В.В. Златпогурский).......................................................................205
Pelobiontida (А. О. Фролов)...........................................................................270
Apusozoa (С.А. Карпов)................................................................................308
Hemimastigophorea (С.А. Карпов).......................................................................329
Ichthyosporea (С.А. Карпов)...........................................................................342
Kathablepharida (А.П. Мыльников)......................................................................370
Haplosporidia (С.А. Карпов)...........................................................................379
Рагатухеа (С.А. Карпов)...............................................................................393
Thaumatomonadida (С.А. Карпов)........................................................................402
Cryomonadida (А.П. Мыльников).........................................................................429
Pansomonadida (А.П. Мыльников)........................................................................442
Указатель латинских названий..........................................................................449
Сведения об авторах...................................................................................472
Научное издание
ПРОТИСТЫ: Руководство по зоологии. Часть 3.
СПб.; М.: Товарищество научных изданий КМК. 2011. 474 с., 26 с цв. вкл.
при участии ИП Михайлова К.Г.
Редактор издательства К.Г. Михайлов
Оригинал-макет: Т.А. Горлина
Для заявок:
123100, Москва, а/я 16, Издательство КМК
электронный адрес mikhailov2000@gmail.com
http ://avtor-kmk.ru
Подписано в печать 29.12.2011. Заказ № 235
Формат 60x90/8. Объём 59,5 + 3,25 п.л. Бумага офсетная и мелов. Тираж 800 экз.
Отпечатано в ППП «Типография «Наука», 121099, Москва, Шубинский пер., 6