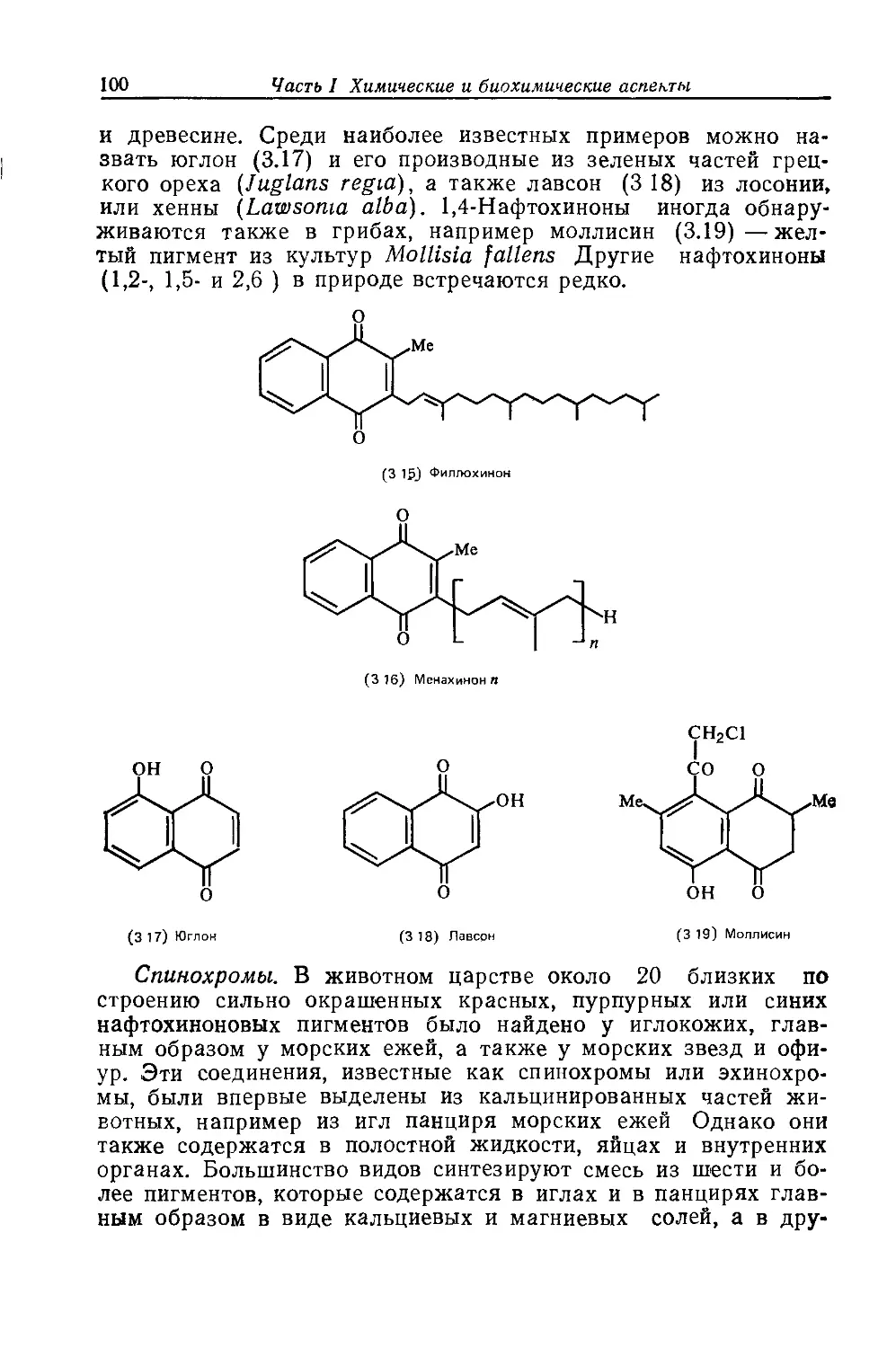
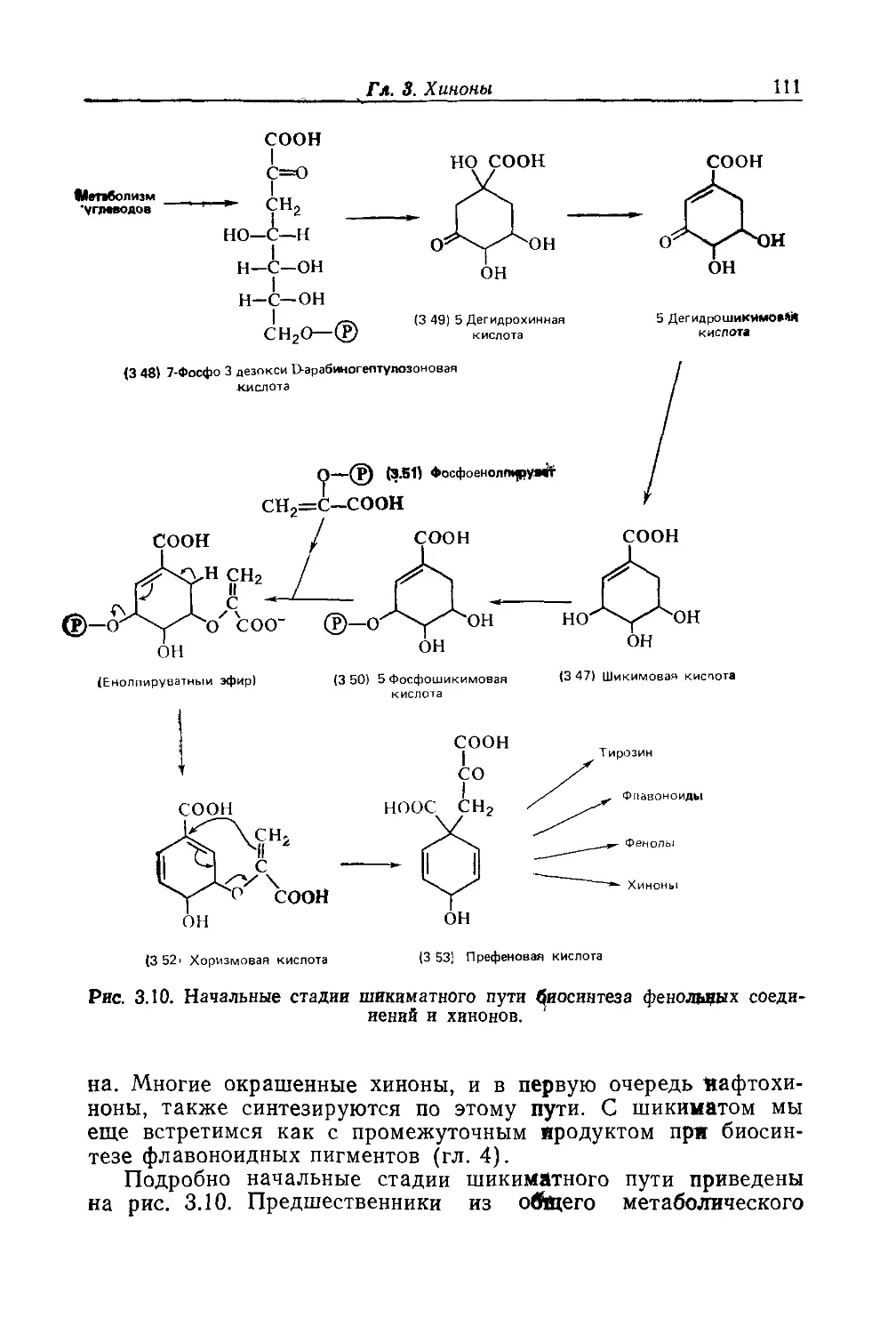
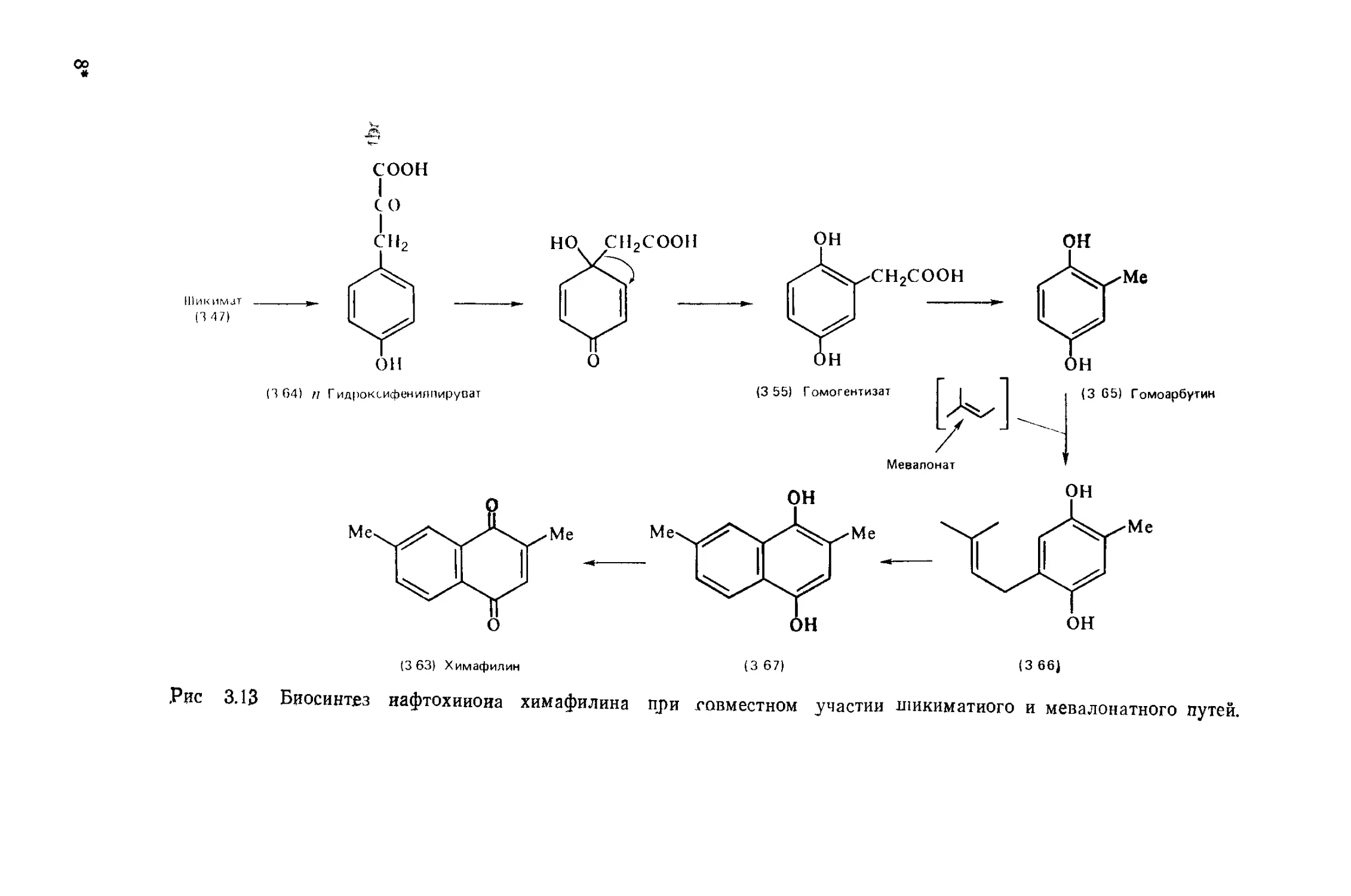
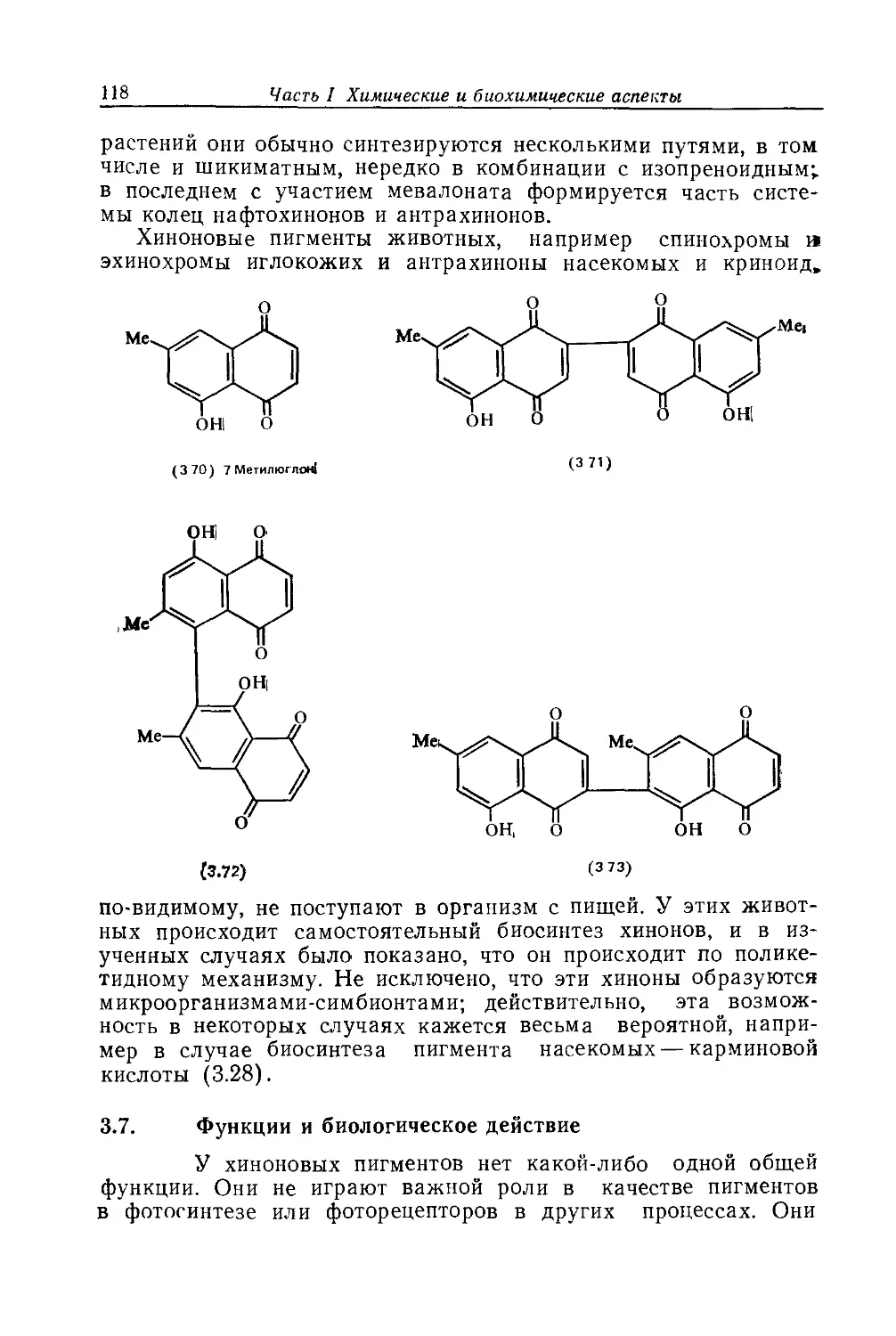
Автор: Бриттон Г.
Теги: материальные основы жизни биохимия молекулярная биология биофизика общая биохимия
Год: 1986
Текст
Биохимия природных пигментов
The Biochemistry of Natural Pigments
G. BRITTON
Cambridge University Press Cambridge New Rochelle London New York
Cambridge University Press
Cambridge
London New York New Rochelle
Melbourne Sydney
Г.Бриттон БИОХИМИЯ ПРИРОДНЫХ > ПИГМЕНТОВ
Перевод с английского
канд. биол. наук В. Д. ЦЫДЕНДАМБАЕВА
под редакцией
проф. М. Н. ЗАПРОМЕТОВА
Москва ,,Мир“ 1986
ББК 28.072 Б87
УДК 577.117.3
Бриттон Г.
Б87 Биохимия природных пигментов: Пер. с англ. — М.: Мир, 1986. — 422 с., ил.
Книга английского автора — первая биохимическая монография, охватывающая все краски живой природы. В доступной, но строго научной форме она знакомит с химией и биохимией пигментов, их распространением в природе (от бактерий до млекопитающих), многообразием функций.
Предназначена для биохимиков и физиологов, зоологов и ботаников, для студентов и преподавателей биологических вузов.
Б
2007020000—261
041/01/—86
143—86, ч. 1
ББК 28.072
Редакция литературы по биологии
Cambridge University Press 1983
This book was originally published in the English language by Cambridge University Press of Cambridge, England.
© перевод на русский язык, «Мир», 1986
Предисловие редактора перевода
Предлагаемая вниманию читателя книга Г. Бриттона «Биохимия природных пигментов» уникальна по замыслу. Автор — известный специалист в области химии и биохимии каротиноидов — взял на себя труд п смелость собрать воедино накопленные к настоящему времени биохимией, химией и биологией сведения о природных пигментах. Если говорить точнее, то это первая монография, охватывающая (преимущественно с биохимических позиций) все краски живой природы, даже те, которые обусловлены прежде всего не наличием специфических пигментов, а интерференцией света в тонких слоях полимерных пленок (например, крылья бабочек и птиц, чешуя рыб).
Для осуществления своего замысла автору пришлось пользоваться литературой по оптике и молекулярной спектроскопии, органической химии и молекулярной биологии, биохимии и физиологии человека и животных, насекомых и микроорганизмов, высших и низших растений, а также по таким более узко специализированным разделам, как фотобиология и фотосинтез, биолюминесценция и хемилюминесценция, химия и фотохимия процессов зрения, поведение животных и экологические аспекты животного и растительного мира.
Книга Г. Бриттона написана простым и ясным языком. Она содержит минимум необходимого материала и поэтому легко читается, временами приближаясь к стилю научно-популярного изложения. При всем этом книга глубоко научна, и для читателя, заинтересующегося каким-либо вопросом более детально, снабжена в конце каждого раздела достаточно обстоятельной библиографией, включающей как монографии, так и обзоры и публикации последних конференций и симпозиумов.
Можно ли объединить все разнообразие красок живой природы в рамках общей биохимической проблемы? После знакомства с книгой Г. Бриттона становится ясным, что на этот вопрос следует дать отрицательный ответ. Действительно, шесть рассматриваемых в книге крупных групп природных пигментов—-каротиноиды, хиноны, О-гетероциклические пигменты (главным образом флавоноиды), тетрапирролы (гем, хлорофиллы, билииы, кобаламины и др.), прочие N-гетероциклические пигменты (флавины, феназины, феноксазины, беталаины и др.) и меланины — во многом, а в некоторых случаях и полностью отличаются друг от друга как по биогенетическим путям, так и по функциям и распространению в природе. В соответствии с этим в книге рассматриваются такие разнообразные и крупные проблемы, как биохимия зрения (и, в частности, цветового зрения), биохимия фотосинтеза у бактерий, прокариотических сине-зеленых водорослей, эукариотиче-
6
Предисловие редактора перевода
ских водорослей и высших растений, вопросы фотобиологии (фитохром и его участие в процессах роста и морфогенеза растений, в фототропизмах и в фототаксисе водорослей и бактерий; изменение окраски животных в зависимости от стадий развития, внешних условий или стрессовых воздействий) и экологические аспекты пигментации у растений и животных.
При таком широком размахе в некоторых случаях совершенно естественна неполнота илн ограниченность информации о функциях той или иной группы рассматриваемых соединений.
Так, например, в книге Г. Бриттона не приведены сведения о влиянии флавоноидов на процессы роста, развития и репродукции растений, об их способности регулировать процесс окислительного фосфорилирования, об их антимутагенной, Р-витаминной и других видах биологической активности, а также о путях их метаболизма в организме животных и человека.
Можно не согласиться и с тем, что автор вычленяет хиноны в особую группу природных пигментов, отрывая их от исходных фенольных соединений (гидрохинонов), хотя он сам признает большую гетерогенность представителей этой группы, их малое участие в окраске наружных покровов или тканей и отсутствие общей биологической функции.
Однако если учесть, что основной целью автора было описание лишь пигментных функций тех или иных веществ, то эти пробелы вполне могут быть оправданы.
Особая ценность книги Г. Бриттона состоит в том, что на фоне стремительно возрастающего объема научной информации и все более узкой специализации исследователей она дает возможность со сравнительно небольшой затратой времени ознакомиться с современным состоянием наших знаний в области химии, биологии и биохимии природных пигментов, имеющих столь важное значение в жизни человека и животных, высших и низших растений, грибов и микроорганизмов.
М. Н. Запрометов
Предисловие
В то время когда я пишу эти строки, листья на деревьях в моем саду меняют свою окраску с летней зеленой на желтые, красные и коричневые цвета осени, розы и другие цветы все еще расцвечены яркими красками, а большинство болотных птиц на берегу уже нарядились в свои зимние наряды. Подобные простые явления служат хорошим примером как распространения окраски, так и ее разнообразия в живой природе; но они настолько привычны, что обычно мы считаем их чем-то само собой разумеющимся. У некоторых животных окраска и характер ее распределения имеют большое значение для маскировки, позволяющей не привлекать внимания хищников. У других животных ее функция состоит в оповещении о своем присутствии потенциального брачного партнера. Яркие цвета окрашенных цветков и плодов важны для привлечения опыляющих и разносящих семена животных. Глаз человека радуют насыщенные или нежные оттенки всевозможных садовых и полевых цветов и краски ярко окрашенных плодов в природных условиях или в витринах магазинов. Нет ничего удивительного в том, что ученые уже давно заинтересовались природой окраски растений и животных и изучают механизмы, лежащие в основе ее образования и проявления. Сейчас уже хорошо известно, что существуют два принципиально различных механизма формирования окраски в природе: физические или оптические явления, связанные со структурой клеток и тканей, обусловливают структурную окраску, а присутствие поглощающих свет веществ — пигментов — обусловливает пигментную окраску. Настоящая книга посвящена биохимии природных пигментов — молекул, создающих множество красок в живом мире. Однако роль многих пигментов не ограничивается тем, что они придают окраску; способность поглощать видимый свет делает их полезными и в других отношениях; они необходимы для таких жизненно важных процессов, как, например, улавливание света при фотосинтезе, восприятие света и различение цветов в процессе зрения, а также многие другие опосредованные светом реакции и регуляторные механизмы. Все эти вопросы, касающиеся роли природных пигментов, и будут рассмотрены в данной книге.
Она разделена на две части. В первой части описаны основные особенности химии и биохимии главных групп природных пигментов, вторая часть посвящена биологическим аспектам и охватывает основные функции пигментов в природе. В книге используется описательный подход и основное внимание уделяется главным свойствам и принципам функционирования пигментов. Такое описание не может быть исчерпывающим, поскольку его ограничивает объем глав, иначе каждая глава разрослась бы до серии в
8
Предисловие
несколько томов. Цель же настоящей книги заключается в том, чтобы дать общую картину, привлечь внимание к наиболее интересным проблемам, привить вкус к их изучению и снабдить читателя ключевыми ссылками. Я с большой тщательностью подошел как к отбору освещаемых в книге тем, так и к определению степени детальности их изложения. Читатели могут ие согласиться с моим выбором, либо могут подумать, что я неоправданно расставил акценты или неудачно распределил материал по главам, однако я вижу предмет, описываемый в данной книге, именно таким, как я его представил. Написание и подготовка этой книги были связаны с новыми ощущениями, часто приятными, иногда расстраивающими и отнимающими время и внимание, которые, возможно, требовались для другого. В ходе подготовки, однако, я много прочел и много узнал о природных пигментах. Это было очень плодотворно, и я надеюсь, что мне удалось донести до читателя хотя бы часть добытых мною знаний и того огромного интереса, который возбуждает во мне данный предмет.
Наконец — и это мне доставляет большое удовольствие — я должен выразить свою благодарность очень многим людям. Прежде всего я хотел бы поблагодарить своих родителей за их жертвы и поддержку в продолжение всех лет моего обучения: я счастливо провел эти годы, изучая мир природных пигментов. Приношу также мою благодарность доктору Э. Хэсламу и профессору Т. В. Гудвину, которые поощряли меня в моей работе и у которых я научился столь многому. Я признателен сотрудникам моей исследовательской группы за снисходительность, проявленную ими на протяжении этих лет, когда я посвящал книге то время и внимание, на которые с полным правом могли рассчитывать они. Я также хотел бы поблагодарить доктора Эрнста Кирквуда, миссис Марион Жуве и других сотрудников «Кэмбридж Юниверсити Пресс» за их труд по превращению моего машинописного текста в книгу.
Я особенно благодарен членам моей семьи, которые терпеливо мирились с тем, что я тратил время и энергию на подготовку книги и часто не уделял им должного внимания. Моя жена Пат вынесла все это со стойкостью и терпением. Более того, она очень помогла мне, превратив мою несовершенную и местами неразборчивую рукопись в безупречный машинописный текст. Мои дети — Ребекка и Джонатан — временами были лишены общения со мной и того отцовского руководства, которое необходимо в их возрасте и которое я сам хотел бы осуществить. Это им я посвящаю настоящую книгу в надежде на то, что они смогут получить столько же удовольствия, сколько получил я, соприкоснувшись с миром живой природы, где цвет играет такую большую роль.
Г. Бриттон
Час ib 1
Химические и биохимические аспекты
Глава 1
Свет и цвет
1.1. Введение
1.1.1. Электромагнитное излучение Солнца
Все процессы жизнедеятельности на Земле в конечном итоге зависят от той части огромных ресурсов солнечной энергии, которая достигает поверхности нашей планеты. Солнце испускает широкий спектр электромагнитных излучений, от длинноволнового инфракрасного (ИК.) и радиочастотного до коротковолнового ультрафиолетового (УФ) и у-лучей. (рис. 1.1). Однако земная атмосфера эффективно отфильтровывает большую часть этого излучения, особенно обладающие высокой энергией и губительные для тканей живых организмов УФ-, рентгеновские и у-лучи.
1.1.2. Видимый свет
Среди разных видов излучений, которые достигают поверхности Земли, с наибольшей легкостью пронизывают атмосферу лучи с длинами волн 380—750 нм (1 нм = 10-9 м). Этот диапазон длин волн, называемый видимым светом, имеет первостепенное значение для поддержания жизни. Животные, в том числе и человек, обладают очень сложными фоторецепторными системами для обнаружения видимого света, а также для точного различения света с разной длиной волны в процессе цветового зрения. Окраска и способность приобретать окраску стали, таким образом, очень важными в мире живого.
Видимый свет — это тот диапазон световой энергии, который используется растениями и микроорганизмами в процессе фотосинтеза. С помощью фотосинтеза атмосферная двуокись углерода фиксируется в такой химической форме, которая используется не только самими растениями, но и служит первичным источником пищи для всего живого мира. Различные фоторецепторы регистрируют также вариации в количестве до-
Часть I. Химические и биохимические аспекты
ступного видимого света, например различия в длине дня и ночи, и это лежит в основе чрезвычайно важных механизмов, регулирующих рост и развитие. Для того чтобы быть окрашенными, различать цвета и осуществлять такие процессы, как рецепция света, фотосинтез и фоторегуляция, живые организмы должны обладать специфическими механизмами, позволяющими им поглощать свет в видимой части спектра. Поэтому молекулы природных пигментов, или биохромов, обладающие особым свойством поглощать свет с длинами волн 380—750 нм,
Рнс. 1.1. Спектр электромагнитного излучения.
имеют фундаментальное значение. Целью настоящей книги является обзор основных химических и биохимических свойств природных пигментов, а также по возможности полное описание их функционирования на молекулярном уровне.
1.2. Цвет и его восприятие
1.2.1. Цвет
Одновременное восприятие всего диапазона 380— 750 нм создает у человека ощущение белого света. Другие животные способны воспринимать излучение с длинами волн, выходящими за пределы этого диапазона. Например, пчелы «видят» УФ-лучи, которые невидимы для человека.
Ощущение цвета создается в том случае, если мы воспринимаем лучи только части видимого диапазона. Белый свет представляет собой совокупность электромагнитных излучений с диапазоном длин волн 380—750 нм. Если его разделить путем пропускания через призму, то образуется ряд полос, каждая из которых охватывает гораздо более узкий диапазон длин волн. Мы видим эти лучи как ряд цветов, в частности красный, оранжевый, желтый, зеленый, голубой, синий и фиолетовый
Гл. 1. Свет и цвет
11
цвета радуги, которые образуются в результате преломления солнечного света на капельках воды. Ощущение каждого отдельного цвета связано с длиной волны светового луча данного диапазона; например ощущение желтого цвета мы получаем от света с длиной волны ~ 580 нм. Ощущения, которые люди с нормальным цветовым зрением отождествляют с определенными длинами волн, перечислены на рис. 1.2. Можно также
III' Фиоле—Синий-Зеленый—Желтый тОранже--Крас-товый ; вый ный;
Г ! I I
X • I 1
Комплементарный \ • [ i |
Цвет (---}Желтый“Оранже--Крас- Пурпур- Синий-[—
।вый» ный ный।
Длина волны^нм 400 500 600 700 800
Рис. 1.2. Видимый участок спектра. Показаны цвета, которые люди с нормальным цветовым зрением идентифицируют как свет с определенной длиной волны, а также комплементарные (цвета, полученные «вычитанием» отдельных длин волн) цвета, наблюдающиеся в тех случаях, когда свет определенного цвета, или диапазона длин волн, «вычитается» из спектра белого света.
получить ощущение определенного цвета при смешивании света с разными длинами волн, например желтый цвет может быть получен при смешивании красного и зеленого света.
Вместе с тем ощущение цвета можно получить путем вычитания из совокупности лучей, составляющих белый свет, довольно узкой полосы (в диапазоне длин волн 20—30 нм). В этом случае виден цвет, комплементарный цвету отсутствующей полосы длин волн. Таким образом, если белый свет пропустить через фильтр или вещество, которое поглощает, например, синий свет, т. е. свет в диапазоне длин волн 480+30 нм, то выходящий луч будет иметь цвет, комплементарный синему, т. е. желтый. Комплементарные, или «вычитаемые», цвета, наблюдающиеся после исключения света определенной длины волны из белого света, также перечислены на рис. 1.2.
1.2.2. Восприятие света и различение цветов
Приведенные выше рассуждения о свете и цвете часто используют при объяснении нашей способности «видеть цвет». Хотя различение и описание цветов в значительной степени субъективны, в их основе должен лежать фундаментальный физиологический механизм, который не только позволял бы об-
12
Часть I. Химические и биохимические аспекты
иаруживать электромагнитное излучение в диапазоне длин волн 380—750 нм, но был бы также ответственным за различные ощущения, возникающие в ответ на излучение определенной длины волны внутри этого диапазона. Насколько нам известно, растения и микроорганизмы зрения не имеют, но и они способны использовать энергию света определенных длин волн, например для фотосинтеза (гл. 10), и способны двигаться или расти по направлению к источнику света либо от него (гл. 11). Однако лишь в животном царстве механизмы восприятия света и различения цветов развились в точный и чувствительный аппарат зрения, который мы знаем и которым пользуемся.
1.2.3. Глаз и цветовое зрение
У животных органом восприятия света и различения цветов служит глаз. У человека и многих животных в сетчатке глаза имеются специфические клетки: палочки и колбочки, которые содержат фоторецепторы, или зрительные пигменты. Палочки в сетчатке млекопитающих ответственны за восприятие света низкой интенсивности. Они содержат пигменты, скотопси-ны, которые чувствительны к свету очень низкой интенсивности. Максимум чувствительности человеческого скотопсина, родопсина, расположен приблизительно при 520 нм; вместе с тем глаз воспринимает свет в достаточно широком диапазоне длин волн, близких к этому значению. Поглощение света соответствующих длин волн зрительным пигментом приводит к генерированию электрического и нервного импульса. Свет разных длин волн вызывает в скотопсине одну и ту же реакцию. Вместе с тем колбочки содержат ряд зрительных пигментов, фо-топсинов, которые чувствительны к свету определенной длины волны. У человека имеются три таких пигмента, чувствительные к синему, зеленому и красному свету. Эти три фоторецептора охватывают почти весь диапазон видимого спектра и обеспечивают механизм различения цветов, достаточно чувствительный для ощущения очень тонких различий в окраске, ее оттенках и нюансах. Данная трихроматическая система и входящие в нее пигменты более подробно описаны в гл. 9. В современном цветном телевидении также используется трихроматическая система, в которой любой цвет или оттенок получают путем сложения красного, зеленого и синего цвета.
1.3. Цвет у живых организмов
В то время как на все живые организмы или ткани падает белый свет, например солнечный, отражается от них и попадает на глаз наблюдателя только часть видимого диапазона,
Гл. 1. Свет и цвет
13
т. е. эти организмы и ткани выглядят окрашенными. Окраска может быть обусловлена физической природой поверхности ткани (структурная окраска) или же присутствием особых химических соединений (пигментов, или биохромов), которые специфически поглощают видимый свет некоторых длин волн.
1.3.1. Структурная окраска
В животном царстве есть много примеров, когда наблюдаемая окраска является результатом таких оптических феноменов, как рассеяние, интерференция или дифракция света содержащимися в тканях микроскопическими структурами. Такую окраску называют структурной. Структурная окраска — весьма обширная и важная тема исследований, но подробное описание разных видов структурной окраски и оптических явлений, которые их вызывают, выходит за рамки этой книги. Поэтому ниже мы охарактеризуем эти явления лишь вкратце.
1.3.2. Светорассеяние; синева Тиндаля
Очень маленькие частицы, диаметр которых меньше длины волны красного или желтого света, могут отражать или рассеивать коротковолновые компоненты белого света сильнее, чем длинноволновые. Наиболее простой пример этого явления — голубизна неба. Мельчайшие частички пыли или других образований в атмосфере рассеивают падающий белый свет таким образом, что свет, отражающийся по направлению к поверхности Земли, содержит больше коротковолновых (синих и фиолетовых), чем длинноволновых (красных и желтых), лучей, и поэтому мы видим небо голубым. Этот процесс часто называют рассеянием Рэлея или Тиндаля, а образующийся цвет известен как синева Тиндаля.
В большинстве случаев нерадужная (непереливчатая) синяя окраска у животных представляет собой синеву Тиндаля. Так, голубой цвет глаз у людей обусловлен рассеянием белого света мельчайшими белковыми частицами радужной оболочки. У многих птиц с голубым оперенением, например у лазоревок, волнистого попугайчика и других попугаев, внутри кератиновых бородок пера содержатся светорассеивающие частицы в форме мельчайших наполненных воздухом пластинок.
В пользу структурного происхождения синевы Тиндаля свидетельствует тот факт, что до сих пор из тканей не удалось выделить ни одного синего пигмента, а также то, что синяя окраска не выявляется при просматривании тканей в проходящем белом свете. Ткани выглядят матовыми без радужной окраски,
14
Часть 1. Химические и биохимические аспекты
причем при рассматривании практически под любым углом они окрашены одинаково.
Зеленая окраска, особенно у перьев, часто обусловлена наложением синего цвета структурного происхождения и желтого цвета пигмента.
1.3.3. Радужная окраска
К числу наиболее ярких визуальных эффектов, наблюдаемых в природе, относится сверкающая радужная структурная окраска, часто встречающаяся в животном царстве, в частности у птиц, насекомых и рыб. Для радужной переливчатой окраски характерно то, что наблюдаемые цвета изменяются в зависимости от угла зрения. Этот эффект обусловлен двумя оптическими явлениями — интерференцией и дифракцией.
Интерференция. Явление интерференции, возможно, наилучшим образом известно на примере тонкой пленки масла на поверхности воды. Свет, отраженный от нижней поверхности (границы масло — вода) пленки, проходит несколько большее расстояние, чем свет, отраженный от верхней поверхности — границы масло — воздух. Когда различие между пройденными расстояниями эквивалентно половине длины волны света, два световых луча, отраженные от верхней и нижней поверхностей, находятся в противофазе и гасят друг друга. Таким образом, в наблюдаемом отраженном свете отсутствует свет отдельных длин волн, в результате чего отраженный луч приобретает окраску. При более остром угле зрения расстояние, которое проходит луч между верхней и нижней поверхностями, больше. Следовательно, в другой части спектра (при большей длине волны) произойдет интерференция, и потому здесь будет наблюдаться иная окраска.
У животных известно много примеров окраски, образующейся в результате интерференции. У многих насекомых тонкой пленкой, обусловливающей появление ряда интерферирующих цветов при рассматривании под разными углами, служит просвечивающее крыло. Многие бабочки имеют на поверхности чешуек крыльев пластинки с мельчайшими воздушными пузырьками между ними. Расстояние между пластинками примерно постоянно, п поэтому в довольно широком диапазоне углов зрения окраска почти не меняется.
Окраска, обусловленная интерференцией, обычно встречается у птиц, например у самца павлина. Уплощенные крючочки на бородках пера пластинчатых структур, играющих роль интерферирующей пленки, повернуты таким образом, что их плоская поверхность обращена в сторону наблюдателя. Во многих случаях яркость переливающихся цветов усиливается в при
Гл. 1. Свет и цвет
15
сутствии подстилающей черной поверхности (меланин), которая поглощает весь остальной свет. Благодаря такой подстилке оперение птиц часто имеет металлический блеск.
Дифракция. Довольно близкий к описанному выше эффекту радужного окрашивания дает дифракция, хотя она менее характерна для природных тканей, чем интерференция. Искусственные дифракционные решетки, используемые в некоторых оптических приборах, состоят из серии очень близко и на одинаковом расстоянии друг от друга расположенных параллельных линий, нанесенных на отшлифованную поверхность. Примером радужной окраски, образующейся на природных пластинчатых структурах, которые ведут себя как дифракционные решетки, является перламутровая окраска раковин моллюсков.
1.3.4. Структурная белизна
Понятие структурной белизны можно проиллюстрировать на примере снега, который своим блестящим белым цветом обязан отражению падающего белого света от поверхности бесчисленных мелких кристалликов. Сходный эффект дает отражение света другими твердыми или жидкими частицами либо поверхностями, содержащимися в среде с иным показателем преломления. Частицы не должны быть слишком малы, чтобы не происходило различного рассеяния лучей с разной длиной волны (тиндалевское рассеяние). Приведем несколько примеров структурной белизны в природе — белые волосы (отражение от пузырьков воздуха, заключенных в прозрачное твердое вещество), белые перья (отражение от множества маленьких бесцветных крючочков на бородке пера), молоко (отражение от капелек в эмульсии, состоящей из двух жидкостей с разными показателями преломления), белые бабочки (отражение от пронизанных жилками и сетчатых, покрытых чешуйками поверхностей), а также белые и серебристые рыбы (отражение от кристаллов гуанина).
1.3.5. Химическая окраска, обусловленная природными пигментами
Разнообразие природной окраски является большей частью результатом преимущественного поглощения света некоторых длин волн химическими веществами, содержащимися в ткани. Химические вещества, ответственные за это поглощение, являются природными пигментами. Именно биохимии этих природных пигментов, или биохромов, посвящена данная книга. Практически все природные пигменты представляют собой органические вещества, но они значительно отличаются от пиг
16
Часть I. Химические и биохимические аспекты
ментов, выпускаемых промышленностью и широко используемых в качестве красок для рисования и красителей. Однако, прежде чем приступить к подробному описанию различных групп природных пигментов, необходимо рассмотреть в общем виде те свойства молекул, которые обусловливают поглощение видимого света.
1.4. Поглощение света
1.4.1. Энергия и длина волны
Когда атом (или молекула) поглощает квант энергии электромагнитного излучения, он переходит из одного энергетического состояния в другое. Электрон может занимать только определенные дискретные энергетические уровни, и поглощение кванта света возможно только в том случае, когда энергия поглощаемого излучения Е равна разности энергий между двумя этими уровнями. Однако, согласно «правилам отбора», не все такие переходы «разрешены»; некоторые из них являются «запрещенными». Будет ли квант поглощен, строго зависит от его энергии, а следовательно, от длины волны излучения, так как
Е = hv,
где Е — энергия кванта, h — постоянная Планка, a v — частота излучения, связанная с длиной волны % соотношением
v = с/Х,
в котором с — скорость света. Таким образом, между энергией и длиной волны имеет место обратная зависимость, или, другими словами, чем больше разность энергий двух энергетических состояний, тем короче длина волны излучения, необходимого для осуществления перехода между ними. Энергия УФ- и видимого излучения достаточно велика для осуществления электронных переходов, т. е. кванты этих видов излучения способны вызывать переход электронов из более низкого в более высокое энергетическое состояние. Кроме того, каждое энергетическое состояние электронов даже в наиболее простых двухатомных молекулах характеризуется различными колебательными и вращательными энергетическими уровнями. Разности колебательных и вращательных энергий значительно меньше, чем электронных, поэтому они соответствуют квантам ИК-излуче-ния.
Гл. 1. Свет и цвет
17
1.4.2. Поглощение излучения атомами
При поглощении атомом кванта света его электрон переходит из основного состояния в возбужденное, причем энергия кванта точно соответствует разности энергий между двумя энергетическими состояниями. Поскольку существует однозначное соответствие между энергией, частотой и длиной волны излучения, при простом переходе электрона с одного уровня на другой поглощенное излучение или свет может быть только-какой-то одной длины волны и в спектре поглощения будет наблюдаться единственная линия.
1.4.3. Поглощение излучения молекулами
В случае молекул ситуация не так проста. Даже двухатомные молекулы велики по сравнению с атомами, и их уже нельзя рассматривать как жесткие частицы. В них происходят молекулярное вращение и колебания ядер, причем энергия вращательного и колебательного движения также квантуется (рис. 1.3). Таким образом, любой электрон в молекуле в основном состоянии может находиться на нескольких колебательных энергетических уровнях, причем для каждого из последних возможно несколько вращательных энергетических уровней. То же самое справедливо и для электрона в возбужденном состоянии. И хотя разницы колебательных и вращательных энергий малы по сравнению с разницей электронных энергий, при обсуждении электронных переходов их необходимо учитывать. Следовательно, для осуществления электронного-перехода энергия кванта не обязательно должна иметь одно-строго определенное значение; она должна соответствовать разности между основным и возбужденными состояниями для различных колебательных и вращательных уровней. Возбуждение электронов может сопровождаться колебательным и вращательным возбуждением молекул. В итоге при электронном возбуждении энергия поглощается в некотором диапазоне длин волн излучения, и поэтому для молекул спектроскопические линии поглощения расширяются до полос поглощения с центром, соответствующим длине волны максимального поглощения (Хтах); обычно ширина полосы составляет 50—100 нм. Как правило, невозможно достичь достаточно хорошего разрешения полос поглощения, по которому можно было бы восстановить тонкую структуру колебательных и вращательных уровней.
Переход электрона в возбужденное состояние на более высокий энергетический уровень происходит чрезвычайно быстро ('---1015 с), тогда как более тяжелые атомные ядра не могут в течение этого времени сколько-нибудь заметно переместиться.
2—84
18
Часть I. Химические и биохимические аспекты
Е2-^^ /Е2---------------------
Второе электронное возбужденное состояние
2
•Ет
0>
Вращательные уровни
'Электронный переход
V3
Колебательные уровни энергии N?
•Первое электронное возбужденное состояние
Некоторые из возможных электронных переходов
Ео
Vo
к. Вращательные уровни
•Ro|
го Основное электронное состояние
1
Рис. 1.3. Диаграмма, ные и вращательные) ронные переходы для
иллюстрирующая электронные (а также колебатель-энергетические уровни и некоторые возможные элект-атома (X) и двухатомной нли многоатомной молекулы (Б).
Следовательно, во время электронных переходов положения ядер, или межъядерные расстояния, практически не меняются (принцип Франка — Кондона).
Молекулярные колебания имеют более или менее гармонический характер, так что колеблющиеся ядра дольше всего находятся в крайних положениях, где движение наиболее медленное. Таким образом, электронные переходы наиболее вероятны в том случае, когда межъядерные расстояния максималь
Гл. 1. Свет и цвет
19*
ны или минимальны, и, следовательно, вероятность поглощения кванта с энергией, соответствующей этим положениям, больше, чем в других случаях. В результате наиболее интенсивным будет поглощение света, состоящего именно из таких квантов.
В общем положение полосы поглощения Хщах определяется энергией, необходимой для наиболее вероятных электронных переходов, а интенсивность поглощения отражает вероятность, происходящего перехода.
1.4.4. Абсорбционные свойства некоторых простых молекул
В простой молекуле способен возбуждаться любой электрон. Требуемая для этого энергия зависит прежде всего от типа занимаемой им орбитали (рис. 1.4). Так, для возбуждения электрона на о-орбитали необходима наиболее высокая энергия. Следовательно, труднее всего возбудить электроны в
Рис. 1.4. Пять электронных состояний, характерных для органических молекул, и наиболее обычные электронные переходы, которые могут происходить в результате поглощения ими УФ- илн видимого света.
таких простых органических молекулах, как насыщенные углеводороды. Единственными доступными электронами у них являются электроны о-связей, и для перехода электрона о-связи на антисвязывающую (разрыхляющую) п*-орбиталь необходимо поглощение большого количества энергии. Таким образом, в простой молекуле, такой, как молекула метана (СН4), для возбуждения электронов требуется энергия ~600 кДж/моль. Это
2*
20
Часть I. Химические и биохимические аспекты
количество энергии может дать электромагнитное излучение в УФ-диапазоне, в случае метана (газ) с длиной волны ~122 нм.
Углерод-углеродная двойная связь С —С может рассматриваться как л-связь. Переход электрона со связывающей л-ор-бнтали на разрыхляющую л*-орбиталь достигается значительно легче, чем переход о—мт*. Меньшее количество энергии, которое необходимо в этом случае, может быть обеспечено УФ-излучением несколько большей длины волны (162 нм для этилена, СН2 = СН2).
Когда гетероатом, такой, как атом кислорода или азота, содержится в насыщенной или ненасыщенной молекуле, его не-связывающий неспаренный р-электрон (обозначается п) может быть переведен на о*-разрыхляющую орбиталь, п—>-о*-Пере-ходы требуют еще меньшей энергии и могут достигаться при поглощении энергии более длинноволнового электромагнитного излучения (183 нм для метанола, СН3ОН).
Переход п—>л* в молекулах, содержащих группу С = О, требует наименьшего количества энергии. Так, ацетон, (СН3)2С = О, для перехода п—>л* имеет максимум поглощения при 280 нм.
1.4.5. Абсорбционные свойства сопряженных полиенов
Так же как и для простых примеров, описанных выше, в случае сложных молекул чем легче происходит возбуждение электрона, тем меньшее количество энергии требуется для этого и тем большую длину волны может иметь свет, способный осуществить переход электрона в возбужденное состояние. Это утверждение хорошо иллюстрируется простым качественным сравнением светопоглощающих свойств полиенов с сопряженными связями.
Если вместо одной двойной связи в молекуле содержится ряд сопряженных двойных связей, можно считать, что л-элект-роны этих двойных связей делокализованы по всей системе сопряженных связей. По мере увеличения длины такой системы возрастает и степень ее стабилизации в результате резонансной делокализации, причем для максимальной резонансной стабилизации система сопряженных двойных связей должна быть плоской. В возбужденном состоянии такая стабилизация даже больше, чем в основном, так что при увеличении длины системы двойных связей разница энергий двух состояний становится меньше. Таким образом, в сопряженной системе электронное возбуждение (л—>-л*-переход) достигается значительно легче, чем в случае изолированной двойной связи. При удлинении сопряженной системы двойных связей требуемая для возбуждения энергия становится меньше и в конце концов может быть
Гл. 1. Свет и цвет
21
достигнута стадия, на которой возбуждение происходит при поглощении видимого света. При этом часть спектра белого света поглощается, а остальная проходит насквозь или отражается, так что соединение выглядит окрашенным. По мере роста цепи с сопряженными двойными связями длина волны максимального поглощения увеличивается и наблюдаемая окраска изменяется: от желтой к оранжевой,, затем к красной и фиолетовой. Этот эффект прекрасно иллюстрируется на примере каротиноидной группы природных пигментов (гл. 2).
Структуры, ответственные за поглощение света, называют хромофорами. В случае упомянутых выше полиенов хромофором является система сопряженных двойных связей. Другие функциональные группы или заместители в молекуле могут изменять положение (главным образом в сторону увеличения длины волны) максимума поглощения; такие группы называются ауксохромами. Они могут либо увеличивать длину хромофора, либо облегчать электронные переходы, повышая стабильность возбужденного состояния.
1.4.6. Поглощение света некоторыми группами природных пигментов
Каротиноиды (гл. 2) являются полиенами, которые имеют хромофор, представляющий собой протяженную систему сопряженных двойных связей. Другие группы природных пигментов обязаны своей окраской другим хромофорам. В большинстве случаев в их образовании участвует сопряженная или ароматическая л-электронная система, в которой присутствуют добавочные электрон-донорные или электрон-акцеп-торные группы; особенно важны атомы азота и кислорода. Разделение зарядов, характерное для молекул этого типа, может вносить значительный вклад в общую резонансную структуру, что приводит к высокой степени стабилизации, особенно в возбужденном состоянии. Поэтому необходимая для возбуждения энергия невелика, и может происходить поглощение видимого света. Этот случай хорошо иллюстрируют хиноны и аналогичные им системы, которые служат основой многих природных пигментов. Наиболее существенной особенностью других классов соединений является вклад в гетероароматиче-скую систему электронов атомов кислорода и азота, не участвующих в образовании связей.
В частности, интенсивное поглощение достигается, когда дипольный момент молекулы в основном состоянии отличается от дипольного момента молекулы в возбужденном состоянии, т. е. возбуждение приводит к перераспределению заряда. Чем больше перераспределение заряда, или дипольный момент пере
22
Часть I. Химические и биохимические аспекты
хода, тем больше интенсивность полосы поглощения света. Дипольные моменты перехода представляют собой векторы. Для сложных молекул возможно существование нескольких электронных возбужденных состояний с различными дипольными моментами перехода и с различной пространственной ориентацией.
Когда хромофоры пигментов расположены близко друг к. другу, между ними могут возникать электронные (экситонные) взаимодействия благодаря сопряжению дипольного момента перехода одной молекулы с соответствующими моментами перехода других сходных или идентичных молекул. Это приводит к образованию различных возбужденных электронных энергетических уровней и к расщеплению полос поглощения. Наблюдается также аналогичное влияние экситонов на полосы кругового дихроизма. Обнаружение экситонного расщепления может дать полезную информацию об относительной ориентации хромофорных молекул, например об упорядоченном расположении их в стопках.
Электронные и структурные особенности, обусловливающие светопоглощающие свойства главных групп природных пигментов, будут рассмотрены в соответствующих главах.
1.4.7. Триплетные состояния, флуоресценция и фосфоресценция
Когда молекулы пигментов поглощают энергию света, они активируются и переходят в более высокоэнергетическое возбужденное электронное состояние. Такое возбужденное состояние с электронами на разрыхляющих орбиталях нестабильно, и после отдачи избытка энергии электроны возвращаются в основное состояние. Это может осуществляться несколькими путями (рис. 1.5). Прежде всего по мере потери возбужденной молекулой избытка колебательной энергии происходит быстрая (10~12 с) колебательная релаксация, в результате чего молекула возвращается на более низкий колебательный уровень. Существует несколько способов релаксации колебательно-возбужденных состояний. Простейшим из них является переход в основное электронное состояние либо путем испускания излучения в процессе флуоресценции, либо путем передачи энергии возбуждения какой-то другой молекуле, которая в свою очередь становится электронновозбужденной. Поскольку колебательная энергия уже потеряна, энергия флуоресценции или передаваемая энергия всегда меньше, чем поглощенная. Поэтому длина волны флуоресценции больше, чем у поглощенного излучения. Аналогичным образом при передаче энергия может поглощаться только молекулой, имеющей максимум по-
Гл. 1. Свет и цвет
23
Синглетные уровни
Триплетные уровни
Рис. 1.5. Некоторые пути, по которым возможна потеря энергии молекулы в первом возбужденном синглетном состоянии. Показаны колебательная релаксация, флуоресценция, межсистемный переход и фосфоресценция.
глощения при большей длине волны, чем у первоначально возбужденной молекулы, например с каротиноида (Хтах = 450 нм) на хлорофилл (Хтах = 680 нм) при фотосинтезе.
Второй возможностью является переход в более низкоэнергетическое триплетное состояние. В возбужденных состояниях, являющихся результатом поглощения света, все электроны обычно спарены, и такие состояния называются синглетными. В триплетном состоянии два электрона не спарены, и потому такое состояние обычно более стабильно, чем соответствующее синглетное (правило Хунда). Следовательно, переход из низшего синглетного возбужденного состояния (Si) в триплетное состояние’ (Т1) энергетически выгоден, хотя вероятность его мала и он происходит довольно медленно. Однако если синглетное состояние живет достаточно долго, то синглет-
24
Часть I. Химические и биохимические аспекты
триплетный переход (3]—>Л), обычно называемый межсистемным, может происходить у значительного числа возбужденных синглетных молекул. Триплетные состояния обычно гораздо более долгоживущие, чем исходные синглетные возбужденные состояния.
В некоторых случаях триплетное состояние, подобно возбужденному синглетному, возвращается в основное состояние (So) путем перехода, сопровождающегося излучением энергии (Т]—*-30), правда, вероятность этого процесса мала. Поскольку изменение энергии при таком переходе невелико, испускаемый свет имеет значительно большую длину волны как по сравнению с поглощенным, так и по сравнению со светом, испускаемым в виде флуоресценции; такое выделение энергии называется фосфоресценцией. Поскольку переход 1\—>30 имеет низкую вероятность и триплетное состояние может быть долгоживущим, фосфоресценция может продолжаться в течение нескольких секунд, т. е. значительно дольше, чем флуоресценция, которая обыкновенно протекает в течение 10~9—10 7 с после исходного поглощения света.
В биологических системах потеря избытка энергии в результате процессов, не сопровождающихся испусканием излучения, имеет особое значение. Избыток энергии может быть перенесен как от молекул в синглетном возбужденном состоянии 3], так и от молекул в более долгоживущем триплетном состоянии Т\ на другие близко расположенные молекулы и может использоваться для осуществления химических реакций. Именно такие процессы, не сопровождающиеся излучением или испусканием света, обусловливают превращение поглощенного света в химическую энергию при фотосинтезе, а также множество других важных реакций в биологических тканях (гл. 9—11).
1.5. Спектроскопические методы исследования природных пигментов
Из приведенного выше краткого обсуждения ясно, что при изучении природных пигментов поглощение света имеет фундаментальное значение. Спектроскопия электронного поглощения, с помощью которой регистрируют поглощение УФ-и видимого света, является основным спектроскопическим методом, применяющимся как для выявления свойств пигментов, так и для их количественного анализа. Однако специфические свойства пигментов в отношении поглощения света позволяют исследовать их и другими методами, главным образом резонансной рамановской спектроскопией и методом кругового ди-хпоизма. Так же как и при изучении других органических мо
Гл. 1. Свет и цвет
25
лекул, чрезвычайно полезными могут оказаться и методы инфракрасной (ПК) спектроскопии, ядерного магнитного резонанса (ЯМР) и масс-спектрометрии.
1.5.1. Спектроскопия поглощения видимого света
Природные пигменты по приведенному выше определению поглощают свет в видимом диапазоне спектра электромагнитного излучения, т. е. между длинами волн 380 и 750 нм. Поэтому их спектр поглощения видимого света имеет по крайней мере один максимум поглощения при длине волны (Хтах), характерной для хромофора молекулы пигмента. Это свойство, а также общая картина спектра дают полную информацию о молекулярной структуре и обычно используются при первых попытках идентифицировать пигмент. Положение Хтах сильно зависит от используемого растворителя, а у некоторых групп пигментов и от величины pH. На спектры поглощения пигментов in vivo часто влияет ближайшее микроокружение молекулы.
Подробно свойства спектров поглощения света различными группами пигментов, а также некоторыми индивидуальными пигментами будут приведены в соответствующих главах этой книги.
При исследовании функционирования пигментов применяют очень сложные модификации основного спектроскопического метода измерения поглощения света. Такие модификации позволяют изучать очень быстро протекающие процессы (в течение пико- или наносекунд). Исследуемую систему периодически освещают короткими интенсивными вспышками света и затем регистрируют изменения в спектре поглощения. Подобные методы позволили получить очень ценную информацию при исследовании первичных реакций фотосинтеза.
1.5.2. Количественный спектрофотометрический анализ
Спектры поглощения света чрезвычайно ценны также для точного, чувствительного и воспроизводимого количественного анализа пигментов. Интенсивность полосы поглощения при какой-либо длине волны регистрируют экспериментально как абсорбцию, экстинкцию, поглощение, или оптическую плотность раствора. Она прямо пропорциональна как концентрации пигмента в растворе, так и расстоянию, проходимому светом через раствор (законы Ламберта — Бэра).
При таком анализе используются два коэффициента. Коэффициент молярного поглощения (или экстинкции) определяется как поглощение света 1 М раствором вещества при длине
26
Часть I. Химические и биохимические аспекты
светового пути через раствор 1 см. Коэффициент удельного поглощения (или экстинкции) А1см1% или (Eicm1 )—это поглощение света 1%-ным (вес/объем) раствором вещества при длине светового пути 1 см. Для большинства групп природных пигментов существуют справочные таблицы этих коэффициентов.
Зная стандартный коэффициент поглощения, концентрацию любого раствора можно определить по величине его поглощения. Так, количество х г пигмента в у мл раствора находят по формуле
х = (Аху)/(А>%1см-100), где А — измеренная величина поглощения света раствором.
1.5.3. Дифференциальные спектры
Два образца одного и того же вещества, находящиеся в разных условиях, могут иметь несколько разные максимумы поглощения, а также несколько разные интенсивности поглощения, но эта разница столь мала, что ее трудно заметить при изучении этих спектров по отдельности. Однако вариации в этих величинах гораздо легче уловить, если один из образцов использовать в качестве стандарта, против которого снимается спектр другого образца. Получаемые при этом дифференциальные спектры являются очень высокочувствительным средством, с помощью которого обнаруживают небольшие изменения в светопоглощающих свойствах. Например, дифференциальные спектры «свет — темнота», в которых сравнивают поглощение света освещенным образцом и образцом, содержащимся в темноте, оказались чрезвычайно ценными при выявлении незначительных изменений этой величины, которые имеют место при освещении фотосинтезирующих тканей или частиц. Дифференциальные спектры окисленных и восстановленных форм были использованы для получения информации об участии цитохромов в цепи переноса электронов и об окислительно-восстановительном состоянии отдельных цитохромов в определенных условиях. С помощью этого основного метода и многих его изощренных модификаций мы узнали очень много нового о физических состояниях пигментов и их функционировании в фотосинтезе и транспорте электронов.
1.5.4. Рамановская спектроскопия
С помощью рамановской спектроскопии регистрируют изменения колебательной и вращательной энергии, причем для возбуждения таких изменений используют поглощение УФ- и
Гл. 1. Свет и цвет
27
видимого света. Когда монохроматический свет проходит через образец, некоторое количество света рассеивается под прямым углом к падающему лучу. При изучении этого процесса было обнаружено, что длина волны рассеянного света отличается от длины волны падающего света, поскольку в колебательной и вращательной энергии молекул за то короткое время, в продолжение которого фотоны падающего света «улавливаются» молекулами образца, происходят определенные изменения. В силу этого величины длин волн соответствуют поглощению или испусканию ИК-излучения. Получаемый при этом спектр содержит ряд полос поглощения (рамановских линий), каждая из которых соответствует отдельному типу колебаний в молекуле, например колебания валентной связи С = С обусловливают полосу поглощения при 1500 см"1. Важно, однако, что ИК-поглощение и рамановские спектры никогда не бывают идентичными. Различия между ними могут давать ценную информацию о молекулярной симметрии, так как симметричная молекула или колебание не дает полосы в ИК-спектре поглощения, но может давать сильную рамановскую полосу.
При работе с пигментами обычно применяется резонансная рамановская спектроскопия. Когда длина волны падающего, или возбуждающего, света приближается к той, при которой происходит максимальное поглощение света образцом, улавливание кванта света становится гораздо более вероятным. Поэтому рассеяние света значительно увеличивается, а интенсивность рамановских линий сильно возрастает. В образце, содержащем смесь соединений, резонансное усиление регистрируется только для тех рамановских линий, которые обусловлены колебаниями молекул, возбужденных падающим УФ- или видимым светом. При этом получают информацию об определенных молекулах, поглощающих свет; другие молекулы, которые не поглощают свет возбуждающей длины волны, не дают резонансно-усиленных рамановских линий. Резонансный рамановский метод, таким образом, особенно ценен для исследования пигментов in situ. Пигменты, находящиеся в панцире, коже и т. п., могут быть обнаружены и количественно изучены с помощью этого метода без предварительной экстракции из ткани и очистки от примесей.
Другой областью применения этого, метода является исследование взаимодействий пигмент (хромофор) — белок, поскольку в этом случае метод позволяет получить избирательную информацию о хромофорной молекуле без разрушения комплекса. В частности, можно обнаружить переход хромофорной молекулы в основное состояние, который происходит при связывании с белком или в результате других изменений в ее микроокружении. Таким образом можно изучать свойства хромо
28
Часть I. Химические и биохимические аспекты
форов в их природном окружении. Этот подход оказался чрезвычайно полезным при изучении связывания ретинальдегида с опсином в зрительных пигментах (гл. 9).
1.5.5. Линейный дихроизм
В предыдущих разделах все рассуждения о поглощении света относились к естественному неполяризованному свету. Однако не менее ценную информацию можно извлечь также из феноменов, связанных с поглощением поляризованного света.
Согласно электромагнитной теории, световая волна состоит из электрических и магнитных векторных компонентов, которые находятся под прямыми углами друг к другу и к направлению распространения волны. Частота колебаний является частотой излучения. Свет, испускаемый природным источником или обычной лампой накаливания, неполяризован. Однако если его пропустить через поляризатор, то пройдет лишь свет с определенной ориентацией электрических и магнитных векторов. Пигмент, у которого хромофорные группы расположены беспорядочно, будет поглощать свет определенной длины волны независимо от того, поляризован свет или нет. Если же благодаря упорядоченной ориентации хромофоров в природной структуре имеет место асимметрия, то поглощение будет зависеть от плоскости поляризации луча света. Существуют две взаимно перпендикулярные плоскости поляризации, характеризующиеся соответственно максимальным и минимальным поглощением, для которых можно получить дихроичное отношение. Этот феномен лежит в основе линейного дихроизма. Исследования с помощью линейного дихроизма оказались очень полезными при изучении ориентации пигментных хромофоров в упорядоченных биологических структурах, особенно в фотосинтетических пигмент-белковых комплексах.
1.5.6. Круговой дихроизм
Родственный линейному дихроизму круговой дихроизм (КД) позволяет не только определять асимметрию, уже существующую в молекуле пигмента, но и обнаруживать асимметрию, индуцированную в хромофоре, например при связывании пигмента с белком. Если совместить два плоскополяризованных луча с плоскостями поляризации под прямым углом друг к другу, имеющих одну и ту же длину волны и амплитуду, но различающихся по фазе на л/2 (или на Зл/2, для того чтобы вызвать вращение в обратном направлении), то образующийся в результате световой луч приобретет круговую поляризацию с направлением вращения плоскости поляризации вправо или
Гл. 1. Свет и цвет
29
влево. Асимметричный, или оптически активный, пигмент поглощает право- или левополяризованный свет неодинаково. Эффект кругового дихроизма изменяется с изменением длины волны, так что может быть получен спектр КД. Круговой дихроизм наблюдается лишь в тех. областях спектра, в которых имеются полосы поглощения. В некотором роде сходную информацию об оптической активности молекул пигментов дает метод дисперсии оптического вращения (ДОВ), который позволяет измерить изменения вращения плоскости поляризации света при изменении длины его волны. Эти методы особенно полезны в органической химии при определении относительной и абсолютной конфигурации хиральных молекул.
Круговой дихроизм, однако, используют не только при определении оптической активности хиральных молекул. Его успешно применяют при выявлении асимметрии, индуцируемой в-результате включения обычно симметричной или нехиральной молекулы в организованную структуру, например при асимметричном связывании с белком. Индуцированная асимметрия может приводить к различному поглощению право- и левовращающего поляризованного света, т. е. в результате КД можно наблюдать в области главных полос поглощения хромофора. При этом удается выявлять различные формы пигмента in situ и получать сведения об искажениях конформации молекулы хромофора, вызванных связыванием с другими молекулами или обусловленных структурной организацией.
1.6. Значение окраски в природе
Многие природные пигменты принимают участие в важных метаболических или физиологических процессах. Особенно детально изучено функционирование хлорофилла и других пигментов в фотосинтезе и роль гемоглобина как переносчика кислорода. Во многих случаях, однако, единственной известной функцией пигмента является то, что он придает окраску организму или той его части, которая содержит данный пигмент.
В растительном царстве ярко окрашенные цветки и плоды,, контрастно выделяющиеся на общем фоне зеленой окраски листвы, привлекают внимание насекомых и других животных. Благодаря этому растения извлекают для себя пользу при опылении и распространении семян. В животном же царстве окраска, обусловленная пигментами или структурными особенностями, может играть как сигнальную роль, так и маскировочную.
Более подробно значение окраски в природе мы обсудим в гл. 8.
30
Часть I. Химические и биохимические аспекты
1.7. Заключение и комментарии
Любые попытки объяснить то многообразие способов, >с помощью которых живые организмы реагируют на свет или используют его, требуют понимания механизмов взаимодействия между светом и молекулами. Молекулы, обладающие особым свойством поглощать свет в видимой части спектра, являются природными пигментами. Без пигментов и без упомянутых выше взаимодействий та жизнь, какой мы ее знаем, была бы невозможна. Цвет в природе играет большую роль. Эта глава «мела своей целью дать очень краткое описание физических основ цвета, а также физических и химических способов, с помощью которых может достигаться и обнаруживаться окраска в природе.
Можно сравнительно просто определить, какую природу — химическую (т. е. обусловленную пигментом) или физическую (обусловленную структурой) — имеет данный цветовой эффект. Идентификация и характеристика пигмента обычно является стандартной задачей в органической химии. В последующих главах первой части этой книги приведены основные химические свойства наиболее крупных групп природных пигментов. Гораздо более сложной является проблема взаимодействия молекул пигмента с их ближайшим микроокружением, напри-ме с белками в мембранах. Применение сложных современных физико-химических методов, таких, как резонансная рамановская спектроскопия, линейный и круговой дихроизм и ядерный магнитный резонанс, позволяет решить эту проблему, а также получить информацию о молекулярных изменениях, которые претерпевают некоторые пигменты при их функционировании. Вторая часть этой книги представляет собой обзор функций природных пигментов как в роли окрашивающих агентов, так я в роли участников гораздо более сложных процессов, таких, как фотосинтез, зрение и другие фотореакции, которые могут протекать за время порядка пикосекунд.
Если об окраске, обусловленной пигментами, известно очень много, то примеры детального изучения окраски, обусловленной структурой, немногочисленны. Вместе с тем систематическое исследование микроскопических структур, участвующих в образовании структурной окраски, должно быть очень увлекательно и информативно.
1.8. Рекомендуемая литература
Большинство читателей книг по биохимии, подобных этой, были бы удовлетворены общим описанием светопоглощающих свойств молекул, которое можно найти в учебниках по
Гл. 1. Свет и цвет
31
органической химии и в монографиях по фотобиологии, например в двухтомнике Клейтона (Clayton, 1971). Не исключено,, однако, что найдутся и такие, которые захотят более глубоко понять физические процессы и теоретические концепции, позволяющие более строго определять и интерпретировать эти светопоглощающие свойства. Им следует познакомиться с теоретической работой Маррелла (Murrell, 1963).
Есть много книг и обзоров, которые посвящены широкому кругу проблем химии, биохимии и биологии природных пигментов в целом и отдельных групп пигментов. В эту книгу включен материал лишь из небольшого их числа, прежде всего наиболее всеобъемлющие работы последних лет, в которых в свою очередь приведены ссылки на более старые издания. Если мы обратимся к некоторым старым работам, читающимся с огромным интересом, то мы как бы вновь пройдем тот путь, по которому шло развитие исследований природных пигментов. Многие из первых работ по растительным пигментам были выполнены химиками, однако работы по окраске животных явились-продолжением описательных работ классических натуралистов. Две статьи Мак-Мунна (MacMunn, 1883 и 1890) и книга Нью-бигина (Newbigin, 1898) содержат обширные обзоры ранних работ по природной окраске у животных. Рост количества знаний о химии пигментов животных позволил Дэнису Фоксу (Denis Fox, 1953) написать исчерпывающую монографию, посвященную окраске животных. Эта книга недавно (в 1976 г.) была переработана; к ней были добавлены приложения, и она стала очень полезным источником информации по распространению-пигментов у животных. В третьей книге этого же автора, рассчитанной на неспециалистов (Fox, 1979), читатель найдет увлекательное описание окраски в природе. Очень популярная книга Фокса и Веверса (Fox, Vevers, 1960) также дает интересное, широкое описание предмета. Очень много информации о физиологических аспектах «зоохромов» можно почерпнуть из-основательного труда Нидхама (Needham, 1974). Более ограниченной по охвату, но несомненно содержащей полезный материал является монография Вюйома (Vuillaume, 1969) о пигментах у беспозвоночных животных.
Особенно полезным источником информации о пигментах растений служит двухтомник под редакцией Гудвина (Goodwin„ 1976), где содержится подробное описание химии, распространения, биосинтеза и функций главных классов растительных пигментов, а также имеются чрезвычайно ценные главы об экспериментальных методах, используемых для их изучения. Второе издание книги под редакцией Цзигана (Czygan, 1980) также в общем посвящено пигментам растений. Другие книги и статьи, посвященные более специальным аспектам, например
32
Часть 1. Химические и биохимические аспекты
каждой отдельной группе пигментов, будут отмечены в последующих главах.
Окраска, обусловленная структурой, изучена не столь хорошо, как окраска, обусловленная пигментами. В книгах Фокса (Fox, 1976) и Фокса и Веверса (Fox, Vevers, 1960) в общих чертах даны главные характеристики структурной окраски и •описаны физические явления, которые ее вызывают. Монография Симона (Simon, 1971) также содержит введение в эту проблему; ей же посвящены несколько подробных статей, вышедших в последнее время, например статья Хаксли (Huxley, 1975). Однако для правильного понимания физических явлений, которые при этом затрагиваются, читателю следует воспользоваться учебником по физике или по оптике.
В настоящее время спектроскопические методы представляют собой существенную часть обучения химиков-органиков; этим методам посвящен ряд учебников. К примеру, учебник Банвелла (Banwell, 1972) включает разделы по электронному поглощению и рамановской спектроскопии. Библиотечка по органической химии должна включать и другие полезные книги. Для более детального ознакомления с методом кругового дихроизма следует обратиться к монографии Снацке (Snatzke, 1967), а с методом резонансной рамановской спектроскопии биологических молекул — к обзорам Варшела (Warshel, 1977) и Кэри (Сагеу, 1978). Юнге (Junge, 1976) дает превосходное описание кинетической флеш-спектроскопии, главным образом в применении к фотосинтезу. Подробное описание спектроскопических свойств различных групп пигментов можно найти в работах, цитируемых в последующих главах; в них же рассматривается применение спектроскопических методов для изучения пигментов.
1.9. Дополнительная литература
Banwell С. N. (1972). Fundamentals of molecular spectroscopy, 2nd edition, London, McGraw-Hill.
Carey P. R. (1978). Resonance Raman spectroscopy. In: Biochemistry and biology, Quart. Rev. Biophys., 11, 309.
Clayton R. K. (1971). Light and living matter, vols 1 and 2, New York, McGraw-Hill.
Czygan F.-C. (ed.) (1980). Pigments in plants, 2nd Edition, Stuttgart and New York, Qustav Fischer.
Fox D. L. (1953). Animal biochromes and structural colours, Cambridge University Press.
Fox D. L. (1976). Animal biochromes and structural colors, 2nd edition, Berkeley, Los Angeles and London, University of California Press.
Fox D. L. (1979). Biochromy: natural coloration of living things, Berkeley, Los Angeles and London, University of California Press.
Fox H. M., Vevers G. (1960). The nature of animal colours, London, Sidgwick and Jackson.
Гл. 1. Свет и цвет
33
Goodwin Т. W. (ed.) (1976). Chemistry and biochemistry of plant pigments, 2nd edition, vols 1 and 2, London, New York and San Francisco, Academic Press.
Huxley J. (1975). The basis of structural colour variation in two species of Papilio, J. Entomol., 50A, 9.
Junge IF. (1976). Flash kinetic spectrophotometry in the study of plant pigments. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 2, ed. T. W. Goodwin, p. 233, London, New York and San Francisco, Academic Press.
MacMunn C. A. (1883). Studies on animal chromatology, Proc. Birmingham Nat. Hist. Soc., 3, 351.
MacMunn C. A. (1890). Contribution to animal chromatology, Quart. J. Microsc. Sci., 30, 51.
Murrell J. N. (1963). The theory of the electronic spectra of organic molecules, London, Mathuen.
Needham A. E. (1974). The significance of zoochromes, Berlin, Heidelberg and New York, Springer-Verlag.
Newbigin M. I. (1898). Colour in nature. London, John Murray.
Simon H. (1971). The splendor of iridescence: structural colors in the animal world, New York, Dodd, Mead.
Snatzke G. (ed.) (1967). Optical rotatory dispersion and circular dichroism in organic chemistry, London, Heyden.
Vulllaume M. (1969). Les pigments des invertebres, Paris, Masson.
Warshel A. (1977). Interpretation of resonance Raman spectra of biological molecules, Ann. Rev. Biophys. Bioeng., 6, 273.
3—84
Глава 2
Каротиноиды
2.1. Введение
Из всех классов природных пигментов каротиноиды, по-видимому, наиболее широко распространены и, несомненно, принадлежат к числу наиболее важных соединений. Они обнаружены у всех представителей растительного царства как в фотосинтезирующих, так и в нефотосинтезирующих тканях, а также часто встречаются у микроорганизмов. Они полностью или частично обусловливают окраску многих животных, особенно птиц, рыб и насекомых. Каротиноиды и их производные имеют большое значение для животных, поскольку они являются основой зрительных пигментов, ответственных за восприятие света и различение цветов.
2.2. Структура и номенклатура
2.2.1. Основная структура
Практически все каротиноиды представляют собой или тетратерпены, т. е. С^-соединения, углеродный скелет которых построен из восьми Cs-изопреновых фрагментов (2.1), или их производные. Основная структура молекулы симметрична и состоит из двух Сго-половин; примером такого соединения может служить ликопин (2.2) — красный пигмент томатов.
С I
С (S
(2.1) Изопреновая единица
(2.2) Ликопин
Гл. 2. Каротиноиды
35
Основная структура иногда бывает модифицирована: на одном или на обоих концах молекулы может присутствовать шестичленное (или иногда пятичленное) кольцо, как, например, у р-каротина (2.3). Последний является оранжевым пигментом корней моркови и обычно рассматривается как «прародитель» для всей группы каротиноидов.
даротиноидные углеводороды известны под названием каротинов. Все их производные с кислородсодержащими функциональными группами именуются ксантофиллами. В каротиноидах обнаруживается большинство обычных кислородсодержащих функциональных групп, например гидрокси-, метокси-, эпокси-, кето-, альдегидная и карбоксильная группы; при этом соответствующие группы могут быть этерифицированы или гликозилированы. Заместители обычно локализованы у Сэ-кон-цевых групп (см. ниже). До настоящего времени в природе не найдены каротиноиды, включающие азот-, серу- или галогенсодержащие заместители.
2.2.2. Номенклатура
Идентифицировано и охарактеризовано около 500 природных каротиноидов. Многие из них, особенно наиболее важные и известные уже в течение многих лет, носят общепринятые тривиальные названия. Обычно такие названия происходят от биологического источника, из которого эти каротиноиды были впервые выделены. В последние годы для внесения ясности в случайную и часто запутанную тривиальную номенклатуру была введена новая полусистематическая номенклатура.
В этой книге хорошо известные каротиноиды обычно будут называться своими тривиальными названиями, но в соответствии с современной практикой при первом упоминании каждому каротиноиду будет дано также полусистематическое наименование.
2.2.3. Правила IUPAC для номенклатуры каротиноидов
Все специальные названия каротиноидов основаны на названии «каротин», соответствующем структуре и порядку нумерации углеродных атомов, показанным на рис. 2.1, на 3*
36
Часть I. Химические и биохимические аспекты
котором также приведен ряд возможных структур концевой Cg-группы. Наименование того или иного каротиноидного углеводорода составляется путем добавления в виде приставки к слову «каротин» двух греческих букв, характеризующих две концевые Cg-группировки. Греческие приставки помещают в алфавитном порядке: р (бета), у (гамма), е (эпсилон), х (каппа), Ф (Фи), X (хи), ф (пси).
Типы С9 концевых групп
Рис. 2.1. Основная структура каротиноидов; типы С9-концевых группы и схема нумерации согласно правилам IUPAC.
Группировки заместителей обозначаются приставкой или суффиксом согласно обычным правилам органической химии.
Система нумерации показана на рис. 2.1. Если две концевые группы различны, то не помеченные штрихом номера даются атомам С той группы, которая обозначена (греческой буквой) в названии соединения первой. Формула должна быть изображена таким образом, чтобы С-атомы, обозначенные без штрихов, были расположены с левой стороны.
2.2.4. Некоторые примеры структуры каротиноидов и их номенклатуры
Каротины. Наиболее известный из всех каротиноидов р-каротин (2.3) обозначается по системе ШРАС как р,р-каро-тин. Его изомер а-каротин (2.4) стал называться р,е-каротином,
Гл. 2. Каротиноиды
37
а ациклический каротиноид ликопин (2.2) получил название ф,ф-каротина.
Каротиноидные углеводороды, отличающиеся от исходных каротинов уровнем восстановления, являются важными биосинтетическими промежуточными продуктами. Их название образуется добавлением к исходному названию приставки «де-
гидро» или «гидро» (с соответствующим коэффициентом), а также указанием номеров атомов углерода, к которым присоединены или у которых отняты водородные атомы. Примером может служить р-зеакаротин (2.5), имеющий полуспстематиче-ское название 7',8'-дигидро-р,г|:-каротин.
(2.5) З-Зеакаротин
Ксантофиллы. Все кислородсодержащие производные каротиноидных углеводородов в настоящее время называют ксантофиллами, хотя в прошлом название «ксантофилл» использовалось только для обозначения каротинолов (каротиноидов, содержащих спиртовые группы) и даже одного-едпнственного соединения — лютеина (см. ниже).
В этом разделе будет приведено лишь несколько примеров строения молекулы и номенклатуры некоторых наиболее важных из сотен встречающихся в природе ксантофиллов. Из всех ксантофиллов наиболее важными и наиболее распространенными янляются каротинолы. Самые широкораспространениые и известные из них — это пигменты листьев — лютеин (2.6) и зе-аксантин (2.7), которые являются дигидроксипроизводными а-каротина и p-каротина соответственно и называются по новой системе р,8-каротин,-3,3'-диолом и р,р-каротин-3,3'-диолом. Известны также ксантофиллы с гидроксигруппами в других положениях молекулы, например при С-2 и С-4 в кольце, а ациклические соединения с третичными гидроксигруппами при С-1 широко распространены у некоторых бактерий (разд. 2.4.4).
38
Часть I. Химические и биохимические аспекты
Циклические каротиноиды могут иметь эпоксигруппы при С-5,6, например в пигменте хлоропластов, виолаксантине [5,6, 5',6'-диэпокси-5,6/5,6'-тетрагидро-|3,|3-каротин-3,3'-диол (2.8)].
Кетогруппы в циклических каротиноидах обычно локализованы при С-4 и находятся в сопряжении с полиеновой системой. Примером такого соединения является астаксантин [3,3'-дигидрокси-|3,р-каротин-4,4'-дион (2.9)]—каротиноид, характерный для многих морских животных.
(2.9) Астаксантин
Со многими другими примерами структуры и номенклатуры ксантофиллов мы встретимся в последующих разделах этой главы.
Ретро-каротиноиды. Термин ретро-каротиноид используется для описания структуры, в которой имеет место формальный сдвиг на одну позицию одинарных и двойных связей в сопряженной полиеновой системе. Примером природного ретро-ка
Гл. 2. Каротиноиды
39
ротиноида может служить родоксантин [4',5'-дидегидро-4,5/-ретро-р,р-каротин-3,3'-дион (2.10)], который придает красный цвет присемянникам («ягодам») тисса.
Примечание. Согласно новой номенклатуре, в паре цифр, предшествующей приставке «ретро», первая цифра означает-атом углерода, который формально потерял протон, а вторая — углеродный атом, который его приобрел.
Гомо-, апо- и нор-каротиноиды. Хотя большинство каротиноидов представляют собой С40-соединения, некоторые могут иметь больше или меньше, чем 40, атомов углерода. С45 и С50-каротиноиды, которые найдены у некоторых бактерий, часто называют высшими или гомо-каротиноидами. Они представля-
ют собой нормальную С40-каротиноидную молекулу с одним или двумя Сэ-заместителями при С-2, С-2'. Они могут быть циклическими или ациклическими, как, например, декапреноксантин [2,2'-бис(4-гидрокси-3-метилбут-2-енил)-е,е-каротин (2.11)] и бактериоруберин [2,2'-бис (З-гидрокси-З-метилбутил) -3,4,3',4'-
тетрадегидро-1,2,1',2'-тетрагидро-ф,ф-каротин-1, l'-диол (2.12) ].
Каротиноиды с меньшим, чем 40, числом атомов углерода подразделяются на две категории. Молекулы, в которых С40-уг-
СН2ОН
40
Часть I. Химические и биохимические аспекты.
леродный скелет укорочен формальным удалением фрагментов с одного или обоих концов, называются апо-(или диапо-) каротиноидами. Например, Сзо-соединение З’Цитраурин [3-гидрокси-8'-апо-р-каротин-8'-аль (2.13)]. Этот и близкие к нему апо-ка-ротиноиды обусловливают окраску апельсинов и плодов других цитрусовых.
(2.13) (З-Цитраурин
Нор-каротиноид — это такой каротиноид, в котором отсутствует один или небольшая группа атомов С не на концах молекулы, а в ее внутренней части. Например, актиния (Actinia equina) содержит заметное количество пурпурного пигмента актиниоэритрина, который лишен С-2 и С-2' и поэтому называется 3,3'-дигидрокси-2,2'-динор-р,р-каротин-4,4'-дион-3,3'-ди-ацилатом (2.14).
2.2.5. Стереохимия
Геометрическая изомерия. Полиеновая система каротиноидов предоставляет широкий простор для существования большого числа геометрических (цис-транс) -изомеров. Так, ликопин (2.2)—симметричная молекула с И сопряженными двойными связями — теоретически способен существовать в 1056 формах, а для несимметричных каротиноидов возможно наличие еще большего числа изомеров. К счастью, для практической реализации многих потенциальных изомеров существуют пространственные препятствия, и поэтому они образуются с трудом. Тем не менее имеется 72 возможных стерически «не-запрещенных» изомера ликопина (о которых не следует забывать) (рис. 2.2). По соглашению термины цис- и транс- в применении к каротиноидам используются для обозначения относительного расположения тех заместителей при двойной связи, которые образуют часть главной цепи углеродных атомов.
Гл. 2. Каротиноиды
41
В природе большинство каротиноидов существует исключительно или главным образом в полностью транс- (полностью £) форме. Имеется, однако, несколько важных исключений. Фитоин (7,8,11,12,7',8\11\12'-октагидро-ф,ф-каротин), обычно рассматриваемый в качестве первого С^-углеводородного промежуточного продукта биосинтеза каротиноидов (разд. 2.6.3), как
Затрудненные Незатрудненные
Рис. 2.2. Стерически «затрудненные» и стерически «незатрудненные» цис-двойные связи.
правило, выделяют в виде 15-цис(2)-изомера (2.15). Возможно, что самым замечательным zpc-каротиноидом является проликопин — поли-^ис-изомер ликопина, встречающийся в природе у ряда растений. Структура проликопина недавно была установлена; было показано, что он представляет собой 7,9,7',9'-тетра^ис-ликопин (2.16).
В общем же следовые количества zpc-изомеров, присутствующие в экстрактах природных объектов, обычно рассматриваются как артефакты, образующиеся в результате стерических изменений природных полностью тра«с-каротиноидов.
(2.16) Проликопин
42
Часть I. Химические и биохимические аспекты
Одинарные связи, входящие в состав полиенового хромофора, имеют конформацию s-транс. В циклических каротиноидах связь С-6,7 обычно принимает з-^ис-конформацию как в кристаллическом состоянии, так и в растворе. Другие детали конформации каротиноидов будут обсуждаться позже в связи с их светопоглощающими свойствами (разд. 2.3.3).
Абсолютная конфигурация. Многие органические молекулы являются хиральными. Это значит, что они существуют только в виде одного из двух возможных энантиомеров — стереоизоме-
(2.18) (ЗЯ)-З-Гидрокси-/^-кольцо
(2. 1 7) (6Я) е Кольцо
(2.19) (ЗЯ)-Концевая группа (2.20} (3S)-Концевая группа
астаксантина (2.9) астаксантина (2.9)
ров, несовместимых со своим зеркальным отражением. Наиболее распространенный тип хиральности наблюдается при наличии асимметрического атома углерода, который теоретически может существовать в двух пространственных конфигурациях. Хиральность часто наблюдается у каротиноидов, и обычно она обусловлена присутствием асимметрического атома углерода в молекуле. Примером хиральных центров является атом С-6 в s-кольце каротиноидов (2.17) и атом С-3 в обычных циклических каротин-3-олах (2.18).
Абсолютная конфигурация многих хиральных каротиноидов была определена главным образом с помощью оптических методов [дисперсии оптического вращения (ДОВ), кругового дихроизма (КД)] и ядерного магнитного резонанса (ЯМР). Недавно было обнаружено, что у разных живых организмов встречаются различные оптические изомеры каротиноидов. Так дрожжи Phaffia rhodozyma образуют (ЗЯ, 3'R)-астаксантин (2.19), в то время как омар накапливает преимущественно (3S, 3'5)-изомер (2.20) наряду с (ЗЯ, 3'R)- и мезо-(ЗР, 3'S)-формами в меньших количествах.
Гл. 2. Каротиноиды
43
2.3. Свойства
2.3.1. Общие физические свойства
Каротиноиды являются липидами. Они растворимы в органических растворителях и могут быть экстрагированы из природных объектов полярными растворителями, такими, как ацетон и спирты. Даже ксантофиллы с четырьмя и более гидроксигруппами в молекуле практически нерастворимы в воде. Однако они становятся растворимыми после гликозилирования или образования комплексов с белками. In vivo каротиноиды^ обычно локализованы в липофильных, гидрофобных районах клетки, таких, как липидные глобулы, кристаллические структуры и мембраны (в последних они находятся в комплексе с белками).
За исключением таких промежуточных продуктов в биосин- , тезе, как фитоин, фитофлуин и обычно ^-каротин, каротиноиды при комнатной температуре представляют собой твердые вещества. Большинство из них может быть получено в кристаллическом виде при использовании соответствующих смесей растворителей.
2.3.2. Стабильность
Выделенные каротиноиды как без растворителя, так и в растворе очень чувствительны к свету и теплу (которые вызывают чмс-трамс-изомеризацию), к кислотам (которые так
Рис. 2.3. Катализируемая кислотой изомеризация 5,6-эпоксикаротиноида в 5,8-фур аноидный оксид.
же вызывают цмс-трамс-изомеризацию и особенно превращение 5,6-эпоксидов в 5,8-фураноидные оксиды; рис. 2.3) и в некоторых случаях к основаниям (которые вызывают аутоокисление З-гидрокси-4-кето-концевых групп, как, например, у астаксантина; рис. 2.4). Система сопряженных двойных связей делает каротиноиды чрезвычайно подверженными окислительному обесцвечиванию кислородом воздуха.
44
Часть I. Химические и биохимические аспекты
In vivo каротиноиды обычно являются составной частью структуры клетки или органеллы и находятся в ассоциации или с белками, или с другими клеточными липидами. В этих условиях каротиноиды стабилизированы и защищены от перечисленных выше вредных влияний.
Рис. 2.4. Окисление (З-гидрокси-4-кето) -концевой группы каротиноидов.
In vitro каротинопротеины, особенно астаксантин-белковые комплексы беспозвоночных (разд. 2.5), также значительно более стабильны, чем свободные каротиноиды.
2.3.3. Поглощение света
Хромофор, ответственный за поглощение каротиноидами видимого света, представляет собой систему сопряженных двойных связей (гл. 1). С увеличением длины полиеновой л-электронной системы стабильность первого возбужденного состояния повышается; при этом электронное возбуждение происходит легче, оно требует меньше энергии и осуществляется светом с большей длиной волны.
Такой возрастающий батохромный эффект (сдвиг в длинноволновую сторону) может быть проиллюстрирован спектрами поглощения биосинтетического ряда (разд. 2.6.4) ациклических
(2.21) Фитофлуин
каротиноидов с возрастающей длиной хромофора (рис. 2.5). Так, фитоин (2.15) [3 сопряженные двойные связи (с. д. с.)] и фитофлуин [7,8,11,12,7',8'-гексагидро-ф,ф-каротин (2.21)] (5 с. д. с.), имеющие Хтах при 275, 285, 296 и 331, 348, 367 нм соответственно, бесцветны; g-каротин [7,8,7/,8/-тетрагидро-ф,ф-каротин (2.22)] (7 с.д. с.) имеет слабое поглощение в голубом участке спектра (Хтах = 378, 400 и 425 нм) и потому выглядит слегка желтоватым, а нейроспорин [7,8-дигидро-ф,ф-каротин
Гл. 2. Каротиноиды
.45
Длина волны, нм
Рис. 2.5. Спектры поглощения света ациклическими каротиноидами с увеличивающейся длиной хромофора. I— фитоин (2.15), II — фитофлуин (2.21), III — ^-каротин (2.22), IV—нейроспорин (2.23), V — ликопин (2.2) (в пет-ролейном эфире).
(2.23)] (9 с.д.с.) и ликопин (2.2) (И с.д.с.) сильно поглощают в видимом диапазоне при 414, 439, 467 и 444, 470, 502 нм соответственно и обладают характерной желтой и оранжевой окраской. Все эти соединения имеют типичный трехпиковый каротиноидный спектр поглощения с четко выраженными максимумами и минимумами.
(2.23) Нейроспорин
На максимумы поглощения, а иногда на степень выявления тонкой структуры спектра большое влияние оказывает используемый растворитель. Максимумы поглощения наблюдаются при большей длине волны, если спектры определяют в ароматических или галогенированных растворителях, а также в CS2, чем в тех случаях, когда в качестве растворителей используют петролейный эфир, гексан или этанол (рис. 2.6).
46
Часть 1. Химические и биохимические аспекты
При циклизации ликопина в е,е-каротин (2.24) или у,у-ка-ротин (2.25) из сопряженной системы удаляются две двойные связи, в результате чего спектры поглощения этих циклических каротиноидов очень сходны со спектром нейроспорина. В случае каротиноидов, имеющих p-кольцо, таких, как (3-каротин,
Длина волны, нм
Рис. 2.6. Влияние растворителя на спектр поглощения света типичного каротиноида ликопина (2.2). I — в петролейиом эфире или этаноле; II—в хлороформе или бензоле, III — в сероуглероде.
двойные связи внутри кольца сопряжены со связями главной полиеновой цепи. Однако из-за пространственных ограничений между метильными заместителями в кольце и главной полиеновой цепью молекула изгибается относительно одинарной связи С-6,7 таким образом, что л-орбиталь 5,6-двойной связи кольца не лежит в одной плоскости с л-электронной системой полиена. Наблюдающееся при этом уменьшение степени перекрывания
{2.25) у} у -Кароти!
Гл. 2. Каротиноиды
47
350 400 450 500 550
Длина волны, нм
Рис. 2.7. Влияние р-колец на спектры поглощения света каротиноидами.
I— р-каротин (2.3), II— у-каротии (2.78) и III — ликопин (2.2) (в петро-лейном эфире).
л-орбиталей означает, что эффективная длина хромофора меньше, чем полная длина системы из И сопряженных двойных связей, и, следовательно, максимум поглощения имеет место при более короткой длине волны, чем в случае ликопина. Изгиб молекулы приводит также к ослаблению тонкой структуры, т. е. к менее выраженным максимумам и минимумам в спектре. На рис. 2.7. сравниваются спектры ликопина, у-каротина (Р,ф-каротина) и р-каротина.
(2.26) Эхиненон
(2.27) КзНтаксантин
48
Часть I. Химические и биохимические аспекты
Влияние на тонкую структуру спектров еще более заметно у каротиноидов, содержащих в сопряжении с полиеновой системой карбонильную группу. Сопряженная группа С = О эффективно удлиняет хромофор так, что максимум поглощения сдвигается в более длинноволновую область, однако при этом
Длина волны, нм
Рис. 2.8. Влияние сопряженных карбонильных групп на спектры поглощения света каротиноидами (в петролейном эфире). I— (3-каротин (2.3), II— эхи-ненон (2.26) (одна группа С = О), III—кантаксантин (2.27; две группы С=О).
почти полностью утрачивается тонкая структура спектра. На рис. 2.8 сравниваются спектры p-каротина, эхиненона [р,р-ка-ротин-4-она (2.26)] и кантаксантина [|р,р-каротин-4,4'-диона (2.27)].
Другие заместители, например ОН-группа, обычно оказывают незначительное влияние на спектр поглощения либо не ока-
Рис. 2.9. Сравнение спектров ностью транс-ликопина (/)
Длина волны, нм поглощения света ( в петролейном эфире) пол-н поли-цнс-изомера проликопина (2.16; II).
Гл. 2, Каротиноиды 49
зывают его вовсе. Так, спектры (3-каротина, (3-криптоксантина [Р,(3-каротин-3-ола (2.28)], изокриптоксантина [р,(3-каротин-4-ола (2.29)], зеаксантина (2.7) и изозеаксантина [р,(3-каротин-4,4'-диола (2.30)] практически идентичны как по положению ^-тах, так и по форме.
Полоса поглощения цис-пзомеров менее интенсивна и сдвинута в более коротковолновую область, чем у соответствующих полностью транс-соединений (рис. 2.9). Это обусловлено иска-
4—«4
so
Часть 1. Химические и биохимические аспекты
Рис. 2.10. Спектроскопическая проба на сопряжение кетогрупп у каротиноидов. Спектры полощеиия света сняты в этаноле. I — кантаксантин (Рф-ка-ротин-4,4'-дион; 2,27); II — изозеаксантин (2.30), продукт восстановления кантаксантииа под действием NaBH<.
350 400 450 500
Длина волны,нм
Рис. 2.11. Спектроскопическая проба на 5,6-эпоксигруппы в циклических каротиноидах. Спектры поглощения света сняты в этаноле. I — диэпоксикароти-яноид виолаксантии (2.8); II — ауроксаитии (2.31), фураноидный оксид, образующийся в результате добавления капли разбавленной НС1.
_1
550
жением расположенной в одной плоскости полиеновой системы из-за поворота части молекулы вокруг одинарной связи, примыкающей к ^«с-двойной связи; при этом уменьшаются стери-ческие препятствия между двумя атомами водорода («незатрудненная щ/с-конфигурация») или между водородным атомом и метильной группой («затрудненная ^«с-конфигурация») (рис. 2.2).
Сдвиги максимума поглощения, происходящие в результате химических реакций, протекающих в очень маленьком объеме
Гл. 2. Каротиноиды
5р
в кювете спектрофотометра, служат очень полезными диагностическими критериями. Так, обработка такого кетокаротиноида, как кантаксантин (2.27), боргидридом натрия приводит к. гипсохромному сдвигу в спектре (т. е. к сдвигу в коротковолновую сторону) и к более четкому выявлению тонкой структуры,, поскольку кантаксантин восстанавливается до изозеаксантина (2.30) (рис. 2.10). Обработка 5,6-эпоксикаротиноидов типа виолаксантина (2.8) следовыми количествами кислот вызывает-
. Рис. 2.12. Спектры поглощения света каротинопротеина крустацианина из омара (/, водный раствор) и его свободной простетнческой группы — каротиноида астаксантина (2.19) (II, этанол).
спектральный сдвиг на 40 нм в коротковолновую область-спектра (на 20 нм для моноэпоксидов) из-за образования фу-раноидного оксида ауроксантина [б.в.б'.в'-диэпоксн-бДб'Х-тетрагидро-0,0-каротин-3,3'-диола (2.31)] (рис. 2.11).
In vivo каротиноиды имеют обычно максимумы поглощения при длинах волн примерно на 10 нм больших, чем в гексановом или этанольном растворе, поскольку в клетке они находятся в ассоциации с липидами или белками. Спектры поглощения каротиноидов in vivo часто напоминают спектры искусственно-полученных мицеллярных суспензий каротиноидов с другими липидами в водной среде.
Стехиометрические каротин-белковые комплексы, характерные для многих беспозвоночных морских животных (разд. 2.5), имеют очень большие сдвиги (например, на ~ 100 нм) максимумов поглощения и потому окрашены в пурпурный или голубой цвет (Хтах = 550—630 нм) в отличие от желто-оранжевых свободных каротиноидов (Z.max = 470 нм) (рис. 2.12). Никакого удовлетворительного объяснения этому феномену до сих пор не найдено.
4»
52 .. Часть I. Химические и биохимические аспекты
2.4. Распространение в природе
Каротиноиды представляют собой наиболее широко распространенный класс природных пигментов. Они обнаружены повсеместно в растительном царстве, а также обычно встречаются у животных и микроорганизмов.
2.4.1. Высшие растения
Фотосинтезирующие ткани. Все зеленые ткани высших растений содержат одни и те же главные каротиноиды, которые локализованы (возможно, исключительно) в хлоропластах. К ним принадлежат 0-каротин (2.3), лютеин (2.6), виолаксан-тин (2.8) и неоксантин [б'.б'-эпокси-б^-дидегидро-ЗДб'.б'-тет-рагидро-0,0-каротин-3,5,3'-триол (2..32)]. Они часто содержатся в хлоропластах вместе с меньшими количествами а-каротина (2.4), зеаксантина (2.7), 0-криптоксантина (2.28) и антераксантина [5,6-эпокси-5,6-дигидро-0,0-каротин-3,3'-диола (2.33)]. Ка-
(2.33) Антераксантин
ротиноиды, вероятно, локализованы в гранах хлоропластов в виде хромопротеинов. Некоторые, если не все, хлоропластные каротиноиды могут присутствовать in vivo в различных формах в разных участках хлоропласта. Значение этого факта и возможные функции каротиноидов в хлоропластах будут обсуждаться в гл. 10.
Нефотосинтезирующие ткани. Многие желтые цветки и оранжево-красные плоды обязаны своей окраской каротиноидам, которые обычно локализованы в хромопластных структурах. Желтые цветки, например у нарцисса и одуванчика, часто содер
Гл 2. Каротиноиды
53
жат большие количества каротиноидных эпоксидов, таких, как виолаксантин (2.8), в то время как оранжевые (например, у абрикоса) и красные (например, у томата) плоды часто окрашены соответственно 0-каротином и ликопином или их простыми гидроксипроизводными. В некоторых случаях, однако, пигментация обусловлена присутствием каротиноидов, которые ветре-
(2,36) Капсорубин
чаются только у одного или у очень небольшого числа видов. Так, цветки эшшольции калифорнийской (Eschscholtzia califor-nica) содержат ретро-каротиноид эшшольцксантин (4',5'-диде-гидро-4,5/-ретро-0,0-каротин-3,3'-диол (2.34)], присемянники («ягоды») тисса (Taxus baccata) содержат ретро-каротиноидный кетон родоксантин (2.10), а знакомая нам окраска красного перца (Capsicum аппишп) обусловлена циклопентановыми каротиноидами капсантином [3,3'-дигидрокси-0,х-каротин-6/-оном (2.35)] и капсорубином [З.З'-дигидрокси-х.х-каротин-6,6'-дионом (2.36)].
В цветках и плодах, а также в стареющих осенних листьях гидроксикаротиноиды обычно этерифицированы жирными кислотами (например, пальмитиновой кислотой).
51
Часть I. Химические и биохимические аспекты
Хотя в корнях каротиноиды обычно не встречаются, в корнях моркови (Daucus carota) содержится большое количество Р- и а-каротина, и именно от моркови этот класс пигментов и получил свое название.
2.4.2. Водоросли
Каротиноиды обычно содержатся в хлоропластах во
дорослей, в том числе и у обычных морских водорослей. Между хлоропластными каротиноидами разных классов водорослей наблюдаются значительные качественные различия, и поэтому
-ОСОСН3
(2.37) Фукоксантин
состав каротиноидов пытаются использовать для решения не-которых проблем в систематике и эволюции водорослей. Каротиноиды иногда присутствуют также вне хлоропласта, например в светочувствительном «глазке» Euglena (гл. 11) ив репродуктивных участках у колониальных видов, таких, как Ulva — зеленого «морского салата», обычно обнаруживаемого в прибрежных водах или в мелководье между скалами. Кетокаротиноиды, в том числе и астаксантин (2.9), могут накапливаться вне хлоропласта у некоторых зеленых водорослей (Chlorophyta) при неблагоприятных условиях культивирования, главным образом при недостатке минеральных веществ или азота.
О -рамнсзз
(2.38) Миксоксантофилл
Состав каротиноидов в хлоропластах зеленых водорослей обычно сходен с их составом в хлоропластах высших растений, что предполагает явную эволюционную связь. Большинство других классов водорослей образуют ацетиленовые или алленовые каротиноиды. Годовой природный синтез фукоксантина [5,6-эпокси-3,3/,5/-тригидрокси-6/,7/-дидегидро-5,6,7,8,5',6/ - гекса
Гл. 2. Каротиноиды
55
гидро-р,р-каротин-8-он-3'-ацетата (2.37)]—характерного каротиноида бурых морских водорослей (Phaeophyta)—оценивается в несколько миллионов тонн.
Примитивные прокариотические сине-зеленые водоросли, или бактерии (Cyanophyta, или Cyanobacteria), синтезируют fi-каротин и несколько его простых гидрокси- и кетопроизводных, но многие виды также накапливают миксоксантофилл [2'- (p-L-рамнопиранозилокси) -3',4'-дидегидро-1',2'-дигидро-р,ф-каротин-3,1'-диол (2.38)] и другие гликозиды каротиноидов, которые более типичны для нефотосинтезирующих бактерий.
2.4.3. Грибы
Каротиноиды широко распространены в природе, но у грибов они встречаются лишь у некоторых видов. Blakeslea tri-spora, например, синтезирует в мицелии p-каротин в таких количествах, что возможно его производство путем ферментации.
(2.39) Торулародин
Большинство каротиногенных грибов накапливают только каротины, особенно p-каротин и у-каротин; ксантофиллы являются редкостью. Очень немногие из макроскопических грибов, съедобных и ядовитых, окрашены каротиноидами. К ним относится съедобный гриб лисичка (Cantharellus cibarius), который окрашен в желтый цвет кантаксантином (2.27). Красные дрожжи (Rhodotorula spp.) образуют характерную для них каротиноидную кислоту торулародин [З'Л'-дидегидро-р.ф-каротин-Ш'-карбоновую кислоту (2.39)].
2.4.4. Бактерии
Если даже кратковременно экспонировать агаровую пластинку на открытом воздухе, то можно увидеть рост на ней микробных колоний, в том числе многих желтых, оранжевых и красных бактерий и дрожжей. Пигменты, обусловливающие их окраску, во многих случаях являются каротиноидами. И, хотя распространение каротиноидов у бактерий систематически не изучалось, все же можно сделать некоторые обобщения.
Н ефотосинтезирующие бактерии. Каротиноиды, найденные у представителей многих классов и семейств нефотосинтезирующих бактерий, обычно локализованы в клеточных мембранах
56
Часть I. Химические и биохимические аспекты
или в клеточной стенке. Часто биосинтез каротиноидов индуцируется светом. Многие виды накапливают простые С40-каро-тиноиды, такие, как p-каротин, у-каротин и их производные. Некоторые бактерии синтезируют С45- и С50-структуры. Так, характерным каротиноидом галофильных Halobacteria являр^ч
(2.40) Сардинаксантин
(2.41) "К.п. 450”
(2.42) "Диапонейроспорин”
(2.43) Слирилпоксантин
(2.44) Гидро ксисфероидин
(2.45) Хлоробактин
О Me
(2.4в) Окенен
Гл. 2. Каротиноиды
57
ациклический С50-пигмент бактериоруберин (2.12), в то время как некоторые виды Flavobacterium, Sarcina и Corinebacterium, в том числе некоторые обычные загрязнители воздуха и растительные и животные патогены, содержат циклические С50-каро-тиноиды, такие, как декапреноксантин (2.11), сарцинаксантин [2,2'-бис-(4-гидрокси-3-метилбут-2-енил)-у,у-каротин (2.40)] и «К- п. 450» [2,2'-бис-(4-гидрокси-3-метилбут-2-енил)-р,р-каротин (2.41)]. Недавно у некоторых патогенных видов Streptococcus it Staphylococcus был обнаружен ряд С30-тритерпеноидных каротиноидов. И, хотя они названы «диапокаротиноидами», эти соединения, например диапонейроспорин (2.42), являются истинными тритерпеноидами, образующимися из фарнезилпиро-фосфата через С30-аналог фитоина (разд. 2.6.3). У нефотосинтезирующих бактерий обычно встречаются также гликозиды Сзо-, С4о- и Сбо-каротиноидов.
Фотосинтезирующие бактерии. Каротиноиды обнаружены у всех фотосинтезирующих бактерий, у которых они являются важными компонентами фотосинтетического аппарата (гл. 10). Пурпурные несерные бактерии (Rhodospirillaceae) характеризуются присутствием ациклических пигментов с третичными гидрокси- или метоксигруппами при С-1 и С-1', примером чему служат спириллоксантин [1,Г-диметокси-3,4,3',4'-тетрадегидро-1,2,1',2'-тетрагидро-ф,ф-каротин (2.43)] из Rhodospirillum rub-rum. и гидроксисфероидин [1'-метокси-3',4'-дидегидро-1,2,7,8,1', 2'-гексагидро-ф,ф-каротин-1-ол (2.44)] из Rhodopseudomonas sphaeroides. В пурпурных и зеленых серных бактериях (Chro-matiaceae и Chlorobiaceae) обычно содержатся ароматические каротиноиды, такие, как хлоробактин [ф,ф-каротин (2.45)] и юкенон [|1'-метокси-1',2'-дигидро-%,ф-каротин-4'-он (2.46)].
2.4.5. Животные
Каротиноиды обусловливают окраску наружных покровов у многих животных, принадлежащих ко всем классам, кроме млекопитающих.
Позвоночные; млекопитающие. Хотя каротиноиды чрезвычайно важны для млекопитающих как предшественники витамина А и часто присутствуют в небольших количествах в печени и жировых тканях, не известно ни одного случая, когда бы эти соединения в сколько-нибудь заметной степени участвовали в формировании нормальной окраски наружных покровов у какого-либо вида млекопитающих. Правда, известны случаи, когда люди, в рацион питания которых входили в чрезмерно большом количестве морковь или апельсины, обладали столь высокой подкожной концентрацией каротиноидов, что их кожа,
58
Часть I. Химические и биохимические аспекты
особенно на ладонях и на ступнях, приобретала оранжевый оттенок.
Птицы. Самая обычная желтая окраска яичного желтка свидетельствует об универсальной важности каротиноидов для птиц. Кроме того, не является необычным окрашивание у них каротиноидами кожи и особенно оперения. Желто-красные перья у многих видов птиц пигментированы каротиноидами. В качестве наиболее известного примера можно привести розово-красноватую окраску перьев фламинго, обусловленную кетокаротиноидами, главным образом кантаксантином (2.27).
(2.47) Д, у Каротин
У многих птиц зеленая окраска перьев является результатом комбинации основной голубой структурной окраски и фоновой желтой, обусловленной каротиноидами.
Рыбы, амфибии и рептилии. Каротиноиды могут окрашивать кожу (например, у золотой рыбки) или мышцы (например, у лосося) рыб. У рыб чаще других встречаются такие каротиноиды, как астаксантин и его сложные эфиры. Обусловленная каротиноидами желтая окраска иногда встречается у амфибий и рептилий.
(2.48) Реньератин
Беспозвоночные; насекомые. Каротиноиды ответственны за окраску некоторых (но далеко не всех) желтых, оранжевых и красных насекомых (см. также гл. 3 и 6). Хорошо известными примерами являются саранча Schistocerca (p-каротин), колорадский жук Leptinotarsa decemlineata (кантаксантин) и божья коровка Coccinella septempunctata, содержащая большое число каротинов, главным образом редко встречающийся 0,у-каротин (2.47) и родственные ему соединения, содержащие у-кольцо.
Морские беспозвоночные. Обусловленная каротиноидами пигментация особенно характерна и важна почти для всех классов морских беспозвоночных. Типичными каротиноидами для них являются кетосоединения, такие, как кантаксантин и астаксантин. Иногда обнаруживают и другие необычные каротино
Гл. 2. Каротиноиды.
59
иды. У широко размножившихся в тропических морях окрашенных в разные цвета губок (Porifera) преобладают арильные каротиноиды, такие, как реньератин [0,%-каротин (2.48)]. Актиния (Actinia equina) — обычный обитатель скальных вод; окрашена в пурпурный цвет нор-каротиноидным эфиром актинио-эритрином (2.14).
У многих морских беспозвоночных преобладающий каротиноид присутствует не в свободной форме, а в виде стехиометрического комплекса с белком (разд. 2.5).
Каротиноиды и каротинопротеины чаще всего содержатся в эпидермисе или в панцире беспозвоночных животных, а также (иногда в высоких концентрациях) в репродуктивных органах и яйцах, хотя значение их присутствия в последних остается пока неизвестным.
2.5. Каротинопротеины
У морских беспозвоночных кетокаротиноиды обычно присутствуют в виде стабильных водорастворимых каротинопротеиновых комплексов. В этих комплексах каротиноиды в стехиометрических соотношениях связаны с белками — липопротеинами или гликопротеинами. В некоторых случаях каротинопротеины могут прочно связываться со структурным материалом наружных покровов тела, хитином или карбонатом кальция. Некоторые каротинопротеины имеют сложную субъединичную структуру, примером чему служит пигмент панциря омара крустацианин, в то время как другие, в частности фиолетовый каротинопротеин морской звезды Asterias rubens, значительно более просты.
Образование каротинопротеинового комплекса обычно приводит к значительному батохромному сдвигу в спектре поглощения (рис. 2.12), и потому эти комплексы часто имеют пурпурный, голубой или зеленый цвет в отличие от желтой или оранжевой окраски свободных каротиноидов. По-видимому, важную роль в спектральном сдвиге играют кетогруппы каротиноидных простетических групп, обычно представленных кан-таксантином или астаксантином, однако природа каротинопротеинового связывания пока остается неясной. Показано лишь, что во взаимодействии каротиноидов с белком не участвуют ковалентные связи, поскольку свободный каротиноид легко высвобождается при денатурации белка нагреванием или органическими растворителями, причем иногда этот процесс обратим.
Вероятно, наиболее известным примером окраски, обусловленной каротинопротеиновым комплексом, является омар Homarus vulgaris. Его панцирь имеет серо-голубой цвет благодаря присутствию каротинопротеина крустацианина. При варке
60
Часть I. Химические и биохимические аспекты
каротинопротеин денатурирует и выделяется свободный каротиноид астаксантин, а также продукт его аутоокисления астацин. Поэтому вареный омар выглядит красным.
Хотя каротинопротеиновые комплексы легко денатурируют при избытке тепла или органических растворителей, в водных растворах они значительно более стабильны по отношению к свету или кислороду, чем свободные каротиноиды.
2.6. Биосинтез
2.6.1. Введение
Было показано, что каротиноиды синтезируются только в растениях и микроорганизмах. В организме многих животных могут накапливаться и даже модифицироваться каротиноиды, полученные с пищей (разд. 2.8), однако биосинтез каротиноидов de novo никогда не был продемонстрирован однозначно ни в одной из животных систем. Биосинтетический путь, который будет обсуждаться ниже, представляет собой некое обобщение, основанное на исследованиях многих каротиногенных систем, главным образом листьев и хлоропластов, плодов и хромопластов томата, грибов и бактерий, а также полученных из них ферментных препаратов.
Каротиноиды являются тетратерпенами, и их биосинтез происходит по нормальному изопреноидному пути, дающему начало также и другим важным природным продуктам, таким, как каучук, стероиды, содержащиеся во многих эфирных маслах моно-, сескви- и дитерпены, а кроме того, боковым цепям хинонов, участвующих в переносе электронов.
Путь биосинтеза каротиноидов может быть разбит на несколько стадий: 1) образование Сго-промежуточного продукта геранилгеранилпирофосфата; 2) образование фитоина — первого Сад-каротипа; 3) ряд реакций десатурации; 4) циклизация и связанные с ней реакции с участием двойной связи С-1,2; 5) окончательные модификации.
Первая стадия образования геранилгеранилпирофосфата является общей для биосинтеза всех изопреноидов, в то время как остальные характерны только для биосинтеза каротиноидов.
2.6.2. Образование геранилгеранилпирофосфата
Большинство экспериментальных данных, касающихся начальных стадий изопреноидного пути биосинтеза, получены на примере образования холестерина, а не каротиноидов. Однако нет оснований считать, что составляющие его реакции для этих классов соединений различаются.
СН3. СО. S. СоА СН3 ОН
к ~ООС 'С' г
2ХCH, . СО.SCoA----ч—*-CH3.CO.CH2CO.SCoA——sr-----•- \ s' X
'3 Л Л СН2 сн2
CoASH CoASH /9 ел\ гляг с' л
(2.49) Ацетоацетил-СоА (2.50) ГМГ-СоА
2 NADPH
/1
®—Аденозин
(2.51) Мевалоновая кислота (МВК|;
(2.53) МВК-5-пирофосфат (2.52) МВК-5-фосфат
| Ангидродекарбоксилаза
СН3
I z-x х-х ИППФ-изомераза
сн2о-$ЧЭ ...............
СН2 V/C\ н н
(2.54) Изопентенилпирофосфат (ИППФ)
ГМ Г-СоА-редуктаза.
(2.55) Диметилаллилпирофосфат (ДМАПФ)
(2.58) Гераниягеранилпирофосфат (ГГПФ)
Рис. 2.13. Образование геранилгеранилпирофосфата (ГГПФ) по основному пути биосинтеза изопреноидов из ацетил-СоА.
<62
Часть I. Химические и биохимические аспекты
Первым общим предшественником изопреноидов является .ацетат в виде ацетил-СоА. Биосинтетический путь от ацетил-'СоА до геранилгеранилпирофосфата (ГГПФ) представлен на рис. 2.13. Ацетил-СоА (3 молекулы) превращается через ацето-.ацетил-СоА (2.49) в З-гидрокси-З-метилглутарил-СоА [ГМГ-СоА (2.50)]. Данные об участии в этом пути в качестве промежуточного продукта малонил-СоА, как в случае биосинтеза жирных кислот, противоречивы.
ГМГ-СоА подвергается восстановлению в две стадии до мевалоновой кислоты {МВД (2.51)]. Эта ГМГ-СоА-редуктазная ^реакция является главной контрольной точкой биосинтеза холестерина; справедливо ли это для каротиногенеза, еще предстоит выяснить. МВК представляет собой первое соединение, которое в биосинтезе изопреноидов используется исключительно в качестве промежуточного продукта. Это соединение, по-разному меченное радиоактивными (3Н и 14С) и стабильными (2Н и 13С) изотопами, было синтезировано и широко применялось в качестве субстрата при изучении биосинтеза каротиноидов.
На следующих стадиях МВК дважды подвергается фосфорилированию с образованием 5-фосфата (2.52) и 5-пирофосфа-та мевалоновой кислоты (2.53) при участии киназ и АТР. Затем МВК-5-пирофосфат декарбоксилируется с образованием -«изопреновой единицы» — изопентенилпирофосфата [ИППФ (2.54)]. Изомераза катализирует обратимую изомеризацию ИППФ и диметилаллилпирофосфата [ДМАПФ (2.55)]. Эти две молекулы являются первыми субстратами пренилтрансферазных ферментов, которые катализируют образование изопреноидных цепей. ДМАПФ функционирует в качестве «затравочной» молекулы, которая конденсируется с молекулой ИППФ с «образованием Сю-промежуточного продукта геранилпирофосфата [ГПФ (2.56)], являющегося предшественником монотерпенов. Последовательное присоединение еще двух молекул ИППФ .дает Cis-фарнезилпирофосфат [ФПФ (2.57)]—предшественник сесквитерпенов, стероидов и тритерпенов, а также С20-ГТПФ (2.58). Процесс удлинения цепи может продолжаться с образованием длинноцепочечных полипренолов, или же ГГПФ может использоваться для синтеза С2о-дитерпенов (в том числе фитола — боковой цепи хлорофилла) или Сад-ка-ротиноидов.
2.6.3. Образование фитоина
В первой стадии биосинтетического процесса, которая .свойственна исключительно каротиноидам, принимают участие щве молекулы ГГПФ и образуется первый С40-каротиноидный
Рис. 2-14. Возможный механизм образования фитоииа.
64
Часть I. Химические и биохимические аспекты
промежуточный продукт. Этим промежуточным продуктом является фитоин (2.61), а не ликоперсин (7,8,11,12,15,7',8',11',12', 15'-декагидро-ф,ф-каротин, 2.62)—Сад-аналог стероидного предшественника сквалена, как предполагалось первоначально. В биосинтезе фитоина участвует Сад-циклопропановый промежуточный продукт — префитоинпирофосфат [ПФПФ (2.59)]. Возможные механизмы образования ПФПФ из ГГПФ и фитоина из ПФПФ приведены на рис. 2.14. Последний промежуточный продукт в этой цепи — ион карбония (2.60) — стабилизируется в результате потери протона, что приводит к образованию фитоина. Последнее более вероятно, чем формальное присоединение Н_ от NADPH, которое должно было бы привести к образованию ликоперсина.
Биосинтез фитоина из МВК, ИППФ, ГГПФ и ПФПФ был продемонстрирован с помощью многочисленных неочищенных ферментных препаратов, выделенных, например, из хлоропластов, хромопластов томата, грибов и бактерий.
Сзо-Тритерпеновые каротиноиды, характерные для некоторых бактерий (разд. 2.4.4), вероятно, синтезируются аналогичным путем из ФПФ и Сзо-прескваленпирофосфата.
Стереохимия. Фитоин, образуемый большинством каротиногенных систем, в том числе высшими растениями, по-видимому, является 15-гщс-изомером (2.15). Образование этого изомера сопровождается потерей 1 -про-S-водородного атома в каждой молекуле ГГПФ, а у некоторых бактерий полностью транс-фитоин (2.61) синтезируется непосредственно в результате потери 1-npo-S-водородного атома у одной молекулы ГГПФ и 1-npo-R-водородного атома у другой (рис. 2.15).
2.6.4. Десатурация
При образовании окрашенных каротиноидов из фитоина прежде всего происходят четыре последовательные десатурации, каждая из которых приводит к введению двойной связи и дальнейшему удлинению полиенового хромофора на две сопряженные двойные связи (рис. 2.16). Промежуточными продуктами в этой последовательности реакций являются фито-•флуин (2.63), ^-каротин (2.64) и нейроспорин (2.66), а конечным продуктом — ликопин (2.67). У многих микроорганизмов ^-каротин целиком или частично замещен его несимметричным изомером 7,8,11,12-тетрагидро-ф,ф-каротином (2.65). Превращение в ликопин и другие каротиноиды меченых фитоина, фи-тофлуина и ^-каротина было достигнуто с помощью бесклеточных препаратов из пластид томата и из бактерий.
У многих микроорганизмов процесс десатурации ингибируются дифениламином, а у высших растений — некоторыми гер-
СП I 32
Рис. 2.15. Стереохимия отщепления водорода при биосинтезе полностью транс- и 15-^ис-фитоииа.
(2.65) 7, 8, 11, 12 -Тетрагидро-0,« 0-каротин
2Н^
(2.67) Ликопин
Рис. 2.16. Ступенчатая десатурация фитоина до ликопина..
Гл. 2. Каротиноиды
G7
бицидами; при этом происходит накопление фитоина. При последующем удалении ингибитора происходит образование более ненасыщенных каротиноидов, по-видимому, за счет накопившегося фитоина.
Почти все природные каротиноиды имеют полностью транс-конфигурацию, и, следовательно, в тканях, где образуется 15-1{МС-фитоин, на одной из стадий процесса десатурации должна происходить изомеризация. Показано, что эта изомеризация в различных системах может происходить на разных стадиях. Предполагают, что у зеленых водорослей имеет место изомери-
Рис. 2.17. Стереохимия потери водорода в реакции десатурации. Символы Нав, Has, H5R и H5S указывают, что эти водородные атомы происходят из 2-npo-R-, 2-npo-S-, 5-npo-R- и 5-npo-S-водородных атомов мевалоната соответственно.
зация ^-каротина, у томатов — фитофлуина и у некоторых бактерий и грибов — фитоина. У бактерий, синтезирующих только транс-фитоин, обнаружены только транс-изомеры каротиноидов.
Механизм реакций десатурации еще не выяснен, однако эксперименты со стереоспецифически меченой 3Н при С-2 или С-5 МВК свидетельствуют о том, что введение каждой двойной связи происходит путем транс-элиминирования водорода (рис. 2.17). Были представлены доказательства, согласно которым необходимыми кофакторами этого процесса в пластидах высших растений служат NADP+ и FAD. У бактерий предполагают участие в нем системы переноса электронов.
2.6.5. Последующие реакции; общие соображения
Последовательность реакций десатурации отнюдь не приводит к образованию полностью сопряженного пентадекае-на ЗДЗ'Д'-тетрагидро-ф.ф-каротина (2,68). Она останавливается на стадии ликопина, в котором остается насыщенной связь С-3,4. Двойные связи С-1,2 остаются изолированными и не участвуют в формировании главного полиенового хромофора. Однако у большинства каротиногенных систем ликопин не является конечным продуктом, а служит лишь промежуточным звеном в биосинтезе главных нормально образующихся каро-5*
68
Часть 1. Химические и биохимические аспекты
тиноидов. В частности, ликопин может подвергаться различным модификациям по изолированной связи С-1,2 с образованием • как ряда характерных для фотосинтезирующих бактерий ацик-
(2.68) 3, 4, 4-Тетрагидроликопин
(2.69) Родопин
лических каротиноидов, так и многих более широко известных моноциклических и бициклических каротиноидов, типичных для растений.
2.6.6. Последующие реакции; биосинтез ациклических каротиноидов
Из ряда дополнительных реакций, которые могут происходить по двойной связи С-1,2, простейшие наблюдаются в ходе биосинтеза ациклических каротиноидов. Наиболее ярким примером является присоединение воды с образованием 1-гидрокси- и 1-метоксикаротиноидов, характерных для фотосинтезирующих и некоторых других бактерий. В случае гидратации ликопина по двойной связи С-1,2 образуется родопин ф1,2-ди-
Рис. 2.18. Механизм образования 1-гидрокси-1,2-дигидрокаротиноидов.
гидро-ф,ф-каротин-1-ол (2.69) ]—главный каротиноид пурпурной бактерии Rhodomicrobium vanniellii. Возможный механизм этой реакции приведен на рис. 2.18.
У фотосинтезирующих бактерий за такой гидратацией обыч-. но следует метилирование (с помощью S-аденозилметионина) третичной гидроксильной группы и десатурация связи С-3,4.
Гл. 2. Каротиноиды
69
Предложенные к настоящему времени схемы биосинтеза сферо-идина '[ 1-метокси-3,4-дидегидро-1,2,7',8'-тетрагидро-ф,ф-кароти-на (2.70)] и спириллоксантина (2.43) —главных каротиноидов Rhodopseudomonas sphaeroides и Rhodospirillutn rubrum. — соответственно представлены на рис. 2.19.
Однако С-1-гидроксилирование и О-метилирование могут происходить на более ранних стадиях десатурации; у этих бактерий при определенных условиях культивирования были обнаружены гидрокси- и метоксипроизводные фитоина, фитофлуина и 1,2,7,8-тетрагидро-ф,ф-каротина.
Описанные биосинтетические реакции протекают в анаэробных условиях. Поступление О2 в культуру R. sphaeroides вызывает быстрое превращение желтого сфероидина в его красное кетопроизводное сфероиденон [1-метокси-3,4-дидегидро-1,2,7',8'-тетрагидро-ф,ф-каротин-2-он (2.71)] (рис. 2.20).
Галобактерии (Halobacteria), приспособившиеся к жизни в условиях сильного засоления, содержат ациклические С45- и Cso-каротиноиды, такие, как бактериоруберин (2.12). Предполагают, что они образуются в реакции, аналогичной гидратации по связи С-1,2 (рис. 2.18), с участием инициирующих электрофильных агентов — С5-фрагментов (рис. 2.21).
2.6.7. Циклизация
Жесткость сопряженной полиеновой системы каротиноидов предотвращает интенсивную циклизацию по типу, который имеет место у ди- и тритерпеноидов. Циклизация у каротиноидов ограничивается образованием единственного шестичленного кольца на одном или на обоих концах молекулы ациклического предшественника. Циклизация каротиноидных промежуточных продуктов может рассматриваться как дополнительный процесс, начинающийся протонной атакой по С-2 у концевой двойной связи С-1,2. Далее, как показано на рис. 2.22, образуется ион карбония (2.72), который может стабилизироваться путем потери протона у С-6, С-4 или С-18; при этом формируются соответственно р-кольцо (2.73), е-кольцо (2.74) или в редких случаях у-кольцо (2.75). Кольца разных типов не способны превращаться друг в друга.
Общая схема биосинтеза обычных каротиноидов, содержащих р- и е-кольца, приведена на рис. 2.23. Согласно этой схеме, существуют две главные точки, в которых может происходить циклизация. Если в норме десатурация завершается до начала циклизации, то непосредственным предшественником моноцик-лических у-каротина (2.78) и 6-каротина [е,ф-каротина (2.79)], а следовательно, и дициклических р-каротина (2.80), а-кароти-на (2.81) и е-каротина (2.82) является ликопин. Если же цик-
•Спириллоксантин (2.43)
Гл. 2. Каротиноиды
71
лизация происходит до окончания десатурации, то ключевыми промежуточными продуктами являются нейроспорин, р- и а-зеакаротин [Т'.в'-дигидро-б,^-каротин (2.76) и 7',8'-дигидро-е,ф-каротин (2.77)]. В любом случае циклизация происходит в
Сфероидин
(2.71) Сфероиденон
Рис. 2.20. Аэробное превращение сфероидина в сфероиденон.
каротиноидной «полумолекуле», которая достигла уровня ненасыщенности ликопина; концевые группы с одинарной связью С-7,8 циклизоваться не могут.
Рнс. 2.21. Биосинтез ациклических С45- и Сзо-каротинондов.
Многие превращения, показанные на рис. 2.23, были продемонстрированы в опытах с ферментными системами из бактерий и высших растений (из пластид томатов), причем у бакте-
Рис. 2.19. Предполагаемые схемы биосинтеза сфероидина и спириллоксан-тииа у фотосинтезирующих бактерий.
Рис. 2.22. Общий механизм циклизации каротиноидов, приводящий к образованию трех типов колец — 0, у и е.
рии это удалось после исключения из реакционной смеси ингибитора циклизации — никотина.
Стереохимия. Эксперименты с применением стабильных изотопов внесли ясность в стереохимию сгибания молекулы, Н+-атаки и циклизации при формировании 0-кольца (рис. 2.24). Несмотря на то что установлены хиральность при С-6, а также стереохимия водородной атаки при С-2 и потери водорода при С-4 (рис. 2.25), стереохимия образования е-кольца все еще остается не ясной. Полученные к настоящему времени результаты свидетельствуют о том, что при биосинтезе 0- и е-колец стереохимия сгибания молекулы может фундаментально различаться.
Циклические С50-каротиноиды. У некоторых нефотосинтезирующих бактерий циклизация инициируется электрофильными Сб-фрагментами (рис. 2.26), что приводит к образованию С45-и Сбо-каротиноидов, имеющих при атоме С-2 0-, g- или у-кольца Сб-заместители, например «К. п. 450» (2.41), декапреноксанти-на (2.11) и сарцинаксантина (2.40).
Стереохимия циклизации при образовании этих «высших каротиноидов» отличается от установленной для С4о-соеди-нений.
/•Зеакаротин (2.76)
ct-Зеакаротин (2.77)
5-Каротин (2.79)
Рис. 2.23. Общая схема биосинтеза обычных каротиноидов с |3- и е-кольцами.
(3-Каротин (2.80)
а-КаротиН (2.81)
оКаротин (2.82)
74
Часть I. Химические и биохимические аспекты
Н Н
Рис. 2.25. Известные к настоящему времени детали стереохимии образования е-кольца.
2.6.8. Окончательные модификации
В предыдущих разделах описаны главные реакции, посредством которых синтезируются основные структуры ациклических и циклических каротиноидов. Индивидуальные каротиноиды образуются в результате последующих модификаций. Некоторые из этих модификаций, и прежде всего включение кислородсодержащих функциональных групп, происходят повсеместно. Другие, по-видимому, уникальны и характерны для биосинтеза единственного каротиноида, встречающегося лишь у одного вида или у группы видов. Диапазон структурных модификаций циклических каротиноидов шире, чем у соединений ациклического ряда. Главные структурные модификации ациклических каротиноидов, в частности у фотосинтезирующих бактерий, были приведены ранее (разд. 2.6.6).
У циклических каротиноидов чаще всего в качестве дополнительной группы встречается ОН-группа. Особенно часто гидроксилирование имеет место при С-3, однако встречаются также и 2-гидрокси- и 4-гидроксикаротиноиды. Последние, как правило, окисляются далее до 4-кетокаротиноидов, таких, как кан-таксантин (2.27) (рис. 2.27). Гидроксильные группы иногда находятся в других положениях молекулы, например при С-19. Из процессов гидроксилирования изучено только введение гидроксила в положение С-3. У растений и бактерий (3/?,3'/?)-зеаксантин (р^-каротин-ЗД'-диол (2.83)] образуется путем
76
Часть I Химические и биохимические аспект и
(2 27) Кантаксантин
Рис 2 27 Образование кетока-
ротиноида кантаксантина.
Рис 2 28. Стереохимия введения 3-гидроксигруппы зеаксантина. Н5Я и H5s были исходно 5-npo-R- и 5-иро-5-водородными атомами мевалоната.
гидроксилирования p-каротина. Источником ОН-группы служит молекулярный О2, и ее присоединение катализируется оксидазой со смешанной функцией (стереохимия реакции показана на рис. 2.28). Лютеин (2.6)—главный ксантофилл листьев — вероятно, образуется аналогичным образом из а-каротина. Хиральность при С-З' в данном случае противоположна хиральности при С-З, а также хиральности у зеаксантина, и потому очевидно, что стереохимия гидроксилирования у них различна.
Хлоропластные ксантофиллы виолаксантин (2.8) и неоксан-тин (2.32) содержат 5,6-эпоксигруппы. Описано ферментатив
Гл. 2. Каротиноиды
77
ное эпоксидирование зеаксантина до виолаксантина. Эпоксиды [или близкие к ним перекисные структуры (2.84)] могут быть важными промежуточными продуктами при различных модификациях каротиноидов. На рис. 2.29 показаны возможные механизмы образования: а) алленовой концевой группы неоксанти-на, б) ацетиленовых концевых групп, таких, как у каротиноида водорослей аллоксантина [7,8,7',8'-тетрадегидро-р,р-каротин-3,3'-диола (2.85)], в) циклопентанового кольца капсантина (2.35) и капсорубина (2.36) и г) ретро-каротиноида эшшольц-
ксантина (2.34). Хотя все эти схемы выглядят очень правдоподобными, практически нет биохимических доказательств, которые бы их подтверждали.
2.6.9. Биосинтез арилкаротиноидов
Обнаружение у бактерий нескольких каротиноидов, содержащих арильные концевые группы, представляет большой интерес, поскольку это свидетельствует в пользу существования еще одного, ранее неизвестного, пути биосинтеза ароматического кольца из мевалоната, а не по шикиматному пути или из ацетата с помощью поликетидного механизма (гл. 3).
Образование 1,2,5-триметилфенильной концевой группы, такой, как у хлоробактина (2.45), включает простую миграцию одной из метильных групп при С-1 в положение С-2. Гораздо более сложная перегруппировка необходима для биосинтеза 1,2,3-триметилфенильной концевой группы, содержащейся в океноне (2.46), Несмотря на то что пока не получено подтверждающих доказательств, предполагают, что в такой перегруппировке участвует промежуточный продукт, имеющий структуру призмы Ладенбурга (рис. 2.30).
78
Часть I. Химические и биохимические аспекты
2.7. Регуляция и контроль биосинтеза каротиноидов н
2.7.1. Грибы и бактерии
Генетический контроль. При изучении биосинтеза каротиноидов широко использовались мутанты плесневого гриба Phycomyces blakesleeanus. Существуют три главные группы мутантов — мутанты, накапливающие ликопин; мутанты, накапливающие фитоин; и мутанты, не способные синтезировать каротиноиды. Обширные комплементационные исследования показали, что в нормальном каротиногенезе участвуют только три гена, обозначаемые как car R, саг В и саг А, и что каждая из трех групп мутантов соответствует мутации в одном из этих генов. Циклизация (ликопина?) осуществляется продуктом гена car R; две копии этого продукта, т. е. два циклазных фермента в едином ферментном комплексе, участвуют в образовании p-каротина. Аналогичным образом четыре копии продукта гена саг В функционируют в дегидрогеназном комплексе, который осуществляет четыре последовательные реакции десатурации, необходимые для превращения фитоина в ликопин. Предполагают, что биосинтез в целом происходит на мульти-ферментном комплексе, включающем десатуразы и циклазы.
Свет. Свет стимулирует дополнительный синтез каротиноидов у многих грибов и бактерий, которые в темноте обычно образуют умеренное их количество. У многих других грибов и бактерий, однако, синтез каротиноидов в темноте происходит в очень ограниченной степени или не происходит вовсе, но может начаться в ответ на одновременное кратковременное воздействие света и кислорода. После освещения перед началом каро-тиногенеза обычно наблюдается индукционный период (около 4 ч), необходимый для синтеза ферментов. Подобный механизм
Рис. 2.29. Возможные механизмы образования различных структур ксаитО' ф ил лов из 5,6-эпоксида или 5,6-перекиси (начало см, на с, 78),
80
Часть I Химические и биохимические аспекты
фотовозбуждения специфического биосинтеза обеспечивает наличие каротиноидов только тогда, когда они необходимы для защиты организма от вредного действия избытка света и кислорода.
В настоящее время выяснено, на какую стадию образования каротиноидов влияет свет. У Mycobacterium при освещении усиливается образование ГГПФ, а образование ПФПФ целиком зависит от освещения. У гриба Neurospora crassa ферменты, катализирующие как образование, так и десатурацию фитоина, по-видимому, являются фотоиндуцируемыми.
Рис. 2.30. Предполагаемый механизм биосинтеза 1,2,3-триметилфенильной концевой группы
У фотосинтезирующих бактерий свет необходим как для синтеза каротиноидов, так и для образования других компонентов фотосинтетических мембран (гл. 10).
Условия культивирования. У многих грибов и бактерий количественный и качественный состав каротиноидов изменяется при изменении условий культивирования. На количество и состав образующихся каротиноидов сильно влияют природа источников углерода и азота, отношение углерод/азот, доступность минеральных солей, витаминов и ростовых факторов, степень аэрации, pH среды и температура.
Химический контроль. Известно, что многие вещества стимулируют или подавляют синтез каротиноидов или вызывают качественные изменения в их составе у микроорганизмов. Некоторые из таких соединений, например дифениламин и никотин, широко использовались в исследованиях биосинтеза каротиноидов (разд. 2.6.4 и 2.6.5).
Гл 2 Каротиноиды
84
Интересный пример химического контроля каротиногенеза в природных биологических системах обнаружен у некоторых гетероталлических грибов, в частности у Blakeslea trispora. При раздельном выращивании ( + )- и (—)-штаммы не образуют каротиноиды в заметных количествах, тогда как в смешанных культурах происходит интенсивный синтез р-каротина. Этот синтез индуцируется триспоровой кислотой (2.86) — гор-
0
(2 86) Триспор я I кислота
моном, который образуется под действием комбинации ферментов из двух штаммов. Триспоровая кислота представляет собой метаболит p-каротина и ее главная функция заключается в стимулировании споруляции и репродукции. Не исключено, что стимуляция каротиногенеза является частью механизма, обеспечивающего усиление образования триспоровой кислоты.
2.7.2. Растения и водоросли
Генетический контроль. Из генетических доказательств следует, что в зеленых тканях высших растений и у водорослей реакции десатурации и циклизации находятся под непосредственным ядерным контролем. Так, были выделены мутанты кукурузы (Zea mays) и зеленой водоросли Scenedesmus obliquus, накапливающие фитоин, ((-каротин или ликопин.
Наиболее важные генетические исследования проведены на томатах. Были сделаны некоторые предположения относительно участков действия генов, которые контролируют биосинтез каротиноидов в плодах томата. Некоторые гены действуют до стадии образования фитоина и контролируют количество предшественников, вступающих в процесс биосинтеза каротиноидов. Другие гены контролируют соответственно десатурацию фитоина, циклизацию ликопина до p-каротина, приводящую к образованию е-, а не p-кольца, или стереохимию конечного продукта. Так, «теневые» (ghost) мутанты томата имеют «белые» плоды, содержащие в большом количестве фитоин; плоды линии «высокий р» («high-р») накапливают в высоких концентра-ьиях p-каротин вместо накапливаемого в нормальных условиях ликопина; дельта-штамм в качестве главного пигмента содержит 6-каротин; а у плодов томата сорта «танжерин» вместо
6—84
Часть I. Химические и биохимические аспекты
«2
---—-----—--------------------------------------- /-------
полностью трамс-ликопина в качестве главного карбтиноида присутствует проликопин.
Синтез каротиноидов в хлоропластах. В фотосинтезирующих тканях каротиноиды локализованы в хлоропластах; весьма вероятно, что они и синтезируются в этих органеллах. Этиолированные проростки и выращенные в темноте культуры Euglena gracilis синтезировали лишь небольшие количества каротиноидов, главным образом ксантофиллов. В ответ на кратковременное освещение нормальные хлоропластные каротиноиды синтезируются по мере образования функционирующих хлоропластов. Полагают, что действие света опосредовано фитохромом. Каротиноиды представляют собой неотъемлемую часть самой •структуры хлоропластов, и регуляция их синтеза тесно взаимосвязана с синтезом хлорофилла и других компонентов хлоропластов (гл. 10).
Многие водоросли образуют хлоропласты, а следовательно, и нормальные хлоропластные каротиноиды даже при росте в темноте.
Синтез каротиноидов в созревающих плодах. У многих плодов созревание сопровождается интенсивным синтезом каротиноидов по мере замены хлоропластов на хромопласты и изменения окраски с зеленой на красную. Образующиеся в ходе созревания плодов или уже-после их сбора каротиноиды часто отсутствуют в исходных хлоропластах, например ликопин в томатах и капсантин в перце. Свет обычно не оказывает существенного влияния на процессы созревания или накопления каротиноидов, тогда как температура является важным фактором этих процессов.
Химический контроль. Известно, что многие вещества стимулируют или ингибируют синтез каротиноидов. В их число входят некоторые гербициды, например Sandoz 6706 [4-хлор-5-(диметиламино) - 2(а,а,а-трифтор-л-толил) -3(2Н) - пиридази-нон], который может ингибировать синтез каротиноидов (блокируя десатурацию фитоина) и таким образом предотвращать правильное развитие хлоропластов.
2.8. Метаболизм каротиноидов у животных
2.8.1. Интактные каротиноиды
Хотя многие животные используют каротиноиды для окраски, полагают, что они не способны синтезировать эти соединения и получают их в необходимых количествах с пищей. Например, фламинго, живущие в зоопарке, теряют свою характерную привлекательную розовую окраску при недостатке кетокаротиноидов, которые в природных условиях они получают,
Гл. 2. Каротиноиды
питаясь \ крошечными рачками. Многие животные (птицы, а также Насекомые и другие беспозвоночные) могут, однако, модифицировать структуру поступающих с пищей каротиноидов, в частности путем введения кетогрупп в положение С-4. Было показано, что некоторые животные — главным образом птицы и беспозвоночные — превращают р-каротин (2.3) и зеаксантин (2.7) в кантаксантин (2.27) и астаксантин (2.9) соответственно^
Рис. 2.31. Образование нор-каротиноида актиниоэритрииа.
Интересной и необычной модификацией является образование у актиний «ор-каротиноида актиниоэритрииа (2.14) из: сложных эфиров астаксантина с помощью процесса, включающего превращение шестичленного кольца в пятичленное. Предложенный механизм (рис. 2.31) включает бензильнокислотную перегруппировку промежуточного трикетосоединения.
У ряда животных были обнаружены каротиноиды, которые-не могли присутствовать в пище или образовываться из присутствующих в пище с помощью какого-либо известного метаболического процесса. Например, божья коровка Coccinella septempunctata содержит необычные каротиноиды с у-кольцом, которые, вероятно, образуются с помощью микробных симбионтов. Происхождение (6S, 6'S) -е-каротина, присутствующего в: окрашенных жировых каплях сетчатки некоторых птиц (гл. 9),. остается загадкой.
2.8.2. Образование ретинальдегида и зрительных пигментов
У многих животных, в том числе у человека, наиболее-важными продуктами метаболизма каротиноидов являются витамины А [ретинол (2.87) и 3,4-дидегидроретинол (2.88) и со-6*
84
Часть I Химические и биохимические аспекты.
ответствующие альдегиды — ретинальдегид (2.89) и 3,4-диде-гидроретинальдегид (2.90)]. Ретинальдегид (ретиналь, рети-нин) образуется в слизистой кишечника в результате окислительного расщепления на две половины молекулы р-каротина (рис. 2.32). Этот процесс катализируется р-каротин-15,^'-диоксигеназой и идет через образование промежуточного перекисного соединения (2.91). Ретинальдегид и ретинол легко превращаются друг в друга в присутствии NAD(H) или NADP(H) алкогольдегидрогеназами, содержащимися в различных тканях,
(2 89) Ретинальдегид (2 90) 3 4 Дидегидроретинальдегид
главным образом (у млекопитающих) в печени и в сетчатке глаза. В крови витамин А транспортируется в виде комплекса с липопротеином (ретинолсвязывающим белком), а запасы эфиров ретинола хранятся в печени.
Процесс зрения зависит от группы фоточувствительных пигментов, которые локализованы в сетчатке глаза. Эти зрительные пигменты представляют собой комплексы опсинов (гликолипопротеинов) и 11-1|пс-ретинальдегида или 11-цпс-дегидро-ретинальдегида. Более детально эти комплексы и их функции в процессе зрения обсуждаются в гл. 9.
2.9. Функции каротиноидов
Основные функции каротиноидов в биологических тканях обусловлены главным образом их способностью поглощать свет. Роль каротиноидов в фотосинтезе, защите от вредного действия света, фототропизме и фоторецепции, а также их вклад в окраску содержащих их тканей обсуждаются во второй части данной книги.
Других функций у каротиноидов не обнаружено. Содержание каротиноидов в высоких концентрациях в репродуктивных
Гл 2 Каротиноиды
85
тканях грибов, водорослей, растений и животных указывает на возможную роль и участие этих соединений в процессах размножения, однако четкие данные по этому поводу отсутствуют.
2.10. Каротиноиды как пищевые красители
Уже в течение многих лет каротиноиды используют в качестве красителей в пищевой промышленности. Их присутствие во многих природных пищевых продуктах делает их иде-
Рис 2 32 Образование ретинальдегида путем окислительного расщепления Р-каротина.
ально пригодными для этой цели. В пищевые жиры, особенно в маргарин, добавляют p-каротин, благодаря чему организм получает дополнительное количество необходимого для него витамина А. Водорастворимые или по крайней мере диспергируемые в воде производные p-каротина, кантаксантин и апо-каротиноиды, применяются для окрашивания напитков и других пищевых продуктов. Если число каротиноидов, которые могут быть использованы, и особенно диапазон красок, который может быть получен, увеличатся, то применение каротиноидов в пищевой промышленности станет еще более широким.
86
Часть I Химические и биохимические аспекты
2.11. Использование каротиноидов в медицине
В медицине каротиноиды используются главным образом для профилактики или лечения авитаминоза А. В этих случаях рекомендуется пищевой рацион, богатый каротиноидами, или специальные препараты. Вместе с тем, как недавно показано, при некоторых кожных заболеваниях, которые обостряются под действием солнечного излучения, каротиноиды играют защитную роль. В частности, большие дозы p-каротина значительно смя! чают симптомы эритропоэтической порфирии. Для этой болезни характерно нарушение метаболизма порфиринов, в результате чего они накапливаются в организме и начинают играть роль фотосенсибилизаторов. У таких больных под влиянием солнечного света появляется зуд, жжение и отечность. В настоящее время рассматривается также возможность использования каротиноидов, главным образом p-каротина и кантаксантина, а также ретиноидов (производных витамина А) для защиты от некоторых видов рака кожи, вызываемого действием УФ-излучения или химических веществ.
2.12. Другие полиеновые пигменты
Светопоглощающие свойства каротиноидов обусловлены главным образом наличием в них сопряженной полиеновой системы. Поэтому не удивительно, что спектры поглощения сопряженных полиенов некаротиноидной природы очень сходны
(2 92) Кортизалин
соон
(2 93) Валлемиг. А
со спектрами собственно каротиноидов, причем настолько сходны, что те немногие сопряженные некаротиноидные полиены, которые сейчас известны, считали сначала каротиноидами.
Все некаротиноидные полиеновые пигменты имеют грибное или бактериальное происхождение. Плодовые тела гриба Corti-ciutn salicinum содержат красный пигмент кортизалин (2.92), а другой гриб, Wallemia sebi, обычно обнаруживаемый на внут
Гл. 2. Каротиноиды
87
ренней стороне пчелиных ульев, содержит пиррольные полиены, например валлемию А (2.93). Из некоторых бактерий были получены арильные полиены, причем оказалось, что они присутствуют в них наряду с каротиноидами. Скользящие бактерии типа Cytophaga— Flexibacterium содержат флексирубины — сложные эфиры со структурой, представленной формулой (2.94), и их хлорпроизводные. Некоторые морские виды Xantho-monas содержат сложные эфиры бромированных арильных полиенов, например ксантомонадин I (2.95).
Биосинтез этих полиенов не изучался. По-видимому, они неизопреноидного происхождения и, скорее всего, синтезируются по поликетидному пути (гл. 3). Информация о распространении, локализации внутри клетки и функциях какого-либо из этих пигментов отсутствует.
2.13. Заключение и комментарии
Каротиноиды представляют собой классический пример группы природных пигментов. Все члены этой группы обладают очень близкой структурой, основанной на сопряженном полиеновом хромофоре, который и обусловливает их светопоглощающие свойства. Они дают возможность наблюдать четкую корреляцию между максимумом поглощения и длиной хромофора. Каротиноиды чрезвычайно широко распространены у живых организмов и принимают участие во всех фотофункциях, обычно связанных с природными пигментами. Именно по этим причинам (а не потому, что автор лучше знаком с данным классом соединений) каротиноиды были рассмотрены бо
83
Часть I Химические и биохимически- аспекты
лее детально, чем будут рассматриваться некоторые другие группы пигментов.
Каротиноиды предоставляют химику-органику большие возможности проявить свое мастерство в установлении структуры молекул. Новые соединения открывают довольно часто, особенно у микроорганизмов и морских животных. В большинстве случаев это сравнительно небольшие модификации основной структуры, однако всегда существует вероятность обнаружить ранее неизвестный тип кольца или открыть азот-, серу- или галогенсодержащие каротиноиды. Необходимо также помнить, что полная характеристика каротиноида должна включать определение его стереохимии, и в первую очередь хиральности, поскольку в настоящее время известно, что «один и тот же» каротиноид может существовать в различных хиральных формах. Искусство химика проверяется также по способности разрабатывать новые методы синтеза, особенно стереоконтроли-руемого синтеза полиеновой цепи, и вводить хиральные концевые группы.
Возможно, самые трудные проблемы в области изучения каротиноидов связаны с их биохимией. Главные пути биосинтеза и последовательности реакций _\же хорошо известны, и предстоит определить лишь стереохимию и механизм некоторых из этих реакций. Однако особого внимания требуют исследования на ферментном уровне, не исключено, что ферменты организованы в связанные с мембранами комплексы, и это может создавать значительные методические трудности. До тех пор пока не будет достигнут прогресс в этой области, невозможно выяснить детали механизмов регуляции и контроля биосинтеза каротиноидов (особенно фоторегуляции). Что касается вопроса о происхождении каротиноидов у животных, то здесь не исключены сюрпризы; старая идея о том, что животные получают каротиноиды только с пищей, сейчас кажется несостоятельной. Животные способны модифицировать попавшие с пищей каротиноиды различными путями, в том числе с помощью стереохимических превращений. Исследование последних очень перспективно, несмотря на то что метаболические превращения обычно происходят медленно и в связи с этим их трудно обнаружить
Ассоциация каротиноидов с белками, в основном с образованием синих комплексов у морских беспозвоночных, — область, в которой можно ожидать прогресса уже в ближайшем будущем. Будучи интересными сами по себе, эти комплексы служат очень полезными моделями взаимодействия белка с небольшими липидными молекулами, и полученные при этом результаты будут представлять несомненную ценность для многих разделов биохимии. Микроокружение и белковые комплек
Гл 2 Каротиноиды
89
сы каротиноидов в разных тканях, особенно в фотосинтетических мембранах, — также важная область исследования. Полученные здесь результаты несомненно будут способствовать лучшему пониманию механизма фотосинтеза. Существует широкий простор для проверки оригинальных идей и исследований функций и механизма действия каротиноидов у различных видов живых организмов и в самых разных тканях.
Использование каротиноидов в качестве пищевых добавок, красителей и провитаминов А уже происходит в больших масштабах и, вполне вероятно, будет расширяться. Эго связано с }величением спроса на природные красители, которые часто предпочитают чисто синтетическим красящим веществам, а также с тем, что постепенно налаживается промышленное производство каротиноидов. В будущем не исключено открытие новых функций каротиноидов у животных, в том числе и у человека. Каротиноиды применяются и будут применяться в дальнейшем в медицине в их собственной роли, а не только в качестве предшественника витамина А.
2.14. Рекомендуемая литература
В качестве стандартного справочника может быть использована обширная монография под редакцией Ислера (Isler, 1971), поскольку она дает очень подробный обзор по химии, спектроскопии, биосинтезу, функциям и промышленному использованию каротиноидов. Эта книга очень хорошо дополняется двухтомной «Сравнительной биохимией каротиноидов» Гудвина (Goodwin, 1980), для которой характерен более биологический и биохимический подход. Первый том посвящен растительному (и микробному), а второй животному царству. «Химия и биохимия растительных пигментов» (под ред Гудвина; Goodwin, 1976) содержит хотя и не всеобъемлющие, но чрезвычайно полезные статьи по химии (Moss, Weedon), распространению в природе (Goodwin) и биосинтезу (Britton) каротиноидов. Более старые работы Фокса (Fox, 1953), Цехмейстера (Zechmeister, 1962), Каррера и Юкера (Karrer, Jucker, 1950) содержат информацию, которая также может быть полезной.
Химия и биохимия каротиноидов ежегодно освещается исчерпывающими литературными обзорами в серии «Терпеноиды и стероиды», издаваемой в рамках серии «Chemical Society’s Specialist Periodical Reports» (например, Britton, 1979), и в выходящих раз в три года публикациях трудов Международного симпозиума по каротиноидам (1966, 1969, 1972, 1975, 1978, 1981) (см. Plenary and Session Lectures, 1967, 1969, 1973, 1976, 1979, 1982).
90
Часть I. Химические и биохимические аспекты
Каротинопротеины специально обсуждаются в обзорах Чиз-мана и др. (Cheesman et al., 1967), Загальского (Zagalsky, 1976) и Бриттона (Симпозиум по каротиноидам, Britton, 1981); много статей по этому вопросу собрано в книге Ли (Lee, 1977).
Обзор использования каротиноидов в медицине был представлен Мэтьюз-Ротом, (Mathews-Roth, 1981) в трудах Симпозиума по каротиноидам, а возможная роль каротиноидов в предотвращении рака обсуждается в работе Пето и др. (Peto et al., 1981). Методы, полезные для работы с каротиноидами, описаны в ряде обзоров (Britton, Goodwin, 1971; Davies, 1976, Liaaen-Jensen, Jensen; 1965; Liaaen-Jensen, 1971).
2.15. Дополнительная литература
Britton G. (1976). Biosynthesis of carotenoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 262, London, New York and San Francisco, Academic Press.
Britton G. (1979). Carotenoids and polyterpenoids. In: Specialist Periodical Reports: Terpenoids and steroids, vol. 9, ed. J. R. Hanson, p. 218, London, The Chemical Society.
Britton G-, Goodwin T. W. (1981). Biosynthesis of carotenoids, Methods Enzy-mol., 180, 654.
Cheesman D. F., Lee IF. L., Zagalsky P. F. (1967). Carotenoproteins in invertebrates, Biol. Rev., 42, 131.
Davies В. H. (1976). Carotenoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 2, ed. T. W. Goodwin, p. 38, London, New York and San Francisco, Academic Press.
Fox D. L. (1953). Animal biochromes and structural colours. Cambridge University Press.
Goodwin T. IF. (1952). The comparative biochemistry of carotenoids, London, Chapman and Hall.
Goodwin T. IF. (1976). Distribution of carotenoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 225, London, New York and San Francisco, Academic Press.
Goodwin T. IF. (1980). The comparative biochemistry of the carotenoids, 2nd
Edition, vol. 1, London, Chapman and Hall. (Vol. 2, in press.)
Isler O. (ed.) (1971). Carotenoids, Basel and Stuttgart, Birkhauser-Verlag.
Karrer P„ Jucker E. (1950). Carotenoids (trans. E. A. Braude), Amsterdam, Elsevier.
Lee IF. L. (1977). Carotenoproteins in animal coloration, Stroudsberg, USA, Dowden, Hutchinson and Ross.
Liaaen-Jensen S. (1971). Isolation, reactions. In: Carotenoids, ed. O. Isler, p. 61, Basel and Stuttgart, Birkhauser-Verlag.
Liaaen-Jensen S., Jensen A. (1965). Recent Progress in carotenoid chemistry, Prog. Chem. Fats other Lipids, 8, 129.
Moss G. P., Weedon В. C. L. (1976). Chemistry of the carotenoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 149, London, New York and San Fancisco, Academic Press.
Peto R., Doll R„ Buckley J. E., Sporn M. B. (1981). Can dietary bets-carotene materially reduce human cancer rates? Nature, 290, 201.
Plenary and Session Lectures, First International Symposium on Carotenoids other than vitamin A 1966(1967), Pure Applied Chem., 14, 227. Also published as Carotenoids other than vitamin A-L, London, Butterworth.
Гл. 2. Каротиноиды
91
Plenary and Session Lectures. Second International Symposium on Carotenoids other than vitamin A (1969), Pure Applied Chem., 20, 365. Also published as Carotenoids other than vitamin A-II, London, Butterworth.
Plenary and Session Lectures, Third International Symposium on Carotenoids other than vitamin A, 1972 (1973), Pure Applied Chem., 35, 1. Also published as Carotenoids other than vitamin A-III, London, Butterworth.
Plenary and Session Lectures, Fourth International Symposium on Carotenoids, 1975 (1976), Pure Applied Chem., 47, 97. Also published as Carotenoids-4 (Berne, 1975), ed. В. C. L. Weedon. Oxford: Pergamon.
Plenary and Session Lectures, Fifth International Symposium on Carotenoids, 1978 (1979), Pure Applied Chem., 51, 436—675, 857—887. Also published as Carotenoids-5 (Madison, 1978), ed. T. W. Goodwin, Oxford, Pergamon.
Plenary and Session Lectures, Sixth International Symposium on Carotenoids 1981. Published (1982) as Carotenoid chemistry and biochemistry, eds. G. Britton and T. W. Goodwin, Oxford, Pergamon.
Zagalsky P. F. (1976). Carotenoid-protein complexes, Pure Applied Chem., 47, 103.
Zechmeister L. (1962). Cis-trans isomeric carotenoids, vitamin A and arylpolyenes, Vienna, Springer.
Глава 3
Хиноны
3.1. Введение
Хиноны представляют собой большую и довольно гетерогенную группу соединений. Их окраска варьирует от бледно-желтой через оранжевую, красную, пурпурную и коричневую до почти черной. Они являются важными пигментами у ряда грибов, лишайников и некоторых групп беспозвоночных животных. Хиноны широко распространены также у высших растений, но, как правило, содержатся в тканях, которые обычно не видны, например в коре, ядровой древесине и корнях. Они редко вносят заметный вклад в наружную окраску высших растений. Некоторые хиноны, однако, являлись основой важнейших красителей еще в античные времена, например хны и марены.
Некоторые изопренилированные хиноны, например убихинон, менахинон, филлохинон и пластохинон, представляют собой чрезвычайно важные биологические молекулы. Те или иные из них можно обнаружить во всех живых тканях, но они не являются пигментами и потому подробно рассматриваться не будут.
3.2. Строение
Основная хиноновая структура представляет собой ненасыщенный циклический дикетон, являющийся производным моноциклического или полициклического ароматического углеводорода. Хиноновые структуры формально могут быть получены окислением соответствующих дигидроксифенолов. Так, простейшими примерами служат орто- пли 1,2-бензохинон (3.1) и пара- или 1,4-бензохинон (3.2)—производные бензола, которые могут рассматриваться как продукты окисления дигидроксифенолов пирокатехина (3.3) и гидрохинона (3.4) соответственно.
Хиноны могут происходить от различных ароматических углеводородов и соответственно получают свои названия и порядок нумерации углеродных атомов от исходного углеводорода. Так, показанные ниже производные нафталина (3.5) и (3.6) называются соответственно 1,2- и 1,4-нафтохиноном. Из нес-
Гл. 3. Хиноны
93
кольких возможных антрахиноновых структур в природных пигментах часто встречается только 9,10-хиноновая структура (3.7), хотя иногда обнаруживаются и производные, содержащие 1,2-хиноновую структуру.
(3.4) Хинол
(3 2) 1,4-Бензохинон
(3.6) 1,4 Нафтохинон
(3.7) 9,10-Ан+рахннон
(3.8) 2,6-Нафтохинон
Хиноновая система не обязательно ограничена одним кольцом. Две кетогруппы могут находиться в разных кольцах, но они должны быть сопряжены с соответствующей л-электронной системой для того, чтобы образовалась растянутая хиноновая структура. Одним из простейших примеров такой структуры служит 2,6-нафтохинон (3.8). Примеры сложных структур, включающих растянутые хиноновые системы, можно встретить среди пигментов тлей (афинов; разд. 3.4.4).
Наиболее широко распространенными и имеющими наибольшее значение как пигменты являются 1,4-нафтохиноны и 9,10-антрахиноны, однако в последующем обзоре нам встретится и несколько других хиноновых структур.
В природных хиноновых пигментах основной хиноновый скелет обычно содержит замещающие группы; наиболее часто
•94
Часть I. Химические и биохимические аспекты
встречаются среди них метильные, гидрокси- и метоксигруппы. Фенольные гидроксигруппы могут быть гликозилированы (особенно у высших растений). Некоторые из более сложных хинонов имеют длинные боковые цепи, которые в ряде случаев могут складываться в добавочные кольца. Другие сложные хиноны могут рассматриваться как димеры обычных простых нафтохиноновых и антрахиноновых структур.
Структура некоторых из наиболее важных встречающихся в природе хинонов приведена в последующих разделах этой главы.
3.3. Свойства
3.3.1. Химические свойства
Хиноны представляют собой скорее сопряженные циклические дикетоны, чем ароматические системы. Однако они в значительной степени стабилизируются за счет образования резонансных заряженных ароматических структур (рис. 3.1). Как травило, 1,2-хиноны менее стабильны, а потому более реакционноспособны, чем 1,4-хиноны или растянутые хиноновые системы.
О О о+
Рис. 3.1. Вклад заряженных ароматических структур в стабилизацию хинонов.
Наиболее характерной химической реакцией для хинонов является обратимое восстановление до соответствующего фенола. Так, 1,2-бензохинон (3.1) и пирокатехин (3.3) или 1,4-бензохинон (3.2) и гидрохинон (3.4) легко превращаются друг в друга. Относительно малозамещенные хиноны, особенно 1,2-хиноны, чрезвычайно подвержены полимеризации, протекающей по свободнорадикальному механизму.
Многие природные хиноны имеют фенольные ОН-группы и как следствие слегка кислую реакцию. Благодаря этому они способны к ионизации и образованию солей в щелочной среде. Это свойство особенно ярко выражено в случае гидроксибензо-гхинона (3.9) и 2-гидрокси-1,4-нафтохинона (3.10).
Гл. 3. Хиноны
95
3.3.2. Физические свойства
Почти все природные хиноны представляют собой твердые вещества и легко кристаллизуются. Большинство из них хорошо растворимы в органических растворителях, тогда как гликозиды и некоторые карбоновые кислоты способны растворяться в воде. Хиноны, которые одновременно являются фенолами или карбоновыми кислотами, растворимы в щелочных водных растворах.
Высшие полициклические хиноны ведут себя подобно полимерам и довольно трудно растворяются в водной или органической среде.
3.3.3. Поглощение света
Детальное теоретическое объяснение светопоглощающих свойств хинонов лежит вне круга тем, затронутых в этой книге. Однако краткое описание спектров поглощения хинонов-и обсуждение факторов, которые влияют на их максимум поглощения, существенны для оценки значения этих соединений как пигментов.
Спектры поглощения прародительских хинонов приведены на рис. 3.2. Наиболее простой спектр — спектр 1,4-бензохино-на — имеет интенсивную полосу поглощения (Z) при ~ 240 нм, полосу «электроннотранспортного перехода» средней интенсив
(3.9) Гидроксибензохинон
(3.10) 2-Гидрокси-1,4-нафтохииоИ
ности (ZZ) при ~285 нм и лишь слабое хиноидное п—»-л*-пог-лощение в видимом диапазоне при ~434 нм (полоса III). Длят нестабильного 1,2-бензохннона максимумы поглощения находятся при значительно более высоких значениях длин волн: для полос II и III при 375 и 586 нм соответственно. Хиноидные' п—>л*-переходы «запрещены», и поэтому полоса поглощения III имеет низкую интенсивность. Хотя хиноны поглощают свет в видимой области спектра, это поглощение слишком мало,, чтобы они выглядели окрашенными. Правда, последнее возможно при очень высоких концентрациях хинонов.
96
Часть I. Химические и биохимические аспекты
Спектры нафтохинонов, антрахинонов и высших хинонов отличаются значительно большей сложностью благодаря присутствию в них полос поглощения, обусловленных бензеноид-ными переходами в дополнение к хиноидному поглощению. Главные полосы поглощения 1,4-нафтохинона локализованы при 245, 257 и 335 нм, а у антрахинона — при 243, 263, 332 и •405 нм (рис. 3.2).
Рис. 3.2. Главные полосы поглощения в электронных спектрах 1,2-бензохи-нона (Л), 1,4-бензохинона (Б), 1,4-нафтохинона (В) и антрахинона (Г). По оси ординат отложены приблизительные величины поглощения (логарифмическая шкала) для каждого соединения, поэтому сравнивать между собой относительные интенсивности полос поглощения различных соединении не следует.
Заместители очень сильно влияют на спектры хинонов. Правда, при введении заместителя в молекулу 1,4-бензохинона полосы / и III почти не изменяются, но полоса II претерпевает значительный «красный сдвиг» (в порядке усиления влияния заместителя) на 27 нм для СН3, 69 нм для ОСН3 и 81 нм для ОН. Влияние второго заместителя менее значительно. В результате замещения полоса поглощения II может оказаться сдвинутой в видимый диапазон спектра и соединение станет окрашенным.
В случае нафтохинонов (рис. 3.3) замещение в хиноновом кольце оказывает слабое действие на положение максимумов поглощения, в то время как замещение в ароматическом кольце, особенно ОН-группами, вызывает батохромный эффект и
Гл. 3. Хиноны
97
Рис. 3.3. Спектры поглощения 1,4-нафтохинона (/), 5-гидрокси-1,4-нафтохи-нона (II) и 5,8-дигидрокси-1,4-нафтохинона (III). Величины поглощения (логарифмическая шкала) даны приблизительно, и для различных соединений сравнивать их не следует.
некоторые УФ-полосы поглощения сдвигаются в видимый диапазон. 77ери-гидроксилирование( например, в положениях 5 и 8 у 1,4-нафтохинона) дает наиболее ощутимый эффект, бензе-ноидная полоса при этом сдвигается почти на 100 нм [напри-
(3,11а) Н; 5-Гидрокси-1,4-нафтохинон
(3,11b) R=OH, 5,8 дигидрокси-1,4-нафтохиноН
мер, у 5-гидрокси-1,4-нафтохинона (3.11а) с 335 до 429 нм]. Нафтазарины (3.11b) с двумя пери-гидроксигруппами обладают сильным многополосным бензеноидным поглощением при 525 нм. Эта структура образует основу спинохромов — интенсивно окрашенных пигментов, найденных у иглокожих (разд. 3.4.2).
7—84
98 Часть I. Химические и биохимические аспекты
Сходным образом у антрахинонов наблюдается сложное бензеноидное поглощение. У них на максимум поглощения доминирующее влияние оказывает присутствие ОН- и алкоксигрупп, особенно в случае наличия нескольких заместителей. Влияние «-гидроксилирования более значительно, чем Р-гидро-ксилирования (за исключением тех случаев, когда р-гидрок-сильная группа находится в положении, соседнем к «-гидроксильной) .
В щелочной среде гидроксипроизводные хинонов способны ионизироваться, что приводит к значительным батохромным
сдвигам. Такие «щелочные сдвиги» имеют большое диагностическое значение, особенно в рядах нафтохинонов и антрахинонов. Так, например, анион 2-гидрокси-1,4-нафтохинона (3.12) имеет оранжевую окраску (ХШах = 459 нм). Сходным образом анион 5-гидрокси-1,4-нафтохинона окрашен в фиолетовый цвет (%тах = 538 нм), а у 2,4-, 5,6- и 5,8-дигидрокси-1,4-нафтохино-нов — в синий (/.max=650, 571 и 655 нм соответственно). Другим полезным диагностическим свойством является то, что восстановление до гидрохинонов (при помощи обработки NaBH4) приводит к образованию ароматической системы, спектр которой относится к бензеноидному типу.
Спектры поглощения хинонов обычно измеряют в этаноле; в тех же случаях, когда используются другие растворители, например хлороформ, значения 7imax несколько отличаются от стандартных. Таблицы максимумов поглощения природных -и модельных хинонов приведены в монографии Томсона (Thomson, 1971), в которой также обсуждаются их ИК-, ЯМР- и масс-спектры.
3.4. Распространение в природе
Окрашенные хиноны обнаружены главным образом у высших растений, грибов и бактерий, а в животном царстве — у членистоногих и иглокожих. Хиноны очень легко образуются окислением соответствующих гидрохинонов. Во многих случа
Гл. 3. Хиноны
99
ях выделяемые хиноны могут быть артефактами, возникающими вследствие процедуры экстракции или высушивания растений или растительных тканей на воздухе.
3.4.1. Бензохиноны
Из природных источников, главным образом из грибов и различных тканей высших растений, было выделено около 100 бензохинонов, из которых почти все являются 1,4-бензохи-нонами. К бензохинонам принадлежат и такие важные в биологическом отношении молекулы, как пластохинон (3.13) и убихинон (3.14). Образцы убихинонов обычно получают в виде смесей молекул с различной длиной изопреноидной цепи (изо-
(3,13) Пластохинон
(3 14) Убихинон-п
пренилогов). В определенной ткани или у того или иного вида обычно преобладает один из изопренилогов. Наиболее часто встречаются убихинон-9 и убихинон-10 с девятью и десятью изопреновыми остатками соответственно. В целом бензохиноны не являются сильно окрашенными соединениями и не вносят сколько-нибудь ощутимого вклада в природную окраску организмов.
3.4.2. Нафтохиноны
Природные нафтохиноны включают витамины К, фил-лохинон (3.15) и менахинон (3.16) —широко распространенные и важные в биологическом отношении молекулы, которые, однако, не являются пигментами. Эти вещества имеют одно и то же нафтохиноновое ядро, но различные изопреноидные боковые цепи. Филлохинон (витамин Ki) из высших растений имеет фитольную боковую цепь, тогда как бактериальные менахиноны (витамин Кг), подобно убихинонам, различаются длиной боковой цепи. Чаще всего встречаются соединения с шестью-девятью изопреновыми единицами. Распространение других нафтохинонов в растениях систематически не изучалось. 1,4-Наф-тохиноны время от времени обнаруживают в различных тканях высших растений — в листьях, цветках, плодах, корнях, коре 7*
100
Часть I Химические и биохимические аспекты
и древесине. Среди наиболее известных примеров можно назвать юглон (3.17) и его производные из зеленых частей грецкого ореха (Juglans regia), а также лавсон (3 18) из лосонии, или хенны (Lawsonia alba). 1,4-Нафтохиноны иногда обнаруживаются также в грибах, например моллисин (3.19)—желтый пигмент из культур Mollisia fallens Другие нафтохиноны (1,2-, 1,5- и 2,6 ) в природе встречаются редко.
(3 17) Юглон
(3 16) Менахинон п
(3 18) Лавсон
(3 19) Моллисин
Спинохромы. В животном царстве около 20 близких по строению сильно окрашенных красных, пурпурных или синих нафтохиноновых пигментов было найдено у иглокожих, главным образом у морских ежей, а также у морских звезд и офи-ур. Эти соединения, известные как спинохромы или эхинохромы, были впервые выделены из кальцинированных частей животных, например из игл панциря морских ежей Однако они также содержатся в полостной жидкости, яйцах и внутренних органах. Большинство видов синтезируют смесь из шести и более пигментов, которые содержатся в иглах и в панцирях главным образом в виде кальциевых и магниевых солей, а в дру
Гл 3 Хиноны
10]
гих тканях, возможно, в виде комплексов с белками В структурном отношении эти пигменты иглокожих представляют собой высокозамещенные и сильно оксигенированные производные юглона или нафтазаринов
Широкое использование тривиальных названий спинохромов часто приводит к недоразумениям, поскольку все главные соединения имеют по нескольку синонимов. Названия спино-
R1 R2 R3
]3 20) Спинохром А ОН И СОМе 3 ацетил 2 7 дигидроксинафтазарин
(3 21) Спинохром В н н ОН 2 3 7 тригидроксиюглон
(3 22) Спинохром С он он СОМс 3 ацетил 2 6 7 три идроксинафтазарин
]3 23) Спинохром D он н ОН 2 3 6 тригид оксинафтазарин
(3 24) Спинохром Е он он ОН 2 3 6 7 тетрагидроксинафтазарин
(3 25) Эхинохром А он СН2СН3 ОН 6 этил-2 3 7 тригидроксинафтазарин
Рис 3 4 Структура и номенклатура некоторых спинохромовых и эхинохромовых пигментов
хромы А—Е и эхинохром А присвоены в настоящее время шести главным членам этой группы веществ, однако лучше применять полусистематическую номенклатуру, согласно которой пигменты называют как замещенные юглоны и нафтазарины. Структуры (3 20—3 25) и полусистематические названия этих главных соединений приведены на рис 3 4
3.4.3. Антрахиноны
Антрахиноны являются самой большой группой природных хинонов В растениях, грибах и лишайниках найдено почти 200 представителей этой группы Наиболее широко распространенным антрахиноном является, вероятно, эмодин (3 26), который был выделен из плесневых и высших грибов, лишайников, цветковых растений и насекомых. Однако в свежесобранных растительных тканях содержится очень мало эмодина или он вообще отсутствует. В большинстве случаев (если не во всех) при разрушении или высушивании тканей в собст
102
Часть I. Химические и биохимические аспекты
венно эмодин легко превращаются содержащиеся в тканях in vivo гликозиды эмодина или восстановленные (гидрохиноновые) формы этих гликозидов. Наиболее известным антрахиноном высших растений является, по-видимому, ализарин (3.27) — главный пигмент марены, Rubio, tinctorium, получаемый из измельченных корней растения. Ализарин был, вероятно, самым важным красителем в античные времена.
Антрахиноны животных. Некоторые насекомые отряда Сос-cidae окрашены антрахинонами. Большинство этих пигментов представляют собой карбоновые кислоты, и некоторые из них, главным образом С-глюкозид карминовой кислоты (3.28) —
(3 26) Эмодин
(3.27) Ализарин
карминово-красное красящее вещество кошенили — и красная кермезиновая кислота (3.29), используются в качестве красителей уже в течение многих веков.
Недавно было обнаружено, что окраска группы австралийских криноид (морских лилий) обусловлена красными или пурпурными антрахинонами, такими, как родоптилометрин (3.30), и сходными пигментами, имеющими в положении 4 антрахиноновой системы колец длинную боковую цепь. Эти вещества весьма сходны с некоторыми антрахиноновыми метаболитами грибов. Галлахром — пигмент некоторых многощетинковых червей — интересен как пример редкой 1,2-антрахиноновой структуры (3.31).
Антрациклиноны. Антрациклиноны из культур некоторых стрептомицетов явно близки к тетрациклиновым антибиотикам. Структурно, однако, они могут рассматриваться как замещенные антрахиноны, например аклавинон (3.32).
3.4.4. Высшие хиноны
Среди высших или более сложных хинонов интересны главным образом афины, изучавшиеся наиболее интенсивно. Афины являются производными протоафинов, которые содержатся в гемолимфе различных тлей. Совершенно очевидно,
Гл. 3. Хиноны
103
что протоафины, например (3.33), являются производными нафтохинонов. После гибели насекомого протоафин превращается в стабильный конечный продукт красного цвета эритро-афин (3.34) через менее стабильные промежуточные соединения, такие, как желтый ксантоафин (3.35) и оранжевый хризо-
(3 29) Кермезиновая кислота
(3 28) Карминовая кислота
(3.30) Родоптилометрин
(3 31) Галлахром
(3 32) Аклавинон
афин (3.36). Разные виды тлей синтезируют разные прото-, ксанто-, хризо- и эритроафиновые структуры с различной стереохимией. Приведенные выше афины представляют собой пигменты, впервые выделенные из Aphis fabae (бобовой тли). Все они являются высшими хинонами, в молекулах которых две карбонильные группировки разделены значительным расстоянием в сложной полициклической сопряженной структуре.
Другими интересными сложными хинонами являются гиперицин (3.37), содержащийся в растениях рода Hypericum (разд. 3.7.2), и несколько соединений, известных как фринге-
(3.37) Гиперицин
(3.38) Фрингелит
Гл. 3. Хиноны
105
литы, например (3.38), который был найден в ископаемых криноидах юрского периода. Гиперицин и фрингелиты представляют собой димеры антрахинонов.
3.5. Вклад в окраску
Изопренилированные хиноны убихинон, пластохинон и т. п., которые обнаруживаются у всех высших растений, не принимают участия в формировании окраски этих растений. Другие хиноны, особенно нафтохиноны и антрахиноны, чрезвычайно широко распространены в различных тканях высших растений, но и они редко вносят существенный вклад в их окраску. В то же время они часто обусловливают окраску,-обычно желтую, оранжевую или коричневую, плесневых и высших грибов, а также лишайников.
Только в животном царстве были обнаружены наиболее' характерные примеры окрашивания хинонами. Так, спинохромы и эхинохромы придают пурпурную, синюю или зеленую' окраску большинству морских ежей; красиво окрашенные декоративные представители некоторых видов морских ежей часто выставляются дома. Антрахиноновые кислоты обусловливают красную окраску некоторых щитовок и приготавливаемого из них пищевого красителя кошенили. Протоафины, содержащиеся в гемолимфе многих видов тлей, при биологических значениях pH ионизированы и образуют фиолетово-красные анионы, которые главным образом и обусловливают темную окраску гемолимфы. После гибели насекомых ферменты гемолимфы превращают протоафины в стабильные окрашенные продукты — афины, которые и придают посмертную окраску насекомым. Афины характерны для темноокрашенных видов тлей, тогда как хорошо известная зеленая тля, не содержащая в гемолимфе афинов, содержит близкие им соединения — водорастворимые гликозиды афанины, имеющие зеленую окраску.
3.6. Биосинтез
3.6.1. Введение
При биосинтезе пигментов любого класса для создания основной структуры используется один главный путь1. Различные индивидуальные соединения образуются затем с помощью последующих модификаций основной структуры.
1 В биосинтезе флавоноидных пигментов (разд. 4) всегда используются два главных биогенетических пути (шикиматный и поликетидный). —-Прим, ред.
106
Часть I. Химические и биохимические аспекты
В случае же хинонов этого не происходит: они представляют собой биосинтетически гетерогенную группу веществ. Как выражение крайнего случая, различные организмы могут синтезировать один и тот же хинон с помощью различных биосинтетических путей.
Большинство хинонов образуются по одному из двух главных путей. В некоторых случаях образование углеродного скелета идет по третьему главному пути. Эти же три главных пути обеспечивают образование всех основных групп хинонов, т. е. бензохинонов, нафтохинонов, антрахинонов и высших хинонов.
Число индивидуальных хинонов, для которых был бы исследован биосинтез, очень невелико. Во многих случаях путь биосинтеза хинона был просто выведен исходя из структурных соображений. И потому положение вещей в этой области Томсон образно назвал «кучкой фактов, поддерживающих гору спекуляций» (Thomson, 1971).
3.6.2. Общие соображения
Хиноны представляют собой окисленные ароматические соединения, и потому не удивительно, что они могут синтезироваться посредством главных путей, с помощью которых обычно образуются ароматические соединения. Этими путями являются поликетидный путь из ацетата и малоната и шикиматный путь биосинтеза. В случае некоторых нафтохинонов и антрахинонов синтез идет по третьему главному пути — изопреноидному. К сожалению, наши знания биосинтеза хинонов еще слишком фрагментарны для того, чтобы сделать даже самые общие выводы о регулирующих этот процесс факторах.
Поэтому в данном разделе будет представлено только самое общее описание важнейших реакций основных биосинтетических путей. Вместе с тем здесь будут приведены некоторые из наиболее важных и хорошо документированных примеров.
3.6.3. Поликетидный путь
Возможно, наиболее часто используется для биосинтеза хиноновых пигментов поликетидный путь. Этот процесс, довольно близкий к ступенчатому удлинению цепи при биосинтезе жирных кислот, приведен на рис. 3.5. На первой стадии конденсация ацетил-СоА и малонил-СоА дает ацетоацетил-СоА. В отличие от биосинтеза жирных кислот образующаяся кетогруппа на этой стадии не восстанавливается. Вместо этого процесс удлинения цепи продолжается путем добавления С2-фрагментов из малонил-СоА до тех пор, пока не достигается требуемая
Гл. 3. Хиноны
107
„SCoA ч сн3—со
ООС
Ацетил СоА
CH2.CO.S Со А
Малонил СоА
СН3.СО.СН2-СО
SCo А О0С s Со А ООС
СН2. СО ( С1
Ацетоацетил
2 Малонил СоА
' СН3.СО.СН2.СО-СН2-СО.СН2.СО.S Со А
Рис. 3 5 Главный поликетидный путь биосинтеза фенолов и хинонов.
длина цепи. Такая система из чередующихся СО- и СН2-групп называется поликетидной системой.
Когда молекула поликетида соответствующим образом изгибается, может происходить циклизация, протекающая путем удаления молекулы воды от соответствующим образом расположенных СО- и СН2-групп, что и приводит к образованию ароматической или хиноновой молекулы.
Картина распределения кислородсодержащих функций через один углеродный атом часто может служить отличительной особенностью молекул, образовавшихся по этому пути, хотя добавление или удаление .замещающих групп часто маскирует тот факт, что данное вещество было синтезировано по полике-тидному пути. Образование хинона по поликетидному пути можно показать с помощью опытов по включению ацетата (или малоната), меченного радиоактивными или стабильными изотопами, а способ изгиба поликетидной молекулы можно выяснить, изучая продукты расщепления меченой молекулы.
108
Часть I. Химические и биохимические аспекты
(3 39)
(3 40) Орселлиновая кислота
(3 41) Спинулозин
Рис. 3.6. Поликетидиый механизм биосинтеза бензохинона спинулозина.
<3 42)
(3 43) Яваницин
.Рис. 3.7. Образование нафтохинона яваницина из гептаацетилполикетида.
Бензохиноны. Простым примером биосинтеза соединений бензохиноновой группы служит синтез грибного метаболита спинулозина (3.41), который образуется из тетраацетатного поликетида (3.39) через орселлиновую кислоту (3.40) (рис. ,3.6).
Нафтохиноны. Для нафтохиноновой группы хинонов в экспериментах по включению меченного ацетата или малоната культурой плесневого гриба Fusarium javanicum было установлено, что яваницин (3.43) образуется из гептаацетильного поликетида (3.42), как это показано на рис. 3.7. Необычно происходящее при этом восстановление терминальной карбоксильной труппы до метильной. Менее простым примером служит образование моллисина (3.19)—другого грибного метаболита, про
Гл. 3. Хиноны
109
дуцируемого культурой Mollisia caesia. Здесь биосинтез опять-таки происходит из ацетата и малоната, но в этом случае образуются две поликетидные цепи — одна из трех, а другая из четырех Сг-фрагментов, а не одна более длинная цепь.
(3 26) Эмодин
Рис. 3.8. Биосинтез антрахинона эмодииа из октаацетилполикетида.
Антрахиноны. Вероятно, многие, а возможно, и большинство антрахинонов, особенно антрахиноны типа эмодина (3.26), также синтезируются по поликетидному механизму. Считается, что сам эмодин образуется путем соответствующего изгиба и конденсации октаацетилполикетидной цепи, как показано на рис. 3.8. Введение или удаление замещающих групп на позд-
0MS) л«м>«ммм* immdrD
110
Часть 1. Химические и биохимические аспекты
них стадиях биосинтеза может затем давать начало ряду природных эмодинподобных хинонов. Для объяснения биосинтеза других антрахинонов, таких, как пигмент лишайников солори-новая кислота (3.44) и хинон насекомых лаккаиновая кислота D (3.45), необходимы альтернативные способы изгиба поли-кетидной цепи.
(3 46) б Пирромицинон
Рис. 3.9. Образование антрациклинона е-пирромициноиа из поликетида.
Высшие хиноны. Многие их хинонов с более крупными молекулами, особенно хиноны, образуемые грибами, также, по-видимому, синтезируются по ацетатно-малонатному пути. Изотопные исследования показали, что антрациклинон е-пирроми-цинон (3.46) образуется из девяти ацетатных (малонатных) фрагментов и одного пропионатного остатка, который служит в качестве затравки и на котором формируется вся цепь (рис. 3.9).
3.6.4. Шикиматный путь
Другой главный путь биосинтеза ароматических соединений и хинонов связан с промежуточным образованием шикимовой кислоты (3.47). Это путь, по которому синтезируются важные, хотя и неокрашенные клеточные компоненты — убихинон, менахинон, филлохинон и пластохинон. Фактически основные детали этого пути биосинтеза хинонов выяснены в результате исследований образования убихинона и менахино-
Гл. 3. Хиноны
111
МеПбопизм ’углеводов
соон
I с=о
I — сн,
I 2 -
но—с—н н—с—он н-с—он сн2о—®
(3 49) 5 Дегидрохинная кислота
5 ДегидрошиКймошЯЙ кислота
(3 47) Шикимовая кислота
(3 50) 5 Фосфошикимовая
(Енолпируватныи эфир)
кислота
(3 52* Хоризмовая кислота
(3 53) Префеновая кислота
Рис. 3.10. Начальные стадии шикиматного пути биосинтеза фенольных соединений и хинонов.
на. Многие окрашенные хиноны, и в первую очередь Мафтохи-ноны, также синтезируются по этому пути. С шикиматом мы еще встретимся как с промежуточным иродуктом прж биосинтезе флавоноидных пигментов (гл. 4).
Подробно начальные стадии шикиматного пути приведены на рис. 3.10. Предшественники из общего метаболического
112
Часть I Химические
и
*ские аспекты
(3 55) Гомогентизиновая кислота
Рис 311 Биосинтез бензохиноновогб кольца убихинона Для введения пре нильной боковой цепи и метильного и метоксильных заместите чей возможны несколько альтернативных последовательностей реакций Другие бензохиноны могут синтезироваться сходным образом из шикимата через п гидроксибензоат или гомогентизат
фонда углеводов дают начало С7-сахару, а именно 7-фосфату З-дезокси-О-арабиногептулозоновой кислоты [ФДАГК (3 48)], который затем подвергается циклизации с образованием 5-де-гидрохинной кислоты (3.49) Последняя превращается в шики-мовую кислоту (3 47) и далее в 5-фосфошикимовую кислоту (3 50) Присоединение следующего С3-фрагмента [в виде фос-фоенолпирувата (3 51)] к 5-фосфошикимовой кислоте дает хоризмовую кислоту (352), которая после внутримолекулярной перегруппировки превращается в префеновую кислоту (3 53) Эти чрезвычайно важные промежуточные соединения являются предшественниками ароматических аминокислот триптофана, фенилаланина и тирозина, флавоноидных пигментов и многих
hooc.ch(nh2).ch2-ch2-cooh (3 56) Глутаминовая кислота
Юг тон
Рис 3 12 Вероятные пути биосинтеза нафтохинонов в том числе менахчно-на, филлохинона, лавсона и юглона, из шикимата ТПФ — тиаминпирофосфат.
8—84
314
Часть I Химические и биохимические аспекты
природных продуктов с ароматической структурой Природные хиноны образуются как через префеновую кислоту, так и из более ранних предшественников, таких, как шикимовая или хо-ризмовая кислоты.
Бензохиноны. Бензохиноновое кольцо убихинона образуется из шикимата через хоризмат (3.52) и п-гидроксибензоат (3 54) (рис 3 11) Возможно, что некоторые другие природные бензохиноны синтезируются из шикимата либо вышеуказанным путем через /г-гидроксибензоат, либо через гомогентизат (3.55) или даже через С6-С3-коричные кислоты (гл. 4). Однако экспериментальные данные для подтверждения этой гипотезы отсутствуют
Нафтохиноны. Роль шикимата в биосинтезе хинонов наилучшим образом изучена на примере нафтохинонов. Выяснены -основные детали пути образования менахинона, филлохинона, лавсона (3 18) и юглона (3 17) (рис 3 12). В опытах с введением меченых предшественников было показано, что шикимат включается в молекулу хинона в виде интактного Су-фрагмента, образующего бензеноидное (А) кольцо и одну из хиноновых карбонильных групп. Три остальных углеродных атома происходят из некарбоксильных углеродных атомов глутамата (3 56) или р-кетоглутарата (3 57). Ключевым промежуточным соединением является, по-видимому, о-сукцинилбензоат (3.58), образующийся в результате присоединения к шикимату тиаминпирофосфатного производного полуальдегида янтарной кислоты (образовавшегося из глутамата или p-кетоглутарата). Конечные стадии, во время которых о-сукцинилбензоат превращается в лавсон, юглон и родственные хиноны, пока не выяснены. Считается, что собственно 1,4-нафтохинон (3.59) и, возможно, также 1,4-нафтогидрохинон (3 60) являются промежуточными продуктами биосинтетического пути, ведущего к образованию логлона В биосинтезе менахинона участвуют нафтилкарбоновая кислота (3.61) и 2-метилнафтохинон [менадион (3.62)].
3.6.5. Мевалонатный путь
Путь через мевалоновую кислоту, очевидно, используется для получения полиизопреноидных боковых цепей убихинона, менахинона и т. п Известны также примеры использования коротких изопреноидных заместителей (С5 или Сю) в промежуточных продуктах для введения недостающих углеродных атомов в систему колец нафтохинонов или антрахинонов. Образующиеся при этом нафтохиноны и антрахиноны являются, таким образом, с биосинтетической точки зрения замещен-лыми бензохинонами и нафтохинонами соответственно.
00
Шикигизт ---------
(3 47)
(3 64) п Гидроксифенилпируват
о
(3 63) Химафилин
Рис 3.13 Биосинтез иафтохииоиа химафилина при говместном участии шикиматиого и мевалонатного путей.
116
Часть I. Химические и биохимические аспекты
Нафтохиноны. Мевалонатный путь биосинтеза нафтохинонов используется растениями сем. Pyrolaceae. Именно по этому пути синтезируется химафилин (3 63). Хиноновое кольцо (В) этого соединения образуется, как и у бензохинонов, обычным путем из шикимата. Недостающие же атомы бензеноидного кольца А и метильный заместитель образуются из мевалоната. Вероятный путь биосинтеза химафилина приведен на рис. 3.13. Он включает перегруппировку п-гидроксифенилпирувата (3.64) в гомогентизат (3.55), который затем превращается в гомоар-
(3 68) Алканнин
Рис. 3.14. Образование пренилироваииого нафтохинона алканнина нз л-гид-роксибеизоата (шикиматный путь) и геранилпирофосфата (из мевалоната)
«бутин (3.65). Пренилирование последнего дает замещенный гидрохинон (3.66), который циклизуется в гидрохиноновую форму химафилина (3 67). Последняя окисляется далее в собственно химафилин. В настоящее время выделены (в виде глюкозидов) почти все промежуточные продукты этого предполагаемого биосинтетического пути.
В случае алканнина (3.68), полученного из корней представителей сем. Boraginaceae, кольцо А образуется из шикимата через /г-гидроксибензоат, а остальные десять углеродных атомов, включая атомы хинонового кольца (кольца В), предоставляются двумя молекулами мевалоната. Биосинтез (рис. 3.14) включает в первую очередь пренилирование п-гидроксибензоа-та геранилпирофосфатом с образованием промежуточного продукта (3.69). Затем следует окислительная циклизация и введение кислородсодержащих групп.
Гл 3 Хиноны
117
Антрахиноны. Биосинтез антрахинонов в растениях сем. Rubiaceae, Bignoniaceae и Verbenaceae, по-видимому, довольно близок к синтезу алканина. Ализарин (3.27) биосинтетически представляет собой замещенный нафтохинон. В него включается метка и из шикимата, и из мевалоната. Кольца А и В образуются из шикимата через о-сукцинилбензоат, как это было описано выше для биосинтеза юглона (рис. 3.12), в то время как кольцо С образуется из мевалоната. Одна метильная группа пренильной боковой цепи в ходе образования ализарина теряется, однако у других близких антрахинонов она сохраняется (иногда в окисленной форме).
3.6.6. Фенольная конденсация
Фенольная конденсация представляет собой биосинтетический процесс, характерный для организмов, синтезирующих фенольные соединения и хиноны. В ходе этого процесса происходит димеризация по свободнорадикальному механизму и образуется связь между весьма реакционноспособными группами мономеров. Многие из встречающихся в природе крупных хинонов имеют структуру, свидетельствующую о том, что они являются димерами или другими продуктами конденсации нафтохинонов или антрахинонов. Иногда в ткани, где они находятся, присутствуют также и мономеры. Общеизвестным примером подобной ситуации служит одновременное присутствие 7-метилюглона (3.70) и нескольких его димеров (3.71—3.73) у видов Drosera и Diospyros, в том числе и в древесине эбенового дерева, где некоторые из них являются предшественниками черного пигмента.
В тех или иных случаях может происходить несколько последовательных фенольных конденсаций. Так, гиперицин является диантрахиноном, в котором мономеры соединены в трех местах.
Фенольная конденсация происходит также при образовании протоафинов у тлей и при посмертной трансформации прото-афинов в ксантоафины, однако химия этих процессов гораздо сложнее, чем до сих пор рассмотренных.
Образование полимеров (меланинов) с помощью той же фенольной конденсации хиноидных мономеров будет описано в гл. 7.
3.6.7. Общая оценка
Сложность биосинтеза хинонов заключается в том, что он может происходить по совершенно различным альтернативным путям. Грибы, по-видимому, образуют хиноны в основном с помощью поликетидного пути, тогда как у высших
118
Часть I Химические и биохимические аспекты
растений они обычно синтезируются несколькими путями, в том числе и шикиматным, нередко в комбинации с изопреноидным; в последнем с участием мевалоната формируется часть системы колец нафтохинонов и антрахинонов.
Хиноновые пигменты животных, например спинохромы и эхинохромы иглокожих и антрахиноны насекомых и криноид»
по-видимому, не поступают в организм с пищей. У этих животных происходит самостоятельный биосинтез хинонов, и в изученных случаях было показано, что он происходит по полике-тидному механизму. Не исключено, что эти хиноны образуются микроорганизмами-симбионтами; действительно, эта возможность в некоторых случаях кажется весьма вероятной, например в случае биосинтеза пигмента насекомых — карминовой кислоты (3.28).
3.7. Функции и биологическое действие
У хиноновых пигментов нет какой-либо одной общей функции. Они не играют важной роли в качестве пигментов в фотосинтезе или фоторецепторов в других процессах. Они
Гл 3 Хиноны
119
редко имеют первостепенное значение в качестве пигментов, придающих внешнюю окраску. Обычно хиноновые пигменты вносят лишь незначительный вклад в окраску организмов и тканей, в которых они образуются и накапливаются.
3.7.1. Окрашивание
Известно несколько примеров окрашивания (обычно в желтый, оранжевый или коричневый цвет) грибов и лишайников нафтохинонами и антрахинонами. Ярко-красная, пурпурная и даже синяя или зеленая окраска некоторых беспозвоночных животных, например морских ежей и ряда близких к ним форм, некоторых криноид (морских лилий), червецов и тлей—наиболее известные примеры проявления пигментных свойств хинонов. Обычно хиноны не являются пигментами высших растений, однако у немногих видов они ответственны за желтую окраску.
3.7.2. Функции, не связанные с поглощением света
Многие хиноны обладают важными биологическими функциями, которые не зависят от их светопоглощающих свойств. Даже в тех случаях, когда соединение может поглощать свет в видимой части спектра и, следовательно, окрашено, это свойство не используется при функционировании молекул данного вещества.
Перенос электронов. Возможно, наиболее существенную роль играют изопренилированные молекулы убихинона и мена-хинона, которые являются дыхательными коферментами в системах переноса электронов у животных, растений и микроорганизмов, а также близкий к ним по строению хинон — пластохинон фотосинтетических систем переноса электронов в хлоропластах (гл. 10). Важным свойством в данном случае является легкость и обратимость восстановления хинонов через семихиноновый радикал до гидрохинонов.
Биологическое действие хинонов, синтезируемых одними организмами, на другие организмы. Многие хиноны обладают разрушающим действием, и поэтому они могут синтезироваться организмами в целях обеспечения безопасности или защиты. Простые бензохиноны — жгучие, токсичные и едкие — используются некоторыми насекомыми, например жуком-бомбардиром, в качестве защитных выделений, которые могут «выстреливаться» нагретыми до высокой температуры прямо в нападающего Некоторые грибные нафтохиноны и антрациклиноны обладают антибактериальными или противовирусными свойствами и поэтому обеспечивают соответствующую защиту про
120
Часть I Химические и биохимические аспекты
дуцирующего их организма. Простой нафтохинон юглон (3.17), синтезируемый грецким орехом, токсичен для многих других растений.
По крайней мере в одном случае функции хинонов обеспечивают скорее нападение, а не защиту. Так, фитопатогенный плесневый гриб Fusarium martii образует несколько нафтохинонов Как было показано, один из них, мартицин (3 74), вызывает увядание растения-хозяина и является, таким образом, важным компонентом атакующего механизма патогена.
Известно, что некоторые хиноны оказывают раздражающее, токсическое или разъедающее действие на ткани человека и
(3 74) Мартицин
других млекопитающих. Наблюдающаяся у многих людей аллергическая реакция при контакте с популярным комнатным растением Primula obconica вызывается бензохиноном прими-ном (3.75). Некоторые нафтохиноны, содержащиеся в древесине, могут вызвать раздражение, чихание и экзему у плотников и столяров, которым приходится дышать воздухом, содержащим древесную пыль.
Сложный высший хинон гиперицин (3 37) и близкие к нему соединения обусловливают токсичность растений рода Hypericum (зверобой) для животных. Гиперицин, по-видимому, действует на животных как фотосенсибилизатор, вызывающий фотоокисление светочувствительных белков. Такое действие может быть причиной воспалений, отеков, а в наиболее тяжелых случаях и гибели животного.
3.7.3. Спинохромы и эхинохромы
Относительно функций спинохромов и эхинохромов у иглокожих было сделано много предположений. К, настоящему времени большая часть из них либо была опровергнута, либо, в лучшем случае, не подтвердилась. Эти соединения обладают алгистатическими свойствами и могут быть полезны животным как вещества, подавляющие рост паразитических сине-зеленых водорослей.
Гл- 3. Хиноны
121
3.8. Использование в промышленности и медицине
3.8.1. Красители
В античные времена некоторые хиноновые пигменты очень ценились как красители. Растения, служившие источниками этих пигментов, часто выращивали на больших полях и плантациях для снабжения сырьем красильщиков. Вероятно, наиболее широко распространенной из античных красок была марена, получаемая из измельченных корней Rubia tinctorum, которую применяли древние персы, египтяне, греки и римляне Красящим веществом марены является смесь антрахинонов, •среди которых преобладает ализарин (3.27), который служит
он о
(3 76) Мориндон
основой стабильных красных красок. Хотя ализарин сейчас практически вышел из употребления как краситель, он все еще находит применение при изучении роста костей.
Хна — желто-коричневый препарат из листьев Lawsonia alba в течение долгого времени использовалась в Африке и на Востоке для окрашивания и в косметических целях. Следы хны до сих пор обнаруживают на ногтях египетских мумий. Красящим веществом ее является нафтохинон лавсон (3 18), который легко экстрагируется из листьев L. alba водным раствором карбоната натрия.
В качестве примеров можно привести также экстракты, содержащие нафтохинон алканин (3 68) и его эпимер шиконин, которые использовались римлянами и древними японцами, и корни моринды, применявшиеся в Индии, на Яве и в Новой Зеландии, красящим веществом которых являются антрахиноны, подобные мориндону (3.76).
Наконец, необходимо упомянуть о хиноновых красителях, приготовляемых из насекомых. Вероятно, наиболее известным античным красителем этого типа является кармин, который получали из огромного числа червецов Kermococcus ilicis. Его красящую основу составляет антрахинон кермезиновая кислота (3.29). Сходное соединение карминовая кислота (3.28) из другого насекомого — Dactylopius coccus — является активным началом кошенили, впервые использованной, вероятно, инками в Перу, и до сих пор в небольших количествах применяющей
122
Часть I. Химические и биохимические аспекты
ся для окрашивания пищевых продуктов, а также гистологических препаратов.
С развитием современной синтетической химии крупномасштабное производство и использование природных хиноновых красителей сильно сократилось; лишь некоторые из них используются до сих пор в небольших количествах в качестве красителей для пищевых продуктов, вин и косметики.
3.8.2. Использование в медицине
Еще в древнейшие времена препараты хинонов применяли в медицине в качестве слабительных. Нафтохиноны и антрахиноны ответственны за хорошо известное и широко используемое послабляющее действие александрийского листа, крушины и ревеня.
I । 1 1 1
Me ОАс ОН ОН Me
(3 77) Стрептоварицин А (стереохимия не показана)
В последнее время у некоторых природных хинонов обнаружена противовирусная, антибактериальная и фунгицидная активность, причем число таких хинонов растет. В некоторых случаях их можно использовать в качестве антибиотиков при лечении инфекционных заболеваний. Так, стрептоварицины, например (3.77), представляющие собой оранжевые макролидные нафтохиноны, проявляют заметную активность in vivo против Mycobacterium tuberculosis. Антрациклиноны также обладают антибиотической активностью, подобной активности тетрациклинов, которых они напоминают по структуре.
3.9. Заключение и комментарии
Каротиноиды, описанные в предыдущей главе, представляют собой однородную группу пигментов и являются производными одного и того же основного углеродного скелета.
Гл. 3. Хиноны
123
Для хинонов наблюдается существенно иная картина. Эта группа включает соединения с различными углеродными скелетами и системами колец, обладающие, однако, одним общим свойством — циклической ендионовой, или хиноновой, структурой. Сколько-нибудь исчерпывающий систематический обзор состава хинонов природных тканей в настоящее время отсутствует, однако совершенно очевидно, что химикам-органикам еще предстоит открыть и установить структуру значительного числа разнообразных новых хинонов. Возможно, при этом будут решены некоторые сложные стереохимические проблемы.
Имеется также ряд неисследованных возможностей и в проблеме биосинтеза хинонов. В настоящее время выяснено, что они синтезируются по двум (иногда трем) главным биосинтетическим путям, однако пока детали этих путей изучены на слишком малом числе примеров. Необходимо отметить, что в данном случае мы имеем интересную ситуацию, когда два •совершенно различных пути используются для биосинтеза очень сходных и даже одних и тех же соединений. Это позволяет разрабатывать вероятные пути и механизмы биосинтеза индивидуальных природных хинонов. Существует также широкий простор для экспериментального выяснения биосинтетических путей, ведущих к тем или иным соединениям, и изучения принимающих в них участие ферментных систем, которые, за очень редкими исключениями, остаются совершенно неисследованными. Пока нет никаких данных, касающихся регуляции биосинтеза хинонов. К проблемам, созревшим для биохимического изучения, можно отнести также локализацию хиноновых пигментов внутри клетки, возможную связь хинонов с белками или другими веществами и функции хинонов в тканях.
Чем больше становится известно о действии, оказываемом (некоторыми хинонами на живые ткани, и чем яснее установлен механизм этого действия, тем больший интерес вызывают хиноны как лекарственные средства, и это в свою очередь стимулирует поиски новых природных типов и структур ХИНОНОВ.
3.10. Рекомендуемая литература
В качестве дополнительного источника сведений о природных хинонах следует воспользоваться всеобъемлющей монографией Томсона (Thomson, 1971), которая дает исчерпывающий обзор химии всех природных хинонов, в том числе пигментов, которые были открыты к 1970 г. Она также содержит живое описание первых работ по установлению структуры некоторых соединений классическими методами и занимательную историю использования некоторых важнейших природных
124
Часть I Химические и биохимические аспекты
хиноновых красителей В этой же книге и в более позднем обзоре того же автора затронут также биосинтез хинонов (Thomson, 1976а) Детали биосинтеза ароматических соединений (в том числе и хинонов) по шикиматному пути обсуждаются в обзоре Хэслама (Haslam, 1979) Два тома пр. химии хиноидных соединений (Patai, 1974) содержат важную информацию о многих природных хинонах Полезные сведения из ранних работ по химии и биохимии хинонов можно найти в более старой монографии Мортона (Morton, 1965) С экспериментальными методами, используемыми в исследованиях хинонов, можно познакомиться в обзоре Томсона (Thomson, 1976). Подробности методов в применении к тем или иным индивидуальным хинонам обсуждаются в работах, на которые ссылается в своей монографии Томсон (Thomson, 1971)
3.11. Дополнительная литература
Haslam Е (1979) Shikimic acid metabolites In Comprehensive organic cne-mistry, vol 5, ed E Haslam, p 1167, Oxford and London, Pergamon
Morton R A (ed) (1965) Biochemistry of quinones, London, Academic Press. Patai S (ed) (1974) The chemistry of the quinonoid compounds, vols 1 and 2,
London and New York, Wiley
Thomson R H (1971) Naturally occurring quinones, 2nd edition London and New York, Academic Press
Thomson R H (1976a) Quinones, nature, distribution and biosynthesis In: Chemistry and biochemistry of plant pigments, 2nd edition, vol 1, ed. T W Goodwin, p 527, London, New York and San Francisco, Academic Press
Thomson R H (1976) Isolation and identification of quinones In Chemistry and biochemistry of plant pigments, 2nd edition, vol. 2, ed. T W. Qoodwm, p 207, London, New York and San Francisco, Academic Press
Глава 4
О-Гетероциклические пигменты — флавоноиды
4.1. Введение
Флавоноиды синтезируются почти исключительно высшими растениями В их число входят антоцианы, ответственные за наиболее яркие цвета, в которые окрашены растения,—-интенсивно красные, пурпурные и синие цветки и плоды. Благодаря своей яркой окраске они контрастно выделяются на фоне зеленой листвы и тем самым привлекают внимание человека и животных Другие флавоноиды также могут вносить свой вклад в формирование окраски растений, хотя на первый взгляд этот вклад и неочевиден.
4.2. Структура и номенклатура
4.2.1. Структурные классы
Все природные флавоноиды являются О-гетероцикли-ческими соединениями, структурную основу которых составляет трициклическая молекула флавона [2-фенилхромона, или 2-фе-нилбензо-у-пирона (4 1)] или флавана [2-фенилбензопирана (42)]. Таким образом, основная флавоноидная структура состоит из двух бензольных колец, обозначаемых А и В, соединенных Сз-фрагментом, который вместе с кислородным атомом образует у-пироновое кольцо Порядок нумерации атомов в. такой структуре показан в формуле (4.1). Атомам бензопироновой системе присвоены номера без штрихов, в то время; как кольцо В рассматривается как заместитель и его атомам; даны номера со штрихами
(4 1) Флавон
(4 2) Флаван
(4 4) Флавонол
(4 5) Антоцианидин
(4 8) Флаван 3 ол
(2R 3S) — Катехин
{2R 3R} — ЭпикатехиЙ
(4 9) Флаванонол [2R, 3R}
(4 10) Флаван 3 4-диол
(2R 3R, 4R) и эпимеру
Гл. 4. О-Гетероциклические пигменты — флавоноиды
127
(4.12) Халкон
(4.13) Аурон
Рис. 4.1. Основные скелеты главных классов флавоноидов.
Связующий С3-фрагмент, который образует гетероциклическое кольцо, определяет класс, к которому принадлежит тот или иной флавоноид. Этот фрагмент может быть представлен1 несколькими состояниями, которые имеют различную степень окисления. Каждое из этих состояний соответствует отдельному классу флавоноидов, как это показано на рис. 4.1. Наиболее важными из этих классов являются флавоны (4.3), их 3-гидроксипроизводные— флавонолы (4.4) и антоцианидины (4.5), в которых гетероциклическое кольцо при выделении их из. кислых растворов находится в форме соли флавилия. Реже встречаются 3-дезоксиантоцианидины (4.6). Производными флавана являются флаваноны (4.7), флаван-3-олы, или катехины (4.8), флаванонолы, или дигидрофлавонолы (4.9), и флаван-3, 4-диолы, или проантоцианидины (4.10). На рис. 4.1 показаны также некоторые классы веществ, родственные флавоноидам,— изофлавоны (4.11), халконы (4.12) и ауроны (4.13). Хотя эти последние и не обладают 2-фенилхромоновым скелетом и потому, строго говоря, не являются флавоноидами, они тем не менее столь близки к флавоноидам химически и биосинтетически, что их всегда включают в группу флавоноидов. Отметим, что, если различные классы истинно флавоноидных соединений обычно именуют производными флавона или флавана, для одной из групп сохранено старое название антоциа-
f28
Часть I Химические и биохимические аспекты
нидины; тривиальные названия часто используются и для некоторых других групп, например для катехинов. Другие старые термины, такие, как антоксантин, антохлор и химохром, в настоящее время используются редко.
4.2.2. Характер замещения в кольце (рис. 4.2)
Внутри каждого класса флавоноиды характеризуются числом и положением заместителей в ароматических кольцах. ‘Обычно эти заместители являются ОН-группами, которые мо-тут быть метилированными или гликозилированными. Локали-
₽ИС. 4 2. Наиболее обычное расположение заместителей в молекулах флаво-* '* ’ ноидов.
зация некоторых ОН-групп является следствием общего биосинтетического пути (разд. 4.6). У большинства флавоноидов кольцо А имеет ОН-группы либо при С-7, либо при С-5 и С-7. Эти ОН-группы редко метилируются. Кольцо В практически всегда гидроксилировано при С-4'1 и обычно также при С-З' и С-5'; в этих последних двух положениях ОН-группы часто метилированы
•4.2.3. Гликозилирование
In vivo флавоноиды существуют в большинстве случаев, а возможно, и всегда в виде гликозидов. У тех флавоноидов, которые обладают С-З-гидроксигруппой, в особен
1 Известны флавоноиды, не гидроксилированные у атома С 4' кольца В, -Хотя они более редко встречаются в природе. — Прим ред.
Гл 4 О Гетероциклические пигменты — флавоноиды 129
ности у антоцианидинов и флавонолов, это положение является преимущественным для гликозилирования, однако гликозидные остатки при С-7, С-4' или С-5 также встречаются очень часто. Не является необычным присутствие сахаров более чем в одном положении флавоноидной молекулы, а также гликозилирование последней ди- или трисахаридами. Природные пигменты обычно представляют собой р-гликозиды с D-глюкозой в качестве наиболее широко распространенного моносахарида, однако L-рамноза и D-галактоза также встречаются часто, тогда как другие сахара — реже. В некоторых случаях сахар может быть ацилирован фенолкарбоновой кислотой, обычно гидроксикоричной.
Нет ничего необычного и в присутствии в экстракте свободного флавоноида (агликона). Однако свободные флавоноиды отсутствуют в ткани in vivo; они быстро образуются в ходе экстракции под действием гликозидазных ферментов, которые в ряде случаев продолжают функционировать даже в присутствии высоких концентраций органических растворителей.
4.2.4. Некоторые важные примеры
Наиболее важными флавоноидными пигментами растений in vivo являются антоцианы (антоцианы представляют собой гликозиды, соответствующие им агликоны носят название
Общая структура антоцианидинов
(4 14) R1 =R2 =Н Пеларгонидин (4 15) R1 =ОН , R2 =Н Цианидин (4 16) R1 =R2 ОН Дельфинидин
Общая структура флавонолов
(4 17) R1 = R2 =Н Кемпферол
(4 18) R1 =ОН , R2 =Н Кверцетин
(4 19) R1 = R2 ОН Мирицетин
антоцианидинов). Среди них наиболее широко распространены, особенно в лепестках цветков, пеларгонидин (4 14), цианидин (4.15) и дельфинидин (4 16). Флавонолы с ОН-группами в соответствующих положениях в кольцах А и В также широко распространены — это кемпферол (4.17), кверцетин (4.18) и Мирицетин (4.19).
9—84
130
Часть I. Химические и биохимические аспекты
Число индивидуальных флавоноидных агликонов велико; оно включает около 300 флавонов и флавонолов, 50 халконов, 20 антоцианидинов. Число же их возможных гликозидов и ацилированных гликозидов поистине огромно. В этой книге будут рассмотрены лишь немногие из флавоноидов. Однако представленная ниже информация относится ко всем представителям данного флавоноидного класса.
4.2.5. Номенклатура
Как видно даже на примере упоминавшихся выше соединений, среди названий флавоноидов преобладают тривиальные, обычно являющиеся производными от названия того растения, из которого данное соединение было впервые выделено или в котором оно обычно содержится, например дельфинидин был выделен из дельфиниума. Это приводит к затруднениям и недоразумениям, поскольку даже очень близкородственные соединения, например разные гликозиды одного и того же агликона могут иметь совершенно несходные наименования. Как выражение крайнего случая иногда для одного и того же соединения используют два совершенно различных названия.
4.3. Свойства
4.3.1. Химические свойства
Химические свойства флавоноидов уже давно интенсивно исследовались методами классической органической химии. С их помощью было разработано несколько главных путей синтеза флавоноидов. Флавоноиды обычно вступают в реакции, характерные для их замещающих групп, например гидроксильных. Связующий Сз-фрагмент гетероциклического кольца может подвергаться восстановлению или окислению; при этом возможны ограниченные превращения флавоноидов одного класса в флавоноиды другого. Щелочное расщепление, часто требующее жестких условий, приводит к разрыву флавоноид* ной молекулы на два фрагмента, содержащие бензольные кольца. Эта реакция может оказаться полезной для установления распределения заместителей в кольце, правда, подобную информацию сейчас обычно получают спектроскопическими методами (УФ- и ЯМР-спектроскопией, масс-спектрометрией).
4.3.2. Физические свойства
Природные флавоноидные гликозиды сравнительно неплохо растворимы в воде и могут экстрагироваться ею или (как это обычно и делают) водными растворами спиртов из
Гл. 4. О-Гетероциклические пигменты — флавоноиды 131
растительных тканей. Антоцианы несут положительный заряд, и их экстракция требует умеренно кислых условий. Обычно флавоноиды более стабильны в отношении света, умеренного нагревания и изменений pH, чем большинство других пигментов1.
Очистка. Разделение и очистка флавоноидов легко достигаются с помощью хроматографии на бумаге или тонкослойной хроматографии. Для быстрого получения результатов при определении в растительных тканях флавоноидов обычно применяют двумерную хроматографию. Даже бесцветные соединения легко обнаруживаются при освещении хроматограмм УФ-светом, особенно в присутствии паров аммиака, когда наблюдается характерная флуоресценция.
4.3.3. Поглощение света
Как уже отмечалось в гл. 1, длина волны света, поглощенного молекулой, является функцией той степени легкости, с которой происходит переход электронов на более высокие энергетические уровни. Чем длиннее сопряженная цепь или хромофор молекулы и чем больше число участвующих в нем функциональных групп или ауксохромов, тем выше степень стабилизации возбужденного состояния и тем легче оно достигается, т. е. тем меньшая энергия требуется для возбуждения и тем большей длины свет поглощается. Это утверждение очень хорошо иллюстрируется на примере флавоноидов.
Производные флавана (рис. 4.3). У гидроксилированных производных флавана, например у флаван-3-олов (4.8) и флаван-3,4-диолов (4.10), одинарная связь С-3,4 эффективно разделяет два бензольных кольца. У этих соединений, таким образом, переходы происходят только в изолированных хромофорах бензольных колец, и они поглощают только в УФ-диа-пазоне спектра при 275—280 нм, как и соответствующие простые фенолы. Флаваноны (4.7) и изофлавоны (4.11) обладают кольцом А, сопряженным с С-4-карбонильной группой, и потому имеют такой же максимум поглощения, как гидроксиацетофенон.
Производные флавона (рис. 4.4). У флавонов (4.3) и флавонолов (4,4) имеет место сопряжение между С-4-карбонильной группой и кольцом В, и потому спектры имеют две интенсивные, хорошо разделенные полосы поглощения. Полоса I в длин-
1 Флавоноиды некоторых классов весьма неустойчивы к действию солнечного света, а также в условиях щелочных значений pH. Это относится прежде всего к катехинам (4.8), проантоцианидинам, флаван-3,4-диолам (4.10), а также к антоцианидинам (4.5) и их гликозидам антоцианам. — Прим ред.
9*
132
Часть I. Химические и биохимические аспекты
Рис. 4.3. Спектры поглощения УФ света этанольными растворами производных флавана: флаван-3,4-диола (/) и флаванона (II).
Рис. 4.4. Спектры поглощения света этанольными растворами флавона (А) и флавонола (5).
новолновой части связана с хромофором, состоящим из кольца В, сопряженного с карбонильной группой, а более коротковолновая полоса II — с кольцом А. В случае флавонолов ви-нильная ОН-группа при С-3 влияет на подвижность электрона. Полоса I смещается в более длинноволновую область, чем у соответствующих флавонов, и поглощение в синем диапазоне
Гл. 4. О-Гетероциклические пигменты — флавоноиды
133
Рис. 4 5 Спектры поглощения света этанольными растворами халкона (7) и аурона (77)
Рис 4 6 Спектры поглощения света антоцианидином 7 — при pH 1,0 преобладает соль флавилия (4 20); 77 — при pH 4,0 преобладает псевдоосновная форма (4 21), 777 — при pH 7,5 преобладает форма ангидрооснования (4 22).
спектра может оказаться достаточным для того, чтобы флавонол приобрел желтую окраску
Халконы и ауроны (рис 4 5) Большая копланарность, возможная у халконов (4 12), а еще в большей степени у ауронов (4 13), облегчает возбуждение электронов и, таким образом,
134
Часть I. Химические и биохимические аспекты
способствует сдвигу Лтах в длинноволновую часть спектра. Поэтому халконы желтые, а ауроны оранжевые.
Антоцианидины (рис. 4 6). У антоцианидинов и их гликозидов, обычно выделяемых в кислом растворе в виде флавилие-вых солей (4.20), электрон гетероциклического атома кислоро-
(4 20) Соль флавилия (цианцдин)
да принимает участие в образовании л-связей в гетероарома-тическом кольце, так что хромофором становится вся молекула. Поэтому из всех флавоноидов антоцианидины поглощают свет с наибольшей длиной волны и окрашены в оранжевый, красный, пурпурный или синий цвет. Однако по мере повыше-
(4 22) Хиноидное основание
Гл 4 О-Гетероциклические пигменты — флавоноиды 135
ния pH раствора антоцианидинов до нейтрального, образуется все больше и больше бесцветных псевдоосновных форм [2-гид-роксихроменов (4.21)]. При величинах pH выше 7 в небольшом количестве образуются хиноидные основания (4.22), поглощающие в более длинноволновой части спектра и окрашенные в синий цвет; в водных растворах эти основания неустойчивы Однако они являются антоциановой формой, которая,, видимо, стабильна in vivo и содержится главным образом в-лепестках цветков, которые часто имеют синий цвет более глубокого тона, чем это можно было бы предполагать по спектрам
Рис 4 7 Влияние замещающих ОН-групп на спектры поглощения света антоцианами Спектры (в этаноле+HCl) I — гликозидов пеларгонидина (4 14);
II — цианидина (4 15), III — дельфинидина (4 16)
поглощения выделенных антоцианов (в форме флавилиевых солей).
Влияние заместителей У флавоноидов всех классов ОН-за-местители вносят несвязывающие электроны, чем увеличивают степень делокализации, стабилизируют возбужденное состояние и тем самым облегчают возбуждение электронов. Влияние увеличения степени гидроксилирования на светопоглощающие свойства хорошо видно на примере спектров трех обычных антоцианидинов (рис. 4.7) Пеларгонидин (4 14), цианидин (4 15) и дельфинидин (4 16) с одной, двумя и тремя ОН-груп-пами в кольце В соответственно имеют оранжевую, красную и пурпурную окраску. Сходный эффект может быть обнаружен и у флавоноидов других классов; например, флавонолы кемпферол (4.17), кверцетин (4 18) и мирицетин (4 19) имеют taiax (в этаноле) при 368, 374 и 478 нм соответственно ОН-группы в других положениях молекулы не дают такого эффек
136
Часть I. Химические и биохимические аспекта
та. Метилирование, гликозилирование или ацилирование ОН-групп обычно уменьшает или вообще исключает этот батохром-ный эффект.
Влияние pH и хелатирования. О влиянии изменений величины pH на ионизацию и спектры поглощения антоцианидинов мы уже упоминали. Все классы флавоноидов представляют собой фенолог, и поэтому их спектры заметно изменяются при высоких pH (выше pH 9), когда происходит ионизация фенольных ОН-групп, а также при образовании хелатов с ионами металлов. (В случае антоцианидинов и их гликозидов при высоких значениях pH наблюдается необратимый распад этих соединений.) При этом их максимумы поглощения сдвигаются в более длинноволновую часть спектра и многие флавоноиды приобретают яркую окраску. Ионизация флавонолов и родственных им соединений, вызываемая выдерживанием в парах аммиака, часто используется для обнаружения их на хроматограммах.
4.4. Распространение
4.4.1. У животных
Сообщений о присутствии флавоноидов у животных очень мало. Флавоны и флавонолы широко, хотя отнюдь не повсеместно, обнаруживаются у личинок и взрослых особей отряда Lepidoptera, особенно у белых и кремовых бабочек. Эти соединения насекомые, вероятно, получают из растений, которыми они питаются. Так, например, гусеница Eupithecia oblongata может быть окрашена в синий или в красный цвет в зависимости от антоциана, содержащегося в цветках, которыми она питается. Такая способность принимать окраску, подобную окраске окружающей среды, явно полезна насекомому в целях маскировки. Флавоноиды и флавоноидоподобные соединения были идентифицированы также в тканях виноградной улитки Helix pomatia (флавон?), у морского гидроида Sertularella и пресноводного жука-плавунца Dytiscus (аурон). Присутствие флавоноида у названного последним вида (хищника) является неожиданным и необъяснимым.
4.4.2. У микроорганизмов
Синтез флавоноида у микроорганизмов был убедительно показан лишь недавно. Плесневый гриб Aspergillus сап-didus продуцирует флавонин (4.23), очевидно, по тому же самому биосинтетическому пути, который используется высшими растениями.
Гл. 4. О-Гетероциклические пигменты — флавоноиды
137
4.4.3. У высших растений
Флавоноиды являются почти исключительно пигментами высших растений. Они могут синтезироваться и накапливаться во всех растительных тканях — в листьях, древесине, корнях, плодах, семенах и во всех частях цветков, главным образом в лепестках. Природные гликозиды растворимы в воде и обнаруживаются обычно в клеточном соке или в вакуолях. В недавних сообщениях высказано предположение, что небольшие количества флавоноидов могут присутствовать в хло--ропластах высших растений.
Были проведены широкие систематические исследования состава флавоноидов в высших растениях различных видов и сортов. Для получения фингерпринтов, позволяющих быстро определять состав флавоноидов у того или иного вида растения, использовали двумерную хроматографию на бумаге. Было показано, что состав флавоноидов является чрезвычайно важным таксономическим признаком как при установлении родства между видами, принадлежащими к одному семейству, так и при выявлении различий между близкородственными видами. В этом отношении может быть очень характерным присутствие флавоноидов тех или иных классов и распределение заместителей у индивидуальных соединений.
4.5. Участие в формировании окраски растений и
4.5.1. Антоцианы
Из всех флавоноидов именно антоцианы вносят наибольший вклад в (формирование окраски растений. Эти соединения ярко окрашены в оранжевый, красный, пурпурный или синий цвет и обусловливают окраску почти всех красно-синих цветков. Известный пример — красная роза, за окраску которой ответственны производные цианидина. Была установлена четкая корреляция между окраской цветков и структурой антоцианов, которые в них содержатся. В ходе систематического
138
Часть I. Химические и биохимические аспены
исследования было обнаружено, что большинство оранжевых цветков содержат пеларгонидин, красно-вишневых — цианидин, а пурпурно-синих — дельфинидин.
Антоциановая окраска характерна для многих красных плодов, таких, как земляника, малина, вишня, яблоки, в которых наличие антоцианов является признаком зрелости. Большинство «черных» плодов, например ежевика, черный виноград, на самом деле окрашены в очень глубокий красный или пурпурный цвет благодаря присутствию антоциана в чрезвычайно высоких концентрациях. Это утверждение прекрасно иллюстрируется тем фактом, что черный виноград дает красное вино, в котором содержание антоцианов уже значительно ниже. Окрашенными благодаря присутствию антоцианов могут быть и другие части растений, такие, как листья (краснокочанная капуста) или стебли (ревень).
Антоцианы часто образуются в большом количестве в молодых побегах и листьях, которые поэтому приобретают красную окраску в отличие от зеленой у зрелых листьев. Общеизвестным примером служит темно-красная окраска стеблей и листьев у первых весенних побегов розы. В некоторых случаях красный антоциан сохраняется до зрелости, обусловливая красную окраску листвы некоторых декоративных видов. Красный цвет осенних листьев также может быть следствием усиленного Синтеза антоцианов. Происходящее осенью разрушение хлорофилла делает антоциановую окраску более заметной.
Окраска, обусловленная антоцианами, особенно цветков и плодов, в которых доминируют хиноидные формы пигментов (4.22), может зависеть от таких факторов, как pH, образование хелатных комплексов с металлами и копигментация. Влияние изменений pH на длину волны поглощаемого антоцианами света уже обсуждалось (разд. 4.3.3). Антоцианы, особенно те, которые содержат орто-ДиГидроксизамёстители в кольце В, способны образовывать хелатные комплексы с ионами металлов, ЧТО обычно приводит К сдвигу Zmax В ДЛИННОВОЛНОВУЮ сторону, т. е. их синяя окраска становится более темной. Хорошо известен пример гортензии Hydrangea macrophylla. У этого растения один и тот же антоциан дельфин-идин-3-глюкозид присутствует в чашелистиках как розовых, так и синих цвет-•йЪв, оДн&кб в сйних цйетках он образует комплексы с ионами Р*^МОния и молибдена. Обогащение почвы соответствующими Ион аки металлов приводит к появлению синих цветков на кус-
Имевшем ранее розовые Цветки. И наоборот, дефицит этих сблей может вызвать превращение синих цветков в розовые. ь Многие садоводческие программы предусматривают выве-дёнйё “разновидностей цветков с «лучшей», т. е. более интен-ЙгЬнбЙ’ Или редкой окраской или необычным ее распределе
Гл. 4. О-Гетероциклические пигменты — флавоноиды
139
нием. Говоря языком биохимии, цель заключается в достижении качественных или количественных изменений состава антоцианов. В качестве примера можно назвать попытки создать голубую розу. В этом случае цель заключалась в том, чтобы создать голубую окраску с помощью либо соответствующей копигментации, либо с помощью замены цианидина на дельфинидин. Последней замены достичь чрезвычайно трудно, поскольку роза в нормальных условиях не обладает необходимыми ферментами для осуществления добавочного гидроксилирования.
4.5.2. Другие флавоноиды
Вклад в окраску растений других классов флавонои-' дов обычно менее очевиден, правда халконы, и особенно ауроны, иногда ответственны за окраску желтых цветков, например у львиного зева Antirrhinum majus.
Флавоны и флавонолы практически не поглощают свет видимой области спектра, но тем не менее ответственны за белую и кремовую окраску цветков, которые без них были бы почти прозрачными. Необходимо также отметить, что флавоны и флавонолы поглощают свет в области ближнего УФ, «видимого» для пчел и других насекомых. Хотя эти соединения и цветки, содержащие их, кажутся нам белыми или бесцветными, они выглядят «окрашенными» для пчел и таким образом помогают привлекать насекомых. Флавоны и флавонолы практически всегда содержатся в листьях, хотя из-за присутствия хлорофилла они не вносят никакого вклада в их окраску.
Мономерные флаваны, флаваноны и их гидроксипроизводные непосредственно не обусловливают окраску растений. Вместе с тем димеры, олигомеры и полимеры, главным образом катехинов и проантоцианидинов, придают коричневую окраску осенним и сухим листьям, а также темной ядровой древесине многих растений. Подобные соединения («конденсированные дубильные вещества») обусловливают также коричневатую окраску чая1.
1 Золотисто-вишневый цвет настоя хорошего черного чая обусловлен димерными продуктами (теафлавинами и теарубигинами), образующимися из катехинов в процессе ферментации листьев чайного растения. Коричневатая же окраска настоя свидетельствует о «переферментации». Продукты, обусловливающие цвет чая, лишь весьма условно могут быть причислены к конденсированным дубильным веществам, поскольку их молекулярная масса слишком мала. — Прим. ред.
140
Часть I Химические и биохимические аспекты
4.5.3. Совместное окрашивание (копигментация)
Будучи бесцветными или почти бесцветными, гидроксифлаваны, флавоны и флавонолы вносят важный вклад в окраску многих цветков путем копигментации. Эти соединения часто присутствуют в цветках вместе с антоцианами и образуют с ними комплексы, которые поглощают свет более интенсивно и при больших длинах волн, чем одни только антоцианы. Многие синие цветки обязаны своей окраской присутствию именно таких комплексов, причем некоторые из них были недавно выделены. Например, пигмент цветков синего ириса содержит хиноидное основание ацилированного дельфинидин-3,5-диглюкозида, стабилизированное путем копигментации с С-гликозилфлавонами. В других случаях копигментационный комплекс может быть стабилизирован ионами металлов, такими, как Mg2+. Вместе с тем у некоторых синих цветков, например у Lobelia, окраска обусловлена не копигментацией и не комплексообразованием с металлами. У этих цветков синее хиноидное основание само по себе стабилизировано путем взаимодействия с кофеильными группами ацилированного сахарного заместителя.
Другие аспекты окрашивания растительных тканей флавоноидами и другими пигментами будут обсуждаться в гл. 8.
4.6. Биосинтез ,
4.6.1. Введение
Биосинтез флавоноидов осуществляется в очень больших масштабах. Показано, что у высших растений на него расходуется почти 2% всего углерода, фиксируемого при фотосинтезе. В общих чертах биосинтез флавоноидов изучен достаточно хорошо, однако многие детали, главным образом касающиеся ферментов, еще ждут своего выяснения. Удобнее всего рассматривать биосинтетический путь по стадиям: 1) образование основного Сб-С3-Сб-скелета, включая два главных пути биосинтеза фенольных соединений — поликетидный и шикимат-ный, 2) пути, по которым флавоноиды различных классов образуются из основного Сб-С3-Сб-предшественника, и возможные взаимопревращения между флавоноидами различных классов, 3) окончательные модификации, такие, как гидроксилирование, метилирование и гликозилирование, которые дают начало многим индивидуальным флавоноидам внутри каждого класса.
Гл 4 О-Гетероциклические пигменты — флавоноиды
141
4.6.2. Образование основного С6-С3-С6-скелета
Уже давно было показано, что кольцо А флавоноидной молекулы происходит из ацетатных фрагментов, в то время как кольцо В и связывающие оба бензольных кольца три углеродных атома составляют фенилпропаноидный остаток, происходящий из шикимата. Подробно шикиматный путь, приводящий к образованию фенилаланина, был рассмотрен в гл. 3. В биосинтезе флавоноидов фундаментальное значение имеет реакция, катализируемая ферментом фенилаланин-аммиак-лиазой (ФАЛ), в ходе которой фенилаланин (4.24) дезаминируется (рис. 4.8) с образованием транс-коричной кислоты (4 25).
(4 24) R= Н Фенилаланин
(4 26) R- ОН Тирозин
(4 25) R-H транс Коричная кислота (4 27) R-OH п Кумаровая кислота
Рис 4.8. Дезаминирование феиилаланииа и тирозина до транс-коричной и n-кумаровой кислот соответственно.
В некоторых случаях сходным образом тирозин (4.26) дезаминируется до n-кумаровой кислоты (4.27), однако последняя обычно образуется путем гидроксилирования коричной кислоты с помощью 4-гидроксилазы коричной кислоты — оксидазы со смешанной функцией, которая использует NADPH и молекулярный кислород. В ходе этой реакции происходит интересная внутримолекулярная миграция водорода, так называемый NIH-сдвиг1 (рис. 4.9).
Образовавшиеся коричные кислоты затем активируются в реакции с коферментом А (рис. 4.10), аналогичной синтезу ацетил-СоА из ацетата. Циннамоил-СоА (4.28) служит затравкой в поликетидном процессе (разд. 3.6.3), в ходе которого он конденсируется с тремя молекулами малоната, активированных СоА, или сходного тиоэфира. В результате циклизации поликетидной системы (4.29) образуется гидроксили-
1 Термином «NIH-сдвиг» принято обозначать внутримолекулярную миграцию атома водорода в бензольном ядре (арильном фрагменте) в процессе монооксигеназного гидроксилирования из пара-положения (С-4) в лета-положение (С-З). Такая миграция (сдвиг) была впервые обнаружена в Национальном институте здоровья, Бетесда, США (National Institute of Health — сокращенно NIH) при исследовании лара-гидроксилнрования L-фенилаланина под действием оксидазы со смешанной функцией (монооксигеназы) в печени животных. — Прим. ред.
Рис. 4 9. Предполагаемый механизм гидроксилирования коричной кислоты
Гл. 4. О-Гетероциклические пигменты — флавонсиды
143
Циииамат -}- АТР ->- Циниамоил-АМР-j-РР,
Циннгмоил-АМР+CoASH------> Циннамоил-S.СоА + АМР
Рнс. 4.10. Образование циннамоил-СоА-тиоэфиров.
1 z ' (4 30) Халкон
Рис. 4.11. Происхождение С6-Сз-Сб-скелета флавоноидов: механизм образования халконов.
рованное кольцо А и завершается формирование Сб-Сз-С^ске-лета халкона (4.30) (рис. 4.11). Образование халкона изщ-ку-мароил-СоА и малонил-СоА под действием ферментов из культуры клеток петрушки (Petroselinum hortense) было показано экспериментально.
4.6.3. Образование флавоноидов различный классов
Сейчас уже хорошо известно, что халконы играют центральную роль в биосинтезе флавоноидов всех других классов. Это показано на рис. 4.12, который суммирует принятые в настоящее время взгляды на возможные биогенетические взаимопревращения между флавоноидами различных классов. Однако, прежде чем многие из этих возможных взаимопревращений можно будет рассматривать как доказанные, необходи-
Рис. 4.12. Общая схема биосинтеза флавоноидов иллюстрирующая установленные (->) и предполагаемые (--------------*)
биогенетические взаимосвязи между флавоноидами различных классов.
Гл 4 О Гетероциклические пигменты — флавоноиГи
145
мо проделать большую работу по выявлению соответствующих ферментов.
Флаваноны. В растворах происходит спонтанная изомеризация халконов в соответствующие флаваноны. Вместе с тем в природе эта реакция катализируется халкон-изомеразой, и ее продуктом является (2S)-флаванон (4.7). In vivo процесс легко обратим, и поэтому очень трудно определить, халкон ли или соответствующий флаванон служит непосредственным предшественником флавоноидов других классов. Доступные в настоящее время доказательства, полученные главным образом в работах с суспензионными культурами клеток петрушки и других видов растений, свидетельствуют в пользу того, что прямыми предшественниками являются флаваноны. Этот вопрос может быть разрешен однозначно лишь при исследовании ферментативных систем, в которых не функционирует халкон-флаванон-изомера-за.
Ауроны. Ауроны могут быть легко получены из халконов химическим окислением. Было показано также их образование m vivo с помощью ферментативного окисления халконов, однако механизм этой реакции неясен.
Флавоны. Считается, что флавоны образуются скорее путем окисления соответствующих флаванонов, чем дегидратацией флаванонолов, однако механизм реакции в этом случае также, не установлен.
Флаванонолы. Показано прямое ферментативное образование этих соединений из флаванонов. В культурах Haplopappus gracilis за него, по-видимому, ответственна микросомальная, оксидаза со смешанной функцией. Происходящее при этом гидроксилирование — очень важный процесс, поскольку не исключено, что флаванонолы служат промежуточными продуктами при биосинтезе флавоноидов других классов (содержащих 3-гидроксигруппу).
Флавонолы. Химическое окисление флаванонолов до флавонолов довольно легко себе представить. Подобное ферментативное дегидрирование почти наверняка происходит в биосинтезе-флавонолов, хотя прямые доказательства этого до сих пор отсутствуют.
Антоцианидины. Превращение флаванонолов в антоцианидины было показано у нескольких видов растений и подтверждено в экспериментах с суспензионными культурами клеток Однако, механизм этого превращения неизвестен. Степень окисления этих соединений формально одна и та же, и поэтому был предложен гипотетический путь, не включающий реакций окисления и восстановления (рис. 4.13). Биосинтез того небольшого числа 3-дезоксиантоцианидинов, которые встречаются в природе^ остается пока загадкой.
10—84
Рис. 4.13. Предполагаемый механизм биосинтеза антоцианидинов.
Гл 4 О-Гетероциклические пигменты — флавоноиды
147
Катехины и флаван-3,4-диолы (проантоцианидины). Эти производные флавана имеют более низкую степень окисления, чем халконы. Об их биосинтезе мало что известно. Чтобы объяснить существующие между ними взаимосвязи (рис. 4.14), предложена лишь гипотетическая схема, предусматривающая восстановление халкона-флаванона до флавена (4.31).
Изофлавоны. Эти соединения образуются из халконов в процессе, включающем миграцию кольца В.
4.6.4. Завершающие модификации
Присутствие ОН-групп при С-5, С-7 и С-4' у большинства флавоноидов обусловлено основным путем их биосинтеза. Индивидуальные флавоноиды образуются в результате удаления одной или нескольких ОН-групп, дальнейшего гидроксилирования, О- или С-метилирования или гликозилирования. Эти модификации обычно происходят на последней стадии биосинтеза, т. е. уже после образования основного Сб-С3-Сб-скелета, хотя удаление кислорода у С-5, возможно, происходит на стадии поликетида.
Показано ферментативное гидроксилирование флавоноидного кольца В при С-З' или С-5'. Вместе с тем не исключено, что перед включением в молекулу флавоноида м-кумаровая кислота гидроксилируется до кофейной кислоты (4.32). Добавочное гидроксилирование может происходить практически при любой степени окисления флавоноидной молекулы.
(4 32) Кофейная кислота
В реакциях О-метилирования в качестве донора метильных групп используется S-аденозилметионин, причем ферменты, катализирующие эти реакции, чрезвычайно специфичны как по отношению к месту метилирования, так и по отношению к классу метилируемого соединения. В нормальных условиях метилтрансферазы флавоноидов катализируют метилирование только на уровне флавонов и флавонолов и не катализируют метилирование антоцианидинов.
Что касается довольно простого процесса — О-гликозилиро-вания, то источником моносахаридных фрагментов в нем являются активированные UDP-производные.
10*
Рис, 4,14. Предполагаемый механизм биосинтеза производных флавана (замещающие ОН-группы в кольцевых не показаны).
Гл. 4. О-Гетероциклические пигменты — флавоноиды.
149
Механизмы С-метилирования и С-гликозилирования мало изучены. По-видимому, в этих процессах используются те же самые доноры, что и при 0-замещении, т. е. S-аденозилметио-нин и UDP-caxapa.
4.6.5. Окислительная полимеризация флавоноидов
Бесцветные гидроксилированные флаваны (катехины, флаван-3,4-диолы) могут давать начало окрашенным продуктам в результате процессов окислительной димеризации и полимери
(4 33) Теафлавин
он
(Галлоил)
зации. Хорошо известный коричневато-красный цвет чая обусловлен продуктами такого рода, в частности теафлавином (4.33).
4.6.6. Генетический контроль биосинтеза флавоноидов
Наследуемость состава антоцианов в цветках послужила основой классических генетических экспериментов Менделя, а строгий генетический контроль биосинтеза флавоноидов был изучен более подробно, чем у какого-либо другого класса веществ растительного происхождения. Описаны многие различия отдельных генов, которые приводят к значительным качественным и количественным вариациям состава флавоноидов. Многие биохимические эффекты, например, общий биосинтез флавоноидов (т. е. наличие окрашенных или альбиносных фенотипов), накопление флавоноидов определенных классов или индивидуальных соединений, структурные модификации, такие, как гидроксилирование, метилирование или гликозилирование, и распределение флавоноидов в различных органах растений, корре
150
Часть I. Химические и биохимические аспекты
лируют со специфическими генетическими факторами. Генетические исследования помогли установить пути биосинтеза флавоноидов, а также заложили основу многих обширных программ селекции, осуществленных в целях получения новых сортов культурных растений.
4.6.7. Другие факторы, влияющие на биосинтез флавоноидов
На биосинтез флавоноидов и его регуляцию оказывают влияние многие внутренние факторы и факторы окружающей среды. К наиболее важным из них относятся свет и стрессовые условия, такие, как ранение или инфекция. Однако в большинстве случаев их влияние изучено на физиологическом, а не биохимическом уровне.
Свет. Наиболее широко исследовалось влияние света. Обычно свет стимулирует синтез флавоноидов, особенно антоцианов, влияя главным образом на активность участвующих в этом процессе ферментов. По своей реакции на индукцию светом эти ферменты подразделяются на две группы. ФАЛ и ферменты, которые превращают коричную кислоту в n-кумароил-СоА, индуцируются значительно быстрее, чем ферменты, катализирующие более поздние биосинтетические реакции и образующие вторую группу. Синтез ферментов de novo начинается после-индукции светом, причем главной регуляторной точкой является ФАЛ. У многих видов показано участие в этом процессе фитохрома, однако могут также функционировать и другие фоторецепторы, например флавин или флавопротеин. Интересно отметить, что регулируется, по-видимому, только образование кольца В (шикиматный путь), тогда как синтез кольца А (поликетид-ный путь) не подвержен регуляции.
Повреждение или инфекция. Синтез флавоноидов в зеленых растениях часто усиливается после механических повреждений или заражения патогенными организмами. Наблюдаемое увеличение содержания флавоноидов может, однако, просто отражать общее возрастание активности фенилаланин—аммиак-лиазь» вызванное необходимостью образования фенольных фитоале? синов и связанное с повышением устойчивости растения к з • болеванию.
Избыточное образование зараженными тканями аитоцианог легко заметно, например в случае поражения грибом листьер персика и миндаля, которое выражается в курчавости листьев. Пораженные листья приобретают вид ярких оранжево-красных стручков или плодов. Другой пример — яблоки. Незрелые пло ды, пораженные личинками насекомых, обычно синтезируют повышенное количество антоцианов и преждевременно выгля
Гл 4. О-Гетероциклические пигменты — флавоношты 151
дят почти зрелыми. По этому признаку их можно легко отличить на дереве от здоровых плодов.
Возраст. Образование флавоноидов в зеленых тканях растений, по-видимому, зависит также от таких факторов, как возраст и общая стадия развития. В молодых тканях содержится больше флавоноидов, чем в зрелых. В частности, антоцианы часто образуются в больших количествах в новых побегах и в листьях; в результате последние могут иметь красную окраску в отличие от зеленой у зрелых листьев.
4.7. Метаболизм флавоноидов у животных
Все травоядные животные поглощают с пищей большое количество флавоноидов. Однако они редко утилизируются животными для пигментации или других целей (разд. 4.4.1). В подавляющем же большинстве случаев флавоноиды, подобно другим чужеродным фенольным соединениям, либо превращаются в сульфаты или глюкуронаты и выделяются, либо расщепляются до фенолкарбоновых кислот (рис. 4.15,Л). Сообщения о каком-либо вредном действии флавоноидов на животных отсутствуют.
4.8. Разрушение флавоноидов микроорганизмами
Работ, посвященных разрушению флавоноидов микроорганизмами, известно очень мало. Показано лишь, что некоторые грибы могут расщеплять С3-связующий фрагмент флавоноидной молекулы и продуцировать таким образом простые фенолы из колец А и В (рис. 4.15,5). Вполне вероятно также, что те почвенные микроорганизмы, которые способны окислять и расщеплять ароматические кольца простых фенолов, могут сходным образом разрушать и флавоноиды.
4.9. Функции флавоноидов в растениях
Главная функция флавоноидов в растениях состоит в пигментации тканей, в которых они синтезируются и накапливаются (гл. 8). Не исключено, что по крайней мере некоторые флавоноиды могут выполнять другие важные функции. Сильное поглощение флавонами, флавонолами и антоцианами света в УФ-диапазоне позволило предположить, что они могут защищать ткани от вредного действия УФ-излучения.
Отмечены также и другие формы защитного действия флавоноидов. Было высказано мнение, например, что флавоноиды, содержащиеся в листьях, могут отпугивать насекомых и таким образом в течение долгого времени предохранять растение от повреждений. Вместе с другими растительными фенолами флавоноиды также, по-видимому, участвуют в формировании устой1-чивости растений к болезням или инфекции.
152
Часть 1. Химические и биохимические аспекты
А Животные
Гомопротокатеховая кислота
Б Микроорганизмы
+С0
Протокатеховая кислота
Рис. 4.15. Метаболизм гликозидов кверцетина, например рутина, у животных (4) и у микроорганизмов (5). Gly — гликозил.
Наконец, в последнее время флавоноиды обнаружены в хлоропластах, причем они были найдены у всех видов, в которых их искали. Это позволяет предполагать, что флавоноиды могут иметь важную, но пока неизвестную функцию в этой органелле.
4.10. Использование антоцианов в качестве пищевых красителей
Применение антоцианов в качестве красящих добавок к пище ограничено использованием экстрактов из сильно пигментированных плодов, таких, как черный виноград и черника. Эти
Гл. 4. О-Гетероциклические пигменты — флавоноиды.153 экстракты представляют собой многокомпонентные смеси, включающие много различных водорастворимых веществ. Чистые препараты антоцианов пока не используются в качестве пищевых красителей, поскольку при значениях pH выше 4 их окраска нестабильна. Однако в настоящее время разрабатываются методы, с помощью которых антоцианидины в форме солей флавилия или хиноидных оснований можно стабилизировать в диапазоне pH, характерном для пищевых продуктов и напитков. Так, например, при этом используют самоассоциацию молекул в форме катионов в высоких концентрациях, благодаря которой получают интенсивную и стабильную окраску. Помогает также ко-пигментация, особенно с присоединением ацетальдегида, что дает сильноокрашенные и стабильные пигменты даже при pH 6.
4.11. Заключение и комментарии
После гетерогенных хинонов в этой главе мы рассмотрели группу соединений, имеющих один и тот же углеродный скелет — флавоноиды. Различная степень окисления обусловливает существование разных классов флавоноидов, каждый из которых характеризуется собственными светопоглощающими свойствами. Соединения одного из классов — антоцианы (возможно, в хиноноидной форме) придают цветкам и плодам наиболее яркую окраску. Они вызывают особый интерес у садоводов, и изменение их состава лежит в основе многих программ по выведению растений с новой необычной окраской цветков.
Состав флавоноидов, в том числе и множества их гликозидных производных, служит и будет продолжать служить полезным признаком для выявления таксономических корреляций. В систематических исследованиях, вероятно, будут обнаружены все новые типы флавоноидов, структуру которых предстоит расшифровать химикам-органикам. Многое еще предстоит сделать и для выяснения биосинтеза флавоноидов. Прямые доказательства предложенных ферментативных взаимопревращений различных классов флавоноидов во многих случаях все еще отсутствуют, механизмы многих реакций до конца не выяснены, а подробных исследований, посвященных катализирующим их ферментам, почти нет. В последнем случае исключение составляют работы с суспензионными культурами клеток некоторых растений (в частности, петрушки). Хотя физиологические факторы и факторы окружающей среды (например, свет), которые регулируют биосинтез флавоноидов, в целом выявлены, механизмы, регулирующие состав флавоноидов и их раздельный биосинтез, особенно антоцианов, в различным образом окрашенных участках цветков и других растительных тканей, почти неизвестны. Их выяснение имеет особый интерес для садово-
154
Часть I. Химические и биохимические аспекты
дов, поскольку позволит лучше понять механизм копигментации и другие феномены, ответственные за изменение основной окраски, обусловленной антоцианами in vivo. Именно при изучении флавоноидов очень полезным может оказаться метод культуры растительных тканей, особенно в случае их биосинтеза и регуляции, а также механизмов обогащения окраски.
Вместе с тем многие проблемы остаются нерешенными. Если небольшие количества флавоноидов содержатся в растительных хлоропластах, то какова их функция в этих органеллах? Действительно ли они отсутствуют у водорослей, хотя присутствуют и играют какую-то роль в хлоропластах растений? Многие животные, в том числе человек, потребляют большие количества флавоноидов с пищей. Каким образом они метаболизируются? Оказывают ли они какое-либо вредное действие? Используются ли они в организме животных ?!
По мере роста требований к применению пищевых добавок интерес к флавоноидам (особенно к антоцианам) как к промышленным пищевым красителям природного происхождения несомненно будет увеличиваться. Поэтому вопросы, связанные с их метаболической судьбой в организме животных, и в частности человека, приобретают еще большую важность. Со временем будут найдены методы промышленного синтеза некоторых флавоноидов или их крупномасштабного биологического производства, возможно, с использованием культур тканей. Особое значение приобретут и способы стабилизации окраски антоцианов в пищевых препаратах.
4.12. Рекомендуемая литература
Наиболее фундаментальной книгой о флавоноидах является большой том под редакцией Харборна, Мэйбри и Мэйбри (Harborne, Mabry, Mabry, 1975). В нем содержится исчерпывающая информация по всем аспектам химии и биохимии этих соединений. Остается также полезной более старая книга под редакцией Гейссмана (Geissman, 1962) по химии флавоноидов. Более биохимический или систематический подход выбран Харборном (Harborne, 1967) в его «Сравнительной биохимии флавоноидов».
1 Если функции флавоноидов в хлоропластах высших растений мало исследованы, то об их метаболизме в организме животных и человека, а также о биологической активности известно довольно много. Показано, что флавоноиды совершенно не токсичны. Они в значительных количествах содержатся в большинстве съедобных плодов и ягод и обладают Р-витаминной активностью Довольно детально изучен и метаболизм флавоноидов многих классов (см., например, монографию R. R. Schelin «Mammalian metabolism of plant xenobiotics», Acad Press, London — New York—San Francisco, 1978). — Прим-ped.
Гл 4 О-Гетероциклические пигменты — флавоноиды 155
Другая книга под редакцией Харборна (НагЬогпе, 1964) по биохимии фенольных соединений в общем также содержит полезный материал. Две недавно вышедшие обзорные статьи Суэйна (Swain, 1976а) и Уонга (Wong, 1976) посвящены соответственно природе и свойствам флавоноидов и их биосинтезу. Функции флавоноидов в растениях обсуждаются Харборном (НагЬогпе, 1976). Статья Хэслама (Haslam, 1979) о шикимат-ном пути биосинтеза включает описание биосинтеза флавоноидов, причем механизмы реакций в ней рассматриваются настолько подробно, насколько это позволяют экспериментальные данные. В статье Гризебаха (Grisebach, 1980) приведена имеющаяся на сегодняшний день информация по избранным аспектам биосинтеза флавоноидов. Совсем новый обзор Тимберлэй-ка (Timberlake, 1980) позволяет вникнуть в проблемы, связанные с использованием антоцианов в качестве пищевых красителей.
Методы, обычно применяющиеся при исследовании биохимии флавоноидов, обсуждаются Суэйном (Swain, 1976b), а более детально они описаны еще в одной книге Харборна (НагЬогпе, 1973).
4.13. Дополнительная литература
Geissman Т. A. (ed.) (1962). The chemistry of flavonoid compounds, New York, Macmillan.
Grisebach H. (1980). Recent developments in flavonoid biosynthesis. In: Pigments in plants, 2nd edition, ed. F.-C. Czygan, p. 187, Stuttgart and New York, Gustav-Fischer.
.Harborne J. B. (ed.) (1964). Biochemistry of phenolic compounds, London and New York, Academic Press.
Harborne J. B. (1967). Comparative biochemistry of the flavonoids, London and New York, Academic Press.
Harborne J. B. (1973). Phytochemical methods. London, Chapman and Hall. Harborne J. B. (i976). Functions of flavonoids in plants. In- Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 736, London, New York and San Francisco, Academic Press.
Harborne J. В, Mabry T. J., Mabry H. (eds.) (1975). The Flavonoids, London, Chapman and Hall.
Haslam E. (1979). Shikimic acid metabolites In- Comprehensive organic chemistry, vol. 5, ed. E Haslam, p. 1167, Oxford and London, Pergamon
Swain T. (i976a). Nature and properties of flavonoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 425, London, New York and San Francisco, Academic Press.
Swain T. (1976b). Flavonoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 2, ed. T. W. Goodwin, p. 166, London, New York and San Francisco, Academic Press.
Timberlake C. F. (1980). Anthocyanins—occurrence, extraction and chemistry, Food Chem , 5, 69.
Wong E. (1976). Biosynthesis of flavonoids. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed T. W. Goodwin, p. 464. London. New York and San Francisco, Academic Press.
Глава 5
Тетрапирролы
5.1. Введение
N-Гетероциклическое соединение пиррол (5.1) является очень стабильной гетероароматической системой, хотя простые монопирролы встречаются в природе нечасто (см., однако, пигменты wallemla). Ди- и трипирролы также редки, хотя красный пигмент бактериального происхождения продигио-зин, как стало теперь известно, представляет собой линейный трипиррол (5.2). Вместе с тем циклические тетрапиррольные природные пигменты широко распространены. К ним относятся такие важные вещества, как хлорофилл — зеленый светоулавливающий пигмент растений и гем, составляющий основу транспортирующих кислород красных пигментов крови. Родственными им соединениями являются также билины — линейные тет
н
(5.1) Пиррол
ОМе R1 R2
(5.2) Продигиозин; R1, R2, R3 = Н или алкил
рапирролы, или тетрапирролы с открытой цепью. Эта группа включает желчные пигменты животных, фикобилины — вспомогательные фотосинтетические пигменты некоторых водорослей, а также хромофор фоторегуляторного пигмента растений — фитохрома.
5.2. Общие структурные свойства
Наиболее важными природными тетрапиррольными пигментами являются порфирины, содержащие «суперкольцо», или макроцикл, в котором четыре пиррольных остатка связаны одноуглеродными мостиками. Основным скелетным каркасом является порфин, структура которого и общепринятая нумерация атомов по Фишеру приведены на рис. 5.1. Четыре пиррольных кольца обозначаются А, В, С, D или I, II, III, IV, а связывающие метиновые мостики, или лгезо-углеродные атомы, — буквами а, р, у, б. Периферические углеродные атомы входящих
Гл. 5. Тетрапирролы
157
Рис. 5.1. Основная структура н схема нумерации по Фишеру для порфиновой системы колец.
в макроцикл пиррольных колец получили номера от 1 до 8. У различных природных пигментов эти углеродные атомы несут добавочные боковые цепи (см. ниже). В 1960 г. комиссия IUPAC рекомендовала новую номенклатуру и систему нумерации атомов молекулы порфина (рис. 5.2). Хотя широкоизвест
Рис. 5.2. Система нумерации ШРАС для порфина.
(5 5) Тетрагидропорфин (бактериохлорин!
ная система обозначения атомов и колец по Фишеру до сих пор сохранила свою популярность, в этой книге мы будем придерживаться системы, рекомендованной IUPAC.
Основная порфиновая структура (5.3) присутствует в геме, в то время как хлорофиллы и бактериохлорофиллы содержат соответственно дигидропорфиновую [хлорин (5.4)] и тетрагид
358
Часть I. Химические и биохимические аспекты
ропорфиновую [бактериохлорин (5.5)] системы. У природных циклических тетрапиррольных пигментов N-атомы пиррольных колец образуют хелатные комплексы с ионами металлов, обычно Mg2+ (в хлорофиллах) или Fe2+ (в геме).
В ходе биосинтетического процесса (разд. 5.9.4.) образуется .первый циклический тетрапиррол, в котором каждое пирроль-гное кольцо несет С2-(уксусная кислота) и Сз-(пропионовая
(5.6) Замещение типа Ш <57> Замещение типа I
(Буквами А и Р обозначены заместители, являющиеся производными ацетатной и пропионатной боковых цепей соответственно)
(5 8) Основной скелет билина
жислота) боковые цепи. Теоретически возможно множество •различных расположений боковых цепей, однако почти все встречающиеся в природе тетрапирролы являются производными предшественника с локализацией боковых цепей, показанной в структуре (5.6). Такой способ распределения заме-стителей называют типом III. Иногда обнаруживаются соединения с еще одним (тип I) способом распределения боковых цепей (5.7). Соединений, обладающих боковыми цепями в иных положениях, в природных объектах, по-видимому, не сущест-
Вует.
Встречающиеся в природе более простые линейные тетрапирролы имеют основную структуру (5.8). Эти соединения, известные как билины, или желчные пигменты, обычно образуются растительными и животными системами из порфириновых •структур путем разрыва а-лезо-углеродного мостика (С-5 по •системе IUPAC). В структуре (5.8) показано распределение за
Гл. 5. Тетрапирролы
159’
мещающих боковых цепей билина, образовавшегося в результате а-расщепления порфирина типа III.
5.3. Общие светопоглощающие свойства тетрапирролов
Тетрапиррольный макроцикл представляет собой плоскую высокосопряженную систему. Делокализация электрона-распространяется по всему макроциклу, что придает ему в значительной степени ароматический характер. В такой ситуации возбуждение электрона происходит очень легко. Перераспределение заряда, сопровождающее возбуждение электрона, неизотропно, что приводит к появлению нескольких дипольных моментов, которые в свою очередь обусловливают возникновение ряда интенсивных полос поглощения в большинстве случаев в диапазоне 470—700 нм, т. е. полос интенсивного красного, пурпурного или зеленого цвета. Очень интенсивная полоса Соре, которая находится приблизительно при 400 нм, обусловлена симметричным расположением четырех пиррольных N-атомов; она чрезвычайно характерна для тетрапиррольного макроцикла.
Протяженность и поляризация сопряженного хромофора, а следовательно, и положение максимумов поглощения зависят от степени гидрирования. На спектр поглощения влияет также-расположение заместителей в пиррольных кольцах. Эти эффекты имеют большое диагностическое значение при идентификации структурных типов. Ионизация в кислых или щелочных условиях также вызывает изменения в спектрах.
Линейные тетрапирролы имеют более простые спектры поглощения в видимом диапазоне. Характерное для них увеличение степени поляризации приводит к сдвигу наиболее длинноволновой полосы поглощения в еще более длинноволновую-область, а полоса Соре, характерная для макроциклических структур, естественно, отсутствует. По мере насыщения двойных связей, особенно при л/езо-углеродных атомах, у линейных тетрапирролов уменьшается длина сопряженного хромофора, а следовательно, и длина волны максимума поглощения.
В следующих разделах этой главы будут рассмотрены некоторые из наиболее важных природных тетрапирролов и во многих случаях приведены подробные спектры поглощения.
5.4. Хлорофиллы
5.4.1. Структура и распространение
Вклад, вносимый хлорофиллами в окраску растительных тканей, проявляется во всеобщем распространении зелениз Во время вегетации. Все зеленые ткани высших растений содер-
1'60
Часть I. Химические и биохимические аспекты
жат в своих фотосинтетических органеллах (хлоропластах) два хлорофилла, а и Ь. Ядром этих соединений служит форбин (5.9), представляющий собой хлориновую структуру, содержащую добавочное изоциклическое кольцо (кольцо Е, или кольцо V). Это кольцо образуется в процессе биосинтеза (разд. 5.9.8.) путем окисления и замыкания цепи пропионатного заместителя при С-13 на углеродный атом у-метикового мостика (С-15). Структуры хлорофиллов а и b (5.10) и (5.11) различи-
(5.10) Хлорофилл a- R СН3
(5.11) Хлорофилл b- R =€НО
ются лишь заместителем при С-7. В хлорофилле а — это — СНз, а в хлорофилле b — СНО. Другими важными особенностями хлорофилла являются хелатирование иона Mg2+ и этерификация С-17-пропионатного заместителя изопреноидным спиртом фитолом. Недавно было показано существование хлорофиллов, в которых роль этерифицирующего спирта играет геранилгера-ниол.
Хлорофилл а характерен для всех водорослей. В Cyanophyta -содержится только хлорофилл а, а в Chlorophyta и Euglena-phyta и хлорофилл а, и хлорофилл Ь. Водоросли других классов также содержат хлорофилл а, но вместе с другими хлорофиллами, слегка отличающимися по картине распределения заместителей. Например, в Chrysophyta, Pyrrophyta и Phaeophyta присутствует хлорофилл с (5.12), а в Rhodophyta— хлорофилл d (5.13).
Фотосинтезирующие бактерии содержат бактериохлорофиллы. У большинства видов это тетрагидропорфины — бактериохлорофилл а (5.14) и бактериохлорофилл Ъ (5.15). Наряду
Гл. 5. Тетрапирролы
161
с фитолом в качестве спиртов в состав молекулы этих бактериохлорофиллов входят фарнезол (5.16) и геранилгераниол (5.17). Серные бактерии Chlorobium содержат ряд хлоробиум-хлорофиллов (бактериохлорофиллы end), которые являются дигидропорфинами (5.18).
Хлорофиллы локализованы в хлоропластах высших растений и водорослей и в более простом фотосинтетическом аппа
(5.12) Хлорофилле
(5.13) Хлорофилл t?
рате прокариотических сине-зеленых водорослей и фотосинтезирующих бактерий. In vivo, было обнаружено несколько спектрофотометрически различающихся форм хлорофиллов, что указывает на возможные различия в их функционировании в процессе фотосинтеза (гл. 10). Вероятно, спектрофотометрические различия обусловлены микроокружением молекул хлорофилла, например ассоциацией их с белками или специальной упаковкой.
5.4.2. Общие свойства
Хлорофиллы представляют собой сложные эфиры; они растворимы в большинстве органических растворителей. Из тканей, в которых они содержатся, их можно экстрагировать полярными органическими растворителями, в частности ацетоном и спиртами. Хлорофиллы не стабильны и легко разрушаются при действии света, Ог, тепла, кислот и щелочей. В растворе, даже при комнатной температуре, хлорофиллы а и b подвергаются изомеризации до близких по структуре хлорофиллов а' и Ь', которые, вероятно, являются эпимерами (по СООМе в кольце Е) собственно хлорофиллов. В присутствии кислот 11—84
162
Часть I. Химические и биохимические аспекты
удаляется ион магния и в результате образуется феофитин (5.19). Это происходит настолько легко, что феофитин в довольно больших количествах обычно обнаруживается как артефакт на хроматограммах растительных экстрактов. Более жесткая обработка кислотой приводит к отщеплению этерифицирующего спирта (фитола и т. п.), в результате чего образуется водораст-
{5 14) Бактериохлорофилл а
(К = фарнезил или Геранилгеранил)
(5 15)Бактериохлорофилп в
(5.16) Фарнезол
r1=ch2.ch3, сн2.сн2.сн3
или СН2.СН(СН3)2
r2= СН3 или сн2.сн3
R3=H,CH3mhCH2-CH3
(5 18) Хлорофиллы СЫогоЫит (бактериохлорофиллы с и d)
Гл. 5. Тетрапирролы
163
воримый феофорбид (5.20). Феофорбиды и их метиловые эфиры, а также хлорофиллид (5.21) являются продуктами щелочного гидролиза хлорофиллов в отсутствие кислорода. Поэтому омыление служит полезным способом разрушения хлорофилла и применяется в целях облегчения работы с другими липидами растений. Водорастворимые продукты разрушения хлорофилла эффективно удаляются промыванием экстракта водой.
Некоторые из этих продуктов широко используются в исследованиях биосинтеза хлорофилла с применением радиоактивных
(5 19) феофитин (Я=Фитил)
(5 20) Феофорбид (R=H)
(14С и 3Н) и стабильных (13С) изотопов. Продукты разрушения хлорофилла относительно стабильны, и работать с ними легко. Кроме того, их легко очистить и получить для них ЯМР- и другие спектры, которые значительно более просто интерпретировать, чем соответствующие спектры собственно хлорофиллов.
5.4.3. Спектроскопические свойства
Спектры поглощения хлорофиллов а и b в диэтиловом эфире приведены на рис. 5.3. Полосы Соре расположены при 430 и 455 нм соответственно, а наибольшие длины волн а-полос поглощения составляют 662 и 641 нм соответственно. Главные свойства спектров хлорофиллов с и d (рис. 5.4), а такжё хло-робиум-хлорофиллов (рис. 5.5) сходны со свойствами спектров хлорофиллов а и Ь, однако максимумы поглощения их спектров различаются.
Бактериохлорофиллы а и b (рис. 5.6) также дают полосы Соре приблизительно при 400 нм (358 и 368 нм соответственно), однако характерная для них более сильная поляризация тетра-11*
Длина волны, нм
Рис, 5.3. Спектры поглощения света хлорофиллом а (/) и хлорофиллом b (II) в диэтнловом эфире.
Рис. 5.4. Спектры поглощения света хлорофиллом с (/) и хлорофиллом d (II) в диэтнловом эфире.
Длина волны, нм
Рис. 5.5. Спектры поглощения света «хлорофиллом-650» (/) и «хлорофиллом-660» (II) из Chlorobium в диэтнловом эфире.
Поглощение
Длина волны, нм
Рис. 5.6. Спектры поглощения света бактериохлорофиллами а (7) и b (II) в диэтнловом эфире.
166
Часть I. Химические и биохимические аспекты
гидропорфинового хромофора вызывает появление a-полос поглощения при значительно больших, чем у хлорофиллов, длинах волн (772 и 794 нм соответственно), находящихся в инфракрасной области спектра. Поэтому бактериохлорофиллы не имеют интенсивной окраски.
5.4.4. Хлорофилл и его производные у животных
Свободного хлорофилла в животных тканях обычно нет; его можно обнаружить лишь в кишечнике травоядных. Некоторые виды животных, в частности водные беспозвоночные, содержат симбиотические одноклеточные водоросли. Интересным примером представляется одна из тропических асцидий, которая, как было обнаружено, содержит неизвестный ранее тип прокариотических зеленых водорослей Prochloron, в настоящее время рассматриваемый многими исследователями как «недостающее звено» в эволюционной цепи высших растений и
(5 21) Хлорофиллид
(5 22] Филлоэритрин
их хлоропластов. Другие животные способны сохранять и накапливать функционирующие хлоропласты из растительного материала, поступающего с пищей. Одним из примеров может служить кишечнодышащий моллюск Elysia virldis, который способен накапливать до 108 хлоропластов (в одном организме). Источником этих хлоропластов является сифоновая водоросль Codium fragile, причем скорость фотосинтеза в хлоропластах, содержащихся в животном, сравнима со скоростью этого процесса в интактных водорослях. Очевидно, все такие животные должны содержать хлорофилл и поэтому окрашены обычно в зеленый цвет.
Гл. 5. Тетрапирролы
167
Продукты распада хлорофиллов, включая феофорбиды, хлорины и филлоэритрин (5.22), in vivo в растениях встречаются редко (хотя они и являются распространенными артефактами). В то же время ряд животных, в частности некоторые многоще-тинковые черви и эхиуриды, используют их в качестве пигментов наружных покровов. Эти соединения могут образовываться в животных из получаемого с пищей хлорофилла или поступать непосредственно с распадающимися растительными остатками, которыми питаются животные. У травоядных или всеядных, в том числе у человека, главным продуктом распада хлорофилла является филлоэритрин, который содержится в пищеварительном тракте и в желчи.
5.5. Гем и гемопротеины
Простетическая группа наиболее известных животных пигментов — белка крови гемоглобина и мышечного белка миоглобина, так же как хлорофилл, является порфирином. Гемоглобин и миоглобин являются гемопротеинами, т. е. белками, содержащими в качестве простетической группы порфирин с хелатированным ионом железа, или гем. К гемопротеинам относятся также цитохромы и некоторые ферменты, такие, как пероксидаза и каталаза. В функционирующих гемоглобине н миоглобине железо находится в восстановленной форме, Fe2+; если же в их молекулах присутствует окисленная Ге3+-форма, то они неактивны. Что касается цитохромов, то их нормальное функционирование зависит от легкости взаимопревращения окисленной и восстановленной форм.
5.5.1. Гемоглобин и миоглобин: структура и свойства
Жизненно важным пигментом крови, переносящим кислород у большинства животных, в том числе у млекопитающих, является гемоглобин — гемопротеин, который в качестве простетической группы содержит протогем (5.23), представляющий собой Fe-хелатный комплекс протопорфирина IX. Мышцы содержат структурно и функционально сходный с ним пигмент — миоглобин. Эти два белка были первыми белками, трехмерная структура которых была установлена с помощью рентгеноструктурного анализа. Миоглобин имеет единственную полипептид-ную цепь, состоящую из 153 аминокислотных остатков (мол. масса 17 800). Его трехмерная структура показана на рис. 5.7. Пептидная цепь миоглобина свернута таким образом, что его молекула очень компактна. Около трех четвертей цепи имеет структуру а-спирали, в которую входят восемь различных спи-рализованных сегментов. С наружной стороны молекулы рас
168
Часть I. Химические и биохимические аспекты
положены как полярные, так и неполярные аминокислотные остатки, в то время как во внутренней части содержатся исключительно неполярные остатки, которые обеспечивают гидрофобное окружение единственного гема. Атом железа в геме на-
Рнс. 5.7. Трехмерная структура миоглобина.
ходится всегда в двухвалентном состоянии (Fe2+); он способен образовывать комплексы с шестью лигандами, четыре из которых являются пиррольными N-атомами порфирина. Пятой координационной связью гем связывается с белком через атом азота имидазольного кольца гистидинового остатка глобина (извест
ного как проксимальный гистидин). По шестой координационной связи легко присоединяется кислород с образованием оксимиоглобина. В дезоксимиоглобине шестая связь остается свободной. Второй гистидиновый остаток глобина (дистальный гистидин) находится очень близко к кислородсодержащему участку, но он не связан с гемом. Если атом железа окислен до Fe3+, т. е. молекула миоглобина превращена в ферримиогло-
Гл. 5. Тетрапирролы
169
бин, то последний способен присоединять по шестой координационной связи лишь воду, а не кислород и потому не может быть переносчиком кислорода.
Белковая структура гемоглобина более сложна. Гемоглобин млекопитающих (в том числе человека) имеет мол. массу 64 500 и состоит из четырех полипептидных цепей, каждая из которых содержит свой собственный гем. Преобладающая форма гемоглобина у взрослых людей •— гемоглобин А — имеет две пары полипептидных цепей: a-цепей, каждая из которых состоит из 141 аминокислотного остатка, и 0-цепей — по 146 остатков в каждой. В содержащемся в небольшом количестве у взрослых людей гемоглобине А2 и в зародышевом гемоглобине F 0-цепи замещены другими полипептидами. Несмотря иа то что аминокислотные последовательности полипептидных цепей гемоглобина и миоглобина в значительной степени различаются, трехмерные структуры их чрезвычайно сходны и гемы в молекулах того и другого занимают гидрофобные полости внутри свернутых полипептидных цепей. Проксимальный и дистальный остатки гистидина входят в число девяти аминокислот, которые одинаковы во всех миоглобинах и гемоглобинах у ряда изученных в этом отношении видов животных.
Четыре полипептидные цепи гемоглобина ассоциированы в примерно тетраэдрическую структуру и образуют почти сферическую молекулу. Каждая из a-цепей контактирует с двумя 0-цепями, в то время как между двумя a-цепями или между двумя 0-цепями взаимодействие почти отсутствует. Каждый из четырех гемов гемоглобина способен присоединить одну молекулу кислорода. Кислородсодержащая форма гемоглобина называется оксигемоглобином (5.24 b), а форма, не содержащая кислорода,— дезоксигемоглобином (5.24 а). Когда дезоксигемоглобин поглощает кислород, в его трехмерной структуре происходит ряд изменений, главным образом перемещение атома Fe2+ в плоскость системы колец гема (см. ниже и рис. 5.8). Как и в случае миоглобина, окисление Fe2+ до Fe3+ приводит к образованию неактивной формы гемоглобина — метгемоглобина, которая не способна присоединять молекулярный кислород.
5.5.2. Гемоглобин и миоглобин: функционирование при переносе кислорода
Способность обратимо образовывать комплексы с кислородом обусловливает жизненно важную роль гемоглобина как переносчика кислорода у животных. У млекопитающих гемоглобин содержится в красных кровяных клетках (эритроцитах) и отвечает за перенос кислорода из легких по артериям, артериолам и капиллярам в различные ткани тела. Он также
170
Часть I. Химические и биохимические аспекты
t Пппги-пгти гольца гема
Г лобин
(5 24а) Двэоксигемоглобин
О2
(5.24b) Оксигемоглобин
Рнс. 5.8. Связывание кислорода гемом в гемоглобине.
помогает переносить двуокись углерода по обратному пути от тканей в легкие. Способность артериальной крови переносить кислород в присутствии гемоглобина в 70 раз выше, чем в его отсутствие. Сродство к кислороду у миоглобина значительно больше, чем у гемоглобина, поэтому миоглобин может принимать кислород от гемоглобина для использования или сохранения его в мышечных клетках.
Детали механизма связывания кислорода гемоглобином сложны, но хорошо изучены. Будучи чрезвычайно важным с физиологической точки зрения, этот процесс служит прекрасной иллюстрацией аллостерических взаимодействий и регуляции. Характерные особенности связывания кислорода гемоглобином могут быть суммированы следующим образом:
1. Кривая связывания — освобождения кислорода гемоглобином имеет сигмоидную форму (тогда как форма соответствующей кривой для миоглобина гиперболическая). Это свиде
Гл. 5. Тетрапирролы
171
тельствует о том, что связывание кислорода гемом — кооперативный процесс, т. е. связывание кислорода одним гемом облегчает его связывание другими гемами.
2. Сродство гемоглобина к кислороду зависит от величины pH и содержания СОг.
3. Органические фосфаты, особенно 2,3-дифосфоглицерат (ДФГ), также оказывают влияние на сродство гемоглобина к кислороду.
Кооперативное связывание кислорода. Когда молекула гемоглобина диссоциирована на составляющие ее полипептидные цепи, поведение последних очень сходно с поведением миоглобина: их кривые освобождения кислорода имеют гиперболиче-
Oj—НЬ в активно метаболизирующей ткани, ^2
главным образом в мышцах
<ЗО2
СО V “ ~ 1 ‘
2 В альвеолярных капиллярах легких
н+ н+
Рис. 5.9. Уравнение, суммирующее эффект Бора. НЬ — гемоглобин.
скую форму, на их кислородсвязывающие свойства не влияют СОг, ДФГ или величина pH. Аллостерические свойства гемоглобина обусловлены взаимодействием четырех субъединиц его молекулы. При связывании кислорода прежде всего происходит перемещение атома железа гема. Как уже отмечалось ранее, в дезоксигемоглобине атом железа в геме вынесен (на 0,75А) за пределы плоскости порфиринового макроцикла. Связывание кислорода приводит к тому, что атом железа перемещается в плоскость гема оксигемоглобина, а проксимальный гистидин приближается к кольцу гема (рис. 5.8). Такое перемещение вызывает последующие небольшие изменения третичной структуры субъединицы, в частности изменяется положение тирозинового остатка и смежной С-концевой аминокислоты. В результате исчезают некоторые взаимодействия между субъединицами; следовательно, четвертичная структура дестабилизируется. При этом изменяется конформация других субъединиц, что облегчает связывание ими кислорода. И наоборот, освобождение кислорода одним из гемов приводит к изменениям конформации и взаимодействий между субъединицами, что облегчает освобождение кислорода другими гемами.
Влияние СО? и величины. pH (эффект Бора) (рис. 5.9). С понижением pH освобождение Ог гемоглобином облегчается. То же происходит при повышении концентрации СОг. Это чрезвычайно важно с физиологической точки зрения, так как в тка
!72 Часть 1. Химические и биохимические аспекты
нях с быстро протекающим обменом веществ, таких, как мышечная ткань, образуется много СОа и кислот. Высокие уровни СОа и Н+ стимулируют освобождение Оа из гемоглобина, и таким образом удовлетворяется потребность в большом количестве кислорода в метаболически активных тканях. После освобождения кислорода дезоксигемоглобин присоединяет Н+ и СО?. Для альвеолярных капилляров легких характерна более высокая концентрация кислорода, и там по мере связывания дезоксигемоглобином кислорода происходит освобождение Н+ и СОа. Структурные превращения, которые претерпевает при этом молекула гемоглобина, были подробно выяснены. При переходе от оксигемоглобина к дезоксигемоглобину в результате конформационных изменений карбоксилсодержащие аминокислот-
НЬ—ДФГ+ 4 О2 нь (О2)4+ ДФГ
Рис. 5.10. Уравнение, отражающее действие дифосфоглицерата (ДФГ) на гемоглобин (НЬ).
ные остатки приближаются к некоторым гистидиновым остаткам и концевым NHa-группам. С изменением локального заряда микроокружения повышается величина рК кислого остатка и таким образом возрастает его сродство к Н+ СО? также значительно легче связывается с дезоксигемоглобином, чем с оксигемоглобином. Она связывается с концевой NHz-группой каждой цепи с образованием карбаминопроизводных.
Влияние ДФГ. У человека ДФГ снижает сродство гемоглобина к кислороду в 26 раз. Это очень важно с физиологической точки зрения, поскольку в отсутствие этого механизма гемоглобину было бы трудно освобождать много кислорода в капиллярах тканей. Такое действие ДФГ обусловлено его способностью связываться с дезоксигемоглобнном, но не с оксигемоглобином. Одна молекула ДФГ связывается с гемоглобиновым тетрамером, располагаясь в центральном пространстве в непосредственной близости ко всем четырем субъединицам. Связывание ДФГ и О2 — взаимоисключающие процессы. В ходе оксигенации конформационные изменения приводят к значительному уменьшению центрального пространства в гемоглобиновом тетрамере и молекула ДФГ вытесняется. Однако при этом необходимо нарушение ДФГ-белкового взаимодействия, что затрудняет связывание кислорода гемоглобином. Для поглощения ДФГ в свою очередь требуется расщепление связи гемоглобин—О?, так что ДФГ облегчает высвобождение кислорода. Функционирование ДФГ в упрощенном виде представлено уравнением на рис. 5.10.
Гл. 5. Тетрапирролы
173
Влияние других веществ. Сродство гемоглобина к окиси углерода гораздо больше, чем к кислороду; следовательно, СО может вытеснять кислород из оксигемоглобина. Образующийся при этом карбоксигемоглобин не способен служить переносчиком кислорода, и поэтому окись углерода является весьма эффективным адом. Карбоксигемоглобин имеет вишнево-красную окраску, характерную для цвета лица людей, отравившихся окисью углерода, что позволяет легко диагностировать отравление. Функционирование гемоглобина могут серьезно нарушать различные лекарственные препараты. Известно, что продукты метаболизма ацетанилида, фенацетина и некоторых других лекарственных препаратов индуцируют окисление гемоглобина до Ре3+-формы (метгемоглобина), приводя к серьезному снижению кислороднереносящей способности крови.
Гемоглобин плода. Так же как и у большинства других животных, у человека на разных стадиях развития организма имеются различные типы гемоглобина в крови. Гемоглобин плода и гемоглобин взрослого человека различаются по спектрам поглощения света и электрофоретическим свойствам. В крови зародыша на ранних стадиях его развития присутствует гемоглобин третьего типа. Зародышевый гемоглобин F обладает более высоким сродством к кислороду, чем гемоглобин А взрослых людей. Благодаря этому возможен оптимальный перенос кислорода от гемоглобина А матери к гемоглобину F плода. Более высокое сродство гемоглобина F к кислороду подтверждается также тем, что он связывает ДФГ менее прочно, чем гемоглобин А.
Генетические дефекты в структуре и функционировании гемоглобина. Существует много генетических вариаций человеческого гемоглобина. Наиболее известная из них найдена при «серповидно-клеточной анемии» — мутации одного гена, кото-торая в гомозиготном состоянии вызывает деформацию эритроцитов с образованием клеток, имеющих форму серпа. Гемоглобин S таких серповидных клеток отличается от нормального гемоглобина лишь одним аминокислотным остатком в р-цепях. В нем происходит замена полярной глутаминовой кислоты на неполярную аминокислоту валин, что приводит к очень сильному снижению растворимости дезоксигемоглобина S, хотя растворимость оксигемоглобина при этом остается нормальной. Дезоксигемоглобин S образует волокнистый осадок, который вызывает деформацию и разрушение эритроцитов и как следствие — хроническую гемолитическую анемию.
В настоящее время известно более 100 мутантных гемоглобинов. Некоторые из замен являются безвредными «поверхностными» заменами, тогда как другие, которые затрагивают кис-лородсвязывающие участки, третичную структуру или взаимо
174
Часть I. Химические и биохимические аспекты
действия субъединиц в четвертичной структуре (что сказывается на аллостерических эффектах), могут очень сильно влиять на связывание кислорода.
5.5.3. Спектроскопические свойства гема и гемоглобина
Подобно хлорофиллу, спектры поглощения гема и гемопротеинов характеризуются интенсивными полосами Соре в районе 400 нм, а также другими интенсивными пиками поглощения между 500 и 600 нм. Максимумы поглощения дезоксигемоглобина ( — 425 и 560 нм) и оксигемоглобина ( — 414, 543 и 578 нм) различны и очень характерны (рис. 5.11). Гемоглобин
Длина волны , нм
Рис. 5.11. Спектры поглощения света гемоглобином (/), оксигемоглобином (II) и карбоксигемоглобином (III).
имеет пурпурную, а оксигемоглобин — оранжево-красную окраску. У карбоксигемоглобина (вишнево-красного) максимумы поглощения слегка сдвинуты в синюю область по сравнению с оксигемоглобином. Спектры поглощения окси- и дезоксимиоглобинов очень сходны со спектрами для соответствующих гемоглобинов. Точные положения максимумов поглощения гемоглобинов у различных видов животных весьма характерны и зависят от свойств белковой молекулы. Этот признак очень полезен при выяснении таксономических корреляций. Гем можно отделить от связанного с ним белка и образовать комплекс через оставшиеся две координационные связи с другими азотсодержащими молекулами, например с пиридином. Такие продукты, известные как гемохромогены, имеют чрезвычайно характерные спектры поглощения и очень полезны при идентификации геминовых простетических групп.
Гл. 5. Тетрапирролы
175
5.5.4. Распространение гемоглобина
Гемоглобин является пигментом крови практически у всех позвоночных, а также у многих беспозвоночных животных. Однако он не обнаружен у Porifera, Coelenterata, Rotifera, Sipuncula, Polyzoa, Brachiopoda, Onychophora, Tardigrada, Chaetognata и Protochordata и довольно редок у Arthropoda. У позвоночных гемоглобин локализован в эритроцитах. У беспозвоночных он может содержаться в специальных частицах, но чаще присутствует в растворенном виде в крови или гемолимфе. Гемоглобин встречается почти во всех тканях тела.
Размеры гемоглобинового комплекса варьируют в очень широких пределах. Как уже упоминалось, гемоглобин млекопитающих имеет тетрамерную форму с мол. массой 64 500. У других представителей животного царства были найдены его мономерные и димерные формы (с мол. массой 17 000 и 34 000 соответственно), в то время как у многих беспозвоночных сложные молекулы значительно крупнее и могут иметь мол. массу до 3 000 000.
Состав и последовательность аминокислот в гемоглобинах различных видов животных сильно варьируют, что приводит к различиям в максимумах поглощения света, растворимости, изоэлектрической точке, сродстве к кислороду и устойчивости изолированных пигментов к кислотам, щелочам и нагреванию. Даже среди млекопитающих имеются значительные различия в стабильности и форме кристаллов выделенных гемоглобинов. Эти структурные различия ограничиваются белковой частью молекулы, тогда как все формы гемоглобинов содержат одну и ту же протогемовую простетическую группу.
Наряду с различиями в гемоглобине между семействами, родами, видами или даже подвидами могут также существовать различия в гемоглобине у какого-либо индивида в разные периоды жизни или даже в одно и то же время. Как упоминалось выше, человек имеет различные типы гемоглобина в крови в разные периоды жизни. Та же ситуация встречается и у других видов; например, гемоглобины цыпленка и курицы или головастика и лягушки различны, причем во всех случаях пигмент молодого организма имеет более высокое сродство к кислороду.
У многих животных имеется более чем один гемоглобиновый компонент в крови; эти компоненты в некоторых случаях выполняют разные функции. Два гемоглобиновых компонента тихоокеанского лосося, Onchorhynchus keta, сильно различаются между собой по сродству к кислороду, этот факт может объясняться необходимостью для этого вида проводить часть жизни в соленой воде, а часть — в пресной.
176
Часть I. Химические и биохимические аспекты
Хотя гемоглобин обычно считается продуктом чисто животного происхождения, одна его форма — леггемоглобин, была обнаружена у бобовых растений. Его присутствие ограничено клетками корневых клубеньков, содержащих симбиотические азотфиксирующие бактерии (Rhizobiutn spp.). Гемопротеины со свойствами гемоглобинов обнаружены также у некоторых грибов и простейших.
5.5.5. Вклад гемоглобина в окраску животных
Гемоглобин эритроцитов в капиллярных кровеносных сосудах кожи придает розоватый оттенок коже людей «белой» расы. У большинства других позвоночных эта окраска скрыта волосами, перьями, чешуей или завуалирована другими кожными пигментами. Гемоглобином обусловлена розовая окраска языка, внутренней части ушей и кончика носа у многих млекопитающих. Некоторые специфические ткани или участки тела могут окрашиваться гемоглобином в красный цвет и играть при этом роль предупреждающих сигналов, или признаков определенного пола (гл. 8), например голая шея у некоторых грифов, бородка у индюка и других птиц, а также ягодицы у павиана. Среди беспозвоночных обусловленная гемоглобином окраска наблюдается у многих многощетинковых и однощетинковых кольчатых червей (например, у «мотыля»), а также при некоторых условиях у ветвистоусых и листоногих Crustaceae. Однако гемоглобин вносит свой вклад в окраску лишь небольшого числа животных, позвоночных и беспозвоночных.
5.5.6. Хлорокруорин
Близкородственным гемоглобину является другой гемопротеин — хлорокруорин, или хлорогемоглобин, который служит переносчиком кислорода в зеленой крови очень ограниченной группы многощетинковых червей. Простетическая группа хлорокруорина— хлорокруорогем (5.25)—отличается от протогема тем, что в нем вместо винильной группы при С-З находится формильная, т. е. альдегидная, группа. Во всех других отношениях, а именно образованием комплекса хлорокруороге-ма с глобиновым белком, а также сродством такого комплекса к кислороду хлорокруорин сходен с гемоглобином. В спектре поглощения оксихлорокруорина полоса Соре наблюдается при 430 нм, а а- fJ-полосы поглощения — при 604 и 558 нм, т. е. при больших длинах волн, чем у оксигемоглобина. Окси- и дезоксиформы хлорокруорина по окраске почти не различаются, однако для этого пигмента характерен сильный дихроизм, и его
Гл. 5. Тетрапирролы
177
окраска при разбавлении меняется от красной до зеленой. Лишь у очень небольшого числа видов хлорокруорин придает телу животного зеленоватую окраску.
5.5.7. Гемоцианин, гемоэритрин и гемованадии
Эти соединения служат пигментами крови или дыхательными пигментами у очень небольшого числа беспозвоночных. Они представляют собой металлопротеины и включены в этот раздел условно, так как, несмотря на названия, не явля-
ются ни производными гема, ни производными порфирина. Например, гемоцианины брюхоногих моллюсков, таких, как улитка Helix pomatia, представляют собой гигантские белки (мол. масса 9> 10е). Их функциональной единицей, которая связывает одну молекулу Ог, служит пара атомов меди, окруженная компактно свернутым полипептидом с мол. массой 50 000. Ог семи до девяти таких функциональных единиц составляют фрагмент с мол. массой 4—5*105, а молекула гемоцианина включает 20 таких фрагментов.
5.5.8. Цитохромы электронтранспортной цепи
Цитохромы представляют собой группу небольших гемопротеинов, у которых в отличие от гемоглобина и миоглобина входящий в состав их гема атом железа легко подвергается обратимому окислению и восстановлению. Это свойство придает им чрезвычайно важное биологическое значение в переносе электронов. Цитохромы содержат все животные, растения и аэробные микроорганизмы. К настоящему времени выявлено и довольно детально изучено большое число цитохромов. На ос
12—84
178
Часть 1. Химические и биохимические аспекты
новании природы содержащейся в них простетической группы и способа ее связи с белками их можно разделить на четыре главные группы — цитохромы а, Ъ, с и d.
Простетическая группа цитохрома b представляет собой протогем (5.23), как и у гемоглобина. Гемогруппа цитохрома а, обозначаемая как гем а (5.26), отличается от протогема заменой метильной группы при С-18 на СНО-группу и модификацией винильной группы при С-3 путем присоединения к ней Ci5-(фарнезил) изопреноидной цепи. Название «цитохром d* применяется к цитохромам с дигидропорфириновой (хлориновой)-простетической группой, содержащей железо (5.27); боковые цепи заместителей у этой простетической группы могут варьировать. Группа цитохрома с включает все цитохромы, у кото-
(5.27) Простетическая группа цитохрома d (заместители R1, R2 и R3 достоверно не выяснены)
Гл. 5. Тетрапирролы
\7<3>
рых боковые цепи гема связаны с белком ковалентными тио-эфирными связями, например (5.28).
Индивидуальные цитохромы внутри этих групп обозначают нижними индексами, например цитохром д6, или в их название входит длина волны a-полосы в спектре поглощения, например цитохром д-550.
Количественный вклад цитохромов в суммарную концентрацию тетрапирролов у организмов, содержащих хлорофилл или гемоглобин, незначителен, однако они жизненно необходимы для функционирования этих организмов, В митохондриях эукариотических клеток они являются основой высокоорганизованной электронтранспортной цепи (рис. 5.12), которая используется для аэробного окисления восстановленных коферментов
Рис. 5.12. Роль цитохромов в митохондриальной электронтранспортной системе.
12
a so
Часть I. Химические и биохимические аспекты
(например, NADH), образующихся в ходе окислительного расщепления питательных веществ. С электронтранспортной цепью связан процесс окислительного фосфорилирования, в котором генерируется большая часть АТР клеток. В цепи участвуют несколько цитохромов, и гемовое железо каждого из них претерпевает окисление и восстановление по мере прохождения
Фис. 5 13. Механизм функционирования цитохрома Р450 при окислении субстрата RH до ROH оксидазой со смешанной функцией.
’электрона по всей цепи вплоть до молекулярного кислорода. •Сходным образом цитохромы функционируют в фотосинтетическом переносе электронов. Без электронтранспортных систем •синтез АТР, необходимого для протекания биохимических реакций, был бы невозможен. Роль цитохромов и других пигментов в этих процессах, особенно в фотосинтетическом транспорте электронов, рассмотрена в гл. 10.
Цитохромы жизненно необходимы для функционирования клеток, но они не вносят никакого вклада в окраску организмов.
5.5.9. Цитохром Р450
Цитохром Р450 представляет собой гемопротеин, который широко используется при биологическом окислении, катализируемом оксидазами со смешанной функцией. Р450 является щитохромом типа b с протогемом IX в качестве простетической .группы. В результате реакции с окисью углерода Ее2+дает ста
Гл. 5. Тетрапирролы
181
бильный продукт с Хтах = 450 нм, от чего и произошло его название «Р450».
Оксидазы со смешанной функцией катализируют введение одного атома молекулы кислорода в органическую молекулу RH с образованием окисленного продукта ROH. Второй атом кислорода восстанавливается до воды. Второй субстрат [кофермент, обычно NAD(P)H] используется при этом в качестве донора электронов. Вся система представляет собой небольшую электронтранспортную цепь, включающую флавопротеин и цитохром Р450, который принимает электроны от восстановленного флавина в две одноэлектронные стадии и передает эти электроны на молекулярный кислород. Субстрат RH в ходе реакции, по-видимому, связывается с цитохромом Р450. Возможный механизм этой реакции приведен на рис. 5.13. Характерно, что такое гидроксилирование протекает с сохранением конфигурации. Примерами реакций, катализируемых оксидазами со смешанной функцией, могут служить гидроксилирование стероидов в микросомах печени, а также гидроксилирование лекарственных препаратов (детоксикация). Индукция цитохрома Р45о происходит под влиянием многих чужеродных органических соединений.
5.5.10. Другие гемопротеиновые ферменты
Помимо цитохромов гемовая простетическая группа необходима также некоторым другим ферментам для их каталитического действия. В число таких гемопротеинов входят пероксидазы и каталазы из различных растительных и животных источников. У этих ферментов порфирин обычно представлен протогемом. Например, пероксидаза хрена с мол. массой 44 000 содержит одну гемовую группу, которая катализирует окисление фенольных соединений с помощью Н2О2. Каталаза (из печени быка) имеет мол. массу 248 000 и содержит четыре гемогруппы. Этот фермент катализирует расщепление Н2О2 до воды с чрезвычайно высокой скоростью.
5.6. Свободные порфирины у животных
Свободные порфирины—протопорфирин (5.29), уропорфирин (5.30) и копропорфирин (5.31)—обычно присутствуют в моче и фекалиях животных. Довольно часто они встречаются также в различных тканях животных, однако, как правило, в количествах, недостаточных для придания окраски этим тканям. У беспозвоночных свободные порфирины и гемы, а также их белковые конъюгаты встречаются спорадически, обычными они являются лишь у червей и моллюсков. Наиболее известен пример окраски наружных покровов у дождевого червя:
182
Часть I. Химические и биохимические аспекты
пурпурно-багровый цвет передне-дорзальной поверхности его тела обусловлен протопорфирином. Раковины некоторых моллюсков содержат очень большие количества уропорфирина, часто изомера уропорфирина I (5.32). Свободные порфирины чрезвычайно редко встречаются или вообще не обнаружены у простейших, кишечнополостных, членистоногих и протохордовых.
НООС.Н2С.Н2С СН2.СН2-СООН
(5 29) Протопорфирин
(5 30) Уропорфирин Ш
У позвоночных, особенно у млекопитающих, свободные порфирины редки, но они иногда встречаются в некоторых внутренних тканях. Имеется, однако, много примеров присутствия протопорфиринов в яичной скорлупе некоторых птиц, благодаря чему их скорлупа может быть окрашена в коричневый цвет и иметь сложный рисунок окраски. Порфирины легко связываются с минеральными веществами, и обусловленная ими окраска яичной скорлупы, как правило, удивительно устойчива. Нет также ничего необычного в присутствии в оперении птиц коп-ропорфирина III, причем иногда в больших количествах. Замечательная ярко-красная окраска перьев бананоеда обусловлена присутствием хелатного комплекса уропорфирина III с медью. Этот пигмент хорошо растворим в воде, хотя, к счастью, лишь
Гл. 5. Тетрапирролы
183
при щелочной реакции среды, так что птице не угрожает потеря окраски в ее природной среде обитания — во влажных тропических лесах.
Подводя итог, следует отметить, однако, что в общем вклад свободных порфиринов в окраску животных невелик.
(5 31) Копропорфирин III
(5 32) Уропорфирин!
5.7. Витамин Bi2
Витамин В12 играет важную роль в организме млекопитающих, в том числе человека. Дефицит этого витамина лежит в основе патогенеза заболевания, именуемого пернициозной анемией. Он является также незаменимым ростовым фактором для некоторых микроорганизмов. Структурно витамин Ви (цианокобаламин) представляет собой циклический тетрапиррол с катионом Со+ в качестве хелатируемого иона металла (5.33). В случае витамина В12 макроцикл является не стандартным порфирином, а представляет собой коррин, в кото
184
Часть I. Химические и биохимические аспекты
ром б-метиновый мостик (С-20) отсутствует, и в результате между кольцами А и D имеется непосредственная ковалентная связь. В то же время а- и 0-метиновые мостики (С-5, С-15) несут добавочные метильные группы и вся система целиком находится в гораздо более восстановленном состоянии, чем в случае порфиринов. Важное значение имеет также присутствие в ней нескольких ацетамидных и пропионамидных заместителей. Наиболее необычным свойством молекулы является содержание диметилбензимидазолрибозилфосфата, связанного через фосфатную группу с боковой цепью кольца D и через атом азота имидазольного кольца (координационной связью) с атомом кобальта. Диметилбензимидазольная группа может быть, заменена на аденин.
(5 33) Витамин В12
Цианокобаламин Х-СК
он он
Гл. 5. Тетрапирролы
185
Обычно витамин В12 выделяют из тканей в растворе, содержащем ионы CN-, которые играют роль шестого лиганда Со+, но комплекс витамина с CN не активен in vivo. Метаболически активная форма (В^-кофермент) вместо CN содержит аденозин, непосредственно связанный с Со+ через С-5 рибозного остатка. Кофермент участвует в реакциях перегруппировки, таких, как перегруппировка метилмалонил-СоА в сукцинил-СоА.
Витамин В12 синтезируется исключительно микроорганизмами: ни животные, ни растения его не образуют. Животные получают свою дозу В12 главным образом от микроорганизмов кишечника. В медицинской промышленности витамин В12 получают из микробных культур.
In vivo витамин В]2 присутствует в столь малых количествах, что его темно-красная окраска не сказывается на внешнем виде микроорганизмов.
5.8. Линейные тетрапирролы — билины
5.8.1. Введение
Билины распространены широко, хотя и нерегулярно, у представителей как растительного, так и животного царства. У животных они представляют собой продукты катаболизма гема. У растений и водорослей они также являются производными порфиринов; у некоторых водорослей они образуются в •больших количествах в виде белковых конъюгатов, которые играют важную роль в фотосинтезе. В структурном отношении билины представляют собой линейные (или открытые) тетрапирролы— производные структуры (5.8). Углеродные мостики (а, Ь, с), связывающие пиррольные кольца, могут быть как насыщенными (—СН2—), так и ненасыщенными (—СН = ). Если все три углеродных мостика насыщены, то молекула представляет собой билан, если же один мостик ненасыщен, то — билен. Билидиены и билитриены имеют соответственно два и три ненасыщенных (—СН = )-мостика. Таким образом, среди структур, представленных ниже, уробилиноген (5.37) служит примером билана, уробилин (5.39) — b-билена, билирубин (5.35) — а, с-билидиена, а биливердин (5.34) — а, Ь, с-билитриена. Все эти соединения, как показано, существуют преимущественно в дикетоформе.
5.8.2. Билины животных (желчные пигменты)
Структура и образование. У млекопитающих разрушение гема гемоглобина и других гемопротеинов приводит к образованию открытых тетрапирролов, издавна известных как желч-
(5 34) Биливердин IX а
он
(5 37) Уробилиноген
(5.38) Стеркобилин
Гл. 5. Тетрапирролы
187
ные пигменты. Этот катаболический процесс происходит главным образом в ретикулоэндотелиальных клетках селезенки, печени, костного мозга и в меньшей степени почек. Источником главной массы гемов, катаболизирующихся по этому пути, является гемоглобин стареющих эритроцитов; аналогичным образом утилизируются также гемовые простетические группы других белков, например гемсодержащих ферментов.
В ходе образования билинов происходит ферментативное расщепление порфириновой системы гема по а-метиновому мостику (С-5), что приводит к образованию первого открытого
соон соон
(5 39) Уробилин
тетрапиррола — билитриена биливердина 1Ха (5.34). Это зеленый желчный пигмент, который окрашивает фекалии большинства птиц и амфибий. У большей части млекопитающих, в том числе и у человека, центральная (—СН = )-группа восстанавливается до (—СН2—)-группы с образованием оранжевого били-диена билирубина (5.35). Он превращается в диглюкуронид (5.36), который проходит через кишечник. Бактерии кишечника осуществляют дальнейшее восстановление последнего с образованием бесцветных продуктов, таких, как билан уробилиноген (5.37). Наряду с восстановлением (—СН = )-мостиков происходит также восстановление винильных боковых цепей до этильных, что приводит к образованию «л*езо»-структур. Эти продукты на воздухе окисляются до желто-коричневых биленов стеркобилина (5.38) и уробилина (5.39), которые главным образом и придают окраску фекалиям и моче. Более подробно эти процессы рассматриваются ниже при обсуждении биосинтеза тетрапирролов (разд. 5.9.14).
Свойства. Биливердин и билирубин представляют собой кислоты и поэтому растворимы в водных растворах едких щелочей. Их соли с большинством ионов нещелочных металлов в воде нерастворимы; кальциевая соль билирубина является главным компонентом желчных камней. Благодаря раскрытию порфиринового макроцикла пиррольные кольца и углеродные атомы метиновых мостиков становятся более доступными для хи
188
Часть I. Химические и биохимические аспекты
мической атаки, и, следовательно, более реакционноспособными.
Для билинов характерно интенсивное поглощение света в видимой области, однако полосы Соре они не дают. Насыщение по метиновым мостикам укорачивает хромофор, и поэтому максимумы поглощения их спектров наблюдаются при более коротких длинах волн. Так, у биливердина %гаах = 680 нм (в кислой среде), у билирубина %таХ = 450 нм, а у уробилина Хтах = 490нм. Биланы, такие, как уробилиноген, в видимом диапазоне спектра не поглощают.
Распространение. Хотя образование билинов из молекул гема наиболее интенсивно изучалось у млекопитающих, этот про-
соон соон
(5.40) Биливердин IX у
цесс широко распространен у всех представителей животного царства. Билины были найдены у большинства главных групп животных. Они служат пигментами покровов тела многих беспозвоночных, особенно червей (например, Nereis diversicolor, обычного ярко-зеленого морского червя прибрежных скалистых банок) и насекомых. Хорошо известная зеленая окраска крови и покровов тела многих кузнечиков, гусениц и т. п. обусловлена билинами биливердинового типа, а вовсе не хлорофиллом, как думали первоначально. Общим для этих беспозвоночных является присутствие глаукобилина (мезобиливердина), у которого винильные боковые цепи восстановлены до этильных групп.
У позвоночных билины хорошо известны как пигменты, обусловливающие окраску желчи и фекалий, но они редко придают окраску каким-либо поверхностным тканям. У человека, однако, такая ситуация известна — при заболевании желтухой кожа принимает желтоватый оттенок. Пигмент, ответственный за этот симптом, представляет собой билирубин, который присутствует в крови в значительных количествах. Другой известный пример такого рода у позвоночных — синяя или зеленая окраска яичной скорлупы у некоторых птиц, которая обусловлена биливердином. К таким птицам относятся лесная завирушка (Prunella modularis), а также некоторые домашние утки (известны «голубые» утиные яйца). У некоторых насеко
Гл. 5. Тетрапирролы
189
мых расщепление гема происходит при у-лгезо-углеродном атоме и в результате образуются билины у-ряда. Так, биливердин! 1Ху (5.40) найден в покровах тела гусеницы белой бабочки-капустницы (Pieris brassicae).
Функции. Несмотря на интенсивное изучение билинов, особенно у позвоночных, их участия в функционировании какого,-либо органа не обнаружено.
5.8.3. Фикобилины и фикобилипротеины
Распространение в природе, свойства и структура.. В растительном царстве билины присутствуют в виде белковых, конъюгатов (фикобилипротеинов) у водорослей трех типов — Rhodophyta (красные водоросли), Cyanophyta (сине-зеленые-водоросли) и Cryptophyta (криптомонады). Билипротеины водорослей представляют собой кислые водорастворимые глобулярные белки. Первоначально предполагали, что они обладают большой молекулярной массой, но, как теперь выяснилось, их молекула состоит из небольших субъединиц (мол. масса — 20 000). Фикобилиновые простетические группы прочно, т. е. ковалентно, присоединены к белку и могут быть удалены лишь, после чрезвычайно жесткого химического воздействия. Это» очень усложняет выяснение структуры фикобилинов. Фикобилипротеины агрегируют с образованием частиц, называемых 'фикобилисомами (разд. 10.8.2 и рис. 10.17). Последние играют важную вспомогательную роль при улавливании света в процессе фотосинтеза.
В водорослях преобладают билипротеины двух главных групп — красные фикоэритрины и синие фикоцианины. Большинство видов водорослей содержит как фикоэритрин, так и. один или несколько фикоцианинов, среди которых обычно преобладает какой-либо один билипротеин. Красные водоросли в> основном содержат фикоэритрин, а сине-зеленые — фикоцианин, хотя имеются представители Cyanophyta, у которых преобладает красный фикоэритрин. Относительные количества присутствующих фикоцианина и фикоэритрина зависят от спектрального состава света, например освещение зеленым светом» благоприятствует синтезу поглощающего в зеленом диапазоне-фикоэритрина, в то время как на красном свету преобладает синтез фикоцианина. В дополнение к этим двум фикобилипро-теинам в ядре фикобилисомной структуры содержится небольшое количество аллофикоцианина.
Спектроскопически можно различить несколько типов фикоэритринов и фикоцианинов. Типичные спектры поглощения пигментов, выделенных из одной водоросли, показаны на рис. 5.14. Хотя все фикоэритрины, выделенные из водорослей, обладают
190
Часть I. Химические и биохимические аспекты
характерным главным максимумом поглощения при 560— 570 нм (максимумы поглощения пигментов из криптомонад могут слегка выходить за пределы этого диапазона), спектры поглощения фикоэритринов из Cyanophyta, Rhodophyta и Crypto-phyta, а также фикоэритринов, выделенных из разных видов, могут различаться. То же относится и к фикоцианинам (Л,тах = 610—620 нм). Аллофикоцианин, который в фикобилисоме при-
Рис. 5.14. Спектры поглощения света фикоцианином (/), фикоэритрином (II) л аллофикоцианином (III) из сине-зеленой водоросли Chlorogloea. Спектры в водном растворе, pH 7,0.
нимает энергию от фикоэритрина и фикоцианина, поглощает даже при еще большей длине волны (650 нм).
Хромофорами простетических групп фикоцианина и фикоэритрина являются фикоцианобилин и фикоэритробилин соответственно. Однако ситуация не всегда столь проста; некоторые билипротеины содержат два различных хромофора, например фикоцианин из Rhodophyta включает как фикоцианобилин, так и фикоэритробилин.
Выяснение структуры этих фикобилиновых хромофоров оказалось чрезвычайно сложным. Сейчас уже показано, что, подобно желчным пигментам животных, все они являются IXa-изомерами и образуются путем разрыва а-метинового мостика порфирина. В старых работах обработка фикобилипротеи-нов кипящим метанолом приводила к высвобождению модифицированных хромофоров «фикоэритробилина-690» [фикобили-вердина (5.41)] и «фикоэритробилина-590» [фиковиолина (5.42а)]. Истинные хромофоры — фикоцианобилин и фикоэри-
Гл. 5. Тетрапирролы
191
тробилин — строятся из них путем образования тиоэфирной связи между этилиденовой группировкой кольца А и цистеиновым остатком белка (рис. 5.15). Можно привести еще один пример. Предполагают, что фикоуробилин из фикоэритрина Rhodophyta образуется из хромофора (5.43) в результате образования тиоэфирных связей с заместителями в кольцах А и D. (Для удобства на рисунках хромофоры представлены в виде линейных структур без учета их истинной природной конформации.)
соон соон
(5 41) Фикоэритробилин-690 = Фикобиливердин
СООН COOR
(5 42а) R =Н; Фикоэритробилин 590 = Фиковиолин
(5 42b) R=CH3, Аплизиовиолин
(5 43) Фикоуробилин
<92
Часть I. Химические и биохимические аспекты
Остаток цистеина
Предполагаемое дополнительное связывание фикоуробилина
Рис. "515. Предполагаемое ковалентное связывание с белком фикоэритробилина, фикоцианобилина и фикоуробилина.
Распространение и функции в растениях. В царстве растений распространение фикобилинов ограничивается тремя классами водорослей. Концентрация билипротеинов у водорослей обычно высока — для фикоцианина зарегистрированы значения, достигающие 24% сухой массы водорослей. Столь высокие концентрации билипротеинов обусловливают характерную голубую и красную окраску большинства представителей Cyanophyta и Rhodophyta. У этих водорослей билипротеиновые пигменты присутствуют в виде агрегатов (билисом) в фотосинтетических структурах, где они играют важную роль в улавли-®ании света. Их функционирование в фотосинтезе будет обсуждаться в гл. 10.
Гл. 5. Тетрапирролы
193
Дальний красный свет 730 нм
Красный свет 660 нм
Рис. 5 16 Предполагаемая модель комплекса тетрапиррол — белок в Реформе фитохрома и механизм его превращения в Ptr-форму.
Распространение у животных. Имеется много сообщений о присутствии билипротеинов, таких, как фикоцианин и фикоэритрин у беспозвоночных животных, в частности моллюсков, причем некоторые из них используют эти пигменты для формирования окраски тела и раковин. Хорошо изученным примером служит аплизиовиолин (5.42b) — метиловый эфир фикоэритробилина — в заметных количествах присутствующий в пурпурном оборонительном секрете моллюска Aplysia. Известно так-
13-64
194
Часть I. Химические и биохимические аспекты
же окрашивание фикобилинами некоторых рыб, например голубого губана. Рыбы получают фикобилины из водорослей, которыми они питаются.
5.8.4. Фитохром
Все высшие растения содержат фитохром — сине-зеленый фотохромный пигмент, который контролирует большое число разнообразных метаболических процессов, а также различные стадии развития организмов. Фитохром представляет собой белок с мол. массой 120 000. В качестве хромофора простетической группы он содержит линейный тетрапиррол, или билин. Фитохром существует и функционирует в двух формах— в форме Рг, которая имеет максимум поглощения в красном диапазоне спектра (660 нм), и в форме Pfr с максимумом поглощения в дальней красной области (730 нм). Эти две формы легко переходят друг в друга; при поглощении красного света форма Рг превращается в форму Ргг, которая в свою очередь дает форму Рг в результате поглощения дальнего красного света.
соон соон
(5.44) Хромофор фитохрома (Рг)
Детали структуры белка и ультраструктуры фитохрома полностью не установлены; структура белка у разных видов растений, по-видимому, различна. Тетрапиррольный хромофор, который может быть выделен (5.44), оказался сходным с фикобилинами водорослей. Точно характер связи хромофора с белком еще не известен, но ясно, что эта связь отличается от той, которая имеется у фикобилипротеинов. На рис. 5.16 показаны предполагаемое связывание тетрапиррол — белок у Реформы фитохрома и механизм ее превращения в Реформу.
Более подробно функционирование фитохрома у растений обсуждается в гл. И.
Гл. 5. Тетрапирролы
195
5.9. Биосинтез и метаболизм тетрапирролов
5.9.1. Введение
Насколько сейчас известно, все живые организмы используют для образования порфиринов один и тот же механизм независимо от того, гем или хлорофилл является конечным продуктом. Как у животных, так и у растений линейные билины образуются из порфириновых предшественников.
Удобнее всего рассматривать биосинтез порфиринов по стадиям: а) образование б-аминолевулиновой кислоты (АЛК)’, б) образование монопиррола, порфобилиногена: в) образование уропорфириногена — первого тетрапиррольного макроцикла; г) модификация путем введения боковых цепей, приводящая к образованию протопорфириногена; д) дегидрирование макроцикла, приводящее к образованию протопорфирина IX; е) образование хелатного комплекса с ионом металла, приводящее к гему или предшественнику хлорофилла — магнийсодержащему протопорфирину IX; ж) последующие модификации, ведущие к образованию хлорофилла.
Стадии от (а) до (е) являются общими при биосинтезе гема и хлорофилла.
5.9.2. Образование б-аминолевулиновой кислоты
б-Аминолевулиновая кислота [АЛК (5.45)] может синтезироваться двумя различными путями. В случае основного пути у животных и, возможно, у бактерий используется фермент АЛК-синтетаза (б-аминолевулинат-синтаза), который катализирует образование АЛК из сукцинил-СоА и глицина. Реакция протекает с участием пиридоксальфосфата через образование промежуточного шиффова основания (рис. 5.17). Такие промежуточные продукты, как, например, а-амино-0-ке-тоадипиновая кислота, остаются связанными в виде шиффовых оснований (5.46), а перед отделением АЛК от пиридоксальфосфата происходит декарбоксилирование. Была выяснена стереохимия этого процесса. 2-про-5-Водородный атом глицина сохраняется в ходе всего процесса; это указывает на то, что при такой последовательности реакций в одном случае происходит сохранение, а в другом — инверсия конфигурации.
У водорослей и высших зеленых растений большая часть, если не вся, АЛК образуется путем переаминирования (рис. 5.18). АЛК-трансаминаза (аминолевулинат — аминотрансфераза) катализирует перенос аминогруппы от аминокислоты, например аланина, на у, б-дикетовалериановую кислоту [а-кето-13*
El н с—соон NHj Гикцнн
HOOC сн2.сн2—c II
Сукцинил-СоА О
SCoA[h]
-I A
И с.сн
nCOO-
CHj.COOH
Пиридоксальфосфат
^c—соон
H N
CoASH
И н
/С\
„ / ХСО.СН2.СН2.СООН rljN
(5.45) 5- Аминолевулиновая кислота
Пиридок сальфосфат
глицина и сукцинил-СоА.
Рис. 5.17. 6-Аминолевулинатсинтетазный путь образования 6-АЛК из
Гл. 5. Тетрапирролы
197
глутаровый альдегид (5.49)], которая в свою очередь образуется из L-глутамата (5.47) в результате переаминирования до а-кетоглутарата (5.48) и восстановления последнего.
5.9.3. Образование порфобилиногена
Асимметричная кнорровская конденсация двух молекул АЛК происходит в ходе процесса (рис. 5.19), который включает альдольную конденсацию, удаление воды и образо-
сн3
соон
Аланин
с=о I
соон
Пируват
Рис. 5.18. Образование б-АЛК путем переаминирования.
вание шиффова основания. Эту реакцию катализирует один фермент — АЛК-дегидратаза (порфобилиногенсинтаза), и ее продуктом является порфобилиноген [ПБГ 5.50)]. На последней стадии происходит потеря водорода при С-2 пиррольного кольца, причем эта реакция является стереоспецифичной, поскольку отщепляется атом, происходящий из про-/?-водородного атома дри С-5 АЛК.
5.9.4. Образование первого тетрапиррола — уропорфириногена III
Это наиболее интересная и наиболее сложная часть всего биосинтетического пути. Тетрапиррольный макроцикл образуется из четырех идентичных монопиррольных фрагментов в форме ПБГ. Простая конденсация по типу «голова-к-хвосту» четырех молекул ПБГ привела бы к образованию тетрапирро-
А. Суммарный процесс
соон
сн2
сн2
СООН к Сг12
СООН
сн2
соон сн2
-I I
‘ СН2
Сн2
н
(5 50) Порфобилиноген
nh2
(ПБ1 )
Б Возможный механизм
соон
ООН
соон
сн2
фермент---NH2
сн2
сн2
сн2
сн2
нс
Фермент---N=C
сн2
Н2О
сн2
сн2
nh2
nh2
СООН f соон сн2
nh2
ООН
соон
сн2
сн2
н+ с=
сн2
сн2
сн2
1 л с-4)н
фермент—N—С
сн2
Н20
Фермент—N= С
сн2
сн2
1
nh2
nh2 н н
nh2
СООН
соон сн2
сн2 сн2 н \==/
Фермент—N-ттС
н+ сн2 V н
nh2
(5 50) ПБГ
Рис 5 19 Образование порфобилиногена- возможный механизм, включающий образование шиффова основания между АЛК и лизиновым остатком АЛК-дегидратазы
Гл. 5 Тетрапирролы
199
ла уропорфириногена I (5.51). Обычно же первым циклическим тетрапирролом, который может быть выделен в качестве промежуточного продукта пути биосинтеза хлорофилла и гема, является другой изомер — уропорфириноген III (5.52), в котором положения боковых цепей ацетатного и пропионатного заместителей у одного из пиррольных колец формально изменены на обратные.
Образование уропорфириногена III из четырех молекул ПБГ — сложный процесс, который все еще продолжают интенсивно изучать. В нем участвуют два фермента —ПБГ-дезами-наза (уропорфириноген I — синтаза) и уропорфириноген Ш-ко-синтетаза, — которые, по-видимому, функционируют совместно а не строго последовательно. При денатурации косинтетазы, например нагреванием до 55—60 °C, первый фермент остается активным, и в результате реакции образуется уропорфириноген I. Однако он уже не может изомеризоваться до уропорфириногена III. Вероятная последовательность происходящих событий приведена на рис. 5.20. Четыре молекулы ПБГ собираются последовательно, начиная с кольца А, в линейный би-лан (5.53). Эта реакция протекает в присутствии ПБГ-дезаминазы, которая затем катализирует образование ключевого промежуточного продукта — гидроксипроизводного этого била-на (5 54). Последний быстро циклизуется косинтетазой с образованием уропорфириногена III. В этой реакции может принимать участие стабилизируемый ферментом промежуточный продукт—метиленпирроленин (5.55). В ходе циклизации происходит внутримолекулярная перегруппировка в кольце D, вероятно, по механизму, ответственному за образование промежуточного продукта спиро-типа (5.56). В отсутствие косинтетазы линейный тетрапиррол может легко циклизоваться до уропорфириногена I.
5.9.5. Превращение в протопорфириноген (рис. 5.21)
Следующей стадией биосинтетического пути является последовательное декарбоксилирование четырех ацетатных боковых цепей уропорфириногена до четырех метильных групп. На этой стадии пропионатные боковые цепи не изменяются. Уропорфириноген I может таким образом превращаться в копропорфириноген I (5.57). Однако обычно в процессе биосинтеза из уропорфириногена III образуется копропорфириноген III (5 58). Удаление всех четырех карбоксильных групп катализируется одним ферментом — уропорфириноген Ш-де-карбоксилазой. Промежуточные продукты в нормальных условиях, по-видимому, не отщепляются от фермента, однако небольшие количества таких продуктов были получены из фека-
(5.Б1) Уропорфириноген 1
(5.52) Уропорфириноген Ш
Рис 5 20 Предполагаемый механизм образования уропорфириногеиа III (А= =--СП2СООН; Р = —СН2СН2.СООН).
Гл. 5. Тетрапирролы
20!
лий крыс. Имеющиеся доказательства подтверждают следующую последовательность декарбоксилирования колец: D, А, В и С. Была также определена стереохимия процесса декарбоксилирования: он протекает с сохранением конфигурации (рис. 5.21, Б).
Две пропионатные боковые цепи копропорфириногена III (в кольце А, а затем в кольце В) далее модифицируются в винильные группы с помощью копропорфириногеноксидазы, для функционирования которой необходим молекулярный кислород. Копропорфириноген I такой модификации не подвергается. Промежуточными продуктами модификации копропорфириногена III могут быть соединения с гидроксилированными пропионатными боковыми цепями, а ее конечным продуктом является протопорфириноген IX (5.59). Установлено также, что при этом наблюдается транс-отщепление водорода (рис. 5.21, Б).
5.9.6. Дегидрирование до протопорфирина IX
Прежде чем произойдет образование хелатного комплекса с металлом, порфириногенный макроцикл в результате удаления шести водородных атомов должен быть превращен в сопряженный окрашенный порфирин (рис. 5.22, А). Последовательность их удаления неизвестна. Продукт этой реакции— протопорфирин IX (5.60) является последним промежуточным продуктом, общим для биосинтеза хлорофилла и гема.
5.9.7. Образование хелатного комплекса с металлом
Биосинтез гема. Гем (протогем; 5.61) образуется из протопорфирина IX и Ре2+-иона под действием фермента феррохелатазы (рис. 5.22, Б). Обычно этот фермент прочно связан с клеточными частицами. Его можно обнаружить в митохондриях животных клеток, в хлоропластах растений и в мембранах фотосинтезирующих бактерий. В некоторых случаях, однако, в клетках присутствует также и растворимая феррохелатаза. Очищенная феррохелатаза способна вводить в протопорфирины (которыми могут быть не только протопорфирины IX), помимо ионов Fe2+, ионы других металлов, например Zn2+ и Со2+. Некоторую роль в этом процессе играет, по-видимому, липид (вероятно, фосфолипид).
Биосинтез хлорофилла. Хотя считают, что введение иона магния при биосинтезе хлорофилла также происходит на стадии протопорфирина IX (рис. 5.22, В), на практике чрезвычайно трудно разделить образование хелатного комплекса с металлом от метилирования пропионатной боковой цепи при С-13.
Изомеры I
НООС HjC HjC CH, соон ноос
Уропорфириноген I
(5 57) Копропорфириноген |
Уропорфириноген III
^/(5 58) Копропорфириноген III снон сн, соон
(5 59) Протопорфириноген । х
Гл. 5. Тетрапирролы
203
Б
1) Декарбоксилирование ( стадия 1 )
СН2.СН2.СООН
2) Элиминирование ( стадия 2
Включение ОН с сохранением
Рис. 5.21. Превращение уропорфириногена в копропорфирииоген и затем в протопорфнрииогеи IX. А. Путь превращения. Б. Стереохимия.
Однако была показана этерификация магнийпротопорфирина IX (5.62) до метилового эфира (5.63) с участием S-аденозилме-тионина. Это подтверждает идею о том, что в нормальных условиях хелатирование предшествует метилированию. Что касается фермента, ответственного за введение иона Mg2+ в молекулу протопорфирина IX, то здесь пока получены лишь предварительные результаты.
5.9.8. Последующие стадии биосинтеза хлорофилла а
Образование изоциклического кольца (кольца Е) и протохлорофиллида а. Метилированная пропионатная боковая цепь в положении 13 кольца С метилмагнийпротопорфири-на IX (5.63) используется для образования изоциклического кольца (кольца Е) с помощью последовательности реакций, показанной на рис. 5.23. Были идентифицированы промежуточные продукты этой последовательности реакций, протекающих по типу р-окисления.
Протопорфириноген IX
<5 61) Гем (протогем)
(5 62) Магнийпротопорфирин IX
(5 63) Метил'магнийпротопорфирин IX
Рис. 5 22 А. Превращение протопорфнриногена IX в протопорфирин IX Б. Хелатирование Fe2+ с образованием гема В Введение магния с образованием метилмагнийпротопорфирина IX
(5.65) Протохлорофил л ид а
Рис. 5.23. Образование изоциклического кольца и протохлорофиллида а.
206
Часть 1. Химические и биохимические аспекта
(5 67) Хлорофилла
Рис. 5.24. Превращение протохлорофиллида а в хлорофиллы а и Ь.
Винильная группа при С-8 образующегося продукта — метилового эфира магний-3,8-дивинилфеопорфирина as (5.64) — затем подвергается насыщению до этильной группы, и образуется протохлорофиллид а {метиловый эфир магнийвинилфео-порфирина as (5.65)]. Вместе с тем есть много аргументов в пользу того, что восстановление винильной группы может происходить до образования изоциклического кольца.
Гл. 5. Тетрапирролы
207
Образование хлорофилла а. Превращение протохлоро-филлида а в хлорофилл а включает только две реакции — гидрирование кольца с образованием дигидропорфиринового (хлоринового) макроцикла и этерификацию последнего Сго-изопре-ноидным спиртом фитолом (рис. 5.24). Хотя эти реакции кажутся простыми, в целом образование хлорофилла а из протохлорофиллида— процесс чрезвычайно сложный.
Сначала происходит восстановление кольца D транс-присоединением двух водородных атомов, что приводит к образованию хлорофиллида а (5.66). У некоторых растений и водорослей, например у Chlorella, которая может синтезировать хлорофилл в темноте, эта реакция является простой катализируемой ферментом темновой реакцией. Большинству растений, однако, для синтеза хлорофилла необходим свет. Кроме того, процесс насыщения кольца D, по-видимому, является фотопревращением, причем не свободного протохлорофиллида а, а протохло-рофиллид-белкового комплекса, известного как протохлоро-филлндный галохром, который содержит одну молекулу протохлорофиллида на молекулу белка. Полученные данные указывают на то, что голохромный белок представляет собой фотофермент протохлорофиллидредуктазу. Образование комплекса протохлорофиллид—фермент — NADPH происходит в темноте, однако для восстановления кольца D протохлорофиллида необходим свет.
Завершающей стадией биосинтеза хлорофилла а (5.67) является этерификация остатка пропионовой кислоты при С-17 (кольцо D) хлорофиллида а фитолом. Хорошо известен фермент хлорофиллаза, который (в присутствии 30%-кого ацетона!) гидролизует или осуществляет переэтерификацию фитильной сложноэфирной группы хлорофилла. После многолетних споров в настоящее время установлено, что хлорофиллаза, действующая в обратном направлении, не принимает участия в нормальном биосинтетическом пути. В качестве донора фитильной группы идентифицирован фитилпирофосфат (5.68), образующийся из геранилгеранилпирофосфата (5.69). Недавно у высших растений были обнаружены разновидности хлорофилла, содержащие геранилгераниол (5.70) и ди-, а также тетра-гидрогеранилгераниол; это позволяет предположить, что в некоторых случаях этерифицирующим спиртом может служить геранилгераниол, который, вероятно, восстанавливается в фитол уже после присоединения к порфирину.
5.9.9. Образование хлорофилла b
Скорее всего, хлорофилл b (5.71) образуется из хлорофилла а путем окисления метильной группы при С-7 до альдегидной. Пока ничего не известно о механизме этого предпо
208
Часть I Химические и биохимические аспекты
лагаемого процесса. Альтернативные предположения, согласно которым эти два хлорофилла синтезируются различными или расходящимися путями или хлорофилл а образуется из хлорофилла Ь, были отвергнуты.
5.9.10. Образование хлорофиллов end
О биосинтезе хлорофиллов с и d ничего не известно. На основании их структуры можно предположить, что хлорофиллы Ci (5.72) и с2 (5.73) образуются из промежуточных продуктов пути биосинтеза хлорофилла а, а хлорофилл d (5.74) — из самого хлорофилла а (рис. 5.25).
5.9.11. Образование бактериохлорофиллов
Были получены мутантные штаммы бактерий (RJiodop-seudomonas spp.), накапливающие протохлорофиллид а, хлорофиллид а и другие близкие к ним соединения, у которых винильная группа в кольце А модифицирована в гидроксиэтиль-ную или ацетильную. Как видно на биосинтетической схеме, приведенной на рис. 5.26, модификация боковой цепи при С-3 происходит перед гидрированием кольца В, приводящем к образованию бактериохлорофиллида а (5.75). Этерификация фитолом или близким к нему спиртом, таким, как фарнезол, является заключительной стадией образования бактериохлорофилла а (5.76). Бактериохлорофилл b (5.77) образуется, по-видимому, путем дегидрирования бактериохлорофилла а.
5.9.12. Образование хлоробиум-хлорофиллов (бактериохлорофиллов cud)
Относительно биосинтеза нескольких хлорофиллов Chlorobium известно очень мало. По-видимому, они образуются из гидроксиэтильного промежуточного продукта (5.78) биосинтеза бактериохлорофиллов и дополнительные алкильные заместители при С-8, С-12 и С-20 вводятся позже путем присоединения к винильным группам; донором при этом служит S-аденозилметионин.
5.9.13. Биосинтез витамина Bi2
Тип III расположения боковых цепей в витамине В12 указывает на фундаментальное сходство его биосинтеза с биосинтезом гема и хлорофилла. Корриновое кольцо происходит от АЛК и ПБГ, и начальные стадии его биосинтеза идентичны стадиям образования порфирина. Уропорфириноген III включается в корриновую систему без какой-либо фрагментации
Гл 5 Тетрапирролы
20»
(5 72) Хлорофилл с, (R ( П2 СИ,)
(5 64) (R -СП -СП;) Метилмагнии-
3,8 дивинипфеопорфирин as
{ReCH2 СПз) Протохлорофиллида
(5 73) Хлорофилл с2 (К -( 11 - Cl I ,}
л. (5 74) Хлорофилл^
(5 67) Хлорофилл a
Рис. 5.25. Возможные пути образования хлорофиллов end.
или перегруппировки четырех колец. Более поздние стадии биосинтеза витамина В12 в настоящее время интенсивно изучаются.
5.9.14. Образование билинов
У животных билины образуются в результате катаболического распада гема, главным образом гема гемоглобина, в результате окислительного элиминирования одного из угле-
14—84
(5 78)
{5.77| Бактериохлорофилл b фарн«ип или геранилгерзнилХ
Рис. 5.26. Образование бактериохлорофиллов и хлоробиумхлорофиллов.
Гл- 5. Тетрапирролы
211
родных атомов метиновых мостиков и потери хелатированного атома железа. Расщепление происходит преимущественно в ретикулоэндотелиальных клетках селезенки, печени, костного' мозга и в меньшей степени почек. Хотя механизм этого процесса еще до конца не ясен, известно, что два вводимых кетоновых, или лактамных, атома кислорода происходят из двух различных молекул О2 и что в этом процессе участвуют цитохром-связанная гем-оксигеназа, NADP+ и аскорбиновая кислота. Метиновый углерод освобождается в виде окиси углерода, железо транспортируется к месту хранения общих запасов железа в организме, а глобин расщепляется до аминокислот, поступающих в общий метаболический фонд. У млекопитающих происходит разрыв исключительно а-метинового мостика (С-5) с образованием биливердина 1Ха (5.79). Расположенный в центре молекулы биливердина углеродный атом метиновой группы затем восстанавливается до СН2 под действием редуктазы [с кофактором NAD(P)H], которая присутствует в печени и селезенке. Образовавшийся таким путем билирубин (5.80) транспортируется в виде альбуминового комплекса в печень, где происходит его связывание с глюкуроновой кислотой и другими сахарами, которое катализируется микросомным ферментом. Водорастворимый конъюгат поступает в желчь и затем в кишечник. В кишечнике билирубиновые конъюгаты гидролизуются p-глюкуронидазой, после чего претерпевают дальнейшие превращения, главным образом восстановление с помощью кишечных бактерий. Эти превращения включают гидрирование винильных боковых цепей, последовательное восстановление двух остающихся метиновых мостиков и ступенчатое восстановление некоторых (двух) двойных связей пиррольных колец с образованием d- и /-уробилиногенов (5.81, 5.82) и /-стеркобилиногена (5.83). Билиногены окисляются на воздухе и дают d- и /-уробилин (5.84, 5.85) и /-стеркобилин (5.86) —желто-коричневые пигменты, которые окрашивают мочу и фекалии.
Предполагаемая суммарная схема образования билинов у млекопитающих приведена на рис. 5.27. К сожалению, пока нет данных, касающихся образования билинов у низших животных.
У растений. У водорослей, так же как и у животных, окислительный разрыв порфиринового кольца происходит практически только по углероду а-метинового мостика, который теряется в виде окиси углерода. Источником билинов у водорослей является, скорее всего, гем, а не хлорофилл, и механизм его распада, вероятно, сходен с механизмом распада у животных. Детали заключительных стадий распада, в результате которого образуются фикобилины с характерной структурой, пока не ясны. Для образования билипротеинов у водорослей; и
14*
(5 80) Билирубин
CH, CH,
I I
соон COOH
(5 79) Биливердин IX a
соон COOH
Б
Гемоглобин эритроцитоз
Ретикулоэндотелиальная система
Печень
Кишечник
рис 5 27,А
Билирубин
В плазме крови в виде
Э альбуминового комплекса
Билирубин
Г люкуроновая кислота и т п.
Конъюгаты билирубина
3 Желчь
Конъюгаты билирубина
Глюкуронидаза
Билирубин
Разрушение микроорганизмами и аутоокисление
рис 5 27, В
Уробилин, стеркобилин
Рис. 5 27. Схема образования билинов из гема у млекопитающих. А. (с, 212). Распад гема до билирубина в ретикулоэндотелиальных тканях Б. Конъюгация билирубина с альбумином и его транспорт в кишечник. В. (с. 214). Распад билирубина, осуществляемый микроорганизмами и его аутоокисление в кишечнике.
(5.83) / -Стеркобилиноген
(5.86) / - Стеркобилин
(5.84) (R=CH=CH2) : d-Уробилин
(5.85) (R=CH2CH3) : / -Уробилин
Гл. 5. Тетрапирролы
215
включения их в фикобилисомы необходим одновременный синтез белка de novo. До сих пор не известно, происходит ли аналогичным путем биосинтез билиновой простетической группы фитохрома.
5.9.15. Факторы, контролирующие синтез и накопление тетрапирролов
Внешние факторы — влияние окружающей среды и условий питания. На синтез тетрапирролов могут влиять различные внешние факторы (например, окружающая среда или питание). Наиболее известным из факторов окружающей среды является освещение, необходимое для биосинтеза хлорофилла или бактериохлорофилла в большинстве фотосинтезирующих систем. Например, у Rhodopseudomonas sphaeroides бактериохлорофилл синтезируется только в анаэробных условиях на свету, хотя синтез гема (цитохромов) у этой бактерии происходит в темноте в присутствии кислорода воздуха. Активность АЛК-синтетазы на свету значительно выше, чем в темноте. Хорошо известно, что большинство высших растений при выдерживании в темноте становятся этиолированными, т. е. они не способны синтезировать нормальные хлоропласты или хлоропластные пигменты, особенно хлорофиллы. Однако при переносе на свет этиолированные проростки образуют большое количество хлорофилла за период около 48 ч и приобретают нормальную зеленую окраску. Такой синтез хлорофилла происходит по стадиям. Очень быстро, даже после кратковременного освещения, небольшое количество протохлорофиллида а (ассоциированного с протохлорофиллидголохромным белком), содержащегося в этиолированных тканях, превращается в хлоро-•филлид а, который впоследствии более медленно этерифици-руется до хлорофилла а. По этому пути образуется небольшое количество хлорофилла в течение первых двух часов позеленения. Затем наступает индукционный период, длящийся в течение нескольких часов, за которым следует быстрый синтез •de novo гораздо больших количеств хлорофилла. Во время индукционного периода происходит интенсивный синтез ферментов и значительно возрастает активность АЛК-синтетазы. Образование хлорофилла представляет собой лишь часть гораздо более сложного процесса формирования хлоропластов, причем факторы, регулирующие образование различных хлоропластных компонентов, точно скоординированы (гл. 10).
Хлороз, т. е. недостаток хлорофилла, является общим симптомом многих болезней растений. Понижение содержания хлорофилла в тканях может быть обусловлено нехваткой питательных веществ, особенно азота, железа и магния. Трудно
216
Часть I Химические и биохимические аспекты
сказать, влияют ли эти факторы только на синтез хлорофилла или на формирование хлоропластов в целом.
У большинства красных и сине-зеленых водорослей на синтез и концентрацию билипротеинов влияют такие факторы, как интенсивность и спектральный состав падающего света. Эти же факторы определяют, синтез какого из них, фикоцианина или фикоэритрина, будет преобладающим. При освещении красным светом преимущественно образуется поглощающий красные лучи фикоцианин, в то время как зеленый свет благоприятствует образованию поглощающего в этой области фикоэритрина.
У животных синтезы двух компонентов гемоглобина — гема и глобина — по-видимому, тесно скоординированы. В ответ на понижение уровня кислорода в окружающей среде происходит возрастание количества гемоглобина (до 20% У человека). Это наблюдается, например, на больших высотах над уровнем моря. При этом происходит также усиление синтеза аллостерического эффектора — 2,3-дифосфоглицерата, — что облегчает и делает более эффективной «разгрузку» кислорода из оксигемоглобина. Эти феномены привлекли внимание широкой публики во время проведения Олимпийских игр 1968 г. в Мехико. Атлеты из Кении и Эфиопии, привычные к условиям большой высоты над уровнем моря, выиграли большинство медалей в беге на средние и длинные дистанции. Спортсмены из других стран, не успевшие в должной мере акклиматизироваться, не показали высоких результатов, поскольку у них, по-видимому, уровни гемоглобина и 2,3-дифосфоглицерата недостаточны для того, чтобы мышцы работали эффективно в течение длительного времени в разреженной атмосфере высокогорья.
Весьма вероятно, что во многих рассмотренных выше случаях первой реакцией на внешний фактор является изменение количества или активности АЛК-синтетазы.
Внутренние факторы — биохимический контроль. В биосинтезе циклических тетрапирролов — гема, хлорофиллов и кор-ринов — у всех живых организмов (животных, растений и микроорганизмов) главные участки биохимического контроля находятся около АЛК и ее ключевых ферментов — АЛК-синтетазы и АЛК-дегидразы. Механизм действия этого контроля в индивидуальных случаях пока изучен недостаточно. Множество экспериментальных данных свидетельствует в пользу того, что у разных организмов и в разных тканях могут функционировать несколько различных механизмов. Тот факт, что АЛК-синтетаза обычно является нерастворимым ферментом митохондрий, в то время как почти все другие ферменты биосинтеза порфиринов растворимы и находятся в цитоплазме, позволяет предположить, что в контролирующем механизме опреде
Гл 5 Тетрапирролы
217
ленную роль играет проницаемость митохондриальной мембраны для АЛК. В большинстве случаев, однако, регулируется активность или концентрация АЛК-синтетазы или фермента, активирующего АЛК-синтетазу. По-видимому, наиболее важной и распространенной является регуляция синтеза или активности фермента конечным продуктом.
В тех случаях, когда организм или ткань синтезирует различные тетрапирролы, например бактериохлорофилл и гем, каждый из биосинтетических путей, вероятно, контролируется отдельно.
5.10. Нарушения метаболизма порфиринов
5.10.1. Порфирии
В нормальных условиях у животных синтез и распад порфиринов контролируются очень четко. У человека обнаружена группа расстройств — врожденных или приобретенных нарушений ферментов, участвующих в биосинтезе гема,— для которых характерно присутствие в различных тканях организма свободных порфиринов и (или) их предшественников. Такие нарушения, называемые порфирией, клинически обнаруживаются по повышенному выделению этих соединений.
При эритропоэтической порфирии наблюдается недостаток уропорфириноген Ш-косинтетазы и накопление больших количеств уропорфириногена I, обусловливающее винно-красное окрашивание мочи и интенсивную флуоресценцию (в красной области спектра) зубного дентина и других тканей в УФ-свете. При острой перемежающейся порфирии поражается печень. В ней накапливаются порфирины и их предшественники, особенно АЛК и порфобилиноген, которые обнаруживаются также в моче. Во время перемежающихся приступов больной испытывает острую боль в брюшной полости. Эти две главные группы порфирий включают несколько типов порфирий, различающихся природой накапливающихся порфиринов или их предшественников, типом наследования, а также клиническими свойствами и симптомами.
Причиной психического расстройства английского короля Георга III, по-видимому, была именно острая перемежающаяся порфирия (пестрая порфирия). Каждому его приступу предшествовала острая боль в брюшной полости, а в бюллетенях о состоянии здоровья отмечалось, что его моча имела характерный красный цвет. Сообщалось также о наличии симптомов, известных сейчас как симптомы порфирии, у его родственников по восходящей и нисходящей линии
При различных типах порфирии в моче и фекалиях могуг накапливаться уро- и копропорфирины (5 30, 5 31), уро- и ко-
218 Часть I. Химические и биохимические аспекты
пропорфириногены (изомеры I и III) (5.51, 5.52, 5.57, 5.58), протопорфирин IX (5.60), АЛК (5.45) и ПБГ (5.50). Их накопление обусловлено главным образом дефектами в регуляции активности АЛК-синтетазы. Порфирию можно вызвать экспериментально введением различных лекарственных препаратов, в том числе барбитуратов.
Свободный порфирин в тканях тела может действовать как сенсибилизатор опасных фотоокислительных процессов, поэтому многим больным порфирией присуща повышенная чувствительность к свету и они страдают от действия попадающего на кожу солнечного света. Интересно, что в некоторых случаях от вредных эффектов фотосенсибилизации защищает р-каро-тин. Это напоминает защитное действие каротиноидов при фотоокислении кислородом в синглетном состоянии—процесса, часто сенсибилизируемого порфиринами у бактерий и растений (гл. 10 и 11).
5.10.2. Нарушения образования билинов
Желтуха. Патологические нарушения, связанные с избытком билинов, называют желтухой. Они могут быть результатом либо избыточного образования, либо пониженной деградации билинов или же нарушения их выведения. В случае желтухи у человека избыток билирубина (5.80) придает интенсивную желтую окраску плазме крови и тканям организма. Билирубин переходит из крови в межтканевое пространство и интенсивно поглощается соединительными тканями.
Имеется несколько причин возникновения желтухи у взрослых. В норме билирубин переходит из ретикулоэндотелиальной системы в печень, где он связывается с глюкуроновой кислотой и экскретируется в желчь. Если распад гемоглобина в значительной степени усиливается, печень не справляется с удалением билирубина из крови (ретенционная, или паренхиматозная, желтуха). Чаще желтуха возникает в результате закупорки желчных путей или некроза печени, что ведет к регургитации компонентов желчи в кровоток (регургитационная, или обтурационная, желтуха). В этом случае в крови и в тканях обнаруживается повышенное содержание связанного билирубина.
Преходящая и безвредная желтуха довольно часто наблюдается у новорожденных. В печени новорожденных не хватает ферментов, ответственных за связывание билирубина; последний же присутствует у них в больших количествах из-за расщепления избытка эритроцитов во время жизни зародыша в матке. В результате накапливается свободный билирубин. Эту безопасную и легкую желтуху необходимо отличать от стой
Гл 5 Тетрапирролы
219
кой и опасной желтухи, сопровождающей гемолитические болезни новорожденных. В этом случае билирубин может избирательно поглощаться тканями мозга, вызывая его стойкое повреждение.
Желтуха бывает не только у человека и млекопитающих. Зеленая «желтуха», вызванная биливердином (5.79), описана У щук.
Образование синяков. Временная черно-синяя и желтая •окраска синяков появляется у человека, когда кровь попадает в межтканевые пространства, где гемоглобин разрушается до таких продуктов, как биливердин (зеленый), уробилин (оранжевый) и биливиолины (фиолетово-синие).
5.11. Функции тетрапиррольных пигментов
Некоторые функции тетрапирролов, не связанные с их светоплоглощающими свойствами, мы уже отмечали (особенно кислородпереносящую функцию гемоглобина). Однако большинство биологических функций этих пигментов связано с их светопоглощающими свойствами. Так, например, они придают окраску тканям, участвуют в фотосинтезе и служат фоторецепторами. Этим темам будут посвящены гл. 10 и 11.
5.12. Заключение и комментарии
Тетрапиррольные пигменты, представляющие собой группу соединений со столь жизненно важными биологическими функциями, изучались чрезвычайно интенсивно. Поэтому о механизмах их образования и функционирования известно больше, чем в случае какой-либо другой группы пигментов. Установление трехмерных структур миоглобина и гемоглобина и механизма, с помощью которого гемоглобин функционирует в транспорте кислорода, представляет собой один из классических образцов научного исследования. Во многом ясным стал также путь, по которому хлорофиллл используется как главный светособирающий пигмент в фотосинтезе (гл. 10). Основные аспекты биосинтеза порфиринов (и коррина), в том числе его детали и стереохимия, изучены в очень элегантных опытах с помощью классических радиоизотопных методов и усовершенствованных методов введения и анализа 13С- и 2Н-метки. Желающий изучать биосинтез порфиринов не смог бы сделать ничего лучшего, чем прежде всего внимательно прочитать эти работы. Тем не менее даже при таком положении вещей ход некоторых биосинтетических превращений до сих пор полностью не установлен. Для изучения образования бактериохлорофиллов, необычных хлорофиллов с и d из водорослей, модифицирован
220
Часть I. Химические и биохимические аспекты
ных гемов некоторых цитохромов и т. д., имеются широкие возможности. Необходимо завершить также структурные исследования этих соединений. Нуждаются в детальных химических исследованиях свободные порфирины, найденные у низших животных. До конца не выяснены взаимодействия между хлорофиллами и белками в специфических комплексах в фотосинтетическом аппарате и ориентация хлорофиллов внутри этих комплексов. Факторы, которые регулируют образование этих комплексов и биосинтез самих молекул хлорофилла (и других порфиринов), — это та область исследований, где биохимиков ждут открытия.
Свойства линейных тетрапирролов, или билинов, совершенно отличны от свойств макроциклических порфиринов, но опять-таки и здесь существует много захватывающих проблем. Эти соединения, известные как желчные пигменты, образуются в организме животных, в том числе и человека, путем разрушения гема. Механизмы распада и превращений с образованием продуктов, которые в конце концов выделяются, заслуживают повторного исследования с применением современных физико-химических методов. К проблемам, заслуживающим внимания, относятся также образование билинов в синяках, при желтухе и при формировании окраски скорлупы птичьих яиц. Широкое поле исследований предоставляют механизмы отложения и связывания билинов и свободных порфиринов с минеральными веществами в яичной скорлупе и факторы, которые регулируют сложный характер окрашивания скорлупы у разных видов. Растительные билины (фикобилины) у сине-зеленых и красных водорослей содержатся в фикобилисомах и функционируют как вспомогательные пигменты в фотосинтезе. Многие вопросы, касающиеся этих пигментов, такие, как способ их поглощения и связывания с белком, остаются пока без ответа. Наиболее интересным растительным билином является фитохром — «неуловимое» вещество, которое служит посредником во многих световых реакциях у представителей растительного мира. Полная картина фитохромных фотоциклов, когда она в конце концов будет целиком выяснена на молекулярном уровне, по-видимому, будет столь же впечатляющей, как и картина циклов превращения зрительного пигмента млекопитающих.
5.13. Рекомендуемая литература
Из множества книг, посвященных тетрапиррольным пигментам, выделяется монография под редакцией Смита (Smith, 1975). В ней исчерпывающе рассмотрена химия этих соединений, а также представлено множество данных об их биосинтезе. Хорошим источником информации может служить
Гл. 5, Тетрапирролы
221
обширное семитомное издание под редакцией Долфина (Dolphin, 1978), правда, к настоящему времени вышли только два тома. Полезным остается сборник докладов, представленных на симпозиуме по порфиринам и родственным им соединениям (Goodwin, 1968). Отдельным аспектам тетрапиррольных пигментов посвящен ряд книг и статей. Например, Джексон (Jack-son, 1976) приводит данные по химии и распространению хлорофиллов, а Вернон и Сили (Vernon, Seely, 1966) обсуждают все аспекты химии и биохимии хлорофилла. Информацию по порфиринам у животных читатель может получить в специальных статьях Кеннеди (Kennedy, 1969, 1976), а также Риминг-тона и Кеннеди (Rimington, Kennedy, 1962); он найдет ее также в соответствующих разделах книг по пигментам животных Фокса (Fox, 1976), Фокса и Веверса (Fox, Vevers, 1960) и Нидхэма (Needham, 1974). Из многих публикаций, посвященных билинам как у животных, так и у растений, можно порекомендовать следующие: Bouchier, Billing, 1967; Hudson, Smith, 1975; Lathe, 1972; O’Carra, O’hEocha, 1976; With, 1968; Rudiger, 1980. Химия и биохимия фитохрома описана Смитом и Кендриком (Smith, Kendrick, 1976), а данные о цитохроме Р450 собраны в книге под редакцией Купера, Розенталя, Снайдера и Уитмера (Cooper, Rosenthal, Snyder and Witmer, 1975).
Что касается биосинтеза порфиринов, то его общую картину с акцентом на механизмы реакций и стереохимию дает статья Ахтара и Джордана (Akhtar, Jordan, 1979), в то время как биохимические и биологические аспекты рассмотрены в работах Богорада (Bogorad, 1976) и Шнейдера (Schneider, 1980). Появившаяся совсем недавно статья Баттерсби и др.. (Battersby et al., 1980) разъясняет ряд моментов, бывших ранее сомнительными. Информацию о биосинтезе порфиринов и билинов можно получить из фундаментальных книг, цитированных выше, главным образом из монографии под редакцией Смита (Smith, 1975). И наконец, следует упомянуть о двух специальных статьях, читающихся с большим интересом, — это обзор Перутца (Perutz, 1970), в котором объясняется механизм кооперативного связывания гемоглобина с кислородом, и статья Тшуди и Шмида (Tschudy, Schmid, 1972), посвященная болезням, входящим в группу порфирий.
5.14. Дополнительная литература
Akhtar М., Jordan Р. М. (1979). Porphyrin, chlorophyll and corrin biosynthesis. In: Comprehensive organic chemistry, vol. 5, ed. E. Haslam, p. 1121, Oxford, Pergamon.
Battersby A. R., Fookes C. J. R., Matcham G. W. J., McDonald E. (1980). Biosynthesis of the pigments of life: formation of the macrocycle, Nature, 285, 17.
222
Часть I. Химические и биохимические аспекты
Bogorad L. (1976). Chlorophyll biosynthesis. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 64, London, New York and San Francisco, Academic Press.
Bouchier I. A. D., Billing В. H. (eds ) (1967). Bilirubin metabolism, Oxford, Blackwell.
Cooper D. F., Rosenthal O., Snyder R., Witmer C. (eds.) (1975). Cytochromes Pisa and b5, New York, Plenum.
Dolphin D. (ed.) (1978). The porhyrins, vols. 1 and 2 (7 vols projected), New York, Academic Press.
Box D. L. (1976). Animal biochromes and structural colours, 2nd edition, Berkeley, Los Angeles and London, University of California Press.
Box H. M„ Vevers G. (1960). The nature of animal colours, London, Sidgwick and Jackson.
Goodwin T. W. (ed.) (1968). Porphyrins and related compounds, London and New York, Academic Press.
Hudson M. B., Smith, К. M. (1975). Bile pigments, Chem. Soc. Revs., 4, 363.
Backson A. H. (1976). Structure, properties and distribution of chlorophylls. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 1, London, New York and San Francisco, Academic Press.
Kennedy G. F. (1969). Pigments of Annelida, Echiuroidea, Sipunculoidea, Priapu-loidea and Phoronidea, Chem. Zool., 4, 311.
Kennedy G. F. (1976). Survey of avian eggshell pigments, Comp. Biochem. Physiol., B55, 117.
Lathe G. H. (1972). The degradation of haem by mammals and its excretion as conjugated bilirubins, Essays in biochemistry, 8, p. 107, London and New York, The Biochemical Society—-Academic Press.
Needham A. E. (1974). The significance of zoochromes, Berlin, Heidelberg and New York, Springer-Verlag.
O’Carra P., OhEocha C. (1976). Algal biliprotein and phycobilins. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol 1, ed. T. W. Goodwin, p. 328, London, New York and San Francisco, Academic Press.
Perutz M. B. (1970). Stereochemistry of cooperative effects of haemoglobin, Nature, 228, 726.
.Rimington C„ Kennedy G. Y. (1962). Porphyrins. In: Comparative biochemistry, vol. 4, eds. M. Florkin and H. S. Mason, p. 557, New York and London, Academic Press.
Rudiger W. (1980). Plant biliproteins. In: Pigments in plants, 2nd edition, ed. F.-C. Czygan, p. 314, Stuttgart and New York, Gustav Fischer.
Schneider H. (1980). Chlorophyll biosynthesis. Enzymes and regulation of enzyme activities In: Pigments in plants, 2nd edition, ed. F.-C. Czygan, p. 237, Stuttgart and New York, Gustav Fischer.
Smith H., Kendrick R. E. (1976). The structure and properties of phytochrome. In- Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 378, New York, London and San Francisco, Academic Press.
Smith К- M. (ed.) (1975). Porphyrins and metalloporphyrins, Amsterdam, Elsevier.
Tschudy D. P., Schmid R. (1972). The porphyrias. In: The metabolic basis of inherited diseases, 3rd edition, eds. J. B. Stanbury, J. B. Wyngaarden and D. S. Predrickson, p. 1087. New York, McGraw-Hill.
Vernon L. P„ Seely G. R. (eds.) (1966). The chlorophylls. New York and London, Academic Press.
'With T. K- (1968). Bile pigments. (Trans. J. P. Kennedy), New York and London, Academic Press.
Глава 6
Другие неполимерные N-гетероциклические пигменты
6.1. Введение
Как уже отмечалось в предыдущей главе, простая система азотсодержащего гетероароматического кольца пиррола лежит в основе многих чрезвычайно важных природных пигментов. В этой главе мы познакомимся с другими азотсодержащими гетероциклическими системами, которые также являются основой пигментов некоторых классов. У большинства этих пигментов скелетами молекул служат конденсированные ди-, три- или олигоциклические гетероароматические системы колец, а также их частично восстановленные производные. У этих соединений возбуждение электрона обычно протекает относительно легко, особенно когда молекула содержит длинный сопряженный хромофор или несколько заместителей. Они могут иметь желтую, красную, и пурпурную или синюю окраску. Обычно полосы поглощения л—>л*-перехода присутствуют у них в диапазоне длин волн, близком к диапазону у соответствующего карбоцикла, а дополнительные п—>л*-переходы обусловливают важное, хотя и менее интенсивное поглощение (запрещенные переходы) при больших длинах волн.
Из нескольких групп пигментов, которые будут описаны,, чрезвычайно важными веществами, синтезируемыми всеми живыми организмами, являются пурины и птеридины, однако-они функционируют в качестве пигментов лишь у небольшого-числа животных. Близкий к ним рибофлавин синтезируется только растениями и микроорганизмами. Он играет чрезвычайно важную роль у животных в качестве витамина, но редко служит пигментом. Оммохромы являются продуктами исключительно животного происхождения (членистоногих). Феназиновая группа пигментов синтезируется только бактериями, которые образуют также другие азотсодержащие пигменты. Беталаины, не содержащие систем конденсированных колец, образуются исключительно в растениях.
В этой главе будут описаны последовательно основные характеристики каждой из групп пигментов: структура, распространение, свойства, функции и биосинтез.
224
Часть I Химические и биохимические аспекты
6.2. Пурины, птерины и флавины
6.2.1. Введение
Вероятно, наиболее важными простыми (т. е. неполимерными) N-гетероцнклическими пигментами в животном царстве после тетрапирролов являются птерины. Общепринято рассматривать одновременно с ними очень близкие к птеринам пурины и флавины. Хотя пурины и не поглощают видимый свет, тем не менее они ответственны за структурную белую и другие структурные окраски у многих животных (гл. 1). Флавины вносят незначительный вклад во внешнюю окраску организмов, однако рибофлавин является важной фоторецепторной молекулой, и мы его рассмотрим в гл. 11.
В последующих разделах вначале будут описаны основные кольцевые системы скелета молекул, а затем по очереди будут рассмотрены распространение в природе, свойства и биологическое значение каждой группы пигментов. Наконец, будет описан биосинтетический путь, дающий начало всем трем группам пигментов.
6.2.2. Основные типы кольцевых систем
Скелеты пуриновых, птеридиновых и флавиновых молекул содержат по четыре гетероциклических атома азота, как это показано на рнс. 6.1. Скелет пуриновых молекул (6.1)
Пурин (6.1}
Рис 6.1. Основной скелет молекул пурина, птеридина и изоаллоксазина. Показаны различные системы нумерации, применяющиеся для пигментов различных классов.
имеет шестичленное пиримидиновое кольцо и пятичленную имидазольную систему. Птеридин (6.2) довольно близок по структуре к пурину, но содержит шестичленную пиразиновую систему вместо имидазольной. Изоаллоксазиновый скелет (6.3), лежащий в основе молекулы флавина, представляет собой замещенный (бензо) птеридин. Как видно на рис. 6.1, для этих трех групп используются различные системы нумерации атомов, так
Гл. 6 Другие неполимерные пигменты
225
что во избежание путаницы следует обращаться с ними крайне осторожно, например при сравнении характера распределения заместителей у представителей различных групп.
6.2.3. Пурины
Распространение в природе. Пурины аденин (6.4) и гуанин (6.5) встречаются у всех организмов, будучи компонентами нуклеиновых кислот и нуклеотидов. Гуанин является также одним из пуринов, участвующих в формировании и распределении окраски у животных, мочевая кислота (6.6) также чрезвычайно широко распространена, тогда как ксантин (6.7) и изогуанин (6.8) встречаются реже. Эти пурины не поглощают видимый свет, но для них характерно сильное поглощение в УФ-свете, и поэтому некоторые животные, главным образом насекомые, могут их видеть. Пурины вносят важный вклад в окрашивание животных благодаря своему участию в формировании структурной окраски, особенно белого и сереб
(6 4) Аденин
(6 5) Гуанин
(6 7) Ксантин
(6 8) Изогуанин
ристого оттенков. В частности, гуанин накапливается в больших количествах в некоторых тканях в микрокристаллической или гранулярной форме. Его кристаллы или частицы, будучи должным образом ориентированы в тканях, отражают весь падающий свет и таким образом придают ткани белую или серебристую окраску, как это нам хорошо знакомо на примере чешуи рыб. В коже и чешуе рыб гуанин содержится в специальных клетках, известных как гуанофоры или иридофоры, причем отражающие свойства гуаниновых кристаллов изменяются в ответ на изменения уровня фонового освещения
15-84
226
Часть / Химические и биохимические аспекты
(гл. 8). В некоторых случаях, как, например, у золотой рыбки, гуанофоры «выложены» снизу каротиноидами, что придает ей золотистый цвет. Гуанин и другие пурины формируют также структурную белую и серебристую окраску у некоторых амфибий и беспозвоночных. Тиндалевское рассеяние света мельчайшими частицами гуанина в совокупности с черной меланиновой окраской подстилающих тканей дает синюю окраску. Пурины не оказывают влияния на окраску или внешний вид каких-либо растений или микроорганизмов.
6.2.4. Птерины
Птерины впервые были открыты как пигменты крыльев бабочек, однако сейчас они стали известны в качестве окрашенных компонентов многих других насекомых, а также ракообразных, амфибий и рептилий. Развернутое химическое название птерина — 2-амино-4-гидроксиптеридин (6.9). Число из
(6 9) Птерин (2 амино-4 гидроксиптеридин)
вестных пигментов животных с птерином в качестве основного скелета сейчас уже велико. Индивидуальные соединения различаются главным образом природой заместителей при С-6 и С-7, а также степенью окисления атомов азота в положениях 5 и 8. У Lepidoptera (бабочки) птерины встречаются преимущественно, хотя и не исключительно, у Pieridae. К наиболее известным птеринам бабочек относятся белый лейкоптерин (6.10), который содержат белые бабочка-капустница (Pieris brassicae) и бабочка-репница (Р.гарае), хризоптерин (6.11), желтый пигмент бабочки-лимонницы (Gonepteryx rhamni), и красный эритроптерин (6.12), присутствующий у бабочки с оранжевой окраской — зорьки Euchloe cardamin.es. Птерины содержатся в кристаллической форме в чешуйках крыльев, а желтые, оранжевые и красные соединения придают соответствующие цвета сложному рисунку на крыльях бабочек. Несмотря на то что лейкоптерин является характерным птерином белых бабочек, он не является белым пигментом; белый цвет их крыльев имеет структурное происхождение.
Впервые птерины были обнаружены у Lepidoptera, но позже было показано, что они являются обычными пигментами у
Гл. 6. Другие неполимерные пигменты
227
Hymenoptera; ксантоптерин (6.13), например, придает желтую окраску обыкновенной осе (Vespula vulgaris). Птерины, однако, в нормальных условиях не содержатся в наружных покровах тела видов Diptera — даже двукрылые сирфиды (журчалки), по внешнему виду напоминающие ос (мимикрия), не исполь-
(6 10) Лейкоптерии
(6 12) Эритроптерин
(6.13) Ксантоптерин
зуют их для формирования желтой окраски. Вместе с тем птерины могут присутствовать у них в глазах. Например, глаза плодовой мушки Drosophila melanogaster содержат смесь птеринов, в том числе димерный дрозоптерин (6.14). Птерины обнаружены в наружных покровах тела и в глазах у ракообразных и других членистоногих, однако у последних они изучались гораздо менее интенсивно, чем у насекомых.
Сейчас известно, что желтая, оранжевая и красная окраска у рыб, а также у амфибий и рептилий, таких, как лягушки,
<614) Дрозоптерин
15'
228
Часть I. Химические и биохимические аспекты
жабы, саламандры и змеи, обусловлена птеринами, которые локализованы (в гранулярной форме) в ксантофорных и эри-трофорных клетках (гл. 8). Наиболее распространенными пте-риновыми пигментами у этих позвоночных являются сепиапте-рин (6.15) и димеры дрозоптеринового типа.
Иногда в глазах позвоночных птерины служат для отражения света, эту же роль они очень часто играют у насекомых и других членистоногих (гл. 9).
У других представителей животного царства, а также у растений и микроорганизмов окрашивание птеринами (или
(6.17) Биоптерин другими птеридинами) не встречается, хотя некоторые из них важны в других отношениях. Производное птеридина — фолиевая кислота (6.16), которая синтезируется микроорганизмами,— является незаменимым витамином для человека и большинства животных. Биоптерин (6.17) также имеет существенное биологическое значение, например, как кофактор при гидроксилировании фенилаланина с образованием тирозина.
Общие свойства. Птерины (а также встречающиеся в природе пурины) представляют собой амфотерные молекулы со слабыми кислотными и основными свойствами. Они плохо растворимы в воде, хорошо растворяются в разбавленных кислотах и щелочах, умеренно растворимы в полярных органических растворителях и не растворяются в неполярных. Большинство птеринов являются потенциальными окислительно-восстановительными агентами, однако при физиологических парциальных давлениях кислорода они полностью окислены.
Птеридины с кислородсодержащими заместителями, в том числе и птерины, могут существовать как в кето-, или хиноидной форме (6.18), так и в виде енола (6.19). Птерины в целом отличаются фотолабильностью.
Гл. 6. Другие неполимерные пигменты
229
Светопоглощающие свойства. В спектре поглощения птерина обычно присутствуют три (иногда два) максимума, но, как правило, в видимой области спектра расположен только один из них (рис. 6.2). Влияние заместителей видно из сравнения максимумов поглощения (в щелочном растворе) лейкоптерина
он
(6.18) Кето-или хиноидная форма (6.19) Енольная форма
^птерина птерина
(6.10) (240, 285 и 340 нм), ксантоптерина (6.13) (255 и
391 нм), хризоптерина (6.11) (252 и 385 нм) и эритроптерина (6.12) (240, 310 и 475 нм). Как можно было ожидать, принимая во внимание амфотерные свойства молекул птеринов, их максимумы поглощения зависят от величины pH. Сдвиги мак
Длина волны, нм
Рис. 6.2. Спектры поглощения света дрозоптерином (6.14) в щелочном растворе (/) н в кислом растворе (II).
симумов обычно не превышают ~40 нм в диапазоне pH от 1 до 13.
Окраска, присущая различным птеринам в живых тканях, обычно обусловлена поглощением света в более длинноволновой области спектра, чем это можно было бы ожидать на основании их максимумов поглощения. Например, ксантоптерин с Хтах=390 нм, имеющий слабо-желтую окраску in vitro,
230
Часть I. Химические и биохимические аспекты
дает оранжевый цвет in situ. Наблюдаемый здесь батохромный эффект может быть обусловлен конъюгацией с белками или сильной стабилизацией кетохиноидной таутомерной формы пигмента (6.18).
Большинство птеринов флуоресцируют в УФ-свете, причем их полосы испускания сдвинуты на 150—200 нм в длинновол
(6 20) Рибофлавин
(6 21) восстановленный рибофлавин
(6 22) Полухиноновый радикал
новую область по сравнению с соответствующими полосами поглощения. In situ при связывании пигмента с белками происходит тушение такой флуоресценции.
6.2.5. Флавины
В основе флавиновых молекул лежит изоаллоксазино-вая структура, которая представляет собой птеридин (не птерин), конденсированный с бензольным кольцом. Флавиновая структура имеет метильные заместители в положениях 6 и 7 этого бензольного кольца, а также заместитель, присоединенный к гетероциклическому атому азота в положении 9. У единственного широко распространенного в природе флавина — рибофлавина или рибитилфлавина [6,7-диметил-9-рибитилизоал-локсазина (6.20) ] — последний заместитель представляет собой сахароспирт рибит.
Распространение. Рибофлавин имеет важное биологическое значение, поскольку он является функциональной частью флавопротеинов и двух коферментов — флавинмононуклеотида (рибофлавинфосфата, FMN) и флавинадениндинуклеотида, FAD, которые используются во многих окислительно-восстано
Гл. 6. Другие неполимерные пигменты 23t
вительных реакциях. Восстановленные формы этих коферментов— FMNH2 и FADH2 — содержат восстановленный рибофлавин (6.21). Флавины и флавиновые коферменты часто встречаются в виде прочно связанных простетических групп у многих ферментов, главным образом ферментов дыхательной цепи. Рибофлавин в качестве главного компонента этих коферментов и ферментов встречается у всех живых организмов. Считается, что животные не способны его синтезировать и должны получать с пищей, т. е. он представляет собой витамин (В2). Растения и микроорганизмы синтезируют рибофлавин, который требуется животным. Образование витамина В2 дрожжами используется в промышленных масштабах уже на протяжении многих лет.
Есть сообщения об эндогенном синтезе рибофлавина у некоторых насекомых, например у таракана Periplaneta, однако, скорее всего, у них за этот синтез ответственны микробы-эндо-симбионты.
Несмотря на повсеместное распространение в природе, рибофлавин редко участвует в формировании внешней окраски живых организмов и никогда — у высших растений. Микроорганизмы, используемые для промышленного получения рибофлавина, могут окрашиваться им в желтый цвет, однако обычно они представляют собой искусственно полученные мутантные штаммы, для которых желтая окраска никакого значения не имеет. Иногда рибофлавин вносит свой вклад в желтую окраску у беспозвоночных, таких, как пиявки и черви, и может быть главным желтым пигментом наружных покровов голотурий Holothuria forskali.
Рибофлавин обычно накапливается в сетчатке глаза у позвоночных. Хорошим примером тому служат такие животные, как галаго (Galago), у которого золотисто-желтые кристаллы рибофлавина составляют прозрачный отражающий слой, выстилающий сзади сетчатку. В глазах членистоногих рибофлавин в отличие от птеринов не обнаружен.
Общие свойства. Присутствие рибита, содержащего много гидроксильных групп, делает рибофлавин хорошо растворимым в воде. Флавиннуклеотиды, содержащие, кроме того, фосфатную, а в случае FAD и сахарную группы, еще лучше растворимы в воде. Свободный рибофлавин растворим в полярных органических растворителях, таких, как ацетон или спирты, но нерастворим в хлороформе. Он легко восстанавливается, а его восстановленная форма вновь легко окисляется. Это свойство используется при биологическом функционировании флавиновых коферментов и в электротранспортной цепи. (гл. 10). Восстановление происходит в две одноэлектронные стадии, т. е. через образование полухинонового радикала (6.22).
232
Часть I. Химические и биохимические аспекты
Светопоглощающие свойства. Рибофлавин имеет максимумы поглощения света при 223, 267, 373, 445 и 475 нм (рис. 6.3), и поэтому его раствор имеет ярко-желтый цвет. Сходство его спектра со спектром p-каротина (гл. 2) приводило ко множеству недоразумений относительно того, какой из этих пигментов, содержащихся в очень малых количествах, является истинным первичным рецептором в ряде фотореакций (гл. И).
УФ-излучение индуцирует сильную флуоресценцию рибо-флавина в диапазоне 520—565 нм. В присутствии флавинну-
200 300 400 500 550
Длина волны, нм
Рис. 6.3. Спектр поглощения рибофлавина при pH 7.0.
клеотидов и других ароматических структур, в том числе остатков ароматических аминокислот в белках, происходит тушение этой флуоресценции
6.2.6. Биосинтез пуринов, птеринов и рибофлавина
Биосинтез всех этих трех групп соединений происходит по одному и тому же основному пути; как птерины, так и рибофлавин синтезируются через пуриновые промежуточные продукты. Поэтому в приводимом ниже описании сначала представлен путь образования пурина гуанина, а затем описаны реакции, посредством которых гуанин (в виде гуанозин-9-три-фосфата, GTP) может превращаться либо в птерин, либо в рибофлавин.
Образование гуанина. Пурины гуанин (6.5) и аденин (6.4) входят в состав нуклеиновых кислот всех живых организмов. Поэтому их биосинтез был изучен очень подробно, и путь, по которому происходит образование пуриновой системы колец из небольших фрагментов, очень хорошо известен. Все живые организмы синтезируют свои пурины по одному и тому же пути (рис. 6.4).
Гл. 6, Другие неполимерные пигменты 233
Сборка пуриновой системы колец происходит на молекуле рибозо-5-фосфата (6.23). Сначала последний активируется в результате превращения в а-5-фосфорибозил-1-пирофосфат (6.24), при участии киназы и АТР. Затем пирофосфатная группа (6.24) заменяется аминогруппой и образуется 5-фосфо-рибозил-1-амин (6.26). Источником аминогруппы является амидная NH2-rpynna глутамина (6.25). Этот азот составит первую часть пуриновой системы колец. В ходе этой реакции происходит инверсия конфигурации при С-1 рибозы. Появляющаяся таким образом p-конфигурация затем сохраняется на протяжении всего биосинтетического пути.
Затем к аминогруппе при С-1 фосфорибозиламина с помощью амидной связи присоединяется глицин (6.27). Для протекания этой реакции, продукт которой известен как глицина-мидрибонуклеотид (6.28), необходим АТР. Следующим этапом является перенос формильной (СНО) группы с кофермента метенил-№-10-тетрагидрофолиевой кислоты (интересно, что сам этот птерин образуется по этому же пути) на свободную аминогруппу (6.28) в присутствии трансформилазы; при этом образуется формилглицинамидрибонуклеотид (6.29).
На этой стадии все атомы, которые войдут в состав имидазольного кольца пуринового ядра, уже присоединены к фосфорибозе. Однако до того, как замкнется имидазольное кольцо, происходит перенос еще одного атома азота — опять от глутамина. Кислород глицинамидного фрагмента амида (6.29) замещается на NH-группу, которая в конечном итоге войдет в состав пиримидинового кольца пурина. И лишь у продукта этой реакции — a-N-формилглицинамидинрибонуклеотида (6.30) в результате процесса дегидратации, при участии АТР, происходит замыкание кольца. Имидазольное ядро образовавшегося таким образом 5-аминоимидазолрибонуклеотида (6.31) затем карбоксилируется путем присоединения СО2 (при участии биотина) с образованием 4-карбокси-5-аминоимидазолрибонуклео-тида (6.32).
Второй атом азота пиримидиновое кольцо получает от аспарагиновой кислоты (6.33). Вначале аспартат присоединяется амидной связью к карбоксильной группе имидазола. Затем полученное сукцинокарбоксамидное производное (6.34) расщепляется и в составе имидазолкарбоксамидного продукта (6.35) остается лишь аминогруппа аспартата. Последний углеродный атом пуринового ядра дает формил-№°-тетрагидрофолиевая кислота; появляющийся при этом 5-формамидоимидазол-4-кар-боксамидрибонуклеотид (6.36) замыкается в кольцо с образованием первого пуринового продукта — инозиновой кислтты [IMP (6.37)].
(6.25) Глутамин
©-о.сн^о н АГр ®-О.СДо н
(СН2)2
CH.NH
СООН
(р)-о.сн2О Г\н^|
ОН он
hWo
AMP /—X
он он
СООН
(6.23) Рибозо-5-фосфат
(6.24) о-5-Фосфорибозил-1 -пирофосфат
(СН2)2 ch.nh2 СООН
,ДннД н у у Н
ОН он
(6.26) б-ФосфорибоЗИЛ/ 1 -амин
Глутаминовая кислота
ho]oc.ch2.nH2|
(6.27) Глицин
hVVoH
(р)-о.сн2О nh.co.ch2.nh.|cho|
Днн/\ н у ун
он он
Метен ил-N5'1 °-ТГФ
©—о.сн2 0 nh|co.ch2.~nh^ Дннд, н у у н он он
(6.29) о -14-ФормилглиЦинамид-рибонуклеотид
(6.28) Глицинамидрибонуклеотид-
н
I
(6.25)
Н2С СИ Глутамин
I II -------------
^С. О
NH
। Ух
Рибоза—Q9
СН
II
о
NH
I У
Рибоза—QP)
А
ATP НС
II СН
,С /
H2N^ N
Рибоза—(?)
(6.29)
(6.30) P-N-Формилглицинамидин -рибонуклеотид
(6.31) 5-Аминоимидазол-рибонуклеотид
(6.33) Аспарагиновая кислота Биотин
О
II
NHf с--<хн
II СН -*-у
Фумаровая
jajiS л| кислота
Рибоза—(Р)
соон
I
СН2 О
I II
CH—NH-C- N
I С" \\
СООН II СН
Н.Х
соон
I сн2
CHNH2
I соон
|со2|
ООС k —
II /СН
H2NxC^N
Рибоза—(Р)
(6.35) 5-Аминоимидазол- (6.34) Б-Аминоимидазол-4-N-
4*карбоксамидрибонуклеотид су кцино карбоксамидрибонуклеотид
(6.32) 4-Карбокси-5-аминоимидазол рибонуклеотид
Рис. 6.4. Главные особенности пути биосинтеза гуанииа и дргих пуринов.
Гл. 6. Другие неполимерные пигменты
235
о
h2n
Формил —N СН ТГФ H2N^'n'
Рибоза - (F)
О
1° _ >С N
__ H3N "У^СИ
Жк >-'Nz
NH I Z-X
Рибоза — (г)
"-N
I
Рибоза-(
(6.35)
(6.36) 5 Формамидопмидазол - (6.37) IMP
4 - карбоксамид -рибонуклеотид
Гуанин
О
1 м <б-25)
С"-^ Глутамин
Рибоза- (р)
Рибоза—(Р)
(6.39) GMP
(6.38) Ксантиловая кислота
(начало см. на с. 234).
Гуаниновая структура в виде гуанинмонофосфата [GMP (6.39)] образуется из IM.P в результате двухстадийного процесса. Сначала в положение С-2 пуринового ядра под действием ПАО+-дегидрогеназы вводится кислород и образуется ксантиловая кислота (6.38). Затем введенный кислород замещается аминогруппой, происходящей из глутамина. Собственно гуанин освобождается путем расщепления нуклеотида GM.P.
Образование птеринов. Птериновое производное — фолиевая кислота (6.16)—является витамином для многих животных, в том числе для человека, и должна поступать с пищей или от кишечных микроорганизмов. Поэтому биосинтез фолиевой кислоты у бактерий, в частности у Escherichia coli, исследован очень подробно. По этому же пути у животных синтезируются птерины, которые затем используются ими для формирования окраски.
Биосинтез птеринов является продолжением пуринового биосинтетического пути. Гуаниннуклеотид [GM.P (6.39)] подвергается дальнейшему фосфорилированию до трифосфата [GTP (6.40)], 9-рибозотрифосфатная группа GTP используется для увеличения имидазольного кольца до пиразинового. Подробно последовательность реакций показана на рис. 6.5. (Примечание. Важно помнить, что схемы нумерации, используемые для пуринового и птеринового рядов, различны; см. разд. 6.2.2.) Сначала расщепляется имидазольное кольцо GTP
0 в "гЛа- т . "? г см₽((.з9>—I12lANA-v h2NAnA СН ^СН.СН2О-®-®-@ 'СН—сн 1 1 ОН ОН (6 40) GTP о он ОН „ он он В II и II 0 /А. /СН—СН-СН2ОН .СИ —СН—СН2О-®-®-© П jTYY л 1°У - 1Г h2n'AnA'xnA h2n-i4n/41 н Н (6.42) Дигидронеоптерин (6.41) 7.8-Дигидронеоптеринтрифосфат Рис. 6.5. Механизм увеличения кольца при синтезе птеринов из пуринов. я'2 —-СН.СП2О-®-®-® ГН-СНОН-СПОН NH 1 2 0 ОН ОН Чг с—СН-СН—СН2О-®-®~® сн2 1
Гл. 6. Другие неполимерные пигменты 237
и теряется атом С-8. Впоследствии место двух недостающих атомов пиразинового кольца, т. е. атомов птерина С-6 и С-7, займут углеродные атомы 1 и 2 трифосфорилированной рибозы. 2-Амино- и 4-гидрокси-(или кето-)заместители находятся на своем месте, так что первый птеридиновый продукт уже представляет собой птерин, а именно 7,8-дигидронеоптеринтри-фосфат (6.41). Последний дефосфорилируется с образованием собственно 7,8-дигидронеоптерина (6.42).
7,8-Дигидронеоптерин является ключевым соединением, которое дает начало (по различным разветвляющимся путям) фолиевой кислоте, биоптерину и многим птериновым пигментам животных. До сих пор в отношении последующих разветвлений главного биосинтетического пути и взаимопревращений образующихся продуктов существует некоторая неопределенность. Те разветвления, которые, по последним данным, кажутся наиболее вероятными, приведены на рис. 6.6. Главные особенности, отраженные на этой схеме, таковы: 1) С-6-боко-вые цепи подвергаются постепенному укорочению и модификации, а в положение С-7 вводятся новые заместители; 2) на различных стадиях в ходе модификации боковых цепей 7,8-ди-гидроптериновая структура дегидрируется до более обычных полностью ароматических птеринов. Все природные птерины и дигидроптерины могут быть получены путем различных превращений, однако детали биохимии большинства предполагаемых реакций еще полностью не исследованы.
Весьма вероятно, что димеризация, с помощью которой образуются птерины, подобные дрозоптерину (6.14), происходит на поздних стадиях биосинтеза, но опять-таки детальные исследования этого процесса не проводились.
Биосинтез рибофлавина (рис. 6.7). Биосинтез рибофлавина у растений и особенно у микроорганизмов также включает разрыв имидазольного кольца GTP и потерю атома С-8. Последующие реакции, однако, отличаются от реакций в случае биосинтеза птеринов. Рибозотрифосфатный заместитель у промежуточного 6-гидрокси-2,4,5-триаминопиримидинового производного (6.43) замещается рибитильной группой (а возможно, превращается в нее), и 2-аминозаместитель рибитилпиримиди-нового продукта (6.44) модифицируется в гидроксильную группу. Затем к промежуточному дигидроксидиаминопиримидиново-му производному (6.45) присоединяется С4-фрагмент (происхождение его неизвестно) с образованием важного промежуточного продукта 6,7-диметил-8-рибитиллюмазина (6.46).
После этого рибофлавин образуется из двух молекул диме-тилрибитиллюмазина под действием рибофлавинсинтазы. В этой реакции С4-остаток, состоящий из углеродных атомов 6 и 7 и связанных с ними метильных заместителей, переносится
СН2ОН
о
с нон
СН-Ю-(Р)
h2n
снон
Дигидронеоптерин-фосфат
снон
о
СН2Ск
I ДЕ
сно-^ч>
N.
о
h2n
снон
сн3
снон
н ДигидронеоптериН’
2’3’ циклофосфат
с=о
HN
h2n
н
Дигидроптерин
h2n
h2n
н
Дигидронеоптерин
N
сн3
снон
снон
h2n
Дигидробиоптерин Н
Птерин
Дрозоптерин (6 14)
Н Сепиалтепин
Рис. 6.6 Возможные биосинтетические взаимосвязи между птеринами.
о
о
GTP (6 40)
(6.47) Рибофлавин (=6 20)
4 Рибитиламино 5 амино 2,6* дигидроксипиримидин
Рнс. 6.7. Схема пути биосинтеза
рибофлавина из GTP (рибитнл = СН.СНОН СНОН СНОН СН2ОН).
240
Часть I. Химические и биохимические аспекты
с одной молекулы люмазина на другую для достраивания диметилбензольного кольца рибофлавина (6.47).
Получены мутантные штаммы дрожжей Sacckaromyces се-revisiae с нарушенным синтезом рибофлавина, у которых накапливаются предполагаемые промежуточные продукты биосинтеза рибофлавина.
6.2.7. Факторы, контролирующие биосинтез пуринов, птеринов и флавина
Несмотря на то что биосинтетические пути этих соединений тесно взаимосвязаны, факторы, контролирующие их образование, различаются. В случае синтеза рибофлавина у микроорганизмов хорошо изучен генетический контроль и продемонстрирована регуляция через обратную связь конечным продуктом.
На синтез и отложение пуринов, и особенно птеринов, влияют многие факторы. Обычно эти вещества локализованы в специфических пигментных клетках, ксантофорах и эритрофорах, которые не только ответственны за окраску наружных покровов тела животных, но и контролируют изменения окраски, происходящие в ответ на изменения факторов окружающей среды, таких, как цвет поверхности, на которой они находятся. Известен гормональный контроль пигментации, главным образом в ходе созревания и развития организма. Помимо действия на синтез птеринов факторы, контролирующие пигментацию, действуют также на биосинтез каротиноидов и меланинов. Регуляция окраски, характер ее распределения у животных и механизмы изменения окраски будут обсуждаться в гл. 8.
6.3. Феназины
6.3.1. Структура
Дибензопиразиновая структура (6.48) феназина имеет внешнее сходство с изоаллоксазиновым скелетом флавинов.
Феназины представляют собой небольшую группу, состоящую примерно из 30 зачастую ярко окрашенных пигментов, образуемых исключительно бактериями. Как правило, в качестве заместителей в положениях 1 и 6 присутствуют гидрокси- и карбоксигруппы, а к азоту пиразинового кольца присоединен кислород или метильная группа. Наиболее известными природными феназинами являются пиоцианин (6.49) и феназин-N-OK-сидиодинин (6.50). Другими примерами служат оксихлорора-фин (6.51) и аэругинозин В (6.52), содержащие в качестве заместителей карбоксамидную и сульфоновую группы соответственно.
Гл. 6. Другие неполимерные пигменты
241
6.3.2. Свойства
Многие феназины, особенно карбоновые кислоты, заметно растворимы в воде и накапливаются в культуральной среде. Часто они образуются в столь высоких концентрациях, что осаждаются в виде плотного осадка. Большинство встречающихся в природе феназинов имеет лишь ограничен
(6 48) Основной дибенэопирэзиновый скелет феназинов
(6 49) Пиоцианин (6 50) Иодинин
(6.51) Оксихлорорафин
ную растворимость в органических растворителях, хотя многие из них можно экстрагировать хлороформом из подкисленных водных растворов.
Обычно феназины интенсивно окрашены и позволяют получить широкое разнообразие оттенков. Они характеризуются несколькими полосами поглощения в ультрафиолете и по крайней мере одной главной полосой в видимой области (400—600 нм), которой феназины обязаны своей окраской (рис. 6.8). Большинство феназинов желтые (Хтах=400—450 нм), однако иодинин — пурпурный (Хтах=530 нм), а пиоцианин--------СИНИЙ
(Хтах=695 нм). Оксихлорорафин и его дигидропроизводное существуют в форме зеленого л-комплекса.
16—84
242
Часть 1, Химические и биохимические аспекты
6.3.3. Распространение
Распространение феназинов ограничено несколькими видами бактерий; Pseudomonas, Streptomyces, Brevibacterium и Nocardia. Иногда, однако, обусловленная феназинами окраска может встретиться и в тканях животных. Так, Pseudomonas является обычным микробным паразитом кожи человека и дру-
Рис. 6.8. Спектр поглощения света иодииина (6 50) в хлороформе тих животных; пиоцианин, синтезируемый этим организмом, может в некоторых случаях окрашивать гной зараженных им ран в синий цвет. Сине-зеленая окраска, иногда обнаруживаемая в шерсти овец, также обусловлена пиоцианином из Р.аеги-g inosa.
6.3.4. Биосинтез
Биосинтез феназинов наиболее интенсивно изучался на примере Pseudomonas aeruginosa и Р. phenazinium, синтезирующих в основном пиоцианин (6.49) и иодинин (6.50) соответственно. Главные особенности этого биосинтетического пути были выявлены в опытах по включению меченых предшественников, а также при изучении накапливающихся промежуточных продуктов у мутантных штаммов. В то же время детали большинства индивидуальных реакций и катализирующие их ферменты до сих пор не установлены.
Биосинтез феназинов представляет собой еще одну ветвь главного шикиматного пути биосинтеза ароматических соединений (гл. 3 и 4). Предполагаемый путь образования феназинового ядра показан на рис. 6.9. Шикимовая кислота (6.3) весьма эффективно включается в феназины. Происхождение атомов азота феназиновой системы пока не известно, однако
Гл. 6. Другие неполимерные пигменты
243
СООН
{6 56) Антраниловая кислотг
СООН
(6 57) Феназин 1, 6 дикарбоновая кислота
Рис. 6 9. Возможные пути образования основной феназиновой структуры из шикимовой кислоты
предполагается участие в ее образовании азотзамещенного ши-киматного промежуточного продукта (еще не идентифицированного), такого, как (6.54). Может быть также использован альтернативный путь через хоризмовую кислоту (6.55) и ее азотсодержащие производные. Очевидным кандидатом в предшественники ранее считалась антраниловая кислота (6.56), однако сейчас известно, что она в феназины не включается.
Каким бы ни был механизм образования феназин-1,6-дикарбоновой кислоты (6.57), в настоящее время ясно, что она является первым феназиновым продуктом и предшественником других феназинов, синтезирующихся по ответвляющимся и альтернативным путям. Некоторые из этих путей показаны на рис. 6.10. Считается, что ОН-группы при С-1 и С-6 вводятся прямым окислительным замещением карбоксильных групп, в то время как ОН-группы в других положениях появляются в результате обычного ароматического гидроксилирования. N-Окисление, приводящее к образованию N-оксидной структуры иодинина, представляет собой ферментативный процесс,
16*
(6.57) Феназин-1, 6-
1, 6-Дигидроксифеназин
дикарбоновая кислота
1 -Г идро ксифеназин
(6.50) Иодинин
1. 8* Дигидроксифеназин
Рис. 6.10. Некоторые взаимопревращения феназинов, в том числе пути биосинтеза пиоцианина (6.49) и иодинина (6.50),
Гл. 6. Другие неполимерные пигменты
245
причем роль субстрата в нем могут играть разные феназины. N-Метильный заместитель пиоцианина образуется обычным образом из S-аденозилметионина.
Синтез феназинов бактериями в большой мере зависит от состава культуральной среды и от условий культивирования, однако детали контролирующих и регулирующих этот процесс механизмов остаются невыясненными.
6.3.5. Биологическая активность
Феназины, синтезируемые одним видом, могут оказывать влияние на другие виды и их ткани, причем это влияние осуществляется различными путями. Они были первыми бактериальными продуктами, для которых была показана антибиотическая активность против других микроорганизмов. Бактериостатические свойства иодинина и пиоцианина сейчас хорошо известны. По-видимому, они обусловлены взаимодействием феназинов с ДНК (преимущественно интеркаляция плоской ароматической системы колец в молекулу ДНК). Есть сообщения, что феназинди-М-оксиды обладают канцеростатической активностью.
(6 58) феноксазиновая система колец
Некоторое биологическое значение могут иметь также окислительно-восстановительные свойства феназинов. Пиоцианин подавляет активность сукцинатдегидрогеназы мозга, но в то же время активирует некоторые другие дегидрогеназы. Сообщалось об активном поглощении и концентрировании феназинов тканями животных, однако пока не известно, имеет ли какое-либо физиологическое значение этот факт, или он случаен.
6.4. Феноксазины
Феноксазиновая циклическая система (6.58) в структурном отношении очень сходна с феназиновой. Наиболее известными феноксазиновыми пигментами являются оммохромы.
246
Часть I. Химические и биохимические аспекты
6.4.1. Оммохромы
Структура. Эти окрашенные в темные цвета вещества впервые были экстрагированы из омматидий сложных глаз членистоногих и сначала считались меланинами. Они подразделяются на две главные подгруппы — омматины и оммины, представляющие собой соответственно димеры и олигомеры производных кинуренина (6.59); были выделены и другие подгруппы, однако полностью они пока не охарактеризованы. Наиболее обычным оммохромом является желтый ксантомма-тин (6.60), который легко восстанавливается до окрашенного
соон
(6 59) Кинуренин
(6 60) Ксантомматин
(6 61) Дигидро ксантомматин
(6 62) -Оммин А
Гл 6 Другие неполимерные пигменты
247
в красный цвет дигидроксантомматина (6.61). Эти соединения служат примерами основной омматиновой структуры, состоящей из феноксазиновой циклической системы с двумя аспартатными боковыми цепями, одна из которых циклизована и образует четвертое кольцо. Вместе с тем оммины представляют собой более крупные недиализующиеся молекулы, содержащие серу. Структура относительно простого тримерного оммина, оммина А, представлена формулой (6.62).
Рис. 6 11. Спектры поглощения (в слабокислом метаноле) ксантомматина (Z) и дигидроксантомматина (И).
В глазах беспозвоночных оммохромы находятся в гранулах в виде комплексов с белками.
Светопоглощающие свойства. Оммохромы сильно поглощают в ультрафиолете, а также имеют характерные полосы поглощения в видимом диапазоне при ~440—500 нм (рис. 6.11), причем их максимумы поглощения зависят от pH. In vivo как ом-матины, так и оммины выглядят темноокрашенными; они могут быть желто-коричневыми, пурпурными или почти черными. Из-за этого их часто принимали за меланины.
Распространение. Оммохромы представляют собой характерные пигменты глаз насекомых и других членистоногих. Они функционируют в глазах не как фоторецепторы, а как защитные пигменты, которые предохраняют фоторецепторы от повреждения рассеянным светом (гл. 9). Оммохромы широко распространены в наружных покровах членистоногих и других беспозвоночных, главным образом у головоногих, а также найдены в яйцах и различных тканях некоторых червей. Предпо-
H2N. /-COOH
CH I CH2 c=o
NH.CHO
(6.63) Триптофан
(6.64) Формилкинуренин . (6.59) Кинуренин
(6.62) Оммин А
(6 65)3 Гидроксикинуренин
(6.66) Феноксазиновый промежуточный продукт
H2N /СООН сн
Рис. 6.12. Путь биосинтеза ксантомматина
(6.60) Ксантомматин
Гл. 6. Другие неполимерные пигменты
249
лагалось, что они встречаются и у некоторых позвоночных, но это не было доказано.
Биосинтез. Много информации о биосинтезе оммохромов было получено из подробных генетических исследований, проведенных на плодовой мушке Drosophila melanogaster, дикий тип которой в качестве коричневого глазного пигмента содержит ксантомматин. Известно много мутантов Drosophila, имеющих аномальную окраску глаз из-за повреждений пути биосинтеза оммохрома, в результате чего накапливаются промежуточные соединения этого процесса.
Путь биосинтеза ксантомматина приведен на рис. 6.12. Несмотря на то что важнейшие особенности этого пути были установлены, детали отдельных реакций в большинстве случаев еще не вполне понятны. Биосинтез начинается с размыкания кольца триптофана (6.63), в результате чего образуется формилкинуре-нин (6.64), который содержит аспартатную боковую цепь. Спонтанное деформилирование последнего дает собственно кинуренин (6.59), который гидроксилируется до 3-гидроксикину-ренина (6.65). Это соединение подвергается окислительной димеризации, приводящей к образованию оксазинового мостика омматиновой структуры (6.66). Затем в результате циклизации аспартатной боковой цепи с замыканием на замещающую аминогруппу второй молекулы гидроксикинуренина образуется четвертое кольцо. Оммины также синтезируются из 3-гидроксики-нуренина, но не через промежуточную омматиновую структуру.
Родственными оммохромам в структурном отношении являются папилиохромы — белые и желтые соединения, найденные только в крыльях бабочек сем. Papilionidae. Эти пигменты также представляют собой производные кинуренина, возможно, в виде комплексов с не содержащими азота хинонами. Собственно кинуренин и гидроксикинуренин также иногда служат желтыми пигментами.
Функции. Функции оммохромов ограничены их участием в формировании внешней окраски и защитной ролью в глазу беспозвоночных.
6.4.2. Микробные феноксазины. Актиномицины
Феноксазиноновый хромофор (6.67) содержится также в молекулах нескольких микробных пигментов, многие из которых имеют важные антибиотические свойства. Наиболее известны из них актиномицины (6.68) — антибиотики красного цвета, синтезируемые плесневым грибом Streptomyces. Весьма вероятно, что биосинтез этих микробных пигментов включает конденсацию 3-гидроксиантраниловой кислоты (6.69) или ее произвол-
250
Часть I. Химические и биохимические аспекты
(6.67) Феноксазиночсвый Хромофор
(6.68) Актиномицины (R,К'-пентапептидные цепи) (6.69) З-Гидроксиантраниловая кислота
ных с помощью процесса, сходного с процессом образования ксантомматина из 3-гидроксикинуренина.
6.5. Беталаины
6.5.1. Введение
Беталаины являются исключительно растительными пигментами. Они имеют очень ограниченное распространение и хорошо известны по интенсивной красно-пурпурной окраске корнеплодов столовой (красной) свеклы. Они растворимы в воде и на первый взгляд сходны с антоцианами; одновременно пигменты этих двух групп в одном объекте не встречаются. Примерно до 1960 г. практически ничего не было известно о химии или биохимии беталаинов, однако сейчас показано, что существуют две главные группы этих пигментов — красно-фиолетовые бетацианины и желтые бетаксантины.
6.5.2. Структура
Бетацианины. За одним исключением, в основе всех встречающихся в природе бетацианинов лежат только два агликона— бетанидин (6.70) и его С-15-эпимер изобетанидин (6.71). Единственным исключением является 2-декарбоксибета-нидин (6.72), к настоящему времени обнаруженный в цветках только одного вида растений (Carpobrotus acinaciformis). Основная структура бетацианинов состоит из двух N-гетероцикличе-ских систем—дигидроиндольной и дигидропиридиновой, связанных между собой двухуглеродным мостиком.
В большинстве случаев природные бетацианины представляют собой гликозиды, у которых к ОН-группе в положении С-5
Гл. 6, Другие неполимерные пигменты
251
или С-6 (но никогда к обеим) дигидроиндольного кольца присоединен моно- или дисахарид. Чаще всего такими сахаридами являются глюкоза или глюкуроновая кислота. Остатки сахаров могут быть ацилированы, обычно коричными кислотами.
Бетаксантины. У бетаксантинов сохраняются дигидропиридиновое кольцо и связующий С2-мостик, однако дигидроиндоль-ное кольцо заменено аминокислотой или аминогруппой, например пролином в индикаксантине (6.73). Другие представители
(6.70) Бетанидин (R' = R‘=COOH; R3=H)
(6.71) Изооетанидин (R1 =R, = COOH ; R2-Н)
(6.72) Карбоксибетанидин (К'= R -П ; R2=COO11)
этой группы содержат вместо пролина гидроксипролин, аспарагиновую кислоту, глутаминовую кислоту или глутамин, метионин, дигидроксифенилаланин, а также моно- или дигидроксифе-нилэтиламин. Во всех случаях связывание с общей для всех них частью молекулы происходит через N-атом аминокислоты. Схемы нумерации атомов вызывают много недоразумений. Для разных бетаксантиновых агликонов используются разные схемы, поскольку нумерация начинается с аминного азота аминокислоты или аминного остатка. Нумерация бетаксантинов отличается от нумерации бетацианинов.
6.5.3. Свойства
Как агликоны, так и гликозиды представляют собой водорастворимые ионизируемые (кислые) соединения. Они оптически активны, а для бетанидина была установлена абсолютная конфигурация при С-2 и С-15. Эпимеризация при С-15 происходит очень легко, возможно, даже спонтанно. Бетаксантины имеют желтую окраску с максимумом поглощения света при ~480 нм, в то время как бетацианины обладают значительно
252
Часть I. Химические и биохимические аспекты
более протяженной сопряженной системой и поглощают при больших длинах волн (534—554 нм), а потому окрашены в красно-фнолетовые цвета. Химия беталаинов подробно не изучалась, однако хотелось бы обратить внимание на одно их свойство —это относительную легкость взаимопревращений различных беталаинов. Так, например, в присутствии L-пролина и аммиака бетанин (бетанидин-5-О-|3-В-глюкозид) легко превращается в бетаксантин индикаксантин (6.73).
(6 73) Индикаксантин
6.5.4. Распространение
Ядовитый гриб Amanita muscarla (мухомор) содержит один фиолетовый и несколько желтых пигментов, которые были идентифицированы как беталаины, например мускааурин I (6.74). Кроме этого гриба беталаины обнаружены только у высших растений, причем лишь у представителей отдельных семейств порядка Centrospermae, в том числе и у многих экзотических растений, таких, как кактусы. Чаще всего они содержатся в цветках, но могут присутствовать и в листьях, плодах или корнях; наиболее известным примером беталаинов служит красновато-пурпурный пигмент корнеплодов столовой свеклы (Beta vulgaris). Окраска последних обусловлена главным обра-разом присутствием бетанина (бетанидин-5-О-р-П-глюкопирано-зида). Пока не обнаружено примеров, когда бетацианины и антоцианы встречались бы у одних и тех же видов, правда, другие флавоноиды могут присутствовать наряду с бетацианинами.
6.5.5. Биосинтез
О биосинтезе беталаинов имеется мало четкой информации, хотя известно, что ароматические аминокислоты, такие, как тирозин и дигидроксифенилаланин [ДОФА (6.75)], включаются
Гл, 6. Другие неполимерные пигменты
253
как в дигидроиндольное, так и в дигидропиридиновое кольцо бетанидина. Полагают, что биосинтетический путь (рис. 6.13) включает разрыв дигидроксифенильного кольца ДОФА, за которым следует рециклизация с образованием беталамовой кислоты (6.76). Дигидроиндольное кольцо [циклоДОФА (6.77) образуется путем циклизации ДОФА] затем присоединяется через атом азота к альдегидной группе беталамовой кислоты с образованием бетанидина. Когда таким же образом к бетала-
но
(6.74) Мускааурин I
мовой кислоте присоединяются другие аминокислоты или ами-ны, образуются бетаксантины.
Что касается гликозилирования, то сведения относительно-того, когда оно происходит, на ранних (например, на стадии циклоДОФА) или на поздних (например, на стадии бетанидина) стадиях биосинтеза, противоречивы. Изобетанидин образуется эпимеризацией бетанидина. Известно, что такая эпимеризация происходит in vitro очень легко, даже спонтанно, однако-in vivo она представляет собой контролируемый процесс, катализируемый ферментом. Об энзимологии и механизмах реакций, протекающих в ходе биосинтеза беталаинов, почти ничего не известно.
По-видимому, у некоторых видов для синтеза беталаинов абсолютно необходим свет. У других видов образование пигментов происходит и в темноте, но при освещении белым светом интенсивность синтеза возрастает. Весьма вероятно, что биосинтез беталаинов находится под прямым ядерным генетическим контролем.
Рис. 6.13. Предлагаемый путь биосинтеза бетанидина.
Гл. 6. Другие неполимерные пигменты 255-
6.5.6. Функции и использование
Физиологические функции беталаинов в растениях не известны. Считают, что они играют ту же роль, что и антоцианы, которых они замещают, так что в плодах и цветках они могут служить для привлечения насекомых, птиц и т. д. в целях распространения семян и опыления (гл. 8). Широкая известность бетанина как природного пигмента корнеплодов столовой свеклы способствовала росту интереса к возможному использованию этого соединения или содержащих его экстрактов в качестве промышленных пищевых красителей.
6.6. Другие N-гетероциклические пигменты
Азотсодержащие гетероциклические пигменты, не принадлежащие ни к одной из уже описанных главных групп, более или менее часто обнаруживаются только у микроорганизмов, в частности у бактерий, хотя некоторые алкалоиды высших растений, например берберин (6.78), окрашены и, следовательно, могут рассматриваться как растительные пигменты.
Интенсивно окрашенные азотсодержащие бактериальные-продукты включают производные индола, например виолацеин> (6.79) из Chromobacterium violaceum, пирролы, например трипиррол продигиозин (6.80) из Serratia spp., и димерные производные пиридина, например индигоидин («бактериальный индиго») из Pseudomonas indigofera (6.81). Светопоглощающие свойства последнего обусловлены диаза-о-дифенохиноновой структурой. Биосинтез и функциональное значение этих соединений в большинстве случаев не исследовались.
Обычно думают, что индиго является растительным пигментом, однако растительный индиго, использовавшийся в качестве красителя для материи и для раскраски тела (вайда) древними, является артефактом. Сок растений Indigofera tinctoria и Isatis tinctoria содержит индикан — бесцветный глюкозид 3-гид-роксииндола (6.82). Пигмент же индиго (6.83) образуется только после его гидролиза и окисления.
Сходная ситуация имеет место и в случае 6,6-диброминдиго (6.84), использовавшегося древними римлянами и другими народами в качестве краски, называемой тирским пурпуром. В данном случае это также артефакт, образующийся в результате фотохимического окисления животного продукта. Природный же предшественник, синтезируемый различными морскими-моллюсками, такими, как Мигех и Nycella, недавно был идентифицирован как тиривердин (6.85).
о
(6 60> Продигиозин
(6 65) Тиривердин
(6 84> 6,6' -Диброминдиго /Тирский пурпур)
Гл. 6, Другие неполимерные пигменты 257
6.7. Заключение и комментарии
Пигменты, описанные в этой главе, не принадлежат все к какой-либо одной группе, однако для удобства они собраны вместе на основании их общего структурного свойства — присутствия по крайней мере одного азотсодержащего кольца. Однако некоторые классы пигментов имеют явное структурное и функциональное сходство; пурины, птерины и флавины, например, обладают сходной системой гетероароматических колец, а также подобными свойствами. Рассмотренные в данной главе пигменты предоставляют широкое поле для дальнейших химических исследований. Поскольку исчерпывающего систематического поиска новых N-гетероциклических пигментов не проводилось, можно не сомневаться в том, что такие пигменты еще будут открыты; не исключено даже, что будут обнаружены совершенно новые группы пигментов. Среди них могут встретиться сложные структуры с интересной стереохимией, трудно поддающиеся исследованию методами синтеза. Здесь много работы и биохимику. В общих чертах биосинтетические пути для большинства групп уже выяснены, однако подробности механизмов отдельных реакций и катализирующие их ферменты все еще не установлены. Мало известно также о регуляции путей биосинтеза. N-Гетероциклические пигменты, как правило, не используются широко в качестве пищевых красителей, хотя в настоящее время интенсивно окрашенные водорастворимые беталаины вызывают интерес в этом отношении.
Подводя итог, следует отметить, что изучение N-гетероцик-лических веществ остается одной из наиболее заброшенных областей изучения пигментов, хотя именно они предоставляют широкое поле для интересных исследований.
6.8. Рекомендуемая литература
РазнообразныеN-гетероциклические пигменты, описанные в этой главе, напоминают разрозненную коллекцию; поэтому не удивительно, что не существует книги или обзора, которые охватили бы все группы этих пигментов. Основные книги о пигментах животных (Fox, Vevers, 1960; Needham, 1974; Fox, 1976) и пигментах растений (Goodwin, 1976) наряду со сведениями о главных пигментах содержат информацию и о большинстве из этих азотсодержащих пигментов. Изучающим данный вопрос необходимо обратиться к более специализированным книгам или статьям, в которых сконцентрирована информация о пигментах определенных групп.
В случае пуринов и птеринов особенно полезны статьи Брауна (Brown, 1971), Циглера (Ziegler, 1961, 1965) и Циглера и Хармсена (Ziegler, Harmsen, 1969), а также два последних то
17—84
258
Часть 1. Химические и биохимические аспекты
ма из серии трудов симпозиумов (Pfleiderer, 1975; Kisliuk, Brown, 1979). Ряд статей, в частности Плота идр. (Plant, 1974), посвящены рибофлавину и его биосинтезу. Последние достижения методологии в области птеринов и флавинов включены в два тома «Methods in enzymology» (McCormick, Wright, 1971, 1980). Оммохромам повезло меньше. В обзоре Линцена (Lin-zen, 1974) приведены подробности биосинтетических исследований и ссылки на более ранние работы по химии и биохимии этих соединений. Что касается микробных феназинов, то статьи Лейзингера и Марграфа (Leizinger, Margraff, 1979), а также Ингрэма и Блэквуда (Ingram, Blackwood, 1970) освещают их в общих чертах и с акцентом на прикладную микробиологию соответственно. Глава, написанная Пиаттелли (Piattelli, 1976) в книге Гудвина о растительных пигментах (Goodwin, 1976), содержит информацию по химии и биохимии беталаинов. Краткое описание некоторых других азотсодержащих пигментов входит в статью Томсона (Thomson, 1976) в этой же книге.
6.9. Дополнительная литература
Brown G. М. (1971). The biosynthesis of pteridines, Adv. Enzymol., 35, 35. Fox D. L. (1976). Animal Biochromes and structural color, 2nd edition. Berkeley, Los Angeles and London, University of California Press.
Fox H. M., Vevers G. (1960). The nature of animal colours, London.
Goodwin T. W. (ed.) (1976). Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1. London, New York and San Francisco, Academic Press.
Ingram I. M„ Blackwood A. C. (1970). Microbial production of phenazines, Adv. Appl. Microbiol., 13, 267.
Kisliuk R. L., Brown G. M. (eds.) (1979). Chemistry and biology of pteridines, New York, Elsevier-North Holland.
Leisinger T., Margraff R. (1979). Secondary metabolites of the fluorescent Pseudomonads, Microbiol. Rev., 43, 422.
Linzen B. (1974). The tryptophan-ommochrome pathway in insects, Adv. Insect. Physiol., 10, 117.
McCormick D. B., Wright L. D. (eds.) (1971). Methods in enzymology, vol. 18B, New York, London and San Francisco, Academic Press.
McCormick D. B., Wright L. D. (eds.) (1980). Methods in enzymology, vol. 66, New York, London and San Francisco, Academic Press.
Needham A. E. (1974). The significance of zoochromes.
Pfleiderer W. (ed.) (1975). Chemistry and biology of pteridines, Berlin.
Piattelli M. (1976). Betalains. In: Chemistry and biochemistry of plant pigments 2nd edition, vol. 1, ed. T. W. Goodwin, p. 560, London, New York and San Francisco, Academic Press.
Plaut G. W. E., Smith С. M., Alworth W. L. (1974). Biosynthesis of water-soluble vitamins, Ann. Rev. Biochem., 43, 899.
Thomson R. H. (1976). Miscellaneous pigments. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 597, London, New York and San Francisco, Academic Press.
Ziegler I. (1961). Genetic aspects of ommochrome and pterin pigments, Adv. Genet., 10, 349.
Ziegler I. (1965). Pterine als Wirkstoffe und Pigments, Ergebn. Physiol., 56, 1. Ziegler I., Harmsen R. (1969). The biology of pterins in insects , Adp. Insect.
Physiol., 6, 139.
Глава 7
Меланины
7.1. Введение
Черная окраска широко распространена у живых организмов . Термин «меланин» обычно применяют для описания нерастворимых полимерных пигментов, ответственных за большинство природных окрасок черного цвета. Его используют также в настоящее время для описания сходных полимерных веществ, которые обусловливают природную коричневую, красную и желтую окраску, главным образом перьев птиц и волос. Меланины являются единственными пигментами, широко используемыми для окрашивания среди млекопитающих, в том числе человека.
Термин «меланин» не несет информации о химической структуре пигментов, за исключением той, что они представляют собой полимеры с относительно высокой молекулярной массой. Были предприняты попытки различить и охарактеризовать отдельные классы меланиновых пигментов. Так, черные пигменты животных обычно называют э у меланинами, в то время как желто-коричневые разновидности известны под названием фео-меланинов. Имеющие некоторое сходство с ними не содержащие азота черные пигменты растений часто называют алломе-ланинами.
Знания о химии и биохимии меланинов в значительной степени ограничены из-за больших технических трудностей, возникающих при изучении этих пигментов. Меланины обычно нерастворимы ни в одном из растворителей, и поэтому их трудно выделить и очистить. Действительно, в случае меланинов почти невозможно узнать, имеем ли мы дело с чистым веществом в том смысле, что в пробе содержится только один вид молекул. Какие-либо диагностические пробы, которые могли бы оказаться полезными для меланинов, а также общие методы специфического расщепления меланиновой молекулы на специфические фрагменты или субъединицы отсутствуют. Невозможно даже доказать идентичность двух образцов меланинов. Связывание с белком, которое в нормальных условиях имеет место по крайней мере в случае меланинов животных, делает выделение и изучение этих пигментов еще более трудным.
На фоне упомянутых экспериментальных трудностей и следует рассматривать современное состояние знаний о биохимии меланинов.
17*
260
Часть I. Химические и биохимические аспекты
7.2. Химия
7.2.1. Общая характеристика
При исследовании природных веществ установление химической структуры часто помогает предположить способ биосинтеза изучаемого соединения. В случае меланинов мы имеем дело в значительной степени с обратной ситуацией, именно биохимические исследования позволили сделать первые предположения относительно химической структуры данной группы веществ.
Сейчас известно, что меланины являются полимерами хиноидных соединений. Классическая структура меланина — это длинноцепочечный полимер, состоящий из индолил-5,6-хиноно-вых (7.1) единиц (рис. 7.1). Ситуация, однако, далеко не так
Рис.7.1. Фрагмент структуры меланина как длинноцепочечного полимера ин-долил-5,6-хинона (7.1).
проста. Во-первых, любой образец меланина почти наверняка состоит из смеси макромолекулярных видов. Во-вторых, меланины редко являются гомополимерами, обычно их молекулы состоят из различных мономерных единиц. Кроме того, разные меланины, например из различных живых организмов, построены из разных мономерных единиц. Ситуация еще более осложняется возможностью разветвления полимерной цепи и перекрестного связывания между цепями.
Гл. 7. Меланины
261
Несмотря на сложность проблемы, биохимические и химические исследования по глубокому расщеплению позволили выяснить главные структурные особенности различных классов меланинов. Необходимо, однако, отдавать себе отчет в том, что ни в одном случае мы не имеем возможности даже приблизиться к полному установлению структуры. Ниже мы обсудим главные структурные особенности и свойства прежде всего пигментов наиболее широко изучавшейся группы — эумеланинов, а затем меланинов других главных групп.
7.2.2. Эумеланины
Распространение. Название «эумеланины» применяют к черным азотсодержащим полимерным пигментам, обычно животного происхождения. Однако эумеланины синтезируются также некоторыми растительными тканями. Различают несколько типов эумеланинов, выделенных из ряда источников. Каждый тип эумеланинов имеет характерный набор элементов и характерный состав продуктов расщепления в жестких условиях: при кипячении с 6М НС1 или при нагревании со щелочью до 300 °C. Наиболее интенсивно изучен сепиомеланин — темно-коричневый пигмент защитных чернил каракатицы (Sepia officinalis) и меланин из меланом млекопитающих. В меньшей степени охарактеризованы меланины, содержащиеся в черных волосах, перьях и коже, а также в сосудистой оболочке глаза и в некоторых внутренних органах. Некоторые черные пигменты растений, в том числе те, которые образуются в результате повреждений клубней картофеля и бананов, также могут принадлежать к эумеланинам. Сходные пигменты (ДОФА-меланины) образуются из дигидроксифенилаланина [ДОФА (7.2)] под действием растительных и грибных ферментов.
Структура. Классическая идея (рис. 7.1) о том, что эумела-нин представляет собой линейный полимер индолил-5,6-хинона (7.1), в сущности верна, однако чрезвычайно упрощенно отражает положение вещей. Действительно, главными мономерами являются индолил-5,6-хинон и его восстановленные производные; кроме того, в полимере может присутствовать небольшое число пиррольных мономеров (7.3), образующихся, по-видимому, из индольных предшественников. В меланинах меланомы могут также содержаться ДОФА и ДОФА-хиноновые (7.4) фрагменты. Исследования с помощью электронного парамагнитного резонанса (ЭПР) указывают на присутствие небольшого количества свободных радикалов, возможно, полухиноновых структур. In vivo с эумеланином могут быть связаны тяжелые металлы, особенно медь, цинк или железо. Степень перекрестного связы
262
Часть I Химические и биохимические аспекты
вания меланиновых цепей не определяли, но, вероятно, она невелика.
Фрагмент предполагаемой структуры сепиомеланина показан на рис. 7.2. Структура других эумеланинов, вероятно, напоминает эту, однако она может отличаться от нее числом мономерных субъединиц и частотой их встречаемости. Природные полимеры представляют собой длинноцепочечные макромолекулы. In vivo они связаны с белком, возможно, через сульфгидрильную группу цистеина.
(7 2) Дигидроксифенилаланин
(7 3)
(7 4) Дофа хинон
Свойства. Эумеланины практически нерастворимы в воде и в органических растворителях. Они чрезвычайно инертны и стабильны и подвергаются изменениям лишь в результате наиболее жестких химических воздействий. Вместе с тем эумеланины могут обесцвечиваться при длительном выдерживании на воздухе на ярком солнечном свету или, особенно эффективно, при продолжительном окислении перекисью водорода. Обесцвечивание человеческих волос, используемое «перекисными блондинками», хорошо известно.
Как и следовало ожидать, эумеланины, имеющие черный цвет, поглощают свет во всем видимом диапазоне. Поглощение происходит более интенсивно при более коротких длинах волн, и, возможно, это не является простым следствием высокосопряженной системы.
С помощью дифракции рентгеновских лучей твердых образцов эумеланинов животных была показана упаковка в стопки индольных и других ароматических фрагментов с образованием л-комплекса. Упакованные в стопки фрагменты могут быть удаленными друг от друга членами одной полимерной цепи или же членами разных полимерных цепей.
Гл. 7. Меланины
263
Рис 7 2 Фрагмент предполагаемой структуры сепиомеланина. Частота встречаемости остатков пиррольных мономеров умышленно сильно преувеличена, чтобы проиллюстрировать несколько различных возможностей связывания В действительности эти мономеры составляют лишь очень небольшую часть всех мономеров.
7.2.3. Феомеланины
Распространение. Феомеланины имеют желтую, красную или коричневую окраску. Некоторые авторы применяют название «феомеланин» только к желтым или светло-желтоватым пигментам и называют красные вещества «эритромеланинами». В этой книге все эти пигменты мы будем называть «феомела-нинами». Распространение феомеланинов, по-видимому, ограничивается волосами и перьями, а, возможно, также и веснуш-
264
Часть I. Химические и биохимические аспекты
ками, которые у людей часто сопутствуют рыжим волосам. Лучше других изучены пигменты рыжих волос человека и красных перьев некоторых линий домашних кур. Содержание фео-меланинов в красных перьях обычно значительно выше, чем в рыжих волосах.
Рис. 7.3 Фрагмент предполагаемой структуры галлофеомеланина.
Структура. Наиболее интенсивно изучались красные пигменты куриных перьев, особенно у красных родайлендов. С ними, по-видимому, сходны пигменты рыжих волос человека и других животных, например орангутана. Эти красные пигменты известны под общим названием галлофеомеланины и представляют собой сложные серусодержащие макромолекулы, образованные из дофахинона и цистеина. Главные единицы, из которых построен полимер, no-видимому, происходят от бензотиазола (7.5); фрагмент возможной структуры такого полимера показан на рис. 7.3. При обработке волос или перьев кислотой освобождается небольшое количество димерных пигментов — трихосидери-
(7 ь) Бензотиазол
(7 6) Трихосидерин
Гл. 7. Меланины
265
нов (7.6). Являются ли эти пигменты природными продуктами или артефактами, остается неизвестным.
Свойства. Феомеланины отличаются от большинства эумеланинов растворимостью в разбавленных щелочах. Вместе с тем у них есть и общие с эумеланинами свойства — это нерастворимость в других растворителях и химическая стабильность.
Феомеланины и трихосидерины интенсивно поглощают свет в видимом диапазоне (500—550 нм), что и обусловливает их красноватую окраску.
7.2.4 Алломеланины
Распространение. Черные пигменты, известные как алломеланины, являются, по-видимому, главным образом продуктами высших растений (они составляют важную часть черных защитных покровов многих зрелых семян) и грибов; у последних они обнаруживаются в спороносном слое и в спорах съедобных грибов и в черных гифах плесневых грибов, таких, как Phycomyces.
Структура. Алломеланины грибов изучались наиболее интенсивно, однако их структура еще далека от выяснения. Характерной особенностью алломеланинов является то, что они содержат мало или вообще не содержат азота и потому не могут быть полимерами индола. Многие из них, по-видимому, представляют собой полимеры простых фенолов, таких, как пирокатехин (7.7), и их хинонов и рассматриваются как пирокатехиновые меланины. Имеющиеся доказательства свидетельствуют в пользу того, что между пирокатехиновыми фрагментами на различных стадиях окисления может происходить далеко идущая конденсация с образованием полимерных структур, в которых мономерные единицы соединены С—С- и С—О—С-связями, как, например, показано во фрагменте структуры (7.8). Пирокатехин, по-видимому, является главным продуктом расщепления растительных алломеланинов. Алломеланины грибов Aspergillus niger и Daldinia concentrica, вероятно, содержат периленовые мономеры, такие, как (7.9), представляющие собой производные 1,8-дигидроксинафталина (7.10).
Свойства. Алломеланины, так же как меланины других групп, нерастворимы ни в каких растворителях и химически стабильны. Они обычно поглощают свет во всем видимом диапазоне, однако иногда наблюдаются максимумы поглощения, главным образом при ~450 нм.
7.2.5. Склеротииы
Склеротины представляют собой полимерные вещества, наиболее характерные для экзоскелета членистоногих. Они ответственны за затвердение и связанное с ним потемнение кутикулы у многих видов насекомых.
266
Часть 1 Химические и биохимические аспекты
Химия склеротиков и биохимия процесса склеротизации изучены мало, однако некоторые их особенности уже известны. Склеротин не простой продукт полимеризации хинонов, как меланин. Это белок, который способен сополимеризоваться с образованными при участии ферментов хинонами, подобными дофахинону, а также с другими близкими к тирозину молекулами. В сополимеризации могут участвовать тирозиновые остатки белка. Усиленный синтез меланина обычно следует после завершения процесса затвердения кутикулы при склеротизации.
7.3. Распространение меланинов
7.3.1. У животных
За исключением гемоглобина крови, меланины являются единственными пигментами, которые синтезируются и широко используются млекопитающими. Они также представляют собой обычные пигменты оперения птиц. Черная кожа, волосы, шерсть и перья окрашены эумеланинами. Желтый, рыжий и коричневый цвет волос и шерсти обусловлены феомеланинами, которые служат также пигментами в коричневых, а в некоторых случаях в желтых и красных перьях. Пигментами желтых и красных перьев могут быть и каротиноиды (гл. 2). Феомела-нины найдены только у млекопитающих и у птиц, тогда как эумеланины широко встречаются также у рыб и беспозвоночных. К наиболее хорошо известным примерам относятся черная окраска многих насекомых и других членистоногих (эумеланины присутствуют вместе со склеротином). Однако в некоторых случаях темная окраска у ряда насекомых и других членистоногих вызывается не меланинами, как думали раньше, а оммохромами (гл. 6).
Наряду с их значением в качестве черных, коричневых и красных пигментов меланиновые частицы или слои обычно ответственны за структурную окраску, обусловленную физическими или структурными причинами (гл. 1).
Меланины обычно рассматриваются как пигменты наружных покровов, однако их находят также и в других тканях. В радужной оболочке глаза содержится меланин, который ответствен за их окраску как непосредственно, в случае карих и черных глаз, так и опосредованно, благодаря светорассеянию коллоидных частиц, обусловливающему голубой цвет глаз. Функционирование меланинов в качестве защитных пигментов в глазах некоторых видов животных будет рассмотрено в гл. 9. Внутренние ткани, такие, как substantia nigra мозга млекопитаю
Гл. 7. Меланины
267
щих, также часто содержат значительные количества меланиновых пигментов. Избыточное образование меланинов служит характерным признаком некоторых опухолей человека — меланом.
Сепиомеланин секретируется и испускается в качестве защитного чернильного облака многими головоногими моллюска
17 9)
(7 10) 1 8 Дигидроксинафталин
ми, например осьминогом или кальмаром. Собранные чернила используются художниками как темно-коричневая «сепия». Устойчивость меланинов делает сепию идеальным по долговечности материалом, хорошо сохраняющим цвет.
Внутриклеточная локализация. В наружных покровах тела меланины обычно присутствуют в специфических клетках, известных как меланоциты или меланофоры. Внутри этих клеток меланины могут быть локализованы в специфических органеллах меланосомах и в ассоциации с белком в виде гранул, обычно около 1 мкм длиной, которые имеют различную форму у
268
Часть I. Химические и биохимическиеаспег.ты
разных видов. Структуры и факторы, которые влияют на морфологию и физиологию этих видов, играют чрезвычайно важную роль в механизмах изменения окраски у животных и будут описаны более подробно в гл. 8.
7.3.2. У растений и микроорганизмов
Черные пятна, полосы и другие метки часто можно увидеть на листьях, цветках и других органах высших растений, где они могут служить указателями направления для опыляющих их насекомых. Черные оболочки семян и стручков также очень обычны, однако здесь может быть более важной инертность материала, чем его черный цвет. Как правило, пигменты, обусловливающие такую черную окраску, не исследуют, а принимают без доказательства, что они являются соединениями меланинового типа. В растениях встречаются индольные эумеланины. Они могут синтезироваться при повреждении тканей, например в плодах банана и в клубнях картофеля. Однако наиболее характерными растительными меланинами являются эумеланины, содержащие мало азота, или не содержащие его совсем. Алломеланины встречаются во многих окрашенных в темный цвет оболочках семян, где они содержатся в пигментированных эпидермальных клетках. Алломеланины являются обычными пигментами спор или гимениальной пластинки у плесневых и других грибов. Некоторые бактерии синтезируют черные пигменты, которые, по-видимому, принадлежат к меланиновому типу, однако они не были охарактеризованы. Феомела-нины в растительном царстве не обнаружены.
7.4. Биосинтез
7.4.1. Введение
Предшественником эумеланинов и феомеланинов является тирозин. Удалось достичь включения тирозина в эумеланин волос, перьев и в чернила головоногих моллюсков, а также тирозина и цистеина в феомеланин. При биосинтезе алломеланинов используются другие фенолы, главным образом пирокатехин (7.7). Ферментативное превращение тирозина в производные индола активно изучалось, и теперь очевидно, что индольные молекулы полимеризуются с образованием меланинов. Для механизмов такой полимеризации были предложены правдоподобные схемы, однако ни одна из них не подтверждена экспериментально.
Гл. 7. Меланины
269
7.4.2. Биосинтез эумеланинов
Ферментативное окисление тирозина. Ферментативное образование пигментов меланинового типа из тирозина было впервые продемонстрировано с препаратом грибно! о фермента, получившего название тирозиназы. Сходное окисление тирозина ферментом из мучного червя (Tenebrio molitor) и аналогичными препаратами из картофеля и грибов интенсивно исследовал Рэпер. Его работы, продолженные позже Мэзоном, привели к появлению классической гипотетической! схемы меланогенеза Рэпера — Мэзона (рис. 7.4). Согласно этой схеме, образование меланина происходит практически в три стадии. Сначала тирозин (7.11) последовательно окисляется до ДОФА (7.12) и дофахинона (7.13), а последний циклизуется с образованием окрашенного в красный цвет дофахрома (7.14). На второй стадии дофахром превращается в бесцветную 5,6-дигидрокси-индол-2-карбоновую кислоту (7.15), а затем в собственно 5,6-дигидроксииндол (7.16). Наконец, окисление последнего до ин-долил-5,6-хинона (7.17) с последующей полимеризацией дает меланиновую макромолекулу. Сходный процесс рассматривался для образования эумеланина млекопитающими и птицами.
Фермент тирозиназа представляет собой полифенолоксидазу (о-дифенол: О2 оксидоредуктазу) с ионом Си2+ в качестве простетической группы. Она, по-видимому, имеет две различные активности — аэробно окисляет тирозин до ДОФА и затем •окисляет сам ДОФА. Остальные стадии образования меланинов могут происходить неферментативным путем.
Схема Рэпера — Мэзона, по-видимому, в основном верна, однако более современные работы неизбежно привели к ее расширению и модификации. Меланины, полученные ферментативным путем из разных субстратов, например из тирозина, ДОФА, дофамина (7.18) и 5,6-дигидроксииндола, выглядят сходными, однако имеют разные свойства. Сейчас также предполагают, что небольшое количество индольных мономеров разрушается до пиррольных фрагментов (рис. 7.5).
Полимеризация. О процессе полимеризации, с помощью которого меланиновая макромолекула строится из мономерных единиц, практически ничего не известно. В молекуле хинона, подобного индолил-5,6-хинону (7.17), атомы углерода в положениях 4 и 7 обладают высокой реакционной способностью. Связывание мономеров по этим положениям через атом азота, атомы углерода 2 и 3 гетероциклического кольца происходит довольно легко (рис. 7.6). Такая же легкость присуща сополимеризации с молекулами других мономеров, таких, как дофа-хинон. Наличие столь большого числа реакционноспособных атомов в молекулах мономеров обеспечивает возможность пе-
(7,16) 5,6-Дигидроксииндол
(7 17) Цндолил-5,6-хинрн
Рис. 7.4. Схема меланогенеза Рэпера — Мэзона.
Гл. 7. Меланины
271
рекрестного связывания. Не все остатки мономеров остаются в форме хинонов. Многие из них присутствуют в виде соответствующих фенолов или частично восстановленных форм. В некоторых случаях процесс полимеризации может протекать на белковом матриксе.
ch2.ch2.nh2
(7 18) Дофамин
Модельная структура эумеланина (сепиомеланина) на рис. 7.2 представляет собой как раз такую структуру, образование которой, по-видимому, происходит в ходе описанных выше процессов.
7.4.3. Биосинтез феомеланинов
Феомеланины образуются по модифицированному эуме-ланиновому пути. Ферментативное окисление тирозина дает опять-таки дофахинон (7.13). Однако в этом случае последний взаимодействует с серусодержащей аминокислотой цистеином
Рис. 7.5. Деградация индольных мономеров до пиррольных единиц.
(7.19), вероятно, с образованием бензотиазолового промежуточного продукта, такого, как (7.20). Димеризация или полимеризация мономерных молекул может затем привести соответственно к образованию молекул трихосидеринового (7.6) типа или феомеланинов. Было продемонстрировано включение меченых тирозина и цистеина в феомеланин, а красно-коричневый фео-меланиноподобный пигмент был получен путем окисления ДОФА (7.2) грибной полифенолоксидазой в присутствии цистеина. Пред-
212
Часть I Химические и биохимические аспекты
Рис. / 9 Механизм окислительной полимеризации индолил-5,6-хинона.
полагаемый механизм, показанный на рис. 7.7, является, однако, чисто спекулятивным и не был подтвержден экспериментально.
7.4.4. Биосинтез алломеланинов
Растения и грибы синтезируют много веществ фенольной природы. Окисление этих веществ полифенолоксидазой дает во многих случаях хиноны, которые легко полимеризуются до черных безазотистых веществ алломеланинового типа. В результате ферментативного окисления пирокатехина (7.7) образуется не только о-бензохинон, но и такие продукты, как гидрокси-/г-бензохинон (7.21). Природные пирокатехиновые алломеланины, по-видимому, образуются путем полимеризации хиноновых молекул, подобных упомянутым выше, с образованием разветвленных структур, таких, как (7.8).
Нафтоловые алломеланины, синтезируемые Aspergillus ni-ger и другими грибами, по-видимому, образуются аналогичным путем из 1,8-дигидроксинафталина (7.10) (поликетидный продукт) через хиноновый и периленовый промежуточные продукты, такие, как (7.9).
Рис. 7 7. Предполагаемый механизм биосинтеза феометанииов и трихосидеринов из дофахинона и ццстецна
274 Часть I, Химические и биохимические аспекты
7.4.5. Общие выводы
Выяснены две общие особенности биосинтеза меланинов: 1) начальные стадии включают ферментативное окисление фенольных или полифенольных предшественников с образованием хинонов, и 2) высокореакционноспособные хиноны легко подвергаются полимеризации или сополимеризации, приводящей к образованию окрашенных меланиновых макромолекул.
Создается впечатление, что делавшиеся до сих пор попытки классифицировать меланиновые вещества на эумеланины, фео-
о
о (7.2V Гидракси-П-бензохинон
меланины и алломеланины и установить биосинтетические пути этих трех групп позволяют получить лишь весьма упрощенную картину. Большинство (если не все) живых тканей обладают ферментами полифенолоксидазного типа. Все живые ткани содержат фенольные соединения, часто (особенно у растений) весьма разнообразные. В результате окисления любого из этих соединений полифенолоксидазой — либо его одного, либо в комбинации с другими фенольными или нефенольными веществами (например, цистеином) — происходит образование хинонов, способных полимеризоваться с образованием макромолекулярных продуктов со свойствами меланинов.
Таким образом, один и тот же основной биосинтетический процесс приводит к образованию огромного числа продуктов, которые могут выглядеть сходными, но иметь совершенно разную структуру. Различия возникают благодаря разнообразию в степени окисления мономерных предшественников и существованию различных последовательностей и механизмов полимеризации, сополимеризации и перекрестного связывания. Детали этих механизмов все еще не установлены ни для одного индивидуального природного меланина. Не исключено, что еще будут идентифицированы новые структурные типы меланинов, молекулы которых построены из пока не открытых мономерных единиц.
Гл. 7. Меланины
275
7.5. Факторы, влияющие на меланогенез
7.5.1. У растений и грибов
Контроль меланогенеза у растений и грибов подробно не* изучался. Вместе с тем известно, что у растений синтез меланина в темных пятнах и характер расположения этих пятен, обусловливающий общий внешний вид листьев и цветков, находится под генетическим контролем. Меланины могут синтезироваться в ответ на механическое повреждение тканей, например у плодов после удара появляются бурые и черные пятна. У ряда грибов наблюдается корреляция между синтезом меланинов и спорообразованием, однако значение этого явления пока не известно. Это может быть связано с образованием прочной инертной устойчивой оболочки спор, а не с их окрашиванием, как в случае оболочек семян растений.
7.5.2. У животных
У животных меланины обычно содержатся в особых органеллах и специфических клетках, так что, скорее всего, регуляторный механизм контролирует процесс дифференциации и образования этих клеток и органелл, а не биосинтез меланинов непосредственно. Конечно, в основном синтез и отложение меланинов, обусловливающие внешнюю окраску или характер ее распределения у животного, находятся под генетическим контролем. Так, люди негроидной расы имеют черную кожу вне зависимости от окружающей среды. Однако факторы среды и сезонные изменения также могут быть чрезвычайно важными. Известно, например, несколько примеров стимуляции меланогенеза низкими температурами или такими факторами, как влажность и роение (у пчел).
Беспозвоночные и пойкилотермные позвоночные. У этих животных изменения окраски как быстрые, так и медленные весьма обычны и, как правило, происходят с участием меланинов и меланинсодержащих клеток. Однако рассматривать в этом случае меланины изолированно нельзя, поскольку в окрашивании клеток участвуют также другие пигменты и другие клетки или типы органелл. Мы обсудим изменения окраски и механизмы таких изменений в гл. 8.
Млекопитающие и птицы. Меланиновая пигментация у млекопитающих и птиц находится под прямым генетическим контролем. Тип изменения окраски у них отличается от того, который обычен для беспозвоночных, амфибий, рептилий и рыб, 18*
276
Часть I. Химические и биохимические аспекты
правда, у некоторых видов наблюдаются сезонные вариации окраски.
Широко изучалась пигментация человеческой кожи. Показано, что в коже происходит быстрое обновление меланинов: они теряются при слущивании эпидермиса и затем вновь синтезируются. У представителей темных рас меланина синтезируется и накапливается значительно больше, чем у представителей так называемой белой расы. Меланоциты обнаруживаются в коже человеческого зародыша, принадлежащего к негроидной расе, уже на одиннадцатой неделе развития.
У людей белой расы хорошо заметен рост содержания меланина в коже в результате экспозиции на солнечном свету при загорании. Загар формируется в две стадии. Сначала, сразу же после облучения солнечным светом, синтезируется некоторое количество меланина в результате фотоокисления предшественников и быстро образуется «заслон», защищающий от солнечных ожогов. Этот быстрый загар возникает в основном под действием света с длиной волны 350 нм. Главный и стойкий загар развивается спустя два дня после экспозиции на солнце и достигает максимума примерно через семь дней. Меланиновые гранулы образуются в эпидермальных меланоцитах, а затем они распространяются в кератиноциты (клетки кожи). Стойкий загар (как и болезненный ожог кожи) наиболее эффективно вызывается светом с длиной волны ~300 нм. На основе биохимических процессов, обусловливающих загар, выросла целая индустрия летнего отдыха, однако механизм этих процессов все еще до конца не ясен.
На синтез меланина в коже человека влияет гормон гипофиза— меланоцитстимулирующий гормон (МСГ). У женщин белой расы избыточный синтез меланинов часто происходит в некоторых участках кожи во время беременности, что отражает обычно повышение активности гипофиза. Меланинстимулиру-ющие гормоны стимулируют меланогенез и распределение меланинов и у других позвоночных и беспозвоночных животных. Известно, что меланогенез у многих низших животных стимулируется светом, но этот эффект явно отсутствует в случае темных перьев птиц или волос млекопитающих.
Сезонные вариации. Хорошо известно, что оперение многих птиц в брачный период отличается от зимнего оперения. Эти различия часто обусловлены вариациями синтеза меланинов (эумеланинов и феомеланинов) в новых перьях, которые растут после линьки. Вероятно, происходящие при этом процессы находятся как под гормональным, так и под генетическим контролем. Некоторые млекопитающие и птицы, живущие в Арктике, летом имеют темную окраску, а зимой полностью или частично белую, т. е. они извлекают максимальную пользу из подобной
Гл 7. Меланины
277
маскировки во все времена года. Факторами, вызывающими сезонную линьку и контролирующими меланогенез в растущих волосах и перьях, могут быть температура и продолжительность дня.
7.5.3. Аномальный меланогенез
Альбинизм. Альбиносные представители млекопитающих и птиц являются рецессивными гомозиготами, у которых в коже, глазах, а также в волосах или перьях отсутствует меланин, и потому они не окрашены в отличие от темного доминантного фенотипа. Такие животные имеют меланоциты, в которых содержатся только бесцветные тени меланиновых гранул, поскольку они лишены тирозиназы (полифенолоксидазы) и потому не
ch(oh).ch2.nh сн3
(7 22) Адреналин
способны превращать тирозин в меланин. Отмечена необычная восприимчивость животных-альбиносов к болезням, хотя не известно, связано ли это с неспособностью образовывать меланин.
Болезни человека, связанные с нарушением метаболизма меланина. У человека и других животных многие опухоли имеют темную окраску. В таких опухолях (меланомах) синтезируются и накапливаются избыточные количества меланина. Много меланина содержится также в родинках и родимых пятнах.
Усиление и ослабление меланогенеза наблюдается при ряде заболеваний, в том числе болезни Паркинсона, аддисоновой болезни, а также при витилиго. Однако изменения меланогенеза являются при этих заболеваниях, по-видимому, вторичными. В некоторых случаях источником мономеров для меланиновых молекул может служить адреналин (7.22) или его предшественники, используемые в нормальных условиях для образования адреналина.
7.6. Функции
Единственная функция меланинов растений состоит в формировании общей окраски растений или характера ее распределения. Что касается очевидной корреляции между синтезом меланинов и споруляцией у различных грибов, то ее значение пока не известно.
278
Часть I. Химические и биохимические аспекты
Две главные функции меланинов у животных, а именно их роль как пигментов наружных покровов и как светозащитных пигментов в глазах и коже, обсуждаются в гл. 8 и 11.
7.7. Заключение и комментарии
Из всех групп природных пигментов, рассмотренных в этой книге, меланины несомненно являются наиболее трудными для изучения. Выделение, очистка и химическое разрушение меланинов представляют такую проблему, что их пришлось охарактеризовать не по какому-либо химическому свойству, а просто как группу темных, чрезвычайно стабильных полимеров. Поэтому в области структуры и биосинтеза меланинов перед увлеченными и настойчивыми исследователями структуры — широкое поле деятельности. Мы еще очень далеки как от возможности определить структуру какого-либо меланина, так и от полного понимания его биосинтеза. В этой связи хотелось бы отметить, что меланины из многих объектов вообще не изучались. В детальной разработке нуждается еще один вопрос — белковое окружение меланинов in vivo.
По-видимому, у меланинов нет других функций, кроме пигментной, но даже в этом случае они заслуживают внимания как единственные пигменты, ответственные за окраску тканей у человека. Желание миллионов представителей белых рас увеличить содержание меланина в коже при загорании на солнечном свету привело к созданию целой индустрии летнего отдыха. Необходимо помнить, что в основе расовых конфликтов и апартеида лежат всего лишь различия в содержании кожных меланинов. По этой причине ни одна другая группа природных пигментов не имеет столь далеко идущих социальных последствий. Как ни трудны химические проблемы, связанные с меланинами, разрешить их, вероятно, все-таки легче, чем проблемы социальные.
7.8. Рекомендуемая литература
Для дополнительного чтения о меланинах, особенно об их химии, распространении и биосинтезе, можно порекомендовать четыре книги и обзорные статьи, написанные Томсоном (Thomson, 1962), Николаусом (Nicolaus, 1968), Сваном (Swan, 1974) и Блойсом (Blois, 1978). Хотя они и были написаны в течение последних 20 лет, на протяжении которых число изученных меланинов все возрастало, и была накоплена огромная информация; фундаментальных изменений в области меланинов за это время не произошло. Каждая из этих статей содержит обширный список оригинальных работ, который может быть ис
Гл. 7. Меланины
279
пользован для получения детальной информации по любому частному вопросу. Наиболее подробные сведения о меланинсо-держащих клетках и их функционировании при изменении окраски животных, а также о гормональной регуляции синтеза и распространения меланинов можно найти в специальной монографии (Bagnara, Hadley, 1973).
7.9. Дополнительная литература
Bagnara J. Т., Hadley М. Е. (1973). Chromatophores and color change: the comparative physiology of animal pigmentation, Englewood Cliffs, New Jersey, Prentice Hall.
Blois M. S. (1978). Melanins. In: Photochemistry and photobiology reviews, vol. 3, ed. К. C. Smith, p. 115, New York, Plenum.
Nicolaus R. A. (1968). Melanins, Paris, Hermann.
Swan G. A. (1974). Structure, chemistry and biosynthesis of the melanins, Fortschr. Chem. Org. Naturst., 31, 521.
Thomson R. H. (1962). Melanins. In: Comparative biochemistry, vol. 3, eds. M. Florkin and H. S. Mason, p. 727, New York and London, Academic Press.
Часть II
Функциональные аспекты
Глава 8
Значение окраски в природе
8.1. Введение
Наиболее очевидная и фундаментальная функция пигментов в живых организмах состоит в том, что они придают тканям окраску. В этой главе сделана попытка объяснить, почему важно это свойство и как оно используется животными и растениями.
Мы распознаем принадлежность животных или растений к тому или иному виду в первую очередь визуально. Вероятно, первыми регистрируемыми зрительными впечатлениями являются общие размеры и форма объекта, однако чрезвычайно важны также его окраска и характер ее распределения. Последнее обычно используется как своего рода «тонкая настройка» в целях различения видов, близких по форме и размерам, но в некоторых случаях окраска и ее распределение могут быть наиболее явными характерными признаками. Большинство видов животных реагируют на такие визуальные сигналы и используют свои зрительные возможности как средство для распознавания пищи, врагов или брачных партнеров. Параллельно с этим у большинства животных и многих растений развилась способность к окрашиванию со своим типом распределения окраски. Эта способность используется животными и растениями для того, чтобы оповестить об их присутствии или скрыть его. Окраска и характер ее распределения изменчивы, причем изменения могут быть связаны с временем года, стадиями развития или быстро появляться в ответ на изменение условий окружающей среды.
Все эти аспекты будут рассмотрены в данной главе, основная цель которой — охарактеризовать значение и важность окраски в животном царстве. Однако и для многих растений важно быть окрашенными либо иметь окрашенные органы или ткани (такие, как цветки и плоды) для привлечения
Гл. 8. Значение окраски в природе
281
тех животных-переносчиков, которые помогают распространению видов растений посредством непроизвольного их опыления или распространения семян. Будут рассмотрены современные виды, образовавшиеся в результате миллионов лет эволюции и отбора по тем признакам, которые давали хотя бы незначительное преимущество для выживания индивида или вида в целом. Какие-либо предположения об эволюции пигментации обсуждаться не будут. Цель данного раздела заключается лишь в демонстрации путей, с помощью которых окраска и характер ее распределения используются с выгодой для себя теми животными и растениями, которые существуют сегодня.
8.2. Окраска и характер ее распределения у животных
Окраска внешних покровов помогает животным укрываться или маскироваться (покровительственная окраска), а также служит для опознавания или предупреждения (предупреждающая окраска). При этом используется как структурная окраска, так и окраска, обусловленная пигментами (любого класса).
8.2.1. Покровительственная окраска
Цель покровительственной окраски заключается в маскировке, т. е. в том, чтобы сделать животное как можно более незаметным в его природных условиях обитания. Покровительственные цвета, имеющие большое значение для животных, используются ими для того, чтобы избежать обнаружения хищником, но они также используются и хищниками, чтобы не быть замеченными будущей жертвой и тем облегчить ее поимку. Покровительственная окраска может быть имитацией фоновой окраски, или она может быть очень сложной, исчерченной полосами, искажающей форму и делающей животное незаметным. Некоторые животные приобретают более яркую или более темную окраску лишь с помощью сочетаний различных оттенков серого цвета, в то время как другие способны воссоздавать в деталях окраску поверхности, на которой находятся, а третьи даже могут копировать окраску пестрых поверхностей. В некоторых случаях то, что на расстоянии выглядит однотипным, в действительности может быть окрашено в яркие цвета, различимые лишь с близкого расстояния. Необходимо также помнить, что внешний вид животного нельзя рассматривать без учета ее природной среды обитания. Так, тигр или зебра очень заметны в зоопарке, но окраска из чередующихся полос может быть чрезвычайно эффективной для маскировки этих животных в среде, окружающей их в естественных условиях.
282
Часть 11. Функциональные аспекты
Животные, перемещающиеся по изменяющейся поверхности, не могут быть хорошо замаскированы все время. Некоторым видам, например крабу Carcinus, присущ полиморфизм окраски. Известны его разные формы, отличающиеся друг от друга по окраске, соответствующей поверхности определенного типа. Краб целенаправленно ищет такую поверхность и проводит там большую часть времени.
Многочисленные опыты подтвердили значение покровительственной окраски для выживания видов. Если насекомые одного и того же вида, но принадлежащие к двум по-разному окрашенным формам обитают на одноцветной поверхности, то те из них, чья окраска контрастирует с поверхностью, с гораздо большей вероятностью станут жертвами хищников, чем те, окраска которых соответствует окраске поверхности.
8.2.2. Предупреждающая окраска
Предупреждающая, или сем этическая, окраска обычно состоит из бросающихся в глаза больших контрастных ярких пятен, имеющих четкие границы. Они узнаются и интерпретируются видящим их животным как предостережение или, наоборот, как приглашение в зависимости от предшествующего жизненного опыта.
Отпугивающая окраска. Об окраске и характере ее распределения говорят, что они отпугивающие, если они предупреждают того, кто их видит, об опасности или неприятном воздействии. Хорошо известным примером такой предупреждающей окраски служит окраска ос (например, Vespula vulgaris), чьи контрастные желтые и черные полосы вызывают страх даже у людей. Бросающаяся в глаза окраска у других насекомых, например красно-черная окраска божьих коровок (Coccinella spp.), служит предупреждением потенциальному хищнику о том, что ее обладатели несомненно невкусны. Таким животным нет нужды прятаться или пытаться избежать встречи с хищником. Хищники, руководствуясь своим предшествующим опытом, не преследуют их.
Опознавательная окраска. Яркая привлекающая внимание окраска (и характер ее распределения), которая служит для привлечения других животных, известна как опознавательная. В большинстве случаев она предназначена для особей своего вида, но противоположного пола и является частью сексуальноаттрактивного демонстрационного поведения. Обычно ярко окрашен только самец и только он активен в демонстрационном поведении, однако в некоторых случаях особи обоих полов сходны и активны как те, так и другие. Помимо того что сексуальное демонстрационное поведение имеет сигнальную функцию,
Гл. 8. Значение окраски в природе
283
благодаря ему, по-видимому, ускоряется созревание гонад и готовность к спариванию, а также увеличивается плодовитость. Развитие сексуально-демонстрационной окраски, как правило, является сезонным и, вероятно, находится под гормональным контролем.
Часто сексуально-демонстрационная окраска вынуждена вступать в компромисс с требованиями маскировки. Яркие цвета и вызывающий характер их распределения необходимы животному только в период ухаживания или во время угрожающего поведения по отношению к сопернику, в остальное же время они должны быть замаскированы.
Использование привлекающей окраски и характера ее распределения в несексуальных целях менее обычно, однако в некоторых случаях с ее помощью привлекается добыча. Некоторые глубоководные рыбы, например удильщики, обычно хорошо маскирующиеся, имеют ярко окрашенную и часто светящуюся «приманку» для привлечения добычи. Сходной цели служат и щупальца актиний.
Псевдосематическая окраска. Псевдосематическая окраска имитирует предупреждающую (сематическую) окраску другого вида. В большинстве случаев встречается псевдоотпугивающая окраска, ведущая к тому, что особи безвредного и «вкусного» вида не атакуются и не поедаются потому, что они внешне напоминают особей неродственного опасного или «невкусного» вида. Например, многие журчалки приобрели осоподобную желто-черную окраску, а некоторые тараканы точно имитируют божьих коровок.
8.3. Пигментные клетки животных — хроматофоры
Во внешних покровах животных, особенно беспозвоночных и пойкилотермных (холоднокровных) позвоночных, пигменты локализованы в специальных клетках. В наиболее ценной монографии о пигментных клетках животных и изменениях окраски последних (Bagnara, Hadley, 1973) для описания этих окрашенных клеток рекомендуется использовать термин «хромато-фор». Такая номенклатура будет принята и в настоящей книге, несмотря на то, что другие авторы используют и альтернативные термины, например «хроматоциты». Различают несколько видов хроматофоров, в первую очередь по цвету, за который они ответственны.
8.3.1. Меланофоры
Черные пигментные клетки, содержащие меланин (гл. 7), известны как меланофоры, правда, в случае млекопитающих и птиц такие клетки чаще называют меланоцитами. У позвоноч
284
Часть 11. Функциональные аспекты
ных существуют по крайней мере два типа меланофорных клеток, которые отличаются по локализации, внешнему виду и реакции на гормоны. Почти у всех пойкилотермных животных чаще всего встречаются дермальные меланофоры — очень крупные клетки до 0,5 мм в диаметре, участвующие в быстрых изменениях окраски. Эпидермальные меланофоры в отличие от дермальных в быстрых изменениях окраски играют незначительную роль. Они представляют собой тонкие удлиненные клетки, которые обычны для рептилий и амфибий, но редко встречаются у рыб. Сходные эпидермальные клетки (меланоциты) обусловливают окрашивание кожи меланином у млекопитающих, а также пигментацию меланинами, в том числе и феоме-ланином, волос и перьев.
Фундаментальным свойством всех меланофоров является их способность синтезировать свой меланиновый пигмент. По крайней мере у позвоночных, синтез меланина внутри меланофора включает отложение меланиновых полимеров на матриксе скрученных в спираль белковых нитей. Такой матрикс называется’ премеланосомой. Премеланосома содержит фермент тирозиназу (полифенолоксидазу), которая и катализирует синтез меланина (гл. 7). Сформировавшиеся субклеточные органеллы называют меланосомами, или меланиновыми гранулами, причем агрегация и распределение этих частиц играют большую роль при изменении окраски животных (разд. 8.4.2).
Судя по немногочисленным исследованиям меланинсодержа-щих клеток и органелл у беспозвоночных животных, они, по-видимому, напоминают аналогичные клетки и органеллы позвоночных.
8.3.2. Ксантофоры и эритрофоры
Меланофоры обычно окрашены в черный цвет, хотя некоторые из них, содержащие феомеланин, могут иметь желтую или оранжево-красную окраску. Большинство желтых, оранжевых и красных клеток наружных покровов принадлежат к разным типам клеток, известным как ксантофоры (желтые) или эритрофоры (красные). Преобладающие пигменты в этих клетках— каротиноиды (гл. 2), содержащиеся в липидных каплях или в виде каротиноидных пузырьков. Яркую окраску многим пойкилотермным позвоночным, таким, как лягушки и жабы, придают птерины (гл. 6), как сами по себе, так и в комбинации с каротиноидами. Птерины локализованы в специализированных небольших органеллах, называемых птериносомами, которые распределены по всей цитоплазме. Даже у видов, которые окрашены главным образом каротиноидами, в развивающихся ксан-тофорах и эритрофорах сначала синтезируются и становятся
Гл 8 Значение окраски в природе
285,
видимыми птерины, тогда как каротиноиды, которые должны быть получены из пищи, выявляются лишь позднее.
Птериновые пигменты глаз Drosophila локализованы в органеллах, удивительно сходных с птериносомами позвоночных.
8.3.3. Иридофоры
У беспозвоночных и пойкилотермных позвоночных очень распространены иридофоры (иногда их называют гуано-форами), представляющие собой клетки наружных покровов. Несмотря на то что иридофоры не являются в прямом смысле пигментсодержащими клетками, подобными меланофорам, ксантофорам и эритрофорам, они тем не менее играют важную роль в формировании окраски и внешнего вида животных. Иридофоры содержат органеллы, которые ориентированы таким образом, что эффективно отражают свет, и таким путем формируют основу многих радужных, или «металлических», цветов структурного происхождения. Главными «пигментами» иридо-форов служат пурины — чаще всего гуанин (гл. 6), —которые имеют белую окраску или вообще бесцветны, но, будучи организованы в виде пачек или бляшек, отражают все или некоторые лучи видимого света и таким образом в большинстве случаев обусловливают серебристый и золотистый металлический блеск, хорошо известный на примере чешуи рыб.
8.3.4. Ассоциации хроматофорных клеток
Функциональная единица хроматофоров дермы. В дермальном слое кожи позвоночных, которые могут быстро и полностью изменять свою окраску, обычно присутствуют хроматофо-ры трех типов, причем они имеют специфическую локализацию. Ксантофоры (или эритрофоры) расположены сверху, иридофоры— непосредственно под ними, а дермальные меланофоры формируют базальный слой. Как правило, число клеток этих трех типов различно. Такая ассоциация клеток трех типов (рис. 8.1) составляет функциональную единицу хроматофоров дермы, благодаря которой и обеспечиваются быстрые изменения окраски. Поглощающие свет меланофоры и отражающие свет иридофоры ответственны за темные и светлые участки соответственно, в то время как ксантофорам и эритрофорам отводится главным образом роль желтого фильтра. Иридофоры могут также участвовать в формировании структурной голубой окраски. Быстрые изменения окраски осуществляются благодаря изменениям вклада, вносимого в ее формирование клетками разных типов, составляющими функциональную единицу (разд. 8.4).
286
Часть 11 Функциональные аспекты
Эпидермальная меланиновая единица. Эпидермальные меланофоры позвоночных определяют цвет наружных покровов в ассоциации с другими клетками. Меланиновый пигмент переносится из места его образования — меланофора — в соседнюю или окружающие его клетки. В целом все меланизированные клетки можно рассматривать как эпидермальную меланиновую единицу. Способность клеток переносить пигменты особенно .важна для млекопитающих и птиц, поскольку она позволяет
Фис. 81. Схематическое изображение функциональной единицы хроматофо ров дермы.
меланинам транспортироваться из собственно меланофоров в эпидермальные клетки (из которых образуются специализированные структуры — волосы, перья и клюв) и откладываться там.
8.3.5. Эмбриональное развитие хроматофоров
Развитие пигментсодержащих клеток и характер образования пигментов у позвоночных подробно изучены Местом образования хроматофоров у всех классов позвоночных является нервный гребень. Например, у земноводных здесь образуются все три основных типа пигментированных клеток — меланофоры, иридофоры и ксантофоры. Наряду с хроматофорами нервный гребень может давать начало клеткам многих других типов, однако факторы, определяющие тип образующихся клеток, пока не известны. Развитие клеток по пути именно хрома-тофора определяется очень рано, еще до образования нервного валика, и появление хроматофоров разных типов происходит в определенной последовательности. Вначале дифференцируются меланофоры дермы, а уже затем ксантофоры и иридофоры.
Гл 8 Значение окраски в природе 287
Эпидермальные меланофоры появляются сравнительно поздно, в некоторых случаях лишь незадолго до метаморфоза.
В ходе эмбриогенеза пигментные клетки должны перемещаться на большие расстояния от нервного гребня до наружных покровов, которым они придают окраску. Миграция хро-матобластов (развивающихся затем в хроматофоры) была продемонстрирована экспериментально на примере лягушки Rana pipiens В основном пигментные клетки перемещаются в форме хроматобластов, причем их перемещение происходит еще до того, как в них синтезируется большая часть пигмента. Вместе с тем наблюдали и некоторые ограниченные перемещения дифференцированных меланофоров.
Характер распределения окраски обусловлен миграцией хроматобластов в генетически предопределенные участки. Белые пятна у некоторых видов или альбиносных мутантов наблюдаются, как правило, потому, что хроматобласты не способны дифференцироваться в хроматофоры, хотя они и переместились в белые участки. Сходным образом у голубых мутантов или у нормальных зеленых лягушек ксантобласты (частично дифференцированные ксантофоры) локализованы в соответствующих им местах, однако они не способны образовывать желтый пигмент.
Природа пигментов, образуемых дифференцированными хроматофорами, генетически детерминирована, в то время как процесс дифференциации клеток и синтез пигмента могут регулироваться гормональными факторами.
8.4. Изменение окраски у животных
Некоторые животные сохраняют одну и ту же окраску и одно и то же ее распределение на протяжении всей своей жизни. За исключением незначительных модификаций (таких, как солнечный загар и потеря пигментов волос), это справедливо для человека и многих других млекопитающих. Единственный пигмент, который должен у них синтезироваться, — это пигмент, требующийся для возмещения потерь, связанных либо с износом и повреждением пигментированных тканей, либо с линькой.
У многих животных, однако, внешний вид меняется как на разных стадиях развития, так и в разное время года. Как правило, эти изменения (по крайней мере частично) связаны с изменениями окраски или характера ее распределения в наружных покровах. Есть также группа животных, в основном это беспозвоночные и пойкилотермные позвоночные, которые способны очень быстро изменять свою окраску и ее рисунок в ог-
288
Часть II. Функциональные аспекты
вет на стрессовые воздействия или изменения окружающей среды.
Эти изменения окраски обусловлены либо изменениями количества содержащегося пигмента в результате его синтеза или разрушения, либо изменениями эффективности, с которой проявляется его окраска.
8.4.1. Изменения окраски, обусловленные синтезом или разрушением пигмента
Такой тип изменения окраски называют по-разному — морфологическим, морфогенетическим или хромогенным. К нему принадлежат изменения (или перераспределение) окраски, связанные с линькой оперения или шерсти и заменой их соответственно перьями или волосами другого цвета. Сюда же относятся и сезонные изменения, связанные с маскировкой (например, белая окраска зимой) или с размножением (приобретение брачной окраски).
К этому же типу принадлежат и некоторые изменения окраски, обусловленные факторами окружающей среды. Обычным примером таких изменений служит адаптация к цвету поверхности. Так, у животных, которых содержат на темной поверхности, синтезируется больше меланина и образуется больше меланосом, тогда как у животных, оказавшихся на более светлой поверхности, наблюдается потеря меланина. Общее число пигментных клеток в коже адаптирующегося животного может увеличиваться или уменьшаться; при этом может происходить как пролиферация уже существующих меланофоров, так и меланизация еще недифференцированных меланобластов. Аналогичные изменения отмечены и для хроматофоров других типов. Так, у рыб светлая поверхность обусловливает усиление образования «пигмента» иридофоров гуанина и одновременно распад меланина и, наоборот, образование меланина, происходящее на темном фоне, сопровождается исчезновением гуанина. Желтый пигмент ксантофоров ведет себя так же, как и меланин, т. е. его синтез усиливается в ответ на потемнение фона.
8.4.2. Физиологические изменения окраски
Физиологические, или хромомоторные, изменения окраски обычно происходят значительно быстрее, чем в только что описанном случае, поскольку они не обусловлены синтезом или распадом пигментов. В этом случае мобилизация уже существующих пигментированных органелл внутри клетки определяет эффективность проявления различных пигментов и, следовательно, общую окраску, приобретаемую животным. Обыч
Гл. 8. Значение окраски в природе
289
но такие реакции протекают легко и обратимо. Они характерны для пресмыкающихся, земноводных, рыб и многих беспозвоночных, но не встречаются у млекопитающих или птиц.
Обычный механизм. У всех животных, за исключением головоногих и крылоногих моллюсков, изменения окраски происходят в результате перемещения пигментных органелл в хромато-форе (рис. 8.2). Например, в меланофорах меланиновые гра-
Меланофорные клетки
агрегированы
Светлый фон .Светлая окраска Меланиновые гранулы
Темный фон
Темная окраска
Меланиновые гранулы
Диспергированы-
Рис. 8.2. Обычный механизм физиологических изменений окраски (посвет-ление — потемнение) путем агрегации и диспергирования меланиновых гранул (меланосом) внутри меланофора.
нулы (или меланосомы) могут распределяться по периферии клетки, где они эффективно поглощают свет, обусловливая тем самым темную окраску, или же могут собираться в небольшом объеме в центре клетки, благодаря чему поглощается лишь незначительное количество падающего света. Таким образом, диспергирование и агрегация меланосом обеспечивает быстрое потемнение или посветление кожи. Функциональная единица хроматофоров дермы (разд. 8.3.4) содержит не только меланофоры, но также иридофоры и ксантофоры (или эритрофоры), в которых пигментные частицы или гранулы также могут быть диспергированы или собраны в одном месте, внося больший или меньший вклад в поглощение света и окраску. Благодаря этому животное может быстро и обратимо менять окраску в широком диапазоне цветов и довольно точно имитировать окраску поверхности, на фоне которой оно находится. Именно таким путем достигается то замечательное разнообразие окраски, которое характерно для хамелеона.
Механизм изменения окраски у головоногих. Головоногие моллюски, например кальмар и осьминог, а также некоторые крылоногие моллюски используют иной механизм изменения 19—84
290
Часть II Функциональные аспекты
окраски (рис. 8.3). Эти животные имеют структуры, представляющие собой крошечные органы, которые состоят из клеток пяти различных типов, включая центральный хромофор. Сокращение радиальных мышечных волокон вызывает растяжение хромофора (до размеров, в 7 раз превышающих исходный диаметр), что сопровождается рассредоточением его пигментных гранул. Хроматофоры могут быть темно-коричневыми, красными и желтыми [темные хроматофоры содержат оммохром (гл. 6), а не меланин], и окраска кожи в данный момент времени
А Б
Рис 8 3. Механизм физиологических изменений окраски у головоногих моллюсков А Светлая окраска Меланиновые гранулы агрегированы путем сжатия центрального хроматофора в небольшом объеме Б. Темная окраска. Меланиновые гранулы диспергированы в результате сокращения радиальных мышечных волокон, вызывающего сильное растяжение центрального хроматофора.
зависит от того, в какой степени расширены хроматофоры всех этих типов. У животных с такими хроматофорными органами изменения окраски происходят чрезвычайно быстро (менее чем за 1с).
8.4.3. Факторы, контролирующие изменения окраски
Все изменения окраски, связанные с приспособлением к цвету фона, независимо от того, происходит ли при этом изменение концентрации пигментов или используется механизм агрегации-диспергирования пигментных гранул, регулируются, по-видимому, одними и теми же факторами. Главным регулирующим фактором скорее всего служит альбедо, т. е. соотношение между количеством света, отраженного от фоновой поверхности, и интенсивностью прямого падающего света. На изменение окраски могут оказывать влияние и другие факторы окружающей среды. Так, низкие температуры или повышенная влажность часто приводят к усилению пигментации как путем синтеза (меланин, птерин, оммохром), так и посредством усиления
Гл 8 Значение окраски, в природе 291
поглощения, транспорта и отложения (экзогенные каротиноиды). У некоторых видов (водных и наземных) позвоночных и беспозвоночных обнаружено существование суточных ритмов изменения окраски.
Часто синтезу пигментов в ходе длительной адаптации к фоновой окраске предшествуют более быстрые физиологические изменения цвета, осуществляющиеся путем агрегации или диспергирования пигментных органелл; возможно, синтез пигментов является необходимым следствием таких изменений.
8.4.4. Механизмы регуляции изменения окраски
Изменения окраски обоих типов могут регулироваться гормональными механизмами или нервной системой. Гормон гипофиза, известный как меланоцитстимулирующий гормон (МСГ), или интермедин, регулирует синтез меланина и диспергирование меланосом. МСГ оказывает влияние и на более ярко-окрашенные пигментные клетки — иридофоры, ксантофоры и эритрофоры. МСГ представляет собой пептид, аминокислотный состав которого у разных видов животных несколько различается. Все к настоящему времени охарактеризованные образцы
(8 1 ) Мелатонин
(8 2) Адреналин (R-CH3)
(8 3 ) Норадреналин (R = Н)
(8 4 ) Тироксин
19*
292
Часть II. Функциональные аспекты
МСГ позвоночных включают активный гептапептид: —Met— Glu—His—Phe—Arg—Trp—Gly—.
Другой гормон — мелатонин (8.1), секретируемый эпифизом, — регулирует реакцию на свет или альбедо у многих видов, ингибируя процесс потемнения. Адреналин (8.2) и норадреналин (8.3), действующие как нейрогормоны, и тироксин (8.4), действующий как инициатор морфологической дифференцировки, также могут влиять на пигментацию и изменение окраски. В качестве вторичного посредника в механизме действия МСГ и адреналина при изменении окраски у позвоночных, вероятно, участвует сАМР (3',5'-циклический аденозннмо-нофосфат). Большое значение для функционирования этих гормонов имеют тиоловые группы белков.
Считают, что физиологические изменения окраски у ракообразных опосредованы несколькими гормонами. Различают отдельные гормоны, вызывающие диспергирование или концентрирование красного, черного и белого пигментов. Они, по-видимому, являются пептидами и синтезируются в глазных стебельках, где локализованы фоторецепторные пигменты, улавливающие изменение фоновой окраски.
Изучение биохимии гормонов, участвующих в механизмах окраски у животных, только начинается.
8.5. Окраска у растений
Представители растительного царства окрашены преимущественно в зеленый цвет. Зеленый цвет, во всем своем разнообразии оттенков, услаждает глаз человека, но можно не сомневаться, что и он стал бы монотонным, если бы зеленый фон не оживлялся всплесками других ярких и контрастных цветов. Ярко окрашенные цветки и плоды невольно притягивают глаз. Однако значение их окраски, по-видимому, не только в этом, но имеет гораздо более фундаментальную основу. Зеленая окраска растений и хлорофилл, который ее обусловливает, играют чрезвычайно важную роль в процессе фотосинтеза, поддерживающего существование любого растения. Значение же контрастирующей окраски цветков и плодов заключается в том, что она облегчает распространение и выживание вида.
Цветки привлекают внимание не только человека, но и многих других более мелких животных, которые оказывают растениям огромную услугу, выполняя роль переносчиков пыльцы. Пчелы, вероятно, в этом отношении изучены лучше, чем любые другие переносящие пыльцу животные. Пчелы способны различать четыре основных «цвета», включая ультрафиолет в диапазоне 340—380 нм. Свет красных длин волн они не видят, предпочитая синие, желтые или поглощающие в УФ-свете (белые)
Гл. 8. Значение окраски в природе
293
цветки. Другие животные, служащие переносчиками пыльцы, имеют иные цветковые «привязанности». Колибри, например, являющиеся важными опылителями в тропиках, предпочитают красные и оранжевые цвета. Некоторые опылители проявляют предпочтение к палевой окраске; ночные бабочки, жуки и (иногда) летучие мыши больше любят белые (ультрафиолетовые), а дневные бабочки —не очень яркие цвета, такие, как розовый или розовато-лиловый.
Яркая, бросающаяся в глаза окраска плодов привлекает питающихся плодами животных, в первую очередь птиц, которые потом разносят неперевариваемые семена на очень большие расстояния.
По-видимому, эволюция у растений была направлена на отбор пигментов, придающих цветкам и плодам окраску, которая привлекала бы животных — главных опылителей и разносчиков семян. Так, виды растений, опыляемые преимущественно пчелами, содержат в цветках бесцветные флавоноиды или синие антоцианы, в то время как тропические виды, опыляемые главным образом колибри, имеют красные цветки, содержащие красные антоцианы.
Необходимо подчеркнуть важную роль в качестве пигментов растений веществ, обладающих сильным поглощением в ближнем ультрафиолете. В отличие от глаз человека глаза многих других животных, преимущественно насекомых, чувствительны к УФ-свету и, следовательно, видят соединения, поглощающие его.
Вещества, поглощающие видимый и УФ-свет, имеют значение при формировании «рисунка» цветков. В ходе эволюции выработалось несколько очень сложных типов рисунков, многие из которых приспособлены к особенностям насекомых-опылителей. Так, многие цветки, например у наперстянки (Digitalis purpurea), имеют «медовые линии» или подобные им метки, которые указывают пчелам и другим насекомым путь к нектару. С этой же целью могут использоваться и высокие концентрации УФ-по-глощающего «пигмента», особенно в основаниях лепестков. Интенсивное УФ-поглощение служит для насекомых указателем их цели — центра цветка, содержащего нектар и пыльцу. Рисунок цветка формируется благодаря как локальному усилению образования пигмента в определенных участках лепестков, так и наложению второго пигмента на главный. Формирование рисунка цветков находится под строгим и сложным генетическим контролем.
Окраску и рисунок почти у всех цветков обусловливают две группы пигментов — каротиноиды (гл. 2) и флавоноиды (гл. 4). Красная, пурпурная и синяя окраска практически всегда обусловлена антоцианами. Белые и кремовые цветки содержат
294
Часть II. Функциональные аспекты
большое количество флавонов и флавонолов, которые являются УФ-поглощающими пигментами, видимыми для насекомых. Желтая или оранжевая окраска обычно вызвана каротиноидами, но в некоторых случаях, целиком или частично, она обусловлена флавоноидами классов халконов и ауронов, или же бетаксантинами (гл. 6). Смеси водорастворимых флавоноидных пигментов, например желтого и красного, дают, как и следовало ожидать, оранжевый цвет. Вместе с тем сочетание пурпурного водорастворимого антоциана и желтого липофильного каротиноида создает обычно коричневую окраску, например у цветков лакфиоли (Cheiranthus cheiril}.
Окраска плодов, особенно красная, пурпурная и синяя, обычно обусловлена антоцианами, хотя в некоторых случаях (например, у томата и апельсина) она имеет каротиноидную природу.
Растительные пигменты как бы оповещают животных о наличии цветка или плода. Цель такого оповещения почти всегда заключается в привлечении полезных животных, а не в предупреждении неблагоприятного воздействия. Таким образом, у растений роль окраски, обусловленной пигментами, значительно более проста, чем у животных. Однако имеется несколько отдельных случаев, в которых экологические факторы могут быть чрезвычайно сложными.
8.6. Заключение и комментарии
Окраска и характер ее распределения, особенно у животных, имеют большое значение в поведенческом и экологическом аспектах, однако они могут оказаться малоинтересными в аспекте биохимическом, если не считать, конечно, идентификации участвующих в их образовании пигментов. Вместе с тем существует ряд биохимических вопросов, достойных внимания, которые все еще остаются без ответа. Особый интерес вызывают вопросы, касающиеся механизмов регуляции синтеза пигментов и отложения их в тканях, а также изменения окраски. В качестве примера можно назвать механизмы, с помощью которых факторы окружающей среды (такие, как свет и температура), вероятно, при участии гормонов вызывают быстрые или медленные изменения окраски, или пути, по которым реализуется генетический контроль распределения окраски. В настоящее время биохимические аспекты этих явлений еще чрезвычайно трудны для изучения, но они несомненно привлекут значительно большее внимание исследователей в ближайшем будущем.
В растительном царстве синтез пигментов является лишь частью грандиозных морфологических изменений, которые происходят по мере развития и созревания цветков и плодов,
Гл. 8. Значение окраски в природе
295
а также частью трансформации хлоропластов в хромопласта, сопровождающей эти изменения. Механизмы регуляции и контроля происходящего при этом синтеза пигментов — увлекательная область исследования для биохимика.
8.7. Рекомендуемая литература
Много примеров, иллюстрирующих значение окраски и характера ее распределения у представителей животного царства, приведены в книгах общего характера (Broughton, 1964; Fox, 1976, 1979; Fox, Vevers, 1960; Needham, 1974). Эта же тема более подробно и широко обсуждается в сохраняющей свое значение работе Котта (Cott, 1940). Пигментным клеткам животных и измерениям окраски посвящено много книг и статей. Среди них монографии Бэгнэра и Хэдли (Bagnara, Hadley, 1973), в которой приводится чрезвычайно полезное общее описание данной области исследования, и более специальные публикации Делла Порта и Мюльбока (Della Porta, Miihlbock, 1966) о меланоцитах, Фингермана (Fingerman, 1970) о хрома-тофорах, а также Новалеса (Novales, 1969) и Рили (Riley, 1972) о регуляции изменений окраски, дополняющих более старую книгу Паркера (Parker, 1948). В еще более специальном труде Сирла (Searle, 1968) приведен обзор генетических данных по окраске покровов тела у млекопитающих.
Общий обзор значения окраски у растений опубликован Харборном (Harborne, 1976). Много интересной информации об экологическом значении окраски цветков и опылении можно извлечь из книги Фэгри и Ван-дер-Пила (Faegri, Van der Pijl, 1971).
8.8. Дополнительная литература
Bagnara J. T., Hadley M. E. (1973). Chromatophores and color change: the comparative physiology of animal pigmentation, Englewood Cliffs, New Jersey, Prentice-Hall.
Broughton W. B. (ed.) (1964). Colour and life, London, Institute of Biology. Cott H. B. (1940). Adaptive coloration in animals, London and New York, Oxford University Press.
Della Porta G., Miihlbock 0. (eds.) (1966). Structure and control of the melanocyte, New York, Springer-Verlag.
Faegri K.., Van der Pijl L. (1971). The principles of pollination ecology, 2nd edition, Oxford, Pergamon.
Fingerman M. (1970). Comparative physiology: chromatiphores, Ann. Rev. Physiol , 32, 345
Fox D. L. (1976). Animal biochromes and structural colors, 2nd edition, Berkeley, Los Angeles and London, University of California Press.
Fox D. L. (1979). Biochromy: natural coloration of living things, Berkeley, Los Angeles and London: University of California Press.
296 Часть II. Функциональные аспекты
Fox Н. М., Vevers G. (1960). The nature of animal colours, London, Sidgwick and Jackson
Harborne I B. (1976). Functions of flavonoids in plants. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed T. W. Goodwin, p. 736. London, New York and San Francisco, Academic Press.
Needham A. E. (1974). The significance of zoochromes, Berlin, Heidelberg and New York, Springer-Verlag.
Novales R R. (ed ) (1969). Cellular aspects of the control of color changes, Amer. Zool, 9, 427.
Parker G. H. (1948). Animal color changes and their neurohumors, Cambridge University Press.
Riley V. (ed ) (1972). Pigmentation: its genesis and control, New York, Apple-ton-Century-Crofts
Searle A. G (1968). Comparative genetics of coat colour in mammals, New York, Academic Press.
Глава 9
Пигменты и зрение
9.1. Введение
Первая часть этой книги посвящена биохимии природных пигментов различных классов, которые придают окраску содержащим их тканям. Далее (в гл. 8) подчеркивалась важность свойства быть окрашенным как для выживания индивида, так и для распространения вида. Ясно, что все это имеет значение лишь в том случае, если окраску и характер ее распределения могут увидеть и распознать различные животные. Другими словами, животные должны обладать способностью обнаруживать свет, а также различать свет разных длин волн. С этой целью у них развились фоторецепторные органы — глаза, в которых центральную роль играют поглощающие свет фоторецепторы, или зрительные пигменты. В дополнение к собственно фоторецепторным пигментам часто используются другие пигменты, играющие вспомогательную роль. В связи с этим в книге о природных пигментах нельзя не остановиться на процессах фоторецепции и зрения. И не только потому, что фоторецепторные молекулы интересны сами по себе, но также и потому, что большинство других природных пигментов были бы не нужны и никогда ие появились, если бы такого механизма различения цветов не существовало.
9.2. Глаз
Большинство живых организмов способны реагировать на свет, потому что они обладают какими-либо фоторецепторными клетками, органеллами или молекулами. Но лишь в животном царстве эта способность реагировать на свет используется наиболее эффективно в процессе зрения. Термин «зрение» означает не просто обнаружение света, но также восприятие положения, формы и перемещения в пространстве объекта, а во многих случаях и различение цветов. Для истинного зрения необходим аппарат, с помощью которого в рецепторных клетках происходило бы формирование истинного изображения; для этого и развились фоторецепторные органы, или глаза. Существуют два основных типа глаз; глаза одного типа свойственны позвоночным, а другого — некоторым беспозвоночным.
Сосудистая оболочка
Радужная оболочка
Роговица
.Ресничные мышцы
Стекловидное тело
Желтое пятно
Хрусталик /
/ Сетчатка
Центральная ямка
Зрительный нерв
Рис, 9.1. Глаз позвоночных. Схематически показаны структурные особенности типичного глаза позвоночных (например, человека).
Стекловидное тело
Свет из хрусталика
Ри^. 9.?. Схематическое изображение структуры сетчатки позвоночных (масштаб не соблюдается).
Гл 9 Пигменты и зрение
299
9.2.1. Глаз позвоночных
Глаз позвоночных (рис. 9.1) представляет собой преломляющий орган с одной большой линзой — хрусталиком. Свет попадает в глаз через роговицу и радужную оболочку и фокусируется хрусталиком на чувствительной поверхности — сетчатке. Наиболее чувствительная область сетчатки, находящаяся точно в фокусе, называется центральной ямкой; она может быть защищена пигментированным экранирующим слоем — желтым пятном.
Пигментный эпителий/
Наружная пограничная
сосудистая обогочка
мембраны и пигменты
Рис. 9 3. Схематическое изображение фоторецептора позвоночных
(палочки).
Структура фоточувствительной сетчатки более подробно показана на рис. 9.2. Сетчатка содержит ряд плотноупакованных фоторецепторных клеток; свет достигает их, пройдя через сеть нервных клеток. Сетчатка включает рецепторные клетки двух типов — палочки, которые в сетчатке человека имеют размер ~28 мкм в длину и 1,5 мкм в диаметре, и суживающиеся к концу более короткие колбочки. Некоторые животные имеют палочки нескольких типов; существуют и двойные колбочки. Число фоторецепторных клеток в сетчатке огромно. Так, например, число палочек в сетчатке глаза крысы оценивается по крайней мере в 15 миллионов.
Фоторецепторные молекулы (или зрительные пигменты) локализованы в наружных сегментах рецепторных клеток (рис. 9.3), соприкасающихся с пигментным эпителием. Последний содержит гранулы пигмента, поглощающие рассеянный свет, и у некоторых видов отражающий слой — зеркальце (tapetum). Пигментный эпителий непосредственно участвует в регенерации зрительных пигментов (разд. 9.4,3). Оси рецепторных клеток направлены в сторону хрусталика, благодаря чему достигается
300
Часть II. Функциональные аспекты
максимум поглощения света. Зрительные пигменты локализованы в стопках мембранных дисков (разд. 9.2.3), расположенных перпендикулярно оси клетки.
9.2.2. Глаз беспозвоночных
У беспозвоночных наблюдается большое разнообразие типов глаз. Их глаза сильно отличаются от глаз позвоночных. Главные свойства глаз беспозвоночных хорошо выявляются на примере сложных глаз членистоногих (рис. 9.4). Глаза членис
Свет
Рис. 9.4. Сложный глаз беспозвоночных. Схема, иллюстрирующая свойства фасеточного глаза членистоногих.
тоногих состоят из большого числа (до ~ 10 000) крошечных отдельных фоторецепторных единиц, называемых омматидиями (или фасетками). Каждый омматидий (рис. 9.5,Л) содержит собственный хрусталик, фокусирующий часть поля зрения на связанные с ним рецепторы. Свет проходит через хрусталик в кристаллический конус, который направляет свет в трубчатые ретикулярные клетки (клетки сетчатки), формирующие структуру рецептора. В сердцевине омматидия расположенные рядом концы ретикулярных клеток образуют рецепторную структуру— рабдом — которая содержит зрительный пигмент и является, таким образом, аналогом наружного слоя сетчатки позвоночных. В одном и том же омматидии могут содержаться зрительные пигменты, имеющие разные максимумы поглощения света. Несущие пигмент мембраны формируются не в располо-
Гл. 9. Пигменты и зрение
30 J
женных стопками плоских слоях, как это имеет место в глазах позвоночных, а в плотноупакованных трубочках, называемых микроворсинками. Часто микроворсинки присутствуют в виде двух перпендикулярных друг другу структур, благодаря которым глаз способен различать по-разному поляризованный свет (рис. 9.5, Б).
А ’
Хрусталик
Базальная мембрана
Пучок пигментных клеток
Свет
Б
Кристаллический конус
Ретикулярные клетки
Микро ворсинки
Пучок пигментных клеток
Ретикулярные клетки
Рис. 9.5. А. Схема, иллюстрирующая главные структурные особенности омматидия. Б. Сечение, показывающее взаимно перпендикулярное расположение микроворсинок в соседних рабдомах.
Рабдом
Ретикулярные клетки, объединенные в пучки, содержат гранулы экранирующего пигмента. При ярком освещении эти гранулы могут перемещаться в омматидий, ограничивая таким образом количество света, которое может достигать рецепторов. Длинные тонкие клетки, расположенные по периферии омматидия, содержат дополнительный экранирующий пигмент, который предотвращает проникновение отклонившегося света в другие омматидии.
Глаз головоногих моллюсков. Глаз некоторых головоногих моллюсков, таких, как осьминог или кальмар, скорее напоминает глаз позвоночных, чем сложные глаза, обычно встречающиеся у беспозвоночных. В общем он проявляет свойства глаза того и другого типа, но в действительности представляет собой рабдомерный глаз особого типа (рис. 9.6). Хотя он, так же как и глаз позвоночных, имеет один большой хрусталик, формирующий изображение на рецепторном слое, его рецепторный слой состоит из рабдомов, которые повернуты «лицевой стороной» к свету и выстланы нервной тканью.
302
Часть II. Функциональные аспекты
9.2.3. Локализация зрительных пигментов в рецепторных мембранах
Структура и расположение мембран наружного сегмента палочек (рис. 9.3) и локализация зрительных пигментов внутри этих структур в настоящее время хорошо известны, хотя в этом отношении были изучены лишь несколько видов животных. Гораздо меньше внимания уделялось рецепторным мембранам колбочек позвоночных и микроворсинкам сложных
Рис. 9.6. Некоторые структурные особенности глаза головоногих моллюсков.
глаз беспозвоночных. Однако, по-видимому, рецепторы всех типов построены в соответствии с одним основным принципом — принципом ориентирования молекул зрительных пигментов в упорядоченной структуре мембраны.
Наружные сегменты палочек сетчатки позвоночных интенсивно иследовались с помощью дифракции рентгеновских лучей, электронной микроскопии и других современных методов. В результате было показано, что они содержат стопки мембранных дисков (рис. 9.7). Эти диски представляют собой структуры, состоящие из двух слоев глобулярного белка (в основном это зрительный пигмент родопсин) и слоя липидов (главным образом фосфолипидов) между ними. Родопсин составляет большую долю (~85°/о) мембранного белка. Молекулы зрительного пигмента ориентированы в рецепторной мембране таким образом, что поглощение света, проходящего вдоль оси палочки, максимально. Была предложена модель, согласно которой молекулы зрительного пигмента могут латерально перемещаться в мембране и вращаться вокруг оси, перпендикулярной поверхности мембраны, причем любые другие перемещения исключены. По-
Гл. 9. Пигменты и зрение
303
Рис. 9 7. Структура фоторецепторных мембран наружного сегмента палочек позвоночных. А. Локализация мембранных дисков в виде стопки в наружном сегменте палочки. 5. Модель ультраструктуры мембранного диска.
лученные к настоящему времени данные подтверждают эту модель.
Измерения величин удельного поглощения показали, что концентрации пигментов в палочках, колбочках и мембранах у большого числа видов животных сходны между собой. Обычно получали величины порядка 108—109 молекул зрительного пигмента на сегмент или рабдом.
9.3. Зрительные пигменты
Внутри рецепторных мембран находится поглощающий свет фоточувствительный пигмент, который играет основную роль в первичном улавливании света. Обычно у животных имеется несколько зрительных пигментов (у человека, например, четыре); причем в палочках и колбочках обнаруживаются разные пигменты. Каждый индивидуальный зрительный пигмент характеризуется своей величиной Хтах. Эти величины для разных зрительных пигментов находятся в диапазоне между 345 и 620 нм, что обеспечивает максимальную чувствительность глаза к свету в этом диапазоне. Все известные зрительные пигменты (а их довольно много) имеют очень сходную структуру. Молекула любого пигмента представляет собой липопротеин, связанный с небольшим хромофором. Во всем животном царстве найдены лишь две очень сходные хромофорные группы. Небольшие различия в структуре и конформации липопротеинов (оп-синов) лежат в основе значительных вариаций величин ?.тах.
304 Часть II. Функциональные аспекты
9.3.1. Хромофор
Хромофорами зрительных пигментов служат ретинальдегид [(9.1), известный также как ретиналь или ретинен] и 3,4-дидегидроретинальдегид [(9.2), использована схема нумерации, принятая для каротиноидов]. Зрительные пигменты, включающие ретинальдегидный хромофор, встречаются почти у всех представителей животного царства, в то время как распространение 3,4-дидегидроретинальдегида ограничивается рядом пресноводных рыб и некоторыми видами земноводных. По этим хро-
мофорам различают два семейства зрительных пигментов — родопсины (содержащие ретинальдегид) и порфиропсины (содержащие дидегидроретинальдегид).
Если сравнить молекулы ретинальдегида и пигмента растений р-каротина [(9.3), гл. 2], то сразу бросается в глаза их структурное сходство. Животные не способны синтезировать ретинальдегид de novo и должны образовывать его из р-кароти-на и родственных ему каротиноидов, получаемых с пищей, или из витамина А [ретинола (9.4)]. В кишечнике млекопитающих фермент с оксигеназной активностью расщепляет p-каротин на две молекулы ретинальдегида (рис. 9.8). Ретинальдегид восстанавливается до ретинола и сохраняется в печени в виде сложных эфиров (главным образом пальмитинового). Для транспорта ретинола в сетчатку глаза используется специфический липопротеин —- ретинолсвязывающий белок. В сетчатке ретинол может превращаться в ретинальдегид и включаться в состав зрительных пигментов. Для образования родопсина необходим «стерически затрудненный» 11-ц«с-изомер ретинальдегида (9.5).
Гл. 9. Пигменты и зрение
305
КИШЕЧНИК
Ретинальдегид
Ретиниловые эфиры
Рис. 9.8. Схема образования ретинальдегида путем расщепления р-каротииаг ферментом с оксигеназной активностью из кишечника млекопитающих.
9.3.2. Белок
Белок, с которым связывается ретинальдегид, известен под названием опсина. Получить олеиновый белок, свободный от липидов и углеводов, довольно трудно. Это обстоятельство, а также нестабильность очищенного свободного белка затрудняет его изучение. Термин «опсин» иногда применяют ко всему
20—84
306
Часть II Функциональные аспекты
комплексу (белка, липидов и углеводов) в целом, а иногда лишь к его белковой части.
Все изученные к настоящему времени опсины, которые были выделены из сетчатки многих видов животных, представляют собой небольшие белки с мол. массой ~ 30 000—40 000. Для опсинов, выделенных из палочек некоторых видов животных, был определен аминокислотный состав (но не последовательность аминокислот). Углеводная часть комплекса, состоящая из одного (или нескольких) остатка глюкозамина и маннозы, прочно связана с аспарагиновым остатком молекулы белка. С белком ассоциировано также значительное количество липидов, главным образом фосфатидилхолин и фосфатидилэтаноламин. Вопрос о том, связаны ли эти фосфолипиды со зрительным пигментом, составляя часть его молекулы, или они просто являются загрязнениями, попавшими из липидной области рецепторной мембраны, остается открытым.
9.3.3. Связывание ретинальдегида с опсином
Почти все исследования по связыванию ретинальдегида .и опсина были проведены с родопсином, выделенным из палочек сетчатки позвоночных, главным образом на примере крупного рогатого скота. По-видимому, другие зрительные пигменты в основном сходны с этим родопсином. Необходимо рассмотреть два вида связывания — первичное связывание, с помощью которого ретинальдегид ковалентно присоединяется к функциональной группе опспна, и вторичное, обусловленное нековалентными взаимодействиями.
Ретинальдегид ковалентно связывается с белком путем образования шиффова основания (или альдимина) между его альдегидной группой и аминогруппой опсина. По общепринятому представлению в этом процессе участвует е-аминогруппа лизинового остатка (рис. 9.9). Однако имеются некоторые экспериментальные данные, свидетельствующие в пользу альтернативной гипотезы, согласно которой шиффово основание, по крайней мере на некоторых стадиях процесса зрения, может образовываться при участии аминогруппы этаноламинового остатка фос-•фатидилэтаноламина.
Чрезвычайно важны также нековалентные взаимодействия между ретинальдегидом и опсином, особенно взаимодействия между боковыми группами аминокислот и л-электронной системой полиена. Подобные взаимодействия определяют конформацию хромофора, а также вызывают поляризацию л-электрон-ной системы. Именно эти эффекты и обусловливают незначительные вариации величины Хтах у разных зрительных пигментов.
Гл. 9. Пигменты и зрение
307
С '
Nil [
H2N—(СНг)4—СН Опои»
Остаток лизина
Альдимин^или шиффово основание
Рис. 9.9. Ковалентное связывание 11-ч«с-ретинальдегида с опсином путем образования шиффова основания (или альдимина) с е-аминогруппой лизинового остатка.
Конформация, принимаемая опсином в результате различных нековалентных взаимодействий, позволяет связываться с ним лишь небольшому числу изомеров ретинальдегида и его аналогов. В природном родопсине с белком связан только 11-г|«с-ретинальдегид (по-видимому, может связываться также его искаженный 6-5-ч«с-изомер). Результаты, полученные с помощью резонансной рамановской спектроскопии и кругового дихроизма, свидетельствуют против считавшегося ранее вероятным связывания 12-$-ц«с-изомера (9.6). Полностью тра«с-ре-тинальдегид не связывается с опсином, и изомеризация связанного 11-цис-ретинальдегида в полностью транс-изомер в процессе зрительного цикла (разд. 9.4) приводит к отщеплению ретинальдегида от опсина.
9.3.4. Свойства
Стабильность. Хранящиеся в темноте экстракты зрительных пигментов очень стабильны. Опсин, освобожденный из пигментного комплекса, гораздо менее стабилен и легко разру
201
'308
Часть II. Функциональные аспекты
шается как in vitro, так и in vivo. Его стабильность восстанавливается после инкубации с 11-г|«с-ретинальдегидом. (При инкубации с 9-ч«с-ретинальдегидом также образуется стабильный, хотя и не встречающийся в природе комплекс — изородопсин.) Родопсин стабилен в широком диапазоне pH (~5—10), тогда
(9 6) Изогнутая 6-з-цис, 12-з-4/ис-конформация 11 Qt/c-ретинальдегида
как свободный опсин сохраняет нативность в значительно более узком диапазоне величин pH.
Поглощение света. Спектры поглощения света 11-цис-рети-нальдегида и родопсина из палочек сетчатки быка приведены на рис. 9.10. Для того чтобы объяснить, каким образом связывание с опсином вызывает столь значительный сдвиг максимума поглощения света, была проделана огромная работа; свободный 11-г|«с-ретинальдегид поглощает при ~375 нм, а зрительные пигменты — при значительно больших длинах волн, например бычий родопсин — при ~500 нм. Этот феномен нельзя объяснить лишь одним образованием шиффова основания, поскольку простые N-ретинилиденальдимины (9.7) поглощают в диапазоне 360—380 нм. При протонировании альдимина (9.8)
Гл 9 Пигменты и зрение
309
длина волны максимума поглощения увеличивается до 440— 450 нм, но это все еще меньше 500 нм —длины волны, при которой поглощает нативный родопсин. Сдвиг Zmax дальше в красную область, вероятно, обусловлен вторичными взаимодействиями между опсином и полиеновой цепью ретинальдегидного хромофора. В настоящее время считается вероятным, что в данном случае имеет место механизм, согласно которому поляризацию
Рис. 9.10. Спектры поглощения света 11-1{ис-ретинальдегидом (в гексане; /) и родопсином палочек быка (в водном растворе; II).
хромофора вызывают отрицательный заряд белка при С-13 и противоион у протонированного атома азота шиффова основания. Вариации этих взаимодействий главным образом и обусловливают различия максимумов поглощения зрительных пигментов. 3,4-Дидегидроретннальдегид поглощает при несколько большей длине волны (393 нм для 11-г|«с-изомера), чем ретинальдегид, а порфиропсин с дидегидроретинальдегидом в качестве хромофора поглощает при соответственно больших длинах волн, чем родопсин, содержащий ретинальдегид.
В УФ-части спектра зрительного пигмента обычно присутствуют также две полосы. у-Полоса с Zmax при 280 нм обусловлена ароматическими аминокислотами (тирозином и триптофаном) белка, в то время как имеющая низкую интенсивность p-полоса при 330 нм обычно рассматривается как «цис-полоса», обусловленная тем, что ретинальдегидные хромофоры имеют цпс-конфигурацию (ср. «цис-ппкп» каротиноидов; разд. 2.3.3). Имеются доказательства, что фотохимическая активность связана с p-полосой поглощения.
310 Часть 11. Функциональные аспекты
9.4. Функционирование зрительных пигментов;
циклы превращений
В сетчатке позвоночных палочки ответственны за ско-топическое, или «ночное», зрение, т. е. улавливание света низкой интенсивности. Это весьма чувствительный процесс, однако он не включает никакого механизма различения цветов и потому является монохроматическим или почти монохроматическим. При более высоких интенсивностях освещения имеет место фотопическое зрение, за которое ответственны колбочки. Последние содержат ряд зрительных пигментов (иногда называемых фотопсинами в отличие от скотопсинов палочек), которые максимально реагируют на свет разных длин волн, благодаря чему возможно различение цветов. К настоящему времени исследован лишь механизм скотопического зрения в палочках сетчатки позвоночных; однако выявленные главные особенности этого механизма свойственны и фотопическому зрению в колбочках, и зрительному процессу в глазах беспозвоночных. В связи с этим в данной книге будут подробно освещены функционирование родопсина и некоторые аспекты цветового зрения.
9.4.1. Обесцвечивание родопсина
Вопрос о том, что происходит, когда фотон света поглощается зрительным пигментом родопсином, весьма сложен и до сих пор до конца не выяснен. Экспериментальные исследования затруднены тем, что ряд стадий этого процесса протекает за очень короткое время (порядка миллисекунд-пикосекунд). В приведенном ниже описании суммированы некоторые современные взгляды на функционирование родопсина, однако по большинству проблем фотохимии нет единой точки зрения. После достаточно долгого пребывания в темноте сетчатка адаптируется к ней и молекулы зрительных пигментов находятся в полностью регенерированной форме (см. ниже), т. е. хромофор 11-цис-ретинальдегид связан с белком опсином в специфической в-з-цис, 12-х-тра«с-конформации. Молекулы пигментов в рецепторной мембране ведут себя как самостоятельные функциональные единицы. Попадающий в глаз свет падает на рецепторные клетки сетчатки и поглощается молекулами зрительного пигмента. Затем происходит обесцвечивание пурпурного зрительного пигмента в ходе серии изменений, которую мы все еще не в состоянии описать на молекулярном уровне. Вместе с тем в общих чертах стадии процесса уже выяснены (рис. 9.11).
Первым событием является поглощение фотона света 11-цис-ретинальдегидным хромофором родопсина. Это приводит к
Батородопсин (полностью транс)
Дальнейшие конформационные изменения
Депротонироваиие
Рис. 9.11. Молекулярные превращения в процессе обесцвечивания родопсина.
312
Часть II. Функциональные аспекты
Родопсин (Х1Пак498нм)
Гипсородопсин (430 нм)
Батородопсин (543 нм; первоначально назывался прелюмироДопсином)
Люмиродопсин (497 нм)
Метародопсин I (478 нм)
Метародопсин II (380 нм)
Метародопсин HI (465 нм) = Парародопсин
транс-К-Ретинилиденолсин (440 365 нм)
Н*
траяс-Ретинальдегид (370 нм) + Опсин
Рис. 9.12. Предполагаемая последовательность промежуточных продуктов при обесцвечивании родопсина.
электронному возбуждению, за которым следуют конформационные изменения и изомеризация до полностью трпнс-ретиналь-дегидной структуры. Последовательные изменения формы рети-нальдегидного хромофора сопровождаются рядом изменений конформации опсина. В результате по мере образования полностью транс-И-ретинилиденопсина специфические взаимодействия между полиеновой системой и белком постепенно сходят на нет и в конце концов исчезают. В комплексе белка с хромофором интактной остается только ковалентная непротониро-ванная альдиминовая связь, которая затем легко и необратимо, расщепляется с образованием свободного полностью транс-ре-тинальдегида и опсина.
Многие промежуточные продукты последовательности обесцвечивания родопсина были идентифицированы с помощью спектроскопических методов. Полученные результаты дают
Гл. 9. Пигменты и зрение
313
представление о происходящих превращениях (рис. 9.12). Однако пока не удалось установить соответствия между различными промежуточными продуктами, выявленными по характерным для них спектральным свойствам, и теми или иными конфигурациями и конформациями комплекса ретинальдегид — опсин.
Свет, по-видимому, необходим только для превращения родопсина в батородопсин, вероятно, лишь для образования очень короткоживущего (3 пс) промежуточного продукта—пребато-родопсина. В альтернативном пути или в ответвлении главного пути превращений принимает участие гипсородопсин. Последующие превращения могут протекать и в темноте. Веские доказательства, полученные с помощью резонансной рамановской спектроскопии и кругового дихроизма, указывают на то, что изомеризация 11-цис-хромофора в полностью транс-форму происходит в ходе фотоконверсии родопсина в батородопсин, вероятно, через стадию пребатородопсина (достаточно четко установлено наличие в батородопсине изогнутого 11-транс-хромофора). В последующих продуктах — люмиродопсине и метародопсине — ре-тинальдегидный хромофор, несомненно, содержится уже в полностью транс-форме, однако взаимодействия между полиеновой цепью и опсином еще в значительной степени сохраняются. Метародопсин I и все предшествующие промежуточные продукты являются, по-видимому, протонированными альдиминами. Депротонирование, сопровождающееся гипсохромным сдвигом, происходит на стадии превращения метародопсина I в метародопсин II. На этой же стадии происходит высвобождение нейромедиатора, инициируемое изменением конформации белка. Неожиданным и необъяснимым является батохромный сдвиг, происходящий при образовании парародопсина (или метародопсина III) из метародопсина II на пути N-ретинилиденопсину.
Совершенно очевидно, что для выяснения процесса обесцвечивания родопсина на молекулярном уровне необходимо затратить еще немалые усилия.
9.4.2. Нервный импульс
Поглощение света молекулой зрительного пигмента, приводящее к электронному возбуждению и последующим превращениям (результатом которых является обесцвечивание пигмента), тесно связано с возникновением нервного импульса, передаваемого в мозг. Исходное поглощение фотона света происходит практически мгновенно, в то время как последующие превращения молекул протекают в течение более длительного времени. Известно, что нервные импульсы возникают через несколько миллисекунд после поглощения света, и в настоящее
314
Часть II. Функциональные аспекты
время уже ясно, что генерация импульса происходит при переходе метародопсина I в метародопсин II. Мы не в состоянии пока ответить на вопросы, каким образом фотовозбуждение единственной молекулы пигмента может вызвать прохождение тока через синапс на отдаленном конце рецепторной клетки и как благодаря ничтожно малой энергии всего лишь одного фотона могут осуществляться значительные перемещения заряда, необходимые для генерации нервного импульса. Считают, что молекулы пигментов каким-то образом контролируют ионные каналы через внутренние мембраны рецепторных клеток. Фотовозбуждение молекулы пигмента вызывает изменение ее конфигурации или заряда. В результате этого открывается канал и возникает поток ионов, который вызывает поляризацию клетки и таким образом стимулирует синапс. Затем ионные насосы должны получить энергию для восстановления нормального распределения ионов. Такой механизм может объяснить необходимое усиление и быстроту реакции на относительно большом расстоянии.
9.4.3. Регенерация родопсина
Процесс фотообесцвечивания приводит к расщеплению родопсина на составляющие компоненты — опсин и ретинальдегид. Ретинальдегид, высвободившийся в виде полностью транс-изомера, прежде чем вновь связаться с опсином, должен превратиться в 11-циоформу. Однако такое превращение не простая изомеризация. Ряд возможных реакций, протекающих при этом, суммирован на рис. 9.13, причем все они проверены в эксперименте.
Ферментативное восстановление тдшноретинальдегида до траноретинола, катализируемое алкогольдегидрогеназой, происходит в рецепторной мембране, и для него необходим NADH. Ретинол транспортируется из рецепторной клетки в пигментный эпителий, где он может этерифицироваться жирными кислотами, главным образом пальмитиновой и стеариновой. Ретинол и ретиниловые эфиры, образовавшиеся из зрительных пигментов вместе с запасными, сохраняющимися в пигментном эпителии, образуют внутриклеточный фонд. Изомеризация ретинола, ретинальдегида и ретиниловых эфиров до цис-11-формы продемонстрирована в эксперименте. Расщепление циоретини-ловых эфиров (где происходит этот процесс, пока не известно) дает 11-циоретинол, который может быть снова окислен в рецепторе до альдегида. Полагают, что рекомбинация 11-цмс-ре-тинальдегида с опсином происходит спонтанно.
Разные виды животных могут использовать различные пути регенерации родопсина. Так, у крыс наибольшее значение име
Гл. 9. Пигменты и зрение
315
ет прямая реизомеризация полностью транс-ретинальдегида в 11-ццс-ретинальдегид, в то время как у крупного рогатого скота главным процессом считается более окружной путь — через ретинол и ретиниловые эфиры.
Регенерация родопсина через ретинол и ретиниловые эфиры протекает довольно медленно по сравнению с процессом фотообесцвечивания; она может занимать несколько минут. Поэтому данным путем родопсин способен синтезироваться в количест-
Полностью транс ретинальдегид ч • - 11 цмс ретинальдегид
Полностью транс ретинол
1Т цис ретинол
Эфиры полностью транс ретинола
Эфиры Т Т цис ретинола
Рис. 9.13. Возможные пути превращения полностью грамс-ретинальдегида в 11-цыс-ретинальдегид в процессе регенерации родопсина.
вах, достаточных для осуществления зрительного цикла лишь при низких интенсивностях света. При дневном свете, когда интенсивность освещения высока, родопсин будет оставаться практически полностью обесцвеченным, так как скорость его регенерации значительно ниже, чем скорость обесцвечивания. В отличие от этого фотопсины колбочек, которыми опосредовано дневное цветовое зрение, должны регенерироваться очень быстро, поскольку они постоянно функционируют при высоких интенсивностях света. Предполагают, что в данном случае действует механизм фоторегенерации, в котором изомеризация полностью транс-ретинальдегида катализируется светом.
Путь регенерации родопсина через фонды ретинола и рети-ниловых эфиров в пигментном эпителии обеспечивает эффективное обновление ретинальдегидной части всех зрительных пигментов палочек и колбочек. Потери ретинальдегида возмещаются из запасов в пигментном эпителии. Эти запасы в свою очередь по мере надобности восполняются путем транспорта рети
316
Часть II. Функциональные аспекты
нола и его эфиров из обширного фонда, сохраняющегося в печени. В экстремальных случаях недостатка витамина А (ретинола) запасы в печени истощаются, и, хотя снабжение сетчатки поддерживается до последней возможности, в конце концов может образоваться его дефицит. В результате организму не удается восполнять потери ретинальдегида и, следовательно, регенерировать зрительный пигмент. Наступает слепота, вначале обратимая, но при длительном дефиците ретинола переходящая в постоянную из-за денатурации опсина, нестабильного в свободном состоянии. Существует мнение, что морковь помогает видеть «в темноте» (т. е. при низких интенсивностях света); по-видимому, оно небезосновательно, поскольку морковь служит непревзойденным источником провитамина А-—(3-каротина и таким образом помогает предотвратить недостаточность витамина А и вызываемую этой недостаточностью слепоту.
Помимо родопсина были исследованы также синтез и обмен других компонентов рецепторной мембраны, а именно белка (опсина), фосфолипидов и углеводов.
9.4.4. Взаимопревращения ретинола
и 3,4-дидегидроретинола
У некоторых видов земноводных и рыб ретинол может превращаться в 3,4-дидегидроретинол (или наоборот), в результате чего пигмент в рецепторе изменяется с родопсина на пор-фиропсин. Опсин в рецепторе может соединяться с 11-цпс-изо-мером как ретинальдегида, так и 3,4-дидегидроретинальдегида, и, следовательно, тип образующегося зрительного пигмента зависит от того, какой хромофор присоединен к опсину. По-видимому, должны существовать механизмы, с помощью которых пигментный эпителий может осуществлять взаимопревращения этих двух ретинолов, а также выбирать «правильный» ретинол, необходимый в данном конкретном случае.
У других видов, в частности у пресноводных рыб, ретинол и 3,4-дидегидроретинол, по-видимому, образуются из разных каротиноидов. Например, предшественником ретинола служит р-каротин, в то время как 3,4-дидегидроретинол образуется из ксантофиллов, таких, как лютеин (9.9) и, возможно, астаксантин (9.10). Механизм этих превращений, и в первую очередь удаления кислородсодержащих заместителей в кольце, пока не установлен.
Замена синтеза порфиропсина на синтез родопсина (или наоборот) часто связана со стадиями развития животного. Например, взрослые амфибии обычно содержат исключительно (или преимущественно) родопсины, в то время как головастики используют порфиропсины. В других случаях, например у рыб.
Гл. 9. Пигменты и зрение
317
такие изменения могут иметь сезонный характер и зависеть от уровня освещенности или же они могут происходить в ответ на переход из соленой морской воды в пресноводную среду обитания.
9.4.5. Циклы превращений зрительных пигментов у беспозвоночных
Было показано, что зрительные пигменты многих беспозвоночных, главным образом ракообразных и головоногих моллюсков, сходны со зрительными пигментами позвоночных и
(9.10) Астаксантин
принадлежат к родопсиновому типу. В принципе те и другие имеют также сходные циклы превращений, однако в деталях последние различаются. Так, у беспозвоночных превращения,, вызываемые освещением, не приводят к высвобождению ретинальдегида и опсина, а заканчиваются на стадии метародопсина, в котором траноретинальдегид остается присоединенным к опсину. Метародопсин может находиться в протонированной (кислой, Хтах—500 нм) или в непротонированной (щелочной,. Агпах^380 нм) форме. Максимумы поглощения этих метародопсинов, например у кальмара, находятся при больших длинах волн, чем у соответствующих N-ретинилиденопсинов позвоночных, что указывает на сохранение взаимодействия между хромофорной группой и белком. Исследования с помощью кругового дихроизма показали, что белковые молекулы метародопсина и исходного родопсина почти не различаются по степени спирализации. Однако родопсин в отличие от метародопсина проявляет индуцированный круговой дихроизм, что указывает на изогнутость углеводородной цепи ретинальдегидного хромофора.
3 i 8 Часть II. Функциональные аспекты
Даже в том случае, когда в глазу содержатся несколько зрительных пигментов с различными величинами %тах, метародопсины, образующиеся из разных форм родопсинов, имеют очень сходные максимумы поглощения. По-видимому, в ходе образования метародопсина вторичные опсин-хромофорные взаимодействия, которые обусловливают различные светопоглощающие свойства зрительных пигментов, исчезают.
Результаты спектроскопических исследований, проведенных на глазах и на сетчатке многих видов беспозвоночных, позволяют предположить, что существует очень много механизмов фотообесцвечивания, которые пока не известны.
Фоторегенерация. У беспозвоночных регенерация зрительного пигмента из метародопсина в нормальных условиях осу-дцествляется с помощью механизма, принципиально отличающегося от соответствующего механизма позвоночных. Относительно стабильный метародопсин превращается непосредственно в исходный пигмент под действием света. Фоторегенерации подвергается как кислая, так и щелочная формы метародопсина. Промежуточный продукт процесса регенерации, названный «Рз8о», был обнаружен у некоторых видов кальмара и осьминога. Полагают, что этот продукт образуется, когда под действием •света транс-ретинальдегидный хромофор кислого метародопсп-на изомеризуется в 11-цис-форму. Затем в темноте быстро происходят небольшие конформационные изменения, которые необходимы для завершения вторичных хромофор-белковых взаимо-.действий родопсина.
В некоторых случаях регенерация может осуществляться и биохимическим путем, однако в нормальных условиях гораздо большее значение имеет фотоиндуцируемый процесс. По-видимому, у некоторых насекомых уровень зрительных пигментов .днем контролируется фоторегенерацией, а ночью для этой цели используется биохимическая регенерация.
Другой путь был описан для фоторегенерации родопсинов в глазах некоторых головоногих. В качестве фотокатализатора у них in vivo служит, по-видимому, ретинохром — второй фото-чувствительный пигмент, который локализован в слое, подстилающем рецепторы. Идентичность фотокатализатора и ретинохрома и механизм функционирования последнего пока не установлены.
‘9.5. Некоторые аспекты цветового зрения
Родопсин в палочках сетчатки представляет собой пигмент, обусловливающий зрение при низких интенсивностях света. Его максимум поглощения света находится примерно при •500 нм, но с его помощью глаз способен лишь обнаруживать
Гл. 9. Пигменты и зрение
319*
свет, но не способен различать цвета. У большинства позвоночных, в том числе и у человека, за цветовое зрение ответственны другие рецепторные клетки сетчатки — колбочки, и в них для этой цели используется другая группа зрительных пигментов — фотопсины.
9.5.1. Цветовое зрение у человека
По вполне понятным причинам наиболее подробно изучено цветовое зрение у человека. В данном случае это три-хроматический процесс, за который ответственны рецепторы трех цветов, чувствительные к разным частям видимого спектра. Эти цветовые рецепторы (колбочки) наиболее многочисленны в сетчатке, в области центральной ямки, которая в связи с этим наиболее цветочувствительна. Каждый из трех различных колбочковых рецепторов содержит свой зрительный пигмент, который и определяет его спектральную чувствительность. У человека эти три пигмента имеют значения А,тах при 440, 535 и 575 нм и, следовательно, чувствительны соответственно к синему, зеленому и красному свету. Различные формы цветовой слепоты у человека обычно обусловлены отсутствием одного или нескольких из этих рецепторных пигментов, поскольку человек теряет способность реагировать на свет, который поглощается этим пигментом. Например, человек, лишенный пигмента с Хтах = 575 нм (поглощающего красные лучи), видит только синие и зеленые цвета и не чувствителен к свету более длинных волн.
При низких интенсивностях света (например, при свете луны) человек не различает цвета, поскольку чувствительность, колбочек составляет лишь около одной тысячной светочувствительности палочек. Однако концентрация пигментов в колбочках и палочках почти одинакова, и фоточувствительность изолированного пигмента колбочек, по-видимому, не ниже чувствительности родопсина палочек.
В структурном отношении пигменты колбочек сходны с родопсином палочек и представляют собой комплексы 11-цис-ретинальдегидного хромофора с опсином. Различия в их максимумах поглощения света обусловлены различиями в конформации опсина и во вторичном связывании хромофора. Пигменты колбочек выделить гораздо труднее, чем родопсин палочек, и потому детали их структуры и промежуточные продукты соответствующих циклов превращения выяснены менее подробно. Полагают, что механизмы фотообесцвечивания, регенерации; пигмента и формирования нервного импульса, которые имеют место при колбочковом зрении, в принципе сходны с соответ
320
Часть 11. Функциональные аспекты
ствующими механизмами в фоторецепторах палочек, однако пока еще мало экспериментальных данных, подтверждающих это мнение.
'9.5.2. Цветовое зрение у животных
Отнюдь не все виды животных обладают механизмами, позволяющими различать цвета, и имеют колбочковые фоторецепторные пигменты; считается, что многие млекопитающие, в том числе крупный рогатый скот и овцы, цветовым зрением не обладают. Вместе с тем многие позвоночные и беспозвоночные способны видеть и различать цвета. Они используют ряд фоторецепторов, максимально чувствительных к свету разных длин волн, и, по-видимому, обладают трихроматической системой, подобной той, которая присуща человеческому глазу. Так, золотая рыбка (Carassius auratus) имеет колбочки трех типов и три зрительных пигмента с величинами Хтах при 455, 530 и 625 нм соответственно. У нее, как и у многих пресноводных рыб, пигменты представлены порфиропсинами, т. е. имеют в качестве хромофора 3,4-дидегидроретинальдегид.
У многих земноводных ситуация намного сложнее. Лягушки, как правило, имеют палочки двух типов, называемые «красными» и «зелеными» палочками, которые поглощают соответственно зеленые и синие лучи. Кроме того, они имеют колбочки разных типов, в том числе двойные колбочки, которые содержат два или три разных пигмента, чувствительные в разных участках спектра. У взрослых амфибий это родопсин с 11-цис-ретинальдегидом в качестве хромофора; у головастиков пигменты очень сходны с пигментами взрослых особей, но содержат 11-цнс-3,4-дидегидроретинальдегид (порфиропсины).
Цветовым зрением обладают и некоторые беспозвоночные животные. У пчел, например, имеются четыре пигмента с максимумами поглощения в диапазонах 300—340, 400—480, 480—500 и 500—650 нм. Пигмент с максимальной чувствительностью в диапазоне 300—340 нм позволяет насекомым видеть длинноволновые УФ-лучи как особый цвет. К сожалению, подробного изучения биохимии цветового зрения у насекомых не проводилось.
В прошлом для зрительных пигментов, которые были либо выделены из животных различных видов, либо просто обнаружены спектроскопически, часто использовались тривиальные названия. Так, пигменты, имевшие желтую, синюю или фиолетовую окраску, называли соответственно хризопсином, цианопсином и йодопсином, а термин родопсин применяли для красных и пурпурных пигментов независимо от их происхождения. Эта терминология неудобна, поскольку при ее использовании
Гл. 9. Пигменты и зрение
321
нельзя получить представления ни о структуре, ни о возможных взаимосвязях этих пигментов, выделенных из разных видов животных.
9.6. Вспомогательные пигменты в процессе зрения
9.6.1. Позвоночные
Меланины. Меланины содержатся в различных тканях глаза позвоночных. Сосудистая оболочка и пигментный эпителий, расположенные на задней стороне глаза, содержат меланиновые гранулы, использующиеся в качестве экранирующих пигментов, которые поглощают отклонившийся свет всех длин волн. Меланин, выделенный из сосудистой оболочки и пигментного эпителия некоторых млекопитающих, представляет собой индольный эумеланин (гл. 7), связанный с белком.
У многих млекопитающих, в том числе и у человека, меланины содержатся также в задней части радужной оболочки и формируют экран, который не позволяет видеть красный цвет крови в капиллярах. Этот красный цвет можно видеть в глазах животных-альбиносов, которые лишены меланинового слоя. Карие и желтые глаза окрашены меланиновыми гранулами стромы радужной оболочки, в то время как голубой цвет глаз у человека и у некоторых других животных обусловлен рассеянием света мельчайшими частицами белка или меланина в радужной оболочке. Меланин, содержащийся в радужной оболочке, в процессе зрения, вероятно, роли не играет.
Зеркальный слой (tapetum lucidum). В сетчатке некоторых животных, которые ведут преимущественно дневной образ жизни, но хорошо видят и в сумерках, под рецепторным слоем лежит отражающий слой. Этот слой у одних видов находится перед слоем пигментного эпителия, у других за ним, а у третьих является его частью. Функции такого отражающего слоя, или «зеркальца», заключаются в возвращении света, который не был поглощен фоторецептором при первом прохождении через сетчатку. Благодаря этому повышается чувствительность глаза. Зеркальный слой обычно состоит из упорядоченных кристаллов, которые действуют как 01ражатели и обусловливают сияние глаз. Обычно кристаллы состоят из птеридинов и пуринов, таких, как гуанин [(9.11), гл. 6]. У некоторых животных, например, у кошки, лемура, галаго, зеркальный слой имеет желтый цвет, поскольку он состоит из кристаллов рибофлавина (9.12). Это позволяет повысить чувствительность глаза к голубому цвету, так как рибофлавин поглощает синий и УФ-свет с длиной волны 450 нм и ниже и испускает его в виде 21—84
322
Часть !!. Функциональные аспекты
флуоресценции при 520 нм. Свет с длиной волны 520 нм более эффективно поглощается родопсином в рецепторах.
Желтое пятно (macula lutea). У человека и у других прима тов, ведущих дневной образ жизни, в центре сетчатки есть область высокой остроты зрения — область центральной ямки. Она в минимальной степени покрыта нервной тканью, а от стекловидного тела отделена желтым фильтрующим слоем, называемым «желтым пятном». По-видимому, его функцией является поглощение некоторой части синего света с длиной волны 450 нм. При этом селективно снижается чувствительность колбочковых рецепторов к синему свету, что способствует умень
(9 12) Рибофлавин
шению размывания изображения из-за коротковолновой хрома тической аберрации хрусталика. На основании спектра поглощения можно предположить, что пигмент желтого пятна человека является каротиноидом, однако точно он пока не охарактеризован.
Светофильтры из масляных капель. Прежде чем свет достигает фоторецепторной мембраны в сетчатке глаза, он должен пройти через внутренний сегмент рецепторной клетки. У некоторых пресмыкающихся и птиц эти сегменты содержат окрашенные масляные капли. Диаметр капель обычно такой же, как у фоточувствительных наружных сегментов, так что весь свет, прежде чем достигнуть зрительного пигмента, должен пройти через них. У цыплят в сетчатке содержатся рецепторные клетки шести типов, и масляные капли присутствуют в колбочках пяти типов. Идентифицированы красные, оранжевожелтые, лимонно-желтые и даже бесцветные, но поглощающие в УФ-свете масляные капли. Каждому из морфологических типов колбочек присущи свои капли.
Было обнаружено, что окрашенные масляные капли содержат в чрезвычайно высоких (почти 1 М) концентрациях свободные каротиноиды. У индейки в красных, желтых и почти бесцветных каплях идентифицированы соответственно астаксантин (9.10), лютеин (9.9) и галлоксантин — С27-апо-каротиноид [Ю'-апо-р-каротин-ЗДО'-диол (9.13)], по-видимому являющийся производным лютеина или зеаксантина (9.14).
Гл. 9. Пигменты и зрение
323
Интересно отметить, что каротин желтых капель с Хтах = = 440 нм, который ранее называли «сарциненом», оказался очень редким (63, 6zS)-e, е-каротином (9.15). Происхождение астаксантина, и особенно данной изомерной формы е-каротина, остается загадкой, поскольку эти пигменты, по всей вероятности, не содержатся в пище птиц (разд. 2.8.1).
(9 15) (6S 6 S) с, с К тотин
Каким бы ни было происхождение этих пигментов, ясно, что масляные капли в сетчатке глаза птиц улучшают различение цветов при цветовом зрении. Различным образом окрашенные капли поглощают свет разных длин волн, так что рецепторной мембраны достигает тоже свет разных длин волн, где он и поглощается зрительным пигментом. Благодаря этому обеспечивается механизм различения цветов, который позволяет сильно сузить диапазон длин волн света, достигающего рецептора, п надежно разделить диапазоны чувствительности разных рецепторных клеток.
Сходные окрашенные масляные капли содержатся в сетчатке глаз некоторых рептилий. Пигменты таких капель у различных видов черепах имеют спектры, типичные для каротиноидов, однако с химической точки зрения они пока не охарактеризованы. Считают, что в данном случае функционирует механизм различения цветов, сходный с механизмом, существующим У птиц.
211
324
Часть 11. Функциональные аспекты
9.6.2. Экранирующие пигменты глаз беспозвоночных
При схематическом описании сложных глаз беспозвоночных и омматидия (разд. 9.2.2) мы уже обращали внимание на присутствие в наружных зонах рецепторных единиц экранирующих пигментов. Неподвижные пигментированные области клеток, расположенных по периферии омматидия, образуют экран, который эффективно изолирует омматидий и не допускает проникновения рассеянного света в соседние омматидии. Рецепторные мембраны стимулирует только свет, направленный
(9 16) Ксантомматин
(9 17) Дрозоптерин
вдоль оси омматидия; весь остальной свет поглощается экрани-рующими пигментами. Это обеспечивает механизм, необходимый для очень точного распознавания внешнего вида и перемещения объектов. Другие экранирующие клетки содержат пигментные гранулы, которые па ярком свету могут рассредоточиваться и таким образом снижать интенсивность света, достигающего глубоко расположенных рецепторных пигментов. На слабом свету гранулы экранирующих пигментов агрегируют и располагаются так, что фоторецепторы могут стимулироваться светом, падающим практически под любым углом. При этом сильно возрастает чувствительность к свету, однако очертания п перемещение объекта не могут более различаться с достаточной точностью.
Экранирующими пигментами в гранулах служат меланины (гл. 7) или, в частности у членистоногих, оммохромы [например, ксантомматин (9.16), гл. 6] и птерины [например, дрозоптерин (9.17), гл. 6]. Птерины и оммохромы имеют характерные максимумы поглощения в видимом диапазоне н в какой-то степени играют роль цветных фильтров. Различия в окраске глаз (т. е. в оммохромовых и птериновых экранирующих пиг
Гл. 9. Пигменты и зрение
325
ментах) у мутантных штаммов Drosophila лежат в основе многих фундаментальных генетических исследований, которые были проведены с этой мушкой.
9.7. Заключение и комментарии
В животном царстве встречается много разных структур глаза, однако, насколько это известно, всем им присущи одни и те же механизмы зрения и сходные ретинальальдегид-белковые пигменты. Ряд усовершенствований основного механизма (например, наличие пигментов с различными величинами Хтах в качестве цветных фильтров) обеспечивает оптимальную эффективность зрения при слабом свете или различение цветов при обычном освещении, что необходимо животному в природных условиях обитания (например, на земле или в воде). Вызывает удивление поразительное сходство зрительных пигментов и циклов их превращения. Ретинальдегид-опсиновый комплекс представляется идеальным для целей улавливания света. Предполагают, что системы зрительных пигментов возникали совершенно независимо друг от друга по крайней мере трижды в ходе эволюции животного мира.
Поскольку современные биохимические и физико-химические методы развиваются очень быстро, можно ожидать, что вскоре накопится обширная информация о циклах превращений зрительных пигментов и их промежуточных продуктах, а также об опсин-хромофорных взаимодействиях, особенно для родопсина палочек. Пройдет, однако, еще немало времени, прежде чем станут известны все детали структуры некоторых короткоживущих промежуточных продуктов, что позволит оценить значение небольших изменений конформации, взаимодействий белок-— хромофор и особенностей поглощения света. Следует также выяснить механизм генерации нервного импульса в ответ на поглощение фотона зрительным пигментом. Даже после того как мы ответим на некоторые вопросы о функционировании родопсина у тех немногих видов, которые наиболее подробно изучены (человек, крыса, крупный рогатый скот), предстоит огромная работа по изучению биохимии цветового зрения у млекопитающих, а также зрительных пигментов и циклов их превращений у других животных.
9.8. Рекомендуемая литература
Зрение чрезвычайно важно для эффективного функционирования практически всех животных, в том числе и человека. Поэтому процесс зрения довольно подробно описан в учебниках по биохимии и физиологии. Число обзорных статей, посвя-22—84
326
Часть II. Функциональные аспекты
щенных широкому набору тем, связанных со зрением, огромно. Для исчерпывающего ознакомления со всеми аспектами зрения читателю следует рекомендовать серию томов, озаглавленную «Глаз», под редакцией Дэвсона (Davson, 1977). В частности, для биохимиков наиболее полезен один из томов — «Фотобиология зрения» (Knowles, Dartnall, 1977), который содержит обширный список ссылок на более ранние работы. В молекулярной биологии и биофизике зрения идеи быстро меняются, и нет ничего необычного в том, что здесь существует много противоречивых мнений. Различные теории, касающиеся процесса зрения, подробно обсуждаются в обзорной статье Отто-лени (Ottolenghi, 1980).
9.9. Дополнительная литература
Davson Н. (ed.) (1977). The eye, 2nd edition, 5 volumes, New York, London and San Francisco, Academic Press.
Knowles A., Dartnail H. J. A. (1977). The photobiology of vision (The eye, 2nd edition, ed. H. Davson, vol. 2B), New York, London and San Francisco, Academic Press.
Ottolenghi M. (1980). The photochemistry of rhodopsins, Adv. Photochem., 12, 97.
Глава 10
Фотосинтез
10.1. Введение
Фотосинтез — это процесс, с помощью которого зеленые растения, водоросли и некоторые бактерии способны переводить энергию солнечного света в химическую форму, доступную для биосинтеза клеточных компонентов. Полученная таким путем химическая энергия используется и запасается растениями и, кроме того, служит (через пищевые цепи) первичным источником энергии для нефотосинтезирующих организмов, в первую очередь для животных. Фотосинтез растений является также источником необходимого для жизни кислорода. Поэтому вся жизнь на нашей планете зависит от фотосинтеза.
В фотосинтезе высших растений и водорослей (рис. 10.1) энергия света поглощается и используется для расщепления молекул воды. Этот простой процесс (световая реакция) приводит к выделению кислорода и к образованию восстановительных эквивалентов, которые затем используются в последовательности темновых реакций для фиксации двуокиси углерода в доступной форме углеводов. Углеводы могут утилизироваться как энергетические запасы или как источник углерода для синтеза всех других молекул, в которых нуждается растение. В ходе фотосинтеза происходит образование АТР по сопряженному механизму фотофосфорилирования.
Как можно видеть из рис. 10.1, в расщеплении двух молекул воды участвуют четыре кванта (фотона) света; при этом выделяется одна молекула кислорода и образуются четыре восстановительных эквивалента. Еще четыре кванта обеспечивают энергией перенос этих четырех восстановительных эквивалентов с образованием в конечном итоге NADPH, который и используется вместе с АТР для восстановления молекулы СО2 и последующего образования углеводов. Таким образом, для восстановления одной молекулы СО2 и выделения одной молекулы О2 необходимо минимум восемь квантов (фотонов).
Некоторые зеленые и пурпурные бактерии, которые в норме живут в анаэробных условиях, например в иле и в стоячей воде, также фототрофны и способны восстанавливать СО2 до углеводов, правда, в ходе фотосинтеза О2 у них не выделяется. Эти бактерии не способны использовать энергию света для 22*
328
Часть II. Функциональные аспекты
расщепления воды; они используют другие доноры водорода (электрона) Н2А (рис. 10.2). Три главные группы фотосинтезирующих бактерий используют разные доноры электрона при фотосинтезе. Пурпурные несерные бактерии Rhodospirillaceae (прежде называвшиеся Athiorhodaceae), например Rhodospi-rillurn rubrum, в нормальных условиях утилизируют простые
А 2Н2О———О2+4Н++4е~
4Л v Б 4Н++ 4e“+2NADP+-----2NADPH
В 2NADPH+CO2 +2Н+ АТР » [СН2О] +2NADP++H2O
Рис. 10.1. Суммарный процесс фотосинтеза у растений. А, Б. Стадии, в которых используется энергия света, или световые реакции. В. Последующие темновые реакции фиксации углерода.
органические молекулы, в то время как зеленые серные бактерии (Chlorobiaceae, прежде называвшиеся Chlorobacteriaceae) например Chlorobium spp., как правило, используют неорганические серусодержащие соединения (например, H2S) или водород. Пурпурные серные бактерии, принадлежащие к Chromatia-сеае (прежде называвшиеся Thiorhodaceae), например Chrorna-tium spp., могут утилизировать как органические молекулы, так и неорганические серусодержащие соединения.
hv
СО2 + 2Н2А ---> [СН2О] + 2А + Н2О.
Рис. 10.2. Суммарный процесс бактериального фотосинтеза.
Детали синтеза углеводов и механизмов фотофосфорилирования лежат за пределами настоящей книги. Однако мы остановимся здесь на роли в этих процессах пигментов, поскольку они имеют фундаментальное значение в улавливании и утилизации энергии света. Светособирающая роль хлорофилла в фотосинтезе— вероятно, наиболее яркий пример специфических биологических фотофункций природного пигмента. Функционирование каротиноидов и фикобилинов в качестве вспомогательных пигментов также прямо связано с их светопоглощающими свойствами. Другие окрашенные молекулы, в том числе цитохромы и флавопротеины, участвуют в фотосинтезе как часть электронтранспортных систем; способность этих соединений поглощать видимый свет не имеет отношения к их функционированию. Ниже будут освещены вопросы о том, как поглощающие свет пигменты расположены в фотосинтетическом аппара
Гл. 10. Фотосинтез
329
те высших растений, водорослей и фотосинтезирующих бактерий и как эти пигменты функционируют в процессе утилизации энергии света.
10.2. Фотосинтетический аппарат эукариот: хлоропласты
10.2.1. Морфология хлоропластов
В фотосинтезирующих клетках активные пигменты расположены внутри ламеллярных мембран в виде функционально-организованных единиц. У фотосинтезирующих эукариот (высших растений и большинства водорослей) несущие пигмент мембраны заключены в специфических органеллах — хлоропластах. У высших растений морфологические различия между хлоропластами невелики, в то время как у водорослей форма и размеры хлоропластов значительно варьируют. Chlorella, например, имеет единственный чашевидный хлоропласт, тогда как хлоропласты некоторых видов Spirogyra представляют собой длинные, спирально закрученные образования, лежащие вдоль всей клетки.
Обобщенная структура хлоропласта высших растений показана на рис. 10.3,Л. Клетки листьев растений могут содержать несколько сотен таких хлоропластов — эллиптической или линзообразной формы — длиной около 3—10 мкм. Хлоропласт состоит из двойной наружной мембраны (или оболочки), заключающей в себе матрикс — строму, которая содержит внутренние фотосинтетические мебраны.
10.2.2. Оболочка хлоропласта
Оболочка хлоропласта представляет собой непрерывную двойную мембрану, которая функционирует как селективный барьер при транспорте метаболитов внутрь органеллы или из нее. Полагают, что внутренняя мембрана может играть некоторую роль в формировании новых внутренних ламелл. У некоторых видов растений к внутренней мембране оболочки хлоропласта прилегает протяженная система трубочек и пузырьков. Эта система, известная как периферический ретикулум, по-видимому, характерна для растений, обладающих Сгпутем фиксации углерода (разд. 10.6), но иногда она обнаруживается и у некоторых С3-растений, в частности в стрессовых условиях окружающей среды. Оболочка хлоропластов хлорофилла не содержит, однако в ней присутствуют каротиноиды, а именно зеаксантин (10.1), антераксантин (10.2) и виолаксантин (10.3), которые с помощью ферментов могут превращаться друг в друга. В последнее время появляется все больше данных, свиде-
330
Часть II. Функциональные аспекты
Б
Рис. 10 3. А. Обобщенная схема хлоропласта высших растений. Б. Увеличенное изображение граны тилакоида, иллюстрирующее главные структурные особенности тилакоидных мембран
тельствующих о том, что оболочка является важным участком синтеза хлоропластных веществ, в первую очередь галактолипидов, пренилхинонов и, возможно, некоторых каротиноидов.
10.2.3. Строма
Внутренний белковый матрикс хлоропласта известен под названием строма. Наряду с фотосинтетическими мембранами ламелл (см. ниже) с помощью электронной микроскопии в строме обнаружены и другие структуры. К ним относятся рибосомы и тяжи ДНК, которые участвуют в хлоропластной саморегуляции и репликации, зерна запасного полисахарида крахмала, осмиофильные глобулы (иначе, пластоглобулы),
Гл 10 Фотосинтез
331
которые, возможно, служат экстраламеллярными фондами мембранных липидов, и пиреноиды (у некоторых водорослей) или сходные с ними стромальные центры (у высших растений). Точные функции последних двух небольших электроноплотных структур неизвестны, однако показано, что большую часть их составляет белок и что они обладают рибулозодифосфат-карбоксилазной активностью
(10 3) Виолаксантик
10.2.4. Фотосинтетическая ламеллярная система мембран
Фотосинтетические пигменты содержатся в протяженной системе внутренних мембран хлоропласта, которые являются местом, где происходит фотосинтез С помощью электронной микроскопии в хлоропласте удалось различить группы замкнутых мешкообразных дисков, названных тилакоидами., которые расположены один над другим, образуя грану (рис. 10 3,5). Внутренний объем, ограниченный мембраной одного тилакоида, известен как локус (loculus; от лат. — ящичек с перегородками, полочками, ларчик). Концы тилакоидов, находящиеся в контакте со стромой, называют краями (margins), а участки, где два тилакоида плотно прилегают друг к другу, — перегородками (partition). Стопки гран связаны между собой мембранами, которые называют одиночными тилакоидами, или ламеллами стромы.
332
Часть II. Функциональные аспекты
10.2.5. Ультраструктура тилакоидной мембраны хлоропласта
Структура мембраны как тилакоидов гран, так и тилакоидов стромы (одиночных тилакоидов) была подробно изучена с помощью электронной микроскопии и иммунологических методов. Много информации получено также и о химическом составе этих мембран.
Их ультраструктура схематически изображена на рис. 10.4. Как и большинство биологических мембран, тилакоиды состоят
Рис. 10.4. Схематическое изображение ультраструктуры мембран тилакоидов, собранных в граны, и мембран одиночных тилакоидов.
главным образом из белков и липидов, содержащихся примерно в равных количествах. Структура мембраны асимметрична, ее липидный матрикс состоит из двух слоев, причем наружный слой толще внутреннего. В липидный матрикс погружено множество белковых частиц, которые видны как на наружной, так и на внутренней поверхности тилакоида. Они видны также по обе стороны от гидрофильной центральной зоны внутри мембраны на срезе препарата, приготовленного методом замораживания — скалывания. Эти частицы могут совершенно свободно перемещаться в жидком липидном матриксе. Их содержится до 6000 на 1 мкм2, и они занимают примерно 70 и 50% площади тилакоидов гран и тилакоидов стромы соответственно. Фотохимическая активность, электронный транспорт и активность метаболических ферментов ассоциированы с частицами разных типов, и катализируемые ими реакции протекают в направлении, перпендикулярном к мембране.
Между тилакоидами стромы и тилакоидами гран имеются не только структурные, но и функциональные различия. Как будет показано ниже, фотосинтез включает две фотохимические реакции, которые протекают в комплексах, известных как фо
Гл. JO. Фотосинтез
333
тосистемы I и II (ФС I и ФС II). Комплексы фотосистем и транспорта электронов локализованы в мембранной структуре со специфическими, хотя и не обязательно регулярными, интервалами в виде групп глобул. Подробно локализация фотосинтетических пигментов в комплексах фотосистем будет описана ниже (разд. 10.4.2). Здесь же следует рассмотреть процесс фотосинтеза в целом. Это поможет лучше оценить значение локализации пигментов в специфических участках или в комплексах и ту роль, которую пигменты играют в фотосинтезе.
10.3. Фотосинтез у растений; общая схема
Система тилакоидных мембран хлоропласта превращает энергию света в форму, которая может быть использована для осуществления химических реакций. Целиком процесс фотосинтеза был схематически представлен на рис. 10.1. В приводимом ниже обсуждении фотосинтеза рассматриваются три стадии. Первая стадия представляет собой световую реакцию — первичный процесс, с помощью которого энергия света поглощается светособирающими пигментами и переносится на фотохимические реакционные центры. На второй стадии поглощенная энергия света используется для осуществления транспорта электронов от воды до NADP+. В ходе электронного транспорта устанавливается градиент заряда, или концентрации протонов, через функциональные везикулы мембраны. Третья стадия представляет собой путь, по которому NADPH, образованный электронтранспортной системой, и АТР, генерируемый за счет различий электрохимического потенциала протонного градиента, используются для фиксации СО2 и синтеза углеводов. Хотя в целях упрощения процесс фотосинтеза разбит на три стадии, необходимо помнить, что поглощение света, транспорт электронов и генерация электрохимического градиента в действительности очень тесно сопряжены.
10.4. Поглощение света — первичный процесс фотосинтеза
10.4.1. Фотосинтетическая единица
Типичный тилакоидный диск, например из зрелого листа шпината, содержит около 200 фотосинтетических элект-ронтранспортных цепей и до 100 000 молекул хлорофилла. Каждая электронтранспортная цепь способна совершать один полный оборот за 15 мс (или около того), тогда как одна молекула хлорофилла не может так быстро поглощать световой квант даже при высокой интенсивности света. Было рассчитано, что при высвобождении одной молекулы О2 и восстановлении од-
334
Часть 11 Функциональные аспекты
нои молекулы СО2 в процесс может вовлекаться до 2500 молекул хлорофилла. Исходя из этого расчета, была разработана концепция фотосинтетической единицы, в которой происходят первичные фотохимические реакции фотосинтеза в так называемом реакционном центре, причем каждый реакционный центр связан со сравнительно большим числом пигментных молекул, поглощающих фотон и передающих ему энергию. Любая фотосинтетическая электронтранспортная цепь включает фотоси-
Свет
Рис. 10.5. Диаграмма, иллюстрирующая механизм действия фотосинтетической единицы.
стемы I и II, которые осуществляют две различные фотохимические реакции, причем та и другая системы имеют свой собственный реакционный центр. В настоящее время известно: для того чтобы выделилась одна молекула О2 и восстановилась одна молекула СО2, через обе фотосистемы должно пройти по четыре электрона (т. е. всего необходимо восемь фотонов). Отсюда следует, что для одной фотохимической реакции требуется около 300 молекул хлорофилла. На самом деле этот расчет сильно упрощен, так как в нем не учитываются влияние на данную величину факторов окружающей среды и межвидовые различия. Однако, если даже цифра в 300 молекул хлорофилла не точна, независимо от этого концепция фотосинтетической единицы, по-видимому, верна. В настоящее время считают, что фотосинтетическая единица для каждой фотосистемы представляет собой комплекс, в котором основная часть молекул хлорофилла образует антенну из светопоглощающих пигментов. Эта антенна собирает энергию света и передает ее на специфический хлорофилловый димер в реакционном центре, в котором она исполь
Гл. 10. Фотосинтез
335
зуется для функционирования фотосинтетической электронтранс-портной системы (рис. 10.5). По последним данным, антенна ФС I содержит 120 молекул хлорофилла а, а антенна ФС II — лишь 60. Наряду с этими двумя фотосистемами обычно присутствует третий светособирающий пигментный комплекс (ССК или LHCP; от англ, light-harvesting chlorophyll protein), связанный с ФС II. В результате большой работы, проведенной в последние годы, удалось многое узнать об организации этих трех фотосинтетических единиц (или частиц) в тилакоидных мембранах. Было показано, что они распределены в мембране неравномерно. Согласно одной из моделей, частицы ФС I распределены как по одиночным, так и по собранным в граны тилакоидам, в то время как большие агрегаты, включающие ФС II и ССК, содержатся лишь в тилакоидах гран. Другая модель предполагает очень низкое содержание единиц ФС I в гранах, соприкасающихся друг с другом, где локализованы главным образом единицы ФС II и ССК. Вместе с этим допускается присутствие единиц ФС I в концевых гранах и в наружных тилакоидах. Согласно этой новейшей модели, системы ФС I и ФС II пространственно разделены, а связь между ними осуществляет «челнок» восстановительных эквивалентов. Роль челнока может играть очень большой фонд пластохинонов.
10.4.2. Светособирающие пигменты
Из обработанных детергентами хлоропластов можно выделить три светособирающие пигментные системы в форме комплексов хлорофилл — белок. Так, ФС I можно разделить на комплекс хлорофилл а — белок, который содержит около 120 молекул хлорофилла а (10.4), входящих в состав антенны, и реакционный центр Р-700 (см. ниже, разд. 10.4.3). В состав ФС II входит комплекс хлорофилл а — белок, содержащий реакционный центр Р-680 и около 60 молекул хлорофилла а. Ни в ФС I, ни в ФС II хлорофилл b (10.5) не содержится. В обе фотосистемы включено некоторое количество р-каротина (10.6), хотя не известно, является ли он частью пигментов антенны или входит в состав реакционных центров.
ССК можно выделить в виде комплекса хлорофилл а/Ь — белок и расщепить его на три компонента хлорофилл — белок. ССК, по-видимому, является единственным комплексом, который содержит хлорофилл Ь, функционирующий как вспомогательный пигмент. В его состав входят в значительных количествах каротиноиды, которые представлены главным образом ксантофиллами [преимущественно лютеином (10.7)]. Роль ССК, тесно связанного с ФС II, заключается в увеличении светособира-ющей способности ФС II, в частности путем расширения спект
336
Часть 11 Функциональные аспекты
рального диапазона света, который может быть использован этой фотосистемой. Исследования, проведенные с проростками гороха, позволили предположить, что существуют светопоглощающие частицы размером 160А, которые состоят из ядра ФСП — хлорофилл а-—белок, окруженного четырьмя едини-
(10 4) Хлорофилл a R - СНз
(10 7) Лютеин
цами ССК (рис 10.6). Рассматривается также возможность использования энергии света, улавливаемой ССК, для осуществления реакции ФС1.
В любой светособирающей системе спектроскопическими методами можно выявить несколько разных форм хлорофилла а со слегка различающимися А,тах. Антенны обеих фотосистем содержат хлорофиллы п-660, п-670, п-678 и п-685 (названы по длинноволновому максимуму поглощения), но наряду с ними в ФС I имеются формы с максимумами поглощения 690, 705 и 720 нм. Различия в максимумах поглощения, по-видимому,
Гл 10 Фотосинтез
337
объясняются различиями в молекулярном окружении молекул хлорофилла, в частности ассоциацией их с белками или взаимодействием с соседними молекулами хлорофилла. Например, сдвиг максимума поглощения хлорофилла a in vivo в красную область спектра до 720 нм обусловлен молекулярной агрегацией. Однако недавно было высказано предположение, что существуют четыре химически различные формы обоих хлорофиллов (а и Ь).
Кванты, поглощенные пигментами антенны, переходят от молекулы к молекуле путем резонансного переноса энергии;
Рис. 10.6. Модель предполагаемой светоулавливающей частицы размером 160 А из проростков гороха
при этом энергия собирается в реакционном центре. Эффективность процесса переноса энергии высока, а энергетические потери в результате испускания флуоресценции или нерациональной фотохимии невелики. Перенос энергии через всю систему антенны происходит очень быстро, протекая за пикосекунды. Резонансный перенос энергии идет в направлении пигментов, поглощающих при больших длинах волн, так что кванты, поглощенные вспомогательными пигментами в ССК, т. е каротиноидами (400—500 нм) и хлорофиллом b (640—650 нм), а также формами хлорофилла а, поглощающими в более коротковолновой области, могут передаваться на хлорофиллы, поглощающие при больших длинах волн, и в конце концов на реакционный центр (рис. 10.7). Таким образом используется большая часть спектра солнечного света.
Защитный механизм против избыточного поглощения света. Размеры антенны в хлоропластах позволяют транспорту электронов идти с полной скоростью даже в облачный день. Очевидно, в условиях яркого освещения (на ярком солнечном свету) может поглощаться гораздо больше квантов, чем способен использовать реакционный центр. Избыток энергии возбужденного хлорофилла может удаляться различными путями. Один из них включает внутрисистемный переход с образованием более дол-
338
Часть II. Функциональные аспекты
Рис. 10.7. Диаграмма, иллюстрирующая прохождение энергии возбуждения через различные формы пигментов в светособирающей антенне фотосистем I и II.
гоживущей, но все еще высокоэнергетической формы 3Хл в триплетном состоянии. От этого «триплетного» хлорофилла избыток энергии может передаваться на находящийся в основном состоянии молекулярный кислород, переводя его в синглетное состояние 'Ог- Этот чрезвычайно реакционноспособный окислитель может окислить любую подходящую акцепторную молекулу, в том числе и сам хлорофилл, и тем самым вызвать сильные, а возможно, и летальные повреждения фотосинтетических мембран. Считают, что одной из главных функций каротиноидов в антенне является защитная. Они предотвращают подобные повреждения путем вмешательства в эту последовательность событий, либо преимущественно реагируя с окисля-
Гл 10. Фотосинтез
339
* Хл Фотосинтез
например Хл)
Рис. 10 8. Потеря энергии возбуждения хлорофиллом (Хл), ведущая к образованию синглетного кислорода (Юг), и три механизма, в которых каротиноиды (КАР) могут функционировать как защитные агенты против опасного или ведущего к летальному исходу окисления, вызываемого 1О2. 1. КАР в основном функционирует как субстрат для окисления. 2. Переход энергии возбуждения с 3Хл на КАР. 3. Переход энергии возбуждения с ’О2 на КАР.
ющим синглетным кислородом, либо принимая на себя энергию возбуждения «триплетного» хлорофилла или «синглетного» кислорода (рис. 10.8).
10.4.3. Фотохимические реакционные центры
Антенна и пигменты ССК участвуют в поглощении света, в результате чего происходит возбуждение электронов, и передают энергию возбуждения от молекулы к молекуле, пока она не достигнет реакционного центра. В реакционном центре эта энергия возбуждения превращается в химически утилизируемую форму. Активным пигментом в реакционных центрах обеих фотосистем служит специфический димер хлорофилла а, который подвергается обратимому окислению.
Реакционный центр I. Пигмент реакционного центра фотосистемы I характеризуется изменениями поглощения света, главным образом при 700 нм, которые выявляются в спектре после освещения хлоропластов вспышками света. Он известен как хлорофилл аг> или пигмент Р-700, и представляет собой
340
Часть И. Функциональные аспекты
специфический комплекс белка с димером, состоящим из двух молекул хлорофилла а. Структура этого димера, или «особой пары», по-видимому, чрезвычайно важна для функционирования центра, но полностью она еще не установлена. Известно, однако, что тетрапиррольные кольца мономеров лежат примерно в плоскости тилакоидной мембраны. Были предложены модели димера, в которых молекулы воды взаимодействуют с атомом
Рис. 10.9. Модель возможных взаимодействий между водой и двумя молекулами хлорофилла в димере Р-700 (хлорофилле as).
магния, находящимся в центре одной из молекул хлорофилла, и карбонильной группой кольца V второй молекулы (рис. 10.9).
Энергия поглощенного антенной света переносится в реакционный центр, и хлорофилл ai подвергается электронному возбуждению. Этот процесс занимает менее 30 пс. В течение последующих 20 нс хлорофилл щ окисляется, вероятно, с образованием катион-радикала (Хл-Хл) + -, в котором неспаренный электрон делокализован по всей системе обоих порфириновых колец. Электрон, отданный хлорофиллом аг в ходе такого окисления, эффективно переносится на первичный акцептор X (Р-430). Хлорофилл «I возвращается в свое нормальное состояние в результате получения электрона от первичного донора Y. Таким образом, реакционный центр ФС I осуществляет эту часть фотосинтетического транспорта электронов путем эффективной передачи электронов от Y на X, т. е. с помощью процесса, который не может происходить самопроизвольно (рис. 10.10,Л).
Гл. 10. Фотосинтез
3411
Рис. 10.10. Первичные реакции в фотосинтетических реакционных центрах. А. Фотосистема I. Б. Фотосистема 11.
Реакционный центр II. Пигмент реакционного центра II представляет собой также комплекс хлорофилла с белком, содержащий димер хлорофилла а, известный как хлорофилл «и, или Р-680. Хотя иной характер поглощения света этим пигментом указывает на то, что молекулы хлорофилла а находятся здесь в другом молекулярном окружении или по-иному ориентированы, чем в случае пигмента Р-700, процессы поглощения света и окисления, происходящие в реакционном центре II, сходны с аналогичными процессами в реакционном центре I. Здесь также энергия электронного возбуждения передается с хлорофилла антенны на хлорофилл ап, который подвергается возбуждению с последующим окислением до катион-ратикала и делокализацией неспаренного электрона. В этом случае электрон передается на первичный акцептор электрона фотосистемы II Q (Х-320). Затем катион-радикал хлорофилла «и восстанавливается, получая электрон от донора Z. Таким образом, фотосистема II эффективно переносит электроны от Z на Q (рис. 10.10).
23—84
342
Часть II. Функциональные аспекты
10.5. Вторичные события; система фотосинтетического транспорта электронов
В эукариотических клетках в процессе окислительного распада питательных веществ образуются восстановительные нуклеотиды, главным образом NADH. Для их окисления молекулярным кислородом используется митохондриальная электрон-транспортная система (рис. 10.11,А). Это термодинамически выгодный процесс, поскольку окислительно-восстановительный
Рис. 10.11. А. Окисление NADH молекулярным О2 в митохондриях. Б. Восстановление NADP+ до NADPH водой и выделение молекулярного О2 при фотосинтезе.
потенциал пары NAD+/NADH ( — 0,32 В) более отрицателен, чем потенциал пары О2/Н2О ( + 0,82), или, другими словами, молекулярный кислород является более сильным окислителем, чем NAD". Ясно, что обратный процесс, в котором NAD+ (пли NADP*-) восстанавливается до NAD(P)H с помощью воды, а вода в свою очередь окисляется до молекулярного кислорода (рис. 10.11,5), энергетически невыгоден и не может происходить спонтанно. В связи с этим становится очевидной чрезвычайная важность фотосинтетического транспорта электронов. Для восстановления NAD+ необходимо поступление энергии, и для этой цели используется энергия света, улавливаемая в первичных реакциях фотосинтеза.
10.5.1. Z-схема
Из множества различных схем, предложенных для транспорта электронов при фотосинтезе, большинству известных данных удовлетворяет лишь зигзагообразная Z-схема (рис.
Рис. 10.12. Z-схема потока электронов при фотосинтезе. Подробное описание промежуточных компонентов приведено в тексте.
344 Часть II. Функциональные аспекты
10.12) , иллюстрирующая, каким образом свет обеспечивает энергией две различные фотореакции. Собранная энергия света используется для образования восстанавливающих агентов, достаточно сильных, чтобы передавать электроны (т. е. для восстановления) на ряд промежуточных компонентов электрон-транспортной последовательности.
10.5.2. Фотосистемы I и II
Свет, поглощенный фотосистемой I, поставляет энергию для переноса электронов от донора Y (окислительно-восстановительный потенциал +0,4 В) через хлорофилл «г (Р-700) реакционного центра на акцептор X (окислительно-восстановительный потенциал ~ —0,6В), т. е. против градиента потенциала в +1,0 В. Восстановленная форма X затем передает электроны (восстанавливает) на NADP+ (окислительно-восстановительный потенциал —0,32 В) через ферредоксин (белок, содержащий железо и серу) с помощью флавопротеинового фермента.
Донор электронов Y для фотосистемы I расположен в конце последовательности компонентов электронтранспортной цепи — после пластохинона, цитохрома f и пластоцианина. Он получает электроны, передающиеся через эти промежуточные компоненты, от соединения Q (окислительно-восстановительный потенциал ~0В). Q является акцептором электронов в фотосистеме II и получает их через Р-680 от донора Z. Как уже отмечалось, восстановительный акцептор Q передает электроны фотосистеме I. Окисленный донор Z является достаточно сильным окислителем, способным окислить воду, что приводит к выделению кислорода. Таким образом, энергия для расщепления воды по-‘Ставляется светом, улавливаемым фотосистемой II.
Общая картина такова, что при переносе электронов от донора на акцептор фотосистемой I образуется сильный восстановитель, который может восстанавливать NADP+ до NADPH, и слабый окислитель, который тем не менее способен получать электроны от пластоцианина. Вместе с тем перенос электронов с донора на акцептор фотосистемой II приводит к образованию сильного окислителя (окисленный донор), который может осуществлять окисление воды и выделение кислорода. Образующийся при этом восстановитель (восстановленный акцептор), хотя и более слабый, чем в фотосистеме I, достаточно силен для передачи электронов через последовательность компонентов пластохинон — цитохром f — пластоцианин.
Гл. 10. Фотосинтез
345
10.5.3. Природа первичных акцепторов и доноров
Компоненты электронтранспортной системы, которые отдают хлорофиллам или получают от них электроны, были идентифицированы главным образом по спектроскопическим данным, однако в химическом отношении они были охарактеризованы далеко не во всех случаях.
Фотосистема I. Первичный акцептор X, который получает электроны от Р-700 (хлорофилла ai), был идентифицирован по изменениям поглощения света. Его назвали Р-430 и считают, что он является белком, содержащим железо и серу. Донор Y представляет собой медьсодержащий белок пластоцианин, который поставляет электроны для восстановления окисленного катион-радикала хлорофилла а\.
Фотосистема II. Первичный акцептор Q фотосистемы II, для которого характерны изменения поглощения света при 320 нм, по-видимому, является прочносвязанной формой пластохинона (10.8). Эта форма отличается от основной формы пластохинона — одного из последующих компонентов в цепи переноса электрона. С акцептором Q тесно связан неидентифицированный компонент С-550, имеющий максимум поглощения при 550 нм. Донор Z, который поставляет электроны для восстановления хлорофилла Оц (Р-680), также неидентифицирован. Предполагают, что он прочно связан с марганцем или цитохромом £559.
10.5.4. Природа других компонентов фотосинтетической электронтранспортной системы
Ряд компонентов фотосинтетической системы транспорта электронов представляют собой молекулы, которые поглощают свет видимых длин волн и поэтому являются окрашенными пигментами. Так, цитохромы, подобные цитохромам митохондриальных систем транспорта электронов, — это железо-(гем)содержащие белки, поглощающие свет примерно при 560 нм и потому окрашенные в красный цвет. (Общие свойства гемов и цитохромов были описаны в гл. 5.) Флавопротеиновый
346
Часть II. Функциональные аспекты
фермент ферредоксин — ЫАВР+-оксидоредуктаза окрашен в желтый цвет, поскольку ь качестве простетической группы содержит рибофлавин (гл. 6). Пластоцианин представляет собой медьсодержащий белок, и его интенсивная синяя окраска обусловлена, вероятно, поглощением в результате переноса заряда медью. Неокрашенный важный компонент системы —-пластохинон (10.8) —представляет собой бензохинон с длинной изопреноидной боковой цепью (свойства бензохинонов были описаны в гл. 3).
Рис. 10.13. Взаимосвязь некоторых фотосинтетических электронтранспортных цепей через большой фонд пластохинона (PQ). Цит — цитохром; ПЦ — пластоцианин; Q — хинон.
Пластохинон выполняет в системе переноса электронов несколько специфических функций (рис. 10.13). Его значительно больше, чем других компонентов цепи, и он служит электронным «буфером», который обеспечивает гладкое функционирование цепи даже при сильных колебаниях в распределении квантов света между двумя фотосистемами. Он способен также связывать между собой несколько электронтранспортных цепей и таким образом повышать надежность системы. Например, если какой-либо реакционный центр II не функционирует, то пластохинон может обеспечить работу связанного с ним реакционного центра I за счет электронов, поступающих из другого реакционного центра II. В результате реакционный центр I не будет испытывать недостатка в электронах. Другая возможная роль пластохинона упоминалась ранее (разд. 10.4.1), когда рассматривалось распределение фотосистем в тилакоидах. Из-за пространственного разделения разных фотосистем необходим механизм, обеспечивающий поток электронов между ними, и предполагают, что в этом механизме главную роль играет пластохинон.
Вместе с тем следует отметить, что способность всех этих соединений поглощать видимый свет не имеет отношения к их функционированию при фотосинтезе, и в первичном поглощении света они не участвуют.
Гл. 10. Фотосинтез
347
10.6. Темновые реакции
Хотя подробное изложение этой темы и не входит в задачу настоящей книги, краткое описание основных ее аспектов необходимо для получения полной картины фотосинтеза.
10.6.1. Фотофосфорилирование
В настоящее время принято считать, что фотосинтетическая электронтранспортная цепь расположена перпендикулярно тилакоидной мембране и дважды пересекает ее (рис. 10.14). В продолжение одного оборота цепи каждый реакционный
Рис. 10.14. Расположение фотосинтетической электронтранспортной цепи в тилакоидной мембране.
центр переносит один электрон с внутренней стороны мембраны на наружную. Одновременно на внутренней стороне мембраны в результате расщепления воды и окисления дигидропластохинона освобождаются протоны, Таким образом, создается градиент электрохимического потенциала с положительным зарядом (или низким pH) на внутренней стороне мембраны и с отрицательным зарядом (или высоким pH) на ее наружной стороне. Согласно хемиосмотической гипотезе Митчелла, энергия этого градиента служит движущей силой синтеза АТР из ADP при помощи ATP-азы, связанной с мембраной. Когда работают обе фотосистемы, поток электронов является нециклическим, и говорят, что образование АТР происходит путем нециклического фотофосфорилирования. Если же функционирует только одна фотосистема (обычно ФС I), наблюдается циклический поток электронов, и говорят, что образование АТР происходит путем циклического фотофосфорилирования.
A CH2OH c=o
н—с—он
н—с—он
I
СН2О— (Р)
СН2О-©
с=о
н—с—он
I
Н—С—он
I
СН2О-(р)
сн2о-®
-оос—с—он
с=о
Н—С—он
I
СН2О-®
соо"
—»-Н—С—ОН
СН2О-®
12 хЗ-Фосфоглицерат
Gx Рибулозо-5-фосфат
6* Рибулозо-
1,5-дифосфат
Регенерация рибулозо-5-фосфата (см. Б)
СН2ОН с=о
ДигидроксиаЦетонфосфат
НО—С—н
СОО—®
Н— С —он
СН2О-®
12* 1,3-Дифосфоглицерат
I н—с—он
СН2О-®
12 х Глицеральдегид-'3-фосфат
хЗ
СН2О-® с=о
НО—с—н
Х1
Глюкоза или ’
крахмал швия Прибавление 1 молекулы гексозьы У///ШШ//Ш
Н—С—ОН
н—С—он
Н—С— он
Н—он
СН2О-®
ЗхФруктозо-6-фосфат
3 хФруктозо-1,6-дмфосфат
Рис. 10.15. Схема пути фотосинтетической фиксации углерода и синтеза углеводов по Кальвину — Бенсону. А. Основные реакции, в которых фиксируется СО2 и используются NADPH и АТР, образующиеся фотосинтетической цепью транспорта электронов и путем фосфорилирования. Суммарное уравнение: 6 СО2 + 18 АТР + 12 NADPH —> Фруктозо-6-фосфат ф-+ 18 ADP+12 NADP++17 Pi.
сно
Н-С —он
44“лицеральдегид -7 3-фосфат
х 2
СН2ОН
н—с—он
сн.он
CH2OH
СН2О—©
сно
ЗхФруктозо-6- фосфат
Н3О~® Ксилулозо-5 фосфат
н —с —он
X 4
с Н2ОН
СН2О-©
Н—С—ОН
н—('—он
I л-4
сн2о-@
Эритроза -
4-фосфат
CHjOH
2 к Дигидрокси-“’’'ацетон фосфат
сн2о— © с=о
но—с—н
н—с—он
х2 H-C-OH
н-с-он
сн2о— ©
Седугептулозо -
7-фосфат
СН2О—®
Седугептулозо -1. 7- бисфосфат
I 6*Рибулозо!-
I ’5-фосфат ' I
(jHO
Н-С—ОН
н—С—ОН
I
СН2О-©
Рибозо-5-фосфат
СН2О-® <Uo Н—<!—ОН н—<!:—он <^н2о-(р) СН2О-® СН2О-®
||-он со2 оос—<!?—он нч
(j—он н—с—он -_!> но^ 9=0 н-с—он
СН2О—(Р) ^н2о—(р)
Рибулозе -1,5-бисфосфат (Энедиол) Промежуточная
Р —оксокислота
СН2О-<₽)
’ООС—с—он
— н
соон
I н—с—он
СН2О-(Р)
2 X 3-Фосфоглицерат
Рис. 10.15 (продолжение) Б. Промежуточные продукты при регенерации рибулозо-1, 5-дифосфата из глицеральдегид-3-фосфата, дигидроксиацетоифосфа-та и фруктозо-6-фосфата. В. Реакция фиксации СО2, катализируемая рибуло-зо-1,5-дифосфат-карбоксилазой (карбоксидисмугазой).
350
Часть II. Функциональные аспекты
10.6.2. Фиксация углерода
Химическая энергия улавливается двумя путями — в форме восстановительного кофактора NADPH и в форме АТР, образующегося в результате сопряженного фосфорилирования (так же как и в случае митохондриального транспорта электронов). NADP и АТР поставляют восстановительные эквивален-
Рис. 10.16. Путь фотосинтетической фиксации СО2 по Хэтчу — Слэку (С4-путь).
ты и химическую энергию для фиксации углерода, с помощью которых СО2 восстанавливается до углеводов. Хотя у разных фотосинтезирующих организмов в образовании углеводов участвуют различные метаболические последовательности, по-видимому, в хлоропластах всех высших растений реакции протекают в основном по циклу Кальвина — Бенсона, приведенному на рис. 10.15.
Наряду с циклом Кальвина — Бенсона (Сз-путем) необходимо отметить и цикл Хэтча — Слэка (С^путь; рис. 10.16), который встречается у некоторых тропических растений, главным образом травянистых, и позволяет осуществлять синтез углеводов из СО2 при низких концентрациях последней и с очень небольшими потерями воды. Особенностью С4-растений является совместное функционирование клеток двух типов —
Гл. 10. Фотосинтез
351
клеток мезофилла и клеток обкладки сосудистого пучка. Фиксация СОа у них происходит в клетках мезофилла в виде малата; последний затем транспортируется в клетки обкладки сосудистого пучка, где он подвергается декарбоксилированию. Выделившаяся СО2 фиксируется в реакции с рибулозо-1,5-бисфосфатом по обычному пути Кальвина — Бенсона.
(10.9.) Хлорофилл с
10.7. Фотосинтез у эукариотических водорослей
Процесс фотосинтеза у зеленых водорослей (Chloro-phyceae) очень напоминает аналогичный процесс в хлоропластах высших растений; многие детали фотосинтеза были выяснены при исследовании зеленых водорослей, и в первую очередь Chlorella, Scenedesmus и Chlamydomonas. В целом фотосинтез у всех эукариотических водорослей, по-видимому, сходен с фотосинтезом у высших растений. У них также в ходе этого процесса выделяется кислород, используются две фотосистемы и функционирует Z-схема транспорта электронов. Однако разные классы водорослей различаются по составу фотосинтетических пигментов ССК. Одни водоросли, например из сем. Chlorophyceae и Euglenophyceae, так же как и высшие растения, содержат хлорофиллы а и Ь, а в качестве вспомогательных пигментов каротиноиды. У других водорослей хлорофилл b отсутствует и заменен хлорофиллами end (10.9; 10.10), которые служат вспомогательными пигментами у Dinophyceae, Chry-sophyceae, Bacillariophyceae, Xanthophyceae, Phaeophyceae и у некоторых представителей Rhodophyceae. Наблюдаются также значительные вариации в составе каротиноидов (гл. 2). Например, бурые морские водоросли (Phaeophyceae, Chrysophyceae, Bacillariophyceae), доля которых в мировой фотосинтетической
352
Часть II. Функциональные аспекты
активности весьма высока, в качестве главного каротиноида содержат фукоксантин (10.11). При разрушении тилакоидов бурых водорослей детергентами выявляются три пигмент-бел-ковых комплекса: комплекс Р-700 — хлорофилл а — белок, сходный с аналогичным комплексом у высших растений, и два
(10 11 ) фукоксантин
(10 13 ) Фикоэритрин
ССК — один комплекс фукоксантин — хлорофилл afct — белок,, а другой комплекс виолаксантин — хлорофилл alc-tlc?. — белок. Морские динофлагелляты содержат водорастворимый ССК, который представляет собой комплекс перидинин (10.12)—хлорофилл а — белок. Фукоксантин и перидинин являются важными вспомогательными пигментами, переносящими энергию на хлорофилл а с высокой эффективностью (70%).
В красных водорослях (Rhodophyceae), в основном содержащих только хлорофилл а, присутствуют в больших количествах фикобилины — комплексы между белками и линейными тетрапирролами, подобными фикоэритрину (10.13; гл. 5),— которые эффективно переносят энергию возбуждения на хлорофилл а в фотосистеме II. Фикобилины присутствуют в клетках водорослей в виде белковых комплексов в частицах, называе
Гл 10. Фотосинтез
353’.
мых фикобилисомами, которые присоединены к ламеллам хлоропластов (разд. 10.8).
Эукариотические водоросли живут в различных местообитаниях и характеризуются большой вариабельностью показателей роста, поэтому нет ничего удивительного в том, что у некоторых видов наряду с различиями в пигментации обнаруживаются и некоторые различия в составе переносчиков электронов и в их последовательности в электронтранспортной цепи. Большое разнообразие наблюдается также и в путях метаболизма углерода. Подробно в этом отношении было изучено лишь несколько видов водорослей; поэтому не исключено, что многие отклонения от фотосинтеза по типу высших растений остаются пока неоткрытыми.
10.8. Фотосинтез у прокариотических сине-зеленых водорослей
10.8.1. Общие особенности
Сине-зеленые водоросли (Cyanophyta или Cyanobacteria) представляют собой единственную большую группу прокариот, которые способны к фотосинтезу с выделением кислорода, сходному с фотосинтезом у высших растений. Однако тилакоидные мембраны у них находятся не в хлоропластах, а распределены по всей цитоплазме клетки, преимущественно на ее периферии. Фотосинтетические пигменты сине-зеленых водо-
о
(10 14 ) Эхиненон
рослей заметно отличаются от хлоропластных пигментов растений и водорослей. Подробно было изучено лишь несколько видов сине-зеленых водорослей, и тем не менее удалось установить главные особенности их фотосинтеза. У этих водорослей также обнаружены две фотосистемы и электронтранспортная цепь Z-типа, а их ФС I, по-видимому, сходна с аналогичной системой у эукариот. Однако состав компонентов их фотосистем,, а также переносчики и их последовательность в системе транспорта электронов отличаются от аналогичных параметров у высших растений. В общем пигменты, фотосистемы и электрон-транспортные компоненты у них, по-видимому, гораздо менее прочно соединены с мембранными структурами, чем у фотосин
.'354
Часть II. Функциональные аспекты
тезирующих эукариот. Были охарактеризованы пигменты сине-зеленых водорослей. Они содержат единственный хлорофилл — ^хлорофилл а, а в качестве вспомогательных пигментов, связанных с фотосистемой II, — фикобилины, локализованные в фико-билисомах (разд. 10.8.2). Из каротиноидов с фотосистемой I ассоциированы p-каротин и, возможно, эхиненон (10.4), а с фотосистемой II — различные ксантофиллы.
Так же как у других организмов в разных условиях роста и окружающей среды у сине-зеленых водорослей наблюдаются .значительные изменения в морфологии, пигментации и деталях механизма фотосинтеза.
10.8.2. Фикобилисомы
Красные водоросли и сине-зеленые водоросли (или бактерии) отличаются от всех других фотосинтезирующих организмов тем, что в качестве вспомогательных светоулавливающих пигментов они используют фикобилипротеины (гл. 5), которые локализованы в специфических структурах, называемых фико-,билисомами. Последние представляют собой макромолекулярные
Рис. 10.17. Модель структуры фикобилисомы красных водорослей.
агрегаты мол. массой до 20-106, упорядоченно расположенные со стороны стромы вдоль тилакоидной мембраны. Эти структуры, по-видимому, очень сходны у всех изученных в данном отношении организмов. Центральное ядро фикобилисомы, которое примыкает к тилакоиду, составляет аллофикоцианин — фикобилипротеин, обладающий поглощением (и испусканием флуоресценции) в длинноволновой области спектра. От этого ядра в направлении стромы радиально расходятся упакованные в стопки палочки, содержащие фикоцианин (внутренние палочки) и фикоэритрин (наружные палочки) (рис. 10.17). В фико-билисоме присутствуют также другие, неокрашенные белки,
Гл. 10. Фотосинтез
355-
которые, по-видимому, играют роль связующих компонентов, поддерживающих ее структуру.
Фикобилисома представляет собой светособирающий комплекс, в котором происходит перенос энергии с фикоэритрина через фикоцианин на аллофикоцианиновое ядро. На ФС II может переноситься около 95% уловленной энергии, что предполагает тесную пространственную взаимосвязь между фикобили-сомами и ФС II. По-видимому, каждая фикобилисома обслуживает несколько реакционных центров ФС II. ФС I у сине-зеленых водорослей, по всей видимости, сходна с аналогичной системой высших растений; она не использует энергии света, улавливаемого фикобилисомами.
10.9. Бактериальный фотосинтез
Свет в качестве первичного источника энергии могут использовать три главные группы бактерий — зеленые и пурпурные серные бактерии (Chlorobiaceae и Chromatiaceae) н пурпурные несерные бактерии (Rhodospirillaceae). Как правило, фотосинтезирующие бактерии имеют клеточную стенку, сходную со стенкой других грамотрицательных бактерий, однако под этой стенкой у них расположена толстая клеточная мембрана. Мембрана фотосинтезирующих бактерий может многократно изгибаться и впячиваться, образуя ламеллярные мембранные структуры или везикулы внутри клетки. Эти структуры несут фотосинтетический аппарат, который значительно отличается от соответствующего аппарата хлоропластов растений. В деталях биохимия фотосинтетических процессов у бактерий и растений также различна. Препараты фотосинтетических мембран можно получить из разрушенных клеток в виде частиц или пузырьков, называемых хроматофорами (ср. с хрома-тофорами животных, гл. 8), но, как правило, интактные клетки, за исключением клеток зеленых серных бактерий (Chlorobiaceae), не содержат таких дискретных структур. Зеленые серные бактерии (например, Chlorobium) отличаются от других фотосинтезирующих бактерий тем, что лишены внутренних мембран; вместе с тем они обладают уплощенными сигарообразными структурами, называемыми хлоросомами, которые присоединены к плазматической мембране. Хлоросомы служат функционально организованными светособирающими антеннами для реакционных центров, которые локализованы в плазматической мембране. Перенос энергии в хлоросоме происходит С’ бактериохлорофилла с (1000—1500 молекул) через бактериохлорофилл а (возможно, 100 молекул в комплексе с белком) на бактериохлорофилл с реакционного центра.
356
Часть II. Функциональные аспекты
Бактериальный фотосинтез во многом отличается от фотосинтеза у растений. Во-первых, бактерии — единственные из -фотосинтезирующих организмов — не способны использовать в качестве конечного восстановителя воду. Они используют другие восстановители, которыми могут быть органические молекулы или неорганические соединения серы, и, следовательно,
ИО 15) Бактериохлорофилл а
(R = фарнезил или Геранил геранил )
(10.16 ) Бактеоиохлооофилл b
•бактерии не выделяют кислород. Во-вторых, фиксация и метаболизм углерода у бактерий происходят не в цикле Кальвина — Бенсона, а иным путем. В-третьих, аппарат первичного улавливания света и переноса электронов у них совершенно отличен от наблюдающихся в растительных клетках; в частности, у них протекает только одна световая реакция, правда, она во многом сходна с реакцией в фотосистеме I растений.
н3со
оснэ
(10 17) Спириллоксантин
Вместе с тем механизм улавливания света у бактерий очень сходен с соответствующим механизмом у растений, хотя фотосинтетические единицы у первых меньше. Так же как в хлоропластах, свет поглощается пигментами антенны, энергия возбуждения быстро передается на реакционный центр и используется в качестве движущей силы в транспорте электронов. Главным фотоактивным пигментом является бактериохлорофилл (БХл), в большинстве случаев бактериохлорофилл а (10.15), а в некоторых случаях (например, у Rhodopseudomo-
Гл. 10. Фотосинтез
357
nets sphaeroides)—бактериохлорофилл b (10.16). Каротиноиды в фотосинтезирующих бактериях представлены характерными для них ациклическими метокси- или арил-каротиноидами (гл. 2), например спириллоксантином (10.17) у Rhodaspirillum rubrum. Собирающая свет антенна передает энергию возбуждения на БХл реакционного центра, который поглощает при 870— 875 нм у Rhodospirillaceae и при 890 нм у Chromatiaceae. БХл реакционного центра, Р-870 или Р-875 аналогичны Р-700, или хлорофиллу ai, ФС1 высших растений. Бактериальный реак
(10.18.) бактериофеофитин а
ционный центр содержит три полипептида (с мол. массой 28 000, 32 000 и 35 000), ассоциированных с четырьмя молекулами бактериохлорофилла, две молекулы бактериофеофнтина (10.18), одну молекулу убихинона (10.19) и негемовое железо. В небольшом количестве в препаратах реакционного центра обнаруживаются также каротиноиды, входящие в состав главным образом светособирающего комплекса антенны.
В тесной связи с реакционным центром находится главная светособирающая антенна, которая у Rhodospirillaceae поглощает при 875 нм. Этот комплекс включает два полипептида, а также бактериохлорофилл и каротиноиды в соотношении 1 : 1. Соотношение БХл: реакционные центры остается постоянным и составляет около 25: 1. У некоторых видов, например у Rhodo-spirillum rubrum, имеется только один ССК, тогда как у других организмов, и в первую очередь у Rhodopseudomonas spp., содержится и второй подобный комплекс, поглощающий при более коротких длинах волн (Хтах = 800 и 850 нм). Он включает два пептида, две формы бактериохлорофилла (две молекулы БХл-850 и одну молекулу БХл-800) и каротиноид (одну молекулу). Отношение числа этих комплексов к числу реакционных
358 Часть II. Функциональные аспекты
центров варьирует в зависимости от условий окружающей среды от 10 до 100 молекул БХл-800-850 на один реакционный центр (разд. 10.11).
В первичной световой реакции энергия возбуждения переносится на Р-870 и один электрон передается от бактериохлорофилла «особой пары» па акцептор. Окисленный Р-870 в свою очередь получает электрон от молекулы донора. Химическая природа этого донора и первичного акцептора пока неизвестна.
Электронтранспортпые цепи у разных видов бактерий различаются в деталях. Наиболее подробно их изучали у Rhodo-spirillum rubrum, у нескольс.их видов Rhodopseudomonas (R. sphaeroides, R. capsulata, R. palustris) из Rhodospirillaceae и у некоторых видов Chromatium и Chlorobium из классов серных бактерий. У всех этих бактерий в цепи переноса электронов участвует несколько цитохромов, тогда как плаетоцианин, по-видимому, ие используется. Те функции, которые пластоциа-нин выполняет у растений, у бактерий может выполнять убихинон. Подробное обсуждение фотосинтетического электронного транспорта у бактерий не входит в задачу данной книги.
10.10. Синтез пигментов в связи с развитием хлоропластов
10.10.1. Формирование хлоропластов высших растений из этиопластов
Структурные изменения. Биохимические и структурные изменения, происходящие в ходе формирования хлоропластов, в основном изучали на зеленеющих этиолированных проростках. Семядоли и листья проростков покрытосеменных, прорастающих и растущих в темноте, отличаются от семядолей и листьев проростков, растущих на свету, по форме (меньшие по размерам, удлиненные) и окраске (они желтые). В этиолированных тканях хлоропласты не образуются, а пропластиды развиваются в этиопласты (около 3—5 мкм в диаметре). Характерной структурной особенностью этиопластов является наличие проламеллярных тел — квазикристаллических трехмерных трубчатых структур, из которых обычно выходят немногочисленные ламеллы. После освещения выросших в темноте проростков из этиопластных мембран образуются хлоропласты. В ходе этого процесса кристаллическое проламеллярное тело теряет свою структурную регулярность, а затем полностью превращается в пластинки перфорированных мембран, которые и дают начало тилакоидам. В недавно опубликованных исследованиях высказывается предположение, что протилакоидные мембраны, соединенные с трубочками проламеллярного тела, могут играть
Гл. 10. Фотосинтез
359
чрезвычайно важную роль в синтезе компонентов развивающихся фотосинтетических мембран, в том числе хлорофилла и каротиноидных пигментов.
Характер развития фотосинтетической активности во времени заметно зависит от вида, возраста и условий роста растения. В течение первых минут после освещения обычно появляется небольшая фотосинтетическая активность, которая быстро усиливается в продолжение первых двух часов, тогда как весь процесс формирования хлоропластов из этиопластов завершается за 48 ч.
Формирование активных фотосистем. Рост тилакоидной мембраны и развитие функционирующего фотосинтетического аппарата в ходе дифференциации этиопласта в хлоропласт — многоступенчатый процесс, который включает не только биосинтез структурных и функциональных компонентов, но также и интеграцию и сборку этих компонентов в функциональные единицы. На разных стадиях развития мембран можно выделить тилакоиды, содержащие ФС I- и ФС П-единицы. Сначала формируются ядра ФС I и ФС II, включающие реакционные центры, а затем простые (мономерные?) формы ССК. Дифференциация первичных тилакоидов в тилакоиды стромы и гран происходит по мере синтеза ССК; в ходе такой дифференциации размер ФС I- и ФСН-единиц увеличивается, а в процессе дальнейшего развития пигмент-белковые комплексы постепенно организуются в большие надмолекулярные структуры полностью развитых хлоропластов.
Регуляция развития хлоропластов светом. Окончательное состояние тилакоидных мембран зависит от условий окружающей среды, главным образом от освещения. Хлоропласты, развивавшиеся при высоких интенсивностях освещения, имеют относительно небольшие, но высокоэффективные ФС I и ФСП, тогда как ССК У них редуцированы. При более низких интенсивностях освещения, при которых поглощение света должно быть по возможности максимально эффективным, большое значение имеет синтез ССК, связанный с организацией тилакоидов в граны. Имеются сообщения, что первичными регуляторами развития хлоропластов служат красный свет и фитохромная система. Однако, согласно другим сообщениям, важную роль в данном случае играет синий свет и пока еще неизвестный фоторецептор.
Образование фотосинтетических пигментов. Путь биосинтеза, по которому образуется хлорофилл, описан в гл. 5. Этиолированные проростки не содержат хлорофилла, но содержат в небольшом количестве протохлорофиллид (10.20), связанный с белком и локализованный в проламеллярных телах. Результаты спектроскопических исследований указывают на существо
360
Часть II. Функциональные аспекты
вание трех форм протохлорофиллида с максимумами поглощения 628, 637 и 650 нм. Эти формы различаются степенью агрегации или способом связывания с белком. После освещения проростков, выросших в темноте, с помощью спектроскопических методов был обнаружен ряд промежуточных продуктов (Хтах = 676, 678, 682 и 672 нм), которые образуются по мере превращения протохлорофиллида в хлорофилл а. Сначала хлорофилл образуется из протохлорофиллида очень быстро, однако затем наблюдается короткий индукционный период, после
Ц0.20.) Протохлорофиллид а
которого более медленно синтезируется большая часть хлорофилла. Предполагают, что скорость синтеза хлорофилла регулируется фитохромом. Хотя ССК быстро становятся фотохимически активными, вначале их размеры невелики по сравнению с хлоропластами зеленых листьев. Главная часть хлорофилла, синтезирующаяся в продолжение нескольких часов после индукционного периода, служит в основном для увеличения размера светсобирающих антенн.
Этиолированные проростки обычно не содержат каротинов, ио в них присутствуют в небольших количествах ксантофиллы и компоненты электронтранспортной цепи, в том числе цитохромы, пластоцианин и пластохинон. На свету параллельно с образованием главной части хлорофилла происходит интенсивный синтез хлоропластных каротиноидов (гл. 2) и компонентов фотосинтетической электронтранспортной цепи, а также включение этих молекул в тилакоиды. Синтезы компонентов хлоропласта в высокой степени взаимозависимы и тесно связаны генетически. Если развитие хлоропластов протекает нормально, на необходимом уровне должно поддерживаться и их
Гл. 10 Фотосинтез
361
снабжение структурными и функциональными компонентами. Прекращение поступления одного из компонентов, например, в результате действия ингибитора, приведет к предотвращению развития хлоропластов и может вызвать блокирование синтеза других компонентов (разд. 10.10.4).
10.10.2. Развитие хлоропластов в тканях растений, выросших на свету
Этиолированные проростки, зеленеющие на свету, представляют собой удобную синхронную систему, на примере которой можно изучать развитие хлоропластов, однако в ходе нормального образования хлоропластов в тканях растений, растущих на свету, процесс позеленения не происходит. В нормальных условиях в меристематических тканях развиваются небольшие пропластиды, которые в конечном итоге и становятся хлоропластами. Такое превращение происходит без промежуточного образования этиопластов. Развитие хлоропластов из пропластид в растениях, растущих на свету, изучать довольно трудно, и поэтому пока нет практически никакой информации о синтезе пигментов и его регуляции в подобных системах. У растений разных видов или растущих в условиях разной освещенности отмечены вариации в размерах ССК и в составе входящих в него пигментов.
В ряде работ показано, что синтез и распад (turnover) хлорофиллов и каротиноидных пигментов продолжается и в зрелых, функционирующих хлоропластах, однако для более детальной характеристики этих процессов необходимы дальнейшие исследования.
10.10.3. Развитие хлоропластов у водорослей
Исследований, посвященных развитию хлоропластов у водорослей, известно немного. Чрезвычайно удобным объектом оказалась Euglena gracilis, поскольку она образует нормальные хлоропласты только на свету. В клетках же, растущих в темноте, содержатся пропластиды (структуры, сходные с этиопластами растений), которые на свету превращаются в функционирующие хлоропласты. Первые 12 ч освещения представляют собой индукционный период, в ходе которого происходит перенос энергии, небольших молекул, восстановительных эквивалентов и, наконец, закодированных в ядре белков в развивающуюся пластиду, в частности из митохондрий, где происходит индуцируемый светом распад запасного углевода парамилона. Между 12 и ~96 ч сама пластида обладает высокой активностью, и в это время в ней образуется большинство хлоропластных ком-
24— S4
362
Часть II. Функциональные аспекты
понентов, в том числе хлорофиллы и каротиноидные пигменты. Функционирование пластидного и непластидного компартмен-тов клетки, по-видимому, координируется двумя разными фоторецепторами. Один из них, вероятно, представляет собой сине-красный фоторецептор, сходный с протохлорофиллидом. Между растущей в темноте Euglena и молодыми этиолированными высшими растениями имеется большое сходство в характере синтеза протохлорофиллида, в организации пропластид и в фотопревращениях, с которых начинается развитие пластид.
Зеленые водоросли, особенно Chlorella, Scenedesmus и Chlamydomonas, изучались весьма широко. При росте на свету они имеют хлоропласты, сходные с хлоропластами высших растений, и содержат сходный набор фотосинтетических пигмен-
(10.21) ("Каротин
тов. Эти же пигменты, однако, содержатся и в культурах, растущих в темноте. При переносе культуры на свет не происходит массированного синтеза ни одного из хлоропластных компонентов, однако свет может быть необходим для фиксирования пигментов в фотосинтетических мембранах или частицах.
Было получено несколько мутантных штаммов водорослей, у которых при выращивании в темноте состав пигментов значительно отличается от состава у дикого штамма; у них может полностью отсутствовать хлорофилл, а биосинтез каротиноидов может быть блокирован на одной из ранних стадий, например на стадии ^-каротина (10.21). При освещении клеток некоторых из этих штаммов происходит нормальное образование хлоропластов, причем данный процесс в некоторых отношениях сходен с позеленением этиопластов. Это делает такие штаммы очень удобным объектом для изучения структурных изменений и превращений пигментов.
Успешно выращивают в темноте лишь несколько видов сине-зеленых водорослей (Cyanophyceae, или Cyanobacteria); в опытах с одним из них (Chlorogloea fritschii) были получены интересные результаты. У этого организма хлорофилл и каротиноидные пигменты синтезируются в темноте, но в фотосинтетические мембраны при этом не встраиваются. Для того чтобы это произошло, необходим свет.
Красные (Rhodophyceae) и сине-зеленые водоросли используют в качестве вспомогательных пигментов фикобилины. К сожалению, синтез этих соединений, так же как и образование
Гл. 10. Фотосинтез
363
фотосинтетических мембран, и особенно фикобилисом, подробно не изучался.
По-видимому, по крайней мере у некоторых видов, соотношение образующихся фикоцианина (Хтах^620 нм) и фикоэритрина (2vmaxc^565 нм) в фикобилинах в большой степени определяется спектральным составом падающего света. Так, на зеленом свету стимулируется синтез поглощающего в зеленой области красного пигмента фикоэритрина, в то время как на красном свету преобладает образование поглощающего красные лучи синего пигмента фикоцианина. Это обеспечивает максимальное поглощение доступного света данными вспомогательными пигментами.
10.10.4. Общая регуляция образования хлоропластов и синтеза пигментов
По-видимому, должен существовать общий механизм, который регулирует образование хлоропласта в целом. Как осуществляются при этом тонкие взаимодействия компонентов и их контроль, не известно, однако были обнаружены тесные генетические взаимосвязи между ними. Должны синтезироваться все компоненты, и все они должны быть доступны для включения в тилакоидные мембраны. В противном случае синтетические процессы подавляются. Например, действие некоторых гербицидов заключается в подавлении биосинтеза каротиноидов. Если этиолированные проростки или культуры водорослей Euglena, выращенные в темноте, обработать такими гербицидами, то нормальные каротиноиды хлоропластов не образуются и, следовательно, не включаются в фотосинтетические мембраны. В результате не синтезируются и другие компоненты хлоропластов, в том числе хлорофилл, и, следовательно, не происходит развития хлоропласта в целом. Даже если это было бы и не так, то подавление образования каротиноидов привело бы к тому, что весь синтезированный хлорофилл и зарождающиеся фотосинтетические мембраны оказались бы без защиты от фотоокисления (разд. 10.4.2) и разрушались бы. Поэтому гербициды, подавляющие биосинтез каротиноидов в растениях, очень эффективны.
10.11. Развитие фотосинтетического аппарата у фотосинтезирующих бактерий
Многие фотосинтезирующие бактерии, в том числе Rhodopseudomonas capsulata, R. palustris и R. sphaeroides, способны расти как в анаэробных условиях на свету, так и в аэробных условиях в темноте. Интенсивность освещения и пар-24*
364
Часть II. Функциональные аспекты
циальное давление кислорода являются главными факторами, управляющими развитием внутренних мембран и обеспечивающими оптимальное использование источника энергии. Так, в темноте аэробные условия вызывают увеличение количества синтезирующихся компонентов дыхательной электронтранспортной цепи и включение их в мембраны. Вместе с тем клетки, растущие на свету в бескислородной среде, синтезируют фотосинтетические мембраны и пигменты, причем максимального уровня синтез достигает при низких интенсивностях освещения, когда необходима наибольшая эффективность поглощения света.
Главным фактором, регулирующим развитие фотосинтетических мембран и синтез пигментов, по-видимому, является парциальное давление кислорода. Если оно выше определенного уровня, дыхание может происходить с достаточной эффективностью, но образования фотосинтетических мембран или синтеза пигментов при этом не наблюдается. Низкое парциальное давление кислорода стимулирует образование фотосинтетического аппарата и пигментов, в первую очередь реакционных центров и главного комплекса светособирающей антенны Р-875. В ответ на изменение интенсивности освещения изменяется и состав пигментов. Так, у Rhodopseudomonas spp., свет низкой интенсивности стимулирует синтез бактериохлорофилла и каротиноидов, поскольку происходит формирование вторичного комплекса светособирающей антенны Р-800-850. Свет высокой интенсивности подавляет формирование этого комплекса, и в результате содержание пигментов снижается. В случае Rhodospi-rillum rubrum, которая не содержит антенны Р-800-850, содержание пигмента главной светособирающей антенны Р-875 регулируется интенсивностью освещения. О том, как протекают и регулируются процессы, в ходе которых фотосинтетические пигменты образуются и включаются в мембраны, известно немного. Гены, контролирующие синтез хлорофилла и каротиноидов, а также, возможно, развитие активного фотосинтетического аппарата в целом, локализованы в хромосоме (но не в плазмиде) и расположены очень близко друг к другу. В кодировании фотосинтетического аппарата может участвовать одна большая генетическая единица.
10.12. Дальнейшая судьба фотосинтетических пигментов в ходе разрушения хлоропластов
Фотосинтезирующие ткани высших растений могут прекращать свою фотохимическую активность по разным причинам Наиболее известны две из них — старение листьев осенью и со
Гл. 10. Фотосинтез
365
зревание плодов. В этих случаях хлоропласты прекращают функционировать и либо разрушаются, либо превращаются в хромопласты.
10.12.1. Распад хлоропластов в листьях
У большинства деревьев осенью листья изменяют свою окраску с зеленой на желтую, красную или коричневую и опадают с ветвей. Этот процесс включает распад хлоропластов и разрушение хлорофилла. Подробно механизм разрушения хлорофилла пока не изучен. Известно лишь, что на ранних стадиях его распада теряются фитол и атом магния, в результате чего образуется феофорбид (10.22). Порфириновая система колец затем расщепляется с образованием бесцветных соединений, имеющих сравнительно небольшую молекулярную массу.
Хлоропластные каротиноиды целиком не теряются, о чем свидетельствует желтая окраска старых листьев. |3-Каротин в заметной степени окисляется через эпоксиды и апо-каротинали, а ксантофиллы этерифицируются жирными кислотами. Ярко-красная окраска некоторых осенних листьев обусловлена интенсивным синтезом в ходе старения антоцианов (гл. 4). Этот процесс, однако, к распаду хлоропластов непосредственного отношения не имеет.
10.12.2. Созревание плодов
Незрелые плоды имеют обычно зеленую окраску и содержат функционирующие хлоропласты. Во многих случаях, когда плоды созревают, хлоропласты превращаются в нефотосинтезирующие хромопласты. По мере потери хлоропластами фотосинтетической активности разрушается и хлорофилл. Иногда разрушаются и хлоропластные каротиноиды, но часто вместо них образуется гораздо большее количество других каротиноидов, которые и придают окраску зрелым плодам. Хорошо известным примером такой замены служат плоды томата, которые приобретают красную окраску в результате интенсивного синтеза ликопина (10.23).
10.13. Заключение и комментарии
Процесс фотосинтеза чрезвычайно важен для жизни на нашей планете, поскольку он осуществляет утилизацию имеющейся в изобилии солнечной энергии в химически доступную форму путем фиксации СОг с образованием углеводов. Пигменты, и в первую очередь хлорофилл, играют главную роль в фотосинтезе, и поэтому данный процесс еще долго будет оставить-
366
Часть II. Функциональные аспекты
ся основной областью исследования пигментов. В настоящее время много внимания уделяется механизму и регуляции синтеза пигментов, включению их в фотосинтетические мембраны, ориентации молекул пигментов в фотосинтетическом аппарате и молекулярным превращениям, которые происходят в течение очень кратковременных первичных фотореакций. Более подробная информация о механизмах фотосинтеза позволит создать простые модельные системы, которые могут быть использова-
соон
(10.22) Феофорбид
(10.23) Ликопин
ны для улавливания и утилизации солнечной энергии. По мере того как пища и традиционные источники энергии в виде полезных ископаемых будут становиться все менее доступными, возникает задача увеличения продуктивности фотосинтеза. Определенные успехи в этом направлении уже достигнуты. Так, в Бразилии такие высокоурожайные культурные растения, как сахарный тростник, используются для получения сахара, из которого затем производят этанол, добавляемый в горючее для двигателей внутреннего сгорания. Фиксированный посредством фотосинтеза углерод, вероятно, заменит каменный уголь и нефть в качестве главного источника сырья для химической промышленности. Одноклеточные водоросли уже широко применяются в качестве богатых витаминами и минеральными веществами питательных кормовых добавок для животных. Интенсивно изучаются с целью получения источников водорода
Гл. 10. Фотосинтез
367
системы, содержащие хлоропласты, гидрогеназы и другие катализаторы. Совершенно очевидно, что в основе успешного осуществления подобных программ должно лежать детальное знание механизма поглощения света фотосинтетическими пигментами.
10.14. Рекомендуемая литература
Литература, посвященная фотосинтезу, огромна; число оригинальных статей, публикуемых ежегодно, насчитывает тысячи наименований. Обзорные статьи и книги также имеются в изобилии, так что здесь могут быть упомянуты лишь некоторые из них. Для неспециалистов могут оказаться полезными такие источники вводного характера, как книги Рабиновича и Го-винджи (Rabinowitch, Govindjee, 1969) и Грегори (Gregory, 1977), Более подробное общее описание читатель найдет в очень авторитетной книге под редакцией Говинджи (Gowindjee, 1975). Чрезвычайно полезными и всеобъемлющими являются пятый и шестой тома из серии «Encyclopaedia of plant physiology» под редакцией Требста и Эврона (Trebst, Avron, 1977) и Гиббса и Латцко (Gibbs, Latzko, 1979) соответственно. Недавно появившаяся серия книг под редакцией Барбера включает тома, посвященные хлоропластам (т. 1, 1976), фотосинтезу (т. 2, 1977) и модельным системам, связанным с фотосинтезом и продуцированием энергии (т. 3, 1979). Все аспекты проблем, связанных с хлоропластами растений и водорослей, включая их структуру, ультраструктуру и развитие, охватывает обширная монография Кирка п Тилни-Бэссета (Kirk, Tilney-Bassett, 1978). Детали развития хлоропластов и фотосинтетического аппарата служат предметом другой книги — под редакцией Акоюноглу и Арджироуди-Акоюноглу (Akoyunoglou, Argyroudi-Akoyunoglou, 1978). Фотосинтез и фотосинтетические пигменты бактерий подробно обсуждаются в монографии по фотосинтезирующим бактериям (Clayton, Sistrom, 1978). Доклады на проходящих раз в три года Международных конгрессах по фотосинтезу (Metz-пег, 1969; Forti et al., 1972; Avron, 1975; Hall et al., 1978; Akoyunoglou, 1981) дают представление о текущей работе в сотнях лабораторий по всему миру, изучающих фотосинтез. Многие методы общего характера, наиболее полезные при исследовании фотосинтеза, описаны в двух томах «Methods in enzymology» (San Pietro, 1971, 1972).
10.15. Дополнительная литература
Akoyunoglou G. (ed.) (1981). Proceedings of the 5th International Congress on Photosynthesis, Philadelphia, Balaban International Science Services.
Akoyunoglou G., Argyroudi-Akoyunoglou J. H. (eds.) (1978). Chloroplast development, Amsterdam, Elsevier.
368
Часть II. Функциональные аспекты
Avron М. (ed ) (1975). Proceedings of the 3rd International Congress on Photosynthesis, Amsterdam, Oxford and New York, Elsevier.
Barber J. (ed.) (1976). The intact chloroplast. (Topics in photosynthesis, vol. 1), Amsterdam, Oxford and New York, Elsevier-North-Holland.
Barber J. (ed.) (1977). Primary processes of photosynthesis. (Topics in photosynthesis, vol. 2), Amsterdam, Oxford and New York, Elsevier-North Holland.
Barber I. (ed.) (1979). Topics in relation to model systems (Topics in photosynthesis, vol. 3), Amsterdam, Oxford and New York, Elsevier-North Holland.
Clayton R K., Sistrom W. R. (eds.) (1978). The photosynthetic bacteria, New York, Plenum.
Fortt G., Avron M.. Melandri A. (eds.) (1972). Proceedings of the 2nd International Congress on Photosynthesis Research, The Hague, Junk N. V.
Gibbs M„ Latzko E. (eds.) (1979). Photosynthesis II: Photosynthetic carbon metabolism and related processes. (Encyclopaedia of plant physiology, vol. 6), Berlin, Heidelberg and New York, Springer-Verlag.
Govindjee (ed.) (1975). Bioenergetics of Photosynthesis, New York, San Francisco and London, Academic Press.
Gregory R. P. F. (1977). Biochemistry of photosynthesis, 2nd edition. Chichester, New York, Brisbane and Toronto, Wiley.
Hall D. 0, Coombs I., Goodwin T. W. (eds.) (1978). Proceedings of the Fourth International Congress on Photosynthesis, London, The Biochemical Society.
Kirk J. T. 0., Tilney-Bassett R. A. E. (1978). The plastids: their chemistry, structure, growth and inheritance, 2nd edition, Amsterdam, New York and Oxford, Elsevier-North Holland.
Metzner H. (ed.) (1969). Progress in photosynthesis research, Tubingen, Laupp.
Rabinowitch E., Govindjee (1969). Photosynthesis. New York, London, Sydney and Toronto, Wiley.
San Pietro A. (ed ) (1971). Photosynthesis, Part A. (Methods in enzymology, vol. 23), New York and London, Academic Press.
San Pietro A. (ed.) (1972). Photosynthesis and nitrogen fixation, Part B. (Methods in enzymology, vol. 24), New York and London, Academic Press.
Trebst A., Avron M. (eds.) (1977). Photosynthesis I: Photosynthetic electron transport and photophosphorylation (Encyclopaedia of plant physiology, vol. 5), Berlin, Heidelberg and New York, Springer-Verlag.
Глава 11
Другие фотофункции природных пигментов
11.1. Введение
Предыдущие главы второй части настоящей книги были посвящены основным аспектам функционирования природных пигментов — окрашиванию тканей, процессу зрения и фотосинтезу. Однако существует много других функций, связанных со светопоглощающими свойствами пигментных молекул, правда, эти функции не так широко распространены, не имеют столь фундаментального значения и не так хорошо изучены, как рассмотренные в гл. 8—10. Особенности некоторых из этих фотофункций пигментов будут описаны в данной главе.
11.2. Фитохром
11.2.1. Введение
Многие аспекты роста и морфологии растений регулируются светом. Большинство (если не все) реакций растений на свет опосредованы одним чрезвычайно важным фоторецепторным пигментом — фитохромом, который содержится в клетках в очень небольших количествах. В структурном отношении фитохром представляет собой белок, имеющий в качестве про-стетической группы (и хромофора) линейный тетрапиррол (би-лин). Детали структуры и свойств фитохрома приведены в гл. 5 (рис. 5.16).
Существуют взаимно переходящие друг в друга формы фитохрома. Одна из них—Рг — поглощает красный свет Umax=660 нм) и превращается при этом в другую форму — Pfr. Форма Pfr поглощает свет в дальней красной части спектра (Хтах=730 нм) и в результате превращается опять в Реформу. Эти две формы функционируют как переключающий механизм. В большинстве случаев активной формой, или «включателем», который инициирует физиологические процессы, служит Pfr-форма. Так, когда красный свет с длиной волны ~ 660 нм поглощается Реформой, образуется Pfr-форма, что стимулирует многие фотореакции, например развитие цветков. Однако, если вслед за освещением красным светом следует вспышка даль-
370 Часть II Функциональные аспекты
него красного света с длиной волны ~730 нм, то Реформа превращается в неактивную форму Рг, и поэтому светозависимый процесс будет предотвращен.
Что касается того, будет или нет протекать светозависимая реакция, то это определяется спектром света, которым освещали растение последний раз. Так, после последовательного освещения дальним красным, красным, дальним красным и снова красным светом фитохром останется в Pfr-форме и будет, следовательно, инициировать ответную реакцию. Вместе с тем после освещения красным, дальним красным, красным и опять дальним красным фотореакция не инициируется, поскольку последним в данной цепи было освещение дальним красным светом и фитохром остался в неактивной Рг-форме. Для того чтобы фотореакция произошла, необходимо освещение красным светом в течение очень короткого промежутка времени (порядка нескольких секунд или даже менее) хотя бы части растения (например, одного листа). Действие красного света в некоторых случаях может быть сведено на нет обработкой дальним красным светом даже по прохождении значительного времени (2—3 ч).
11.2.2. Распространение и локализация
Фитохромные системы обнаруживаются во всем растительном царстве: у высших растений, мхов, папоротников и водорослей, правда, более-менее подробно они изучены только у высших растений. У многих высших растений фитохром сосредоточен в некоторых специфических тканях. Например, в этиолированных проростках овса высокие концентрации фитохрома обнаружены в паренхиме и в эпидермальных клетках, расположенных несколько ниже (на 0,1 —1,5 мм) верхушки колеоптиля, в то время как в самом ее кончике пигмент отсутствует. Внутри клетки фитохром (в Реформе) связан с ядерной оболочкой, а также содержится в таких органеллах, как митохондрии, амилопласты, этиопласты и хлоропласты. По-видимому, Pfr-форма более прочно, чем Реформа, ассоциирована с мембранными структурами, в которых, как предполагают, находятся дискретные рецепторные участки. Не исключено также наличие внутри клетки различных фондов фитохрома. Протекание фотореакции обусловлено, возможно, лишь небольшим количеством прочно связанной Pfr-формы фитохрома, в то время как большая часть фитохрома в Реформе остается в свободном виде (не связанной с рецепторными участками) и в инициировании фотореакции непосредственно не участвует.
Гл, И. Другие фотофункции природных пигментов 371
11.2.3. Примеры процессов, контролируемых фитохромом
Из многих фотореакций, опосредованных фитохромом, лучше всего изучены, вероятно, инициация цветения, прорастание семян и позеленение этиолированных тканей. В первом случае очень кратковременное освещение даже части растения (одного листа) светом требуемой длины волны инициирует реакцию, для завершения которой необходимо несколько недель. Ясно, что при этом происходит экспрессия новой генетической информации. В природных условиях начало цветения определяется длиной дня, или, говоря более точно, продолжительностью темнового периода. Так, у растений короткого дня цветение начинается в условиях длинной ночи и короткого дня, в то время как для растений длинного дня необходимы прямо противоположные условия — длинный световой и короткий темновой период. В обоих случаях фитохром является фоторецептором, который опосредует реакцию.
Прорастание семян в большинстве случаев стимулируется образующимся на красном свету Pfr-фитохромом, однако в некоторых случаях свет может подавлять этот процесс.
Кратковременное освещение красным светом этиолированных проростков влечет за собой глубокие изменения. Последние выражаются в том, что увеличиваются размеры листьев, ткани приобретают зеленую окраску (обусловленную синтезом хлорофилла и других хлоропластных компонентов), а запасы крахмала интенсивно утилизируются до начала активного фотосинтеза.
У различных растений фитохромная система используется также как регулятор состояния покоя и старения, роста корней, движения листьев и общего поддержания внешнего вида в процессе роста.
11.2.4. Способ функционирования фитохрома
Было предпринято много попыток объяснить действие фитохрома и предлагались различные модели его функционирования. Ясно одно: первичным событием является поглощение света, вызывающее возбуждение фитохрома, в результате чего происходит превращение Реформы в Pfr-форму и наоборот (рис. 5.16). Изменения конформации фитохромного белка при этом, по-видимому, невелики, однако различия в прочности связывания между фитохромом и мембранными структурами для двух форм могут быть значительными.
В недавних исследованиях с применением низких температур и флеш-фотолиза обнаружены промежуточные формы между Р1г и Рг с различными максимумами поглощения. На осно
372
Часть II. Функциональные аспекты
вании полученных результатов была предложена схема, описывающая их взаимопревращения (рис. 11.1). Эту циклическую схему пока еще нельзя интерпретировать на молекулярном уровне. Показано, что среди ее компонентов встречаются цис-изомеры билинового хромофора [например, (11.1)], и предпо-
Рис. 11.1. Цикл взаимопревращений двух форм фитохрома (приводится с учетом обнаруженных к настоящему времени промежуточных соединений). Вероятно, имеют место также и альтернативные параллельные пути превращения. Нижние индексы у прописной буквы Р соответствуют максимумам поглощения света промежуточными формами фитохрома. Ры и Рх — слабо поглощающие формы. Реакции, помеченные буквой «т», являются темновыми.
лагают, что наряду со структурными изменениями, показанными на рис. 5.16, происходят и изменения конформации белка. В какой-то степени взаимопревращения двух форм фитохрома могут происходить и в темноте. При этом Реформа образуется
непосредственно из Ри-формы, в то время как Pfr-форма, вероятно, образуется из промежуточного продукта Peso, а не из Рг-формы.
Прорастание семян очень часто происходит в темноте, так что регуляция этого процесса фоторецепторным фитохромом на
Гл. It. Другие фотофункции природных пигментов
373
первый взгляд кажется парадоксальной. Вероятно, это можно объяснить тем, что фитохром «консервируется» в Pfr-форме во время созревания семян. Затем в соответствующее время семена поглощают воду, ткани оводняются и Pfr-фитохром начинает активно функционировать.
Полагают, что действие фитохрома опосредуется веществами с гормональной активностью, такими, как цикло-АМР
А Короткий день
День Вечерние сумерки Ночь Утренняя заря День
Солнечный сеет Красный, дальний красный - 3 1 Красный: дальний красный -0,7:1 Темнота Красный: дальний красный - 0,7:1 Красный: дальний красный - 3.1
Б Длинный день
День
Вечерние сумерки
Ночь
Утренняя заря
День
Солнечный свет
Красный; дальний красный - 3 1
Красный; дальний красный - 0,7:1
Темнота
Красный: дальний красный - 0.7:1
Красный: дальний красный /^>3:1
Преобладает Pfr-
‘Преобладает РГ'
Преобладает Pfr
Рис. 11.2. Преобладающие формы фитохрома при разной длине дня. А. Короткий день/длинная ночь. Б. Длинный день/короткая ночь
(сАМР), ацетилхолин или различные ростовые вещества растений. В разных тканях, однако, существует много различных реакций, регулируемых фитохромной системой. Некоторые из них могут протекать очень быстро (за несколько секунд или даже быстрее), другие же — значительно медленнее (за несколько часов, дней или даже недель). По-видимому, фитохром осуществляет свое действие с помощью нескольких разных механизмов. К таким механизмам можно отнести влияние на 1) ионные потоки, 2) биоэлектрические потенциалы, 3) проницаемость мембран или 4) активность дыхания. Однако все они являются гипотетическими, и в настоящее время данных, подтверждающих какой-либо из них, далеко не достаточно.
Детали действия фитохрома были установлены главным образом при изучении влияния на него красного и дальнего красного света, но нельзя забывать, что в природных условиях
374 Часть II. Функциональные аспекты
растения либо находятся в темноте, либо освещаются белым светом. Свет с длиной волны между ~500 и 700 нм обеспечивает равновесие, при котором преобладает Pfr-форма (~80% всего фитохрома), в то время как свет с длинами волн вне этого диапазона приводит к равновесию, в котором преобладает Pr-фитохром. Поэтому большое значение имеют изменения спектрального состава падающего света, происходящие в течение дня. Так, на протяжении большей части дня соотношение энергий красных и дальних красных лучей в солнечном свете составляет ~3: 1, что благоприятствует превращению Рг—>Pfr. Однако в сумерки и в темноте это соотношение снижается до 0,7: 1 (т. е. преобладает дальний красный свет) и фитохромное равновесие сдвигается в сторону Реформы. Таким образом, в условиях длинного дня в продолжение большего периода времени в избытке будет содержаться Pfr-форма, в то время как при коротком дне (и длинной ночи) более длительное время будет доминировать образующийся в сумерках Рг-фитохром (рис. 11.2). Этим можно объяснить хорошо известное влияние продолжительности дня на процессы роста у растений. Подобные эффекты, а также другие возможные суточные ритмы должны приниматься во внимание при оценке действия фитохрома в природной среде обитания растений.
11.3. Фототаксис
Фототаксисом называют индуцированное светом направленное движение или изменение движения либо всего организма, либо отдельных клеток или органелл. Индуцированное движение обычно зависит от направления падающего света и может быть «положительным» (направленным к свету) или «отрицательным» (от света). Интенсивность освещения может также влиять на скорость движения; такое явление называется фотокинезом.
Многочисленные примеры фототаксиса были обнаружены у водорослей, динофлагеллят, грибов и бактерий; описано также зависимое от света движение хлоропластов в клетках водорослей. Предполагают, что у разных организмов в фотореакциях принимают участие сразу несколько пигментов или групп пигментов, действие которых обусловлено их спектрами действия. В число таких пигментов входят хлорофилл, бактериохлорофилл, каротиноиды, билипротеины, фитохром и рибофлавин. К сожалению, более подробная их идентификация пока не проводилась.
Фототаксис изучали у многих видов, в частности у одноклеточных водорослей и динофлагеллят, но наиболее распространенным объектом была Euglena gracilis. При постоянном
Гл. 11, Другие фотофункции природных пигментов 375 однородном освещении клеток или в темноте никакой фотореакции не наблюдается. Фотостимуляция Euglena происходит в ответ на изменение интенсивности освещения выше или ниже некоторого порогового значения. Нормальная реакция на свет у Euglena — положительная, т. е. клетки движутся в направлении источника света (интенсивность освещения при этом возрастает) так, чтобы достигалось наибольшее образование энергии в результате фотосинтеза. Однако свет очень высокой
Рис. 11.3. Схематическое изображение клетки Euglena gracilis (длина 40— 50 мкм).
интенсивности, который может быть опасным, вызывает отрицательный фототропный эффект.— наблюдается характерное движение клеток от источника света.
На рис. 11.3 схематически изображена клетка Euglena. С фотодвигательной реакцией связаны две области клетки — область собственно фоторецептора (парафлагеллярное тело), а также стигма («глазок»). Фоторецептор получает максимальное количество света в том случае, если клетка ориентирована таким образом, что падающий свет направлен прямо вниз в отверстие, или так называемую «глотку». Чтобы достичь этого, и происходит соответствующее движение, или ориентация клеток. Первичный фоторецептор в парафлагеллярном теле состоит из упорядоченных флавиновых молекул. Механизм фотореакции и путь, с помощью которого в результате поглощения света происходит двигательная реакция, пока еще не известны.
Стигма также играет важную, хотя и не главную роль в фототактической реакции. Она содержит высокие концентрации каротиноидов, которые служат экранирующими пигментами. Поскольку движение Euglena имеет сложный характер и
376
Часть II. Функциональные аспекты
включает вращение, пигментированная стигма периодически заслоняет фоторецептор от света. Считают, что это регулирует выпрямление и движение жгутика и таким путем контролируется направление движения.
11.4. Фототропизм
Фототропизм — это индуцируемый светом рост или образование изгибов у растений и грибов, происходящие обычно в направлении источника света (положительный фототропизм), а иногда и от него (отрицательный фототропизм). Очевидно, что и в этом случае происходит поглощение света фоторецепторным пигментом. Спектры действия, определенные для многих фототропных реакций, имеют максимумы при 450—460 нм и очень напоминают спектры поглощения р-каротина (11.2) и рибофлавина (И.З). После продолжительных дискуссий в настоящее время пришли к тому, что рибофлавин в большей степени, чем p-каротин, удовлетворяет требованиям фоторецепторного пигмента, и почти несомненно именно он используется в качестве фоторецепторного компонента.
(112) 3 Каротин
(113) Рибофлавин
В молодых тканях высших растений фототропные реакции влияют на характер роста. Свет поглощается рибофлавином, в результате чего происходит либо разрушение ауксина (индо-лил-3-уксусной кислоты) на свету, либо его удаление из освещенной области. В результате затененная сторона растения имеет возможность больше удлиняться и побег или стебель изгибаются в направлении света. В зрелых тканях растений фототропные реакции обусловлены изменениями тургора под действием света.
Гл. 11. Другие фотофункции природных пигментов 377
При перемещении или росте грибных гиф в направлении света фоторецепторным пигментом также служит рибофлавин, тогда как ауксин в этом не участвует. В некоторых недавно опубликованных сообщениях высказывается предположение о-том, что первичный рибофлавиновый фоторецептор образует комплекс с белком и с антенной из каротиноидных молекул, которая повышает эффективность улавливания света.
11.5. Бактериородопсин
Некоторые галофильные бактерии способны использовать энергию света для образования АТР с помощью процесса, который не похож на фотосинтез у растений или бактерий. В частности, H.halobium используют для образования АТР обычное аэробное дыхание, если имеется в достаточном количестве необходимый для этого кислород. В условиях же нехватки кислорода в клеточной мембране этих бактерий появляются специфические пурпурные образования, так называемые заплаты (patches). Пигмент, обусловливающий их пурпурную-окраску, представляет собой белок бактериородопсин. Последний служит фоторецептором в процессе превращения энергии света в протонный градиент, который в свою очередь является движущей силой синтеза АТР с помощью хемиосмотического механизма. Фоточувствительная пурпурная мембрана состоит из липопротеинового матрикса, причем с помощью дифракции рентгеновских лучей показано, что молекулы бактериородопсина расположены в этой мембране в виде жесткой двумерной решетки.
Бактериородопсин, представляющий собой липопротеин с мол. массой 26 000, сходен со зрительными пигментами глаза. В качестве простетической группы он содержит ретинальдегид, связанный в виде протонированного шиффова основания (или альдимина) с е-аминогруппой лизинового остатка белка (11.4). Адаптированная к темноте фотореактивная пурпурная форма бактериодопсина имеет Хтах —560 нм и, по-видимому, состоит из смеси двух видов, включающих полностью транс- и 13-цис-ретинальдегидные хромофоры, которые поглощают соответственно при 570 и 550 нм. Эти виды содержатся в соотношении 1 : 1 и принимают участие в двух различных, хотя и необязательно независимых, фотоциклах. Один из них, для транс-формы, изучен лучше. Его главная особенность заключается в том, что поглощение света приводит к обесцвечиванию хромофора и образованию формы с Zmax = 410 нм (М4ю), в которой альди-мин больше не протонирован (11.5). Ее хромофор, видимо, имеет 13-цис-конформацию; вполне вероятны и другие конформационные изменения, касающиеся одинарных или двойных
25-84
378
Часть II. Функциональные аспекты
связей. Было также показано, что виды бактериородопсина, поглощающие при 625, 610 и 550 нм, представляют собой короткоживущие (10-12—10-6) промежуточные продукту при образовании М4ю. Предполагают, что между ними и видами, поглощающими при 520 и 640 нм, возможны взаимные переходы. Образование М4ю из транс-бактериородопсина происходит с потерей протона протонированным альдимином, тогда как для регенерации бактериородопсина из М4ю необходимо поглощение протона. Эти-то направленные чередующиеся потеря и поглощение протонов и создают протонный градиен!'.
(11 4) Протонлров<1чмп^ форм. альдмммновои связи ретинальдегида с лизином
(115) Henpoiончрованная ферма альдиминовои связи ретинальдегида с лизином
В настоящее время даже приблизительно невозможно определить последовательность событий в фотоцикле 13-цис-бакте-риородопсина; известно лишь, что при этом несомненно происходит г{пс-транс-изомеризация. Вероятно также, что существуют точки, перекрестно связывающие два цикла, однако более подробные данные об этом отсутствуют.
Между фотоциклами бактериородопсина и зрительного пигмента родопсина (гл. 9) существуют два фундаментальных различия. Во-первых, в случае бактериородопсина ретинальде-гидный хромофор никогда не отделяется от белка и альдими-новая связь остается все время интактной. Во-вторых, кинетика фотоцикла молекулы транс-бактериородопсина зависит от того, происходят ли фотоциклические изменения и у ближайших соседних с ней молекул.
Образование АТР в бактериородопсиновых циклах служит одним из лучших примеров функционирования хемиосмотиче-
Гл 11 Другие фотофункции природных пигментов
379
ского механизма. Существенной особенностью действия бактериородопсина является установление протонного градиента. Свет индуцирует депротонирование протонированной альдими-новой группы бактериородопсина, и образующийся при этом обесцвеченный пигмент впоследствии вновь протонируется в ходе темновой реакции Выделение и поглощение протонов происходит в строго определенном направлении: потеря протона происходит с наружной, а поглощение протона — с внутренней стороны мембраны. Таким образом, через мембрану устанавливается градиент протонов и заряда, который и используется в качестве движущей силы для синтеза АТР из ADP, катализируемого АТРазой (ср. с фотосинтетическим фосфорилированием, гл. 10).
Функционирование бактериальной пурпурной мембраны вызывает неослабевающий интерес. Это связано с тем, что в его основе лежит относительно простой механизм улавливания энергии света без участия хлорофилла, а рецепторный пигмент, бактериородопсин, сходен со зрительными пигментами животных.
11.6. Внеглазные фоторецепторы у животных
11.6.1. Введение
В настоящее время не вызывает сомнений, что у многих животных сетчатка глаза является не единственной светочувствительной тканью. Внеглазные фоторецепторы обнаружены к настоящему времени у многих видов как позвоночных, так и беспозвоночных животных. Эти фоторецепторы не позволяют животному «видеть», как это происходит при истинном зрении, когда животное способно воспринимать образ, а также быстро распознавать форму, положение и перемещение объекта в пространстве. Однако они принимают участие в опосредовании долговременных эффектов, которые зависят от изменений общей интенсивности освещения. Примерами процессов, которые регулируются светом, детектируемым внеглазными рецепторами, могут служить поддержание суточных ритмов и ритмов с более длинными периодами (лунных) изменения окраски в ответ на изменения освещенности фона (посветление или потемнение кожи) и изменения сроков метаморфоза (влияние на диапаузу у некоторых насекомых). Тот факт, что реакция на интенсивность освещения осуществляется не с помощью глаз, а каким-то иным путем, можно подтвердить тем, что эта реакция не подавляется и не ослабляется у ослепленных животных. Фоточувствительные ткани могут быть локализованы в специфических органах, таких, как глазки (стигмы) и эпифиз, либо 25*
380
Часть II. Функциональные аспекты
.фоточувствительность может проявлять наружный покров в целом. Ниже мы приведем несколько примеров, однако следует отметить, что экспериментальных данных очень мало и ни в одном из исследованных случаев фоторецепторный пигмент не был убедительно идентифицирован. Скорее всего, существуют различные механизмы фотореакций, и маловероятно, чтобы они представляли собой сложные регенерационные циклы, подобные описанному в гл. 9 для родопсина.
11.6.2. Медиальный глазок беспозвоночных
Одним из наиболее высокоразвитых примитивных фоторецепторов является так называемый медиальный глазок многих членистоногих. Так, например, мечехвост Limulus ро-lyphemus обладает парой таких рецепторов, которые расположены на средней линии тела. Хотя эти органы представляют собой примитивные глазки, они снабжены хрусталиковыми структурами.
Чувствительность таких глазков на порядок ниже, чем у обычного (сложного) глаза, однако длины волн, при которых чувствительность максимальна, у них сходны (520—530 нм). Глазок имеет второй рецепторный пигмент с высокой чувствительностью к УФ-свету (370 нм). Считают, что пигменты глазиков принадлежат к родопсиновому типу.
11.6.3. Эпифиз и подобные ему ткани
Было показано, что у многих видов рыб и земноводных эпифиз или близко примыкающий к нему участок промежуточного мозга чувствительны к свету и оказывают влияние на регуляцию меланофорных реакций в механизмах изменения -окраски. Во многих случаях эпифиз ответствен за реакцию побледнения кожи; животные, у которых он удален, остаются темными. В отсутствие света реакция эпифиза состоит в том, что он выделяет гормон, опосредующий диспергирование меланина, в результате чего происходит потемнение тканей. Свет, уловленный эпифизом, подавляет эту реакцию, и происходит посветление тела.
Фоторецепторные структуры были найдены в эпифизе земноводных. Аналогичные структуры были обнаружены в родственных органах рептилий — в так называемом «лобном органе» и в «теменном глазу». Рецепторные клетки этих структур, по крайней мере внешне, сходны с фоторецепторами сетчатки и связаны с мозгом нервами. Природа пигментов в фоторецепторных структурах пока не выяснена.
Гл. 11. Другие фотофункции природных пигментов 381
В чем-то сходна с ними гардерова железа у новорожденных грызунов, которая, как считают, является внеглазным фоторецептором, контролирующим их циркадианные ритмы. Эта железа наряду со значительным количеством протопорфирина IX (11.7) содержит необычный, с тремя карбоксильными группами, порфирин (11.6). Напрашивается предположение, что эти порфирины представляют собой фоторецепторные пигменты, но оно пока не проверено.
11.6.4. Наружные покровы животных как фоторецептор
Известно, что у многих животных фоточувствительны наружные покровы, а иногда и более глубоко лежащие ткани. Особенно чувствительными могут быть некоторые специфические области тела, например сифон у двустворчатых моллюсков и асцидий. Явление фоточувствительности наружных покровов может быть продемонстрировано на животных, у которых удалены глаза, эпифиз и глазки, но которые все еще сохраняют способность к фотореакции; она исчезает лишь в том случае,
(11 6) Гардеропорфирин
(117) Протопорфирин IX
382
Часть II. Функциональные аспекты
если поверхность тела покрыть непрозрачной краской. Обычно в наружных покровах таких животных в значительном количестве содержатся каротиноиды, а иногда присутствуют и пигменты других классов. Однако специфические фоторецепторные клетки у них, как правило, отсутствуют, и это затрудняет локализацию и идентификацию фоторецепторных пигментов. Тот факт, что такой пигмент должен содержаться лишь в незначительном количестве, делает его идентификацию чрезвычайно трудной, поскольку он легко может быть замаскирован гораздо большими количествами главных пигментов наружных покровов. Исследования поведения животных и спектров действия пигментов позволили в некоторых случаях найти ключ
(11.8) ЭхинохромА
к установлению того, к какому классу пигментов принадлежит данное соединение.
Явление фоточувствительности наружных покровов обнаружено у отдельных представителей всех главных систематических групп беспозвоночных. По-видимому, оно часто встречается у водных животных, а у насекомых фоточувствительность играет важную роль в регуляции циркадианных ритмов.
Большинство доказательств (хотя и не очень строгих) свидетельствует в пользу того, что рецепторными веществами дермы являются каротиноиды или ретинальдегид-белковые комплексы. Зарегистрированные спектры действия, например максимумы чувствительности фоторецепторных пигментов некоторых двустворчатых моллюсков, усоногих раков и рыб, часто находятся в том же диапазоне, что и в случае родопсин — порфиропсина.
У некоторых морских звезд, голотурий и насекомых, а также у многих червей активными пигментами могут быть порфирины. Предполагают, что и рибофлавин может обладать полезной фотосенсибилизирующей функцией в наружных покровах голотурий и в покровах спинной стороны ракообразных.
В некоторых случаях в качестве фоторецепторов функционируют нервные клетки. Хорошо известный пример — генитальный ганглий у моллюска Aplysia. Нервные клетки этого ганглия содержат каротиноид и гемопротеин и поэтому очень чув-
Гл. И. Другие фотофункции природных пигментов
383
ствительны к свету именно тех длин волн, которые максимально поглощают эти пигменты. У других животных фоторецепторами могут служить пигменты других классов. Непосредственная фоточувствительность нервного тяжа у Branchiostoma приписывается наличию в нем меланина, а у иглокожего Diadema и у морской лилии Antedon наблюдаемые спектры действия указывают на присутствие хинона эхинохромового типа (11.8).
Эти примитивные фотореакции можно разделить на две главные группы: на явные трансформации и на более медленно протекающие реакции, подобные наблюдаемым при циркадианных циклах. В обоих случаях механизмы их действия пока не выяснены.
11.7. Фотозащита
11.7.1. Введение
До сих пор обсуждался вопрос о том, как свет с помощью различных механизмов используется живыми организмами с пользой для них, но не следует упускать из виду тот факт, что световая энергия может также наносить повреждения живым тканям. При поглощении света природным пигментом •его молекула переходит в нестабильное и короткоживущее возбужденное состояние с повышенным уровнем энергии. Этот .избыток энергии обычно используется в организме; например, •он обеспечивает синтез АТР (в фотосинтетическом транспорте электронов) или образование нервного импульса, вызывающего ответную реакцию. Примерами такого использования света служат различные фотофункции природных пигментов, рассмотренные в данной книге.
Однако энергия, уловленная в возбужденных молекулах, может также вызывать повреждения, осуществляя нежелательные химические реакции, которые могут привести к разрушению живых тканей. Различные природные пигменты (особенно порфирины) могли бы служить сенсибилизаторами для катализируемых светом повреждений, особенно в присутствии кислорода, если бы не было соответствующего защитного механизма. Вредное действие на ткани может оказывать не только видимый свет. Ультрафиолет высокой интенсивности поглощается белками и нуклеиновыми кислотами и потенциально способен повреждать эти жизненно важные молекулы.
Одна из наиболее существенных функций многих природных пигментов, главным образом каротиноидов и меланинов, заключается в защите жизненно важных тканей от фотодинамического и в первую очередь фотоокислительного повреждения. Подробно описаны три случая такого фотозащитного дей
384
Часть II. Функциональные аспекты
ствия. На двух из них — роли каротиноидов в защите бактерий от фотоокисления и предотвращении развития фотоинду-цированных повреждений у животных—-мы остановимся ниже. О третьем случае — фотозащите фотосинтетических тканей — уже упоминалось в гл. 10.
11.7.2. Восстановление ДНК, поврежденной УФ-излучением
ДНК кодирует генетическую информацию, которая определяет практически все структуры и функции самих клеток, а также организма, частью которого они являются. Повреждение молекулы ДНК ведет к изменению информации, закодированной в последовательности ДНК и потому может иметь ужасные последствия, если не будет исправлено. Поскольку число молекул ДНК в клетке невелико, а величина этих молекул огромна, существует большая опасность их повреждения химическими веществами, излучением и т. п. Особенно хорошо изучено действие УФ-лучей. Нуклеиновые кислоты погло
УФ-свет (260 нм)
Фермент / свет (300-500 нм)
Тиминовые основания
Рис. 11.4. Димеризация соседних тиминовых оснований в ДНК и обращение этого процесса под действием фотоактивируемого репарнрующего фермента.
(11.9) Тиминовый "циклобутановый димер
щают УФ-излучение с Х=260 нм, которое может вызвать в их молекулах структурные изменения. В основном при этом происходит (рис. 11.4) димеризация в ДНК соседних пиримидиновых оснований (обычно остатков тимина) с образованием так называемых «циклобутановых продуктов» (11.9). В результате димеризации нарушаются нормальные водородные связи между цепями и, следовательно, разрушается структура двойной спирали в этом участке макромолекулы.
К счастью, клетки имеют ряд защитных механизмов, посредством которых они могут восстанавливать повреждения в цепях ДНК. В частности, для исправления повреждений,
Гл. 11. Другие фотофункции природных пигментов 385
вызываемых различными воздействиями, в том числе и УФ-из-.лучением, используется механизм репарации путем выщепле-ния, в ходе которого небольшой участок поврежденной цепи ДНК удаляется и замещается новосинтезированным неповрежденным участком. Многие клетки, главным образом бактериальные (но также и клетки человека) используют для репарации ДНК механизм фотореактивации, с помощью которого повреждение может быть исправлено без расщепления молекулы ДНК. При этом с молекулой ДНК, содержащей пиримидиновый димер, связывается фермент. В результате поглощения света (300—500 нм) комплексом фермент —ДНК фермент активируется и восстанавливает поврежденный участок молекулы, расщепляя димеры с образованием нормальных пиримидиновых оснований.
11.7.3. Защита от фотоокисления у бактерий
Известно много случаев, когда бескаротиноидные мутанты бактерий (в норме образующих каротиноиды) гибнут в результате совместного действия света и кислорода, в то время как окрашенные организмы, принадлежащие к дикому типу, в тех же условиях повреждений не получают. Защитное действие каротиноидов было продемонстрировано на примере как фотосинтезирующих, так и нефотосинтезирующих бактерий.
Фотозащитным действием обладают лишь те каротиноиды, которые поглощают в видимом диапазоне (>400 нм), т. е. для такого действия необходим хромофор, содержащий по крайней мере восемь сопряженных двойных связей. Возможно, что в некоторых случаях каротиноиды в клеточной оболочке осуществляют защиту клетки, отфильтровывая свет опасных длин волн, однако обычно они более непосредственно участвуют в процессе фотосенсибилизации.
Фотодинамическая гибель бактерий наблюдается при наличии света, кислорода, а также эндогенного или экзогенного фотосенсибилизатора. Свет поглощается сенсибилизирующим пигментом, который подвергается межсистемным превращениям и переходит в более долгоживущее, но все еще высокоэнергетическое триплетное состояние. Пигмент в таком состоянии способен передавать избыток энергии молекулярному кислороду, переводя его в высокореакционноспособное синглетное состояние (‘Ог). Образовавшийся синглетный кислород может окислить любую подходящую акцепторную молекулу, например молекулу ненасыщенной жирной кислоты. При этом образуются перекиси, которые могут вызвать обширные, а иногда и летальные повреждения чувствительных внутриклеточных процессов.
386
Часть II. Функциональные аспекты
Каротиноид может нарушить эту последовательность событий, выступая в роли либо предпочитаемого субстрата окисления, либо акцептора избытка энергии триплетного сенсибилизатора или Ю2.
Образующийся при этом триплетный каротиноид распадается, не вызывая нарушений. Подобный защитный механизм очень сходен с описанными механизмами защиты фотосинтетических мембран (разд. 10.4.2), показанными на рис. 10.8.
Защита от фотоокисления, вероятно, является главной функцией каротиноидов у нефотосинтезирующих микроорганизмов. В организмах некоторых примитивных животных для защиты от фотоокисления используются сходные механизмы.
Возможно, у некоторых организмов и в некоторых тканях аналогичную фотозащитную функцию могут выполнять другие поглощающие свет соединения, обладающие антиокислитель-ным действием (например, хиноны), однако сколько-нибудь подробно в этом отношении изучены пока только каротиноиды.
Синглетный кислород, образующийся не в фотохимических, а в каких-то других процессах, также может быть опасен для бактерий. Предполагают, что фагоцитоз бактерий полиморфноядерными лейкоцитами животных происходит с участием образующегося биохимическим путем ’О2. В этом случае каротиногенные бактерии оказываются более защищенными от воздействия *О2, чем бескаротиноидные.
11.7.4. Фотозащита у животных
У животных защита от облучения светом обычно обеспечивается экранирующим слоем пигмента, который либо поглощает свет всех длин волн, либо отфильтровывает особенно опасные лучи. Для целей экранирования наилучшими являются, очевидно, темные пигменты, такие, как меланины, поскольку они сильно поглощают во всем диапазоне видимого и УФ-света. Наиболее известным примером фотозащитной реакции служит пигментация кожи человека. Так называемая «белая кожа» у человека почти прозрачна, однако кератин рогового слоя поглощает значительную часть УФ-лучей. В ответ на продолжительное освещение солнечным светом в процессе формирования солнечного загара усиливается образование кератина и особенно меланина. Загоревшая белая кожа пропускает лишь 5% УФ-лучей с длиной волны 300 нм, тогда как незагоревшая— 25%. У людей с темной кожей почти весь УФ-свет поглощается значительными количествами меланина в коже. Этим обеспечивается адекватная защита от высоких доз лучистой энергии, характерных для тех областей земного шара, где живут темные расы.
Гл. 11. Другие фотофункции природных пигментов 387
Защитные меланины встречаются и у низших животных. Черный слизень (Arion ater) накапливает в наружном покрове меланин в количествах, пропорциональных количеству фотодинамически свободного порфирина. Сходные примеры корреляции между содержанием меланина и свободных порфиринов были описаны у морских животных.
Свободные порфирины, будучи фотосенсибилизаторами, могут оказывать вредное (даже губительное) действие на млекопитающих, в том числе и на человека. Они могут накапливаться при нарушении метаболизма гема, поскольку являются промежуточными продуктами этого процесса. Для больных порфирией (разд. 5.10.1) характерна чрезвычайная фоточувствительность; они совершенно не выдерживают освещения солнечным светом. У них отсутствует эндогенный экранирующий пигмент для защиты от действия света. Если больному порфирией ввести p-каротин, то он будет откладываться в тканях кожи и поглощать свет опасных длин волн. Такой искусственный пигментный экран предотвращает поглощение света порфириновым фотосенсибилизатором.
Считают, что у низших животных в качестве фильтрующих или экранирующих пигментов функционируют не каротиноиды, а соединения других классов, например нафтохиноны у иглокожих. Каротиноиды — широко распространенные пигменты наружных покровов — являются антиоксидантами и в то же время активно поглощают свет. Вполне вероятно, что у животных они осуществляют защиту от фотоокисления так же, как они делают это у бактерий (разд. 11.7.3). Высокие концентрации каротиноидов в яйцах животных, живущих на суше и на мелководье, могут отражать эту фотозащитную роль.
11.8. Биолюминесценция
11.8.1. Введение
Предшествующие части этой главы, да и всей книги, были посвящены поглощению света молекулами различных пигментов. В заключение следует хотя бы кратко остановиться на обратном процессе — биолюминесценции, — в котором биохимическая энергия используется живыми организмами для генерирования видимого света.
11.8.2 Распространение биолюминесценции
Биолюминесценция была обнаружена у морских бактерий и динофлагеллят, а также у небольшого числа видов грибов. Это явление, однако, лучше изучено у представителей
388 Часть II. Функциональные аспекты
животного царства. Наиболее известный пример — светляк (и его личинка) — наземное насекомое, которое ночью для привлечения партнера использует вспышки или непрерывно испускаемый свет. Однако наиболее часто биолюминесценция встречается у морских животных: рыб, ракообразных, моллюсков, кольчатых червей и кишечнополостных. Биолюминесценция некоторых светящихся животных, главным образом рыб и некоторых головоногих моллюсков, обусловлена их симбиозом с колониями испускающих свет бактерий. У других животных люминесценция является их собственной особенностью и не зависит от симбионтов.
Испускающие свет бактерии принадлежат к двум родам: все симбиотические виды — к роду Photobacterium, а все сво-бодноживущие — к роду Berteckea. У животных, которые используют Photobacterium, микроорганизмы содержатся в специальных светящихся органах. Наиболее удивительным примером такого органа служит, вероятно, «приманка» морского черта. Поддерживание существования бактериальных симбионтов в таких органах выдвигает свои проблемы. Распространение бактерий внутри тела животного должно ограничиваться светоносным органом. Кроме того, они должны передаваться без загрязнений бактериями других видов в светоносные органы особей последующих поколений. Бактерии люминесцируют непрерывно, так что животным необходим какой-то механизм, контролирующий испускание света этим органом. Такой контроль может осуществляться с помощью либо 'перемещения самого органа, либо хроматофоров, поглощающих испускаемый свет, либо различных механизмов типа «жалюзи». Люминесценция у животных, которые не используют бактерий, также происходит лишь в специальных светоносных органах. У таких животных число светоносных органов обычно больше, чем у симбиотических видов, и они, как правило, имеют характерный рисунок расположения.
11.8.3. Механизмы
Обычно явление биолюминесценции объясняют на примере окисления субстрата (люциферина) ферментом (люциферазой), в результате которого на одной из стадий этого процесса происходит испускание фотона. В недавних исследованиях были выяснены детали реакций, протекающих у некоторых организмов.
Конечно, было бы идеально разделить примеры биолюминесценции на сравнительно небольшое число типов и разработать классификацию по типу реакций. Однако в настоящее
Гл. 11. Другие фотофункции природных пигментов
389-
время фрагментарность наших знаний о биолюминесценции не позволяет сделать это.
Для непрерывного испускания света бактериям необходим фермент (названный бактериальной люциферазой), длинноцепочечный алифатический альдегид или родственное ему соединение в качестве субстрата (так называемого люциферина), молекулярный кислород и восстановленный флавинмононуклеотид (FMNH2). Полагают, что свет испускается в виде флуоресценции возбужденным окисленным флавиннуклеотидом, образующимся в ходе реакции.
Лучше других изучена биолюминесценция светляка. Сначала люциферин [лампирин (11.10)] реагирует с АТР с образованием связанного с ферментом люциферин-АМР-производного, которое затем окисляется до оксилюциферина (11.11) молекулярным кислородом в реакции, протекающей в несколько стадий. Фермент при этом претерпевает ряд значительных конформационных изменений, и в результате на одной из стадий, происходит испускание света.
Механизмы испускания света другими организмами в принципе сходны и различаются лишь степенью ассоциации или сложности люциферин-люциферазной системы. Так, у гидроидной медузы Aequorea люцифераза и люциферин [коэлентеразин (11.12)] остаются прочно связанными в виде стабильного фо-
(11 10) Лампирин (люциферин светляка)
(11 11) Дегидролампирин (оксилюциферин))
‘J2) Коэлентеразин
(11 13) Коэлентеразин
(связанная с белком форма в стабильном комплексе — экворине)
390
Часть II. Функциональные аспекты
тобелкового комплекса (11.13). У кораллового полипа — Ren.il-1а — тот же самый люциферин (11.12) сохраняется в виде сульфатного производного и высвобождается в результате удаления сульфатной группы при действии 3',5'-дифосфоаденозина и фермента люциферинсульфокиназы. В присутствии молекулярного кислорода неустойчивый люциферин окисляется до окси-.люциферина и происходит испускание света.
(11.15) Люциферин Latia
Небольшой ракушковый рачок Cypridina образует свой люциферин (11.14) и люциферазу в разных железах. Оба компонента выпускаются струей в морскую воду, где происходит люминесцентная реакция. Некоторые рыбы, очевидно, для обеспечения себя люциферином и люциферазой используют Cypri-dina в пищу.
Хотя биолюминесценция водных животных обычно связана с морской средой, хорошо известна люминесценция и у одного пресноводного вида — брюхоногого моллюска Latia. Люциферин Latia (11.15) очень сходен с каротиноидными пигментами (гл. 2).
Окраска (т. е. длина волны) испускаемого света в разных случаях различна; например, динофлагеллятам присуща флуо
Гл. И. Другие фотофункции природных пигментов 391
ресценция красного цвета, a Renilla и Aequorea — сине-зеленого. На эту окраску в значительной степени влияет конформация фермента, которая в свою очередь подвержена влиянию таких факторов, как температура, величина pH, давление, концентрация солей и АТР.
11.8.4. Функции биолюминесценции
Цели, которым служит биолюминесценция у свободно-живущих бактерий, пока не ясны. Гораздо легче понять возможную пользу, извлекаемую из биолюминесценции животными. Люминесценция, как собственная, так и обусловленная бактериями-симбионтами, используется животными, живущими в темноте, с теми же целями, что и окраска животными, живущими в мире света, т. е. для привлечения жертв или брачных партнеров, для предупреждения (предостережения), а у некоторых рыб для маскировки путем искажения темного силуэта, который, если смотреть снизу, хорошо виден на светлом фоне.
11.9. Заключение и комментарии
В первой части настоящей книги были описаны основные характеристики главных групп природных пигментов. В предыдущих главах второй части обсуждались наиболее известные и понятные биологические функции этих пигментов, а именно окрашивание, улавливание света и распознавание цвета (зрение), а также улавливание энергии света в фотосинтезе. В этой последней главе объединены некоторые другие аспекты фотобиологии, описаны процессы, в которых природные пигменты играют важную роль. Здесь рассмотрены фоторецепторы, такие, как фитохром и флавины, которыми обладают растения и микроорганизмы, а также бактериородопсин, используемый для образования АТР у Halobacteria.
Один из разделов посвящен встречающимся у животных,, но пока неидентифицированным внеглазным фоторецепторам. Кратко рассмотрены также защитные функции пигментов, которые помогают живым организмам избегать вредного действия облучения УФ- и видимым светом. Хотя эти функции пигментов и не вызывают столь сильного интереса, как перечисленные выше, они чрезвычайно важны для выживания организмов. Наконец, некоторое внимание было уделено и биолюминесценции, с помощью которой живые организмы используют химическую-энергию для испускания света.
В области идентификации фоторецепторов, а также изучения на молекулярном уровне изменений, происходящих в ходе функционирования этих фоторецепторов и наблюдаемых при
392 Часть II. Функциональные аспекты
этом реакций, для биохимиков существует широчайшее поле деятельности. Такая работа чрезвычайно трудна, поскольку фоторецепторы обычно присутствуют в тканях в крайне малых количествах, а изменения, по которым можно судить о реакции, могут быть очень незначительными. Эти проблемы представляют собой вызов мастерству биохимика. Наряду с явлениями, описанными в этой главе, по-видимому, существует много других форм или примеров взаимодействия между светом и живыми организмами (через природные пигменты), которые пока еще не открыты и могут служить новыми объектами исследования.
11.10. Рекомендуемая литература
Как и следовало ожидать, к главе, охватывающей столь широкое разнообразие тем и направлений, можно дать очень много ссылок. Приводимый ниже список ни в коей мере не может считаться исчерпывающим. Все входящие в его состав литературные источники очень информативны, однако в хорошей библиотеке читатель найдет другие книги и обзоры литературы по этим же проблемам, которые также окажутся полезными.
Несколько книг, посвященных фотобиологии, включают большинство или даже все темы, затронутые в этой главе. Клэйтон (Clayton, 1971) дает ценное вводное описание, а в книгах Ка-стеллани (Castellani, 1977), Чекуччи и Вила (Checucci, Weal, 1973), Смита (Smith, 1977) и Уолкена (Wolken, 1975) освещены подробно различные аспекты фотобиологии. Ежегодная серия «Photochemical and photobiological Reviews» (Smith, 1976— 1979) содержит самые современные обзорные статьи по ряду проблем фотобиологии.
Для получения информации по фототаксису и фототропизму читателю следует обратиться к книгам Клэйтона (Clayton, 1971) и Уолкена (Wolken, 1975) и к статье Хэнда (Hand, 1977). Много публикаций посвящено фитохрому. В некоторых из них рассмотрены и биохимические аспекты проблемы, в частности в книге Митракоса и Шропшира (Mitrakos, Shropshire, 1972), обзорах Ли (Lee, 1977), Пратта (Pratt, 1979), Сэттера и Гэл-стона (Satter, Galston, 1976), Шропшира (Shropshire, 1977), а также Смита и Кендрика (Smith, Kendrick, 1976). В работах о бактериородопсине и пурпурных мембранах Halobacteria чаще всего приводят ссылки на книгу под редакцией Каплана и Гинзбурга (Caplan, Ginzburg, 1978) и обзор Оттолени (Ottolenghi, 1980), содержащий наиболее современные взгляды на механизм фотоциклов бактериородопсина.
,Гл- 11- Другие фотофункции природных пигментов 393
Фотозащитное действие пигментов, и в первую очередь каротиноидов, описано Кринским (Krinsky, 1971), а информацию о фотоповреждениях и фоторепарации ДНК можно получить из книги Ванга (Wang, 1976) и из недавно вышедшего обзора Лемана и Бриджеса (Lehmann, Bridges, 1977). Несколько книг и обзоров (например, Millott, 1968; Eakin, 1974; Menaker, 1977; Bennett, 1979; Yoshida, 1979) посвящены вне-глазным фоторецепторам; в них подчеркивается отсутствие биохимических сведений по этому предмету. И наконец, биолюминесценция рассматривается в обзорах Гастингса (Hastings, 1968), Джонсона и Ханеды (Johnson, Haneda, 1966) и Уарда (Ward, 1979), а также в недавно вышедшей книге под редакцией Герринга (Herring, 1978). Соответствующие методы собраны в томе «Methods in enzymology» (De Luca, 1978).
11.11. Дополнительная литература
Bennett Al. F. (1979). Extraocular light receptors and circadian rhythms. In: Handbook of sensory physiology, vol. VII/6A. Vision in invertebrates, ed. H. Autrum, p. 641, Heidelberg, Berlin and New York, Springer-Verlag.
Caplan S. R., Ginzburg M. (eds.) (1978). Energetics and structure of halophilic microorganisms, New York, Elsevier-North Holland.
Castellani A. (ed.) (1977). Research in photobiology, New York and London, Plenum.
Checucci A., Weal R. A. (eds.) (1973). Primary molecular events in photobiology, Amsterdam, Elsevier.
Clayton R. K. (1971). Light and living matter, vol. 2, The biological part, New York, McGraw-Hill.
De Luca M. (ed.) (1978). Bioluminescence and chemiluminescence (Methods in enzymology, vol. 57), New York, Academic Press.
Eakin R. M. (1974). The third eye, Berkeley, University of California Press.
Hand W. G. (1977) Photomovement. In: The sciences of photobiology, ed.
К. C. Smith, p. 313, New York and London, Plenum.
Hastings J. W. (1968). Bioluminescence, Ann. Rev. Biochem., 37, 597.
Herring F. J. (ed.) (1978). Bioluminescence in action, London, New York and San Francisco, Academic Press.
Johnson F. H, Haneda Y. (eds.) (1966). Bioluminescence in progress. New Jersey, Princeton University Press.
Krinsky N. I. (1971). Function. In: Carotenoids, ed. O. Isler, p. 669, Basel and Stuttgart, Birkhauser. _ v c
Lee J. (1977). Bioluminescence. In: The science of photobiology, ed. К. C. Smith, p. 371, New York and London, Plenum. .
Lehmann A. R„ Bridges B. A. (1977). DNA repair, Essays. In: Biochemistry, 13, 71, London, The Biochemical Society-Academic Press. h„tnhi„Uov
Menaker M. (1977). Extraretinal photoreception. In: The science of photobiology, ed. К. C. Smith, p. 227, New York and London, Plenum.
Millott N. (1968). The dermal light sense, Symp Zool. Soc. London,
Mitrakos K„ Shropshire W„ Jr. (eds.) (1972). Phytochrome, London and New York, Academic Press. n , .
OHolenghi M. (1980). The photochemistry of rhodopsins, Adv. Photocnem., 12, 97. ...
Pratt L. H. (1979). Phytochrome. In: Photochemical and photobiological reviews, vol. 4, ed. К. C. Smith, p. 59, New York, Plenum.
26—84
394 Часть II. Функциональные аспекты
Satter R. L„ Galston A. W. (1976). The physiological functions of phytochrome. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 681, London, New York and San Francisco, Academic Press
Shropshire W„ Jr. (1977). Photomorphogenesis In: The science of photobiology, ed. К. C. Smith, p. 281, New York and London, Plenum.
Smith H , Kendrick R. E. (1976). The structure and properties of phytochrome. In: Chemistry and biochemistry of plant pigments, 2nd edition, vol. 1, ed. T. W. Goodwin, p. 378, London, New York and San Francisco, Academic Press.
Smith К. C. (ed.) (1976—1979). Photochemical and photobiological reviews,, vols 1—4, New York, Plenum.
Smith К- C. (ed.) (1977). The science of photobiology, New York and London, Plenum.
Wang S. У. (ed.) (1976). Photochemistry and photobiology of nucleic acids, vol. 2, Biology, New York, Academic Press.
Ward W. W. (1979). Energetics of bioluminescence. In: Photochemical and Pho-tobiological Reviews, vol 4, ed К C Smith, p. 1, New York, Plenum.
Wolken J. J (1975). Photoprocesses, photoreceptors and evolution, New York, San Francisco and London, Academic Press.
Yoshida M. (1979). Extraocular photoreception. In Handbook of sensory physiology, vol. VII/6A, Vision in invertebrates, Heidelberg, Berlin and New York, Springer-Verlag.
Задачи
1. Считают, что в большинстве случаев белая «окраска» по происхождению является структурной. Приведите несколько примеров белой окраски и выскажите ваши предположения относительно того, какими структурными элементами и физическими явлениями она может быть обусловлена.
2. Определите батохромный, гипсохромный и гипохромный эффекты в терминах энергетических изменений и вероятностей переходов.
3. Для количественного определения веществ в биохимии часто используют простой колориметр, с помощью которого измеряют количество света, прошедшего через окрашенный раствор. Между источником белого света и образцом обычно помещают простой светофильтр. Объясните, почему полученные результаты будут наиболее точными, если используют -фильтр, имеющий окраску, комплементарную окраске изучаемого образца?
4. Образец соединения М (0,026 мг) растворили в 10,0 мл соответствующего растворителя. Коэффициент удельной экстинкции Micm1”7” для соединения М равен 1600. Рассчитайте: 1) поглощение 10 мл раствора в 1-см кювете; 2) поглощение 10 мл раствора в 3-см кювете; 3) поглощение 3 мл раствора в 1-см кювете; 4) поглощение в 3-см кювете объемом 10 мл ра-<твора, приготовленного разбавлением 3 мл исходного раствора до 10 мл.
5. Экстракт листьев в водном 80%-ном ацетоне имеет поглощение 0,50 и 1,00 при 645 и 663 нм соответственно (в 1-см кювете). Рассчитайте концентрации (в мг/л) хлорофиллов а и b в экстракте, если для хлорофилла а А1см1%=820 и 170 (при 663 и 645 нм соответственно), а для хлорофилла b AiCM1% = 100 и 450 (при 663 и 645 нм соответственно).
Упрощенный метод расчета концентраций хлорофиллов включает использование уравнений:
Суммарный хлорофилл (мг/л) =20,2 A64s+8,02 А663
Хлорофилл а (мг/л) = 12,7 А663—2,69 А645
Хлорофилл в (мг/л) =22,9 А645—4,68 А66з,
где А645 и А663 — зарегистрированные величины поглощения при 26*
396
Задачи
645 и 663 нм соответственно. Даст ли применение этих уравнений в данном случае точные значения концентрации хлорофиллов?
6. а) Пигмент X (3,43 мг) в гексановом растворе (500 мл) после пятикратного разбавления имеет при 450 нм поглощение 0,346. Рассчитайте его коэффициент молярной экстинкции (мол. масса пигмента равна 536).
б) Растворитель выпарили и полученную суспензию X инкубировали в аэробных условиях с препаратом кишечного фермента в присутствии NADPH. После инкубации полученные продукты экстрагировали гексаном (800 мл). Гексановый раствор обладал поглощением при 450 нм (0,577) и имел новый максимум поглощения (А = 0,272) при 366 нм. Рассчитайте общее количество непрореагировавшего X и образовавшегося продукта У в растворе (в мг и мкмоль), если коэффициент удельной экстинкции А1см1% продукта Y (Хтах=366 нм) составляет 1740, а коэффициент молярной экстинкции 49 500. Сделайте свои заключения о ферментативной реакции. (Внимание} Учтите, что X не поглощает при 366 нм, а У не поглощает при 450 нм.)
в) Очищенный продукт реакции У (1,25 мг) при инкубации со специфическим белком образует (с количественным выходом) водорастворимый комплекс, имеющий Хтах = 500 нм. Общий объем водного раствора составил 100 мл, а наблюдаемое поглощение 1,76. Рассчитайте молекулярную массу белка, если А1см1% (при 500 нм) для комплекса составляет 9,8 при эквимолярном соотношении У: белок. (Внимание! Во всех случаях использовались 1-см кюветы общим объемом 3 мл.)
7. В приводимой ниже таблице содержатся коэффициенты миллимолярной экстинкции окисленной (еох) и восстановленной (еге<1) форм цитохрома с. Постройте дифференциальный спектр (восстановленной формы минус окисленной) по этим данным. Стоит ли пытаться различить окисленную и восстановленную формы лишь по спектрам поглощения этих форм?
Л, нм £ох £red К ®ох £r?d л £ох £red
370 28,0 14,0 440 20,0 8,0 520 8,0 13,5
380 34,5 20,0 450 13,0 4,5 530 9,0 9,0
390 45,5 32,0 460 9,5 2,0 540 9,5 8,0
400 73,0 53,0 470 6,5 1,0 550 8,0 24,0
410 105,0 110,0 480 5,5 1,5 560 6,5 2,0
415 88,0 128,0 490 5,5 2,0 570 5,5 1,5
420 60,9 94,0 500 6,0 4,0 580 4,5 1,0
430 ! 32,0 32,0 510 6,5 8,0 590 2,0 0,5
I
Задачи
397
8. Установите приблизительное положение главных максимумов поглощения света для следующих каротиноидов: родо-пина, е-каротина, 4-кето-у-каротина, 5,6-эпокси-5,6-дигидро-ф,ф-каротина, у-каротин-5,6-эпоксида, зеаксантина, 4-кето-р-зеакаротина, лороксантина (|3,е-каротин-3,19,3'-триола) и Р,|3-каротин-2,2'-диона. Известно, что нейроспорин, ликопин, у-каротин, p-каротин и эхиненон имеют Хтах при 440, 470, 460, 450 и 458 нм соответственно. (Структура и полусистематическая номенклатура каротиноидов приведены в гл. 2.)
9. Объясните следующие наблюдения:
1) Разбавленный раствор хлорофилла в диэтиловом эфире имеет зеленую окраску, в то время как концентрированный раствор может выглядеть красным.
2) В УФ-свете хлорофилл имеет красную окраску.
3) Если при освещении солнечным светом смотреть на дерево через фильтр, прозрачный для узкого диапазона длин волн красного света, то листья выглядят розовыми на почти черном фоне.
10. Открыт новый вид животного, которое имеет синюю окраску. Как вы определите, имеет ли окраска структурное происхождение, или же она обусловлена пигментом. Если верно последнее, то как можно идентифицировать класс, к которому принадлежит данный пигмент?
11. Каротиногенные бактерии инкубировали с [2-14С, (5R)-5-3HJ -мевалоновой кислотой. Меченые каротиноиды — фитоин, p-каротин и зеаксантин — экстрагировали, очищали, а затем определяли их радиоактивность. Получили следующие
соотношения 14С : 3Н для:
[2-14С, (5/?) -5-3Н!] -мевалоновой кислоты 1:1
фитоина 1:1
Р-каротина 1:0,5
(3R, 3'R)-зеаксантина 1:0,25
Какие можно сделать выводы о последовательности реакций при биосинтезе?
С1Ц он / 1 н ноос ^.с
Чн', сщ ^он
। 2-,4С-(5А J-5-3Н, ] Мевалоновая кислота
12. Биосинтез нафтохинона моллисина происходит из двух поликетидов, состоящих из трех и четырех Сг-фрагментов соответственно. Нарисуйте схему образования моллисина по этому
398
Задачи
биосинтетическому пути и объясните, как этот путь можно экспериментально отличить от пути, в котором участвует только одна гептакетидная цепь.
Предложите также правдоподобный способ изгибания поли-кетидной цепи, который мог бы иметь место при биосинтезе антрахинона солориновой кислоты (пигмента лишайников) и лаккаиновой кислоты D (пигмента насекомых).
о
Лаккаиновая кислота D
13. Считают, что антрахинон ализарин (3.27) синтезируется в результате комбинации шикиматного и мевалонатного путей через пренилированный промежуточный продукт
Предложите механизм образования ализарина по этому пути, а также по альтернативному пути либо только с помощью по-ликетидного механизма, либо с помощью комбинации его с шикиматным путем. Позволят ли исследования с меченым ацетатом установить, в результате какого из альтернативных путей биосинтеза образовался ализарин?
14. Из лепестков обычного садового цветка, имеющих кремовую окраску, выделили значительное количество водорастворимого «пигмента», который можно пометить инкубацией с 14С-ацетатом или |4С-фенилаланином. Выделенное соединение
Задачи.
399
имело мол. массу 480, а значение его Хтах (в метаноле), равное 365 нм, сдвигалось до 425 нм в присутствии щелочи. Обработка этого соединения диазометаном приводила к образованию его пентаметилового эфира, в то время как при действии ацетангидрида в пиридине получали его нонаацетильное производное. В результате гидролиза пигмента р-глюкозидазой получили продукт с брутто-формулой С15Н10О8, максимум поглощения которого был лишь слегка сдвинут по сравнению с максимумом исходного пигмента (Хтах=378 нм). После обработки диазометаном этот продукт опять давал пентаметиловый эфир, однако его ацетилирование в данном случае приводило к образованию гексаацетильного производного. На основании этих данных и биосинтетических соображений воссоздайте структуру исходного пигмента и объясните, как она может быть подтверждена.
15. Колонка для гель-фильтрации (Сефадекс G-25) была уравновешена 0,05 М К-фосфатным буфером, pH 7,0. В колонку внесли свежеприготовленный раствор дитионита натрия, который проник в гель. Затем добавили смесь гемоглобина и феррицианида калия, и после ее впитывания было продолжено элюирование фосфатным буфером, pH 7,0. Пока смесь гемоглобин— феррицианид не достигла зоны дитионита, она имела коричневую окраску. Однако вышедшее из зоны дитионита вещество было пурпурным и постепенно по мере продвижения к нижней части колонки и при переходе в элюат становилось алым. Объясните эти наблюдения.
16. Опишите, какое действие на сродство гемоглобина А к кислороду окажут следующие изменения и почему: 1) 4-крат-ное увеличение парциального давления СОг’, 2) 4-кратное увеличение концентрации 2,3-дифосфогдицерата (ДФГ); 3) снижение pH с 7,4 до 7,2; 4) диссоциация молекулы гемоглобина на мономерные субъединицы.
17. Одноклеточная водоросль может расти в отсутствие фотосинтеза на глюкозе в качестве источника углерода. В этих условиях глюкоза метаболизируется до ацетата, который и используется для биосинтеза клеточных компонентов. Если клетки культивировать в условиях отсутствия фотосинтеза, в качестве единственного источника воды использовать оксид дейтерия (2Н2О), а в качестве источника углерода — обычную [!Н]-глюкозу, то распределение ‘Н и 2Н в образующихся молекулах каротина и хлорофилла будет строго определенным. Если же культуру перенести в условия, при которых возможен фотосинтез (свет+СОг в качестве источника углерода), то как со временем будет изменяться характер распределения метки в пигментах? (Источником воды остается оксид дейтерия.)
400
Задачи
18. Каким будет распределение метки при биосинтезе фикобилинового хромофора [например, (5.41)] из [5-14С]-АЛК {6-аминолевулиновой кислоты). Можно ли, пользуясь таким распределением метки, установить, какой из двух альтернативных предшественников — гем или хлорофилл — был истинным?
19. У крысы расщепление гема происходит с образованием биливердина, который в свою очередь превращается в билирубин. В ходе расщепления в молекулу вводятся две кислородсодержащие группы (кетогруппы). Были предложены три альтернативных механизма, по которым может протекать эта реакция: 1) оба вводимых атома кислорода происходят из одной молекулы О2; 2) оба атома кислорода происходят из молекулярного О2, но из двух разных молекул; 3) один атом кислорода происходит из молекулярного кислорода, а другой — из воды.
Молекулярная масса нормального (16О) билирубина составляет 584. Предскажите для каждого механизма характер распределения метки и молекулярную массу образующегося билирубина, если реакция протекает с 18О2 (100%) и Н216О (100%). Если расщепление гема происходит в атмосфере, содержащей смесь кислорода 18О2 (20%) и кислорода 16О2 (80%), то можно ли с помощью соотношения между содержанием молекулярных видов билирубина с мол. массами 584, 586 и 588 (определенного путем масс-спектрометрии) установить, по какому из этих трех механизмов происходит расщепление гема?
20. Дрозоптерин (6.14) представляет собой димерный птерин. Из какой мономерной формы (или форм) может образоваться его молекула? Предложите возможный механизм димеризации. Спектр поглощения дрозоптерина был определен в нейтральной среде, в 0,1 М НС1 и в 0,1 М NaOH. В нейтральном растворе максимумы поглощения наблюдались при 265 и 485 нм. Как будут отличаться от спектра в нейтральном растворе спектры в кислом и щелочном растворах?
21. Бактерия Pseudomonas phenazinium образует и секретирует в культуральную среду большое количество феназинового пигмента иодинина (6.50). Были получены два мутантных штамма этой бактерии, один из которых (F11) накапливает 6-гидроксифеназин-1-карбоновую кислоту (см. рис. 6.10), а другой (13Z) не образует никакого пигмента. Культуры этих двух штаммов посеяли на агар взаимно перпендикулярными полосами. При проверке агара через 7 дней обнаружили, что вокруг точек пересечения культур этих двух штаммов происходит образование иодинина. Объясните этот результат.
22. Модель части структуры сепиомеланина показана на рис. 7.2. Приведите структуру молекул мономеров, из которых она была получена. Предложите альтернативную частичную
Задачи
401
структуру молекулы меланина, сконструированную из этих мономеров, и предскажите схему его биосинтеза.
23. Гусеницы бражника питаются листьями тополя (Populus spp.) и ивы (Salix spp.). Полевые исследования показали, что гусеницы, обнаруживаемые на беловатой нижней стороне листьев тополя, имеют серую окраску, в то время как гусеницы, встречающиеся на ярко-зеленых листьях ивы, имеют зеленую окраску. Была начата исследовательская работа по изучению экологических факторов и факторов питания, которые определяют и поддерживавают такой диморфизм окраски. Среди запланированных опытов были: 1) анализ состава и определение содержания пигментов у гусениц обоих типов и в листьях обоих видов, и 2) изучение влияния на диморфизм окраски света и темноты (при выведении гусениц на листьях различных видов растений). Какую полезную информацию дадут эти опыты? Предложите возможные объяснения диморфизма окраски и разработайте другие эксперименты для проверки этих гипотез.
24. Объясните, каким образом трихроматическая система, основанная на трех фоторецепторных пигментах, имеющих максимумы поглощения при разных длинах волн, может обеспечить чувствительный механизм различения цветов?
25. Сетчатка глаза птиц содержит несколько фоторецепторов, включающих зрительные пигменты, и ряд интенсивно, но по-разному окрашенных масляных капель, которые действуют как светофильтры; свет достигает рецептора только после прохождения через масляную каплю. Рассмотрим систему из двух фоторецепторов, поглощающих в диапазоне 400—600 нм (Хтах=500 нм) и 470—670 нм (Zmax = 570 нм), и две масляные капли, поглощающие при 400—500 нм (Zmax = 450 нм) и 420— 520 нм (Хтах==470 нм) соответственно. Какое действие окажет каждый из этих фильтров на поглощение света каждым фоторецептором и каким образом это скажется на чувствительности различения оттенков? (Предполагается, что все спектры имеют симметричную форму.)
26. Солнечный свет может проникать в чистые воды океана на значительную глубину. Тем не менее при этом происходит некоторое поглощение света, и с возрастанием глубины диапазон непоглощенных волн становится все уже. На глубине 1000 м остается очень узкая полоса длин волн с центром при 470 нм, которую все еще можно увидеть невооруженным глазом. В более мутных прибрежных водах свет виден лишь до глубины 50 м, глубже всего проникают волны в диапазоне ~570 нм. Каковы должны быть принципы организации пигментов и фоторецепторных систем, которые были бы наиболее выгодны рыбам и другим животным; а) обитающим на разных,
402
Ответы
но всегда примерно одних и тех же глубинах океанских и прибрежных вод, б) обитающим в водах океана, но способным более свободно перемещаться между поверхностью и морским дном, и в) свободно перемещающимся на всех глубинах как прибрежных, так и океанских вод.
27. Прокариотические сине-зеленые водоросли (цианобактерии) являются простейшими фотосинтезирующими организмами, выделяющими кислород. Они не содержат хлоропластов, но имеют более или менее развитые внутренние фотосинтетические мембраны, включающие хлорофилл а, каротиноиды и фикобилины. Опишите все изменения в морфологии, ультраструктуре и составе пигментов, которые можно ожидать при переносе цианобактерий из: 1) условий низкой освещенности в условия высокой освещенности и высокого содержания кислорода, 2) условий высокой освещенности в условия низкой освещенности, 3) условий освещения белым светом в условия освещения зеленым или красным светом.
28. Объясните следующие явления:
а) Осенью листья изменяют свою окраску с зеленой на желтую, красную или коричневую.
б) Дающая много цветков роза «Маскарад» имеет зеленые бутоны, которые распускаются в желтые цветки, приобретающие позже красную окраску.
в) Листья зеленых в нормальных условиях растений становятся желтыми, если растение содержится несколько дней в темноте, или если оно испытывает недостаток магния или железа.
29. Спектр действия фототропной реакции гриба очень сходен со спектром поглощения как (З-каротина, так и рибофлавина. Предложите экспериментальный подход, с помощью которого можно было бы определить, какой из этих пигментов является фоторецептором.
30. Для индуцирования цветения растениям длинного дня необходимы условия с длинным днем и короткой ночью, тогда как растения короткого дня цветут только в условиях короткого дня и длинной ночи. Объясните, как один и тот же фоторецептор, фитохром, может индуцировать цветение у растений обоих типов.
Ответы
1. См. разд. 1.3.4. Структурная белая окраска обусловлена обычно светом, отраженным от мельчайших кристалликов, частиц или капелек.
2. Определения этих выражений, правда не в терминах вероятностей переходов и изменений энергии, приведены в гл.1.
Ответы
403
Изменения энергии при переходе определяют длину волны максимума поглощения, а вероятность перехода определяет интенсивность поглощения.
3. Фотоячейка колориметра детектирует проходящий свет во всем видимом диапазоне. Выбранный фильтр пропустит лучи лишь тех длин волн, в диапазоне которых поглощает образец, так что небольшие различия в концентрации приведут к значительным различиям в поглощении.
4. 1) 0,416, 2) 1,248, 3) 0,416, 4) 0,374. Вспомните законы Ламберта — Бэра: поглощение света веществом пропорционально концентрации вещества и длине пути света, проходящего через его раствор.
5. Полученные с помощью упрощенных уравнений концентрации хлорофиллов а и b равны соответственно 11,35 и 6,77 мг/л. Эти значения идентичны полученным с применением более сложных уравнений:
АвМ = (А1%1см для Хл а при 645 нм • Концентрация Хл а)-)-
-[-(А1'“1см ДЛЯ Хл b при 645 нм-Концентрация Хл Ь)
А66з= (А,%! см для Хл а при 663 нм• Концентрация Хл a)-f-
+ (А1%1См Для Хл b при 663 нм • Концентрация Хл Ь)
6. а) 135-103.
б) Экстрагировано 1,83 мг X (3,415 мкмоль) и 1,25 мг У (4,40 мкмоль). Отсюда мол. масса У равна 284 в соответствии с реакцией Х-\-О2—^2У (т. е. У=1/2Х-|-О).
в) 180 мг комплекса составляют 4,4 мкмоль, отсюда мол. масса равна 41 000.
7. В качестве ординаты откладывают величины (еох—еге<1) (они могут быть положительными или отрицательными), а в качестве абсциссы — длину волны. Окисленная и восстановленная формы цитохрома имеют величины Хшах соответственно при ~410 и ~415 нм, поэтому различить эти формы или установить состав их смеси лишь на основании спектров поглощения практически невозможно.
8. Величины Zmax находятся при 470, 440, 468, 455, 455, 450г 438, 445 и 450 нм соответственно. Нейроспорин — хромофор с девятью сопряженными внециклическими двойными связями — имеет А.тах = 440 нм; при сопряжении каждой дополнительной внециклической двойной связи с хромофором А.тах увеличивается на 15 нм. (3-Кольцо имеет одну двойную связь в сопряжении с ациклическим полиеном, благодаря которой А.тах увеличивается лишь на 5 нм. При сопряжении с хромофором кетогруппы при С-4 Zmax увеличивается на 8 нм. Эпоксидирование двойной связи нарушает сопряжение в этой точке; другие заместители,
404
Ответы
например гидроксильная или несопряженная кетогруппа, на поглощение света хромофором не влияют. Двойная связь g-кольца не сопряжена, она не вносит вклада в формирование хромофора и не влияет на величину его Zmax-
9. Ключом к объяснению этих наблюдений является то, что хлорофилл не только сильно поглощает свет в нескольких участках видимого спектра, но также обладает очень сильной красной флуоресценцией.
10. Структурный голубей цвет воспринимается как голубой лишь в отраженном, но не в проходящем свете. Окраска может зависеть также от угла падения света и от угла наблюдения. При погружении животного в воду или в другой растворитель окраска структурного происхождения, вероятно, исчезнет, а после испарения растворителя восстановигся. Если окраска обусловлена пигментом, то последний можно экстрагировать из тканей водой или органическими растворителями. Информацию о хромофоре может дать резонансная рамановская спектроскопия. Изучение растворимости, физико-химических и спектроскопических свойств выделенного пигмента (см. соответствующие главы данной книги) позволит идентифицировать класс, к которому принадлежит это соединение.
11. См. в гл. 2 общий путь биосинтеза каротиноидов. Фитоин образуется из восьми молекул мевалоновой кислоты (МК), и поэтому образовавшаяся молекула фитоина сохраняет все восемь меченых углеродных атомов и восемь атомов трития из субстрата с двойной меткой. Образование фитоина, таким образом, происходит стереоспецифически; водородный атом, теряющийся из положения С-1 геранилгеранилпирофосфата в ходе образования С-15, ^'-двойной связи фитоина, должен быть немеченым Н-атомом из положения С-5 МК- В p-каротине сохраняется восемь 14С-атомов, но лишь четыре атома трития. Тритиевые атомы должны стереоспецифически теряться в ходе десатурации. Сходным образом должен теряться 3Н-замести-тель из положения С-З обоих колец p-каротина при его гидроксилировании до зеаксантина.
12. Наиболее вероятные способы образования этих соединений в результате изгибания молекул соответствующих поли-кетидов приведены ниже:
Ответы
405
Моллисин
Наилучший способ проверки подобных схем состоит в использовании меченого [ 1,2-13С2]-ацетата. Если этот 13С-субстрат будет включаться в образующийся продукт с достаточной эффективностью (не менее 1% включения), то атомы углерода, источником которых является интактная молекула ацетата, будут обладать 13С-13С-спин-спиновым взаимодействием при ЯМР-спектроскопии. Если же уровень включения не превышает 10%, между другими углеродными атомами заметного спин-спинового взаимодействия не будет происходить. Таким образом можно установить положение ацетатных фрагментов, образующих поликетидную цепь, в молекуле конечного продукта.
13. Этот промежуточный продукт образуется в результате присоединения Cs-изопренового фрагмента к о-сукцинилбензоа-ту или к нафтол/нафтохиноновому промежуточному соединению (см. рис. 3.12). Четыре из пяти углеродных атомов этого изопренового фрагмента будут затем использованы для образования кольца С ализарина. Метод включения [13Сг]-ацетата, упомянутый в ответе на вопрос № 12, позволяет различить большинство возможных альтернативных механизмов — любая часть молекулы, происходящая от немеченого ацетата, не будет содержать метки.
14. Включение меченого ацетата и фенилаланина в состав этого водорастворимого пигмента позволяет предположить, что он принадлежит к классу флавоноидов. Другие его характеристики соответствуют структуре p-D-глюкозида мирицетина (4.19). Обработка диазометаном приводит к метилированию только фенольных ОН-групп, в то время как ацетилируются и все первичные, и все вторичные ОН-группы.
406
Ответы
15. Феррицианид окисляет гемоглобин до метгемоглобина, обладающего бурой окраской. Колонка будет задерживать небольшие молекулы и ионы, например дитионит и феррицианид, в значительно большей степени, чем крупные молекулы гемоглобина. В процессе хроматографирования метгемоглобин, быстрее двигающийся в колонке, достигнет зоны дитионита и восстановится в гемоглобин. Последний в ходе дальнейшего элюирования окисляется кислородом воздуха, растворенным в. элюирующем буфере, с образованием оксигемоглобина.
16. Влияние СО2, Н+ и ДФГ на сродство гемоглобина к кислороду и на кооперативность функционирования ассоциированных гемоглобиновых субъединиц описаны в гл. 5 (разд. 5.5.2).
17. Образующийся из [*Н]-глюкозы ацетат содержит 'Н в метильной группе (у С-2). Когда этот ацетат далее метаболизируется в среде с 1 2 3Н2О, при восстановлении С-1 карбоксильной группы ацетата к нему будет присоединяться только дейтерий. Таким образом, молекулы каротина и хлорофилла у тех углеродных атомов, которые произошли из атомов С-1 ацетата, будут содержать только дейтерий, но сохранят 'Н у атомов углерода, источником которых был атом С-2 ацетата. В условиях фотосинтеза, когда источником углерода служит СО2, а единственным доступным водородом в среде является дейтерий из 2Н2О, во всех положениях синтезирующихся молекул будет содержаться только дейтерий.
18. Схемы превращения АЛК в гем и хлорофилл, а также схема образования фикобилиновой структуры из порфиринов приведены в гл. 5. Из этих схем следует, что распределение метки в фикобилине будет одинаковым независимо от того, гем или хлорофилл были промежуточными продуктами его биосинтеза.
19. Если в системе присутствует смесь кислорода 18О2 и кислорода 16О2, то в случае механизма 1 оба кислородных атома билирубина будут происходить из одной и той же молекулы, будь то 18О2 или 16О2. При биосинтезе билирубина по механизму 2 оба кислородных атома могут поставляться как 18О2, так и 16О2. В случае же использования механизма 3 молекула О2(либо 18О2, либо 16О2) поставляет лишь один из двух атомов кислорода. Если смесь состоит из 20% 18О2 и 80% 16О2, то синтезируемый по этим трем механизмам билирубин будет иметь следующий состав:
1) 584 (80%), 586 (0%) и 588 (20%);
2) 584 (64%), 586 (32%) и 588 (4%);
3) 584 (80%), 586 (20%) и 588 (0%).
Ответы
407
Этот состав легко установить с помощью масс-спектрометрии.; Если используемый в опыте кислород был представлен лишЬ 18О2-видом, то билирубин, образовавшийся по механизму 3, содержал бы лишь один меченый 18О-атом и имел бы мол. массу 586, в то время как синтез по механизмам 1 и 2 привел бы к образованию лишь одного молекулярного вида билирубина с мол. массой 588. Следовательно, с помощью одной масс-спектрометрии нельзя установить, какой из этих механизмов был использован для синтеза билирубина.
20. Вероятным мономерным предшественником при синтезе дрозоптерина является сепиаптерин (6.15), Сз-боковая цепь которого может использоваться для формирования связывающего мономеры пятичленного кольца. Спектры поглощения дрозоптерина в кислой и щелочной среде см. на рис. 6.2, а его свойства описаны в разд. 6.2.4. Для объяснения изменений в спектрах следует принять во внимание способность амфотерных молекул птеринов к ионизации.
21. У обоих этих штаммов содержится неполный набор ферментов, катализирующих образование феназинов. Промежуточный продукт, накапливаемый штаммом F11, может превращаться в иодинин штаммом 13Z.
22. Ниже приведены главные мономерные структуры, вероятно участвующие в синтезе меланинов. Путем окислительной конденсации полифенольных структур из них может образоваться много различных меланиновых структур.
ноос^____
// \\ и другие пирролкарбоновые
х—СООН кислоты
МООС, н
ио- хинон этого соединения
23. Следует принять во внимание общую стратегию покровительственной окраски, описанную в гл. 8. Опыт 1 покажет, действительно ли гусеница поглощает и запасает различные пигменты, содержащиеся в листьях разных видов растений. Однако не исключено, что различия в окраске листьев обусловлены особенностями структуры, а не различиями в составе пигментов. Опыт 2 позволит выяснить, реагируют ли гусеницы на окраску фоновой поверхности при участии какого-либо фоторецепторного механизма, или приспособление к фоновой
408
Ответы
окраске происходит в ответ на какой-то другой раздражитель, например на какое-то вещество, содержащееся в листьях одного вида, но отсутствующее в листьях другого. Не следует также упускать из виду вероятность того, что по-разному окрашенные формы могут представлять собой две генетически различающиеся популяции.
24. Трихроматическая система зрительных пигментов в принципе сходна с трихроматической системой, использующейся в цветном телевидении или в цветной фотографии. Свет трех разных длин волн (соответствующий трем основным цветам) можно смешать в бесчисленном числе комбинаций цвета и интенсивности и получить любой необходимый цвет или его оттенок любой интенсивности. Сходным образом, если диапазон поглощения трех зрительных пигментов охватывает практически весь видимый участок спектра и максимумы поглощения этих пигментов четко разграничены, свет любого цвета (или с любым распределением длин волн) можно разделить на три первичных компонента, которые будут детектироваться этими тремя пигментами.
25. Постройте графики спектров поглощения для фоторецепторов в присутствии и в отсутствие масляных капель. Имейте при этом в виду, что капли интенсивно окрашены и значительная часть света с длинами волн в диапазоне их поглощения не достигнет фоторецептора. Из графика станет ясно, каким образом с помощью этих капель достигается получение более узких и лучше разделенных спектров поглощения зрительных пигментов.
26. Несмотря на неизбежные межвидовые различия, эволюция животных, вероятно, будет происходить в направлении использования фоторецепторов, которые наиболее эффективно поглощают свет, проникающий на большую глубину в условиях их обитания. Для окрашивания же будут использоваться пигменты, максимально поглощающие либо максимально пропускающие свет в этом оптимальном диапазоне длин волн. Свободное перемещение животных между различными средами обитания предполагает необходимость использования ими фоторецепторов для различных условий освещения; при этом они могут использовать более сложные комбинации пигментов.
27. 1) В этих условиях отпадает необходимость очень эффективного улавливания света и, следовательно, будет достаточно меньшего количества вспомогательных светособирающих пигментов. Однако при этом возникает необходимость более эффективной защиты фотосинтетического аппарата от фотоокисления, так что можно ожидать усиления синтеза каротина.
2) В этих условиях улавливание света должно стать максимально эффективным за счет синтеза большего количества
Ответы
40 9
светособирающих пигментов; наблюдаемый эффект будет сопровождаться увеличением размеров фикобилисом.
3) В результате такого переноса будет синтезироваться больше фикобилинов, поглощающих соответственно в зеленой или в красной области спектра. Этим будет достигаться максимальное использование доступного света.
28. а) По мере старения листьев происходит разрушение хлоропластов и их зеленого пигмента хлорофилла и становятся видны содержащиеся в них желтые каротиноиды. Затем начинают синтезироваться окрашенные в красный цвет антоцианы и, наконец, окислительная конденсация фенольных соединений приводит к образованию полимерных соединений коричневого цвета.
б) Наблюдаемая окраска обусловлена последовательно зеленым хлорофиллом, желтым каротиноидом и, наконец, красным антоцианом.
в) В отсутствие света хлоропласты разрушаются и происходит распад хлорофилла. Растения становятся желтыми и вместо хлоропластов содержат этиопласты, окраску которым придают каротиноиды. Восстановление зеленой окраски и повторное образование хлорофилла и хлоропластов происходит при освещении растений. Дефицит железа или магния вызывает подавление синтеза хлорофилла (разд. 5.9.7 и 5.9.15).
29. Это сделать очень трудно. Такой фоторецептор должен содержаться в очень небольших количествах вместе с другими неактивными пигментами, концентрация которых гораздо больше. Вероятно, для этой цели можно использовать сложный метод спектроскопического исследования быстрых процессов. Не исключено, однако, что единственный путь, с помощью которого можно было бы установить природу действующего фоторецепторного пигмента, — это его выделение и химическая идентификация.
30. Рассмотрите свойства фитохрома, описанные в разд. 11.2 и иллюстрируемые рис. 11.2. Помните, что активной формой фитохрома является, по-видимому, Pfr-форма, тогда как Рг-форма играет лишь пассивную роль.
27—84
Предметный указатель
Абсорбция 25
Агликон 129
Адаптация к высоте 216
S-Аденозилметионин 68, 147, 149, 203, 208, 245
Адреналин 277, 292
Азотсодержащие пигменты 254—257
Аклавннон 102, 103
Актиномицин 249, 250
Актнноэритрин 40, 59, 83
Александрийский лист 122
Ализарин 102, 117, 121
Алканнин 116, 121
АЛК см. 6-Аминолевулиновая кислота
АЛК-дегидратаза (порфибилиноген-синтаза) 195—198, 216
АЛК-сннтетаза 195, 196, 215—218
АЛК-трансаминаза (аминолевулинат — аминотрансфераза) 196
Аллоксантин 77
Алломеланины 259, 265, 268, 272
Аллофикоцианин 189, 190, 354
Альбедо 290
Альбинизм, альбиносы 277, 287, 321
5-Аминоимидазолрибонуклеотид 233, 234
Ампнолевулинат — аминотрансфераза см. АЛК-трансаминаза
б-Аминолевулиновая кислота (АЛК) 195—197, 208, 215, 216
Ангидрородовнбрин 70
Антенны (светособирающие пигменты) 334—339, 364
Антераксантин 52, 329, 331
Антибиотики 249
Антибиотические свойства пигментов 119—120, 122, 249
Антоксантин 128
Антохлор 128
Антоцианидины 126—129, 133—136, 144—146
Антоцианы 125, 129, 137—139, 149— 154, 252, 365
Антрахиноны 93, 96, 98, 101 —102, 105, 109—110, 114, 118, 119, 121, 122
Антрациклиноны 102, НО, 122
Аплизиовиолин 191, 193
Апо-каротиноиды 39—40, 85, 365
Арильные полиены 87
Астаксантин 38, 42, 44, 51, 54, 58—
60, 83, 316, 317, 323
Астацин 60
Ауксохромы 21
Ауроксантин 49, 50
Ауроны 127, 133—134, 139, 145, 294
Афины 93, 102, 103, 105, 117
Аэругннозин 240, 241
Бактериальный синтез 327—ь328,
355—358, 367
Бактериородопсин 377—380
Бактериоруберин 39, 57, 69
Бактериофеофитин 357
Бактериохлорин 157, 158
Бактериохлорофиллид а 208, 210
Бактериохлорофиллы 157, 160—162, 165, 166, 208, 210, 219, 355—358, 364, 374
Батородопсин 312, 313
Батохромный эффект 44, 59
Бензотиазол 264
Бензохиноны 92—96, 99, 106, 108, 114, 116, 119—120, 272, 274
Берберин 255, 256
Бетаксантины 250—251, 253, 294
Беталаины 250—255, 257, 258
Беталамовая кислота 253, 254
Бетанидин 251—254
Бетанин (бетанидин-5-О-Р-глюкопи-ранозид) 252
Бетацианины 250—255
Биливердины 185—188, 211, 212, 219
Билины см Желчные пигменты
Билипротеины 374
Билирубин 185—188, 211, 212, 214, 218
Биолюминесценция 387—392
Биоптерин 228, 238
Биохромы 10, 13, 15—16
Бора эффект 171 —172
Валлемия А 86, 87
Видимый свет 9—11
Виолаксантин 38, 52, 53, 76, 329, 331
Внолаксантин — хлорофилл a/ci/cz — белок, комплекс 352
Виолацеин 255, 256
Витамин А (ретинол, 3,4-дидегид-роретинол) 83—85, 89, 304, 305, 315, 316
— В[2 183—185, 208—209
Галлахром 102, 103
Галлоксантин 322, 323
Галлофеомеланин 264
Галобактерии 69
Гардерова железа 381
Гардеропорфирин 381
Гем 156, 158, 167, 170, 171, 174, 185, 209, 212, 213, 217, 382, 387
— биосинтез 201, 204, 215
Гемованадин 177
Гемоглобин 29, 167—177, 187, 216, 219
Предметный указатель
41k
— А 169, 173
— А2 169
— F 169, 173
— S 173
Гемолимфа 105, 175
Гемопротеины 167, 382. См. также Гемоглобин, Миоглобин
Гемоцианин 177 Гемоэритрин 177 Геранилгеранилпирофосфат (ГГПФ) 60—62, 80, 206, 207
Геранилгераниол 161, 162, 206, 207 Геранилпирофосфат 61, 62, 116 Гербициды 64, 67, 82, 363 З-Гидроксиантраниловая кислота 249, 250
Гидроксибензоат 116 Гидрокси-п-бензохинон 272, 274 ЗТидроксииндол 255, 256 рТидрокси-р-метилглутарил-СоА (ГМГ-СоА) 61, 62
Гидроксинафтохиноны 95—98 Гидроксисфероидин 56, 57, 70 2-Гидроксихромены 134, 135 Гидрохинон 92—94, 115, 116 Гиперицин 103, 104, 120 Гипсородопсин 312, 313 Гипсохромный сдвиг 51 Глаз беспозвоночных 300—302 — позвоночных 297—300 Глаукобилин (мезобиливердин) 188 Гликозиды флавоноидов 128—129 Глицин 233, 234 Глицинамидрибонуклеотид 233, 234 Голохромный белок (протохлорофил-лидредуктаза) 207, 213
Гомоарбутин 115, 116
Гомогентизиновая кислота 112, 114, 115
Гомо-каротиноиды 39
Гомопротокатеховая кислота 152 Гуанин 15, 225, 226, 285, 288, 321, 322
— биосинтез 232—237 Гуанинмонофосфат 235 Гуаниннуклеотид 235 Гуанофоры см. Иридофоры
3-Дезоксиантоцианидин 126, 127, 145 Дезоксигемоглобин 168—169, 173— 175
Дезоксимиоглобин 168 Декапреноксантин 39, 57, 74 2-Декарбоксибетанидин 250, 251 Дельфинидин 129, 135, 138—140 «Диапонейроспорин» 56, 57 Дибензопиразин 240. 241 27*
6,6-Диброминдиго 255, 256
Дигидроксантомматин 246, 247
1,8-Дигидроксинафталин 265, 267, 272
Дигндрокси-1,4-нафтохиноны 97
7,8-Дигидронеоптерин 236—238
Дигидропорфирины 157, 161, 178, 207
3,4-Дидегидроретинальдегид 84, 304, 309, 316, 320
3,4-Дидегидроретинол (витамин А2) 83, 84, 316
Диметилаллилпирофосфат (ДМАПФ) 62
6,7-Диметил-8-рибитиллюмазин 237, 239
Дисперсия оптического вращения (ДОВ) 29, 42
3,5-Дифосфоаденозин 390
2,3-Дифосфоглицерат (ДФГ) 171 — 173, 216
Дифракция 15
ДОФА (дигидроксифенилаланин) 252—254, 261, 262, 269—271
ДОФА-меланин 261
Дофамин 269, 271
Дофахинон 261, 262, 264, 269—271, 273
Дофахром 269, 270
Древесина, кора 92, 99—100, 117, 120, 137 139
Дрозоптерин 227, 237, 238, 324
ДФГ см. 2,3-Дифосфоглицерат
Желтое пятно 298, 299, 322
Желчные пигменты (билины) 156, 158, 185—194, 209, 211—215, 218— 221, 372
Желчный камень 187
Загар 276, 287, 386
а-Зеакаротин 71, 73
Р-Зеакаротин 37, 71, 73
Зеаксантин 38, 49, 52, 76, 83, 322,. 329, 331
Зеркальный слой (tapetum lucidum) 321____322
Зрение 11—13, 30, 34, 227, 228, 247, 249, 266, 285, 297—326
Зрительные пигменты (фоторецепторные молекулы) 299, 302—303, 310— 318
— циклы 310—318, 325
Изоаллоксазин 224, 230, 240
Изобетанидин 250, 251
Изогуанин 225
Изозеаксантин 49, 50
Изокриптоксантин 49
412
Предметный указатель
Изоксантоптерин 238 Изопентенилпирофосфат 62 Изопреновая единица 34 Изопреновые заместители 114
Изопреноидный путь 61, 106, 118
Изопсин 320
Изородопсин 308
Изофлавоны 127, 131, 144, 147
Индиго 255, 256
Инднгоиднн 255, 256
Индигоксантин 252
Индикан (3-гидроксииндоглюкозид) 255, 256
Индолил-5,6-хинон 260, 261, 269, 270, 272
5,6-Индол-2-карбоновая кислота 269, 270
Инозиновая кислота 233, 235
Интерференция 14—15
Инфракрасная спектроскопия (ИК) 25, 98
Иодннии 240—245
Иодофоры 225, 285, 286, 291
Кантаксантин 47, 48, 50, 51, 55, 58, 76, 83, 85, 86
Капсантин 53, 77
Капсорубин 53
Карбоксигемоглобин 173—174
Карминовая кислота 102, 103, 118, 121
«-Каротян 36, 37, 52, 54, 69, 73, 76 Р-Каротин 35—37, 46—49, 52—58, 69, 73, 76, 81, 83, 85, 86, 218, 304, 305, 335, 336, 354, 365, 376
р,р-Каротин 76
Р,у-Каротин 58
у-Каротин 47, 55, 56, 69, 73
у,у-Каротин 46
6-Каротин 69, 73, 81
Е-Каротин 69, 73, 83, 322
Е,Е-Каротин 46, 323
^-Каротин 43—45, 64, 66, 81, 362
Каротиноиды 21, 23, 34—90, 122, 226, 240, 284, 293, 294, 304, 309, 322, 328, 329, 338, 339, 351, 357—365, 374—377, 382, 383, 385—387
Сз0-Каротиноиды 40, 57, 62, 64
С40-Каротиноиды 39—41
С45,Сзо-Каротиноиды 39, 56, 57, 69, 71, 72, 74, 75
Каротинопротеин 44, 51, 59—60, 90
Каталаза 167, 181
Катехины 139, 146, 149
Кверцетин 129, 135, 152
Кемпферол 129, 135
Кератин 386
Кермезнновая кислота 102, 103, 121 а-Кетоглутарат 197
Кинуренин 246—249
Колебательная релаксация 22, 23
Коэлентеразин 389
Комплементарные цвета 11
Конденсированные дубильные вещества 139
Копигментация 140, 154
Копропорфириноген (III) 199—203
Коричные кислоты 114, 139, 141, 142, 150
Коррнн 183
Кортизалин 86
Кофейная кислота 147
Кошениль 102, 105, 121
Коэффициент молярного поглощения 25
— удельного поглощения 26
«К. п. 450» 56, 57, 74
Красители 92, 121—122, 255, 256
Красное внно 138
В-Криптоксантин 49
Круговой дихроизм (КД) 22, 24, 28— 30, 32, 42, 307, 313, 317
Крустацианины 51, 59
Ксантиловая кислота 235
Ксантин 225
Ксантоафнн 103, 104, 117
Ксантобласты 287
Ксантомматин 246—249, 324
Ксантомонаднн I 87
Ксантоптернн 227, 229, 238
Ксантофиллы 35, 37—38, 335, 354, 360, 365
Ксантофоры 240, 284—286, 291 n-Кумаровая кислота 141, 147
Культуры клеток растений (петрушки) 143, 145, 153, 154
Курчавость листьев 150
Лавсон 100, ИЗ, 114, 121
Лаккаиновая кислота D 109
Ламберта—Бэра законы 25
Лампирин 389
Леггемоглобин 176
Лейкоптерин 227, 229, 238
Ликоперсин 63, 64
Ликопин 34, 37, 41, 44—48, 53, 64— 71, 73, 78, 81, 82, 365, 366
Линейный дихроизм 28, 30
Листья, побеги 138, 139, 150
Люмнродопсин 312, 313
Лютеин 37, 38, 52, 316, 317, 322, 335, 336
Люцифераза 388—390
Предметный указатель
413
Люциферин 388—390
Магнийпротопорфирин IX 203, 204
Мартицин 120
Масляные капли 322—323
Масс-спектрометрия 25, 98, 130
Мевалонат см. АТевалоновая кислота
Мевалонатный путь 114—117
Мевалоновая кислота, мевалонат
(МВК) 61, 62, 67, 76, 77, 114—118
Медиальный глазок 380
Межсистемный переход 23, 24, 385
Меланиновые гранулы (меланосомы)
267, 276, 277, 284, 289, 290, 291
Меланины 226, 240, 259—279, 283—
284, 286, 290, 321, 324, 386, 387
— биосинтез 268—274
Меланогенез 268—273
— аномальный 277
Меланома 261, 267, 277
Меланосомы см. Меланиновые гранулы
Меланофоры 283—286, 291
Меланоцитстимулирующий гормон
(МСГ) 276, 291—292
Меланоциты 267, 276, 283—284, 295, 386
Мелатонин 291, 292
Менадион 113, 114
Менахинон 92, 99, 100, ПО, 114, 119
Метародопсииы 312—314, 317
Метгемоглобин 169, 173
Метилмагнийпротопорфирин IX 203—
205
7-Метилюглон 117, 118
Микроокружение пигментов 25, 27,
30, 161, 225
Миксоксантофилл 54, 55
Миоглобин 167—174, 219
Мирицетин 129, 135
Моллисин 100
Мориндон 121
Мочевая кислота 225
Мускааурин 252, 253
Нафтазарииы 101
Нафтохиноны 93—94, 96—101, 105, 106, 108—109, 114—122
Нейроспорин 44, 45, 64, 66, 70, 71, 73
Неоксантин 52, 76, 77
Норадреналин 292
Нор-каротиноиды 39—40, 83
Окенон 56, 57, 77
Окраска (в природе) 29, 31—32, 220, 281—283. См. также Структурная окраска
— влияние гормонов 291—292
— изменение у животных 287—292
— наружных покровов 57—59, 175, 181, 188, 226, 240, 265—267, 278, 295
— оперения 182
— раковины моллюсков 182, 193
— суточные ритмы 291
— у растений 292—294
— яичной скорлупы 182, 220
Оксигемоглобин 168—174, 176
Оксидазы со смешанной функцией 76, 181
Оксилюциферин 390
Оксихлорорафин 240, 241
Омматины 246—249
Оммины 246—248
Оммохромы 223, 246—249, 258, 266, 290, 324
Опсины 28, 84, 305—319, 325
Оптическая плотность 25
Отравление окисью углерода 173
Папилиохромы 249
Пеларгонидин 129, 135, 138
Перенос электронов (электронный транспорт, электронтранспортная система) 119, 177—180
— — при фотосинтезе 327, 328, 332— 335, 337, 342—348, 352, 353, 355— 358, 360, 383
Перидинин 352
Перламутр 15
Пероксидаза 167, 181
Пигмент — белок, комплексы 28, 30, 352, 360
Пиоциании 240—242, 244, 245
Пирокатехин 92—94, 265, 267, 268, 272
е-Пирромнцинон ПО
Пищевые красители 85, 89, 105 121, 152—154, 257
— цепи 327
Пластоглобулины 330
Пластохиноны 92, 99, 105, ПО, 119, 335, 343—346
Пластоцианин 344—347, 358, 360
Поглощение света 16—24
Покровительственная окраска 281 — 282
Покровные ткани как фоторецептор 381—383
Поликетидиый путь 77, 87, 106—110, 117, 140, 141, 150
Полифенолоксидаза см. Тирозиназа
Полухиноиовый радикал 230, 231
414
Предметный указатель
Порфии 157
Порфирии 217—218
Порфирины 86, 156—183, 195—221, 365, 381, 382, 387
Порфиропсины 304, 316, 320, 382
Порфобилиноген (ПБГ) 195, 197—
199, 208, 217
Пребатородопсии 313
Предупреждающая окраска 281—283
Префеновая кислота 111,112
Префитоиипирофосфат (ПФПФ) 63, 64, 80
Примни 120
Природные пигменты 10, 15—16
Провитамин А 89, 316
Продигиозии 156, 255, 256
Проламеллярные тела 358, 359
Проликопин 41, 48, 82
Пропластиды 358, 361
Протилакоидные мембраны 358—359
Протоафииы 102—105, 117
Протогем 167, 168
Протокатеховая кислота 152
Протопорфирин I 201
Протопорфирии IX 167, 182, 195, 201, 381
Протопорфирииогеи IX 195, 199,
201—204
Протохлорофиллид а (магнийвинил-феопорфириновый эфир) 203, 205— 209, 359—360, 362
Птеридины 223, 224, 228
Птерииосомы 284, 285
Птерины 224, 226—230, 232—238, 240, 257, 258, 285, 290
Пурины 223—226, 232—240, 258
Рамановская спектроскопия 24, 26— 28, 30, 32, 307, 313
Реакционные центры 333—346, 355— 359, 364
Рентгеноструктурный анализ 167
Реньератии 58, 59
Ретикуло-эидотелиальиая система 187, 213
Ретинальдегид (ретииаль, ретинен) 28, 83—85, 304, 310—321, 325, 378, 382
Ретииол (витамин Ai) 83—84, 86, 304, 305, 314, 315
Ретинолсвязывающий белок 84, 305
Ретииохром 318
Ретро-каротиноиды 38—39, 53, 77
Рибофлавин (витамин В2) 223, 224, 232—240 258 321 322, 374—376, 382
Родовибрии 70
Родоксантин 39, 53
Родопин 68, 70
Родопсин 12, 302, 314—316, 320, 325
Родоптилометрин 102, 103
Рэлея рассеяние 13
Сарциноксантии 56, 57, 74
Световые реакции 327
Светорассеяние 13—14
Светособирающий комплекс 335—337, 360
Сепиаптерин 227, 228, 238
Сепиомелаиии 261—263, 267, 271
Серповидно-клеточная анемия 173
Сетчатка 12, 83, 84, 231, 298, 299, 319, 321, 322
Сигнальная окраска 29, 175, 391. См. также Предупреждающая окраска
Симбиоз 83, 118, 187, 231, 388
Синглетные состояния 23—24, 338, 385
Склеротины 265—266
Скотопическое («ночное») зрение 310
Скотопсины 12, 310
Сложный глаз 300—301
Солорииовая кислота 109, НО
Соре полосы 159
Спектроскопия 24—28
Спинохромы 97, 100—101, 118, 120
Спинулозии 108
Спириллоксаитин 56, 57, 69, 70, 356, 357
Стеркобилин 186, 187, 211, 214
Стеркобилиноген 211, 214
Стигма 375
Стрептоварицин А 122
Строма (хлоропластов) 329—331
Структурная белизна 15, 224
— окраска 13, 30, 32, 224, 266, 281, 285—286
о-Сукцинилбензоат 113, 114, 117
Сфероидеион 69, 71
Сфероидин 69—71
Z-Схема (транспорта электронов) 342—344, 351, 353
Таксономия 137, 153, 166, 175
Теафлавины 139, 149
Темновые реакции 327, 328, 346—349
Тетрагидропорфирии (бактериохло-рии) 157, 160, 163, 166
3,4,3',4'-Тетрадегидроликопии 67, 68
Тетрапирролы 156—222
Тетратерпеиы 34
Тиамиипирофосфат 113
Тилакоидная мембрана 330—332, 340, 346, 347, 360, 363
Предметный указатель
415
----бурых водорослей 352
----сине-зеленых водорослей 353 353
Тилакоидные граны 52, 330—332, 335, 359
Тиминовые основания 384
Тиндаля синева 13—15
Тиривердин 255, 256
Тирозин 141, 268—270, 309
Тирозиназа (полифеиолоксидаза) 269, 271, 274, 277, 284
Тироксин 291, 292
Тирский пурпур 255
Торулародин 55
Триплетные состояния 22—24, 338, 386
Триптофан 248, 249, 309
Триспоровая кислота 81
Трихосидерииы 264—265, 271
Убихинон 92, 99, 105, 110, 112, 113, 119, 357, 358
Уробилиноген 186—188, 211, 214
Уробилины 187, 188, 211, 214
Уропорфирин 181 —183
Уропорфириноген 'III) 197—200, 203
Уропорфириногеиы 197, 199—201,
208, 217—218
Феназин-1,6-дикарбоиовая кислота
243
Феназины 223, 240—245, 258
Фенилаланин 141
Фенилаланин-аммиак-лиаза (ФАЛ) 141, 150
Феноксазины 245—249
Фенольная конденсация 117
Феомеланины 222, 263—266, 268, 271—273
Феофитин 162, 163
Феофорбиды 163, 167, 365, 366
Ферредоксин, 344 347
Ферримиоглобии 168—169
Феррохелатаза 201
Фикобилины и фикобилипротеины 156, 192, 211, 220, 328, 352—354, 362, 363
Фикобилисомы 189, 192, 211, 220, 353—355, 363
Фикоуробилин 191, 192
Фикоцианин 189 190, 192, 216, 354, 363
Фикоцианобилин 190, 192
Фикоэритрин 189—191, 193, 216, 352, 354, 363
Фикоэритробилин (фикобиливердии, фиковиолин) 190—194
Фиксация углерода 350—351
Филлохинои 92, 99, 100, 110, ИЗ, 114
Филлоэритрии 166, 167
Фитилпирофосфат 206, 207
Фитоалексины 150
Фитоин 41, 43, 45, 57, 60, 62—67 78, 80—82
Фитол 62, 160, 162, 207, 208, 365
Фитофлуин 43—45, 64, 66, 69
Фитохром 83, 150, 156, 193, 194 215, 220, 221, 359, 360, 369—374, 391
Ф лаван-3,4-диолы (проантоцианиди-
ны) 126, 127, 132, 144, 147, 148
Флаванонолы (дигидрофлавонолы)
126, 127, 130, 144—146
Флаван-З-олы (катехины) 126—128, 131, 144, 148, 149
Флаваноны 126, 127, 131, 132, 139, 144, 145, 148
Флаваны 125, 131, 132, 144, 147, 149
Флавилиевые соли 133—135
Флавины и флавопротеины 150, 181, 230—240, 257, 258, 328 344, 375, 389, 391
Флавоиин 136, 137
Флавоноиды 111, 112, 125—155,
293—294
Флавонолы 126, 127, 129, 132, 133, 135, 136, 139, 140, 144, 145, 151, 294
Флавоны 125—127, 130—132, 136, 139, 144, 145, 147, 151, 294
Флексирубины 87
Флешспектроскопия 32
Флеш-фотолиз 371
Флороглюциикарбоиовая кислота 152
Флуоресценция 22—24, 131, 230,
232, 321—322, 337, 389
Фолиевая кислота 228, 235
Форбин 160
Формилглицинамидрибоиуклеотид
233, 234
Формилкииурении 248, 249
Формил-№°-тетрагидрофолиевая кислота 233
Фосфоресценция 22—24
Фотодинамическое повреждение 384— 386
Фотозащита 79, 80, 84—86, 384—386
Фотопическое зрение 310
Фотопсииы 12, 310, 315, 319
Фоторегеиерация 318
Фоторецепция 12, 84, 299—301
Фотосеисибилизация 120
Фотосинтез 9, 23—26, 29, 30, 32, 84,
416
Предметный указатель
118, 140, 156, 160, 166, 185, 189, 219, 220, 326—368
Фотосинтезирующие бактерии 57, 68, 76, 80, 160, 161, 201, 327—329, 355—358, 363—364, 385—386
— единицы 333—335, 356
Фотосистемы I и II (ФС1 и ФСП) 330, 332—347, 354—357, 359
Фототаксис 374—376, 392
Фототропизм 84, 376—377, 392
Фотофосфорилирование 327, 328,
347—349
Фоточувствятельность и фотозащита 120, 380—384
Фрингелиты 104, 105
Фукоксантин 54—55, 352
Фукоксантин — хлорофилл а/сг — белок, комплекс 352
«Халконовая форма» 134
Халконы 127, 133—134, 139, 143, 144, 147, 294
Химафилин 115, 116
Химохром 128
Хиноидное основание 134, 135
Хинол 92—94
Хиноны 92—124
Хлорины 157, .160, 167, 178, 207
Хлоробактин 56, 57, 77
Хлоробиум-хлорофиллы 208
Хлорозы 215
Хлорокруорин 176—177
Хлорокруорогем 177
Хлороксантин 70
Хлоропласты 38, 52, 54, 60, 64, 76, 82 152, 154, 160, 166—167, 201, 329—333, 358—365, 370, 374
Хлоросомы 355
Хлорофилл а 159—165, 206—209,
215, 334—337, 340, 341, 351—352 — а' 161
— щ (Р = 700) 335, 338—340, 343— 345, 352, 357
— ап (Р = 680) 335, 338, 341, 343, 345
— alb — белок, комплекс 335, 338
— b 160—163, 207—208, 335—338, 351
— Ь' 161
Хлорофиллаза 207
Хлорофилл — белок, комплексы 335— 337
Хлорофиллид а 163, 166, 206. 207, 210
Хлорофиллы 29, 62, 82, 138, 156— 167, 195—217, 219, 220, 221, 329 — биосинтез 195—210, 334—341
— сине-зеленых водорослей 354 — cad 160—164, 208, 209, 219, 351 Хна 92, 121
Хоризмовая кислота 111, 112, 243
Хризоафин 103, 104
Хризопсин 320
Хризоптерин 226, 227, 229, 238
Хроматобласты 287
Хроматофоры 283—287, 295, 355
Хромопласты 60, 64, 67, 71, 294, 365
Хромофоры 21
Хунда правило 23
Цвет 10—И
Цветки и плоды 29, 52, 53, 99 125, 129, 137—140, 149—153, 268, 280, 292____295 371
Цветовое зрение 11 —12, 318—321, 325
Цианидин 135, 139
Цианокобаламин 184
Цианопсины 320
Циркадианные ритмы 381—383
Цитохромы 167, 177—181, 215, 328
Р-Цитраурин 40
Червецы 119
Шикиматный путь 110—116, 118, 124, 140, 141, 150
Шикимовая кислота (шикимат) ПО— 113, 115, 117
Шиконин 121
Экситонные взаимодействия 22
Экстинкция 25
Электронтранспортная цепь см Перенос электронов
Электрохимические градиенты 333, 347, 377—379
Эмодин 101, 102, 106
Эпифиз 380—381
Эритроафин 103, 104
Эритроптерин 227, 229, 238
Эритрофоры 240, 284 — 286, 291
Эхиненои 47, 48, 353, 354
Эхинохромы 100, 101, 382, 383
Эшшольцксантин 53, 77, 79
Юглоны 100, 101, 113, 114, 117, 120
Яваницин 108
Ядерный магнитный резонанс (ЯМР) 25, 42, 98, 130, 163
Яичный желток 58
ЯМР см. Ядерный магнитный резонанс
Указатель латинских названий
Actinia equina 59
Aequorea 389
Amantia muscaria 252
Antedon 383
Antirrhinum majus 139
Aphis fabae 103
Aplysia 193, 382
Arion ater 387
Arthropoda 175
Aspergillus candidus 136
— niger 265, 272
Asterias rubens 59
Bacillariophycea 351
Beneckea 388
Beta vulgaris 252
Bignoniaceae 117
Blakeslea trispora 55, 81
Boraginaceae 116
Brachiopoda 175
Branchiostoma 383
Brevibacterium 242
Cantharellus cibarius 55
Capsicum annuum 53
Carassius auratus 320
Carcinus 282
Carpobrotus acinaciformis 250
Centrospermae 252
Chaetognatha 175
Cheiranthus cheirii 294
Chlamydomonas 351
Chlorella 207, 329, 351, 362
•Chlorobacteriaceae 328
Chlorobiaceae 57, 328, 355
Chlorobium 161, 208, 355, 358
Chlorogloea 190
— fritschit 362
Chlorophyceae 351
Chlorophyta 160
Chromatiaceae 57, 355
Chromatium 328, 358
Chromobacterium violaceum 255
Chrysophyceae 351
Coccinella septempunctata 58
Codium fragile 166
Coelenterata 175
Corticium salicinum 86
Corynebacterium 57
Cryptophyta 189, 190
Cyanobacteria 55
Cyanophyta 55, 189, 190
Cypridina 390
Cytophaga 87
Dactylopius coccus 121
Daldinia concentrica 265
Daucus carota 54
Diadema 383
Digitalis purpurea 293
Dinophyceae 351
Diospyros 117
Diptera 227
Drosera 117
Drosophila melanogaster 227, 249, 325
Dytiscus 136
Elysia viridis 166
Escherichia coli 235
Eschscholtzia californica 53
Euchloe cardamines 226
Euglena 54, 362, 363, 375
— gracilis 82, 361, 374
Euglenophyceae 351
Eupithecia oblongata 136
Flavobacterium 57
Flexibacterium 87
Fusarium javanicum 108
— martii 120
Galago 231
Gonepteryx rhamni 226
Halobacteria 56, 69, 391
Haplopappus gracilis 145
Helix pomatia 136, 177
Holothuria forskali 231
Homarus vulgaris 59
Hydrangea macrophylla 138
Hymenoptera 227
Hypericum 103, 120
Indigofera tinctoria 255
Isatis tinctoria 255
Juglans regia 100
Kermococcus ilicis 121
Latia 390
Lawsonia alba 100, 121
Lepidoptera 226
Leptinotarsa decemlineata 58
Limulus polyphemus 380
Lobelia 140
Mollisia caesia 109
•— fallens 100
Myrex 255
418
Указатель латинских названий
Mycobacterium 80
— tuberculosis 122
Nereis diversicolor 188
Neurospora crassa 80
Nocardia 242
Nucella 255
Onchorhynchus keta 175
Onychophora 175
Papilionidae 249
Periplaneta 231
Petroselinum Hortense 143
Phaeophyceae 351
Phaeophyta 160
Phaffta rhodozyma 42
Photobacterium. 388
Phycomyces blakesleeanus 78, 265
Pieridae 226
Pieris brassicae 189, 226
— rapae 226
Polyzoa 175
Porifera 59, 175
Primula obconica 120
Prochloron 166
Protochordata 175
Prunella modularis 188
Pseudomonas aeruginosa 242
— indigofera 255
— phenaztntum 242
Pyrrophyta 160
Лапа pipiens 287
Renilla 391
Rhizobium spp. 175
Rhodomicrobium vanniellii 68
Rhodophyta 160, 189, 190
Rhodopseudomonas 57, 69, 208, 357, 364
— capsulata 356, 363
— palustris 358, 363
•— sphaerotdes 69, 215, 356—358, 363
Rhodospirillaceae 57
Rhodospirillum rubrum 57, 69, 328, 357,.
358, 364
Rhodotorula spp 55
Rotifera 175
Rubia tinctorum 102, 121
Rubiacea 117
Saccharomyces cerevisiae 240
Sarcina 57
Scenedesmus 351, 362
— obliquus 81
Schistocerca 58
Septia officinalis 261
Serratia 255
Sertularella 136
Sipunculata 175
Spirogyra 329
Staphylococcus 57
Streptococcus 57
Spreptomyces 249
Tardigrada 175
Taxus baccata 53
Tenebrio molitor 269
Ulva 54
Vespula vulgaris 227
Wallemia sebi 86
Xanthomonas 87
Xanthophyceae 351
Zea mays 81
ОГЛАВЛЕНИЕ
Предисловие редактора перевода .................................... 5
Предисловие........................................................ 7
Часть I. Химические и биохимические аспекты
Глава 1. Свет и цвет.............................................. 9
1.1 Введение................................................. 9
1.2. Цвет и его восприятие....................................10
1.3 Цвет у живых организмов...................................12
1.4. Поглощение света.........................................16
1.5. Спектроскопические методы исследования природных пигментов 24
1.6. Значение окраски в природе...............................29
1.7. Заключение и комментарии.................................30
1.8. Рекомендуемая литература..................................30
1.9. Дополнительная литература................................32
Глава 2. Каротиноиды............................................. 34
2.1. Введение.................................................34
2 2. Структура и номенклатура............................. 34
2.3. Свойства.................................................43
2.4. Распространение в природе................................52
2.5. Каротинопротеины.........................................59
2.6. Биосинтез................................................60
2.7. Регуляция и контроль биосинтеза каротиноидов .... 78
2.8. Метаболизм каротиноидов у животных...................... 82
2.9. Функции каротиноидов.................................... 84
2.10. Каротиноиды как пищевые красители ....... 85
2.11. Использование каротиноидов в медицине....................86
2.12. Другие полиеновые пигменты...............................86
2.13. Заключение и комментарии.................................87
2.14. Рекомендуемая литература.................................89
2.15. Дополнительная литература................................90
Глава 3. Хиноны...................................................92
3.1. Введение.................................................92
3.2. Строение.................................................92
3.3. Свойства.................................................94
3.4. Распространение в природе................................98
3 5. Вклад в окраску......................................105
420
Оглавление
3.6. Биосинтез...............................................105-
3 7. Функции и биологическое действие..............US'
3.8. Использование в промышленности и медицине .... 121
3.9. Заключение н комментарии............................ ... 122
3.10 Рекомендуемая литература........................... .... 123
3.11. Дополнительная литература.............................. .124
Глава 4. О-Гетероциклические пигменты—флавоноиды...................125
4.1. Введение.................................................125
4.2. Структура и номенклатура.................................125
4.3. Свойства.................................................130
4.4. Распростраиеиие..........................................136
4.5. Участие в формировании окраски растений..................137
4.6. Биосинтез................................................140'
4.7. Метаболизм флавоноидов у животных.........................151
4 8. Разрушение флавоноидов микроорганизмами.......151
4.9. Функции флавоноидов в растениях..........................151
4.10. Использование антоцианов в качестве пищевых красителей 152
4.11. Заключение н комментарии.................................153
4 12. Рекомендуемая литература..............................154
4.13. Дополнительная литература................................155
Глава 5. Тетрапирролы.............................................156
5.1. Введение.................................................156
5.2 Общие структурные свойства...............................156
5.3. Общие светопоглощающие свойства тетрапирролов . . . 159
5.4. Хлорофиллы...............................................159
5.5. Гем н гемопротенны.......................................167
5.6. Свободные порфирины у животных...........................181
5.7. Витамин В|2..............................................183
5.8. Линейные тетрапирролы — билины...........................185
5 9. Биосинтез и метаболизм тетрапирролов................195
5.10. Нарушения метаболизма порфиринов.........................217
5.11. Функции тетрапиррольных пигментов....................... 219
5.12. Заключение и комментарии.................................219
5.13. Рекомендуемая литература.................................220
5.14. Дополнительная литература................................221
Глава 6. Другие неполимерные N-гетероциклические пигменты 223
6.1. Введение.................................................223
6.2. Пурины, птерины и флавины................................224
6.3. Феназины.................................................240
6.4. Феноксазнны..............................................245
6.5. Беталаины.............................................. 250!
6.6. Другие N-гетероцнклические пигменты......................255
6.7. Заключение и комментарии.................................257
6.8. Рекомендуемая литература.................................257
6.9. Дополнительная литература................................258
Глава 7. Меланины...........................................259
7.1. Введение.............................................259
7.2. Химия.............................................. 260'
Оглавление 421
7.3. Распространение меланинов .... , 266
7.4. Биосинтез.......................................’ ’ 26В
7.5. Факторы, влияющие на меланогенез . . •...............275
7.6. Функции............................................’ ‘ 277
7.7. Заключение и комментарии 278
7.8. Рекомендуемая литература..............................278
7.9. Дополнительная литература..............................279
Часть II. Функциональные аспекты
Глава 8. Значение окраски в природе...................щ . ... 280
8.1. Введение.............................................280
8.2. Окраска и характер ее распределения у животных . „ . 281
8.3. Пигментные клетки животных — хроматофоры .... 283
8.4. Изменение окраски у животных.........................287
8.5. Окраска у растений...................................292
8.6. Заключение и комментарии.............................294
8.7. Рекомендуемая литература.............................295
8.8. Дополнительная литература....................... 295
Глава 9, Пигменты и зрение......................................297
9.1. Введение..................................................297
9.2. Глаз......................................................297
9 3. Зрительные пигменты..................................303
9.4. Функционирование зрительных пигментов; циклы превраще-
9.5. Некоторые аспекты цветового зрения.............318-
9.6. Вспомогательные пигменты в процессе зрения .... 321
9.7. Заключение и комментарии..................................325
9.8. Рекомендуемая литература...........325
9.9. Дополнительная литература...........326
Глава 10. Фотосинтез..................................................327
10.1. Введение................................................
10.2. Фотосинтетический аппарат эукариот: хлоропласты .
10.3. Фотосинтез у растений; общая схема......................
10.4. Поглощение света — первичный процесс фотосинтеза
10 5. Вторичные события; система фотосинтетического транспорта электронов ...................................................
10 6. Темновые реакции.................;...................
10.7. Фотосинтез у эукариотических водорослей .
10.8, Фотосинтез у прокариотических сине-зеленых водорослей
10.9. Бактериальный фотосинтез................................
10.10. Синтез пигментов в связи с развитием хлоропластов
10 11. Развитие фотосинтетического аппарата у фотосинтезирующих бактерий .................................................
10.12. Дальнейшая судьба фотосинтетических пигментов в ходе разрушения хлоропластов.......................................
10.13. Заключение и комментарии...............................
10.14. Рекомендуемая литература
10.15. Дополнительная литература..............................
327 329
333
333
342
347
351
353 355
358
363
364
365
367
367
422 ____________________________Оглавление____________________________
Глава 11. Другие фотофункции природных пигментов.................369
11.1 Введение............................................... 369
11.2 . Фитохром.............................................369
11.3 Фототаксис..............................................374
11 4 Фототропизм.........................................376
11.5 . Бактериородопсии......................................377
11.6 . Внеглазные фоторецепторы у животных...................379
11.7 . Фотозащита............................................383
11 8. Биолюминесценция....................................387
119 Заключение и комментарии................................391
11 10 Рекомендуемая литература............................392
11.11. Дополнительная литература..............................393
Задачи............................................................395
«Ответы...........................................................402
Предметный указатель..............................................410
^Указатель латинских названий . . 417
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее оформлении, качестве перевода и другие просим присылать по адресу:
129820. Москва, И-110, ГСП
1-й Рижский пер., д. 2, издательство «Мир»
Монография
Г. Бриттон
БИОХИМИЯ ПРИРОДНЫХ ПИГМЕНТОВ
Научный редактор Т. И. Пономарева Мл. научн. редактор 3. В. Соллертинская Художник В. П. Груздев Художественный редактор Л. М. Кузнецова Технический редактор Н. И. Манохина Корректор Н. В. Андреева
ИБ № 5609
Сдано в набор 15.01.86. Подписано к печати 04.07.86.
Формат 6ОХ90’/1б. Бумага типографская № 1.
Печать высокая. Гарнитура литературная.
Объем 13,25 бум. л. Усл. печ. л. 26,50.
Усл. кр.-отт. 26,50. Уч.-изД. л. 27,12. Изд. № 4/4189.
Тираж 3.050 экз. Зак. 84. Цена 3 р. 90 к.
ИЗДАТЕЛЬСТВО «МИР».
129820, ГСП, Москва, И-110, 1-й Рижский пер., 2.
Московская типография № П Союзполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли.
113105, Москва, Нагатинская ул., д. 1.
Отсканировал Семенюченко Владимир chem_vova@mail.univ.kiev.ua;
vova2002@mail.ru