Автор: Успенская А.В.
Теги: protozoa биология микробиология биология клетки цитология цитология миксоспоридий
Год: 1984
Текст
А. В. УСПЕНСКАЯ
I ЦИТОЛОГИЯ
d МИКСОСПОРИДИЙ
ft- *1
АКАДЕМИЯ НАУК СССР
институт цитологии
А. В. УСПЕНСКАЯ
цитология
МИКСОСПОРИДИЙ
Ответственный редактор
Ю. И. ПОЛЯНСКИЙ
ЛЕНИНГРАД
<Н А У К А>
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
1984
УДК 593.194 : 576.36
Успенская А. В. Цитология миксоспоридий. — Л.: Наука, 1984. — 112 с.
Рассматриваются особенности цитологии, метаболизма, ядерного и жизненного циклов
паразитических простейших — миксоспоридий. Они являются возбудителями опасных заболе-
ваний рыб и приносят значительный ущерб рыболовству и рыбоводству. В книге обобщены
данные по ультратонкому строению миксоспоридий, полученные как автором, так и другими
исследователями. На основании собственных цитофотометрических данных автором пересмот-
рены представления о ядерном и жизненном циклах миксоспоридий; сообщаются новые
сведения о биологии, обмене веществ и способах питания этих паразитических организмов,
а также об их взаимоотношениях с клетками и тканями хозяина.
Приведенные сведения будут полезны биологам широкого профиля, специалистам
в области зоологии, цитологии, паразитологии, а также ихтиопатологам и ветеринарным
врачам. Библиогр. 380 назв. Ил. 6 + 25 табл. Табл. 6.
Рецензенты:
О. Н. Б а у е р, И. Б. Райков
Анна Всеволодовна Успенская
ЦИТОЛОГИЯ МИКСОСПОРИДИЙ
Утверждено к печати
Научным советом по проблемам цитологии
и Институтом цитологии Академии наук СССР
Редактор издательства Л. С. Евстигнеева. Художник Г. В. Смирнов.
Технический редактор Е. В. Траскевич. Корректоры Э. Н. Липпа и Э. Г. Рабинович.
ИБ № 20870
Сдано в набор 12.08.83. Подписано к печати 25.11.83.
М-19364. Формат 70X108,/ie- Бумага для глубокой печати.
Гарнитура литературная. Печать офсетная. Усл. печ. л. 12.6.
Усл. кр.-отт. 12.95. Уч.-изд. л. 13.4. Тираж 1000. Тип. зак. № 679.
Цена 2 р. 10 к.
Издательство «Наука». Ленинградское отделение.
199164, Ленинград, В-164, Менделеевская лин., 1.
Ордена Трудового Красного Знамени
Первая типография издательства «Наука».
199034, Ленинград, В-34, 9 линия, 12.
2001010000-502
042(02)-84
I
245-84 — I
© Издательство «Наука», 1984 г.
ВВЕДЕНИЕ
Миксоспоридии — своеобразная группа паразитических организмов,
место которых в системе органического мира до сих пор не определено
и вызывает оживленные дискуссии (Grasse, 1960; Шульман, 1966; Lom, 1973,
1977; Grasse, Lavette, 1978). По последней системе, предложенной между-
народной комиссией протозоологов по систематике и эволюции простейших,
они выделены в тип Myxozoa Grasse 1970 emend в качестве класса Мухо-
sporea Butschli 1881. Второй класс, включенный в этот тип, — Actinospora
Е. Noble n. cl. (Levine et al., 1980).
Миксоспоридии сочетают в себе, с одной стороны, целый ряд черт, сбли-
жающих их с простейшими, с другой — по ряду признаков- они выходят
за рамки Protozoa, поднимаясь до надклеточного и даже многоклеточного
уровня (Noble, 1944; Grasse, 1960; Шульман, 1966; Lorn, 1973, 1977; Grasse,
Lavette, 1978, и др.).
Одни исследователи считают, что миксоспоридии — низшая ступень эво-
люции многоклеточности и что, в связи с их переходом к паразитическому
образу жизни, ветвь эта не дала дальнейшего развития в сторону Metazoa
и закончилась слепо (Grasse, 1960; Шульман, 1966; Grasse, Lavette, 1978).
Другие рассматривают их как животных (кишечнополостных), регрессиро-
вавших в результате паразитизма (Weill, 1938; Lom, 1973, 1977); третьи свя-
зывают их с Mesozoa (Dunkerly, 1925; Gottschalk, 1957).
Миксоспоридии паразитируют в основном в рыбах (морских и пресновод-
ных), а также в других холоднокровных водных позвоночных, единичные
виды известны и у беспозвоночных.
Многие виды миксоспоридий (возбудители опасных заболеваний) вызы-
вают массовую гибель рыб и наносят существенный урон рыбному промыслу
и рыбоводству.
Из перечисленных свойств миксоспоридий ясно, что подробное их исследо-
вание имеет большое общебиологическое значение, так как может пролить
свет на закономерности эволюции многоклеточности и внести вклад в изу-
чение явления паразитизма. Выявление особенностей строения миксоспори-
дий, их органоидов, поверхностной мембраны, ядерного и жизненного циклов
представляет интерес для общей паразитологии и цитологии. Подробные све-
дения о биологии должны помочь разработке мер борьбы с ними, т. е. имеют
существенное практическое значение.
Изучение миксоспоридий началось в XIX в. Первая работа появилась
в 1825 г. (Jurine, 1825). За прошедшие с тех пор годы накопились сведения
об их морфологии, экологии, биологии и жизненных циклах. Много внимания
было уделено системе, обсуждалась филогения, болезнетворное значение,
влияние на хозяина, накапливался материал о распространении миксоспори-
дий по зоогеографическим зонам (Thelohan, 1895; Auerbach, 1907а, 1907b,
1910b, 1911, 1912а, 1912b, 1917; Keysselitz, 1908a, 1908b; Erdmann, 1911, 1917;
Nemeczek, 1911; Georgevitsch, 1917, 1935, 1937; Kudo, 1916, 1918, 1919—1920,
1930, 1933; Davis, 1923; Naville, 1931; Догель, 19326; Noble, 1943, 1944; Шуль-
ман, 1966, и др.).
С. С. Шульман (1966) в своей обширной монографии подвел итог исследо-
ваниям миксоспоридий на светооптическом уровне. В ней дана подробная
сводка литературы до 1966 г. Этот период в основном охватывает изучение
миксоспоридий под световым микроскопом, хотя первая основополагающая
работа Грассе (Grasse, 1960), выполненная под электронным микроскопом,
уже отражена в монографии, и описание миксоспоридий в ней строится
на признании их многоклеточной природы. Очевидно, излишне рассматривать
I* 3
период светооптических исследований миксоспоридий, полно и критически
освещенных С. С. Шульманом. Здесь будет приведен обзор работ, осу-
ществленных на электронно-микроскопическом уровне, а также другими ци-
тологическими методами, в частности методами цитохимии и цитофото-
метрии.
Начало электронно-микроскопическим исследованиям положил Грассе
(Grasse, 1960). Сразу же стало ясно, как важно исследование ультраструк-
туры этих животных. В этой работе окончательно было доказано, что миксо-
споридии не являются одноклеточными животными, что не только их споры
представляют собой многоклеточные образования, но и внутри плазмодиев
выделяются и размножаются отдельные генеративные клетки. При изучении
миксоспоридий под световым микроскопом об этом можно было только дога-
дываться (Kudo, 1922; Догель, 19326; Noble, 1944).
В 1961 г. была опубликована первая электронно-микроскопическая ра-
бота, касавшаяся ультраструктуры спор миксоспоридий (Хейсин и др.,
1961). Некоторые данные, полученные этими авторами и не вошедшие в ста-
тью, приводятся в монографии С. С. Шульмана (1966). Затем Лом и Вавра
(Lorn, Vavra, 1965) проследили ряд этапов морфогенеза полярных капсул.
Лом под электронным микроскопом исследовал строение стрекательной нити,
выстрелившей в искусственных условиях (Lom, 1964). В 1965 г. Лом и Пюто-
рак (Lom, Puytorac, 1965а) изучили ультратонкое строение плазмодиев
нескольких видов миксоспоридий, а в другой работе (Lom, Puytorac, 1965b)
описали процесс развития стрекательного аппарата их спор и, обнаружив
огромное сходство в его развитии и строении с книдоцистами кишечнополост-
ных, возродили гипотезу Вейла (Weill, 1934, 1938) о том, что миксоспори-
дии — упрощенные в связи с паразитизмом кишечнополостные (Lom, Vavra,
1964; Lom, Puytorac, 1965b; Lom, 1973, 1977).
Вслед за этими работами опубликован целый ряд исследований ультра-
тонкого строения разных видов миксоспоридий (Успенская, 1966, 1969, 19726,
1979в, 1981а, 1981г, 1982а, 19826, 1982в; Schubert, 1968; Lom, 1969; Lunger
et al., 1975; Current, Janovy, 1976, 1977, 1978; Desser, Paterson, 1978; Grasse,
Lavette, 1978; Voelker et al., 1978; Current, 1979; Current et al., 1979;
Yamamoto, Sanders, 1979; Booker, Current, 1980; Egusa, Nakajama, 1981;
Listebarger, Mitchell, 1981; Lom, Dykova, 1981; Lom et al., 1982).
Под электронным микроскопом изучено два случая гиперпаразитизма
миксоспоридий из рода Fabespora у трематод, обитающих в рыбах (Weidner,
Overstreet, 1979; Siau et al., 1981).
Изучалось строение оболочки спор и поверхности плазмодия также и под
сканирующим микроскопом (Lom, Hoffman, 1971; Morrison, Pratt, 1973;
Горюшкин, Мусселиус, 1977; Current. Janovy, 1978; Desser, Paterson, 1978;
Voelker et al., 1978; Hine, 1980; Booker, Current, 1981).
В большинстве этих работ сообщаются сведения об ультратонком строе-
нии отдельных или разных стадий развития какого-нибудь вида миксоспори-
дий, до сих пор совсем не изучавшегося под сканирующим электронным
микроскопом или в проходящих электронных лучах. В ряде случаев приво-
дится сравнение ультратонкого строения нескольких видов (Lom, Puytorac,
1965а, 1965b; Шульман, 1966; Lom, 1969; Успенская, 1971, 1981а, 1981г,
1982в) или форм, обитающих в разных местах (например, в различных участ-
ках жабр — Current, Janovy, 1978). Некоторые работы посвящены специаль-
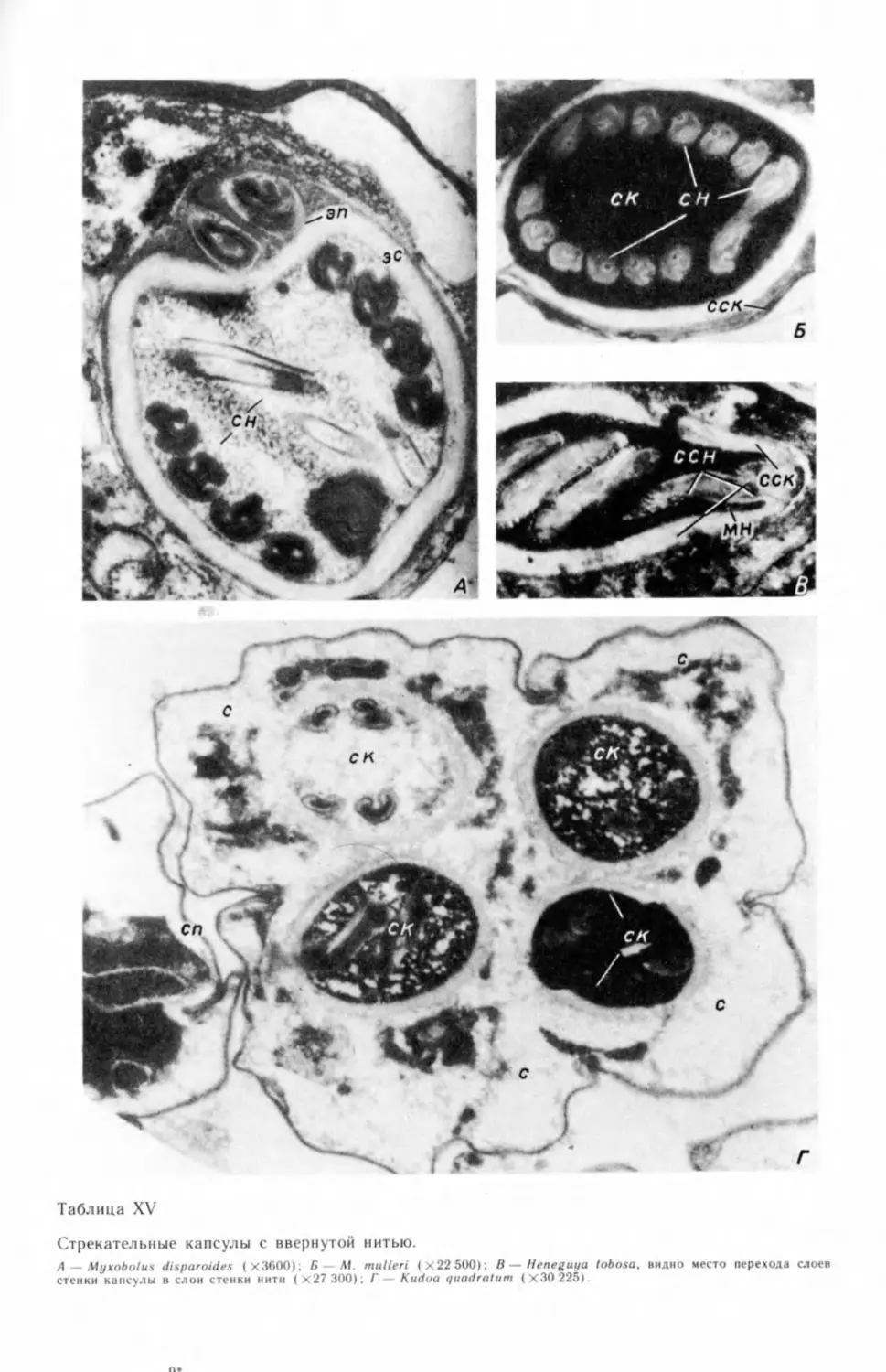
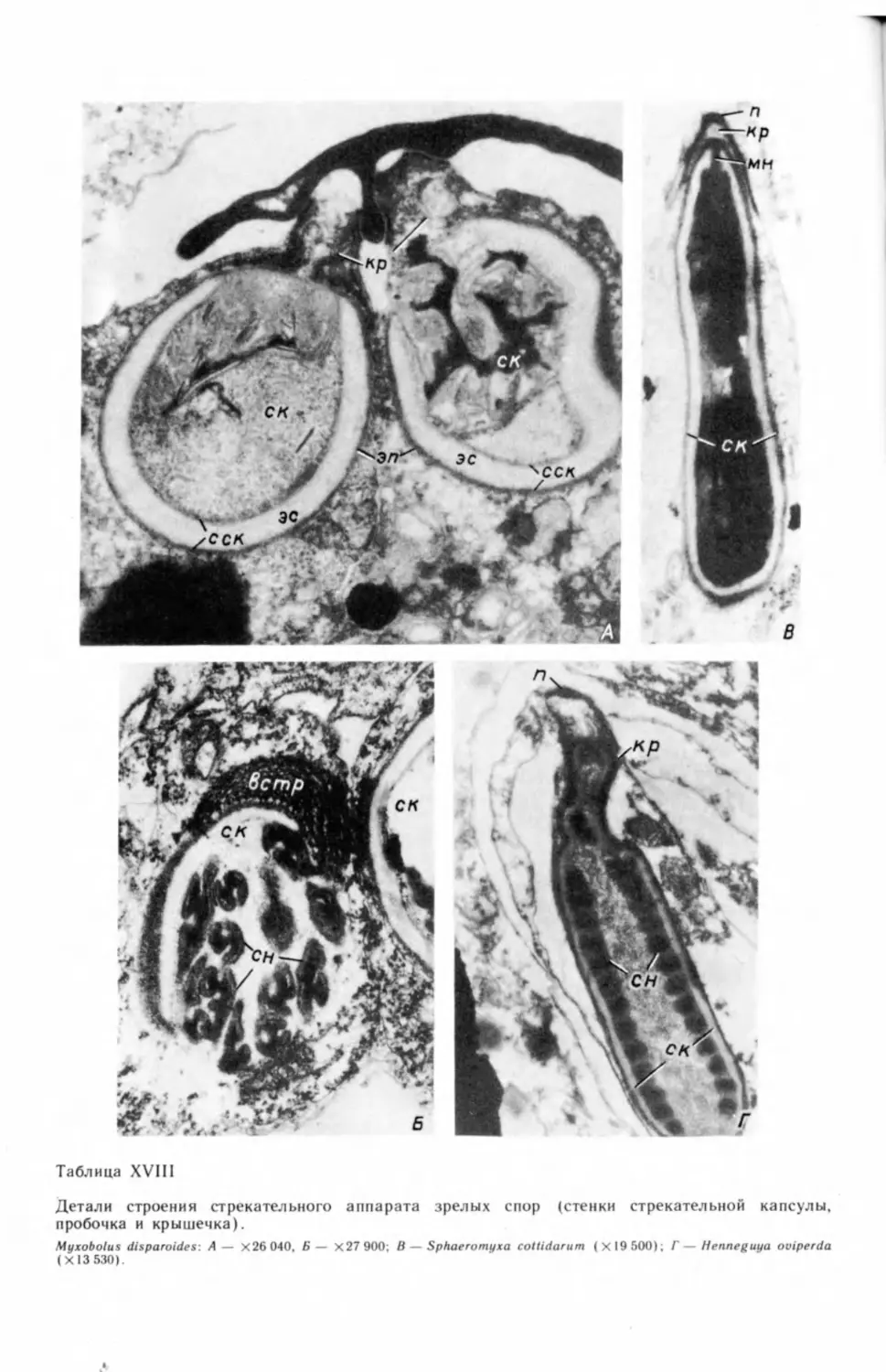
ным вопросам: строению стрекательного аппарата (Lom, 1964; Lom, Vavra,
1964, 1965; Lom, Puytorac, 1965b; Успенская, 19726), способам питания
(Успенская, 1966, 19796, 1981г, 1982в), сравнительному изучению строения
поверхности (Успенская, 1981в, 1981г, 1982а, 1982в), строению вегетативных
стадий, называемых цистами (Успенская, 1982а, 19826, 1982в).
Сообщения о спорогенезе в литературе встречаются редко (Lom, Puytorac,
1965b; Current, 1979; Успенская, 1981a). В небольшой части исследований
высказываются гипотезы о происхождении миксоспоридий на основании дан-
ных, полученных при изучении их под электронным микроскопом (Grasse,
4
1960, 1970; Lom, Vavra, 1964; Lom, Puytorac, 1965b; Lom, 1973, 1977). В моно-
графическом исследовании вида Sphaeromyxa sabrazesi Грассе и Лаветт
(Grasse, Lavette, 1978) приводят данные о строении миксоспоридий в целом.
Авторы утверждают, что эти организмы обладают четырьмя категориями кле-
ток, и это является основанием для выделения миксоспоридий за пределы
Protozoa и для филогенетических построений. В некоторых работах этого
периода подводятся итоги исследованиям миксоспоридий (Lom, 1973, 1977;
Mitchell, 1977; Lom et al., 1981).
Изучение метаболизма миксоспоридий развивается очень медленно. Из-за
невозможности получить одновременно большое количество материала
в стационарных условиях затрудняются биохимические исследования. Прове-
дено лишь небольшое количество определений содержания ряда веществ
у миксоспоридий цитохимическими методами. Большинство работ посвящено
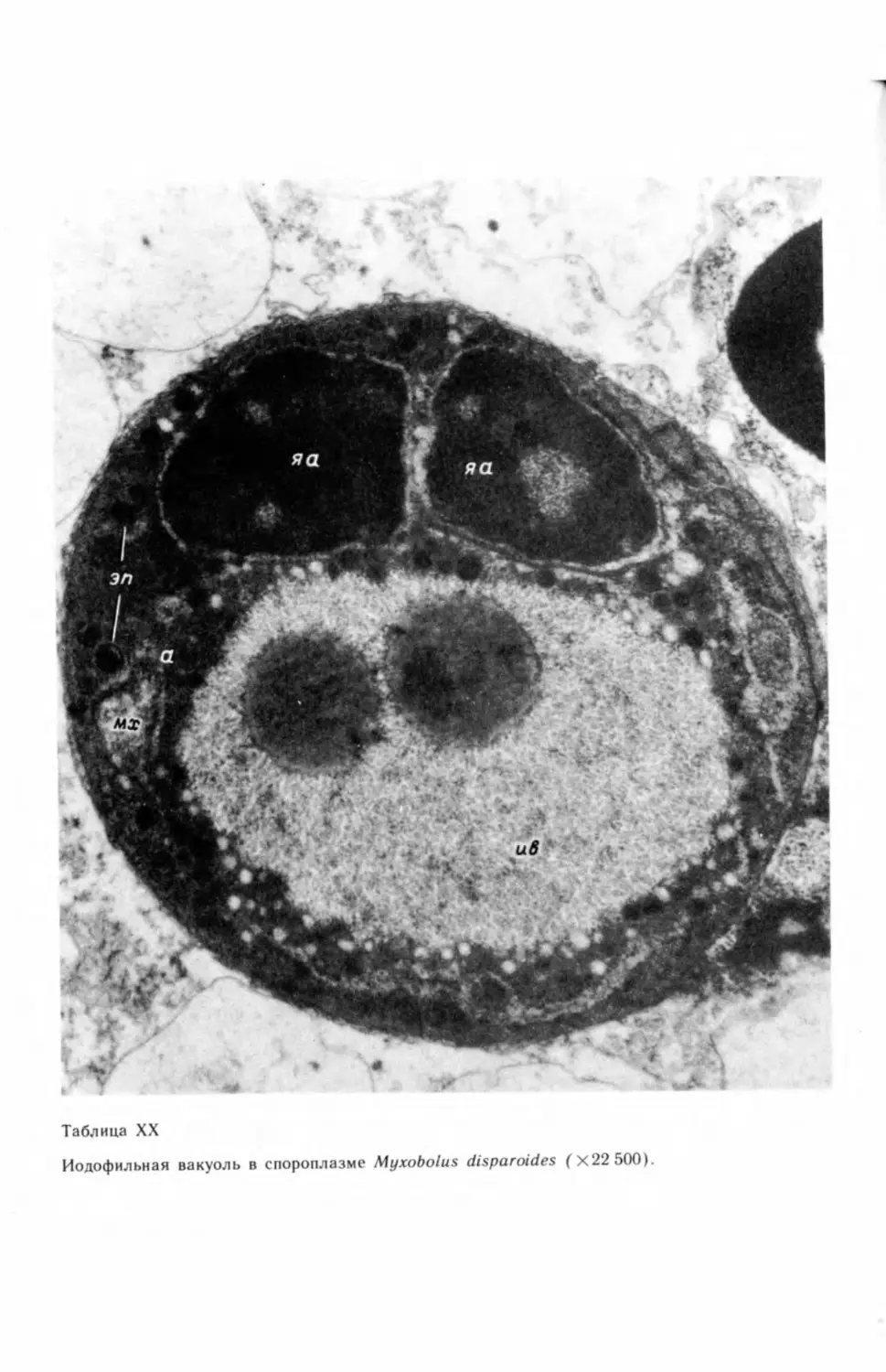
полисахаридам иодофильной вакуоли (Thelohan, 1889; Keysselitz, 1908а,
1908b; Kudo, 1919, 1921а, 1933; Walliker, 1968; Galinsky, Meglitsch, 1969;
Подлипаев, 1974; Desser, Paterson, 1978; Подлипаев, Шульман, 1978). Есть
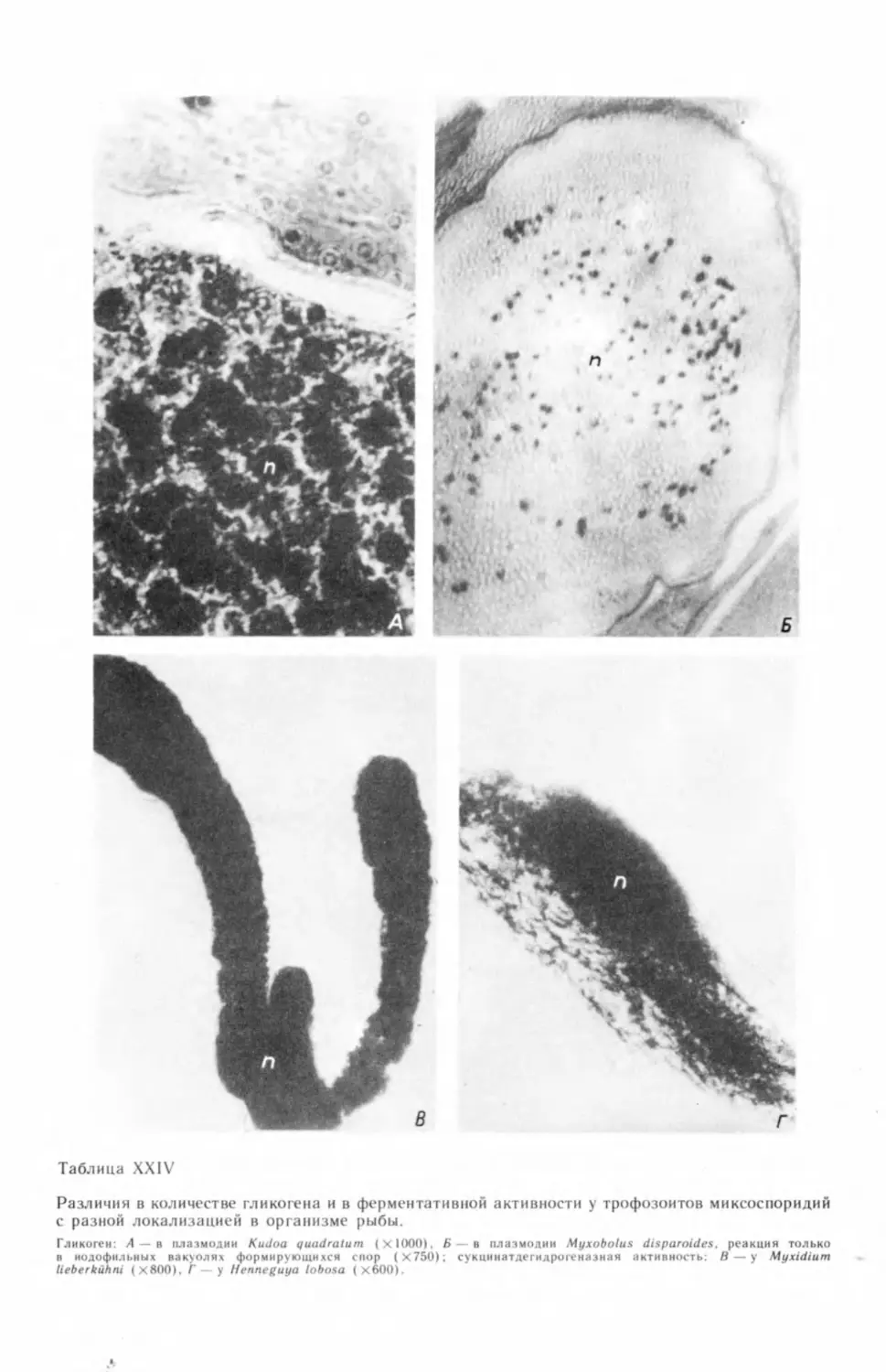
сведения о присутствии в плазмодиях гликогена (Erdmann, 1917b; Петрушев-
ский, 1932; Успенская, 1966, 1969, 1979в, 1981 в, 1981г, 19826, 1982в; Подли-
паев, 1974; Voelker et aL, 1978; Lom et al., 1982). О наличии капель жира
в плазмодиях известно давно (Butschli, 1882; Auerbach, 1909; Петрушевский,
1932; Успенская, 1966; Подлипаев, 1974). Специально определялись кислые
жиры (Успенская, 1969). Обнаружены кислые мукополисахариды в плазмо-
диях (Успенская, 1981 в, 1981г) и в слизистом веществе, окружающем спору
(Lom, Vavra, 1963; Kalavati, 1981). Специфическими методами выявлялись
нуклеиновые кислоты в цитоплазме плазмодия (Maity et al., 1964; Успенская,
1966, 19786) и в ядрах всех стадий (Петрушевский, 1932; Chakravarty et al.,
1962; Успенская, 1966, 1975, 1976а, 1978а, 1979а). Проводилась реакция
на содержание общего белка в плазмодиях (Успенская, 1966, 1969).
Довольно много исследователей занималось выявлением химизма створок
и стрекательных капсул споры (Biitschli, 1881с; Thelohan, 1895; Davis, 1917;
Kudo, 1921а; Lom, 1964, 1977; Kalavati, 1981; Bajpai, Haidar, 1982). Эти дан-
ные обсуждаются в ряде обзоров (Шульман, 1966; Успенская, 1977; Mitchell,
1977). Лишь в небольшом количестве работ есть сведения об утилизации гли-
когена иодофильной вакуоли амебоидного зародыша, что связывается с его
метаболизмом (Galinsky, Meglitsch, 1969; Подлипаев, 1974; Подлипаев,
Шульман, 1978), и совсем мало работ, в которых авторы подводят итоги
о цитохимии миксоспоридий (Mitchell, 1977) и пытаются судить об обмене
веществ у них (Успенская, 19796, 1981в, 1981г, 19826, 1982в).
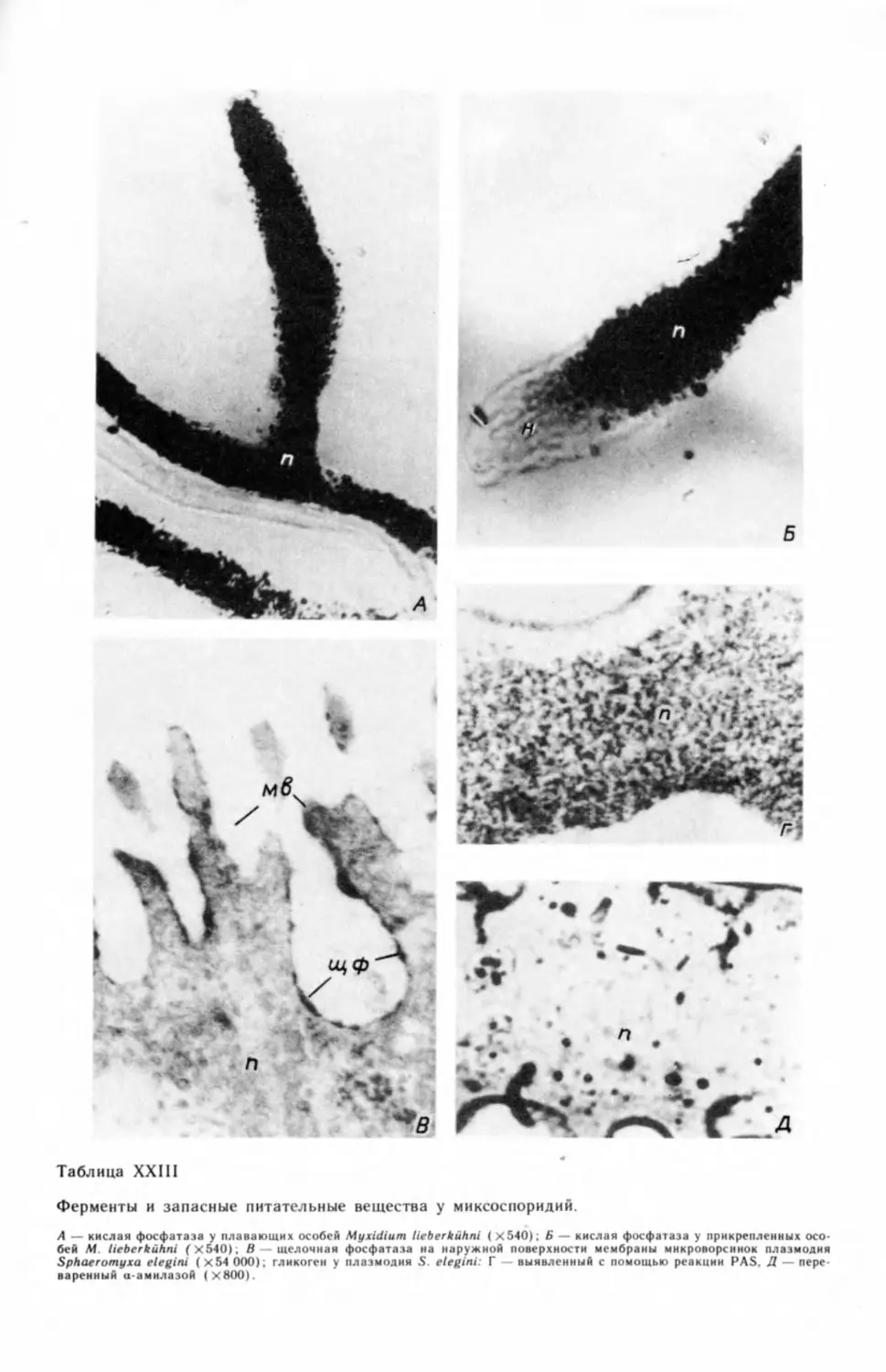
Чрезвычайно скудны данные о ферментативной активности миксоспори-
дий: у них выявлены только фосфатазы, сукцинатдегидрогеназа, гиалурони-
даза, акрил-сульфатаза и АТФаза (Успенская, 1966, 1969, 19766, 1977, 1979в,
1981 в, 19826, 1982в; Listebarger, Mitchell, 1981). Кроме того, в тканях рыб,
зараженных миксоспоридиями из рода Kudoa, выявляли протеазы (Копа-
gaya, 1980; Okada et al., 1981). При изучении механизма действия стрекатель-
ного аппарата большинство исследователей испытывало разные вещества,
вызывающие выбрасывание нити (Thelohan, 1895; Kudo, 1918; Plehn, 1924;
Успенская, 1957; Lom, 1964; Донец, Соломатова, 1979; Донец, 1982). Нами
был предложен новый подход к этой проблеме — изучение его с помощью
глицериновых моделей спор (Успенская, 1975, 1977).
Еще одним аспектом цитологии миксоспоридий является исследование их
ядерного аппарата количественным методом цитофотометрии. Такие работы
оказались весьма полезными для понимания места мейоза в ядерном цикле,
плоидности ядер разных стадий и вообще для изучения ядерного и жизнен-
ного циклов миксоспоридий (Успенская, 1975, 1976а, 1978а, 1979а, 1981а,
1982а, 19826).
Итак, за 20 лет, прошедшие со времени выхода в свет статьи Грассе
(Grasse, 1960), накопилось довольно большое количество работ, проведенных
с применением электронного микроскопа и других цитологических методов ис-
5
следования, в частности цитохимии и цитофотометрии, которые во мно-
гом изменили представление о сущности этих животных и уточнили
имеющиеся данные. Знания о них уже не могут оставаться на прежнем
уровне. Новые сведения о миксоспоридиях важны и в теоретическом,
и в практическом отношении, так как разработка мер борьбы с ними и прог-
нозы для рыбоводства могут строиться только на правильных представлениях
об их биологии и способах питания, об их метаболизме, жизненном цикле,
взаимоотношениях с хозяином. Новые сведения нужны также и для определе-
ния положения миксоспоридий в системе, для установления их филогенети-
ческих связей.
Эта книга посвящена в основном цитологии миксоспоридий. Приведенный
материал основывается на результатах собственных исследований автора
и на критическом осмыслении литературных данных. Основной задачей было
обобщить все имеющиеся данные в плане сравнительной цитологии
и на основе принципов догелевской экологической паразитологии.
Это дает возможность составить более подробное представление о плане
строения миксоспоридий, об их цитологии, биологии и обмене веществ,
высказать соображения об их ядерном и жизненном циклах, обсудить в свете
новых данных имеющиеся гипотезы о происхождении миксоспоридий.
В «Приложении» на конкретном примере показано, как, зная биологию
и экологию паразита, в условиях рыбоводных хозяйств можно с успехом
избавиться даже от такого трудноликвидируемого заболевания, как вертеж
лососевых. Изучением последнего автор начал заниматься с тех пор, когда
впервые в пределах нашей страны произошла вспышка этого заболевания
в одном из форелевых хозяйств.
Настоящее исследование миксоспоридий было начато в 1953 г. в лаборато-
рии болезней рыб ВНИОРХ, основанной и руководимой в то время чл.-кор.
АН СССР проф. В. А. Догелем, котрый поручил мне заняться разработкой
мер борьбы против вертежа лососевых, биологией и экологией возбудителя
этого заболевания, В дальнейшем с большим вниманием к этой работе отно-
сился докт. биол. наук Г. К. Петрушевский, сменивший В. А. Догеля после его
кончины на посту заведующего лабораторией, а затем докт. биол. наук
О. Н. Бауэр. При внедрении в практику рекомендованных мною для борьбы
с вертежом (Успенская, 1959) профилактических мероприятий и лекарствен-
ных средств большую роль сыграли энергия и энтузиазм главного рыбо-
вода в рыбхозе Ропша В. В. Лавровского, а также усилия других сотруд-
ников и рабочих этого рыбхоза.
Позднее изучение ультратонкого строения, ядерного цикла и цитохимиче-
ских особенностей миксоспоридий было продолжено мною в стенах лаборато-
рии цитологии одноклеточных организмов Института цитологии АН СССР
под руководством чл.-кор. АН СССР проф. Ю. И. Полянского, взявшего на
себя нелегкий труд по редактированию этой книги, за что автор приносит ему
глубокую благодарность. Постоянный интерес к моей работе проявлял также
докт. биол. наук С. С. Шульман. Во время экспедиций я неизменно получала
помощь и поддержку руководителей и сотрудников учреждений, на базе кото-
рых проводилась работа. Часть материала по миксоспоридиям была мне
любезно предоставлена О. Н. Юнчисом. При выполнении цитофотометриче-
ских и электронно-микроскопических исследований большую помощь мне ока-
зали Г. В. Селиванова, Б. Н. Кудрявцев, Г. И. Штейн, В. М. Семенов и
С. Е. Филатов. Я выражаю сердечную благодарность всем тем, кто помогал
при выполнении этой работы, в частности своим непосредственным помощ-
ницам, в разные годы участвовавшим в сборе материала и его обра-
ботке: В. В. Смирновой, Н. В. Махновской и Б. И. Хари.
Особенно я благодарна моему учителю чл.-кор. АН СССР В. А. Догелю.
Относясь с глубоким уважением к его памяти, я старалась выполнить свою
работу в духе догелевской экологической паразитологии, применяя современ-
ную технику исследования.
6
ЖИЗНЕННЫЙ ЦИКЛ МИКСОСПОРИДИЙ
Жизненный цикл миксоспоридий слагается из двух фаз. Паразитиче-
ская фаза представлена активно питающимися и растущими трофо-
зоитами в виде многоядерных плазмодиев (у разных видов форма и раз-
меры их различны), паразитирующих в тканях и органах рыб и других хозяев.
На этой стадии происходит размножение трофозоитов — увеличение их коли-
чества путем плазмотомии и почкования с предшествующей нуклеогонией.
Нуклеогония (по: Noble, 1944) — это увеличение числа ядер, не сопро-
вождающееся делением цитоплазмы. Плазмотомия — деление много-
ядерного плазмодия на более мелкие многоядерные участки. Почкова-
ние — отделение более мелких участков, содержащих от одного до несколь-
ких ядер. В случае наличия одного ядра в почке число их увеличивается путем
нуклеогонии (Шульман, 1966).
Трофозоиты затем приступают к спорообразованию. Это сложный про-
цесс, заключающийся в выделении в цитоплазме плазмодия особых гене-
ративных клеток, дающих начало первой стадии спорогенеза —
споробласту или панспоробласту (см. с. 45—48). Путем деле-
ния и дифференцировки клеток последнего и морфогенетических преобразо-
ваний в них образуются многоклеточные споры. В крупных плазмодиях выде-
ляется огромное количество генеративных клеток. В результате спорогенеза
возникают тысячи спор, каждая из которых содержит амебоидного зародыша,
способного заразить новую особь хозяина. Паразитическая фаза — фаза
накопления паразитов в тканях хозяина, т. е. фаза аггломерации (по:
Догель, 1947, 1962).
Покоящаяся спора — это другая фаза жизненного цикла, фаза
дисперсии (по: Догель, 1947, 1962), она протекает во внешней среде.
Споры служат для заражения новой особи хозяина, т. е. для расселения пара-
зитов, и представляют собой многоклеточные образования, состоящие
из соматических элементов (створки оболочки споры и стрекатель-
ные капсулы, внутри которых находится свернутая стрекатель-
ная нить) и гамет — амебоидного зародыша или споро-
плазмы. Могут быть две 1-ядерные спороплазмы или одна 2-ядерная.
Их ядра являются гаметическими ядрами, участвующими в половом процессе
(рис. I).1 Споры выводятся во внешнюю среду, где для некоторых видов уста-
новлен обязательный (несколько месяцев) период дозревания, необходимый
для достижения ими инвазионности.
Наличие такого периода дозревания впервые было доказано нами экспе-
риментально для Myxosome cerebralis (Успенская, 1955а, 19786), а затем
подтверждено для этого вида и другими исследователями (Hoffman, Putz,
1969; Halliday, 1974, 1976). Позднее О. Н. Юнчис (1974) экспериментально
доказал необходимость периода дозревания для спор трех видов Myxobolus.
Возможно, что такой период имеет место у многих видов и связан с их локали-
зацией в хозяине и биологией последнего.
Выход спор во внешнюю среду происходит разными путями: из желчного
пузыря — через пищеварительный канал с фекалиями, из мочевого пузыря —
с мочой, у миксоспоридий, поражающих яйцеклетки рыб — с выметанной
икрой, у тканевых — при разрыве тканей рыбы либо после ее гибели.
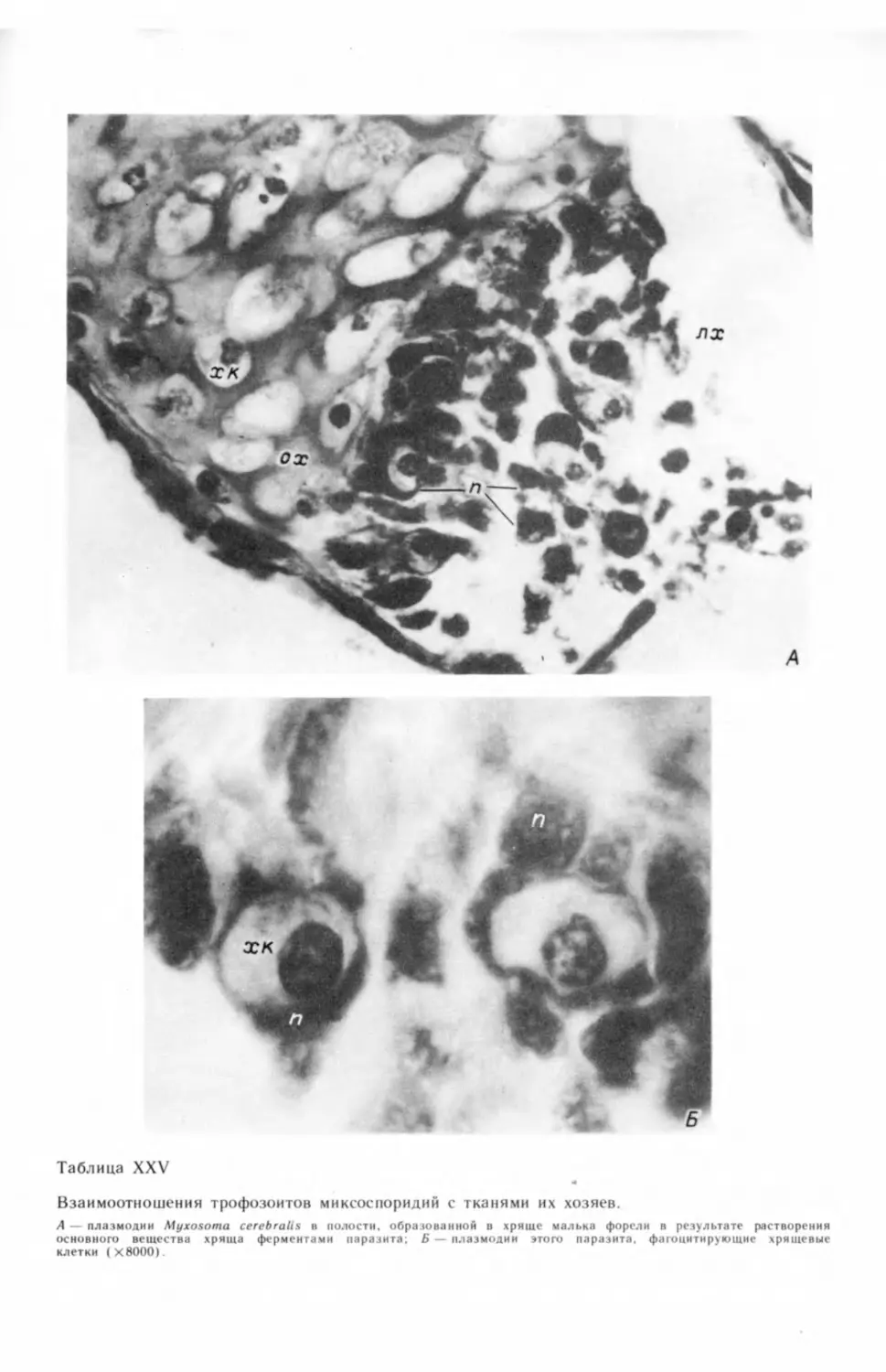
Для Myxosoma cerebralis было показано, что в период массового споро-
образования споры этого вида встречаются не только в хрящах, но и во внут-
ренних органах и тканях: в головном мозге, мышцах, печени, желчном пузыре
и в просвете кишечника (Успенская, 1957; Rydlo, 1971). По-видимому, из раз-
1 Обозначения здесь и на других рисунках см. в «Списке сокращений», с. 112.
7
рушенных хрящей споры попадают в лимфатические или кровеносные
сосуды и током лимфы или крови разносятся в разные органы, в том числе
и в желчные протоки, откуда через кишечник выводятся наружу с фекалиями.
Таким образом, и при паразитировании глубоко в тканях хозяина возможен
частичный вывод спор из организма живой рыбы. Доказано, что рыбоядные
птицы способствуют распространению спор, которые не перевариваются в их
кишечнике (Schaperclaus, 1954; Taylor, Lott, 1978). Синдерман (Sinderman,
1970, цит. по: Mitchell, 1977) предполагает, что планктонные беспозвоночные,
являющиеся кормом для рыб, могут быть носителями спор. Возможно, что
заражение происходит также при канибализме и хищничестве (Thelohan,
1895; Mitchell, 1977; Ковалева, Шульман, 1978).
По-видимому, рыбы заражаются при заглатывании зрелых спор.
С. С. Шульман (1966) считает, что этот путь заражения хорошо прослежен
ч установлен рядом авторов (Thelohan, 1895; Doflein, 1898, 1899; Auerbach,
1910с, 1912b; Kudo, 1922). Мит-
челл (Mitchell, 1977) относится бо-
лее критически к этим данным,
считая, что они не были повторены
и не имели надежного контроля.
В опытах с Myxosoma cereb rails
мы вводили инвазионные споры
пипеткой прямо в желудок маль-
ков форели, стараясь миновать
ротовую полость для того, чтобы
споры не были выброшены через
жаберные щели наружу (Успен-
ская, 1955а, 19786) ; поэтому полу-
чив положительный результат, мы
считали, что заражение происхо-
дит через пищеварительный тракт.
Содержание спор в желудке фо-
рели в мешочке из полупроницае-
Рис. 2. Схема жизненного цикла миксо-
споридий на примере Myxosoma cerebralis
из хрящевого скелета лососевых.
/ — паразитическая фаза агломерации в хрящах
форели (2п); 2 — покоящаяся фаза дисперсии (спора)
во внешней среде (п).
8
мой пленки в течение 56 ч не привело к выбрасыванию стрекательных нитей и
раскрытию створок (Успенская, 1957). Это подтверждает вывод, сделанный
Плен (Plehn, 1924) о том, что заражение осуществляется в щелочной
среде кишечника, тем более что выстреливание стрекательной нити не проис-
ходит ни в аптечном желудочном соке, ни в растворе соляной кислоты.
По сообщениям исследователей первой половины века,этот процесс совер-
шается под действием либо желчи, либо сначала желудочного сока, а затем
желчи, либо желудочного и кишечного соков (Auerbach, 1912b; Davis, 1916;
Erdman, 1917a; Georgevitsch, 1917; Kudo, 1922; см. также: Шульман, 1966).
О. H. Юнчис (1974, 1979), которому удалось осуществить заражение рыб
тремя видами миксоспоридий, отмечает, что выстреливание нитей происходит
в содержимом кишечника, но для каждого конкретного вида в строго опреде-
ленном участке; поэтому автор считает, что проникновение миксоспоридий
в хозяина осуществляется только через пищеварительный тракт. Заражение
вышедшими из споры в условиях эксперимента амебоидными зародышами,
так же как спорами с выстрелившими нитями, ему не удавалось.
Гоффман и Путц (Hoffman, Putz, 1971), которым не удалось заражение
форели спорами Myxosotna cerebralis через рот, наблюдали больную верте-
жом личинку форели, обладающую еще желточным мешком, после того как
она в течение 3 сут находилась в контакте со спорами. Эти авторы предпола-
гают, что заражение могло осуществиться через жаберные щели прямо через
эпителий жабр или поверхности жаберной полости. Митчелл (Mitchell, 1977)
расценивает эти факты как аргумент в пользу возможности инвазии миксо-
споридиями и не через рот. Большинство авторов все же считает, что для
заражения миксоспоридиями их споры должны попасть в пищеварительный
тракт рыбы. Инъекция спор в мускулатуру и полость тела не привела к зара-
жению (Hoffman et al., 1962; Schafer, 1968).
После раскрытия створок споры спороплазма выходит наружу. В это
время или еще до выхода ее из споры происходит слияние двух ядер споро-
плазмы или, при наличии двух спороплазм в одной споре, сначала сливается
их цитоплазма, а несколько позже — ядра, т. е. совершается половой процесс
(Schroder, 1907; Kudo, 1922; Siau, 1977). В зависимости от места паразитиро-
вания данного вида миксоспоридий в организме хозяина 1-ядерный амебоид-
ный зародыш (зигота) по желчным протокам, лимфатическому или кровя-
ному руслу проникает к характерному для вида месту паразитирования. Эта
часть цикла все еще плохо изучена (Шульман, 1966; Mitchell, 1977).
После окончательной локализации паразита начинается активное питание
амебоидной зиготы, которая путем деления ядер (нуклеогонии) разрастается
в многоядерный плазмодий. Многоядерные трофозоиты размножаются почко-
ванием или плазмотомией, и возникает новое поколение плазмодиев. Жизнен-
ный цикл замыкается (рис. 2).
9
ЯДЕРНЫЙ цикл МИКСОСПОРИДИЙ
ДИФФЕРЕНЦИРОВКА ЯДЕР У МИКСОСПОРИДИЙ
Характерной чертой плазмодиальных вегетативных стадий (трофозоитов)
миксоспоридий является их многоядерность и разнокачественность их ядер.
Количество ядер у трофозоитов варьирует в широких пределах. Существуют
мелкие 3—4-ядерные или с десятками ядер плазмодии (например, у предста-
вителей родов Ceratomyxa, Chloromyxum, Sphaerospora) и крупные плазмо-
дии с огромным количеством ядер (тысячи и даже сотни тысяч у представите-
тей родов Sphaeromyxa, Myxidium и Myxobolus).
Разнокачественность ядер миксоспоридий выражается в наличии у плаз-
модиев двух категорий ядер — вегетативных и генеративных,
причем их дифференцировка начинается очень рано. По данным Сио (Siau,
1977), уже в 9—12-ядерном трофозоите Myxobolus exiguus, выращиваемом
на искусственной среде, различаются вегетативные и генеративные ядра.
По данным Нобля, Ямамото и Сандерса (Noble, 1941, 1944; Yamamoto, San-
ders, 1979), у Ceratomyxa и Leptotheca эта дифференцировка начинается
с 1-го же деления ядра зиготы. У Myxidium gasterostei мы наблюдали генера-
тивные клетки на ультратонких срезах через червеобразный плазмодий содер-
жащий немногим более десятка ядер (Успенская, 1969). Вегетативные и гене-
ративные ядра могут отличаться друг от друга по размерам и форме. У боль-
шинства миксоспоридий вегетативные ядра крупнее генеративных (рис. 3):
например, у Myxidium perniciosum и Sphaeromyxa elegini (Успенская, 1975,
1979а), а также у Myxobolus exiguus (Siau, 1977) и у ряда других. Однако
у некоторых видов, наоборот, генеративные ядра крупнее: например
у Ortholinea polymorpha и Leptotheca ohlmacheri (Шульман, 1966).
Как было доказано при изучении миксоспоридий под электронным микро-
скопом (Grasse, 1960), основным отличием генеративных ядер является то,
что они заключены в особых клетках (генеративных клетках). Именно эти
клетки участвуют в спорогенезе и, по существующим представлениям, дают
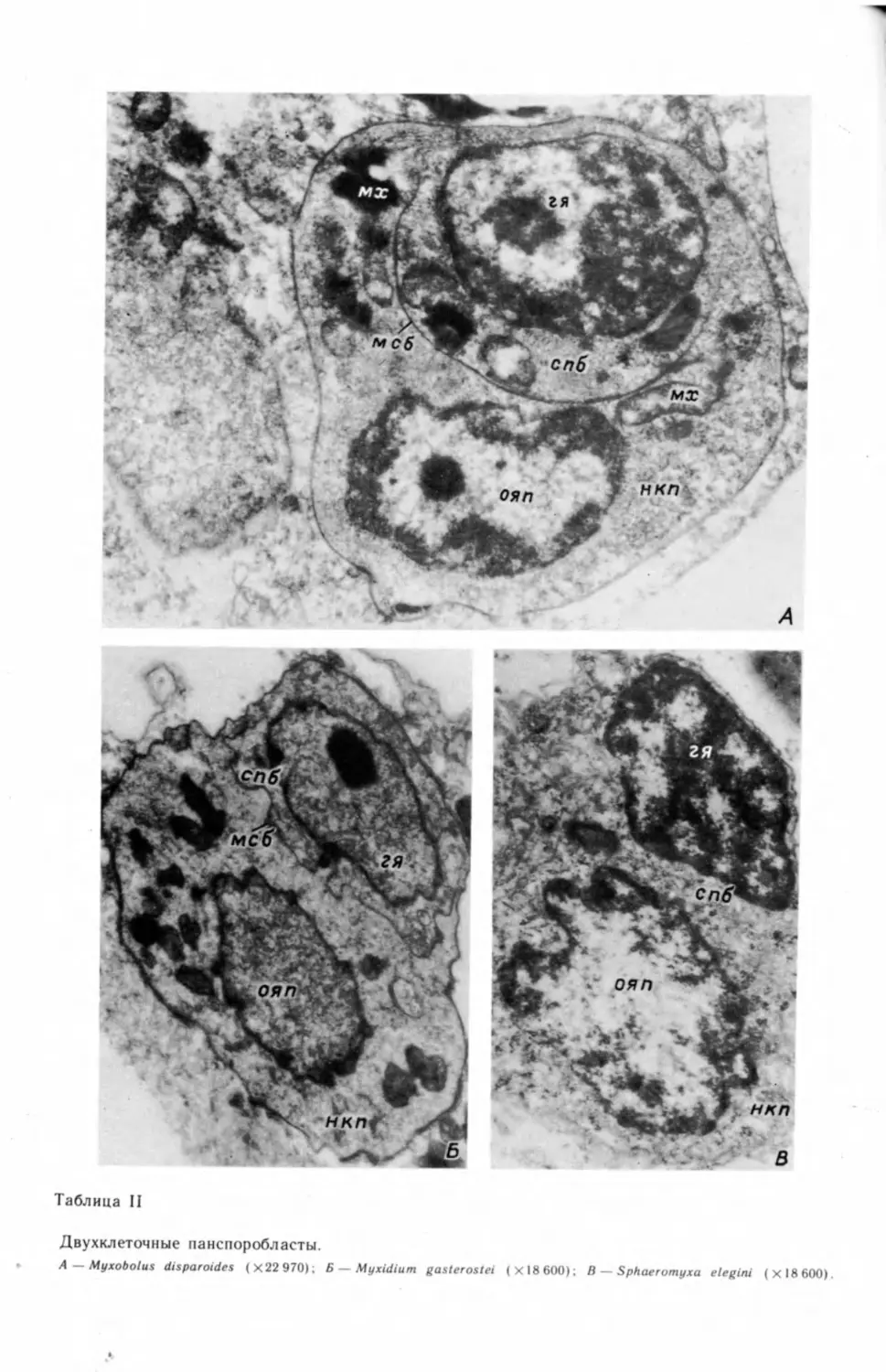
начало его первой стадии — одноклеточному споробласту или двуклеточному
панспоробласту. Панспоробласт состоит из двух клеток, одна из которых
заключена в другой. Наружная клетка содержит вегетативное ядро, а внут-
ренняя — генеративное ядро, участвующее в спорогенезе. Формирующаяся
спора, как уже говорилось при описании жизненного цикла, состоит из сома-
тических (т. е. содержащих вегетативные ядра) клеток и спороплазмы,
внутри которой находятся генеративные гаметические ядра.
Судьба разнокачественных ядер различна: генеративные ядра путем пов-
торных делений, а также при отделении от себя вегетативных соматических
ядер в конечном счете дают начало гаметическим ядрам, участвующим
в половом процессе, а вегетативные ядра постепенно дегенерируют.
В отношении ядерного цикла миксоспоридий в течение всего периода его
изучения существовали разногласия, которые мы попытались разрешить, при-
менив методы цитофотометрии и электронной микроскопии.
Известно, что ядра спороплазмы участвуют в половом процессе и, следо-
вательно, гаплоидны (Schroder, 1907; Siau, 1977, и др.). Отсюда можно было
ожидать, что, измерив количество ДНК в ядрах разных стадий и сравнив его
с таковым в заведомо гаплоидных ядрах спороплазмы, мы получим представ-
ление о плоидности изучаемых стадий (обычно количество ДНК коррелирует
с числом хромосом). Такие сведения дают возможность лучше понять ядер-
ный цикл миксоспоридий.
10
1
Рис. 3. Схематическое изображение ядер разных стадий спорогенеза Sphaeromyxa elegini, в кото-
рых цитофотометрическими методами измерялось количество ДНК (по: Успенская, 1976).
/—дублеты ядер (клеток); 2 — 2 ядра внутри панспоробласта; 3 — 4 ядра внутри панспоробласта; 4 — 8 ядер
внутри панспоробласта; 5 — спора первой стадии зрелости; 6 — спора второй стадии зрелости; 7 — спора третьей
стадии зрелости; 8— вегетативные ядра плазмодия.
ИСТОРИЯ ИЗУЧЕНИЯ ЯДЕРНОГО ЦИКЛА МИКСОСПОРИДИЙ
Относительно ядерного цикла миксоспоридий не существовало единого
мнения, несмотря на многочисленные морфологические исследования, посвя-
щенные изучению этого вопроса (Аверинцев, 1908; Keysselitz, 1908а; Auer-
bach, 1910а 1910b, 1910с, 1912а; Naville, 1931; Noble, 1944; Tuzet,
Ormieres, 1957; Шульман, 1966, 1972; Lom, 1973; Шульман, Семенович, 1973,
и др.). Разногласия касались ряда вопросов: 1) гаплонты или диплонты мик-
соспоридии (Noble, 1944; Tuzet, Ormieres, 1957; Шульман, 1966;
Lom, 1973; Siau, 1979); 2) в каком месте цикла совершается мейоз; 3) одно-
ступенчатый он или двуступенчатый (Georgevitch, 1935, 1937; Noble, 1944;
Шульман, Семенович, 1973; Успенская, 1981а, 1982в); 4) как возникает пан-
споробласт — путем деления генеративной клетки (Mavor, 1916; Noble, 1944;
Шульман, 1966, 1972; Siau, 1977) или путем обволакивания одной клетки
другою (Grasse, 1960; Schubert, 1968; Lom, 1973; Current, Janovy, 1978;
Desser, Paterson, 1978; Current, 1979; Current et aL, 1979; Listebarger, Mit-
chell, 1981, и др.).
С. С. Шульман (1966, 1972) дал подробный обзор литературы по ядерному
циклу миксоспоридий и классифицировал эти работы, объединив их в группы.
Можно выделить четыре принципиально отличающиеся друг от друга гипо-
тезы.
1. Образование гамет и их слияние происходит до спорогенеза (Аверин-
цев, 1908; Mercier, 1909). Макро- и микрогаметы, образовавшиеся путем
11
редукционного деления в теле плазмодия, сливаются, и синкарион дает
начало панспоробласту. Только здесь имеет место половой процесс. В споре
полового процесса нет, и лишь после размножения ядер в плазмодии вновь
образуются макро- и микрогаметы. Таким образом, все ядра споробластов,
так же как и ядра амебоидного зародыша в споре, диплоидны. Наличие слия-
ния ядер в амебоидном зародыше, открытое Шредером (Schroder, 1907),
заставило многих авторов отказаться от такой схемы.
2. Формирование гамет и слияние их ядер происходят в течение жизнен-
ного цикла дважды: перед образованием панспоробласта и в амебоидном
зародыше. В начале спорогенеза ядра диплоидны, а затем, во время 2-го деле-
ния у монобластических форм и во время 3-го деления у дибластических форм,
происходит мейоз. Ядра споробластов последующих стадий спорогенеза: кап-
сулогенные, вальвогенные и ядра амебоидного зародыша — гаплоидны.
Таким способом происходит восстановление гаплоидности ядра спороплазмы
перед образованием внутри нее синкариона и превращением ее в зиготу
(Parisi, 1913; Southwell, Prashad, 1918; Naville, 1931).
3. Единственный половой процесс у миксоспоридий сильно растянут, гап-
лоидные ядра образуются задолго до формирования спор, а сливаются
они только в амебоидном зародыше, поэтому все ядра споробластов
гаплоидны, так же как вальвогенные и капсулогенные ядра (Schrdder, 1910;
Auerbach, 1912b; Erdmann, 1917b; Naville, 1931).
4. Единственный половой процесс происходит в амебоидном зародыше,
мейоз совершается только перед образованием его ядер, которые гаплоидны,
все остальные ядра диплоидны (Noble, 1944; Шульман, 1966, 1972; Шульман,
Семенович, 1973). Эта точка зрения наиболее широко принята в последнее
время.
Расхождения в толковании ядерного цикла приводят к различным взгля-
дам на положение миксоспоридий в системе и на их филогению (Tuzet, Ormi-
eres, 1957; Grasse, 1960; Шульман, 1966; Lom, 1973, 1977; Шульман, Семено-
вич, 1973). Все эти разногласия вызваны сложностью морфологических
исследований в связи с мелкими размерами ядер миксоспоридий и несинхрон-
ностью спорогенеза в пределах одного плазмодия. Электронная микроскопия,
хотя и много дала для понимания тонкого строения и процессов спорогенеза
у миксоспоридий, однако в трактовку ядерного цикла внесла мало нового.
С помощью одних морфологических исследований проблема не могла быть
решена. Для этих целей необходимо было привлечь другие методы, такие как
цитофотометрия и авторадиография. В связи с этим была сделана попытка
провести измерения количества ДНК в ядрах миксоспоридий.
МЕТОДЫ ИССЛЕДОВАНИЯ КОЛИЧЕСТВА ДНК
В ЯДРАХ МИКСОСПОРИДИЙ
Количественное определение ДНК в ядрах миксоспоридий представляет
значительные трудности. Ядра миксоспоридий малы (1—6 мкм); у многих
видов при выявлении ДНК по Фельгену они красятся крайне слабо, и при
помощи имеющихся в нашем распоряжении приборов мы не могли их иссле-
довать. Поэтому приходится проводить предварительный отбор подходящих
для метода видов. В основном таковыми оказались виды, имеющие крупные
плазмодии: Sphaeromyxa elegini, S. hellandi, Myxidium perniciosum, Henne-
guya zschokkei, Zschokkella nova.
Измерение количества ДНК в ядрах крупных многоядерных плазмо-
диев имеет то преимущество, что на одном препарате в разных участках плаз-
модия благодаря несинхронности спорогенеза можно произвести измерение
ядер на всех его стадиях, что нивелирует ошибку, связанную с расхождением
во времени гидролиза и окраски, наблюдающуюся в случае использования
разных препаратов, обработанных не одновременно. С другой стороны, изме-
рять количество ДНК в ядрах крупных плазмодиев достаточно трудно,
поскольку число ядер в них так велико, что они могут располагаться в не-
12
сколько слоев, создавая дополнительный фон даже при очень точной фокуси-
ровке на измеряемое ядро. Кроме того, ядра лежат близко друг к Jjpyry, и
требуются очень маленькие зонды для их измерения порознь.
Оболочка споры и гликокаликс плазмодия обладают собственной флуорес-
ценцией, что делает невозможным применение более простого и точного
метода цитофлуориметрии. Знакомство с разными методами цитофотометрии
убедило нас в том, что наилучшим из имеющихся в нашем распоряжении
является метод с использованием фотографического способа регистрации
(Агроскин, Папаян, 1977) и с применением в цитофотометрическом анализе
фотографии с окрашенного по Фельгену ядра. Использование увеличенных
фотокопий объекта облегчает процесс измерения, хотя точность по сравнению
с методом прямой фотоэлектрической регистрации снижается. Кроме того,
в этом случае легче разобраться в топографии измеряемого ядра, что важно
при близком расположении ядер, относящихся к разным стадиям (Агроскин,
Папаян, 1977). Позднее нам удалось получить дополнительные результаты
на «Морфокванте» — приборе, в основе которого лежит сканирование ядер
на окрашенных по Фельгену препаратах с прямой фотоэлектрической реги-
страцией количества ДНК. Прибор имеет зонд диаметром 0.2 мкм, что позво-
ляет сканировать даже мелкие ядра миксоспоридий.
В соответствии с первой из указанных методик производилось фотогра-
фирование окрашенных ядер на МУФ-6 в монохроматическом зеленом свете
(длина волны 546 нм). Негативы фотометрировались на микрофотометре
МФ-4. Измерение площади ядер по рисункам, сделанным с негативов через
фотоувеличитель, проводилось с помощью планиметра. Окраска препаратов,
фиксированных жидкостью Карнуа, производилась после 8-минутного гидро-
лиза (1 н. НС1 при 60 °C) в растворе Шиффа в течение суток при 4 °C.
Раствор («холодный Шифф») приготавливался по прописи Р. Лилли (1969).
Таким методом ядра миксоспоридий окрашиваются наиболее интенсивно.
Для получения представления о плоидности ядер на разных стадиях
развития миксоспоридий мы сравнивали количество ДНК в их ядрах с тако-
вым в заведомо гаплоидных ядрах спороплазмы.
При приготовлении препаратов мы старались все стадии, ядра которых
подлежат измерению, помещать на одно стекло. Это необходимо, чтобы избе-
жать ошибок за счет расхождения во времени гидролиза и окраски, влияю-
щего на интенсивность реакции Фельгена (Маршак и др., 1970; Котельников,
Литинская, 1979; Голикова и др., 1980; Магакян и др., 1980). Если же не уда-
валось в один сезон собрать все изучаемые стадии миксоспоридий данного
вида, то в каждый препарат, наряду с этими стадиями, всегда как эталон
гаплоидного количества ДНК помещались споры данного вида, содержащие
спороплазму. Таким образом можно было получить более надежные резуль-
таты.
Из имеющихся в нашем распоряжении видов наиболее полно удалось изу-
чить ядерный цикл Sphaeromyxa elegini, паразитирующей в желчном пузыре
тихоокеанской наваги и обладающей очень крупными плазмодиями (до 1.5 см
в диаметре) в виде округло-овальных лепешек. Соответственно и ядра
их достаточно крупны и содержат количество ДНК, поддающееся измерению
при помощи имеющихся в нашем распоряжении приборов. Только в плазмо-
диях Sphaeromyxa elegini, хотя и редко, попадались нам пары — дублеты
клеток, ядро одной из которых было меньше ядра другой. Такая пара клеток
походила на предшествующую образованию панспоробласта стадию, кото-
рую многие авторы принимали за макро- и микрогаметы перед их слиянием
(Schroder, 1907; Erdmann, 1917b). Количество ДНК в ядрах споры (в амебо-
идном зародыше, в капсулогенных и вальвогенных ядрах) измерялось на раз-
ных этапах формирования споры: 1) в начале этого процесса, когда все ядра
спорообразующих клеток еще округлые, без признаков дегенерации, и когда
вальвогенные клетки не превратились еще в плотные створки; 2) в тот пе-
риод, когда вальвогенные клетки уже вытянулись, уплотнились и вальвоген-
ные ядра приняли колбасовидную форму; 3) во вполне сформированных спо-
13
Таблица 1
Среднее количество ДНК в ядрах различных стадий
Sphaeromyxa elegini (фотографический метод)
Ядра ЧИСЛО измере- ний Количество ДНК, усл. ед. Коэффи- циент вариации (GV), %
Ив спороплазмы: 1.78±0.05
споры 1-й стадии зрелости 62 23
споры 2-й стадии зрелости 25 2.24±0.12 28
споры 3-й стадии зрелости Капсулогенные: 175 2.32+0.05 26
споры 1-й стадии зрелости 58 1.80+0.06 25
споры 3-й стадии зрелости Вальвогенные: 50 2.26±0.09 28
споры 1-й стадии зрелости 61 1.81+0.05 23
споры 2-й стадии зрелости Ив панспоробласта: 50 1.76+0.08 30
2-ядерного 50 4.07±0.17 30
4-ядерного 50 4.01±0.17 34
8-ядерного 50 4.07 ±0.20 35
на разных стадиях деле- ния в сумме Из дублетов клеток: 248 4.00+0.08 32
маленькое ядро 12 4.12 ±0.44 37
большое ядро 12 4.20±0.50 42
в сумме 24 4.16±0.37 43
Вегетативные ядра плазмодия 48 9.19±0.44 30
Таблица 2
Проверка ошибки измерения фотографическим
методом содержания ДНК в каждом из двух
ядер спороплазмы Sphaeromyxa elegini
Ядро Количество ДНК, усл. ед. Минимум— максимум CV, о/о
1-е 1.73±0.06 1.38-2.13 15
2-е 1.15±0.06 1.15—2.29 15
Примечание. Количество ДНК измерялось
в каждом ядре по 20 раз.
рах, когда вальвогенные ядра уже исчезают, но, кроме ядер амебоидного
зародыша, у этого вида сохраняются еще капсулогенные ядра. Эти этапы
развития спор в таблицах и на рисунках для краткости обозначены как споры
1-й, 2-й и 3-й стадии зрелости (рис. 3).
Нами было показано, что плотная оболочка споры, хотя она и прозрачна,
все же рассеивает свет. Поэтому в тех случаях, когда измерения проводятся
сквозь нее, возникает систематическая ошибка и завышаются значения ДНК
для этих ядер (Зандриттер, 1969; Успенская, 1975, 1976а). Это отражено
в табл. 1, где количество ДНК в ядрах амебоидного зародыша (спороплазмы)
из спор 1-й стадии зрелости значительно ниже такового из спор 3-й стадии
зрелости. К сожалению, далеко не у всех изученных видов можно было
обнаружить споры на 1-й стадии зрелости, и тогда приходилось учитывать,
что получаемые цифры завышены.
Для проверки ошибки измерения проведено 20-кратное определение коли-
честв ДНК в двух ядрах спороплазмы из одной и той же споры. Для каждого
из двух ядер получился довольно большой разброс величин ДНК. Коэффи-
циент вариации оказался для каждого из них равным 15% (табл. 2). Содер-
14
жание ДНК у этого вида также было измерено в вегетативных ядрах
плазмодия, в упомянутых дублетах клеток — ранней стадии образования
панспоробласта (малое количество ядер из-за редкой их встречаемости),
в ядрах панспоробласта на разных стадиях его деления (2, 4, 8 ядер внутри
панспоробласта, рис. 3). Измерить количество ДНК в генеративных клетках
плазмодия на этом материале не удалось. Позднее пробел этот был восполнен
измерениями, проведенными на «Морфокванте».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ЯДЕРНОГО ЦИКЛА
SPHAEROMYXA ELEGINI И ИХ ОБСУЖДЕНИЕ
Средние количества ДНК, полученные для всех исследованных групп ядер
Sphaeromyxa elegini, приведены в табл. 1. При сравнении видно, что в гамети-
ческих ядрах амебоидного зародыша, измеренных у спор 1-й стадии зрелости
(где измерению не мешает преломляющая свет оболочка), в 2 раза меньше
ДНК, чем в ядрах панспоробласта на всех стадиях его деления, и в 4 раза
меньше, чем в вегетативных ядрах плазмодия. На стадии споры количество
ДНК в вальвогенных и капсулогенных ядрах приблизительно равно таковому
в амебоидном зародыше. Исходя из этих данных, можно сделать вывод, что
ядра всех клеток, составляющих спору, как соматических (вальвогенных
и капсулогенных), так и гаметических (ядра спороплазмы), гаплоидны. Ядра
споробластов на всех стадиях деления диплоидны. Диплоидными оказались
и ядра генеративных клеток (табл. 3, Sphaeromyxa elegini), а также пар или
дублетов клеток, которые принимались рядом авторов (см. выше) за ядра
гамет, т. е. предполагалось, что они должны быть гаплоидными. Вегетатив-
ные ядра плазмодия оказались в среднем тетраплоидными (табл. 1).
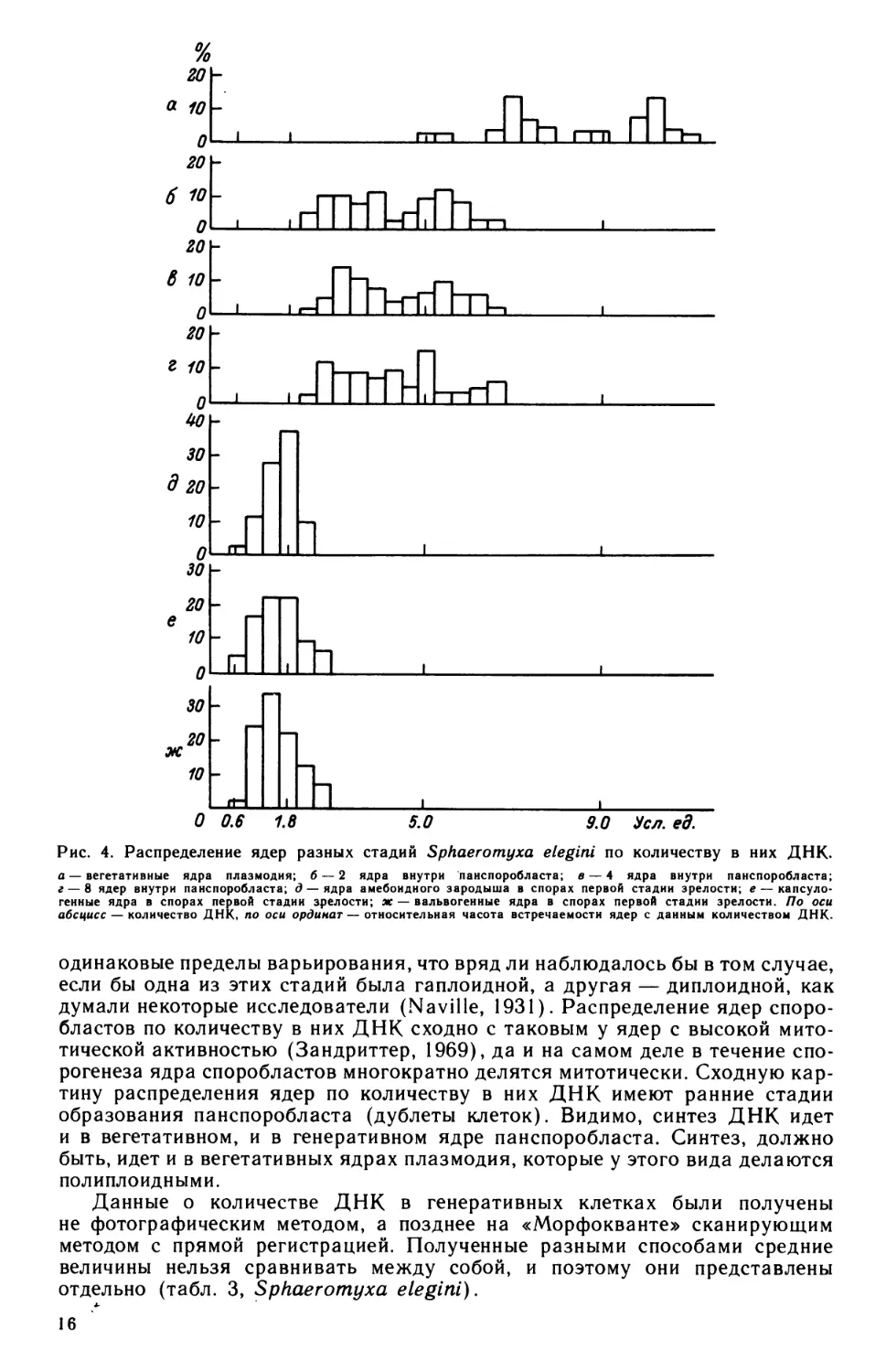
Распределение ядер амебоидного зародыша по количеству ДНК, при изме-
рении их на всех стадиях зрелости споры, является нормальным по критерию
X2 (рис. 4). Вместе с тем обращает на себя внимание большой размах варьи-
рования признака (CV = 23, 28, 25%). Поскольку ядра спороплазмы пред-
ставляют собой гаметические ядра, то синтеза ДНК здесь быть не должно.
Однако существуют данные, что в тех ядрах, где не происходит синтеза ДНК и
ее содержание, казалось бы, должно быть стабильным (ядра кровяных кле-
ток, ядра сперматозоидов), можно получить разные количества ДНК при ци-
тофотометрии окрашенных по Фельгену препаратов из-за изменения прочно-
сти связей ДНК с белком в хроматине (Hale, Willson, 1961; Atkin, Richard,
1966, Miiller, 1967; Маршак и др., 1970; Ringerts et al., 1970; Noeske, 1971; Аг-
роскин, Папаян, 1977). Отмечено, что существует два типа хроматина, кото-
рые отличаются по стабильности связей ДНК с белком. Среднее количество
ДНК изменяется в зависимости от количественного соотношения между
двумя этими формами хроматина (Sibatini, 1953; Bonner, 1965; Renandes,
Keyl, 1967; Noeske, 1971). Широкое варьирование содержания ДНК в ядрах
амебоидного зародыша, вероятно, может быть объяснено изменением в фи-
зико-химическом состоянии хроматина на разных этапах постмейотического
существования гаметических ядер спороплазмы. Кроме того, ошибка измере-
ния весьма значительна (табл. 1). Аналогичная проверка, проведенная
на «Морфокванте», дала CV = 3.9%. Поэтому и разброс величин при изме-
рении ядер амебоидного зародыша на этом приборе меньше (табл. 3—4).
Распределение ядер по количеству ДНК в капсулогенных клетках,
так же как и в вальвогенных, нормально по критерию х2- В спорах 1-й ста-
дии зрелости ядра имеют округлую форму и не проявляют признаков дегене-
рации, интенсивно окрашиваясь по Фельгену (рис. 3).
Распределение ядер споробластов по количеству в них ДНК представлено
двувершинной кривой, что связано с неоднородностью совокупности из-за
присутствия пре- и постсинтетических ядер в измеряемых группах (Успен-
ская, 1976а). Гистограммы этого распределения на всех этапах деления спо-
рогенной клетки (2, 4, 8 ядер внутри панспоробласта) имеют совершенно
15
Рис. 4. Распределение ядер разных стадий Sphaeromyxa elegini по количеству в них ДНК.
а — вегетативные ядра плазмодия; б — 2 ядра внутри панспоробласта; в — 4 ядра внутри панспоробласта;
г — 8 ядер внутри панспоробласта; д — ядра амебоидного зародыша в спорах первой стадии зрелости; е — капсуло-
генные ядра в спорах первой стадии зрелости; ж — вальвогенные ядра в спорах первой стадии зрелости. По оси
абсцисс — количество ДНК, по оси ординат — относительная часота встречаемости ядер с данным количеством ДНК.
одинаковые пределы варьирования, что вряд ли наблюдалось бы в том случае,
если бы одна из этих стадий была гаплоидной, а другая — диплоидной, как
думали некоторые исследователи (xNaville, 1931). Распределение ядер споро-
бластов по количеству в них ДНК сходно с таковым у ядер с высокой мито-
тической активностью (Зандриттер, 1969), да и на самом деле в течение спо-
рогенеза ядра споробластов многократно делятся митотически. Сходную кар-
тину распределения ядер по количеству в них ДНК имеют ранние стадии
образования панспоробласта (дублеты клеток). Видимо, синтез ДНК идет
и в вегетативном, и в генеративном ядре панспоробласта. Синтез, должно
быть, идет и в вегетативных ядрах плазмодия, которые у этого вида делаются
полиплоидными.
Данные о количестве ДНК в генеративных клетках были получены
не фотографическим методом, а позднее на «Морфокванте» сканирующим
методом с прямой регистрацией. Полученные разными способами средние
величины нельзя сравнивать между собой, и поэтому они представлены
отдельно (табл. 3, Sphaeromyxa elegini).
16
Таблица 3
Среднее количество ДНК в ядрах миксоспоридий
на разных стадиях развития
Ядра Число намерений Количество ДНК, усл. ед. су, %
Myxidium perniciosum*
Из спор 2-й стадии: спороплазма 134 0.679 ±0.012 20
капсулогенные 68 0.566±0.018 27
вальвогенные 98 0.643±0.017 26
Из 8-ядерного панспоробласта 60 1.307 ±0.046 29
Вегетативные ядра плазмодия 100 2.286+0.076 33
Henneguya zschokkei*
Из спор 2-й стадии:
спороплазма 170 0.995±0.017 23
капсулогенные 133 0.808±0.015 21
вальвогенные 106 0.827 ±0.020 24
Sphaeromyxa elegini**
Из спороплазмы 1 1 30 1 1 8.475+ 0.1621 1 10
Из генеративных клеток 30 16.952±0.5031 16
Sphaeromyxa h ell an di**
Из спороплазмы 1 30 6.836 ±0.1981 1 *5
Из 2-ядерного панспоробласта 30 16.236±0.436 14
(оба ядра) |
Myxidium pernicioeum**
Из спороплазмы 30 3.347 ±0.148 24
Из 2-ядерного панспоробласта 70 9.263±0.264 23
Из 8-ядерного панспоробласта 30 9.428± 0.444 25
♦ Фотографический метод.
♦♦ Метод прямой фотоэлектрической регистрации («Мор-
фо квант»).
Таблица 4
Среднее количество ДНК в ядрах стадий ZachokkeUa пом
на трех стеклах, окрашенных неодновременно («Морфоквант»)
Ядра
Число
иамере-
Количество
ДНК, усл. ед.
CV, %
Стекло Из спороплазмы I Из генеративных клеток 1 № 30 30 1 I 5.042±0.09 4 I 13.141±0.414 I 10 17
Стекло № 2
Из спороплазмы 30 I 5.171±0.069 | 7
Из 2-ядерного панспоробласта 30 12.737±0.450 19
(оба ядра)
Стекло № 3
Из спороплазмы I 30 6.922±0.266 I 19
Капсулогенные 30 6.299±0.202 17
Вальвогенные 30 5.798±0.212 20
17
СХЕМА ЯДЕРНОГО ЦИКЛА SPHAEROMYXA ELEGINI
Многие исследователи пытались изучать ядерный цикл Sphaeromyxa мор-
фологическими методами. Большинство авторов, работавших со Sphaero-
myxa, придерживались гипотезы Шредера (Schroder, 1907) относительно
ядерного цикла миксоспоридий (см. с. 12). По мнению Шредера и Навия
(Schroder, 1910; Naville, 1931), половой процесс у Sphaeromyxa состоит
из двух этапов: плазмогамии — перед образованием спор, кариогамии —
в конце спорогенеза внутри спороплазмы. Двуядерный панспоробласт возни-
кает в результате слияния цитоплазмы двух гаплоидных гаметических
элементов — микро- и макрогаметы. Поскольку кариогамия задерживается,
то все ядра споробластов гаплоидны.
Дебазье (Debaisieux, 1924) тоже присоединяется к этой точке зрения,
но с осторожностью. В отношении Sphaeromyxa он предполагает возмож-
ность и другого пути формирования панспоробластов.
Георгевич (Georgevitch, 1937) считает, что у Sphaeromyxa, так же как и
у всех миксоспоридий, 2-ядерный панспоробласт является не результатом
слияния, а результатом деления генеративной клетки. Поэтому все ядра спо-
робластов диплоидны. Мейоз имеет место только перед образованием двух
ядер спороплазмы. Это — единственная гаплоидная стадия.
По мнению Шредера и Дебазье (Schroder, 1907; Debaisieux, 1924), оста-
точные ядра панспоробласта (вегетативные ядра панспоробласта) возникают
на последнем этапе деления при спорогенезе, и тогда панспоробласт последо-
вательно должен содержать 2, 4, 8, 14 ядер.
По схемам, предложенным Навием и Георгевичем (Naville, 1931; George-
vitch, 1937), остаточные ядра панспоробласта выделяются и прекращают
делиться после 1-го деления ядер 2-ядерного панспоробласта, а вальвоген-
ные ядра не участвуют в последнем делении, и тогда в панспоробласте должно
содержаться последовательно 2, 4, 6, 10, 14 ядер.
В нашем материале внутри панспоробласта встречалось 2, 4, 8, редко
14 ядер и гораздо чаще 12 ядер (клеток). Эти уже дифференцированные
и занявшие характерное для них положение по отношению друг к другу
клетки образуют две споры (рис. 3). Остаточные ядра панспоробласта к этому
времени, видимо, дегенерируют. На основании этих фактов мы предполо-
жили, что остаточные ядра выделяются на 8-ядерной стадии и не участвуют
в последнем делении (Успенская, 1975, 1976а). Однако вопрос о судьбе оста-
точных ядер еще не решен и будет обсуждаться ниже (см. с. 23—24).
Полученные нами данные по плоидности ядер 3. elegini не укладывались
ни в одну из ранее предложенных схем ядерного цикла миксоспоридий.
В свете наших фактов нельзя было принять схемы Шредера, Дебезье и
Навия (Schroder, 1907, 1910; Debaisieux, 1924; Naville, 1931), которые пред-
полагают, что всо^ядра споробластов гаплоидны, по нашим же данным стадии
с 2, 4 и 8 ядрами внутри панспоробласта диплоидны. Вынуждены мы также
были отказаться от схем Георгевича, Нобля, Шульмана и Семинович
(Georgevitch, 1937; Noble, 1944; Шульман, Семенович, 1973), так
как соматические ядра споры (капсулогенные и вальвогенные), так же
как ядра спороплазмы, у 3. elegini оказались гаплоидными, а по схемам
этих авторов они диплоидны.
Нами на основании многолетних исследований была предложена новая
схема ядерного цикла 3. elegini во время спорогенеза, начиная с деления спо-
рогенной (содержащей генеративное ядро) клетки панспоробласта (Успен-
ская, 1969, 1975). По этой схеме диплоидное генеративное ядро панспоро-
бласта (ядро спорогенной клетки) делится митотически 3 раза, после чего
наступает мейоз и клетки, образующие спору, оказываются гаплоидными,
т. е. спора — целиком гаплоидное образование, и мейоз во время спорогене-
за занимает промежуточное положение по отношению к зиготической или
гаметической редукции (Успенская, 1976а, 1979а, 1981а, 19816, 19826,
1982в).
18
Таблица 5
Плоидность ядер разных стадии у изученных видов миксоспоридий,
принадлежащих к разным систематическим группам (цитофотометрия)
Фааы жизненного цикла Ядра, в которых измерялось количество ДНК Подотряд Bipolaria t Подотряд Platisporea
Sphaeromyxa elegini Sphaeromyxa hellandi Myxidium perniciosum Zschokkella nova Henneguya zschokkei
Паразитическая фаза аггломерации в теле Соматические (вегетативные): в цитоплазме плазмодия 4n 4n
хозяина (трофозоиты в панспоробласте 2n 2n 2n 2n —
в виде плазмодиев) Генеративные: в генеративных клетках 2n — — 2n —
плазмодия в панспоробласте: 2-ядериом 2n 2n 2n 2n
4-ядерном 2n — 2n — । । •
Покоящаяся фаза дис- персии во внешней сре- 8-ядерном 2n — 2n — —
Гаметические: в спороплазме n n n n n
де (спора) Соматические (вегетативные): вальь генные n n n n n
капсулогенные n n n n n
Для того чтобы проверить, справедлива ли эта схема для миксоспоридий
в целом, были предприняты дальнейшие исследования плоидности ядер пред-
ставителей других семейств на разных стадиях их жизненного цикла. •
К настоящему времени методами цитофотометрии нами установлена
плоидность ядер разных стадий жизненного цикла следующих видов: Sphae-
romyxa elegini, S. hellandi, Myxidium perniciosum, Henneguya zschokkei,
Zschokella nova (табл. 2—4; рис. 4). Однако наиболее полно изучен ядерный
цикл Sphaeromyxa elegini. В экспедиционных сборах попадаются далеко
не все стадии цикла, да и указанные трудности метода делают эти исследова-
ния медленными и кропотливыми, но и полученные на сегодняшний день
данные меняют прежние представления о ядерном цикле миксоспоридий.
У всех изученных видов споры имеют по две створки и по две капсулы.
Виды, имеющие многостворчатые и многокапсульные споры, пока не охва-
чены цитофотометрическими исследованиями. Однако их изучение представ-
ляло бы значительный интерес, так как важно узнать, в каком месте споро-
генеза происходят добавочные митотические деления, ведущие к увеличению
числа створок и капсул.
Плоидность ядер одних и тех же стадий у представителей разных
родов, семейств и подотрядов совпадает (табл. 5).
Паразитические плазмодии содержат вегетативные ядра, плоидность
которых колеблется у крупных плазмодиев от 2п до 8п (в среднем 4п), и ди-
плоидные генеративные ядра, т. е. паразитическая фаза жизненного цикла
диплоидна. Мейоз совершается при переходе к другой фазе жизненного
цикла, и в результате возникает гаплоидная спора — покоящаяся фаза жиз-
ненного цикла.
Таким образом, в течение жизненного цикла миксоспоридий происходит
чередование диплоидной и гаплоидной фаз.
19
2*
СРАВНЕНИЕ РЕЗУЛЬТАТОВ ЦИТОФОТОМЕТРИЧЕСКИХ
И ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКИХ ИССЛЕДОВАНИЙ
СПОРОГЕНЕЗА У МИКСОСПОРИДИЙ
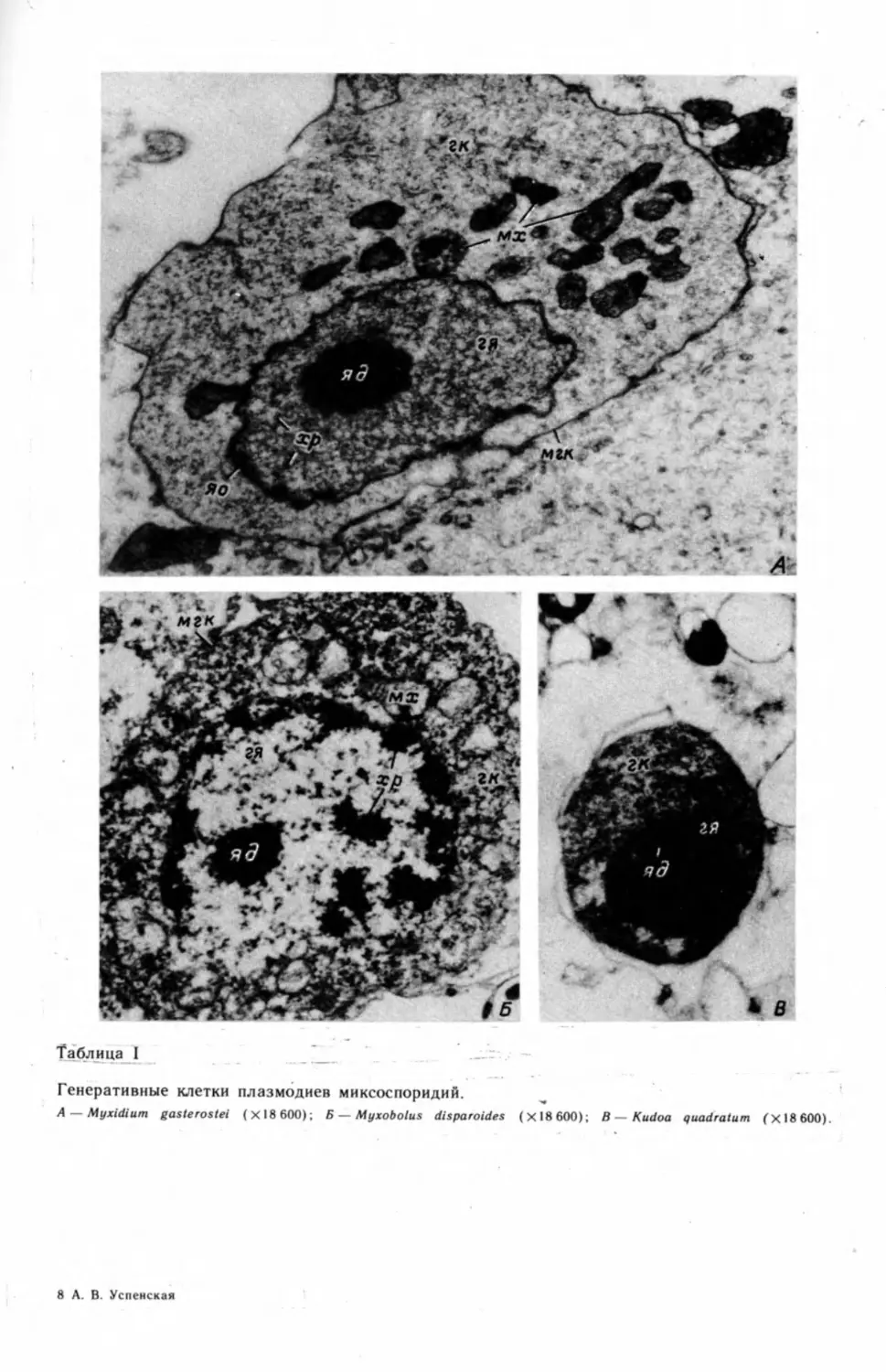
В первом электронно-микроскопическом исследовании миксоспоридий
Грассе (Grasse, 1960) ясно показал, что процесс спорогенеза сопровождается
не только делением ядер плазмодия, но и дифференциацией внутри него осо-
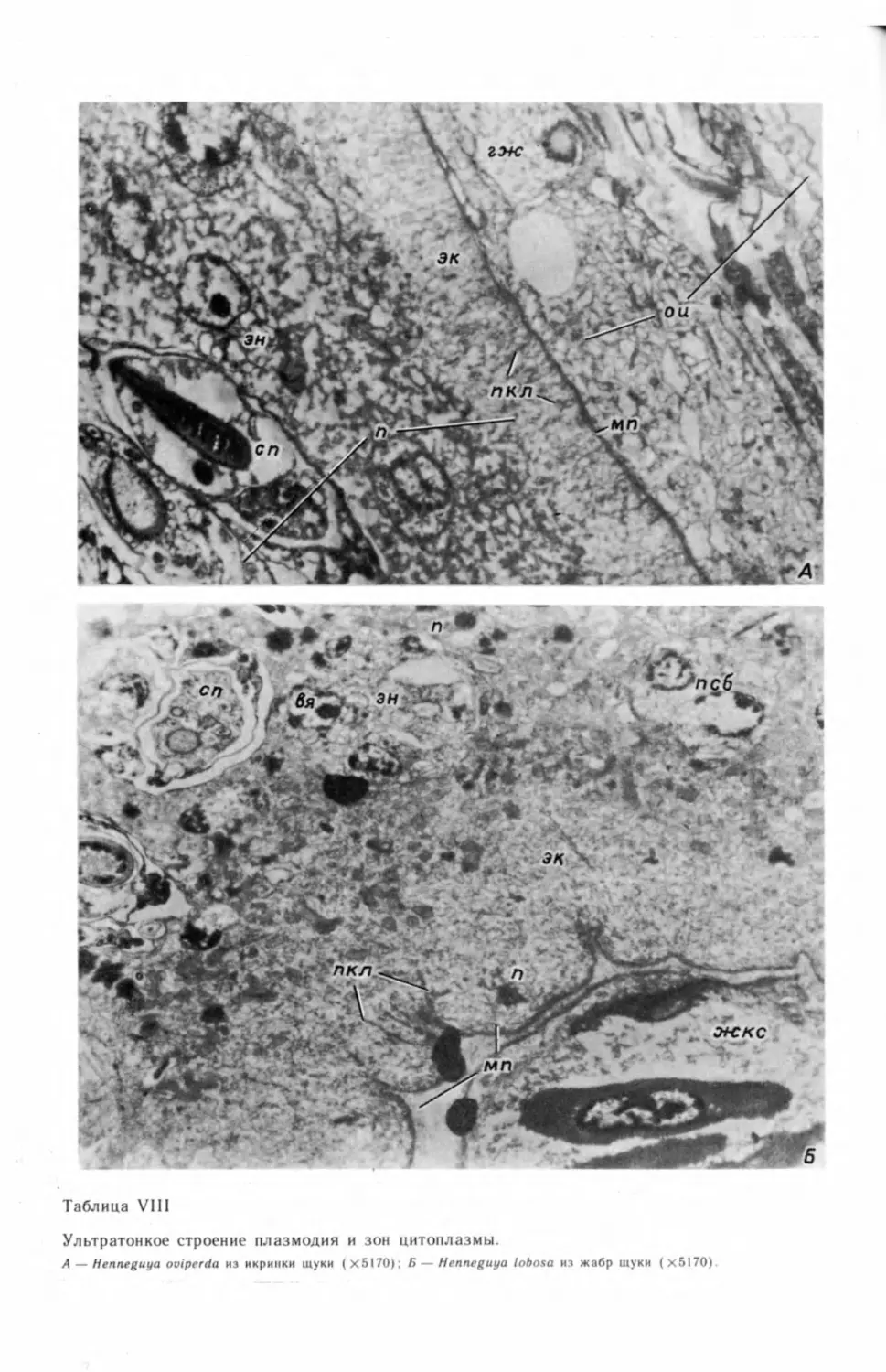
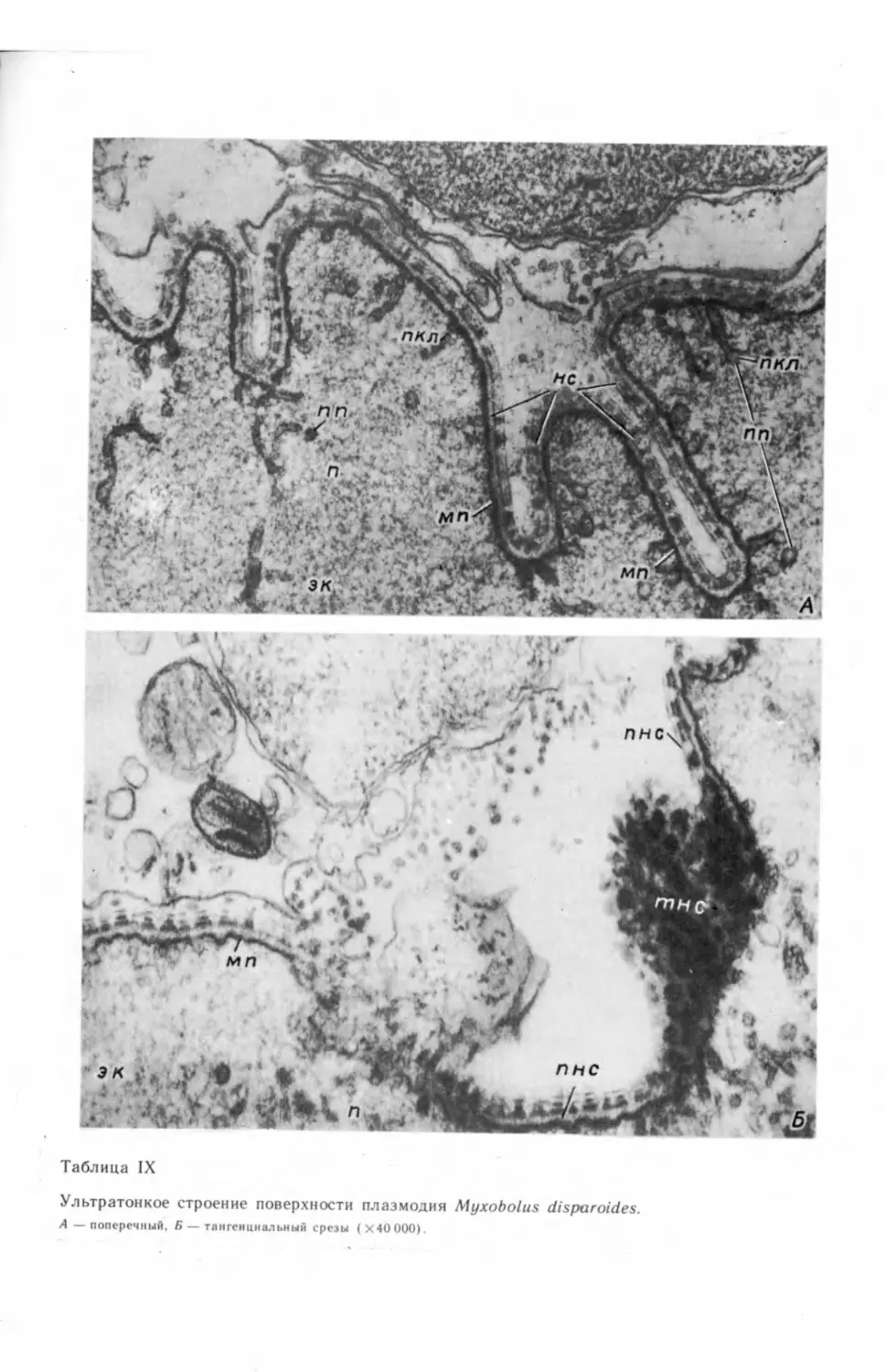
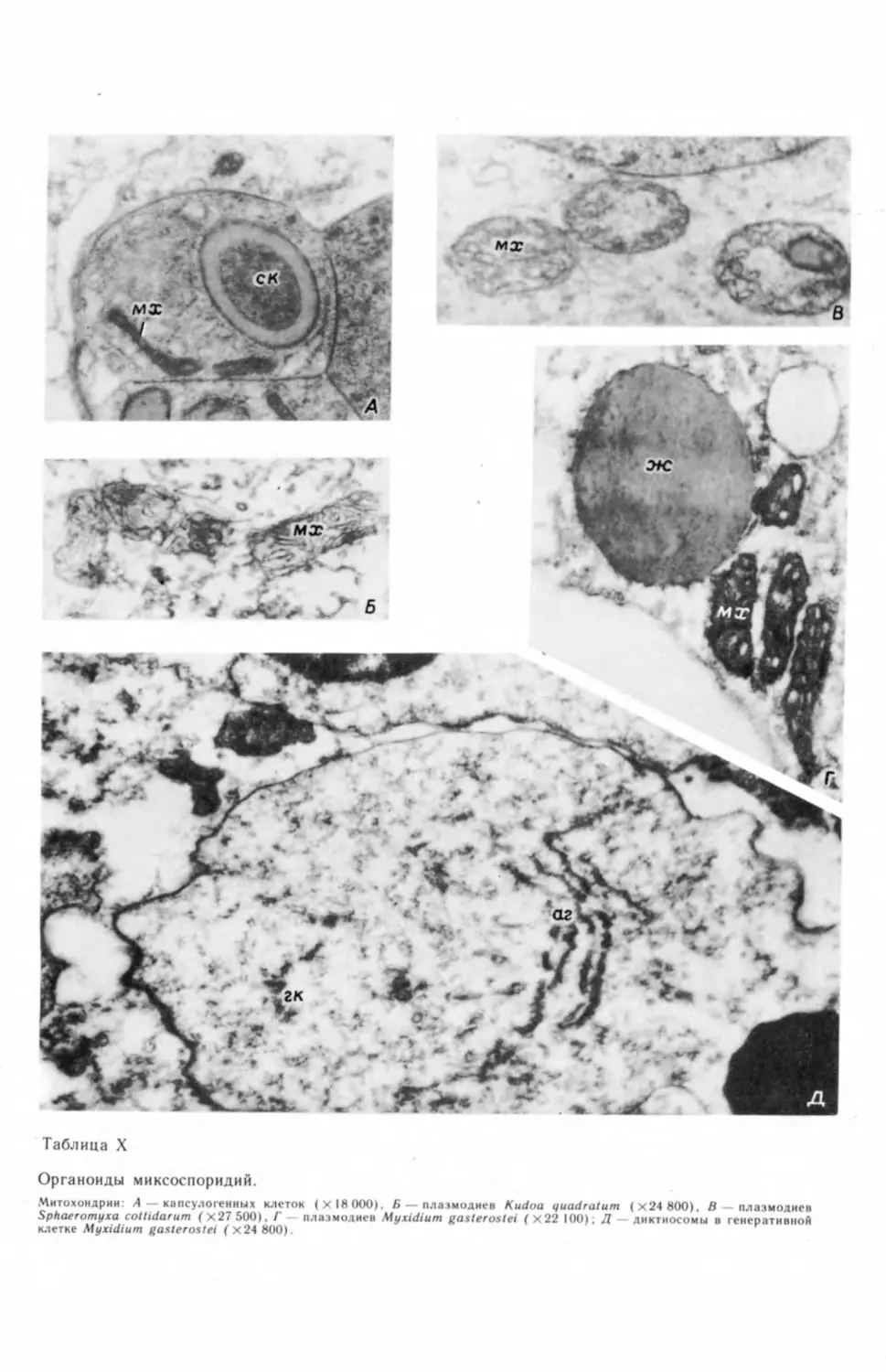
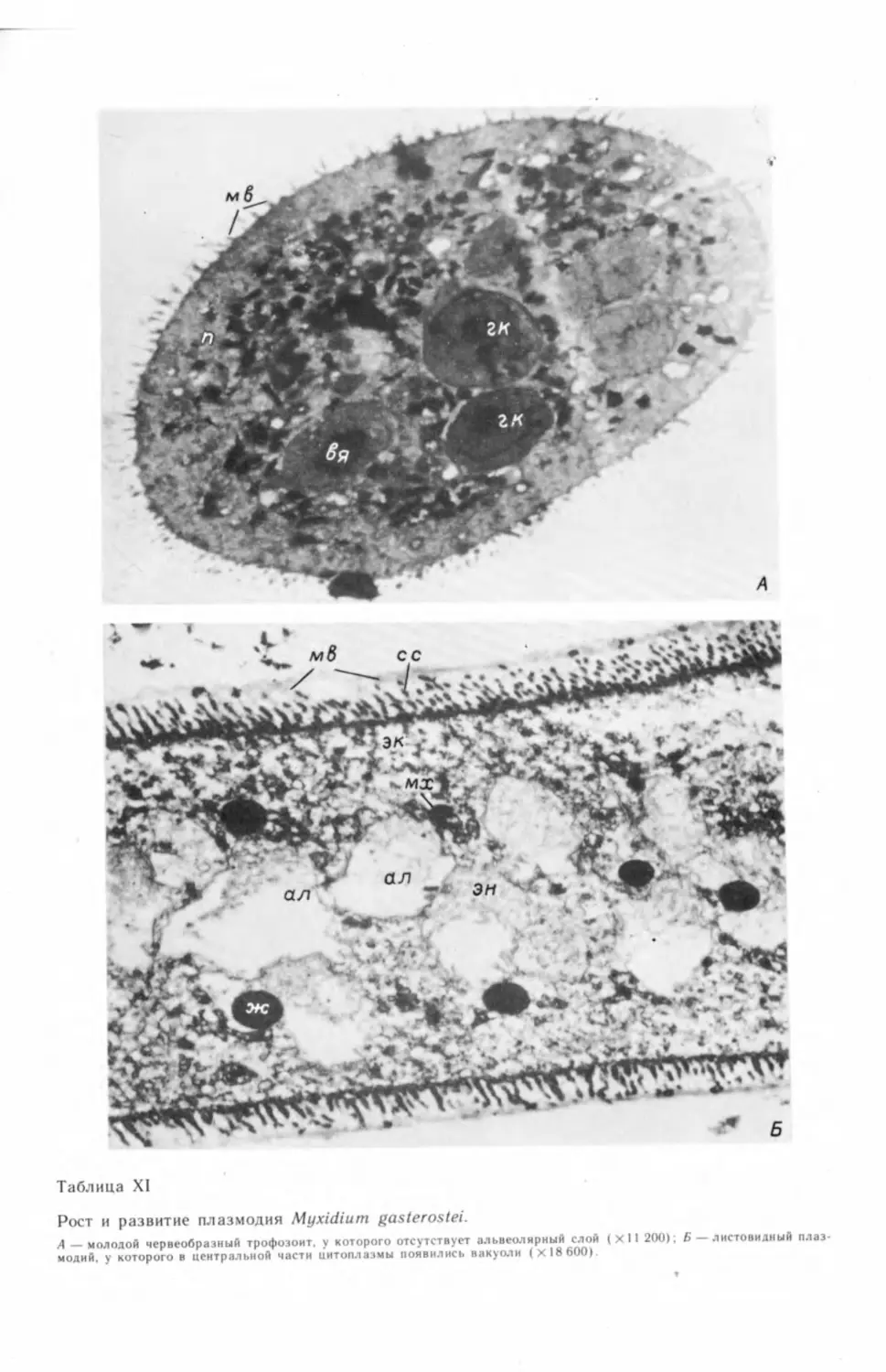
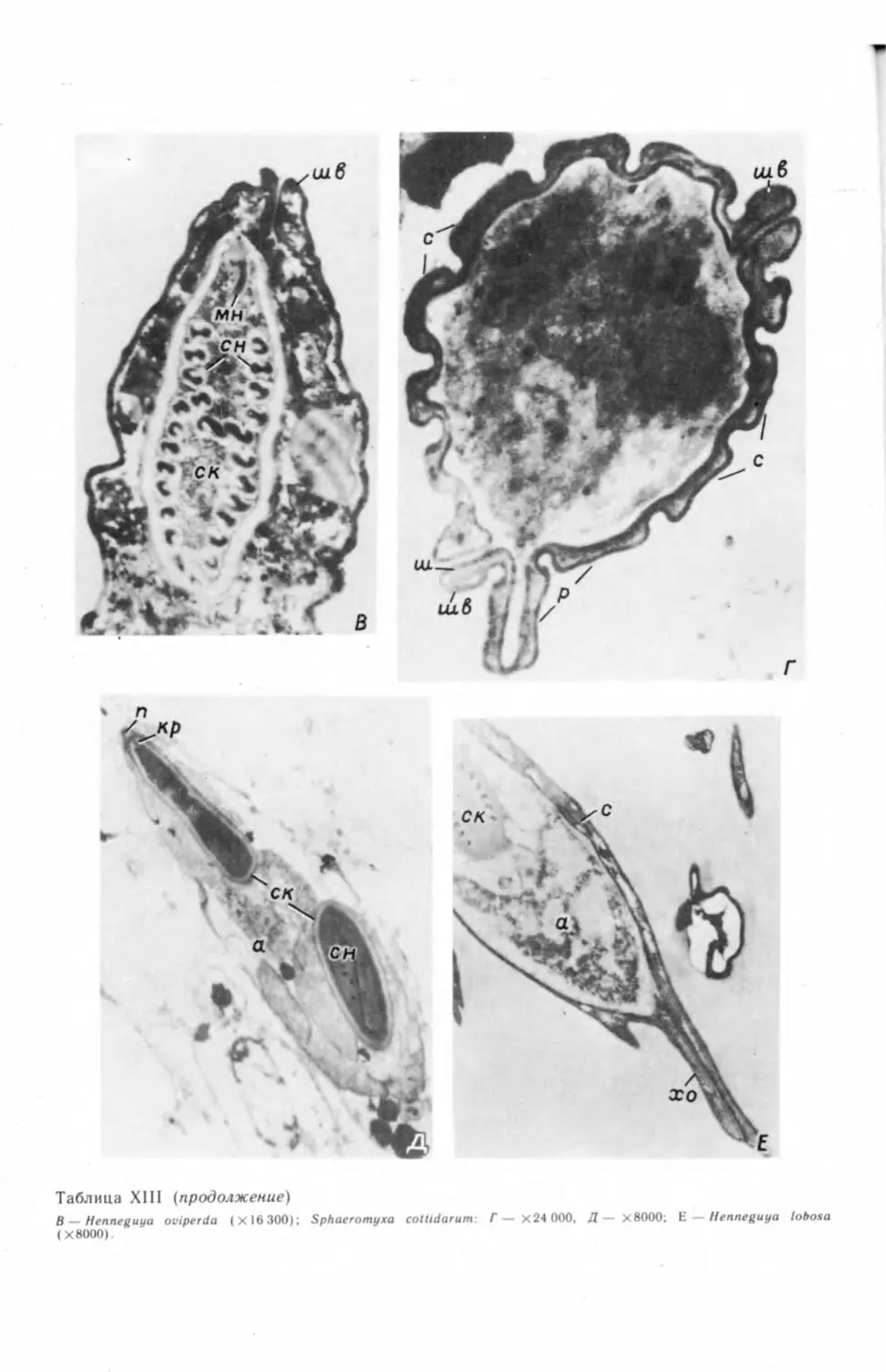
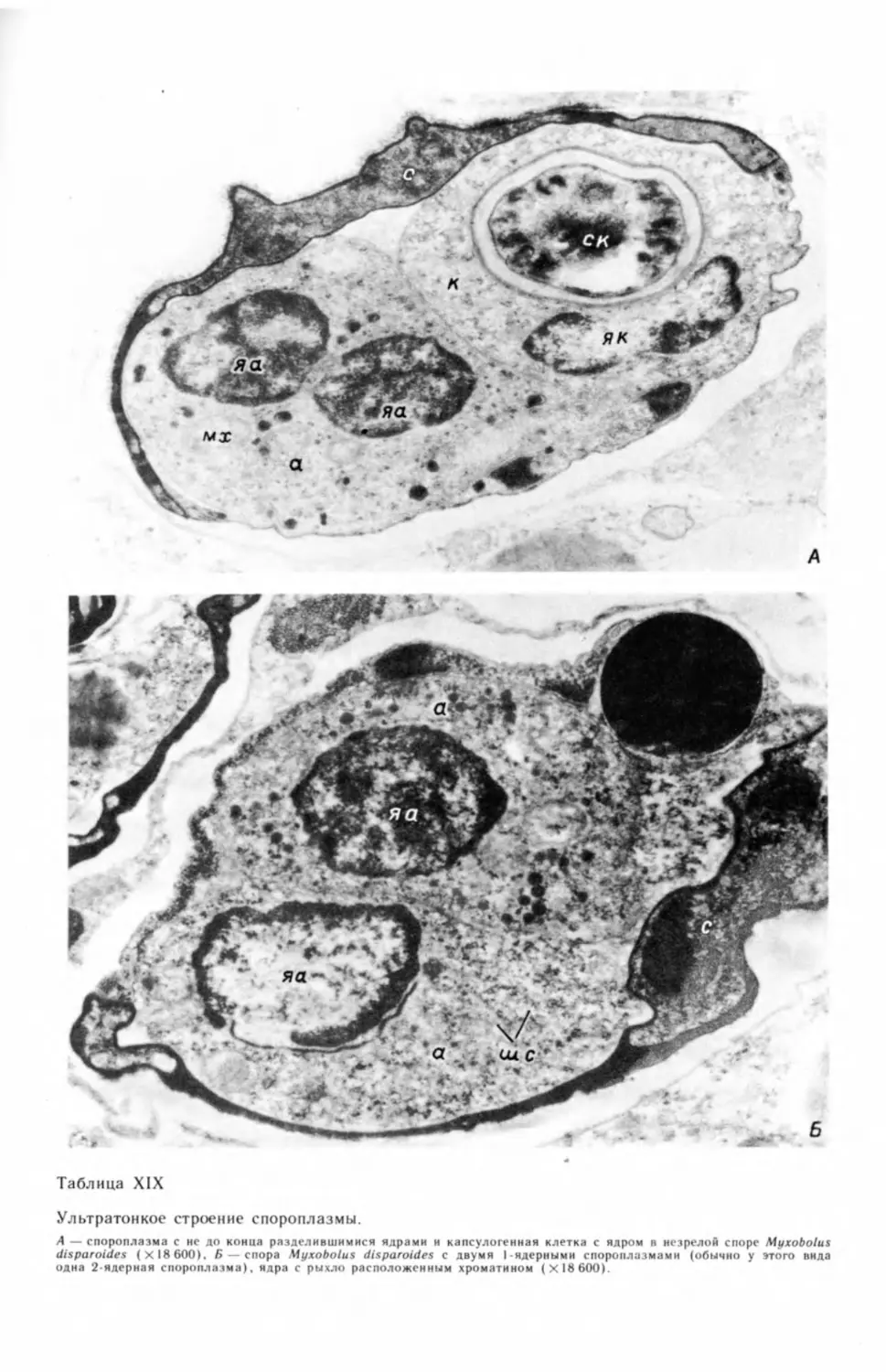
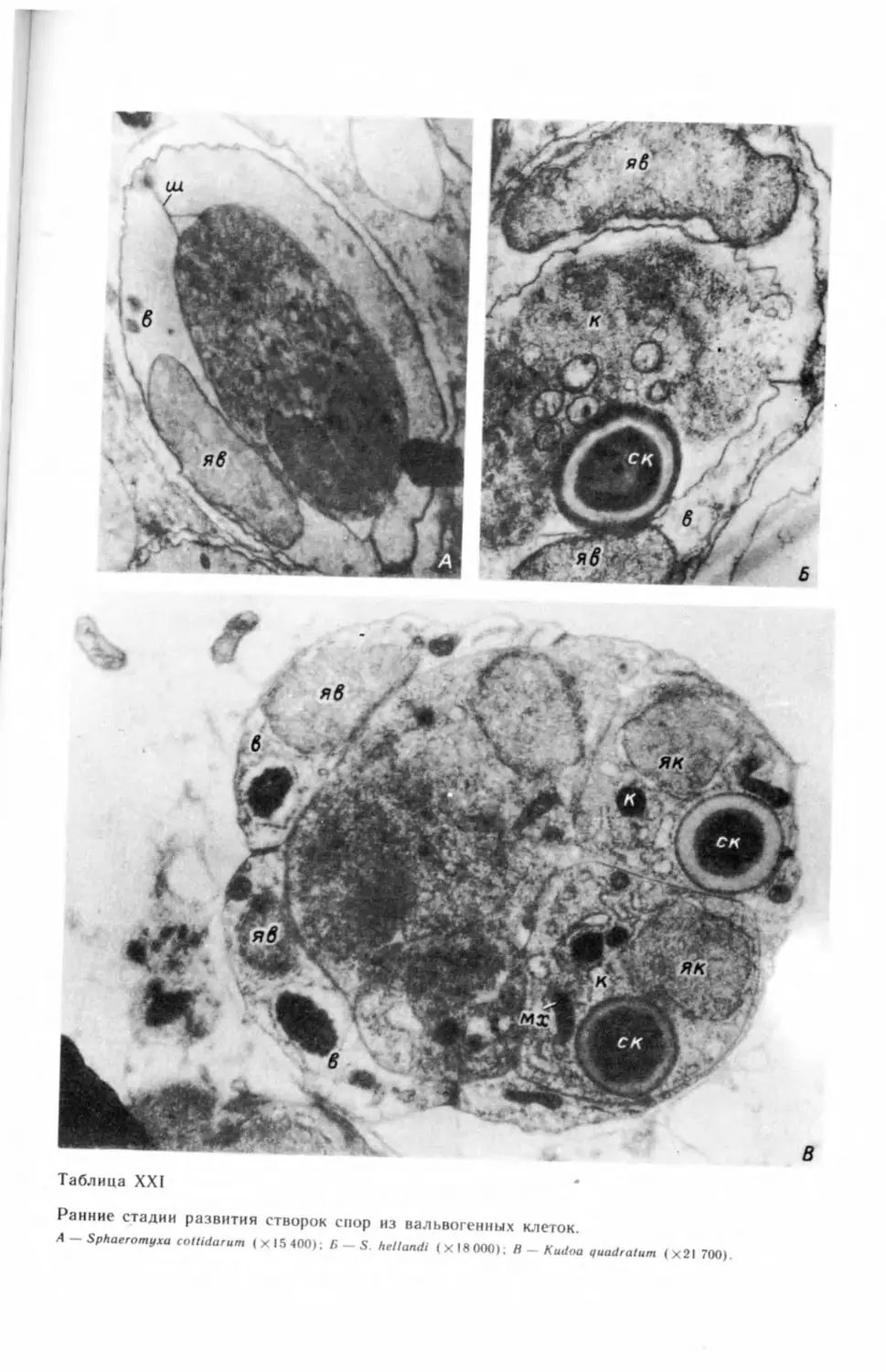
бых генеративных клеток и их делением (табл. I, А—В) ,2 На препаратах, под-
готовленных для цитофотометрии (по Фельгену окрашиваются лишь ядра),
трудно разглядеть границы клеток и проследить последовательность их деле-
ний при спорогенезе. Точные сведения о клеточном цикле можно получить
лишь с помощью электронного микроскопа.
Для того чтобы иметь полное представление о ходе спорогенеза, необхо-
димо увязать нашу схему ядерного цикла с данными о клеточных делениях,
полученными при электронно-микроскопическом изучении. После упомянутой
работы Грассе (Grasse, 1960) появился ряд исследований ультратонкого
строения миксоспоридий, в которых затрагивается проблема спорогенеза
и описываются разные его стадии на основании размещения в определенной
последовательности картин, наблюдавшихся на отдельных ультратонких сре-
зах. В этих работах очень редко удавалось проследить какую-нибудь клетку
на серии срезов (Lom, 1977). Ни в одной из них не оговаривается, что выводы
сделаны в результате реконструкции по серийным срезам (Lom, Puytorac,
1965а, 1965b; Успенская, 1966, 1969, 1981а; Schubert, 1968; Lom, 1969; Cur-
rent, Janovy, 1976, 1977, 1978; Lom, 1977; Desser, Paterson, 1978; Grasse,
Lavette, 1978; Current, 1979; Listebarger, Mitchell, 1981; Lom, Dykova,
1981, и др.).
Почти во всех исследованиях иностранных авторов за начало спорогенеза
принимается объединение двух клеток. Некоторые авторы называют их гене-
ративными клетками, не отличая друг от друга (Lom, Puytorac, 1965b);
многие указывают, что одна из этих клеток меньше другой (Schubert, 1968;
Lom, 1969; Current, 1979, и др.). В работе, посвященной Sphaeromyxa sabra-
zesi, Грассе и Лаветт (Grasse, Lavette, 1978) утверждают, что эти клетки раз-
личны по своей потенции, морфологии и судьбе. Одну из них эти авторы назы-
вают перицит, а другую — спороцит.
Большинство из перечисленных иностранных исследователей, начиная
с Грассе (Grasse, 1960), Лома и Пюторака (Lom, Puytorac, 1965а, 1965b),
считают, что происходит передвижение этих двух клеток, их сближение,
а затем обволакивание или заглатывание одной клетки другою (enveloping,
engulfing). При этом большинство авторов не привлекают каких-либо дока-
зательств существования такого процесса, а приводят в статье 1—2 изобра-
жения двух клеток, лежащих рядом, а затем двух клеток, из которых одна
находится в другой (Lom, 1969; Grasse, Lavette, 1978; Current, 1979, и др.).
Лишь Шуберт (Schubert, 1968) отмечает, что трудно точно сказать, происхо-
дит ли в данном случае деление одной клетки на две или сближение двух кле-
ток. Грассе и Лаветт (Grasse, Lavette, 1978) затрагивают вопрос о том, куда
девается мембрана фагоцитарной вакуоли в том случае, когда одна клетка
обволакивает другую, но так и не дают на него ясного ответа. Все упомянутые
авторы не считают этот процесс половым: по их мнению, здесь не происходит
слияния ядер и цитоплазмы. Наружная клетка лишь образует соматическую
оболочку, выполняющую вегетативные функции и содержащую вегетативное
(остаточное) ядро панспоробласта. Внутренняя клетка является спороген-
ной, она дает начало всем клеткам споры, в ней находится генеративное ядро
панспоробласта.
В единственной экспериментальной работе (Siau, 1977), где изучались
рост и развитие спороплазмы Myxobolus exiguus в культуре на искусственной
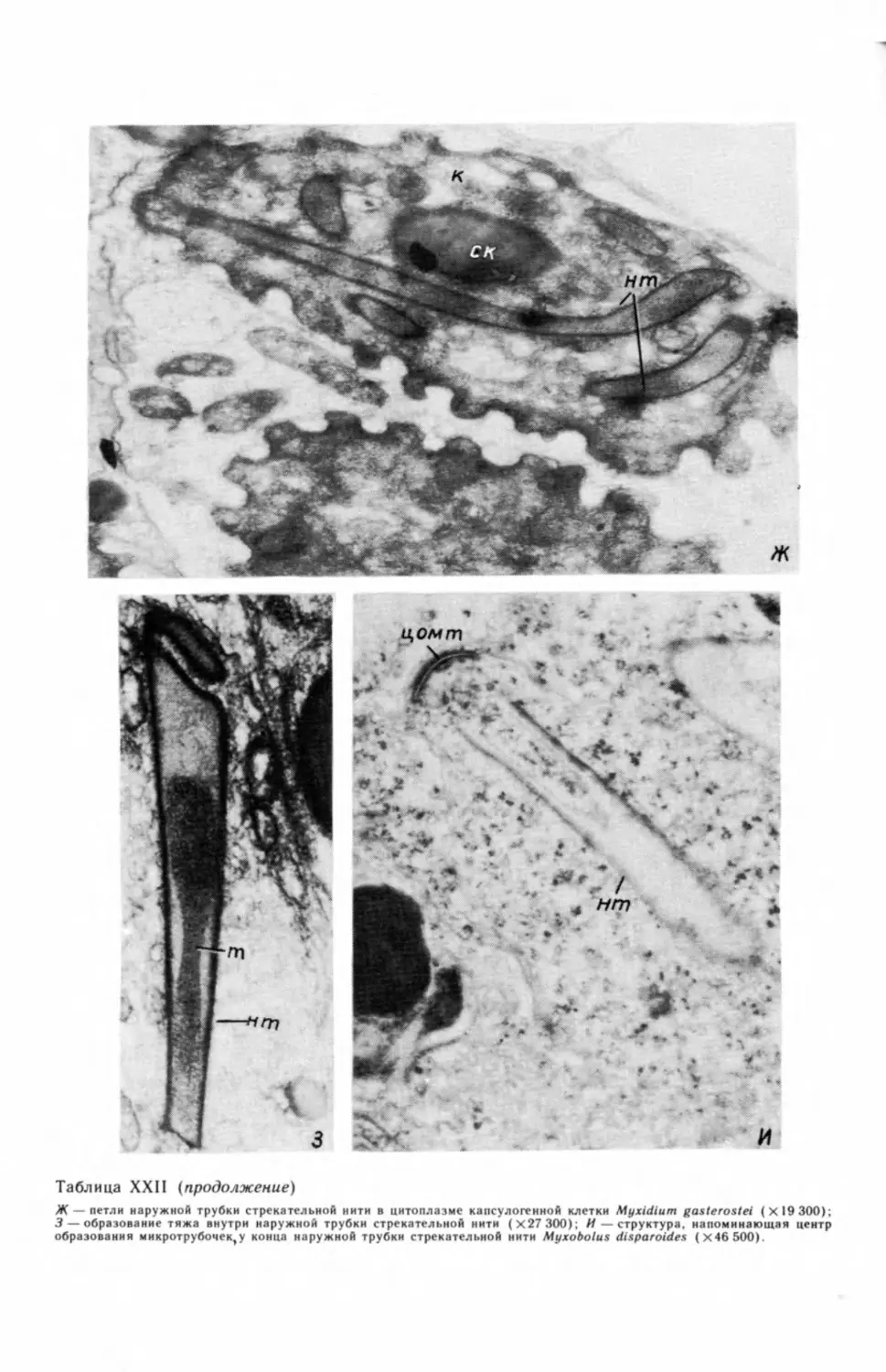
2 Электронно-микроскопические фотографии (таблицы с римской нумерацией) см. на
вклейках.
20
среде, утверждается, что спорогенез, начинается не со сближения двух гене-
ративных клеток, а с неравного деления одной генеративной клетки ца две,
одна из которых меньше другой и окружает последнюю в виде полумесяца.
Сио (Siau, 1977) подчеркивает, что это не гетерогамия и что половой процесс
перед спорогенезом отсутствует, а оплодотворение совершается в споро-
плазме.
На данном этапе исследований, нам наиболее обоснованной кажется гипо-
теза о делении генеративной клетки (Успенская, 1981а), тем более что в ра-
боте Сио (Siau, 1977) приводятся прямые наблюдения за ее делением. Эта
точка зрения совпадает с мнением ряда авторов (Georgevitch, 1935; Noble,
1944; Шульман, 1966), проводивших исследования под световым микроско-
пом.
С. С. Шульман и С. А. Подлипаев (1980) полагают, что спорогенная
клетка внутри панспоробласта возникает путем обособления вокруг его гене-
ративного ядра цитоплазмы, т. е. способом, наиболее признанным для образо-
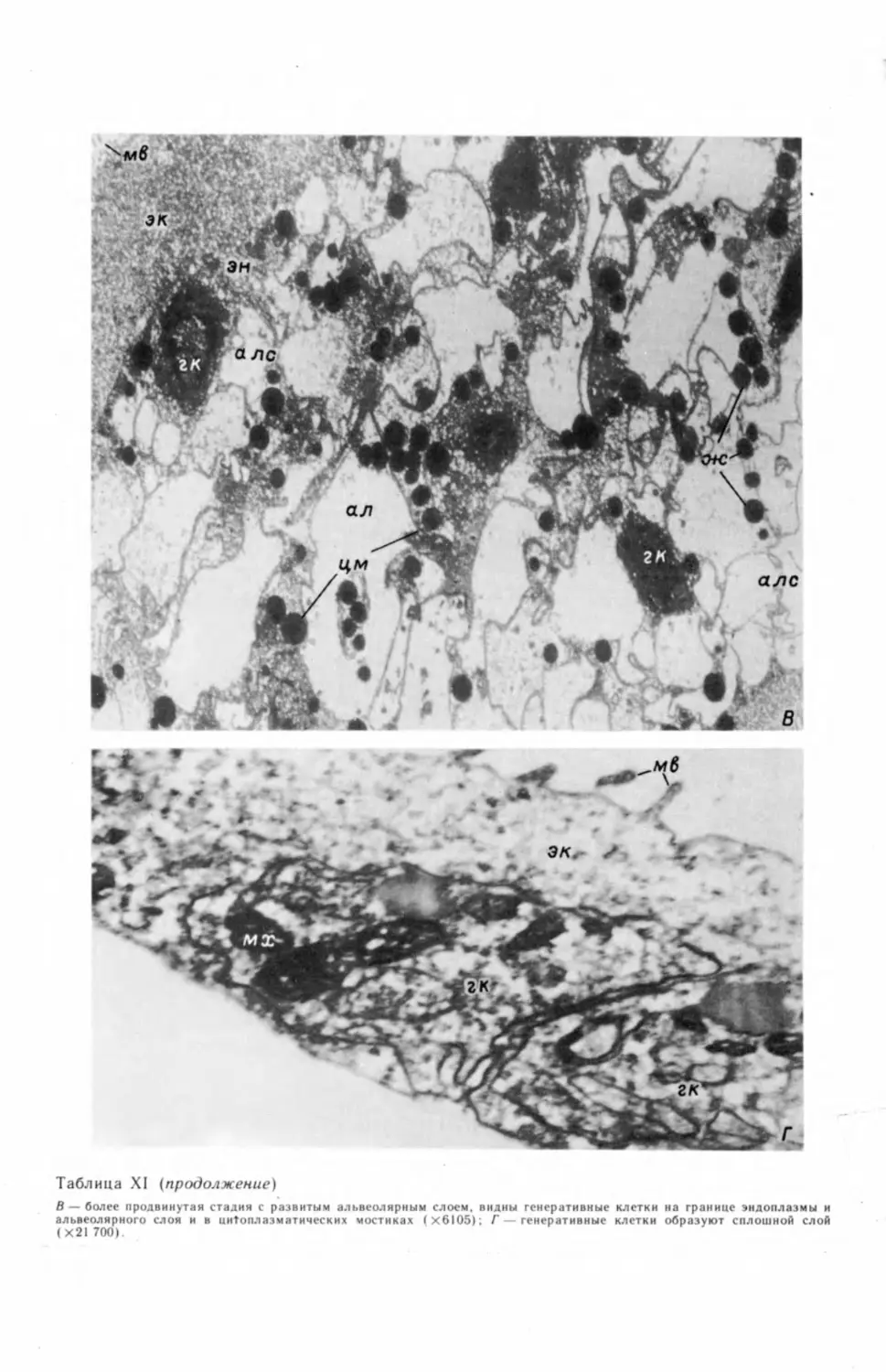
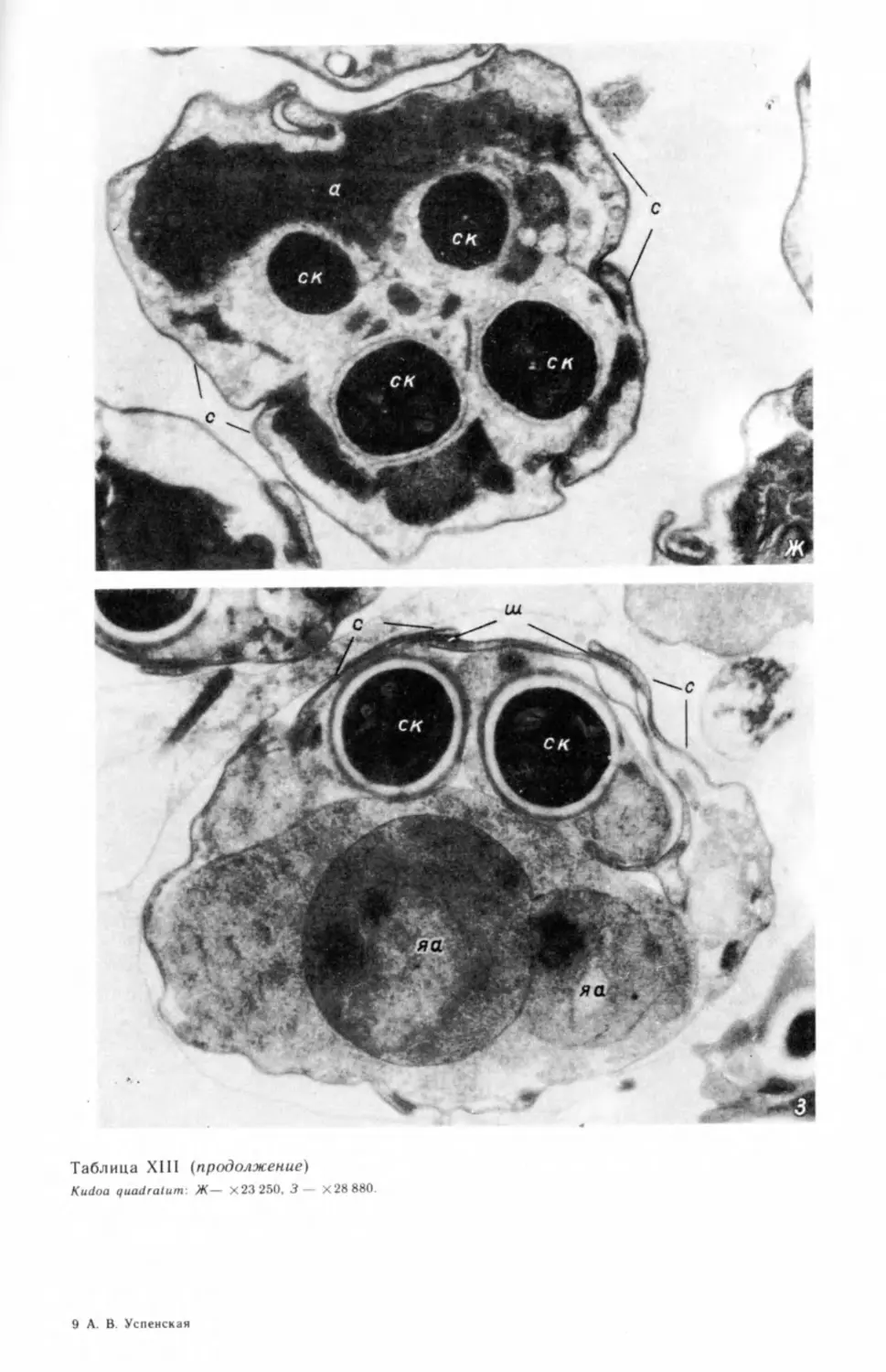
вания генеративной клетки (табл. II, А—В).
Гипотеза о сближении двух клеток с последующим обволакиванием
одной клетки другою пока не имеет достоверных доказательств, так как бази-
руется на статичных и несерийных изображениях, которые можно располо-
жить в любом порядке и трактовать по-разному (Успенская, 1981а). Подроб-
нее об этом будет сказано ниже (см. с. 20—21).
Следует здесь упомянуть и о другой работе Сио (Siau, 1979), которая,
хотя и не касается спорогенеза, а рассматривает предшествующие стадии
цикла, однако основывается на данных электронной микроскопии, и в ней
высказывается суждение о плоидности ядер в течение всего жизненного
цикла миксоспоридий. В этой работе сообщается об обнаружении на срезах
синаптонемального комплекса в ядрах 1-ядерных клеток миксоспоридии
Myxobolus exiguus. Выполненные при малом увеличении снимки не дают пол-
ной уверенности в том, что это действительно синаптонемальный комплекс.
Подтверждение этих данных указывало бы на наличие в упомянутых клетках
мейоза. Эти 1-ядерные клетки Сио считает либо спороплазмами после осво-
бождения из споры и автогамии, либо шизозоитами, произошедшими путем
шизогонии из зиготы (после автогамии). Мейоз, по его мнению, происхо-
дит либо в начале цикла во время 1-го деления синкариона, либо после
шизогонии, перед дифференцировкой генеративных и вегетативных ядер
в трофозоите. Исходя из своих предположений, Сио делает вывод, что в жиз-
ненном цикле миксоспоридий только спороплазма и шизозоит — диплоидные
стадии, все же остальные — гаплоидны.
Эти выводы совершенно не согласуются с нашими данными о плоидности
ядер миксоспоридий на стадиях спорогенеза и о плоидности вегетативных
ядер плазмодия (табл. 1). Из работы Сио, в которой отсутствует раздел
«Материал и метод», трудно понять, что это за «скопление 1-ядерных клеток»
на срезах, в котором он наблюдал синаптонемальные комплексы; возможно,
что это многоклеточные панспоробласты.
Стадии, предшествующие образованию многоядерных плазмодиев, нами
не изучались ни цитофотометрически, ни электронно-микроскопически.
Однако наличие диплоидных генеративных клеток, диплодных дублетов
клеток и диплоидных 2-, 4- и 8-ядерных панспоробластов скорее говорит
о существовании одного мейоза в жизненном цикле миксоспоридий.
Лом и Дикова (Lom, Dykova, 1981) в кратких тезисах сообщают о том, что
им удалось под электронным микроскопом изучить ранние стадии развития
Sphaerospora и Mitrospora, находившиеся внутри эпителиальных клеток по-
чечных канальцев. Они не отмечали наличия синаптонемальных комплексов
в ядрах этих стадий. Что касается самого мейоза, то под электронным микро-
скопом он не изучен. Комплексы эти пока не отмечены больше ни в одном
электронно-микроскопическом исследовании: ни в генеративных клетках,
ни в двухклеточных (2-ядерных) панспоробластах, ни на более ранних ста-
диях (Yamomoto, Sanders, 1979).
21
Данные по морфологии мейоза у миксоспоридий, полученные под свето-
вым микроскопом, разноречивы и неточны. Большинство авторов описывали
мейоз не в том месте, где он был установлен с помощью цитофотометрии
(Успенская, 1976а, 1981а, 19816, 19826, 1982в). Нобль (Noble, 1944)
полагал, что во время редукционного деления, перед формированием двух
ядер спороплазмы, хромосомы распределяются на две группы без деления
и каждое ядро получает половинный набор хромосом. По Георгевичу (Geor-
gevitch, 1923, 1937), во время мейоза каждое ядро получает диплоидное число
хромосом, но затем только половина их окружается ядерной оболочкой. В бо-
лее поздних публикациях (Шульман, 1972; Шульман, Семенович, 1973) ут-
верждается, что мейоз у миксоспоридий одноступенчатый, и этот факт
используется как доказательство примитивности миксоспоридий.
Цитофотометрические данные не дают возможности окончательно решить,
включает ли мейоз одно или два деления. Восьмиядерный панспоробласт
содержит диплоидные ядра. Следующая стадия (что определяют по коли-
честву ядер) содержит уже гаплоидные ядра — это клетки, из которых фор-
мируется спора. Кажется, что для 2-го мейотического деления просто нет
места. Однако кривая распределения ядер по количеству в них ДНК у 8-ядер-
ной стадии указывает на существование в них уровня ДНК, соответствую-
щего 2с и 4с, тогда как ядра клеток, образующих спору (следующая стадия),
имеют уровень, равный 1с. Этот уровень не может быть достигнут в резуль-
тате только одного деления. Уменьшение количества ДНК с 4с до 1с можно
было бы объяснить, например, элиминацией части хроматина (Georgevitch,
1923, 1937) или выделением полярного тельца, как это описывает Янышев-
ская (Jeniszewska, 1955, 1957) для родственных миксоспоридиям живот-
ных — актиномиксидий.
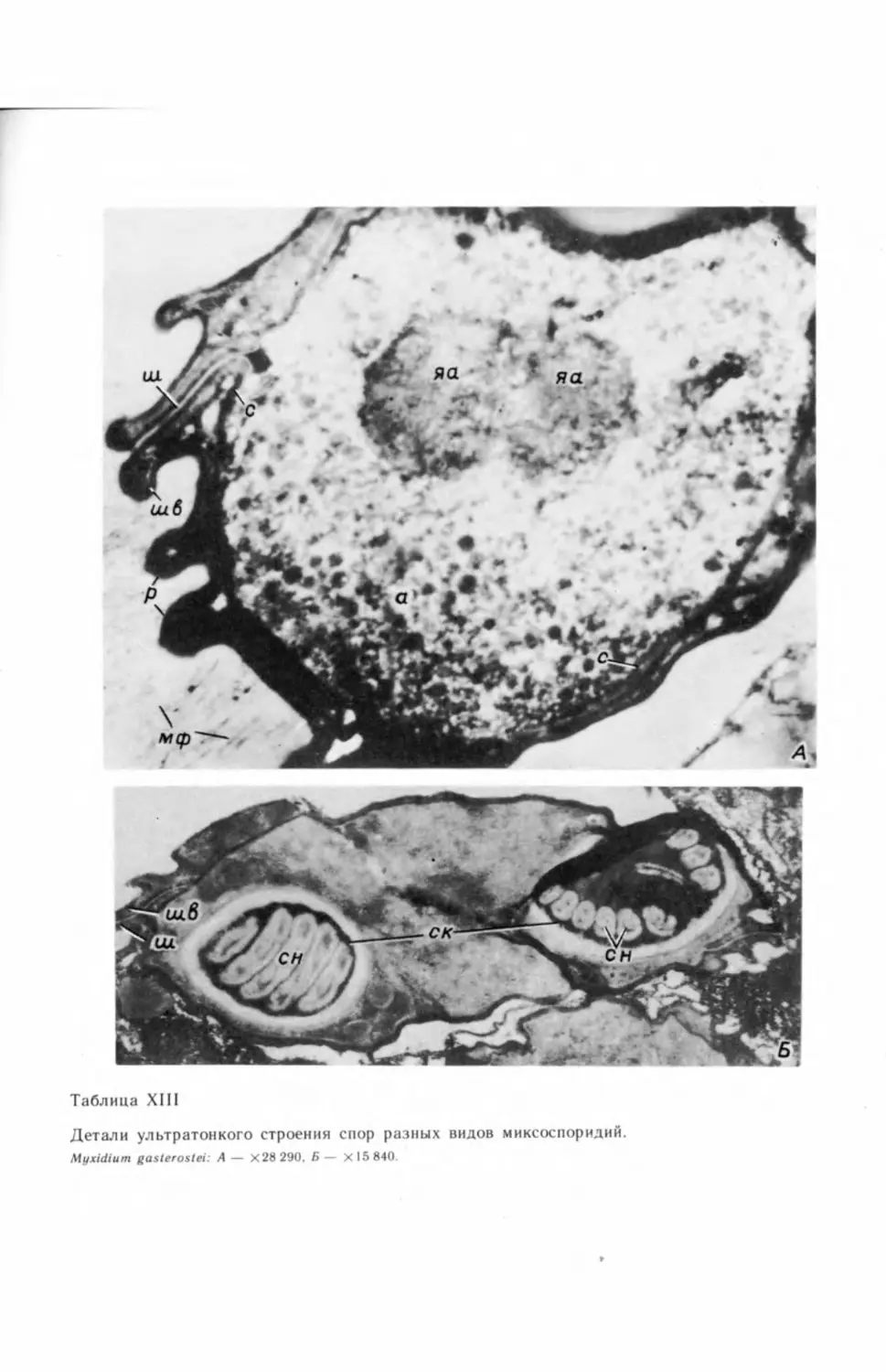
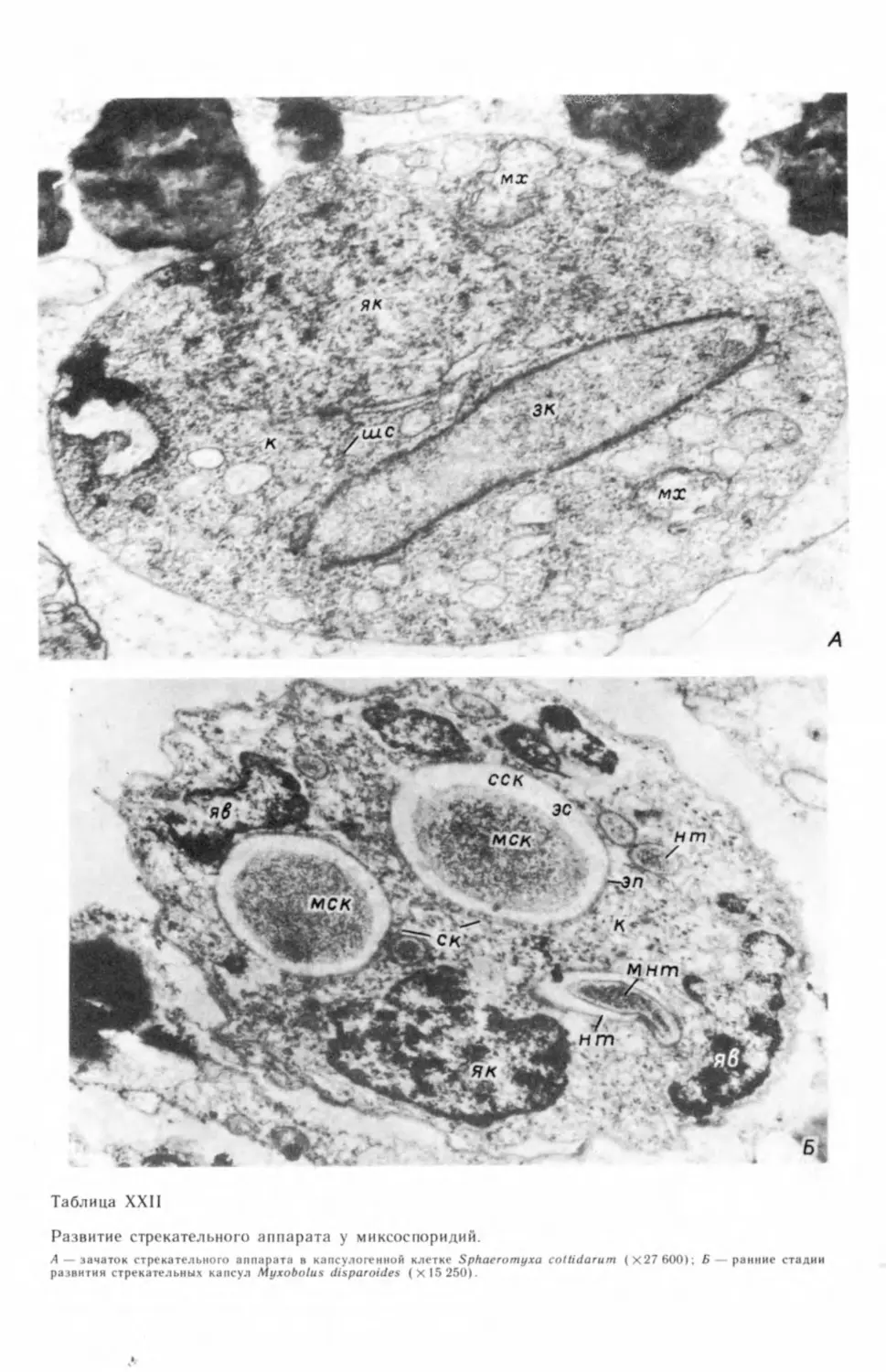
Под электронным микроскопом у Myxidium gasterostei мы наблюдали
картину, напоминающую выделение редукционного тельца (табл. III, Л),
но поскольку такая картина была встречена только у одного вида, то сущест-
вование этого способа редукции хроматина у миксоспоридий надо подтвер-
дить на большем материале (Успенская, 1982в). Ранее эту же картину
мы трактовали как возможный способ образования остаточных ядер панспо-
робласта (Успенская, 1981а).
Используя полученные с помощью метода цитофотометрии и электронной
микроскопии данные о количестве ядер и клеток на разных стадиях споро-
генеза и о их плоидности (табл. 1), мы попытались составить схему
(см. ниже), отражающую последовательность ядерных и клеточных делений
в этот период. Схема эта составлялась для видов с двухспоровым панспоро-
бластом с двухстворчатыми и двухкапсульными спорами, так как наибольшее
количество сведений есть именно о таких миксоспоридиях. Для односпо-
рового панспоробласта процесс должен быть сокращен на одно митотическое
деление, а в случае многостворчатых и многокапсульных спор, видимо,
должны быть добавочные митозы для умножения количества вальвогенных
и капсулогенных клеток. В схеме отражены обе гипотезы образования панспо-
робласта. При составлении схемы выяснилось, что из-за недостатка электрон-
но-микроскопических данных по ряду вопросов нельзя прийти к единому ре-
шению; поэтому приходится предложить несколько возможных вариантов
схемы. Неясности касаются типа мейоза (одноступенчатый или двухступен-
чатый), а также способов образования остаточных (вегетативных) ядер пан-
споробласта и их количества.
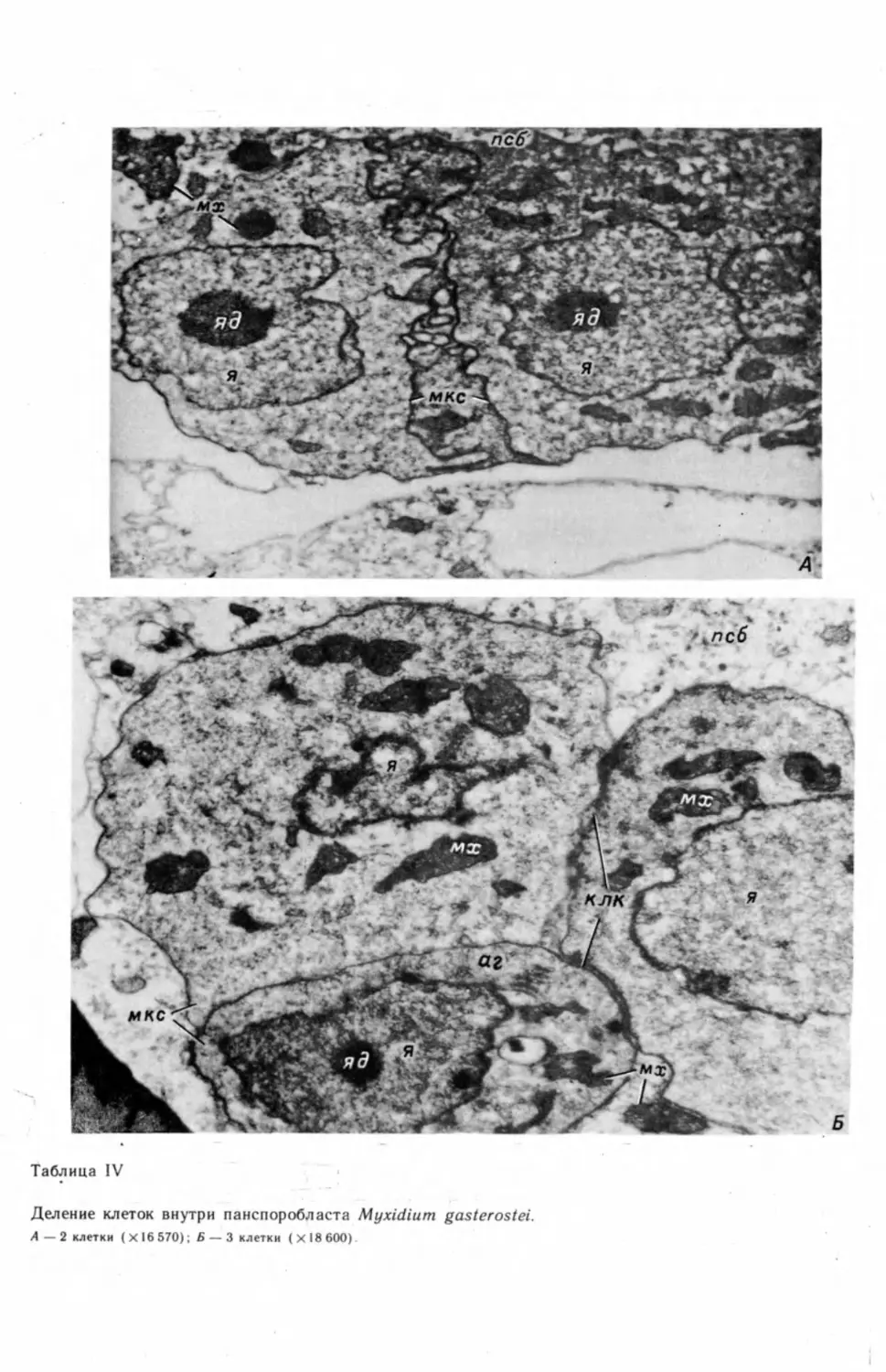
Как уже говорилось, непосредственно в спорообразовании принимает
участие только внутренняя (спорогенная) клетка панспоробласта, которая
делится митотически и является родоначальницей всех клеток споры
(табл. IV, А, Б). Ядро наружной клетки выполняет вегетативные функции
и в конечном счете дегенерирует. Многие исследователи утверждают, что оно
вообще не делится (Lom, 1969; Grasse, Lavette, 1978; Current, 1979; и др.).
Однако Шуберт (Schubert, 1968) указывает, что на срезах через многоклеточ-
ный панспоробласт наружная, обволакивающая клетка двуядерна. Если
22
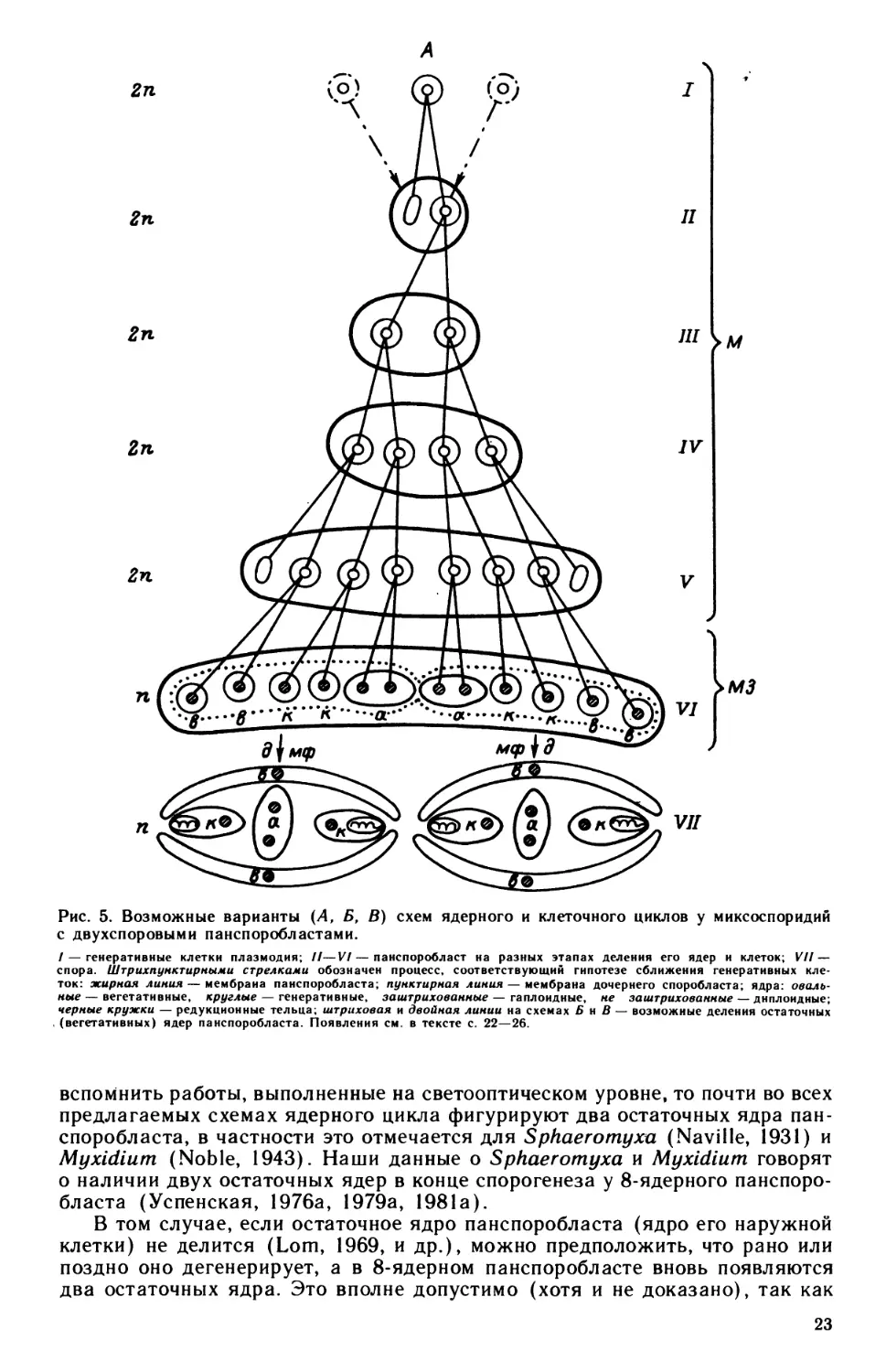
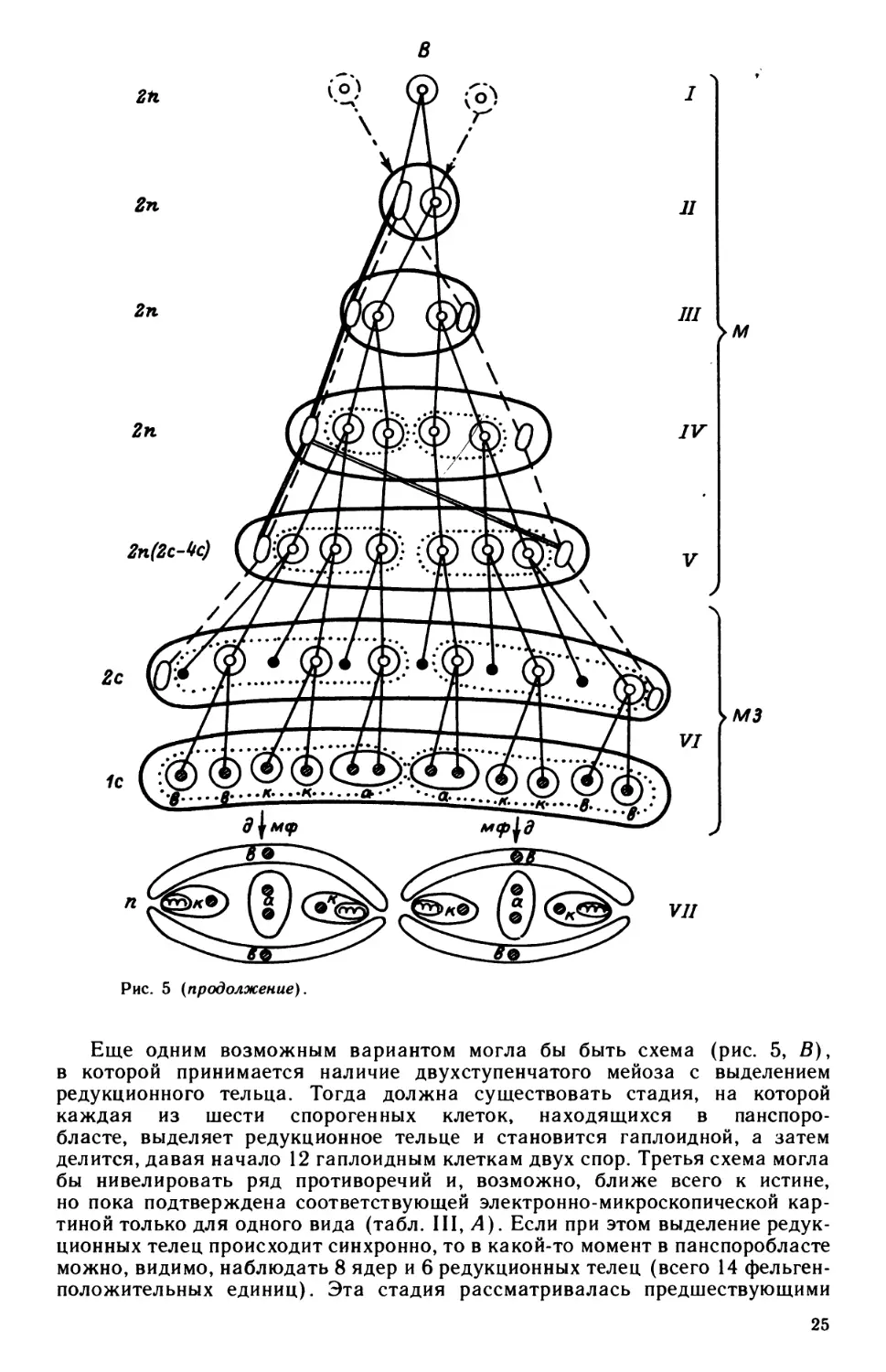
Рис. 5. Возможные варианты (А, Б, В) схем ядерного и клеточного циклов у миксоспоридий
с двухспоровыми панспоробластами.
/ — генеративные клетки плазмодия; //—V!—панспоробласт на разных этапах деления его ядер и клеток; VII—
спора. Штрихпунктирными стрелками обозначен процесс, соответствующий гипотезе сближения генеративных кле-
ток: жирная линия — мембрана панспоробласта; пунктирная линия — мембрана дочернего споробласта; ядра: оваль-
ные — вегетативные, круглые — генеративные, заштрихованные — гаплоидные, не заштрихованные — диплоидные;
черные кружки — редукционные тельца; штриховая и двойная линии на схемах Б н В — возможные деления остаточных
(вегетативных) ядер панспоробласта. Появления см. в тексте с. 22—26.
вспомнить работы, выполненные на светооптическом уровне, то почти во всех
предлагаемых схемах ядерного цикла фигурируют два остаточных ядра пан-
споробласта, в частности это отмечается для Sphaeromyxa (Naville, 1931) и
Myxidium (Noble, 1943). Наши данные о Sphaeromyxa и Myxidium говорят
о наличии двух остаточных ядер в конце спорогенеза у 8-ядерного панспоро-
бласта (Успенская, 1976а, 1979а, 1981а).
В том случае, если остаточное ядро панспоробласта (ядро его наружной
клетки) не делится (Lom, 1969, и др.), можно предположить, что рано или
поздно оно дегенерирует, а в 8-ядерном панспоробласте вновь появляются
два остаточных ядра. Это вполне допустимо (хотя и не доказано), так как
23
Б
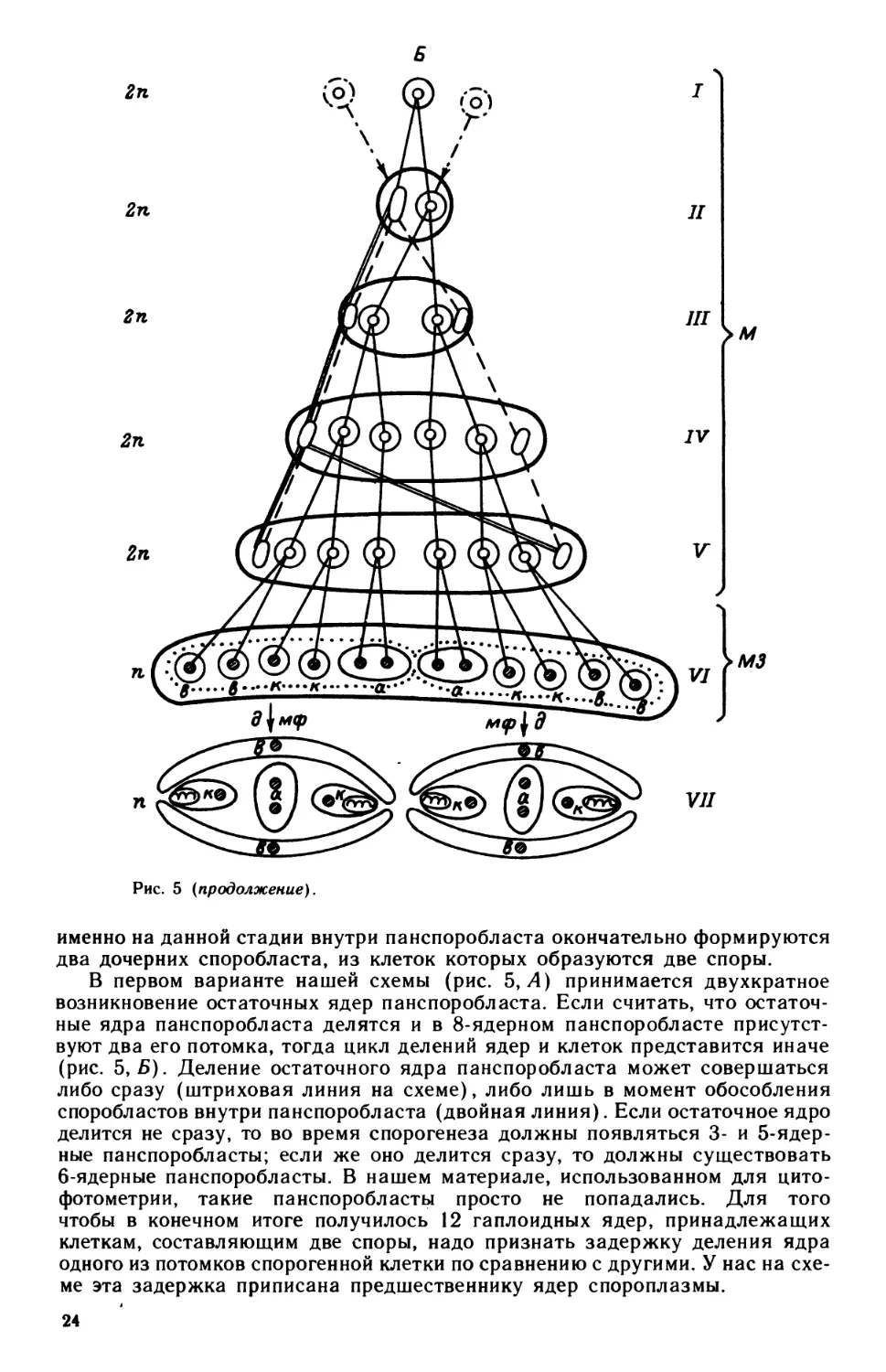
Рис. 5 (продолжение).
именно на данной стадии внутри панспоробласта окончательно формируются
два дочерних споробласта, из клеток которых образуются две споры.
В первом варианте нашей схемы (рис. 5, Л) принимается двухкратное
возникновение остаточных ядер панспоробласта. Если считать, что остаточ-
ные ядра панспоробласта делятся и в 8-ядерном панспоробласте присутст-
вуют два его потомка, тогда цикл делений ядер и клеток представится иначе
(рис. 5, Б). Деление остаточного ядра панспоробласта может совершаться
либо сразу (штриховая линия на схеме), либо лишь в момент обособления
споробластов внутри панспоробласта (двойная линия). Если остаточное ядро
делится не сразу, то во время спорогенеза должны появляться 3- и 5-ядер-
ные панспоробласты; если же оно делится сразу, то должны существовать
6-ядерные панспоробласты. В нашем материале, использованном для цито-
фотометрии, такие панспоробласты просто не попадались. Для того
чтобы в конечном итоге получилось 12 гаплоидных ядер, принадлежащих
клеткам, составляющим две споры, надо признать задержку деления ядра
одного из потомков спорогенной клетки по сравнению с другими. У нас на схе-
ме эта задержка приписана предшественнику ядер спороплазмы.
24
в
Рис. 5 (продолжение).
Еще одним возможным вариантом могла бы быть схема (рис. 5, В),
в которой принимается наличие двухступенчатого мейоза с выделением
редукционного тельца. Тогда должна существовать стадия, на которой
каждая из шести спорогенных клеток, находящихся в панспоро-
бласте, выделяет редукционное тельце и становится гаплоидной, а затем
делится, давая начало 12 гаплоидным клеткам двух спор. Третья схема могла
бы нивелировать ряд противоречий и, возможно, ближе всего к истине,
но пока подтверждена соответствующей электронно-микроскопической кар-
тиной только для одного вида (табл. III, Л). Если при этом выделение редук-
ционных телец происходит синхронно, то в какой-то момент в панспоробласте
можно, видимо, наблюдать 8 ядер и 6 редукционных телец (всего 14 фельген-
положительных единиц). Эта стадия рассматривалась предшествующими
25
авторами как 14-ядерный панспоробласт (Naville, 1931; Georgevitch, 1937).
Следует обратить внимание на то, что на схемах пунктирной линией изоб-
ражена мембрана, окружающая каждую группу из шести клеток внутри
панспоробласта (такие группы клеток дают начало одной споре) — очевидно,
это мембрана дочерних споробластов. Пока ее удалось продемонстрировать
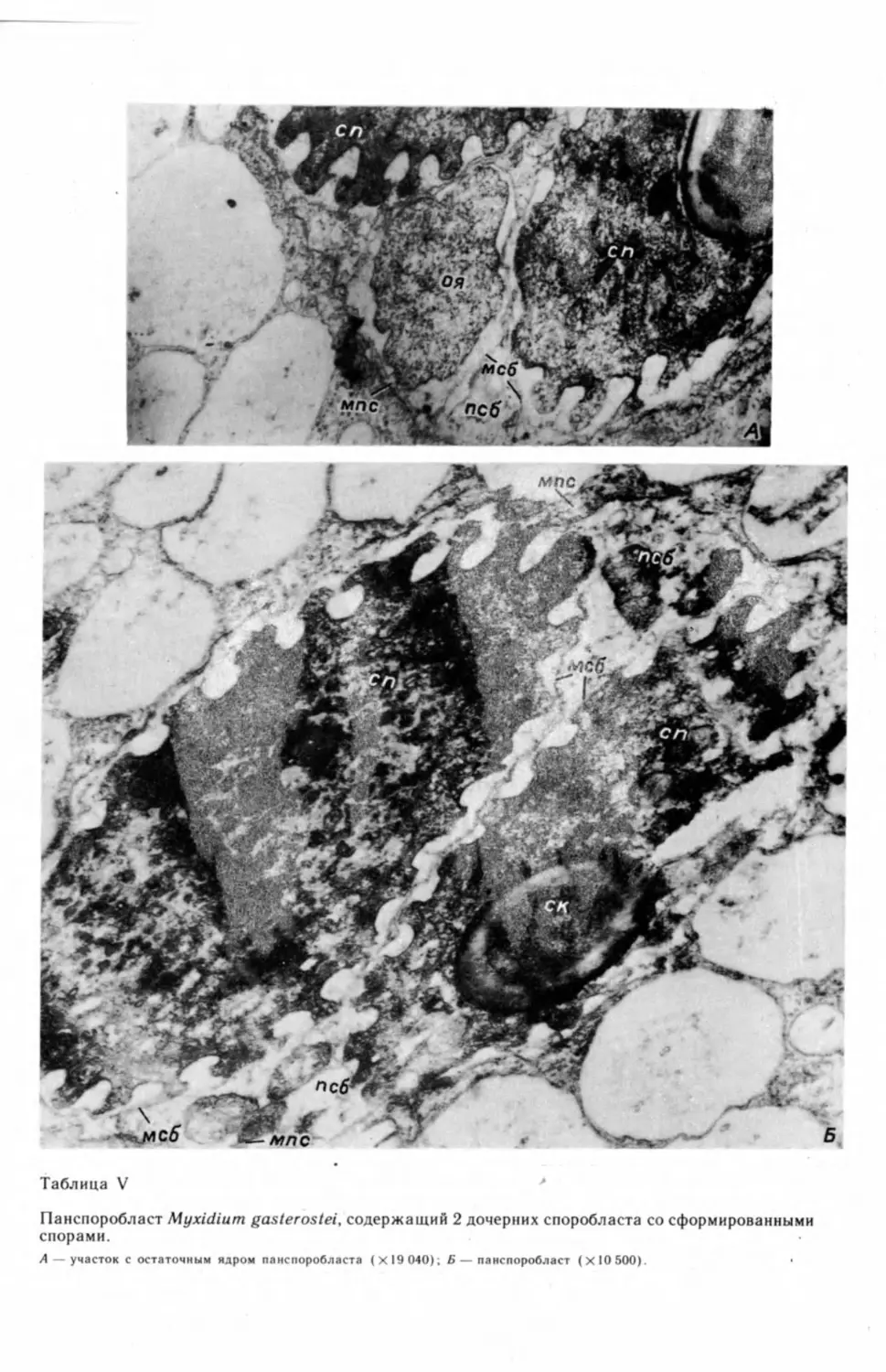
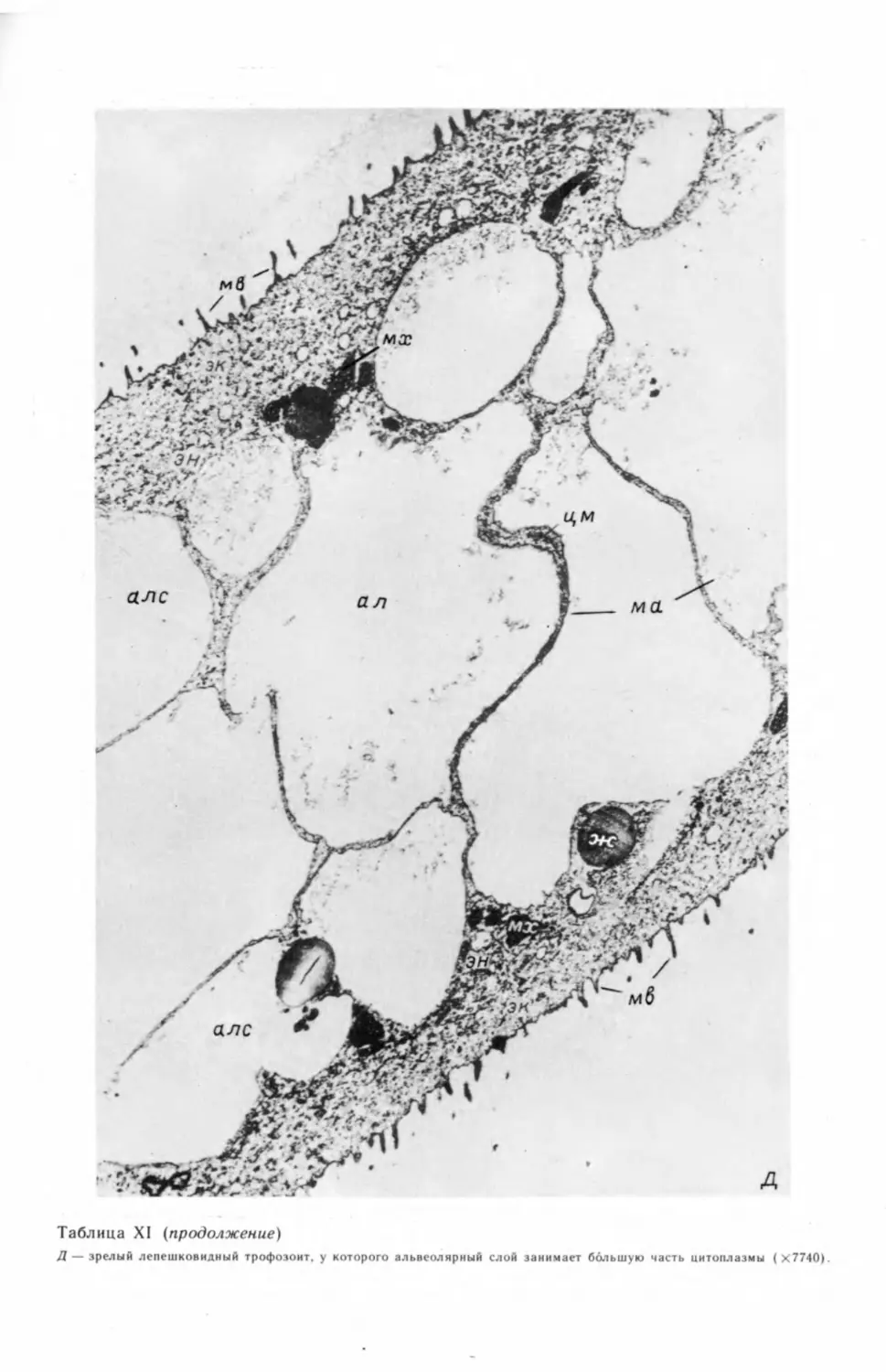
лишь на последних этапах спорогенеза (табл. V, А, Б).
Предложенные схемы приводят в соответствие данные о спорогенезе,
полученные к настоящему времени с помощью цитофотометрии и электрон-
ной микроскопии. Каждая из схем содержит моменты, которые предстоит
еще уточнить. Вторая схема близка к таковой Каррента (Current, 1979),
предложенной им для Henneguya excilis, но в его схеме нет данных о плоид-
ности ядер; кроме того, он не обсуждает судьбу остаточных ядер панспоро-
бласта и придерживается гипотезы сближения и объединения генеративных
клеток при спорогенезе. С. С. Шульман и С. А. Подлипаев (1980), хотя и при-
няли нашу трактовку ядерного и жизненного циклов миксоспоридий, но при-
водят в статье свою схему, которая, однако, не согласуется с нашими цитофо-
тометрическими данными. По нашим данным, 8-ядерные панспоробласты
диплоидны у всех изученных миксоспоридий, и ядерный цикл Sphaeromyxa
elegini по числу делений не отличается от такового представителей Myxobo-
lidae. Ранее предложенная нами схема (Успенская, 1976а) отражает судьбу
генеративного ядра панспоробласта, т. е. ядра споробласта, или спорогенной
клетки; данные по плоидности генеративных клеток плазмодия в ней еще
не сообщаются.
26
ОСОБЕННОСТИ ЖИЗНЕННОГО ЦИКЛА МИКСОСПОРИДИЙ
В СВЕТЕ ЦИТОФОТОМЕТРИЧЕСКИХ ИССЛЕДОВАНИЙ
ИХ ЯДЕРНОГО ЦИКЛА И ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКИХ
ИССЛЕДОВАНИЙ КЛЕТОЧНОГО ЦИКЛА
ЖИЗНЕННЫЙ ЦИКЛ МИКСОСПОРИДИЙ
В СВЕТЕ ДАННЫХ ЦИТОФОТОМЕТРИИ
С помощью цитофотометрических методов было установлено, что миксо-
споридии имеют сложный жизненный цикл с чередованием дипло- и гапло-
фазы (Успенская, 1976а, 1979а, 1981а, 19816; 19826, 1982в). Такой жизнен-
ный цикл в пределах простейших характерен для фораминифер и слизевиков
(которых теперь склонны относить к Protozoa), а за пределами простей-
ших широко распространен у растений со сменой диплоидного спорофита и
гаплоидного гаметофита.
Фазы ядерного цикла у миксоспоридий совпадают с фазами жизненного
цикла. По нашим данным (Успенская, 1976а, 1979а, 1981а 19816, 19826,
1982в), покоящаяся фаза жизненного цикла миксоспоридий, служащая для
расселения паразитов (фаза дисперсии), проходящая во внешней среде и
представленная спорой, является гаплофазой. Паразитическая фаза
жизненного цикла (фаза аггломерации), представленная плазмодиями,
является диплофазой, она протекает в теле хозяина. Таким образом,
миксоспоридии имеют гетерофазный жизненный цикл со сменой гапло- и
диплофазы.
ЗНАЧЕНИЕ ДИФФЕРЕНЦИРОВКИ ЯДЕР
У МИКСОСПОРИДИЙ
Как уже отмечалось, для трофозоитов миксоспоридий характерна много-
ядерность. Крупные плазмодии обладают огромным количеством ядер,
т. е. представляют собой полиэнергидные организмы (Шульман,
1966). Такие организмы находятся на надклеточном уровне организации,
промежуточном между клеточным уровнем и уровнем многоклеточного орга-
низма (Райков, 1967).
Плазмодии миксоспоридий обладают ядерной дифференцировкой,
т. е. у них есть две категории ядер — вегетативные и генеративные. Эти ядра
отличаются друг от друга по размерам и по форме, но главное их отличие
в том, что генеративные ядра находятся в особых генеративных клетках,
а вегетативные ядра плазмодия остаются в общей цитоплазме. Дифферен-
цировка ядер начинается очень рано, при первых же делениях ядра зиготы,
возникшего в результате слияния ядер спороплазмы (Noble, 1944; Успенская,
1969; Siau, 1977). Вегетативные (соматические) ядра плазмодия и ядра гене-
ративных клеток генетически имеют одно и то же происхождение: они воз-
никли из ядра зиготы. И. Б. Райков (1978) считает, что различие между
такими ядрами заключается в стабилизации активности какой-то части генов
в соматическом ядре. Предполагается, что соматическое ядро может возни-
кать из генеративного, а генеративное из соматического не может. Однако
нет окончательной ясности в том, как происходит дальнейшее умножение
числа вегетативных ядер и ядер генеративных клеток в плазмодии. Возможно,
имеет место один из следующих процессов: 1) после начальной дифферен-
цировки ядер на генеративные и вегетативные происходит дальнейшее
их деление с образованием себе подобных; 2) существует какой-то фонд
недифференцированных ядер, которые могут давать начало и тому, и дру-
27
тому сорту ядер; 3) делится лишь тотипатентное генеративное ядро и отде-
ляет от себя и вегетативное, и дочернее генеративное ядро (такое явление,
видимо, наблюдается при образовании начальной стадии спорогенеза —
панспоробласта).
Ядерный дуализм отмечен у ряда простейших (Райков, 1967). Он анало-
гичен дифференцировке на соматические и половые (генеративные) клетки
у Metazoa, но у Protozoa и генеративные, и вегетативные (соматические)
ядра находятся в общей цитоплазме.
В отличие от простейших, обладающих ядерным дуализмом, у миксоспо-
ридий вегетативные ядра находятся в общей цитоплазме плазмодия, а гене-
ративные ядра выделены в особые генеративные клетки, которые
во время спорогенеза дают начало его исходной стадии — двухклеточному,
а затем и многоклеточному панспоробласту. Таким образом, на стадии плаз-
модия миксоспоридии ближе стоят к многоклеточным организмам, чем другие
полиэнергидные простейшие (Шульман, 1966; Райков, 1967). В отличие от
Protozoa, у которых не бывает дальнейшей дифференцировки соматических
ядер, у миксоспоридий во время спорогенеза и формирования многоклеточ-
ной споры происходит дифференцировка не только ядер на соматические и
генеративные, но и клеток многоклеточной споры (как у Metazoa). На основа-
нии этих данных Райков (1978) считает, что у миксоспоридий нет ядерного
дуализма, а есть клеточная дифференцировка, аналогичная таковой Metazoa.
Правда, в отличие от многоклеточных животных, соматические клетки споры
у миксоспоридий гаплоидны, так же как у гаметофита растений (Успенская,
1981а, 19816, 19826, 1982в).
Цитофотометрические данные говорят о том, что вегетативные ядра круп-
ных плазмодиев полиплоидны (до 8п, в среднем 4п). Таким образом, интен-
сификация функций здесь может достигаться и увеличением количества ядер,
и их полиплоидизацией (Успенская, 1976а, 19796, 19816, 19826, 1982в). Воз-
можно, что обслуживание крупных плазмодиев делает необходимой такую
интенсификацию. Однако в итоге вегетативные ядра дегенерируют вместе
с телом плазмодия после завершения спорогенеза, поэтому не исключено,
что полиплоидизация здесь дегенеративная, связанная с нарушением деления
дегенерирующего ядра. С другой стороны, есть доказательства функциони-
рования вегетативных ядер во время спорогенеза, например связь их обо-
лочки с рулонами шероховатой эндоплазматической сети (Успенская,
1969).
СПОСОБЫ РАЗМНОЖЕНИЯ У МИКСОСПОРИДИЙ
В течение жизненного цикла миксоспоридий наблюдаются и размножение
вегетативных особей, и спорогенез, и половой процесс.
Половой процесс у них совершается внутри споры или после
выхода спороплазмы из споры. Протекает он по типу автогамии (в том
случае, когда в споре содержится одна 2-ядерная спороплазма) или по типу
педогамии (если в споре содержатся две 1-ядерных спороплазмы), что
наблюдается реже. Возникшая в результате полового процесса амебоидная
1-ядерная зигота мигрирует к месту паразитирования данного вида в орга-
низме рыбы. Там она разрастается в плазмодий: совершается цитоплазмати-
ческий рост, и диплоидное ядро зиготы многократно делится, отчего плазмо-
дий становится многоядерным (нуклеогония). При этом происходит диффе-
ренцировка ядер на вегетативные и генеративные. Последние же выделяются
в особые генеративные клетки внутри плазмодия. Явление это называют цел-
люляцией (Догель, 1951), или целлюляризацией (Шульман, 1966). Ядра
генеративных клеток, как мы видели, диплоидны. Одновременно с нуклеого-
нией и цитоплазматическим ростом происходит и размножение трофозои-
тов — увеличение их числа.
Размножение миксоспоридий протекает как бы в два этапа: во-первых,
происходит увеличение массы и числа вегетативных особей путем нуклеого-
28
нии и цитоплазматического роста, а затем плазмотомии и почкования (разли-
чаются наружное и внутреннее почкование); во-вторых, внутри плазмодия
совершается спорогенез, предпосылкой к которому является выделение гене-
ративных клеток, и в результате возникает большое количество спор
(несколько сотен тысяч), содержащих спороплазму. Каждая спора, попав
в новую особь хозяина, после полового процесса дает начало новым вегета-
тивным особям.
При почковании и плазмотомии от плазмодия отделяются многоядерные
и многоклеточные (в том случае, если в отделившийся кусок попало несколько
генеративных ядер) участки, которые превращаются в самостоятельные
особи. В. А. Догель (1947, 1962) считает, что почкование миксоспоридий
надо скорее относить к плазмотомии, при которой от плазмодия отделяются
более мелкие участки, чем к настоящему почкованию. Ранее Нобль (Noble,
1944) подчеркивал, что у миксоспоридий нет настоящей шизогонии, а имеют
место почкование и плазмотомия.
Спорогенез у миксоспоридий — это сложный процесс, во время
которого происходит дифференцировка не только ядер, но и клеток. Во время
спорообразования делятся лишь генеративные клетки, вегетативные же ядра
плазмодия выполняют соматические функции, поддерживая физиологиче-
скую активность плазмодия (Grasse, 1960; Lom, Puytorac, 1965а; Шульман,
1966; Успенская, 1969, и др.).
Согласно электронно-микроскопическим данным, начало спорогенеза
знаменуется появлением панспоробласта. В отношении возникновения
последнего существуют разные точки зрения, обсуждавшиеся ранее. Как
бы то ни было, в начале спорогенеза образуется двухклеточный панспоро-
бласт, у которого наружная клетка содержит вегетативное ядро и представ-
ляет собой соматическую клетку, а внутренняя спорогенная клетка несет гене-
ративное ядро и является родоначальницей всех клеток споры. Спорогенная
клетка делится митотически несколько раз, а затем наступает мейоз, в резуль-
тате которого в панспоробласте возникают гаплоидные клетки, образующие
спору. Затем совершается дифференцировка этих клеток на вальвогенные
(которые превращаются в створки споры), капсулогенные клетки (внутри
которых формируется стрекательный аппарат) и спороплазму, несущую гаме-
тические ядра. Далее происходит морфогенез (формирование створок разной
формы и развитие сложного стрекательного аппарата) и протекают процессы,
ведущие к созреванию спор.
Споры выводятся во внешнюю среду и после периода дозревания, харак-
терного для ряда видов, достигают инвазионности. Попав в нового хозяина,
они его заражают. Перед выходов амебоидного зародыша из споры или сразу
после него совершается половой процесс — слияние ядер спороплазмы.
При рассмотрении способов размножения у миксоспоридий возникают
аналогии с таковыми у других организмов (например, у растений), тоже
имеющих гетерофазный жизненный цикл.
Размножение трофозоитов миксоспоридий (почкование, плазмотомия)
является вегетативным размножением и, так же как у растений,
не связано с образованием спор и половым процессом. Спорогенез и у миксо-
споридий, и у растений состоит в образовании спор, которое сопровождается
редукционным делением и уменьшением числа хромосом в 2 раза.
К. Мейер (1937) называет спорогенез растений бесполым размножением,
отличая его от вегетативного и считая, что спора образуется бесполым путем,
но является «отдаленным последствием» полового процесса, так как удвоение
числа хромосом происходит в результате полового процесса. Во время споро-
генеза имеет место редукционное деление с уменьшением числа хромосом
в 2 раза, поэтому половое размножение тесно связано со сменой поколений и
бесполым размножением. Мейер различает три способа размножения у расте-
ний: вегетативное, бесполое и половое.
Эти взгляды совпадают со взглядами М. Гартмана (1936). Он впервые
подчеркнул отличие вегетативного размножения (размножение многоклеточ-
29
ными или многоядерными участками) от бесполого, которое, по мнению
Гартмана, заключается в размножении клетки (цитогонии), что как раз и
характерно для спорогенеза.
У миксоспоридий, так же как и у растений, спорогенез представляет собой
особый способ размножения, принципиально отличающийся от вегетативного
размножения (плазмотомии): он заключается в выделении и размножении
особых генеративных клеток (целлюляция и цитогония) и приводит (через
редукционное деление) к образованию гаплоидных спор. Мейоз и оплодотво-
рение — это процессы, которые лежат в основе полового размножения и явля-
ются вехами, разделяющими ядерный цикл на две фазы (Вилли, Детье, 1974).
В гаплофазе миксоспоридий (от мейоза до слияния гаметических ядер) про-
исходят развитие клеток, образующих спору, и формирование многоклеточ-
ной споры. В диплофазе (от момента слияния гаметических ядер до мейоза)
происходит развитие трофозоитов.
Таким образом, у миксоспоридий, так же как у растений, мы различаем
три способа размножения: вегетативное (плазмотомия), бесполое
(спорогенез) и половое (образование и слияние гаметических ядер).
ТИПЫ ДЕЛЕНИЯ ЯДЕР И СООТНОШЕНИЕ МИТОЗА,
МЕЙОЗА И ПРОЦЕССА ОПЛОДОТВОРЕНИЯ
В ЯДЕРНОМ ЦИКЛЕ МИКСОСПОРИДИЙ
Митоз у миксоспоридий изучен лишь на светооптическом уровне и в обзор-
ных работах последних лет характеризуется как внутриядерный (Lom, Puyto-
rac, 1965b; Шульман, 1972; Lom, 1977); по мнению ряда авторов он ацентри-
ческий (Lom, Puytorac, 1965b; Шульман, 1972), однако это еще не доказано
(Grasse, Lavette, 1978). Многие авторы первой половины века описывали
образование центриолей при делении ядер миксоспоридий (Keysselitz, 1908а;
Аверинцев, 1909; Georgevitsch, 1935, и др.; см. также: Шульман, 1966; Grasse,
Lavette, 1978). Сведений по электронной микроскопии митоза очень мало
(Lom, Puytorac, 1965b; Grasse, Lavette, 1978; Успенская, 1981a, 1982b).
По данным цитофотометрии, митотически делятся генеративные ядра плазмо-
дия, генеративные ядра панспоробласта (ядра спорогенной клетки) и произ-
водные последних. Лишь перед появлением образующих спору клеток
совершается мейоз, в результате которого возникает целиком гаплоидная
спора (Успенская, 1976а, 1978а, 19796, 1981а, 19816, 1982в). Это и не зиготи-
ческая, и не гаметическая редукция — она занимает промежуточное положе-
ние. Такое положение мейоза характерно для гетерофазных жизненных цик-
лов с чередованием дипло- и гаплофазы (Райков, 1978).
Относительно типа мейоза пока еще нет окончательной ясности — одно-
ступенчатый он или двухступенчатый (Успенская, 1982в).
30
УЛЬТРАТОНКОЕ СТРОЕНИЕ
СТАДИЙ РАЗВИТИЯ МИКСОСПОРИДИЙ
СТРОЕНИЕ ТРОФОЗОИТОВ
Форма и размеры
Паразитические трофозоиты миксоспоридий имеют вид плазмодиев. Раз-
меры плазмодиев варьируют от 15—20 мкм (Myxosoma cerebralis, Chloro-
my хит, Sphaerospora, Ceratomyxa и др.) до 10—20 мм (Sphaeromyxa,
некоторые Myxidium, Myxobolus, Kudoa) и более. Их форма очень разно-
образна, она зависит от локализации паразита в теле рыбы (Шульман,
1966; Mitchell, 1977).
Наиболее разнообразна форма полостных миксоспоридий. Они могут
иметь вид мелких амебоидов (округлые, овальные, треугольные, удлиненные,
ветвящиеся) или очень крупных округло-овальных лепешек. Мелкие формы
образуют разнообразные цитоплазматические выросты в виде тупозакруглен-
ных, нитевидных, лучевидных, ветвящихся псевдоподий, которые могут ана-
стомозировать между собой.
Миксоспоридии, обитающие в полостях, часто обладают подвижностью,
поэтому форма псевдоподий трофозоитов у представителей одного и того же
вида может быть разной. В большинстве случаев псевдоподии могут возни-
кать в любом месте плазмодия, и тело их не имеет ориентации. Реже
наблюдается определенная ориентация трофозоитов. Так, у некоторых пред-
ставителей Ceratomyxa и Leptotheca псевдоподии образуются только на рас-
ширенном конце булавовидных плазмодиев, а противоположный конец лишен
их. У Ceratomyxa ramosa многочисленные ветвящиеся псевдоподии отходят
от определенного конца (Шульман, 1966). У Myxidium lieberkilhni среди
трофозоитов различаются плавающие и прикрепленные. У прикрепленных
особей наблюдается дифференцировка на тело, обращенное в полость моче-
вого пузыря, и «ножку» — плазматический вырост, с помощью которого
трофозоиты внедряются в межклеточное вещество эпителия. Ножка может
возникнуть и на широкой поверхности удлиненного плазмодия, и на суженном
его конце. Она лишена микроворсинок и отличается от остальной части
биохимически и функционально (Успенская, 1966). У Ceratomyxa coris
(Stempell, 1919; цит. по: Шульман, 1966) одна сторона широкой подошвой
прикрепляется к стенке желчного пузыря, а от другой отходят длинные
ветвящиеся выросты, направленные в полость пузыря. Они, видимо,
служат для всасывания питательных веществ из желчи.
Миксоспоридии, обитающие в тканях, также имеют разную форму и
размеры. Это могут быть очень мелкие подвижные амебовидные плазмодии
с псевдоподиями разной формы, например Myxosoma cerebralis из хрящей
лососевых рыб (Hofer, 1903; Plehn, 1924; Schaperclaus, 1954; Успенская,
1955а, 19556, 1957, и др.), либо крупные амебоиды с тупыми лобоподиями,
например Myxobolus гапае из кожи лягушки (Guyenot, Naville, 1922; Шуль-
ман, 1966). Чаще же они представляют собой крупные шаровидные, овальные
или веретеновидные, обычно молочно-белые или желтоватые, резко
выделяющиеся на фоне тканей хозяина, похожие на цисту плазмодии.
Однако, как мы увидим дальше, это не цисты. Похожи на цисту и некоторые
внутриклеточные миксоспоридии, такие как Henneguya oviperda, заполняю-
щие икринки щуки, или веретеновидные плазмодии Kudoa quadratum из мы-
шечных волокон.
Следует отметить, что форма тела часто зависит от возраста трофозоита.
В начале развития из спороплазмы все трофозоиты имеют вид амебы, а затем,
31’
по мере роста и развития, форма у многих видов изменяется. Так, у Myxidium
gasterostei самый молодой из найденных трофозоитов (8-ядерный) имеет вид
амебы, затем он вытягивается: сначала в виде запятой, позднее принимая
червеобразную форму, потом становится листовидным, а самые старые плаз-
модии имеют вид довольно толстой, округлой лепешки (Noble, 1944; Успен-
ская, J969). Молодые Myxidium lieberkiihni имеют округло-овальную форму,
а затем они вытягиваются в длину и в результате почкования принимают дре-
вовидную форму. Кроме того, есть данные, что форма плазмодиев одного
вида зависит от сезона года (Booker, Current, 1981). То, что форма
плазмодиев зависит от места их обитания, доказывается на примере
тех видов, которые встречаются в разных органах и тканях.
Так, Myxidium lieberkiihni, паразитируя в мочевом пузыре щуки, имеет удли-
ненные плазмодии, а в мальпигиевых клубочках они принимают вид «цисты»
(Kudo, 1921b; Шульман, 1966).
Наружная мембрана
и ультратонкое строение трофозоитов
Электронно-микроскопические исследования плазмодиев миксоспоридий
с различной локализацией в организме хозяина выявили значительное раз-
нообразие в ультратонком строении их поверхности. Многие авторы указы-
вают на разницу в строении поверхности плазмодиев полостных и тканевых
миксоспоридий, считая, что для первых характерно наличие микроворсинок,
а для вторых — усиленной пиноцитозной активности поверхностной мем-
браны (Lom, 1973, 1977; Mitchell, 1977; Current, 1979; Current et al., 1979).
Поверхность полостных миксоспоридий. У большинства миксоспоридий,
обитающих в полостях, плазмодии ограничены одной плазматической мем-
браной, для которой указывается толщина приблизительно от 6 до 10 нм,
например: Myxidium lieberkiihni (Lom, Puytorac, 1965a; Успенская, 1966),
M. gasterostei (Успенская, 1969), Chloromyxum cristatum (Lom, Puytorac,
1965a, 1965b), Ch, truttae (наши данные), Sphaeromyxa sabrazesi (Grasse,
1960; Grasse, Lavette, 1978), S. magna, Sphaeromyxa sp. (Lom, 1969), S. fte/-
landi, S, cottidarum, S. elegini (Успенская, 1972a, 1981г, 1982в). Лишь
у Zchokkella nova Лом и Пюторак (Lom, Puytorac, 1965a) отмечают двойную
поверхностную мембрану.
Поверхность большинства трофозоитов имеет более или менее много-
численные микроворсинки. У Chloromyxum cristatum (Lom, Puytorac, 1965a)
и у Myxidium lieberkiihni (Успенская, 1966) они довольно редкие (табл. VI,
Л). У крупных плазмодиев Sphaeromyxa hellandy, и особенно у Myxidium
gasterostei, ворсинки частые и длинные (табл. VI, Б), они образуют густую
щеточную кайму (Успенская, 1969, 1981г). У S. sabrazesi, S, magna, S, elegini
и S. cottidarum микроворсинки ветвятся и анастомозируют между собой
(табл. VI, В) в виде сети (Grasse, 1960; Lom, 1969; Успенская, 1969, 19726,
1981г, 1982в). У основания микроворсинок возникают пиноцитозные
пузырьки (Lom, Puytorac, 1965а; Успенская, 1969, и др.). Снаружи мембраны
микроворсинок имеются примембранный слой в виде тонких фибрилл и слйзи-
стыйслой (Lom, Puytorac, 1965а; Успенская, 1966, 1969, 19726, 1981г), подоб-
ный гликокаликсу, дающий положительную реакцию на мукополисахариды
с альциановым синим (Успенская, 19796, 1981г, 1982в).
Поверхность тканевых миксоспоридий. Крупные трофозоиты тканевых
и внутриклеточных миксоспоридий имеют либо более или менее гладкую
поверхность, либо складчатую, с глубокими выпячиваниями. Микроворсинки
у нах обычно не развиты, однако у молодых особей этих же видов
они имеются.
Ультратонкое строение тканевых плазмодиев оказалось достаточно разно-
образным. У внутриклеточного паразита Kudoa quadratum из мышечного
волокна бычка Myoxocephalus scorpius плазмодий имеет одну плазматиче-
скую мембрану, образующую тупые и короткие микроворсинки (табл. VII, Л),
32 '
Рис. 6. Схема строения надмембранного
слоя у Myxobolus disparoides.
количество которых уменьшается
с возрастом (Успенская, 1981в,
1981г, 1982а). У Henneguya ovi-
perda, паразита яйцеклетки щуки,
молодые плазмодии также имеют
короткие цитоплазматические вы-
росты (Шульман, 1966). У зрелых
плазмодиев микроворсинок нет, а
плазматическая мембрана (тол-
щина примерно 7.5 нм) образует
большое количество глубоких пи-
ноцитозных каналов, перпендику-
лярных поверхности (табл. VIII,
А) и создающих под световым
микроскопом впечатление исчер-
ченности. От дистальных концов
каналов отделяются пиноцитозные
вакуоли (Успенская, 1981г, 1982в). //. pinnae, паразитирующая под эпите-
лием плавников, имеет одну мембрану, обладающую пиноцитозной актив-
ностью (Schubert, 1968). У Н. adiposa из соединительной ткани плавников
плазматическая мембрана покрыта снаружи тонкогранулированным слоем
(Current, 1979). Паразитирующая в жаберных кровеносных сосудах Н. pso-
rospermica имеет одну элементарную мембрану, от которой в глубь цито-
плазмы отделяются пиноцитозные пузырьки (Lom, Puytorac, 1965а).
У большинства миксоспоридий, обитающих в жаберной ткани, отмечается
наличие поверх плазматической мембраны добавочных надмембранных
слоев. Myxosoma funduli, паразитирующая вблизи синусов и капилляров
жаберного лепестка, имеет поверхностную мембрану, покрытую тонкограну-
лярным слоем (Current et al., 1979). То же самое можно сказать о Henneguya
lobosa (табл. VIII, В). По нашим данным, на поверхности плазмодия Myxobo-
lus disparoides (паразит жаберных тканей маринки) поверх плазматической
мембраны находится сложно устроенный надмембранный слой. Он обла-
дает низкой электронной плотностью, имеет одинаковую толщину на всем
протяжении (приблизительно 0.08 мкм) и в точности повторяет все изгибы
поверхности плазмодия. В этом слое равномерно располагаются более элек-
тронно-плотные образования, которые на поперечных срезах имеют вид пира-
мидок, слагающихся из трех слоев электронно-плотного вещества, переме-
жающихся с электронно-прозрачными слоями равной толщины. На попереч-
ном срезе этот рисунок равномерно повторяется вдоль всей поверхности
плазмодия (табл. IX, А, Б).
На тангенциальном срезе эти образования имеют вид усеченных конусов,
бугорков или бляшек, утопленных в электронно-прозрачном веществе. Каж-
дый конус составлен из трех электронно-плотных пластинок разной величины
округло-овальной формы, располагающихся на равном расстоянии друг
от друга, так что пластинка большего диаметра находится у мембраны плаз-
модия. Как уже говорилось, пластинки эти утоплены в электронно-прозрач-
ном веществе равномерно по всему его слою (табл. IX, А, Б). Схематически
строение этого слоя изображено на рис. 6. Должно быть, чередование участ-
ков, укрепленных такими пластинками, и электронно-прозрачных, лишенных
укрепления, делает эту оболочку эластичной, способной изгибаться именно
благодаря пирамидообразному строению плотных участков.
Интересно, что у разных форм одного и того же вида, обитающих в разных
участках жабр, строение поверхности различно. Так, у непатогенной формы
Henneguya excilis, располагающейся между жаберными лепестками, описы-
вают одну элементарную мембрану, покрытую гранулярным слоем; у патоген-
3 А. В. Успенская
33
ной формы этого же вида, обитающей внутри жаберных лепестков, имеются
две элементарные мембраны, внутренняя из которых образует пиноцитозные
каналы, а наружная покрыта еще гранулярным слоем (Current, Janovy,
1978). У Myxobolus sp. Дезер и Патерсон (Desser, Paterson, 1978) описывают
две мембраны (они их называют мембраноподобными слоями), между кото-
рыми имеется пространство, равное 3 нм. По их описанию, наружная мем-
брана покрыта плотным ворсистым материалом, а внутренняя образует длин-
ные пиноцитозные каналы.
Ультратонкое строение «цист» миксоспоридий
За вегетативными стадиями многих тканевых и внутриклеточных миксо-
споридий прочно закрепилось название «циста». Так они до сих пор обозна-
чаются в определителях и при описании этих видов. Однако уже в исследова-
ниях под световым микроскопом было установлено, что многие из них
не являются цистами в строгом смысле этого термина и, во всяком случае,
не имеют ничего общего с цистами покоя и..-d размножения простейших
(Шульман, 1966; Гинецинская, Добровольский, 1978).
Часто это крупные шаровидные или овальные плазмодии, которые
не выделяют никаких оболочек. Благодаря белому или желтоватому цвету
они резко выделяются на фоне органов или тканей хозяина, отчего возникает
сходство с цистой (Шульман, 1966). Впечатление дополнительных оболочек
может создаваться от плотно прилегающих к плазмодию стенок сосудов или
желчных протоков (Davis, 1923; Шульман, 1966). В ряде случаев элементы
тканей хозяина (мышечные волокна, коллагеновые волокна, соединительная
ткань, эпителиальные клетки) образуют вокруг паразита более или менее
толстые оболочки (Шульман, 1966). Иногда возникает сложная капсула
из соединительной ткани хозяина или пролиферирующих эпителиальных кле-
ток, пронизанная сосудами. В этих случаях вегетативные стадии действи-
тельно принимают облик цист (Schroder, 1906; Nemeczek, 1911; Kudo, 1916;
Plehn, 1925; Заварзин, 1938; Schubert, 1968).
Таким образом, в результате исследований под световым микроскопом
создалось впечатление, что паразит не выделяет дополнительно оболочек
и имеет одну мембрану, а все дополнительные оболочки — это производное
тканей хозяина (Шульман, 1966).
В работах, проведенных на электронно-микроскопическом уровне (Lom,
Puytorac, 1965а, 1965b; Schubert, 1968; Current, Janovy, 1976, 1978; Desser,
Paterson, 1978; Current, 1979; Current et al., 1979), указывается на наличие
различных надмембранных слоев и в некоторых случаях двух мембран.
Мы специально провели исследование под электронным микроскопом трех
видов миксоспоридий из разных мест обитания, вегетативные стадии которых
обозначаются как «цисты» (Успенская, 1981в, 1982а, 19826).
Kudoa quadratum. Вегетативные стадии /С quadratum паразитируют
в мышечных волокнах бычка Myoxocephalus scorpius, таким образом
их можно приравнять к внутриклеточным паразитам. Вегетативные стадии,
называемые цистами, на самом деле представляют собой довольно круп-
ные (в нашем материале до 0.3X2 мм) веретеновидные плазмодии, поверх-
ность которых ограничена одной элементарной мембраной, образующей тупо-
конечные ц короткие микроворсинки, особенно выраженные у молодых
особей (табл. VII, Л). По мере роста плазмодий заполняет мышечную клетку,
и его поверхность близко прилегает к мембране мышечного волокна, что соз-
дает впечатление наличия дополнительной оболочки у плазмодия. Однако
под электронным микроскопом обычно между двумя этими оболочками можно
видеть остатки не полностью лизированных под влиянием ферментов пара-
зита протофибрилл мышечного волокна и митохондрий последнего
(табл. VII, Б).
Внутрь от наружной мембраны плазмодия последовательно распола-
гаются характерные для миксоспоридий зоны цитоплазмы, описание которых
34
приводится ниже (см. с. 36). Генеративные клетки и клетки споробластов
у Kudoa quadratum имеют гораздо более плотную цитоплазму, чем окружаю-
щая их цитоплазма плазмодия (табл. I, В), благодаря чему под световым
микроскопом они резко выделяются на фоне последней. Должно быть поэтому
они принимались за мелких плазмодиев, находящихся внутри цисты (Кова-
лева, Шульман, 1978; Шульман, 1978) или капсулы. В каждом мышечном
волокне может быть только один плазмодий, и он всегда находится внутри
оболочки волокна. Видимо, весь цикл трофозоита К. quadratum вплоть до
завершения спорообразования протекает внутри одного мышечного волокна
хозяина. Лишь после дезинтеграции самого плазмодия, набитого зрелыми
спорами, разрушается оболочка мышечного волокна, миофибриллы которого
были лизированы паразитом, и по существу от волокна остается лишь одна
мембрана, прилегающая к паразиту. После этого зрелые споры можно наблю-
дать и в межклеточном пространстве.
Henneguya oviperda. Представители этого вида паразитируют внутри
икринки щуки и, так же как Kudoa quadratum, являются внутриклеточными
паразитами. У вегетативных стадий Henneguya oviperda, представляющих
собой округлых плазмодиев, имеется только одна плазматическая мембрана,
внутрь от которой отмечаются те же слои цитоплазмы, что и у всех плазмо-
диев миксоспоридий (табл. VIII, Л).
Цитоплазма ооцита в зараженной икринке отсутствует: остаются лишь
глыбки желтка, которые располагаются снаружи поверхностной мембраны
плазмодия. Далее следуют оболочки икринки: zona pel 1 ucida, фолликулярный
эпителий, базальная мембрана, клетки тэки и другие оболочки, характерные
для икринки щуки (табл. VIII, Л).
Паразит использует ресурсы, предназначенные для питания ооцита.
Мембрана плазмодия обладает способностью к пиноцитозной активности, и,
следовательно, происходит усиленное питание плазмодия (табл. VIII, Л).
Myxobolus disparoides. У М. disparoides надмембранный слой имеет
сложное строение (см. с. 33). Может быть, его можно сравнивать
с гликокаликсом некоторых амеб, а бугорки — с гликостилями, хотя устроены
они по-разному. Слой этот интенсивно красится альциановым синим.
Таким образом, электронно-микроскопические исследования выявили
у плазмодиев всех миксоспоридий наличие мембраны, обладающей пино-
цитозной активностью и находящейся в контакте с цитоплазмой плазмодия.
Это плазматическая мембрана толщиной 7.5 нм. Для большинства видов
характерно наличие надмембранных комплексов различного строения.
Существует большое разнообразие в строении поверхности миксоспори-
дий. Оно не сводится только к различиям между полостными и тканевыми
паразитами, но указывает и на значительную вариабельность в пределах этих
двух групп, связанную с приспособлением к конкретным условиям их место-
обитания (ткани или органы рыб). Дальнейшие электронно-микроскопиче-
ские исследования несомненно приведут к открытию все большего и большего
разнообразия, которое может иметь значение и для систематики.
Как мы видели, плазмодии не образуют цист, внутри которых происходило
бы вегетативное размножение трофозоитов, или цист покоя. Их надмембран-
ные комплексы представляют собой единую систему с плазматической мемб-
раной и являются, видимо, приспособлением к условиям существования
(например, Myxobolus disparoides). Различного рода капсулы, которые
в ряде случаев развиваются вокруг плазмодия, представляют собой производ-
ное самого хозяина.
В связи с этим целесообразно отказаться от использования термина
«цист а» по отношению к миксоспоридиям, несмотря на его широкое приме-
нение: этот термин вносит путаницу в представления о вегетативных стадиях
миксоспоридий. Внутри цисты, по аналогии с другими простейшими, обычно
ожидают увидеть либо покоящуюся стадию, что не согласуется с активно
питающимися трофозоитами, либо (как в цисте размножения других простей-
ших) скопление особей, отчего часто панспоробласты или генеративные
з*
35
клетки ошибочно описываются как плазмодии, заполняющие цисту. Вегета-
тивную стадию миксоспоридий следует называть трофозоит или п л аз-
мод и й, а образования, возникающие вокруг плазмодиев в результате жиз-
недеятельности хозяина, надо называть капсулой.
Строение разнообразных капсул, образуемых хозяином в ответ на вред-
ные воздействия выделяемых паразитом веществ, достаточно хорошо изучено
под световым микроскопом и подробно разобрано в монографии С. С. Шуль-
мана (1966). Капсулы эти образуются из соединительной ткани, мускульных
фибрилл, пролиферирующих эпителиальных клеток. В этом случае вегетатив-
ные формы действительно принимают облик цисты. Под электронным микро-
скопом эти образования изучены еще недостаточно. Их ультратонкое строе-
ние будет рассматриваться ниже (с. 75).
Цитоплазма плазмодиев
Под световым микроскопом цитоплазма плазмодиев кажется разделенной
на два слоя: эктоплазму и эндоплазму. Некоторые авторы пред-
полагали еще наличие мезоплазмы, описывая более темный слой между двумя
названными слоями (см. обзор: Шульман, 1966).
Электронно-микроскопические исследования позволили уточнить строение
цитоплазмы, распределение в ней различных слоев и органоидов. Лучше всего
это продемонстрировать на примере крупных плазмодиев, таких как виды
родов Henneguya (Lom, Puytorac, 1965а, 1965b, Schubert, 1968; Current,
Janovy, 1977, 1978; Current, 1979; Успенская, 1981г, 1982a, 19826) и
Sphaeromyxa (Lom, 1969; Успенская, 19726; Grasse, Lavette, 1978), Myxobo-
lus sp. (Desser, Paterson, 1978), M. disparoides, Kudoa quadratum (Успен-
ская, 1981b, 1981г, 1982a, 19826) и Myxidium gasterostei (Успенская, 1969).
Под наружной мембраной плазмодиев перечисленных видов находится
слой тонкогранулированной, более или менее гомогенной цитоплазмы.
Он пронизан пиноцитозными каналами или богат пиноцитозными вакуолями
(табл. VI, Б; VIII, А, Б\ IX, Л). В нем можно видеть элементы гладкой эндо-
плазматической сети, свободные рибосомы, пучки микротрубочек, лежащих
ближе к поверхности, и сеть тонких микрофиламентов. Этот слой под свето-
вым микроскопом обозначался как эктоплазма.
Далее вглубь располагается эндоплазма — слой, богатый мито-
хондриями и жировыми включениями в виде чернящихся осмием шаровидных
тел (табл. X, Г\ XI, Б, В, Д) .В нем находятся многочисленные вакуоли разной
величины с различными включениями, природа которых не всегда ясна. Еще
дальше вглубь располагается слой, содержащий вегетативные ядра плазмо-
диев, генеративные клетки и стадии спорогенеза (табл. VIII, А, Б; XI, В, Г, Д).
В этой зоне сильно развита шероховатая эндоплазматическая сеть. Более зре-
лые споры обычно расположены еще глубже. Эта зона цитоплазмы, видимо
благодаря насыщенности разными органоидами и включениями, под свето-
вым микроскопом выглядит более плотной; она и обозначалась как мезо-
плазма, однако ряд исследователей относил ее к эндоплазме (см. Шульман,
1966).
Внутренняя часть крупных плазмодиев обычно представлена альвеоляр-
ным слоем (табл. XI, В, Д). Он слагается из больших альвеол, заполненных
жидким содержимым, которое при фиксации выглядит хлопьевидным (Lom,
1969; Успенская, 1969) либо содержащим какие-то пластинчатые или фиб-
риллярные структуры (Grasse, Lavette, 1978). Часть этого содержимого дает
положительную реакцию PAS, а часть красится на кислые жиры Нильским
голубым (Успенская, 1969). Альвеолы отделены друг от друга цитоплазмати-
ческими мостиками или островками цитоплазмы, в которых могут распола-
гаться вегетативные ядра, зрелые споры, генеративные клетки (табл. XI, В).
Альвеолы представляют собой сильно раздувшиеся цистерны эндоплазмати-
ческой сети. Иногда между ними не остается цитоплазмы, и две мембраны
соседних цистерн почти примыкают друг к другу (табл. XI, Д).
36
В плазмодиях, имеющих разные размеры и возраст, соотношение этих
слоев различно. У мелких амебовидных трофозоитов их трудно разграничить;
у тканевых цистообразных плазмодиев внутренний альвеолярный слой развит
не сильно; наоборот, у крупных полостных плазмодиев, таких как Myxidium
gasterostei, альвеолярный слой занимает более половины всего объема
(табл. XI, Д), так что остальные слои на поперечных срезах имеют вид срав-
нительно узкой каймы. У молодых червеобразных плазмодиев этого же вида
средняя часть занята генеративными клетками и вегетативными ядрами,
а альвеолы отсутствуют — в цитоплазме видны лишь относительно мелкие
(табл. XI. Л) вакуоли (Успенская, 1969).
Ультраструктура ядер миксоспоридий
Плазмодии миксоспоридий имеют вегетативные и генеративные ядра,
которые могут различаться по своей плоидности, размерам и форме. Генера-
тивные ядра обычно меньше (хотя известны и обратные соотношения) и пра-
вильной шаровидной формы (табл. I, А—В), тогда как вегетативные — менее
правильных очертаний и уплощены, из-за чего на ультратонких срезах часто
имеют колбасовидную форму (табл. XII, В). Однако и те, и другие относятся
к группе типичных пузырьковидных ядер (Райков, 1978). Размеры ядер
варьируют от 1 до 6 мкм у разных видов. Ядра богаты кариолимфой. Хрома-
тин располагается по периферии в виде сгущений и в основном деконден-
сирован. Ядра содержат одно типичное ядрышко, несколько эксцентрично
расположенное. Оно богато РНК: при окраске метиловым зеленым—пирони-
ном выявляется пиронинофилия; не окрашивается галлоцианином—хромо-
выми квасцами после обработки РНКазой; не красится по Фельгену.
В ядрышке под электронным микроскопом можно различить гранулярный
и фибриллярный компоненты. Ядерная оболочка типичная, состоит из двух
параллельных мембран по 7.5 нм, разделенных перенуклеарным простран-
ством. Ядерные поры немногочисленны, на тангенциальных срезах можно
видеть иногда аннулусы. Тонкости строения порового комплеска не изучены.
Органоиды и включения
Митохондрии плазмодиев имеют разную форму: от шарообразных,
как у видов рода Myxobolus (Desser, Paterson, 1978), или продолговато-
овальных, как у Henneguya psorospermica (Lom, Puytorac, 1965a, 1965b),
до лентовидных, как у Myxidium gasterostei (Успенская, 1969). У изученных
видов митохондрии имеют трубчатые кристы, количество которых различно,
эти кристы могут быть рыхло или более плотно упакованы у разных видов
(табл. X, А—Г) и у разных стадий одного вида. Однако в работе Лома с соав-
торами (Lom et al., 1982) указывается, что у Sphaerospora встречаются мито-
хондрии с пластинчатыми кристами. Считается, что увеличение количества
крист говорит о большей затрате энергии в данной ткани или органе (Машан-
ский и др., 1975). Лом, а затем и другие авторы (Lom, 1969; Current, Janovy,
1978; Grasse, Lavette, 1978) обнаружили внутри митохондрий митохонд-
риальную ДНК. Лом упоминает и еще о каких-то электронно-плотных вклю-
чениях, возможно это кальций. Каррент (Current, 1979) описывает у 30%
митохондрий Henneguya adiposa паракристаллические гексагональные тела.
Их же отмечают Дезер и Патерсон (Desser, Paterson, 1978) у Mysobolus sp.
Количество митохондрий меняется от стадии к стадии. Они образуют осо-
бенно большие скопления в тех зонах, где идет усиленный обмен: на границе
экто- и эндоплазмы и вокруг формирующихся спор в цитоплазме плазмодия
(табл. XI, В). Митохондрии обнаружены также в генеративных клетках
(табл. I, Л), во всех клетках, возникающих при спорогенезе, и в спороплазме
(табл. II, Л; IV, Б; X, Л).
Аппарат Гольджи имеет вид диктиосом с небольшим коли-
чеством плоских цистерн со вздутиями на концах (табл. IV, Б; X, Д) и встре-
37
чается в цитоплазме плазмодиев, в генеративных клетках (Lom, Puytorac,
1965b, и др.) и во всех клетках стадий спорогенеза (Grasse, Lavette, 1978;
наши данные), а также в спороплазме (Шульман, 1966, и др.).
Эндоплазматическая сеть. В эктоплазме обычно наблюда-
ются элементы гладкой эндоплазматической сети и свободные рибосомы.
В эндоплазме, особенно в тех участках, где происходит спорогенез, сильно
развит шероховатый ретикулум. Сильного развития он достигает и во всех
спорогенных клетках, особенно в последней их генерации — в клетках, из ко-
торых дифференцируется спора и в которых происходит усиленный морфоге-
нез при развитии стрекательного аппарата и створок споры. Была замечена
связь рулонов шероховатого ретикулума с оболочкой вегетативных ядер плаз-
модия и с оболочкой генеративной клетки (Успенская, 1969). Альвеолы
альвеолярного слоя образованы эндоплазматической сетью — ее раздутыми
цистернами (табл. XI, Д).
Включения. Из включений в цитоплазме плазмодиев отмечается
большое количество капель жира разных размеров (табл. X, Г; XI, Б). Гисто-
химически в цитоплазме плазмодия выявлялись нейтральный жир (красится
Суданом III, Суданом черным «Б» и чернится при обработке жидкостью
Шампи с Na2S), а также кислые жиры (реакция с нильским голубым). В ци-
топлазме многих видов локализуются глыбки гликогена; они дают положи-
тельную реакцию PAS, красновато-коричневую окраску с жидкостью Люголя,
разрушаются а-амилазой и растворяются в горячей воде. В цитоплазме плаз-
модия также содержатся вакуоли с разнообразными гранулами (табл. XII, Б)
и образования (табл. XII, А), которые Лом и Пюторак (Lom, Puytorac, 1965а,
1965b) считают миелиновыми. У некоторых видов в цитоплазме образуются
кристаллы: у Myxidium lieberkiihni, обитателя мочевого пузыря щуки, всегда
в большом количестве имеются желтовато-коричневые кристаллы,
которые раньше считались гематоидином, однако они не дают характерных
для гематоидина реакций (реакция Гмелина). Лом и Пюторак (Lom, Puyto-
rac, 1965b) считают их кристаллами мочевой кислоты. У некоторых видов
рода Chloromyxum из желчных пузырей отмечены зеленоватые кристаллы
(Шульман, 1966).
Микротрубочки и микрофиламенты. Скопления эктоплаз-
матических микротрубочек обнаружены Ломом (по: Lom, 1969, — диаметр
50 нм, длина 0.5 мкм) в примембранных слоях эктоплазмы. Грассе и Лаветт
(по: Grasse, Lavette, 1978, — диаметр 0.04 мкм, длина 0.4—0.12 мкм) счи-
тают, что эти микротрубочки принимают участие в пиноцитозе. Во всех элект-
ронно-микроскопических исследованиях отмечается, что микротрубочки
играют большую роль в формировании стрекательного аппарата. Длинные
микротрубочки обвивают наружную трубку стрекательной нити (табл. III, Б).
Большие скопления микротрубочек можно видеть внутри стрекательной кап-
сулы (табл. III, В) в определенные моменты развития (наши данные) и по ее
периферии (Current, Janovy, 1977, и др.). Они участвуют в образовании
ребрышек и шовного валика створок споры (Current, Janovy, 1977; Desser,
Paterson, 1978; Успенская, 1981в, 1982в). Микротрубочки, участвующие
в формировании споры, по мнению разных авторов, имеют диаметр 19—25 нм.
Как и у других организмов, микротрубочки образуют веретено деления ядер
(Grasse, Lavette, 1978; Успенская, 1981а, 1982в). По нашим данным, их
диаметр 25 нм (табл. III, А).
Микрофиламенты образуют сеть в эндоплазме плазмодия и, видимо,
способствуют изменчивости формы плазмодия и участвуют в образовании
псевдоподий (Lom, 1969; Grasse, Lavette, 1978). На микрофиламентах подве-
шены в вакуолях зрелые споры (табл. XIII, А); микрофиламенты, так же как
и микротрубочки, встречаются во всех спорообразующих клетках (Успенская,
1969).
38
УЛЬТРАТОНКОЕ СТРОЕНИЕ
ЗРЕЛЫХ СПОР МИКСОСПОРИДИЙ
Споры являются носительницами инвазионного начала — спороплазмы
(амебоидного зародыша) и представляют собой сложное многоклеточное
образование, формирующееся, как мы видели, внутри плазмодия, а затем
выводящееся во внешнюю среду.
Несмотря на большое разнообразие формы спор у разных видов, лежа-
щее в основе систематики миксоспоридий, зрелые споры имеют общий план
строения и состоят из трех основных элементов (рис.1): створок (2—6),
стрекательных капсул (1—6) и спороплазмы (одной 2-ядерной или двух
1 -ядерных).
Створки, смыкаясь друг с другом, образуют плотную оболочку споры,
внутри образовавшейся полости располагаются стрекательные капсулы и
спороплазмы. Смыкаясь друг с другом по шовной линии, створки образуют
утолщение, называемое шовным валиком (табл. XIII, А—Г). Форма споры
определяется формой створок. Створки могут вытягиваться в плоскости шва
или в плоскости, перпендикулярной к шву, они могут образовывать различ-
ного рода отростки, разрастаться и изгибаться в разных направлениях, иметь
на своей поверхности ребрышки (табл. XIII, А, Г).
Архитектоника спор определяется количеством и взаимным расположе-
нием створок и стрекательных капсул. Капсулы могут располагаться на одном
конце споры или на противоположных ее концах, в плоскости шва или в пло-
скости, перпендикулярной шву (табл. XIII, Б, Д, Ж, 3). Споры могут иметь
шаровидную, линзообразную, яйцевидную, веретеновидную, сигарообразную,
бобовидную, звездчатую формы. Подробно внешняя морфология, архитекто-
ника и функциональная морфология спор разобраны в монографии
С. С. Шульмана (1966). Там же обсуждается систематическое значение мор-
фологических особенностей спор.
Ультратонкое строение спор разных видов миксоспоридий описывалось
многими авторами (Хейсин и др., 1961; Lom, Puytorac, 1965b; Lom, Vavra,
1965; Шульман, 1966; Lom, 1969; Успенская, 1969, 19726; Lunger et al., 1975;
Current, Janovy, 1977; Desser, Paterson, 1978; Grasse, Lavette, 1978; Current,
1979; Current et al., 1979; Yamamoto, Sanders, 1979; Weidner, Overstreet,
1979; Booker, Current, 1981, и др.).
Створки
Створки зрелых спор слагаются из двух электронно-плотных мембран,
между которыми заключен электронно-светлый гомогенный слой (табл. XIII,
Г, Е). На поперечных срезах через зрелую спору видно, что края створок
плотно смыкаются друг с другом по шовной линии с помощью десмо-
сом (Lom, 1969; Current, Janovy, 1977; Desser, Paterson, 1978; Weidner,
Overstreet, 1979) и цементирующего вещества (Хейсин и др.,
1961).
В месте соединения двух створок образуется выпуклый край, поверхность
которого, обращенная в сторону соседней створки, ровная; она строго парал-
лельна такой же поверхности второй створки (табл. XIII, А, Г). Так возникает
шовный валик, характерный для многих двустворчатых спор. За выпук-
лостью шовного валика в стенке образуется выпячивание, соответствующее
желобку, отделяющему шовный валик от остальной поверхности створки.
Такой желобок образуется не у всех видов. Шовный валик и желобок очень
хорошо видны в сканирующий электронный микроскоп у Myxosoma cerebralis
(Lom, Hoffman, 1971), Sphaeromyxa mayami (Morrison, Pratt, 1973), Myxo-
bolus sp. (Desser, Paterson, 1978), a у Myxosoma cartilagines желобка
не образуется, и шовный валик плавно переходит в куполообразную створку
(Lom, Hoffman, 1971). У других видов шов образуется путем перекрывания
края одной створки краем другой. Такую картину (табл. XIII, 3) можно
39
наблюдать у тонкостенных спор Kudoa quadratum (наши данные) и у Fabe-
spora vermicola (Weidner, Overstreet, 1979). В этом случае они соединены
напоминающими десмосомы структурами с филаментами, толщиной 7 нм.
Наружная поверхность створок может иметь ребрышки, характерные для
некоторых видов; они хорошо видны в сканирующий электронный микроскоп
(Morrison, Pratt, 1973; Горюшкин, Мусселиус, 1977; Hine, 1980). Внутренняя
поверхность створок обычно гладкая (табл. XIII, Л).
У представителей подотряда Platysporea между дистальными концами
полярных капсул имеется образование, названное интеркапсуляр-
ным отростком,— треугольная тонкая пластинка, вершина которой
выступает в полость споры. Этот отросток разделяет каналы для выбра-
сывания стрекательной нити двух стрекательных капсул (Шульман, 1966).
Каналы эти открываются на створках вблизи шовной линии. Отростки,
отходящие от створок, представляют собой выпячивания створок и состоят
из тех же веществ, но срединный слой в них может быть вакуолизирован
(табл. XIII, Е).
Толщина створок у разных видов неодинакова. Так, у Myxobolus kavabaty
она равна 70 нм (Шульман, 1966), Myxidium gasterostei— 100 нм (Успен-
ская, 1966), Sphaeromyxa cottidarum — 150 нм в месте образования ребры-
шек и 80 нм между ними, в то время как у Fabespora vermicola толщина ство-
рок всего 10 нм (Weidner, Overstreet, 1979), а у Kudoa quadratum — 18 нм
(наши данные).
Для спор Fabespora vermicola описано интересное образование в месте
сочленения створок с капсулой, которое, как считают Вейднер и Оверстрит
(Weidner, Overstreet, 1979), развивается из створок и является особым ком-
понентом стрекательного аппарата. Это образование имеет вид шапочки,
которую пронизывают каналы (диаметр 10 нм), направляющиеся от поверх-
ности шапочки в сторону стрекательной капсулы. Створка в месте расположе-
ния шапочки имеет толщину в 2 раза меньшую, чем в остальных частях споры.
Авторы полагают, что эта шапочка играет какую-то роль в выстреливании
полярной нити. Похожее образование мы обнаружили у Kudoa quadratum.
Стрекательный аппарат
Стрекательные капсулы имеют грушевидную, яйцевидную или шаровид-
ную форму. Стенки этих капсул у зрелых спор более или менее толстые, сла-
гающиеся из двух слоев: наружного электронно-плотного тонкогранулиро-
ванного и внутреннего электронно-прозрачного, обычно более толстого (слои
эти ограничены мембранами). Полость капсулы заполнена гранулярным
содержимым (табл. XIV, Д). Внутри капсулы располагается стрекательная
нить. Это полая трубка, ввернутая, внутрь капсулы наподобие пальца
перчатки. У видов с короткой стрекательной нитью, например у видов рода
Sphaeromyxa (табл. XIV, А), она образует небольшое количество (2.5—3.5)
продольных петель (Lom, 1969; Успенская, 1969). У видов с длинной нитью
она укладывается по спирали тесными витками (табл. XV, А). При этом
сама нить перекручивается вокруг своей оси (табл. XV, А, Б), отчего на попе-
речных срезах имеет вид восьмерки (Шульман, 1966).
Стенки стрекательной нити непосредственно переходят в стенки капсулы
(табл. XV, В). Похоже, что они составлены теми же слоями, что и стенки
капсулы, но хорошо развит лишь электронно-светлый слой. В связи с вворачи-
ванием нити слои, слагающие ее стенку, инвертированы. Просвет ее высти-
лается наружным электронно-плотным слоем, а в полость капсулы обращен
электронно-светлый слой. Видимо, в связи с этим витки ввернутой нити
кажутся белыми на фоне темного содержимого капсулы. При выворачивании
нити картина получается обратной. Стенки ввернутой нити имеют периодиче-
скую исчерченность (табл. XVI, А). Изучение выстрелившей нити под элект-
ронным микроскопом не дало четких представлений о ее строении. Часто
на прперечных срезах она полая (Lom, 1964), в другом случае (табл. XVI, Б)
40
она имеет какое-то вакуолизированное содержимое (Успенская, 1976,
1977). Выстрелившая нить набухает в воде. Лом и Пюторак (Lom, Puytorac,
1973) отмечают наличие паракристаллического тела внутри ввернутбй нити.
Проксимальная часть нити, непосредственно переходящая в стенку кап-
сулы, обычно направлена вертикально, и эту часть называют иногда м а н у-
бриум (табл. XII, В; XV, В). Нить в этом участке бывает перекручена
вокруг своей оси. В толще стенки капсулы образуется канал для выбрасыва-
ния стрекательной нити. У Sphaeromyxa cottidarum он щелевидный, и просвет
проходящей сквозь него нити сплющен (табл. XVII, Л), у Myxobolus dispa-
roides он овальный (табл. XVII, Б). Шуберт с соавторами (Schubert et al.,
1975) указывают на недоразвитие у Unicapsula канала для выбрасывания
стрекательной нити. Канал этот проходит через цитоплазму капсулогенной
клетки в той части, где последняя примыкает к створке. Здесь вокруг канала
имеется протоплазматический колпачок (или крышечка) особого строе-
ния. У разных видов эта крышечка имеет разную форму и по-разному раз-
вита. По-видимому, она образует сочленение между стрекательной капсулой
и створкой и укрепляет стенки канала для выбрасывания нити на этом участке
(табл. XVIII, А, В, Г). Величина и форма крышечки зависят от величины
расстояния между вершиной капсулы и створкой. На некоторых срезах в ней
видны фибриллярные структуры (табл. XVIII, Б). Из изученных нами видов
крышечка сильно развита у Myxobolus disparoides (табл. XVIII, Л), довольно
длинная у Henneguya lobosa (табл. XVIII, Г), слабее развита у Sphaeromyxa
cottidarum (табл. XVIII, В). Возможно, существует зависимость между
длиной нити и необходимостью более мощного сочленения и укрепления сте-
нок канала. Дальше канал проходит уже в стенке створки. Здесь его просвет
заткнут электронно-плотной пробочкой (табл. XVIII, В).
В отношении деталей строения этой части стрекательного аппарата в лите-
ратуре существует некоторая несогласованность. Описание Лома и Пюторака
(Lom, Puytorac, 1965b) в общем соответствует приведенному нами описанию.
По их данным, пробочка («cork», «stopper») затыкает часть канала, прохо-
дящую в створке. Пространство между створкой и капсулой заполнено про-
теиновым колпачком или крышечкой («сар»). Правда, позднее Лом (Lom,
1969) у изученных им двух видов рода Sphaeromyxa не обнаружил протеино-
вой крышечки и считает ее отсутствие признаком рода. Однако мы у Sphaero-
myxa cottidarum наблюдали такую крышечку и считаем, что ее отсутствие
не может рассматриваться как признак рода (Успенская, 1972).
В описании Дезера и Патерсона (Desser, Paterson, 1978) пробочка заты-
кает канал для выстреливания нити в той его части, где он проходит сквозь
стенку капсулы, а крышечкой («сар») они называют электронно-плотный
материал на вершинах двух смыкающихся по шовной линии створок. Однако
на приводимых ими фотографиях можно разглядеть «proteinaceous сар»
Лома и Пюторака (Lom, Puytorac, 1965b), а структуры, рассматриваемые
ими в качестве «stopper», можно трактовать как стенку ввернутой стрека-
тельной нити. В описании Е. М. Хейсина с соавторами (1961), а позднее
С. С. Шульмана (1966), их крышечка в общем совпадает с «proteinaceous
сар» Лома и Пюторака (Lom, Puytorac, 1965b), пробочка же, по их мнению,
располагается в части канала, проходящей сквозь крышечку. На приводимых
ими фотографиях из-за плохой сохранности окружащих стрекательную кап-
сулу частей споры трудно понять соотношение между крышечкой и пробочкой,
с одной стороны, и створками и цитоплазмой капсулогенной клетки — с дру-
гой, хотя вполне вероятно, что пробочка может достигать и более глубоких
частей канала.
Как видно из приведенных фотографий, наш материал подтверждает дан-
ные Лома и Пюторака (Lom, Puytorac, 1965b).
Уточнение деталей строения стрекательного аппарата очень важно для
понимания механизма его действия.
41
Спороплазма (амебоидный зародыш)
Спороплазма в зрелой споре занимает пространство, остающееся между
стрекательными капсулами и створками либо позади капсул, если они распо-
ложены на одном полюсе споры (табл. XIII, Е, 3), либо между ними, если
они обращены к противоположным полюсам споры (табл. XIII, Д). Чаще
имеется один 2-ядерный амебоидный зародыш, иногда их два 1-ядерных.
Спороплазма представляет собой амебоидную клетку, одетую плазмати-
ческой мембраной и содержащую различные клеточные органоиды и вклю-
чения. В ее цитоплазме можно видеть митохондрии (табл. XIX, Л; XX),
диктиосомы, каналы гладкой и шероховатой эндоплазматической сети
в начале формирования спороплазмы, а затем свободные рибосомы. Харак-
терны для спороплазмы окруженные мембраной округлые электронно-плот-
ные включения (табл. XX), которые раньше принимались за митохондрии
(Шульман, 1966).
Для представителей семейства Myxobolidae чрезвычайно характерно
наличие у спороплазмы так называемой иодофильной вакуоли
(табл. XX). Как было выяснено цитохимическими методами, это крупное
скопление гликогена (Thelochan, 1889; Keysselitz, 1908а, 1908b; Kudo, 1921а;
Bond, 1940; Walliker, 1968; Galinsky, Meglitsch, 1969; Подлипаев,
1974, и др.). Дезер и Патерсон (Desser, Paterson, 1978) с помощью метода
электронно-микроскопической цитохимии определили его как 0-гликоген. Под
электронным микроскопом вокруг этого скопления гликогена мембрана
на обнаруживается (Schubert, 1968; Desser, Paterson, 1978; Успенская,
1982в), так что название «вакуоль» условно. Большинство авторов сходятся
во мнении, что это депо запасных питательных веществ, что доказывается
экспериментами (Bond, 1940; Galinsky, Meglitsch, 1969; Подлипаев, 1974;
Подлипаев, Шульман, 1978). Предположение о том, что эта вакуоль играет
роль гидростатического аппарата (Подлипаев, Шульман, 1978), пока недо-
статочно подтверждено.
Ядра амебоидного зародыша более компактны (табл. XX), чем ядра плаз-
модия и споробластов. Они также содержат крупное ядрышко, в котором
выявляется гранулярный и фибриллярный компоненты. Хроматин располо-
жен по периферии ядра, но в некоторых случаях глыбки его видны и в центре.
Видимо, сразу после мейоза и позднее состояние ядра спороплазмы различно.
Это отмечается и под световым микроскопом (Шульман, Семенович, 1973).
В одни периоды оно более рыхлое (табл. XIX, Л), а в другие — более компакт-
ное (табл. XX). Возможно, что этими внутриядерными перестройками и раз-
ной прочностью связи ДНК с белком объясняется большой разброс
в содержании ДНК (выявляемой по Фельгену) после завершения формиро-
вания споры. Пока нет достаточной информации, чтобы разобраться в этих
процессах.
42
РАЗВИТИЕ МИКСОСПОРИДИЙ
ПО ДАННЫМ электронной микроскопии
РАЗВИТИЕ ТРОФОЗОИТОВ
И ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
После попадания спор миксоспоридий в тело хозяина и выхода из споры
амебоидного зародыша (спороплазмы), как уже говорилось, происходит
слияние гаплоидных гаметических ядер последнего, т. е. совершается половой
процесс. Дальнейший путь такого зародыша с диплоидным синкарионом
прямо не прослежен. Считается, что если вид паразитирует в желчном пузыре,
то амебоид по желчным протокам прямо попадает в пузырь и, по мнению
некоторых авторов, остается в его полости, прикрепляясь к эпителию стенок
пузыря (Stempll, 1919). Нам удалось на срезах через желчный пузырь ко-
люшки, зараженной Myxidium gasterostei, видеть молодого, 8-ядерного
плазмодия, прикрепленного к эпителиальной клетке пузыря (Успенская,
1969).
Есть данные о том, что происходит внедрение амебоидного зародыша
в клетки эпителия желчного пузыря или протока, он остается здесь некоторое
время, не увеличиваясь в размерах, а затем выходит в полость желчного
пузыря и начинает расти (Auerbach, 1910b). В тех же случаях, когда миксо-
споридии паразитируют в любом другом органе, предполагается, что аме-
боидные зародыши по выходе из споры внедряются в эпителий кишечника,
а затем проникают в кровеносные или лимфатические сосуды и с током
крови или лимфы достигают нужного органа. Относительно этой части
жизненного цикла нет непосредственных наблюдений, так как искусственное
заражение миксоспоридиями удается с большим трудом. На серийных гисто-
логических срезах трудно найти 1 -ядерного амебоида, заражать же мечеными
спороплазмами никто не пытался.
Результаты выращивания ранних стадий миксоспоридий на искусствен-
ных средах отражены всего в одной работе и ничего не говорят о путях
миграции спороплазмы (Siau, 1977). Известно лишь, что от момента зара-
жения до появления первых симптомов заболевания у рыб при локализации
паразита в тканях проходил длительный срок. Например, при заражении
форели спорами Myxosoma cerebralis первые признаки вертежа появляются
на 18-е сутки (Успенская, 1955а, 1959, 19786), а при заражении лососевых
Ceratomyxa shasts путем высаживания рыб в воду, содержащую споры, уже
на 7-е сутки можно было встретить в их кишечнике трофозоитов (Yamamoto,
Sanders, 1979). Однако есть указания, что ранние стадии развития тканевых
миксоспоридий сначала инвазируют клетки, а затем могут выходить в меж-
клеточные пространства (Weiser, 1949; Lom, Dykova, 1981). Возможно, что
это судьба всех молодых трофозоитов, как полостных, так и тканевых миксо-
споридий.
В месте паразитирования, характерном для данного вида, начинается
развитие амебоидного зародыша в трофозоит. Оно сопровождается ростом
амебоида и многократным делением его синкариона (нуклеогония), за кото-
рым не сразу следует деление цитоплазмы (плазмотомия).
У всех видов с мелкими плазмодиями плазмотомия наступает довольно
часто и плазмодии их имеют 3—4 ядра, из которых либо два генеративных,
одно вегетативное, либо их по два каждого сорта. В зависимости от этого
в плазмодии развивается либо одна, либо две споры (Шульман, 1966).
У видов с крупными плазмодиями нуклеогония приводит к образованию
огромного числа ядер, а затем начинается плазмотомия (разделение на мно-
гоядерные участки) или совершается почкование, наружное или внутреннее.
43
Наружные почки легко отделяются от материнской особи и также путем
деления их ядер превращаются в плазмодиев, которые в свою очередь отде-
ляют почки (Myxidium lieberkuhn). В случае внутреннего почкования, как
это было отмечено для Chloromyxum leydigi и Myxidium rhodei (Erdman,
1917a, 1917b; Кашковский, 1966; цит. по: Шульман, 1966), выход внутренних
почек из материнского плазмодия осуществляется путем разрушения мате-
ринской особи.
Ранние стадии развития мало изучены под электронным микроскопом.
Лому и Пютораку (Lom, Puytorac, 1965b) удалось наблюдать очень раннюю
стадию Henneguya psorospermica — паразита кровеносных капилляров вто-
ричных жаберных лепестков щуки. Эта молодая особь прикреплялась к клет-
кам эндотелия капилляра проксимальной части жаберного лепестка. Ее
можно было отличить от окружающих клеток по осмиофильным жировым
включениям. На срезах через изучаемый экземпляр не удалось увидеть
митохондрии. Были видны одно ядро с нуклеолой и многочисленные пузырьки,
некоторые из которых были заполнены электронно-плотным материалом и
напоминали таковые у спороплазмы. У другой, более продвинутой стадии
были обнаружены митохондрии, рибосомы и микротрубочки в цитоплазме.
В кратких тезисах Лом и Дикова (Lom, Dykova, 1981) сообщают, что,
изучая под электронным микроскопом паразитов почечных канальцев рыб
(Sphaerospora и Mitrospora), они обнаружили ранние стадии в клетках
эпителия почечных канальцев, однако подробное их описание не приводится.
Сио (Siau, 1977) наблюдал развитие спороплазмы Myxobolus exiguus
в культуре на искусственной среде и получил ранние стадии. Им установлено,
что уже на стадии 8—10-ядерного плазмодия в его цитоплазме содержатся
генеративные клетки. В другом сообщении (Siau, 1979) указывается, что ему
удалось обнаружить под электронным микроскопом скопление 1-ядерных
стадий Myxobolus exiguus, в ядрах которых он обнаружил синаптонемальные
комплексы. Сио считает, что либо это спороплазмы, освобожденные из споры,
либо шизозоиты, образовавшиеся путем шизогонии из спороплазмы. По-
скольку в работе нет раздела «Материал и метод», то совершенно непонятно,
что это за стадии. Из последующих рассуждений похоже, что материал был
получен от зараженных в природных условиях рыб, с их жабр. На жабрах
обычно можно найти крупных плазмодиев, в которых за скопление 1-ядер-
ных клеток могут быть приняты стадии деления споробласта. По указанным
причинам трудно понять, с какой стадией автор имел дело, и потому сложно
оценить эти данные. Никто не описывал под электронным микроскопом
процессы нуклеогонии, плазмотомии и почкования. Нам удалось получить
лишь несколько срезов в районе почки у Myxidium lieberkiihni. Почки
образуются как выпячивание цитоплазмы, покрытое общей с плазмодием
мембраной. В районе образования почек отсутствуют микроворсинки. Затем
они появляются вновь, почка интенсивно питается, и ее поверхность дает
положительную реакцию на кислую фосфатазу (Успенская, 1966).
Мы под электронным микроскопом исследовали сравнительно ранние ста-
дии развития Myxidium gasterostei — паразита желчного пузыря колюшки.
Наиболее ранней стадией, обнаруженной нами под световым микроскопом,
был 8-ядерный амебовидный плазмодий (Успенская, 1969), который прикреп-
лялся к эпителию желчного пузыря, охватывая эпителиальную клетку
плазматическими выростами. Следующая стадия развития — свободно пла-
вающие в желчи мелкие организмы в форме запятой. Иногда они тоже при-
креплены к стенке желчного пузыря, эти организмы имеют уже большее
число ядер. Затем они вырастают в червеобразных плазмодиев, имеющих
немногим более десятка ядер. Эту стадию нам удалось изучить под электрон-
ным микроскопом (Успенская, 1969). В таком плазмодии уже есть генера-
тивные клетки (табл. XI, Л), а его поверхность имеет еще сравнительно ред-
кие и короткие микроворсинки. Эктоплазма тонко гранулирована и содержит
пиноцитозные пузырьки. Остальная часть цитоплазмы не разделена на четкие
слои. Многочисленные лентовидные митохондрии, вегетативные ядра и гене-
44
ративные клетки располагаются в центральной части плазмодия. Альвео-
лярный слой совершенно не развит, в центре нет даже более или менее круп-
ных вакуолей (табл. XI, А).
Обычно в желчном пузыре одной колюшки встречается до 10—15 особей
в виде запятой, количество червеобразных особей меньше (не более 10),
зрелых плазмодиев в пузыре еще меньше (2—5). Видимо, размножение
плазмодиев плазмотомией или почкованием происходит на ранних стадиях,
затем частично они гибнут, и до спорообразования доживают не все особи.
Червеобразные формы, развившиеся из спороплазмы путем нуклеогонии и
цитоплазматического роста, превращаются в листовидных крупных плазмо-
диев. По мере роста внутренняя часть плазмодиев все более вакуолизируется
(табл. XI, Б, В). Затем они превращаются в округлые толстые лепешки,
свернутые в трубочку внутри желчного пузыря, одна в другой; при этом
снаружи оказывается самый крупный плазмодий, а внутри потоньше и
поменьше. У толстого лепешковидного плазмодия альвеолярный слой зани-
мает уже более половины объема. Слои экто- и эндоплазмы образуют
сравнительно тонкий ободок по периферии лепешки (табл. XI, Д). Генера-
тивные клетки иногда лежат близко друг к другу, образуя подобие клеточного
слоя (табл. XI, Г).
СПОРОГЕНЕЗ
Вторым этапом развития и размножения у миксоспоридий является
спорогенез. Генеративные ядра плазмодия, выделенные в особые генератив-
ные клетки (Grasse, 1960), окружены собственной мембраной (табл. I, А,
Б, В). Для некоторых видов установлено наличие двух мембран (Lom,
Puytorac, 1965b; Current, Janovy, 1977). Ядро генеративной клетки имеет
крупную эксцентричную нуклеолу, периферический хроматин и небольшие
агрегаты хроматина, разбросанные в нуклеоплазме. Цитоплазма генератив-
ных клеток содержит митохондрии (табл. 1,А), часто с фибриллярными
тельцами, которые считают митохондриальной ДНК (Schubert, 1968; Lom,
1969; Current, Janovy, 1977), диктиосомы, свободные рибосомы, эндоплаз-
матическую сеть, пучки микротрубочек и различного рода вауколи и пу-
зырьки. Как было уже сказано, выделение генеративных клеток происходит
на ранних стадиях (Успенская, 1969; Siau, 1977). Неизвестно, как происходит
выделение этих клеток. С. С. Шульман (1966) считает, что этот процесс
аналогичен образованию внутренних почек (целлюляция — по: Догель, 1951;
целлюляризация — по: Шульман, 1966). Неизвестно также, как происходит
увеличение количества генеративных клеток по мере роста крупных плазмо-
диев; путем деления одной генеративной клетки — предшественницы всех
последующих, или путем нуклеогонии и обособления вокруг вновь и вновь
возникающих генеративных ядер участков цитоплазмы и возникновения
вокруг них мембраны.
Генеративные клетки являются предшественницами первой стадии споро-
генеза—панспоробласта, по современным представлениям—это двукле-
точная стадия. В ней различается наружная клетка, содержащая вегетатив-
ное ядро, которое часто называют остаточным ядром панспоробласта, и
внутренняя спорогенная клетка, содержащая генеративное ядро (табл. II,
А—В). Эта клетка в процессе деления дает начало всем клеткам многоклеточ-
ной споры. Относительно происхождения панспоробласта существуют, как
уже говорилось, разные точки зрения. Ранее (см. с. 20, 45—47) мы уже дали
обзор гипотезам о происхождении панспоробласта: большинство авторов, как
мы видели, считают, что происходят сближение двух генеративных клеток и
последующее обволакивание одной клетки другою (Lom, Puytorac, 1965b;
Lom, 1969; Current, Janovy, 1977; Desser, Paterson, 1978; Current, 1979; Lom,
Dykova, 1981, и др.).
По мнению придерживающихся этой точки зрения Грассе и Лаветта
(Grasse, Lavette, 1978), миксоспоридии — подлинно многоклеточные орга-
45
низмы, имеющие четыре категории клеток: тело плазмодия — истин-
ная сома с большим количеством ядер, спороцит — производящая споры
клетка, пере ц и т — обволакивающая спороцит клетка (до объединения
они существуют порознь и различаются морфологически) и лобоцит —
фагоцитирующая клетка.
С. С. Шульман (1966) на основании наблюдений под световым микроско-
пом, а позднее С. С. Шульман и С. А. Подлипаев (1980) на основании крити-
ческого разбора статьи Грассе и Лаветта (Grasse, Lavette, 1978) считают, что
образование панспоробласта происходит путем деления ядра генеративной
клетки, с последующим обособлением вокруг него участка цитоплазмы и
выделением его в отдельную клетку, заключенную внутри генеративной
(целлюляризация). Основным аргументом против трактовки Грассе и Ла-
ветта эти авторы считают отсутствие фагоцитарной вакуоли или хотя бы
двойной мембраны у внутренних спорогенных клеток («спороциты», по:
Grasse, Lavette, 1978). Это положение, однако, оспаривается Ломом с соав-
торами (Lom et al., 1982). Они считают, что в ряде случаев мембрана фаго-
цитарной вакуоли четко видна и предполагают, что ее сохранность может
зависеть от способа приготовления материала.
На наших фотографиях, так же как при изучении фотографий, приводи-
мых другими авторами, не удалось обнаружить фагоцитарную вакуоль или
хотя бы двойную мембрану у внутренних спорогенных клеток. Правда,
четких картин формирования мембраны внутри генеративной клетки тоже
нет.
На снимках (табл. I, II, IV) приводятся изображения генеративных кле-
ток, панспоробластов и стадий деления спорогенной клетки внутри споро-
бласта, из которых видно, что далеко не у всех миксоспоридий генеративные
клетки имеют псевдоподии. Например, у Kudoa quadratum все клетки, участ-
вующие в спорогенезе, имеют округло-овальную форму (табл. II, В) с доста-
точно гладкой поверхностью, что не говорит в пользу их активного передви-
жения в поисках партнера, и среди них нельзя отличить спороцит, перицит
и лобоцит. У Myxidium gasterostei генеративные клетки имеют неровные края
(табл. I, А) и выросты, похожие на псевдоподии. Однако неровные края
характерны также и для спорообразующих клеток этого вида (табл. IV, А, Б),
находящихся внутри панспоробласта, для которых никто не предполагает
активного передвижения и фагоцитирования, а лишь дальнейшее деление,
вплоть до дифференцировки формирующих спору клеток.
У тканевых паразитов (представители родов Kudoa, Hanneguya и Myxobo-
lus) не удавалось обнаружить морфологически напоминающие описанные
Грассе и Лаветтом (Grasse, Lavette, 1978) категории клеток.
Начальной стадией спорогенеза (табл. II, Л—В), как выясняется из
электронно-микроскопических данных, всегда является стадия с одной
клеткой, заключенной в другую (Lom, Puytorac. 1965b; Lom, 1969; Current,
Janovy, 1978; Desser, Paterson, 1978; Grasse, Lavette, 1978; Current, 1979;
Yamamoto, Sanders, 1979; Lom, Dykova, 1981, Lom et al., 1982, и др.).
На основании статичных картин трудно решить, происходит ли деление
или объединение генеративных клеток. Помочь здесь могло бы изучение
паразита в культуре с фиксацией одной стадии за другой, чтобы быть уве-
ренным в последовательности. Такое изучение начал Сио (Siau, 1977).
Он считает, что при образовании панспоробласта происходит не сближение
двух генеративных клеток, а разделение одной клетки на две неравные, одна
из которых, меньшая, окружает большую в виде полумесяца, постепенно
обрастая ее. При такой трактовке отпадает необходимость в существовании
двух категорий клеток — перицита и спороцита, как особых клеток, раздельно
существующих в цитоплазме плазмодия.
Интересна для решения этого вопроса работа Ямамото и Сандерса (Yama-
moto, Sanders, 1979), изучивших под электронным микроскопом развитие
Ceratomyxa shasta, начиная с ранних (7—14 сут после заражения) стадий.
У С. shasta получившиеся в результате вегетативного размножения мелкие
46
(2—3-ядерные) плазмодии целиком превращаются в панспоробласт. Веге-
тативное его ядро (обычно имеется одно, реже два) не участвует в споро-
образовании и вместе с цитоплазмой трофозоита выполняет ту же рол£, что и
наружная клетка панспоробласта крупных плазмодиев. Предшествующее
спорообразованию объединение двух клеток авторы не наблюдали. Им уда-
лось видеть лишь ранние стадии деления генеративной клетки. В результате
она дает начало 12 клеткам, которые затем разделяются на две группы
(по 6 клеток), образующие каждую из двух спор. Из приведенного описания
видно, что две клетки панспоробласта не возникают у этого вида путем
деления одной или объединения двух генеративных клеток, а образуются
выделением генеративной клетки (целлюляция) внутри плазмодия, который
играет роль наружной клетки панспоробласта.
Кажется маловероятным, что у мелких и крупных плазмодиев панспоро-
бласт может возникать разными способами: у одного — выделением, а у дру-
гого — объединением генеративных клеток.
Однако Лом с соавторами (Lom et al., 1982) считают, что существование
такого различия между двуспоровыми и полиспоровыми видами вполне
вероятно. Рассуждая о том, каким способом одна клетка может оказаться
внутри другой, эти авторы полагают, что у миксоспоридий могут происхо-
дить и дифференцировка дочерней клетки внутри материнской (как при
образовании генеративных клеток), и объединение двух клеток с последую-
щим обволакиванием одной другою (так, по их мнению, образуется панспоро-
бласт у полиспоровых видов).
Здесь уместно будет остановиться на вопросе о неоднородности термино-
логии, употребляемой разными авторами в отношении стадий спорогенеза.
В упомянутой статье Лома с соавторами частично принимается термино-
логия Грассе и Лаветта (Grasse, Lavette, 1978): наружная клетка называется
перицитом, а внутренняя — спорогенной клеткой. В другой работе (Lom,
Dykova, 1981) термином «споробласт» обозначают стадию, состоящую из
двух клеток и дающую в конце развития одну или две споры. Ямомото и
Сандерс (Yamamoto, Sanders, 1979) споробластом называют генеративную
клетку, дающую начало двум спорам, а группу клеток, дающую начало
каждой споре, называют споронтом. Одни называют двуклеточную стадию
споробластом, другие — панспоробластом. Внутреннюю клетку панспоро-
бласта часто называют споронтом, а иногда споробластом, или спорогенной
клеткой.
Нобль (Noble, 1944) предложил споронтом, или споробластом называть
стадию, которая развивается в одну спору путем внутреннего развития,
а панспоробластом — стадию, развивающуюся в две или более спор.
С. С. Шульман (1966) считает такой подход формальным. В его пони-
мании панспоробласт — это многоядерное и многоклеточное образование,
содержащее один, два или более развивающихся споробластов и одно, два
или более вегетативных ядер. Вслед за Дебазье (Debaisieux, 1925) он считает
панспоробласт гомологом моноспоровых, диспоровых или небольших поли-
споровых трофозоитов. Споробластом он предлагает считать многоядерное
и многоклеточное образование, лишенное вегетативных ядер и после опреде-
ленного развития превращающееся в спору. Споробласт развивается внутри
плазмодия или панспоробласта только из генеративных ядер, обособившихся
в отдельную клетку.
Основываясь на электронно-микроскопических данных, панспоро-
бластом надо считать двуклеточное образование, у которого наружная
клетка содержит вегетативное ядро и не делится, а внутренняя содержит
генеративное ядро и путем деления и развития превращается в одну, две
(доказано) и, может быть, несколько спор. Споробластом надо счи-
тать клетку, содержащую только генеративное ядро и путем деления целиком
превращающуюся в спору или споры. Он возникает внутри плазмодия или
панспоробласта и в первом случае соответствует генеративной клетке (или
развивается из нее), а во втором — внутренней клетке панспоробласта,
47
т. е. совпадает с понятием «споробласт», предположенным Шульманом.
Его можно также называть спорогенной клеткой. Группу клеток,
возникших при делении споробласта и идущих на формирование только
одной споры, видимо, в отличие от споробласта, можно называть дочерним
споробластом. Как уже говорилось (см. с. 26), время их обособления не
совсем ясно.
Данные Ямамото и Сандерса (Yamamoto, Sanders, 1979) подтверждают
точку зрения Дебазье (Debaisieux, 1925) и Шульмана (1966). Однако,
Шульман (1966) отмечает, что, хотя панспоробласт и гомологичен примитив-
ным плазмодиям и возник в процессе эволюции как незавершенная внутрен-
няя плазмотомия (почкование), он функционально существенно отличается
от плазмодиев, так как уже не является самостоятельным организмом,
а функционирует как орган размножения.
К этому следует добавить, что панспоробласт крупных плазмодиев воз-
никает только из генеративных клеток. Развитие его ведет к половому про-
цессу через спорообразование. Почка или молодой трофозоит путем нуклео-
гонии и повторной плазмотомии могут дать начало новым трофозоитам, что
приведет к увеличению количества плазмодиев в том же органе или особи
хозяина, т. е. к аутоинвазии. Панспоробласт никогда не дает начала новым
трофозоитам, и развившиеся из них споры не приводят к аутоинвазии,
а должны быть выведены во внешнюю среду для дальнейшего развития.
Функция почки — аггломерация. Функция панспоробласта (через
цитогонию и спорообразование) — дисперсия.
Дальнейшее развитие панспоробласта и процессы спорообразования опи-
сываются разными авторами более или менее одинаково, и работы, основан-
ные на электронно-микроскопических методах исследования, дополняют и
уточняют детали этих процессов, в основном описанных уже Ломом и
Пютораком (Lom, Puytorac, 1965b; Schubert, 1968; Lom, 1969; Успенская,
1969, 19726; Current, Janovy, 1976, 1977; Desser, Paterson, 1978; Current,
1979; Current et al., 1979; Booker, Current, 1981; Lom, Dykova, 1981, и др.).
Разногласия касаются лишь количества остаточных ядер панспоробласта,
момента их деления и места мейоза в жизненном цикле. Эти вопросы уже
были разобраны выше (см. с. 22—23; рис. 5).
Как нам уже известно, непосредственно в спорообразовании принимает
участие только внутренняя (спорогенная) клетка панспоробласта, которая
делится митотически и является родоначальницей всех клеток споры. Наруж-
ная клетка выполняет вегетативные функции. Внутренняя клетка панспоро-
бласта округлая и содержит т.е же органоиды, что и генеративные клетки.
Наружная обволакивающая клетка на срезах имеет обычно форму полу-
месяца (табл. II, Л). В начале образования панспоробласта ядро ее тоже
округлое, а затем сплющивается и имеет бобовидную форму, нуклеола
исчезает, и само ядро, так же как и цитоплазма этой клетки, дегенерирует
по мере развития спор внутри панспоробласта, так что зрелая спора оказы-
вается подвешенной на тонких фибриллах к стенкам вакуоли, образовав-
шейся на месте наружной клетки (табл. XIII, Л).
Картины митотического деления спорогенной клетки не прослежены под
электронным микроскопом. Как уже говорилось (см. с. 30), в работах, прове-
денных на светооптическом уровне, даются традиционные изображения мито-
зов со всеми последовательными стадиями, и митоз считается внутриядерным
и ацентрическим (Keysselitz, 1908а; Schroder, 1912; Tuzet, Olmieres, 1957,
и др.). Под электронным микроскопом картин митоза никто не описывает,
и Лом, Грассе и Лаветт (Lom, 1969; Grasse, Lavette, 1978) с удивлением
отмечают, что, несмотря на большое количество исследованных срезов,
митоз проследить никому не удалось. Грассе и Лаветт приводят лишь один
снимок с изображением веретена деления. В их интерпретации это — деление
.юбоцита, т. е. 1-ядерной клетки, находящейся в цитоплазме трофозоита и
имеющей, по их мнению, фагоцитарную функцию (Grasse, Lavette,
1978).
48
В процессе электронно-микроскопических исследований нам однажды
встретилось хорошо сохранившееся веретено в продвинутой стадии спороге-
неза (табл. III, Л). Мы предположили, что это может быть момент выделения
редукционного тельца перед возникновением гаплоидных, образующих спору
клеток (см. с. 25). Уже из этих данных ясно, что при делении клеток, находя-
щихся как в цитоплазме трофозоита, так и внутри панспоробласта, образу-
ется веретено с хорошо развитыми микротрубочками. По-видимому, нет
оснований предполагать существование амитоза у миксоспоридий, и картины,
приводимые Грассе и Лаветтом (Grasse, Lavette, 1978) в пользу этого пред-
положения, вероятно, отражают аномалии в развитии.
Каждая спора дифференцируется в простейшем случае (при наличии
двух створок, двух капсул и одной спороплазмы) из пяти клеток, из которых
две вальвогенные превращаются в створки споры, в двух капсулогенных раз-
виваются стрекательные капсулы и одна (2-ядерная) является амебоидным
зародышем (спороплазмой). В случае развития двух таких спор в панспоро-
бласте дифференцируется 10 клеток (две 2-ядерные и восемь 1-ядерных).
При развитии многокапсульных и многостворчатых спор количество споро-
образующих клеток меняется в зависимости от числа створок и капсул и
от числа спор, образующихся в панспоробласте. Эти слагающие спору клетки
появляются в результате мейоза, который наступает после нескольких
(в первом случае после 3-го) митотических делений спорогенной клетки
панспоробласта. Как уже говорилось, мы на основании цитофотометрии
и электронной микроскопии предполагаем возможность двуступенчатого
мейоза с выделением редукционного тельца (Успенская, 1982в). Все потомки
спорогенной клетки в течение нескольких первых делений остаются недиф-
ференцированными (табл. IV, Б), содержат митохондрии, диктиосомы, рибо-
сомы, эндоплазматическую сеть, микротрубочки, вакуоли. Ядра их имеют
крупную нуклеолу, расположенную эксцентрично. В двуспоровых панспоро-
бластах каждая группа клеток, дающая начало одной споре, ограни-
чена своей мембраной — это дочерние споробласты, и, как упоминалось,
время их обособления неясно. Остаточные ядра располагаются вне этих
мембран.
РАЗВИТИЕ СПОРЫ
Дифференцировка клеток споры начинается уже после завершения
мейоза. Клетки, образующие каждую спору, располагаются определенным
образом по отношению друг к другу.
Развитие створок споры
Вальвогенные клетки (их может быть 2—6) вначале имеют вид обычной
клетки с ядром и клеточными органоидами (митохондрии, эндоплазмати-
ческая сеть, диктиосомы, микротрубочки). При дифференцировке эти клетки
занимают периферическое положение по отношению к амебоиду и капсуло-
генным клеткам (рис. 3). Затем они начинают вытягиваться, распластываясь
снаружи и охватывая остальные клетки (табл. XXI, Л—В). Ядра их вытяги-
ваются, принимая колбасовидную форму, а затем и вовсе дегенерируют.
Распластанные клетки смыкаются краями друг с другом, и в этом месте
возникает шовная линия (табл. XXI, Л). Клетки настолько растягиваются,
что слой цитоплазмы между противоположными мембранами становится
тонким и уплотняется. Каррент и Джанови (Current, Janovy, 1977) описы-
вают появление в периферической части цитоплазмы электронно-плотных
лент, 0.33 мкм шириной и 0.10 мкм толщиной, расположенных продольно и
равномерно распределенных по периферии развивающихся створок. Микро-
трубочки, многочисленные в цитоплазме вальвогенной клетки, распола-
гаются вблизи шовной линии под наружной мембраной вдоль впячивания
поверхности створок, благодаря появлению которых последняя делается реб-
4 А. В. Успенская
49
ристой. Наиболее толстый слой цитоплазмы сохраняется вблизи шовной
линии, здесь образуется наиболее выдающееся выпячивание цитоплазмы —
шовный валик (табл. XIII, Г). Смыкающиеся края створок образуют гладкую
поверхность и прочно соединяются при помощи десмосом и цементирующего
вещества. В этой части цитоплазмы довольно долго можно видеть диктиосомы
(Schubert, 1968). Затем ядро дегенерирует, а цитоплазма становится гомо-
генной (табл. XIII, Г) и плотной, в виде электронно-прозрачного срединного
слоя, ограниченного мембранами вальвогенной клетки. Наружная мембрана
укреплена микротрубочками, несколько утолщенная и очень электронно-
плотная. Таким образом, образуются прочные створки споры. Вблизи
шовного валика в каждой створке возникает канал для выбрасыва-
ния стрекательной нити, который затыкается электронно-плотной про-
бочкой.
Развитие стрекательного аппарата
миксоспоридий
Стрекательные капсулы миксоспоридий развиваются в особых капсуло-
генных клетках, которых может быть от одной до шести среди спорообразую-
щих клеток. Вначале это обычная клетка с ядром и цитоплазмой, содержащей
митохондрии, сильно развитую гранулярную эндоплазматическую сеть,
диктиосомы. Под световым микроскопом процесс образования стрекательных
капсул часто описывался неверно. Считалось, что в образовании полярной
нити принимает участие ядро капсулогенной клетки (Kudo, 1921а), а стенки
капсулы — это уплотненная цитоплазма капсулогенной клетки, оттесненная
к периферии растущей внутри клетки вакуолью (Schroder, 1907; Шульман,
1966). На основании этих данных С. С. Шульман (1966) в своей монографии
дает неверную схему развития стрекательной капсулы. Однако и под свето-
вым микроскопом Бючли (Butschli, 1882) заметил, что полярная капсула фор-
мируется из сферического тельца, в которое внедряется филамент — будущая
стрекательная нить. Ауэрбах (Auerbach, 1909) описывает формирование
крупного сферического тела, соединенного с длинной, спирально свернутой
трубкой. Стемпел (Stempell, 1919) наблюдал длинную трубку вокруг ядра
капсулогенной клетки, у которой конец разрастается в шар, а затем трубка
втягивается в него.
Под электронным микроскопом впервые процесс развития стрекательного
аппарата был описан Ломом и Пютораком (Lom, Puytorac, 1965b), а затем
уточнен и другими исследователями (Schubert, 1968; Lom, 1969; Успенская,
1969, 19726; Schubert et al., 1975; Current, Janovy, 1976, 1977; Desser,
Paterson, 1978; Grasse, Lavette, 1978; Current, 1979; Current et al., 1979;
Weidner, Overstreet, 1979).
В капсулогенной клетке появляется капсулярный зачаток в виде малень-
кого пузырька, окруженного микротрубочками. Пузырек имеет гладкие
стенки, откуда Лом (Lom, 1969) заключил, что он может происходить или
из гладкой эндоплазматической сети, или из пузырьков аппарата Гольджи.
Он разрастается в продолговато-овальное образование (табл. XXII, А),
имеющее тонкогранулированный осмиофильный наружный слой, более свет-
лый внутренний слой и скопление электронно-плотных гранул в середине.
Один конец зачатка вздувается и превращается в зачаток собственно кап-
сулы (табл. XXII, Б, В), другой растет в длину и образует наружную трубку
стрекательной нити (табл. XXII, В—£). Во время роста зачаток окружен
сильно развитой гранулярной эндоплазматической сетью, цистерны которой
сильно раздуты и тесно усажены с наружной стороны рибосомами, некоторые
из них объединяются в полирибосомы. Вокруг наружной поверхности зачатка
располагается продольно более 30 микротрубочек, их диаметр 19—25 нм.
Как отмечают Лом и Пюторак (Lom, Puytorac, 1965b), с самого начала
узкая часть зачатка, т. е. дистальный конец, заканчивается в той части
капсулогенной клетки, которая связана с каналом для выбрасывания стрека-
50 1
тельной нити. К мембране переднего конца наружной трубки стрекательной
нити примыкает скопление электронно-плотного материала — будущая про-
бочка. Снаружи трубку обвивают по спирали длинные, тесно расположённые
микротрубочки (табл. III, Б). Наружный слой капсулы уплотняется, образуя
электронно-плотную оболочку. Центральная часть концентрируется в до-
вольно плотный матрикс. Более светлый слой, находящийся между оболочкой
и матриксом, утолщается. Электронно-плотный и электронно-светлый слои
снаружи ограничены мембраной (табл. XXII, Б, Е). Наружная трубка имеет
то же ультратонкое строение, что и капсулярный зачаток, но все ее слои
тоньше. Элекронно-светлый слой развит гораздо сильнее других. На более
поздних стадиях матрикс наружной трубки концентрируется и образует
электронно-плотный мелкогранулированный тяж с собственной мембраной
(табл. XIV, Б\ XXII, 3). По мере удлинения наружной трубки темный матрикс
внутри стрекательной капсулы расходуется. В какой-то момент развития
внутри капсулы обнаруживается скопление коротких фрагментов микротру-
бочек (табл. III, В). Наружная трубка образует петли в цитоплазме капсуло-
генной клетки (табл. XXII, Ж). Стенки наружной трубки имеют поперечную
или косую исчерченность (табл. XVI, Л). Многие авторы считают, что микро-
трубочки исчезают, когда формирование трубки заканчивается (Desser,
Paterson, 1978; Grasse, Lavette, 1978; Current, 1979, и др.).
Согласно гипотетической схеме Лома и Пюторака (Lom, Puytorac, 1965а),
стрекательная нить начинает формироваться от дистального конца наружной
трубки и растет в сторону стрекательной капсулы, врастая в нее, а наружная
трубка дегенерирует. Грассе и Лаветт (Grasse, Lavette, 1978) полагают, что
на каком-то этапе наружная трубка отделяется от зачатка капсулы и соб-
ственно стрекательная нить начинает формироваться из матрикса стрекатель-
ной капсулы. Однако есть и другие наблюдения, которые говорят о том, что
внутри капсулы к моменту появления витков стрекательной нити не остается
элекронно-плотного матрикса. Кроме того, точке зрения Грассе и Лаветта
относительно отделения наружной трубки от капсулы противоречат картины
(табл. XXII, И), показывающие витки стрекательной нити внутри наружной
трубки (Lom, Puytorac, 1965b; Current, Janovy, 1977; Current, 1979; наши
данные), что может трактоваться либо как рост стрекательной нити de novo
от дистального конца наружной трубки, либо как момент вворачивания
наружной трубки внутрь капсулы.
В пользу непосредственного превращения наружной трубки в стрека-
тельную нить говорит много фактов: 1) непосредственный переход стенок
нити, так же как и наружной трубки, в стенки капсулы (табл. XV, В), причем
в случае роста этой нити от дистального конца трубки надо еще объяснить,
каким образом она прирастет к стенкам капсулы; 2) соответствие длины на-
ружной трубки длине стрекательной нити данного вида; 3) одинаковое строе-
ние стенок наружной трубки и стенок стрекательной нити (табл. XVI, Л, Б),
т. е. одинаковая толщина внутреннего слоя и наличие периодической исчер-
ченности. У находящейся внутри капсулы нити, представляющей собой полую
трубку, внутренний слой (электронно-плотный) непосредственно переходит
в наружный слой стрекательной капсулы, а слой, обращенный в полость
капсулы, является продолжением внутреннего электронно-светлого слоя кап-
сулы, (табл. XV, В). Видимо, поэтому на достаточно толстых срезах нить
кажется белой на черном фоне содержимого капсулы. Такое извращение
слоев как раз легко представить себе при вворачивании наружной трубки
внутрь (табл. XV, Г).
Процесс вворачивания или врастания нити внутрь капсулы настолько
быстрый, что промежуточные стадии удается наблюдать очень редко. Однако
нам удалось проследить, что на всех срезах, где встречается одновременно и
наружная трубка, и капсула, витки нити (если они видны уже внутри кап-
сулы) обязательно будут и внутри трубки. Это обстоятельство говорит против
возможности возникновения нити из матрикса внутри капсулы. Скорее
происходит постепенное вворачивание трубки внутрь, начиная от дистального
4*
51
ее конца. Кроме того, если в цитоплазме видна перерезанная наружная
трубка, то расположенные внутри капсулы витки нити не имеют завершенного
вида. Все эти факты говорят за вворачивание трубки внутрь. Есть и другая
точка зрения: Вейднер и Оверстрит (Weidner, Overstreet, 1979) полагают,
что наружная трубка вворачивается внутрь капсулы, где происходит ее
разборка и сборка заново с образованием стрекательной нити.
Следующая стадия — это капсула с ввернутой в нее нитью. Считается,
что из цитоплазмы капсулогенной клетки возникает крышечка, образующая
сочленение со створкой в месте возникновения канала для выбрасывания
нити. Канал затыкается пробочкой (табл. XVIII, А, В, Г).
Строение стрекательного аппарата миксоспоридий, так же как и его
развитие, до мельчайших деталей совпадает с таковыми книдоцист кишечно-
полостных. При изучении развития книдоцист возникали такие же гипотезы
и споры о судьбе и назначении наружной трубки и о происхождении самой
стрекательной нити. По мнению ряда авторов, наружная трубка книдоцисты
вворачивается внутрь капсулы и формирует внутреннюю трубку или целиком,
или соединяясь с вооруженной ее частью, заложившейся внутри капсулы
(Slauterbeck,, Fowcett, 1959; Наумов, 1960; Slauterbeck, 1960, 1967; Lentz,
Barnett, 1965; Picken, Skaer, 1966; Reisinger, 1969; Carre, Carre, 1973; Skaer,
1973; Holstein, 1981). Особенно убедительны в этом отношении прижизненные
наблюдения Карре и Скаера (Саггё, Саггё, 1973; Skaer, 1973; Саггё, 1974)
и подробные исследования процесса вворачивания трубки под электронным
микроскопом, проведенные Холштейном (Holstein, 1981). Однако другие
авторы считают, что наружная трубка не вворачивается, а включается
в состав книдоцисты путем ассимиляции или резорбируется в цитоплазме
книдобласта, внутренняя же трубка (нить) формируется внутри капсулы из
ее содержимого (Westfall, 1966; Massin, 1972). Холштейн (Holstein, 1981)
считает, что стенки наружной трубки книдоцист гидры имеют три слоя:
наружную мембрану, средний электронно-прозрачный слой и внутренний
электронно-плотный. По мнению этого автора, внутрь вворачивается средний
слой, тогда как наружный изменяется в элекронно-плотный материал, из ко-
торого формируется крышечка, закрывающая конец ввернутой трубки.
По наблюдениям Холштейна, микротрубочки, спирально обвивающие наруж-
ную трубку, окружают лишь растущую трубку и исчезают перед ее вворачи-
ванием. В том случае, если у миксоспоридий внутрь капсулы вворачивается
лишь электронно-прозрачный слой наружной трубки, гипотеза Лома и Пюто-
рака (Lom, Puytorac, 1965в) вполне примиряется с гипотезой о вворачивании
наружной трубки (Успенская, 19766, 1977) и превращении ее в собственно
стрекательную нить. Тогда делается понятным, почему витки вновь вверну-
той в капсулу нити (трубки) имеют меньший диаметр, чем наружная
трубка.
Развитие амебоидного зародыша
(спороплазмы)
Спороплазма обычно дифференцируется из одной клетки (табл. XIX, А,
Б)\ в этом случае она 2-ядерная, реже в споре возникают два 1-ядерных
зародыша (Yamamoto, Sanders, 1979). Грассе и Лаветт (Огаээё, Lavette,
1978) считают, что деление ядра этой клетки запаздывает и делится оно уже
тогда, когда клетка заняла характерное для нее место между створками и
капсулами. Процесс деления под электронным микроскопом не прослежен.
В спороплазме сохраняются диктиосомы и митохондрии (табл. XIX, Л). В ци-
топлазме имеются многочисленные рибосомы и появляются характерные,
окруженные мембраной, электронно-плотные включения (табл. XX). У видов,
обладающих иодофильной вакуолью, она появляется в конце созревания
споры (табл. XX). В начале развития можно видеть в цитоплазме цистерны
гранулярного ретикулума, затем они исчезают, и многочисленные свободные
рибосомы делают цитоплазму элекронно-плотной.
52
Как уже говорилось, в ядрах амебоида, когда он уже дифференцировался,
происходят какие-то перестройки, но подробно эти процессы не прослежены.
У окончательно сформированной споры ядра и цитоплазма капсулогейных и
вальвогенных клеток дегенерируют, у разных видов в разной последователь-
ности. Живая цитоплазма и ядро сохраняются только у спороплазмы. После
завершения спорогенеза вегетативные ядра и цитоплазма панспоробластов
и самого плазмодия разрушаются, и споры выводятся во внешнюю среду.
Как уже говорилось, для некоторых видов миксоспоридий доказано наличие
довольно длительного периода дозревания спор во внешней среде, необходи-
мого для достижения ими инвазионности (Успенская, 1955а; 1978а; Юнчис,
1974). Предполагается, что за этот срок включаются какие-то ферментатив-
ные системы, возможно связанные с функционированием стрекательного
аппарата, в механизме действия которого основой являются сократительные
системы — белки (Успенская, 1976а, 1977).
53
БИОЛОГИЯ И ФИЗИОЛОГИЯ МИКСОСПОРИДИЙ
ИЗ РАЗНЫХ МЕСТ ОБИТАНИЯ
СВЕДЕНИЯ ПО ЦИТОХИМИИ МИКСОСПОРИДИЙ
Цитохимия трофозоитов
Применение цитохимических методик при изучении миксоспоридий позво-
лило нам составить общее представление о локализации в них разных
веществ (Успенская, 1966, 1969, 19796, 1981в, 1982в). Цитоплазма плазмо-
диев дает положительную реакцию на общий белок с сулемовым бромфено-
ловым синим. Этим методом интенсивно красится зона мелкогранулирован-
ной эктоплазмы; более темную окраску дает плотная цитоплазма генера-
тивных клеток и клеток панспоробласта. В альвеолярном слое в синий цвет
(реакция на белок) окрашиваются цитоплазматические мостики. Цитоплазма
содержит нейтральный жир, окрашивающийся Суданом III, Суданом черным
«Б» и чернящийся при фиксации жидкостью Шампи с Na2S. В цитоплазме,
так же как и в хлопьевидном содержимом альвеол, выявляются кислые жиры
при окраске нильским голубым. Для плазмодиев характерно наличие глико-
гена, дающего положительную реакцию PAS (табл. XXIII, Г), который
полностью разрушается а-амилазой (табл. XXIII, Д) и диастазой, плохо
растворяется в холодной воде, а в горячей — гораздо медленнее, чем гликоген
многоклеточных организмов. С жидкостью Люголя он дает красновато-
коричневое окрашивание. Количество гликогена и жира зависит от места
обитания плазмодия. Методом окраски метиловым зеленым—пиронином
выявляется значительная пиронинофилия цитоплазмы, исчезающая при пред-
варительной обработке РНКазой. Окраска цитоплазмы галлоцианином—
хромовыми квасцами также убирается РНКазой, что говорит о наличии
большого количества в ней РНК. РНКаза снимает и окраску ядрышек,
содержащих РНК. Положительную реакцию Фельгена на РНК дают все ядра
плазмодия и стадий спорогенеза. Положительная реакция с альциановым
синим на кислые мукополисахариды обнаруживается в примембранном слое
(гликокаликс) плазмодиев.
О наличии гликогена в плазмодиях известно и из работ других авторов
(Erdmann, 1917а; Петрушевский, 1932; Подлипаев, 1974; Voelker et al.,
1978; Lom et al., 1982), так же как и о наличии капель нейтрального жира
(Biitschli, 1882; Doflein, 1898; Auerbach, 1910b; Davis, 1917; Петрушевский,
1932; Подлипаев, 1974). Из ферментов у плазмодиев мы выявили кислую
(табл. XXIII, А, Б) и щелочную фосфатазы (табл. XXIII, В), а также сукци-
натдегидрогеназу (табл. XXIV, В, Г). Подробно об их локализации будет
сказано позже (см. с. 58). Кислая фосфатаза была нами выявлена на поверх-
ности Myxidium lieberkuhni из мочевого пузыря щуки. У паразита желчного
пузыря М. gasterostei на поверхности выявлялась щелочная фосфатаза, а по-
ложительная реакция на кислую фосфатазу отмечена лишь в некоторых
участках цитоплазмы, причем значительной она была лишь в местах повреж-
дений плазмодия. Листебаргер и Митчелл (Listebarger, Mitchell, 1981) также
не выявили кислой фосфатазы на поверхности Chloromyxum trijugum
из желчного пузыря, а обнаружили ее в вакуолях. Реакция на арил-сульфа-
тазу, проведенная ими, дала отрицательный результат.
54
Цитохимия зрелых спор
Многие исследователи пытались выявить химизм составных частей»’спор
(Biitschli, 1881b; Thelohan, 1890а, 1890b, 1895; Davis, 1917; Kudo, 1918, 1921a;
Bond, 1937, 1938; Lom, 1964, 1981; Успенская, 1977; Kalavati, 1981; Bajpai,
Holdar, 1982). Эти данные обсуждаются в ряде обзорных работ (Lom, 1964;
Шульман, 1966; Mitchell, 1977; Успенская, 1977). Наиболее подробные
наблюдения проведены Кудо и Ломом (Kudo, 1921а; Lom, 1964). Кудо
показал, что аммиачный раствор окиси меди, растворяющий целлюлозу,
не действует на створки спор миксоспоридий, что жидкость Люголя
окрашивает целлюлозу в темно-коричневый цвет, а створки — в слабо-
желтый, и что смесь раствора Люголя и серной кислоты окрашивает целлю-
лозу в фиолетовый цвет, хитин — в голубовато-желтый, а створки — в слабо-
желтый; окраска хлор—цинк—иодом придает целлюлозе голубовато-фиоле-
товый цвет, хитину — темно-коричневый и створкам спор — светло-желтый.
В опытах Кудо створки спор миксоспоридий растворялись полностью при
кипячении в концентрированной серной кислоте. При кипячении в соляной
кислоте створки разрушались, а при комнатной температуре — частично
растворялись и делались тонкими. В азотной кислоте и при кипячении, и при
комнатной температуре они лишь разбухали. На основании этих опытов Кудо
приходит к выводу, что створки не содержат ни целлюлозы, ни хитина. Кроме
того, этот же автор отмечает, что створки окрашиваются метиленовым синим
в 0.01%-ном КОН по Леффлеру — в темно-фиолетовый цвет, по Гимза —
в ярко-красный; аммиачный раствор азотно-кислого серебра по Фонтану
окрашивал створки в темно-коричневый цвет (Kudo, 1921а; см. также:
Шульман, 1966).
Лом (Lom, 1964) показал, что окраска хлор—цинк—иодом на хитин
не дала положительных результатов. По его данным, реакция тетразониевого
сочетания на трипсин, гистидин, триптофан по Берстону дает только слабое
окрашивание створок; реакция азосочетания на тирозин не дает результатов;
реакция с надмуравьиной кислотой и альциановым синим на SS-группы
отрицательна; DDD-реакция на SH-группы дает слабую положительную
окраску; кислые мукополисахариды также не выявлялись по PAS и с альциа-
новым синим. В опытах Лома створки спор миксоспоридий растворялись,
при щелочном гидролизе в NaOH в автоклаве и в 30%-ном КОН после 9 мин
кипячения, но были устойчивы к перевариванию трипсином и пепсином.
Створки дают положительную реакцию с сулемовым бромфеноловым синим
на общие белки. Лом отмечает, что после щелочного гидролиза в 30%-ном
КОН при комнатной температуре окраска эта делается более интенсивной.
На основании своих данных Лом приходит к выводу, что створки миксоспори-
дий имеют протеиновую природу и состоят из очень стабильного протеина,
скорее всего из кератиноподобного, сходного с содержащимся в зубцах три-
ходин и, как и у последних, не дающего оптической анизотропии. Калавати
(Kalavati, 1981) отмечает, что створки окрашиваются всеми способами на
общие белки.
По нашим данным, створки спор окрашиваются сулемовым бромфено-
ловым синим, для створок развивающихся спор характерна пиронинофилия,
и в них го Фельгену выявляются дегенерирующие ядра. О наличии РНК и
ДНК в таких створках писали и другие авторы (Chakravarty et al., 1962).
Поскольку створки происходят из видоизмененной цитоплазмы вальвогенных
клеток, то на разных этапах их развития в них можно обнаружить характер-
ные для цитоплазмы химические вещества. После завершения формирования
они действительно состоят из очень стойких белков. Их не удавалось раство-
рить пепсином, трипсином, аптечным желудочным соком, проназой, лизоци-
мом, додецилсульфатом. В нашем с В. И. Гельфандом опыте невыстрелившие
споры не растворялись в течение часа в 0.1%-ном растворе дитиотреитола.
Требуются еще дальнейшие исследования, чтобы определить их химический
состав.
55
Амебоидный зародыш, по нашим данным, красится на основные белки,
содержит капли нейтрального жира, гранулы гликогена или его скопление
в виде иодофильной вакуоли; цитоплазма дает реакцию на РНК, ядра интен-
сивно красятся по Фельгену, ядрышко содержит РНК (Успенская, 19796,
1982в).
Эти данные подтверждают и расширяют сведения, полученные другими
авторами. Так, Хакраварти и Маити с соавторами (Chakravarty et al., 1962;
Maiti et al., 1964) отмечают присутствие РНК в цитоплазме и ядрышке и ДНК
в ядре амебоидного зародыша. Многие авторы указывают на наличие глико-
гена в иодофильной вакуоли (Thelohan, 1889; Keysselitz, 1908а; Kudo, 1918,
1921а, 1921b; Bond, 1940; Walliker, 1968; Galinsky, Meglitch, 1969; Подли-
паев, 1974; Desser, Paterson, 1978; Подлипаев, Шульман, 1978); отмечались
также и жировые включения (Петрушевский, 1932; Bond, 1940). Об исследо-
ваниях химизма стрекательного аппарата спор миксоспоридий будет гово-
риться в специальной главе (см. с. 64—67).
Окружающее створки споры слизистое вещество, по данным Лома и
Вавры (Lom, Vavra, 1963b), красится толуидиновым синим в слабо-красный
цвет, по данным Калавати (Kalavati, 1881), дает положительную реакцию
на кислые мукополисахариды по PAS, с альциановым синим и диализованным
железом.
ИССЛЕДОВАНИЕ СПОСОБОВ ПИТАНИЯ И ТИПОВ ОБМЕНА ВЕЩЕСТВ
У ПЛАЗМОДИЕВ МИКСОСПОРИДИЙ ИЗ РАЗНЫХ МЕСТ ОБИТАНИЯ
При исследовании миксоспоридий из разных мест обитания под электрон-
ным микроскопом и при изучении их цитохимических особенностей выяв-
ляется значительное разнообразие, в ультратонком строении их поверхности,
способах питания и типе обмена. В этом аспекте нами было проведено сравни-
тельное изучение как видов, обитающих в полостях, так и обитающих в тка-
нях (в том числе внутриклеточных) миксоспоридий. Были изучены полостные
миксоспоридии — Myxidium Ueberkuhni из мочевого пузыря щуки и М. gaste-
rostei, М. perniciosum, Sphaeromyxa hellandi, S. cottidarum, S. elegini из
желчного пузыря морских и пресноводных рыб; тканевые миксоспоридии —
Myxosoma cerebralis из хрящевой ткани лососевых, Myxobolus disparoides
и Henneguya lobosa из жабр маринки и щуки, Henneguya oviperda из яйце-
клеток щуки, Kudoa quadratum из мышечных волокон бычка Myoxocepkalus
scopius.
Способы питания трофозоитов миксоспоридий
Форма тела и строение поверхности плазмодия теснейшим образом
связаны со способом его питания. У миксоспоридий к настоящему времени
известны все возможные типы клеточного питания (Успенская, 1981 в, 1981г,
19826). Доказано, что многие амебоидные плазмодии питаются при помощи
фагоцитоза. Так, известно, что Myxosoma cerebralis (Успенская, 19796)
способна фагоцитировать хрящевые клетки (табл. XXV, Б); Myxobolus гапае
(Guyenot, Naville, 1822) активно, с помощью псевдоподий, отторгает эпите-
лиальные клетки и фагоцитирует их; Kudoa quadratum фагоцитирует пучки
протофибрилл, и они затем видны в вакуолях (Успенская, 1981г, 19826).
Пищеварение при этом осуществляется в цитоплазме плазмодия, в фагосомах
и пищеварительных вакуолях с помощью ферментов лизосом (внутри-
клеточное переваривание).
Для исследованных миксоспоридий доказано и внеклеточное, наружное
переваривание пищи, или дистантное пищеварение. Давно из-
вестно, что Myxosoma crebralis осуществляет ферментативное расщепление
основного вещества хряща лососевых (табл. XXV, А), эти плазмодии активно
передвигаются в полостях, возникших в результате такого расщепления
(Hofer, 1903; Plehn, 1924; Успенская, 1955а, 19556, 1957, 19796; Holliday,
56
1973, 1974, 1976). Установлено, что Myxidium lieberkuhni с помощью фермен-
тов, выделяемых ножкой, растворяет мукополисахариды межклеточников
(табл. XXV, Г) стенки мочевого пузыря щуки (Успенская, 1966). Попытка
выявить у М. lieberkuhni гиалуронидазу не увенчалась успехом (Успенская,
1966). Как оказалось, межклеточники мочевого пузыря щуки не содержат
гиалуроновой кислоты (Гинецинский, 1964), а потому и фермент, растворяю-
щий их, должен быть иным. Kudos quadraium из мышечных волокон бычка
(табл. XXV, В) лизирует находящиеся снаружи мембраны плазмодиев пучки
протофибрилл мышечного волокна (Успенская, 1981 в, 1981г). Лизис мышеч-
ной ткани считается свойственным представителям рода Kudoa и некоторым
видам родов Henneguya и Myxobolus (см. также обзор: Ковалева, Шульман,
1978; Mitchell, 1977). Отмечается, что они вызывают гистолиз не только
содержимого клеточного волокна, но и сарколеммы и всей окружающей
волокно ткани, причем гистолиз усиливается после смерти хозяина, отчего
рыба становится непригодной в пищу, даже если после вылова ее хранили
в холодильнике. А. В. Лосева (1973; цит. по: Ковалева, Шульман, 1978)
наблюдала в пораженной ткани повышенную ферментативную активность.
В зараженной мускулатуре была выявлена, в частности, повышенная актив-
ность протеаз (Konagaya, 1980; Okada et al., 1981).
Часть продуктов, полученных в результате расщепления тканей выделяе-
мым наружу ферментом, утилизируется плазмодием с помощью п и н о ц и-
т о з а, который играет большую роль во всасывании пищи у миксоспоридий.
Пиноцитозные вакуоли (табл. VI, В) располагаются у основания микроворси-
нок щеточной каймы полостных миксоспоридий (Lom, 1969; Успенская,
1969). У внутриклеточных Henneguya oviperda эктоплазма пронизана пино-
цитозными каналами, на дистальном конце которых отшнуровываются пино-
цитозные пузырьки (табл. IX, А). Наличие таких пиноцитозных каналов
считается характерной чертой крупных плазмодиев тканевых миксоспоридий
(Current, Janovy, 1976, 1977, 1978; Desser, Paterson, 1978; Current, 1979;
Current et al., 1979). Очень сильно развиты такие пиноцитозные каналы
у паразитов жаберной ткани Henneguya lobosa из щуки и Myxobolus disparo-
ides из маринки (табл. VIII, А, Б; IX, А, Б). Наличие у последнего сложно
устроенного надмембранного слоя (табл. IX А, Б\ см. также с. 33) не препят-
ствует проникновению питательных веществ к элементарной мембране плаз-
модия, от которой внутрь эктоплазмы отходит большое количество длинных
пиноцитозных каналов. Можно предположить, что через электронно-прозрач-
ные участки надмембранного слоя, как сквозь поры, проникают питатель-
ные вещества. Может быть, при изгибании поверхности, укрепленной пира-
мидками из электронно-плотного вещества, и при сближении вершин этих
пирамидок жидкость, омывающая паразита (лимфа, плазма крови), отжима-
ется в сторону плазматической мембраны, имеющей высокую пиноцитозную
активность (Успенская, 1981 г).
Грассе и Лаветт (Grasse, Lavette, 1978) называют миксоспоридии микро-
фаготрофами на том основании, что их мембрана обладает высокой пиноци-
тозной активностью. Ранее Грассе (Grasse, 1960) считал миксоспоридии
осмотрофами. Наличие у них микроворсинок на поверхности он рассматривал
как способ ее увеличения при осмотрофном питании.
После обоснования теории пристеночного или мембранного пищеварения
у высших животных (Уголев, 1962, 1967), структурной основой которого яв-
ляются микроворсинки кишечных клеток, С. С. Шульман (1966) предполо-
жил, что наличие такого типа пищеварения характерно и для миксоспоридий,
так как поверхность их покрыта микроворсинками. Однако существование
микроворсинок само по себе не является доказательством наличия пристеноч-
ного пищеварения. Так, например, клетки почечных канальцев также имеют
щеточную кайму, однако функция, так же как и ультраструктура щеточной
каймы кишечных клеток, сильно отличается от таковых почечных канальцев
(Уголев, 1967). Основная особенность пристеночного пищеварения по
А. М. Уголеву в том, что оно осуществляется ферментами, фиксированными
57
на клеточной мембране, и происходит на границе внеклеточной и внутри-
клеточной среды. В физико-химическом аспекте этот процесс напоминает
гетерогенный катализ на неоднородных поверхностях (Уголев, 1967). По
представлениям А. М. Уголева, возникновение микроворсинок — это важный
этап в эволюции пристеночного пищеварения; однако пищеварение за счет
ферментов, сорбированных на внешней стороне клеточной мембраны, воз-
никло, по-видимому, в процессе филогенеза значительно раньше, чем появи-
лись микроворсинки (дрожжи, бактерии).
Применив методы световой и электронной цитохимии, мы доказали, что
одним из способов питания миксоспоридий действительно является пищева-
рение по типу пристеночного, контактного или мембранного (Успенская,
1966, 19786, 1981 г). Оно имеет сходство с пищеварением в кишечнике млеко-
питающих (Уголев, 1962, 1967, 1972) и облегчает активный мембранный
транспорт. Нами было показано наличие в зоне щеточной каймы, на наруж-
ной поверхности микроворсинок, кислой и щелочной фосфатаз — ферментов,
играющих роль при этом типе пищеварения. Локализация ферментов на
наружной поверхности мембраны микроворсинок подтверждает наличие
мембранного пищеварения, при котором в зоне щеточной каймы происходит
расщепление макромолекул на мономеры, что облегчает их всасывание
(Уголев, 1962, 1967). В этой зоне у миксоспоридий наблюдается положи-
тельная реакция с альциановым синим на мукополисахариды, что характерно
для гликокаликса. Кислая фосфатаза была обнаружена нами у Myxidium
lieberkiihni (Успенская, 1966). При этом у плавающих форм фермент выяв-
ляется по всей периферии плазмодия (табл. XXIII, А), а у форм, прикреп-
ленных к стенке пузыря, — только на поверхности, обращенной в полость
мочевого пузыря (паразит получает питательные вещества из мочи). Ножка,
которая внедряется в межклеточники эпителия мочевого пузыря и не прини-
мает участия во всасывании пищи, не обладает фосфатазной активностью
(табл. XXIII, Б) — она выделяет фермент, лизирующий мукополисахариды
межклеточников стенки мочевого пузыря, и, возможно, продукты лизиса
обогащают мочу питательными веществами. Плазмодии, у которых цито-
плазма забита зрелыми спорами и которые уже прекратили питаться, не
имеют фосфатазной активности в зоне щеточной каймы, а молодые почки,
сидящие на таком плазмодии, дают интенсивную реакцию на фосфатазу
(табл. XXIII, А). Эти данные говорят о том, что различные участки плазмодия
в разные периоды его жизненного цикла принимают неодинаковое участие
в питании (Успенская, 1966).
У Myxidium gasterostei и видов рода Sphaeromyxa, у которых микровор-
синки образуют густую щеточную кайму, в зоне этой каймы выявлена
щелочная фосфатаза (табл. XXIII, В). На поверхности Kudoa quadratum,
внутриклеточного паразита, также была выявлена щелочная фосфатаза.
У всех этих миксоспоридий методом с альциановым синим в надмембранном
слое выявляются мукополисахариды (Успенская, 1981в). Размеры микровор-
синок у них близки к таковым в кишечнике млекопитающих. У основания
микроворсинок отшнуровываются от мембраны пиноцитозные вакуоли.
У миксоспоридий с густой щеточной каймой последние, как и в кишечнике
млекопитающих, могут рассматриваться в качестве пористого катализатора
(Уголев, 1962). Щеточная кайма сильно увеличивает всасывающую поверх-
ность, что в таких бедных питательными веществами жидкостях, как моча
и желчь, может иметь существенное значение.
Таким образом, сравнительное изучение миксоспоридий из разных мест
обитания доказывает наличие у них всех возможных способов питания и
типов пищеварения, по-разному комбинирующихся в зависимости от пищи,
которую они могут получить в данном органе или ткани хозяина: 1) внекле-
точное (дистантное) переваривание за счет ферментов, выделяемых пара-
зитом наружу; 2) пиноцитоз и фагоцитоз с последующим внутриклеточным
перевариванием; 3) мембранное пищеварение с последующим активным
транспортом.
58
Именно приспособление миксоспоридий к самым разнообразным условиям
существования в организме рыбы привело к наличию у них всех возможных
типов питания, которые могут по-разному комбинироваться у разных видов.
С. С. Шульман (1966) считает пристеночное пищеварение основным способом
питания миксоспоридий, который сыграл большую роль в эволюции полост-
ных форм, пошедших по пути интенсификации пристеночного пищеварения.
Проведенное сравнение убеждает нас в том, что у миксоспоридий в боль-
шинстве случаев сочетаются два или все три типа пищеварения: дистант-
ное, пристеночное, внутриклеточное. Чаще всего они допол-
няют друг друга, и трудно говорить о доминировании одного из них (У Myxo-
soma cerebralis — дистантное, фагоцитоз, внутриклеточное; у Kudoa quadra-
tum— пиноцитоз, фагоцитоз, дистантное, пристеночное и т. д.).
Приведенные данные не противоречат взглядам А. М. Уголева (1967),
который полагает, что все три механизма гидролиза пищевых веществ имеют
место на всех ступенях эволюционной лестницы. Каждый из основных типов
пищеварения обладает достоинствами, только ему присущими, и это позво-
лило им не только сохраниться, но и прогрессировать в процессе эволюции;
однако каждый тип пищеварения одновременно обладает и ограничениями.
Достоинства и ограничения этих механизмов и привели к тому, что в про-
цессе эволюции большинство организмов стало их сочетать.
Представление об обмене веществ
у миксоспоридий
В литературе практически отсутствуют данные о метаболизме миксоспо-
ридий. Мы сопоставили полученные нами сведения по цитохимии этих
паразитов (из разных мест обитания в организме рыбы) и скудные литера-
турные данные об их ферментативой активности с имеющимися суждениями
о метаболизме других паразитических организмов. На основании такого
сопоставления мы попытались составить представление об обмене веществ
у миксоспоридий, которое может расцениваться лишь как предварительное
и ценность которого в том, чтобы указать на пути изучения этой проблемы.
Из перечисления мест обитания изученных нами видов миксоспоридий
(см. с. 56) видно, что среди них встречаются виды, живущие в аэробных (жа-
берные лепестки, хорошо снабжаемые кровью и омываемые водой, кровенос-
ные сосуды), полуанаэробных (мочевой и желчный пузыри некоторых рыб)
и анаэробных условиях (основное вещество хряща, мышечные волокна).
Соответственно и обмен у них может идти или по аэробному, или по анаэроб-
ному пути.
Известно, что у паразитических животных, живущих в анаэробных
условиях, основным запасным питательным веществом является гликоген,
а эктопаразиты, живущие в аэробных условиях, способны утилизировать и
другие вещества (Brand, 1950, 1952, 1966). Для паразитических животных
ранее было показано, что о типе обмена у них можно судить по количеству
гликогена и экскреторного жира в их тканях и клетках (Brand, 1950, 1952,
1966; Марков, 1950, 1958, 1961; Oldung, 1955; Пальм, 1967, 1968; Гинецин-
ская, 1968, и др.). У оксибионтов количество этих веществ гораздо меньше,
чем у аноксибионтов. Этот критерий мы попытались применить при оценке
типа обмена веществ у миксоспоридий из разных мест обитания.
Для гельминтов было доказано, что индикатором перехода от аэробного
образа жизни к облигатному анаэробиозу может служить соотношение
сукцинатдегидрогеназной и фумаратредуктазной активностей (Brand, 1966;
Сопрунов, 1971).
Экспедиционные условия сбора материала большей частью не давали
возможности исследовать ферментативную активность, поэтому лишь в неко-
торых случаях нам удалось провести опыты по выявлению сукцинатдегидро-
геназной активности - индикатора цикла Кребса у этих животных (Пирс,
1965; Штрауб, 1965; Pearse, 1968, 1972; Ленинджер, 1974).
59
Применив реакцию PAS и реакцию на нейтральный жир (судан III,
жидкость Шампи с Na2S), мы установили, что цитоплазма мелких плазмо-
диев Myxosoma cerebralis содержит крупные гранулы гликогена и капли
нейтрального жира (видимо, экскреторного). Обитая в анаэробных условиях
основного вещества хряща, они используют в качестве главного источника
энергии гликоген. Углеводы эти плазмодии получают, лизируя богатое поли-
сахаридами основное вещество хряща и фагоцитируя хрящевые клетки.
Можно считать, что обмен у вегетативных стадий М. cerebralis совершается
по типу анаэробного (Успенская, 19796). Анаэробным метаболизмом обла-
дают также Kudoa quadraturn из мышечных волокон бычка. Цитоплазма
этих плазмодиев богата гликогеном (табл. XXIV, А). Метод с Суданом III
выявляет мелкие, диффузно распределенные по цитоплазме плазмодия
капли нейтрального жира. Многократное повторение опыта по выявлению
сукцинатдегидрогеназной активности у К- quadratum дало отрицательные
результаты. Отрицательные результаты были получены и при попытке выя-
вить сукцинатдегидрогеназу у плазмодия Myxobolus musculi, паразити-
рующего в мышцах леща. Должно быть, энергию эти паразиты получают
путем гликолиза, используя как основной источник энергии гликоген. Это
несомненно связано с таким местообитанием, как мышечная ткань рыб (в ос-
новном белая мускулатура), где при работе создаются почти анаэробные
условия. Для этой ткани характерно явление кислородной задолженности,
а способами производства энергии являются анаэробное превращение
креатинфосфата и анаэробное расщепление углеводов (Ленинджер, 1974).
В отличие от Myxosoma cerebralis и Kudoa quadratum паразиты жаберных
лепестков являются аэробами. Так, у Myxobolus disparoides из маринки
и у Henneguya lobosa из щуки, которые локализуются в жаберных лепестках
в непосредственной близости к кровеносным капиллярам и отделяются
от внешней среды лишь тонким слоем жаберного эпителия, хорошо выражена
сукцинатдегидрогеназная активность (табл. XXIV, Г). Соответственно угле-
воды в их обмене не играют большой роли. В цитоплазме плазмодиев почти
отсутствует гликоген. Интенсивная положительная реакция PAS наблю-
дается лишь в иодофильной вакуоли зрелых спор, в центральной части
плазмодия (табл. XXIV, Б).
Что касается полостных миксоспоридий, то картина здесь оказалась
менее ясной. Myxidium lieberkuhni, паразит мочевого пузыря щуки, содер-
жащий в цитоплазме довольно большое количество гликогена и крупные
капли нейтрального жира, в то же время обладает высокой сукцинатдегидро-
геназной активностью (табл. XXIV, В). Возможно, что особенности анатомии
выделительной системы щуки, а главным образом особенности водно-соле-
вого обмена пресноводных рыб, создают условия для повышенной сукцинат-
дегидрогеназной активности у паразитов мочевого пузыря. Пресноводные
рыбы — гипертоники по отношению к внешней среде. Защищаясь от осмоти-
ческого действия проходящей через жабры воды, им приходится постоянно,
при помощи активной клеточной деятельности, выделять огромное количество
воды через почки и мочевой пузырь (Гинецинский, 1964; Штрауб, 1965;
Шульман, 1966). Для них характерно обильное отделение гипотонической
мочи (Гинецинский, 1964). У щуки образуется резко гипотоническая моча,
почти лишенная Na. Известно, что клетки органов, связанных с активным
транспортом Na, обладают высокой сукцинатдегидрогеназной активностью.
У пресноводных рыб эту функцию осуществляют экскреторные клетки жабр
и клетки дистальных канальцев почки, которые соответственно и обладают
такой активностью (Гинецинский, 1964).
Может быть, у М. lieberkuhni, который обитает в мочевом пузыре и омы-
вается гипотонической мочой, усиленная сукцинатдегидрогеназная актив-
ность связана с регуляцией концентрации ионов Na в его цитоплазме.
Однако возможно, что повышенная скорость водного обмена приводит к не-
полному обеднению кислородом фильтрующейся через почки жидкости, и его
количества достаточно для протекания аэробных процессов в плазмодии
60
M. lieberkiihni. Так, известно, что мелкие сосальщики из мочевого пузыря
лягушки имеют обмен веществ, близкий к оксибиозу (цит. по: Марков, 1958).
Можно было бы подумать, что наличие крупных капель жира В цито-
плазме М. lieberkiihni приводит к неспецифической адсорбции дитетразолия
липидами (Pears, 1972), однако и при фиксации ацетоном—ЭДТА сукцинат-
дегидрогеназная активность не снимается, лишь распределение формазана
делается более диффузным.
Обитатели желчного пузыря — Myxidium gasterostei из колюшки и виды
рода Sphaeromyxa из морских рыб — содержат значительное количество
гликогена (табл. XXIII, Г) и мелкие, диффузно распределенные по цито-
плазме капли нейтрального жира, отчего при окраске Суданом III создается
слабо оранжевый фон. Что касается сукцинатдегидрогеназной активности
у паразитов желчного пузыря, то у Myxidium gasterostei из колюшки окисле-
ние нитросинего тетразолия шло до образования моноформазана, а у мелких
плазмодиев М. incurvatum из желчного пузыря бычка Myoxocephalus scor-
pius сукцинатдегидрогеназная активность не обнаружена вовсе.
На основании этих еще не полных данных по цитохимии миксоспоридий
создается впечатление, что их нельзя отнести ни к облигатным аэробам,
ни к облигатным анаэробам. Похоже, что они могут обладать набором
ферментов и аэробного, и анаэробного обмена. Это положение подтверждает
тот факт, что среди миксоспоридий существуют виды (например, из рода
Myxobolus и др.), которые могут обитать в разных тканях и органах как
в аэробных, так и в анаэробных условиях. Кроме того, разные стадии миксо-
споридий — плазмодии и споры (последние всегда выводятся во внешнюю
среду) — могут иметь разный тип обмена (все стадии развития миксоспори-
дий имеют митохондрии).
Обмен веществ у миксоспоридий может идти и по аэробному, и по анаэроб-
ному пути, однако о характере обмена нельзя судить a priori исходя лишь
из факта хорошего или плохого снабжения кислородом органа или ткани,
где обитает паразит. Должны быть учтены многие факторы, не всегда лежа-
щие на поверхности. Поэтому необходимо изучение каждого конкретного
случая отдельно.
Как и другие паразиты внутренних органов (Марков, 1958), миксоспо-
ридии могут быть аноксибионтами, способными длительно существовать
при низком парциальном давлении кислорода или даже при полном его
отсутствии.
Приведенные здесь данные не дают возможности судить о том, какими
точно путями совершается у миксоспоридий анаэробный обмен и как адапти-
рован их метаболизм к паразитизму. У гельминтов, например, выявлены
уникальные адаптивные изменения путей углеводно-жирового и энергетиче-
ского обменов, которые связаны с выделением энергии за счет превращения
жирных кислот в углеводы на аэробной фазе и углеводов в жирные кислоты
на анаэробной фазе жизненного цикла. У них цепочка тканевого дыхания
укорочена: водород не переносится к кислороду, а идет на синтез жирных
кислот. Кроме того, произошла деградация цикла Кребса: дикарбоновый
отрезок цикла у анаэробов сохраняется, но функционирует в обратном
направлении; у аэробов преобладает окисление сукцината в фумарат, у анаэ-
робов — обратная реакция восстановления фумарата в сукцинат. Обмен
веществ гельминтов кишечника (анаэробов) характеризуется не только
изменением направления энзиматической реакции фумарат—сукцинат, но и
ее усложнением. Фумаратредуктазная реакция сопряжена с фосфорилиро-
ванием, благодаря чему у гельминтов вдвое увеличивается энергетическая
эффективность анаэробного распада углеводов. У гельминтов имеется также
активный пентозо-фосфатный путь, гликолиз у них происходит с некоторыми
специфическими чертами (Сопрунов, 1970, 1971). Для миксоспоридий все
эти стороны обмена веществ совершенно не выяснены.
Характер превращения углеводов в жирные кислоты на разных стадиях
жизненного цикла гельминтов зависит от условий их обитания. Так, у полово-
61
зрелой (анаэробной) стадии жирные кислоты выделяются как отбросы,
лишенные энергетической ценности в анаэробных условиях кишечника, или
они закладываются в яйца как энергетический резерв для обмена будущей
аэробной личинки (Сопрунов, 1971). У миксоспоридий, принадлежащих
к семейству Myxobolidae, в качестве энергетического резерва заклады-
вается гликоген в иодофильной вакуоли, что, может быть, является указанием
на то, что спороплазма у этих видов имеет анаэробный обмен. Последнее
вполне возможно, так как споры долгое время находятся на дне водоема
в илу, в остатках гниющей рыбы (в случае ее гибели) без достаточного
доступа кислорода.
У паразитических простейших пути обмена веществ очень разнообразны
и меняются от стадии к стадии. Так, например, у внекишечных эндозоитов
Toxoplasma gondii обнаружен смешанный окислительный метаболизм, вклю-
чающий гликолиз, дыхание и пентозофосфатный путь. Для них характерно
небольшое количество полисахарида амилопектина. У кишечных стадий
(мерозоитов) выявлены ферменты пентозофосфатного пути и диафоразы,
а другие оксиредуктазы не выявлены (Бейер, 1978).
Подробное изучение особенностей метаболизма миксоспоридий — важная
задача. Эти знания нужны при поисках лекарственных средств против
миксоспоридиозов.
Относительно метаболизма спороплазмы есть наблюдения лишь за расхо-
дованием гликогена иодофильной вакуоли: в частности, при содержании спор
в воде в экспериментальных условиях он сначала диффундирует в цито-
плазму амебоидного зародыша, а затем утилизируется им (Galinsky,
Meglitsch, 1969; Подлипаев, 1974; Подлипаев, Шульман, 1978). С. А. Подли-
паев (1974) предполагает, что расходование полисахаридов начинается
в споре еще до попадания ее в воду сразу после потери связи с панспоро-
бластом. После того как гликоген будет израсходован и в цитоплазме,
зародыш погибает. По данным Подлипаева (1974), при комнатной темпера-
туре гибель большинства спор Myxobolus albovy, М. cyprinoides и М. mullery
происходит на 5—7 сут. Эти данные находятся в некотором противоречии
со сведениями о длительности выживания спор разных видов Myxobolidae
в воде. Правда, как Подлипаев (1974), так и Галинский и Меглич (Galinsky,
Meglitsch, 1969) указывают на зависимость скорости утилизации гликогена
в спорах от температуры : повышение температуры ускоряет этот процесс.
Начиная с конца прошлого века многих ученых интересовала длитель-
ность выживания спор миксоспоридий вне хозяина. Телоан (Thelohan, 1895)
изучал споры разных видов и отметил, что в воде они дегенерируют за 1 —
2 мес; Бонд (Bond, 1938) проводил эксперименты со спорами разных видов
миксоспоридий (Myxosoma subtecalis, М. funduli, Myxidium folium, Myxobo-
lus bilineatum) и обнаружил, что споры имеют разные сроки выживания
в воде. Состояние спор он проверял на препаратах, окрашенных по Фельгену
и железным гематоксилином. Критерием гибели были вакуолизация цито-
плазмы амебоида и пикноз его ядер, а также выстреливание полярных нитей.
Сроки выживания спор испытанных им видов колебались от 10 до 20 сут,
а у Myxobolus bilineatum через 28 сут амебоид лишь округлялся, не обнару-
живая других признаков умирания. Лом (Lom, 1964) указывает, что споры
большинства видов родов Myxobolus и Myxosoma могут сохраняться в воде
при температуре 4 °C более года.
Наши опыты с Myxosoma cerebralis (Успенская, 1955а, 19786) показали,
что споры, хранившиеся в течение 4—5 мес в воде с остатками хрящей,
очищенных от мягких тканей, сохраняли жизнеспособность и инвазионность.
При окраске по Фельгену и железным гематоксилином не выявлялось каких-
либо заметных изменений по сравнению с контрольными спорами, только что
добытыми из рыб. Они по-прежнему содержали два гаплоидных ядра, без
признаков дегенерации. Сулемовый бромфеноловый синий и в опыте, и в конт-
роле наиболее сильно окрашивал стрекательные капсулы; витки стрекатель-
ной нити можно было отчетливо видеть при достаточной дифференцировке.
62
Окрашивались также створки споры и цитоплазма амебоидного зародыша.
Последняя не была вакуолизирована и выглядела одинаково в опыте и конт-
роле при разных окрасках. Окрашивание подопытных и контрольных спор
флуоресцентным красителем акридиновым оранжевым 1 : 20 000 показало,
что и ядро, и цитоплазма амебоида и в том, и в другом случае имеют зеленый
цвет. Оболочка спор, хранящихся с осени до весны, оказалась оранжевой,
а у свежевыделенных спор она флуоресцирует зеленым цветом. Таким обра-
зом, в результате применения указанных цитохимических методик не было
замечено каких-либо изменений в строении цитоплазмы амебоидного заро-
дыша и в состоянии его ядер за 4 мес хранения спор в воде.
В наших совместных с О. Н. Юнчисом длительных и еще не завершенных
опытах по проверке выживаемости спор разных миксоспоридий споры ряда
видов из родов Myxobolus и Henneguya после 5 лет хранения в чистой воде
при 4 °C не выстреливали уже в эксперименте с концентрированной мочеви-
ной; амебоид во многих спорах не сохранился, в других был вакуолизирован
и с пикнотическими ядрами. Часть спор в пробе была уже с выстрелившими
нитями и даже с раскрытыми створками. Однако 4 мес хранения на боль-
шинстве из них не сказались пагубно. Эти наши опыты и данные Лома (Lom,
1964) показали, что споры, лучше очищенные от гниющих остатков тканей
рыб, дольше сохраняют жизнеспособность, но, должно быть, это не обязатель-
ное правило для всех, и возможно, что споры каких-то видов способны выдер-
живать анаэробные условия. Так, по данным Ауэрбаха (Auerbach, 1909,
1910с) и в наших опытах споры Myxosoma cerebralis сохранялись более года
среди гниющих остатков хряща. По данным С. С. Шульмана (1966), споры
Myxobolus kawabatae, М. gigi и М. uniporus оставались жизнеспособными
в гнилых остатках рыбьих тканей в течение 2 мес.
Известно, что споры многих видов выдерживают значительную соленость.
По данным Линтона (Linton, 1895; цит. по: Bond, 1938), споры Myxobolus
lintoni могут находиться в морской воде Юсут без ущерба. Бонд отмечает, что
споры четырех видов миксоспоридий из тканей Fundulus heteroclitus имели
одинаковую продолжительность жизни в 1 %-ном растворе поваренной соли и
в питьевой воде (Bond, 1938). Нам приходилось хранить споры морских видов
(роды Sphaeromyxa и Kudoa) в течение 2 и 3 лет, и они сохраняли нормаль-
ный вид и способность выстреливать нить. Однако в опытах С. С. Шульмана
споры морского вида Myxobolus aeglefini гибли в пресной воде за 24 ч.
Споры многих видов хорошо переносят длительное высушивание и замора-
живание. Споры Myxobolus elipsoides сохраняют способность выстреливать
полярную нить после многомесячного высушивания (Thelohan, 1895), а споры
М. aeglifini из тресковых, высушенные на предметном стекле и через 2 года
помещенные в воду, не отличались внешне от свежевыделенных и выстрели-
вали нить (Auerbach, 1910с). Споры М. mulleri выстреливали после 35-суточ-
ного содержания в сухих мазках (Lom, 1964). Споры Myxosoma cerebralis
сохраняли инвазионность и вызывали вспышку заражения после летования
прудов в течение ряда лет (22-месячное — по: Hoffman et al., 1962; 12-лет-
нее— по: Plehn, 1924; Schaperclaus, 1954).
В наших опытах по замораживанию (—20 °C, от 10 мин до 35 ч) и высу-
шиванию спор М. cerebralis с последующей их окраской в течение 5 мин
акридиновым оранжевым (1 : 20 000) споры имели зеленую флуоресценцию
амебоидного зародыша и оболочки, т. е. такую же^как и у свежевыделенных
из рыб.
Споры после 4-месячного высушивания с последующим 30-минутным раз-
мачиванием имели зеленую флуоресценцию амебоидного зародыша и оран-
жевую оболочку. Споры, подвергавшиеся нагреванию до 100 °C в течение
10 мин, имели оранжевого амебоида и оранжевую оболочку. Таким образом,
реакция с акридиновым оранжевым после замораживания и высушивания
амебоида не изменялась по сравнению с контролем, а после нагревания до
100 °C — изменялась. Поскольку ранее считалось, что акридиновый оран-
жевый окрашивает в зеленый цвет живые, а в оранжевый мертвые клетки
63
(Schummelfeder, 1950), то, на основании этих опытов, мы сделали вывод, что
споры М. cerebralis переносят длительное высушивание и, по крайней мере,
3-часовое замораживание (Успенская, 1955а, 19786).
Гоффман и Путц (Hoffman, Putz, 1969, 1971) получили более надежные
данные. Они провели опыты по заражению рыб спорами, подвергавшимися
замораживанию в течение 3. 10, 18 сут и 2, 9, 22 мес, и пришли к выводу, что
споры М, cerebralis выдерживают замораживание при —20 °C в течение
2 мес, сохраняя при этом инвазионность.
Из перечисленных опытов наиболее надежные те, в которых проводилась
проверка на инвазионность. Однако все эти результаты дают представление
о том, что споры многих видов имеют большую стойкость к условиям среды.
Они могут иметь очень длительный период покоя, во время которого, видимо,
чрезвычайно понижен обмен веществ спороплазмы, благодаря чему обеспе-
чивается их выживаемость в течение долгого срока
МЕХАНИЗМ ДЕЙСТВИЯ СТРЕКАТЕЛЬНОГО АППАРАТА
МИКСОСПОРИДИЙ
К настоящему времени имеется не так уж много данных о механизме
действия стрекательного аппарата миксоспоридий. Все авторы сходятся на
том, что при выбрасывании стрекательной нити из капсулы она выворачи-
вается наизнанку наподобие пальца перчатки. Это можно наблюдать под
световым микроскопом в экспериментальных условиях. Как показали иссле-
дования многих авторов, добиться выбрасывания стрекательной нити в экспе-
рименте довольно сложно. Оказалось, что желудочный сок, пепсин, пепсин
с соляной кислотой и трипсин при разных pH не вызывают выстреливания.
Добиться выбрасывания нити удавалось в 1%-ном растворе КОН или NaOH,
5%-ном феноле, известковой воде, углекислом К и Na, 30%-ной перекиси
водорода и концентрированном растворе мочевины 1:1с жидкостью, содер-
жащей споры (см. обзоры: Lom, 1964; Mitchell, 1977; Успенская, 1977).
Механизму действия стрекательного аппарата миксоспоридий много вни-
мания уделял Лом (Lom, 1964). Испытывая разные вещества как с разным,
так и с одинаковым осмотическим давлением, он пришел к выводу, что
стрекательный аппарат миксоспоридий не действует как простой осмометр,
что вещества, вызывающие выбрасывание нити, не изменяют объема поляр-
ных капсул. По его описанию, при применении концентрированного раствора
мочевины, благодаря высокой гипертоничности среды, спора значительно
сморщивается, полярные же капсулы при этом не изменяют своего объема
(насыщенный раствор мочевины при 4-23 °C имеет осмотическое давление
около 255 атм). Затем нить выбрасывается, и спора принимает нормальную
форму, как будто она перестает действовать как полупроницаемая мембрана.
Перед выбрасыванием нити капсула кажется немного менее прозрачной,
как будто ее содержимое начинает как-то изменяться. После выстреливания
нити внутреннее пространство споры начинает сообщаться с внешней средой.
Лом (Lom, 1964) отмечает, что ему не вполне ясно, каким путем мочевина
вызывает выстреливание, однако оно происходит явно не под влиянием осмо-
тического давления, так как растворы NaCl и сахарозы со сходным осмоти-
ческим давлением, наоборот, задерживают выстреливание. Если насытить
раствор мочевины NaCl, то выстреливания не произойдет; нить выбрасыва-
ется лишь в том случае, если уменьшить осмотическое давление NaCl
в растворе мочевины до 70 атм. Сходный результат был получен этим автором
при активации спор из рода Myxobolus раствором Н2О2 в концентрированном
растворе сахарозы. Таким образом, Лом делает вывод, что гипертонический
раствор так изменяет активность содержимого капсулы, что задерживается
экструзия.
Лом сравнивает свои наблюдения с данными Янагиты (Yanagita, 1973)
по выстреливанию книдоцист Coelenterata. Янагита, как это будет сказано
ниже, предполагает наличие stoper-механизма в книдоцистах. По его мнению,
64 '
после разрушения stoper-механизм перестает сдерживать давление или
натяжение, которое существует в капсуле, и нить выбрасывается. Лом (Lom,
1964) приравнивает протеиновую пробочку миксоспоридий к stoper-меха-
низму, но отмечает, что поскольку на нее не действует (в отличие от книдоцист
Coelenterata) тиогликолат натрия и трипсин, но влияет мочевина, то скорее
всего эта пробочка состоит из белков глобулярного типа. Разрушив пробочку,
мочевина может активировать внутреннее содержимое капсулы и вывернуть
филамент, или, что еще более вероятно, разрушение stoper-механизма само
по себе вызывает изменения, в результате которых происходит выстрели-
вание.
Выстрелившая капсула имеет гораздо меньший объем, чем интактная,
а это говорит о том, что здесь не происходит насасывания воды, как было от-
мечено для микроспоридий (Lom, Vavra, 1963а; Успенская, 1977).
Эти рассуждения, однако, оставляют неясным, откуда внутри капсулы
создается такое давление, которое способно вывернуть нить наизнанку,
причем это выворачивание происходит мгновенно, и нить выбрасывается
с огромной силой.
Вопреки мнению Лома, который считает, что осмотическое давление не
играет роли при выстреливании стрекательной нити, в работе 3. С. Донец
и В. П. Соламатовой (1979; Донец, 1982) делается попытка доказать, что
выстреливание стрекательной нити происходит под влиянием осмотического
давления. Однако опыты, проведенные этими авторами, не кажутся доказа-
тельными.
В качестве реагентов они используют достаточно крепкие растворы
едких щелочей (2—4%-ные); pH таких растворов должен быть очень
высоким (13—14). Действие этих растворов может быть аналогичным
действию крепкого раствора мочевины или перекиси водорода, которые
испытывал Лом, и может заключаться в разрушении stoper-механизма
и высвобождении энергии, заключенной в нити и не имеющей отношения
к осмотическому давлению. Никаких надежных контролей к опыту, которые
позволили бы вычленить возможные механизмы действия стрекательного
аппарата, указанные авторы не ставили.
Нам удавалось растворить пробочку более мягкими способами, выдер-
живая споры в экстрагирующих растворах определенного состава (подробнее
см. ниже, с. 66). При перенесении спор с разрушенными пробочками в отмы-
вающие буферные растворы, однако, не происходило насасывания этих
растворов в капсулу и выстреливания нити, что можно было бы ожидать
в случае, если бы осмотическое давление действительно играло роль в этом
процессе.
Как уже говорилось при описании развития стрекательного аппарата, нет
достаточной ясности в том, как возникает стрекательная нить. Если придер-
живаться мнения, что она представляет собой результат вворачивания внутрь
капсулы наружной трубки или внутреннего ее слоя (нам больше импонирует
эта точка зрения), то нужно знать, какие силы могут ввернуть ее внутрь
капсулы. Нам показалось возможным представить себе, что такой тянущей
силой может быть тяж, развивающийся внутри наружной трубки и ограни-
ченный собственной мембраной (табл. XIV, Б). Такой тяж появляется на
определенной стадии развития стрекательного аппарата (Успенская, 1972а,
19766, 1977). Если этот тяж оказался бы состоящим из сократительных
белков, то, мгновенно сократившись, он мог бы с силой втянуть внутрь
капсулы наружную трубку стрекательной нити. При этом внутри капсулы
должно сильно повыситься давление, так как наружная трубка займет зна-
чительный объем нерастяжимой капсулы. После растворения пробочки и
расслабления тяжа при содействии создавшегося уже внутри капсулы давле-
ния нить должна с силой выбрасываться, а стенки капсулы слегка спадаться,
как это заметил уже Лом (Lom, 1964).
Чтобы проверить, играет ли роль тяж при выстреливании нити, были
получены продольные срезы через стрекательную ниты выстрелившую под
5 А. В. Успенская
65
действием мочевины и быстро от нее отмытую. Фотографии со срезов пока-
зали, что хотя внутренняя часть нити сильно вакуолизирована (возможно, что
это артефакт, вызванный действием мочевины), она все же кажется внутри
не пустой (табл. XVI, Б). Для проверки идеи о роли сократимого тяжа
или другой сократительной системы в выстреливании нити были приготовлены
глицериновые модели из зрелых спор (Успенская, 1972а, 19766, 1977), с кото-
рыми проводились опыты. Было выяснено, что воздействие ЭГТА в концент-
рации 2Х10-3 моль/л приводит к выбрасыванию нити у 100% глицериновых
моделей за срок менее 1 мин. Раствор с половинной концентрацией ЭГТА
вызывает выстреливание не всех спор и значительно позднее. Предвари-
тельное выдерживание моделей спор в течение 30 мин в растворе КС1 при
концентрации 0.6 моль/л не повлияло при тех же условиях на выстреливание.
При воздействии в течение 1 сут смесью 1 X10“3 моль/л ЭГТА + 4Х
Х10~3 моль/л АТФ не удавалось получить выбрасывания нити.
Попытки заставить выстрелившую нить ввернуться обратно не увенчались
успехом. Видимо, дело в том, что стрекательный аппарат представляет собой
механизм однократного действия. Однако если выстрелившая модель спор,
отмытая от ЭГТА, помещалась в рабочий раствор, содержащий СаС12 в кон-
центрации не менее 2Х10-4 моль/л и АТФ (2Х1О“3 моль/л), то нить либо
изгибалась, либо, если конец ее был закреплен, спора подтягивалась к этому
концу. В отсутствие ионов Са2+ только с АТФ такого результата не наблю-
далось. С помощью гистохимических методов на уровне как световой, так и
электронной микроскопии внутри нити нами был выявлен кальций
(табл. XIV, В, Г). По методу Педикуле и Гермени (см. Pearse, 1972) было
обнаружено наличие АТФазной активности внутри капсулы.
Эти еще очень предварительные данные говорят о том, что выбрасы-
вание стрекательной нити — активный процесс, и что ионы Са2+ играют
в нем значительную роль. В связи с этим есть основания предполагать
участие сократительных белков в механизме действия стрекательного аппа-
рата миксоспоридий. Энергизация системы, возможно, происходит во время
развития стрекательного аппарата. Активными компонентами системы могут
быть микротрубочки, которые, как уже описывалось (см. с. 51), обвивают
наружную трубку и обнаруживаются в капсуле на разных стадиях ее разви-
тия. Стенки ввернутой стрекательной нити имеют периодическую исчер-
ченность и сами могут быть сократимыми. Какую-то роль в выбрасывании
нити может играть центральный тяж, проходящий в центре наружной трубки.
Лом и Пюторак (Lom, Puytorac, 1973) указывают на то, что после вворачи-
вания нити внурь капсулы последняя заполняется аморфной или паракри-
сталлической субстанцией. Во время вворачивания наружной трубки может
создаваться натяжение в нити, как в пружине (Успенская, 19756, 1977); но
разрушение пробочки само по себе не ведет к выстреливанию, которое про-
исходит только после изъятия ионов Са2+.
Вместе с В. И. Гельфандом мы попытались применить метод иммуно-
флуоресценции для выявления актина и тубулина. Первые опыты не дали
четких результатов. Очень слабое свечение нити наблюдалось в некоторых
случаях в пробах на актин. Опыты эти требуют повторения и развития.
В опытах с колхицином и цитохалазином В, по предварительным данным,
колхицин не оказывал влияния на выстреливание нити, а цитохалазин
несколько задерживал ее выстреливание, после отмывания цитохалазина
способность выстреливать восстанавливалась. В отношении действия цито-
халазина В существуют разные мнения (Cartr, 1967; Estersen et al., 1971;
Burnside, Monasek, 1972; Haltzer, Sanger, 1972; Torer et al., 1972; Kelly,
Sambrook, 1973; Milsson et al., 1973; Axline, Reaven, 1974; Liik et al., 1974;
Shin Lin et al., 1974; Sweigard et al., 1979; Бершадский и др., 1981; Britch,
Allen, 1981, и др.); полагают, в частности, что он влияет на процессы, связан-
ные с образованием и функцией актиновых микрофиламентов.
В отличие от микроспоридий, где спора развивается из одной клетки и
полярная нить, заключенная в одну оболочку с зародышем, по существующей
66
гипотезе (Lom, Vavra, 1963a), может служить для инъецирования зародыша
в ткани хозяина, у миксоспоридий спора — многоклеточное образование,
ее спороплазма заключена в пространстве между створками споры й стре-
кательными капсулами. Считается, что выбрасывание полярной нити служит
для заякоривания спор в тканях хозяина, после чего споры раскрываются
и амебоидный зародыш выходит наружу.
ЦИТОЛОГИЯ ПАР^ЗИТОХОЗЯИННЫХ ОТНОШЕНИЙ
ПРИ ЗАРАЖЕНИИ МИКСОСПОРИДИЯМИ
Паразитической фазой жизненного цикла миксоспоридий являются тро-
фозиты в виде плазмодиев, поэтому понятно, что при обсуждении цитологии
паразитохозяинных отношений речь пойдет именно о взаимодействии
трофозоитов с клетками и тканями рыб. Адаптации к паразитизму осущест-
вляются на всех фазах жизненного цикла паразитов, но инвазионная покоя-
щаяся стадия (спора) миксоспоридий находится во внешней среде, а поэтому
ее адаптации состоят в усовершенствовании путей и увеличении возмож-
ностей попадания спор в хозяина и больше связаны с приспособлениями
к биологии, жизненному циклу и экологии хозяина. Уже в момент проникно-
вения спороплазмы в хозяина может идти речь о взаимоотношении с тканями
и клетками хозяина, но эта часть жизненного цикла миксоспоридий совер-
шенно не изучена.
Как и другие паразитические животные, плазмодии миксоспоридий имеют
разные пути влияния на хозяина: 1) механическое воздействие; 2) отнятие
у хозяина веществ, необходимых для нормальной жизнедеятельности;
3) выделение токсических веществ, действующих локально или на весь орга-
низм хозяина в целом; 4) открытие путей для микробной инфекции; 5) общее
ослабление хозяина и повышение его чувствительности к другим заболе-
ваниям (Догель, 1947, 1962). Биохимических исследований токсического
влияния миксоспоридий на рыбу почти не проводилось (Лосева, 1973, цит. по:
Ковалева, Шульман, 1978; Konagaya, 1980; Okada et al., 1981; см. также
обзор: Mitchell, 1977), поэтому о нем судят по косвенным признакам. Здесь
в основном речь пойдет о механическом воздействии на клетки и ткани в про-
цессе жизнедеятельности трофозоитов (питание, внедрение, закрепление,
вытеснение, давление). Ответ хозяина на паразита выражается в иммунной
и в клеточной и тканевой реакциях (гипертрофия, гиперплазия, воспалитель-
ная реакция и т. п.). Иммунитет еще мало изучен, а потому здесь речь пойдет
о последнем типе реакции.
Как уже говорилось, различаются полостные, тканевые и внутриклеточные
миксоспоридии. Соответственно и адаптации их к среде обитания первого
порядка различны. Это положение хорошо иллюстрируется различиями
в строении поверхности и существованием различных комбинаций способов
питания у видов с разной локализацией.
Среди миксоспоридий существует большое количество видов, вызываю-
щих серьезные заболевания рыб. В этих случаях естественно ожидать наи-
большего разрушения тканей или клеток хозяина. В другом случае, наоборот,
выявляется некое равновесие — взаимная приспособленность паразита и
хозяина. Часто гибель хозяина невыгодна паразиту, и взаимное приспособ-
ление и непатогенность паразита являются выражением длительности су-
ществования системы паразит—хозяин.
В ряде работ по общей паразитологии и паразитологии рыб приводятся
сведения о влиянии миксоспоридий на хозяина (Plehn, 1924; Догель, 1947;
Schaperclaus, 1954; Davis, 1958; Догель, 1962; Шульман, 1966; Mitchell,
1977; Бауэр и др., 1981, и др.). До 70-х годов данных о цитологии паразито-
хозяинных отношений при миксоспоридиозах было мало (Bauer, 1922; Plehn,
1924; Bond, 1938; Noble, 1944; Davis, 1958, и др.). За последние 15—20 лет
появилось довольно много гистопатологических исследований миксоспори-
дий, выполненных на светооптическом уровне (Успенская, 1957; Yasutake,
5*
67
Wood, 1957; Hoffman et al., 1962; Patashnik, Groninger, 1964; Lom, 1970;
Aisa, 1972; Halliday, 1974, 1976; McCraren et al., 1975; Dykova, Lom, 1978;
Heckmann, Jensen, 1978; Yasutake, 1979; Sanaulah, Ahmed, 1980; Smith,
Inslee, 1980; Kabata, Whittaker, 1981; Kalavati, 1981; Sheriff, 1982). Многие
из этих работ освещены в обзоре Митчелла (Mitchell, 1977). На электронно-
микроскопическом уровне аналогичных исследований проведено гораздо
меньше (Lom, Puytorac, 1965а, 1965b; Успенская, 1966, 1969, 1981г, 19826;
Schubert, 1968; Current, Janovy, 1978; Current, 1979; Yamamoto, Sanders,
1979; Listebarger, Mitchell, 1981; Lom, Dykova, 1981, и др.).
В целом полостные миксоспоридии считаются менее патогенными, чем
тканевые (Шульман, 1966; Mitchell, 1977). Среди исследованных нами по-
лостных миксоспоридий примером хорошей приспособленности паразита
к хозяину может служить Myxidium lieberkiihni (Шульман, 1966), который
паразитирует у 100% щук, встречаясь и у сеголетков, и у половозрелых, и
у старых рыб. Даже при очень большом количестве паразитов в пузыре рыба
не имеет внешних признаков заболевания, сильное воспаление мочевого
пузыря также наблюдается редко. Если раньше, при гистопатологическом
исследовании под световым микроскопом, считалось, что М. lieberkiihni
погружает особые отростки (ножки) в клетки эпителия мочевого пузыря и
высасывает их (Biitschli, 1882; Balbiani, 1883; Pfeffer, 1890; Cohn, 1896;
Bauer, 1922), то электронно-микроскопические данные (Успенская, 1966)
ясно показали, что с помощью плазматических выростов (ножек) М. lieber-
kiihni проникает в межклеточное пространство эпителия мочевого пузыря,
а не в клетки (табл. XXV, Г).
Эпителиальные клетки, лежащие в непосредственной близости к ножке,
имеют нормальные ядра и цитоплазму и большей частью остаются совер-
шенно нетронутыми, хотя временами, вследствие механического сжатия,
нарушения целостности эпителиального слоя и отделения клеток от остальной
ткани, наблюдаются их гипертрофия и отслаивание части эпителия. Исполь-
зуя вискозиметрический метод, мы попытались выявить у М. lieberkiihni
гиалуронидазу, но попытка эта не увенчалась. успехом. Оказалось, что
мукополисахариды почечных канальцев рыб не являются ни гиалуроновой
кислотой, ни хондроитинсульфатом С (Гинецинский, 1964), а так как мочевой
пузырь щуки представляет собой простое расширение мезонефридиальных
протоков, то и его межклеточники не должны подвергаться деполимеризую-
щему действию гиалуронидазы. Видимо, нет оснований предполагать наличие
этого фермента и у М. lieberkiihni (Успенская, 1966).
Далее было выяснено, что ножка служит лишь для прикрепления. Ее дея-
тельность, видимо, сводится к растворению вещества межклеточников,
поскольку фосфатаза у прикрепленных особей выявляется только в той части
поверхности, которая обращена в полость пузыря, а в ножке фосфатазная
активность отсутствует. У плавающих плазмодиев вся поверхность обладает
фосфатазной активностью. Трудно сказать, какие вещества получает паразит
из мочи (Марков, 1958; Brand, 1966). Есть данные, что некоторые паразиты
способны утилизировать аммиак.
Расположение микроворсинок на поверхности М. lieberkiihni довольно
редкое. Именно сравнительно редкое расположение ворсинок может ока-
заться более выгодным в такой довольно бедной питательными веществами
среде, как моча. Слишком тесное расположение ворсинок препятствовало бы
свободному току жидкости и способствовало бы образованию застойной
зоны.
Как уже говорилось, возможно, что наличие сильной сукцинат-дегидро-
геназной активности у М. lieberkiihni говорит о приспособлении к жизни
в гипотонической моче щуки. В очень сильно зараженных пузырях моча
бывает густой, содержит слизь, изредка кровь. Видимо, при большом скоп-
лении паразитов продукты их жизнедеятельности оказывают токсическое
действие, следствием является не только гипертрофия эпителиальных клеток,
но и изменение среднего слоя эпителия, а в ряде случаев набухание membrana
68
propria и подслизистой, гиперемия и слабая инфильтрация (Bauer, 1922).
Споры М. lieberkuhni легко выводятся с мочой наружу, и для завершения
цикла не нужна гибель рыбы. v
Такие полостные паразиты, как Myxidium gasterostei, Sphaeromyxa
elegini, S. hellandi, S. cottidarum, обитающие в желчном пузыре, питаются
за счет желчи с помощью пристеночного пищеварения и пиноцитоза (Успен-
ская, 1969, 1981г, 1982в), как и другие представители этих родов (см. обзор:
Mitchell, 1977). Только ранние 8-ядерные стадии Myxidium gasterostei уда-
лось видеть прикрепленными к поверхности эпителиальной клетки, червеоб-
разные и более крупные плазмодии уже плавают в желчи, свернутые один
в другом в трубочку, только самая крупная наружная особь может соприка-
саться со стенками пузыря. Митчелл (Mitchell, 1977), правда, указывает, что
иногда могут происходить закупорка желчных протоков и увеличение печени.
С. С. Шульман (1966) отмечает, что большие изменения инвазированного
органа можно наблюдать в том случае, когда паразит обитает в узких желч-
ных протоках или в почечных канальцах.
Мол нар (Molnar, 1979) описывает гистопатологию при сфероспорозе,
вызванном паразитом почечных канальцев карпа — Sphaerospora angulata.
Плазмодии локализуются исключительно в просвете канальцев, не внедряясь
в эпителий. Эпителиальные клетки и их щеточная кайма остаются интакт-
ными. Однако скопления спор и остатков плазмодиев, разрушившихся после
завершения спорообразования, попадающие в абсорбционный сегмент
канальцев, образуют так называемые гиалиновые цилиндры, закупориваю-
щие просвет и вызывающие нефроз.
Из более патогенных паразитов выделительной системы под электронным
и световым микроскопом изучались Sphaerospora sp. и Mitrospora cyprini
(Lom, Dykova, 1981). Было обнаружено, что ранние стадии инвазируют
клетки эпителия, выстилающего почечные канальцы. В результате паразити-
рования происходят дистрофические изменения эпителия канальцев. Сильное
заражение приводит к расширению канальцев с атрофией эпителиальной
выстилки, пролиферацией гистиоцитов и фиброзом. Функция канальцев
серьезно повреждается.
Митчелл с соавторами (Mitchell et al., 1980) изучали под световым и
электронным микроскопами гистопатологию при заражении желчного пузыря
рыб из семейства центрархид плазмодиями Chloromyxum trijugum. Эти
мелкие плазмодии прикрепляются к эпителиальным клеткам стенок пузыря
с помощью псевдоподий, что приводит к нарушению слизистого слоя.
На месте соединения паразита с клеткой хозяина, на обеих поверхностных
мембранах, разделенных расстоянием в 12.5 нм, образуется зона плотных
бляшек. Пространство между паразитом и клеткой хозяина заполнено
ворсистым материалом. Клетки, к которым прикреплен паразит, имеют
нечеткие границы, меньшую высоту, и ядро их изменено по сравнению
с нормой.
Еще более патогенным является паразитирующий в желчных протоках
печени и в желчном пузыре лососевых Chloromyxum truttae. Его гистопато-
логия пока еще не описана. Клиническая картина — острое воспаление
кишечника, экскременты приобретают желто-бурый цвет, рыба перестает
брать корм, наблюдается желтуха, истощение и смерть. Печень больной рыбы
светлая, желчный пузырь сильно увеличен и гиперемирован. Желчь окрашена
кровью (Бауэр, Никольская, 1940; Семенова, Ковальская, 1975; Семенова
и др., 1976).
Из паразитов пищеварительного тракта под электронным микроскопом
изучен очень патогенный вид Ceratomyxa shasts. Ямамото и Сандерс (Yama-
moto, Sanders, 1979) провели заражение в лабораторных условиях и наблю-
дали развитие паразита стадия за стадией. На 7-е сутки после заражения
уже можно было видеть отдельных, развивающихся мелких плазмодиев, но
изменений в кишечнике рыб еще не наблюдалось. На 14-е сутки уже прои-
зошли определенные изменения в пилорических отростках, проявляющиеся
69
в разрастании соединительной ткани между наружной мускулатурой и эпите-
лиальным слоем. На 21-е сутки заражения этот соединительно-тканный слой
был инфильтрирован большим количеством развивающихся трофозоитов.
Постепенно все слои тканей кишечного тракта оказываются зараженными.
Кишечник вздувается, наблюдаются кровоизлияния, и трофозоиты видны
повсюду в брюшной полости. При наиболее сильном заражении практически
все внутренние органы й мускулатура содержат споры и разные стадии
развития трофозоитов. Могут развиваться крупные нарывы. Ткани кишеч-
ника, печени, почек разрушаются. Смерть обычно наступает на 40-е сутки
после заражения. В основном болезни подвержена молодь, но есть сообщения
о том, что в преднерестовый период наблюдаются большие потери взрослых
лососевых (Mitchell, 1977). Хотя С. schasta встречается в полостях, но все же
она является тканевым паразитом.
Из огромного количества тканевых миксоспоридий известно относительно
небольшое число видов, вызывающих гибель в естественных водоемах.
Однако при искусственном разведении рыб, с увеличением плотности посадки
и возможности контакта здоровых и больных рыб, многие из этих паразитов
становятся опасными. Разные виды родов Henneguya, Myxobolus и Sphaero-
spora, поселяясь в жаберных тканях или кровеносных сосудах жабр, могут
вызвать массовую гибел'ь рыб из-за нарушения дыхательной функции жабер-
ных лепестков.
Нами под электронным микроскопом изучался Myxobolus disparoides
из жабр маринки. Как уже описывалось, М. disparoides имеет особый над-
мембранный слой, который может рассматриваться как адаптация к условиям
существования в жаберной ткани.
Роль этого надмембранного слоя, возможно, сводится к защите плазмо-
дия, придавая ему упругость, необходимую при паразитировании в таких
сравнительно мягких тканях, как жаберная, находящихся под постоянным
давлением воды, тем более что благодаря паразиту в них может быть нарушен
тургор. С другой сторонц, этот слой может выполнять какие-то функции
при питании. То, что он проницаем для питательных веществ, подтверждается
высокой пиноцитозной активностью плазматической мембраны трофозоита.
Видимо, электронно-прозрачные участки проницаемы для веществ, раство-
ренных в лимфе или плазме крови. Через них, как сквозь сито, эти вещества
могут проникать к плазматической мембране, а может быть, при изгибании
поверхности и сближении вершин пирамидок, отжиматься в сторону мемб-
раны.
Можно было бы предположить, что надмембранный слой играет опреде-
ленную роль в осморегуляции (паразиту пресноводной рыбы эти механизмы,
видимо, важны, так же как и самой рыбе). Известно, что гликокаликс и
гликостили амеб имеют существенное значение в регуляции ионного потока
(Page, Blakey, 1979). М. disparoides паразитирует во вторичных жаберных
лепестках, и в боковых, и в терминальных. В зараженном терминальном
лепестке нарушено нормальное расположение клеток, кровеносный сосуд
оттеснен к периферии и сдавлен. От внешней среды паразит отделяется лишь
тонким слоем эпителиальных клеток. С проксимальной стороны жаберного
лепестка к нему примыкают клетки жаберной ткани, клетки крови, столбчатые
клетки и базальная мембрана капилляров, часто вокруг паразита обра-
зуется фиброзный слой. Разрастаясь, плазмодий может пережимать капил-
ляры и кровеносные сосуды, нарушать лимфоотток, и это приводит к атрофии
жаберного лепестки. После созревания спор фиброзная капсула лопается, и
споры выводятся наружу.
Сходные взаимоотношения с тканями хозяина характерны для Heneguya
lobosa. Эти плазмодии также располагаются вблизи кровеносных сосудов
жаберных лепестков, но их надмембранный слой устроен иначе
(табл. VIII, Б). I
Каррент и Джанови (Current, Janovy, 1978) провели сравнительное
электронно-микроскопическое\ исследование двух форм вида Henneguya
70
excUis, одна из которых, поселяющаяся внутри жаберного лепестка, непато-
генна, а вторая, поселяющаяся между лепестками, патогенна. Патогенная
форма располагается первоначально среди базальных клеток и вызывает их
гиперплазию. Базальные клетки замещают большинство остальных типов
клеток нормальной жабры. Жаберный лепесток оказывается состоящим из
базальных клеток и не может участвовать в дыхании.
При заражении непатогенной формой не наблюдается никакой гиперпла-
зии. Паразита окружают нормальные клетки жаберного лепестка хозяина,
которые уплощены и близко прилегают к поверхности плазмодия.
Было показано, что эти две формы Н. excilis отличаются друг от друга
строением поверхности. Как отмечают Каррент и Джанови (Current, Janovy,
1978), поверхность патогенной формы имеет две элементарные мембраны.
Наружная мембрана покрыта гранулярным слоем неравномерной толщины.
Это говорит о том, что он выделяется тканями хозяина. У непатогенной
формы поверхность ограничена одной элементарной мембраной, которая
образует пиноцитозные каналы и покрыта снаружи тонкогоанулярным слоем
одинаковой толщины, последний эти авторы считают принадлежностью
паразита. Этот слой препятствует прямому контакту паразита с клетками
хозяина. Непатогенная форма никогда не находится в близком контакте
с эндотелиальными клетками, выстилающими кровеносные синусы. Как и
в случае с Myxobolus disparoides, плазмодий окружают различные типы
клеток, гиперплазии не наблюдается. Патогенная форма, вступая в контакт
с базальными клетками, вызывает их пролиферацию, приводящую к наруше-
нию дыхательной функции жаберного лепестка. Каррент и Джанови считают,
что различия в строении поверхности отражают разницу в поведении пара-
зита и связаны с патогенностью или непатогенностью этих форм.
Тканевая реакция на заражение двумя другими видами жаберных
паразитов, относящихся к роду Henneguya, изучена Диковой и Ломом (Dy-
kova, Lom, 1978). Так, Н. psorospermica у окуня развивается в артериолах
вторичных жаберных лепестков, а у щуки — в артериях первичного жабер-
ного лепестка. У окуня вокруг плазмодия возникает капсула, стенки которой
образованы эндотелиальными клетками артериолы. По мере роста плазмо-
дия снаружи эндотелиальные клетки капсулы окружаются плоскими эпите-
лиальными клетками вторичных жаберных лепестков. Столбчатый эпителий
между ними исчезает. Гипертрофия эпителиального слоя приводит к образо-
ванию толстой стенки капсулы. Дыхательный эпителий полностью отсутст-
вует. После созревания спор происходит разрыв стенок капсулы. Опусто-
шившаяся или набитая спорами капсула заполняется макрофагами, которые
фагоцитируют споры. Позднее происходит инфильтрация фибробластами
и гистиоцитами, завершающаяся формированием типичной гранулемы.
Наружный слой гранулемы образуется псевдоэпителиальными клетками,
происходящими от мезенхимных клеток. Удалось проследить развитие воспа-
лительного процесса, приводящего к обратному развитию капсулы. Новые
капилляры образовывались на периферии капсулы перпендикулярно к ней.
Поверхность плазмодия оставалась нетронутой. Капилляры прорастали
стенку капсулы. Клетки, участвующие в воспалительном процессе, главным
образом полиморфноядерные, собираются вокруг поверхности капилляров.
Диапедез и разрушение этих клеток вместе с выделением ферментов, видимо,
и приводят к изменению окраски по Гимза этих капсул.
В результате этих наблюдений и оценки данных других исследователей
Дикова и Лом приходят к выводу, что тканевой ответ рыб на инвазию миксо-
споридиями мягких тканей совершается в два этапа. Первый этап наблю-
дается во время роста и созревания плазмодия. Изменения в окружающих его
тканях заключаются в смещении, атрофии, гиперплазии. Если заражение
тяжелое, то функция органа может быть частично или полностью нарушена.
Во время этого периода рыба, видимо, не проявляет защитной реакции
на паразита. Второй этап начинается, когда капсула полна зрелых спор.
На этой стадии имеет место реакция рыбы, выражающаяся в быстром заме-
71
щении капсулы грануломатозной тканью. Эта реакция очень сходна с тако-
вой у млекопитающих. Образованию гранулемы способствует повышение
температуры; должно быть, это связано с изменением паразитохозяинного
равновесия. Известно, что иммунный ответ пойкилотермных животных зави-
сит от температуры (Fin, Nielsen, 1971).
Пока еще мало известно об иммунитете по отношению к миксоспоридиям.
Есть данные, что, в частности, Myxosoma cerebralis избегает выработки
антител, имитируя антигены хозяина (Halliday, 1974; Pauley, 1974).
Калавати (Kalavati, 1981) при помощи гистохимических методов выяснил,
что тканевая реакция на Henneguya waltairensis из жабр Channa punctata
приводит к образованию соединительно-тканной капсулы каллогеновой при-
роды.
Интересный пример взаимоотношения паразита и хозяина представляет
собой паразит мышечного волокна — Kudoa quadratum. В нашем материале
в одном мышечном волокне встречалось всегда по одному плазмодию. Под
электронным микроскопом не удавалось наблюдать разрыва оболочек
мышечных волокон. Такое впечатление, что развитие плазмодия вплоть
до образования зрелых спор протекает внутри одного волокна. Это типичный
внутриклеточный паразит. В межклеточном пространстве мы наблюдали
лишь зрелые споры. Выход их в межклеточники, видимо, осуществляется
после дегенерации плазмодия и отмирания пораженного волокна.
Плазмодии лизируют пучки протофибрилл и усваивают продукты разло-
жения путем пиноцитоза. В ряде случаев в вакуолях попадались не вполне
переваренные протофибриллы, т. е., по-видимому, плазмодии способны фаго-
цитировать более крупные частицы. На поверхности плазмодиев выявляется
щелочная фосфатаза, так что пищеварение может осуществляться и по типу
мембранного. Цитоплазма К. quadratum богата гликогеном. В плазмодиях
не выявляется сукцинатдегидрогеназная активность. Должно быть, их обмен
совершается по типу анаэробного, и в качестве основного источника энергии
используется гликоген.
В том случае если плазмодии не достигли слишком крупных размеров и
не оказывают физического давления на соседнюю ткань, волокна, прилегаю-
щие к зараженному волокну, кажутся нормальными (табл. XXV, Л). Лизиса
мышечной ткани, считающегося характерным результатом паразитирования
Multivalvulea, ни прижизненно, ни после гибели бычков (при содержании
их в холодильнике и при комнатной температуре) Kudoa quadratum не вызы-
вает.
Паразитирование К. quadratum представляет собой, видимо, еще один
пример сбалансированной системы паразит—хозяин. Токсического воздейст-
вия этот плазмодий, вероятно, не оказывает. Повреждается лишь занятое
им мышечное волокно. Описаны и другие случаи внутриклеточного паразити-
рования миксоспоридий в мышечном волокне (Davis, 1924; Mitchell, 1977).
Например, при паразитировании Unicapsula muscularis плазмодии запол-
няют волокно, которое увеличивается вдвое и имеет вид белого червя.
Однако известны случаи энзиматического протеолиза мускулатуры рыб,
зараженных миксоспоридиями родов Kudoa и Hexacapsula: Kudoa histoll-
tica, К. thyrisitis, К. cruciformis, К. musquliquefaciens, Hexacapsula neo-
thuni и др. (Patashnik, Groninger, 1964; Awakura, Kimura, 1977; Mitchell,
1977; Ковалева, Шульман, 1978; Konagaya, 1980, и др.). Некоторые предста-
вители родов Henneguya и Myxobolus приводят к тому же эффекту у пресно-
водных рыб и анадромных форелей и лососей. В этих случаях паразитирова-
ние часто сопровождается у живой рыбы локальными некрозами, появлением
поверхностных язв, а в тяжелых случаях истощением и смертью (Mitchell,
1977). Правда, А. А. Ковалева и С. С. Шульман (1978), разбирая вопрос
о патогенности Multivalvulea в целом, считают единственно достоверным
указание на патогенное воздействие Kudoa clupeidae, вызвавшее заболевание
молоди сельди (Sindermann, Rosenfield, 1954; Sinderman, 1970). На коже
молоди появлялись изъязвления, через которые споры вместе с некротиче-
72
ской тканью выделялись наружу. В язвах развивалась богатая бактериаль-
ная флора, что и приводило к гибели молоди. Ковалева и Шульман приходят
к выводу, что в большинстве случаев при заражении рыб видами рода Kudoa
в системе паразит—хозяин возникает более или менее устойчивое равновесие,
при котором патогенность паразита не велика.
Однако у выловленной рыбы дряблость и разжижение зараженной мы-
шечной ткани могут наступить вскоре после ее гибели, но чаще всего после
нескольких суток хранения в холодильнике даже в замороженном виде. Суще-
ствует мнение, что протеолитические ферменты все время продуцируются
в мышечных некрозах, но в живой рыбе они диффундируют в кровь и денату-
рируются, а после смерти хозяина они становятся локально активными (Mit-
chell, 1977). А. В. Лосева (1973, цит. по: Ковалева, Шульман, 1978), изучив-
шая причины деструкции мяса саблезубого палтуса при обработке, обнару-
жила повышенную ферментативную активность в зараженных тканях. Она
предположила, что миксоспоридии не непосредственно разжижают ткань,
а скорее запускают автолиз, т. е. происходит саморазжижение мышечной
ткани. При разжижении тканей споры миксоспоридий получают возможность
выхода из тела погибшей рыбы.
Канагая (Konagaya, 1980) выявил в мышцах камбалы Limanda, сильно
зараженной миксоспоридиями Kadoa, высокую протеазную активность. Такие
мышцы быстро разжижались при комнатной температуре. Было выявлено два
типа протеаз: А и Б. Протеаза А лизирует гемоглобин при оптимуме pH 3,
протеаза Б лизирует казеин при оптимуме pH 6.5. В мало зараженных мыш-
цах протеаза Б не выявлялась. Мышцы, содержащие обе протеазы, очень
легко желефицировались. С помощью разных биохимических тестов было
выяснено, что эти протеазы принадлежат к группе тиоловых ферментов.
Если представители Multivalvulea и не приводят к гибели рыб, то во вся-
ком случае они снижают товарную ценность рыбы, разжижая мускулатуру
или образуя некротические участки.
Есть данные, не очень понятные с точки зрения привычных представле-
ний о жизненном цикле миксоспоридий (согласно которым заражение проис-
ходит в кишечнике), о том, что флуктуация температур (перепады от 4 до
20 °C или замораживание при —16 °C с последующим медленным оттаива-
нием в течение 8 ч при комнатной температуре) приводит к исчезновению спор
миксоспоридий рода Kudoa и появлению активных трофозоитов в пробах
желефицированных мышц палтуса.
Одним из примеров внутриклеточного паразитизма является Henneguya
oviperda, инвазирующая икринки щук. Ее крупные плазмодии покрыты одной
мембраной, обладающей сильной пиноцитозной активностью. Они заполняют
икринку, отчего последняя имеет молочно-белый цвет и крупнее незаражен-
ных. Цитоплазма овоцита в зараженной икринке отсутствует, ее место занято
плазмодием, снаружи которого располагаются глыбки желтка и оболочки,
характерные для икринки щуки. Паразит использует ресурсы, предназначен-
ные для питания овоцита. Яичник — орган, хорошо снабжающийся кислоро-
дом, богатый кровеносными сосудами. Это, видимо, позволяет трофозоиту
Н. oviperda получать кислород из окружающей его ткани, а потому, судя
по малому количеству в нем гликогена, он оксибионт. Спорообразование
завершается обычно в преднерестовый период (конец марта—май), и, таким
образом, споры выводятся в воду вместе с выметанной икрой. Для процвета-
ния вида выгодно нормальное функционирование яичника; возможно, что
поэтому и не отмечается никакого токсического воздействия паразита.
Однако плодовитость хозяина несомненно снижается, так как зараженная
икринка не развивается в личинку.
К настоящему времени достаточно хорошо изучена гистопатология и
цитология паразитохозяинных отношений у возбудителя вертежа лососевых
(Myxosoma cerebralis), инвазирующего хрящевую ткань. Гистопатология
этого заболевания изучена давно (Plehn, 1904, 1924; Heushmann, 1940,
1949; Dyk, 1952; Luling, 1952; Schaperclaus, 1954; Scolari, 1954; Успен-
73
ская, 1955а, 19556, 1957; Hoffman et al., 1962). M. cerebralis лизирует
хрящевую ткань и, как было выяснено нами (Успенская, 19786), фагоцити-
рует хрящевые клетки. Судя по тому, что плазмодии всегда находятся у края
полости, образовавшейся в результате их жезнедеятельности, и их псевдо-
подии направлены в сторону основного вещества хряща и еще неразрушен-
ных хрящевых клеток, нет сомнения, что полость образуется в результате
энзиматического переваривания хряща ферментами, выделяемыми самим
плазмодием., а не в результате некроза, как думает Холлидей (Halliday, 1973,
1974, 1976). Плазмодии активно фагоцитируют. Полость обычно бывает
свободной от большого количества некротической ткани. Во время активного
роста и питания плазмодиев не наблюдается ответа хозяина
на заражение, а после завершения спорообразования начинается воспа-
лительный процесс, выражающийся в пролиферации гранулемы эпителиаль-
ного типа. Эпителоид окружает массу спор (Hoffman et al., 1962).
По мере окостенения хряща споры оказываются замурованными внутри этих
окостенений. О других аспектах жизнедеятельности М. cerebralis речь будет
дальше. Последнее время этим паразитом усиленно занимаются во многих
странах и особенно в Америке. Много внимания уделено изучению иммуни-
тета у лососевых к М. cerebralis (Halliday, 1974; Pauley, 1974; Markiv, Wolf,
1977, 1978; Griffin, Davis, 1978). Было установлено, что иммунный ответ
на М. cerebralis у форели осуществляется по типу мимикрии, т. е. паразит
избегает выработки антител, имитируя антигены хозяина (Pauley, 1974;
Halliday, 1974).
Из приведенных примеров видно, что при заражении миксоспоридиями
есть случаи хорошо сбалансированной системы паразит—хозяин, например
при паразитировании Myxidium lieberkiihni и особенно Henneguya oviperda,
и случаи нарушения равновесия, когда паразит приводит хозяина к гибели.
Реакцией хозяина на паразита является воспалительный процесс, описанный
для некоторых миксоспоридий. Другим типом реакции хозяина может быть
образование вокруг плазмодиев различного рода капсул; последние обра-
зуются, например, вокруг многих тканевых миксоспоридий. В недавней статье
Ю. А. Березанцева (1982) анализируются причины, механизмы и следствия
образования капсул вокруг тканевых гельминтов. Тканевые паразиты служат
открытой мишенью для всех специфических и неспецифических реакций
хозяина. В процессе эволюции у личинок гельминтов появилась способность
(вероятно, путем выделения веществ) индуцировать у хозяина специфиче-
скую реакцию капсулообразования. По мнению этого автора, капсула физио-
логически чрезвычайно активна: через нее идет интенсивный транспорт пита-
тельных веществ к паразиту против градиента концентрации. Иногда капсула
приобретает органоподобную структуру, и в ней развивается сеть кровенос-
ных капилляров, активно участвующих в транспорте. Следовательно, тка-
невые гельминты вызывают у хозяина полезные для себя морфологические
и биохимические изменения.
Аналогичные процессы капсулообразования можно наблюдать и
у миксоспоридий. Многие тканевые миксоспоридии окружены капсулами раз-
личной степени сложности (подробное описание этих образований см.: Шуль-
ман, 1966; Mitchell, 1977). Митчелл (Mitchell, 1977) приводит несколько при-
меров образования таких капсул. Так, Myxobolus pfeifferi из Barbus sp. пора-
жает соединительную ткань мускулатуры и вызывает язвенную болезнь.
На поверхности рыбы образуются опухоли до 5—6 см в диаметре. После
созревания спор миксоспоридий эти опухоли размягчаются и образуются
язвы, из которых истекает экссудат, содержащий споры. Вторичное пораже-
ние язв бактериями или грибками часто приводит рыб к гибели. Наблюдается
гиперплазия и гипертрофия соединительной ткани, и вокруг трофозоитов
формируется соединительно-тканная капсула. Myxobolus sp., поражающий
Ptychacheilus oregonensis, вызывает гиперплазию соединительной ткани,
которая образует тонкую плотную капсулу вокруг массы трофозоитов, причем
внутрь от нее отходят выросты, разделяющие всю капсулу на отдельные
74
камеры. Подстилающий эпидермис часто утолщается. В капсулу включаются
мелкие кровеносные сосуды. Воспалительная реакция обычно слабая и огра-
ничивается тканями капсулы и усилением кровоснабжения окружающей
мышечной ткани. В соединительно-тканной капсуле часто встречаются фаго-
циты. После разрыва капсулы и излияния ее содержимого полость заполня-
ется пролиферирующей соединительной тканью, и, таким образом, ею заме-
щаются ранее располагавшиеся в этом месте пучки мышечных волокон (Mit-
chell, 1977).
Нигрелли и Смит (Nigrelli, Smith, 1938) показали, что Myxobolus lintoni
вызывает образование опухоли из фибробластов в коже Cyprinodon varrega-
tus. В большинстве случаев эпидермис отсутствует и меланофоры составляют
большую часть капсулы. Развивается умеренный воспалительный процесс,
на что указывает присутствие лимфоцитов, полиморфноядерных клеток и
меланофоров. Капилляры и мелкие нервные волокна врастают в капсулу.
Ее заполняет эозинофильная сыворотка или альбуминозный экссудат.
Хотя ответ ткани хозяина обычно ограничивается капсулой, Нигрелли
и Смит (Nigrelli, Smith, 1940) описали гиперплазию подстилающего эпите-
лия при заражении Ictalurus nebulosus плазмодиями Henneguya ameiuren-
sis. Этот паразит локализуется в соединительной ткани кожи. Опухоль
имеет вид сосочка. Эпителий утолщается, образуя несколько слоев, наблю-
дается также гиперплазия слизистых клеток, железистых клеток и мелано-
форов.
В случае заражения Moxosto/na sp. трофозоитами Myxobolus тохо-
stomi (Nigrelli, 1948) разрастается эпителий и возникают ненормальные
клетки с межклеточными мостиками, вытесняющие нормальные эпителиаль-
ные клетки. Очень часто плазмодии тканевых миксоспоридий окружаются
соединительно-тканной капсулой (Myxobolus gigas). Иногда наблюдается
отчуждение соединительно-тканных капсул от тканей хозяина, и они свободно
плавают в полости тела (М. carassii). От соединительно-тканной капсулы
внутрь врастают складки, выстланные эпителием: на этих складках в свою
очередь образуются складочки, и возникает многокамерное образование,
напоминающее капиллярную аденокистому (Thelohanellus pyriformis).
Иногда образуются капсулы из пролиферирующего эпителия хозяина (Hen-
neguya creplini из жабр ерша Acerina сегпиа); утолщенный слой эпителия
может содержать расширенные капилляры (Henneguya gigantea, Myxobolus
tayamai). В ряде случаев трофозоит окружен слоем эпителия, а поверх
него — соединительно-тканной капсулой (Thelohanellus notatus). Этот
эпителий образует вдающиеся внутрь складочки, в которых находится
соединительная ткань, пронизанная кровеносными сосудами и лакунами
(данные разных авторов, см. по: Шульман, 1966).
Под электронным микроскопом эти образования совсем не изучены. Лишь
Шуберт. (Schubert, 1968) приводит данные об эпителоиде вокруг плазмодия
Henneguya pinnae, да Каррент и Джанови (Carrent, Janovy, 1976, 1977,
1978), описывая патогенную форму Н. excilis, отмечают, что ткани хозяина
выделяют вокруг паразита гранулярный слой и вызывают разрастание
базальных клеток. В некоторых уже упомянутых работах говорится о гипер-
плазии и гипертрофическом росте эпителиальных клеток или базаль-
ных клеток жаберных лепестков. Мы наблюдали некоторую гипертро-
фию фибриллярных структур вокруг ряда плазмодиев Myxobolus dispar-
oides.
Все описанные капсулы несомненно похожи на капсулы, образуемые
вокруг гельминтов; видимо, значение их и функционирование имеют много
общего. Как и в случае паразитирования гельминтов, тканевой паразитизм
требует от миксоспоридий специальных адаптаций, так как среда первого
порядка — ткань хозяина — обладает комплексом защитных реакций. Пара-
зит и хозяин включены в единую энергетическую систему. При этом в про-
цессе адаптации должны быть отрегулированы обмены веществ обоих парт-
неров.
75
Капсула обеспечивает транспорт питательных веществ к паразиту против
градиента концентрации, т. е. с участием ферментов и с затратой энергии. Она
не пропускает антитела хозяина к паразиту, защищая его от реакции хозяина
(Березанцев, 1982).
Заканчивая главу о физиологии и биологии миксоспоридий, следует
кратко подвести итог сказанному.
Приведенные примеры подкрепляют положения экологической паразито-
логии В. А. Догеля (1947, 1962) о взаимной адаптации паразита и хозяина,
являющегося средой первого порядка для паразита. С позиций догелевской
экологической паразитологии морфофизиологические особенности миксоспо-
ридий обсуждались и самим В. А. Догелем (1947), и особенно подробно
С. С. Шульманом (1966). Рассматривались закономерности их эволюции
в связи с паразитизмом (Шульман, 1966; Полянский, 1969). По существу эти
проблемы в какой-то мере затрагиваются почти в каждой работе паразитоло-
гов догелевской школы, в которой речь идет о миксоспоридиях как представи-
телях паразитофауны той или иной рыбы, того или иного водоема.
Данные, полученные на ультраструктурном уровне, несколько расширили
наши знания и внесли коррективы в прежние представления.
Приспосабливаясь к многообразию условий существования в организме
рыбы (в разных органах и тканях, в среде разного химического состава),
миксоспоридии сочетают в различных комбинациях все возможные для
клетки и организма способы питания и типы пищеварения (дистантное,
пристеночное, внутриклеточное, фагоцитоз, пиноцитоз, активный транспорт).
Эти адаптации выражаются в особенностях ультратонкого строения поверх-*
ности, в развитии надмембранных слоев разного строения, а также в различии
выделяемых плазмодием ферментов, специфично действующих на опреде-
ленный субстрат, представленный в конкретном месте обитания данного
вида.
Метаболизм миксоспоридий еще недостаточно изучен, но даже имею-
щиеся сведения говорят о том, что их ферментативные системы позволяют
им обитать как в аэробных, так и в анаэробных условиях. В последнем случае
(как и другие паразиты — анаэробы или аноксибионты) они запасают
гликоген в качестве основного источника энергии.
Что касается паразитохозяинных взаимоотношений, то в случае пара-
зитирования миксоспоридий (Шульман, 1966), так же как и при паразитиро-
вании других животных, в основе их лежит антагонизм. Однако взаимные
адаптации паразита и хозяина направлены на преодоление этого антагонизма
и установление равновесия, так как паразиту часто невыгодна гибель хозяина
(Гусев, Полянский, 1978), за счет которого он живет. Чем древнее система
паразит—хозяин, тем большее равновесие достигается в процессе эволюции.
В случае паразитирования миксоспоридий можно установить те же спо-
собы воздействия на хозяина, о которых говорил В. А. Догель (1947, 1962),
как о характерных при любом паразитизме (механическое, токсическое,
отнятие нужных хозяину веществ, открытие путей для инфекции, общее
ослабление организма хозяина и уменьшение сопротивляемости к другим
болезням и вредным воздействиям). В приведенных примерах затрагивались
все эти способы. Следует отметить, что общее токсическое воздействие
на хозяина наблюдается достаточно редко, чаще при массовом заражении,
и характерно для сравнительно небольшого числа видов миксоспоридий.
Ответ хозяина на паразитирование миксоспоридий в их тканях, как и при
паразитировании других животных, выражается в иммунной реакции. В слу-
чае заражения рыб миксоспоридиями она еще плохо изучена. Есть некоторые
данные относительно Myxosoma cerebralis, которые говорят, что здесь реак-
ция осуществляется по типу мимикрии и выражается в адсорбции антигенов
хозяина на поверхности паразита (Pauley, 1974).
76 ‘
В качестве ответа на заражение миксоспоридиями наблюдается также
воспалительная реакция (разной силы при паразитировании разных видов).
Чаще она умеренная, в результате на месте плазмодия и образованных
им полостей происходит грануляция (Mitchell, 1977; Dykova, Lom, 1978).
Защитной реакцией хозяина против многих видов миксоспоридий
является также капсулообразование (см. обзоры: Шульман, 1966; Mitchell,
1977). По мнению Ю. А. Березанцева (1982), эта способность индуцировать
(видимо, выделением веществ) у хозяина специфическую реакцию капсуло-
образования паразит выработал в процессе эволюции, защищаясь от специ-
фических антигенов хозяина.
Случаи внутриклеточного паразитизма у миксоспоридий на ультраструк-
турном уровне изучены мало. В приводимых нами двух примерах (Kudoa
quadratum из мышечного волокна и Henneguya oviperda из икринки) не было
замечено образования паразитофорной вакуоли (правда, самых ранних ста-
дий заражения мы не наблюдали). Самые ранние стадии изучались под элек-
тронным микроскопом Ломом и Диковой (Lom, Dykova, 1981), но пока эти
материалы изложены в кратких тезисах, и вопрос о проникновении этих пара-
зитов в клетку не обсуждается. Видимо, при паразитировании Kudoa quadra-
tum плазмодий способен подавлять активность лизосомных ферментов клетки
хозяина. В конечном итоге все содержимое мышечного волокна разрушается
и утилизируется паразитом, после чего он приступает к спорообразованию,
не выходя за пределы одной клетки. Никакого лизиса ткани после смерти
рыбы не происходит. Если этот лизис является результатом автолиза, то
в данном случае лизосомные ферменты подавлены, а позднее вообще не оста-
ется содержимого клетки. Если этот лизис обусловлен выделяемыми парази-
том протеазами, то эти ферменты у К. quadratum не действуют на оболочку
мышечного волокна. При паразитировании Henneguya oviperda плазмодии
уничтожают саму яйцеклетку и (возможно, подавляя лизосомные ферменты
и не вызывая реакции хозяина) питаются за счет ресурсов, предназначенных
для овоцита. Эти питательные вещества обеспечиваются оболочками ик-
ринки, которые остаются интактными. Ко времени икрометания (к весне)
заканчивается спорообразование, и споры попадают в воду.
Рассмотрение адаптации спор (фазы дисперсии) к существованию во
внешней среде выходит за рамки цитологии паразитохозяинных отноше-
ний. Однако морфологические особенности спор и их сложный стрекательный
аппарат (ультраструктура и развитие были нами разобраны) являются пред-
посылками морфофизиологических адаптаций спор, которые обеспечивают
их попадание в нового хозяина и поддерживают существование вида. Изуче-
нию морфофизиологических особенностей спор много внимания уделял
С. С. Шульман (1966). Ему принадлежит идея о существовании быстро и
медленно спускающихся спор и о связи этой особенности с приуроченностью
видов миксоспоридий к определенным видам рыб с разной экологией и
биологией. Гипотеза эта затем использовалась многими паразитологами при
фаунистических исследованиях.
Наличие длительного периода дозревания спор в воде, открытое у Myxo-
soma cerebralis (Успенская, 1955а) и у видов рода Myxobolus (Юнчис, 1974),
тоже является адаптацией паразита к биологии хозяина (см. с. 86). Воз-
можно, это явление распространено гораздо шире. При рассуждении о зави-
симости зараженности рыб миксоспоридиями от скорости опускания спор
надо иметь в виду еще и существование у некоторых видов длительной неин-
вазионности находящихся в воде спор.
77
К ВОПРОСУ О ФИЛОГЕНИИ МИКСОСПОРИДИЙ
За последнее время появилось много классификаций органического мира,
в которых его разделяют на разное количество царств (от 2 до 18). В работе
Виттакера (Whittaker, 1977) приводится обзор этих классификаций, а также
его собственная система. Относительно состава подцарства Protozoa также
существуют разные мнения, изменяющиеся по мере более подробного изуче-
ния простейших организмов. Так, например, сравнительно недавно в состав
Protozoa ввели слизевиков, которых раньше относили к низшим грибам
(Olive, 1975; Levine et al., 1980). Высказывалось мнение, что Cnido-
sporidia, в состав которых входят миксоспоридии и актиномиксидии, должны
быть выведены за пределы Protozoa (Grell, 1958; Grasse, 1960; Lom, 1969;
Canning, Vavra, 1977; Grasse, Lavette, 1978).
Для установления родственных связей многих простейших еще не хватает
сведений. На современном уровне знаний попытки установить более конкрет-
ные филогенетические связи Myxosporidia могут расцениваться лишь как
гипотезы. В связи с этим задачей является дальнейшее накопление данных
о сходстве и различии миксоспоридий с другими группами организмов и,
в частности, о сходстве и различии их жизненных циклов и ультратонкого
строения. На последнем вопросе мы и хотим здесь остановиться, учитывая,
что за последнее время были получены новые сведения и об их жизненном
цикле, и об ультраструктуре.
ЗНАЧЕНИЕ ВЫЯВЛЕНИЯ ГЕТЕРОФАЗНОГО
ЖИЗНЕННОГО ЦИКЛА У МИКСОСПОРИДИЙ
Явление чередования дипло- и гаплофазы в жизненном цикле миксоспори-
дий, установленное с помощью цитофотометрии (Успенская, 1975, 1976а,
1978а, 1979а, 1981а, 19816, 1982в), должно учитываться при решении вопроса
о родственных связях и филогении этих организмов. Как уже говорилось, ге-
терофазный жизненный цикл широко распространен у растений. Сходство его
с таковым миксоспоридий уже обсуждалось выше. Кроме того, такой цикл
наблюдается у слизевиков — организмов, положение которых в системе орга-
нического мира еще не определено и является предметом спора: одни исследо-
ватели относят их к низшим грибам, другие — к простейшим (Мейер, 1937;
Зеров, 1972; Olive, 1975; Levine et al., 1980; Сидорова, Тарасов, 1980). Такой
цикл также характерен для фораминифер из Protozoa. Не давая подробную
характеристику строения перечисленных организмов, мы хотим лишь указать
на некоторые черты сходства и различия в их жизненных циклах, что может
дать информацию для размышления о происхождении миксоспоридий.
Одноядерный агамонт фораминифер диплоиден. На какой-то стадии деле-
ния его ядер (далеко не всегда известно, на какой) происходит мейоз.
Он занимает промежуточное положение по сравнению с зиготической или
гаметической редукцией. У высших гетерокариотных форм диплоидное сома-
тическое ядро сохраняется в течение жизни агамонта. После того как генера-
тивные его ядра претерпели мейоз, в клетках агамонта одновременно суще-
ствуют и гаплоидные, и диплоидные ядра: явление, которое известно еще и
для инфузорий (Михалевич, 1980; Полянский, 1982), недавно указано для
жгутиконосцев (Ширкина, 1981) и для миксоспоридий (Успенская, 1976).
Гаплофаза фораминифер (гамонт) представляет собой вегетативное активно
питающееся и растущее поколение. Сначала гамонт содержит одно ядро,
а затем последнее многократно делится митотически. Этим они отличаются
от миксоспоридий, у которых гаплофаза — покоящаяся фаза, редуцирован-
ная подобно гаметофиту растений, и деления гаплоидных ядер у них не наб-
78
людается. У ряда фораминифер, как и у миксоспоридий, наблюдается диф-
ференцировка ядер на соматические и генеративные и в гапло-, и в диплофазе
(Grell, 1958; Lee et al., 1965; Воронова, 1976, 1978a, 19786). Соматические
ядра ряда фораминифер, как и у крупных плазмодиев миксоспоридий, поли-
плоидны (Воронова, 1976). Митоз у фораминифер совершается по типу за-
крытого плевромитоза (Райков, 1967, 1978), в большинстве случаев он ацент-
рический. Митоз миксоспоридий, по данным световой микроскопии, ацентри-
ческий, внутриядерный. Мейоз ряда фораминифер двуступенчатый (Zech,
1964; Воронова, 19786). Как уже говорилось, тип мейоза миксоспоридий пока
недостаточно ясен. Соматические ядра фораминифер в мейозе не участвуют,
и в них не образуется синаптонемальных комплексов. Для жизненного
цикла фораминифер характерно наличие жгутиковых подвижных гамет, хотя
среди них есть виды с амебоидными гаметами. У миксоспоридий гаметы
амебоидны, и в большинстве случаев в одном амебоиде заключено два
гаметических ядра. Половой процесс у фораминифер совершается по типу
авто-, гетеро- и пластогамии, а у миксоспоридий — по типу авто- и педогамии.
Миксомицеты — организмы, у которых в пределах одного жизненного
цикла комбинируются стадии, похожие на животных — питающиеся стадии,
и похожие на растения — плодовые тела (Olive, 1975).
Объем группы слизевиков очень по-разному расценивается разными авто-
рами. Некоторые выводят лабиринтуловых из состава слизевиков (Зеров,
1972; Levine et al., 1980). Плазмодиефоровые многими авторами рассматри-
ваются как рано обособившаяся ветвь слизевиков, эволюционировавшая
в условиях внутриклеточного паразитизма (Зеров, 1972; Olive, 1975; Ново-
жилов, 1978). В последних классификациях слизевиков относят не к грибам,
а к простейшим, на том основании, что им свойственно голозойное питание
(Olive, 1975; Levine et al., 1980). Олив (Olive, 1975) предлагает царство Pro-
tista разделить на тип Euprotista, куда входят Protozoa и одноклеточные
водоросли, и тип Gymnomyxa, куда входят три подтипа: Mycetozoa (настоя-
щие слизевики и акразиевые), Plasmodiophorina и Labirinthuhna, считая, что
подтипы имеют независимое происхождение.
Мы сознательно будем акцентировать внимание на тех чертах жизненного
цикла слизевиков (учитывая, что они свойственны не всем представителям),
которые в какой-то степени аналогичны жизненным циклам миксоспоридий.
Для слизевиков характерно наличие гетерофазного жизненного цикла.
Трофическая стадия у них может быть представлена многоядерными плазмо-
диями или 1-ядерными амебами. Для плазмодиев характерно размножение
путем плазмотомии. Единичные амебы или многоядерные части плазмодиев
могут претерпевать период покоя путем образования цист. Вышедшие из цист
жгутиковые или амебоидные зооспоры могут дать начало новым трофическим
стадиям. Это вегетативное размножение слизевиков (Мейер, 1937). В опреде-
ленных условиях плазмодии приступают к спорообразованию. Из целого
плазмодия или из его части, путем образования перегородки, формируется
спорангий (Мейер, 1937; Зеров, 1972). В молодом спорангии происходит ми-
тотическое деление ядер и распадение протопласта на 1-ядерные споры.
Перед созреванием спор в спорангии совершается мейоз, при этом три
из четырех гаплоидных ядер дегенерируют (Olive, 1975).
При прорастании споры из нее выходят либо жгутиковые, либо амебоид-
ные зооспоры. Они гаплоидны, и с них начинается гаплоидная фаза цикла.
Зооспоры размножаются делением, это бесполое размножение (Мейер, 1937).
Для многих слизевиков доказано наличие полового процесса. Амебоидные
или жгутиковые клетки (гаметы) сливаются, образуя 2-ядерную клетку, срок
существования которой различен; а затем происходит кариогамия — начи-
нается диплоидная фаза цикла. Зигота вырастает в плазмодий. Ядра плаз-
модия делятся митотически синхронно. Для некоторых видов характерны раз-
ные размеры ядер плазмодия, и подозревается разница в их плоидности
(Olive, 1975). Митоз у слизевиков — это закрытый внутриядерный плевроми-
тоз, как у многих простейших и грибов. В отличие от простейших у разных
79
стадий одного и того же вида может встретиться и центрический, и ацентри-
ческий митоз (Новожилов, 1978, и др.). Мейоз у изученных видов слизевиков
двухступенчатый.
Характерная черта миксомицетов — образование плодовых тел, заклю-
чающих спорангии, — не свойственна другим простейшим. Олив (Oliv, 1975)
считает, что это независимая линия эволюции, ведущая от водных простей-
ших к наземным формам. К. Мейер (1937) отмечает, что для жизненного
цикла слизевиков, как и для растений, характерно развитие со сменой веге-
тативного, бесполого и полового размножения.
При классификации жизненных циклов простейших В. А. Догель с соав-
торами (Догель и др., 1962), руководствуясь данными Грелля (Grell, 1958),
рассматривают жизненный цикл фораминифер как цикл развития с чередова-
нием полового процесса и бесполого размножения, с гетерофазной сменой
поколений. Эти авторы указывают, что соотношение в цикле фораминифер
гапло- и диплофазы напоминает чередование гаметофита и спорофита
растений.
Жизненный цикл миксоспоридий эти авторы рассматривают как цикл раз-
вития со сменой бесполого размножения, образования спор и полового про-
цесса. Тогда еще не было установлено место мейоза в жизненном цикле мик-
соспоридий. Нам кажется, что плазмотомию миксоспоридий надо считать
вегетативным размножением, а спорогенез — бесполым (по: Гартман, 1936;
Мейер, 1937), и тогда возможно сравнение их цикла с гетерофазными жизнен-
ными циклами других организмов.
Происхождение фораминифер и слизевиков, так же как и миксоспоридий,
еще далеко не установлено, фораминифер сначала выводили из саркодовых
(Догель, 1959). Последнее же время многие авторы склонны считать
за их предков жгутиконосцев (Loeblich, 1974; Михалевич, 1980, и др.).
Миксомицетов одни производят от амебоидных организмов, другие — от жгу-
тиконосцев (Olive, 1975; Сидорова, Тарасов, 1980).
Предками миксоспоридий С. С. Шульман (1966) предлагает считать
паразитических амеб. Однако паразитические животные обычно уже узко
специализированы в выработке биохимических особенностей, обеспечиваю-
щих жизнь в определенном хозяине, и в выработке способов проникновения
в хозяина. Приспособлением, облегчающим попадание в хозяина, у миксоспо-
ридий является стрекательный аппарат — сложно устроенная экструсома.
У паразитических амеб экструсом не обнаружено, и вообще пока только
у трех видов амеб обнаружены трихоцистоподобные тельца (Fizer, Wilhelm,
1978; Page, 1979). Зато у жгутиконосцев они широко распространены и разно-
образны (Hovasse, 1965; Успенская, 1977; Hausmann, 1978).
Характерные для миксоспоридий черты: гетерофазный жизненный цикл,
плазмодиальные вегетативные стадии и полиэнергидность этих стадий, поли-
плоидные соматические ядра, ядерная дифференцировка, наличие сложных
экструсом и митохондрий с трубчатыми кристами, многоклеточные стадии
развития — порознь встречаются и в других группах простейших (у жгутико-
носцев, фораминифер, слизевиков, лабиринтуловых, инфузорий), боль-
шинство из которых выводят из свободноживущих жгутиконосцев.
Нам кажется не менее вероятным, что миксоспоридии произошли от сво-
бодноживущих простейших, уже имевших экструсомы (например, от каких-
нибудь жгутиконосцев, жизненный цикл которых включал плазмодиальные
стадии), по сравнению с возможностью их происхождения от паразитических
амеб, приспособившихся без помощи экструсом проникать в хозяина.
Тем более что, как известно, паразитизм возникал у разных групп простей-
ших независимо и параллельно (Догель, 1962), а эндопаразитизм в большин-
стве случаев развивался в результате случайного заноса в пищеварительную
систему хозяина покоящихся стадий свободноживущих организмов (Догель,
1962). Лом, Митчелл и Гоффман (Lom, 1977; Mitchell, 1977; Hoffman, 1981),
рассматривая гипотезу С. С. Шульмана (1966), считают, что это только
предположение, к тому же недостаточно подтвержденное. Митчелл (Mitchell,
80
1977) отмечает, что хотя у паразитирующей в рыбах саркодовой Schizamoeba
saimonis и образуются многоклеточные цисты, но у них нет дифференцировки
на соматические и генеративные клетки.
Грассе и Лаветт (Grasse, Lavette, 1978) предлагают выделить миксоспо-
ридий из Protozoa в качестве равнозначного таксона на том основании, что
они различают у миксоспоридий три категории клеток. Это положение оспа-
ривается С. С. Шульманом и С. А. Подлипаевым (1980). Выше мы уже
обсуждали данные, говорящие против гипотезы Грассе и Лаветта.
Установление гетерофазного жизненного цикла у миксоспоридий мешает
принятию гипотезы Готшалка (Gottschalk, 1957), выводящего миксоспоридий
через актиномиксидий от дициемид (Mesozoa).
ЗНАЧЕНИЕ ИЗУЧЕНИЯ
УЛЬТРАСТРУКТУРЫ И МЕХАНИЗМА ДЕЙСТВИЯ
СТРЕКАТЕЛЬНОГО АППАРАТА МИКСОСПОРИДИЙ
Почти все авторы, касающиеся вопроса о филогении миксоспоридий,
обсуждают большое сходство строения и развития стрекательных капсул мик-
соспоридий с книдоцистами кишечнополостных. Это сходство было подмечено
давно (Biitschli, 1882) и дало повод Вейлу (Weill, 1938) выдвинуть гипотезу
о том, что миксоспоридии — регрессировавшие в связи с паразитизмом
кишечнополостные. Исследование ультраструктуры этих экструсом и их раз-
вития под электронным микроскопом усугубило это сходство, что привело
к возрождению гипотезы Вейла (Lom, Vavra, 1964; Lom, Puytorac, 1965b;
Lom, 1973, 1977). И действительно, строение и развитие этих органелл очень
сходно. Стенки капсулы имеют два слоя — электронно-плотный и электронно-
прозрачный. В обоих случаях при развитии зачаток появляется в виде неболь-
шого тонкостенного пузырька, который затем вытягивается. В том и в другом
случае один конец зачатка вытягивается в наружную трубку стрекательной
нити, которая затем вворачивается внутрь капсулы (возможно, вворачива-
ется только внутренний слой, развиваясь в стрекательную нить). И для той, и
для другой органеллы характерно участие микротрубочек в построении
наружной трубки и нити. Нами у Sphaeromyxa elegini обнаружена вблизи
конца наружной трубки стрекательной нити структура (табл. XXII, И), очень
похожая на описываемую у Polypodium hydriforme, как центр образования
микротрубочек (Райкова, 1978).
Есть, правда, мнение, что эти две органеллы отличаются друг от друга
своим происхождением и что книдоцисты возникают из гладкой эндоплаз-
матической сети с участием аппарата Гольджи (Райкова, 1978; Holstein,
1981, и др.), а стрекательные капсулы — из шероховатой эндоплазматической
сети (Schubert, 1968; Desser, Paterson, 1978; Grasse, Lavette, 1978). На этом
различии настаивает Каннинг (Cunning, 1982), ссылаясь на данные Дезера
и Патерсона (Desser, Paterson, 1978), однако мнение последних основано
лишь на том, что им не удалось обнаружить аппарат Гольджи в капсулоген-
ной клетке. На наш взгляд, эти данные нисколько не доказательнее данных
Лома о роли аппарата Гольджи в образовании зачатка стрекательной кап-
сулы. Если прав Лом (Lom, 1969), то различие в происхождении этих двух
органелл отсутствует. В недифференцированных клетках споробластов часто
приходится наблюдать аппарат Гольджи.
Что касается механизма действия обоих стрекательных аппаратов, то дан-
ные, касающиеся миксоспоридий, мы уже обсуждали и думаем, что роль здесь
играют сократительные белки, и выбрасывание нити индуцируется измене-
нием концентрации ионов Са2+ (Успенская, 1972а, 19766, 1977).
В отношении механизма действия книдоцист существуют различные точки
зрения, но ни одна из них еще не может считаться окончательно доказанной.
Поскольку стимул и ответное выбрасывание нити разделяются очень малым
промежутком времени (у пресноводной гидры нить выстреливает через 40—
60 мс после стимуляции электрическим током), то считается, что причиной
6 А. В. Успенская
81
выстреливания не может быть химическое растворение крышечки, которое
потребует больше времени (Robson, 1973). Предполагалось, что увеличение
внутрикапсулярного давления может быть достигнуто при сокращении цито-
плазматических фибрилл, но не у всех книдоцист есть такие фибриллы
(Robson, 1973). Есть точка зрения, что книдоцисты функционируют как осмо-
метр (Robson, 1953, 1973). Робсон предполагает, что трубчатый ретикулум
и вакуоль, которые окружают капсулу, ответственны за регуляцию ионов
в клетке. Происходит деполимеризация клеточной мембраны, и изменяется
ее проницаемость; благодаря уменьшению проницаемости клетки книда начи-
нает насасывать воду. По мнению Робсона (Robson, 1973), сама капсула
может и не быть под давлением, а раздувание ее стимули-
руется изменением проницаемости клеточной мембраны и ионного состава
в клетке. По данным Пикена и Скаера (Picken, Skaer, 1966), осмотическое
давление содержимого капсулы очень велико. У стрептолин Carynactis sp.
оно равно 140 атм.
Янагита (Yanagita, 1973) выдвинул идею о наличии stopper-механизма,
согласно которой крышечка книдоцисты играет роль такого stopper-
механизма. Будучи разрушена, она перестает сдерживать давление или
натяжение, существующее в капсуле, и под его действием нить с силой
выбрасывается. Примерно тот же механизм предполагают Карре и
Карре (Саггё, Саггё, 1980). По их мнению, нить в капсуле находится
под напряжением подобно часовой пружине, и требуется лишь запуск меха-
низма. В своей обзорной работе Янагита (Yanagita, 1973) проводит парал-
лель между мышечным сокращением и выстреливанием книдоцисты. В ре-
зультате ряда экспериментов он приходит к выводу, что роль,
которую играют ионы Са2+ при мышечном сокращении, во время выстрели-
вания книдоцист могут играть анионы (все одновалентные и некоторые много-
валентные, за исключением SO2”). Янагита отмечает, что в естественных
условиях морские кишечнополостные могут встретиться лишь с определен-
ной концентрацией ионов CL”. По его мнению, для пресноводной гидры суще-
ственное значение могут иметь ионы НРО2”, поступающие изнутри, как и
в случае мышечных сокращений.
Янагита (Yanagita, 1973) рассмотрел проблему снабжения энергией при
выстреливании книдоцист. На основании опытов по выстреливанию изолиро-
ванных органоидов автор делает вывод, что использование АТФ здесь не обя-
зательно: энергия должна быть запасена заранее или встроена в структуру,
и нужен только пусковой сигнал. Книдоцисты энергизируются во время
книдогенеза. Они используются один раз и заменяются новыми.
В последнее время все чаще появляются сведения о нервной регуляции
работы книдоцист. Книдоцисты часто считаются независимыми эффекторами:
только та книдоциста выстреливает, на которую направлен стимул. Сущест-
вует и другая точка зрения, согласно которой выстреливание книдоцист
контролируется самим животным (Yanagita, 1973; Mariscal, 1974). Есть мне-
ние, что контроль за выстреливанием осуществляется «нервной системой»:
и под световым, и под электронным микроскопами описывались волокна,
оканчивающиеся вблизи книдоцист, которые рассматривались как нервы.
Предполагается также существование невротрансмиттеров (веществ, пере-
дающих нервный импульс) и, в частности, катехоламина. Под электронным
микроскопом многими авторами наблюдалось наличие синапсов между кни-
доцистой и невритом (см. обзоры: Yanagita, 1973; Mariscal, 1974). В этих
обзорах обсуждается также возможность контролирования выстреливания
книдоцист с помощью эпителиальной или нервной проводящей системы,
которая описана для кишечнополостных. Для гидр выявлено наличие как
нервной (Lentz, Barrnett, 1965), так и эпителиальной и миоэпителиальной
проводимости (Mariscal, 1978). Электрические импульсы, передающиеся эпи-
телием, очень напоминают нервные импульсы. Книдоцит (книдобласт) —
это клетка, в которой находится и развивается книдоциста. Она имеет особую
чувствительную систему в виде книдоциля и других структур.
82
В отличие от книдоцист стрекательная капсула миксоспоридий после за-
вершения спорообразования не связана с капсулогенной клеткой. Сама
клетка дегенерирует, так что здесь не может быть речи о нервном контроле.
Однако, как можно видеть из приведенного описания, в механизме их дейст-
вия есть много общего, хотя он и не вполне идентичен. В одной из своих пос-
ледних работ Марискал (Mariscal, 1980) сообщает результаты микроанализа
с помощью Х-лучей: он показал, что капсула книдоцисты состоит из колла-
геноподобного белка, связанного дисульфидными мостиками. Вейл, Лом
и Пюторак (Weill, 1938; Lom, Puytorac, 1965b) считают, что сходство миксо-
споридий с кишечнополостными заключается еще и в сходстве между пан-
споробластом с его наружной питающей клеткой и ранними стадиями овоге-
неза у некоторых кишечнополостных (наркомедуз) с их овоцитом, окружен-
ным питающей клеткой.
Похожие на ранний панспоробласт стадии наблюдаются и при гаметоге-
незе у Polypodium hydreforme (Райкова, 1961). Однако наличие гетерофаз-
ного жизненного цикла у миксоспоридий является препятствием для приня-
тия гипотезы о родстве миксоспоридий и кишечнополостных. Для Metazoa
не свойственны циклы с чередованием гапло- и диплофазы. Сходство их стре-
кательных органелл, видимо, надо рассматривать как конвергенцию. Книдо-
цисты с выворачивающейся наизнанку нитью известны и у других групп про-
стейших, хотя они и не так похожи на стрекательные капсулы миксоспоридий,
как книдоцисты кишечнополостных. С. С. Шульман и С. А. Подлипаев (1980)
также отмечают, что не существует сходства между Cnidosporidia и Cnidaria
в общем плане их строения и в морфологии их клеток. Грассе и Лаветт
(Grasse, Lavette, 1978) тоже отрицают это родство.
Большинство авторов считают, что миксоспоридии имеют мало сходства
с остальными таксонами простейших и предлагают их вместе с актиномикси-
диями выделить в особый тип Cnidosporiidia (Шульман, Подлипаев, 1980;
Догель, 1981) или Myxozoa (Levine et aL, 1980).
Близкими родственниками миксоспоридий считают актиномиксидий (см.:
Шульман, 1966). Однако в работе Шульмана и Подлипаева (1980) на основа-
нии сопоставления ядерных циклов этих двух групп выдвигается гипотеза
о негомологичности у них спор; на этом основании авторы предполагают, что
это давно разошедшиеся в эволюции формы, связанные лишь далеким общим
предком. Это любопытное суждение, однако пока оно не имеет достаточно
оснований. Приводимая авторами схема ядерного цикла актиномиксидий
не подтверждена надежными доказательствами. Шульман и Подлипаев
(1980) отмечают, что их схема базируется на данных Янышевской (Janiszew-
ska, 1957). Однако эти авторы совершенно произвольно опускают факт нали-
чия второго редукционного деления перед образованием спор, которое описы-
вает Янышевская, и, таким образом, вывод о диплоидности спор актиномик-
сидий оказывается не подтвержденным фактическим материалом. Других
более достоверных данных по ядерному циклу актиномиксидий пока нет.
Как уже говорилось, многие исследователи считают, что Cnidosporidia
на основании их многоклеточности должны быть выведены за пределы Proto-
zoa (Grasse, 1960; Grell, 1973; Lom, 1973; Grasse, Lavette, 1978). Шульман
и Подлипаев (1980) думают, что этот вывод необоснован. Они приводят при-
меры возникновения многоклеточное™ или приближения к этому состоянию
среди простейших (Haplozoon, Neresheimeria, Zoothamnium и т. п.), в отно-
шении которых, однако, не возникал вопрос о выведении их за пределы своих
таксонов. Низкая степень интеграции, примитивный половой процесс, изога-
мия, копуляция, одноступенчатый мейоз — черты, которые эти авторы приво-
дят в защиту близости миксоспоридий к Protozoa. Мы можем добавить к ним
также существование гетерофазного жизненного цикла у миксоспоридий.
Для установления родственных связей миксоспоридий предстоит еще мно-
гое уточнить и выяснить, и прежде всего необходимо изучить начальные
стадии жизненного цикла. При исследовании в этом плане надо иметь в виду
указанные сходства с другими низшими организмами.
6*
83
ПРИМЕР ИСПОЛЬЗОВАНИЯ ЗНАНИЙ БИОЛОГИИ
МИКСОСПОРИДИЙ В ПРАКТИКЕ
ВЕРТЕЖ ЛОСОСЕВЫХ
Симптомы заболевания
Одним из наиболее опасных среди известных паразитарных заболеваний,
вызываемых миксоспоридиями, считается вертеж лососевых, вызываемый
Myxosoma cerebralis. Это заболевание описано Хофером и Плен (Hofer, 1903;
Plehn, 1904, 1924). Возбудитель вертежа паразитирует в хрящевых тканях
молоди форелей, разрушая основное вещество хряща. Чаще всего он пора-
жает хрящи внутреннего уха, а также и другие части скелета: хрящи черепа,
позвоночника, плавников и т. д. Такое своеобразие в выборе места паразити-
рования проявляется в очень характерных симптомах заболевания.
Наиболее типичный симптом — расстройство двигательной функции.
В связи с разрушением хрящевой слуховой капсулы нарушается чувство рав-
новесия, рыба теряет способность к нормальному движению и начинает лихо-
радочно плавать в одном направлении маленькими кругами, затем наступает
период покоя, когда она лежит на дне. Разрушение хрящей скелета приводит
к различного рода уродствам: к искривлению позвоночника в разных направ-
лениях, недоразвитию жаберных крышек, появлению мопсовидной головы и
т. п. Признаком вертежа также является резкое почернение хвостовой части
тела. Потемневшая часть четкой границей отделяется от остального нор-
мально окрашенного тела. Это связано с нарушением пигментомоторной
функции симпатической нервной системы.
Возбудитель вертежа М. cerebralis строго приурочен к определенному
местообитанию и никогда не выходит за пределы хрящевой ткани. Однако
споры М. cerebralis можно обнаружить и в других местах: в мозгу, мускула-
туре, печени, желчном пузыре и в содержимом кишечника. Этот факт дает
основания думать, что споры из разрушенных хрящей с током крови или
лимфы могут выноситься в пищеварительный тракт и через него наружу
(Успенская, 1955а, 1957; Rydlo, 1971). Возбудитель вертежа, как и другие
миксоспоридии, имеет две фазы развития: 1) паразитическая фаза — в виде
мелких многоядерных плазмодиев с лобоподиями или лучевидными псевдо-
подиями, которая и приносит вред рыбе, разрушая ее хрящи; 2) покоящаяся
фаза — спора, которая служит для передачи паразита другому хозяину,
т. е. для расселения. Как уже говорилось, споры обладают огромной стой-
костью к высушиванию. Известны случаи, когда даже 12-летнее высушивание
(летование) прудов не избавляло хозяйство от вертежа. Они выдерживают
и замораживание (см. с. 63).
Наибольшую опасность со смертельным исходом вертеж представляет
для рыб ранних возрастов, когда скелет еще не окостенел. По мере окостене-
ния скелета паразит переходит к спорообразованию, и его болезнетворное
воздействие снижается (Успенская, 1957).
История изучения вертежа в СССР
Первое сообщение о возможности появления вертежа в Советском Союзе
относится к 1932 г., когда В. А. Догель наблюдал в Сайменском канале дикую
форель с внешними признаками вертежа (черные хвосты). Осенью 1952 г.
рыбоводы обратили внимание на появление у радужной форели в рыбхозе
Ропша симптомов, которые были определены Догелем как характерные для
вертежа. При осеннем облове наиболее мелкие слабые мальки форели были
84
отсажены в один из прудов ропшинского хозяйства. К зиме часть из них
оказалась сильно истощенной, плохо брала корм. Проведенное нами парази-
тологическое исследование показало, что они на 100% заражены сборами
Myxosoma cerebralis, и, таким образом, впервые на территории СССР был
зарегистрирован возбудитель вертежа'(Успенская, 1955а, 19556). На рыбхоз
Ропша был наложен строжайший карантин, и мы занялись изучением заболе-
вания. В 1954 г. возбудитель вертежа М, cerebralis был обнаружен нами и
на Кавказе в Чернореченском форелевом хозяйстве. Кроме радужной форели,
этот паразит был обнаружен у ручьевой форели, семги и балтийского лосося,
выращиваемых в Ропше, а также у дикого черноморского лосося (Salma
trutta labrax) и одичавшей радужной форели в реке Черной на Кавказе.
Таким образом, был выявлен естественный очаг заражения вертежом.
Поскольку в Чернореченское форелевое хозяйство икра форели была заве-
зена из Ропши, то трудно было судить, является ли этот очаг природным
в понимании Е. Н. Павловского или возник в результате деятельности чело-
века. Во всяком случае для рыбхоза существовал естественный постоянный
источник заражения (Успенская, 1955а, 19556, 1957). В течение 1953—
1959 гг. мы проводили систематические наблюдения за больной форелью
в прудах рыбхоза Ропша, в результате чего были выяснены скорость накоп-
ления заразного начала в условиях этих хозяйств и сезонность в развитии
паразита. Установлено, что в различных климатических зонах сроки зараже-
ния и спорообразования не одинаковы, и в хозяйствах с разной системой
форелеводства скорость накопления заразного начала различна. Нами про-
водились ^акжё рпыты по лечению вертежа осарсолом3 и по искусственному
заражению форели М. cerebralis, испытание влияния некоторых веществ,
замораживания и высушивания на споры. На основании изучения биологии
и экологии М, cerebralis в зараженных форелевых хозяйствах (Успенская,
1955а, 19556), а также используя опыт зарубежных ихтиопатологов (в основ-
ном немецких), мы составили методические указания по борьбе с вертежом
лососевых, которые и были с успехом применены в конкретных условиях форе-
левых хозяйств (Успенская, 1959).
Позднее вертеж был обнаружен в значительном числе районов нашей
страны. Е. А. Богданова (1960) нашла его возбудителя на Дальнем Востоке
у выращиваемых в рыбхозах и у диких тихоокеанских лососей. Она считает,
что ею установлен природный очаг заражения вертежом на Дальнем Востоке.
Начиная с 1960 г. изучением вертежа в СССР в основном занимается Богда-
нова. Итоги своих исследований она обобщила в монографии (Богданова,
1977), в которой приводится полный обзор ее работ по вертежу. Богдановой
и некоторыми другими ихтиопатологами возбудитель вертежа в эти годы был
обнаружен, кроме Дальнего Востока, на Кольском полуострове, в бассейне
Северной Двины, в Закарпатье, в Алтайском, Краснодарском, Ставрополь-
ском краях, в Армении, в бассейне оз. Иссык-Куль (Ивасик, 1963; Алту-
хов и др., 1967; Тарейкин и др., 1968; Титарев, 1972, 1975; Никулин, Мар-
ченко, 1976; Богданова, 1977; Бокучаева, 1977, и др.).
Кроме перечисленных выше рыб, этот паразит (М. cerebralis) зарегистри-
рован у севанской форели, тихоокеанского лосося, у гольцов, палеи, сталь-
ноголового лосося (Богданова, 1977). Богданова выделяет несколько зон
природной очаговости вертежа и пытается составить представление об их
формировании. Ею изучены особенности заражения возбудителем вертежа
разных видов тихоокеанских лососей.
Несмотря на широкое распространение М. cerebralis, настоящая эпи-
зоотия, со 100%-ным заражением в отдельных прудах, возникла лишь
в Ропше, гибель молоди наблюдалась и в Чернореченском форелевом хозяй-
стве. В лососевых же хозяйствах, по данным Богдановой (1977), вертеж
не приносит вреда в силу биотехники лососеводства в нашей стране.
3 Отечественный аналог стоварсола, применявшегося в этих целях итальянским исследова-
телем Сколари (Scolary, 1954).
85
Биологические особенности инвазионной стадии
Myxosoma cerebralis
В последние 25 лет интерес к биологии Myxosoma cerebralis сильно возрос
из-за ущерба, приносимого лососевым хозяйствам, и из-за более широкого
распространения среди выращиваемых видов лососевых и завоза паразита
в те страны, где вертеж ранее не отмечался. Особенно интенсивные исследо-
вания развернуты в Америке, так как этот паразит, завезенный в 1956 г.
из Европы, стал представлять серьезную опасность для лососевых хозяйств
(Hoffman et al., 1962; Гоффман, 1971). В статье Вольфа (Wolf, 1974) была
намечена обширная программа изучения М. cerebralis, включающая те сто-
роны биологии, патологии, иммунологии, которые еще оставались неясными.
С тех пор появилось уже большое число работ, в той или иной мере отвечаю-
щих на поставленные Вольфом вопросы (Hoffman et al., 1962; Hoffman,
Putz, 1971; Rydlo, 1971; Hoffman, Hoffman, 1972; Hallyday, 1973, 1974, 1976;
Landolt, 1973; Tidd et al., 1973; Hoffman, 1974a, 1974b; Pauley, 1974; Grod-
nik’o, 1975, 1979; Маргаритов, Шикалия, 1976; Wolf, Markiv, 1976, 1979,
1980; Богданова, 1977; Бокучаева, 1977; Hoffman, Grodnik’o, 1977; Hoffman,
Markiw, 1977; Markiw, Wolf, 1977, 1978; Ghittino, Vigliany, 1978; Griffin,
Davis, 1978; Taylor, Lott, 1978; Lannan, 1979; Kozel et al., 1980; Prihoda,
1981, и др.).
В 50-е годы вертеж был известен в основном в Европе, и европейские
рыбоводы накопили уже какой-то опыт борьбы с ним (см.: Kocylowski, 1953;
Schaperclaus, 1954; Успенская, 1957; Догель и др., 1958; Богданова, 1977;
Бауэр и др., 1981).
В нашу задачу не входит обзор литературы по изучению вертежа в миро-
вом масштабе, мы хотим лишь наглядно показать, как подробные исследова-
ния биологии возбудителя, его жизненного цикла, особенностей обмена
и цитологии дают возможность разработать эффективные меры борьбы с бо-
лезнью, тем более что мы принимали непосредственное участие как в изуче-
нии возбудителя, так и в составлении и внедрении методических указаний
по борьбе с ним.
В течение 1953—1960 гг. нами были получены сведения по биологии пара-
зита в хозяйствах, расположенных в разных климатических зонах (Рыбхоз
Ропша в Ленинградской области и Чернореченское форелевое хозяйство
на Кавказе), и разработаны меры профилактики и лечения применительно
к конкретным условиям зараженных хозяйств (Успенская, 1955а, 19556,
1959). Однако многие стороны жизнедеятельности этой миксоспоридии оста-
лись невыясненными.
Позднее нами были проведены также цитохимические исследования раз-
ных стадий М. cerebralis, которые дополняют имеющиеся сведения (Успен-
ская, 19786, 19796).
Для подробного исследования жизненного цикла М. cerebralis, для изуче-
ния последовательных стадий и для испытания воздействия лекарственных
веществ на определенные этапы паразитической фазы жизненного цикла,
необходимо было научиться проводить искусственное заражение рыб спорами
этого паразита. Однако еще Плен (Plehn, 1924) отмечала, что заразить маль-
ков форели свежевыделенными из хрящей больных рыб спорами не удается.
Наши попытки заразить такими спорами молодь тоже не увенчались успехом
(Успенская, 1955а, 19556). Позднее это подтвердили и другие авторы
(Hoffman, Putz, 1969; Гоффман, 1971).
Руководствуясь этим фактом и исходя из того, что вертеж поражает маль-
ков лососевых лишь в первые месяцы жизни до начала окостенения их ске-
лета, мы предположили, что споры М. cerebralis могут обладать латентным
периодом. Наличие такого периода было бы вполне биологически обосновано,
так как споры образуются в хрящах больных рыб к осени, когда скелет сего-
летков начинает окостеневать и паразит уже не может в нем беспрепятственно
развеваться, а следующее поколение молоди появляется лишь весной. В усло-
86
виях северных хозяйств разрыв между этими моментами составляет 4—5 мес
(Успенская, 1957, 1969). Для сохранения вида было бы важно, чтобы споры,
попавшие в воду, достигали инвазионности именно ко времени йыклева
молоди. Таким образом, длительность латентного периода у спор М. cerebralis
могла бы быть равной нескольким месяцам.
Для проверки этого предположения нами в 1954—1955 гг. были проведены
опыты по заражению молоди спорами М. cerebralis, выдержанными в воде
в течение 4—4.5, 10 и 12 мес. Результаты этих исследований были подробно
сообщены в докладе на VIII Всесоюзном совещании по паразитологическим
проблемам 1955 г. (Успенская, 1955а), а также упомянуты в книге «Основ-
ные проблемы паразитологии рыб» (1958, с. 294), в монографии С. С. Шуль-
мана (1966, с. 308) и в обзоре Митчелла (Mitchell, 1977). Подробное описание
опытов приведено в нашей статье 1978 г. (Успенская, 19786).
Поскольку методика и результаты опытов были учтены в дальнейших
наших исследованиях и в экспериментах других паразитологов (Hoffman,
Putz, 1969, 1971; Гоффман, 1971), а искусственное заражение миксоспори-
диями до сих пор удается с трудом и для оценки результатов надо знать по-
дробности эксперимента, мы считаем нужным привести здесь описание этих
опытов.
Споры, очищенные от тканей путем повторного центрифугирования
измельченных хрящей (из голов зараженных рыб), помещались в пробирки,
которые были поставлены в широкогорлую банку, затянутую планктонным
газом. Банка устанавливалась на дне ключа с температурой воды летом 8 °C,
а зимой — 4 °C. Так имитировались естественные условия, в которых
споры находятся на дне водоема.
По прошествии 4—4.5, 10 и 12 мес эти споры применялись для искусствен-
ного заражения. Банка вынималась из ручья и переносилась в лабораторию
при температуре от 15 до 20 °C. В опытах использовали молодь радужной
форели, полученную из икры в ключевой воде в условиях, исключающих зара-
жение. Рыб содержали в ключевой воде и кормили искусственным кормом,
100 мальков были отсажены в аквариум и служили контролем. За контроль-
ными рыбами велись наблюдения в течение 90 сут. Ни у одной из них не было
замечено признаков вертежа. Хотя в течение опыта 19 рыб погибли, однако
в них не было найдено спор. В конце опыта 81 контрольная рыба была
вскрыта, и ни в одной из них не было обнаружено спор.
Заражение спорами с 10—12-месячными сроками хранения не дало
результатов: часть подопытных мальков погибла в ранние сроки, часть оказа-
лась незараженной. Заражение удалось спорами с 4—4.5-месячным сроком
хранения (табл. 6).
В итоге наших опытов был сделан вывод, что для достижения инвазион-
ности споры М. cerebralis должны побыть в воде несколько месяцев, не менее
4 (Успенская, 19556; см. также: Основные проблемы..., 1958; Шульман, 1966;
Mitchell, 1977).
Позднее Гоффман и Путц (Hoffman, Putz, 1969; Гоффман, 1971), ознако-
мившись со схемой и результатами наших работ, поставили эксперимент
в более широком масштабе. Свои опыты они проводили в больших аквариу-
мах, на дно которых был помещен ил, смешанный со спорами, добытыми
из зараженных форелей. Споры вносились в аквариум за 0.3—113 сут и за 4—
6 мес до высадки туда молоди. В результате рыбы заразились лишь в тех
аквариумах, в которых споры были внесены за 4 мес до высадки туда молоди.
Все эти данные говорят о том, что споры М, cerebralis действительно
имеют длительный период дозревания в воде (около 4 мес). Этот факт учиты-
вается сейчас многими исследователями, стремящимися получить заражение
в экспериментальных условиях (Hoffman, Putz, 1971; Halliday, 1973, 1974;
Hoffman, 1974b; Markiw, Wolf, 1974).
Наличие периода дозревания, естественно, поднимает вопрос о том, что
препятствует свежевыделенным спорам стать инвазионными и какие компо-
ненты споры или какие процессы ответственны за ее созревание?
87
Т а б л й ц а 6
Результаты опытов по заражению малыков форели спорами Myxosoma cerebralis*
выдержанными в воде 4.5-—5 мес
№ опыта Способ заражения всего £ заразивших- g ся о « Е л здоровых Сроки появле- ния признаков вертежа, сут Продолжитель- ность наблюде- ния, сут Число погибших рыб Примечание
Опыт 1а Споры вводились пипеткой в же- 8 4 4 18—33 80 4 На срезах через че- реп зараженной ры-
Опыт 16 лудок малька Взвесь спор по- 8 1 7 33 80 5 бы обнаружены плазмодии То же
Контроль 1 мещалась в аква- риум с рыбой 100 .81 ♦ 80 19 Не заражены
Опыт 2а Споры вводились 10 2 8 35 60 — Внешние признаки
Опыт 26 в желудок Тот же 13 1 12 29 60 вертежа То же
Контроль 2 — 100 — 100 — 60 — Не заражены
* Часть рыб погибла по другим причинам.
Стремясь разрешить его, мы подвергли ряду гистохимических реакций
свежевыделенные из рыб споры и споры, хранившиеся в течение 4 мес в тех
же условиях, что и использовавшиеся в опытах по искусственному зараже-
нию. При сравнении этих двух категорий спор в неокрашенном виде у долго
находившихся в воде даже не наблюдалось округления амебоидного заро-
дыша. Окраска по Фельгену и железным гематоксилином не выявила
сколько-нибудь заметных изменений в ядерном аппарате амебоидного заро-
дыша в результате длительного хранения. В спорах, хранившихся в течение
4 мес, по-прежнему остается два гаплоидных ядра у амебоида. Их слияние
(половой процесс) внутри спор не происходит. Фельген-положительный мате-
риал располагается по периферии ядра, в центре находится крупная
нуклеола, никаких признаков дегенерации этих ядер нет. У части свежевыде-
ленных спор по Фельгену окрашиваются еще и капсулогенные, и вальвоген-
ные ядра. Это, видимо, не вполне зрелые споры. У спор, длительно находив-
шихся в воде, этих ядер уже нет; должно быть, недоразвитые споры погибают
во время хранения.
Питание и обмен у вегетативных стадий
Myxosoma cerebralis
Вегетативные стадии миксоспоридии Myxosoma cerebralis, возбудителя
вертежа лососевых, имеют вид мелких, многоядерных плазмодиев с псевдо-
подиями. Питание осуществляется путем гистолиза или ферментативного
расщепления основного вещества хряща (Hofer, 1903; Plehn, 1924; Dyk, 1952;
Vanco, 1952; Успенская, 19556, 1957, 1959, 19786; Volf, 1956; Шульман, 1966;
Halliday, 1976). В недавней обзорной статье Холлидея (Holliday, 1976) по
биологии М. cerebralis в качестве способа питания указывается адсорбция
питательных веществ поверхностью трофозоита. Кроме того, они фагоцити-
руют хрящевые клетки (Успенская, 19796).
Основное вещество гиалинового хряща, кроме белков, состоит из муко-
полисахаридов— хондроитинсульфатов А и С (Пирс, 1962; Штрауб, 1965;
Pearse, 1968; Лилли, 1969). Подробного анализа состава гиалиновых хрящей
молоди радужной форели не производилось. Из растворяющих основное
88
вещество хряща ферментов указываются гиалуронидаза, пектиназа, поли-
галактуронидаза, хондромуциназа (Пирс, 1962; Штрауб, 1965; Pearse, 1968;
Лилли, 1969).
Как показали цитохимические исследования, в теле трофозоита обнару-
живаются значительные запасы полисахаридов, представленные мелкой зер-
нистостью и крупными глыбками PAS-положительного материала, целиком
убирающегося 1%-ным раствором а-амилазы при pH 5.6 за 3 ч, а также мел-
кие капли нейтрального жира. Сулемовым бромфеноловым синим интенсивно
окрашивается цитоплазма плазмодия на общие белки. У тех плазмодиев,
внутри которых начался спорогенез, споробласты красятся интенсивнее, чем
остальная цитоплазма. Отмечено наличие РНК в цитоплазме. Во время спо-
рогенеза для построения спор требуется, видимо, усиление синтеза белков.
Как и у других видов миксоспоридий, ДНК в ядрах Л4. cerebralis распола-
гается по периферии, а центр занят крупной нуклеолой.
Локализуясь внутри хрящевой ткани, плазмодии М. cerebralis являются
типичными анаэробами, поэтому они запасают углеводы, а жир и белки
в этих условиях, как правило, не используются (Марков, 1950, 1958, 1961;
Brand, 1952; Пальм, 1967, 1968; Гинецинская, 1968). Как материал для син-
теза гликогена они используют сахара, получаемые из пищи. В результате
анаэробного расщепления углеводов в качестве одного из конечных продук-
тов образуется нейтральный жир. При его синтезе из организма удаляются
вредные продукты обмена (Успенская, 19786).
Знание способов питания и обмена помогает подбору лекарственных пре-
паратов. Известно, что у рыб мышьяк депонируется, кроме других органов,
и в хрящевой ткани жаберных дужек, черепной коробки и осевого скелета
(Sornsen et al., 1979). М. cerebralis, утилизируя основное вещество хряща,
получает дозу мышьяка при лечении форели мышьяковистым препаратом
осарсолом, что приводит к гибели плазмодиев. Считается также, что осарсол
убыстряет окостенение скелета, что ведет к ускорению спорообразования,
т. е. перехода паразита от активной фазы к покоящейся (Успенская, 1957,
1959; Бауэр и др., 1981).
В наших опытах по лечению больных (чернохвостых) форелей осарсолом
при скармливании лекарства рыбе в тот период, когда паразит находится
еще на плазмодиальной стадии развития, от заболевания вылечивалось
60% рыб.
Опыты, по выяснению стойкости спор М. cerebralis при замораживании
и высушивании показали, что они переносят длительное высушивание и замо-
раживание, сохраняя при этом инвазионность (Успенская, 1955а, 19786; Hoff-
man, Putz, 1969, 1971; см. также с. 63).
Из дезинфицирующих веществ мы испытали хлорную известь (Успен-
ская, 1957, 1959). Наши эксперименты показали, что 20%-ный раствор хлор-
ной извести (200 г на 1 л воды), приходя в соприкосновение со спорами,
нацело растворяет их в течение 3—15 мин. Нужно учитывать, что в поступаю-
щей в продажу хлорной извести не всегда содержится одинаковое количество
свободного хлора. Поэтому время, необходимое для растворения спор, может
быть разным. Например, в эксперименте 20%-ный раствор, содержащий
5.7 мл свободного хлора в 1 см3, растворяет споры за 3 мин, а 20%-ный
раствор, содержащий 3.12, 4.15, 5.6 мл хлора в 1 см3, растворяет споры
за 10—15 мин. Хлорная известь на основании этих опытов рекомендовалась
нами в виде крепких растворов. Гоффман и Гродник (Hoffman, Grodnik’o,
1977) считают, что нужна концентрация 10 мг/л, чтобы убить споры.
Поскольку в разных климатических условиях спорообразование происхо-
дит в разные сроки, а при разной системе ведения рыбного хозяйства накоп-
ление спор идет с неодинаковой скоростью, то при рекомендации мер борьбы
эффективными могут быть лишь те, которые учитывают конкретные условия
каждого хозяйства. Изучив экологию и биологию М. cerebralis в зараженных
рыбхозах, мы составили методические указания по борьбе с вертежом с уче-
том этих данных (Успенская, 1959).
89
Результаты проведения мероприятий
по борьбе с вертежом
Начиная с 1959 г. в соответствии с методическими указаниями (см. с. 94)
в рыбхозе Ропша (на который после обнаружения возбудителя вертежа
в 1953 г. был наложен строжайший карантин) начались мероприятия по его
оздоровлению. Была принята схема постепенного оздоровления хозяйства,
начиная с головной системы прудов (система Мельничных прудов). Предва-
рительно был очищен Михайловский ручей, из которого вода поступает в пруд
Мельничный-1. Из этого пруда, в свою очередь, берет воду инкубатор.
Пруд Мельничный-1 был обеззаражен, и ложе пруда укреплено путем его
засева, чтобы уменьшить возможность взмучивания спор со дна. Забор воды
в инкубатор был обеспечен из средних слоев воды для предотвращения всасы-
вания спор с илом со дна пруда. В качестве дезинфицирующего средства был
выбран цианамид кальция (см. с. 95). Строжайшим образом ограждали
инкубатор и всю территорию с этими прудами от возможного заноса зара-
женного ила с инвентарем и на сапогах из других прудов. При взятии икры
у производителей их обмывали в сильной струе ключевой воды, так же как и
рамки для икры. На время дезинфекции пруда Мельничного-1 вода в инкуба-
тор поступала из ключа. Затем была обеззаражена и вся система Мельничных
прудов. Строго придерживались правила раздельного выращивания молоди,
и в эти пруды уже не сажали рыб старших возрастов. Молодь и в латках инку-
батора, и в выростном Артемьевском пруде (большой пруд с естественным
кормом) подкармливали селезенкой и давали им нужную дозу осарсола. Про-
изводилась своевременная высадка молоди (до спорообразования у миксо-
споридий) из выростных прудов первой очереди в пруды второй очереди. Уже
с 1962 г. вертеж в Мельничных прудах был ликвидирован (Бауер и др., 1969,
1981; Богданова, 1977). В 1976 г. мы провели контрольное вскрытие спе-
циально отсаженных выбракованных недомерков и рыб с искривленными
позвоночниками (50 экз.), спор возбудителя в них обнаружено не было.
Уже с 1963 г. и до настоящего времени в рыбхозе не повторялись вспышки
вертежа. Таким образом, предложенные мероприятия надо считать эффектив-
ными (Богданова, 1977; Бауер и др., 1981; см. также: «Наука и жизнь», 1981,
№ 4).
В Чернореченском форелевом хозяйстве, как уже говорилось, имеется
постоянный приток заразного начала от зараженных диких лососевых (черно-
морский лосось и одичавшая радужная форель). В этом хозяйстве не отме-
чалось сильной вспышки вертежа до 1956 г. После того как мы установили
наличие там вертежа в 1956 г., хозяйству были даны соответствующие реко-
мендации. Молодь профилактически кормили осарсолом по инструкции, пере-
садку рыбы также производили ‘по инструкции. В 1973 г. мы провели
совместно с Л. Н. Гелашвили проверку зараженности рыб в рыбхозе и в реке.
В рыбхозе было заражено 27% рыб, но спор в одной рыбе было мало (единич-
ные споры в черепной коробке). Среди диких рыб заражен 21%, количество
спор в одной рыбе было значительным. Возможно, что снижение интенсив-
ности заражения у рыб в хозяйстве происходило благодаря профилактиче-
скому скармливанию осарсола. В 1975 г. хозяйство было закрыто, тщательно
продезинфицировано из-за инфекционного заболевания форелей. Сильных
вспышек вертежа там не наблюдалось. Вследствие возможности заноса вер-
тежа из Черной речки нужно постоянно продолжать ведение этого хозяйства
по схеме, рекомендованной в инструкции. Несмотря на то что в 1972 г. были
установлены песчаные фильтры на водозаборе, все же из реки попадали
в хозяйство споры возбудителя.
Если до 1969 г. в отчетах ихтиологической комиссии возбудитель вертежа
М. cerebralis постоянно упоминался как «приносящий урон возбудитель»,
а затем как «потенциально опасный паразит», то в последние годы он снят
с повестки дня. Наглядные примеры эффективности борьбы с ним снизили
его значимость в ряду угрожающих рыбоводству паразитов. Однако, учиты-
90
вая наличие естественных очагов заражения, вертеж нельзя совсем списывать
со счета, и при первой же вспышке заболевания немедленно следует
карантинизировать зараженное хозяйство и приниматься за борьбу’с этим
паразитом, что предотвратит массовую гибель рыб и нанесение ущерба форе-
леводству.
После выхода в свет наших методических указаний по борьбе с вертежом
Гофман предложил уничтожение спор в воде с помощью ультрафиолетовых
лучей (Hoffman, 1974а). Эффективность метода подтверждается автором.
Предложено скармливать рыбе комплекс витаминов для повышения ее упи-
танности и скорейшего окостенения скелета (Бокучаевы, 1977).
Еще раньше было показано, что нагревание спор до 60—100 °C в течение
10 мин приводит к гибели спор Л4. cerebralis (Успенская, 1955а, 19786; Hoff-
man, Putz, 1969, 1971), а замораживание они переносят хорошо, сохраняя
инвазионность. Недавно это было подтверждено также результатами опытов,
которые показали, что в замороженной форели споры сохраняют жизнеспо-
собность (Wolf, Markiw, 1982), так же как и при замораживании—солении,
тогда как горячее копчение при 60 °C в течение 40 мин убивает споры. Эти
данные полезно учесть при разработке мер борьбы с миксоспоридиями,
вызывающими разжижение мяса рыб во время ее хранения в рефрижераторе
(виды родов Kudoa, Henneguya, Myxobolus). Надо, видимо, рекомендовать
рыбу из уловов при сильном ее заражении обрабатывать горячим копчением,
а не хранить в замороженном виде, тем более что протеазы, выделяемые пара-
зитом, тоже должны инактивироваться при высоких температурах.
Приведенный пример сравнительно быстрого избавления от вертежа
сильно зараженного хозяйства, при соблюдении и в дальнейшем мер профи-
лактики, говорит об эффективности указанных в инструкции мероприятий.
Знание биологии, стадий развития, способов питания, механизма действия
стрекательного аппарата спор, особенностей инвазионной стадии М. cerebra-
lis дает основание не считать этого паразита настолько опасным, каким он
считался ранее, несмотря на то что теперь доказано наличие возбудителя
вертежа в ряде районов СССР у диких рыб и, следовательно, существуют
естественные очаги инвазии (Догель, 1932а; Успенская, 1957; Богданова,
1960).
Дальнейшее изучение должно быть направлено на поиски менее ядовитых
средств дезинфекции, учитывая новые сведения о механизме действия стре-
кательного аппарата (Успенская, 1977). Должно быть, можно найти и лекар-
ственные средства, которые не депонировались бы в организме рыбы, а дей-
ствовали бы так же эффективно на плазмодиев, как стоварсол и осарсол.
Правда, подсчеты показывают, что осарсол в дозе, рекомендованной
на 1 кг массы рыбы, и при продолжительности лечения, назначаемого
курсами (до 6-месячного возраста рыб), может накопиться в теле рыбы
в количестве по крайней мере в 50 раз меньшем, чем одноразовая доза, реко-
мендуемая при лечении человека (даже если считать, что весь мышьяк
депонируется в съедобных частях рыбы).
Наибольшее значение для успешного оздоровления форелевых и лосо-
севых хозяйств имело знание биологии и экологии возбудителя в конкретных
условиях этих хозяйств и то, что меры борьбы были разработаны с учетом
особенностей биотехники разведения рыб в них.
91
ЗАКЛЮЧЕНИЕ
Подводя итог всему сказанному о миксоспоридиях, хочется дать им крат-
кую морфофизиологическую характеристику, базируясь на приводимых ранее
описаниях (Догель, 1932&, 1962; Grasse, 1960; Шульман, 1966* Райков, 1967,
1978; Lom, 1973, 1977; Mitchell, 1977; Grasse, Lavette, 1978) и принимая
во внимание новые электронно-микроскопические, цитохимические и цитофо-
тометрические данные.
Миксоспоридии — это паразитические организмы, главным образом пара-
зитирующие в костистых рыбах, а также в других рыбах и холоднокровных
водных позвоночных. В единичных случаях миксоспоридии встречаются
в беспозвоночных. Они поселяются в полостях, тканях и клетках хозяев.
Многие из них являются возбудителями серьезных заболеваний промысловых
и искусственно разводимых рыб.
С одной стороны, миксоспоридии обладают свойствами, сближающими
их с простейшими, с другой стороны — чертами, поднимающими эти орга-
низмы до надклеточного и даже до многоклеточного уровня. Они имеют гете-
рофазный жизненный цикл с чередованием гапло- и диплофазы, с промежу-
точной редукцией. Является ли их мейоз одноступенчатым или двухступен-
чатым, окончательно еще не выяснено. По данным световой микроскопии,
митоз у них внутриядерный и ацентрический. Подобно другим организмам
с гетерофазным жизненным циклом, миксоспоридии имеют три типа размно-
жения: вегетативное (плазмотомия, почкование), бесполое (спорогенез),
половой процесс (слияние гаметических ядер спороплазмы). Половой процесс
у них примитивен и протекает по типу авто- или педогамии.
Диплофаза миксоспоридий представлена паразитическими трофозоитами
в виде многоядерных (полиэнергидных) плазмодиев, варьирующих по форме
и размерам. Цитоплазма плазмодия содержит типичные для клеток орга-
ноиды и включения: микротрубочки, микрофиламенты, гладкую и шерохова-
тую эндоплазматическую сеть, митохондрии, диктиосомы, вакуоли, свобод-
ные рибосомы и включения в виде гранул или глыбок гликогена, капель жира,
различного рода кристаллов. Плазмодии имеют одну плазматическую мем-
брану, которая может быть снабжена разного рода надмембранными
слоями, иногда довольно сложного строения. Поверхность плазмодиев может
образовывать микроворсинки, увеличивающие ее площадь. От плазматиче-
ской мембраны внутрь плазмодия направляются пиноцитозные каналы или
отшнуровываются пиноцитозные пузырьки. Иногда плазмодии окружаются
капсулами, являющимися дериватами тканей хозяина. Сами плазмодии
не образуют цист в точном смысле этого термина. Цитоплазма плазмодиев
подразделяется на экто- и эндоплазму и на альвеолярный слой, по-разному
развитые у разных видов и в зависимости от возраста.
Миксоспоридии не являются ни облигатными аэробами, ни облигатными
анаэробами. Обмен веществ у них, видимо, может совершаться и тем, и дру-
гим путем, у разных видов и стадий в зависимости от места их обитания
в организме хозяина.
Миксоспоридии обладают всеми известными типами пищеварения и спо-
собами питания (дистантное, пристеночное, внутриклеточное, фагоцитоз,
пиноцитоз, активный транспорт), которые могут комбинироваться по-разному
в зависимости от локализации паразита в хозяине. С типом питания тесно
связаны ультратонкое строение поверхности плазмодия, его форма и размеры.
Полиэнергидные плазмодии размножаются вегетативно (плазмотомия,
почкование), и в организме хозяина происходит накопление паразитов.
Диплрфаза — паразитическая репродуктивная фаза агломерации.
92
Для плазмодиев характерна ядерная дифференцировка на генеративные
и вегетативные ядра. Вегетативные ядра плазмодиев становятся полиплоид-
ными. Внутри плазмодия происходят полиплоидизация и размножение ядер
(полиэнергизация). Вегетативные ядра находятся в общей цитоплазме
трофозоита (как у гетерокариотных организмов), а в отличие цт них генера-
тивные ядра выделяются в особые генеративные клетки, аналогичные поло-
вым клеткам многоклеточных организмов. Генеративные клетки дают начало
первой стадии спорогенеза — панспоробласту. Во время спорогенеза проис-
ходит деление генеративной клетки и ее потомков (цитогония), что и харак-
терно для бесполого размножения. В начале спорогенеза генеративные клетки
и их потомки делятся митотически, а затем совершается мейоз, в результате
которого возникает целиком гаплоидная спора. В конце спорогенеза происхо-
дит дифференцировка соматических клеток споры на капсулогенные и вальво-
генные, что аналогично соматической дифференцировке у многоклеточных.
Затем в обоих типах клеток совершается морфогенез (образование сложного
стрекательного аппарата и прочных створок различной формы у разных
видов).
Гаплофаза у миксоспоридий, таким образом, представлена многокле-
точной спорой, состоящей из соматических (створки и стрекательные кап-
сулы) и половых элементов (спороплазма). В споре могут быть одна 2-ядер-
ная или две 1-ядерные спороплазмы, 1—6 капсул и 2—6 створок у раз-
ных видов.
Спора служит для распространения паразитов, это также покоящаяся
фаза жизненного цикла и фаза дисперсии. Типично для спор миксоспоридий
существование стрекательного аппарата, состоящего из полярных капсул
со свернутой внутри нитью. Капсулогенез связан, видимо, с аппаратом
Гольджи и до тонкостей совпадает с книдогенезом кишечнополостных. В отли-
чие от книдобласта капсулогенная клетка у миксоспоридий дегенерирует
после завершения капсулогенеза. В основе механизма действия стрекатель-
ного аппарата лежит сократительная система. Удаление ионов Са2+
из системы приводит к выстреливанию нити.
Примитивный половой процесс имеет место в момент, когда спороплазма
покидает спору (т. е. когда она проглочена рыбой), он заключается в слиянии
гаплоидных ядер спороплазмы.
93
ПРИЛОЖЕНИЕ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО БОРЬБЕ
С ВЕРТЕЖОМ ЛОСОСЕВЫХ
МЕРЫ БОРЬБЫ С ВОЗБУДИТЕЛЕМ ВЕРТЕЖА
Профилактика заболевания
1. В свободные от вертежа хозяйства нельзя завозить ни посадочный
материал, ни маточное стадо из зараженного хозяйства даже в том случае,
если отобранные для перевозки рыбы не имеют внешних признаков заболева-
ния. Рыбы всех возрастов в зараженном хозяйстве могут служить резервуа-
ром инвазии. Перевозка икры из зараженного хозяйства возможна лишь
в том случае, если икра не инкубировалась, т. е. сразу же после ее получения и
оплодотворения.
2. Для предотвращения возможности возникновения в хозяйстве этого
заболевания необходимым условием является снабжение инкубатора водой
из ключа или из водоема, не заселенного рыбой.
3. Возможность распространения в хозяйстве вертежа значительно огра-
ничивается в том случае, если водоемы рыбхоза имеют независимое водоснаб-
жение.
4. При обнаружении в хозяйстве этого заболевания необходимо немед-
ленно наложить на него строжайший карантин. Накладывается запрет
на вывоз рыбы всех возрастов и инкубированной икры, если инкубатор полу-
чает воду из зарыбленного или заведомо зараженного водоема.
5. В хозяйстве, в котором замечен вертеж, необходимо строго соблюдать
раздельное выращивание молоди и рыбы старших возрастов.
6. Пруды, в которых выращивается молодь, должны облавливаться и осу-
шаться еще до наступления массового спорообразования паразита и оста-
ваться незарыбленными до следующего периода выращивания молоди. (Спо-
рообразование наступает примерно 2.5 мес спустя после появления внешних
признаков заболевания). В эти пруды ни в коем случае нельзя помещать годо-
виков и рыб более старших возрастов даже на короткий срок, так как в слу-
чае их гибели они неизбежно заразят дно спорами.
7. Воду выростных прудов следует брать либо из ключа, либо из незарыб-
ленного водоема.
8. Незараженные выростные пруды, а также источники водоснабжения
инкубатора должны тщательно ограждаться от заноса в них спор птицами
и домашними животными, доступ к водоемам разрешается только обслужи-
вающему персоналу; нельзя использовать инвентарь и спецодежду, употреб-
лявшиеся при работе на зараженных прудах.
9. За инкубатором должны быть строго закреплены штат рабочих,
не имеющих дела с зараженными прудами, особый инвентарь и спецодежда.
10. Обслуживающий персонал должен следить за тем, чтобы не перенести
на своей обуви и спецодежде споры из одного пруда в другой. После работы
в зараженной вертежом зоне необходимо смывать с сапог, плащей и т. д. при-
липший к ним ил сильной струей воды, должны смываться также всякие
следы прилипшего грунта, в котором могут быть споры паразита, над спе-
циально отведенной для этого сточной ямой. Споры могут быть убиты также
и кипятком.
11. Сильная проточность в зараженных прудах вызывает взмучивание
спор и перенос их в нижележащие пруды, что способствует заражению
молоди, особенно в первые дни ее активного питания. Поэтому нужно под-
94
держивать минимальную проточность, конечно, если это не приносит вреда
рыбе.
12. Выращивание молоди в больших прудах на естественных кормах
предохраняет ее от заражения. В этом случае посадка рыб в пруды осуществ-
ляется с меньшей плотностью; при питании планктоном и подкормке селезен-
кой с решеток в верхних слоях воды у рыб нет надобности искать пищу у дна,
и если в таком пруде еще поддерживается слабая проточность, не вызываю-
щая взмучивания, то контакт между спорами и рыбой сильно уменьшается.
13. Одной из мер, способствующих оздоровлению прудового хозяйства,
является создание условий, стимулирующих повышение упитанности выра-
щиваемой молоди. Создание таких условий приводит к быстрому росту рыбы
и скорейшему окостенению скелета, которое препятствует развитию паразита.
14. В зараженном хозяйстве, где невозможно быстро провести оздоровле-
ние и обеспечить раздельное выращивание молоди и рыб старших возрастов,
необходимо подкармливать молодь в течение 4 недель в свободной от спор
воде, что приводит к большей устойчивости молоди по отношению к заболе-
ванию и хотя не ограждает ее целиком от заражения, но снижает смертность.
15. Форель, перенесшую болезнь с сильно выраженными симптомами,
необходимо уничтожить. Выращивание больной форели до товарной массы
нерентабельно, так как болезнь приводит к задержке роста и истощению.
Дезинфекция
16. Профилактические мероприятия не снимают необходимости проведе-
ния тщательной дезинфекции прудов в зараженном хозяйстве для полной
ликвидации спор возбудителя.
17. Дезинфекция негашеной известью. Ложе пруда,
откосы и дамбы посыпаются свежей негашеной известью из расчета 20 ц
на 1 га, и затем напускается небольшое количество воды для получения из-
весткового молока. Через несколько недель после обработки известью пруд
можно использовать без промывки.
18. Дезинфекция цианистым кальцием.4 Обработка циа-
нистым кальцием дает лучшие результаты (Tack, 1951). Для дезинфекции
рекомендуется употреблять немаслянистый цианистый кальций. Он хорошо
распыляется, что позволяет распределить его равномерным слоем. Масля-
нистый цианистый кальций содержит комочки, хуже рассеивается и по этой
причине менее действен. Рассеивание цианистого кальция должно произво-
диться из расчета 0.5—1 кг/м2. Уменьшение дозы нецелесообразно, так как
при засыпке менее 0.5 кг/м2 не гарантирована полная дезинфекция. Циа-
нистый кальций надо рассеивать по ложу спущенного пруда. Дезинфекцию
лучше всего производить при безветренной сухой погоде, чтобы избежать
вымывания и выдувания порошка. При ветреной погоде порошковидный
цианистый кальций следует смешивать с влажным грунтом.
При обработке цианистым кальцием пруд должен возможно дольше
оставаться незалитым (минимум 8 сут, лучше 4 недели). Порошок увлаж-
няется, впитывая донную сырость и росу. При этом образуется цианамид
кальции — ядовитое соединение, имеющее основное значение в дезинфекции.
В дальнейшем цианамид кальция, вступая в реакцию с водой, разлагается
с выделением аммиака и превращается постепенно в безвредные вещества.
Дезинфицировать нужно не только дно пруда и внутренние откосы,
но также и дамбы. В некоторых случаях, когда споры могут быть занесены
домашними животными, птицами или людьми, нужно обрабатывать и терри-
торию вокруг пруда.
Дезинфекцию лучше всего производить 2 раза в год: первый раз после
осенних обловов (пруд не заливается), и второй раз за 5—6 недель до весен-
4 При применении этого ядохимиката необходимо получать разрешение Госсанииспекции
Министерства здравоохранения и пользоваться инструкцией о применении ядовитых веществ.
95
него зарыбления. Спустя 4 недели после второй дезинфекции пруд заполня-
ется водой. Вода может быть еще сильно ядовитой (особенно если сокращен
срок выдерживания пруда без воды), поэтому первую воду нужно спустить.
Необходимо соблюдать большую осторожность и спускать воду медленно,
постепенно, чтобы не отравить рыбу в нижележащих водоемах. Пруд
снова заполняется водой и устанавливается проточность. При этом про-
веряется pH, который в связи с дезинфекцией сильно повышается. Когда pH
достигает нормы, пруд может быть снова зарыблен.
При заливке и спуске пруда нужно остерегаться взмучивания, иначе
спрятанные глубоко в грунте, еще живые споры могут быть вынесены
на поверхность и заразить новую партию рыбы.
Целесообразно оздоровлять все хозяйство одновременно. Когда оздоров-
ление хозяйства проводится по частям, то дезинфекция может дать хорошие
результаты только.в том случае, если соблюдены все правила профилактики
и устранена возможность заноса новых спор.
Так как цианамид кальция ядовит для животных и человека, то приме-
нять его нужно с осторожностью, соблюдая ряд правил, принятых при работе
с ядохимикатами.
19. Дезинфекция хлорной известью. Раствор хлорной
извести должен рассеиваться равномерным слоем из леек или распылителей.
Если считать, что толщина слоя, покрывающего грунт, равна 1 мм, то при
применении 20%-ного раствора его потребуется около 2 т на 1 га.
20. Выбракованную рыбу, так же как и погибшую от вертежа во время
выращивания, следует свозить в особую яму, заливать крепким дезинфици-
рующим раствором и закапывать.
Лечение
21. Борьба с заболеванием может вестись и лечебными средствами.
Итальянским исследователем Сколари (Scolari, 1954) в качестве лекарствен-
ного вещества был предложен мышьяковый препарат стоварсол в дозе 0.01 г
на 1 кг массы тела рыбы в сутки. Указанная доза стоварсола дается 3 сут под-
ряд, после чего наступает 7-суточный перерыв; затем применение лекарства
повторяется. Лечение рыб продолжается до 6-месячного возраста.
Испытанный нами отечественный препарат осарсол также с успехом
может применяться для лечения и профилактики заболевания. Скармливание
осарсола здоровой молоди предохраняет ее от заражения. Лечение прово-
дится 5-суточными циклами с недельными интервалами между ними. Первые
3 сут дается по 0.01 г на 1 кг массы тела рыбы в 1 сут, последующие 2 сут доза
удваивается (0.02 г на 1 кг массы тела рыбы). Лекарство скармливается
с утренней порцией пищи. Для того чтобы легче смешивать порошок с кормом,
можно его разводить в содовом растворе: 0.03—0.04 г соды и 0.01 г осарсола
на 1 см3 воды. Осарсол должен полностью раствориться (помутнение
раствора указывает на недоброкачественность препарата).
22. Некоторые зараженные вертежом рыбные хозяйства стран Западной
Европы в том случае, если они не в состоянии быстро произвести оздоров-
ление прудов, отказываются от инкубации икры и выращивания сеголетков,
а завозят из здоровых хозяйств годовиков, с тем чтобы доращивать их до
товарных размеров. Такой способ не избавляет рыбное стадо этого хозяйства
от заболевания, но позволяет давать товарную продукцию.
ПУТИ БОРЬБЫ С ВЕРТЕЖОМ В РЫБХОЗЕ РОПША В 1959 Г.
Рыбхоз Ропша имеет зависимую систему водоснабжения. Водоемы пред-
ставлены прудами площадью от 0.02 до 44.85 га. Методика ведения фореле-
вого хозяйства соответствует интенсивной форме по М. Н. Грачевой. Перво-
начальное выращивание личинок осуществляется в прудах с большими пло-
щадями на естественных кормах. Подкормка искусственными кормами начи-
96 ‘
нается осенью и продолжается всю зиму. Рыбы старших возрастов выращи-
ваются в прудах с меньшей площадью при большой плотности посадки
на искусственных кормах.
Развитие возбудителя вертежа, по нашим данным, в Ропше идет по сле-
дующей схеме: заражение молоди начинается еще в инкубаторе, до того как
личинки приступают к самостоятельному питанию (июнь), и продолжается
после высадки молоди в пруды (июнь—июль).
Плазмодиальная стадия длится до середины августа. Спорообразование
начинается со второй половины августа, когда можно найти единичные споры.
В конце августа—сентября начинается массовое спорообразование.
Для борьбы с вертежом в Ропше нами были предложены и осуществ-
лялись следующие мероприятия.
1. На рыбхоз Ропша, в котором вертеж принял характер эпизоотии
и зараженность рыб достигла огромных размеров (60—100%), был наложен
строжайший карантин с запретом какой-либо перевозки рыбы всех возрастов
в другие хозяйства. Запрещена была также и перевозка инкубированной
икры, так как инкубатор получал воду из сильно зараженного пруда.
2. Мероприятием первостепенной важности является обеззараживание
источника водоснабжения инкубатора, чего можно достигнуть либо переведя
его на ключевое водоснабжение, либо очистив пруд, из которого поступает
вода в инкубатор (Мельничный-1), от спор паразита. Для осуществления
этой задачи была проведена тщательная и многократная дезинфекция
этого пруда (Успенская, 1959), и больше его уже не зарыбляли. Предвари-
тельно был очищен от рыбы Михайловский ручей, из которого вода посту-
пает в пруд. В это время инкубатор был временно переведен на ключевое
питание.
Для того чтобы при возможном взмучивании ила вынесенные на поверх-
ность из глубоких слоев не убитые дезинфекцией споры не могли попасть с во-
дой в инкубатор, был обеспечен забор воды из средних горизонтов пруда,
а позднее ложе пруда укреплено путем засева.
3. Так как производители в Ропше содержались в зараженных прудах,
то перед взятием икры их обмывали в сильном токе чистой воды. В носилки,
в которые их отсаживали, наливалась вода из ключа. Рамки с икрой тоже
смачивались ключевой водой.
4. После исключения возможности заражения личинок в инкубаторе,
должна быть проведена подготовка выростных прудов. Под выростные пруды
можно либо использовать свободные от возбудителя вертежа пруды, либо
путем тщательной дезинфекции обеззаразить какой-либо из головных участ-
ков системы, состоящий из прудов, пригодных для выращивания личинок
форели. Участок этот должен дезинфицироваться весь целиком.
После подготовки выростных прудов выращивание в них должно произ-
водиться с соблюдением следующих правил: а) ни в коем случае эту часть
системы не зарыблять форелью других возрастов, кроме личинок из инку-
батора; б) выращивание в этих прудах (выростные пруды 1-й очереди) про-
водить лишь до момента спорообразования, т. е. в условиях Ропши облавли-
вать к первой декаде августа; в) после облова выростных прудов необходимо
их спустить до следующего периода выращивания, при этом первые 2—3 года
каждый раз следует после спуска повторить дезинфекцию; г) из этих прудов
в первой декаде августа рыба на доращивание должна быть пересажена
в другие пруды (выростные пруды 2-й очереди). При такой системе выращи-
вания среди рыб, населяющих выростные пруды 1-й очереди, никогда
не будет спороносителей. Поэтому, если даже после дезинфекции в них оста-
нутся споры, из года в год количество их будет уменьшаться. Если при этом
еще придерживаться принятой в рыбхозе Ропша методики первоначального
выращивания молоди на естественных кормах и под выростные пруды исполь-
зовать большие пруды и поддерживать в них минимальную проточность,
то зараженность сеголетков даже в первые годы проведения оздоровительных
мероприятий должна резко снизиться.
7 А. В. Успенская
97
5. Это не снимает, однако, необходимости постепенно провести дезинфек-
цию всей системы прудов в хозяйстве.
6. Из дезинфицирующих веществ, употребляемых при вертеже, для
Ропши можно рекомендовать негашеную и хлорную известь. Так как все
пруды в Ропше обладают зависимым водоснабжением и вода системы попа-
дает в р. Стрелку, откуда население берет питьевую воду, дезинфекция циа-
нистым кальцием опасна, при его применении требуется строжайшее соблю-
дение мер предосторожности, предотвращающих возможность отравления
населения.
7. По установившимся в Ропше правилам, очень скоро после того как
личинки приступят к активному питанию, их высаживают в большие пруды
на естественные корма. При такой схеме лечение и профилактика с помощью
осарсола затруднены. Однако осарсол надо давать уже в латках, докармли-
вая личинок в прудах 1-й очереди селезенкой с решеток; в прудах 2-й очереди
при кормлении искусственным кормом целесообразно примешивать осарсол
в нужной дозе рыбам до 4—6-месячного возраста. Позднее дача осарсола уже
не будет нужна, так как скелет рыбы достаточно окостенеет и новое зараже-
ние ей уже не будет опасно.
8. При проведении всех этих мероприятий необходимо всячески противо-
действовать переброске заразного начала из одного пруда в другой, а также
изъять из прудов всех недомерков и сильно изуродованных болезнью рыб,
выращивание которых уже не имеет смысла; их легко отбраковать во время
осенних и летних обловов.
9. Другим путем борьбы с вертежом может быть отказ от инкубации
икры и выращивания молоди и завоз в хозяйство годовиков из лишенных
этого заболевания хозяйств для подращивания их до товарной массы. Этим
путем не будет достигнуто оздоровление хозяйства, но оно будет давать
какую-то продукцию.
10. Третий путь — выведение всего хозяйства из строя и основательная
чистка и дезинфекция всей системы прудов сразу.
В Ропше был принят первый путь оздоровления хозяйства и уже в 1959 г.
были обеззаражены Михайловский ручей и пруд Мельничный-1, из которых
вода поступала в инкубатор. Были приняты строжайшие меры против заноса
в инкубатор спор возбудителя вместе с грунтом, икрой или инвентарем. Затем
была продезинфицирована вся система головных Мельничных прудов —
прудов 1-й очереди. Дезинфекция проводилась цианистым кальцием. Дальше
соблюдались меры профилактики (своевременная пересадка рыб, раздельное
выращивание молоди и рыб старших возрастов и т. д.) и лечения (молоди
давался осарсол по инструкции). В результате уже в 1962 г. Мельничная
система прудов была свободна от вертежа, и эпизоотия в Ропше была прекра-
щена (Богданова, 1977). В 1976 г. мы специально просмотрели 50 рыб с ис-
кривлениями позвоночника, отловленных во время облова. Спор Myxosoma
cerebralis в этих рыбах обнаружено не было (искривление позвоночника
не всегда является следствием вертежа, а может быть вызвано нарушениями
в период эмбрионального развития и др.).
До сих пор в Ропше не возникало новых вспышек вертежа. Заболевание
было вовремя распознано и ликвидировано за сравнительно короткий срок
достаточно радикально.
ПУТИ БОРЬБЫ С ВЕРТЕЖОМ
В ЧЕРНОРЕЧЕНСКОМ ФОРЕЛЕВОМ ХОЗЯЙСТВЕ В 1959 г.
В Чернореченском форелевом хозяйстве источником водоснабжения инку-
батора и питомников служит р. Черная, заселенная дикими лососевыми —
носителями спор возбудителя вертежа (Успенская, 1955а, 19556, 1957).
Рацион рыбы в основном состоит из искусственных кормов. Живые корма
даются только на начальных стадиях развития, а позднее составляют ничтож-
ный процент рациона.
98
Выращивание ведется при довольно высоких плотностях посадки. Все это
благоприятствует развитию вертежа. Однако существуют обстоятельства,
благодаря которым значительно уменьшается опасность возникновения эпи-
зоотии и упрощается борьба с заболеванием. Все пруды и питомники Черно-
реченского форелевого хозяйства имеют независимое водоснабжение и водо-
сброс. Выростные водоемы представляют собой бетонные бассейны, и только
рыбы старших возрастов высаживаются в земляные пруды. Произвести
дезинфекцию и чистку таких бассейнов гораздо проще, чем земляных прудов
Ропши. Кроме того, по принятой на Чернореченском хозяйстве схеме выращи-
вания, рыб в течение выростного периода несколько раз пересаживают из бас-
сейна в бассейн (из инкубатора в личиночные питомники, из личиночных
питомников при массе тела 3 г — в круглые бассейны, а оттуда^при массе тела
25 г — в пруды), что также может помочь в борьбе с вертежом. В случае
возможной вспышки в этом хозяйстве вертежа рациональным нужно считать
следующие меры борьбы с возбудителем.
1. Так как вертеж наибольшую опасность представляет для рыб ранних
возрастов, то основная задача — не допустить накопления спор возбудителя
в личиночных питомниках. Для этого пересаживать зараженную вертежом
популяцию рыб из личиночных бассейнов нужно еще до того, как больные
особи станут переносчиками инвазии, т. е. до периода образования спор.
В условиях Чернореченского хозяйства массовое спорообразование можно
ожидать уже в июле. Однако поскольку выклев рыбы происходит в течение
растянутого периода, а споры паразита из реки поступают в питомник в раз-
личное время, то спорообразование может происходить в питомниках неодно-
временно. Поэтому сроки пересадки зараженной популяции рыб в круглые
бассейны нужно устанавливать для каждого питомника отдельно. Пересадка
производится не позже чем через 2.5 мес после появления в питомнике рыбы
с внешними признаками вертежа.
2. У пересаженной в круглые бассейны зараженной рыбы паразит посте-
пенно приступает к спорообразованию, и, таким образом, рыба превращается
в распространителя инвазии. Водоснабжение бассейнов таково, что споры
из них могут быть вынесены в реку. Для того чтобы не увеличивать заражен-
ность рыб в реке (что имеет большое значение для хозяйства), после освобож-
дения бассейнов от рыбы их нужно обрабатывать крепким раствором хлор-
ной извести, не менее чем 20%-ным (т. е. 200 г на 1л), который растворяет
оболочки спор и убивает амебоидных зародышей. При проведении дезинфек-
ции надо следить, чтобы хлорная известь не попадала в реку, так как это при-
ведет к гибели в ней рыбы. Таким образом, обработка бассейнов должна вес-
тись при закрытом водосливе. После тщательной промывки стенок бассейна
дезинфицирующим веществом его наливают слоем в несколько сантиметров
(2—4 см) на дно, и бассейн в таком виде оставляют на некоторое время. Сво-
бодный хлор постепенно улетучивается из раствора, и хлорная известь
утрачивает свои ядовитые свойства. Определяют этот момент по исчезнове-
нию запаха хлора. После дезинфекции бассейны должны быть тщательно про-
мыты водой.
Для Чернореченского хозяйства можно рекомендовать цианистый каль-
ций как более эффективное вещество. По дну бассейна при этом рассеивается
слой цианистого кальция и заливается небольшим количеством воды. В таком
виде бассейн оставляется на 4 недели. Когда цианамид кальция превра-
тится в безвредные соединения, бассейны промывают и зарыбляют (надо про-
верять pH). Необходимо внимательно следить, чтобы вода из дезинфици-
руемых бассейнов не попадала в реку. Для большей безопасности мыть бас-
сейны следует только при закрытом водосливе, открыть который нужно после
того, как бассейн будет тщательно промыт. Спускать воду нужно постепенно,
небольшими порциями.
3. В латках с молодью, после ее перехода к активному питанию, и в бас-
сейнах в случае появления большого количества вертящихся форелей можно
применять лечение осарсолом, примешивая его в нужной дозе к пище.
7*
99
ЛИТЕРАТУРА
Аверинцев С. В. Исследование над паразитическими простейшими. — Тр. СПб о-ва
естествоиспыт., 1908, т. 38, с. 1 —139.
Агроскин Л. С., Папаян Г. В. Цитофотометрия. Л., 1977. 282 с.
Алтухов К. О., Г а л а с у н П. Т., Демченко I. Ф., I в а с и к В. М. Разведение форели
на Украине. Кжв, 1967. 80 с.
Бауэр О. Н., М у с с е л и у с В. А., Стрелков Ю. А. Болезни прудовых рыб. М., 1981.
319 с.
Бауэр О. Н., Никольская Н. П. Желтуха форелей. — Информ, бюл. ВНИОРХ, 1940, т. 3,
с. 19—21.
Бейер Т. В., Шибалова Т. А., Костенко Л. А. Цитология кокцидий. Л., 1978.
186 с.
Березанцев Ю. А. Проблема тканевого паразитизма. — Паразитология, 1982, т. 16,
№ 4, с. 265—273.
Бершадский А. Д., Васильев Ю. М., Блиох Ж. Л., Домина Л. В., И в а-
н о в а О. Ю., Свиткине Т. М., Тиит И. С., Гельфанд И. М., Смоляни-
нов В. В. Механизмы морфогенетических реакций, определяющих форму и движение
нормальных и трансформированных клеток в культуре. — В кн.: Немышечные двига-
тельные системы. М., 1981, с. 65—75.
Богданова Е. А. Природный очаг вертежа лососевых на острове Сахалин. — ДАН СССР,
1960, т. 134, № 6, с. 273—277.
Богданова Е. А. Паразиты и инвазионные болезни лососевых и сиговых в рыбоводных
хозяйствах. — Изв. ГосНИОРХ, 1977, т. 120, с. 1 —160.
Бокучаева Г. Л. Применение витаминов при вертеже форелей. — В кн.: Новое в борьбе
с инвазионными болезнями рыб в условиях промышленного рыбоводства: Тез. докл.
Всес. совещ. по инфекционным болезням рыб. М., 1977, с. 23—24.
Вилли К., Детье В. Биология. М., 1974. 823 с.
Воронова М. Н. О полиплоидии соматических ядер агамонтов фораминиферы Cibicides loba-
tulus. — Цитология, 1976, т. 18, № 4, с. 509—512.
Воронова М. Н. Ядерный дуализм гамонтов фораминифер Cibicides lobatulus. — Цитология,
1978а, т. 20, № 8, с. 959—967.
Воронова М. Н. Мейоз у фораминиферы Cibicides lobatulus. — Цитология, 19786, т. 20,
№ 11, с. 1328—1331.
Гартман М. Общая биология. Л.; М., 1936. 747 с.
Гинецинский А. Г. Физиологические механизмы водно-солевого равновесия. М.; Л., 1964.
425 с.
Гинецинская Т. А. Трематоды. Их жизненные циклы, биология и эволюция. Л., 1968.
411 с.
Гинецинская Т. А., Добровольский А. А. Частная паразитология. Паразитические
простейшие и плоские черви. М., 1978. 302 с.
(Голикова М. Н., Селиванова Г. В., Соколова Л. В.) Golikova М. N.,
Selivanova G. V., Sokolova L. \. The effect of hydrolysis condition and functional
state of the ciliates Paramecium bursaria on the intensity of the Feulgen reaction in their
nuclei. — Arch. Protistenk., 1980, Bd 123, S. 202—214.
Горюшкин Г. E., Мусселиус В. А. Сканирующая электронная микроскопия при ис-
следованиях некоторых паразитических простейших рыб. — Паразитология, 1977, т. 11,
вып. 5, с. 399—402.
Гоффман Г. Л. Вертеж форелей и лосося, вызванный Myxosoma cerebralis (Myxosporidia,
Myxosomatidae) в Соединенных Штатах Америки. — Паразитология, 1971, т. 5, № 2,
с. 182—185.
Гусев А. В., Полянский Ю. И. Экологическая сущность паразитологии. — Вести.
Ленингр. ун-та, 1978, № 3, с. 5—13.
Догель В. А. Паразитарные заболевания рыб. 1932а. 151 с.
Догель В. А. Пресноводные Myxosporidia СССР. Л., 19326, т. 4, с. 1—70. (Определители
организмов пресных вод СССР).
Догель В. А. Курс общей паразитологии. Л., 1947. 372 с.
Догель В. А. Общая протистология. М., 1951. 603 с.
Догель В. А. Олигомеризация гомологичных органов. Л., 1954. 368 с.
Догель В. А. Зоология беспозвоночных. 5-е изд., доп./Под ред. А. В. Иванова, Ю. И. По-
лянского, А. А. Стрелкова. М., 1959. 511 с.
Догель В. А. Общая паразитология. Изд. перераб. и доп. Ю. И. Полянским и Е. М. Хейсиным.
Л., 1962. 464 с.
Дот ел ь В. А. Зоология беспозвоночных. М., 1981. 577 с.
Догель В. А., Полянский Ю. И., Хейсин Е. М. Общая протозоология. М.; Л., 1962.
,502 с.
100
Донец 3. С. Миксоспоридии бассейнов южных рек СССР (фауна, экология, эволюция и
зоогеография): Автореф. докт. дис. Л., 1982. 28 с. (Ленингр. гос. ун-т).
Донец 3. С., Соломатова В. П. К вопросу о строении и функции полярных'капсул
миксоспоридий. — В кн.: Экологическая и экспериментальная паразитология. Л., 1979,
вып. 2, с. 166—172.
Заварзин А. А. Об изменениях мышечного волокна соматической мускулатуры бычка
(Cottus cottus) под влиянием внутреннего паразита. — Арх. анат., гистол. и эмбриол.,
1938, т. 19, № 3, с. 333—341.
Зандриттер В. Методы и результаты количественных цитохимических исследований. —
В кн.: Введение в количественную цитохимию. М., 1969, с. 133—154.
Зеров Д. К- Очерк филогении бессосудистых растений. Киев, 1972. 315 с.
И в а с и к В. М. Захварювание рыб. — В кн.: Поради рыбоводам. Лв1в, 1963, с. 71.
Ковалева А. А., Шульман С. С. Многостворчатые миксоспоридии рыб. — Тр.
ЗИН АН СССР, 1978, т. 78, с. 16—29.
Котельников В. М., Литинская Л. Л. Факторы, влияющие на ход кислотного
гидролиза ДНК при проведении реакции Фельгена. — Цитология, 1979, т. 21, № 5,
с. 491—507.
Ленинджер А. Биохимия. М., 1974. 955 с.
Лилли Р. Патогистологическая техника и практическая гистохимия. М., 1969. 718 с.
Магакян Ю. А.,Карамова Е. М.,Х о ч и к я н Р.Э., Аветисян А. С. Влияние темпе-
ратуры гидролиза, концентрации кислоты и продолжительности гидролиза на интенсив-
ность реакции Фельгена. — Цитология, 1980, т. 22, № 9, с. 1054—1066.
Маргаритов Н., Шакалия Г. Определение на сроки на спорообразование при
Myxosoma cerebralis причинителе на въртеза на дъговатта пъстърва при условиях на ДРС
в самоне. — Рыбное стопанство, 1976, т. 23, № 8, с. 1—3.
Марков Г. С. Гликоген и жир у некоторых гельминтов в зависимости от условий их существо-
вания. — Докл. АН СССР, 1950, т. 74, вып. 1, с. 165—167.
Марков Г. С. Физиология паразитов рыб. — В кн.: Основные проблемы паразитологии рыб.
Л., 1958, с. 122—144.
Марков Г. С. О типах обмена веществ паразитических червей. — Уч. зап. Сталинград,
гос. пед. ин-та, 1961, вып. 13, с. 90—100.
Маршак Г. Л., Бродский В. Я., У р ы в а е в а И. В. Влияние свойств ДНП и условий
проведения гидролиза на интенсивность окрашивания при реакции Фельгена. — Онтоге-
нез, 1970, т. 1, с. 421—428.
Мейер К. Размножение растений. М. 1937. 395 с.
Михалевич В. М. Систематика и эволюция фораминифер в свете новых данных по их
цитологии и ультраструктуре. — Тр. ЗИН АН СССР, 1980, т. 94, с. 42—61.
Машанский В. Ф., Боброва И. Ф., Дроздов А. Л., Рижмадзе Н. А. Консер-
ватизм в ультраструктуре мембранных компонентов митохондрий. — В кн.: Структура
и функции биологических мембран. М., 1975. 347 с.
Никулина В. Н., Марченко А. М. Паразиты форели прудов совхоза «Урожайный»
Алтайского края. — Тр. Новосиб. с.-х. ин-та, 1976, т. 95, с. 9—99.
Новожилов Ю. К. Проблемы систематики миксомицетов. — Микология и фитопатология,
1978, т. 12, вып. 5, с. 435—442.
Наумов Д. В. Гидроиды и гидромедузы. М.; Л., 1960. 585 с.
Основные проблемы паразитологии рыб / Под ред. В. А. Догеля, Г. К. Петрушевского,
Ю. И. Полянского, Л., 1958. 364 с.
Пальм В. Запасные питательные вещества — гликоген и жир — у гельминтов и зависимость
их накопления от различных биологических и экологических факторов: Автореф. канд.
дис. Л., 1967. 16 с. (Ленингр. гос. ун-т).
Пальм В. Сравнительное изучение запасных питательных веществ — жира и гликогена —
у трех видов трематод из ужей. — Тр. Астрахан. заповеди., 1968, вып. 11, с. 114—121.
(Петрушевский Г. К.) Petruschewsky G. К. Zur Systematik und Cytologie der
Myxosporidia aus Fischen des Weifien Meers. — Arch. Protistenk., 1932, Bd 72, xN 3,
S. 543—556.
Пирс Э. Гистохимия. M., 1965. 962 с.
Подлипаев С. А. Жир в спорах и цистах некоторых слизистых споровиков. — Паразитоло-
гия, 1972, т. 6, № 5, с. 506—508.
Подлипаев С. А. Полисахариды в спорах слизистых споровиков Myxobolidae. — Парази-
тология, 1974, т. 8, № 6, с. 536—542.
(П о д л и п а е в С. А., Ш у л ь м а н С. С.) Р о d 1 i р а е v S. A., S с h u 1 m a n S. S. The na-
ture of the iodophilous vacuole in Myxosporidia. — Acta protozooL, 1978, t. 17, N 1, s. 109—
124.
Полянский Ю. И. О некоторых морфологических закономерностях эволюции паразити-
, ческих животных. — Паразитол. сб. (ЗИН АН СССР), 1969, т. 24, с. 209—218.
Полянский Ю. И. Жизненные циклы фораминифер. — В кн.: Вопросы микропалеонтологии.
Л., 1982, вып. 25, с. 3—17.
Райков И. Б. Кариология простейших. Л., 1967. 260 с.
Райков И. Б. Ядро простейших. Морфология и эволюция. Л., 1978. 327 с.
Райкова Е. В. Развитие мужских гонад и сперматогенез у Polypodium hydriforme.—
Цитология, 1961, т. 3, № 5, с. 528—544.
Райкова Е. В. Электронно-микроскопическое исследование развития стрекательных капсул
101
у паразитического столона Polypodium hydriforme. — Цитология, 1978, т. 20, № 4,
с. 384—390.
Семенова Н. В., Бауэр О. Н., Ковальская М. Т. Гепатома форелей. — Рыб. хоз-во,
1976, № 10, с. 26—27.
Семенова Н. В., Ковальская М. Т. Хлоромиксоз молоди лососевых рыб. — В кн.:
Материалы VI Всесоюзного совещания по болезням рыб. М., 1975, с. 99—102.
Сидорова И. И., Тарасов К. Л. Современные представления о филогении и систематике
грибов. — В кн.: Ботаника. М., 1980. Т. 4. Вопросы микологии, с. 3—48. (Итоги науки
и техники).
Сопрунов Ф. Ф. Особенности обмена кишечных гельминтов и проблема синтеза специфи-
ческих антигельминтных препаратов. — В кн.: Вопросы медицинской паразитологии.
М., 1970, с. 135—145.
Сопрунов Ф. Ф. Биохимические механизмы адаптации гельминтов к паразитированию. —
Тр. ВНИИ гельминтол., 1971, т. 17, с. 9—26.
Тарейкин С. И., Ветрова Т. И., Никулина В. Н. Некоторые данные о паразитарных
заболеваниях рыб, новых для водоемов Алтайского края. — В кн.: Тезисы докладов 5-го
Всесоюзного совещания по болезням и паразитам рыб и водных беспозвоночных.
Л., 1968, с. 73.
Титарев Е. Ф. Опыт выращивания молоди радужной форели в условиях Алтайского края. —
Сб. науч. тр. ВНИИПРХ, 1972, вып. 14, с. 95—105.
Титарев Е. Ф. Перспективы развития форелеводства в Алтайском крае. — В кн.: Совещание
по обмену опытом в форелеводстве. Л., 1975, с. 59—60. (Краткие тез. докл.).
У гол ев А. М. Пристеночное (контактное) пищеварение. М.; Л., 1962. 203 с.
У гол ев А. М. Физиология и патология пристеночного пищеварения. Л., 1967. 230 с.
Угол ев А. М. Пристеночное пищеварение. Л., 1972. 358 с.
Успенская А. В. Биология, распространение и рыбохозяйственное значение Myxosoma
cerebralis — возбудителя вертежа форелей. — В кн.: Тезисы докладов VIII Всесоюзного
совещания по паразитологическим проблемам. М.; Л., 1955а, с. 155—156.
Успенская А. В. К биологии и распространению Myxosoma cerebralis (Hofer, 1903;
Plehn, 1905) — возбудителя вертежа форели. — Докл. АН СССР, 19556, т. 105, № 5,
с. 1132—1135.
Успенская А. В. Экология и распространение возбудителя вертежа форелей — Myxosoma
cerebralis (Hofer, 1903; Plehn, 1905) в прудовых хозяйствах Советского Союза. — Изв.
ВНИОРХ, 1957, т. 42, с. 43—52.
Успенская А. В. Методические указания по борьбе с вертежом лососевых. Л., 1959. 19 с.
Успенская А. В. О способе питания вегетативных стадий Myxidium lieberkiihni (Biltschli).
Acta protozool., 1966, t. 4, s. 81—88.
Успенская А. В. Ультратонкое строение некоторых стадий Myxidium gasterostei Noble,
1943. — Acta protozool., 1969, t. 7, N 7, s. 71—79.
Успенская А. В. Ультратонкое строение некоторых видов миксоспоридий. — В кн.: Мате-
риалы I съезда Всесоюзного общества протозоологов. Баку, 1971, с. 93.
Успенская А. В. Исследование механизма действия полярных капсул миксоспоридий
рыб. — В кн.: Тезисы докладов на научной конференции ИНЦ АН СССР к 15-летию
института. 1972а, с. 94—95.
Успенская А. В. Ультраструктура стрекательного аппарата миксоспоридии Sphaeromyxa
cottidarum. — Цитология, 19726, т. 14, № 6, с. 779—782.
Успенская А. В. Цитофотометрические исследования ядерного цикла миксоспоридии
Sphaeromyxa elegini— Цитология, 1975, т. 17, № 2, с. 200—205.
(Успенская А. В.) Uspenskaja А. V. The nuclear cycle of Myxosporidia according to
cytophotometry. — Acta protozool., 1976a, t. 15, xN 3, s. 301—313.
Успенская А. В. Механизм действия стрекательного аппарата у миксоспоридий. — В кн.:
Немышечные формы подвижности. Пущино, 19766, с. 102—107.
Успенская А. В. Экструсомы беспозвоночных. — В кн.: Движение немышечных клеток
и их компонентов. Л., 1977, с. 66—103.
Успенская А. В. Плоидность ядер спорообразующих клеток миксоспоридии Myxidium
perniciosum. — Цитология, 1978а, т. 20, № 11, с. 1331 —1333.
Успенская А. В. Биологические особенности инвазионной стадии Myxosoma cerebralis
(Myxosporidia, Myxosomatidae). — Паразитология, 19786, т. 12, № 1, с. 15—20.
(Успенская А. В.) U s р е n s k a j а А. V. Further investigation of the nuclear cycle of
Myxosporidia with aid of cytophotometry. — J. Protozool., 1979a, vol. 26, p. 37.
Успенская А. В. О питании вегетативных стадий Myxosoma cerebralis (Hofer, 1903;
Plehn, 1905) (Myxosporidia). — Паразитология, 19796, т. 13, № 1, с. 169—171.
Успенская А. В. Электронно-микроскопические, цитохимические и цитофотометрические
исследования представителей рода Sphaeromyxa (Myxosporidia), паразитирующих
в морских рыбах. — В кн.: Тезисы докладов VII Всесоюзного совещания по паразитам
и болезням рыб. Л., 1979в, с. 111 — 112.
У с п е н с к ая А. В. Сравнение результатов цитофотометрических и электронно-микроскопи-
ческих исследований спорогенеза у миксоспоридий из разных систематических
групп. — Цитология, 1981а, т. 23, № 5, с. 570—580.
(Успенская А. В.) Uspenskaja А. V. Results of cytophotometric investigations of the
nuclear ploidy in Myxosporidia of different taxonomic groups. — In: Progress in proto-
zoology: Abstr. VI Intern, congr. protozool. Warszawa, 19816, p. 377.
102
Успенская А. В. Изучение ультратонкого строения и цитохимических особенностей
Kudoa quadratum (Thelohan, 1895) (Myxosporidia: Multivalvulea). —В кн.: Тезисы
докладов симпозиума по паразитологии морских организмов. Л., 1981в, с. 107—108.
Успенская А. В. Исследования ультратонкого строения поверхности, способов питания и
типов обмена у плазмодиев миксоспоридий из разных мест обитания. — Тр.
ЗИН АН СССР, 1981г, т. 108, с. 46—51.
Успенская А. В. Ультратонкое строение так называемых «цист» миксоспоридий. —
Паразитология, 1982а, т. 16, № 1, с. 13—17.
Успенская А. В. Новые данные о жизненном цикле и биологии миксоспоридий (Protozoa). —
ДАН СССР, 19826, т. 262, № 2, с. 503—507.
(Успенская А. В.) LJspenskaja А. V. New data on the life cycle and biology of
Myxosporidia. — Arch. Protistenk., 1982b, Bd 126, S. 309—338.
X e й с и н E. M., Шульман С. С., Винниченко Л. H. Строение спор Myxobolus. —
Цитология, 1961, т. 3, № 6, с. 662—667.
Чернышева Н. Б., Юнчис О. Н. Биология миксоспоридий молоди некоторых видов
рыб. — В кн.: Материалы II Всесоюзного съезда протозоологов. Киев, 1976, с. 147—148.
Ширкина Н. И. Особенности биологии бесцветного жгутиконосца Thaumatoinonas lauter-
borni De Seedeleir, 1931. — В кн.: Современные проблемы паразитологии: Материалы
к Третьему съезду Всесоюзного общества протозоологов. Вильнюс, 1982, с. 393.
Штрауб Ф. Б. Биохимия, Будапешт, 1965. 772 с.
Шульман С. С. Миксоспоридии фауны СССР. М.; Л., 1966. 506 с.
Шульман С. С. Половой процесс у миксоспоридий. — В кн.: Тезисы докладов отчетной
научной сессии (по итогам работ за 1971 г.) Зоологического института АН СССР. Л.,
1972, с. 30—31.
(Ш ульман С. С.) Schulman S. S. New data on the order Multivalvulea (Myxosporidia,
Cnidosporidia). — In: Progress in parasitology: Abstr. IV Intern, congr. parasitol. War-
szawa, 1978, p. 15.
Шульман С. С., Подлипаев С. А. Положение Cnidosporidia в системе Protozoa. —
Тр. ЗИН АН СССР, 1980, т. 94, с. 85—102.
(Шульман С. С., С е м е н о в и ч В. Н.) Schulman S. S., Semenovitch V. N.
The life cycle in Myxosporidia and the taxonomic position of Cnidosporidia in the animal
kingdom. — In: Progress in protozoology: Abstr. IV Intern, congr. protozool. Clermont-
Ferrand, 1973, p. 368.
Юнчис О. H. Некоторые особенности биологии миксоспоридий. — В кн.: Тезисы докладов
VI Всесоюзного совещания по болезням и паразитам рыб. М., 1974, с. 306—308.
Юнчис О. Н. Факторы, определяющие заражение рыб миксоспоридиями и возникновение
миксоспоридиозов. — В кн.: Тезисы докладов VII Всесоюзного совещания по паразитам
и болезням рыб. Л., 1979, с. 121 —122.
A i s а Е. Osservazioni suuna missoboliasi della Tinch. — Parasitologia, 1972, vol. 14, N 2,
p. 219—225.
Atkin N. B., R ich a r d s В. M. Desoxyribonucleic acid in human tumours as measured by
microspectrophotometry of Feulgen stain a comparison of tumours arising at different si-
tes. — Brit. J. Cancer, 1966, vol. 10. d. 769—773.
Auerbach M. Ein neue Myxobolus im Brachsen (Abramis brama L.). — Zool. Anz., 1907a,
Bd 31, S. 386—391.
Auerbach M. Weitere Mitteilungen fiber Myxobolus aeglefin Auerb. — Zool. Anz., 1907b,
Bd 31, S. 115—119.
Auerbach M. Bemerkungen fiber Myxosporidien. — Zool. Anz., 1909, Bd 34, S. 65—82.
Auerbach M. Die Sporenbildung von Zschokkella und die System der Myxosporidien. — Zool.
Anz., 1910a, Bd 36, S. 440—441.
Auerbach M. Die Cnidosporidien (Myxosporidien, Actynomyxidien, Microsporidien). Eine
Monographische Studie. Leipzig, 1910b, Bd 8. 261 S.
Auerbach M. Biologische und morphologische Bemerkungen fiber Myxosporidien. — Zool.
Anz., 1910c, Bd 35, S. 57—63.
Auerbach M. LJntersuchungen uber Henneguya psorospermica Thelohan. — Verh. naturw.
Vereins. Karlsruhe, 1911, Bd *24, S. 1—25.
Auerbach M. Die Sporenbildung der Myxosporidien. — Zool. Anz., 1912a, Bd 40, S. 204—207.
Auerbach M. Studien fiber Myxosporidien der norwegische Seefische und ihre Verbreitung. —
Zool. Jahrb., 1912b, Bd 34, N 1, S. 1—50.
Auerbach M. Bemerkungen uber Myxosporidien. — Zool. Anz., 1917, Bd 49, S. 145—157.
Awakura T., Kimura T. On the milky sondilion in scoked coho salmon (Oncorhynchus
kisutch) caused by myxosporidian parasite. — Fish Pathol., 1977, vol. 12, N 3, p. 178—184.
Axline S., Reaven E. Inhibition of phagocytosis and plasma membrane mobility of the
cultivated macrophage by cytochalasin B. — J. Cell Biol., 1974, vol. 62, N 3, p. 647—
659.
В a j p a i R. R. N., H a 1 d a r D. P. Observations a new species of Unicauda Davis., 1944
(Protozoa: Myxosporida) from the teleost, Rita rita Hamilton. — Arch. Protistenk., 1982,
Bd 125, S. 79—86.
В a 1 b i a n i E. G. Myxosporidies ou psorospermies des poissons. — J. Micrography (Paris),
1883, vol. 7, p. 143—281.
В a u e r G. Die Histologie der Harnblase von Esox lucius und histologische-patologische Verande-
103
rungen derselben hervorgerufen durch Myxidium lieberkuhni (BOtschli).—Zool. Jahrb.,
1922, Bd 43, S. 150—170.
Bond F. F. A probable constituent of spore coat of myxosporidian spores. — J. ParasitoL,
1937, vol. 23, p. 542—543.
Bond F. F. Resistance of myxosporidian spores to conditions outside of the host. — J. ParasitoL,
1938, vol. 24, N 5, p. 470—471.
Bond F. F. Glycogenous material in myxosporidian spores. — J. ParasitoL, 1940, vol. 26, p. 29.
Bonner J. The template of chromatin. — J. Cell. Comp. Physiol., 1965, vol. 66, N 1, p. 77—90.
Booker O. J., C u r r e n t W. L. Myxobilatus mictospora (Kudo, 1920) (Myxozoa, Myxosporea)
in the largemouth bass (Micropterus salmoides Lacepede), plasmodium morphology and
fine structure. — J. ParasitoL, 1981, vol. 67, N 6, p. 859—865.
Brand Th. von. The carbohydrate metabolism of parasites. — J. ParasitoL, 1950, vol. 36,
N 3, p. 178—192.
Brand Th. von. Chemical physiology of endoparasitic animals. New York, 1952. 339 p.
Brand Th. von. Biochemistry of parasites. New York; London, 1966. 375 p.
Britch M., Allen T. D. The effects of cytochalasin В on the cytopla-. iib contractile
network revealed bv whole cell transmission electron microscopy. — Exp. Cell Res., 1981,
vol. 131, N 1, p. 161 — 172.
Burnside B., Monasek F. G. Cytochalasin В problems in interpretation its effect on
cells. — Develop. BioL, 1972, vol. 27, p. 443—444.
В u t sc h 1 i O. Sarkodina und Sporozoa. — In: Bronn’s Klass Ordnung, des Tierreichs: Proto-
zoa. Bonn, 1881a, Bd 1, S. 225—320.
Biitschli O. Myxosporidien. — Zool. Jahrb., 1881b, Bd 1, S. 162—164.
В u t s c h 1 i O. Beitrage zur Kenntnis der Fischpsorospermien. — Zeitschr. Wissensch. Zool.,
B, 1881c, Bd 35, S. 629—651.
В й t s c h 1 i O. Myxosporidia. — In: Bronn’s Klass Ordnung, des Tierreichs: Protozoa. Bonn,
1882, Bd 1, S. 590—603.
Canning E. LL The evolutionary and taxonomic relationships of Microspora and Myxozoa. —
In: Parasites — their world and ours. Amsterdam; New York; Oxford, 1982, p. 175—178.
Canning E. U., Va v r a J. Microspora and Myxospora. — In: Proceedings of the 5th Interna-
tional congress of protozoology. New York, 1977, p. 42—50.
Carre D. Formation, maturation et migration des nematoblastes et des nematocystes
chez les Siphonophores. — Ann. embriol et morphogen., 1974, t. 7, p. 205—242.
Carre D. Hypothese sur le mecanisme de I'evagination du filament urticant des cnidocystes. —
Europ. J. Cell BioL, 1980, vol. 20, p. 265—271.
Carre C., Carre D. Etude de cnidome et de la cnidogenese chez Apolemia uvaria (Lesueur,
1811) (Siphonophore Phisonecte). — Exp. Cell Res., 1973, vol. 181, N 1, p. 234—249.
Carre D., Carre C. On triggering and control of cnidocyst discharge. — Mar. Behav. and
Physiol., 1980, vol. 6, p. 109—117.
Cartr S. Effect of cytohalasin on mammalian cells. — Nature, 1967, N 5073, p. 261—263.
Chakravarty M. M., M a i t i P. K., R а у H. xN. Observations on the nucleic acids in
myxosporidian spores. — Proc. ZooL Soc. Calcutta, 1962, vol. 15, p. 91—96.
Cohn J. Ober die Myxosporidien von Esox lucius und Perea fluuiatilis. — ZooL Jahrb., 1896,
Bd 2, S. 227—272.
Current W. L. Henneguya adiposa Minchew (Myxosporidia) in the channel catfish:
ultrastructure of the plasmodium wall and sporogenesis.—J. ProtozooL, 1979, vol. 26,
p. 209—217.
С и г г e n t W. L., J a n о v у J. J. infrastructure of interlamellar Henneguya excilis in the channel
catefish.—J. ParasitoL, 1976, vol. 62, xN 6, p. 975—981.
С и г r e n t W. L., J a n о v у J. J. Sporogenesis in Henneguya excilis infecting the channel cat-
fish an ultrastructural study. — Protistologica, 1977, t. 13, N 2, p. 157—167.
Current W. L., J a n о v у J. J. Comparative study of ultrastructure of interlamellar and
intralamellar types of Henneguya excilis, Kado, from channel catfish. — J. ProtozooL,
1978, vol. 25, p. 56—65.
Current W. L., J a n о v у J. J., К n i g h t S. A. Myxosoma fundali Kudo (Myxosporidia)
in Fundules kansae. infrastructure of the plasmodium wall and of sporogenesis. — J.
ProtozooL, 1979, vol. 26, N 4, p. 574—583.
Davis H. S. The structure and development of a Myxosporidian parasite of the Squeteague,
Cynoscion regalis. — J. MorphoL, 1916, vol. 27, p. 333—377.
Davis H. S. Myxosporidia of the Beaufort region. A systematic and biological study. — Wash.
Bull. U. S. Bur. Fish., 1917, vol. 35, p. 203—243.
Davis H. S. Studies on sporulation and development of the cysts in a new species of Myxosporidia
Lentospora ovalis. — J. Morph., 1923, vol. 37, p. 425—455.
Davis H. S. A new myxosporidian parasite, the cause of “wormy” halibut. — Rept. U. S.
Comm. Fish, 1924, Append. 8, p. 1—5.
(Davis H. S.) Д э в и с А. С. Паразиты и болезни промысловых рыб. — В кн.: Разведение и
болезни промысловых рыб. М., 1958, ч. 2. ПО с.
Debaisieux Р. Sphaeromyxa sabrazesi, Laveran et Mesnile. — Cellule, 1924, t. 35,
p. 267—301.
Debaisieux P. Etudes sur les myxosporidies. III. Myxobolus notatus Mavor. — Arch. zool.
exp. et gen., 1925, N 64, p. 353—385.
Desser S. S., Paterson W. Ultrastructural and cytochemical observations on sporogenesis
104
of Myxobolus sp. (Myxosporida: Myxobolidae), from the common shiner Notropis cornu-
tus. —J. Protozool., 1978, vol. 25, N 3, p. 314—326.
Doflein F. Studien zur Naturgeschichte der Protozoen. III. Uber Myxosporidien*'—Zool.
Jahrb., 1898, Bd 2, N 11, S. 281—350.
Doflein F. Fortschritte auf dem Gebiete der Myxosporidien Kunde. Zussamenfassende
Uebersicht. — Zool. Zbl., 1899, Bd 6, S. 361—379.
Dunkerly J. S. The development and relationships of the Myxosporidia. — Quart. J.
Microsc. Soc., 1925, vol. 69, p. 185—216.
D у к V. Nemoci у nasich ryb. Praha, 1952. 392 s.
D у к о v a J., L о m J. Histopathological changes in fish gills infected with myxosporidian para-
sites of the genus Henneguya. —J. Fish. Biol., 1978, vol. 12, p. 197—202.
E g u s a S., N a ka j i m a K. A new myxozoa Thelohanelus kitanei the cause of intestinale
giant cystic disease df carp. — Fish. Pathol., 1981, vol. 15, N 3—4, p. 213—218.
Erdmann R. Zur lebensgeshichte von Chloromyxum leydigi. — Arch. Protistenk., 1911,
Bd 24, S. 149—162.
Erdmann R. Chloromyxum leydigi und seine Beziehungen zu anderen Myxosporidien. — Arch.
Protistenk., 1917a, Bd 37, S. 276—326.
Erdmann R. New facts and views concerning the occurence of sexual process in the Myxospo-
ridian life cycle. — Amer. Natur., 1917b, vol. 51, p. 719—739.
Estersen R. D., Rosenberg M., Scharidan J. D. Cytochalasin B: microfilaments and
contractile processes. — Science, 1971, vol. 179, N 3994, p. 356—358.
Finn J. P., N i e 1 s e n N. O. The effect of temperature variation on the inflamatory response of
rainbow trout. — J. Pathol., 1971, vol. 4, p. 257—269.
F i z e r E. R., W i 1 h e 1 m W. E. Promitozis and rod occurence in the limax amoeba Vohlkampfia
lobospinosa. — J. Protozool., 1978, vol. 25, p. 24—27.
Galinsky G., Meglitsch P. Notes on the effect of pretreatment of spores on the iodinophile
vacuole of Henneguya exilis. — Proc. Jova Acad. Sci., 1969, vol. 76, p. 431—435.
Georgevitsch J. Recherches sur le development de Ceratomyxa herauardi Georg. —
Arch. zool. exp. et gen., 1917, t. 56, p. 375—399.
Georgevitsch J. Sur les phenomenes de sexualite chez Myxobolus pfeifferi. — С. r. Soc. biol.,
1923, t. 89, p. 3—6.
Georgevitsch J. Uber Diplo- und Haplophase in Entwicklungsreise der Myxosporidien. —
Arch. Protistenk., 1935, Bd 84, N 2, S. 419—428.
Georgevitsch J. Nouvelles etudes sur les myxosporidies. — Bull. Acad. sci. Belgrade,
1937, t. 3, p. 1 — 153.
G h i 11 i n о В., V i g 1 i a n i E. La mixosomias: della truta une vecchia parasitosi d’impertaza
attuale. — Riv. ital. piscic. ittiop., 1978, vol. 13, N 1, p. 1 — 16.
Gottschalk C. Die Amoebosporidien. Eine vergleichende Betrachtung ihrer Entwicklungs-
zyklen unter Berucksichtigung ihrer sistematishen Stellung in Tierreich. — Zeitscht.
Wissensch. Zool., 1957, Bd 160, S. 1—38.
Grasse P. P. Les myxosporidies sont des organismes pluricellulaires. — Comp. rend. Acad,
sci., 1960, t. 251, p. 2638—2640.
Grasse P. P. Embranchement des myxozoaires. — In: Zoologie, Paris, 1970. T. 1. Invertebres,
p. 107—112.
Grasse P. P., L a v e t t e A. La myxosporidie Sphaeromyxa sabra zesi et le nouvel embranche-
ment des myxozoaires (Myxozoa). Recherches sur 1’etat pluricellulaire primitif et considera-
tions phylogenetiques. — Ann. sci. natur. Zool., 1978, t. 20, p. 193—285.
G г e 1 1 K G. Studien zum Differenzirungsproblem en Foraminiferen. — Naturwissenschaften,
1958, Bd 45, S. 25—32.
G r e 1 1 K. G. Eibildung und Furchung von Trichoplax adhaerens. — Zeitscht. Morph. Tiere
1972a, Bd 73, S. 297—341.
Grell K. G. Trichoplax adhaerens (Placozoe). Eizellen und Furschungstadien. — In:
Encyclopedic Cinematographia. Gottingen, 1972b. 15 S.
Grell KG. Protozoology. Berlin; New York, 1973. 652 S.
Grell K. G., В ar de 1 e C. F. Light and electron microscopical studies on the fdraminifera
Rotaliella heterocariotica. — In: Abstracts V International Congress of Protozoology. 1977,
New York, p. 369.
Griffin B. R., D a v i s E. M. Myxosoma cerebralis'. detection of circulatory antibodies in
infected rainbow trout (Salmo gairdneri). — J. Fish. Res. Board Can., 1978, vol. 33, N 9,
p. 1186—1190.
Grodnick’o J. J. Whirling disease. Myxosoma cerebralis spore concentration using the
continuous plankton centrifuge.—J. Wildlife Diseases, 1975, vol. 11, p. 54—57.
Grodnick’o J. J. Susceptibility of various salmonids to whirling disease (Myxosoma
cerebralis). — Trans. Amer. Fish. Soc., 1979, vol. 108, N 2, p. 187—190.
Guyenot E., Naville A. Sur une myxosporidie (Myxobolus ranae n. sp.) et les microsporidies
parasites de Rana temporaria. — Rev. suisse zool., 1922, t. 29, p. 413—425.
Hale A. J., W i 1 1 s о n S. J. The DNA content of the leucocites in human blood narrow and
lymph glands. — J. Pathol. Bacteriol., 1961, vol. 82, p. 483—491.
Halliday M. M. Studies on Myxosoma cerebralis a parasite of salmonides. I. The diagnosis of
infection. II. The development and pathology of Myxosoma cerebralis in experimentally
infected rainbow trout (Salmo gairdneri), fry reared at different water temperatures.—
Nord, veterinarmed., 1973, bd 25, s. 345—358.
105
Halliday M. M. Studies on Myxosoma cerebralis in Denmark Ireland and Scotland. IV.
A preliminary immunofluorescent investigation of the spores of Myxosoma cerebralis. —
Nord, veterinarmed., 1974, bd 26, s. 165—179.
Halliday M. M. The biology of Myxosoma cerebralis the causative organism of whirling
disease of salmonids. — J. Fish. Biol., 1976, vol. 9, p. 339—357.
Haltzer H., Sanger J. Cytochalasin B, mikrofilaments cell movement and what else? —
Develop. Biol., 1972, vol. 27, N 3, p. 444—446.
Hausmann K. Extrusive organelles in protists. — Intern. Rev. Cytol., 1978, vol. 52, p. 197—276.
Heckmann R. A., Jensen L. A. The histopathology and prevalence of Henneguya sebasta
and Kuaoa clupeidae in the rockfish Sebastes parcispinis of Southern California. —
J. Wildlife Diseases, 1978, vol. 14, N 2, p. 259—262.
Heuschmann O. Ober die Ausbreitung der Drehkrankheiten in Suddeutschland-Allgem. —
Fisch. Ztg., 1940, Bd 65, N 3, S. 75—81.
Heuschmann O. Die Drehkrankheit der Salmoniden. — Allg. Fisch. Ztg., 1949, Bd 74, xN 11,
S. 196—197; N 12, S. 216—217.
Hine P. M. A review of some species of Myxidium Btltschli, 1882 (Myxozosporea) from eels
(Anguilla sp.) —J. Protozool., 1980, vol. 27, N 3, p. 260—267.
Hofer B. Ober die Drehkrankheiten der Regenbogenforelle. — Allg. Fisch. Ztg., 1903, Bd 28,
xN 1, S. 7—8.
Hoffman G. L. Disinfection of contaminated water by ultraviolet irradiation with emphasis on
whirling disease (Myxosoma cerebralis) and its effect on fish. — Trans. Amer. Fish. Soc.,
1974a, vol. 103, p. 541—550.
Hoffman G. L. Fish age as related to susceptibility to Myxosoma cerebralis cause
of whirling disease. — Progr. Fish-Cult., 1974b, vol. 30, N 3, p. 151.
Hoffman G. L. Phylogenetic relationships among Protozoa phylum Myxozoa. — In: Progress
in protozoology: Abstr. VI Intern, congr. protozool. Warszawa, 1981, p. 141.
Hoffman G. L., D u n b а г С. E., В г a d f о r d A. Whirling disease of trouts caused by
Myxosoma cerebralis in the United States. — U. S. Fish Wildl. Serv., Spec. Sci. Rep.-
Fish., 1962, vol. 427, p. 1 — 15.
Hoffman G. L, H о f f m a n G. L. Studies on the control of whirling disease (Myxosoma ce-
rebrals) . The effects of chemicals on spores in vitro and of calcium oxide as a disinfectant in
simulated ponds. — J. Wildelife Diseases, 1972, vol. 8, N 1, p. 49—53.
Hoffman G. L, Ma г к i w M. E. Control of whirling disease (Myxosoma cerebralis)
use of methylen blue staining as a possible indicator of effect of heat on spores. — J.
Fish. Biol., 1977, vol. 10, N 2, p. 181 — 183.
Hoffman G. L., G г о d n i с к ’ о J. J. Control of whirling disease (Myxosoma cerebralis)
effects of draying and disinfection with hydrated lime or chlorine. — J. Fish. Biol., 1977,
vol. 10, N 2, p. 175—179.
Hoffman G. L., P u t z R. Host susceptibility and the effect of aging, freezing, heat and
chemicals on spores of Myxosoma cerebralis. — Progr. Fish-Cult., 1969, vol. 31, N 1,
p. 35—37.
Hoffman G. L., P u t z R. Effect of freezing and aging on the spores of Myxosoma cerebra-
lis — the causal agent of salmonid whirling disease. — Progr. Fish-Cult., 1971, vol. 33, N 2,
p. 95—98.
Holstein T. The morphogenesis of nematocystes. — J. Ultrastruct. Res., 1981, vol. 75s,
p. 276—290.
Hovasse R. Trichocysts, corp trychocystoides, cnydocystes et colloblastes. — Protoplasmatolo-
gica, 1965, t. 3, p. 1—57.
Janiszewska J. Actinomyxidia. Morphology, ecology, history of investigations systematics
development. — Acta parasitol pol. (Warszawa), 1955, t. 21, N 11, Fasc. 30, s. 406—440.
Janiszevska J. Actinomyxidia. New systematics, suxual cycle, descryption of new genera and
species. — Zool. pol., 1957, t. 8, Fasc. 1, s. 3—34.
Jurine L. L. Histoire des poissone du lee Leman. — Mem. Soc., phys. et hist, nat., 1825,
t. 3, p. 42—45.
Kaba t a Z., Whittaker D. J. Two species of Kudo parasites in the fish of Merlecius pro-
duces (Agres 1856) in the Canadian Pacific. — Can. J. Zool., 1981, vol. 59, N 11,
p. 2085—2091.
Kalavati C. Histopathological observation in Myxosporidia infection. — In: Progress in
protozoology: Abstr. VI Intern, congr. protozool. Warszawa, 1981, p. 166.
Kelly F., Sambrook J. Differential effect of cytochalasin В on normal and transformed
mause cells. — Nature New Biol., 1973, vol. 242, p. 217—219.
Keysselitz G. Die Entwicklung von Myxobolus pfefferi. — Arch. Protistenk., 1908a, Bd 11,
Th. I, S. 252—308.
Keysselitz G. Ober durch Sporozoan (Myxosporidien) hervorgerufene pathologishe.—
Verh. Dtsch. Ges. Naturforsch. Arzti. Vers., 1908b, Bd 79, S. 452—453.
Kocylowski B. Chorody ryb i ich Knalkanie. — Gosp. rybna, 1953, t. 1, s. 24—26.
Konagaya S. JelIification and protease activity of yellowfin sole musle in association
with a myxosporidian parasite. — Bull. Jap. Soc. Sci. Fish., 1980, vol. 46, N 8, p. 1019—1026.
Kozel T. R.. Lot t M Taylor R. Isolation of Myxosoma cerebralis (Whirling disease)
spores from infected fish by use of a physical separation technique. — Can. J. Fish.
Aquat. Sci., 1980, vol. 37, N 6, p. 1032—1035.
Kudo R. Contribution to the study to the parasitic Protozoa. III. Note on Myxosporidia
106
found in some fresh-water fishes of Japan with the description of 3 new species. — J.
ParasitoL, 1916, vol. 3, N 3, p. 3—9.
Kudo R. Experiments on the extrusion of polar filaments of cnidosporidian spores. — J. Para-
sitoL, 1918, vol. 4, p. 141 —147.
Kudo R. Studies on Myxosporidia. A synopsis of genera and species. — III. Biol. Monogr.,
1919—1920. vol. 5, N 3—4, p. 1—265.
Kudo R. On the nature of structure characteristic of cnidosporidian spores. — Trans. Amer.
Microsc. Soc., 1921a, vol. 11, N 4, p. 161 —167.
Kudo R. On some Protozoa parasites in fresh-water fishes of New York. — J. ParasitoL,
1921b, vol. 7, p. 137—143.
Kudo R. On the morphology and life history of a myxosporidian Leptotheca olmacheri
parasitic in Rana clamitans and R. pipiens. — Parasitologia, 1922, vol. 14, p. 221 —
224.
Kudo R. Myxosporidia. — In: Problems and methods of research in protozoology. New York,
1930, p. 303—324.
Kudo R. A. taxonomic consideration of Myxosporidia. — Trans. Amer. Microsc. Soc., 1933,
vol. 52, p. 195—216.
L a n d о 1 t M. Myxosoma cerebralis: isolation and concentration from fish skeletal elements by
trypsin digestion method. — J. Fish. Res. Board Can., 1973, vol. 30, p. 1710—1713.
L a n n a n C. N. Diagnosis of parasitic diseases: whirling disease and ceratomyxosis. — In:
Proceeding from a conference on disease inspection and certification of fish and fish eggs.
Oreg. State, 1979, p. 29—31.
Lee J. J., F r e u d e n t h a 1 H. D., К os soy V., В e A. Cytological observation on two
planctonic foraminifera Globigerina bulloides d’Orbigni, 1826 and Globigerinoides ruber
(d’Orbigni, 1839) Cuschman 1927. — J. ProtozooL, 1965, vol. 12, N 1, p. 531—542.
Lentz T. L., В а г г n e t t R. The structure of the nervous system of Hydra. — Amer. ZooL,
1965, vol. 5, p. 341—356.
Levine M. D., Corliss J. O., Cox F. E. G., Dereu x G., Grain J., Honig-
b e r g В. M., Leed a le G.F., Loeb I ich A. K-,Lom J. Lyn n D.,Mer in f el d E.G.,
Page F. С., P о 1 j a n s к у G., S p r a g u e V., V a v r a J., WallaceF. G.,
WeiserJ. A new revised clasification of the Protozoa.—J. ProtozooL, 1980, vol. 27,
p. 37—58.
L i i к S., S a n t i D. W., Sp г ad ich J. A. Biochemical studies on the mode of action of
3H-cytochalasin В and studies on its binding to cells.—J. BioL Chem., 1974, vol. 249,
p. 2268—2274.
L i s t e b а г g e г J. K-, Mitchell L. G. Scanning electron microscopy of spores of the
myxosporidies Chloromyxum trijugum Kudo and Chloromyxum catastomi Kudo. — J.
ProtozooL, 1980, vol. 27, N 2, p. 155—159.
ListebargerJ. K-, Mitchell L. G. Plasmodial ultrastructure and cytochemistry of the
Myxozoa Chloromyxum trijugum. — In: Progress in protozoology: Abstr. VI Intern, congr.
protozooL Warszawa, 1981, p. 219.
Loeb 1 ic h A. R. III. Protisten phylogeny as indicated by the fossil records. — Taxon, 1974,
vol. 23, N 2/4, p. 277—290.
Lom J. Notes on the extrusion and some other features of myxosporidian spores. — Acta proto-
zooL, 1964, t. 2, N 32, s. 322—327.
L о m J. Notes on the ultrastructure and sporoblasts development in fish parasitizing myxospori-
dian of the genus Sphaeromyxa. — Z. Zellforsch., 1969, Bd 97, S. 416—437.
L о m J. Some aspects of the host-parasite relation in myxosporidians of the genus Henneguya. —
J. ParasitoL, 1970, vol. 56, p. 442.
L о m J. Current status of Myxo- and Microsporidia. — In: Progress in protozoology : Abstr. IV
Intern, congr. protozooL Clermont-Ferrand, 1973, p. 254.
L о m J. Myxosporidian ultrastructure. An attempt at a synthesis. — In: Progress in protozoo-
logy: Abstr. V Intern, congr. protozooL New York, 1977, p. 271.
L о m J., D у к о v a I. Biological and morphological features of two myxozoans of the genera
Sphaerospora and Mitrospora, infecting carps. — In: Progress in protozoology : Abstr,
VI Intern, congr. protozooL Warszawa, 1981, p. 222.
Lom J., DykovaL, LhotcekovaS. Fine structure of Sphaerospora renikola Dykoda and
Lom, 1982 a myxosporean from carp kidney and comments on the origin of pansporo-
blast. — Protistologica, t. 18, 1982, p. 489—502.
L о m J., H о f f m a n G. L. Morphology of the spores of Myxosoma cerebralis (Hofer, 1903)
and M. cartilaginis (Hoffman, Putz and Dunbar, 1965).—J. ParasitoL, 1971, vol. 57,
p. 1302—1308.
Lom J., Puytorac P. de. Observations sur I’ultrastructure des trophozoites de myxospori-
dies. — С. r. Acad. Sci. Paris, 1965a, t. 260, p. 2588—2590.
Lom J., Puytorac P. de. Studies on the myxosporidian ultrastructure and polar capsule
development. — Protistologica, 1965b. t. 1. N 1. o. 53—65.
L о m J., P u у t о г a с P. d e. Electron microscopic studies on myxosporidien morphogenesis. —
In: Progress in protozoology : Abstr. IV Intern, congr. protozooL Clermont-Ferrand,
1973, p. 254.
Lom J., Sprague V., N о b I e E. R. Phylum Myxospora. — In: Review of advances in para-
sitology: Proceed, fourth Intern, congr. of parasitoL (Icopa IV) held in Warszawa. 1978.
Warszawa, 1981, p. 285—288.
107
Lom J., V a v г a J. The mode of sporoplasm extrusion in microsporidian spores. — Acta proto-
zool., 1963a, t. 1. s. 81—90.
Lom J., V a v r a J. Mucous envelopes of spores of the subphylum Cnidospora (Doflein,
1901). — Vest. Cs. Spol. Zool., 1963b, cv. 27, N 1, s. 4—6.
Lom J., V a v r a J. Parallel features in the development of myxosporidian polare capsules and of
coelenterate nematocysts. — In: III European congress of electron microscopic. Prague,
1964, p. 191 — 192.
Lom J., V a v r a J. Notes on the morphogenesis of the polar filament in Henneguya (Protozoa:
Cnidosporidia). — Acta protozool., 1965, t. 3, s. 57—60.
Lucky Z. Pathological changes and diagnosis of myxosomosis of the rainbow trout (Salmo
gairdneri irideus).—Acta vet. (Brno), 1970, vol. 40, suppl. 1, p. 19—29.
Luling К. H. Die Erreger der Knotchen. Baulen und Drehkrankheiten unserer Fisch. — Osterr.
Fischerer, 1952, Bd 6, S. 122—126; Bd 7, S. 145—156; Bd 8, S. 171 — 173.
Lunger Ph. D., В e t t у L., Rhood s L., W о I f К., M а г к i w M. E. Thin section electron
microscopy of mature Myxosoma cerebralis (Myxosporidea) spores. — J. ParasitoL, 1975,
vol. 61, N 3, p. 476—480.
Maiti P. K-, Chakravarty M. M., Ray H. N. Observations on the nucleic acids in
different phases of development in three species of Myxosporidia (Protozoa, Sporozoa). —
Proc. Zool. Soc. Calcutta, 1964, vol. 17, p. 55—61.
Mariscal R. N. Nematocysts. — In: Coelenterate "Biology. New York, 1974, p. 129—178.
Mariscal R. N. The elemental composition of nematocysts as determined by X-ray microanaly-
sis. — Develop. Cell Biol. Coelenterates, 1980, vol. 12, p. 337—342.
M а г i s c a 1 R. N., С о u к 1 i n E. L, В i g ge г С. H. The putative sensory receptors associated
with the cnidae of Cnidariens. — Scanning Electron Microsc., 1978, vol. 2, p. 959—966.
M а г к i w M. E., W о 1 f K. Myxosoma cerebralis: isolation and concentration from fish skeletal
elements — sequential enzymatic digestions and purification by differented centrifuga-
tion.— J. Fish Res. Board Can., 1974, vol. 31, p. 15—20.
Markiw M. E., W о 1 f K- Myxosoma cerebralis: results of indirect and direct fluorescent
antibody testing. — Fish. Health. News, 1977, vol. 6, N 4, p. 191 —193.
M а г к i w M. E., Wol f K. Myxosoma cerebralis: fluorescent antibody techniques for antigen
recognition. — J. Fish. Res. Board Can., 1978, vol. 35, N -6, p. 828—832.
M a s s i n C. Contribution a 1’etude de la cnidogenese chez Craspeaacusta sowerbii (Lank) Limno-
polipe. — In: Memoire presente en vue de 1’oltention du grade de Licencie en sciences
Zoologiques. Bruxelle, 1972, p. 1—88.
Ma vo r J. W. On the life-history of Ceratomyxa acadiensis a new species of Myxosporidia from
Eastern Coast of Canada. — Proc. Amer. Acad., 1916, vol. 51, p. 531—578.
M с С r a r e n J. P., L a n d о 1 t M. L., H о f f m a n G. L., M e у e r F. P. Variation in response of
channel catfish to Henneguya sp. infections (Protozoa: Myxosporidia). — J. Wildlife
Diseases, 1975, vol. 11, p. 2—7.
Mercier D. Contribution a 1’etude de la sexualite chez les Myxosporidies. — Mem. class, sci.
Acad. Roy., Belgrade, 1909, t. 2, p. 3—36.
Mitchell L. G. Myxosporidia. — In: Parasitic protozoa / Ed. J. P. Kreier. Ohio State, 1977,
vol. 4, p. 115—155.
M i t c h e 1 1 L. G., L i s t e b а г g e г J. К., В a i 1 e у W. C. Epizootiology and histopathology
of Chloromyxum trijugum (Myxospora: Myxosporida) in centrarchid fishes from Iowa. —
J. Wildlife Diseases, 1980, vol. 16, N 2, p. 233—236.
Molnar K. Gill sphaerosporosis in the common carp and grass carp. — Acta vet. Acad,
sci. hungar., 1979, vol. 27, p. 99—113.
Morrison N. D., P г a 11 I. Sphaeromyxa maiyai n. sp. (Protozoa: Myxosporidea), coelozoic
parasite of the Pacific tomcod, Microgadus proximus. — J. Protozool., 1973, vol. 20,
p. 214—217.
M u 1 1 e r D. LJnterzuchungen fiber Generationszeiten der Eritropoes unter verschidenen Funktion-
zustanden. — Blut. Z. Gesamte. Blutforsch., 1967, Bd 14, S. 356—362.
xN a v i 1 1 e A. Les sporozoaires (cycle chromosomiques et sexualite). — In: Memoires de la societe
de physique et d’histoire naturelle de Geneve. Geneve, 1931, t. 41, p. 1—223.
Nemeczek A. Beitrage zur Kenntniss Myxo- und Microsporidien der Fische. — Arch.
Protistenk., 1911, Bd 22, S. 143—169.
N i g r e 1 1 i R. F. Prickle cell hyperplasic in the snout of the redhorse sucker (Moxostoma
auredum) associated with an infection by the myxosporidian Myxobolus moxostome sp.
nov. — Zoologica (USA), 1948, vol. 33, p. 43—45.
N i g г e 1 1 i R. F., S m i t h G. M. Tissue responses of Cyprinodon uariegatus to the myxosporidian
parasite, Myxobolus lintoni Gurley. — Zoologica (USA), 1938, vol. 23, p. 195—202.
N i g г e 1 1 i R. F., S m i t h G. M. A papillary cystic disease affecting the baibela of Ameiurus
nebulosus (Le Sueur), caused by the myxosporidian Henneguya ameiurensis sp. nov.—
Zoologica (USA), 1940, vol. 25, p. 89—96.
Nilsson J. R., R i с к e 11 T. R., Z e u t h e n E. Effect of cytochalasin В on cell division and
vacuole formation in Tetrahymena pyriformis G. L. — Exp. Cell Res., 1973, vol. 79,
p. 456—459.
N о b 1 e E. R. Nuclear cycle in the life history of the protozoan genus Ceratomyxa. — J. Morphol.,
1941, vol. 69, p. 445—479.
Noble E. R. Nuclear cycles in the protozoan parasite Myxidium gasterostei n. sp. — J. MorphoL,
1943, vol. 73, N 2, p. 281—292.
108
Noble E. R. Life cycles in the Myxosporidia. — Quart. Rev. Biol., 1944, vol. 19, N 3, p. 213—235.
Noble E. R. On a myxosporidian (protozoan) parasite of California trout. — J. Parasitol., 1950,
vol. 36, p. 457—460.
N о e s к e K. Discrepancies between cytophotometric Feulgen values and DNA content. — J.
Histochem. and Cytochem., 1971, vol. 19, p. 169—174.
О d 1 a n g T. The quantitative determination of glycogen in some parasites of Amphibia. — J.
Parasitol., 1955, vol. 41, N 3, p. 7—8.
Okada M., Aradu N., Sukava Y., Edward Y. Myxosporidian infestation of peruvien
hake (Kudoa). — Bull. Jap. Soc. Sci. Fish., 1981, vol. 47, N 2, p. 229—238.
Olive L. S. The mycetozoans. New York; London, 1975. 293 p.
Page F. G. Vexillifera armata n. sp. (Cymnamebia, Paramebia) an estuarian amoeba with
distinctive surface structure and trichocystlike bodies. — Protistologica, 1979, t. 15, N 1,
p. 111 — 122.
Page F. G., В 1 а к e у S. M. Cell surface structure as a taxonomic character in the Thecamoebi-
dae (Protozoa, Gymnamoebia). — Zool. J. Linnean Soc., 1979, vol. 66, p. 113—135.
Parisi B. Sulla Sphaerospora caudata Parisi. — Atti Soc. ital. sci. natur., 1913, vol. 51,
p. 396—402.
Patashnik M., Groninger H. S. Observations on the milky condition in some Pacific
coast fishes. — J. Fish. Res. Board Can., 1964, vol. 21, p. 335—346.
Pauley G. B. Fish sporozoa: extraction of antigens from Myxosoma cerebralis spores which
mimic tissue antigens of rainbow trout (Salmo gairdneri).— J. Fish. Res. Board Can.,
1974, vol. 31, p. 1481 — 1484.
P e а г s e A. G. Histochemistry. London, 1968. 963 p.
P e a r s e A. G. Hystochemistry. Theoretical and applied. Edinburg; London, 1972, vol. 2. 752 p.
Pfeiffer L. Die Protozoen als Krankheitserreger. Jena, 1890. 216 p.
P i с к e n L. E. R., S к a e r R. J. A review of researches on nematocysts. — Symp. Zool. Soc.
London, 1966, vol. 10, p. 19—50.
P I e h n M. Ober die Drehkrankheiten der Salmoniden [Lentospora cerebralis (Hofer,
Plehn)]. — Arch. Protistenk., 1904, Bd 5, S. 145—166.
P I e h n M. Praktikum der Fischkrankheiten. Stuttgart, 1924. 300 S.
Plehn M. Eine neue Schleienkrankheit. — Allg. Fisch. Ztg., 1925, Bd 28, S. 299—300.
P rasher J. В., Г i d d W. M., Tubb R. A. Techniques for extracting and quantitatively
studying the spore stage of the protozoan parasite Myxosoma cerebralis. — Prog. Fish-
Cult., 1971, vol. 33, p. 193—196.
P г i h о d a J. Histopatologicke zmeny pri myxozomize u pstruhov duhovych. — Vet. med.
(CSSR), 1981, cv. 26, N 7, S. 439—447.
R e i d Y. J., E d w a r d s M. L., С о n n о с к M. J. Cobolt staining of Actinia equina nemato-
cysts. — Stain Technol., 1978, vol. 53, N 5, p. 283—286.
Reisinger E. Ultrastrukturforschung und Evolution. — Ber. Phys.-med. Ges., 1969, Bd 77,
S. 5—47.
R e n a n d e s H. D., К e у 1 H. G. Distribution of DNA in heterochromatin of polytene nuclei of
Drosophila hidei. — Genetics, 1967, vol. 57, p. 1 —13.
RingertsN. R., GledhillB. L., DarzynkieviezZ. Changes in deoxyribonucleic
acid during spermiogenesis in the bull. — Exp. Cell Res., 1970, vol. 62, p. 204—218.
Robson E. A. Nematocysts of Carynactis: The activity of the filament during discharge. —
Quart. J. Microsc. Soc., 1953, vol. 94, p. 229—235.
Robson E. A. The discharge of nematocysts in relation to properties of the capsule. — Dubl.
Seto Mar. Biol. Lab., 1973, vol. 20, p. 653—673.
R у d 1 о M. Evidence of Myxosoma cerebralis spores in various organs of rainbow trout
offlicted with whirling disease. — Osterr. Fischerer, 1971, Bd 24, S. 97—99.
S a n a u 1 1 a h M., Ahmed T. A. Gill myxoboliasis of major carps in Bangladesh. — J. Fish.
Diseases, 1980, vol. 3, p. 349—354.
Schafer W. E. Studies on the epizootology of the myxosporidan, Ceratomyxa shasta Noble. —
Calif. Fish and Game, 1968, vol. 54, p. 90—99.
Schaperclaus W. Die Drehkrankheit in der Forelenzucht und ihre Bekampfung. — Ztschr.
Fischer., 1931, Bd 29, N 4, S. 521—567.
Schaperclaus W. Fischkrancheiten. Berlin, 1954. 708 S.
Schroder O. Eine neue Myxosporilien Art aus den Keemen von Acerina cernua (Henneguya
acerina n. sp.). — Arch. ProtistenK., 1906, Bd 7, S. 186—196.
Schroder O. Beitrage zur Entwicklungsgescmchte der Myxosporidien Sphaeromyxa sabrazesi
(Laveran et Mesnil). — Arch. Protistenk., 1907, Bd 19, S. 356—381.
Schroder O. Ueber die Anlage der Sporocyste (Pansporoblast) bei Sphaeromyxa sabrazest
(Laveran et Mesnil). — Arch. Protistenk., 1910, Bd 19, S. 1—5.
Schroder O. Cnidosporidia (Mixosporidia and Microsporidia) general account. — In:
Prowazek’s Handbuch der pathogenen Protozoen. Heidelberg, 1912, Bd 1, S. 324—336.
Schubert G. Elektronenmikroskbpische Untersuchungen zur Sporentwicklung von Henne-
guya pinnae Schubert (Sporozoa, Myxosporidia, Myxobolidae). — Z. Parasitenk., 1968,
Bd 30, S. 57—77.
Schubert G., Sprague V., Reinboth R. Observation on a new species of Unicauda
(Myxosporidia) in the fish Maena smarts (L.), by conventional and electron microscopy. —
Z. Parasitenk., 1975, Bd 46, S. 245—252.
SchummelfederN. Fluorochromierung des lebenden, Gberlebenden und toten Protoplasmes
109
mit dem hasischen Farbstoff Acridin orange und ihre Besehung zur Stoffwehselaktivitat
der Zelle. — Virchows Arch, pathol. Anat. und Physiol., 1950, Bd 318, S. 119—154.
Scolari C. Sull’impiego dello stovarsolo nella profilassi dei ,,capostorno“ о ,,lentosporiasi“
delle trote d’allevamento. — Clin. vet. (Milano), 1954, 77, N 2, p. 50—53.
S h e r i f i M. Henneguya shahrini sp. nov. a parsite of marble soly Oxyeleatris maimaiatus. — J.
Fish Diseases, 1982, vol. 5, N 1, p. 37—45.
Shin Lin, S a n t i D. V., S p u d i c h J. A. Biochemical studies on the mode of action of cyto-
chalasin B. — J. Biol. Chem., 1974, vol. 249, N 7, p. 2268—2274.
Siau Y. Premiere studes du developpement experimental en cultures de spores de la Myxosporidie
Myxobolus exiguus Thelohan. 1895. — C. r. Acad. sci. D, 1977, t. 285, N 6 p. 681 —
683.
Siau Y. Observation en microscopic electronique du complex synaptonematique chez des myxo-
sporidies. — C. r. Acad. sci. D, 1979, t. 288, p. 403—404.
Siau Y., Gasc G., M a i 1 1 о r d C. Premieres observations ultrastructurales d’une Myxospori-
die apparienaut ou genre Fabespora parasitte de trematode. — Protistologica, 1981, t. 17,
N 1, p. 131 — 137.
Si bat ini A. Feulgen reaction" and quantitative cytochemistry of desoxypentose nucleic acid.
III. Effect of histone on the Feulgen-reaction in vitro. — J. Biochem. (Tokio), 1953, vol. 40,
p. 119—126.
Sindermann C. J. Principal diseases of marine fish and shellfish. New York; London, 1970.
369 p.
Sindermann C. J., Rosenfield A. Diseases of fishes of the western North Atlantic. I.
Diseases of the sea herring (Clupea harengus).— Pres. Bull. Dept. Sea Shore Fish.,
1954, vol. 18, p. 23.
S к a e r R. J. The secretion and development of nematocysts in a Siphonophora. — J. Cell Sci.,
1973, vol. 13, p. *371—393.
Skaer R. J., Pic ken L. R. The structure of the nematocyst thread and the geometry of
discharge in Carynactis viridis.—Alim. Phit Trans. R. Soc., 1965, Ser. B, vol. 250,
p. 131 — 164.
SlauterbackD. B. Nematocyst development. — In: The biology of Hydra / Ed. H. M. Lenhoff,
W. F. Loomis. Miami (Florida), 1960, p. 77—129.
SlauterbeckD. B. The cnidoblast musculoepithelial cell complex in the tentacles of Hydra. —
Z. Zellforsch., 1967, Bd 79, S. 296—318
Slauterbeck D. B., Fowcett D. W. The development of the cnidoblast of Hydra.
An electron microscopic study of cell differentiation. — J. Biophys. and Biochem. CytoL,
1959. vol. 5, N 3, p. 411—452.
S m i t h С. E., I n s 1 e e T. Interlamellar Henneguya infestation in adult channel catfish
Ictalurus punctatus (Rafinesque). — J. Fish Diseases, 1980, vol. 3, p. 257—260.
Sornsen E. M. B., Henry R. E., Ramirez-Mitchell R. Arsenic accumulation tissue
distribution and cytotoxycity in teleosts folowing indirect aqueous exposures. — Bull. Envi-
ron. Contam. and Toxicol., 1979, vol. 21, N 1—2, d. 162—169.
Southwell T., Prashad B. Notes from the Bengal Fisheries laboratory N 5. Parasites of
Indian Fishes. — Rec. Ind. Mus., 1918, vol. 15, p. 341—355.
S t e m p e 1 1 W. Untersuchungen fiber Leptotheca coris n. sp. und in dieser schmarotzende
Nosema marionis Thel. — Arch. Protistenk., 1919, Bd 40, S. 113—157.
S w e i g а г d J. A., G г о v e S. N.,S mucker A. A. Cytochalasin as a tool for investigations
the mechanism of apical growth in fungi. —J. Cell BioL, 1979, vol. 83, p. 307a.
Tack E. Bekampfung der Drehkrankheit mit Kalkstikstoff. — Fischwirt., 1951, Bd 1, N 5,
S. 123—130.
T e у 1 о r R. L., L о t t M. Transmission of Salmonide whirling disease by birds fed traut infected
with Myxosoma cerebralis. — J. ProtozooL, 1978, vol. 25, N 1, p. 105—106.
Thelohan P. Sur la constitution des Spores des Myxosporidies. — C. r. Acad. sci. (Paris),
1889, t. 109. d. 919—922.
Thelohan P. Rechershes sur le development des spores chez les myxosporidies. — C. r. Soc.
bioL, 1890a, t. 10, N 2, p. 601—604.
Thelohan P. Nouvelles recherches sur les spores des myxosporidies. Structure et develop-
ment.— C. r. Acad, sci., 1890b, t. 3, p. 692—695.
Thelohan P. Recherches sur les Myxosporides. — Bull. sci. France et Belgique, 1895, t. 26,
p. 100—394.
T i d d W. M., Tabb R. A., W r i g h t V. Modification of Myxosoma cerebralis spore
extraction technique. — Progr. Fish-Cult., 1973, vol. 35, p. 227—228.
Torer A., Emmersen J., Behnke O. Cytochalasin B: does it affect actin-like filaments. —
Science, 1972, vol. 175, p. 774—776.
Tuzet O., Ormieres R. Ceratomyxa anguillae nov. sp. Myxosporidie parasite de la vesicule
biliare des anguiles de 1’etang de Than. — Ann. parasit. hum. comp., 1957, vol. 32,
p. 189—196.
V a n с о R. Contribution a Let tide de la pathologic des alevins de truite. Paris, 1952. 92 p.
Voelker Г. A., К a s s e 1 S. H., Weinberg H. D., McKee A. E. Microskopic and
ultrastruktural characteristics of Kuaoa infection of Butterfly Fish (Chaetoc on). — Vet.
PathoL, 1978, vol. 15, N 1, p. 40—48.
Volf F. Nove nebezpeci pro nase pstruharstvi. — Cs. rybarstvi, 1956, N 11, s. 1 —15.
W a 1 1 i к e г D. The nature of the iodinophilous vacuole of myxosporidien spores and a proposal
110
synonymize the genus Myxosoma Thelohan, 1892, with the genus Myxobolus Biitschli. — J.
Protozool., 1968, vol. 15, p. 571—575.
Weidner E., Overstreet R. M. Sporogenesis of a myxosporidan with motile spores. —
Cell Tissue Res., 1979, vol. 201, p. 331—342.
Weill R. F. Contribution a 1’etude des Cnidaries et de leurs nematocystes. I. Recherches sur les
nematocystes. Wimereux, 1934. 347 p. (Trav. Sec. Zool.fT. 10).
Weill R. L’interpretation des cnidosporidies et la valeur taxonomigue de leur cnidomes.
Leur cycle compare a la phase larvaire des narcomeduses cuninides. Wimereux, 1938,
p. 727—744 (Trav. Sec. Zool.; T. 13).
Weiser J. Parasites of fresh-water fish. II. Myxosporidia. — V£st. Cs. Spot., Zool., 1949,
cv. 13, N 9, s. 364—371.
Wes se I I s N. K.. S p о о n e r B. S., A s h J. F., В r a d 1 e у M. O., L u d u e n a M. A.,
Taylor E. L., W i e n n J. T., Y a m a d e К. M. Microfilaments in cellular and deve-
lopmental processes. — Science, 1974, vol. 171, p. 135—143.
Westfall J. A. Development of nematocysts in the Cnidaria. — Amer. Zool., 1965, vol 5,
p. 377—393.
W e s t f a 1 1 J. A. The differentiation of nematocysts and assocyated structures in the Cnidaria. —
Z. Zellforsch., 1966, Bd 75, N 2, S. 381—403.
West fall J. A. Nervous control of nematocyst discharge: chemical synapses. — Ann.
zool. PAN, 1969, t. 9, s. 1141.
Whittaker R. H. Broad classification: the kingdom and protozoans. — In: Parasitic protozoa/
Ed. J. P. Kreier. New York etc., 1977, vol. 1. 441 p.
Wolf K. Whirling disease research, a deliniation of needs. — Fish. Health. News, 1974, vol. 3,
N 4, p. 1 — 12.
Wolf К., M а г к i w M. E. Myxosoma cerebralis-. comparative sensitivity of plankton centrifuge
and sequential enzymatic digestion methods for recovery of spores. — Fish. Health. News,
1975a, vol. 4, N 3, p. 9—10.
W о 1 f К., M а г к i w M. E. Myxosoma cerebralis serological identification by indirect fluorescent
antibody test. — Fish. Health. News, 1975b, vol. 4, N 4, p. 8.
W о 1 f К., M а г к i w M. E. Myxosoma cerebralis-. in vitro sporulation of the myxosporidies
of salmonid wnirling disease. — J. Protozool., 1976, vol. 23, p. 425—427.
Wolf К., M а г к i w M. E. Myxosoma cerebralis: a method for staining spores and other stages
with silver nitrate. — J. Fish. Res. Board Can., 1979, vol. 36, N 1, p. 88—89.
Wolf К., M а г к i w M. Myxosoma cerebralis inactivation of spores by hot smoking of infected
trout. — Can. J. Fish, and Aquat. Sci., 1982, vol. 39, N 6, p. 882.
Yamamoto T., Sanders J. E. Light and electron microscopic observations of sporogenesis
in the myxosporida. Ceratomyxa shasta. — J. Fish Diseases, 1979, vol. 2, N 5, p. 411—428.
Yanagita T. M. The “Cnidoblasts’’ as excitable system. — Publ. Seto Mar. Biol. Lab., 1973,
vol. 20, p. 675—693.
Y a s u t a к e W. T., W о о d E. M. Some Myxosporidia found in Pacific Northwest salmonids. —
J. ParasitoL, 1957, vol. 43, p. 633—642.
Yasutake W. T. Histopathology of selected diseases of salmonids: Dissertation Ph. D. Tokyo,
1979. 139 p. (University of Tokyo).
Yoder W. G. The spread of Myxosoma cerebralis into native trout population in Michigan. —
Prog. Fish-Cult., 1972, vol. 34, p. 103—106.
Zech L. Zytochemische Messungen an den Zell-Kernen der Foraminiferen Patellina corrugata
und Rotaliella heterocariotica. — Arch. Protistenk., 1964, Bd 107, S. 295—330.
Ill
СПИСОК СОКРАЩЕНИЙ
(рис. 1—6, табл. I—XXV)
а — амебоидный зародыш
аГ — аппарат Гольджи (диктиосомы)
ал —-альвеолы
алс — альвеолярный слой
в — вальвогенные клетки
ва — вакуоль
встр — волокнистые структурны вокруг
канала для выбрасывания нити
вя — вегетативное ядро
гж — глыбки желтка в икринке
гк — генеративная клетка
д — дифференцировка
ж — жировые включения
жкс — кровеносный сосуд жаберного ле-
пестка
зк — зачаток стрекательной капсулы
змв — зараженное мышечное волокно
ив — иодофильная вакуоль
ио — интеркапсулярный отросток
к — капсулогенная клетка
кл — канал для выбрасывания стрека-
тельной нити
клк — клеточные контакты
кр — крышечка
кеб — клетки споробластов (т. е. возник-
шие в результате деления споро-
бластов)
кя — ядра капсулогенных клеток
лпф — лизированные протофибриллы
лх — полость, образовавшаяся в резуль-
тате лизиса основного вещества
хряща
м — митоз
ма — мембрана альвеол
мв — микроворсинки
мгк — мембрана генеративной клетки
мз — мейоз
мкс — мембрана клеток споробластов
мкф — микрофиламенты
ммв — мембрана мышечного волокна
мн — манубриум
мнк — мембрана наружной клетки пан-
споробласта
мо — миелиновые образования
мп — мембрана плазмодия
мпс — мембрана панспоробласта
мсб — мембрана споробласта (спороген-
ной клетки или внутренней клетки
панспоробласта).
мск — мембрана стрекательной капсулы
мтб — микротрубочки
мтв — микротрубочки веретена
мф — морфогенез
мфб — миофибриллы
мх — митохондрии
мхмв — митохондрии мышечного волокна
н — ножка
нкп — наружная клетка панспоробласта
нмв — незараженное мышечное волокно
нт — наружная трубка стрекательной
нити
нс — надмембранный слой
ои — оболочки икринки
ох — основное вещество хряща
ояп — остаточное ядро панспоробласта
п — плазмодий
пкл — пиноцитозные каналы
пл — электронно-плотные пластинки
в надмембранном слое
пне — надмембранный слой, поперечный
разрез
пп — пиноцитозные пузырьки
пр — пробочка
пс — периодическая структура
псб — панспоробласт
пф — протофибриллы
р — ребрышки створок споры
рт — редукционное тельце
с — створки споры
ск — стрекательная капсула
сн — стрекательная нить
сп — спора
епб — споробласт
сс — слизистый слой
сск — стенка стрекательной капсулы
ссн — стенка стрекательной нити
т — тяж внутри наружной трубки
стрекательной нити
тне — тангенциальный разрез через над-
мембранный слой
хк — хрящевые клетки
хо — хвостовые отростки створок споры
хр — хроматин
цм — цитоплазматические мостики
ш — шовная линия
шв — шовный валик
шс — шероховатая эндоплазматическая
сеть
эк — эктоплазма
эмп — клетки эпителия мочевого пузыря
эн — эндоплазма
эп — электронно-плотный слой или
электронно-плотные образования
эс — электронно-светлый слой стенки
стрекательной капсулы и нити
я — ядро
яа — ядро амебоидного зародыша (спо-
роплазмы)
яв — ядро вальвогенной клетки
яд — ядрышко
як — ядро капсулогенной клетки
яп — ядерные поры
яо — ядерная оболочка
112
Таблица I
Генеративные клетки плазмодиев миксоспоридий.
А — Myxidium gasterostei (X 18 600); Б — Myxobolus disparoides (X 18 600); В — Kudoa quadratum (X18 600).
8 А. В. Успенская
Таблица II
Двухклеточные панспоробласты.
Л — Myxobolus disparoides (Х22 970); Б — Myxidium gasterostei (X 18 600); В — Sphaeromyxa elegini (X 18 600).
Таблица III
Микротрубочки на разных стадиях развития миксоспоридий.
А — веретено деления с микротрубочками, выделение редукционного тельца ядром клетки — потомка споробласта
(X 18 000); Б — наружная трубка стрекательной нити, обвитая по спирали микротрубочками (Х27 900); В — стрека-
тельная капсула Myxobolus disparoides, матрикс содержит микротрубочки, диаметр которых около 20 нм (Х51 000).
8'
Таблица IV
Деление клеток внутри панспоробласта Myxidium gasterostei.
А — 2 клетки (X 16 570); Б — 3 клетки ( X 18 600)
Таблица V
Панспоробласт Myxidium gasterostei, содержащий 2 дочерних споробласта со сформированными
спорами.
А — участок с остаточным ядром панспоробласта (X 19 040); Б — панспоробласт (X 10 500). •
Таблица VI
Ультратонкое строение поверхности полостных миксоспоридий.
Л—сравнительно редкие микроворсинкн Myxidium lieberkuhni (Х9000); Б — густая щеточная кайма Myxidium
gasterostei (X 18 600); В—анастомозирующие микроворсинки Sphaeromyxa cottidarum (X 18 600).
Таблица VII
Плазмодий Kudoa quadratum.
А—ультратонкое строение поверхности (Х25 200); Б — плазмодий внутри мышечного волокна, видны митохондрии
мышечного волокна между мембранами плазмодия и мышечного волокна (Х25 200).
Таблица VIII
Ультратонкое строение плазмодия и зон цитоплазмы.
А — Henneguya ouiperda из икринки щуки (X5I70); Б— Henneguya lobosa из жабр щуки (X5I70)
Таблица IX
Ультратонкое строение поверхности плазмодия Myxobolus disparoides.
А — поперечный. Б — тангенциальный срезы (Х40 000).
Таблица X
Органоиды миксоспоридий.
Митохондрии: /1 — капсулогенных клеток (X 18 000). Б — плазмодиев Kudoa quadratum (Х24 800). В — плазмодиев
Sphaeromyxa cottidarum (Х27 500), / плазмодиев Myxidium gasterostei (Х22 100); Д диктиосомы в генеративной
клетке Myxidium gasterostei (X 24 800).
Таблица XI
Рост и развитие плазмодия Myxidium gasterostei.
Л— молодой червеобразный трофозоит, у которого отсутствует альвеолярный слой (XII 200); Б — листовидный плаз
модий. у которого в центральной части цитоплазмы появились вакуоли (X 18 600).
Таблица XI (продолжение)
В — более продвинутая стадия с развитым альвеолярным слоем, видны генеративные клетки на границе эндоплазмы и
альвеолярного слоя и в цитоплазматических мостиках < X6I05); Г —генеративные клетки образуют сплошной слой
(X2I 700).
Таблица XI (продолжение)
Д — зрелый лепешковидный трофозоит, у которого альвеолярный слой занимает большую часть цитоплазмы (Х7740).
Таблица XII
Компоненты эндоплазмы плазмодиев миксоспоридий.
Л — миелиновое образование (Х35 100); Б — вакуоли с различного рода включениями (XI8700); В — вегетативное
ядро плазмодия Myxidium gasterostei.
Таблица XIII
Детали ультратонкого строения спор разных видов миксоспоридий.
Myxidium gasterostei: А — X 28 290. Б — X 15 840.
Таблица XIII (продолжение)
В —Henneguya oviperda (X16 300); Sphaeromyxa cottidarum. Г— X24 000, Д — Х8000; Е — Henneguya lobosa
(Х8000).
Таблица XIII (продолжение)
Kudoa quadratum. Ж— Х23 25О. 3— Х28880
9 А. В. Успенская
Таблица XIV
Особенности стрекательного аппарата миксоспоридий.
Л — продольные петли стрекательной нити внутри стрекательной капсулы споры Sphaeromyxa cottidarum (Х4О5ОО);
Б — электронно-пл.пный тяж с мембраной внутри наружной трубки стрекательной нити Myxidium gasterostei
(X 30 000), кальции внутри стрекательной нити: В — на ультраструктурном уровне ( XI7 ООО). Г на светооптическом
(Х4000); Д — поперечный срез через стрекательную капсулу Sphaeromyxa cottidarum (X 18000).
Таблица XV
Стрекательные капсулы с ввернутой нитью.
А — Myxobolus disparoides (Х3600). Б — М mulleri (Х22 5ОО); В — HeneRuya tobosa, видно место перехода слоев
стенки капсулы в слои стенки нити (Х27 300); Г— Kudoa quadratum (Х30 225)
1
Таблица XVI
Строение стрекательной нити.
А — нить, ввернутая внутрь стрекательной капсулы, видна периодическая структура (Х90 000); Б — нить, выстрелив-
шая в мочевине (Х27 000).
Таблица XVII
Канал для выбрасывания стрекательной нити в стенке стрекательной капсулы.
А — Sphaeromyxa cottidarum ( Х39 200); Б — Myxobolus disparoides ( хЗб ООО).
Таблица XVIII
Детали строения стрекательного аппарата зрелых спор (стенки стрекательной капсулы,
пробочка и крышечка).
Myxobolus disparoides: А — Х26 040, Б — X27 900; В — Sphaeromyxa cottidarum (X 19 500); Г — Henneguya oviperda
(X 13 530).
Таблица XIX
Ультратонкое строение спороплазмы.
А — спороплазма с не до конца разделившимися ядрами и капсулогенная клетка с ядром в незрелой споре Myxobolus
disparoides (X18 600), В — спора Myxobolus disparoides с двумя 1-ядерными спороплазмами (обычно у этого вида
одна 2-ядерная спороплазма), ядра с рыхло расположенным хроматином (X 18 600).
Таблица XX
Иодофильная вакуоль в спороплазме Myxobolus disparoides (Х22 500).
Таблица XXI
Ранние стадии развития створок спор из вальвогенных клеток.
А — Sphaeromyxa cottidarum (X 15 400); Б- S hellandi (X 18 000); Н — Kudoa quadratum (X 21 700).
Таблица XXII
Развитие стрекательного аппарата у миксоспоридий.
Л — зачаток стрекательного аппарата в капсулогенной клетке Sphaeromyxa cottidarum (Х27 6ОО); Б — ранние стадии
развития стрекательных капсул Myxobolus disparoides (X 15 250).
Таблица XXII (продолжение)
Развитие стрекательных капсул и наружной трубки стрекательной нити: В — Myxobolus disparoides (Х36 000),
Г — Sphaeromyxa cottidarum ( X 14 500). Д — Kudoa quadratum ( X 18 000). E — Myxidium gasterostei ( X 16 000).
Таблица XXII (продолжение)
5. И
Ж — петли наружной трубки стрекательной нити в цитоплазме капсулогенной клетки Myxidium gasterostei (X 19 300);
3 — образование тяжа внутри наружной трубки стрекательной нити (Х27 300); И — структура, напоминающая центр
образования микротрубочек,у конца наружной трубки стрекательной нити Myxobolus disparoides (Х46 500).
1
Таблица XXIII
Ферменты и запасные питательные вещества у миксоспоридий.
А — кислая фосфатаза у плавающих особей Myxidium lieberkiihni ( Х540); Б — кислая фосфатаза у прикрепленных осо-
бей М. lieberkiihni (х540), В — щелочная фосфатаза на наружной поверхности мембраны микроворсинок плазмодия
Sphaeromyxa elegini (Х54 000); гликоген у плазмодия S. elegini: Г — выявленный с помощью реакции PAS, Д — пере-
варенный а-амилазой (Х800).
Таблица XXIV
Различия в количестве гликогена и в ферментативной активности у трофозоитов миксоспоридий
с разной локализацией в организме рыбы.
Гликоген: А — в плазмодии Kudoa quadratum (Х1000). Б— в плазмодии Myxobolus disparoides, реакция только
в иодофил ьных вакуолях формирующихся спор (Х750); сукцинатдегидрогеназная активность: В — у Myxidium
lieberkiihni (Х800), Г — у Henneguya lobosa (хбОО).
Таблица XXV
Взаимоотношения трофозоитов миксоспоридий с тканями их хозяев.
А — плазмодии Myxosoma cerebralis в полости, образованной в хряще малька форели в результате растворения
основного вещества хряща ферментами паразита; Б — плазмодии этого паразита, фагоцитирующие хрящевые
клетки (Х8000)
Таблица XXV (продолжение)
В — мышечные волокна бычка Myoxocephatus scorpius зараженное Kudoa quadratum, разрушенное под влиянием фер-
ментов плазмодия и соседнее, незараженное (X25I00); Г внедрение плазмодия Myxidium lieberkuhni с помощью
ножек в межклеточники эпителия мочевого пузыря щуки (Х800).
ИСПРАВЛЕНИЯ И ОПЕЧАТКИ
Стра- ница Строка Напечатано Должно быть
5 18 снизу акрил-сульфатаза арил-сульфатаза
23 И » Появления Пояснения
32 7 » выпячиваниями впячиваниями
39 9 » выпячивания впячивания
54 20 » реакция Фельгена на РНК реакция Фельгена на ДНК
81 2 сверху saimonis saimonis
103 И снизу milki sondition in scoked milki condition in smoked
104 17 » Fundules Fundulus
104 18 » Myxosoma fundali Myxosoma funduli
105 10 сверху Dykova J. Dykova I.
Успенская
ОГЛАВЛЕНИЕ
Введение ......................................................................... 3
Жизненный цикл миксоспоридий . 7
Ядерный цикл миксоспоридий....................................................... 10
Дифференцировка ядер у миксоспоридий......................................... 10
История изучения ядерного цикла миксоспоридий .............................. .11
Методы исследования количества ДНК в ядрах миксоспоридий..................... 12
Результаты исследования ядерного цикла Sphaeromyxa elegini и их обсуждение ... 15
Схема ядерного цикла Sphaeromyxa elegini..................................... 18
Сравнение результатов цитофотометрических и электронно-микроскопических ис-
следований спорогенеза у миксоспоридий . . . . 20
Особенности жизненного цикла миксоспоридий в свете цитофотометрических исследова-
ний их ядерного цикла и электронно-микроскопических исследований клеточного
цикла............................................................................ 27
Жизненный цикл миксоспоридий в свете данных цитофотометрии . .27
Значение дифференцировки ядер у миксоспоридий .... 27
Способы размножения у миксоспоридий.......................................... 28
Типы деления ядер и соотношение митоза, мейоза и процесса оплодотворения в ядер-
ном цикле миксоспоридий................................... . . ... 30
Ультратонкое строение стадий развития миксоспоридий . 31
Строение трофозоитов......................................................... 31
Ультратонкое строение зрелых спор миксоспоридий . . 39
Развитие миксоспоридий по данным электронной микроскопии . 43
Развитие трофозоитов и вегетативное размножение . 43
Спорогенез................................................................... 45
Развитие споры................................ ... 49
Биология и физиология миксоспоридий из разных мест обитания...................... 54
Сведения по цитохимии миксоспоридий.......................................... 54
Исследование способов питания и типов обмена веществ у плазмодиев миксоспоридий
из разных мест обитания...................................................... 56
Механизм действия стрекательного аппарата миксоспоридий...................... 64
Цитология паразитохозяинных отношений при заражении миксоспоридиями . ... 67
К вопросу о филогении миксоспоридий.............................................. 78
Значение выявления гетерофазного жизненного цикла у миксоспоридий............ 78
Значение изучения ультраструктуры и механизма действия стрекательного аппарата
миксоспоридий......................................................... ... 81
Пример использования знаний биологии миксоспоридий в практике . 84
Вертеж лососевых............................................................. 84
Заключение........................................ ... 92
Приложение. Методические указания по борьбе с вертежом лососевых ... 94
Меры борьбы с возбудителем вертежа..................... ... 94
Пути бог ьбы с вертежом в рыбхозе Ропша в 1959 г............................. 96
Пути 5 ^рьбы с вертежом в Чернореченском форелевом хозяйстве в 1959 г. 98
Литература. ....................... 100
Список сокращений (рис. 1—6, табл. I—XXV) ... 112